Автор: Переводчикова Н.И.
Теги: опухоли новообразования бластомы хористомы гамартомы онкология лекарственные средства в соответствии с их активным веществом медицина лечение
ISBN: 978-5-98811-180-1
Год: 2011
РУКОВОДСТВО
ПО ХИМИОТЕРАПИИ
ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Под редакцией Н.И. Переводчиковой
3-е издание, дополненное и переработанное
практическая медицина
Москва 201 1
УДК 616-006:615.277.3
ББК 55.6
Р85
Р85 Руководство по химиотерапии опухолевых заболеваний / Под ред. Н.И. Переводчико-
вой. — 3-е изд., доп. и пер. — М.: Практическая медицина, 2011. — 512 с.
ISBN 978-5-98811-180-1
Настоящее издание классического руководства по химиотерапии (предыдущее издание
вышло в 2005 г.) полностью переработано и дополнено информацией о новых противоопу-
холевых лекарственных средствах, вошедших в клиническую практику за последние 5 лет, в
частности о молекулярно-нацеленных (таргетных) препаратах. Книга содержит сведения о
принципах противоопухолевой химиотерапии, о лекарственных препаратах противоопухо-
левого действия, а также о методиках химиотерапии основных онкологических заболеваний
каку взрослых, так и у детей. Представлены схемы лечения отдельных нозологических форм
злокачественных новообразований, наряду с клиническими классификациями представле-
на характеристика стадий отдельных заболеваний по системе TNM. Описаны побочные эф-
фекты и осложнения химиотерапии, их предупреждение и лечение.
Для онкологов, гематологов и врачей других специальностей, занимающихся лечением
злокачественных опухолей.
УДК 616-006:615.277.3
ББК 55.6
Были предприняты все возможные меры по проверке точности дозировок
и режимов введения лекарственных средств, упомянутых в данном издании.
Однако перед назначением препарата просьба тщательно изучать вложенную
инструкцию по применению. Авторы и издательство не несут ответственно-
сти за любые неблагоприятные последствия, связанные с назначением обсу-
ждаемых в книге лекарственных средств.
Противоопухолевые препараты, представленные в книге, преимущественно
указаны в виде международных названий. В ряде случаев, в интересах читате-
лей, в скобках даны торговые наименования.
ISBN 978-5-98811-180-1
© Коллектив авторов, 2010
© Издательский дом лр^йчёасаям^цина 2010
Коллектив авторов
Артамонова Елена Владимировна — д.м.н., ведущий научный сотрудник отделения
изучения новых противоопухолевых лекарств (с однодневным стационаром химио-
терапии) РОНЦ им. Н.Н. Блохина РАМН
Базин Игорь Сергеевич — д.м.н., старший научный сотрудник отделения клинической
фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН
Баранова Ольга Юрьевна — к.м.н., научный сотрудник отделения химиотерапии гемо-
бластозов РОНЦ им. Н.Н. Блохина РАМН
Бесова Наталья Сергеевна — к.м.н., старший научный сотрудник отделения химиоте-
рапии РОНЦ им. Н.Н. Блохина РАМН
Бойченко Елена Игоревна — к.м.н., доцент кафедры детской онкологии РМАПО
Бычков Марк Борисович — профессор, д.м.н., ведущий научный сотрудник отделения
химиотерапии РОНЦ им. Н.Н. Блохина РАМН
Волкова Майя Александровна — профессор, д.м.н., ведущий научный сотрудник от-
деления химиотерапии гемобластозов РОНЦ им. Н.Н. Блохина РАМН
Вотякова Ольга Михайловна — к.м.н., старший научный сотрудник отделения химио-
терапии гемобластозов РОНЦ им. Н.Н. Блохина
Гарин Август Михайлович — профессор, д.м.н., главный научный сотрудник отделения
клинической фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН
Горбунова Вера Андреевна — профессор, д.м.н., заведующая отделением химиотера-
пии РОНЦ им. Н.Н. Блохина РАМН
Демина Елена Андреевна — д.м.н., ведущий научный сотрудник отделения химиотера-
пии гемобластозов РОНЦ им. Н.Н. Блохина РАМН
Дмитриева Наталья Владимировна — профессор, д.м.н., заведующая лаборато-
рией микробиологической диагностики и лечения инфекций в онкологии РОНЦ
им. Н.Н. Блохина РАМН
Иванова Надежда Михайловна — д.м.н., профессор, заведующая отделением хирур-
гического №3 (опухолей опорно-двигательного аппарата) НИИ детской онкологии и
гематологии РОНЦ им. Н.Н. Блохина РАМН
Ильяшенко Виктор Владимирович — к.м.н., старший научный сотрудник отделе-
ния химиотерапии гемобластозов НИИ детской онкологии и гематологии РОНЦ
им. Н.Н. Блохина РАМН
Кадагидзе Заира Григорьевна — профессор, д.м.н., заведующая лабораторией кли-
нической иммунологии опухолей РОНЦ им. Н.Н. Блохина РАМН
Казанцев Анатолий Петрович — к.м.н., старший научный сотрудник отделения №2
торакально-абдоминальной локализации НИИ детской онкологии и гематологии
РОНЦ им. Н.Н. Блохина РАМН
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 3
Купчан Дина Зурабовна — к.м.н., заведующая отделением организации и проведения
клинических исследований РОНЦ им. Н.Н. Блохина РАМН
Манзюк Людмила Валентиновна — профессор, д.м.н., заведующая отделением из-
учения новых противоопухолевых лекарств (с однодневным стационаром химиоте-
рапии) РОНЦ им. Н.Н. Блохина РАМН
Маренич Александр Федорович — к.м.н., старший научный сотрудник отделения хи-
миотерапии РОНЦ им. Н.Н. Блохина РАМН
Маякова Светлана Александровна — профессор, д.м.н., ведущий научный сотруд-
ник отделения химиотерапии гемобластозов НИИ детской онкологии и гематологии
РОНЦ им. Н.Н. Блохина РАМН
Морозова Ольга Вячеславовна — д.м.н., ведущий научный сотрудник отделения хими-
отерапии гемобластозов НИИ детской онкологии и гематологии РОНЦ им. Н.Н. Бло-
хина РАМН
Насхлеташвили Давид Романович — к.м.н., старший научный сотрудник отделения
нейрохирургического (онкологического) РОНЦ им. Н.Н. Блохина РАМН
Орел Надежда Федоровна — д.м.н., ведущий научный сотрудник отделения химиоте-
рапии РОНЦ им. Н.Н. Блохина РАМН
Петухова Ирина Николаевна — д.м.н., ведущий научный сотрудник лаборатории ми-
кробиологической диагностики и лечения инфекций в онкологии РОНЦ им. Н.Н. Бло-
хина РАМН
Переводчикова Наталия Иннокентьевна - профессор, д.м.н., ведущий научный
сотрудник отделения химиотерапии РОНЦ им. Н.Н. Блохина РАМН
Поддубная Ирина Владимировна — чл-корр РАМН, профессор, д.м.н., заведующая
кафедрой онкологии Российской медицинской академии последипломного образо-
вания
Поляков Владимир Георгиевич — чл-корр РАМН, профессор, д.м.н., заместитель ди-
ректора НИИ детской онкологии и гематологии, заведующий отделом общей онколо-
гии НИИ ДОиГ РОНЦ им. Н.Н. Блохина РАМН, заведующий кафедрой детской онко-
логии РМАПО
Попа Александр Валентинович — профессор, д.м.н., ведущий научный сотрудник от-
деления химиотерапии гемобластозов НИИ детской онкологии и гематологии РОНЦ
им. Н.Н. Блохина РАМН
Рзаев Дзарахмат Салманович — аспирант отделения химиотерапии РОНЦ
им. Н.Н. Блохина РАМН
Романов Илья Станиславович — к.м.н., старший научный сотрудник отделения хи-
рургического №11 (опухолей верхних дыхательно-пищеварительных путей) РОНЦ
им. Н.Н. Блохина РАМН
Сусулева Наталья Александровна — д.м.н., профессор кафедры детской онкологии
РМАПО
Трякин Алексей Александрович — к.м.н., старший научный сотрудник отделения
клинической фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН
Трусилова Елена Владимировна — аспирант отделения химиотерапии РОНЦ
им. Н.Н. Блохина РАМН
Ушакова Татьяна Леонидовна — врач-офтальмолог отделения хирургического №1
(опухолей головы и шеи) НИИ детской онкологии и гематологии РОНЦ им. Н.Н. Бло-
хина РАМН
Федотенко Сергей Петрович — к.м.н., ведущий научный сотрудник отделения хи-
рургического №11 (опухолей верхних дыхательно-пищеварительных путей) РОНЦ
им. Н.Н. Блохина РАМН
Феденко Александр Александрович — к.м.н., старший научный сотрудник отделе-
ния химиотерапии РОНЦ им. Н.Н. Блохина РАМН
Шварова Анна Викторовна — к.м.н., старший научный сотрудник отделения хирурги-
ческого №3 (опухолей опорно-двигательного аппарата) НИИ детской онкологии и ге-
матологии РОНЦ им. Н.Н. Блохина РАМН
Ширин Антон Дмитриевич — к.м.н., старший научный сотрудник отделения химиоте-
рапии гемобластозов РОНЦ им. Н.Н. Блохина РАМН
4 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Оглавление
Предисловие........................................12
От редактора........................................в
Список сокращений...................................и
Введение (Переводчикова Н. И.).....................17
ЧАСТЬ!. ОБЩИЕ СВЕДЕНИЯ
О ПРОТИВООПУХОЛЕВОЙ
ХИМИОТЕРАПИИ И ЛЕКАРСТВЕННЫХ
СРЕДСТВАХ ПРОТИВООПУХОЛЕВОГО
ДЕЙСТВИЯ..................19
Глава 1. Общие сведения
О клинической химиотерапии (Переводчикова Н. И.)....21
1.1. Принципы клинической химиотерапии........................21
1.2. Современные возможности химиотерапии.....................25
1.3. Оценка лечебного действия противоопухолевых средств......26
1.4. Адъювантная и неоадъювантная химиотерапия (Гарин а. /и.).28
Глава 2. Клинико-фармакологическая характеристика
противоопухолевых средств (Переводчикова Н. И.).....30
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 5
Глава 3. Таргетные (молекулярно-нацеленные)
препараты (Переводчикова Н. И.)....................41
3.1. Особенности механизма действия таргетных
препаратов.....................................41
3.2. Клиническое применение таргетных препаратов...43
Глава 4. Современные методы иммунотерапии
в онкологии.
Модификаторы биологических реакций (КадагидзеЗ.Г.)--49
Глава 5. Колониестимулирующие
факторы (Переводчикова Н. И.)......................55
Глава 6. Бисфосфонаты (Переводчикова Н. И.).........62
Глава 7. Препараты, обеспечивающие
переносимость цитостатиков и улучшающие
качество жизни больных в процессе химиотерапии
(сопроводительные препараты) (Переводчикова Н. И.)..67
Глава 8. Характеристика отдельных
противоопухолевых препаратов (Купчанд.з.)...........и
ЧАСТЬ II. ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ
ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ............................121
Глава 9. Химиотерапия солидных опухолей...........123
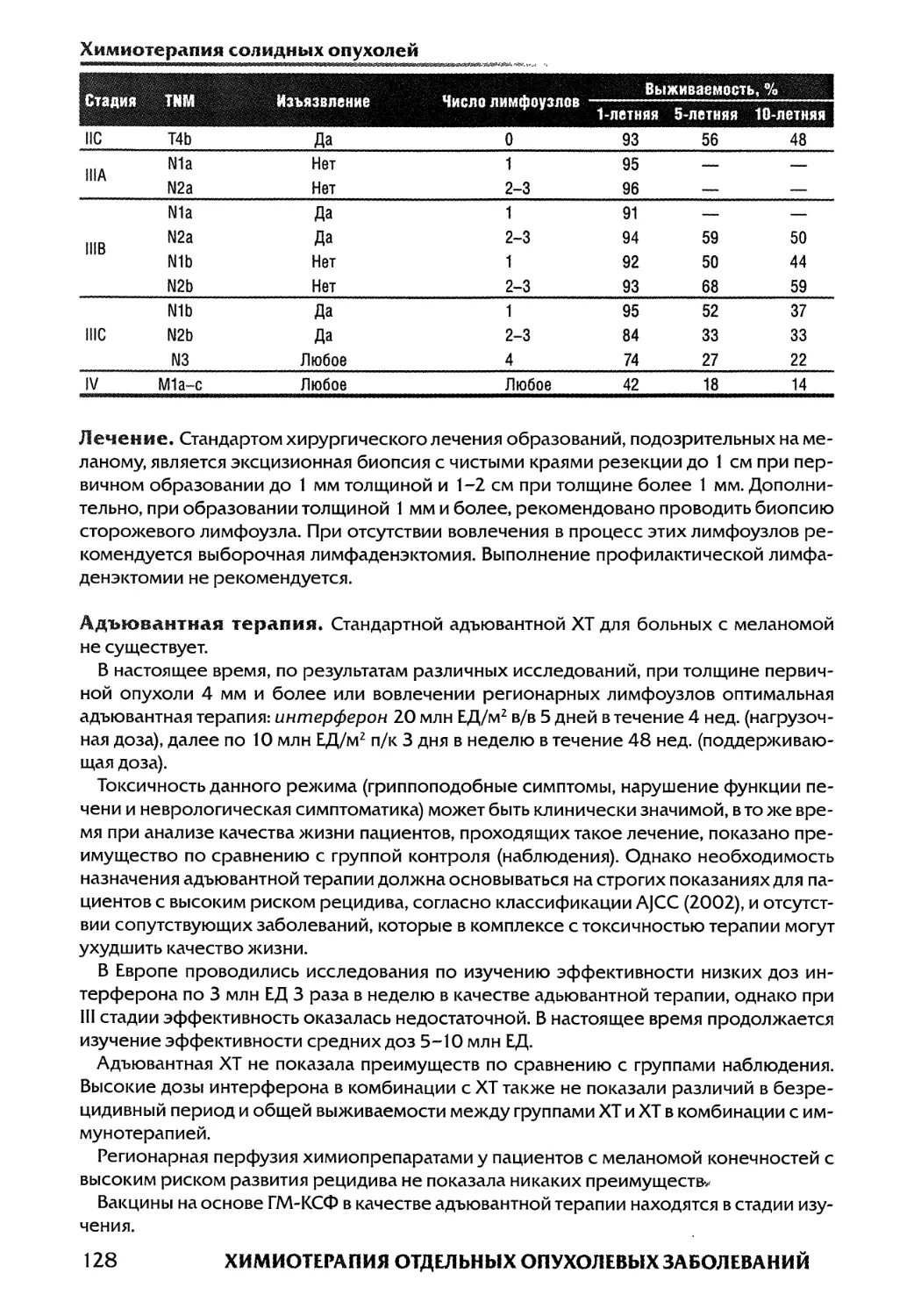
9.1. Рак кожи и карцинома Меркеля (Маренич а. ф.)...123
9.2. Меланома КОЖИ (Феденко А. А.)................126
9.3. Злокачественные опухоли
ГОЛОВЫ И шеи (Федотенко С. П., Романов И. С.)...132
9.4. Рак легкого (Бычков М. Б.).....................139
9.4.1. Немелкоклеточный рак легкого.............141
9.4.2. Мелкоклеточный рак легкого...............145
9.5. Мезотелиома плевры (Бычков М. Б.)--------------149
9.6. Опухолевые плевриты (Бычков М. Б.).............151
6 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
9.7. Злокачественные опухоли желудочно-кишечного тракта...................153
9.7.1. Рак пищевода (Манзюк Л. В.).........................153
9.7.2. Рак желудка (Гарин А. М., Базин И. С.)........................156
9.7.3. Рак толстой кишки (Манзюк Л. В., Артамонова Е. В.)..161
9.7.3.1. Рак ободочной кишки.....................................162
9.7.3.2. Рак прямой кишки........................................167
9.7.4. Анальный рак (Манзюк Л. В.).........................169
9.7.5. Рак поджелудочной железы (Гарин А. М., Базин И. С.).170
9.7.6. Рак печени (Манзюк Л. В.)...........................175
9.7.6.1. Гепатоцеллюлярный рак.........................175
Э.7.6.2. Холангиоцеллюлярный рак печени................177
9.7.7. Рак желчного пузыря (Манзюк Л. В.)------------------178
9.8. Неэпителиальные злокачественные опухоли
желудочно-кишечного тракта (Поддубная И. В.)....................179
9.9. Гастроинтестинальные стромальные
опухоли (Поддубная И. В.).......................................181
9.10. Рак МОЛОЧНОЙ железы (Орел Н. Ф.)..........................182
9.10.1. Лекарственная терапия раннего
(операбельного) рака молочной железы......................185
9.10.2. Местнораспространенный и инфильтрированный
рак молочной железы.......................................188
9.10.3. Лекарственная терапия метастатического
рака молочной железы......................................189
9.10.4. Рак молочной железы у мужчин.......................192
9.11. Злокачественные опухоли
женских ПОЛОВЫХ органов (Горбунова В. А.)......................196
9.11.1. Злокачественные опухоли яичников...................196
9.11.1.1. Ракяичников..................................197
9.11.1.2. Стромальные и герминогенные опухоли яичников.207
9.11.2. Рак шейки матки....................................210
9.11.3. Рак вульвы.........................................214
9.11.4. Рак влагалища......................................216
9.11.5. Рак эндометрия.....................................216
9.11.6. Саркома матки......................................221
9.11.7. Трофобластическая болезнь..........................223
9.11.7.1. Хориокарцинома...............................224
9.11.7.2. Пузырный занос...............................228
9.12. Опухоли мочеполовых органов...............................229
9.12.1. Рак почки (Манзюк Л. В.)-------------------------------------229
9.12.2. Рак мочевого пузыря (Манзюк Л. В.).................232
9.12.3. Рак простаты (Манзюк Л. В.)----------------------------------236
9.12.4. Рак полового члена (Манзюк Л. В.)..................240
9.12.5. Злокачественные опухоли яичка (Горбунова В. А.,Трякин А. А.)-241
9.13. Злокачественные опухоли
МЯГКИХ тканей (Горбунова В. А., ФеденкоА.А.)...................247
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 7
9.14. Саркома Капоши (Горбунова В. А.)....................256
9.15. Первичные злокачественные опухоли костей (Феденко а. а.).258
9.15.1. Остеосаркома.................................259
9.15.2. Хондросаркома................................262
9.15.3. Злокачественная фиброзная гистиоцитома кости.263
9.15.4. Саркома Юинга и примитивные
нейроэктодермальные опухоли.........................264
9.16. Опухоли центральной нервной системы.................266
(Бычков М. Б., Насхлеташвили Д. Р.)
9.16.1. Первичные опухоли головного мозга............266
9.16.2. Метастатические опухоли головного мозга......268
9.17. Опухоли надпочечников (Горбунова В. А.).............270
9.17.1. Рак коры надпочечников.......................270
9.17.2. Феохромоцитома...............................271
9.18. Опухоли вилочковой железы (Орел н. Ф.)..............272
9.19. Нейроэндокринные опухоли (Орел Н. Ф.)...............273
9.19.1. Хемодектомы (параганглиомы)..................277
9.20. Метастазы из невыделенного первичного очага.........277
(МанзюкЛ. В., Артамонова Е. В.)
Глава 10. Опухолевые заболевания
кроветворной и лимфоидной ткани...........................281
10.1. Острые лейкозы (Волкова М. А.)......................281
10.1.1. Острые нелимфобластные лейкозы...............282
10.1.2. Острые лимфобластные лейкозы.................290
10.2. Миелодиспластические синдромы.......................298
(Ширин А.Д., Баранова О. Ю.)
10.3. Хронические лейкозы (Волкова М. А.).................306
10.3.1. Хронический миелолейкоз......................306
10.3.2. Большие эозинофилии..........................312
10.3.3. Истинная полицитемия.........................313
10.3.4. Эссенциальная тромбоцитемия..................317
10.3.5. Идиопатический миелофиброз...................318
10.3.6. Хронический лимфолейкоз......................321
10.3.7. Волосатоклеточный лейкоз.....................329
10.3.8. Макроглобулинемия Вальденстрема..............331
10.4. Лимфома Ходжкина (Демина Е. А.).....................334
10.5. Неходжкинские лимфомы (Поддубная И. В.).............345
10.6. Множественная миелома (Вотякова О. М.)..............362
Глава 11. Злокачественные опухоли у детей.................373
11.1. Нефробластома (Бойченко Е. И.)......................373
11.2. Нейробластома (Казанцев А. П., Бойченко Е. И.)......377
8 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
11.3. Рабдомиосаркома (Иванова Н. М., Шварова А. В.)......383
11.4. Злокачественные опухоли костей (Иванова Н.М.).......388
11.4.1. Остеосаркома..................................388
11.4.2. Опухоли семейства саркомы Юинга...............391
11.5. Недифференцированный рак НОСОГЛОТКИ (Поляков В. Г.).395
11.5. Опухоли печени (Поляков В. Г.)----------------------397
11.7. Ретинобластома (Поляков В. Г., Ушакова Т. Л.).......399
Глава 12. Опухолевые заболевания кроветворной
и лимфоидной ткани у детей...................................доз
12.1. Острые лейкозы (Маякова С. А., Попа А. В.).........403
12.2. Лимфома ХодЖКИНа (Сусулева Н. А., Ильяшенко В. В.).410
12.3. Неходжкинские лимфомы (Морозова О. В., Сусулева Н. А.).416
ЧАСТЬ III. ОСЛОЖНЕНИЯ
ПРОТИВООПУХОЛЕВОЙ
ХИМИОТЕРАПИИ. ТЕРАПИЯ
НЕОТЛОЖНЫХ СОСТОЯНИЙ..........................423
Глава 13. Побочные реакции и осложнения
противоопухолевой лекарственной терапии..........425
(Поддубная И. В., Орел Н. Ф.)
13.1. Токсическое действие на кроветворение......426
13.2. Токсическое действие на желудочно-кишечный тракт.429
13.3. КарДИОТОКСИЧНОСТЬ..........................435
13.4. Легочная токсичность.......................436
13.5. Поражение мочевыводящей системы............437
13.6. Аллергические реакции......................439
13.7. Нейротоксичность...........................ддо
13.8. Токсическое действие на кожу и ее придатки.441
13.9. Токсические гипертермические реакции.......ддз
13.10. Токсические флебиты.......................ддз
13.11. Местное токсическое действие
при экстравазации цитостатиков...............ддд
13.12. Поздние осложнения........................445
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 9
Глава 14. Лечение и профилактика фебрильной
нейтропении у онкологических больных.................447
(Петухова И. Н., Дмитриева Н. В.)
14.1. Выбор режима первой линии антибиотикотерапии.449
14.2. Тактика антибиотикотерапии в течение
первой недели лечения.............................453
14.3. Длительность антимикробной терапии.............457
14.4. Применение противовирусных препаратов..........458
14.5. Трансфузии гранулоцитов........................459
14.6. Применение колониестимулирующих факторов.......459
14.7. Лечение катетер-ассоциированных инфекций.......460
14.8. Антибиотикопрофилактика при нейтропении........460
Глава 15. Особенности противоопухолевой
лекарственной терапии
У ЛИЦ ПОЖИЛОГО возраста (Бесова Н. С.)...............463
Глава 16. Терапия неотложных состояний
У онкологических больных (Феденко А. А., РзаевД. С.).471
16.1. Компрессия спинного мозга......................471
16.2. Синдром сдавления верхней полой вены...........473
16.3. Синдром лизиса опухоли.........................474
16.4. Отек головного мозга...........................476
16.5. Гиперкальциемия................................478
16.6. Анафилаксия и анафилактоидные реакции..........479
ПРИЛОЖЕНИЯ 48i
Приложение 1. Общее состояние больного
по шкале Карновского и ECOG-WHO......................4вз
Приложение 2. Соотношение роста, массы тела
и поверхности тела взрослого человека................484
Приложение 3. Расчет площади поверхности тела........485
Приложение 4. Расчет клиренса креатинина..........486
10 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Приложение 5. Расчет дозы карбоплатина
по площади под фармакокинетической кривой...........486
Приложение 6. Коррекция дозы препаратов
в зависимости от функции почек......................487
Приложение 7. Коррекция дозы препаратов
при нарушении функции печени........................488
Приложение 8. Кожные реакции при применении
ингибиторов EGFR....................................490
Приложение 9. Коррекция дозы цетуксимаба
при КОЖНОЙ СЫПИ.....................................490
Приложение 10. Коррекция дозы сорафениба
при КОЖНОЙ ТОКСИЧНОСТИ..............................491
Приложение 11. Шкала токсичности (критерии nci стс).492
Предметный указатель................................502
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
И
Предисловие
Противоопухолевая химиотерапия — один из наиболее динамично развивающихся
разделов современной онкологии. Ежегодно в практику входят новые противоопухо-
левые препараты, апробируются новые терапевтические режимы, что расширяет воз-
можности терапии, улучшает результаты лечения онкологических больных.
Адекватное использование современной химиотерапии требует постоянного об-
новления информации о противоопухолевых препаратах и методиках их использо-
вания.
Задачу кратко суммировать состояние проблемы и представить принципы совре-
менной химиотерапии наиболее часто встречающихся опухолевых заболеваний ста-
вит перед собой коллектив специалистов-химиотерапевтов Российского онкологиче-
ского научного центра им. Н. Н. Блохина РАМН, подготовивший настоящее, 3-е издание
руководства по противоопухолевой терапии, 1-е и 2-е издания которого опубликова-
ны в 2000 и 2005 г. соответственно.
За прошедшие годы существенно расширились возможности химиотерапии опухо-
левых заболеваний за счет не только введения в практику новых более активных пре-
паратов, но и расширения наших представлений о биологических особенностях раз-
личных опухолей, что способствовало индивидуализации терапевтических подходов.
Хотелось бы надеяться, что новое издание руководства будет полезным для широко-
го круга врачей, использующих в своей практике противоопухолевую химиотерапию.
Директор
Российского онкологического
научного центра им. Н. Н. Блохина РАМН,
академик РАН и РАМН
профессор М. И. Давыдов
12
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
От редактора
Дорогие коллеги!
Подготовленное сотрудниками Российского онкологического научного центра
им. Н.Н. Блохина РАМН руководство по химиотерапии опухолевых заболеваний, 1-е
издание которого вышло в 2000 г., а 2-е — в 2005 г., по полученным нами отзывам
пользуется определенной популярностью у специалистов.
Быстрое развитие противоопухолевой химиотерапии привело к тому, что за
истекшие годы в практику вошел ряд принципиально новых противоопухолевых
препаратов и новых терапевтических режимов, изменивших возможности лечения
многих опухолевых заболеваний. Это побудило нас подготовить настоящее, 3-е из-
дание руководства, дополнив его сведениями о новых подходах к лечению ряда
опухолей, таких как саркомы мягких тканей, нейроэндокринные опухоли, опухоли
мозга, почки и др.
Надеемся, что наша книга будет полезна не только онкологам-химиотерапевтам, но
и врачам других специальностей, использующих в своей практике противоопухоле-
вую терапию. Мы старались учесть полученные замечания и будем благодарны за но-
вые советы и критические отзывы.
В заключение считаю своим приятным долгом поблагодарить всех коллег, участ-
вовавших в подготовке настоящего издания, а также выразить благодарность за по-
мощь и поддержку руководству и коллективу Российского онкологического научного
центра им. Н.Н. Блохина РАМН, лично проф. Б.П. Копнину, проф. В.Б. Матвееву, проф.
Г. К. Герасимовой за их ценные советы, а также выразить признательность фирме «Но-
вартис», традиционно поддерживающей издание нашего руководства.
Профессор Н. И. Переводчикова
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
13
Список сокращений
AJCC — Американский объединенный комитет по онкологическим заболева- ниям
ASCO AUG ECOG — Американское общество клинической онкологии — площадь под фармакокинетической кривой — Многоцентровая онкологическая исследовательская группа Востока США
EGF EGFR ESM0 FAB FDA — эпидермальный фактор рост — рецептор эпидермального фактора роста — Европейское общество медицинской онкологии — Франко-американо-британская классификация — Управление по контролю за качеством пищевых продуктов и лекар- ственных средств США
FDR FIGO FISH GIST HIF IPSS LH-RH MALT MASCC — фиксированная дозировка введения — Международная ассоциация акушеров и гинекологов — флюоресцентная гибридизация in situ — гастроинтестинальные стромальные опухоли — гипоксия-индуцируемые факторы (Hypoxia-inducible factors) — международная прогностическая система оценки — рилизинг-гормон лютеинизирующего гормона гипофиза — мукозо-ассоциированная лимфома — Многонациональная ассоциация сопроводительной помощи в онко- логии
mTOR NCCN NCI NK PDGF PDGFR Ph PNET SERD — мишень рапамицинау млекопитающих — Национальная всеобщая онкологическая сеть США — Национальный институт рака США — естественные киллеры — тромбоцитарный фактор роста — рецептор тромбоцитарного фактора роста — филадельфийская хромосома — примитивные нейроэктодермальные опухоли — селективный супрессор эстрогенных рецепторов
14 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
SERM — селективный модулятор эстрогенных рецепторов
VEGF — фактор роста эндотелия сосудов
VEGFR — рецептор фактора роста эндотелия сосудов
5-ФУ — 5-фторурацил
АКТГ — адренокортикотропный гормон
АлАТ — аланинаминотрансфераза
АсАТ — аспартатаминотрансфераза
АТФ — аденозинтрифосфат
АФП — а-фетопротеин
БКР — базальноклеточный рак
вгн — верхняя граница нормы
вкл — волосатоклеточный лейкоз
ВОЗ (WHO) — Всемирная организация здравоохранения
ггт — гамма-глутамилтрансфераза
Г-КСФ — гранулоцитарный колониестимулирующий фактор
ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор
ГПДР — гастропанкреатодуоденальная резекция
ГСК — гемопоэтические стволовые клетки
ГЦР — гепатоцеллюлярный рак
ГЭБ — гематоэнцефалический барьер
две — диссеминированное внутрисосудистое свертывание
ил — интерлейкин
ИМФ — идиопатический миелофиброз
ип — истинная полицитемия
ИФН — интерферон
КРР — колоректальный рак
КСФ — колониестимулирующий фактор
кт — компьютерная томография
ЛАК — лимфокин-активированные клетки
лдг — лактатдегидрогеназа
лнг — лихорадка неясного генеза
лпс — ладонно-подошвенный синдром
лх — лимфома Ходжкина
МАИР — Международное агентство по изучению рака
мди — микробиологически доказанная инфекция
мде — миелодиспластический синдром
МКА — моноклональные антитела
М-КСФ — макрофагальный колониестимулирующий фактор
мпи — международный прогностический индекс
МРЛ — мелкоклеточный рак легкого
МРТ — магнитно-резонансная томография
МЭН — множественная эндокринная неоплазия
НБ — нейробластома
НМРЛ — немелкоклеточный рак легкого
НПО — невыявленный первичный очаг
нхл — неходжкинские лимфомы
олл — острый лимфобластный лейкоз
онлл — острый нелимфобластный лейкоз
опл — острый промиелоцитарный лейкоз
оссю — опухоли семейства саркомы Юинга
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 15
ОФЭ — орхифуникулэктомия
пвх — поливинилхлорид
ПКР — плоскоклеточный рак
ПСА — простатический специфический антиген
пск — периферические стволовые клетки
пхт — полихимиотерапия
ПЦР — полимеразная цепная реакция
ПЭТ — позитронно-эмиссионная томография
РБ — рети нобл астома
РЖ — рак желудка
РМЖ — рак молочной железы
РМС — рабдомиосаркома
РОД — разовая очаговая доза
РП — рецепторы прогестерона
РПЖ — рак поджелудочной железы
РЭ — рецепторы эстрогенов
РЭА — раково-эмбриональный антиген
ело — синдром лизиса опухоли
сод — суммарная очаговая доза
ссвпв — синдром сдавления верхней полой вены
ТУР — трансуретральная резекция
ФН — фебрильная нейтропения
ФНО — фактор некроза опухолей
хг — хорионический гонадотропин
хлл — хронический лимфолейкоз
хмл — хронический миелолейкоз
хммл — хронический миеломоноцитарный лейкоз
XT — химиотерапия
цмв — цитомегаловирус
ЩФ — щелочная фосфатаза
эпо — эритропоэтин
эсп — эритропоэзстимулирующий препарат
эт — эссенциальная тромбоцитемия
16
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Введение
Н. И. Переводчикова
Химиотерапия злокачественных опухолей — это использование с лечебной целью ле-
карственных средств, тормозящих пролиферацию или необратимо повреждающих
опухолевые клетки.
Термин «химиотерапия опухолей» в широком смысле отражает все виды медика-
ментозного лечения злокачественных новообразований, связанного с влиянием фар-
макологических средств непосредственно на опухоль. Противоопухолевую терапию
гормонами или их синтетическими аналогами и антигормонами обозначают терми-
ном «гормонотерапия». Однако наиболее полно все аспекты химиотерапии опухолей
отражает термин «лекарственная терапия опухолей», подразумевающий применение
синтетических препаратов, веществ природного происхождения, антибиотиков, гор-
монов и других противоопухолевых средств, в т.ч. модификаторов биологических ре-
акций и молекулярно-нацеленных (таргетных) препаратов.
Работы по созданию новых противоопухолевых средств направлены на получение
таких препаратов, которые при максимальном ингибирующем воздействии на опу-
холевые клетки минимально повреждали бы нормальные клетки и ткани организма.
Поиск противоопухолевых препаратов, преимущественно цитотоксических средств,
в течение длительного времени проводился во многом эмпирически. В связи с этим
большинство существующих противоопухолевых средств не обладает достаточно вы-
сокой избирательностью и оказывает побочное влияние на нормальные, прежде все-
го интенсивно пролиферирующие, ткани.
Введение в практику антигормонов (антиэстрогенов, антиандрогенов, ингибиторов
ароматазы, суперагонистов рилизинг-гормона лютеинизирующего гормона) проде-
монстрировало возможность успешного и в то же время относительно малотоксич-
ного медикаментозного лечения гормонозависимых опухолей.
Успехи молекулярной биологии, позволившие установить закономерности кле-
точного цикла и смерти, понять механизмы их контроля, поддержания генетической
стабильности и путей передачи сигнала от рецепторов в ядро, открыли перспекти-
вы создания препаратов молекулярно-нацеленного действия (таргетных, от англ, tar-
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 17
ли *•
get — мишень, цель). Препараты этой группы, такие как трастузумаб (Герцептин), има-
тиниб (Гливек), ритуксимаб (Мабтера), бевацизумаб (Авастин), цетуксимаб (Эрбитукс)
и др., уже реально вошли в клиническую практику.
Использование модификаторов биологических реакций, в первую очередь цито-
кинов (интерфероны, интерлейкины, колониестимулирующие факторы), расширило
возможности медикаментозного лечения опухолей.
Повышение эффективности химиотерапии опухолей идет по разным направлениям.
Главные из них — создание новых, более избирательно действующих на опухолевые
клетки препаратов, разработка комбинированного применения двух и более препа-
ратов (полихимиотерапия), оптимизация методик применения препаратов (дозирова-
ние, режим применения), совершенствование химиотерапии как звена или этапа ком-
плексного и комбинированного лечения опухолей, применение других лекарственных
средств с целью уменьшить побочное действие противоопухолевых препаратов и др.
Особое внимание уделяется механизмам действия препаратов, их фармакокинети-
ке (изучение путей поступления, распределения, метаболизма и выведения лекарств)
и фармакодинамике (изучение эффектов, вызываемых лекарством). На основе полу-
ченных данных разрабатываются рациональные методы использования известных
препаратов и определяются пути создания новых эффективных противоопухолевых
средств. Особую важность представляет преодоление естественной и приобретен-
ной устойчивости опухолевых клеток к препаратам противоопухолевого действия.
Противоопухолевые препараты все шире применяются в клинике. В процессе ле-
чения практически каждого онкологического больного на том или ином этапе рас-
сматривается вопрос о возможности и целесообразности химиотерапии. Однако ис-
пользование этого метода всегда должно быть индивидуализировано. Химиотерапию
следует применять строго по показаниям, с учетом не только особенностей патоло-
гического процесса, но и общего состояния больного. В связи с этим особое значе-
ние имеет разработка маркеров, имеющих предсказательное значение, позволяющих
индивидуализировать терапию для каждого пациента. Использование таких биомар-
керов, как рецепторы стероидных гормонов и гиперэкспрессия/амплификация HER2
при раке молочной железы, динамика раково-эмбрионального антигена в процессе
лечения больных колоректальным раком и СА-125 при раке яичников, показатели хо-
рионического гонадотропина при трофобластической болезни и а-фетопротеина при
герминогенных опухолях, стали обязательным условием выбора и проведения хими-
отерапии.
Генетическая характеристика опухолей уже сегодня считается обязательным усло-
вием успешного применения молекулярно-нацеленных (таргетных) препаратов.
Определение профиля экспрессии генов, позволяя уточнить прогноз, может быть ис-
пользовано для оптимизации программы лечения больного.
Нередко, особенно при лечении солидных опухолей, химиотерапию используют
как один из компонентов комплексной терапии, т.е. применяют в сочетании с хирур-
гическим лечением, лучевой и/или иммунотерапией. Именно это направление ока-
залось наиболее перспективным. Так, усовершенствование методов лечения ранне-
го рака молочной железы с использованием после операции адъювантной системной
терапии позволило не только улучшить результаты лечения, но и в ряде стран снизить
смертность от этого заболевания.
18
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
ЧАСТЬ I
ОБЩИЕ СВЕДЕНИЯ
О ПРОТИВООПУХОЛЕВОЙ
ХИМИОТЕРАПИИ
И ЛЕКАРСТВЕННЫХ
СРЕДСТВАХ
ПРОТИВООПУХОЛЕВОГО
ДЕЙСТВИЯ
Глава 1
Общие сведения о клинической
химиотерапии
Н. И. Переводчикова
1.1. Принципы клинической химиотерапии
В клиническую практику вошло более 100 противоопухолевых средств, и за послед-
ние годы достигнуты определенные успехи в лекарственной терапии ряда опухолей.
Однако не существует универсального средства, дающего лечебный эффект при всех
злокачественных опухолях. Как правило, спектр действия того или иного противоо-
пухолевого препарата ограничивается несколькими, а иногда только одной опухолью
или ее морфологическим вариантом.
К основным принципам химиотерапии опухолей, имеющим практическое значение,
относятся:
подбор препарата соответственно спектру его противоопухолевого действия;
выбор оптимальной дозы, режима и способа применения препарата, обеспечи-
вающий лечебный эффект без необратимых побочных явлений;
М учет факторов, требующих коррекции доз и режимов во избежание тяжелых
осложнений химиотерапии.
Противоопухолевые средства применяют, когда диагноз опухоли подтвержден ги-
стологическим исследованием; лечебный эффект химиотерапии должен оценивать-
ся по объективным показателям, которые отражают реакцию опухоли на противоо-
пухолевый препарат; обязательна оценка индивидуальной переносимости препарата.
Не следует применять химиотерапию, если отсутствуют условия для выявления (диаг-
ностики) и лечения возможных побочных эффектов противоопухолевого препарата.
Вопрос о применении химиотерапии у конкретных больных решается с участием спе-
циалиста — онколога-химиотерапевта.
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 21
Общие сведения о клинической химиотерапии
Режим применения
Доза, режим и методика введения препарата (струйно, в виде длительной инфузии,
высоких доз, дробных доз), интервал между введениями определяются характером
используемого противоопухолевого средства, в частности его цикло- и фазоспеци-
фичностью, а также переносимостью, и отрабатываются в процессе клинических ис-
пытаний.
Опухоли со значительной фракцией роста, т.е. со значительным числом активно де-
лящихся клеток, более чувствительны к традиционным цитотоксическим средствам,
особенно к фазоспецифическим препаратам.
При химиочувствительной опухоли потенциальная эффективность химиотера-
пии зависит от размера опухоли и, в частности, от ее ростовой фракции — количест-
ва активно делящихся клеток. Ростовая фракция уменьшается по мере роста опухо-
ли, и соответственно снижается возможность получения эффекта от химиотерапии
при большой массе опухоли. Отсюда целесообразность раннего начала химиотера-
пии, циторедуктивных операций и использования адъювантной (послеоперационной)
терапии, направленной на эрадикацию микрометастазов опухоли.
Есть разница в чувствительности различных метастазов и первичной опухоли. Раз-
личные варианты одного типа опухолей могут иметь неодинаковую чувствительность
к противоопухолевым препаратам. Например, разные варианты опухолей яичка и яич-
ников отличаются по своей чувствительности к противоопухолевым препаратам.
Дозировка противоопухолевых средств
Избирательность действия химиотерапии зависит от различия кривых «доза-эф-
фект» в нормальной и опухолевой ткани.
Как правило, существует прямая зависимость между разовой и суммарной дозой
препарата и терапевтическим эффектом. Однако повышение дозы препарата ограни-
чивается проявлениями токсичности.
Обычно дозы рассчитывают на единицу поверхности тела, определяя ее по номог-
рамме или по формуле (см. приложение 2).
У больных с ожирением при расчете поверхности тела используют «идеальную»
массу тела, которую определяют по специальной таблице, добавляя к соответствую-
щему показателю 73.
Если поверхность тела больного превышает 2 м2, расчет дозы делают на 2 м2.
Для детей младше 1 года дозы рассчитывают на 1 кг массы тела. Некоторые таргет-
ные препараты для взрослых также рассчитываются на 1 кг массы тела.
Для карбоплатина оптимальным расчетом дозы служит использование площади под
фармакокинетической кривой (AUC) по формуле Кальверта.
В ряде случаев требуется модификация дозы препарата, которая определяется его
переносимостью. Модификация дозы цитотоксических препаратов осуществляется в
зависимости от влияния на гемопоэз, гепатотоксичности и почечной токсичности (см.
приложения).
Обычно повторные курсы химиотерапии цитотоксическими препаратами прово-
дятся каждые 3-4 нед. (период, в течение которого восстанавливаются показатели
лейкоцитов и тромбоцитов). При использовании некоторых нитрозопроизводных этот
интервал увеличивается до 6 нед.
Интенсивность химиотерапии определяется как доза, вводимая в единицу времени
(в мг/м2/нед.). Интенсивность дозы рассчитывают для каждого препарата, исходя из пе-
риода назначения схемы химиотерапии. Интенсивность может быть повышена за счет
либо увеличения дозы (высокодозная терапия), либо сокращения интервала между
курсами (уплотненные режимы).
22 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Принципы клинической химиотерапии
Иногда используют метрономные режимы применения цитотоксиков, когда малые
дозы препаратов вводятся постоянно в течение длительного времени.
Длительное ежедневное введение используется при лечении гормональными и не-
которыми таргетными препаратами.
Предшествующее лечение и общее состояние больного
Предшествующая химиотерапия или облучение могут заметно изменить (понизить
или, реже, повысить) чувствительность опухоли.
Кроме того, на эффективность лечения ряда опухолевых заболеваний влияют такие
факторы, как возраст, пол, состояние иммунитета, общее состояние больного, его ге-
нетическая характеристика (например, гомозиготность 28-го аллеля LIGTIAI, опреде-
ляющая непереносимость иринотекана).
Общее состояние пациента — важнейший прогностический фактор и в значитель-
ной мере определяет возможности химиотерапии. Больным в терминальном состо-
янии с огромной массой опухолевой ткани, значительным нарушением функции жиз-
ненно важных органов химиотерапия может принести скорее вред, чем облегчение.
Исключением считаются случаи, когда тяжесть состояния больного обусловлена ме-
ханическим сдавлением жизненно важных органов опухолью, высокочувствитель-
ной к химиотерапевтическим воздействиям. В приложении 1 представлены критерии
оценки общего состояния онкологического больного (шкала Карновского и шкала
ECOG-WHO).
Способы применения
По способу (путям введения) применения противоопухолевых препаратов различа-
ют системную, регионарную и локальную химиотерапию, ^системной химиотерапии
опухолей относится введение препаратов внутрь, подкожно (п/к), внутривенно (в/в),
внутримышечно (в/м) и ректально, рассчитанное на общий (резорбтивный) противоо-
пухолевый эффект. Регионарная химиотерапия опухолей подразумевает воздействие
противоопухолевого препарата в повышенных концентрациях с ограничением его по-
ступления в другие органы путем введения в сосуды, питающие новообразование. При
локальной химиотерапии цитостатики в соответствующих лекарственных формах
(мази, растворы) наносят на поверхностные опухолевые очаги (кожные язвы), вводят в
серозные полости при выпотах (асцит, плеврит) или в спинномозговой канал (интрате-
кально) при поражении мозговых оболочек, внутрипузырно — при новообразовани-
ях мочевого пузыря и т. д.
Монохимиотерапия и комбинированная терапия
Выделяют монохимиотерапию при использовании одного препарата и комбини-
рованную химиотерапию (полихимиотерапию) при использовании нескольких ци-
тотоксических препаратов (цитотоксиков) или их применение в комбинации с гор-
монами, либо таргетными препаратами, либо модификаторами биологических
реакций.
Известно множество комбинаций, в состав которых входит два и более противоопу-
холевых препарата.
Выделяют несколько принципов (подходов), объясняющих преимущества полихи-
миотерапии перед монохимиотерапией и указывающих возможные пути создания
новых эффективных комбинаций.
Для комбинированной химиотерапии обычно подбирают противоопухолевые пре-
параты, совпадающие по противоопухолевой активности, но различающиеся (на мо-
лекулярном, клеточном уровнях или на уровне организма) по механизму действия.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 23
Общие сведения о клинической химиотерапии
яяявя®8вйвяяав«йя»авймв«явайв»^^ х
Исходя из токсикологического принципа, в комбинацию включают препараты, кото-
рые при монотерапии активны в отношении данной опухоли, но обладают разной ток-
сичностью.
В некоторых случаях с целью снизить токсичность противоопухолевых препаратов
применяют другие лекарственные средства, не обладающие противоопухолевой ак-
тивностью, но снимающие побочные эффекты. Типичным примером комбинации типа
«цитотоксик + антидот» служит использование фолината кальция (лейковорин) при
применении метотрексата. Лейковорин защищает нормальные ткани от действия ме-
тотрексата, который в этих условиях может применяться в больших дозах.
Важное направление в химиотерапии — биохимическая модификация действия
противоопухолевых препаратов, в частности антиметаболитов. Примером такой ком-
бинации «антиметаболит + модификатор его биохимического действия» служит соче-
тание фторпроизводных пиримидина (фторурацил, тегафур) с лейковорином.
Биохимический принцип побуждает включать в комбинации препараты, приводя-
щие к различным биохимическим повреждениям.
В процессе деления опухолевые, так же как и нормальные, клетки проходят фазы
клеточного цикла, начиная с постмитотической фазы Gr во время которой продуци-
руются ферменты, необходимые для создания ДНК, другие белки и РНК. За ней следу-
ет фаза S, во время которой происходит весь синтез ДНК, а затем — премитотическая
фаза G2, во время которой продолжается синтез белков и РНК, после чего наступает
митоз (М), а после фазы покоя (Go) образующиеся дочерние клетки начинают новый
цикл.
Классические цитотоксики в зависимости от их противоопухолевой активности в
различные фазы клеточного цикла делят на фазоспецифические (антиметаболиты, ин-
гибиторы топоизомеразы I и II, таксаны, винкаалкалоиды), циклоспецифические, дей-
ствующие в течение всего цикла (алкилирующие агенты, антрациклины), и циклоне-
специфические (нитрозомочевины), действующие на клетки в фазе покоя (Go).
Комбинация циклоспецифических или циклонеспецифических препаратов с фазо-
специфическими позволяет рассчитывать на повреждение большего числа опухоле-
вых клеток, как делящихся, так и находящихся в фазе Go.
Цитокинетический принцип заключается в синхронизации клеточных циклов с по-
мощью одного препарата, например винкристина, губительно действующего на клетки
в митозе. Клетки, неубитые препаратом, вступают в новый клеточный цикл синхронно.
Когда они находятся в фазе S, действует специфический для этой фазы препарат, на-
пример цитарабин. Цитокинетическим принципом можно объяснить эффективность
комбинаций с производными нитрозометилмочевины. Препараты этой группы пора-
жают клетки, находящиеся в фазе Go. Однако этот принцип, весьма привлекательный
сточки зрения создания рациональных систем комбинированной химиотерапии, пра-
ктически невозможно использовать для индивидуализации терапевтического режима
у отдельного больного, в первую очередь в связи с гетерогенностью клеточного соста-
ва опухоли.
В последние годы активно изучается целесообразность использования комбина-
ции традиционных цитотоксиков, работающих на уровне синтеза ДНК и митоза, и
молекулярно-нацеленных (так называемых таргетных) препаратов. Так, комбинация
паклитаксела (Таксол) и трастузумаба (Герцептин) оказалась более эффективной,
чем применение одного паклитаксела при НЕК2-позитивном раке молочной желе-
зы, включение цетуксимаба в традиционную комбинацию фторурацил-цисплатин
повышает ее эффективность при плоскоклеточном раке головы и шеи, цетуксимаб и
бевацизумаб повышают эффективность комбинированной химиотерапии колорек-
тального рака.
24 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Современные возможности химиотерапии
1.2. Современные возможности химиотерапии
При гемобластозах и диссеминированных формах солидных опухолей химиотерапия
считается основным методом лечения; в то же время на ранних стадиях солидных зло-
качественных опухолей химиотерапия в основном может быть использована в качест-
ве одного из компонентов комплексного лечения, например в качестве послеопера-
ционной (адъювантной) либо неоадъювантной терапии.
Число опухолевых заболеваний, при которых химиотерапия ведет к излечению, не-
велико, чаще даже эффективная химиотерапия вызывает клиническую ремиссию на
определенный период времени. Возможности современной химиотерапии представ-
лены в табл. 1.1.
Таблица 1.1. Чувствительность солидных злокачественных опухолей и
гемобластозов к современным методам химиотерапии
Высокая частота регрессии Регрессия опухоли
Возможно излечение опухоли, продление жизни, у 20-50% больных, Малочувствительны
с помощью лекарст- излечение менее чем у 10% возможно продление к лекарственной
венной терапии больных жизни терапии
Хориокарцинома матки Саркома Юинга и примитив- ные нейроэктодермальные опухоли (PNET) Рак желудка Рак печени
Злокачественные гер- миногенные опухоли (яичка, яичников, вне- гонадные) Рак простаты Рак пищевода Рак поджелудочной железы
Анальный рак (соче- тание с лучевой тера- пией) Острый лимфобласт- ный лейкоз (ОЛЛ) у детей Колоректальный рак (КРР) Мелкоклеточный рак легко- го (МРЛ) Рак яичников Рак почки Немелкоклеточный рак легкого (НМРЛ) Рак щитовидной же- лезы
Лимфома Ходжкина Рак мочевого пузыря Нейробластома у детей Рак шейки матки
Опухоль Беркитта Хронический миело- лейкоз (ХМЛ) Нефробластома у детей Эмбриональная рабдо- миосаркома у детей Рак гортани Ретинобластома Острые лейкозы Миеломная болезнь Эритремия Неходжкинские лимфомы (НХЛ) Гастроинтестинальные стро- мальные опухоли (GIST) Меланома Рак молочной железы (РМЖ)* Рак тела матки Плоскоклеточный рак (ПКР) головы и шеи Саркомы мягких тканей Остеогенная саркома* Глиобластома Рак влагалища
* Излечение в случае применения адъювантной и неоадъювантной химиотерапии при локализованных (операбель-
ных) формах.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
25
Общие сведения о клинической химиотерапии
1.3. Оценка лечебного действия
противоопухолевых средств
Основным показателем эффективности лечения, как и при других заболеваниях,
считают выживаемость больных со злокачественными опухолями. Вместе с тем
для оценки непосредственного лечебного действия разработаны единые крите-
рии объективного и субъективного эффекта. Критерием объективного эффекта
(ответа на терапию) при лечении солидных опухолей служит уменьшение опухо-
ли и метастазов.
Традиционно в течение длительного времени для оценки объективного эффекта хи-
миотерапии использовались критерии комитета экспертов ВОЗ. При этом применя-
лась оценка размера опухоли и метастазов как производное двух наибольших перпен-
дикулярных диаметров.
Критерии эффекта по шкале ВОЗ при солидных опухолях:
Я Полный эффект — исчезновение всех поражений на срок не менее 4 нед.
Я Частичный эффект — большее или равное 50 % уменьшение всех или отдельных
опухолей при отсутствии прогрессирования других очагов.
Я Стабилизация (без изменений) — уменьшение менее чем на 50 % или увеличение
менее чем на 25 % при отсутствии новых очагов поражения.
Я Прогрессирование — увеличение более чем на 25 % одной или более опухолей
либо появление новых очагов поражения.
С 2000 г. в международных клинических исследованиях стала использовать-
ся новая методика оценки эффективности терапии солидных опухолей по шкале
RECIST (Response Evaluation Criteria In Solid Tumors — шкала RECIST 1.1), пересмо-
тренная в 2009 г.
Опухоли оцениваются как измеряемые (20 мм или более при стандартном ис-
следовании, 10 мм при использовании спиральной КТ) либо неизмеряемые (мень-
ше размеров, указанных выше). Определяют наибольший диаметр 5 очагов пора-
жения (до 2 в одном органе или до 5 в различных органах)1. Сумма диаметров до
лечения рассматривается как базовый показатель и сравнивается с таковой после
лечения.
Критерии эффективности по шкале RECIST:
Я Полный эффект — исчезновение всех очагов поражения на срок не менее 4 нед.
Я Частичный эффект — уменьшение измеряемых очагов на 30 % или более.
Я Прогрессирование — увеличение на 20% наименьшей суммы очагов пора-
жения, зарегистрированной за время наблюдения, или появление новых оча-
гов.
Я Стабилизация — нет уменьшения, достаточного для оценки как частичный эф-
фект, или увеличения, которое можно оценить как прогрессирование.
Существуют отдельные критерии эффективности при лечении метастазов в ко-
стях. Полный эффект — полное исчезновение всех поражений на рентгенограм-
мах или сканограммах; частичный эффект — частичное уменьшение остеолитиче-
ских метастазов, их рекальцификация или уменьшение плотности остеобластных
поражений; стабилизация — отсутствие изменений в течение 8 нед. от начала ле-
чения; прогрессирование — увеличение существующих или появление новых оча-
гов поражения.
1 Вместо критерия REGIST 2000, при котором измерялось до 5 очагов 1 органа и до 10 очагов в различных органах.
26 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Оценка лечебного действия противоопухолевых средств
Критерии эффективности при гемобластозах:
Полная ремиссия — нет признаков болезни, нормализация картины крови, кост-
ного мозга, исчезновение экстрамедуллярных очагов поражения. Продолжи-
тельность ремиссии — не менее 4 нед.
Частичная ремиссия — уменьшение всех признаков (бластоз костного мозга и
крови, уменьшение лимфоузлов, увеличенных органов) не менее чем на 50 %.
Продолжительность ремиссии — не менее 4 нед.
Полная цитогенетическая ремиссия — полное исчезновение (во всех клет-
ках при исследовании по методу FISH — флюоресцентной гибридизации in situ)
бывших до лечения цитогенетических аберраций.
Полная молекулярная ремиссия — отсутствие опухолевых клеток при опреде-
лении методом количественной полимеразной цепной реакции (ПЦР).
Оценка продолжительности эффекта
Время до прогрессирования (TTP — time to progression) — это период от начала тера-
пии до первых признаков прогрессирования заболевания. Этот показатель может при-
меняться как у больных с измеряемыми, так и неизмеряемыми очагами поражения, а
также при стабилизации и при использовании адъювантной (послеоперационной) те-
рапии. Иногда применяется критерий TTF (time to failure) — период от начала терапии
до первых признаков прогрессирования либо прекращения лечения в связи с токсич-
ностью или смертью больного. Особое значение эти показатели имеют при оценке
таргетных препаратов, в основном обладающих цитостатическим свойством.
Продолжительность полной и частичной регрессии (ремиссии) отсчитывают от
даты, когда она впервые зарегистрирована, до даты, когда отмечено прогрессирова-
ние болезни. Длительность стабилизации считается от первого дня лечения до даты
первых признаков прогрессирования болезни.
При оценке объективного эффекта учитывается также динамика биохимических
и других лабораторных показателей. Так, например, в оценке эффективности имеют
значение биохимические и иммунологические маркеры опухолей, такие как хорио-
нический гонадотропин (ХГ) при хориокарциноме, а-фетопротеин (АФП) при несеми-
номных герминогенных опухолях яичка и раке печени, патологический глобулин при
миеломной болезни и др. Объективная оценка противоопухолевого действия позво-
ляет своевременно изменить или прекратить химиотерапию при ее неэффективности.
Минимальной продолжительностью лечебного эффекта считается 4-недельный пе-
риод. Преходящее уменьшение опухоли не расценивается как эффект.
Наиболее значительным критерием эффективности служит выживаемость боль-
ных. Как правило, приводятся показатели медианы общей и безрецидивной выжива-
емости. При сравнении результатов лечения групп больных используется показатель
относительного риска (HR — Hazard Ratio).
Субъективный эффект оценивают по изменению статуса, уменьшению или исчез-
новению боли и изменению массы тела. Статус больного (Performance status) оцени-
вают до начала лечения, в процессе и после его окончания по 5-балльной системе
EGOG-WHO, представляющей собой модификацию шкалы Карновского.
Для характеристики болевого синдрома, аппетита и функции органов рекомендует-
ся следующая шкала: 0 — нет симптомов, 1 — умеренные симптомы, 2 — средней вы-
раженности, 3 — тяжелые, 4 — особенно тяжелые, угрожающие жизни.
Общая характеристика побочных эффектов и факторов риска при химиотерапии
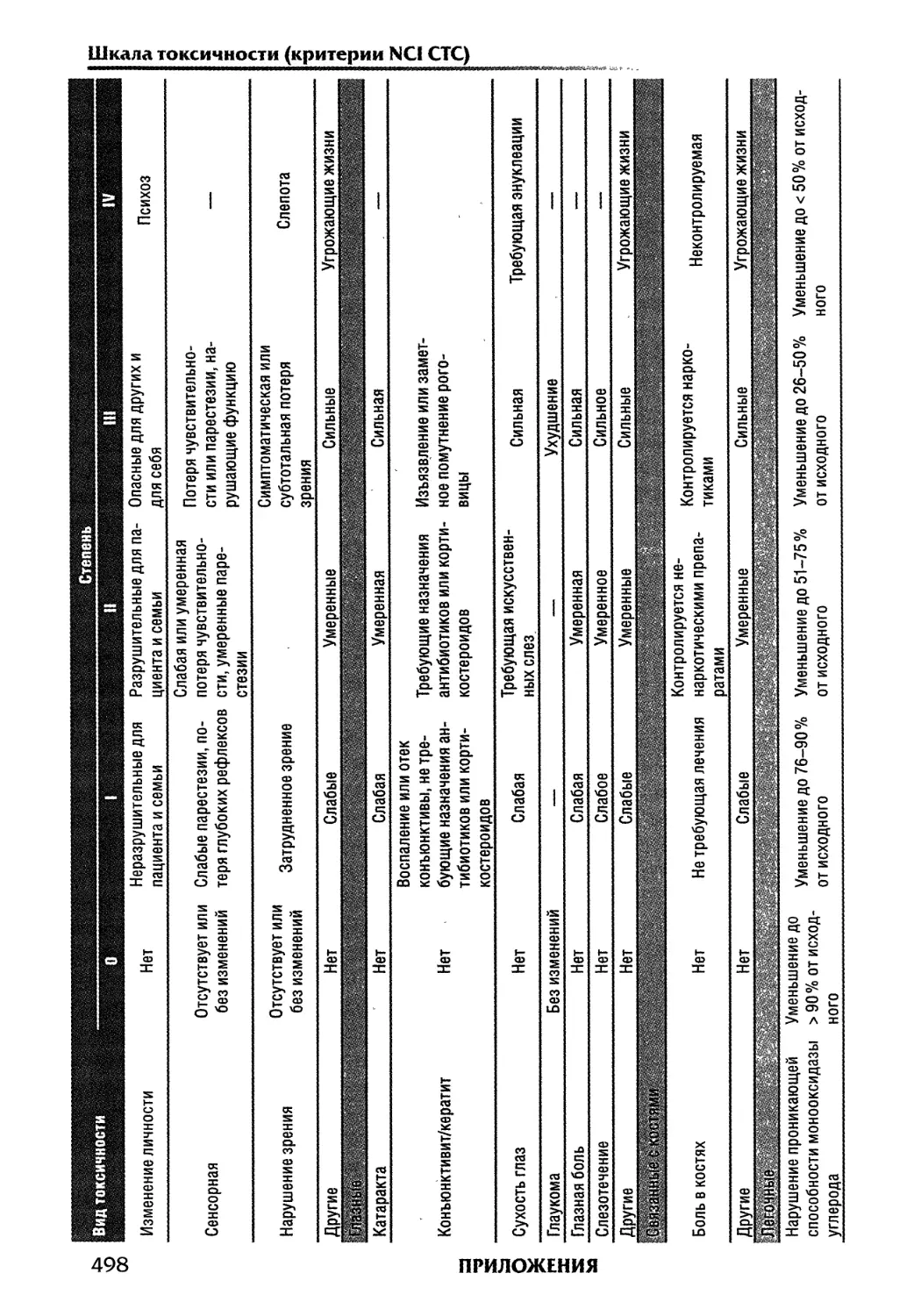
опухолей рассматривается в гл. 13. Таблица для определения степени токсичности по
шкале NCI СТС дана в приложении 10.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 27
Общие сведения о клинической химиотерапии
В последнее время особое значение придается качеству жизни больных (Quality of
Life — QL) в процессе химиотерапии. Для оценки качества жизни пользуются специ-
альными анкетами, которые больные заполняют повторно в процессе лечения. Чаще
всего используется анкета EORTC — EORTC QLQ-30, содержащая 30 основных вопро-
сов, которые характеризуют качество жизни.
Объективная оценка эффективности и переносимости лекарственных средств и но-
вых терапевтических режимов — обязательное условие для рекомендации их в кли-
ническую практику.
Как правило, рекомендации нового препарата или терапевтического режима пред-
лагаются на основе статистически достоверных результатов многоцентровых рандо-
мизированных (контролируемых) исследований и их метаанализа.
1.4. Адъювантная и неоадъювантная
химиотерапия
А.М. Гарин
Адъювантная терапия — вспомогательное, дополняющее хирургические и лучевые
методы медикаментозное лечение. Иногда такую терапию называют профилактиче-
ской. Цель адъювантной терапии — эрадикация или длительное подавление микро-
метастазов рака после удаления или лучевого излечения первичной опухоли. Неви-
димые метастазы служат причиной неудовлетворительных отдаленных результатов
хирургического или лучевого лечения первичного опухолевого очага. Для планирова-
ния адъювантной терапии нужно учитывать биологические и клинические особенно-
сти разных форм рака и возможности химиотерапевтической помощи больным в ста-
дии диссеминации. Например, базалиомы кожи не дают отдаленных метастазов и их
хирургическое или лучевое лечение не должно сопровождаться адъювантной тера-
пией. Рак шейки матки I стадии излечивается более чем в 90% случаев, поэтому адъю-
вантную терапию проводить нецелесообразно.
При раке молочной железы, яичников, остеогенных саркомах, мелкоклеточном и
немелкоклеточном раке легкого, опухолях мозга, раке толстой кишки, желудка, под-
желудочной железы, саркоме Юинга, нефробластоме, поверхностном раке мочево-
го пузыря, рабдомиосаркоме и нейробластоме (III стадия) у детей, медуллобластомах
адъювантная терапия улучшает отдаленные результаты лечения.
При высоком риске рецидива адъювантную терапию можно назначать факультатив-
но больным с другими опухолями (рак тела матки, меланома).
С помощью адъювантной терапии надеются увеличить выживаемость больных и
продлить безрецидивный период. При этом важно, чтобы в случае возврата болезни
после адъювантной терапии опухоли оставались чувствительными к лекарственным
средствам. Иначе безрецидивный период увеличится, а пострецидивный период со-
кратится из-за возникновения резистентности к терапии, что в итоге уменьшит сроки
выживаемости.
Критерии эффективности адъювантной терапии — медиана продолжительности жиз-
ни, процент выживших в течение 3 и 5 лет, частота рецидивов болезни и продолжитель-
ность безрецидивного периода (продолжительность времени до прогрессирования).
В современной онкологии обычно используют многомесячную адъювантную тера-
пию. Микрометастазы состоят из гетерогенной популяции опухолевых клеток, многие
из них долго не пролиферируют. Эти клетки слабо или совсем не повреждаются хими-
28 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Адъювантная и неоадъювантная химиотерапия
©препаратами. Если адъювантная терапия ограничивается одним или двумя курсами, то
можно воздействовать лишь на часть клеток, а остальные (неповрежденные) приведут
к рецидиву заболевания. Малая избирательность действия современных химиотера-
певтических препаратов обусловливает повреждение и нормальных клеток кишечно-
го эпителия, кроветворения и др., поэтому следует обязательно соблюдать адекватный
интервал между введениями лекарств. Обычно интервал 3-4 нед. обеспечивает пол-
ную регенерацию поврежденных нормальных тканей. Непрерывно применяются толь-
ко гормоны и антигормоны, а также некоторые таргетные препараты (трастузумаб).
В тех случаях, когда польза адъювантной терапии доказана статистически (например,
при раке молочной железы), установлена прямая зависимость эффекта от величины доз.
Чем меньше доза (например, в случае снижения доз с целью улучшить переносимость),
тем менее эффективна адъювантная терапия в предотвращении рецидива заболевания.
При планировании адъювантной терапии в первую очередь используют препараты,
высокоэффективные при лечении диссеминированных опухолей. Препараты, не вли-
яющие на рост данной опухоли, для адъювантной терапии применяются лишь в неко-
торых случаях, если, например, доказано их синергическое влияние на эффект других
противоопухолевых средств.
Для адъювантной терапии чаще назначают комбинации химиопрепаратов, хотя мо-
нотерапия имеет право на существование, например, послеоперационное лечение та-
моксифеном больных раком молочной железы или применение карбоплатина после
орхиэктомии при семиноме яичка.
Послеоперационную адъювантную терапию в зависимости от объема операции, со-
стояния больного назначают обычно через 2-4 нед. после операции.
Для адъювантной терапии в некоторых случаях используют иммуномодуляторы,
например интерфероны и таргетные препараты (трастузумаб при НЕК2-позитивном
раке молочной железы).
Важно, чтобы длительная адъювантная терапия не привела к развитию вторичных
опухолей. Так, известно, что длительное применение тамоксифена, улучшая отдален-
ные результаты лечения, может стимулировать пролиферативные процессы в эндоме-
трии или печени.
Учет влияния адъювантной терапии на нормальные системы организма — ответст-
венная задача. Особенно актуальны эти проблемы в детской онкологической практи-
ке. Адъювантная терапия может сказаться на общем развитии ребенка, его росте, со-
стоянии зубов, слухе, половом созревании, умственном развитии и др. Известно, что у
детей, получающих адъювантную терапию, чаще возникают и тяжелее протекают ин-
фекционные болезни (корь, краснуха, ветрянка и др.).
Химиотерапия, назначенная без достаточных показаний в токсическом режиме, мо-
жет способствовать иммунодепрессии и тем самым приблизить рецидив болезни.
В 1980-е годы появилось представление о неоадъювантной терапии. Химиотера-
пию назначают не после операции или облучения, а до них. При этом преследуют цель
уменьшить массу опухоли, снизить стадию заболевания, облегчить выполнение хирур-
гических вмешательств (уменьшить их объем) или облучения. При последующем па-
тологоанатомическом исследовании удаленной опухоли можно оценить степень по-
вреждения химиопрепаратами. При полном или частичном повреждении опухоли эти
же лекарственные средства используют и во время адъювантной химиотерапии, при
низкой чувствительности опухоли к препаратам план терапии изменяют и назначают
другие противоопухолевые лекарства.
Вопросы, связанные с адъювантной и неоадъювантной химиотерапией при отдель-
ных злокачественных новообразованиях, рассматриваются в соответствующих раз-
делах.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ.,. 29
Глава 2
Клинико-фармакологическая
характеристика противоопухолевых
средств
Н. И. Переводчикова
Противоопухолевые средства, способные уничтожать опухолевые клетки (цитотокси-
ческий эффект) или угнетать их пролиферативную активность (цитостатический эф-
фект), можно разделить по происхождению на синтетические и природные.
К синтетическим относятся алкилирующие агенты и антиметаболиты, различающие-
ся между собой по механизму действия. К продуктам природного происхождения при-
числяют антибиотики, вещества растительного происхождения, ферменты и гормоны.
Следует отметить, что такая классификация условна. Так, например, некоторые пре-
параты, отнесенные к гормонам, на самом деле являются их синтетическими анало-
гами либо синтетическими препаратами, блокирующими рецепторы гормонов или
нарушающими их метаболизм; механизм действия отдельных антибиотиков сходен с
таковым алкилирующих агентов и др.
Выделенная в конце XX — начале XXI в. группа молекулярно-нацеленных (таргет-
ных) препаратов отличается от классических цитотоксических препаратов тем, что
мишенью их служат белки, участвующие в канцерогенезе и определяющие способ-
ность опухоли к прогрессии и метастазированию. Препараты этой группы характери-
зуются в основном цитостатическим действием, и те из них, которые на сегодняшний
день используются в клинике, являются либо моноклональными антителами и их конъ-
югатами, либо синтетическими малыми молекулами — ингибиторами протеинкиназ.
Противоопухолевым свойством обладают также некоторые препараты группы им-
муномодуляторов и модификаторов биологических реакций, которым в связи с их
особенностями посвящен специальный раздел. В табл. 2.1 представлены данные об
основных группах современных противоопухолевых препаратов в зависимости от их
механизма действия.
30 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Клинико-фармакологическая характеристика противоопухолевых средств
Таблица 2.1. Основные противоопухолевые препараты
I. Алкилирующие агенты (образующие ковалентные связи с ДНК)
Хлорэтиламины Мехлорэтамин (Эмбихин, Мустарген), хлорамбуцил (Лейкеран), мел- фалан (Алкеран), сарколизин, допан, циклофосфамид (циклофос- фан), цифелин, ифосфамид (Холоксан), хлоксиперазин (Проспидин)
Азиридины (этиленимины) Тиотепа (Тиофосфамид), альтретамин (Гексаметилмеламин, Гекса- лен)
Эфиры дисульфоновых кислот Бусульфан (Миелосан, Милеран)
Производные нитрозомочевины Кармустин (BCNU), ломустин (CCNU), нимустин (ACNU), Араноза, фо- темустин (Мюстофоран), стрептозоцин (Занозар), лизомустин
Комплексные соединения платины Цисплатин, карбоплатин, циклоплатам, оксалиплатин (Элоксатин)
Триазины Дакарбазин (ДТИК), прокарбазин (Натулан), темозоломид (Темодал)
11. Антиметаболиты 1
Антагонисты фолиевой кислоты (антифолаты) Метотрексат, триметрексат, пеметрексед (Алимта)
Ингибиторы тимидилатсинтазы Ралтитрексед (Томудекс)
Антагонисты пиримидина Фторпиримидины Аналоги цитидина Фторурацил, тегафур (Фторафур), тегафур/урацил (УФТ), капецита- бин (Кселода) Цитарабин (Цитозар), гемцитабин (Гемзар)
Антагонисты пуринов 6-меркаптопурин, тиогуанин, пентостатин, кладрибин, флударабин
Ингибиторы рибонуклеозидре- дуктазы Гидроксимочевина (Гидроксикарбомид)
III. Противоопухолевые антибиотики и близкие к ним препараты
Актиномицины Дактиномицин (Актиномицин Д)
Антрациклины Даунорубицин (Рубомицин), даунорубицин липосомный, доксору- бицин (Адриамицин), эпирубицин (Фарморубицин), карминомицин, акларубицин, идарубицин (Заведос), валрубицин (Вальстар), пегили- рованный липосомный доксорубицин (Келикс)
Антрацендионы Митоксантрон (Новантрон)
Флеомицины Блеомицин, блеомицитин, пепломицин
Производные ауреловой кислоты Оливомицин, пликамицин (Митрамицин)
Прочие антибиотики Брунеомицин, митомицин
IV. Препараты растительного и природного происхождения
Ингибиторы митоза Винкаалкалоиды (торможение образования митотического ве- ретена) Таксаны (стабилизаторы поли- меризации микротрубочек) Эпотилоны Винбластин (Розевин), винкристин (Онковин), виндезин (Элдезин), винорелбин (Навельбин) Паклитаксел (Таксол), NAB-паклитаксел (Абраксан), доцетаксел (Так- сотер) Иксабепилон (Иксемпра)
Ингибиторы топоизомераз ДНК Ингибиторы топоизомеразы 1 Ингибиторы топоизомеразы II Топотекан (Гикамтин), иринотекан (Кампто) Этопозид (Вепезид), тенипозид (Вумон)
Алкалоид, влияющий на транскрипцию ДНК Трабектедин (Йонделис)
IV. Ферментные препараты
Аспарагиназа (L-аспарагиназа)
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
31
Клинико-фармакологическая характеристика противоопухолевых средств
VI. Гормоны и антигормоны
Андрогены Тестостерона пропионат, медротестостерона пропионат, пролоте- стон, тетрастерон, метилтестостерон
Эстрогены и их производные Этинилэстрадиол, хлортрианизен, синестрол, полиэстрадиола фос- фат (Эстрадурин)
Прогестины Медроксипрогестерона ацетат (Провера), мегестрол (Мегейс), гесто- норона капроат (Депостат)
Кортикостероиды Дексаметазон, преднизолон, метилпреднизолон
Антиэстрогены Селективные модуляторы эстрогенных рецепторов (SERM) Селективные супрессоры эстро- генных рецепторов (SERD) Тамоксифен, торемифен (Фарестон), ралоксифен Фульвестрант (Фазлодекс)
Антиандрогены Бикалутамид (Касодекс), нилутамид (Ниландрон, Анандрон), флута- мид (Флуцином), ципротерон (Андрокур)
Суперагонисты рилизинг-гормона гонадотропных гормонов гипофи- за (GnH-RH) Гозерелин (Золадекс), лейпрорелин (Простап, Энантон), трипторелин (Декапептил), бусерелин (Супрефект)
Ингибиторы ароматазы Нестероидные Стероидные Летрозол (Фемара), анастрозол (Аримидекс), аминоглутетимид (Ори- метен, Мамомит) Экземестан (Аромазин)
Аналоги соматостатина Октреотид (Сандостатин, Октреотид ЛАР, Сандостатин ЛАР)
Супрессоры коры надпочечников Митотан (Хлодитан, Лизодрен, орто-пара-ДДД)
Гормоны щитовидной железы Лиотиронин,левотироксин
Гормоноцитостатики Эстрамустин (Эстрацит), преднимустин (Стерицит)
VII. Молекулярно-нацеленные {таргетные) препараты
Моноклональные антитела к: EGFR VEGF CD20 CD52 Трастузумаб (Герцептин), цетуксимаб (Эрбитукс), панитумумаб (Век- тибикс) Бевацизумаб (Авастин) Ритуксимаб (Мабтера) Алемтузумаб (Кэмпас)
Ингибиторы протеинкиназ Иматиниб (Гливек), гефитиниб (Пресса), эрлотиниб (Тарцева), лапа- тиниб (тайверб, тайкерб), дазатиниб (Спрайсел), нилотиниб (Тасиг- на), сунитиниб (Сутент), сорафениб (Нексавар), темсиролимус (Тори- сел), эверолимус (Афинитор)
Ингибиторы протеасом Бортезомиб (Велкейд)
Ингибиторы рецепторов ретино- идов Третиноин (ATRA, Весаноид)
VIII. Модификаторы биологических реакций
Цитокины Интерфероны (ИФН) Интерлейкины (ИЛ) ИФН-а (Интрон А, Роферон А, Реаферон), ИФН-у Алдеслейкин (ИЛ-2, Пролейкин)
Колониестимулирующие факто- ры (КСФ)* Г-КСФ: филграстим (Нейпоген), ленограстим (Граноцит), ПЭГ-фил- грастим (Неуластин) ГМ-КСФ: молграмостим (Лейкомакс); сарграмостим (Lukine), эритро- поэтины (Эпрекс, Рекормон), дарбэпоэтин (Аранесп) Мегакариоцитарный КСФ: опрелвекин (ИЛ-11, Ньюмега)
32
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Клинико-фармакологическая характеристика противоопухолевых средств
Таргетные иммуномодуляторы Талидомид, Леналидомид (Ревлимид) Иммуноконъюганты: денилейкин-дифитокс (Онтак)
Неспецифические иммуномоду- ляторы БЦЖ, иммунофан, полиоксидоний, ликопид, галавит
IX. Бисфосфонаты
Золедроновая кислота (Зомета), памидроновая кислота (Аредиа), ибандроновая кислота (Бондронат),
клодроновая кислота (Клодронат, Бонефос)
EGFR — рецептор эпидермального фактора роста, VEGF — фактор роста эндотелия сосудов
* КСФ, относящиеся к цитокинам, не являются собственно противоопухолевыми препаратами
Соединения алкилирующего действия — обширная группа противоопухоле-
вых препаратов, имеющих в молекуле хлорэтиламинные, эпоксидные, этилениминные
группы или остатки метансульфоновой кислоты. К алкилирующим препаратам относят
также производные нитрозомочевины и комплексные соединения платины.
Биологическое действие препаратов этой группы определяется тем, что они присо-
единяются ко многим веществам путем алкилирования, т.е. замещения атома водоро-
да какого-либо соединения на алкильную группу. Алкилированию подвергаются мно-
гие органические соединения, включая макромолекулы, но определяющим считается
взаимодействие с ДНК.
В результате нарушения репликации ДНК возникают мутации и гибель клетки. Соот-
ветственно, алкилаторы обладают не только противоопухолевым, но и мутагенным и
тератогенным свойствами. В связи с тем, что они взаимодействуют со сформирован-
ными ДНК, РНК и белками, алкилирующие агенты не характеризуются фазоспецифич-
ностью и действие некоторых из них, в частности нитрозопроизводных, не зависит от
клеточного цикла.
При использовании в качестве носителя алкилирующих групп различных соедине-
ний удается изменить их свойства, что служит основой поиска новых, более совер-
шенных препаратов этой группы.
Большинство алкилирующих агентов хорошо всасывается в ЖКТ, однако в связи с
сильным местно-раздражающим действием многие из них вводят в/в.
Через гематоэнцефалический барьер (ГЭБ) из алкилирующих агентов проникают
производные нитрозомочевины, прокарбазин, темозоломид. Как правило, за сутки
препараты метаболизируются и выводятся из организма.
В основном, алкилирующие препараты оказывают сходные побочные действия на
ЖКТ (тошнота и рвота в первые часы после введения), на кроветворение (лейкопения
и тромбоцитопения), реже проявляется нейротоксичность, наиболее выраженная у
производных платины. Препараты этой группы оказывают более или менее выражен-
ное иммунодепрессивное действие.
Хлорэтиламины и этиленимины первые вошли в арсенал онкологов-химиотера-
певтов, и многие из препаратов этой группы не потеряли своего значения и в наши дни.
Циклофосфамид, ифосфамид, тиотепа относятся к числу препаратов, активно исполь-
зуемых при лечении онкологических больных.
Хлорэтиламины и этиленимины активны при гемобластозах, некоторые из них при-
меняются при раке молочной железы (РМЖ), раке яичников, злокачественных опухо-
лях яичка, мелкоклеточном раке легкого (МРЛ) и других солидных опухолях.
Производные нитрозомочевины отличаются от других алкилирующих аген-
тов отсутствием перекрестной устойчивости по отношению к другим препаратам этой
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 33
Клинико-фармакологическая характеристика противоопухолевых средств
группы, липофильностью и отсроченным миелосупрессивным действием (5-6 нед.).
Производные нитрозомочевины используются при опухолях ЦНС, а также в комбини-
рованной химиотерапии ряда солидных опухолей и гемобластозов.
Комплексные соединения платины нарушают синтез ДНК путем внутри- и меж-
нитевых сшивок ДНК, а также связывания с клеточными мембранами. Препараты этой
группы, обладая широким спектром противоопухолевого действия, активны при раке
яичников, злокачественных опухолях яичка, используются в комбинированной хи-
миотерапии рака легкого и ряда других солидных опухолей. Особый интерес в по-
следнее время вызывает оксалиплатин в связи с его активностью при колоректальном
раке (КРР). Из побочных реакций для препаратов этой группы характерны тошнота и
рвота, угнетение миелопоэза, нефро- и нейротоксичность. Карбоплатин характери-
зуется меньшей по сравнению с цисплатином почечной токсичностью и большим уг-
нетающим действием на кроветворение; оксалиплатин практически не обладает не-
фротоксическим свойством и умеренно угнетает кроветворение, однако возможны
проявления нейротоксичности и признаков ладонно-подошвенного синдрома (ЛПС).
Противоопухолевая активность антиметаболитов основана на структурном или
функциональном подобии их метаболитам, участвующим в синтезе нуклеиновых ки-
слот. В результате нераспознавания и включения в обмен опухолевой клетки антиме-
таболиты либо нарушают функцию ферментов, участвующих в синтезе нуклеиновых
кислот, либо включаются в нуклеиновые кислоты, нарушая их код, что ведет к гибели
клеток. В связи с тем, что точкой приложения антиметаболитов является синтез ДНК,
они наиболее активны в быстрорастущих клетках и большей частью являются фазо-
специфическими препаратами.
Антагонисты фолиевой кислоты, и в частности наиболее популярный препа-
рат этой группы метотрексат, ингибируют дигидрофолатредуктазу. В активно проли-
ферирующих клетках ингибирование дигидрофолатредуктазы приводит к снижению
уровня восстановленных фолатов и, как следствие снижению биосинтеза метаболи-
тов, сопряженных с циклом фолатов: тимидилата, пуринов de novo, аминокислот (се-
рина, метионина) и многих других. Таким образом, торможение дигидрофолатредук-
тазы приводит к нарушению метаболизма жизненно важных субстратов в клетке. При
высоких концентрациях метотрексата в крови, что имеет место при лечении высокими
дозами препарата, возможно также торможение активности фермента тимидилатси-
назы. Ингибирование синтеза тимидилата и пуринов приводит к нарушению структу-
ры и прекращению синтеза ДНК, следствием чего является включение механизма са-
моликвидации клетки (апоптоза).
Метотрексат в небольших дозах легко всасывается вЖКТ, однако всасывание боль-
ших доз происходит медленно и не полностью. Он практически не проникает через
ГЭБ, поэтому при показаниях (нейролейкоз) его вводят интралюмбально. Побочное
действие метотрексата выражается в поражении слизистых оболочек ЖКТ и наруше-
нии функции почек. Наблюдается также алопеция, угнетение функции костного мозга
(лейкопения, тромбоцитопения) и иногда печени.
Использование сверхвысоких доз метотрексата возможно под прикрытием его ан-
тидотом — фолинатом кальция (лейковорин), который, превращаясь в тетрагидрофо-
лиевую кислоту, защищает нормальные ткани организма. Метотрексат используется
при опухолях головы и шеи, остеогенных саркомах, раке молочной железы.
Пеметрексед (Алимта) — антифолат, ингибирующий в основном тимидилатсинта-
зу, а также дигидрофолатредуктазу и глицинамидрибонуклеотидформилтрансфера-
зу — ферменты, необходимые для синтеза тимидина и гипоксантина. Этот многоцеле-
34 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Клинико-фармакологическая характеристика противоопухолевых средств
вой антиметаболит активен при мезотелиоме, раке головы и шеи, немелкоклеточном
раке легкого (НМРЛ).
Характерная особенность других антиметаболитов, аналогов пуринов и пиримиди-
нов, состоит в том, что они под действием ферментов должны пройти «летальный син-
тез» и превратиться в биологически активные нуклеотиды, ингибиторы ферментов.
Антагонисты пиримидина ингибируют ферменты, необходимые для синтеза ну-
клеиновых кислот, и могут включаться в ДНК и РНК. К препаратам этой группы отно-
сятся фторпиримидины: 5-фторурацил, тегафур (Фторафур), УФТ, FUDR, капецитабин
(Кселода).
Аналог пиримидина фторурацил после введения в организм подвергается разру-
шению в печени и частично (20%) выводится через почки. После в/в введения кон-
центрация фторурацила в плазме уменьшается через 10-20 мин в 2 раза, и через
3 ч препарат практически не определяется. В отличие от этого тегафур постепенно
высвобождает фторурацил, и в этом случае концентрация последнего снижается в
2 раза через 5 ч, но и через 24 ч препарат продолжает определяться. Тегафур под-
вергается деградации в печени и выводится в неизмененном виде почками (> 25%).
Он лучше, чем фторурацил, растворим в липидах, поэтому проникает через ГЭБ и че-
рез 1 ч после введения накапливается в одинаковой концентрации в мозге, селезен-
ке, тонкой кишке, почках и печени. Тегафур всасывается в ЖКТ, поэтому его можно
назначать внутрь. Практическое применение получил УФТ — комплексный препарат,
содержащий тегафур и урацил в молярном соотношении 1:4. Фторурацил применя-
ют при опухолях ЖКТ, РМЖ и в составе лекарственных комбинаций при ряде других
солидных опухолей.
Основные побочные эффекты фторурацила и тегафура состоят в действии на слизи-
стые оболочки ЖКТ и кроветворение; оба препарата в некоторых случаях проявляют
нейротоксическое действие.
Биохимическая модуляция фторурацила с помощью лейковорина повышает проти-
воопухолевую активность фторурацила, а их комбинация стала стандартом при лече-
нии опухолей ЖКТ.
Капецитабин (Кселода) при приеме внутрь обладает способностью превращаться в
5-фторурацил в опухолевой клетке, оказывая таким образом нацеленное действие на
опухоль. Этот препарат активен при РМЖ и раке ЖКТ.
Среди аналогов дезоксицитидина практическое применение в онкогематологии по-
лучил цитозин-арабинозид (Цитарабин, Цитозар).
Новый препарат этой группы гемцитабин (Гемзар) представляет собой 2,2-дифтор-
дезоксицитидин. В процессе метаболизма он подвергается трехэтапному фосфори-
лированию. Основной его метаболит гемцитабина трифосфат включается в концевые
участки ДНК, нарушая репликацию и восстановление, подавляя активность ДНК по-
лимераз. Другие метаболиты гемцитабина на разных этапах также вызывают цитоток-
сический эффект (так называемый феномен самопотенцирования). Гемцитабин при-
влекает внимание клиницистов благодаря противоопухолевой активности при ряде
солидных опухолей (рак легких, поджелудочной железы, мочевого пузыря, молочной
железы, рак яичников).
Ингибитор тимидилатсинтазы ралтитрексед (Томудекс) является хиназолино-
вым производным, аналогом тетрагидрофолатного кофактора. Кроме того, тормо-
жение тимидилатсинтазы осуществляется продуктами метаболизма ралтитрекседа
после полиглутамации. Ни ралтитрексед, ни его метаболиты не инкорпорируются в
нуклеиновые кислоты. Препарат активен при КРР, а также при РМЖ.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 35
Клинико-фармакологическая характеристика противоопухолевых средств
Антагонисты пуринов нарушают синтез ДНК и РНК за счет изменения обмена пу-
рина. Меркаптопурин и тиогуанин являются аналогами пуринов и отличаются от есте-
ственных (гипоксантин и гуанин) тем, что атом кислорода заменен на серу. Метабо-
лизируются в организме до 6-тиомочевой кислоты и неорганического сульфата. Эти
препараты используются при лечении лейкозов и неходжкинских лимфом (НХЛ), их
основное побочное действие — угнетение костномозгового кроветворения и пора-
жение слизистой оболочки ЖКТ и ротовой полости.
Новые препараты этой группы — пентостатин, кладрибин, флударабин — также
обладают противоопухолевой активностью при гемобластозах.
Среди противоопухолевых препаратов природного происхождения выделяют про-
тивоопухолевые антибиотики, вещества растительного происхождения, ферменты.
Противоопухолевые антибиотики — продукты жизнедеятельности грибов, по-
давляют синтез нуклеиновых кислот, действуя науровне ДНК-матрицы. Дактиномицин
(из актиномицетов Str. paruullus и др.), оливомицин (из лучистого гриба Actinomyces
oliuoreticuli), карминомицин (антрациклиновый антибиотик излучистого гриба Actino-
madura carminata), эпирубицин (Фарморубицин, из гриба Actinomyces coeruleorubidus)
и доксорубицин (антрациклиновый антибиотик из гриба Streptomyces peucetius oar.
caesius) образуют с ДНК комплексы, препятствующие продвижению ферментов вдоль
ДНК-матрицы. Брунеомицин (Actinomyces albus var. bruneomycini) и блеомицин (Str.
oerticillus) вызывают одиночные разрывы ДНК, митомицин по механизму действия бли-
зок к алкилаторам, обусловливая связывание и повреждение ДНК.
Из актиномицинов практическое применение находит актиномицин D (Дактиноми-
цин).
Дактиномицин через несколько минут после в/в введения исчезает из кровотока, в
неизмененном виде выводится из организма с желчью (50%) и мочой (10%). Препа-
рат накапливается в печени, почках, селезенке и слюнных железах, в незначительных
количествах проникает в семенники и головной мозг. Дактиномицин применяют при
хориокарциноме, опухоли Вильмса и в комбинации с другими препаратами при ряде
других опухолей. Среди побочных действий на первый план выступают нарушения
ЖКТ, повреждение слизистой оболочки ротовой полости, угнетение кроветворения.
Наибольшее применение в клинике получили антрациклиновые антибиотики.
Механизм их действия сводится к интеркаляции и ковалентному связыванию ДНК, тор-
можению топоизомеразы II, формированию свободных радикалов. Антрациклино-
вые антибиотики быстро исчезают из крови, но выделяются сравнительно медленно
с мочой (20%) и калом (10%) в течение 2 дней. Препараты этой группы — доксоруби-
цин (Адриабластин), эпирубицин (Фарморубицин) — используют при гемобластозах и
солидных опухолях. Наибольшее практическое применение в связи с широким спек-
тром противоопухолевого действия получил доксорубицин, активный при РМЖ, МРЛ,
остеогенных саркомах, саркомах мягких тканей и гемобластозах. Кроме типичных для
цитотоксиков побочных явлений (тошнота, рвота, угнетение костномозгового кровет-
ворения, алопеция) антрациклиновые антибиотики кардиотоксичны. Эпирубицин ме-
нее кардиотоксичен, чем доксорубицин.
Пегилированный липосомный доксорубицин (Келикс) обладает минимальной кар-
диотоксичностью.
К группе антрациклиновых антибиотиков относится также идарубицин (Заведос) и
акларубицин, активные при острых лейкозах.
Близки к антрациклинам синтетические препараты группы антрацендионов и
антрапиразолов. Практическое применение получил митоксантрон, эффективность
которого при РМЖ близка к таковой доксорубицина при меньшей токсичности.
36 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Клинико-фармакологическая характеристика противоопухолевых средств
К антибиотикам группы флеомицинов относятся блеомицин и пепломицин. Блеоми-
цин в тканях подвергается ферментативной инактивации, причем активность инакти-
вирующего фермента в коже и легких ниже, чем в других органах. Блеомицин акти-
вен при плоскоклеточном раке (ПКР) различных локализаций и лимфоме Ходжкина;
он используется в комбинированной химиотерапии опухолей яичка и гемобластозов,
особенно в связи с тем, что не оказывает побочного действия на кроветворение. От-
мечаются такие побочные эффекты, как гипертермия, дерматиты, стоматит, алопеция.
Наиболее серьезным осложнением является пульмонит, часто без повышения темпе-
ратуры тела, завершающийся фиброзом.
Среди противоопухолевых препаратов растительного происхождения на-
ибольший практический интерес представляют винкаалкалоиды (винбластин, вин-
кристин, виндезин и винорелбин), содержащиеся в растениях барвинок розовый
(Vinca rosea), катарантус розовый (Catharantus roseus), таксаны (паклитаксел, полу-
ченный из тихоокеанского тиса Taxus brevifolia, и доцетаксел, синтезированный с ис-
пользованием алкалоида баккатина, полученного из европейского тиса Taxus baccata),
камптотецины (иринотекан и топотекан), впервые полученные из растения Сатр-
totheca acuminatau, подофиллотоксины (этопозид и тенипозид) — синтетические про-
изводные подофиллотоксинов, выделяемых из Podophyllum peltatum.
По механизму действия они подразделяются на препараты, точкой приложения ко-
торых являются микротрубочки митотического аппарата клетки (винкаалкалоиды и
таксаны), и ингибиторы топоизомераз ДНК: ингибиторы топоизомеразы I (камптоте-
цины) и ингибиторы топоизомеразы II (подофиллотоксины).
Винкаалкалоиды имеют минимальные отличия в химической структуре, сходный
механизм действия, но отличаются спектром противоопухолевого действия и побоч-
ными эффектами. Механизм действия этих препаратов сводится к денатурации тубу-
лина — белка, который входит в состав микротрубочек митотического веретена и ряда
поверхностных антигенов лимфоцитов. Взаимодействие винкаалкалоидов с тубули-
ном вызывает деполяризацию последнего, приводит к остановке митоза и нарушению
клеточно-специфических функций лимфоцитов.
Винбластин применяют при лимфогранулематозе, лимфосаркомах, опухолях яичка,
хориокарциноме матки, нейробластоме. Винкристин широко используют в комбини-
рованной химиотерапии гемобластозов, РМЖ, рака легкого и других злокачественных
опухолей. Эти алкалоиды дают разный побочный эффект: угнетение кроветворения
лимитирует применение винбластина, нейротоксичность (парестезии, невралгиче-
ские боли, атаксия, арефлексия, парез кишечника) — винкристина. Квинкаалкалоидам
относят также виндезин и винорелбин (Навельбин). Эти препараты обладают проти-
воопухолевой активностью при некоторых солидных опухолях: виндезин — при раке
легкого, винорелбин — при РМЖ и раке легкого.
Таксаны, так же как и винкаалкалоиды, являются антимитогенами, однако механизм
их действия на микротрубочковый аппарат клетки отличен. Таксаны стимулируют по-
лимеризацию клеточного белка тубулина и препятствуют его деполимеризации, сдви-
гая равновесие в сторону образования избытка дефектных микротрубочек, что при-
водит к нарушению процесса формирования клеточного веретена и задержке клеток
в G2- и М-фазах митоза. Блокируется процесс деления клетки, и повреждается ее ци-
тоскелет, что приводит к нарушению подвижности, внутриклеточного транспорта и
передачи трансмембранных сигналов.
Несмотря на сходное строение и принципиально общий механизм действия, па-
клитаксел (Таксол) и доцетаксел (Таксотер) отличаются по действию на молекулярном
уровне и по ряду клинических показателей, в частности по токсичности (паклитаксел
обладает большей нейротоксичностью, доцетаксел — большей миелотоксичностью).
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ.,. 37
Клинико-фармакологическая характеристика противоопухолевых средств
Оба препарата оказывают выраженный противоопухолевый эффект при РМЖ, раке
яичников, НМРЛ и эпителиальных опухолях головы и шеи, и в настоящее время ши-
роко применяются в комбинированной химиотерапии солидных опухолей. Новый
препарат — альбумин-связанный паклитаксел (Абраксан) — представляет собой па-
клитаксел, связанный с наночастицами альбумина (наб-паклитаксел — nanoparticle al-
bumin-bound paclitaxel). Отсутствие кремофора позволяет использовать Абраксан без
премедикации. Обладает противоопухолевой активностью при РМЖ.
Эпотилоны — новый класс противоопухолевых препаратов, нарушающих митоз за
счет стабилизации динамики микротрубочек, что ведет к апоптотической гибели кле-
ток. Особенность эпотилонов заключается в их способности преодолевать множест-
венную лекарственную устойчивость. Иксабепилон (Иксемпра) — полусинтетический
аналог эпотилона В — обладает противоопухолевой активностью при РМЖ, резистен-
тном к антрациклинам и таксанам, и в настоящее время изучается как в монорежиме,
так и в составе комбинаций при этом заболевании.
Открытые в 70-е годы прошлого века ферменты топоизомеразы I и II, контролирую-
щие репликацию и транскрипцию ДНК, стали новой мишенью противоопухолевой ле-
карственной терапии.
Ингибиторами топоизомеразы I являются дериваты камптотецина — иринотекан
(Кампто) и топотекан (Hycamthin, Evotopin). Первый из этих препаратов привлек внима-
ние противоопухолевой активностью при КРР и МРЛ, второй — активностью при рези-
стентном к производным платины раке яичников. Клиническое изучение этих препа-
ратов продолжается.
Ингибиторами топоизомеразы 11 являются производные подофиллотоксинов —
тенипозид и этопозид. Для них характерно блокирование клеток в фазе G2, т. е. тормо-
жение их вступления в митоз. Этопозид хорошо всасывается при приеме внутрь, оба
препарата выделяются преимущественно с мочой. Тенипозид проникает через ГЭБ и
используется при опухолях мозга, а также при гематосаркомах. Этопозид применяет-
ся при раке легкого, НХЛ, остром миелолейкозе, опухолях яичника. Основные побоч-
ные эффекты: гематотоксичность, гастроинтестинальная токсичность, алопеция, пери-
ферическая нейропатия.
Принципиально новым является препарат природного происхождения трабектедин
(Йонделис), обладающий противоопухолевой активностью при саркомах мягких тка-
ней и раке яичников. Он подавляет транскрипцию генов и взаимодействует с системой
репарации нуклеотидов, связанной с транскрипцией.
Поиск ферментов, воздействующих на опухолевую клетку, привел к созданию пре-
парата аспарагиназы (L-аспарагиназа), используемой при лейкозах. Клетки отдельных
опухолей не синтезируют аспарагин, а используют аспарагин, имеющийся в крови и
лимфе. При введении аспарагиназы происходит временное разрушение аспарагина
и клетки, нуждающиеся в нем, погибают. Однако и некоторые нормальные клетки не
могут синтезировать аспарагин (например, лимфоциты).
Концентрация аспарагина в крови после в/в введения аспарагиназы снижается в
среднем через 18 ч. При ежедневном применении поддерживается постоянный уро-
вень аспарагиназы в крови, причем после окончания инъекций измеримая активность
фермента определяется в течение 10 дней. При приеме внутрь аспарагиназа теряет
активность.
Гормоны и антагонисты гормонов (антигормоны), обладающие противо-
опухолевой активностью и используемые в онкологической клинике, включают сте-
роидные гормоны (эстрогены, прогестины, андрогены), кортикостероиды и их синте-
тические производные нестероидные синтетические соединения со стероидным и
38 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Клинико-фармакологическая характеристика противоопухолевых средств
стероид-антагонистическим действием, аналоги LH-RH, а также тиреоидные гормоны
и аналоги соматостатина. Механизм действия препаратов этой группы сложен и свя-
зан как с их способностью изменять гормональные соотношения в организме, так и с
возможностью непосредственно влиять на опухолевые клетки. Наличие специфиче-
ских рецепторов гормонов в опухолевых клетках лежит в основе их чувствительности
к препаратам этой группы. Действие антагонистов гормонов определяется их конку-
ренцией с соответствующим гормонами на уровне клеточных рецепторов.
Задача гормональной терапии гормонозависимых опухолей — подавить продукцию
гипофизарных тканевых гормонов — стимуляторов роста опухолевых клеток и блоки-
ровать передачу сигналов, способствующих прогрессии последних.
Стероидные гормоны образуют комплексы с белковыми молекулами (рецептора-
ми), проникают в ядра клеток, связываются с хроматином и нарушают синтез нукле-
иновых кислот в клетках-мишенях (клетках, чувствительных к данному гормону); в
определенных дозах они угнетают пролиферативные процессы в молочной железе
(андрогены, эстрогены), простате (эстрогены), кроветворных органах (кортикостеро-
иды), эндометрии (гестагены).
Возможны также стимуляция или торможение аутокринных и паракринных факто-
ров роста. Эффект гормонотерапии может осуществляться и с помощью непрямого
воздействия на гипоталамус и продуцируемые им гормоны, регулирующие продук-
цию гормонов гипофиза. В конечном счете, мишенью гормонотерапии является опу-
холевая клетка, сохранившая некоторую способность отвечать на прямые или опос-
редованные гормональные воздействия.
Исключение в этом отношении представляет механизм действия кортикостероидов
при лейкозах и лимфомах: эти препараты оказывают прямое литическое воздействие
на патологические лимфоидные клетки, содержащие большое количество рецепто-
ров кортикостероидов.
Ниже приводятся данные о механизме действия основных групп гормонов и их ан-
тагонистов.
Андрогены вызывают противоопухолевый эффект, опосредованно влияя на фун-
кцию гипофиза либо оказывая воздействие непосредственно на опухолевые клетки.
Применяются при РМЖ преимущественно у молодых женщин. Побочные явления —
вирилизация, гиперкальциемия, гипербилирубинемия.
Эстрогены через гипоталамус угнетают продукцию тестостерона при раке проста-
ты, при РМЖу женщин в менопаузе могут изменять ответ на пролактин. Побочные яв-
ления — феминизация у мужчин, маточные кровотечения у женщин, недостаточность
кровообращения, тромбоэмболические осложнения.
Механизм действия прогестинов (гестагенов) неясен; по-видимому, они оказывают
влияние на уровне рецепторов клетки, содействуя ее дифференцировке. Применяют-
ся при раке эндометрия и РМЖ.
Кортикостероиды вызывают распад лимфоидных опухолей, цитоплазма клеток ко-
торых содержит специфические рецепторы, а также могут оказывать непрямое дей-
ствие. Применяются при острых и хронических лимфолейкозах, миеломной болезни,
РМЖ, а также в качестве симптоматического средства при отеке мозга и повышении
внутричерепного давления и как противорвотное средство. Побочные эффекты за-
ключаются в нарушении водно-солевого обмена, гипергликемии, появлении невроти-
ческих симптомов. Возможно развитие синдрома Кушинга, образование язв желудка
и двенадцатиперстной кишки.
Следует отметить, что применение стероидных гормонов (эстрогенов и андрогенов)
при РМЖ и раке простаты практически полностью уступило место антигормонам (ан-
тиэстрогенам и антиандрогенам), ингибиторам ароматазы и суперагонистам LH-RH.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 39
Клинико-фармакологическая характеристика противоопухолевых средств
Эти препараты, не обладая тягостными побочными эффектами типа выраженной фе-
минизации или вирилизации, характеризуются не меньшей эффективностью у боль-
ных с положительными рецепторами стероидных гормонов.
Антиэстрогены блокируют рецепторы эстрогенов. Комплекс рецептор-гормон
контролирует промоторный участок гена, от которого зависит рост клетки. Разли-
чают селективные модуляторы рецепторов эстрогенов (SERM), к которым относят-
ся тамоксифен и торемифен, и селектитвные супрессоры рецепторов эстрогенов
(SERD), представителем которых является фульвестрант (Фазлодекс). Тамоксифен и
торемифен (Фарестон) — препараты первой линии гормонотерапии при рецептор-
положительном РМЖу женщин в пременопаузе и широко используются у больных в
менопаузе.
Антиандрогены блокируют рецепторы андрогенов и с успехом применяются при
раке простаты.
Ингибиторьх ароматазы препятствуют действию этого фермента, превращающе-
го андростендион в эстрон, а затем в эстрадиол, снижая таким образом содержание
эстрогенов у больных в менопаузе. На смену не обладающему избирательным свойст-
вом аминоглутетимиду пришли новые селективные ингибиторы ароматазы — летро-
зол (Фемара) и анастрозол (Аримидекс), блокирующие превращение андростендиона
в эстрадиол в периферических тканях без нарушения синтеза прогестинов и корти-
костероидов, а также стероидный необратимый ингибитор ароматазы — экземестан
(Аромазин). Ингибиторы ароматазы широко применяются при РМЖ с положительны-
ми рецепторами эстрогенов (РЭ) у женщин в менопаузе, каку больных с метастатиче-
ским РМЖ, так и в адъювантной терапии раннего РЭ-положительного РМЖ.
Суперагонисты LH-RH подавляют продукцию лютеинизирующего и фолликуло-
стимулирующего гормонов гипофиза, ингибируя соответственно продукцию тесто-
стерона у мужчин либо эстрогенов у женщин гонадами.
Применяются при раке простаты в качестве химической кастрации и при РМЖ для
выключения функции яичников у больных в пременопаузе.
Тиреоидные гормоны ингибируют выброс тиреоидстимулирующего гормона и тем
самым подавляют рост высокодифференцированного рака щитовидной железы.
Аналоги соматостатина, в частности октреотид (Сандостатин и Сандостатин
ЛАР), используются для купирования карциноидного синдрома, характерного для
некоторых нейроэндокринных опухолей (АПУДом). Систематическое применение
октреотида позволяет полностью снять тягостную симптоматику у 30-75% больных.
В последние годы появились также сообщения об антипролиферативном действии
высоких доз аналогов октреотида.
В известной мере условно к числу антигормонов можно отнести химический су-
прессор коры надпочечников митотан (Орто-пара-ДДД, Хлодитан, Лизодрен), исполь-
зуемый при кортикостеромах.
Особую группу составляют гормоноцитостатики — препараты, обладающие ци-
тостатическим и гормональным свойствами, такие как эстрамустин (Эстрацит) и пред-
нимустин (Стерицит).
40
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Глава 3
Таргетные (молекулярно-нацеленные)
препараты
Н. И. Переводчикова
Успехи молекулярной биологии конца XX в., позволившие установить механизмы ре-
гуляции деления и гибели клеток, открыли перспективы создания противоопухолевых
препаратов молекулярно-нацеленного действия, получивших название таргетных (от
англ, target — мишень, цель). В принципе первыми противоопухолевыми препаратами
молекулярно-нацеленного действия были созданные в 80-90-е годы XX в. блокато-
ры рецепторов стероидных гормонов (антиэстрогены и антиандрогены), традиционно
рассматриваемые в классе гормональных препаратов.
С развитием биотехнологий появились реальные возможности создания препара-
тов, которые направленно действуют на белки, участвующие в канцерогенезе и опре-
деляющие способность опухоли к прогрессии и метастазированию.
3.1. Особенности механизма действия
таргетных препаратов
Принципиальное отличие таргетных от классических противоопухолевых препара-
тов цитотоксического действия (алкилирующие агенты, антиметаболиты, антибиоти-
ки, винкаалкалоиды, таксаны, ингибиторы топоизомеразы) состоит в том, что первые
действуют направленно на молекулы, участвующие в процессе канцерогененза, а вто-
рые, также обладающие специфической направленностью, имеют своей точкой при-
ложения такие общебиологические процессы, как синтез ДНК и митоз.
Объединяемые общим принципом молекулярно-нацеленного действия таргетные
препараты по своей природе относятся к различным соединениям: это моноклональ-
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 41
Таргетные (молекулярно-нацеленные) препараты
•ЯИВИЯ8ЖИВв8аИвИВ8ЯЯЯЯЙЯвИЯ(ЯМЯ8а®ИЙЙЙвЙЙИйа^^ «Лий 1 г-
ные антитела (МКА) к факторам роста и их рецепторам: трастузумаб (Герцептин), це-
туксимаб (Эрбитукс), панитумумаб (Вектибикс), бевацизумаб (Авастин); нерецеп-
торные МКА и их конъюгаты: ритуксимаб (Мабтера), алемтузумаб (Кэмпас); малые
синтетические молекулы — ингибиторы протеинкиназ: иматиниба мезилат (Гливек),
гефитиниб (Пресса), эрлотиниб (Тарцева), сунитиниб (Сутент), лапатиниб (Тайкерб),
дазатиниб (Спрайсел), сорафениб (Нексавар), нилотиниб (Тасигна), темсиролимус (То-
рисел), эверолимус (Афинитор); короткие синтетические отрезки ДНК, связывающие-
ся с мРНК, — антисмысловые нуклеотиды: облимерсен (Генасенс); природные соеди-
нения (Неовастат, флавоперидол); вирусы (AdP53, ONIX-015).
По принципу действия таргетные препараты могут быть разделены на две основные
группы: 1) нацеленные на пути передачи сигнала в опухолевой клетке и 2) нацеленные
на уникальный фенотип опухолевой клетки. Последняя группа включает используе-
мые в онкогематологии МКА, распознающие и блокирующие специфические нере-
цепторные антигены на поверхности клеток и оказывающие прямое цитотоксическое
действие на эти клетки. К таким препаратам относятся гуманизированное мышиное
антитело к поверхностному антигену CD20 В-клеток — ритуксимаб (Мабтера), с успе-
хом используемое при В-клеточных НХЛ и хроническом лимфолейкозе (ХЛЛ), а так-
же гуманизированное мышиное МКА алемтузумаб против гликопротеида CD52 на по-
верхности В- и Т-клеток, естественных киллеров (NK), моноцитов и макрофагов, также
используемое при В-клеточном ХЛЛ. На базе этих МКА созданы конъюгаты с токсина-
ми — гемтузумаб озогамицин (Милотарг), а также радиоиммуноконъюгаты — ибриту-
момаб тиуксетан (Зевалин) и 13,1 тозитумомаб (Бексар).
Основной принцип действия таргетных препаратов первой группы, т.е. блокирую-
щих передачу сигнала, базируется на том, что в норме лиганды (молекулы гормонов,
цитокинов, факторов роста и др.) взаимодействуют с рецепторами клетки, а те пере-
дают сигнал через сеть молекул, преимущественно белковых киназ к ядру, что опре-
деляет способность клетки к пролиферации, дифференцировке, апоптозу, адгезии,
ангиогенезу. В процессе канцерогенеза эта система дисрегулируется и клетка подвер-
гается злокачественной трансформации.
На принципе блокирования передачи митогенных и антиапоптотических сигналов
основано действие препаратов, имеющих своей мишенью рецепторы эпидермально-
го фактора роста (EGFR). Семейство трансмембранных EGFR состоит из четырех чле-
нов: EGFR1 (син.: HER1, ErbBl), EGFR2 (HER2, ErbB2), EGFR3 (HER3, ЕгЬВЗ), EGFR4 (HER4,
ЕгЬВ4). Рецепторы представляют собой гликопротеиды, состоящие из трех доменов:
экстрацеллюлярного, обладающего способностью связываться с лигандом, трансмем-
бранного и интрацеллюлярного, обладающего тирозинкиназной активностью.
При связывании лиганда, например EGF, с экстрацеллюлярным доменом рецептора
происходит димеризация, т.е. объединение двух связанных с лигандом рецепторов в
единый функциональный комплекс с последующим аутофосфорилированием тиро-
зинкиназы внутриклеточного домена рецептора, что обеспечивает передачу сигнала
внутрь клетки и затем внутриклеточную передачу его к ядру.
Стратегия таргетной терапии может включать:
И блокаду циркулирующих лигандов;
блокаду связывания лигандов с экстрацеллюлярным доменом рецептора;
ингибицию тирозинкиназ внутриклеточного домена рецептора, что ведет к бло-
каде фосфорилирования, нарушая передачу сигнала от рецептора к молекулам,
осуществляющим внутриклеточную передачу сигнала;
внутриклеточную ингибицию белков, осуществляющих интрацеллюлярную пе-
редачу сигнала.
42 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Клиническое применение таргетных препаратов
* V. ч.-’-м-’ч ча?
Примером блокады путем нейтрализации лиганда до его возможного связывания
с рецептором служит применение бевацизумаба — МКА к фактору роста эндотелия
сосудов (VEGF), циркулирующему в крови; примером блокады путем конкурентного
связывания с экстрацеллюлярным доменом рецептора — использование МКА к EGFR1
цетуксимаба и панитумумаба.
Трастузумаб — МКА к рецептору HER2, лиганд которого неизвестен, блокирует этот
рецептор, связываясь с его экстрацеллюлярным доменом.
Блокаду активности внутриклеточного домена EGFR1 осуществляют малые молеку-
лы — ингибиторы тирозинкиназ эрлотиниб и гефитиниб.
Двойной ингибитор тирозинкиназ лапатиниб блокирует активность внутриклеточ-
ного домена рецепторов EGFR1 и HER2 (EGFR2).
Внутриклеточную блокаду передачи сигнала осуществляют мультитаргетные ин-
гибиторы киназ иматиниб, дазатиниб, сунитиниб, сорафениб, причем два последних
препарата ингибируют рецепторы VEGF и тромбоцитарного фактора роста (PDGF),
оказывая антиангиогенное действие, благодаря чему их обычно относят к антиангио-
генным препаратам.
Ингибиторы белка mTOR (мишень рапамицина у млекопитающих), внутриклеточной
серин-треониновой киназы, регулирующей пролиферацию клеток и ангиогенез, тем-
сиролимус и эверолимус оказывают противоопухолевое действие при раке почки.
В процессе развития опухоли важнейшую роль играет неоангиогенез, определя-
ющий возможность роста и метастазирование опухоли и, соответственно, служащий
перспективной мишенью таргетной терапии. Наиболее практически ценным препа-
ратом из группы ингибиторов ангиогенеза оказался бевацизумаб — рекомбинантное
гуманизированное МКА к VEGE Блокада VEGF с помощью бевацизумаба ведет к инги-
биции неоангиогенеза и вызывает противоопухолевый эффект при КРР, РМЖ, раке по-
чки, НМРЛ.
Ктаргетным относятся также препараты, влияющие на деградацию белков, в част-
ности действующие на протеасомы. При миеломной болезни с успехом используется
бортезомиб (Велкейд), ингибирующий функцию протеасомы 26S, которая отвечает за
внутриклеточную деградацию белка.
3.2. Клиническое применение таргетных
препаратов
За 10 лет, прошедших с того времени, когда появились первые клинические данные об
эффективности трастузумаба (Герцептин) при НЕР2-позитивном РМЖи иматиниба (Гли-
век) при хроническом миелолейкозе (ХМЛ), огромное количество таргетных препара-
тов изучалось и изучается сточки зрения возможности их использования в клинике.
На сегодняшний день практическое применение получило 17 препаратов, использу-
емых как в онкогематологии, так и при лечении солидных опухолей (табл. 3.1).
По своему строению они являются МКА либо синтетически малыми молекулами —
ингибиторами протеинкиназ.
Для получения современных препаратов используются гуманизированные (со-
держащие мышиный вариабельный домен и человеческий константный домен) и хи-
мерные антитела (мышиный IgG представлен только вариабельными участками, от-
ветственными за распознавание антигена, а остальная часть вариабельного домена и
константный домен являются фрагментами человеческого IgG).
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 43
Таргетные (молекулярно-нацеленные) препараты
Такими препаратами являются МКА к EGFR — трастузумаб (Герцептин) и цетуксимаб
(Эрбитукс), а также МКА к VEGF — бевацизумаб (Авастин). Недавно вошедший в пра-
ктику панитумумаб (Вектибикс) является полностью гуманизированным МКА к EGFR1.
Особую подгруппу составляют препараты, являющиеся нерецепторными МКА к
антигену С20 В-клеток — ритуксимаб и к антигену CD52 В- и Т-лимфоцитов — алем-
тузумаб и их конъюгаты, используемые в терапии гемобластозов.
К синтетическим ингибиторам протеинкиназ относятся малые молекулы ингибито-
ры тирозинкиназ EGFR гефитиниб, эрлотиниб и лапатиниб, а также мультитаргетные
ингибиторы протеинкиназ (иматиниб, дазатиниб, нилотиниб, сунитиниб, сорафениб) и
ингибиторы киназы mTOR (темсиролимус и эверолимус)/
Сведения об этих препаратах включены в гл. 8, где в алфавитном порядке представ-
лены данные о противоопухолевых препаратах, зарегистрированных в России.
Таблица 3.1. Таргетные препараты, получившие клиническое применение
Препарату Мишень________________________Противоопухолевое действие (спектр)
Ингибиторы EGFR
1. МКА к рецепторам EGF Трастузумаб (Герцептин) HER2 (EGFR2) Цетуксимаб (Эрбитукс) EGFR1 Панитумумаб (Вектибикс) EGFR НЕН2-позитивный РМЖ КРР, ПКР головы и шеи, НМРЛ КРР
2. Ингибиторы тирозинкиназ EGFR Эрлотиниб (Тарцева) EGFR1 Гефитиниб (Пресса) EGFR1 Лапатиниб (Тайкерб, Тайверб) EGFR1, HER2 (EGFR2) НМРЛ, рак поджелудочной железы НМРЛ НЕЛ2-позитивный РМЖ
1. МКА к VEGF Бевацизумаб (Авастин) VEGF КРР, НМРЛ, рак почки, РМЖ
2. Мультитаргетные ингибиторы киназ, включая тирозинкиназы VEGFR и PDGFR
Сунитиниб (Сутент) Сорафениб (Нексавар) VEGFR, PDGFR, c-Kit, FLT3, CSF1R, RET C-RAF, BRAF, VEGFR2/3, PDGFR, c-Kit, FLT3, RET GIST, почечноклеточный рак Почечноклеточный рак, гепатоцеллю- лярный рак
Мультитаргетные ингибиторы киназ
Иматиниб (Гливек) BCR-ABL, PDGF, SCT, c-Kit ХМЛ, ОЛЛ, GIST
Дазатиниб (Спрайсел) BCR-ABL, c-Kit, PDGFR/? ХМЛ, Ph+ ОЛЛ
Нилотиниб (Тасигна) BCR-ABL ХМЛ
Темсиролимус (Торизел) mTOR Почечноклеточный рак
Эверолимус (Афинитор) mTOR Почечноклеточный рак
МКА к мембранным нерецелторным антигенам
Ритуксимаб (Мабтера) CD20 В-клеточных лимфоцитов В-клеточные НХЛ и ХЛЛ, экспрессиру- ющий В-маркер
Алемтузумаб (Кэмпас) CD52 ХЛЛ, В-клеточные НХЛ
Ингибиторы протеасом (ингибиторы деградации белков)
Бортезомиб (Велкейд) Протеасома 26S Миеломная болезнь
Учитывая механизм действия таргетных препаратов, теоретически их применение
оправдано лишь у больных, опухоли которых содержат конкретные мишени для воз-
действия этих препаратов. Так, гуманизированное МКА к EGFR (HER2) — трастузумаб
44 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Клиническое применение таргетных препаратов
(Герцептин) эффективно у 26% больных при РМЖ в случае гиперэкспрессии или ам-
плификации HER2 и не работает при НЕК2-негативных опухолях. Эффективность инги-
биторов тирозинкиназы EGFR1 гефитиниба и эрлотиниба при НМРЛ связана с наличи-
ем мутаций гена EGFR. Наличие мутаций в виде делеций экзонов 19 и 21 и увеличение
копий гена EGFR по результатам FISH (флюоресцентная гибридизация in situ) положи-
тельно коррелируют с эффективностью ингибиторов тирозинкиназы. Характерно, что
мутации тирозинкиназного домена EGFR чаще встречаются при аденокарциноме лег-
кого и, особенно, при бронхиолоальвеолярном раке легкого у никогда не куривших
женщин азиатского происхождения. Эти клинические характеристики нередко ис-
пользуются в качестве суррогатного биомаркера при решении вопроса о применении
эрлотиниба и гефитиниба.
При метастатическом КРР применение цетуксимаба достоверно улучшает резуль-
таты терапии в режиме FOLFIR1 только у больных с немутантным (диким) геном KRAS.
Токсичность таргетных препаратов своеобразна и отличается от таковой большин-
ства классических цитостатиков. При меньшем угнетающем действии на кроветворе-
ние эти препараты чаще вызывают кожные сыпи, диарею, аллергические реакции, на-
рушение общего состояния, усталость. Препараты, имеющие своей мишенью EGFR
(эрлотиниб, гефитиниб, цетуксимаб), вызывают характерные кожные изменения — ак-
неподобные высыпания, что нередко положительно коррелирует с эффективностью
этих препаратов. При клинических испытаниях антиангиогенных препаратов лимити-
рующей токсичностью оказались геморрагии и артериальная гипертензия, тромбоэм-
болические осложнения.
Токсичность каждого таргетного препарата имеет свои особенности. Так, тра-
стузумаб обладает кардиотоксичностью, что ограничивает возможности его комби-
нации с антрациклинами, а при использовании бевацизумаба описано редкое, но опа-
сное осложнение — гастроинтестинальные перфорации. При терапии сорафенибом
лимитирующей токсичностью служит Л ПС.
Противоопухолевая активность и переносимость таргетных препаратов изучаются
в процессе клинических испытаний, методика которых в принципе отличается от тра-
диционных клинических испытаний классических цитостатиков. Таргетные препараты
оказывают в основном цитостатическое, а не цитотоксическое действие, поэтому ос-
новным клиническим критерием их эффективности служит время до прогрессирова-
ния и выживаемость больных.
При солидных опухолях при оценке эффективности по шкале RECIST эффектив-
ность таргетных препаратов невысока и обычно не превышает 10-20%. Большинство
современных таргетных препаратов дает наиболее выраженный противоопухолевый
эффект в составе лекарственных комбинаций с классическими противоопухолевыми
препаратами.
Таргетные препараты, являющиеся МКА, обычно достаточно успешно взаимодейст-
вуют с классическими цитотоксиками. Разработаны режимы комбинированной хими-
отерапии РМЖ с использованием трастузумаба в сочетании с таксанами, алкилиру-
ющими агентами, капецитабином, винорелбином, гемцитабином. Показана высокая
противоопухолевая активность и в то же время опасная кардиотоксичность одномо-
ментного применения трастузумаба и антрациклинов, поэтому одновременное их
применение не рекомендуется.
В многоцентровых рандомизированных исследованиях III фазы показана возмож-
ность улучшения результатов комбинированной химиотерапии путем использования
бевацизумаба либо цетуксимаба в сочетании с комбинацией 5-фторурацила и лей-
коворина и комбинаций FOLFOX либо IFL при КРР, возможность успешного сочетания
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 45
Таргетные (молекулярно-нацеленные) препараты
цетуксимаба и комбинации 5-фторурацила с производными платины при ПКР голо-
вы и шеи, а также улучшение результатов применения комбинации паклитаксела либо
гемцитабина с производными платины при НМРЛ в случае одновременного исполь-
зования бевацизумаба. Таким образом, МКА к EGFR и VEGF могут быть с успехом ис-
пользованы в сочетании с традиционными цитотоксическими препаратами и их ком-
бинациями.
Несомненно, оправданы дальнейшие исследования по комбинации таргет-
ных препаратов и классических средств цитотоксического действия. С этой точ-
ки зрения особенно интересна новая группа таргетных препаратов — ингибито-
ры поли(АДФ-рибозил)полимеразы. Семейство PARP состоит из 17 членов. PARP-1
и PARP-2 участвуют в репарации ДНК. Соответственно ингибиция PARP усилива-
ет антипролиферативную активность агентов, повреждающих ДНК. В рандомизиро-
ванном исследовании показано, что ингибитор PARP-1 препарат BSI-2O1 достоверно
повышал эффективность комбинации гемцитабина с карбоплатином при трижды не-
гативном метастатическом РМЖ.
Актуальна проблема сочетанного применения нескольких таргетных препаратов.
Возможно последовательное или одномоментное назначение двух и более ингибито-
ров различных ферментов одного из важнейших путей передачи сигнала (так называ-
емая вертикальная комбинация, направленная на вертикальную блокаду одного пути
сигнала) и сочетанное применение таргетных препаратов, имеющих мишенью пути
передачи сигнала в клетках различного происхождения, например в опухолевой клет-
ке и клетке эндотелия (горизонтальная комбинация, направленная на горизонтальную
блокаду). Принцип сочетания различных таргетных препаратов, несомненно, привле-
кателен, но каждая комбинация требует специального изучения в виде I фазы клини-
ческих испытаний для отработки оптимального дозового режима, учитывая реальную
опасность повышения токсичности.
Что изменилось в терапии больных опухолевыми заболеваниями с появлением тар-
гетных препаратов?
Принципиально изменились возможности терапии опухолевых заболеваний кро-
ветворной и лимфоидной ткани. При A7VL7 медиана выживаемости увеличилась до 83-
89 мес., 5-летняя выживаемость — до 70-84%, 10-летняя выживаемость, ранее едва
достигавшая 5%, теперь составляет 40%, а у больных с полным цитологическим эф-
фектом — 80%.
При использовании иматиниба мезилата (Гливек) гематологический эффект достига-
ется у 90-95 % больных в хронической стадии и у 30 % — при бластном кризе, при этом
у 50 % больных с возвратом в хроническую стадию болезни.
У больных НХЛ, отличающимися большим разнообразием вариантов, использова-
ние ритуксимаба дало возможность улучшить прогноз и результаты лечения.
Введение в практику бортезомиба (Велкейд) позволило изменить тактику ведения
больных с множественной миеломой и повысить эффективность лечения.
Применение дазатиниба и нилотиниба открыло определенные возможности для
больных ХМЛ и Ph+ ОЛЛ, устойчивых к иматинибу.
Реально изменились современные подходы к терапии НЕК2-позитивного РМЖ. Ги-
перэкспрессия или амплификация гена HER2 обнаруживаются у 20-30 % общей попу-
ляции больных РМЖ и ассоциируются с агрессивным течением заболевания, высоким
риском метастазирования и низкой выживаемостью, т.е. являются абсолютно неблаго-
приятным прогностическим признаком.
Применение трастузумаба в виде монотерапии у больных с метастатическим HER2-
позитивным РМЖ эффективно в 15-35% случаев, в комбинации же с классическими
цитостатиками — таксанами, производными платины, винорелбином, гемцитабином,
46 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Клиническое применение таргетных препаратов
капецитабином — дает выраженный клинический эффекту 40-78% больных, досто-
верно повышая не только эффективность и продолжительность ремиссии, но и об-
щую выживаемость больных. В крупных многоцентровых рандомизированных иссле-
дованиях показано, что использование трастузумаба в адъювантной терапии ранних
форм НЕК2-позитивного РМЖ уменьшает риск рецидива заболевания и увеличива-
ет 3-летнюю безрецидивную выживаемость, снижая относительный риск рецидива и
метастазов на 36-58% и риск смерти от опухоли на 34% (относительный риск 0,66).
Включение трастузумаба (Герцептин) в алгоритм лечения НЕК2~позитивного
РМЖ стало современным стандартом терапии этого заболевания.
Дополнительные перспективы открывает для больных с НЕК2-позитивным РМЖ воз-
можность применения двойного ингибитора тирозинкиназ рецепторов HER1 (EGFR1)
и HER2 (EGFR2) лапатиниба (Тайверб).
Таргетная терапия стала основой современной лекарственной терапии стромальных
опухолей ЖКТ (gastro intestinal stromal tumors, GIST), совершенно не чувствительных
к классическим цитотоксическим препаратам. Эти соединительнотканные опухоли,
встречающиеся достаточно редко — 10-15 случаев на 1 000 000 человек, характери-
зуются мутациями гена c-Kit и образование мутантного трансмембранного тирозинки-
назного рецептора стволового фактора роста — Kit (регистрируются у 85% больных),
а также мутациями рецептора тромбоцитарного фактора роста альфа (PDGFRA), кото-
рые обнаруживаются у 10-15% больных.
Мультитаргетный ингибитор тирозинкиназ иматиниб (Гливек) способен блокиро-
вать рецепторы Kit и PDGFRA и, соответственно, высокоактивен при GIST. Использова-
ние иматиниба позволяет контролировать рост опухоли более чему 90% больных и в
настоящее время считается общепризнанным стандартом современного лечения GIST.
В последние годы появились данные о противоопухолевой активности при GIST су-
нитиниба — другого мультитаргетного ингибитора тирозинкиназ, способного инги-
бировать тирозинкиназные рецепторы Kit и PDGFA. При иматиниб-резистентных GIST
применение сунитиниба увеличивает время до прогрессирования в 4 раза и выжива-
емость до 20 мес.
Современная терапия GIST строится на использовании таргетных препаратов: има-
тиниба в качестве первой линии и сунитиниба в качестве второй линии терапии для
лечения больных с метастатическим процессом. Сунитиниб в качестве второй линии
обосновано применять после прогрессирования на фоне увеличения дозы иматиниба
в два раза (с 400 мг/сут до 800 мг/сут). Кроме того, доказана целесообразность адъю-
вантной терапии иматинибом после радикальной операции у больных с локализован-
ными GIST, а также изучаются возможности использования сунитиниба в качестве адъ-
юванта.
Исследования последних лет, доказавшие противоопухолевую активность при
светлоклеточном раке почки бевацизумаба (Авастин), сунитиниба (Сутент), сорафе-
ниба (Нексавар) и ингибиторов киназы тТСЖтемсиролимуса (Торизел) и эверолиму-
са (Афинитор), позволили разработать новый алгоритм терапии метастатического рака
почки. Последовательное использование таргетных препаратов позволило увеличить
время до прогрессирования и медиану выживаемости больных метастатическим ра-
ком почки, т.е. появилась реальная возможность продлить стабилизацию опухолевого
процесса у этой ранее совершенно бесперспективной группы больных.
При ПКР головы и шеи, в 80-100% случаев характеризующемся повышенной эк-
спрессией EGFR, применение МКА к EGFR1 цетуксимаба в сочетании с традиционной
химиотерапией 5-фторурацилом и лейковорином либо с лучевой терапией стало сов-
ременным стандартом, достоверно увеличивающим общую и безрецидивную выжи-
ваемость больных.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 47
Таргетные (молекулярно-нацеленные) препараты
Возможности лечения больных метастатическим КРР существенно изменились
за последнее десятилетие. В ряде рандомизированных исследований показано, что
включение в состав комбинированной химиотерапии таргетных препаратов бевацизу-
маба, цетуксимаба, панитумумаба улучшает результаты терапии.
Современная терапия метастатического КРР включает в себя последовательное и
комбинированное использование всех активных при этом раке противоопухолевых
препаратов — фторпроизводных пиримидина, оксалиплатина, иринотекана, бевацизу-
маба, цетуксимаба, что позволяет увеличить медиану выживаемости этих пациентов
от 8 мес. при одной симптоматической терапии до 2 лет и делает реально достижимой
ближайшую цель — увеличение этого показателя до 3 лет.
При НМРЛ используют ингибиторы тирозинкиназы EGFR гефитиниб и эрлотиниб, а
также ингибитор VEGF бевацизумаб; изучается возможность и целесообразность при-
менения цетуксимаба в составе лекарственных комбинаций.
У больных НМРЛ, прогрессировавших после химиотерапии с включением плати-
носодержащих комбинаций, терапия эрлотинибом достоверно увеличивает общую
выживаемость по сравнению с одной симптоматической терапией (в исследовании
BR 21: медиана — 6,7 мес., в контроле — 4,7 мес.), а также безрецидивную выживае-
мость (9,7 us 8,0 нед.) и вызывает симптоматический эффект при удовлетворительной
переносимости. Международное исследование TRUST с участием более 7000 боль-
ных НМРЛ, получавших эрлотиниб, подтвердило эти данные.
Эффективность ингибиторов тирозинкиназ EGFR зависит от генетической характе-
ристики опухоли (мутаций генов EGFR и KRAS), причем наличие мутации гена EGFR по-
ложительно коррелирует с эффективностью, а мутации KRAS являются неблагопри-
ятным признаком. При НМРЛ с мутированным EGFR использование гефитиниба либо
эрлотиниба стало приемлемой альтернативой применению комбинаций цитотоксиче-
ских препаратов.
За последние 10 лет таргетные препараты уверенно вошли в арсенал современной
противоопухолевой химиотерапии и стали неотъемлемым компонентом комбиниро-
ванной терапии гемобластозов и ряда солидных опухолей, в первую очередь РМЖ с
гиперэкспрессией HER2 и GIST, при которых использование этих препаратов жизнен-
но необходимо.
Таргетные препараты позволили улучшить результаты химиотерапии метастатиче-
ского КРР, ПКР головы и шеи, НМРЛ и впервые открыли некоторые перспективы для
больных с метастатическим раком почки.
Особое значение приобретает проблема уточнения показаний для использования
этих препаратов, т.е. вопрос разработки биомаркеров, позволяющих индивидуали-
зировать терапию, оценивая перспективность применения препарата у конкретного
больного, а также фармакоэкономические проблемы, связанные с высокой стоимо-
стью таргетных препаратов.
48
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Глава 4
Современные методы иммунотерапии
в онкологии. Модификаторы
биологических реакций
3. Г, Кадагидзе
Полученные в последние 25 лет данные о состоянии иммунной системы у онкологи-
ческих больных свидетельствуют, что рост большинства злокачественных новообра-
зований сопровождается определенными нарушениями иммунного ответа. Выявлены
закономерности влияния развивающейся опухоли на иммунную систему организма,
зависимость степени подавления иммунного ответа от размера опухоли и проводимо-
го лечения. Эти данные послужили основанием для использования методов иммуно-
терапии в комплексном лечении злокачественных новообразований.
Основные задачи современной иммунотерапии опухолей:
1) снижение побочных эффектов традиционной противоопухолевой терапии (ми-
елосупрессии, иммуносупрессии), коррекция общетоксических эффектов;
2) профилактика и лечение сопутствующих инфекционных осложнений;
3) профилактика рецидивов опухоли;
4) непосредственный противоопухолевый эффект.
К настоящему времени реальные достижения наблюдаются в решении первых трех
задач. С этой целью используются различные иммуномодуляторы, которые в терапев-
тических дозах восстанавливают функции иммунной системы. Почти 25-летний опыт
применения различных иммуномодуляторов в онкологии выявил как положительные,
так и отрицательные стороны этого вида лечения. Показано, что ряд препаратов спо-
собствует быстрому восстановлению иммунологических и гематологических показа-
телей после хирургического лечения, химио- и лучевой терапии, что позволяет рань-
ше начать следующие курсы лечения, а это, в свою очередь, повышает эффективность
проводимой терапии. Ряд препаратов при их профилактическом применении способ-
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 49
Современные методы иммунотерапии в онкологии ...
ствует увеличению длительности ремиссии. В то же время отмечено, что неадекват-
ное применение иммунотропных препаратов может способствовать ускорению опу-
холевого роста.
Агенты, способные изменять биологическую реакцию организма на опухоль таким
образом, что это дает терапевтический эффект, называют модификаторами биоло-
гических реакций. К числу таких препаратов относятся цитокины (интерфероны, ин-
терлейкины, фактор некроза опухолей, колониестимулирующие факторы, таргетные
модуляторы иммунного ответа (производные талидомида — леналидомид), иммуно-
конъюгаты, включая иммунотоксины (денилейкин дифтитокс), а также неспецифиче-
ские иммуномодуляторы (полиоксидоний, иммунофан, галавит, ликопид и др.).
Цитокины
Цитокины — биологически активные вещества пептидной природы, регулирующие
широкий спектр процессов, протекающих в организме. (Термин «цитокины» был пред-
ложен N. Cohen в 1974 г.) Основные функции цитокинов: регуляция гемопоэза, иммун-
ного ответа и воспалительных процессов, участие в ангиогенезе, апоптозе, хемотак-
сисе, эмбриогенезе. Продукция цитокинов определяет развитие ряда заболеваний, в
связи с чем встает вопрос об их использовании или применении антагонистов к ним в
терапевтических целях. Цитокины нашли наиболее широкое применение в онкологи-
ческой практике.
В настоящее время имеется обширная литература по эффективности применения
цитокинов при различных злокачественных новообразованиях как в режиме моноте-
рапии, так и в сочетании с химиотерапией и другими видами лечения. В клиническую
практику вошло применение интерферона-альфа (ИФН-сс), интерлейкина (ИЛ-2) и их
комбинаций при лечении некоторых опухолей. Проводятся исследования по приме-
нению фактора некроза опухоли (ФИО) и интерферона-гамма (ИФН-у).
Интерферон-альфа. Изучение эффективности ИФН-сс проводилось при всех фор-
мах злокачественных новообразований. К настоящему времени в ведущих клиниках
США и Европы выполнено большое количество проспективных кооперированных ис-
следований, которые позволили разработать ряд рекомендаций. Показано, что адью-
вантное применение малых доз ИФН-сс (3-5 млн ME) дает определенный эффект на
ранней стадии заболевания, что выражается в снижении риска метастазирования и
улучшении показателей безрецидивной выживаемости. Лечение хорошо перено-
сится больными (возможны лишь температурные реакции) и должно продолжаться
не менее 12-18 мес. Использованные дозы ИФН обладали иммунокорригирующим
свойством: у больных повышались число NK-клеток и их активность, увеличивалась эк-
спрессия CD95 и ряда активационных антигенов, а также активировались процессы
апоптоза. В настоящее время Европейское медицинское агентство по изучению эф-
фективности лекарственных средств рекомендует назначение малых доз ИФН-сс в ка-
честве профилактического лечения меланомы II стадии после операции. В то же вре-
мя для больных с меланомой III стадии малые дозы ИФН оказались недостаточными
для получения клинического эффекта, в связи с чем предложены схемы, включающие
высокие дозы ИФН (10-20 млн МЕ/м2), при которых сам ИФН-а проявляет антипроли-
феративное действие. В международных исследованиях было показано, что исполь-
зование высоких доз ИФН позволяет добиться увеличения не только безрецидивной,
но и общей выживаемости. Безусловно, такие дозы ИФН достаточно токсичны. Наи-
более часто наблюдаются гриппоподобные симптомы (лихорадка, озноб, миалгия),
усталость, депрессия, миелосупрессия, тромбоцитопения, нарушение функции пече-
ни. Кроме того, оказалось, что длительность клинического эффекта напрямую связана
с общей продолжительностью лечения, т.к. после отмены препарата довольно скоро
50 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Современные методы иммунотерапии в онкологии...
возникал рецидив заболевания. В связи с этим вопросы дозы и длительности примене-
ния ИФН у больных с метастатической меланомой являются предметом проходящих в
настоящее время кооперированных исследований.
Рекомбинантный ИФН-а2 при метастатическом раке почки оценивался во многих
исследованиях. По данным РОНЦ РАМН, эффективность различных режимов коле-
блется от 6 до 26 %, при этом у больных с хорошим соматическим статусом и длитель-
ным безрецидивным периодом после нефрэктомии она достигала 30% при продол-
жительности ремиссий более 27 мес.
Особый интерес представляют данные об использовании ИФН при лечении гемоб-
ластозов. Наиболее широко он исследовался в детской гематологии каку нас, так и за
рубежом. Оказалось, что как клинический, так и иммунокорригирующий эффект зави-
сел от стадии заболевания и сроков начала лечения относительно периода ремиссии.
В отделении детской гематологии РОНЦ РАМН препарат применяли в комплексном
лечении 351 ребенка с диагнозом ОЛЛ (220 детей) и НХЛ (131 ребенок). Проведенное
рандомизированное исследование показало способность рекомбинантного ИФН по-
вышать эффективность проводимого комплексного лечения и улучшать его отдален-
ные результаты.
Препараты ИФН часто используются в онкологии с целью иммунокоррекции. На-
пример, Виферон — комплексный препарат, в состав которого входят рекомбинан-
тный ИФН-а, мембраностабилизирующие компоненты, токоферола ацетат, аскорби-
новая кислота и основа, применяется в качестве иммуномодулятора в комплексной
терапии злокачественных новообразований при снижении показателей естественно-
го иммунитета, для профилактики хронических воспалительных заболеваний, лече-
ния и профилактики рецидивирования вирус-ассоциированных неопластических за-
болеваний: генитальной папилломавирусной инфекции, саркомы Калоши. У больных с
онкологическими заболеваниями для терапии хронических вирусных гепатитов В и С
препарат назначают по схеме: при гепатите В — суточная доза 5 млн МЕ/м2, при гепати-
те С — 3 млн МЕ/м2 3 раза в неделю в течение 6-12 мес. Виферон совместим и хорошо
сочетается с химио- и гормонотерапией, не вызывая каких-либо побочных эффектов.
Интерферон-гамма. ИФН-у — лимфоцитарный иммунный интерферон являет-
ся ключевым цитокином как естественного, так и адаптивного иммунитета. Он играет
центральную роль в защите организма от патогенных микроорганизмов и служит не-
обходимым компонентом системы иммунного надзора и регуляции опухолевого ро-
ста. По-видимому, противоопухолевое действие ИФН-у обусловлено комбинацией
его иммуномодулирующей активности, прямого антипролиферативного действия на
опухолевые клетки с подавлением ангиогенеза.
В Российском онкологическом научном центре им. Н. Н. Блохина РАМН проводи-
лось исследование влияния отечественного рекомбинантного ИФН-у Ингарона на эф-
фективность химиотерапии и продолжительность ремиссии у больных диссеминиро-
ванной меланомой кожи. Применялась комбинация противоопухолевых препаратов:
дакарбазин + ломустин + цисплатин. Ингарон назначался по 500 000 ME п/к 5 дней в
неделю до недельного курса химиотерапии и затем, после химиотерапии, 3 дня в не-
делю. Было проведено 84 курса химиотерапии и 1180 введений Ингарона. Оценено
39 больных. Результаты лечения: полный эффект — 10,3 %, частичный эффект — 23,1 %,
стабилизация болезни — 40,3%.
Интерлейкин-2. ИЛ-2 — белок с молекулярной массой 15 кДа, был впервые описан
в 1976 г. как фактор роста Т-клеток. Он продуцируется активированными Т-клетками и
способствует дальнейшему росту Т-лимфоцитов. ИЛ-2 — важный медиатор, в основ-
ном, клеточного иммунитета. К настоящему времени более 20 000 больных во всем
мире получили лечение ИЛ-2 по различным схемам: самостоятельно в различных до-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 51
Современные методы иммунотерапии в онкологии ...
зах, ИЛ-2 + ЛАК (лимфокин-активированные клетки), ИЛ-2 + ИФН, ИЛ-2 + цитостатики
и др. Однако, несмотря на большие надежды, спектр опухолей, при которых ИЛ-2 эф-
фективен, оказался довольно узким, наилучшие результаты получены при раке почки
и метастатической меланоме. Высокодозная иммунотерапия ИЛ-2 имеет в основном
историческое значение и практически не используется в настоящее время из-за воз-
никающих осложнений, вызванных токсичностью препарата.
Один из подходов повышения эффективности терапии рака почки и злокачественной
меланомы — комбинация ИЛ-2 и ИФН-а + химиопрепараты. Комбинация данных цито-
кинов с 5-фторурацилом в нескольких исследованиях вызвала до 17 % полных ответов и
12-39% частичных ответов у больных метастатическим раком почки. В других исследо-
ваниях с помощью химиоцитокинотерапии объективный эффект достигнут в 33% слу-
чаев, комбинация ИЛ-2 + ИФН-а давала 28% эффективности, а только ИЛ-2 — всего 6%.
Длительные инфузии ИЛ-2 в низких дозах применяются для стимуляции иммунного
ответа против инфекционных агентов и подавления роста опухолевых клеток у боль-
ных гемобластозами после трансплантации костного мозга.
Фактор некроза опухолей занимает особое место среди цитокинов. Свое название
он получил в связи со способностью вызывать геморрагический некроз некоторых
опухолей у экспериментальных животных. Клиническое применение ФНО ограниче-
но его высокой токсичностью, вследствие чего основные исследования направлены
на разработку методов снижения этой токсичности. Наиболее часто встречающимся
проявлением токсичности при в/в введении были развитие в ближайшее время после
него озноба, повышение АД, тахикардия; спустя 1-2ч — повышение температуры тела
длительностью в несколько часов. Учитывая дозолимитирующую токсичность при си-
стемном введении, разрабатываются альтернативные методы введения, позволяющие
создать локально высокую концентрацию препарата. Один из таких методов — со-
здание искусственного круга кровообращения для введения ФНО больным с локали-
зацией опухоли на конечностях. Введение больным с меланомой и саркомой мягких
тканей ФНО в дозе до 0,2 мг в течение определенного времени (от нескольких часов
до суток) в изолированную конечность самостоятельно или в комбинации с ИФН-а
и химиопрепаратами давало значительный клинический эффект. К данному мето-
ду можно также отнести разрабатываемое в настоящее время в России регионарное
введение препарата при меланоме глаза (сучетом анатомических особенностей кро-
воснабжения).
В настоящее время изучается отечественный препарат Альнорин — человеческий
рекомбинантный ФНО, это полипептид из 153 аминокислотных остатков, выделенных
из трансформированных клеток £. со//. Введение Альнорина в течение 2 нед. (1-3 ME
в 1-3-й день) до химиотерапии позволило получить медиану общей выживаемости
больных с диссеминированной злокачественной меланомой 27 мес. по сравнению с
9,3 мес. в контрольной группе.
В настоящее время проводятся исследования по изучению клинической эффектив-
ности некоторых других цитокинов и их комбинации с противоопухолевыми препа-
ратами.
Цитокины способны стимулировать рост и дифференцировку клеток - предшест-
венников гемопоэза, т.е. являются ростовыми факторами гемопоэза. Группа ростовых
факторов гемопоэза получила название колониестимулирующих факторов (КСФ),
т.к. они определяются в основном по способности формировать клеточные колонии
в культуре клеток костного мозга. КСФ не обладают противоопухолевыми свойства-
ми, но учитывая то значение, которое они приобрели в современной клинической хи-
миотерапии опухолевых заболеваний, им посвящен специальный раздел (гл. 5) и они
включены в гл. 8.
52 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Современные методы иммунотерапии в онкологии ...
Иммуномодуляторы
В последние годы появились принципиально новые иммуномодуляторы направлен-
ного (таргетного) действия. К ним относятся производные талидомида и иммуноконъ-
югаты.
Леналидомид (Ревлимид) — производное талидомида, обладает иммуномодулиру-
ющим свойством (пролиферация Т-лимфоцитов, продукция ИЛ-2 и ИФН-у, ингибирует
синтез ФНО-а и ИЛ-6 и снижает экспрессию молекулы адгезии, подобно талидомиду,
подавляет ангиогенез). При приеме внутрь в дозе 10 мг/сут используется при трансфу-
зионно-зависимых миелодиспластических синдромах (МДС) низкого и промежуточ-
ного риска с делецией 5q. В сочетании с дексаметазоном в качестве второй линии хи-
миотерапии применяется при множественной миеломе в дозе 25 мг/сут (1-21-й день
каждые 28 дней). Учитывая опасность пороков развития плода, абсолютно противо-
показан при беременности.
Денилейкин дифтитокс (Онтак) — это рекомбинантный иммунотоксин, пред-
ставляющий собой химерный белок из фрагмента человеческого ИЛ-2 и субъеди-
ниц А и В дифтерийного токсина. Специфически связываясь с рецептором ИЛ-2, CD52
проникает в клетку, где высвобождение дифтерийного токсина приводит к ее гибели.
В дозе 9-18 мкг/сут каждый 21-й день применяется при Т-клеточных лимфомах кожи,
экспрессирующих CD52, в случае устойчивости к стандартной химиотерапии и при
рецидивах. Побочные эффекты: гриппоподобный синдром, аллергические реакции,
повышенная проницаемость капилляров, диарея, гепатотоксичность.
Неспецифические иммуномодуляторы
Иммуномодуляторы в настоящее время широко используются в онкологии. Одна-
ко рекомендованы могут быть лишь те препараты, которые прошли клинические ис-
следования и для которых разработаны показания и режимы введения. Большинство
этих препаратов обладает хорошо изученным механизмом действия и преимущест-
венным влиянием на то или иное звено иммунной системы, что указывает на необхо-
димость предварительной оценки состояния иммунитета в каждом конкретном слу-
чае и назначения препарата в соответствии с ее дефектом. Наиболее целесообразно
применять их при вторичных иммунодефицитах, являющихся следствием опухолево-
го процесса, а также хронических, вялотекущих и рецидивирующих инфекционно-
воспалительных процессах любой локализации. Рекомендуется также раннее при-
менение иммуномодуляторов при назначении этиотропных химиотерапевтических
средств или в различных комбинациях со стандартным противоопухолевым лечением.
Полиоксидоний. Влияние полиоксидония на эффективность лечения онкологиче-
ских больных, переносимость послеоперационной химиотерапии исследовалось при
широком спектре злокачественных новообразований.
В большинстве исследований с применением полиоксидония у онкологических
больных сообщается об иммунокоррекции основных иммунологических и гематоло-
гических показателей, что позволяет проводить адекватное лечение и улучшать каче-
ство жизни больных. Оказалось, что применение препарата по 6 мг в/м через день в
интервалах между курсами химиотерапии сопровождается улучшением как основ-
ных, так и дополнительных показателей качества жизни больных РМЖ. Режим удобен
для амбулаторного применения и может быть использован в качестве сопроводитель-
ной терапии у онкологических больных.
Иммунофан. Химиотерапия в сочетании с иммунофаном проводилась больным с
различными злокачественными опухолями. В исследовании, включавшем 224 боль-
ных, препарат назначался по 1 мл в/м через день, 10 инъекций или по 2 мл через
день, 5 инъекций. Как правило, лечение иммунофаном начиналось за 3-5 дней до
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 53
Современные методы иммунотерапии в онкологии ...
введения противоопухолевых препаратов и продолжалось во время химиотерапии.
Положительное влияние иммунофана на продолжительность ремиссии отмечено при
РМЖ и МРЛ.
При химиотерапии опухолей различной локализации у больных, леченных с приме-
нением иммунофана, лейкопения возникает на 4-30% (в среднем на 17 %) реже, гепа-
тотоксичность встречалась в 1,5-2 раза реже. В целом пациенты, получавшие иммуно-
фан, переносили химиотерапию лучше, чем те, кто не подвергался иммунокоррекции.
Исследование иммунологических показателей выявило, что применение иммунофа-
на способствовало сохранению и даже повышению уровня Т-клеточных популяций у
больных, проходивших агрессивную химиотерапию. Кроме того, полученные данные
указывают, что сопутствующие вирусные заболевания при использовании иммунофа-
на возникают в 1,5-2 раза реже.
Побочные явления иммунофана выявлены у 2,4 % больных и выражались в сыпи, зуде
кожи, аллергических реакциях в виде затрудненного дыхания, беспокойства, возбу-
ждения. Указанные токсические реакции, связанные с приемом иммунофана, харак-
теризовались умеренной выраженностью и продолжались после отмены препарата
не более 1 нед.
Галавит — натриевая соль аминофталазина, зарегистрирован как противовоспали-
тельный препарат с иммуномодулирующим действием. Основные свойства препара-
та (регуляция активности макрофагов и синтеза ими про- (ИЛ-1, ИЛ-6, ФНО-а) и про-
тивовоспалительных (ИЛ-10) цитокинов; стимулирующее действие на фагоцитарную
активность нейтрофилов при ее исходном дефиците; антиоксидантное действие; ре-
гуляция репарации поврежденных тканей) позволили применять его в онкологии. Ис-
следования проводились при различных нозологических формах опухолей (рак же-
лудка, пищевода, молочной железы, мочевого пузыря и др.). Применение галавита в
ранний послеоперационный период (за 5 дней до и в течение 5 дней после операции
ежедневно в дозе 0,1 г, суммарная доза 1 г) вызывало статистически значимое увели-
чение количества лимфоцитов, экспрессирующих CD3, CD7, CD38, CD50, CD20. Кроме
того, исследовали поглотительную способность и ферментативную функцию нейтро-
филов (миелопероксидаза, щелочная фосфатаза). Показано, что применение галавита
способствует снижению частоты развития и тяжести течения инфекционных заболе-
ваний; улучшает переносимость полихимиотерапии, снижая частоту развития побоч-
ных эффектов; улучшает общее состояние больных и повышает качество их жизни;
способствует коррекции показателей иммунной системы.
Ликопид представляет собой синтезированный универсальный фрагмент клеточной
оболочки практически всех бактерий (глюкозаминилмурамилдипептид). Основной
мишенью препарата являются клетки моноцитарно-макрофагального ряда. Под вли-
янием ликопида повышается фагоцитоз, возрастает продукция цитокинов (ИЛ-1, ФИО,
КСФ, ИФН и др.), растет экспрессия антигенов HLA-DR. Ликопид применялся у больных
раком легкого и ЖКТ (больные получали препарат по стандартной схеме 10 мг внутрь
утром натощак в течение 7-10 дней, 1 или 2 курса препарата с интервалом 2 нед. на
фоне основной терапии). В группе получавших ликопид отмечалась положительная
динамика иммунологических показателей: увеличение клеток CD3+, CD4+, соотноше-
ния CD4+/CD8+, усиление поглотительной и переваривающей функций нейтрофилов,
уменьшение или отсутствие эпизодов инфекционных заболеваний, положительная
клиническая динамика в виде уменьшения тяжести течения инфекционного процес-
са. Таким образом, результаты исследований позволяют заключить, что ликопид может
применяться при лечении инфекционных осложнений у больных с распространенны-
ми формами злокачественных новообразований в комплексной поддерживающей те-
рапии данной категории пациентов.
54 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Глава 5
Колониестимулирующие факторы
Н. И. Переводчикова
Колониестимулирующие факторы (КСФ) — это цитокины, необходимые для прогрес-
сии клеток от полипотентной стволовой до зрелых дифференцированных клеток кро-
ви, обладающих также способностью влиять на функцию последних.
К ним относятся гранулоцитарный колониестимулирующий фактор (Г-КСФ), сти-
мулирующий продукцию нейтрофилов, гранулоцитарно-макрофагальный КСФ (ГМ-
КСФ), стимулирующий продукцию гранулоцитов и макрофагов, макрофагальный КСФ
(М-КСФ), стимулирующий продукцию моноцитов, ИЛ-3 и И Л-11, обладающие способ-
ностью влиять на клетки-предшественники белой, красной крови и мегакариоцитов,
эритропоэтин (ЭПО), влияющий на клетки-предшественники эритроцитов и мегака-
риоцитов, тромбопоэтин, стимулирующий развитие мегакариоцитов, а также фактор
роста стволовых клеток, способный стимулировать рост стволовых кроветворных
клеток, и ФЛЕ 3 — лиганд, стимулирующий рост ранних предшественников в костном
мозге и периферической крови.
Эти КСФ теперь получают методами биотехнологии.
В настоящее время в клинической практике широко используются Г-КСФ, ГМ-КСФ,
ЭПО и ИЛ-11. Применение КСФ способствует проведению полноценных режимов
противоопухолевой химиотерапии; у больных отмечается значительно более корот-
кий период нейтропении, менее выраженная тромбоцитопения и меньшее количе-
ство инфекционных осложнений. Кроме того, появляется возможность проведения
более интенсивной химиотерапии, т.к. применение КСФ позволяет уменьшить интер-
вал между курсами лечения. КСФ используются при трансплантации костного моз-
га; в результате при аутологичной трансплантации длительность нейтропении IV сте-
пени сокращалась с 20 до 13 дней. При аллогенной трансплантации использование
КСФ рекомендуется для стимуляции приживления нейтрофилов, особенно у больных
с высоким риском отторжения трансплантатов. Особое значение имеет использова-
ние КСФ для мобилизации стволовых клеток периферической крови; Г-КСФ и ГМ-КСФ
уже на 4-5-й день введения способствуют их максимальному выбросу.
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 55
Колониестимулирующие факторы
Таблица 5.1, Сравнительная характеристика эффектов гранулоцитарного и
гранулоцитарно-макрофагального колониестимулирующих факторов
Пролиферация/дифференцировка Г-КСФ (филграстим) ГМ-КСФ (сарграмостим)
Нейтрофилы Да Да
Эозинофилы Нет Да
Макрофаги Нет Да
Миграция нейтрофилов Усиливает Ингибирует
ЭПО позволяют снизить потребность в гемотрансфузиях у больных, у которых про-
тивоопухолевая химиотерапия осложнена анемией.
В табл. 5.1 представлена сравнительная характеристика эффектов Г-КСФ и ГМ-КСФ.
Сравнительные клинические исследования Г-КСФ и ГМ-КСФ (филграстима и саргра-
мостима) показали несколько более выраженные побочные эффекты ГМ-КСФ, однако
четких доказательств преимущества одного препарата перед другим получено не было.
Г-КСФ и ГМ-КСФ широко используются в клинике для борьбы с нейтропенией, а так-
же для предупреждения миелосупрессии при интенсификации терапии; тем не менее
следует учитывать, что они значительно удорожают лечение.
Применение этих препаратов позволяет уменьшить число опасных для жизни ин-
фекционных осложнений, которые развиваются у больных с нейтропенией.
По современным представлениям, применение Г-КСФ и ГМ-КСФ показано:
В для уменьшения возможности развития нейтропении при проведении первого
цикла химиотерапии, если риск этого осложнения выше или равен 20% (первич-
ная профилактика);
® при проведении повторных циклов химиотерапии, если предыдущий цикл
осложнился фебрильной нейтропенией (ФН), а снижение дозы цитостатиков не-
желательно, т.к. может ухудшить результаты химиотерапии (вторичная профи-
лактика);
® при высокодозной химиотерапии под защитой трансплантацией стволовых кле-
ток периферической крови или аутотрансплантацией костного мозга;
И при лечении развившейся ФН, обычно при угрожающей жизни инфекции или
при необходимости длительной терапии антибиотиками и противогрибковыми
препаратами.
Особым показанием к применению КСФ при проведении стандартной химиотера-
пии служит снижение резервов костномозгового кроветворения вследствие ранее
проведенной химио- или лучевой терапии, наличие ВИЧ (СПИДа), проведение химио-
терапии на фоне активной инфекции.
КСФ вводят не ранее чем через 24 ч после цитостатиков, но не одновременно с ними.
Использование КСФ противопоказано во время облучения органов грудной клетки в
связи с риском осложнений.
Гранулоцитарный колониестимулирующий фактор
Клиническое применение получили три препарата Г-КСФ: филграстим (Нейпоген,
Лейкостим, Грасальва, Граноген), ленограстим (Граноцит), пэгфилграстим (Неуластим).
Филграстим (Filgrastim) (Нейпоген) представляет собой негликозилированный
рекомбинантный человеческий метиониловый Г-КСФ. Это высокоочищенный белок,
состоящий из 175 аминокислот, который регулирует продукцию нейтрофилов и их
выход в кровь из костного мозга.
56 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Колониестимулирующие факторы
Показания: сокращение продолжительности нейтропении и уменьшение ее выра-
женности у больных, получающих цитостатики по поводу злокачественных
немиелоидных опухолевых заболеваний.
Дозы и режимы: 0,5 млн ЕД (5 мкг) на 1 кг массы тела 1 раз в сутки парентерально.
У больных, получающих интенсивную химиотерапию с аутотранспланта-
цией костного мозга, филграстим применяют в дозе 2 млн ЕД (20 мкг)/кг в
сутки непрерывным п/к вливанием или 3 млн ЕД (30 мкг)/кг в сутки непре-
рывным в/в вливанием. Суточная доза у таких больных корректируется в за-
висимости от числа нейтрофилов в периферической крови и может дохо-
дить до 70 млн ЕД/кг. Филграстим вводится как п/к, так и в/в, причем первую
дозу следует вводить не ранее чем через 24 ч после введения цитостатиков.
Как правило, через 1-2 дня после начала применения препарата наблюдает-
ся преходящее увеличение количества нейтрофилов, однако лечение следу-
ет продолжить, пока показатели крови стабильно не нормализуются (обычно
7-14 дней). Филграстим можно разводить 5% раствором глюкозы, однако если
он разводится до концентрации менее 1,5 млн ЕД (15 мкг) на 1 мл, то к раство-
ру надо прибавлять сывороточный глобулин человека. Нельзя разводить пре-
парат до конечной концентрации менее 0,2 млн ЕД (2 мкг)/мл. Нельзя разво-
дить его солевыми растворами.
Побочное действие: боль в мышцах и костях, дизурия, преходящее понижение
АД, обратимое умеренное повышение активности ЛДГ, ЩФ, ГГТ и уровня сы-
вороточной мочевой кислоты, лейкоцитоз 100 х 109/л и выше у небольшого
числа больных.
Ленограстим (Lenograstim) (Граноцит) — рекомбинантный человеческий глико-
зилированный Г-КСФ, высокоочищенный рекомбинантный протеин, регулирующий
механизм пролиферации дифференцировки и активности клеток крови нейтрофиль-
ного ряда, увеличивает количество нейтрофилов в периферической крови и повыша-
ет их способность к фагоцитозу и миграции.
Показания: профилактика и лечение нейтропений у больных, получающих миело-
супрессивную цитостатическую терапию по поводу немиелоидных злокаче-
ственных опухолей, при трансплантации костного мозга и периферических
стволовых клеток, а также у больных с врожденными и приобретенными апла-
зиями костного мозга и ВИЧ-инфекцией.
Дозы и режимы: 150 мкг (19,2 млн ME) на 1 м2 в сутки. При химиотерапии применя-
ют через сутки после окончания курса лечения и вводят п/к (разводят содер-
жимое флакона прилагаемой водой для инъекций) ежедневно до достижения
стабильного уровня нейтрофилов в периферической крови. При трансплан-
тации костного мозга вводят в/в в течение 30 мин ежедневно до стабильной
нормализации содержания количества нейтрофилов в периферической кро-
ви. Для в/в инфузий содержимое флакона разводят вначале прилагаемой во-
дой для инъекций, а затем 0,9% раствором натрия хлорида (дозу 13,4 млн ME
не более чем в 50 мл, дозу 33,6 млн ME не более чем в 140 мл).
Побочное действие: мышечная и костная боль, лейкоцитоз, тромбоцитопения,
боль в месте введения.
Пэгфилграстим (Pegfilgrastim) (Неуластим) — рекомбинантный пегилированный
Г-КСФ (филграстим), конъюгированный с полиэтиленгликолем, что увеличивает пери-
од его полувыведения с 3,5 до 15-30 ч после однократного п/к введения. Способст-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 57
Колониестимулирующие факторы
вует росту и дифференцировке стволовых клеток миелоидного ряда. Может улучшать
выживаемость и функцию гранулоцитов.
Показания: профилактика гранулоцитопении и связанных с нею инфекций у боль-
ных с немиелоидными опухолевыми заболеваниями и высоким риском разви-
тия этих осложнений в результате химиотерапии.
Дозы и режимы: п/к в дозе 6 мг однократно, обычно на 2-е сутки после введе-
ния противоопухолевого препарата с повторением после каждого 21- или
28-дневного цикла химиотерапии. Вводится не позже 14 дней и не ранее чем
через 24 ч после каждого цикла химиотерапии.
Использование пэгфилграстима у больных с заболеваниями миелоидного
кроветворения требует осторожности, т.к. может способствовать росту лей-
козных клеток.
У детей рекомендовано не использовать стандартную дозу 6 мг, а применять
индивидуальную дозу, так же как и у взрослых с массой тела менее 45 кг.
Побочное действие: лейкоцитоз с появлением незрелых форм лейкоцитов в пе-
риферической крови, обострение ранее существовавших кожных заболева-
ний, возможно развитие пиодермии, боль в мышцах и костях, спленомегалия,
повышение активности ЛДГ, аллергические реакции, возможно развитие ле-
гочного дистресс-синдрома.
Гранулоцитарно-макрофагальный колониестимулирующий фактор
ГМ-КСФ — белок, состоящий из 127 аминокислот. Молекулярная масса варьирует
от 14 до 35 кДа в зависимости от степени гликозилирования. Продуцируется моно-
цитами/макрофагами, эндотелиальными и тучными клетками, фибробластами, Т- и 13-
лимфоцитами. Стимулирует пролиферацию и дифференцировку ранних миелоидных
клеток-предшественников, гранулоцитов и моноцитов, усиливает цитотоксическую
и гранулоцитарную активность гранулоцитов и эозинофилов, усиливает продукцию
тромбоцитов и ряда цитокинов (ИЛ-1, ИЛ-6, ФИО).
Молграмостим (Molgramostim) (Лейкомакс) — рекомбинантный человеческий
ГМ-КСФ, представляет собой водорастворимый негликозилированный белок, содер-
жащий изолейцин в положении 100. Обладает способностью стимулировать проли-
ферацию и активацию гранулоцитов и моноцитов/макрофагов.
Показания: применяется у больных, получающих миелосупрессивную противоо-
пухолевую химиотерапию, особенно в случае интенсификации лечения для
уменьшения степени нейтропении и снижения риска инфекционных ослож-
нений, а также у больных с другими состояниями недостаточности костного
мозга (МДС, апластическая анемия), при пересадках аутологичного или син-
генного костного мозга для ускорения восстановления миелоидного кровет-
ворения, при лейкопениях, вызванных инфекциями (включая ВИЧ).
Дозы и режимы: п/к 5-10 мкг/кг массы тела в день ежедневно в течение 7-10 дней.
Лечение начинают не ранее чем через 24 ч после введения цитостатиков. Ис-
ходная доза обычно 5 мкг/кг/сут. При трансплантации костного мозга суточная
доза 10 мкг/кг в/в, при инфекциях — 1-3 мкг/кг/сут п/к. Перед использовани-
ем молграмостим разводят, добавляя во флакон 1 мл растворителя (бактери-
остатическая или стерильная вода для инъекций), полученный раствор вво-
дят п/к. При в/в введении раствор молграмостима, полученный как описано
выше, разводят дополнительно нормальным физиологическим раствором или
5% раствором глюкозы так, чтобы получить концентрацию не менее 7 мкг/мл.
Необходимо следовать специальной инструкции по применению, чтобы из-
58 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Колониестимулирующие факторы
бежать потери препарата в результате адсорбции на компонентах систем для
вливания.
Побочное действие: наиболее часто отмечаются подъем температуры тела, тош-
нота, одышка, диарея, высыпания, судороги, реакции в месте инъекции (при
п/к введении), рвота, чувство усталости, анорексия, мышечно-скелетная боль
и астенические явления.
Сарграмостим (Sargramostim) (Лейкин) — ГМ-КСФ, представляет собой глико-
зилированный белок, способствующий росту и дифференцировке клеток-предше-
ственников миелоидного ряда, улучшающий выживаемость и функцию гранулоцитов,
эозинофилов, моноцитов и макрофагов. Вызывает освобождение вторичных цитоки-
нов (ИЛ-1 и ФНО).
Показания: восстановление количества нейтрофилов после индукционной терапии
острого миелолейкоза, миелоидного кроветворения после трансплантации
костного мозга или стволовых клеток, мобилизация стволовых клеток пери-
ферической крови, а также в случаях гранулоцитопении при МДС, апласти-
ческой анемии и гранулоцитопении, осложняющей СПИД и его терапию, при
нейтропении на фоне химиотерапии солидных опухолей.
Дозы и режимы: при индукционной терапии острого миелолейкоза — 250 мкг/м2/сут
4-часовая в/в инфузия через 4 дня после завершения индукционной терапии
до восстановления количества нейтрофилов, но не более 42 дней. Мобили-
зация стволовых клеток в периферической крови — 250 мкг/м2/сут 24-часо-
вая в/в инфузия или п/к 1 раз в сутки. Трансплантация стволовых клеток пери-
ферической крови — 250 мкг/м2/сут 24-часовая в/в инфузия или п/к 1 раз в
сутки сразу после инфузии стволовых клеток. Трансплантация костного моз-
га — 250 мкг/м2/сут 2-часовая в/в инфузия через 2-4 ч после трансплантации.
Безуспешная трансплантация костного мозга или ее отсрочка — 250 мкг/м2/
сут 2-часовая в/в инфузия на протяжении 14 дней. Нейтропения на фоне хи-
миотерапии солидных опухолей — 250 мкг/м2/сут п/к не ранее чем через 24 ч
после завершения химиотерапии. При апластической анемии, МДС, СПИДе —
150-100 мкг/м2 п/к или в/м ежедневно. Противопоказан при высоком содер-
жании бластов (> 10%) в крови или костном мозге.
Побочное действие: тахикардия, одышка и тошнота нередко возникают после
первого введения, возможно обострение дерматологических заболеваний,
сыпь, боль в костях, в спине, гриппоподобный синдром, при высоких дозах
иногда задержка жидкости, перикардит, тромбы.
В России сарграмостим не зарегистрирован.
Опрелвекин (Oprelvekin) (ИЛ-11, Ньюмега) — фактор роста мегакариоцитов, вхо-
дит в группу КСФ. Стимулирует пролиферацию предшественников мегакариоцитов
и способствует их созреванию, увеличивая тем самым количество тромбоцитов при
тромбоцитопении, осложняющей использование цитостатиков.
Показания: предупреждение тяжелой тромбоцитопении, осложняющей химиоте-
рапию немиелоидных опухолевых заболеваний.
Дозы и режимы: 50 мкг/кг п/к 1 раз в сутки ежедневно, начиная с 6-24 ч после
окончания курса химиотерапии до восстановления количества тромбоцитов
до 50 000/мкл (не рекомендовано применять более 21 дня). Следующий курс
химиотерапии начинают не ранее чем через 2 дня после окончания введения
опрелвекина. Особая осторожность нужна у больных с предсердной арит-
мией или сердечной недостаточностью.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 59
Колониестимулирующие факторы
Побочное действие: аритмия (мерцание) возможны фибрилляция предсердий, за-
держка жидкости, отеки, аллергические реакции, конъюнктивальная инъекция,
нарушение зрения, отек зрительного нерва, головокружение, нарушение сна.
Эритропоэтин (Erythropoietin)
Анемия — один из наиболее частых симптомов, сопровождающих развитие злока-
чественных опухолевых процессов, служит независимым фактором неблагоприятно-
го прогноза выживаемости больных.
Анемия наблюдается у 40% больных немиелоидными злокачественными опухоля-
ми: легкая — в 30% случаев, умеренная — в 9% и тяжелая — в 1 %. Общая частота ане-
мии во время противоопухолевого лечения (химио- или лучевой терапии) составляет
54% (легкая — 39 %, умеренная — 14%, тяжелая — 1 %). Чаще всего анемия осложняет
терапию производными платины.
Рекомендации ESMO (Европейское общество медицинской онкологии) определяют
анемию как снижение концентрации гемоглобина (НЬ), числа эритроцитов или гема-
токрита ниже нормального уровня. В зависимости от концентрации гемоглобина вы-
деляют анемию легкой (НЬ 10-11,9 г/дл), умеренной (НЬ 8,0-9,9 г/дл) и тяжелой степе-
ни (НЬ < 8 г/дл).
Эритропоэтин (ЭПО) — гликопротеид, состоящий из 193 аминокислот, с молекуляр-
ной массой 34 кДа. Синтезируется клетками почек, в небольших количествах — купфе-
ровскими клетками печени. ЭПО действует на ранних стадиях гемопоэза и способствует
пролиферации и созреванию клеток-предшественников эритроидного ряда.
В клинической практике используется эпоэтин — рекомбинантный человеческий
ЭПО, способствующий образованию эритроцитов из стволовых клеток. В онкологи-
ческой практике применяется при анемиях, осложняющих химиотерапию немиело-
идных злокачественных новообразований, в частности при длительном применении
производных платины, а также при анемиях, осложняющих течение опухолевого за-
болевания, и у ВИЧ-инфицированных больных, получающих лечение зидовудином.
Характерной особенностью ЭПО является его медленное действие, поэтому оцени-
вать его эффективность можно не ранее чем через 4-8 нед. с момента начала лечения.
Выпускается в виде эпоэтина-а и эпоэтина-/?.
Эпоэтин-а (Эпрекс, Эпокрин, Эритростим, Эпоген, Эпокрит) применяется п/к или
в/в в начальной дозе 150 МЕ/кг массы тела 3 раза в неделю с возможной эскалацией
дозы до 200 МЕ/кг 3 раза в неделю. Выпускается во флаконах и шприц-ампулах, содер-
жащих от 1000 до ЮОООЭПО-сг.
Эпоэтин-/? (Рекормон, Эпостим) вводится п/к или в/в в дозе 450 МЕ/кг в неделю
(недельная доза делится на 3-7 введений). Выпускается во флаконах, содержащих
1000, 2000 и 5000 ME лиофилизированного ЭПО-Д
Дарбэпоэтин-а (Аранесп) — рекомбинантный гликопротеид, по биологическим
свойствам сходный с эндогенным ЭПО. В отличие от эндогенных и рекомбинантных
ЭПО содержит не 3, а 5 N-связанных углеводных цепей, почему обладает более дли-
тельным периодом полувыведения.
Показание: симптоматическая анемия у взрослых онкологических больных с неми-
елоидными злокачественными опухолями, получающих противоопухолевую
химиотерапию.
Дозы и режимы: вводится п/к или в/в. Начальная доза препарата 500 мкг (6,75 мкг/кг)
1 раз в 3 нед. либо по 2,25 мкг/кг 1 раз в неделю. Целевой уровень гемогло-
бина составляет от 10 до 12 г/л. После достижения целевого уровня гемогло-
бина дозировку уменьшают на 25-30% для адъювантного контроля анемии
с использованием минимальных доз препарата. Возможно титрование дозы
60 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Колониестимулирующие факторы
между 500, 300 и 150 мкг. Применение дарбэпоэтина прекращают после за-
вершения химиотерапии.
Побочное действие: возможны аллергические реакции вплоть до развития ана-
филаксии, одышка, сыпь, крапивница, тромбоэмболии, повышение АД, диа-
рея, изредка — тошнота и рвота.
Применение препаратов, стимулирующих эритропоэз — ЭСП (эпоэтины и дарбэпо-
этин), позволяет уменьшить анемию без использования гемотрансфузий, однако тре-
бует осторожности. Метаанализ 57 рандомизированных исследований показал, что
применение ЭСП может ухудшать отдаленные результаты лечения онкологических
больных, что, возможно, связано со стимуляцией опухолевого роста. Соответственно
проводятся дополнительные исследования и внесены изменения в рекомендации по
применению стимуляторов эритропоэза, которые в принципе сводятся к тому, что эти
препараты в минимальных дозах целесообразно применять только при анемиях, выз-
ванных химиотерапией, и не следует использовать у больных, которые химиотерапию
не получают.
Приводим последние рекомендации ESMO по применению ЭСП (2009).
Назначение ЭСП показано для лечения симптомной анемии, индуцированной хи-
миотерапией, у взрослых пациентов, страдающих немиелоидными злокачественны-
ми опухолями. Целью применения служит предупреждение гемотрансфузий, связан-
ных с ними осложнений и возможность улучшения качества жизни за счет повышения
уровня гемоглобина.
Больным, получающим химиотерапию, показано назначение ЭСП при уровне
НЬ < 10 г/дл в целях повышения его концентрации не более 12 г/дл или преду-
преждения дальнейшего его снижения.
Больным, получающим химиотерапию, при уровне НЬ 10-12 г/дл ЭСП могут быть
назначены при наличии симптомов анемии или для предупреждения дальней-
шего снижения концентрации гемоглобина. Однако это выходит за рамки ин-
струкций по использованию ЭСП.
Больным, не получающим химиотерапию, ЭСП не показаны поскольку не исклю-
чена возможность повышения риска смерти в случае попытки повысить содер-
жание НЬ > 12 г/дл.
Больным, получающим терапию с возможностью излечения, ЭСП должны назна-
чаться с осторожностью.
И При повышении концентрации НЬ < 1 г/дл по сравнению с исходной после 4 нед.
применения ЭСП вводимая доза должна быть увеличена. Если после дополни-
тельных 4 нед. применения ЭСП уровень гемоглобина повышается более чем на
1 г/дл, вводимая доза может быть оставлена такой же или редуцирована на 25-
50%.
В случае эффективного лечения ЭСП их применение должно быть прекращено
через 4 нед. после прекращения химиотерапии.
При повышении концентрации НЬ < 1 г/дл по сравнению с исходной после
8-9 нед. применения терапия ЭСП считается неэффективной и должна быть
прекращена.
При приросте НЬ > 2 г/дл за 4 нед. или уровне НЬ > 12 г/дл вводимая доза долж-
на быть редуцирована на 25-50%.
При НЬ > 12 г/дл введение ЭСП необходимо прекратить, дождаться снижения
НЬ < 12 г/дл, после чего возобновить введение ЭСП в дозе, сниженной на 25 % по
сравнению с предыдущей.
Концентрация гемоглобина не должна превышать 12 г/дл на фоне лечения ЭСП!
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 61
Глава 6
Бисфосфонаты
Н. И. Переводчикова
Метастатическое поражение костей — одно из частых проявлений опухолевых заболе-
ваний. Костные метастазы часто осложняют течение РМЖ, рака простаты, легкого, почки
и щитовидной железы. ОпухолиЖКТ, ракяичников, меланомы, лимфомы хотя и реже, но
также могут метастазировать в кости. При миеломной болезни множественное опухо-
левое поражение костей — одно из основных проявлений заболевания. Костные мета-
стазы существенно отягчают состояние больных, вызывая боль, патологические пере-
ломы. При поражении позвоночника возникают симптомы компрессии спинного мозга
с явлениями пареза либо паралича конечностей и тазовыми нарушениями.
Обменные нарушения при костных метастазах включают такое потенциально жиз-
неопасное осложнение, как гиперкальциемия.
Медиана выживаемости больных с костными метастазами колеблется от 6 до
48 мес. в зависимости от типа опухоли, а при использовании современных методов
лечения может быть значительно больше и, соответственно, особое значение прио-
бретает качество их жизни. Современная терапия, включающая облучение, хирурги-
ческое вмешательство, химио- и гормонотерапию,улучшает результаты лечения паци-
ентов с костными метастазами, в первую очередь больных, страдающих РМЖ и раком
простаты, а также миеломной болезнью. Особое значение в лечении больных с кост-
ными метастазами имеет использование препаратов, способных специфически влиять
на костную ткань, — бисфосфонатов.
Известно, что костеобразование, происходящее в течение всей жизни человека,
осуществляется за счет активности остеокластов, резорбирующих кость, и остеобла-
стов, формирующих новую костную ткань.
Опухолевые клетки продуцируют ряд факторов роста и цитокинов, а также белок,
ассоциированный с паратиреоидным гормоном (PTHrP — parathyreoid-hormone relat-
ed protein), который рекрутирует предшественники остеокластов и активирует зрелые
остеокласты.
62 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Бисфосфонаты
Один из основных механизмов стимуляции активности остеокластов — активация
рецептора ядерного фактора каппа В (RANK) его природным лигандом RANK-L. RANK
и остеопротегерин конкурируют за связь с RANK-L, что в физиологических условиях
модулирует активность остеокластов и обеспечивает нормальное костеобразование.
При избыточной активности остеокластов без соответствующей активации остеобла-
стов происходит избыточная резорбция кости и образование костных метастазов.
В связи с этим попытки воздействовать на остеокласты, препятствуя их активации,
созреванию и рекрутированию их предшественников, стали основным направлением
исследований по терапии костных метастазов.
Среди препаратов, ингибирующих активность остеокластов (кальцитонин, нитрат
галлия, бисфосфонаты), наиболее активными оказались бисфосфонаты.
Азотсодержащие бисфосфонаты — более активные ингибиторы костной ре-
зорбции, чем бисфосфонаты I поколения. В преклинических исследованиях было по-
казано, что азотсодержащие бисфосфонаты, в частности памидронат, в 10—100 раз
активнее клодроната, ибандронат в 10 раз активнее памидроната, а золедроновая ки-
слота, содержащая в молекуле два атома азота, в 30-850 раз активнее памидроната.
Более выраженная активность азотсодержащих бисфосфонатов позволила сокра-
тить время их введения. Памидронат (Аредиа) в дозе 90 мг вводится в течение 4 ч, ибан-
дронат (Бондронат) в дозе 6 мг— 1 -2 ч, золедроновая кислота (Зомета) в дозе 4 мг — в
течение 15 мин. Доза и время в/в введения бисфосфонатов лимитируются возможной
почечной недостаточностью, следовательно, рекомендуется определение креатини-
на сыворотки крови перед началом применения, а также перед каждым введением
препарата. В случае повышения креатинина очередная инфузия откладывается до тех
пор, пока показатели креатинина не снизятся до исходного уровня или до цифр, лишь
на 10% превосходящих исходный уровень.
При соблюдении критериев отбора больных и мониторирования показателей креа-
тинина в процессе лечения возможно длительное применение современных бисфос-
фонатов без существенных проявлений нефротоксичности.
Другие побочные явления при использовании бисфосфонатов выражены умерен-
но и, как правило, не требуют отмены препарата. В/в введение может сопровождаться
гриппоподобным синдромом, чаще возникающим после первого введения. Это прояв-
ляется лихорадкой, чувством усталости, болью в костях.
Ретроспективный анализ 10 000 больных, получавших терапию бисфосфоната-
ми, выявил редкое, но серьезное осложнение, встречающееся менее чему 1 % боль-
ных, — остеонекроз челюсти. Природа этого осложнения остается неясной, поэтому
рекомендуется тщательно следить за состоянием полости рта у больных, получающих
бисфосфонаты, и избегать во время лечения инвазивных стоматологических вмеша-
тельств.
Клинические исследования показали, что в/в введение бисфосфонатов — метод вы-
бора при гиперкальциемии, вызванной опухолевым поражением костей. Клодронат,
ибандронат, памидронат и золедроновая кислота в рандомизированных исследова-
ниях показали способность снижать число скелетных осложнений, включая перело-
мы, боль, гиперкальциемию и компрессию спинного мозга. Клинические испытания
выявили увеличение времени до первого скелетного осложнения (события), т.е. уве-
личение бессобытийного периода, снижение потребности в лучевой терапии и орто-
педических пособиях и улучшение качества жизни больных с костными метастазами
злокачественных опухолей при использовании бисфосфонатов.
У больных с костными метастазами РМЖ применение бисфосфонатов в дополнение
к гормоно- и химиотерапии снижает риск развития скелетных осложнений. Приме-
нение же бисфосфонатов у больных РМЖ без костных метастазов нецелесообразно.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ.,. 63
Бисфосфонаты
«пяйвиайаяямядаимйияввяйваяамяйвяййв»^^ * ч --w
В связи с тем, что бисфосфонаты используются для лечения остеопении и остеопо-
роза, в настоящее время изучается целесообразность применения этих препаратов у
больных РМЖ в менопаузе, получающих ингибиторы ароматазы в качестве адъюван-
тной терапии.
Первые результаты исследования Z-FAST (Zometa-Femara Adjuvant Synergy Trial) ука-
зывают на то, что использование золедроновой кислоты в дозе 4 мг в/в 1 раз в 6 мес.
может предупреждать явления остеопении у больных, получающих адъювантно ле-
трозол (Фемара).
Аналогичные результаты получены в исследовании ARIBON при использовании
ибандроната в дозе 150 мг внутрь 1 раз в месяцу больных РМЖ, получавших адъюван-
тно анастрозол (Аримидекс).
Использование бисфосфонатов преимущественно в виде ежемесячных в/в инъек-
ций считается международным стандартом лечения больных с костными метастазами,
независимо и одновременно с проведением другой терапии (химио-, гормоно-, луче-
вая терапия).
Применение бисфосфонатов должно начинаться сразу же после обнаружения кост-
ных метастазов и продолжаться неопределенно долго, в зависимости от переносимо-
сти, при регулярном мониторировании функции почек (определение уровня креати-
нина перед очередным введением препарата).
Особый интерес представляет изучение прямого противоопухолевого действия
бисфосфонатов. В экспериментах показана возможность влияния золедроновой ки-
слоты на опухолевый рост in vitro и in vivo путем как прямого воздействия на адгезию
и инвазию опухолевых клеток, так и непрямого влияния на ангиогенез и иммуномоду-
ляцию, а также возможность синергизма золедроновой кислоты и классических про-
тивоопухолевых препаратов, таких кактаксаны и антрациклины.
В одном рандомизированном клиническом исследовании показано улучшение ре-
зультатов у больных РМЖ, получавших адъювантную терапию в комбинации с исполь-
зованием золедроновой кислоты.
Введение в клиническую практику бисфосфонатов существенно улучшило возмож-
ности лечения больных с костными метастазами злокачественных опухолей. Это в
первую очередь относится к больным с костными метастазами РМЖ, при лечении ко-
торых эффективность бисфосфонатов убедительно доказана в метаанализе несколь-
ких тысяч больных, получавших лечение входе современных многоцентровых рандо-
мизированных исследований.
Выявлена возможность снижения числа осложнений, связанных с поражением ко-
стей, так называемых скелетных осложнений, а также возможность уменьшения боли
и улучшения качества жизни больных с помощью бисфосфонатов. Убедительно дока-
зана целесообразность терапии бисфосфонатами больных с костными метастазами
рака простаты и других солидных опухолей (рака легкого, почки).
Наиболее активными препаратами среди бисфосфонатов являются современные
азотсодержащие бисфосфонаты последнего поколения: золедроновая кислота, па-
мидронат, ибандронат. Использование бисфосфонатов при костных метастазах зло-
качественных опухолей параллельно с химио-, гормоно- и лучевой терапией стало
современным международным стандартом лечения больных с костными метастазами
злокачественных опухолей, так же как и пациентов с миеломной болезнью.
Препараты группы бисфосфонатов
Механизм действия: ингибируют резорбцию костной ткани, опосредуемую
остеокластами. Селективное действие основывается на высоком сродстве к
минеральным компонентам кости. Тормозят поступление предшественников
64 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Бисфосфонаты
остеокластов в костную ткань и их последующее превращение в зрелые осте-
окласты, ответственные за резорбцию этой ткани. При наличии гиперкальци-
емии, вызванной опухолью, снижаютуровень кальция и фосфора в сыворотке
крови и уменьшают их выведение, а также выведение гидроксипролина с мо-
чой.
Золедроновая кислота (Zoledronic acid)
Синонимы: Зомета (Zometa), Резорба.
Показания: костные метастазы злокачественных опухолей (рака молочной желе-
зы, рака предстательной железы, рака почки и других злокачественных ново-
образований) и миеломная болезнь (множественная миелома); гиперкальцие-
мия, обусловленная злокачественными опухолями.
Дозы и режимы: в/в капельно в течение 15 мин в дозе 4 мг, каждые 3-4 недели.
Побочное действие: гипертермия, гриппоподобный синдром, головная боль,
конъюнктивит, тошнота, рвота, анорексия, нарушение функции почек, реак-
ции повышенной чувствительности, гипофосфатемия, гипокальциемия, повы-
шение уровня креатинина и мочевины в сыворотке крови.
Форма выпуска: лиофилизированный порошок во флаконах 4 мг.
Ибандроновая кислота (Ibandronic acid)
Синонимы: Бондронат (Bondronat), Ибандронат.
Показания: такие же, каку золедроновой кислоты.
Дозы и режимы: в/в капельно в течение 2 ч в дозе 2-4 мг (в зависимости от степе-
ни гиперкальциемии). Перед введением требуется адекватная регидратация.
При метастатическом поражении костей 6 мг в/в капельно в течение 1 -2 ч (при
нормальной функции почек возможно введение в/в капельно в течение не ме-
нее 15 мин) 1 раз в 3-4 нед. или 50 мг внутрь ежедневно.
Побочное действие: гипертермия, гриппоподобный синдром, реакции повышен-
ной чувствительности.
Форма выпуска: концентрат для инфузий во флаконах 2 мг/2 мл или 6 мг/6 мл; та-
блетки, покрытые оболочкой, 50 мг.
Клодроновая кислота (Clodronic acid)
Синонимы: Бонефос (Bonefos), Клодронат, Клобир, Синдронат, дихлорметиленбис-
фосфонат. Аналог естественного пирофосфата.
Показания: такие же, каку золедроновой кислоты.
Дозы и режимы: применяется внутрь при гиперкальциемии в дозе 3200-
2400 мг/сут, разделенные на 3-4 приема. При нормальном содержании каль-
ция в сыворотке крови суточная доза составляет 2400-1600 мг, разделенных
на 2-3 приема. В/в используется в дозе 3-5 мг/кг. Разводится физиологическим
раствором и вводится в течение 3 ч ежедневно 3-7 дней. После нормализации
содержания кальция в крови больные переводятся на пероральное лечение.
Побочное действие: боль в животе, диарея; редко — головокружение, чувство
усталости, проявляющиеся в начале лечения и затем, при его продолжении,
прекращающиеся. Описано повышение активности ЛДГ. При в/в использова-
нии дозы выше рекомендованных описаны случаи почечной недостаточности.
Необходим контроль за функцией почек и печени.
Форма выпуска: таблетки 400 и 800 мг; капсулы 400 мг; концентрат для инфузий
300 мг/5 мл.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 65
Бисфосфонаты
ммтмнмммаммкммшймямв*титвмимямммймй»мя18тздваж ' * п ч
Памидроновая кислота (Pamidronic acid)
Синонимы: Аредиа (Aredia), Помегара, динатрий памидронат.
Показания: такие же, каку золедроновой кислоты.
Дозы и режимы: 90 мг в 250 мл инфузионного раствора в виде 2-часовой в/в ин-
фузии (скорость не более 60 мг/ч) однократно или по 15-30 мг в течение
2-4 дней. Суммарная доза препарата зависит от содержания кальция в сыво-
ротке крови и не должна превышать 90 мг. При миеломной болезни и гипер-
кальциемии препарат вводится в течение 4 ч и более в 500 мл инфузионного
раствора. Перед введением или в ходе терапии рекомендуется провести ре-
гидратацию 0,9% раствором натрия хлорида. Повторные курсы проводят че-
рез 3-4 нед.
Побочное действие: бессимптомная гипокальциемия, гипертермия, гриппопо-
добные симптомы; иногда — тошнота, рвота, головная боль; редко — мышеч-
ные спазмы, парестезии, гематурия, острая почечная недостаточность.
Форма выпуска: раствор в ампулах 15 мг/5 мл или лиофилизат во флаконах 15,30,
60 и 90 мг с прилагаемым растворителем.
66
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Глава 7
Препараты, обеспечивающие
переносимость цитостатиков
и улучшающие качество жизни
больных в процессе химиотерапии
(сопроводительные препараты)
Н. И. Переводчикова
С развитием химиотерапии (XT), введением в практику ряда новых противоопухоле-
вых препаратов и улучшением результатов лечения онкологических больных особую
актуальность приобрела проблема качества их жизни, в частности качества жизни в
процессе XT.
Использование современной интенсивной XT требует системы обеспечения ее пе-
реносимости. От этого зависит как возможность дать дозу, достаточную для получения
эффекта, так и качество жизни больного в процессе лечения.
В настоящее время в клиническую практику вошел ряд препаратов различного ме-
ханизма действия, направленных на обеспечение переносимости цитостатиков.
Наиболее частое осложнение XT — угнетение миелопоэза.
Использование КСФ позволило получить действенное средство для борьбы с мие-
лосупрессией в процессе противоопухолевой терапии и существенно снизить число
опасных для жизни инфекционных осложнений, возникающих при нейтропении. КСФ
посвящена гл. 5, где приводятся данные о получивших практическое применение пре-
паратах. Они также включены в гл. 8.
Менее опасными для жизни человека, но не менее часто встречающимися ослож-
нениями противоопухолевой XT являются тошнота и рвота. При использовании высо-
коэметогенных терапевтических режимов тошнота и рвота — наиболее субъективно
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 67
Препараты, обеспечивающие переносимость цитостатиков...
ИЯМИ1ИИИ8ЯдаВааВ81ЙЙЙИВЙЙЙ8ИВвЙЛ88Яа38Й88Ща®ай®ЯвайЯЙЙ^^ * *
тягостные для больных токсические проявления, существенно ухудшающие качест-
во жизни больных и нередко служащие основанием для отказа от лечения. Эметоген-
ность различных цитостатиков представлена в гл. 13 табл. 1.
Использование известных антиэметиков, таких как метоклопрамид, кортикостеро-
иды, лоразепам и «коктейли» из этих препаратов, оказывает определенное противо-
рвотное действие, но вызывает ряд побочных явлений, в т.ч. экстрапирамидные рас-
стройства, возникающие при использовании высоких доз метоклопрамида.
Создание противорвотных препаратов группы антагонистов рецепторов серотони-
на (5-НТ3) было результатом направленного поиска активных антиэметиков для боль-
ных, получающих цитостатики и лучевую терапию.
Механизм тошноты и рвоты, возникающей в процессе противоопухолевой тера-
пии, связан с выбросом серотонина (5-НТ) из энтерохромаффиноподобных клеток в
слизистой оболочке тонкого кишечника, что вызывает рвотный рефлекс и ощущение
тошноты за счет активации афферентных волокон блуждающего нерва; это, в свою
очередь, обусловливает освобождение серотонина в area postrema, расположенной
в области дна IV желудочка. Эта богатая рецепторами серотонина формация подвер-
жена и прямому воздействию препаратов, поступающих сюда с кровью.
Эффект препаратов группы антагонистов рецепторов 5-НТ3 по предупреждению
тошноты и рвоты, вызываемых цитостатиками и облучением, связан с блокадой этих
рецепторов на уровне нейронов как периферической, так и центральной нервной си-
стемы.
В настоящее время в нашей стране используется четыре препарата группы сетро-
нов: трописетрон (Навобан, Тропиндол), ондансетрон (Зофран, Латран), гранисетрон
(Китрил) и палоносетрон (Алокси). Применение этих препаратов позволяет полно-
стью купировать или значительно уменьшить тошноту и острую рвоту у 70-80% боль-
ных, а в сочетании с дексаметазоном — у 70-90% пациентов, получающих высоко-
эметогенную XT (цисплатин в дозе более 100 мг/м), и практически у всех больных,
получающих менее эметогенные препараты.
Обладая общим механизмом действия и близкой эффективностью, различные пре-
параты группы антагонистов рецепторов 5-НТ3 отличаются по своей фармакокинети-
ке и, соответственно, по методике применения.
Следует иметь в виду, что при условно-рефлекторной рвоте, носящей психогенный
характер, антагонисты рецепторов 5-НТ3 малоэффективны, т.к. механизм ее возник-
новения иной, и таким больным, скорее, показано применение психотропных средств
(лоразепам).
Для купирования отсроченной рвоты целесообразно дополнительно применять
кортикостероиды и метоклопрамид.
Противорвотным свойством обладают препараты группы антагонистов рецепторов
нейрокинина 1, тормозящие появление рвотного рефлекса путем блокады этих ре-
цепторов (субстанции Р) на уровне ЦНС. К таким препаратам относятся апрепитант
(Эменд), используемый перорально в дозе 80-125 мг в сочетании с дексаметазоном
и сетронами.
Антиэметики группы антагонистов рецепторов серотонина
(антагонисты 5-НТ3~рецепторов, сетроны)
Гранисетрон (Granisetron)
Синонимы: Китрил (Kytril).
Дозы и режимы: вводится в/в до начала цитостатической терапии (при профилак-
тике) или во время появления рвоты либо тошноты (лечение) путем медлен-
68 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Препараты, обеспечивающие переносимость цитостатиков...
ной инъекции (не менее 30 с) или капельно в 20-50 мл 0,9% раствора натрия
хлорида или 5% раствора декстрозы в течение 5 мин в дозе 3 мг. Внутрь назна-
чают по 1 мг 2 раза в сутки, при этом первая доза должна быть принята за 1 ч
до введения химиопрепаратов. В большинстве случаев однократного приме-
нения гранисетрона достаточно для контроля рвоты и тошноты в течение 24 ч.
В случае необходимости возможны повторные дополнительные в/в введения
(с интервалом не менее 10 мин) или прием внутрь до 7 мг дополнительно. Мак-
симальная суточная доза не должна превышать 9 мг.
Побочное действие: головная боль, запор, преходящее повышение активности
аминотрансфераз в сыворотке крови без клинических проявлений гепатоток-
сичности.
Форма выпуска: раствор в ампулах 1 мг/1 мл и 3 мг/3 мл,- таблетки 3 мг.
Ондансетрон (Ondansetron)
Синонимы: Зофран (Zofran), Латран (Latran), Ондасол (Ondasol), Эмесет (Emeset),
Эметрон (Emetron), Домеган, Осетрон.
Дозы и режимы: при умеренной эметогенной химио- или лучевой терапии — 8 мг
в/в струйно медленно или в/м непосредственно перед началом терапии. Он-
дансетрон также можно назначить внутрь в дозе 8 мг за 1 -2 ч до начала основ-
ной терапии с последующим приемом еще 8 мг внутрь через 12 ч или в виде
ректальных суппозиториев 16 мг однократно за 1-2 ч до начала терапии. При
высокоэметогенной XT — 8 мг в/в струйно медленно непосредственно перед
началом XT, а затем еще две в/в инъекции по 8 мг, каждая из которых осуществ-
ляется через 2-4 ч; или непрерывная 24-часовая инфузия препарата в дозе
24 мг со скоростью 1 мг/ч; или 16-32 мг, разведенные в 50-100 мл соответст-
вующего инфузионного раствора, в виде 15-минутной инфузии непосредст-
венно перед началом XT. Рекомендуемая доза для приема внутрь составляет
24 или 16 мг (1 суппозиторий однократно) за 1-2 ч до начала XT. Эффектив-
ность ондансетрона может быть увеличена путем разового в/в введения кор-
тикостероида (например, 20 мг фосфорно-натриевой соли дексаметазона) до
начала XT. Для профилактики поздней или длительной рвоты, возникающей
через 24 ч после окончания курса химио- или лучевой терапии, следует про-
должить прием препарата по 8 мг 2 раза в сутки или по 16 мг (1 суппозиторий)
1 раз в сутки в течение 5 дней.
Побочное действие: головная боль, головокружение, чувство жара в голове и в
эпигастрии, нарушения сна, икота, сухость во рту, запор или диарея.
Форма выпуска: раствор в ампулах 4 мг/2 мл и 8 мг/4 мл; таблетки 4 и 8 мг; сироп во
флаконах 40 мг/50 мл; суппозитории ректальные 16 мг.
Палоносетрон (Palonosetron)
Синонимы: Алокси Хелсинн.
Дозы и режимы: 0,25 мг в/в медленно (не менее 30 с) за 30 мин до начала XT. Не ре-
комендуется введение препарата в течение последующих 7 дней. Эффект
препарата по предотвращению тошноты и рвоты, вызываемых проведением
XT, возрастает при одновременном назначении кортикостероидов.
Побочное действие: головная боль, головокружение, запор, боль в животе, ди-
арея, повышенная сонливость или бессонница, чувство беспокойства, эйфо-
рия, транзиторное повышение активности печеночных аминотрансфераз.
Форма выпуска: раствор во флаконах 0,25 мг/5 мл.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 69
Препараты, обеспечивающие переносимость цитостатиков...
Трописетрон (Tropisetron)
Синонимы: Навобан (Navoban), Тропиндол (Tropindol).
Дозы и режимы: в/в 5 мг, растворенных в 100 мл 0,9% раствора натрия хлорида
или 5% раствора декстрозы непосредственно перед введением цитостатиков
(возможно медленное в/в введение содержимого ампулы без разведения).
Последующие 5 дней по 5 мг внутрь утром за 1 ч до завтрака.
Побочное действие: головная боль, головокружение, запор, боль в животе, диа-
рея, чувство усталости.
Форма выпуска: раствор в ампулах 5 мг/5 мл; капсулы 5 мг.
Антиэметики группы антагонистов рецепторов нейрокинина 1
(антагонисты NK1-рецепторов)
Лекарственные средства, тормозящие появление рвотного рефлекса путем блока-
ды рецепторов NK1 (субстанции Р) на уровне ЦНС.
Апрепитант (Aprepitant)
Синонимы: Эменд (Emend).
Дозы и режимы: внутрь вне зависимости от приема пищи. При высокоэметогенной
XT препарат применяется в дозе 125 мг за 1 ч до начала XT в 1-й день в соче-
тании с дексаметазоном (12 мг внутрь) и ондансетроном (32 мг в/в) за 30 мин
до начала XT. Во 2-й и 3-й дни апрепитант 80 мг принимают внутрь однократно
утром вместе с дексаметазоном 8 мг. В 4-й день рекомендуется утром принять
только дексаметазон в дозе 8 мг. При умеренно эметогенной XT апрепитант
применяется в тех же дозах и режиме в 1 —3-й день; ондансетрон (внутрь 8 мг
за 30-60 мин до начала XT и 8 мг через 8 ч после первой дозы) и дексамета-
зон (12 мг внутрь за 30 мин до начала XT) принимают только в 1-й день лечения.
Побочное действие: икота, слабость/повышенная утомляемость, повышение ак-
тивности АлАТ, запор, головная боль и анорексия.
Форма выпуска: капсулы 80 и 125 мг.
Другие лекарственные средства, обеспечивающие переносимость
химиотерапии
Месна (Уромитексан), уропротектор, представляющий собой 2-меркаптоэтансуль-
фат, связывая метаболит ифосфамида акролеин, предупреждает развитие акролеи-
новых циститов у больных, получающих ифосфамид (Холоксан), и является обязатель-
ным компонентом XT ифосфамидом (см. гл. 8).
Препарат используется также для защиты мочевых путей у больных, получающих
высокие дозы циклофосфамида, особенно из группы риска (циститы после примене-
ния циклофосфамида в анамнезе, воспалительные заболевания мочевых путей, облу-
чение таза).
Использование фолината кальция (Лейковорин) обеспечивает возможность
применения высоких и сверхвысоких доз метотрексата, превышающих стандартные
дозы в 200-500 раз. Фолинат кальция, влияя на транспорт метотрексата через кле-
точные мембраны, уменьшает его токсическое действие, что позволяет при правиль-
но подобранной на основе фармакокинетических данных о содержании метотрекса-
та в сыворотке крови дозировке получить выраженный терапевтический эффект без
токсикоза. Вследствие различия в механизмах транспорта высоких доз метотрекса-
та и терапевтических доз фолината кальция удается избирательно защитить нормаль-
ные ткани организма при сохранении противоопухолевого эффекта высоких доз ме-
тотрексата.
70
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Препараты, обеспечивающие переносимость цитостатиков...
Фолинат кальция используется также для биохимической модификации действия
фторпроизводных пиримидина (5-фторурацил, тегафур), повышая их противоопухо-
левую активность за счет изменения метаболизма этих препаратов (см. гл. 8).
Возможности использования антрациклинов лимитируются их кардиотоксично-
стью. Так, длительное применение доксорубицина (Адриамицин) при кумулятивной
дозе более 550 мг/м2 чревато развитием хронической миокардиопатии с явлениями
сердечной недостаточности, особенно опасной для детей.
Использование в качестве кардиопротектора дексразоксана (Кардиоксан, диокси-
пиперазинил пропана гидрохлорид), снижая содержание свободных радикалов ки-
слорода в клетках миокарда за счет хелирования железа, позволяет предупредить
развитие кардиотоксичности, не снижая противоопухолевого эффекта доксорубици-
на (см. гл. 8).
Рекомбинантный фактор роста кератиноцитов палифермин (Кежевакс) использу-
ется в онкогематологии. Снижает частоту и тяжесть оральных мукозитов у гематологи-
ческих больных, получающих миелотоксическую XT, и в частности высокодозную те-
рапию с трансплантацией стволовых клеток. Изучается возможность использования
палифермина для борьбы с интестинальным мукозитом у больных с солидными опу-
холями, а также для предупреждения реакции «трансплантат против хозяина» при ал-
логенной трансплантации.
Палифермин применяется в дозе 60 мкг/кг/сут в/в ежедневно 3 дня подряд не менее
чем за 34 ч до и после миелотоксической XT.
К числу препаратов, улучшающих качество жизни онкологических больных, можно
отнести препараты, используемые для борьбы с карциноидным синдромом.
Злокачественные нейроэндокринные опухоли в ряде случаев характеризуются от-
носительно медленным ростом и моментом, определяющим тяжесть состояния; не-
посредственную угрозу жизни может представлять активная продукция гормонов с
соответствующими метаболическими нарушениями. Известно, что 73 пациентов с кар-
циноидным синдромом погибает от вызванной им сердечной недостаточности. Для
этих больных использование аналогов соматостатина, в частности октреотида (Сан-
достатин), является одним из важнейших компонентов комплексного лечения, позво-
ляя полностью снять тягостную симптоматику в 30-75 % случаев.
Также условно в эту группу могут быть отнесены бисфосфонаты — препараты,
уменьшающие костную резорбцию и снижающие содержание кальция в сыворот-
ке крови у больных с костными метастазами. Снижение эпизодов гиперкальциемии,
уменьшение болевого синдрома и риска патологических переломов улучшают каче-
ство жизни больных с костными метастазами злокачественных опухолей.
Учитывая их практическое значение, бисфосфонаты, как и КСФ, более подробно
представлены в гл. 8.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
71
Глава 8
Характеристика отдельных
противоопухолевых препаратов
Д. 3. Купчан
В этой главе приводятся сведения об основных используемых в клинической практи-
ке противоопухолевых препаратах, относящихся к различным классам соединений —
цитотоксикам, гормональным, таргетным препаратам, цитокинам. Включены также не
являющиеся собственно противоопухолевыми препаратами колониестимулирующие
факторы и бисфосфонаты в связи с их широким использованием при лечении онколо-
гических больных.
Препараты расположены в алфавитном порядке соответственно их международ-
ным непатентованным названиям. Приводятся другие зарегистрированные их назва-
ния (синонимы), краткие данные по механизму действия, основным показаниям к при-
менению, дозах и режимах использования, побочных эффектах и форме выпуска.
Андрогены, эстрогены, прогестагены, агонисты гонадотропин-рилизинг гормона,
интерфероны представлены в виде соответствующих групп, включающих сведения об
отдельных входящих в них препаратах.
Азацитидин (Azacitidine)
Синонимы: Вайдаза (Vidaza).
Механизм действия: антиметаболит — аналог пиримидина. Проявляет цитоток-
сическое действие в отношении патологически измененных гемопоэтических
клеток костного мозга. Ингибирует синтез ДНК, РНК и белка. Инкорпорация
азацитидина в ДНК приводит к инактивации метилтрансферазы ДНК, что при-
водит к гипометилированию ДНК и реактивации и экспрессии абберантно ме-
тилированных генов, в частности гена — супрессора опухолевого роста. Не-
пролиферирующие клетки практически нечувствительны к азацитидину.
72 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Характеристика отдельных противоопухолевых препаратов
Показания: лечение больных с миелодиспластическими синдромами высокой или
промежуточной-2 степенью риска, либо с хроническим миеломоноцитарным
лейкозом (количество бластов в костном мозге 10-29%) без признаков МДС,
либо с острым миелолейкозом с количеством бластов 20-30% и множествен-
ной дисплазией, которым не может быть выполнена трансплантация гемопоэ-
тических стволовых клеток.
Дозы и режимы: 75 мг/м2 п/к в область предплечья, бедра или живота (чередуя ме-
ста введения) ежедневно в течение 7 дней с последующим 21-дневным пере-
рывом.
Побочное действие: нейтропения, тромбоцитопения, анемия, панцитопения,
тошнота/рвота, анорексия, запор, боль в животе, нефротоксичность (повыше-
ние уровня сывороточного креатинина, почечный канальцевый ацидоз), гипо-
калиемия, периферические отеки, одышка, головокружение, головная боль,
кровоизлияния, артралгия/миалгия, реакции в месте введения препарата.
Форма выпуска: лиофилизат для приготовления раствора для п/к введения во фла-
конах 100 мг.
Альбумин-стабилизированный нанодисперсный паклитаксел
Син он имы: Абраксан (Abraxane).
Механизм действия: действующим веществом препарата является паклитаксел.
В состав Абраксана не входят такие растворители, как Кремофор и этанол. Не
требует премедикации. Считается, что при применении Абраксана транспорт
паклитаксела осуществляется посредством альбумина, что обеспечивает бо-
лее высокое проникновение в опухолевую ткань, высокую биодоступность
паклитаксела и его быструю доставку в опухолевые ткани.
Показания: метастатический рак молочной железы при неудаче терапии первой ли-
нии или при противопоказаниях к стандартной антрациклинсодержащей те-
рапии.
Дозы и режимы: в/в капельно в течение 30 мин в дозе 260 мг/м2 1 раз в 3 нед. При
развитии тяжелой нейтропении (число нейтрофилов менее 500/мкл в течение
недели или более), тромбоцитопении или тяжелой сенсорной нейропатии сле-
дует приостановить лечение до восстановления нейтрофилов до 1500/мкл и
более, тромбоцитов — 100 000/мкл или снижения выраженности нейропатии
как минимум до умеренной степени. При проведении повторных курсов следу-
ет уменьшить дозу до 220 мг/м2. При повторном развитии тяжелых форм ней-
тропении или сенсорной нейропатии необходимо снизить дозу до 180 мг/м2.
Побочное действие: нейтропения, анемия, реже — тромбоцитопения, паресте-
зии, нарушение зрения, тошнота/рвота, диарея, мукозит, слабость, повышен-
ная утомляемость, транзиторное повышение сывороточной активности АлАТ,
АсАТ, ЩФ и уровня билирубина, алопеция, артралгия/миалгия, реакции в ме-
сте введения препарата.
Форма выпуска: лиофилизат для приготовления суспензии для инфузии во флако-
нах 100 мг.
Алдеслейкин (Aldesleukin)
Синонимы: Пролейкин (Proleukin), Интерлейкин-2 (IL-2), Ронколейкин.
Механизм действия: рекомбинантный человеческий интерлейкин-2 (рИЛ-2),
получаемый с помощью технологии рекомбинантной ДНК, с использовани-
ем штамма Е. coli, содержащего модифицированный ген человеческого ИЛ-2.
Стимулирует эндогенную иммунную защиту, активирует Т-лимфоциты и есте-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 73
Характеристика отдельных противоопухолевых препаратов
ственные киллерные клетки, способствует продукции антител В-клетка-
ми, стимулирует клеточную секрецию вторичных цитокинов (ИФН-у, ФНО,
ИЛ-1, ГМ-КФС), стимулирует факторы комплемента, а также запускает меха-
низмы высвобождения гормонов (АКТГ, кортизол).
Показания: гипернефроидный рак почки, меланома.
Дозы и режимы: в/в в дозах от 6 до 72 млн МЕ/м2 в зависимости от терапевтиче-
ского режима (ежедневно в течение 5 дней, 3 раза в неделю, в виде постоян-
ной инфузии).
Побочное действие: синдром повышенной проницаемости капилляров, гипо-
тензия, отек легких, инфаркт миокарда, аритмии, азотемия, тошнота и рвота,
тромбоцитопения, мукозиты, кожный зуд, анорексия, нарушения функции пе-
чени, лихорадка, психические нарушения.
Форма выпуска: лиофилизат во флаконах 1,2 мг (22 млн ME).
Алемтузумаб (Alemtuzumab)
Синонимы: Кэмпас (Campath).
Механизм действия: алемтузумаб представляет собой рекомбинантные гума-
низированные МКА lgGu, специфически связывающиеся с гликопротеидом
CD52, который экспрессируется на поверхности нормальных и малигнизиро-
ванных В- и Т-лимфоцитов крови. Вызывает антителозависимую цитотоксич-
ность или комплемент-индуцированный распад клеток. Алемтузумаб не по-
вреждает стволовые кроветворные клетки и клетки-предшественники.
Показания: хронический лимфолейкоз.
Дозы и режимы: вводится в виде 2-часовой в/в инфузии. За 30 мин до введения
проводится премедикация парацетамолом (500 мг внутрь) и дифенгидрами-
ном (50 мг внутрь). Первые 7 дней препарат вводится ежедневно в повышаю-
щихся дозах. Начальная доза 3 мг, при хорошей переносимости доза может
быть увеличена до 10 мг и далее до 30 мг. В дальнейшем препарат вводится в
дозе 30 мг через день. Максимальная длительность лечения 12 нед.
Побочное действие: выраженная иммуносупрессия, присоединение вторичных
инфекций, повышение температуры тела, озноб, миалгия, тошнота/рвота, го-
ловная боль, головокружение, кожная сыпь, крапивница, повышение АД, диа-
рея, тремор, парестезии/гипестезии, нейтропения, тромбоцитопения, анемия;
редко — панцитопения.
Форма выпуска: раствор для инфузий во флаконах 30 мг/3 мл.
Альтретамин (Aitretamine)
Синонимы: Гексален (Hexalen), Hexamethyimelamine, Гексастат.
Механизм действия: структурно сходный с триэтиленмеламином (алкилирую-
щим веществом), хотя ни сам препарат, ни его метаболиты алкилирующими
свойствами не обладают. Противоопухолевая активность обусловлена мета-
болитами, образующими ковалентные связи с РНК и ДНК, препятствующими
включению в ДНКтимидина. Проникает через ГЭБ.
Показания: рак яичников.
Дозы и режимы: внутрь по 200-260 мг/м2/сутв4 приема, курсами 14-21 деньсин-
тервалом 7-14 дней.
Побочное действие: тошнота, рвота, мукозиты, головокружение, нарушения на-
строения и сознания, атаксия, периферическая нейропатия, лейкопения и
тромбоцитопения.
Форма выпуска: капсулы 50 мг.
74 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Аминоглутетимид (Aminoglutethimide)
Синонимы: Orimeten, Citadren, Mamomit.
Механизм действия: ингибитор ароматазы — фермента, участвующего в прев-
ращении андрогенов в эстрогены. Приводит к снижению синтеза эстрогенов у
женщин как в период пре-, так и постменопаузы. Однако в периоде пременопа-
узы снижение синтеза эстрогенов яичниками может быть компенсировано по-
вышением уровня гонадотропинов. Конкурентно связывается с цитохромом
Р450, участвующим в синтезе стероидных гормонов в коре надпочечников на
этапе гидроксилирования, которое включает ферментативное превращение
холестерола в прегненолон. Уменьшает выработку кортикостероидов и мине-
ралокортикоидов в коре надпочечников.
Показания: рак молочной железы, опухоли надпочечника.
Дозы и режимы: по 250 мг 2-3 раза в сутки внутрь вместе с гидрокортизоном
30 мг/сут, или кортизона ацетатом 37,5 мг/сут (25 мгутром и 12,5 мгднем), или
дексаметазоном по 2 мг 3 раза в сутки.
Побочное действие: сыпь, седативный эффект, надпочечниковая недостаточность.
Форма выпуска:таблетки 250 мг.
Амифостин (Amifostine)
Синонимы:Эт]лол (Ethyol).
Механизм действия: являясь органическим тиофосфатом, обладает комплексо-
образующей активностью. Избирательно защищает нормальные неопухоле-
вые клетки организма от цитотоксического действия ионизирующей радиации
и ДНК-связывающих противоопухолевых лекарственных средств (алкилирую-
щих препаратов).
Показания: предупреждение гематологической токсичности, вызываемой цикло-
фосфамидом, митомицином С и аналогами цисплатина, и острой негематоло-
гической токсичности (нефротоксичности, нейротоксичности и ототоксично-
сти), связанной с терапией на основе платиновых производных.
Дозы и режимы: в/в капельно в течение 15 мин в дозе 740-910 мг/м2 за 30 мин до
введения цитостатиков или 3-минутная инъекция 200 мг/м2 за 15-30 мин до
фракционной лучевой терапии. При снижении исходного АД на 20-25 % вве-
дение амифостина следует прекратить до нормализации АД.
Побочное действие: гипотензия (мониторирование АД во время введения), тош-
нота, рвота, покраснение лица, ощущение тепла или озноб и ощущение холо-
да, головокружение, сонливость, икота, чиханье, снижение уровня кальция в
сыворотке крови, аллергические реакции в виде слабовыраженной кожной
сыпи.
Форма выпуска: лиофилизат во флаконах 375 и 500 мг.
Анастрозол (Anastrozole)
Синонимы: Аримидекс (Arimidex), Анастера (Anastera), Маммозол (Mammozol).
Механизм действия: нестероидный ингибитор ароматазы — фермента, с помо-
щью которого у женщин в постменопаузе андростендион в периферических
тканях превращается в эстрон и далее в эстрадиол. Не обладает прогестаген-
ной, андрогенной и эстрогенной активностью. В суточной дозе до 10 мг не
оказывает влияния на секрецию кортизола и альдостерона.
Показания: адъювантная терапия раннего рака молочной железы с положительны-
ми гормональными рецепторами у женщин в постменопаузе. Первая линия те-
рапии местнораспространенного или метастатического РМЖ с положитель-
ОБЩИЕСВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 75
Характеристика отдельных противоопухолевых препаратов
ным или неизвестным гормональным статусом у женщин в постменопаузе.
Вторая линия терапии распространенного РМЖ, прогрессирующего после
лечения тамоксифеном.
Дозы и режимы: внутрь 1 мгежедневно, длительно.
Побочное действие: приливы, сухость влагалища, истончение волос, анорексия,
тошнота, рвота, диарея, повышение уровня холестерина, активности ЩФ и ГГТ
в сыворотке крови, сонливость, головная боль, кожная сыпь, астения.
Форма выпуска: таблетки 1 мг.
Андрогены
Механизм действия: группа мужских половых гормонов, введение которых по-
давляет выработку гипофизарных гонадотропинов, что приводит куменьшению
синтеза эстрогенов. Также обладают прямым антиэстрогенным эффектом.
Показания: рак молочной железы у женщин с сохраненной менструальной фун-
кцией.
Побочное действие: задержка жидкости, вирилизация (гирсутизм, акне, охри-
плость голоса), усиление либидо, возможна холестатическая желтуха, нару-
шение сердечной деятельности.
В эту группу входят следующие препараты.
Тестостерона пропионат (Testosterone propionate).
Синонимы: Agovirin, Androfort, Androlon, Homosteron, Melestron, Oreton F, Perandren,
Sterandryl, Testolutin.
Дозы и режимы: в/м 50-100 мг ежедневно в течение нескольких месяцев.
Форма выпуска: ампулы 1 мл 1 и 5% раствора в масле.
Медротестрона пропионат (Medrotestrone propionat).
Синонимы: Drostanoloni Propionas, Emdisterone, Masterid, Permastil.
Дозы и режимы: в/м 100-50 мгежедневно, длительно.
Форма выпуска: ампулы 1 мл 5% масляного раствора.
Метилтестостерон (Methyltestosterone).
Синонимы: Androral, Hormale, Madiol, Metandren, Oraviron, Oreton M, Stenendiol,
Testoral, Vironnoneoral.
Дозы и режимы: 50-100 мг внутрь ежедневно в течение нескольких месяцев.
Форма выпуска: таблетки 5, 10 и 25 мг.
Пролотестон (Prolotestone).
Синонимы: нет.
Дозы и режимы: 350-700 мг в/м 1 раз в 2 нед., длительно.
Форма выпуска: ампулы 1 мл 35% масляного раствора.
Тетрастерон (Tetrasterone).
Синонимы: Sustanon, Omnadren.
Комбинированный препарат, содержащий в 1 мл масляного раствора 30 мг тесто-
стерона пропионата, по 60 мг тестостерона фенилпропионата и тестостерона изока-
проната и 100 мг тестостерона капроната.
Дозы и режимы: в/м 1 мл 2-3 раза в месяц.
Форма выпуска: ампулы 1 мл масляного раствора.
76 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Араноза (Aranoza).
Синонимы: нет.
Механизм действия: алкилирующее соединение из группы нитрозомочевины,
ингибирует синтез ДНК.
Показания: меланома кожи.
Дозы и режимы: в/в 550-800 мг/м2 в сутки, в течение 3 дней каждые 4 нед
Побочное действие: тошнота, рвота,угнетение кроветворения, диарея.
Форма выпуска: порошок во флаконах 500 мг.
Аспарагиназа (Asparaginase)
Синонимы: Краснитин, Лейназа, Kridolase, Elspar, L-Asparaginase, Пегаспаргаза, Он-
каспар (Oncaspar).
Механизм действия: фермент, катализирующий расщепление аминокислоты —
аспарагина, необходимой для жизнедеятельности клеток. Максимум ее актив-
ности по подавлению пролиферации отмечается в постмитотической Gj-фа-
зе клеточного цикла. Действие аспарагиназы основано на снижении уровня
аспарагина в лейкозных опухолевых клетках, которые в отличие от нормаль-
ных клеток не способны синтезировать собственный аспарагин. В результате
нарушается синтез белка, а также синтез ДНК и РНК. Пегаспаргаза — L-acnapa-
гиназа, ковалентно связанная с монометоксиполигликолем. Данная модифи-
кация увеличивает период полувыведения препарата, а также уменьшает рас-
познавание ее иммунной системой, что позволяет использовать препарат при
развитии гиперчувствительности к нативным формам L-аспарагиназы.
Показания: острый лимфобластный лейкоз (индукция ремиссии), лимфобластные
неходжкинские лимфомы. Не рекомендуется использовать в составе схем
поддерживающей терапии вследствие быстрого развития резистентности к
препарату (подавление способности клеток синтезировать аспарагин).
Дозы и режимы: 200-300 МЕ/кг в/в или в/м ежедневно или через день, суммарная
доза 300 000-400 000 ME. Пегаспаргаза вводится в дозе 2500 МЕ/м2в/м или
в/в капельно в течение 1-2 ч каждые 14 дней.
Побочное действие: аллергические реакции, тошнота, рвота, гипотермия, кра-
пивница, нарушение свертываемости крови, гепатит, нефрит, панкреатит, ги-
потензия или гипертензия, гипергликемия.
Форма выпуска: лиофилизат во флаконах 5000 и 10 000 ME; Пегаспаргаза — рас-
твор во флаконах 3750 МЕ/5 мл.
Бевацизумаб (Bevacizumab)
Синонимы: Авастин (Avastin).
Механизм действия: рекомбинантное гуманизированное МКА к VEGE Ингиби-
рует связывание VEGF с его рецепторами (Flt-1, KDR) на поверхности эндоте-
лиальных клеток.
Показания: метастатический колоректальный рак (в комбинации с химиотерапией
на основе производных фторпиримидина), местно-рецидивирующий или ме-
тастатический рак молочной железы (первая линия терапии в комбинации с
химиотерапией на основе таксанов), распространенный неоперабельный ме-
тастатический или рецидивирующий неплоскоклеточный НМРЛ (первая линия
терапии дополнительно к химиотерапии на основе препаратов платины), рас-
пространенный и/или метастатический почечноклеточный рак (первая линия
терапии в комбинации с ИФН-а-2а), глиобластома.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 77
Характеристика отдельных противоопухолевых препаратов
Дозы и режимы: в/в 90-60-30-минутная инфузия в дозе 5-10 мг/кг 1 раз в 2 нед.
или 15 мг/кг 1 раз в 3 нед., длительно.
Побочное действие: повышение АД, нейтропения, тромбоцитопения, диарея,
тошнота/рвота, стоматит, перфорация ЖКТ, кровоизлияния, включая легоч-
ные кровотечения/кровохарканье (чаще встречаются у больных НМРЛ), ар-
териальная тромбоэмболия, эксфолиативный дерматит, ладонно-подошвен-
ный синдром, периферическая сенсорная нейропатия, извращение вкуса,
головная боль, нарушение зрительной функции, повышенное слезотечение,
артралгия, протеинурия, застойная сердечная недостаточность, ухудшение
заживления ран.
Форма выпуска: концентрат во флаконах 100 мг/4 мл и 400 мг/16 мл.
Би калугам ид (Bicalutamide)
Синонимы: Касодекс (Casodex), Калумид (Calumid), Билумид (Bilumid), Бикалутера.
Механизм действия: нестероидный антиандрогенный препарат — конкурентный
антагонист эндогенных андрогенов (не обладает иной эндокринной активно-
стью).
Показания: рак простаты в сочетании с медикаментозной или хирургической ка-
страцией.
Дозы и режимы: внутрь 50 мг ежедневно, длительно.
Побочное действие: приливы, зуд, набухание и болезненность молочных желез,
диарея, тошнота, рвота, астения, сухость кожи.
Форма выпуска: таблетки 50 и 150 мг.
Блеомицин (Bleomycin)
Синонимы: Bleocin, Blenoxane, Blenamax, BLEO.
Механизм действия: противоопухолевый антибиотик (смесь структурно связан-
ных водорастворимых солей гликопептидных антибиотиков). Фрагментирует
ДНК, разрушает ее спиралевидную структуру. В меньшей степени влияет на
РНК и синтез белка.
Показания: плоскоклеточный рак головы и шеи, кожи, пищевода, шейки матки, вуль-
вы, полового члена, лимфома Ходжкина, неходжкинские лимфомы, в составе
лекарственных комбинаций при опухолях яичка, меланоме, опухолях слюн-
ных желез, хориокарциноме матки, опухоли Вильмса, нейробластоме.
Дозы и режимы:в/вилив/м 15мг Зраза в неделю или 30 мг 1-2 раза в неделю, сум-
марная доза не более 400 мг. Внутриплеврально 60 мг в 150 мл 0,9% раство-
ра натрия хлорида.
Побочное действие: гипертермия, тошнота, рвота, гиперкератоз, пневмонит, фи-
броз легких.
Форма выпуска: лиофилизате ампулах по 15 мгили ME.
Блеомицетин (Bleomycetin)
Синонимы: Пинъянмицин, Блеомицин А5.
Механизм действия: противоопухолевый антибиотик (смесь структурно связан-
ных водорастворимых солей гликопептидных антибиотиков, главным компо-
нентом которого является чистый блеомицин А5).
Показания: такие же, как у блеомицина.
Дозы и режимы: в/в или в/м 5-10 мг Зраза в неделю или 15 мг 2 раза в неделю, сум-
марная доза 250-300 мг. Внутриплеврально 50-60 мг в 40 мл 0,9% раствора
натрия хлорида.
78 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Побочное действие: такое же, каку блеомицина.
Форма выпуска: лиофилизат в ампулах или флаконах 5 мг.
Бортезомиб (Bortezomib)
Синонимы: Велкейд (Velcade), PS341.
Механизм действия: обратимый ингибитор протеасомы 26S, ключевого компо-
нента катализации расщепления основных белков, участвующих в управлении
жизненным циклом клеток. Представляет собой модифицированную борную
кислоту.
Показания: множественная миелома (вторая линия терапии и первая линия терапии
в составе комбинированной терапии), лимфома зоны мантии (вторая линия те-
рапии).
Дозы и режимы: 1,3 мг/м2 в/в струйно (3-5 с) в 1, 4, 8 и 11-й дни с последующим
10-дневным перерывом. Между двумя последовательными введениями Вел-
кейда должно пройти не менее 72 ч.
Побочное действие: тромбоцитопения, анемия, нейтропения, тошнота, рвота,
анорексия, стоматит, диарея, запор, периферическая нейропатия, головная
боль, головокружение, извращение вкуса, кожная сыпь, артралгия, оссалгия,
миалгия, мышечные судороги, астения, лихорадка.
Форма выпуска: лиофилизат во флаконах 3,5 мг.
Бусульфан (Busulfan).
Синонимы: Миелосан (Myelosanum), Myleran.
Механизм действия: бифункциональный алкилирующий препарат из группы ал-
кил сульфонатов (эфировдисульфоновых кислот). Оказываетугнетающее дей-
ствие на миелоидную ткань. Избирательно угнетает гранулоцитопоэз (преи-
мущественно уменьшает количество незрелых гранулоцитов), при этом не
влияет на гиперплазию ретикулярных клеток, гемогистиобластов, гемоцитоб-
ластов (иногда их количество даже возрастает).
Показания: хронический миелолейкоз, эритремия.
Дозы и режимы: внутрь 2-6 мг ежедневно.
По бочное дейст вие: лейкопения, тромбоцитопения, анемия, аменорея, гиперпиг-
ментация, аддисоно-подобный синдром; редко — фиброз легких.
Форма выпуска: таблетки 2 мг.
Винбластин (Vinblastine)
Си н он и мы: VLB, Velban, Velba, Velbe.
Механизм действия: алкалоид растительного происхождения, обратимо блоки-
рует митотическое деление клеток в метафазе клеточного цикла за счет свя-
зывания с микротрубочками посредством торможения образования митоти-
ческих веретен.
Показания: лимфома Ходжкина, лимфосаркомы, нейробластома, в составе лекар-
ственных комбинаций при опухолях яичка, саркомах мягких тканей, раке мо-
лочной железы, хориокарциноме матци, раке почки, мочевого пузыря, опухо-
ли Вильмса, меланоме, опухолях головы и шеи.
Дозы и режимы: в/в 4-10 мг/м2 1 раз в неделю, суммарная доза 50 мг/м2.
Побочное действие: тошнота, рвота, лейко- и тромбоцитопения, запор, алопеция,
аменорея, нейротоксичность.
Форма выпуска: лиофилизат во флаконах 5 и 10 мг; раствор во флаконах 5 мг/5 мл
и 10мг/10мл.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 79
Характеристика отдельных противоопухолевых препаратов
Виндезин (Vindesine)
Синонимы: Eldesin.
Механизм действия: полусинтетическое производное винбластина — алкалоида
барвинка розового. Блокирует митоз клеток на стадии метафазы, связываясь с
молекулами тубулина.
Показания: острый лимфобластный лейкоз, бластный криз хронического миело-
лейкоза, меланома, рак молочной железы, легкого.
Дозы и режимы: в/в 3 мг/м2 1 раз в неделю, суммарная доза 9-15 мг/м2.
Побочное действие:лейко-,тромбоцитопения,анемия, парестезии,миалгия,ало-
пеция.
Форма выпуска: флаконы 1,4 и 5 мг.
Винкристин (Vincristine)
Синонимы: Oncovin, Cytomid, VCR.
Механизм действия: такой же, как у винбластина.
Показания: острый лейкоз, лимфома Ходжкина, лимфосаркомы, саркомы мягких
тканей, миеломная болезнь, нейробластома, опухоль Вильмса, саркома Юин-
га, в составе лекарственных комбинаций при хронических лейкозах, раке мо-
лочной железы, шейки матки, легкого, меланоме, опухолях головы и шеи, раке
гортани, опухолях слюнных желез, мезотелиоме плевры, раке пищевода, же-
лудка, кишечника, рабдомиосаркоме, хориокарциноме матки, раке почки, по-
лового члена, яичка, тимоме, феохромоцитоме, ретинобластоме.
Дозы и режимы: в/в 1,4 мг/м2 1 раз в неделю, суммарная доза до 5,6 мг/м2, более
высокие дозы (до 18 мг/м2) применяют в гематологии.
Побочное действие: локально тромбофлебиты, лейко-, тромбоцитопения, не-
фрит, запор, паралитический илеус, кишечная колика, парестезии, мышечные
судороги, гепатит, алопеция.
Форма выпуска: лиофилизат во флаконах 0,5 и 1 мг.
Винорелбин (Vinorelbine)
Синонимы: Навельбин (Navelbine), Винельбин (Vinelbine), Винкарел ьбин (Vincarelbine),
Маверекс (Maverex), Велбин, Винкатера.
Механизм действия: полусинтетический алкалоид барвинка розового. Цитоста-
тическое действие обусловлено ингибированием полимеризации тубулина
в процессе клеточного митоза, что приводит к блокированию митоза в фазе
G2/M и вызывает разрушение клеток в интерфазе или при последующем ми-
тозе. Действует преимущественно на митотические трубочки, в больших до-
зах также и на аксональные трубочки.
Показания: рак легкого, молочной железы.
Дозы и режимы: в/в капельно (6-10 мин) 25-30 мг/м2 еженедельно (разовая доза
не должна превышать 60 мг). Внутрь 60-80 мг/м2 еженедельно (разовая доза
не должна превышать 120-160 мг соответственно). Применение препарата
внутрь в дозе 60 и 80 мг/м2 соответствует в/в введению его в дозе 25 и 30 мг/м2.
Побочное действие: гранулоцитопения, нейротоксичность (снижение сухожиль-
ных рефлексов, парестезии, возможен парез кишечника); редко — тошнота и
рвота, состояние затрудненного дыхания, бронхоспазм, алопеция, боль в челю-
сти. При попадании препарата под кожу местные реакции вплоть до некроза.
Форма выпуска: раствор во флаконах 10 мг/1 мл и 50 мг/5 мл; капсулы 20, 30, 40
и 80 мг.
80 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Гемцитабин (Gemcitabine).
Синонимы: Гемзар (Gemzar), Гемцитера, Гемцитар, Цитогем.
Механизм действия: антиметаболит группы аналогов пиримидина. Циклоспеци-
фичен (фазы S и G/S).
Показания: рак поджелудочной железы, НМРЛ, рак молочной железы, мочевого пу-
зыря, простаты, яичников, шейки матки.
Дозы и режимы: в/в капельно втечение 30 мин по Ю00мг/м2 1 раз в неделю в тече-
ние 3 нед. Повторные курсы проводятся с недельным перерывом.
По б он ное действие: нейтропения, тромбоцитопения, тошнота, рвота, алопеция.
Форма в ы п у ска: лиофилизат во флаконах 200 мг и 1 г.
Гефитиниб (Gefitinib)
Синонимы: Иресса (Iressa).
Механизм действия: селективный ингибитортирозинкиназы EGFR(HER1),тормо-
зит рост опухоли, метастазирование и ангиогенез, а также ускоряет апоптоз
опухолевых клеток.
Показания: местнораспространенный или метастатический НМРЛ, рефрактерный к
режимам химиотерапии, содержащим платину и доцетаксел.
Дозы и режимы: внутрь 250 мг 1 раз в сутки.
Побочное действие: диарея, кожная сыпь, зуд, сухость кожи, гематурия, носовые
кровотечения, тошнота, рвота, анорексия, стоматит, повышение активности
аминотрансфераз, конъюнктивит, интерстициальная пневмония, изменения
ногтей, алопеция, астения; редко — токсический эпидермальный некролиз и
мультиформная экссудативная эритема.
Форма выпуска: таблетки 250 мг.
Гидроксикарбамид (Hydroxycarbamide)
Синонимы: Гидроксимочевина (Hydroxyurea), Hydrea.
Механизм действия: антиметаболит (по некоторым данным — алкилирующе-
го действия). Блокирует рост клеток в интерфазе G/S, что существенно для
проводимой одновременно лучевой терапии, поскольку появляется синер-
гическая чувствительность опухолевых клеток в фазе G! на облучение. Уси-
ливая действие ингибитора РНК-редуктазы — рибонуклеозиддифосфатре-
дуктазы, вызывает подавление синтеза ДНК. Препарат не влияет на синтез
РНК и белка.
Показания: хронический миелолейкоз, эритремия, опухоли головы и шеи, мелано-
ма кожи.
Дозы и режимы: внутрь 80 мг/кг 1 раз в 3 дня или 20-30 мг/кг ежедневно в течение
Знед.
Побочное действие:анорексия,тошнота, рвота,стоматит,лейкопения,тромбоци-
топения, анемия, мегалобластоз, алопеция, дерматит.
Форма вы пуска: капсулы 500 мг.
Гонадотропин-рилизинг гормона гипофиза агонисты
Механизм действия: синтетические аналоги природного гонадотропина-рилизинг
гормона гипофиза. При постоянном применении ингибируют выделение ги-
пофизом лютеинизирующего гормона и фолликулостимулирующего гормо-
на, что ведет к снижению концентрации тестостерона в сыворотке крови у
мужчин и эстрадиола — у женщин до кассационных уровней. Данный эффект
обратим после отмены терапии.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 81
Характеристика отдельных противоопухолевых препаратов
Показания: с целью медикаментозная кастрация при раке простаты и раке молочной
железы у женщин в пременопаузе.
Бусерелин (Buserelin)
Синонимы: Супрефакт (Suprefact).
Дозы и режимы: по 0,5 мг п/к 3 раза в сутки 7 дней, затем по 4 мг интраназально
3 раза в сутки, длительно.
Побочное действие:тошнота, рвота, головокружение.
Форма выпуска: ампулы 0,5 мг препарата и флаконы для интраназального приме-
нения.
Гозерелин (Goserelin)
Синонимы: Золадекс (Zoladex).
Дозы и режимы: п/к 3,6 мг каждые 28 дней ил и 10,8 мг каждые 12 нед.
Побочное действие: приливы, снижение либидо, изредка — гинекомастия, сыпь.
Форма выпуска: шприц-ампула, содержащая 3,6 или 10,8 мг действующего ве-
щества.
Лейпрорелин (Leuprorelin)
Синонимы: Люкрин-Депо, Lupron Depo, Prostap, Enanton.
Дозы и режимы: в/м 3,75 мг каждые 28 дней.
Побочное действие: приливы, импотенция, гинекомастия,тошнота, рвота, кожный
зуд, парестезии.
Форма выпуска: лиофилизированные микросферы во флаконах 3,75,7,5 и 11,25 мг.
Трипторелин (Triptorelin)
Синонимы: Декапептил (Decapeptyl), Диферелин (Diphereline).
Дозы и режимы: в/м 3,75 мг каждые 28 дней или 11,25 мг каждые 3 мес.
Побочное действие: приливы, импотенция, снижение либидо, аллергические ре-
акции; редко — тошнота, рвота, увеличение массы тела, повышение АД, сме-
на настроения, ухудшение зрения, гинекомастия. Длительное применение мо-
жет привести к деминерализации костей.
Форма выпуска: лиофилизированные микросферы во флаконах 3,75 и 11,25 мг
или шприц-ампулах 3,75 мг с прилагаемым растворителем.
Дазатиниб (Dasatinib)
Синонимы: Спрайсел (Sprycel).
Механизм действия: ингибирует киназы BCR-ABL, семейство SRC (SRC, LCK, YES,
FYN), c-Kit, ЕРНА2 и PDGFR/L Преодолевает резистентность к иматинибу, свя-
занную с мутациями домена BCR-ABL-киназы.
/7о/<азания:хроническиймиелолейкозвхронической фазе, фазе акселерации; лим-
фоидный или миелоидный бластный криз при резистентности или неперено-
симости предыдущей терапии, включавшей иматиниб; Ph+ ОЛЛ при резистен-
тности или непереносимости предыдущей терапии.
Дозы и режимы: внутрь во время еды или натощак по 70 мг 2 раза в сутки ежед-
невно. В отсутствие гематологического и цитогенетического эффекта при при-
емлемой переносимости возможно повышение разовой дозы до 90-100 мг.
Побочное действие:миелосупрессия,диарея,тошнота/рвота,запор,стоматит,су-
хость кожи, акне, дерматит, изменение ногтей, легочные инфильтраты, извра-
82 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
щение вкуса, сонливость, тремор, судороги, мышечная слабость, миозит, сте-
нокардия, кардиомегалия, приливы, снижение или повышение АД, задержка
жидкости, кровотечения, учащенное мочеиспускание, почечная недостаточ-
ность, гинекомастия, конъюнктивит, шум в ушах, увеличение активности креа-
тинфосфокиназы, уровня тропонина, гиперурикемия.
Форма выпуска: таблетки, покрытые пленочной оболочкой, 20, 50 и 70 мг.
Дакарбазин (Dacarbazine)
Синонимы: Детисен, ДТИК, Имидазол-карбоксамид, DTIC, DIC, ICDT.
Механизм действия: активируется после метаболизма в печени, с образованием
активного метаболита диметил-триазено-имидазол-карбоксамида. Предпола-
гают три пути механизма действия: алкилирование за счет ионов карбония, уг-
нетение пуриновых оснований и взаимодействие с SH-группами. Подвергаясь
метаболизму в печени, высвобождается диазометан, ковалентно связывающий-
ся с SH-группами биомолекул. Являясь аналогом пуриновых оснований, дакар-
базин обладает также свойствами антиметаболита: блокирует синтез РНК и ДНК
(за счет образования комплексов с карбониевыми ионами). Фазонеспецифичен.
Показания: лимфома Ходжкина, меланома, саркомы мягких тканей, нейробласто-
ма, инсулома, карциноидные опухоли.
Дозы и режимы: в/в 2-4,5 мг/кг ежедневно в течение 10 дней или 250 мг/м2 ежед-
невно в течение 5 дней с интервалом 3-4 нед.
Побочное действие: тошнота, рвота, анорексия, гепатит, умеренное угнетение
миелопоэза; редко — диарея, гипертермия.
Форма выпуска: лиофилизат во флаконах 100и 200 мг.
Дактиномицин (Dactinomycin)
Синонимы: Actinomycin D, Lyovac, Космеген (Cosmegen).
Механизм действия: противоопухолевый антибиотик из группы актиномицинов.
Связываясь с ДНК, ингибирует ДНК-зависимый синтез РНК. Ингибитор топои-
зомеразы II.
Показания: хориокарцинома матки, саркома Юинга, опухоль Вильмса, рабдомио-
саркома у детей, саркомы мягких тканей, злокачественные опухоли яичка, ме-
ланома, лимфосаркомы, нейробластома.
Дозы и режимы: в/в 350 мкг/м2 ежедневно в течение 5 дней каждые 3-5 нед. или
1-2 раза в неделю в течение 3-5 нед., суммарная доза 3000 мкг.
Побочное действие: лейкопения, тромбоцитопения, анемия, тошнота, рвота, сто-
матиты, глосситы, проктиты, алопеция.
Форма выпуска: лиофилизат в ампулах 500 мкг.
Дарбэпоэтин (Darbepoetin)
Синонимы: Аранесп (Aranesp).
Механизм действия: рекомбинантный гликопротеид, обладающий биологиче-
ским эффектом эндогенного эритропоэтина. В отличие от эндогенного и ре-
комбинантного эритропоэтина содержит не 3, а 5 N-связанных олигосаха-
ридных цепей, почему обладает более длительным периодом полувыведения.
Стимулирует деление и дифференцировку клеток-предшественников кра-
сной крови в костном мозге.
Показания: анемия, вызванная химиотерапией у больных немиелоидными опухо-
левыми заболеваниями. Анемия, связанная с хронической почечной недоста-
точностью.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 83
Характеристика отдельных противоопухолевых препаратов
Дозы и режимы: применяется в/в или п/к. Стартовая доза 2,25 мкг/кг в неделю п/к,
либо 100 мг еженедельно, 200 мг каждые 2 нед., 300 мг подежно 1 раз в 3 нед.
Снижение, либо повышение дозы на 25-40% с тем, чтобы содержание гемо-
глобина не превышало 12,0 г/дл.
Побочное действие: аллергические реакции, одышка, кожные высыпания, тром-
боэмболии, повышение АД, диарея, тошнота, рвота, редко — апластическая
анемия.
Форма выпуска: шприц-ампула по 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 300,
500 мкг.
Даунорубицин (Daunorubicin)
Синонимы: Дауномицин (Daunomycin), Рубомицин (Rubomycinum), Rubidomycine,
Cerubidine, Daunoblastin.
Механизм действия: противоопухолевый антибиотик антрациклинового ряда.
Цитотоксическое действие обусловлено ингибированием синтеза ДНК, РНК
и белков. Механизм действия основан на интеркаляции антрациклина меж-
ду соседними парами оснований двойной спирали ДНК, что препятствует ее
«разворачиванию» для последующей репликации.
Показания: острый лейкоз, неходжкинские лимфомы, хориокарцинома матки, лим-
фома Ходжкина, нейробластома.
Дозы и режимы: в/в 30-60 мг/м2 ежедневно в течение 3 дней или 20-40 мг/м2
ежедневно в течение 5 дней, суммарная доза 300 мг/м2. Максимальная сум-
марная доза 600 мг/м2. У пациентов, которые ранее получили курс лучевой
терапии на область грудной клетки, максимальная суммарная доза составля-
ет 450 мг/м2.
Побочное действие:лейкопения,гранулоцитопения,тошнота, рвота,стоматит,ди-
арея, флебиты (при попадании под кожу некроз окружающих тканей), алопе-
ция, цистит, аллергические реакции, стенокардия, тахикардия, снижение АД,
изменения на ЭКГ.
Форма выпуска: лиофилизат во флаконах 20 и 40 мг.
Даунорубицин липосомный (Daunorubicin Liposomal)
Синонимы: Даунозом (Daunoxome).
Механизм действия: аналогичен даунорубицину. Размещение даунорубицина в
липосомах минимизирует связывание его с белками и уменьшает его погло-
щение нормальными тканями, исключая ретикулоэндотелиальную систему.
При проникновении Даунозома в опухолевые клетки происходит разрыв ли-
посом с высвобождением свободного даунорубицина.
Показания: саркома Капоши у больных СПИДом с низким содержанием лимфоци-
тов CD4 (< 200/мкл), при обширном поражении кожно-слизистых покровов
или при поражении внутренних органов.
Дозы и режимы: в/в капельно в течение 30-60 мин 40 мг/м2, разведенных в кон-
центрации 0,2-1 мг/1 мл 5% раствора декстрозы, 1 раз в 2 нед. При концентра-
ции креатинина в сыворотке крови более 3 мг/дл дозу снижают на 50%; при
нарушении функции печени и концентрации билирубина в сыворотке крови
1,2-3 мг/дл дозу снижают на 25 %, выше 3 мг/дл — на 50 %.
Побочное действие: такое же, каку даунорубицина. Могут наблюдаться инфузи-
онные реакции в виде боли в спине, сыпи, чувства сдавления грудной клетки,
исчезающие при снижении скорости вливания или его прекращении.
Форма выпуска: концентрат во флаконах 50 мг/25 мл.
84 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Дексразоксан (Dexrazoxane)
Синонимы: Кардиоксан (Cardioxan), ICRF-187.
Механизм действия: снижение содержания свободных радикалов в клетках ми-
окарда путем хелирования железа уменьшает кардиотоксичность антраци-
клинов.
Показания: предупреждение кардиотоксичности при лечении антрациклинами.
Дозы и режимы: вводится в/в в дозе, превышающей используемую дозу антраци-
клина в 20 раз (у детей — в 10—15 раз). Суммарная доза препарата не должна
превышать 1000 мг/м2. Во избежание флебитов содержимое ампулы раство-
ряют в 25 мл стерильной воды для инъекции, затем разводят в растворе лакта-
та Рингера или лактата натрия до объема 250-500 мл и вводят за 45-60 мин до
введения антрациклина в течение 20-30 мин.
Побочное действие: местные реакции — флебиты.
Форма выпуска: лиофилизат во флаконах 500 мг.
Доксорубицин (Doxorubicin)
Синонuaiw: Adriblastin, Adrim, Doxolem, Rastocin, ADM, Синдроксоцин.
Механизм действия: противоопухолевый антибиотик антрациклинового ряда.
Взаимодействует с ДНК, образует свободные радикалы, а также непосредст-
венно воздействует на мембрану клеток с подавлением синтеза нуклеиновых
кислот. Клетки чувствительны к препарату в фазах S и G2. Ингибитор топоизо-
меразы II.
Показания: рак молочной железы, легкого, мезотелиома, рак пищевода, желуд-
ка, первичный рак печени, рак поджелудочной железы, инсулинома, карци-
ноид, рак головы и шеи, щитовидной железы, злокачественная тимома, рак
яичников, герминогенные опухоли яичка, трофобластические опухоли, рак
простаты, мочевого пузыря, эндометрия, шейки матки, саркома матки, сарко-
ма Юинга, рабдомиосаркома, нейробластома, опухоль Вильмса, остеогенная
саркома, саркомы мягких тканей, саркома Капоши, острые лейкозы, лимфома
Ходжкина, неходжкинские лимфомы, множественная миелома.
Дозы и режимы: в/в 60-70 мг/м2 1 раз в 3 нед. или 30 мг/м2/сутЗ дня подряд, интер-
вал 3 нед., максимальная общая суммарная доза до 550 мг/м2.
Побочное действие: тошнота, рвота, лихорадка, красный цвет мочи, лейкопе-
ния, тромбоцитопения, стоматит, алопеция, стенокардия, тахикардия, сниже-
ние АД, изменения на ЭКГ, при длительном применении и превышении дозы
550 мг/м2 — кардиотоксичность (токсическая миокардиодистрофия с нео-
братимой недостаточностью кровообращения), при экстравазации — некроз
окружающих тканей.
Форма выпуска: лиофилизат во флаконах 10 и 50 мг; раствор во флаконах
10 мг/5 мл, 20 мг/10 мл и 50 мг/25 мл.
Доксорубицин липосомный (Doxorubicin Liposomal)
Синонимы: Келикс (Caelyx), Doxil.
Механизм действия: представляет собой пегилированную липосомную форму
доксорубицина, длительно циркулирующую в крови и обеспечивающую бо-
лее высокую концентрацию доксорубицина в опухолевой ткани, чем в нор-
мальных тканях.
Показания: ракяичников, молочной железы.
Дозы и режимы:в/ь капельно в течение 60-90 мин 50 мг/м2 1 раз в 4 нед. Препарат
разводят в 5% растворе декстрозы.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 85
Характеристика отдельных противоопухолевых препаратов
Побочное действие: такое же, каку доксорубицина; ладонно-подошвенный син-
дром, инфузионные реакции. Частота и выраженность симптомов кардиоток-
сичности ниже, чем при терапии (в сопоставимых дозах) традиционным док-
сорубицином.
Форма выпуска: раствор во флаконах 20 мг/10 мл и 50 мг/25 мл.
Доцетаксел (Docetaxel)
Синонимы: Таксотер (Taxoter), Таутакс (Tautax), Доцетакс (Docetax), Доцетера
(Docetera).
Механизм действия: противоопухолевое средство растительного происхожде-
ния, стабилизирует микротрубочки, угнетая их распад, что приводит к сниже-
нию концентрации свободного тубулина и нарушению фазы митоза и меж-
фазных процессов.
Показания: рак молочной железы, яичников, НМРЛ, плоскоклеточный рак головы и
шеи, рак простаты, желудка.
Дозы и режимы: в/в 100 мг/м2 (в комбинации с другими цитостатиками — 75 мг/м2)
в виде 1-часовой инфузии 1 раз в 3 нед. Обязательна премедикация корти-
костероидами для предупреждения реакции гиперчувствительности (декса-
метазон по 8 мг внутрь 2 раза в сутки в течение 3 дней, начиная за 1 день до
введения доцетаксела).
Побочное действие: реакции гиперчувствительности, нейтропения, кожные ре-
акции, тошнота, рвота, диарея, мукозиты, парестезии, алопеция, астения, фле-
биты, задержка жидкости, повышение активности печеночных ферментов,
билирубинемия.
Форма выпуска: концентрат во флаконах 20 мг/0,5 мл и 80 мг/2 мл (Таксотер, До-
цетакс, Доцетера); концентрат во флаконах 20 мг/1 мл, 40 мг/2 мл и 80 мг/4 мл
(Таутакс).
Золедроновая кислота (Zoledronic acid)
Синонимы: Зомета (Zometa), Резорба.
Показания: костные метастазы злокачественных опухолей (преимущественно
остеолитического характера) и миеломная болезнь (множественная миело-
ма); гиперкальциемия, обусловленная злокачественными опухолями.
Дозы и режимы: в/в капельно втечение 15 мин в дозе 4-8 мг (в зависимости от сте-
пени гиперкальциемии).
Побочное действие: гипертермия, гриппоподобный синдром, головная боль,
конъюнктивит, тошнота, рвота, анорексия, нарушение функции почек, реак-
ции повышенной чувствительности, гипофосфатемия, гипокальциемия, повы-
шение уровня креатинина и мочевины в сыворотке крови.
Форма выпуска: лиофилизированный порошок во флаконах 4 мг.
Ибандроновая кислота (Ibandronic acid)
Синонимы: Бондронат (Bondronat), Ибандронат.
Показания: такие же, как у золедроновой кислоты.
Дозы и режимы: в/в капельно в течение 2 ч в дозе 2-4 мг (в зависимости от степе-
ни гиперкальциемии). Перед введением требуется адекватная регидратация.
При метастатическом поражении костей 6 мг в/в капельно в течение 1 -2 ч (при
нормальной функции почек возможно введение в/в капельно в течение не ме-
нее 15 мин) 1 раз в 3-4 нед. или 50 мг внутрь ежедневно.
86 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Побочное действие: гипертермия, гриппоподобный синдром, реакции повышен-
ной чувствительности.
Форма выпуска: концентрат для инфузий во флаконах 2 мг/2 мл или 6 мг/6 мл; та-
блетки, покрытые оболочкой, 50 мг.
Ибритумомаб (Ibritumomab).
Син он им ы: Зевалин, Ибритумомаб тиуксетан.
Механизм действия: Является конъюгатом МКА против антигена CD20 и тиуксе-
тана, хелированного с иттрием 90 (90Y). Цитотоксическое действие и клеточ-
но-направленная лучевая терапия (радиоиммунотерапия).
Показания: неходжкинская лимфома фолликулярная, В-клеточная С020-позитив-
ная при рефрактерное™ к ритуксимабу.
Дозы и режимы: ритуксимаб 250 мг/м2 в 1-й и 8-й дни и 90Y ибритумомаб 0,3-
0,4 mCi/кг в/в — 8 дней (максимальная доза 32 mCi).
Побочное действие: миелосупрессия, тошнота, рвота,уртикария, зуд, аллергиче-
ские реакции, иногда лихорадка, озноб, головокружение, боли в спине, ар-
тралгия, гипертензия, инфаркт миокарда, кардиогенный шок, уртикарная сыпь.
Идарубицин (Idarubicin)
Синонимы: Заведос (Zavedos), Idamicin, Рубида (Rubida).
Механизм действия: противоопухолевый антибиотик антрациклинового ряда.
Встраивается в ДНК, взаимодействует с топоизомеразой II и ингибирует син-
тез нуклеиновых кислот.
Показания: индукция ремиссии при остром нелимфобластном и миелобластном
лейкозах у взрослых. Вторая линия терапии при остром лимфобластном лей-
козе.
Дозы и режимы: в/в 8 мг/м2 ежедневно в течение 5 дней или 10-12 мг/м2 ежеднев-
но в течение 3 дней. В качестве растворителя используется только вода для
инъекций. Препарат вводится в течение 10 мин. Внутрь 30 мг/м2 ежедневно в
течение 3 дней.
Побочное действие: тошнота, рвота, озноб, гипертермия, сыпь, стоматит, диарея,
алопеция, угнетение функции костного мозга, кардиотоксичность; редко —
гепатотоксичность.
Форма выпуска: лиофилизат во флаконах 5 и 10 мг; капсулы 5, 10 и 25 мг.
Иксабепилон (Ixabepilone)
Синонимы: Иксемпра (Ixempra).
Механизм действия: полусинтетический эпотилон. Связывается с тубулином и
подавляет динамику микротрубочек большого числа изоформ ^-тубулина, в
т.ч. тубулина /ЛII, избыточная экспрессия которого сопровождается развити-
ем устойчивости ктаксанам. Помимо непосредственного противоопухолево-
го действия обладает антиангиогенным свойством.
Показания: монотерапия метастатического или местнораспространенного рака
молочной железы в случае резистентности или рефрактерное™ опухоли к
антрациклинам, таксанам и капецитабину. В комбинации с капецитабином для
лечения больных метастатическим или местнораспространенным РМЖ, рези-
стентным к антрациклинам, таксанам, или в случае резистентности к таксанам
при наличии противопоказаний к применению антрациклинов.
Дозы и режимы: 40 мг/м2 3-часовая в/в инфузия каждые 3 нед. Перед введени-
ем необходима премедикация Н,-блокаторами (например, хлорфенирамин
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 87
Характеристика отдельных противоопухолевых препаратов
10 мг в/в или дексхлорфенирамин 2 мг внутрь) и Н2-блокаторами (например,
ранитидин 150-300 мг внутрь или 50 мг в/в).
Побочное действие: нейтропения, лейкопения, тромбоцитопения, перифериче-
ская сенсорная нейропатия, головокружение, утомляемость/астения, артрал-
гия/миалгия, алопеция, тошнота/рвота, мукозит, диарея, кожные высыпания,
одышка, кашель, приливы, повышение температуры тела.
Форма выпуска: лиофилизат для приготовления раствора для инфузий во флако-
нах 15 и 45 мг.
Иматиниб (Imatinib)
Синонимы: Гливек (Glivec), STI-571 (signal transduction inhibitor 571).
Механизм действия: ингибитор BCR-ABL-тирозинкиназы. Селективно подавляет
пролиферацию и вызывает апоптоз клеточных линий, позитивных по BCR-ABL,
а также молодых лейкозных клеток при Ph+ ХМЛ и при ОЛЛ. Ингибирует про-
лиферацию и индуцирует апоптоз клеток GIST, экспрессирующих тирозинки-
назу с мутацией гена c-Kit.
Показания: Ph+ ХМЛ в фазе акселерации, бластного криза, а также в хронической
фазе в качестве терапии первой линии или при неудаче предшествующей те-
рапии ИФН-а у взрослых и детей; Ph+ ОЛЛ у взрослых (терапия первой линии
в сочетании с химиотерапией, терапия второй линии в виде монотерапии); ми-
елодиспластические/миелопролиферативные заболевания, связанные с ген-
ными перестройками PDGFR, у взрослых; хронический эозинофильный лей-
коз у взрослых. Неоперабельные и/или метастатические GIST, позитивные по
рецепторам Kit. Неоперабельная рецидивирующая и/или метастатическая вы-
бухающая дерматофибросаркома у взрослых пациентов.
Дозы и режимы: внутрь 400-800 мг (детям старше 2 лет — 340 мг/м2/сут, общая
суточная доза не должна превышать 600 мг) ежедневно, до тех пор пока со-
храняется эффект. Оптимальная длительность адъювантной терапии не уста-
новлена.
Побочное действие: нейтропения, тромбоцитопения, анемия, тошнота, рвота, ди-
арея, анорексия, боль в животе, повышенная утомляемость, артралгия, миал-
гия, судороги, периферические отеки, задержка жидкости, кровоточивость
опухолевых узлов при GIST, головная боль, головокружение, кожная сыпь, на-
рушение сна, конъюнктивит, слезотечение, алопеция, нарушение вкуса, паре-
стезии, гипербилирубинемия, повышение активности печеночных ферментов.
Форма выпуска: капсулы 50и 100 мг; таблетки, покрытые оболочкой, 100и400мг. * 3
Интерфероны альфа
Механизм действия: ингибирование роста опухолевых клеток и модуляция им-
мунного ответа носителя опухоли.
Показания: волосатоклеточный лейкоз, хронический миелолейкоз, меланома, ги-
пернефроидный рак почки, множественная миелома.
Интрон A (Intron А) — рекомбинантный интерферон а-2Ь.
Дозы и режимы: п/к 3 раза в неделю (через день) 2-5-10 млн МЕ/м2. В/в капельно
50 млн МЕ/м2 ежедневно 5 дней подряд, перерыв 9 дней, курс повторяют. П/к
3 раза в неделю (через день) по 10 млн МЕ/м2 в течение 2 мес. или по 2 млн МЕ/м2
в течение 1-2 мес.
Побочное действие: лихорадка, усталость, анорексия, диарея, тошнота, миалгия,
головная боль, лейкопения, тромбоцитопения; редко — рвота, лабильность
88 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
АД, головокружение, спутанность сознания, атаксия, парестезия, судороги
икроножных мышц, депрессия, сонливость, алопеция, запор, герпетические
высыпания, крапивница, носовые кровотечения, стоматит, нарушения зрения.
Крайне редко — ортостатическая гипотензия, одышка, слюнотечение, язвен-
ный стоматит, нарушение функции печени.
Форма выпуска: флаконы 3, 5, 10 и 30 млн ME.
Роферон A (Roferon А) — рекомбинантный интерферон а-2а.
Дозы и режимы: п/к или в/м 3 млн ME ежедневно в течение 16-24 нед., поддержи-
вающая доза 3 млн ME 3 раза в неделю (через день).
Побочное действие: гипертермия, вялость, лихорадка, озноб, потеря аппетита,
миалгия, головная боль, боль в суставах, тошнота; редко — гепатит, паресте-
зии, нейропатия, лейко-, тромбоцитопения.
Форма выпуска: флаконы 3,6 и 9 млн ME.
Реаферон (Reapheron) — рекомбинантный интерферона-2.
Дозы и режимы: в/м 3 млн ЕД ежедневно в течение 10 дней с интервалом между
курсами 2-3 нед.
Побочное действие: гипертермия, лейкопения.
Форма выпуска: ампулы 1 млн ЕД.
Реальдирон (Realdiron) — интерферон а-2Ь.
Дозы и режимы: в/м 3-9 млн ЕД ежедневно в течение 10 дней с интервалом меж-
ду курсами 2-3 нед.
Побочное действие: гриппоподобный синдром, лейкопения, тромбоцитопения.
Форма выпуска:ампулы 1,Зи6млнЕД.
Велферон (Wellferon) — человеческий лимфобластный интерферон a-nl.
Дозы и режимы: в/м или п/к по 10-15 млн ME (до 7,5 млн МЕ/м2) 3 раза в неделю
в течение 12 нед. При лечении более 6 мес. следует применять пониженные
дозы (5-10 млн ME 3 раза в неделю).
Побочное действие: повышение или понижение температуры тела, озноб, голов-
ная боль, миалгия, вялость, анорексия, лейко-, тромбоцитопения, анемия, на-
рушение свертывания крови, депрессия, судороги, кома, экстрапирамидные
двигательные расстройства.
Форма выпуска: флаконы 3 и 10 млн ME.
Иринотекан (Irinotecan)
Синонимы: Кампто (Campto), Иритен (Iriten), Камптотекан (Camptotecan), Камптера,
Camptozar, СРТ-11.
Механизм действия: полусинтетическое производное камптотецина — специфи-
ческий ингибитор клеточного фермента топоизомеразы I. В тканях препарат
метаболизируется с образованием активного метаболита SN-38, который пре-
восходит по своей активности иринотекан. Иринотекан и метаболит SN-38 ста-
билизируют комплекс топоизомеразы I с ДНК, что препятствует ее репликации.
Показания: колоректальный рак, рак шейки матки.
Дозы и режимы: в/в капельно (не менее 30 мин) 350 мг/м2 1 раз в 3 нед.
Побочное действие: диарея (ранняя и отсроченная), нейтропения, анемия, тром-
боцитопения, тошнота, рвота, мукозиты, транзиторный холинергический син-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 89
Характеристика отдельных противоопухолевых препаратов
дром (ранняя диарея, боль в животе, конъюнктивит, ринит, снижение АД, ва-
зодилатация, потливость, парестезии, головокружение, расстройство зрения,
миоз, слезоточивость и саливация), астения, алопеция.
Форма выпуска-, раствор во флаконах 40 мг/2 мл и 100 мг/5 мл.
Ифосфамид (Ifosfamide)
Синонимы-.Холоксзн (Holoxan).
Механизм действия: алкилирующий цитостатик из группы хлорэтиламинов, про-
изводное оксазафосфоринов. Алкилирует нуклеофильные центры, нарушает
синтез ДНК и блокирует митотическое деление опухолевых клеток.
Показания: рак яичников, молочной железы, опухоли яичка, мелкоклеточный рак
легкого, рак шейки матки, остеогенная саркома, саркомы мягких тканей, зло-
качественные лимфомы.
Дозы и режимы: в/в раздельными дозами в течение нескольких дней или в виде вы-
сокой дозы (обычно путем непрерывной инфузии в течение 24 ч). При введе-
нии ифосфамида раздельными дозами курсовая доза составляет 250-300 мг/кг
(10-12 г/м2). Препарат вводится в течение 5 дней, ежедневная доза составля-
ет 50-60 мг/кг (2-2,4 г/м2). При введении путем непрерывной инфузии назна-
чают 5-8 г/м2 в сутки с перерывом 3-4 нед. Если ифосфамид вводится в виде
непрерывной инфузии в течение нескольких дней, то максимальная перено-
симая доза при 5-суточной инфузии — 3,2 г/м2/сут. Интервал между курсами
составляет 3-4 нед. в зависимости от показателей крови и степени выражен-
ности побочных явлений. Для профилактики лекарственного цистита лечение
ифосфамидом обязательно проводят на фоне введения уропротектора Ме-
сны. ДозаМесны — 20-100% от введенной дозы ифосфамида.
Побочное действие: лейкопения,тромбоцитопения,анемия, цистит, гепатит,тош-
нота, рвота, алопеция; редко — нарушение функции почек, энцефалопатия.
Форма выпуска: порошок во флаконах 200 и 500 мг, 1 и 2 г.
Кальция фолинат (Calcium folinate)
Синонимы: Лейковорин (Leucovorin), Дализол (Dalizol), Санфицинат, фолиниевая ки-
слота.
Механизм действия: восстановленная форма фолиевой кислоты, антидот анта-
гонистов фолиевой кислоты и биохимический модулятор фторпроизводных
пиримидина. Защитное действие кальция фолината проявляется только в от-
ношении здоровых клеток, т.е. препарат предотвращает токсическое дейст-
вие метотрексата на клетки костного мозга и ЖКТ, но не влияет существенно
на уже развившийся нефротоксический эффект метотрексата.
Показания: передозировка метотрексата, профилактика токсикоза при примене-
нии средних (> 200 мг) и высоких доз метотрексата, в комбинации с 5-фтору-
рацилом (5-ФУ) и тегафуром с целью модуляции их действия.
Дозы и режимы: применяется в/в, в/м, внутрь. При случайной передозировке ме-
тотрексата до истечения 1 ч после его введения кальция фолинат вводят па-
рентерально в дозе, равной или превышающей дозу введенного метотрексата,
далее — по 10 мг/м2 каждые 3 ч. При плановом использовании высоких доз ме-
тотрексата кальция фолинат вводят, начиная с 12 ч после введения метотрекса-
та, парентерально или перорально по 6-12 мг/м2 каждые 3-6 ч. При примене-
нии сверхвысоких доз метотрексата дозировка и ритм введения определяются
содержанием метотрексата в сыворотке крови больного. При использовании
кальция фолината с целью биохимической модификации действия фторпро-
90 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
изводных пиримидина (5-ФУ, тегафур) препарат вводят либо парентерально в
дозе 20-500 мг/м2, либо перорально в дозе 100 мг 3-5 раз в сутки.
Побочное действие-, редко — аллергические реакции; при высоких дозах — нару-
шение сна, возбуждение, депрессия, нарушения ЖКТ; при применении в соче-
тании с 5-ФУ и тегафуром — усиление токсичности этих препаратов.
Форма выпуска-, лиофилизат во флаконах 10, 25, 50, 100 и 350 мг; раствор в ам-
пулах 3 мг/1 мл, 30 мг/3 мл, 50 мг/4 мл и во флаконах 15 мг/5 мл, 50 мг/5 мл,
100 мг/10 мл, 200 мг/20 мл, 300 мг/30 мл, 500 мг/50 мл; капсулы или таблет-
ки 15 мг.
Капецитабин (Capecitabine)
Синонимы: Кселода (Xeloda).
Механизм действия: производное фторпиримидина карбамата, активируется
в ткани опухоли и оказывает на нее селективное цитотоксическое действие.
In vitro капецитабин не обладает цитотоксическим эффектом. In vivo под дей-
ствием опухолевого ангиогенного фактора тимидинфосфорилазы, активность
которого в первичной опухоли в 4 раза выше, чем в здоровой ткани, он прев-
ращается в цитотоксическое соединение — 5-ФУ. В результате селективной
активации содержание 5-ФУ в опухоли значительно превышает его уровень в
здоровых тканях, тем самым уменьшая системное воздействие 5-ФУ на здоро-
вые ткани организма.
Показания: рак молочной железы, толстой кишки (адъювантная терапия и терапия
первой линии), распространенный рак желудка (терапия первой линии).
Дозы и режимы-, суточная доза 2500 мг/м2 в 2 приема (по определенной схеме в
зависимости от суточной суммарной дозы) после еды ежедневно в течение
2 нед., интервал между курсами 1 нед.
Побочное действие: диарея, тошнота, рвота, боль в животе, стоматит, ладонно-
подошвенный синдром (парестезии, безболезненный или болезненный отек
и покраснение, шелушение, образование волдырей), слабость, мукозиты, ли-
хорадка, астения и сонливость, головная боль, головокружения и бессонница.
Форма выпуска: таблетки 150 и 500 мг.
Карбоплатин (Carboplatin)
Синонимы: Параплатин (Paraplatin), Циклоплатин (Cycloplatin), Кемокарб (Kemocarb),
Бластокарб (Blastocarb), Карботера, Паракт, CBDCA.
Механизм действия-, неорганическое комплексное соединение, содержащее
платину. Основной механизм действия данного препарата обусловлен связы-
ванием с ДНК, в результате чего образуются преимущественно внутриспи-
ральные сшивки, которые изменяют структуру ДНК и подавляют ее синтез.
Этот эффект проявляется вне зависимости от фазы клеточного цикла. Гидрата-
ция карбоплатина, в результате которой образуется активная форма (формы)
препарата, происходит медленнее, чем гидратация цисплатина.
Показания: ракяичников, злокачественные опухоли яичка, плоскоклеточный рак го-
ловы и шеи, рак шейки и тела матки, легкого, молочной железы, саркомы мяг-
ких тканей.
Дозы и режимы: в/в капельно (15-60 мин) 100 мг/м2 ежедневно 5 дней с повто-
рением курса каждые 4-5 нед. В/в капельно 150 мг/м2 1 раз в неделю в тече-
ние 4 нед., интервал между курсами 6 нед. В/в капельно 300-400 мг/м2 1 раз
в 4 нед. Оптимальный расчет доз карбоплатина проводится по формуле, учи-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 91
Характеристика отдельных противоопухолевых препаратов
тывающей AUC и клиренс креатинина (см. приложение 3-5). В отличие от ци-
сплатина карбоплатин вводят без гипергидратации.
Побочное действие: тошнота, рвота, миелосупрессия, почечная токсичность ми-
нимальная.
Форма выпуска: лиофилизат во флаконах 50, 150 и 450 мг; раствор во флаконах
50 мг/5 мл, 150 мг/15 мл и 450 мг/45 мл.
Кармустин (Carmustine)
Синонимы: БИКНУ, BCNU, Bischlorethylnitrosourea.
Механизм действия: алкилирующее соединение, производное нитрозомочеви-
ны. Предполагается, что кармустин способен алкилировать ДНК и РНК, подав-
лять ряд ключевых ферментативных процессов за счет карбамоилирования
аминокислот в белках. Не имеет перекрестной устойчивости по отношению
к другим алкилирующим препаратам.
Показания: глиобластома, неходжкинские лимфомы, миеломная болезнь, мелано-
ма, в составе лекарственных комбинаций при раке желудка, толстой и прямой
кишки, лимфома Ходжкина.
Дозы и режимы: в/в капельно в течение 1-2 ч в дозе 150-200 мг/м2 1 раз в 6 нед.
Побочное действие: тошнота, рвота, гепатит, лейкопения, тромбоцитопения, не-
фрит; редко — легочный фиброз, невриты.
Форма выпуска: лиофилизат во флаконах 100 мг.
Кладрибин (Cladribine)
Синонимы: Leustatin, 2-Chlorodeoxyadenosine, Лейкладин.
Механизм действия: нуклеозидный аналог пурина. Ингибируетаденозиндиами-
назу. Проникает через ГЭБ. Не обладает фазоспецифичностью.
Показания: волосатоклеточный лейкоз, В-клеточный хронический лимфолейкоз,
неходжкинские лимфомы, макроглобулинемия Вальденстрема.
Дозы и режимы: 0,09 мг/кг/сут непрерывной инфузией в течение 7 дней.
Побочное действие: лейкопения, нейтропения,тромбоцитопения, анемия, имму-
нодепрессия, вторичные инфекции, тошнота, анорексия, кожная сыпь, повы-
шение температуры тела, озноб, головная боль, головокружение, нарушение
сна, миалгия, артралгия, периферические отеки, тахикардия, кашель, одышка.
Форма выпуска: раствор во флаконах 10мг/10мл.
Клодроновая кислота (Clodronic acid)
Аналог естественного пирофосфата.
Синонимы: Бонефос (Bonefos), Клодронат, Клобир, Синдронат, дихлорметиленбис-
фосфонат.
Показания: костные метастазы злокачественных опухолей, миеломная болезнь, ги-
перкальциемия.
Дозы и режимы: применяется внутрь при гиперкальциемии в дозе 3200-
2400 мг/сут, разделенные на 3-4 приема. При нормальном содержании
кальция в сыворотке крови суточная доза составляет 2400-1600 мг, разде-
ленных на 2-3 приема. В/в используется в дозе 3-5 мг/кг. Разводится физио-
логическим раствором и вводится в течение 3 ч ежедневно 3-7 дней. После
нормализации содержания кальция в крови больные переводятся на перо-
ральное лечение.
Побочное действие: боль в животе, диарея; редко — головокружение, чувство
усталости, проявляющиеся в начале лечения и затем, при его продолжении,
92 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
прекращающиеся. Описано повышение активности ЛДГ. При в/в использова-
нии дозы выше рекомендованных, описаны случаи почечной недостаточно-
сти. Необходим контроль за функцией почек и печени.
Форма выпуска: таблетки 400 и 800 мг; капсулы 400 мг; концентрат для инфузий
300 мг/5 мл.
Лапатиниб (Lapatinib)
Синонимы-.Тгмверб (Tyverb),Tykerb.
Механизм действия: селективный ингибитор внутриклеточной тирозинкиназы,
связывающийся с рецепторами EGFR(ErbBl) и HER2 (ЕгЬВ2+). Отличается от дру-
гих быстро обратимых ингибиторов тирозинкиназы более медленной диссо-
циацией с рецепторами ErbB 1 и ЕгЬВ2 (период полувыведения около 300 мин).
Показания: распространенный и/или метастатический рак молочной железы с гипер-
экспрессией ErbB2+ (HER2+) в комбинации с капецитабином; у больных, ранее
получавших терапию с включением антрациклинов, таксанов и трастузумаба.
Дозы и режимЫ: внутрь за 1 ч до или через 1 ч после еды 1250 мг/сут однократно
ежедневно.
Побочное действие: анорексия, диарея, гипербилирубинемия, кожная сыпь
(включая акне), снижение фракции выброса левого желудочка.
Форма выпуска: таблетки, покрытые пленочной оболочкой, 250 мг.
Леналидомид (Lenalidomid)
Синонимы: Ревлимид (Revlimid).
Механизм действия: обладает иммуномодулирующими и антиангиогенными
свойствами. Ингибирует секрецию провоспалительных цитокинов, включая
ФНО-а, ИЛ-1/?, ИЛ-6 и ИЛ-12, из липополисахарид (ЛПС)-стимулированных
периферических мононуклеарных клеток крови (ПМКК). Повышает про-
дукцию противовоспалительного цитокина ИЛ-10 из ЛПС-стимулированных
ПМКК, вследствие чего происходит ингибирование экспрессии, но не фер-
ментативной активности циклооксигеназы-2. Индуцирует пролиферацию Т-
клеток, повышает синтез ИЛ-2 и ИФН-у, а также цитотоксическую активность
собственных NK-клеток. Ингибирует пролиферацию клеток различных линий
гемопоэтических опухолей, главным образом тех, которые имеют цитогене-
тические дефекты хромосомы 5. Ингибирует ангиогенез, блокируя образо-
вание микрососудов и эндотелиальных каналов, а также миграцию эндотели-
альных клеток. Кроме того, ингибирует синтез проангиогенного фактора VEGE
Показания: леналидомид в комбинации с дексаметазоном показан для лечения
больных с множественной миеломой, которые получили по крайней мере
одну линию терапии.
Дозы и режимы: внутрь 25 мг 1 раз в сутки в 1-21-й день повторных 28-дневных
циклов.
Побочное действие: нейтропения, тромбоцитопения, анемия, лейкопения, лим-
фопения, слабость, мышечные судороги, тремор, бессонница, мышечная сла-
бость, увеличение риска тромбоэмболических явлений, головокружение, за-
пор, диарея, тошнота, одышка, снижение массы тела.
Форма выпуска: капсулы 5, 10, 15 и 25 мг.
Ленограстим (Lenograstim)
Синонимы: Граноцит (Granocyte), гранулоцитарный колониестимулирующий фак-
тор, G-CSE
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 93
Характеристика отдельных противоопухолевых препаратов
Механизм действия: гемопоэтический фактор роста, регулирует продукцию и
высвобождение нейтрофилов из костного мозга в периферическую кровь.
Дозозависимо увеличивает количество нейтрофилов с нормальной или повы-
шенной функциональной активностью.
Показания: профилактика и лечение нейтропении у больных, получающих цитоста-
тическую терапию. Трансплантация костного мозга. Мобилизация перифери-
ческих клеток-предшественников гемопоэза.
Дозы и режимы: п/к по 150 мкг (19,2 млн МЕ)/м2 ежедневно в среднем от 3 до
7 дней (не более 28 дней). Лечение начинают не ранее чем через 24 ч после
введения химиопрепаратов.
Побочное действие: болезненность в месте инъекции, оссалгия, головная боль,
астения, боль в животе.
Форма выпуска: лиофилизат во флаконах 13,4,33,6 и 47 млн ME.
Летрозол (Letrozole)
Синонимы: Фемара (Femara), Экстраза, Летротера.
Механизм действия: нестероидный ингибитор ароматазы. Подавляет синтез
эстрогена в периферических тканях.
Показания: рак молочной железы у женщин в менопаузе в качестве первой и второй
линий гормональной терапии, адъювантная терапия, в т.ч. после завершения
стандартной терапии тамоксифеном.
Дозы и режимы: внутрь 2,5 мг ежедневно, длительно.
Побочное действие: тошнота, периферические отеки, общая слабость, приливы,
сыпь, диспепсия, увеличение массы тела, миалгия и артралгия, анорексия.
Форма выпуска: таблетки 2,5 мг.
Лизомустин
Синонимы: нет.
Механизм действия: антиметаболит аминокислоты — лизина, тормозит синтез
ДНК в опухолевых клетках.
Показания: меланома кожи, рак легкого.
Дозы и режимы: только в условиях стационара в виде монотерапии в дозе 500-
550 мг/м2 однократно в/в капельно (30-40 мин) в 200 мл 5% раствора дек-
строзы. Разовая доза препарата не должна превышать 1 г. Повторные курсы
проводят с интервалом 4-6 нед. при отсутствии каких-либо проявлений ток-
сичности. Для профилактики реакции гиперчувствительности (сосудистый
коллапс) за 30 мин до введения лизомустина требуется премедикация: декса-
метазон 20 мг в/м, димедрол 1 мг в/м.
Побочное действие: лейкопения, тромбоцитопения; редко — эритроцитопения и
снижение гемоглобина; тошнота, рвота, стоматит и анорексия; головная боль,
заторможенность, вялость, разбитость и сонливость; геморрагический син-
дром; редко — аллергические реакции, алопеция, увеличение активности пе-
ченочных ферментов, протеинурия, сосудистый коллапс.
Форма выпуска-, лиофилизат во флаконах 100 мг.
Ломустин (Lomustine)
Синонимы: СииНУ, CCNU, CiNU, Belustine, CeCeNU.
Механизм действия: алкилирующее соединение из группы нитрозомочевины.
Ингибирование синтеза ДНК обусловлено карбамоилированием ДНК-поли-
меразы и других ферментов репарации ДНК, повреждением ДНК-матрицы.
94 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Препарат может также тормозить ключевые ферментативные процессы пу-
тем изменения структуры и функции многих белков и ферментов. Ломустин
действует в поздней фазе Gj и ранней S-фазе клеточного цикла. Проникает че-
рез ГЭБ.
Показания: глиобластома, лимфома Ходжкина, лимфосаркомы, в составе лекарст-
венных комбинаций при меланоме, раке желудка, толстой и прямой кишки,
легкого, тимоме, феохромоцитоме.
Дозы и режимы: внутрь 80-130 мг/м2 1 раз в 6 нед.
Побочное действие: тошнота, рвота, лейкопения, тромбоцитопения, стоматит,
алопеция.
Форма выпуска: капсулы или таблетки 10,40, 100 мг.
Мелфалан (Melphalan)
Си нон им Ы: Alkeran, Phenylalanine mustard, L-Sarcolysin, L-Pam.
Механизм действия: бифункциональное алкилирующее средство, относящее-
ся к группе хлорэтиламинов. Процесс алкилирования состоит в ковалентном
связывании образующихся из двух бис-2-хлорэтильных групп углеродных
промежуточных соединений с 7-азотом гуанина в ДНК и перекрестном свя-
зывании двух спиралей ДНК, что приводит к нарушению репликации клеток.
Показания: множественная миелома, нейробластома, меланома и саркома мягких
тканей конечностей (гипертермическая регионарная перфузия).
Дозы и режимы: внутрь 10 мг/м2 ежедневно в течение 4 дней каждые 6 нед. или
25 мг/м2 в/в 1 раз в неделю в течение 3-4 нед.
Побочное действие: анорексия, тошнота, рвота, лейкопения, тромбоцитопения,
анемия.
Форма выпуска: таблетки 2 мг; лиофилизат во флаконах 50 мг.
Меркаптопурин (Mercaptopurine)
Си нон им Ы: 6-меркаптопурин, 6-МР, Пуринетол (Purinethol).
Механизм действия: оказывает противоопухолевое и иммунодепрессивное
действие; является конкурентным антагонистом пуриновых оснований.
Показания: острый миелобластный и лимфобластный лейкозы, хронический мие-
лолейкоз, лимфосаркомы.
Дозы и режимы: внутрь 2-3 мг/кг в 1 или 2-3 приема ежедневно; в случае хорошей
переносимости доза может быть увеличена до 5 мг/кг, но не более.
Побочное действие: тошнота, рвота, анорексия, гепатит, лейкопения, тромбоци-
топения.
Форма выпуска: таблетки 50 мг.
Месна (Mesna).
Синонимы: Уромитексан (Uromitexan), Mesnex.
Механизм действия: антидот акролеина, метаболита противоопухолевых
средств из группы оксазафосфоринов (ифосфамид, циклофосфамид), кото-
рый оказывает раздражающее действие на слизистую оболочку мочевого пу-
зыря. Защитные свойства месны обусловлены взаимодействием с двойной
связью молекулы акролеина, что приводит к образованию стабильного неток-
сичного тиоэфира. Уменьшая уротоксические эффекты оксазафосфоринов,
месна не ослабляет их противоопухолевого действия.
Показания: при введении оксазафосфоринов в высоких дозах (> 10 мг/кг); у паци-
ентов группы риска — проведенная ранее лучевая терапия на область мало-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 95
Характеристика отдельных противоопухолевых препаратов
го таза, развитие цистита во время предыдущей терапии оксазафосфоринами,
заболевания мочевой системы в анамнезе.
Дозы и режимы: вводится в/в струйно (медленно), разовая доза составляет 20% от
разовой дозы оксазафосфорина. Первое введение проводят одновременно с
первым введением оксазафосфорина, вторую и третью инъекции — через 4 и
8 ч после введения оксазафосфорина соответственно.
При непрерывной инфузии (24 ч) ифосфамида или циклофосфамида месну
следует вводить в дозе 20% от дозы цитостатика в начале инфузии, затем — в
дозе 100% от дозы цитостатика в виде 24-часовой инфузии, по окончании вве-
дения цитостатика введение месны продолжают еще 6-12 ч в той же дозе.
Комбинированная внутривенная и пероральная терапия месной: в момент
введения цитостатика месна вводится в дозе, составляющей 20% от дозы ок-
сазафосфоринов в/в. Через 2 и 6 ч после инъекции внутрь принимают 40% от
дозы оксазафосфорина в виде таблеток.
Предельная разовая доза месны 60 мг/кг. В водных растворах месна совместима с
ифосфамидом и циклофосфамидом.
Побочное действие: в случае превышения дозы 60 мг/кг возможны тошнота, рво-
та, диарея.
Форма выпуска: раствор в ампулах 400 мг/4 мл; таблетки 400 и 600 мг.
Метотрексат (Methotrexate)
Синон им ы: Amethopterin, Зексат (Zexate), Триксилем (Trixilem), Methylaminopterinum,
МТХ.
Механизм действия: антиметаболит, относящийся к группе аналогов фолие-
вой кислоты. Активность метотрексата обусловлена ингибированием синтеза
ДНК, РНК, тимидилата и белка в результате связывания с дигидрофолатредук-
тазой, что препятствует восстановлению дигидрофолата в активный тетраги-
дрофолат. Оказывает действие в S-фазе клеточного цикла.
Показания: острые лейкозы, рак легкого, плоскоклеточный рак головы и шеи, рак
молочной железы, хориокарцинома матки, рак шейки матки, вульвы, яичка,
остеогенная саркома, саркомы мягких тканей, медуллобластома у детей, рак
кожи, пищевода, желудка, мочевого пузыря, полового члена, простаты.
Дозы и режимы: в/в, в/м или внутрь 2,5-5 мг ежедневно, или по 25 мг 2-3 раза в
неделю, или по 30-40 мг 1 раз в неделю; суммарная доза 200-300 мг, интра-
люмбально (при нейролейкозе) — 12,5 мг/м2. Высокие и сверхвысокие дозы
метотрексата вводят под прикрытием антидота лейковорина. Препарат водят в
виде 4-24-часовой в/в инфузии в дозе 7,5-12 г/м2. Лекарственные формы, со-
держащие консерванты, в частности бензиловый спирт, запрещается исполь-
зовать для интратекального введения и при высокодозной терапии.
Побочное действие:стоматит,конъюнктивит,диарея,нефрит,алопеция,дерматит,
тромбоцитопения, анемия, при интралюмбальном введении возможны судо-
роги, парезы.
Форма выпуска: таблетки 2,5 и 5 мг; раствор в ампулах или флаконах 5 мг/2 мл,
25 мг/2 мл, 50 мг/5 мл, 100 мг/10 мл, 1000 мг/20 мл.
Милтефозин (Miltefozine)
Синонимы: Милтекс (Miltex).
Механизм действия: ингибирует протеинкиназу С, фосфолипазу С и синтез фос-
фотидилхолина, воздействует на мембраны опухолевых клеток.
Показания: кожные метастазы рака молочной железы.
96 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Дозы и режимы: местно на пораженный опухолью участок кожи по 1-2 капли на
10 см2 кожи в начале 1 раз в сутки, далее 2 раза в сутки (не более 5 мл в день)
как минимум в течение 8 нед. При эффективности — до полной инволюции
кожных метастазов.
Побочное действие: зуд, покраснение, чувство напряжения, сухость кожи с шелу-
шением, болезненное жжение; редко — тошнота и рвота.
Форма выпуска: раствор во флаконах 600 мг/10 мл.
Митоксантрон (Mitoxantrone)
С и нон им ы: Новантрон (Novantrone), Онкотрон (Oncotron), Dyhydroxyanthracenedione,
DHAD, DHAQ.
Механизм действия: синтетическое производное антрацендиона. Механизм
действия окончательно не выяснен. Препарат встраивается между основа-
ниями молекулы ДНК, блокируя процессы репликации и транскрипции; кро-
ме того, митоксантрон ингибирует топоизомеразу II, оказывает неспецифиче-
ское действие на клеточный цикл.
Показания: рак молочной железы, неходжкинские лимфомы, острый нелимфоб-
ластный лейкозу взрослых, рак печени, яичников.
Дозы и режимы: в/в капельно в течение 5-30 мин в дозе 12-14 мг/м2 1 раз в 3 нед.
при солидных опухолях и 10-12 мг/м2 ежедневно в течение 5 дней (до сум-
марной дозы 50-60 мг/м2) каждые 3 нед. при остром нелимфобластном лей-
козе. Максимальная суммарная доза 200 мг/м2.
Побочное действие: миелосупрессия, тошнота, рвота, кардиотоксичность незна-
чительная; редко — алопеция.
Форма выпуска: раствор во флаконах 10 мг/5мл, 20 мг/10 мл, 25 мг/12,5 мл и
30мг/15мл.
Митомицин (Mitomycin)
Синонимы: Митомицин С, Ametycine, Mutamycin, ММС.
Механизм действия: противоопухолевый антибиотик, выделенный из культуры
гриба Streptomyces caespitosus. Ингибирует синтез ДНК, при высоких концен-
трациях подавляет синтез белка и РНК. Наиболее активен в фазах митоза G и S.
После ферментативной активации в тканях он действует как би- или трифун-
кциональный алкилирующий препарат. Обладает относительно слабой имму-
нодепрессивной активностью.
Показания: рак желудка, кишечника, поджелудочной железы, мочевого пузыря, мо-
лочной железы, легкого, вульвы, простаты (в составе лекарственных комбинаций).
Дозы и режимы: в/в 10 мг/м2 1 раз в 3-4 нед. (в составе лекарственных комбина-
ций) или 2 мг/м2 в 1-5-й и 8-12-й дни курса, суммарная доза 50 мг/м2. Внутри-
пузырно 40-60 мг в 20-40 мл физиологического раствора 1 раз в неделю в
течение 6-8 нед.
Побочное действие: тошнота, рвота, диарея, тромбофлебиты, лейко- и тромбо-
цитопения, стоматиты, алопеция, гематурия.
Форма выпуска: лиофилизат во флаконах 2, 5 и 20 мг.
Митотан (Mitotane)
Синонимы: Lysodren, Орто-пара-ДДД.
Механизм действия: ингибитор синтеза гормонов надпочечников. Подавляет се-
крецию глюкокортикостероидов, вызывает деструктивные изменения нор-
мальной и опухолевой ткани коры надпочечника.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 97
Характеристика отдельных противоопухолевых препаратов
Показания: рак коры надпочечников (гормонально-активная форма).
Дозы и режимы: внутрь в 3-4 приема через 15-20 мин после еды, в первые 3 дня
суточная доза 2-6 г с последующим повышением до максимально переноси-
мой дозы 8-10 г/сут. Средняя курсовая доза 200-300 г. После приема каждых
80-100 г допускается перерыв 2-3 дня. Для предотвращения надпочечнико-
вой недостаточности одновременно назначают кортикостероиды в поддер-
живающих дозах (например, кортизона ацетат внутрь 25 мг днем и 12,5 мг на
ночь).
Побочное действие: тошнота, снижение аппетита, диарея, головная боль, голо-
вокружение, сонливость, депрессия, мышечный тремор, аллергические реак-
ции; редко — белок в моче, геморрагический цистит, повышение АД, ортоста-
тическая гипотензия, нарушение зрения.
Форма вы пуска: таблетки 500 мг.
Молграмостим (Molgramostim)
Синонимы: Лейкомакс
Механизм действия: рекомбинантный человеческий ГМ-КСФ. Обладает способ-
ностью стимулировать пролиферацию и активацию гранулоцитов и моноци-
тов/макрофагов.
Показания: применяется у больных, получающих миелосупрессивную противоо-
пухолевую химиотерапию, особенно в случае интенсификации лечения для
уменьшения степени нейтропении и снижения риска инфекционных ослож-
нений, а также у больных с другими состояниями недостаточности костного
мозга (МДС, апластическая анемия), при пересадках аутологичного или син-
генного костного мозга для ускорения восстановления миелоидного кровет-
ворения, при лейкопениях, вызванных инфекциями (включая ВИЧ).
Дозы и режимы: п/к 5-10 мкг/кг массы тела в день ежедневно в течение 7-10 дней.
Лечение начинают не ранее чем через 24 ч после введения цитостатиков. Ис-
ходная доза обычно 5 мкг/кг/сут. При трансплантации костного мозга суточ-
ная доза 10 мкг/кг в/в, при инфекциях — 1-3 мкг/кг/сут п/к. Подробнее опи-
сан в гл. 5.
Побочное действие: наиболее часто отмечаются подъем температуры тела, тош-
нота, одышка, диарея, высыпания, судороги, реакции в месте инъекции (при
п/к введении), рвота, чувство усталости, анорексия, мышечно-скелетная боль
и астеническиеявления.
Нилотиниб (Nilotinib)
С ин он ил4Ы:Тасигна (Tasigna).
Механизм действия: ингибирует тирозинкиназную активность онкопротеина
Всг-АЫ. Активен в отношении иматиниб-резистентных 32/33 мутантных форм
Всг-АЫ, за исключением мутации ТЗ151.
Показания: Ph+ ХМЛ в хронической фазе и фазе акселерации у взрослых пациентов
при непереносимости или резистентности к предшествующей терапии, вклю-
чая иматиниб.
Дозы и режимы: внутрь через 2 ч после еды (после применения Тасигны прини-
мать пищу можно не ранее чем через 1 ч) по 400 мг 2 раза в сутки ежеднев-
но. Лечение препаратом проводят до тех пор, пока сохраняется клинический
эффект.
Побочное действие: тромбоцитопения, нейтропения, анемия, кожная сыпь, кож-
ный зуд, алопеция, головная боль, повышенная утомляемость, тошнота/рвота,
98 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
запор и диарея, боль в костях, артралгия, миалгия, спазм мышц, перифериче-
ские отеки.
Форма выпуска: капсулы 200 мг.
Нилутамид (Nilutamide)
Синонимы: Anandron.
Механизм действия: нестероидный антиандроген. Блокирует рецепторы андро-
генов, не действует на другие стероидные рецепторы (в связи с этим лишен
любой другой гормональной и антигормональной активности).
Показания: рак простаты.
Дозы и режимы: внутрь 300 мг/сут в течение месяца, затем 150 мг/сут, длительно.
Побочное действие: тошнота, рвота, нарушение аккомодации, интерстициальный
легочный синдром, повышение активности аминотрансфераз.
Форма выпуска:таблетки 50и 100мг.
Нимустин (Nimustine)
Синонимы: Нидран (Nidran), ACNU.
Механизм действия: относится к группе нитрозомочевины. В отличие от других ци-
тостатиков группы нитрозомочевины Нидран водорастворим, что позволяет вво-
дить его внутривенно или внутриартериально. Предполагается, что основным ме-
ханизмом действия Нидрана является уменьшение молекулярной массы ДНК за
счет алкилирования внутриклеточной ДНК и ингибирования ДНК-синтеза.
Показания: опухоли головного мозга, рак легкого, злокачественные лимфомы.
Дозы и режимы: в/в или внутриартериально 2-3 мг/кг однократно, интервал меж-
ду введениями 6 нед.
Побочное действие: лейкопения, тромбоцитопения, анемия, иногда сыпь, увели-
чение показателей печеночных проб, креатинина и мочевины, протеинурия,
анорексия, тошнота, рвота, реже — стоматит, общая слабость, лихорадка, го-
ловная боль, головокружение, судороги, выпадение волос, гипопротеинемия;
редко — интерстициальная пневмония.
Форма выпуска: лиофилизат во флаконах 25 и 50 мг.
Оксалиплатин (Oxaliplatin)
Си нон имы: Элоксатин (Eloxatin), Оксатера, Плаксат, Платикад, Синоксал, Экзорум.
Механизм действия: производное платины, в котором атом платины образует
комплекс с оксалатом и 1,2-диаминоциклогексаном. Взаимодействует с ДНК
путем образования меж- и внутритяжевых мостиков и подавляет синтез ДНК.
Показания: адъювантная терапия колоректального рака III стадии, монотерапия или
в комбинации с фторпиримидинами для лечения колоректального рака. При
раке яичников в качестве второй линии терапии.
Дозы и режимы: в/в капельно в течение 2-6 ч в дозе 130 мг/м2 каждые 3 нед. или
85 мг/м2 еженедельно.
Побочное действие: умеренная миелосупрессия, тошнота, рвота, диарея, паре-
стезии конечностей; иногда — судороги, дистезия околоротовой области и
верхних дыхательных и пищеварительных путей, которая может вызывать кли-
ническую картину ларингоспазма без анатомического субстрата.
Форма выпуска: лиофилизат во флаконах 50 и 100 мг.
Октреотид (Octreotide)
Синонимы: Сандостатин (Sandostatin), Сандостатин ЛАР, Sandostatin LAR Depot.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 99
Характеристика отдельных противоопухолевых препаратов
Механизм действия: синтетический аналог естественного гормона соматоста-
тина. Подавляет патологически повышенную секрецию гормона роста, а так-
же пептидов и серотонина, продуцируемых в гастро-энтеро-панкреатической
эндокринной системе.
Показания: эндокринные опухоли ЖКТ, продуцирующие вазоактивный кишеч-
ный пептид, карциноидный синдром. Применяется также для профилактики
осложнений при операциях на поджелудочной железе (угнетение экзокрин-
ной функции последней), для лечения диареи, вызванной противоопухолевой
химиотерапией.
Дозы и режимы: п/к по 0,05 мг 1-2 раза в сутки, доза постепенно увеличивается до
0,1-0,2 мг 3 раза в сутки, лечение длительное. Депонированную форму октре-
отида — Сандостатин ЛАР вводят больным, у которых п/к введения обеспечива-
ют адекватный контроль проявлений заболевания. Препарат вводят глубоко в/м
в дозе 20 мг 1 раз в 4 нед., при этом п/к введение октреотида продолжают еще
2 нед. после первого введения Сандостатина ЛАР. В зависимости от эффекта дозу
Сандостатина ЛАР можно уменьшить до 10 мг или увеличить до 30 мг 1 развДнед.
Побочное действие: боль в месте введения, зуд, жжение, припухлость, тошно-
та, рвота, метеоризм, диарея, запор; возможны гипергликемия, образование
желчных камней, у больных с инсулинзависимым диабетом — гипогликемия.
Форма выпуска: раствор вампулах0,05,0,1,0,5 мг/мл. Сандостатин ЛАР — микрос-
феры во флаконах 10, 20 и 30 мг в комплекте с растворителем и инъекцион-
ным набором.
Опрелвекин (Oprelvekin)
Синонимы: Ньюмега (Neumega), Интерлейкин-11, ИЛ-11.
Механизм действия: тромбопоэтический фактор роста, который непосредст-
венно стимулирует пролиферацию гемопоэтических стволовых клеток и кле-
ток-предшественников мегакариоцитов, индуцирует созревание мегакарио-
цитов, что приводит к увеличению продукции тромбоцитов.
Показания: профилактика тромбоцитопении и снижение потребности в трансфузи-
ях тромбоцитов после курсов миелосупрессивной терапии у больных с неми-
елоидными злокачественными заболеваниями. Применение препарата не по-
казано после курсов миелоаблятивной химиотерапии.
Дозы и режимы: 50 мкг/кг 1 раз в сутки п/к в область живота, бедра или плеча спу-
стя 6-24 ч после завершения химиотерапии (не более 21 дня). Терапия пре-
паратом должна быть прекращена как минимум за 2 дня до очередного кур-
са химиотерапии.
Побочное действие: задержка жидкости, предсердные аритмии (фибрилляция
или трепетание предсердий), амблиопия, отек диска зрительного нерва па-
рестезии, изменение цвета кожи, эксфолиативный дерматит, кровоизлияния
в глаза, астения, снижение концентрации гемоглобина, снижение альбумина и
других белков, снижение концентрации кальция.
Форма выпуска: лиофилизат во флаконах 5 мг с прилагаемым растворителем (вода
для инъекций).
Паклитаксел (Paclitaxel)
С и нон им Ы:Таксол (Taxol), Абитаксел (Abitaxel), Интаксел (Intaxel), Митотакс (Mitotax),
Паклитакс (Paclitax), Паксен (Рахеп), Синдаксел, Таксакад.
Механизм действия: алкалоид природного происхождения, получаемый полу-
синтетическим путем из растения Taxus Baccata. Механизм действия связан со
100 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
способностью стимулировать сборку микротрубочек из димерных молекул
тубулина, стабилизировать их структуру и тормозить динамическую реорга-
низацию в интерфазе, что нарушает митотическую функцию клетки.
Показания: метастатический рак яичников, рак молочной железы, в комбинаци-
ях при раке легкого, опухолях головы и шеи, при саркоме Капоши у больных
СПИДом в качестве второй линии терапии.
Дозы и режимы: в/в 3-часовая инфузия 175 мг/м2 1 раз в 3 нед. Обязательна пре-
медикация для предупреждения реакции гиперчувствительности: дексамета-
зон 20 мг внутрь или в/м за 12 и 6 ч до введения паклитаксела, дифенгидрамин
50 мг в/в за 30-60 мин и циметидин 300 мг или ранитидин 50 мг в/в за 30-
60 мин до введения паклитаксела.
Побочное действие: реакции гиперчувствительности (гипотензия, сосудистый отек,
нарушения дыхания, уртикарная сыпь), угнетение костномозгового кроветворе-
ния (нейтропения), тошнота, рвота, алопеция, периферическая нейропатия.
Форма выпуска: концентрат во флаконах 30 мг/5 мл, 100 мг/16,7 мл, 150 мг/25 мл
и 300 мг/50 мл.
Памидроновая кислота (Pamidronic acid)
Синонимы: Аредиа (Aredia), Помегара, динатрий памидронат.
Показания: костные метастазы злокачественных опухолей, миеломная болезнь, ги-
перкальциемия.
Дозы и режимы: 90 мг в 250 мл инфузионного раствора в виде 2-часовой в/в ин-
фузии (скорость не более 60 мг/ч) однократно или по 15-30 мг в течение
2-4 дней. Суммарная доза препарата зависит от содержания кальция в сыво-
ротке крови и не должна превышать 90 мг. При миеломной болезни и гипер-
кальциемии препарат вводится в течение 4 ч и более в 500 мл инфузионного
раствора. Перед введением или в ходе терапии рекомендуется провести ре-
гидратацию 0,9% раствором натрия хлорида. Повторные курсы проводят че-
рез 3-4 нед.
Побочное действие: бессимптомная гипокальциемия, гипертермия, гриппопо-
добные симптомы; иногда — тошнота, рвота, головная боль; редко — мышеч-
ные спазмы, парестезии, гематурия, острая почечная недостаточность.
Форма выпуска: раствор в ампулах 15 мг/5 мл или лиофилизат во флаконах 15, 30,
60 и 90 мг с прилагаемым растворителем.
Панитумумаб (Panitumumab)
Синонимы: Вектибикс (Vectibix).
Механизм действия: человеческое МКА IgG2 к EGFR.
Показания: монотерапия метастатического EGFR-экпрессирующего колоректаль-
ного рака с немутантным (диким) геном KRAS, при прогрессии заболевания на
фоне или после предшествующего курса химиотерапии фторпиримидин-, ок-
салиплатин- и иринотекансодержащими режимами.
Дозы и режимы: в/в 60-минутная инфузия 6 мг/кг 1 раз в 2 нед. (длительность
введения препарата в дозе более 1000 мг должна составлять приблизитель-
но 90 мин). Вектибикс должен вводиться через встроенный фильтр 0,2 или
0,22 мкм с низкой степенью связывания белков.
Побочное действие: кожная сыпь, эритема, шелушение кожи, кожный зуд, сухость
кожи, кожные трещины, паронихии, онихолизис, гипертрихоз, алопеция, ди-
арея, тошнота, рвота, стоматит, одышка, кашель, конъюнктивит, головная боль,
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 101
Характеристика отдельных противоопухолевых препаратов
легочная эмболия, повышение температуры тела, озноб, реакции гиперчувст-
вительности.
Форма выпуска: концентрат во флаконах 100 мг/5 мл, 200 мг/10 мл, 400 мг/20 мл.
Пеметрексед (Pemetrexed)
Си нон им ы: Алимта (Alimta), LY231514, МТА.
Механизм действия: антифолат, ингибирует в основном тимидилатсинтазу, а так-
же дигидрофолатредуктазу и глицинамидрибонуклеотидформилтрансфера-
зу — ферменты, необходимые для синтеза тимидина и гипоксантина.
Показания: злокачественная мезотелиома плевры, неплоскоклеточный НМРЛ (аде-
нокарцинома, крупноклеточный рак).
Дозы и режимы: 500 мг/м2 в/в в течение 10 мин каждые 21 день. Для профилакти-
ки недостаточности фолатов препарат вводится на фоне приема фолиевой ки-
слоты 0,5-1 мг внутрь за день и в день введения пеметрекседа и цианокобала-
мина (витамина В12) по 1000 мкг в/м каждые 9 нед. Для профилактики кожных
реакций проводится премедикация дексаметазоном по 4 мг внутрь 2 раза в
сутки в течение 3 дней подряд, начиная за 1 день до введения пеметрекседа.
Побочное действие: нейтропения, анемия, тромбоцитопения, тошнота, рвота, ди-
арея, кожная сыпь, кожный зуд, повышение уровня билирубина и активности
аминотрансфераз в сыворотке крови.
Форма выпуска: лиофилизат во флаконах 500 мг.
Прогестагены
Точный механизм противоопухолевого действия прогестагенов — гормонов жел-
того тела неизвестен. При лечении гормонально-зависимых злокачественных ново-
образований действие прогестинов может быть связано с влиянием на гипоталамо-
гипофизарно-гонадную систему, рецепторы прогестинов и эстрогенов и метаболизм
стероидов на клеточном уровне.
Гестоноронкапроат (Gestonoroncaproat)
Синонимы: Depostat, Primostat.
Показания: рак эндометрия, молочной железы.
Дозы и режимы: в/м 200 мг 1 раз в неделю, суммарная доза 1-3 г.
Побочное действие: боль в области молочных желез, снижение потенции, гепа-
тит.
Форма выпуска: масляный раствор в ампулах 200 мг/2 мл.
Гидроксипрогестерон (Hydroxyprogesterone)
Синонимы: Оксипрогестерона капронат (Oxyprogesterone caproate), 17-ОПК.
Показания: рак эндометрия, почки, молочной железы.
Дозы и режимы: 3-4мл 25% раствора в/м ежедневно или через день в течение дли-
тельного времени (30-300 дней).
Побочное действие: задержка жидкости, изредка — синдром Кушинга.
Форма выпуска: масляный раствор в ампулах 250 мг/1 мл (25% раствор).
Мегестрол (Megestrol)
Синонимы: Мегейс (Megace), Мегестрола ацетат.
Показания: паллиативное лечение поздних стадий рака молочной железы и ракаэн-
дометрия.
102 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Дозы и режимы: внутрь по 40-320 мг в день дробными дозами длительно, мини-
мум в течение 2 мес.
Побочное действие:увеличение массы тела; описаны случаи развития туннельно-
го синдрома запястья, тромбофлебита глубоких вен, а также алопеция.
Форма выпуска:таблетки 40 и 160 мг.
Медроксипрогестерон (Medroxiprogesterone)
С и нон имы: Провера (Provera), Medroxyprogesterone Acetate, MPA, Farlutal, Депо-Про-
вера (Depo-Provera).
Показания: рак эндометрия, рак молочной железы.
Дозы и режимы: 200-800 мг внутрь ежедневно, длительно (не менее 8-Ю нед.).
Депо-Провера вводится в/м по 500-1000 мг в неделю.
Побочное действие: анафилаксия, тромбоэмболические расстройства, нервоз-
ность, бессонница, депрессия, головная боль, крапивница, зуд, гирсутизм,
алопеция, тошнота, задержка жидкости, синдром Кушинга.
Форма выпуска: таблетки 100, 250 и 500 мг. Депо-Провера — суспензия для инъ-
екций во флаконах 150 мг/1 мл, 500 мг/3,3 мл и 1000 мг/6,7 мл.
Прокарбазин (Procarbasine)
Синонимы: Nathulan, Methylhydrazine, Benzmethyzin, Natulanar, Natulane.
Механизм действия: алкилирующее соединение (из группы метилгидразинов). I
Нарушает процессы трансметилирования — переноса метильных радикалов ।
с метионина на транспортную РНК (тРНК).
Показания: лимфома Ходжкина, неходжкинские лимфомы, опухоли головного моз-
га, рак легкого, хронический лимфолейкоз.
Дозы и режимы: внутрь 100-200 мг/м2 ежедневно втечениеЗ нед., затем уменьша-
ют дозу до 50-80 мг/м2, суммарная доза 4500-6000 мг/м2. В составе комбина-
ций 60-100 мг/м2 —14 дней.
Побочное действие: тошнота, рвота, сонливость, спутанность сознания, мозжеч-
ковая атаксия, депрессия, периферическая нейропатия, миалгия, артралгия;
редко — диарея, стоматит, алопеция, дисменорея, дерматит, гиперпигмента-
ция.
Форма выпуска: капсулы 50 мг.
Пэгфилграстим (pegfilgrastim)
Синонимы: Неуластим (Neulastim).
Механизм действия: такой же, как у филграстима. Представляет собой ковален-
тный конъюгат филграстима с одной молекулой полиэтиленгликоля, с пролон-
гированным действием в результате снижения почечного клиренса.
Показания: нейтропения, фебрильная нейтропения, применяется с целью снизить
длительность нейтропении и частоту фебрильной нейтропении при интенсив-
ной миелосупрессивной цитотоксической химиотерапии по поводу злокаче-
ственных образований.
Дозы и режимы: п/к по 6 мг однократно через 24 ч после проведения каждого ци-
кла цитотоксической химиотерапии.
Побочное действие: миалгия, артралгия, сыпь, преходящее повышение ЛДГ, ще-
лочной фосфатазы и мочевой кислоты в сыворотке крови.
Форма выпуска: раствор 6 мг/0,6 мл в шприц-тюбиках.
ОБЩИЕСВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 103
Характеристика отдельных противоопухолевых препаратов
Ралтитрексед (Raltitrexed)
Синонимы:Томудекс (Tomudex).
Механизм действия: ингибитор тимидилатсинтазы класса антиметаболитов.
Представляет собой аналог фолата, который в отличие от других антиметабо-
литов, таких как 5-ФУ или метотрексат, обладает прямым и высокоспецифич-
ным ингибирующим свойством в отношении тимидилатсинтазы.
Показания: распространенный колоректальный рак, рак поджелудочной железы,
молочной железы.
Дозы и режимы: в/в 15-минутная инфузия 3 мг/м2 однократно с интервалом 3 нед.
Побочное действие: лейкопения, анемия; редко — тромбоцитопения, тошно-
та, рвота, диарея, анорексия, стоматит, запор, астения, лихорадка, обратимое
увеличение активности АлАТ, АсАТ и ЩФ, сыпь, иногда сочетающаяся с зудом.
Форма выпуска: лиофилизат во флаконах 2 мг.
Ритуксимаб (Rituximab)
Синонимы: Мабтера (Mabthera), Rituxan.
Механизм действия: генно-инженерное химерное МКА, специфически свя-
зывающееся с трансмембранным антигеном CD20, который расположен на
пре-В-лимфоцитах и зрелых В-лимфоцитах, но отсутствует на стволовых ге-
мопоэтических клетках, про-В-клетках, здоровых плазматических клетках и
здоровых клетках других тканей. CD20 не циркулирует в плазме в виде сво-
бодного антигена и поэтому не конкурирует за связывание с антителами.
Связываясь с антигеном CD20 на В-лимфоцитах, инициирует иммунные ре-
акции, опосредующие распад В-клеток. Возможные механизмы клеточно-
го распада включают комплемент-зависимую цитотоксичность и антителоза-
висимую клеточную цитотоксичность. Сенсибилизирует линии В-клеточной
лимфомы человека к цитотоксическому действию некоторых химиотерапев-
тических препаратов.
Показания: рецидивирующие или устойчивые к химиотерапии В-клеточные не-
ходжкинские лимфомы.
Дозы и режимы: в/в капельно 375 мг/м2 в течение 2-3 ч на фоне премедикации па-
рацетамолом и дифенгидрамином за 30-60 мин до инфузии 1 раз в неделю
4-кратно.
Побочное действие: лихорадка, озноб, дрожь, тошнота, рвота, крапивница или
кожная сыпь, слабость, головная боль, зуд, бронхоспазм и одышка, ангионев-
ротический отек, ринит, транзиторная гипотония, приливы, аритмия, боль в
области локализации опухоли. При повторных инфузиях побочные явления
менее выражены.
Форма выпуска: раствор во флаконах 100 мг/10 мл и 500 мг/50 мл.
Сорафениб (Sorafenib)
Синонимы: Нексавар (Nexavar).
Механизм действия: ингибитор многочисленных ферментов из группы киназ.
Ингибирование деления опухолевых клеток сопровождается уменьшением
ангиогенеза в опухолевой ткани.
Показания: метастатический почечноклеточный рак, печеночноклеточный рак.
Дозы и режимы: по 400 мг 2 раза в сутки внутрь либо в промежутках между при-
емами пищи, либо вместе с пищей, содержащей умеренное количество жира,
длительно. При необходимости доза сорафениба может быть снижена до
104 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
- 4 г wo?-#,
400-200 мг 1 раз в сутки. При появлении признаков прогрессирования лече-
ние прекращают.
Побочное действие: лейкопения, лимфопения, анемия, нейтропения, тромбоци-
топения, кровотечения, приливы, повышение АД, охриплость, кожная сыпь,
алопеция, ладонно-подошвенная эритродизестезия, эритема, кожный зуд, эк-
сфолиативный дерматит, акне, диарея, тошнота, рвота, мукозиты, запор, паре-
стезия, дизестезия, депрессия, артралгия, миалгия, гриппоподобный синдром,
гипофосфатемия, увеличение активности липазы и амилазы, транзиторное по-
вышение активности аминотрансфераз (АсАТ, АлАТ).
Форма выпуска: таблетки, покрытые пленочной оболочкой, 200 мг.
Стрептозоцин (Streptozocin)
Синонимы: Занозар (Zanosar), Стрептозотоцин (Streptozotocin).
Механизм действия: алкилирующее соединение, производное нитрозомоче-
вины. Подавляет синтез ДНК и пролиферацию клеток, ингибирует митоз. Не
обладает фазоспецифичностью.
Показания: островковоклеточный рак поджелудочной железы (инсулома), злокаче-
ственный карциноид, феохромоцитома, в составе лекарственных комбинаций
при раке поджелудочной железы.
Дозы и режимы: в/в капельно (30-60 мин) 1 г/м2 1 раз в неделю в течение 4 нед. или
500 мг/м2 в 1-5-й день каждые 6 нед.
Побочное действие:тошнота, рвота, нефрит, лейкопения; редко — гепатит.
Форма выпуски: порошок во флаконах 1 г.
Сунитиниб (Sunitinib)
Синонимы: Сутент (Sutent).
Механизм действия: ингибитор рецепторов тромбоцитарного фактора ро-
ста (PDGFRoc и PDGRFP), фактора роста эндотелия сосудов (VEGRF1, VEGRF2
и VEGRF3), фактора стволовых клеток (Kit), Fms-подобной тирозинкиназы-3
(FLT), колониестимулирующего фактора (CSF-1R) и нейротрофического гли-
ального фактора (RET).
Показания: GIST при отсутствии эффекта от терапии иматинибом вследствие рези-
стентности или непереносимости; первая или вторая (при отсутствии эффекта
от терапии цитокинами) линия терапии распространенного и/или метастати-
ческого почечноклеточного рака.
Дозы и режимы: внутрь вне зависимости от приема пищи 50 мг/сут в течение 4 нед.
с последующим 2-недельным перерывом. В зависимости от индивидуальной
переносимости доза Сутента может быть уменьшена или увеличена на 12,5 мг.
Суточная доза должна быть не более 87,5 мг, но не менее 25 мг.
Побочное действие: анемия, нейтропения, тромбоцитопения, диарея, тошнота,
рвота, стоматит, нарушение вкуса, глоссодиния, изменение окраски кожи, эри-
тродизестезия, кожная сыпь, артралгия, миалгия, головная боль, повышение
АД, снижение фракции выброса, венозные тромбоэмболии, легочная эмболия,
надпочечниковая недостаточность, гипотиреоидизм.
Форма выпуски: капсулы 12,5, 25 и 50 мг.
Талидомид (Thalidomide)
Синонимы: Талидомид Фармион.
Механизм действия: иммуномодулятор. Помимо иммуномодулирующего эф-
фекта талидомид обладает противовоспалительными и потенциальными про-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 105
Характеристика отдельных противоопухолевых препаратов
тивоопухолевыми свойствами благодаря способности подавлять избыточную
продукцию ФНО-а. Кроме того, талидомид проявляет центральное седатив-
ное и гипнотическое действие, отличное от барбитуратов. Оказывает выра-
женное тератогенное действие на человека.
Показания: в комбинации с мелфаланом и преднизолоном в качестве терапии пер-
вой линии у больных с впервые выявленной множественной миеломой в воз-
растной группе 65 лет и старше или в случаях, когда назначение высоких доз
химиопрепаратов невозможно.
Дозы и режимы: 200 мг внутрь 1 раз в сутки перед сном (с учетом наличия снот-
ворного эффекта) ежедневно вне связи с приемом пищи. Необходимо пройти
как минимум 12 циклов по 6 нед. каждый.
Побочное действие: тромбоэмболии (необходимо рассмотреть возможность
профилактики тромбоза в течение первых 5 мес. терапии низкомолекулярны-
ми гепаринами или варфарином), периферическая сенсорная и двигательная
нейропатия, слабость, ортостатическая гипотензия, головокружение, запор,
макулопапулезная кожная сыпь, крапивница, сухость кожи, синдром Стивен-
са-Джонсона, повышенная сонливость, слабость.
Форма выпуска: капсулы 50 мг.
Тамоксифен (Tamoxifen)
Синонимы: Нолвадекс (Nolvadex), Атосса (Atossa), Билем (Bilem), Зитазониум
(Zitazonium).
Механизм действия: нестероидный антиэстроген, обладающий слабыми эстро-
генными свойствами. Тамоксифен, а также некоторые его метаболиты конку-
рируют с эстрадиолом за места связывания с цитоплазматическими РЭ в тка-
нях молочной железы, матки, влагалища, передней доли гипофиза и опухолях
с высоким содержанием РЭ. В противоположность комплексу РЭ рецептор-
ный комплекс тамоксифена не стимулирует синтез ДНК в ядре, а угнетает де-
ление клетки, что приводит к регрессии опухолевых клеток и их гибели.
Показания: рак молочной железы, эндометрия, почки (в дозе 80 мг/сут), саркомы
мягких тканей.
Дозы и режимы: внутрь по 10-20 мг 2 раза в сутки, длительно.
Побочное действие: тошнота, рвота, головокружение, кожная сыпь, гиперкальци-
емия, тромбоцитопения, метроррагия.
Форма выпуска: таблетки 10, 20, 30 и 40 мг.
Тегафур (Tegafur)
Синонимы: Фторафур (Phtorafur), Futrafur, FT.
Механизм действия: антиметаболит. Образующийся в результате гидролизафто-
рурацил ингибирует тимидилатсинтазу и синтез ДНК, внедряется в структуру
РНК вместо урацила. Проникает через ГЭБ. Менее токсичен и лучше перено-
сится больными, чем 5-ФУ.
Показания: рак ободочной и прямой кишки, молочной железы, опухоли мозга, рак
желудка.
Дозы и режимы: в/в или внутрь 800-1000 мг/м2 ежедневно в 2-3 приема (не более
2 г/сут), курсовая доза до 30-40 г. Интервал между курсами 4 нед.
Побочное действие: диарея, стоматит, лейкопения, тромбоцитопения, тошнота,
головная боль, головокружение.
Форма выпуска: капсулы 400мг.
106 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Темозоломид (Temozolomide)
Синонимы:Темодал (Temodal).
Механизм действия: имидазотетразиновый алкилирующий препарат. При попа-
дании в системный кровоток, при физиологических значениях pH подверга-
ется быстрому химическому превращению с образованием активного соеди-
нения — монометилтриазеноимидазолкарбоксамида (МТИК). Считается, что
цитотоксичность МТИК обусловлена в первую очередь алкилированием гуа-
нина в положении О6 и дополнительным алкилированием в положении N7.
Показания: злокачественные глиомы в качестве терапии второй линии, мультифор-
мная глиобластома в комбинированном лечении с лучевой терапией и после-
дующей адъювантной монотерапией, злокачественная меланома в качестве
терапии первой линии.
Дозы и режимы: внутрь (натощак, не менее чем за 1 ч до еды) 150-200 мг/м2 ежед-
невно в течение 5 дней с повторением цикла каждые 28 дней.
Побочное действие: тромбоцитопения, нейтропения, тошнота, рвота, запор или
диарея, анорексия, повышенная утомляемость, головная боль, головокруже-
ние, кожная сыпь, повышение температуры тела, сонливость, снижение массы
тела, алопеция, нарушение вкуса, парестезии.
Форма выпуска: капсулы 5, 20, 100 и 250 мг.
Темсиролимус (Temsirolimus)
Синонил!Ы:Торизел (Torisel).
Механизм действия: селективный ингибитор киназы mTOR.. Связывается с вну-
триклеточным белком (FKBP-12), образуя комплекс белок-темсиролимус, ко-
торый подавляет активность mTOR и опосредованно контролирует деление
клеток (прекращение роста опухолевых клеток в фазе G,). Способен снижать
уровень гипоксия-индуцируемых факторов (HIF, Hypoxia-inducible factors) и
VEGF в опухоли или опухолевой микросреде, что приводит к торможению раз-
вития кровеносных сосудов.
Показания: распространенный почечноклеточный рак в качестве терапии первой
линии.
Дозы и режимы: в/в 30-60-минутная инфузия 25 мг 1 раз в неделю. При приго-
товлении, хранении и введении Торизела следует пользоваться оборудова-
нием, которое не содержит деталей из ПВХ (растворитель содержит поли-
сорбат-80).
Побочное действие: анемия, тромбоцитопения, нейтропения, тошнота, рвота, из-
вращение вкуса, стоматит, кожная сыпь, эксфолиативный дерматит, отек лица,
периферические отеки, боль в спине, артралгия, реакции гиперчувствитель-
ности, гипергликемия/непереносимость глюкозы, интерстициальные пнев-
монии, гиперлипидемия, внутричерепное кровоизлияние, почечная недоста-
точность, перфорация кишечника, осложненное заживление ран, повышение
температуры тела, повышение активности АлАТ/АсАТ.
Форма выпуска: концентрат во флаконах 30 мг/1,2 мл с прилагаемым растворите-
лем во флаконах 1,8 мл.
Тенипозид (Teniposid)
Синонимы: Вумон (Vumon), VM-26.
Механизм действия: противоопухолевое средство растительного происхожде-
ния — полусинтетическое производное подофиллотоксина. Фазоспецифи-
ческий препарат, действующий в позднюю S2- или С2-фазу клеточного цикла.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 107
Характеристика отдельных противоопухолевых препаратов
Подавляет активность топоизомеразы II, блокирует репликацию ДНК. Ингиби-
рует вступление клеток в фазу митоза, препятствует инкорпорации тимидина в
фазе S, вызывает разрывы одиночных или двойных нитей в молекуле ДНК и пе-
рекрестных связей ДНК-белок.
Показания: опухоли головного мозга, неходжкинские лимфомы, рак мочевого пу-
зыря, яичников.
Дозы и режимы: 30-60 мг/м2 в/в капельно (не менее 30 мин) ежедневно в 1-5-й
день, суммарная доза 150-300 мг/м2. Интервал между курсами 3 нед.
Побочное действие: тошнота, рвота, слабость, диарея, аллергические реакции;
редко — анафилаксия, гипотензия (при быстром введении), лейко-, тромбо-
цитопения, алопеция. У детей при превышении рекомендованных доз препа-
рата и на фоне премедикации противорвотными препаратами возможно уг-
нетение ЦНС, снижение АД и метаболический ацидоз. Содержит бензиловый
спирт и кремофор.
Форма выпуска: раствор в ампулах 50 мг/5 мл.
Тиогуанин (Thioguanine)
Синонимы: 6-тиогуанин, Lanvis, 6-TG.
Механизм действия: антиметаболит пуринового основания (сульфгидрильное
производное гуанина). Является S-фазоспецифическим препаратом. Метабо-
лизируясь в активную форму (тиогуаниловую кислоту), нарушает синтез пури-
нов и взаимопревращение пуриновых нуклеотидов.
Показания: острый лейкоз.
Дозы и режимы: внутрь по 100 мг/м2 2 раза в сутки в течение 5 дней каждые 4 нед.
Побочное действие:тошнота, рвота, лейкопения,тромбоцитопения, анемия.
Форма выпуска:таблетки 40 мг.
Тиотепа (Thiotepa)
Синонимы: Тиофосфамид (Thiophosphamid), ТиоТЭФ, ТЕРА, Tespamine.
Механизм действия: алкилирующее соединение группы этилениминов. Отно-
сится к трифункциональным алкилирующим соединениям и является цикло-
неспецифическим. Угнетает гемопоэз, нарушает обмен нуклеиновых кислот и
блокирует митоз, образуя комплексные связи с ДНК.
Показания: рак яичников, молочной железы, мезотелиома, ретинобластома, лим-
фома Ходжкина, рак мочевого пузыря.
Дозы и режимы: в/в или в/м 10-30 мг 3 раза в неделю, или 0,2 мг/кгежедневно, или
40-60 мг 1 раз в неделю, или 80-100 мг 1 раз в 3-4 нед.; суммарная доза 120-
200 мг. Внутриплеврально 20-40 мг, внутрибрюшинно 20-100 мг.
Побочное действие: лейкопения, гранулоцитопения, тромбоцитопения; редко —
васкулиты.
Форма выпуска: лиофилизат во флаконах 10и20мг.
Топотекан (Topotecan)
Синонимы: Гикамтин (Hycamtin).
Механизм действия: ингибитор топоизомеразы I.
Показания: ракяичников, мелкоклеточный рак легкого, рецидивирующий или пер-
систирующий рак шейки матки, не поддающийся хирургическому лечению
и/или лучевой терапии (стадия IVB), в составе комбинированной терапии с ци-
сплатином.
108 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ.,.
Характеристика отдельных противоопухолевых препаратов
Дозы и режимы: в/в капельно (не менее 30 мин) 1,5 мг/м2 5 дней подряд с интер-
валом 3 нед.
Побочное действие: нейтропения, лейкопения, тромбоцитопения, анемия, тош-
нота, рвота, диарея, стоматит, астения, алопеция.
Форма выпуска: лиофилизат во флаконах 4 мг.
Торемифен (Toremifene)
Синонимы: Фарестон (Fareston).
Механизм действия: нестероидный антиэстроген, производное трифенилэти-
лена. Специфически связывается с РЭ, конкурируя с эстрадиолом, ингибиру-
ет вызванный эстрогенами синтез ДНК и репликацию клеток. При высоких до-
зах торемифен может вызывать противоопухолевый эффект, не связанный с
эстрогензависимым действием.
Показания: рак молочной железы.
Дозы и режимы: внутрь 60 мг 1 раз в сутки ежедневно. В качестве второй линии те-
рапии доза может быть увеличена до 120 мг 2 раза в сутки.
Побочное действие: тошнота, потливость, головокружение, чувство жара, в на-
чале лечения у больных с костными метастазами возможна гиперкальциемия.
Форма выпуска: таблетки 20 и 60 мг.
Трабектедин (Trabectedin)
Синонимы: Йонделис (Yondelis).
Механизм действия: представляет собой тристетрагидроизохинолиновый ал-
калоид, выделенный из морской асцидии. Препарат является первым пред-
ставителем нового класса противоопухолевых препаратов с комплексным
механизмом действия, который угнетает активацию генов посредством про-
мотер-специфического механизма и зависимую от транскрипции эксцизион-
ную репарацию нуклеотидов. Связывается с малой бороздой ДНК, в резуль-
тате чего спираль ДНК изгибается в сторону большой борозды, что запускает
каскад процессов, влияющих на факторы транскрипции ДНК, белки, связыва-
ющиеся с ДНК, и механизмы репарации ДНК.
Показания: поздние стадии саркомы мягких тканей у больных, нечувствительных к
антрациклинам и ифосфамиду либо с противопоказаниями к их применению.
Эффективность показана в основном у больных с липосаркомой и лейомио-
саркомой. Рецидивирующий рак яичников в сочетании с липосомным доксо-
рубицином.
Дозы и режимы: 24-часовая в/в инфузия 1,5 мг/м2 с интервалом 3 нед. Всем боль-
ным следует проводить премедикацию кортикостероидами, например декса-
метазоном 20 мг в/в за 30 мин до каждой инфузии Йонделиса, с целью профи-
лактики рвоты, а также с возможным гепатопротекторным действием.
Побочное действие: нейтропения, тромбоцитопения, анемия, тошнота, рвота,
анорексия, диарея/запор, стоматит, повышение активности АсАТ/АлАТ, голов-
ная боль, парестезии, снижение АД, алопеция, миалгия, артралгия, перифери-
ческие отеки, рабдомиолиз.
Форма выпуска: лиофилизат во флаконах 1 мг.
Трастузумаб (Trastuzumab)
Синонимы: Герцептин (Herceptin), HER.2.
Механизм действия: рекомбинантные гуманизированные МКА, которые се-
лективно взаимодействуют с внеклеточным доменом белка, HER.2. Подавля-
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 109
Характеристика отдельных противоопухолевых препаратов
ет пролиферацию опухолевых клеток человека, которые характеризуются ги-
перэкспрессией HER2.
Показания: рак молочной железы при гиперэкспрессии HER2.
Дозы и режимы: в/в капельно по 4 мг/кгмассы тела втечение 90 мин (ударная доза),
затем по 2 мг/кг в течение 30 мин еженедельно.
Побочное действие: озноб, лихорадка, астения, боль в груди и спине, тошнота и
рвота, головная боль чаще во время первого вливания, сердечные нарушения
(снижение фракции выброса левого желудочка у 5% больных, при использо-
вании в сочетании с антрациклинами — у 27 %). Возможны одышка, кашель, ди-
арея, зуд и кожные высыпания.
Форма выпуска: лиофилизат во флаконах 440 мг.
Треосульфан (Treosulfan)
Синонимы: Треосул ьфан медак.
Механизм действия: предшественник бифункционального алкилирующего ци-
тотоксического агента диэпоксибутана. Оказывает угнетающее действие на ге-
мопоэтические стволовые клетки, Т- и В-лимфоциты, а также оказывает цито-
токсическое действие на ряд солидных и гемопоэтических опухолей.
Показания: паллиативное лечение эпителиальных опухолей яичников стадии II-IV
в сочетании с цисплатином или в монотерапии (при противопоказаниях для
применения цисплатина).
Дозы и режимы: в/в 15-30-минутная инфузия 8 г/м2 (в режиме монотерапии) или
5 г/м2 (совместно с цисплатином) 1 раз в 3-4 нед.
Побочное действие: лейкопения, нейтропения, тромбоцитопения, анемия, ало-
пеция, пигментация кожи, крапивница, эритема, склеродермия, псориатиче-
ские бляшки, тошнота, рвота, при экстравазации — боль, воспаление окружа-
ющей подкожной клетчатки; редко — аллергический альвеолит, пневмония,
легочный фиброз, гриппоподобный синдром, парестезии, геморрагический
цистит, снижение функции коры надпочечников, гипогликемия.
Форма выпуска: порошок для приготовления раствора для инфузий во флаконах 1 г.
Третиноин (Tretinoin)
Синонимы: Весаноид (Vesanoid), транс-ретиноевая кислота.
Механизм действия: естественный метаболит ретинола; подавляет дифферен-
циацию и рост клона измененных клеток крови, включая миелолейкозные
клетки человека. Механизм действия при остром промиелоцитарном лейкозе
обусловлен повреждениями, вызванными связью третиноина с ядерными ре-
цепторами ретиноевой кислоты.
Показания: индукция ремиссии при остром промиелоцитарном лейкозе.
Дозы и режимы: внутрь 45 мг/м2 в 2 приема ежедневно в течение 30-90 дней до
достижения полной ремиссии.
Побочное действие: ксеродермия, сухость во рту, сыпь, периферические отеки,
тошнота, рвота, боль в костях, головная боль, повышение уровня триглицери-
дов, холестерина, активности аминотрансфераз в сыворотке крови; синдром
ретиноевой кислоты, проявляющийся лихорадкой, одышкой, острым респи-
раторным дистресс-синдромом, возникновением легочных инфильтратов, ги-
перлейкоцитозом, гипотензией, плевральным выпотом, печеночной, почеч-
ной и полиорганной недостаточностью.
Форма выпуска: капсулы 10 мг.
110 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
УФТ (тегафур/урацил)
Синонимы: UFT.
Механизм действия: антиметаболит, содержащий тегафур и урацил. В организме
тегафур трансформируется в активный метаболит 5-ФУ. Урацил является конку-
рентным ингибитором дигидропиримидиндегидрогеназы, препятствующим раз-
рушению 5-ФУ, заснет чего концентрация последнего в плазме увеличивается.
Показания: колоректальный рак, рак молочной железы, желудка, плоскоклеточный
рак головы и шеи, НМРЛ, рак поджелудочной железы, желчного и мочевого
пузыря.
Дозы и режимы: внутрь натощак за 1 ч до приема пищи в суточной дозе 300 мг/м2
(исходя из содержания тегафура в капсуле), разделенной на 3 приема, ежед-
невно в течение 14-28 дней с интервалом между курсами 7-14 дней.
Побочное действие: нейтропения, тромбоцитопения, диарея, тошнота, рвота, ано-
рексия, боль в животе, дерматит, гиперпигментация кожи, атаксия, светобоязнь.
Форма выпуска: капсулы, содержащие 100 мгтегафура и 224 мгурацила.
Филграстим (Filgrastim)
Синонимы: Нейпоген (Neupogen), Грасальва, Граноген, Лейкостим, Лейцита, Мие-
ластра, Нейпомакс, Нейтростим, гранулоцитарный колониестимулирующий
фактор, G-CSF.
Механизм действия: Г-КСФ, регулирует продукцию нейтрофилов и их выход в
кровь из костного мозга, а также их активность.
Показания: сокращение продолжительности нейтропении и частоты фебрильной
нейтропении у больных, получающих цитостатическую терапию по поводу
немиелоидных злокачественных заболеваний, а также у больных, получаю-
щих миелоаблятивную терапию с последующей пересадкой костного мозга.
Дозы и режимы: п/к или в/в 5-10 мкг (0,5-1 млн МЕ)/кг массы тела в сутки в тече-
ние 3-5 (до 14) дней.
Побочное действие: миалгия, артралгия, дизурия, транзиторная артериальная
гипотензия, повышение активности ЛДГ, ЩФ, ГГТ, уровня мочевой кислоты в
плазме крови.
Форма выпуска: раствор во флаконах 350 мкг (30 млн МЕ)/1 мл и 480 мкг
(48 млн МЕ)/1,6 мл или в шприц-тюбиках 350 мкг (30 млн МЕ)/0,5, 1,0 или
1,6 мл и 480 мкг (48 млн МЕ)/0,5, 1 или 1,6 мл.
Флударабин (Fludarabine)
Синонимы: Флудара (Fludara).
Механизм действия: антиметаболит, фторированный нуклеотидный аналог про-
тивовирусного агента видарабина (ара-А). В организме быстро дефосфори-
лируется до 2-фтор-ара-А, который внутриклеточно фосфорилируется до
активного трифосфата (2-фтор-ара-АТФ), ингибирующего РНК-редуктазу,
ДНК-полимеразу, ДНК-праймазу и ДНК-лигазу, что ведет к нарушению синтеза
ДНК. Кроме того, частично ингибируется РНК-полимераза II с последующим
снижением белкового синтеза.
Показания: В-клеточный хронический лимфолейкоз, злокачественные лимфомы.
Дозы и режимы: в/в капельно в течение 30 мин 25 мг/м2 или внутрь 40 мг/м2 ежед-
невно в течение 5 дней. Повторные курсы с интервалом 4 нед.
Побочное действие: нейтропения,тромбоцитопения, анемия,тошнота, рвота, по-
вышение температуры тела, слабость, парестезии.
Форма выпуска: лиофилизат во флаконах 50 мг; таблетки 10 мг.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 111
Характеристика отдельных противоопухолевых препаратов
Флутамид (Flutamide)
Синонимы: Flucinom, Frugil, Flutaplex.
Механизм действия: конкурентно связывает рецепторы андрогенов в андроген-
зависимых органах. Его способность препятствовать действию тестостерона
на клеточном уровне служит дополнением к лекарственной кастрации, вы-
зываемой агонистами гонадотропин-рилизинг гормона. Органами-мишеня-
ми фармакологического действия флутамида являются простата и семенные
пузырьки. Флутамид не обладает эстрогенной, антиэстрогенной, прогестаген-
ной и антигестагенной активностью.
Показания: рак простаты.
Дозы и режимы: внутрь по 250 мг 3 раза в сутки, длительно.
Побочное действие:тошнота, рвота, гинекомастия.
Форма выпуска: таблетки 250 мг.
Фотемустин (Fotemustine)
Синонимы: Мюстофоран (Mustoforan), Muphoran.
Механизм действия: алкилирующее средство, производное нитрозомочевины.
Показания: меланома, опухоли головного мозга.
Дозы и режимы: в/в капельно в течение 1 ч 100 мг/м2 1 раз в неделю, 3 дозы. По-
вторные курсы с интервалом 5 нед.
Побочное действие: нейтропения, тромбоцитопения, тошнота, рвота.
Форма выпуска: порошок во флаконах 208 мг.
Фторурацил (Phtoruracil).
Синонимы: Флуороурацил (Fluorouracil), Фивофлу (Fivoflu), Флурокс (Flurox), 5-FU.
Механизм действия: антиметаболит урацила. Механизм действия обусловлен
превращением препарата в тканях в активный метаболит фторуридинмоно-
фосфат, который является конкурентным ингибитором тимидилатсинтазы,
принимающей участие в синтезе нуклеиновых кислот. Нарушает синтез ДНК и
вызывает образование структурно несовершенной РНК, угнетая деление опу-
холевых клеток.
Показания: рак молочной железы, яичников, пищевода, желудка, ободочной и пря-
мой кишки, печени, шейки матки, вульвы, мочевого пузыря, простаты, опухоли
головы и шеи, слюнных желез, надпочечника, поджелудочной железы.
Дозы и режимы: в/в 300-600 мг/м2 ежедневно 3-5 дней каждые 4 нед., или че-
рез день, или 1 раз в неделю; суммарная доза 3-5 г; в/в 500 мг/м2 ежеднев-
но в1-5-й день каждые 4 нед.; 450-600 мг/м2 еженедельно; 200-400 мг/м2 в
день в виде длительной в/в инфузии; 1000 мг/м2 в день в течение 4 дней в виде
длительной в/в инфузии каждые 3 или 4 нед.; 425 мг/м2 в/в с предварительным
введением кальция фолината в/в по 20 мг/м2 ежедневно в течение 5 дней с по-
вторением курсов каждые 4 нед.
Побочное действие: стоматит, диарея, тошнота, лейкопения, тромбоцитопения,
анемия, иногда — агранулоцитоз.
Форма выпуска: раствор в ампулах 250 мг (5 мл 5% раствора).
Фульвестрант (Fulvestrant)
Синонимы: Фазлодекс (Faslodex).
Механизм действия:антагонистРЭ.
Показания: РЭ+ рак молочной железы, прогрессирующий после антиэстрогенной
терапии у женщин в менопаузе.
112 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Дозы и режимы: 250 мг в/м 1 раз в месяц.
Побочное действие: тошнота, иногда рвота, запор, диарея, кожная сыпь, повы-
шенная потливость, головная боль, боль в спине, брюшной полости; иногда —
гриппоподобный синдром, бессонница, депрессия, парестезии, фарингит, ди-
спноэ, кашель.
Форма выпуска: масляный раствор во флаконах 250 мг/5 мл. Препарат не зареги-
стрирован.
Хлоксиперазин (Chloxiperazine)
Синонимы: Проспидин (Prospidin), Prospidii Chloridum.
Механизм действия: алкилирующее соединение.
Показания: рак гортани и злокачественные новообразования глотки (при неэффек-
тивности других методов лечения). Более чувствительны к препарату экзофит-
но растущие и гистологически малодифференцированные новообразования.
Препарат эффективен также при папилломатозе верхних дыхательных путей
(применяют преимущественно при распространенном, часто рецидивирую-
щем процессе в гортани, трахее, полости носа и придаточных пазухах), при
ретикулезах кожи (ангиоретикулез Капоши, грибовидный микоз, саркоматоз
кожи), при базалиоме кожи (при неэффективности других методов лечения).
Дозы и режимы: в/в медленно струйно или капельно в течение 30-40 мин или в/м
100-200 мг через день либо 2 раза в неделю, суммарная доза до 60 г. Местно
0,4-3 г 1 раз в сутки или через 1-2 дня, 20-30 аппликаций.
Побочное действие: парестезии, головная боль, сонливость; редко — кратковре-
менная потеря сознания, нефрит, гипокалиемия, стоматит, алопеция, тошнота,
рвота, лейкопения, тромбоцитопения.
Форма выпуска: лиофилизат в ампулах 100 мг; мазь 30 или 50%втубах 15и30г.
Хлорамбуцил (Chlorambucil)
Синонимы: Хлорбутин (Chlorbutin), Ambochlorin, СВ 1348, Chloraminophene, Echloril,
Leukeran, Leukoran, Lenykoran, Lympholysin.
Механизм действия: бифункциональное алкилирующее соединение, аромати-
ческое производное азотистого иприта. Алкилирование происходит посред-
ством образования высокоактивных радикалов этилениммония.
Показания: хронический лимфолейкоз, неходжкинские лимфомы низкой степени
злокачественности, лимфома Ходжкина.
Дозы и режимы: внутрь 0,2-0,3 мг/кг ежедневно, суммарная доза 300-600 мг.
Побочное действие: гранулоцитопения, тромбоцитопения; редко — тошнота,
рвота, судороги.
Форма выпуска:таблетки 2 и 5 мг.
Цетуксимаб (Cetuximab)
Синонимы: Эрбитукс (Erbitux).
Механизм действия: рекомбинантное гуманизированное антитело к рецептору
Erb-1 (HER1) EGE
Показания: метастатический колоректальный рак в комбинации со стандартной хи-
миотерапией или в монотерапии в случае неэффективности предшествующей
химиотерапии с включением иринотекана или оксалиплатина, а также при не-
переносимости иринотекана. Не активен при мутации KRAS. Местнораспро-
страненный плоскоклеточный рак головы и шеи в комбинации с лучевой те-
рапией. Рецидивирующий или метастатический плоскоклеточный рак головы
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 113
Характеристика отдельных противоопухолевых препаратов
и шеи в случае неэффективности предшествующей химиотерапии на основе
препаратов платины.
Дозы и режимы: в/в инфузия (скорость не более 10 мг/мин с использованием ли-
нейного фильтра) 1 раз в неделю в начальной дозе 400 мг/м2 в течение 120 мин
и далее в дозе 250 мг/м2 в течение 60 мин. Перед инфузией необходима пре-
медикация антигистаминными препаратами. Иринотекан вводится не ранее
чем через 1 ч после Эрбитукса. Лечение Эрбитуксом рекомендуется начинать
за 7 дней до начала лучевой терапии и продолжать еженедельные введения
препарата до ее окончания.
Побочное действие: инфузионные реакции, тошнота, рвота, диарея, акнеподоб-
ная сыпь, кожный зуд, сухость кожи, шелушение, гипертрихоз, изменение
ногтей (например, паронихия), стоматит, одышка, конъюнктивит, повышение
активности печеночных ферментов, в сочетании с лучевой терапией — повы-
шение частоты лучевых реакций.
Форма выпуска: концентрат для инфузий во флаконах 50 мг/10 мл, 100 мг/20 мл,
250 мг/50 мл, 500 мг/100 мл (5 мг/мл) и 100 мг/5 мл (2 мг/мл).
Циклофосфамид (Cyclophosphamide)
Синонимы: Циклофосфан, Endoxan, Cytoxan, СТХ, Oaten, Enduxan, Genoxal, Procytox,
Mitoxan, Sendoxan.
Механизм действия: алкилирующий цитостатический препарат группы хлорэти-
ламинов.
Показания: острый лимфобластный лейкоз, хронический лимфолейкоз, лимфома
Ходжкина, неходжкинские лимфомы, рак молочной железы, яичников, легко-
го, шейки матки, пищевода, мочевого пузыря, яичка, хориокарцинома матки,
саркомы мягких тканей, костная ретикулосаркома, саркома Юинга, нейроб-
ластома, опухоль Вильмса, опухоли слюнных желез, простаты, головы и шеи,
рак гортани, щитовидной железы, тимома, рабдомиосаркома, миеломная бо-
лезнь, ретинобластома.
Дозы и режимы: внутрь, в/в или в/м 100-150 мг/м2 ежедневно, или 200-300 мг/м2
через день, или 600-750 мг/м2 1 раз в 5 дней, или 1500-2000 мг/м2 1 раз в
2-3 нед.; суммарная доза 6-12 г.
Побочное действие:тошнота, рвота,анорексия, стоматит; редко — гепатит, лейко-
пения, анемия, тромбоцитопения, геморрагический цистит, алопеция, гипер-
пигментация.
Форма выпуска: порошок во флаконах 200 и 500 мг; таблетки 50 мг.
Ципротерон (Cyproteron)
Синонимы: Androcur, Cyproteron acetate, Cyproplex.
Механизм действия: синтетический антиандрогеннный препарат. Механизм дей-
ствия основан на конкурентном связывании с рецепторами андрогенов в ан-
дрогензависимых органах, что приводит к снижению их функциональной ак-
тивности. В дополнение к антиандрогенному действию ципротерона ацетат
обладает также сильными антигонадотропными свойствами и гестагенной ак-
тивностью. Применение препарата приводит к снижению уровня тестостеро-
на в сыворотке крови.
Показания: рак простаты.
Дозы и режимы: внутрь 200-300 мг/сут, длительно. Андрокур-депо 300 мг в/м
1 раз в неделю.
Побочное действие: изменение массы тела, депрессия,усталость, гинекомастия.
114 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Форма выпуска: таблетки 50 и 100 мг; масляный раствор в ампулах 300 мг/3 мл.
Цисплатин (Cisplatin)
Синонимы: Платинол (Platinol), Платидиам (Platidiam), Кемоплат (Kemoplat), Цитопла-
тин (Citoplatin), Диспланор, ДДП, DDP, CDDP.
Механизм действия: содержит тяжелый металл платину, обладает сходными
свойствами с бифункциональными алкилирующими средствами.
Показания: злокачественные опухоли яичка, рак яичников, плоскоклеточный рак
головы и шеи, шейки матки, эндометрия, мочевого пузыря, хориокарцинома
матки, остеогенная саркома, саркомы мягких тканей, рак пищевода, желудка,
кишечника, легкого, почки, кожи, простаты, опухоли слюнных желез, тимома,
феохромоцитома, хемодектома, опухоль Вильмса, саркома Юинга, нейробла-
стома, меланома.
Дозы и режимы: в/в капельно 30 мг/м2 1 раз в неделю, или 60-150 мг/м2 каждые
3-5 нед., или 20 мг/м2 ежедневно 5 дней с повторением каждые 4 нед., или
50 мг/м2 в 1-й и 8-й дни каждые 4 нед.
Побочное действие: тошнота, рвота, нефрит, лейкопения, тромбоцитопения, сни-
жение слуха, полиневриты, дерматит. Для уменьшения токсичности использу-
ют гипергидратацию и форсированный диурез.
Форма выпуска: лиофилизат во флаконах 10, 25, 50 и 100 мг; раствор во флаконах
10 мг/20 мл, 25 мг/50 мл и 50 мг/100 мл.
Цитарабин (Cytarabine)
Синонимы: Цитозар (Cytosar), Алексан (Alexan), Cytosinearabinoside, Aracytidin.
Механизм действия: антиметаболит группы пиримидинового обмена, S-фазо-
специфический препарат. Тормозит синтез ДНК в клетке. Антилейкозную ак-
тивность препарат приобретает в результате фосфорилирования, которое на-
иболее интенсивно протекает в миелобластах, лимфобластах, лимфоцитах, в
меньшей степени — в гранулоцитах, эритроцитах и тромбоцитах.
Показания: острый лейкоз, лимфосаркома, грибовидный микоз.
Дозы и режимы:в/в 100-200мг/м2 ежедневно 5-10 дней с интервалом4 нед.
Побочное действие: лейкопения,тромбоцитопения,анемия,тошнота,рвота,диарея,
тромбофлебиты, лихорадка; редко — анорексия, геморрагия, нефрит, гепатит.
Форма выпуска: лиофилизат во флаконах 100 и 500 мг, 1 г; раствор во флаконах
40 мг/2 мл, 100 мг/5 мл, 500 мг/10 мл и 1 г/20 мл.
Цифелин (Cyphelin)
Синонимы: нет.
Механизм действия: алкилирующее средство. Реагирует с нуклеофильными
центрами белковых молекул и ДНК (в меньшей степени — РНК), в результате
чего нарушается жизнедеятельность опухолевых клеток и блокируется их ми-
тотическое деление. По спектру действия близок к сарколизину, отличается от
него слабовыраженным действием на кроветворение.
Показания: миеломная болезнь, злокачественные лимфомы.
Дозы и режимы: внутрь по 500 мг 2 раза в сутки, курсовая доза 20 г. Повторные
курсы с интервалом 4-6 нед.
Побочное действив:умеренная нейтропения, тромбоцитопения, анемия, сниже-
ние аппетита, тошнота; редко — рвота, незначительное повышение активности
печеночных аминотрансфераз, алопеция.
Форма выпуска: таблетки 250 мг.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 115
Характеристика отдельных противоопухолевых препаратов
Эверолимус (Everolimus)
Синонимы: Афинитор (Afinitor).
Механизм действия: ингибитор передачи пролиферативного сигнала. Избира-
тельный ингибитор серин-треониновой киназы mTOR, специфически воздей-
ствующий на комплекс mTORCl сигналпреобразующей mTOR-киназы и регу-
ляторного raptor-протеина (regulatory associated protein of mTOR). Проявляет
свою активность за счет высокоаффинного взаимодействия с внутриклеточ-
ным рецепторным белком FKBP12. Комплекс FKBPlZ-эверолимус связывается
с mTORCl, ингибируя его способность к передаче сигналов.
Показания: распространенный и/или метастатический почечноклеточный рак.
Дозы и режимы: 10 мг внутрь ежедневно натощак или после приема небольшого
количества пищи, не содержащей жира, длительно.
Побочное действие: стоматит, кожная сыпь, повышенная утомляемость, астения,
диарея, анорексия, воспаление слизистых оболочек, тошнота/рвота, кашель,
периферические отеки, присоединение вторичных инфекций, сухость кожи,
кровотечения из носа, кожный зуд, одышка, пневмонит, лимфоцитопения, ане-
мия, тромбоцитопения, нейтропения, головная боль, повышение АД, повыше-
ние концентрации холестерина, триглицеридов, глюкозы, креатинина, актив-
ности АсАТ, АлАТ, снижение концентрации фосфора в крови.
Форма выпуска: таблетки 5 и 10 мг.
Эксеместан (Exemestane)
Синонимы: Аромазин (Aromasin).
Механизм действия: необратимый стероидный ингибитор ароматазы, сходный
по структуре с природным веществом андростендионом. Блокирует образо-
вание эстрогенов из андрогенов у женщин в постменопаузе. Не обладает про-
гестагенной и эстрогенной активностью. Не влияет на биосинтез кортизола и
альдостерона.
Показания: рак молочной железы у женщин в менопаузе в качестве второй линии
гормонотерапии. Адъювантная терапия раннего РМЖу женщин в постменопа-
узе с РЭ-положительным или неизвестным рецепторным статусом.
Дозы и режимы: внутрь 25 мгежедневно, длительно.
Побочное действие: приливы, тошнота, астения, повышенная потливость, голово-
кружение, головная боль, бессонница, кожная сыпь, боль в области живота,
анорексия, депрессия, алопеция, периферические отеки, диарея или запор;
редко — тромбоцитопения и лейкопения, повышение активности печеночных
ферментов и ЩФ в сыворотке крови.
Форма выпуска: таблетки 25 мг.
Эпирубицин (Epirubicin)
Синонимы: Фарморубицин (Pharmorubicin), Эпилем (Epilem), Эписиндан, 4-epi-
doxorubicin.
Механизм действия: противоопухолевый антибиотик антрациклинового ряда.
Преимущественно локализуется в ядре. Образует комплекс с ДНК посредст-
вом интеркаляции его между основными нуклеотидными парами, следствием
которой является нарушение синтеза ДНК, РНК и белков; кроме того, интерка-
ляция в ДНК служит пусковым механизмом расщепления ДНК под действием
топоизомеразы II, приводя к серьезным нарушениям в третичной структуре
ДНК. Как и доксорубицин, эпирубицин может быть вовлечен в реакции оки-
116 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
сления/восстановления с образованием высокоактивных и высокотоксичных
свободных радикалов.
Показания: такие же, каку доксорубицина.
Дозы и режимы: в/в 30 мг/м2 в 1-3-й день с интервалом 3 нед., 60-90 мг/м2 1 раз
в 3 нед.
Побочное действие: тошнота, рвота, алопеция, лейко- и тромбоцитопения, повы-
шение температуры тела. Кардиотоксичность слабо выражена и проявляется
при суммарной дозе более 1000 мг/м2.
Форма выпуска: лиофилизат во флаконах 10 и 50 мг; раствор во флаконах
10 мг/5 мл, 20 мг/10 мл и 50 мг/25 мл.
Эпоэтин~& (Epoetin Alfa)
Синонимы: Эпрекс (Ергех), Эритропоэтин.
Механизм действия: рекомбинантный эритропоэтин человека. Стимулирует об-
разование эритроцитов из клеток-предшественников эритроцитарного ряда,
стимулирует их дифференцировку и увеличивает синтез гемоглобина в раз-
вивающихся эритробластах. Увеличивает число эритроцитов, ретикулоцитов,
гематокрит и уровень гемоглобина в крови. Не влияет на лейкопоэз.
Показания: профилактика и лечение анемии у онкологических больных с немиело-
идными опухолями, получающих длительные курсы химиотерапии.
Дозы и режимы:п/к 150-300 МЕ/кг массы тела 3 раза в неделю в течение 8 нед.
Побочное действие: повышение АД, головная боль, спутанность сознания, чувст-
вительные и двигательные нарушения; редко — аллергические реакции (зуд,
сыпь, крапивница). Повышение числа тромбоцитов, повышение риска разви-
тия тромботических осложнений.
Форма выпуска: раствор в шприцах 1000 МЕ/0,5 мл, 2000 МЕ/0,5 мл,
3000 МЕ/0,3 мл, 4000 МЕ/0,4 мл, 10000 МЕ/1 мл или во флаконах
1000 МЕ/0,5 мл и 2000, 4000 или 10000 МЕ/1 мл.
Эпоэтин-/? (Epoetin Beta)
Синонимы: Рекормон (Recormon), Эритропоэтин.
Механизм действия: такой же, какуэпоэтина-а.
Показ ания: такие же, как у эпоэтина-а.
Дозы и режимы: п/к 150-300 МЕ/кг массы тела Зраза в неделю в течение 8 нед.
Побочное действие: такое же, как у эпоэтина-а.
Форма выпуска: лиофилизат во флаконах 1000, 2000 и 5000 ME или в картриджах
для шприц-ручки 10 000 и 20 000 ME.
Эрлотиниб (Erlotinib).
Синонимы: Тарцева (Tarceva).
Механизм действия: ингибитор тирозинкиназы EGFR(HERl).
Показания: местнораспространенный или метастатический НМРЛ (вторая линия те-
рапии). Первая линия терапии местнораспространенного, неоперабельного
или метастатического рака поджелудочной железы в комбинации с гемцита-
бином.
Дозы и режимы: 150 мг внутрь ежедневно, длительно. В комбинации с гемцитаби-
ном по 100 мг ежедневно.
Побочное действие: кожная сыпь, кожный зуд, сухость кожи, диарея, тошнота,
рвота, стоматит, конъюнктивит, кашель, алопеция.
Форма выпуска: таблетки 25, 100 и 150 мг.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 117
Характеристика отдельных противоопухолевых препаратов
Эстрамустин (Estramustine)
Синонимы: Эстрацит (Estracyt), Estramustinphosphat.
Механизм действия: представляет собой конъюгат фосфорилированного эстра-
диола и азотистого иприта с двойным механизмом действия. Эстрон и эстра-
диол, продукты метаболизма эстрамустина фосфата, обладают антигонадо-
тропной активностью и вызывают снижение уровня тестостерона, сходное с
таковым после хирургической кастрации. В процессе дефосфорилирования
препаратаобразуются метаболиты, обладающие цитотоксическим свойством
за счет ингибирования образования микротрубочек в метафазе и их разруше-
ния в интерфазе.
Показания: рак простаты.
Дозы и режимы: внутрь 560-840 мг в сутки ежедневно; в/в медленно 5 мг/кг мас-
сы тела (300-450 мг) ежедневно в течение 3 нед., затем по 300 мг 2 раза в не-
делю в качестве поддерживающей терапии. Также можно вводить в/в капель-
но в течение не более 3 ч, при этом препарат разводят в 250 мл 5% раствора
декстрозы. При отсутствии эффекта в течение 4-6 нед. лечение должно быть
прекращено.
Побочное действие: лейкопения, тромбоцитопения, феминизация, задержка
жидкости, тошнота, рвота.
Форма выпуска: лиофилизат во флаконах 150 и 300 мг с прилагаемым раствори-
телем; капсулы 140 мг.
Эстрогены и их производные
Угнетают продукцию тестостерона. У женщин в менопаузе изменяют ответ на про-
лактин.
Синэстрол (Sinoestrolum).
Синонимы: Cycloestrol, Dihydrostilbostrol, Estronal, Folliplex, Hexestrolum, Syntex.
Показания: рак простаты, рак молочной железы (у женщин в менопаузе).
Дозы и режимы: 3-4 мл 2% раствора (60-80 мг) в/м ежедневно в течение 2 мес.,
затем 0.5-1 мл 2% раствора в/м или внутрь ежедневно.
Побочное действие: тошнота, рвота, задержка жидкости, сердечно-сосудистые
нарушения, маточные кровотечения, у мужчин — феминизация.
Форма выпуска: раствор в ампулах 20 мг/1 мл, таблетки 1 мг.
Фосфэстрол (Phosphoestrolum)
Синонимы: Cytonal, Difostilben, Honvan, Honvol, Stilphostrol.
Показания: рак простаты.
Дозы и режимы: в/в 500-1500 мг ежедневно в течение 10-15 дней, после чего су-
точная доза в течение 10-20 дней составляет 250 мг.
Побочное действие: тошнота, рвота, зуд и боль в области заднего прохода и ге-
ниталий, незначительная феминизация, возможно снижение свертываемости
крови с геморрагиями.
Форма выпуска: раствор в ампулах 300 мг/5 мл; таблетки 100 мг.
Хлортрианизен (Chlortrianisenum)
Синонимы: Chlorotrisin, Hormonisene, Metace, Тасе, Trianisoestrol.
Показания: рак простаты, рак молочной железы в поздней менопаузе.
Дозы и режимы: внутрь 12 мг 2-3 раза в день, длительно.
Побочное действие: слабое феминизирующее действие.
118 ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Характеристика отдельных противоопухолевых препаратов
Форма выпуска: таблетки 12 мг.
Этинилэстрадиол (Aethinyloestradiol)
Синонимы: Микрофоллин форте, Diogyn Б, Diolyn, Dylofonn, Estigyn, Ethidol, Ethinoral,
Kolpolyn, Linoral, Oestralyn, Ostral, Primogyn C, Progynon C.
Показания: рак простаты
Дозы и режимы: внутрь по 50 мкг 2-3 раза в день, длительно.
Побочное действие:тошнота, рвота, головокружение.
Форма выпуска.’таблетки 50мкг.
Полиэстрадиола фосфат (Polyestradiol phosphate)
Синонимы: Эстрадурин (Estradurin)
Показания: рак простаты
Дозы и режим ы: в/м 80-160 мг 1 раз в месяц в течение 2-3 мес., затем дозу умень-
шают до 40-80 мг в месяц.
Побочное действие: такое же, какухлортрианизена.
Форма выпуска: лиофилизат во флаконах 80 мг в комплекте с растворителем.
Этопозид (Etoposid)
Синонимы: Вепезид (Vepesid), Ластет (Lastet), Фитозид (Fytosid), Цитопозид
(Cytoposid), Этопос (Etopos), VP-16-213.
Механизм действия: полусинтетическое производное подофиллотоксина, инги-
битор топоизомеразы II. Повреждает ДНК, блокирует митоз, вызывая гибель
клеток в G-фазе и поздней S-фазе митотического цикла. Высокие концентра-
ции препарата вызывают распад клеток в премитотической фазе. Также подав-
ляет проникновение нуклеотидов через плазматическую мембрану, что пре-
пятствует синтезу и восстановлению ДНК.
Показания: рак легкого, неходжкинские лимфомы, острый миелолейкоз, опухоли
яичка, рак яичников, рак желудка, кишечника, хемодектомы.
Дозы и режимы: 50-100 мг/м2 в/в (30-60 мин) ежедневно в 1-5-й день каждые
3-4 нед. Внутрь по 50 мг/м2 ежедневно в течение 21 дня с повторением ци-
клов каждые 28 дней ил и по 100-200 мг/м2 5 дней подряд с интервалом 3 нед.
Побочное действие: угнетение миелоидного кроветворения (лейкопения, тром-
боцитопения), тошнота и рвота, диарея, обратимая алопеция, гипотензия, ней-
ропатии; редко — анафилаксия.
Форма выпуска: раствор в ампулах 100 мг/5 мл; капсулы 25, 50 и 100 мг.
ОБЩИЕ СВЕДЕНИЯ О ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
119
ЧАСТЬ II
ХИМИОТЕРАПИЯ
ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ
ЗАБОЛЕВАНИЙ
Глава 9
Химиотерапия солидных опухолей
9.1. Рак кожи и карцинома Меркеля
А Ф. Маренич
Злокачественные эпителиальные опухоли кожи подразделяются на базальноклеточ-
ный рак (БКР), или базалиому (около 70-75% случаев), и ПКР (25-30%). К редким фор-
мам относятся карцинома Меркеля, рак придатков кожи.
Рак кожи
Как БКР, так и ПКР кожи встречаются преимущественно у лиц пожилого возраста.
Воздействие солнечного излучения — основной фактор риска, особенно у людей со
светлой кожей. Обычно имеются множественные (30-50% случаев) очаги БКР или
ПКР. Другие этиологические факторы: радиоактивное излучение, ожоги, рубцы, воз-
действие на кожу мышьяка, хроническое воспаление. Больные с хронической имму-
носупрессией (при трансплантации органов, ХЛЛ) имеют повышенный риск заболева-
ния, как и пациенты с генетическими нарушениями, включая пигментную ксеродерму.
Очевидно, что заражение ВИЧ может способствовать более агрессивному течению
БКР и ПКР.
Диагноз ставят на основании биопсии путем иссечения опухоли или соскоба в зави-
симости от клинической ситуации.
Система стадирования, используемая для этих опухолей, нетипична, поскольку спо-
собность к метастазированию у них низкая. БКР может иметь как узловую, так и язвен-
ную форму. Метастазирует 0,1 % базальноклеточных опухолей. Обычно это наблюда-
ется при длительно существующих опухолях, наиболее часто поражаются лимфоузлы,
а также легкие и кости.
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 123
Химиотерапия солидных опухолей
вМ0ЯИййЯй»аяй«а«^^ - -д г«- « *-
ПКР имеет большую способность к метастазированию (2%). Если он развивается на
фоне иммуносупрессии, то протекает более злокачественно и метастазирует в 20-
50% случаев. Язвенные формы, низкодифференцированные опухоли имеют явную
склонность к метастазированию и худшему прогнозу.
В большинстве случаев метастазы вначале появляются в лимфоузлах (90%) с вероят-
ностью развития отдаленных метастазов в легких и костях в 50% случаев.
Местное лечение
Хирургическое иссечение, электрокоагуляция, лучевая терапия и криодеструк-
ция обладают примерно одинаковой эффективностью и могут быть выбраны в
зависимости от индивидуальных и клинических особенностей случая. Хирурги-
ческое иссечение для ПКР может быть предпочтительнее при соблюдении прин-
ципов абластики. Это особенно важно, поскольку этот тип рака имеет большую,
чем БКР, способность к метастазированию. Для лечения БКР может использовать-
ся любой из предложенных способов, включая криотерапию. Лучевая терапия мо-
жет быть методом выбора в случае локализации обоих видов опухоли на участках
кожи, где хирургическое иссечение может привести к плохому косметическому
эффекту.
Использование ежедневных в течение 3-4 нед. аппликаций 30% проспидиновой
мази либо эмульсии фторурацила возможно лишь при ограниченном поверхностном
поражении и широкого применения не получило.
Лечение метастатических форм рака кожи
Для лечения всех форм диссеминированного рака кожи используются платиносо-
держащие режимы XT. Эффективность составляет около 70%.
1. Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Доксорубицин — 50 мг/м2 в/в капельно в 1-й день.
Интервал между курсами 3 нед.
2. Цисплатин — 25 мг/м2 в/в капельно в 1-5-й день.
Метотрексат — 15 мг/м2 в/в капельно в 1,8 и 15-й дни.
Блеомицин — 15 мг в/в в 1, 3, 5,8, 10 и 12-й дни.
Интервал между курсами 3 нед.
3. Этопозид — 100 мг/м2 в/в капельно в 1-3-й день.
Цисплатин — 100 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 3 нед.
-Карцинома Меркеля
Карцинома Меркеля — редкая агрессивная злокачественная опухоль кожи, встре-
чается преимущественно у пожилых представителей белой расы. Характеризуется
склонностью к местным рецидивам и регионарному метастазированию. Существует
несколько названий этой опухоли, которые используются в литературе: трабекуляр-
ноклеточная карцинома, нейроэндокринная или первичная мелкоклеточная карцино-
ма кожи, анапластический рак кожи.
Заболеваемость, по данным США (1994 г.), составляет 0,23 случая на 100 000 бело-
го населения и 0,1 на 100 000 афроамериканцев. Болеют чаще мужчины — 0,65 слу-
чая на 100 000 населения, вто время каку женщин заболеваемость составляет 0,26 на
100 000 (2001 г.); средний возраст заболевших 68-70 лет. Однако заболевание встре-
124 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак кожи и карцинома Меркеля
чается и в более молодом возрасте у больных с компрометированной иммунной си-
стемой.
Опухоль происходит из клеток Меркеля, которые локализуются в базальном слое
эпидермиса и волосяных фолликулах. Клетки Меркеля связаны с чувствительными не-
рвными окончаниями в кожных сосочках — механорецепторах кожи. Существует аль-
тернативная гипотеза, согласно которой опухоль развивается из незрелой полипо-
тентной стволовой клетки, приобретающей свойства нейроэндокринной в процессе
злокачественной трансформации. Этиология заболевания неизвестна. Главный фак-
тор риска — повышенная инсоляция.
Общепринятой системы стадирования для этой опухоли нет. В целом опухоль ха-
рактеризуется агрессивным рецидивирующим течением, сходным с МРЛ и мелано-
мой. У большинства больных рецидивы появляются в течение первых 12 мес. от начала
лечения. Прогрессирование может развиваться как местно, так и вовлекать регионар-
ные лимфоузлы, позже появляются отдаленные метастазы в легких, печени и костях.
Стандартное лечение — хирургическое удаление первичной опухоли, отступив 2 см
от края, затем — диссекция регионарных лимфоузлов. В связи с высоким риском мест-
ного рецидива лучевая терапия может быть использована адъювантно на область уда-
ленной первичной опухоли и регионарные зоны.
Адъювантная лучевая терапия рекомендуется больным при наличии хотя бы одного
из следующих признаков:
размер первичной опухоли более 2 см;
наличие опухолевых клеток по краю резекции;
инвазия лимфатических сосудов;
поражение регионарных лимфоузлов;
иммунокомпрометированные больные.
Облучение регионарных зон по эффективности сопоставимо с лимфодиссекцией и
является методом выбора. Роль адъювантной XT не изучена. Комбинация химио- и лу-
чевой терапии дает лучшие результаты у больных с местнораспространенным процес-
сом, особенно у больных с хорошим общим состоянием.
При диссеминированном процессе применяется два основных режима XT: CAV и ЕР,
как при МРЛ. Эффективность составляет около 60%. Общая выживаемость у больных
с диссеминированным процессом составляет 22 мес.; 2- и 5-летняя выживаемость —
36 и 17 % соответственно.
Режимы терапии первой линии
ЕР
Этопозид — 100 мг/м2 в/в капельно в 1 —3-й день.
Цисплатин — 100 мг/м2 в/в капельно в 1-й день.
Интервал между курсами 3 нед.
Замена цисплатина на карбоплатин в этой комбинации может улучшить переноси-
мость лечения, особенно у пожилых больных.
CAV
Циклофосфамид — 1000 мг/м2 в/в в 1-й день.
Доксорубицин — 50 мг/м2 в/в в 1-й день.
Винкристин — 1,4 мг/м2 в/в в 1-й день.
Интервал между курсами 3 нед.
При прогрессировании опухолевого процесса после первой линии лечения воз-
можно проведение второй линии XT такими препаратами, как топотекан, иринотекан,
гемцитабин, таксаны в монорежиме, поскольку они оказались эффективны при нейро-
эндокринных опухолях разных локализаций.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 125
Химиотерапия солидных опухолей
яйяйеяяяяияяяивваяиижяяямдаеяая^^ v -
9.2. Меланома кожи
А. А. Феденко
Меланома кожи составляет около 1,5% всех опухолей и 6,5 % опухолей кожи, этот про-
цент постоянно растет. Меланома, раньше считавшаяся относительно редкой опухолью,
в настоящее время встречается значительно чаще, составляя в странах Европы 10 случа-
ев на 100 000 населения в год. Полагают, что росту заболеваемости меланомой способ-
ствует интенсивное ультрафиолетовое облучение, особенно у людей со светлой кожей.
Средняя возрастная группа составляет 50 лет. Частота заболеваемости у мужчин выше.
Этиология. Клетки меланомы берут свое начало из продуцирующих пигмент мела-
ноцитов, которые мигрируют в кожу, оболочки глаза, слизистую оболочку ротоглотки,
влагалища и ануса в процессе эмбриогенеза.
Выделяют четыре основных вида кожных проявлений меланомы:
Я Поверхностно распространяющаяся меланома — наиболее часто встречающий-
ся подтип, располагается на туловище у мужчин и нижних конечностях у жен-
щин, составляет около 70%.
Я Узловая (нодулярная) меланома встречается в 10-15 % случаев, как правило, на
коже туловища у мужчин и характеризуется ранним вертикальным ростом.
Я Злокачественное лентиго составляет около 10 % случаев и характеризуется пло-
скими большими образованиями (1-5 см в диаметре) на коже кисти, предплечья
и лица у пожилых пациентов (средний возраст около 70 лет).
Я Периферическое (акральное) злокачественное лентиго составляет 3-5 % всех
случаев, чаще всего локализуется наладонной поверхности кисти, подошвенной
поверхности стоп и в области ногтевого ложа. Характерно для людей с темной и
пигментированной кожей.
В 5 % случаев пациенты обращаются за медицинской помощью в связи с увеличен-
ными регионарными лимфоузлами или отдаленными метастазами без явного первич-
ного очага.
Отдельно выделяется меланома глаза, которая может возникать во всех структурах
глаза, в которых присутствуют меланоциты. Стандартом лечения является энуклеация
или брахитерапия с ,251. Эти опухоли, как правило, метастазируют в печень и наименее
чувствительны как к биотерапии, так и XT по сравнению с меланомой кожи.
Характеристика опухолевого роста и особенности метастазирования.
В развитии меланомы выделяют две основные фазы роста: начальная радиальная, кото-
рая характеризуется увеличением очага по поверхности в пределах базальной мембраны
кожи, и вертикальная, при которой опухольуглубляется в более глубокие слои кожи и под-
кожную жировую клетчатку. Именно при вертикальной фазе риск метастазирования уве-
личивается в сотни раз. Для меланомы характерен как лимфогенный, так и гематогенный
тип метастазирования в любую часть тела. Наиболее часто метастазирует в легкие, печень,
кости, подкожную жировую клетчатку, на поздних стадиях — в головной мозг. У 25% паци-
ентов развиваются отдаленные метастазы, у 15% — процесс ограничивается только вовле-
чением лимфоузлов. У больных с поражением лимфоузлов или отдаленными метастазами
редко (< 1%) отмечается феномен спонтанной регрессии первичного очага, это объясня-
ется отчасти реакцией иммунной системы, однако механизмы до конца не изучены.
Стадирование. В 2002 г. система стадирования по системе TNMAJCC (табл. 9.1) пре-
терпела значительные изменения, что в настоящее время позволяет более четко опре-
делять стадию заболевания и, самое важное, прогноз течения заболевания (табл. 9.2).
126 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Меланома кожи
Таблица9.1. Классификация меланомы по системе TNMAJCC (2002)
тх Первичная опухоль не определяется (поверхностная биопсия, феномен регрессии)
Tis Меланома in situ
Т1 < 1,0 мм а: без изъязвления и уровень инвазии II/III* Ь: с изъязвлением или уровень инвазии IV/V*
Т2 1,01-2,0 мм а: без изъязвления Ь: с изъязвлением
ТЗ 2,01-4,0 мм а: без изъязвления Ь: с изъязвлением
Т4 > 4,0 мм а: без изъязвления Ь: с изъязвлением
*7 £ * St $ *v л & \ «•?-д г V
N1 Один лимфатический узел а: микрометастазы** (клинически не выявляются) Ь: макрометастазы*** (клинически определяются)
2-3 лимфоузла
а: микрометастазы**
Ь: макрометастазы***
с: транзиторные или сателлитные метастазы без поражения лимфоузлов
N3 4 и более лимфоузлов или вколоченные лимфоузлы либо транзиторные или сателлитные мета- стазы с поражением лимфоузлов
Мт-
М1а Отдаленные кожные, подкожные метастазы или метастазы в лимфоузлах, нормальная активность лдг
М1Ь Метастазы в легких, нормальная активность ЛДГ
М1с Висцеральные метастазы (кроме легких), нормальная активность ЛДГ Любые отдаленные метастазы, повышенная активность ЛДГ
* Инвазия по Кларку уровень I — ограничена эпидермисом клетки меланомы не распространяются за базальную мембрану уровень II — вовлечен сосочковый слой дермы уровень III — вовле
чение пространства между сосочковым и ретикулярным слоем уровень IV — вовлечение ретикулярного слоя дермы уровень V — инвазия подкожной жировой клетчатки
* * Микрометастазы диагностируются после выборочной биопсии лимфоузлов или биопсии сторожевого лимфоузла
* * Макрометастазы определяются клинически и подтверждаются при лечебной лимфаденэктомии или когда метастаз в лимфоузле прорастает капсулу
Таблица 9.2. Выживаемость больных меланомой в зависимости от TNM и
стадии заболевания
Стадия ТИМ Изъязвление Число лимфоузлов Выживаемость, %
1-летняя 5-летняя 10-летняя
IA Т1а Нет 0 100 99 97
IR Т1Ь Есть или уровень IV, V 0 99 94 90
ID Т2а Нет 0 100 91 84
НА Т2Ь Да 0 96 77 65
11г\ ТЗа Нет 0 98 78 67
1IR тзь Да 0 95 71 62
IID Т4а Нет 0 96 67 56
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 127
Химиотерапия солидных опухолей
яяяаяявваяййняввяиюяяивйяияйи^^
Стадия TNM Изъязвление Число лимфоузлов Выживаемость, %
1-летняя 5-летняя 10-летняя
НС Т4Ь Да 0 93 56 48
III д N1a Нет 1 95 — —
HIM N2a Нет 2-3 96 — —
N1a Да 1 91 — —
IIIB N2a Да 2-3 94 59 50
M1b Нет 1 92 50 44
N2b Нет 2-3 93 68 59
N1b Да 1 95 52 37
IIIC N2b Да 2-3 84 33 33
М3 Любое 4 74 27 22
IV M1a-c Любое Любое 42 18 14
Лечение. Стандартом хирургического лечения образований, подозрительных на ме-
ланому, является эксцизионная биопсия с чистыми краями резекции до 1 см при пер-
вичном образовании до 1 мм толщиной и 1-2 см при толщине более 1 мм. Дополни-
тельно, при образовании толщиной 1 мм и более, рекомендовано проводить биопсию
сторожевого лимфоузла. При отсутствии вовлечения в процесс этих лимфоузлов ре-
комендуется выборочная лимфаденэктомия. Выполнение профилактической лимфа-
денэктомии не рекомендуется.
Адъювантная терапия. Стандартной адъювантной XT для больных с меланомой
не существует.
В настоящее время, по результатам различных исследований, при толщине первич-
ной опухоли 4 мм и более или вовлечении регионарных лимфоузлов оптимальная
адъювантная терапия: интерферон 20 млн ЕД/м2 в/в 5 дней в течение 4 нед. (нагрузоч-
ная доза), далее по 10 млн ЕД/м2 п/к 3 дня в неделю в течение 48 нед. (поддерживаю-
щая доза).
Токсичность данного режима (гриппоподобные симптомы, нарушение функции пе-
чени и неврологическая симптоматика) может быть клинически значимой, в то же вре-
мя при анализе качества жизни пациентов, проходящих такое лечение, показано пре-
имущество по сравнению с группой контроля (наблюдения). Однако необходимость
назначения адъювантной терапии должна основываться на строгих показаниях для па-
циентов с высоким риском рецидива, согласно классификации AJCC (2002), и отсутст-
вии сопутствующих заболеваний, которые в комплексе с токсичностью терапии могут
ухудшить качество жизни.
В Европе проводились исследования по изучению эффективности низких доз ин-
терферона по 3 млн ЕД 3 раза в неделю в качестве адьювантной терапии, однако при
III стадии эффективность оказалась недостаточной. В настоящее время продолжается
изучение эффективности средних доз 5-10 млн ЕД.
Адъювантная XT не показала преимуществ по сравнению с группами наблюдения.
Высокие дозы интерферона в комбинации с XT также не показали различий в безре-
цидивный период и общей выживаемости между группами XT и XT в комбинации с им-
мунотерапией.
Регионарная перфузия химиопрепаратами у пациентов с меланомой конечностей с
высоким риском развития рецидива не показала никаких преимуществ*
Вакцины на основе ГМ-КСФ в качестве адъювантной терапии находятся в стадии изу-
чения.
128 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Меланома кожи
Терапия диссеминированных форм
Биотерапия. Интерлейкин-2 обладает противоопухолевой активностью при мела-
номе кожи. Используется следующий режим: 600 000 МЕ/кг 15-минутная в/в инфузия
каждые 8 ч, всего 14 введений. Эффективность данного режима составляет 15-20 % у
пациентов с висцеральными метастазами и до 50% при кожных/подкожных проявле-
ниях. У ответивших на лечение пациентов вероятность сохранения полного эффекта в
течение 5 лет более 50%. Однако применение интерлейкина лимитировано его ток-
сичностью.
Данный режим является высокотоксичным: гипотензия, задержка жидкости, по-
чечная и печеночная недостаточность, отек легких и т.д., пациенты нуждаются в по-
стоянном мониторировании, специфической премедикации и симптоматической
сопутствующей терапии. Его использование рекомендуется только в условиях специ-
ализированного стационара.
В амбулаторных условиях возможно использование комбинации ИЛ-2 в средней
дозе 22 млн МЕ/м2 в/в 15-минутная инфузия в 4-8-й и 11-15-й дни и циклофосфами-
да 350 мг/м2 в/в в 1-й день. Интервал между первыми 3 курсами составляет 21 день, а
с 4-го курса — 28-42 дня.
ИФН-а-2Ь и ИФН-а-2а. Эффективность этих препаратов при диссеминированном
процессе составляет 10-15 %, по данным разных авторов. Иногда наблюдаются случаи
длительной стабилизации. Рекомендуется использовать в дозе 3-5 млн ЕД п/к 3 раза в
неделю.
Таргетная терапия. Сорафениб в монотерапии, по данным 2 исследований, пока-
зал противоречивые результаты. Более детальное изучение продолжается.
Комбинированная биотерапия, биохимиотерапия, терапевтические вакцины и кле-
точная терапия находятся в стадии изучения.
Химиотерапия
Монохимиотерапия. Большинство химиопрепаратов относительно малоэффек-
тивно при данном виде опухоли. Наибольшая эффективность отмечается при метаста-
зах в легких и невисцеральных проявлениях болезни, в основному бессимптомных па-
циентов.
Дакарбазин — наиболее эффективный препарат при диссеминированной мелано-
ме. Эффективность составляет от 8 до 20%, по данным разных авторов; однако боль-
шинство эффектов частичные и мало продолжительные — от 4 до 6 мес.
Применяется в дозировках: 250 мг/м2 в/в в 1-5-й день с 3-недельным интервалом
или 850-1000 мг/м2 в/в 1 раз в 3-4 нед. Эффективность не зависит от режима введе-
ния, однако при использовании однодневного режима необходимо более мощное ан-
тиэметическое прикрытие.
Темозоломид — аналог дакарбазина, оба препарата конвертируются в один актив-
ный метаболит. Наиболее часто используется при поражении головного мозга в ком-
бинации с лучевой терапией, возможны комбинации с XT при выраженных эффектах
для профилактики поражения головного мозга.
Дозировка: 150-200 мг/м2 внутрь в течение 5 дней каждые 28 дней.
Производные платины. Цисплатин применяется в дозе 100-120 мг/м2 в/в 1 раз в
21 день, эффективность его составляет от 15 до 20%. Карбоплатин применяется по
400 мг/м2 также 1 раз в 21 день. Различий в эффективности между этими препарата-
ми не отмечено.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 129
Химиотерапия солидных опухолей
Производные нитрозомочевины. Фотемустин (FCNU), ломустин (CCNU), кармустин
(BCNU) и араноза эффективны в 13-18% случаев. В некоторых европейских странах
фотемустин используется в качестве первой линии лечения. В единичных исследова-
ниях показано значительное увеличение времени до появления метастазов в головном
мозге 22,7 и 7,2 мес. по сравнению с дакарбазином. Эффективность аранозы при ме-
ланоме не уступает эффективности дакарбазина.
Таксаны. Доцетаксел 60-100 мг/м2 в виде часовой инфузии 1 раз в 3 нед. или пакли-
таксел 135-225 мг/м2 3-часовая инфузия также 1 раз в 3 нед. Данная группа препара-
тов чаще используется в качестве второй-третьей линии терапии в монорежиме или
комбинации с карбоплатином и/или тамоксифеном.
Комбинированная химиотерапия. По последним результатам исследований,
комбинированная терапия показала некоторое увеличение частоты объективных от-
ветов, однако медиана выживаемости в группах монотерапии дакарбазином и комби-
нированных режимов была одинаковой и составила 7 мес. При этом при применении
комбинированных режимов токсичность была существенно выше.
Гормонотерапия
Несмотря на то что гормональные рецепторы были обнаружены на некоторых кле-
точных линиях меланомы, применение тамоксифена и мегестрола ацетата с противо-
опухолевой целью неэффективно. Однако, по данным in vitro и некоторым клиниче-
ским данным, эта группа препаратов может потенцировать действие цитостатиков и
именно для этого применяется в некоторых комбинациях.
Лучевая терапия
Адъювантная лучевая терапия не является стандартным методом лечения меланомы,
однако в некоторых случаях ее применение оправдано, в частности:
после резекции меланом с десмопластическими и нейротропными морфологи-
ческими характеристиками;
И при меланоме толщиной более 4 мм с изъязвлением или сателлитными метаста-
зами;
при меланоме головы и шеи с вовлечением слизистых оболочек;
при невозможности радикального хирургического удаления опухоли.
Лучевая терапия при диссеминированном процессе используется в основном с пал-
лиативной целью при метастазах в костях и головном мозге.
Рекомендации
Адъювантная терапия интерфероном показана пациентам с высокой степенью ри-
ска развития рецидива при толщине первичной опухоли более 4 мм, особенно при на-
личии изъязвлений.
Для терапии больных с диссеминированной меланомой может быть использована
как монотерапия, так и комбинированная XT.
При метастатическом поражении головного мозга методом выбора является комби-
нированная химиолучевая терапия (дистанционная или стереотаксическая) на фоне
темозоломида или фотемустина.
Адъювантная терапия
ИФН 20 млн МЕ/м2 в/в 5 дней в неделю в течение 4 нед. в качестве нагрузочной дозы,
далее 10 млн МЕ/м2 п/к 3 раза в неделю в течение 48 нед. в качестве поддерживаю-
щей терапии.
130 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Меланома кожи
Режим биотерапии для амбулаторного применения
при диссеминированном процессе
Циклофосфамид — 350 мг/м2 в/в болюс в 1-й день.
ИЛ-2 — 22 млн МЕ/м2 в/в болюс в 4-8-й и 11 -15-й дни.
Первые 3 курса интервал между курсами составляет 3 нед., далее — 1 раз в 28-42 дня.
Режимы терапии при диссеминированном процессе
Монохимиотерапия
Дакарбазин — 250 мг/м2 в/в в 1-4-й день. Интервал между курсами 21-28 дней.
Фотемустин — 100 мг/м2 в/в в 1,8 и 15-й дни. Интервал между курсами 5 нед.
Араноза — 800 мг/м2 в/в в 1-3-й день. Интервал между курсами 3 нед.
Темозоломид — 150-200 мг/м2 внутрь в 1 -5-й день. Каждые 28 дней.
Комбинированная химиотерапия
1. CVD. Дакарбазин — 800 мг/м2 в/в капельно в 1-й день.
Винбластин — 1,6 мг/м2 в/в в 1-5-й день.
Цисплатин — 20 мг/м2 в/в капельно во 2-5-й день.
Интервал между курсами 3 нед.
2. Ломустин — 80 мг/м2 внутрь в 1-й день.
Винкристин — 1,4 мг/м2 в/в в 1-й и 8-й дни.
Цисплатин — 30 мг/м2 в/в капельно на фоне гипергидратации в 3-6-й день.
Интервал между курсами 6 нед.
3. Винбластин — 6 мг/м2 в/в в 1-й и 2-й дни.
Блеомицин — 15 мг в/в или в/м в 1-5-й день.
Цисплатин — 50 мг/м2 в/в капельно на фоне гипергидратации в 5-й день.
Интервал между курсами 3 нед.
4. Араноза — 1000 мг/м2 в/в в 1-й и 2-й дни.
Винкристин — 2 мг/м2 в/в в 1-й день.
Цисплатин — 80 мг/м2 в/в капельно на фоне гидратации в 4-й день.
Интервал между курсами 3-4 нед.
5. Араноза — 600-700 мг/м2 в/в в 1-3-й день.
Винкристин — 2 мг/м2 в/в в 1-й и 8-й дни.
Дактиномицин — 0,5 мг/м2 в/в в 1, 3, 5 и 8-й дни.
Интервал между курсами 3-4 нед.
6. Фотемустин — 100 мг/м2 в/в в 1-й день.
Дакарбазин —• 300 мг/м2 в/в во 2-4-й дни.
Цисплатин — 25 мг/м2 в/в в 3-й и 4-й дни.
Интервал между введениями 4 нед.
+ ИФН-а2-Ь — 3 млн ME п/к 3 раза в неделю.
7. Кармустин — 150 мг/м2 в/в в 1-й день каждые 6 нед.
Цисплатин — 25 мг/м2 в/в в 1-3-й день каждые 3 нед.
Дакарбазин — 220 мг/м2 в/в в 1-3-й день каждые 3 нед.
Тамоксифен — 20 мг внутрь ежедневно.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 131
Химиотерапия сол идных опухолей
9.3. Злокачественные опухоли головы и шеи
С. П. Федотенко, И. С. Романов
Злокачественные опухоли головы и шеи в России составляют около 20% всех злока-
чественных новообразований. В основном эти опухоли представляют собой ПКР (до
90%), возникающий в слизистой оболочке верхних отделов дыхательной и пищевари-
тельной систем: полости носа и ее придаточных пазух, полости рта, носо-, рото- и гор-
таноглотки, гортани. Некоторую долю составляют эпителиальные злокачественные
опухоли, возникающие в больших и малых слюнных железах, а также в щитовидной
железе. В данной главе мы не рассматриваем вопросы лечения рака кожи, меланомы,
сарком области головы и шеи.
Традиционно при изучении эффективности противоопухолевых препаратов ле-
чение опухолей головы и шеи различных локализаций рассматривается как единая
проблема. Главным образом, это ПКР разных отделов верхних дыхательных и пище-
варительных путей, таких как полость рта, глотка, гортань и слизистая оболочка при-
даточных пазух. Факторами риска развития этих заболеваний являются табакокуре-
ние, употребление крепких спиртных напитков. В последние годы появились работы
о вирусе папилломы человека как факторе риска развития ПКР головы и шеи, осо-
бенно интересен факт лучшего прогноза заболевания и высокой чувствительности
опухоли к химиолучевому лечению у пациентов с определяемым папилломавиру-
сом. У ПКР головы и шеи есть общие особенности: увеличение частоты рака с уве-
личением возраста, трудность определения первоначальной локализации опухоли
в связи с близостью границ различных отделов и органов, включающих полость рта,
ротоглотку, полость носа, гортань и гортаноглотку. Общность проявляется также и в
направлении метастазирования, преимущественно в регионарные лимфоузлы шеи.
Отдаленные метастазы достаточно редки и обнаруживаются, как правило, в легких,
лимфоузлах средостения, реже — в печени и костях скелета. Костные поражения
вторичного характера при ПКР головы и шеи происходят преимущественно путем
местного распространения на соседние структуры. От локализации опухоли зави-
сит симптоматика, тактика обследования, клиническое течение заболевания, харак-
тер метастазирования, прогноз заболевания, что в конечном счете определяет план
оптимального лечения.
Стадирование рака головы и шеи
Разработана классификация по системе TNM для основных локализаций опухоли в
области головы и шеи: губы и полости рта, ротоглотки, носоглотки, гортаноглотки, гор-
тани, полости носа и ее придаточных пазух, слюнных желез, щитовидной железы.
Помимо системы TNM для оценки степени распространенности опухолевого про-
цесса и оценки прогноза заболевания обязательно использование классификации
рака по стадиям. В табл. 9.3 отражена классификация ПКР по стадиям и группировка
по системе TNM для основных локализаций в области головы и шеи.
Цель химиотерапии
XT применялась ранее у больных раком головы и шеи в основном с паллиативной
целью при неоперабельных распространенных опухолевых процессах, чаще реци-
дивного характера, с наличием отдаленных метастазов. В последние годы она исполь-
зуется в качестве равноправного компонента сочетанного воздействия вместе с хи-
рургическим и лучевым методами лечения. Лечение ПКР головы и шеи проблематично
в основном из-за того, что на всех этапах развития болезни требуется" тщательный
мультидисциплинарный подход для выбора существующих опций лечения больных.
132 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли головы и шеи
Таблица 9,3. Группировка плоскоклеточного рака головы и шеи по стадиям
1 Т1 NO МО
II Т2 NO МО
in ТЗ NO МО
in Т1-3 N1 МО
Т4 NO МО
IV Т1-4 N2-3 МО
T1-4N1-3 М1
На рис. 9.1 показан мультидисциплинарный подход к лечению ПКР головы и шеи.
В верхней части рисунка — возможные стадии развития опухолевого процесса; в
средней части — возможные варианты применяемого консервативного лечения; в ни-
жней части — хирургический метод лечения, использование которого возможно на
любом этапе развития болезни как с лечебной, так и паллиативной целью.
Таким образом, на сегодняшний день XT при ПКР головы и шеи применяется в сле-
дующих клинических ситуациях. При лечении первичных местнораспространенных
опухолевых процессов в виде нескольких курсов индукционной (неоадъювантной)
полихимиотерапии (ПХТ) перед хирургическим лечением или облучением. Индукци-
онная XT позволяет отобрать пациентов с опухолями, чувствительными к дальнейше-
му лучевому лечению, и выполнить хирургическое вмешательство на ранних этапах в
случае неудовлетворительного ответа на XT. Индукционная XT не увеличивает коли-
чество осложнений от последующего хирургического вмешательства, снижает риск
развития отдаленных метастазов и дает возможность сохранения органов, но не улуч-
шает выживаемость. Основная критика использования индукционной XT заключается
в том, что она применяется только для отбора пациентов и в дозах, недостаточных, что-
бы оказать реальное влияние на их выживаемость.
В последние годы вошло в широкую клиническую практику применение
конкурентного (сочетанного или одномоментного) химиолуиевого лечения, когда
на фоне лучевой терапии больному вводят химиопрепараты, что обеспечивает по-
вышение выживаемости, улучшение локорегионарного контроля и увеличение доли
сохранения органов, что особенно важно при лечении рака таких локализаций, как
Ранние Местнораспространенные
Рецидивные/метастатические
Рефрактерные
Лучевая
терапия
Химиолучевая
терапия
Химиотерапия
Симптома-
тическая
терапия
^Хирургическое лечение
Рис. 9.1. Схема мультидисциплинарного подхода к лечению плоскоклеточного рака головы
и шеи
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 133
Химиотерапия солидных опухолей
гортань и гортаноглотка. Логичным продолжением применения XT при местнораспро-
страненных первичных опухолях стало появление схем так называемого последова-
тельного, или секвентального, химиолучевого лечения. При данном виде лечения на
первом этапе проводится несколько курсов индукционной ПХТ с последующим кон-
курентным химиолучевым лечением. Основными комбинациями, используемыми при
индукционной ПХТ, на сегодняшний день признаны цисплатин с 5-ФУ, доцетаксел с ци-
сплатином и 5-ФУ. Последняя схема представляется как наиболее эффективная, но и
наиболее токсичная.
При развитии рецидива опухоли и невозможности выполнения радикального хи-
рургического вмешательства пациентам обычно предлагается XT как лечение первой
линии. С точки зрения ограниченных возможностей лечения эта категория пациен-
тов с ПКР головы и шеи давно нуждалась в более современных химиотерапевтиче-
ских средствах, но за последние десятилетия не появилось комбинаций химиопре-
паратов, улучшавших показатели выживаемости этой группы больных. Стандартом
лечения этих больных была комбинация цисплатина и 5-ФУ, но при этом примене-
ние комбинации этих препаратов лишь увеличивало количество ответов опухоли на
XT, не изменяя показатели выживаемости пациентов. По последним данным, един-
ственной комбинацией химиопрепаратов, дающей не только увеличение количе-
ства полных и частичных ремиссий, но и увеличивающей продолжительность жиз-
ни больных с рецидивами и отдаленными метастазами ПКР головы и шеи, считается
схема с использованием цетуксимаба, цисплатина и 5-ФУ. На сегодняшний день эта
комбинация стала «золотым стандартом» при сравнении эффективности примене-
ния различных химиопрепаратов в лечении ПКР головы и шеи для всех крупных мно-
гоцентровых исследований. В последние годы появление таргетных препаратов (в
частности, цетуксимаба) и результаты исследований его применения у данной кате-
гории пациентов дают обоснованную надежду на увеличение арсенала химиотера-
певтических средств для лечения неоперабельных локорегионарных рецидивов и
отдаленных метастазов ПКР головы и шеи.
Отбор пациентов для проведения химиолучевого лечения. Для принятия
решения о проведении химиолучевого лечения удобно пользоваться следующим раз-
делением пациентов с первичными опухолевыми процессами области головы и шеи,
когда речь идет о ПКР.
Ранние стадии Т1 или Т2 (экзофитные формы) NO или N1 МО
Умеренные стадии Т2 (инфильтративные формы) или ТЗ (экзофитные формы) NO или N1 МО
Распространенные стадии ТЗ (инфильтративные формы) Т4 N2 или N3 МО
В настоящее время принято считать, что пациенты с ранними стадиями болезни
успешно лечатся с применением лучевой терапии в самостоятельном варианте, а у па-
циентов с умеренными и распространенными стадиями могут применяться химиолу-
чевые методы лечения.
134 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Злокачественные опухоли головы и шеи
Химиотерапия
Наиболее активными противоопухолевыми средствами при ПКР головы и шеи счи-
таются производные платины (цисплатин, карбоплатин), метотрексат, блеомицин,
5-ФУ, ифосфамид, таксаны (паклитаксел и доцетаксел). Активны при раке головы и шеи
также гидроксимочевина, доксорубицин, гемцитабин, капецитабин. Из таргетных пре-
паратов в настоящее время в клиническую практику вошел цетуксимаб.
Монохимиотерапия отдельными препаратами
Монохимиотерапия применяется либо когда возможно только сугубо паллиативное
лечение у ослабленных больных, которые не могут перенести более активную ком-
бинированную XT, либо когда XT проводится одновременно с лучевой терапией. В по-
следнем случае наиболее часто используются производные платины, обладающие
способностью потенцировать эффект лучевой терапии, а также 5-ФУ, таксаны и це-
туксимаб.
Химиотерапия рака некоторых локализаций в области головы и шеи
Рак гортани. При I и 11 стадиях рака гортани, как правило, проводится лучевая тера-
пия или хирургическое лечение, при этом предпочтение отдается облучению. Стан-
дартом лечения рака гортани III стадии является комплексный подход, включающий
химиолучевое лечение, либо в виде нескольких курсов индукционной ПХТ с последу-
ющей лучевой терапией, либо в виде конкурентного химиолучевого лечения с опера-
цией в случае неэффективности лучевой терапии. Клиническими исследованиями до-
казано повышение эффективности лучевой терапии при проведении одновременной
с ней XT или индукционной XT. Такой подход позволяетувеличить количество больных
раком гортани III стадии, которым удается сохранить гортань, и этим улучшить качест-
во их жизни. При раке гортани IV стадии стандартом лечения является ларингэктомия
с последующим облучением. Однако в настоящее время проводятся исследования по
изучению возможности проведения на первом этапе неоадъювантной или одновре-
менной с облучением XT.
Рак гортаноглотки. При ПКР гортаноглотки может быть рекомендована индукци-
онная или комбинированная (конкурентная) с лучевой терапией XT при заболевании
II-IV стадии. В случае неэффективности индукционной ПХТ или первого этапа хими-
олучевого лечения принимается решение об операции. При распространении реги-
онарных метастазов до стадии N2 и N3 и полной регрессии первичной опухоли ре-
комендуется обязательное выполнение шейной лимфодиссекции на завершающем
этапе лечения.
Рак ротоглотки. В начальных стадиях ПКР ротоглотки (I и II стадий) проводится лу-
чевое лечение. Также возможно использование хирургического метода лечения. В этих
случаях выбор метода лечения обусловлен в основном локализацией опухоли и пред-
полагаемой степенью возможных функциональных послеоперационных нарушений.
При III и IV стадиях рака ротоглотки стандартом лечения является химиолучевой метод.
Использование противоопухолевых препаратов в виде 1 -2 курсов индукционной XT це-
лесообразно при распространенных опухолевых процессах в расчете на уменьшение
объема опухоли к моменту облучения. При неоперабельных опухолях целесообразно
проводить XT одновременно с облучением. По данным клинических исследований, в та-
ких ситуациях XT позволяет улучшить местный контроль опухоли, а также улучшить без-
рецидивную и общую выживаемость по сравнению с одной лучевой терапией.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 135
Химиотерапия солидных опухолей
Рак носоглотки. Кроме ПКР носоглотки сюда относятся также переходноклеточ-
ный рак и лимфоэпителиома (опухоль Шминке). При раке носоглотки XT, как прави-
ло, является компонентом химиолучевого лечения. Противоопухолевые препараты
вводятся в виде 1-2 курсов до начала облучения. Такая индукционная XT позволя-
ет в значительной степени уменьшить объем опухоли носоглотки и, если имеются,
регионарных метастазов. В случае высоко- и умеренно дифференцированного рака
чаще используется комбинация цисплатина и 5-ФУ, но возможны и другие сочетания
противоопухолевых препаратов. При недифференцированном раке так называемо-
го носоглоточного типа, связанного с вирусом Эпштейна—Барр, высокоэффективна
схема АЦОП + цисплатин.
Рак полости рта. При раке полости рта 1 стадии проводится операция или облуче-
ние. Стандартом лечения рака II стадии кроме операции или облучения может быть
комбинация этих методов. При этих стадиях XT, как правило, не проводится. Посколь-
ку результаты хирургического, лучевого или комбинированного методов лечения рас-
пространенного рака полости рта, соответствующего III и IV стадиям, до настоящего
времени остаются неудовлетворительными, многими исследователями проводятся
клинические испытания, направленные на изучение роли дополнительной индукцион-
ной XT. Показано, что неоадъювантная XT приводит к уменьшению размера опухоли и,
тем самым, способствует большей радикальности операции или облучения. Относи-
тельно улучшения показателей безрецидивной и общей выживаемости при методах
лечения, включающих XT, выводы пока неоднозначны, требуется продолжение про-
спективных рандомизированных исследований. Тем не менее XT стала составной ча-
стью комплексного лечения рака полости рта.
Рак придаточных пазух носа. На сегодняшний день наиболее эффективным ви-
дом лечения ПКР придаточных пазух и полости носа считается комплексное, включа-
ющее химиолучевую терапию и операцию на втором этапе.
Рак слюнных желез. Рак слюнных желез в большинстве случаев имеет желези-
стую природу. Основные методы лечения — операция и облучение, чаще в виде ком-
бинации этих методов. Роль XT при раке слюнных желез изучается в серии клиниче-
ских исследований. Есть данные о том, что некоторые гистологические варианты рака
слюнных желез могут быть чувствительны к XT. При неоперабельных формах рака ис-
следуется эффективность химиолучевого воздействия с использованием схем, вклю-
чающих цисплатин, циклофосфамид, 5-ФУ и доксорубицин.
Рак щитовидной железы. Принципы лечения рака щитовидной железы определя-
ются морфологическим вариантом опухоли и ее стадией. Для дифференцированно-
го рака (папиллярная, фолликулярная и папиллярно-фолликулярная аденокарцинома)
основным методом при I, II и III стадиях служит хирургическое лечение. Возможно ис-
пользование радиоактивного йода (,3,1) в расчете на снижение риска рецидива и мета-
стазов. При IV стадии выполняется тиреоидэктомия, в дальнейшем, при наличии отда-
ленных метастазов, в зависимости от их способности накапливать изотоп применяется
либо 1311, либо наружное облучение и гормонотерапия Т4. Известны попытки XT с ис-
пользованием доксорубицинсодержащих комбинаций.
При недифференцированном раке щитовидной железы применение 1311 и гормо-
нотерапии бесперспективно. При медуллярных формах рака лечение начинают с
операции, при III стадии — в сочетании с облучением. При наличии отдаленных ме-
тастазов медуллярного рака применяют XT с использованием доксорубицинсодер-
136 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли головы и шеи
жащих комбинаций. В последние годы при этой форме рака успешно применяется
ИФН-а (роферон) и октреотид.
При анапластическом раке щитовидной железы в случае возможности использует-
ся хирургическое лечение и наружное облучение. Применяется XT. Наибольшая эф-
фективность (около 30%) при раке щитовидной железы отмечается у доксорубицина и
эпирубицина. Противоопухолевой активностью при этой форме рака обладает также
цисплатин, блеомицин. Показано, что комбинация доксорубицина с цисплатином име-
ет преимущество перед применением одного доксорубицина.
В стадии клинических исследований находится изучение сочетанного химиолуче-
вого лечения при анапластическом раке. При полном клиническом эффекте становит-
ся возможным выполнить операцию, что может улучшить выживаемость больных ана-
пластическим раком.
Режимы терапии
Ниже приведены схемы наиболее часто используемых режимов ПХТ при ПКР лю-
бой локализации в области головы и шеи. Они могут применяться в качестве индук-
ционной XT с последующим хирургическим вмешательством или лучевой терапией, а
также при рецидивных или метастатических опухолях.
1. Цисплатин — 100 мг/м2 в/в в 1-й день.
5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день.
Повторение цикла каждые 21 (28) день.
2. Цисплатин — 100 мг/м2 в/в в 1-й день.
5-ФУ — 750 мг/м2/сутки в/в 120-часовая непрерывная инфузия в 1-5-й день.
Повторение цикла каждые 21 день.
3. Карбоплатин — AUC 6 в/в 1-й день.
5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день.
Повторение цикла каждые 21 день.
4. Цисплатин — 75 мг/м2/сутки в/в в 1-й день.
Капецитабин — 1000 мг/м2 внутрь 2 раза в сутки в 1-14-й день.
Повторение цикла каждые на 21 день.
5. Паклитаксел — 175 мг/м2 в/в в 1-й день.
Цисплатин — 75 мг/м2 в/в во 2-й день.
Повторение цикла каждые 21 день.
6. Паклитаксел — 175 мг/м2 в/в в 1-й день.
Карбоплатин — AUC 6 в/в в 1-й день.
Повторение цикла каждые на 21 день.
7. Доцетаксел — 75 мг/м2 в/в в 1-й день.
Цисплатин — 75 мг/м2 в/в в 1-й день.
Повторение курса 21 день.
8. Доцетаксел — 75 мг/м2 в/в в 1-й день.
Цисплатин — 75-100 мг/м2 в/в в 1-й день.
5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день.
Повторение цикла каждые 21 день.
9. Паклитаксел — 175 мг/м2 в/в в 1-й день.
Цисплатин — 100 мг/м2 в/в во 2-й день.
5-ФУ — 500 мг/м2/сут непрерывная инфузия 120-часовая в 1-5-й день.
Повторение цикла каждые 21 день.
10. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день 1-го курса, затем
250 мг/м2 в/в 1-часовая инфузия в 8-й и 15-й дни и в 1-й день последующих курсов.
Цисплатин — 75-100 мг/м2 в/в в 1-й день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 137
Химиотерапия солидных опухолей
5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день.
Повторение цикла каждые 21 день.
При проведении конкурентного одновременного химиолучевого лечения рекомен-
дованы следующие курсы XT:
1. Цисплатин — 100 мг/м2 в/в в 1, 22 и 43-й дни лучевой терапии.
Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
2. Цисплатин — 20 мг/м2 в/в еженедельно при проведении лучевой терапии.
Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
3. Карбоплатин — AUC 1,5 в/в еженедельно при проведении лучевой терапии.
Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
4. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия за неделю до начала лучевой тера-
пии, затем 250 мг/м2 в/в 1-часовая инфузия еженедельно при проведении лучевой
терапии.
Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
При проведении монохимиотерапии рекомендовано применение следующих схем:
1. Доцетаксел — 75 мг/м2 в/в в 1-й день.
Повторение цикла через 21 день.
2. Паклитаксел — 175 мг/м2 в/в в 1-й день.
Повторение цикла через 21 день.
3. Метотрексат — 40 мг/м2 в/в или в/м.
Повторение цикла каждую неделю.
4. Винорелбин — 30 мг/м2 в/в.
Повторение цикла каждую неделю.
5. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день, затем 250 мг/м2 в/в
1 -часовая инфузия еженедельно.
При эстезионейробластоме полости носа и недифференцированном раке носоглот-
ки используется схема АЦОП с цисплатином в сочетании с лучевой терапией:
Доксорубицин — 40 мг/м2 в/в в 1-й день.
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Винкристин — 2 мг/м2 в/в в 1-й день.
Цисплатин — 100 мг/м2 в/в в 4-й день.
Преднизолон — 1 мг/кг внутрь в 1-5-й день.
Повторение цикла каждые 21 день.
При раке головы и шеи железистого происхождения (рак больших и малых слюнных
желез, неоперабельный рак щитовидной железы) возможно применение следующих
режимов медикаментозного противоопухолевого лечения:
1. Доксорубицин — 60 мг/м2 в/в в 1-й день.
Цисплатин — 40 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21 день.
2. Дакарбазин — 200 мг/м2 в/в в 1-3-й день.
Эпирубицин — 25 мг/м2 в/в в 1-3-й день.
5-ФУ — 250 мг/м2 в/в в 1-3-й день.
Повторение цикла каждые 21 день.
3. Доксорубицин — 60 мг/м2 в/в в 1-й день.
Блеомицин — 15 мг в/в в 1-5-й день.
Винкристин — 1,4 мг/м2 в/в в 1-й и 8-й дни.
138 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак легкого
Повторение цикла каждые 21 день.
4. Винкристин — 1,4 мг/м2 в/в в 1-й день.
Доксорубицин — 60 мг/м2 в/в в 1-й день.
Циклофосфамид — 1000 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21 день.
9.4. Рак легкого
Л4. Б. Бычков
Рак легкого — острейшая проблема современной онкологии. По заболеваемости он
занимает 1-е место среди других злокачественных опухолей у мужчин в России, а по
смертности — 1-е место среди мужчин и женщин как в России, так и в мире.
В России в 2008 г. раком легкого заболело 56 767 человек (24% всех злокаче-
ственных опухолей), умерло 52 787 человек (35,1 % среди других злокачествен-
ных опухолей). Таким образом, каждый четвертый больной среди общего числа
вновь зарегистрированных онкологических больных и каждый третий, умирающий
от этих болезней, — это больные раком легкого. От рака легкого ежегодно умира-
ет больше больных, чем от рака простаты, молочной железы и толстой кишки вме-
сте взятых.
Согласно морфологической классификации ВОЗ, выделяют четыре основные груп-
пы рака легкого: ПКР (40% больных), аденокарцинома (40-50%), МРЛ (15-20%), круп-
ноклеточный рак (5-10%) (табл. 9.4).
Таблица 9.4. Международная гистологическая классификация рака легкого
Плоскоклеточный рак Папиллярный Светлоклеточный Мелкоклеточный Базальноклеточный
Мелкоклеточный рак Комбинированный мелкоклеточный рак
Аденокарцинома Ацинарная Папиллярная Бронхиолоальвеолярный рак Солидный рак с образованием муцина Другие
Крупноклеточный рак Крупноклеточная нейроэндокринная карцинома Другие
Другие формы Карциносаркома, карциноид, веретеноклеточная карцинома и др.
Эти группы составляют около 90% всех случаев опухолей легкого. Остальные 10%
охватывают редко встречающиеся смешанные формы, саркомы, меланомы, мезоте-
лиомы легкого и др.
Ниже представлено распределение рака легкого по стадиям и TNM (табл. 9.5).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 139
Химиотерапия солидных опухолей
Таблица 9.5. Стадии рака легкого, классификация IASLC, 2009
Стадия
I/IA Т1 NO МО
IB Т2 NO МО
II/IIA Т1 N1 МО, Т2 NO МО
НВ Т2 N1 МО, ТЗ NO МО
III Т4 NO МО, Т4 N1 МО, ТЗ N2 МО
IIIA ТЗ N1 МО, Т1-3 N2 МО, Т1-4 N0-2 МО
IIIB T4N2 МО, Т1-4 N3 МО
IV Т1-4 NO-3 М1
Лечение. Основным методом лечения рака легкого является хирургический. Однако
радикальную операцию удается выполнить только у 10-20% всех заболевших. 5-лет-
няя выживаемость при всех формах рака легкого составляет 20-25%.
Лучевую терапию обычно проводят больным без отдаленных метастазов, которым
не показано хирургическое лечение. 5-летняя выживаемость больных, получавших
только лучевую терапию, не превышает 10%.
XT выполняют больным, не подлежащим операции (метастазы в лимфоузлах средо-
стения, периферических лимфоузлах и других органах) (стадии ШЬ и IV).
По чувствительности к XT все морфологические формы рака легкого делят на МРЛ,
высокочувствительный к XT, и немелкоклеточный (НМРЛ) рак (плоскоклеточный, аде-
нокарцинома, крупноклеточный), обладающий меньшей чувствительностью к XT.
В табл. 9.6 представлена активность отдельных химиопрепаратов при НМРЛ и МРЛ.
Таблица 9.6. Активность отдельных групп химиопрепаратов при раке легкого
Препарат Эффективность» %
НМРЛ МРЛ |
Таксаны Паклитаксел 21-24 52
Доцетаксел 23-34 50
Алкилирующие препараты Циклофосфамид 20-23 37
Ифосфамид 15-18 50
Производные платины Цисплатин 15-20 18
Карбоплатин 10-17 40
Антиметаболиты Метотрексат 20-22 29
Гемцитабин 20-27 25
Пеметрексед 16-23 ?
Производные нитрозомочевины Ломустин (CCNU) 13-17 19
Нимустин (ACNU) 15-20 50
Антибиотики Доксорубицин 18-20 27
Митомицин 18-22 ?
Винкаалкалоиды Винкристин 15-20 27
Винбластин 15-18 ?
Винорелбин (Навельбин) 20-26 24
Иринотекан 18-32 32
Ингибиторы топоизомераз Топотекан 20-26с 40
Этопозид 15-18 40
140
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак легкого
При НМРЛ наибольшей активностью обладают таксаны (доцетаксел и паклитаксел),
производные платины, гемцитабин, винорелбин, пеметрексед, топоизомеразы I (ири-
нотекан и топотекан), циклофосфамид и другие препараты.
В то же время при МРЛ активность отдельных цитостатиков в 2-3 раза больше, чем
при НМРЛ. Среди активных препаратов при МРЛ следует отметить те же таксаны (пакли-
таксел и доцетаксел), ифосфамид, производные платины (цисплатин, карбоплатин), ни-
мустин (ACNLI), иринотекан, топотекан, этопозид, циклофосфамид, доксорубицин, вин-
кристин.
Именно из этих препаратов составлены различные схемы комбинированной XT при
раке легкого.
9.4.1. Немелкоклеточный рак легкого
К моменту установления диагноза более 75% всех больных раком легкого имеют
местнораспространенный или метастатический процесс. По данным ВОЗ, на разных
этапах лечения до 80 % больных раком легкого нуждаются в XT.
Место XT в лечении НМРЛ:
й Лечение больных с распространенным процессом (III-IV стадия)
И В качестве индукционной (предоперационной) терапии.
й В качестве адъювантной (послеоперационной) XT
И В комбинации с лучевой терапией при неоперабельных формах.
Лечение больных с распространенным процессом III—IV ст.
Эффективность различных схем комбинированной химиотерапии НМРЛ колеблет-
ся от 30 до 60%. Наиболее активны комбинации, содержащие производные платины.
Ниже приводятся платиновые и неплатиновые схемы комбинированной XT НМРЛ.
Платиновые схемы:
Таксол + цисплатин;
й Таксол + карбоплатин;
И Таксотер + цисплатин;
й Гемзар + цисплатин;
В Гемзар + карбоплатин;
И Алимта + цисплатин;
» Навельбин + цисплатин;
В Этопозид + цисплатин.
Неплатиновые схемы:
Я Гемзар + Навельбин;
В Гемзар + Таксол;
Я Гемзар + Таксотер;
Я Гемзар + Алимта;
й Таксол + Навельбин;
Я Таксотер + Навельбин/
Платиновые схемы обладают одинаковой эффективностью, при этом схемы с пакли-
такселом (Таксолом) чаще используются в США, а схемы с Гемзаром — в Европе.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 141
Химиотерапия солидных опухолей
В табл. 9.7 представлены современные стандартные режимы химиотерапии НМРЛ.
Использование платиновых режимов улучшило эффективность XT диссеминиро-
ванных и местнораспространенных форм НМРЛ до 30-40%, медиану выживаемо-
сти — до 6,5 мес., 1-летнюю выживаемость — до 25%, а применение в 1990-е годы
новых цитостатиков (пеметрексед, таксаны, гемцитабин, винорелбин, топотекан) уве-
личило эти показатели до 40-60%, 8-9 мес. и 40-45% соответственно.
Современными стандартами химиотерапии НМРЛ считаются режимы, которые
включают комбинацию гемцитабина, паклитаксела, доцетаксела, винорелбина, этопо-
зида или алимты с цисплатином или карбоплатином.
Таблица 9.7. Активные режимы химиотерапии НМРЛ
Режим Схема лечения Интервал между курсами, дни 1
Этопозид Цисплатин 120 мг/м2 в/в в 1,3 и 5-й дни 80 мг/м2 в/в в 1-й день 21
Паклитаксел Карбоплатин 175 мг/м2в/в в 1-й день за 3 ч AUG 6 в/в в 1-й день 21
Гемцитабин Цисплатин 1000-1250 мг/м2 в/в в 1-й и 8-й дни 80 мг/м2 в/в в 1-й день 21
Винорелбин Цисплатин 25 мг/м2 в/в 1,8 и 15-й дни 80 мг/м2 в/в в 1-й день 28
Паклитаксел Цисплатин 175 мг/м2 в/в 1-й день за 3 ч 80 мг/м2 в/в в 1-й день 21
Доцетаксел Цисплатин 75 мг/м2 в/в в 1 -й день 75 мг/м2 в/в в 1-й день 21
Доцетаксел Карбоплатин 75 мг/м2 в/в в 1-й день AUG 5 в/в в 1-й день 21
Гемцитабин Карбоплатин 1000 мг/м2 в/в в 1-й и 8-й дни AUG 5 в/в в 1-й день 21
Пеметрексед Цисплатин 500 мг/м2 в 1-й день 75 мг/м2 в 1-й день 21
Двухкомпонентные платиносодержащие режимы химиотерапии НМРЛ увеличива-
ют продолжительность и качество жизни больных по сравнению с наилучшей симпто-
матической терапией.
Платиносодержащие схемы доминируют, но цисплатин постепенно заменяется кар-
боплатином. Цисплатин обладает минимальной гематологической токсичностью, удо-
бен в комбинациях с другими цитостатиками и лучевой терапией, потенцируя ее эф-
фективность. В то же время карбоплатин обладает минимальной нефротоксичностью
и очень удобен для амбулатоного лечения и паллиативной терапии.
Платиновые и неплатиновые схемы комбинированной XT обладают сходной эф-
фективностью. В то же время платиновые режимы дают более высокую 1-летнюю вы-
живаемость и более высокий процент объективных эффектов, но увеличивают число
анемий, нейтропений, нефро- и нейротоксичности.
Неплатиновые схемы с новыми препаратами могут быть использованы в случаях,
когда препараты платины не показаны.
Введение в схему терапии третьего препарата может увеличить объективный эф-
фект ценой дополнительной токсичности, но не увеличивает выживаемость.
Выбор той или иной равноэффективной схемы зависит от предпочтений врача и
больного, профиля токсичности и стоимости лечения.
В настоящее время все большее значение для выбора схемы XT имеют подвиды
НМРЛ. Так, при ПКР преимущество имеет схема гемцитабин + цисплатин, или вино-
142 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак легкого
релбин + цисплатин, или доцетаксел + цисплатин. Для аденокарциномы и бронхоаль-
веолярного рака преимущество имеют схемы пеметрексед + цисплатин или паклитак-
сел + карбоплатин с бевацизумабом или без него.
Вторая линия химиотерапии НМРЛ обладает недостаточной эффективностью, и в
этом направлении ведутся интенсивные научные исследования. В настоящее время
для второй линии химиотерапии НМРЛ Международной ассоциацией по изучению
рака легкого и Управлением по контролю за качеством пищевых продуктов и лекарст-
венных средств США (FDA) рекомендованы пеметрексед (Алимта), доцетаксел (Таксо-
тер), эрлотиниб (Тарцева).
Для второй линии XT могут быть использованы также этопозид, винорелбин, пакли-
таксел, гемцитабин в монотерапии, а также в комбинации с платиновыми и другими
производными, если они не применялись в первой линии лечения. В настоящее вре-
мя нет данных о преимуществах комбинированной XT по сравнению с монотерапией
указанными препаратами для второй линии лечения НМРЛ. Использование второй ли-
нии XT приводит к улучшению качества жизни и увеличению выживаемости.
Третья линия XT. При прогрессировании болезни после второй линии XT боль-
ным в удовлетворительном состоянии может быть рекомендовано лечение эрло-
тинибом или гефитинибом. Это не исключает возможности использования для тре-
тьей или четвертой линии других цитостатиков, которые больной ранее не получал
(этопозид, винорелбин, паклитаксел, неплатиновые комбинации). Однако больные,
получающие третью, или четвертую линии XT, редко достигают объективного улуч-
шения, которое обычно бывает очень коротким при значительной токсичности. Для
этих больных единственно правильным методом лечения является симптоматиче-
ская терапия.
Длительность химиотерапии НМРЛ
На основании анализа публикаций о длительности лечения больных НМРЛ ASCO
(2009) дает следующие рекомендации:
1. При проведении первой линии XT должна быть прекращена в случаях прогрес-
сирования болезни или при циклов неэффективности лечения после 4 циклов.
2. Лечение может быть прекращено после 6 циклов даже у больных, у которых от-
мечен эффект.
3. При более длительном лечении увеличивается токсичность без какой-либо
пользы для больного.
Индукционная (неоадъювантная, предоперационная) и адъювантная
химиотерапия НМРЛ
Обоснованием индукционной (предоперационной) XT служит:
1. плохая выживаемость после только хирургического лечения даже при ранних
стадиях НМРЛ;
2. высокие цифры объективного эффекта при использовании новых платиносо-
держащих комбинаций;
3. локорегионарный циторедуктивный эффект до операции с воздействием на ме-
диастинальные лимфоузлы при III стадии;
4. возможности раннего воздействия на отдаленные метастазы;
5. лучшая переносимость по сравнению с послеоперационным применением XT.
Активность различных индукционных режимов XT при НМРЛ стадии IIIA/N2 (гем-
цитабин + цисплатин, паклитаксел + карбоплатин, доцетаксел + цисплатин, этопозид +
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 143
Химиотерапия солидных опухолей
цисплатин и др.) равна 42-65%, при этом у 5-7 % больных отмечается патоморфоло-
гически доказанная полная ремиссия, а радикальную операцию удается выполнить у
75-85% пациентов. Индукционная XT описанными выше режимами проводится, как
правило, 3 циклами с интервалом 3 нед. Однако в последние годы появились работы,
в которых показано, что проведение предоперационной XT не увеличивало выживае-
мость после радикальных операций у больных со П-111 стадией НМРЛ. По данным по-
следних публикаций 2010 г., у больных с морфологически доказанной IIIA-N2 стадией
НМРЛ преимущество имеет химиолучевая терапия по сравнению с операцией. Паци-
ентам с выявленной после операции pN2 должна быть предложена адъювантная XT и,
возможно, послеоперационная лучевая терапия.
Индукционная XT перед химиолучевой терапией может быть использована с целью
снижения объема опухоли, но не рекомендуется больным, у которых объем опухоли
сразу позволяет провести лучевую терапию.
Проведение адъювантной XT при НМРЛ в течение длительного времени не оправ-
дывало надежд. Большие рандомизированные исследования показали максимально
5%-е увеличение выживаемости. Однако в последнее время вновь возрос интерес к
изучению целесообразности проведения адъювантной XT с использованием новых
противоопухолевых препаратов и появились первые сообщения об увеличении вы-
живаемости больных НМРЛ, получавших новые рациональные современные режимы
комбинированной XT. По данным Американского общества клинической онкологии
(VIII-2007), адъювантная XT на основе цисплатина может быть рекомендована при ПА,
ПВ и IIIА стадиях НМРЛ. При стадиях IA и IB адъювантная XT не показала преимуществ в
увеличении выживаемости по сравнению с одной операцией и поэтому при этих ста-
диях не рекомендуется. Адъювантная лучевая терапия, по данным рандомизирован-
ных исследований, показала даже ухудшение выживаемости, хотя имеются данные об
уменьшении частоты местных рецидивов. Адъювантная лучевая терапия может быть
умеренно эффективной при НМРЛ стадии IIIA/N2.
Химиолучевая терапия при местнораспространенном НМРЛ. Лучевая те-
рапия в течение многих лет была стандартом лечения больных НМРЛ стадии IIIА или
IIIB. Однако медиана выживаемости у больных неоперабельным НМРЛ после луче-
вой терапии составляет около 10 мес., а 5-летняя выживаемость — около 5%. С це-
лью улучшить эти результаты разработаны различные платиносодержащие режимы
комбинированной XT, включение которых в 80-е годы прошлого века в комбинации с
лучевой терапией в СОД 60-65 Гр позволило увеличить медиану выживаемости, 1- и
2-летнюю выживаемость почти в 2 раза. В настоящее время в США и странах Западной
Европы одновременная химиолучевая терапия заменила одну лучевую терапию при
местнораспространенном НМРЛ и стала стандартным методом лечения у больных с
III стадией. 5-летняя выживаемость при одновременной химиолучевой терапии рав-
няется 16% по сравнению с 9% при последовательной терапии. На сегодняшний день
нет четких данных о более высокой частоте пульмонитов и стриктур пищевода при од-
новременной химиолучевой терапии НМРЛ. В схемах XT используются платиносодер-
жащие схемы: этопозид + цисплатин, паклитаксел + цисплатин и др.
Таргетная терапия в последние годы активно применяется при НМРЛ. В настоящее
время могут быть рекомендованы три препарата: ингибиторы EGFR — эрлотиниб, ге-
фитиниб и ингибитор VEGF — бевацизумаб.
Эрлотиниб (Тарцева) — применяют по 150 мг внутрь длительно, до прогрессирова-
ния болезни.
144 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак легкого
Гефитиниб (Пресса) — применяют по 250 мг внутрь длительно, также до прогресси-
рования заболевания.
Бевацизумаб (Авастин) — применяют по 5 мг/кг 1 раз в 2 нед. В комбинации па-
клитаксел + карбоплатин + бевацизумаб было достигнуто увеличение количества
объективных эффектов и медианы выживаемости по сравнению со схемой без бе-
вацизумаба.
Цетуксимаб (Эрбитукс) — применяют по 400 мг/м2 в/в капельно в течение 120 мин,
затем для поддерживающей терапии — по 250 мг/м2 1 раз в неделю.
Все 4 препарата показаны больным для получения эффекта или для остановки про-
грессирования болезни. Отмечено также, что эрлотиниб и гефитиниб обладают боль-
шей активностью при аденокарциноме, бронхоальвеолярном раке и у женщин.
Ингибиторы тирозинкиназы EGFR (эрлотиниб, гефитиниб) эффективны у больных
НМРЛ с мутированным EGFR, почему определение этого биомаркера имеет практиче-
ское значение для выбора оптимального терапевтического режима.
9.4.2. Мелкоклеточный рак легкого
МРЛ — особая форма, которая выявляется у 15-20% больных раком легкого, харак-
теризуется быстрым ростом, ранним метастазированием, высокой чувствительно-
стью к лучевой и химиотерапии. Для МРЛ характерны делеция хромосомы Зр, мута-
ции гена р53, экспрессия Вс1-2, активация теломеразы и немутантного c-Kity 75-90%
пациентов.
При МРЛ наблюдаются и другие молекулярные нарушения: экспрессия VEGF, потеря
гетерозиготности хромосом 9р и 10q у большинства пациентов. Аномалии KRAS \лр16
при МРЛ редки по сравнению с НМРЛ.
При диагностике МРЛ особое значение имеет оценка распространенности процес-
са, определяющая выбор терапевтической тактики. После морфологического под-
тверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия
метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и
брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головно-
го мозга (с контрастированием) и сканирование костей.
В последнее время появились сообщения о том, что позитронно-эмиссионная то-
мография (ПЭТ) позволяет дополнительно уточнить стадию процесса.
При МРЛ, как и при других формах рака легкого, используется стадирование по ме-
ждународной системе TNM, однако большинство больных МРЛ в момент установле-
ния диагноза уже имеют III—IV стадию заболевания, поэтому до настоящего времени
не потеряла своего значения классификация, согласно которой различают больных с
локализованным и распространенным МРЛ.
При локализованном МРЛ опухолевое поражение ограничено одним гемитораксом
с вовлечением в процесс регионарных и контралатеральных лимфоузлов корня сре-
достения и ипсилатеральных надключичных лимфоузлов, когда технически возможно
облучение с использованием одного поля.
Распространенным МРЛ считается процесс, выходящий за пределы локализованно-
го. Ипсилатеральные легочные метастазы и наличие опухолевого плеврита указывают
на распространенный МРЛ.
Стадия процесса, определяющая терапевтические возможности, служит основным
прогностическим фактором при МРЛ.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 145
Химиотерапия солидных опухолей
Прогностические факторы:
степень распространенности процесса. У больных с локализованным процес-
сом (не выходящим за пределы грудной клетки) достигаются лучшие результаты
при химиолучевой терапии: объективный эффект — у 80-100% больных, полная
ремиссия — у 50-70%, медиана выживаемости — 18-24 мес., 5-летняя выжива-
емость и выздоровление — 10-15% пациентов;
® достижение полной регрессии первичной опухоли и метастазов. Лишь дости-
жение полной ремиссии приводит к существенному увеличению длительности
жизни и возможности полного выздоровления;
общее состояние пациента. Больные, начинающие лечение в хорошем состоя-
нии, имеют лучшие результаты лечения и большую выживаемость, чем больные
в тяжелом состоянии, истощенные, с выраженными симптомами болезни, гема-
тологическими и биохимическими изменениями.
Лечение
Хирургическое лечение показано только при ранних стадиях МРЛ (T1-2N0-1).
Оно должно дополняться послеоперационной XT (4 курса). 5-летняя выживаемость у
этой группы больных составляет 39-40 %. Однако хирургическое лечение возможно и
в случаях с морфологически не уточненным предоперационным диагнозом, с наличи-
ем смешанной гистологической формы (с мелкоклеточным и немелкоклеточным ком-
понентами). При других, более поздних стадиях МРЛ хирургическое лечение не пока-
зано даже после успешной индукционной XT.
Лучевая терапия приводит к регрессии опухоли у 60-80% больных, однако она в
самостоятельном виде не увеличивает продолжительность жизни из-за появления от-
даленных метастазов, требующих дополнительной XT.
Основным методом лечения МРЛ является комбинированная химиотерапия
с платиносодержащими схемами, при этом цисплатин постепенно вытесняется кар-
боплатином. В табл. 9.8 представлены схемы и режимы современной химиотерапии
МРЛ. Следует отметить, что в последние годы первой линией XT стала схема ЕР, кото-
рая сменила широко используемую ранее схему CAV.
Таблица 9.8. Режимы комбинированной химиотерапии мелкоклеточного рака
легкого
Схема лечения Интервал меж; w курсами
Цисплатин Этопозид 80 мг/м2 в/в в 1-й день 120 мг/м2 в/в в 1-3-й день 1 раз в 3 нед.
СОЕ
Циклофосфамид Доксорубицин Этопозид 1000 мг/м2в/вв1-йдень 45 мг/м2 в/в в 1-й день 100 мг/м2 в/в в 1,2,3-й или 1,3,5-й дни 1 раз в 3 нед.
CAV
Циклофосфамид Доксорубицин Винкристин 1000 мг/м2 в/в в 1-й день 50 мг/м2 в/в в 1-й день 1,4 мг/м2 в/в в 1-й день 1 раз в 3 нед. г
146 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак легкого
Режим Схема лечения Интервал между курсами !
Нимустин
Этопозид 100 мг/м2 в/в в 4-6-й день 1 раз в 4-6 нед.
Цисплатин 40 мг/м2 в/в во 2-й и 8-й дни
CODE
Цисплатин 25 мг/м2 в/в в 1-й день
Винкристин 1 мг/м2 в/в в 1-й день
Доксорубицин 40 мг/м2 в/в в 1-й день 1 раз в неделю в течение 8 нед.
Этопозид 80 мг/м2 в/в в 1-3-й день
ТС МИ
Паклитаксел 135 мг/м2 в/в в 1-й день
Карбоплатин АИС 5 в/в в 1-й день 1 раз в 3-4 нед.
Иринотекан 60 мг/м2 в/в в 1,8 и 15-й дни
Цисплатин 60 мг/м2 в/в в 1-й день 1 раз в 3 нед.
Доцетаксел 75 мг/м2 в/в в 1-й день
Цисплатин 75 мг/м2 в/в в 1-й день 1 раз в 3 нед.
GP
Гемцитабин 1000 мг/м2 в/в в 1-й и 8-й дни
Цисплатин 70 мг/м2 в/в в 1-й день 1 раз в 3 нед.
Эффективность современной терапии при локализованном МРЛ колеблется от 65
до 90%, с полной регрессией опухоли у 45-75% больных и медианой выживаемости
18-24 мес. Больные, начавшие лечение в хорошем общем состоянии (PS 0-1 балл) и
ответившие на индукционную терапию, имеют шансы на 5-летнюю безрецидивную
выживаемость.
Больным, у которых достигнута полная ремиссия, рекомендуется профилактиче-
ское облучение мозга в СОД 30 Гр в связи с высоким риском (до 70%) метастазирова-
ния в мозг.
В последние годы показана также польза профилактического облучения мозга у
больных МРЛ с выраженной частичной ремиссией после проведенной XT. Медиана
выживаемости больных с локализованным МРЛ при использовании комбинаций хи-
мио- и лучевой терапии в оптимальном режиме составляет 18-24 мес., а 5-летняя вы-
живаемость — 25%.
Лечение больных с распространенным МРЛ
Благодаря использованию новых методов диагностики (КТ, МРТ, ПЭТ) число больных
с распространенным МРЛ, по данным зарубежных авторов, за последние годы снизи-
лось с 75 до 60%.
У больных с распространенным МРЛ основным методом лечения считается комби-
нированная XT в тех же режимах, а облучение проводится только по специальным по-
казаниям. Общая эффективность XT составляет 70%, но полная регрессия достигается
лишь в 3-20% случаев. В то же время выживаемость больных при достижении полной
регрессии опухоли достоверно выше, чем у пролеченных с частичным эффектом, и
приближается к таковой у больных с локализованным МРЛ.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 147
Химиотерапия солидных опухолей
При метастазах МРЛ в костном мозге, метастатическом плеврите, метастазах в
отдаленных лимфоузлах методом выбора служит комбинированная XT. При ме-
тастатическом поражении лимфоузлов средостения с синдромом сдавления вер-
хней полой вены целесообразно применять комбинированное лечение (XT в со-
четании с лучевой терапией). При метастатическом поражении костей, головного
мозга, надпочечников методом выбора остается лучевая терапия. При метастазах в
головном мозге лучевая терапия в СОД 30 Гр позволяет получить клинический эф-
фект у 70% больных, причем у ’/2 из них регистрируется полная регрессия опухо-
ли по данным КТ и МРТ.
Показана также эффективность различных схем комбинированной XT при мета-
стазах МРЛ в мозге. Так, схемы ACNLI + ЕР, иринотекан + цисплатин и другие позво-
ляют получить объективное улучшение у 40-60% пациентов и полную регрессию —
у 50%.
Терапевтическая тактика при рецидивном МРЛ
Несмотря на высокую чувствительность к химио- и лучевой терапии, МРЛ, как пра-
вило, рецидивирует, и в таких случаях выбор терапевтической тактики (XT второй
линии) зависит от ответа на первую линию терапии, интервала времени, прошедше-
го после ее окончания, и от характера распространения опухоли (локализация ме-
тастазов).
Принято различать больных с чувствительным рецидивом МРЛ, имевших полный или
частичный эффект от первой линии XT и прогрессирование опухолевого процесса не
ранее 3 мес. после окончания индукционной терапии, и больных с рефрактерным ре-
цидивом, прогрессировавших в процессе индукционной терапии или менее чем че-
рез 3 мес. после ее окончания.
Прогноз для больных с рецидивом МРЛ крайне неблагоприятен, и нет оснований
рассчитывать на их излечение. Особенно неблагоприятен он для больных при реф-
рактерном рецидиве МРЛ: медиана выживаемости после обнаружения рецидива не
превышает 3-4 мес.
При чувствительном рецидиве рекомендуется повторное применение терапевтиче-
ского режима, который был эффективен при индукционной терапии.
Для больных с рефрактерным рецидивом целесообразно применение противоопу-
холевых препаратов или их комбинаций, не использовавшихся в процессе индукци-
онной терапии. В качестве второй линии XT могут применяться такие препараты, как
топотекан, паклитаксел, гемцитабин, этопозид, ифосфамид, в монотерапии для оста-
новки прогрессирования болезни и стабилизации процесса.
Таргетная терапия МРЛ
Для МРЛ в настоящее время еще не определен молекулярный патогенез. Хотя мно-
гие варианты таргетной терапии были изучены при МРЛ, однако большинство иссле-
дований было проведено у «нетаргетной популяции». В этом плане неэффективными
при МРЛ оказались интерфероны, ингибиторы матрикс-металлопротеиназы, имати-
ниб, гефитиниб, облимерсен, темсиролимус, вандетамид, бортезомиб, талидомид.
Другие препараты находятся в стадии изучения по II—III фазе (бевацизумаб, ингибито-
ры тирозинкиназы ZD6474 и BAY-43-9006).
148 ХИМИОТЕРАПИЯ ОТДЕЛ ЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Мезотелиома плевры
9.5. Мезотелиома плевры
/И. Б. Бычков
Мезотелиома как злокачественная опухоль была впервые описана в 1870 г. Чаще
встречается поражение плевры, чем брюшины, с преобладанием правосторонней ло-
кализации. Поданным США, мужчины болеют чаще, чем женщины, в соотношении 6:1.
Мезотелиома может встречаться в любом возрасте, даже у детей 2-4 лет.
В этиологии мезотелиомы основное значение имеет длительность контактов с ас-
бестом и минералом эрионитом. В качестве этиологического фактора называют так-
же обезьяний вирус SV40 и генетическую предрасположенность. Эти факторы могут
быть причиной мезотелиомы плевры как каждый в отдельности, так и при их взаимо-
действии.
По гистологической классификации ВОЗ (1999), злокачественные мезотелиомы де-
лятся на три вида:
1) эпителиальные;
2) саркоматоидные;
3) бифазные.
Наиболее частым является злокачественный саркоматоидный вариант.
Выпот в плевральной полости бываету 60-80 % больных, но постепенно рост опухо-
ли может привести к полной облитерации плевральной полости.
Дифференциальный диагноз часто затруднен и проводится между метастазами в
плевре рака различных опухолей (рак молочной железы, рак легкого, почки, толстой
кишки, яичников и др.) и синовиальной саркомой. Определение мезотелиомы плевры
на обычных рентгенограммах невозможно. МРТ и ПЭТ в настоящее время становятся
стандартом диагностики. Для правильного диагноза желательна торакоскопия с биоп-
сией (рекомендуется взять не менее 10 кусочков ткани). Точный диагноз мезотелиомы
плевры может быть поставлен только после иммуногистохимического исследования.
Хирургическое лечение (плеврэктомия/плевропневмонэктомия) проводится редко
(7-10% больных). 2-летняя выживаемость после таких операций составляет 10-35%.
Лучевая терапия приводит к уменьшению боли, но не увеличивает длительность
жизни. Прогноз при мезотелиоме плевры неблагоприятный, медиана выживаемости
12 мес.
Имеются данные, что адъювантная XT увеличивает выживаемость больных после
плевропневмонэктомии.
Химиотерапия
Мезотелиома плевры — опухоль, слабочувствительноая к химиотерапии, однако с
появлением новых цитостатиков и новых схем комбинированной XT объективный эф-
фектудается получитьу 20-40% пациентов. В настоящее время имеется несколько ак-
тивных препаратов (пеметрексед, цисплатин, доксорубицин, митомицин С, гемцита-
бин, винорелбин, ралтитрексед), которые в монотерапии и в комбинациях показали
активность при этой болезни.
В последние годы основной схемой XT первой линии мезотелиомы плевры стала
схема пеметрексед + цисплатин с эффективностью у 41 % больных. Также обладают
активностью у 30-35 % пациентов схемы гемцитабин + цисплатин (карбоплатин) и рал-
титрексед + цисплатин.
Прогностические факторы: стадия процесса, гистологический вариант опухоли
(эпителиальный имеет лучший прогноз), проведение адъювантной химио- и лучевой
терапии.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 149
Химиотерапия солидных опухолей
При наличии выпота используется введение различных цитостатиков внутриплев-
рально (см. разд. 9.6). Ниже приводятся режимы комбинированной XT мезотелиомы.
Пеметрексед (Алимта) — 500 мг/м2 в/в в 1-й день.
Цисплатин — 75 мг/м2 в/в в 1-й день.
Повторение цикла через 3 нед.
GP
Гемцитабин (Гемзар) — 1200 мг/м2 в/в в 1-й и 8-й дни.
Цисплатин — 75 мг/м2 в/в в 1-й день.
Повторение цикла через 3-4 нед.
GC
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1,8 и 15-й дни.
Карбоплатин — AUC 5 в/в в 1-й день.
Повторение цикла через 4 нед.
Ралтитрексед (Томудекс) — 3 мг/м2 в/в в 1-й день.
Цисплатин — 80 мг/м2 в/в в 1-й день.
Повторение цикла каждые 3 нед.
GemOX
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1-й и 8-й дни.
Оксалиплатин — 80 мг/м2 в/в в 1-й и 8-й дни.
Повторение цикла через 3 нед.
IPM
Иринотекан — 100 мг/м2 в/в в 1-й и 15-й дни.
Цисплатин — 40 мг/м2 в/в в 1-й и 15-й дни.
Митомицин — 6 мг/м2 в/в в 1-й день.
Повторение цикла через 4 нед.
CAD
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Доксорубицин — 50 мг/м2 в/в в 1-й день.
Дакарбазин — 400 мг/м2 в/в в 1-й и 2-й дни.
Повторение цикла через 3-4 нед.
АР
Доксорубицин — 90 мг/м2 в/в в 1-й день.
Цисплатин — 100-120 мг/м2 в/в 2-3-часовая инфузия в 1-й день.
Повторение цикла через 3-4 нед.
MVP
Митомицин — 8 мг/м2 в/в в 1-й день.
Винбластин — 6 мг/м2 в/в в 1-й день.
Цисплатин — 50 мг/м2 в/в инфузия в 1-й день.
Повторение цикла через 3 нед.
У больных с мезотелиомой плевры отмечается гиперэкспрессия ангиогенного
(VEGF), а также эпидермального (EGFR) факторов роста. Мезотелиома плевры проду-
цирует также ряд цитокинов, таких как ИЛ-6 и ФИО, что имеет прогностическую цен-
150 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухолевые плевриты
-t. •» з и.йяц» teiM^isaaaffiats3£aga8ag&asaa&8g^^
ность. Однако, использование ряда ингибиторов EGFR и VEGF не показало их эффек-
тивности при данной патологии.
9.6. Опухолевые плевриты
М. Б. Бычков
Опухолевый (метастатический) плеврит — частое осложнение при раке легко-
го, РМЖ, раке яичников, а также при лимфомах и лейкозах. Так, при раке легкого он
встречается у 24-50% больных, при РМЖ — до 48%, при лимфомах — до 26%, а при
раке яичников — до 10%. При других злокачественных опухолях опухолевый плев-
рит выявляется у 1-6% пациентов (рак желудка, толстой кишки, поджелудочной желе-
зы, саркомы, меланомы и др.). Наиболее распространенные причины экссудативных
плевритов — метастазы в плевре и лимфоузлах средостения. Плеврит, как правило,
свидетельствует о далеко зашедшем опухолевом процессе и является следствием
опухолевых высыпаний по плевре.
Диагноз опухолевого плеврального выпота устанавливают при обнаружении злока-
чественных клеток в плевральной жидкости или в плевре, в большинстве случаев с по-
мощью цитологического исследования плевральной жидкости. Частота обнаружения
опухолевых клеток при этом достигает 80-90%. На основании цитологического ис-
следования плевральной жидкости часто удается определить морфологический ха-
рактер первичной опухоли.
Накопление жидкости в плевральной полости приводит к сдавлению легкого, сме-
щению средостения, что, в свою очередь, вызывает усиление одышки, нарушение ды-
хательной и сердечной деятельности. Часто плеврит, будучи единственным проявле-
нием опухолевого процесса, может быть причиной смерти больного при отсутствии
других метастазов.
Лечение больных с выпотом в плевральную полость заключается прежде всего в
эвакуации жидкости, введении внутриплеврально лекарственных средств для прекра-
щения накопления жидкости в плевральной полости и рассасывания экссудата. Это
приводит кулучшению состояния больного, уменьшению одышки, боли, легочно-сер-
дечной недостаточности и, тем самым, к удлинению жизни.
Перед решением вопроса о введении внутриплеврально тех или иных лекарствен-
ных средств необходимо уточнить локализацию первичного процесса, т.к. при РМЖ,
раке яичников, МРЛ, лимфомах системная XT может привести к ликвидации плевраль-
ного выпота у 30-60% пациентов.
В тех случаях, когда системная XT не показана или неэффективна, необходимо вну-
триплевральное введение лекарственных препаратов (табл. 9.9).
Показанием для плевральных пункций и внутриплеврального введения лекарств
служит наличие выпота в плевральной полости выше уровня 11-111 ребра (счет спере-
ди), выраженной одышки с явлениями легочной или легочно-сердечной недостаточ-
ности, при ожидаемой продолжительности жизни более 2 нед. При наличии выпота
без клинической симптоматики нет смысла проводить плевральные пункции и вводить
те или иные лекарственные средства.
Внутриплевральное введение изотопов использовалось в середине прошлого века,
но в настоящее время оставлено.
Ниже приводится методика введения цитостатиков, их разовые и суммарные дозы, а
также режим лечения.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 151
Химиотерапия солидных опухолей
Тиотепа (Тиофосфамид) — 30-40 мг 1 раз в 7-14 дней, 3-4 введения, всего 120-
160 мг.
Фторурацил — 500-1000 мг 1 раз в 7 дней, 3-4 введения, всего 2000-3000 мг.
Блеомицин — 15-30 мг 1 раз в 7 дней, 4-5 введений, всего 60-150 мг.
Доксорубицин — 30-40 мг 1 раз в 7 дней, 3-4 введения, всего 90-120 мг.
Цисплатин — 50-60 мг 1 раз в 7 дней, 2-3 введения, всего 100-180 мг.
Митоксантрон (Новантрон) — 20-25 мг, 2-3 введения.
Этопозид — 150-200 мг 2 раза в 7 дней, 3-4 введения, всего 600 мг.
Тиотепа (Тиофосфамид) 30-40 мг + фторурацил 500 мг 1 раз в 7 дней, 3 введения.
Таблица 9.9. Эффективность внутриплеврального введения цитостатиков и
средств плевродеза при опухолевых плевритах
Класс препаратов Препарат Разовая доза Эффективность, %
Тиотепа 30-40 мг 54
5-ФУ 750-1000 мг 60
Доксорубицин 30 мг 54
Цитостатики Этопозид 200 мг 40-92
Митоксантрон 25-30 мг 80
Цисплатин 40-60 мг/м2 82
Блеомицин 60 мг 62-81
Циклоплатам 100 мг 54
С. parvum 5-10 мг 40-81
Модификаторы биологических ИЛ-2 + ЛАК 500 тыс. ME+ 10 млн ЛАК 69
реакций ИФН 5-20 млн ME 38-50
ОК-432 71
Тальк 2-6 г 88
Склерозирующие препараты Хинакрин 100 мл 78
Тетрациклин 1,2-1,6 г 47-90
Доксициклин 500 мг 67-88
Эффективность внутриплеврального введения отдельных цитостатиков при раке
легкого и РМЖ колеблется от 60 до 80%. При этом можно рассчитывать как на специ-
фический противоопухолевый эффект, так и на развитие плевродеза.
Особого внимания заслуживают методы неспецифической терапии с использова-
нием различных склерозирующих средств с целью достичь химического серозита,
склеивания плевральных листков и, таким образом, ликвидации выпота в плевральной
полости. К этим веществам относятся тальк, хинакрин (акрихин), делагил и тетраци-
клин (доксициклин). Эффективность введения талька, акрихина, делагила достигает
55-60%, а тетрациклина — 80-90%. Однако в России тетрациклин и доксициклин для
парентерального введения не производятся.
Внутриплевральная инсуффляция тальком в дозе 5-10 г проводится путем тора-
коскопии под общим наркозом. Наиболее популярен плевродез с помощью блео-
мицина.
Методика плевродеза следующая. Больному под местной анестезией проводят пун-
кцию плевральной полости с введением тонкой силиконовой трубки, по которой с по-
мощью вакуум-отсоса эвакуируют жидкость. После этого трубку зажимают и под рен-
тгеновским контролем убеждаются, что легкое расправилось. В случае, если легкое
не расправилось или имеется смещение средостения в сторону плеврального выпо-
та, не следует вводить склерозирующие препараты из-за возможности образования
152 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
«панцирного легкого». Поскольку введение склерозирующих веществ может сопрово-
ждаться болевыми ощущениями, то в плевру предварительно вводят 50 мл 0,5% рас-
твора новокаина через дренажную трубку. После введения препарата трубку пережи-
мают на 1-2 ч, а больного просят несколько раз менять положение тела. Через 1-2 ч
зажим снимают, а дренажную трубку подключают к вакуум-отсосу с постоянным дав-
лением (от 15 до 20 см вод. ст.). Аспирацию продолжают не менее 24 ч, пока объем
выводимой жидкости не будет менее 150-200 мл/сут. После этого дренажную трубку
удаляют. Процедура считается успешной, если у больного в результате введения скле-
розирующего препарата развился острый плеврит, а с помощью дренирования было
обеспечено сближение висцеральной и париетальной плевры и этим достигнута об-
литерация плевральной полости. Неудачи данной методики связаны в основном с не-
достаточно полным дренированием плевральной полости.
Метаанализ, проведенный Belani и соавт. по эффективности отдельных цитостатиков
в различных исследованиях, показал, что наиболее эффективные препараты для плев-
родеза — тетрациклин, тальк и блеомицин. В практической работе наиболее широко
используются для внутриплеврального введения цисплатин, блеомицин и тальк.
9.7. Злокачественные опухоли желудочно-
кишечного тракта
9.7.1. Рак пищевода
77. В. Манзкж
Заболеваемость раком пищевода в России в последние годы имеет тенденцию к сни-
жению каку мужчин, так и у женщин. В 2001 г. выявлено 7478 больных, а в 2005 г. —
7084. В США в 2006 г. выявлено 14 550 вновь заболевших. Мужчины болеют чаще
женщин. Факторами риска у мужчин являются табакокурение и злоупотребление ал-
коголем. Наиболее частая локализация — нижний грудной и абдоминальный отделы
пищевода. По гистологическому строению в большинстве случаев рак пищевода пло-
скоклеточный, значительно реже встречается аденокарцинома. В последние годы в
США вырос процент больных, страдающих железистым раком: в 60-е годы XX в. их
было 10%, в 1996 г. — 50%, в 2004 г. — 75%. Эта гистологическая форма выявляется
преимущественно у белых мужчин среднего возраста и не связана с табакокурением
и злоупотреблением алкоголем. Железистый рак часто возникает на фоне синдрома
Баррета — метаплазии эпителия, которая может быть связана с рефлюкс-эзофагитом,
поражая нижнюю треть пищевода. Фактором риска является ожирение.
Классификация рака пищевода по системе TNM
Первичная опухоль (Т)
ТХ — недостаточно данных для оценки первичной опухоли.
ТО — первичная опухоль не определяется.
Tis — рак in situ.
Т1 — опухоль инфильтрирует собственную пластинку слизистой оболочки и под-
слизистую основу.
Т2 — опухоль инфильтрирует мышечный слой.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 153
Химиотерапия солидных опухолей
вйЮЙ®»аЯЙЯЙЙЙ»а1ЯЯЙЙИИ8ЙЙЯВ&ЙЙвВЙЯЙвЯЯ^^ -> ->'
ТЗ — опухоль инфильтрирует адвентицию.
Т4 — опухоль распространяется на соседние органы и ткани.
Регионарные лимфоузлы (N)
NX — недостаточно данных для оценки регионарных лимфоузлов.
NO — метастазов в регионарных лимфоузлах нет.
N1 — метастазы в регионарных лимфоузлах.
Отдаленные метастазы (М)
MX — недостаточно данных для выявления отдаленных метастазов.
МО — отдаленных метастазов нет.
Ml — имеются отдаленные метастазы.
Опухоли нижнегрудного отдела пищевода
М1а — метастазы в чревных лимфоузлах.
М1Ь — другие отдаленные метастазы.
Опухоли среднегрудного отдела пищевода
Ml а — в классификации не определены.
М1Ь — метастазы в нерегионарных лимфоузлах и/или другие отдаленные метастазы.
Опухоли верхнегрудного отдела пищевода
М1а — метастазы в верхнешейных лимфоузлах.
М1Ь — другие отдаленные метастазы.
5-летняя выживаемость при раке пищевода колеблется от 5 до 30%, что связано с
распространенностью процесса в момент диагностики (табл. 9.10).
Таблица 9.10. Группировка рака пищевода по стадиям (2002) и 5-летняя
выживаемость
Стадия TNM 5-летняя выживаемость, % 1
0 Tis МО МО 100
1 Т1 NO МО 75
ПА Т2 40
ТЗ NO МО 25
IIB Т1 или Т2 М1 МО 15
III ТЗ N1 МО или Т4 Млюбая МО 10
IV Тлюбая Млюбая М1 <5-10
Возможности хирургического лечения обусловлены общим состоянием больного,
стадией заболевания и локализацией процесса — операция практически выполняется
лишь при поражении нижней и средней трети пищевода. Очень важно правильно оце-
нить степень местного распространения опухоли, т.е. ее инвазию. Для этого использу-
ется эндоскопическое УЗИ. Прогноз заболевания связан с расположением опухоли,
вовлечением лимфоузлов, наличием пенетрации.
Рак пищевода является чувствительной к XT опухолью. Эффективность монотерапии
такими препаратами, как цисплатин, карбоплатин, фторурацил, блеомицин, митоми-
цин, эпирубицин (Фарморубицин), виндезин, этопозид, паклитаксел, доцетаксел, ири-
нотекан, составляет 15-30%. Наиболее активны цисплатин, паклитаксел, фторурацил.
В основном, к этим цитостатикам, за исключением паклитаксела, чувствителен ПКР
154 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
пищевода. Паклитаксел одинаково эффективен при железистом и плоскоклеточном
раке. Установлена активность при ПКР таргетного препарата гефитиниб — тирозинки-
назного ингибитора EGFR. Последние 10 лет активно изучается комбинированная XT,
которая более эффективна, чем монорежимы, как по частоте, так и по длительности
ремиссий. При ПКР пищевода стандартной является комбинация цисплатина с 5-ФУ,
при аденокарциноме — паклитаксел с цисплатином. Комбинация цисплатина с 5-ФУ и
паклитакселом эффективна при обеих гистологических формах.
Изучаются комбинации, включающие иринотекан, доцетаксел, гемцитабин, капеци-
табин. Эффективность лекарственных комбинаций на основе цисплатина около 45 %.
В настоящее время установлено, что ПХТ (фторурацил + цисплатин) в сочетании с
лучевой терапией (50 Гр) улучшает выживаемость больных, давая до 20% морфоло-
гически доказанных полных регрессий опухоли по сравнению с 5% при примене-
нии только XT. При местнораспространенном раке пищевода сочетание ПХТ с луче-
вой терапией дает шанс на выполнение радикальной операции у больных, леченных
с эффектом, что ведет к улучшению отдаленных результатов: 5-летняя выживаемость
после лучевой терапии составляет 0-10% а после химиолучевого лечения увеличи-
вается до 27 %. Метаанализ 9 рандомизированных исследований показал, что 3-лет-
няя выживаемость больных, получивших неоадъювантное химиолучевое лечение, а
затем прооперированных, достоверно выше по сравнению с группой пациентов, под-
вергшихся только операции.
Режимы терапии
Монохимиотерапия
Цисплатин — 20 мг/м2 в/в в 1-5-й день каждые 3 нед. или 80 мг/м2 в/в 1 раз в 3 нед.
Блеомицин или блеомицетин — 10-15 мг/м2 в/в 2 раза в неделю до суммарной дозы
200-300 мг.
Доксорубицин (Адриамицин) — 40 мг/м2 в/в 2 дня подряд каждые 3 нед.
Эпирубицин (Фарморубицин) — 30 мг/м2 в/в 3 дня подряд каждые 3 нед.
Фторурацил — 600 мг/м2 в/в еженедельно или 500 мг/м2 в/в в 1 -5-й день каждые 5 нед.
Метотрексат — 40 мг/м2 в/в еженедельно, длительно.
Винорелбин — 25 мг/м2 в/в капельно еженедельно, длительно.
Митомицин — 20 мг/м2 в/в 1 раз в 4-6 нед.
Метотрексат, блеомицин, винорелбин и митомицин в монорежиме чаще используют
как вторую линию терапии.
Комбинированная химиотерапия
1. Цисплатин — 75-100 мг/м2 в/в в 1-й день.
Фторурацил — 1000 мг/м2/сут длительная в/в инфузия в 1-5-й день.
Повторение цикла каждые 28 дней.
2. Паклитаксел — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 3 нед.
3. Карбоплатин — AUC 5 в/в капельно в 1-й день.
Паклитаксел — 150 мг/м2 в/в 3-часовая инфузия в 1-й день.
Повторение цикла каждые 3 нед.
4. Паклитаксел — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Цисплатин — 20 мг/м2 в/в капельно в 1-5-й день.
Фторурацил — 750 мг/м2/сут длительная в/в инфузия в 1-5-й день.
Повторение цикла каждые 28 дней.
5. Цисплатин — 25-30 мг/м2 в/в капельно в 1,8, 15 и 22-й дни.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 155
Химиотерапия солидных опухолей
Иринотекан — 50-65 мг/м2 в/в 30-минутная инфузия в 1,8, 15 и 22-й дни.
Повторение цикла через 3 нед.
Комбинированная химиолучевая терапия
Лучевая терапия — 1,8-2 Гр в сутки в 1-5-й день еженедельно до СОД 50 Гр.
Фторурацил — 1 г/м2/сут в/в 96-часовая инфузия в 1, 5,9 и 13-ю недели.
Цисплатин — 75 мг/м2 в/в капельно в 1-й день каждого цикла (1, 5, 9 и 13-й недели).
9.7.2. Рак желудка
А. М. Гарин, И. С. Базин
Темпы снижения частоты рака желудка (РЖ) во всех регионах мира составляют от 2
до 7 %, тем не менее, несмотря на повсеместную тенденцию к снижению заболевае-
мости, РЖ остается важнейшей мировой онкологической проблемой; 8,6% всех вновь
регистрируемых в мире опухолей — это РЖ, в абсолютных цифрах — 1 067 000 чело-
век. РЖ по частоте стоит на 4-м месте после рака легкого, РМЖ, рака толстой кишки,
как причина онкологической смертности — на 2-м месте после рака легкого.
В 2006 г. в России выявлено 41 930 новых больных РЖ. В структуре онкологиче-
ской заболеваемости мужчин и женщин на эту форму приходится соответственно
10,8 и 7,0% (3-е место по частоте для обоего пола). Умерло от РЖ в 2006 г. в России
37 360 больных. В структуре онкологической смертности на долю РЖ приходит-
ся 13,9% для мужчин и 12,4% для женщин (2-е место для обоего пола). Соотношение
умерших ко вновь регистрируемым составляет 0,89. В Западной Европе в 2006 г. это
соотношение было 0,74, в Японии — 0,47.
Неуменьшается заболеваемость РЖ проксимальных локализаций. Кардиальный рак,
по своей сути являющийся самой неблагоприятной формой, растет на 4% в год в раз-
витых странах. Темпы роста рака кардиального отдела желудка обгоняют темпы роста
рака легкого в США.
В аналитической эпидемиологии широко пользуются классификацией РЖ, предло-
женной финским патологом Lauren. Выделяют две формы РЖ: кишечную и диффузную.
Кишечную форму называют эпидемической, поскольку она доминирует в странах с
наибольшим распространением РЖ. Этот вариант аденокарциномы более дифферен-
цирован. Развитию опухоли предшествуют атрофия слизистой оболочки, дисплазии,
кишечная метаплазия эпителия. Такой рак чаще встречается в дистальных отделах же-
лудка. У мужчин пожилого возраста четче прослеживается связь с инфицированно-
стью Helicobacter pylori.
Диффузная (или эндемическая) форма регистрируется чащеу молодых лиц, морфо-
логически менее дифференцирована (имеет перстневидноклеточную структуру). На
долю диффузной формы приходится 73 всех опухолей желудка. Типичны инфильтра-
ция подслизистой основы желудка и контактное распространение по стенкам желуд-
ка и за его пределами. Характерно преобладание этой формы в проксимальных отде-
лах желудка.
Прогностически важно стадирование РЖ по системе TNM. Эта классификация объ-
единяет три важных элемента, влияющих на прогноз и результативность хирургиче-
ского лечения.
Категория Т характеризует первичную опухоль, варианты пенетрации желудочной
стенки.
156
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
Классификация рака желудка по системе TNM
Т1 — опухоль прорастает слизистую оболочку или слизистую оболочку и подслизи-
стую основу.
Т2 — опухоль прорастает слизистую оболочку, подслизистую основу и мышечный
слой, возможна также инфильтрация субсерозного слоя.
ТЗ — опухоль прорастает все слои желудка — от слизистой до серозной.
Т4 — опухоль прорастает все слои желудка, а также соседние структуры.
Категория N предусматривает пять вариантов.
NX — вовлеченность лимфоузлов в опухолевый процесс неизвестна.
NO — нет метастазов в регионарных лимфоузлах.
N1 — метастазы в лимфоузлах 1-6-й зоны.
N2 — метастазы в лимфоузлах 7-15-й зоны.
N3 — метастазы в лимфоузлах 15-16-й зоны.
Категория М обозначена стандартно.
МО — нет метастазов.
MX — нельзя оценить наличие метастазов.
Ml — наличие отдаленных метастазов.
Система стадирования выглядит следующим образом (табл. 9.11).
Таблица 9.11. Группировка рака желудка по стадиям
Стадия TNM 1
IA Т1 NO МО
IB Т1 N1 МО Т2 NO МО
II Т1 N1 МО Т2 N1 МО ТЗ NO МО
IIIA Т2 N2 МО ТЗ N1 МО Т4 NO МО
IIIB ТЗ N2 МО
IV Т4 N1-2 МО Тлюбая N3 МО Тлюбая NnK)6afl М1
Уровень инвазии стенок желудка — очень важный прогностический фактор.
Втабл. 9.12 представлены материалы 4 исследований (8240 больных), из которыхясно
прямо пропорциональное ухудшение отдаленных результатов по мере опухолевого
захвата новых слоев желудочной стенки.
Таблица 9.12, 5-летняя выживаемость больных раком желудка после
радикальной операции в зависимости от глубины инвазии
Глубина инвазии 5-летняя выживаемость, %
Общее число больных 8240
Поражение только слизистой оболочки 84-94
Поражение слизистой оболочки и подслизистой основы 74-91
Поражение слизистой оболочки, подслизистой основы и мышечного слоя 56-82
ХИМИОТЕРАПИЯ ОТДЕЛ ЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
157
Химиотерапия солидных опухолей
SrtrWW* * W ‘ *
Глубина инвазий 5-летняя выживаемость, % 1
Поражение стенки желудка, включая субсерозный слой 40-65
Тотальное поражение всех слоев желудка 23-34
Поражение всей стенки желудка и вовлечение соседних органов 5-25
Тотальная и субтотальная гастрэктомии остаются стандартными операциями при РЖ.
Революционным является хирургический подход, суть которого в расширении объе-
ма л имфодиссекции до D2.
Неудовлетворенность результатами хирургического лечения больных со II и III ста-
диями РЖ стимулировала многих исследователей на проведение адъювантной
химиотерапии. Обычно ее назначают в срок от 4 до 8 нед. после операции.
Задача адъювантной XT — воздействие на недиагностируемые макрометастазы,
оставшиеся после хирургического удаления первичного очага, а также на микромета-
стазы. Критерии эффекта адъювантной терапии: время до развития локального реци-
дива и частота рецидивов, время до появления отдаленных метастазов, выживаемость
1, 2, 3 и 5 лет.
Необходимость адъювантной XT при операбельном РЖ не определена, однако фа-
культативно она может назначаться больным с III стадией, а также при неуверенности в
радикальности выполненной операции.
Американские исследователи в 2001 г. опубликовали итоги международного ис-
следования INT-0116 (резекция D0-1 + химиолучевая терапия: 5 послеоперационных
курсов XT фторурацилом с лейковорином и облучение 45 Гр) у 550 больных РЖ. Ме-
диана выживаемости пациентов, получивших адъювантную химиолучевую терапию,
составила 36 мес., в контрольной группе — 27 мес.; 3-летняя безрецидивная выжи-
ваемость после химиолучевой адъювантной терапии была 49%, в контрольной груп-
пе — 32%, 3-летняя выживаемость — 52 и 41 % соответственно. Увеличение медианы
продолжительности жизни на 25 % стало аргументом для признания такого вида адъю-
вантного лечения стандартом, и такое решение в США было принято.
В Японии стандартом лечения резектабельного РЖ служит выполнение лимфодис-
секции D2 с последующей адъювантной терапией препаратом S1 в течение года.
В отличие отяпонских и американских онкологов европейские исследователи скло-
няются к проведению неоадъювантной терапии с последующей операцией и продол-
жением XT. Они считают, что эта методика позволяет снизить стадию процесса, увели-
чивает частоту радикальных резекций, время, свободное от болезни, улучшает общую
выживаемость.
Известны итоги большого исследования, в котором при РЖ III стадии неоадъюван-
тно применялся доцетаксел 75 мг/м2 и цисплатин 75 мг/м2. В 50% случаев III стадия РЖ
была переведена во II стадию.
Наибольший интерес исследователей вызвали результаты, полученные D. Cunning-
ham в 2008 г. (исследование MAGIC). В исследовании было две группы: группа наблю-
дения и лечебная группа — 3 курса ECF (эпирубицин + цисплатин + 5-ФУ) до и 3 кур-
са после операции. В первой группе 240 (95%) пациентам выполнена операция; во
второй группе предоперационную XT начало 237 (95%) больных, завершило — 215
(86%); прооперировано 219 (88%) пациентов; послеоперационное лечение начато у
137 (55 %) больных, завершено — у! 04 (42 %); частота послеоперационных осложне-
ний и летальности была одинакова в обеих группах. 2-летняя выживаемость состави-
ла 50 и 41 %, 5-летняя — 36 и 23 % соответственно, т.е. больше в группе XT. Использо-
вание пред- и послеоперационной XT снизило риск прогрессирования на 34% и риск
смерти от прогрессирования заболевания на 25% (р = 0,0001 и р = 0,009 соответст-
венно).
158 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
Небольшое исследование FNLCC 94012-FFCD 9703 (до операции 2-3 курса CF —
операция — 3-4 курса CF после операции) также продемонстрировало преимуще-
ство мультидисциплинарного подхода в сравнении с классическим хирургическим:
5-летняя выживаемость больше на 14% (38 us 24%), медиана выживаемости — на
8 мес. (28 us 20 мес.).
Аргументы в пользу адъювантной внутрибрюшинной химиотерапии базируются
на фактах преимущественно локальной диссеминации (40-65 % случаев) после ра-
дикальных операций на желудке. Прорастание опухолью серозной оболочки желуд-
ка повышает риск диссеминации по брюшине. Опухолевые клетки в абдоминальных
смывах у таких больных находят в 12,4% случаев. В Японии разрабатывается интрапе-
ритонеальная гипертермическая перфузия. Используют препараты цисплатин и мито-
мицин С, которые вводят в брюшную полость сразу после хирургического удаления
желудка. Пока установлено, что частота локальных рецидивов после такой манипуля-
ции уменьшается. Что касается сроков жизни и медианы выживаемости, данных, сви-
детельствующих об улучшении этих показателей, еще нет.
XT — основной метод лечения больных РЖ в стадии диссеминации. Возможности
метода ограничены. У 30-50% больных удается добиться временного уменьшения
первичной опухоли и метастазов, полный эффект регистрируется менее чем в 10%
случаев и также является временным. Однако показано, что не получающие XT боль-
ные с диссеминированным РЖ живут 3-4 мес., а при использовании активной XT мож-
но добиться медианы выживаемости 11 мес. В онкологической практике для лечения
РЖ применяют комбинированную XT, но для составления комбинаций нужно знать, ка-
кой вклад каждого из препаратов в режиме монотерапии. Среди противоопухолевых
препаратов для лечения РЖ — фторурацил, тегафур (Фторафур), УФТ, S-1, ралтитрек-
сед, метотрексат, доксорубицин, эпирубицин, иринотекан, этопозид, тенипозид, до-
цетаксел, паклитаксел, цисплатин, оксалиплатин. Противоопухолевая активность этих
препаратов не превышает 10-30%.
Комбинированную химиотерапию РЖ применяют с 1980-х годов.
Распространенной считается комбинация ELE В ее состав входят этопозид, лейково-
рин и фторурацил. По данным разных авторов, эффект наблюдается в диапазоне 20-
40%, полная ремиссия — 6-12%, медиана выживаемости — 8 мес. В сравнительных
исследованиях комбинации ELF и интенсивной симптоматической терапии было пока-
зано, что средняя выживаемость в группе получавших ELF составила 8 мес., в группе с
симптоматическим лечением — 4 мес. Режим легко переносится, может назначаться
истощенным, пожилым и пациентам с соматически отягощенным статусом.
Режим PELF состоит из цисплатина, эпирубицина, лейковорина и фторурацила. Ци-
клы повторяют каждые 4 нед. Общий эффект регистрируется в 40% случаев, пол-
ный — в 10%. 1-летняя выживаемость составляет 30,8%, 2-летняя — 15,7%.
Популярна комбинация 1990-х годов CF: цисплатин + фторурацил в виде 5-дневной
инфузии. Эффективность режима в диапазоне 25-41 %, время до прогрессирования
4-7 мес., медиана выживаемости 7-9 мес.
Следующим шагом была разработка трехкомпонентного режима DCF (доцетак-
сел 4- цисплатин 4- 5-ФУ). В 2007 г. были подведены итоги исследования V-325B, в ко-
тором сравнивались режимы DCF и CF. Полученные результаты продемонстрировали
преимущества режима DCF в сравнении с CF по эффективности (35 us 24%), медиане
общей выживаемости (9,2 us 8,6 мес.), 2-летней выживаемости (18,4 us 8,8%). В то же
время в этом исследовании была показана большая токсичность комбинации DCF (ФН
в 29 и 12% случаев, нейтропения III и IV степени в 82 и 57% случаев, диарея в 19 и 8%
случаев соответственно).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 159
Химиотерапия солидных опухолей
»айаяяя»ияявйймйм»йямйд»йваай»»^^ ' д '
В современной практике для снижения токсичности часто используется замена ци-
сплатина на оксалиплатин и 5-ФУ на капецитабин. Большинство исследователей под-
тверждают снижение токсичности без потери эффективности.
Kang и соавт. в 2007 г. опубликовали результаты рандомизированного исследования,
сравнивавшего CF и ХР (капецитабин 2000 мг/м2/сут в 1—14-й день + цисплатин 80 мг/м2
в 1 -й день каждые 3 нед.). Эффект при режиме ХР достигается у 43 % пациентов, стаби-
лизация — еще у 50 %, время до прогрессирования составляет 5,6 мес., медиана выжи-
ваемости — 10,7 мес. (для CF — 5 и 9,5 мес. соответственно).
Удобна и малотоксична комбинация FLOT, состоящая из 5-ФУ, лейковорина, окса-
липлатина и доцетаксела. Ремиссия отмечалась у 59% больных, стабилизация опухо-
левого роста — еще у 32%, без прогрессирования в течение года жили 34% пациентов,
медиана общей выживаемости —11,3 мес.
Комбинации на основе иринотекана (IP: иринотекан 60 мг/м2 + цисплатин 30 мг/м2
каждые 2 нед., 7 циклов; FOLFIRI: фторурацил 400 мг/м2 в 1-й день струйно, затем
46-часовая инфузия 2400 мг/м2 в 1-й и 2-й дни, лейковорин 200 мг/м2 инфузия 1-2 ч
до ФУ, иринотекан 180 мг/м2 в 1-й день) не нашли широкого применения в первой ли-
нии терапии РЖ.
При рандомизированном сравнении FOLFIRI и CF эффект составил 31,8 и 25 %, время
до прогрессирования — 6 и 4,2 мес., медиана общей выживаемости — 9 и 8 мес. соот-
ветственно, но различия статистически недостоверны.
Нами апробирована комбинация митомицина С и иринотекана во второй линии ле-
чения РЖ. Результаты обнадеживают: время до прогрессирования более 6 мес.
В 2009 г. опубликованы результаты исследования TOGA. Больные РЖ с HER2+ опухо-
лью помимо XT по схеме цисплатин + капецитабин получали трастузумаб. Добавление
этого таргетного препарата позволило достоверно увеличить выживаемость на 4 мес.
Для лечения больных РЖ активно изучается бевацизумаб.
Заканчивая изложение материала по применению комбинированной XT для лечения
диссеминированного РЖ, подчеркнем, что последнее время в большинстве стран в ка-
честве стандарта лечения больных метастатическим РЖ с общим состоянием по шкале
ECOG 0—1 балл (шкала Многоцентровой онкологической исследовательской группы
Востока США) признается режим DCF и его модификация, режим CF или ELF назначают
пациентам с ECOG 2+, ослабленным и пожилым.
XT диссеминированного РЖ имеет паллиативные цели. Выживаемость пациентов
после комбинированных режимов терапии составляет 9-11 мес., после включения в
алгоритм трастузумаба, лапатиниба — 19 мес. Ближайшая цель — достичь медиану вы-
живаемости 18 мес. у этой категории пациентов.
Активно внедряются в клиническую практику адъювантные и неоадъювантные ме-
тоды XT и химиолучевой терапии (приняты как стандарт в США и Японии).
Режимы терапии
DCF
Доцетаксел — 75 мг/м2 в/в в течение 1 ч в 1-й день.
Цисплатин — 75 мг/м2 в/в в течение 2 ч в 1-й день.
Фторурацил — 750 мг/м2/сут в/в постоянная инфузия в 1-5-й день.
Дексаметазон — 8 мг 2 раза в сутки за день до XT, во время и в 1 -й день после XT.
Повторение цикла каждые 21 день.
DCF — вариант для амбулаторного применения.
Доцетаксел — 75 мг/м2 в/в во 2-й день.
Цисплатин — 75 мг/м2 в/в во 2-й день.
160 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
Фторурацил — 500 мг/м2 в/в 3-часовая инфузия в 1-3-й день.
Лейковорин — 20 мг/м2 в/в в 1-3-й день.
Повторение цикла каждые 28 дней.
CF
Цисплатин — 100 мг/м2 в/в в течение 2 ч в 1-й день.
Фторурацил — 1000 мг/м2/сут в/в постоянная инфузия в 1-5-й день.
Повторение цикла каждые 28 дней.
ECF
Эпирубицин — 50 мг/м2 в/в в 1-й день, затем
Цисплатин — 60 мг/м2 в/в в течение 2 ч в 1-й день.
Фторурацил — 200 мг/м2/сут постоянная инфузия в 1-21-й день.
Продолжительность курса 24 нед.
Повторение цикла каждые 21 день.
ELF
Лейковорин — 300 мг/м2 в/в в течение 10 мин в 1-3-й день, затем
Этопозид — 120 мг/м2 в/в в течение 50 мин в 1-3-й день.
Фторурацил — 500 мг/м2 в/в в течение 10 мин в 1-3-й день.
Повторение цикла каждые 21-28 дней.
IP
Иринотекан — 70 мг/м2 в/в в 1-й и 15-й дни.
Цисплатин — 80 мг/м2 в/в в 1-й день.
Повторение цикла каждые 28 дней.
Адъювантная химиолучевая терапия
Фторурацил — 425 мг/м2 в/в в 1-5-й день.
Лейковорин — 20 мг/м2 в/в в 1-5-й день.
С 28-го дня начинается химиолучевая терапия. Лучевая терапия СОД 45 Гр (1,8 Гр/сут
5 дней еженедельно в течение 5 нед.).
Фторурацил — 400 мг/м2 в/в в 1-4-й и 23-25-й дни (т.е. первые 4 дня и последние
3 дня облучения).
Лейковорин — 20 мг/м2 в/в в 1-4-й и 23-25-й дни; затем, через 1 мес. после окончания
лучевой терапии 2 цикла XT с интервалом 1 мес.
Фторурацил — 425 мг/м2 в/в в 1-5-й день.
Лейковорин — 20 мг/м2 в/в в 1-5-й день.
9.7.3. Рак толстой кишки
77. В. Манзюк, £. В. Артамонова
Рак толстой кишки включает рак ободочной и прямой кишки. Для его определения ча-
сто используют термин «колоректальный рак» (КРР).
По данным МАИР (Международное агентство по изучению рака), КРР в структу-
ре онкологической заболеваемости у мужчин находится на 4-м месте, у женщин —
на 3-м.
Прогноз заболевания и выживаемость больных напрямую связаны со стадией в мо-
ментустановления диагноза. Классификация КРР по системе TNM, модифицированная
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 161
Химиотерапия солидных опухолей
классификация Dukes и выживаемость в зависимости от стадии болезни представле-
ны ниже (табл. 9.13).
Классификация колоректального рака по системе TNM
Первичная опухоль (Т)
ТХ — недостаточно данных для оценки первичной опухоли.
ТО — первичная опухоль не определяется.
Т1 — опухоль инфильтрирует подслизистую основу.
Т2 — опухоль инфильтрирует мышечную пластинку слизистой оболочки.
ТЗ — опухоль проникает через мышечную пластинку слизистой оболочки в субсероз-
ный слой или неперитонизированные участки околоободочной или периректальной
клетчатки.
Т4 — опухоль распространяется на соседние органы и ткани и/или прорастает висце-
ральную брюшину.
Регионарные лимфоузлы (N)
NX — недостаточно данных для оценки регионарных лимфоузлов.
N1 — метастазы в 1-3 лимфоузлах.
N2 — метастазы в 4 лимфоузлах и более.
Отдаленные метастазы (М)
MX — недостаточно данных для оценки отдаленных метастазов.
МО — отдаленных метастазов нет.
Ml — отдаленные метастазы есть.
Таблица 9.13. Классификация колоректального рака и 5-летняя выживаемость
в зависимости от стадии
Стадия TNM* Модифицированная классификация Dukes 5-летняя выживаемость, %
Рак ободочной кишки Рак прямой кишки
0 Tis NO МО — 100 100
1 Т1-2 NO МО А >90 >90
НА ТЗ NO МО В1 75-85 70-85
НВ Т4 NO МО В2 70-75 70-75
HIA Т1-2 N1 МО С1 59 55
IIIB ТЗ-4 N1 МО С2 42 35
IIIC Т любая N2 МО СЗ 27 24
IV Т любая N любая М1 D < 5 <5
Для установления индекса NO требуется гистологическое исследование не менее 12 регионарных лимфоузлов.
9.7.3.1. Рак ободочной кишки
В 2006 г. в России выявлено 30 129 вновь заболевших. В 70 % случаев опухоль пора-
жает сигмовидную и слепую кишку.
По гистологическому строению рак ободочной кишки в 80 % случаев представлен
аденокарциномой разной степени дифференцировки, значительно реже встречаются
другие формы рака (муцинозная аденокарцинома, железисто-плоскоклеточный рак,
162 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
медуллярный рак, мелкоклеточный рак, перстневидноклеточный рак, ПКР, недиффе-
ренцированный рак).
Раково-эмбриональный антиген (РЭА, гликопротеид с молекулярной массой
180 кДа) — наиболее известный маркер рака толстой кишки и выявляется примерно
у 60% больных КРР. Высокий уровень РЭА до начала лечения служит фактором небла-
гоприятного прогноза, а сохраняющееся его повышение после операции может сви-
детельствовать о нерадикальности проведенного лечения. Наиболее часто определе-
ние уровня РЭА используется при оценке эффективности проводимой XT, но только в
дополнение к объективным методам обследования.
Основной метод лечения рака ободочной кишки — хирургический. Характер и объ-
ем вмешательства зависят от локализации и распространения опухоли, осложнений
опухолевого процесса и общего состояния больного. 5-летняя выживаемость после
радикальных операций составляет около 70%.
Заболевание протекает с большой частотой рецидивов, которые возникают при-
мерно у 50% больных. При рецидивах рака ободочной кишки и IV стадии болезни
проводят паллиативные резекции, накладывают обходные анастомозы и колостомы
для ликвидации непроходимости и ее профилактики, что продлевает жизнь больных
и улучшает ее качество. В последние годы все чаще проводится хирургическое удале-
ние единичных метастазов в легких, яичниках, печени.
Метастазы рака ободочной кишки в печени требуют комплексного подхода, но хи-
рургическое вмешательство считается наиболее адекватным методом лечения. Только
активная хирургическая тактика может значительно продлить жизнь больных, 5-лет-
няя выживаемость у таких пациентов составляет 20-40%, а стандарты адъювантной
терапии после подобных операций в настоящее время разрабатываются. При невоз-
можности оперативного лечения проводят эмболизацию или химиоэмболизацию во-
ротной вены или печеночной артерии, а также регионарную или системную XT. Вну-
триартериальная XT дает больший процент объективных ремиссий, но не улучшает
показатели выживаемости по сравнению с системным лечением. При переводе про-
цесса в операбельное состояние целесообразна резекция печени. Кроме того, ис-
пользуется криодеструкция метастазов под контролем интраоперационного УЗИ или
радиочастотная абляция. Показатели выживаемости после применения этих методов
выше, чем при одной системной XT.
Лучевая терапия при раке ободочной кишки малоэффективна, однако проводится с
паллиативной целью, в частности, при поражении забрюшинных или периферических
лимфоузлов.
XT у больных с IV стадией или рецидивом заболевания используется с паллиатив-
ной целью. Рак ободочной кишки считается относительно резистентной к воздейст-
вию цитостатиков опухолью. В течение более 40 лет единственным активным препа-
ратом был антиметаболит из группы производных фторпиримидина — 5-фторурацил.
Эффективность его не превышает 10—15%, причем чаще удается достичь лишь частич-
ных ремиссий длительностью 4-6 мес. или стабилизации. Позже был создан препарат
для перорального применения тегафур (Фторафур), который по сути является тран-
спортной формой 5-ФУ. Биохимическая модуляция 5-ФУ и тегафура с помощью фо-
лината кальция (Лейковорин) позволила увеличить их противоопухолевую активность
до 20-30%.
В дальнейшем в клиническую практику вошли новые цитостатики из группы анти-
метаболитов — УФТ (смесь тегафура и урацила), который так же, как тегафур, создает
постоянный уровень 5-ФУ в сыворотке крови, капецитабин (Кселода), который тран-
сформируется в 5-ФУ непосредственно в опухоли, а также прямой ингибитор тимиди-
латсинтазы — ралтитрексед (Томудекс). Рак ободочной кишки оказался чувствителен
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 163
Химиотерапия солидных опухолей
«вмжмйпятжвяшятмтяявмааппгятяктпж л * * г
к цитостатикам с оригинальным механизмом действия — ингибитору топоизомеразы I
иринотекану (Кампто) и производному платины III поколения — оксалиплатину (Элок-
сатин). Использование этих препаратов в составе лекарственных комбинаций (FOLF-
OX, FOLFIRJ) расширило возможности XT рака ободочной кишки, увеличив ее эффек-
тивность. Однако 5-ФУ не потерял своего значения, оставаясь основой лекарственной
терапии рака ободочной кишки. В современных терапевтических режимах чаще всего
используют длительные (22-46 ч) инфузии 5-ФУ в сочетании с лейковорином, вводи-
мые еженедельно или 1 раз в 2 нед. Такие режимы имеют преимущества по непосред-
ственной эффективности, переносимости и выживаемости больных.
В ряде случаев схемы комбинированной XT с использованием новых цитостати-
ков и фторурацила эффективны при резистентности к 5-ФУ с лейковерином. Акту-
ален выбор последовательности различных режимов лечения. Комбинации FOLFOX
и FOLFIRJ равноэффективны в качестве первой линии. Монохимиотерапия капецита-
бином не менее эффективна, чем комбинация 5-ФУ с лейковорином, а комбинации на
основе капецитабина служат альтернативой режимам с 5-ФУ. Вторая и третья линии
XT зависят от первой.
Рак ободочной кишки — одна из немногих злокачественных опухолей, при которых
внедрение современных молекулярно-нацеленных (таргетных) препаратов позволи-
ло существенно расширить возможности медикаментозного лечения и повысить его
эффективность.
Антиангиогенный препарат бевацизумаб (Авастин) — МКА к VEGF — в сочетании с
цитостатиками усиливает противоопухолевое действие последних, а в ряде случаев
позволяет преодолеть резистентность к лекарственным средствам. Цетуксимаб (Эр-
битукс) и панитумумаб (Вектибикс) — МКА к EGFR, гиперэкспрессия которого при
метастатическом раке ободочной кишки отмечается более чем у 80% больных. Эти
препараты подавляют способность опухоли к пролиферации, инвазивному росту и
метастазированию. Назначение цетуксимаба целесообразно при опухолях с нему-
тантным (диким) типом гена KRAS, который является ключевым маркером, предска-
зывающим успех такого лечения. Эффективность комбинации FOLFOX или FOLFIRJ
с цетуксимабом в качестве первой линии достигает 80%. Комбинация цетуксима-
ба с иринотеканом (Кампто) позволяет преодолеть резистентность к последнему и
контролировать рост опухоли в 50% случаев.
Таким образом, современная стратегия лечения метастатического КРР включает ис-
пользование на разных этапах всех активных при этой опухоли препаратов в режиме
практически непрерывного лечения, что позволяет увеличить медиану выживаемости
пациентов более чем до 24 мес.
Адъювантная химиотерапия
В результате многочисленных рандомизированных исследований установлено, что
применение комбинации фторурацил + фолинат кальция (Лейковорин) в течение
6 мес. после радикальных операций при III стадии рака ободочной кишки на 15-20 <
увеличивает 5-летнюю выживаемость. На сегодняшний день для адъювантного лече-
ния вариантом выбора являются режимы FOLFOX-4 (12 курсов каждые 2 нед.), XELOX,
а также капецитабин (Кселода) в монорежиме. Адъювантная XT при II стадии (стадия
В2 по Dukes) рака ободочной кишки не считается стандартом, но применяется при на-
личии неблагоприятных факторов прогноза у молодых пациентов.
164 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
- ч- ?-#- ;^^п^Г1Х^_~‘1^Г^^тП1Т?.^11Т1ГтТ1ТГ.тГтТПТЮТ‘ТГпТ1Х1^1Т111Т1П?.т1Т1ТП11Т1Г1Т1Ш1П11Ш1та
Режимы терапии
Монохимиотерапия
5-ФУ — 2600 мг/м2 24-часовая в/в инфузия еженедельно до проявления токсичности.
Тегафур (Фторафур) — 800-1000 мг/м2 внутрь ежедневно (доза делится на 2 приема)
до суммарной дозы 30 г. Повторение цикла через 2-3 нед.
УФТ (тегафур/урацил) — 400 мг/м2 внутрь (доза делится на 2-3 приема) ежедневно в
течение 3-4 нед. Повторение цикла через 1-2 нед.
Капецитабин (Кселода) — 2500 мг/м2 внутрь (доза делится на 2 приема) ежедневно в
течение 2 нед. Повторение цикла через 1 нед.
Ралтитрексед (Томудекс) — 3 мг/м2 в/в 15-минутная инфузия 1 раз в 3 нед.
Иринотекан (Кампто) — 350 мг/м2 в/в 1-часовая инфузия 1 раз в 3 нед. или 125 мг/м2 в/в
90-минутная инфузия еженедельно в течение 4 нед. Повторение цикла через 2 нед.
Цетуксимаб (Эрбитукс) — 400 мг/м2 1-я доза, затем 250 мг/м2 в/в капельно еженедельно.
Панитумумаб (Вектибикс) — 6 мг/кг в/в 90 мин 1 раз в 2 нед.
Комбинированная химиотерапия
5-ФУ/ЛВ (режим Мейо)
Лейковорин — 20 мг/м2 в/в струйно в 1 — 5-й день.
5-ФУ — 425 мг/м2 в/в струйно после введения лейковорина в 1-5-й день.
Повторение цикла через 3 нед.
5-ФУ/ЛВ (режим Rosvell Park)
Лейковорин — 500 мг/м2 в/в 2-часовая инфузия в 1,8, 15, 22, 29 и 36-й дни.
5-ФУ — 500 мг/м2 в/в струйно через 1 ч после начала инфузии лейковорина в 1,8, 15,
22, 29 и 36-й дни.
Повторение цикла через 2 нед.
5ФУ/ЛВ (режим De Gramon)
День 1: лейковорин — 200 мг/м2 в/в 2-часовая инфузия, 5-ФУ — 400 мг/м2 в/в струйно,
затем 5-ФУ — 600 мг/м2 в/в 22-часовая инфузия.
День 2: все повторяется.
Повторение циклов каждые 2 нед.
FOLFOX-4
Оксалиплатин — 85 мг/м2 в/в в 250-500 мл 5% раствора глюкозы 2-часовая инфузия в
1-й день.
Лейковорин — 200 мг/м2 в/в 2-часовая инфузия в 1-й и 2-й дни.
5-ФУ — 400 мг/м2 в/в струйно в 1-й и 2-й дни.
5-ФУ ~ 600 мг/м2 в/в 22-часовая инфузия в 1-й и 2-й дни.
Повторение циклов каждые 2 нед.
FOLFOX-6
Оксалиплатин — 100 мг/м2 в/в 2-часовая инфузия в 1-й день.
Лейковорин — 400 мг/м2 в/в 2-часовая инфузия в 1-й день.
5-ФУ — 400 мг/м2 в/в струйно в 1-й день.
5-ФУ — 2400 мг/м2 в/в 46-часовая инфузия в 1-й день.
Повторение циклов каждые 2 нед.
FUFOX
Оксалиплатин — 50 мг/м2 в/в 2-часовая инфузия в 1,8, 15 и 22-й дни.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 165
Химиотерапия солидных опухолей
Лейковорин — 500 мг/м2 в/в 2-часовая инфузия в 1,8, 15 и 22-й дни.
5-ФУ — 2000 мг/м2 в/в 22-часовая инфузия в 1,8, 15 и 22-й дни.
Повторение цикла через 2 нед.
FLOX
Оксалиплатин — 85 мг/м2 в/в 2-часовая инфузия в 1, 15 и 29-й дни.
Лейковорин — 500 мг/м2 в/в струйно в 1,8, 15, 22, 29 и 36-й дни.
5-ФУ — 500 мг/м2 в/в струйно в 1,8, 15, 22, 29 и 36-й дни.
Повторение цикла каждые 8 нед.
XELOX
Оксалиплатин — 135 мг/м2 в/в капельно в 1-й день.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема с 1-го дня (вечер) по 15-й день
(Утро).
Повторение цикла каждые 3 нед.
САРОХ
Оксалиплатин — 70 мг/м2 в/в капельно в 1-й и 8-й дни.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема с 1-го дня (вечер) по 15-й день (утро).
Повторение цикла каждые 3 нед.
1FL (режим Saltz)
Иринотекан — 125 мг/м2 в/в 90-минутная инфузия в 1,8, 15 и 22-й дни.
Лейковорин — 20 мг/м2 в/в болюсно в 1,8, 15 и 22-й дни.
5-ФУ — 500 мг/м2 в/в болюсно в 1,8, 15 и 22-й дни.
Повторение циклов каждые 6 нед.
FOLFIRI
Иринотекан — 180 мг/м2 в/в 90-минутная инфузия.
Лейковорин — 400 мг/м2 в/в 2-часовая инфузия.
5-ФУ — 400 мг/м2 в/в струйно.
5-ФУ — 2400 мг/м2 в/в 46-часовая инфузия.
Повторение циклов каждые 2 нед.
Режим Douiilard
Иринотекан — 180 мг/м2 в/в 90-минутная инфузия в 1-й день.
Лейковорин — 200 мг/м2 в/в 2-часовая инфузия в 1-й и 2-й дни.
5-ФУ — 400 мг/м2 в/в струйно в 1-й и 2-й дни.
5-ФУ — 600 мг/м2 в/в 22-часовая инфузия в 1-й и 2-й дни.
Повторение циклов каждые 2 нед.
FOLFOXIRI
Иринотекан — 165 мг/м2 в 1-й день.
Оксалиплатин — 85 мг/м2 в 1-й день.
Лейковорин — 200 мг/м2 в/в 2-часовая инфузия в 1-й день.
5-ФУ — 3200 мг/м2 в/в 48-часовая инфузия.
Повторение циклов каждые 2 нед.
АЮ
Иринотекан — 80 мг/м2 в/в 2-часовая инфузия.
166 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
Лейковорин — 500 мг/м2 в/в 2-часовая инфузия.
5-ФУ — 2000 мг/м2 в/в 24-часовая инфузия еженедельно 4 нед.
Повторение цикла через 2 нед.
XELIRI
Иринотекан — 250 мг/м2 в/в 90-минутная инфузия в 1-й день.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема с 1 -го дня (вечер) по 15-й день (утро).
Повторение цикла каждые 3 нед.
IC
Иринотекан — 180 мг/м2 в/в 90-минутная инфузия 1 раз в 2 нед.
Цетуксимаб — 400 мг/м2 1-я доза, затем 250 мг/м2 в/в капельно еженедельно.
МСАР
Митомицин С — 5 мг/м2 в/в 1 раз в 3 нед. или 10 мг/м2 в/в 1 раз в 6 нед.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема в 1-14-й день 3-недельного цикла.
UFT/LV
УФТ — 250 мг/м2/сут ежедневно внутрь в 1-14-й день.
Лейковорин — 90 мг/м2/сут ежедневно внутрь в 1-14-й день.
Повторение цикла каждые 3 нед.
Добавление бевацизумаба к режимам FOLFOX, FOLFIRI, IFL, De Gramon, Rosvell Park:
бевацизумаб 5 мг/кг в/в 30-90-минутная инфузия 1 раз в 2 нед.; к режимам XELOX,
XELIRI — 7,5 мг/кг в/в 30-90-минутная инфузия 1 раз в 3 нед.
Добавление цетуксимаба к режимам FOLFOX, FUFOX, CAPOX, FOLFIRI, CAPIRI, UFT/LV:
стартовая доза — 400 мг/м2 2-часовая инфузия, затем — 250 мг/м2 в/в 1-часовая инфу-
зия еженедельно.
Адъювантная терапия рака ободочной кишки
Режим FOLFOX-4 — 12 циклов каждые 2 нед. в течение 6 мес. (только для III стадии).
Режим XELOX — в течение 6 мес. (только для III стадии).
Капецитабин в монорежиме — в течение 6 мес.
Режим Мейо — 6 циклов.
Режим Roswell Park — 4 цикла.
9.7.3.2. Рак прямой кишки
Рак прямой кишки составляет 20-25 % всех злокачественных опухолей ЖКТ, а по тем-
пам прироста заболеваемости вышел на 1-е место в большинстве развитых стран.
В 2006 г. в России выявлено 16 466 вновь заболевших. По гистологическому строению
рак прямой кишки чаще всего является аденокарциномой, включая муцинозную или
перстневидноклеточную аденокарциномы, значительно реже встречается скирроз-
ный рак, еще реже — нейроэндокринные опухоли. Заболеваемость мужчин и женщин
приблизительно одинакова. Опухоль чаще развивается в ампулярном отделе прямой
кишки, реже — в супраампулярном и редко — в аноректальном.
Прогноз заболевания напрямую зависит от стадии процесса в момент установления
диагноза (см. табл. 9.13). Максимально точное предоперационное стадирование очень
важно, т. к. помогает правильно планировать лечебную тактику. Обследование включа-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 167
Химиотерапия солидных опухолей
ет обязательное эндоскопическое исследование с биопсией, КТ или МРТ малого таза
и брюшной полости, а также эндоскопическое УЗИ. Последнее позволяет с точностью
до 95% оценить степень прорастания опухолью стенки кишки и до 75% — состояние
регионарных лимфоузлов.
Хирургический метод лечения — основной. 5-летняя выживаемость после ради-
кальных операций 50-60%. При раке ректосигмоидного и верхнеампулярного отде-
лов прямой кишки и локальном опухолевом процессе (опухоль до 5 см, нет данных
о поражении лимфоузлов) методом выбора служит оперативное вмешательство; при
большей распространенности заболевания, а также раке средне- и нижнеампулярно-
го отделов прямой кишки показано комбинированное лечение с предоперационной
лучевой терапией.
Лучевая терапия играет важную роль в лечении рака прямой кишки. Часто комби-
нируется с XT и служит важной частью адъювантного лечения. Доказано, что адъю-
вантная XT 5-фторурацилом в сочетании с лучевой терапией (50-55 Гр) достоверно
улучшает общую и безрецидивную выживаемость больных. Неоадъювантная химио-
лучевая терапия имеет преимущество в отношении локорегионарного контроля и ча-
стоты выполнения сфинктеросохраняющих операций по сравнению с адъювантным
лечением, но не влияет на общую выживаемость. Многочисленные международные
исследования позволили выработать оптимальную современную стратегию комби-
нированного лечения рака прямой кишки, которая включает в себя неоадъювантную
химиолучевую терапию (длительные инфузии 5-ФУ предпочтительны), оперативное
вмешательство и последующую адъювантную XT.
Химиолучевая терапия часто используется в качестве самостоятельного метода ле-
чения при неоперабельном раке прямой кишки. Рак прямой кишки является опухо-
лью, чувствительной к воздействию цитостатиков. При распространенном процес-
се (IV стадия) используются те же препараты и лекарственные комбинации, что и при
раке ободочной кишки (см. разд. 9.7.3.1). Тактика лечения изолированного поражения
печени также аналогична и включает хирургическое лечение или различные методы
абляции. Все чаще выполняется резекция единичных метастазов в легких, иногда в со-
четании с удалением метастазов в печени. Роль дополнительной системной XT после
резекции печени не определена. В ряде случаев проводят регионарную внутриарте-
риальную XT фторурацилом с фолинатом кальция, однако достоверного увеличения
медианы выживаемости не выявлено.
Несмотря на отсутствие в настоящее время четко доказанных преимуществ эффек-
тивности новых лекарственных агентов или комбинаций перед 5-ФУ, они все чаще ис-
пользуются в нео- и/или адъювантной терапии рака прямой кишки.
Схемы лечения II-111 стадии
Один из возможных вариантов лечения П-Ш стадии заболевания — проведение
4 курсов неоадъювантной XT по схеме XELOX, затем лучевая терапия на фоне капеци-
табина (Кселода) как радиосенсибилизатора (1650 мг/м2 в сутки ежедневно в течение
всего курса лучевой терапии или 1800 мг/м2 в сутки с 1 -го по 5-й день каждой недели),
выполнение оперативного вмешательства, после которого назначается Кселода еще в
течение 12 нед. в адъювантном режиме.
Варианты послеоперационного лечения при II-III стадии рака прямой кишки (если
неоадъювантная химиолучевая терапия не проводилась):
1. 5-ФУ — 500 мг/м2 в/в струйно ежедневно в 1-5-й и 36-40-й дни, затем
Лучевая терапия 45 Гр (фракции по 1,8 Гр) в течение 5 нед. с дополнительным ло-
кальным облучением ложа опухоли в дозе 5,4-9,0 Гр начиная с 64-го дня на фоне дли-
168 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
тельной в/в инфузии 5-ФУ 225 мг/м2 в день одновременно с лучевой терапией в 64-
105-й день, затем
5-ФУ — 500 мг/м2 в/в струйно ежедневно в 134-138-й и 169-173-й дни.
2. 5-ФУ — 500 мг/м2 3 дня в 1-ю и 5-ю недели с одновременной лучевой терапией в
дозе 50-54 Гр.
3. Один цикл XT (Лейковорин 200 мг/м2 2-часовая инфузия, после которой 5-ФУ
450 мг/м2 в/в струйно 1 раз в неделю в течение 4 нед.), затем облучение всего
малого таза в СОД 45 Гр и дополнительно ложа опухоли в РОД 5 Гр на фоне 5-ФУ
500 мг/м2 в/в струйно в течение 3 первых и 3 последних дней лучевой терапии,
затем продолжается XT комбинацией 5-ФУ/ЛВ суммарно до 6 курсов или до не-
приемлемой токсичности.
9.7.4. Анальный рак
Л. В. Манзюк
Анальный рак составляет 1-3% всех новообразований толстой кишки и чаще встре-
чается у женщин. В последние годы растет заболеваемость у мужчин, особенно у го-
мосексуалистов. По гистологическому строению это преимущественно ПКР, реже
встречается клоакогенный (базалиоидный переходноклеточный) рак, очень редко —
аденокарцинома, исходящая из анальных желез. Две первые формы ассоциируются с
папилломавирусной инфекцией.
Группировка анального рака по стадиям приведена в табл. 9.14.
Таблица 9.14. Группировка анального рака по стадиям
Стадия TNM
0 Tis NO МО
1 Т1 NO МО
II Т2-3 NO МО
IIIA Т1-3 N1 МО
IIIB Т4 или любая N2-3 МО
Стадия IV Тлюбая Nлюбaя М1
Анальный рак излечим, его биологической особенностью является чувствитель-
ность к химио- и лучевой терапии. 5-летняя выживаемость больных с I-II-III стадией
колеблется от 57 до 67 %. К факторам неблагоприятного прогноза относятся метаста-
зы в лимфоузлах, изъязвление кожи и мужской пол. Аденокарцинома анального кана-
ла лечится по тем же схемам, что и аденокарцинома прямой кишки.
Современные сфинктеросохраняющие подходы ограничивают хирургическое вме-
шательство эксцизией малых опухолей перианальной области или области края ану-
са, не вовлекающих в процесс сфинктер. Ранее широко применявшаяся брюшно-про-
межностная резекция используется для остаточных и рецидивных опухолей после
химио- и/или лучевого лечения.
XT в сочетании с лучевой терапией позволяет излечить 75-80% больных анальным
раком.
При местном процессе проводится лучевая терапия в объеме 45 Гр (25 фракций в те-
чение 5 нед.) с одновременной инфузией фторурацила в дозе 1000 мг/м2/сут в 1-4-й и
29-32-й дни и введением 10 мг/м2 митомицина в/в в 1-й и 29-й дни.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 169
Химиотерапия солидных опухолей
вяявойвяяяявваяяаяйдаяйвяягаяийвйвйянввя^^ “«? ч »* »
Если после лечения имеется морфологически доказанная остаточная опу-
холь, дополнительно дается 9 Гр (в виде 5 фракций) с одновременным введени-
ем 1 000 мг/м2 фторурацила в 1 -4-й день и 100 мг/м2 цисплатина в/в в течение 2 дней.
У больных с остаточной опухолью после наружного облучения может быть эффектив-
на внутритканевая лучевая терапия (,921г).
В случае повторно морфологически подтвержденного наличия остаточной опухоли
выполняется брюшно-промежностная резекция.
Больным с IV стадией заболевания проводится комбинированная XT на основе пре-
паратов платины или монохимиотерапия при опухоли, чувствительной к 5-ФУ, мито-
мицину, иринотекану, блеомицину, метотрексату, доксорубицину. Однако полные ре-
миссии в этом случае единичны, а длительность их короткая.
Режимы терапии
Митомицин — 10 мг/м2 в/в 2 раза каждые 4 нед., затем каждые 10 нед.
Доксорубицин — 30 мг/м2 в/в 2 раза каждые 4 нед., затем каждые 5 нед.
Цисплатин — 60 мг/м2 в/в 2 раза каждые 4 нед., затем каждые 5 нед.
9.7.5. Рак поджелудочной железы
AM Гарин, И. С. Базин
Рак поджелудочной железы (РПЖ) — самая сложная область клинической онкологии.
Долго живущие больные с этим диагнозом описываются как исключение.
Мировая онкологическая статистика, представленная МАИР за 2002 г., свидетель-
ствует о том, что РПЖ по заболеваемости занимает 13-е место для обоих полов, а по
смертности — 8-е. В абсолютных цифрах диагностировано 232 306 вновь заболев-
ших, умерло 227 023 пациента. Соотношение смертности к заболеваемости близ-
ко к единице — 0,98. Такой грозный показатель не приводится ни для какой другой
формы опухоли. Практически показатели заболеваемости и смертности одинаковы.
В России заболеваемость РПЖ составляет 9 случаев на 100 000 населения (10-е
место в структуре злокачественных новообразований). В 2006 г. вновь диагности-
ровано 13 223 пациента с РПЖ, умерло 14 116 больных (6-е место по уровню смер-
тности). С 1990 г. заболеваемость РПЖ у мужчин увеличилась на 7,4%, у женщин —
на 4,9 %.
Самая частая злокачественная опухоль поджелудочной железы — протоковая аде-
нокарцинома (80% больных).
Стадирование рака поджелудочной железы приведено в табл. 9.15.
Таблица 9.15. Группировка рака поджелудочной железы по стадиям
Стадия TNM
IA Т1 (опухоль < 2 см, ограничена поджелудочной железой) NO МО
IB Т2 (опухоль > 2 см, ограничена поджелудочной железой) NO МО
ПА ТЗ (опухоль выходит за пределы поджелудочной железы, однако чревный ствол и верхняя брыжеечная артерия не поражены) NO МО
IIB Т1-3 N1 МО
III Т4 (инвазия чревного ствола и верхней брыжеечной артерии) NO МО
IV Т1-4 NO-1 М1
170 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
Панкреатический рак метастазирует не только по лимфатическим сосудам, но и че-
рез систему воротной вены, а кроме того, периневрально. Отдаленные метастазы опи-
сываются в печени, легких, по брюшине у 60% больных во время первичной диагно-
стики.
Только радикальная гастропанкреатодуоденальная резекция (ГПДР) имеет потенци-
альную возможность излечения больных РПЖ. Однако опухоли у 85-95% больных с
впервые установленным диагнозом РПЖ нерезектабельны либо из-за местного рас-
пространения, либо в связи с отдаленным метастазированием. В США среди больных
с 1996 по 2002 г. лишь у 8% был локальный рак, у 31 % — регионарное распростране-
ние и у 61 % — метастатический РПЖ.
Выживают пациенты, у которых по краям резекции нет опухолевых клеток, нет ин-
вазии магистральных сосудов (этот тип операций обозначают символом R0). В об-
зоре публикаций 1990-х годов (13 сообщений) подводятся итоги выполнения ГПДР
у 1238 больных. Средняя их выживаемость составила 15,5 мес., 5-летняя выживае-
мость — 11,1 %.
Споры по поводу роли хирургии при РПЖ продолжаются в течение многих лет. Есть
крайние точки зрения: полный отказ от радикальных операций и требование расши-
рения объемов и показаний к хирургическому лечению.
Консерваторы считают, что после паллиативных вмешательств больные живут ком-
фортабельнее и дольше, чем после радикальных резекций, при которых высока по-
слеоперационная летальность и неудовлетворительны отдаленные результаты.
Сторонники агрессивных подходов исходят из того, что послеоперационная леталь-
ность благодаря развитию анестезиологии и реанимации сократилась, а шанс выжить
имеют лишь радикально прооперированные больные.
После радикальных операций по поводу РПЖ у 50-80% пациентов возникают ме-
тастазы. Отсюда понятно стремление онкологов с помощью химиолучевого лечения
снизить частоту рецидивов болезни и повысить показатели общей выживаемости.
Международное исследование CONCO-OOl (2008), проведенное у 354 опериро-
ванных по поводу локального РПЖ больных, показало, что гемцитабин в адъювантном
режиме приводит к медиане выживаемости 22,8 мес., в группе наблюдения этот по-
казатель равен 20,2 мес. (р = 0,005). Безрецидивная выживаемость у получавших гем-
цитабин составила 13,4 мес., в контрольной группе — 6,9 мес. (р < 0,001). При стра-
тификации больных по типу операции на КО и R1 безрецидивная выживаемость у
получавших адъювантно гемцитабин составила 15,8 и 13,1 мес., а в группах наблюде-
ния — 7,3 и 5,5 мес. соответственно.
В выводах Международной конференции по гастроинтестинальному раку (Бар-
селона, 2007 г.) утверждается, что адъювантная терапия после ГПДР требуется 80%
больных РПЖ.
В настоящее время проводятся исследования, оценивающие значение комбинаций в
сравнении с монотерапией при адъювантном лечении РПЖ.
Тема неоадъювантной терапии РПЖ разрабатывалась в раковом центре MD Ander-
son в Хьюстоне. В качестве предоперационного лечения применялась комбинация
фторурацила, доцетаксела и гемцитабина + облучение (30 и 50 Гр). Медиана выжи-
ваемости при неоадъювантном химиолучевом лечении и ГПДР — 25 мес., в хирурги-
ческом контроле — 17 мес. (Pisters, 1998). Новый режим, который сейчас изучается,
предусматривает 5 циклов гемцитабина и цисплатина 1 раз в 2 нед., затем в течение
3 нед. облучение (30 Гр в виде 3 фракций) и еще 4 дозы гемцитабина. Операция вы-
полняется на 16-й неделе. Медиана выживаемости у 86 больных составила 30 мес.
(Wolff etal., 2002).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 171
Химиотерапия солидных опухолей
Ведутся работы по применению химиолучевой терапии и таргетных препаратов не-
оадъювантно. РПЖ — химиорезистентная опухоль; из-за скоротечности и фатально-
сти заболевания главные критерии оценки терапевтических воздействий — медиана
общей выживаемости, 1- и 2-летняя выживаемость.
В настоящее время нет единого стандарта лекарственной терапии нерезектабель-
ного РПЖ. Большинство исследователей отмечают слабую эффективность химиоте-
рапии РПЖ. Тем не менее известны работы, целью которых было сравнение эффек-
тивности энергичной симптоматической терапии и XT. Показано, что получавшие лишь
симптоматическое лечение прожили в среднем 2,5-3 мес. В то же время в группе
больных, подвергнутых лечению противоопухолевыми препаратами, медиана выжи-
ваемости составила 6 мес. При этом в последней группе качество жизни пациентов
было лучше.
Инфузионное введение фторурацила с лейковорином, или применение фторпири-
мидинов (капецитабин, УФТ, S-1), или таких препаратов, как митомицин, могут привести
к частичному эффекту до 8% при медиане выживаемости 5-6 мес.
С 1996 г. основным препаратом для лечения РПЖ стал гемцитабин. По данным кон-
ца XX в„ гемцитабин вызвал уменьшение опухоли поджелудочной железы или ее
метастазов всего в 12% случаев, но у многих больных отмечался выраженный сим-
птоматический эффект (до 30%), обозначаемый как клиническое улучшение. Была
разработана система оценки эффекта при РПЖ. Критериями улучшения считаются
ослабление болевого синдрома на 50%, снижение потребления анальгетиков и на-
ркотиков на 50%, изменение статуса Карновского в лучшую сторону на 20% и поло-
жительная динамика массы тела. В сравнительных исследованиях гемцитабин оказал-
ся эффективнее капельно вводимого фторурацила и по проценту общего эффекта, и
по контролю симптомов, и по клиническому улучшению, и по медиане выживаемости
(после применения гемцитабина 1 год выжило 18% пациентов, после назначения фто-
рурацила — 2 %).
Кроме стандартных доз гемцитабина (1000-1500 мг/м2 за 30 мин в 1, 8 и 15-й дни)
изучен еще один вариант применения препарата в режиме фиксированной дозиров-
ки введения (FDR) 10 мг/м2/мин. В эксперименте было показано, что такое дозирование
позволяет увеличить внутриклеточный уровень фосфорилированных метаболитов
гемцитабина (трифосфат гемцитабина) — основного ингибитора рибонуклеотидре-
дуктазы.
Прямое сравнение гемцитабина в стандартных и FDR-дозах обнаружило при РПЖ
некоторое увеличение медианы выживаемости — с 5 до 8 мес. Но это увеличение
обозначено исследователями как тенденция из-за статистической недостоверности
(р = 0,13). Не удалось подтвердить достоверность продления медианы при использо-
вании гемцитабина в режиме FDRb комбинациях с другими препаратами.
В связи с ярким паллиативным и симптоматическим эффектом гемцитабина разра-
ботаны его комбинации почти со всеми химиопрепаратами, к которым выявлена чув-
ствительность в режиме монотерапии при РПЖ, а также с зарегистрированными для
лечения солидных опухолей таргетными препаратами.
Комбинация GF включает гемцитабин (1000 мг/м2 в 1, 8 и 15-й дни) и фторурацил
(струйно 400 мг/м2 в 1-й и 2-й дни или капельно 600 мг/м2 в течение 22 ч в 1-й и 2-й
дни). Эффект при этом режиме достигается в 19% случаев, но клиническое улучшение
регистрируется у 59% пациентов, 1 год выживает 38% больных. При сравнении с мо-
нотерапией режим повышает медиану выживаемости с 5,4 до 6,7 мес.
Комбинация GemCap состоит из гемцитабина (1000 мг/м2 в 1,8 и 15-й дни) и капе-
цитабина (1600 мг/м2 ежедневно в течение 3 нед.), циклы повторяют каждые 4 нед. Эф-
фект отмечается в 45,4% случаев, клиническое улучшение — в 63,6%. В рандомизиро-
172 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
ванном исследовании медиана выживаемости после комбинаций составила 8,4 мес.,
после монотерапии — 7,2 мес.
Режим GP: гемцитабин 1000 мг/м2 и цисплатин 25 мг/м2. Оба препарата вводят в 1,
8 и 15-й дни каждые 28 дней. Результаты у ранее не леченных и леченных больных
одинаковы, объективный эффект в 24-30% случаев. В рандомизированном исследо-
вании медиана выживаемости при комбинации составила 7,5 мес., при монотерапии —
5 мес.
Комбинация GM включает гемцитабин (1000 мг/м2 в 1, 8 и 15-й дни) и митомицин
(5 мг/м2 в 1 -й день). Циклы повторяют каждые 4 нед., эффект фиксируется в 28,5 % слу-
чаев, клиническое улучшение — в 46,6 %.
Режим DG состоит из доцетаксела (35 мг/м2) и гемцитабина (1000 мг/м2), оба препа-
рата применяют в 1, 8 и 15-й дни 28-дневного цикла. Эффект отмечается у 20 % боль-
ных, стабилизация — у 53 %.
Режим GemOx: гемцитабин 1000 мг/м2 в 1-й и 8-й дни и оксалиплатин 85 мг/м2 в 1-й
и 15-й дни. Эффект наблюдается у ’/ больных, клиническоеулучшение — у 58%, меди-
ана выживаемости составляет 10,3 мес. В рандомизированном исследовании медиана
выживаемости при комбинации равнялась 9 мес., при монотерапии — 5 мес.
4-компонентная комбинация FOLFIRINOX состоит из оксалиплатина (85 мг/м2 в 1-й
день), иринотекана (180 мг/м2 в 1-й день), лейковорина (400 мг/м2 в 1-й день) и фтору-
рацила (400 мг/м2 струйно в 1-й день, 2,6 г/м2 капельно в течение 96 ч в 1-4-й день).
Эффект регистрируется в 33,3 % случаев, стабилизация — в 50 %; 1 год выживает 38,8 %
больных, медиана выживаемости составляет 9,5 мес.
При местнораспространенном РПЖ используют в комплексе XT и облучение.
В рандомизированных исследованиях 1960-х годов сравнивался эффект облучения
40 Гр и XT (фторурацил) с облучением. Медиана общей выживаемости составила со-
ответственно 6,3 и 10,4 мес., 1-летняя выживаемость — 6 и 25%. В 1980-е годы доза
лучевой терапии была увеличена до 60 Гр, при этом медиана выживаемости составила
5,3 и 11,4 мес. соответственно.
Активно комбинируют облучение с режимом GP (гемцитабин + цисплатин). При этом
50% больных выживают более года,у 60% отмечается клиническоеулучшение, объ-
ективный эффект регистрируется в 30% случаев.
Комбинация доцетаксела (65 мг/м2 в 1, 15 и 29-й дни) и гемцитабина (400 мг/м2 в 1,
15 и 29-й дни) с облучением (50,4 Гр) при нерезектабельном раке приводит к эффек-
ту в 67 % случаев, 30% пациентов удается после такой терапии выполнить радикальную
операцию.
Исследование GERGOR (Хьюстон) показало, что при местнораспространенном РПЖ
параллельное облучение и XT хуже по результатам, чем последовательное примене-
ние XT, а затем — облучения. Медиана выживаемости при параллельном назначении
двух методов терапии равнялась 8,5 мес., при последовательном (сначала XT, а затем
лучевая терапия) — 11,9 мес.
Существует представление, что РПЖ относится к гормонозависимым опухолям.
В пользу этого положения свидетельствуют половые различия в частоте РПЖ (чаще у
мужчин), а также обнаружение в опухолевых клетках рецепторов стероидных гормо-
нов. Правда, была замечена низкая способность связывания рецепторов с гормонами
в культуре клеток человеческого РПЖ.
У пожилых женщин с РПЖ отмечен эффект тамоксифена (медиана выживаемости
7 мес.). Регистрируется снижение маркера СА 19-9 после применения этого антиэ-
строгена; в ряде исследований утверждается, что 1-летняя выживаемость в этой груп-
пе может достигать 25 %.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 173
Химиотерапия солидных опухолей
Октреотид (100-200 мг/сут п/к) приводит к стабилизации опухолевого процесса в
27% случаев, 9% леченных октреотидом переживают 1 год. Депо-форма октреоти-
да (Сандостатин ЛАР) можетусиливать эффект гемцитабина. Препарат применяется по
160 мг в/м каждые 2 нед., всего 4 инъекции. РПЖ характеризуется генетическими му-
тациями KRAS, инактивацией супрессорных генов р53, DPC4, р16, BRCA2, мутациями
генов, ответственных за исправление дефектов ДНК, гиперэкспрессией EGFR и VEGFR.
В комбинационных режимах на основе гемцитабина оценивается роль бевацизума-
ба, эрлотиниба и цетуксимаба как при терапии метастатического РПЖ, так и в адъюван-
тных режимах после операции. Пока достоверные результаты достигнуты при срав-
нении эффекта комбинации эрлотиниба и гемцитабина и монотерапии гемцитабином
при метастатическом РПЖ. Выживаемость 1 год составляет 24 и 17 % соответственно.
Эрлотиниб зарегистрирован для терапии метастатического РПЖ.
Стандартным препаратом, на основе которого разрабатываются химиотерапевтиче-
ские режимы для РПЖ, является гемцитабин. Будучи малоактивным в режиме моноте-
рапии (8-12%), препарат характеризуется выраженным симптоматическим эффектом
до 30%, а в комбинациях с фторурацилом или оксалиплатином, цисплатином, или ми-
томицином, или доцетакселом приводит к клиническому улучшению в 50-60% случа-
ев и медиане выживаемости 10-11 мес. у ответивших на терапию.
Неоадъювантная XT гемцитабином и капецитабином (2 курса) выполняется больным
с ПА стадией РПЖ как тест на операбельность. Если больные прогрессируют, операция
не проводится (Tempero 2010). Гемцитабин в адъювантном режиме после ГПДР уве-
личивает медиану безрецидивной выживаемости с 6,9 до 13,4 мес. В адъювантной XT
гемцитабином нуждается 80% оперированных больных. Надежды контроля РПЖ свя-
зывают с дальнейшими разработками молекулярной биологии.
Режимы терапии
Адъювантная терапия
Гемцитабин — 1000 мг/м2 в/в в 1,8 и 15-й дни; повторяют каждые 28 дней, всего 6 ци-
клов.
Местнораспространенный процесс
Фторурацил — 500 мг/м2 в/в в 1-3-й и 29-31-й дни, затем еженедельно начиная с
21-го дня.
Лучевая терапия в СОД 4000 Гр начинается одновременно и проводится одномомен-
тно с XT.
Гемцитабин — 1000 мг/м2 в/в в 1,8 и 15-й дни. Лучевая терапия в СОД 5040 Гр, 1,8Гр/сут.
Химио- и лучевая терапия начинаются одновременно и проводятся одномоментно.
После окончания химиолучевой терапии проводят 3 цикла гемцитабина 1000 мг/м2
в/в в 1,8 и 15-й дни каждые 28 дней.
Метастатический рак поджелудочной железы
GEM-CAP
Гемцитабин — 1000 мг/м2 в/в в 1-й и 8-й дни.
Капецитабин — 650 мг/м2 внутрь 2 раза в сутки в 1-14-й день.
Повторение цикла каждые 21 день.
или
Гемцитабин — 1000 мг/м2 в/в в 1,8 и 15-й дни.
Капецитабин — 880 мг/м2 внутрь 2 раза в сутки в 1-21-й день.
Повторение цикла каждые 28 дней.
174 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
GEM-OX
Гемцитабин — 1000 мг/м2 в/в в 1-й и 8-й дни.
Оксалиплатин — 85 мг/м2 в/в в 1-й и 15-й дни.
Повторение цикла каждые 3 нед.
GP
Гемцитабин — 1000 мг/м2 в/в в 1,8 и 15-й дни.
Цисплатин — 25 мг/м2 в/в в 1,8 и 15-й дни.
Повторение цикла каждые 28 дней.
FOLFIRINOX
Оксалиплатин — 85 мг/м2 в/в в 1-й день.
Иринотекан — 180 мг/м2 в/в в 1-й день.
Лейковорин — 400 мг/м2 в/в в 1-й день.
Фторурацил — 400 мг/м2 в/в струйно в 1-й день + 2600 мг/м2 в/в 96-часовая инфузия
в 1-4-й день.
Повторение цикла каждые 3 нед.
Гемцитабин+эрлотиниб
Гемцитабин 1000 мг/м2 в/в еженедельно 7 нед., затем после перерыва (1 нед.) ежене-
дельно 3 нед.
Эрлотиниб 1000 мг/м2 перорально ежедневно.
Повторение 3-недельных циклов каждые 28 дней.
9.7.6. Рак печени
77. В. Манзюк
Первичные злокачественные опухоли печени составляют менее 2% всех злокачест-
венных новообразований. В 2006 г. в России было выявлено 6183 больных. Это одна из
основных причин смертности от рака в некоторых регионах Африки и Азии.
До 90% всех злокачественных опухолей печени приходятся на гепатоцеллюлярный
рак (ГЦР), около 7% — нахолангиоцеллюлярный рак, крайне редко встречается сме-
шанный рак и гепатобластома. Также редки неэпителиальные опухоли печени — анги-
осаркома и другие саркомы. ГЦР чаще заболевают мужчины в возрасте 60 лет и стар-
ше.
9.7.6Л. Гепатоцеллюлярный рак
Основной причиной ГЦР являются вирусные гепатиты В и С. Важную роль в развитии
ГЦР играет алкогольный цирроз печени, который имеется у 75% больных. В Африке
высокая заболеваемость ГЦР связана с зараженностью продуктов афлатоксином, про-
дуцируемым грибами Aspergillus flauus и Aspergillus parasiticus. Анаболические сте-
роиды также могут способствовать развитию ГЦР, а отмена гормонов в ряде случаев
ведет к регрессии опухоли. Более чему 70 % больных ГЦР повышен уровень АФП. Уль-
тразвуковая томография позволяет выявить опухоли до 1 см в диаметре. Для подтвер-
ждения диагноза необходима биопсия.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 175
Химиотерапия солидных опухолей
Классификация первичного рака печени по системе TNM (6-е издание,
2002)
Первичная опухоль (Т)
Т1 — солитарная опухоль без инвазии сосудов.
Т2 — солитарная опухоль (< 5 см) с инвазией сосудов или несколько опухолей менее
5 см каждая.
ТЗ — множественные опухоли более 5 см или опухоль с инвазией основных ветвей во-
ротной либо печеночной вены.
Т4 — опухоль с инвазией прилежащих органов, кроме желчного пузыря, либо прора-
стающая висцеральную брюшину.
Регионарные лимфоузлы (N)
NX — недостаточно данных для оценки регионарных лимфоузлов.
NO ~ метастазов в регионарных лимфоузлах нет.
N1 — метастазы в регионарных лимфоузлах.
Отдаленные метастазы (М)
MX — недостаточно данных для выявления отдаленных метастазов.
МО — отдаленных метастазов нет.
Ml — имеются отдаленные метастазы.
В табл. 9.16. приводится группировка рака печени по стадиям.
Таблица 9.16. Группировка рака печени по стадиям
I Стадия TNM
1 Т1 NO МО
II Т2 NO МО
IIIA ТЗ NO МО
IIIB Т4 NO МО
IIIC Тлюбая N1 МО
IV Тлюбая Nnio6afl М1
Для выбора лечебной тактики нередко используется клиническая классификация
ГЦР, оценивающая прогноз.
Стадия А (ранняя) — от 1 до 3 узлов в печени менее 3 см в диаметре. Симптомов бо-
лезни нет.
Стадия В (промежуточная) — в печени множественные узлы. Состояние больного хо-
рошее (ECOG 0 баллов).
Стадия С — множественные узлы в печени, опухоль распространяется за ее преде-
лы, общее состояние пациента относительно удовлетворительное (ECOG 1-2 балла).
Стадия D — терминальная, возможна лишь симптоматическая терапия.
Больные со стадией А потенциально могут подвергаться резекции, их 25-30%.
Цирроз печени часто лимитирует выполнение радикальных операций. Операционная
летальность высока — от 10 до 30%. Длительная выживаемость радикально опериро-
ванных больных, по данным различных клиник, колеблется от 15 до 30%.
Больным со стадией В шанс на выздоровление дает пересадка донорской печени.
Выживаемость после этих операций такая же, как после радикальной резекции. Реци-
дивы болезни возможны в печени, лимфоузлах, легких, костях.
176 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Злокачественные опухоли желудочно-кишечного тракта
Больным со стадией С проводится паллиативное лечение. Чрескожные инъекции
этанола в опухоль могут контролировать процессу некоторых больных.
Применение лучевой терапии крайне ограничено из-за низкой толерантности пе-
чени к этому воздействию. При маленьких поражениях применяется радиочастотная
абляция, выполняемая чрескожно. При узлах более 3 см используется криотерапия,
но она требует лапаротомии.
Химиотерапия
Эффективность различных цитостатиков (доксорубицин, фторурацил, цисплатин,
этопозид, митоксантрон) в режиме системной монохимиотерапии в пределах 15-
20%. ПХТ не улучшает результатов лечения. Некоторые обнадеживающие результаты
получены при применении паклитаксела, гемцитабина (Гемзар), иринотекана (Кампто),
оксалиплатина, а также ИФН-а.
С конца 70-х годов XX в. используется метод регионарного введения цитостатиков
внутриартериально в печеночную артерию и ее ветви либо через пупочную вену. Чаще
всего применяют доксорубицин, фторурацил, митомицин. Регионарная XT дает непло-
хие непосредственные результаты (30-40%), однако не улучшает отдаленные резуль-
таты. Используется метод эмболизации и химиоэмболизации (с доксорубицином или
эпирубицином), который может обеспечить клиническое улучшение у 40% больных с
медианой жизни около 1 года. Химиоэмболизация проводится также с фторурацилом
и цисплатином, эффективность ее выше, чем эмболизации. Однако все перечислен-
ные методы консервативного лечения — паллиативные. Особый интерес вызывают
результаты применения таргетного препарата сорафениба (ингибитор тирозинкиназ,
оказывает антипролиферативное и антиангиогенное действие). В рандомизированном
исследовании показано удвоение времени до прогрессирования и увеличение общей
выживаемости на 44% по сравнению с плацебо у больных с нерезектабельной фор-
мой заболевания при использовании сорафениба. Начато изучение роли сорафениба
в адъювантном лечении ГЦР печени.
Режимы терапии
Сорафениб (Нексавар) — 400 мг/м2 внутрь 2 раза в сутки ежедневно длительно,
до прогрессирования болезни или неприемлемой токсичности.
Доксорубицин — 40 мг/м2 в/в 1 раз в 3 нед.
9.7.Б.2. Холангиоцеллюлярный рак печени
Холангиоцеллюлярный рак печени чаще встречается у мужчин пожилого и старческо-
го возраста. Нередко сочетается с желчнокаменной болезнью, неспецифическим яз-
венным колитом, первичным склерозирующим холангитом и врожденными аномали-
ями панкреатикобилиарной системы. Кроме того, в развитии этой опухоли играет роль
хроническая гельминтная инвазия, воздействие канцерогенов (торотраст, радон, ас-
бест) и наследственный фактор. По гистологическому строению холангиоцеллюряр-
ный рак в подавляющем большинстве (85-90%) представлен аденокарциномой. ПКР и
смешанный железисто-плоскоклеточный рак редки.
Радикальным методом лечения является только панкреатодуоденальная резек-
ция. Она выполнима у 2/3 больных. Послеоперационная летальность — до 10% слу-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 177
Химиотерапия солидных опухолей
чаев, 5-летняя выживаемость — до 20%. Крайне редко выполняется транспланта-
ция печени.
Роль лучевой терапии при опухоли этого типа крайне ограничена. В ряде случаев она
применяется адъювантно после радикальной операции, иногда — с паллиативной це-
лью.
Химиотерапия
Изучались многие цитостатики как в моно-, так и в режиме ПХТ. Наибольшее приме-
нение нашел фторурацил. В последние годы выявлена активность гемцитабина и капе-
цитабина, а также комбинации фторурацила с гемцитабином.
Режимы терапии
1. Фторурацил — 500 мг/м2 в/в струйно в 1 — 5-й день каждые 4 нед. или 500 мг/м2
еженедельно, длительно.
2. Капецитабин — 2500 мг/м2 внутрь ежедневно в 2 приема в 1—14-й день.
Повторение цикла каждые 3 нед.
3. Гемцитабин (Гемзар) — 1000 мг/м2 в/в капельно в 1,8 и 15-й дни.
Фторурацил — 600 мг/м2 в/в в 1,8 и 15-й дни.
Фолинат кальция (Лейковорин) — 20 мг/м2 в/в в 1, 8 и 15-й дни.
Повторение цикла каждые 4 нед.
4. Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1-й и 8-й дни.
Капецитабин — 650 мг/м2 внутрь 2 раза в сутки в 1-14-й день.
Повторение цикла каждые 3 нед.
5. Гемцитабин (Гемзар) — 1000 мг/м2.
Оксалиплатин — 80 мг/м2 в/в.
Повторение цикла каждые 2 нед.
9.7.7. Рак желчного пузыря
77. В. Манзюк
В 2006 г. в России зарегистрировано 3065 случаев рака желчного пузыря. Эта опухоль
чаще встречается у пожилых женщин в Центральной и Восточной Европе, в Израиле, а
также у американских индейцев. К предрасполагающим факторам относятся желчно-
каменная болезнь, аномалии строения желчных протоков, ожирение. По гистологи-
ческому строению рак желчного пузыря в 90% случаев представлен аденокарцино-
мой. ПКР и железисто-плоскоклеточный рак редки. Рак желчного пузыря относится к
быстро прогрессирующим опухолям, часто врастает в соседние органы и дает мета-
стазы в регионарных лимфоузлах, печени и т.д. Общая 5-летняя выживаемость боль-
ных этим видом рака низкая — около 5 %, а медиана выживаемости колеблется от 3 до
8 мес. Однако, если первичная опухоль не выходит за пределы слизистой оболочки и
подслизистой основы и больному выполняется радикальная операция в объеме рас-
ширенной холецистэктомии, 5-летняя выживаемость составляет 64%, а 44% пациен-
тов живут 10 лети более. При распространенном процессе проводится паллиативное
медикаментозное лечение. Опухоль чувствительна к фторурацилу, капецитабину, гем-
цитабину.
178 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неэпителиальные злокачественные опухоли желудочно-кишечного тракта
Режимы терапии
1. Фторурацил — 500 мг/м2 в/в струйно в 1-5-й день каждые 4 нед. или 500-600 мг/м2
еженедельно в течение 5-6 нед.
2. Гемцитабин (Гемзар) — 1000 мг/м2 в/в 30 мин в 1,8 и 15-й дни.
Фторурацил — 600 мг/м2 в/в струйно после фолината кальция (Лейковорин) в 1, 8 и
15-й дни.
Фолинат кальция (Лейковорин) — 25 мг/м2 в/в струйно в 1,8 и 15-й дни.
Повторение цикла через 2 нед.
3. Оксалиплатин — 100 мг/м2 в/в 2-часовая инфузия во 2-й день.
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1-й день.
Повторение цикла через 2 нед.
4. Митомицин — 8 мг/м2 в/в в 1-й день каждые 4 нед.
Капецитабин — 1000 мг/м2 внутрь в 2 приема ежедневно в 1-14-й день.
Повторение цикла каждые 4 нед.
5. Гемцитабин — 1000 мг/м2 в/в в 1-й и 8-й дни.
Цисплатин — 70 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21 день.
9.8. Неэпителиальные злокачественные опухоли
желудочно-кишечного тракта
И. В. Поддубная
Злокачественные новообразования ЖКТ неэпителиальной природы представляют со-
бой разнообразную и редко встречающуюся группу опухолей. С учетом гистогене-
за выделяют следующие виды злокачественных неэпителиальных опухолей: опухо-
ли кроветворной и лимфоидной ткани, опухоли мышечной ткани — лейомиосаркомы,
фиброзной ткани — фибросаркомы, жировой ткани — липосаркомы, нервной тка-
ни — неврилеммомы и нейрофибросаркомы, сосудистой ткани — гемангиосаркомы
и лимфангиосаркомы.
Основная часть злокачественных неэпителиальных опухолей представлена злока-
чественными НХЛ, которые составляют до 70% (60-82%, по данным разных авторов).
Значительно реже (около 5%) встречаются злокачественные новообразования мы-
шечной и сосудистой природы, еще реже развиваются фибросаркомы, липосаркомы,
неврогенные опухоли, лимфома Ходжкина.
Частота поражения различных отделов пищеварительного тракта первичными
саркомами неодинакова: НХЛ наиболее часто выявляются в желудке (53%), вовле-
чение кишечника отмечается реже (тонкая кишка — толстая кишка — 15% с
преимущественной локализацией в слепой и прямой кишке); саркомы другого ги-
стогенеза наиболее часто поражают тонкую кишку (60-65% всех злокачественных
опухолей этой локализации), в то время как в желудке и толстой кишке встречаются
лишь в 1-5% случаев.
Лечебная тактика при злокачественных неэпителиальных новообразованиях пище-
варительного тракта зависит от гистогенеза опухоли.
Основным методом лечения неэпителиальных опухолей ЖКТ, не относящихся к
лимфомам, считается хирургический. Эффективность традиционной XT низка: она ко-
леблется от 8 до 18% и выражается в основном в достижении кратковременных ча-
стичных ремиссий.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 179
Химиотерапия солидных опухолей
Особым видом неэпителиальных опухолей ЖКТявляются стромальные гастроинте-
стинальные опухоли (GIST), высокочувствительные к иматинибу.
Лечение первичных изолированных неходжкинских лимфом ЖКТ
Первичное изолированное поражение любого отдела пищеварительной трубки
должно быть подтверждено полным обследованием больного, а диагноз основывает-
ся на морфоиммунологическом исследовании биоптата опухоли.
В настоящее время установилось мнение о том, что лечение следует начинать с нео-
адъювантной XT: при агрессивных НХЛ — в режиме R-CHOP-21, R-CHOP-14, EPOCH-R;
при индолентных — R-COP, CVP, R-CVP, FND, хлорамбуцил (Лейкеран) ± ритуксимаб.
При эффективности 2-3 курсов, установленной при динамическом эндоскопическом
исследовании, лечение должно быть продолжено до достижения полной ремиссии;
при отсутствии эффекта выполняется оперативное вмешательство. После радикаль-
ной операции необходимо проведение адъювантной XT, вид которой определяется
морфоиммунологическим вариантом НХЛ: при агрессивных лимфомах (В-диффузная
крупноклеточная лимфома, лимфома зоны мантии) предпочтительно использование
режимов с антрациклинами (4 цикла при благоприятном прогнозе, 6 — в случае ин-
вазии всей стенки органа с прорастанием серозы и наличием вторичных изменений в
регионарных лимфоузлах); при индолентных НХЛ — 4-6 стандартных режимов СОР,
CVP с учетом факторов прогноза. Целесообразно добавление к любой из схем ПХТ
ритуксимаба (в первый день цикла в дозе 375 мг/м2).
Показанием к началу терапии с хирургического вмешательстваявляется наличиеугро-
жающих жизни осложнений (кровотечение, перфорация, кишечная непроходимость).
Лечение паллиативно оперированных больных, рецидивов и исходно III и IV стадий
НХЛ с вторичным поражением пищеварительной трубки осуществляется в соответст-
вии с общими принципами терапии этого типа опухолей, приведенными в разд. 10.5.
При первичной MALT (мукозо-ассоциированной) лимфоме желудка мелкоклеточ-
ного строения, часто сочетающейся с инфицированием Helicobacter pylori, эффек-
тивной противоопухолевой терапией в определенных случаях является антихелико-
бактерная антибиотикотерапия. Однако следует помнить, что, принимая решение об
использовании антихеликобактерной терапии, нужно быть уверенным в правильно-
сти определения морфологического варианта — мелкоклеточный подвариант MALT-
лимфомы и I стадии болезни. Эффект антихеликобактерной терапии реализуется
после эрадикации Н. pylori в среднем через 5,5 мес. и равен 87,5 %. Полученные пол-
ные ремиссии, подтвержденные всеми диагностическими методами, продолжитель-
ны — 51 мес. (медиана). Рецидивы редки (7,1 %) и возникают преимущественно в тече-
ние первого года. Признаки трансформации MALT в агрессивную лимфому требуют
сочетания противоопухолевой XT с антихеликобактерными антибиотиками: R-CHOP,
R-CHOP + VP-16 (EPOCH + R) в сочетании с одним 2-недельным курсом антихелико-
бактерной терапии (амоксицилин — по 1000 мг 2 раза в сутки, кларитромицин — по
500 мг 2 раза в сутки, омепразол — 20 мг/сут).
Первичное поражение ЖКТ при лимфоме Ходжкина встречается крайне редко
(< 1 %). Некоторые исследователи прибегают к применению облучения в послеопера-
ционный периоду радикально оперированных больных (дистанционная гамма-тера-
пия на весь живот в СОД 30-36 Гр), однако это не является альтернативой лекарствен-
ной терапии. Поражение ЖКТ при генерализованном процессе требует системного
медикаментозного лечения (см. разд. 10.4).
180 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Гастроинтестинальные стромальные опухоли
9.9. Гастроинтестинальные стромальные опухоли
И. В. Поддубная
Особый раздел неэпителиальных опухолей представляют GIST — недавно выделен-
ная самостоятельная нозологическая единица, имеющая индивидуальные гистоло-
гические, иммуногистохимические и молекулярно-генетические признаки. Впервые
термин «стромальная опухоль желудочно-кишечного тракта» использовали в 1983 г.
Mazur и Clark для описания новообразований, имеющих признаки гладкомышечной и
нейрогенной дифференцировки. Большая часть стромальных опухолей локализуется
в желудке и тонкой кишке. В настоящее время уточнен их гистогенез: вероятнее всего,
опухоль происходит из интерстициальных клеток Кахаля — регуляторов перисталь-
тики ЖКТ. Подавляющее большинство GIST (> 90%) является злокачественным. Под-
тверждением диагноза стромальных опухолей служит выявление в опухолевых клет-
ках экспрессии рецептора Kit (CD117) иммуногистохимическим методом.
В случаях первично операбельных GIST показано радикальное удаление опухоли.
Использование иматиниба с адъювантной целью (400 мг/сут внутрь в течение 1 года)
у больных с высоким риском раннего прогрессирования (большой размер опухоли
(> 5 см), высокая митотическая активность опухолевых клеток (> 5 митозов на 50 по-
лей зрения), локализация опухоли не в желудке, разрыв опухоли во время операции и
наличие неблагоприятных молекулярных прогностических факторов — мутация c-Kit
в 9 и 11 экзоне) увеличивает время до прогрессирования. По данным 3-летнего на-
блюдения, применение иматиниба в течение 12 мес. в 10 раз сократило число рециди-
вову больных с высоким риском метастазирования. Однако отсутствует уверенность в
том, что длительность адъювантной терапии должна быть ограничена 12 мес. исполь-
зования препарата. Этот вопрос и влияние адъювантной терапии иматинибом на об-
щую выживаемость изучаются.
Лечение иматинибом применяется при условно-операбельных опухолях с неоадъ-
ювантной целью и при диссеминированных либо неоперабельных GIST. Эффектив-
ность традиционных цитостатиков при этом крайне низкая. Сведения об увеличении
тирозинкиназной активности рецепторов Kit при GIST обусловили целесообразность
использования таргетного препарата иматиниб, оказывающего выраженное клиниче-
ское действие: мировой опыт применения иматиниба в терапии нерезектабельных и
метастатических форм GIST демонстрируетубедительноеувеличение общей выжива-
емости с 19 мес. в историческом контроле до 57 мес. (медиана) в эру иматиниба.
В случае неоперабельных и метастатических GIST показано применение иматини-
ба в дозе 400 мг/сут внутрь постоянно длительно. При развитии резистентности и при
наличии мутации онкогена c-Kit в экзоне 9 целесообразно увеличение дозы иматини-
ба до 800 мг/сут. Прекращение терапии даже через 5 лет использования значитель-
но ухудшает результаты и увеличивается риск быстрого прогрессирования. Перено-
симость терапии иматинибом удовлетворительная: токсичность III—IV степени редка
(< 5 %); наиболее часто развивается анорексия, мукозит отеки, утомляемость и анемия.
Целесообразно хирургическое удаление резидуальных опухолевых масс и мета-
стазов GIST, осуществляемое после достижения максимального клинического эффек-
та иматиниба, т.к. это достоверно увеличивает время до прогрессирования (64,4 us
9,7 % без хирургического вмешательства). При развитии рецидива болезни у пациен-
тов, ранее леченных иматинибом, данные о повторном его использовании (400 мг/сут)
в сочетании с малыми дозами доксорубицина (15-20 мг/м2 в неделю) оптимистичны.
При резистентности к иматинибу целесообразно увеличение дозы препарата до
800 мг/сут. Получены обнадеживающие результаты использования после прогресси-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 181
Химиотерапия солидных опухолей
яюмнямиваяяввжйиимвювйяяяявввямвваяв»^^ -ш- -
рования после прогрессирования на фоне лечения иматинибом во второй линии те-
рапии сунитиниба и нилотиниба (в монорежиме или в комбинации с иматинибом).
Сунитиниб (Сутент) применяют в дозе 50 мг/сут перорально ежедневно в течение
4 нед., затем следует 2-недельный перерыв с возобновлением терапии.
9.10. Рак молочной железы
Н. Ф. Орел
В развитых странах в структуре онкологической заболеваемости женщин РМЖ зани-
мает 1-е место (26% всех случаев рака). По данным ВОЗ, в мире ежегодно умирает от
РМЖ 590 000 женщин. В 2006 г. в России РМЖ составил 17,8% всех злокачествен-
ных опухолей у женщин. Показатель заболеваемости в 2006 г. составил 65,5 случая
на 100 000 населения, абсолютное число заболевших — 48 821. Смертность в 2006 г.
равнялась 29,5 случая на 100 000 женского населения, 1 -летняя летальность — 11,5%.
Мутация генов BRCA1 и BRCA2 увеличивает риск РМЖ.
Выбор метода лечения больных РМЖ зависит от стадии заболевания и от биологи-
ческой характеристики опухоли (степень злокачественности, рецепторный статус, эк-
спрессия HER2).
Ниже приводится классификация РМЖ по системе TNM и группировка по стадиям
(табл. 9.17).
Классификация рака молочной железы по системе TNM (6-е издание, 2002)
Первичная опухоль (Т)
ТХ — недостаточно данных для оценки первичной опухоли.
ТО — признаков первичной опухоли нет.
Tis — рак in situ.
Tis (DCIS) — протоковый рак in situ.
Tis (LCIS) — дольковый рак in situ.
Tis (Paget’s) — рак Педжета соска при отсутствии опухоли в паренхиме железы. При
этом рак Педжета в сочетании с опухолью паренхимы оценивают в соответствии с
размерами последней.
Т1 — опухоль не более 2 см в наибольшем измерении.
Tlmic — микроинвазивный рак размером 0,1 см и менее в наибольшем измерении.
Т1а — опухоль более 0,1 см, но не более 0,5 см.
Tib — опухоль более 0,5 см, но не более 1 см.
Tie — опухоль более 1 см, но не более 2 см.
Т2 — опухоль более 2 см, но не более 5 см в наибольшем измерении.
ТЗ — опухоль более 5 см в наибольшем измерении.
Т4 — опухоль любого размера с непосредственным распространением на а) грудную
стенку, Ь) кожу с учетом описанных ниже принципов:
Т4а — опухоль поражает грудную стенку;
Т4Ь — отек (включая симптом лимонной корки), изъязвление кожи или метастазы в
коже той же молочной железы;
Т4с — сочетание признаков Т4а и Т4Ь;
T4d — диффузный рак.
Примечание, втяжение кожи или соска, любые другие изменения, описанные для Т4Ь, могут наблюдаться при
опухолях, соответствующих T1-3; при этом стадия опухоли не меняется
182 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Рак молочной железы
Регионарные лимфоузлы (N)
NX — недостаточно данных для оценки регионарных лимфоузлов (например, они
были ранее удалены).
NO — регионарные лимфоузлы не пальпируются.
N1 — пальпируются подвижные подмышечные лимфоузлы с той же стороны.
N2 — пальпируются подмышечные лимфоузлы с той же стороны, спаянные друг с дру-
гом или окружающими тканями, либо имеются клинические признаки метастазов в
окологрудинных лимфоузлах той же стороны при отсутствии таких признаков для под-
мышечных лимфоузлов.
N2a — подмышечные лимфоузлы на стороне опухоли спаяны друг с другом или окру-
жающими тканями.
N2b — клинические признаки метастазов в окологрудинных лимфоузлах той же сто-
роны при отсутствии таких признаков для подмышечных лимфоузлов.
N3 — пальпируются подключичные лимфоузлы (лимфоузел) вне зависимости от со-
стояния подмышечных лимфоузлов, либо имеются клинические признаки метастазов
в окологрудинных и подмышечных лимфоузлах, либо имеются метастазы в надклю-
чичных лимфоузлах, необязательно в сочетании с метастазами в подмышечных или
окологрудинных лимфоузлах.
Отдаленные метастазы (М)
MX — недостаточно данных для оценки отдаленных метастазов.
МО — отдаленных метастазов нет.
М1 — отдаленные метастазы имеются.
Таблица 9.17. Группировка рака молочной железы по стадиям
(6-е издание, 2002)
Стадия TNM
О Tis NO МО_________________________________________________________
j_______Т1 NO МО (включая Т1 mic)___________________________________
ПА ТО N1 МО, Т1 N1 МО (включая T1mic), Т2 NO МО_____________________
НВ T2N1 МО, ТЗ NO МО________________________________________________
IIIA ТО N2 МО, Т1 N2 МО (включая Т1 mic), Т2 N2 МО, ТЗ N1 МО, ТЗ N2 МО
IIIB Т4 Nлюбaя МО________________________________________________
ШС Тлюбая N3 МО________________________________________________
IV Тлюбая Nmo6afl М1
Своеобразное течение РМЖ и биологические особенности этой опухоли обуслов-
ливают использование на определенных этапах заболевания всех существующих ме-
тодов лечения — хирургического, лучевого, гормонального, химиотерапевтического,
включая таргетную терапию; однако оптимальная последовательность их применения
до настоящего времени остается предметом активных клинических исследований.
По современным представлениям, для выбора оптимальной терапии больной РМЖ
необходимо иметь сведения о содержании в опухоли рецепторов стероидных гормо-
нов (РЭ, РП), экспрессии HER2 и степени злокачественности опухоли, определяемой
по степени ее дифференцировки.
С точки зрения биологических особенностей, определяющих возможности лече-
ния, все больные РМЖ делятся на три группы:
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 183
Химиотерапия солидных опухолей
зяя»а®8®®к®й8»яаяй5®йав®®йв«йя8®^^ * --
1) больные с гормоночувствительными опухолями, содержащими РЭ, РП; в лечении
этих больных, как правило, используется гормонотерапия;
2) больные, опухоль которых характеризуется гиперэкспрессией HER2; этим боль-
ным показан трастузумаб (Герцептин);
3) больные РМЖ, у которых опухоль не содержит ни рецепторов стероидных гор-
монов, ни HER2 (так называемые трижды негативные опухоли); при лечении та-
ких больных наиболее перспективна цитотоксическая XT.
Эти клинические группы соответствуют молекулярным подтипам РМЖ (люминаль-
ный А и Б НЕР2-позитивный, базальный нормоклеточный).
Гормонотерапия — один из важнейших методов лечения РМЖ. Около 60% боль-
ных РМЖ (а среди пожилых больных до 80%) имеют гормонозависимые опухоли, т.е.
опухоли, содержащие РЭ и РП.
Существует прямая корреляция между наличием и уровнем рецепторов стероид-
ных гормонов и эффективностью гормонотерапии. Эффективность лечения РЭ-по-
ложительных опухолей составляет 50-60%, тогда как при РЭ-отрицательных злока-
чественных опухолях молочной железы положительный эффект гормонотерапии
отмечается лишь у 5-10% больных. Около 30% больных с неизвестным рецепторным
статусом отвечают на гормональные воздействия.
К методам гормонотерапии относятся: хирургическая, лучевая и химическая (с по-
мощью суперагонистов LH-RH) кастрация у женщин с сохранной менструальной фун-
кцией, применение антиэстрогенов, ингибиторов ароматазы, прогестинов, андроге-
нов и их аналогов, кортикостероидов.
В принципе в основе всех методов гормонотерапии РМЖ лежит попытка воспрепят-
ствовать стимулирующему воздействию стероидных гормонов (эстрогенов) на клет-
ки опухоли.
У женщин в пременопаузе это может быть достигнуто путем овариэктомии или об-
лучения яичников либо с помощью применения суперагонистов LH-RH, под влиянием
которых функционируют яичники. Такая химическая кастрация носит обратимый ха-
рактер и достигается применением гозерелина (Золадекс) или лейпрорелина, бусе-
релина.
У женщин в менопаузе синтез эстрогенов происходит в основном в жировой тка-
ни путем реакции ароматизации андрогенов, продуцируемых корой надпочечников,
а следовательно, использование ингибиторов ароматазы снижает содержание эстро-
генов.
К селективным ингибиторам ароматазы относятся нестероидные — летрозол (Фе-
мара), анастрозол (Аримидекс) — и стероидный ингибитор экземестан (Аромазин).
Антиэстрогены блокируют РЭ в опухоли. В эту группу входят селективные модуля-
торы эстрогенных рецепторов (SERM) — тамоксифен и торемифен и селективный су-
прессор эстрогенных рецепторов (SERD) — фульвестрант (Фазлодекс). Эти препараты
активны как в пре-, так и в менопаузе.
Менее ясен механизм противоопухолевого действия прогестинов (мегестрол, ме-
дроксипрогестерон), которые также используются в гормонотерапии РМЖ.
РМЖ — опухоль, чувствительная к большинству современных противоопухолевых
цитотоксических препаратов, прежде всего к антрациклинам — доксорубицину, ко-
торый эффективен у 40% больных. Аналогичная эффективность и у эпирубицина, ми-
токсантрона, циклофосфамида (35%), метотрексата (35%), фторурацила и тегафура
(25 %). В 1990-е годы в клиническую практику вошли таксаны: паклитаксел (Таксол), эф-
фективность 56-60%, доцетаксел (Таксотер) — 57-75%, винорелбин (Навельбин) —
41-51 %, капецитабин (Кселода) вторая линия — 20-36%, гемцитабин (Гемзар) вторая
184 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак молочной железы
линия — 25%. У больных с гиперэкспрессией HER2 эффективен таргетный препарат
трастузумаб (Герцептин) — гуманизированное МКА к EGFR — и лапатиниб (Тайверб,
Тайкерб) — двойной ингибитор тирозинкиназы рецепторов EGF (HER2/HER1).
9.10.1. Лекарственная терапия раннего (операбельного)
рака молочной железы
Больные с операбельным РМЖ нуждаются в дополнительной (адъювантной) лекар-
ственной терапии, улучшающей отдаленные результаты лечения, снижающей риск
рецидива заболевания и увеличивающей выживаемость больных. Исключение со-
ставляет лишь небольшая прогностически благоприятная группа больных старше
35 лет с высокодифференцированной (G1) гормоночувствительной (РЭ+, РП+) опу-
холью размером до 1 см, без метастазов в лимфоузлах (TlaNOMO) и без гиперэк-
спрессии HER2.
Важнейшими прогностическими факторами являются наличие и число поражен-
ных лимфоузлов, размер первичной опухоли, степень злокачественности, опреде-
ляемая по дифференцировке опухоли (G), возраст больной и состояние ее менстру-
альной функции, содержание РЭ и/или РП в опухоли, а также гиперэкспрессия HER2
(табл. 9.18).
Таблица 9.18. Распределение больных раком молочной железы на категории
риска
Прогностическая группа Признак I
Низкий риск РЭ+ и/или РП+ HER2- рТ < 2 см NO Степень злокачественности 1 Нет перитуморальной инвазии сосудов Возраст > 35 лет
Промежуточный риск РЭ+ и/или РП+ рТ > 2 см NO Степень злокачественности 11-111 Наличие перитуморальной инвазии сосудов HER2+, возраст < 35 лет или N+ (1-3 лимфоузла) HER2-
Высокий риск РЭ- и/или РП-, N+ (1-3 узла) HER2+ рТ > 2см Степень злокачественности II-III Возраст < 35 или N+ (> 4 лимфоузлов)
Рекомендации по выбору методов лечения в зависимости от чувствительности РМЖ
к гормонотерапии приведены в табл. 9.19 и 9.20.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 185
Химиотерапия солидных опухолей
Таблица 9.19. Рекомендации по выбору методов лечения в зависимости от
чувствительности к гормонотерапии (ГТ)
Категория риска Чувствительность к гормонотерапии
Высокая Неполная Нечувствительные
Низкий ГТ или наблюдение ГТ или наблюдение —
Промежуточный ГТ илиХТ-ГТа ХТ-ГТ XT
Высокий ХТ-ГТа ХТ-ГТа XT
а При необходимости назначения XT и тамоксифена прием последнего должен быть начат после завершения
XT (ХТ-*ГТ) Вопрос относительно последовательности назначения ингибиторов ароматазы и XT (XT + ГТ или
ХТ-*ГТ) остается дискутабельным У больных в пременопаузе применение аналогов гонадотропин-рилизинг гор-
мона может быть начато одновременно с XT для максимально быстрого достижения менопаузы.
Таблица 9.20. Рекомендации по лечению больных с гормоночувствительными
опухолями
Группа риска Пременопауза Постменопауза 1
Низкий Т, или наблюдение, или агонисты LH-RH Т -»ИА, или ИА, или наблюдение
Промежуточный Т (± ОС) (+ XT), или XT Т (± ОС), или Т, или ОС Т ИА, или ИА, или XT -> Т ИА, или XT-* ИА
Высокий XT Т, или XT -* Т + ОС, или XT (ИА + ОС) XT Т ИА или XT ИА
Примечание. В круглых скобках указаны лечебные опции, являющиеся предметом дискуссий и оцениваемые в
соответствующих клинических исследованиях. Т — тамоксифен; ИА — ингибиторы ароматазы, ГТ — гормоноте-
рапия; ОС — овариальная супрессия
При высоком риске NO и отсутствии гормональных рецепторов послеоперационно
проводится 4-6 курсов XT с включением антрациклинов (AC, FAC) или 6 курсов CMF.
Больным в пременопаузе с положительными рецепторами и NO после XT назначается
тамоксифен на 5 лет. Альтернативой у этой категории пациенток служит выключение
функции яичников с назначением тамоксифена.
У больных с низким риском в пременопаузе с NO используется выключение функции
яичников с помощью агонистов LH-RH в течение 2 лет, изучается целесообразность
более длительного применения этих препаратов.
У больных в постменопаузе с NO и положительными рецепторами используются ин-
гибиторы ароматазы либо тамоксифен в течение 5 лет или прием тамоксифена в тече-
ние 2-3 лет с последующим переходом на ингибиторы ароматазы (до 5 лет). У больных
в постменопаузе адъювантная гормонотерапия на любом этапе ее проведения может
включать ингибиторы ароматазы. В ряде исследований было показано, что лечение та-
моксифеном неэффективно у НЕК2-позитивных больных, что служит показателем ре-
зистентности к тамоксифену.
При высоком риске и NO даже в менопаузе считается целесообразным назначение
XT, а затем гормонотерапии ингибиторами ароматазы или тамоксифеном. У больных
старше 70 лет основой адъювантной лекарственной терапии является тамоксифен.
При N+ в пременопаузе и при количестве метастазов в подмышечных лимфоузлах
менее 4 показано проведение 6 курсов антрациклинсодержащих комбинаций CAF,
FAC, АС или 6 курсов классического режима CMF с пероральным приемом циклофос-
фамида. При наличии 4 метастазов и более считается целесообразным назначение
более длительной XT с дополнительным использованием таксанов. Далее при поло-
жительных рецепторах назначается тамоксифен на 5 лет.
186 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Рак молочной железы
У больных с сохранной менструальной функцией при поражении не более 3 лим-
фоузлов и положительных рецепторах допустимо выключение функции яичников с
одновременным приемом тамоксифена.
У больных в постменопаузе с положительными рецепторами основой адъювантного
лечения считается гормонотерапия (ингибиторы ароматазы или тамоксифен), но при
поражении 4 лимфоузлов и более показано на I этапе проведение XT с последующей
гормонотерапией. При отрицательных рецепторах в постменопаузе рекомендуется
только XT.
Комитет экспертов конференции (St. Gallen, 2009) предложил упростить вопрос вы-
бора показаний к применению гормонотерапии при операбельном РМЖ: все больные,
у которых обнаружены РЭ+ (независимо от их уровня), должны получать гормоноте-
рапию. РЭ-положительными считаются все опухоли, в которых при иммуногистохи-
мическом исследовании обнаруживается даже минимальное количество РЭ-положи-
тельных клеток. При окрашивании более 50% клеток опухоль рассматривается как
высокочувствительная к гормонотерапии.
Стандарт гормонотерапии для больных в пременопаузе — это применение тамок-
сифена либо тамоксифена + выключение функции яичников; ингибиторы аромата-
зы пациенткам в пременопаузе противопоказаны и могут применяться лишь в случае
противопоказаний к использованию тамоксифена, при условии надежного выключе-
ния функции яичников по показателю содержания эстрадиола в сыворотке крови (ве-
рификация выключения функции яичников желательна даже при назначении ингиби-
торов ароматазы пациенткам в менопаузе моложе 60 лет). Для женщин в менопаузе
предпочтительна гормонотерапия ингибиторами ароматазы, хотя у отдельных боль-
ных возможно использование тамоксифена. У больных с высоким риском предпочти-
тельны ингибиторы ароматазы.
Показано, что у больных в менопаузе при рецептор-положительном РМЖ длитель-
ное применение летрозола (Фемара) по 2,5 мг/сут после окончания 5-летнего приема
тамоксифена улучшает эффективность адъювантной гормонотерапии, снижая к 4 го-
дам наблюдения относительный риск рецидива на 42 %.
Современный выбор оптимальных режимов адъювантной XT достаточно широк и
включает использование антрациклинов и таксанов.
Применение антрациклинсодержащих комбинаций позволяет по сравнению с CMF
уменьшить риск рецидива на 12%, риск смерти — на 11 % и увеличить 5-летнюю безре-
цидивную выживаемость на 3,2%, 5-летнюю общую выживаемость — на 2,7%. В США
в адъювантном лечении у больных с плохим прогнозом используется паклитаксел по-
сле нескольких курсов антрациклинсодержащих комбинаций, в Европе активно ве-
дутся исследования по использованию доцетаксела в адъювантной терапии, показав-
шие его высокую активность.
У больных с HER2+ РМЖ в рандомизированных исследованиях показано значение
адъювантного применения трастузумаба (Герцептин).
На основании предварительного анализа результатов этих исследований междуна-
родным консенсусом в 2007 г. рекомендовано использование трастузумаба при ран-
них стадиях HER2+ РМЖ в течение 1 года. Остается неясным вопрос о длительности
его применения, целесообразности назначения при N0 и Т < 1 см. В каждом конкрет-
ном случае при выборе адъювантной терапии должны учитываться возможная польза,
ожидаемые побочные эффекты и предпочтения больной.
Для проведения предоперационного лечения (неоадъювантная терапия) чаще
всего используется XT, однако у определенных групп больных в настоящее время
активно изучаются возможности предоперационной гормонотерапии. Проведе-
ние предоперационной XT показано тем больным, у которых невозможно выпол-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 187
Химиотерапия солидных опухолей
нение органосохраняющих операций на I этапе. Достижение морфологически
подтвержденной полной регрессии опухоли достоверно улучшает отдаленные
результаты лечения. Современные исследования подтверждают перспективность
интенсификации предоперационной XT за счет увеличения числа курсов лече-
ния (с 4 до 6) и использования новых цитостатиков (таксаны). Так, 6 предопераци-
онных курсов комбинации паклитаксел + доксорубицин приводят к повышению
частоты полных ремиссий с 17 до 28%. Добавление доцетаксела и увеличение
продолжительности предоперационной XT (4АС + 4 курса доцетаксела) привело
к 2-кратному росту морфологических полных ремиссий — с 14 до 26% (NSABP
В-27). Содержащие таксаны режимы рекомендованы для неоадъювантного ис-
пользования.
Преимуществом неоадъювантной терапии является ранее начало системного воз-
действия на микрометастазы, а также возможность объективно оценить чувстви-
тельность конкретной опухоли к используемым препаратам, что позволяет индиви-
дуализировать дальнейшую XT после операции. Однако, при сравнительной оценке
отдаленных результатов лечения РМЖ с использованием неоадъювантной и адъюван-
тной XT получены практически одинаковые результаты.
Как правило, неоадъювантно используются комбинации наиболее активных пре-
паратов (не менее 6 курсов). У пожилых больных с высоко гормоночувствительными
опухолями может быть использована гормонотерапия, которая проводится в течение
6 мес. Ингибиторы ароматазы в таких случаях дают лучшие результаты по сравнению
с тамоксифеном.
Инфильтративно-отечный РМЖ, прогностически наиболее неблагоприятная фор-
ма, нередко требует включения в план лечения лучевой терапии. При инфильтратив-
но-отечном раке могут использоваться схемы с антрациклинами, цисплатином, вино-
релбином, таксанами в сочетании с облучением.
В настоящее время для неоадъювантной XT изучаются уплотненные режимы с бо-
лее частым введением стандартных доз цитостатиков и профилактическим использо-
ванием КСФ.
Полученные предварительные результаты обнадеживают.
Изучается целесообразность использования бисфосфонатов в адъювантных режи-
мах. Большое внимание уделяется вопросам сохранения фертильности у больных, по-
лучающих адъювантное лечение.
9.10.2. Местнораспространенный и инфильтрированный
рак молочной железы
Больные этими формами РМЖ нуждаются в комплексном лечении с использовани-
ем XT и местного воздействия (оперативное лечение). Лечение у больных с местнора-
спространенным РМЖ начинают с XT (иногда в комплексе с лучевой терапией), которая
у большинства больных позволяет перевести неоперабельную опухоль в операбель-
ное состояние, в ряде случаев снизив стадию процесса. При местнораспространен-
ном раке после максимального ответа на XT с антрациклинами и/или таксанами сле-
дует использовать местнорегиональное лечение (мастэктомия + лучевая терапия), что
увеличивает выживаемость больных.
188 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак молочной железы
9.10.3. Лекарственная терапия метастатического рака
молочной железы
Специфическое медикаментозное лечение при диссеминированном РМЖ являет-
ся паллиативным, т.к. вылечить этих больных невозможно. Однако повышение медиа-
ны выживаемости, уменьшение симптомов заболевания, улучшение качества жизни —
реальные задачи.
При выборе метода лекарственной терапии прежде всего рассматривается вопрос
о перспективности использования гормонотерапии, что определяется содержанием
рецепторов стероидных гормонов в опухоли и гормональным статусом больной (со-
стояние овариальной функции).
Ответ на гормонотерапию более вероятен при следующих условиях:
длительный период без метастазирования (> 5 лет);
пожилой возраст;
метастазы в костях, локорегионарные метастазы, минимальные метастазы в лег-
ких;
И гистологически установленная НИ степень злокачественности (G1-G2);
И большая длительность полученной ранее ремиссии в результате предшество-
вавшей гормонотерапии.
Ответ на гормонотерапию маловероятен в следующих случаях:
короткий период без метастазирования (< 1 года);
возраст моложе 35 лет;
быстрое и распространенное метастазирование, метастазы в печени, головном
мозге, лимфангоит легких;
И гистологически установленная III-IV степень злокачественности (G3-G4);
И неэффективность либо короткая ремиссия после проведенной ранее гормоно-
терапии.
Больные, которые в течение 8 нед. не отвечают на первичное гормональное лече-
ние, нуждаются в смене гормонального препарата или в переводе на XT.
Смена гормонального препаратау пациенток, отвечающих на гормонотерапию пер-
вой линии, может оказаться эффективной в 30-50 % случаев. Гормонотерапия должна
быть подобрана индивидуально с учетом профиля токсичности. Больные с признака-
ми резистентности к гормонотерапии должны получать XT. Одновременное назначе-
ние XT и гормонотерапии тамоксифеном не рекомендуется. Последовательность ис-
пользования гормонотерапии у больных с диссеминированным РМЖ представлена в
табл. 9.21 и 9.22.
Таблица 9.21. Гормонотерапия, наиболее часто используемая
при метастатическом раке молочной железы
Селективные модуляторы РЭ Тамоксифен, торемифен
Антагонисты РЭ Фульвестрант
Агонисты LH-RH Гозерелин, лепролеин,трипторелин,бусерелин
Ингибиторы ароматазы 111 поколения Нестероидные: анастрозол, летрозол Стероидные: экземестан
Прогестины Медроксипрогестерона ацетат, мегестрола ацетат
ХИМИОТЕРАПИЯ ОТДЕЛ ЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 189
Химиотерапия солидных опухолей
Таблица 9«22. Последовательность гормонотерапии при метастатическом раке
молочной железы
Лечение Пременопауза Постменопауза 1
1-я линия Выключение функции яичников: агонисты LH-RH, или лучевая кастрация, или овариэктомия + анти- эстрогены (тамоксифен) Антиэстрогены или ингибиторы аро- матазы
2-я линия Ингибиторы ароматазы (только после кастрации!) Ингибиторы ароматазы либо (если они ранее не применялись) антиэстрогены
3-я линия Прогестины Прогестины
4-я линия Андрогены (при метастазах в костях) Андрогены
У больных с РЭ+ и/или РП+, но экспрессией HER2+ антиэстрогены малоэффективны,
поэтому используются ингибиторы ароматазы (на фоне искусственной или естествен-
ной менопаузы).
Используются антиэстрогены из группы SERM — тамоксифен и торемифен. Тамок-
сифен (Нолвадекс, Зитазониум) применяется в дозе 20-40 мг внутрь ежедневно дли-
тельно (не менее 2-3 мес.), торемифен — в дозе 60 мг/сут, длительно. Конкурирующий
антагонист РЭ фульвестрант (Фазлодекс) применяется в дозе 250 мг в/м 1 раз в месяц.
Современные препараты из группы ингибиторов ароматазы летрозол (Фемара) и
анастрозол (Аримидекс), в отличие от ранее применявшегося аминоглутетемида, не
требуют применения кортикостероидов. Летрозол назначается внутрь в дозе 2,5 мг
ежедневно, анастрозол — 1 мг/сут ежедневно. Стероидный ингибитор ароматазы эк-
земестан (Аромазин) используется в дозе 25 мг/сут. Нестероидные, стероидные инги-
биторы ароматазы и антиэстрогены не обладают перекрестной устойчивостью, поэто-
му при отсутствии эффекта от одного препарата переходят к другому.
Прогестины (медроксипрогестерон) используются в дозе до 1000 мг в/м или 500-
600 мг внутрь ежедневно, мегестрол (Мегейс) — в дозе 160 мг/сут.
Как уже упоминалось, активность цитостатиков при РМЖ колеблется от 30 до 60-
70%, причем наибольшей противоопухолевой активностью обладают антрациклины
и таксаны.
Поскольку доказано преимущество комбинированной XT при РМЖ, монохими-
отерапию применяют редко. Современные схемы комбинированной XT позволя-
ют добиться выраженного клинического эффекта у 50-60% пациенток с диссеми-
нированным РМЖ при средней продолжительности ремиссии 6-14 мес. и медиане
продолжительности жизни с момента начала лечения около 2 лет. Как правило, ис-
пользуют различные сочетания наиболее активных при этой опухоли цитостатиче-
ских препаратов: циклофосфамид, метотрексат, фторурацил, доксорубицин, эпиру-
бицин, доцетаксел, паклитаксел, винорелбин, капецитабин, гемцитабин, производные
платины.
Большинство современных схем комбинированной химиотерапии РМЖ включает в
себя антрациклины, что повышает их противоопухолевую активность и увеличивает
количество полных ремиссий. В то же время доксорубицин имеет кумулятивную кар-
диотоксичность, его суммарная доза не должна превышать 550 мг/м2. Все более ши-
рокое применение находит эпирубицин (Фарморубицин), обладающий меньшей кар-
диотоксичностью по сравнению с доксорубицином. Суммарная доза эпирубицина не
должна превышать 1000 мг/м2. Применяется также менее кардиотоксичный миток-
сантрон и пегилированный липосомный доксорубицин (Келикс).
У больных с распространенным процессом и висцеральными поражениями пред-
почтительнее использовать в первой линии лечения комбинации с антрациклинами и
таксанами.
190
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак молочной железы
Для второй линии применяются комбинации, не обладающие перекрестной рези-
стентностью. Если вначале использовалась комбинация CMF, то дальше могут быть ре-
комендованы комбинации с антрациклинами. После антрациклинов следует вводить
таксаны. Могут использоваться также комбинации, включающие винорелбин, циспла-
тин, митомицин, капецитабин, гемцитабин. В проведенном недавно популяционном
исследовании было показано, что у женщин с метастатическим РМЖ на момент по-
становки диагноза удаление первичной опухоли с отсутствием раковых клеток в краях
резекции значительно улучшало выживаемость, особенно при наличии только кост-
ных метастазов.
При выпоте в серозных полостях системная XT может вести к исчезновению плев-
рита. В случае отсутствия ответа на системную XT показано внутриполостное введе-
ние блеомицина до 60 мг, тиотепы 20-40 мг, фторурацила 500-750 мг, митоксантрона
25-30 мг, цисплатина 50-60 мг 1 раз в 7 дней, суммарно 100-800 мг. Возможно сов-
местное внутриполостное введение 20-25 мг тиотепы и 500 мг фторурацила. Перед
повторным введением необходимо контролировать показатели крови.
При метастазах РМЖ в костях и костном мозге у больных с рецептор-положитель-
ной опухолью наиболее эффективно сочетание летрозола или анастрозола с доксо-
рубицином (или со схемой, включающей доксорубицин). Лечение можно дополнить
локальным облучением пораженных участков скелета. При костных метастазах ис-
пользуют препараты из группы бисфосфонатов: золедроновая кислота (Зомета, Резор-
ба), ибандронат (Бондронат), клодронат натрия (Бонефос), что снижает риск развития
гиперкальциемии и патологических переломов, а также уменьшает боль и способст-
вует репаративным процессам в костях. В отдельных случаях выполняются паллиатив-
ные операции.
У больных с метастазами в головном мозге можно применять темозоломид (Темо-
дал), нитрозопроизводные — ломустин (CCNU), нимустин (ACNU, Нидран), производ-
ные платины или облучение головного мозга. При одиночных метастазах возможны
операция или стереотаксическое облучение.
Обычно терапия проводится на фоне активной дегидратации, включающей приме-
нение дексаметазона. При поражении оболочек мозга используется эндолюмбальное
введение метотрексата (12,5 мг/м2).
Больные с трижды негативным РМЖ (РЭ-, РП-, HER2-) составляют 10—15% боль-
ных РМЖ. Эти опухоли отличаются низкой дифференцировкой, агрессивным тече-
нием, резистентностью к гормонотерапии, в ряде случаев ассоциированы с мутацией
BRCA1. Показана ихчувствительность к производным платины, инфузиям 5-ФУ, инги-
биторам неоангиогенеза (бевацизумаб).
У больных с гиперэкспрессией HER2 используется МКА к HER2 — трастузумаб (Гер-
цептин). Трастузумаб рекомендуется вводить в первоначальной дозе 4 мг/кг в/в в те-
чение 90 мин; при удовлетворительной переносимости последующая еженедельная
доза составляет 2 мг/кг в течение 30 мин. Лечение проводится до прогрессирования
опухоли. Трастузумаб может использоваться как самостоятельно у больных, резистен-
тных к стандартной терапии (эффект 21 %), так и в комбинации с химиопрепаратами
(эффект 57-64,9 %).
При прогрессировании на фоне трастузумаба можно использовать лапатиниб (Тай-
верб) (ингибитор тирозинкиназы рецепторов EGF — HER2/HER1) в комбинации с капе-
цитабином (Кселода) или трастузумабом либо в монотерапии. Лапатиниб применяется
в дозе 1500 мг внутрь ежедневно, эффект оценивается каждые 3 мес. лечения.
Другой таргетный препарат — бевацизумаб (ингибитор VEGF) в исследовании III фазы
в комбинации с паклитакселом показал значительно большую эффективность по срав-
нению с монотерапией последним.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 191
Химиотерапия солидных опухолей
9.10.4. Рак молочной железы у мужчин
РМЖ у мужчин встречается в 100 раз реже, чем у женщин. Медиана возраста на мо-
мент постановки диагноза — приблизительно 65 лет. Заболевание диагностируется
позже и прогноз считается худшим, чему женщин. Как и у женщин, имеет значение но-
сительство гена BR.CA2 или BRCA /. РМЖу мужчин обладает выраженной чувствитель-
ностью к гормонотерапии. РЭ обнаруживаются в 84 % опухолей. Кастрация эффектив-
на у 50-60% пациентов. У больных с РЭ-положительными опухолями эффективность
использования тамоксифена составляет 30-50%. Показана также высокая чувстви-
тельность этой категории больных к медроксипрогестерону, ингибиторы ароматазы
считаются малоэффективными. Имеются сведения об эффективности антиандроге-
нов при РМЖ у мужчин. Могут использоваться антагонисты LH-RH. При РЭ-положи-
тельном статусе больным может рекомендоваться орхиэктомия + антиэстрогены. При
РМЖу мужчин применяют такие же химиотерапевтические режимы, как и у женщин.
При стадиях ПВ и III рекомендуется послеоперационная лучевая терапия. Хотя рандо-
мизированных исследований не проводилось, по аналогии с лечением РМЖу женщин
рекомендуется при II-III стадии использование адъювантной XT тамоксифеном.
Режимы терапии
CMF
Циклофосфамид — 100 мг/м2 внутрь ежедневно в 1-14-й день.
Метотрексат — 40 мг/м2 в/в в 1-й и 8-й дни.
Фторурацил — 600 мг/м2 в/в в 1-й и 8-й дни.
Повторение цикла каждые 4 нед. (интервал 2 нед.).
VC
Винорелбин — 25 мг/м2 в/в в 1,8, 15 и 22-й дни.
Капецитабин — 1000 мг/м2 внутрь 2 раза в сутки (2 г/м2/сут) в 1-14-й день.
Интервал между курсами 1 нед.
САЕ
Циклофосфамид — 100 мг/м2 внутрь или в/м в 1-14-й день.
Доксорубицин — 30 мг/м2 в/в в 1-й и 8-й дни.
Фторурацил — 500 мг/м2 в/в в 1-й и 8-й дни.
Повторение цикла каждые 4 нед.
РАС
Фторурацил — 500 мг/м2 в/в в 1-й день.
Доксорубицин — 50 мг/м2 в/в в 1-й день.
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Повторение цикла каждые 3 нед.
FEC
Фторурацил — 500 мг/м2 в/в в 1-й день.
Эпирубицин (Фарморубицин) — 50-100 мг/м2 в/в в 1-й день.
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Повторение цикла через 3 нед.
АС
Доксорубицин — 60 мг/м2 в/в 1-й день.
192 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак молочной железы
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21 день.
DA
Доксорубицин — 50 мг/м2 в/в в 1-й день, затем
Доцетаксел (Таксотер) — 75 мг/м2 в/в 1-часовая инфузия в 1-й день.
Интервал между курсами 3 нед.
Возможно использование доцетаксела и доксорубицина в дозе 60 мг/м2.
РА
Доксорубицин — 50 мг/м2 в/в в 1-й день, затем
Паклитаксел (Таксол) — 175-220 мг/м2 в/в 3-часовая инфузия с соответствующей пре-
медикацией (не ранее чем через 4 ч после доксорубицина!).
Интервал между курсами 3 нед.
CNF
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Митоксантрон (Новантрон) — 10 мг/м2 в/в в 1-й день.
Фторурацил — 500 мг/м2 в/в в 1-й день.
Повторение цикла через 3 нед.
NFL
Митоксантрон (Новантрон) — 12 мг/м2 в/в в 1-й день.
Фолинат кальция (Лейковорин) — 300 мг суммарно в/в за 1 ч до фторурацила.
Фторурацил — 350 мг/м2 в/в в 1-3-й день.
Повторение цикла через 3 нед.
DAC
Доксорубицин — 50 мг/м2 в/в в 1-й день.
Доцетаксел (Таксотер) — 75 мг/м2 в/в 1-часовая инфузия в 1-й день (на фоне соответ-
ствующей премедикации).
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Интервал между курсами 3 нед.
ED
Эпирубицин (Фарморубицин) — 75-80 мг/м2 в/в в 1-й день.
Доцетаксел (Таксотер) — 75 мг/м2 в/в 1-часовая инфузия в 1-й день (на фоне премеди-
кации).
Интервал между курсами 3 нед.
Доцетаксел (Таксотер) — 75 мг/м2 в/в 1-часовая инфузия в 1-й день.
Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 3 нед.
Доцетаксел (Таксотер) — 75-85 мг/м2 1-часовая инфузия (на фоне соответствующей
премедикации) в 1-й день.
Винорелбин (Навельбин) — 20 мг/м2 в/в в 1-й и 5-й дни.
Цисплатин — 60 мг/м2 в/в в 1-й день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 193
Химиотерапия солидных опухолей
ва®ЯЙйа8МЙЯИваа®аИ8В«8ЯИ»£ЙЙЙЙЗ^^ л v '
Паклитаксел (Таксол) — 90 мг/м2 3-часовая инфузия в 1-й день (на фоне премедика-
ции).
Повторение цикла через 2 нед., всего 4-6 курсов.
Паклитаксел (Таксол) — 135 мг/м2 3-часовая инфузия в 1-й день (на фоне премедика-
ции).
Винорелбин (Навельбин) — 20 мг/м2 в/в в 1-й и 8-й дни.
Повторение цикла через 3 нед.
Винорелбин (Навельбин) — 20-25 мг/м2 в/в в 1-й и 15-й дни.
Цисплатин — 80 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 28 дней.
Винорелбин (Навельбин) — 25 мг/м2 в/в в 1-й и 8-й дни.
Митомицин — 7 мг/м2 в/в в 1-й день.
Повторение цикла каждые 28 дней.
САР
Циклофосфамид — 400 мг/м2 в/в в 1-й день.
Доксорубицин — 40 мг/м2 в/в в 1-й день.
Цисплатин — 40 мг/м2 в/в капельно в 1-3-й день.
Повторение цикла каждые 3 нед.
МММ
Митомицин — 8 мг/м2 в/в в 1-й день.
Митоксантрон (Новантрон) — 8 мг/м2 в/в в 1-й день.
Метотрексат — 30 мг/м2 в/в в 1-й день.
Повторение цикла каждые 5 нед.
Капецитабин (Кселода) — 1250 мг/м2 внутрь 2 раза в сутки (2500 мг/м2/сут) в 1-14-й
день.
Доцетаксел (Таксотер) — 75 мг/м2 в/в в 1-й день.
Повторение цикла каждые 3 нед.
Капецитабин (Кселода) — 1650 мг/м2 внутрь в 2 приема в 1-14-й день.
Цисплатин — 80 мг/м2 в/в в 1-й день.
Преднизон — 0,5 мг/кг внутрь в 1-14-й день.
Повторение цикла каждые 3 нед.
TCisH
Доцетаксел (Таксотер) — 70 мг/м2 в/в в 1, 22,43 и 64-й дни.
Цисплатин — 70 мг/м2 в/в в 1, 22,43 и 64-й дни.
Трастузумаб (Герцептин) — 4 мг/кг в/в в 1-й день, далее 2 мг/кг 1 раз в неделю в тече-
ние 11 нед.
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1-й и 8-й дни.
Паклитаксел (Таксол) — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Повторение цикла каждые 3 нед.
194 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рак молочной железы
Гемцитабин (Гемзар) — 900 мг/м2 в/в в 1-й и 8-й дни.
Доцетаксел — 75 мг/м2 в/в в 8-й день.
Повторение цикла каждые 3 нед.
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1-й и 8-й дни.
Доксорубицин — 60 мг/м2 в/в в 1-й день.
Повторение цикла каждые 3 нед.
Гемцитабин — 2000 мг/м2 в/в в 1-й день или 1 мг/м2 в 1-й и 8-й дни.
Капецитабин — 2500 мг/м2/сут внутрь в 2 приема в 1 -14-й день.
Повторение цикла каждые 4 нед.
Винорелбин (Навельбин) — 25 мг/м2 в/в в 1-й и 8-й дни.
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1-й и 8-й дни.
Повторение цикла каждые 2 нед.
Доцетаксел (Таксотер) — 75 мг/м2 в/в в 1-й день.
Карбоплатин — АИС 6 в/в в 1-й день.
Повторение цикла каждые 3 нед.
Доксорубицин (Келикс) — 50 мг/м2 в/в в 1-й день каждые 4 нед.
Трастузумаб — 4 мг/кг в/в, затем 2 мг/кг еженедельно.
Доцетаксел — 35 мг/м2 в/в в 1,8 и 15-й дни.
Трастузумаб — 4 мг/кг в/в, затем 2 мг/кг в 8-й и 15-й дни.
Интервал между курсами 1 нед.
Паклитаксел — 80 мг/м2 в/в в 1,8 и 21-й дни.
Трастузумаб — 4 мг/кг в/в, затем 2 мг/кг еженедельно.
Капецитабин — 1000 мг/м2 2 раза в сутки внутрь, 1—14 день.
Лапатиниб — 1250 мг/м2 внутрь ежедневно.
Повторение цикла каждые 3 нед.
Трастузумаб — 4 мг/кг 1-я доза, затем 2 мг/кг в/в еженедельно.
Лапатиниб — 1250 мг/м2 внутрь ежедневно.
постоянный прием до прогрессирования.
Бевацизумаб (Авастин) — 10 мг/кг в/в каждые 2 нед.
Паклитаксел — 90 мг/м2 в/в в 1,8 и 15-й дни каждые 3 нед.
Доцетаксел — 75-100 мг/м2 в/в каждые 3 нед.
Бевацизумаб — 15 мг/кг в/в каждые 3 нед.
Паклитаксел — 175 мг/м2 в/в каждые 3 нед.
Бевацизумаб — 15 мг/кг в/в каждые 3 нед.
Гемцитабин — 1250 мг/м2 в/в в 1-й и 8-й дни 3-недельного цикла.
Бевацизумаб — 15 мг/кг в/в каждые 3 нед.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
195
Химиотерапия солидных опухолей
Винорелбин — 30 мг/м2 в/в еженедельно.
Бевацизумаб — 10 мг/кг в/в каждые 3 нед.
Капецитабин — 1000 мг/м2 внутрь 2 раза в сутки в 1-14-й день 3-недельного цикла.
Бевацизумаб — 15 мг/кг в/в каждые 3 нед.
Карбоплатин — АИС 6 в/в в 1-й день.
Паклитаксел — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Повторение цикла каждые 3 нед.
Метрономная терапия
Циклофосфан (Эндоксан) — 50 мг/сут внутрь ежедневно.
Метотрексат — 2,5 мг внутрь в 1-й и 2-й дни недели.
Длительно (до проявления токсичности) с контролем через 2 мес.
Циклофосфан (Эндоксан) — 50 мг/сут внутрь.
Капецитабин (Кселода) — 500 мг внутрь 3 раза в сутки.
± Бевацизумаб (Авастин) — 100 мг/кг 1 раз в 2 нед.
Длительно (до проявления токсичности) с контролем каждые 2 мес.
9.11. Злокачественные опухоли женских половых
органов
В. А. Горбунова
9.11.1. Злокачественные опухоли яичников
Всемирной организацией здравоохранения (ВОЗ) и Международной ассоциацией
акушеров и гинекологов (FIGO) принята единая морфологическая классификация
злокачественных опухолей яичников, выделяющая эпителиальные опухоли, опухоли
стромы полового тяжа и герминогенные опухоли. Большинство злокачественных опу-
холей (80-90%) — эпителиальные. Среди них серозная цистаденокарцинома — 42%,
муцинозная цистаденокарцинома — 12%, эндометриоидная карцинома — 15%, не-
дифференцированная карцинома — 17 %, светлоклеточная карцинома — 6%. В основ-
ных типах выделены пограничные (потенциально низкой злокачественности) опухо-
ли. Они составляют около 15 % эпителиальных опухолей. Помимо морфологического
типа опухоли, важнейшим независимым прогностическим фактором эффективности
лечения и выживаемости больных служит степень клеточной дифференцировки эпи-
телиальных опухолей, определяющая степень ее злокачественности. Используется
система гистологической оценки по Бродерсу, причем прогностически более благо-
приятна I степень дифференцировки и наименее благоприятна — III (G1 — высоко-
дифференцированная, G2 — средняя, G3 — низкодифференцированная).
Из всех опухолей стромального происхождения, включающих гранулезо-, тека-
коллагенпродуцирующие, а также Сертоли/Лейдиго-стромальные клетки или их эм-
бриональные предшественники, наиболее часто встречается гранулезоклеточная
опухоль.
196 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Герминогенные опухоли составляют менее 5% всех злокачественных опухолей
яичников, но имеют важное значение, т.к. возникают у молодых девушек и женщин и
требуют особого лечения, отличного от других опухолей яичников. Наиболее частыми
среди этих опухолей являются дисгерминома, похожая на семиному яичек (опухоль
эндодермального генеза), и эмбриональный рак, при котором отмечается повышение
уровня опухолевых маркеров (сывороточного ХГ и АФП).
Пограничные опухоли, или опухоли со слабым потенциалом малигнизации, со-
ставляют примерно 15 % всех эпителиальных опухолей яичников.
Необходимо обязательное морфологическое подтверждение диагноза подобной
опухоли, поскольку ее прогноз и лечение абсолютно отличаются от других злокачест-
венных новообразований.
Обзор 22 исследований (953 больных) со средним периодом наблюдения 7 лет по-
казал выживаемость 92% при распространенном процессе с исключением случаев
инвазивных имплантатов опухоли.
Метод лечения пограничных опухолей — операция, объем которой определяет-
ся стадией процесса, возрастом больной и ее желанием сохранить репродуктивную
функцию. Больным с распространенным процессом выполняют радикальные опера-
ции в объеме экстирпации или надвлагалищной ампутации матки с придатками, удале-
ние большого сальника и всех опухолевых узлов в виде так называемой агрессивной
циторедукции.
Больным с остаточными пограничными опухолями химио- и лучевая терапия не про-
водятся, т. к. в многочисленных исследованиях (в т. ч. и в РОНЦ им. Н. Н. Блохина РАМН)
не показано ее значение. Больные без остаточных опухолей, не получающие адъюван-
тного лечения, имеют такие же или лучшие результаты выживаемости при сравнении
с лечебной группой.
В случаях быстрого роста остаточных опухолей и их повторного удаления некото-
рые авторы используют мелфалан или цисплатин.
9.11.1.1. Ракяичников
Рак яичников — одна из наиболее частых злокачественных гинекологических опухо-
лей, занимает 5-е место в смертности от ракау женщин. 50 % всех случаев заболевания
приходится на возраст старше 65 лет. 5-летняя выживаемость значительно улучшается
с течением времени: с 36% в середине 1970-х годов до 45% в 2002 г. Приблизитель-
но 5-10% рака яичников — семейное заболевание в трех наиболее частых вариантах:
только ракяичников, ракяичников и рак молочной железы, ракяичников и рак толстой
кишки. В первую очередь прослеживается наследственность у родственников первой
степени (мать, дочь, сестра). Меньший риску женщин второй степени родства (бабуш-
ка, тетя). При генетических исследованиях обнаруживаются мутации BRCA1 в локу-
се 17q21. Ген BRCA2, также отвечающий за возникновение семейного рака яичников и
РМЖ, расположен на хромосоме 13ql 2.
У женщин с повышенным риском заболевания старше 35 лет, имеющих детей, может
рассматриваться вопрос о профилактической овариэктомии, однако ее значимость до
сих пор окончательно не установлена. Описаны случаи заболевания после профилак-
тической операции, начинающиеся с перитонеальных опухолевых разрастаний, по-
добных раку яичников.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 197
Химиотерапия солидных опухолей
яаяяаяяа»йв8йай®8йй8йй®®кйяйя®а^ vv -. ^ д s и
Особенность рака яичников — распространение в брюшную полость путем имплан-
тации клеток и локальная инвазия в мочевой пузырь и кишечник. Частота поражения
лимфоузлов составляет 24% при I стадии, 50% — при II, 74% — при III и 73% — при
IV стадии. Тазовые лимфоузлы вовлекаются так же часто, как и парааортальные. Опу-
холь путем трансдиафрагмального распространения может блокировать диафраг-
мальный лимфоотток, что служит причиной асцита и плеврита.
Наиболее информативные факторы прогноза при раке яичников включают следую-
щие (табл. 9.23).
Таблица 9.23. Основные факторы прогноза при раке яичников
1 Факторы Прогноз I
У(линй,чвскйе,факторь( .4 -
Возраст старше 65 лет -
Стадия
1-11 +
UI-IV —
Возраст больной
< 40 лет >40 лет +
Общее состояние по шкале ВОЗ
0-1 балл +
2-3 балла —
Асцит до лечения -
Уровень СА-125 до лечения (для серозного рака)
< 1000 МЕ/мл +
>1000 МЕ/мл -
Гистологические факторы -: • :х- f
Морфологическая структура опухоли
Серозная цистаденокарцинома +
Эндометриоидная цистаденокарцинома -
Муцинозная цистаденокарцинома -
Светлоклеточная аденокарцинома -
Степень дифференцировки опухоли
Высокодифференцированная +
Низкодифференцированная -
Плоидность опухоли
Преимущественно диплоидная +
Преимущественно анеуплоидная -
Остаточная опухоль после циторедуктивной операции
Нет остаточной опухоли
< 2 см +
>2 см -
Динамика снижения СА-125 при проведении химиотерапии (после 2 курсов)
>50% *• +
<50% -
198
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
I Факторы Прогноз
Чувствительности опухоли к химиотерапии первой линии
>50% +
<50% —
Степень лечебного патоморфоза опухоли
Выраженный +
Слабый —
Примечание.«+» — благоприятный;«-»— неблагоприятный, «±» — промежуточный
Для больных с I стадией наиболее важна степень морфологической дифференци-
ровки опухоли. Проточный цитометрический анализ ДНК при I и 11А стадиях может вы-
явить группу повышенного риска.
После оптимальных операций при III стадии медиана выживаемости составляет 52-
63 мес.
В табл. 9.24 приводится классификация рака яичников по FIGO.
Таблица 9.24. Классификация рака яичников (FIGO)
Стадия 1 Опухоль ограничена яичниками
IA Опухоль ограничена одним яичником, асцита нет. Нет опухолевых проявлений на внешней поверхности яичника, капсула интактна
IB Опухоль ограничена двумя яичниками, нет асцита. Нет опухоли на внешней поверхности, капсулы интактны
IC Опухоль такая же, как в стадиях IA и IB, но с наличием опухоли на поверхности одного либо обоих яичников, или с нарушением капсулы, или имеется асцит, и/или обнаруживаются опу- холевые клетки в перитонеальном смыве
Стадия II Опухоль вовлекает один или оба яичника и распространяется в полость малого таза
ПА Опухоль характеризуется распространением и/или метастазами в матку и/или в маточные трубы
НВ Распространение на другие ткани малого таза
ПС Опухоль такая же, как в стадиях ПА и ИВ, но имеется опухоль на поверхности одного либо обоих яичников, или отмечается разрыв капсулы, или асцит, и/или обнаруживаются опухо- левые клетки в перитонеальном смыве
Стадия III Опухоль вовлекает один или оба яичника с перитонеальными имплантатами и/или метаста- зами в забрюшинные либо паховые лимфоузлы. Метастазы по поверхности печени. Распро- странение ограничено областью малого таза, но с верифицированными метастазами в боль- шом сальнике
IIIA Опухоль ограничена областью малого таза, нет метастазов в лимфоузлах, но имеются гисто- логически доказанные микроскопические метастазы по брюшине и брюшной полости
IIIB Опухоль одного или обоих яичников с гистологически доказанными метастазами по брюши- не, диаметр которых не превышает 2 см; в лимфоузлах метастазов нет
П1С Метастазы в брюшную полость диаметром более 2 см и/или метастазы в забрюшинные либо паховые лимфоузлы
Стадия IV Опухоль одного или обоих яичников с отдаленными метастазами. Плеврит с цитологически обнаруживаемыми опухолевыми клетками, паренхиматозные метастазы в печени
Выживаемость больных напрямую зависит от стадии процесса (табл. 9.25).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
199
Химиотерапия солидных опухолей
яявияяаяиввдяяийаяяйвяивйявейяй»»^^ ^ < .•• -л -
Таблица 9.25. Выживаемость больных соответственно стадиям FIGO
Стадии Число больных 1-летняя Общая выживаемость, % 2-летняя 5-летняя
IA 467 98,5 97,8 89,3
IB 58 94,7 85,8 64,8
IC 560 96,2 89,9 78,2
ПА 73 93,1 88,9 79,2
НВ 105 91,4 82,7 64,3
ПС 206 92,1 83,9 68,2
IIIA 120 86,6 76,1 49,2
IIIB 251 86,1 65,5 40,8
IIIC 1653 81,5 61,1 28,9
IV 511 64,7 39,3 13,4
Для диагностики и контроля за эффективностью лечения при эпителиальных опухо-
лях используют такие опухолевые маркеры, как РЭА и опухолево-специфический ан-
тиген СА-125. Имеется высокая корреляция уровня СА-125 через месяц после 3-го
курса XT при III и IV стадиях и выживаемости. В случаях нормализации этого маркера в
процессе лечения повторное его повышение определяет активацию процесса, хотя и
не означает необходимость незамедлительного лечения.
Повышенный уровень СА-125 указывает на высокую вероятность рака яичников, в
то же время отрицательный ответ не исключает наличие остаточной опухоли. Уровень
СА-125 может быть повышен как при других злокачественных опухолях, так и при раз-
ных заболеваниях половых органов, например при эндометриозе.
Методы лечения зависят от стадии процесса. Ключевым моментом в лечении являет-
ся операция. В отличие от других опухолей женских половых органов, стадия процес-
са при ракеяичниковустанавливается после хирургического вмешательства. Несмотря
на то что лишь незначительное число больных может быть излечено одной операцией,
успех терапии определяется объемом первоначального вмешательства. Возможность
достижения в последующем полной ремиссии, подтвержденной морфологически,
зависит от размера остаточных опухолей. Радикальной операцией при раке яичников
считается двусторонняя овариосальпингэктомия с экстирпацией матки и удалением
большого сальника. У молодых женщин, настаивающих на сохранении репродуктив-
ной функции, при I стадии и I степени злокачественности (G1) возможна односторон-
няя овариэктомия. Во время операции для уточнения стадии и морфологического ва-
рианта берут биоптат из латеральных каналов, тазовой брюшины и диафрагмы, связки,
подвешивающей яичник, парааортальных, общих подвздошных, наружных и внутрен-
них подвздошных лимфоузлов, серозы прямой кишки и мочевого пузыря.
Проведенные исследования не показали улучшения отдаленных результатов с по-
мощью неоадъювантной XT. В настоящее время агрессивная оперативная тактика в ка-
честве начальной терапии считается предпочтительной для наилучшей выживаемо-
сти. Однако в случае сомнительного успеха операции у больных с потенциальными
осложнениями и сопутствующими заболеваниями возможна неоадъювантная XT.
Тактика лечения
Стадия I. Больным с опухолями в IA-IB стадии с высокой или средней степенью диф-
ференцировки (т.е. I-II степенью злокачественности, G1-G2) после операции не тре-
буется дополнительного лечения.
200 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
При Ill степени злокачественности (G3) IC стадии высока вероятность рецидива (до
20 %), что требует дополнительных методов лечения.
Возможны системная XT, внутрибрюшинное (в/б) введение радиоактивного фос-
фора 32Р или облучение брюшной полости и малого таза. Однако введение 32Р оказа-
лось более токсичным при одинаковой эффективности при сравнении с проведением
6 курсов цисплатина.
Стадия II. После хирургического лечения проводится адъювантная XT по схеме ТС.
Стадия III. Экстирпация или надвлагалищная ампутация матки с придатками с резек-
цией большого сальника и удалением всех или большинства опухолей. При отсутствии
видимых опухолей проводят множественные биопсии и смывы из брюшной полости.
Дальнейшее лечение включает следующее.
1. При минимальных остаточных опухолях (< 2 см) системная XT:
ТС — паклитаксел (Таксол) + карбоплатин или цисплатин (ТР), либо
СР — циклофосфамид + цисплатин, либо
СС — циклофосфамид + карбоплатин.
Возможно тотальное облучение брюшной полости и малого таза (только в случае,
если нет макроскопических проявлений болезни в брюшной полости и имеются ми-
нимальные остаточные опухоли менее 0,5 см в диаметре в полости малого таза) либо
в/б введение 32Р (только, если остаточные опухоли менее 1 см) или коллоидного ради-
оактивного золота.
2. При макроскопических остаточных опухолях более 2 см в диаметре в полости
таза проводят комбинированную XT в режиме ТС, ТР, СР или СС.
Эффективность XT оценивается клинически, радиологически и по уровню маркера.
Все большее значение для подтверждения полной ремиссии приобретает ПЭТ.
Исследовательские программы продемонстрировали статистически значимое
улучшение безрецидивной выживаемости у больных с минимальными остаточными
опухолями, которым цисплатин вводили в/б, а паклитаксел — в/б и в/в, по сравнению
с теми, кто получал лишь в/в режим цисплатина с паклитакселом. Эти данные откры-
вают перспективы для внутрибрюшинной XT у больных с минимальными остаточными
опухолями.
Стадии III и IV. Операции в полном объеме и циторедуктивные для удаления наи-
большего объема опухолевых масс, после которых проводят комбинированную XT.
Рекомендуемые терапевтические режимы:
ТС или ТР: паклитаксел (Таксол) + карбоплатин или цисплатин;
СС: циклофосфамид + карбоплатин;
СР: циклофосфамид + цисплатин.
Терапевтические подходы при III и IV стадиях рака яичников одинаковые, несмотря
на то что прогноз для больных с IV стадией хуже. У больных с IV стадией основным
проявлением, как правило, являются большие опухоли в брюшной полости и циторе-
дуктивная операция, если возможна, должна проводиться с целью возможного макси-
мального уменьшения объема опухолевых масс.
Объем остаточных опухолей — прогностический фактор, существенно влияющий
на выживаемость. Медиана выживаемости у больных после оптимальной циторедук-
тивной операции составляет 39 мес., а после субоптимальной циторедукции — только
17 мес. В случае технической невозможности выполнения операции лечение может
быть начато с XT, чтобы после 3 курсов повторно оценить возможность циторедуктив-
ной операции. Значение повторных циторедуктивных операций не доказано.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 201
Химиотерапия солидных опухолей
Рекомендовавшиеся ранее повторные обзорные лапаротомии («second-look») у
больных с клинически подтвержденной полной ремиссией не имеют терапевтическо-
го значения и в настоящее время не используются.
Химиотерапия
Платиновые производные составляют основу комбинаций первой линии XT распро-
страненного рака яичников. Стандартной считается доза цисплатина 75 мг/м2 и карбо-
платина AU С-6,0-7,5.
Цисплатин и карбоплатин эквивалентны по эффективности при раке яичников. Лишь
в отдельных исследованиях показано преимущество карбоплатина (AUC 7,5) + пакли-
таксела (175 мг/м2) 3-часовая инфузия по сравнению с цисплатином (75 мг/м2) + пакли-
таксел (135 мг/м2) 24-часовая инфузия.
Альтернативой режиму с паклитакселом служит схема с доцетакселом и карбопла-
тином, показавшая одинаковую эффективность в сравнительном исследовании при
большей гематологической и меньшей нейротоксичности. Выживаемость к 2 годам
наблюдения остается одинаковой. Наилучшим для первоначальной XT с учетом эф-
фективности, токсичности и качества жизни пациента считается режим ТС (паклитак-
сел и карбоплатин). Цисплатин ассоциируется с большей нейро-, нефро-, ото- и га-
строинтестинальной токсичностью, но меньшей миелосупрессией, чем карбоплатин.
Несмотря на отдельные данные об эквивалентной эффективности режимов ТС, САР
и монотерапии карбоплатином (ICON-3), большинство авторов считают предпочти-
тельной схему ТС.
Доцетаксел может заменить паклитаксел в случаях, требующих уменьшения нейро-
токсичности. Добавление третьего агента к таким комбинациям не оправдано.
Стартовый режим: паклитаксел 175 мг/м2 3-часовая инфузия и карбоплатин AUC
6,0-7,5 (высокая доза для больных в хорошем общем состоянии) каждые 3 нед., всего
6 циклов. XT должна быть начата спустя 4-6 нед. после операции.
Внутрибрюшинная XT в сравнительном исследовании продемонстрировала значи-
тельное улучшение медианы выживаемости без прогрессирования (29,8 us 18,3 мес.)
и общей выживаемости (65,6 us 49,7 мес.).
Этот вид лечения может обсуждаться для больных с минимальными остаточны-
ми опухолями, т.к. именно для этой категории пациенток он имеет преимущество:
медиана выживаемости при минимальных опухолях равна 66 мес., а при больших
остаточных опухолях — 26 мес. Предпочтительным изученным режимом являет-
ся следующий: паклитаксел 135 мг/м2 в/в 24-часовая инфузия в 1-й день. Последо-
вательно цисплатин 100 мг/м2 в/б во 2-й день и паклитаксел 60 мг/м2в/б в 8-й день.
Всего проводится шесть 21-дневных курсов лечения.
Этот подход должен быть детально обсужден с пациенткой, т.к. сопряжен с более
значительной токсичностью, чем внутривенная XT. В дополнение к катетер-ассоции-
рованным осложнениям (инфекция, выпадение, закупорка) она может сопровождать-
ся III-IV степенью усталости, нейтро- и тромбоцитопении, а также гастроинтестиналь-
ной токсичностью, болью в животе, метаболическими нарушениями, нейропатией.
Проводить внутрибрюшинную терапию следует только в клиниках, имеющих соот-
ветствующий опыт.
Новые препараты, такие как гемцитабин (Гемзар), оксалиплатин, топотекан, и трех-
компонентные режимы, включающие эпирубицин (Фарморубицин) и альтретамин,
продолжают изучаться и показывают обнадеживающие результаты.
Поддерживающая и консолидирующая XT, так же как и высокодозная XT, не оправ-
дана в связи с отсутствием данных об улучшении общей выживаемости.
202 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Рецидивы рака яичников. Вторая линия химиотерапии
Наиболее важными факторами прогноза рецидива рака яичников служат клиниче-
ская стадия и размер остаточных опухолей (табл. 9.26).
Таблица 9.26. Факторы прогноза рецидива рака яичников
Стадии болезни Риск Частота рецидива, %
1 Низкий 10
1 II — Высокий 20
III-IV Минимальные (< 2 см) 60-70
III-IV Большие ост. опухоли 80-85
Имеет значение и возраст больных: 5-летняя выживаемость у женщин моложе и
старше 40 лет соотносится как 65 и 20%. Другие отрицательные факторы включают
светлоклеточную или муцинозную гистологию, низкую дифференцировку, плохое
общее состояние, неплатиновые режимы первой линии XT, наличие асцита. В целом
частота рецидивов составляет 62 %.
Выбор второй линии XT основывается на чувствительности опухоли к первой линии
XT. Выделяют:
Я платино-чувствительные опухоли — первая линия с производными платины эф-
фективна, безрецидивный интервал составляет более 6 мес.;
Я платино-резистентные — безрецидивный интервал составляет менее 6 мес.;
Я рефрактерные случаи — больные прогрессируют в процессе первой линии XT.
Рецидивы рака яичников могут клинически манифестировать появлением новых
симптомов или радиографическими находками по данным КТ, а также ростом уровня
СА-125, который может предшествовать другим симптомам за 6 мес. и более.
Для женщин с бессимптомными рецидивами вопрос о целесообразности немед-
ленного начала лечения должен быть тщательно продуман и обсужден.
Цель — паллиативное лечение с длительными ремиссиями, поскольку излечение в
данной ситуации маловероятно. Немедленное начало лечения оправдано для боль-
ных с симптомами болезни, а также при наличии маленького объема опухоли, лучше
отвечающего на XT. Наибольшая эффективность вероятнау больных с платино-чувст-
вительным рецидивом и безрецидивным интервалом 12-24 мес. и более. Она состав-
ляет до 60% с медианой выживаемости до 2-4 лет. Эти больные подлежат незамедли-
тельному началу лечения.
Для больных же с платино-резистентным рецидивом и коротким безрецидивным
промежутком времени лечение может быть отсрочено до определенного момента
(появление симптомов и др.), а только рост маркера СА-125 требует дальнейшего на-
блюдения.
Для платино-чувствительных рецидивов методом выбора является возобновление
платиносодержащих режимов, в первую очередь ТС или ТР. Исключение составляет
светлоклеточная аденокарцинома (мезонефроидная), которая относительно рези-
стентна к этим режимам.
Другими режимами могут быть: липосомный доксорубицин + карбоплатин или кар-
боплатин + гемцитабин. Последний режим предпочтителен для больных с остаточной
нейротоксичностью после первой линии XT.
Комбинированная XT продемонстрировала лучшие результаты по сравнению с мо-
нотерапией одним из платиновых производных. Успех зависит от продолжительности
безрецидивного интервала: если он 5-12 мес. — эффект 27%, с патоморфологиче-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 203
Химиотерапия солидных опухолей
ской полной ремиссией (пПР) — 5 %, 13-24 мес. — 33 % и пПР — 11 %, более 24 мес. —
51%ипПР- 22%.
Платино-резистентные рецидивы. Паклитаксел должен быть использован, если
он не применялся в первой линии XT.
Препаратом выбора для платино- и таксано-резистентных рецидивов служит липо-
сомный доксорубицин (Доксил — в США, Келикс — в Европе). Пероральный этопо-
зид, топотекан, гемцитабин, винорелбин, 5-ФУ с лейковорином и ифосфамид обла-
дают определенной эффективностью. Альтретамин (Гексален) и оксалиплатин также
могут быть использованы.
Тамоксифен дает 9,6% объективных эффектов.
Для второй линии XT более эффективны еженедельные режимы паклитаксела и
карбоплатина или же доцетаксела и карбоплатина.
Активным и относительно хорошо переносимым режимом является комбинация
гемцитабина 650 мг/м2 в 1-й и 8-й дни и липосомного доксорубицина 30 мг/м2 в 1-й
день. Гемцитабин может быть использован в комбинации с цисплатином и оксалипла-
тином.
Топотекан используют в разных дозовых режимах: стандартный 5-дневный по
1,5 мг/м2/сут (нейтропения IV степени составляет 70-80% и требует снижения дозы
до 1 мг/м2/сут). Для снижения гематологической токсичности топотекан может быть
дополнен амифостином.
Еженедельный режим топотекана 4 мг/м2 в 1,8 и 15-й дни 28-дневного цикла менее
токсичен. На практике 15-й день введения зачастую должен быть пропущен. Изучает-
ся 24-часовая инфузия 8,5 мг/м2 каждые 3 нед., а также пероральная форма топотека-
на 2,3 мг/м2 ежедневно 5 дней каждые 3 нед. Миелосупрессия при этом ниже. Имеют-
ся литературные данные об эффективности иринотекана у платино-резистентных или
рефрактерных больных (250-300 мг/м2 90-минутная инфузия каждые 3 нед.).
Эффективность при рефрактерном раке составляет: ифосфамид — 12-20 %, альтрета-
мин (Гексаметилмеламин) — 12-14%, фторурацил с фолинатом кальция (Лейковорин) —
10-17%, этопозид (перорально) — 6-26%,эпирубицин (Фарморубицин) — 16-30%.
Эффективность доцетаксела — 24-41 %, винорелбина — 15%, топотекана — 14-
37%, иринотекана (Кампто) — 21 %, гемцитабина (Гемзар) — 15-28%, оксалиплати-
на (Элоксатин) — 29% (46% — при потенциально платино-чувствительных опухолях,
17% — при резистентных), липосомного доксорубицина — 19,7%.
Некоторые исследования продемонстрировали эффективность талидомида и лена-
лидомида как самостоятельно, так и в комбинации с другими агентами.
Перспективным является новый препарат трабектедин (Йонделис), выделенный из
морского продукта Ecteinascidia turbinata, а затем производимый синтетическим пу-
тем, который характеризуется уникальным механизмом действия.
При платино-чувствительных рецидивах трабектедин 1,3 мг/м2 в виде 3-ча-
совой инфузии каждые 3 нед. вызвал объективный эффекту 43 % больных с медианой
до прогрессирования 7,9 мес. Преимущественной токсичностью были астения, ней-
тропения и повышение активности аминотрансфераз. Другие исследования подтвер-
дили эффективность 28,3% у режима 1,3 мг/м2 3-часовая инфузия каждые 3 нед. и
29,6 % у режима 1,5 мг/м2 24-часовая инфузия каждые 3 нед. Эффективность, согласно
3 исследованиям II фазы, составила 34% с медианой до прогрессирования 5,8 мес.
у больных с платино-чувствительными опухолями и 8% и 2,1 мес. — с платино-ре-
зистентными. Комбинированный режим трабектедина с доксорубицином считается
перспективным в качестве второй линии XT рецидивов рака яичников.
204 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Бевацизумаб (Авастин) в дозе 15 мг/кг в/в каждые 3 нед. показал обнадеживающие
результаты. Он может применяться в комбинации с паклитакселом (3-недельный или
еженедельный режим) или с эндоксаном (50 мг/сут внутрь длительно под контролем
за показателями крови). Следует иметь в виду побочные эффекты бевацизумаба, осо-
бенно опасность перфорации кишки при ее вовлечении в процесс или же после облу-
чения брюшной полости.
Режимы терапии
Монохимиотерапия
Паклитаксел (Таксол) — 175-250 мг/м2 ± Г-КСФ 3-часовая в/в инфузия 1 раз в 3 нед.
с премедикацией кортикостероидами, антигистаминными препаратами и блокатора-
ми Н2-рецепторов: 20 мг дексаметазона внутрь или в/м за 12 и 6 ч, 300 мг циметидина
или 50 мг ранитидина и 50 мг димедрола (дифенилгидралин гидрохлорид) в/в струй-
но за 30-60 мин до введения. Необходимо использование специальных инфузионных
систем, не содержащих поливинилхлорид (ПВХ).
Паклитаксел 70-80 мг/м2 в растворе 0,9% натрия хлорида или 5% глюкозы до кон-
центрации 0,3-1,2 мг/мл в/в 60-минутная инфузия еженедельно в течение 6 нед. или
в 1, 8 и 15-й дни каждые 28 дней. Премедикация: дексаметазон 20 мг в/в струйно за
30 мин, димедрол 50 мг в/в за 30 мин и ранитидин 50 мг в/в в 20-100 мл 0,9% раствора
натрия хлорида или 5% глюкозы за 30 мин до введения паклитаксела.
Доцетаксел — 75-100 мг/м2 1-часовая в/в инфузия 1 раз в 3 нед. с пре- и постмеди-
кацией кортикостероидами: 32 мг метилпреднизолона или 8 мг дексаметазона внутрь
за 13, 7 и 1 ч до введения и затем 2 раза в сутки в течение 3-4 дней.
Цисплатин — 75-100 мг/м2 в/в капельно с гипергидратацией и форсированным ди-
урезом каждые 3 нед.
Карбоплатин — 400-450 мг/м2 в/в капельно 1 раз в 4 нед. Учитывая значительное
различие AUC и клиренса креатинина у больных с нормальной и нарушенной почеч-
ной функцией, рекомендуется расчет дозы по формуле Калверта (см. приложение 4).
Доксорубицин липосомный (Доксил, Келикс) — 40-50 мг/м2 в/в инфузия в 250 мл 5%
глюкозы для дозы до 90 мг и в 500 мл — для дозы более 90 мг каждые 3-4 нед. Началь-
ная скорость введения 1 мг/мин в течение 10-15 мин. При отсутствии реакций ско-
рость увеличивают и вся доза может быть введена за 60 мин.
Альтретамин (Гексаметилмеламин, Гексален) — 6-8 мг/кг внутрь ежедневно в тече-
ние 21-28 дней, или 65 мг/м2 внутрь 4 раза в сутки после еды и на ночь ежедневно в
течение 14 дней 28-дневного цикла (общая доза на цикл — 3640 мг/м2), или 65 мг/м2
внутрь 4 раза в сутки после еды и на ночь ежедневно в течение 21 дня 28-дневного ци-
кла (общая доза на цикл — 5460 мг/м2).
Оксалиплатин — 135 мг/м2 в/в 2-часовая инфузия каждые 3 нед., разводить в 5% рас-
творе глюкозы.
Винорелбин (Навельбин) — 25-30 мг/м2 в/в еженедельно в течение 8-10 нед.
Гемцитабин (Гемзар) — 800-1250 мг/м2 в/в в 1,8 и 15-й дни 28-дневного цикла.
Топотекан —1,5 мг/м2/сут в/в 30-минутная инфузия в течение 5 дней, или 2,3 мг/м2/сут
внутрь в течение 5 дней, или 2,25-4 мг/м2 30-минутная инфузия в 50-250 мл 0,9% рас-
твора натрия хлорида или 5% глюкозы в 1,8 и 15-й дни 28-дневного цикла.
Иринотекан — 250-350 мг/м2 30-минутная в/в инфузия 1 раз в 3 нед.; в случае диа-
реи дозу снижают до не более 250 мг/м2.
Эпирубицин (Фарморубицин) — 75-100 мг/м2 в/в 1 раз в 3 нед.
Этопозид (Вепезид, Ластед) — 50 мг/сут внутрь в течение 21 дня каждые 4 нед. (об-
щая доза на цикл — 1050 мг).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 205
Химиотерапия солидных опухолей
5-ФУ + Л В: лейковорин — 500 мг/м2 в 25-100 мл 0,9% раствора натрия хлорида или
5% глюкозы в/в 30-минутная инфузия ежедневно в 1 — 5-й день 21-дневного цикла. Че-
рез 1 ч 5-ФУ — 375 мг/м2 в/в струйно за 3-5 мин ежедневно в 1—5-й день 21-дневно-
го цикла.
Трабектедин (Йонделис) — 1,3 мг/м2 3-часовая инфузия или 1,5 мг/м2 24-часовая ин-
фузия каждые 3 нед.
Комбинированная химиотерапия
ТС
Паклитаксел (Таксол) — 175 мг/м2 3-часовая в/в инфузия с премедикацией.
Карбоплатин — AUC 5,0-7,5 в/в.
Повторение цикла каждые 3 нед.
ТР
Паклитаксел (Таксол) — 175 мг/м2 3-часовая в/в инфузия с премедикацией, затем
Цисплатин — 75 мг/м2 в/в капельно с гидратацией.
Повторение цикла каждые 3 нед.
Паклитаксел (Таксол) — 135 мг/м2 в/в 24-часовая инфузия в 1-й день.
Цисплатин — 75 мг/м2 в/в во 2-й день.
DC
Доцетаксел (Таксотер) — 75 мг/м2 в 1-й день с пре- и постмедикацией.
Карбоплатин — AUC 6 в/в или цисплатин — 75 мг/м2 в/в в 1-й день.
Повторение цикла через 3 нед.
СР
Цисплатин — 75 мг/м2 в 1-й день или 20 мг/м2/сут в течение 5 дней.
Циклофосфамид — 600-750 мг/м2 в 1-й день.
Повторение цикла через 3 нед.
СС
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Карбоплатин — AUC 5-6 в/в в 1-й день.
Повторение цикла через 3-4 нед.
САР
Цисплатин — 75 мг/м2 в/в в 1-й день.
Доксорубицин — 40-50 мг/м2 в/в в 1-й день.
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Повторение цикла через 3 нед.
IP
Ифосфамид — 3000-4000 мг/м2 в/в (+ месна) в 1-й день или 1500 мг/м2 в/в в 1-5-й
день (4- месна).
Цисплатин — 60 мг/м2 в/в в 1-й день.
Повторение цикла каждые 4 нед.
GP
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1,8 и 15-й дни.
206 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Цисплатин — 75 мг/м2 в 1-й или 8-й день.
Повторение цикла через 2 нед.
Гемцитабин — 750 мг/м2 в/в в 1-й и 8-й дни.
Цисплатин — 30 мг/м2 в/в в 1-й и 8-й дни.
Повторение цикла каждые 21 день.
Гемцитабин — 650 мг/м2 в/в в 1-й и 8-й дни.
Липосомный доксорубицин — 30 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21 день.
VP
Винорелбин (Навельбин) — 25 мг/м2 в/в в 1-й и 8-й дни.
Цисплатин — 75 мг/м2 в/в в 1-й или 8-й дни.
Повторение цикла каждые 21 день.
Липосомный доксорубицин (Доксил, Келикс) — 30 мг/м2 90-минутная инфузия, затем
Трабектедин — 1,1 мг/м2 3-часовая инфузия.
Повторение цикла каждые 3 нед.
При лечении экссудативных плевритов и асцитов эффективны производные плати-
ны, а также следующие препараты, вводимые внутрибрюшинно или внутриплевраль-
но после эвакуации экссудата: тиотепа — 20-40 мг, фторурацил — 0,75-1 г (или их
комбинация), блеомицин — 30-60 мг, митоксантрон — 25-50 мг. В/б можно ввести
и большую дозу тиотепы — 60-100 мг. Эффективно в/б введение цисплатина (100-
200 мг в 200-1000 мл физиологического раствора с в/в гидратацией) или карбоплати-
на (600-750 мг), а также ИФН-сг2 по 5-50 млн ЕД.
9.11.1.2. Стромальные и герминогенные опухоли яичников
Эти опухоли составляют от 5 до 10% всех злокачественных опухолей яичников. Они
могут быть разделены на три группы:
1) содержащие овариальные стромальные компоненты (гранулезоклеточная, Сер-
толи/Лейдиго-клеточные опухоли);
2) происходящие из герминогенных клеточных элементов (злокачественная тера-
тома, эмбриональный рак, опухоль эндодермального синуса (желточного меш-
ка) и дисгерминома);
3) хориокарцинома.
Стромальные опухоли яичников связаны с повышенной секрецией эстроге-
нов и сопутствующим раком эндометрия у 7,8% больных. 43% опухолей бывают те-
каклеточными, 24% — гранулезоклеточными и 33% — смешанными тека- и грануле-
зоклеточными. Наихудший прогноз при гранулезоклеточных опухолях с метастазами.
В случае остаточных опухолей после операции используют лучевую терапию в дозе
50-60 Гр на область малого таза. При распространенных метастазах применяют алки-
лирующие агенты, доксорубицин, комбинацию PVB и комбинации, используемые при
раке яичников.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 207
Химиотерапия солидных опухолей
Опыт лечения Сертоли/Лейдиго-клеточных опухолей невелик в связи с их редко-
стью. Описана эффективность комбинаций VAC (винкристин, дактиномицин, цикло-
фосфамид) и САР (циклофосфамид + доксорубицин + цисплатин).
При злокачественных смешанных опухолях яичников размер опухоли и гистологи-
ческое строение служат основными факторами, определяющими прогноз. Прогноз,
как правило, бывает плохим при больших опухолях, в которых более 73 составляют
элементы опухоли эндодермального синуса, хориокарциномы или незрелой терато-
мы III степени злокачественности.
При герминогенных опухолях, которые чаще всего встречаются в юном и под-
ростковом возрасте, операцией выбора при поражении одного яичника служит одно-
сторонняя овариосальпингэктомия и биопсия второго яичника. При двустороннем по-
ражении проводится пангистерэктомия.
Многие опухоли продуцируют белки и ферменты, которые могут быть определены
в сыворотке в качестве маркеров опухоли: АФП, ХГ, ЛДГ.
5-летняя выживаемость зависит от стадии: при стадии IC — 100%, стадии II — 85%,
стадии III — 79%, стадии IV — 71 %.
При дисгерминомах менее 10 см в диаметре без нарушения капсулы и прора-
стания в другие органы и без асцита 10-летняя выживаемость после консервативных
операций составила 88,6% в одной серии исследований; при этом многие женщины
имели по одной и более нормальной беременности, закончившейся родами после од-
носторонней овариосальпингэктомии. Даже в случае нерадикальных операций после
последующей XT по схеме ВЕР или PVB возможны хорошие отдаленные результаты.
Платиносодержащие режимы значительно улучшили прогноз.
Все больные, за исключением тех, кто имеет I стадию и I степень злокачественности (G1)
незрелой тератомы и стадию IA дисгерминомы, нуждаются в послеоперационной XT.
Больным после операций с неполным удалением опухолей (циторедуктивные) так-
же проводится 3-4 курса XT по схеме ВЕР или PVB (табл. 9.27).
Таблица 9.27. Рекомендации попечению овариальных герминогенных
опухолей
1 Тип опухоли/стадия Рекомендуемое лечение 1
Дисгерминома Стадия 1 Стадия IIB или НС Стадии II и III Стадия IV Операция Операция + 3 курса ВЕР или СЕ Операция + 4 курса ВЕР или СЕ Операция + 4 курса ВЕР
Незрелая тератома Стадия 1, не прорастает капсулу, G1 Стадия I с прорастанием капсулы, G2-G3 Операция Операция + 3 курса ВЕР
Все другие типы опухолей Стадия I Стадии II и III, полностью операбельные Остаточные опухоли или IV стадия Операция + 3 курса ВЕР Операция + 4 курса ВЕР Операция + 6 курсов ВЕР
У больных, имеющих множественные внебрюшинные поражения или же не подле-
жащих оперативному лечению по общему состоянию, на I этапе лечения проводится
XT. Больные, не ответившие на схему ВЕР, получают в качестве второй линии XT по схе-
ме VAC или VIP. Вопрос о последующей операции решается после тщательного обсле-
дования и контроля уровня маркеров.
208 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Комбинированная XT включает набор препаратов и схем лечения, используемых
при герминогенных опухолях яичка. С целью уменьшения легочной токсичности бле-
омицина для юных пациенток предложена некоторая модификация режимов лечения
по схемам PVB и ВЕР.
Может ли карбоплатин заменить цисплатин в используемых комбинациях? Карбо-
платин ассоциируется с меньшей ото- и нейротоксичностью. При многих опухолях,
однако не при всех, карбоплатин может заменить цисплатин, не снижая эффективно-
сти. Однако это не относится к герминогенным опухолям яичка. При овариальных гер-
миногенных опухолях карбоплатин может быть заменой цисплатину.
При лечении детей с экстракраниальными герминогенными опухолями 5-летняя вы-
живаемость и безрецидивная выживаемость составили 91 и 88% соответственно при
использовании комбинации карбоплатина, этопозида и блеомицина.
Режимы терапии
Схемы первой линии химиотерапии
ВЕР
Блеомицин — 30 мг в/в или в/м 1 раз в неделю в течение 12 нед.
Этопозид (VP-16) — 100 мг/м2 в/в капельно ежедневно в 1-5-й день.
Цисплатин — 20 мг/м2 в/в капельно ежедневно в 1-5-й день.
Повторение циклов каждые 3 нед.
PVB или VBC
Винбластин — 3 мг/м2 в/в в 1-й и 2-й дни.
Блеомицин — 15 мг/м2 (максимально 20 мг) непрерывная в/в 24-часовая инфузия
ежедневно в 1-3-й день.
Цисплатин — 20 мг/м2 в/в капельно в 4-8-й день.
Повторение циклов каждые 3 нед.
VPIC
Этопозид (Вепезид) — 100 мг/м2 в/в капельно в 1-3-й дни.
Ифосфамид — 1500 мг/м2 в/в капельно ежедневно в 1-5-й день с месной в стандар-
тном режиме.
Цисплатин — 20 мг/м2 в/в капельно ежедневно в 1-5-й день.
Повторение циклов каждые 3 нед.
VI
Этопозид (Вепезид) — 100 мг/м2 в/в капельно в 1-3-й день.
Ифосфамид — 1500 мг/м2 в/в капельно ежедневно в 1-5-й день с месной в стандар-
тном режиме.
VelP
Винбластин — 0,11 мг/м2/сут в/в в 1-й и 2-й дни.
Ифосфамид — 1200 мг/м2/сут в/в в 1-5-й день.
Цисплатин — 25 мг/м2/сут в/в в 1-5-й день.
TIP
Паклитаксел (Таксол) — 250 мг/м2 в/в 24-часовая инфузия в 1-й день, затем
Ифосфамид — 1500 мг/м2/сут в/в во 2-6-й день.
Цисплатин — 20 мг/м2/сут в/в во 2-6-й день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 209
Химиотерапия солидных опухолей
Карбоплатин — 600 мг/м2 в/в во 2-й день.
Этопозид — 120 мг/м2 в/в в 1 —3-й день.
Блеомицин — 15 мг/м2 в/в в 3-й день.
Повторение циклов каждые 3-4 нед.
Схемой второй линии химиотерапии служит комбинация VAC (винкристин, дакти-
номицин, циклофосфамид).
Для незрелых тератом II и III степени злокачественности лучшей считается схема
VAC или подобная комбинация с винбластином:
Винбластин — 3 мг/м2 в/в в 1-й и 2-й дни.
Дактиномицин — 0,5 мг/м2 в/в в 1-3-й день.
Циклофосфамид — 800 мг/м2 в/в в 3-й день.
9.11.2. Рак шейки матки
Рак шейки матки — наиболее частая злокачественная опухоль женских половых орга-
нов, он составляет 6 % всех злокачественных опухолей у женщин.
Гистологически чаще всего наблюдается ПКР (около 90%) и аденокарцинома (около
10%). Крайне редко встречается аденоэпидермоидный и мелкоклеточный рак. Описа-
ны случаи первичных сарком и злокачественных лимфом шейки матки.
Морфология рака шейки матки
Плоскоклеточный рак:
крупноклеточный с ороговением;
крупноклеточный без ороговения;
мелкоклеточный (не нейроэндокринный);
веррукозная карцинома.
Аденокарцинома:
И аденома злокачественная;
в муцинозная;
Я папиллярная;
И светлоклеточная;
аденозная киста.
Аденосквамозный рак — встречается редко.
Гласси-клеточная карцинома — редко.
Нейроэндокринный мелкоклеточный рак — редко.
Степень гистологической дифференцировки
GX — невозможно определить.
G1 — высокодифференцированная.
G2 — среднедифференцированная.
G3 — низкодифференцированная.
G4 — недифференцированная.
210 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Таблица 9.28. Клиническая классификация рака шейки матки FIGO и
по системе TNM
TNM FIGO Описание 1
тх то Tis 0 Оценка первичной опухоли невозможна Первичная опухоль не обнаружена Рак in situ
Т1 I Опухоль ограничена в пределах матки (распространение опухоли на тело матки не яв- ляется важным признаком)
Т1а IA Инвазивный рак выявляют только при микроскопии. Максимальная глубина инвазии в строму достигает 5 мм, а максимальный размер — до 7 мм. Выявление опухолевых эмболов в сосудах не влияет на классификацию
Т1а1 IA1 Инвазия опухоли в строму 3 мм или менее, ее размер — до 7 мм или менее
Т1а2 IA2 Инвазия опухоли в строму более 3 мм, но менее 5 мм, ее размер — до 7 мм или менее
Т1Ь IB Макроскопическая опухоль в пределах шейки матки либо макроскопическая опухоль, превышающая критерий Т1а2/1А2
Т1Ы IB1 Макроскопическая опухоль размером до 4 см в наибольшем измерении
Т1Ь2 IB2 Макроскопическая опухоль размером более 4 см в наибольшем измерении
Т2 II Опухоль распространяется за пределы матки, но не поражает стенку таза и нижнюю треть влагалища
Т2а ПА Опухоль без поражения клетчатки параметрия
Т2Ь ИВ Опухоль с поражением клетчатки параметрия
ТЗ III Опухоль распространяется на стенку таза и/или нижнюю треть влагалища, а также все случаи рака шейки матки с гидронефрозом или нефункционирующей почкой
ТЗа IIIA Вовлечение нижней трети влагалища без поражения стенки таза
ТЗЬ ШВ Распространение на стенку таза, сочетание с гидронефрозом или нефункционирую- щей почкой
Т4 IVA Опухоль распространяется за пределы малого таза либо прорастает слизистую обо- лочку мочевого пузыря или прямой кишки
М1 IVB Отдаленные метастазы
Примечание. Буллезный отек слизистой оболочки не позволяет отнести опухоль к группе Т4. Поражение слизи-
стой оболочки мочевого пузыря и прямой кишки следует доказывать путем биопсии.
5-летняя выживаемость зависит от стадии процесса (табл. 9.29).
Таблица 9.29. 5-летняя выживаемость при раке шейки матки
Стадия 5-летняя выживаемость, %
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
211
Химиотерапия солидных опухолей
Возрастной пик заболеваемости приходится на возраст 48-55 лет, пик для карцино-
мы in situ — 25-40 лет. Лечение больных раком шейки матки начальных стадий вклю-
чает оперативное вмешательство и различные способы лучевой терапии.
Поскольку основные методы лечения рака шейки матки — хирургический и луче-
вой, роль XT при данной локализации изучена менее полно. Она применяется у боль-
ных с метастазами в тазовых и периаортальных лимфоузлах, имеющих малые шансы
на излечение стандартными методами. Кроме того, XT может играть роль сенсибили-
затора при использовании в комбинации с лучевой терапией. С этой целью чаще ис-
пользуют цисплатин.
Одновременные с лучевой терапией цисплатинсодержащие режимы XT становят-
ся стандартом при лечении местнораспространенного процесса. Цисплатин исполь-
зуется в дозе 40-50 мг/м2 1 раз в неделю. Изучается также применение карбоплатина
в еженедельном режиме. Одновременная химиолучевая терапия позволяет снизить
смертность. Она должна проводиться у больных с высоким риском локального реци-
дива или с регионарными метастазами.
Выживаемость и эффективность первоначального лечения коррелируют с дозой
лучевой терапии и временем введения. Наилучшие результаты получают при высокой
дозе облучения и коротком периоде введения.
Локализация и частота отдаленных метастазов при раке шейки матки следующая:
легкие — 21 %, кости — 16%, парааортальные лимфоузлы — 11 %, брюшная полость —
8%, надключичные лимфоузлы — 7%. Большинство рецидивов заболевания появляет-
ся в течение 2 лет от первоначального лечения.
В последние годы изучаются новые возможности XT, в т.ч. внутриартериальная XT
через катетер, введенный по Сельдингеру во внутреннюю подвздошную или внутрен-
нюю подчревную артерию. При регионарной инфузионной XT используют фторура-
цил и цисплатин; цисплатин, метотрексат и блеомицин; митомицин, блеомицин и вин-
кристин.
Одним из новых направлений в XT рака шейки матки является применение ее в ка-
честве неоадъювантной (до операции и лучевой терапии). Теоретическими пред-
посылками к этому служат лучшая доставка лекарств к опухоли сосудами, не по-
врежденными вследствие лучевой терапии и операции; возможность уменьшения
опухоли с целью большей эффективности последующих методов лечения; вероят-
ность патоморфологической оценки эффекта и эрадикация микрометастазов.
С целью неоадъювантной терапии предпочтительны режимы комбинированной XT
(цисплатин + гемцитабин или цисплатин + иринотекан; таксаны + производные платины).
Нейроэндокринный рак шейки матки чрезвычайно редок, однако высокоагресси-
вен. 5-летняя выживаемость составляет 35,7% по сравнению с ПКР (60,5%) и адено-
карциномой (69,7 %).
Многие авторы рассматривают мелкоклеточный и крупноклеточный рак шейки
матки какэкстрапульмональный вариант МРЛ и используют схемы лечения, применя-
емые при этом раке: VAC/РЕ, цисплатин + доксорубицин + этопозид. Вполне вероятна
эффективность комбинации иринотекана (Кампто) с цисплатином.
Режимы терапии
Одновременная химиолучевая терапия
Возможны три разных варианта лечения.
1. Цисплатин — 40 мг/м2 60-минутная инфузия с гидратацией в 1,8, 15, 22, 29 и 36-й
дни за 4 ч до облучения еженедельно 6 нед. Лучевая терапия 1,8-2 Гр до СОД 45 Гр.
2. Цисплатин — 50-75 мг/м2 с гидратацией за 4 ч каждые 3 нед., 3 цикла; введе-
ние начинается в течение 16 ч после начала лучевой терапии + 5-ФУ 1000 мг/м2
212 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
24-часовая инфузия ежедневно в течение 4 дней (96-часовая инфузия каждые
3 нед.), начало в 1, 22 и 43-й дни, введение начинают сразу же после окончания ин-
фузии цисплатина (доза на цикл — 4000 мг/м2).
3. Карбоплатин — AUC 2 в/в 30-минутные инфузии еженедельно.
Монохимиотерапия
Эффективность отдельных противоопухолевых препаратов при раке шейки матки
составляет от 10 до 40%: цисплатин — 15-25%, фторурацил — 20%, ифосфамид —
31 %, карбоплатин — 28%, паклитаксел — 17%, доцетаксел — 13%, иринотекан (Кам-
пто) — 21 % (у больных, прежде получавших химиотерапию), гемцитабин (Гемзар) —
11-18%, эпирубицин (Фарморубицин) — 48% (в дозе 120 мг/м2), топотекан — 19%,
винорелбин — 18%.
Фторурацил используется в стандартных режимах или в виде длительной в/в либо
внутриартериальной инфузии 1 г/м2/сут непрерывно в 1-5-й день цикла.
Повторение циклов каждые 3 нед.
Цисплатин может быть использован в следующих режимах:
а) 75-100 мг/м2 в/в капельно однократно каждые 3 нед.;
б) 20 мг/м2 в/в капельно ежедневно в 1-5-й день каждые 3 нед.
Ифосфамид — 1,2-1,5 г/м2 в/в капельно ежедневно в 1-5-й день каждые 3 нед. с
уропротектором месной (Уромитексан) из расчета 100% к дозе ифосфамида.
Паклитаксел (Таксол) — 175 мг/м2 в/в 3-часовая инфузия 1 раз в 3 нед. с общеприня-
той премедикацией дексаметазоном, димедролом, циметидином.
Доцетаксел (Таксотер) — 100 мг/м2 в/в 1-часовая инфузия 1 раз в 3 нед. с общепри-
нятой пре- и постмедикацией дексаметазоном.
Иринотекан (Кампто) — 250-300 мг/м2 в/в 90-минутная инфузия каждые 3 нед.
У больных старше 70 лет и с общим состоянием по критериям ВОЗ 2 балла и выше ис-
пользуются дозы менее 300 мг/м2.
Другими режимами иринотекана могут быть: 100 мг/м2/нед. 3-4 введения или
150 мг/м21 раз в 2 нед.
Топотекан — 1,5 мг/м2/сут в/в в течение 5 дней каждые 3 нед.
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1,8 и 15-й дни каждые 4 нед.
Комбинированная химиотерапия
Комбинированная XT с использованием цисплатина и новых лекарств улучшает эф-
фективность медикаментозного лечения до 40-60%.
1. Цисплатин — 50 мг/м2 в/в в 1-й день.
Топотекан — 0,75 мг/м2/сут в/в 30-минутная инфузия в 1-3-й день 21-дневного цикла.
Цисплатин вводят в 1-й день после завершения введения топотекана.
2. Иринотекан (Кампто) — 60 мг/м2 в/в 90-минутная инфузия в 1,8 и 15-й или 1-й и
8-й дни.
Цисплатин — 60 мг/м2 в/в капельно с гидратацией в 1-й день или 40 мг/м2 в 1-й и 8-й
дни.
Повторение цикла каждые 28 дней.
3. Иринотекан — 180 мг/м2 в/в 90-минутная инфузия в 1-й день.
Цисплатин — 75 мг/м2 в/в в 1-й день.
Повторение цикла каждые 3 нед.
4. Паклитаксел (Таксол) — 175 мг/м2 в/в 3-часовая инфузия в 1-й день с премедика-
цией.
Цисплатин — 60-80 мг/м2 в/в капельно с гидратацией в 1-й день.
Повторение цикла каждые 21 день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 213
Химиотерапия солидных опухолей
®ИЙВвЯЯ8ИВВ®Я®®Й®«ЯИ8ЯЙв8ЯЯЯ0®ЙЯгв8ЙЯ98в®ЯЯ88^^ "«• -»« <>
5. Доцетаксел (Таксотер) — 75 мг/м2 в/в в 1-й день.
Цисплатин — 75 мг/м2 в/в капельно с гидратацией в 5-й день или карбоплатин AUC 6 в
1-й день.
Повторение цикла каждые 21 день.
6. Гемцитабин (Гемзар) — 800-1000 мг/м2 в/в в 1-й и 8-й дни.
Цисплатин — 80 мг/м2 в 1-й день.
Повторение цикла каждые 21 день.
7. Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Фторурацил — 1 г/м2/сут в/в инфузия непрерывно в 1-4-й дни.
Повторение цикла каждые 3 нед.
8. Винорелбин (Навельбин) — 25 мг/м2 в/в в 1-й и 8-й дни.
Цисплатин — 80 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21 день.
9. Карбоплатин — AUC 4 в/в капельно в 1-й день.
Ифосфамид — 1,5 г/м2 в/в капельно в 1-3-й день с месной.
Повторение цикла каждые 21 день.
10. Доксорубицин — 60-75 мг/м2 в/в в 1-й день.
Блеомицин — 15 мг/м2 в/в или в/м в 1-й и 8-й дни.
Повторение цикла каждые 3-4 нед.
11. Блеомицин — 15 мг/м2 в/в в 1-й день.
Ифосфамид — 1000 мг/м2 в/в в 1-5-й день (+ месна).
Цисплатин — 50 мг/м2 в/в в 1-й день.
Повторение цикла каждые 3 нед.
Режим может быть использован без блеомицина.
9.11.3. Рак вульвы
Рак вульвы занимает 4-е место среди опухолей женских половых органов после рака
эндометрия, яичников и шейки матки. Встречается преимущественно в менопаузе,
хотя может быть и у молодых женщин. Локализуется чаще на больших половых губах,
реже — в других отделах.
Выживаемость операбельных больных, не имеющих поражения лимфоузлов, со-
ставляет 90%. При вовлечении лимфоузлов 5-летняя выживаемость снижается до
50-60%.
ПКР составляет 90% всех опухолей. Редко встречается малодифференцированный
рак, который прогностически неблагоприятен. Другие типы опухолей включают зло-
качественную меланому, аденокарциному больших (бартолиновых) и малых желез
преддверия. Крайне редко встречается саркома вульвы.
Течение рака вульвы медленное, распространение идет по протяжению или по лим-
фатическим путям. Больные с подозрением на рак вульвы должны быть тщательно об-
следованы, включая полное обследование полости малого таза и паховых лимфоузлов
с цитологическим исследованием и кольпоскопией шейки матки, влагалища и вульвы
в связи с возможностью мультифокусной природы интраэпителиального поражения
этих областей.
Лечение должно быть строго индивидуализированным, особенно при ранних ста-
диях процесса с целью наиболее консервативной терапии для излечения, имея в виду
минимум периоперационных осложнений и максимально длительное сохранение
психосексуальной и физической активности.
214 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Консерватизм и индивидуализм оперативного вмешательства характеризует основ-
ной подход при I стадии. При II стадии проводится модифицированная радикальная
вульвэктомия и пахово-бедренная лимфаденэктомия.
Показано улучшение результатов при использовании адъювантной лучевой терапии.
Вопрос о том, какие группы больных подлежат данному подходу, продолжает изучать-
ся, однако при высоком риске рецидива следует иметь в виду именно такую тактику.
При III и IV стадиях выполняют расширенные операции типа радикальной вульвэк-
томии с экзентерацией малого таза, используя предоперационно лучевую или хими-
олучевую терапию с целью уменьшить размер опухоли и улучшить возможности опе-
рирования.
Химиолучевая терапия с использованием цисплатина, цисплатина с 5-ФУ или мито-
мицина с 5-ФУ не только создает возможности резектабельности опухоли, но и в не-
которых исследованиях вызывает полную регрессию опухолей у 47-50 % больных.
Изучается также значение неоадъювантной XT без лучевой терапии. В описанных
исследованиях применяли режим РМВ: цисплатин, метотрексат, блеомицин; блеоми-
цин, ломустин, метотрексат; митомицин и 5-ФУ.
Создается впечатление, что комбинированное химиолучевое лечение более эффек-
тивно. Соответственно 5-летней выживаемости выделяют четыре категории риска:
И минимальный риск — опухоль до 2 см, отсутствие метастазов в лимфоузлах —
100-98%;
низкий риск — опухоль 2,1 -8,0 см и негативный лимфоузел или опухоль менее
2 см и 1 позитивный лимфоузел1 — 97-87 %;
Я промежуточный риск — опухоль более 8 см и негативные лимфоузлы, или опу-
холь более 2 см и 1 позитивный лимфоузел, или опухоль до 8 см и 2 позитивных
лимфоузла с одной стороны — 82-75%;
И высокий риск — опухоль более 8 см и 2 позитивных лимфоузла с одной сторо-
ны, или 3 пораженных лимфоузла и более, или билатеральные метастазы в лим-
фоузлах.
5-летняя выживаемость зависит от стадии процесса (табл. 9.30).
Таблица 9.30. Выживаемость при раке вульвы
Стадия FIGO Число больных - Общая выживаемость. %
1 год 2 года 5 лет
1 160 97,4 92,0 76,9
II 202 87,8 76,5 54,8
III 125 66,0 47,1 30,8
IV 44 39,5 16,6
При рецидивах, метастазах, в случае невозможности химиолучевой терапии при
раке вульвы могут быть использованы схемы, которые применяют для лечения рака
шейки матки.
Поскольку наиболее частой морфологической формой рака вульвы является ПКР, то
для системной XT этой локализации применимы все рекомендации по моно- и поли-
химиотерапии рака шейки матки. Могут быть использованы также следующие комби-
нации препаратов.
1. Блеомицин — 10 мг/м2 в/м 2 раза в неделю в течение 2-3 нед.
Метотрексат — 10 мг/м2 внутрь 2 раза в неделю в течение 2-3 нед.
Повторение циклов через 3 нед.
Позитивный лимфоузел — наличие метастаза.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 215
Химиотерапия солидных опухолей
ЯЯЯЯЯ«ВЙКввЯаМВ«МЯвЯ»ЙЯЙИ^^ V • '-V .. д- . -
2. Митомицин — 10 мг/м2 в/в в 1-й день.
Фторурацил — 1 г/м2 в/в 24-часовая инфузия, начиная через 30 мин после митомици-
на, ежедневно в 1-3-й день.
Этот режим может дополняться лучевой терапией, которая начинается через
10 дней после XT.
Новые агенты, такие как ингибиторы тирозинкиназ EGFR, показали обнадеживаю-
щие результаты и продолжают изучаться.
9.11.4. Рак влагалища
Рак влагалища составляет 1 -2 % всех злокачественных опухолей женских половых ор-
ганов. При ранних стадиях болезнь излечима.
Гистологическая классификация: ПКР — около 85 %, метастазирует чаще всего в лег-
кие и печень; аденокарцинома — 15%, встречается чаще в возрасте 17-21 года, ме-
тастазирует в легкие, надпочечники и тазовые лимфоузлы. Аденоэпидермоидная кар-
цинома встречается редко (1-2% случаев) и обладает выраженной агрессивностью.
Очень редко наблюдаются светлоклеточные аденокарциномы у женщин моложе
30 лет, матери которых в I триместре беременности применяли диэтилстильбэстрол.
Молодые женщины, имеющие этот факт в анамнезе, должны внимательно наблюдать-
ся и обследоваться с целью возможно более раннего выявления заболевания, кото-
рое хорошо излечивается на ранних стадиях.
Терапевтические возможности зависят от стадии: хирургический метод и лучевая
терапия — на ранних стадиях, лучевая терапия — при более распространенном про-
цессе. XT не столь эффективна при распространенном раке влагалища, чтобы быть
стандартным методом лечения. При ПКР in situ иногда, в случае невозможности опе-
ративного лечения или лучевой и лазерной терапии, используют интравагинальную XT
5% фторурациловой мазью.
При ПКР применяют те же виды XT, что и при раке шейки матки.
9.11.5. Рак эндометрия
Рак эндометрия составляет 13 % всех злокачественных опухолей у женщин. В развитых
странах отмечается повышение частоты рака тела матки.
Рак тела матки обычно встречается в возрасте 55-60 лет. Морфологически опухоль
чаще всего представляет собой эндометриоидную аденокарциному (75-80%), подра-
зделяющуюся на цилиарную, секреторную, папиллярную и с плоскоклеточной диф-
ференцировкой. Менее чем в 10% случаев встречается папиллярная серозная аде-
нокарцинома, в 1 % случаев — муцинозная, в 4% — светлоклеточная аденокарцинома,
менее чем в 1 % — ПКР, в 10% — смешанная опухоль, редко — недифференцирован-
ные формы рака.
Морфологическое строение рака эндометрия
Я Эндометриоидная карцинома.
Цилиарная карцинома.
Аденокарцинома с доброкачественными сквамозными элементами, плоскокле-
точной метаплазией и плоскоклеточной дифференцировкой (аденоакантома).
216 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Аденосквамозная карцинома (смешанная аденокарцинома и плоскоклеточная
карцинома).
Я Муцинозная аденокарцинома.
Я Серозная аденокарцинома (папиллярно-серозная).
Я Светлоклеточная карцинома.
Я Плоскоклеточная карцинома.
Я Недифференцированная карцинома.
Я Злокачественная смешанная мезодермальная опухоль.
Степень злокачественности при раке эндометрия количественно отражает наличие
солидных структур в опухоли:
G1 — солидная форма роста составляет не более 5 % опухоли;
G2 — солидная форма роста составляет 5-50% опухоли;
G3 — солидная форма роста составляет более 50 % опухоли (серозный, светлоклеточ-
ный рак и карциносаркома рассматриваются как опухоль высокой степени злокачест-
венности — G3).
Факторами прогноза при раке эндометрия считаются наличие и уровень рецепто-
ров прогестрона (РП), экспрессия онкогенов, ДНК-плоидность, фракция клеток в S-
фазе клеточного цикла. Некоторые авторы отмечают также значение РЭ.
Классификация рака эндометрия по стадиям FIGO
Стадия I (около 50%) — ограничена телом.
IA — опухоль поражает эндометрий.
IB — инвазия менее 72 миометрия.
IC — инвазия более У2 миометрия.
Стадия II — вовлекается тело и шейка матки.
ПА — вовлечена только железистая часть цервикального канала.
ПВ — инвазия стромы шейки матки.
Стадия III — распространение опухоли за пределы матки в пределах малого таза.
IIIА — опухоль выходит за пределы серозной оболочки и/или имеются перитонеаль-
ные метастазы.
11 IB — вагинальные метастазы.
IIIC — метастазы в тазовых или парааортальных лимфоузлах.
Стадия IV — вовлечение в процесс мочевого пузыря или кишки либо отдаленные ме-
тастазы.
IVA — инвазия мочевого пузыря или кишки.
IVB — отдаленные метастазы, включая внутрибрюшинные и/или паховые лимфоуз-
лы.
Выживаемость зависит от стадии процесса (табл. 9.31).
Таблица 9.31. Выживаемость при раке эндометрия в зависимости от стадий
...... U........ ... .и Общая выживаемость, %
ыадин гши пиияи UUJJOnOIA 1 год 2 года 5 лет
IA 1063 98,5 96,8 91,1
IB 2735 98,2 96,1 89,7
IC 1219 97,6 92,3 81,3
ПА 364 95,8 90,3 78,7
НВ 426 97,4 87,5 71,4
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 217
Химиотерапия солидных опухолей
Стадия FIGO Число больных — ______ Общая выживаемость, %
1 год 2 года 5 лет
IIIA 484 89,9 77,3 60,4
IIIB 73 70,6 51,7 30,2
IIIC 293 85,7 70,7 52,1
IVA 47 65,6 39,4 14,6
IVB 160 51,1 38,6 17,0
Основной метод лечения — хирургический в объеме расширенной экстирпации
матки с придатками. Лучевая терапия используется в качестве дополнительного пред-
и послеоперационного воздействия у больных с высоким риском рецидива. Самосто-
ятельно лучевая терапия проводится при наличии противопоказаний к оперативному
вмешательству.
Наиболее принятым методом системной терапии рака эндометрия считается гор-
монотерапия прогестинами, которые суспехом используют при рецидивах и/или дис-
семинации болезни. Изучение прогестинов в качестве адъювантной терапии в рандо-
мизированном исследовании при I стадии болезни не показало клинически значимых
результатов. Однако таких исследований не проводилось при более распространен-
ных стадиях.
Гормональная терапия прогестинами при распространенном процессе бывает эф-
фективна у 15-30% больных, что ассоциируется со значительным увеличением в по-
казателях выживаемости, эффективности и коррелирует с наличием и уровнем гор-
мональных рецепторов и степенью злокачественности опухоли в зависимости от ее
дифференцировки.
При наличии РП в опухолевой ткани у 40% женщин наблюдается эффект от приме-
нения прогестинов и лишь у 17 % и менее — в случае отсутствия РП в опухоли. Отрица-
тельный рецепторный статус определяет не только низкую эффективность прогести-
нов, но и лучший прогноз в отношении противоопухолевой активности XT (табл. 9.32).
Таблица 9,32. Связь эффекта гормонотерапии и экспрессии гормональных
рецепторов
Автор, год Число больных Гормональная терапия Эффективность, % РП-
РЗ+ РП+
A. Kauppila, 1984 105 Гидроксипрогестерона капроат 64 89 11 17
Т. Thigpen, 1986 47 Мегестрола ацетат 23 40 12 12
Т. Thigpen, 1999 132 Мегестрола ацетат 26 37 7 8
Гормонотерапия более эффективна при РП- и РЭ-положительных опухолях и вы-
сокой степени дифференцировки (G1). В большинстве случаев ремиссии бывают ча-
стичными и относительно короткими, но у отдельных больных длительность ремиссии
составила более 2 лет. Медиана выживаемости при I степени злокачественности опу-
холей (G1) равнялась 18,8 мес., а при III степени — 6,9 мес.
Стандартные схемы лечения
Гестонорон (Депостат) — 200 мг в/м 1 раз в неделю, длительно.
Медроксипрогестерон (Провера, Фарлутал) — 200-800 мг внутрь ежедневно, дли-
тельно (не менее 8-10 нед.). Депо-провера — 500-1500 мг в/м ежедневно в течение
28-30 дней, затем 2 раза в неделю, длительно.
218 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Мегестрол (Мегейс) — 160-320 мг/сут, длительно.
Более высокие дозы (800-1000 мг/сут) не улучшают эффективность, но увеличива-
ют побочные эффекты (тромбофлебиты, увеличение массы тела, отеки).
Описана активность антиэстрогена тамоксифена при диссеминированном процес-
се, что может объясняться наличием РЭ в опухоли.
Имеются данные об эффективности тамоксифена у 20% больных, которые не отве-
чали на стандартную прогестиновую терапию. Может ли тамоксифен быть более эф-
фективен, чем прогестин, для первоначальной терапии — неясно. В одном исследова-
нии у женщин с гормонорецептор-положительными опухолями эффективность была
одинаковой (35 и 46 % от тамоксифена и медроксипрогестерона соответственно).
Изучаются также другие ингибиторы РЭ, в т.ч. арзоксифен, оказавшийся эффектив-
ным у 31 % больных.
Исследовалась комбинация тамоксифена и прогестинов, однако убедительных дан-
ных о преимуществе такого подхода не получено.
Эффективность ингибиторов ароматазы не превышает 10%.
Агонисты гонадотропин-рилизинг гормона продемонстрировали эффект лишь в од-
ном исследовании.
Многие авторы рекомендуют использовать гормонотерапию для первоначаль-
ной терапии гормонорецептор-положительных опухолей и начинать лечение с XT у
остальных больных.
Стандартной XT ввиду малой эффективности не существует. Однако несколько клас-
сов противоопухолевых препаратов обладает активностью при данной опухоли. К ним
относятся антрациклины, платиновые производные и таксаны. Длительность ремиссий
обычно короткая. Эффективность отдельных препаратов составляет от 21 до 40%: ци-
сплатин — 21 %, карбоплатин — 28%, доксорубицин — 26%, ифосфамид — 24%, па-
клитаксел — 36%,топотекан — 20%.
Комбинированные режимы эффективны у 36-67 % больных.
В рандомизированных исследованиях показано преимущество комбинации доксо-
рубицина с циклофосфамидом или цисплатином по сравнению с монотерапией док-
сорубицином.
Поданным последних лет, наиболее эффективны режимы с паклитакселом (пакли-
таксел + карбоплатин или цисплатин), вызывающие до 50% объективных эффектов
и более с улучшением выживаемости без прогрессирования. Эти режимы эффек-
тивны также и при более агрессивных неэндометриоидных аденокарциномах матки.
В двух исследованиях получено улучшение с помощью паклитакселсодержащих ре-
жимов: эффективность комбинации паклитаксел + карбоплатин по сравнению с док-
сорубицин + цисплатин составила 35 ds 28 %, выживаемость за 15 мес. — 41 ds 2.1 %;
ТАР (паклитаксел, доксорубицин, цисплатин) по сравнению с доксорубицином и ци-
сплатином: эффективность — 57 os 34 %, медиана без прогрессирования — 8 ds 5 мес.,
медиана выживаемости — 15 ds 12 мес. Режим ТАР, однако, был более токсичен.
Другие комбинации: цисплатин + винорелбин, цисплатин+ доксорубицин + это-
позид.
Комбинация химиогормонотерапии в одном из исследований, в котором схему
CAF сравнивали с той же схемой + медроксипрогестерон (200 мг ежедневно 3 нед.,
а затем тамоксифен 20 мг/сут 3 нед.), оказалась лучше: эффективность — 43 ds 14%,
медиана выживаемости — 14 ds 11 мес.
Для серозно-папиллярных и светлоклеточных опухолей показана эффективность па-
клитакселсодержащих режимов (паклитаксел + карбоплатин) с или без лучевой терапии.
Нерандомизированное сравнительное исследование схем мелфалан + 5-ФУ + ме-
дроксипрогестерона ацетат и цисплатин + доксорубицин + этопозид + мегестрол
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 219
Химиотерапия солидных опухолей
(PAV-М) продемонстрировало значительное преимущество последней схемы по 2-
(55 os 7 %) и 5-летней (15 us 0%) выживаемости и медиане выживаемости (27 os 7 мес.)
у женщин со светлоклеточной, серозно-папиллярной, аденосквамозной карциномой
и недифференцированным раком матки.
Стандартными комбинациями являются доксорубицин + цисплатин и карбоплатин +
паклитаксел. Заслуживает внимания новая комбинация цисплатина и винорелбина с
общей эффективностью 57 % и полной ремиссией у 11 % больных. Приблизительно у
17-50% лечившихся больных обнаружена высокая гиперэкспрессия HER2. Эти дан-
ные открывают перспективу для будущих исследований с ингибиторами HER2 тра-
стузумабом (Герцептин) и лапатинибом (Тайкерб, Тайверб), а также ингибиторами ре-
цепторов EGFR и HER2.
Режимы терапии
Монохим иотерапия
Доксорубицин — 60 мг/м2 в/в однократно каждые 3 нед.
Эпирубицин (Фарморубицин) — 75-100 мг/м2 в/в каждые 3 нед.
Цисплатин — 75-100 мг/м2 в/в капельно 1 раз каждые 3 нед.
Карбоплатин — AUC 5-6 в/в капельно каждые 3-4 нед.
Паклитаксел (Таксол) — 175 мг/м2 в/в 3-часовая инфузия с премедикацией дексаме-
тазоном, димедролом, циметидином каждые 3-4 нед.
Ифосфамид —1,5 г/м2 в/в капельно с месной в течение 3-5 дней каждые 3-4 нед.
Комбинированная химиотерапия
СР
Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Доксорубицин — 50 мг/м2 в/в в 1-й день.
Повторение циклов каждые 3 нед.
Паклитаксел (Таксол) — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Карбоплатин — AUC 5-7 в/в капельно или цисплатин — 75 мг/м2 в/в капельно с гидра-
тацией.
Повторение цикла каждые 3-4 нед.
ТАР
Паклитаксел — 160 мг/м2 в/в 3-часовая инфузия во 2-й день.
Доксорубицин — 45 мг/м2 в/в в 1-й день.
Цисплатин — 50 мг/м2 в 1-й день с Г-КСФ.
Повторение цикла каждые 3 нед.
Паклитаксел (Таксол) — 135 мг/м2 в/в 3-часовая инфузия в 1-й день.
Доксорубицин — 50 мг/м2 в/в капельно с гидратацией в 1-й день ± Г-КСФ.
Повторение цикла каждые 3 нед.
САР
Цисплатин — 50 мг/м2 в/в капельно в 1-й день.
Доксорубицин (Адриамицин) — 50 мг/м2 в/в в 1-й день.
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Повторение циклов каждые 3-4 нед.
Цисплатин — 80 мг/м2 в/в капельно в 1-й день.
220 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Винорелбин — 25 мг/м2 в/в в 1-й и 8-й дни.
Повторение цикла каждые 3 нед.
В настоящее время изучается роль адъювантной XT.
9.11.6. Саркома матки
Саркомы матки составляют менее 1 % всех гинекологических злокачественных опу-
холей и 2-5 % всех злокачественных новообразований матки. Они могут исходить из
двух ИСТОЧНИКОВ:
1) лейомиосаркома — из мышечного слоя (миометрия);
2) мезодермальные и стромальные саркомы — из эндометриального эндотелия.
Саркомы матки — редкая опухоль, прогноз которых хуже, чем рака эндометрия. Рас-
сматриваются четыре наиболее частых морфологических типа: карциносаркомы, лейо-
миосаркомы, эндометриальные стромальные саркомы (G1) и недифференцированные
саркомы (иногда их называют эндометриальными стромальными саркомами, G3).
Рецидивы возникают у 44% больных при гомогенных опухолях и у 63 % — при гете-
рогенных.
Лейомиосаркома — наиболее агрессивная опухоль, размер более 5 см в диаметре
указывает на плохой прогноз. Одним из важных факторов прогноза служит также ми-
тотический индекс и стадия процесса. При I стадии 5-летняя выживаемость составля-
ет 50% по сравнению с 0-20% при всех других стадиях.
По новой гистологической международной классификации, все опухоли матки, со-
держащие злокачественные элементы эпителиального и стромального происхожде-
ния, называются карциносаркомами.
Оперативный метод считается единственно радикальным. Операция проводится в
объеме расширенной экстирпации матки с придатками и тазовой и периаортальной
лимфаденэктомии. Как при I, так и II стадии многие исследователи используют допол-
нительно адъювантную лучевую и/или химиотерапию.
Вопрос о возможности сохранения яичников у женщин детородного возраста с I-
II стадией болезни остается открытым. В одном из исследований у больных с лейоми-
осаркомой матки выживаемость была одинаковой с овариэктомией и без нее (83 %).
Значение циторедуктивных операций также дискутабельно. В отдельных исследо-
ваниях показана роль маленького объема остаточных опухолей (< 2 см) в отношении
влияния на выживаемость — 53 ds 2 мес. при объеме более 2 см. Однако ретроспек-
тивный вывод затруднен из-за выраженных различий в группах больных. Нет очевидно-
го значения оптимальной циторедукции для больных с высокодифференцированны-
ми опухолями. В редких случаях, когда молодым женщинам выполняют миомэктомию
по поводу лейомиомы, а находят лейосаркому высокой степени дифференцировки
(GI), иногда гистерэктомию не проводят. Однако в подобных случаях следует обсудить
это с пациенткой, получить ее согласие и осуществлять тщательное последующее на-
блюдение с МРТ-исследованиями.
Целесообразность адъювантной лучевой терапии при саркомах матки также диску-
табельна, т.к. данные разноречивы и даже если есть влияние на частоту рецидивов, то
нет улучшения в плане выживаемости. Очень мало исследований в гомогенной попу-
ляции больных. В отношении карциносарком есть несколько исследований, показыва-
ющих улучшение выживаемости, в других этого не получено.
Значение послеоперационного облучения всей брюшной полости по сравнению с
XT было предметом исследования гинекологической онкологической группы — GOG-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 221
Химиотерапия солидных опухолей
150, в котором рандомизировано 232 женщины после циторедуктивных операций
оптимального объема (< 1 см остаточные опухоли) на группу получающих облуче-
ние всей брюшной полости (30 Гр с дополнительной дозой на область малого таза) и
группу получающих 3 курса цисплатина (20 мг/м2/сут 4 дня) с ифосфамидом (1,5 мг/м2
ежедневно 4 дня + месна). Среднее время наблюдения составило 63 мес. Отмечена
тенденция к снижению числа рецидивов и улучшению выживаемости в группе полу-
чавших XT, однако разница не была статистически значимой.
По имеющимся данным, адъювантная лучевая терапия уменьшает частоту локаль-
ных рецидивов, но влияние ее на выживаемость не определено. В отношении карци-
носарком облучение всей брюшной полости (WAI) может быть предпочтительно, как
и адъювантная XT. Инструкции национальной онкологической сети США указывают,
что адъювантная лучевая терапия должна применяться у больных с лейомиосарко-
мой матки HI стадии или низкодифференцированными саркомами (G3), но не при эн-
дометриальных стромальных саркомах (G1). Карциносаркомы следует лечить так же,
как и другие опухоли матки высокого риска (серозно-папиллярные и светлоклеточ-
ный рак эндометрия):
в IA стадия — наблюдение или брахитерапия;
другие варианты IA стадии — лучевая и химиотерапия;
IB, IC, II, а также III и IV стадии после адекватных циторедуктивных операций —
XT с лучевой терапией на малый таз или без нее либо облучение всей брюшной
полости с вагинальной брахитерапией или без нее;
другие варианты III-IVA стадии — XT с лучевой терапией или без нее.
Гормональная терапия с или без лучевой терапии рекомендуется для III стадии эн-
дометриальных стромальных сарком, одна гормонотерапия — для IV стадии болезни.
При III—IV стадии лейомиосарком или недифференцированных саркомах (G3) адъ-
ювантная XT должна применяться с лучевой терапией или без нее.
Для лейомиосарком может быть использована комбинация гемцитабина и доцетак-
села (6 циклов) или же монотерапия доксорубицином.
Для карциносарком предпочтителен режим ТАР (паклитаксел, доксорубицин, ци-
сплатин).
Для эндометриальных стромальных сарком — адъювантная гормонотерапия меге-
строла ацетатом, начиная с дозы 40 мг 2 раза в сутки и повышая затем до 80 мг 2 раза
в сутки в зависимости от переносимости в течение 6-12 мес., при хорошей переноси-
мости — более длительно.
При рецидивах и метастазах может быть использовано хирургическое лечение, ко-
торое также возможно для удаления изолированных метастазов. Наилучшие канди-
даты для оперативного вмешательства — больные с длительным интервалом без про-
грессирования и изолированными поражениями.
XT при распространенном процессе применяется с паллиативной целью.
Для карциносарком более эффективны цисплатинсодержащие режимы и ифосфа-
мид, в то время как для лейомиосарком — комбинация гемцитабина и доцетаксела.
Сообщается о 53% эффективности данной комбинации стремя полными регрессия-
ми и медианой выживаемости 18 мес.
Для второй линии XT может быть рекомендован темозоломид (Темодал), эффекты
от которого были достигнуты у 2 из 12 и у 5 из 11 больных в 2 исследованиях соответ-
ственно.
Для карциносарком наиболее активными считаются цисплатин (эффективность
19%), паклитаксел — 18%, ифосфамид — 29-39%, доксорубицин — 10 %, топотекан —
10%.
222
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Эффективны комбинированные режимы: паклитаксел + ифосфамид, доксоруби-
цин + циклофосфамид, цисплатин + ифосфамид, паклитаксел + карбоплатин, циспла-
ин + доксорубицин + дакарбазин.
Многие авторы предпочитают комбинацию ТАР или ТС (паклитаксел с карбоплати-
юм). Возможна также монотерапия ифосфамидом.
Для стромальных сарком при неэффективности гормонотерапии может быть реко-
лендован цисплатин один или в комбинации с паклитакселом либо доксорубицином,
i также монотерапия липосомным доксорубицином (Доксил, Келикс). При стромаль-
ных саркомах описаны отдельные эффекты от гормонотерапии прогестинами, а также
ингибиторами ароматазы и аналогами LH-RH.
Режимы терапии
См. саркомы мягких тканей (разд. 9.13).
9.11.7. Трофобластическая болезнь
Понятие «трофобластическая болезнь» включает пузырный занос, инвазивный пузыр-
ный занос (деструирующая хорионаденома) и хориокарциному как злокачественную
форму заболевания.
При всех типах трофобластической болезни продуцируется ХГ и его количество
пропорционально объему поражения. Поскольку а-ХГ обладает перекрестной ре-
активностью с лютеинизирующим гормоном, во избежание ошибок в диагностике
разработан метод определения /3-ХГ, который используют в качестве маркера забо-
левания.
Некоторые авторы выделяют плацентарную трофобластическую болезнь — чрез-
вычайно редкую опухоль, растущую из места прикрепления плаценты. Трофобласти-
ческие клетки инфильтруют миометрий с инвазией в сосуды, а уровень ХГ при этом
бывает низким.
Патоморфологически трофобластические неоплазмы подразделяют следующим
образом.
Пузырный занос составляет 1 случай на 1000-2000 беременностей (США и Евро-
па), хориокарцинома — 1 на 20 000-40 000. Трофобластическая болезнь — это забо-
левание репродуктивного возраста, которое чаще всего поражает женщин в возрасте
более 20 и менее 40 лет.
Трофобластическая болезнь
Доброкачественный (80%) процесс
Полный пузырный занос
Частичный пузырный занос
Плацентарная трофобластическая опухоль
(редко)
Эпителиоидная трофобластическая опу-
холь (редко)
Трофобластическая неоплазма (20%)
Инвазивный пузырный занос (18%)
Хориокарцинома (2%)
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 223
Химиотерапия солидных опухолей
> a-vW x-i “
9.11.7.1. Хориокарцинома
Это весьма редкое заболевание. В СССР в 1990 г. было выявлено 380 больных. Хорио-
карцинома наблюдается преимущественно у повторно беременных.
Считается, что хориокарцинома возникает из элементов трофобласта предшеству-
ющей беременности — нормальной или патологической (пузырный занос). По данным
РОНЦ РАМН, хориокарциноме предшествовали роды у 17,7% больных, аборты — у
39,2 %, пузырный занос — у 43 % больных.
Отдаленные метастазы встречаются у 5% больных. Хориокарцинома характеризу-
ется гематогенным метастазированием, наиболее частыми очагами являются легкие
(80%), влагалище (30%), малый таз (20%), печень (10%), головной мозг (10%), кишечник,
почки, селезенка (5 %).
Существует ряд классификаций трофобластической болезни, в частности по систе-
ме TNM (6-е издание, 2002) и объединенная классификация FIGO-WHO.
Классификация хориокарциномы по системе TNM
Первичная опухоль (Т)
ТХ — первичная опухоль не может быть определена.
Т — нет очевидной первичной опухоли.
Т1 — заболевание ограничено маткой.
Т2 — поражение вышло за пределы матки, но ограничено гениталиями: яичники, тру-
бы, влагалище, широкие связки.
Отдаленные метастазы (М)
МО — нет клинических метастазов.
М1а — метастазы в легких.
М1Ь — метастазы в других органах.
Соотношение классификаций TNM и FIGO представлены в табл. 9.33.
Таблица 9.33. Группировка хориокарциномы по стадиям TNM и FIGO
TNM FIGO Описание
ТХ Недостаточно данных для оценки первичной опухоли
то Первичная опухоль не определяется
Т1 I Опухоль ограничена маткой
Т2 II Опухоль распространяется на другие структуры: влагалище, яичник, широкую связку мат- ки, маточную трубу в виде метастазов или прорастания
М1а III Метастазы в легких
М1Ь IV Другие метастазы ± метастазы в легких
Стадии по FIGO подразделены на А, В, С соответственно факторам риска:
А — без факторов риска;
В — с одним фактором риска;
С — с двумя факторами риска;
Факторы риска по данной классификации:
1. ХГ> 100 000 ME в 24-часовой моче.
2. Признаки заболевания более чем через 6 мес. после завершения предшествую-
щей беременности.
224 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
Существуют различные системы оценки по факторам прогноза. Приводим модифи-
цированную систему оценки прогноза (классификация ВОЗ) (табл. 9.34).
Таблица 9.34. Модифицированная система прогноза хориокарциномы ВОЗ
Баллы
прогностический фактор 0 1
Возраст, лет <39 >39 — —
Предшествующая беременность Пузырный занос Аборт Беременность —
Интервал от беременности, мес. <4 4-6 7-12 >12
Уровень £-ХГ, ME <1000 1000-10 000 >10 000-100 000 >100 000
Наибольший размер опухоли, включая матку, см — 3-4 5 —
Локализация метастазов Легкие Селезенка, печень ЖКТ Головной мозг, печень
Число метастатических очагов 0 1-4 4-8 >8
Предшествующая неэффектив- ная XT — — Монотерапия > 2 препаратов
Общее число баллов суммируется, включая каждый прогностический фактор: об-
щий балл 0-6 — низкий риск, > 7 баллов — высокий риск.
Лечебные подходы определяются стадией болезни и степенью риска.
I. Неметастатическая стадия (FIGO I-III стадия, ВОЗ < 7 баллов).
1. Хороший прогноз. Ремиссии после XT у 100% больных. Гистерэктомия возмож-
на как составной компонент первоначальной терапии у больных, не желающих
иметь детей в будущем.
2. У большинства больных ремиссии достигают с помощью монохимиотерапии.
Наиболее активны метотрексат, дактиномицин и этопозид.
3. Лечение начинают с метотрексата. Далее возможен переход на:
а) другую монотерапию (например, дактиномицин), если уровень/3-ХГ растет по-
сле первоначально хорошего ответа;
б) комбинированную XT, если нет ответа и растет уровень /3-ХГ.
II. Высокий риск метастатической болезни (FIGO IV стадия, ВОЗ > 7 баллов).
1. Стандартом является комбинированная XT. Наиболее частый режим ЕМА/СО
(этопозид, метотрексат, дактиномицин, циклофосфамид, винкристин).
2. Терапия «спасения» или вторая линия включают комбинацию платиновых произ-
водных и этопозида с метотрексатом или дактиномицином (ЕЗ/ЕМА), блеомици-
ном (ВЕР), ифосфамидом (VIP, ICE) либо паклитакселом.
3. Следует знать о риске вторичных лейкозов, возрастающем в 16,6 раза через
5 лет после лечения этопозидом, а также вероятности вторичных опухолей, та-
ких как рак толстой кишки, РМЖ, меланомы, через 5, 10 и 25 лет соответствен-
но. Рекомендуется ограничить время лечения менее 6 мес., т.к. этот фактор име-
ет значение.
4. Дальнейшая беременность возможна без опасности отклонений у плода.
Больные трофобластической болезнью должны лечиться в региональных центрах
по трофобластической болезни или в специализированных онкологических центрах.
Наличие у больной хотя бы одного из факторов высокого риска является показани-
ем к комбинированной XT.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 225
Химиотерапия солидных опухолей
При хориокарциноме XT считается основным методом лечения, позволяющим со-
хранить детородную функцию у ряда пациенток.
Хирургическое лечение необходимо при неотложных состояниях в случаях маточ-
ного кровотечения, угрозе или перфорации матки. Плановые операции показаны при
большом размере матки (более 12 нед. беременности) и неэффективности XT. Изоли-
рованные метастазы также могут быть оперированы. Лучевая терапия имеет вспомо-
гательное значение при остаточной опухоли в параметрии, метастазах во влагалище и
головном мозге.
Метастазы в ЦНС. Применяют два вида воздействия: лучевая терапия (20-30 Гр по
2 Гр в день) и XT. Некоторые авторы склоняются к одновременному с лучевой тера-
пией введению метотрексата, однако это чревато возрастанием токсичности.
Альтернативой служит схема EMA/СО с или без одновременного интратекально-
го введения метотрексата в дозе 12,5 мг в 8-й день (день введения винкристина и ци-
клофосфамида), с последующим пероральным приемом лейковорина 15 мг через 24
и 36 ч. Повышенные дозы метотрексата при парентеральном введении создают адек-
ватный уровень метотрексата в цереброспинальной жидкости.
При плацентарном типе трофобластической болезни удаление матки считается ос-
новным методом лечения, т. к., несмотря на относительную доброкачественность этих
опухолей, они бывают резистентны к XT и могут быть фатальными.
Плацентарные трофобластические опухоли. Редкая форма опухоли трофо-
бласта, которая может инфильтрировать в окружающие ткани, распространяться по
лимфатическим путям, а также метастазировать преимущественно в легкие. Эта опу-
холь исключена из оценочной шкалы ВОЗ, поскольку отличается от типичной трофо-
бластической болезни.
Выбором лечения служит гистерэктомия при локализованном процессе. Для мета-
статической стадии болезни режимом XT является ЕР/ЕМА.
После начала XT эффект контролируют по снижению уровня сывороточного /3-ХГ.
Одним из важных условий успеха лечения служит раннее начало XT и ее продолжение
с короткими интервалами (14-21 дня) до нормализации уровня ХГ. Лечение продол-
жают до тех пор, пока показатели не будут оставаться на нормальном уровне в течение
3 нед., после чего проводится еще 1-3 курса терапии. Наблюдение с исследованием
уровня /?-ХГ продолжается затем в течение года.
Трофобластические опухоли чувствительны к метотрексату, дактиномицину, этопо-
зиду, даунорубомицину (Рубомицин).
Неметастатические опухоли лечат, используя преимущественно метотрексат или
метотрексат с фолинатом кальция (Лейковорин), а при нарушении функции печени —
дактиномицин. При наличии метастазов у больных с хорошим прогнозом проводят XT
метотрексатом с фолинатом кальция, при резистентности — комбинированную хи-
миотерапию: EMA-СО (этопозид, метотрексат, дактиномицин, циклофосфамид, вин-
кристин), МАС (метотрексат, дактиномицин, хлорамбуцил).
У больных с высоким риском лечение начинают с комбинированной XT (обычно
комбинация EMA-СО, реже — МАС), при резистентности переходят на комбинации,
содержащие производные платины (ЕМА-РЕ — известная также как комбинация ЕМА-
СЕ), либо другие альтернативные режимы.
У женщин, излеченных с помощью только XT, восстанавливается менструальный
цикл. Они способны забеременеть, нормально выносить беременность и благополуч-
но родить нормального, доношенного и жизнеспособного ребенка. Женщинам реко-
мендуют не беременеть в течение года после лечения.
226 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли женских половых органов
По данным РОНЦ, удается достичь излечения 97 % больных во всех стадиях заболе-
вания; в I и II стадиях — до 100%, IIIА стадии — 80%, IIIB стадии — 97 %, IV стадии — 60%
больных.
Режимы терапии
Для больных с низким риском
1 -я линия:
1. Метотрексат — 1 мг/кг в/в или в/м в 1, 3, 5 и 7-й дни.
Фолинат кальция (Лейковорин) — 0,1 мг/кг в/м через 24 ч после введения метотрек-
сата.
Повторение цикла с 15-го дня XT.
2. Метотрексат — 0,4 мг/кг/сут (максимальная суточная доза — 25 мг) в/в или в/м
ежедневно в 1-5-й день каждые 2 нед. (максимально на цикл — 125 мг).
3. Метотрексат — 100 мг/м2 инфузионно с последующей 12-часовой инфузией
200 мг/м2 метотрексата с лейковорином или без него.
4. Метотрексат — 30-50 мг/м2 еженедельно до падения уровня ХГ до нормы в тече-
ние 3 последовательных недель.
2-я линия:
1. Дактиномицин — 300 мкг/м2 в/в в 1-5-й день.
Повторение цикла с 15-го дня.
2. Дактиномицин — 1,25 мг/м2 в/в 1 раз в 2 нед., по крайней мере 2 курса.
3. Этопозид — 100 мг/м2 ежедневно 5 дней каждые 10 дней до получения ремиссии.
4. 5-фторурацил — 30 мг/кг ежедневно в течение 10 дней каждые 28 дней.
EMA-C0 (для больных с плохим прогнозом)
Курс 1. 1-й день: 100 мг/м2 этопозида (за 30 мин) + 100 мг/м2 метотрексата в/в с по-
следующей 12-часовой инфузией 200 мг/м2 метотрексата + 0,5 мг дактиномицина в/в.
2-й день: 100 мг/м2 этопозида (за 30 мин) + 0,5 мг дактиномицина в/в + 15 мг фоли-
ната кальция (Лейковорин) внутрь или в/м каждые 12 ч (4 дозы) начиная через 24 ч по-
сле метотрексата.
Курс 2: 1 мг/м2 винкристина + 600 мг/м2 циклофосфамида в/в (за 30 мин) в 8-й день.
Альтернирующие курсы проводятся еженедельно, таким образом, лечение проводит-
ся в 1, 2, 8, 15, 16 и 22-й дни ит.д.
ЕМА-РЕ (ЕМА-СЕ)
Этопозид — 100 мг/м2 в/в капельно в 1-й и 2-й дни.
Метотрексат — 100 мг/м2 в/в струйно с последующей 12-часовой инфузией
1000 мг/м2 в 1-й день.
Дактиномицин — 500 мкг в/в в 1-й и 2-й дни.
Фолинат кальция (Лейковорин) — 30 мг в/в через 24 ч после введения метотрексата,
затем каждые 12 ч, всего 8 доз.
Цисплатин — 60 мг/м2 в/в в 8-й день.
Этопозид — 100 мг/м2 в/в в 8-й день.
Повторение циклов с 15-го дня XT.
Этот режим может быть использован при рефрактерности или резистентности к
EMA/СО. Другим режимом при резистентности может быть ЕР (этопозид, цисплатин).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 227
Химиотерапия солидных опухолей
Модифицированный. MAC III
Метотрексат — 1 мг/кг/сут в/м в 1, 3, 5 и 7-й дни.
Лейковорин — 0,1 мг/кг/сут в/м, в/в или внутрь во 2,4, 6 и 8-й дни.
Дактиномицин — 12 мкг/кг/сут в/в в 1-5-й день.
Циклофосфамид — 3 мг/кг/сут в/в в 1-5-й день.
Повторение цикла каждые 21 день.
ЕНММАС (альтернативное лечение для больных с плохим прогнозом)
Курс 1: 100 мг/м2 этопозида в/в в 200 мл физиологического раствора ежедневно в
1-5-й день.
Курс 2: 0,5 г гидроксимочевины внутрь с повторением каждые 12 ч (всего 2 дозы)
в 1-5-й день + 50 мг метотрексата (или 1 мг/кг, но не более 70 мг) в/м каждые 48 ч
(4 дозы) во 2,4,6 и 8-й дни + 6 мг фолината кальция (Лейковорин) в/м через 30 ч после
каждой дозы метотрексата и 75 мг внутрь в альтернирующие (без метотрексата) дни.
Курс 3: 0,5 мг дактиномицина в/в в 1-5-й день.
Курс 4: 1 мг/м2 винкристина в/в + 400 мг/м2 циклофосфамида в/в в 1-й и 3-й дни. Курс
проводят с интервалом 10-14 дней в зависимости от токсичности.
Другие режимы
Высокие дозы 5-ФУ и дактиномицин.
Паклитаксел один или в комбинации с ифосфамидом, карбоплатином, цисплатином.
Цисплатин + этопозид.
Может быть использована высокодозная XT ифосфамидом, карбоплатином и этопози-
дом с КСФ и трансплантацией стволовых клеток.
Некоторые авторы рекомендуют использовать КСФ для первичной профилактики
ФН у больных с высоким риском ее развития с учетом возраста, анамнеза, характери-
стики заболевания и предполагаемой миелотоксичности режима лечения.
Вторичная профилактика (введение КСФ) при последующих курсах рекомендуется
больным, имеющим нейтропенические осложнения после первого курса. Целью яв-
ляется сохранение дозы и режима лечения.
Г-КСФ может быть введен в 3-4-й день, затем в 9-14-й день при лечении по схемам
EMA/СО и ЕМА/ЕР и в 6-14-й день при VIP/ICE, PVB или ВЕР. Альтернативой служит пе-
гилированная форма Г-КСФ (пэгфилграстим) с пролонгированным периодом полувы-
ведения, который может вводиться однократно.
9.11.7.2. Пузырный занос
Целесообразность проведения XT всем больным с профилактической целью после
удаления пузырного заноса остается спорной.
Больным с повышенным риском (возраст старше 40 лет, большой срок беремен-
ности, предшествовавшее применение прогестинов) показана XT метотрексатом или
дактиномицином. После удаления пузырного заноса обязательно наблюдают за уров-
нем ХГ с еженедельным его измерением до показателя менее 100 МЕ/мл, затем — ка-
ждые 2 нед. вместе с гинекологическим осмотром. Рентгенография грудной клетки
осуществляется каждые 4-6 нед. до снижения ХГ до нормального уровня. После это-
го уровень /3-ХГ определяется каждые 2 нед. в течение первых 3 мес., затем — каждый
месяц в течение 3 мес., каждые 2 мес. — в течение последующих 6 мес., затем — ка-
ждые 6 мес. в течение 3 лет.
228 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
После удаления пузырного заноса повышенные титры ХГ исчезают, как правило, в
течение 8-10 нед., однако приблизительно у 25% этот срок удлиняется до 14—16 нед.
Повышенный титр гормона после этого срока, так ясе как и увеличение размера матки,
служит показанием к XT.
XT проводится в тех же режимах, что и при неметастатической хориокарциноме.
9.12. Опухоли мочеполовых органов
9.12.1. Рак почки
Л. В. Манзюк
Злокачественные опухоли почки составляют около 2-3 % все злокачественных новоо-
бразований. В последние годы отмечается рост заболеваемости: в России в 2001 г. вы-
явлено 13 933 вновь заболевших, а в 2006 г. — 16 032. Смертность также неуклонно
растет. Мужчины болеют чаще женщин.
До 85 % первичных злокачественных эпителиальных опухолей почки представлены
почечноклеточной аденокарциномой, исходящей из паренхимы (син.: светлоклеточ-
ный рак, гипернефроидный рак, опухоль Гравитца).
Около 7 % опухолей почки приходятся на переходноклеточный рак почечной лохан-
ки, исходящий, как и переходноклеточный рак мочеточников, из эпителия коллектор-
ной системы. По своим биологическим особенностям эти опухоли близки к переход-
ноклеточному раку мочевого пузыря.
Классификация рака почки по системе TNM (2002)
Первичная опухоль (Т)
ТХ — первичная опухоль не может быть оценена.
ТО — нет подтверждения наличия первичной опухоли.
Т1 — опухоль до 7 см.
Т1а — опухоль до 4 см.
Tib — опухоль 4 см и более.
Т2 — опухоль более 7 см.
ТЗ — опухоль, вовлекающая вены, или надпочечники, или околопочечную клетчатку,
не выходя за пределы фасции Героты.
ТЗа — распространение на надпочечник или околопочечную клетчатку, не выходя за
пределы фасции Героты.
ТЗЬ — вовлечение в процессу, renalis или v. cava ниже диафрагмы.
ТЗс — вовлечение в процесс v. renalis или v. cava выше диафрагмы.
Т4 — опухоль распространяется за пределы фасции Героты.
Регионарные лимфоузлы (N)
N1 — метастазы в 1 лимфоузле.
N2 — метастазы более чем в 1 лимфоузле.
В табл. 9.35 приведена группировка рака почки по стадиям.
Таблица 9.35. Группировка рака почки по стадиям
Стадия TNM
I____________________Т1 NO МО
II Т2 NO МО
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
229
Химиотерапия солидных опухолей
Стадия TNM
... Т1 N1 МО, Т2N1 МО, ТЗа NO МО, ТЗа N1 МО, ТЗЬ NO МО, ТЗЬ N1 МО, ТЗс NO МО, ТЗс N1 МО,
2__________Т4 NO МО, Т4 N1 МО, Тлюбая N2 МО______________________________
IV Тлюбая Nnioban М1
Основным фактором прогноза при раке почки служит стадия заболевания в момент
установления диагноза: 10-летняя выживаемость при I стадии более 80%, при IV ста-
дии медиана выживаемости менее 1 года. Продолжительность жизни большинства
неоперированных больных с опухолью почки с момента появления первых симпто-
мов составляет 1-3 года, но известны единичные случаи индолентного течения болез-
ни, когда пациенты живут 5 лет и более. Длительное выживание наблюдается в ряде
случаев после хирургического удаления первичной опухоли и единичных отдаленных
метастатических узлов, включая единичные метастазы в головном мозге.
Рак почки — одно из редких заболеваний, при котором описаны случаи спонтанной
регрессии опухоли без проведения специфического лечения.
Единственный радикальный метод лечения опухолей почки — нефрэктомия. Резек-
ция может использоваться при двустороннем поражении, чтобы избежать диализа или
трансплантации, разрабатываются и другие методы местного воздействия.
Аденокарцинома почки и ее метастазы малочувствительны к лучевой терапии. Од-
нако ее используют с паллиативной целью для местного контроля и снятия болевого
синдрома при костных поражениях, иногда — при метастазах в головном мозге.
Рак почки — одна из наиболее устойчивых к XT опухолей, что обусловлено гиперэк-
спрессией гена множественной лекарственной устойчивости (MDR).
Эффективность таких препаратов, какломустин (CCNU), фторбензотеф, блеомицин,
винбластин, винкристин, цисплатин, этопозид, доксорубицин, гидроксимочевина, ци-
клофосфамид, метотрексат, незначительна. Комбинированная XT при раке почки так-
же малоэффективна (до 5 %).
Попытки использования прогестинов, антиэстрогенов оказались безуспешными.
Для оценки перспектив системного медикаментозного лечения метастатического
рака почки используют следующие прогностические факторы (критерии MSKC — Me-
morial Sloan Kettering Cancer Center):
И общее состояние по шкале Карновского не более 70 %;
количество пораженных органов 3 и более;
низкий уровень гемоглобина;
высокий уровень кальция сыворотки (> 10 мг/дл);
И активность ЛДГ сыворотки, превышающая норму в 1,5 раза;
интервал менее 1 года от постановки диагноза до начала лечения.
Также к неблагоприятным факторам относится неудаленная опухоль. При отсутст-
вии перечисленных факторов прогноз благоприятный (низкий риск). Если сумма фак-
торов риска менее 3, прогноз средний (промежуточный риск) и медиана выживаемо-
сти 10-20 мес. При сумме факторов риска 3 и более прогноз плохой (высокий риск) и
медиана выживаемости около 4 мес.
На протяжении более 20 последних лет стандартом лечения при метастатическом
раке почки была неспецифическая иммунотерапия с использованием цитокинов: ин-
терфероны, интерлейкины. Продолжается изучение возможностей специфической
иммунотерапии вакцинами.
Нефрэктомия, выполненная перед медикаментозным лечением, увеличивает вре-
мя до прогрессирования и общую выживаемость. ИФН-а дает до 15 % объективных
ремиссий. Регрессиям подвергаются, как правило, единичные метастазы в легких не-
большого размера. Эффект от применения ИФН может иногда проявляться через не-
230 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
сколько месяцев после начала терапии. Лечение необходимо проводить постоянно,
не прерывая его и после достижения ремиссии. Препараты ИФН вводят в дозе от 6 до
20 млн ЕД; они вызывают такие побочные эффекты, как гипертермия, боль в мышцах,
иногда — снижение массы тела. По эффективности с ИФН может конкурировать толь-
ко ИЛ-2 (Пролейкин), который дает до 20% объективных ремиссий, включая 5% пол-
ных регрессий опухоли. ИЛ-2 характеризуется выраженными побочными эффектами.
Оптимальные дозы и режимы введения ИЛ-2 окончательно не установлены. Сущест-
вуют режимы высоких и низких доз (см. ниже). Высокодозная терапия более эффек-
тивна, но и высокотоксичная. Сочетанное лечение ИЛ-2 с ИФН-ct не показало преиму-
ществ перед применением только высоких доз ИЛ-2.
Появление лекарственных средств молекулярно-нацеленного механизма действия
и внедрение в практику таргетной терапии открыли определенные перспективы для
больных с метастатическим раком почки. Рандомизированные плацебо-контролируе-
мые исследования показали эффективность антиангиогенного препарата бевацизума-
ба в комбинации с ИФН-а в 1-й линии терапии, что позволяет почти в 2 раза увеличить
время до прогрессирования — с 5,2 до 8,5 мес. Мультитаргетные ингибиторы тиро-
зинкиназ (сунитиниб и сорафениб), оказывающие антиангиоген ное и антипролифера-
тивное действие на опухоль, эффективны в 1-й и 2-й линиях, в т.ч. при резистентности
к терапии с цитокинами. При этом удается получить объективные ремиссии и стабили-
зацию 3 мес. и более с медианой времени до прогрессирования выше 24 нед.
Специфический ингибитор mTOR темсиролимус (Торизел) показал увеличение об-
щей выживаемости у больных с плохим прогнозом по сравнению с ИФН-сс (8,2
6,8 мес. соответственно). У пациентов после неудачи антиангиогенной терапии назна-
чение эверолимуса (Афинитор) позволяет добиться ответа на лечение у 69% пациен-
тов, при этом у 25 % отмечается стабилизация заболевания после 10 месяцев терапии.
Эверолимус показал клиническую эффективность во всех возрастных группах и во
всех группах прогноза.
Современные рекомендации по лечению метастатического почечноклеточного
рака в зависимости от прогноза включают ИФН-ct в комбинации с высокими дозами
бевацизумаба или сунитиниб (Сутент) в первой линии у больных с низким или умерен-
ным риском. В качестве второй линии терапии эти пациенты могут получать сорафе-
ниб (Нексавар). Больным группы высокого риска в качестве терапии 1-й линии можно
назначать темсиролимус. Эверолимус включен в рекомендации по терапии распро-
страненного рака почки и может быть назначен больным, у которых отмечено про-
грессирование заболевания после терапии антиангиогенными препаратами (сунити-
нибом, сорафенибом, другими препаратами направленного на VEGFR воздействия).
Современный алгоритм терапии метастатического рака почки приведен в табл. 9.36.
Таблица 9.36. Современный алгоритм терапии метастатического рака почки
Гистологический Группа риска Стандарт Возможные
вариант варианты
Светлоклеточный рак
1-я линия Низкий или промежуточный риск Высокий риск Сунитиниб Бевацизумаб + интерферон Темсиролимус Цитокины Сунитиниб
2-я линия Ранее получавшие цитокины Получавшие ингибиторы тиро- зинкиназы Сорафениб Эверолимус Сунитиниб
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 231
Химиотерапия солидных опухолей
Гистологический Гпоп„_ вариант Группа риска Стандарт Возможные варианты
Несветлоклеточный рак Темсиролимус Сунитиниб
Сорафениб
Режимы терапии
1. Алдеслейкин (Пролейкин) — 9-18 х 106 ЕД п/к 3-5 раз в неделю в течение 4-6 нед.
Интервал между курсами 2-3 нед. (амбулаторный режим).
2. Алдеслейкин (Пролейкин) — 600 000-720 000 МЕ/кг в/в в течение 15 мин каждые
8 ч в течение 5 дней.
Перерыв 7-10 дней, затем повторный курс (стационарный режим).
3. Реаферон (ИФН-сс) — 3 млн ЕД в/м ежедневно в течение 10-14 дней.
Интервал между курсами 3 нед.
4. Интрон А (ИФН-«-2Ь) — 6 млн ЕД/м2 п/к 3 раза в неделю или в том же режиме, как
Реаферон.
5. Бевацизумаб (Авастин) — 10 мг/кг в/в капельно 1 раз в 2 нед. в комбинации с ИФН-сс,
длительно.
6. Сунитиниб (Сутент) — 50 мг внутрь ежедневно в течение 4 нед., затем перерыв
2 нед.
Повторение циклов каждые 6 нед.
7. Сорафениб (Нексавар) — 400 мг внутрь 2 раза в сутки (утром и вечером) ежеднев-
но, длительно.
8. Темсиролимус (Торизел) — 25 мг в/в капельно 30-60-минутная инфузия 1 раз в не-
делю, до прогрессирования или неприемлемой токсичности.
9. Эверолимус (Афинитор) — 10 мг ежедневно однократно внутрь, до прогресси-
рования. При появлении признаков плохой переносимости возможно снижение
дозы на 2 уровня — 5 мг ежедневно внутрь однократно, 5 мг 1 раз в 2 дня.
9.12.2. Рак мочевого пузыря
Л. В. Манзюк
Новообразования мочевого пузыря встречаются довольно часто, занимая 2-е место
среди всех онкоурологических заболеваний. Заболеваемость в последние годы имеет
тенденцию к росту, в 2006 г. в России выявлен 12 721 больной раком мочевого пузыря.
Мужчины страдают в 4 раза чаще женщин. В основном заболевают лица старше 60 лет.
Опухоли мочевого пузыря по гистогенезу достаточно разнообразны, но в подавляю-
щем большинстве случаев имеют эпителиальную природу (95%). Эпителиальные опу-
холи бывают доброкачественными (папиллома) и злокачественными (переходнокле-
точный рак, ПКР, аденокарцинома). Переходноклеточный рак составляет более 90%,
ПКР — 6-8%, аденокарцинома — около 2%. Гистологический вариант, распростра-
ненность и глубина инвазии первичной опухоли, степень ее дифференцировки (G)
служат важнейшими факторами прогноза при раке мочевого пузыря.
Различают высокодифференцированный (G1), умеренно дифференцированный
(G2) и низкодифференцированный (G3) рак. К важным биологическим факторам про-
гноза относятся плоидность опухоли и наличие ряда генетических нарушений. Мута-
ция и гиперэкспрессия гена р53 связаны с плохим прогнозом при поверхностном, ин-
вазивном раке и карциноме in situ.
232 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
Классификация рака мочевого пузыря по системе TNM
Первичная опухоль (Т)
Т — первичная опухоль не может быть оценена.
ТО — нет данных о первичной опухоли.
Та — неинвазивная папиллярная карцинома.
Tis — карцинома in situ (плоская опухоль).
Т1 — опухоль распространяется на субэпителиальную соединительную ткань.
Т2 — опухолевая инвазия мышечного слоя.
Т2а — опухолевая инвазия поверхностного мышечного слоя (внутренняя половина).
Т2Ь — опухолевая инвазия глубокого мышечного слоя (наружная половина).
ТЗ — опухоль распространяется на паравезикальную клетчатку.
ТЗа — микроскопически.
ТЗЬ — макроскопически (экстравезикальный конгломерат).
Т4 — опухоль распространяется на любой из следующих органов: простата, матка, вла-
галище, стенка таза, брюшина.
Т4а — опухолевая инвазия простаты или матки, влагалища.
Т4Ь — опухолевая инвазия стенки таза или брюшной стенки.
Регионарные лимфоузлы (N)
N1 — метастазы в 1 лимфоузле до 2 см.
N2 — метастазы в 1 лимфоузле более 2 см, но менее 5 см или в нескольких лимфоуз-
лах до 5 см.
N3 — метастазы более 5 см.
Группировка рака мочевого пузыря по стадиям дана в табл. 9.37.
Таблица 9.37. Группировка рака мочевого пузыря по стадиям
Стадия TNM
0 Tis или Та NO МО
1 Т1 NO МО
II T2a-b NO МО
III ТЗа-b или Т4а NO МО
IV T4b NO МО или Тлюбая N1-3 МО-1
Выбор метода лечения и прогноз при раке мочевого пузыря зависят от стадии забо-
левания. Около 70-80% больных с впервые установленным диагнозом имеют повер-
хностный рак. При поверхностных опухолях прогноз считается благоприятным: 5 лет
живут около 70-80% больных, но Ю-летняя выживаемость составляет только 43%.
Хуже прогнозу больных с инвазивными опухолями. Неудовлетворительны результаты
лечения больных с опухолевой инфильтрацией паравезикальной клетчатки.
Первичная карцинома in situ представляет собой интраэпителиальную опухоль с
низкой степенью дифференцировки (G3). Течение этого новообразования часто не-
предсказуемо: опухоль может протекать годами, не инвазируя стенку мочевого пузы-
ря, или принимать агрессивное течение с инфильтрацией стенки пузыря и метастази-
рованием. Риск развития инвазивного рака при различных формах карциномы in situ
колеблется от 40 до 70-80%.
Основной метод лечения рака мочевого пузыря — хирургическое вмешательство.
При поверхностных опухолях (Т0-1) с низкой степенью злокачественности пред-
почтение отдается трансуретральной резекции (ТУР), которая обеспечивает локаль-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 233
Химиотерапия солидных опухолей
ный контроль более чем у 80% больных. Однако ТУР не предупреждает возникно-
вение рецидивов в других отделах мочевого пузыря причем с более выраженной
степенью злокачественности, т.к. поверхностные опухоли имеют склонность к реци-
дивированию и прогрессированию — переход в инвазивную форму. При опухолях
промежуточного и высокого риска развития рецидивов после ТУР (Та-Т 1), а также для
лечения карциномы m situ используется внутрипузырная XT, которая улучшает безре-
цидивную выживаемость, не оказывая влияния на общую продолжительность жизни.
Методом выбора служит внутрипузырное введение вакцины БЦЖ. Обычно 50-
100 мг, разведенных в 50 мл изотонического раствора натрия хлорида, вводят на 2 ч
1 раз в неделю в течение 6 нед. Если эффект недостаточен, продолжают лечение еще
6 нед., при поддерживающей терапии доза БЦЖ может быть снижена до 90 мг.
При внутрипузырной БЦЖ-терапии карциномы in situ (Tis) ответ на лечение являет-
ся одним из факторов прогноза: при достижении полного эффекта риск прогрессиро-
вания в течение 5 лет низок — 20%, если полного эффекта нет, этот показатель возра-
стает до 95 %.
Для внутрипузырной XT используются следующие препараты.
Митомицин — 40 мг в 40 мл изотонического раствора натрия хлорида внутрипузыр-
но 1 раз в неделю в течение 8 нед.
Эпирубицин (Фарморубицин) — 50 мг в 50 мл дистиллированной воды внутрипу-
зырно на 1 ч еженедельно в течение 8 нед.
Доксорубицин — 50 мг в 50 мл дистиллированной воды внутрипузырно на 1 ч еже-
недельно в течение 6-8 нед.
Тиотепа — 60 мг в 50 мл или 30 мг в 30 мл 0,5% раствора новокаина внутрипузырно
на 1 ч 1-2 раза в неделю до суммарной дозы 240-300 мг.
При применении внутрипузырной XT с целью профилактики рецидива после ТУР ис-
пользуют те же препараты в аналогичных дозах, но вводят 1 раз в месяц в течение 10-
12 мес. Внутрипузырную терапию ИФН-ct проводят в дозе 50-100 млн ЕД ежемесяч-
но в течение 9 мес.
Эффективность внутрипузырной XT составляет 40-70%. Активность вакцины БЦЖ
для предупреждения рецидивов выше, поэтому ей отдается предпочтение.
Изучаются возможности фотодинамической терапии как второй линии при рези-
стентности к БЦЖ. Таким образом, основным методом лечения поверхностного рака
мочевого пузыря является ТУР ± внутрипузырная БЦЖ или XT. У отдельных больных
выполняется радикальная цистэктомия.
При инвазивном раке мочевого пузыря основной метод лечения — операция: ТУР,
резекция, радикальная цистэктомия.
В качестве дополнительного воздействия при хирургическом лечении применяют
лучевую терапию. Как самостоятельный метод лечения облучение используют обыч-
но при неоперабельных опухолях с паллиативной целью. Дистанционная гамма-тера-
пия с одновременным введением цисплатина дает лучшие результаты, чем одна луче-
вая терапия. Высокий риск рецидивов после радикальной цистэктомии (50%) диктует
необходимость проведения неоадъювантной ПХТ с включением препаратов платины.
Неоадъювантная XT повышает резектабельность, дает полную патоморфологическую
регрессию опухоли более чем в 30% случаев, оказывает раннее воздействие на ми-
крометастазы и лучше переносится, чем адъювантная XT, которая в настоящее время
в стандарты лечения не входит. Метаанализ нескольких рандомизированных исследо-
ваний показал, что неоадъювантная ПХТ на основе препаратов платины перед цистэк-
томией увеличивает 5-летнюю выживаемость с 45 до 55 %, уменьшая риск смерти на
13%. Системная XT как самостоятельный метод лечения используется при метастати-
ческом раке мочевого пузыря и при рецидивах заболевания.
234 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛ ЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
Рак мочевого пузыря чувствителен к цисплатину, карбоплатину и оксалиплатину,
паклитакселу, гемцитабину, метотрексату, ифосфамиду, доксорубицину, фторура-
цилу, винбластину, митомицину, пеметрекседу. Предпочтение отдается ПХТ. До по-
явления гемцитабина наиболее активным и часто используемым был режим M-VAC
(метотрексат, винбластин, доксорубицин, цисплатин). В настоящее время стандартом
лечения стала комбинация гемцитабина с цисплатином или карбоплатином. Рандоми-
зированные исследования показали равную эффективность комбинации гемцитабина
с цисплатином (GP) по сравнению с М-VAC по частоте эффекта, времени до прогресси-
рования и общей выживаемости, но значительно большую токсичность. Комбинация
паклитаксела с карбоплатином во второй линии терапии дает до 20% эффекта. Изуча-
ется активность тройной комбинации: цисплатин + гемцитабин + паклитаксел, в т.ч. и в
качестве неоадъювантного лечения. При диссеминированном процессе в ряде случаев
используется высокодозный режим М-VAC с поддержкой Г-КСФ, который дает 5-лет-
нюю выживаемость 22 ps 14% при стандартном режиме.
Режимы терапии
Цисплатин — 50-60 мг/м2 в/в капельно в 1-й день.
Гемцитабин (Гемзар) — 800-1000 мг/м2 в/в капельно в 1-й и 8-й дни.
Повторение цикла через 28 дней.
Гемцитабин (Гемзар) — 1000 мг/м2 в/в в 1-й день.
Оксалиплатин — 100 мг/м2 в/в 2-часовая инфузия во 2-й день.
Повторение циклов каждые 2 нед.
Паклитаксел — 175 мг/м2 3-часовая в/в инфузия в 1-й день.
Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Повторение циклов каждые 3 нед.
Доцетаксел — 75 мг/м2 1-часовая в/в инфузия в 1-й день.
Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Повторение циклов каждые 3 нед.
M-VAC
Метотрексат — 30 мг/м2 в/в в 1-й день.
Винбластин — 3 мг/м2 в/в во 2-й день.
Доксорубицин (Адриамицин) — 30 мг/м2 в/в во 2-й день.
Цисплатин — 70 мг/м2 в/в капельно во 2-й день.
Повторение циклов каждые 4 нед.
Дозы метотрексата и винбластина повторяют в 15-й и 22-й дни при нормальных пока-
зателях крови.
M-VEC
Тот же режим с заменой доксорубицина на эпирубицин (Фарморубицин) 50 мг/м2.
CMV
Цисплатин — 100 мг/м2 в/в капельно во 2-й день.
Метотрексат — 30 мг/м2 в/в в 1-й и 8-й дни.
Винбластин — 4 мг/м2 в/в в 1-й и 8-й дни.
Повторение циклов через 3 нед.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 235
Химиотерапия солидных опухолей
CISCA (САР)
Циклофосфамид — 400 мг/м2 в/в в 1-й день.
Доксорубицин (Адриамицин) — 40 мг/м2 в/в в 1-й день.
Цисплатин — 70 мг/м2 в/в капельно в 1-й день.
Повторение циклов через 4 нед.
Карбоплатин — AUC 5 в/в капельно в 1-й день.
Метотрексат — 40 мг/м2 в/в в 1-й и 8-й дни.
Винбластин — 4 мг/м2 в/в в 1-й и 8-й дни.
Повторение циклов каждые 4 нед.
9.12.3. Рак простаты
77. В. Манзюк
Рак простаты — одна из наиболее распространенных злокачественных опухолей у
мужчин старшей возрастной группы. Заболеваемость наиболее высока в развитых
странах, в развивающихся — существенно ниже. В России рак простаты занимает 4-е
место (после рака легкого, желудка и кожи), в последние годы отмечается рост забо-
леваемости и смертности. Более чему 20% заболевание диагностируется в IV стадии.
При этом лишь 30% мужчин погибают от прогрессирования болезни, остальные 2/3 —
от других причин, в первую очередь от сердечно-сосудистых заболеваний.
В США заболеваемость раком простаты находится на 1-м месте. Благодаря активно-
му скринингу с исследованием ПСА (простатический специфический антиген — наи-
более эффективный маркер) выявляемость рака простаты в США выросла в 90-е годы
XX в. на 50% по сравнению с предыдущим десятилетием. У 50% лиц с показателем
ПСА > 3-4 мг/мл выявляется рак простаты. Маркер играет важную роль не только для
диагностики, но и мониторинга в процессе лечения и прогноза.
Аденокарцинома (ацинарная) — наиболее частая гистологическая форма (95%),
редкие формы — протоковая, муцинозная, мелкоклеточная, переходноклеточная
аденокарцинома. Прогностически важно определение степени дифференцировки
опухоли, которая может быть высокой (G1), умеренной (G2) и низкой (G3-4).
Важное практическое значение имеет гистологическая классификация Глисона, в
основу которой заложена оценка степени дифференцировки железистых структур
опухоли по 5-балльной шкале — от высокодифференцированной (1) до низкодиффе-
ренцированной (5). Поскольку рак простаты имеет неоднородную структуру, для оп-
ределения числа Глисона складывают две наиболее часто встречающиеся градации.
Таким образом, опухоли с числом Глисона 2-4 являются высоко и хорошо дифферен-
цированными. Чем выше это число, тем ниже степень дифференцировки, самые не-
дифференцированные имеют показатель 8-9. Промежуточные опухоли (число 5-6 и
7) — умеренно- и низкодифференцированные. Число Глисона — важный прогности-
ческий фактор, учитываемый при выборе лечебной тактики и оценке прогноза.
Классификация рака простаты по системе TNM (UICC, 6-е издание, 2002)
Первичная опухоль (Т)
ТХ — недостаточно данных для оценки первичной опухоли.
ТО — первичная опухоль не определяется.
Т1 — опухоль клинически не определяется.
236 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
Т1а — при гистологическом исследовании опухоль занимает 5% или менее удаленной
ткани при ТУР простаты.
Tib-— опухоль занимает более 5 % удаленной ткани.
Tie — опухоль определяется при пункционной биопсии.
Т2 — опухоль ограничена простатой.
Т2а — опухоль ограничена половиной одной доли.
Т2Ь — опухоль занимает более половины одной доли.
Т2с — опухоль занимает обе доли.
ТЗ — опухоль выходит за пределы капсулы простаты.
ТЗа — опухоль прорастает простату с одной стороны или билатерально.
ТЗЬ — опухоль переходит на семенные пузырьки.
Т4 — опухоль фиксирована или переходит на соседние структуры (кроме семенных
пузырьков): шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцы-ле-
ваторы, стенки таза.
Регионарные лимфоузлы (N)
NX — недостаточно данных для оценки регионарных лимфоузлов.
NO — метастазов в регионарных лимфоузлах нет.
N1 — есть метастазы в регионарных лимфоузлах.
Отдаленные метастазы (М)
MX — недостаточно данных для определения отдаленных метастазов.
МО — нет признаков отдаленных метастазов.
Ml — имеются отдаленные метастазы.
М1а — есть метастазы в лимфоузлах, но не регионарных.
М1Ь — есть метастазы в костях.
М1с — другие отдаленные метастазы.
Таблица 9.38. Группировка рака простаты по стадиям
Стадия TNM
J________________Т1а NO МО G1_______________________________
Т1а NO M0G2-4
II T1b NO МО блюбая
_________________Т2 NO МО блюбая________________________
III _____________ТЗ NO МО блюбая_______________________
Т4 NO МО блюбая
IV Тлюбая N1 МО блюбая
Тлюбая Nлюбaя М1 блюбая
Правильное определение стадии процесса имеет решающее значение для выбора
тактики лечения. При этом выделяется локализованный рак, когда опухоль не выходит
за пределы капсулы простаты (Т1-2). Местнораспространенный рак сопровождает-
ся прорастанием опухолью капсулы простаты, либо вовлечением в процесс сосед-
них органов (ТЗ-4), либо метастазами в регионарных лимфоузлах (N1) независимо от
категории Т. Распространенный рак характеризуется метастазами в лимфоузлах таза
и/или наличием отдаленных метастазов (N+M+).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 237
Химиотерапия солидных опухолей
Продолжительность жизни больных раком простаты определяется стадией заболе-
вания. При I стадии 90% больных живут более 10 лет, при II стадии этот показатель со-
ставляет 60-70%, при III стадии — 30-40% и при IV стадии — 10-15%.
Существует строгая корреляция между клинической стадией, степенью диффе-
ренцировки опухоли, ее биологическими особенностями и прогнозом. Кроме уров-
ня ПСА прогностическими факторами служат размер опухоли в каждой клинической
стадии, уровень кислой фосфатазы в сыворотке крови, поражение регионарных лим-
фоузлов, обнаруживаемое при сканировании поражение костей, эффективность про-
водимой терапии. Тактика лечения зависит от стадии болезни, возраста и общего со-
стояния пациента. Радикальное лечение, включающее радикальную простатэктомию
или лучевую терапию, возможно только при локализованном раке простаты. Больные
старше 60 лет с опухолью Т1а могут только наблюдаться, их выживаемость не отлича-
ется от группы контроля.
При II стадии (Tib, Tic, Т2) тактика лечения спорна, т.к. общепризнанные методы —
радикальная простатэктомия и радикальная лучевая терапия — дают одинаковые отда-
ленные результаты. Возможно также активное наблюдение за пациентами с опухоля-
ми низкой степени злокачественности. Выбор тактики определяется с учетом общего
состояния пациента и осложнений, присущих каждому методу. Рецидивы болезни по-
сле радикального лечения наблюдаются у 20-25 % больных этой группы.
У больных с местнораспространенным процессом (III стадия) основным методом
лечения считается лучевая терапия, дающая 5-летнюю выживаемость от 70 до 80%.
Одновременно с радикальной лучевой терапией, до или после нее, применяются ме-
тоды андрогенного подавления, что улучшает показатели безрецидивной выживаемо-
сти и повышает радиочувствительность опухолевых клеток. Лучевую терапию исполь-
зуют и с паллиативной целью при распространенном процессе как местно, так и для
облучения костных метастазов. При распространенной болезни (IV стадия) лечение —
антиандрогенная терапия — носит паллиативный характер, т.к. рак простаты является
гормонозависимой опухолью. Примерно 75 % больных чувствительны к гормонотера-
пии. Существует также тактика наблюдения за пациентами с бессимптомным течением
болезни, лечение начинают только при появлении симптомов.
На протяжении многих лет «золотым стандартом» в лечении распространенного
рака простаты была двусторонняя орхиэктомия. Применение эстрогенов способ-
ствует клиническому улучшению у 70-80% больных, вызывая объективную рег-
рессию опухоли в 30-40 % случаев. В связи с многочисленными побочными эффек-
тами — кардиотоксичность, тромбофлебиты, тромбоэмболии и др. — эстрогены
в настоящее время практически не применяются. В последние годы антиандро-
генная терапия проводится современными высокоэффективными препаратами —
агонистами LH-RH и/или антиандрогенами. Внедрение агонистов LH-RH позволи-
ло заменить двустороннюю орхиэктомию медикаментозной кастрацией, т.к. эти
препараты снижают концентрацию тестостерона в крови до посткастрационного
уровня за счет десенситизации гипофизарных рецепторов рилизинг-гормона и со-
ответствующего снижения уровня лютеинизирующего гормона гипофиза, контр-
олирующего продукцию тестостерона. Антиандрогены (стероидные и нестероид-
ные) подавляют связывание андрогенных гормонов с их рецепторами в простате.
Комбинированное применение агонистов LH-RH с антиандрогенами получило на-
звание максимальной андрогенной блокады. Этот метод не является стандартом,
но не утратил своего значения и теперь.
В 1990-е годы была разработана концепция прерывистой эндокринной терапии
диссеминированного рака простаты. Цель этого метода — максимально долго сохра-
нить чувствительные к гормонотерапии клоны опухолевых клеток. Применяя аналоги
238 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
LH-RH и/или антиандрогены, добиваются нормализации уровня ПСА в течение 6 мес.,
затем лечение прекращают. Возобновляют его при появлении клинических симпто-
мов или повышении уровня ПСА в течение нескольких месяцев. Прерывистая гормо-
нотерапия обеспечивает пациентам более высокое качество жизни, а также снижа-
ет стоимость лечения. Лечение гормонорезистентного рака простаты — наиболее
сложная проблема. Возможно применение бикалутамида в дозе 150 мг/сут, для
подавления андрогенов надпочечников используется противогрибковый препарат
кетоконазол с гидрокортизоном. В качестве антиэстрогена применяются высокие
дозы тамоксифена (до 200 мг/м2) или торемифен.
Химиотерапия при раке простаты рекомендуется в основном при распростра-
ненном процессе в случаях первичной или вторичной резистентности к гормональ-
ным препаратам. Критерии эффективности XT: падение ПСА, уменьшение боли,
улучшение качества жизни. Однако ее эффективность не превышает 20%, и она не
оказывает влияния на выживаемость больных. В настоящее время препаратом первой
линии для лечения распространенного рака простаты служит доцетаксел, применяе-
мый в монорежиме и в комбинациях. Кроме того, эффективны митоксантрон, эстра-
мустин, доксорубицин, паклитаксел, винбластин, карбоплатин, капецитабин и ряд дру-
гих. Предпочтение отдается ПХТ.
Изучаются новые препараты — производные эпотилонов (иксабепилон, Еро906), а
также таргетные препараты (бевацизумаб, талидомид и др.).
Больным с костными метастазами рака простаты наряду с гормонами и/или XT с пал-
лиативной целью показано введение золедроновой кислоты (Зомета). Терапия золе-
дроновой кислотой снижает частоту развития осложнений костных метастазов, а в
ряде случаев — стимулирует репарацию костной ткани.
Агонисты LH-RH
Гозерелин (Золадекс) — 3,6 мг под кожу передней брюшной стенки каждые 28 дней
или 10,8 мг каждые 3 мес.
Лейпрорелин (Простап, Энантон) — 3,6 мг п/к каждые 28 дней.
Лейпролид — 7,5 мгв/м каждые 28дней.
Лейпролид депо — 22,5 мг в/м каждые 3 мес., 30 мг в/м каждые 4 мес.
Бусерелин (Супрефакт) — 500 мкг п/к 3 раза в сутки в течение первых 7 дней, затем по
400 мкг 3 раза в сутки интраназально от 3 до 6 мес.
Трипторелин (Декапептил) — 478,1 мкг п/к ежедневно в течение первых 7 дней, затем
95,6 мкг ежедневно в качестве поддерживающей терапии.
Нестероидные антиандрогены
Бикалутамид (Касодекс) — 50 мг 1 раз в сутки внутрь ежедневно длительно или
150 мг/сут, длительно.
Флутамид (Флуцином) — 250 мг внутрь 3 раза в сутки, длительно.
Нилутамид (Анандрон) — 300 мг/сут внутрь ежедневно 1 мес., затем 150 мг/сут.
Стероидные антиандрогены
Ципротерон (Андрокур) — 200-300 мг/сут внутрь длительно или 300 мг в/м 1 раз в
неделю.
Эстрогены
Синестрол — 60-80 мг в/м ежедневно в течение 2 мес., затем дозу снижают до 20-
40 мг/сут в течение 2-3 нед.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 239
Химиотерапия солидных опухолей
Диэтилстильбэстрола дифосфат (Фосфэстрол) — 300-600 мг в/в в течение 2-3 дней.
В случае хорошей переносимости дозу увеличивают постепенно до 700-1200 мг и
вводят ежедневно, длительно.
Хлортрианизен — 24-36 мг внутрь (12 мг 2-3 раза в сутки) ежедневно, длительно.
Полиэстрадиола фосфат (Эстрадурин) — 40-80 мг в/м 2-4 раза в месяц.
Этинилэстрадиол (Микрофоллин-форте) — 0,05 мг внутрь 3 раза в сутки ежедневно,
длительно (как поддерживающее лечение).
Диэтилстильбэстрол — 1 мг 1 раз в сутки, длительно.
2-я линия гормонотерапии
1. Кетоконазол — 400 мг внутрь каждые 8 ч, длительно.
2. Гидрокортизон — внутрь 20 мгутром и 10 мг вечером непрерывно, длительно.
3. Мегестрол (Мегейс) — 40 мг внутрь ежедневно, длительно.
Режимы терапии
1. Доцетаксел — 75 мг/м2 в/в 1-часовая инфузия каждые 3 нед.
Преднизолон — 5 мг внутрь 2 раза в сутки, длительно.
2. Митоксантрон — 12 мг/м2 в/в 1 раз в 3 нед.
Преднизолон — 5 мг внутрь 2 раза в сутки, длительно.
3. Доцетаксел — 75 мг/м2 в/в капельно 1-часовая инфузия в 1-й день.
Эстрамустин — 600 мг/м2 внутрь ежедневно в 1-42-й день.
Повторение циклов каждые 3 нед.
4. Паклитаксел — 120 мг/м2 в/в 3-часовая инфузия в 1-й день.
Эстрамустин — 600 мг/м2 внутрь ежедневно, длительно.
Повторные введения паклитаксела каждые 3 нед.
5. Эстрамустин — 600 мг/м2 внутрь ежедневно в 1-42-й день.
Винбластин — 4 мг/м2 еженедельно.
Курс лечения 6 нед., затем перерыв 2 нед.
9.12.4. Рак полового члена
77. В. Манзюк
Рак полового члена — редкое заболевание. В развитых странах заболеваемость со-
ставляет менее 1 случая на 100 000 мужского населения. В 2006 г. в России выявлено
438 заболевших. Имеются данные о связи этиопатогенеза с вирусом папилломы че-
ловека 16-го типа.
По гистологическому строению рак полового члена всегда плоскоклеточный оро-
говевающий или неороговевающий.
Прогноз у больных раком полового члена тем лучше, чем раньше начато лечение.
Даже при стадии заболевания TisNOMO/TaNOMO у 5-15 % больных опухоль переходит
в инвазивный ПКР. В I стадии заболевания стойкое излечение наступает почти у всех
больных, во II и III стадиях 5-летняя выживаемость составляет около 70-60%. Неле-
ченные больные живут в среднем около 3 лет.
Основные методы лечения больных раком полового члена — хирургический, лу-
чевой и комбинированный. Предпочтение отдается комбинированному методу, ве-
дущая роль в котором отводится хирургическому вмешательству. Предоперацион-
ная лучевая терапия позволяет в ряде случаев выполнить оперативное вмешательство
меньшего объема.
240 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
Рак полового члена относится к умеренно чувствительным к медикаментозному ле-
чению опухолям.
XT обычно назначают при раке полового члена 1-11 стадии. В поздних стадиях при
массивных метастазах в лимфоузлах или висцеральных органах XT самостоятельного
значения не имеет и применяется в сочетании с лучевой терапией, а также неоадъю-
вантно для улучшения условий при последующем оперативном вмешательстве. В ряде
случаев становится возможным последующее органосохраняющее лечение.
По данным ГУ РОНЦ им. Н. Н. Блохина РАМН, сочетание хирургического лечения, лу-
чевой терапии и XT блеомицином повышает 5-летнюю выживаемость до 75%.
Отмечена чувствительность рака полового члена к метотрексату, блеомицину, ком-
бинации цисплатина с 5-ФУ. При стадии О эффективно местное применение фторура-
циловой мази.
Режимы терапии
1. Блеомицин — 15 мг в/в или в/м 3 раза в неделю.
Винкристин — 1,5-2 мг в/в в 1,8 и 15-й дни.
Длительность курса 2 нед.
Повторение циклов через 3 нед.
Блеомицин можно заменить блеомицетином, который вводят по 10 мг в/в или в/м в том
же режиме.
2. Метотрексат — 20 мг/м2 в/в в 1,8, 15 и 21-й дни.
Блеомицин — 15 мг/м2 в/в или в/м в 1,8, 15 и 21 -й дни.
Повторение циклов через 4 нед.
3. Цисплатин — 100 мг/м2 в/в капельно в 1-й день.
Фторурацил — 1 мг/м2 в/в 96-часовая инфузия.
Повторение циклов через 3 нед.
9.12.5. Злокачественные опухоли яичка
В. А. Горбунова, А. А. Трякин
Злокачественные опухоли яичка развиваются, как правило, у мужчин молодого и сред-
него возраста, составляя около 1 % всех злокачественных новообразований у мужчин.
Герминогенные опухоли яичка составляют 95 % всех злокачественных опухолей яичка,
5% — гонадные стромальные опухоли (Сертоли/Лейдиго-клеточные, гранулезокле-
точные; герминогенные и гонадные — гонадобластома; аднексальные и паратестику-
лярные — мезотелиома, аднексальные из неспустившегося яичка, другие — карци-
ноид и лимфомы). Герминогенные опухоли делятся на семиномы и несеминомы. Это
подразделение важно для выбора метода лечения, т.к. семиномы более чувствитель-
ны клучевой терапии.
Смешанные опухоли, содержащие компоненты семиномы и несеминомы, лечат как
несеминому. Несеминомы включают эмбриональный рак, тератому, опухоль жел-
точного мешка, хориокарциному и различные их комбинации. При гистологическом
заключении о наличии семиномы, но с повышенным уровнем АФП больной должен
получать лечение, как при несеминоме. Подъем уровня /?-ХГ обнаруживают прибли-
зительно у 10% больных с чистой семиномой, но повышение более 300 ЕД/мл свиде-
тельствует о наличии хориокарциномы.
Риск метастазирования наименьший для тератом и наибольший для хориокарцином.
Независимые факторы, предполагающие плохой прогноз:
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 241
Химиотерапия солидных опухолей
WftwmRsm wj ' г
в наличие метастазов в печени, костях, головном мозге;
высокий уровень сывороточных маркеров;
первичная несеминома средостения;
большое количество легочных метастазов.
Пожилой возраст и отсутствие элементов эмбрионального рака также ассоцииру-
ются с худшим прогнозом.
Важным аспектом диагностики и наблюдения является использование сывороточ-
ных маркеров, включающих АФП, ХГ и ЛДГ. Они могут помочь в обнаружении малень-
ких опухолей, недоступных другим методам диагностики. У лиц моложе 15 лет около
90% опухолей представляют собой опухоли желточного мешка, уровень АФП у них
бывает повышенным.
Ключевым моментом в стадировании служит уточнение поражения забрюшинных
лимфоузлов. Приблизительно 25-30% больных имеют микроскопические метастазы,
которые не выявляются посредством КТ.
Классификация опухолей яичка по системе TNM
Протяженность первичной опухоли классифицируется после радикальной орхиэк-
томии.
рТХ — первичная опухоль не может быть определена (если орхиэктомии не было,
выставляется стадия ТХ).
рТО — нет признаков первичной опухоли (в т.ч. и при гистологическом исследова-
нии яичка).
pTis — интратубулярная неоплазма (карцинома in situ).
pTl — опухоль ограничена яичком и придатком без лимфатической и васкулярной
инвазии.
рТ2 — опухоль поражаетяичко и придаток, имеется инвазия в лимфатические щели
и сосуды, или опухоль прорастает в белочную оболочку.
рТЗ — опухоль переходит на семявыносящий проток с либо без сосудистой и/или
лимфатической инвазии.
рТ4 — опухоль прорастает в мошонку с либо без сосудистой и/или лимфатической
инвазии.
Регионарные лимфоузлы (N)
NX — поражение регионарных лимфоузлов не может быть уточнено.
NO — нет метастазов в регионарных лимфоузлах.
N1 — метастазы в отдельном лимфоузле размером 2 см или менее в наибольшем из-
мерении.
N2 — метастазы в одном или нескольких лимфоузлах размером от 2 до 5 см в наиболь-
шем измерении.
N3 — метастазы более 5 см в диаметре.
Отдаленные метастазы (М)
MX — наличие отдаленных метастазов не может быть определено.
МО — нет отдаленных метастазов.
Ml — имеются отдаленные метастазы.
М1а— поражение нерегионарных лимфоузлов или легких.
М1Ь — любые другие метастазы.
Сывороточные маркеры (S)
SX — исследование маркеров недоступно или не проводилось.
242 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
SO — уровень маркеров в норме.
S1 -ЛДГ< 1,5 х ВГН*; ХГ < 5000 МЕ/л; АФП < 1000 нг/мл.
S2 - ЛДГ 1,5-10 х ВГН;ХГ 5000-50 000 МЕ/л; АФП 1000-10 000 нг/мл.
S3 - ЛДГ > 10 х ВГН; ХГ > 50 000 МЕ/л; АФП > 10 000 нг/мл.
* ВГН — верхняя граница нормы
В табл. 9.39 приведена группировка опухолей яичка по стадиям.
Таблица 9.39. Группировка опухолей яичка по стадиям
I Стадия TNM
0 pTis NO MO SO
1 рТ1-4 NO МО SX
IA pT1 NO MO SO
IB pT2 NO MO SO pT3 NO MO SO pT4 NO MO SO
IC рТлюбая TXNO M0S1-3
II рТлюбая TX N1-3 МО SX
НА рТлюбая ТХ N1 МО SO рТлюбая ТХ N1 МО S1
НВ рТлюбая ТХ N2 МО SO
рТлюбая ТХ N2 МО S1
НС рТлюбая ТХ N3 МО SO рТлюбая ТХ N3 M0S1
III рТлюбая ТХ Nлюбaя М1 -1 a SX
IIIA рТлюбая ТХ Nлюбaя М1а SO рТлюбая ТХ Nлюбaя М1а S1
HIB рТлюбая ТХ N1-3 МО S2 рТлюбая ТХ Nлюбaя М1а S2
IHC рТлюбая TXN1-3 МО S3 рТлюбая ТХ Nлюбaя М1а S3 рТлюбая ТХ Nлюбaя Злюбая
Таким образом, 1 стадия ограничена яичками. Стадия II обозначает вовлечение в про-
цесс яичек и ретроперитонеальных или парааортальных лимфоузлов. Риск рециди-
вов возрастает при поражении более 5 лимфоузлов и при размере более 2 см или при
прорастании в жировую ткань. Распространенная II стадия включает больных с обшир-
ными забрюшинными метастазами (> 5 см), которым первоначально проводится XT.
Стадия III также разделяется на две категории:
поражение только лимфоузлов и легких с размером метастазов не более 2 см в
диаметре;
обширное поражение — это большие опухолевые массы в забрюшинных лим-
фоузлах и легких или распространение на другие органы, например печень и го-
ловной мозг.
Злокачественные опухоли яичка подразделяются на две большие группы: семиномы
и несеминомы — в связи с чувствительностью семиномы к лучевой терапии. Сущест-
вует также прогностическая классификация, разработанная Международным коми-
тетом на основе ретроспективной оценки лечения около 6000 больных и согласован-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 243
Химиотерапия солидных опухолей
нал повсеместно в мире со всеми большими клиническими группами, занимающимися
лечением пациентов со злокачественными опухолями яичка (табл. 9.40).
Таблица 9.40. Прогностическая классификация для пациентов с
распространенными герминогенными опухолями
Хороший прогноз TV?г,? "-г, ’ ...
Поражение яичка/забрюшинных лимфоузлов, отсутствие не- легочных висцеральных метастазов и низкий уровень марке- ров: АФП < 1000 нг/мл, ХГ < 5000 МЕ/л и ЛДГ < 1,5 х ВГН. 56%всехнесемином. 5-летняя безрецидивная выживаемость —89%. 5-летняя выживаемость — 92% Любое первичное поражение, нет неле- гочных висцеральных метастазов, АФП в норме, любые показатели ХГ и ЛДГ. 90% всех семином. 5-летняя безрецидивная выживае- мость—82%. 5-летняя выживаемость —86%
ПромежуточнййШШз
Яички/забрюшинные лимфоузлы, нет нелегочных висце- ральных метастазов, промежуточные маркеры: АФП > 1000 < 10 000 нг/мл, ХГ > 5000 < 50 000 МЕ/л, ЛДГ > 1,5 < 10 х ВГН. 28% всех несемином. 5-летняя безрецидивная выживаемость — 75%. 5-летняя выживаемость —80% Любое первичное поражение, имеются не- легочные висцеральные метастазы, АФП в норме, любые показатели ХГ и ЛДГ. 10% всех семином. 5-летняя безрецидивная выживае- мость— 67%. 5-летняя выживаемость — 72 %
i I ж Ж
Средостение — первичное поражение, или нелегочные висцеральные метастазы, или высокие уровни маркеров: АФП > 10 000 нг/мл, ХГ > 50 000 МЕ/л, ЛДГ > 10 х ВГН. 16% всех несемином. 5-летняя безрецидивная выживаемость —41 %. 5-летняя выживаемость — 48 % Нет случаев, классифицируемых как пло- хой прогноз
5-летняя выживаемость для больных с хорошим прогнозом составляет 91 %, с про-
межуточным — 79%, с плохим — 48%.
Стандарты лечения определяются стадией заболевания при постановке первично-
го диагноза.
Семинома
/ стадия — излечима более чем в 95% случаев (T1-4N0M0).
На первом этапе выполняется радикальная паховая орхифуникулэктомия (ОФЭ). Су-
ществуют три равнозначные опции, обеспечивающие близкую к 100% общую выжи-
ваемость. Стандартом является динамическое наблюдение (риск развития рецидива
около 15%, но вылечиваются 3 курсами ВЕР). При невозможности наблюдения пока-
зано проведение 1 курса XT карбоплатином в дозе AUC 7 или лучевой терапии на параа-
ортальные лимфоузлы до СОД = 20Гр. Риск дальнейшего прогрессирования в таком слу-
чае не превышает 3 % (рис. 9.2).
II стадия — поражение забрюшинных лимфоузлов.
ПА стадия — радикальная (ОФЭ) с последующей лучевой терапией на забрюшин-
ные лимфоузлы (СОД = 30 Гр) или 3 курса XT по схеме ВЕР.
IIB-IIC стадия — ОФЭ + три курса XT по схеме ВЕР или 4 — по схеме ЕР. При про-
тивопоказаниях к XT возможно проведение лучевой терапии до СОД = 36 Гр,
однако это ассоциировано с большей частотой местных рецидивов (рис. 9.3).
244 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли мочеполовых органов
III стадия - 3 курса ВЕР с 3-недельным интервалом для больных с хорошим про-
гнозом. Альтернативой ВЕР могут быть 4 курса ЕР.
При промежуточном прогнозе при IGCCCG показано проведение 4 курсов ВЕР.
Остаточные опухолевые массы обычно наблюдают. При резидуальной опухоли > 3
см может быть выполнена ПЭТ. В случае накопления РФП показано выполнение за-
брюшинной лимфаденэктомии. Лучевая терапия на резидуальные после XT лимфоуз-
лы проводится только в случае их морфологической верификации.
Несеминома
При всех стадиях на первом этапе выполняется ОФЭ. Лишь при тяжелом общем со-
стоянии больного, обсусловленном распространенностью опухолевого процесса, по-
казано немедленное начало XT. Диагноз в таких случаяхустанавливается на основании
типичной клинической картины и повышенного уровня опухолевых маркеров.
I стадия - основным фактором риска развития рецидива является инвазия опухо-
ли в кровеносные и лимфатические сосуды. При ее наличии риск прогресси-
рования составляет около 50%, а при отсутствии — около 25 %.
Семинома CSI_
/ I \
или_____________________или или
I I I
Рис. 9.2. Алгоритм лечения семиномы I стадии
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
245
Химиотерапия солидных опухолей
Рис. 9.3. Алгоритм лечения семиномы II стадии
При высоком риске показано проведение 2 курсов ВЕР, что снижает риск рециди-
ва примерно до 3 %. Альтернативой XT является частое динамическое наблюдение.
При низком риске рекомендовано наблюдение (контроль АФП, ХГ 1 раз в месяц в те-
чение первого года и каждые 2 раза - на второй год). При невозможности тщательно-
го наблюдения возможно проведение 2 курсов ВЕР. В случае противопоказаний к XT и
невозможности адекватного наблюдения рекомендовано выполнение нервосберега-
ющей забрюшинной лимфаденэктомии. При любой из методик длительная общая вы-
живаемость превышает 95 %.
НА стадия (лимфоузлы < 2 см)
При нормальных опухолевых маркерах показано выполнение нервосберегающей
забрюшинной лимфаденэктомии. При повышении маркеров вместо операции реко-
мендуется проведение 3 курсов ВЕР.
IIB-C / III стадия — проводится XT в соответствии с прогнозом по IGCCCG. При
благоприятном прогнозе — 3 курса ВЕР или 4 курса ЕР. При промежуточном
или неблагоприятном прогнозе — 4 курса ВЕР. При противопоказаниях к вве-
дению блеомицина могут быть проведены 4 курса по программе PEL При нор-
мализации маркеров после XT показано удаление резидуальной опухоли >
1см. Чаще всего это забрюшинные лимфоузлы. В случае обнаружения некро-
за или зрелой тератомы дальнейшее лечение не проводится, тогда как при на-
личии жизнеспособной злокачественной опухоли вудаленныхузлах показано
проведение 2-4 курсов PEI или TIP.
Рецидивы заболевания
В случае роста или появления метастазов на фоне нормальных маркеров необхо-
димо прежде всего исключить синдром растущей зрелой тератомы. При повышении
маркеров или обнаружении в биоптате злокачественной опухоли показано проведе-
ние 4 курсов XT второй линиикомбинациями TIP или VelP. При нормализации марке-
ров обязательно удаление резидуальной опухоли.
Режимы терапии
ВЕР
Блеомицин — 30 мг в/в или в/м 1 раз в неделю течение 12 нед.
Этопозид — 100 мг/м2 в/в капельно ежедневно в 1-5-й день.
Цисплатин (Платидиам) — 20 мг/м2 в/в капельно ежедневно в 1-5-й день.
Повторение циклов каждые 3 нед.
ЕР
Цисплатин — 20 мг/м2 в/в капельно ежедневно в 1-5-й день.
Этопозид — 100 мг/м2 в/в капельно ежедневно в 1-5-й день.
4 курса с 3-недельным интервалом для больных с хорошим прогнозом.
246 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Злокачественные опухоли мягких тканей
РЕ!
Цисплатин — 20 мг/м2 в/в капельно с 1 -5-й день.
Этопозид — 75 мг/м2 в/в 1-5-й день.
Ифосфамид — 1,2 г/м2 в/в капельно с 1-го по 5-й день.
Месна (Уромитексан) — 800 мг в/в струйно до введения ифосфамида, через 4 ч и 8 ч
после его инфузии 1-5 день
Повторение цикла каждые 3 нед.
VelP
Винбластин — 0,11 мг/кг в/в в 1-й и 2-й дни.
Ифосфамид — 1200 мг/м2 в/в 30-60-минутная инфузия в 1-5-й день.
Цисплатин — 20 мг/м2 в/в 30-60 минутная инфузия в 1-5-й день.
Месна (Уромитексан) — 800 мг в/в струйно до введения ифосфамида, через 4 и 8 ч по-
сле его инфузии в 1-5-й день.
Повторение циикла каждые 21 день.
Гидратация 0,9% раствором натрия хлорида для достижения диуреза 100 мл/ч до
окончания XT, контроль электролитов и магния.
TIP
Паклитаксел — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Ифосфамид — 1200 мг/м2 в/в 30-60-минутная инфузия в 1-5-й день.
Цисплатин — 20 мг/м2 в/в 30-60-минутная инфузия в 1-5-й день.
Месна (Уромитексан) — 800 мг в/в струйно до введения ифосфамида, через 4 и 8 ч
после его инфузии в 1-5-й день.
Повторение цикла каждые 21 день.
9.13. Злокачественные опухоли мягких тканей
В. А. Горбунова, А. А. Феденко
Саркомы — сравнительно редкая группа опухолей. В России ежегодно регистрирует-
ся около 10 000 новых случаев, что составляет 1 % всех злокачественных новообразо-
ваний. Заболеваемость — 30 случаев на 1 000 000 населения, 80 % составляют сарко-
мы мягких тканей. В детском возрасте частота выше — 6,5 %.
Гистологический спектр сарком очень широк, это объясняется тем, что происходят
они из эмбриональных мезенхимных клеток, которые впоследствии могут дифферен-
цироваться в клетки поперечнополосатой, гладкой мускулатуры, жировую или соеди-
нительную ткань, кости или хрящи. К саркомам мягких тканей принято также относить
опухоли периферических нервов, которые имеют эктодермальное происхождение,
но сходны по тактике лечения, клинике и прогнозам с саркомами мягких тканей.
С конца прошлого века верифицированный диагноз диссеминированной саркомы
мягких тканей для большинства химиотерапевтов означал, что необходимо следовать
определенному алгоритму лечебных мероприятий, в наши дни эта концепция полно-
стью изменилась. Сейчас без гистологического, а в более чем 50% случаев и иммуно-
гистохимического определения типа саркомы с указанием степени злокачественно-
сти построение лечебной тактики просто невозможно.
В настоящее время выделяется более 50 различных гистологических подвидов,
обладающих вариабельной чувствительностью к многокомпонентному лечению, что
требует кардинально разных лечебных подходов и алгоритмов. Саркомы, объединен-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 247
Химиотерапия солидных опухолей
яяииге»яйкм»да№Вйявййавйй»айямя«ж««^^ ..-ъх -г
ные одним названием (например, липосаркома), но имеющие разную степень злока-
чественности (G1 — высокодифференцированная, G2 — умеренно дифференциро-
ванная, G3 — дедифференцированная), представляют собой три абсолютно разные
по течению, прогнозу и лечебной тактике опухоли.
В табл. 9.41 представлены данные по частоте встречаемости различных гистологиче-
ских подтипов сарком за последние 20 лет.
Таблица 9.41. Частота встречаемости различных гистологических подтипов
сарком
ВНшимЩ Исследование MGH, 1994 Russell, 1987 Coindre, 2001 Lawrence, 1997
Число пациентов 738 1215 1240 5885
Злокачественная фиброзная гистиоцитома 22% 11% 28% 21%
Липосаркома 16% 18% 15% 20%
Фибросаркома 11% 19% Нет данных 8%
Лейомиосаркома 10% 7% 12% 14%
Неклассифицируемые саркомы 9% 10% 11% 5%
Синовиальная саркома 8% 7% 10% 4%
Нейрогенные саркомы 10% 5% 6% 4%
Рабдомиосаркома 3% 19% 5% 5%
Другие 12% 5% 13% 19%
Анатомически отмечается следующее распределение:
нижние конечности, включая ягодичную область, — 46%;
верхние конечности — 13%;
туловище — 18%;
забрюшинное пространство — 13%;
Я голова, шея — 9%.
Факторы прогноза
За последние 20 лет выявлено несколько факторов прогноза, влияющих на выжи-
ваемость, частоту местных рецидивов и отдаленных метастазов. Наиболее важными
факторами прогноза являются гистологический подтип, степень злокачественности
и размер опухоли. С плохим прогнозом ассоциируется высокая степень злокачест-
венности (G2-3), размер опухоли более 5 см, наличие мелко- или круглоклеточного
компонента. Возраст старше 50 лет служит фактором плохого прогноза в отношении
местного рецидивирования. В табл. 9.42 представлены данные по 5-летней безреци-
дивной выживаемости в зависимости от гистологического подтипа и степени злокаче-
ственности.
Таблица 9.42. 5-летняя безрецидивная выживаемость в зависимости
от гистологического подтипа и степени злокачественности сарком -
(данные по 1240 пациентам)
Гистологический подтип Степень
1(61) II (G2) 111(63)
Злокачественная фиброзная гистиоцитома 90% 77% 48%
Липосаркома 94% 72% 59%
Лейомиосаркома 93% 67% 45%
Нейрогенные саркомы 78% 56% 52%
248 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли мягких тканей
Гистологический подтип Степень
1 (G1) II (62) lll(G3) 1
Синовиальная саркома — 75% 35%
Рабдомиосаркома — 75% 42%
Неклассифицируемые саркомы — 70% 40%
Другие 82% 69% 37%
Определение степени злокачественности сарком очень важно для выбора такти-
ки дальнейшего лечения. Существует две системы определения: система NC1 (Нацио-
нальный институт рака США) и система FNCLCC (Французская национальная федера-
ция союза центров по борьбе с раком). По системе NCI оценивается гистологический
подтип, количество клеток в поле зрения, плеоморфизм, количество митозов и выра-
женность очагов некрозов. Различают:
G1 — I степень злокачественности (высокодифференцированная, наилучший про-
гноз, редко метастазирует, практически не чувствительна к XT);
G2 — II степень злокачественности (умеренно дифференцированная);
G3 — III степень злокачественности (низкодифференцированная, плохой прогноз,
очень часто метастазирует, большинство химиочувствительно).
В Европе наиболее часто используется система FNCLCC, которая также является
3-ступенчатой, причем оценивается суммарный балл по дифференцировке опухо-
ли, митотическому индексу и количеству некрозов. По сути, степени обеих шкал сов-
падают.
Классификация
Классификация TNM построена на основании размера и глубины расположения
опухоли относительно поверхностной фасции для сарком конечностей (а — повер-
хностно расположенные, b — прорастающие фасцию и все опухоли брюшной поло-
сти, полости таза, грудной клетки и забрюшинного пространства).
Классификация сарком мягких тканей по системе TNM AJCC (6-е издание,
2002)
Первичная опухоль (Т)
Т1 — опухоль до 5 см в наибольшем измерении.
Т1а — поверхностная опухоль.
Tib — глубокая опухоль.
Т2 — опухоль более 5 см в диаметре.
Т2а — поверхностная опухоль.
Т2Ь — глубокая опухоль.
Регионарные лимфоузлы (N)
NO — нет гистологически верифицированных пораженных лимфоузлов.
N1 — метастазы в регионарных лимфоузлах.
Отдаленные метастазы (М)
МО — нет отдаленных метастазов.
Ml — есть отдаленные метастазы.
Степень злокачественности (G)
G1 — высокодифференцированная.
G2 — умеренно дифференцированная.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 249
Химиотерапия солидных опухолей
G3 — низкодифференцированная.
G4 — дедифференцированная (только для 4-ступенчатой системы).
В табл. 9.43 приводится группировка сарком мягких тканей по стадиям.
Таблица 9«43. Группировка сарком мягких тканей по стадиям
Стадия TNM I
1 Т1 a—b NO МО G1—2 (G1 по 3-ступенчатой системе) T2a-b NO МО G1-2 (G1 по 3-ступенчатой системе)
II Т1 a 1b NO МО G3-4 (G2 по 3-ступенчатой системе) Т2а NO МО G3—4 (G2 по 3-ступенчатой системе)
III T2b NO МО G3-4 (G2 по 3-ступенчатой системе)
IV Тлюбая N1 МО блюбая Тлюбая NO М1 блюбая
В системе TNM представлена 4-ступенчатая шкала степени злокачественности, од-
нако уже после 2002 г. принято использование 3-ступенчатой системы, в которой G3
и G4 объединены вместе, что не меняет сути и проще в использовании.
5-летняя выживаемость составляет при I стадии более 50%, а при более распро-
страненном процессе снижается до 10% и менее. Примерно 10-25% больных имеют
отдаленные метастазы к моменту установления диагноза.
Лечение
Основной метод лечения сарком мягких тканей — хирургический. Широкие орга-
носохраняющие резекции с пред- и/или послеоперационной лучевой терапией дают
хорошие отдаленные результаты при высокодифференцированных саркомах конеч-
ностей. При таких же саркомах туловища, области головы и шеи хирургический метод
вместе с лучевой и химиотерапией или без последней также дает хороший локальный
контроль заболевания.
Лечение забрюшинных сарком более сложное, т. к. радикальное удаление опухолей
бывает затруднено и доза лучевой терапии должна быть ограничена.
Изучение значения адъювантной XT с доксорубицином при саркомах мягких тка-
ней дало противоречивые результаты. Метаанализ 2008 г., основанный на данных
1568 больных из 14 клинических исследований, показал абсолютное преимущест-
во адъювантной терапии в 6% случаев для локального безрецидивного интервала и
в 10% — для появления отдаленных метастазов. К 10 годам наблюдения влияния на
общую выживаемость выявлено не было. Достаточно низкие показатели эффектив-
ности, возможно, связаны с тем, что при подсчете результатов не учитывался гисто-
логический подтип опухоли (в исследование включались пациенты с GIST, альвеоляр-
ными и светлоклеточными саркомами, которые не чувствительны к стандартной XT, а
также с забрюшинными саркомами). Принято считать, что больные с высокой степе-
нью злокачественности (G3-4) и опухолями более 5 см могут участвовать в клиниче-
ских исследованиях по изучению новых режимов адъювантной XT. Результаты одно-
го из подобных исследований, проведенных в Италии, с использованием эпирубицина
(Фарморубицин) в дозе 60 мг/м2 в 1 -й и 2-й дни, ифосфамида 1,8 г/м2 в 1 -5-й день с ме-
сной и филграстима 300 мкг/сут в 8-15-й день 5 курсов каждые 3 нед. продемонстри-
ровало достоверное увеличение безрецидивной (медиана 48 us 16 мес.; р = 0,04) и
общей выживаемости (медиана 75 ps 46 мес.; р = 0,03).
250 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли мягких тканей
Радикальная операция зачастую невозможна у больных с ретроперитонеальными
саркомами. Однако рандомизированные исследования не выявляют улучшения ре-
зультатов при использовании предоперационной неоадъювантной или послеопера-
ционной адъювантной XT в этой подгруппе больных.
В некоторых ситуациях лучевая терапия или XT могут быть использованы перед опе-
рацией для уменьшения размера опухоли и увеличения возможности радикальной
органосохраняющей резекции. После операции возможно продолжение лучевой те-
рапии. При опухолях более 5 см после радикальной операции проводится лучевая
терапия. Изучается одновременная XT доксорубицином и лучевая терапия в виде на-
ружного облучения в качестве неоадъювантного метода с последующей операцией и
продолжением облучения.
Результаты неоадъювантной XT в сочетании с регионарной гипертермией у боль-
ных с ретроперитонеальными и висцеральными саркомами показали улучшение без-
рецидивной и общей выживаемости для больных, ответивших на лечение. У больных
с IV стадией процесса хирургический метод может быть также использован в случае
операбельных легочных метастазов. У ряда больных оперативное удаление метаста-
зов обеспечивает длительную безрецидивную выживаемость и даже излечение. Чаще
всего это бывает при изолированных легочных метастазах.
В одном из исследований у 213 (30%) из 719 больных с метастазами сарком мягких
тканей в легких они были потенциально резектабельны и у 161 (22%) можно было вы-
полнить радикальную резекцию легочных метастазов.
Для оценки возможности резекции при метастатической болезни принимают во
внимание следующие положения:
нет экстраторакальных проявлений, плеврального выпота и метастазов в лимфо-
узлах корня и средостения;
первичная опухоль излечена или может быть излечена;
нет противопоказаний для торакотомии и резекции метастазов;
8 радикальная резекция представляется возможной.
Многие центры используют торакотомию с резекцией метастазов, другие — видео-
торакоскопию (VATS).
В опубликованных результатах резекции метастазов сарком мягких тканей в легких
3-летняя выживаемость составила 46-54%, 5-летняя — 37-40%. Прогностическими
факторами служат длительный безрецидивный интервал (> 2,5 года), микроскопиче-
ское отсутствие опухолевых клеток в краях резекции и гистологически низкая степень
злокачественности первичной опухоли (G1-2), а также размер (< 2 см) и количество
метастазов. При благоприятных факторах прогноза 5-летняя выживаемость составила
60%. Описаны повторные метастазэктомии при рецидиве метастазирования в легкие.
Вопрос о целесообразности до- или послеоперационной XT остается открытым.
Возможно, предпочтительнее предоперационная XT для определения ее эффектив-
ности у конкретного пациента и выработки более рациональной дальнейшей тактики.
Метастазы в печени также могут быть резецированы, однако мировой опыт невелик,
хотя создается впечатление об увеличении выживаемости в случае радикальности по-
добных вмешательств. Описаны резекции печени и высокочастотные абляции.
XT сарком мягких тканей в последние годы начинает претерпевать значительные из-
менения: меняются подходы к выбору лекарственных комбинаций в зависимости от
строения сарком, появляются новые препараты, приобретает клинические перспек-
тивы таргетная терапия.
Для больных с распространенным процессом системная терапия все еще являет-
ся паллиативной, однако может продлить выживаемость, улучшить общее состояние
л качество жизни.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 251
Химиотерапия солидных опухолей
веяяиаяяяяйгаяяямяайямяяййяяяя^ - v -
Выбор терапии должен быть индивидуализирован и основан на ряде факторов. *
первую очередь морфологическом строении опухоли и ее биологических характе-
ристиках, а также состоянии и предпочтениях пациента.
Отдельно рассматриваются вопросы лечения GIST и рабдомиосарком, которые
чаще поражают детей.
В настоящее время различные морфологические типы сарком мягких тканей требу-
ют разной терапии.
Синовиальная саркома и миксоидная липосаркома наиболее чувствительны к XT
миксоидная липосаркома — к доксорубицинсодержащим режимам, синовиальна?
саркома — к алкилирующим агентам, таким как ифосфамид.
Лейомиосаркомы матки, эндометриальные стромальные саркомы, миксофибро-
саркомы, дедифференцированные липосаркомы, злокачественные опухоли оболоч-
ки периферических нервов имеют индивидуальную чувствительность к XT. Объектив-
ные эффекты при этих опухолях возможны и при применении режимов, содержащих
антрациклин и ифосфамид или гемцитабин и доцетаксел. Активность гемцитабина с
доцетакселом первоначально была отмечена при лейомиосаркомах матки и ЖКТ. Она
составила 53%. В дальнейшем эффективность комбинации в одном исследовании
43%, в другом — 18% была получена и при забрюшинных и лейомиосаркомах конеч-
ностей, остеосаркомах, злокачественных фиброзных гистиоцитомах, саркоме Юинга.
злокачественных опухолях оболочки периферических нервов. Сравнение активности
комбинации гемцитабина с доцетакселом и монохимиотерапии гемцитабином пока-
зало преимущество комбинации.
Миксоидные липосаркомы оказались особенно чувствительны к новому препара-
ту трабектедину — уникальному агенту из морского продукта, который действует на
ядерную ДНК, повреждая механизмы репарации.
Ангиосаркомы, особенно в области головы, чувствительны ктаксанам. Липосомный док-
сорубицин (Доксил — в США, Келикс — в Европе) также эффективен при ангиосаркомах.
Для других типов сарком, нечувствительных к обычным цитостатическим агентам,
изучение молекулярных механизмов патогенеза может открыть новые терапевтиче-
ские стратегии, как это, например, продемонстрировано для распространенных GIST
с помощью иматиниба мезилата (Гливек) и сунитиниба (Сутент).
Имеются также данные об эффективности иматиниба у больных с дерматофибро-
мой протуберанец и десмоидных опухолях.
Появились сообщения об активности сорафениба (Нексавар) — мультитаргетного ти-
розинкиназного ингибитора, подавляющего RAF-киназу и блокирующего внутрикле-
точные рецепторы VEGF, при ангиосаркомах и некоторых подтипах лейомиосарком.
Стабилизация процесса с удлинением выживаемости может быть основной целью
при использовании таргетных препаратов.
Первый препарат, активный при саркомах мягких тканей, в 1970-е годы был доксо-
рубицин, эффективность которого зависит от дозы (> 60 мг/м2 или 70 мг/м2) и состав-
ляет 10-25 %.
Менее кардиотоксичные антрациклины — эпидоксорубицин (Фарморубицин) и ли-
посомный доксорубицин (Доксил, Келикс) — оказались равноэффективными доксо-
рубицину, по данным немногочисленных сравнительных рандомизированных иссле-
дований. Липосомный доксорубицин активен при ангиосаркомах.
Алкилирующий препарат ифосфамид считается вторым эффективным средством
при саркомах мягких тканей, вызывая 7-41 % объективных ответов у больных, ранее
получавших доксорубицин. Дозы и режимы ифосфамида широко варьируют, однако
следует иметь в виду необходимость достаточной для эффекта дозы — 6 г/м2. Неко-
торые авторы отмечают, что его эффективность дозозависима и необходимо приме-
252 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли мягких тканей
нять 10 г/м2 и более. Прямое сравнение одного доксорубицина (75 мг/м2 3 нед.) и двух
режимов ифосфамида (3 г/м2/4 ч ежедневно 3 дня или 9 г/м2 в виде 72-часовой инфу-
зии) у больных с метастазами сарком мягких тканей показало одинаковые результаты
по эффективности, но большую токсичность режимов ифосфамида. Следует помнить,
что ифосфамид всегда используют с уропротектором месной.
Доцетаксел при саркомах мягких тканей относительно неактивен, за исключением
ангиосарком. Паклитаксел также используют для лечения ангиосарком, особенно го-
ловы. Имеется сообщение о большей эффективности еженедельного режима.
Другие препараты, обладающие эффективностью 20% и более при саркомах мягких
тканей: винорелбин, стандартные дозы метотрексата, темозоломид (особенно при лей-
омиосаркомах), цисплатин, карбоплатин, трабектедин. Отмечена также эффективность
гемцитабина в одном из исследований при лейомиосаркомах негастроинтестинально-
го происхожденияу 4 из 10 больных. В других исследованиях эффективность меньше.
Однако эффективность комбинации гемцитабина (фиксированная скорость инфу-
зии) и доцетаксела или винорелбина подчеркивается многими авторами как для лейо-
миосарком матки и ЖКТ, так и для лечения других типов мягкотканных сарком.
Топотекан также обладает активностью при лейомиосаркомах (нематочного проис-
хождения).
Много лекарственных комбинаций изучено при саркомах мягких тканей:
S доксорубицин, ифосфамид, месна;
MAID (месна, доксорубицин, ифосфамид, дакарбазин);
в гемцитабин + доцетаксел или винорелбин;
Я альтернирующие курсы ифосфамида с этопозидом и винкристина с доксоруби-
цином и циклофосфамидом (VAC/1E);
Я ифосфамид, этопозид, цисплатин;
Я CYVADIC (циклофосфамид, винкристин, доксорубицин, дакарбазин);
Я МАС (митомицин, доксорубицин, цисплатин);
Я AD (доксорубицин, дакарбазин);
Я ифосфамид, липосомный доксорубицин.
Эффективность этих режимов составляет 16-46% с полными ремиссиями у 5-10%
больных и длительностью безрецидивной выживаемости у 73 из них.
Сравнение комбинированных режимов с монотерапией доксорубицином показало
увеличение частоты объективных эффектов при использовании комбинаций без влия-
ния на выживаемость. Полные ремиссии не превышали 10%.
Длительные инфузии препаратов менее токсичны. Лечение в любом случае должно
быть индивидуализировано. В случаях, когда необходимо быстрее повлиять на сим-
птомы болезни и вызвать уменьшение опухоли, например при местнораспространен-
ном процессе (неоадъювантная XT) с целью дальнейшей операции, предпочтительнее
комбинированные режимы.
Новые подходы
Трабектедин (EJ-743, Ecteinascidin, Йонделис) — новый алкалоид из морского продук-
та Esteinascidia turbinate оказался достаточно эффективным при саркомах мягких тканей,
особенно при миксоидных липосаркомах и лейомиосаркомах. Механизмом действия
является повреждение ядерной ДНК путем нарушения механизма репарации.
В исследовании II фазы трабектедин был эффективен у 17% больных, с учетом ста-
билизации — у 24 %. Медиана выживаемости составила 15,8 мес., и 72 % больных были
хивы в течение первого года наблюдения. Отмечались следующие побочные явления:
-ейтропения IV степени — 33%, повышение активности аминотрансфераз III—IV сте-
пени — 33 %, тошнота III степени — 14 %, усталость III—IV степени — 11 %.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 253
Химиотерапия солидных опухолей
маапапиммжаяаякеамтяаюямгавяаэдтяйвдймв^^ s , п •
Высокая эффективность трабектедина наблюдалась при миксоидных липосарко-
мах. Она составила 51 % полных и частичных ремиссий. 88 % больных наблюдались без
прогрессирования в течение 6 мес.
Сорафениб (Нексавар) — мультитаргетный тирозинкиназный ингибитор. Исследо-
вание II фазы продемонстрировало объективные эффекты при лейомиосаркомах (5 %
и ангиосаркомах (15%). Более того, 74% больных с ангиосаркомами и 54% — с лейо-
миосаркомами не прогрессировали в течение 12 нед.
Бевацизумаб (Авастин) — МКА, ингибирующее VEGE Показана возможность объек-
тивных эффектов и стабилизации у больных с лейомиосаркомами при использовании
комбинации доксорубицина и бевацизумаба. Кардиотоксичность ограничивает воз-
можность применения данной комбинации.
Производное камптотецина — пероральный препарат гиматекан (Gimatecan) вызвал
стабилизацию болезни, по данным II фазы, у 35 % пациентов с саркомой Юинга, лейо-
и липосаркомой.
В табл. 9.44 представлены общие принципы терапевтической тактики при саркомах
мягких тканей.
Таблица 9.44. Принципы выбора терапевтической тактики при саркомах
мягких тканей (R. Benjamin, 2007)
Стадия TNM Степень диф- ференцировки Методы лечения
1 T1a-b, T2a-b NO MO G1-2 Хирургия
II T1a-b NO MO G3-4 Хирургия + адъювантная лучевая терапия/адъювантная XT
III T2b NO MO Любая G Хирургия + адъювантная XT
IV Тлюбая N1 MO Тлюбая NO M1 Любая G XT ± хирургия и лучевая терапия
Режимы терапии
Монохимиотерапия
Доксорубицин — 30 мг/м2 в/в 2 раза в неделю в течение 3 нед.
Доксорубицин — 30 мг/м2 в/в в 1-3-й день.
Доксорубицин — 60-75 мг/м2 в/в 1 раз в 3 нед.
Эпирубицин (Фарморубицин) — 100 мг/м2 в/в 1 раз в 3 нед.
Метотрексат — 1,5-2 г/м2 в/в инфузия с фолинатом кальция (Лейковорин) 10-15 мг
внутрь или в/м каждые 6 ч, начиная через 20-24 ч после введения метотрексата, всего
10 доз. (Лечение под контролем фармакокинетики метотрексата.) Высокие дозы ме-
тотрексата могут быть использованы и в комбинации с другими препаратами, подоб-
но схемам, применяемым при остеогенных саркомах (см. соответствующий раздел).
Ифосфамид — 5 г/м2 в/в либо в/в инфузия в 1-й день или 1,6-2,5 г/м2/сут в течение
5 дней с месной (Уромитексан) из расчета 20 % + 100 % от дозы ифосфамида одновре-
менно с ним.
Гемцитабин — 1200 мг/м2 за не менее 120 мин в 1-й и 8-й дни каждые 21 день с фикси-
рованной скоростью инфузии 9-10 мг/м2/мин.
Винорелбин — 25-30 мг/м2 в/в 1 раз в неделю в течение 8-10 нед.
Полихимиотерапия
AI
Доксорубицин — 75 мг/м2 в/в 72-часовая инфузия.
Ифосфамид — 2,5 г/м2 в/в 3-часовая инфузия в 1-4-й день.
254 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли мягких тканей
Месна — 500 мг/м2 в 1-й день вместе с ифосфамидом, далее 1500 мг/м2 24-часовая
инфузия в течение 4 дней.
Филграстим — 300 мкг п/к в 5-15-й день или до восстановления уровня нейтрофилов
Интервал между курсами 3 нед.
GemTax
Гемцитабин — 900 мг/м2 в/в 90-минутная инфузия в 1-й и 8-й дни.
Доцетаксел — 100 мг/м2 в/в в 8-й день.
Филграстим — 300 мкг п/к в 5-15-й день или до восстановления уровня нейтрофилов.
Для пациентов, уже получавших XT, проводится редукция доз гемцитабина до 675 мг/
м2 в 1-й и 8-й дни и доцетаксела до 75 мг/м2, также на фоне КСФ.
Интервал между курсами 3 нед.
MAID
Месна — ОД 8000 мг/м2 в/в 96-часовая инфузия (2000 мг/м2/сут 4 дня).
Доксорубицин — 60 мг/м2 в/в 72-часовая инфузия.
Ифосфамид — 6000 мг/м2 в/в 72-часовая инфузия или 2000 мг/м2 в/в 4-часовая инфу-
зия в 1-3-й день.
Дакарбазин — 900 мг/м2 в/в 72-часовая инфузия, растворенный вместе с доксоруби-
цином.
Интервал между курсами 3-4 нед.
ADIC
Доксорубицин — 90 мг/м2 в/в 96-часовая инфузия.
Дакарбазин — 900 мг/м2 в/в 96-часовая инфузия, растворенный вместе с доксоруби-
цином.
Интервал между курсами 3-4 нед.
CyADIC
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Доксорубицин — 60 мг/м2 в/в 96-часовая инфузия.
Дакарбазин — 1000 мг/м2 в/в 96-часовая инфузия, растворенный вместе с доксору-
бицином.
Интервал между курсами 3-4 нед.
Режимы химиотерапии при рабдомиосаркоме
VAI
Винкристин — 2 мг ОД в 1-й день.
Доксорубицин — 75 мг/м2 72-часовая инфузия.
Ифосфамид — 2,5 г/м2 в/в 3-часовая инфузия в 1-4-й день.
Месна — 500 мг/м2 в 1-й день вместе с ифосфамидом, далее 1500 мг/м2 24-часовая
инфузия в течение 4 дней.
Филграстим — 300 мкг п/к в 5-15-й день или до восстановления уровня нейтрофилов.
Интервал между курсами 3 нед.
VAC
Винкристин — 2 мг в/в в 1-й и 8-й дни, интервал 5 нед.
Дактиномицин — 0,5 мг/м2 в 1-5-й день (повторять каждые 3 мес., до 5 курсов).
'Диклофосфамид — 300 мг/м2 ежедневно в течение 7 дней каждые 6 нед.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 255
Химиотерапия солидных опухолей
вайяяяа®!и»®аяакв®®явй8й®яйй8й8^^ '• -
VAdriaC
Винкристин — 1,5 мг/м2 в 1, 8 и 15-й дни в течение первых 2 курсов, далее только в 1-х
день.
Доксорубицин — 60 мг/м2 48-часовая инфузия.
Циклофосфамид — 600 мг/м2 в течение 2 дней.
Перерыв 3 нед., затем
Ифосфамид — 1800 мг/м2 + месна по схеме в течение 5 дней.
Этопозид — 100 мг/м2 в 1-5-й день.
Интервал между курсами 3 нед.
9.14. Саркома Капоши
В. А. Горбунова
Саркома Капоши впервые была описана венгерским дерматологом Моритцем Капоши
в 1872 г. С тех пор и до последнего времени, когда это заболевание стало появляться \
больных СПИДом, классическая саркома Капоши считалась редкой опухолью. Ключе-
вым моментом в патогенезе было открытие человеческого вируса герпеса 8-го типа,
или гамма-вируса герпеса, известного также как вирус герпеса саркомы Капоши, кото-
рый определяется в пораженных тканях при всех клинических формах заболевания,
но отсутствует в окружающих тканях.
Выделяют четыре клинических типа опухоли (табл. 9.45). Кроме того, описаны слу-
чаи саркомы Калоши у гомосексуалистов, не инфицированных ВИЧ.
Таблица 9.45. Клинические типы сарком Капоши
Тип Поражаемая популяция Соотношение мужчин/женщин Клинические проявления Прогноз и течение
Классический Пожилые люди (50-80 лет) Европа и Северная Америка 15:1 Поражение кожи ни- жних конечностей Медленно прогресси- рует. Выживаемость 10-15 лет. У1/3 боль- ных возникают вто- рые злокачественные опухоли, чаще все- го НХЛ
Африканский Молодые пациенты (25-40 лет) Экваториальная Африка Дети (2-13 лет) 13:1 3:1 Узловатые кожные по- ражения нижних конеч- ностей, генерализован- ная лимфаденопатия, висцеральные пора- жения Локально-агрессив- ное течение, пора- жаются подлежащие ткани, включая кости. Быстро прогресси- рует, выживаемость 2-3 года
Ятрогенный (по- сттрансплантаци- онный), иммуно- депрессивный После трансплантации по- чек у иммунодепрессивных больных 23:1 Локализованные кож- ные поражения или ге- нерализованные Медленно текущее или прогрессиру- ющее, фатальное у 30% больных
256
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Саркома Капоши
Диссеминированные
поражения кожи и ели- Молниеносное тече-
Эпидемический Больные СПИДом 20:1 зистых оболочек с во- ние. 2-летняя выжива-
влечением внутренних емость 20 %
органов
В нескольких исследованиях продемонстрировано значение абсолютного числа
Т-хелперов (лимфоцитов CD4) и соотношение Т-хелперов и Т-супрессоров (CD8) как
предсказателя выживаемости. Другими факторами прогноза служат наличие оппор-
тунистических инфекций и наличие или отсутствие симптомов системных поражений.
На основании этого выделяют четыре стадии болезни:
I стадия — нет оппортунистических инфекций (ОИ) и системных симптомов (СС),
CD4 > 300/мкл;
II стадия — нет ОИ и СС, CD4 < 300/мкл;
III стадия — нет ОИ, но есть СС;
IV стадия — есть ОИ.
Имеется также отдельная классификация для эпидемической саркомы Капоши,
предложенная специальным комитетом по СПИДу, которая основана на тех же крите-
риях. В ней выделяют благоприятный и неблагоприятный прогноз, в последнюю груп-
пу включают больных, имеющих отек и изъязвление локальных поражений, пораже-
ния полости рта и/или висцеральные, CD4 < 200/мкл, наличие системных симптомов,
общий статус по шкале Карновского менее 70%, другие ВИЧ-обусловленные забо-
левания. Классическая саркома Капоши чаще всего ограничена кожей. Эти больные
предрасположены к появлению вторых опухолей, что следует иметь в виду в период
наблюдения за больными. Для лечения солитарных поражений чаще всего использу-
ется лучевая терапия фотонами или электронным пучком.
Применение высокоактивной антиретровирусной терапии помимо того, что уве-
личивает выживаемость больных и снижает риск оппортунистических инфекций,
способствует снижению заболеваемости саркомой Капоши у больных СПИДом.
В одном из исследований эффективность этого метода, состоящего из двух нукле-
отидных ингибиторов обратной транскриптазы и одного ингибитора протеазы, со-
ставила 91,6%.
В качестве локального воздействия может использоваться хирургический метод или
криодеструкция при ограниченных местных поражениях.
Иматиниба мезилат также может давать эффект при саркоме Капоши, оказывая ин-
гибирующее действие на сигнальные пути передачи.
Имеется ограниченный опыт XT при локализованном кожном поражении: использо-
вался винбластин в дозе 0,1 мкг/кг/нед. длительно.
Описано интратуморальное введение 0,25-0,5 мг винкристина с полным исчезно-
вением поражений кожи.
При иммунодепрессивной форме иногда достаточно отменить иммунодепрес-
санты.
При более распространенной болезни, при эпидемической саркоме Капоши ис-
-ользуются различные химиотерапевтические препараты как в монорежиме (на бо-
лее ранних стадиях), так и в комбинациях (при далеко зашедших стадиях процесса).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 257
Химиотерапия солидных опухолей
Описана более высокая эффективность при распространенном процессе и продле-
ние безрецидивной выживаемости при низких дозах комбинированной XT доксору-
бицином, блеомицином и винкристином (ABV) по сравнению с одним доксорубици-
ном, однако разницы в общей выживаемости не отмечено. Изучается высокодозная
XT. У ВИЧ-инфицированных больных антиретровирусная терапия зидовудином про-
длевает выживаемость и уменьшает частоту инфекционных осложнений.
Хотя имеется довольно широкий спектр препаратов, которые могут быть использо-
ваны для лечения саркомы Капоши, на сегодня стандартом считается липосомный ин-
капсулированный доксорубицин (Доксил, Келикс), позволяющий увеличить концен-
трацию антрациклина в опухоли и модифицировать токсический профиль.
Рандомизированное многоцентровое исследование показало улучшение эффек-
тивности (45-60 us 20-25%) и лучшую переносимость липосомного доксорубицина
по сравнению с комбинацией доксорубицина, винкристина и блеомицина (ABV) или
блеомицина и винкристина (BV).
Паклитаксел также показал высокую эффективность (50%) во время II фазы клини-
ческого испытания.
ИФН -а дает эффект у 40% больных с эпидемической формой саркомы Капоши.
Режимы терапии
Монотерапия (эффективность)
Винбластин — 0,1 мг/кг/нед. еженедельно, длительно (26%).
Этопозид — 100 мг/м2 в/в в 1 -5-й день (76 %).
Винкристин — 1 мг/м2/нед. в/в еженедельно (61 %).
Иматиниба мезилат — 400 мг/сут внутрь вплоть до реализации эффекта.
Блеомицин —15 мг в/в или в/м 3 раза в неделю или 30 мг 1-2 раза в неделю, суммар-
но до 300 мг (77 %).
Доксорубицин — 50-60 мг/м2 1 раз в 3 нед. или 30 мг/м2/сут в течение 3 дней с интер-
валом 3 нед., суммарно до 550 мг/м2 (48%).
Доксорубицин липосомный — 20 мг/м2 30-минутная инфузия каждые 3 нед.
Комбинированная химиотерапия
Комбинации блеомицин + винбластин либо винкристин и доксорубицин + блеоми-
цин + винбластин или винкристин эффективны у 60-88% больных.
9.15. Первичные злокачественные опухоли костей
А. А. Феденко
Злокачественные опухоли костей в структуре заболеваемости злокачественными но-
вообразованиями занимают менее 1 % у взрослых и 7-10% у детей. Наиболее часто
встречаются саркомы семейства Юинга, остеосаркома, хондросаркома, злокачест-
венная фиброзная гистиоцитома кости.
Классификация злокачественных опухолей костей по системе TNM AJCC
(6-е издание, 2002)
Первичная опухоль (Т)
ТХ — первичная опухоль не оценена.
ТО — первичная опухоль отсутствует.
Т1 — опухоль 8 см и менее.
258 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Первичные злокачественные опухоли костей
Т2 — опухоль 8 см и более.
ТЗ — первичные множественные опухоли кости.
Регионарные лимфоузлы (N)
NX — лимфоузлы не оценены.
NO — отсутствие метастазов в регионарных лимфоузлах.
N1 — метастазы в регионарных лимфоузлах.
Отдаленные метастазы (М)
MX — недостаточно данных для оценки отдаленных метастазов.
МО — нет отдаленных метастазов.
Ml — отдаленные метастазы.
Ml а — легкое.
М1Ь — другие локализации.
Степень дифференцировки (G)
GX — не может быть оценена.
G1 — высокодифференцированная (низкая степень злокачественности).
G2 — умеренно дифференцированная (низкая степень злокачественности).
G3 — низкодифференцированная (высокая степень злокачественности).
G4 — недифференцированная (высокая степень злокачественности).
Внимание: саркома Юинга и примитивные нейроэктодермальные опухоли (PNET)
всегда G4.
В табл. 9.46 приводится группировка опухолей костей по стадиям.
Таблица 9.46. Группировка злокачественных опухолей костей по стадиям
I Стадия TNM
IA T1 NO MO G1, II (низкая) степень злокачественности
IB Т2 NO МО G1, II (низкая) степень злокачественности
ПА Т1 NO МО G3, IV (высокая) степень злокачественности
НВ Т2 NO МО G3, IV (высокая) степень злокачественности
III ТЗ NO МО блюбая
IVA Тлюбая NO М1а блюбая
IVB Тлюбая N1 Млюбая блюбая Тлюбая NnK)6an M1b блюбая
9.15.1. Остеосаркома
Регистрируется около 700-900 новых случаев в год, отмечается бимодальный пик во
зторой-третьей и шестой декадах жизни, встречается в 2 раза чаще у лиц мужского
пола и составляет 45 % всех первичных злокачественных опухолей костей.
Локализуется преимущественно в метафизах трубчатых костей — дистальная часть
бедренной кости, проксимальная часть большеберцовой кости и проксимальная часть
плечевой кости (три наиболее часто встречающиеся локализации, расположены по
мере убывания частоты встречаемости), в 90% случаев характеризуется выраженным
мягкотканным компонентом.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 259
Химиотерапия солидных опухолей
Первичная причина неизвестна, более чем в 90% отмечается делеция гена Rb, из
вторичных необходимо отметить экспозицию радием, предшествующую лучевую те-
рапию, болезнь Педжета, другие доброкачественные опухоли костей.
Для классификации и стадирования используется система, общая для злокачествен-
ных опухолей костей, — AJCC (TNM) и MSTS (Enneking).
Диагностика остеосаркомы проводится по следующим характеристикам.
Клинические признаки — возраст, локализация, анамнез и данные объективного ос-
мотра (болевой синдром, горячая, твердая — каменистой плотности опухолевая мас-
са и, редко, патологические переломы).
Рентгенологическая оценка: на этапе обследования целесообразно выполнить рен-
тгенографию пораженной кости, сцинтиграфию костей скелета для выявления кост-
ных метастазов, КТ зоны первичной опухоли (для детальной визуализации костных
структур), МРТ для визуализации мягкотканного компонента и костномозговых струк-
тур, рентгенографию и КТ грудной клетки для исключения метастатического пораже-
ния легких.
Ангиография не используется в качестве метода диагностики, но очень информатив-
на для оценки степени ответа опухоли на предоперационную XT.
Патоморфологическая верификация: в большинстве случаев толсто игольная би-
опсия позволяет поставить патоморфологический диагноз, в редких случаях исполь-
зуется трепан- или открытая биопсия. Биопсия должна выполняться в специализи-
рованных учреждениях, в которых есть группа по лечению сарком, и в идеале тем
же хирургом-ортопедом, который будет впоследствии выполнять хирургический
этап лечения. Зона биопсии должна быть удалена вместе с первичной опухолью, что
крайне важно и критически влияет на отдаленные результаты всего комплексного
лечения.
Факторы благоприятного прогноза. При многофакторном анализе наиболее
важным фактором, влияющим на выживаемость и безрецидивный период, оказался
ответ на предоперационную XT. К другим факторам относятся морфологическая ха-
рактеристика опухоли, локализация, распространенность процесса, степень злока-
чественности и размер первичной опухоли, продолжительность заболевания, потеря
массы тела более чем на 4,5 кг с момента заболевания, отек в зоне первичной опухоли
и наличие литической деструкции кости.
Лечение
Ранее 2-летняя выживаемость больных с остеосаркомой, получивших только хи-
рургическое лечение, составляла 5-20%, что связано с очень высоким процентом
метастазирования в легкие и кости. Эти данные стимулировали проведение рандо-
мизированных исследований с использованием адъювантной XT, которые показали
значительное преимущество по всем онкологическим показателям по сравнению с
только хирургическим подходом. В настоящее время стандартом лечения считается
комплексный подход с использованием предоперационной (неоадъювантной) XT, хи-
рургического лечения и адъювантной XT. Использование предоперационной XT дает
возможность выполнять органосохраняющие операции в 80-90% случаев, при этом
можно оценить эффективность режима XT in uiuo для правильного выбора схемы адъ-
ювантной терапии, что позволяет в 50-80% случаев добиться полного излечения па-
циентов в результате комплексного лечения.
Хирургическое лечение. С использованием комбинированных подходов в настоящее
время нет разницы в показателях общей выживаемости и проценте местных рециди-
вов при проведении органосохраняющих оперативных вмешательств и ампутации ко-
260 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Первичные злокачественные опухоли костей
нечности. При отсутствии противопоказаний методом выбора являются органосохра-
няющие операции.
Лучевая терапия. Остеосаркома — опухоль, резистентная к лучевой терапии. Вле-
чении классической остеосаркомы конечностей не применяется.
Химиотерапия. XT используется на пред- и послеоперационном этапах. При дости-
жении IV степени лечебного патоморфоза (более 90% некротизированных клеток)
удается значительно увеличить показатели общей выживаемости. Предоперационная
XT проводится, как правило, в течение 3-4 мес. перед хирургическим лечением. Вы-
бор режима послеоперационной XT проводится по данным гистологического иссле-
дования удаленного материала.
К наиболее эффективным препаратам относятся цисплатин, доксорубицин, ифос-
фамид, метотрексат в высоких дозах.
Для лечения остеосарком используются комбинированные режимы XT или монохи-
миотерапия в высоких дозах (ифосфамид 14 г/м2).
Выбор тактики лечения при локализованной остеосаркоме
1. Проведение 3-4 курсов предоперационной XT с использованием следующих
режимов.
Доксорубицин — 90 мг/м2 96-часовая инфузия по 22,5 мг/м2 в сутки в 1-4-й день.
Цисплатин — 120 мг/м2 внутриартериально (только при первичной опухоли) или в/в
в 6-й день.
Интервал между курсами 28 дней.
2. Через 1 мес. после завершения предоперационной XT выполняется оператив-
ное вмешательство.
3. Оценка степени лечебного патоморфоза и послеоперационная XT.
Если количество некротизированных клеток в операционном материале составля-
ет 90% и более, рекомендуется проведение еще 3-6 курсов (зависит от достижения
кумулятивной дозы доксорубицина 800 мг/м2 при использовании инфузионного вари-
анта введения) послеоперационной XT по прежней схеме. При невозможности даль-
нейшего использования цисплатина рекомендуется переход на схему: доксорубицин
75 мг/м2 72-часовая инфузия + ифосфамид 2,5 г/м2 3-часовая инфузия в 1-4-й день на
фоне месны.
Если количество некротизированных клеток в операционном материале составляет
менее 90%, рекомендуется переход на альтернативный режим XT.
Альтернирующий режим по следующей схеме.
Высокодозный метотрексат — 12 г/м2 в/в с лейковорином 1 раз в 2 нед. в течение
8 нед. Данный режим введения должен использоваться в соответствии со специально
разработанным протоколом введения в специализированныхучреждениях. Далее че-
рез 3 нед. после окончания 2-го курса по схеме:
Ифосфамид — 2 г/м2 3-часовая инфузия + месна 100% по схеме в 1-5-й день.
Доксорубицин — 75 мг/м2 72-часовая инфузия.
КСФ (филграстим и т.п.) — 5 мкг/кг п/к в 6-16-й день.
Интервал между курсами 3 нед.
Далее повторение всего цикла (4 курса метотрексата, 2 курса ифосфамида с доксо-
рубицином) и в завершение 4 курса метотрексата.
Проведение этого высокоэффективного комплексного лечения возможно только в
специализированных медицинских учреждениях.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 261
Химиотерапия солидных опухолей
ЯЯЙЯМЯЯввЯИИЙДЯйЙЯЯЙЮИВЙВВЙЙВваВЙвЯйй^^ #г’“ » •*
Выбор тактики лечения при диссеминированной остеосаркоме
Подходы к лечению метастатического процесса существенно отличаются при мета-
статическом поражении легких и костей. Проявление болезни в костях свидетельству-
ет о крайне плохом прогнозе. При наличии первичной опухоли и метастатического по-
ражения легких у пациентов, ранее не получавших специфического лечения, должна
применяться тактика, направленная на излечение, а не с паллиативной целью. Так, при
хорошем ответе на предоперационную XT возможно выполнение полной метастазэк-
томии, при этом безрецидивная и общая выживаемость могут составлять более 30%.
Таким пациентам должно проводиться комплексное лечение, как и при локализован-
ных формах.
При появлении симптомов болезни более чем через 6 мес. после комплексного ле-
чения возможно повторное использование ранее применявшихся схем.
Большинство пациентов после комбинированного лечения уже получали 4 наибо-
лее эффективных схемы XT, стандартов в лечении диссеминированного процесса нет.
Наилучшие результаты показала схема IE:
Ифосфамид — 1800 мг/м2 в/в 3-часовая инфузия в 1-5-й день + месна 120% по
схеме.
Этопозид — 100 мг/м2 в/в в 1-5-й день.
КСФ — 5 мкг/кг п/к в 6-16-й день.
Интервал между курсами 3 нед.
В настоящее время продолжают изучать эффективность комбинации гемцитабина и
доцетаксела при диссеминированных остеогенных саркомах. По данным II фазы ис-
следования, эффективность этого режима составляет до 30%.
Гемцитабин — 675 мг/м2 в/в 90-минутная инфузия в 1-й и 8-й дни.
Доцетаксел — 75 мг/м2 в 8-й день.
КСФ — 5 мкг/кг п/к в 9-19-й день.
Интервал между курсами 3 нед. (каждые 21 день).
9.15.2. Хондросаркома
Хондросаркома — вторая по частоте саркома костей.
Большинство пациентов старше 40 лет, только 4% пациентов моложе 20 лет.
Локализация: таз — 30%, бедро — 20% и плечевой пояс — 15%. Хондросаркома —
наиболее частая злокачественная опухоль лопатки и грудины.
Основная симптоматика появляется за счет механического сдавления окружающих
тканей. При жалобах пациента на болевые ощущения в области образования, которое
выглядит как энхондрома, следует предполагать наличие хондросаркомы.
Выделяют три основных подтипа.
Классическая хондросаркома (Gl-З). Классические хондросаркомы химиорези-
стентны, и единственным методом лечения является хирургический. Они представ-
лены в основном образованиями I-II степени злокачественности. Классические хонд-
росаркомы III степени злокачественности метастазируют в 75% случаев. В настоящее
время эффективных режимов XT для лечения классических хондросарком не суще-
ствует.
Мезенхимальная хондросаркома характеризуется мелкоклеточным компонентом,
химиочувствительна, является редкой, высокозлокачественной опухолью, в основном
наблюдается у молодых пациентов, поражает плоские кости, 10-летняя выживаемость
составляет 28%. Тактика лечения своеобразная — хирургическое удаление и послео-
262 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Первичные злокачественные опухоли костей
перационная XT (режимы, как при саркоме Юинга/PNET). Может отвечать на лучевую
терапию.
Дедифференцированная хондросаркома химиочувствительна. Дедифференциро-
ванный компонент, как правило, представлен остеосаркомой или злокачественной
фиброзной гистиоцитомой, для лечения используются соответствующие режимы
ПХТ. Отмечается 100%-е метастазирование в течение 12 мес. после постановки диаг-
ноза и практически 100%-я летальность в течение 24 мес. При использовании адъю-
вантной ПХТ 5-летний безрецидивный период, по данным разных авторов, составля-
ет до 45 %.
9.15.3. Злокачественная фиброзная гистиоцитома кости
Данный гистологический подтип выделен отдельно в начале 1970-х годов. Нередко
является компонентом дедифференцированной хондросаркомы и очень часто ком-
понентом остеосаркомы. Этот подтип относится к высокозлокачественным опухолям
костей, и тактика лечения не отличается от остеосарком. При этом более чем в 50%
случаев удается добиться некроза опухолевых клеток более 90% после проведения
предоперационной XT (медиана выживаемости составляет 66 мес.).
Режимы XT при остеосаркоме, мезенхимальной дедифференцированной хондро-
саркоме и злокачественной фиброзной гистиоцитоме кости следующие.
АР
Доксорубицин — 90 мг/м2 в/в 96-часовая инфузия по 22,5 мг/м2 в сутки в 1 —4-й день.
Цисплатин — 120 мг/м2 внутриартериально (только при первичной опухоли) или в/в в
6-й день.
Интервал между курсами 3 нед.
HDMTX
Высокодозный метотрексат 12 г/м2 в/в с лейковорином 1 раз в 2 нед. в течение 8 нед.
Данный режим введения должен использоваться в соответствии со специально разра-
ботанным протоколом введения в специализированных учреждениях.
AI
Ифосфамид — 2 г/м2 3-часовая инфузия + месна 120% по схеме в 1-5-й день.
Доксорубицин — 75 мг/м2 72-часовая инфузия.
КСФ (филграстим и т. п.) — 5 мкг/кг п/к в 6-16-й день.
Интервал между курсами 3 нед. (начало следующего курса на 21-й день).
1Е
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день + месна 100% по схеме.
Этопозид — 100 мг/м2 в/в в 1-5-й день.
КСФ — п/к в 6-16-й день.
Интервал между курсами 3 нед. (начало следующего курса на 21-й день).
GemTax
Гемцитабин — 675 мг/м2 в/в 90-минутная инфузия в 1-й и 8-й дни.
Доцетаксел — 75 мг/м2 в 8-й день.
КСФ — п/к в 9-19-й день.
Интервал между курсами 3 нед. (начало следующего курса на 21-й день).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 263
Химиотерапия солидных опухолей
9.15.4. Саркома Юинга и примитивные
нейроэктодермальные опухоли
Саркома Юинга — высокозлокачественная мелкокруглоклеточная опухоль костей, со-
ставляет 15-20% всех первичных опухолей скелета. Чаще всего наблюдается во вто-
рой декаде жизни.
Локализация: таз/крестец — 20%; проксимальные конечности: бедренная кость —
21 %, плечевая кость — 10%; дистальные конечности: большеберцовая кость — 11 %,
локтевая кость — 14%; другие локализации: ребра — 7%, позвонки — 5%, лопатка —
4%, другие кости — менее 2%.
До начала эры XT 5-летняя выживаемость составляла менее 10% и летальность в те-
чение первого года после постановки диагноза — более 50%.
По определению, это высокозлокачественное (G4) системное заболевание, т.к. в
100% случаев, даже при наличии только первичной опухоли, есть отдаленные микро-
метастазы.
Классифицируется и стадируется стандартно, по AJCC, хотя для саркомы Юинга ста-
дирование используется редко, при этом выделяется IVA стадия при метастазах в лег-
ких и IVB — при поражении других костей, что связано с гораздо худшим прогнозом.
Редко встречаются экстраоссальные формы саркомы Юинга, тактика их лечения не
отличается от классических.
Клинически наиболее часто представляет собой мягкотканное образование по-
раженной зоны, и, как правило, пациенты жалуются на непродолжительный боле-
вой синдром. Часто наблюдается слабость, потеря массы тела, лихорадка (чаще у па-
циентов с диссеминированным процессом), лейкоцитоз. Диссеминированная стадия
встречается в 15-50% случаев на момент обращения.
Диагностические исследования необходимо начинать с рентгенографии грудной
клетки для исключения метастатического поражения, рентгенографии первичной
опухоли, а также КТ/МРТ первичной опухоли и грудной клетки. Сцинтиграфия костей
скелета необходима для исключения костных поражений. Для исключения метастати-
ческого поражения костного мозга можно выполнить МРТ позвоночника, т.к. наибо-
лее часто метастазы в костном мозге определяются в телах позвонков.
Положительные факторы прогноза:
возраст менее 16 лет;
В преобладание костного компонента: 5-летняя выживаемость до 87 %, а при пре-
обладании мягкотканного — всего 20%;
® первичная опухоль дистальных конечностей (длинных трубчатых костей);
® нормальная активность ЛДГ в сыворотке крови;
отсутствие видимого метастатического поражения;
Я полный ответ на XT.
Лечение
В настоящее время используется комплексный подход в лечении этой группы сарком.
Один хирургический метод дает не более 10% отдаленных результатов, что связано с
исходным наличием микрометастазов. В прошлом десятилетии активно использова-
лась комбинация лучевой терапии (СОД 50 Гр, выживаемость 16-25% при непосред-
ственной эффективности 44-86%) и XT (непосредственная эффективность 80% при
поражении дистальных отделов конечностей, 60-80% — проксимальных отделов и
таза). Сейчас лучевая терапия активно заменяется органосохраняющими операция-
ми, которые в ряде случаев позволяют добиться лучших результатов в комбинации с
264 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Первичные злокачественные опухоли костей
XT. Лечение должно проводиться в специализированных лечебных учреждениях, за-
нимающихся лечением данной группы заболеваний, т.к. только при комплексном под-
ходе можно добиться излечения 60-70% пациентов.
Химиотерапия
У большинства пациентов с метастатическим поражением удается достичь полного
ответа, однако практически у всех, и в особенности с наличием костных метастазов,
возникнет рецидив заболевания и быстрый смертельный исход. При отсутствии види-
мого исходно метастатического поражения и первичной локализации опухоли в длин-
ных трубчатых костях удается добиться излечения в 60-70% случаев.
Эффективные препараты в лечении саркомы Юинга (при использовании в моноте-
рапии): циклофосфамид — 50%, доксорубицин — 40%, ифосфамид — 32%, винкрис-
тин — 30%, дактиномицин — 33%, этопозид — 30%, цисплатин — 7%.
Наиболее эффективны режимы XT с включением винкристина, доксорубици-
на и ифосфамида (VAI) или циклофосфамида (VArdiaC) с добавлением дакарбазина
(CyVADIC) или без него.
В качестве индукционной (предоперационной) XT используется альтернирующий
режим XT:
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день + месна по схеме.
Этопозид — 100 мг/м2 в/в в 1-5-й день.
Далее через 3 нед. переход на схему:
Циклофосфамид — 1200 мг/м2 в/в в 1-й день.
Доксорубицин — 75 мг/м2 в/в в 1-й день.
Винкристин — 2 мг ОД в/в в 1-й день.
Интервал 3 нед. и далее снова режим с ифосфамидом.
На предоперационном этапе проводится 4-6 курсов XT по указанной схеме; затем, по-
сле оперативного вмешательства, при хорошем лечебном патоморфозе проводится адъ-
ювантная XT по этой же схеме. Общая продолжительность лечения составляет до 12 мес.
Режимы XT при саркоме Юинга/PNET (для нелеченных пациентов)
VAI
Ифосфамид — 2,5 г/м2 3-часовая инфузия в 1-4-й день + месна 100% по схеме.
Доксорубицин — 75 мг/м2 72-часовая инфузия.
Винкристин — 2 мг ОД в/в в 1-й день.
КСФ (филграстим и т. п.) — в 5-15-й день.
Интервал между курсами 3 нед.
CyVADIC
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Винкристин — 1,4 мг/м2 (максимальная доза 2 мг) в/в еженедельно в течение 6 нед., да-
лее в 1-й день каждого цикла.
Доксорубицин — 60 мг/м2 в/в 96-часовая инфузия через центральный венозный кате-
тер (15 мг/м2 в сутки) в 1-4-й день.
Дакарбазин — 1000 мг/м2 в/в 96-часовая инфузия вместе с доксорубицином в од-
ном флаконе (250 мг/м2 в сутки) в 1-4-й день. Дозы должны быть разделены на четыре
24-часовые инфузии, это связано со стабильностью разведенных растворов.
Интервал между курсами 3-4 нед.
1E/CAV
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день + месна 100% по схеме.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 265
Химиотерапия солидных опухолей
Этопозид — 100 мг/м2 в/в в 1—5-й день, далее через 3 нед. переход на альтернирую-
щую схему:
Циклофосфамид — 1200 мг/м2 в/в в 1-й день.
Доксорубицин — 75 мг/м2 в/в в 1-й день.
Винкристин — 2 мг ОД в/в в 1-й день.
Интервал 3 нед., далее снова режим с ифосфамидом.
Режимы XT при саркоме Юинга/PNET (при прогрессировании после комплексного
лечения)
При позднем прогрессировании (более 12 мес.) возможно повторное использова-
ние ранее применявшихся режимов. Некоторую эффективность показали ингиби-
торы топоизомеразы I, этопозид, алкилирующие агенты, производные нитрозомо-
чевины и цисплатин. Также возможно применение доксорубицина в высоких дозах
(90 мг/м2) в виде 96-часовой инфузии или ифосфамида 2000 мг/м2 3-часовая инфу-
зия в 1 -7-й день, общая доза 14 г/м2, на фоне месны у пациентов, получавших ранее эти
препараты в стандартных дозах, и если не выбрана кумулятивная доза доксорубицина.
Однако повторные ответы на XT крайне редки, а продолжительность жизни после ре-
цидива заболевания измеряется неделями.
9.16. Опухоли центральной нервной системы
М. Б. Бычков, Д. Р. Насхлеташвили
9.16.1. Первичные опухоли головного мозга
Опухоли ЦНС составляют 1,5% всех опухолей и являются причиной смерти 2,3%
онкологических больных. Они встречаются в 9 раз чаще у пожилых лиц, чем у моло-
дых, и несколько чаще у мужчин.
Гистологические формы злокачественных опухолей мозга:
Я менингиомы (26,7 % больных);
Я глиобластомы (21,7%);
Я астроцитомы (16,6%);
Я эпендиомы (2,3%);
Я олигодендроглиомы (у 3,1 %);
эмбриональные опухоли, включая медуллобластомы (до 2%);
Я другие формы (лимфомы, гемангиомы, герминогенные опухоли и др.) (3,5-1 %).
Первые три формы составляют более 60% всех опухолей мозга. Наиболее высокая
частота опухолей мозга встречается в возрасте 75-84 лет.
Лечение
Методом выбора для больных с опухолями ЦНС является операция. Хирургическое
лечение рекомендуется для большинства видов опухолей и разнообразных их лока-
лизаций в мозге. Оно должно быть как можно более полным. Исключение может быть
сделано для глубокорасположенных опухолей, которые можно лечить без оператив-
ного вмешательства.
В большинстве случаев, тем не менее, желательно уточнение морфологического
строения опухоли. Стереотаксическая биопсия может быть использована при опухо-
лях, трудных для удаления.
266 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли центральной нервной системы
> - . у-г4 -hr г-~г .г.~т г^у?штигТ1тэт‘ЖТ1Тггт]тгтпог|Лтшотажи1адтош
Хирургическое лечение обычно дополняют облучением. Лучевая терапия является
эффективной адъювантной терапией, и в проспективных рандомизированных иссле-
дованиях было показано увеличение выживаемости больных с глиобластомами при
использовании послеоперационной лучевой терапии по сравнению с одной опера-
цией. Лучевая терапия после операции — наиболее эффективное лечение для всех ги-
стологических видов злокачественных опухолей мозга.
Химиотерапия
XT обычно используется адъювантно после операции или лучевой терапии, а также
при неоперабельных и рецидивных опухолях.
XT увеличивает выживаемость больных при некоторых видах опухолей мозга и дли-
тельность периода без прогрессирования у больных с глиомами, медуллобластомами
и герминогенными опухолями.
В качестве цитостатиков используют такие препараты, как темозоломид (Темодал),
прокарбазин (Натулан), нитрозопроизводные — ломустин (CCNU), кармустин (BCNU),
нимустин (ACNU, Нидран), фотемустин (Мюстофоран), дакарбазин (ДТИК), а также
иринотекан, этопозид, тенипозид, винкристин, цисплатин, карбоплатин, паклитаксел.
Эффективность XT, по данным литературы, колеблется от 20 до 60%. Лечение об-
ычно проводят на фоне активной дегидратации с использованием кортикостероидов
(дексаметазона).
Режимы терапии
1. Темозоломид (Темодал) — 150-200 мг/м2 внутрь в 1 -5-й день каждые 28 дней.
2. PCV. Ломустин (CCNU) — 100 мг/м2 внутрь в 1-й день.
Прокарбазин (Натулан) — 60 мг/м2 внутрь в 8-21-й день.
Винкристин — 1,5 мг/м2 в/в в 1-й и 8-й дни.
Повторение циклов на 42-й день, считая от 1-го дня предыдущего цикла.
3. Ломустин (CCNU) — 60 мг/м2 внутрь в 1-й день.
Доксорубицин — 45 мг/м2 в/в во 2-й день.
Тенипозид — 60 мг/м2 в/в во 2-й день.
Повторение циклов через 6 нед.
4. Цисплатин — 75 мг/м2 внутриартериально.
Ломустин (BCNU) — 100 мг/м2 внутриартериально в 1-й день.
Повторение циклов через 4 нед.
5. Цисплатин — 45 мг/м2 в/в в 1-й день.
Доксорубицин — 45 мг/м2 в/в в 1-й день.
Циклофосфамид — 450 мг/м2 в/в в 1-й день.
Повторение циклов через 4 нед.
6. Нимустин (ACNU, Нидран) — 90 мг/м2 в/в в 1-й день.
Тенипозид — 60 мг/м2 в/в в 1-3-й день.
Повторение циклов через 6-8 нед.
7. Дакарбазин (ДТИК) — 250 мг/м2 в/в в 1-4-й день.
Карбоплатин — 100 мг/м2 в/в в 1-4-й день.
Повторение циклов через 4 нед.
Для второй линии терапии может быть использована схема ЕР: этопозид 100 мг/м2 в
1 -3-й день + цисплатин 100 мг/м2 в 1-й день. У больных с рецидивами глиобластом по-
казана эффективность терапии по схеме: бевацизумаб (Авастин) 10 мг/кг 1 раз в 2 нед.
Прогноз у больных с опухолями ЦНС определяется гистологической формой опу-
холи, стадией заболевания, возрастом и состоянием больного, а также степенью выра-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 267
Химиотерапия солидных опухолей
женности неврологических нарушений. В последние годы показана зависимость вы-
живаемости больных со злокачественными глиомами от молекулярно-генетических
факторов: статуса MGMT (метилгуанинметилтрансферазы) и экспрессии EGFR (рецеп-
тора эпидермального фактора роста) в опухоли. Наиболее благоприятный прогноз
имеют больные со злокачественными глиомами с метилированием MGMT в опухоли
и отсутствием экспрессии EGFR. У больных анапластическими олигодендроглиомами
(глиомы III степени злокачественности) выживаемость зависит от делеции генов 1р и
lq в опухоли. XT (схема PCV) высокоэффективнау больных с анапластическими олиго-
дендроглиомами с наличием делеции lp/lq в опухоли.
Медиана выживаемости у больных с глиобластомами (глиомы IV степени злокачест-
венности) без лечения составляет 3-6 мес., при хирургическом лечении — 6-9 мес..
при сочетании хирургического лечения с лучевой терапией — 9-12 мес., а при ком-
плексном лечении (операция с последующей лучевой терапией и XT темозоломи-
дом) — 15-18 мес.
9.16.2. Метастатические опухоли головного мозга
Среди больных с интракраниальными опухолями у 20-40 % имеет место метастатиче-
ское поражение мозга.
Улучшение результатов системной терапии рака легкого привело к увеличению ко-
личества больных, живущих достаточно долго, чтобы развились метастазы в мозг. Улуч-
шилась также диагностика метастатических опухолей головного мозга с использова-
нием КТ и МРТ головного мозга. Риск развития метастазов в головном мозге зависит от
первичной локализации и морфологии опухоли:
» МРЛ - до 80%;
Я НМРЛ - 25-30%;
Я меланома — до 50%;
И РМЖ — до 15-20% (у больных с гиперэкспрессией HER2 — 28-43 %);
Я рак почки — 10%;
Я рак яичка — до 15%;
Я хориокарцинома — 10-15%.
Метастазы в мозг могут проявляться на любом этапе заболевания раком, чаще возни-
кают метахронно, но могут появляться синхронно или даже до выявления первичной
опухоли. Как правило, в ЦНС метастазируют эпителиальные опухоли. Метастазы в моз-
ге сарком, герминогенных опухолей яичка и других опухолей бывают относительно
редко. Обычно метастазы в мозге развиваются в течение от 6 мес. до 2 лет после уста-
новления диагноза первичной опухоли и всегда ассоциируются с прогрессированием
болезни. Метастазы в мозге всегда гематогенные. Опухолевые клетки продуцируют и
секретируют ангиогенные субстанции, которые стимулируют процессы неоангиоге-
неза, и это, в свою очередь, вызывает нарушение ГЭБ. Дифференциальная диагности-
ка метастатических опухолей головного мозга проводится обычно с абсцессами, пер-
вичными опухолями мозга, демиелинизированными изменениями.
Лечение
Показания к хирургическому лечению метастазов в мозге:
Я необходимость установления диагноза в сомнительных случаях;
» удаление ведущего в клинической картине очага для быстрой паллиативной по-
мощи больному;
268 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли центральной нервной системы
® возможность продления жизни больным с солитарными метастазами в головном
мозге (по ретроспективном данным, с медианой выживаемости более 12 мес.).
Лучевая терапия проводится в неоперабельных случаях или после паллиативных
операций и рецидивов в СОД 30-40 Гр по 1,5-2 Гр 5 дней в неделю. У больных с еди-
ничными метастазами в головном мозге (1-4 очага в головном мозге размером не бо-
лее 3 см), хорошим соматическим статусом (> 70% по Карновскому) и контролем
экстракраниальных проявлений опухолевого процесса возможно проведение стере-
отаксической лучевой терапии (18-22 Гр за один сеанс) на отдельные опухолевые оча-
ги с или без последующей лучевой терапии на весь головной мозг.
Химиотерапия
Выбор препаратов для лечения должен определяться в зависимости от чувствитель-
ности первичной опухоли. В монотерапии изучались такие препараты, как темозоло-
мид (Темодал), фотемустин (Мюстофоран), этопозид, тенипозид, ломустин (CCNU), ги-
дроксимочевина, прокарбазин (Натулан), фторурацил, карбоплатин. Их активность
составляет от 8 до 40%. Комбинированная XT по схемам CAP, CAV, AVP и другим при-
водила к объективному эффекту у 27-50% больных (независимо от локализации пер-
вичного очага). Наибольший успех удается получать при лечении метастазов в мозге
МРЛ (до 70%) и РМЖ. Могут быть использованы и другие режимы XT (гемцитабин + ви-
норелбин ± карбоплатин, паклитаксел + цисплатин).
В последние годы для лечения метастазов в мозге рака легкого, меланомы, РМЖ ис-
пользуется темозоломид (Темодал) в монотерапии (150-200 мг/м2 внутрь 5 дней под-
ряд каждые 28 дней) или в комбинации с облучением мозга (75 мг/м2/сут внутрь в
1-14-й день, с первого дня проведения лучевой терапии).
При метастазах в мозге НМРЛ наиболее эффективна комбинированная XT гемцита-
бин + цисплатин по схеме:
Гемцитабин (Гемзар) — 1 г/м2 в/в в 1-й и 8-й дни.
Цисплатин — 50 мг/м2 в/в в 1-й и 8-й дни.
Повторение циклов с интервалом 3 нед.
При метастазах в мозге МРЛ рекомендуются следующие схемы.
1. Нимустин (Нидран, ACNU) — 2 мг/кг в/в в 1-й день.
Этопозид — 100 мг/м2 в/в в 1-3 день.
Цисплатин — 80 мг/м2 в/в в 1-й день.
Курсы проводятся 1 раз в 6 нед.
2. Иринотекан — 60 мг/м2 в/в в 1,8 и 15-й дни.
Цисплатин — 60 мг/м2 в/в в 1-й день.
Курсы проводятся 1 раз в 3 нед.
У больных РМЖ с метастазами в головном мозге эффективны режимы XT с включе-
нием антрациклинов (CAF, АС), а также схема CMF. В литературе есть данные об эф-
фективности капецитабина, топотекана, комбинированных режимов XT с включением
препаратов платины (гемцитабин + цисплатин, этопозид + цисплатин).
У больных с гиперэкспрессией HER2 возможно проведение XT по схеме:
Капецитабин (Кселода) — 2000 мг/м2/сут внутрь в 1-14-й день каждые 3 нед. + лапа-
тиниб (Тайверб) — 1250 мг/сут (постоянно).
У больных с меланомой и метастазами в головном мозге используют режимы мо-
нохимиотерапии с включением темозоломида (Темодал), нитрозопроизводных (фо-
темустин, ломустин, нимустин) или комбинированные режимы XT (темозоломид + ци-
сплатин, фотемустин + цисплатин, ломустин (или нимустин) + дакарбазин + цисплатин).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 269
Химиотерапия солидных опухолей
жв8Яйй8Яяаявиаявваюйа1й®дай®88®йй®8Еййа®я^^ а\? гь -ч л
При наличии отека мозга обычно назначают кортикостероиды: дексаметазон по 8 мг
в/м 2-3 раза в сутки. Улучшение состояния обычно наступает в течение 6-24 ч после
применения кортикостероидов, а максимальный эффект достигается на 3-7-й день.
При эпилептических приступах назначают антиконвульсанты (финлепсин, депакин).
Медиана выживаемости у больных с метастазами в мозге без лечения составляет
1 -2 мес., при приеме кортикостероидов — 2-3 мес., после операции с лучевой те-
рапией или без нее (при солитарных и единичных метастазах в головном мозге) —
6-16 мес., а после XT (при лечении рака легкого и РМЖ) — 8-12 мес.
9.17. Опухоли надпочечников
В. А. Горбунова
По морфологическим и клиническим признакам новообразования надпочечников
можно разделить на две основные группы:
опухоли, исходящие из коркового вещества надпочечников;
опухоли, исходящие из мозгового вещества надпочечников.
Как зрелые аденомы, так и незрелые формы рака, как правило, обладают гормо-
нальной активностью, определяющей основные клинические симптомы заболевания.
9.17.1. Рак коры надпочечников (адренокортикальный рак)
Среди злокачественных опухолей, исходящих из кортикального слоя надпочечников,
наиболее часто встречается злокачественная кортикостерома, клинически характе-
ризующаяся развитием синдрома Кушинга.
Основной метод лечения опухолей коркового вещества — хирургический. В после-
операционный период показана заместительная терапия кортикостероидами.
В случаях невозможности проведения радикального лечения предпринимаются по-
пытки консервативного лечения. Применяют митотан (Хлодитан, Лизодрен). Этот пре-
парат представляет собой Орто-пара-ДДД. Он угнетает биосинтез кортикостероидов
и повреждает клетки коры надпочечников. Поэтому противоопухолевый эффект ми-
тотана при кортикостероме выражается в первую очередь в снижении избыточной
продукции гормонов коры надпочечников (70% больных), и только у 30-40% больных
отмечается уменьшение опухолевых узлов, обычно частичная регрессия (медиана ре-
миссии 10,5 мес.).
Учитывая свойства митотана, дозу препарата повышают постепенно, желательно под
контролем фармакокинетического определения его содержания в сыворотке кро-
ви. Концентрация препарата должна составлять 14-20 мкг/мл.В связи с возможностью
развития надпочечниковой недостаточности терапию проводят на фоне применения
кортикостероидов. В случае травмы или шока прием митотана прекращают и вводят
высокие дозы кортикостероидов. Для оценки активности опухоли необходимо регу-
лярно контролировать уровень кортизола в крови и суточной моче.
При отсутствии эффекта в течение 3 мес. переходят на терапию аминоглутети-
мидом (250 мг внутрь каждые 6 ч до суточной дозы 2 г), кетоконазолом (200-
600 мг/сут) либо используют комбинированную XT цисплатином с этопозидом и бле-
омицином или комбинацию САР.
Возможно сочетанное применение митотана и цитостатиков.
270 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли надпочечников
Режимы терапии
1. Митотан — 2 г внутрь 3-4 раза в сутки, длительно. Целесообразно начинать прием
этого препарата в дозе 6-15 мг/кг внутрь, постепенно повышая дозу на 500 мг/сут
до достижения суточной дозы 8-12 г.
2. Доксорубицин — 40 мг/м2 в/в в день.
Этопозид — 100 мг/м2 в/в 2-4 дни.
Цисплатин — 40 мг/м2 в/в 3 день.
Повторение цикла каждые 28 дней
3. Аминоглутетимид — 250 мг внутрь через каждые 6 ч, дозу постепенно повышают
до суточной дозы 2 г.
4. Цисплатин — 40 мг/м2 в/в в 1-й день.
Этопозид — 100 мг/м2 в/в в 1-й день.
Блеомицин — 30 ME в/в в 1-й день.
Повторение цикла каждые 28 дней.
5. Цисплатин — 50 мг/м2 в/в в 1-й день.
Доксорубицин — 40 мг/м2 в/в в 1-й день.
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21 день.
6. Митотан — 5 г внутрь ежедневно в течение 14 нед.
Фторурацил — 500 мг/м2 в/в 1 раз в 3 нед.
9.17.2. Феохромоцитома
Редкая опухоль, происходящая из мозгового вещества надпочечников. Чаще все-
го встречается в возрасте 30-50 лет и у 10% больных бывает двусторонней. В этом
случае она бывает семейной и зачастую наблюдается у лиц, страдающих семейным
синдромом множественных эндокринных неоплазм (МЭН). У лиц с синдромом МЭН
типа II риск развития второй контралатеральной опухоли после удаления первой со-
ставляет 50%.
Экстрадреналовая феохромоцитома, или функциональная параганглиома, на-
блюдается приблизительно в 10-15 % случаев и может развиваться из хромаффин-
ной ткани симпатических ганглиев; она локализуется чаще всего в брюшной поло-
сти, бывает более злокачественной и имеет худший прогноз.
Продуцируя катехоламины, феохромоцитома вызывает постоянную или парок-
сизмальную гипертонию, всегда тяжелую, с признаками энцефалопатии, ретино-
патии и протеинурии.
Диагноз устанавливается на основании повышенной экскреции катехоламинов
(норэпинефрина и эпинефрина) или их метаболитов (ВМА и метанефринов) в 24-часо-
вой моче. Измерение метанефринов в плазме — более чувствительный метод.
После постановки диагноза феохромоцитомы с целью блокады «-адренерги-
ческой активности начинают лечение феноксибензамином или антагонистами
«^адренергических рецепторов, такими как празозин.
Низкие дозы /3-блокаторов могут быть использованы для контроля АД и тахиа-
ритмий, но только после «-блокаторов. Довольно эффективен «- и/3-адренергиче-
ский блокатор лабеталол. Использование комбинации «- и /3-блокаторов или анта-
гонистов кальция может быть длительным. В более резистентных случаях или при
более продолжительной и тяжелой гипертонии при злокачественном процессе с
целью торможения катехоламинового синтеза эффективен «-метилпаратирозин.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 271
Химиотерапия солидных опухолей
Этот препарат может снизить уровень циркулирующих катехоламинов на 80% и снять
большинство симптомов болезни.
При локализованной феохромоцитоме адекватным лечением считается радикаль-
ная операция в объеме тотальной адреналэктомии.
При феохромоцитоме с регионарными метастазами, а также местнораспростра-
ненной или с метастазами проводится хирургическое лечение — агрессивные опера-
ции с максимальным удалением всех возможных опухолей.
В случаях наличия остаточных опухолей применяются адреноблокаторы как сим-
птоматическое средство.
В качестве паллиативного лечения при остаточных и метастатических опухолях ис-
пользуют лучевую или комбинированную XT. Лучевая терапия с использованием ме-
ченого ,311-мета-йодобензилгуанидина в группе с успешным захватом радиоизотопа
опухолью позволяет получить частичный эффекту 23% больных и биохимическое
улучшение — у 43 %.
Наиболее активной комбинированной XT считается схема CVD (циклофосфамид,
винкристин, дакарбазин), вызывающая объективный эффекту 61 % больных и биохи-
мическое улучшение — у 74 %. Кроме того, снижается АД, улучшается состояние и ка-
чество жизни больных без влияния на выживаемость. Используется также стрептозо-
цин в монохимиотерапии и в составе лекарственных комбинаций.
CVD
Циклофосфамид — 750 мг/м2 в/в в 1-й день.
Винкристин — 1,4 мг/м2 в/в в 1-й день.
Дакарбазин — 600 мг/м2 в/в в 1-й день.
Повторение цикла каждые 21-28 дней.
0.18. Опухоли вилочковой железы
Н. Ф. Орел
Опухоли вилочковой железы относятся к числу редких заболеваний и составляют
около 2,5 % всех опухолей средостения.
Различают тимомы — эпителиальные опухоли тимуса без явных признаков атипии.
нередко сопровождающиеся паранеопластическим синдромом (миастения, полими-
озит, красная волчанка, тиреоидит, ревматоидный артрит, анемия, гипогаммаглобули-
немия, эктопический синдром Кушинга, дерматомиозит, гранулематозный миокардит,
гипертрофическая остеоартропатия), рак тимуса (тимома типа С) и нейроэндокрин-
ные опухоли тимуса (карциноиды). Тимомы типа С могут иметь инвазивный рост, во-
влекая в процесс окружающие ткани.
Хирургическое лечение и лучевая терапия могут контролировать заболевание. У
больных с I-III и IVA стадиями лучевая терапия проводится адъювантно и неоадъю-
вантно. Лучевая терапия также с эффектом может сочетаться с XT при рецидивах ти-
момы. В случаях агрессивного течения можно использовать ифосфамид, доксоруби-
цин, цисплатин, этопозид, циклофосфамид, кортикостероиды. Появились публикации
об активности пеметрекседа при рецидивах тимомы. Монотерапия и комбинирован-
ная XT применяются адъювантно и неоадъювантно. В комбинированной XT преиму-
щество отдается платиносодержащим режимам. При типичном и атипичном карцино-
иде обычно используются комбинации этопозида с цисплатином или стрептозоцина
(Стрептозотоцин) с 5-ФУ, изучается темозоломид (Темодал). В некоторых случаях мо-
гут применяться октреотид (при октреотид-положительных опухолях) и кортикосте-
272 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Нейроэндокринные опухоли
роиды. Также ведутся исследования по изучению таргетных препаратов (иматиниб, да-
затиниб).
Режимы терапии
1. Доксорубицин — 40 мг/м2 в/в в 1-й день.
Цисплатин — 50 мг/м2 в/в в 1-й день.
Винкристин — 0,6 мг/м2 в/в в 3-й день.
Циклофосфамид — 700 мг/м2 в/в в 4-й день.
Повторение цикла каждые 4 нед. при октреотид-положительной тимоме.
2. Доксорубицин — 50 мг/м2 в/в в 1-й день.
Цисплатин — 30 мг/м2 в/в капельно в 1-3-й день.
Повторение цикла каждые 3 нед.
3. Цисплатин — 50 мг/м2 в/в в 1-й день.
Доксорубицин — 50 мг/м2 в/в в 1-й день.
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Повторение цикла каждые 3 нед.
4. Цисплатин — 30 мг/м2 в/в в 1-3-й день.
Циклофосфамид — 500 мг/м2 в 1-й день.
Доксорубицин — 20 мг/м2/сут постоянная инфузия.
Преднизолон — 100 мг внутрь в 1-5-й день.
Повторение цикла каждые 3 нед.
5. ЕР. Цисплатин — 80 мг/м2 в/в в 1-й день.
Этопозид — 120 мг/м2 в/в в 1-3-й день.
Повторение цикла каждые 3 нед.
6. Этопозид — 75 мг/м2 в/в в 1-4-й день.
Ифосфамид — 1,2 г/м2 в/в в 1-4-й день.
Месна — 240 мг/м2 в/в 3 раза в сутки в 1-4-й день.
Цисплатин — 20 мг/м2 в/в в 1-4-й день.
Повторение цикла каждые 3 нед.
7. Доксорубицин — 40 мг/м2 в/в в 1-й день.
Цисплатин — 50 мг/м2 в/в в 1-й день.
Ифосфамид — 1 г/м2 в/в во 2-й и 3-й дни + месна по схеме.
Повторение цикла каждые 4 нед.
8. Темозоломид — 150 мг/м2 внутрь в 1-7-й день, перерыв 1 нед., затем повторение.
Талидомид — 50-400 мг/м2 внутрь ежедневно.
Монотерапия
Ифосфамид — 1500 мг/м2 (+ Месна) в 1-5-й день каждые 3 нед.
Октреотид — 0,5 мг п/к 3 раза в сутки ежедневно ± преднизолон — 0,6 мг/кг 4 раза в
сутки. Максимум 1 год.
9.19. Нейроэндокринные опухоли
Н. Ф. Орел
Термин «нейроэндокринные опухоли» объединяет гетерогенную группу новообра-
зований из клеток нейроэндокринной системы. Происхождение этих опухолей от-
носится к АПУД-системе, представленной эндокринными клетками, широко распро-
страненными в различных органах и тканях человека. Ее клетки (апудоциты) относятся
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 273
Химиотерапия солидных опухолей
к дериватам нейроэктодермы и вырабатывают различные биогенные амины и поли-
пептиды, обладающие функциями гормонов. Для этой группы опухолей используют-
ся множество синонимов: карциноидная опухоль, АПУДома, опухоли из островковых
клеток поджелудочной железы. Термин «карциноид», предложенный Оберндорфе-
ром в 1907 г., в настоящее время используется для нейроэндокринных опухолей лег-
ких (типичный и атипичный карциноид). Для опухолей ЖКТ и поджелудочной железы
используют термин «нейроэндокринные опухоли» с указанием степени дифференци-
ровки. Соответственно к нейроэндокринным опухолям относятся различные опухо-
ли, описываемые в зависимости от гистологического строения и локализации: опухоли
поджелудочной железы, продуцирующие полипептидные гормоны (инсулинома, глю-
кагонома, соматостатинома и др.).
Поскольку большинство нейроэндокринных опухолей являются гормонально-ак-
тивными, в клинической картине превалируют изменения, связанные с гиперпродук-
цией того или иного гормона либо биогенного амина. Однако имеются и негормоно-
продуцирующие нейроэндокринные опухоли.
К нейроэндокринным опухолям относятся также МЭН — группа аутосомно-доми-
нантных опухолевых синдромов. Различают два типа: I и П. МЭН I включает следую-
щие поражения: аденома гипофиза, опухоли из островковых клеток, гиперплазия па-
ращитовидных желез. МЭН II — медуллярный рак щитовидной железы, двусторонняя
феохромоцитома, гиперплазия щитовидных желез, множественные ганглионевромы
слизистых оболочек (губ, языка, век), иногда синдром Кушинга.
Наиболее часто встречаются нейроэндокринные опухоли, которые локализуются
в колоректальной области и тонкой кишке. Доказано, что нейроэндокринные опухо-
ли содержат большое количество серотонина, основным метаболитом которого явля-
ется 5-гидроксиндолилуксусная кислота. Клиническая картина этих гормонально-ак-
тивных нейроэндокринных опухолей связана с повышением содержания серотонина
и характеризуется диареей, покраснением лица, вазомоторными реакциями, гипер-
тензией, бронхоспазмами, отеками, обмороками (карциноидный синдром). К нейро-
эндокринным опухолям ЖКТ относятся такие редкие опухоли, как глюкагонома, га-
стринома, инсулинома, ВИПомаидр. Для гастрином характерны гастриты, диарея, язвы
ЖКТ, синдром Золлингера—Эллисона. При инсулиноме отмечается гипогликемия с со-
ответствующей ей клинической картиной. Синдром Вернера—Моррисона при ВИПо-
ме проявляется диареей (до 5 л в день), гипокалиемией, ахлоргидрией. Более редко
встречаются глюкагонома, соматостатинома, опухоль, продуцирующая гормон роста.
По классификации ВОЗ (2000), нейроэндокринные опухоли по степени дифферен-
цировки разделены на пять больших категорий:
1) высокодифференцированная нейроэндокринная опухоль;
2) высокодифференцированная эндокринная карцинома;
3) низкодифференцированная нейроэндокринная карцинома (мелкоклеточная);
4) смешанная экзокринная эндокринная опухоль;
5) редкие нейроэндокриноподобные поражения.
Для диагностики и выбора метода лечения в опухоли определяют иммуногистохи-
мически панэндокринные маркеры — хромогранин А, синаптофизин и нейронспеци-
фическую энолазу (NSE), а также оценивают пролиферативную активность по маркеру
пролиферации Ki-67, в сыворотке крови определяют хромогранин А, в моче — уро-
вень 5-гидроксииндолилуксусной кислоты. Уровень рецепторов октреотида оцени-
вают с помощью сканирования с меченым октреотидом (Индий In-111 пентетреотид).
Основным методом лечения этих опухолей считается хирургический, однако боль-
шинство больных к моменту постановки диагноза имеют отдаленные метастазы. Тем
не менее при наличии резектабельных метастазов в печени в первую очередь должен
274 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Нейроэндокринные опухоли
рассматриваться вопрос о возможности выполнения паллиативной операции. В слу-
чае множественного поражения обеих долей обычно проводится эмболизация либо
химиоэмболизация (с доксорубицином, реже — с митомицином или цисплатином) пе-
ченочной артерии. Кратковременного (3—12 мес.) значительного уменьшения прояв-
лений карциноидного синдрома после выполнения этой процедуры обычно удается
достичь у большинства больных. Циторедуктивные процедуры могут включать также
высокочастотную абляцию. За рубежом изучается опухолево-направленное радиоак-
тивное лечение на базе аналогов соматостатина.
Злокачественные нейроэндокринные опухоли в ряде случаев характеризуются от-
носительно медленным ростом; моментом же, определяющим тяжесть состояния и
представляющим непосредственную угрозу жизни, является активная продукция гор-
монов с соответствующими метаболическими нарушениями.
Погибает 73 пациентов с карциноидным синдромом от вызываемой им сердечной
недостаточности. У этих больных применение аналогов соматостатина, в частности
октреотида (Сандостатин ЛАР, октреотид-депо) и ланреотида, служит одним из важ-
нейших компонентов комплексного лечения, позволяя полностью снять тягостную
симптоматику в 30-75% случаев. Частичные ремиссии регистрируются у 10-20%
больных, стабилизация в течение 8-16 мес. — у 50%. В последнее время появились
сообщения и об антипролиферативном действии высоких доз пролонгированного
октреотида. Для лечения нейроэндокринных опухолей используется также ИФН-а,
позволяющий в 15% случаев добиться регрессии опухоли.
На сегодняшний день у этих больных используются пролонгированные аналоги со-
матостатина (Сандостатин ЛАР, октреотид-депо, ланреотид) и ИФН-а (ПЭГ-интерфе-
рон). Общая выживаемость больных со злокачественными карциноидами и карцино-
идным синдромом увеличилась с 2 до 9 лет и более.
Помимо симптоматического эффекта Сандостатин ЛАР также обладает противоо-
пухолевой активностью в дозе 30 мг 1 раз в 28 дней, поэтому его можно назначить и
пациентам без клинических проявлений, чтобы предотвратить рост опухоли. Согласно
исследованию PROMID, Сандостатин ЛАР в 3 раза увеличивает время до прогрессиро-
вания у пациентов с высокодифференцированными НЭО кишечника (как с функцио-
нирующими, так и нефункционирующими опухолями).
Алгоритм выбора терапии при невозможности хирургического лечения у больных с
высокодифференцированными нейроэндокринными опухолями представлен на схе-
ме. При нейроэндокринных опухолях изучаются таксаны, иринотекан, темозоломид,
араноза, капецитабин, а также таргетные препараты: бевацизумаб, сунитиниб, сора-
фениб, эверолимус и новый аналог соматостатина SOM 230.
Режимы терапии
Октреотид (Сандостатин) — 50-500 мкг п/к 3 раза в сутки (доза подбирается ин-
дивидуально). Депонированная форма октреотида (Сандостатин ЛАР, октреотид-де-
по, ланреотид): для больных, получавших ранее октреотид, рекомендуемая начальная
доза Сандостатина ЛАР 20 мг в/м каждые 28 дней. Лечение октреотидом продолжает-
ся в эффективной дозе еще 2 нед. после инъекции Сандостатина ЛАР; для больных, ра-
нее не получавших октреотид, лечение начинают с Сандостатина в дозе 100 мкг 3 раза
в сутки в течение 2 нед. При хорошей переносимости и клиническом эффекте пере-
ходят на Сандостатин ЛАР.
Доза Сандостатина ЛАР может регулироваться после 3 мес. лечения: при хорошем
контроле симптомов и биологических маркеров доза может быть уменьшена до 10 мг
каждые 4 нед., при возврате симптомов дозу повышают до 20 мг; если симптомы контро-
лируются только частично, то доза может быть повышена до 30 мг каждые 4 нед.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 275
Химиотерапия солидных опухолей
Ланреотид — дозы и режимы лечения подбирают индивидуально после оценки от-
ветной реакции. Обычно рекомендуется 60-120 мг в/м каждые 4 нед.
Октреотид-депо, так же как Сандостатин ЛАР, обычно применяют в дозе 20 мг в w
1 раз в месяц, при необходимости доза может быть увеличена.
ИФН -а — 3-5 млн ЕД п/к 3 раза в неделю. Доза подбирается индивидуально по пе-
реносимости.
Комбинированная химиотерапия
1. Циклофосфамид — 500 мг/м2 в/в в 1-й и 8-й дни.
Фторурацил — 500 мг/м2 в/в в 1-й и 8-й дни.
Стрептозоцин — 500 мг/м2 в/в в 1-й и 8-й дни.
Интервал между курсами 4 нед.
2. FAC-S. Фторурацил — 400 мг/м2 в/в в 1-й и 8-й дни.
Доксорубицин — 30 мг/м2 в/в в 1-й день.
Циклофосфамид — 75 мг/м2 внутрь в 1-14-й день.
Стрептозоцин — 400 мг/м2 в/в в 1-й и 8-й дни.
Интервал между курсами 4 нед.
3. Цисплатин — 80 мг/м2 в/в капельно в 1-й день.
Этопозид — 120 мг/м2 в/в капельно в 1-3-й день.
Повторение цикла каждые 4 нед.
4. Карбоплатин — AUC 4-5.
Этопозид — 100 мг/м2 в 1-3-й день.
Повторение цикла каждые 4 нед.
5. Доксорубицин — 50 мг/м2 в/в в 1-й день.
Стрептозоцин — 500 мг/м2 в/в в 1-4-й день.
Повторение цикла каждые 4 нед.
6. Стрептозоцин — 1 г/м2 в/в в 1-й день.
Фторурацил — 600 мг/м2 в/в в 1-й день или 325 мг/м2 в 1-5-й день.
Повторение цикла каждые 4 нед.
7. Дакарбазин — 200 мг/м2 в/в в 1-3-й день.
Эпирубицин (Фарморубицин) — 25 мг/м2 в/в в 1-3-й день.
Фторурацил — 250 мг/м2 в/в в 1-3-й день.
Повторение цикла каждые 3 нед.
8. Темозоломид — 150 мг/м2/сут внутрь 7 дней, перерыв 7 дней.
Бевацизумаб — 5 мг/кг в/в 1 раз в 2 нед.
Алгоритм выбора лечения при метастатических нейроэндокринных опухолях
Операция ±радиотермоабляция
Эмболизация/химиоэмболизация
Ki 67 < 2%, WHO Ki 67 3-20%, WHO 1-2 Ki 67 > 20%, WHO 3
Биотерапия: аналоги соматостатина
(ан. Сом) а-ИФН комбинации:
ан. Сом. +ИФ, ан. Сом. +Эверолимус;
ан. Сом. +Бевацизумаб
Химиотерапия: Стр +докс,
Стрептозотоцин/5 ФУ + Эверолимус,
Темодал + Кселода;
ан. Сом. — контроль симптомов
Химиотерапия Темозоламид +
Капецитабин +Бевацизумаб,
Цисплатин + Этопозид;
ан. Сом. — контроль симптомов
Таргетная радиотерапия:
177Lu-D0TA- octreotat, 9OY-DOTA,
экспериментальные протоколы
Oberg К, ESM0-2009
276 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Метастазы из невыявленного первичного очага
-1; -
Продолжительность курса 22 нед.
9. Темозоломид — 150 мг/м2/сут внутрь в 1-5-й день.
Капецитабин (Кселода) — 2 г/м2/сут внутрь в 1-14-й день.
Повторение цикла каждые 28 дней.
9.19.1. Хемодектомы (параганглиомы)
Наиболее часто встречаются хемодектомы шеи (каротидного гломуса, блуждающего
нерва) и среднего уха. При хемодектомах выявляется повышенное содержание кате-
холаминов (норадреналина, адреналина, дофамина) в моче и в опухоли. В 54% случа-
ев хемодектомы гормонально-активны.
Ведущий методом в лечении хемодектом — хирургический. После радикальной
операции профилактическая лучевая терапия и XT не используются. XT недостаточно
эффективна, объективный эффект отмечается не более чему 15-20% больных.
Режимы терапии
1. Доксорубицин — 50 мг/м2 в/в в 1-й день.
Цисплатин — 50 мг/м2 в/в капельно в 1-й день.
Интервал между курсами 3-4 нед.
2. Винкристин — 1 мг/м2 в/в в 1-й и 8-й дни.
Доксорубицин — 35 мг/м2 в/в в 1-й день.
Циклофосфамид — 500 мг/м2 в/в в 1-й день.
Блеомицин — 15 мг в/м во 2-7-й день.
Преднизолон — 30 мг/м2 внутрь в 1-8-й день.
Интервал между курсами 4 нед.
3. Винкристин — 1 мг/м2 в/в в 1-й и 8-й дни.
Доксорубицин — 30 мг/м2 в/в в 1-й день.
Циклофосфамид — 500 мг/м2 в/в в 1-й день
Цисплатин — 100 мг/м2 в/в капельно во 2-й день.
Интервал между курсами 4 нед.
9.20. Метастазы из невыявленного
первичного очага
Л. В. Манзюк, Е. В. Артамонова
Метастазы из невыявленного первичного очага (НПО) имеют около 3-5% больных с
впервые установленным диагнозом злокачественной опухоли. Это гетерогенная груп-
па заболеваний, впервые проявляющихся метастазами и имеющих плохой прогноз.
Наиболее часто таким образом манифестирует рак легкого и поджелудочной железы,
несколько реже — КРР, РМЖ, рак простаты и др. У 15-25% больных первичную опу-
холь не удается обнаружить при последующей аутопсии.
Медиана выживаемости пациентов с метастазами из НПО, как правило, не превыша-
ет 0,5 года, составляя в среднем 3-4 мес. Хотя большинство заболеваний рефрактер-
-о к системной терапии, современное противоопухолевое лечение, в частности хи-
мио- и гормонотерапия, может улучшить выживаемость и некоторая часть больных
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 277
Химиотерапия солидных опухолей
живет значительно дольше. 1-летняя выживаемость при метастазах из НПО составля-
ет 25 %, 5-летняя — 10%.
Диагностический алгоритм у больных с метастазами злокачественной опухоли из
НПО включает оценку общего состояния пациента, морфологическую верификацию
опухоли, оценку распространенности процесса и поиск первичного очага.
Морфологическому исследованию опухоли отводится основная роль в постановке
диагноза. Проводится рутинное гистологическое исследование, иммуногистохимиче-
ское исследование, при необходимости — электронная микроскопия, а также опре-
деляются гормональные рецепторы, по показаниям — HER2 и другие опухолевые
маркеры. Важное значение имеет степень дифференцировки опухоли: для умерен-
но и высокодифференцированных опухолей необходимо установить эпителиальную
или неэпителиальную природу, в группе эпителиальных опухолей определить, адено-
карцинома это или ПКР. В ряде случаев морфологическое исследование может пред-
положительно установить первичный очаг и наметить направление дальнейшего кли-
нического поиска.
Поражение верхних и средних шейных лимфоузлов, как правило, обусловлено ПКР
и опухолями головы и шеи. Значительно реже опухоли головы и шеи могут быть пред-
ставлены аденокарциномами и анаплазированным раком.
Поражение нижних шейных и надключичных лимфоузлов чаще связано с аденокар-
циномой. У этих больных впоследствии нередко выявляется рак легкого или ЖКТ. ПКР
с поражением этой же группы лимфоузлов чаще исходит из легкого.
До 40% метастазов аденокарциномы из НПО составляет рак легкого и поджелудоч-
ной железы. По 10% аденокарцином приходятся на рак желудка, толстой кишки, пе-
чени и желчных путей. Аденокарциномы и недифференцированные карциномы с ме-
тастазами в печени и левых надключичных лимфоузлах, как правило, исходят из ЖКТ.
Общие принципы лечения
Лечебная тактика при метастазах злокачественной опухоли из НПО зависит от ее
морфологического строения, степени распространенности и предполагаемой лока-
лизации первичного очага. Основная задача морфологического исследования заклю-
чается в выявлении опухолей, лечение или эффективный контроль которых реально
возможны (лимфомы, герминогенные, трофобластические и нейроэндокринные опу-
холи, РМЖ, рак простаты, яичников и др.). XT проводится по стандартным схемам в за-
висимости от гистологии и предполагаемой нозологии.
Плоскоклеточный рак. Если выявлены метастазы ПКР только в одной группе лим-
фоузлов, возможна длительная выживаемость при адекватной лечебной тактике. Ме-
тастазы ПКР в лимфоузлах шеи требуют тщательного исследования верхних дыхатель-
ных путей, т.к. у 2-5% больных с опухолями этой локализации заболевание впервые
проявляется таким образом. У 10% больных этой группы выявляется билатеральное
поражение лимфоузлов.
Пациенты с вовлечением шейных лимфоузлов выше надключичной области долж-
ны получать полный курс лучевой терапии на область от основания черепа до клю-
чиц. Как альтернативный вариант можно применять радикальную лимфодиссекцию
с последующей лучевой терапией. Лучевая терапия необходима для воздействия на
возможные скрытые очаги в области головы и шеи. Выживаемость в этой группе та-
кая же, каку больных с выявленным первичным очагом в области головы и шеи (от 35
до 59%).
Изолированное поражение подмышечных лимфоузлов — это, как правило, рак лег-
кого. Изолированное поражение паховых лимфоузлов встречается редко. Больным
278 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Метастазы из невыявленного первичного очага
этих двух групп показана регионарная лимфодиссекция с последующей лучевой те-
рапией.
При диссеминированном ПКР проводится системная XT по схемам, разработанным
для рака головы и шеи и НМРЛ.
ПКР с генерализованным вовлечением лимфоузлов, как правило, сочетается с пора-
жением внутренних органов и практически не поддается лечению.
Аденокарцинома и низкодифференцированная карцинома. У женщин
с метастазами аденокарциномы или низкодифференцированного рака обязательна
маммография и исследование органов малого таза, а также определение рецепторов
гормонов и НЕК2-статуса. Если в результате обследования предполагается первич-
ная опухоль в молочной железе и имеет место поражение подмышечных лимфоузлов,
проводят лечение, как при РМЖ стадии: иссечение лимфоузлов с последующей
лучевой терапией на молочную железу и подмышечную область; радикальная мастэк-
томия с последующей лучевой терапией; адъювантная химио- и гормонотерапия.
Женщинам с метастазами аденокарциномы в брюшной полости проводится XT, как
при раке яичников (комбинации на основе цисплатина), с включением на определен-
ном этапе адекватной хирургической циторедукции.
У мужчин с метастазами аденокарциномы или низкодифференцированного рака
обязательно определение сывороточной фосфатазы, ПСА, ХГ, АФП и ЛДГ для исклю-
чения рака простаты и герминогенных опухолей. При повышении уровня ПСА прово-
дится гормонотерапия, как при раке простаты. При положительных реакциях на АФП
и ХГ проводится лечение, как при герминогенных опухолях.
Если выявлены метастазы низкодифференцированной карциномы в верхних и сред-
них лимфоузлах шеи, проводится лечение, как при опухолях головы и шеи.
При метастазах аденокарциномы и низкодифференцированного рака из НПО при-
меняют XT на основе цисплатина: ВЕР (блеомицин, этопозид, цисплатин), ЕР (этопозид,
цисплатин). Эти комбинации дают до 60 % объективных эффектов и до 20 % полных ре-
миссий. Длительная выживаемость около 13%. Комбинации на основе паклитаксела
дают до 45 % объективных эффектов, а комбинации доксорубицина с митомицином
С — до 30%.
Меланома. У 5% больных с метастазами меланомы не удается обнаружить первич-
ную опухоль. При поражении одной группы лимфоузлов заболевание расценивает-
ся как II стадия и основным методом лечения служит радикальная лимфаденэктомия.
При диссеминированном процессе проводится стандартная системная XT: дакарба-
зин и комбинации на его основе, производные нитрозомочевины и комбинации с ци-
сплатином.
Нейроэндокринная карцинома. Метастазы низкодифференцированной ней-
роэндокринной карциномы составляют около 13% всех аденокарцином или низ-
кодифференцированного рака. При локальном поражении выполняется опера-
тивное вмешательство или лучевая терапия. При распространенном процессе
проводится ПХТ с включением цисплатина — ЕР (этопозид, цисплатин) или с вклю-
чением доксорубицина — САР (цисплатин, доксорубицин, циклофосфамид).
Режимы терапии
Плоскоклеточный рак
CF
Цисплатин — 100 мг/м2 в/в капельно в 1-й день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 279
Химиотерапия солидных опухолей
Фторурацил — 1000 мг/м2 в/в капельно 24-часовая инфузия в 1-4-й день.
Повторение цикла каждые 3 нед.
МВР
Метотрексат — 40 мг/м2 в/м в 1-й и 15-й дни.
Блеомицин — 10 мг в/м в 1,8 и 15-й дни.
Цисплатин — 50 мг/м2 в/в капельно в 4-й день.
Повторение цикла каждые 3 нед.
Аденокарцинома, низкодифференцированный рак
ВЕР
Блеомицин — 30 мг в/в или в/м 1 раз в неделю в течение 12 нед.
Этопозид — 100 мг/м2 в/в капельно ежедневно в 1 — 5-й день.
Цисплатин — 20 мг/м2 в/в капельно ежедневно в 1 — 5-й день.
Повторение цикла каждые 3 нед.
ЕР
Цисплатин — 20 мг/м2 в/в капельно ежедневно в 1-5-й день.
Этопозид — 100 мг/м2 в/в капельно ежедневно в 1-5-й день.
Повторение цикла каждые 3 нед.
или
Этопозид — 120 мг/м2 в/в капельно в 1,3 и 5-й дни.
Цисплатин — 80 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 3 нед.
РСЕ
Паклитаксел — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Карбоплатин — AUC 6 в/в капельно 30-60-минутная инфузия в 1-й день.
Этопозид — 50 и 100 мг/сут внутрь чередовать с 1-го по 10-й день.
Повторение цикла каждые 3 нед.
DM
Доксорубицин — 50 мг/м2 в/в в 1-й и 22-й дни.
Митомицин —10 мг/м2 в/в в 1-й день.
Повторение цикла каждые 42 дня.
GI
Гемцитабин — 1000 мг/м2 в/в капельно 30-минутная инфузия в 1-й и 8-й дни.
Иринотекан — 100 мг/м2 в/в капельно 90-минутная инфузия в 1-й и 8-й дни.
Повторение цикла каждые 3 нед.
DC
Доцетаксел — 75 мг/м2 в/в капельно в 1-й день с пре- и постмедикацией.
Карбоплатин — AUC 5-6.
или
Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 3 нед.
280
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Глава 10
Опухолевые заболевания
кроветворной и лимфоидной ткани
10.1. Острые лейкозы
Л4. А Волкова
Острые лейкозы — клоновые опухолевые заболевания системы крови, возникающие
в результате соматической мутации или мутаций, которые вызывают изменения генов,
контролирующих пролиферацию, дифференцировку и созревание нормальных кро-
ветворных клеток. При острых лейкозах изменения могут произойти в геноме стволо-
вой клетки, в результате чего возникают так называемые стволовоклеточные лейкозы,
но чаще мутации происходят в геноме соответствующих клеток-предшественников —
предшественника миелопоэза при возникновении острых миелоидных, или, правиль-
нее, острых нелимфобластных лейкозов (ОНЛЛ), и предшественника лимфопоэза при
развитии острых лимфобластных лейкозов (ОЛЛ).
Острые лейкозы распространены повсеместно, заболеваемость в разных странах
составляет от 2 до 4 случаев на 100 000 населения в год. У взрослых 75-80% среди
всех острых лейкозов составляют ОНЛЛ, 20-25 % приходятся на долю ОЛЛ. Заболева-
емость ОНЛЛ увеличивается с возрастом, достигая в популяции старше 65 лет часто-
ты 10-15 случаев на 100 000 населения в год. Мужчины и женщины заболевают с рав-
ной частотой.
Диагноз острого лейкозаустанавливается только на основании обнаружения в крови
и костном мозге (иногда только в костном мозге!) бластных клеток, число которых, со-
гласно последней классификации ВОЗ, должно составлять не менее 20%.
Современная терапия позволяет получить полные ремиссии у 65-75% больных
ОНЛЛ и у 75-90% больных ОЛЛ, но лишь в том случае, если лечение начато непо-
средственно после установления диагноза и проводится по программе, которая в на-
стоящее время признается оптимальной для данного варианта лейкоза. Определять
вариант лейкоза следует сразу же при установлении диагноза, поскольку не толь-
ко программы лечения ОЛЛ и ОНЛЛ совершенно различны, но и есть существен-
ные, а иногда принципиальные отличия в терапии разных подвариантов как ОЛЛ, так
и ОНЛЛ.
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 281
Опухолевые заболевания кроветворной и лимфоидной ткани
При правильном лечении от 25 до 45% взрослых больных, у которых получены пол-
ные ремиссии, остаются в полной ремиссии 5 лет и более, что для большинства случа-
ев может расцениваться как выздоровление. Полная ремиссия констатируется только
при содержании в костном мозге не более 5% бластных клеток при его нормаль-
ной клеточности, при нормализации картины крови и отсутствии экстрамедулляр-
ных очагов поражения, в том случае, если такая картина сохраняется не менее 1 мес.
При снижении числа бластных клеток не менее чем на 50% по сравнению с исход-
ным констатируется частичная ремиссия, которая может стать полной при проведении
дальнейшей терапии.
Реальное увеличение продолжительности жизни достигается лишь при получении
полной длительной ремиссии.
Поскольку при современной терапии у большинства больных развиваются реци-
дивы, всем больным моложе 50 лет при наличии совместимого родственного донора
после достижения полной ремиссии должна быть предложена трансплантация ство-
ловых кроветворных клеток. Исключение составляют лишь больные ОНЛЛ, относя-
щиеся к группе с благоприятным прогнозом — ct(8;21), inv!6, t(16;l 6), t(l 5;17) и с мута-
цией гена нуклеофозмина (NPM1) без одновременной мутации гена FLT3. У больных
этой группы при современной цитостатической терапии достигаются наиболее высо-
кие результаты, которые в группе в целом не улучшаются после трансплантации в свя-
зи со смертностью, связанной с процедурой. При ОНЛЛ трансплантация в первой пол-
ной ремиссии обеспечивает 5-летнее безрецидивное течение у 40-60 % больных, во
второй ремиссии — у 30%, при ОЛЛ — у 45-50 и 20-25% больных соответственно.
Рецидивы при остром лейкозе могут быть костномозговыми и внекостномозговыми.
Костномозговой рецидив — любое увеличение количества бластных клеток в миело-
грамме более 5%; внекостномозговой рецидив — появление специфического пора-
жения органов и/или тканей при сохранении костномозговой ремиссии. Наиболее ча-
стым внекостномозговым рецидивом, особенно при ОЛЛ, является поражение ЦНС.
чаще всего в виде лептобазального менингита, реже в виде опухолевого поражения
вещества головного или спинного мозга либо инфильтрации черепно-мозговых не-
рвов.
10.1.1. Острые нелимфобластные лейкозы
Классификация, клинические особенности, прогноз
В классификации ВОЗ (2008) опухолей гемопоэтических и лимфоидных тканей
острые лейкозы классифицируются на основании цитогенетических изменений и эк-
спрессии определенных генов. Однако, учитывая необходимость быстрого начала те-
рапии при острых лейкозах, когда еще не получены данные о цитогенетических из-
менениях, в практической работе используется также Франко-американо-британская
(FAB) классификация острых лейкозов, основанная на морфологических и цитохими-
ческих характеристиках бластных клеток. По этой классификации, все ОНЛЛ подра-
зделяются на 8 вариантов, обозначаемых буквой «М» и соответствующей цифрой для
каждого из них (М0-М7).
МО — острый миелобластный лейкоз с минимальной дифференцировкой. На его
долю приходится не более 5% всех ОНЛЛ. Бластные клетки не имеют характерных
морфологических признаков, поэтому его трудно дифференцировать от ОЛЛ, острого
монобластного и острого мегакариобластного лейкозов. Диагноз устанавливается на
282 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
основании цитохимического исследования, выявляющего миелопероксидазу не бо-
лее чем в 3% бластных клеток и ШИК-положительное вещество в диффузной форме,
и иммунологического анализа, при котором на поверхности бластных клеток обнару-
живаются антигены CD 13, CD33, часто CD34 при отсутствии антигенов, характерных
для лимфоидных и моноцитоидных линий. Специфических хромосомных аберраций
не выявлено.
М1 — острый миелобластный лейкоз без созревания. На его долю приходится око-
ло 10% всех ОНЛЛ. Бластные клетки могут иметь четкие признаки миелобластов (па-
лочки Ауэра), но могут и не иметь их, напоминая лимфобласты. При цитохимическом
исследовании миелопероксидаза и Судан черный Б обнаруживаются более чем в 3 %
бластных клеток. Характерно малое количество промиелоцитов (< 3 %) и зрелых гра-
нулоцитов (< 10 %) в костном мозге. Иммунные данные такие же, как при МО. Специфи-
ческие хромосомные аберрации не описаны.
М2 — острый миелобластный лейкоз с созреванием. На долю этого варианта при-
ходится 35-40% всех ОНЛЛ. Более чем в 10% бластов содержится азурофильная зер-
нистость в цитоплазме, миелопероксидаза и гранулоцитарная эстераза обнаружива-
ются в большинстве клеток, ШИК-положительное вещество — в диффузной форме,
характерно большое количество палочек Ауэра. Имеется экспрессия антигенов CD 13,
CD33, часто CD19 и CD34. Более чем у 40% больных при цитогенетическом анализе
обнаруживается t(8;21).
М3 — острый промиелоцитарный лейкоз (ОПЛ). Составляет не более 5-8% всех
ОНЛЛ. В большинстве случаев диагноз удается установить на основании морфологи-
ческого анализа по характерной лопастной форме ядра бластных клеток, обильной
вишнево-фиолетовой зернистости в цитоплазме и большому количеству палочек Ауэ-
ра, располагающихся пучками. Трудности возникают при атипичном варианте М3, ког-
да бластные клетки имеют бобовидное или двулопастное ядро, очень мелкую зерни-
стость в цитоплазме, различимую лишь при электронной микроскопии, и небольшое
количество не образующих пучков палочек Ауэра. Бластные клетки при М3 содержат
большое количество пероксидазы, гранулоцитарной эстеразы, ШИК-положительное
вещество в диффузной форме. Иммунологический анализ выявляет антигены CD 13,
CD33, часто CD2. В 95% случаев при М3 обнаруживается специфическая транслока-
ция t(l 5;17), которая никогда не встречается при других вариантах ОНЛЛ. При М3 с ати-
пичной морфологией нередко обнаруживаются другие транслокации сучастием хро-
мосомы 17 — t(5;l7), t(ll;17) и вариант с изменением только хромосомы 17 — derl7.
Цитогенетический анализ при М3 чрезвычайно важен, поскольку варианты с различ-
ными транслокациями должны лечиться по-разному и имеют различный прогноз. Для
типичного М3 характерно низкое количество лейкоцитов, часто менее 1 х 109/л, при
этом бластные клетки в крови могут быть единичными при их большом количестве в
костном мозге. При гипогранулярном варианте М3 лейкоцитоз обычно высокий. Для
М3 характерно развитие геморрагического диатеза в результате диссеминированного
внутрисосудистого свертывания (ДВС), что становится частой причиной ранней смер-
ти больных, поэтому специфическая для М3 терапия, которая предотвращает разви-
тие ДВС-синдрома, должна начинаться сразу после установления диагноза.
М4 — острый миеломонобластный лейкоз, составляет 15-25% всех ОНЛЛ. В боль-
шинстве случаев одни бластные клетки имеют черты миелобластов, другие — мо-
нобластов, реже бласты имеют морфологические черты миелобластов, но при ци-
тохимическом исследовании в них обнаруживается характерная для монобластов
неспецифическая эстераза, ингибируемая натрия фторидом. В бластных клетках по-
мимо неспецифической эстеразы есть миелопероксидаза и гранулоцитарная эстера-
за, обнаруживается экспрессия антигенов CD13, CD14, CD1 lb, CD11с, CD33, CD64.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 283
Опухолевые заболевания кроветворной и лимфоидной ткани
Существует разновидность М4 — М4Ео (эозинофильный), при котором в костном
мозге кроме указанных черт М4 имеется обычно небольшое (3-5 %) число эозинофи-
лов. У 100 % больных с М4Ео и у 40 % с обычным М4 обнаруживаются изменения хро-
мосомы 16, обычно inv!6 или t(l6;16). Для М4 характерны экстрамедуллярные обра-
зования — гиперплазия десен, кожные лейкемиды.
М5 — острый монобластный лейкоз, обычно диагностируемый при морфологиче-
ском исследовании по характерной моноцитоидной форме ядра бластных клеток и
серо-голубой цитоплазме без вакуолей. На М5 приходится 10-15 % всех ОНЛЛ. Цито-
химический анализ выявляет большое количество неспецифической эстеразы, подав-
ляемой натрия фторидом, — признак, обязательный для диагноза М5. Пероксидаза и
липиды могут отсутствовать или содержаться в небольшом количестве. Иммунологи-
чески определяются те же антигены, что и при М4. Выделяют два варианта М5: М5а —
монобластный без созревания и М5Ь — монобластный с созреванием. В классифи-
кации ВОЗ 2001 г. М5а обозначается как монобластный лейкоз, М5Ь — как острый
моноцитарный; в классификации ВОЗ 2008 г. они обозначаются как острый моноб-
ластный и острый моноцитарный лейкозы без буквенного обозначения. Характерны
те же экстрамедуллярные проявления, что и при М4.
Мб — острый эритроидный лейкоз. На его долю приходится не более 5-6% всех
ОНЛЛ. Согласно классификации ВОЗ 2001 г., выделяют два варианта Мб: Мба — эри-
тромиелоз и М6Ь — эритролейкоз. Мбаустанавливается при наличии в костном моз-
ге более 50% эритроидных предшественников при одновременном обнаружении бо-
лее 20% бластов среди неэритроидной популяции клеток. В эритроидных клетках
преобладают диспластические формы с мегалобластоидным ядром, диссоциацией
созревания ядра и цитоплазмы, множественными или фрагментированными ядрами,
гигантскими пронормобластами, наличием телецЖолли, увеличением количества си-
деробластов. Бластные клетки имеют гранулы и, иногда, палочки Ауэра. При цитохи-
мическом анализе обычно не выявляются пероксидаза и другие миелоидные марке-
ры. Для подтверждения диагноза необходимо иммунологическое исследование, при
котором обнаруживается гликофорин А. При М6Ь основную часть бластной популя-
ции, обычно более 80%, составляют бластные клетки, которые на основании морфо-
логических, а чаще иммунных признаков могут быть отнесены к эритробластам, при
этом миелобласты, в отличие от предыдущего варианта, отсутствуют. В классификации
ВОЗ 2008 г. вариант, соответствующий Мба, обозначен как эритролейкоз (эритроид-
но-миелоидный лейкоз), М6Ь — как чисто эритроидный лейкоз.
М7 — острый мегакариобластный лейкоз — вариант ОНЛЛ, при котором, согласно
классификации ВОЗ, не менее 50% бластов принадлежат к мегакариобластной ли-
нии. Иногда при М7 бласты имеют отростчатые очертания, резко базофильную ци-
топлазму, несколько ядер, напоминая уродливые мегакариоциты. В других, наиболее
трудных для диагноза случаях это мелкие клетки, напоминающие лимфобласты или
бластные клетки при МО- или Ml-варианте ОНЛЛ. Бласты не содержат миелоперок-
сидазы, но имеют неспецифическую эстеразу, устойчивую к натрия фториду. Диагноз
подтверждается иммунологически обнаружением экспрессии цитоплазматических
тромбоцитарных антигенов CD41 и CD61.
В классификации ВОЗ к острым лейкозам отнесен также острый панмиелоз с
миелофиброзом, который раньше обозначался как острый миелофиброз и рас-
сматривался как вариант миелофиброза. Очень редкая форма заболевания. Ха-
рактерна панцитопения и дисплазия всех трех ростков гемопоэза. Пунктат кост-
ного мозга получить трудно из-за выраженного фиброза, обычно ретикулинового
характера. При трепанобиопсии выявляется гиперклеточность костного мозга с
очаговыми скоплениями бластных клеток, среди которых встречаются предшест-
284 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
венники всех трех линий гемопоэза, что подтверждается иммунологическим ис-
следованием. Специфических хромосомных аберраций не обнаружено, но часто
выявляются изменения кариотипа, вовлекающие хромосомы 5 и 7, или комплек-
сные хромосомные аберрации.
В классификации 2008 г. также выделяются некоторые редкие формы лейкоза:
миелоидная саркома, в прошлом называвшаяся хлоромой, — экстрамедуллярная
опухоль из миелобластов, иногда с примесью промиелоцитов, острый базофильный
лейкоз и острый лейкоз, морфологическим субстратом которого служат дендрит-
ные клетки.
На основании частоты полных ремиссий и длительности безрецидивной и общей
выживаемости выделяют благоприятные и неблагоприятные варианты заболевания.
К благоприятным вариантам относится Ml, М2, особенно с t(8;21), М3 с t(15;17) и М4 с
изменениями хромосомы 16. Остальные варианты расцениваются как неблагоприят-
ные. К прогностически неблагоприятным независимо от варианта относятся все вто-
ричные ОНЛЛ, возникающие в результате ятрогенного воздействия при лечении
ранее имевшихся у больного других опухолевых заболеваний, а также лейкозы, яв-
ляющиеся исходом МДС. К неблагоприятным признакам также относятся отсутст-
вие миелопероксидазы в бластных клетках, экспрессия на них иммунных маркеров
CD34, CD7, определенные хромосомные аберрации — моносомия хромосом 5 и 7,
изменения хромосомы 3, множественные хромосомные аберрации. К неблагопри-
ятным отнесены ОНЛЛ, которые в классификации ВОЗ 2001 г. на основании диспла-
зии двух или более линий гемопоэза обозначались как лейкозы с мультилинейной
дисплазией. В классификации 2008 г. эта форма обозначена как острый миелоидный
лейкоз с миелодиспластическими чертами. Морфологические черты миелодиспла-
зии должны иметь не менее 20% бластных клеток. К этому же варианту отнесены и
острые лейкозы с предшествующим МДС.
Лечение острых нелимфобластных лейкозов
Основой современной терапии всех ОНЛЛ является сочетание цитозина-арабино-
зида и антрациклинов с обязательным включением на одном из этапов лечения высо-
ких доз цитозина-арабинозида. Терапия ОПЛ обязательно включает также полностью
транс-ретиноевую кислоту (АТКА).
Современная терапия ОНЛЛ состоит из двух этапов: индукция ремиссии и ее консо-
лидация. Поддерживающая терапия большинством клиник не проводится, т.к. рандо-
мизированными исследованиями не доказана ее эффективность при ОНЛЛ.
Наиболее распространенной схемой индукции ремиссии ОНЛЛ в настоящее вре-
мя считается схема «7+3» — сочетание цитозина-арабинозида с каким-либо из антра-
циклинов:
В цитозин-арабинозид — 100 мг/м2 в/в 1-часовая инфузия 2 раза в сутки в 1-7-й
день;
даунорубицин — 45 либо 60 мг/м2, или идарубицин 12 мг/м2, или митоксантрон
12 мг/м2 1 раз в сутки короткой в/в инфузией в 1-3-й день. В большинстве клиник
для лечения больных моложе 60 лет применяют дозу даунорубицина 60 мг/м2.
Для больных с неблагоприятными вариантами, при которых ремиссии часто корот-
кие, рекомендуется включение в схему лечения этопозида, поскольку показано, что
это достоверно удлиняет безрецидивную выживаемость.
Чаще всего используется схема «7+3+7»:
цитозин-арабинозид и даунорубицин, или идарубицин, или митоксантрон так же,
как в предыдущих схемах;
этопозид — 75 мг/м2 в/в быстрая инфузия 1 раз в сутки в 1-7-й день.
ХИМИОТЕРАПИЯ ОТДЕЛ ЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 285
Опухолевые заболевания кроветворной и лимфоидной ткани
яямйвяявмйййаяйййаввая^^ г*-** » >» -
После получения полной ремиссии и восстановления показателей крови проводит-
ся 2-3 курса консолидации с использованием высоких доз цитозина-арабинозида, по-
сле чего больной остается под наблюдением.
Цитозин-арабинозид — 3 г/м2 2 раза в сутки 3-4-часовая инфузия в 1, 3 и 5-й дни.
Даунорубицин — 45 мг/м2 либо идарубицин (или митоксантрон) — 10 мг/м2 в сутки
короткая в/в инфузия во 2-й и 4-й дни.
Интервал между курсами — до восстановления показателей крови и клеточности
костного мозга, но не менее 6 нед.
При наличии родственного донора больным моложе 50 лет после 1-2 курсов кон-
солидации предлагается проведение аллогенной трансплантации стволовых кровет-
ворных клеток.
Даунорубицин (Рубомицин) имеет более низкую стоимость по сравнению с другими
антрациклинами, однако митоксантрон и идарубицин обладают меньшей кардиоток-
сичностью, чем даунорубицин. Кроме того, при использовании идарубицина в сочета-
нии с цитозином-арабинозидом более 90 % достигнутых полных ремиссий удается по-
лучить после первого курса терапии. Рандомизированными исследованиями доказана
статистически значимая более высокая безрецидивная и общая выживаемость боль-
ных^ которых полная ремиссия получена после первого индукционного курса.
Если полная ремиссия не получена после первого курса индукции, проводится вто-
рой курс по той же схеме. Если ремиссия не получена после двух курсов, больной счи-
тается резистентным к данной лечебной схеме и переводится на другое лечение.
Большинство авторов считают, что при неполучении полной ремиссии после перво-
го курса, проведенного в полных стандартных дозах с использованием идарубицина
или митоксантрона, не следует проводить второй курс по той же схеме, т.к. даже при
получении ремиссии после второго курса она всегда оказывается непродолжитель-
ной. При неэффективности первого курса терапии рекомендуется сразу переводить
больного на схемы с высокими дозами цитозина-арабинозида и сменить антрацикли-
новый антибиотик. При этом следует иметь в виду, что замена идарубицина или миток-
сантрона даунорубицином неэффективна.
В некоторых клиниках рекомендуют начинать лечение с высокодозной индукции
ремиссии, например со схемы НАМ:
Цитозин-арабинозид — 3 г/м2 длительная (3-4 ч) в/в инфузия 2 раза в сутки в 1-3-й
день.
Митоксантрон — 10 мг/м2 в/в 1 раз в сутки в 3-5-й день.
Модификацией схемы НАМ является схема S-HAM:
Цитозин-арабинозид — 1 г/м2 длительная (2-3 ч) в/в инфузия 2 раза в сутки в 1, 2, 8
и 9-й дни.
Митоксантрон — 10 мг/м2 в/в 1 раз в сутки в 3,4, 10 и 11-й дни.
При получении ремиссии проводится консолидация 2-4 курсами такой же тера-
пии, после чего лечение прекращают и молодым больным предлагают транспланта-
цию стволовых кроветворных клеток.
Большинство авторов, однако, полагают, что больному легче перенести высоко-
дозную консолидацию, будучи уже в состоянии полной ремиссии, чем высокодозную
индукцию.
Следует подчеркнуть, что попытки уменьшения дозы антрациклинов в период ин-
дукции или исключение высокодозной консолидации у больных с благоприятным
прогнозом приводят к достоверному повышению числа рецидивов и сокращению
продолжительности безрецидивного периода. Показано, что снижение дозы препа-
ратов на 20% ведет к уменьшению эффективности терапии на 50%.
286 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Острые лейкозы
Профилактика нейролейкоза
У больных с высоким лейкоцитозом при всех вариантах, а при М4 и М5 независимо
от высоты лейкоцитоза нередко уже при установлении диагноза, как правило, в период
ремиссии развивается поражение ЦНС. Наиболее часто это проявляется в виде ней-
ролейкоза — поражения оболочек головного мозга с картиной специфического ме-
нингита, реже в виде отдельных очагов в веществе головного или спинного мозга либо
инфильтрации черепно-мозговых нервов. Учитывая это, всем больным с числом лей-
коцитов в дебюте заболевания более 30 х 109/л и больным с М4- и М5-вариантами
ОНЛЛ независимо от числа лейкоцитов обязательно должна проводиться профилак-
тика нейролейкоза — интратекальное введение трех препаратов:
И метотрексат 12,5 мг/м2, но не более 15 мг,
цитозин-арабинозид 20 мг/м2 (40 мг),
преднизолон 30 мг или дексаметазон 4 мг.
Первая пункция с введением указанных препаратов выполняется накануне первого
курса лечения, последующие — перед каждым курсом.
При диагностировании нейролейкоза указанные препараты вводят интратекально с
интервалом 3 дня до получения последовательно трех нормальных показателей со-
става ликвора (< 3/мкл), затем интратекальное введение препаратов повторяют перед
каждым курсом терапии.
При рецидивах нейролейкоза проводится медикаментозное лечение, а после него и
получения трех последовательных нормальных показателей состава ликвора — облу-
чение головного мозга в дозе 24 Гр.
Вслед за развитием нейролейкоза, как правило, вскоре следует развернутый реци-
див заболевания, поэтому после ликвидации признаков поражения ЦНС больному не-
обходимо вновь провести полный курс индукционной и консолидирующей терапии.
При современной терапии поражение ЦНС нередко осложняет течение М3 (ОПЛ),
поэтому при этом варианте заболевания также обязательна профилактика нейролей-
коза. У больных с другими вариантами ОНЛЛ при невысоком лейкоцитозе в дебюте за-
болевания поражение ЦНС развивается редко, поэтому профилактика нейролейкоза
необязательна, хотя в связи с увеличением продолжительности жизни больных в по-
следние годы появились отдельные случаи нейролейкоза и при этих вариантах ОНЛЛ.
Таким образом, профилактику нейролейкоза рекомендуется проводить всем больным
ОНЛЛ.
Экстрамедуллярные поражения при ОНЛЛ
У больных с М2, М4 и М5, иногда и при других вариантах в момент установления ди-
агноза часто имеются экстрамедуллярные очаги поражения: увеличение лимфоузлов,
селезенки, поражение кожи, мягких тканей, иногда тканей орбиты, кишечника. Нали-
чие экстрамедуллярных поражений — неблагоприятный прогностический признак.
Полная ремиссия в этих случаях может быть констатирована только при нормализа-
ции показателей крови и костного мозга и полном исчезновении всех указанных оча-
гов, что обычно требует 2-3 дополнительных курсов индукционной терапии при уже
достигнутой костномозговой ремиссии.
Иногда экстрамедуллярное поражение является дебютом заболевания при количе-
стве бластных клеток в костном мозге менее 20 % или при их отсутствии. В этом случае
ставится диагноз гранулоцитарной саркомы или, как это обозначается в класси-
фикации ВОЗ, миелоидной саркомы. При диагностировании экстрамедуллярной
гранулоцитарной опухоли даже без одновременного поражения костного мозга ле-
чение должно проводиться по правилам лечения ОНЛЛ. Терапия по другим схемам
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 287
Опухолевые заболевания кроветворной и лимфоидной ткани
даже в случаях получения полного местного эффекта не предотвращает очень бы-
строго поражения костного мозга со всеми симптомами острого лейкоза.
Экстрамедуллярные поражения могут быть и единственным признаком рецидива
ОНЛЛ. В этих случаях также обязательно лечение по схемам терапии рецидива ОНЛЛ
Лечение рецидивов ОНЛЛ
Эффективность терапии при рецидивах всегда значительно ниже, чему первичные
больных.
В случае рецидива может быть применена прежняя схема терапии, особенно при
поздних (возникших после года ремиссии) рецидивах. При ранних рецидивах пред-
почтительнее сменить схему терапии, используя высокие дозы цитозина-арабинозида
в сочетании с тем антрациклиновым антибиотиком, которого больной не получал ра-
нее (при этом следует учитывать, что после лечения идарубицином даунорубицин не
дает эффекта, поэтому следует использовать митоксантрон). Помимо указанных схем
может быть рекомендована схема FLAG:
Флударабин — 30 мг/м2 в/в 0,5-часовая инфузия в 1-5-й день.
И Цитозин-арабинозид — 2 г/м2 в/в 4-часовая инфузия 1 раз в сутки через 4 ч по-
сле введения флударабина.
И Г-КСФ — 5 мкг/кг в сутки, начиная накануне 1-го дня терапии и продолжая до
восстановления количества лейкоцитов.
При отсутствии эффекта отуказанных схем лечения ставится задача продления жиз-
ни больного и улучшения ее качества, поэтому назначают лечение малыми дозами ци-
тозина-арабинозида — по 15-20 мг/м2 п/к 2 раза в сутки в течение 2-3 нед. с интер-
валом до восстановления числа лейкоцитов. Может быть назначен 6-меркаптопури.-
100-150 мг/сут и метотрексат по 20 мг/м2 1-2 раза в неделю при сохранении числа
лейкоцитов не менее 2 х 109/л.
Лечение острого промиелоцитарного лейкоза (М3)
Современная терапия М3 отличается от лечения всех остальных вариантов ОНЛЛ
При ОПЛ всегда имеются хромосомные транслокации, вовлекающие участок хро-
мосомы 17 в месте локализации гена рецептора ретиноевой кислоты. Этот рецептор
связывает и транспортирует в клетку ретиноиды, играющие важнейшую роль в диф-
ференцировке и созревании клеток миелоидного ряда. В лечении ОПЛ обязательно
использование важнейшего из ретиноидов — полного транс-изомера ретиноевой ки-
слоты — АТКА (в России — Весаноид).
Лечение АТКА вызывает созревание патологических клеток, а не их распад, как этс
имеет место при цитостатической терапии. Это позволяет избежать цитопении и ге-
моррагического диатеза, развитие которого при ОПЛ связано с попаданием в кровх
большого количества протеаз из распадающихся бластных клеток. Поскольку ремис-
сии, получаемые с помощью только АТКА, непродолжительны, препарат назначается
вместе с цитостатическими средствами, обязательно с антрациклинами, а при небла-
гоприятном прогнозе (к группе неблагоприятного прогноза относятся пациенты с чи-
слом лейкоцитов в дебюте заболевания более 10 х 109/л) — с антрациклинами и высо-
кими дозами цитозина-арабинозида.
Несмотря на то что диагноз ОПЛ считается доказанным только при подтвержде-
нии цитогенетическим или молекулярным исследованием, лечение должно начинать-
ся немедленно при подозрении на ОПЛ, возникшем при морфологическом исследо-
вании, для предотвращения геморрагических осложнений, обусловленных быстрым
развитием ДВС-синдрома.
288 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
Прежде всего назначается ATRA 45 мг/м2 в сутки в 2 приема (препарат принимается
каждые 12 ч) внутрь. Одновременно для профилактики геморрагических осложнений
назначают трансфузии свежезамороженной плазмы, фибриногена и тромбоцитов.
Желательно, чтобы концентрация фибриногена в крови была не менее 100-150 мг/дл,
а число тромбоцитов — не ниже 30-50 х 109/л.
Поскольку при лечении АТКА у ряда больных развивается так называемый синдром
дифференциации ОПЛ, иначе известный как ATRA-синдром, при первых его призна-
ках необходимо назначение дексаметазона по 10 мг в/в 2 раза в сутки до купирования
всех явлений (обычно 3-4 дня). Подробнее см. разд. «Осложнения терапии острых
лейкозов и их лечение».
При получении подтверждения диагноза, а также при количестве лейкоцитов более
10 х 109/л одновременно с применением ATRA назначают антрациклины, предпочти-
тельно идарубицин (в рандомизированных исследованиях именно при использовании
идарубицина получены высокие результаты без применения цитозина-арабинозида).
Идарубицин назначается по 12 мг/м2 в 2,4,6 и 8-й дни индукции ремиссии. АТКА при-
нимается до получения ремиссии.
Больным с числом лейкоцитов в дебюте более 10 х 109/л после подтверждения ди-
агноза одновременно с АТКА назначают антрациклины и цитозин-арабинозид. Веса-
ноид применяется в дозе 45 мг/м2/сут внутрь в 2 приема (препарат принимается ка-
ждые 12 ч). Лечение по схеме «7+3» со стандартными дозами цитозина-арабинозида и
антрациклинов (при использовании даунорубицина назначается доза 60 мг/м2) реко-
мендуется начинать не позднее 3-го дня терапии Весаноидом.
В результате такой терапии полные ремиссии к концу месячного лечебного курса
удается получить у 90-95 % больных независимо от их возраста.
При получении ремиссии проводится курс консолидации цитостатическими препа-
ратами. Чаще всего для консолидации используют только антрациклины без цитози-
на-арабинозида. Европейская группа экспертов (European Leukemia Net) рекомендует
проводить следующие три курса консолидации:
1-й курс: идарубицин — 5 мг/м2 в 1-4-й день;
2-й курс: митоксантрон — 10 мг/м2 в 1-5-й день;
3-й курс: идарубицин — 12 мг/м2 в 1-й день.
Далее в течение 2 лет все больные получают поддерживающее лечение:
6-меркаптопурин — 90 мг/м2 в сутки постоянно.
Метотрексат — 15 мг/м2 внутрь 1 раз в неделю.
(Возможны короткие перерывы при снижении количества лейкоцитов ниже
2 х 109/л или тромбоцитов ниже 100 х 109/л.)
АТКА (Весаноид) — 45 мг/м2/сут в течение 15 дней каждые 3 мес., не прекращая на
это время цитостатического лечения.
Такая терапия позволяет получить безрецидивную 4-летнюю выживаемость у 85-
90% больных независимо от возраста.
У большинства пациентов на протяжении всего времени наблюдения сохраняется не
только цитогенетическая ремиссия — отсутствие t( 15; 17), но и молекулярная — отсут-
ствие транскрипта PML/RARa при исследовании с помощью ПЦР.
Появление молекулярного рецидива предвещает скорое наступление клинико-ге-
матологического рецидива, поэтому при его возникновении необходимо незамедли-
тельно повторить курс индукционной терапии.
Поскольку в последние годы при лечении АТКА участились случаи развития нейро-
лейкоза, при ОПЛ всем больным необходимо проводить его профилактику по той же
схеме, как и остальным больным ОНЛЛ.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 289
Опухолевые заболевания кроветворной и лимфоидной ткани
Ктерапии АТКА чувствительны больные ОПЛ с t(l5;17), t(5;l7) и t(ll;17)(q13;q21). Два
варианта ОПЛ — с t(l 1 ;17)(q23;q21) и с вовлечением только хромосомы 17 — к ATRA
нечувствительны. Лечение больных с этими вариантами ОПЛ должно проводиться по
указанным выше схемам химиотерапии ОНЛЛ с использованием высоких доз цитози-
на-арабинозида, однако ремиссии удается получить редко.
Вторым препаратом в терапии ОПЛ, показавшим свою активность как в лечении пер-
вичных больных, так и при рецидивах, является триоксид мышьяка (As2O3, АТО,Три-
зенокс), позволяющий получить до 50-65 % полных ремиссий у больных с рефрак-
терными к лечению АТКА рецидивами ОПЛ и 85-87 % полных ремиссий у ранее не
леченных больных. Более чему 90% больных с полными ремиссиями при исследова-
нии методом ПЦР не обнаруживается транскрипта PML/RAKa, т.е. достигается моле-
кулярная ремиссия.
Препарат назначается в дозе 0,15 мг/кг/сут в/в в виде 1-2-часовой инфузии. Терапия
проводится до получения ремиссии, но если она не получена к 50-му дню, лечение
прекращают. Препарат может употребляться в сочетании с XT. При получении ремис-
сии проводится консолидация — введение триоксид мышьяка в той же ежедневной
дозе 5 дней в неделю с 2-дневным перерывом, всего в течение 5 нед. Некоторые авто-
ры в консолидирующем курсе вводят препарат ежедневно в течение 25 дней. Безре-
цидивная выживаемость значительно выше при проведении повторных курсов тера-
пии сочетанием триоксида мышьяка и цитостатических препаратов.
Нечувствительны к триоксиду мышьяка больные с теми же вариантами ОПЛ, кото-
рые нечувствительны кАТКА.
10.1.2. Острые лимфобластные лейкозы
Классификация, клинические особенности, прогноз
ОЛЛ разделяются на В- и Т-клеточные в зависимости оттого, предшественнику какой
линии лимфоцитов соответствует иммунофенотип бластных клеток.
Цитохимическое исследование бластных клеток при ОЛЛ обнаруживает отсутствие
пероксидазы, В-лимфобласты часто содержат ШИК-положительное вещество, обыч-
но в форме гранул, Т-лимфобласты, как правило, ШИК-негативны. В Т-лимфобластах
часто обнаруживается кислая фосфатаза. Окончательная принадлежность лимфобла-
стов к В- или Т-линии лимфопоэза может быть установлена только на основании дан-
ных иммунологического анализа.
У взрослых более 60% ОЛЛ составляют лейкозы из В-линейных предшественников.
Характеризуются экспрессией на поверхности лейкозных клеток антигенов HLA-DRn
CD19. Выделяют следующие подтипы.
Про~В — лейкоз из клеток, находящихся на наиболее ранней стадии В-клеточ-
ной дифференцировки. Характеризуется помимо указанных антигенов экспрессией
CD34. Клетки содержат фермент TdT — терминальную дезоклинуклеотидилтрансфе-
разу. На долю про-В у взрослых приходится не более 10% всех ОЛЛ. При этом вариан-
те, особенно часто у детей, встречается t(4; 11), что служит неблагоприятным прогно-
стическим признаком, т.к. достигаемые ремиссии, как правило, непродолжительны.
Пре-пре~В (син.: ранний пре-В, общий). Лейкоз из лимфоидных предшественников
с экспрессией антигена CD10 на их поверхности. Наиболее частый вариант среди ОЛЛ
(встречается у 65 % детей и более чем у 50 % взрослых). Прогноз благоприятный, если
одновременно не обнаруживается t(9;22). Эта транслокация наиболее часто встреча-
ется именно при пре-пре-В и пре-В ОЛЛ, особенно у больных старше 50 лет, и до по-
290 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
явления ингибиторов тирозинкиназ была самым неблагоприятным прогностическим
признаком при ОЛЛ.
Пре~В — вариант, соответствующий следующей стадии дифференцировки В-лим-
фоцитов. Встречается у взрослых примерно в 10% случаев. Иногда сочетается с не-
благоприятной t(l ;19).
В~клеточный (зрелый) ОЛЛ — соответствует конечному костномозговому эта-
пу дифференцировки В-лимфоцитов, характеризуется экспрессией на мембране бласт-
ных клеток помимо HLA-DRn CD 19 антигенов CD20, CD22 и IgM. Самый редкий вариант,
на его долю приходится не более 2-3 % всех ОЛЛ взрослых. Неблагоприятный как по ча-
стоте достигаемых ремиссий, так и по их продолжительности. Более чем у 73 больных
имеются экстрамедуллярные очаги поражения (вовлечение органов и ЦНС).
Т~клеточный — иммуноподвариант, встречается у взрослых примерно в 24-25%
случаев (у детей вдвое реже).
Т-клеточные лейкозы характеризуются наличием TdT в цитоплазме бластных клеток
и экспрессией антигена CD7 на всех стадиях их дифференцировки. Часть клеток эк-
спрессирует CD5, в ряде случаев может определяться CD10.
В отличие от В-ОЛЛ выделение иммунных подвариантов Т-ОЛЛ не получило широ-
кого распространения, поскольку нет четких отличий в их клинической картине и ре-
акции налечение.
Для Т-ОЛЛ характерен высокий лейкоцитоз (часто более 100 х 109/л), нередко зна-
чительно увеличены лимфоузлы средостения, иногда с симптомами сдавления вер-
хней полой вены и плевральным выпотом, периферические лимфоузлы, в т.ч. необыч-
ной локализации — кубитальные, подколенные, часто увеличена селезенка. В начале
заболевания нередко имеется поражение ЦНС, иногда выражающееся лишь в увели-
чении цитоза ликвора без каких-либо клинических проявлений.
Как при В-, так и Т-линейных ОЛЛ у взрослых больных факторами неблагоприятно-
го прогноза считаются: возраст старше 50 и, особенно, старше 60 лет, про-В (ранний
В-клеточный CD 10-отрицательный), В-зрелоклеточный, ранний и зрелоклеточный Т-
иммунофенотип, цитогенетические изменения — t(9;22), t(4;l 1), лейкоцитоз — более
30 х 109/лдля В-клеточных ОЛЛ и более 100х 109/л для Т-клеточных, достижение ре-
миссии только после 3-4 нед. терапии. Больные с t(9;22) и В-зрелоклеточным вариан-
том рассматриваются как пациенты с очень высоким риском (наиболее неблагоприят-
ным прогнозом). Благоприятные признаки — возраст до ЗОлет, гиперплоидия с числом
хромосом более 50, число лейкоцитов в дебюте заболевания менее 30x109/л, дости-
жение ремиссии до 3 нед. терапии.
Лечение острых лимфобластных лейкозов
В дебюте ОЛЛ часто наблюдаются анемия, тромбоцитопения и инфекции. Лечение
инфекционных осложнений и сопроводительная терапия, направленная на ликвида-
цию анемии и поддержание уровня тромбоцитов не менее 20 х 109/л, должны начи-
наться немедленно после поступления больного под наблюдение еще до начала цито-
статической терапии и продолжаться при ее проведении.
Современная цитостатическая терапия ОЛЛ часто дает очень быстрый циторедук-
тивный эффект, поэтому всем больным с высоким лейкоцитозом и/или большими экс-
трамедуллярными опухолевыми поражениями необходимо до начала XT назначать ал-
лопуринол, применение которого затем продолжается и во время XT до нормализации
количества лейкоцитов и ликвидации экстрамедуллярных опухолевых поражений.
Главные принципы современной терапии ОЛЛ взрослых — применение в програм-
ме лечения многих препаратов с обязательным включением кортикостероидных гор-
монов, L-аспарагиназы, винкристина и антрациклинов, проведение консолидации с
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 291
Опухолевые заболевания кроветворной и лимфоидной ткани
использованием высоких доз метотрексата и цитозина-арабинозида, длительная под-
держивающая терапия, обязательная профилактика нейролейкоза с самого начала ле-
чения. Для лечения В-ОЛЛ из клеток-предшественников и Т-ОЛЛ применяются еди-
ные программы терапии. Лечение больных со зрелоклеточным В-иммунофенотипом
и t(9;22) проводится по специальным программам.
Применение этих подходов к терапии ОЛЛ у взрослых позволяет получить 75-85 %
полных ремиссий и 5-летнюю безрецидивную выживаемость 30-40%.
Предлагаемая программа терапии, используемая в нашей клинике, является моди-
фикацией широко известной немецкой программы (Hoelzer) и практически не отли-
чается от программ, используемых большинством клиник мира.
Лечение В-ОЛЛ из клеток-предшественников и Т-ОЛЛ
Индукция ремиссии
1. Накануне или в 1-й день лечения делают люмбальную пункцию с введением трех
препаратов: метотрексат 15 мг, цитозин-арабинозид 30 мг и дексаметазон 4 мг или
преднизолон 30 мг.
2. При количестве лейкоцитов более 30 х 109/л и/или наличии больших опухолевых
масс обязательно применение аллопуринола за 1-2 дня до начала терапии и далее
на всем ее протяжении до нормализации количества лейкоцитов и значительной
редукции массы опухоли.
3. Дексаметазон 10 мг/м2 или преднизолон 60 мг/м2 в день внутрь с 1-го дня лечения
(при количестве лейкоцитов более 1 х 109/л и наличии больших опухолевых масс
во избежание синдрома лизиса опухоли (СЛО) в 1-й день дают ’/3 дозы препарата,
во 2-й день — 2/3 и лишь с 3-го дня — полная доза) на протяжении 5 нед.
4. Винкристин — 1,5 мг/м2 (суммарно не более 2 мг) в/в в 1,8, 15, 22 и 29-й дни.
5. Циклофосфамид — 1 г/м2 в/в капельно в течение часа однократно во 2-й день те-
рапии, а при высоком лейкоцитозе и/или больших массах опухоли — в 9-й день.
Инфузия этой дозы циклофосфамида должна проводиться на фоне введения жид-
кости. Всего за сутки больной должен получить 3 л/м2 жидкости (в равных количе-
ствах физиологический раствор и 5% глюкоза). Кроме того, необходимо введение
калия из расчета 2 ммоль/кг/сут. Калий распределяется равномерно добавлением
в каждую дозу жидкости. Через 6 и 12 ч после начала инфузии жидкости вводится
в/в фуросемид 0,5 мг/кг или лазикс 20-40 мг в/в струйно.
6. L-аспарагиназа — 10 000 ЕД/м2 в/в 1-часовая инфузия в 3, 6,9, 12, 15, 18, 21 и 24-й
дни (при количестве лейкоцитов более 100 х 109/л и/или больших опухолевых
массах первое введение проводится в 6-й день, затем в том же режиме с послед-
ним введением в 27-й день).
7. Идарубицин — 15 мг/м2 в/в в 1,8, 15, 22 и 29-й дни (при опасности СЛО из-за вы-
сокого лейкоцитоза и/или больших опухолевых масс, как указано выше, лечение
начинается с 8-го дня в том же режиме до 36-го дня).
8. Через неделю после последнего введения идарубицина 6-меркаптопурин —
60 мг/м2/сут внутрь в течение месяца.
9. Цитозин-арабинозид — 100 мг/м2 в/в капельно 1 раз в сутки 4 дня подряд, начиная
с 1-го дня каждой недели с того момента, когда начинается прием 6-меркаптопу-
рина. Всего введение цитозина-арабинозида больной получает 4 раза.
10. Профилактика нейролейкоза тремя препаратами: метотрексат 15 мг, цитозин-ара-
бинозид 30 мг и дексаметазон 4 мг или преднизолон 30 мг — 5 раз на протяже-
нии 5-недельного курса и 2 люмбальных пункции на протяжении месяца лечения
6-меркаптопурином и цитарабином (Цитозар). В случае обнаружения в спинно-
мозговом пунктате более 3 клеток диагностируется поражение ЦНС. В этом слу-
292 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
чае люмбальные пункции выполняют каждый 4-5-й день до получения трех по-
следовательных пунктатов с содержанием не более 3 клеток в 1 мкл ликвора.
После этого проводится дальнейшее лечение по программе профилактики нейро-
лейкоза (1 раз в неделю).
Перерыв в лечении может быть сделан при возникновении тяжелых инфекционных
или токсических осложнений (пневмония и сепсис в период панцитопении, тяжелый
стоматит или энтеропатия, индуцированный тяжелый сахарный диабет и т. п.). При этом
желательно не прекращать терапию полностью, а временно воздержаться от введения
тех препаратов, которыми может быть индуцировано данное осложнение.
Стернальная пункция выполняется через 4 нед. от начала терапии. При констата-
ции полной или частичной ремиссии лечение продолжается по указанной програм-
ме. В случае получения лишь частичной ремиссии следующая стернальная пункция
выполняется через 2 нед. после первой. При недостижении полной ремиссии через
6 нед., а также при отсутствии эффекта (неполучение даже частичной ремиссии) по-
сле 4 нед. больной переводится на программу лечения пациентов с неблагоприятным
вариантом — В-ОЛЛ из клеток с иммунофенотипом, соответствующим иммунофено-
типу лимфоцитов конечных этапов дифференцировки.
Консолидация ремиссии
После завершения этапа индукции все больные с полной ремиссией должны полу-
чить программу консолидации. Консолидация может быть начата при количестве лей-
коцитов не менее 2,5 х 109/л, тромбоцитов не менее 100 х 109/л и уровне гемоглоби-
на не менее 100 г/л.
Консолидация включает два этапа.
1-й этап» 6-меркаптопурин — 25 мг/м2/сут внутрь на протяжении всего 1-го этапа
консолидации.
Метотрексат — 1,5-3 г/м2/сут в/в 24-часовая непрерывная инфузия 1 раз в 2 нед., на-
чиная с 8-го дня данного курса. Для больных моложе 50 лет — 4 введения, для боль-
ных старше 50 лет — 2 введения с удлинением интервала между курсами до 3-4 нед.
За 12 ч до введения метотрексата должна быть начата инфузия жидкости в том же со-
ставе, как указано выше при лечении циклофосфамидом.
Введение жидкости в дозе 3 л/м2 в сутки должно продолжаться в течение всего вре-
мени введения метотрексата и 2 дня после его окончания.
Перед началом инфузии метотрексата определяют pH мочи (которая в норме долж-
на быть кислой) и вводят соду (4,2% раствор натрия гидрокарбоната) до тех пор, пока
реакция мочи не станет щелочной: введение метотрексата может быть начато только
после того, как pH мочи станет выше 7,0.
Далее pH мочи измеряют каждые 2 ч, при pH < 7,0 добавляют 200 г соды.
Метотрексат разводится из расчета 25 мг в 1 мл жидкости. За первые 30 мин вводит-
ся 710 дозы, остальное количество — за оставшиеся 23,5 ч суток.
Через 2 ч от начала инфузии делают люмбальную пункцию с введением трех препа-
ратов, как указано выше.
Через 42 ч от начала инфузии метотрексата вводят лейковорин в дозе 15 мг/м2 и да-
лее каждые 6 ч в зависимости от концентрации метотрексата в сыворотке (введение
лейковорина прекращается при концентрации метотрексата не более 0,1 ммоль/л).
При невозможности определения концентрации метотрексата лейковорин в ука-
занной дозе назначают первый раз через 42 ч от начала инфузии метотрексата и затем
каждые 6 ч в течение не менее суток после окончания его введения.
2-й этап. Начинается через 2 нед. после получения больным последней дозы ме-
тотрексата.
ХИМИОТЕРАПИЯ ОТДЕЛ ЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 293
Опухолевые заболевания кроветворной и лимфоидной ткани
Дексаметазон — 10 мг/м2/сут или преднизолон 60 мг/м2/сут внутрь в 1-15-й день.
Винкристин — 1,5 мг/м2 (не более 2 мг) в/в в 1,8 и 15-й дни.
L-аспарагиназа — 10 000 ЕД/м2 в/в в 1,8 и 15-й дни.
Цитозин-арабинозид — 1,5 г/м2 в/в 1-часовая инфузия 2 раза в сутки в 18-20-й день,
всего 6 доз.
Идарубицин — 15 мг/м2 в/в однократно в 18-й день.
После интервала 2-3 нед. при восстановлении показателей крови у больных моло-
же 50 лет проводится второй курс цитозина-арабинозида и идарубицина (для больных
старше 50 лет — только 1 курс).
После интервала 2-3 нед. при восстановлении показателей крови проводится 2 кур-
са терапии цитозином-арабинозидом по 100 мг/м2 2 раза в сутки п/к или в/в и этопо-
зидом 100 мг/м2/сут в/в в течение 5 дней с интервалом между курсами не менее 2 нед.
Люмбальная пункция с введением трех препаратов перед началом каждого курса
цитозина-арабинозида и этопозида.
Поддерживающая терапия
Начинается через 2-3 нед. после окончания курса консолидации. Проводится на
протяжении 2 лет, а для больных мужского пола моложе 30 лет с Т-ОЛЛ, высоким на-
чальным лейкоцитозом и большими опухолевыми массами — на протяжении 3 лет.
6-меркаптопурин — 100 мг/м2 внутрь в 1-30-й день.
Метотрексат — 15 мг/м2 внутрь 1 раз в неделю, начиная с 1-го дня, всего 4 дозы.
Винкристин — 1,5 мг/м2 (не более 2 мг) в/в в 31-й и 38-й дни.
Преднизолон — 40 мг/м2/сут внутрь или дексаметазон 8 мг/м2 внутрь в 31 -38-й день
с последующей постепенной отменой.
Идарубицин — 10 мг/м2 в/в в 43-й и 44-й дни.
Люмбальная пункция с введением трех препаратов в 50-й и 54-й дни.
Цикл повторяется после недельного перерыва, но в 43-й день вместо идарубицина
вводится циклофосфамид в дозе 800 мг/м2/сут в/в (больному в этот день должно быть
рекомендовано обильное питье).
Далее циклы повторяются, чередуясь, как указано выше, с недельными интервала-
ми между ними.
Профилактика нейролейкоза проводится на протяжении всего первого года тера-
пии.
Лучевая терапия
У больных моложе 50 лет с нейролейкозом в дебюте заболевания после заверше-
ния программы консолидации осуществляется краниальное облучение в дозе 24 Гр.
В это же время при отсутствии лейкопении проводится поддерживающая терапия.
Далее при поддерживающей терапии люмбальные пункции выполняются в том же
режиме, как и остальным больным, на протяжении первого года терапии. Больным
старше 50 лет в связи с нередким развитием осложнений краниальное облучение
не проводится.
У больных с увеличением лимфоузлов средостения в дебюте заболевания после за-
вершения программы консолидации выполняют облучение средостения в дозе 30 Гр.
При отсутствии лейкопении в это же время может проводиться поддерживающая те-
рапия.
При одновременной констатации в дебюте заболевания нейролейкоза и увеличе-
ния лимфоузлов средостения вначале следует назначить краниальное облучение, за-
тем после перерыва 2-3 нед., во время которого при отсутствии лейкопении больной
получает поддерживающее лечение, проводится облучение средостения.
294 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
Лечение зрелоклеточных В-ОЛЛ (ОЛЛ из клеток, соответствующих лимфоцитам
конечных этапов костномозговой дифференцировки) проводится по программе Ну-
per-CVAD или ее модификации.
Hyper-CVAD. Программа состоит из 8 чередующихся курсов терапии.
Курсы 1, 3, 5, 7
Циклофосфамид — 300 мг/м2 в/в 1-часовая инфузия 2 раза в сутки в 1—3-й день.
Винкристин — 2 мг в/в в 4-й и 11 -й дни.
Доксорубицин — 50 мг/м2 в/в в 4-й день.
Дексаметазон — 40 мг/м2 внутрь в 1-4-й и 11-14-й дни.
Люмбальная пункция с введением трех препаратов в 1-й день каждого курса.
Курсы 2, 4, 6, 8
Метотрексат — 1 г/м2 в/в 24-часовая инфузия в 1-й день.
Лейковорин — 15 мг/м2 через 12, 18 и 24 ч после введения метотрексата.
Цитозин-арабинозид — 3 г/м2 2 раза в сутки в/в 1-часовая инфузия во 2-й и 3-й дни
(для больных старше 50 лет — 1,5 г).
Все циклы обязательно проводятся с введением Г-КСФ в дозе 5 мкг/кг до восстанов-
ления числа нейтрофилов не менее 1 х 109/л.
Интервалы между всеми курсами — до восстановления числа нейтрофилов не ме-
нее 1,5 х 109/л и тромбоцитов не менее 100 х 109/л.
Люмбальная пункция с введением трех препаратов в 1-й день каждого курса.
Лечение ОЛЛ с t(9;22)
В программу лечения этой группы больных обязательно входит ингибитор BCR-ABL-
тирозинкиназы — иматиниба мезилат (Гливек) или ингибитор второй линии дазатиниб
(Спрайсел).
Возможны два варианта терапии.
1. Лечение проводится по программе Hyper-CVAD, иматиниб назначается по 400-
600 мг/сут в течение 14 дней перед каждым курсом на протяжении всех 8 курсов
терапии (дзатиниб — по 70 мг 3 раза в сутки). Возможно одновременное назначе-
ние курсов Hyper-CVAD и иматиниба с короткими перерывами только при разви-
тии глубокой нейтропении, во время которой обязательно назначают КСФ. Профи-
лактика нейролейкоза проводится с 1-го дня лечения.
2. Лечение проводится по программе терапии В-ОЛЛ из клеток-предшественников с
одновременным приемом иматиниба 400-600 мг/сут или дазатиниба по 140мг в
сутки на протяжении всех этапов терапии.
При указанной терапии удается получить 90-95% полных ремиссий, в т.ч. у боль-
шинства больных — цитогенетических.
После достижения полной ремиссии при наличии любого из неблагоприятных при-
знаков больным моложе 50 лет рекомендуется аллогенная трансплантация стволо-
вых кроветворных клеток от родственного или неродственного донора уже в первой
ремиссии. Во второй полной ремиссии трансплантация должна быть рекомендова-
на всем больным моложе 50 лет. Больные с t(9;22) после аллогенной трансплантации
должны получать иматиниб в прежней дозе в течение 2 лет.
Осложнения терапии острых лейкозов и их лечение
Современная XT острых лейкозов неизбежно сопряжена с развитием цитостати-
ческой миелосупрессии и ее следствия — цитопении. В периоде цитопении от 7 до
20% больных погибают, главным образом, от бактериальных и грибковых инфекций,
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 295
Опухолевые заболевания кроветворной и лимфоидной ткани
наиболее часто от пневмонии или сепсиса. Лечение этих осложнений должно про-
водиться в соответствии с современными правилами антибиотической и противог-
рибковой терапии у больных с ФН. Поскольку частота инфекционных осложнений
прямо коррелирует с длительностью нейтропении, для сокращения периода ней-
тропении показано назначение Г-КСФ или ГМ-КСФ 5 мг/кг ежедневно, начиная со
следующего дня после окончания XT и продолжая до восстановления числа нейтро-
филов до 0,5 х 109/л.
Во избежание геморрагических осложнений необходимы переливания тромбоци-
тов — не менее 4-8 доз каждый раз (1 доза — количество тромбоцитов, получаемое
из 500 мл крови). Количество вводимых тромбоцитов при каждом переливании и ча-
стота переливаний должны быть такими, чтобы поддерживать тромбоциты на уровне
не менее 20 х 109/л, а у больных с инфекциями — не менее 30 х 109/л.
Для уменьшения эметогенного эффекта цитостатических препаратов назначают
блокаторы 5-НТ3-рецепторов афферентных нейронов блуждающего нерва: трописе-
трон, ондансетрон или гранисетрон.
При высокодозной XT для уменьшения интоксикации и сохранения водно-электро-
литного баланса необходимо ежедневное введение 3-5 л жидкости — в равных коли-
чествах физиологический раствор и 5% глюкоза с добавлением электролитов в зави-
симости от биохимических показателей.
При первых признаках цитостатического поражения желудка или кишечника (боль
в животе, жидкий стул), опасных образованием язвенно-некротических участков, ре-
зультатом которых могут быть желудочно-кишечные кровотечения и септические
осложнения в результате проникновения кишечной флоры в кровяное русло, необ-
ходим немедленный переход на полное парентеральное питание до ликвидации всех
симптомов. При этом объем вводимых растворов глюкозы, электролитов, витаминов,
аминокислот и липидов должен составлять в сумме не менее 35-40 мл/кг в сутки при
энергетической ценности 30 ккал/кг.
При длительном применении антрациклиновых антибиотиков в результате кумуля-
тивного эффекта может развиться поражение мышцы сердца с деградацией миоци-
тов, появлением участков некроза и конечным диффузным фиброзом миокарда с сим-
птомами сердечной недостаточности, которая иногда оказывается причиной гибели
больного, излеченного от острого лейкоза. Во избежание этого следует стараться не
превышать рекомендуемых максимальных кумулятивных доз антрациклинов (дауно-
рубицин — 650-700 мг/м2, доксорубицин — 550 мг/м2, идарубицин — 150 мг/м2, ми-
токсантрон — 160 мг/м2).
При лечении рецидивов острых лейкозов или терапии вторичных лейкозов, когда
больной уже получал антрациклины ранее по поводу прежнего онкологического за-
болевания, возникает необходимость их повторного применения. Повторное исполь-
зование антрациклинов увеличивает опасность поражения сердечной мышцы. Такая
же опасность возникает, если больной ранее получал облучение, включавшее область
сердца, что значительно повышает чувствительность сердечной мышцы к антрацикли-
нам. В этих случаях рекомендуется очень медленное (24-48-часовое) введение су-
точной дозы препарата. Повторные биопсии сердечной мышцы показали, что при та-
ком введении изменения мышцы сердца гораздо менее выражены, чем при быстром
введении препаратов. Кроме того, рекомендуется применение дексразоксана (Кар-
диоксан). Его защитное действие обусловлено связыванием ионов железа, уменьша-
ющим образование свободных радикалов кислорода, играющих основную роль в па-
тогенезе поражения мышцы сердца. Кардиоксан вводится в/в в течение 30 мин перед
введением антрациклина в дозе, которая должна в 20 раз превышать дозу антрацикли-
на, но не более 1 г/м2.
296 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Острые лейкозы
При лечении ОПЛ как АТКА, так и триоксидом мышьяка у ряда больных (по раз-
ным данным, от 10 до 40%) развиваются побочные явления, характеризующиеся
симптомокомплексом, названным ATRA-синдромом, синдромом ретиноевой ки-
слоты, синдромом активации лейкоцитов или дифференцирующим ОПЛ-синдро-
мом. Симптомокомплекс включает быстрое нарастание числа лейкоцитов, однов-
ременное повышение температуры тела до 37,5-38,5 °C, сухость кожи и слизистых
оболочек, отеки, выпот в плевральных полостях и полости перикарда, инфильтра-
ты в легочной ткани из созревающих нейтрофилов, которые могут провоцировать
отек легкого, развитие почечной недостаточности и гипотензии. Причиной это-
го синдрома служит увеличение секреции ФНО-а и ряда цитокинов (в частности,
ИЛ-1 и ИЛ-2) и повышение адгезивных свойств гранулоцитов. Без лечения возмо-
жен летальный исход.
При первых признаках этого синдрома необходимо назначение дексаметазона по
10 мг в/в 2 раза в сутки, которое обычно купирует все симптомы в течение 3-4 дней.
Если признаки синдрома ретиноевой кислоты выражены незначительно, возможно
продолжение лечения ATRA или триоксидом мышьяка, если они не купируются после
2-3 дней лечения дексаметазоном, рекомендуется сделать короткий перерыв в лече-
нии АТКА или триоксидом мышьяка.
При применении триоксида мышьякау большинства больных наблюдается значи-
тельное (в отдельных наблюдениях — до 100 х 109/л) повышение числа лейкоцитов,
которое не требует отмены препарата или назначения цитостатических средств.
При продолжении лечения триоксидом мышьяка лейкоцитоз снижается самосто-
ятельно.
При лечении триоксидом мышьяка необходим регулярный ЭКГ-контроль, т. к. у мно-
гих больных отмечается постепенное удлинение интервала Q-T, которое отражает на-
растающее ухудшение состояния миокарда. У некоторых больных развивается полная
атриовентрикулярная блокада, описаны отдельные наблюдения трепетания желудоч-
ков с внезапной остановкой сердца. Это осложнение учащается при одновременном
назначении препаратов, ведущих к развитию гипокалиемии (диуретики, амфотери-
цин В).
Почти у всех больных, получающих триоксид мышьяка, отмечается умеренная, обы-
чно не требующая коррекции гипергликемия и некоторое повышение активности
аминотрансфераз, чаще всего не требующее отмены препарата.
При лечении ОЛЛ одновременное назначение кортикостероидов и L-аспарагиназы
нередко вызывает гипергликемию, иногда сопровождающуюся симптомами сахарно-
го диабета. В этих случаях приходится уменьшать дозу кортикостероидов, при резко
выраженных симптомах временно отменять введение L-аспарагиназы и проводить ле-
чение сахарного диабета, что наиболее надежно и быстро достигается при назначе-
нии инсулина.
При применении L-аспарагиназы, а иногда в менее выраженной степени и при ле-
чении антрациклиновыми антибиотиками нередко наблюдается увеличение ак-
тивности аминотрансфераз, в несколько раз превышающее нормальные значения.
L-аспарагиназа в этих случаях должна быть отменена и проведено лечение введением
жидкости, 5% глюкозы, витаминов, а при упорном сохранении высокой активности пе-
ченочных ферментов и наличии гипербилирубинемии — назначение гепатопротекто-
ров (урсодеоксихолевая кислота, орнитин).
При любом повышении активности аминотрансфераз и уровня билирубина необ-
ходимо исключение вирусного гепатита (чаще всего В и/или С), который бывает не-
редким осложнением частых переливаний компонентов крови.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 297
Опухолевые заболевания кроветворной и лимфоидной ткани
10.2. Миелодиспластические синдромы
А. Д. Ширин, О. Ю. Баранова
Термин «миелодиспластические синдромы» объединяет гетерогенную группу клоно-
вых опухолевых заболеваний системы кроветворения, при которых поражается по-
липотентная столовая клетка. МДС характеризуется сочетанием дисплазии и неэф-
фективного гемопоэза одного, двух или трех ростков миелопоэза, что проявляется
соответствующей цитопенией (анемия, нейтропения, тромбоцитопения или их ком-
бинации) в сочетании с гиперклеточным костным мозгом. Типичным, но необязатель-
ным признаком является пролиферация бластных клеток и трансформация МДС в
острый лейкоз.
Заболеваемость в среднем составляет 3 случая на 100 000 населения в год, уве-
личиваясь с возрастом и достигая 20 на 100 000 лиц старше 70 лет в год. Мужчины
и женщины заболевают примерно с одинаковой частотой. Длительность заболева-
ния различна — от нескольких месяцев до 10 лет и более. Основные причины смерти
больных — инфекции и развитие острого лейкоза.
Этиология МДС остается неизвестной в 80-90 % случаев. Считается, что факторами
риска могут быть бензин, выхлопные газы, курение, пестициды, органические раство-
рители, аммиак, кварц, асбест, олово, никель, радиация, химиопрепараты и др. К от-
дельной группе относят МДС, развившиеся после XT и/или лучевой терапии предше-
ствующих заболеваний (преимущественно, онкологических). Они составляют 10-15%
от ежегодно выявляемых случаев МДС и называются вторичными МДС.
Клинические проявления МДС неспецифичны, в связи с чем диагноз устанавливают
на основании лабораторных исследований. Анемия — самый частый симптом МДС,
она обнаруживается у 85-90% больных, и жалобы пациентов чаще всего обусловле-
ны ею. Не менее чем у 50 % больных обнаруживается лейкопения, которая иногда слу-
жит причиной склонности к развитию инфекционных заболеваний. Тромбоцитопения
встречается примерно у 50% пациентов, и некоторые впервые обращаются к врачу в
связи с геморрагическим синдромом. Увеличение органов (лимфоузлов, селезенки и
печени) встречается крайне редко.
В 2007 г. были опубликованы стандарты диагностики МДС (табл. 10.1). Международ-
ная группа экспертов выделила три группы признаков: А) необходимые (prerequisite-
type) критерии; В) убедительные (decisive) критерии; С) дополнительные (co-criteria)
критерии.
Цитопения одного и более ростков миелопоэза в течение 6 мес. и более: эритроид-
ного (НЬ < 11 г/дл), гранулоцитарного (абсолютное число нейтрофилов < 1,5 х 109/л,
мегакариоцитарного (тромбоциты < ЮОх 109/л) — в сочетании с отсутствием мини-
мальных критериев МДС, которая не может быть обусловлена другими гематологиче-
скими или негематологическими заболеваниями, обозначается термином «идиопати-
ческая цитопения неясного (неопределенного) значения (ICUS — idiopathic cytopenia
of uncertain (undetermined) significance). Эта категория больных должна находиться под
внимательным наблюдением с проведением регулярных исследований для подтвер-
ждения или исключения МДС.
Ранее МДС обозначались как гемопоэтическая дисплазия, малопроцентный лей-
коз или тлеющий острый лейкоз. В 1982 г. Франко-американо-британская (FAB) группа
ввела термин «МДС» и выделила пять его вариантов:
рефрактерная анемия (РА);
рефрактерная анемия с кольцевыми сидеробластами (РАКС);
рефрактерная анемия с избытком бластов (РАИБ);
298 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Миелодиспластические синдромы
Таблица 10.1. Минимальные диагностические критерии
миелодиспластических синдромов1
А Необходимые критерии_______________________________________________________________
Постоянная цитопения одного и более ростков: эритроидного (НЬ < 11 г/дл), гранулоцитарного (абсо-
лютное число нейтрофилов < 1,5 х 109/л), мегакариоцитарного (тромбоциты < 100 х 109/л)
Отсутствие других гематологических и негематологических заболеваний, которые могут являться
причиной цитопении/дисплазии* 1 2______________________________________________
В Связанные с МДС (убедительные)_____________________________________________________
Дисплазия не менее 10% клеток, принадлежащих к одному из ростков миелопоэза, выявляемая при
исследовании мазков костного мозга (эритроидного, гранулоцитарного, мегакариоцитарного), или
более 15% кольцевых сидеробластов (при окраске на железо)
5-19% бластных клеток в костном мозге
Типичные хромосомные аномалии (при обычном цитогенетическом исследовании или при исследо-
вании методом FISH)3_____________________________________________________________
Дополнительные критерии4 * * * В (для случаев наличия критериев А, но отсутствия критериев В или при
С типичных клинических ситуациях, например макроцитарная анемия, требующая проведения гемо-
трансфузий)__________________________________________________________________________
Аномальный фенотип клеток костного мозга, отчетливо указывающий на моноклональную популя-
цию эритроидных и/или миелоидных клеток, определяемый методом проточной цитометрии
Отчетливые молекулярные признаки наличия моноклональной клеточной популяции, определяемые
с использованием микрочипов или исследования точечных мутаций генов (например, RAS)
Значительно и постоянно сниженная колониеобразующая (± кластерообразование) способность
клеток-предшественников костного мозга и/или периферической крови
1 Диагноз МДС устанавливается при наличии 2 необходимых (prerequisite-type criteria) критериев и по крайней
мере 1 (из трех) связанных с МДС (убедительных) критериев (MDS-related (decisive) criteria) При отсутствии убе-
дительных критериев, но при подозрении на наличие клонального заболевания миелоидной природы следу-
ет использовать дополнительные критерии (co-criteria) для решения вопроса о наличии у больного МДС или се-
рьезного подозрения на МДС.
2 Поскольку есть пациенты с одновременным опухолевым поражением костного мозга (разными заболеваниями),
следует учитывать, что диагноз МДС может быть установлен даже при наличии другого сопутствующего заболе-
вания, способного вызывать цитопению
3 К типичным хромосомным аномалиям относят те изменения кариотипа, которые периодически встречаются при
МДС (+8, -7, 5q-, 20q- и др.). В тех случаях, когда аномальный кариотип — единственный диагностический крите-
рий, это состояние следует расценивать как серьезное подозрение на МДС.
4 Дополнительные критерии не следует рассматривать в качестве стандартов в рутинной гематологической пра-
ктике При невозможности выполнения этих исследований в спорных случаях следует наблюдать за больным и
мониторировать показатели, на основании которых устанавливается диагноз МДС
рефрактерная анемия с избытком бластов в стадии трансформации в острый
лейкоз (РАИБ-Т);
И хронический миеломоноцитарный лейкоз (ХММЛ).
В 1997 г. ВОЗ предложила внести поправки в FAB-классификацию, которые были
приняты и опубликованы в 2001 г. Сравнение классификаций FAB и ВОЗ представле-
но в табл. 10.2.
Варианты МДС (классификация ВОЗ, 2001):
1. Рефрактерная анемия характеризуется анемией и дисплазией только клеток
эритроидного ряда.
2. Рефрактерная анемия с кольцевыми сидеробластами отличается от предыдуще-
го варианта обнаружением среди эритробластов более 15 % кольцевых сидеро-
бластов.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 299
Опухолевые заболевания кроветворной и лимфоидной ткани
Таблица 10.2. Сопоставление классификаций FAB и ВОЗ
миелодиспластических синдромов
I Классификация IFAB (1982) РА
РА РЦМД (рефрактерная цитопения с мультилинейной дисплазией) МДС с изолированной del(5q) МДС-Н (миелодиспластический синдром неклассифицируемый) РАКС
РАКС РЦМД-КС (рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сиде- робластами)
РАИБ РАИБ-1 (число бластных клеток костного мозга 5-9%) РАИБ-2 (число бластных клеток костного мозга 10-19%)
РАИБ-Т Острый миелоидный лейкоз
ХММЛ Миелодиспластические/миелопролиферативные заболевания
Вторичные МДС Острый миелоидный лейкоз и МДС, связанные с лечением
3. Рефрактерная цитопения с мультилинейной дисплазией, для которой характер-
на двух- или трехростковая цитопения с чертами дисплазии в двух или трех ли-
ниях миелопоэза.
4. Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеро-
бластами отличается от предыдущего варианта наличием более 15 % кольцевых
сидеробластов в костном мозге.
5. Рефрактерная анемия с избытком бластов 1 характеризуется цитопенией, одно-,
двух- или трехростковой дисплазией и обнаружением в костном мозге 5-9%
бластных клеток, в крови — менее 5 % бластных клеток.
6. Рефрактерная анемия с избытком бластов 2 отличается от предыдущего вари-
анта количеством бластных клеток в костном мозге (10-19%) и в крови (5-19%) и
возможностью обнаружения палочек Ауэра.
7. Неклассифицируемый миелодиспластический синдром характеризуется ней-
тропенией или тромбоцитопенией и дисплазией гранулоцитарного или мегака-
риоцитарного ростка.
8. МДС с изолированной хромосомной аномалией 5q— делецией части длинного
плеча хромосомы 5 (син.: синдром 5q-), который характеризуется выраженной,
как правило макроцитарной, анемией с дисплазией клеток эритроидного ряда,
иногда умеренной нейтропенией, увеличенным или нормальным количеством
тромбоцитов, высокой продолжительностью жизни больных и низкой вероятно-
стью трансформации в острый лейкоз.
В этой классификации отсутствует «рефрактерная анемия с избытком бластов в
стадии трансформации в острый лейкоз», т.к. этот вариант устанавливался при числе
бластных клеток в костном мозге или в крови 20-30%. В классификации ВОЗ случаи с
числом бластных клеток в костном мозге или в крови 20% и более расцениваются как
острый лейкоз. Исключения составляют:
1) острый миелоидный лейкоз с t(8;21)(q22;q22), в результате которой образуется
слитный ген AML1/ET0;
2) острый миелоидный лейкоз с inv(16)(p!3;q22) или t(16;16)(p!3;q22) с образова-
нием слитного гена CBF/3/MYH1 /;
3) острый промиелоцитарный лейкоз с t(l 5;17)(q22;ql 2) с образованием слитного
гена PML/RARa и другие варианты ОПЛ.
300 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Миелодиспластические синдромы
При выявлении у больных этих транслокаций и/или генов даже при числе бласт-
ных клеток в костном мозге менее 20% устанавливается диагноз острого миелоидно-
го лейкоза.
Кроме того, в этой классификации ХММЛ рассматривается в группе заболеваний,
обозначенных термином «миелодиспластические/миелопролиферативные болезни»,
поскольку они имеют черты как миелопролиферативных заболеваний (увеличение
количества лейкоцитов или тромбоцитов), так и миелодисплазий.
В 2008 г. классификация ВОЗ была модифицирована. Предложены следующие ва-
рианты МДС:
И рефрактерная цитопения с одноростковой дисплазией (рефрактерная анемия,
рефрактерная нейтропения и рефрактерная тромбоцитопения);
® рефрактерная анемия с кольцевыми сидеробластами;
Н рефрактерная цитопения с мультилинейной дисплазией;
И рефрактерная анемия с избытком бластов (рефрактерная анемия с избытком
бластов 1, рефрактерная анемия с избытком бластов 2)
в МДС с изолированной хромосомной аномалией del (5q);
® МДС неклассифицируемый;
детский вариант МДС (рефрактерная цитопения у детей).
К наиболее важным прогностическим факторам выживаемости и трансформации в
острый лейкоз относятся FAB-варианты МДС и прогностические группы, выделяемые
международной прогностической системой оценки (IPSS, 1997) (табл. 10.3). Каждый
прогностический признак оценивается в баллах. В соответствии с суммарным числом
баллов больных объединяют в четыре группы: низкого (0 баллов), промежуточного-1
(0,5-1 балл), промежуточного-2 (1,5—2 балла) и высокого (2,5 балла и более) риска.
Общая выживаемость и вероятность трансформации в острый лейкоз в разных про-
гностических группах представлены в табл. 10.4.
В связи с тем, что цитогенетическое исследование может быть недоступным или
неинформативным, предлагается использовать какую-либо из ранее предложенных
прогностических систем или крайне упрощенное разделение больных на две группы,
при котором учитывается только число бластных клеток в костном мозге и/или кро-
ви, с благоприятным (< 10% бластов) и неблагоприятным (> 10% бластов) прогнозом.
С 2007 г. обсуждается новая числовая прогностическая система, адаптированная к
ВОЗ-классификации МДС (WHO classification-based prognostic scoring system, WPSS).
Она учитывает вариант МДС по классификации ВОЗ, кариотип и необходимость про-
ведения гемотрансфузий. Несмотря на новые предложения, «золотым стандартом»
по-прежнему остается IPSS.
При оценке результатов терапии следует пользоваться стандартизованными крите-
риями Международной рабочей группы (IWG), которые были впервые предложены в
2000 г. и модифицированы в 2006 г. Полной ремиссией считается нормализация по-
казателей всех ростков кроветворения костного мозга с или без признаков дисплазии
(следует указывать) и при количестве бластных клеток менее 5%, отсутствии бласт-
ных клеток с или без признаков дисплазии в крови при сохранении гемоглобина бо-
лее НО г/л, нейтрофилов не менее 1,0 х 109/л, тромбоцитов не менее 100 х 109/л на
протяжении не менее 2 мес. без лечения, в т.ч. без применения ростовых факторов.
Частичная ремиссия констатируется при уменьшении количества бластных кле-
ток в костном мозге не менее чем на 50% от исходного, но сохранении их на уров-
не 5% и более. Все остальные признаки должны соответствовать полной ремиссии.
Клеточность костного мозга и его морфологические изменения не учитываются. Дли-
тельность частичной ремиссии должна составлять не менее 2 мес. Костномозговая
полная ремиссия устанавливается при количестве бластных клеток в костном мозге
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 301
Опухолевые заболевания кроветворной и лимфоидной ткани
менее 5% и может сопровождаться определенными улучшениями гемограммы (сле-
дует отмечать наличие или отсутствие гематологического улучшения).
Таблица 10.3. Оценка прогностических признаков миелодиспластических
синдромов по шкале IPSS (1997)
Признак Число баллов 1
Число бластных клеток в костном мозге
<5 0
5-10 0,5
11-20 1,5
21-30 2,0
Кариотип
Благоприятный (нормальный кариотип, 5q-, 20q-, -Y) 0
Неблагоприятный (> 3 аномалий и аномалии хромосомы 7) 1,0
Промежуточный (остальные аномалии) 0,5
Характер цитопении
0/1-ростковая 0
2/3-ростковая 0,5
Примечание. Цитопенией считается уровень гемоглобина менее 10 г/дл, нейтрофилов — менее 1,8 х 109/л, тром-
боцитов — менее 100 х 109/л. IPSS была разработана на основании анализа больных только с первичными МДС,
не получавших интенсивную XT (допускалось предшествующее лечение малыми дозами химиопрепаратов
для приема внутрь и ростовыми факторами). Из анализа были исключены случаи пролиферативного варианта
ХММЛ с числом лейкоцитов в крови более 12 х 109/л. Приемлемость градации IPSS для пациентов со вторичны-
ми МДС достаточно спорная. Большинство исследователей единодушно относят случаи МДС, развившиеся по-
сле предшествующей XT и/или лучевой терапии по поводу других заболеваний (например, МДС после химиолу-
чевого лечения РМЖ или других опухолей), к прогностически крайне неблагоприятной группе
Таблица 10.4. Прогностическое значение групп риска по шкале IPSS
Срок трансформации МДС в острый лейкоз у 25% больных, годы
Низкий 5,7 9,4
Промежуточный-1 3,5 3,3
Промежуточный-2 1,2 1,1
Высокий 0,4 0,2
Лечение
Лечение больных МДС до настоящего времени остается нерешенной проблемой.
Единственным методом лечения, позволяющим существенно увеличить продолжи-
тельность жизни больных МДС, считается аллогенная трансплантация гемопоэтиче-
ских стволовых клеток (ГСК). Длительная безрецидивная выживаемость у пациентов с
благоприятным прогнозом достигает 60-70 %, а с неблагоприятным — менее 50% (ча-
стота рецидивов 35-40%). Однако применение аллогенной трансплантации не всег-
да возможно в связи с пожилым возрастом большинства больных и отсутствием иден-
тичного родственного донора.
Стратегия лечения больных МДС определяется, прежде всего, принадлежностью
больного к той или иной прогностической группе. К группе благоприятного прогноза
относят случаи низкого и промежуточного-1 риска (по IPSS), к группе неблагоприят-
ного прогноза — промежуточного-2 и высокого риска.
302 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Миелодиспластические синдромы
При благоприятном прогнозе и минимальных проявлениях заболевания (цитопе-
ния, не требующая гемозаместительного лечения и не нарушающая качества жизни)
целесообразно ограничиться наблюдением за больным до тех пор, пока показатели
крови и костного мозга остаются стабильными. При цитопении, угрожающей ослож-
нениями, необходимости в гемотрансфузиях и при нестабильном течении МДС (уве-
личение выраженности цитопении или потребности в гемотрансфузиях) решается во-
прос о выборе терапии.
По показаниям осуществляется сопроводительная терапия. К сопроводительной те-
рапии при МДС относят гемотрансфузии эритроцитов и тромбоцитов, антимикроб-
ную терапию, в т.ч. в комбинации с Г-КСФ или ГМ-КСФ, использование комплексонов
железа, лечение осложнений специфической терапии. К сопроводительной терапии
зачастую относят применение ЭСП, в т.ч. в сочетании с Г-КСФ. Следует учитывать, что у
больных, которым требуется проведение трансфузий эритроцитов, имеется риск раз-
вития гемосидероза. В этих случаях рекомендуется лечение комплексонами желе-
за (хелаторами): препарат для парентерального введения (дефероксамин, Десферал)
или для приема внутрь (деферазирокс, Эксиджад). В Руководстве по терапии хелато-
рами при МДС (2008 г.) показаниями для использования препаратов этой группы яв-
ляются:
уровень ферритина сыворотки 1000 мкг/л и более;
частота гемотрансфузий, проводимых больному, — 2 и более дозы эритроцитов
в месяц на протяжении более одного года;
И невозможность проведения или отсутствие эффекта первичной лекарственной
терапии для коррекции анемии.
Рекомендуемая начальная суточная доза деферазирокса составляет 20 мг/кг в сутки.
Коррекция дозы проводится каждые 3-6 мес. Максимальная доза составляет 30 мг/кг
в день. Целевой уровень ферритина — менее 1000 мкг/л. Концентрацию ферритина
рекомендуется контролировать ежемесячно.
К ЭСП относятся эпоэтин (ЭПО) а//3 и дарбэпоэтин-а. До 2007 г. Национальная все-
общая онкологическая сеть США (NCCN) рекомендовала использовать ЭПО 150-
300 МЕ/кг/сут п/к в течение 2-3 мес. На настоящий момент в рекомендациях NCCN
фигурирует доза ЭПО 40 000-60 000 ME п/к 1-3 раза в неделю с оценкой ответа че-
рез 6-8 нед. Кроме того, имеются рекомендации по терапии дарбэпоэтином-а (Ара-
несп): 150-300 мкг/нед. п/к. При отсутствии улучшения показателей красной крови
через 2-3 мес. лечение ЭПО возможно дополнить Г-КСФ (обычно в дозе 1-2 мкг/кг
п/к в сутки, 1-3 раза в неделю. Наилучший эффект достигается у больных МДС с низ-
кой концентрацией эндогенного ЭПО (< 200 ЕД/л) при отсутствии потребности в гемо-
трансфузиях и отсутствии кольцевых сидеробластов. При исходном уровне эндоген-
ного ЭПО > 500 ЕД/л лечение ЭСП не показано.
Г-КСФ и ГМ-КСФ самостоятельного значения в лечении МДС не имеют, посколь-
ку повышение числа нейтрофилов после прекращения лечения обычно сохраняет-
ся не более нескольких недель, эта терапия не увеличивает продолжительности жиз-
ни больных и не предотвращает развития инфекций. Г-КСФ и ГМ-КСФ рекомендуется
применять совместно с антибиотиками и противогрибковыми препаратами при тера-
пии инфекционных осложнений.
В патогенезе МДС (по крайней мере, у некоторых больных) признается роль аутоим-
мунного механизма разрушения кроветворных клеток, в связи с чем применяют раз-
личные виды иммуносупрессивной терапии. В последние годы чаще всего использу-
ется циклоспорин А, при лечении которым описаны не только частичные, но и полные
ремиссии продолжительностью более года. Начальная суточная доза препарата со-
ставляет 5 мг/кг, которая делится на 2 приема с интервалом 12 ч, а в дальнейшем под-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 303
Опухолевые заболевания кроветворной и лимфоидной ткани
бор дозы осуществляется в зависимости от концентрации препарата в крови, которая
должна составлять 100-400 нг/мл. Окончательная оценка эффективности лечения
осуществляется не ранее 4 мес. терапии. При получении ремиссии или гематологиче-
ского улучшения лечение может проводиться длительно — 1-2 года. Наилучшие ре-
зультаты достигаются у молодых больных с гипоклеточным костным мозгом при числе
бластных клеток менее 5%, нормальном кариотипе, скоплениях лимфоидных клеток
в трепанобиоптате, наличии клона клеток, составляющих субстрат пароксизмальной
ночной гемоглобинурии, и у HLA-DR-15-позитивных больных.
В результате применения другого иммунодепрессивного препарата — антитимоци-
тарного иммуноглобулина 40 мг/кг/сут в течение 4 дней подряд отмечено гематологи-
ческое улучшение трех ростков кроветворения, преимущественно выражающееся в
прекращении необходимости в гемотрансфузиях.
На практике при МДС нередко применяют кортикостероидные гормоны, иногда в
высоких дозах и длительно. Следует подчеркнуть, что отмечаемый в некоторых слу-
чаях эффект увеличения количества эритроцитов и тромбоцитов оказывается вре-
менным, а применение препаратов этой группы может провоцировать инфекционные
осложнения.
Ряд препаратов обладает свойством ингибировать ангиогенез. Этот механизм дейст-
вия и иммуномодулирующий эффект рассматриваются в качестве основных у талидо-
мида. В среднем, по данным разных исследований, частота ликвидации зависимости от
гемотрансфузий при его использовании составляет 25%. Леналидомид (Ревлимид) —
производное талидомида — в 2005 г. был зарегистрирован FDA для лечения МДС, про-
текающих с анемией, которая требует проведения гемотрансфузий, и хромосомной
аномалией 5q- с или без дополнительных цитогенетических аномалий, особенно при
низком и промежуточном-1 риске по шкале 1PSS. У этой категории больных ликви-
дация трансфузионной зависимости отмечена в 67 % случаев, а в 44% — достижение
полной цитогенетической ремиссии. В настоящее время леналидомид зарегистриро-
ван в России, но только для лечения множественной миеломы.
При неудаче лечения ЭСП, циклоспорином А, леналидомидом или при уровне эндо-
генного ЭПО > 500 ЕД/л рекомендуется лечение децитабином (Дакоген) или азаци-
тидином (Вайдаза). Децитабин и азацитидин являются единственными препаратами,
одобренными FDA и зарегистрированными в России для терапии МДС. Децитабин
может назначаться при всех FAB-вариантах МДС. Рекомендуемая доза составляет
15 мг/м2 путем непрерывной 3-часовой в/в инфузии каждые 8 ч в течение 3 дней. Пе-
ред инфузией следует провести премедикацию противорвотными препаратами. Ци-
клы лечения повторяют каждые 6 нед. Для получения эффекта рекомендуется ми-
нимум 4-6 циклов терапии, но может потребоваться и более длительная терапия.
Введение децитабина можно продолжать настолько долго, насколько сохраняется
терапевтический эффект. Дозы или отсрочка очередного введения препарата опре-
деляются результатами общего клинического анализа крови, биохимических пока-
зателей, наличия инфекции. Наиболее частый побочный эффект — миелосупрессия.
Высокую эффективность (частота общего ответа 43-81 %) показала следующая схе-
ма лечения: 20 мг/м2 в/в 1-часовая инфузия 1 раз в сутки в течение 5 дней. Циклы лече-
ния повторяют каждые 28 дней.
В России азацитидин зарегистрирован для лечения больных МДС из высокой или
промежуточной-2 групп риска (по IPSS), однако группа NCCN рекомендует использо-
вать азацитидин или децитабин в качестве второй линии терапии при неудаче терапии
эритропоэз-стимулирующими препаратами у больных с низким и промежуточным-1
риском. Перед введением азацитидина рекомендуется назначать противорвотные
препараты. Рекомендуемая начальная доза азацитидина при проведении первого ци-
304 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Миелодиспластические синдромы
кла терапии для всех больных, независимо от значений исходных гематологических
показателей, составляет 75 мг/м2, которая вводится ежедневно в течение 7 дней с по-
следующим перерывом в 21 день (28-дневный терапевтический цикл). Препарат вво-
дится подкожно. Для получения эффекта рекомендуют провести не менее 6 циклов
лечения. Терапию продолжают до сохранения достигнутого эффекта или до прогрес-
сирования МДС. Во время лечения могут возникнуть осложнения, требующие сниже-
ния дозы или увеличения продолжительности перерывов между курсами. Наиболее
частыми осложнениями являются гематологическая токсичность и тошнота. Частота
общего ответа не терапию азацитидином и малыми дозами цитарабина составила 84
и 37%, а продолжительность ответа 20,9 и 7 мес. соответственно. Исследование эф-
фективности азацитидина и других видов лечения (объединенная группа: сопроводи-
тельная терапия, или малые дозы цитарабина, или стандартная терапия ОМЛ) также
показало преимущество азацитидина: медиана выживаемости в этих группах состави-
ла 24,5 и 15 мес., а 2-летняя выживаемость — 50,8 и 26,0% соответственно.
В настоящее время при МДС продолжают изучать комбинации гипометилирующих
препаратов (децитабин, азацитидин) и ингибиторов гистондеацетилазы (вальпроевая
кислота). Децитабин и азацитидин относятся к тем немногим препаратам, которые по-
зволяют увеличить выживаемость больных и уменьшить риск трансформации МДС в
острый лейкоз.
Применение индукторов дифференцировки ГСК (производные витамина D3, ре-
тиноиды, ИФН-а, интерлейкины) позволяет улучшить показатели крови лишь у не-
значительного числа больных и на короткое время. Схема ПЦД (пентоксифиллин,
ципрофлоксацин и дексаметазон), направленная на ингибирование апоптоза, не про-
демонстрировала высокого эффекта.
При неблагоприятном прогнозе прежде всего решается вопрос о проведении ал-
логенной трансплантации ГСК. В отсутствие трансплантации показана терапия децита-
бином или азацитидином, лечение по программам терапии острого миелоидного лей-
коза, а при невозможности этих видов терапии, в т.ч. из-за соматического состояния
больного, — малыми дозами цитостатических препаратов.
Лечение децитабином и азацитидином проводится аналогично схемам, использу-
емым при благоприятном прогнозе. В качестве альтернативы лечению децитабином
и азацитидином выступают программы терапии острого миелоидного лейкоза: схе-
мы «3+7», «3+7+этопозид», НАМ, FLAG. Может применяться комбинация топотекан
1,25 мг/м2/сут в виде длительной инфузии в течение 5 дней + цитозин-арабинозид 1 г/м2
2-часовая инфузия ежедневно в течение 5 дней. При интенсивных режимах XT удает-
ся получить от 34 до 79 % полных ремиссий, однако такая терапия сопровождается ча-
стым развитием инфекционных и геморрагических осложнений. Профилактика ней-
ролейкоза при МДС не проводится.
Для терапии цитостатическими препаратами в малых дозах используется цито-
зин-арабинозид по 10 мг/м2 п/к 2 раза в сутки с 12-часовым интервалом (или по
20 мг/м2 п/к 1 раз в день) на протяжении 14-28 дней, перерыв между курсами 14-
30 дней. Для получения ремиссии зачастую необходимо не менее 2-3 циклов тера-
пии. После получения ремиссии проводятся аналогичные курсы или 7-дневные в тех
же дозах длительно — 2-3 года. Менее распространенным препаратом при терапии
МДС является мелфалан, который назначают в дозе 2 мг внутрь ежедневно до дости-
жения полной ремиссии, развития неприемлемой токсичности или до прогрессиро-
вания.
Многие препараты проходят клинические испытания: инфликсимаб, этанерсепт, ти-
пифарниб, лонафарниб, триоксид мышьяка, бортезомиб, вориностат и др.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 305
Опухолевые заболевания кроветворной и лимфоидной ткани
10.3. Хронические лейкозы
Л4. А. Волкова
10.3.1. Хронический миелолейкоз
ХМЛ — распространенный вид лейкоза, на его долю приходится около 20% всех лей-
козов. В странах Европы и Северной Америки ХМЛ занимает 3-е место по частоте по-
сле острых лейкозов и ХЛЛ. Ежегодная заболеваемость составляет 1—1,5 случая на
100 000 населения.
ХМЛ возникает вследствие соматической мутации в ГСК, результатом которой явля-
ется образование t(9;22)(q34;ql 1) судлинением длинного плеча одной из хромосом 9
и укорочением одной из хромосом 22. Укороченная хромосома 22 называется фила-
дельфийской и обозначается как Ph-хромосома. В результате t(9;22)(q34;q11) образу-
ется слитный ген BCR/ABL, кодирующий выработку BCR-ABL-тирозинкиназы, в которой
в результате произошедших структурных изменений ABL-тирозинкиназа оказывается
постоянно активированной. Вследствие увеличения активности ABL-тирозинкиназы
ускоряется фосфорилирование тирозиновых остатков белков — основной механизм
передачи сигнала пролиферации и предотвращения апоптоза в клетке. Кроме того, на-
блюдается нарушение адгезии клеток миелоидного ряда к клеткам стромы, что ве-
дет к выходу в кровь клеток-предшественников и незрелых элементов миелоидного
ряда. В результате этого одновременно с нарушением апоптоза происходит увеличе-
ние массы опухолевых клеток и выживание клеток с добавочными мутациями — про-
цесс, который в конечном итоге приводит к эволюции заболевания в терминальную
стадию, т.е. развитию бластного криза.
Цитогенетический анализ обнаруживает Ph-хромосому t(9;22)(q34-,ql 1) у 95 % боль-
ных ХМЛ. В остальных случаях наличие слитного гена BCR-ABL можно выявить мето-
дами FISH или ПЦР в реальном времени. В настоящее время признано, что типичного
ХМЛ без химерного гена BCR-ABL не существует. Цитогенетическое подтверждение
диагноза ХМЛ считается обязательным.
В тех случаях, когда t(9;22)(q34;ql 1) не удается обнаружить, речь идет о других за-
болеваниях, похожих на ХМЛ по клиническим проявлениям (спленомегалия) и карти-
не крови (гиперлейкоцитоз, нейтрофилез). Чаще всего это ХММЛ, который относится
к МДС. Похож на ХМЛ по уровню лейкоцитоза и гепатоспленомегалии и так называе-
мый хронический нейтрофильный лейкоз — редкое заболевание (всего описано не
более 100 случаев), при котором в отличие от ХМЛ в крови даже при высоком лейко-
цитозе обычно имеется очень небольшое количество незрелых элементов миелоид-
ного ряда. Специфических хромосомных изменений при хроническом нейтрофиль-
ном лейкозе не отмечено.
В течении ХМЛ выделяюттри стадии: 1) хроническая, 2) продвинутая, или стадия аксе-
лерации, и 3) острая, или терминальная. Продолжительность этих стадий болезни у раз-
ных пациентов различна, болезнь может быть впервые диагностирована в любой из них.
Хроническая стадия характеризуется постепенно нарастающим лейкоцитозом —
15-20 х 109/л в начале заболевания, иногда до 500-900 х 109/л и более при развер-
нутой клинической картине. Одновременно в крови появляются незрелые гранулоци-
ты: миелоциты, метамиелоциты, иногда — промиелоциты и даже единичные бластные
клетки. Характерно увеличение количества базофилов до 5-10% и нередко одновре-
менно эозинофилов — эозинофильно-базофильная ассоциация. В большинстве слу-
чаев отмечается увеличение количества тромбоцитов. Костный мозг гиперклеточный
306 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
с большим количеством молодых гранулоцитов. Характерно резкое снижение актив-
ности ЩФ и содержания нейтрофилов в крови и костном мозге.
Вначале заболевание может протекать почти бессимптомно, через несколько ме-
сяцев при осмотре обнаруживается увеличение селезенки, которая без лечения по-
степенно достигает огромных размеров. В этих случаях в ней часто бывают инфаркты,
которые в момент возникновения сопровождаются сильной болью. При выраженной
спленомегалии может быть увеличена печень.
Основным признаком перехода заболевания в стадию акселерации служит измене-
ние картины крови, отражающее снижение чувствительности к терапии: склонность к
увеличению количества лейкоцитов при прежних дозах лечебных препаратов, нара-
стание числа незрелых гранулоцитов, у некоторых больных отмечается значительное
повышение процента базофилов.
Существуют международно принятые признаки стадии акселерации, причем доста-
точно наличия одного из них:
1) обнаружение помимо t(9;22) других хромосомных аберраций;
2) 15 % и более бластных клеток в крови;
3) 30% и более в сумме бластов и промиелоцитов в крови;
4) 20% и более базофилов в крови;
5) менее 100 х Ю9/л тромбоцитов в крови;
6) увеличение размера селезенки и количества лейкоцитов, нечувствительное
к проводимой терапии.
Терминальная стадия у 80-85% больных характеризуется развитием бластного кри-
за — появлением в крови и костном мозге 30-60-90% бластных клеток. Число лей-
коцитов при этом может и не повышаться по сравнению с предыдущей стадией. Как
правило, в этой стадии развивается не отмечавшаяся на предыдущих этапах болезни
анемия, зачастую одновременно и тромбоцитопения. У большинства больных в этой
стадии имеются жалобы: повышение температуры тела, ноющая боль в костях, озно-
бы, быстрое увеличение селезенки в размере. Наиболее часто диагностируется мие-
лобластный вариант бластного криза, реже — лимфобластный или бластный криз из
клеток-предшественников. У 10-15 % больных переход в терминальную стадию харак-
теризуется не бластным кризом, а появлением локальных экстрамедуллярных бласт-
ных инфильтратов в лимфоузлах, костях, коже (лейкемиды), легочной ткани или ЦНС с
картиной нейролейкоза.
В подавляющем числе наблюдений цитогенетический анализ в этой стадии помимо
Ph-хромосомы обнаруживает добавочные хромосомные аберрации, чаще всего три-
сомию хромосомы 8, invl7 или комплексные хромосомные аберрации. Продолжи-
тельность этой стадии болезни до недавнего времени даже при лечении, как правило,
не превышала 0,5 года.
Лечение
Лечение всех больных ХМЛ в хронической стадии должно проводиться ингибито-
рами BCR-ABL-тирозинкиназы. В настоящее время для терапии ХМЛ существуют три
препарата этой группы: иматиниба мезилат (Гливек), нилотиниб (Тасигна) и дазатиниб
(Спрайсел). Первые два выпускаются компанией «Новартис», дазатиниб — «Бристол-
Майерс-Сквибб». Все три препарата представляют собой малые молекулы, которые
встраиваются в ответственный за связывание аденозинтрифосфата (АТФ) участок ABL-
тирозинкиназы, называемый «тирозиновым карманом», в который обычно встраивает-
ся АТФ в процессе фосфорилирования. Это блокирует процесс фосфорилирования
и последовательно всю цепь событий, приводящих к пролиферации патологических
клеток.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 307
Опухолевые заболевания кроветворной и лимфоидной ткани
вЯ№ЯЙвЯЯйМДМайвйЙЙЙйавЯЯвйа®ЙЙЯЙВ^^ «Ч л 5- v i » .. л
Иматиниб появился первым из указанных препаратов, и в настоящее время счита-
ется, что терапия ранее не леченных больных или больных, получавших лечение дру-
гими препаратами (миелосан, гидроксимочевина), должна проводиться иматинибом.
Нилотиниб и дазатиниб в настоящее время используются как препараты второй линии,
они назначаются при неэффективности или непереносимости иматиниба. Нилотиниб
структурно похож на иматиниб, но прочно соединяется с АТФ-«карманом» BCR-ABL-
тирозинкиназы благодаря липофильным взаимодействиям и большему соответст-
вию формы молекулы карману связывания. При исследовании in vitro он в 20-25 раз
успешнее иматиниба блокирует рост Ph+ клеток. Дазатиниб структурно отличается от
иматиниба и нилотиниба. По сравнению с двумя первыми препаратами он блокиру-
ет активность BCR-ABL-тирозинкиназы не только в ее неактивной конформации, но и
в активной. При исследовании in vitro дазатиниб подавляет активность Ph+ клеток в
16 раз активнее нилотиниба и в 325 раз активнее иматиниба.
Результаты, достигаемые при использовании ингибиторов BCR-ABL-тирозинкиназы,
превосходят полученные ранее при лечении больных ХМЛ любыми другими препара-
тами. Для оценки полученных результатов были введены следующие критерии эф*
фективности терапии.
Полная гематологическая ремиссия — число лейкоцитов не превышает 10 х 109/л,
лейкоцитарная формула нормальная, число тромбоцитов не более 450 х 109/л,
симптомы болезни отсутствуют.
Частичная гематологическая ремиссия — число лейкоцитов не превышает
10 х 109/л, но в крови обнаруживаются незрелые гранулоциты, или остается
увеличенной селезенка, или имеется тромбоцитоз, но эти признаки по вели-
чине не должны составлять более 50% от исходных.
Полная цитогенетическая ремиссия — в крови и костном мозге цитогенетическими
методами, в т.ч. методом FISH, не удается обнаружить Ph+ клеток.
Частичная цитогенетическая ремиссия — удается обнаружить от 1 до 34% Ph+ кле-
ток.
Большой цитогенетический ответ — сумма полных и частичных цитогенетических
ремиссий.
Минимальный цитогенетический ответ — обнаруживается от 35 до 95% Ph+ кле-
ток.
Отсутствие цитогенетического ответа — все исследованные клетки крови и
костного мозга являются Ph-позитивными.
Большой молекулярный ответ — уменьшение числа Ph+ клеток при ПЦР-исследова-
нии по сравнению с исходным в 1000 раз (обнаружение не более 0,1 % от ис-
ходного их числа).
Отсутствие BCR-ABL-позитивных клеток при ПЦР-исследовании не расценивается
как полный молекулярный ответ, поскольку чувствительность методов молекулярного
исследования различна, употребляется термин «неопределяемый транскрипт».
При лечении иматинибом ранее не леченных больных в хронической стадии полная
гематологическая ремиссия достигается в 97 % случаев, большой цитогенетический
ответ через 6 мес. — в 60%, а через 12 — в 80 %, у 40% больных — полная цитогене-
тическая ремиссия. Через 1,5 года лечения большой цитогенетический ответ достига-
ется у 87% больных, полная цитогенетическая ремиссия — у 76%, молекулярные ре-
миссии — у 40%. Более 90% больных, лечение которых начато в хронической стадии
болезни, остаются в этой стадии без каких-либо признаков прогрессирования в тече-
ние 5 лет, у 85 % не отмечается гематологического или цитогенетического рецидива.
Даже среди больных, начавших лечение в фазе акселерации, у 40 % в течение 3 лет не
наблюдается признаков прогрессирования. Эти данные показывают, что при терапии
308 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
иматинибом большинство больных ХМЛ имеют шанс прожить многие годы, сохраняя
хорошее соматическое состояние и работоспособность.
В 2009 г. международная группа экспертов опубликовала рекомендации по оценке
эфективности лечения ХМЛ иматинибом (Recommendation of Leukemia Net).
Согласно этим рекомендациям эффект считается оптимальным, если:
В после 3 мес. лечения иматинибом достигнута полная гематологическая ремис-
сия и хотя бы малый цитогенетический ответ (обнаруживается не более 65 % Ph-
позитивных клеток);
S через 6 мес. достигнута частичная цитогенетическая ремиссия (не более 35 %
Ph-позитивных клеток) при сохранении полной гематологической ремиссии;
Н через 12 мес. имеется полная цитогенетическая ремиссия (не обнаруживается
Ph-позитивных клеток);
® через 18 мес. имеется большой молекулярный ответ (отношение BCR-ABL/ABL
< 0,1 %).
Показано, что сохранение хронической стадии болезни и выживаемость больных
достоверно выше при достижении всех указанных признаков в указанное время. При
неполучении любого указанного результата и подтверждении этого повторным иссле-
дованием больного рекомендуется перевести на лечение ингибиторами тирозинки-
наз второго поколения — нилотинибом или дазатинибом. При неполучении указанных
результатов при лечении ингибиторами тирозинкиназ второго поколения рекоменду-
ется трансплантация костного мозга от родственного или неродственного донора.
Среди пациентов, лечение которых иматинибом впервые начато во время бластного
криза, без признаков прогрессирования в течение 3 лет остается не более 10 %, но при
использовании всех ранее применявшихся препаратов и схем терапии после развития
бластного криза продолжительность жизни больных очень редко превышает 6 мес.
Иматиниб (Гливек) выпускается в капсулах 100 мг и назначается в хронической ста-
дии по 400 мг/сут (вся доза однократно), при неэффективности дозу увеличивают до
600 мг/сут. В стадии акселерации и при бластном кризе назначают 600 мг/сут, также
однократно, в ряде исследований в этих стадиях применяется доза 800 мг/сут, разде-
ленная на 2 приема. Препарат может приниматься до и после приема пищи, доза не за-
висит от возраста и массы тела пациента.
Терапия иматинибом может быть начата при любом уровне лейкоцитов, превышаю-
щем норму. Если количество лейкоцитов более 20 х 109/л, рекомендуется одновре-
менно назначить аллопуринол до нормализации уровня лейкоцитов, хотя СПО при те-
рапии иматинибом очень редок.
Число лейкоцитов начинает снижаться через 1-2 нед. и нормализуется к 4-6 нед. ле-
чения. Уменьшение повышенного количества тромбоцитов обычно отстает на 1-2 нед.
При лечении больных в хронической стадии ХМЛ при снижении числа гранулоцитов
менее 1 х 109/л и/или тромбоцитов менее 50 х 109/л рекомендуется сделать перерыв
влечении и возобновить его при увеличении количества гранулоцитов до 1,5 х 109/л и
тромбоцитов до 100 х 109/л.
У больных в стадии акселерации и при бластном кризе лечение должно начинаться
и продолжаться и при более низких показателях крови с одновременным проведени-
ем заместительной терапии.
Снижение дозы до 300 мг/сут может быть показано только больным с постоянной
склонностью к развитию нейтропении и тромбоцитопении с периодом восстановле-
ния показателей более 3-4 нед. Снижение дозы менее 300 мг/сут не рекомендуется,
т.к. эта доза ниже терапевтической, лучше сделать короткий перерыв в лечении. При
необходимости повторных перерывов констатируется непереносимость иматиниба и
рекомендуется переход на терапию нилотинибом или дазатинибом.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 309
Опухолевые заболевания кроветворной и лимфоидной ткани
При лечении иматинибом может наблюдаться ряд побочных явлений. Более чем у
50 % больных появляются отеки, наиболее часто периорбитальные и отеки нижних ко-
нечностей, а у 1-2% — генерализованные с признаками отека легких либо плевраль-
ного или перикардиального выпота. Учитывая это, при отмечаемой больным быстрой
прибавке массы тела или наличии видимых отеков необходимо тщательное исследо-
вание и назначение диуретиков, а при значительных отеках — временная отмена пре-
парата.
Метаболизм иматиниба происходит в печени с участием ферментов CYP3A4/5 си-
стемы цитохрома Р450. При одновременном приеме иматиниба и препаратов, стиму-
лирующих или ингибирующих указанные ферменты, может изменяться концентрация
иматиниба в плазме. При назначении иматиниба следует рекомендовать больному из-
бегать приема других препаратов, а при необходимости их применения — свериться с
имеющимися конкретными данными об их возможном влиянии на активность указан-
ных ферментов. В частности, не рекомендуется сочетать прием иматиниба и параце-
тамола.
Снижение концентрации иматиниба в плазме в результате стимуляции указанных
печеночных ферментов происходит при приеме кортикостероидов, пирамидона, ри-
фампицина, фенобарбитала. Ингибируют указанные печеночные ферменты и тем са-
мым могут вызвать повышение концентрации иматиниба в плазме итраконазол и кето-
коназол, циклоспорины, эритромицин, ранитидин, верапамил.
У ряда больных при приеме препарата натощак может наблюдаться нерезко выра-
женная тошнота. В таких случаях рекомендуется принимать препарат вместе с пищей,
а если тошнота сохраняется и после этого — разделить дневную дозу препарата на
2 приема.
Иногда при приеме иматиниба появляются судороги в кистях рук, стопах, голенях
или бедрах. Причина этого явления неизвестна, т.к. уровень кальция и магния в сыво-
ротке при этом обычно не изменяется. Тем не менее применение препаратов кальция
и магния, как правило, приводит к исчезновению этого симптома. У 20-40% больных в
первый месяц приема иматиниба отмечается боль в костях или суставах. Причина это-
го явления также неизвестна. При резко выраженной боли можно прибегнуть к назна-
чению нестероидных противовоспалительных средств. В большинстве случаев через
1-2 мес. эти явления самостоятельно проходят.
Изредка при приеме иматиниба появляется кожная сыпь, нерезко выраженная и
снимаемая антигистаминными препаратами. У больных с высоким содержанием ба-
зофилов в крови иногда развиваются уртикарные высыпания, вызванные высвобожде-
нием гистамина из разрушающихся базофилов. Очень редко появляются дескваматив-
ные изменения кожи, которые требуют немедленной отмены препарата.
У некоторых больных отмечается диарея, обычно нерезко выраженная и снимаемая
препаратами, которые уменьшают моторику кишечника.
Повышение уровня билирубина и активности аминотрансфераз наблюдается редко,
однако в течение первого месяца терапии следует проводить биохимический анализ
крови каждые 2 нед., а в последующем при нормальных показателях — каждый месяц.
Отмена препарата необходима при 4-5-кратном повышении показателей. Лишь ме-
нее чему 1 % больных приходится отменять препарат из-за гепатотоксичности.
Несмотря на высокую эффективность иматиниба, у небольшой части больных с са-
мого начала не удается получить полного цитогенетического или большого молеку-
лярного ответа, у других он утрачивается на протяжении заболевания. Самая частая
причина резистентности к иматинибу — появление мутаций в разных участках гена
BCR-ABL, кодирующих различные структуры BCR-ABL-тирозинкиназы. Существовав-
шие до начала лечения или появившиеся в процессе терапии мутации ответственны за
310 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хроническиелейкозы
резистентность к терапии в 90% случаев. В результате мутации происходит замена, как
правило, одной из аминокислот в молекуле BCR-ABL-тирозинкиназы, что ведет к изме-
нению ее пространственной конфигурации таким образом, что становится невозмож-
ной связь лекарственного средства с «тирозиновым карманом» и блокирование захвата
АТФ BCR-ABL-тирозинкиназой. Для правильной оценки эффективности терапии с нача-
ла лечения иматинибом рекомендуется цитогенетическое исследование каждые 6 мес.
После достижения полной цитогенетической ремиссии рекомендуется на протя-
жении всего заболевания каждые 3 мес. делать исследование на наличие BCR-ABL-
транскрипта с помощью ПЦР в реальном времени. Если констатировано появление
транскрипта или его увеличение на 0,5—1 log, необходимо повысить дозу иматиниба
до 600-800 мг, а при плохой переносимости этой дозы или отсутствии эффекта при
увеличенной дозе в течение 3 мес. — перевести больного на лечение нилотинибом
или дазатинибом.
При обнаружении мутаций BCR-ABL-тирозинкиназы показано назначение больному
ингибиторов II поколения (нилотиниб или дазатиниб).
Нилотиниб выпускается под торговым названием Тасигна, в капсулах 200 мг. Назна-
чают по 400 мг 2 раза в сутки, желательно с интервалом 12 ч. Не должен применять-
ся одновременно с пищей, принимается не позднее чем за 1 ч до или через 2 ч после
приема пищи.
Более 70 % больных, резистентных к иматинибу или не переносивших его, при пере-
ходе на нилотиниб ответили достижением полной гематологической ремиссии, у 48%
получен большой цитогенетический ответ, а у 31 % — полный. По данным Kantarjian
(ASH 2009 абстракт 1129), ПГО - в 85 %, БЦО - в 59 %, ПЦО - в 44 %. У ранее не ле-
ченных больных после 6 мес. терапии полная гематологическая ремиссия достигнута
в 100% случаев, большой цитогенетический ответ после 9 мес. — в 45%. Полный ци-
тогенетический ответ к 12 мес. — в 80%.
При лечении нилотинибом помимо тех же побочных явлений, что и при терапии
иматинибом, у некоторых больных отмечается удлинение интервала Q-T на ЭКГ, сви-
детельствующее об ухудшении проводимости электрического сигнала в сердечной
мышце, которое встречается при различных повреждениях миокарда — инфарктах,
миокардитах, перикардитах.
Дазатиниб выпускается под торговым названием Спрайсел в таблетках, покрытых
пленочной оболочкой. Каждая таблетка содержит 20, 50 или 70 мг препарата. Пре-
парат принимают внутрь независимо от приема пищи. В хронической стадии ХМЛ да-
затиниб применяют в дозе 100 мг 1 раз в сутки, в стадии акселерации и при бластном
кризе — по 70 мг 2 раза в сутки.
Проведенные исследования показали, что у 87 % больных в хронической стадии
ХМЛ, не ответивших достижением полной гематологической ремиссии, и у 56% не
имевших большого цитогенетического ответа при лечении иматинибом они получены
при переводе на дазатиниб. Даже в стадии акселерации у 45 % пациентов, а при бласт-
ном кризе в 30% случаев, резистентных к иматинибу, получена полная гематологиче-
ская ремиссия.
Дазатиниб обладает наибольшей из всех ингибиторов BCR-ABL-тирозинкиназы ак-
тивностью в подавлении пролиферации клеток с ее мутациями. Он подавляет проли-
ферацию клеток со всеми мутациями, кроме одной — Т3151. Ни один из современных
ингибиторов BCR-ABL-тирозинкиназы не подавляет пролиферацию клеток с этой мута-
цией. Больным, у которых обнаружена эта мутация, следует рекомендовать трансплан-
тацию стволовых кроветворных клеток от родственного или неродственного донора.
Наиболее частыми побочными явлениями при терапии дазатинибом III—IV степени
тяжести являются гематологические, которые встречаются с различной частотой у па-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 311
Опухолевые заболевания кроветворной и лимфоидной ткани
циентов, находящихся в разных стадиях болезни: лейкопения отмечалась у 27 % боль-
ных в хронической стадии болезни и у 58% в стадии акселерации, анемия — у 18 и
70%, тромбоцитопения — у 48 и 75% соответственно. ФН наблюдалась в 4% случа-
ев, пневмонии - в 3%, сепсис — в 1 % случаев. Иногда тромбоцитопения становит-
ся причиной десневых, маточных, гастроинтестинальных кровотечений и кровоизли-
яний в головной мозг. Тяжелые желудочно-кишечные кровотечения, потребовавшие
прекращения приема препарата и проведения гемотрансфузий, отмечены у 4% боль-
ных. Кровоизлияния наблюдались менее чем в 1 % случаев. У ряда пациентов наблюда-
лись стоматиты, гастриты, колиты,у 73 больных — диарея, менее чему 1 % — тошнота
и рвота. Изредка (менее чем в 1 % случаев III—IV степени тяжести) отмечаются артрал-
гия и миалгия, высыпания на коже. У некоторых больных, главным образом у прини-
мавших антиаритмические препараты, зафиксировано удлинение интервала Q-T на
ЭКГ. Одним из наиболее серьезных побочных проявлений дазатиниба считается за-
держка жидкости, которая отмечается почти у 50% больных. При этому 73 пациентов
наблюдаются периферические отеки, обычно нерезко выраженные, но у !7% паци-
ентов отмечено развитие плевритов,у 4% — тяжелых, потребовавшихторакоцентеза.
В 1 % случаев развился выпот в полость перикарда, иногда одновременно с плевритом.
В тех случаях, когда была проведена эвакуация жидкости, ее анализ показал нали-
чие экссудата с большим количеством лимфоцитов. Временная отмена или снижение
дозы дазатиниба, назначение преднизолона 40 мг/сут на 4-5 дней и петлевых диуре-
тиков приводят к исчезновению выпота в большинстве случаев в течение 72 ч, однако
некоторым больным требуется торакоцентез, иногда неоднократный.
В стадии акселерации и, особенно, при бластном кризе можно использовать сочета-
ние иматиниба (Гливек) 600 мг/сут и цитозина-арабинозида по 100 мг/м2 2 раза в сутки.
При неэффективности ингибиторов BCR-ABL-тирозинкиназы, что при правильном
диагнозе практически не встречается, рекомендуется лечение гидроксимочевиной
(Hydrea, Литалир) 40-50 мг/кг в сутки в 2 приема до получения эффекта.
Ни один из современных препаратов не приводит к излечению ХМЛ. Стволовые Ph+
клетки оказываются мало или вовсе нечувствительными к действию современных ин-
гибиторов BCR-ABL-тирозинкиназы, поэтому лечение ими следует проводить посто-
янно, прекращение терапии даже у больных с полной цитогенетической ремиссией и
большим молекулярным ответом через некоторое время приводит к рецидиву. Учиты-
вая это, молодым пациентам при наличии совместимого родственного донора должна
быть предложена альтернатива: лечение ингибиторами BCR-ABL-тирозинкиназы или
трансплантация стволовых кроветворных клеток.
В настоящее время ведутся исследования, а в некоторых случаях уже клинические
испытания блокаторов BCR-ABL-тирозинкиназы следующего поколения, способных
подавлять пролиферацию клеток с мутацией T315I и стволовых Ph+ клеток.
10.3.2. Большие эозинофилии
В последние годы установлено, что в большинстве случаев так называемых больших
эозинофилий имеются хромосомные аберрации, в результате которых происходит
образование слитных генов с активированными тирозинкиназными доменами.
В классификации ВОЗ 2008 г. группа заболеваний, ранее относимых к гиперэози-
нофильным синдромам, обозначается как «миелоидные и лимфоидные неоплазмы с
эозинофилией и аберрациями PDGFRA, PDGFRB или FGFR1». Гены PDGFRA и PDGFRB
кодируют соответственно а- и /3-рецепторы тромбоцитарного фактора роста, ген
312 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
FGFR / — рецептор фактора роста фибробластов. Помимо указанных в классификации
обнаружены многочисленные другие хромосомные аберрации, при которых возни-
кает гиперэозинофилия. Все они обозначаются как миелоидные неоплазмы с гипер-
эозинофилией.
При исследовании крови обнаруживается лейкоцитоз, в большинстве случаев от
10 х Ю9/л до 30 х Ю9/л, лишь у отдельных больных достигающий 50-100 х Ю9/л. Эо-
зинофилы составляют от 30 до 70-80% форменных элементов крови. Большинство
эозинофилов имеет морфологию нормальных зрелых клеток, иногда обнаруживают-
ся отдельные эозинофильные миелоциты и метамиелоциты. Костный мозг гиперкле-
точный, от 25 до 75% элементов гемопоэза составляют эозинофилы разной степени
зрелости.
Наиболее часто поражается сердце. Пристеночный эндокардит захватывает стен-
ки и клапаны сердца, постепенно развивается фиброз с кардиомегалией и застойной
сердечной недостаточностью, которая является исходом заболевания у 50-75 % боль-
ных. Поражение клапанов сердца с формированием их недостаточности приводит к
регургитации крови и образованию тромбов, которые иногда становятся причиной
эмболии мозговых сосудов. В 50-60% случаев развиваются поражения легких с каш-
лем и астмоидными хрипами. Более чему 70% пациентов поражается кожа в виде ур-
тикарной сыпи или инфильтратов. Иногда развиваются инфильтраты в желудке или ки-
шечнике, печени, реже — в почках и на склерах.
В настоящее время для лечения гиперэозинофильного синдрома применяется има-
тиниб.
Блокирование фосфорилирования тирозина при гиперэозинофильном синдро-
ме происходит с помощью меньших доз иматиниба, чем блокирование BCR/ABL-
тирозинкиназы при ХМЛ. Нормализация картины крови начинается в первые дни и до-
стигается при ежедневном приеме 100 мг препарата в течение 3-4 нед., но при отмене
препарата наступают рецидивы. При развитии резистентности к иматинибу преодо-
леть ее не удается путем увеличения дозы препарата, поскольку это, как правило, свя-
зано с появлением мутаций участвующих в транслокациях химерных генов. Культура
мутировавших клеток оказалась более чем в 1000 раз резистентнее к иматинибу, чем
исходная клеточная линия у больного. Пока нет данных об эффективности при гипер-
эозинофильном синдроме ингибиторов тирозинкиназ II поколения (нилотиниб, даза-
тиниб).
При первичной или развившейся при рецидиве резистентности к иматинибу пока-
зана трансплантация стволовых кроветворных клеток от родственного или неродст-
венного донора.
10.3.3. Истинная полицитемия
Истинная полицитемия (ИП; син.: эритремия, болезнь Вакеза, истинная красная по-
лицитемия) — клоновое неопластическое миелопролиферативное заболевание, ха-
рактеризующееся преимущественной пролиферацией эритропоэтического ростка
кроветворения с увеличенным образованием эритроцитов и независимостью эри-
тропоэза от нормальных механизмов его регуляции. Одновременно почти всегда,
хотя и в меньшей степени оказывается увеличенной продукция лейкоцитов и тром-
боцитов.
Заболеваемость ИП имеет значительные различия в разных регионах мира и состав-
ляет в Европе и Северной Америке 0,8-1 случая на 100 000 населения в год, вЯпо-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 313
Опухолевые заболевания кроветворной и лимфоидной ткани
нии — 0,2, в Австралии — 1,3. Средний возраст заболевших 60 лет, но есть случаи
заболевания в молодом и детском возрасте. Мужчины заболевают несколько чаще
женщин.
В настоящее время считается доказанным, что в патогенезе заболевания играет роль
мутация генаJcik2 тирозинкиназы — замена валина на фенилаланин в 617-м положении
полипептидной цепи ее молекулы. ]ак-киназы участвуют в передаче в клетке сигналов
пролиферации, поступающих от ростовых факторов и интерферонов. ]акЗ-киназа иг-
рает роль в созревании и дифференцировке лимфоидных клеток, Jak2 — миелоид-
ных. Мутация Jak2V617F приводит к резкому увеличению чувствительности несущих
ее клеток к эритро- и тромбопоэтинам. Эта мутация обнаруживается более чему 90 %
больных ИП.
Открытие мутации Jak2V617F и установление ее роли в развитии ИП привели к из-
менению диагностических критериев заболевания. В настоящее время предлагают-
ся следующие критерии диагноза ИП, которые представлены в классификации ВОЗ
(2008).
Большие критерии:
1. Гемоглобин более 18,5 г/дл для мужчин и 16,5 г/дл для женщин.
2. Наличие мутации Jak2V617F или похожих мутаций, например мутация Jak2 экзо-
на 12.
Малые критерии:
1. Обнаружение при биопсии костного мозга трехростковой гиперплазии — уве-
личение пролиферации элементов эритроидного, гранулоцитарного и мегака-
риоцитарного ростков миелопоэза.
2. Уровень ЭПО сыворотки ниже нормального.
3. Образование эритроидных колоний в культуре при посеве костномозговых кле-
ток больного без добавления эритропоэтина.
Для диагноза ИП необходимо наличие обоих больших и одного малого критерия
или первого большого и двух малых.
Обнаружение мутации Jak2V617F — самый главный дифференциальный признак,
позволяющий отличить ИП от вторичных эритроцитозов. Надежным методом диффе-
ренциального диагноза служит также исследование уровня ЭПО. Для ИП характерно
низкое содержание ЭПО в сыворотке крови с отсутствием колебаний его уровня при
кровопусканиях. Для гипоксических эритроцитозов (при хронических заболеваниях
легких, длительном курении с образованием карбоксигемоглобина в крови, ожире-
нии) характерно увеличенное содержание ЭПО с дальнейшим его увеличением после
кровопускания.
Клинические симптомы ИП в наибольшей степени связаны с увеличением массы
циркулирующих эритроцитов (плетора), в меньшей, по крайней мере в начале заболе-
вания, — с увеличенной пролиферацией гранулоцитов и тромбоцитов. Нередко воз-
никают преходящие нарушения церебрального кровообращения, но высока также
частота тромбозов и кровоизлияний. Примерно у 25% больных первыми проявлени-
ями заболевания служат венозные тромбозы, инфаркт миокарда или церебральные
нарушения. Характерные для ИП микроциркуляторные осложнения чаще всего про-
являются клинической картиной эритромелалгии — приступами резкой жгучей боли
в кончиках пальцев рук или ног с их покраснением или посинением и отеком. Упорная
эритромелалгия часто является предвестником тромбоза крупного сосуда.
Замедленное кровообращение при одновременном увеличении в крови количест-
ва гистамина и серотонина, обусловленное повышенным содержанием тромбоцитов,
314 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
iu*
служит причиной развития язв желудка и двенадцатиперстной кишки — нередкого
осложнения при ИП. В связи с повышенным числом лейкоцитов и их постоянным раз-
рушением часто отмечается нарушение обмена мочевой кислоты с картиной нефро-
литиаза или подагры.
Развернутая эритремическая стадия болезни без лечения может закончиться
смертью в течение нескольких месяцев от кровоизлияния в головной мозг или инфар-
кта миокарда, но при правильном современном лечении может продолжаться 10-
20 лет и более.
Быстрое увеличение селезенки, нарастающий лейкоцитоз с выраженным сдвигом
формулы влево, развитие анемии и тромбоцитопении, как и упорной лейкопении, на-
растание признаков дисплазии в любом из ростков кроветворения часто предшеству-
ют одному из возможных исходов эритремии — развитию острого лейкоза.
Частота развития острого лейкоза при ИП составляет 1,5—3% у больных, леченных
кровопусканиями, возрастает до 10% среди получавших лечение радиоактивным
фосфором и до 13,5 % у леченных хлорамбуцилом.
Лечение
Лечение эритремии зависит от стадии, клинико-гематологических проявлений бо-
лезни и возраста больного. При преобладании жалоб и симптомов, обусловленных
плеторой, при гематокрите выше 55% и содержании гемоглобина более 180 г/л, осо-
бенно при незначительном увеличении количества лейкоцитов и тромбоцитов, пока-
заны кровопускания. Их делают 2-3 раза в неделю, каждый раз удаляя 500 мл крови.
Для профилактики тромботических осложнений накануне, в течение всего време-
ни кровопусканий и 2 нед. после их окончания назначается дезагрегантная терапия:
аспирин 0,2-0,3 г/сут или курантил 150-200 мг/сут. Непосредственно перед крово-
пусканием вводится 400 мг реополиглюкина, а в момент начала кровопускания — в/в
5000 ЕД гепарина. Больным старше 65-70 лет и лицам, страдающим сердечно-сосу-
дистыми заболеваниями, рекомендуется удалять 350 мл крови не чаще 1 раза в не-
делю в связи с опасностью тромботических осложнений. Кровопускания могут быть
заменены эритроцитаферезом. Однократно удаляется 1000-1500 мл эритроконцен-
трата, плазма при этом возвращается, а удаленный объем эритроцитов замещается
физиологическим раствором. Обычно бывает достаточно 2-3 процедур с интервалом
5-7 дней. Эритроцитаферез хорошо переносится, а нормализация показателей кра-
сной крови сохраняется обычно не менее года.
Задача кровопусканий и эритроцитафереза заключается в снижении уровня гемо-
глобина до 140-150 г/л и гематокрита до 45%, поскольку при этих показателях нор-
мализуется вязкость крови. Необходимость достижения этих показателей определяет
длительность эксфузионной терапии.
Следует иметь в виду, что возникающий в результате эксфузионной терапии дефицит
железа хорошо переносится и не требует терапии препаратами железа, поскольку их
прием уменьшает продолжительность достигнутого эффекта.
Алкилирующие препараты — миелосан, имифос, циклофосфамид, хлорамбуцил —
в настоящее время в терапии ИП практически не применяются в связи с их выражен-
ным лейкозогенным эффектом при этом заболевании.
Препаратом выбора в терапии ИП служит ИФН-а, назначается по 3 ME ежед-
невно или через день. При хорошей переносимости лечение проводится дли-
тельно, месяцами и годами. Перерывы делают при снижении числа лейкоцитов
до 1 х 109/л и/или тромбоцитов до 50 х 109/л, лечение возобновляется при вос-
становлении показателей. У большинства больных, отвечающих на лечение, полная
ремиссия достигается к концу первого года терапии, после чего лечение продол-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 315
Опухолевые заболевания кроветворной и лимфоидной ткани
жают в поддерживающих дозах — 2-3 ME 3 раза в неделю. При такой терапии у
большинства больных можно получить не только клинический и гематологиче-
ский, но и молекулярный эффект — уменьшение количества или даже исчезнове-
ние клеток с Jak2V617F, чего не удается добиться при терапии цитостатическими
химиопрепаратами. Кроме основного лечебного эффекта терапия ИФН-а помо-
гает ликвидировать кожный зуд, который невозможно устранить другими сред-
ствами. Уменьшение зуда наступает очень часто, но лишь при длительной терапии
ИФН-а.
При плохой переносимости ИФН-а, недостаточном эффекте и больным стар-
ше 70 лет, у которых нередко при таком лечении развиваются психические рас-
стройства, рекомендуется терапия гидроксимочевиной (Hydrea). Для индукции
ремиссии препарат назначают в дозе 30 мг/кг в сутки. По мере снижения числа
эритроцитов и уровня гемоглобина дозу уменьшают до 15 мг/кг/сут. Одновремен-
но с показателями красной крови обычно уменьшается и количество лейкоци-
тов и тромбоцитов. При нормализации показателей назначается поддерживаю-
щая доза — 500-1000 мг (1-2 капсулы) в сутки. У молодых пациентов применение
гидроксимочевины не рекомендуется в связи с ее лейкозогенным эффектом, ко-
торый реализуется спустя длительное время. Среди больных, леченных только
гидроксимочевиной и прослеженных в течение менее 5 лет, частота развития
острого лейкоза составляет 1-3 %, среди прослеженных 5-10 лет — 6%, при дли-
тельности наблюдения более 10 лет ОНЛЛ отмечаются у 10-12% больных и до-
стигают частоты 15 % к 15-16 годам наблюдения.
Интерферон и гидроксимочевина могут применяться одновременно, особенно при
спленомегалии.
Для уменьшения количества тромбоцитов может применяться анагрелид (Агри-
! лин) — избирательный ингибитор тромбоцитопоэза. Препарат назначают по 0,5-3 мг
• в сутки. Доза может быть разделена на 2 приема. Снижение числа тромбоцитов до
нормального уровня наступает в течение 2-4 нед. терапии. Побочные эффекты при
лечении анагрелидом (головная боль, чувство пульсации в голове, тахикардия, диа-
рея) обычно постепенно смягчаются и прекращаются через 2-4 нед. Лечение сле-
дует проводить постоянно, т.к. при его прекращении начинается быстрое нарастание
тромбоцитов.
Для профилактики сосудистых осложнений больным ИП рекомендуется постоян-
ный прием небольших доз аспирина (80-100 мг/сут). При резко выраженной эритро-
мелалгии однократный прием 500 мг аспирина нередко уменьшает боль, а затем пол-
ностью ее устраняет в течение 2-3 дней.
Для профилактики подагры и образования уратовых камней в почках, отложения
уратов в ушных раковинах рекомендуется постоянный профилактический прием ал-
лопуринола 100-300 мг/сут. Дозу увеличивают до 400-600 мг/сут при проведении
цитостатической терапии.
При развитии анемии в поздней стадии заболевания показано сочетанное лечение
ИФН -а вуказанных выше дозах и ЭПО 5000 ME в сутки или через день либо 30 000 ME
1 раз в неделю. В случаях развития анемии или тромбоцитопении, обусловленной ги-
перспленизмом, показана спленэктомия.
Молодым пациентам, имеющим HLA-совместимого сиблинга, должна быть реко-
мендована аллогенная трансплантация ГСК.
316 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
10.3.4. Эссенциальная тромбоцитемия
Эссенциальная тромбоцитемия (ЭТ; син.: первичный тромбоцитоз, идиопатический
тромбоцитоз, геморрагическая тромбоцитемия) — хроническое миелопролифера-
тивное заболевание, характеризующееся постоянной повышенной пролиферацией
мегакариоцитов, в результате которой стабильно увеличивается количество тромбо-
цитов.
В классификации ВОЗ 2008 г. предлагается ввести следующие критерии диагноза.
1. Стабильно увеличенное количество тромбоцитов, превышающее 450 х 109/л.
2. Наличие в костном мозге признаков повышенной пролиферации больших зре-
лых мегакариоцитов без одновременного увеличения гранулоцитарной и эри-
троидной пролиферации.
3. Отсутствие других миелопролиферативных заболеваний.
4. Наличие мутации Jak2V617F или отсутствие причин для вторичного тромбоцито-
за.
Для установления диагноза ЭТ необходимо наличие всех четырех признаков.
Истинная частота ЭТ неизвестна. Считается, что она встречается не более чем в 1-2
случаях на 100 000 населения в год.
Длительность заболевания, как правило, составляет 10-15 лет. Основные причины
смерти следующие: кровоизлияния в головной мозг, тромбоз церебральных сосудов,
инфаркт миокарда, тромбоэмболия легочной артерии, источником которой являют-
ся тромбы крупных вен конечностей. Развитие МДС и острых лейкозов нехарактерно.
Лечение
В последние годы препаратом выбора в терапии ЭТ стал анагрелид — препарат из
группы хининов, который избирательно ингибирует пролиферацию и дифференци-
ровку мегакариоцитов. Особенно рекомендуется молодым пациентам, поскольку
не дает лейкозогенного эффекта. Лечение начинают с дозы 2 мг/сут, разделенной на
4 приема, постепенно увеличивая ее по 0,5 мг/сут каждые 7 дней до той дозы, кото-
рая позволяет получить желаемый эффект, но не более 10 мг/сут. У большинства бол fa-
ных снижение числа тромбоцитов до 400 х 109/л достигается в течение 2-4 нед., но
известны случаи гораздо более медленного эффекта — лишь после нескольких ме-
сяцев приема препарата. Анагрелид считается наиболее эффективным терапевтиче-
ским средством при ЭТ, позволяющим снизить число тромбоцитов до 400 х 109/л у
60-90% больных независимо от возраста, пола, размера селезенки, выраженности
клинических симптомов и предшествующего лечения. Почти 70% больных, получав-
ших ранее без достаточного эффекта гидроксимочевину, оказываются чувствительны-
ми к анагрелиду.
При нормализации количества тромбоцитов дозу 1 мг 4 раза в сутки принимают
постоянно (годами). При лечении анагрелидом не уменьшается количество мегакари-
оцитов в костном мозге, но снижается продукция тромбоцитов за счет блокирования
в мегакариоцитах фосфодиэстеразы.
При применении анагрелида часты побочные эффекты: головная боль, задержка
жидкости, сердцебиение, диарея. Обычно они прекращаются через 2-4 нед. и в даль-
нейшем не возвращаются. Некоторые больные из-за сильной головной боли не могут
принимать препарат в лечебных дозах. В этих случаях рекомендуется снизить дозу до
переносимой, а затем медленно ее увеличивать до терапевтической.
Кроме анагрелида в лечении ЭТ широко применяется ИФН-а 3 МЕ/сут и гидрокси-
мочевина 30 мг/кг/сут. Дозу гидроксимочевины снижают после достижения нормаль-
ного уровня тромбоцитов, в дальнейшем препарат применяется в поддерживающей
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 317
Опухолевые заболевания кроветворной и лимфоидной ткани
дозе 15-20 мг/кг в сутки. Поддерживающая доза интерферона — 3 ME 1-2 раза в не-
делю. Задача лечения — достижение полной ремиссии, т.е. уменьшение количества
тромбоцитов до 400 х 109/л или менее. Эта задача определяет длительность терапии.
При получении ремиссии необходимо постоянное поддерживающее лечение. При
длительном лечении ИФН-а у больных с мутацией Jak2V617F наблюдается уменьше-
ние или полное исчезновение клеток с этой аномалией.
Еще один препарат, с помощью которого достигается избирательное снижение ко-
личества тромбоцитов, — пипоброман. Пипоброман назначают по 0,8-1 мг/кг в сут-
ки, а при нормализации количества тромбоцитов дозу уменьшают до 0,3-0,6 мг/кг/сут.
Поддерживающее лечение в таких дозах проводилось годами без каких-либо побоч-
ных эффектов, позволяя сохранять количество тромбоцитов не более 400 х 109/л.
Если полной ремиссии получить не удается, следует применять все возможные ле-
чебные средства, чтобы число тромбоцитов не превышало 600 х 109/л. Следует иметь
в виду, что достижение полной нормализации числа тромбоцитов более надежно
предупреждает развитие сосудистых осложнений. Для профилактики сосудистых
осложнений рекомендуется постоянный прием аспирина 50-80 мг/сут.
При эпизодах нарушения микроциркуляции у больных с неполной ремиссией ре-
комендуется повторное проведение тромбоцитафереза в объеме, позволяющем сни-
зить число тромбоцитов после каждой процедуры до 500 х 109/л.
Острые тромбозы сосудов лечат так же, как возникшие у больных без тромбоци-
темии, с обязательным применением низкомолекулярных гепаринов (фраксипарин,
фрагмин). Одновременно следует принять меры для максимально быстрого снижения
числа тромбоцитов с помощью анагрелида или гидроксимочевины.
Спленэктомия при ЭТ не рекомендуется, т.к. она приводит к быстрому увеличе-
нию количества тромбоцитов, что способствует развитию сосудистых осложнений и
уменьшению продолжительности жизни больных.
При развитии заболевания в молодом возрасте и недостаточном лечебном эффек-
те терапии, не позволяющей надежно контролировать число тромбоцитов, показана
трансплантация стволовых кроветворных клеток.
10.3.5. Идиопатический миелофиброз
Идиопатический, или первичный, миелофиброз (ИМФ) известен под многими назва-
ниями: хронический идиопатический миелофиброз, агногенная миелоидная метапла-
зия, миелосклероз с миелоидной метаплазией, сублейкемический миелоз, хрониче-
ский гранулоцитарно-мегакариоцитарный миелоз.
ИМФ — клоновое миелопролиферативное заболевание с первичным поражением
стволовой кроветворной клетки, характеризующееся пролиферацией гранулоцитов
и мегакариоцитов с образованием экстрамедуллярных очагов кроветворения и ран-
ним развитием фиброза костного мозга.
Предлагаемые критерии диагноза ИМФ в классификации ВОЗ 2008 г. следующие.
Большие критерии:
1. Наличие пролиферации и атипии мегакариоцитов и ретикулинового фиброза.
2. Отсутствие признаков ИП, ХМЛ и МДС.
3. Наличие мутации Jak2V617F, MPLW515L или MPLW515K, а при их отсутствии —
отсутствие причин для реактивного фиброза.
318 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
Малые критерии:
1. Лейкоэритробластоз (наличие в крови единичных эритробластов и незрелых
гранулоцитов).
2. Повышение активности ЛДГ.
3. Анемия.
4. Пальпируемая селезенка.
Для уверенности в диагнозе необходимо наличие всех трех больших и двух малых
критериев.
Частота ИМФ составляет 0,5-1,5 случая на 100 000 населения в год. Заболевание
чаще развивается в возрасте после 60 лет. Мужчины и женщины заболевают с одина-
ковой частотой.
В развитии фиброза, по всей видимости, главную роль играют мегакариоциты, ко-
торые продуцируют основные факторы, стимулирующие рост фибробластов: фактор
роста тромбоцитов (PDGF) и трансформирующий фактор роста/3 (TGF-/3). Эти цитоки-
ны стимулируют синтез белков, участвующих в развитии фиброза.
Уже в самых ранних стадиях имеется очаговый или диффузный нерезко выражен-
ный ретикулиновый фиброз костного мозга. Постепенно фиброз увеличивается и при-
обретает характер коллагенового, в поздних стадиях заболевания обычно развивается
остеомиелосклероз. Развивающийся фиброз приводит к постепенному вытеснению
кроветворных элементов, уменьшению клеточности костного мозга, которое сопро-
вождается нарастающей анемией, а иногда и лейкопенией. Число тромбоцитов обыч-
но остается повышенным или нормальным и снижается только в самых поздних ста-
диях болезни. Для диагноза ИМФ и определения степени фиброза костного мозга
обязательна трепанобиопсия.
Специфические хромосомные аберрации при ИМФ не обнаружены, но более чем
в 50% случаев определяется мутация Jak2V617F, реже — мутации тромбопоэтинового
рецептора MPLW515L или MPLW515K.
Основной клинический симптом заболевания — увеличение селезенки, которое
обнаруживается в момент установления диагноза у 97-100% больных. Увеличенная
селезенка часто сдавливает левый мочеточник и почку, из-за чего присоединяется
левосторонний пиелит, нередко формируются уратовые камни в почках. При боль-
шом размере селезенки часто появляются жалобы на тяжесть в области живота, ма-
лую вместимость желудка, иногда — на острую боль, вызванную инфарктом селезен-
ки. Через 3-4 года может присоединиться асцит, дистрофия.
Продолжительность ИМФ колеблется от 1-2 до 10-15 лет, но чаще всего она со-
ставляет 3-5 лет. Наиболее частые причины смерти — инфекции или геморрагии, раз-
вивающиеся в поздних стадиях болезни в связи с лейкопенией и тромбоцитопенией.
Причиной смерти могут стать тромботические осложнения в связи с тромбоцитозом,
сердечная недостаточность при асците и анемии, а при портальной гипертензии —
кровотечения из расширенных вен пищевода. В тех случаях, когда эти осложнения не-
фатальные, обычным исходом ИМФ является развитие острого лейкоза.
Лечение
Наиболее часто лечение ИМФ в настоящее время проводится ИФН-а 3 ME ежед-
невно или через день длительно. Такое лечение у большинства больных приводит к
уменьшению тромбоцитоза, количества лейкоцитов и размера селезенки. У больных с
гемолитическим характером анемии показатели красной крови также нередко улуч-
шаются. При достижении эффекта, который можно расценивать как частичную ре-
миссию, обычно назначается поддерживающая доза интерферона — 3 ME 2-3 раза
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 319
Опухолевые заболевания кроветворной и лимфоидной ткани
в неделю. При такой терапии у ряда больных уменьшается количество или полностью
исчезают клетки с мутацией Jak2V617F либо тромбопоэтинового рецептора.
При плохой переносимости или неэффективности ИФН-а, при продолжающемся
увеличении селезенки проводится лечение гидроксимочевиной в меньших, чем при
ХМЛ, дозах из-за склонности к лейкопении — 500-1000 мг/сут. После достижения
желаемого эффекта с целью сохранить его та же доза препарата в качестве поддержи-
вающей терапии назначается 2-3 раза в неделю.
В последние годы в терапии ИМФ стали применяться талидомид и леналидомид. Та-
лидомид назначают в дозе 300 мг/сут длительно при хорошей переносимости. У 50%
больных достигнуто уменьшение анемии. Еще лучшие результаты с уменьшением или
ликвидацией анемии получены при назначении малых доз талидомида (50 мг/сут) в со-
четании с преднизолоном — эффект достигнут у 60% больных. Леналидомид назнача-
ют по 10 мг/сут, а при количестве тромбоцитов менее 100 х 109/л — по 5 мг/сут на про-
тяжении 3-4 мес., при получении эффекта лечение в такой или наполовину сниженной
дозе продолжается до 2 лет. Сообщается о нормализации количества тромбоцитов у
50% пациентов и эритроцитов — у 25%. Спленомегалия уменьшилась или исчезла у ’/3
больных.
При упорной анемии рекомендуется применять ЭПО 5000 ME ежедневно или через
день. Эффект отмечается лишь у части больных. Его удается добиться чаще при сочета-
нии ЭПО с ГМ-КСФ (3-5 мкг/кг в сутки).
Кортикостероидные гормоны оказываются полезными лишь при гемолитическом
характере анемии, их эффект обычно непродолжителен.
При значительной спленомегалии, особенно в случаях, когда она сопровождается
развитием гемолитической анемии или тромбоцитопении, показана спленэктомия.
Она противопоказана при выраженном фиброзе костного мозга с вытеснением гемо-
поэза, когда кроветворение локализуется преимущественно в селезенке. Примерно у
15-25 % больных после спленэктомии постепенно развивается значительное увеличе-
ние печени, которое, однако, крайне редко бывает причиной печеночной недостаточ-
ности и смерти больного. Тем не менее в тех случаях, когда гепатомегалия имеется до
спленэктомии, операция считается противопоказанной.
Гиперклеточность костного мозга — наиболее благоприятный прогностический
фактор для исхода спленэктомии. В этих случаях обычно достигается увеличение про-
должительности жизни. При гипо- и нормоклеточности костного мозга увеличения
продолжительности жизни в результате операции, как правило, не бывает.
Тромбоцитопению обычно не удается купировать в результате спленэктомии. Разви-
тие тромбоцитопении при ИМФ, как правило, свидетельствует о начавшемся прогрес-
сировании заболевания и чаще всего предвещает скорое развитие острого лейкоза,
которое никогда не удается предотвратить спленэктомией.
В тех случаях, когда размер селезенки значителен, а соматическое состояние боль-
ного заставляет сомневаться в исходе спленэктомии, можно рекомендовать облуче-
ние селезенки (во избежание длительной нейтропении и тромбоцитопении обычно
не более 20 Гр), которое вызывает уменьшение органа и снятие тягостных симптомов
нередко на 0,5-1 год.
При развитии острого лейкоза лечение проводится по программам терапии острых
лейкозов в соответствии с вариантом ОЛ.
Единственным методом излечения ИМФ остается аллогенная трансплантация ГСК.
Она должна быть предложена больным моложе 50 лет, имеющим HLA-совместимого
сиблинга,уже в начале заболевания, поскольку развитие коллагенового фиброза и сни-
жение уровня гемоглобина менее 100 г/л заметно ухудшают прогноз трансплантации.
До трансплантации рекомендуется спленэктомия, чтобы избежать рецидива заболева-
320 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
ния в связи с циркуляцией патологического клона клеток, остающихся в селезенке. Свя-
занная с операцией смертность низка, а приживление трансплантата наблюдается почти
всегда. По имеющимся данным, общая 4-летняя выживаемость у перенесших тран-
сплантацию больных ИМФ составляет 70%, а безрецидивная — почти 60%.
10.3.6. Хронический лимфолейкоз
ХЛЛ — клоновое опухолевое заболевание, морфологическим субстратом которого
являются зрелые В-лимфоциты с небольшой примесью пролимфоцитов.
Для установления диагноза ХЛЛ, согласно современным критериям, необходимо
наличие трех признаков: абсолютное число лимфоцитов крови не менее 5 х 109/л, бо-
лее 30% лимфоцитов в костном мозге, иммунологическое подтверждение наличия В-
клеточного клона лимфоцитов — преобладание среди элементов крови и костного
мозга лимфоцитов, экспрессирующих на своей поверхности одновременно антигены
CD19, CD20, CD21, CD5 и CD23. Без иммунологического подтверждения диагноз ХЛЛ
не может считаться доказанным, поскольку дифференциальный диагноз с похожими
заболеваниями проводится на основании данных иммунофенотипирования.
ХЛЛ — наиболее распространенный вид лейкоза в странах Европы и Северной Аме-
рики, где на его долю приходится до 30% всех лейкозов. Ежегодная заболеваемость
ХЛЛ в этих странах составляет 3-3,5 случая на 100 000 населения в год, при этом сре-
ди лиц старше 65 лет — до 20 случаев и старше 70 лет — до 50 на 100 000.
Средний возраст заболевших 65 лет, почти 70% заболевают между 50 и 70 годами и
только около 10% — до 40 лет. Мужчины заболевают в 2 раза чаще женщин.
Известно два варианта ХЛЛ: в 50% случаев морфологическим субстратом заболе-
вания являются В-лимфоциты, не прошедшие в своем развитии стадию соматических
гипермутаций в генах вариабельной части тяжелых цепей иммуноглобулинов (VH-
регион); в другой половине случаев патологические В-лимфоциты имеют признаки
соматических мутаций VH-генов. ХЛЛ с лимфоцитами без признаков соматических
мутаций VH-генов имеет более агрессивное течение и требует более интенсивной те-
рапии.
В большинстве случаев на первых этапах болезни ХЛЛ характеризуется медленным
течением с постепенно нарастающим лейкоцитозом, который без лечения может до-
стигать 500-1000 х 109/л и более, и лимфоцитозом, обычно коррелирующим с уров-
нем лейкоцитоза и составляющим 70-85-99%. Преобладают морфологически зре-
лые лимфоциты, но, как правило, обнаруживается 5-10% пролимфоцитов. Уровень
гемоглобина, число эритроцитов и тромбоцитов на ранних этапах болезни обычно
нормальные, при высоком лейкоцитозе и лимфоцитозе — часто сниженные за счет
вытеснения нормального кроветворения лейкозным клоном или присоединения не-
редких при ХЛЛ аутоиммунных осложнений — аутоиммунной гемолитической ане-
мии и/или тромбоцитопении.
При биохимическом исследовании обычно обнаруживают снижение уровня белка
сыворотки за счет гипогаммаглобулинемии, которая нарастает по мере развития за-
болевания.
В костном мозге отмечается увеличение количества зрелых лимфоцитов, которое
может достигать 80-90%, число пролимфоцитов колеблется от 2-3 до 20-30%.
Морфологическое исследование лимфоузлов и селезенки показывает стирание ри-
сунка строения с преобладанием лимфоцитов малого размера и редкими митозами.
В селезенке типична инфильтрация белой пульпы.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 321
Опухолевые заболевания кроветворной и лимфоидной ткани
Современные методы цитогенетического анализа позволяют обнаружить хромо-
сомные аберрации более чему 80% больныхХЛЛ. Наиболее часто встречающиеся и
прогностически значимые — делеции длинного плеча хромосомы 13 (13q-) и хромо-
сомы 11 (1 lq-), короткого плеча хромосомы 17 (17р-), частичная трисомия хромосо-
мы 12 (+12q). Наличие единственной аномалии 13q- предвещает стабильное состоя-
ние или медленное течение болезни и благоприятный ответ на терапию, при трисомии
12q как единственной аномалии прогноз также благоприятный. Обнаружение абер-
раций 1 lq- и, особенно, 17р- предвещает быстрое прогрессирование и рефрактер-
ность к терапии.
Наиболее значимым прогностическим признаком служит мутационный статус*, при
отсутствии мутаций IgVH-генов медиана выживаемости при современной терапии ко-
леблется от 79 до 119 мес., при их наличии — составляет 200-300 мес., а некоторые
больные этой группы никогда не нуждаются в лечении.
Неблагоприятными прогностическими признаками также являются экспрессия ан-
тигена CD38 на поверхности более 7 % лимфоцитов, активность ЛДГ сыворотки более
450 ЕД/л иуровень^2-микроглобулина выше 3 мг/л.
Дифференциальный диагноз при ХЛЛ должен проводиться со зрелоклеточными
лимфомами с лейкемизацией (чаще всего с лимфомой мантий зоны) и некоторыми
редкими вариантами лейкозов: В- и Т-клеточными пролимфоцитарными и Т-клеточ-
ным лейкозом из больших гранулярных лимфоцитов.
Темпы течения болезни и продолжительность жизни при ХЛЛ колеблются в широ-
ких пределах — от 2-3 до 20-30 лет. Медленное развитие в начале болезни — при-
чина того, что у 70% больных ХЛЛ диагностируется при анализе крови, сделанном
в связи с другими заболеваниями. Примерно у 15-20% больных клинические и ге-
матологические признаки заболевания остаются стабильными и минимально выра-
женными без лечения на протяжении многих лет и не влияют на продолжительность
жизни.
Существуют и используются во всех странах две общепринятые международные
классификации ХЛЛ — модифицированная Rai и Binet. В обеих выделяют три стадии
заболевания.
Классификация Rai:
стадия низкого риска прогрессирования — имеется только лимфоцитоз бо-
лее 15x109/л в крови и более 40 % в костном мозге;
стадия промежуточного риска — имеется лимфоцитоз и увеличение лимфо-
узлов, и/или спленомегалия, и/или гепатомегалия;
стадия высокого риска — лимфоцитоз и снижение уровня гемоглобина менее
110 г/л и/или количества тромбоцитов менее 100 х 109/л независимо отувели-
чения лимфоузлов и органов.
Классификация Binet:
стадия А — при наличии подтвержденного ХЛЛ содержание гемоглобина состав-
ляет более 100 г/л, тромбоцитов — более 100 х 109/л, имеется увеличение
лимфоузлов в 1-2 областях;
стадия В — содержание гемоглобина и тромбоцитов такое же, как при стадии А,
увеличены лимфоузлы в 3 областях или более;
стадия С — содержание гемоглобина менее 100 г/л, тромбоцитов менее 100 х 109/л
при любом количестве зон с увеличенными лимфоузлами и независимо от
увеличения органов.
322 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
* t <5-' ?w «st msgrmwr
Хронические лейкозы
Лечение
Начало лечения при ХЛЛ определяется стадией заболевания. Оно обычно не прово-
дится до тех пор, пока больной остается в стадии А, и может не проводиться в стадии В
при стабильном состоянии болезни, отсутствии таких симптомов, как усталость, пот-
ливость, снижение массы тела. В настоящее время тактика «наблюдай и жди» целесоо-
бразна только для больных с минимальными проявлениями заболевания и лишь до тех
пор, пока не появляются любые признаки прогрессирования.
Лечение показано:
при массивной инфильтрации костного мозга лимфоцитами (более 80 % лимфо-
цитов в миелограмме), особенно если при этом имеется даже минимальное сни-
жение уровня эритроцитов и тромбоцитов;
И при быстром нарастании лимфоцитоза — удвоении абсолютного числа лимфо-
цитов в крови менее чем за 12 мес.,
оно обязательно в стадии С и независимо от стадии при прогностически небла-
гоприятных хромосомных аберрациях (11 q- и 17р-);
при высоком уровне /?2-микроглобулина и повышении активности ЛДГ в 2-3 раза
по сравнению с нормой.
Следует помнить, что развитие аутоиммунной анемии или тромбоцитопении и уве-
личенная подверженность больного бактериальным инфекциям служат не противо-
показанием, как это часто расценивается на практике, а показанием к проведению ци-
тостатической терапии после ликвидации острых симптомов.
В настоящее время препаратами выбора в терапии ХЛЛ являются флударабин и флу-
дарабинсодержащие режимы. При использовании флударабина в качестве единст-
венного препаратау ранее не леченных больных удается получить 70-80% ремиссий,
из которых 25-35% — полные, средняя продолжительность достигнутого эффекта —
30 мес. У больных, ранее леченных алкилирующими препаратами, достигается 45-
50% ремиссий, из которых 15-20% — полные, средняя продолжительность эффек-
та — 8-Ю мес. Даже у пациентов, нечувствительных к алкилирующим препаратам, в
т.ч. в схемах ПХТ, с помощью флударабина в монорежиме удается получить до 35%
ремиссий.
Флударабин назначается в дозе 25 мг/м2 в/в 5 дней подряд. Проводится 6-8 курсов
с интервалом между ними 28 дней. При получении полной ремиссии желательно про-
вести 2 курса консолидации.
Флударабин для приема внутрь назначается в дозе 40 мг/м2 в сутки 5 дней подряд ка-
ждые 4 нед., всего проводится 6-8 курсов. Эффективность перорального и в/в вводи-
мого препаратов одинакова.
В настоящее время флударабин в монорежиме используется редко, более эффек-
тивной является его комбинация с циклофосфамидом:
Флударабин — 25 мг/м2 в/в.
Циклофосфамид — 300-350 мг/м2 в/в в 1-3-й день.
Интервал между курсами 28 дней.
Преимущества этой комбинации подтверждены данными международного коопе-
рированного рандомизированного исследования CLL4: флударабин — общий эффект
(полные и частичные ремиссии) 80%, полные ремиссии 15 %; флударабин + циклофос-
фамид — общий эффект 94%, полные ремиссии 39%.
Высокоэффективно сочетание флударабина, циклофосфамида и митоксантрона:
Флударабин — 25 мг/м2 в/в в 1-3-й день.
Циклофосфамид — 200 мг/м2 в/в в 1-3-й день или 600 мг/м2 в 1-й день.
Митоксантрон — 6 мг/м2 в/в в 1-й день.
Интервал между курсами 28 дней.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 323
Опухолевые заболевания кроветворной и лимфоидной ткани
У ранее леченных больных достигается 70-75 % ремиссий, из них до 30% — полные,
у ранее не леченных — 95-100% ремиссий, из которых до 60% — полные.
Еще более эффективна комбинация флударабина, циклофосфамида (Циклофос-
фан) и ритуксимаба (РФЦ). Ритуксимаб (Мабтера) — МКА к антигену CD20, экспресси-
рованному на зрелых В-лимфоцитах. Применяется следующий режим терапии:
Ритуксимаб — 375 мг/м2 в/в 4-часовая инфузия в 1-й день в первом курсе, в осталь-
ных 500 мг/м2.
Флударабин — 25 мг/м2 в/в во 2-4-й день.
Циклофосфамид — 300-350 мг/м2 в/в во 2-4-й день.
Интервалы между курсами 28 дней. Всего проводится 6-8 курсов, при хорошей пе-
реносимости дозу ритуксимаба, начиная со 2-го курса, увеличивают до 500 мг/м2.
При такой терапии у ранее не леченных больных достигается 95-100% ремиссий, у
70-80% — полные. При лечении рецидивов после другой терапии ремиссии получе-
ны у 65-70% больных, у 20-25% — полные.
Продолжительность ремиссий и выживаемости показывает преимущества комби-
нации РФЦ: по данным MD Anderson Cancer Center, при терапии ранее не леченных
больных флударабином медиана продолжительности ремиссии составила 2,5 года,
общей выживаемости — 6,5 года, при лечении сочетанием флударабина и циклофос-
фамида соответственно 3,5 и 8 лет, при использовании РФЦ медиана длительности ре-
миссии составила 4,5 года, медиана выживаемости не достигнута за период наблюде-
ния, 85 % больных были живы более 5 лет наблюдения.
Международное рандомизированное исследование REACH на большой группе ра-
нее леченных и международное исследование CLL-8 на ранее не леченных больных
показали достоверно более частое получение как общих ответов, так и полных ре-
миссий и удлинение беспрогрессивной выживаемости при использовании сочета-
ния флударабина, циклофосфана и ритуксимаба по сравнению с применением только
комбинации флударабина с циклофосфаном. Выживаемость больных ХЛЛ при ис-
пользовании для лечения трех препаратов указанной комбинации превысила таковую
при использовании всех ранее применяемых средств терапии.
В последнее время в терапии ХЛЛ стал применяться алемтузумаб (Кэмпас) — анти-
тела к антигену CD52. Антиген CD52 экспрессирован почти на всех В- и Т-лимфоцитах
человека, как нормальных, так и опухолевых, не экспрессирован на стволовых клет-
ках, гранулоцитах и тромбоцитах. Алемтузумаб в монорежиме применяется по 30 мг
3 раза в неделю в течение 18 нед. При этому ранее не леченных больных достигается
до 80% ремиссий, из них до 20% — полные, у много леченных и рефрактерных к дру-
гой терапии больных ремиссии удается получить в 30% случаев.
У больных с ремиссией после другой терапии алемтузумаб позволяет в 50% случа-
ев добиться молекулярной ремиссии — при иммунофенотипировании не обнаружи-
ваются клетки с иммунофенотипом В-ХЛЛ. При достижении молекулярной ремиссии
у большинства больных в течение 3-4 лет нет признаков рецидива ХЛЛ.
Применение алемтузумаба позволяет преодолеть неблагоприятное прогностиче-
ское значение делеции 17р. Большинство больных с 17р- оказываются нечувствитель-
ными к современной терапии: ремиссии или не удается получить, или в ближайшее
время наступает рецидив заболевания, однако при использовании алемтузумаба до-
стигаются длительные стойкие ремиссии.
Имеются сообщения об эффективности комбинации алемтузумаба с метилпредни-
золоном. Метилпреднизолон назначался по 1 г/м2 5 дней подряд, алемтузумаб — по
30 мг 3 раза в неделю. Каждый цикл продолжался 28 дней, всего проводилось до 4 ци-
клов. Ремиссии получены у всех больных с 17р-,у 50% — полные.
324 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
В настоящее время все шире используется комбинация алемтузумаба с флудараби-
ном — Флукам. Флударабин назначают по 30 мг/м2 3 дня подряд, в эти же дни применя-
ют алемтузумаб 30 мг/сут. Интервалы между циклами 28 дней, всего проводится 4-6
циклов. У больных с рецидивом или рефрактерностью к флударабину либо сочетанию
флударабина и ритуксимаба после лечения по схеме Флукам достигается более 80%
ремиссий, из них 30% — полные.
Алкилирующие препараты, главным образом хлорамбуцил, в настоящее время при-
меняются мало, однако они не утратили своего значения для проведения сдерживаю-
щей терапии у пожилых пациентов, особенно с сопутствующими легочными и сердеч-
ными заболеваниями и медленно прогрессирующим ХЛЛ. Хлорамбуцил (Лейкеран) в
этих случаях назначают по 10-15 мг 1-3 раза в неделю очень длительно. Такая тера-
пия у ряда больных позволяет на годы сдерживать рост лейкоцитоза и размеров лим-
фоузлов. При высоком лейкоцитозе (100-200 х 109/л и более) в тех случаях, когда нет
неблагоприятных прогностических признаков ХЛЛ, определяющих необходимость
более интенсивного лечения, можно проводить курсовое лечение хлорамбуцилом
10-15 мг/сут до общей курсовой дозы 500-600 мг. Анализы крови при этом следует
делать еженедельно, поскольку бывают случаи быстрого снижения числа лейкоцитов.
Приуменьшении количества лейкоцитов до 20-30 х 109/л необходим перерыв в тера-
пии на 1-2 нед., после чего прием хлорамбуцила можно возобновить уже в поддержи-
вающем режиме. В международных исследованиях часто используется другой режим
хлорамбуцила — 20-25 мг/м2 1 раз в месяц. При сочетании лейкоцитоза с выражен-
ной лимфаденопатией или спленомегалией хлорамбуцил в указанных дозах обычно
сочетают с преднизолоном 20-40 мг/сут.
Для достижения более быстрого сокращения размера лимфоузлов и селезенки у
больных, у которых нежелательно или невозможно применить флударабинсодержа-
щие режимы, можно использовать повторные курсы СОР, CHOP или CID.
СОР
Циклофосфамид — 400 мг/м2 в/в или в/м в 1-5-й день.
Винкристин — 1,4 мг/м2 (не более 2 мг) в/в в 1-й день.
Преднизолон — 50-60 мг/м2 внутрь в 1-5-й день.
CHOP
Циклофосфамид — 750 мг/м2 в/в в 1-й день.
Винкристин — 1,4 мг/м2 (не более 2 мг) в/в в 1-й день.
Доксорубицин — 50 мг/м2 в/в в 1-й день.
Преднизолон — 50-60 мг/м2 внутрь в 1-5-й день.
CID
Хлорамбуцил — 20 мг/м2 внутрь в 1-3-й день.
Идарубицин — 10 мг/м2 внутрь в 1-3-й день или 10 мг/м2 в/в в 1-й день.
Дексаметазон — 4 мг внутрь 2 раза в сутки в 1-5-й день.
Все указанные схемы терапии могут комбинироваться с ритуксимабом, вводимым в
1 -й день в дозах, указанных выше.
Следует иметь в виду, что даже проводимая длительно терапия хлорамбуцилом или
его сочетанием с преднизолоном никогда не приводит к полным ремиссиям. Исполь-
зование указанных здесь и аналогичных комбинированных схем терапии позволило в
зависимости от стадии болезни получать от 15 до 60% полных ремиссий, но, как пока-
зали рандомизированные сравнительные исследования, не увеличило продолжитель-
ности жизни по сравнению с достигнутой при лечении комбинацией хлорамбуцила с
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 325
Опухолевые заболевания кроветворной и лимфоидной ткани
преднизолоном. В настоящее время, когда имеются высокоэффективные препараты,
позволяющие получать полные длительные ремиссии, в т.ч. молекулярные, перед на-
значением лечения больному ХЛЛ необходимо тщательно взвесить имеющиеся кли-
нические (стадия болезни) и прогностические признаки ХЛЛ (наличие хромосомных
аберраций, процент экспрессирующих CD38 лимфоцитов, активность ЛДГ и уровень
/?2-микроглобулина, если возможно, мутационный статус VH-генов), а также состояние
органов больного (сердечно-сосудистой системы, легких, почек, печени) для реше-
ния вопроса о том, какая терапия наиболее показана и безопасна в каждом конкрет-
ном случае.
При всех применяемых в терапии ХЛЛ препаратах могут возникать побочные явле-
ния и требуются конкретные меры, чтобы их избежать.
Несмотря на то что синдром распада опухоли очень редко развивается при лече-
нии ХЛЛ, при всех видах цитостатической терапии, если она проводится больным с вы-
соким уровнем лейкоцитов, во избежание урикемии необходимо назначение алло-
пуринола 400-600 мг в сутки за 1-2 дня до начала терапии, на всем ее протяжении и
2-3 дня после окончания.
У большинства больных в связи с характерным для ХЛЛ снижением иммунитета в те-
чение болезни развиваются инфекционные осложнения (пневмонии, бронхиты, па-
рапроктиты, пиелиты), которые наблюдаются с увеличивающейся частотой по мере
прогрессирования заболевания. Нейтропения в результате цитостатической терапии
может быть дополнительной причиной присоединения инфекционных осложнений.
Лечение флударабином в связи с вызываемым препаратом значительным и длитель-
ным снижением числа Т-хелперов (CD4+) может способствовать учащению инфекций
как во время терапии, так и в течение длительного периода после нее.
Флударабин выводится почками, поэтому при снижении их функции может созда-
ваться повышенная концентрация препарата в крови с развитием осложнений. Во из-
бежание этого перед курсом терапии необходимо исследовать клиренс креатинина.
Флударабин вводится в полной дозе при клиренсе выше 70 мл/мин, в половинной —
при клиренсе 30-70 мл/мин и не должен вводиться при клиренсе ниже 30 мл/мин.
При лечении ритуксимабом известны случаи реактивации вируса гепатита В с разви-
тием фульминантного гепатита со смертельным исходом. Это бывает при носительст-
ве не только вируса, но и антител к нему и обусловлено резким снижением уровня ан-
тител приуменьшении вызванного ритуксимабом количества В-лимфоцитов. Поэтому
до лечения ритуксимабом рекомендуется всем больным провести исследование на
носительство вируса гепатита В или наличие антител к нему. В случае положительно-
го результата необходимо до применения ритуксимаба начать курс лечения гепатита В,
который должен быть продолжен на протяжении цитостатической терапии и прекра-
щен только при повторных отрицательных результатах анализов.
Поскольку аммтузумаб (Campath-1 Н) снижает число как В-, так и Т-лимфоцитов, он
является сильным иммунодепрессантом, что обусловливает повышенный риск ин-
фекционных осложнений при его применении, особенно герпетических инфекций и
пневмоцистной пневмонии. До начала лечения алемтузумабом необходимо исследо-
вание на носительство цитомегаловирусной (ЦМВ) инфекции, при положительном от-
вете до начала терапии следует провести лечение ганцикловиром. Во время лечения
алемтузумабом при появлении лихорадочных эпизодов снова необходима проверка
на возможность реактивации ЦМВ и при положительном ответе — терапия ганцикло-
виром. Для профилактики пневмоцистной пневмонии и herpes zoster рекомендуется
на протяжении всего периода лечения и в течение 2 мес. после его окончания при-
ем котримоксазола (бисептола) по 480 мг 2 раза в сутки 3 раза в неделю и ациклови-
ра 800 мг/сут.
326
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
При лечении МКА (как ритуксимаб, так и алемтузумаб) в 1-е сутки введения почти
у всех больных наблюдается повышение температуры тела, озноб, одышка, иногда —
падение АД. Эта реакция связана с появлением в крови большого количества ИЛ-6 и
ФНО, высвобождающихся из распадающихся лимфоцитов. Для ее уменьшения перед
началом инфузии вводится 30 мг преднизолона или 8 мг дексаметазона, какой-либо из
антигистаминных препаратов и жаропонижающие средства, лучше всего 500-1000 мг
парацетамола. При последующих введениях описанных реакций почти не бывает.
В начале лечения алемтузумабом обязательно постепенное увеличение дозы препа-
рата: в 1-й день вводят 3 мг, при хорошей переносимости на следующий день — 10 мг,
и лишь в 3-й день вводится лечебная доза 30 мг. При развитии озноба, тремора, подъ-
ема температуры тела в следующий раз вводится та же доза, ее введение повторяется
до полного исчезновения всех указанных симптомов и лишь после этого проводится
эскалация дозы с постепенным выходом на лечебную.
При развитии цитостатической миелосупрессии с нейтропенией после цикла XT
желательно использование Г-КСФ 3-5 мкг/кг в сутки до восстановления количества
нейтрофилов не менее 1 х 109/л.
Аутоиммунные и инфекционные осложнения при ХЛЛ
Течение ХЛЛ у 10-20% больных осложняется развитием аутоиммунной анемии, у
1-2% — парциальной красноклеточной аплазии, примерно у 2% бывают эпизоды ау-
тоиммунной тромбоцитопении. Развитие аутоиммунных осложнений при правильном
и успешном лечении не влияет на дальнейшее течение заболевания и продолжитель-
ность жизни больного.
В лечении аутоиммунных осложнений основная роль принадлежит кортикосте-
роидным гормонам. При острых гемолитических кризах необходимо применять
1-1,5 мг/кг преднизолона в сутки до полной ликвидации всех признаков гемолиза.
Следует иметь в виду, что наиболее выражено действие гормонов при приеме внутрь.
Применяется также в/в введение иммуноглобулина (IgG) 400 мг/кг в сутки 5 дней
подряд.
Лечение ритуксимабом в монорежиме или в сочетании с преднизолоном дает стой-
кий эффект в большинстве случаев аутоиммунной анемии и тромбоцитопении. Ри-
туксимаб вводится в дозе 375 - 500 мг/м2 еженедельно до ликвидации признаков ау-
тоиммунного конфликта. Наличие антител в сыворотке больного вызывает гемолиз
перелитых эритроцитов или тромбоцитов, поэтому в период лечения гемолитическо-
го криза гемотрансфузии следует назначать только по жизненным показаниям и с ин-
дивидуальным подбором.
У многих больных в связи с характерным для ХЛЛ снижением иммунитета в течение
болезни развиваются инфекционные осложнения, которые учащаются по мере про-
грессирования заболевания. Нейтропения в результате цитостатической терапии мо-
жет быть дополнительной причиной присоединения инфекционных осложнений. Ле-
чение флударабином и алемтузумабом может способствовать учащению инфекций
как во время проведения терапии, так и в течение длительного периода после нее.
Лечение инфекций у больных ХЛЛ должно проводиться антибиотиками широкого
спектра действия, как можно раньше при появлении первых симптомов (повышение
температуры тела), в высоких терапевтических дозах и в комбинациях. При подозре-
нии на присоединение грибковой инфекции назначают противогрибковые средства.
Частым при ХЛЛ является развитие herpes zoster. При отсрочке с лечением наблю-
дается склонность к поражению обширных участков кожи и распространению на
внутренние органы. Лечение следует проводить ацикловиром (Зовиракс, Виро-
лекс) или фамвиром. Ацикловир назначают внутрь по 800 мг 5 раз в сутки или в/в
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 327
Опухолевые заболевания кроветворной и лимфоидной ткани
по 10 мг/кг каждые 8 ч. Лечение проводится до полного прекращения новых вы-
сыпаний, но не менее 7-10 дней. Фамвир назначают по 500 мг 3 раза в сутки на та-
кой же период.
Исходы ХЛЛ
Инфекционные осложнения оказываются непосредственной причиной смерти 75-
80% больных ХЛЛ.
Примерно 10-15% больных умирают от причин, не связанных непосредственно с
ХЛЛ, — обычные для лиц пожилого возраста сердечно-сосудистые заболевания.
У 5-10% больных ХЛЛ развиваются вторые опухоли. Возможно, причиной их более
частого развития, чем в соответствующей возрастной группе, служит снижение им-
мунокомпетентности. Наиболее часты рак кожи, желудка и легких. Наличие ХЛЛ не
является противопоказанием к хирургическому лечению опухоли, оперативные вме-
шательства переносятся больными ХЛЛ также, как пациентами без сопутствующих ге-
матологических заболеваний.
Примерно у 5 % больных ХЛЛ исходом заболевания бывает развитие диффузной
крупноклеточной В-клеточной лимфомы — синдром Рихтера. Чаще он развивается у
пациентов с несколькими хромосомными аберрациями. У большинства больных появ-
ляется массивная лимфаденопатия, особенно часто — прогрессирующее увеличение
лимфоузлов брюшной полости, в 50% случаев одновременно вовлечены экстрано-
дальные области: плевра, ЦНС, кожа, кости, костный мозг, реже — ЖКТ. У большинства
больных отмечается повышение температуры тела, резкая потливость, нарастающая
слабость, потеря массы. Морфологические и иммуногистохимические исследования
выявляют одновременно признаки ХЛЛ и диффузной крупноклеточной лимфомы в
одних и тех же органах.
Лечение проводится комбинациями препаратов, применяемых в терапии крупно-
клеточной лимфомы, но эффективность их мала и продолжительность эффекта ко-
роткая. Используются известные схемы МАСОР-В, DHAP, BEAM, IVAM, а также схемы
с флударабином.
1. Цисплатин — 100 мг/м2 непрерывная в/в инфузия в течение 96 ч.
Флударабин — 30 мг/м2 в/в в 3-й и 4-й дни.
Цитозин-арабинозид — 500 мг/м2 в/в в течение часа в 3-й и 4-й дни.
Интервал между курсами 28 дней.
2. Циклофосфамид — 250 мг/м2 в/в каждые 12 ч в 1-3-й день.
Флударабин — 30 мг/м2 в/в в 3-й и 4-й дни.
Цитозин-арабинозид — 500 мг/м2 в/в в течение часа в 3-й и 4-й дни.
Интервал между курсами 28 дней.
Имеется сообщение об эффективности схемы с оксалиплатином, ритуксимабом и
флударабином.
OFAR
Оксалиплатин — 25 мг/м2 в/в в 1-4-й день.
Флударабин — 30 мг/м2 в/в во 2-3-й день.
Цитозин-арабинозид — 1 г/м2 в/в во 2-3-й день.
Ритуксимаб — 375 мг/м2 в 3-й день 1-го цикла и в 1-й день последующих.
С 6-го дня обязательно введение КСФ.
Интервал между курсами 28 дней, максимальное число циклов — 6.
Имеется сообщение о лечении по этой схеме 20 больных с синдромом Рихтера, по-
лучено 50% ремиссий с медианой длительности 10 мес.
328 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
Редкие формы ХЛЛ
В~пролимфоцитарный лейкоз. В отличие от терминальной стадии обычного
В-ХЛЛ, в которой тоже иногда бывает увеличение количества пролимфоцитов, при В-
пролимфоцитарном лейкозе с самого начала заболевания обнаруживается 60-90%
пролимфоцитов в крови, высокий лейкоцитоз, в момент установления диагноза не-
редко превышающий 100 х 109/л, выраженная спленомегалия без лимфаденопатии.
На лейкозных клетках обычно отсутствует экспрессия CD23, a CD5 экспрессируется
лишь в 30-40% случаев. Характерен слабый ответ даже на интенсивную терапию, флу-
дарабинсодержащие режимы и спленэктомия дают лишь кратковременный эффект.
Продолжительность жизни при современной терапии обычно составляет 2-5 лет.
Т-пролимфоцитарный лейкоз. Характеризуется высоким лейкоцитозом, вы-
раженной лимфаденопатией и гепатоспленомегалией, анемией и тромбоцитопенией.
В отличие от обычного ХЛЛ женщины болеют в 4 раза чаще, чем мужчины. Морфо-
логическим субстратом заболевания являются пролимфоциты, экспрессирующие ан-
тигены CD2, CD3, CD5, CD7, в 60% случаев — CD4 при отсутствии CD8, в 25% — оба
антигена (CD4+, CD8+). У 2/3 пациентов имеется инверсия хромосомы 14 или трансло-
кация t( 14; 14). У многих больных обнаруживается делеция 1 lq-, нередки комплексные
хромосомные аберрации. Характерно быстрое прогрессирование с продолжитель-
ностью жизни менее 1 года. XT малоэффективна, описаны случаи ремиссии после ле-
чения антителами к CD52 — алемтузумаб (Кэмпас, Campath-1 Н).
Т-клеточный лимфолейкоз, или Т-клеточный лейкоз из больших гра-
нулярных лимфоцитов. Диагностируется по обнаружению в крови и костном
мозге больших лимфоцитов с обильной цитоплазмой, содержащей азурофильные
гранулы. В большинстве случаев экспрессируются антигены CD3, CD8 и Т-клеточный
рецептор. Лейкоцитоз обычно не превышает 20 х 109/л, а во многих случаях имеется
лейкопения и анемия. Характерна умеренная спленомегалия. Часто сочетание с рев-
матоидным артритом. Течение болезни медленное, без лечения может продолжаться
10 лети более. Нередки опасные для жизни инфекционные осложнения, обусловлен-
ные абсолютной нейтропенией. При спокойном течении лечение не проводится, при
прогрессировании положительный эффект дают алкилирующие препараты. При зна-
чительной спленомегалии с синдромом гиперспленизма показана спленэктомия.
10.3.7. Волосатоклеточный лейкоз
Волосатоклеточный лейкоз (ВКЛ) — опухолевое лимфопролиферативное заболе-
вание, морфологическим субстратом которого являются клетки с иммунофеноти-
пом зрелых В-лимфоцитов и своеобразной морфологией. Они имеют размер малого
лимфоцита или несколько больший, овальное ядро, часто с выемкой, нередко с нук-
леолами, обильную серо-голубую цитоплазму с тонкими ворсинчатыми отростками,
от которых болезнь и получила свое название. При иммунологическом исследова-
нии лейкозных клеток определяется экспрессия антигенов зрелых В-лимфоцитов —
CD 19, CD20, CD22. Характерный иммунологический признак ВКЛ — сильная экспрес-
сия CD25, CD11с и CD 103. Как правило, патологические клетки не экспрессируют CD5,
CD10 и CD23. Подтверждает диагноз обнаружение в патологических клетках при ци-
тохимическом исследовании тартрат-резистентной кислой фосфатазы. Специфиче-
ские цитогенетические аномалии не обнаружены. Количество патологических клеток
в крови, а иногда и в костном мозге может быть небольшим. Для установления диагно-
за их должно быть не менее 10%.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 329
Опухолевые заболевания кроветворной и лимфоидной ткани
Типичная картина крови при ВКЛ — одно-, двух- или чаще трехростковая цитопения
с характерной моноцитопенией. В патогенезе цитопении основная роль принадлежит
гиперспленизму. Каких-либо особенностей в биохимических анализах крови обычно
нет. В 50-75 % случаев обнаруживается повышенная экспрессия циклина D1.
Костномозговой пунктат, нередко получаемый с трудом из-за сопутствующего фи-
броза, может быть гипо-, нормо- или гиперклеточным с диффузной инфильтрацией
патологическими клетками, но их количество при подсчете миелограммы может быть
небольшим. Для подтверждения диагноза необходимо исследовать трепанобиоптат
костного мозга, в котором нередко видны кластеры патологических клеток и, как пра-
вило, ретикулиновый фиброз. При морфологическом исследовании обнаруживается
инфильтрация патологическими клетками красной пульпы селезенки.
ВКЛ — редкий вариант лейкоза, на его долю приходится не более 2% всех лейкозов.
Ежегодная заболеваемость ВКЛ составляет 1 случай на 150 000 населения. Заболева-
ют чаще всего в среднем и пожилом возрасте, средний возраст — 55 лет. Мужчины за-
болевают в 5 раз чаще женщин.
Характерным клиническим признаком является спленомегалия без лимфаденопа-
тии. Пальпируемые лимфоузлы обнаруживаются не более чему 10% больных. При вы-
раженной спленомегалии может быть увеличена и печень. Прогрессирование заболе-
вания может сопровождаться увеличением лимфоузлов брюшной полости, а иногда и
инфильтрацией брюшины патологическими клетками с развитием асцита.
Примерно у 20% больных ВКЛ отмечаются аутоиммунные осложнения, которые
проявляются не аутоиммунной анемией или тромбоцитопенией, а кожными васкули-
тами, узловатой эритемой, артралгией или артритами.
Существует так называемый вариантный ВКЛ, который характеризуется высоким
лейкоцитозом (часто 50-100 х 109/л) с большим количеством (60-95%) лейкозных
клеток в крови и выраженной сплено- и гепатомегалией. Морфологическая картина
костного мозга и селезенки такая же, как при классическом ВКЛ, патологические клет-
ки в крови часто напоминают пролимфоциты. В большинстве случаев патологические
клетки при этом варианте не экспрессируют CD25, а иногда и CD103, нередко в них не
обнаруживается и тартрат-резистентной кислой фосфатазы. Отличается от обычного
ВКЛ более быстрым прогрессированием и плохим ответом на терапию.
Течение ВКЛ медленное и на начальном этапе бессимптомное. При первом обра-
щении к врачу обычны жалобы на слабость, обусловленную анемией, но у 85-90%
уже имеются развернутые клинические и лабораторные признаки заболевания. Не-
редко диагноз устанавливается при обращении по поводу инфекций, частота которых
при ВКЛ повышена и обусловлена нейтро- и моноцитопенией.
Продолжительность жизни при ВКЛ без лечения колеблется в очень широких пре-
делах — от 1 до 30 лет, в среднем до современной терапии она составляла 5 лет. Ос-
новной причиной смерти больных чаще всего оказываются инфекции.
В настоящее время препаратом выбора в терапии ВКЛ является пуриновый аналог
кладрибин (Леустатин, 2-хлордезоксиаденозин, 2-CdA). В России выпускается Веро-
кладрибин фирмы «Верофарм». Кладрибин вводится в/в 0,1 мг/кг в сутки путем непре-
рывной инфузии в течение 7 дней подряд или 0,1-0,14 мг/кг 2-часовой в/в инфузией
5 дней подряд. В результате единственного курса терапии кладрибином ремиссии
удается получить у 95-100% больных, в т.ч. у 75-90% — полные, с равной частотой
у ранее не леченных больных, больных с рецидивом после другого лечения и у реф-
рактерных ко всей предыдущей терапии. Продолжительность полученных ремиссий
без поддерживающего лечения в среднем составляет 5-6 лет при полной ремиссии
и 3-3,5 года — при частичной. Повторные курсы терапии кладрибином при рецидиве
ВКЛ оказываются столь же эффективными.
330 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
Более медленно эффект достигается при лечении другим пуриновым аналогом —
пентостатином (2-дезоксикоформицин). Препарат вводится в/в, для лечения ВКЛ оп-
тимальная доза 4 мг/м2 1 раз в 2 нед. В зависимости от клинических проявлений и
длительности болезни требуется от 4 до 10 введений препарата, после чего для кон-
солидации полученной ремиссии делают еще 2 дополнительные инфузии.
Общая эффективность как у ранее не леченных, так и у леченных составляет 95-
100%, полные ремиссии удается получить у 65-90% больных. Продолжительность
ремиссий без поддерживающего лечения в среднем составляет 5 лет и более. Дли-
тельные многоцентровые исследования показали, что 5-летняя выживаемость при ле-
чении пентостатином составляет 90-92%, причем 85-90% больных живут без реци-
дива в течение 5 лет, 75 % — 6-8 лет.
Некоторые авторы отмечают особенно высокие результаты в тех случаях, когда
было проведено лечение ИФН-а, а непосредственно вслед за этим — кладрибином:
получено 80% полных и 20% частичных ремиссий, 9-летняя общая выживаемость со-
ставила 90 %, безрецидивная — 70%.
Лечение пуриновыми аналогами переносится хорошо, но оба препарата вызыва-
ют миелосупрессию, которая опасна возможным развитием инфекций. Поскольку ос-
новной путь выведения пуриновых аналогов — почки, каждый раз перед применени-
ем пуриновых аналогов необходимо исследовать клиренс креатинина. В полных дозах
препараты назначают при клиренсе выше 70 мл/мин. При клиренсе ниже 70, но выше
30 мл/мин доза препарата должна быть снижена вдвое, при клиренсе менее 30 мл/мин
пуриновые аналоги применяться не должны.
В настоящее время рекомендуется всем больным начинать лечение с 2-3-месячного
введения интерферона 3 млн ME в/м ежедневно, что в большинстве случаев приводит
к нормализации картины крови и, кроме того, уменьшает частоту инфекций при цито-
пении после лечения пуриновыми аналогами. После курса лечения интерфероном на-
значают пуриновые аналоги. При таких недлительных курсах единственным побочным
действием интерферона бывает подъем температуры тела, сопровождающийся озно-
бом и болью в мышцах и суставах после первых 1-3 введений.
Спленэктомия, которая была основным средством терапии до появления интерфе-
рона и пуриновых аналогов, в настоящее время практически не применяется, посколь-
ку у подавляющего числа больных гематологический эффект ликвидации гиперспле-
низма после операции сохраняется не более года.
Сопоставление выживаемости больных ВКЛ при лечении пуриновыми аналогами с
темпами смертности соответственно возрасту в общей популяции показывает, что вы-
живаемость больных ВКЛ при современной терапии практически не отличается от по-
пуляционной.
10.3.8. Макроглобулинемия Вальденстрема
Макроглобулинемия Вальденстрема — опухолевое клоновое заболевание, мор-
фологическим субстратом которого являются зрелые В-лимфоциты, плазматиче-
ские клетки и переходные, так называемые лимфоплазмоцитоидные клетки (клетки
с обильной базофильной цитоплазмой и ядром лимфоцита), при котором имеется ги-
перпродукция моноклонового иммуноглобулина М (IgM) и обусловленная этим повы-
шенная вязкость крови. В классификации ВОЗ 2008 г. заболевание обозначается как
лимфоплазмоцитарная лимфома с вовлечением костного мозга и моноклоновой IgM-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 331
Опухолевые заболевания кроветворной и лимфоидной ткани
гаммапатией. Патологические клетки имеют мутировавшие гены вариабельного реги-
она тяжелых цепей иммуноглобулинов.
Макроглобулинемия Вальденстрема — редкое заболевание, на его долю приходит-
ся около 2 % всех гемобластозов. Заболеваемость составляет 3 случая на 1 млн насе-
ления в год, преимущественно белой расы (на представителей других рас приходится
только 5% больных). Средний возраст заболевших — 63 года, более 60% больных —
мужчины.
Единственный характерный признак в картине крови — повышенная СОЭ, почти
всегда более 30 мм/ч и часто до высоких значений. Количество лейкоцитов обычно
в норме или слегка повышено, но может быть и лейкопения, часто бывает умеренная
анемия и небольшой лимфоцитоз. При биохимическом исследовании крови обнару-
живается гиперпротеинемия, иммунохимический анализ выявляет снижение уровня
IgA и IgG и наличие моноклонового IgM в сыворотке. В моче нередко присутствуют
свободные легкие цепи (белок Бенс-Джонса).
В костномозговом пунктате определяется инфильтрация патологическими клет-
ками, при трепанобиопсии видно, что патологические клетки преимущественно ин-
фильтрируют внутритрабекулярные пространства. Специфических цитогенетических
изменений не обнаружено, у 50% больных обнаруживается делеция длинного плеча
хромосомы 6 (6q-).
Для установления диагноза необходимы и практически всегда достаточны два при-
знака: лимфоплазмоцитарная инфильтрация костного мозга и наличие моноклоново-
го IgM в сыворотке. Подтверждает диагноз характерный иммунофенотип патологиче-
ских клеток: CD19+, CD20+, CD22+, CD5-, CD10-, CD 103-
Наиболее часты жалобы на слабость, снижение аппетита, ночные поты, небольшие
подъемы температуры тела, артралгию, парестезии, ухудшение зрения, головокруже-
ния и (особенно) на кровоточивость слизистых оболочек носа, десен, кожные гемор-
рагии, а иногда — кишечные кровотечения. Кровоточивость не связана с тромбоцито-
пенией и обусловлена повышенной вязкостью крови в связи с большим количеством
белка в плазме, имеющего склонность к полимеризации и образованию комплексов с
другими белками.
Течение болезни в начале обычно медленное, ухудшение связано с усилением кро-
воточивости или с развитием амилоидоза. При современной терапии продолжитель-
ность жизни обычно составляет 7-10 лет, причинами смерти чаще всего оказываются
инфекции в связи со сниженной продукцией нормальных антител.
По IPSS выделяют следующие признаки, на основании которых больные относятся к
определенным прогностическим группам: возраст старше 65 лет, уровень /^-микро-
глобулина более 3 мг/л, уровень моноклонального белка более 70 г/л, уровень гемо-
глобина менее 11,5 г/дл, тромбоцитов менее 100 х 109/л. Пациент относится к группе
низкого риска при наличии одного признака, кроме возраста, к группе высокого ри-
ска — при наличии более двух признаков и в группу промежуточного риска — при на-
личии двух признаков или возрасте старше 65 лет. Эти группы риска коррелируют с
продолжительностью жизни: 5-летняя выживаемость составляет 87 % в группе низко-
го риска, 62% — в группе промежуточного и 25% — в группе высокого.
Лечение
При бессимптомном течении болезни лечение обычно не проводится. Показанием
к началу терапии служит появление клинических симптомов или снижение уровня ге-
моглобина менее 10 г/дл и/или тромбоцитов менее 100 х 109/л. Лечение всегда назна-
чается при высоком уровне моноклонового белка и симптомах, связанных с повышен-
ной вязкостью крови.
332 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Хронические лейкозы
При симптомах гипервязкости до начала XT показаны повторные процедуры плаз-
мафереза. Эффект достигается, если удается удалить 50% циркулирующего IgM при
каждой процедуре. Иногда для ликвидации симптомов гипервязкости достаточ-
но 1-2 процедур. Медикаментозное лечение может проводиться алкилирующими
препаратами, например хлорамбуцилом (Лейкеран) 10 мг/сут под контролем пока-
зателей крови до получения эффекта сокращения размера лимфоузлов, селезенки
и уменьшения лимфоидной инфильтрации костного мозга. Лейкеран для более бы-
строго эффекта может комбинироваться с преднизолоном 20-30 мг/сут. При полу-
чении эффекта назначают поддерживающую терапию лейкераном по 10 мг 1-2 раза
в неделю.
Для достижения более быстрого эффекта можно применять комбинированные схе-
мы, например mini-CHOP или VAD.
mini-CHOP
Циклофосфамид — 300 мг/м2 в/в в 1-5-й день.
Винкристин — 1,4 мг/м2 (не более 2 мг) в/в в 1-й день.
Доксорубицин — 25 мг/м2 в/в в 1-й день.
Преднизолон — 40 мг/м2 внутрь в 1-5-й день.
Интервал между курсами 21 день.
VAD
Винкристин — 0,4 мг/м2 в/в непрерывная инфузия в 1-4-й день.
Доксорубицин — 9 мг/м2 в/в непрерывная инфузия в 1-4-й день.
Дексаметазон — 40 мг/сут в 1 прием в 1-4,9-12 и 17-20-й дни.
Повторение цикла каждые 28 дней, считая от 1-го дня предыдущего цикла.
Могут применяться и другие схемы, используемые в терапии ХЛЛ.
Эффективность лейкерана и указанных курсов комбинированной терапии коле-
блется от 30 до 90% в зависимости от прогностических факторов. В последние годы
стали широко применяться пуриновые аналоги:
Кладрибин — 0,1 мг/кг в/в в течение 2 ч 5 дней подряд, всего 3 цикла с месячным ин-
тервалом. Сообщается о 40-90% частичных ремиссий.
Флударабин — 30 мг/кг в/в или 40 мг/кг внутрь 5 дней подряд, всего 6 циклов с ме-
сячным интервалом. Частота частичных ремиссий, по данным разных публикаций, ко-
леблется от 30 до 100%, их продолжительность — от 6 до 32 мес.
Высокая эффективность обоих препаратов, однако, сочетается с иммуносупрес-
сией, которая может стать причиной развития инфекционных осложнений.
В терапии больных с аутоиммунной нейропатией, анемией или тромбоцитопенией
используется ритуксимаб 375 мг/м2/сут 1 раз в неделю в течение 2-4 мес. Отмечена
очень высокая частота эффекта.
В последние годы стал применяться талидомид 200 мг/сут в качестве начальной дозы
с постепенным увеличением каждые 14 дней до максимальной дозы 600 мг/сут. Эта
схема при макроглобулинемии Вальденстрема обладает выраженной гематологиче-
ской токсичностью, поэтому чаще применяется лечение более низкими дозами: от на-
чальной дозы 50 мг с постепенным увеличением до 200 мг в сутки в сочетании с декса-
метазоном 40 мг 1 раз в неделю. После месячной терапии отмечено 83 % ремиссий, в
т.ч. 30% — полные. Отдельные наблюдения хорошего эффекта получены при исполь-
зовании аналога талидомида — леналидомида. Препарат назначался по 25 мг/сут или
по 15 мг 2 раза в сутки.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 333
Опухолевые заболевания кроветворной и лимфоидной ткани
лтеввививм»яаймйияйй1йявйя0®йайвв»8^^ а г •>- -
Имеются немногочисленные данные о применении аутологичной и аллогенной
трансплантации для больных от 30 до 60 лет. Смертность, связанная с процедурой,
редка, полные и частичные ремиссии достигаются у большинства больных.
10.4. Лимфома Ходжкина
Е. А. Демина
Лимфома Ходжкина (название введено ВОЗ в 2001 г., устаревшие названия: лимфог-
ранулематоз, болезнь Ходжкина) — это опухолевое заболевание, при котором пер-
вично поражается лимфатическая система. Заболевание впервые было описано Тома-
сом Ходжкиным в 1832 г. Заболеваемость лимфомой Ходжкина в России составляет
2,3 случая на 100 000 населения. Болеютлимфомой Ходжкина люди любого возраста,
мужчины заболевают несколько чаще, но женщин больше среди молодых больных.
Пик заболеваемости приходится на возраст 20-35 лет. Отмечавшийся ранее второй
пик в возрасте старше 50 лет после введения в диагностическую практику иммуно-
фенотипирования перестал определяться — у большинства больных в этой возраст-
ной группе выявляются другие варианты крупноклеточных лимфом. Несмотря на то
что описаны редкие случаи заболевания лимфомой Ходжкина в одной семье, реаль-
но высокий риск имеется лишь у монозиготного близнеца больного и только пока они
находятся в молодом возрасте. Это свидетельствует о том, что лишь отдельные случаи
семейной лимфомы Ходжкина могут быть обусловлены генетически.
Существует зависимость между инфицированностью вирусом Эпштейна—Барр и
частотой возникновения лимфомы Ходжкина. Сероположительная реакция на вирус
Эпштейна—Барр достоверно чаще встречается среди больных со смешанно-клеточ-
ным вариантом заболевания (50-70%) и реже при нодулярном склерозе (10-42%).
Опухолевым субстратом лимфомы Ходжкина является гигантская клетка Березов-
ского—Рид—Штернберга (син.: клетка Березовского—Штернберга или Штернберга-
Рид). Клетки Березовского—Рид—Штернберга представляют собой малигнизирован-
ный клон клеток лимфоидного ряда, происходящих из герминального (зародышевого)
центра фолликулов лимфоузла в 95 % случаев, т.е. имеют В-клеточную природу. В 5 %
случаев они Т-клеточные.
Диагноз лимфомы Ходжкина устанавливают исключительно гистологически по би-
опсированному лимфоузлу и считается доказанным только в том случае, если при
гистологическом исследовании найдены специфические многоядерные клетки
Березовского—Рид—Штернберга. В сложных случаях необходимо иммунофенотипи-
рование. Цитологическое исследование является необходимой и очень ценной диаг-
ностической процедурой, но его недостаточно для выбора программы лечения.
В классификации ВОЗ 2001 г. по иммуноморфологическим характеристикам выде-
лено четыре гистологических варианта классической лимфомы Ходжкина:
1) богатый лимфоцитами (5-6% случаев);
2) нодулярный (узловатый) склероз (до 60-80%). В зависимости от клеточного со-
става узелков (нодулей) выделяют два подтипа: смешанно-клеточный (I тип) и с
лимфоидным истощением (II тип). Больные со II типом клеточного состава ноду-
лей имеют худшее течение болезни, у них чаще отмечаются генерализованные
стадии и более короткая выживаемость;
3) смешанно-клеточный (до 15-20%);
4) лимфоидное истощение или подавление по типу диффузного фиброза (или по
так называемому ретикулярному типу) — до 10%.
334 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Лимфома Ходжкина
Все варианты классической лимфомы Ходжкина имеют одинаковый иммунноло-
гический фенотип: CD15+, CD30+, CD20+/-, CD45-, т.е. на поверхности опухолевой
клетки экспрессируются антигены CD15 и CD30, отсутствуют или имеются в неболь-
шом количестве клетки с экспрессией CD20 и отсутствуют клетки, несущие на своей
поверхности маркер CD45.
Отдельно выделена небольшая группа больных, имеющая сходную с классической
лимфомой Ходжкина морфологическую характеристику, но иную иммуннологиче-
скую. Характерные для классической лимфомы Ходжкина маркеры CD 15 и CD30 от-
сутствуют, но на поверхности крупных клеток L и Н (lymphocytic and histiocytic) с мно-
годольчатыми пузырьковидными ядрами экспрессируются антигены CD20+, CD45+,
CD79A+ и ЕМА+. Эта форма болезни получила название нодулярная с лимфоидным
преобладанием лимфома Ходжкина. Течение этого варианта индолентное и при лока-
лизованных стадиях длительное время не прогрессирует и не требует лечения. В по-
следнее время обсуждается вопрос о включении этого заболевания в группу нежодж-
кинских лимфом (НХЛ). Лечение этого варианта проводится по тем же показаниям и
программам, как и классической лимфомы Ходжкина.
Лимфома Ходжкина сопровождается угнетением Т-клеточного иммунитета, что вы-
ражается в высокой частоте герпетических инфекций (herpes zoster развивается у 16 %
больных) с тенденцией к развитию некротических форм и генерализации.
Международная клиническая классификация выделяет четыре стадии лимфомы
Ходжкина.
Стадия I — поражение одной лимфатической зоны или структуры1 (I), а также ло-
кализованное поражение одного экстралимфатического органа или ткани в пределах
одного сегмента с поражением только регионарных лимфоузлов или без них (IE)1 2.
Стадия II — поражение двух или более лимфатических зон по одну сторону диаф-
рагмы (например, средостение — одна зона, при этом корни легких — самостоятель-
ные зоны) или поражение одного экстралимфатического органа или ткани в преде-
лах одного сегмента с поражением регионарных лимфатических узлов и поражением
других лимфатических зон по туже сторону диафрагмы (НЕ). Для II стадии необходимо
указывать число пораженных лимфатических областей, например П4 (о различии по-
нятий «зона поражения» и «область поражения» см. в разделе, посвященном прогно-
стическим группам).
Стадия III — поражение лимфатических узлов или структур по обе стороны ди-
афрагмы, которое может сочетаться с локализованным поражением одного экстра-
лимфатического органа или ткани (II1E), либо с поражением селезенки (IIIS)3, или с
поражением того и другого (IIIE+S). Выделяют поражение верхних абдоминальных
лимфатическихузлов (ворота печени, селезенки, чревные) — ИИ и поражение нижних
абдоминальных (парааортальные, мезентериальные) — 1112.
Стадия IV — диссеминированное (многофокусное) поражение одного или не-
скольких экстралимфатических органов, с или без поражения лимфатических узлов
или изолированное поражение экстралимфатического органа с поражением отда-
ленных (не регионарных) лимфоузлов. Поражение печени и костного мозга — всег-
да IV стадия.
При установлении стадии необходимо дополнительно указывать наличие или отсут-
ствие симптомов интоксикации, к которым относятся ночные профузные поты, повы-
шение температуры выше 38 °C не менее 3 дней подряд без признаков воспалитель-
1 К лимфатическим структурам относятся лимфоузлы, селезенка, кольцо Вальдейера, червеобразный отросток
слепой кишки, пейеровы бляшки.
2 Символом Е обозначается локализованное поражение одного экстралимфатического органа или ткани в преде-
лах одного сегмента (стадии IE, НЕ, IIIE)
3 Поражение селезенки обозначается символом S (стадии IS, IIS, IIIS)
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 335
Опухолевые заболевания кроветворной и лимфоидной ткани
ного процесса, потеря на 10 % массы тела за последние 6 мес. Кожный зуд до расчесов
исключен из симптомов интоксикации.
Наличие хотя бы одного из симптомов интоксикации обозначается символом В (на-
пример стадия НВ), а их отсутствие — символом А.
Кроме стадии и симптомов интоксикации для выбора тактики лечения и его объемау
больных с лимфомой Ходжкина в настоящее время используется группа прогностиче-
ских факторов, так называемые факторы риска, которые в большей или меньшей сте-
пени определяют прогноз заболевания. К ним относятся:
1) массивное поражение лимфоузлов средостения (МТИ > 0,33, МТИ — медиа-
стинально-торакальный индекс — отношение наибольшего размера средин-
ной тени в самом широком ее месте к наибольшему диаметру грудной клетки на
прямой рентгенограмме);
2) поражение 3 или более областей лимфоузлов;
3) ускорение СОЭ > 30 мм/ч при стадии В и СОЭ > 50 мм/ч при стадии А;
4) экстранодальное поражение в пределах, обозначаемых символом Е.
Рецидивы при лимфоме Ходжкина подразделяются на ранние (возникшие в интер-
вале от 3 до 12 мес. после окончания лечения) и поздние (возникшие более чем че-
рез 12 мес. после окончания лечения). Возобновление роста опухоли в исходных зо-
нах или появление новых опухолевых очагов в срок до 3 мес. после окончания лечения
расцениваются как прогрессирование заболевания даже в тех случаях, если во время
лечения или непосредственно после его окончания опухолевые проявления заболе-
вания не выявлялись. Такое разделение имеет большое значение при выборе интен-
сивности лечения рецидива.
Для выбора адекватного объема терапии в план обязательного обследования вхо-
дят:
1) пункция и последующая биопсия лимфатического узла (в сложных случаях с
иммунофенотипированием). Для адекватной диагностики лимфатический узел
должен быть взят целиком, т. к. для качественного заключения морфологу необ-
ходимо видеть структуру всего лимфатического узла;
2) общий анализ крови с формулой, тромбоцитами и СОЭ;
3) биохимический анализ крови с исследованием уровня белка и ЩФ, определени-
ем показателей функционального состояния печени и почек;
4) рентгенография легких, обязательно в прямой и боковой проекциях;
5) КТ с контрастированием грудной клетки с включением шейно-надключичных
и подмышечных областей, а также брюшной полости и малого таза. При не-
возможности выполнения КТ в полном объеме абсолютно обязательно иссле-
дование грудной клетки в случае отсутствия изменений на стандартных рен-
тгенограммах, а также, при очень большом размере лимфатических узлов
средостения, для исключения невидимых при обычной рентгенографии увели-
ченных лимфатических узлов в средостении в первом случае и поражения ле-
гочной ткани и перикарда — во втором;
6) УЗИ всех групп периферических, внутрибрюшных и забрюшинных лимфоузлов,
печени и селезенки, щитовидной железы при больших лимфатических узлах
шеи;
7) трепанобиопсия подвздошной кости для исключения поражения костного мозга
у больных с локализованными I—ПВ стадиями, при III—IV стадиях, а также у боль-
ных с поражением забрюшинных лимфоузлов при любой стадии заболевания;
8) сканирование костей и, при показаниях, рентгенография костей.
В последнее десятилетие КТ шейно-надключичных, подмышечных областей, груд-
ной клетки, брюшной полости, малого таза и паховых областей с контрастировани-
336 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Лимфома Ходжкина
ем стала обязательной для всех больных при установлении стадии заболевания и под-
тверждении ремиссии, особенно полной.
Поскольку объем лучевой терапии определяется до начала лечения, тщательное вы-
полнение указанного объема обследования во многом определяет успех терапевти-
ческой программы.
В 2007 г. Международной рабочей группой (International Working Group) под руко-
водством B.D. Cheson были сформулированы новые критерии эффективности при
лимфоме Ходжкина, базирующиеся на оценке данных КТ и ПЭТ. По этим критери-
ям, полная ремиссия может быть констатирована, независимо от размера остаточной
опухоли, выявленной по данным КТ, если через 3 мес. после окончания лечения ре-
зультаты ПЭТ, позитивные до начала лечения, стали негативны.
Лимфома Ходжкина стала одним из первых онкологических заболеваний, при кото-
ром была показана возможность излечения большой группы больных. Если в начале
1940-х годов 5 лет переживало лишь 5% больных с лимфомой Ходжкина, то при ис-
пользовании комбинированных программ предыдущего поколения 20-летняя безре-
цидивная выживаемость составила 60%, а в группе пациентов с локализованными ста-
диями она достигла 80-90%. Программы последнего поколения позволили получить
10-летнюю общую выживаемость на уровне 80-90% для всех больных, независимо
от стадии заболевания.
Хирургический метод не применяется при лечении лимфомы Ходжкина, т. к. неулуч-
шает эффективности терапии при использовании современных комбинированных хи-
миолучевых лечебных программ. Диагностическая лапаротомия со спленэктомией и
биопсией внутрибрюшных лимфоузлов и печени в настоящее время полностью поте-
ряла свое значение в связи с широким внедрением УЗИ и КТ.
Радикальная лучевая терапия длительное время была основным методом лечения
1—III стадии лимфомы Ходжкина, а до последнего времени этот метод лечения успеш-
но использовался отдельными клиниками лишь в очень небольшой группе больных с
локализованными стадиями и очень благоприятным прогнозом. Это больные с I А—IIА
стадией, преимущественно женщины моложе 40 лет, без факторов риска (см. выше).
Полные ремиссии при использовании радикальной лучевой терапии достигаются у
93-95 % этих больных, 5-летнее безрецидивное течение — у 80-82 %, а 15-летняя об-
щая выживаемость — у 93-98%. Однако в последние годы рандомизированные ис-
следования с длительным наблюдением показали и в этой группе больных преимуще-
ство комбинированной терапии.
В настоящее время основным методом лечения лимфомы Ходжкина является XT, ко-
торая у большинства больных сочетается с лучевой терапией.
Монохимиотерапия применяется крайне редко и исключительно в качестве палли-
ативной терапии у ослабленных пациентов пожилого возраста или у много леченных
больных с гипоплазией костного мозга. В монорежиме может быть использован лю-
бой противоопухолевый агент, эффективный при лимфоме Ходжкина, однако наибо-
лее часто применяют: винбластин 6 мг/м2 еженедельно с последующим удлинением
интервалов до 2-3 нед. после 3-й или 4-й инъекции; натулан 100 мг ежедневно курса-
ми с суммарной дозой 6-8 г; хлорамбуцил 10 мг 5 дней в неделю курсами с суммарной
дозой 400-500 мг. Эффективность монохимиотерапии низкая — 15-30% непродол-
жительных полных ремиссий у первичных больных, однако она нередко обеспечива-
ет довольно длительное удовлетворительное самочувствие и сдерживание прогрес-
сирования лимфомы Ходжкина у тех пациентов, у которых проведение современной
терапии невозможно.
К концу прошлого века было опубликовано несколько исследований, показавших
преимущество программы ABVD перед программой МОРР и ее аналогами по отдален-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 337
Опухолевые заболевания кроветворной и лимфоидной ткани
ным результатам лечения и поздней токсичности (бесплодие, миелоидные лейкозы).
На V Международном симпозиуме по лимфоме Ходжкина в сентябре 2001 г. в г. Кель-
не схема ABVD была признана «золотым стандартом» для первичных больных с благо-
приятным и промежуточным прогнозом — больные с локализованной 1-II стадией и
небольшой опухолевой массой.
Схема первой линии терапии
ABVD
Адриамицин (Доксорубицин) — 25 мг/м2 в/в в 1-й и 14-й дни.
Блеомицин — 10 мг/м2 в/в в 1-й и 14-й дни.
Винбластин — 6 мг/м2 в/в в 1-й и 14-й дни.
ДТИК (имидазол-карбоксамид, дакарбазин, детисен) — 375 мг/м2 в/в в 1-й и 14-й дни.
Интервал между циклами 2 нед.
При применении одной только цикловой ПХТ у больных с любой стадией лимфомы
Ходжкина лечение следует проводить до достижения полной ремиссии, после чего
необходимо провести как минимум два консолидирующих (закрепляющих) цикла.
Полная ремиссия у больных с благоприятным и промежуточным прогнозом после
3 циклов ПХТ достигается не более чем в 50% случаев, а у больных с распространен-
ными стадиями заболевания этот рубеж преодолевается после 6 циклов ПХТ, поэто-
му необходимый минимум всей программы лечения составляет не менее 6 циклов, но
может достигать и 12 циклов.
При использовании только ПХТ полные ремиссии индуцируются у 70-85% боль-
ных, а 20-летняя безрецидивная выживаемость составляет 60%. Однако у 40% боль-
ных возникают рецидивы. В отличие от лучевой терапии, где рецидивы чаще возника-
ют в новых зонах, после ПХТ рецедивы чаще отмечаются в исходных зонах поражения.
Совмещение в одной программе лечения ПХТ с лучевой терапией не только улучши-
ло общую выживаемость больных с лимфомой Ходжкина, но и позволило в 3-4 раза
сократить число рецидивов (до 10-12%).
В последние два десятилетия комбинированное химиолучевое лечение стало мето-
дом выбора для абсолютного большинства больных с лимфомой Ходжкина. Основным
принципом лечения стал тезис: «Объем лечения соответствует объему поражения».
Выделение факторов риска дополнительно к стадии и симптомам интоксикации
разделило больных с лимфомой Ходжкина на три большие группы: больные с ранни-
ми стадиями, среди которых выделяют две группы (с благоприятным и неблагоприят-
ным прогнозом), и группа больных с распространенными стадиями (табл. 10.5), при
этом стадия и симптомы интоксикации, оставаясь ведущими в прогнозе заболевания
и выборе программы лечения, перестали быть единственно определяющими лечеб-
ную тактику.
В связи с тем, что понятие «поражение 3 и более лимфатических областей» неод-
нозначно трактовалось разными исследователями, на V Международном симпозиуме
по лимфоме Ходжкина в сентябре 2001 г. было уточнено, что термином «зона» (region)
обозначаются анатомические зоны, по которым устанавливается стадия заболевания
в соответствии с классификацией Ann-Arbor. По зонам формируются поля для про-
ведения лучевой терапии. Термин «область» (area) — более широкое понятие, область
включает в себя одну или более зон:
правые шейные + правые над-/подключичные лимфоузлы;
левые шейные + левые над-/подключичные лимфоузлы;
лимфоузлы правого/левого корня + медиастинальные;
правые подмышечные лимфоузлы;
338 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Лимфома Ходжкина
Таблица 10.5. Прогностические группы для выбора терапии при лимфоме
Ходжкина
прогностические группы |
Ранние стадии благоприятные Ранние стадии неблагоприятные Стадии распространенные
IA и НА без ФР IA и IB, НВ с ФР: стадия Е ускорение СОЭ* НА с ФР: стадия Е ускорение СОЭ* поражение 3 и более областей** ЛК IIB с ФР: ускорение СОЭ* поражение 3 и более областей** ЛК 1 и НА с ФР: массивное средостение НВ с ФР: массивное средостение стадия Е все больные с III и IV
ФР — факторы риска; ЛК — лимфатические коллекторы.
* СОЭ > 30 мм/ч при стадии В и СОЭ > 50 мм/ч при стадии А
** Объяснение понятия «область» см. в тексте.
И левые подмышечные лимфоузлы;
верхние абдоминальные лимфоузлы (ворот печени, ворот селезенки, чревные);
нижние абдоминальные лимфоузлы (парааортальные и мезентериальные);
правые подвздошные лимфоузлы;
И левые подвздошные лимфоузлы;
И правые паховые + бедренные лимфоузлы;
И левые паховые + бедренные лимфоузлы.
Для лечения больных с I и II стадиями без факторов риска (группа больных с ранни-
ми стадиями и благоприятным прогнозом) используется сокращенная программа ле-
чения, которая включает 2-4 цикла ПХТ по схеме ABVD + облучение только зон исход-
ного поражения в дозе, не превышающей 30-36 Гр. Сокращение числа циклов ПХТ до
2 зависит от возможности проведения полноценного объема обследования перед на-
чалом лечения, включающего КТ-исследование с контрастированием от угла нижней
челюсти до середины бедра. Такая программа лечения позволяет получить 98% пол-
ных ремиссий, 6-летнее безрецидивное течение составляет 94%, 6-летняя общая вы-
живаемость достигает 98-100 %.
Для больных с ранними стадиями и неблагоприятным прогнозом необходим боль-
ший объем терапии. Наиболее распространенной программой служит комбинация
из 4-6 циклов ПХТ по схеме ABVD + облучение зон исходного поражения в дозе не
более 30-36 Гр. Сокращение числа циклов ПХТ до 4 так же, как и в благоприятной
прогностической группе, зависит от возможности проведения полноценного объема
обследования перед началом лечения, включающего КТ-исследование с контрастиро-
ванием от угла нижней челюсти до середины бедра. Такая программа лечения позво-
ляет получить 93-98% полных ремиссий при 79-90% 6-летней выживаемости, сво-
бодной от неудач лечения. В последнее десятилетие облучение всех лимфатических
коллекторов выше диафрагмы и селезенки у этих больных не применяется, т. к., по дан-
ным крупных рандомизированных исследований (и данным РОНЦ), непосредствен-
ные и отдаленные результаты этих программ не отличаются от результатов лечения
по программам с облучением только зон исходного поражения. Как и в предыдущей
группе, использование программ с уменьшенным объемом облучения требует обяза-
тельного и тщательного соблюдения указанного выше объема обследования в клини-
ке, оснащенной современной диагностической аппаратурой, включая компьютерный
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 339
Опухолевые заболевания кроветворной и лимфоидной ткани
томограф. Такой объем обследования необходим для уточнения объема планируемой
лучевой терапии.
Лечение больных с распространенными стадиями лимфомы Ходжкина
С середины 1960-х годов, когда впервые была предложена ПХТ по программе МОРР,
и до начала 1990-х существенных успехов в лечении этой группы больных достигнуто
не было. При применении любых стандартных схем ПХТ первой линии типа МОРР или
ABVD и их комбинаций ремиссии достигаются в 60-80% случаев, однако 5-7-летняя
выживаемость не превышает 70%.
В середине 1990-х годов был предложен другой принцип интенсификации лече-
ния больных с лимфомой Ходжкина с распространенными стадиями: для программ
первой линии сокращение интервала между курсами ПХТ или увеличение разовых и
курсовых доз базовых препаратов с последующим облучением зон массивного пора-
жения в сниженных до 30 Гр дозах или остаточных опухолевых масс. Внедрение в кли-
ническую практику КСФ создало благоприятные возможности для таких программ.
В настоящее время у больных с распространенными стадиями преимущественно ис-
пользуется программа первой линии ВЕАСОРР, предложенная Германской группой по
изучению лимфомы Ходжкина (German Study Hodgkin’s Lymphoma Group, GSHG). Было
предложено три варианта этой программы: ВЕАСОРР-базовый, ВЕАСОРР-эскалиро-
ванный и ВЕАСОРР-14.
ВЕАСОРР-базовый (для эскалированного варианта дозы препаратов указаны в скоб-
ках)
Циклофосфамид — 650 мг/м2 (1250) в/в в 1-й день.
Доксорубицин — 25 мг/м2 (35) в/в в 1-й день.
Этопозид — 100 мг/м2 (200) в/в в 1 —3-й день.
Прокарбазин — 100 мг/м2 внутрь в 1-7-й день (возможна замена на дакарбазин
375 мг/м2 в/в в 1-й день).
Преднизолон — 40 мг/м2 внутрь в 1-14-й день.
Винкристин — 1,4 мг/м2 в/в в 8-й день.
Блеомицин — 10 мг/м2 в/в в 8-й день.
Для программы ВЕАСОРР-эскалированный необходимо плановое использование КСФ
в стандартных дозах с 10-го дня до восстановления числа лейкоцитов до 3000.
Повторение цикла каждые 21 день.
Программа ВЕАСОРР-базовый редко требует поддержки КСФ. В программе
ВЕАСОРР-14 используются те же дозы химиопрепаратов, что и в ВЕАСОРР-базовый,
но в 9-13-й день вводятся КСФ в стандартных дозах, благодаря чему цикл возобновля-
ется на 15-й день.
Проводится 8 циклов XT и затем лучевая терапия в дозе 36-40 Гр на остаточные лим-
фоузлы и/или зоны исходно больших опухолевых масс.
Частота полных ремиссий во всех этих программах превысила 90%, 10-летняя вы-
живаемость, свободная от неудач лечении, по данным рандомизированного иссле-
дования GSHG, достигла 70% при ВЕАСОРР-базовый и 82% при ВЕАСОРР-эскали-
рованный, а 10-летняя общая выживаемость составила 80 и 86% соответственно.
Однако токсичность программы ВЕАСОРР-эскалированный оказалась выше и 73 боль-
ных не получила всего объема лечения. Эффективность программы ВЕАСОРР-14 ока-
залась аналогичной таковой ВЕАСОРР-эскалированный при токсичности, сравнимой с
ВЕАСОРР-базовый. Кроме того, программа ВЕАСОРР-14 имеет дополнительное преи-
340 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Лимфома Ходжкина
мущество: она на 6 нед. короче программ ВЕАСОРР-базовый и ВЕАСОРР-эскалирован-
ный. В последнее время предпочтение отдается программе ВЕАСОРР-14.
Применение современных интенсивных программ терапии у больных с лимфомой
Ходжкина исключило необходимость проведения поддерживающего лечения в лю-
бом виде.
При использовании современных программ лечения рецидивы возникаюту 10—15%
больных в зависимости от исходной стадии заболевания и прогностических призна-
ков. Из общего числа рецидивов половина возникают в первый год после окончания
лечения (ранние рецидивы), еще 20-25% — в течение второго года, остальные реци-
дивы наблюдаются позже без какой-либо закономерности.
Легче всего поддаются повторному лечению рецидивы лимфомы Ходжкина, воз-
никшие после радикальной лучевой терапии, и поздние рецидивы, появившиеся после
многолетних ремиссий. Частота повторных полных ремиссий при рецидивах, возник-
ших после радикальной лучевой терапии, составляет 90% при использовании любо-
го режима ПХТ первой линии, в результате длительная безрецидивная выживаемость
достигает 60-70%. Частота повторных полных ремиссий в группе больных с поздни-
ми рецидивами достигает 75%, а 10-летнее безрецидивное течение в группе с повто-
ром, полной ремиссией — 45 %, однако длительная общая выживаемость почти вдвое
ниже из-за вторичных миелолейкозов, других опухолей и иных осложнений, связан-
ных с повторным лечением.
Больные с лимфомой Ходжкина и рецидивами после ПХТ или комбинированного
лечения по срокам возникновения рецидива, характеру его течения и ответу на по-
вторное лечение подразделяются натри группы: 1) больные с прогрессированием за-
болевания, не достигшие полной ремиссии после первой программы лечения, или с
полной ремиссией менее 3 мес. после окончания лечения; 2) больные, у которых пол-
ная ремиссия сохранялась более 3 мес., но менее 1 года; 3) больные, у которых полная
ремиссия сохранялась более 1 года. Медиана выживаемости после рецидива состав-
ляет в этих группах 1,3, 2,6 и 4,3 года соответственно. При использовании XT первой
линии, в т.ч. программы ВЕАСОРР после программы ABVD, повторные полные ремис-
сии достигаются лишь у 10-15 % больных первых двух групп и у 50-85 % больных, если
первая ремиссия длилась более года. Пережить 20-летний рубеж после повторного
лечения в группе больных с первой ремиссией продолжительностью менее года мо-
гут лишь 11 % больных и 24% больных в группе с ремиссией, длившейся более года.
Применение схем второй линии позволяет увеличить частоту полных ремиссий у
больных с ранними рецидивами лимфомы Ходжкина до 25-40% (схемы СЕР, B-CAV,
CEVD, Dexa-BEAM и др.), однако 3-летнее безрецидивное течение наблюдается лишь у
10-30% больных. За последние 30 лет предложено немало схем второй линии, одна-
ко эффективность их остается на прежнем уровне.
В последние два десятилетия для лечения этой группы больных все шире исполь-
зуется высокодозная XT под защитой пересадки аутологичного костного мозга и/или
аутологичных клеток-предшественников кроветворения из периферической крови.
Основными показаниями для высокодозной XT являются первый ранний и второй ре-
цидивы. Применение этого метода лечения у первично-резистентных больных и боль-
ных в третьем и последующих рецидивах менее успешно. Лечение состоит из двух эта-
пов. На первом этапе проводится индукционная терапия 2-4 циклами ПХТ по одной из
схем второй линии. В последние годы для этой цели предложены схемы второй линии
ICE, IGEV, DHAP, ASHAP, Dexa-BEAM (см. далее). После достижения полной или частич-
ной ремиссии длительностью не менее 4 нед. проводится мобилизация клеток-пред-
шественников кроветворения КСФ, сбор клеток-предшественников кроветворения из
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 341
Опухолевые заболевания кроветворной и лимфоидной ткани
периферической крови и/или эксфузия костного мозга, а затем проводится высоко-
дозный этап.
Наиболее распространенными режимами высокодозной терапии являются схемы
BEAM и CBV.
BEAM
Кармустин (BCNU) — 300 мг/м2 в 1-й день.
Этопозид — 100-200 мг/м2 во 2 - 5-й день.
Цитарабин (Цитозар) — 200-400 мг/м2 во 2 - 5-й день.
Мелфалан — 140 мг/м2 в 6-й день.
Возвращение клеток-предшественников кроветворения периферической крови
и/или аутомиелотрансплантация проводятся в 7-й день.
CBV
Циклофосфамид — 1,5 г/м2 в 1-4-й день.
Этопозид — 100-150 мг/м2 каждые 12 ч в 1-3-й день, 6 введений.
Кармустин (BCNU) — 300 мг/м2 в 1-й день.
Возвращение клеток-предшественников кроветворения периферической крови
и/или аутомиелотрансплантация проводятся в 5-й день.
Противопоказания для высокодозной XT: отсутствие стойкой (менее 4-6 нед.) пол-
ной или частичной ремиссии, статус по ECOG > 2 баллов, снижение сердечного вы-
броса до 60% и менее, наличие функциональной легочной недостаточности, некон-
тролируемая инфекция.
Индукционная терапия по любым схемам второй линии проводится в обычных хи-
миотерапевтических или гематологических отделениях, но высокодозный этап мо-
жет выполняться только в специализированных отделениях, имеющих соответствен-
но обученный медицинский персонал и соответствующее оборудование.
Эти программы лечения позволили увеличить число полных ремиссий до 60-80%,
3-летнюю безрецидивную выживаемость до 40-60%, однако различия в 5-летней
общей выживаемости менее значимы, т.к. многие больные после неудачи лечения по
программам второй линии получают высокодозную XT во втором или последующем
рецидиве.
Следующие схемы второй линии используются преимущественно для индукции ре-
миссии перед высокодозной XT.
IGEV
Ифосфамид — 2000 мг/м2 в 400 мл 0,9% раствора натрия хлорида в/в 6-часовая инфу-
зия ежедневно в 1-4-й день.
Необходимо поддержание щелочной реакции мочи (pH > 7,4), что обычно достига-
ется введением 200 мл 4,2% раствора натрия гидрокарбоната перед началом введе-
ния ифосфамида. Для защиты слизистой оболочки мочевого пузыря от воздействия
ифосфамида используется месна (Уромитексан) в общей дозе 100% от дозы цитоста-
тика. Введение месны проводится по следующей схеме: 50% от суточной дозы в/в ка-
пельно с обычной скоростью параллельно инфузии ифосфамида (возможно введение
в одном флаконе с ифосфамидом). После окончания инфузии ифосфамида рекомен-
дуется в/в капельное введение месны в дозе 25 % от дозы ифосфамида через 4 и 8 ч.
Гемцитабин (Гемзар) — 800 мг/м2 в 400 мл 0,9% раствора натрия хлорида в/в капельно
в течение 30 мин в 1-й и 4-й дни.
342 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Лимфома Ходжкина
Винорелбин (Навельбин) — 20 мг/м2 в 100-150 мл 0,9% раствора натрия хлорида в/в
капельно в течение 6-8 мин в 1 -й день.
Преднизолон — 100 мг/м2 внутрь в 1-4-й день терапии с постепенной отменой за
3-4 дня.
Повторение цикла на 21-28-й день, считая от 1-го дня предыдущего цикла.
ICE
Ифосфамид — 5000 мг/м2 в/в 12-часовая инфузия во 2-й день + месна (см. схему 1GEV).
Карбоплатин — AUC 5 (не более 800 мг) в/в капельно во 2-й день.
Этопозид — 100 мг/м2 в/в в 1-3-й день.
Повторение цикла на 21-28-й день, считая от 1-го дня предыдущего цикла.
ASHAP
Доксорубицин — 10 мг/м2 в/в длительная инфузия в 1-4-й день.
Цисплатин — 25 мг/м2 в/в длительная инфузия в 1 -4-й день (водная нагрузка в соответ-
ствии с инструкцией по введению цисплатина).
Цитарабин — 1500 мг/м2 в/в 2-часовая непрерывная инфузия в 5-й день.
Метилпреднизолон — 500 мг/м2 в/в 15-минутная инфузия в 1-5-й день.
Повторение цикла на 21-28-й день, считая от 1-го дня предыдущего цикла.
DHAP
Дексаметазон — 40 мг/м2 в/в ежедневно в 1-5-й день.
Цитарабин — 2000 мг/м2 в/в 2 раза в сутки во 2-й день.
Цисплатин — 100 мг/м2 в/в 24-часовая непрерывная инфузия в 1-й день (водная на-
грузка в соответствии с инструкцией по введению цисплатина).
Повторение цикла на 21-28-й день.
Dexa-BEAM
Дексаметазон — 8 мг внутрь 3 раза в сутки в 1-10-й день.
Кармустин (BCNU) — 60 мг/м2 в/в во 2-й день или
Ломустин (CCNU) — 80 мг/м2 в/в во 2-й день.
Мелфалан — 20 мг/м2 в/в в 3-й день.
Этопозид — 200 мг/м2 в/в в 4-7-й день.
Цитарабин (Цитозар) — 100 мг/м2 в/в каждые 12 ч в 4-7-й день.
КСФ — в 8-18-й день.
Повторение цикла на 28-й день.
Примечания:
1. За 48 ч до начала и весь период проведения цикла ПХТ рекомендуется при-
ем аллопуринола в дозе 600 мг в сутки, при этом суточный объем мочи должен
быть адекватным, а реакция мочи — нейтральной или слегка щелочной. При по-
чечной недостаточности доза аллопуринола корректируется соответственно
уровню креатинина.
2. Одним из методов форсированного диуреза для поддержания полиурии выше
2000 мл/сут может быть суммарная водная нагрузка 2000-3000 мл/м2 (раствор
Рингера, 5% раствор глюкозы, 0,9% раствор натрия хлорида) с введением диуре-
тиков по показаниям. В суммарную водную нагрузку входит все выпитое количе-
ство жидкости и вся жидкость, введенная парентерально.
3. Во время цикла ПХТ необходимо ежедневное введение антиэметиков (ондансе-
трон, гранисетрон и т. д.).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 343
Опухолевые заболевания кроветворной и лимфоидной ткани
4. С целью защиты слизистой оболочки ЖКТ в период приема преднизолона реко-
мендован прием омепразола (либо париета) в дозе 20 мг/сут.
5. Рекомендуется применение Г-КСФ (нейпоген в дозе 5 мкг/кг или его аналоги в
адекватных дозах) при наличии стандартных показаний: лейкопения ниже 1000
и лимфопения ниже 300 или лейкопения III степени, сопровождающаяся фе-
брильной лихорадкой.
6. Рекомендовано резко ограничить соки, морсы, свежие фрукты и овощи, а также
прием препаратов, включающих высокие дозы аскорбиновой кислоты, исклю-
чить не подвергавшиеся термической обработке продукты. Питьевой режим —
слабощелочные минеральные воды.
Целесообразно начинать питьевую водную нагрузку 2000-3000 мл/сут за 1-2 дня
до начала XT.
При лечении повторных рецидивов в зависимости от времени их возникновения и
предшествующей терапии используют схемы как первой, так и второй линии. Одна-
ко каждый следующий рецидив снижает шансы больного на долговременную выжи-
ваемость: 10-летний рубеж переживает менее 10% больных с четвертым рецидивом
лимфомы Ходжкина.
B-CAVe
Блеомицин — 5 мг/м2 в в/в 1, 28 и 35-й дни.
Ломустин (CCNU) — 100 мг/м2 внутрь в 1-й день.
Доксорубицин (Адриамицин) — 50 мг/м2 в/в в 1-й день.
Винбластин — 6 мг/м2 в/в в 1-й день.
Повторение цикла на 42-й день.
ABD1C
Доксорубицин — 45 мг/м2 в/в в 1-й день.
Блеомицин — 5 мг/м2 в/в ежедневно в 1-5-й день.
Дакарбазин — 200 мг/м2 в/в ежедневно в 1-5-й день.
Ломустин — 50 мг/м2 внутрь в 1-й день.
Этопозид — 40 мг/м2 с в/в ежедневно в 1-5-й день.
Повторение цикла на 28-й день.
Поскольку у большинства больных с множественными рецидивами затруднен доступ
к периферическим венам, ниже приводится несколько пероральных схем второй ли-
нии.
Схемы с пероральным применением химиопрепаратов
СЕР (пероральная модификация)
Преднизолон — 40 мг/м2 внутрь ежедневно в 1-7-й день.
Этопозид — 100 мг/м2 внутрь ежедневно в 1-3-й день.
Ломустин (CCNU) — 80 мг/м2 внутрь в 1-й день.
Хлорамбуцил (Лейкеран) — 20 мг/м2 внутрь ежедневно в 1-4-й день.
Повторение цикла на 28-35-й день.
СЕМ
Ломустин — 80 мг/м2 внутрь в 1-й день.
Этопозид — 100 мг/м2 внутрь в 1-3-й и 21-23-й дни.
Метотрексат — 30 мг/м2 внутрь в 1,8, 21 и 28-й дни.
Повторение цикла на 42-й день.
344 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
CAVP
Ломустин — 80 мг/м2 внутрь в 1-й день.
Мелфалан (Алкеран) — 7,5 мг/м2 внутрь ежедневно в 1 -5-й день.
Этопозид — 100 мг/м2 внутрь ежедневно в 6-10-й день.
Преднизолон — 100 мг/м2 внутрь ежедневно в 1-10-й день.
Повторение цикла на 42-й день.
Возможно использование других схем.
Течение лимфомы Ходжкина у больных старших возрастных групп имеет свои осо-
бенности. Это связано с поздней обращаемостью больных, большим числом генера-
лизованных стадий и меньшим объемом обследования. Эффективность моно- и поли-
химиотерапии в сниженных дозах невысока, однако при адекватном обследовании и
применении современных программ лечения, а также у пациентов старше 60 лет мож-
но получить до 70-80 % полных ремиссий, при этом у больных с локализованными ста-
диями 5-летняя выживаемость достигает 90%. Лечение этой группы пациентов требу-
ет значительно большего объема сопутствующей терапии и внимания врача.
Реальная возможность выздоровления большого контингента молодых больных по-
ставила перед врачами совершенно новую проблему — возможность беременности
и родов у излечившихся от лимфомы Ходжкина женщин — и в связи с этим задачу за-
щиты яичников от повреждающего действия химиопрепаратов, в первую очередь от
алкилирующих препаратов. С этой целью назначают гормональные препараты, подав-
ляющие овуляцию. У молодых женщин до 25 лет возможно назначение низкодозиро-
ванных пероральных контрацептивов (регулон, новинет, марвелон, марселон), а у па-
циенток старше 25 лет предпочтительнее назначение агонистов LH-RH (гозерелин,
бусерелин), подбор которых должен осуществлять гинеколог. Препараты назначают
до начала XT, и прием их осуществляется непрерывно все время проведения лечения.
Последующая отмена согласуется с гинекологом.
Как показал опыт ряда отечественных и зарубежных клиник, беременность и роды
в период стойкой ремиссии не отягощают прогноза болезни. Частота рецидивов лим-
фомы Ходжкина у женщин, рожавших в полной ремиссии, составляет только 14%, что
не превышает числа рецидивов в популяции больных с лимфомой Ходжкина в целом.
Число рецидивов ниже (лишь 9%) в группе пациенток, находившихся в полной ремис-
сии более 3 лет, но достигает 44% у женщин, рожавших в течение первых 3 лет после
окончания лечения, что соответствует распределению частоты рецидивов в эти же сро-
ки во всей популяции больных с лимфомой Ходжкина. Кроме того, в первые 3-5 лет по-
сле окончания лечения у больных лимфомой Ходжкина сохраняется высокая частота
вирусных и бактериальных инфекций, что связано с медленным восстановлением им-
мунной системы и неблагоприятно сказывается на течении беременности и здоровье
ребенка. Таким образом, следует предупреждать женщин о нежелательности бере-
менности в первые 3-5 лет после окончания лечения. Частота патологии у детей, ро-
жденных матерями, перенесшими лимфому Ходжкина и ее лечение, не выше, чем в
общей популяции здоровых женщин.
10.5. Неходжкинские лимфомы
И. В. Поддубная
НХЛ (син.: злокачественные лимфомы, лимфосаркомы) представляют собой разно-
родную группу злокачественных опухолей, различающихся между собой по морфо-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 345
Опухолевые заболевания кроветворной и лимфоидной ткани
логическому строению опухолевой ткани, иммунному типу, клиническим проявлени-
ям, ответу на лечение и прогнозу. Они развиваются из одиночного опухолевого узла и
распространяются путем гематогенного и/или лимфогенного метастазирования.
НХЛ болеют люди любого возраста — с раннего детства до глубокой старости. Про-
должительность жизни больных колеблется в широких пределах в зависимости от
клинических и иммуноморфологических вариантов лимфом: 5-летняя выживаемость
пациентов с прогностически благоприятными вариантами лимфом превышает 80%, с
неблагоприятными — не достигает и 30%. Заболеваемость лимфомами за последние
годы имеет тенденцию к неуклонному росту.
Распространение НХЛ происходит по-разному в зависимости от локализации пер-
вичного поражения. Для определения распространенности процесса использует-
ся Анн-Арборская классификация, предложенная в 1971 г. для лимфомы Ходжкина и
адаптированная для НХЛ. Она наиболее приемлема для лимфом с первичным пораже-
нием лимфоузлов. Для лимфом некоторых других локализаций в нее внесены поправ-
ки. Определение распространенности процесса базируется не на принципах Анн-Ар-
борской классификации при НХЛ ЖКТ, лимфоме Беркитта и др. Клиническая стадия
и степень распространения должны быть установлены самым тщательным образом с
включением в план обследования кроме таких общепринятых методов, как фиброла-
рингоскопия, гастроскопия, КТ грудной клетки, КТ и УЗИ органов и лимфоузлов брюш-
ной полости, забрюшинного пространства, пахово-подвздошной областей, обязатель-
но — исследование аспирата и трепаната костного мозга, по показаниям — пункция
печени, сканирование лимфоузлов с галлием и костей с технецием.
Определение иммуноморфологического варианта НХЛ основано на критериях об-
новленной классификации ВОЗ 2008 г.
Течение болезни зависит от клинических и молекулярно-биологических особенно-
стей опухоли.
Лимфомы разделены на индолентные (медленно протекающие) и в разной степе-
ни агрессивные, близкие по характеру и понятиям прежним лимфомам низкой, про-
межуточной и высокой степени злокачественности; морфологически индолентные —
преимущественно зрелоклеточные, мелкоклеточные, а агрессивные — бластные,
крупноклеточные (табл. 10.6). Сроки жизни нелеченных больных с длительно проте-
кающими лимфомами исчисляются годами (медиана 7-10 лет), агрессивными — меся-
цами и даже неделями (медиана 1,5-2 года).
Для определения прогноза у больных НХЛ был разработан специальный междуна-
родный прогностический индекс (МПИ). Выделено пять неблагоприятных прогности-
ческих факторов: возраст (старше 60 лет), стадия (III—IV), общее состояние больного
(2-4 балла по шкале ECOG), число зон экстранодального поражения (более 1), повы-
шение уровня ЛДГ в сыворотке крови. По числу этих показателей составлены груп-
пы низкой (0-1 фактор), промежуточной/низкой (2 фактора), промежуточной/высо-
кой (3 фактора) и высокой (4-5 факторов) степени риска раннего прогрессирования
и неудач лечения.
Однако этот единый прогностический индекс не смог отразить все особенности
большого разнообразия иммуноморфологических и клинических вариантов НХЛ.
Позднее МПИ был уточнен для пожилых пациентов (адаптирован к возрасту), раз-
работаны прогностические шкалы для фолликулярной лимфомы (FLIPI), для лимфом
зоны мантии, выделены прогностические факторы для отдельных вариантов болезни
(яичка, кожи, желудка, грибовидного микоза и др.).
По совокупности прогностических признаков, согласно существующим моделям,
можно предсказать не только прогноз болезни, но и результат лечения. Кроме обо-
значенных в МПИ пяти признаков важное прогностическое значение имеют иммуно-
346 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
‘ - р г^ге&^йа&аааааавз^^
Таблица 10.6. Подразделение неходжкинских лимфом в зависимости от
прогноза
Индолентные Агрессивные Высокоагрессивные 1
5-летняя выживаемость
>50% 30-50% <30%
В-клеточные: ХЛЛ/мелкоклеточная лимфоцитарная лимфома Лимфомы маргинальной зоны: Лимфомы селезенки, нодальные Экстранодальные лимфомы (MALT) Фолликулярные лимфомы (1-11 тип) Т-клеточные: Грибовидный микоз Ангиоиммунобластная лимфома (T-, 0-фенотип) Анапластическая крупноклеточная лимфома (ALK+) В-клеточные: Фолликулярная лимфома (111 тип) Диффузная В-крупноклеточная лимфома Первичная медиастинальная В- крупноклеточная лимфома Плазмоцитома/миелома Т-клеточные: Анапластическая крупноклеточная лимфома (ALK-) Т- и В-лимфобластная лим- фома/лейкоз из клеток- предшественников В-клеточные: Лимфома зоны мантии Лимфома Беркитта Т-клеточные: Периферические Т-клеточ- ные лимфомы Тонкокишечная Т-клеточная лимфома
морфологический вариант лимфомы, число зон опухолевого поражения, симптомы
интоксикации (В-симптомы), большой размер отдельных опухолевых образований
(bulky), поражение костного мозга, предшествующее лечение и его результаты.
Для лечения лимфом применяются все виды противоопухолевой терапии.
Хирургическое лечение считалось показанным только при одиночных первич-
ных опухолях ЖКТ. Существовало мнение о целесообразности оперативных вмеша-
тельств при I стадии болезни (после радикальной операции почти 60% больных жи-
вут без рецидивов 5 лет и более). В настоящее время это положение пересмотрено.
Хирургическое вмешательство является I этапом лечения только при отсутствии до-
операционного определения гистогенеза выявленной опухоли ЖКТ.
Лечение установленных иммуноморфологически первичных НХЛ ЖКТ, из которых 2/3
локализуются в желудке, начинается с неоадъювантной лекарственной терапии (схема
XT выбирается в соответствии с иммуноморфологическим диагнозом лимфомы).
Динамическое обследование (последовательно после каждых 2 циклов) определя-
ет лечебную тактику в целом: при нарастающем эффекте продолжается лекарствен-
ная терапия до максимального эффекта; при появлении признаков прогрессирования
обсуждается возможность выполнения хирургического вмешательства с решени-
ем вопроса о дальнейшей терапии в зависимости от объема выполненной операции.
При развитии клинических проявлений НХЛ, требующих экстренного хирургическо-
го вмешательства (кровотечение, перфорация полого органа, кишечная непроходи-
мость), необходимо выполнение операции, возможно паллиативного характера (под-
робно см. разд. 9.8).
Попытки радикального удаления лимфом периферических лимфоузлов, средосте-
ния, кожи, миндалин и других органов и тканей нецелесообразны, т.к. они и без опе-
рации могут быть успешно излечены при использовании химио- и лучевой терапии.
Исключением является селезеночная форма лимфомы маргинальной зоны, частота
которой составляет 20% всех НХЛ маргинальной зоны и 3% всех НХЛ. Возникая пре-
имущественно в возрасте старше 50 лет, опухоль характеризуется спленомегалией и
поражением костного мозга без вовлечения периферических лимфоузлов. Опухоле-
вое поражение селезенки выявляется всегда, независимо от ее размера (даже если
установлено только поражение костного мозга). Существуют отчетливые диагности-
ческие сложности, но при подтверждении этого варианта НХЛ (включая t(l 1 ;14)) спле-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 347
Опухолевые заболевания кроветворной и лимфоидной ткани
.r : * * ir - *
нэктомия — один из основных методов лечения, ау 50 % больных — единственный. Ре-
зультатом спленэктомии является ликвидация цитопении, улучшение качества жизни и
уменьшение опухолевой инфильтрации костного мозга (вплоть до нормализации). На-
ступившие ремиссии длительны. По показаниям дополнением к спленэктомии может
быть монотерапия алкилирующими агентами + ритуксимаб. Обсуждается иммуноте-
рапия (ритуксимаб) как альтернатива спленэктомии, особенно при выраженной цито-
пении, и использование неинтенсивных режимов ПХТ.
Лучевая терапия — эффективный метод лечения лимфом. Местные рецидивы в
зоне облучения редки. Тем не менее лучевая терапия при лимфомах в виде самостоя-
тельного метода лечения применяется редко. Лучевая терапия используется в основ-
ном в комбинации с XT в качестве завершающего этапа лечения.
В виде самостоятельного лечебного подхода лучевая терапия может быть использо-
вана при I (реже — II) стадии фолликулярных лимфом (1-П цитологического типа), I ста-
дии He/zcobacter-негативной MALT-лимфомы желудка. При других иммуноморфологи-
ческих вариантах НХЛ независимо от степени распространенности процесса лучевая
терапия применяется только после окончания индукционного курса химио- или им-
мунохимиотерапии.
Комбинированное химиолучевое лечение всегда следует начинать с XT. Степень ин-
тенсивности комбинированного лечения и выбор метода XT зависят от стадии, имму-
номорфологического варианта лимфомы и времени наступления полной ремиссии.
В определенных клинических ситуациях (ранние (1-П) стадии индолентных лимфом
в сочетании с быстрым наступлением полной ремиссии) количество индукционных
курсов перед лучевым воздействием может быть сокращено до 3-4. Облучению под-
лежат только зоны бывшего поражения. При агрессивных НХЛ лучевую терапию сле-
дует осуществлять по завершении всего индукционного курса лекарственной тера-
пии (6-8 циклов) независимо от времени наступления полного эффекта. Сокращение
объема XT в этих случаях увеличивает риск рецидива.
У пожилых и ослабленных пациентов при наличии противопоказаний к XT может
обсуждаться вопрос о паллиативной лучевой терапии на зоны поражения (СОД 30-
36 Гр), однако результаты лечения будут заведомо хуже.
Химиотерапия — универсальный метод лечения, применяется при всех имму-
номорфологических вариантах, стадиях и локализациях НХЛ. Опухолевые узлы при
лимфомах обнаруживают чувствительность практически ко всем имеющимся проти-
воопухолевым препаратам. Общая эффективность монохимиотерапии каждым пре-
паратом колеблется в широких пределах, но при этом частота полных ремиссий не-
велика (10-30%). При использовании же ПХТ ремиссии развиваются чаще, более
продолжительны. Отчетливое улучшение лекарственной терапии в последние годы
отмечается при применении таргетных препаратов в сочетании с цитотоксической XT:
ритуксимаб (Мабтера) практически при всех вариантах В-клеточных НХЛ, бортезо-
миб (Велкейд) при лимфомах зоны мантии, алемтузумаб (Кэмпас) при НХЛ Т-клеточ-
ного происхождения.
Терапевтическая тактика при НХЛ основывается на иммуноморфологическом вари-
анте лимфомы, распространенности процесса (стадия), локализации первичного оча-
га (клинический вариант болезни в соответствии с классификацией ВОЗ 2008 г.), про-
гнозе и этапе развития болезни (первая линия, лечение рецидива или рефрактерных
форм). Основа успешного лечения — достижение эффекта при проведении первой
линии терапии.
Монохимиотерапия при НХЛ используется нечасто, т. к. доказана возможность уве-
личения эффекта при применении ПХТ практически при всех вариантах НХЛ. Моно-
терапия алкилирующими агентами может быть использована у пожилых больных при
348 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
фолликулярной лимфоме (I-II цитологического типа), модальной лимфоме маргиналь-
ной зоны, когда клинические проявления умеренны, а сопутствующая патология слу-
жит противопоказанием для более интенсивного воздействия.
Полихимиотерапия чаще всего проводится в виде коротких (1-2 нед.) циклов с ин-
тервалом 2-3 нед. Лечение продолжается до полной ремиссии или до тех пор, пока
противоопухолевое действие от цикла к циклу нарастает. Проводимое лечение не
отменяют и не переводят больного на другие методы ПХТ сразу после первого ци-
кла, если он оказался безрезультатным, за исключением случаев, когда заболевание
прогрессирует. Для определения чувствительности опухолевой ткани к каждому кон-
кретному виду ПХТ необходимо провести не менее 2 циклов лечения. Если же и 2 ци-
кла не привели к положительному результату, метод лечения заменяют на другой. Ког-
да опухолевые узлы быстро уменьшаются, а за время перерыва между циклами вновь
увеличиваются, можно говорить о резистентности опухоли и метод лечения должен
быть изменен.
Принципы лечения агрессивных лимфоидных опухолей по сравнению с длитель-
но протекающими индолентными различны. Продолжительность жизни больных с
агрессивными типами лимфом находится в прямой зависимости от результатов ле-
чения, степени выраженности эффекта. Эти больные всегда с самого начала нужда-
ются в активном лечении с целью получения максимального лечебного эффекта при
первой линии терапии — достижение полной ремиссии. Для больных с индолентны-
ми лимфомами зависимость срока жизни от результатов лечения менее заметна. Это
обстоятельство послужило основанием, например, для предложения воздерживать-
ся от лечения до появления выраженной клинической симптоматики при фолликуляр-
ных лимфомах (I-II типа) и в дальнейшем без особой необходимости не интенсифи-
цировать проводимую терапию для непременного достижения полной ремиссии. Тем
не менее, если рассчитывать на выздоровление и хорошее качество жизни, надо стре-
миться достичь полной ремиссии при любом варианте лимфом.
В связи с различной встречаемостью большое число иммуноморфологических ва-
риантов лимфом на практике сводится к лечению нескольких видов опухолей, т. к. ча-
стота диффузной В-крупноклеточной лимфомы составляет более 30%, фоллику-
лярных лимфом — 22-25%, лимфом маргинальной зоны — 7-8%, периферических
Т-клеточных — 7 %. Другие варианты встречаются с меньшей частотой.
Опухоли агрессивные и высокоагрессивные обычно быстро растут и бурно про-
грессируют, поэтому для них с самого начала (индукция первой ремиссии) требуется
интенсивное, быстродействующее лечение — ПХТ. Следует помнить, что целью лече-
ния любого иммуноморфологического варианта НХЛ является достижение макси-
мального эффекта. Однако при агрессивных лимфомах (диффузной В-крупноклеточ-
ной, анапластической Т/О-фенотипа ALK-негативной, лимфоме Беркитта и др.) только
достижение полной ремиссии считается эффективным лечением; достижение же ча-
стичной ремиссии относится к неэффективной терапии.
При схожести лечебной тактики при агрессивных и индолентных лимфомах терапия
каждого варианта имеет свои особенности.
Диффузная В-крупноклеточная лимфома. У первичных больных с диффузной В-
крупноклеточной лимфомой в первой линии терапии рекомендуется использование
6-8 курсов иммунохимиотерапии (R-CHOP-21, R-CHOP-14, R-EPOCH-21, R-EPOCH-14).
Основываясь на данных об эффективности и токсичности, в настоящее время при-
знано целесообразным у больных в возрасте до 60 лет применять схемы с этопо-
зидом (R-EPOCH); при благоприятном прогнозе — схему R-EPOCH-21, а при неблаго-
приятном прогнозе (наличие более 3 неблагоприятных факторов прогноза, большие
опухолевые массы — более 10 см в диаметре, тестикулярная лимфома) — R-CHOP-14,
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 349
Опухолевые заболевания кроветворной и лимфоидной ткани
1ил1лммиипмм1мп1ип1мппшнм^^ rrrtt.v* \\ иъ v 1 ••
CHOP-14, R-EPOCH-14. Схема R-EPOCH оказывается высокотоксичной у пожилых па-
циентов. Уменьшение длительности интервала положительно сказывается на резуль-
татах. Сокращение интервала до 10 дней в схемах R-CHOP-14, R-EPOCH-14 требует
осуществления лечения с обязательным профилактическим применением КСФ- фил-
грастима сразу после 1-го курса (нейпоген, неуластим, лейкостим) в стандартной дозе
в 6-11-й день каждого цикла. Завершается лечение лучевой терапией (30-36 Гр). По-
казаниями к лучевой терапии (локальная лучевая консолидация) служат зоны больших
опухолевых масс (> 10 см, bulky), экстранодальные зоны и остаточные опухоли более
2 см. На зоны больших опухолевых масс доза лучевой терапии увеличивается до 30-
40 Гр и осуществляется независимо от стадии болезни.
При начальных стадиях (HI) и благоприятном прогнозе возможна модификация те-
рапевтической тактики: проведение 3-4 курсов R-CHOP-21 с последующей лучевой
терапией (30-36 Гр).
При наличии неблагоприятных прогностических факторов и, особенно, у молодых
пациентов в качестве консолидации первой полной ремиссии целесообразно прове-
дение высокодозной XT.
Достижение частичной ремиссии и прогрессирование болезни служат показани-
ем для проведения лечения схемами второй линии. Терапия неэффективно леченных
больных аналогична таковой при рецидивах и рефрактерных формах болезни. В этих
клинических ситуациях обсуждается возможность проведения высокодозной XT с
последующей аутологичной трансплантацией стволовых клеток (реже — аллогенной
трансплантацией) и в зависимости от эффективности схемы второй линии различают-
ся. При планировании высокодозной XT для достижения полной или частичной ремис-
сии используют схемы DHAP, ESHAP, GDP, GemOx, ICE, MINE, mini-BEAM; возможно
добавление ритуксимаба к любой из комбинаций. Если высокодозная XT не планиру-
ется (больной не является кандидатом), то применяются следующие схемы второй ли-
нии: СЕРР, РЕРС, EPOCH + ритуксимаб и паллиативная лучевая терапия.
Из-за отсутствия большого мирового опыта по индивидуализации лечения различ-
ных морфоиммунологических вариантов НХЛ тактика ведения больных с диффузной
В-крупноклеточной лимфомой служит основой для лечения других вариантов агрес-
сивных опухолей.
Своеобразный агрессивный вариант НХЛ — лимфома зоны мантии. Прогноз бо-
лее благоприятен у больных при поражении селезенки, костного мозга, наличии опу-
холевых клеток в периферической крови без лимфаденопатии — так называемый ин-
долентный вариант лимфомы зоны мантии. При лимфоме зоны мантии необходима
интенсификация лечения, особенно у молодых пациентов: первая линия терапии —
R-Hyper-CVAD/R-MA, R-EPOCH, R-maxi-CHOP/R-A. Включение в схемы антрациклинов
достаточно эффективно. Добавление ритуксимаба к любой из схем ПХТ оправдано и
повышает результативность. Завершением лечения может быть локальная лучевая те-
рапия на исходные зоны поражения в дозе 30-36 Гр. Лечение пожилых больных более
щадящее: использование R+CHOP, модифицированная схема Hyper-CVAD с последу-
ющей поддерживающей терапией ритуксимабом в монорежиме. Оптимистично при-
менение кладрибина в сочетании с ритуксимабом. Задачей первичной терапии ман-
тийноклеточной НХЛ является достижение полной ремиссии. Для лечения рецидивов
и рефрактерных форм болезни (терапия второй линии) следует использовать кладри-
бин, бортезомиб, ПХТ (FC, FCMR, FMR, РЕРС и др.). Получены предварительные, но убе-
дительные данные о целесообразности проведения поддерживающей монотерапии
ритуксимабом как в первой линии, так и при достижении эффекта во второй линии.
Также с целью консолидации эффекта возможно осуществление высокодозной XT с
поддержкой аутологичной или аллогенной трансплантацией ГСК.
350 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
Наиболее продолжительно и интенсивно лечение лимфомы Беркитта. Склон-
ность к раннему гематогенному распространению и необходимость достижения пол-
ной ремиссии именно у первичных больных требуют проведения интенсивной тера-
пии. Традиционно в течение многих лет эффективно применяется не менее 6 блоков
альтернативных циклов (A/В, A/В, А/В) — протокол BFM-90 (табл. 10.7).
Таблица 10.7. Протокол BFM-90
Блок Препарат Доза и режим введения День введения 1
Префаза Циклофосфамид Преднизолон 200 мг/м2 в/в 20 мг/м2 внутрь 3 раза в сутки 1-5-й 1-5-й
СразуШзза
БлокА Винкристин Метотрексат Ифосфамид Этопозид Цитарабин Дексаметазон 2 мг в/в 3000 мг/м2 в/в 3-часовая инфузия с фолинатом кальция(Лейковорин) 800 мг/м2 в/в 1-часовая инфузия в сочетании с ме- сной 100 мг/м2 в/в 150 мг/м2 в/в 2 раза в сутки 10 мг/м2 внутрь 1-й 1-й 1-5-й 4-й, 5-й 4-й, 5-й 1-5-й
Блок В Винкристин Метотрексат Циклофосфамид Доксорубицин Дексаметазон 2 мг в/в 3000 мг/м2 в/в 3-часовая инфузия с фолинатом кальция (Лейковорин) 200 мг/м2 в/в 25 мг/м2 в/в 5-минутная инфузия 10 мг/м2 внутрь 1-й 1-й 1-5-й 4-й, 5-й 1-5-й
БлокС (завершающий) Виндезин Цитарабин Этопозид Дексаметазон 3 мг в/в 200 мг/м2 в/в 3-часовая инфузия 2 раза в сутки 150 мг/м2 в/в 1-часовая инфузия 10 мг/м2 внутрь 1-й 1-й, 2-й 3-5-й 1-5-й
Интратекальная профилактика поражения ЦНС в 1-й и 5-й дни каждого блока.
Строго обязательна профилактика СЛО. Основным видом профилактики поражения
ЦНС является интратекальное введение метотрексата и цитарабина.
Лучевая терапия (краниальное и краниоспинальное облучение) не является адекват-
ным профилактическим мероприятием и не имеет преимуществ перед интратекаль-
ной XT — констатировано развитие большого числа ранних рецидивов в ЦНС и увели-
чение отдаленных токсических повреждающих эффектов.
В настоящее время появились модифицированные, но не менее интенсивные ре-
жимы и определение вариантов лечения в зависимости от прогноза. При лимфоме
Беркитта к низкому риску относятся нормальная активность ЛДГ, наличие одиночной
экстраабдоминальной опухоли размером менее 10 см и выполнение радикальной ре-
зекции абдоминальной опухоли.
Для больных с низким риском рекомендуется лечение по одной из следующих про-
грамм: R-CODOX-M, R-Hyper CVAD/R-MA, R+EPOCH. При невозможности проведения
более интенсивных режимов и высоком риске рекомендуется R-CODOX-M/R-IVAC
или схемы, используемые при низком риске. Лечение должно сопровождаться про-
филактикой СЛО и обязательным интратекальным введением метотрексата. При вы-
соком риске раннего прогрессирования в качестве консолидации достигнутой полной
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 351
Опухолевые заболевания кроветворной и лимфоидной ткани
ремиссии возможно проведение высокодозной XT. При отсутствии полной ремиссии
прогноз неблагоприятный, эффективной терапии второй линии практически нет, об-
суждается использование высокодозной XT с поддержкой аутологичной или аллоген-
ной трансплантацией ГСК и паллиативной лучевой терапии.
Первичная медиастинальная (В-клеточная) лимфома клинически характеризует-
ся обширным поражением преимущественно лимфоузлов средостения, обладает от-
носительно благоприятным прогнозом, но требует применения многокомпонентной
ПХТ с целью достижения полной регрессии опухолевых очагов. Наиболее эффектив-
но использование схемы МАСОР-В; количество индукционных циклов 6-8 с последу-
ющей лучевой терапией на средостение (СОД 32-36 Гр). Влияние на эффективность
терапии добавления ритуксимаба к схемам ПХТ изучается.
Совсем по другим принципам проводится XT индолентных лимфом.
Один из частых вариантов индолентных лимфом — фолликулярные, которые пред-
ставляют собой гетерогенную группу опухолей с различным прогнозом. Наиболее
благоприятный прогноз при фолликулярных лимфомах I-II цитологического типа.
Терапевтическая тактика у первичных больных при этой патологии зависит от выра-
женности клинических проявлений болезни. Тактика «наблюдай и жди» возможна при
отсутствии клинических показаний к началу терапии (отсутствие у больного жалоб,
умеренная лимфаденопатия, отсутствие симптомов интоксикации и выраженной опу-
холевой инфильтрации костного мозга). Констатация клинически выраженных прояв-
лений болезни служит показанием к началу лечения.
В отличие от агрессивных лимфом, лечение которых всегда начинают с ПХТ, при ин-
дукции ремиссии фолликулярных лимфом I-II цитологического типа в течение неко-
торого времени с успехом может проводиться монохимиотерапия. При небольшом
увеличении лимфоузлов, умеренной лимфоидной инфильтрации костного мозга без
анемии и тромбоцитопении и при отсутствии симптомов болезни оправдано приме-
нение монохимиотерапии (наиболее часто хлорамбуцилом, флударабином) или мо-
нотерапия ритуксимабом — 4-8 еженедельных введения в дозе 375 мг/м2.
У пожилых и ослабленных больных с сопутствующей патологией при I стадии фол-
ликулярной лимфомы I-II цитологического типа возможно проведение только локаль-
ной лучевой терапии на зоны поражения.
При распространенном процессе в качестве первой линии терапии используется
ПХТ с обязательным включением ритуксимаба — R-COP, R-CVP, R-E, R-FND, R-CHOP.
Повышение эффективности при ПХТ с ритуксимабом в настоящее время не вызывает
сомнений. Схемы с флударабином также хорошо зарекомендовали себя в этих кли-
нических ситуациях. Необходимо помнить о том, что при использовании флудара-
бина возможно развитие гемолитической анемии и повышается риск инфекционных
осложнений, особенно у больных пожилого возраста и при наличии сопутствующих
хронических инфекций. Развитие гемолитической анемии требует временной отме-
ны флударабина и назначения кортикостероидов (преднизолон в дозе 1 мг/кг внутрь с
последующей коррекцией дозы в зависимости от динамики уровня гемоглобина). ПХТ
с антрациклинами (R-CHOP-21) в первой линии лечения фолликулярной лимфомы 1-И
цитологического типа используется при наличии большой опухолевой массы и выра-
женной клинической симптоматике (например, сдавление и/или нарушение функции
жизненно важных органов опухолевыми конгломератами, быстрое увеличение ранее
небольших опухолей, наличие неблагоприятных факторов прогноза) и при фолли-
кулярной лимфоме III цитологического типа. Количество индукционных циклов 6-8.
При достижении полной или частичной ремиссии показано проведение поддержи-
вающей терапии ритуксимабом в течение 2 лет: 375 мг/м2 ритуксимаба в виде в/в ин-
фузии каждые 2 мес. Целесообразность поддерживающей терапии ритуксимабом
352 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
г - U Л -унг-1 ?
убедительно доказана: использование современных терапевтических подходов по-
зволило впервые продемонстрировать увеличение показателя общей выживаемости
больных при фолликулярной лимфоме.
При отсутствии эффекта (рефрактерные формы), развитии рецидива болезни или
констатации трансформации фолликулярной лимфомы в диффузную крупноклеточ-
ную опухоль целесообразно проведение лечения по одной из схем второй линии
(R-FCM, R-CHOP, схемы, используемые при диффузной крупноклеточной лимфоме).
Возможно обсуждение применения высокодозной XT с поддержкой аутологичной
трансплантацией ГСК или аллогенной трансплантацией костного мозга у небольшо-
го числа пациентов. Повторные ремиссии наступают реже, продолжительность их
меньше.
Терапия других вариантов индолентных лимфом (нодальные и экстранодальные
лимфомы маргинальной зоны) осуществляется по программам лечения фолликуляр-
ных лимфом.
Наибольшие терапевтические сложности вызывают периферические Т-клеточные
лимфомы (неспецифицированная, ангиоиммунобластная, анапластическая крупно-
клеточная, Т-лимфома, ассоциированная с энтеропатией, NK-лимфома). Стандартной
терапевтической тактики пока не разработано. Учитывая более неблагоприятный
прогноз лимфом Т-клеточной природы по сравнению с В-клеточными, лечение осу-
ществляется по программам агрессивных лимфом: 6-8 курсов XT + лучевая терапия
при локальных стадиях заболевания в дозе 30-40 Гр. В первой линии терапии могут
использоваться схемы CHOP, EPOCH, Hyper-CVAD/MA. Обоснована интенсификация
первой линии терапии анапластической крупноклеточной лимфомы при отсутствии
экспрессии ALK-белка, так называемой анапластической ALK-негативной лимфомы,
т.к. этот вариант характеризуется более неблагоприятным прогнозом. Цель лечения —
достижение полной ремиссии. При наличии неблагоприятных факторов прогноза (вы-
сокий риск в соответствии с МПИ) показана консолидация первой полной ремиссии
высокодозной XT. Достижение частичной ремиссии расценивается как неэффектив-
ное лечение. При частичной ремиссии, прогрессировании заболевания и развитии
рецидива больным рекомендуется вторая линия терапии, если больной может быть
кандидатом для проведения высокодозной терапии, но необходимо лечение по одной
из циторедуктивных схем второй линии (DHAP, ESHAP, GDP, GemOx, ICE, mini-BEAM,
MINE) с последующей оценкой эффекта. При достижении полной или частичной ре-
миссии — проведение высокодозной XT с последующей поддержкой аутологичной
трансплантацией ГСК или аллогенной трансплантацией костного мозга. Если больно-
му не планируется высокодозная XT, то терапия ограничивается применением алем-
тузумаба (Кэмпас), бортезомиба (Велкейд), гемцитабина (Гемзар) в сочетании с палли-
ативной лучевой терапией.
Следует помнить об особенностях лечения отдельных клинических вариантов НХЛ.
При первичной НХЛ яичка первой линией терапии служит радикальная ОФЭ. Од-
нако ОФЭ в самостоятельном виде считается неадекватным лечебным воздействием:
у подавляющего числа пациентов без дополнительных лечебных мероприятий раз-
вивается рецидив болезни в первые 2 года. Учитывая выраженную склонность к ге-
матогенному диссеминированию и билатеральному поражению яичка, терапия начи-
нается с проведения XT — 3 курса антрациклинсодержащих схем (CHOP, R-CHOP-21,
R-CHOP-14, R-CHOEP) с обязательной профилактикой поражения ЦНС (интратекаль-
ное введение 12 мг/м2 метотрексата, 20 мг/м2 цитарабина, 20 мг/м2 преднизолона по
завершении каждого цикла XT). При достижении ремиссии после 3 курсов необходи-
мо проведение еще 3 курсов XT с обязательной последующей лучевой терапией: при
1 стадии — 25-30 Гр на мошонку, при II стадии — 30-35 Гр на мошонку и лимфоузлы
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 353
Опухолевые заболевания кроветворной и лимфоидной ткани
малого таза и парааортальных областей. При констатации частичной ремиссии после
3 индукционных курсов XT общее число курсов увеличивается до 6-8 с обязательным
последующим осуществлением лучевой терапии на мошонку и регионарные лимфо-
узлы сувеличением СОД до 35-45 Гр. Адекватная лечебная тактика позволяет добить-
ся стойких положительных результатов: 4-летняя безрецидивная выживаемость 93 %.
При благоприятном прогнозе в целом поражение различных отделов костной
системы оказывает неодинаковое влияние на судьбу больных: неблагоприятно по-
ражение позвоночника и костей таза (10-летняя выживаемость 24 и 36% соответ-
ственно), при вовлечении лицевого скелета 60% больных переживают этот срок, а
развитие изолированных опухолей голеней наиболее благоприятно (10-летняя вы-
живаемость 80%).
Больные с локальным поражением костей должны получать ПХТ (антрациклинсо-
держащие схемы) с последующим облучением всей кости в дозе 35 Гр. Нет показа-
ний для профилактики поражения ЦНС. Адекватная комбинированная терапия демон-
стрирует стойкую безрецидивную выживаемость более чем в 70% случаев.
При первичной лимфоме ЦНС хирургическое лечение наименее перспективно;
вследствие мультифокальности опухоли (в ранние сроки появляются новые опухоле-
вые очаги, наступает быстрое прогрессирование) медиана выживаемости составляет
4-6 мес.
Использование только лучевой терапии также нельзя признать эффективным: у всех
больных рецидивы наступают в первые 12 мес., а переживает этот срок менее 20%
больных.
В настоящее время признаны преимущества применения комбинированного хими-
олучевого лечения, которое превосходит по результатам XT. Большой мировой опыт
использования разных вариантов лучевой терапии позволяет утверждать, что в це-
лях наилучшей результативности в сочетании с максимальной безопасностью лучевой
компонент лечения должен быть завершающим этапом химиолучевой терапии и осу-
ществляться при констатации полной ремиссии. У пожилых больных (> 60 лет) сум-
марная доза лучевой терапии должна быть снижена.
Использование системной XT затрудняется сложностью проникновения противоо-
пухолевых агентов через ГЭБ. Поэтому при выявлении поражения вещества головного
мозга должна осуществляться системная XT цитостатиками в высоких разовых дозах:
2-3 г/м2 метотрексата, или 3 г/м2 цитарабина, или 2 г/м2 циклофосфамида. Эффек-
тивность использования больших доз метотрексата (> 3 г/м2) обусловлена его трех-
фазным плазменным клиренсом с хорошим проникновением через ГЭБ. Введение
должно осуществляться в виде длительных (> 3 ч) в/в инфузий со стандартной профи-
лактикой кальция фолинатом (Лейковорин) и повторением введений каждые 2-3 нед.
Применение системной ПХТ уступает по результативности использованию высоких
доз метотрексата. В то же время добавление к большим дозам метотрексата высоких
доз цитарабина (2 г/м2) или других цитостатиков увеличивает эффект. Высока эффек-
тивность сочетания метотрексата (1,5 г/м2) с циклофосфамидом (15-30 мг/кг) на фоне
2-недельного использования прокарбазина (100-150 мг/сут) и дексаметазона (24 мг/
сут): полные ремиссии зафиксированы более чем в 80% случаев. Обсуждается целе-
сообразность добавления к метотрексату этопозида, препаратов нитрозомочевины
(ломустин, кармустин). Накапливается мировой опыт по использованию темозоломида
(Темодал). Отрицательное влияние на результаты оказывает возраст (результаты хуже
у лиц старше 65 лет), тяжелое общее состояние больного (2-3 балла по ECOG), вы-
раженный неврологический дефицит, требующий применения противосудорожных
препаратов, снижение клиренса креатинина.
354 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
Гематогенное (метастатическое) лептоменингеальное поражение ЦНС развивается
при всех вариантах НХЛ (чаще — при агрессивных). Поражение оболочек мозга под-
тверждается при выполнении люмбальной пункции высоким содержанием опухоле-
вых клеток в ликворе. С лечебной целью в спинномозговой канал с интервалом 4 дня
вводятся одномоментно метотрексат 12,5 мг/м2, цитарабин 20 мг/м2 и дексаметазон
4 мг/м2 или преднизолон 25-30 мг/м2. Лечение продолжается до тех пор, пока в трех
последовательных анализах спинномозговой жидкости будет обнаруживаться не бо-
лее 5/мкл (нормальный цитоз).
В процессе проведениях! наблюдаются осложнения и побочные явления, обуслов-
ленные препаратами, входящими в состав поли- и монохимиотерапии. Принципы ве-
дения больных с развившимися побочными явлениями изложены в соответствующей
главе.
Режимы терапии представлены в табл. 10.8.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
355
356 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Таблица 10.8. Режимы терапии при неходжкинских лимфомах
Препарат Доза и путь введения День введения Периодичность, дни
Ритуксимаб 375 мг/м2 в/в 0-й
Циклофосфан 750 мг/м2 в/в 1-й
R-CHOP-21/14* Адриабластин 50 мг/м2 в/в 1-й 21 или 14
Винкристин 1,4 мг/м2 в/в 1-й
Преднизолон 40 мг/м2 внутрь 1-5-й
Ритуксимаб 375 мг/м2 в/в 0-й
R-COP* Циклофосфан 400 мг/м2 в/в 1-5-й 21
Винкристин 1,4 мг/м2 в/в 1-й
Преднизолон 40 мг/м2 внутрь 1-5-й
Ритуксимаб 375 мг/м2 в/в 0-й
R-CVP* Циклофосфан 750 мг/м2 в/в 1-й 21
Винкристин 1,4 мг/м2 в/в 1-й
Преднизолон 60 мг/м2 внутрь 1-5-й
Ритуксимаб 375 мг/м2 в/в 0-й
Циклофосфан 750 мг/м2 в/в 1-й
R-CHOEP-21/14* Адриабластин 50 мг/м2 в/в 1-й 21 или 14
Винкристин 1,4 мг/м2 в/в 1-й
Этопозид 100 мг/м2 в/в 1-й
Преднизолон 40 мг/м2 внутрь 1-5-й
Циклофосфан 125 мг/м2 в/м 1-14-й
COP-BLEO Винкристин 1,4 мг/м2 в/в 1-й, 8-й 28
Преднизолон 60 мг/м2 внутрь 1-5-й
Блеомицин 10 мг/м2 в/в 1-й, 8-й
Циклофосфан 650 мг/м2 в/в 1-й, 8-й
СОРР Винкристин 1,4 мг/м2 в/в 1-й, 8-й 28
Натулан 100 мг/м2 внутрь 1-14-й
Преднизолон 40 мг/м2 внутрь 1-14-й
Опухолевые заболевания кроветворной и лимфоидной ткани
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИИ
Препарат Доза и путь введения День введения Периодичность, дни
R-FC* Флударабин Циклофосфан 25 мг/м2 в/в 400 мг/м2 в/в 1-3-й 1-3-й 21
FMP Флударабин Митоксантрон или Идарубицин Преднизолон 25 мг/м2 в/в 10 мг/м2 в/в 12 мг/м2 в/в 40 мг/м2 внутрь 1-3-й
1-й 1-5-й 28
Доксорубицин 50 мг/м2 в/в 48-часовая инфузия 1-2-й
ASHAP Солу-Медрол 500 мг/м2 в/в 1-5-й 35-42
Цитарабин 1500 мг/м2 в/в 2-часовая инфузия 5-й
Цисплатин 100 мг/м2 в/в 96-часовая инфузия 1-4-й
Этопозид 60 мг/м2 в/в 1-часовая инфузия 1-4-й
ESHAP Цитарабин 500 мг/м2 в/в 15-минутная инфузия 1-4-й 28-35
Цисплатин 2000 мг/м2 в/в 2-часовая инфузия 5-й
Метилпреднизолон 25 мг/м2 в/в длительно 1-4-й
Ломустин 1000 мг/м2 внутрь 1-й
LABO Адриабластин 35 мг/м2 в/в 1-й, 8-й 21-28
Блеомицин 15 мг/м2 в/в 1-й, 8-й
Винкристин 1,4 мг/м2 в/в 1-й, 8-й
Адриабластин 40 мг/м2 в/в 1-й, 2-й
high-CHOP Винкристин 1,4 мг/м2 в/в 1-й 28
Циклофосфан 1200 мг/м2 в/в 1-й
Преднизолон 60 мг/м2 внутрь 1-5-й
Цисплатин 100 мг/м2 в/в 24-часовая инфузия 1-й
DHAP Цитарабин 2000 мг/м2 в/в 3-часовая инфузия 2 раза в сутки 2-й 28-35
Дексаметазон 30 мг/м2 в/в 1-4-й
Ломустин (Белустин) 100 мг/м2 в/в 1-й
ВАЕМ Цитарабин 100 мг/м2 п/к 2 раза в сутки 1-5-й 28
Этопозид 100 мг/м2 в/в 3-5-й
Медрол 40 мг/м2 внутрь 1-5-й
Неходжкинские лимфомы
358 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
День введения Периодичность, дни
Метотрексат 200 мг/м2 в/в 8-й,15-й
Блеомицин 4 мг/м2 в/в 1-й
m-BACOD Адриабластин 45 мг/м2 в/в 1-й 21
Циклофосфан 600 мг/м2 в/в 1-й
Винкристин 1 мг/м2 в/в 1-й
Дексаметазон 6 мг/м2 внутрь 1-5-й
Ритуксимаб 375 мг/м2 в/в 0-й
R-ICE* Этопозид 100 мг/м2 в/в 1-3-й 21-28
Карбоплатин AUC 5 в/в (максимально 800 мг) 2-й
Ифосфамид 5000 мг/м2 в/в 2-й
Ифосфамид 1333 мг/м2 в/в 1-часовая инфузия 1-3-й
MINE Митоксантрон 8 мг/м2 в/в 15-минутная инфузия 1-й 21-28
Этопозид 65 мг/м2 в/в 1-часовая инфузия 1-3-й
650 мг/м2 в/в 1-й
Циклофосфан
Адриабластин 25 мг/м2 в/в 1-й
Этопозид 120 мг/м2 в/в 1-й
Pro-MACE-CytaBOM Преднизолон 60 мг/м2 внутрь 1-15-й 21
Цитарабин 300 мг/м2 в/в 8-й
Блеомицин 5 мг/м2 в/в 8-й
Винкристин 1,4 мг/м2 в/в 8-й
Метотрексат 120 мг/м2 в/в 8-й
R-F Ритуксимаб 375 мг/м2 в/в 1-й, 4-й — в 1-й цикл; 1-й — в остальные циклы 28
Флударабин 25 мг/м2 в/в 1-5-й
GEMOX Гемцитабин 1000 мг/м2 в/в 1-й 14
Оксалиплатин 100 мг/м2 в/в 2-й
Ритуксимаб 375 мг/м2 в/в 0-й
R-FND Флударабин 25 мг/м2 в/в 1-3-й 28
Митоксантрон 10 мг/м2 в/в 1-й
Дексаметазон 20 мг/м2 в/в.или внутрь 1-5-й
Опухолевые заболевания кроветворной и лимфоидной ткани
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИИ 359
Схема Препарат Доза и путь введения День введения Периодичность, дни |
Гемцитабин 1000 мг/м2 в/в 1-й, 8-й
GDP Цисплатин 75 мг/м2 в/в 1-й 21
Дексаметазон 40 мг/м2 внутрь 1-4-й
Кармустин 60 мг/м2 в/в 1-й
mini-BEAM Этопозид Цитарабин 75 мг/м2 в/в 100 мг/м2 в/в 2 раза в сутки 2-5-й 2-5-й Каждые 4-6 нед.
Мелфалан 30 мг/м2 в/в 6-й
Ритуксимаб 375 мг/м2 в/в 0-й
FCM (± R) Флударабин Циклофосфан 25 мг/м2 в/в 200 мг/м2 в/в 1-3-й 1-3-й 21-28
Митоксантрон 8 мг/м2 в/в 1-й
м tati
Ритуксимаб 375 мг/м2 в/в 0-й
Циклофосфан 1200 мг/м2 в/в 1-й
R-maxi-CHOP Адриабластин 75 мг/м2 в/в 1-й 21-28 |
Винкристин 2 мг/м2 в/в 1-й
Преднизолон 100 мг/м2 внутрь 1-5-й в
R-A Ритуксимаб Цитозар 375 мг/м2 в/в 3000 мг/м2 в/в 2 раза в сутки 0-й 1-2-й 21-28
РЕР-С Преднизилон Циклофосфан Этопозид Прокарбазин 20 мг/м2 внутрь 50 мг/м2 внутрь 50 мг/м2 внутрь 50 мг/м2 внутрь Длительно под контролем уровня лейкоцитов. Прервать при лейкоцитах < 3 х 109/л, после вос- становления — возобновить
Hyper-CVAD - - л л г?;/'- - '' : \ > - - -• г '
Ритуксимаб 375 мг/м2 в/в 1-й
Циклы 1, 3, 5,7 Ритуксимаб + Hyper-CVAD Циклофосфан 300 мг/м2 в/в 3-часовая инфузия 2 раза в сутки 2—4-й
Месна Доксорубицин Винкристин 600 мг/м2 в/в непрерывно 16,7 мг/м2 в/в 72-часовая инфузия 2 мг в/в 2-4-й 5-7-й 5-й, 12-й 21
Дексаметазон 40 мг в/в или внутрь 2-5-й, 12-15-й
Неходжкинские лимфомы
360 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
День введения Периодичность,дни 1 О
I Схема Препарат Доза и путь введения я ч*
Циклы 2,4, 6, 8 Ритуксимаб + мето- трексат/цитарабин Ритуксимаб 375 мг/м2 в/в 1-й X 0
Метотрексат 200 мг/м2 в/в 2-часовая инфузия 2-й 21 йз (Ъ
Метотрексат 800 мг/м2 в/в 22-часовая инфузия 2-й £ 1 Я Е ж
Цитарабин 3000 мг/м2 в/в 2 раза в сутки 3-й, 4-й г» W
R-C0D0X/R-IVAC ’ / ''7 JZ >•’ ’ ’ „Л,"\ & Ф
Ритуксимаб 375 мг/м2 в/в 0-й © я
Цитарабин 20 мг/сут интратекально 1-й, 3-й 05
Циклофосфан 800 мг/м2 в/в 1-й & Я
Винкристин 1,4 мг/м2 в/в 1-й, 8-й 5
Доксорубицин 40 мг/м2 в/в 1-й j g
R-CODOX Циклофосфан 200 мг/м2 в/в 2-5-й io
1-й, 3-й циклы или Метотрексат 1200 мг/м2 в/в 1-часовая инфузия 10-й : я * ©
1-3-й циклы Метотрексат 240 мг/м2 в/в 23-часовая инфузия 10-й ‘ W
Лейковорин 192 мг/м2 в/в Через 36 ч после метотрексата ХТ возобновил- ' *©
Лейковорин 12 мг/м2 в/в Каждые 6 ч ется сразу по- : я ’ ©
Метотрексат 12 мг интратекально 15-й сле восстанов- - £<
Лейковорин 15 мг внутрь Через 36 ч после метотрексата леНия показа- S
Г-КСФ при нейтрофилах < 1 х 109/л 5 мг/кг 3-8-й, 12-й телей «а S
Ритуксимаб 375 мг/м2 в/в 0-й §
Этопозид 60 мг/м2 в/в 1-часовая инфузия 1-5-й ©
R-IVAC 2-й, 4-й циклы Ифосфамид 1500 мг/м2 в/в 1-часовая инфузия 1-5-й s $3
Месна с ифосфамидом Месна 360 мг/м2 в/в 1-часовая инфузия 360 мг/м2 в/в 3 раза в сутки 1-5-й 1-5-й ж © Sc
Цитарабин 2000 мг/м2 в/в 2 раза в сутки 1-й, 2-й й
Метотрексат 12 мг интратекально 5-й 3
Г-КСФ при нейтрофилах < 1 х 109/л 5 мг/кг 6-7-й S
R-MAG0P-B Препараты вводят 1 раз в неделю
Ритуксимаб 375 мг/м2 в/в
1,3,5, 7,9,11-я недели
Циклофосфан
Адриабластин
350 мг/м2 в/в
50 мг/м2 в/в
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
. День введения Периодичность, дни
Винкристин 1,4 мг/м2 в/в 2,4,6,8,10,12-я недели
Блеомицин 10 мг/м2 в/в 4,8,12-я недели
Метотрексат 100 мг/м2 в/в 2,6,10-я недели
Лейковорин 15 мг/м2 в/в или внутрь 4 раза в сутки
Преднизолон 75 мг/сут внутрь В течение 12 нед. с постепенной отменой в тече- ние 10-12 нед.
R-EPOCH Ритуксимаб 375 мг/м2 в/в 0>й Этопозид 50 мг/м2 в/в непрерывно3 1-4-й Винкристин 0,4 мг/м2 в/в непрерывно 1-4-й Доксорубицин 10 мг/м2 в/в непрерывно 1-4-й Циклофосфан 750 мг/м2 в/в 15-30-минутная инфузия 5-6-й Преднизолон 60 мг/м2 внутрь 1-6-й Введение циклофосфана сопровождается водной нагрузкой: до 900 мг/м2 — 500 мл, 900-1500 мг/м2 —1000 мл, более 1500 мг/м2—1300 мл. а Смесь «3 в 1» — последовательность смешивания: этопозид + доксорубицин + винкристин. Суммарная доза этопозида Объем физ. р-ра < 62 мг 250 мл 62,1-125 мг 500 мл > 125 мг 1000 мл Итоговая концентрация этопозида менее 250 мкг/мл. Разводить в полиолефиновом пакете. 21
* Схемы могут быть использованы без ритуксимаба
о
Неходжкинские лимфомы
Опухолевые заболевания кроветворной и лимфоидной ткани
10.6. Множественная миелома
О. М. Вотякова
Множественная миелома (син.: миеломная болезнь, болезнь Рустицкого—Калера), по
классификациям REAL/WHO, относится к периферическим (зрелоклеточным) В-кле-
точным опухолям. Ограниченная опухоль того же строения, но располагающаяся как
в костях, так и вне костной системы, — плазмоцитома, как правило, бывает начальным
проявлением множественной миеломы. Опухолевая ткань миеломы состоит из клеток
плазмоцитарного ряда, обычно продуцирующих парапротеин (моноклональный им-
муноглобулин, М-градиент). Моноклональная продукция характеризуется синтезом
структурно полноценных молекул иммуноглобулинов, фрагментов иммуноглобули-
нов или сочетанием тех и других.
Заболеваемость множественной миеломой составляет приблизительно 3-4 случая на
100 000 населения. Смертность от миеломы довольно высока: медиана выживаемости
больных, получавших лечение, по данным разных авторов, колеблется от 18 до 51 мес..
нелеченных — значительно меньше. Миелома — заболевание старшего и пожилого воз-
раста. У лиц моложе 30-40 лет встречается реже, у детей — практически никогда.
При диагностике множественной миеломы основными служат три критерия:
1) обнаружение клональных плазматических клеток в миелограмме и/или плазмо-
клеточной опухоли в материале, полученном из пораженной ткани;
2) наличие моноклонального иммуноглобулина в сыворотке крови и/или в моче1;
3) выявление признаков поражения органов и тканей, связанных с миеломой (1 и
более)1 2:
С — гиперкальциемия (уровень кальция сыворотки крови на 0,25 ммоль/л выше
верхней границы нормы или более 2,75 ммоль/л);
R — почечная недостаточность (уровень креатинина в сыворотке крови более
173 мкмоль/л);
А — анемия (уровень гемоглобина на 2 г/дл ниже нижней границы нормы или ме-
нее 10 г/дл);
В — остеолитические очаги или остеопороз с компрессионными переломами.
Для диагностики множественной миеломы обязательно наличие плазмоклеточно-
го опухолевого поражения. Использование этой диагностической системы позволяет
выделить группу пациентов с активной или симптоматической миеломой, которым не-
обходимо лечение.
Миелома подразделяется на варианты по типу продуцируемого моноклонального
иммуноглобулина. Частота распределения различных иммунохимических типов ми-
еломы приблизительно соответствует концентрации различных классов нормальных
иммуноглобулинов в сыворотке: миелома G обнаруживается в 53-59% случаев, мие-
лома А — в 23-25 %, D — в 2-5 %, Е и М — менее чем в 1 % случаев. Миелома Бенс-Джон-
са встречается у 11-21 % больных, несекретирующая и диклоновая — очень редко.
Поскольку множественная миелома более чем в 90% случаев исходно является ге-
нерализованным опухолевым заболеванием, в наиболее распространенной класси-
фикации В. G.M. Durie, S. Е Salmon миелома распределяется по стадиям в соответствии
с клинико-лабораторными признаками, косвенно отображающими объем опухоле-
вой массы (табл. 10.9).
1 Если моноклональный белок не определяется (несекретирующая миелома), то в миелограмме количество плаз-
матических клеток должно составлять 10% и более или должна быть выявлена плазмоклеточная опухоль в мате-
риале, полученном из пораженной ткани.
2 Могут присутствовать другие признаки нарушения функции органов и систем, связанные с миеломой, такие как
синдром гипервязкости, рецидивирующие бактериальные инфекции (более 2 эпизодов в течение 12 мес.), амило-
идоз и т.д.
362 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Множественная миелома
Таблица 10.9. Стадии множественной миеломы (B.G.M. Durie, S.E Salmon, 1975)
Стадия Признак Клеточная масса, 1012/м2 1
1 II Все из перечисленных: Гемоглобин >100 г/л Нормальный уровень кальция сыворотки Рентгенологически — нормальная структура костей или солитар- ный очаг плазмоцитомы < 0,6 (низкая) Низкий уровень парапротеина: IgG < 50 г/л IgA < 30 г/л ВJ < 4 г/сут в моче Показатели, не соответствующие ни I, ни III стадии 0,6-1,2 (средняя)
III Один или более из перечисленных: Гемоглобин < 85 г/л Уровень кальция сыворотки > 3 ммоль/л > 3 литических очагов в костях 4 п . « ~ > 1,2 (высокая) Высокий уровень парапротеина: v ' IgG > 70 г/л IgA > 30 г/л BJ > 12 г/сут в моче
Дополнительным признаком, определяющим подстадию, является состояние фун-
кции почек:
А — относительно нормальная (креатинин сыворотки менее 170 мкмоль/л);
В — недостаточная (креатинин сыворотки равен или более 170 мкмоль/л).
В 2005 г. была предложена новая международная классификация множест-
венной миеломы (International Staging System, ISS), которая выделяет три стадии забо-
левания в зависимости от уровня альбумина и /?2-микроглобулина в сыворотке крови
(табл. 10.10). Эта международная система стадирования миеломы признана прогно-
стически высокозначимой, т.к. позволяет оценить прогноз болезни у пациентов раз-
личных возрастных групп, проживающих в любых географических регионах, незави-
симо от интенсивности XT.
Таблица 10.10. Международная классификация множественной миеломы
(ISS, 2005)
Стадия Число пациентов, % Лабораторные показатели Медиана выживаемости, мес. 1
I 28 /?2-микроглобулин < 3,5 мг/л Альбумин > 3,5 мг/дл 62
II 33 /?2-микроглобулин < 3,5 мг/л Альбумин < 3,5 мг/дл или Д-микроглобулин от 3,5 до < 5,5 мг/л 44
III 39 &-микроглобулин > 5,5 мг/л 29
На прогноз множественной миеломы кроме показателей /?2-микроглобулина и
альбумина сыворотки крови влияет и ряд других признаков. К неблагоприятным
прогностическим факторам относятся повышение уровня С-реактивного белка, ак-
тивности ЛДГ, высокий пролиферативный индекс плазматических клеток, плазмоб-
ластная морфология опухолевых клеток, возраст больных 69 лет и старше, а также
тяжелое общее состояние. Существенно влияют на прогноз хромосомные аномалии.
Прогноз хуже при моносомии или делеции хромосомы 13, гиподиплоидии, делеции
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 363
Опухолевые заболевания кроветворной и лимфоидной ткани
ь 4\ г v i v «ц п *1
хромосомы 17 с мутацией или утратой гена-супрессора р53, транслокациях t(4;l4«
(pl6.3;q32) и t(l4; 16)(q32;q23).
Выбор метода терапии зависит от исходных прогностических признаков, воз-
раста больных, предшествующего лечения и его результатов, периода заболевания,
наличия инфекционных осложнений и сопутствующих заболеваний.
Хирургическое лечение в виде ламинэктомии при сдавлении спинного мозга
опухолевыми массами с целью быстрого его освобождения применяют в исклю-
чительных случаях, когда, несмотря на системную XT, нарастает неврологическая
симптоматика. При переломах в местах крупных опухолевых узлов с большим диа-
стазом отломков используют хирургический остеосинтез. Большие опухоли длин-
ных трубчатых костей удаляют оперативно с последующим эндопротезированием.
Для лечения боли при компрессионных переломах позвонков применяют новей-
шие методы — чрескожную вертебропластику и чрескожную баллонную кифо-
пластику.
Лучевое лечение проводят в качестве паллиативного локального облучения в
дозе 30-36 Гр крупных очагов поражения в опорных частях скелета (позвоночник, ко-
сти таза, бедренные, мало- и большеберцовые, плечевые кости) во всех случаях уг-
розы патологических переломов. Для облегчения боли в костях при множественной
миеломе рекомендуется однократное облучение в дозе 8-10 Гр. Лучевому лечению
также подлежат локальные плазмоцитомы и опухолевые массы, сдавливающие спин-
ной мозг или его корешки.
Гормонотерапия применяется как в виде самостоятельного противоопухолево-
го лечения, так и в сочетании с XT. В целях гормонотерапии используют кортикосте-
роидные препараты: дексаметазон, преднизолон, метилпреднизолон (Медрол) и др.
Гормонотерапия в монорежиме проводится при рефрактерной к лечению миеломе и
невозможности лечения цитостатическими агентами из-за низкого уровня лейкоцитов
и/или тромбоцитов. В этих случаях глюкокортикоиды назначают в повышенных дозах:
дексаметазон 20 мг/м2, Солу-Медрол 1 г/м2 или соответствующие дозы других корти-
костероидов внутрь или в/в 3-4 раза в неделю, ежедневно или через день, в течение
3-4 нед. с интервалом 4-5 нед. Кортикостероидные гормоны входят в состав подав-
ляющего большинства программ XT. В ряде схем (VAD и ее аналоги) кортикостероиды
используются не как дополнительный компонент, а как одно из основных средств про-
тивоопухолевого воздействия.
Химиотерапия — основной метод лечения множественной миеломы, с ее помо-
щью у 50-80% больных удается получить довольно стойкую ремиссию, во время ко-
торой многие прежде лежачие больные получают возможность не только передви-
гаться, но и возвращаться к посильному труду.
Тактика ведения больных моложе 65 лет и пожилых пациентов отличается. Для лече-
ния первичных пациентов с множественной миеломой моложе 65 лет используют вы-
сокодозную XT с трансплантацией аутологичных ГСК. Пожилым и пациентам, имею-
щим противопоказания к высокодозной XT, назначают стандартную XT.
Стандартная химиотерапия. Чаще всего для лечения миеломы применяется мел-
фалан в монорежиме либо в сочетании с преднизолоном и в комплексе с другими пре-
паратами, в виде ПХТ. Эффективность XT мелфаланом и преднизолоном (схема МР)
составляет 60%, длительность ремиссии — 18 мес., продолжительность жизни — 24-
36 мес. Полные ремиссии при терапии по схеме МР достигаются редко.
Мелфалан (Алкеран) применяют в разных дозах и режимах. Низкие дозы — 0,1 мг/кг,
в среднем 6-8 мг в сутки или 10 мг через день — дают внутрь ежедневно длительно, до
снижения числа лейкоцитов или тромбоцитов. После восстановления их количества
курсы лечения повторяют. Лейкопения и/или тромбоцитопения у больных с миеломой
364 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Множественная миелома
наступает часто и держится дольше, чем при многих других гемобластозах. Средние
дозы — внутрь 0,15-0,25 мг/кг или 10-15 мг в сутки — используют короткими, 4- или
7-дневными циклами, повторяя каждые 4-6 нед. Мелфалан следует принимать нато-
щак, за 1 ч до завтрака. Повышенные дозы — 16-20 мг/м2, в среднем 30-40 мг/сут —
вводят в/в 3-4 раза каждые 2 нед. После 4-недельного перерыва циклы повторяют.
В/в в тех же дозах вводят также сарколизин. Во избежание выраженного угнетения
нормального кроветворения при почечной недостаточности дозы мелфалана и сар-
колизина должны быть уменьшены на 30-50%.
Равноценное с мелфаланом и сарколизином действие оказывает циклофосфамид,
препарат менее гемодепрессивный, чем мелфалан. Циклофосфамид вводится в/м
дробными дозами (150-200 мг ежедневно или 400 мг через день) или 1000-1200 мг
в/в 1 раз в неделю, суммарно в среднем 6-8 г.
Мелфалан и циклофосфамид можно применять последовательно, чередовать и да-
вать вместе в сниженных наполовину дозах каждого из них. Частота ремиссий при ле-
чении мелфаланом и циклофосфамидом составляет 50-60% и несколько возрастает
при добавлении к ним преднизолона. Последний предпочтительно применять не дли-
тельно малыми дробными дозами, а короткими интенсивными циклами по 4-7 дней в
дозе 1-2 мг/кг (40-60 мг/м2) параллельно с введением химиопрепаратов.
Обычно у нелеченных больных терапию начинают с применения мелфалана с пред-
низолоном. Большинство авторов рекомендуют следующий режим сочетания мелфа-
лана с преднизолоном (МР):
Мелфалан — 9 мг/м2 (0,25 мг/кг) внутрь в 1-4-й день.
Преднизолон — 1-2 мг/кг внутрь в 1-4-й день.
При лейкопении и/или тромбоцитопении вместо циклофосфамида и мелфалана мо-
жет быть использован отечественный препарат цифелин (Асалин), пептидное произ-
водное сарколизина, в дозе 0,5-1 г ежедневно в течение 20-25 дней.
Комбинированная химиотерапия, благодаря интенсивному и разнообразному
воздействию, немного чаще и быстрее вызывает ремиссии, чем лечение по схеме МР,
но на длительность ремиссий и продолжительность жизни эти различия влияют мало.
ПХТ обычно назначают при быстро прогрессирующей миеломе, при наличии проти-
вопоказаний к высокодозной XT или при развитии резистентности к терапии мелфа-
ланом и преднизолоном. Из схем ПХТ наиболее широкое распространение получили
программы М2 и альтернирующий режим VMCP/VBAP (табл. 10.11).
Программа АВСМ предпочтительна при лечении пациентов с сахарным диабетом,
язвенной болезнью желудка или двенадцатиперстной кишки и нейропатией, посколь-
ку в нее не входят кортикостероиды и винкристин.
Схему VAD чаще используют при агрессивно протекающей миеломе, когда необхо-
димо быстро получить ответ, а также при почечной недостаточности в связи с тем, что
невозможно подобрать адекватную негемодепрессивную дозу мелфалана.
Стандартную терапию продолжают до достижения максимального противоопу-
холевого эффекта, а затем еще 3-6 мес., т.е. до фазы плато. Фаза плато — стойкая
стабилизация болезни, продолжающаяся не менее 6 мес., с максимально низким
уровнем М-протеина в сыворотке крови и/или моче, отсутствием необходимости
в трансфузиях. Как правило, фаза плато достигается после как минимум 6-12 кур-
сов XT.
Постоянное поддерживающее лечение цитостатическими препаратами нецелесо-
образно, т. к. его польза сомнительна, а риск развития вторичного лейкоза и инфекци-
онных осложнений увеличивается.
В последние годы для лечения первичных больных с миеломой стали использовать
новые лекарственные агенты (талидомид, бортезомиб).
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 365
Опухолевые заболевания кроветворной и лимфоидной ткани
Таблица 10.11. Основные режимы полихимиотерапии и гормонотерапии
при множественной миеломе
Схема Препарат Доза и День введения Периодичность, 1
путь введения ДНИ I
Винкристин 1 мг/м2 в/в 1-й
VMCP Мелфалан 6 мг/м2 внутрь 1-4-й Каждые 21-28
Циклофосфамид 125 мг/м2 в/в 1-4-й
Преднизолон 60 мг/м2 внутрь 1-4-й
Винкристин 1 мг/м2 в/в 1-й
VBAP Кармустин* 30 мг/м2 в/в 1-й Каждые 21-28
Доксорубицин (Адриамицин) 30 мг/м2 в/в 1-й
Преднизолон 60 мг/м2 внутрь 1-4-й
Винкристин 1,2 мг/м2 в/в 1-й
VBMCP (М2) Кармустин* 20 мг/м2 в/в 1-й
Мелфалан 8 мг/м2 внутрь 1-4-й Каждые 35-42
Циклофосфамид 400 мг/м2 в/в 1-й
Преднизолон 40 мг/м2 внутрь 1-7-й
Доксорубицин (Адриамицин) 30 мг/м2 в/в 1-й
АВСМ Кармустин* 30 мг/м2 в/в 1-й Каждые 46
Циклофосфамид 100 мг/м2 в/в 22-25-й
Мелфалан 6 мг/м2 внутрь 22-25-й
Винкристин 0,2 мг/м2** 1-4-й
VAD Доксорубицин (Адриамицин) 9 мг/м2** 1-4-й Каждые 28
Дексаметазон 40 мг внутрь 1-4, 9-12 и 17- 20-й
Дексаметазон Дексаметазон 40 мг внутрь 1-4, 9-12 и 17- 20-й Каждые 28-35
Винкристин 1 мг/м2 в/в 1-й
VID Идарубицин 10 мг/м2 внутрь 1-4-й Каждые 28
Дексаметазон 40 мг внутрь 1-4,9-12 и 17-20-й
Митоксантрон 16 мг/м2 в/в 1-й
NOP Винкристин 2 мгв/в 1-й Каждые 28
Преднизолон 250 мг внутрь 1-4-й и 17-20-й
Циклофосфамид 600 мг в/в 5,10 и 20-й
Винкристин 0,5 мг** 1-4-й
CVAD Доксорубицин (Адриамицин) 9 мг/м2** 1-4-й Каждые 28
Дексаметазон 40 мг внутрь 10-13-й и 20- 24-й
Этопозид 100 мг/м2** 1-4-й
Дексаметазон 40 мг внутрь 1-5-й Курс повторяют
EDAP Цитарабин 1 г/м2 в/в 5-й после восста- новления пока- зателей крови
Цисплатин 25 мг/м2** 1-4-й
Г-КСФ 250 мг/м2 п/к С 6-го
366 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Множественная миелома
Схема Препарат Доза и путь введения День введения Периодичность, дни
Дексаметазон 40 мг внутрь 1-4-й
Циклофосфамид 500 мг/м2 в/в 5-й Каждые 28 или
DC-IE Идарубицин 5 мг/м2 в/в 8-10-й после восста- новления пока- зателей крови
Этопозид 100 мг/м2** 8-10-й
Г-КСФ 250 мг/м2 п/к 12-20-й
Бортезомиб Бортезомиб (Велкейд) 1,3 мг/м2 в/в 1, 4, 8 и 11-й Каждые 22
Бортезомиб (Велкейд) 1,3 мг/м2 в/в 1, 4, 8 и 11-й
VD Дексаметазон 20 мг внутрь 1,2, 4, 5,8,9,11 и 12-й Каждые 22
* Кармустин может быть заменен Белустином (CCNU) в дозе 80 мг внутрь в схемах VBAP и ABCM, VBMCP
** В режиме непрерывной в/в инфузии
Талидомид широко применялся в мире как седативное и снотворное средство, а за-
тем был запрещен из-за тератогенного эффекта. Препарат в России не зарегистриро-
ван. Талидомид оказывает антиангиогенное действие, уменьшая васкуляризацию опу-
холи, индуцирует апоптоз миеломных клеток, ингибирует экспрессию цитокинов,
вовлеченных в регуляцию пролиферации опухолевых клеток при миеломе. Талидо-
мид назначают по 200 мг/сут внутрь в сочетании с короткими 4-дневными курсами
дексаметазона 40 мг внутрь (схема TD). Эффективность лечения по схеме TD состав-
ляет 64-72%.
Для лечения пациентов с множественной миеломой, которым не планируется вы-
сокодозная XT, применяют также сочетание талидомида с MP-терапией (схема МРТ).
Основанием для использования данной программы лечения стали результаты двух
крупных рандомизированных клинических исследований, которые показали более
высокую эффективность терапии по схеме МРТ по сравнению MP-терапией. При эф-
фективности МРТ-терапии 76-81 % частота полных ремиссий составляет 16%. Более
того, добавление талидомида к MP-терапии в одном из этих исследований почти на
2 года улучшило медиану выживаемости.
Из побочных эффектов талидомида следует обратить внимание на тромбозы глубо-
ких вен, нейротоксичность, сонливость, отеки, запор, слабость, головокружения, бра-
дикардию. Во время лечения талидомидом необходимо профилактическое назначе-
ние антикоагулянтов.
Бортезомиб (Велкейд, PS-341) представляет собой дипептид борониковой кислоты
и является мощным селективным обратимым ингибитором протеасомного комплекса.
Бортезомиб подавляет активность химотрипсина, который является одним из компо-
нентов ферментного комплекса протеасомы 26S, препятствует расщеплению 1/сВ (ин-
гибитора ядерного фактора каппа В — NF/cB). В результате активация NF/cB становится
невозможной, что, в свою очередь, тормозит каскад событий, способствующих опу-
холевой пролиферации.
Для лечения первичных больных с множественной миеломой используют сочетание
бортезомиба с мелфаланом и преднизолоном (схема VMP). Более высокая эффектив-
ность лечения по схеме VMP по сравнению с MP-терапией показана в крупном рандо-
мизированном исследовании VISTA. Эффективность VMP составила 71 %, полные ре-
миссии получены в 30% случаев, медиана времени до прогрессирования — 24 мес.
На основании полученных результатов авторами обсуждается возможность примене-
ния VMP в качестве стандартной терапии первой линии при множественной миеломе.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 367
Опухолевые заболевания кроветворной и лимфоидной ткани
Авторы рекомендуют следующий режим сочетания бортезомиба с мелфаланом и
преднизолоном (VMP).
Циклы 1-4:
Бортезомиб — 1,3 мг/м2 в/в в 1,4, 8, 11, 22, 25, 29 и 32-й дни.
Мелфалан —9 мг/м2 внутрь в 1-4-й день.
Преднизолон — 60 мг/м2 внутрь в 1-4-й день.
Интервал между циклами 10 дней.
Циклы 5-9:
Бортезомиб — 1,3 мг/м2 в/в в 1, 8, 22 и 29-й дни.
Мелфалан — 9 мг/м2 внутрь в 1-4-й день.
Преднизолон — 60 мг/м2 внутрь в 1-4-й день.
Интервал между циклами 14 дней.
Во время лечения бортезомибом из нежелательных явлений наиболее часто возни-
кают желудочно-кишечные симптомы, такие как тошнота, рвота, диарея и запор. Кро-
ме того, часто отмечается утомляемость, тромбоцитопения и сенсорная нейропатия.
Высокодозная XT с трансплантацией аутологичных ГСК. Этот метод обы-
чно рекомендуют для лечения первичных больных с множественной миеломой моло-
же 65 лет при удовлетворительном общем состоянии и сохранной функции внутрен-
них органов. Высокодозная XT увеличивает частоту достижения полных ремиссий до
22-44%, улучшает общую выживаемость и выживаемость, свободную от прогрес-
сирования, по сравнению со стандартными методами XT. Так, медиана общей выжи-
ваемости продолжительнее на 12-15 мес., а медиана выживаемости, свободной от
прогрессирования, — на 10-22 мес. при использовании высокодозной XT с аутотран-
сплантацией ГСК по сравнению со стандартной XT.
При планировании высокодозного лечения индукционный этап предполагает про-
ведение 3-4 курсов индукционной XT. Мобилизация и сбор ГСК осуществляются пу-
тем в/в введения циклофосфамида в дозе 4-6 г/м2 с последующим назначением ре-
комбинантных ростовых факторов Г-КСФ или ГМ-КСФ 250 мкг/м2 п/к. При повторных
цитаферезах желательно получить такое количество клеток CD34+, которое оказа-
лось бы достаточным для проведения двух аутотрансплантаций. После сбора стволо-
вых клеток CD34+ выполняется высокодозная XT (консолидация) с трансплантацией
ГСК. Наиболее часто используемым режимом кондиционирования является введение
мелфалана в дозе 200 мг/м2.
В настоящее время продолжаются исследования по оценке эффективности повтор-
ных курсов высокодозной XT с трансплантацией ГСК. Имеющиеся данные пока не по-
зволяют рекомендовать плановую двукратную высокодозную XT с двойной аутотран-
сплантацией ГСК, но целесообразно заготавливать стволовые клетки в количестве,
достаточном для двух трансплантаций.
Согласно опубликованным результатам, преимущество от повторной высокодозной
XT имеют лишь больные, не достигшие очень хорошей частичной ремиссии после
первой высокодозной XT. Интервал между курсами составляет 3-6 мес.
При планировании высокодозной XT для индукции ремиссии обычно применяли
дексаметазон в высокой дозе, схему VAD или аналогичные программы. Использова-
ние программы VAD позволяет получить быстрый противоопухолевый эффект и не
оказывает воздействия на качество сбора ГСК. Однако для лечения по схеме VAD тре-
буется установление венозного катетера, что значительно повышает риск катетерной
инфекции и тромбозов. Кроме тогб, при использовании схемы VAD частота полных
368 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Множественная миелома
ремиссий составляет не более 10%. Достижение полной или очень хорошей частич-
ной ремиссии обычно сопровождается улучшением выживаемости, поэтому целью
индукционных программ служит увеличение частоты полных ремиссий для улучше-
ния отдаленных результатов.
Включение в индукционные режимы перед высокодозной XT новых лекарственных
агентов (талидомида и бортезомиба) значительно повышает эффективность лечения,
не влияет на качество собранных ГСК и восстановление гемопоэза после транспланта-
ции. Для индукции ремиссии при множественной миеломе назначают талидомид в со-
четании с дексаметазоном в высокой дозе (схема TD). Эффективность лечения по схе-
ме TD достигает 63-65%, но частота полных или почти полных ремиссий составляет
лишь 7,7 %.
Индукционная программа, включающая бортезомиб с высокими дозами дексамета-
зона (схема VD), эффективна у 82% пациентов с множественной миеломой, при этом в
15 % случаев удается получить полную или почти полную ремиссию.
VD (предтрасплантационная)
Бортезомиб — 1,3 мг/м2 в/в в 1,4, 8 и 11-й дни.
Дексаметазон — 40 мг внутрь в 1-4-й и 9-12-й дни (1-й, 2-й циклы), с 3-го цикла —
только в 1-4-й день.
Интервал между циклами 10 дней.
Для индукции ремиссии перед высокодозной XT используют также сочетание борте-
зомиба, дексаметазона и доксорубицина (схема PAD), эффективность этой програм-
мы составляет 83 %, частота достижения очень хорошей частичной ремиссии — 42%.
PAD
Бортезомиб — 1,3 мг/м2 в/в в 1,4, 8 и 11-й дни.
Доксорубицин — 9 мг/м2 в/в 24-часовая инфузия 1-4-й день.
Дексаметазон — 40 мг внутрь в 1-4, 8-11 и 15-18-й дни 1-го цикла; со 2-го по 4-й
цикл — только в 1-4-й день.
Повторение цикла на 29-й день, считая от 1-го дня предыдущего цикла.
Учитывая более высокую эффективность индукционных программ с включением но-
вых лекарственных препаратов, лечение по схеме VAD не следует применять в качест-
ве индукционной терапии перед высокодозной XT.
Совершенно очевидно, что при миеломе и высокодозное лечение не предотвраща-
ет развития рецедивов. Многие годы для поддержания ремиссии использовали ИФН-а
(Интрон А, Роферон А, Реаферон) в дозе 3 млн МЕ/м2 п/к 3 раза в неделю. Учитывая ча-
стоту развития побочных эффектов и незначательное улучшение выживаемости, этот
метод используется редко.
Чаще используется поддерживающая терапия талидомидом в дозе 200 мг в день. Под-
держивающая терапия талидомидом может быть рекомендована в течение года для па-
циентов, не достигших полной ремиссии после трансплантации аутологичных ГСК.
Оценка результатов лечения множественной миеломы в настоящее время прово-
дится согласно международным критериям по оценке эффективности лечения (2006)
по изменению уровня М-градиента в сыворотке и по экскреции легких цепей иммуно-
глобулина с мочой (табл. 10.12). Обязательным признаком успешного лечения считает-
ся отсутствие новых очагов поражения в костях и нормальный уровень кальция в сыво-
ротке. Исследование костного мозга необходимо только для подтверждения полной
ремиссии и оценки эффективности лечения при несекретирующей миеломе. Любой
полученный ответ необходимо подтвердить дважды результатами повторных иссле-
дований.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 369
Опухолевые заболевания кроветворной и лимфоидной ткани
Таблица 10.12. Международные критерии эффективности лечения
множественной миеломы (B.G.M. Durie и соавт., 2006)
Степень ответа Критерии ответа 1
Убедительная полная ре- миссия Все критерии соответствуют полной ремиссии, а также: Нормальное соотношение свободных легких цепей иммуноглобулина в сыво- ротке крови Отсутствие клональных плазматических клеток в костном мозге при иммуно- гистохимическом исследовании или иммунофлюоресценции
Полная ремиссия Отсутствие парапротеина в сыворотке и моче по данным иммунофиксации Количество плазматических клеток в миелограмме менее 5% Отсутствие мягкотканных плазмоцитом
Очень хорошая частичная ремиссия Парапротеин в сыворотке крови и моче выявляется только методом иммуно- фиксации или снижение уровня М-градиента более чем на 90% в сыворотке крови и до уровня менее 100 мг/сут в моче
Частичная ремиссия Уменьшение уровня парапротеина в сыворотке крови на 50% и более Уменьшение уровня М-протеина в моче на 90% и более или до уровня менее 200 мг/сут Уменьшение размера мягкотканных плазмоцитом на 50% и более
Стабилизация Показатели ответа не соответствуют критериям ремиссии или прогрессирова- ния болезни
Прогрессирование Один или более из перечисленных признаков: Увеличение на 25% и более парапротеина в сыворотке крови (обязательно на 0,5 г/дл и более в абсолютном значении), М-градиента в моче (обязательно на 200 мг/сут и более в абсолютном значении) Увеличение количества плазматических клеток в костном мозге (абсолютное количество плазматических клеток должно быть 10% и более) Появление новых очагов поражения в костях или мягкотканных плазмоцитом либо увеличение размера очагов поражения в костях или плазмоцитом Гиперкальциемия (уровень корригированного кальция сыворотки >11,5 мг/дл, или > 2,66 ммоль/л)
Клинический рецидив Один или более из перечисленных признаков: Появление новых мягкотканных плазмоцитом или очагов поражения в костях Увеличение размера имеющихся плазмоцитом или очагов поражения в костях на 50% Гиперкальциемия (уровень корригированного кальция сыворотки > 11,5 мг/дл, или > 2,66 ммоль/л) Снижение уровня НЬ > 2 г/дл Повышение уровня креатинина сыворотки крови > 2 мг/дл, или > 177 мкмоль/л
Рецидив после достиже- ния полной ремиссии Один или более из перечисленных признаков: Появление парапротеина в сыворотке крови или в моче при исследовании ме- тодами иммунофиксации или электрофореза Увеличение количества плазматических клеток в костном мозге > 5% Появление новых мягкотканных плазмоцитом или очагов поражения в костях Гиперкальциемия
Рецидивы при множественной миеломе неизбежно наступают у большинства
больных. Если рецидив развивается после 6 мес. сохранения фазы плато, то возоб-
новление первичной терапии успешно в 50% случаев. Эффективность повторной те-
рапии выше у больных с длительностью фазы плато более 1 года. В случае развития
ранних рецидивов в первые полгода после завершения лечения целесообразна сме-
на программы терапии.
Для лечения рецидивов множественной миеломы с успехом используется бортезо-
миб (Велкейд) как в монорежиме, так и в сочетании с дексаметазоном (схема VD) (см.
370 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Множественная миелома
табл. 10.11). Высокая эффективность бортезомиба (35%) показана в крупном иссле-
довании, при этому 10% пациентов получены полные ремиссии. Результаты другого
рандомизированного исследования выявили бол^е высокую эффективность борте-
зомиба (43%) по сравнению с высокими дозами Дексаметазона (18%). Медиана вы-
живаемости, свободной от прогрессирования, составила 6,2 мес. при лечении бор-
тезомибом и 3,5 мес. при назначении дексаметазона; медиана общей выживаемости
оказалась продолжительнее на 6 мес. по сравнению с лечением дексаметазоном и со-
ставила 29,8 us 23,7 мес. соответственно.
Сочетание бортезомиба с пегилированным липосомным доксорубицином также
применяют для лечения рецидивов множественной миеломы. (Пегилированный липо-
сомный доксорубицин в России для лечения миеломы не зарегистрирован.)
Одной из эффективных при ранних рецидивах является схема VAD, позволяющая
достичь 40-65 % объективных ответов. Кроме VAD для лечения рецидивов могут ис-
пользоваться аналогичные программы: VID, NOP.
При развитии резистентности к схеме VAD и ее аналогам используют такие схемы,
как EDAP, DC-IE, а также циклофосфамид в высокой дозе (3,6 г/м2). Применение этих
режимов XT возможно при обеспечении адекватной сопроводительной терапии, и
прежде всего назначении ГМ-КСФ или Г-КСФ, а при необходимости — антибактери-
ального и противогрибкового лечения. Использование высоких доз циклофосфамида
должно обязательно сопровождаться введением месны (Уромитексан).
В большинстве стран мира для лечения рецидивов множественной миеломы в на-
стоящее время применяют талидомид в монорежиме и в сочетании с дексаметазо-
ном. Эффективность талидомида в монорежиме составляет приблизительно 30%,
а добавление дексаметазона повышает эффективность терапии до 50-60%. Обыч-
но лечение начинают с талидомида; в отсутствие эффекта через 6-8 нед. добавля-
ют дексаметазон.
Исследования последних лет показали высокую эффективность сочетания ленали-
домида с дексаметазоном. Леналидомид (Ревлимид, СС-5013) — аналог талидомида
и по эффективности не уступает своему предшественнику. В двух крупных рандоми-
зированных исследованиях показано, что сочетание леналидомида с дексаметазоном
у больных с рецидивом множественной миеломы существенно увеличивало общую
эффективность лечения (60%) по сравнению с дексаметазоном (22%). Частота полных
ремиссий также оказалась значительно выше при сочетании леналидомида и дексаме-
тазона (15 %), чем при лечении дексаметазоном (2 %).
В обоих исследованиях показано увеличение медианы выживаемости, свободной
от прогрессирования, при лечении леналидомидом и дексаметазоном по сравнению
с дексаметазоном (11,1 us 4,7 мес.) и медианы общей выживаемости (35 us 31 мес.).
Результаты этих исследований позволяют рекомендовать сочетание леналидомида с
дексаметазоном для лечения рецидивов миеломы.
Циклы 1-4:
Леналидомид — 25 мг внутрь в 1-21-й день.
Дексаметазон — 40 мг внутрь в 1-4,9-12, 17-20-й дни.
Курс возобновляется на 29-й день от начала предыдущего курса.
С 5-го цикла:
Леналидомид — 25 мг внутрь в 1-21-й день.
Дексаметазон — 40 мг внутрь в 1-4-й день.
Курс возобновляется на 29 день от начала предыдущего курса.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 371
Опухолевые заболевания кроветворной и лимфоидной ткани
Переносимость леналидомида лучше, чем талидомида. Лечение леналидомидом об-
ычно не вызывает сонливости, запора или нейропатии, хотя миелосупрессия (нейтро-
пения и тромбоцитопения) развивается чаще, чем при лечении талидомидом. Учитывая
увеличение риска развития тромбозов при использовании леналидомида, необходи-
ма профилактическая антикоагулянтная терапия низкомолекулярным гепарином или
назначение аспирина.
Бисфосфонаты. Стандартная практика ведения больных с множественной мие-
ломой включает назначение бисфосфонатов для профилактики и лечения костных
осложнений. Бисфосфонаты вводят больным с миеломой и остеолитическими по-
ражениями или остеопенией с компрессионными переломами позвонков. Каждые
3-4 нед. для в/в введения используют такие бисфосфонаты, как золедроновая кислота
(Зомета) по 4 мг, памидронат натрия (Аредиа) по 90 мг. Лечение золедроновой кисло-
той или памидронатом натрия следует продолжать в течение 2 лет. Клодронат, как пе-
роральный, так и внутривенный, в качестве альтернативного бисфосфоната использу-
ется во всем мире, кроме США.
Поскольку лечение бисфосфонатами может сопровождаться нарушением функции
почек, исследование уровня креатинина сыворотки крови необходимо выполнять пе-
ред каждым введением препаратов. В случае развития почечной недостаточности в
процессе лечения бисфосфонатами его следует прервать. Учитывая риск развития
остеонекроза челюсти при лечении бисфосфонатами, перед назначением препара-
тов этой группы необходимо тщательное стоматологическое обследование, лечение
инфекций полости рта. Во время лечения необходимо регулярное наблюдение боль-
ных стоматологом, соблюдение правил гигиены полости рта во избежание инвазивных
стоматологических манипуляций.
372
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Глава 11
Злокачественные опухоли у детей
Химиотерапия служит обязательным компонентом комплексного лечения многих
опухолей у детей, даже в ранних стадиях заболевания. Специфичность XT злокаче-
ственных опухолей у детей обусловлена не только анатомо-физиологическими осо-
бенностями детского организма, но и высокой чувствительностью большинства ново-
образований у детей к противоопухолевым препаратам. При относительно хорошей
непосредственной переносимости противоопухолевых препаратов детьми следует
учитывать возможность повреждающего действия цитостатиков на растущий и еще не
сформировавшийся организм ребенка. Возможность поздних осложнений XT прио-
бретает особую актуальность в связи с возрастающим числом детей, излеченных от
опухолей с помощью комплексных методов лечения. Поэтому адекватный выбор про-
тивоопухолевых средств в детской онкологии особенно важен и сложен.
11.1. Нефробластома
£. И. Бойченко
Нефробластома (син.: опухоль Вильмса) — часто встречающаяся злокачественная
опухоль детского возраста. В структуре всех злокачественных опухолей у детей стар-
ше 1 года нефробластома занимает 4-5-е место (6-7 %), уступая гемобластозам, опу-
холям ЦНС и саркомам мягких тканей, и конкурирует по частоте с нейробластомой.
Преимущественно наблюдается монолатеральная нефробластома, реже (10% всех
злокачественных опухолей почек у детей) встречается двустороннее поражение по-
чек. Чаще всего нефробластома встречается у детей в возрасте 2-5 лет, редко — у но-
ворожденных. Как казуистика встречаются описания нефробластомы у взрослых.
С точки зрения эмбриогенеза нефробластома представляет собой солидную злока-
чественную опухоль, состоящую из производных нефрогенной ткани на разной сте-
пени дифференцировки. Большинство исследователей считают, что опухоль возника-
ет из аномально пролиферирующей метанефрогенной бластемы.
Морфологически выделяют типичную нефробластому (в т.ч. с преобладанием не-
дифференцированной бластемы), атипичные варианты — саркоматозные (вт.ч. рабдо-
идный, светлоклеточный и др.), тубулярный, фетальный рабдомиоматозный, кистозный
варианты, неклассифицируемую нефробластому (в т.ч. опухоль с резко выраженным
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 373
Злокачественные опухоли у детей
лечебным патоморфозом), мезобластическую нефрому и нефробластоматоз. В по-
следние годы светлоклеточная саркома выделена в самостоятельную нозологическую
форму, отличающуюся высокой биологической агрессией, тяжелым клиническим те-
чением, склонностью к рецидивированию, раннему метастазированию и плохим про-
гнозом.
Для стадирования нефробластомы чаще используется классификация по системе
TNM/pTNM (1987 г., 4-е издание, пересмотр 1992 г., TNM с добавлениями 1993 г.) с ре-
комендациями Международного союза онкопедиатров (SIOP), одобренной Между-
народным противораковым союзом и Национальным комитетом TNM, включая AJCC.
Классификация нефробластомы по системе TNM
Первичная опухоль (Т)
ТХ — недостаточно данных для оценки первичной опухоли.
ТО — первичная опухоль не определяется.
Т1 — опухоль одной почки до 80 см2 (включая почку).
Т2 — опухоль одной почки более 80 см2 (включая почку).
ТЗ — опухоль одной почки с разрывом до лечения.
Т4 — двусторонние опухоли.
Примечание: площадь опухоли определяется путем перемножения вертикальных и горизонтальных размеров но-
вообразования, включая и размер почки, определенный на рентгенограмме
Регионарные лимфоузлы (N)
NX — недостаточно данных для оценки состояния регионарных лимфоузлов.
NO — нет признаков регионарного поражения лимфоузлов.
N1 — регионарные лимфоузлы поражены метастазами.
Отдаленные метастазы (М)
MX — недостаточно данных для определения отдаленных метастазов.
МО — нет признаков отдаленных метастазов.
Ml — имеются отдаленные метастазы.
Представленные выше категории Т, N, М группируются в стадии заболевания, кото-
рые отражают степень распространения патологического процесса (табл. 11.1).
Таблица 11.1. Группировка нефробластомы по стадиям
| Стадия ТНМ J
Стадийная классификация по результатам операции рТ, pN, рМ
Первичная опухоль (рТ)
рТХ — недостаточно данных для оценки первичной опухоли.
рТО — первичная опухоль не определяется.
374 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Нефробластома
pTl — опухоль расположена внутри почки, полностью инкапсулирована, возможно
полное удаление, по краю резекции при гистологическом исследовании опухолевая
ткань отсутствует.
рТ2 — опухоль распространяется за пределы капсулы или паренхимы почки*, возмож-
но полное удаление.
рТЗ — опухоль распространяется за пределы капсулы или паренхимы почки*, возмож-
ны частичное удаление либо предоперационный или интраоперационный разрыв.
рТЗа — микроскопически определяемая резидуальная опухоль, ограниченная ложем
опухоли.
рТЗЬ — макроскопически определяемая резидуальная опухоль или наличие злокаче-
ственного асцита.
рТЗс — пробное хирургическое вмешательство, невозможность удаления опухоли.
рТ4 — двусторонние опухоли.
Регионарные лимфоузлы (pN)
pNX — недостаточно данных для оценки состояния регионарных лимфоузлов.
pNO — нет признаков регионарных метастазов.
pNI — регионарные лимфоузлы поражены метастазами.
pNla — регионарные пораженные лимфоузлы могут быть полностью удалены.
pNlb — регионарные пораженные лимфоузлы могут быть удалены лишь частично.
Отдаленные метастазы (рМ)
Категория рМ соответствует категориям М.
* Включаются понятия разрыв почечной капсулы и/или микроскопическая верификация опухоли за пределами
капсулы; наличие опухолевых тромбов в почечных сосудах вне почки; распространение за почечную лоханку
и/или мочеточник, клетчатку около лоханки.
Лечение нефробластомы сегодня находится в прямой зависимости от стадии за-
болевания и морфологического варианта опухоли (благоприятный и неблагопри-
ятный) и осуществляется согласно разработанным протоколам терапии, в которых
используется неоадъювантная XT, хирургический этап, лучевая терапия и адъю-
вантная XT. Важное значение имеет определение эффективности лечения по ре-
зультатам комплексного обследования с обязательным включением УЗИ брюшной
полости, КТ грудной и брюшной полости с контрастированием, радионуклидное
исследование почек.
Лекарственная терапия нефробластомы — обязательный компонент комбиниро-
ванного лечения. При нефробластоме с успехом используют следующие препараты:
дактиномицин (актиномицин D), винкристин, доксорубицин, циклофосфамид, ифос-
фамид, этопозид, карбоплатин.
Лечение локализованных стадий нефробластомы (I и II стадии)
У детей с / стадией опухолевого процесса терапию начинают, как правило, с опера-
тивного вмешательства, а в послеоперационный период проводят 3 курса XT с интер-
валом 21 день по схеме:
Винкристин — 1,5 мг/м2 (разовая доза не более 2 мг) в/в струйно в 1,8 и 15-й дни.
Дактиномицин — 1000 мкг/м2 в/в капельно в 1-й день.
У детей со II стадией нефробластомы проводится неоадъювантная XT винкристи-
ном и дактиномицином 15-дневным курсом (винкристин в 1, 8 и 15-й дни) и дактино-
мицин в 1-й день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 375
Злокачественные опухоли у детей
Если к 15-му дню терапии не получен выраженный клинический эффект (более 50%
сокращения опухоли), то вместе с 3-й инъекцией винкристина вводят 40 мг/м2 доксо-
рубицина в/в капельно.
После контрольного обследования, включающего УЗИ брюшной полости, КТ с контра-
стированием брюшной полости и легких, радионуклидное исследование почек, ангиог-
рафию (для уточнения объема операции), выполняется хирургический этап лечения в
объеме нефроуретерэктомии, удаления паранефральной клетчатки и подозрительных
в отношении метастазов лимфоузлов. По показаниям проводится органосохраняющая
операция со срочным гистологическим исследованием краев резекции.
Адъювантная полихимиотерапия назначается через 7-10 дней после операции,
получив гистологическое (иммуногистохимическое) заключение удаленной опухоли.
Адъювантная полихимиотерапия
Винкристин — 1,5 мг/м2 (разовая доза не более 2 мг) в/в струйно в 1-й и 8-й дни.
Дактиномицин — 1000 мкг/м2 в/в капельно в 1-й день.
Всего после операции проводится 6 курсов ПХТ с интервалом между курсами 3 нед.
При наличии опухолевых клеток в удаленных лимфоузлах, околопочечной клетчат-
ке, при разрыве опухоли во время операции и неблагоприятном гистологическом ва-
рианте опухоли послеоперационная ПХТ проводится по плану лечения больных с III-
IV стадией нефробластомы (см. ниже), дополняя сочетанием XT с лучевой терапией.
Лечение местнораспространенной и диссеминированной форм нефро-
бластомы (III-IV стадия)
Лечение начинается с неоадъювантной ПХТ 36-дневным курсом (режим А):
Винкристин —1,5 мг/м2 (разовая доза не более 2 мг) в/в струйно в 1,8,15,22,29 и 36-й дни.
Дактиномицин — 1200 мкг/м2 в/в капельно в 1-й и 22-й дни.
Доксорубицин — 50 мг/м2 в/в капельно в 1-й и 22-й дни.
Лечение проводится под контролем анализов крови, мочи, биохимических исследо-
ваний крови, на фоне дезинтоксикационной, корригирующей и симптоматической те-
рапии (объем вводимой жидкости — 2 л/м2).
При неэффективности предоперационной ПХТ (режим А) переходят на режим В:
Этопозид — 100 мг/м2 в/в капельно в 1-5-й и 22-26-й дни.
Ифосфамид — 1800 мг/м2 в/в капельно в 1-5-й и 22-26-й дни.
Ифосфамид вводится на фоне месны в дозировке, аналогичной таковой ифосфамида.
У больных с полным или выраженным частичным эффектом проводится оператив-
ное вмешательство в объеме нефроуретерэктомии с лимфодиссекцией (по показа-
ниям). Больным с III стадией заболевания при радикально выполненных операци-
ях (любых морфологических вариантах опухоли) проводится послеоперационная
лучевая терапия на соответствующую поражению половину брюшной полости в
СОД 10,8 Гр. В случае нерадикальной операции или разрыва опухоли облучают всю
брюшную полость в СОД 10,8 Гр с локальным воздействием на пораженную сторону
до СОД 21,6 Гр. Больным с поражением легких (IV стадия) проводится их облучение
в СОД 12 Гр. При остаточных метастазах в легких возможно дополнительное облуче-
ние зон поражения локальным полем.
Адъювантная ПХТ назначается через 7-10 дней после операции, после получения
гистологического и, при необходимости, иммуногистохимического заключения ана-
лиза удаленной опухоли.
Схема адъювантной полихимиотерапии:
Винкристин — 1,5 мг/м2 в/в струйно в 1-й день.
376 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Нейробластома
Дактиномицин — 1200 мкг/м2 в/в капельно в 1-й день.
Циклофосфамид (Циклофосфан) — 600 мг/м2 в/в капельно в 1-й и 2-й дни.
Всего после операции проводится 6 курсов адъювантной ПХТ.
Послеоперационная XT начинается как можно раньше после заживления раны.
С учетом массивности предоперационной XT проводят 4 курса адъювантной ПХТ.
У больных в возрасте до 1 года с I стадией заболевания проводится только хирургиче-
ское лечение. При И—IV стадии заболевания лечение выполняют по описанной выше про-
грамме. Расчет химиопрепаратов осуществляется не на поверхность, а на 1 кг массы тела.
Врожденные мезобластические нефромы, которые встречаются у детей до года,
обычно бывают доброкачественными процессами, но могут расти периренально. Этим
больным проводится только хирургическое лечение. При нерадикальности операции,
рецидивах опухоли или при клеточных формах врожденной мезобластической нефро-
мы у детей старше 3 мес. рекомендуется комплексное химиолучевое лечение.
У больных с неблагоприятным гистологическим вариантом опухоли проводят ин-
тенсивную ПХТ в послеоперационный период согласно одной из двух представлен-
ных ниже схем (6 курсов).
Схема I
Циклофосфамид — 400 мг/м2 в/в капельно в 1 — 5-й день.
Карбоплатин — 500 мг/м2 в/в капельно в 4-й день.
Этопозид — 100 мг/м2 в/в капельно в 1-5-й день.
Схема И
Вместо циклофосфамида вводится ифосфамид в дозе 1800 мг/м2 в/в капельно в 1 -5-й
день. Для предотвращения развития осложнений со стороны мочевых путей ифосфа-
мид рекомендуется вводить вместе с уропротектором месной.
Карбоплатин и этопозид вводят из расчета и в режиме, представленном в схеме 1.
Перспективным направлением в лечении резистентных форм и рецидивов нефроб-
ластомы в настоящее время считается использование высокодозных режимов XT с ау-
тологичной трансплантацией периферических стволовых клеток (ПСК).
Прогноз нефробластом определяется в основном распространенностью опухоле-
вого процесса, морфологическим вариантом опухоли, возрастом ребенка, а также
адекватностью проведенной терапии. Наиболее благоприятный прогноз у больных
раннего возраста с типичными морфологическими вариантами нефробластомы I-II
стадии: 5-летняя выживаемость составляет 95-97 %, при адекватно леченной 111 ста-
дии — 93 %. В случае рецидива заболевания выживаемость снижается до 63 %, а при
отдаленных метастазах (IV стадия) — до 30%.
11.2. Нейробластома
А. П. Казанцев, Е. И. Бойченко
Нейробластома (НБ) — злокачественная опухоль, которая развивается из эмбриональ-
ных нейробластов симпатической нервной системы. Одна из наиболее часто встречаю-
щихся опухолей детского возраста. Среди детей до 1 года заболеваемость НБ состав-
ляет 38% всех опухолей. В структуре опухолей у детей НБ занимает 4-е место, уступая
гемобластозам, опухолям ЦНС и саркомам мягких тканей. По частоте НБ конкурируете
нефробластомой. Удельный вес опухоли составляет 7-8% всех злокачественных опухо-
лей у детей. Чаще НБ регистрируется у детей в возрасте 2-5 лет. В 70% случаев уже при
установлении первичного диагноза выявляются отдаленные метастазы.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 377
Злокачественные опухоли у детей
Большинство опухолей локализуется забрюшинно в надпочечнике — 32%, вне-
органно паравертебрально — 28%, в средостении — 15%, в области таза — 5,6%, на
шее — 2%. Число неустановленных зон первичного развития опухоли — около 17%.
НБ имеет тенденцию к метастазированию в определенные зоны: костный мозг — 81 %,
кости — 69%, лимфоузлы — 65%, печень — 19%, легкие —10%, ЦНС — 8%.
У детей первого года жизни опухоль может самостоятельно регрессировать, у дру-
гих больных НБ может подвергаться спонтанному созреванию до доброкачественной
опухоли — ганглионевромы.
Гистологическое строение НБ представляет большой теоретический и практиче-
ский интерес. Опухоль развивается из симпатических ганглиев. Различают три типа
опухолей, отличающихся друг от друга степенью дифференцировки: нейробластома,
ганглионейробластома и ганглионеврома. В зависимости от клеточного состава разли-
чают три разновидности нейробластомы: симпатогониома, симпатобластома, гангли-
онейробластома.
Стадирование
Для определения распространенности опухолевого процесса используется класси-
фикация TNM (табл. 11.2).
Таблица 11.2. Классификация нейробластомы по системе TNM и группировка
по стадиям (SIOP, 1987)
Стадия Категории Т, К, М
। Т1 — единичная опухоль размером < 5 см в наибольшем измерении; МО — нет признаков по-
ражения лимфоузлов; МО — нет признаков отдаленных метастазов________________
Л Т2 — единичная опухоль > 5, но < 10 см в диаметре; NO — нет признаков поражения лимфоуз-
лов; МО — нет признаков отдаленных метастазов_______________________________
Т1-2; N1 — метастатическое поражение регионарных лимфоузлов; МО — нет признаков отда-
III ленных метастазов
ТЗ — единичная опухоль > 10 см в диаметре; любая N; МО______________
IVA Т1-3; любая N; М1 — есть отдаленные метастазы___________________________
IVB Т4 — множественные синхронные опухоли; любая N; любая М_________________
IVS Дети до 1 года с Т1-3; NO; метастазы в костный мозг, под кожу, печень
Лечение
Для лечения НБ применяют комбинированный и комплексный методы. На первом
этапе, если возможно, выполняется оперативное удаление опухоли. При невозмож-
ности хирургического этапа из-за большого размера новообразования лечение начи-
нается с XT. Наиболее эффективные х^миопрепараты: винкристин, циклофосфамид,
доксорубицин, этопозид, препараты платины.
Химиотерапия. У детей в возрасте до 1 года и при массе тела менее 10 кг расчет
химиопрепаратов проводится на 1 кг массы тела пациента: винкристин — 0,05 мг/кг.
этопозид — 4 мг/кг, доксорубицин — 1,25 мг/кг, цисплатин — 1,5 мг/кг, циклофосфа-
мид — 10 мг/кг, карбоплатин — 6 мг/кг. Интервалы между курсами 3 нед.
Альтернативные режимы химиотерапии
1. Винкристин — 1,5 мг/м* 1 2 в/в струйно в 1-й и 5-й дни.
Циклофосфамид (Циклофосфан) — 300 мг/м2 в/в капельно в 1-5-й день.
Доксорубицин — 60 мг/м2 в/в капельно в 5-й день.
2. Этопозид — 100 мг/м2 в/в капельно в 1-5-й день.
378 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Нейробластома
Карбоплатин — 150 мг/м2 в/в капельно в 1-5-й день.
3. Винкристин —1,5 мг/м2 в/в струйно в 1-й день.
Доксорубицин — 30 мг/м2 в/в капельно во 2-й и 3-й дни.
Циклофосфамид — 600-800 мг/м2 в/в капельно в 1-й день.
Месна — 1000 мг/м2 в 400 мл физиологического раствора в/в 4-часовая инфузия, за-
тем 300 мг/м2 в/в струйно через 3 ч. Всего 3 введения.
Цисплатин — 60-70 мг/м2 в/в капельно в 4-й день.
4. Карбоплатин — 560 мг/м2 (18 мг/кг) в/в капельно 1-часовая инфузия в 1-й день.
Этопозид — 120 мг/м2 (4 мг/кг) в/в капельно 2-часовая инфузия во 2-4-й день.
Циклофосфамид — 1000 мг/м2 (33 мг/кг) в/в капельно 1-часовая инфузия в 3-й день.
Месна — 1000 мг/м2 в 400 мл физиологического раствора в/в 4-часовая инфузия, за-
тем 300 мг/м2 в/в струйно через 3 ч. Всего 3 введения.
Доксорубицин — 30 мг/м2 (1 мг/кг) в/в капельно 1-часовая инфузия в 4-й день.
У больных с IV стадией заболевания старше 1 года при наличии множественных от-
даленных метастазов лечение в НИИ ДОГ проводится по следующей программе.
I этап включает 4 курса индукционной XT со сбором ПСК.
1-й и 4-й курсы химиотерапии VACCE:
Винкристин — 1,5 мг/м2 в/в струйно в 1-й день.
Циклофосфамид — 600 мг/м2 в/в капельно 1-часовая инфузия.
Доксорубицин — 30 мг/м2 в/в струйно в 1-й и 2-й дни.
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 3-й и 4-й дни (концентрация
этопозида не более 0,4 мг/мл растворителя).
Цисплатин — 80 мг/м2 в/в капельно 4-часовая инфузия в 4-й день.
2-й курс химиотерапии VACCE-3:
Винкристин — 1,5 мг/м2 в/в струйно в 1-й день.
Ифосфамид 3 г/м2 + месна 1000 мг/м2 капельно в/в 1-часовая инфузия в 1-3-й день.
Месна — 1000 мг/м2 в 400 мл физиологического раствора в/в 4-часовая инфузия, за-
тем 300 мг/м2 в/в струйно через 3 ч. Всего 3 введения.
Доксорубицин — 30 мг/м2 в/в струйно в 1-й и 2-й дни.
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 3-й и 4-й дни (концентрация
этопозида не более 0,4 мг/мл растворителя).
Цисплатин — 80 мг/м2 в/в 4-часовая инфузия в 4-й день.
3-й курс химиотерапии VACCE-12:
Винкристин — 1,5 мг/м2 в/в струйно в 1-й день.
Циклофосфамид — 1200 мг/м2 в/в 1-часовая инфузия в 1-й и 2-й дни.
Месна — 1000 мг/м2 в 400 мл физиологического раствора в/в 4-часовая инфузия, за-
тем 300 мг/м2 в/в струйно через 3 ч. Всего 3 введения.
Доксорубицин — 30 мг/м2 в/в струйно в 1-й и 2-й дни.
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 3-й и 4-й дни (концентрация
этопозида не более 0,4 мг/мл растворителя).
Цисплатин — 80 мг/м2 в/в 4-часовая инфузия в 4-й день.
Интервал между курсами 3 нед.
Рекомендуемый интервал между курсами 3 нед., считая от 1-го дня XT, при условии,
что показатель лейкоцитов крови более 2500/мм3, тромбоцитов более 75 000/мм3.
Если на фоне введения циклофосфамида в дозе 1200 мг/м2 или ифосфамида 3 г/м2
наблюдается органная токсичность IV степени (по критериям ВОЗ) или макроскопи-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 379
Злокачественные опухоли у детей
ЯЗвЯЯЯЮЯЯМЯМЖИйаяКИИаЙЙввЯЙ^^ Z « "•
ческая гематурия, дозы цитостатиков должны быть снижены (циклофосфамид — дс
600 мг/м2, ифосфамид — до 1,8 г/м2) во всех следующих курсах.
II этап — проведение операции и послеоперационного облучения. В случае невоз-
можности выполнения операции (неоперабельный случай) планируется проведение
лучевой терапии на область первичной опухоли и/или метастазов. После оценки эф-
фекта лучевой терапии, если возможно, можно вернуться к обсуждению вопроса с
хирургическом лечении.
111 этап — один курс XT по схеме VACCE-12 после локального контроля с целью кон-
солидации.
IV этап — высокодозная XT с аутотрансплантацией ПСК.
Биотерапия начинается со дня 84+ после трансплантации костного мозга. Лече-
ние проводится 13-цисретиноидной кислотой (Роаккутан) в дозе 160 мг/м2 в сутки
(доза делится на 2 приема). Лечение проводится в течение 14 дней под контролем би-
охимических анализов крови: кальций, фосфор, АсАТ, АлАТ. Затем перерыв 2 нед. Об-
щее число курсов 6.
Результаты лечения НБ в целом неудовлетворительные. 2-летняя выживаемость не
превышает 35%, за исключением опухолей средостения (локализованные формы),
при которых выживаемость более 90%.
В связи с этим во всех клиниках мира ведется интенсивный поиск новых подходов к
проблеме лечения НБ детского возраста.
Современное представление о лечении НБ базируется на возрастных особенностях
пациента, установлении клинико-морфологической стадии заболевания, гистологиче-
ском анализе опухоли, определении ее молекулярно-генетических маркеров.
Для диагностики НБ применяют следующие методы: клиническое, лабораторные,
лучевые исследования (КТ, МРТ, ангиография), радионуклидные исследования, анализ
миелограммы, морфологическое, иммуногистохимическое, молекулярно-генетиче-
ское исследования.
С конца 2007 г. в НИИ ДОГ лечение больных с локализованной и местнораспростра-
ненной НБ (I-1I1 стадии) проводится по протоколу COG 9641 А3961 (США).
В основе протокола лежит идея продемонстрировать, что уменьшение интенсифи-
кации и сроков терапии у больных НБ не ухудшает результатов лечения.
Критерии включения: пациенты с морфологически подтвержденной I-1II стадией
нейробластомы, кроме пациентов со I1-1II стадией заболевания в возрасте более
1 года с амплификацией гена N-myc более 10 копий и с неблагоприятной гистологией
и пациентов с 111 стадией заболевания в возрасте менее 1 года с амплификацией гена
N-myc более 10 копий.
Для клинического стадирования НБ используется классификация по системе INSS
(табл. 11.3).
Важное место в определении стратегии и тактики терапии НБ отводится определе-
нию группы риска пациента, для чего выполняется морфологический анализ опухоли
(определение гистологического типа, митоза кариорексиса) и последующая оценка
по классификации Н. Shimada (табл. 11.4).
Большое значение для выработки лечебной тактики имеет определение независи-
мого маркера онкогена N-myc. В случае амплификации гена N-myc (> 10 копий) про-
гноз болезни неблагоприятный. При отсутствии амплификации онкогена можно про-
гнозировать благоприятное течение заболевания. В табл. 11.5 представлен подход к
определению группы рискау больных НБ.
После установления группы риска (см. табл. 11.5) определяется лечебная тактика у
больного НБ. При проведении XT используются две схемы лечения (табл. 11.6).
380 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Нейробластома
Таблица 11.3. Стадирование нейробластомы по системе INSS
Стадия Распространенность опухолевого процесса
Локализованная опухоль с возможностью полной резекции (с или без микроскопических рези-
। дуальных очагов опухоли; в лимфоузлах той же стороны при микроскопическом исследовании
опухолевые клетки не обнаруживаются; лимфоузлы, прилежащие к первичной опухоли и уда-
ляемые вместе с нею, могут содержать опухолевые клетки)
Локализованная опухоль, макроскопически полностью не удаляемая; в лимфоузлах той же
НА стороны, не примыкающих к опухоли, при микроскопическом исследовании опухолевые клет-
ки не обнаруживаются
Локализованная опухоль с возможностью макроскопической полной или частичной резекции;
IIВ в лимфоузлах той же стороны, не примыкающих к опухоли, определяются опухолевые клетки.
Увеличенные лимфоузлы на противоположной стороне не содержат опухолевых клеток
Локализованная опухоль с возможностью макроскопической полной или частичной резекции;
III в лимфоузлах той же стороны, не примыкающих к опухоли, определяются опухолевые клетки.
Увеличенные лимфоузлы на противоположной стороне не содержат опухолевых клеток
Любая первичная опухоль с поражением отдаленных лимфоузлов, костей скелета, костного
IV мозга, печени, кожи и/или других органов (за исключением органов, обозначенных в стадии
IVS)
Jvq Локализованная первичная опухоль (как при стадиях I, ПА или IIB) с диссеминацией в кожу, пе-
чень и/или костный мозг (строго у детей до 1 года)
Таблица 11.4. Классификация нейробластомы (по Н. Shimada и соавт.)
Признак Благоприятный гистологический тип Неблагоприятный гистологический тип
НБ, богатая стромой, воз- раст любой НБ, богатая стромой, хорошо диффе- ренцированный подтип Смешанный подтип НБ, богатая стромой, узловой подтип (возраст любой)
НБ, беднаястромой^ -л у-
Возраст <1,5 лет МКГ <200 MKI > 200
Возраст 1,5—5 лет MKI < 100 MKI > 100 и дифференцированная, или недифференцированная
Возраст > 5 лет Нет Все
* MKI — индекс «митоз/кариорексис» (количество митозов и кариорексиса на 5000 клеток)
Таблица 11.5. Определение группы риска для больных в возрасте до 21 года
Возраст__________________________< 12 мес.______________________________12 мес.
Амплификация н т гена N-myc е Есть Нет Есть
Гистологический Благопри- Неблаго- тип по Н. Shimada ятный приятный Благопри- Неблаго- Благопри- Неблаго- Благопри- Неблаго- ятный приятный ятный приятный ятный приятный
ДНК-плоидия >1 1 >1 1 >1 1 >1 1 >1 1 >1 1 >1 1 >1 1
Стадия 1
Стадия IIA-IIB Стадия III НВ Стадия IV Стадия IVS |ЦМ
1—1 низкий риск 1 [средний риск 1 К высокий риск
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 381
Злокачественные опухоли у детей
Таблица 11.6. Программа химиотерапии нейробластомы
Препарат Схема 1, день цикла Схема 2, день цикла 1
Карбоплатин 560 мг/м2 (18 мг/кг) в/в 0,21 и 63-й 105-й и 126-й
Этопозид 120 мг/м2 (4 мг/кг) в/в 0,1,2, 42,43, 44,64 и 65-й 84, 85, 86,126,127 и 128-й
Циклофосфамид 1000 мг/м2 <33 мг/кг) в/в 21-й и 42-й 84,105 и 147-й
Доксорубицин 30 мг/м2 (1 мг/кг) в/в 21-й и 63-й 105 и 147-й
В зависимости от сокращения размера опухоли оценивают эффект от проведенной
XT:
полный ответ — тотальное исчезновение опухоли с отсутствием проявлений бо-
лезни; катехоламины в моче в норме;
выраженный эффект — первичная опухоль уменьшилась на 90-99 %; нет прояв-
лений со стороны метастазов; катехоламины в моче в норме; отсутствуют оста-
точные поражения костного мозга;
И частичный эффект — уменьшение размера опухоли на 50-90%; количество ме-
тастазов уменьшилось более чем на 50%; не более одного очага поражения
костного мозга;
И смешанный эффект — нет новых поражений; уменьшение первичной опухоли и
метастазов на 50-90 %; уменьшение метастатических очагов менее чем на 50 %;
увеличение количества метастатических очагов менее 25 %;
отсутствие эффекта — нет новых очагов поражения; сокращение размера
первичной опухоли менее 50 %; увеличение любого видимого очага менее
чем на 25%;
прогрессирование болезни — появление новых очагов поражения; увеличение
видимых очагов более чем на 25 %; появление новых метастазов в костном мозге.
Ниже представлены схемы стратегии лечения больных НБ в зависимости от стадии
болезни (по классификации INSS).
При I стадии INSS (низкий риск) выполняется обследование с последующим хирур-
гическим лечением. В дальнейшем проводится динамическое наблюдение за пациен-
том без назначения ПХТ.
При НА и НВ стадиях INSS (низкий риск) выполняется обследование с последующим
хирургическим лечением. При удалении более 50% опухоли проводится динамиче-
ское наблюдение за пациентом; при удалении менее 50% опухоли проводится ПХТ по
схеме 1 с дальнейшим динамическим наблюдением.
При III стадии INSS (средний риск) выполняется обследование с последующим хи-
рургическим лечением (полное или частичное удаление), затем проводится ПХТ по
схеме 1 или 2. Для оценки эффекта от ПХТ выполняется повторный оперативный этап,
после которого решается вопрос о продолжении ПХТ по схеме 1 или 2, лучевой тера-
пии или динамического наблюдения.
При прогрессировании заболевания у пациентов с низким и средним риском прово-
дятся противорецидивные курсы ПХТ.
Лучевая терапия. Для всех стадий среднего риска (кроме IVS) лучевая терапия
проводится в СОД 20-24 Гр. РОД составляет 2 Гр на первичную опухоль и метастазы.
СОД на печень, легкое, почку составляет не более 12 Гр.
В 1998-2004 гг. в США было проведено исследование, касающееся лечения боль-
ных НБ по протоколу COG 9641 А3961. Результаты 2-летней общей выживаемости,
опубликованные в 2005 г., оказались следующими: у больных с I стадией — 99%, со
ПА стадией — 99%, с ПВ стадией — 81 %; с III стадией: дети до 1 года — 98%, дети стар-
ше 1 года — 96%.
382 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рабдомиосаркома
11.3. Рабдомиосаркома
Н. М. Иванова, А. В. Шварова
Рабдомиосаркома (РМС) — наиболее распространенный вид сарком мягких тканей у
детей и составляет 7 % всех опухолей детского возраста. Рабдомиосаркомы чаще по-
ражают органы мочеполовой сферы (51,4%) и область головы и шеи (33%), реже — ту-
ловище и конечность (18%).
При гистологическом исследовании, согласно классификации ВОЗ, выявлены раз-
личные типы РМС: эмбриональный, включая ботриоидный (73 %), альвеолярный (9,3 %),
смешанный (2%), Юинго-подобный (1,4%) и неклассифицируемый (14,3%).
С учетом возможности осуществления радикальной операции принято деление
больных на клинические группы.
I группа — локализованная опухоль полностью удалена, без метастазов в регионар-
ных лимфоузлах, что подтверждено гистологическим исследованием.
II группа: а) большая опухоль удалена с микроскопически выявляемыми ее остатка-
ми, без метастазов в регионарных лимфоузлах; Ь) большая опухоль удалена полностью
или с микроскопическими признаками нерадикальной операции, имеются метастазы
в удаленных регионарных лимфоузлах.
III группа — проведено частичное удаление или только биопсия опухоли с метаста-
зами в регионарных лимфоузлах либо без них.
IV группа — имеются отдаленные метастазы при первичной диагностике заболева-
ния.
Основные принципы комплексного лечения детей с РМС определяются группой, к
которой относится заболевание (табл. 11.7).
Таблица 11.7. Методы лечения рабдомиосарком в зависимости от клинической
группы заболевания
Клиническая группа Первичная операция XT Лучевая терапия Повторная операция XT Лучевая терапия
1 + + - — - -
На + + + + +/-
НЬ + + +/- + + +/-
III + + +/- +/- , + +
IV + + +/- +/- + + (включая метастазы)
Примечание: «+»— обязательное применение метода лечения;«-»• метод лечения применяется по показаниям. — метод лечения не применяется; «+/-» —
Лечение
После выполнения первичного оперативного вмешательства всем больным назнача-
ется системная ПХТ по схеме VACA:
Винкристин — 2 мг/м2 в/в струйно 1 раз в неделю 6 нед.
Доксорубицин (Адриамицин) — 30 мг/м2 в/в капельно в 1-й и 2-й дни.
Циклофосфамид (Циклофосфан) — 500 мг/м2 в/в капельно в 1 —3-й день.
Дактиномицин — 15 мкг/кг в/в струйно в 1-5-й день.
Три последних препарата вводят с интервалом 4 нед.
Затем в клинических группах I-III этот курс повторяется. У больных IV группы и у де-
тей, у которых первый курс оказался малоэффективным, циклофосфан заменяется на
цисплатин 120 мг/м2, который вводится в/в капельно в 3-й день 1-й и 7-й недель лече-
ния.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 383
Злокачественные опухоли у детей
яиаямияюйивваяйвяяййвяяаййяяввяя»^^ vf - -
В дальнейшем противоопухолевая лекарственная терапия у больных клинических
групп I и На состоит из 6 курсов XT с 3-недельным интервалом между ними по схеме
VA:
Винкристин — 1,5 мг/м2 в/в струйно в 1-й день.
Дактиномицин — 15 мкг/кг в/в струйно в 1 — 5-й день.
У детей 11b и Ill групп проводится 2 курса по схеме VACA, а затем — 6 курсов XT пс
схеме VAC:
Винкристин — 1,5 мг/м2 в/в струйно в 1-й день.
Дактиномицин — 15 мкг/кг в/в струйно в 1-5-й день.
Циклофосфамид — 300-400 мг/м2 в/в струйно в 1-5-й день.
В IV клинической группе после 2 курсов по схеме VACA используется XT по схеме
VECA (доксорубицин заменяется на этопозид 150 мг/м2, который вводится в/в капель-
но в 1-3-й день 1-й и 7-й недель).
Лечение длится 36 нед. для больных I и Па групп и 56 нед. — в группах lib, III и IV.
Больным с параменингеальными новообразованиями рекомендуется дополнитель-
ное интратекальное введение химиопрепаратов (8 раз в течение 16 нед.). В зависи-
мости от возраста можно вводить различные дозы лекарств: метотрексат — 6, 8, 10 и
12 мг, цитозин-арабинозид — 10, 16, 24 и 30 мг (для детей в возрасте 1-2, 2-3, 3-7 лет
и старше 7 лет соответственно).
В последние годы комплексная терапия РМС проводится на основании современных
протоколов лечения данного вида опухоли, согласно которым больные разделяются
на прогностические группы в зависимости от локализации и гистологического вари-
анта опухоли, клинической и патологической стадии болезни (с учетом радикальности
выполненного хирургического вмешательства).
В группу низкого риска включаются больные с I стадией болезни (pTINOMO), бла-
гоприятным гистологическим вариантом, выполненной на первом этапе радикальной
операцией. Для этой группы больных используется XT (от 2 до 4 курсов) по следую-
щей схеме.
VA
Винкристин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в струйно в 1,8, 15 и 22-й дни.
Дактиномицин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в капельно в 1-й и 22-й дни.
В группу среднего риска включаются больные со II и III стадиями заболевания (рТ-
2N0M0), благоприятным гистологическим вариантом, без поражения регионарных
лимфоузлов. Этим пациентам проводится XT по следующим схемам.
IVA
Винкристин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в струйно в 1,8 и 15-й дни.
Дактиномицин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в капельно в 1-й день.
Ифосфамид — 3 г/м2 в/в капельно в 1-3-й день на фоне месны.
Всего 8-10 курсов. Повторение цикла на 21-й день, считая от 1-го дня предыдущего
цикла.
IVA-2
Винкристин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в струйно в 1,8 и 15-й дни.
Дактиномицин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в капельно в 1-й день.
Ифосфамид — 3 г/м2 в/в капельно в 1-й и 2-й дни на фоне месны.
Всего 9 курсов. Повторение цикла на 21 -й день, считая от 1 -го дня предыдущего цикла.
VAC
Винкристин —1,5 мг/м2 (не более 2 мг на 1 введение) в/в струйно в 1, 8 и 15-й дни.
384 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Рабдомиосаркома
Дактиномицин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в капельно в 1-й день.
Циклофосфамид — 2,2 г/м2 в/в капельно в 1-й день на фоне месны.
Всего 10 курсов. Повторение цикла на 21-й день, считая от 1-го дня предыдущего ци-
кла.
Больным РМС параменингеальной локализации в группе среднего риска проводят
следующую XT.
CarboVAC
Карбоплатин — 360 мг/м2 в/в капельно в 1-й день.
Винкристин — 1 мг/м2 (не более 2 мг на 1 введение) в/в струйно в 1-й и 8-й дни.
Циклофосфамид — 500 мг/м2 в/в капельно в 1-й и 8-й дни.
Доксорубицин — 20 мг/м2 в/в капельно во 2-й и 4-й дни.
Всего 8 курсов. Повторение цикла на 21-й день, считая от 1-го дня предыдущего цикла.
В группу высокого риска включаются больные со II и III стадиями заболевания, небла-
гоприятным гистологическим вариантом, поражением регионарных лимфоузлов. Для
этой группы больных используется 9 альтернирующих курсов XT.
VAIA
Винкристин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в струйно в 1-й день на 1-7, 10,
13, 16, 19, 22 и 25-й неделях.
Дактиномицин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в капельно в 1-й день на 1, 7,
16, 19 и 25-й неделях.
Ифосфамид — 3 г/м2 в/в капельно в 1-й и 2-й дни на фоне месны на 1,4, 7, 10, 13, 16,
19, 22 и 25-й неделях.
Доксорубицин — 40 мг/м2 в/в капельно в 1-й и 2-й дни на 4, 13 и 22-й неделях.
CEVA1E
Карбоплатин — 500 мг/м2 в/в капельно 1-часовая инфузия в 1-й день на 4, 13 и 22-й не-
делях.
Эпирубицин — 150 мг/м2 в/в капельно 6-часовая инфузия в 1-й день на 4, 13 и 22-й не-
делях.
Этопозид — 150 мг/м2 в/в капельно 2-4-часовая инфузия в 1 —3-й день на 7, 16 и 25-й
неделях.
Винкристин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в струйно в 1-й день на 1-7, 10,
13, 16, 19, 22 и 25-й неделях.
Дактиномицин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в капельно в 1-й день на 1-й
и 19-й неделях.
Ифосфамид — 3 г/м2 в/в капельно в 1-3-й день на фоне месны на 7, 10, 16 и 19-й не-
делях.
Ифосфамид — 3 г/м2 в/в капельно в 1 -й и 2-й дни на фоне месны на 1 -й и 25-й неделях.
Для лечения больных с IV стадией болезни (группа высокого риска) предлагается так-
же следующая программа, состоящая из альтернирующих курсов XT по схемам:
1. Карбоплатин — 500 мг/м2 в/в капельно в 1-й день.
Эпирубицин — 150 мг/м2 в/в капельно в 1-й день.
Винкристин —1,5 мг/м2 в/в струйно в 1-й и 8-й дни.
2. Ифосфамид — 3 г/м2 в/в капельно в 1-3-й день на фоне месны.
Дактиномицин — 1,5 мг/м2 (не более 2 мг на 1 введение) в/в капельно в 1-й день.
Винкристин — 1,5 мг/м2 в/в струйно в 1-й и 8-й дни.
3. Ифосфамид — 3 г/м2 в/в капельно в 1-3-й день на фоне месны.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 385
Злокачественные опухоли у детей
Этопозид (Вепезид) — 200 мг/м2 в/в капельно в 1-3-й день.
Винкристин — 1,5 мг/м2 в/в струйно в 1-й и 8-й дни.
У детей до 12 мес. дозы снижают на 50 %, затем, при хорошей переносимости, увели-
чивают на 25%.
После проведения первых 3 курсов XT по указанным выше схемам оценивают эф-
фект: при сокращении опухоли более чем на 50% проводятся еще таких же 3 курса
XT с дальнейшим хирургическим вмешательством, послеоперационным облучением,
и адъювантной XT теми же цитостатиками в прежнем режиме (6 курсов); в случае со-
кращения опухоли менее чем на 50% больного готовят к высокодозной XT с аутотран-
сплантацией костного мозга и/или ПСК.
В последние годы в НИИ ДОГ ГУ РОНЦ применяется протокол для больных РМС вы-
сокой степени риска (пациенты с рецидивными, резистентными к проводимой тера-
пии, первично-диссеминированными, неблагоприятного гистологического варианта
опухолями). Для таких больных разработана методика интенсивной противоопухоле-
вой терапии со сбором ПСК в отделении трансплантации костного мозга.
Проводится 8 курсов XT по следующей схеме.
Carbo ЕС
Циклофосфамид — 400 мг/м2 в 200 мл 0,9% раствора натрия хлорида в/в капельно
1-часовая инфузия в 1-5-й день.
Карбоплатин — 500 мг/м2 в 100-200 мл 0,9% раствора натрия хлорида в/в капельно
6-часовая инфузия в 4-й день.
Этопозид — 100 мг/м2 в 200-400 мл 0,9% раствора натрия хлорида в/в капельно
1-часовая инфузия в 1-5-й день (если концентрация этопозида более 0,4 мг/мл рас-
творителя, необходимо увеличить объем инфузии).
Вначале проводится 2 курса XT. ПСК собирают в фазе восстановления гемопоэза
после 1-го и, если необходимо, 2-го курсов XT по общепринятым стандартам. Мо-
билизация осуществляется с использованием Г-КСФ. Затем, как правило, проводит-
ся операция с последующей лучевой терапией и 6 курсами XT в тех же дозах и по
той же схеме с реинфузией субтрансплантационных доз ПСК с целью уменьшить
гематологическую токсичность. Собранные ранее ПСК переливают на следующий
день (день 6+) после окончания терапии в/в струйно. Доза переливаемых ПСК ко-
леблется от 0,3 до 0,5 х 106 СЭ34+/кг в зависимости от количества ранее собран-
ных клеток. После переливания ПСК могут назначаться КСФ, обычно Г-КСФ, в дозе
2-5 мкг/кг/сут.
Указанная выше методика может быть использована в медицинских учреждени-
ях при наличии специализированных отделений высокодозной XT и трансплантации
костного мозга.
Схема ДОРМС. В НИИ ДОГ с 2006 г. для лечения РМС среднего риска применяется
протокол ДОРМС-2006.
Критерии включения в протокол следующие: 1) пациенты с неметастатической аль-
веолярной РМС; 2) пациенты со стадиями II и III, клинической группы III, с эмбриональ-
ной РМС; 3) пациенты до 10 лет со стадией IV, клинической группы IV, с эмбриональ-
ной РМС.
Лечение состоит из трех этапов; индукция, локальный контроль и консолидация.
Индукция: схемы VAC (0,6 нед.), VTC (3,9 нед.).
Локальный контроль: операция на 12-й неделе после оценки эффекта.
386 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Рабдомиосаркома
Схемы VAC (12 нед.), VTC (21 нед.), VC (15, 18 нед.). Лучевая терапия с 13-й по 18-ю
неделю.
Консолидация после оценки эффекта на 24-й неделе.
Схемы VAC (24, 30 и 36-я недели), VTC (27, 33 и 39-я недели).
VAC
Винкристин — в/в струйно в 1,8 и 15-й дни.
Циклофосфамид — в/в капельно в 1-й день.
Дактиномицин — в/в струйно в 1-й день.
Дозы препаратов в схеме VAC
До 1 года: винкристин 0,025 мг/кг, дактиномицин 0,025 мг/кг, циклофосфамид 36 мг/кг.
1-3 года: винкристин 0,05 мг/кг, дактиномицин 0,045 мг/кг, циклофосфамид 73 мг/кг.
Старше 3 лет: винкристин 1,5 мг/м2, дактиномицин 0,045 мг/кг, циклофосфамид
2200 мг/м2.
Циклофосфамид вводится вместе с месной (Уромитексан) в соотношении 1:1.
VTC
Винкристин — в 1,8 и 15-й дни.
Топотекан — в 1-5-й день.
Циклофосфамид — в 1-5-й день.
Дозы препаратов в схеме VTC
Винкристин — те же.
Циклофосфамид — 250 мг/м2.
Топотекан — 0,75 мг/м2.
Лечение завершается на 39-й неделе. На 42-й неделе проводится оценка эффекта.
Таргетная терапия. В связи с неудовлетворительной выживаемостью детей с РМС
IV клинической группы, а также стремлением детских онкологов снизить токсичность
противоопухолевого лечения исследуется эффективность применения при данной
опухоли препаратов направленного действия, так называемых таргетных.
Так, начаты исследования эффективности иматиниба мезилата (Гливек). Его исполь-
зование при РМС основано на определении рецепторов Kit тирозинкиназы, поскольку
иматиниб блокирует тирозинкиназу.
Еще одним эффективным при РМС таргетным препаратом может стать бевацизумаб,
представляющий собой МКА к VEGFR, способное блокировать неоангиогенез в опу-
холи. Препарат показал активность при КРР и РМЖ, клинические исследования его
применения при РМС продолжаются.
Помимо таргетных препаратов продолжается поиск новых эффективных при РМС
цитостатиков. Одним из таких препаратов можно считать капецитабин (Кселода), ко-
торый под действием тимидинфосфорилазы в клетках опухоли превращается в актив-
ный метаболит — 5-фторурацил. Известно, что часть РМС несет рецепторы тимидин-
фосфорилазы, благодаря чему можно предположить эффективность капецитабина
при РМС, которая в настоящее время изучается в различных исследованиях. В случае
наличия рецепторов дигидропиримидиндегидрогеназы активен 5-фторурацил. Таким
образом, продолжается поиск новых более эффективных лекарств, активных в отно-
шении РМС, и их комбинаций.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 387
Злокачественные опухоли у детей
11.4. Злокачественные опухоли костей
Н. М. Иванова
Опухоли костей у детей наблюдаются преимущественно во втором десятилетии жизни
и составляют около 10-15 % всех злокачественных новообразований детского возра-
ста. Наиболее часто встречаются остеосаркома и опухоли семейства саркомы Юинга.
11.4.1. Остеосаркома
Остеосаркома у детей составляет до 4,5% всех костных опухолей и дисплазий и око-
ло 70% всех злокачественных опухолей костей. На момент первичной диагностики у
20-25 % детей с остеосаркомой определяются отдаленные метастазы. Наиболее ча-
сто метастазами поражаются легкие и кости. Примерно 70-80% больных имеют ме-
тастазы, которые клинически не выявляются при первичной диагностике заболевания.
Таким образом, можно считать остеосаркому детского возраста первично-диссеми-
нированным процессом.
Лечение больных с остеосаркомой включает предоперационную (неоадъювантную)
XT, радикальное хирургическое вмешательство с дальнейшим проведением профи-
лактической послеоперационной (адъювантной) XT. Необходимо отметить, что повы-
шение эффективности ПХТ наряду с совершенствованием конструкции эндопротезов
позволило в последние годы существенно повысить частоту органосохраняющих опе-
раций, в т.ч. у самых маленьких детей. При наличии метастазов в легких выполняет-
ся их хирургическое удаление с последующей комбинированной XT. Лучевая терапия
практически не применяется у детей с остеосаркомой в связи с относительной ради-
орезистентностью опухоли, что требует подведения сверхвысоких доз (70-80 Гр) и
неприемлемо в детской практике. Тем не менее облучение в дозе 40-60 Гр использу-
ется в качестве паллиативного лечения при неоперабельной и/или диссеминирован-
ной остеосаркоме с целью купировать болевой синдром.
В последние годы XT остеосаркомы у детей проводится по различным современным
протоколам.
Европейское межгрупповое исследование по остеосаркоме (1993-
2002). Для пациентов с локализованной остеосаркомой конечностей предложены
следующие схемы.
РЕЖИМ С
Неоадъювантная химиотерапия (2 цикла)
Цисплатин — 100 мг/м2 в/в в 1-й день.
Доксорубицин — 25 мг/м2 в/в в 1-3-й день.
Адъювантная химиотерапия (4 цикла)
Цисплатин — 100 мг/м2 в/в в 1-й день.
Доксорубицин — 25 мг/м2 в/в в 1-3-й день.
Повторение цикла на 21-й день, считая от 1-го дня предыдущего цикла.
РЕЖИМ D1
Неоадъювантная химиотерапия (2 цикла)
Цисплатин — 100 мг/м2 в/в в 1-й день.
Доксорубицин — 25 мг/м2 в/в в 1-3-й день.
388 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли костей
Г-КСФ — 5 мкг/кг п/к в 4-13-й день.
Адъювантная химиотерапия (4 цикла)
Цисплатин — 100 мг/м2 в/в в 1-й день.
Доксорубицин — 25 мг/м2 в/в в 1—3-й день.
Г-КСФ — 5 мкг/кг п/к в 4-13-й день.
Повторение цикла на 14-й день, считая от 1-го дня предыдущего цикла.
Протокол итальянской и скандинавской групп по изучению сарком.
Протокол ISG/SSG-1 по лечению пациентов с локализованной остеосаркомой конеч-
ностей проводится с 1997 г.
Неоадъювантная химиотерапия
Метотрексат — 12 г/м2 в/в 4-часовая инфузия в 1-й день и на 7-й неделе.
Доксорубицин — 75 мг/м2 в/в 24-часовая инфузия на 2-й и 8-й неделях.
Цисплатин — 120 мг/м2 в/в 48-часовая инфузия на 2-й и 8-й неделях.
Ифосфамид — 15 г/м2 в/в 24-часовая инфузия в течение 5 дней на 4-й и 10-й неделях.
Адъювантная химиотерапия (при хорошем патоморфозе)
Метотрексат — 12 г/м2 в/в 4-часовая инфузия на 19-й и 28-й неделях.
Доксорубицин — 90 мг/м2 в/в 24-часовая инфузия на 14-й и 23-й неделях.
Цисплатин — 120 мг/м2 в/в 48-часовая инфузия на 20, 29 и 35-й неделях.
Ифосфамид — 15 г/м2 в/в 24-часовая инфузия в течение 5 дней на 17-й и 26-й неделях.
Адъювантная химиотерапия (при плохом патоморфозе)
Метотрексат — 12 г/м2 в/в 4-часовая инфузия на 19, 28 и 34-й неделях.
Доксорубицин — 90 мг/м2 в/в 24-часовая инфузия на 14-й и 23-й неделях.
Цисплатин — 150 мг/м2 в/в 48-часовая инфузия на 20, 29 и 35-й неделях.
Ифосфамид — 15 г/м2 в/в 24-часовая инфузия в течение 5 дней на 17, 26 и 32-й неде-
лях.
НИИ ДОГ ГУ РОНЦ 002006. В настоящее время в НИИ ДОГ применяется следу-
ющий протокол по лечению остеосаркомы у детей.
Неоадъювантная химиотерапия (4 блока)
БЛОК А (1-я неделя)
Цисплатин — 50 мг/м2 в/в капельно 24-часовая инфузия в 1-й и 2-й дни.
Доксорубицин — 45 мг/м2 в/в капельно 24-часовая инфузия в 3-й и 4-й дни.
БЛОК В (4-я неделя)
Метотрексат — 12 г/м2 (максимальная разовая доза 20 г) в/в капельно 4-часовая инфу-
зия в 1-й и 8-й дни.
Лейковорин — 15 мг/м2 в/в струйно каждые 6 ч спустя 24 ч от начала инфузии мето-
трексата, 10—12 введений.
Ифосфамид — 3 г/м2 в/в капельно 1-часовая инфузия в 15-17-й день.
Этопозид — 150 мг/м2 в/в капельно 1-часовая инфузия в 15-17-й день.
БЛОК С (7-8-я неделя)
Метотрексат — 12 г/м2 (максимальная разовая доза 20 г) в/в капельно 4-часовая инфу-
зия в 1-й и 8-й дни.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 389
Злокачественные опухоли у детей
Лейковорин — 15 мг/м2 в/в струйно каждые 6 ч спустя 24 ч от начала инфузии мето-
трексата, 10—12 введений.
Цисплатин — 50 мг/м2 в/в капельно 24-часовая инфузия в 15-й и 16-й дни.
Доксорубицин — 45 мг/м2 в/в капельно 24-часовая инфузия в 17-й и 18-й дни.
БЛОК D (12-я неделя)
Цисплатин — 50 мг/м2 в/в капельно 24-часовая инфузия в 1-й и 2-й дни.
Ифосфамид — 3 г/м2 в/в капельно 1-часовая инфузия в 3-5-й день.
Адъювантная химиотерапия (5 блоков) при III-IV стадии лечебного патоморфоза
БЛОК Е (16-я неделя)
Ифосфамид — 3 г/м2 в/в капельно 1-часовая инфузия в 1 —3-й день.
Этопозид — 150 мг/м2 в/в капельно 1-часовая инфузия в 1-3-й день.
БЛОК А А (19-я неделя)
Метотрексат — 8 г/м2 в/в капельно 4-часовая инфузия в 1-й и 8-й дни.
Лейковорин — 15 мг/м2 в/в струйно каждые 6 ч спустя 24 ч от начала инфузии мето-
трексата, 10-12 введений.
Цисплатин — 50 мг/м2 в/в капельно 24-часовая инфузия в 15-й и 16-й дни.
Доксорубицин — 45 мг/м2 в/в капельно 24-часовая инфузия в 17-й и 18-й дни.
БЛОК ВВ (22-я неделя)
Ифосфамид — 3 г/м2 в/в капельно 1-часовая инфузия в 1-3-й день.
Этопозид — 150 мг/м2 в/в капельно 1-часовая инфузия в 1-3-й день.
БЛОК СС (25-я неделя)
Метотрексат — 8 г/м2 в/в капельно 4-часовая инфузия в 1-й и 8-й дни.
Лейковорин — 15 мг/м2 в/в струйно каждые 6 ч спустя 24 ч от начала инфузии мето-
трексата, 10-12 введений.
Ифосфамид — 3 г/м2 в/в капельно 1-часовая инфузия в 15-17-й день.
Этопозид — 150 мг/м2 в/в капельно 1-часовая инфузия в 15-17-й день.
БЛОК DD (28-я неделя)
Цисплатин — 50 мг/м2 в/в капельно 24-часовая инфузия в 1-й и 2-й дни.
Ифосфамид — 3 г/м2 в/в капельно 1-часовая инфузия в 3-5-й день.
Адъювантная химиотерапия (4 курса) при 1-П стадии лечебного патоморфоза
КУРСЫ 1, 3 (19-я и 25-я недели соответственно)
Цисплатин — 50 мг/м2 в/в капельно 24-часовая инфузия в 15-й и 16-й дни.
Доксорубицин — 45 мг/м2 в/в капельно 24-часовая инфузия в 17-й и 18-й дни.
КУРСЫ 2,4 (22-я и 28-я недели соответственно)
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день.
Циклофосфамид — 400 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день.
Карбоплатин — 500 мг/м2 в/в капельно 2-часовая инфузия в 4-й день.
Далее применяется аутологичная дендритная вакцина в течение года (всего 15 вве-
дений).
Также в лечении остеосаркомы у детей применяются следующие схемы лечения.
1. Цисплатин — 150 мг/м2 в/в в 1-й день.
390 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли костей
Доксорубицин — 30 мг/м2 в/в в 1 —3-й день.
2. Ифосфамид — 1600 мг/м2 в/в в 1 — 5-й день.
Цисплатин — 20 мг/м2 в/в в 1 -5-й день.
3. Ифосфамид — 1800 мг/м2 в/в в 1-5-й день.
Этопозид — 100 мг/м2 в/в в 1 -5-й день.
4. Циклофосфан — 600 мг/м2 в/в капельно в 1-й день.
Доксорубицин — 40 мг/м2 в/в капельно в 1-й день.
Цисплатин — 100 мг/м2 в/в капельно в 1-й день или 30 мг/м2 в/в капельно в 1 —3-й день.
Применение комплексного лечения, включающего в себя неоадъювантную XT, по-
зволило увеличить 5-летнюю безрецидивную выживаемость детей с локализованной
остеосаркомой до 60-70 %.
Актуальной проблемой остается поиск путей повышения эффективности лечения
детей с диссеминированной и неоперабельной остеосаркомой, 5-летняя безреци-
дивная выживаемость у которых не превышает 20-30%. В последнее десятилетие
прогресс в улучшении результатов лечения данной категории больных замедлился.
Несмотря на поиск новых активных препаратов и их комбинаций, повысить безреци-
дивную выживаемость неудается. Попытки применения блокаторов рецепторов HER2
и иматиниба не увенчались успехом. В настоящее время в клиниках Европы и Америки
дети с остеосаркомой лечатся по объединенному протоколу EURAMOS, в котором в
дополнение к традиционной ПХТ комбинациями с платиной, доксорубицином, ифос-
фамидом и хирургическому лечению проводится иммунотерапия ПЭГ-интерфероном
на каждом курсе ПХТ. Планируется включить в исследование более 2000 больных.
Итоги должны быть подведены к 2014-2016 гг.
11.4.2. Опухоли семейства саркомы Юинга
Опухоли семейства саркомы Юинга (ОССЮ) составляют до 20% первично-костных
злокачественных опухолей у детей и включают классическую саркому Юинга кости,
внескелетную саркому Юинга, периферическую примитивную нейроэктодермаль-
ную опухоль (pPNET) и опухоль Аскина (PNET торакопульмональной зоны), а также
нейроэпителиому. Данные новообразования характеризуются крайне высокой степе-
нью биологической агрессивности, проявляющейся в чрезвычайно быстром росте и
раннем, преимущественно гематогенном, метастазировании.
В настоящее время общепринятым считается комплексное или комбинирован-
ное лечение детей с ОССЮ с обязательным включением в программу оперативно-
го вмешательства при операбельных локализациях наряду с химиолучевыми мето-
дами лечения.
В НИИ ДОГ ГУ РОНЦ с 1996 г. используется следующая комплексная программа ле-
чения детей с саркомой Юинга и PNET.
Для пациентов ОССЮ группы стандартного риска (отсутствие регионарных и отда-
ленных метастазов, объем опухоли менее 100 см3, отсутствие патологического пере-
лома или прорастания опухоли в магистральные сосуды) рекомендовано проведение
10 курсов ПХТ в альтернирующем режиме. Каждый курс должен быть начат на 21-й
день от начала предыдущего курса при условии восстановления абсолютного числа
лейкоцитов более 2000/мкл, тромбоцитов более 75 000/мкл (но не позднее 25-го
дня). Уровень креатинина сыворотки крови не должен превышать норму в 2 раза и в
1,5 раза — перед назначением ифосфамида.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 391
Злокачественные опухоли у детей
вИв8ЯИ»аВ8ЙИвЯЯЙЙЮ«ВКйЙ®«ЯЙ®8Я8йаЯЕвФЙв®ВаЯ5^^ г
Ниже приведена схема ПХТ для детей с ОССЮ стандартного риска.
БЛОК VAC
Циклофосфамид — 1400 мг/м2 в/в капельно 1-часовая инфузия в 1-й и 2-й дни (курсо-
вая доза 2800 мг/м2).
Месна — 1600 мг/м2 в 1-й и 2-й дни в/в. Первые 400 мг/м2 в/в капельно 4-часовая ин-
фузия, затем в/в капельно в течение суток, или 300 мг/м2 через каждые 3 ч в/в струй-
но, или внутрь.
Доксорубицин — 25 мг/м2 в/в капельно 24-часовая инфузия в 1-й и 2-й дни (курсовая
доза 50 мг/м2).
Винкристин — 1,5 мг/м2 (максимальная доза 2 мг) в/в струйно в 1, 8 и 15-й дни (курсо-
вая доза 4,5 мг/м2).
БЛОК IE
Ифосфамид — 3 г/м2 в/в капельно 1-часовая инфузия в 1 —3-й день (курсовая доза
9 г/м2).
Месна — 3000 мг/м2 в/в в 1 —3-й день. Первые 800 мг/м2 за 4 ч капельно, затем в/в ка-
пельно в течение суток, или 600 мг/м2 в/в струйно через каждые 3 ч, или внутрь.
Этопозид — 150 мг/м2 в/в капельно 1-часовая инфузия в 1—3-й день (курсовая доза
450 мг/м2).
При отсутствии ифосфамида он может быть заменен на циклофосфамид (БЛОК СЕ) в
эквитоксической дозе (циклофосфан 700 мг/м2 в/в капельно 1-часовая инфузия в 1 —3-й
день (курсовая доза 2,1 г/м2) с аналогичным применением месны.
Для больных ОССЮ высокого риска (нерезектабельные опухоли осевого скелета,
такие как кости таза, черепа, позвоночника) с большим объемом (более 100 см3) вне-
костного мягкотканного компонента и протяженностью поражения длинных трубча-
тых костей более 8 см, а также при наличии рецидива заболевания и отдаленных ме-
тастазов проводят 5 курсов ПХТ в альтернирующем режиме.
БЛОКУАС: курсы 1, 3 и 5
Винкристин — 1,5 мг/м2 (максимальная доза 2 мг) в/в струйно в 1, 8 и 15-й дни (курсо-
вая доза 4,5 мг/м2).
Циклофосфамид — 2100 мг/м2 в/в капельно 1-часовая инфузия в 1-й и 2-й дни (курсо-
вая доза 4200 мг/м2).
Месна — 2600 мг/м2 в/в в 1-й и 2-й дни. Первые 400 мг/м2 за 4 ч капельно, начать вме-
сте с циклофосфамидом, затем в/в капельно в течение суток, или 300 мг/м2 через ка-
ждые 3 ч в/в струйно, или внутрь.
Доксорубицин — 37,5 мг/м2 в/в капельно 24-часовая инфузия в 1-й и 2-й дни (курсо-
вая доза 75 мг/м2).
БЛОК IE: курсы 2 и 4
Ифосфамид — 2,4 г/м2 в/в капельно 1-часовая инфузия в 1—5-й день (курсовая доза
12 г/м2).
Месна — 3000 мг/м2 в/в в 1-3-й день. Первые 800 мг/м2 за 4 ч капельно, затем в/в ка-
пельно в течение суток, или 600 мг/м2 через каждые 3 ч в/в струйно, или внутрь.
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день (курсовая доза
500 мг/м2).
Интервал между курсами составляет 21 день, критерием начала очередного кур-
са ПХТ служит восстановление уровня лейкоцитов более 1,5 х 109/мл и тромбоцитов
более 75 х 109/мл. Сбор ПСК и/или эксфузия костного мозга для обеспечения прове-
392 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Злокачественные опухоли костей
дения высокодозной XT проводятся минимум после 2 курсов индукционной ПХТ при
условии санации костного мозга. Высокодозная XT проводится в режиме: бусульфан
4 мг/кг с -7-го по -3-й день + тиофосфамид 300 мг/м2 с -3-го по -2-й день + мелфалан
70 мг/м2 с -3-го по -2-й день + трансплантация стволовых клеток в 0-й день.
Лечение больных ОССЮ высокой степени риска проводится только в условиях вы-
сокоспециализированного онкологического стационара при наличии отделения тран-
сплантации костного мозга для проведения высокодозной XT.
Протокол EUROEWING-99. В настоящее время в европейских странах (Германия,
Австрия, Нидерланды, Франция, Великобритания, Швейцария) и ведущих клиниках
США (группы POG, COG) лечение ОССЮ проводится по протоколу EUROEWING-99.
В соответствии с данным протоколом на этапе индукции предусмотрено проведе-
ние 6 курсов по схеме VIDE.
Этап индукции
VIDE
Винкристин — 1,5 мг/м2 в/в в 1-й день (курсовая доза 1,5 мг/м2).
Ифосфамид — 3 г/м2 в/в в 1 —3-й день (курсовая доза 9 г/м2).
Доксорубицин — 20 мг/м2 в/в в 1-3-й день (курсовая доза 60 мг/м2).
Этопозид — 150 мг/м2 в/в в 1-3-й день (курсовая доза 450 мг/м2).
Повторение цикла на 21-й день, считая от 1-го дня предыдущего цикла.
Далее проводится этап локального контроля (операция ± лучевая терапия на пер-
вичный очаг).
На этапе консолидации в зависимости от стадии, объема опухоли, наличия ради-
кальной операции на этапе локального контроля и степени лечебного патоморфоза
проводятся различные схемы ПХТ.
При локализованных операбельных ОССЮ объемом менее 200 см3 и хорошим ле-
чебным патоморфозом (< 5 % живых клеток опухоли) проводится 8 курсов по схеме
VAI или 1 курс VAI и далее 7 курсов по схеме VAC. При локализованных неоперабель-
ных ОССЮ, локализованных операбельных ОССЮ с плохим лечебным патоморфозом
(> 5% живых клеток опухоли при гистологическом исследовании) и при метастатиче-
ских ОССЮ с поражением только легких проводится 8 курсов VAI или 1 курс VAI и да-
лее высокодозная ПХТ по схеме бусульфан + мелфалан. При метастатических ОССЮ
(внелегочные или комбинированные метастазы) проводится высокодозная XT комби-
нацией бусульфан + мелфалан.
VA1
Винкристин — 1,5 мг/м2 в/в в 1-й день (курсовая доза 1,5 мг/м2).
Дактиномицин — 0,75 мг/м2 в/в в 1-й и 2-й дни (курсовая доза 1,5 мг/м2).
Ифосфамид — 3000 мг/м2 в/в в 1-й и 2-й дни (курсовая доза 6000 мг/м2).
VAC
Винкристин —1,5 мг/м2 в/в в 1 -й день (курсовая доза 1,5 мг/м2).
Дактиномицин — 0,75 мг/м2 в/в в 1-й и 2-й дни (курсовая доза 1,5 мг/м2).
Циклофосфамид — 1500 мг/м2 в/в в 1-й день (курсовая доза 1500 мг/м2).
Схема высокодозной XT (бусульфан + мелфалан)
Бусульфан — 600 мг/м2 в-6, -5, -4, -3-й дни внутрь (курсовая доза).
Мелфалан — 140 мг/м2 в/в во 2-й день (курсовая доза).
Аутологичная трансплантация ПСК.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 393
Злокачественные опухоли у детей
Планируется включить в протокол EUROEWING-99 более 1200 больных. Набор
больных продолжается в настоящее время.
В Италии лечение ОССЮ осуществляется по протоколу REN-3 в рамках коопери-
рованной итальянской группы по изучению сарком ISG с 1997 г.
Индуктивная ПХТ (3 курса)
КУРСЫ 1, 3 (0-я и 6-я недели)
Винкристин —1,5 мг/м2 в/в в 1-й и 8-й дни (курсовая доза 3 мг/м2).
Доксорубицин — 40 мг/м2 в/в в 1-й и 2-й дни (курсовая доза 80 мг/м2).
Циклофосфамид — 1200 мг/м2 в/в в 1-й день (курсовая доза 1200 мг/м2).
КУРС 2 (3-я неделя)
Винкристин — 1,5 мг/м2 в/в в 1-й и 8-й дни (курсовая доза 3 мг/м2).
Актиномицин — 1,25 мг/м2 в/в в 1-й день (курсовая доза 1,25 мг/м2).
Ифосфамид — 1800 мг/м2 в/в в 1 -5-й день (курсовая доза (9000 мг/м2).
Этап локального контроля (операция и/или лучевая терапия) проводится на 9-10-й
неделе.
Консолидация
КУРСЫ 4,6,8, 10, 12 (11, 17, 23, 29 и 35-я недели соответственно)
Винкристин — 1,5 мг/м2 в/в в 1-й день (курсовая доза 3 мг/м2).
Доксорубицин — 40 мг/м2 в/в в 1-й и 2-й дни (курсовая доза 80 мг/м2).
Циклофосфамид — 1200 мг/м2 в/в в 1 -й день (курсовая доза 1200 мг/м2).
КУРСЫ 5, 7 (14-я и 20-я недели соответственно)
Винкристин — 1,5 мг/м2 в/в в 1-й день (курсовая доза 3 мг/м2).
Актиномицин — 1,25 мг/м2 в/в в 1-й день (курсовая доза 1,25 мг/м2).
Ифосфамид — 1800 мг/м2 в/в в 1 — 5-й день (курсовая доза 9000 мг/м2).
КУРСЫ 9, 11, 13 (26, 32 и 38-я недели соответственно)
Этопозид — 100 мг/м2 в/в в 1-5-й день (курсовая доза 500 мг/м2).
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день (курсовая доза 9000 мг/м2).
Аналогичный протокол проводится в скандинавских странах (Швеция, Дания, Норве-
гия и Финляндия) скандинавской группой по изучению сарком (SSG) с 1997 г.
Альтернирующие курсы
VID
Винкристин — 1,5 мг/м2 в/в в 1-й и 8-й дни (курсовая доза 3 мг/м2).
Актиномицин — 1,25мг/м2в/вв 1-й день (курсовая доза 1,25 мг/м2).
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день (курсовая доза 9000 мг/м2).
PID
Цисплатин (Платидиам) — 40 мг/м2 в/в в 1-й и 2-й дни (курсовая доза 80 мг/м2).
Актиномицин — 1,25 мг/м2 в/в в 1-й день (курсовая доза 1,25 мг/м2).
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день (курсовая доза 9000 мг/м2).
Эффективны также следующие режимы при лечении детей с саркомой Юинга.
VACA
Винкристин — 1,5 мг/м2 в/в в 1-й день на 4, 7, 10, 13, 16, 19,22,25,28,31,34,37 и 40-й
неделях (максимум 2 мг).
394 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Недифференцированный рак носоглотки
Доксорубицин — 20 мг/м2 в/в 4-часовая инфузия в 1 —3-й день.
Циклофосфамид — 1200 мг/м2 в/в в 1-й день на 1,4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34,
37 и 40-й неделях.
Актиномицин D —0,5 мг/м2 в/в 4-часовая инфузия в 1 —3-й день на 4, 10, 16, 22, 28, 34
и 40-й неделях.
VAIA
Винкристин — 1,5 мг/м2 в/в в 1-й день на 4, 7, 10, 13, 15, 19, 22, 25, 28, 31,34, 37 и 40-й
неделях (максимум 2 мг).
Доксорубицин — 20 мг/м2 в/в 4-часовая инфузия в 1 —3-й день на 1,7, 13, 19, 25, 31 и
37-й неделях.
Ифосфамид — 2 г/м2 в/в в 1 —3-й день на 1,4, 7, 10, 13, 16, 19, 22, 25, 28, 31, 34, 37 и
40-й неделях.
Актиномицин D — 0,5 мг/м2 в/в 4-часовая инфузия в 1 —3-й день на 4, 10, 16, 19, 25, 31
и 37-й неделях.
1. Винкристин — 1,5 мг/м2 в/в струйно в 1-й день.
Доксорубицин — 50 мг/м2 в/в капельно в 1-й день.
Циклофосфан — 1200 мг/м2 в/в капельно во 2-й день.
Цисплатин — 100 мг/м2 в/в капельно в 4-й день.
2. Этопозид — 100 мг/м2 в/в капельно в 1-5-й день.
Циклофосфан — 300 мг/м2 в/в капельно в 1-5-й день.
Цисплатин — 30 мг/м2 в/в капельно в 1-5-й день.
Эпирубицин (Фарморубицин) — 40 мг/м2 в/в капельно во 2-й и 3-й дни.
3. Этопозид — 100 мг/м2 в/в капельно в 1-5-й день.
Карбоплатин — 100 мг/м2 в/в капельно в 1-5-й день.
4. Ифосфамид — 3 г/м2 в/в капельно с месной в 1-й и 2-й дни.
Доксорубицин (Адриамицин) — 30 мг/м2 в/в капельно в 1-й и 2-й дни.
Винкристин —1,5 мг/м2 в/в струйно в 1,8 и 15-й дни.
Дактиномицин — 0,5 мг/м2 в/в капельно в 1-3-й день.
Интенсификация программного лечения детей с ОССЮ в НИИ ДОГ способствовало
повышению 5-летней безрецидивной выживаемости всей группы до 72,5 ± 3,8%. Вы-
живаемость детей с локализованными ОССЮ достигла 79-80%. Проблемным оста-
ется лечение детей с диссеминированной стадией болезни, при которой, по данным
НИИ ДОГ и зарубежных клиник, 5-летняя безрецидивная выживаемость составляет
50-55%. Необходимо отметить, что лучшие результаты выживаемости отмечаются
при метастатическом поражении легких (5-летняя безрецидивная выживаемость до
60%). При поражении скелета, костного мозга, комбинированных метастазах, по дан-
ным большинства исследований, не удается преодолеть рубеж 5-летней безрецидив-
ной выживаемости в 30-40% случаев.
11.5. Недифференцированный рак носоглотки
В. Г. Поляков
Больные со злокачественными опухолями носоглотки составляют 1-3% от обще-
го числа детей со злокачественными новообразованиями, до 10-12% злокачествен-
ных опухолей головы и шеи и около 25 % всех опухолевых заболеваний ЛОР-органов.
Наиболее существенным отличием от рака у взрослых служит особенность гистоло-
гического варианта рака носоглотки. Среди эпителиальных злокачественных ново-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 395
Злокачественные опухоли у детей
в8ЯйЖйЯ8йИ0вяв®ая®яйй®ййвйяяйййй^ •»' а. \
образований носоглотки 99,9% представлены недифференцированным раком, кото-
рый характеризуется агрессивным течением, высокой биологической активностью со
склонностью к быстрому и обширному как регионарному, так и отдаленному мета-
стазированию. Метастазирование в регионарные лимфоузлы отмечается более чем в
90% случаев. Отдаленные метастазы могут поражать легкие, кости, мягкие ткани, пе-
чень и другие органы. Анатомо-топографические особенности носоглотки предопре-
деляют варианты клинического течения болезни, связанные с быстрым распростране-
нием опухоли в близлежащие структуры с развитием соответствующей симптоматики.
Одной из причин развития недифференцированного рака считается наличие герпе-
свируса Эпштейна—Барр, антитела к которому определяются в 100% случаев при ло-
кализации опухоли в носоглотке. Заболевание чаще всего развивается у мальчиков в
возрасте 10—15 лет.
Последняя классификация злокачественных опухолей (TNM, 6-е издание) указыва-
ет на то, что для установления категорий Т, N и М необходимо проведение следую-
щих исследований: для категории Т — физикальные методы исследования, эндоско-
пия и лучевая диагностика; для категорий N и М — физикальные и лучевые методы.
Для оценки распространенности опухоли отмечается первоначальное расположе-
ние опухоли соответственно следующим анатомическим локализациям носоглотки:
а) задневерхняя стенка от уровня соединения мягкого и твердого нёба до основания
черепа, б) латеральная стенка включает ямку Розенмюллера, в) нижней стенкой явля-
ется верхняя поверхность мягкого нёба.
Классификация недифференцированного рака носоглотки по системе
TNM
Первичная опухоль (Т)
Т1 — опухоль занимает носоглотку.
Т2 — опухоль распространяется на мягкие ткани.
Т2а — опухоль распространяется в ротоглотку и/или в полость носа без распростра-
нения на парафарингеальное пространство (подразумевает инфильтрацию заднела-
теральных отделов или проникновение опухоли за фарингобазилярную фасцию).
Т2Ь — опухоль захватывает парафарингеальное пространство.
ТЗ — опухоль поражает костные структуры и/или околоносовые пазухи.
Т4 — опухоль имеет интракраниальное распространение и/или вовлекает черепные
нервы, подвисочную ямку, нижние отделы глотки, орбиту, область сосцевидного от-
ростка.
Регионарные лимфоузлы (N)
NX — регионарные лимфоузлы не могут быть оценены.
NO — нет поражения регионарных лимфоузлов.
N1 — одностороннее поражение лимфоузлов не более 6 см в наибольшем измерении
над надключичной ямкой.
N2 — двустороннее поражение лимфоузлов не более 6 см в наибольшем измерении
выше надключичной ямки.
N3 — поражение лимфоузлов размером более 6 см или поражение лимфоузлов в
надключичной ямке.
Примечание лимфоузлы средней линии расцениваются как ипсилатеральные.
Отдаленные метастазы (М)
MX — отдаленные метастазы не могут быть оценены.
396 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Опухоли печени
МО — нет отдаленных метастазов.
Ml — имеются отдаленные метастазы.
Выживаемость больных зависит от стадии заболевания. При 1 стадии 5-летняя вы-
живаемость достигает более 89%, при II стадии — 70%, при III стадии — 25-30%, при
IV стадии — 5-15%.
Хирургическое лечение при недифференцированном раке носоглотки не применя-
ется, проводится только биопсия опухоли для подтверждения гистологического диаг-
ноза. В связи с этим используется комбинация медикаментозного и лучевого лечения.
На первом этапе, как правило, применяют химиотерапевтические режимы. В клинике
НИИ ДОГ в предыдущие годы успешно использовалась оригинальная комбинация хи-
миопрепаратов.
1. Циклофосфамид — 500 мг/м2 в/в в 1,8 и 15-й дни.
Винбластин — 5 мг/м2 в/в в 1, 8 и 15-й дни.
Блеомицин — 15 мг/м2 в/в в 8-й и 15-й дни.
Хлоксиперазин (Проспидин) — 50-100 мг (в зависимости от возраста) в/м до суммар-
ной дозы 1 -2 г.
Интервал между курсами 3 нед.
2. Циклофосфамид — 600 мг/м2 в/в в 1,8 и 15-й дни.
Винкристин —1,5 мг/м2 в/в в 1,8 и 15-й дни (разовая доза не более 2 мг).
Блеомицин — 15 мг/м2 в/в в 8-й и 15-й дни.
Хлоксиперазин (Проспидин) — 50-100 мг (в зависимости от возраста) в/м до суммар-
ной дозы 1-2 г.
Интервал между курсами 4 нед.
3. Карбоплатин — 360 мг/м2 в/в в 1-й день.
Фторурацил — 250 мг/м2 в/в 2-часовая инфузия в 1-4-й день.
4. Циклофосфамид — 500 мг/м2 в/в в 1-й и 8-й дни.
Винкристин — 1,5 мг/м2 в/в в 1-й и 8-й дни (разовая доза не более 2 мг).
Доксорубицин — 30 мг/м2 в/в в 1-й день.
Цисплатин — 100 мг/м2 с прегидратацией в 4-й день.
5. Доксорубицин — 60 мг/м2 в/в 1,5-часовая инфузия в 1 -й день или 20 мг/м2 в том же
режиме введения в 1-3-й день.
Циклофосфамид — 600 мг/м2 в/в 1-часовая инфузия в 1-й день.
Винкристин — 1,5 мг/м2 в/в струйно в 1-й день (разовая доза не более 2 мг).
Проводится 5 курсов указанной комбинацией химиопрепаратов с интервалом 3 нед.,
затем — курс лучевой терапии на опухоль и зоны регионарного метастазирования с
двух сторон в СОД 55 и 42 Гр соответственно. В дальнейшем поводится 3 курса ПХТ с
заменой доксорубицина на дактиномицин в дозе 300 мг/м2 в 1-3-й день курса.
При недостаточной эффективности указанных режимов возможны комбинации хи-
миопрепаратов, не обладающих перекрестной устойчивостью к ранее применявшим-
ся лекарственным средствам.
11.6. Опухоли печени
В. Г. Поляков
В структуре злокачественных новообразований у детей опухоли печени составляют
1-2%, по данным разных авторов. Наибольшее количество злокачественных опухолей
печени представлено гепатобластомой, которая развивается преимущественно в млад-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 397
Злокачественные опухоли у детей
шем детском возрасте, чаще до 3 лет. Реже встречается гепатоцеллюлярный рак (гепато-
целлюлярная карцинома) печени и еще реже мезенхимальные опухоли — саркомы. Для
рака печени характерен более старший возраст детей — 5 лет и более. Развитие гепато-
бластомы зачатую уже на ранних стадиях сопровождается проявлениями общего опу-
холевого симптомокомплекса (вялость, слабость, адинамия, отсутствие аппетита, поте-
ря массы тела, субфебрильная температура), в дальнейшем появляется тошнота, рвота,
увеличение живота в объеме, наличие в брюшной полости крупно- или мелкобугристо-
го неподвижного плотного образования, наличие болевого синдрома, лихорадки. Еще
в ранних стадиях у ребенка может появляться желтуха, что зависит от первичной лока-
лизации опухоли и обусловлено механическим сдавлением желчных протоков. В неко-
торых случаях заболевание развивается остро, больные госпитализируются в хирурги-
ческие отделения с диагнозом острого живота и во время операции обнаруживается
опухоль печени. При запущенных стадиях на коже передней брюшной стенки нередко
проявляются расширенные вены, определяется асцит. Для отражения специфических
особенностей проявления первичных злокачественных опухолей у детей используется
международная классификация, предложенная L. Pollice в 1973 г.
I. Эпителиальные опухоли.
А. Доброкачественные опухоли:
а) аденома (гепатоцеллюлярная, холангиоцеллюлярная);
б) гипернефроидная аденома.
Б. Злокачественные опухоли:
а) гепатобластома (фетальная, анапластическая, эмбриональная, смешанная).
II. Мезенхимальные опухоли.
А. Доброкачественные опухоли:
а) гемангиома;
б) инфантильная гемангиоэндотелиома;
в) мезенхимальная гамартома;
г) лимфангиома (кавернозная, кистозная).
Б. Злокачественные опухоли:
а) миелобластическая саркома (рабдомиосаркома);
б) мезенхимома;
в) фибросаркома;
г) ангиосаркома.
При проведении лучевых методов диагностики, как правило, выявляют объемный
процесс, занимающий правую или левую долю печени. Достаточно часто имеется то-
тальное поражение печени многоузловым образованием. В связи с изначальной боль-
шой распространенностью опухолевого поражения первичное хирургическое лече-
ние бесперспективно. До последнего времени результаты лечения опухолей печени у
детей были неутешительными. Однако с внедрением в детскую клинику новых препа-
ратов появились большие надежды на оптимистический прогнозу этой тяжелой кате-
гории больных. Гепатоцеллюлярный рак относится к резистентным видам злокачест-
венных новообразований, поэтому основным методом, определяющим судьбу таких
детей, служит хирургическое лечение в объеме не менее гемигепатэктомии. При воз-
можности выполняют расширенные операции, включающие право- или левосторон-
нюю гемигепатэктомию и дополняемые сегментэктомией противоположной доли. То
же можно сказать и о саркомах печени. Редко удается достичь эффекта при проведе-
нии ПХТ, отсутствует чувствительность опухоли к лучевой терапии и надежда только на
раннюю диагностику и радикальное хирургическое вмешательство.
К настоящему времени изменилось отношение к прогнозу гепатобластомы, которая
демонстрирует достаточно высокую чувствительность к медикаментозному лечению.
398 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Ретинобластома
Так, использование комбинаций препаратов, включающих доксорубицин, цисплатин,
карбоплатин, 5-фторурацил, этопозид, позволяет достичь успех в неоадъювантном
режиме и провести после этого радикальное хирургическое вмешательство. Что ка-
сается комбинаций препаратов, то к настоящему времени применяют следующие ре-
жимы терапии.
Режимы терапии
1. Цисплатин — 100 мг/м2 в/в 1-часовая инфузия с прегидратацией.
Доксорубицин — 30 мг/м2 в/в 3-часовая инфузия в 1-й и 2-й дни.
Карбоплатин — 100 мг/м2 в/в 2-часовая инфузия в 1 - 5-й день (суммарная доза 500 мг/м2).
Повторение цикла каждые 3 нед.
2. Цисплатин — 100 мг/м2 в/в 2-часовая инфузия с прегидратацией в 1-й день.
Доксорубицин — 20 мг/м2 в/в длительная инфузия в 1-3-й день.
Карбоплатин — 360 мг/м2 в/в 2-часовая инфузия в 15-й день.
Повторение цикла каждые 3 нед.
3. Цисплатин — 100 мг/м2 в/в 2-часовая инфузия с прегидратацией.
Доксорубицин — 50 мг/м2 в/в 3-часовая инфузия.
Повторение цикла каждые 3 нед.
4. Цисплатин — 100 мг/м2 в/в 2-часовая инфузия с прегидратацией в 1-й день.
Винкристин — 1,5 мг/м2 в 1,8 и 15-й дни.
5-ФУ — 600 мг/м2 в 3-й день.
Повторение цикла каждые 3 нед.
Курсы лечения проводятся с интервалом 3 нед. После 1-го или 2-го курса ПХТ прово-
дится хирургическое вмешательство с последующей оценкой лекарственного пато-
морфоза. При достижении III-IV степени лечебного патоморфоза выполняют еще 4
аналогичных курса ПХТ. При I-II степени патоморфоза схему XT меняют. Лучевое ле-
чение не используется. При тотальном поражении печени единственным спаситель-
ным вариантом лечения может быть только трансплантация печени.
11.7. Ретинобластома
В. Г. Поляков, Т Л. Ушакова
Ретинобластома (РБ) — опухоль нейроэпителиального происхождения. РБ может
иметь различную степень роста, солитарные и множественные очаги в одном или обо-
их глазах.
Удельный вес РБ среди всех злокачественных опухолей у детей составляет 2,5-4,5 %.
Частота встречаемости РБ среди новорожденных в среднем составляет от 1:34 000 до
1:14 000. В 80% случаев это заболевание диагностируется в возрасте до 3-4 лет.
На долю билатеральной РБ приходится от 20 до 40%. При одностороннем пораже-
нии чаще встречаются запущенные стадии заболевания. Пик заболеваемости при мо-
нолатеральной РБ отмечается в возрасте 24-29 мес., при билатеральной — в первые
12 мес. жизни.
Опухоль развивается спорадически в 60% случаев, в 40% случаев наследуется по
аутосомно-доминантному типу. Наследственные РБ обычно двусторонние и много-
очаговые, в то время как односторонние — чаще спорадические, монофокусные и
возникающие поздно. Отмечаются случаи трилатеральной РБ, когда двусторонняя РБ
сочетается с опухолью шишковидной железы, по гистологическому строению анало-
гичной РБ.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 399
Злокачественные опухоли у детей
«вмяяяаймяйвйюийиавиййаяяйяикавяй^^ *.v г -« Sv
Пациенты с наследственной РБ имеют существенный риск развития второй злокаче-
ственной опухоли, появляющейся после перенесенной ПХТ и лучевой терапии.
Генетическое консультирование больных РБ и их семей — обязательная составляю-
щая терапевтической тактики при этой опухоли.
По морфологическому строению различают три основных варианта:
Я недифференцированная РБ, когда клетки опухоли формируются в псевдорозет-
ке вокруг сосудов;
Я дифференцированная РБ, когда опухоль состоит из истинных розеток Флексне-
ра—Винтерштейнера;
Я смешанная форма.
При неправильном лечении опухоль распространяется экстрабульбарно в орбиту,
околоносовые пазухи, полость носа, интракраниально, появляются регионарные и от-
даленные метастазы в костном мозге, костях, ЦНС.
Клиническая (дооперационная) классификация ретинобластомы
по системе TNM (1997)
Первичная опухоль (Т)
ТХ — недостаточно данных для оценки первичной опухоли.
ТО — первичная опухоль не определяется.
Т1 — опухоль поражает не более 25 % сетчатки.
Т2 — опухоль поражает не более 50% сетчатки.
ТЗ — опухоль поражает более 50% сетчатки и/или распространяется за пределы сет-
чатки, но внутри глаз.
ТЗа — опухоль поражает более 50% сетчатки, и/или опухолевые клетки выявляются в
стекловидном теле.
ТЗЬ — опухоль распространяется на диск зрительного нерва.
ТЗс — опухоль распространяется на переднюю камеру и/или сосудистую оболочку
глаза.
Т4 — опухоль распространяется за пределы глаза.
Т4а — опухоль распространяется ретробульбарно по зрительному нерву, но не дохо-
дит до уровня резекции.
Т4Ь — опухоль распространяется экстраокулярно или доходит до уровня резекции.
Для уточнения категорий Т могут использоваться следующие префиксы:
(т) — указывает на множественность опухоли;
(f) — указывает на семейный характер патологии;
(d) — указывает на диффузный характер поражения сетчатки без образования дис-
кретной массы.
Регионарные лимфоузлы (N)
Отдаленные метастазы (М)
Патогистологическая классификация (рТ)
рТХ — недостаточно данных для оценки первичной опухоли.
рТО — первичная опухоль не определяется.
рТ1-рТЗа — соответствует Т1-ТЗа.
рТЗЬ — опухоль распространяется на зрительный нерв до решетчатой пластинки.
рТЗс — опухоль распространяется в переднюю камеру, и/или на всю толщину сосуди-
стой оболочки, и/или на склеру.
рТ4 — соответствует Т4.
400 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Ретинобластома
рТ4а — опухоль распространяется по нерву за решетчатую пластинку, по линии резек-
ции опухоли нет.
рТ4Ь — опухоль определяется по линии резекции или распространяется на другие
структуры за пределами глаза.
Классификация интраокулярной ретинобластомы Resse—Ellsworth
(1963)
Используется для прогноза сохранения глаза, пораженного РБ. Данная классифика-
ция не охватывает экстраокулярной распространенности опухолевого процесса, т.е.
возможное регионарное и отдаленное метастазирование, и не имеет связи с продол-
жительностью жизни больных.
I. Очень благоприятная для сохранения зрения группа.
А — солитарная опухоль менее 4 диаметров диска около или за экватором (диаметр
диска 1,5 мм).
В — многофокусная опухоль не более 4 диаметров диска, располагается около или за
экватором.
II. Благоприятная группа.
А — солитарная опухоль размером 4-10 диаметров диска у экватора или за ним.
В — многофокусная опухоль размером 4-10 диаметров диска, расположенная за эк-
ватором.
III. Сомнительная группа (возможно сохранение зрения).
А — любое поражение кпереди от экватора.
В — солитарный узел более 10 диаметров диска за экватором.
IV. Неблагоприятная группа.
А — многофокусная опухоль более 10 диаметров диска.
В — любое поражение с распространением до зубчатой линии (ora serrata).
V. Очень неблагоприятная группа.
А — опухоль вовлекает более 50% сетчатки.
В — витреальные опухолевые отсевы.
Около 90% больных обращаются к врачу с поражением одного или двух глаз
(rpynnaV).
Применение XT в лечении РБ традиционно использовалось при локальном экстрао-
кулярном росте по зрительному нерву или в орбиту, в ряде случаев — при дистанцион-
ных метастазах или эктопированной первичной опухоли, такой как пинеалобластома.
Химиоредукция — понятие, охватывающее стратегию предварительного лечения
пациентов системной XT, которая делает опухоль более доступной к другим видам те-
рапии: криодеструкция, лазерокоагуляция, брахитерапия, наружное облучение.
При инициальном лечении интраокулярной одно- и двусторонней РБ в последние
годы используются следующие режимы XT.
Режимы терапии
Монохимиотерапия
Карбоплатин — 560 мг/м2 в/в в 1-й день, интервал между введениями 3 нед., не менее
6 курсов.
Комбинированная химиотерапия
1. Карбоплатин — 360 мг/м2 в/в в 1-й день.
Доксорубицин — 20 мг/м2 в/в в 1 —3-й день.
Повторение цикла каждые 3 нед.
2. Цисплатин — 80 мг/м2 в/в в 1-й день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 401
Злокачественные опухоли у детей
Доксорубицин — 20 мг/м2 в/в в 1-3-й день.
Повторение цикла каждые 3 нед.
3. Винкристин — 1,5 мг/м2 в/в в 1-й день.
Этопозид — 150 мг/м2 в/в в 1-й и 2-й дни.
Карбоплатин — 560 мг/м2 в/в в 1-й день.
Детям в возрасте до 36 мес. дозу рассчитывают на 1 кг массы тела: винкристин —
0,05 мг/кг, карбоплатин — 18,6 мг/кг, этопозид — 5 мг/кг.
Как с целью химиоредукции, так и в послеоперационный период используется сле-
дующая схема:
Этопозид — 100 мг/м2 (при массе тела до 12 кг — 3,3 мг/кг) в/в в 1-5-й день.
Циклофосфамид — 400 мг/м2 (13 мг/кг) в/в в 1-5-й день.
Карбоплатин — 500 мг/м2 (12 мг/кг) в/в в 5-й день.
Разовая доза винкристина при расчете на 1 м2 не должна превышать 2 мг.
Условиями, влияющими на стратегию комплексного лечения РБ, служат распростра-
ненность опухоли, ее чувствительность к медикаментозному лечению, рецидивный
или метастатический характер, что определяет назначение наружного облучения,
объем хирургического вмешательства от энуклеации до поднадкостничной экзенте-
рации орбиты и более расширенных операций.
Совершенствование методов локальной терапии после адекватной химиоредук-
ции — основное направление в программах современного лечения РБ. Выбор тактики
лечения должен проводиться в зависимости от возраста пациента, размера и локали-
зации опухоли, одно- и двусторонности поражения, наследственности.
402
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Глава 12
Опухолевые заболевания
кроветворной и лимфоидной ткани
у детей
12.1. Острые лейкозы
С. А. Маякова, А. В. Попа
Острые лейкозы у детей — наиболее частое злокачественное новообразование (38-
40%), они обусловливают высокую летальность, уступая 1-е место среди причин смер-
тностиудетей старше 2 лет л ишь травмам. Частота лейкозов составляет 3,2-4,4 случая
на 100 000 детского населения. Чаще болеют дети в возрасте 2-5 лет.
Острый лейкоз встречается в 95-98 % случаев, редко наблюдается ХМЛ (2-5 %). ХЛЛ
у детей не описан.
По морфологическим критериям бластных клеток различают лимфобластные (ОЛЛ)
и нелимфобластные (ОНЛЛ) варианты острого лейкоза (аналогично острым лейкозам
взрослых).
В детском возрасте чаще встречаются лимфобластные варианты острого лейкоза
(78-80%). Нелимфобластные варианты более характерны для детей старшего возра-
ста и составляют 17-20%, а у детей раннего возраста — до 40%.
Выделяют иммунные подварианты заболевания. Различные морфологические вари-
анты острых лейкозов характеризуются специфическими хромосомными аномалия-
ми, что важно для дифференциальной диагностики и прогноза заболеваний.
При назначении лечения при остром лейкозе у детей ориентируются на прогности-
ческие факторы. Первостепенное значение для прогноза имеет цитогенетический тип
лейкоза.
Выделяют благоприятный, промежуточный и неблагоприятный прогноз заболева-
ния. Наиболее разработаны прогностические факторы, влияющие на выживаемость
больных при ОЛЛ у детей (табл. 12.1).
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 403
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
Таблица 12.1. Прогностические факторы при остром лимфобластном лейкозе
у детей
Прогноз 1
Фактор Благоприятный Промежуточный Неблагоприятный I
Основные
Лейкоцитоз 20х109/л 20-50 х 109/л > 50 х 109/л
Возраст, лет 1-10 >10 <1
Иммунный фенотип Общий антиген- положительный Т- и В-клеточные варианты, CD34+, Му+
Цитогенетика Гиперплоидность (9;22), t(4;11)
Второстепенные
Пол Женский Мужской
Морфология L1 L2-L3
Лимфоузлы, периферические Нормальные Увеличены
или средостения
Печень Нормальная Увеличена
Селезенка Нормальная Увеличена
Поражение ЦНС Нет Есть
Ответ на терапию В течение 2 нед. _ . Нет ремиссии к 33-му дню В течение 4 нед. ,J н лечения
При ОНЛЛ у детей, так же как и у взрослых, для прогноза имеет значение морфоло-
гический вариант, иммунофенотипические признаки бластных клеток и хромосомные
аберрации.
Химиотерапия острого лимфобластного лейкоза
В настоящее время широко используется терапия ОЛЛ по программам БФМ, преду-
сматривающим интенсификацию на всех этапах лечения.
Программа ОЛЛ-мБФМ 90 (стандартный и средний риск — больные ОЛЛ с бла-
гоприятным и промежуточным прогнозом)
Протокол I (64 дня) — индукция
Преднизолон — 60 мг/м2 внутрь в 1-28-й день с отменой за 2-3 дня.
Винкристин — 1,5 мг/м2 в/в в 8, 15, 22 и 29-й дни.
Даунорубицин (Рубомицин) — 30 мг/м2 в/в в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 10 000 МЕ/м2 в/в в 12, 15, 18, 21, 24 и 27-й дни.
Циклофосфамид (Циклофосфан) — 1 000 мг/м2 в/в капельно + месна в 36-й и 64-й дни.
Цитарабин (Цитозар) — 75 мг/м2 в/в капельно в 38-41,45-48, 52-55 и 59-62-й дни.
6-меркаптопурин — 60 мг/м2 внутрь в 36-63-й день.
Метотрексат — эндолюмбально в 0, 15, 29, 45 и 59-й дни: в возрасте < 1 года — 6 мг,
1-2 года — 8 мг, 2-3 года — 10 мг, > 3 лет — 12 мг.
Протокол М (56 дней) — консолидация
6-меркаптопурин — 25 мг/м2 внутрь в 1-56-й день.
Метотрексат — 1 г/м2 в/в капельно (10% дозы в течение 30 мин, 90% дозы в течение
23 ч 30 мин) в 8, 22, 36 и 50-й дни.
Лейковерин — 15 мг/м2 в/в через 42,48 и 54 ч от начала введения метотрексата.
404 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Острые лейкозы
Метотрексат — эндолюмбально в 8, 22, 36 и 50-й дни: в возрасте < 1 года — 6 мг,
1-2 года — 8 мг, 2-3 года — Ю мг, > 3 лет — 12 мг.
Протокол II (49 дней) — реиндукция
Дексаметазон — 10 мг/м2 внутрь в 1-21-й день с отменой за 2-3 дня.
Винкристин — 1,5 мг/м2 в/в в 8, 15, 22 и 29-й дни.
Доксорубицин — 30 мг/м2 в/в в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 10 000МЕ/м2в/вв8, И, 15 и 18-й дни.
Циклофосфамид — 1000 мг/м2 в/в капельно + месна в 36-й день.
Цитозин-арабинозид — 75 мг/м2 в/в капельно в 38-41-й и 45-48-й дни.
Тиогуанин — 60 мг/м2 внутрь в 36-49-й день.
Лучевая терапия на область головного мозга 12 Гр (при стандартном риске не прово-
дится).
Поддерживающая терапия в ремиссии (до 104-й недели от начала лечения)
6-меркаптопурин — 40 мг/м2/сут внутрь.
Метотрексат — 20 мг/м2/нед. внутрь.
Программа ОЛЛ-мБФМ 95 (для детей со стандартным и средним риском ОЛЛ)
имеет следующие особенности в сравнении с программой ОЛЛ-мБФМ 90.
Больным со стандартным и средним риском ОЛЛ:
1) в протоколе I L-аспарагиназа вводится в меньшей дозе (в/в 5000 МЕ/м2);
2) лучевая терапия не проводится (за исключением больных с Т-клеточным ОЛЛ —
12 Гр и при инициальном поражении ЦНС — 18 Гр).
Больным со средним риском ОЛЛ:
1) в протокол М добавляется цитозин-арабинозид 200 мг/м2/сут, вводимый в тече-
ние 24 ч (9, 23, 37 и 51-й дни). Препарат применяется сразу же после окончания
инфузии метотрексата;
2) в поддерживающей терапии используются реиндукционные курсы (в течение
7 дней) 1 раз в 2 мес.:
Дексаметазон — 6 мг/м2 внутрь ежедневно.
Винкристин — 1,5 мг/м2 в/в еженедельно, всего 2 раза.
Мальчикам со стандартным риском ОЛЛ поддерживающее лечение 6-меркаптопури-
ном и метотрексатом проводится до 156-й недели от начала лечения.
Программа ALL IC-BFM 2002 в сравнении с предыдущими программами у боль-
ных со стандартным и средним риском ОЛЛ характеризуется следующим:
1) стратификация больных осуществляется на основании первичного уровня лей-
коцитов, возраста, данных цитогенетики и степени санации костного мозга к
15-му дню терапии;
2) в протоколе I уменьшено количество введений даунорубицинау пациентов из
стандартной группы риска;
3) в протоколе М доза метотрексата в основном составляет 2000 мг/м2, за исклю-
чением больных с Т-клеточным ОЛЛ, получающих метотрексат 5000 мг/м2.
Программа ОЛЛ-мБФМ 90 (высокий риск — больные ОЛЛ с неблагоприятным
прогнозом)
Индукция ремиссии (30 дней)
Преднизолон — 60 мг/м2 внутрь в 1-22-й день.
Винкристин — 1,5 мг/м2 в/в в 8, 15, 22 и 29-й дни.
Даунорубицин (Рубомицин) — 30 мг/м2 в/в в 8, 15, 22 и 29-й дни.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 405
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
ятяиммнмяажвымшпяятмжмтяаяяямпняяюаийвяяпятбяаая^ г -
L-аспарагиназа — 10 000 МЕ/м2 в/в в 12, 15, 18, 21, 24 и 27-й дни.
Метотрексат — эндолюмбально в 0,18 и 30-й дни: в возрасте < 1 года — 6 мг, > 1 года —
8 мг, > 2 лет — 10 мг, > 3 лет — 12 мг.
Перерыв 2 нед., затем проведение 9 блоков Rl-M, R2-M и R3 последовательно с ин-
тервалом 2 нед.
БЛОК R1-M (6 дней)
Дексаметазон — 20 мг/м2 внутрь в 1 -6-й день.
Винкристин — 1,5 мг/м2 в/в в 1-6-й день.
L-аспарагиназа — 20 000 МЕ/м2 в/в в 6-й день.
Метотрексат — 1 г/м2 в/в капельно (10% дозы в течение 30 мин, 90% дозы в течение
23 ч 30 мин) в 5-й день.
Лейковорин — 15 мг/м2 в/в через 48 и 54 ч от начала введения метотрексата.
Цитозар — 2 г/м2 в/в капельно каждые 12 ч в 4-й день.
6-меркаптопурин — 100 мг/м2 внутрь в 1-5-й день.
Дозы метотрексата, цитозара и преднизолона для эндолюмбального введения у де-
тей в зависимости от возраста даны в табл. 12.2.
Таблица 12.2. Дозы метотрексата, цитозара и преднизолона
для эндолюмбального введения
Доза в зависимости от возраста
Препарат - < 1 года > 1, но < 2 лет > 2, но < 3 лет >3лет
Метотрексат 6 мг 8 мг 10 мг 12 мг
Цитозар 16 мг 20 мг 25 мг 30 мг
Преднизолон 4 мг 6 мг 8 мг 10 мг
БЛОК R2-M (6 дней)
Дексаметазон — 20 мг/м2 внутрь в 1-5-й день.
6-меркаптопурин (6-тиогуанин) — 100 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 в/в в 1-й день за 1 ч до введения метотрексата.
Рубомицин — 50 мг/м2 в/в капельно 24-часовая инфузия в 4-й день.
Метотрексат — 1 г/м2 в/в капельно (10% дозы в течение 30 мин, 90% дозы в течение
23 ч 30 мин) в 1-й день.
Лейковорин — 15 мг/м2 в/в через 48 и 54 ч от начала введения метотрексата.
Ифосфамид — 400 мг/м2 в/в капельно в 1-5-й день.
L-аспарагиназа — 25 000 МЕ/м2 в/в в 6-й день.
Дозы метотрексата, цитозара и преднизолона для эндолюмбального введения у детей
в зависимости от возраста — см. табл. 12.2.
БЛОК R3 (6 дней)
Дексаметазон — 20 мг/м2 внутрь в 1-6-й день.
Цитозар — 2 г/м2 в/в капельно каждые 12 ч в 1-й и 2-й дни.
Этопозид — 150 мг/м2 в/в капельно в 3-5-й день.
L-аспарагиназа — 25 000 МЕ/м2 в/в в 6-й день.
Дозы метотрексата, цитозара и преднизолона для эндолюмбального введения у детей
в зависимости от возраста — см. табл. 12.2.
После 9 блоков лучевая терапия на область головного мозга 12 Гр.
Поддерживающая терапия в ремиссии (104 нед.)
406 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
6-меркаптопурин — 50 мг/м2/сут внутрь.
Метотрексат — 20 мг/м2/нед. внутрь.
Программа ОЛЛ-мБФМ 95 (для детей с высоким риском ОЛЛ) имеет следующие
особенности по сравнению с программой ОЛЛ-мБФМ 90:
1) индукция ремиссии аналогична протоколу мБФМ-90, а затем проводится лече-
ние 6 блоками последовательно (HR-1, HR-2, HR-3) с интервалом в 2 нед.;
2) в блок HR-1, аналогичный блоку Rl-М программы мБФМ-90, добавлен цикло-
фосфамид 200 мг/м2 в/в 1-часовая инфузия каждые 12 ч во 2-4-й день (всего
5 инфузий);
3) в блоке HR-2 (аналогичном блоку R2-M) доза ифосфамидаувеличена
до 800 мг/м2;
4) в блоке HR-3 (аналогичном блоку R3) этопозид в дозе 100 мг/м2 в/в вводится ка-
ждые 12 ч в 3-5-й день (всего 5 введений);
5) после 6 блоков лучевая терапия на область головного мозга 12 Гр;
6) у детей с высоким риском ОЛЛ доза метотрексата, включаемого в блоки, состав-
ляет 5000 мг/м2.
Программа ALL IC-BFM 2002. В сравнении с предыдущими программами у боль-
ных со стандартным и средним риском ОЛЛ, а также из группы высокого риска осу-
ществляют две фазы протокола I, а не одну, как в BFM ALL 95.
С целью консолидации проводится 6 блоков XT (HR1, HR2 и HR3), после которых
следует протокол II. В каждом блоке увеличена доза L-аспарагиназы до 25000 МЕ/м2,
которая вводится 2 раза — в 6-й и 11-й дни.
Показания к аллогенной трансплантации костного мозга у больных с высо-
ким риском развития рецидива следующие:
1) отсутствие ремиссии к 33-му дню терапии;
2) плохой ответ на преднизолон в сочетании со следующими факторами: Т-линей-
ный или про-В иммунный подвариант, лейкоцитоз периферической крови более
100 х 109/л, изменения генетические и молекулярно-биологические: t(9;22) или
BCR/ABL; t(4; 11) или MLL/AF4;
3) состояние М3 костного мозга к 15-му дню индукции ремиссии у детей с высо-
ким риском рецидива;
4) хороший ответ на преднизолон при наличии t(9;22) или BCR/ABL.
Общие принципы лечения рецидивов. Применяются интенсивные программы
лечения, в частности программа БФМ для больных с рецидивом (ОЛЛ-РЕЦ-БФМ 95).
Лечение нейролейкоза
Спинномозговая пункция позволяет диагностировать поражение нервной системы
даже в отсутствие клинической симптоматики. При анализе ликвора в качестве нормы
принимаются следующие показатели: цитоз 0-6 лимфоцитов/мкл, белок 0,2-0,3 %,
сахар 50-75 мг%, мочевая кислота 0,2-0,5 мг (по методике Мюллера—Зейферта). При
увеличении количества ядерных элементов в ликворе следует думать о нейролейкозе,
чаще всего в этих случаях повышен и уровень белка. Однако возможны случаи, когда
клинически имеются неврологические симптомы, а в ликворе отсутствует цитоз. При
этом следует обращать внимание на увеличение количества белка.
Международные критерии оценки поражения ЦНС
ЦНС статус I (негативный):
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 407
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
Нет клинических проявлений поражения ЦНС.
И Нет данных за поражение ЦНС по результатам КТ/МРТ.
Нормальное глазное дно.
в В ликворе полностью отсутствуют бластные клетки.
ЦНС статус II (негативный):
И Бласты в ликворе не определяются. Соотношение эритроцитов и лейкоцитов
100:1 по препаратам, сделанным на цитоспине. Количество клеток в 1 мл ликво-
ра не превышает 5. Пункция визуально не была травматичной.
Я Определяются лимфобласты, но соотношение эритроцитов и лейкоцитов более
100:1 по препаратам, сделанным на цитоспине. Данное соотношение эритроци-
тов и лейкоцитов рассматривается как результат травматичной пункции (ликвор
был контаминирован кровью).
Я Травматичная пункция (ликвор на глаз контаминирован кровью). Количество лей-
коцитов в 1 мл ликвора более 50.
ЦНС статус III (позитивный):
Я Массивное поражение мозга или мозговых оболочек по данным КТ/МРТ.
Я Лейкозное поражение сетчатки даже при отсутствии бластов в ликворе.
Я Нетравматичная люмбальная пункция, более 5 клеток в 1 мл ликвора, при этом
большинство клеток по данным цитологического исследования (цитоспин) —
бласты.
Я Если контаминация ликвора кровью сомнительная, лейкозное поражение ЦНС
должно быть констатировано при следующих показателях:
а) более 5 клеток в 1 мл ликвора + большинство из них бласты (цитоспин) + соот-
ношение лейкоцитов к эритроцитам 100:1 (цитоспин);
б) более 5 клеток в 1 мл ликвора + более высокий процент бластов в ликворе,
чем в периферической крови (цитоспин).
При исследовании ликвора методом иммунофореза с ПЦР при первичной диагно-
стике ОЛЛ у всех детей выявляется наличие бластов в ликворе даже в случаях отрица-
тельного результата при цитологическом исследовании.
С целью диагностики поражения нервной системы проводятся также дополнитель-
ные исследования: рентгеновская КТ, МРТ, ЭЭГ и ЭхоЭЭГ.
В случаях нейролейкоза эндолюмбально вводят метотрексат (12 мг) или метотрексат в
сочетании с цитарабином (30 мг) и преднизолоном (10 мг) до получения трех нормаль-
ных анализов спинномозговой жидкости. В последующем рекомендуется эндолюмбаль-
ное введение химиопрепаратов 1 раз в 1—1,5 мес. с целью поддерживающей терапии.
Одновременно проводят высокодозную системную XT (программа мБФМ для боль-
ных с рецидивом ОЛЛ). При показаниях с терапевтической целью осуществляют по-
вторную гамма-терапию на область головного мозга (СОД 30 Гр).
Химиотерапия острых нелимфобластных лейкозов
При лечении детей с ОНЛЛ наибольшая эффективность была получена при при-
менении программ AML BFM 98, AML BFM 2002, МКС 10 и МКС 12, которые состоят
из индукции ремиссии и послеиндукционного лечения — консолидации ремиссии и
поддерживающей терапии.
Индукция ремиссии
С целью индукции ремиссии применяется два курса XT: AIE и НАМ.
AIE
Цитозин-арабинозид (Ага-С) — 100 мг/м2/сут в/в 48-часовая инфузия в 1-й и 2-й дни.
Ага-С — 100 мг/м2 в/в 30-минутная инфузия каждые 12 ч в 3-8-й день.
Идарубицин — 12 мг/м2/сут в/в в 3, 5 и 7-й дни.
408 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Острые лейкозы
Этопозид — 150 мг/м2/сут в/в 30-минутная инфузия в 6-8-й день.
Ага-С — эндолюмбально в 1-й и 8-й дни: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг,
2-3 года — 34 мг, > 3 лет — 40 мг.
НАМ
Ага-С — 3 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Митоксантрон — 10 мг/м2 в/в 30-минутная инфузия через 3 ч после окончания Ага-С
в 3-й и 4-й дни.
Ага-С — эндолюмбально в 6-й день: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг,
2-3 года — 34 мг, > 3 лет — 40 мг.
Послеиндукционная химиотерапия
С целью консолидации проводят еще 2 курса из нижеперечисленных.
AI/2CDA
Ага-С — 500 мг/м2/сут в/в 96-часовая инфузия в 1-4-й день.
2-хлордеоксиаденозид (2-CDA) — 6 мг/м2/сут в/в 30-минутная инфузия в 1-й и 3-й дни.
Идарубицин — 7 мг/м2/сут в/в 60-минутная инфузия в 3-й и 5-й дни.
Ага-С — эндолюмбально в 1-й и 6-й дни: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг,
2-3 года — 34 мг, > 3 лет — 40 мг.
AI
Ага-С — 500 мг/м2/сут в/в 96-часовая инфузия в 1-4-й день.
Идарубицин — 7 мг/м2/сут в/в 60-минутная инфузия в 3-й и 5-й дни.
Ага-С — эндолюмбально в 1-й и 6-й дни: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг,
2-3 года — 34 мг, > 3 лет — 40 мг.
ЬАМ
Ага-С — 1 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Митоксантрон — 10 мг/м2 в/в 30-минутная инфузия через 3 ч после окончания Ага-С
в 3-й и 4-й дни.
Ага-С — эндолюмбально в 1-й и 6-й дни: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг,
2-3 года — 34 мг, > 3 лет — 40 мг.
НАЕ
Ага-С — 3 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Этопозид (VP-16) —125 мг/м2 в/в 60-минутная инфузия через 3 ч после окончания Ага-
С во 2-5-й день.
Ага-С — эндолюмбально в 1-й день: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг,
2-3 года — 34 мг, > 3 лет — 40 мг.
ЬАЕ
Ага-С — 1 г/м2 в/в 3-часовая инфузия каждые 12 ч в 1-3-й день.
Этопозид (VP-16) — 125 мг/м2 в/в 60-минутная инфузия через 3 ч после окончания Ага-
С во 2-5-й день.
Ага-С — эндолюмбально в 1-й день: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг,
2-3 года — 34 мг, > 3 лет — 40 мг.
FLAG
Г-КСФ (Граноцит или Нейпоген) — 5 мкг/кг/сут п/к в 1-7-й день.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 409
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
Флударабин (Флудара) — 30 мг/м2 в/в капельно 30-минутная инфузия во 2-6-й день
Препарат развести в концентрации, не превышающей 1 мг/мл.
Ага-С — 2 г/м2/сут в/в капельно 4-часовая инфузия во 2-6-й день. Препарат развести в
200 мл 0,9% раствора натрия хлорида. Инфузию начать через 4 ч от окончания введе-
ния флударабина.
Ага-С — эндолюмбально в 1-й день: в возрасте < 1 года — 20 мг, 1-2 года — 26 мг.
2-3 года — 34 мг, > 3 лет — 40 мг.
Поддерживающая терапия (до 78-й недели от начала терапии индукции ремиссии)
6-меркаптопурин — 40 мг/м2/сут внутрь ежедневно.
Ага-С — 40 мг/м2 в/в 1 раз в сутки 4-дневным курсом каждые 28 дней.
12.2. Лимфома Ходжкина
Н.А. Сусулева, В. В. Ильяшенко
Среди первичных больных лимфомой Ходжкина (ЛХ) дети до 16 лет составляют от 10
до 23 %, в среднем 18%. Стандартизованный показатель заболеваемости в России со-
ставляет 1,9 случая на 100 000 детского населения, и в последние годы это заболева-
ние среди гемобластозов у детей занимает 3-е место после лейкозов и НХЛ. В возра-
сте до года ЛХ не встречается, к 4-6 годам наблюдается первый пик заболеваемости,
а к 12-14 годам — второй. Мальчики до 7 лет болеют в 3 раза чаще девочек, но к 15-
16 годам это соотношение выравнивается.
Возраст обусловливает некоторые клинические особенности течения заболевания.
Так, в раннем детском возрасте до 6 лет отсутствует первичное поражение средосте-
ния, а вовлечение медиастинальных лимфоузлов — следствие дальнейшего распро-
странения процесса. Чаще наблюдается выраженность конгломератов лимфоузлов
типичной локализации (в шейной области). В препубертатный и пубертатный периоды
первичное поражение средостения составляет до 30% случаев, нередко отмечается
устойчивость к проводимой терапии и склонность к рецидивам заболевания, что сни-
жает выживаемость больных и требует более интенсивных режимов лечения.
Клинические проявления, диагностика, морфологические варианты и стадирование
процесса у детей не отличаются оттаковыху взрослых больных ЛХ.
Современные программы лечения ЛХ у детей позволяют достичь высоких резуль-
татов. Общая выживаемость более 10 лет отмечена более чему 90% больных, безре-
цидивная выживаемость — у 80%. Однако с увеличением продолжительности жизни
больных стали проявляться последствия интенсивного лечения в виде нарушений ор-
ганов и систем: задержка роста, деформации, гипотрофии, эндокринные нарушения,
патология со стороны сердечно-сосудистой, легочной систем, проявления вторично-
го иммунодефицита. Отмечаются проблемы в воспроизводстве, особенно у мужской
популяции больных, которые связаны с кумулятивными дозами прокарбазина и алки-
лирующих препаратов. Существенную угрозу жизни представляют вторые опухоли,
риск развития которых возрастает с каждым прожитым десятилетием от окончания
лечения, обусловленные мутагенным эффектом из-за кумулятивных доз применяемых
противоопухолевых препаратов, особенно алкилирующих агентов, в сочетании с об-
лучением. Особенно чувствительными к облучению органами являются щитовидная,
молочная железы, ЦНС и некоторые другие. При этом важен возраст больного, в кото-
ром проводится облучение, а также СОД. Проблемы лечения ЛХ у детей сходны с та-
410 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Лимфома Ходжкина
ковыми у взрослых больных, но имеют ряд особенностей из-за чувствительности дет-
ского организма к лучевому воздействию, особенно в сочетании с XT.
В лечении ЛХ у детей ведущим методом служит XT. Лучевая терапия утратила свои
позиции, используется только в сочетании с XT в программе комплексного лечения
при исходно большой массе опухоли и наличии остаточной опухоли после примене-
ния индукционной XT. Для снижения поздних побочных эффектов XT и лучевого ле-
чения применяется комбинация невысоких кумулятивных доз химиопрепаратов, сни-
женных СОД лучевой терапии и уменьшения количества полей облучения.
У детей наиболее эффективны схемы МОРР, ABVD, ОРРА, затем поубыванию эффек-
тивности идут CVPP и СОРР. Включение в схемы CVPP и СОРР противоопухолевого ан-
тибиотика антрациклинового ряда — доксорубицина, эпирубицина (Фарморубицин),
идарубицина — повышает результативность лечения и показано больным с факторами
риска (см. ниже). Важно соблюдение режимов терапии, т.к. введение неполных кур-
совых доз препаратов и удлинение интервалов между циклами значительно снижа-
ют эффективность проводимой XT. В связи с этим показана профилактика гематоло-
гической токсичности и инфекционных осложнений как основных причин нарушения
режимов XT в виде своевременного назначения соответствующих симптоматических
средств во время перерывов между циклами.
Циклы XT большинства применяемых режимов проводятся в течение 2 нед. с 2-не-
дельными интервалами. Каждый последующий цикл проводится при удовлетвори-
тельном состоянии больного и отсутствии признаков гипоплазии костного мозга: чи-
сло лейкоцитов более 2000/мкл, гранулоцитов более 500/мкл, тромбоцитов более
100 000/мкл.
Лечение прерывается и не проводится при развитии интеркуррентных инфекций
(пневмония, сепсис, ветряная оспа и др.) с лихорадкой выше 38,5 °C.
Режимы XT при ЛХу детей приведены в табл. 12.3.
Таблица 12.3. Режимы химиотерапии, используемые при лимфоме Ходжкина
у детей
I Препарат Доза, мг/м2 Путь введения День введения
ВИЙВИЯКМ ИП ияяая
Циклофосфамид 600 В/в капельно в течение 1 ч 1-й, 8-й
Винбластин 6 (максимальная ра- зовая доза 10) В/в струйно 1-й, 8-й
Прокарбазин (Натулан) 100** Внутрь 1-14-й
Преднизолон 30* Внутрь 1-14-й
Антрациклиновый антибиотик (доксорубицин) 30 В/в капельно в течение 30 мин 3-й, 15-й
Циклофосфамид 600 В/в капельно в течение 1 ч 1-й, 8-й
Винкристин 1,5 (максимальная разовая доза 2) В/в струйно 1-й, 8-й
Прокарбазин (Натулан) 100** Внутрь 1-14-й
Преднизолон '*.< 30* Внутрь 1-14-й
Антрациклиновый антибиотик (доксорубицин) 30 В/в капельно в течение 30 мин 3-й, 15-й
Этопозид (только в схеме ОЕРРА) 120 В/в инфузия в течение 1 ч 3-6-й
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 411
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
сйммпмапанммаатвмтяиивмтяяяннвмгаявяяпяяяяяква^^ - -
Препарат Доза, мг/м2 Путь введения День введения I
Винкристин 1,5 (максимальная разовая доза 2) В/в струйно 1,8,15-й
Прокарбазин (Натулан) 100** Внутрь 1-14-й
Преднизолон 60 Внутрь 1-14-й
Антрациклиновый антибиотик (доксорубицин) 40 В/в капельно в течение 30 мин 1-й,15-й
* При включении в схемы CVPP, СОРР антрациклинового антибиотика суточная доза преднизолона увеличивается
до 40 мг/м2. Применение преднизолона не является обязательным компонентом, и при многоцикловом (6 циклое
лечении возможно исключение его из схемы, особенно у детей пубертатного возраста.
** Разовая доза Натулана рассчитывается путем определения курсовой дозы (1400 мг/м2) и распределения этой
дозы кратно 50 в течение 14 дней с постепенным увеличением дозы от 1-го к 14-му дню (50,100,150,200 мг) до
достижения рассчитанной курсовой дозы
При лечении ЛХу детей, как и у взрослых, встает задача по возможности сократить
интенсивность терапии. В то же время небольшая часть больных, напротив, нужда-
ется в интенсификации лечения в связи с развитием резистентности к стандартным
программам и непрерывным рецидивированием процесса. Уменьшение риска позд-
них осложнений при сохранении высокой эффективности терапии ЛХ у детей воз-
можно только при дифференцированном подходе к лечению с учетом прогностиче-
ских факторов.
В большинстве лечебных протоколов стратификация основывается на стадии ЛХ и
наличии или отсутствии симптомов интоксикации. Ряд протоколов учитывает и дру-
гие прогностические факторы: наличие экстранодальных локализаций ЛХ, выра-
женность массы опухоли, особенно в средостении по медиастинально-торакаль-
ному индексу (МТИ), размер периферических лимфоузлов (различной градации в
разных протоколах — более 5, 7 и 10 см по наибольшему размеру конгломерата) и
др. При планировании лечения ЛХу детей учитывается морфологический вариант за-
болевания. Вариант нодулярного склероза, особенно II типа, считается неблагопри-
ятным прогностическим фактором и определяет применение более интенсивных
программ лечения с использованием схем, включающих алкилирующие препараты,
прокарбазин, при выраженности массы опухоли в средостении — антрациклиновые
антибиотики. Неблагоприятные прогностические факторы: изначальные поддиаф-
рагмальные локализации ЛХ, поражение лимфоузлов ниже бифуркации брюшной
аорты, подвздошных, паховых и бедренных лимфоузлов, увеличение СОЭ > 30 мм/ч.
Наличие факторов неблагоприятного прогноза определяет необходимость более
интенсивного лечения.
В планировании лечения ЛХу детей немаловажное значение имеет скорость дости-
жения положительного эффекта. Оценка эффективности терапии после 2 и 4 индук-
ционных циклов XT определяет дальнейший прогноз заболевания и тактику лечения.
Введено понятие полной и неуверенной (почти полной) ремиссии. Сокращение опу-
холевых образований менее 70 % от исходного размера характеризует частичный эф-
фект с необходимостью интенсификации лечения, изменения применяемой схемы,
проведения облучения.
Для оценки эффекта проводимой терапии важно использовать комплекс диагности-
ческих методов с обязательным включением при первичной диагностике и в контроле
КТ с двойным контрастированием. В последние годы для правильной оценки первич-
ной стадии заболевания и резидуальной опухоли при проведении программного ле-
чения стало важным включение в диагностический комплекс радионуклидных мето-
дов исследования (особенно ПЭТ).
412 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Лимфома Ходжкина
Большинство современных программ лечения ЛХ у детей выделяет три группы ри-
ска.
1-я группа — благоприятного прогноза, к которой относят больных с ло-
кализованными формами заболевания (I—ПА стадия) и отсутствием неблагоприятных
прогностических факторов: поражения средостения, первичного поражения ниже
диафрагмы, экстранодального поражения, отсутствия выраженности массы опухоли
по размеру конгломератов лимфоузлов. В некоторых протоколах также исключаются
больные с морфологическим вариантом нодулярного склероза II типа ЛХ, с выражен-
ной эозинофильной инфильтрацией опухоли.
В этой группе проводят наиболее щадящее лечение с использованием схем неин-
тенсивной XT в объеме 2-4 циклов в зависимости от скорости достижения полного
эффекта и планируемой лучевой терапии.
В последние годы все больше исследователей склоняются к мнению о необходимо-
сти исключить алкилирующие препараты и антрациклины из схем XT при лечении не-
распространенных стадий ЛХ, предлагая схему VBVP (винбластин, блеомицин, этопо-
зид, прокарбазин) и дополняя ее при необходимости локальным облучением в низких
дозах (20-26 Гр).
VBVP
Винбластин (Велбе) — 6 мг/м2 в/в струйно в 1-й и 8-й дни.
Этопозид — 100 мг/м2 в/в 1-часовая инфузия ежедневно в 1-5-й день.
Блеомицин — 10 мг/м2 в/в струйно 10-минутная инфузия в 1-й день.
Преднизолон — 40 мг/м2 внутрь ежедневно в 1-8-й день.
Повторение цикла на 21-й день, считая с 1-го дня предыдущего цикла.
Для случаев локализованных стадий ЛХ возможно использование менее токсичных
схем: CVPP — циклофосфамид, винбластин, прокарбазин, преднизолон; СОРР — ци-
клофосфамид, винкристин (Онковин), прокарбазин, преднизолон; АВОР — доксору-
бицин, блеомицин, винкристин (Онковин), преднизолон (отличающийся от режима
ABVD отсутствием в схеме дакарбазина и включением преднизолона в дозе 40 мг/м2
ежедневно внутрь в 1-15-й день).
Высокоэффективен у этой группы больных режим ABVE.
ABVE
Доксорубицин (Адриамицин) — 25 мг/м2 в/в струйно 15-минутная инфузия в 1-й и 15-й
дни.
Блеомицин — 10 мг/м2 в/в струйно 10-минутная инфузия в 1-й и 15-й дни.
Винкристин — 1,5 мг/м2 (максимум 2 мг) в/в струйно в 1-й и 15-й дни.
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день.
Интервал между циклами 2 нед.
2-я группа — промежуточного риска, включает в себя больных с локализо-
ванной стадией ЛХ (I—IIА), имеющих поражение средостения, выраженные конгломе-
раты периферических лимфоузлов, при наличии симптомов интоксикации (I- 11В ста-
дии) и больных с III стадией ЛХ без симптомов интоксикации (IIIА стадия). Условием
отнесения к этой группе является отсутствие выраженной массы опухоли в средосте-
нии (медиастинально-торакальный индекс (МТИ) менее 0,33), экстранодальных лока-
лизаций, первичного поражения лимфоузлов, расположенных ниже диафрагмы, по-
ражения лимфоузлов ниже бифуркации брюшной аорты при ША стадии ЛХ.
Лечение этой группы больных основано на использовании более эффективных схем
XT, к которым относятся ABVD и ее модификации, МОРР (режим аналогичен при-
меняемому у взрослых больных), ОРРА, АСОРР (СОРР + антрациклиновый антибио-
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 413
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
ммввааанмяшмиймяктмвямнвеяаяаяюввйтяянвйваа»^^ ? *•>.. v-1
тик). По непосредственной эффективности эти схемы равнозначны, но значитель-
но различаются по токсичности, особенно поздней. Наиболее токсична схема МОРР.
и ее применение у детей должно быть ограничено. Токсичность МОРР определяет
прежде всего развитие вторых опухолей и, особенно, лейкозов, нарушения со сто-
роны щитовидной железы, герминогенной функции. Схема ABVD менее токсична, а
при ограничении общего числа циклов до 3 не давала легочной и кардиотоксично-
сти. В некоторых протоколах применяют сочетание режимов МОРР и ABVD, добиваясь
высоких результатов при снижении токсичности. В последние годы у больных, отно-
сящихся к промежуточной группе риска, стала использоваться схема ВЕАСОРР-14 (cnl
разд. 10.4). В большинстве протоколов для получения высоких лечебных результатов в
группе промежуточного риска проводится от 4 до 6 циклов XT в сочетании с последу-
ющей лучевой терапией со снижением СОД (до 20-25 Гр по эффекту) и полей облу-
чения (только зоны первичного поражения).
Оценивается эффективность каждых 2 циклов проводимой XT. При недостаточном
эффекте (сокращение опухоли менее 70% от исходного размера) целесообразно ин-
тенсифицировать лечение. При использовании схемы ВЕАСОРР-14 дальнейшее лече-
ние проводят по схеме ВЕАСОРР-интенсифицированная (как в группе высокого риска).
Если после 2 циклов по схеме ВЕАСОРР-интенсифицированная эффект не нарастает
(сокращение опухоли менее 70% или стабилизация процесса), возможно полное из-
менение режима с переходом на схемы второй линии, применяемые при развитии ре-
зистентности и рецидивах заболевания, аналогичные режимам у взрослых больных.
Это схемы В-МОРР, CCVPP, МАВОР, ABD1C, B-CAVe, CEVD, Dexa-BEAM, BEAM, CBV и др.
У детей эффективны следующие комбинации второй линии.
IEP
Ифосфамид — 2 г/м2/сутв/в постоянная 24-часовая инфузия в 1—5-й день + месна
(Уромитексан).
Этопозид — 120мг/м2/сутв/в 1-часовая инфузия в 1-5-й день.
Преднизолон — 100 мг/м2/сут внутрь в 3 приема в 1 -5-й день.
СЕР (модифицированная без хлорамбуцила)
Ломустин (CCNU, Белустин,) — 80 мг/м2 внутрь в 1-й день.
Этопозид — 100 мг/м2 внутрь в 1 -5-й день.
Преднизолон — 60 мг/м2 внутрь в 1-5-й день.
IPP
Ифосфамид — 2 г/м2/сут в/в постоянная инфузия в 1 — 5-й день + месна (Уромитексан).
Цисплатин — 20 мг/м2/сутв/в 30-минутная инфузия в 1 -5-й день.
Преднизолон — 100 мг/м2/сутвнутрь в 1-5-й день.
При полном эффекте у больных с выраженной исходной массой опухоли, особенно
при морфологическом варианте нодулярного склероза, показано применение консо-
лидирующей лучевой терапии в дозе 20-22 Гр. При выраженном, но неполном эффек-
те с сокращением опухоли более 70% от первоначального размера важны данные по
активности процесса по результатам радионуклидного исследования. При неполной
регрессии опухоли после окончания XT, особенно при большом исходном размере
опухоли и морфологическом варианте ЛХ — нодулярном склерозе, целесообразно
применение облучения с подведением дозы к очагу до 26-30 Гр.
3-я группа — высокого риска. К ней относят больных с неблагоприятными
прогностическими факторами: первичная локализация поражения ниже диафрагмы,
414 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Лимфома Ходжкина
выраженная масса опухоли в средостении, экстранодальные локализации, поражение
ниже бифуркации брюшной аорты у больных с 1ПА, II1B и IV стадиями ЛХ.
В группе высокого риска результаты большинства лечебных протоколов на 20-40%
хуже, чем в группах промежуточного риска, и в этой группе больных проводится на-
иболее интенсивная терапия с увеличением количества применяемых циклов до 8 и
более. Используются интенсифицированные режимы ПХТ — схема ВЕАСОРР (интен-
сифицированная). Интенсификация заключается в повышении доз циклофосфамида,
этопозида и винкристина, сокращении интервала между циклами.
ВЕАСОРР
Блеомицин — 10 мг/м2 в/в в 8-й день.
Этопозид — 200 мг/м2 в/в в 1-3-й день.
Доксорубицин — 35 мг/м2 в/в в 1-й день.
Циклофосфамид — 1200 мг/м2 в/в в 1 -й день.
Винкристин — 2 мг/м2 (не более 2 мг) в/в в 8-й день.
Прокарбазин (Натулан) — 100 мг/м2 внутрь в 1-7-й день.
Преднизолон — 20 мг/м2 внутрь в 1-14-й день.
Повторение цикла на 21-й день, считая от 1-го дня предыдущего цикла.
При лейкопении на 8-10-й день цикла используют Г-КСФ в дозе 5 мкг/кг/сут.
После 4 циклов XT по схеме ВЕАСОРР-интенсифицированная оценивают эффект.
При полном или выраженном эффекте (сокращение опухоли более 70%) девочкам
проводят 4 цикла по схеме СОРР/ABV, а мальчикам — 2 цикла по схеме ABVD и облу-
чение зон первичного поражения (СОД 20 Гр). При сокращении опухоли менее 70%,
независимо от пола, проводится еще 4 цикла по схеме ВЕАСОРР-интенсифицирован-
ная и облучение зон первичного поражения (СОД 30-35 Гр на остаточную опухоль).
При прогрессировании процесса переходят на режимы ПХТ второй-третьей линии.
COPP/ABV
Циклофосфамид — 600 мг/м2 в/в 30-минутная инфузия в 1-й день.
Винкристин — 1,4 мг/м2 (не более 2 мг) в/в в 1-й день.
Прокарбазин — 100 мг/м2 внутрь в 1-7-й день.
Преднизолон — 20 мг/м2 внутрь в 1-14-й день.
Доксорубицин — 35 мг/м2 в/в 30-минутная инфузия в 8-й день.
Блеомицин — 10 мг/м2 в/в струйно 10-минутная инфузия в 8-й день.
Винбластин — 6 мг/м2 (не более 10 мг) в/в в 8-й день.
В последние годы поднимается вопрос о выделении группы больных очень небла-
гоприятного прогноза с необходимостью проведения им высокодозной XT в ранние
сроки, что повысит ее эффективность и снизит токсичность, т.к. токсичность высоко-
дозной XT напрямую зависит от числа циклов и интенсивности предшествующей ей XT
и облучения. Группа эта малочисленна, четких критериев ее выделения до настоящего
времени нет. Эту группу формируют больные с поражением костной ткани, замедлен-
ным достижением полного или выраженного частичного ответа.
Эффективной в лечении ЛХу детей является модифицированная программа БФМ —
DAL-HD-98 с использованием схем ОРРА (у девочек) и ОЕРА (у мальчиков):
больным 1-й группы риска (1-ПА стадия ЛХ) проводят 2 цикла ОРРА (ОЕРА) и ло-
кальное облучение зон первичного поражения в дозе 25 Гр;
в больным 2-й группы риска (ПВ-П1А стадия ЛХ) 2 цикла ОРРА (ОЕРА) дополняют
2 циклами СОРР и проводят локальное облучение зон первичного поражения в
дозе 20 Гр;
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 415
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
'ИИЦ№11111ШП1ОП11111ЯШ1№Я1П11№МШШ1ШНМ01ШГО1^ г-1 - e t •. v. г
больным 3~й группы риска (111B-1V стадия ЛХ, экстранодальные поражения при
любой стадии) 2 цикла ОРРА (ОЕРА) дополняют 4 циклами СОРР с последующим
локальным облучением зон первичного поражения в дозе 20 Гр.
Проводимое лечение позволяет получить 5-летнюю безрецидивную выживаемость
у 90-93 % детей.
При рецидиве ЛХ используют различные программы лечения в зависимости от ха-
рактера и времени возникновения рецидива с возможностью использования при
поздних рецидивах ранее применявшихся и эффективных для данного больного схем
ПХТ или применения режимов ПХТ второй-третьей линии. При непрерывно рециди-
вирующем течении используются высокие дозы химиопрепаратов (циклофосфамид,
этопозид, кармустин и др.) с пересадкой аутологичного костного мозга или ПСК.
В последние годы начаты попытки применения препаратов на основе МКА в группах
больных с неблагоприятным прогнозом течения ЛХ (первично-резистентные и с ран-
ними рецидивами заболевания).
12.3. Неходжкинские лимфомы
О. В. Морозова, Н. А. Сусулева
НХЛ составляют 7-8% всех злокачественных опухолей у детей и наиболее часто ди-
агностируются в возрасте 5-9 лет. У детей до 1 года это заболевание встречается ис-
ключительно редко. НХЛ у детей существенно отличаются от лимфом взрослых. Для
НХЛ детского возраста характерна высокая пролиферативная активность незрелых
опухолевых клеток со склонностью к диффузному росту, ранней диссеминации, по-
ражению костного мозга и ЦНС. Поэтому около 80% больных поступают в стационар
с распространенным процессом. В результате интенсивных исследований за послед-
ние годы достигнуты существенные успехи влечении НХЛ у детей.
Длительная безрецидивная выживаемость детей при использовании современных
программ лечения варьирует от 70 до 90% в зависимости от стадии и клеточного типа
опухоли.
Высокая митотическая активность клеток определяет высокую чувствительность
НХЛ к XT, которая используется при всех случаях НХЛ. Применяемые противоопухо-
левые препараты, их дозы и длительность лечения зависят от иммунного типа НХЛ, ста-
дии заболевания и характеристики прогноза, т. е. групп риска. Ограничено применение
лучевой терапии в виде облучения ЦНС только случаями Т-клеточной НХЛ. Облуче-
ние нодальных поражений ни с профилактической целью, ни при наличии остаточ-
ной опухоли не проводится. При всех случаях детских НХЛ обязательна профилакти-
ка нейролейкоза. Использование интенсивных программ лечения требует проведения
сопроводительной терапии.
Важно определение активности опухолевой ткани при остаточной массе на фоне
проводимой программы лечения, используя повторные операции с морфологиче-
ским исследованием. При отсутствии «живой» опухолевой ткани программа лечения
признается эффективной и коррекции в лечении не требует. При обнаружении «жи-
вой» опухолевой ткани проводится коррекция лечения с возможностью применения
протоколов высокодозной XT с трансплантацией костного мозга или ПСК.
Одна из наиболее эффективных программ лечения данного заболевания — разра-
ботанный германо-австрийской группой онкопедиатров протокол для НХЛ (BFM-NHL)
с учетом клеточной принадлежности опухоли (Т-, В- и крупноклеточные анапластиче-
ские лимфомы), которая уточняется иммунофенотипированием.
Основная часть Т-клеточных (не-В-клеточных) лимфом локализуется в средостении,
а В-клеточных — в брюшной полости и носоглотке.
416 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
При определении стадии заболевания чаще всего используют классификацию Анн-
Арбор в модификации Мэрфи для НХЛ у детей (1980).
Программа лечения лимфобластных (из предшественников Т- и В-клеток) и Т-кле-
точных лимфом идентична программе лечения ОЛЛ:
длительный непрерывный (в течение 2 лет) курс лечения;
й использование в программе антрациклинов и L-аспарагиназы;
Я для профилактики ЦНС применяют эндолюмбальную XT и облучение головно-
го мозга;
Я поддерживающая терапия проводится в течение 1,5 года;
В различия в программе лечения зависят только от стадии заболевания и скорости
достижения эффекта.
Программы лечения В-клеточных лимфом (лимфома/лейкоз Беркитта, диффузная
В-крупноклеточная лимфома) отличаются следующим:
И использование коротких курсов интенсифицированной XT, проводимых в жест-
ко установленные СрОКИ;
Я общая продолжительность лечения менее 0,5 года;
использование в программе метотрексата в высоких дозах (1-5 г/м2 на 1 введе-
ние) и фракционно циклофосфамида;
Я профилактика и лечение поражения ЦНС осуществляются эндолюмбальным
введением химиопрепаратов (трех) без облучения головного мозга;
Я поддерживающая терапия не проводится;
Я тактика XT в отношении доз и длительности терапии зависит не только от стадии,
но и от массы опухоли, определяемой полным удалением (резектабельностью)
во время хирургического вмешательства, активностью сывороточной ЛДГ, ис-
ходным поражением ЦНС.
Для программ лечения крупноклеточных анапластических лимфом характерно:
В использование для индукции ремиссии коротких курсов интенсифицированной
XT, проводимой в жестко установленные сроки, как при В-клеточной лимфоме;
интенсивность и продолжительность XT зависят от стадии и резектабельности
ОПУХОЛИ;
И с учетом иммунофенотипических различий внутри группы крупноклеточных
анапластических лимфом необходим дифференцированный подход к проведе-
нию поддерживающего лечения.
Степени риска при НХЛ у детей
Лимфобластная и Т-клеточная лимфомы:
I (стандартная) группа риска — 1-11 стадия.
II (средняя) группа риска — III—IV стадия.
Ill группа риска — остаточная опухоль более 30% от исходной массы, и/или более 5 %
бластов в костном мозге, и/или сохранение бластов в спинномозговой жидкости на
33-й день лечения, или прогрессия опухоли.
В-клеточная лимфома:
1 группа риска — 1-11 стадия; первичная опухоль макроскопически полностью удалена.
II группа риска — 1-11 стадия, первичная опухоль макроскопически не полностью уда-
лена; Ш стадия, при показателях ЛДГ, не превышающих 500 ЕД/л.
Ill группа риска — III—IV стадия; показатели ЛДГ, не превышающие 1000 ЕД/л, отсутст-
вует поражение ЦНС.
IV группа риска — III—IV стадия; показатели ЛДГ, превышающие 1000 ЕД/л, и/или име-
ется поражение ЦНС.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 417
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
Крупноклеточная анапластическая лимфома:
1 группа риска — 1-11 стадия; первичная опухоль макроскопически полностью удалена.
11 группа риска — 1-11 стадия, первичная опухоль макроскопически не полностью уда-
лена; 111 стадия.
111 группа риска — IV стадия (поражение костного мозга и/или ЦНС); вне зависимости
от стадии множественное поражение костей, и/или поражение кожи, и/или пораже-
ние легких, и/или крупноклеточная анапластическая лимфома (вторая опухоль), и/или
лимфогистиоцитарная лимфома.
Лечение лимфобластной и Т-клеточной лимфом
Программа лечения детей в I группе прогностического риска
Протокол I
Преднизолон — 60 мг/м2 внутрь в 1-28-й день с постепенной отменой с 29-го по 36-й
день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 8, 15, 22 и 29-й дни.
Рубомицин — 30 мг/м2 в/в капельно 1 -часовая инфузия в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 5000 ЕД/м2 в/в капельно 1-часовая инфузия в 12, 15, 18, 21, 24, 27.
30 и 33-й дни.
Циклофосфамид — 1000 мг/м2 в/в капельно 1-часовая инфузия на фоне введения ме-
сны в 36-й и 64-й дни.
Цитозин-арабинозид — 75 мг/м2 в/в струйно в 38-41,45-48, 52-55 и 59-62-й дни.
6-меркаптопурин — 60 мг/м2 внутрь в 36-63-й день.
Метотрексат — 6-12 мг (в зависимости от возраста) эндолюмбально в 1, 12, 33, 45 и
59-й дни.
Протокол М
6-меркаптопурин — 25 мг/м2 внутрь в 1-56-й день.
Метотрексат — 5000 мг/м2 (для Т-клеточных лимфом) или 2000 мг/м2 (для лимфом из
предшественников В-клеток) в/в капельно 24-часовая инфузия в 8, 22, 36 и 50-й дни
(при невозможности применения указанной дозы используется 1000 мг/м2).
Фолинат кальция — 30 мг/м2 в/в в течение 42 ч, 15 мг/м2 в течение 48 и 52 ч от начала
инфузии метотрексата (коррекция доз и кратности введения в зависимости от концен-
трации метотрексата в сыворотке крови).
Метотрексат — 6-12 мг эндолюмбально в 8, 22, 36 и 50-й дни.
Примечание лечение при протоколе М начинается через 2 нед. после окончания лечения по протоколу I
Программа лечения детей во II группе прогностического риска
Протокол 1 (см. выше)
Протокол М (см. выше)
Протокол 11
Дексаметазон — 10 мг/м2 внутрь в 1-21-й день с дальнейшей постепенной отменой.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 8, 15, 22 и 29-й дни.
Доксорубицин — 30 мг/м2 в/в капельно 1-часовая инфузия в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 10 000 ЕД/м2 в/в капельно 1-часовая инфузия в 8, 11, 15 и 18-й дни.
Циклофосфан — 1000 мг/м2 в/в капельно 1-часовая инфузия в 36-й день.
418 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
Цитозар — 75 мг/м2 в/в струйно в 38-41-й и 45-48-й дни.
6-меркаптопурин — 60 мг/м2/сут внутрь в 36-49-й день.
Метотрексат — 6-12 мгэндолюмбально в 38-й и 45-й дни.
Лучевая терапия на головной мозг в СОД 12 Гр с 43-го дня цикла.
Примечание: протокол М начинается через 2 нед после окончания протокола I, протокол II начинается через
2 нед после окончания протокола М.
Программа лечения детей в III группе прогностического риска
Лечение по программе протокола ОЛЛ у детей из группы высокого риска, используя
блоки интенсивной XT.
Поддерживающее лечение одинаково для всех групп риска:
6-меркаптопурин — 50 мг/м2 внутрь ежедневно до 104-й недели (24 мес.).
Метотрексат — 20 мг/м2 в/м 1 раз в неделю до 104-й недели (24 мес.).
Примечание дозы химиопрепаратов корректируются в зависимости от количества лейкоцитов (см лечение ОЛЛ)
Лечение В~клеточной лимфомы
Циторедуктивная фаза
Дексаметазон — 5-10 мг/м2 внутрь в 1-5-й день.
Циклофосфан — 200 мг/м2 в/в капельно 1-часовая инфузия в 1-2-й день.
Метотрексат 6-12 мг (в зависимости от возраста) + цитозар 16-30 мг + преднизолон
4-10 мгэндолюмбально в 1-й день.
Программа лечения детей в I группе риска
БЛОКА
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 1000 мг/м2 в/в капельно 24-часовая инфузия (назначение фолината
кальция — см. протокол М).
Ифосфамид — 800 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день (на фоне вве-
дения месны).
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Цитозар — 150 мг/м2 в/в капельно 1-часовая инфузия, 4 введения с интервалом 12 ч в
4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
БЛОК В
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 1000 мг/м2 в/в капельно 24-часовая инфузия в 1-й день (назначение
фолината кальция — см. протокол М).
Циклофосфан — 200 мг/м2 в/в струйно на фоне месны в 1-5-й день.
Доксорубицин — 25 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
Примечание' программа лечения состоит из двух блоков (А + В), проводимых с интервалом 2 нед
Программа лечения детей во II группе риска
Проводится с использованием циторедуктивной фазы и 4 чередующихся блоков
А и В, проводимых с интервалом 2 нед.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 419
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
Программа лечения детей в III и IV группах риска
БЛОК АА
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 5000 мг/м2 в/в капельно (см. выше) в 1-й день.
Ифосфамид — 800 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день (на фоне вве-
дения месны).
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Цитозар — 150 мг/м2 в/в капельно 1-часовая инфузия, 4 введения с интервалом 12 <- г
4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
БЛОК ВВ
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 5000 мг/м2 в/в капельно (см. выше) в 1-й день.
Доксорубицин — 25 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
БЛОК СС
Дексаметазон — 20 мг/м2 внутрь в 1-5-й день.
Виндезин — 3 мг/м2 (максимально 6 мг), при отсутствии — винкристин 1,5 мг/м2 (мак-
симально 2 мг) в/в струйно в 1-й день.
Цитозар — 3000 мг/м2 в/в капельно 3-часовая инфузия, 4 введения с интервалом 12 ч
в 1-й и 2-й дни.
Этопозид — 100 мг/м2 в/в капельно 2-часовая инфузия, 5 введений с интервалом
12 ч в 3-5-й день.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально в 5-й день.
Примечание лечение проводится чередованием блоков АА, ВВ и СС с интервалом 2 нед , 5 блоков в III группе ри-
ска и 6 блоков в IV группе риска
Программа лечения детей с поражением ЦНС состоит из 6 чередующихся блоков
AAz, BBz и CCz, отличающихся эндолюмбальным введением метотрексата и предни-
золона (первое введение через 24 ч от начала в/в инфузии высоких доз метотрексата
ежедневно во 2-5-й день в 74 разовых доз от вводимых в блоках АА и ВВ). Через 24 ч
от окончания эндолюмбального введения метотрексата и преднизолона в 6-й день эн-
долюмбально вводится цитозар в дозе 16-30 мг (в зависимости от возраста). При про-
ведении блока CCz первое эндолюмбальное введение метотрексата и преднизолона
осуществляется через 24 ч от последней инфузии высоких доз цитозара ежедневно в
3-6-й день в '/4 разовых доз от вводимых в блоке СС. На 7-й день через 24 ч от эндо-
люмбального введения метотрексата и преднизолона вводится эндолюмбально цито-
зар в дозе 16-30 мг (в зависимости от возраста).
Ритуксимаб вводится в дозе 375 мг/м2 в/в капельно с использованием инфузомата за
24 ч до начала каждого блока XT у детей с лимфомой Беркитта и диффузной В-круп-
ноклеточной лимфомой в III и IV группах прогностического риска.
Лечение крупноклеточных анапластических лимфом
У детей I группы риска проводится циторедуктивная фаза и 3 чередующихся бло-
ка XT (а и б).
420 ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Неходжкинские лимфомы
Во II группе риска проводится циторедуктивная фаза и 6 чередующихся блоков
XT (а и б). Блоки а и б отличаются от блоков А и В дозой метотрексата — 500 вместо
1000 мг/м2.
В III группе риска после циторедуктивной фазы используют 6 чередующихся бло-
ков АА, ВВ и СС.
При Т-клеточной крупноклеточной анапластической лимфоме (CD3+) используют
блоки высокого риска (НК) программы ОЛЛ или Т-НХЛ, после окончания основного
курса лечения проводится поддерживающая XT винбластином 6 мг/м2 в/в струйно ка-
ждые 3 нед. до 12 мес. от начала всей программы терапии.
Тактика сопроводительной терапии
Разработан комплекс мер, позволяющих уменьшить частоту и тяжесть побочных ре-
акций и осложнений во время проведения лечения НХЛ у детей.
В начале лечения главную опасность представляет СЛО и развитие мочекислой не-
фропатии с острой почечной недостаточностью.
Главное условие предупреждения развития токсических реакций, вызванных
СЛО, — массивная инфузионная терапия в дозе 3000 мл/м2 в сутки (125 мг/м2/ч), вклю-
чая 1500 мл/м2/сут 5% глюкозы, 1320 мл/м2/сут 0,9% натрия хлорида, 180 мл/м2/сут
4% натрия гидрокарбоната. Диурез стимулируется введением лазикса. В профилак-
тике мочекислой нефропатии важную роль играет назначение аллопуринола в дозе
300 мг/м2 в 3 приема в сутки (10 мг/кг) в первые 3-8 дней лечения.
В тяжелых случаях показаны гемодиализ и гемофильтрация.
Тромбоконцентрат переливается при угрозе повышенной кровоточивости или ин-
фекционном осложнении при количестве тромбоцитов менее 25 х 109/л. Эритроцит-
ная масса переливается для поддержания гематокрита на уровне 30%, исключая слу-
чаи с инициальным гиперлейкоцитозом, когда трансфузия эритроцитной массы может
резко повысить риск церебрального лейкостаза.
Инфекционные осложнения возможны на любом этапе лечения, однако наиболее
опасны при развитии агранулоцитоза в периферической крови (с количеством грану-
лоцитов менее 500/мкл).
При развитии агранулоцитоза в периферической крови требуется изоляция ребен-
ка и проведение соответствующей терапии с использованием КСФ и антибактериаль-
ных препаратов.
ХИМИОТЕРАПИЯ ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
421
ЧАСТЬ III
ОСЛОЖНЕНИЯ
ПРОТИВООПУХОЛЕВОЙ
I ХИМИОТЕРАПИИ.
| ТЕРАПИЯ НЕОТЛОЖНЫХ
J СОСТОЯНИЙ
Глава 13
Побочные реакции и осложнения
противоопухолевой лекарственной
терапии
И. В. Поддубная, Н. Ф. Орел
Использование противоопухолевых препаратов часто сопровождается развитием
побочных эффектов. Среди них преобладают реакции, обусловленные поражением
быстро обновляющихся (с высоким темпом пролиферации) клеток кроветворных и
иммунокомпетентных органов, в первую очередь костного мозга. Кроме того, проти-
воопухолевые агенты способны повреждать с разной частотой практически все нор-
мальные структуры. Частота различных видов токсичности неодинакова: наиболее
часто встречаются гастроинтестинальная (до 90%) и гематологическая (85-90%) ток-
сичность. Несколько реже (40-50%) выявляется гепатонефротропная, а также карди-
оваскулярная токсичность. Поражение нервно-мышечной и респираторной систем
отмечается у 20-25% пациентов.
В последние годы в клинической практике онкологи стали использовать препара-
ты принципиально новой группы — таргетные препараты, имеющие отличный от ци-
тотоксической терапии профиль безопасности. В целом эти препараты относительно
хорошо переносятся, в меньшей степени угнетают кроветворение, однако вызывают
специфические побочные явления, такие как кожные поражения, типичные для инги-
биторов EGF, повышение АД и сосудистые изменения (ингибиторы ангиогенеза), кар-
диотоксическое действие (трастузумаб).
Степень токсичности определяют в соответствии с рекомендациями ВОЗ и NCI, в
которых детально отражены основные виды побочного действия противоопухолевых
препаратов (см. приложение 10). На степень выраженности токсичности цитостати-
ков оказывает влияние исходное общее состояние больного, определяемое по шкале
Карновского или ECOG. Снижение функциональной активности менее 50% по шкале
Карновского или выше И степени по ECOG требует строгого мониторинга больных и, в
ряде случаев, модификации дозы противоопухолевого агента. Врачебная тактика при
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 425
Побочные реакции и осложнения...
проведении XT складывается из осуществления мероприятий по профилактике разви-
тия побочных реакций и осложнений и коррекции развившейся токсичности с реше-
нием вопроса о необходимости модификации режима XT.
На токсичность препаратов могут влиять генетические полиморфизмы. К настояще-
му времени благодаря фармакогенетическим исследованиям идентифицировано не-
сколько полиморфизмов, ассоциированных с повышенной чувствительностью к ци-
тостатикам. Носители мутантных аллелей гена тиопуринметилтрансферазы (ТПМТ)
плохо метаболизируют меркаптопурин и требуют 10-15-кратного уменьшения дозы
этого препарата. Низкая экспрессия гена дигидропиримидиндегидрогеназы (ДПД).
вовлеченного в метаболизм фторурацила, может привести к угрожающим жизни ток-
сическим эффектам фторпиримидинов. Лица со сниженной экспрессией гена ДПД
составляют менее 1 % населения. Полиморфизм генауридиндифосфатглюкуронозил-
трансферазы (УГТ1А1) распространен более широко и встречается приблизительно
у 10% пациентов. Генотип 7/7 у неазиатского населения приводит к нарушению мета-
болизма иринотекана, и у обладателей такого генотипа применение последнего со-
провождается выраженной лейкопенией и диареей. FDA одобрило тест для выявления
больных с повышенным риском побочных эффектов иринотекана, потребуются даль-
нейшие клинические исследования для этого фармакогенетического теста.
13.1. Токсическое действие на кроветворение
Токсическое действие на гемопоэз — наиболее частый побочный эффект XT. Воздей-
ствуя, в основном, на пролиферирующие клетки костного мозга и, значительно реже,
на покоящиеся клетки, противоопухолевые препараты способны вызывать угнетение
любого ростка кроветворения. Однако наиболее часто отмечается снижение пока-
зателей гранулоцитарного и тромбоцитарного ростков; эритроидный росток мень-
ше подвергается токсическому действию. Наиболее выраженное миелосупрессивное
действие оказывают алкилирующие вещества, антрациклиновые антибиотики, цита-
рабин, производные мочевины, таксаны. Преимущественно красный росток (с воз-
можностью развития длительной анемии) поражают препараты платины, метотрексат,
хлорамбуцил (Лейкеран), флударабин. Генез развития анемии неодинаков — от пря-
мого угнетающего действия (хлорамбуцил) до гемолиза (флударабин).
Развитие нейтропении — один из основных дозолимитирующих факторов, обуслов-
ливающих несоблюдение дозового режима XT, сроков введения химиопрепаратов и,
как следствие, снижение эффективности лечения. Нейтропения III—IV степени — ча-
стое осложнение лекарственной терапии, увеличивает риск развития угрожающих
жизни инфекций, частоту госпитализаций и использования антибиотиков. Это отри-
цательно сказывается на качестве жизни больных и увеличивает финансовые затраты.
К факторам риска выраженной миелосупрессии относятся предшествующие лекар-
ственная и лучевая терапия (преимущественно с облучением плоских костей — гру-
дины и таза), возраст (старше 60 лет и моложе 1 года), неудовлетворительное общее
состояние больного, истощение. Решающим в прогнозе развития гипоплазии является
исходное состояние костного мозга, косвенным отражением которого следует счи-
тать данные о его клеточности.
Принято считать, что для начала и проведения XT количество лейкоцитов в пери-
ферической крови должно быть не менее 4000/мкл и тромбоцитов 120х 103/мкл.
Поскольку основную защитную роль в отношении инфекций играют нейтрофилы, с
большей надежностью следует ориентироваться на их количество, которое должно
426 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Токсическое действие на кроветворение
превышать 1500-2000/мкл. Эти показатели условны, т.к. лечение некоторыми «щадя-
щими» цитостатиками может осуществляться и при более низких показателях.
Обычно миелосупрессивный эффект реализуется в ближайшие дни после введения
химиопрепаратов (7-12-й день). Однако ряд препаратов оказывает отсроченный ток-
сический эффект, поэтому контроль за показателями периферической крови целесо-
образно продолжать еще некоторое время после окончания введения препаратов (в
ряде случаев — до 3-6 нед.).
Нейтропения опасна развитием инфекционных осложнений. В период нейтропении
источником инфекции становится эндогенная и экзогенная микробная флора, резко
возрастает роль внутрибольничной инфекции.
К факторам риска развития нейтропенических инфекций относятся глубина и дли-
тельность нейтропении, наличие повреждений кожи и слизистых оболочек (мукозит,
раны, трещины), сопутствующий иммунодефицит (вследствие развития опухоли, про-
водимого иммуносупрессивного лечения — XT, применение кортикостероидов, об-
ширных оперативных вмешательств) и сопутствующие хронические инфекции. При
числе нейтрофилов в крови менее 0,5 х 109/л (абсолютный агранулоцитоз) риск ин-
фекционных осложнений превышает 50%.
Постоянные в/в катетеры часто служат входными воротами инфекции, вызванной
грибами рода Candida, реже — Aspergillus spp. Использование современных централь-
ных венозных катетеров, имплантируемых портсистем, соблюдение правил асептики
и антисептики при установке и длительной эксплуатации снижают риск развития кате-
терной инфекции. Если больной нуждается в установке в/в катетера в условиях глубо-
кой нейтропении, то эффективной профилактикой осложнений служит однократная
инъекция ванкомицина или тейкопланина. Поврежденная слизистая оболочка поло-
сти рта (мукозиты) может способствовать проникновению микроорганизмов, обычно
вегетирующих в этой зоне, в частности зеленящих стрептококков, Stomatococcus ти-
cilaginosus, Capnocytophaga spp. и грибов, а усиливающаяся кишечная проницаемость
опасна при цитостатической токсической энтеропатии. Инфекционные осложнения
при ослаблении защитных механизмов могут быть вызваны представителями нормаль-
ной флоры кожи и слизистых оболочек, а также экзогенной флорой, попадающей в
организм при употреблении контаминированной пищи и жидкости. Для предотвраще-
ния инвазии флоры с кожи, слизистых оболочек дыхательных путей и алиментарного
тракта ряд авторов рекомендуют профилактическое применение противомикробных
препаратов с целью снижения риска развития инфекции.
Как правило, при ФН (т. е. лихорадка выше 38 °C на фоне нейтропении II1-IV степени)
терапия назначается эмпирически. При наличии очага инфекции необходимо учиты-
вать чувствительность к антибиотикам микроорганизма, выделенного из инфекцион-
ного очага. Алгоритм антибактериальной терапии при ФН изложен в гл. 14.
При развитии тканевой инфекции (пневмония, абсцесс, флегмона и др.) в услови-
ях длительной нейтропении целесообразно добавление к антибиотикам КСФ (Г-КСФ
или ГМ-КСФ).
Первым и ведущим симптомом в клинике грибковой инфекции (Candida, Aspergillus)
является стойкая лихорадка. Отсутствие эффекта от антибактериальных препаратов в
течение первых 3 дней требует решения вопроса о присоединении противогрибко-
вых средств: амфотерицин В 0,4-1,2 мг/кг в/в инфузия ежедневно или через день; флу-
коназол (Дифлюкан) 400 мг/сут в/в, затем внутрь; итраконазол 5 мг/кг/сут внутрь.
У больных с повышенным риском развития грибковой инфекции (наличие ее в анам-
незе, высокодозная XT с трансплантацией костного мозга и др.) противогрибковые
препараты назначают с 1-го дня антибиотикотерапии. Следует учитывать, что Aspergil-
lus обладает меньшей чувствительностью к терапии, чем Candida.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 427
Побочные реакции и осложнения ...
Диагностика грибковых инфекций сложна, особое значение имеют клинические и
рентгенологические данные (при поражении дыхательных путей). Бесспорным дока-
зательством грибковой инфекции служит рост грибов в культуре или обнаружение их
в биоптате (кожа, легкое, синусы, пищевод и т.д.), однако отсутствие бактериологиче-
ского доказательства не позволяет отказаться от существующих принципов лечения.
Не менее сложна диагностика вирусных инфекций, из которых наибольшую пробле-
му представляет ЦМВ-инфекция, клинически наиболее часто проявляющаяся ринита-
ми, энтеритами, интерстициальными пневмониями. Обнаружение ЦМВ в крови, моче,
ткани пораженного органа весьма затруднено. Особое диагностическое значение име-
ет выявление специфических ЦМВ-антител. Наиболее часто ЦМВ-инфекция развива-
ется при высокоинтенсивных режимах XT с трансплантацией костного мозга. У осла-
бленных больных с гранулоцитопенией лечение антибиотиками должно сочетаться с
профилактикой ЦМВ-инфекции: иммуноглобулин, ацикловир (по 500-800 мг 3 раза в
сутки в/в в течение 7-14 дней) или валтрекс (по 1 г 3 раза в сутки внутрь). С терапевти-
ческой целью следует использовать ганцикловир, эффективность которого в серопози-
тивных ситуациях может быть усилена применением иммуноглобулина. При выделении
пневмоцист целесообразно назначение бисептола (15 мг/кг/сут), дапсона, пентамидина.
Закономерна реактивация ЦМВ-инфекции при использовании алемтузумаба, тре-
бующая не только тщательного мониторинга, но и применения противовирусных пре-
паратов с профилактической целью.
У ослабленных больных в период нейтропении могут активироваться любые хро-
нические инфекции, требующие стандартных мер профилактики и лечения. Не-
редко обостряется герпетическая инфекция, обусловленная инфицированием ви-
русом простого герпеса или опоясывающего лишая (вирус varicella-zoster). При
герпетической инфекции с лечебной целью используются антивирусные препара-
ты: при вирусе простого герпеса 1-го и 2-го типов — ацикловир (зовиракс) (1 г за 5
приемов в сутки) или валтрекс (1 г/сут за 2 приема) в течение 5-10 дней; при вирусе
varicella-zoster — зовиракс (4 г/сут за 5 приемов) или валтрекс (3 г/сут за 3 приема) в
течение 7-10 дней. При диссеминированном опоясывающем лишае доза зовиракса
повышается до 10 мг/кг (3 раза в сутки в/в). С целью профилактики развития рециди-
ва герпетической инфекции применяют однодневные методики: при вирусе простого
герпеса — зовиракс (800 мгза 2 приема) или валтрекс (500 мгза 1 прием), а при виру-
се varicella-zoster — зовиракс (4 г/сут за 5 приемов), валтрекс (3 г/сут за 3 приема).
Тромбоцитопения опасна развитием геморрагического диатеза. Критическим уров-
нем тромбоцитов считается 20 х 103/мкл. В условиях цитостатической тромбопении
кровоточивость определяется не только глубиной тромбоцитопении, но и ее про-
должительностью; могут наблюдаться носовые, желудочно-кишечные геморрагии,
кровоизлияния в мозг и др. Для борьбы с осложнениями цитостатической тромбо-
цитопении — тромбоцитопеническим геморрагическим синдромом — используют
трансфузии тромбоконцентрата.
При необходимости длительных многократных переливаний тромбоконцентратов
важен подбор пары донор-реципиент с учетом антигенов системы HLA (таких доно-
ров легче найти среди братьев и сестер реципиентов). Для единичных или неотлож-
ных переливаний вполне достаточно совместимости донора и реципиента по антиген-
ным системам АВО и резус.
Для купирования анемии (при снижении гемоглобина до II степени и ниже по кри-
териям ВОЗ) можно использовать эритроцитную массу (лучше — отмытые эритроци-
ты). Особенно тщательный мониторинг гемоглобина необходим у пожилых пациентов,
у которых восполнение уровня гемоглобина необходимо с 90-100 г/л для предотвра-
щения функциональных нарушений.
428 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ,..
Токсическое действие на желудочно-кишечный тракт
Патогенетическим и истинно эффективным при миелосупрессии следует считать ис-
пользование цитокинов. В настоящее время существует большое количество гемопо-
этических факторов роста (КСФ, ЭПО, тромбопоэтин и др.). Наибольшее распростра-
нение получили КСФ. При использовании химиотерапевтических режимов с риском
миелосупрессии более 20% и при наличии в анамнезе отчетливого снижения нейтро-
филов после предыдущих аналогичных циклов для профилактики нейтропении це-
лесообразно применение Г-КСФ (Граноцит, Нейпоген, Лейкостим) в дозе 5 мкг/кг/сут
в течение 7-10 дней, начиная не ранее чем через 24 ч после введения цитостатика.
Абсолютными показаниями к применению КСФ служат снижение нейтрофилов ме-
нее 500/мкл и/или развитие ФН независимо от глубины подавления количества ней-
трофилов. Особый интерес представляет пэгфилграстим — пролонгированная форма
филграстима — Неуластим. Длительный период полувыведения из плазмы (около 80 ч)
обеспечивает возможность однократного введения Неуластима в течение цикла XT.
Пегилированный филграстим имеет опосредованный нейтрофилами клиренс, сыво-
роточная концентрация его остается высокой в течение всего периода нейтропении,
препарат начинает элиминироваться, как только уровень нейтрофилов возвращается к
норме. Фиксированная доза Неуластима 6 мг эффективна у пациентов с любой массой
тела и при любом цикле XT. Препарат обладает сравнимым с филграстимом профи-
лем переносимости. Быстрый стойкий прирост числа гранулоцитов снижает часто-
ту инфекционных осложнений. Наименее результативно влияние КСФ на тромбо-
цитопоэз. Препаратом, стимулирующим продукцию и созревание мегакариоцитов,
является ИЛ-11 — опрелвекин (Ньюмега). Для борьбы с анемией эффективно приме-
нение ЭПО (Рекормон, Эпрекс, Аранесп). Поддержание нормального уровня гемо-
глобина не только обеспечивает нормальное функционирование жизненно важных
органов (особенно у лиц пожилого возраста), но и способствует улучшению резуль-
тативности медикаментозного лечения. С осторожностью следует использовать ЭПО
у больных с тромбозом в анамнезе, после хирургических вмешательств с длительным
периодом ограничения двигательной активности из-за риска развития тромбоэмболи-
ческих осложнений. ЭПО применяется у онкологических больных строго по показа-
ниям, только пока они получают противоопухолевую терапию (см. гл. 5).
13.2. Токсическое действие на желудочно-
кишечный тракт
Многие противоопухолевые препараты оказывают токсическое действие наЖКТ, обу-
словливая развитие тошноты, рвоты, мукозитов (стоматиты, эзофагиты, энтериты), ди-
ареи, запора, гепатотоксичности.
Лечение тошноты и рвоты
Тошнота и рвота являются если не самыми опасными для жизни, то часто встреча-
ющимися и субъективно наиболее тягостными проявлениями токсического действия
цитостатиков. При применении производных платины эти реакции наиболее выраже-
ны и нередко служат причиной отказа от лечения. Противоопухолевые агенты услов-
но разделены на несколько групп в зависимости от интенсивности их эметогенного
эффекта; для некоторых из них установленны суммарные дозы, характеризующиеся
выраженным проявлением этого вида токсичности. Эметогенный потенциал основных
цитостатиков представлен в табл. 13.1.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 429
Побочные реакции и осложнения...
»®И8ЯЯ»Я»»ВД«Ю»вв»вИЯВИвава^^ V И 1 5 ' Л '
Таблица 13.1. Потенциальная эметогенность противоопухолевых препаратов
Эметогенность Препарат 1
Высокая частота (> 90%) Дакарбазин Кармустин > 250 мг/м2 Ломустин > 60 мг/м2 Стрептозоцин Циклофосфамид > 1,5т/м2 Цисплатин > 50 мг/м2
Дактиномицин > 1,5 мг/м2 Доксорубицин > 60 мг/м2 Кармустин < 250 мг/м2 Карбоплатин Метотрексат > 1000 мг/м2
Умеренно высокая частота (60-90%) Прокарбазин перорально Цисплатин < 50 мг/м2 Цитарабин > 1000 г/м2 Циклофосфамид 750-1500 мг/м2 Эпирубицин (Фарморубицин) > 90 мг/м2
Альтретамин Доксорубицин 20-60 мг/м2 Иринотекан Ифосфамид Идарубицин Метотрексат 250-1000 мг/м2
Умеренная частота (30-60%) Митоксантрон Оксалиплатин Фторурацил 2,6 г/м2 Циклофосфамид перорально Цитарабин (в терапевтических дозах) Эпирубицин < 90 мг/м2
Аспарагиназа Гемцитабин Доцетаксел Иматиниб
Низкая частота (10-30%) Капецитабин Липосомный доксорубицин Метотрексат 50-250 мг/м2 Митомицин Паклитаксел Ритуксимаб Темозоломид Тенипозид - Тиотепа Топотекан Трастузумаб Этопозид
430 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Токсическое действие на желудочно-кишечный тракт
Эметогенност
Препарат
Блеомицин
Бусульфан в стандартных дозах
Бортезомиб (Велкейд)
Винкристин/винбластин/винорелбин
Очень низкая частота (< 10%) Гидроксимочевина (Гидроксикарбамид, Гидреа)
Ununb пИоКал ndulUid lv zol
Мелфалан перорально
Меркаптопурин
Метотрексат < 50 мг/м2
Хлорамбуцил
Флударабин
По времени возникновения тошноты и рвоты выделяют острые тошноту и рвоту, воз-
никающие в течение первых 24 ч после начала XT, отсроченные — через 24 ч и далее
после проведения XT и условно-рефлекторную, возникающую хотя бы после одного
курса XT и развивающуюся по принципам формирования условного рефлекса. Слож-
ный механизм возникновения тошноты и рвоты, в котором участвует рвотный центр
ретикулярной формации мозжечка, координирующий сигналы с периферии и струк-
тур высшей нервной деятельности и хеморецепторной триггерной зоны, определяет
возможность использования антиэметиков различного механизма действия, таких как
антигистамины, антагонисты дофамина, антихолинергические средства, производные
фенотиазина, бутирофеноны, бензодиазепины, кортикостероиды, холинолитики, ан-
тагонисты серотонина.
Наибольшую популярность среди препаратов перечисленных групп приобрел ме-
токлопрамид (Церукал, Реглан), который целесообразно применять в сочетании с кор-
тикостероидами (метилпреднизолоном или дексаметазоном). Препаратами, облада-
ющими специфическим противорвотным свойством при использовании цитостатиков,
являются антагонисты рецепторов 5-НТ3 — сетроны. Эффект препаратов этой группы
связан с блокадой рецепторов 5-НТ3 на уровне нейронов как периферической, так и
центральной нервной системы. Применение этих препаратов позволяет значительно
уменьшить тошноту и рвоту у 70-90% больных, получающих высокоэметогенную XT
(цисплатин в дозе 100 мг/м2 и более), и практически у всех больных, получающих ме-
нее эметогенные препараты. В настоящее время в клинике используются препараты из
группы 5-НТ3: трописетрон, ондансетрон, гранисетрон. Для усиления эффективности
5-НТ3-блокаторов при высокоэметогенной терапии и контроля отсроченной тошноты
и рвоты используются блокаторы NK-1-рецепторов — апрепитант (Эменд).
Для лечения условно-рефлекторной рвоты рекомендуются препараты из группы
бензодиазепинов (лоразепам).
Стандартным считается использование комбинированных режимов противорвот-
ных препаратов. В табл. 13.2-13.4 приводится схема приема препаратов в зависимости
от степени эметогенности противоопухолевой терапии.
Таблица 13.2. Рекомендации ESMO (2008) по профилактике тошноты и рвоты,
обусловленных проведением химиотерапии
Эметогенная активность Рекомендуемые препараты
Остраятошнрта
Высокая__________________Антагонисты рецепторов серотонина + кортикостероиды + апрепитант
Умеренная_____ Антагонисты рецепторов серотонина или кортикостероиды
Низкая_____________Один препарат, в частности кортикостероидной группы___________
Минимальная Без проведения противорвотной профилактики
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 431
Побочные реакции и осложнения
ЯВЙЙЙЯЯЙЙМИЯЯЙЯ^ИЙЙ^^ .V4 » Vw*-^ ач?
1 Эметогенная активность Рекомендуемые препараты 1
Отсроченная тошнота и рвота ' 'г'-'-
Высокая Кортикостероиды + апрепитант
Умеренная Кортикостероиды или антагонисты серотонина
Низкая Без профилактики
Минимальная Без профилактики
Особые ситуации - Рекомендации ,?• - •
Многодневная XT В дни проведения XT профилактика острой тошноты и рвоты; профи- лактика отсроченной рвоты в следующие 1-2 дня после окончания XT. Апрепитант и палоносетрон не изучались для этих целей
Рефрактерная тошнота и рвота Добавить антагонисты дофамина к антагонистам рецепторов серотони- на и кортикостероидам
Рефлекторная тошнота и рвота Назначить лоразепам/аутотренинг
Высокодозная XT Кортикостероиды, антагонисты рецепторов серотонина или антагони- сты дофамина в/в в полных дозах
Таблица 13.3. Высокоэметогенная химиотерапия
День 2 ДеньЗ День 4 J
Апрепитант (Эменд) 125 мг внутрь за 1 ч до начала XT 80 мг (утром) 80 мг (утром) —
Дексаметазон 12 мг внутрь за 30 мин до начала XT 8 мгвнутрь (утром) 8 мг внутрь (утром) 8 мг внутрь (утром)
Ондасетрон 32 мг в/в за 30 мин до начала XT — — —
Таблица 13Л. Умеренная эметогенная химиотерапия
День 3 I
Апрепитант (Эменд) 125 мг внутрь за 1 ч до начала XT 80 мг (утром) 80 мг(утром)
Дексаметазон 12 мг внутрь за 30 мин до начала XT — —
Ондасетрон 8 мг внутрь 2 раза в сутки (8 мг за 30-60 мин до на- чала XT и еще 8 мг через 8 ч после первой дозы он- — дасетрона) —
Лечение мукозитов
В лечении стоматита используют:
® мягкую зубную щетку;
Я диету — мягкая, теплая, нераздражающая пища;
Я полоскание этакридина лактатом (Риванол) 0,1 % раствором, фурацилином
(1:5000). Смазывание слизистой оболочки полости рта метиленовым синим, по-
лоскание белком куриного яйца (белок яйца на 200 мл воды), отварами ромаш-
ки, коры дуба, смазывание маслом шиповника или облепиховым маслом, вита-
мином В12, раствором прополиса. Может использоваться маалокс, метациловая
эмульсия (суспензия метилурацила), ротокан (полоскание);
Я для обезболивания — полоскание 0,25-1,0% раствором новокаина, 1-2% рас-
твором лидокаина, анестезина. Хорошим обезболивающим эффектом обладает
также Тантум-верде (полоскание или аэрозоль);
В при доказанных кандидозных поражениях слизистых оболочек — низорал (по
1 таблетке 2 раза в сутки), нистатин (не менее 8 млн ЕД/сут за 4-5 приемов) +
амфотерицин в виде ингаляций или амфоглюкамин от 2 до 10 таблеток в сутки
(1 таблетка = 100 000 ЕД); 1% водный раствор генцианового фиолетового, или
432 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Токсическое действие на желудочно-кишечный тракт
метиленового синего, или бриллиантового зеленого; полоскание растворами
перманганата калия (1:5000) и гидрокарбоната натрия (2-3%).
Для профилактики мукозитов рекомендуется полноценная санация полости рта пе-
ред началом XT; рассасывание кусочков льда за 10-15 мин до и во время XT; обязателен
систематический осмотр слизистой оболочки ротовой полости для решения вопроса
об интенсивности лечения и своевременности выявления присоединения инфекции
(бактериальной или грибковой). Низкодозная лазерная терапия эффективно снижает
проявления стоматита и обладает выраженным обезболивающим свойством. Показа-
на эффективность фактора роста кератиноцитов (Палифермин) в дозе 40 мкг/кг/сут в
течение 3 дней, применяемого при высокодозной терапии гемобластозов.
В табл. 13.5 приводится лечебная тактика при стоматите/мукозите.
Таблица 13.5. Лечебная тактика при стоматите/мукозите
Степень выраженности Осмотр полости рта 2 раза в сутки. Пациент должен чистить зубы после еды мягкой, не раздражающей десны пастой. Полоскание полости рта каждые 24 ч противовоспали- тельными жидкостями, содой, солевыми растворами. Исключить алкоголь, табак
Полоскать рот каждые 2 ч (ночью каждые 6 ч) противовоспалительными растворами, . использование слабых анестетиков каждые 3-4 ч. Оценка необходимости приема перо- ральных противогрибковых препаратов. Исключить острую, раздражающую пищу. Ис- пользовать мягкую пищу с большим содержанием белка
II Использование обезболивающих средств. Контроль массы тела. При потере массы тела более 10% — парентеральное питание
III Оценка наличия инфекции. Посевы с подозрительных участков. Промывание полости рта теплыми растворами с антибактериальной или антифунгальной суспензией каждые 2 ч днем и 4 ч ночью
IV Смазывание губ каждые 2 ч. Орошение полости рта раствором соды. Парентеральное питание, гидратация. Местные и системные обезболивающие препараты
Лечение токсических энтероколитов
Диарея может наблюдаться при лечении фторурацилом ± фолинат кальция (Лейко-
ворин), капецитабином, иринотеканом и др.
Лечение токсических энтероколитов не отличается по принципам диеты и фарма-
котерапии от обыкновенных форм подострого и хронического воспаления оболоч-
ки ЖКТ.
При появлении признаков некротической энтеропатии во время лечения острых
лейкозов необходимо перевести больного на парентеральное питание, исключить
прием препаратов внутрь.
Эффективным лечебным препаратом является октреотид (Сандостатин) в дозе 0,1 мг
п/к 2 раза в сутки в течение 3-5 дней. При доказанном или предполагаемом дисбакте-
риозе применяется сухой колибактерин (8-12 таблеток, содержащих по 1 дозе), лакто-
бактерии (4-8 раз в сутки), бификол (5-10 раз в сутки), бифидум-бактерин (5 доз в день).
Диарея является лимитирующей токсичностью при лечении иринотеканом (Кампто):
она может наблюдаться во время или сразу после инфузии (ранняя диарея), что связа-
но с развитием холинергического синдрома, который хорошо купируется и в после-
дующем предупреждается введением атропина в дозе 0,25-1,0 мг п/к. Поздняя ди-
арея, связанная с метаболизмом препарата в кишечнике, обычно возникает на 2-7-е
сутки после введения и хорошо контролируется приемом лоперамида (Имодиум) по
схеме: 4 мг (2 капсулы) сразу после начала диареи, далее по 2 мг (1 капсула) каждые
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 433
Побочные реакции и осложнения...
2 ч; лечение необходимо продолжать до прекращения диареи и еще в течение 12 ч
после последнего эпизода жидкого стула, но не более 48 ч. Если диарея не купиру-
ется, могут использоваться октреотид, хилак форте, линекс, энтерол. Правильная так-
тика позволяет не только облегчить больному переносимость иринотекана, но и без
осложнений соблюдать режим XT.
Продолжающаяся более 48 ч диарея (особенно на фоне быстрой потери массы
тела) требует инфузионной терапии для компенсации электролитных нарушений, пре-
дотвращения гиповолемии и шока. Для нормализации водно-электролитного баланса
можно рекомендовать прием внутрь раствора регидрона до 1,5 л в сутки или обильное
питье смеси: 1 чайная ложка поваренной соли, 1 чайная ложка питьевой соды, 4 столо-
вых ложки сахарного песка, 1 стакан фруктового сока на 1 л воды. При наличии боле-
вого синдрома назначают анальгетики, спазмолитики. Дополнительными средствами
лечения могут быть калоформирующие сложные порошки на основе кальция карбо-
ната, настои, отвары вяжущих средств растительного происхождения.
При возникновении жидкого стула во время лечения капецитабином прием препа-
рата прекращается до нормализации стула. Нельзя забывать, что на фоне антидиарей-
ных препаратов капецитабин не используется.
При запоре, вызванном нейротоксическим действием цитостатиков (винкаалкалои-
ды, этопозид, цисплатин), назначают прозерин по 0,015 г внутрь 2 раза в сутки или 1 мл
0,05% раствора п/к в комбинации с глутаминовой кислотой по 0,5 г 4-6 раз в сутки.
Необходимо соблюдение диеты, содержащей достаточное количество клетчатки, ки-
сломолочных продуктов, растительное масло, а также очистительные клизмы. Ранити-
дин и омепразол рекомендуются для предотвращения боли в эпигастрии, возникаю-
щей при применении циклофосфамида, метотрексата, 5-ФУ ± лейковорин.
Лечение гепатотоксических реакций
Гепатотоксические реакции могут развиваться при использовании различных групп
противоопухолевых препаратов.
При проведении комбинированной XT гепатотоксичность отмечается в 15% случа-
ев и может быть обусловлена повреждением паренхиматозных клеток с жировой ди-
строфией, развитием гепатоцеллюлярного некроза или фиброза, протоковыми на-
рушениями с холестазом. Более часто они проявляются у пациентов с синдромом
Жильбера, перенесших гепатит, имеющих незначительное повышение активности
АлАТ, АсАТ, ЩФ, уровня билирубина. При лечении таких пациентов требуется коррек-
ция дозы химиопрепаратов (см. ниже).
Выделяют три основных группы гепатотоксических осложнений: гепатопатии, ток-
сические гепатиты, циррозы печени. Значительная роль в развитии патологических из-
менений в печени отводится вирусной инфекции, что может затруднять проведение XT
и способствовать развитию тяжелых осложнений.
Программа лечения больного с печеночной недостаточностью должна быть ком-
плексной. Большинству больных назначается патогенетическое и симптоматическое
лечение. Препараты, используемые при поражении печени: S-адеметионин (Гептрал),
урсодеоксихолевая кислота (Урсофальк, Урсосан), L-орнитин-Е-аспартат или ОФ (Ге-
па-Мерц), флумецинол (Зиксорин), метадоксин (Метадоксил).
У больных с проявлениями желтухи и гиперферментемией при токсическом или
вирусном гепатите, при планировании высокодозных курсов XT, у перенесших ранее
токсический гепатит назначается адеметионин (Гептрал) первоначально парентераль-
но (в/в или в/м) 400-800 мг в течение 10-14 дней, затем по 400-800 мг внутрь 2 раза
в сутки. Продолжительность курса 30 дней. При необходимости возможно продление
или повторение курса.
434 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Кардиотоксичность
Прием урсодезоксихолевой кислоты (Урсосана или Урсофалыса) оказывает хоро-
ший терапевтический эффект при гипербилирубинемии: 10—15 мг/кг в сутки до разре-
шения холестаза.
Больным, исходно инфицированным вирусом гепатитов В и С, больным, у которых в
анамнезе имеются сведения о значительных реакциях на предшествующее лечение,
назначают Зиксорин в дозе 10 мг/кг (не более 800 мг) 1 раз в неделю; 1-2 приема Зик-
сорина в дозе 10 мг/кг для уменьшения уже развившихся проявлений гепатопатии и по-
стоянный прием во время XT для профилактики усиления гепатотоксичности.
Больным, у которых в анамнезе есть алкогольное поражение печени, гепатотоксич-
ность уже развивалась ранее на фоне XT, при планировании высокодозной XT назнача-
ют метадоксин первоначально парентерально 300-600 мг в/в или в/м 10—14 дней, за-
тем по 500-1000 мг внутрь 2 раза в сутки, курс лечения 30 дней.
Гепа-Мерц используется при лечении печеночной энцефалопатии (табл. 13.6).
Таблица 13.6. Схема применения L-орнитина-к-аспартата (Гепа-Мерц)
Форма препарата
Гранулят
Концентрат для инфузий
Хронические гепатиты различного генеза (вт.ч.
вирусные, алкогольные, токсические), жировая
дистрофия
При выраженной симптоматике: по 2 пакетика гра-
нулята 3 раза в день
При средневыраженных симптомах: по 1 пакетику
гранулята 2-3 раза в день
Цирроз печени с выраженной симптоматикой пе-
ченочной энцефалопатии: по 1-2 пакетика грану-
лята 3 раза в день в зависимости от тяжести забо-
левания
Хронические гепатиты различного генеза (в т.ч. ви-
русные, алкогольные, токсические), жировая ди-
строфия
При выраженной неврологической симптоматике
(высокая дозировка): до 4 ампул в день
Цирроз печени со средневыраженной симптомати-
кой: 1-4 ампулы в день
Цирроз печени с выраженной симптоматикой пече-
ночной энцефалопатии, с расстройствами сознания
(прекома) или коматозное состояние: до 8 ампул в
день
Примечание. Гранулят растворяют в 200 мл жидкости и принимают после еды Концентрат для инфузионного
введения растворяют в 500 мл инфузионного раствора.
13.3. Кардиотоксичность
Кардиотоксичность возникает в основном при лечении антрациклинами — доксору-
бицин, эпирубицин (Фарморубицин), даунорубицин (Рубомицин) — и редко при ис-
пользовании других препаратов: циклофосфамид, фторурацил, этопозид, тенипозид,
паклитаксел (Таксол), трастузумаб (Герцептин), лапатиниб (Тайверб). Различные пре-
параты по-разному воздействуют на сердечно-сосудистую систему в связи с неоди-
наковым механизмом кардиотоксичности: препараты, вызывающие снижение сокра-
тительной или расслабляющей функции миокарда (антрациклины, антраценидионы),
препараты, вызывающие или обостряющие ишемию (5-ФУ, винкристин, винбластин,
блеомицин, цисплатин, ИЛ-2), препараты, влияющие на проводящую систему, в ре-
зультате чего возникает аритмия или блокада проводимости (антрациклины, антраце-
нидионы, ифосфамид, паклитаксел).
Ранние проявления кардиотоксичности: падение АД, синусовая тахикардия, арит-
мия, левожелудочковая дисфункция, боль в области сердца. Изменение на ЭКГ: сниже-
ние вольтажа комплекса QRS, зубца Л интервала S-Т ниже изолинии, синусовая тахи-
кардия, аритмия; снижение фракции выброса левого желудочка.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 435
Побочные реакции и осложнения ...
Более поздние проявления кардиотоксичности: синдромы миокардита и перикар-
дита с расстройством ритма, функциональными левожелудочковыми нарушениями,
иногда — инфарктами миокарда.
Поздние проявления кардиотоксичности (спустя недели и месяцы после начала
лечения): дегенеративные кардиомиопатии с левожелудочковой недостаточностью,
вплоть до развития дилатационной застойной кардиомиопатии. Признаки развивше-
гося миокардита: тахикардия, одышка, увеличение размера сердца, декомпенсация
кровообращения. Миокардит может развиться сразу или отсроченно, в период до
6 мес.
Основной способ профилактики при лечении антрациклинами — соблюдение
предельных суммарных доз препарата (доксорубицин — 550 мг/м2, эпирубицин
(Фарморубицин) — 1000 мг/м2), использование пегилированного липосомного док-
сорубицина (Келикс). Необходимо раннее выявление кардиотоксичности с помо-
щью ЭхоКГ и ЭКГ.
Факторы риска: возраст старше 60 лет, наличие сердечно-сосудистой патологии —
ишемическая болезнь сердца (в настоящее время или в анамнезе), облучение легких
или средостения, проведение ранее XT с использованием препаратов, обладающих
кардиотоксичностью.
Следует учитывать возможность повышения кардиотоксичности при комбиниро-
ванной XT, если не соблюдается последовательность. Например, в случае введения
паклитаксела перед доксорубицином изменяется фармакокинетика последнего и по-
вышается его кардиотоксичность. Поэтому паклитаксел должен вводиться не ранее
чем через 4 ч после доксорубицина. Кардиотоксичностью обладает сочетание тра-
стузумаба (Герцептин) с антрациклинами, следовательно, одномоментное примене-
ние этих препаратов не может быть рекомендовано.
При необходимости XT проводится на фоне симптоматической кардиальной те-
рапии.
Препаратом, используемым для предупреждения кардиотоксичности антрацикли-
нов, служит дексразоксан (Кардиоксан), применяемый в дозе, в 20 раз превышающей
дозу антрациклина, до 1000 мг/м2 за 30 мин до введения последнего. Повышение дозы
(2000 мг) используется при наличии факторов риска развития кардиотоксичности (по-
жилой возраст, высокие дозы антрациклинов, наличие сопутствующей сердечно-со-
судистой патологии). Для детей доза дексразоксана должна превышать дозу антраци-
клинов в 10—15 раз.
13.4. Легочная токсичность
В литературе описана легочная токсичность при использовании большого числа пре-
паратов с частотой до 20% больных. Частота подобного осложнения в случаях приме-
нения блеомицина составляет 5-20% при непосредственной летальности от интер-
стициального пневмонита с исходом в фиброз до 1 % случаев.
В основе патогенеза легочных осложнений лежат различные процессы: некроз аль-
веолярных эндотелиальных клеток, стимуляция пролиферации фибробластов и уве-
личение коллагена с развитием фиброза, нарушение проницаемости капилляров, ин-
фильтрация лимфоцитами. Это ведет к формированию различных форм легочной
токсичности (табл. 13.7).
436 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Поражение мочевыводящей системы
Таблица 13.7. Легочная токсичность противоопухолевых препаратов
Форма легочной токсичности Противоопухолевый аге
Облитерирующий бронхолит, пневмонит БлеомИ1^ Циклофосфан, метотрексат, митомицин, прокарба-
к J к зин, гемцитабин
Острая дыхательная недостаточность Цитарабин (Цитозар), ИЛ-2, метотрексат, блеомицин, доксору- бицин + облучение, прокарбазин, митомицин
Веноокклюзивные нарушения Кармустин, циклофосфамид, блеомицин, этопозид, митомицин
Отек легких Цитарабин (Цитозар), метотрексат, циклофосфамид, тенипо- зид, митомицин, блеомицин, ИЛ-2
Срок возникновения пневмонита различный — от нескольких недель при использо-
вании блеомицина до 3-4 лет при применении циклофосфамида и бусульфана.
В целях предупреждения этого осложнения для ряда препаратов нежелательно
превышать рекомендуемые суммарные дозы: кармустин — 1000 мг/м2, митомицин —
250 мг/м2, блеомицин — 330 мг/м2.
Блеомицин и кармустин вызывают дозозависимое поражение интерстиция, сход-
ное с острым респираторным дистресс-синдромом, особенно у больных с сопутст-
вующими легочными заболеваниями. Пневмонит при применении метотрексата не
зависит от дозы препарата; его клинические проявления: лихорадка, сухой кашель,
одышка. Очень редко легочная токсичность встречается при использовании гемци-
табина.
Факторами риска легочной токсичности являются пожилой возраст (частота ле-
гочных осложнений в 70 лет в 3 раза выше, чем в 40 лет), сопутствующая легочная
патология (пневмония, пневмосклероз), одновременная или последовательная луче-
вая и цитостатическая терапия. При появлении первых симптомов лекарственного
пневмонита препарат, вызвавший легочную токсичность, должен быть отменен; на-
значают кортикостероиды (преднизолон 30-60 мг), сульфаниламиды, бронхолити-
ки, витамины (А, С, Е), токоферол, цитомак (цитохром С), актовегин. Применяют аэро-
зольные ингаляции надосадочного раствора: метилурацил 2 г + бикарбонат натрия
2 г + вода 100 мл.
13.5. Поражение мочевыводящей системы
При проведении XT встречаются два вида поражения мочевыводящей системы: не-
фротоксичность и токсические циститы. Большинство цитостатиков выделяется почка-
ми, некоторые из них (тиотепа, метотрексат, блеомицин, пликамицин (Митрамицин),
дакарбазин, прокарбазин, цисплатин) метаболизируются в них. Основными в механиз-
ме повреждающего влияния противоопухолевых препаратов на почки, по-видимому,
служат непосредственная цитотоксичность и аутоиммунный характер осложнения.
Степень токсического поражения почек цитостатиками зависит от дозы препарата, со-
путствующей патологии почек и функции почек (клиренс креатинина, величина диуре-
за), изменений метаболизма цитостатиков в печени.
Нефротоксичность выражается развитием разного типа патологических процес-
сов в почках: цисплатин вызывает тубулярный некроз, митомицин — гломерулярный
васкулит, ифосфамид — проксимальный тубулярный дефект, гематурию, химический
(акролеиновый) цистит, циклофосфамид — острый геморрагический цистит, нитрозо-
мочевина — хронический интерстициальный нефрит, стрептозоцин — тубулоинтер-
стициальный нефрит, тубулярную атрофию, метотрексат способствует преципитации
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 437
Побочные реакции и осложнения...
препарата в канальцах почек. Основным маркером функционального состояния почек
служит клиренс креатинина — показатель скорости клубочковой фильтрации. Кли-
ренс креатинина определяется по формуле:
1Z Концентрация креатинина в моче х минутный диурез
Клиренс креатинина =----ас—
Концентрация креатинина в сыворотке
или по формуле Cockroft:
„ Кх (140 - возраст) х масса тела (кг)
Клиренс креатинина = —
Креатинин сыворотки (мкмоль/л)
Для женщин К = 1,05, для мужчин К= 1,23.
Нарушение функциональных способностей почек увеличивает все виды токсично-
сти агентов, экскретируемых почками или метаболизируемых в них. Большое значе-
ние имеет возраст, с увеличением которого при нормальном уровне сывороточно-
го креатинина физиологически снижается его клиренс. Изменение функции почек
влияет на фармакокинетику цитостатиков, изменяя их сывороточную концентрацию,
которая характеризуется показателем AUC — площадью под фармакокинетической
кривой «концентрация — время». Клиренс большинства цитостатиков коррелирует с
клиренсом креатинина. В частности, такая корреляция доказана для карбоплатина; это
используется при расчете доз этого препарата (см. приложение 4). Нарушение фун-
кции почек в процессе XT наиболее выражено при использовании производных пла-
тины. С целью предупреждения нефротоксичности у больных с повышенным риском
развития этого осложнения проводится постоянный динамический контроль за об-
щим анализом мочи и биохимическими показателями уровня креатинина в сыворотке
крови и в моче, клиренсом креатинина.
При повышении уровня сывороточного креатинина, протеинурии, цилиндру-
рии, гематурии введение цисплатина, метотрексата, митомицина, хлоксиперазина
(Проспидин), кармустина противопоказано. Дозы других препаратов должны быть
снижены на 50% (см. приложение 5). С целью предотвратить токсическое пораже-
ние почек при использовании цисплатина применяют гипергидратацию до введе-
ния препарата (в/в вводят до 3 л жидкости); высокие разовые дозы этого препарата
(> 150 мг/м2) вводят в 3% растворе натрия хлорида. Высокие дозы метотрексата (1-
12 г/м2) применяют с предварительным введением натрия бикарбоната до дости-
жения pH мочи 7,4 и выше и обязательным дальнейшим мониторингом уровня pH
мочи путем введения натрия бикарбоната и последовательным введением фолина-
та кальция (Лейковорин 10 мг/м2) каждые 6 ч через 24 ч после введения метотрек-
сата (всего 10 доз).
Для лечения почечной токсичности создают состояние форсированного диуреза
введением 2,5-3 л жидкости, а затем — маннитола (25-50 г), лазикса (40-80 мг в/в
или в/м), 1-2% натрия гидрокарбоната (50-100 мл), панангина, 5% раствора витамина С
(20-40 мл), сердечных средств, аллопуринола (от 300 до 900 мг в день).
СЛО — это сложный многокомпонентный ответ на лекарственную терапию — мо-
чекислая канальцевая нефропатия с развитием острой почечной недостаточности,
а также электролитные и метаболические расстройства. При высокой чувствитель-
ности опухоли к XT быстро наступающее и значительное сокращение опухолевых
масс (СЛО) обусловливает выделение большого количества деградантов белка и мо-
жет сопровождаться гиперурикемией — увеличением в сыворотке крови больного
уровня мочевой кислоты (конечного продукта распада пуриновых оснований). Ги-
438 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ»..
Аллергические реакции
перурикемия без медикаментозной профилактики аллопуринолом приводит к вы-
падению в осадок кристаллов мочевой кислоты в канальцах почек и может обусло-
вить развитие обструктивной мочекислой нефропатии (с летальным исходом в 1 %
случаев).
Для предупреждения этого осложнения при опухолях, чувствительных к XT, и
при больших опухолевых массах целесообразно до назначения противоопухоле-
вых агентов начать лечение аллопуринолом (Милурит, Зилорик) по 100 мг 4-6 раз
в сутки. Лечение следует продолжить в течение всего периода сокращения разме-
ра опухоли.
При развитии на фоне высокоэффективной противоопухолевой лекарственной те-
рапии признаков начинающейся мочекислой нефропатии (уменьшение диуреза, по-
явление большого количества кристаллов мочевой кислоты в осадке мочи, гиперу-
рикемия, азотемия) доза аллопуринола должна быть увеличена до 600-800 мг/сут,
показаны форсированный диурез и поддержание щелочной реакции мочи путем вве-
дения натрия гидрокарбоната.
Аллопуринол практически не имеет противопоказаний, обладая хорошей перено-
симостью. Однако при использовании его на фоне лечения меркаптопурином доза по-
следнего должна быть снижена не менее чем на 25 %.
Препарат Алломарон содержит в 1 таблетке 100 мг аллопуринола в сочетании с
20 мг бензобромарона, усиливающего выведение мочевой кислоты, и назначается в
тех же дозах, что и аллопуринол. При развитии тяжелой почечной недостаточности
может использоваться гемодиализ.
Токсические циститы. При лечении ифосфамидом и высокими дозами цикло-
фосфамида могут развиваться геморрагические циститы, индуцируемые акролеином,
одним из метаболитов этих препаратов.
Для предупреждения химических циститов ифосфамид и высокие дозы циклофос-
фамида используются только с одновременным применением уропротектора месны
(Уромитексан) в дозе, соответствующей 60-120% дозы ифосфамида, с обязатель-
ным предварительным и последующим ощелачиванием мочи. Первую дозу (20% дозы
ифосфамида) — сразу после введения ифосфамида, вторую — через 4 ч и третью —
через 8 ч после цитостатика.
При лечении токсических циститов рекомендуют соблюдение диеты, расширенный
водный режим, инстилляции противовоспалительных вяжущих средств, обезболива-
ющих растворов, введение спазмолитиков.
13.6. Аллергические реакции
Практически все группы химиопрепаратов могут вызывать реакции гиперчувст-
вительности в 5-10% случаев. При использовании паклитаксела и доцетаксела без
премедикации, аспарагиназы аллергические реакции встречаются часто и нередко
обладают дозолимитирующей токсичностью. При применении аспарагиназы аллер-
гические реакции отмечены в 10-25% случаев. Для предотвращения аллергических
реакций паклитаксел и доцетаксел вводят с обязательной предварительной преме-
дикацией кортикостероидами, а паклитаксел — еще и димедролом и циметидином.
Лечение аллергических реакций осуществляется стандартными лекарственными
средствами.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 439
Побочные реакции и осложнения...
13.7. Нейротоксичность
Нейротоксичность может проявляться на всех уровнях нервной системы. Перифери-
ческая нейротоксичность представлена периферическими вегетативными нарушени-
ями (запор, холинергический синдром, синдром Рейно), дистальной (мононейропатия,
ретикулопатия и полинейропатия — сенсорная, рефлекторная, сенсомоторная) и кра-
ниальной периферической нейротоксичностью (нейропатия тройничного или слухо-
вого нерва).
Центральная нейротоксичность может проявляться двигательными нарушени-
ями (пирамидными, мозжечковыми, экстрапирамидными), нарушениями уровня
сознания (сонливость, обмороки), вегетативными и психовегетативными наруше-
ниями (вегетативные кризы, тревога, депрессия, астения), головной болью и на-
рушением памяти и ментальности. Наиболее часто наблюдается полинейропатия
(> 30%) и ее сочетание с ототоксичностью (11 %). Все остальные виды нейроток-
сичности встречаются реже — 1-5 % наблюдений. В большинстве случаев она сла-
бо выражена, весьма разнообразна и наблюдается при лечении многими препа-
ратами. Прежде всего, нейротоксическое действие присуще винкаалкалоидам и
производным платины, но может быть вызвано хлоксиперазином (Проспидин), по-
дофиллотоксинами (этопозид), прокарбазином (Натулан), таксанами (паклитаксел,
доцетаксел), фторурацилом, капецитабином и другими препаратами. Особенно-
стью проявлений нейротоксичности служит отсроченность ее развития после
окончания лечения.
К факторам риска периферической нейротоксичности относятся использование
2 и более нейротоксичных препаратов одновременно (особенно таксанов, циспла-
тина, винкаалкалоидов), сахарный диабет, злоупотребление алкоголем, нейропатии
различного генеза и прием нейротоксичных препаратов в анамнезе. Полинейропатия
I степени, выявленная до начала специфического медикаментозного лечения, не явля-
ется противопоказанием для XT.
При кумулятивной дозе оксалиплатина 520 мг/м2 и более полинейропатия I-II степе-
ни выявляется у 90-100% больных (у большинства — полное исчезновение симптомов
между курсами). При кумулятивной дозе 780-1170 мг/м2 (после 6-9 курсов) III—IV сте-
пень токсичности регистрируется у 9-50% больных. После прекращения XT регресс
симптомов отмечается в течение 4-6 мес. (> 80%), полное восстановление — в тече-
ние 6-8 мес. (> 40%).
Кумулятивная доза паклитаксела для развития нейротоксичности составляет
350 мг/м2 и более. Поражение ног (жгучая боль в подошвах и стопах), сопутствую-
щая артралгия и миалгия развиваются при разовой дозе паклитаксела 220 мг/м2 и бо-
лее. Восстановление сухожильных рефлексов происходит в порядке, обратном выпа-
дению (через 6-12 мес. после окончания лечения).
При использовании доцетаксела основным видом нейротоксичности является сен-
сорная полинейропатия I-II степени (до 50-70%), реже — моторная (1-12%); тяже-
лая токсичность редка — 1-7 % случаев. Кумулятивная доза доцетаксела для развития
осложнения составляет 300-400 мг/м2. Синдром задержки жидкости усугубляет по-
линейропатию.
Периферическая нейротоксичность, как правило, носит характер полинейропатии,
начинается с легких временных парестезий в пальцах, переходя затем в стойкие нару-
шения чувствительности (невриты, нейромускульные расстройства, парезы кишечни-
ка, дистальные полиневриты). Электрофизиологические исследования указывают на
дистальную аксональную дегенерацию, демиелинизацию. В некоторых случаях пери-
440 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Токсическое действие на кожу и ее придатки
ферическая нейротоксичность может проявляться изолированным поражением слу-
хового (ототоксичность) или зрительного нерва.
Общепринятых схем лечения нейротоксичности нет. Терапия эмпирическая. При
развитии периферической нейротоксичности начинать лечение следуетуже при I сте-
пени, т.е. при первых признаках ухудшения качества жизни. Осложнения II—111 степени
выраженности требуют редукции дозы цитостатика или временного прекращения его
введения. При лечении периферических нейропатий используются: глутаминовая ки-
слота (до 4 г/сут внутрь), прозерин (по 0,15 г 2 раза в сутки внутрь или 1 мл 0,05% рас-
твора п/к), витамины Вр В6 и В12, галантамин (Нивалин) 1 мл 1% раствора п/к. Целесоо-
бразно применение нейропептидов, коротких фрагментов АКТГ (семакс), блокаторов
кальциевых каналов (нимотоп, нимодипин), уменьшающих нейротоксичность платины.
Симптомы центральной нейротоксичности купируют приемом седативных средств,
транквилизаторов, ноотропными и сосудистыми препаратами.
Влияние химиопрепаратов на вегетативную нервную систему изучено недостаточ-
но. К осложнениям, связанным с поражением вегетативной нервной системы, может
быть отнесен так называемый ладонно-подошвенный синдром (ЛПС), возникающий
при лечении капецитабином, 5-ФУ, пегилированным липосомным доксорубицином
(см. кожная токсичность).
Острый холинергический синдром при использовании иринотекана встречает-
ся в 20-30%. Это обусловлено тем, что иринотекан ингибирует антихолинэстеразу
и активирует парасимпатическую иннервацию. Под острым холинергическим син-
дромом подразумевается развитие клинических симптомов во время введения пре-
парата и/или в течение 24 ч после инфузии. Появляются повышенная потливость, сле-
зотечение, слюнотечение, расстройства зрения, диарея, кишечные колики. Редко
протекает тяжело и требует прерывания лечения.
Нейротоксичность может наблюдаться при интратекальном введении химиопрепа-
ратов (метотрексата, цитарабина, преднизолона) или после применения высоких доз
некоторых препаратов, проникающих через ГЭБ. У больных могут возникать головная
боль, головокружение, тошнота, рвота, обратимые нейропатии в виде диплопии, сим-
птомы раздражения нервных корешков, парезов и нарушения ориентировки и созна-
ния. Весьма редкие осложнения при интратекальном введении — арахноидиты, пара-
плегии, энцефалопатии. При введении препаратов интратекально необходимо строго
соблюдать правила предварительной эвакуации спинномозговой жидкости, концен-
трацию химиопрепарата в растворе, объем вводимого раствора, равный эвакуирован-
ному объему ликвора. Преходящий характер реакций на интратекальное введение
препаратов, как правило, не требует дополнительных коррегирующих мероприятий.
Лечение более выраженных нейропатий осуществляется под наблюдением специа-
листа-невропатолога. В случае признаков повышения внутричерепного давления воз-
можно введение парентерально диуретиков (лазикс), маннитола, 40% раствора глюко-
зы, 25% раствора магния сульфата.
13.8. Токсическое действие на кожу и ее придатки
Поражения кожи токсического генеза относительно стандартны по проявлениям и
свойственны отдельным цитостатикам и группам препаратов. Часть кожных реакций
носит отчетливо аллергический характер. Ранние побочные эффекты выражаются по-
явлением эритемы, уртикарной сыпи и могут сопровождаться кожным зудом, повы-
шением температуры тела и снижением чувствительности с последующим развитием
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ,.. 441
Побочные реакции и осложнения...
«мвяяиаяа»явяяяй8я»й«»йиайа»}^^ г < * и
гиперестезии и парестезии. Позднее они способны трансформироваться в довольно
стойкие дерматопатии типа гиперкератоза, продуктивной (нередко бляшковидной)
сыпи, десквамации с возможным развитием вторичной инфекции, гиперпигментации
(кожи, ногтей, слизистых оболочек).
Гиперпигментация кожи в виде четко очерченных пятен или полос характерна для
блеомицина, пепломицина, бусульфана. Фотосенсибилизирующий эффект наблю-
дается при лечении фторурацилом и дакарбазином. Множественные склеротиче-
ские изменения кожи (нодулярные образования в ее толще), гиперкератоз, иногда
некрозы — довольно характерные осложнения XT блеомицином. Кожные лучевые
реакции (эритема, десквамация, гиперпигментация) могут отмечаться в процессе ле-
чения дактиномицином или после его окончания. Для прокарбазина (Натулан) харак-
терны клинические изменения в виде эритематозных (кореподобных) экзантем, для
метотрексата — макулопапулезных высыпаний. Токсикодермии при лечении проти-
воопухолевыми антибиотиками обычно протекают более тяжело и с выраженным
ульцеративно-экссудативным компонентом. При использовании таксанов отмечаются
гиперкератозы, десквамация кожи, сыпь, кожный зуд, изменение ногтей. Кожная ток-
сичность более выражена при лечении доцетакселом. При лечении капецитабином,
5-ФУ в виде длительных инфузий, пегилированным липосомным доксорубицином, со-
рафенибом часто отмечается избирательная десквамация, отек, гиперемия кожи стоп
и кистей (ладонно-подошвенная эритродизестезия).
ЛПС 1 степени не нарушает повседневной активности больного и проявляется
онемением, дизестезиями и парестезиями, покалыванием или покраснением ла-
доней и/или подошв, физическим дискомфортом. ЛПС II степени характеризуется бо-
лезненным покраснением кожи и отеками кистей и/или стоп, причем вызываемый эти-
ми симптомами дискомфорт нарушает повседневную активность пациента. При ЛПС
III степени наблюдается влажная десквамация, изъязвление, образование пузырей и
резкая боль в кистях и/или стопах, а также сильный дискомфорт, делающий невозмож-
ными для пациента любые виды повседневной активности. При ЛПС II или 111 степени
применение препарата нужно прервать до исчезновения симптомов или их уменьше-
ния до I степени. IV степень токсичности характеризуется наличием инфицированных
осложнений, требующих госпитализации.
В настоящее время рекомендуются следующие мероприятия для уменьшения про-
явлений ЛПС:
снижение дозы препарата при возобновлении лечения;
применение кожных кремов, содержащих вазелин, ланолин или молочную ки-
слоту. После нанесения крема следует надеть хлопковую перчатку и/или носок
(особенно на ночь), чтобы максимальное количество крема могло всосаться и
кожа оставалась покрытой им.
Иногда могут рекомендоваться местные или пероральные кортикостероиды, вита-
мин В6 (пиридоксин). Применение пиридоксина в широко варьирующей дозе от 50 до
150 мг 3 раза в сутки в течение 6 нед. может способствовать уменьшению ЛПС при
лечении капецитабином (Кселода). Витамин В6 не рекомендуется применять при ком-
бинации капецитабина с цисплатином, т.к. он может снижать эффективность послед-
него. Также могут использоваться холодные ванны или прикладывание к наиболее
проблемным местам пакетов с замораживающим гелем. Охлаждение ладоней и стоп
уменьшает кровоток и может сделать все симптомы ЛПС менее выраженными. Иногда
помогает приподнятое (высокое) положение стоп и ладоней. При развитии ЛПС паци-
ентам рекомендуется носить комфортную и свободную одежду и обувь, дома — до-
машние тапочки.
442
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Токсические флебиты
Длительное использование горячей воды для рук и ног недопустимо. Для мытья ре-
комендуется холодная или слегка подогретая вода. После мытья кожу следует осто-
рожно промокать досуха, но не растирать. Все открытые участки кожи должны быть
защищены от солнечных лучей при нахождении вне дома. Нельзя допускать сухости
кожи на руках. Рекомендуется использовать мягкие увлажняющие средства. Должны
быть также исключены все виды физической деятельности, которые могут оказывать
давление на кожу или трение, включая домашнюю работу, спорт, длительные пеше-
ходные прогулки.
Многие из токсических реакций кожи (гиперпигментация, склеротические измене-
ния, гиперкератоз, язвы) и трофические изменения ногтей проходят самостоятельно и
довольно быстро после прекращения XT. Такие изменения кожи, как гиперпигмента-
ция, гиперкератоз, как правило, отмены лечения не требуют. Поражение кожи — ти-
пичное осложнение при использовании ингибиторов EGFR (гефитиниб, эрлотиниб, це-
туксимаб).
Алопеция — проявление токсического повреждения придатков кожи при исполь-
зовании некоторых противоопухолевых препаратов. Это осложнение возникает в
результате подавления пролиферации эпителия волосяных фолликулов. Алопеция
обратима, однако является тяжелой психической травмой. Она закономерно сопро-
вождает XT доксорубицином, эпирубицином, этопозидом, таксанами, иринотеканом и
отмечается у 10-30% больных, получающих лечение циклофосфамидом, дактиноми-
цином, митомицином, винбластином, винкристином, VM-26, гемцитабином, цисплати-
ном. Полное восстановление волосяного покрова головы происходит через 3-6 мес.
после окончания медикаментозного лечения.
13.9. Токсические гипертермические реакции
Токсические гипертермические реакции наиболее характерны при использовании
блеомицина. Они сопровождают каждое введение препаратау 60-80% больных. По-
вышение температуры тела отмечается также при использовании аспарагиназы, цита-
рабина, реже — доксорубицина, митомицина, фторурацила, этопозида, гемцитабина,
интерферона.
Температура тела быстро нормализуется и, как правило, не служит причиной отме-
ны лечения.
При повышении температуры тела выше 37,5 °C назначают жаропонижающие и ан-
тигистаминные препараты. При лечении ралтитрекседом (Томудекс) через 24-48 ч
после введения препарата иногда отмечается подъем температуры тела до 38-39 °C,
который может сохраняться в течение нескольких дней и купируется традиционными
жаропонижающими средствами. При III—IV степени реакции принимается решение о
замене препарата.
13.10. Токсические флебиты
Реакции со стороны вен (флебиты, тромбофлебиты, флебосклероз) развиваются чаще
после нескольких в/в введений цитостатиков. Воспалительно-склеротические реак-
ции со стороны поверхностных вен проявляются разнообразно — от выраженной
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 443
Побочные реакции и осложнения ...
боли по ходу сосудов уже во время инъекции до подострых флебитов, тромбофле-
битов, флеботромбозов с исходом в облитерацию вен. Это повреждающее действие
усугубляется многократными инъекциями препаратов в одну и ту же вену. В некото-
рых случаях флебиты могут возникнуть в венах проксимальнее введения препаратов.
Наиболее часто токсические флебиты развиваются при лечении мети л хлорэти ламина
гидрохлоридом (Эмбихин, Мустарген), цитарабином (Цитозар), винбластином, дакти-
номицином, доксорубицином, дауномицином, эпирубицином (Фарморубицин), кар-
миномицином, дакарбазином, митомицином, таксанами, винорелбином.
С целью профилактики осложнений со стороны вен используют инъекции раство-
ров цитостатиков в минимально допустимых концентрациях. Капельные инфузии с
большим количеством жидкости служат лучшим способом предупреждения повре-
ждений стенки вен (только в случаях, когда это рекомендовано как способ введения
цитостатика). Если препарат вводят струйно, то необходимо разведение повреждаю-
щего стенку вены препарата в 20-30 мл рекомендуемого растворителя, промывание
вены после инъекции препарата изотоническим раствором натрия хлорида. Инъек-
ции препаратов должны проводиться попеременно в вены обеих конечностей.
При проведении суточных инфузий фторурацила рекомендуется добавление
10 000 ЕД гепарина для профилактики флебитов. Целесообразно более широкое ис-
пользование центральных венозных катетеров.
Лечение флебитов и тромбофлебитов, вызванных введением цитостатиков, не отли-
чается от лечения этих заболеваний, возникших вследствие других причин.
13.11 Местное токсическое действие
при экстравазации цитостатиков
При использовании производных нитрозомочевины, антрациклинов, актиномицина,
винкаалкалоидов, блеомицина, митомицина, дакарбазина, таксанов, этопозида, ци-
сплатина нередко возникают некрозы при попадании препарата под кожу, которые
могут потребовать даже хирургического лечения. При неправильной тактике лечения
сразу после попадания препарата п/к или в последующем возможно развитие контра-
ктур.
При попадании препарата мимо сосудов или возникновении боли в месте инъекции
необходимо прекратить введение лекарства, попытаться аспирировать препарат, по-
павший в подкожную клетчатку, применять холод (лед) на 30 мин 4 раза в сутки, об-
колоть места поражения дексаметазоном, гепарином, гидрокортизоном (кроме слу-
чаев экстравазации винорелбина, этопозида, винкристина и винбластина). Возможна
аппликация гидрокортизоновой мази. При экстравазации, вызванной винкаалкалои-
дами, рекомендуется обкалывание гиалуронидазой (150-200 ЕД в 2-6 мл физиологи-
ческого раствора). В таких случаях показано не охлаждение, а тепло на 15-20 мин не-
сколько раз в сутки в течение первых 24-48 ч.
При попадании под кожу цисплатина и метилхлорэтиламина применяют натрия тио-
сульфат (4 мл 10% раствора натрия тиосульфата дополнительно разводят 6 мл стериль-
ной воды для инъекций и вводят из расчета 2 мл раствора на каждые 100 мг цисплати-
на или на 1 мл раствора метилхлорэтиламина; вводят через ту же иглу или катетеры,
которые использовались для введения цитостатиков). При развитии глубокого и об-
ширного некроза возможно хирургическое вмешательство.
444 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Поздние осложнения
13.12. Поздние осложнения
Поздние осложнения встречаются нечасто, развиваются в течение года или более
длительного периода после проведенного лечения. Наиболее опасными считаются
тератогенный, канцерогенный и мутагенный эффекты как отдельных препаратов, так
и их комбинаций. При длительном лечении кортикостероидами и ингибиторами аро-
матазы может развиться остеопороз; при лечении циклофосфамидом, ифосфамидом
происходит изменение слизистой оболочки мочевого пузыря и возможно развитие
опухолей. У детей при лечении циклофосфамидом, метотрексатом, дактиномицином
(Актиномицин D), доксорубицином и кортикостероидами возможны нарушения роста
и физического развития. При использовании метилхлорэтиламина (Эмбихин, Мустар-
ген), бусульфана, хлорамбуцина, циклофосфамида, ломустина, кармустина, прокар-
базина бывают случаи бесплодия. Инфертильность возможна при лечении цисплати-
ном, цитарабином, доксорубицином, этопозидом, винбластином. При планировании
лечения этими препаратами может осуществляться криоконсервация спермы и оо-
цитов у пациентов детородного возраста при желании иметь детей после излечения.
Больные, длительно получавшие XT и/или лучевую терапию, имеют более высокий
риск развития вторичных опухолей.
В поздние сроки могут развиваться стойкая цитопения, МДС, иммуносупрессия, на-
рушение гонадотропной функции, кардиомиопатии, пневмопатии, ухудшение памяти,
снижение ментальной функции.
Токсическое действие таргетных препаратов
Появление в онкологической практике новых противоопухолевых препаратов мо-
лекулярно-нацеленного действия (таргетных) привнесло дополнения в частоту и
структуру побочных реакций. Не обладая в большинстве случаев типичной для XT ток-
сичностью, таргетные агенты характеризуются развитием новых вариантов побочно-
го действия.
Возникновение инфузионных реакций (как правило, при первом введении) в виде
повышения температуры тела, озноба, головной боли, крапивницы, артериальной
гипотензии отмечается при использовании ритуксимаба, трастузумаба, цетуксима-
ба, бевацизумаба. Для профилактики гиперчувствительности к чужеродным белкам
применяют антигистаминную и кортикостероидную премедикацию. Если инфузион-
ная реакция легкой или умеренной степени выраженности, следует временно прио-
становить инфузию, использовать дексаметазон (8-12 мг), жаропонижающие и другие
симптоматические средства и возобновить инфузионное введение после купирова-
ния симптомов, уменьшив скорость введения. Пациент должен быть предупрежден о
возможности отсроченных реакций (до 12 ч после инфузии) и проинструктирован о
необходимости обращения к врачу при их возникновении.
Дерматологические реакции, нарушения структуры ногтей достаточно часто сопро-
вождают терапию таргетными препаратами; они, в частности, характерны для ингиби-
торов EGFR. Угреподобная макулопапулезная сыпь, сухость кожи, шелушение развива-
ются при использовании гефитиниба, эрлотиниба, цетуксимаба; сорафениб может быть
причиной ЛПС. Большинство кожных реакций развивается в первые 3 нед. лечения, не-
сколько раньше (7-10-й день) при использовании эрлотиниба. После стихания воспа-
лительного компонента может развиться гипо- или гиперпигментация кожи на месте
бывших высыпаний. Установлено, что дерматологическая токсичность может быть кос-
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 445
Побочные реакции и осложнения...
венным показателем эффективности при лечении эрлотинибом и, в меньшей степени,
цетуксимабом. Для профилактики и ликвидации дерматологических реакций требует-
ся щадящий для кожного покрова режим, интенсивное увлажнение кожного покрова,
местное применение противовоспалительных средств (пимекролимус, такролимус).
использование одновременно с местным лечением антигистаминных препаратов, ги-
дрокортизона; при II степени выраженности и выше назначают тетрациклины.
Токсичность со стороны ЖКТ (тошнота, рвота, анорексия) в незначительной степени
выраженности характерна для многих таргетных препаратов, но не является лимити-
рующей и требует стандартных лечебных мероприятий. Диарея наблюдается при ис-
пользовании эрлотиниба, гефитиниба, сунитиниба, лапатиниба; обычно имеет транзи-
торный характер и в большинстве случаев хорошо поддается терапии лоперамидом.
Кардиотоксичность развивается нечасто при монотерапии трастузумабом и суни-
тинибом (до 10% случаев). Однако риск кардиотоксичности возрастает при сочетании
трастузумаба с антрациклинами и, в меньшей степени, с паклитакселом, циклофос-
фамидом. Умеренная артериальная гипертензия возникает на фоне лечения бевациз-
умабом, сорафенибом и сунитинибом. Тщательный кардиологический мониторинг
(динамика фракции выброса левого желудочка), адекватная оценка состояния сер-
дечно-сосудистой системы и стандартная лекарственная терапия клинических прояв-
лений кардиоваскулярной токсичности позволяют эффективно предупреждать и ку-
пировать эти токсические проявления.
Миелосупрессия отмечается в основном при сочетании таргетных агентов с цито-
токсическими препаратами.
Изменения свертывающей системы в виде гипокоагуляции и развития кратковре-
менных, преимущественно носовых, кровотечений отмечаются на фоне лечения ге-
фитинибом, сорафенибом. Большого внимания заслуживает гиперкоагуляция с фор-
мированием тромбоэмболических осложнений при использовании бевацизумаба.
Наибольший риск отмечается у больных старше 65 лет и при наличии в анамнезе арте-
риальных тромбоэмболических осложнений. При развитии тромбоэмболии лечение
бевацизумабом прекращают, вопрос о возобновлении терапии решается индивиду-
ально с учетом динамики клинической картины и показателей коагулограммы.
Бевацизумаб характеризуется и другими нестандартными побочными явлениями
различной значимости: развитие протеинурии требует исследования функции по-
чек, тщательного наблюдения. При развитии протеинурии IV степени (нефротический
синдром) лечение бевацизумабом следует отменить. Склонность к нарушению про-
цесса заживления ран обусловливает соблюдение временных параметров при соче-
тании хирургического вмешательства с использованием бевацизумаба: лечение бева-
цизумабом следует начинать не ранее чем через 28 дней после операции. В случае
планирования хирургического воздействия после терапии бевацизумабом необходи-
мо временно отменить препарат; время между последним введением бевацизумаба и
операцией должно составлять не менее 6 нед. При выполнении малого оперативного
вмешательства лечение бевацизумабом может быть начато не ранее чем через 7 дней.
Редким (< 1 -4 %) ранним осложнением (проявляется в среднем через 2 мес. от нача-
ла терапии) является перфорация стенки кишечника.
Описаны различные редкие токсические проявления при использовании таргетных
препаратов (гипотиреоз, недостаточность функции надпочечников, конъюнктивит,
бессимптомное повышение активности аминотрансфераз и др.).
446
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Глава 14
Лечение и профилактика фебрильной
нейтропении у онкологических
больных
И. Н. Петухова, Н. В. Дмитриева
Повышенный риск развития инфекции на фоне снижения числа нейтрофилов обусло-
вил выделение симптомокомплекса — фебрильной нейтропении (ФН), требующей
применения системы лечебных и диагностических мероприятий, а также присталь-
ного внимания к больному ввиду повышенной частоты развития угрожающих жизни
осложнений. Для того чтобы уменьшить смертность, связанную с запоздалым лече-
нием серьезных инфекций, развившихся на фоне нейтропении, большинству больных
требуется госпитализация для проведения немедленной клинической оценки и назна-
чения эмпирической терапии антибиотиками широкого спектра действия.
Под ФН принято понимать повышение температуры тела (измеренной орально)
выше 38,5 °C однократно или выше 38 °C более 2 раз в течение 12-часового периода
времени при числе нейтрофилов менее 500/мкл (нейтропения IV степени) или менее
1000/мкл (нейтропения III степени) по шкале СТСАЕ (версия З.О., 2003) с ожидаемым
в ближайшее время дальнейшим их снижением. При измерении в подмышечной впа-
дине пороговое значение температуры на 0,4 °C ниже, чем при оральном измерении.
Риск развития глубокой и ФН варьирует в зависимости от конкретно используемых
препаратов и интенсивности XT (т.е. количества препарата, полученного больным за
определенный интервал времени).
В настоящее время химиотерапевтические режимы, при которых частота ожидае-
мой ФН составляет более 20%, считают режимами с высоким миелотоксическим по-
тенциалом, а 10-20% — с умеренным.
Классически инфекцию у больных ФН относят к одной из трех стандартных категорий:
1. Микробиологически доказанная инфекция (МДИ) (с наличием или без сепсиса/
бактериемии) — 25-30% эпизодов лихорадки на фоне нейтропении.
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 447
Лечение и профилактика фебрильной нейтропении...
2. Клинически доказанная инфекция — 20-30% эпизодов ФН.
3. Лихорадка неясного генеза (ЛНГ). К ЛНГ относятся фебрильные эпизоды, кото-
рые не сопровождаются клинически или микробиологически подтвержденной
инфекцией. По разным данным, ЛНГ составляет от 40 до 70% фебрильных эпи-
зодов на фоне нейтропении. Наличие ответа на антибиотикотерапию в отдель-
ных случаях ретроспективно позволяет расценить ЛНГ как лихорадку инфекци-
онной природы.
Большинство инфекций у больных ФН вызвано представителями эндогенной ми-
крофлоры, колонизирующей первичный очаг инфекции. Причиной примерно 50%
инфекций служат нозокомиальные (госпитальные) микроорганизмы, приобретенные
после поступления больного в стационар.
В последнее десятилетие отмечены изменения в структуре микроорганизмов, выде-
ляемых у онкологических больных. До недавнего времени 60-70% МДИ вызывались
грамположительными бактериями, включая метициллин-резистентные Staphyloco-
cus aureus и метициллин-резистентные коагулазанегативные стафилококки, чувстви-
тельные к ванкомицину и линезолиду, а также ванкомицин-резистентные энтерокок-
ки, чувствительные к линезолиду.
Сейчас наметилась тенденция к постепенному росту числа грамотрицательных ми-
кроорганизмов, причем инфекции нередко вызваны полирезистентными штаммами
микробов, что затрудняет их лечение. Важное значение среди них имеют синегной-
ные палочки (Pseudomonas aeruginosa), кишечные палочки и другие энтеробактерии,
продуцирующие /3-лактамазы расширенного спектра действия (Klebsiella spp., Entero-
bacterspp., Serratia spp.) и полирезистентные Acinetobacter spp.
Параллельно с этим отмечается увеличение количества грибковых инфекций, чему
способствуют наличие постоянных внутрисосудистых катетеров, мукозиты, использо-
вание антибиотиков широкого спектра действия, изменяющих эндогенную микроф-
лору и вызывающих пролиферацию грибов, а также профилактическое использо-
вание антимикотиков, которые могут повышать число возбудителей, резистентных к
стандартной противогрибковой терапии.
Бактериальные и грибковые инфекции могут успешно сосуществовать, при этом
бактериальная инфекция может маскировать грибковую инфекцию. Последняя может
проявляться в виде лихорадки после эрадикации бактериальной инфекции.
Инфекции, вызванные вирусом простого герпеса и вирусом varicella-zoster, как пер-
вично приобретенные, так и в результате реактивации вируса, часто встречаются у
больных лейкозами и лимфомами, особенно после цитостатической терапии и лече-
ния кортикостероидами. ЦМВ-инфекция чаще встречается у больных с выраженны-
ми нарушениями практически всех звеньев иммунитета (больные, перенесшие тран-
сплантацию костного мозга или солидных органов).
К основным факторам риска развития инфекции относятся глубина и длительность
нейтропении. Последняя вместе с другими факторами позволяет отнести больного
к группе высокого или низкого риска развития инфекции в соответствии со шкалой
MASCC (Многонациональная ассоциация сопроводительной помощи в онкологии),
которая с точностью прогноза 91 %, специфичностью 68% и чувствительностью 71 %
позволяет выявлять больных с низким риском развития инфекции (табл. 14.1).
Сумма баллов 21 и более свидетельствует о том, что у больного имеется низкий риск
развития инфекционных осложнений.
Несмотря на широкие клинические испытания, проводимые с начала 1970-х годов,
единого режима эмпирической антибиотикотерапии для первоначального лечения
ФН не существует. При выборе первоначального режима антибиотикотерапии учиты-
вают вид, частоту выделения и антибиотикочувствительность микроорганизмов, выде-
448 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Выбор режима первой линии антибиотикотерапии
ленных в этом же учреждении от других пациентов (т.е. данные микробиологического
мониторинга). Кроме того, применение некоторых антибиотиков может ограничи-
ваться наличием лекарственной аллергии, сопутствующей печеночной или почечной
недостаточности либо возможностью дальнейшего их развития в результате аддитив-
ной или кумулятивной токсичности антибиотиков и/или химиопрепаратов.
Таблица 14.1. Шкала MASCC для оценки степени риска развития тяжелых
инфекционных осложнений при фебрильной нейтропении
Распространенность заболевания* Отсутствие симптомов Слабовыраженные симптомы Умеренно выраженные симптомы 5 5 3
Отсутствие артериальной гипотензии 5
Отсутствие хронической обструктивной болезни легких 4
Солидная опухоль или отсутствие грибковой инфекции у онкогематологического больного 4
Отсутствие дегидратации 3
Пребывание вне стационара в момент начала лихорадки 3
Возраст моложе 60 лет* * 2
* Выберите только один признак.
** Неприменима к пациентам моложе 16 лет. У детей первоначальное число моноцитов 100/мкл и более, отсутствие
сопутствующих заболеваний, нормальные рентгенограммы грудной клетки указывают на то, что имеется низкий
риск инфекции в отношении значимых бактериальных инфекций
14.1. Выбор режима первой линии
антибиотикотерапии
Ввиду возможности быстрого прогрессирования инфекции у больных ФН и отсутст-
вия надежных отличительных признаков у пациентов с ранней бактериальной инфек-
цией с момента возникновения лихорадки всем больным ФН немедленно должна на-
значаться эмпирическая антибактериальная терапия.
Больные ФН без лихорадки, но имеющие симптомы, не позволяющие исключить
инфекцию, также должны получать эмпирическую антибиотикотерапию. Алгоритм
выбора первоначальной эмпирической терапии (первая линия лечения) показан на
рис. 14.1.
Прежде всего определите по шкале MASCC, имеет ли больной низкий или высокий
риск серьезных, угрожающих жизни инфекций в момент начала ФН. Если риск высо-
кий, следует использовать в/в введение антибиотиков. Если риск низкий, то больной
может получать как парентеральную, так и пероральную антибиотикотерапию.
Первая линия эмпирической антибактериальной терапии больных ФН
Монотерапия в/в антибиотиками
В настоящее время при эмпирическом лечении неосложненных эпизодов лихорад-
ки у больных ФН используется монотерапия 1 из 4 препаратов: цефалоспорины III—IV
поколения (цефтазидим или цефепим) и карбапенемы (имипенем/циластатин или ме-
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 449
Лечение и профилактика фебрильной нейтропении ...
Рис. 14.1. Алгоритм первоначального лечения больных с фебрильной нейтропенией
ропенем) (табл. 14.2). При этом исследования показали отсутствие заметной разницы
в эффективности монотерапии и комбинаций препаратов.
Таблица 14.2. Антибиотики, наиболее часто используемые в эмпирической
терапии фебрильной нейтропении
Препарат Дозовый режим I
Цефалоспорины ill-IV поколения с антисинегнойной активностью . «<Jr.
Цефтазидим Цефепим 2 г 3 раза в сутки 2 г 3 раза в сутки
«Защищенные пенициллины» а антисинегнойной активностью i ", \ ' п-1 г,
Пиперациллин/тазобактам 4,5 г 3 раза в сутки
Карбапенемы - ';•
Имипенем/циластатин Меропенем 0,5—1 г 4 раза в сутки 1 г 3 раза в сутки
Амииоглйкозиды* *'
Амикацин Гентамицин, тобрамицин 15 мг/кг/сут (максимальная доза 1,5 г) 5 мг/кг/сут
Гликопептиды
Ванкомицин 0,5 г 4 раза в сутки или 1-2 раза в сутки
Возможно однократное введение суточной дозы.
450
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Выбор режима первой линии антибиотикотерапии
Распространение/З-лактамаз расширенного спектра действия и /3-лактамаз 1-го типа
уменьшили роль цефтазидима при его использовании в монотерапии. Кроме того, це-
фепим, имипенем/циластатин и меропенем (в отличие от цефтазидима) обладают от-
личной активностью против зеленящих стрептококков и пневмококков.
Лечение аминогликозидами в монотерапии не является оптимальным, даже если in
nitro выделены чувствительные возбудители.
Комбинированная в/в антибиотикотерапия без добавления ванкомицина
Наиболее часто используемые двухкомпонентные комбинации включают в себя
аминогликозид (амикацин, тобрамицин, гентамицин) + антисинегнойный уреидопени-
циллин (пиперациллин/тазобактам), либо аминогликозид с антисинегнойным цефало-
спорином (цефепим или цефтазидим), либо аминогликозид + карбапенем (имипенем/
циластатин или меропенем).
В частных исследованиях у больных с низким риском инфекции была показана воз-
можность использования комбинации цефтриаксона 2-4 г 1 раз в сутки с аминоглико-
зидом (амикацин 15 мг/кг/сут).
Преимущества комбинированной терапии заключаются в потенциальном синерги-
ческом эффекте в отношении некоторых грамотрицательных палочек и уменьшении
возникновения резистентных штаммов микроорганизмов во время лечения.
Ограничения, связанные с невозможностью применения аминогликозидов у боль-
ных с почечной недостаточностью, могут быть преодолены путем назначения ком-
бинаций, состоящих из двух /3-лактамных антибиотиков (например, антисинегнойный
уреидопенициллин + антисинегнойный цефалоспорин).
В некоторых исследованиях было показано, что комбинации фторхинолонов с /?-
лактамами или гликопептидами служат возможным выбором для первоначальной те-
рапии у больных, не получавших профилактику фторхинолонами.
Важно иметь в виду, что любая антибиотикотерапия первой линии должна включать
препараты с антисинегнойной активностью.
Комбинированная терапия пероральными антибиотиками
Монотерапия пероральными антибиотиками не проводится.
Пероральная терапия рекомендуется больным с низким риском развития инфекции
и может применяться в амбулаторных условиях, при этом ее результаты эквивалентны
полученным при в/в терапии у больных с низким риском, получавших лечение в амбу-
латорных условиях.
Пероральная терапия имеет ряд преимуществ: более низкая стоимость и упроще-
ние лечения, а также отсутствие необходимости использования в/в катетеров, что
уменьшает риск развития госпитальной и катетер-ассоциированной инфекции.
Среди пероральных режимов у взрослых, как правило, используется комбинация
ципрофлоксацина по 0,5-0,75 г 2-3 раза в сутки (суточная доза 1,5 г) и амоксицилли-
на/клавуланата по 0,625 г 3 раза в сутки или 1 г 2 раза в сутки. Для больных с аллер-
гией к пенициллинам была предложена альтернативная комбинация ципрофлоксаци-
на (в тех же дозах) и клиндамицина (600 мг 3 раза в сутки).
Следует иметь в виду, что фторхинолоны не должны использоваться в первой линии
терапии ФН у больных, ранее получавших профилактику этими препаратами. Кроме
того, в настоящее время фторхинолоны (в частности, ципрофлоксацин) по-прежне-
му не одобрены для применения у детей до 18 лет. Поэтомуу последних практикуется
ранний переход с в/в на пероральную терапию цефиксимом спустя 48 ч и более от на-
чала лечения в/в антибиотиками в условиях стационара.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 451
Лечение и профилактика фебрильной нейтропении ...
«»яяямя«й®вя®яа8»8«яи®яйяя»»»^^ г * * и г -* \ •*
Вопрос о проведении больному ФН пероральной антибиотикотерапии может paccv.a-
триваться только при отсутствии явного очага инфекции или симптомов (например, п*-
потензия), не позволяющих исключить начинающийся сепсис. Тщательное наблюдение
за пациентом и возможность быстрого получения необходимой медицинской помошх
должны быть гарантированы больному круглосуточно — 24 ч в сутки и 7 дней в неделю.
Лечение антибиотиками больных ФН низкого риска должно продолжаться в тече-
ние 7 дней или более, если не исчезли симптомы и не произошла эрадикация возбу-
дителя инфекции. Желательно, чтобы при отмене антибиотиков число нейтрофило®
превышало 500/мкл.
В период амбулаторной терапии ФН оценка состояния больного должна проводить-
ся ежедневно, а при ухудшении состояния больного, при развитии серьезных инфек-
ций или нежелательных явлений необходима госпитализация больного.
Комбинированная в/в антибиотикотерапия с добавлением
ванкомицина в первой или второй линии терапии больных с ФН
В учреждениях, в которых грамположительные инфекции редки, ванкомицин не
должен рутинно использоваться до тех пор, пока результаты микробиологических ис-
следований не покажут необходимость в этом антибиотике. Как правило, вопрос о до-
бавлении ванкомицина решается при неэффективности первой линии терапии.
В учреждениях, в которых грамположительные бактерии — частая причина серьез-
ных инфекций, ванкомицин может быть включен в первоначальные терапевтические
режимы в группах больных с высоким риском. Терапию в этом случае начинают с двух-
или трехкомпонентной комбинации, включающей ванкомицин + цефепим или цефта-
зидим либо карбапенем (имипенем/циластатин или меропенем) с или без аминогли-
козида. Введение препарата может быть прекращено спустя 24-48 ч, если нет данных
за развитие инфекции, вызванной грамположительными микроорганизмами.
Включение ванкомицина в первоначальную эмпирическую терапию целесообраз-
но у отдельных больных в следующих клинических ситуациях: 1) клинически подо-
зреваемая катетер-ассоциированная инфекция (бактериемия, целлюлит); 2) наличие
данных о колонизации пенициллин- и цефалоспорин-резистентными пневмококками
или метициллин-резистентными S. aureus; 3) положительные результаты посева кро-
ви с выделением грамположительных бактерий до окончательной их идентификации
и получения данных антибиотикочувствительности; 4) гипотензия или другие призна-
ки сердечно-сосудистых нарушений.
К сожалению, токсичность ванкомицина (в первую очередь, нефротоксичность) ог-
раничивает возможность его использования у больных с почечной недостаточностью.
Во всех случаях предпочтительным является назначение хроматографически очищен-
ного ванкомицина (Ванкоцин Х.О.) либо ванкомицина, имеющего степень очистки не
менее 93 %.
Кроме того, нерациональное использование препаратов из группы гликопептидов
способствует появлению резистентных микроорганизмов (ванкомицин-резистентных
энтерококков, стафилококков с промежуточной чувствительностью). Линезолид —
препарат из группы оксазолидинонов, может применяться для лечения инфекций, вы-
зываемых подобными микроорганизмами, однако существует проблема ассоцииро-
ванной с данным препаратом миелосупрессии.
В отсутствие эффекта от терапии второй линии решается вопрос о назначении про-
тивогрибковой терапии (как правило, это третья линия лечения).
Следует иметь в виду, что в отличие от гемобластозов у пациентов с солидными опу-
холями эффект лечения обычно наблюдается после первой линии терапии, а модифи-
кация лечения требуется лишь у незначительного числа больных.
452 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Тактика антибиотикотерапии в течение первой недели лечения
При выборе тактики лечения следует, во-первых, определить, имеет ли больной низ-
кий или высокий риск серьезных, угрожающих жизни инфекций в момент начала ФН
на основе шкалы MASCC (см. рис. 14.1). Во-вторых, нужно решить, нужна ли в данном
случае терапия ванкомицином. Если требуется, лечение начинают с двух- или трех-
компонентной комбинации (ванкомицин + цефепим или цефтазидим либо карбапе-
нем (имипенем/циластатин или меропенем) ± аминогликозид). Если ванкомицин не
показан, то в неосложненных случаях начинают в/в монотерапию цефалоспорином
(цефепим или цефтазидим) либо карбапенемом (имипенем/циластатин или меропе-
нем). Двухкомпонентная комбинация может быть использована для лечения ослож-
ненных случаев или если резистентность микроорганизмов в стационаре представля-
ет собой проблему.
14.2. Тактика антибиотикотерапии в течение
первой недели лечения
Период времени до исчезновения лихорадки у больных ФН, получающих антибак-
териальную терапию, в среднем составляет 5 (2-7) дней. Оценка эффекта первона-
чального режима лечения осуществляется через 3-5 дней. Если нет ухудшения кли-
нического состояния больного или не получены результаты микробиологического
исследования, требующего модификации режима лечения, несмотря на наличие фе-
брильной лихорадки, прежде чем изменить режим антимикробной терапии, врач дол-
жен выждать 5 дней.
Больной не имеет лихорадки к 3-5-му дню лечения. Если возбудитель определен,
то модифицируйте антибиотикотерапию в отношении того микроорганизма, который
идентифицирован, чтобы сочетать оптимальное лечение с минимальными побочны-
ми эффектами и наименьшей стоимостью, однако новый режим по-прежнему должен
обладать широким спектром антибактериальной активности в целях предотвращения
«бактериемии прорыва».
Продолжайте лечение антибиотиками в течение 7 дней и более или до тех пор, пока
посевы не станут стерильными и не наступит клинического выздоровления больного
(рис. 14.2). Желательно, чтобы, до того как лечение будет прекращено, число нейтро-
филов превысило 500/мкл.
Однако, если нейтропения продолжается и указанные выше эффекты были достиг-
нуты, решение о прекращении терапии может быть принято до того, как число ней-
трофилов превысит 500/мкл. Это может быть предпринято, если больной тщательно
наблюдается, слизистые оболочки и кожа больного чистые (т.е. нет мукозита, изъяз-
влений, признаков катетерной инфекции или кровоточивости) и ему не предстоит ни-
каких инвазивных процедур или аблятивной XT.
В отсутствие видимого заболевания (т. е. пневмонии, энтероколита, тифлита, эндокар-
дита, катетер-ассоциированной инфекции или флегмоны) и роста микроорганизмов
спустя 2 дня и более в/в терапии взрослые пациенты могут быть переведены на ком-
бинацию пероральных антибиотиков (ципрофлоксацин + амоксициллин/клавуланат).
Тактика ведения больного, если возбудитель не обнаружен, отражена на рис. 14.2.
Персистирование лихорадки в течение первых 3-5 дней лечения. Персистирова-
ние лихорадки более 3 дней при отсутствии очага инфекции или если микроорганизм
не был идентифицирован предполагает, что у больного небактериальная инфекция
либо бактериальная инфекция, резистентная к антибиотику(ам) или медленно отве-
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
453
Лечение и профилактика фебрильной нейтропении...
ЯВДОЙЯЯдавОДйОДЭДНОДОД 3<W>tV ' Uh n < t •> И > <
Лихорадка прекратилась в первые 3-5 дней лечения
Рис. $4.2. Алгоритм лечения больных при исчезновении лихорадки в течение первых
3-5 дней от начала антибиотикотерапии
чающая на используемый препарат, либо имеет место вторая инфекция, неадекват-
ный сывороточный и тканевый уровень антибиотиков, лекарственная лихорадка и др.
На рис. 14.3 суммированы рекомендации по лечению больных с лихорадкой, кото-
рая персистирует в течение более 3 дней. Начинайте повторную оценку больного спу-
стя 3 дня лечения. К 5-му дню, если лихорадка сохраняется и повторная оценка не об-
наружила ее причины, следует выбрать один из следующих вариантов: 1) продолжить
назначение того же антибиотика(ов), если состояние больного клинически стабиль-
ное; 2) сменить антибиотики, если имеются данные о прогрессировании заболевания
или лекарственной токсичности; 3) добавить антифунгальный препарат, если ожидает-
ся, что у больного нейтропения будет продолжаться более 5-7 дней.
Если первоначальное лечение включало ванкомицин как часть терапевтического ре-
жима, то выбор должен быть сделан в пользу удаления ванкомицина, чтобы свести к
минимуму развитие резистентности к этому важному препарату. Как правило, к 3-му
дню лечения уже известны результаты посевов, взятых при поступлении, что позволит
решить этот вопрос. Применение других первоначальных антибиотиков может быть
продолжено, если нет признаков прогрессирования заболевания, а если больной от-
носится к категории низкого риска (см. табл. 14.1), то он может быть переведен на пе-
роральные антибиотики, даже если у него имеется лихорадка.
Считается, что 73 больных ФН, не отвечающих на недельный курс лечения антиби-
отиками, имеет системную грибковую инфекцию, вызванную в большинстве случа-
ев Candida spp. или Aspergillus spp. Больной с глубокой нейтропенией длительностью
5 дней и более и лихорадкой, несмотря на назначение адекватных доз антибиотиков
454 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Тактика антибиотикотерапии в течение первой недели лечения
Персистирующая лихорадка в течение первых 3-5 дней лечения:
Возбудитель не выявлен
I
Рис. 14.3. Алгоритм лечения больных с персистирующей лихорадкой спустя 3-5 дней ле-
чения и больных, у которых причина лихорадки не установлена
широкого спектра действия, является кандидатом для проведения противогрибковой
терапии (табл. 14.3).
Таблица 14.3. Противогрибковые препараты в эмпирической терапии больных
с фебрильной нейтропенией
Препарат
Амфотерицин В дезоксихолат 0,5-0,7-1 мг/кг/сут
Липосомный амфотерицин В 3-5 мг/кг/сут
Липидный амфотерицин В 3-5 мг/кг/сут
Флуконазол 400 мг/сут
Итраконазол 5 мг/кг/сут
Вориконазол В 1-й день по 6 мг/кг 2 раза в сутки, далее — по 4 мг/кг 2 раза
Позаконазол 400 мг 2 раза в сутки
Каспофунгин В 1-й день 70 мг, далее — 50 мг/сут
В отдельных случаях может потребоваться использовать противогрибковые препа-
раты раньше или позже этого срока или вообще не использовать антимикотики. По-
следнее возможно у больного без видимого грибкового поражения, не имеющего
роста Candida или Aspergillus spp. ни в одной локализации и у которого в течение не-
скольких дней ожидается повышение числа нейтрофилов. В этом случае, если пациент
клинически стабилен, лечение амфотерицином В может быть прекращено и пациент
должен быть подвергнут тщательному динамическому наблюдению.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 455
Лечение и профилактика фебрильной нейтропении...
В целом до начала терапии амфотерицином В должны быть предприняты все уси-
лия, чтобы определить, есть ли у больного системная грибковая инфекция. Проводятся
следующие исследования: биопсия подозрительных очагов, рентгенография грудной
клетки и придаточных пазух, эндоскопия носовых ходов при синусите, посевы биоло-
гических материалов и КТ брюшной полости и грудной клетки.
Решение начать эмпирическое применение антифунгального препарата не
столь сложно, гораздо сложнее принять решение о прекращении использования
препарата.
Среди противогрибковых препаратов первое место по частоте назначения в эм-
пирической терапии удерживает амфотерицин В дезоксихолат (стандартный амфо-
терицин В), имеющий широкий спектр противогрибковой активности. Несмотря на
то что многие десятилетия этот препарат считался «золотым стандартом» лечения
грибковых инфекций, побочные эффекты (пирексия, аллергические реакции и, осо-
бенно, кумулятивная нефротоксичность) ограничивают его применение у больных с
длительной ФН, а пороговое значение суточной дозы (максимум 1,5 мг/кг) недоста-
точно для успешного лечения инфекций, вызванных мицелиальными грибами, в т.ч.
Aspergillus spp.
Липосомные и липидные формы амфотерицина В позволяют нивелировать ток-
сичность данного препарата и использовать суточные дозы до 3-5 мг/кг/сут. Од-
нако высокая стоимость данных препаратов не способствует их широкому при-
менению.
Флуконазол может использоваться в качестве эмпирической противогрибко-
вой терапии лишь в немногочисленных учреждениях, в которых инфекции, вызы-
ваемые плесневыми грибами (Aspergillus spp.) и резистентными к лекарственным
препаратам Candida spp. (Candida krusei и некоторые штаммы Candida glabrata).
нечасты.
Больные с легочной инфекцией или синуситом имеют высокую вероятность инфек-
ции, вызванной Aspergillus spp. или другими плесневыми грибами. Решение об эмпи-
рической терапии флуконазолом не должно приниматься у больных, которые имеют
симптомы синусита, или рентгенологические признаки легочной инфекции, или полу-
чали флуконазол в качестве профилактики. То же касается любого пациента, у которо-
го в посеве были выделены Aspergillus spp.
Итраконазол — препарат, имеющий только пероральную лекарственную форму и
невысокую биодоступность, что значительно ограничивает его применение, несмотря
на его действие на более широкий спектр грибов рода Candida и умеренную актив-
ность в отношении Aspergillus spp.
Среди новых противогрибковых препаратов азолового ряда в настоящее время стал
широко применяться вориконазол, активный вт.ч. против резистентных штаммов Can-
dida (Candida krusei, Candida glabrata), а также служащий препаратом выбора для ле-
чения аспергиллеза. Кроме того, вориконазол обладает действием в отношении дру-
гих мицелиальных грибов — Fusarium spp. и Scedosporium spp.
Другой препарат той же группы — позаконазол, активен при рефрактерном аспер-
гиллезе, а также может использоваться для профилактики грибковых инфекций у
больных, перенесших трансплантацию костного мозга.
Каспофунгин — новый препарат из группы эхинокандинов, недавно был зарегистри-
рован для использования при широком спектре показаний, включая инвазивный кан-
дидоз у больных с нейтропенией и без нее, орофарингеальный кандидоз, кандидоз
пищевода; он также может применяться в комбинации (например, с вориконазолом)
при рефрактерном аспергиллезе.
456 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Длительность антимикробной терапии
14.3. Длительность антимикробной терапии
Единственной наиболее важной детерминантой успешного прекращения введения
антибиотиков служит число нейтрофилов.
Если спустя 3 дня лечения доказательства инфекции отсутствуют, число нейтрофи-
лов к этому моменту времени составляет 500/мкл и более в течение 2 дней подряд,
пациент не имеет лихорадки в течение 48 ч и более, антибиотикотерапия может быть
прекращена.
Если у больного исчезла лихорадка, но сохраняется нейтропения, следуйте алго-
ритму, представленному на рис. 14.4. При этом, если введение антибиотиков прекра-
щено, больной подлежит динамическому наблюдению, а при возобновлении лихо-
радки или других признаках бактериальной инфекции ему вновь немедленно должны
быть назначены в/в антибиотики.
У больных с глубокой нейтропенией (< 100/мкл), при поражении слизистых обо-
лочек полости рта или ЖКТ, нестабильных функциях организма или наличии других
факторов риска целесообразно длительное применение антибиотиков в течение все-
го периода нейтропении.
Рис. 14.4. Ориентировочная схема для оценки длительности назначения антибиотиков
АЧН — абсолютное число нейтрофилов.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 457
Лечение и профилактика фебрильной нейтропении ...
У больных с длительной нейтропенией, у которых не ожидается восстановления ге-
матологических показателей, возможно прекращение антибиотикотерапии через
2 нед., если никаких очагов инфекции не будет найдено и больной находится под на-
блюдением. Некоторые эксперты рекомендуют смену терапевтического режима на
один из профилактических режимов (см. ниже).
Длительность противогрибковой терапии варьирует. Если доказана системная гриб-
ковая инфекция, то продолжительность курса ее лечения определяется видом воз-
будителя и распространенностью заболевания. Однако, если грибковой инфекции
не обнаружено, длительность применения противогрибковых препаратов четко не
определена.
Опыт большинства исследователей ограничивается преимущественно амфотери-
цином В дезоксихолатом, введение которого может быть прекращено, если нейтро-
пения разрешилась, больной хорошо себя чувствует и КТ брюшной полости и грудной
клетки не выявляет подозрительных очагов.
При длительной нейтропении у клинически стабильных пациентов при отсутст-
вии видимых очагов инфекции при клиническом обследовании, рентгенографии
(или КТ) грудной клетки и КТ брюшной полости спустя 2 нед. после назначения
ежедневных доз амфотерицина В дезоксихолата введение препарата может быть
прекращено. У тяжелого больного или с высоким риском грибковой инфекции
скорее всего, целесообразно продолжить терапию антибиотиками и антимикоти-
ками в течение всего эпизода нейтропении в ожидании восстановления гематоло-
гических показателей.
Длительность лечения новыми антимикотиками также нередко зависит от наличия
или отсутствия препаратов, суммарной стоимости лечения, наличия или отсутствия
токсических проявлений.
Больных, у которых после восстановления числа нейтрофилов до 500/мкл на фоне
антибактериальной терапии препаратами широкого спектра действия сохраняется
лихорадка, необходимо повторно оценить на предмет недиагностированной грибко-
вой инфекции (хронический системный кандидоз и аспергиллез). Если очагов инфек-
ции не найдено, несмотря на персистирующую лихорадку, антибиотикотерапия мо-
жет быть прекращена спустя 4-5 дней после того, как число нейтрофилов достигнет
500/мкл и более.
14.4. Применение противовирусных препаратов
Показаний для эмпирического использования противовирусных препаратов у боль-
ных ФН в отсутствие признаков вирусной инфекции нет. Однако, если на коже или сли-
зистых оболочках имеются очаги herpes simplex или varicella-zoster, даже когда они не
являются причиной лихорадки, показано лечение ацикловиром либо современным
пероральным препаратом валацикловиром. Задача состоит в том, чтобы улучшить за-
живление этих поражений, представляющих собой входные ворота инфекции во вре-
мя периода нейтропении.
ЦМВ-инфекция лечится ганцикловиром или фоскарнетом. Более новые препараты
(цидофовир, валганцикловир и фомивирсен) эффективны влечении ЦМВ-ретинитау
больных СПИДом, но исследований среди больных ФН недостаточно.
Если вскоре после начала ФН у больного выявлена некая вирусная инфекция респи-
раторного тракта, оправдано применение подходящих противовирусных препаратов
(например, рибавирин в случае инфекции, вызванной респираторно-синцитиальным
458 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Применение колониестимулирующих факторов
вирусом, и занамивир, озелтамивир, ремантадин или амантадин дли инфекций, выз-
ванных вирусом гриппа).
14.5. Трансфузии гранулоцитов
Рутинное использование трансфузий гранулоцитов большинством специали-
стов не рекомендуется. Убедительных данных в пользу эффективности трансфу-
зии большого числа гранулоцитов, полученных от донора после назначения Г-КСФ
с или без дексаметазона, которые проводятся некоторыми клиницистами, в насто-
ящее время нет.
Значительная опасность и токсичность трансфузий гранулоцитов для реципиента,
включая возможную передачу ЦМВ-инфекции, аллоиммунизацию (+ лихорадка), ре-
акции «трансплантат против хозяина» (если гранулоциты не облучены), прогрессивную
рефрактерность тромбоцитов и, возможно, дыхательную недостаточность при однов-
ременном назначении амфотерицина В, оправдывают мнение большинства экспертов
о том, что трансфузии гранулоцитов в настоящее время — экспериментальный метод
терапии.
14.6. Применение колониестимулирующих
факторов
Рутинное использование гемопоэтических факторов роста в неосложненных случаях
ФН не рекомендуется. Однако в ряде ситуаций (при прогнозируемом ухудшении тече-
ния и ожидаемой длительной задержке восстановления костного мозга) назначение
КСФ может быть показано. К таким ситуациям могут быть отнесены пневмония, эпи-
зоды гипотензии, развитие целлюлита (флегмоны) или синусита, системные грибко-
вые инфекции, вторичная полиорганная недостаточность при сепсисе. Использование
КСФ может быть целесообразно у больных с сохраняющейся выраженной нейтропе-
нией и документированной инфекцией, не отвечающей на соответствующую антими-
кробную терапию.
NCCN рекомендует основывать клиническое решение об использовании миелоид-
ных факторов в зависимости от миелосупрессивного потенциала химиотерапевтиче-
ского режима. При режимах с ожидаемой частотой ФН > 20% целесообразно вве-
дение КСФ при первом и последующем циклах XT. При умеренном риске (10-20%)
профилактика КСФ должна рассматриваться в зависимости от целей лечения и нали-
чия или отсутствия пользы. Для больных с низким риском (< 10%) рутинное использо-
вание профилактики КСФ не рекомендуется.
Еще одним показанием к применению КСФ считается возникновение осложнений
(нейтропения, ФН) после подтвержденного эпизода ФН во время предшествующего
курса XT, т.е. вторичная профилактика.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 459
Лечение и профилактика фебрильной нейтропении ...
14.7. Лечение катетер-ассоциированных
инфекций
Согласно мнению ряда специалистов, в т.ч. экспертов IDSA, сосудистые катетеры (ка-
тетеры Хикмана—Бровиака или подкожные порты) на фоне лечения антибиотиками
могут быть оставлены на месте у большинства больных, даже если обнаружена ло-
кальная инфекция в месте входа катетера или катетер-ассоциированная бактериемия.
Это связано с тем, что коагулазанегативные стафилококки, наиболее часто выделяе-
мые при катетер-ассоциированных инфекциях, во-первых, являются значимыми воз-
будителями только при повторном их выделении, а во-вторых, как правило, отвечают
на лечение парентеральными антибиотиками без удаления катетера, если нет призна-
ков туннельной инфекции.
Если инфекция рецидивирующая или ответ на антибиотики не очевиден спустя
2-3 дня терапии, может понадобиться удаление катетера независимо от этиологии
процесса. Наличие данных о подкожной туннельной или перипортальной инфекции,
септические эмболы, гипотензия, связанная с использованием катетера, илиустановка
непатентованного катетера также служат показанием для его удаления одновремен-
но с немедленным назначением антибиотиков.
Бактериемия, вызванная Bacillus spp., Acinetobacter spp., Pseudomonas aeruginosa.
Stenotrophomonas maltophilia, Corynebacterium jeikeium, Staphylococcus aureus или
ванкомицин-резистентными энтерококками, либо фунгемия, вызванная Candida spp..
нередко плохо поддаются антимикробному лечению, в связи с чем рекомендуется не-
медленное удаление катетера. Широкое иссечение инфицированных тканей однов-
ременно с удалением катетера целесообразно у больных с инфекцией, вызванной
атипичными микобактериями.
Для профилактики катетер-ассоциированных инфекций ряд исследователей пред-
лагали использование импрегнированных антибиотиками катетеров, введение ан-
тибиотиков через оба просвета, ротацию доставки антибиотиков через многопрос-
ветные катетеры и использование антибиотиксодержащих гепариновых растворов
(антибиотиковый «замок») в качестве дополнения к системной терапии. Такая практи-
ка спорна и не может быть рекомендована в качестве стандарта лечения всех пациен-
тов. Также не показана целесообразность рутинного профилактического использова-
ния ванкомицина.
14.8. Антибиотикопрофилактика
при нейтропении
В настоящее время с целью антибиотикопрофилактики при нейтропении исполь-
зуют в основном триметоприм/сульфаметоксазол, фторхинолоны и антимикотики
(табл. 14.4).
Триметоприм/сульфаметоксазол (TMP-SMZ; син.: котримоксазол, бисептол).
Мнения экспертов в отношении рутинного использования TMP-SMZ в период ней-
тропении различны, что связано с отсутствием влияния профилактики на смертность
больных. Эффективность профилактики TMP-SMZ доказана для больных, имеющих
риск развития пневмонии, вызываемой Pneumocystis carinii (например, больные лей-
460 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Антибиотикопрофилактика при нейтропении
козами, некоторыми солидными опухолями, гистиоцитозом или СПИДом), независи-
мо от того, есть у них нейтропения или нет. При этом TMP-SMZ также способствует
профилактике бактериальных инфекций.
Не следует также забывать о том, что данный препарат небезобиден в связи с воз-
можными побочными реакциями, связанными с сульфаниламидным компонентом
TMP-SMZ, возможной миелосупрессией, развитием резистентности бактерий и кан-
дидоза ротовой полости.
Таблица 14.4. Антимикробные препараты, используемые для
антибиотикопрофилактики у больных с нейтропенией в отсутствие
фебрилитета
I Препарат Дозовый режим
Триметоприм/сульфаметоксазол 960 мг 2 раза в сутки
Ципрофлоксацин 0,5 г 2 раза в сутки
Флуконазол 400 мг 1 раз в сутки
Вориконазол 3 мг/кг каждые 12 ч
Позаконазол 200 мг 3 раза в сутки
Фторхинолоны. Метаанализы эффективности антибиотикопрофилактики с ис-
пользованием фторхинолонов показали существенное уменьшение частоты лихорад-
ки и МДИ у пациентов с нейтропенией. В то же время у этих больных было продемон-
стрировано возникновение фторхинолон-резистентных грамотрицательных палочек.
Кроме того, фторхинолоны до сих пор не разрешены для применения у детей.
Фторхинолоны не должны использоваться в качестве рутинной профилактики ФН в
стационарах, где уже имеется резистентность к этой группе препаратов или применя-
емые режимы эмпирической терапии ФН включают парентеральные фторхинолоны.
Учитывая, что традиционно используемые хинолоны (фтор, ципрофлоксацин, оф-
локсацин) недостаточно активно предотвращают инфекции, вызываемые грамполо-
жительными микроорганизмами, проводились и проводятся попытки ликвидировать
этот недостаток путем добавления препаратов, обладающих активностью в отноше-
нии грамположительных микроорганизмов (пенициллин, рифампицин), либо приме-
нения новых фторхинолонов с улучшенной активностью против грамположительных
бактерий (моксифлоксацин, левофлоксацин).
В отдельных случаяху больных с глубокой и пролонгированной нейтропенией анти-
биотикопрофилактика фторхинолонами в комбинации с пенициллином или TMP-SMZ
может применяться в критические периоды нейтропении, если целесообразность ан-
тибиотикопрофилактики перевешивает риск, связанный с увеличением числа рези-
стентных микроорганизмов.
Ванкомицин. Как уже упоминалось выше, в/в введение ванкомицина в качестве про-
филактики катетер-ассоциированных либо связанных с использованием фторхино-
лонов грамположительных инфекций, несмотря на эффективность данного подхода,
не может быть рекомендовано из-за возможности возникновения ванкомицин-рези-
стентных штаммов микроорганизмов. Также не следует использовать с этой целью ли-
незолид.
Противогрибковые препараты. Антибиотикопрофилактика флуконазолом в
дозе 400 мг/сут при трансплантации костного мозга, начиная со дня трансплантации,
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 461
Лечение и профилактика фебрильной нейтропении ...
ЯЯЯЯ8ВЯЯ1ШЯЯИВЯИИ®ЯЙВадЯЮЯЯ»вЯ8®вЯЙЙ^ - -- -
уменьшает частоту как поверхностных, так и системных грибковых инфекций. Одна-
ко эффективность флуконазола ограничена в связи с отсутствием его активности в от-
ношении С. krusei и некоторых штаммов С. glabrata, а также плесневых грибов. В ряде
медицинских учреждений, где использовался флуконазол, сообщалось о повышен-
ной частоте колонизации пациентов штаммами С. krusei и С. glabrata.
Поэтому, несмотря на то что в метаанализе эффективности противогрибковой про-
филактики, проведенной более чему 7000 рандомизированных пациентов, наблюда-
лось уменьшение частоты использования эмпирической противогрибковой терапии,
снижение частоты поверхностных грибковых инфекций, инвазивных грибковых ин-
фекций и смертности, связанной с грибковыми инфекциями, рутинное использова-
ние флуконазола для профилактики грибковой инфекции при нейтропении не реко-
мендуется (за исключением больных, подвергшихся трансплантации костного мозга).
Использование вориконазола и позаконазола с целью профилактики грибковых ин-
фекций целесообразно лишь при трансплантации костного мозга либо у больных, для
которых характерен очень высокий риск грибковых инфекций (больные с рецидивом
лейкоза).
Аксиомой профилактики служит то, что используемый антибиотик должен назна-
чаться в течение возможно более короткого периода времени и у возможно мень-
шего числа больных.
В заключение следует заменить, что при лечении ФН не существует ни одного пре-
парата, ни одной схемы, ни определенного периода, когда следовало бы назначать ле-
чение, которые были бы универсально эффективными. Поэтому все вышеизложенное
носит рекомендательный характер. Для принятия решения необходима всесторон-
няя оценка каждого конкретного случая. Кроме того, к решению вопроса о тактике
лечения больного ФН рекомендуется привлекать специалистов (клинических фар-
макологов) по антимикробной XT, знакомых с проблемой лечения инфекций у имму-
нокомпрометированных больных. Это поможет не только решить вопрос о лечении
конкретного пациента, но и разработать стратегию терапии больных ФН, получающих
лечение в данном медицинском учреждении, а также избежать распространения ми-
кроорганизмов, резистентных к антибиотикам и антимикотикам, что возможно при
нерациональном применении этих препаратов.
462
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Глава 15
Особенности противоопухолевой
лекарственной терапии у лиц пожилого
возраста
Н. С. Бесова
Старение — прогрессивное полиорганное снижение функциональных резервов ор-
ганизма с соответствующим снижением толерантности к стрессам, в т.ч. и к XT. Воз-
растные физиологические процессы — изменение объема распределения, снижение
функциональных резервов костного мозга, метаболической активности печени, гло-
мерулярной фильтрации — объективные предпосылки, повышающие риск возникно-
вения побочных эффектов XT у пожилых больных.
Объем распределения зависит от содержания жировой ткани и жидкости в ор-
ганизме, уровня сывороточного альбумина и количества эритроцитов. С возрастом
происходит увеличение процентного содержания жировой ткани (с 15 до 30% от
массы тела), уменьшение объема общей и внутриклеточной жидкости. Наблюда-
ется также снижение уровня альбумина и гемоглобина. В этих условиях возможно
увеличение токсичности цитостатиков, связывающихся с белками или эритроцита-
ми. К ним относятся таксаны, эпиподофиллотоксины, камптотецин, антрациклины и
антрацендионы. Анемия может стать причиной снижения эффективности препара-
тов, транспорт которых осуществляется эритроцитами (антрациклины, камптоте-
цин). Кроме того, анемия может привести к декомпенсации сердечно-сосудистых
заболеваний, столь часто встречающихся у пожилых больных, и снижению толе-
рантности к XT. Известно, что анемия способствует развитию резистентности зло-
качественной опухоли к лекарственной и лучевой терапии и повышению агрессив-
ности опухоли.
Учитывая негативное влияние анемии на функциональный статус, эффективность и пе-
реносимость XT, коррекция уровня гемоглобина у пациентов преклонного возраста обя-
зательна. Показано, что оптимальный для пожилыхуровень гемоглобина 12 г/дл и выше.
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 463
Особенности противоопухолевой медикаментозной терапии...
Метаболическая функция печени зависит от массы печени, печеночного кровото-
ка, скорости экскреции лекарственных средств гепатоцитами, внутриклеточной кон-
центрации и активности ферментов. Метаболизм препаратов в печени включает в себя
две основные фазы реакций: окислительные реакции с участием системы цитохрома
Р450 (I фаза) и реакции конъюгации (II фаза), которые дают возможность водораство-
римым компонентам экскретироваться с желчью и мочой. На активность этих реакций
влияют как возраст, так и различные лекарственные средства. С возрастом происхо-
дит уменьшение печени, печеночного кровотока, снижение белково-синтетическо?
функции и активности ферментных систем цитохрома Р450. Изменения в реакциям
I фазы могут повлиять на активность и токсичность препаратов, метаболизирующихся
посредством данного механизма (циклофосфан, ифосфамид, идарубицин). Полипраг-
мазия, характерная для пациентов пожилого возраста, может стать причиной измене-
ния активности цитохрома Р450.
Нарушения функции печени при нормальной функции почек не требуют коррекции
доз эпиподофиллотоксинов и большинства алкилирующих агентов. Дозы винбластина,
доксорубицина и митоксантрона должны быть снижены на 50% при повышении уровня
билирубина более 1,5 мг/дл и на 75 %, если уровень билирубина превышает 3 мг/дл. Вве-
дение паклитаксела при нарушении функции печени сопровождается значительныv
увеличением AUC и соответствующим ростом токсичности, главным образом нейтро-
пении. Скорость выведения доцетаксела у пожилых больных снижена на 25%. Реко-
мендации по коррекции доз таксанов представлены в табл. 15.1.
Таблица 15.1. Коррекция разовой дозы таксанов в зависимости от нарушения
функции печени при режиме введения 1 раз в 3 недели
Доза и режим, мг/м2, Зч, Знед.
*' г № Паклитаксел Доцетаксел
Общий билирубин N АлАТ/АсАТ 1,5-2,5 х ВГН ЩФ > 2,5 х ВГН 175 75
Общий билирубин N АлАТ/АсАТ 2,5-5,0 х ВГН и/или ЩФ > 2,5 х ВГН 130 50
Общий билирубин 1,5-3,0 х ВГН АлАТ/АсАТ 1,5-2,5 х ВГН и/или ЩФ > 2,5 х ВГН 130 50
Общий билирубин 1,5-3,0 х ВГН АлАТ/АсАТ 2,5-5,0 х ВГН и/или ЩФ>2,5х ВГН 90 25
Общий билирубин>3х ВГН АлАТ/АсАТ/ЩФ любые или АлАТ/АсАТ > 5,0 х ВГН ЩФ/общий билирубин любые 50 12
N — норма
Одним из способов уменьшения токсичности таксанов у пожилых больных без сни-
жения их эффективности служит режим еженедельного введения.
Согласно данным большинства исследований, возраст не оказывает существенного
влияния на фармакокинетику и токсичность иринотекана. Тем не менее в первых клини-
ческих исследованиях иринотекана пожилой возраст выделяли как потенциальный фак-
тор увеличения токсичности. На этом основании была рекомендована редукция старто-
464 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Особенности противоопухолевой медикаментозной терапии...
вой дозы препарата с 350 до 300 мг/м2 в режиме инфузионного введения 1 раз в 3 нед. у
больных старше 70 лет. Согласно результатам дальнейших исследований, пожилой воз-
раст не влияет на частоту побочных эффектов III-IV степени (нейтропения, диарея) при
лечении иринотеканом как в монорежиме, так и в комбинациях с фторпиримидинами.
Одним из наиболее стойких функциональных изменений, присущих пожилому воз-
расту, является снижение скорости клубочковой фильтрации. Рутинное определение
уровня сывороточного креатинина не дает адекватной оценки функции почек: возраст-
ная потеря мышечной массы приводит к уменьшению продукции креатинина и ложной
нормализации его уровня. Более точно функцию почек отражает клиренс креатини-
на, рассчитанный по формуле Cockroft (см. приложение 3). Снижение гломерулярной
фильтрации приводит к увеличению токсичности химиопрепаратов, основным путем
выведения которых являются почки (блеомицин, метотрексат, цисплатин), а также про-
тивоопухолевых агентов, метаболиты которых выводятся с мочой. В связи с этим до на-
чала любой XT у пожилых пациентов необходимо определять клиренс креатинина и
проводить соответствующую коррекцию доз вводимых цитостатиков (табл. 15.2).
Таблица 15.2. Коррекция доз противоопухолевых препаратов в зависимости
от клиренса креатинина у пожилого больного
Клиренс креатинина, мл/мин
Препарат 60-46
Доза препарата, мг/м2 в сутки 1
Блеомицин 0,7 0,6 Вводить не рекомендуется
Кармустин 0,8 0,75 Вводить не рекомендуется
Цисплатин 0,75 0,5 Вводить не рекомендуется
Цитарабин 0,6 0,5 Вводить не рекомендуется
Дакарбазин 0,8 0,75 0,7
Ифосфамид 0,8 0,75 0,7
Мелфалан 0,85 0,75 0,7
Метотрексат 0,65 0,5 Вводить не рекомендуется
Этопозид 0,85 0,8 0,75
Доза карбоплатина рассчитывается по формуле Calvert (см. приложение 4).
Коррекции дозы оксалиплатина при клиренсе креатинина более 30 мл/мин не тре-
буется.
Возрастное снижение клиренса креатинина приводит к повышению токсичности
стандартного режима введения топотекана (1,5 мг/м2 в/в ежедневно в течение 5 дней
каждые 3 нед.) у пожилых больных. В связи с этим необходима коррекция ежеднев-
ной дозы препарата каку первичных больных, так и у пациентов, ранее получавших XT
(табл. 15.3).
Таблица 15.3. Коррекция доз топотекана в зависимости от клиренса
креатинина
Клиренс креатинина Доза топотекана, мг/м2 в сутки , Первичные больные Получавшие химиотерапию
> 60 мл/мин 1,5 1,5
40-59 мл/мин 1,5 1,0
20-39 мл/мин 0,75 0,5
< 20 мл/мин Вводить не рекомендуется
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 465
Особенности противоопухолевой медикаментозной терапии ...
Нарушение почечной функции приводит к повышению токсичности капецитабина.
Рекомендации по модификации суточной дозы препарата в зависимости от клиренса
креатинина приведены в табл. 15.4.
Таблица 15.4. Коррекция суточной дозы капецитабина в зависимости
от клиренса креатинина
Клиренс креатинйна ______________Суточная доза капецитабина
>50 мл/мин 100%
30—50 мл/мин 75%
< 30 мл/мин Вводить не рекомендуется
Изучение активности капецитабинау пожилых (65-80 лет) больных РМЖ в первой
линии терапии показало, что снижение разовой дозы до 1000 мг/м* 2 * * * * * В 2 раза в сутки
не уступает по частоте объективных эффектов стандартной дозе (1250 мг/м2 2 раза
в сутки) — 37 и 43% соответственно. При этом снижается частота токсичности III-
IV степени, в частности диареи — с 13 до 2%, одышки — с 10 до 5%, тошноты — с 7
до 5% и рвоты — с 3 до 0%. Аналогичные результаты получены при сравнении двух
дозовых режимов во второй линии XT. Редукция дозы капецитабина до 1000 мг/м2
2 раза в сутки привела к снижению частоты Л ПС (с 18 до 7 %) и мукозитов (с 12 до 7 %)
III-IV степени.
Таким образом, для лечения пожилых больных рекомендована стартовая доза капе-
цитабина по 1000 мг/м2 2 раза в сутки.
Возрастное снижение резервов костного мозга служит причиной развития непред-
сказуемой миелотоксичности и увеличения частоты глубоких нейтропений на фоне
стандартных режимов XT (CMF, АС, 5-ФУ + лейковорин ± иринотекан, FOLFOX4, ци-
сплатин в комбинации с этопозидом, паклитакселом, доцетакселом, гемцитабином или
винорелбином, карбоплатин в комбинации с паклитакселом или доцетакселом). Воз-
растает также частота глубокой тромбоцитопении (FOLFOX4, режимы с карбоплати-
ном). В связи с миелотоксичностью пожилым больным чаще проводится редукция доз
и отсрочка очередного курса лечения.
XT оксалиплатином в комбинации с капецитабином (режим Xelox) не сопровожда-
ется повышением токсичности у пожилых.
Применение КСФ снижает риск развития нейтропении и инфекционных осложне-
ний на 32-83 %. В связи с этим NCCN и ASCO рекомендуют первичную профилактику
КСФ у всех больных старше 70 лет, получающих XT в режимах, интенсивность которых
подобна CHOP.
При тромбоцитопении вместо карбоплатина может быть использован цисплатин
при отсутствии противопоказаний к гидратации.
В литературных источниках имеются указания на то, что редукция дозы цисплати-
на не снижает эффективности лечения у пожилых больных. Так, при НМРЛ изучение
цисплатина в диапазоне доз 60-90 мг/м2 в комбинации с винорелбином у пациентов
старше 70 лет показало, что доза цисплатина не влияла на непосредственный эффект.
Представленный Chiara анализ результатов XT цисплатином (в разовой дозе преиму-
щественно 50 мг/м2) в комбинации с циклофосфамидом или с циклофосфамидом и
антрациклинами не выявил существенных отличий в эффективности и токсичности
этих режимов у больных раком яичников старше и моложе 65 лет.
Атрофические и дистрофические процессы, приводящие к кардиосклерозу и фи-
брозу миокарда, негативно сказываются на функциональных и компенсаторных воз-
можностях миокарда. В этих условиях возможно повышение кардиотоксичности
466 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Особенности противоопухолевой медикаментозной терапии...
антрациклинов. Как известно, при отсутствии тяжелых сердечно-сосудистых заболе-
ваний риск развития кардиотоксичности повышается после достижения определен-
ной кумулятивной дозы препаратов. Для пожилых пациентов кумулятивная доза док-
сорубицина не должна превышать 400 мг/м2.
Будучи препаратами широкого противоопухолевого действия, антрациклины при-
меняются при многих злокачественных опухолях и не должны исключаться из XT у па-
циентов пожилого возраста при условии адекватной коррекции сопутствующих сер-
дечно-сосудистых заболеваний. Обязательно определение фракции выброса левого
желудочка как до назначения антрациклинов, так и в процессе и после окончания ле-
чения. Противопоказанием к назначению антрациклинов служит абсолютное сниже-
ние фракции выброса левого желудочка менее 45%. О повышении риска развития
кардиотоксичности в процессе лечения свидетельствует снижение фракции выброса
левого желудочка на 20% от исходного значения. Токсическая кардиомиопатия диаг-
ностируется в следующих случаях: снижение фракции выброса левого желудочка на
10% от исходного, при этом значение становится ниже нижней границы нормы; сни-
жение фракции выброса левого желудочка менее 45 %; появление симптомов застой-
ной сердечной недостаточности. Клинические симптомы служат поздним признаком
кардиотоксичности. Более ранним маркером может быть тропониновый тест, свиде-
тельствующий о поражении миокарда.
В целях профилактики кардиотоксичности может быть рекомендован кардиоксан.
Однако препарат не исследовался у пожилых больных; есть литературные данные о
том, что он может способствовать повышению гематологической токсичности и сни-
жению противоопухолевой активности доксорубицина.
Поскольку повреждающее действие на миокард зависит от пиковой плазменной
концентрации доксорубицина, то наряду с кумулятивной имеет значение и разовая
доза препарата. В связи с этим одним из способов снижения кардиотоксичности док-
сорубицина служит модификация режима введения: еженедельное или инфузионное
(на протяжении 48-96 ч) введение. Последнее сопровождается повышением часто-
ты мукозитов.
Альтернативой традиционному доксорубицину служит липосомная форма препа-
рата (Келикс, Доксил), обладающая низкой кардиотоксичностью.
Препараты, оказывающие токсическое действие на миокард, представлены в
табл. 15.5.
Таблица 15.5. Противоопухолевые препараты, обладающие
кардиотоксичностью
Токсическая доза (для лиц моложе 65 лет) Комментарий Частота,%
Антрациклины Доксорубицин Эпирубицин Кумулятивная доза >450 мг/м2 >720 мг/м2 Кардиомиопатия, ЗСН, аритмия 2-12 4-15
Паклитаксел Стандартные дозы Брадикардия, в комбинациях — ЗСН —
Циклофосфамид > 100-120 мг/кг ЗСН, миокардит/геморрагический пе- рикардит —
5-ФУ, капецитабин Стандартные дозы Стенокардия/инфаркт миокарда 2-3
Цисплатин Стандартные дозы Острая ишемия миокарда 5
‘Таргетные препараты»^
Трастузумаб (Герцептин) Стандартные дозы ЗСН, кардиомиопатия 3-28
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 467
Особенности противоопухолевой медикаментозной терапии ...
eaE89asaa3rea02aaaasEESS!6aa®as8eassftj®saaaaseas&0®E0Maiaa5sftsseaasEEeaEee^^ .
Токсическая доза Комментзрий (для лиц моложе 65 лет) Частота,
Лапатиниб Стандартные дозы ЗСН, кардиомиопатия 2-4
Бевацизумаб Стандартные дозы Гипертензия, тромбоз, кардиомиопатия 5-20
Сунитиниб Стандартные дозы Гипертензия, тромбоз, кардиомиопатия 10-30
Сорафениб Стандартные дозы Гипертензия, тромбоз, кардиомиопатия 3-17
ЗСН — застойная сердечная недостаточность.
Применение некоторых таргетных препаратов также сопровождается увеличением
токсичности 111—IV степени тяжести у пожилых пациентов. Анализ переносимости бе-
вацизумаба в комбинации с паклитакселом и карбоплатином при НМРЛ показал, что
включение бевацизумаба в режим лечения больных 70 лет и старше сопровождалось
увеличением частоты ФН, протеинурии и гипертензии по сравнению с пациентами мо-
ложе 70 лет, достоверно чаще развивались нейтропения, кровотечения, протеинурия,
мышечная слабость и моторная нейропатия. Повышение токсичности III—IV степени в
отсутствие увеличения продолжительности жизни по сравнению с XT паклитакселом
в комбинации с карбоплатином не позволяет рекомендовать включение бевацизума-
ба в лекарственную терапию первой линии НМРЛ пожилым больным. Согласно ре-
зультатам изучения эрлотиниба во второй-третьей линии лечения НМРЛ, у пациентов
70 лет и старше возрастает частота слабости, стоматитов, дегидратации III степени тя-
жести и выше.
Возрастные изменения центральной и периферической нервной системы повыша-
ют риск развития как периферической, так и центральной нейротоксичности проти-
воопухолевых препаратов (винкаалкалоидов, эпиподофиллотоксинов, таксанов, про-
изводных платины). Авторы исследования ТАХ 326 отметили, что XT цисплатином в
комбинации с доцетакселом или винорелбином при НМРЛ сопровождалась увеличе-
нием частоты периферических нейропатий III—IV степени у лиц старше 64 лет. По дан-
ным Langer и соавт., на фоне XT цисплатином в комбинации с этопозидом или пакли-
такселом при НМРЛ проявления центральной нейротоксичности чаще встречались у
больных 70 лет и старше, чему пациентов моложе 70 лет.
Больные пожилого возраста значительно различаются по физическому, психическо-
му и интеллектуальному статусу. Это обстоятельство свидетельствует о том, что выбор
лечебной тактики должен в большей степени основываться не на хронологическом, а
на биологическом возрасте, более точно отражающем индивидуальные особенности
пациента. Ключевые вопросы при выборе лечебной тактики следующие:
» каково влияние онкологического заболевания на продолжительность и качество
жизни пожилого больного;
Я способен ли пациент перенести XT;
Я каково соотношение пользы и вреда от противоопухолевой терапии у конкрет-
ного индивидуума.
К сожалению, в настоящее время не существует единых стандартизованных кри-
териев отбора пожилых онкологических больных для XT. Шкалы, традиционно ис-
пользуемые в гериатрии, не адаптированы для онкологических заболеваний, а шкалы
оценки функционального состояния больного, применяемые в онкологии, не учиты-
вают возрастные изменения. Попыткой решить эту проблему является инициирован-
ная Balducci и Extrmann гериатрическая онкологическая программа, предлагающая
использовать многофакторную гериатрическую шкалу оценки (CGA) для решения во-
проса о назначении XT онкологическому больному пожилого возраста. Шкала скри-
нинга включает следующие параметры:
S стадия и прогноз онкологического заболевания;
468 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Особенности противоопухолевой медикаментозной терапии ...
8S функциональное состояние больного: оценка функционального статуса по шка-
ле ВОЗ или Карновского, а также по мультипараметрическим шкалам ADL (Activ-
ities Daily Living, Katz) и IADL (Instrumental Activities of Daily Living, Lawton);
оценка количества и тяжести сопутствующих заболеваний;
когнитивный статус (оценка мини-ментального статуса по Folstein);
эмоциональное состояние (гериатрическая шкала депрессий);
социальный статус (помощь родственников и друзей, возможность организации
наблюдения в целях своевременного выявления побочных эффектов XT, обес-
печение постоянного контакта с врачом, возможность транспортировки больно-
го в экстренных случаях);
в препараты сопутствующей терапии, их количество, показания к назначению, воз-
можное взаимодействие с цитостатиками;
И питание больного (диета, соответствие массы и роста, динамика массы тела, уро-
вень альбумина в сыворотке крови);
наличие гериатрических синдромов (делириозный, депрессии, деменции, осте-
опороза, «падений», «недержания», «неряшливости», когнитивных расстройств).
Шкала ADL позволяет оценить возможность пациента самостоятельно, без посто-
ронней помощи обслуживать себя: принимать ванну, соблюдать личную гигиену, оде-
ваться, ложиться в кровать и вставать, перемещаться (выходить из дома, подниматься
по лестнице), принимать пищу.
Шкала IADL оценивает уровень бытовой активности: способность самостоятель-
но или с небольшой посторонней помощью пользоваться общественным или личным
транспортом, делать покупки, готовить пищу, наводить порядок в доме, выполнять мел-
кую домашнюю работу, пользоваться телефоном, принимать лекарства, вести финан-
совые расчеты. Неспособность пациента самостоятельно пользоваться телефоном,
делать покупки, расплачиваться по счетам может стать предвестником развивающейся
деменции и свидетельствовать о снижении толерантности к XT.
Использование этих шкал позволяет получить более полное представление не толь-
ко о функциональном состоянии пациента, но и о возможной продолжительности
жизни. Показана корреляция между функциональной зависимостью больного от по-
сторонней помощи и продолжительностью жизни. Так, средняя продолжительность
жизни больных, нуждающихся в постоянной посторонней помощи хотя бы по одному
из пунктов шкалы ADL, не превышала 3 лет.
Сопутствующие заболевания, так же как и функциональный статус, служат незави-
симым неблагоприятным прогностическим фактором, отрицательно влияющим на
общее состояние и продолжительность жизни пожилых больных, а также снижают
толерантность к XT. Наиболее значимые: коронарная болезнь сердца, сердечная не-
достаточность, хроническая обструктивная болезнь легких, почечная недостаточ-
ность, цереброваскулярные заболевания, сосудистые осложнения сахарного диабе-
та, артриты, анемии.
Оценка когнитивного и эмоционального статуса больного необходима для выявления
нарушений памяти и скрытой депрессии, затрудняющих планомерное проведение ле-
чения, своевременное выявление и коррекцию побочных эффектов. Нарушения памяти
можно определить уже при опросе пациента: попросить назвать дату и место рождения,
возраст, сегодняшнее число и год, возраст детей, их профессию; перечислить больному
три предмета и попросить сразу и спустя 15-20 мин повторить их названия.
Для оценки эмоционального статуса необходимо выяснить настроение пациента,
часто ли он испытывает чувство тревоги, уныния, безысходности. При положительном
ответе необходимо более тщательное обследование у психоневролога и последую-
щее лечение депрессии и тревоги.
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 469
Особенности противоопухолевой медикаментозной терапии ...
Социальная поддержка пациента зачастую является залогом безопасности лечения.
Оценка нутритивного статуса пациента направлена на выявление нарушения пи-
тания и его коррекцию. Сниженный нутритивный статус связан с повышением риска
осложнений XT.
Гериатрические синдромы, как правило, свидетельствуют об истощении функцио-
нальных резервов организма и служат противопоказанием для XT.
В соответствии с полученными результатами Balducci и Extrmann предлагают подра-
зделять больных на три группы. На соответствии пациента критериям той или иной
группы базируется выбор лечебной тактики.
1. Пожилые больные, ведущие активный образ жизни, самостоятельно обслуживаю-
щие себя, имеющие адекватный интеллектуальный уровень, без тяжелых сопутст-
вующих заболеваний, гериатрических синдромов и полипрагмазии.
Лечебная тактика: пациентам данной категории возможно назначение стандар-
тных режимов XT.
2. Пожилые больные, частично нуждающиеся в посторонней помощи и страдающие
двумя и более сопутствующими заболеваниями.
Лечебная тактика: если злокачественная опухоль не сокращает продолжитель-
ность жизни больного или имеет место низкая толерантностьк лекарственной терапии,
может быть назначена симптоматическая терапия. В тех случаях, когда злокачествен-
ная опухоль является основным заболеванием, определяющим продолжительность
жизни, пациентам данной группы может быть назначена XT с исходной редукцией доз
вводимых препаратов и последующей их коррекцией в зависимости от переносимо-
сти, часто используется монотерапия.
3. Больные в возрасте 85 лет и старше, пациенты, нуждающиеся в постоянной посто-
ронней помощи хотя бы по одному из пунктов шкалы ADL, пожилые, отягощенные
тремя и более сопутствующими заболеваниями или имеющие хотя бы один гериа-
трический синдром.
Лечебная тактика: больные данной группы классифицируются как ослабленные,
им показана только симптоматическая терапия.
Таким образом, авторы предлагают методику комплексной оценки функциональ-
ного состояния пожилых онкологических больных, которая позволяет более точно
оценить индивидуальные функциональные резервы организма, предполагаемую про-
должительность жизни, толерантность к XT. Полученные результаты служат основой
алгоритма лечения.
Процесс старения характеризуется снижением толерантности организма к цитоста-
тикам. Однако хронологический возраст как таковой не является противопоказанием
к XT. Адекватная оценка функциональных резервов организма способствует выработ-
ке оптимальной лечебной тактики с учетом индивидуальных особенностей гериатри-
ческого больного. Выбор оптимальных лечебных режимов, адаптация доз вводимых
препаратов в соответствии с физиологическими особенностями организма, использо-
вание всего арсенала средств сопроводительной терапии служат залогом эффектив-
ности и безопасности XT у онкологических больных пожилого возраста.
470
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Глава 16
Терапия неотложных состояний
у онкологических больных
А. А. Феденко,Д. С. Рзаев
16.1. Компрессия спинного мозга
Этиология. Компрессия спинного мозга — одно из неотложных состояний в онко-
логии. Компрессия спинного мозга в 85 % случаев бывает вызвана распространением
метастазов в тела позвонков, в 10% — ростом опухоли в межпозвоночное отверстие
(особенно при лимфомах), в 4% — ростом интрамедуллярной первичной опухоли.
Наиболее часто компрессию спинного мозга вызывают метастазы рака молочной
железы, легкого, простаты — до 40% случаев. Компрессия спинного мозга может так-
же возникать при метастазах рака почки, саркомах, лимфомах и миеломной болезни.
Клинические проявления. У 95% больных первыми симптомами бывают выну-
жденное положение лежа, боль в спине, часто усиливающаяся при движении и каш-
ле. Боль отмечается наиболее часто на стороне поражения тела позвонка, но может
быть корешкового происхождения, локализуясь в пределах 1-2 позвонков от места
повреждения. Обычно вслед за болью в спине постепенно появляются другие сим-
птомы: слабость, потеря чувствительности, нарушение функций кишечника и мочево-
го пузыря; но может отмечаться и очень быстрое ухудшение состояния, заканчиваю-
щееся параплегией.
Болевой синдром обычно возникает за несколько недель или месяцев до появле-
ния других симптомов и признаков компрессии спинного мозга. Болевые ощущения
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ 471
Терапия неотложных состояний у онкологических больных
могут быть вызваны сдавлением нервных структур и нестабильностью позвоночно-
го столба.
Диагностика. Крайне важна своевременная диагностика для определения тактики
лечения. Методом выбора служит рентгенография и MPT. МРТ позволяет визуализи-
ровать мягкотканные структуры позвоночника: связки, межпозвонковые диски, обо-
лочки спинного мозга и сам спинной мозг с имеющимися в нем изменениями (ишемия,
отек, кровоизлияние), экстра- и интрадуральные кровоизлияния, а также изменения в
телах позвонков. Альтернативным методом диагностики может послужить КТ.
При установке диагноза компрессии спинного мозга в первую очередь необходимы
следующие мероприятия:
И Немедленная консультация нейрохирурга и радиолога!
® Купирование болевого синдрома для проведения полноценного неврологиче-
ского осмотра. Кортикостероиды обычно дают облегчение на несколько часов,
но большинству больных приходится применять опиоидные анальгетики.
И Покой. Обычно нет необходимости принудительного покоя, т. к. пациенты сами
выбирают оптимальное положение для уменьшения болевых ощущений без ри-
ска ухудшения неврологического статуса.
Я Профилактическое назначение антикоагулянтов после выполнения спинномоз-
говой пункции или при отсутствии показаний к ней.
Я Профилактика запора, который возможен на фоне поражения спинного мозга и
применения анальгетиков, угнетающих моторику кишечника.
Я Применение корсетов у больных, не отвечающих на обезболивающую терапию.
Лечение. Кортикостероиды уменьшают отек окружающей ткани и могут значитель-
но улучшить состояние больного до начала лечения. Обычно назначается в/в дексаме-
тазон в начальной дозе 10 мг и в дальнейшем 4-6 мг в/в или внутрь каждые 6 ч. Учи-
тывая, что кортикостероиды имеют выраженные побочные эффекты, их доза должна
быть быстро снижена сразу после начала терапии. При этом назначение противояз-
венной терапии для профилактики язвенных или эрозивных дефектов органов ЖКТ,
вызванных кортикостероидами, обязательно.
Лучевая терапия. Цель лучевой терапии больных с компрессией спинного мозга —
срочная декомпрессия для сохранения способности самостоятельно передвигаться и
предупреждения атонии кишечника и мочевого пузыря. Лучевая терапия проводится в
СОД 40-45 Гр при РОД 2-2,5 Гр. Также применяется облучение в дозе 4-8 Гр первые
2-3 дня с последующим уменьшением дозы до стандартной.
Хирургическое лечение. Передняя или задняя декомпрессия может дать немедлен-
ный эффект. Хирургическое лечение абсолютно показано при сдавлении спинно-
го мозга костными фрагментами. При выборе показаний к хирургическому лечению
необходимо учитывать соматический статус пациента, костную и висцеральную дис-
семинацию, чувствительность к химио- и лучевой терапии и длительность невроло-
гической симптоматики. Также хирургический метод применяется для стабилизации
позвоночного столба (даже в отсутствие признаков компрессии). При компрессион-
ных переломах тел позвонков вследствие литических метастазов в настоящее время
активно используется чрескожная вертебропластика.
Химиотерапия применяется редко и только у больных с высокочувствительны-
ми опухолями. Большой опыт применения этого метода накоплен у детей с саркомой
Юинга и нейробластомой. Также возможно использование эмболизации высокова-
скуляризованных опухолей, а также методов стереотаксической хирургии, особенно
у больных, получавших ранее лучевую терапию.
472 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Синдром сдавления верхней полой вены
16.2. Синдром сдавления верхней полой вены
Этиология и патогенез. Синдром сдавления верхней полой вены (ССВПВ) — тяже-
лое осложнение опухолевого процесса, обусловленное нарушением тока крови по
стволу верхней полой вены. ССВПВ может развиться по нескольким причинам: сдав-
ление вены извне, тромбоз верхней полой вены, прорастание стенки вены опухолью.
ССВПВ развивается очень быстро при сдавлении вены в верхнем средостении. Тол-
щина стенки верхней полой вены очень мала. Кроме того, она полностью окружена
лимфоузлами, в которые могут метастазировать рак легкого, НХЛ, диссеминирован-
ный РМЖ. При частичной обструкции кровообращение развивается по коллатералям
V. asygos, v. esophagus, vv. lateralis thoracic. Подкожные вены также служат важными пу-
тями оттока, поэтому их расширение может свидетельствовать о развитии ССВПВ.
К злокачественным опухолям, часто осложняющимся ССВПВ, относятся рак легкого
(чаще МРЛ, реже — аденокарцинома; по локализации — чаще правого легкого), лим-
фомы, диссеминированный РМЖ, саркомы мягких тканей, тимомы.
Тромбоз и тромбофлебит верхней полой вены могут также вызывать полную или ча-
стичную обструкцию сосуда с нарушением оттока. Длительное использование цен-
тральных венозных катетеров способствует тромбообразованию и инфицированию с
последующим развитием тромбофлебита, на этот процесс также влияет гиперкоагу-
ляция, вызванная опухолевым процессом.
Клинические проявления. Одышка — один из первых симптомов развития
ССВПВ. Кроме того, больные чаще всего жалуются на отечность лица и верхних конеч-
ностей, тяжесть в голове, боль в грудной клетке и дисфагию.
При физикальном обследовании обращают внимание на отечность лица, набухание
вен шеи и подкожных вен передней грудной стенки. Реже встречается кашель, отеч-
ность верхних конечностей, боль за грудиной, цианоз.
Диагностика. Диагноз ССВПВ может быть поставлен на основании клинических
симптомов и характерных признаков рентгенографии грудной клетки (наличие опухо-
ли, расширение тени средостения), данных КТ и флебографии. При отсутствии морфо-
логического диагноза необходима верификация процесса: цитологическое исследо-
вание мокроты, бронхоскопия и медиастиноскопия с биопсией, стернальная пункция,
биопсия лимфоузлов. Верификация диагноза помогает клиницисту в выборе тактики
лечения.
Лечение. При наличии опухолей, высокочувствительных к цитостатикам, таких как
МРЛ, лимфопролиферативные заболевания, герминогенные опухоли, лечение следу-
ет начинать с XT. Клиническоеулучшение в этом случае наступает в течение недели.
При локализованном МРЛ и НХЛ предпочтительнее проводить химиолучевую тера-
пию. При этом надо учитывать частые осложнения при одновременном проведении XT
и лучевой терапии — дисфагию и гематологическую токсичность. В связи с этим целе-
сообразно последовательное проведение химиолучевой терапии.
При НМРЛ наличие ССВПВ служит фактором неблагоприятного прогноза. Методом
выбора при этом является крупнофракционная лучевая терапия (4 Гр в первые дни ле-
чения с последующим уменьшением РОД). Эффективность ее составляет около 70%.
Экстренные мероприятия направлены на купирование патологических симптомов,
обеспечение адекватного поступления воздуха в легкие, устранение обструкции вер-
хней полой вены и сдавления органов средостения. Кроме покоя, оксигенотерапии
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 473
Терапия неотложных состояний у онкологических больных
иногда прибегают к трахеостомии, интубации, введению противосудорожных препа-
ратов, использованию кортикостероидов.
При ССВПВ, вызванном тромбозом вены, показана тромболитическая терапия. Эф-
фективность тромболитической терапии тем выше, чем меньше срок существования
тромба. Применяется стрептокиназа 250 000 ЕД в/в струйно в течение более 30 мин,
урокиназа 4400 ЕД/кг в/в струйно более 10 мин.
Для обеспечения полноценного кровотока в верхней полой вене используется уста-
новка внутрисосудистых стентов. Симптомы исчезают в течение 48 ч после стентиро-
вания. Причем полная обструкция верхней полой вены не является противопоказани-
ем к стентированию, возможна также повторная установка внутрисосудистого стента.
Назначение в данном случае тромболитической терапии сомнительно. Явных преиму-
ществ применения тромболитической терапии после стентирования нет. Рекомендо-
ван прием варфарина 1 мг/сут до достижения МНО > 1,671
16.3. Синдром лизиса опухоли
Этиология. СЛО — экстренное неотложное состояние в онкологии, вызван быстрым и
массивным распадом опухоли, сопровождающимся выбросом в кровяное русло боль-
шого количества внутриклеточных электролитов (калия, фосфора, кальция) и продук-
тов деградации пуринов (мочевая кислота, ксантины и гипоксантины). Катаболизм ну-
клеиновых кислот приводит к гиперурикемии, а высокое содержание мочевой кислоты
в моче может обусловить ее кристаллизацию и осаждение нерастворимых кристаллов
в почечных канальцах и собирательных трубочках, что вызывает острую почечную не-
достаточность. К острой почечной недостаточности также может привести гиперфос-
фатемия, вызывающая преципитацию нерастворимых соединений фосфора и кальция в
почечных канальцах. Наряду с этим возникает гипокальциемия, часто приводящая к ги-
помагнеземии, нарушению нервно-мышечной проводимости и сократимости гладкой и
скелетной мускулатуры (судороги, спазмофилия, аритмии, остановка сердца).
Чаще всего СЛО наблюдается при лечении острых лейкозов, высокодифферен-
цированной лимфомы; реже отмечается при лечении солидных опухолей с высокой
пролиферативной способностью — МРЛ, герминогенных опухолей.
Классификация
Лабораторный СЛО: отклонение двух или более показателей сыворотки крови:
И мочевая кислота 476 мкмоль/л и более или повышение на 25 % от исходного
УРОВНЯ;
й калий 6 ммоль/л и более или повышение на 25 % от исходного уровня;
фосфор 1,45 ммоль/л и более или повышение на 25 % от исходного уровня;
В кальций 1,75 ммоль/л и менее или снижение на 25 % от исходного уровня.
Клинический СЛО представляет совокупность данных лабораторного СЛО и одного
из следующих факторов:
повышение уровня креатинина (> 1,5 х ВГН);
И наличие аритмии или конвульсий.
1 МНО (международное нормализованное отношение) — дополнительный способ представления результатов
протромбинового теста, рекомендованный для контроля терапии непрямыми антикоагулянтами комитетом эк-
спертов ВОЗ, Международным комитетом по изучению тромбозов и гемостаза и Международным комитетом по
стандартизации в гематологии МНО рассчитывается по формуле1 МНО = Протромбиновое время пациента / Нор-
мальное среднее протромбиновое время МНО и протромбин по Квику коррелируют отрицательно снижение
протромбина по Квику соответствует повышению МНО
474 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Синдром лизиса опухоли
Факторы риска
Связанные непосредственно со свойством опухоли:
В высокая пролиферативная способность;
® чувствительность к XT;
» большой размер опухоли (> 10 см в диаметре) ± лейкоцитоз (> 50 000/мкл) или
ЛДГ > 2 х ВГН.
Способствующие развитию СЛО:
В гиперурикемия (мочевая кислота более 446 мкмоль/л) или гиперфосфатемия;
Я предшествующие нарушения функции почек;
В олигурия;
Я гиповолемия.
Профилактика. Для профилактики клинических проявлений СЛО применяется ак-
тивная гидратация, ощелачивание мочи, использование ингибиторов ксантиноксида-
зы и уриказы.
Активная в/в гидратация — основной метод предотвращения развития СЛО. Целью
гидратации служит увеличение экскреции мочи, что уменьшает возможность преци-
питации солей мочевой кислоты в канальцах и собирательных трубочках. Назначается
гидратация раствором 5% декстрозы и физиологическим раствором в пропорции 1:4
от 2 до 3 л/м2 в день под контролем диуреза (при диурезе менее 80-100 мл/м2/ч це-
лесообразно назначение диуретиков). Роль ощелачивания мочи ацетазоломидом или
натрия бикарбонатом остается неясной и дискутабельной. В прошлом рекомендовали
ощелачивание мочи до pH 6,5-7,0 и выше. При этом мочевая кислота превращается в
растворимые соединения, тем самым уменьшая преципитацию в почечных канальцах.
Лечение. Аллопуринол — аналог ксантина, конкурентно ингибирует ксантиноксида-
зу, блокирует метаболизм гипоксантина и ксантина в мочевую кислоту. Аллопуринол
эффективно снижает образование мочевой кислоты и снижает риск развития нефро-
патии. В то же время аллопуринол не уменьшает количество мочевой кислоты в моче
(действуя только на ее образование). Поэтому больным с исходной гиперурикемией
целесообразнее назначать гипоурикемические агенты типа уриказы. Аллопуринол
также увеличивает количество предшественников пуринов (ксантина и гипоксантина)
и может стать причиной развития ксантинурии, отложения кристаллов ксантина в по-
чечных канальцах и острой почечной недостаточности. Также необходимо редуциро-
вать дозы аллопуринола на 65-75 % у больных, получающих 6-меркаптопурин и азати-
оприн. Назначается аллопуринол в дозе 100 мг/м2 каждые 8 ч (суточная доза не должна
превышать 800 мг). При развитии почечной недостаточности доза аллопуринола реду-
цируется на 50%. Возможно также в/в применение аллопуринола 200-400 мг/м2 в 2-3
введения (максимальная суточная доза 600 мг). Обычно назначается за 1-2 дня до нача-
ла XT и продолжается 3-7 дней до нормализации уровня мочевой кислоты.
При электролитных нарушениях, почечной недостаточности, вымывании кристал-
лов мочевой кислоты показана стимуляция диуреза. В первую очередь необходи-
ма адекватная гидратация. Гиперфосфатемия обычно купируется назначением перо-
ральной гидроокиси алюминия. Гиперкалиемия может контролироваться различными
препаратами, выбор которых определяет сам клиницист. Действие одних направле-
но на снижение уровня калия в сыворотке крови, повышая при этом его внутрикле-
точное содержание, — декстроза и инсулин, натрия бикарбонат; другие же препараты
способствуют выведению калия из организма: фуросемид выводит калий с мочой, по-
листирол натрия — через ЖКТ. При этом необходимо мониторирование сердечного
ритма по ЭКГ до нормализации показателей электролитов. Кроме того, в связи сугро-
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 475
Терапия неотложных состояний у онкологических больных
зой развития сердечной аритмии в результате гиперкалиемии и гипокальциемии мож-
но профилактически вводить в/в растворы кальция.
Рекомендуется следующая лечебная тактика.
Для пациентов с небольшим повышением уровня калия (< 5,5 ммоль/л) — нарастаю-
щая гидратация изотоническим физиологическим раствором с однократным введени-
ем 20 мг фуросемида в/в. Вместо изотонического физиологического раствора может
быть использован 5% раствор натрия бикарбоната 200 мл в 1 л 5% декстрозы.
Для пациентов суровнем калия в сыворотке крови 5,5-6 ммоль/л кроме увеличения
дозы в/в инфузий и фуросемида возможно применение полистирола натрия сульфата
в таблетках по 30 г вместе с сорбитолом.
Для пациентов с уровнем калия в сыворотке крови выше 6 ммоль/л или с подтвер-
жденной сердечной аритмией возможны различные варианты:
Я в/в введение 10 мл 10% раствора кальция глюконата с последующим увеличени-
ем объема в/в инфузии, фуросемид и дополнительное введение 1 ампулы 50%
декстрозы и 10 ЕД инсулина в/в;
® полистирол натрия с сорбитолом (за исключением пациентов с застойной сер-
дечной недостаточностью в анамнезе или нарушением проводимости в левом
желудочке).
16.4. Отек головного мозга
Этиология. Отек головного мозга — патологический процесс, характеризующийся
избыточным накоплением жидкости в ткани головного мозга. Развивающееся увеличе-
ние объема головного мозга ведет к повышению внутричерепного давления.
У онкологических больных отек головного мозга наблюдается при метастатическом
поражении вещества головного мозга. Источником метастазов может стать практиче-
ски любое новообразование^ взрослых это преимущественно рак легкого (40-50%).
молочной железы (15-20%), меланома (10-11 %), опухоли из невыявленного первич-
ного очага (5-15 %), рак почки (6 %), опухоли ЖКТ (5 %), матки (5 %), яичников (2 %).
Клинические проявления. Метастазы в веществе головного мозга обычно сопро-
вождаются рядом неврологических нарушений. Дебют неврологических нарушений
может быть различным:
И опухолеподобный вариант, когда общемозговые и очаговые симптомы нараста-
ют на протяжении нескольких дней или недель;
Я апоплексический вариант, имитирующий инсульт, когда очаговые симптомы
(афазия, гемипарез, фокальные эпиприпадки и др.) возникают остро и, как пра-
вило, обусловлены кровоизлиянием в метастаз или окклюзией мозгового сосуда
метастатическим эмболом (такое течение характерно для метастазов хориокар-
циномы, меланомы, рака легкого);
Я ремиттирующий вариант, когда общемозговые и очаговые симптомы имеют вол-
нообразное течение, напоминающее сосудистый или воспалительный процесс.
Клиническая картина чаще обусловлена сочетанием очаговых и общемозговых сим-
птомов и зависит от локализации метастазов в головном мозге, их размера и степени
выраженности перифокального отека. У 40-50% больных возникает головная боль, у
20% — гемипарез, нарушения когнитивной функции и поведения, фокальные или ге-
нерализованные судорожные припадки. У 3-7 % пациентов наблюдается бессимптом-
ное течение, особенно характерное для рака легкого.
476 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Отек головного мозга
Перифокальный отек нередко увеличивает объем мозга гораздо сильнее, чем сама
метастатическая опухоль, и вместе с ней приводит к повышению внутричерепного
давления, которое проявляется следующими общемозговыми симптомами:
• головная боль, нередко диффузная, усиливающаяся при перемене положения
головы и туловища и сочетающаяся с головокружением;
тошнота и рвота, которые нередки на высоте головной боли и могут быть ранним
признаком метастатического поражения головного мозга;
застойные диски зрительных нервов при исследовании глазного дна;
И сонливость, угнетенное сознание, диплопия, преходящие эпизоды нарушения
зрения, стойкая икота.
На критическое повышение внутричерепного давления указывает триада Кушинга:
повышение систолического АД, брадикардия и урежение дыхания. Внутричерепная
гипертензия может привести к диффузной ишемии мозга и ущемлению или вклинению
мозговой ткани в вырезку намета мозжечка (транстенториальное вклинение), в боль-
шое затылочное отверстие или под мозговой серп. Чаще всего это и служит непосред-
ственной причиной смерти больных.
Диагностика. Основной метод диагностики метастатических опухолей головного
мозга — МРТ, которая обладает наиболее высокой чувствительностью и позволяет об-
наружить множественные метастазы даже в тех случаях, когда при КТ виден только
один очаг.
Лечение. Больным с клиническими признаками внутричерепной гипертензии, а так-
же при обнаружении на КТ или МРТ отека головного мозга либо смещения его струк-
тур начинают терапию кортикостероидами. Препаратом выбора служит дексамета-
зон благодаря его биодоступности и минимальным побочным эффектам. Стандартные
дозы дексаметазона составляют 4-6 мг каждые 6-8 ч. При недостаточной эффектив-
ности дозу увеличивают до сверхвысокой, иногда достигающей 25 мг каждые 6 ч. Учи-
тывая высокую частоту побочных эффектов, доза кортикостероидов должна быть по
возможности минимальной. Из-за риска желудочно-кишечного кровотечения и дру-
гих побочных эффектов высокие дозы (> 32 мг/сут) не назначают более чем на 48-
72 ч. Кроме того, с профилактической целью необходимо использовать препараты,
защищающие слизистую оболочку желудка. Кортикостероиды позволяют контроли-
ровать неврологические симптомы от нескольких недель до нескольких месяцев, при
их назначении медиана выживаемости больных с клиническими проявлениями мета-
стазов в головном мозге, не получающих противоопухолевого лечения, увеличивает-
ся с 1 до 2 мес. Противосудорожные препараты назначают только при фокальных или
генерализованных судорожных припадках.
Пациентам с выраженным отеком головного мозга и повышением внутричерепно-
го давления или ущемлением ствола головного мозга должна проводиться агрессив-
ная дегидратация. Назначают маннитол в дозе 50-100 мг (в 20-25% растворе) в/в в те-
чение 30 мин с последующим введением 20-40 мг лазикса в/м для предотвращения
компенсаторного накопления жидкости в веществе головного мозга. Введения можно
повторять каждые 6-8 ч под контролем электролитов крови. В редких случаях прово-
дится интубация для гипервентиляции и уменьшения давления углекислого газа до 25-
30 мм рт. ст., чтобы снизить внутричерепное давление.
При стабилизации состояния больного проводится терапия, направленная на устра-
нение причины отека головного мозга. Лучевая терапия как самостоятельный метод
лечения показана при множественных метастазах в головном мозге и солитарных не-
операбельных метастазах. Суммарная доза облучения всего головного мозга состав-
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 477
Терапия неотложных состояний у онкологических больных
ляет 30-36 Гр в течение 2-3 нед. Эффективность лечения метастазов во многом зави-
сит от радиочувствительности опухоли (при раке молочной железы и легких обычно
выше, чем при меланоме). XT метастазов в головном мозге в основном используется в
тех случаях, когда первичная опухоль чувствительна к проводимому лечению (герми-
ногенные опухоли, МРЛ, хориокарцинома, лимфомы), а противоопухолевый препарат
способен проникнуть через ГЭБ. Хирургическое лечение проводят преимущественно
больным с солитарным метастазом в головном мозге при контролируемом первичном
очаге. Чаще оперируют метастазы, расположенные в относительно безопасных для
нейрохирургического вмешательства областях мозга, например в лобной доле, моз-
жечке, височной доле недоминантного полушария. При наличии кистозной опухоли
возможна установка резервуара Оммайя для дренирования опухолевой кисты и, сле-
довательно, декомпрессии.
16.5. Гиперкальциемия
Этиология. Гиперкальциемия при злокачественных новообразованиях — наиболее
распространенное проявление паранеопластического синдрома и составляет около
40% всех случаев гиперкальциемии. Гиперкальциемия на фоне онкологических забо-
леваний у 80 % пациентов обусловлена воздействием пептидов, подобных паратгор-
мону^ 20% больных развивается под влиянием цитокинов, таких как ИЛ и ФИО.
Причины гиперкальциемии при злокачественных новообразованиях:
метастазы в костях — локальное воздействие цитокинов, стимулирующих фак-
тор активации остеокластов;
И миеломная болезнь — выработка парапротеина, связывающего белки с кальци-
ем, тем самым повышая содержание кальция в сыворотке крови;
секреция пептидов, подобных паратгормону.
Опухоли, при которых наиболее часто встречается гиперкальциемия:
® РМЖ;
® МРЛ;
почечноклеточный рак;
Я рак мочевого пузыря;
И миеломная болезнь.
Клинические проявления. Одними из первых признаков служат полиурия и ник-
турия как следствие нарушения концентрационной функции почек. Общие симпто-
мы — анорексия, мышечная слабость, запор, быстрая утомляемость. Гиперкальцие-
мия может вызывать серьезное обезвоживание, азотемию, ступор, кому и сердечный
коллапс.
Наравне с гиперкальциемией в сыворотке крови можно выявить гипокалиемию, ги-
перальбуминемию, повышение креатина и остаточного азота в крови. Также наблю-
дается гипохлоремический метаболический алкалоз, а при наличии гиперпаратирео-
за — метаболический ацидоз.
Лечение гиперкальциемии при злокачественных опухолях заключается в двух на-
правлениях:
Я уменьшение уровня кальция в сыворотке крови;
Я лечение основной причины возникновения гиперкальциемии.
478 ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
Анафилаксия и анафилактоидные реакции
Неотложные мероприятия необходимы при содержании кальция более 3,5 ммоль/л,
нарушении сознания, гипотензии, сильной боли в животе, тяжелой дегидратации, при-
водящей к возникновению почечной недостаточности.
Основные составляющие при терапии гиперкальциемии:
» регидратация 0,9% раствором натрия хлорида;
терапия бисфосфонатами (золедроновая кислота, Аредиа, Бондронат);
солевой диурез (0,9% раствор натрия хлорида + фуросемид).
Регидратация и восстановление объема циркулирующей крови — наиболее важ-
ный пункт терапии гиперкальциемии. Проводится изотоническим раствором натрия
хлорида и часто требует введения 4-6 л в 1 -е сутки. Регидратация без дополнительных
мер может незначительно снизить уровень кальция в крови — до 10 %. При этом стиму-
лируется работа почек, что ведет к экскреции кальция с мочой.
Солевой диурез. После восстановления объема циркулирующей крови можно фор-
сировать диурез. Введение изотонического солевого раствора в дозе 200-300 мл/ч
сопровождается в/в введением 20-80 мг фуросемида каждые 2-4 ч для достижения
диуреза 100-150 мл/ч. Этот метод требует строгого контроля за состоянием дыха-
тельной и сердечно-сосудистой систем, необходимо избегать перегрузки жидкостью.
Также требуется постоянный контроль лабораторных данных о состоянии электроли-
тов крови, чтобы поддержать кислотно-основной баланс и предотвратить электролит-
ные нарушения, связанные с повышенным выведением с мочой натрия, калия, магния.
Бисфосфонаты — аналоги неорганического пирофосфата, который связывается с
гидроксиапатитом на поверхности кости и снижает резорбцию путем подавления ак-
тивности остеокластов.
Золедроновая кислота (Зомета, отечественный аналог — Резорба) в связи с удобст-
вом применения стала наиболее популярным препаратом в терапии гиперкальциемии.
Вводится в дозе 4-8 мг в течение 15 мин.
Ибандронат (Бондронат) вводится в/в капельно в течение 2 ч в дозе 2-4 мг в зависи-
мости от степени тяжести гиперкальциемии.
Памидронат натрия (Аредиа). Для умеренной гиперкальциемии (кальций
3-3,4 ммоль/л) рекомендуется доза памидроната натрия 60 мг в/в в течение 4 ч 1 раз в
28 дней, при более высоких показателях кальция в сыворотке крови — 90 мг в/в в те-
чение 6 ч.
Большие начальные дозы гидрокортизона — 250-500 мг в/в каждые 8 ч (или адек-
ватные дозы других кортикостероидов) — могут быть эффективны при лечении гипер-
кальциемии, связанной с лимфопролиферативными заболеваниями, или у больных
РМЖ с костными метастазами. Следует учесть, что при применении кортикостерои-
дов может понадобиться несколько дней, чтобы уменьшился уровень кальция в кро-
ви. Поддерживающая терапия должна начинаться с преднизолона в дозе 10-30 мг/сут
внутрь на фоне противоязвенной терапии.
При неэффективности других методов используется гемодиализ. Особенно актуа-
лен этот метод у больных с почечной, сердечной недостаточностью.
16.6. Анафилаксия и анафилактоидные реакции
Этиология, Анафилаксия — IgE-опосредованная реакция гиперчувствительности на
контакт с аллергеном, сопровождающаяся активным выбросом гистамина из тучных
клеток с вовлечением в процесс звеньев иммунной системы и полиорганной недо-
статочностью. Наиболее часто наблюдается на антибактериальные препараты пени-
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ... 479
Терапия неотложных состояний у онкологических больных
ЮаЯЙЙМ»8ЙЯЯа®»ЯЙЙ8а1аЯИЯИИ®»®ЙЯЙ^^ w ->Чг-
циллинового ряда, пищевые агенты, пыльцу растений и др. Характеризуется высокой
частотой летальности. Анафилактоидные реакции — это реакции, возникающие в ре-
зультате непосредственного воздействия аллергена на тучные клетки с последующим
высвобождением гистамина. Наблюдаются при применении лекарственных средств,
компонентов крови, бактериальных продуктов, йодсодержащих контрастных препа-
ратов, МКА. Характеризуются отсутствием признаков полиорганной недостаточности,
более легким клиническим течением и более низкой летальностью.
Клинические проявления. Анафилаксия, как и анафилактоидные реакции, харак-
теризуется сходными клиническими проявлениями: гипотензия, тревога, гиперемия,
тахикардия, бронхоспазм, одышка, зуд, крапивница, кашель, чиханье, нарушение со-
знания.
Симптомы, требующие неотложных мероприятий: быстрое нарастание симптома-
тики, респираторный дистресс-синдром (одышка, усиление работы дыхательной му-
скулатуры, постоянный кашель, стридор), неукротимая рвота, гипотензия, аритмия,
боль за грудиной, синкоп.
Лечение. Препаратом выбора при анафилаксии служит адреналин. Водный раствор
адреналина 0,3-0,5 мг вводится в/м в передненаружную поверхность бедра, повторить
через 3-5 мин при необходимости. При неэффективности в/м и в/в введения адрена-
лина возможно применение продолжительной инфузии адреналина 2-10 мкг/мин, ти-
тровать до достижения эффекта с постоянным гемодинамическим мониторингом. Надо
помнить, что при симптомах анафилаксии противопоказаний к применению адрена-
лина нет!
При симптомах ангионевротического отека с нарушением проходимости дыхатель-
ных путей необходима незамедлительная интубация, при невозможности техниче-
ского выполнения — трахеотомия или крикотомия. Оксигенотерапия — 6-8 л/мин че-
рез лицевую маску, возможно применение 100% кислорода. При бронхоспазме, не
купирующемся в/м введением адреналина, использовать 2,5-5 мг альбутерола в 3 мл
физиологического раствора через небулайзер. При гиперергических реакциях необ-
ходимо добавление антигистаминных препаратов — Н^блокаторов (дифенгидрамин
25-50 мг в/в), Н2-блокаторов (ранитидин 50 мг в/в), кортикостероидов (метилпредни-
золон 125 мг в/в).
При явлениях гипотензии следует применить струйную инфузию 1-2 л физиологи-
ческого раствора, при необходимости повторить. Возможно массивное перераспре-
деление жидкости с выраженным снижением объема циркулирующей крови, для
исключения этого следует уложить пациента и придать возвышенное положение ни-
жним конечностям. Может потребоваться большое количество в/в кристаллоидов для
поддержания гемодинамики. При неэффективности адреналина и большого объема
физиологического раствора может применяться допамин 5-20 мкг/кг/мин в виде дли-
тельной инфузии при постоянном гемодинамическом и пульс-оксиметрическом мо-
ниторинге.
480
ОСЛОЖНЕНИЯ ПРОТИВООПУХОЛЕВОЙ ХИМИОТЕРАПИИ...
ПРИЛОЖЕНИЯ
Приложение 1
Общее состояние больного по шкале
Карновского и ECOG-WHO
I Шкала Карновского (активность) Активность, % ECOG-WHO Баллы I
Состояние нормальное, жалоб нет 100 Нормальная активность 0
Способен к нормальной деятельности, незначи- тельные симптомы или признаки заболевания Нормальная активность с усилием 90 Есть симптомы заболевания, но 1
ближе к нормальному состоянию
80
Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе 70 Больше 50% дневного времени проводит не в постели, но иногда нуждается в отдыхе лежа 2
Нуждается порой в помощи, но способен сам удов- летворять большую часть своих потребностей 60
Нуждается в значительной помощи и медицинском обслуживании 50 Нуждается в пребывании в по- стели более 50% дневного вре- 3
Инвалид. Нуждается в специализированной помо- щи, в т.ч. медицинской 40 мени
Тяжелая инвалидность, показана госпитализация 30
Тяжелый больной. Госпитализация необходима. 20 Не способен обслуживать себя. 4
Необходимо активное лечение Умирающий 10 Прикован к постели
ПРИЛОЖЕНИЯ
483
Приложение 2
Соотношение роста, массы тела и
поверхности тела взрослого человека
вжжи S «5* <Е £
145 150 155 160 165 170 175 180 185 190
45 1,34 1,37 1,40 1,44 1,47 1,50 1,53 1,53 1,59 1,63 1,66
50 1,40 1,43 1,47 1,50 1,53 1,57 1,60 1,63 1,67 1,70 1,73
55 1,46 1,49 1,53 1,56 1,60 1,63 1,67 1,70 1,74 1,77 1,80
60 1,51 1,55 1,59 1,62 1,66 1,69 1,73 1,77 1,80 1,84 1,87
65 1,56 1,60 1,64 1,68 1,72 1,75 1,79 1,83 1,86 1,90 1,94
70 1,61 1,65 1,69 1,73 1,77 1,81 1,85 1,89 1,92 1,96 2,00
75 1,66 1,70 1,74 1,78 1,82 1,88 1,90 1,94 1,98 2,02 2,06
80 1,71 1,75 1,79 1,83 1,87 1,92 1,96 2,00 2,04 2,08 2,12
85 1,75 1,79 1,84 1,88 1,92 1,97 2,01 2,05 2,09 2,13 2,17
90 1,79 1,84 1,88 1,93 1,97 2,01 2,06 2,10 2,14 2,18 2,22
95 1,84 1,88 1,93 1,97 2,02 2,06 2,10 2,15 2,19 2,23 2,28
100 1,88 1,92 1,97 2,01 2,06 2,11 2,15 2,20 2,24 2,28 2,33
105 1,92 1,96 2,01 2,06 2,10 2,15 2,20 2,24 2,29 2,33 2,37
110 1,95 2,00 2,05 2,10 2,15 2,19 2,24 2,29 2,33 2,38 2,42
115 1,99 2,04 2,09 2,14 2,19 2,23 2,28 2,33 2,38 2,42 2,47
120 2,03 2,08 2,13 2,18 2,23 2,28 2,32 2,39 2,42 2,47 2,51
125 2,06 2,11 2,17 2,22 2,27 2,32 2,36 2,41 2,46 2,51 2,56
Примечание 1 При избыточной массе тела для пересчета доз следует исходить из идеальной массы
2 Как правило, при поверхности тела свыше 2 м2 доза рассчитывается на 2 м2
484
ПРИЛОЖЕНИЯ
Приложение 3
Расчет площади поверхности тела
osQAse ... . ... \ n r v
VPoct (см) х масса тела (кг)
3600
При расчете дозы препаратау больных с ожирением используется показатель «иде-
альной» массы тела, к которому добавляют '/3 от найденного показателя.
«Идеальную» массу (ИМ) рассчитывают по формуле:
ИМ =
Рост (см) х окружность грудной клетки (см)
240
или находят по таблице:
«Идеальная» масса тела,
Рост, см Астеник Нормостеник Гиперстеник
Мужчины
155,0 49,3 56,0 62,2
157,5 51,7 58,0 64,0
160,0 53,5 60,0 66,0
162,5 55,3 51,7 68,0
165,0 57,1 53,5 69,5
167,5 59,3 65,8 71,8
170,0 60,5 57,8 73,8
172,5 63,3 69,7 76,8
175,0 65,3 71,7 77,8
180,0 68,9 75,2 81,2
182,2 70,9 77,2 83,6
185,0 72,8 79,2 85,2
Женщины
152,5 47,8 54,0 59,0
155,0 49,2 55,2 61,6
157,5 50,8 57,0 63,1
160,0 52,1 58,5 64,8
162,5 53,8 60,1 66,3
165,0 55,3 61,8 67,8
167,5 56,6 63,0 69,0
170,0 57,8 64,0 70,0
172,5 59,0 65,2 71,2
175,0 60,3 66,5 72,5
177,5 61,5 67,7 74,9
180,0 62,7 68,9 75,7
ПРИЛОЖЕНИЯ
485
Приложение 4
Расчет клиренса креатинина
Расчет клиренса креатинина проводят по формуле Cockroft и Gault (1978):
,, К х (140 - возраст) х масса тела (кг)
Клиренс креатинина = ——5----------с—‘—;-----------, ;
Креатинин сыворотки (мкмоль/л)
Для женщин К = 1,05, для мужчин К = 1,25.
Приложение 5
Расчет дозы карбоплатина по площади
под фармакокинетической кривой
Расчет дозы карбоплатина по площади под фармакокинетической кривой (AUC) про-
водится по формуле Calvert (1989):
Доза карбоплатина = AUC х (Клиренс креатинина + 25).
AUC = 5-7 при монохимиотерапии и у ранее не леченных больных.
AUC = 4-6 при использовании карбоплатина в комбинации и у ранее леченных боль-
ных.
486
ПРИЛОЖЕНИЯ
Приложение 6
Коррекция дозы препаратов (%)
в зависимости от функции почек
Препарат — Клиренс креатинина, мл/мин I
>60 30-60 10-30 <10
Блеомицин 100 50 Отмена Отмена
Цисплатин 100 50 Отмена Отмена
Циклофосфамид 100 100 100 50
Цитарабин (Цитозар) 100 50 Отмена Отмена
Аспарагиназа 100 Отмена Отмена Отмена
Дакарбазин 100 75 50 Отмена
Этопозид 100 100 75 50
Флударабин 100 75 50 Отмена
Гидроксимочевина 100 75 75 50
Ифосфамид 100 75 50 Отмена
Мелфалан 100 75 75 50
Метотрексат 100 50 Отмена Отмена
Пликамицин (Митрамицин) 100 75 50 Отмена
Митомицин 100 75 50 Отмена
Нитрозопроизводные 100 Отмена Отмена Отмена
Пентостатин 100 50 Отмена Отмена
Топотекан 100 75 50 Отмена
Карбоплатин Расчет по формуле Calvert
Капецитабин 100 75 Отмена Отмена
Препараты, не требующие редукции дозы в зависимости от степени на-
рушения почечной функции: дактиномицин, бусульфан, хлорамбуцил, даунору-
бицин, доцетаксел, доксорубицин, фторурацил, гемцитабин, идарубицин, мелфалан,
меркаптопурин, митоксантрон, паклитаксел, прокарбазин, тенипозид, тиогуанин, тио-
тепа, винбластин, винкристин, виндезин, винорелбин, иринотекан.
Источник. Michel С Perry. The Chemotherapy Source book Third Edition, 2001; Edward Chu. Chemotherapy Drug Manu-
al, 2007.
ПРИЛОЖЕНИЯ
487
Приложение 7
Коррекция дозы препаратов
при нарушении функции печени
ИВНй 1 Амсакрин J... 1 При уровне билирубина > 2 мг% (34,2 мкмоль/л) дозу уменьшают на 25 %
Анастрозол Может потребоваться, но официальных рекомендаций нет
Винбластин При уровне билирубина 1,5—3 мг% (25,7-51,3 мкмоль/л) или активности АсАТ 60- 180 МЕ/л дозу уменьшают на 50% При уровне билирубина > 3 мг% (51,3 мкмоль/л) или активности АсАТ > 180 МЕ/л пре- парат не назначают
Винкристин При уровне билирубина 1,5-3 мг% (25,7-51,3 мкмоль/л) или активности АсАТ 60- 180 МЕ/л дозу уменьшают на 50% При уровне билирубина > 3 мг% (51,3 мкмоль/л) или активности АсАТ > 180 МЕ/л пре- парат не назначают
Винорелбин При уровне билирубина 2-3 мг% (34,2-51,3 мкмоль/л) или активности АсАТ 60- 180 МЕ/л дозу уменьшают на 50% При уровне билирубина 3,1-5 мг% (53-85,5 мкмоль/л) дозу уменьшают на 75 % При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Дактиномицин При уровне билирубина > 3 мг% (51,3 мкмоль/л) дозу уменьшают на 50%
Даунорубицин При уровне билирубина 1,5-3 мг% (25,7-51,3 мкмоль/л) дозу уменьшают на 25% При уровне билирубина 3,1-5 мг% (53-85,5 мкмоль/л) дозу уменьшают на 50% При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Доксорубицин При уровне билирубина 1,5-3 мг% (25,7-51,3 мкмоль/л) дозу уменьшают на 50% При уровне билирубина 3,1-5 мг% (53-85,5 мкмоль/л) дозу уменьшают на 75% При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Доксорубицин липосомный При уровне билирубина 1,5-3 мг% (25,7-51,3 мкмоль/л) дозу уменьшают на 50% При уровне билирубина 3,1-5 мг% (53-85,5 мкмоль/л) дозу уменьшают на 75 % При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Доцетаксел Не назначают, если уровень билирубина > 1,5 мг% (25,7-51,3 мкмоль/л), активность АсАТ > 60 МЕ/л или активность ЩФ > 2,5 х ВГН
Идарубицин При уровне билирубина 1,5-3 мг% (25,7-51,3 мкмоль/л) или активности АсАТ 60- 180 МЕ/л дозу уменьшают на 25% При уровне билирубина 3,1-5 мг% (53-85,5 мкмоль/л) или активности АсАТ > 180 МЕ/л дозу уменьшают на 50 % При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Иматиниб Если уровень билирубина превышает ВГН в 3 раза или активность АсАТ — в 5 раз, препарат отменяют. Лечение возобновляют, если уровень билирубина превышает ВГН < 1,5 раза, при этом дозу уменьшают с 400 до 300 мг или с 600 до 400 мг
Иринотекан Может потребоваться, но официальных рекомендаций нет
Метотрексат При уровне билирубина 1,5-3 мг% (25,7-51,3 мкмоль/л) или активности АсАТ > 180 МЕ/л дозу уменьшают на 25 % При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Митоксантрон При уровне билирубина > 3 мг% (51,3 мкмоль/л) дозу уменьшают на 25%
Паклитаксел При уровне билирубина > 5 мг% (85,5 мкмоль/л) или активности АсАТ > 180 МЕ/л пре- парат отменяют
Прокарбазин Может потребоваться, но официальных рекомендаций нет
488
ПРИЛОЖЕНИЯ
'Препарат Снижение дозы при нарушении функции печени
Тиогуанин При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Тиотепа Может потребоваться, но официальных рекомендаций нет
Третиноин Может потребоваться, но официальных рекомендаций нет
Флутамид Может потребоваться, но официальных рекомендаций нет
Фторурацил При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Циклофосфамид При уровне билирубина 3,1-5 мг% (51,3-85,5 мкмоль/л) или активности АсАТ > 180 МЕ/л дозу уменьшают на 25 % При уровне билирубина > 5 мг% (85,5 мкмоль/л) препарат не назначают
Цитарабин Может потребоваться, но официальных рекомендаций нет
Этопозид При уровне билирубина 1,5-3 мг% (25,7-51,3 мкмоль/л) или активности АсАТ 60- 180 МЕ/л дозу уменьшают на 50 % При уровне билирубина > 3 мг% (51,3 мкмоль/л) или активности АсАТ > 180 МЕ/л пре- парат не назначают
Препараты, не требующие редукции дозы при нарушении функции пе-
чени: альтретамин, аминоглутетимид, амифостин, блеомицин, бусульфан, гемцита-
бин, гидроксимочевина, дакарбазин, интерферон-а, ифосфамид, кальция фолинат,
капецитабин, карбоплатин, кармустин, кладрибин, лейпрорелин, ломустин, мелфалан,
меркаптопурин, митомицин, пеметрексед, пентостатин, ритуксимаб, стрептозоцин,
темозоломид, топотекан, флударабин, хлорамбуцил, цисплатин.
Препараты, для которых нет данных о необходимости снижения дозы
при нарушении функции печени: алемтузумаб, оксалиплатин, талидомид, тра-
стузумаб.
Источник Химиотерапия злокачественных новообразований / Под ред Э. Чу и В. Де Виты-мл М , 2008
ПРИЛОЖЕНИЯ
489
Приложение 8
Кожные реакции при применении
ингибиторов EGFR
Специфическая шкала токсичности
Степень тяжести 1
Сыпь Локализованная папу- лопустулезная Генерализованная папу- Генерализованная папу- лопустулезная лопустулезная
Клинические симптомы Минимальны Незначительны (кожный Выраженные (кожный зуд, болезненность) зуд, болезненность)
“=повселне‘"’" 0TC”™’SI Минимально Существенное
Признаки суперинфекции Отсутствуют Высокая вероятность Отсутствуют или присоединение су- перинфекции
Приложение 9
Коррекция дозы цетуксимаба
при кожной сыпи
Кожная токсичность III степени:
1. Очередное введение цетуксимаба откладывается на 1 нед. В случае улучше-
ния (кожная сыпь соответствует II степени) лечение цетуксимабом продолжают
в полной или редуцированной дозе в зависимости оттого, в какой раз возникла
кожная сыпь III степени;
И впервые — лечение в дозе 250 мг/м* 1 2;
во второй раз — лечение в дозе 200 мг/м2;
в третий раз — лечение в дозе 150 мг/м2;
в четвертый раз — лечение цетуксимабом прекращают.
2. Если интервал между введением цетуксимаба превышает 21 день, терапию це-
туксимабом прекращают.
490
ПРИЛОЖЕНИЯ
Приложение 10
Коррекция дозы сорафениба
при кожной токсичности
Степень кожной токсичности Время развития токсичности Коррекция дозы сорафениба
1 степень: онемение, дизестезия, безболезненная отечность, эри- тема или ощущение дискомфор- та в руках либо ногах, которые препятствуют нормальной ак- тивности пациента Лечение продолжают с применением местной симптоматической терапии
II степень: эритема и отечность рук или ног, сопровождающие- ся болью, и/или ощущение ди- скомфорта, которые ограничи- При 1-м эпизоде Лечение продолжают с применением местной симптоматической терапии. В случае отсутствия улучшения в тече- ние 7 дней —- см. ниже
вают нормальную активность пациента Отсутствие уменьшения ин- тенсивности кожной симпто- матики в течение 7 дней или 2—3-й эпизод развития ток- сичности Приостановить терапию сорафенибом до тех пор, пока кожная токсичность не купируется или ее выраженность не снизится до I степени. При возобновле- нии терапии снизить дозу сорафениба на один уровень (400 мг/сут ежедневно или по 400 мг через день)
При 4-м эпизоде Терапию сорафенибом следует полно- стью отменить
III степень: влажная десквама- ция, изъязвления, волдыри, или выраженная боль в руках либо ногах, или выраженный диском- форт, не позволяющий пациенту выполнять свои профессиональ- ные обязанности либо обслужи- вать себя При 1-м или 2-м эпизоде При 3-м эпизоде Приостановить терапию сорафенибом до тех пор, пока кожная токсичность не купируется или ее выраженность не снизится до I степени. При возобновле- нии терапии снизить дозу сорафениба на один уровень (400 мг/сут ежедневно или по 400 мг через день) Терапию сорафенибом следует пре- кратить
ПРИЛОЖЕНИЯ
491
492 ПРИЛОЖЕНИЯ
Приложение 11
Шкала токсичности (критерии NCI СТС)
Вид токсичности Степень
IV
Гематологическая Г г/\ «С * Q /' Qi ' - 4, ’« » >АС,--В.
Лейкоциты >4х 109/л 3,0-3,9 2,0-2,9 1,0-1,9 <1,0
Тромбоциты ВПН* 75,0 —норма 50,0-74,9 25,0-49,0 <25,0
Гемоглобин г/мл г/л ммоль/л ВПН 10,0 — норма 100 —норма 6,2 —норма 8,0-10,0 80-100 4,95-6,2 6,5-7,9 65-79 4,0-4,9 <6,5 <65 <4,0
Гранулоциты >2х 109/л 1,5-1,9 1,0-1,4 0,5-0,9 <0,5
Лимфоциты >2х 109/л 1,5-1,9 1,0-1,4 0,5-0,9 <0,5
Другие Нет Легкие Средние Тяжелые Угрожающие жизни
Кровопотеря - J .Х/л 4-л? п\ 1 Ж -УК” г ’ УУ
Клинически установленная Нет Небольшая, не требую- щая переливания Значительная, 1-2 тран- сфузии Значительная, 3-4 тран- Массив ? 4 трансфузий сфузии н
Инфекция - \Z й М Ass*-. - >
Инфекция Нет Легкая, не требует актив- ного лечения Средняя, пероральные антибиотики Тяжелая, в/в антибиоти- ки, противогрибковые, Угрожающая жизни госпитализация
Фебрильная нейтропения (гранулоциты < 1 х 109, Отсутствует — — температура >38,5 °C) Присутствует —
Гастроинтестинальная ? - У v -• ” " ^5:. >, г
Анорексия Нет Слабая Умеренная Сильная —
ПРИЛОЖЕНИЯ 493
Вид токсичное шл BS ~ ~ ШШШШШШ. 8
Ухудшение аппетита Нет Незначительное Существенное — —
Асцит (неопухолевый) Нет Слабый Умеренный Выраженный Непереносимый
Диарея Нет 2-3 эпизода стула, сла- бое увеличение отделяе- мого колостомы 4-6 эпизодов, или стул несколько раз ночью, 7-9 эпизодов, недержа- ние, синдром мальабсор- бции, значительное уве- личение водянистого от- деляемого > 10 раз в сутки или обильная кровяная диарея, обильный вы- ход из колостомы, требующий
или умеренное увеличе- ние отделяемого парентерального питания, обез- воживание, запор
Запор Нет или без изме- Слабый, коррекция дие- нений той или клизма Умеренный, постоянные симптомы, использова- ние слабительных Сильный, влияет на ежедневную активность Угрожающий жизни (кишечная непроходимость)
Эзофагит/дисфагия Нет Не требующие лечения или безболезненные язвы при ЭГС Требующие лечения Продолжающиеся > 14 дней, несмотря на лечение Потеря массы тела, обезвожива- ние, требуется госпитализация
Сухость рта/носа Нет Слабая Умеренная Сильная —
Изжога Нет Слабая Умеренная Сильная —
Фистула (пищевода, тонкой и толстой кишки) Нет Требуется вмешатель- ство Требуется операция <
Желудочно-кишечное кро- вотечение Нет Слабое, не требует пере- ливания Обильное, перелива- ние 1-2 доз на каждый эпизод Обильное, переливание 3-4 доз на эпизод г i Массивное, переливание > 4 доз j на эпизод
Тошнота Нет Потребление умеренного количества пищи Количество пищи зна- чительно уменьшено, но потребляет Практически не потре- бляет пищи
Рвота Нет 1 раз в сутки 2-5 раз в сутки 6-10 раз в сутки > 10 раз в сутки или требуется регидратация
Тонкокишечная непроходи- мость Нет Периодически Требуется вмешатель- ство Требуется операция
Боль в животе Нет Не требует лечения Контролируется аналь- гетиками Контролируется нарко- тиками Неконтролируемая
Безболезненные язвы, Болезненная гиперемия, Требующие лечения ги- Некроз слизистой, требуется эн-
Стоматит Нет гиперемия или слабое отек или язвы, но пита- перемия, отек или язвы, теральная или парентеральная
воспаление ние возможно питание возможно поддержка, обезвоживание
Шкала токсичности (критерии NCI СТС)
n Степень Е
рид тиксичниити О II 111 IV
Гастрит Нет Купируется антацидами Требует активного кон- сервативного лечения Не контролируется кон- сервативно Перфорация или кровотечение £ о я а S £ X 0
Проктит Нет Перианальный зуд, геморрой Тенезмы или изъязвле- ния, купируемые меди- каментозно Тенезмы или изъязвле- ния, не купируемые ме- дикаментозно Некроз слизистой, геморрагия и другие угрожающие жизни случаи
Нарушение вкуса Нет Слабое Умеренное Сильное — п S ?! ^5 S
Другие Нет Слабые Умеренные Сильные Угрожающие жизни
ЩФ впн <2,5х ВГН 2,6-5,Ох ВГН 5,1-20,0 х ВГН > 20,0 х ВГН
АлАТ впн <2,5х ВГН 2,6-5,0 х ВГН 5,1-20,0 х ВГН >20,0х ВГН "53 S
АсАТ впн <2,5х ВГН 2,6-5,0 х ВГН 5,1-20,0 х ВГН >20,0х ВГН и NCI
Билирубин впн <1,5х ВГН 1,5-3,Ох ВГН > 3,0-10,0 х ВГН >10,0х ВГН
лдг впн <2,5х ВГН 2,6-5,0 х ВГН 5,1-20,0 х ВГН >20,0х ВГН Q
J3 . Клиника Нет — — Прекома Печеночная кома 5
s . Другие Нет Слабые Умеренные Сильные Угрожающие жизни
is | i 4 X X & г. % . \ Д* Аз»/.:?* / / .. ' С;\ .<У* л & > ... 1
Изменения мочевого пузыря Нет Легкая атрофия эпите- лия или незначительные телеангиэктазии Распространенные теле- ангиэктазии Субтотальные телеанги- эктазии, петехии или со- кращение емкости пузы- ря < 15 мл Некроз, фиброз или сокращение ’ емкости пузыря < 100 мл
Креатинин ВПН <1,5х ВГН 1,5-3,Ох ВГН 3,1-6,0 х ВГН >6,0х ВГН
Цистит (небактериальный) Нет Слабые симптомы Симптомы, поддающие- ся лечению Неустраняемые сим- птомы Тяжелый, угрожающий жизни
Фистула (вагинальная, ве- зиковагинальная) Нет — — Требуется вмешатель- ство Требуется операция
Гематурия Нет Только микрогематурия Макрогематурия без сгустков Макрогематурия со сгустками Требуется переливание
Недержание мочи Нет Слабое Умеренное Выраженное —
Степень
Вид токсичности 0 II II! IV
Боль в мочеполовых орга- нах (дизурия, дисменорея) Нет Не требует лечения Контролируется не- контролируется наркоти- наркотическими аналь- % анальгетиками гетиками Неконтролируемая
Протеинурия Без изменений в сравнении с ис- ходной 1+, или <0,3 г%, или < 3 г/л 2-3+, или 0,3-1 г%, или 4+, или > 1 г%, 3-10 г/л или > 10 г/л Нефротический синдром
Вагинит (вагинальные выде- ления неинфекционные) Нет Слабый, не требующий лечения Умеренный, поддающий- Сильный, не поддаю- ся лечению щийся лечению Угрожающий жизни
Другие Отсутствуют Слабые Умеренные — —
ПРИЛОЖЕНИЯ 495
Аллергия Нет Преходящая сыпь, тем- пература < 38 °C Крапивница, температу- ра > 38 °C Сывороточная болезнь, бронхоспазмы, требу- ющие парентерального введения лекарств Анафилаксия
Другие Нет Слабые Умеренные Сильные Угрожающие жизни
ОМЖ о
Лихорадка в отсутствие ин- фекции (включая лекарст- венную) Нет 37,1-38,0 °C 38,1-40,0 °C > 40 °C < 24 ч >40 °С>24ч
Сенная лихорадка (чиханье, заложенность носа, выделе- ния из носа) Нет Слабая Умеренная Сильная
Артралгия Нет Слабая Умеренная Сильная —
Усталость, недомогание Нет Падение на 1 уровень по ECOG Падение на 2 уровня по ECOG Падение на 3 уровня по ECOG —
Миалгия Нет Слабая Умеренная Сильная —
Потливость Нет Слабая Умеренная Сильная —
Познабливание Нет Слабое или кратковре- менное Умеренно выраженное или длительное —
Шкала токсичности (критерии NCI СТС)
496 ПРИЛОЖЕНИЯ
Е 2 :э
Вид токсичности <Д\:'/V Ulv \ J
Кардиоваскулярная* &
Венозная Нет Поверхностная Глубокий венозный тромбоз, не требующий лечения Глубокий венозный тромбоз, требующий ан- тикоагулянтной терапии Эмболия легочной артерии 8 я н S ж г © п s
Аритмия Нет Бессимптомная, прехо- дящая, не требующая ле- чения Повторяющаяся или по- стоянная, не требующая лечения Требующая лечения Требующая мониторинга желу- дочковая тахикардия, фибрил- ляция
Отек Нет 1+ или возникающий только вечером 2+ или развивающийся в течение дня 3+ 4+, анасарка j
Повышение АД Нет или без изменений Бессимптомное пре- ходящее повышение АД >20 мм. рт. ст. или до 150/100 мм рт. ст. (если ранее в норме), не требу- ет лечения Повторяющееся или по- стоянное клинически проявляющееся повы- шение АД > 20 мм рт.ст. или до 150/100 мм рт. ст. (если ранее в норме), не требует лечения или мо- нотерапии Требуется комбиниро- ванное лечение Гипертонический криз i ! 1 ! : = *
Гипотензия Нет или без изменений Не требующая лечения Требует лечения, но без госпитализации Лечение + госпитализа- ция, разрешается в тече- ние 48 ч Лечение + госпитализация,си- туация разрешается в тече- ние > 48ч
Ишемия миокарда Нет Неспецифическое вы- равнивание зубца Т Бессимптомное измене- ние сегмента ST Ишемия без данных за инфаркт Инфаркт миокарда
Боль в груди Нет Не требует лечения Контролируется не- наркотическими препа- ратами Контролируется нарко- тиками Неконтролируемая
Перикардит Нет Бессимптомный Боль в груди, изменения на ЭКГ Симптоматический вы- пот, требуется дренаж Срочно требуется дренаж или констриктивный, требуется опе- рация
Синусовая тахикардия Нет Незначительная Средняя Выраженная Угрожающая жизни
Вид токсичности 7-.S'r ? 5, W: ?'Л/. ; •• -!
Нарушение функции Нет Бессимптомное сниже- ние фракции выброса на 10-20% Бессимптомное сни- жение фракции выбро- са >20% Невыраженная недоста- точность кровообраще- ния, поддающаяся ле- чению Выраженная резистентная недо- статочность кровообращения
ПРИЛОЖЕНИЯ 497
Другие Нет Мягкие Средние Тяжелые Угрожающие жизни
|Нёвролога®^я? > '
Мозжечковая Нет Слабая дискоординация Тремор, асимметрия, не- внятная речь, нистагм Локомоторная атаксия Некроз мозжечка
Выраженная сонливость,
Корковая Нет Легкая сонливость Умеренная сонливость путаница сознания, де- зориентация, галлюци- нации Кома, припадки, токсический психоз
Головокружение Нет Слабое Умеренное Сильное (включая об- морок)
Мышечные спазмы, гла-
Экстрапирамидная Нет Небольшой тремор Умеренный тремор зодвигательный криз, выраженный тремор —
Головная боль Нет Слабая Умеренная или сильная преходящая Постоянная сильная
Изменение слуха Нет Только при аудиометрии Шум в ушах, снижение слуха, не требующее ле- чения или слухового ап- парата Потеря слуха, корриги- руемая с помощью ап- парата Некорригируемые изменения слуха или глухота
Бессонница Нет Слабая Умеренная Сильная —
Настроение Без изменений Легкая обеспокоенность или депрессия Умеренная обеспокоен- ность или депрессия Сильная обеспокоен- ность или депрессия Мания самоубийства
Нарушение моторики Отсутствует или без изменений Субъективная слабость Легкая объективная сла- бость без значительного влияния на функциони- рование Объективная слабость со значительным влиянием на функционирование Паралич
Невралгическая боль Нет Не требует лечения Контролируется ненарко- тическими препаратами Контролируется нарко* тиками Неконтролируемая боль
Шкала токсичности (критерии NCI СТС)
498 ПРИЛОЖЕНИЯ
Вид токсичности Степень
0 1 II III IV
Изменение личности Нет Неразрушительные для пациента и семьи Разрушительные для па- циента и семьи Опасные для других и для себя Психоз
Сенсорная Отсутствует или без изменений Слабые парестезии, по- теря глубоких рефлексов Слабая или умеренная потеря чувствительно- сти, умеренные паре- стезии Потеря чувствительно- сти или парестезии, на- рушающие функцию —
Нарушение зрения Отсутствует или без изменений Затрудненное зрение Симптоматическая или субтотальная потеря зрения Слепота
Другие Катаракта Нет Слабые Слабая Умеренные Умеренная Сильные Сильная Угрожающие жизни
Воспаление или отек конъюнктивы, не тре- Требующие назначения Изъязвление или замет-
Конъюнктивит/кератит Нет бующие назначения ан- антибиотиков или корти- ное помутнение рого-
тибиотиков или корти- костероидов костероидов вицы
Сухость глаз Нет Слабая Требующая искусствен- ных слез Сильная Требующая энуклеации
Глаукома Без изменений — — Ухудшение —
Глазная боль Нет Слабая Умеренная Сильная —
Слезотечение Нет Слабое Умеренное Сильное —
Нет Слабые Умеренные Сильные Угоожаюшие жизни
Двязанные с костями и
Боль в костях Нет Не требующая лечения Контролируется не- наркотическими препа- ратами Контролируется нарко- тиками Неконтролируемая
Другие Нет Слабые Умеренные Сильные Угрожающие жизни
» vw: ’ •*•**•* • ***/*«,• « им*** **
Нарушение проникающей способности монооксидазы углерода Уменьшение до >90% от исход- ного Уменьшение до 76-90% от исходного Уменьшение до 51-75% от исходного Уменьшение до 26-50% от исходного Уменьшение до < 50% от исход- ного
Шкала токсичности (критерии NCI СТС)
ПРИЛОЖЕНИЯ 499
Степень
вид iunun*inuviM 0 II III IV
Кашель Нет Слабый Умеренный Сильный —
Отек легких Нет — Амбулаторный контроль Стационарный контроль Требуется интубация
Плеврит Нет Незначительный Умеренный Выраженный Угрожающий жизни
Легочный фиброз ВПН Рентгенологические из- менения, бессимптомные — Симптоматические из- менения
Кровохарканье (исключая кровотечение) Нет Слабое, не требует гемо- трансфузии Выраженное, 1-2 гемо- трансфузии за эпизод Обильное, 3-4 гемотран- сфузии за эпизод
Икота Нет Слабая Умеренная Сильная
Боль Нет Не требующая лечения Контролируемая не- наркотическими препа- ратами Контролируемая нарко- тиками
Пульмонит Нет Рентгенологические из- менения Требуются кортикосте- роиды Требуется кислород
Одышка Отсутствует или без изменений Бессимптомная, выявля- емая при исследовании функции внешнего ды- хания Одышка при физической нагрузке Одышка при нормальной активности
Изменения голоса Нет Слабые Умеренные Сильные
Другие Нет Слабые Умеренные Сильные
Пневмония рассматривается как инфекция
fev ^гА:' -к "4Л ЛЛ'Л-Л'1 'Л >2 . >’ -VJ'’ Л‘А'
Алопеция Нет Легкое выпадение волос Выраженное или почти полное выпадение Тотальное выпадение во- лос нателе
Изменения кожи (например, фотосенсибилизация) Нет изменений пигментации Локальные Распространенные изме- нения пигментации или атрофия Подкожный фиброз или местное мелкое изъяз- вление Распространенное изъязвление или некроз
Десквамация Нет Сухая Влажная Сливная —
Сухость кожи Нет Слабая Умеренная Сильная —
Поверхностное покраснение Нет Слабое Умеренное Сильное —
Шкала токсичности (критерии NCI СТС)
500 ПРИЛОЖЕНИЯ
ifkiSOBkOffi !Н
Синяки/кровотечение Нет Слабовыраженные Обширные, 1-2 дозы крови на переливание Массивное кровотече- ние, >4 доз на перели- вание —
Местная токсичность (экс- травазация) Нет Боль Боль и припухлость, флебит Изъязвление Показана пластическая операция
Изменения ногтей Нет Слабые Умеренные Сильные —
Кожная боль Нет Не требует лечения Контролируется не- наркотическими препа- ратами Контролируется нарко- тиками Неконтролируемая
Эритема, пятнистые или
Сыпь/зуд (неаллергической природы) Нет Эритема, пятнистые или узелковые высыпания узелковые высыпания с нагноением или другими ассоциируемыми сим- птомами Эритема, пятнистые, узелковые или папулез- ные высыпания Отслаивающийся или язвенный $ дерматит
Другие Нет Слабые Умеренные Сильные Угрожающие жизни
Изменение массы тела
Прибавка массы <5% 5,0-9,9 % 10,0-19,9% >20% —
Потеря массы <5% 5,0-9,9 % 10,0-19,9% >20% —
Нарушения свертываемости
Фибриноген ВПН 0,99-0,75 х ВГН** 0,74-0,50 х ВГН 0,49-0,25 х ВГН < 0,24 х ВГН
Протромбиновое время ВПН 1,01-1,25 х ВГН 1,26-1,50 х ВГН 1,51-2,00 х ВГН >2,00х ВГН
Частичное протромбиновое время ВПН 1,01-1,66 х ВГН 1,67-2,33 х ВГН 2,34-3,00 х ВГН >3,00х ВГН
Другие Нет Слабые Умеренные Сильные —
Метаболические нарушения
Гиперкальциемия, ммоль/л <2,64 2,64-2,88 2,89-3,12 3,13-3,37 >3,37
Гипокальциемия, ммоль/л >2,10 2,10-1,93 1,92-1,74 1,73-1,51 <1,50
Гипергликемия, ммоль/л < 6,44 6,44-8,90 8,91-13,8 13,9-27,8 > 27,8 или кетоацидоз
Гипогликемия, ммоль/л >3,5 3,03-3,55 2,19-3,02 1,66-2,18 <1,66
Гипокалиемия, ммоль/л Без изменений или > 3,5 3,1-3,5 2,6-3,0 2,1-2,5 <2,0
Шкала токсичности (критерии NCI СТС)
ПРИЛОЖЕНИЯ
СП
о
вид токсичности
0
Гипонатриемия, ммоль/л Без изменений или >135 131-135 126-130 121-125 <0,29
Гипомагниемия, ммоль/л >0,70 0,70-0,58 0,57-0,38 0,37-0,30 <0,29
Другие Нет Слабые Умеренные Сильные Угрожающие жизни
- - ' .. Ж. 'ЛW* ? ,.'?к ..' Л It 11Ж t
Аменорея Нет Нерегулярные менструации >3 мес. — —
Синдром Иценко—Кушинга Нет Слабовыраженный Выраженный — —
Приливы Нет Слабые или менее 1 раза в сутки Средние или > 1 раза в сутки Частые, мешают нормальной жизни
ДРУГИ6, Нет Слабые Умеренные Сильные Угрожающие жизни
шамв
Разрушение зубов Нет нарушений Слабое Выраженное Сильное —
Зубная боль Нет Не требует лечения Контролируется не- наркотическими препа- ратами Контролируется нарко- тиками Неконтролируемая
Другие Боль, связанная с опухолью Нет Слабые Не требует лечения Средние Контролируется не- наркотическими препа- ратами Тяжелые Контролируется нарко- тиками ^Угро^ющие жизни __ Неконтролируемая
Другие ' Отсутствуют Слабые Умеренные Тяжелые Угрожающие жизни
* ВПН — в пределах нормы. **ВГН — верхняя граница нормы.
Шкала токсичности (критерии NCI СТС
Предметный указатель
А
Абитаксел (Abitaxel) — см. Паклитаксел
Абраксан (Abraxane) — см. Альбумин-стаби-
лизированный нанодисперсный паклитаксел
Авастин (Avastin) — см. Бевацизумаб
Адъювантная и неоадъювантная химиотера-
пия... 28-29
Азацитидин (Azacitidine)...72, 305
Алдеслейкин (Aldesleukin)... 73,231
Алексан (Alexan) — см. Цитарабин
Алемтузумаб (Alemtuzumab)...74, 324-329
Алимта (Alimta) — см. Пеметрексед
Аллергические реакции...439
Алокси Хелсинн — см. Палоносетрон
Альбумин-стабилизированный нанодиспер-
сный паклитаксел... 73
Альтретамин (Altretamine)...74,204
Аминоглутетимид (Aminoglutethimide)...75,
271
Амифостин (Amifostine)...75, 204
Анастера (Anastera) — см. Анастрозол
Анастрозол (Anastrozole)...75, 189-191
Анафилаксия.. .479
Андрогены...33-40, 76,238
Андрокур — см. Ципротерон
Антагонисты гормонов...38
Антагонисты фолиевой кислоты...34
Антибиотики противоопухолевые...36
Антиэметики... 70
Ап репитант... 70
Аранесп (Aranesp) — см. Дарбэпоэтин
Араноза (Aranoza)...77, 130
Аредиа (Aredia) — см. Памидроновая кислота
Аримидекс (Arimidex) — см. Анастрозол
Аромазин (Aromasin) — см. Эксеместан
Аспарагиназа (Asparaginase)...38, 77,291-297,
404-407,416
Атосса (Atossa) — см. Тамоксифен
Афинитор (Afinitor) — см. Эверолимус
Б
Бевацизумаб (Bevacizumab)...42-48, 77, 145,
164,195,205,446
Бикалутамид (Bicalutamide)...76,238
Бикалутера — см. Бикалутамид
БИКНУ — см. Кармустин
Билем (Bilem) — см. Тамоксифен
Билумид (Bilumid) — см. Бикалутамид
Бисфосфонаты...62-66,372,479
Бластокарб (Blastocarb) — см. Карбоплатин
Блеомицетин (Bleomycetin)...78
Блеомицин (Bleomycin)...78, 152, 155,209,
241,258,437
Блеомицин А5 — см. Блеомицетин
Бондронат (Bondronat) — см. Ибандроновая
кислота
Бонефос (Bonefos) — см. Клодроновая ки-
слота
Бортезомиб (Bortezomib)...79, 367-371
Бусерелин (Buserelin)...82
Бусульфан (Busulfan)...79, 393
502 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
в
Вайдаза (Vidaza) — см. Азацитидин
Вальденстрема макроглобул инемия... 331
Вектибикс (Vectibix) — см. Панитумумаб
Велбин — см. Винорелбин
Велкейд (Velcade) — см. Бортезомиб
Велферон (Wellferon)...39
Вепезид (Vepesid) — см. Этопозид
Весаноид (Vesanoid) — см. Третиноин
Вилочковой железы опухоли...272
Винбластин (Vinblastine)...37, 79
Виндезин (Vindesine)...37, 80
Винельбин (Vinelbine) — см. Винорелбин
Винкарельбин (Vincarelbine) — см. Винорел-
бин
Винкатера — см. Винорелбин
Винкристин (Vincristine)...37, 80,258, 356,
366, 375-419
Винорелбин (Vinorelbine)...37 80
Вумон (Vumon) — см. Тенипозид
Г
Гексален (Hexalen) — см. Альтретамин
Гексастат — см. Альтретамин
Гемзар (Gemzar) — см. Гемцитабин
Гемцитабин (Gemcitabine)...35, 81, 150, 171-
175,204
Гемцитар — см. Гемцитабин
Гемцитера — см. Гемцитабин
Герцептин (Herceptin) — см. Трастузумаб
Гестоноронкапроат (Gestonoroncaproat)... 702
Гефитиниб (Gefitinib)...S/, 145
Гидроксикарбамид (Hydroxycarbamide)...81
Гидроксимочевина (Hydroxyurea) — см. Ги-
дроксикарбамид
Гидроксипрогестерон
(Hydroxyprogesterone)... 102
Гикамтин (Hycamtin) — см. Топотекан
Гиперкальциемия.. .478
Гипертермические реакции...443
Гливек (Glivec) — см. Иматиниб
Гозерелин (Goserelin)...S2
Головного мозга опухоли...255
Головы и шеи опухоли... 132
Гонадотропин-рилизинг гормона гипофиза
агонисты.. .81
Гормональные препараты...38
Гранисетрон...59
Граноген — см. Филграстим
Граноцит (Granocyte) — см. Ленограстим
Г-КСФ — см. Ленограстим, Филграстим
ГМ-КСФ — см. Молграмостим, Сарграмостим
Грасальва — см. Филграстим
Дазатиниб (Dasatinib)...S2, 308-312
Дакарбазин (Dacarbazine)...S3, 129-131
Дактиномицин (Dactinomycin)...35, 83,226-
228,375,384-387
Дализол (Dalizol) — см. Кальция фолинат
Дарбэпоэтин (Darbepoetin)...60, 83, 303
Даунозом (Daunoxome) — см. Даунорубицин
липосомный
Дауномицин (Daunomycin) — см. Дауноруби-
цин
Даунорубицин (Daunorubicin)...84, 285, 404
Даунорубицин липосомный (Daunorubicin
Liposomal) 84
ДДП — Цисплатин
Декапептил (Decapeptyl) — см. Трипторелин
Дексразоксан (Dexrazoxane)...S5, 435
Депо-Провера (Depo-Provera) — см. Медрок-
сипрогестерон
Детисен — см. Дакарбазин
Динатрий памидронат — см. Памидроновая
кислота
Диспланор — Цисплатин
Диферелин (Diphereline) — см. Трипторелин
Дихлорметиленбисфосфонат — см. Клодро-
новая кислота
Доксорубицин (Doxorubicin)...35, 71, 85, 13Б-
141, 177,190,219,252-256,378,388,467
Доксорубицин липосомный (Doxorubicin
Liposomal) 85
Доцетакс (Docetax) — см. Доцетаксел
Доцетаксел (Docetaxel)...86, 193,202-206,
252,440
Доцетера (Docetera) — см. Доцетаксел
ДТИК — см. Дакарбазин
Ж
Женских половых органов опухоли...196-228
ЖКТ опухоли... 153-182
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 503
3
Заведос (Zavedos) — см. Идарубицин
Занозар (Zanosar) — см. Стрептозоцин
Зевалин — см. Ибритумомаб
Зексат (Zexate) — см. Метотрексат
Зитазониум (Zitazonium) — см. Тамоксифен
Золадекс (Zoladex) — см. Гозерелин
Золедроновая кислота (Zoledronic acid)...63-
66, 86, 372
Зомета (Zometa) — см. Золедроновая кисло-
та
Зофран — см. Ондансетрон
и
Ибандронат — см. Ибандроновая кислота
Ибандроновая кислота (Ibandronic acid)...65,
86
Ибритумомаб (Ibritumomab)...S7
Ибритумомаб тиуксетан — см. Ибритумомаб
Идарубицин (Idarubicin)...S7,285-289,292-
296
Иксабепилон (lxabepilone)...3S, 87
Иксемпра (ixempra) — см. Иксабепилон
ИЛ-11 — см. Опрелвекин
Иматиниб (Imatinib)...43-47, 88,181,295,
308-313
Имидазол-карбоксамид — см. Дакарбазин
Иммунотерапия... 49-54
Ингибиторы ароматазы...40
Интаксел (Intaxel) — см. Паклитаксел
Интерлейкин-11 — см. Опрелвекин
Интерлейкин-2 (1L-2) — см. Алдеслейкин
Интерферон альфа...50, 88, 331
Интрон A (Intron А)...89
Пресса (Iressa) — см. Гефитиниб
Иринотекан (Irinotecan)...89, 160, 166, 212,
464
Иритен (Iriten) — см. Иринотекан
Ифосфамид (Ifosfamide)... 70, 90, 96,252-256,
264,342, 376
Йонделис (Yondelis) — см. Трабектедин
к
Калумид (Calumid) — см. Бикалутамид
Кальция фолинат (Calcium folinate)...70, 90,
226
Камптера — см. Иринотекан
Кампто (Campto) — см. Иринотекан
Камптотекан (Camptotecan) — см. Ириноте-
кан
Капецитабин (Capecitabine)...97, 164, 178, 466
Карбоплатин (Carboplatin)...9/, 141-145, 201-
213,485
Карботера — см. Карбоплатин
Кардиоксан (Cardioxan) — см. Дексразоксан
Карминомицин (Carminomycin)...36
Кармустин (Carmustine)...92, 130, 342, 437
Касодекс (Casodex) — см. Бикалутамид
Келикс (Caelyx) — см. Доксорубицин липо-
сомный
Кемокарб (Kemocarb) — см. Карбоплатин
Кемоплат (Kemoplat) — Цисплатин
Китрил — см. Гранисетрон
Кладрибин (Cladribine)...92, 330
Клобир — см. Клодроновая кислота
Клодронат — см. Клодроновая кислота
Клодроновая кислота (Clodronic acid)...65, 92
Кожные реакции...489
Колониестимулирующие факторы...55-61,
295,303,340,429,459
Коррекция дозы препаратов...486, 487
Космеген (Cosmegen) — см. Дактиномицин
Костей опухоли первичные...258
у детей 388
Краснитин — см. Аспарагиназа
Кроветворной и лимфоидной ткани опухо-
лп...281-372
Кселода (Xeloda) — см. Капецитабин
Кэмпас (Campath) — см. Алемтузумаб
л
Лапатиниб (Lapati nib)... 93, 191
Ластет (Lastet) — см. Этопозид
Лейкин — см. Сарграмостим
Лейкладин — см. Кладрибин
Лейковорин (Leucovorin) — см. Кальция фо-
линат
Лейкоз волосатоклеточный...329
Лейкозы острые...281
лимфобластные...290
нелимфобластные.. .282
у детей...-403
Лейкозы хронические...306
Лейкомакс — см. Молграмостим
Лейкостим — см. Филграстим
Лейназа — см. Аспарагиназа
504 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Лейпрорелин (Leuprorelin)...S3
Лейцита — см. Филграстим
Леналидомид (Lenalidomid)...53, 93, 304, 371
Ленограстим (Lenograstim)...57, 93
Летрозол (Letrozole)...94, 187-191
Летротера — см. Летрозол
Л изомустин... 94
Лимфолейкоз хронический. ..321
Ломустин (Lomustine)...94, 267, 344
Люкрин-Депо — см. Лейпрорелин
м
wwwww. ллд а? v v- '• '
Мабтера (Mabthera) — см. Ритуксимаб
Маверекс (Maverex) — см. Винорелбин
Маммозол (Mammozol) — см. Анастрозол
Мегейс (Megace) — см. Мегестрол
Мегестрол (Megestrol).../02, 130, 218
Мегестрола ацетат — см. Мегестрол
Медроксипрогестерон
(Medroxiprogesterone)...103, 189,219
Медротестрона пропионат (Medrotestrone
propionat)... 76
Мезотелиома плевры...149
Меланома кожи... 126
Мелфалан (Melphalan)...95, 364-368, 392
Меркаптопурин (Mercaptopurine)...95, 292,
406
Меркеля карцинома...124
Месна (Mesna)... 70, 95,246
Метастазы из невыделенного первичного
очага... 277
Метилтестостерон (Methyltestosterone)...76
Метотрексат (Methotrexate)...34, 96, 225-228,
293, 351-355, 404, 437
Миеластра — см. Филграстим
Миелодиспластические синдромы.. .297
Миелолейкоз хронический...306
Миелома множественная...362
Миелосан (Myelosanum) — см. Бусульфан
Миелофиброз идиопатический...318
Микрофоллин форте — см. Этинилэстради-
ол
Милтекс (Miltex) — см. Милтефозин
Милтефозин (Miltefozine)...97
Митоксантрон (Mitoxantrone)...97, 286
Митомицин (Mitomycin)...97, 437
Митомицин С — см. Митомицин
Митотакс (Mitotax) — см. Паклитаксел
Митотан (Mitotane)... 97, 270
Молграмостим...53, 98
Мочеполовых органов опухоли...229-247
Мюстофоран (Mustoforan) — см. Фотемустин
Мягких тканей опухоли...247-256
н
Навельбин (Navelbine) — см. Винорелбин
Навобан — см. Трописетрон
Надпочечников опухоли...270
Нейпоген (Neupogen) — см. Филграстим
Нейпомакс — см. Филграстим
Нейробластома...377
Нейроэктодермальные опухоли...264
Нейроэндокринные опухоли...274
Нейтростим — см. Филграстим
Нексавар (Nexavar) — см. Сорафениб
Неотложных состояний терапия...471
Неуластим (Neulastim) — см. Пэгфилграстим
Нефробластома.. .373
Неходжкинские лимфомы...345-35/
у детей...415
Неэпителиальные опухоли ЖКТ...179
Нидран (Nidran) — см. Нимустин
Нилотиниб (Nilotinib)...93, 307-313
Нилутамид (Nilutamide)...99
Нимустин (Nimustine)...99, 267
Новантрон (Novantrone) — см. Митоксантрон
Нолвадекс (Nolvadex) — см. Тамоксифен
Ньюмега (Neumega) — см. Опрелвекин
О
Оксалиплатин (Oxaliplatin)...99
Оксатера — см. Оксалиплатин
Оксипрогестерона капронат
(Oxyprogesterone caproate) — см. Гидрокси-
прогестерон
Октреотид (Octreotide)...40, 99,273-276, 433
Ондансетрон...59
Онкаспар (Oncaspar) — см. Аспарагиназа
Онкотрон (Oncotron) — см. Митоксантрон
Опрелвекин (Oprelvekin)...59, 100, 429
Орто-пара-ДДД — см. Митотан
Осложнения химиотерапии...425-446
Остеосаркома.. .259
у детей...333
Отек головного мозга...476
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 505
п
Паклитакс (Paclitax) — см. Паклитаксел
Паклитаксел (Paclitaxel)...73, 100, 142-148,
155,201-206,435,439
Паксен (Рахеп) — см. Паклитаксел
палоносетрон...69
Памидроновая кислота (Pamidronic acid)...63,
66,101,372,479
Панитумумаб (Panitumumab).../O/, 164
Параганглиомы...277
Паракт — см. Карбоплатин
Параплатин (Paraplatin) — см. Карбоплатин
Пегаспаргаза — см. Аспарагиназа
Пеметрексед (Pemetrexed)...34, 102
Печени опухоли у детей...397
Пинъянмицин — см. Блеомицетин
Плаксат — см. Оксалиплатин
Платидиам (Platidiam) — Цисплатин
Платикад — см. Оксалиплатин
Платинол (Platinol) — Цисплатин
Плевриты опухолевые... 151
Побочные реакции химиотерапии...425-446
Полицитемия истинная...313
Полиэстрадиола фосфат (Polyestradiol
phosphate)...119,239
Помегара — см. Памидроновая кислота
Провера (Provera) — см. Медроксипрогесте-
рон
П рогестагены... 102
Прокарбазин (Procarbasine).../03,267, 411-
415
Пролейкин (Proleukin) — см. Алдеслейкин
Пролотестон (Prolotestone)... 76
Проспидин (Prospidin) — см. Хлоксиперазин
Пузырный занос...228
Пуринетол (Purinethol) — см. Меркаптопу-
рин
Пэгфилграстим (pegfilgrastim)...57, 103, 228,
429
р
Рабдомиосаркома... 383
Рак
анальный.. .169
влагалища...2/6
вульвы.. .214
желудка.../56
желчного пузыря... 178
кожи... 123
коры надпочечников...?70
легкого.../39
молочной железы... 182-196
мочевого пузыря...232
носоглотки... 395
печени.. .175
пищевода.../53
поджелудочной железы...170
полового члена...240
почки... 229
простаты...236
толстой кишки... 161
шейки матки...210
эндометрия.. .216
яичников.. .197
Ралтитрексед (Raltitrexed)... 35, 104
Расчет клиренса креатинина...485
Расчет площади поверхности тела...484
Реальдирон (Realdiron)...S9
Реаферон (Reapheron)...30
Ревлимид (Revlimid) — см. Леналидомид
Резорба — см. Золедроновая кислота
Рекормон — см. Эпоэтин-бета
Ретинобластома. ..399
Ритуксимаб (Rituximab)...104, 324-328, 348-
353,420
Ронколейкин — см. Алдеслейкин
Роферон A (Roferon А)... 89
Руби да (Rubida) — см. Идарубицин
Рубомицин (Rubomycinum) — см. Даунору-
бицин
С
Сандостатин (Sandostatin) — см. Октреотид
Сандостатин ЛАР — см. Октреотид
Санфицинат — см. Кальция фолинат
Сарграмостим...59
Саркома Капоши...256
Саркома матки...22/
Саркома Юинга...264
у детей...391
Саркомы.. .247-256
Семинома...244
СииНУ — см. Ломустин
Синдаксел — см. Паклитаксел
Синдроксоцин — см. Доксорубицин
Синдром лизиса опухоли...474
Синдром сдавления ВПВ...473
506 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Синдронат — см. Клодроновая кислота
Синоксал — см. Оксалиплатин
Синэстрол (Sinoestrolum)...//S
Сопроводительные препараты...67-71
Сорафениб (Sorafenib)...104, 129, 177,231, 491
Спинного мозга компрессия...471
Спрайсел (Sprycel) — см. Дазатиниб
Стрептозотоцин (Streptozotocin) — см. Стреп-
тозоцин
Стрептозоцин (Streptozocin)... 705
Стромальные опухоли ЖКТ... 181
Стромальные опухоли яичников...207
Сунитиниб (Sunitinib)...47 105,231
Супрефакт (Suprefact) — см. Бусерелин
Сутент (Sutent) — см. Сунитиниб
т
Тайверб (Tyverb) — см. Лапатиниб
Таксакад — см. Паклитаксел
Таксол (Тахо!) — см. Паклитаксел
Таксотер (Taxoter) — см. Доцетаксел
Талидомид (Thalidomide)...53, 105, 367-372
Талидомид Фармион — см. Талидомид
Тамоксифен (Tamoxifen)...106, 186-192,219
Таргетные (молекулярно-нацеленные) пре-
параты... 41-48,445
Тарцева (Tarceva) — см. Эрлотиниб
Тасигна (Tasigna) — см. Нилотиниб
Таутакс (Tautax) — см. Доцетаксел
Тегафур (Tegafur)...35, 106, 110
Темодал (Temodal) — см. Темозоломид
Темозоломид (Temozolomide)...107, 129
Темсиролимус (Temsirolimus)... 707,231
Тенипозид (Teniposid)...33, 107
Тестостерона пропионат (Testosterone
propionate)... 76
Тетрастерон (Tetrasterone)...76
Тиогуанин (Thioguanine)...108, 405
Тиотепа (Thiotepa)...70S, 152
ТиоТЭФ — см. Тиотепа
Тиофосфамид (Thiophosphamid) — см. Тио-
тепа
Токсическое воздействие
на вены...443
на ЖКТ...429
на кожу...441
на кроветворение...426
на легкие...436
на мочевые пути...437
на нервную систему...440
на сердце...435
Томудекс (Tomudex) — см. Ралтитрексед
Топотекан (Topotecan)...70S, 141,204,213, 465
Торемифен (Toremifene)...709
Торизел (Torisel) — см. Темсиролимус
Трабектедин (Trabectedin)...7O9,204, 252
Транс-ретиноевая кислота — см. Третиноин
Трастузумаб (Trastuzumab)...43-47, 109, 187-
192
Треосульфан (Treosulfan)...770
Треосульфан медак — см. Треосульфан
Третиноин (Tretinoin)... 110
Триксилем (Trixilem) — см. Метотрексат
Трипторелин (Triptorelin)...S2
Тромбоцитемия эссенциальная.. .317
Трописетрон...70
Трофобластическая болезнь...223
У________________________
Уромитексан (Uromitexan) — см. Месна
УФТ (тегафу p/у рацил)... 111
ф________________________
Фазлодекс (Faslodex) — см. Фульвестрант
Фарестон (Fareston) — см. Торемифен
Фарморубицин (Pharmorubicin) — см. Эпиру-
бицин
Фебрильная нейтропения...447-462
Фемара (Femara) — см. Летрозол
Феохромоцитома... 271
Фиброзная гистиоцитома кости...263
Фивофлу (Fivoflu) — см. Флуороурацил
Филграстим (Filgrastim)...56, 111, 429
Фитозид (Fytosid) — см. Этопозид
Флебиты токсические...443
Флудара (Fludara) — см. Флударабин
Флударабин (Fludarabine)...777, 288, 323-328,
352
Флуороурацил (Fluorouracil)
Флурокс (Flurox) — см. Флуороурацил
Флутамид (Flutamide)...772
Фолиниевая кислота — см. Кальция фолинат
Фосфэстрол (Phosphoestrolum)...118
Фотемустин (Fotemustine)...772, 130
Фторафур (Phtorafur) — см. Тегафур
Фторурацил (Phtoruracil)...35, 112, 158-164,
178,387
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 507
Фульвестрант (Fulvestrant).../72
X
«шяамвммишяктяэджнватзод - -
Хемодектомы... 277
Химиотерапия солидных опухолей...123-280
Химиотерапия у пожилых...463
Хлоксиперазин (Chloxiperazine).../73, 397
Хлорамбуцил (Chlorambucil)... 113, 325
Хлорбутин (Chlorbutin) — см. Хлорамбуцил
Хлортрианизен (Chlortrianisenum)... 7 79, 239
Ходжкина лимфома...334
у детей...410
Холоксан (Holoxan) — см. Ифосфамид
Хондросаркома. ,.282
Хориокарцинома.. .224
ц ..
Цетуксимаб (Cetuximab)...113, 164, 490
Циклоплатам (Cydoplatam)...774
Циклоплатин (Cycloplatin) — см. Карбоплатин
Циклофосфамид (Cyclophosphamide)... 114
Циклофосфан — см. Циклофосфамид
Ципротерон (Суproteron)...714,239
Цисплатин (Cisplatin)... 115
Цитарабин (Cytarabine)... 115
Цитогем — см. Гемцитабин
Цитозар (Cytosar) — см. Цитарабин
Цитокины... 50
Цитоплатин (Citoplatin) — Цисплатин
Цитопозид (Cytoposid) — см. Этопозид
Цифелин (Cyphelin)...775
ЦНС опухоли...266
ш
Шкала Карновского... 483
Шкала токсичности...492
э
Эверолимус (Everolimus)...776,231
Экзорум — см. Оксалиплатин
Эксеместан (Exemestane)...776
Экстраза — см. Летрозол
Элоксатин (Eloxatin) — см. Оксалиплатин
Эменд — см. Апрепитант
Эозинофилии большие...312
Эпилем (Epilem) — см. Эпирубицин
508
Эпирубицин (Epirubicin)...776
Эписиндан — см. Эпирубицин
Эпоэтин-альфа (Epoetin Alfa)...60, 117, 303
Эпоэтин-бета (Epoetin Beta)...60, 117, 303
Эпрекс (Eprex) — см. Эпоэтин-альфа
Эрбитукс (Erbitux) — см. Цетуксимаб
Эритропоэтин — см. Эпоэтин
Эрлотиниб (Erlotinib)...45, 117, 145, 174
Эстрадурин (Estradurin) — см. Полиэстрадио
ла фосфат
Эстрамустин (Estramustine)...77S, 240
Эстрацит (Estracyt) — см. Эстрамустин
Эстрогены...38, 118,239
Этинилэстрадиол (Aethinyloestradiol)...779,
239
Этиол (Ethyol) — см. Амифостин
Этопозид (Etoposid)...779
Этопос (Etopos) — см. Этопозид
я
Яичка опухоли...241
А
ACNU — см. Нимустин
Actinomycin D — см. Дактиномицин
ADM — см. Доксорубицин
Adriblastin — см. Доксорубицин
Adrim — см. Доксорубицин
Agovirin — см. Тестостерона пропионат
Alkeran — см. Мелфалан
Ambochlorin — см. Хлорамбуцил
Amethopterin — см. Метотрексат
Ametycine — см. Митомицин
Anandron — см. Нилутамид
Androcur — см. Ципротерон
Androfort — см. Тестостерона пропионат
Androlon — см. Тестостерона пропионат
Androral — см. Метилтестостерон
Aracytidin — см. Цитарабин
В
BCNU — см. Кармустин
Belustine — см. Ломустин
Benzmethyzin — см. Прокарбазин
Bischlorethylnitrosourea — см. Кармустин
Blenamax — см. Блеомицин
Blenoxane — см. Блеомицин
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
BLEO — см. Блеомицин
Bleocin — см. Блеомицин
С
Camptozar — см. Иринотекан
Carubicin — см. Карминомицин
СВ 1348 — см. Хлорамбуцил
CBDCA — см. Карбоплатин
CCNU — см. Ломустин
CDDP — Цисплатин
CeCeNL! — см. Ломустин
Cerubidine — см. Даунорубицин
Chloraminophene — см. Хлорамбуцил
Chlorotrisin — см. Хлортрианизен
CiNU — см. Ломустин
Citadren — см. Аминоглутетимид
Clafen — см. Циклофосфамид
СРТ-11 — см. Иринотекан
СТХ — см. Циклофосфамид
Cycloestrol — см. Синэстрол
Cyproplex — см. Ципротерон
Cyproteron acetate — см. Ципротерон
Cytomid — см. Винкристин
Cytonal — см. Фосфэстрол
Cytosinearabinoside — см. Цитарабин
Cytoxan — см. Циклофосфамид
D
Daunoblastin — см. Даунорубицин
DDP — Цисплатин
Depostat — см. Гестоноронкапроат
DHAD — см. Митоксантрон
DHAQ — см. Митоксантрон
DIC — см. Дакарбазин
Difostilben — см. Фосфэстрол
Dihydrostilbostrol — см. Синэстрол
Diogyn Б — см. Этинилэстрадиол
Diolyn — см. Этинилэстрадиол
Doxil — см. Доксорубицин липосомный
Doxolem — см. Доксорубицин
Drostanoloni Propionas — см. Медротестрона
пропионат
DTIC — см. Дакарбазин
Dyhydroxyanthracenedione — см. Митоксан-
трон
Dylofonn — см. Этинилэстрадиол
Е
Echloril — см. Хлорамбуцил
Eldesin — см. Виндезин
Elspar — см. Аспарагиназа
Emdisterone — см. Медротестрона пропионат
Enanton — см. Лейпрорелин
Endoxan — см. Циклофосфамид
Enduxan — см. Циклофосфамид
Estigyn — см. Этинилэстрадиол
Estramustinphosphat — см. Эстрамустин
Estronal — см. Синэстрол
Ethidol — см. Этинилэстрадиол
Ethinoral — см. Этинилэстрадиол
F
Farlutal — см. Медроксипрогестерон
Flucinom — см. Флутамид
Flutaplex — см. Флутамид
Folliplex — см. Синэстрол
Frugil — см. Флутамид
FT — см. Те гафур
Futrafur — см. Тегафур
G
G-CSF — см. Ленограстим, Филграстим
GM-CSF — см. Молграмостим, Сарграмостим
Genoxal — см. Циклофосфамид
GIST...737
Н
HER2 — см. Трастузумаб
Hexamethylmelamine — см. Альтретамин
Hexestrolum — см. Синэстрол
Homosteron — см. Тестостерона пропионат
Honvan — см. Фосфэстрол
Honvol — см. Фосфэстрол
Hormale — см. Метилтестостерон
Hormonisene — см. Хлортрианизен
Hydrea — см. Гидроксикарбамид
I
да --
1CDT — см. Дакарбазин
ICRF-187 — см. Дексразоксан
Idamicin — см. Идарубицин
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ 509
К
О
Kolpolyn — см. Этинилэстрадиол
Kridolase — см. Аспарагиназа
L
Lanvis — см. Тиогуанин
L-Asparaginase — см. Аспарагиназа
Lenykoran — см. Хлорамбуцил
Leukeran — см. Хлорамбуцил
Lenkoran — см. Хлорамбуцил
Leustatin — см. Кладрибин
Linoral — см. Этинилэстрадиол
L-Pam — см. Мелфалан
L-Sarcolysin — см. Мелфалан
Lupron Depo — см. Лейпрорелин
LY231514 — см. Пеметрексед
Lympholysin — см. Хлорамбуцил
Lyovac — см. Дактиномицин
Lysodren — см. Митотан
м
Madiol — см. Метилтестостерон
Mamomit — см. Аминоглутетимид
Masterid — см. Медротестрона пропионат
Medroxyprogesterone Acetate — см. Медрок-
сипрогестерон
Melestron — см. Тестостерона пропионат
Mesnex — см. Месна
Metace — см. Хлортрианизен
Metandren — см. Метилтестостерон
Methylaminopterinum — см. Метотрексат
Methylhydrazine — см. Прокарбазин
Methyltestosterone — см. Метилтестостерон
Mitoxan — см. Циклофосфамид
ММС — см. Митомицин
МРА — см. Медроксипрогестерон
МТА — см. Пеметрексед
МТХ — см. Метотрексат
Muphoran — см. Фотемустин
Mutamycin — см. Митомицин
Myleran — см. Бусульфан
N
Nathulan — см. Прокарбазин
Natulanar — см. Прокарбазин
Natulane — см. Прокарбазин
Oestraiyn — см. Этинилэстрадиол
Omnadren — см. Тетрастерон
Oncovin — см. Винкристин
Oraviron — см. Метилтестостерон
Oreton F — см. Тестостерона пропионат
Oreton М — см. Метилтестостерон
Orimeten — см. Аминоглутетимид
Ostral — см. Этинилэстрадиол
р
Perandren — см. Тестостерона пропионат
Permastil — см. Медротестрона пропионат
Phenylalanine mustard — см. Мелфалан
Primogyn С — см. Этинилэстрадиол
Primostat — см. Гестоноронкапроат
Procytox — см. Циклофосфамид
Progynon С — см. Этинилэстрадиол
Prospidii Chloridum — см. Хлоксиперазин
Prostap — см. Лейпрорелин
PS341 — см. Бортезомиб
R
Rastocin — см. Доксорубицин
Rituxan — см. Ритуксимаб
Rubidomycine — см. Даунорубицин
S
Sandostatin LAR Depot — см. Октреотид
Sendoxan — см. Циклофосфамид
Stenendiol — см. Метилтестостерон
Sterandryl — см. Тестостерона пропионат
STI-571 (signal transduction inhibitor 571) — см.
Иматиниб
Stilphostrol — см. Фосфэстрол
Sustanon — см. Тетрастерон
Syntex — см. Синэстрол
т
Тасе — см. Хлортрианизен
ТЕРА — см. Тиотепа
Tespamine — см. Тиотепа
Testolutin — см. Тестостерона пропионат
Testoral — см. Метилтестостерон
Trianisoestrol — см. Хлортрианизен
510 РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
Tykerb — см. Лапатиниб
u
U FT — см. УФТ (тегафур/урацил)
V
mimnrimiwrowmiTiiitiin№iinTnnrm'mmiTKimMi^wiim‘T<^ntnr^~~/? •*"ч
VCR — см. Винкристин
Velba — см. Винбластин
Velban — см. Винбластин
Velbe — см. Винбластин
Vironnoneoral — см. Метилтестостерон
VLB — см. Винбластин
VM-26 — см. Тенипозид
VP-16-213 — см. Этопозид
17-ОПК — см. Гидроксипрогестерон
2-Chlorodeoxyadenosine — см. Кладрибин
4-epidoxorubicin — см. Эпирубицин
5-FLI — см. Флуороурацил
6-МР — см. Меркаптопурин
6-TG — см. Тиогуанин
6-меркаптопурин — см. Меркаптопурин
6-тиогуанин — см. Тиогуанин
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХЗАБОЛЕВАНИЙ
511
Научно-практическое издание
РУКОВОДСТВО ПО ХИМИОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ
3-е издание, дополненное и переработанное
Под редакцией Наталии Иннокентьевны Переводчиковой
Главный редактор, канд. мед. наук Д.Д. Проценко
Выпускающий редактор Ю. А. Захарова
Редактор Е. Б. Родина
Корректор Т. Е. Белоусова
Макет, производство Д. Р. Сысоев
Подписано в печать 27 10.2010 г
Формат 70x100 1/i7 Физ.печ. листов 32. Авторских листов 32
Гарнитура типа «антиква-гротеск».
Бумага офсетная. Печать офсетная.
Тираж 4000 экз Зак. 4869.
______Издательство
практическая медицина
Сан -эпид, заключение
№ 77 99.60 953.Д.008765 07 07 от 25.07.2007 г
Для контактов:
Тел.:+7(495)324-93-29 -редакция
+7(916)320-01-55 -производство
+7(495)648-34-22 - реализация
E-mail: medprint@mail.ru; tezey@obook.su, medrel@mail.ru
www.medprint.ru
Отпечатано в полном соответствии с качеством предоставленных
издательством материалов в ОАО «Тверской ордена Трудового Красного
Знамени полиграфкомбинат детской литературы им 50-летия СССР»
170040, г Тверь, проспект 50 лет Октября, 46
lllflOl
5