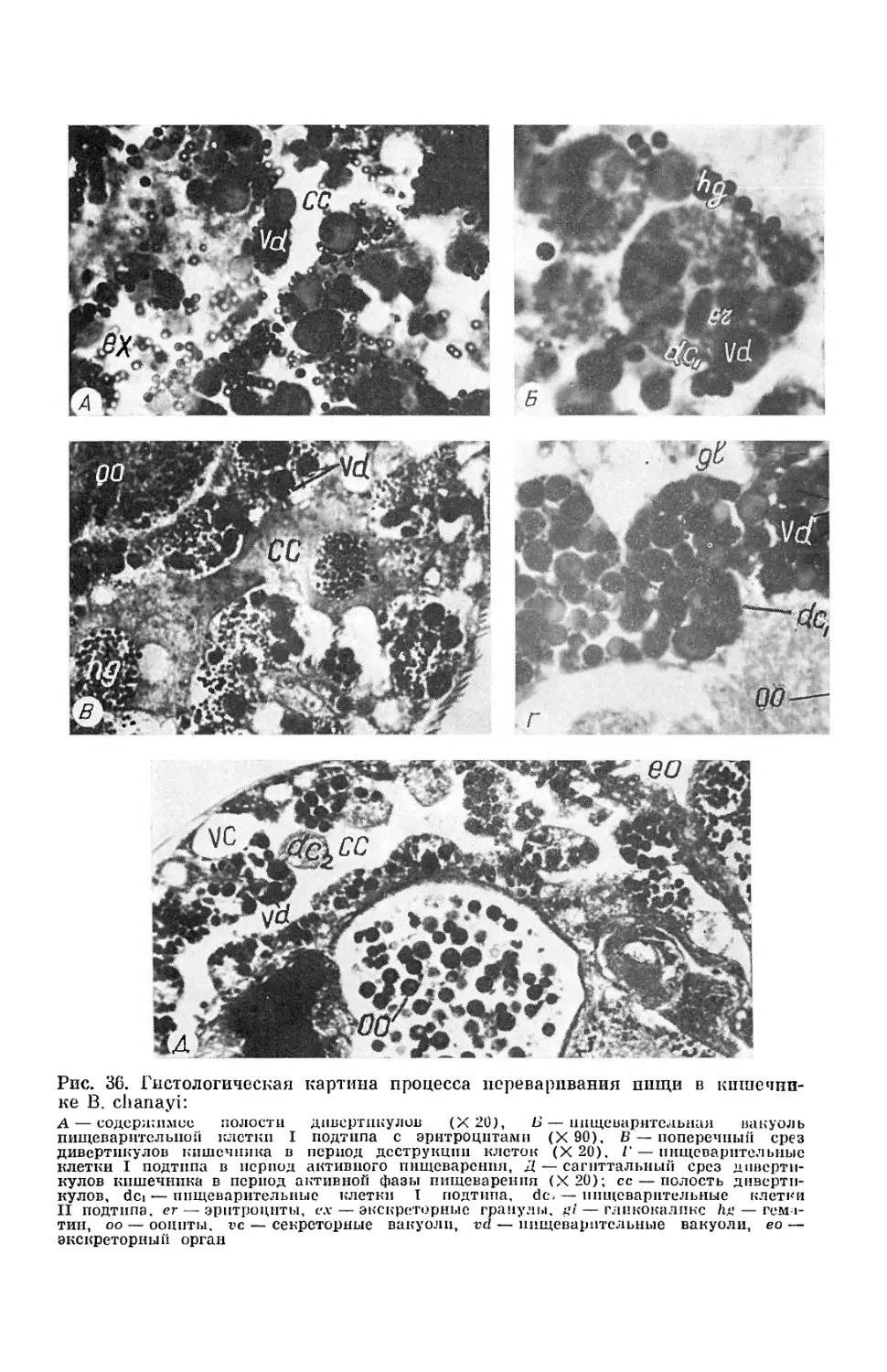
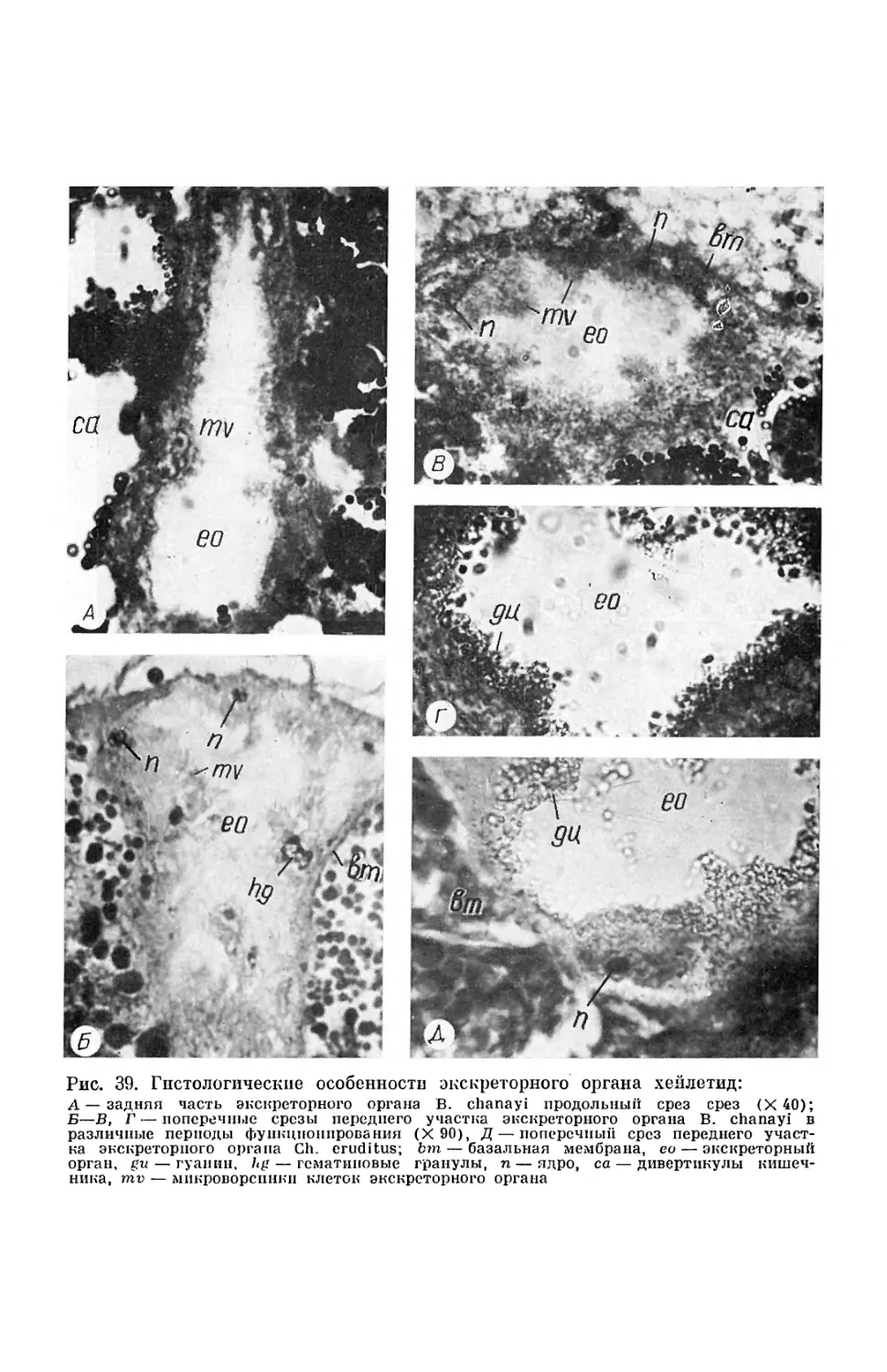
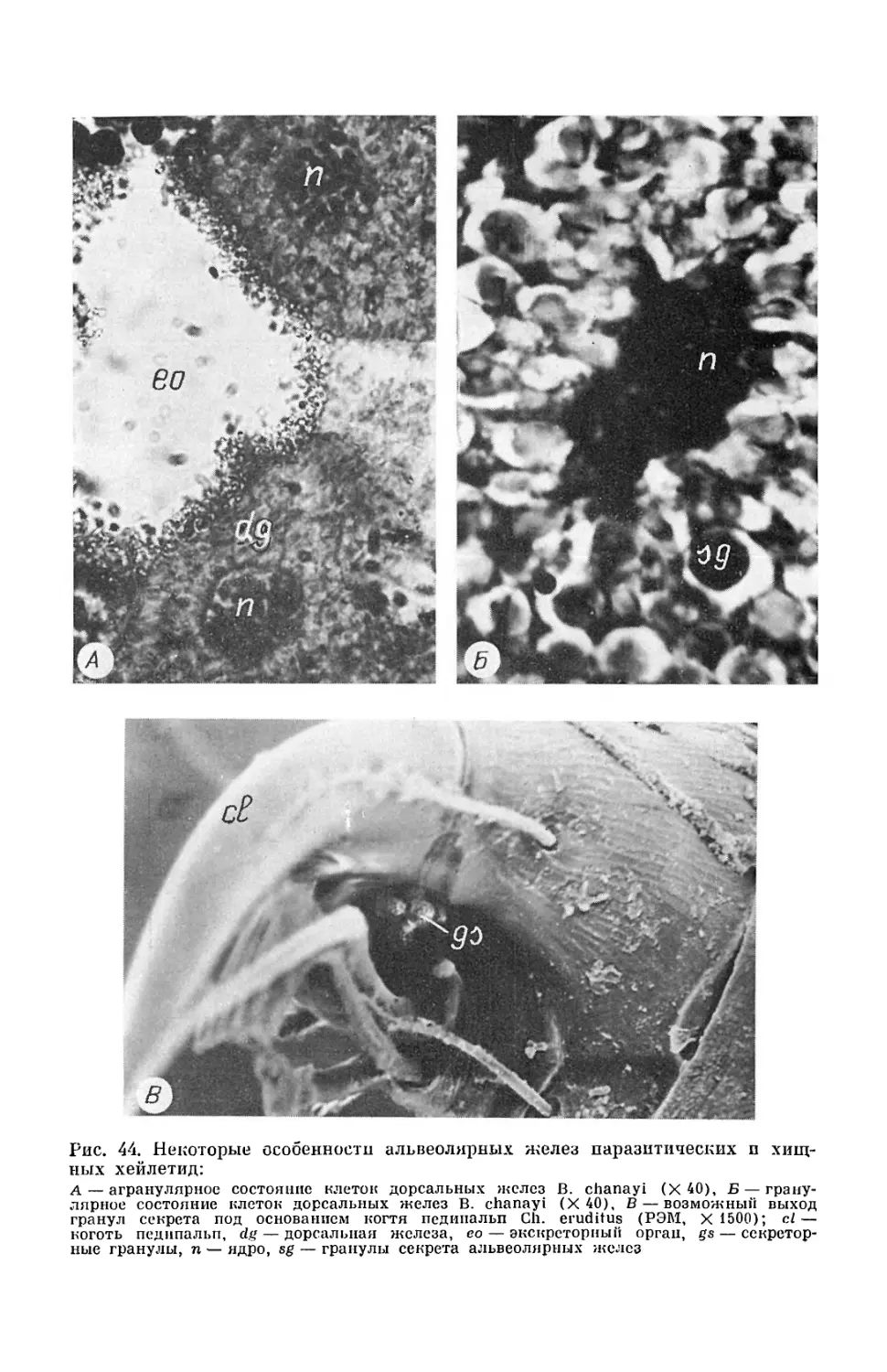
Текст
И.А.Атаюв 3. T. Ibptaes
АКАДЕМИЯ НАУК УКРАИНСКОЙ ССР ИНСТИТУТ ЗООЛОГИИ ИМ. И. И. ШМАЛЬГАУЗЕНА
д.д.дкимов, В.Т. Горголь
ХЕ ТИ bI
УДК 595.42 Ответственный редактор В. П. Васильев Утверждено к печати ученым советом Института зоологии им. И. И. Шмальгаузен» Ац УССР Редакция биологической литературы Редактор В. Х1. Зу батоь- НАУЧНОЕ ИЗДАНИЕ Акильов Игорь Андреевич Горголь Валентина Tu~ьофеевна ХИЩНЫЕ И ПАРАЗИТИЧЕСКИЕ КЛЕЩИ-ХЕИЛЕТИДЫ Оформление художника В. 3. Куницы. Художественный редактор Р. И. Калыш. Технический редактор А. М. Капустина. Корректоры d. Я. Белокопы7ова, Л. Н. Регета ИБ № 10692 Сдано в набор 21.11.89. Подп. в печ. 25.07.90. БФ 01136. Бум. тип. № 1. Обыкн. нов. гарн: Цыс. печ. Физ. печ. л. 7,5+2,75 л. вкл. на мел. бум. Усл. печ. л. 13,33. Усл. кр-отт: 13,33: Уч.-изд. л. 13.2. Тиран~ 800 экз. Заказ 9 — 2893. Цена 3 р. Издательство «Наукова думка». 252601 Киев 4, ул. Репина, 3. Отпечатано с матриц Головного предприятия республиканского производственного объединения «Полиграфкнига» 252057, Киев, 57, ул. Довженко, 3. в Нестеоовской городской ~~пографии, 292310, Нестеров. Львовской обл., ~л. Горького, 8 Зак. 3319. А 1907000000-330,М221 (04) -90 ISBN 5-12-001360-0 � И. А. Акимов, В. Т. Горголь, 1990 Хищные и паразитические клещи-хейлетиды / Акимов И. А., Горголь В. Т.; Отв. ред. Васильев В. П.; AH УССР. Ин-т зоологии им. И. И. Шмальгаузена.— Киев . Наук. думка, 1990.— 120 с.— ISBN 5-12-001360-0 В монографии рассмотрены пути специализации практически ванной группы клещей-хейлетпд к хищничеству и паразитизму. Показано преобразование морфоло- гии и функция органов и систем хейлетид, изменение этологических реакций и эколо- гии видов в связи с эволхоцией трофпкп этих клещей. Впервые описаны некоторые этологические реакции четырех видов клещей-хейлет Бд и особенности паразито- хозяинных отношений у двух паразитических видов. Изложены новые оригинальные данные об особенностях птпцеварительной. выделительной, мышечпой. репродуктив- ной, дыхательной, нервной систем хейлетид. Исследована и детально описана ред- кая, а в набл~одаемой у хейлетид форме — уникальная для клещей вообще способ- ность и паутипопрядению. Выявлены два направления трофической специализации в семействе в процессе становления паразитизма — лимфофагия и гематофагия. Для акарологoR, преподавателей и студентов вузов. Ил. 66. Табл. 7. Библиогр.: С. 112 — 119.
ПРЕДИСЛОВИЕ В большом и экологически многообразном подотряде Trombidiformes существует семейство Cheyletidae, охватывающее до 200 видов небольших (0,2 — 1,6 мм) бело- ватых или желто-оранжевых клещей. Его считают одним из центральных семейств подотряда (Волгин, 1969). Отличительной особенностью семейства является экологи- ческая специализация, в связи с чем его делят (Волгин, 1978) на два подсемей- ства — Cheyletinae и Cheyletiellinae. Некоторые систематики (Smiley, 1970, 1978) считают их даже самостоятельными семействами. Первое подсемейство более много- численное. В него входят хищники, которые, обитая в подстилке, почве, в гнездах различных животных, на растениях и даже на теле насекомых, млекопитающих и птиц, поедают мелких членистоногих, в том числв вредителей растений, пищевых запасов и эктопаразитов. Второе подсемейство значительно меньше первого по объему и включает около двух десятков видов паразитов теплокровных позвоноч- ных — млекопитающих и птиц. Следует отметить, что семейство Cheyletidae — единственное из шести семейств в надсемействе Cheyletoidea (Дубинин, 1957; Волгин, 1978), включающее хищные формы. Остальные семейства этого таксона объединяют исключительно паразитов. Литературные сведения ограничены преимущественно данными о фауне и систематике хейлетид (Волгин, 1969, 1978; Smiley, 1970, 1978). Особенности экологии, анатомии и физиологии этих клещей изучены фрагментарно. Так, экология исследо- валась на примере лишь одного вида — хищного клеща Cheyletus eruditus (Boczek, 1959) . У других представителей семейства изучение экологии сводилось главным образом к констатации отдельных, резко выраженных черт специализации и вредонос- ности некоторых паразитических форм (Волгин, Николаева, 1965; Ewing, Mosier, г охх. 1967; Foxx, Eving, 1969; Furman, Souse, 1969; Haarlov, Morch, 1975). Морфофункцио- нальные особенности хейлетид освещены еще меньше. Они представлены лишь фрагментами анатомии клеща Cheyletus eruditus (Hughes, 1958, 1959; Hafiz, 1935) и характеристикой ротовых органов некоторых паразитических видов хейлетид. Лишь в последние годы были опубликованы также некоторые результаты наших исследований. В то же время изучение хейлетид представляет несомненный инте- рес, во-первых, для выявления возможности участия хищных видов этих клещей в регулировании численности некоторых вредных членистоногих, а во-вторых, для выяснения патогенности и эпидемиологического значения паразитических форм. Изучение хейлетид важно также в сравнительном и эволюционном планах, так как они обладают большим своеобразием морфологии и биологии. В данной монографии обобщены все новые, преимущественно оригинальные сведения о функциональной морфологии, экологии и некоторых сторонах этологии хейлетид. При этом специально изучалась биологическая роль такой своеобразной их особенности, как выделение паутины. Учитывая, что в семействе об ьединены хищные и паразитические формы, особое внимание нами было уделено путям специализации систем органов при переходе этих клещей к паразитизму. hpoMe того, полученные результаты рассматривались с точки зрения возможностей хейле-
~ д как р~~уля~оров численности членистоногих — вредителей сельского хозяйства как потенциальных переносчиков возбудителей заболеваний позвоночных животных. Наконец, особенности морфофункциональной организации и биологии хейлетид свидетельствуют о своеобразии эволюции этого семейства и проявлении эволюцион ных тенденций в надсемействе Cheyletoidea. Работа представляет часть комплексных исследований практически важных групп клещей, проводимых в Институте зоологии им. И. N. Щмальгаузена АН УССР ааатериалом для экологических, этологических и функционально-морфологических исследований хейлетид послужили лабораторные культуры клещей, сборы их с птиц во время весенних и осенних миграций. Наиболее подробно были изучены Cheyletus eruditus ', Cheletomorpha lepidopterorum, Baliericheyla chanayi, Ornitho- cheyletia sp., Использованы имеющиеся в литературе сведения о паразитических клещах Cheyletiella yasguri, Cheyletiella parasitivoraz. Ch. blakei. Для сравнення привлекались результаты исследований некоторых других простигматических тромбидиформных клещей (сем. Anystidae, Tetranychidae и др.). Авторы благодарны за помощь в получении живого материала и в овладении методами его исследования сотрудникам Института зоологии АН УССР В. В. Ба- рабановой, Л. В. Ястребцову, А. М. Полуде и сотруднику Института биологип вну- тренних вод АН СССР Б. И. Куперману. ' Рукопись была подготовлена к печати, когда представилась возможность определить этот вид как Ornithocheyletia leiothrix Fain, 1972, за что авторы благо- дарны А. В. Бочкову (3ИН АН CCCP).
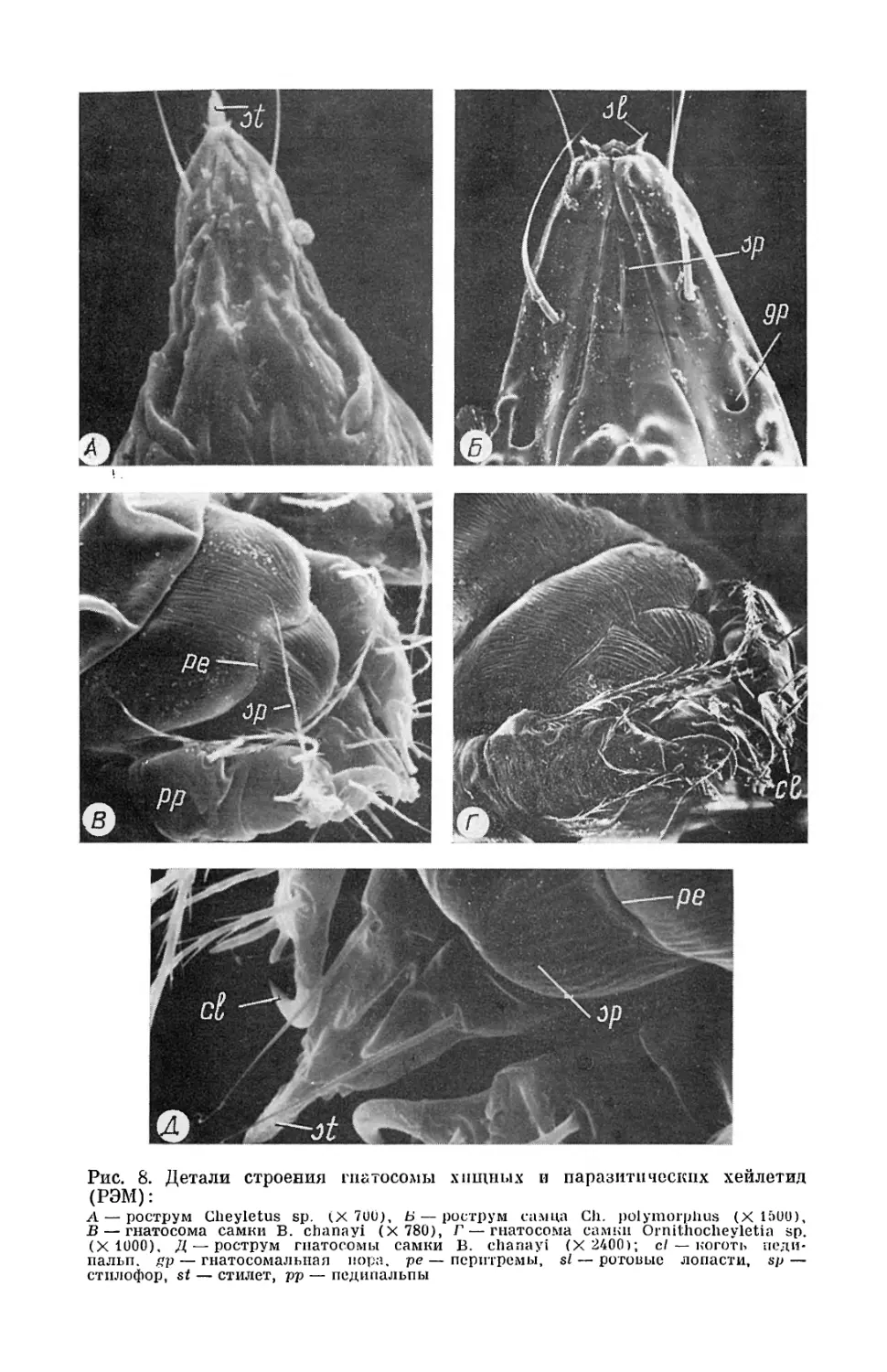
ОБЩАЯ ХАРАКТЕРИСТИКА ХЕЙЛЕТИД ВНЕШНЕЕ СТРОЕНИЕ И ТАГМОЗИС Хейлетиды — сравнительно небольшие клещи (от 0,2 до 1,6 мм) с ром- бовидным уплощенным телом (рис. 1). Реже встречаются формы более округлые или, наоборот, сильно вытянутые (рис. 2, 3, 4) ', специализи- рованные к обитанию в узких пространствах, например в полости очина птичьего пера. На окраску хейлетид влияет содержимое кишечника, про- свечивающееся сквозь светлые покровы и ткани, но чаще всего они жел- товатые или оранжевые, реже — коричневые. Тело клещей четко делится на несущую комплекс ротовых органов гнатосому и ромбовидную идиосому с четырьмя парами ходильных ко- нечностей. Ипиосома, как и у других клещей, лишена сегментации, одна- ко следы деления ее на отделы (тагмы) сохраняются (рис. 1, 2). За- метно (рис. 1) деление на такие тагмы, как проподосома (слившиеся сегменты 1 и II пар ног), метаподосома (слившиеся сегменты III и IV пар ног) и опистосома (лишенная ходильных конечностей) . Отдельные сегменты тела, как и у всех клещей, слиты, причем общее их количе- ство у хейлетид достигает, как считают (Волгин, 1969), 13. Внешний вид клещей-хейлетид и подробный анализ отдельных важ- ных для систематики этих клещей признаков приведены В. И. Волги- ным (1969) . Мы даем наиболее обобщенную характеристику внешнего строения клещей, связанную с функциональными особенностями частей их тела. Наиболее характерная часть тела клещей — гнатосома — у хейлетид очень своеобразна и часто служит признаком, отличающим хейлетид от других тромбидиформных клещей (рис. 5). У хищных форм длина гна- тосомы может достигать более половины длины тела и благодаря мощ- ным, латерально расположенным педипальпам гнатосома часто имеет угловатую, ромбовидную или трапециевидную форму, а такие педипаль- пы, снабженные крупным когтевидным выростом на предпоследнем, вер- шинном, членике — характерный пример конечносте~~, специализирован- ных к захвату и удержанию добычи (рис. 5 — 7). У паразитических форм гнатосома гораздо меньше, педипальпы менее мощные, ориентированы вниз н служат для временной фиксации на теле хозяина (птиц и пи- щух) при питании (рис. 5, 8). У некоторых хейлетид, паразитирующих в шерсти тропи блески~ мле- копитающих (в основном лемуров и виверовых), педипальпы совмест- но с рострумом гнатосомы образуют настоящие органы прикрепления в виде выростов и шипов, между которыми зажимаются отдельные волос- ки шерстного покрова (рис. 5). ' Рисунки 2 — 4, 6 — 13, 19, 20, 24, 25, 28, 29, 31, 32, 34 — 40, 43 — 46, 48 — 50, 52 — 55, 60 — 66 помещены на вклейку.
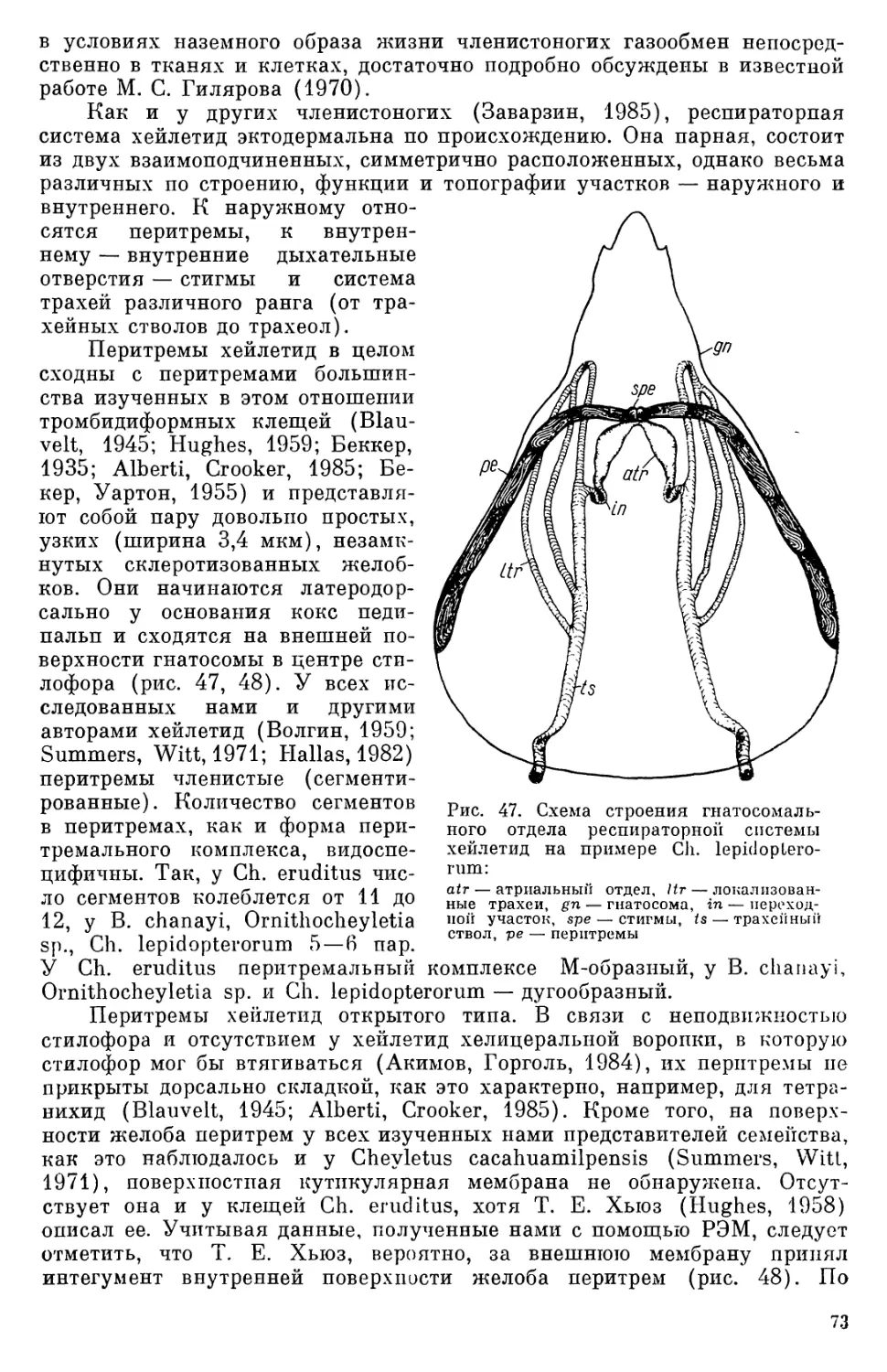
С гнатосомой связаны внешние органы дыхательной системы, так называемые перитремы, которые открываются на дорсальной ее стороне дыхательными отверстиями. Педипальпы (щупальцы) состоят из пяти подвижных члеников (рис. 5 — 8). Вершинный членик (лапка, или тарсус) несет чувствитель- ные гребенчатые щетинки (рис. 6). Ближе к основанию расположен членик (голень. или тибия), несущий упомянутый выше когтевидный мощный шип. За ним следует наиболее хорошо развитый членик РР (бедро, или фемур). Основание гнатосомы образовано тазиками (коксами) щупалец. Проксималь- но между фемуром и коксами рас- полагаются узкие кутикулярные кольца щупалец, представляющие собой сочленов ные части конеч- ности и не обладающие, как будет показано далее, собственными мышцами. Идиосома хейлетид песет че- Ф.-"Ф тыре пары ног и дорсально покры- 'I та чаще всего двумя щитами— передним (протеросомальным) и Ъ-- задним (гистеросомальным) (рис. 1). Изредка щит может быть один (передний) или их три (пе- редний и два задних) . На щитах и свободной от них поверхности кутикулы располагаются щетинки, топография и форма которых слу- Pac. 1. Саыка клеща Cheyletus eruditus (Schrank) (Родендорф, 1940): цп — гнатосома, с1 — коготь педипальп, й~з этих клещей. По бокам переднего гистеросомальный щит, Ы — идиосома, op — щитз на протеросоме у многих оп исто сома, рр — педипальпы, prs — проподо- сомальный щит открыто живущих хейлетид рас- полагаются линз овидные глаза (одна пара). Щиты вентральной стороны скорее редкое исключение для некоторых видов, чем правило. На вентральной стороне идиосомы распо- ложены генитальное (более впереди) и анальное отверстия. Разнообразные по форме щетинки располагаются на поверхности идиосомы и на члениках ног. Их размещение, форма и количество— важный систематический признак. БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ Места обитания хейлетидных клещей самые разнообразные. Хищные формы постоянно встречаются в растительных остатках, подстилке, по- верхностных. слоях почвы, скоплениях зерна, в том числе в запасах, сде- ланных в норах и гнездах мелких млекопитающих, просто в гнездах млекопитающих и птиц, в хранилищах продовольственных запасов че- ловека, на листьях и ветвях деревьев и кустарников. Здесь они всегда находят добычу — клещей и других мелких членистоногих. Некоторые из жилищных хейлетид в поисках добычи переселились не только в гнез- да, но и на тело других животных — млекопита1ощих, птиц и даже
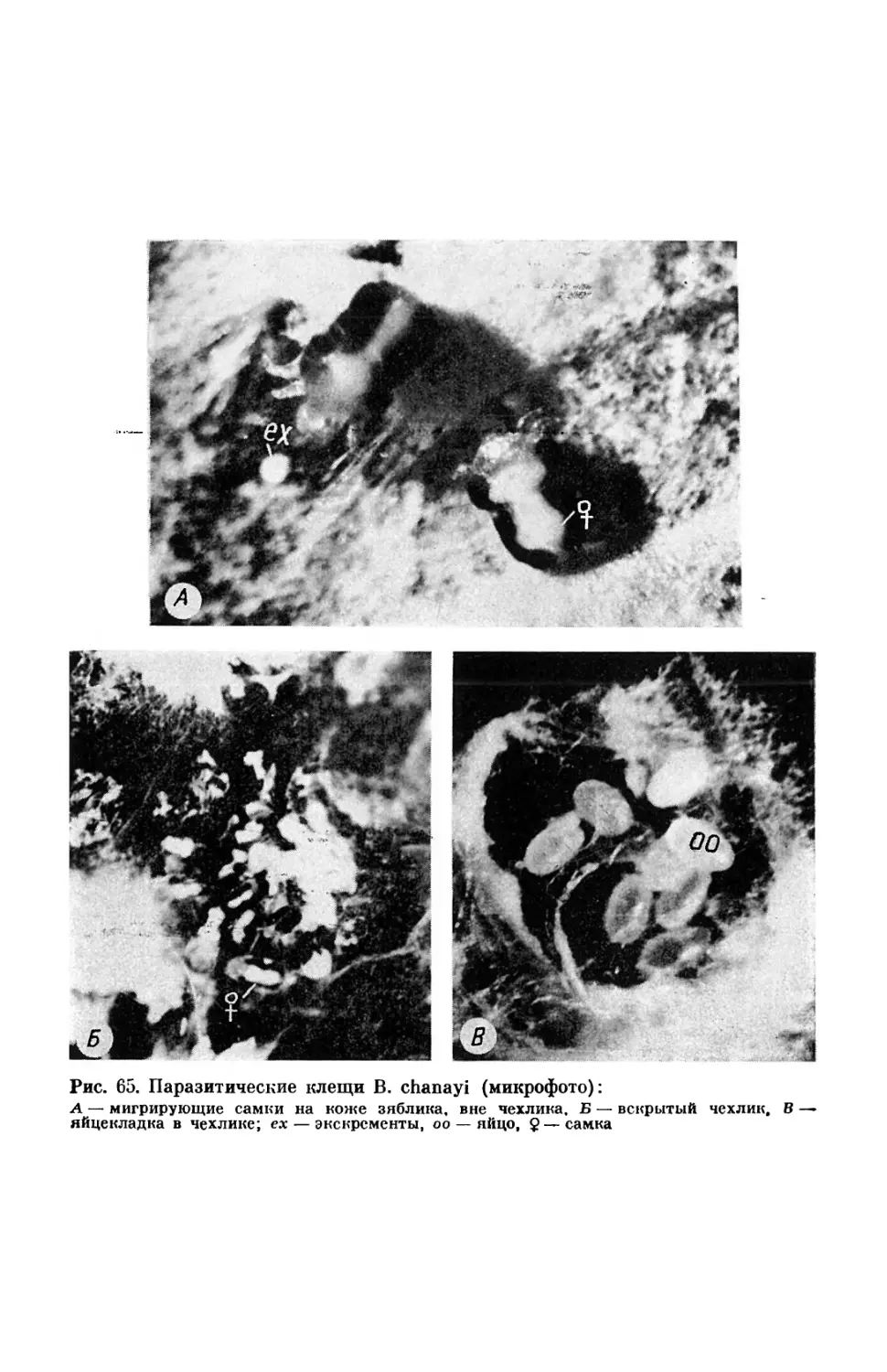
Рис. 5. Гнатосома некоторых свободноживущих и паразитических хейлетид (схе-матизировапно): А — Ch. eruditus (дорсально), Б — Ornithocheyletia sp. (дорсально), В — В. chanayi (дор-сально), Г — Hem icheyletus carvidens (вептрально), Д — Cheyletiella parasitivorax (вентраль-но); cl — коготь педипальп, сз — гребневпдные щетинки, ре — перитремы, рр — педипальпы, spe — стигмы внутрь очинов перьев. На далеко не все представители сем. Cheyletidae сохранили хищничество как стереотип питания. Среди них немало па-разитов, иита~ощихся кровью и лимфой млекопитающих и птиц.
Для хейлетид характерен половой диморфизм. Часто он проявляет- ся не только в размерах (самцы обычно меньше), но и в пропорциях отдельных органов, дополнительных щетинках, щитках, степени скле- ротизации. Лишь у немногих представителей семейства половой димор- физм выражен слабо. Хейлетиды откладывают различное количество яиц, развитие кото- рых происходит по схеме: яйцо — личинка — нимфа 1 — нимфа П— взрослая особь. Как и для других клещей, для личинок хейлетид харак- терны три пары подвижных ног. Четвертая пара появляется у нимфы I. В процессе онтогенеза увеличиваются размеры и количество сегментов тела, усиливается склеротизация покровов. Среди хейлетид развит партеногенез. У многих видов самцы встре- чаются крайне редко или даже неизвестны. Яйца ряда видов хейлетид развиваются под прикрытием паутины (Michael, 1878). У некоторых хейлетид отмечается своеобразное, направленное на защиту потомства (Волгин, 1969) поведение. Хищные формы этих клещей очень прожорливы (Волгин, 1969), однако могут при необходимости длительное время голодать. У многих из них чрезвычайно развит каннибализм. СИСТЕМАТИЧЕСКОЕ ПОЛОЖЕНИЕ В систематическом отношении хейлетид рассматривают (Волгин, 1969, 1978) в качестве надсемейства Cheyletoidea, которое входит в состав по- дотряда Trombidiformes отряда Acariformes. В свою очередь надсемейство Cheyletoidea состоит из шести семейств (Cheyletidae, Harpirhynchidae, C]oacaridae, Psorergatidae, Ophioptidae, Syringophilidae), из которых пер- вое включает наряду с хищниками паразитов, последнее представлено хищными формами клещей, обитающих исключительно в очинах перьев некоторых птиц, а второе — пятое — представлено целиком паразитиче- скими видами. Семейство Cheyletidae делят (Волгин, 1969) на большее по объему, включающее преимущественно свободных хищников, но эко- логически и морфологически неоднородное подсемейство Cheyletinae и меньшее, объединяющее паразитов млекопитающих и птиц подсемейство Cheyletiellinae.
МОРФОЛОГИЯ И ФУНКЦИИ СИСТЕМ ОРГАНОВ ПОКРОВЫ Как и у других клещеобразных хелицерат, покровы хейлетид, а также их производные служат источником таксономической информации (Волгин, 1969; Grandjean, 1951). Кроме того, в условиях характерного для этих клещей наземного существования они выполняют ряд жизненно важных функций — опорную и механическую (Горголь, Ястребцов, 1987), барьер- ную, рецепторную (Волгин, 1969) и другие (Alberti, Storch, Renner, 1981). Микроскопическое строение покровов хейлетид нами специально не изучалось. Однако исследования, проведенные на примере 71 вида кле- щей, в том числе на большом количестве представителей Prostigmata, включая Ch. eruditus (Alberti, Storch, Renner, 1981), позволяют экстра- полировать эти данные на всех представителей семейства Cheyletidae. Покровы хейлетид ничем принципиальным не отличаются от анало- гичной системы органов других членистоногих, в том числе и клещей. Они состоят из эпидермиса (гиподермы или гиподермальной ткани) и продуцируемой ею кутикулы. Эпидермис подстилает тонкая неклеточная мембрана, которая, как полагают (Тыщенко, 1986), имеет мезодермаль- ное происхождение и не относится к покровным тканям. Эпидермис Ch. eruditus однородный в пределах всей гиподермальной ткани, состоит из слоя уплощенных клеток, содержащих обычные для эпителия артроподного типа органеллы (Заварзин, 1986; Шубникова, 1981; Alberti, Crooker, 1985). У хищных клещей Ch. lepidopterorum в эпидермисе содержатся пигменты, вероятно, каротиноиды. Строение кутикулы — паиболее поверхностного участка покровов— довольно целостное. Как и у других Actinotrichida, кутикула всех хей- летид обладает двойным лучепреломлением. Ф. Гранжан (Grandjean, 1951), оонаруживший это явление у клещей, приписывает его наличию в кутикуле хитина особой структуры — актинохитина. Как и у боль- шинства тромбидиформных клещей, у Ch. eruditus и у всех других хей- летид кутикула тонкая, гибкая, прозрачная. Ее поверхность характеризу- ется рельефной структурой (складчатым, бороздчатым, штриховидным, ребристым рисунками, а так;ке различного рода бугристостью; рис. 9). Среди изу иемых нами видов хейлетид наиболее разнообразен орнамент покровов у СЬ. lepidopteror<im. В целом кутикулярные покровы хейлетид могут быть соизмеримы е одной из ра новидностей покровов паразитиформных клещей — растя- жимой кутикулой (Амосова, 1975; Балашов, 1979; Hackman, 1982). Помимо преобладающей у хейлетид «мягкой кутикулы» имеются об- ласти со сравнительно более склеротизованными покровами (рис. 1). Это рострум, проподосомальный и гистеросомальный щитки (Волгин, 1969). Однако морфологически они выражены слабо и от мягкой кути-
кулы отграничены не столь контрастно, как, например, у клещей-мезо- стигмат (Wharton, Parrish, Johnston, 1968; Hackman, 1982; Акимов, Ста- ровир, Ястребцов, Горголь, 1988) . Кутикула хейлетид, описание которой приводится на примере Ch. eruditus, состоит из тонкого наружного эпикутикулярного и внутреннего. прокутикулярного слоев. Эпикутикула имеет типичное для клещей строе- ние, отличается незначительной механической прочностью, состоит из гомогенного материала. Над ней постоянно находится слой секрета, из- вестный у членистоногих как цементный или восковой слой (Балашов, 1979; Hackman, 1982; Тыщенко, 1986). Благодаря химическому составу, основу которого составляют липидные соединения (Гиляров, 1970; Ты- щенко, 1986), эпикутикула играет барьерную роль, предохраняя тело хейлетид от испарения в. лаги. Кроме того, эпикутикула определяет рель- еф покровов. В отличие от эпикутикулы прокутикула хейлетид четко зонирова- на. Ее внутренний, примыкающий к эпидермису слой состоит из несколь- ких, преимущественно одинаковых по толщине слоев умеренной плот- ности. Внешний, подстилающий эпикутикулу слой прокутикулы — более тонкий и более рыхлый, чем предыдущий. Прокутикула пронизана вер- тикальными каналами пор, идущих от гиподермальных клеток. Они за- канчиваются под эпикутикулой небольшими углублениями. По сравне- нию с клещами-тетранихидами (Alberti, Storch, Renner, 1981) поры в кутикуле хейлетид более упорядочены. В дистальных отделах этих пор наблюдаются отложения электронпоплотного материал а. Предполагают, что поровые каналы имеют большое значение при транспортировке к поверхности кутикулы липидов и некоторых других веществ, входящих в состав эпикутикулы (Тыщенко, 1986) . В местах нахождения таких скелетных элементов хейлетид, как щиты, слои прокутикулы утончаются в направлении к дистальным краям щитов и становятся электронно- плотными. В этих участках слои прокутикулы менее отчетливые, чем в мягкой прокутикуле, и рыхлый, примыкающий к эпикутикуле слой (суб- эпикутикулярный слой прокутикулы) не образуется. В области щитов эпикутикула не образует складок или других рельефных структур. Учи- тывая эти незначительные отличия, поверхностный слой прокутикулы хейлетид в области щитов может быть идентичным экзокутикуле ана- логичных участков покровов других клещей. Однако четкая дифферен- цировка прокутикулы хейлетид на экзо- и эндокутикулу затрудпительна, как, впрочем, у близкородственных тетранихид л других Prostigmata (Alberti, Storch, Renner. 1981; Alberti, Crooker, 1985). Покровы хейлетид, как и интегумент других членистоногих и кле- щей, образует ряд производных, которые по аналогии с производными покровов насекомых можно подразделить на скульптурные и структур- ные образования (Бей-Биенко, 1980). Первые уже упоминались выше- это различного рода эпикутикулярные рельефные структуры (рис. 9). Наиболее характерными для хейлетид, как и для большинства клещей, структурными образованиями являются щетинки (хеты) . Их форма, число и взаимное расположение (рис. 10, 11) служат важными таксоно- иическими признаками, используемыми в систематике (Волгин, 1969) . С кутикулой все хеты имеют чашевидное сочленение и большинство из них выполняет механорецепторную функцию (Mills, 1973; Alberti, Croo- ker, 1985). Общее количество хет у каждого отдельно взятого вида хей- летид невелико, хотя типовое разнообразие их в пределах семейства зна- чительно (Волгин, 1969). Для исследованных видов хейлетид характер- 12
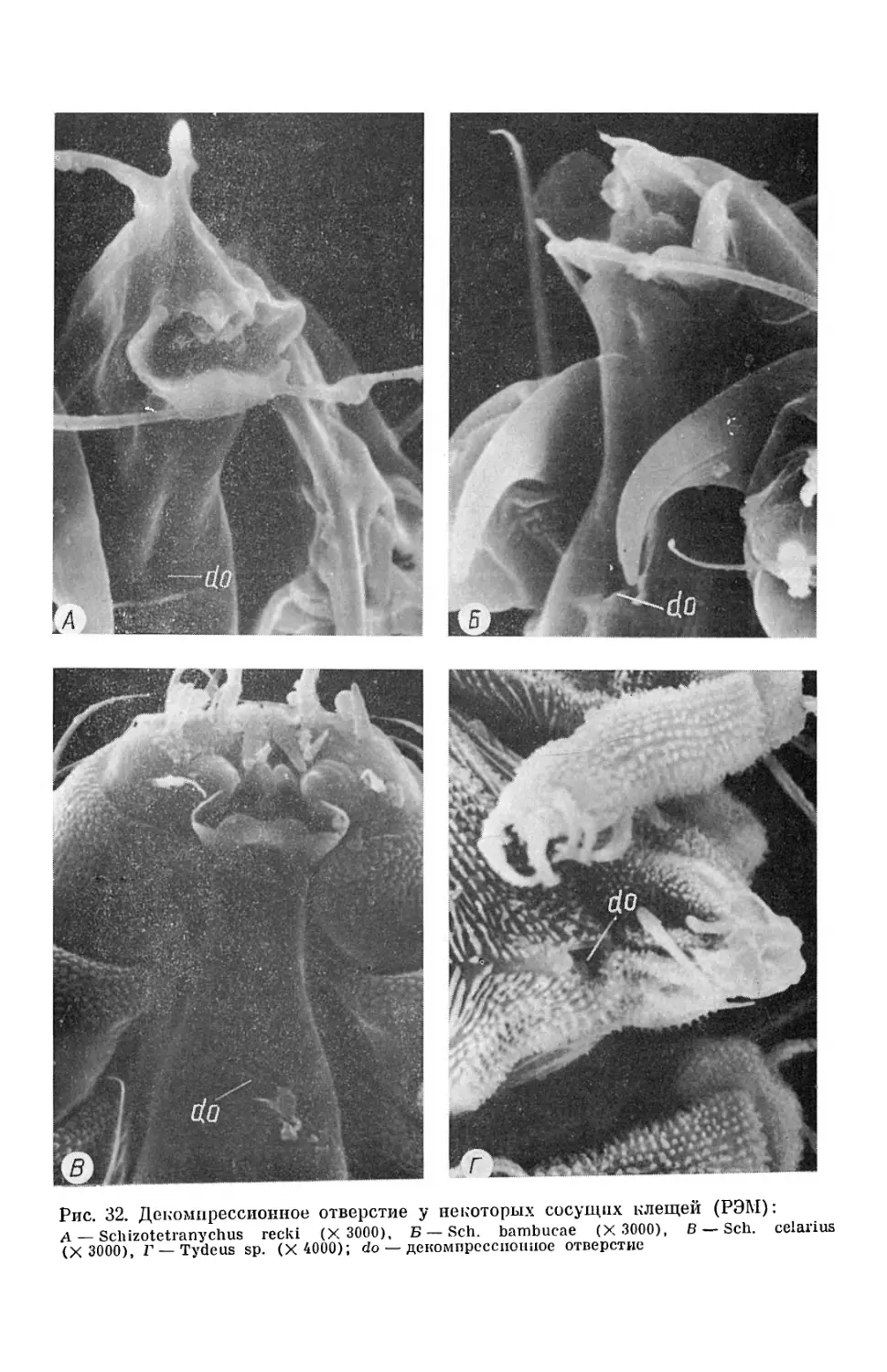
ны только некоторые разновидности хет, встречаемые у представителей семейства Cbeyletidae. Так, педипальпы хищных хейлетид (Ch. eruditus, Ch. lepidopterorum) снабжены двумя парами неодинаковых по разме- рам гребневидных щетинок (рис. 10), несущих на внутренней поверх- ности от двух до четырех десятков невысоких отростков (Волгин, 1969), у паразитических хейлетид они лишены таких щетинок (рис. 12). На всех других участках тела хейлетид, включая гнатосому, идиосому и ко- нечности, располагаются щетинки волосовидные (гладкие и опушенные), с различной степенью утолщенности, длины и перистости (рис. 10 — 13). Кроме того, у всех хейлетид (у Ch. eruditus на базальной половине лапки I; у Ch. lepidopterorurn — на голени I и II; у В. chanayi — на го- лениях I; у Ornithocheyletia sp. на дорсальном закруглении лапок I) расположены так называемые соленидии — хетоидные органы чувств. Они сравнительно небольшие (рис. 12), у хищных клещей постепенно заостряющиеся к вершине, у паразитических — слабо булавовидные. Впервые для хейлетид нами обнаружены связанные с покровами колоколовидные погруженные сенсиллы (рис. 12). Они являются эле- ментарными сенсорными единицами, функционально аналогичными ли- ровидным органам некоторых членистоногих (Тыщенко, 1986). У насеко- мых, например, сенсиллы такого типа служат проприцепторами, реа- гирующими на деформацию кутикулы во время мышечных сокращепий и могут подавать в нервные центры информацию о силе и о направле- нии действия механических нагрузок. Топография сенсилл у хейлетид (у Ch. lepidopterorum они расположены на внешней поверхности голе- ней педипальп и на внутренней поверхности кокс I, у Ch. eruditus — на внутренней поверхности кокс J и у проксимальных членикоз перитрем), вероятно, связана с возможностью такой функции. Однако не исключена возможность участия таких сенсилл в выполнении у хейлетид и других функций, поскольку они расположены в непосредственной близости к экскреторным порам тубулярных желез, а также наружным частям ре- спираторной системы — перитремам. Последним некоторые исследователи также приписывают не только дыхательную, но и определенную сенсор- ную функцию (Witalinski, 1980) . У многих представителей семейства Cheyletidae имеются глаза (Вол- гин, 1969), которые, как правило, расположены на проподосоме позади второй пары краевых хет. У изученных нами видов хейлетид они обна- ружены только у хищного клеща Ch. lepidopterorum (рис. 13). Их одна пара, как и у других клещей (Binnington, 1972; Mills, 1974; Панфилова, 1976) они построены по типу простых глазков (оцел). Глазные линзы образованы склеротизов анной кути кулой, выпуклые, полусферической формы. Микроскопическое исследование аналогичных органов других членистоногих свидетельствует о том, что под наружной линзой этих глаз располагаются фоторецепторные клетки, от которых отходит глаз- ной нерв, следующий в оптический центр синганглия. Структурная ор- ганизация глаз некоторых других тромбидиформных клещей (П.анфило- ва, 1970; Bunnington, 1972; Mills, 1974) свидетельствует о том, что как органы зрения они обладают сравнительно невысокими функциональны- ми показателями. К структурным образованиям покровов хейлетид следует также от- нести целый ряд парных и непарных отверстий, обнаруженных нами с помощью растровой электронной микроскопии (рис. 12, 13). Это в пер- вую очередь декомпрессионное отверстие (рис. 17, 31, 32), расположен- ное на вентральной поверкности рострума гыатосомы у всех изученных 13
нами видов, а также парные отверстия на конце рострума гнатосомы хищного клеща Ch. eruditus и парные отверстия у основания кокс I па- ры ног Ch. eruditus и Ch. lepidopterorum. Декомпрессионное отверстие, о чем будет сказано ниже, связано с функционированием ротового аппарата хейлетид, а парные отверстия, по всей видимости, являются экскреторными порами проподосом альных желез. СКЕЛЕТНО-МЫШЕЧНАЯ СИСТЕМА Строение скелетно-мышечной системы клещей-хейлетид представляет часть общеанатомической характеристики этих членистоногих с прису- щим им наружным скелетом. Поэтому описание отдельных скелетных структур и групп мышц основывается на данных о тагмозисе этих кле- щей, что позволяет скелетно-мышечную систему хейлетид морфологичес- ки и функционально разделить на скелетно-мышечные комплексы гна- тосомы, ходильных конечностей и идиосомы. Тем не менее некоторые мышцы гнатосомы и ходильных конечностей принадлежат идиосоме, по- скольку берут начало на ее скелетных элементах. Сказанное относится к соматической (скелетной) мускулатуре. Что касается мускулатуры висцеральной, мышечные элементы которой входят в состав внутренних органов, то она рассматривается как часть определенных систем органов. Гнатосома Строение гнатосомы хейлетид отражено в ряде публикаций, в которых описаны результаты изучения этой части тела у видов родов Cheyletus (Summers, Witt, 1971), Ornithocheyletia (Haarlov, Morch, 1975), Cheyle- tiella (Hallas, 1982), т. е. практически у представителей основных на- правлений пищевой специализации в семействе — xHIII;HHEQB, гемато- и лимфофагов. Однако даже при беглом сравнении этих работ и результа- тов морфологических исследований гнатосомы близких хейлетидам те- траниховых клещей (Беккер, 1935; Blauvelt, 1945; Акимов, Барабанова, 1977; Andre, Remacle, 1984) возникают трудности в гомологизации и интерпретации описанных структур. Дело в том, что строение гнатосомы хейлетид как части тела не совсем обычно, особенно при сравнении с гнатосомой других клещей, тех, которые обладают менее специализиро- ванным способом питания. Более того, степень специализации гнатосо- мы хейлетид так высока (рис. 5 — 8), что уяснить происхождение и функции той или иной структуры или даже органа можно лишь при со- поставлении их с исходной схемой гнатосомы менее специализированных видов. К сожалению, в работах, посвященных гнатосоме хейлетид, это часто не делалось, что при исключительно интересных исходных данных приводило к совершенно неверной трактовке обнаруженных структур (Hallas, 1982). К сожалению, упомянутые выше исследователи не поль- зовались данными своих предшественников, что препятствовало вклю- чению новой информации в процесс изучения гнатосомы этих клещей. Поэтому для понимания происхождения той или иной структуры гнато- сомы хейлетид мы воспользовались в качестве исходной модели строе- нием гнатосомы достаточно полно нами изученных (Акимов, 1985) ака- роидных клещей. У последних свободные, снабженные клешнями хели- церы располагаются над так называемым субкапитулюмом, который об- 14
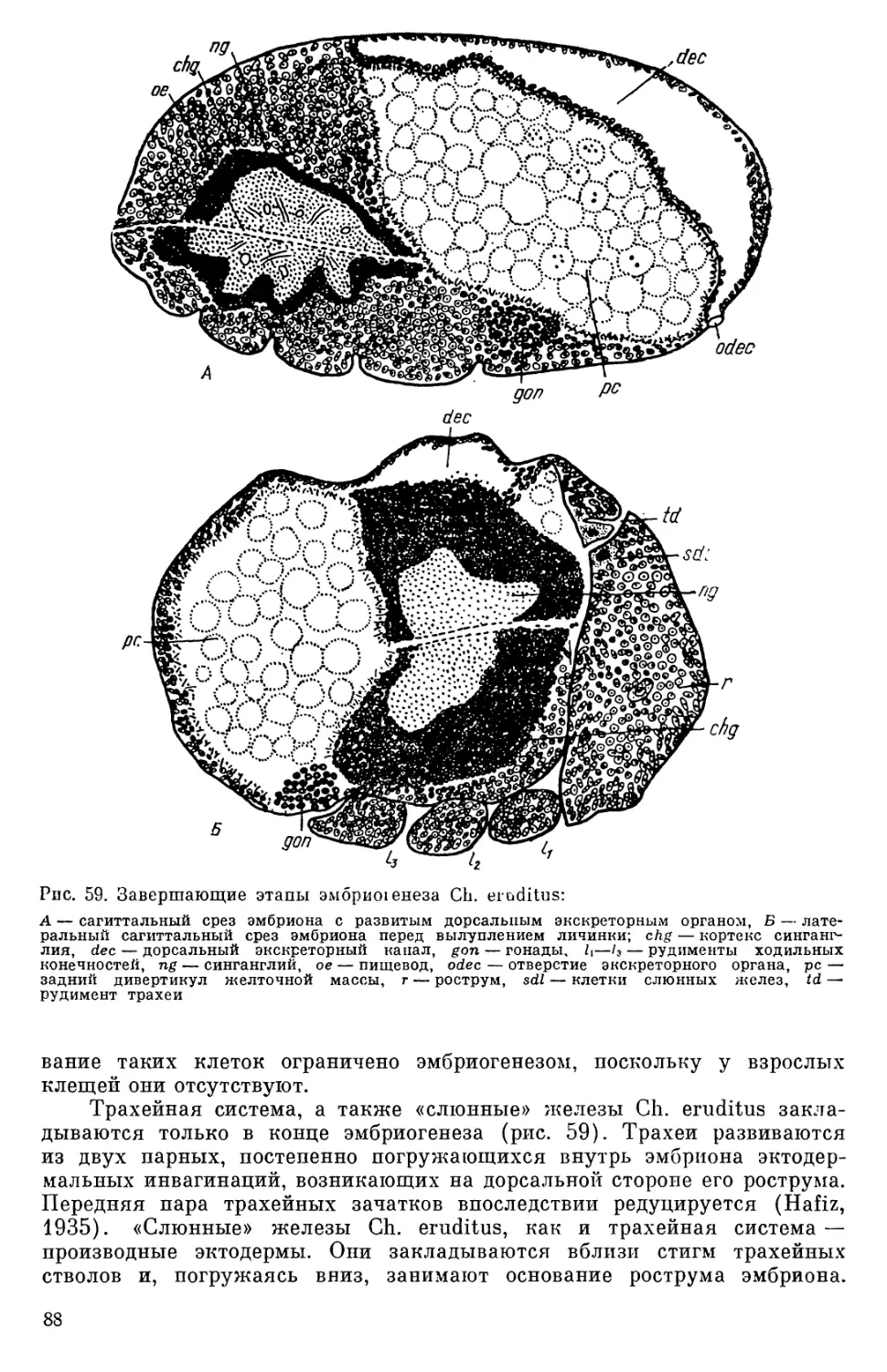
Рис. 14. Ст роение гнатосомы н А — 0 ы некоторых ака о р идных клеш,ей. Rhiz oglyphus удалении хелицер В — т ного среза ротовых о г м — то, система, саги иттально ер,, копстрикторы глотки, Ш )э эпифаринкс — гипостом ии, р- мышцы лабрума тс1- ди" от — ротовое отве дипальпы, тс — ретра педипал, кторы хелицер, т р, то — ретракторы азов и альные мышцы глотки 15 р ан выростами к Т ур и имеет довольно сложное и кокс педипальп (гнатококсами), рядом г сложное строение (рис. 14 щ~~ такие ~ыросты р сполагающипся сальными вы постом — сложную выростами прик ы пластинки с азличн того, дорсаль льно, в виде м рывает всю гнатос сому сниз и чнымн дор- ся пласти тинка наз р ~~) коксами п мом, кото ая в гает- р я впереди переходит в уз-
кую, часто языковидную структуру — лабрум (рис. 14). Латеральные кромки гипостома и его щетинки у эндеостигмат и всех акароидных кле- щей формируют особую подвижную, но лишенную собственных мышц часть ротовых органов — рутеллюм, или простомальные зубцы (Акимов, 1985) (рис. 14). Они играют значительную роль в функционировании жующего ротового аппарата как упор при откусывании пищевого суб- страта и как зубцы, о которые разрываются захваченные клешнями ку- сочки пищи. Дорсальная часть гипостома формирует, во-первых, два желоба, в которых лежат и по которым движутся тела хелицер. Во- вторых, несет между этими желобками гипостома своеобразную языко- видную структуру — гипофаринкс, частично сросшуюся вентрально с поверхностью гипостома. Над гипофаринксом располагается длинный эпифаринкс, часто срастающийся с ле'кащим еще выше лабрумом (рис. 14). Причем над основанием эпифаринкса, между ним и гипофа- ринксом, располагается ротовое отверстие, ведущее в глотку. Факти- чески дорсальная стенка глотки продолжается вперед и виде эпифаринк- са, а вентральная стенка — в виде гипофаринкса. Глотка, таким обра- зом, лежит под эпистомом, в пространстве между ним и вентральной частью гипостома. В этом месте глотка снабжена мышцами-дилататора- ми и констрикторами, причем первые прикрепляются к дорсальной стенке глотки и к эпистому, а также к вентральной стенке ее и к ги- постому. Такова, в целом, схема строения исходного жующего типа ротового аппарата наиболее примитивных тромбидиформных и акароидных кле- щей (рис. 14). В отличие от такого исходного типа строения гнатосома хейлетид характеризуется максимальным слиянием своих частей. Она образована слиянием конечностей редуцированных сегментов — хелице- рального и педипальпального (Вайнштейн, 1960) и, как и у тетранихид, может быть подразделена на стилофор, субкапитуллюм и относительно подвижные и расчлененные пальпы (Беккер, 1935; Blauvelt, 1945) (рис. 6, 8). У всех описанных в литературе (Hughes, 1958; Summers, Witt, 1971; Haarlov, Morch, 1975; Hallas, 1982), а такхсе исследованных нами (Акимов, Горголь, 1984) видов хейлетид общий план строения гнатосо- мы сходен. Однако на фоне общего сходства наблюдается ряд морфоло- гических различий, которые, хотя и не являются принципиальныъид, но все же указывают на определенную специализацию, связанную с биоло- гическими особенностями различных представителей семейства. В пер- вую очередь следует отметить существенную разницу в размерах гнато- сомы. У Ch. eruditus и Ch. lepidopterorum она составляет половину дли- ны идиосомы, а у В. chanayi и Ornithocheyletia sp. только 0,2 ее длины. Кроме того, у первых двух видов гнатосома более вытянута и благодаря мощным коксам педипальп, которые составляют значительную ее часть, угловатая, ее рострум длиннее, он конусовидный со слегка притуплен- ной вершиной (рис. 5). У двух последних видов гнатосома более широ- кая, рострум короткий, шлемовидный, с широко загнутой вершиной. В целом гнатосома хейлетид представляет собой конусовидную или клю- вообразную, вздутую у основания структуру. Вздутое основание ее назы- вается гнатобазой, или basis capituli. Между подвижными частями педи- пальп, причлененных к гнатобазе, располагается рострум гнатосомы (рис. 15) с отверстием на вершине, сквозь которое высовываются тонкие .колющие стилеты. Дорсально на гнатосоме расположены четковидпые желобы перитрем (рис. 15). Медиально они образуют два вертикальных :16
ствола, дающих затем начало двум главным трахеям. В гнатосоме хей- летид, как и у тетраниховых клещей (Blauvelt, 1945), стилофор лежит на субкапитулюме, однако внешне их разделение незаметно. Первая пара конечностей (хелицер) у хейлетид видоизменена в связи со значительной морфологической и функциональной специализа- цией. Хелицеры хейлетид несвободны, они срастаются между собой и с другими частями гнатосомы, образуя дорсально общую структуру- стилофор, т. е. «несущий стилеты» (рис. 15). Лишь на снимках в ра- стровом микроскопе заметны следы слияния этих конечностей (см. рис. 6 — 8). Процесс превращения подвижного пальца клешни хелицер рсд Рис. 15. Схема строения рострума гнатосомы Ch. eruditus, сагит- тально: bch — основания хелицер, do — декомпрессионное отверстие; dph — дила- таторы глотки, es — эпистом, hc — гипостомальная полость, La — лабрум, ое — пищевод, от, — первичное ротовое отверстие (соединяющее предро- товую полость с глоткой), от~ — вторичное ротовое отверстие (у входа хелицер), рЬ — предротовая полость, pch — протракторы хелицер, ph— глотка, rch — ретракторы хелицер, зре — стигма, st — стилеты, ts — тра- хейный ствол в колющий стилет прослежен на сравнительно-морфологическом ряде тромбидиформных клещей (Вайнштейн, 1960) . Правда, это было сдела- но для TBTpaHHxoBbIx клещей, у которых тела хелицер, срастаясь, обра- зуют подвижный стилофор. У хейлетид тела хелицер, образуя стилофор, полностью теряют подвижность и при этом срастаются с окружающими его структурами, что отмечалось для некоторых других тромбидиформ- ных клещей (Summers, Witt, 1971; Desch, Nutting, 1977). Единственными их частями, способными к движению, остаются стилеты (рис. 15, 16). Последние, как считает Халлас (Hallas, 1982), образованы, во-первых, терминальными члениками хелицер — тарсусами, которые в виде V-об- разных на поперечных срезах структур служат местом прикрепления протракторов и ретракторов. С этими тарсусами подвижно сочленованы основания стилетов (рис. 16), а уже с последними — колющие их части. Роль скелетных структур выполняют также трахейные стволы, откры- вающиеся на дорсальной поверхности гнатосомы стигмами. К мощным вертикально расположенным трахейным стволам тяжами, как это было показано впервые у Cheyletiella yasguri (Hallas, 1982), крепятся тарсу- сы хелицер. Во-вторых, колющие части хелицер — стилеты — образова- 17 2 9-3893
пы, вероятно, амбулакрумов конечностей. На поперечных срезах они выпукло-вогнутые (рис. 17, 18), а сложенные вместе образуют трубочку, подобную игле шприца (рис. 15). Субкапитулюм гнатосомы хейлетид представляет собой нижнечелюст- ную часть гнатосомы и лежит непосредственно под стилофором. Как и у менее специализированных акариформных клещей, он образован (Ланге, 1962) прежде всего тазиками педипальп Ггнатококсамп) и их Рис. 16. Строение гнатосомы Cheyletiella yasguri (но Hallas, 1982): А — сагиттальный срез гнатосомы, Б — дорсальный срез рострума, 8 — втянутая хелнцера, Г — стилет хелицер, Д — основание хелицер с сочленовым отростком, Е — причленение осно- вания хелицер; ap — крючковидная щетинка, bc' — основание хелицер, со — сочленовные отростки, Ы — идиосома, la — лабрум, or> — вторичное ротовое отверстие, pch — протракторы хелицер, ph — глотка, sp — стилофор, st — стилет, ts — трахейный ствол выростами (коксэндитами), а возможно, такясе и остатками второго сег- мента (дейтостернума), однако все эти структуры подвергались в про- цессе специализации гнатосомы значительной модификации. Они обра- зуют скелет для внутренних мышц гнатосомы и футляр для ее прово- дящих путей. Субкапитулюм формирует ложе стилофора и вторичный рот. Внутри стилофора располагаются предротовая полость, первичный рот, глотка п частично пищевод (рис. 19, 20). Вентрально выросты кокс педипальп (коксэндиты) у хейлетпд обра- зуют гипостом. Он формирует вентральную и латеральную поверхности гнатосомы, а его выросты, загибаясь на дорсальную сторону, сливаются затем с дорсальнымп покровами стилофора, образуя общий тегмен (Hal- las, 1982). Гипостом, как существенная часть субкапитул1ома, а такнсе стилофор, образуют упомянутую выше передшою, клювовидную часть гна- тосомы — рострум (рис. 19). По сравнению с дорсальной частью гнато- сомы рострум довольно мал, но сложен морфологпчески. Он вмещает и направляет дистальные части стилетов, несет протоки cJIIoHEIIIx желез, лабрума и т. д. На вершине рострума, как уже указывалось, распола-
гается отверстие для насасывания пищи и выдвижения стилетов (вто- ричный рот). Дорсальная часть субкапитулюма вместе с рудиментами хелицеральных футляров, а возможно, и гипофаринкса, образует направ- ляющие гребни, вдоль которых скользят внутри рострума выдвигаемые стилеты (рис. 20). У основания стилетов хелицер гребень один, а под ним располагается основание лабрума с двумя внутренними мышцами bch /а (а cbz do Рис. 17. Гнатосома Ch. eruditus на поперечных срезах (от вершины — А, и основа- нию — Г): bch — основание хелицер, chs — футляры белицер, es — эпистом, hc — гипостомальная полость, ph — гипофаринкс, hs — гипостом, la — лабруи, Lm — мышцы лабрума, ое — пищевод, ре- перитремы, ph — глотка, st — стилеты, tr — трахеи этого органа (рис. 17). Дистально основание лабрума оказывается в ку- тикулярном чехле и, наконец, между двумя гребнями гппофаринкса (рис. 17, 19). У В. chanayi рострум и лабрум более широкие, но сам рострум гораздо короче (рис. ", 19). Снизу, с вентральной стороны, на гипостоме располагается отвер- стие, хорошо заметное на снимках РЭМ у всех хейлетпд. Такое отвер- стне впервые указывалось для паутинного клеща Bryobia гubrioculus (Summers, Gonsales, Witt, 1973), но у хейлетид его не заметилп (Hal- las, 1982). В последнее время оно было описано у тенуипальпид (Nuz- zaci, Lillo, 1988). На серии поперечных срезов Ch. eruditus видно. что отверстие связано с небольшой полостью, расположенпой в вентральиой части гипостома. Впереди эта полость имеет вид трехлучевой звезды (рис. 17), а ближе к глотке превращается в продольную щель, латераль- ные стенки которой образованы толстой лучисто исчерченной кутикулой. Щель открывается в «ротовую» полость и прикрыта сверху вептральной , 19
частью лабрума (рис. 17) . Таким образом, отверстие на вентральной поверхности гипостома, названное нами декомпрессионным, ведет в рото- вую полость. Ламбрум у Ch. eruditus узкий, лежит в желобе гипофаринкса (рис. 17), который представляет собой продолжение вентральной по- верхности глотки и формирует упомянутые выше направляющие гребни Рис. 18. Серия поперечных срезов (А — Ж) гнатосомы Cheyletus cacahuamilpensis (по Summers, Witt, 1971) и фронтальный срез стенки глотки (8): abd — абдукторы трохантера, bch — основания хелицер, che — хелицера, chs — футляр хели- цер, dph — дилататоры глотки, es — апистом, la — лабрум, hc — гипостомальная полость, pch — протракторы хелицер, ре — перитремы, ph — глотка, rch — ретракторы хелицер, st— стилет, 1т — трахеи для стилетов. Гипофаринкс срастается с дорсальной поверхностью ги- постома. У хейлетид эпифаринкс срастается с лабрумом в единую струк- туру — лабрум, берущий начало над глоткой (см. рис. 15). Как указы- валось выше, у акароидных клещей лабрум служит непосредственным продолжением эпистома — мостика между гнатококсами (Johnston, 1965; Акимов, 1985). У хейлетид от эпистома остается аподема (рис. 18), ко- торая является каудальным продолжением гребней (рис. 17). Т. Е. Хал- лас (Hallas, 1982) упоминает эту аподему, хотя и не трактует ее как эпистом. У Cheyletus cacahuamilpensis эпистом оыл назван горизонталь- ной септой (Summers, Witt, 1971), причем показано, что именно к ней прикреплены дилататоры глотки (рис. 16). Последнее, т. е. место при- крепления глоточной мускулатуры, служит надежным признаком эписто- ма. Упомянутая септа (элистам) представлена пластинкой с гребнем, расположенным под хелицерами, и ее двумя аподемами (рис. 16 — 18). Существенная часть гнатосомы — педипальпы, как конечности, пре- 20
терпели по сравнению с ногами специализацию, хотя и не столь карди- нальную, как хелицеры. Количество подвижных члеников их сократи- лось, и они превратились в орган захвата объекта питания. В. И. Вол- гин (1969) указывал, что педипальпы хейлетид состоят из пяти подвиж- ных члеников (трохантер, фемур, гену, тибия, тарсус), предпоследний из которых несет вырост, образующий коготь (рис. 5). Специальное изу- чение состава члеников педипальп показало, что такой членик, как трохантер, в значительной мере редуцирован и представлен у исследуе- MbIx видов небольшими склеритами, не принимающими участия в движе- нии. Непосредственно к гнатобазе (видоизмененным сросшимся коксам педипальп) причленены с помощью одномыщелковых латеральных суста- вов фемуры, гипертрофированные у таких хищных форм, как Ch. erudi- tus и Ch. lepidopterorum. Следующий членик (гену) развит у исследо- ванных видов в различной степени. У В. chanayi он хорошо выражен, а у Ch. eruditus в значительной степени редуцирован. У Ch. lepidopterorum дорсальная часть этого членика сливается с фемуром, а вентральная четко отделена от него. Тибия у всех видов хорошо развита, несет ког- тевидный вырост, направленный у хищников к центральной оси тела, а у паразитов — вниз (рис. 10 — 11). Когтевидный вырост тибии имеет мем- бранное сочленение, однако собственной мускулатурой не обладает (рис. 21). У паразитических форм такие когтевидные выросты занима- ЕоТ терминальное положение и из-за очень MRJIbIx размеров последнего членика (тарсуса) могут быть ошибочно приняты за него. Последний членик педипальп (тарсус) очень мал, у паразитических видов срастает- ся с тибией, несет гребневидные щетинки. Сочленения всех члеников педипальп между собой однотипные и осуществляются с помощью дор- сальных одномыщелковых суставов, позволяющих членикам двигаться в одной плоскости. Глотка хейлетид, расположенная под основаниями хелицер, очень своеобразна и сходна с глоткой тетраниховых клещей (Беккер, 1935; Blauvelt, 1945; Andre, Remakle, 1984) . На поперечном срезе она очень широкая, фигурная (рис. 17, 19), а на сагиттальном- узкая. Дорсальная стенка глотки представлена эластичной упругой мем- браной, интенсивно окрашивающейся в синий цвет в гематоксилине H красный — в азане. За глоткой следует узкий длинный пищевод (рис. 15, 20), в стенках которого кольцевые мышцы-констрикторы не обнаружены. В основание гнатосомы входят дистальные железистые части неко- торых экзокринных желез, в частности паутинных и слюнных, протоки которых открываются в гнатосоме. Движение многих структур этой части тела обеспечивается мышечным комплексом гнатосомы, прежде всего мышцами хелицер, лабрума, глотки и многочисленными мышцами пе- дипальп, которые образуют внешние мышцы гнатосомы (рис. 17, 21). Мышечная система хейлетид, в том числе и мышц гнатосомы, была под- робно изучена у хищных (роды Cheyletus и Cheletomorpha) и паразити- ческих (роды Bakericheyla и Ornithocheyletia) форм (Горголь, Ястребцов, 1987, 1989) . Мышцы хелицер представлены двумя функциональными группами (рис. 15, 21), берут начало на дорсолатеральной и дорсальной поверх- ностях гнатосомы (стилофора) и заканчиваются двумя сухожилиями на дорсальной и вентральной поверхностях их базального членика (табл. 1). Эти мышцы являются антагонистами (протракторами и ретракторами), поскольку прикрепляются с двух сторон от оси артикуляции основания стилетов и при сокращении вызывают поворот базального членика хе- лицер вокруг мыщелка, расположенного в его передней части. Это, 21
gis Lgn йтп б or,' Рис. 21. Мышечная система гнатосомы кейлетид: А — гнатосома В. chanayi, сагиттально, B — внешние мышцы гнатосомы (стрелками указа- ны суставы, схема артикуляции которых представлена справа), В — мышцы гпатосомы Ch. eruditus и расиоло>кениг артикуляционных отростков в суставах его педипальп; abd— абдукторы педипальп, adcL — аддукторы псдииальп, bch — базальный членик хелицер, cl— когти педипальп, dg~' — депрессоры гиатосомы, clo — декомпрессионное отверстие, dph— дилататоры глотки, е8 — эпистом, fpa -- флексоры педииальн, gis — гистеросомальный щит, — рсальпыс продольные мышцы, цп — гнатосома, la — лабрум, lm — мышцы лабрума, fpn — леваторы гиатосомы, ое — пищевод, or — вторичное ротовое отверстие, рс — р р торы хелицер, ph — глоi i'а, pTs — проподосомальный щит, rch — ретракторы хелицер, spe— стигма, st — 'Tилет, stт — склерит трохантсра, 1а — тарсус 22 в свою очередь, приводит к выдвижению терминальных члеников хели- цер (стилетов) по типу ретракция — протракция. Так как каждый из стилетов обеспечен собственным набором мышц, то движения стилетов могут осуществляться независимо друг от друга, что и наблюдается при питании кейлетид. Две мышцы внутри лабрума (рис. 17) заканчиваются на передней кромке эпистома. Мускулатура глотки представлена исключительно дилататорами (внешними и внутренними), которые мощным общим сухожилием закан- чиваются на ее эластичной утолщенной дорсальной стенке. Их насчиты-
Т а б л и ц а 1. Мышечная система клеща Cheyletus eruditus Конец Название мышц Начало Мышечный комплекс гнатосояы Мышцы хелицер Ретракторы (rch) поверх- (стило- Протракторы (pch) Мышцы лабрума (ml) Передняя дор сальная по- Д орсом едиальная задняя верхность глотки поверхность эпистома Там же Там же Дорсолатеральная и вептро- латеральная антиаксиаль- ная поверхность фемура Абдукторы фемура (abd) Там же Флексоры гену (Ера,) Дорсальная (антиансиаль- ная) поверхность фемура Там же »» Вентролатеральная задняя поверхность гену Там же »» тибии (Ерар) тарсуса (Ераз} Мышцы гнатосомы Леваторы (}gn) Дорсолатеральная задняя поверхность гнатосомы Депрессоры (dgn) Вентролатеральный задний край гнатосомы Мышечный комплеьс ходильных конечноапей Ремоторы трохантера (rpe) Внешняя латеральная по-верхность трохантера Внутренняя лате ральная поверхность трохаптера Там же Промоторы трохантера (рре,) Промотопы трохантера (рре2) (внешние) Флексоры фемура (ере,} Экстензоры фемура (ере1) Вентролатеральная задняя поверхность феиура Дорсолатеральная задняя поверхность фемура Флсксоры гену (fpe2) Вентролатеральная поверх-ность гену Вентролатеральна я задняя поверхность тибии Лорсолатеральная поверх-ность фемура Яорсолатеральная поверх-ность фемура и гену тибии ([ре,) 23 Мышцы глотки Внешние дилататоры (семь пар мышечных пучков) dph, Внутренние дилататоры (пять пар мышечных пучков) dph2 Мышцы педипальп Лддукторы фемура (аИ) Дор сальная поверхность базального членика хели-цер Вентролатеральная поверх-ность базального чле ника хелицер Внутренняя поверхность лабрума Вентральная аподема гна- тосомы (вдоль всей ее по- верхности), вентральная задняя поверхность гнато- сомы Задняя поверхность гнато- сомы, частично на поверх- ности вентральной аподемы Дорсолатеральная и дорсо- медиальная поверхность проподосомального щита Вентролатеральная поверх- ность идиосо мы, в районе медиальных аподем кокс П пары ног Передняя аксиальная по-верхность аподемы кокс Задняя аксиальная поверх-ность аподемы кокс Вентральная поверхность идиосомы в районе между II и Ш парами кокс Дорсолатеральная поверх-ность трохантера Вентролатеральная поверх-ность аподемы кокс Дорсолатеральная ность гнато сомы фор) Дорсолатеральная задняя поверхность гнато сомы (стилофор) Передний край эпистома
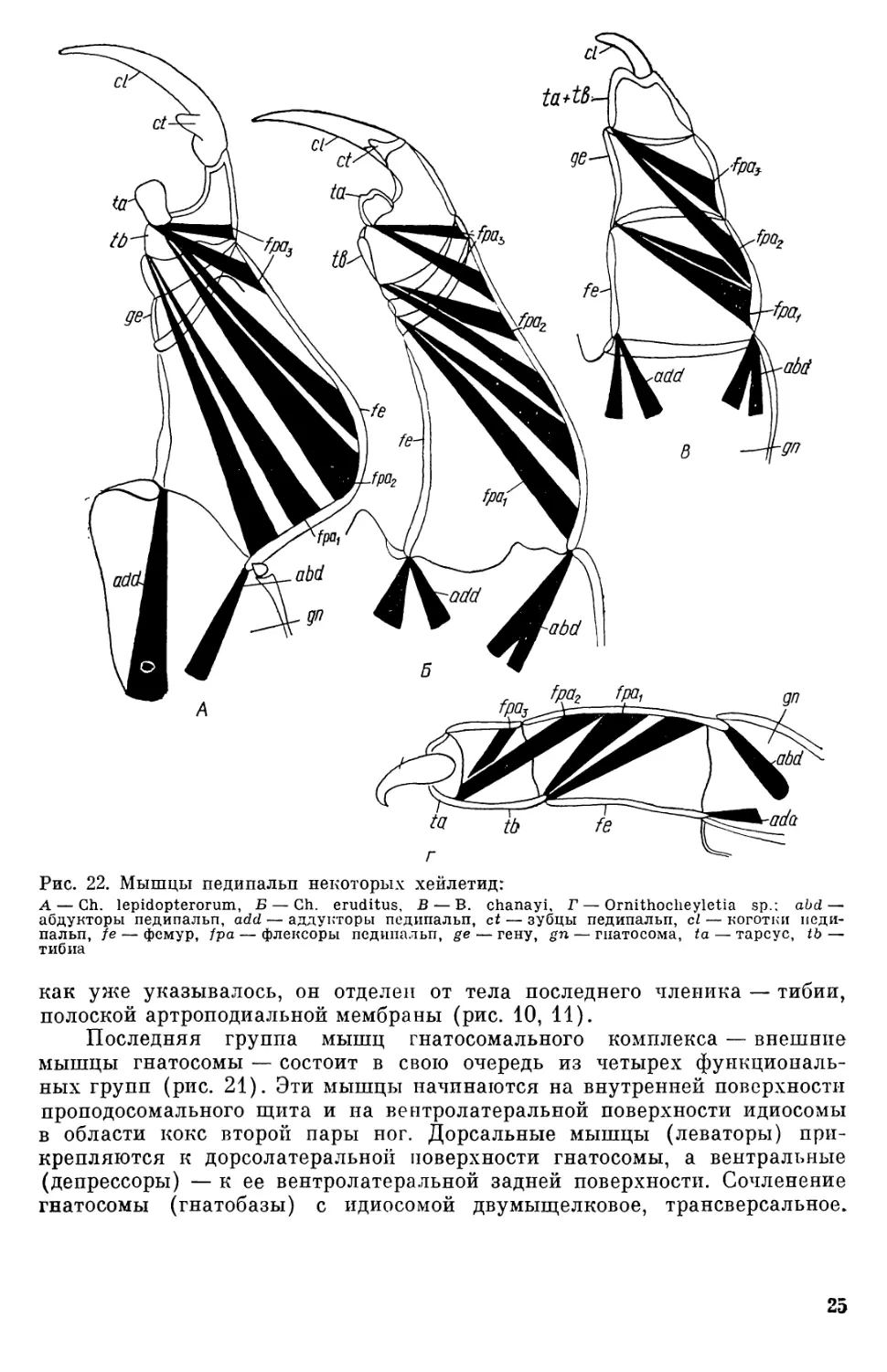
Продолжение табл. 1 Конец Начало Название мышц тарсуса (fpeq) амбулакрума (ере2) Дорсолатеральная поверх-ность тибии Там же Дорсолатеральная задняя поверхность тарсуса Вентральная поверхность амбулакрума Дорсальная поверхность амбулакрума Экстензоры амбулакрума Дорсолатеральная поверх- (ереа ) ность тарсуса Мышечный комплекс идиосомы Задняя поверхность про-подосомального щита Внутренняя поверхность проподосомального и ги-стеросомального щитов, между дивертикулами сред-ней кишки Латеродорсальная поверх- НОСТЬ ОПИСТОСОМЫ Дорсальные продольные мышцы (две пары) (itm) Дор сов ентральные мышцы идиосомы (пять пар групп, число пучков в группе ва- рьирует) (dvm~ 5) Латеральная поверхность гистеросомального щита Вентральная и вентролате- ральная поверхность идио- сомы Дилататоры вагины (две пары коротких мышечных пучков) dva Мышцы-дефекаторы (два мышечных пучка) dre> Внутренняя поверхность стенок вагины Заднедорсальная описто сомы Внутренняя кутикулярной ректума Внутренняя стенка аналь-ного клапана стенка Дилататоры ректума (четы- Латерокаудальная стенка ре пары мышечных пуч- описто сомы ков) dre> 24 вается 12 пар у Ch. eruditus и 8 — у В. chanayi. Начинаются эти мыш- цы на вентральной поверхности глотки в передней ее части (рис. 15, 19). Сокращение дилататоров вызывает изгиб эластичной дорсальной стенки глотки и расширение ее полости, влекущее поступление пищи. Еон- стрикторы глотки у исследованных хейлетид, как и у некоторых других тромбидиформных клещей со сходным строением гнатосомы, в частности тетранихид (Blauvelt, 1945; Summers, Witt, 1971; Andre, Remacle, 1984), не обнаружены. Описание Т. Е. Халласом (Hallas, 1982) констрикторов глотки, приведенное, однако, без рисунка, вероятно, ошибочно. Сужение просвета глотки хейлетид происходит за счет эластичности ее стенок. Мышцы педипальп, особенно у хищных форм, наиболее мощные из всех мышц гнатосомального комплекса хейлетид (рис. 21, 22). Они пред- ставлены многочисленными пучками мышц-антагонистов, расположенных в базальных члениках (гнатококсах), и мышцами-депрессорами — в тер- минальных (рис. 22), топография которых как у хищных, так и парази- тических видов хейлетид одинакова. Мышцы фемура берут начало на задней и латеральной поверхности гнатосомы. Аддукторы фемура закан- чиваются на дорсолатеральной и вентролатеральной (аксиальной) по- верхностях фемура. Антагонисты фемура занимают большую часть объ- ема гнатобазы у хищных видов, в то время как у паразитических — лишь незначительную ее часть. Следует отметить, что в терминальных члени- ках педипальп мышцы-экстензоры (антагонисты флексоров) обнаруже- ны не были. У Ch. lepidopterorum начало мышц-флексоров смещено к фемуру, кроме того, у этого вида отсутствуют флексоры редуцированно- го гену. У клеща В. chanayi редуцированы мышцы тарсуса педипальп. Когтевидный вырост педипальп хейлетид, представляющий собой вы- рост предпоследнего членика, не снабжен мускулатурой. Тем не менее,
Рис. 22. Мышцы педипальп некоторы» кейлетид: А — Ch. lepidopterorum, Б — Ch. eruditus, В — В. chanayi, Г — Ornithocheyletia sp.; abd— абдукторы педипальп, асЫ — аддукторы псдипальп, ct — зубцы педипальп, cl — коготки педи- пальп, fe — фемур, /ра — флексоры педипальп, ge — гену, ~п — гпатосома, ta — тарсус, tb— тибиа как уже указывалось, он отделен от тела последнего членика — тибии, полоской артроподиапьной мембраны (рис. 10, 11). Последняя группа мышц гнатосомального комплекса — внешние мышцы гнатосомы — состоит в свою очередь из четырех функциональ- ных групп (рис. 21). Эти мышцы начинаются на внутренней поверхности проподосомального щита и на вентролатеральной поверхности идиосомы в области кокс второй пары ног. Дорсальные мышцы (леваторы) при- крепляются к дорсолатеральной поверхности гнатосомы, а вентральные (депрессоры) — к ее вентролатеральной задней поверхности. Сочленение гнатосомы (гнатобазы) с идиосомой двумыщелковое, трансверсальное.
Ходильные конечности Как и у других тромбидиформных клещей, ходильные конечности хей- летид, состоящие из 7, включая амбулакрум, члеников, характеризуются срастанием тазиков (кокс) с идиосомой. При этом коксы превращаются в опорный скелетный элемепт основания конечностей на идиосоме. Фор- ма и размеры конечностей хейлетид, а также пропорции отдельных чле- ников (коксы, трохантера, фемура, гену, тибии, тарсуса и амбулакрума) варьируют в зависимости от специализации к различным условиям оби- тания и от скорости передвижения этих клещей. Это хорошо заметно при сравнении свободноживущих и паразитических хейлетпд (рис. 23). Кок- cbI ходильных конечностей могут быть солижены, как, например, у Ch. lepidopteI'orum, или же между вторыми и третьими парами кокс мо- ;I;ei быть проме".куток. Интересно сравнение строения ног хейлетид и с помощью «индекса формы», т. е. соотношения длины члеников п их диаметра (табл. 2). Терминальный членик ног — амбулакрум редуцирован и имеет вид коготка с основанием (рис. 24, 25). Так, у Ch. eruditus амбулакральный аппарат небоньшо~~, состоит из парных базальных- вставочных когтевид- ных и нескольких видоизмененных склеритов. Лртикуляция члеников и Рис. 23. Форма ходильных конечностей хищных (Л. Б) п парааптпчесипх (В) Х 011Л<='ТНД: A — Ch. егабйпэ, Б — Ch. lepidopterorum, В — В. chanayi; 1 — 1Ч — иорядковыш номер конечно- сти; ant — амбулаируы, сх — кокса, fe — фемур, ge — гену, ta — тарсус, tb — тибиа, tr — тро- хантср 26
ЭС I и и 1 9 1 1 ° 9 S 1 11 ° Э ° ° < ° ° ' ' Э Э ° ° и ° ° и М ° и ° ° Э Э и Э и ° ° ° . ° ° и 1 1 1 I 1 IeвЭ I 1 I 1 е! I 9 1 I 1 1 ° 1 I ° I I I I II1II 1 1 991 ' Э I е I I ° юе I I e ° ° ° ° ° ° ° е ° ° ° ) ю ° ° ° ! е ю в 3 ° в е в ° в 3 ° в 3 ° 6 ° ° ° ) ° 69613 ' г ° ° I ° 3 еГ ° 6 ° ° б ° ° 6 ° ° 6 6 ' ° г ° ° 6 ° ' I ° ° Г ° i ° ) ° ° в 6) ° е ° е ) в ° 1 ° I 1 ° Г ° ° Г ° ° г ) б ° 3 Г ° в ° ю б ° ~ ° ° в 1 ' ° ° ° ° )г I ° ° ) ! ) Эб) 6 ° ° 1 ) 1 6'3' "I ° ' 6 ' ° ° ° ° ° е ° ° ° ° ° в 1 е 1 ° 3 е ° ° ° 6 ° ! ° '6е Э 6 ° е е ° в I e . ° ° ° I ° е ° ° ° е е ° ° Э ° ° ° ° в е б i ° е ° е ) ° ° ° ° I в ° ° е ° е ° ° 6 ° ° ° ° ° ° ° г е е ° ° ! е ° в ° 3 ° ° в 6 ° в ° ° ° В ° ' ° ° ! ° ! - ! ° ° ° 1 ° ° ° 6 ° ° 6 ° s s sЭг ° ° б б ° б е ° ° в ° ° ' ° i е е ° 6 е ° ° ВЭ I ° ° ° Э Э ° ° 6 Э в 6 ° е ° °, ° ° ° 6 ° г ° Э ° ° ! В е ° в ! е ° б б а 3 ° ф ° 6 е г ° ° 1 ° Э В 6 Э Э ° в ° е ° ° ° ° ° ° е ° 3 е 6e' 16 ° е ° б г ° в г r ) ° ! ° ° ° ° P б ° е ° 6 ° б ° 3 В ) Э ° ° 6 ã в ! ° ° ° I ° ° ° ° 3 ° ° ° ° ° 6 в ° 1 ° в ° б ° ° ° б ° Э ° б ° Э е е ° в ° И ° ! г ° Э ° ° Э 3 ° ° ! б 6 ° е ) 6 3 в 3 II ° ° ° е 6 ° ° ° ° г ° 6 Э ° ° ° ° 6 б 3 ° е е Э ° в б г ° 6 ° s 3 ° 5 ° Э ° ° 3 ' ° ° 11 " ° е в ° ° е ° ° ° ! ° Э б ° ° 3 ° е 6 ° ° 1 6 ° ° б 1 ° б ° ° ° в ° ° Э 1 ' И ' ° ° г г ° ° ° ° ! ° ° !. ' !'! 5 ° ° ° е° ! е ° ° °° ' ° ° ° ' ° ° ° ° ° "" 6 ° ° ° ° ° ° ° ° ° ° Г Г ° Г е ° ° в ° ° ° ° li ю 1 1 6 г ° в ° е в ° ю i i6 ' ° ю ° ° I е ° 6 б е ° ° ° 1 11 II 1I и ! I I II в I 1 ! I 1 I I 'I 1 ! Э 1 1 1 1 I ° 1 I ! ° ! I 1 1 ° I 1 1 1 1 1 !е 1 1 в в
Рис. 26. Скелетные элементы и мышцы ходильных конечностей хейлетид: А — В — нога I y Ch. lepidopterorum (А), Ch. eruditus (Б), В. chanayi (В), Г — схема мышц и суставных поверхностей ходильных конечностей Ch. eruditus, Д — Е — амбулакрум ходиль- ной конечности Ch. eruditus (Д — сбоку, Z — снизу); bsc — базальный склерит, csc — когте- видный склерит, epe — экстензоры ног; fpe — флексоры ног, isc — промежуточный склерит, рре — промоторы ног, тре — ремоторы ног, tex — сухожилие мышц-экстензоров, tfl — сухожи- лие мышц-флексоров ритов, связанных сочленовной мембраной (рис. 26). Форма склеритов у исследованных видов варьирует, но во всех случаях хорошо видна пара базальных, интеркалярных и когтевидных склеритов (см. рис. 24, 25). Идиосома Скелетную функцию идиосомы выполняют главным образом дорсальные щиты — протеросомальный и гистеросомальный, слившиеся с покровами коксы ходильных конечностей, и сами покровы (рис. 1). В мышечный комплекс идиосомы (рис. 27) входят дорсовентраль- ные и продольные дорсальные мышцы, а также мышцы ректального и генитального клапанов (см. табл. 1). Первые представлены мышечными группами, проходящими симметрично продольной оси тела между крип- тами кишечника. У Ch. eruditus таких мышечных групп 5 пар, у В. cha- aayi — 4. Число мышечных волокон в дорсовентральных мышцах идио- сомы значительно варьирует (от 2 до 7). Продольных дорсальных мышц идиосомы y Ch. eruditus — две пары.
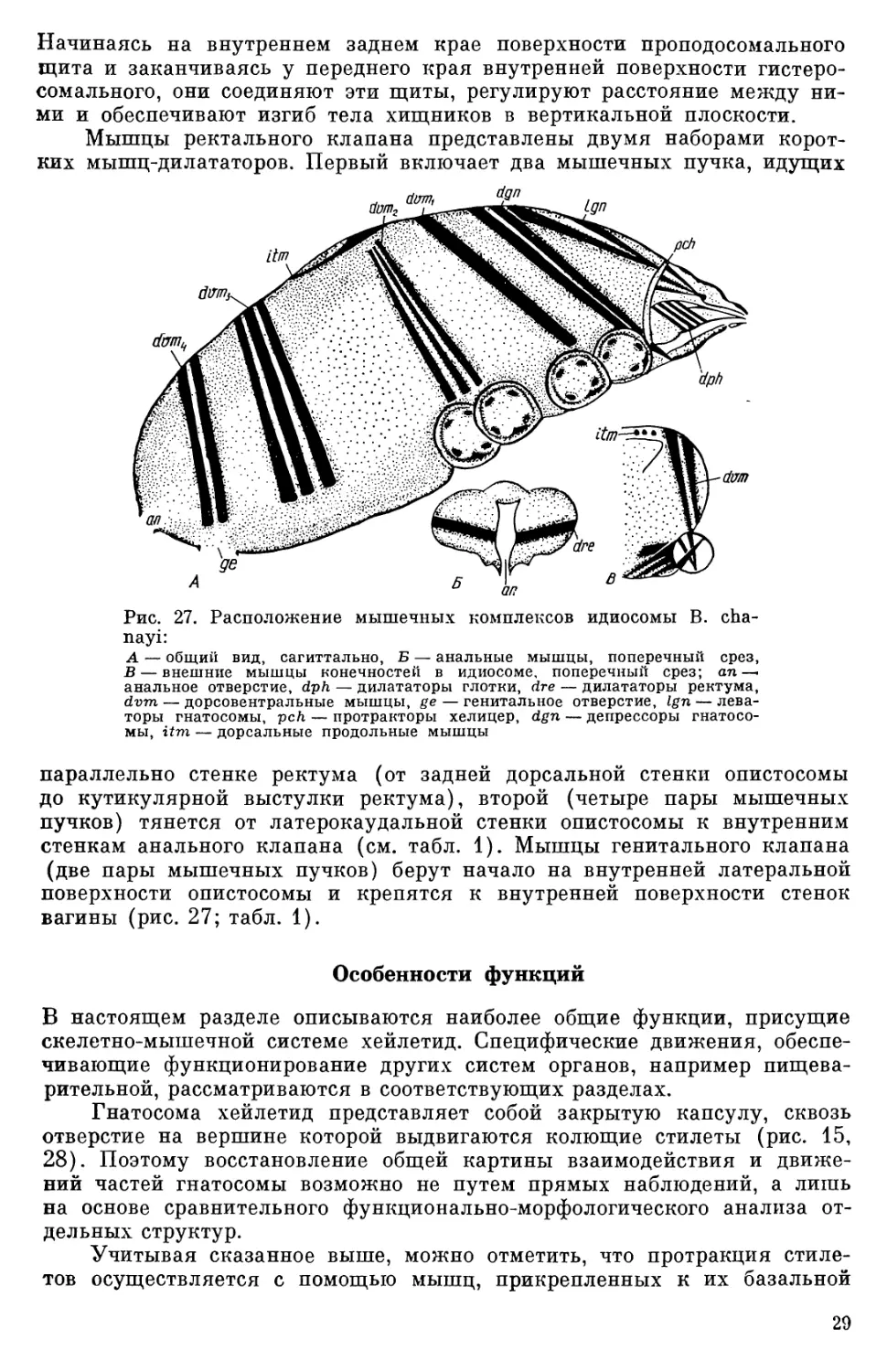
Начинаясь на внутреннем заднем крае поверхности проподосомального щита и заканчиваясь у переднего края внутренней поверхности гистеро- сомального, они соединяют эти щиты, регулируют расстояние между ни- ми и обеспечивают изгиб тела хищников в вертикальной плоскости. Мышцы ректального клапана представлены двумя наборами корот- ких мышц-дилататоров. Первый включает два мышечных пучка, идущих de 1 L Рис. 27. Расположение мышечных комплексов идиосомы В. cha- nayi А — общий вид, сагиттально, Б — анальные мышцы, поперечный срез, В — внешние мышцы конечностей в идиосоме, поперечный срез; ап— анальное отверстие, dph — дилататоры глотки, dre — дилататоры ректума, d~m — дорсовентральные мышцы, ge — генитальное отверстие, Lgn — лева- торы гнатосомы, pch — протракторы хелицер, dgn — депрессоры гнатосо- мы, imam — дорсальные продольные мышцы параллельно стенке ректума (от задней дорсальной стенки опистосомы до кутикулярной выстулки ректума), второй (четыре пары мышечных пучков) тянется от латерокаудальной стенки опистосомы к внутренним стенкам анального клапана (см. табл. 1). Мышцы генитального клапана (две пары мышечных пучков) берут начало на внутренней латеральной поверхности опистосомы и крепятся к внутренней поверхности стенок вагины (рис. 27; табл. 1). Особенности функций В настоящем разделе описываются наиболее общие функции, присущие скелетно-мышечной системе хейлетид. Специфические движения, обеспе- чивающие функционирование других систем органов, например пищева- рительной, рассматриваются в соответствующих разделах. Гнатосома хейлетид представляет собой закрытую капсулу, сквозь отверстие на вершине которой выдвигаются колющие стилеты (рис. 15, 28) . Поэтому восстановление общей картины взаимодействия и движе- ний частей гнатосомы возможно не путем прямых наблюдений, а лишь на основе сравнительного функционально-морфологического анализа от- дельных структур. Учитывая сказанное выше, можно отметить, что протракция стиле- тов осуществляется с помощью мышц, прикрепленных к их базальной
части (рис. 15). Места прикрепления сухожилий этих мышц к базаль- ным частям стилетов (тарсусов) находятся впереди, так что сухожилие огибает закругленную часть тарсуса и при сокращении поворачивает эту часть на 180' вокруг перпендикулярной оси. Благодаря этому располо- женный сзади участок тарсуса, подвижно сочлененный со стилетами, толкает его вперед. Таким образом осуществляется протракция стилетов, которые скользят вдоль желобов гипофаринкса и своих футляров к от- верстию на вершине рострума. При выходе из гнатосомы правый и левый стилеты соединяются вместе вогнутыми поверхностями и образуют тон- кую заостренную трубочку (рис. 28, 29). Глотка, лишенная структурно оформленных мышц-констрикто ров, функционирует подобно мембранному насосу, расширяясь прп сокра- щении мощных мышц-дилататоров. Дорсальная стенка глотки, которая служит сократимой эласти шой мембраной этого своеобразного пасоса, после расширения дилататорами возвращается в исходное положение за счет эластичности. Возвращение стенки глотки в исходное состояние связано с выравниванием давления в полости благодаря декомпрессион- ному отверстию. Так как этот процесс непосредственно связан с приемом пищи, он будет подробпо рассмотрен при описании передней кишки. Сокращение двух небольшпх мышц внутри лабрума (рис. 17) может, ве- роятно, приводить к утолщен1ио последнего илп к его выгибанию вверх и левации. Основное двп>кеш|е подвижной части педипальп в горизонтальной плоскости осуществляется посредством сокращения мышц-антагонистов базальных члеников (гнатококс) и одномыщелкового аксиального сочле- нения с члениками педипальп. Кроме того, латеровентральное прикреп- ление мышц к терминальным членикам и структурам суставов позволя- ет педипальпам совершать при асинхронном сокращении мышц также незначительные движения и в вертикальной плоскости. Движением гнатосомы управляют, сокращаясь в различных комби- нациях, внешние мышцы гнатосомы. Причем в вертикальной плоскости наблюдается большая амплитуда движений, в то время как в горизон- тальной они ограничены трансверсальным одномыщелковым соедине- нием гнатосомы с идиосомой и аподемамп неподвижных кокс первой пары ходильных конечностей. Движения ходильных конечностей хейле- тид сходны с движением ног других, изученных в этом отношении кле- щей (Manton, 1973; Akimov, Jastrebtsov, 1987) . Взаимно перпендикулярное расположение осей артикуляции между члениками кокса — трохантер и трохантер — фемур (рис. 26) ходильных ног при сокращении мышц этих члеников задает основное положение ко- нечности в пространстве. Именно эти членики обладают не только флек- сорами (или же промоторами), как и все членики ног, но и антагониста- ми — экстензорами (и ремоторами) . Дорсолатеральные мышцы идиосомы, сокращаясь, вызывают повы- шение внутреннего давления в полости тела хейлетид. Такое гидравли- ческое давление передается во все членики конечностей, что позволяет согнутым терминальным членикам ног (от гену до тарсуса) разгибаться без специальных мышц-экстензоров. Гидравлическая система передачи движений весьма характерна для клещей (Manton, 1973; Акимов и др., 1988). Продольные мышцы между проподосомальным и гистеросомальньп| щитами при сокращении также несколько увеличивают внутреннее дав- ление и, кроме того, несколько изгибают продольную ось тела. При со- 30
кращении ректальных мышц диаметр ректума увеличивается и расширя- ется анальное отверстие. Это облегчает дефекацию, которая осуществля- ется за счет давления на кишечник, создаваемого дорсовентральной му- скулатурой гистеросомы. Действие генитальных мышц направлено на расширение вагины в момент яйцеклетки. Анализируя в целом строение и функции мышечной системы изученных хейлетид (Summers, Witt, 1971; Горголь, Ястребцов, 1987, 1989), можно отметить, что топографически и функционально она прин- ципиально однотипна у хищных и паразитических видов и аналогична таковой некоторых тромбидиформных клещей (Blauvelt, 1945; Mitchell, 1962, 1964). Особенно это относится к хелицеральным, глоточным и внешним мышцам гнатосомального комплекса, которые обеспечивают до- бычу и поглощение пищи (Беккер, 1935; Blauvelt, 1945; Акимов, Ястреб- цов, 1981; Andre, Remacle, 1984). Однако в деталях мышцы и-скелетные элементы этого комплекса подверглись и наибольшим изменениям в про- цессе специализации клещей к питанию различными объектами. Что касается мышц идиосомы, то их комплекс у хейлетид значительно беднее по сравнению с другими тромбидиформнымп клещами (Mitchell, 1962, 1964) и представлен лишь дорсовентральными, а также узкоспециализи- рованными мышцами. В мышечной системе клещей-хейлетид представляют интерес мышцы и элементы скелета педипальп и ходильных конечностей — органов, обе- спечивающих успех поиска и захвата добычи — жертвы. У хищных представителей хейлетид надежное удержание и поимка жертвы потребовали увеличения жесткости педипальп, которая достиг- нута уменьшением количества степеней свободы этих конечностей в ре- зультате редукции члеников или их срастания друг с другом. В боль- шинстве случаев таким редуцирующимся члеником оказался гену. Наи- более ярко это видно на примере С. lepidopterorum, у которого происхо- дит не только частичное слияние гену с фемуром, но и полная редукция мышц у этого членика. С другой стороны, излишняя жесткость системы члеников, образующих педипальпу, компенсл~уется мембранным сочле- нением когтя педипальп с тибией. Благодаря этому при резких движе- ниях захваченной жертвы коготь, играющий основную роль в захвата п удерживании ее, смягчает такие движения, не позволяет им повредить педип альпы. В отличие от хищных хейлетид у паразитических видов педипальпы небольшие, а гену не редуцирован. Основная функция таких педипальп осязательная, например у В. chanayi, Ornithocheyletia sp. В связи с этим коготь тибии у них менее развит и смещен апикаль- но, а тарсус слит с тибией и не имеет собственных мышц (рис. 22). Су- ществует и иное направление специализации педипальп — у паразитиче- ских видов хейлетид — как органов фиксации на теле животного-хозяи- на, например (рис. 5) у видов рода Hemicheyletus (Волгин, 1959). Следует отметить, что в отличие от ходильных конечностей в педп- пальпах хейлетид не обнаружено структуры, аналогичной амбулакруму ходильных конечностей. В целом педипальпы этих клещей могут быть представлены неподвижной коксой (гнатококсой) с причлененным к ней рудиментарным трохантером, гипертрофированным фемуром, пебольшпм, иногда рудиментарным гену, тибпей с антиаксиальным выростом в виде когтя и редуцированным тарсусом. Гребневидные щетинки тарсуса не 31
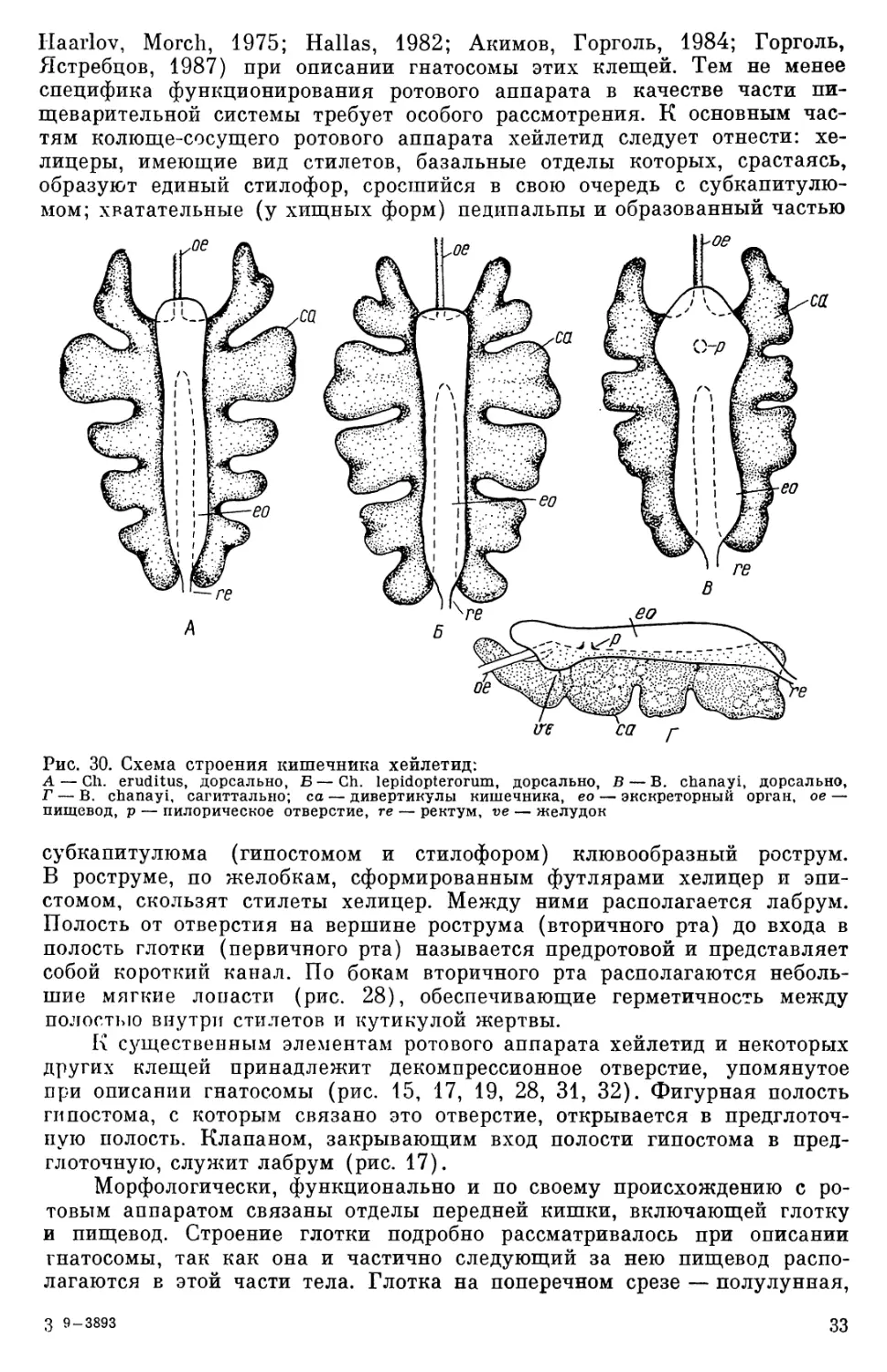
явдяцутся гомологами амбулакрума ходильных конечностей, так как в отличие от них не имеют собственных мышц. ~то касается ходильных конечностей хейлетид, то в основе их дея- тельности лехсит схема, типичная для функционирования конечностей клещей в целом (Акимов и др., 1988). Однако все же существуют неко- торые отличия, связанные, в первую очередь, с фиксированной, как и у других тромбидиформных клещей, коксой хейлетпд. В связи с этим у хейлетид базальный членик подвижной части конечностей представлеп только трохантером, который за счет мышц-антагонистов и особенностей артикуляции с коксой и фемуром обеспечивает движение в двух взаим- цо перпендикулярных плоскостях. Неподвижная кокса является основ- ным скелетным элементом для прикрепления внутренних мышц-антаго- нистов, внешние мышцы ходильных конечностей практически отсутству- ют. Терминальный комплекс конечности хейлетид представлен весьма гомономными элементами, Все отмеченные выше особенности ходильных конечностей в значи- тельной степени обусловливают достаточно четко выраженную их разно- качественность. Метрические характеристики (см. табл. 2), а также визуальные наблюдения за движением первой пары ног Ch. eruditus свидетельствуют о том, что она в основном выполняет тактильные функ- ции, в то время как локомоторные осуществляются ею весьма посред- ственно и спорадически. Основная локомоторная функция выполняется I I и IV парами ног, причем IV пара конечностей служит также для кле- щей упором и стабилизирует тело хищников при движении. Несмотря на то что по метрическим характеристикам (см. табл. 2) конечности Ch. eruditus являются типично бегательными, у них, в отли- чие от бегательных конечностей других клещей (Ястребцов, 1986), об- ладающих высокой мобильностью, отсутствуют на члениках всех конеч- ностей специализированные демферные структуры. Амбулакральный аппарат у свободноживущих хейлетид развит до- вольно слабо. Он не позволяет этим хищникам достаточно надежно фик- сироваться на субстрате и не может, учитывая высокую двигательную активность, предохранить их конечности от деформации. У других хей- летид, например у паразитических клещей трибы Ornithocheyletini, он манжет быть достаточно развитым, выполняя функции фиксации парази- та на теле хозяина. ПИЩЕВАРИТЕЛЬНАЯ СИСТЕМА Пищеварительная система хейлетид состоит из ротового аппарата и ки- шечника. Кишечник принадлежит к тромбидиформному типу (Reuter, 1909) и делится на переднюю, среднюю и заднюю кишки, включающие такие отделы, как глотка, пищевод, дивертикулы средней кишки, экскре- торный орган и ректум (рис. 30). С пищеварительной системой морфо- логически и функционально связаны некоторые экзокринные железы, функционирующие как слюнные и как органы выделения. Ротовой аппарат и передняя кишка Строение. Ротовой аппарат представляет собой отдел пищеварительной 'системы, обеспечивающий прежде всего добычу, поглощение и первичную обработку пищи. Основные элементы ротового аппарата хейлетид рас- смотрены нами и другими авторами (Hughes, 1959; Summers, Witt, 1971; -32
Morch, 1975; Hallas, 1982; Акимов, Горголь, 1984 Горголь, Ястребцов, 1987) при описании гнатосомы этих клещей. Тем не менее специфика функционирования ротового аппарата в качестве части пи- щеварительной системы требует особого рассмотрения. К основным час- тям колюще-сосущего ротового аппарата хейлетид следует отнести: хе- лицеры, имеющие вид стилетов, базальные отделы которых, срастаясь, образуют единый стилофор, сросшийся в свою очередь с субкапитулю- мом; хватательные (у хищных форм) педипальпы и образованный частью са Рис. 30. Схема строения кишечника хейлетид: А — Ch. eruditus, дорсально, Б — Ch. lepidopterorum, дорсально, В — В. chanayi, дорсально, — В. chanayi, сагиттально; ca — дивертикулы кишечника, ео — экскреторный орган, ое- пищевод, р — пилорическое отверстие, те — ректум, юе — желудок В ост м субкапитулюма гипостомом и стилофором) клювообразный ростр м. роструме, по желобкам, сформированным футлярами хелицер и эпи- У стомом, скользят стилеты хелицер. Между ними располагается лабрум. Полость от отверстия на вершине рострума (вторичного рта) до входа в полость глотки (первичного рта) называется предротовой и представляет со ой короткий канал. По бокам вторичного рта располагаются неболь- шие мягкие лопасти (рис. 28), обеспечивающие герметичнос ь между полостью внутри стилетов и кутикулой жертвы. (В fi существе~и|ым элементам ротового аппарата хейлетид и некоторых других клещей принадлежит деком прессионное отверстие, упомянутое при описании гнатосомы (рис. 15, 17, 19, 28, 31, 32). Фигурная полость ги постома, с которым связано это отверстие, открывается в предглоточ- пую полость. Клапаном, закрывающим вход полости гипостома в пред- глоточную, служит лабрум (рис. 17). Морфологически, функционально и по своему происхождению с ро- товым аппаратом связаны отделы передней кишки, включающей глотку и пищевод. Строение глотки подробно рассматривалось при описании гнатосомы, так как она и частично следующий за нею пищевод распо- лагаются в этой части тела. Глотка на поперечном срезе — полулунная 7 3 9-3893
как часть передней кишки выстлана кутикулой (рис. 15, 17, 19). Она начинается в глубине рострума первичным ртом, отделяющим ее от предротовой полости, и за базальными члениками хелицер переходит в пищевод (рис. 19, 20). Ширина ее у хищного клеща Ch. eruditus состав- ляет 3, у Ornithocheyletia sp.— 0,5, у В. chanayi — 1,5 мкм. Структур- ные компоненты глотки у всех изучаемых видов хейлетидных клещей сходны. Пищевод представляет собой тонкую трубку, соединяющую заднюю вентральную часть глотки с непарным центральным отделом средней кишки. В последний пищевод входит медиовентрально, на 20 — 30 мкм ниже его переднего края, на уровне кокс второй пары ног (рпс. 30). По ходу от глотки пищевод плавно поднимается в дорсокаудальном паправ- лении и проходит сквозь синганглий (мозг), пронизывая его под острым углом (рис. 20). У всех исследованных видов хейлетид длина пищевода составляет 1/5 — 1/6 часть длины тела и у Ch. eruditus равна 70 — 90 мкм, у В. cha- nayi — 97 — 102, у Ornithocheyletia sp. 25 — 30 мкм. На поперечххоы сре- зе пищевод круглый по всей длине (рис. 20). На участке от глотки до выхода из мозга его диаметр в среднем у Ch. eruditus составляет 5— 6 мкм, у В. chanayi — 7 — 9, у Ornithocheyletia sp.— 1,7 мкм. Прп 1хыходе из мозга пищевод воронкообразно расширяется, образуя проваптрику- лярный клапан, препятствующий обратному движению пищи из средней кишки. Клапан представляет собой короткое, наподобие телескоппческой трубки впячивание задней стенки пищевода в среднюю кишку. которое сопровождается нагромождением клеток, создающих впечатление много- слойного эпителия (рис. 20). Максимальный диаметр клапанов у Ch. exu- ditus — 9 — 10, у В. chanayi — 13 — 15 мкм. По строенихо и функциональ- ной роли провентрикулярный клапан изученных нами хейлотид соответ- ствует аналогичному образованию представителей различных групп кле- щей (Blauvelt, 1945; Jakeman, 1961; Балашов, 1967; Кио, Nesbitt, 1970; Grandjean, Aeschlimann, 1973; Старовир, 1975; Акимов, 1975; Baker. 1975; Desch, Nutting, 1977; Vistorin, 1980; Mothes, Seitz, 1980, 1981a). Макроморфология и гистология пищевода изученньхх видов одно- типна. Стенка состоит из одного слоя небольших овальных или вытяну- тых в длину клеток, которые располагаются на тонкой базальной мем- бране. У хищного клеща Ch. eruditus размеры клеток — 1,0 Х 3,5, у В. chanayi — '1,7X 2,1 мкм. Клетки пищевода гематофага В. chanayi располагаются плотно друг к другу, на поперечном срезе их насчитыва- ется 6 — 8 (рис. 20). У Ch. eruditus клетхххх пемногочпсленные менее ре- гулярные, на поперечньхх срезах ххх 1 — 3, но по направлению и провен- трикулярному клапану количество клеток увеличивается. У Ornithochey- letia sp. клетки пищевода очень мелкие, очертание их границ нечеткое, отчетливо просматриваются лишь интенсивно окрашиваемые ядра. Цхх- топлазма клеток у всех видов мелкодисперсная, слабовакуолизирована, без включений и содержит овальные, центрально расположепные ядра 0,7 — 0,9 мкм в диаметре. У клещей В. chanayi апикальные частп клеток пищевода несут невысокий, но довольно плотный слой микроворсинок. У клещей Ch. eruditus н Ornithocheyletia sp. микроворспнки отсутствухот. На всем протяжении просвет пищевода вьтстилает тонкая интима, которая по ходу от глотки к средней кишке утоньшается, а в провентри- кулярном клапане отсутствует вовсе. Следует отметить, что клетки про- вентрикулярного клапана крупнее клеток, выстилающих стенку основной части пищевода. У клещей Ch. eruditus OHH имехот размер 4,2>(6,8, а у 34
В. chanayi — 2,8X3,2 мкм. Ядра расположены в центре клеток, но чаще всего наблюдаются у основания, почти у базальной мембраны, а цито- плазма в дистальных концах клеток сильно вакуолизирована. Однако клетки провентрикулярного клапана, как и клетки всего пищевода, не содержат никаких включений. Морфологически клетки провентрикулярного клапана более всего соответствуют недифференцированным клеткам средней кишки, что про- тиворечит данным по изучению иксодовых (Балашов, 1957, 1961), тетра- ниховых (McEnroe, 1961), а также клещей-эрейнетид (Baker, 1970, 1977) . Базальная мембрана, на которой располагаются клетки пищевода, снаружи оплетена хаотично разбросанными волокнами висце ральной мускулатуры. Дифференцированные кольцевые мышцы, обнаруженные в пищеводе других клещей, например акароидных и гамазовых, у изучен- ных видов хейлетид отсутствуют (Hughes Т. Е., 1950, 1954; Prasse, 1967; Кио, Nesbitt, 1970; Coons, 1978). Из изложенного выше следует, что пищевод клещей-хейпетид имеет простое гистологическое строение, которое соответствует строению этого органа у других клещей и указывает на его незначительную роль в про- цессах пищеварения. Пищевод служит только для транспорта пищи к основному месту ее обработки — средней кишке. Однако слой микровор- синок клеток пищевода у паразитического клеща В. chanayi указывает на возможное участие их либо в процессе всасывания, либо в процессе экструзии. Возможно, что этот факт следует рассматривать как черту специализации кишечника к гематофагии. Функции ротового аппарата и передней кишки. В захвате объекта пи- тания, поглощении и первичной обработке пищи ротовой аппарат и пе- редняя кишка принимают непосредственное участие, причем функции их в этом отношении глубоко взаимосвязаны. Захват и фиксация относи- тельно ротового аппарата объекта питания осуществляются педипальиа- ми. Мощная мускулатура и когтевидный вырост предпоследнего тленц:ка педипальп обеспечивают выполнение этих функций. По-видимому, чув- ствительные щетинки у основания указанных тсогтевидны~ «ыростов скальп участвуют в распознании пригодности объекта для питания. Через вторичное ротовое отверстие прижатого к поверкпости пище- вого объекта рострума стилеты прокалывают кутикулу объекта питания и подстилающую ткань (рис. 33). В ранку, судя по направлепности про- токов (рис. 17) желез, вводится слюна, которая вызывает гпстолнз тка- ней жертвы. При прокалывании стилеты, сложенные вместе, образуют трубку, благодаря которой не только увеличиваются прочность тт упру- гость стилета, но и обеспечивается засасывание жидкой пищи. Послед- нее осуществляется благодаря непрерывной работе глотки (глоточного насоса), функционирование которой сходно у многих тромбидифорипых клещей. Особенностью этого насоса служит отсутствие в нем констрпк- торов. Все мышцы глотки хейлетид представлены дилататорами, которые расширяют ее полость, представляющую собой эластичную выпукло-во- гнутую капсулу с подводящими каналами (предротовая полость п пище- вод) (Summers, ШИ, 1971; Haarlov, Morch, 1975; Hallas, 198; Акимов, Горголь, 1984). Возвращение глотки в исходное после дилатацпи состоя- ние, соответствующее фазе констрикции других клещей, происходит за счет упругости стенок этой своеобразной капсулы. Процессу возвращения глотки в исходное состояние может препятствовать герметичность 3"
Рис. ЗЗ. Фазы поглощснпя пищи Ch. егцййця: А. — фаза прокалывания кутикулы жертвы, Б — фаза засасывания гемолимфы жертвы сквозь ОТВеРСТИе На КОП'те СОМКН~ТЫК CTJI.tICTOB В ПРеДРОТОВУЮ ПОЛОСТЬ И СКВОЗЬ ПеРВИЧНОе РОТОВОе отверстие в полость глотки, В — фаза декомпрессии (выравнивание давления внутри глотки с наружным при открывания декомпрессионного отверстия), Г — фаза констрикции глотки за счет сс эластпчпо11 дорсальноЙ стенки и перекачиванис содержимого глотки в пищевод; bch — основание хелицер, ср — кутпкула жертвы, do — декомпрессионное отверстие, La — лаб- рум, oe — пищевод, or~ — первичное ротовое отверстие, рй — глотка, st — стилеты соединения рострума с покровами объекта питания в месте выхода стиле- тов и расположения втори 1пого рта. Однако у хейлетид существует деком- прессионное отверстие, которое обеспечивает выравнивание давления в полости глотки по отношению к атмосферному давлению. Лвторы, впер- вые описавшие такое отвсрстие у клеща В. rubrloculus, пе акцентиро- вали внимание на его функции (Summers, Gonzales, Witt, 1973). В даль- нейшем такое отверстие было обнаружено у всех изученных нами хей- летид и подтверждено для других, не исследованных ранее тетранихид, тидеид и, возможно, иксодид (рпс. 32), т. е. у клещей с колюще-сосущим ротовым аппаратом, которые насасывают жидкую пищу сквозь модифици- рованные хелицеры. В последнее время функционирование декомпрес- сионного отверстия было описано Нузачн (Nuzzaci, Lillo, f988) у те- нуипальпид (Сепора lpus pulcher) . В процессе питания декомпрессионное отверстие у хейлетид закры- вается сверху узким длинным лаыорумом, играющим роль клапана (рис. 17, 33). При поднятом лабруме воздух манжет проходить сквозь де- компрессионное отверстие в предротовую полость, выравнивая давление. Затем лабрум вновь перекрывает это отверстие, оставляя открытым канал для Dpoxoæäåíèÿ пищи. После выравнивания давления на некоторое время может быть перекрыт и канал для поступления пищи, при этом упругая дорсальная стенка глотки за счет ослабления натяжения дила- таторов возвращается в исходное положение, выталкивая содержимое глотки в пищевод. Такая схеМа функционирования ротового аппарата и
глоточного насоса позволяет клещам, не вытягивая погруженные в обьект питания стилеты, осуществлять непрерывный процесс насасывания пищи. Для хейлетид это достаточно важно, так как позволяет им, схватив жер- тву или наметив точку питания на хозяине, не прерывать процесс наса- сывания жидкой пищи. Косвенным указанием на то, что такой же про- цесс происходит у мерзее специализированных клещей сем. Nicolettiellidae, служит наблюдаемый в инфракапитулюме этих клещей во время пита- ния декомпрессионный пузырек воздуха (Vistorin, 1980). Глубина проникновения в покровы жертвы и особенно хозяина за- висит от длины стилетной части хелицер. У хищника Ch. eruditus сти- летная часть хелицер составляет 89,2, у клеща В. chanayi — 42,8, а у Ornithocheyletia sp.— 29,3 мкм. Вероятно, глубиной проникновения в кожные покровы птиц (сосудистый или капиллярный слой), а также внутренним диаметром проводящей части стилетов определяется поступ- ление в кишечник экстопаразитов либо крови с ее форменными элемен- тами, либо только лимфы. Средняя кишка Строение дивертикулов средней кишки. Средняя кишка — основной, са- мый крупный отдел кишечника. Она занимает 2/3 объема полости тела клещей, проникает во все его отделы и контактирует со всеми внутрен- ними органами, прикрывая их с дорсальной стороны (рис. 30). У всех исследованных нами видов хейлетид она состоит из двух симметричных, слепых на оральном и аборальном IIo JIIocRx мешков — дивертикулов, сросшихся над второй и третьей парами ног в непарный отдел, называе- мый у некоторых клещей желудком (Blauvelt, 1945; Brown, 1952; Moss, 1962; Mitchell, 1964; Alberti, 1973; Березанцев, 1980; Mothes, Seitz, 1981а) . Однако у клещей-хейлетид желудок морфологически не обособ- лен (рис. 30) и средняя кишка представляет собой единую полость (Аки- мов, Горголь, 1984). Передние отростки дивертикулов, значительно су- жаясь от соединения, широко раздвинуты синганглием (мозгом) и экзо- кринными железами, простираются до основания кокс первой пары ног. Задние дивертикулы вдвое длиннее передних (у Ch. eruditus — 202, у В. chanayi — 220, а у Ornithocheyetia sp.— 60 — 70 мкм), охватывают с боков органы репродуктивной системы и, слегка загибаясь на вентраль- ную сторону, совпадают с контурами опистосомы. По дорсомедиальной линии средняя кишка у всех хейлетид прикрыта экскреторпым органом (рис. 30). Ширина и высота днвертпкулов непостоянна и в значительной степени зависит от насыщения клешей и от этапа пищеваренн». Внутрен- ние степки дивертикулов сглажены, а латеральные, примыкающие к боковым внутренним степкам покровов, образуют лопастп (pic. 30), вы- емки между которыми могут составлять до трети ширины, чивертикулов у паразитических (30 — 40 мкм у В. chanayi) п до 3/4 — у хищного клеща Ch. eruditus (60 — 70 мкм). Между лопастями, а так1ке сквозь специаль- ные каналы в дивертикулах кишечника проходят пучки дорсоваптраль- HhIx мышц идиосомы. Такими глубокими выемками каждый из дивертп- кулов кишечника клещей В. chanayi и Ornithocheyletia sp. разделен на четыре лопасти, из которых наиболее крупные — задние. У СЬ. eruditus дивертикулы разделены на шесть одинаковых лопастей, кроме того, каж- дая из затих первичных лопастей подразделяется па две-три вторичные. В целом расчленение средней кишки у клещей Ch. eruditus выражено 37
значительно сильнее, чем у паразитических видов хейлетид (рис. 30). Следует, однако, отметить, что разделение дивертикулов на отдельные лопасти как у хищных, так и у паразитических хейлетид варьирует даже у особей одной популяции. Это зависит от степени заполнения кишечни- ка пищей, периода пищеварения и времени голодания, а также индиви- дуальных особенностей особей. Гистологическое строение кишечника клещей Ch. eruditus, B. chanayi и Ornithocheyletia sp. сходно (рис. 34 — 37). Снаружи стенка кишечника включает слой висцеральной мускулатуры в виде хаотично разбросанных немногочисленных миофибрилл, который обеспечивает весьма слабую, едва уловимую при наблюдениях за живыми клещами перистальтику. Средний слой стенки кишечника образован неклеточной, хорошо разви- той соединительнотканной мембраной, а внутренний — эпителиальной тканью. Из перечисленных выше элементов наиболее функционально активной является эпителиальная ткань. По характеру морфологических особенностей и функциональной ак- тивности клетки эпителия средней кишки исследуемых видов клещей подразделяются на недифференцированные и функционально активные. Первые из них у всех хейлетид однотипны, а вторые достаточно резко отличаются у изученных видов. Функционально-гистологические особенности. Недифференцирован- ные клетки. Данные клетки образуют самый низкий ряд однослойного, ыестами однорядного эпителия высотой 2 — 6 мкм. Несмотря на значи- тельные различия в величине исследуемых клещей, размеры их недиф- ференцированных клеток отличаются незначительно (у Ch. eruditus— 3,5Х2,1, у В. chanayi — 4,5X6, у Ornithocheyletia sp.— 3,5X5,1 мкм). Структура клеток у всех видов хейлетид также сходна. Клетки разно- образной формы — от вытянутой и уплощенной до кубической. Цито- плазма их мелкодисперсная, слабо вакуолизирована, без четкой поляр- ности и включений, тяготеет к базофилии, окрашивается со средней интенсивностью. Ядра клеток преимущественно овальные (у Ch. erudi- tus — 1,4Х1,6 В. chanayi — 1,6X2, Ornithocheyletia sp.— 1,2X1,7 мкм). Они располагаются базально, у самой мембраны, богаты РНК, го~иоген- ны и окрышиваются значительно интенсивнее цитоплазмы. Недифферен- цированные клетки не имеют строгих мест локализации в стенках сред- ней кишки и встречаются повсеместно — по всему периметру дивертику- лов, среди функционально активных клеток. Их количество непостоянно и зависит от этапа пищеварения. Наиболее многочисленны недифферен- цированные клетки после поступления новых порций пищи в кишечник в зонах выемок латеральнык стенок дивертикулов. По мере углубления процесса пищенарения, дифференциации функционально активных кле- ток средней кишки и резороции пищевых веществ из ее полости коли- чество недифференцированных клеток убывает. У клещей В. chanayi, длительное время не принимавших пищи и содержащих в средней киш- ке лишь непереваренные от предыдущего питания остатки (гематин), педифференцированные клетки отсутствуют, в то время как у хищника Ch. eruditus даже после двухнедельного голодания они не единичны. Из изложенного выше следует, что недифференцированные клетки средней кишки клещей-хейлетид представляют собой камбиальные эле- менты, за счет последующей дифференцировки которых происходит обра- зование функционально активных клеток. Они являются обязательным злементом эпителиальной ткани средней кишки многих групп клещей (Bader, 1938; Iiughes Т. Е., 1950, 1952; Балашов, 1957; Беккер, 1957; 38
Белозеров, 1957; Кио, Nesbitt, 1970; Акимов, 1975; Акимов, Старовир, 1976; Mothes, Seitz, 1981а). Функционально активные клетки эпителия кишечника хищного кле- ила Ch. eruditus. Изучение различных модификаций функционально ак- тивных клеток кишечника хищного клеща Ch. eruditus показало, что по своим морфохимическим характеристикам клетки однотипны. Они обла- дают большой функциональной пластичностью и в процессе жизнедея- Тельности подвергаются значительным габитуальным и реконструктивным изменениям. Эти изменения связаны с режимом питания хищников, про- исходят циклично, сопровождая каждый новый этап пищеварения, и вы- ражаются в двух морфофункциональных состояниях клеток. Наиболее яркие различия проявляются при сравнении эпителия у длительно го- лодавших (от 4 сут до 2 недель) и сытых, т. е. с кратковременными, ис- числяемыми часами, перерывами в приеме пищи клещей. У особей со стабильным режимом питания различия в эпителии про- слеживаются не так часто. У голодных клещей клетки кишечника по виду II структуре соответствуют секреторным, которые неоднократно опи- сывались при исследовании пищеварительной системы акариформпых клещей (Hughes Т. Е., 1950; Беккер, 1959; Hughes Т. Е., 1959; Ehara, 1960; МсЕпгое, 1961; Wright, Newell, 1964; Кио, Nesbitt, 1970; Alberti, 1973; Акимов, 1975; Baker, 1975; Петрова, Петров, 1977; Mothes, Seitz, 1981а). Они имеют пирамидальную или кубическую форму, размеры их варьируют от 15 до 25 икм в высоту, располагаются по всему периметру кишечника, но наиболее многочисленны на внутренних поверхностях стенок и в зонах выемок крипт. Из-за тесного расположения клетки де- формируют друг друга и часто их границы различаются с трудом (рис. 34). Внутреннее пространство клеток заполнено многочисленными вакуолями круглой и неправильной формы величиной 0,5 — 6 мкм. Преи- мущественное большинство вакуолей имеет размеры 1,7 — 3,4 мкм. На срезах все вакуоли выглядят пустыми, за исключением наименьших, рас- положи!пых в кортикальном слое цитоплазмы, содержимое которых окрашивается азанои в слабо-сиреневьш цвет (рис. 34). Интенсивно вос- принимают окраску, в основном кислыми красителями, только оболочки вакуолей. Ядра клеток однородны, круглые или овальные (8,7X5,5 мкм), располагаются, как правило, у базальной мембраны — в базальной части клеток. Их нуклеолемма неровная, вдавлена внутрь ядра вакуолями, рас- положенными в цитоплазме. Ядра содержат по одному крупному, зани- мающему 1/2 часть объема ядра, гомогенному, богатому РНК ядрышку. В клетками собственно цитоплазматических структур мало. Небольшое количество мелкодисперсного гранулярного материала наблюдается толь- ко в уз!'их межвакуолярных пространствах и околоядерной зоне. Следует отметить. что кроме целых клеток на внутренней стороно базальной мембраны наолюдаются и их фрагменты. Такие же части клеток видны и в просвете кишечника. Причем при недельном голодании хищников наблюдается массовое отторжение клеток эпителия пластами, состоящи- ми из десятков клеток. Таким образом, для клеток голодных клещей Ch. eruditus характерен морфонекротический (Уголев, 1961) способ регенерации. Они замещают- ся дифференцирующимися камбиальными элементами, присутствующими в стенках кишечника постоянно. Как следует из литературных источни- ков (Baker, '1971; Петрова, Петров, 1977; Mothes, Seitz, 1981а), такие клетки в своих вакуолях содержат пищеварительные ферменты, которые расходуются при их деструкции на процессы полостного пищеварения-
В данном случае процесс секреции этих ферментов постоянен даже в условиях длительного голодания хищников. Это свидетельствует о неиз- менной готовности Ch. eruditus к приему и переработке пищи, что монс- но рассматривать как важную черту специализации к хищному способу питания. При поступлении в полость кишечника клещей Ch. eruditus пищи, которую составляют гемолимфа и небольшое количество содержимого кишечника жертв (Горголь, Барабанова, 1979), наблюдается одновремен- ное массовое отторжение сформированных в процессе голодания хищни- ков клеток (рис. 34). Новая их генерация характеризуется быстрыми темпами дифференцировки и значительно отличается от старой. Клетки приобретают кубическую форму. Вначале (спустя 1 — 2 ч после кормле- ния Ch. eruditus) эти клетки немногочисленны и располагаются далеко друг от друга. Но очень быстро их количество возрастает и промежутки между клетками исчезают (рис. 34). Вакуоли, которые у голодных кле- щей выглядели пустыми, у напитавшихся заполняются гомогенным со- держимым и приобретают отчетливую сферическую форму (рис. 34). Азаном эти вакуоли красятся в различные оттенки розового и сиренево- го цветов, гематоксилином — чернятся, эозином красятся в красный и мэлиновый цвета, ШИК-реакция дает гамму цветов от сиреневого до малинового. С толуидиновым синим содержимое вакуолей дает мета- хромазию. Такой набор морфохимических характеристик свидетельствует о том, что вакуоли представляют собой гликопротеиновые комплексы, анало- гичные пищеварительпым вакуолям, внутри IcoTopbIx происходит актив- ный процесс переваривания питательных веществ (WVright, Newell, '1964; Балашов, 1967; Кио, Nesbitt, 1970; Baker, 1971, 1973; Барабанова, 1973; Акимов, Старовир, 1974; Петрова, Петров, 1977; Mothes, Seitz, 1981а; О. Grand j can, 1983) . Вакуоли более мелких размеров сосредоточены преимущественно в апикальных частях клеток, т. е. в зоне их поверхностного аппарата. Бо- лее крупные (6,8 — 8,5 мкм) смещены к центру. Количество вакуолей невелико, на поперечных срезах дивертикулов их насчитывается от 3 до 10 в каждой клетке (рис. 34). Всю остальную часть клеток по-пре кпему запимают такие же вакуоли, как у голодных клещей — пустые и неокра- шивающиеся. При появлении в цитоплазме клеток пищеварительных (окрашенных) вакуолей, неокрашенные могут сливаться в одну большую вакуоль. последняя занимает центральное место в клетке, оттесняя «дро в апикальную часть. Такие клетки наблюдаются в стенке дивертикулов редко, вероятно, они очень недолго функционируют в прикрепленном состоянии и сразу же отторгаются в просвет кишечника (рис. 34). Ха- рактерно, что они встречаются, преимущественно, сразу после кормле- ния хищников, голодавших несколько суток, и могут быть показателем длительности голодания клещей. Со временем прикрепленные к базальной мембране пищеваритегг!.- ные клетки Ch. eruditus утрачивают пустые вакуоли (рис. 34), но ири этом количество окрашенных вакуолей не увеличивается, а структу ра изменяется. Содержимое таких вакуолей постепенно диспергируется, вну- три у них появляются отдельные гранулярные элементы (0,3 — 1,7 мкм), распределяющиеся без определенной ориентации — диффузно. Некото- рые вакуоли (на полутонких срезах) интенсивно чернятся осмием, что указывает на присутствие в них липидов (рис. 34). Одновременна ШИК-реакция позволяет выявить в базальных частях клеток гликогеп. 40
Вместе с липидами в очень ограниченном количестве присутствутот и мукополисакаридные включения. В клетках наблюдаются отдельные кри- сталлические гранулы размером 0,1 — 0,2 мкм, не обладающие интенсив- ным свечением в поляризованном свете (рис. 34). Природа их неизвест- на, но, возможно, это результат процессов аутофагии, при которых гидролизу подвергаются органеллы клеток. Периодически меняя друг дру- га, клетки с таким содержимым отторгаются в просвет кишечника и сме- шиваются в его полости с фрагментами других клеток. При отторжении клеток плазматическая мембрана разрывается и пищеварительные ва- куоли оказываются в полости кишечника. Многие из них не успевают пройти внутриклеточный цикл переваривания и поэтому завершают его в полости дивертикулов, при этом оболочка свободно плавающих в про- свете кишечника вакуолей уплотняется сорбированными на поверхности частичками. Окраска оболочки вакуолей различными гистологическими методами (ШИК, гематоксилин Гейденгаххна, азан) свидетельствует о наличии элементов перитрофической мемораны вокруг вакуолей-, кото- рая, как известно, присутствует при процессах полостного нищевареп1~я (Уголев, 1961, 1963; Prasse, 1967; Кио, Nesbii,t, 1970; Grandjean, Aeschli- mann, 1973; Акимов, 1975). Со временем такие свободно плавающие ва- куоли претерпевают деструктив i ~ые изменения, в результате которы. внутри них образухотся гльхбовхх;хххьхе конкрецпи фекального материала, вьхходящие после разрыва вакуолей в полость дпвертикулов (рпс. 34). По мере убывания пищи из просвета дивертикулов скорость «озоб- новлеиия кишечного эпителпя падает. Клетки, поглотившие последние порции пищи из просвета кишечника, более длительное время ocTBIoTcsE прикрепленными к базальноц маморане, чем клетки, поглотившие пер- вые порции, и разрушаются лишь при полной деструкции в них пище- варительных вакуолей. Если после полного цикла переваривания посту- пивших в кишечник питательных веществ не будет их пополнения, то клетки опять приобретают вид секреторных. При отсутствии HoBbIx пор- ций пищи энителиальные клетки Ch. erud1tus способны поглощать бал- ластные вещества, бесполезно дублируя цикл пищеварения своих пред- шественников. Об этоъх свидетельствует присутствие в секреторных клет- ках таких же непереваренных остатков пищи, которые наблюдаются в полости кишечника. В процессе длительного голодания клещей в клет- ках возрастает количество крпсхаллов, имехощххх форму и размеры экс- креторыых, но не обладающих свечением в поляризованном свете. Оче- видно, они являются продуктами разлххчххьхх процессов аутофагихх, посредством которьхх клетки восх:олххяхот дефицит пластических материа- лов для возобновления собственных цитонлазматических структур. Зтим, и~.роятно, можно ооъяснить и иысоку10 5lcTofI~1èâoñòü хищников h голо- данию. Следует отметить, что наряду с синхронностью функционирования кишечный эпителий С1х. eruditu~ обладает и топографической циклич- ххостьхо фунххцххоххххроххах1ххя. Последххяя выражается в том что клетки эпителия, локалпзующиеся на примыкающих к экскреторному органу стенках псрвьпш HB 1wíàþò поглощение пищевых частиц из просвета дивертикулов. Вслед за ними в этот процесс включаются клетки лате- ральных стенок задних дивертикулов — крипт. Последними начинают адсорбцию клетки дорсальной и вентральной поверхностей средней киш- ки. Последовательность этих процессов прослеживается не только на глстологических препаратах, но п при визуальных наблюдениях за из- менением окраски кишечника клещей в период голодания (Акимов, 41
Горголь, 1987). В местах первоочередного поглощения клетками эпителия пищи, кишечник окрашивается более интенсивно, причем это наблюда- -ется у хищников с изначально различной интенсивностью его окраски- от светло-желтой до темно-коричневой. В последнем случае, однако, ин- тенсивность потемнения окраски в местах первоочередного поглощения пищи в 2 — 3 раза выше. Опыты по скармливанию хищникам Ch. eruditus акароидных клещей А. QvBtus, которых предварительно кормили питательной смесью, содер- жащей китайскую тушь, показали, что после этого в течение 4 сут тушь в полости кишечника Ch. eruditus сохраняется. В виде мелких конкре- ций она наряду с гранулами, освободившимися из пищеварительных ва- куолей, рассредоточивается в полости, обнаружена в отторгнутых и при- крепленных к базальной мембране клетках (рис. 3 ~). Выделение ее с экскретами через экскреторный орган не наблюдалось. Такие же ре- зультаты были получены при скармливании хищникам и тетраниховых клещей, содержавших в своем кишечнике значительное количество оставшихся после переваривания хлорофилла веществ (рис. 34), и ге- матофагов-нидиколов с наличием в полости дивертикулов гематина (рпс. ~5 — 37) . В обоих случаях балластные вещества жертв, поступив- шие в кишечник Ch. t.'ruditus при питании, в дальнейшем из его орга- низма не выводились, а аккумулировалпсь в нем цо конца жизни. Эти факты свидетельствуют о том, что кишечник изучаемого хищника замк- нут слепо и не имеет связи с экскреторным органом. Кроме того, в отли- чие от клещей тромбикулид, ичеющих аналогичное строение кишечника, у Ch. eruditus не наблюдалось и явление шизокинеза (Mitchell, Nadcha- tram, 1968; Mitchell, 1970). Функционально активные клетки эпителия кишечника паразитиче- ского клегца-лимфоф ага Ornithocheyletia sp. Функционально активный эпителий кишечника клеща Ornithocheyletia sp., как и хищного клеща Ch. eruditus, представлен одним типом клеток. По сравнению с размера- ми самих клещей эти клетки относительно крупнее, чем у Ch. eruditus. Функциональное состояние клеток кишечника Ornithocheyletia sp. подчинено общему для кишечного эпителия клещей циклу и, поскольку изучаемые эктопаразиты питаются постоянно, то одновременно у них можно наблюдать все его фазы. Молодые клетки кишечника Огп1йо- с he ylet id sp., кото рые преобладают в стенках во время поступления в полость дивертикулов лимфы, кубической формы. В пределах всего орга- на их размеры практически одинаковы (20X32 мкм). Клетки распола- гаются однослойно, не деформируют друг друга, их апикальные концы выступают в просвет (рис. 34). Ядра клеток круглые, 3,4 мкм в диамет- .ре, с одним гомогенным и богатым РНК ядрышком, занимающим поло- вину объема ядра (1,7X2 мкм) (рис. 34). Ядра располонсены в центре, апикальной или базальной частях клеток. Цитоплазма клеток мелкодис- иерсная, интенсивно базофильная. В ней выявляется небольшое коли- чество белковых и ШИК-положительных веществ, вероятно, полисаха- ридов, весьыа отличающихся, однако, от гликогена. Внутри клеток со- держатся 4 — 6 больших вакуолей диаметром от 5 до 12 мкм. Их содер- жимое слабо окрашивается эозином, и в большинстве случаев они вы- глядят пустыми. Апикальная часть клеток неровная, окрашивается ин- тенсивнее цитоплазмы и оболочек вакуолей внутри клеток, однако слой микроворсинок не просматривается. Следует отметить, что в некоторых случаях апикальные поверхности клеток могут смыкаться и QoJIHocTbEo заполнять просвет кишечника (рис. 34).
На следующем этапе переваривания, который проявляется в усиле- окраски кишечника и переходе ее от желтой к оранжевой, количе- ство пустых вакуолей в клетках увеличивается, а размер их уменьшает- ся (0,8 — 1 мкм). Параллельно этому усиливается гранулярность цито- плазмы. Отдельные гранулы появляются и внутри вакуолей, которые ранее были пустыми. Лзан такие клетки окрашивает в различные цвета (от красного до синего и фиолетового) с различными оттенками. Далее, когда содержимое кишечника Ornithocheyletia sp. становится темно-оран- жевым, в его клетках хорошо дифференцируются белоксодержащие плот- ные вакуоли диаметром от 0,8 до 5 мкм. Эозином они окрашиваются в розовый цвет, а при обработке толуидиновым синим приобретают интен- сивно сине-фиолетовую окраску. Структура их соответствует вакуолям, наблюдаемым в клетках кишечника хищного клеща Ch. eruditus и кле- ща-гематофага В. chanayi, но в отличие от последнего, они не содержат гемоглобина (бензидиновая реакция была отрицательной) . Это свиде- тельствует о том, что по характеру питания Ornithocheyletia sp.— лим- фофаг. Тем не менее появление в клетках вакуолей указывает на то, что н них осуществляется внутриклеточное переваривание пищи, поступившей из полости дивертикулов путем эндоцитоза. Следует отметить, что коли- чество вакуолей в клетках средней кишки Ornithocheyletia sp., как и у Ch. eruditus, невелико и составляет 10 — 12. В дальнейшем вакуоли пи- щеварительных клеток Ornithocheyletia sp. распадаются и на их месте остаются только небольшие глыбки непереваренных веществ. На этом этапе клетки начинают отторгаться от базальной мембраны и разру- шаться в полости кишечника. Однако чаще всего клетки дегенерируют, оставаясь прикрепленными к базальной мембране. Балластные вещества, оставшиеся в просвете кишечника и попавшие в него из разрушившихся клеток, в виде отдельных глыбок поступают в экскреторный орган и вместе с гуанином выделяются наружу. Функционально активные клетки эпителия кишечника паразитиче- ского клеща-гелсатофага В. ehanayi. Эпителий кишечника клеща-гемато- фага В. chanayi представлен двумя типами функционально активных клеток — типом 1 и тппом II (Акимов, Горголь, 1984). Соотношение ме- жду этими типами клеток у В. chanayi согласуется с основными этапа- ми переваривания пищи (крови), установленными для других кровосо- сущих членистоногих, и в частности для иксодовых и аргазовых клещей (Балашов, 1967; Grandjean, Aeschlimann, 1973; Grandjean, 1983, 1984). На первом этапе происходит гемолиз форменных элементов, на втором— усвоение гемоглобина, иа третьем — удаление из кишечника не подле- жащих утилизации ~ялластных веществ. Клещи В. chanayi, как и другие постоянные эктопаразиты, не испы- тывают недостатка в нище и питаются при первой необходимости, в свя- зи с чем у пих отсутствует строгая цикличность между отдельными эта- иами пищеварения. Енсе этапы проходят одновременно и в «чистом» видо выделить их невозможно. 11оэтому, основываясь на окраске кишечника и цитологических его особенностях, мо~кно говорить только о преиму- щественном протекании того или иного этапа. С поступлением свежих порций крови в окраске кишечника живых ~<лещей В. chanayi преобладают красные тона. В полости дивертикулов содержится негемолизированная птичья кровь с характерными для нее ядерными эритроцитами овальной формы (2,4Х6,8 мкм) без видимых повреждений и следов агглюцинации (рис. 35). Вероятно, это связано е незначительной гемолитической и антикоагуляционной деятельностью
ферментов слюнных желез этих эктопаразитов, как это наблюдается у аргазовых клещей, в отличие от иксодовых (Балашов, 1967; О. Grandje- an, 1983) . При поступлении кровь равномерно заполняет все отделы средней кишки, в эпителии которой в этот период дифференцируется большое количество клеток 1 типа. Они преимущественно кубические, но могут быть вытянутыми и булавовидными. Апикальная поверхность клеток I типа пузыревидно вздута (12 — 25 мкм), базальная — плоская, низкая (3,5 — 5 мкм) (рис. 35). На срезах апикальная часть представ- ляет собой одну большую вакуоль с неровными внешними стенками. Ее содержимое не окрашивается ни кислыми, ни основными красителями, но оболочка дает ШИК-положительную реакцию на мукополисахариды. Базальная часть клеток содержит овальное ядро (0,8Х1,3 мкм) и боль- шое количество базофильпых волокнистых структур, среди которых раз- мещаются мелкие кристаллические гранулы. Чаще всего клетки 1 типа наблюдаются отторгнутыми в просвет кишечника, который при их мас- совом выходе (отторженин) как будто заполнен пеной (рис. 35). По- скольку в отторгнутых частях клеток не удалось обнаружить каких.-либо структурных компонентов цитоплазмы, есть основания предполох'ить, что данным клеткам свойствен макроапокриновый способ экструзии (Шубникова, 1981). Не исключено, что в прикрепленном состоянии они выделяют секрет мерокриновым способом, так как окраска оболочки указывает на присутствие к ней мукоидных веществ. По мере уменьшения находящихся в просвете кишечника В. chanayi негемолизированных эритроцитов, количество клеток I типа постепенно убывает и на последу~ощих этапах пищеварения, если новая кровь не поступала, эти клетки единичны. Следует отметить, что клетки подоб- ного типа встречались в кишечнике акароидных (Кио, Nesbitt, 1970; Акимов, 1975), тетранпховых (Петрова, Петров, 1977; Mothes, Seitz, 1981а), аргазовых (Балашов, Райхель, 1978) и фитосейидных клещей (Акимов, Старовир, 1974, 1976), у которых они названы секреторными. По морфологическим признакам, а также по приуроченности секретор- ного цикла к моменту приема пищи (крови) клетки I типа клещей В. chanayi наиболее соответствуют секреторным клеткам аргазовых кле- щей, которые, как и изучаемые эктопаразиты, являются гематофагаии и паразитируют, в основном, на птицах (Балашов, 1961, 1957, 1982). Как и у аргазид, клетки ! типа клещей В. chanayi обеспечивают первые этапы физико-химических изменений поглощенной крови — гемолпз ее форменных элементов (эритроцитов), которые поступают в кишечнпк без изменений. Следует отметить, что у иксодовых клещей, которые осу- ществляют процесс гемолиза эритроцитов за счет протеолитической ак- тивности слюны за пределами своего организма — в гематоме, образо- ванной в теле хозяина, секреторные клетки в кишечнике менее развиты, чем у аргазид (Балашов, 1967). Гемолиз эритроцитов у клещей В. chanayi начинается только в ки- шечнике, проходит очень медленно и даже на 5 — 6-е сутки после крово- сосания в просвете двертикул некоторые из них сохраняются без изме- нений. Белковые строиы эритроцитов сначала появляются в перифери- ческой зоне крови — у внутренних стенок дивертикулов. Постепенно этот процесс проникает и в центральную область просвета кишечника. Гемо- глобин, освободившийся из эритроцитов после их гемолиза, остается в кишечнике в растворенном состоянии или х'е концентрируется в про- свете кишечника в небольшие скопления (рис. 35), но не кристаллизу- ется, как это наблюдается в отдельных случаях у иксодовых m аргазо- 44
вых клещей (Балашов, 1967, 1982; Grandjean О., 1983). С появлением первых порций гемоглобина параллельно I этапу пищеварения эпителий кишечника В. chanayi вступает во II этап, связанный с его усвоением. При этом количество клеток I типа заметно уменьшается, окраска ки- шечника темнеет и становится буро-коричневой. На этом этапе пищева- рения ведущим элементом эпителия становятся клетки II типа. Они ко- личественно преооладают над недифференцированными и секреторными и характеризуются относительно большими размерами и сложной клеточ- ной организацией. Указанные клетки по характеру включений и периоду функциони- рования могут быть подразделены на два подтипа (IIB и 116), хотя и имеют много общих черт строения (рис. 36, 37) . Общим для клеток обоих подтипов являются способность к эндоцитозу, соразмерность, воз- можность функционировать в интактном и в контактном состояниях, ку- бическая форма прикрепленных и, согласно законам поверхностного натяжения, округлая отторгнутых. На апикальной поверхности обеих разновидностей клеток I I типа расположены микроворсинки и - глико- к аликс. На поперечных срезах клетки I Ia подтипа располагаются на ба- зальной мембране плотной цепочкой по всему периметру дивертикулов и присутствуют в кишечнике В. chanayi от момента поступления в него пищи до полной ее утилизации (рис. 36, 37). Их жизненный цикл вклю- чает ряд переходов от одного функционального состояния к другому. В начале функционирования эти клетки имеют небольшие размеры (10— 20 мкм), с базофильной и мелкогранулярной цитоплазмой, овальным (3 — 4 мкм) или круглым ядром и небольшим количеством плотных вклю- чений (рис. 36). Ядро без строгой локализации и встречается в центре клеток и у основания, даже в апикальной ооласти. Наблюдаемые в клет- ке немногочисленные включения располагаются главным образом в кор- тикальном слое цитоплазмы. Азан окрашивает их в темно-малиновьш цвет, гематоксилин Гейденгайпа — в черный. БФС дает положительную реакцию на содержание в них белка, а бензидиновая реакция подтвер- ждает содержание в них гемоглобина. Слсдовательпо, эти включения содержат гемоглобин крови хозяина, поступивший из просвета кишеч- ника эктопаразитов в клетки. Оболочка включений неправильной фор- мы, окрашивается так же пнтенсивно, как и содержимое в ней, и отра- жает способность мелких включений к слиянию в более крупные. Плазм алемма клеток II типа неровная, снаружи с невысоким, но плотным слоем микроворсинок длиной 0,3 — 0,4 мкм, уплотненным сор- 5ированными на его поверхности частичками пищи. Азаном поверхность клеток окрашивается в синий или фиолетовый цвет и дает положитель- ную ШИК-реакцию на мукополисахариды. Это указывает на присутст- вие в области микроворсинок гликокаликса, который представляет собой неотъемлемую часть плазматических мембран адсорбционных клеток и играет важную роль в процессах всасывания и пристеночного пищева- рения (Vitzthum, 1943; Hughes Т. Е., 1950; Уголев, 1967; Prasse, 1,)67; Акимов, 1975; Заварзин, 1976), а также на активно протекающие про- цессы эндоцитоза. Базальная часть клеток имеет сетчато-гранулярную структуру, описанные выше сферические включения в ней встречаются редко, химический состав этой части клеток гетерогенный, склонен к базофилии. Изредка встречаются пустые вакуоли с мукополисахаридной основой. Вероятно, эта часть клеток IIа подтипа может участвовать в процессах адсорбции. 45
Со временем клетки I Ia ~одтипа значительно увеличиваются в раз- мерах (от 20 до 65 мкм), принимают более четкую кубическую фор- му. На поперечных срезах дивертикулов на уровне третьей пары ног их можно насчитать от 6 до 17 (рис. 36). Плазмалемма таких гипертро- фированных клеток в апикальной части более ровная, чем у «молодых» клеток, зона гликокаликса в ней распределена менее равномерно и со- держит меньшее количество сорбированных частиц. Эндогенные цито- плазматические структуры в базальной части клеток и ядро становятся незаметными, маскируясь многочисленными включениями экзоге нного характера. Эти включения полностью заполняют объем клеток, pacHOJIa- гаются тесно и иногда деформируют друг друга (рис. 36, 37). Такие включения представлены темноокрашенными вакуолями, имеют гораздо большие по сравнению с вакуолями в «молодых» клетках размеры (от 12 до 20 мкм) п пз оптически плотных превращаются в диспергпровап- ные — с ровной HOBBpxHocTI Io, более светлым основным тоном окраски и темными глыбовидными конкрециями внутри. При больших увеличе- ниях микроскопа видно, что такие крупные вакуоли состоят из много- численных мелких. Они по-прежнему дают поло~кительную реакцию на гемоглобин, подтверждается их белковая природа, однако спектр окрас- ки более широк, что, вероятно, отражает различную степень продвину- тости процессов переваривания в них. Гематоксилин Гейденгайна окра- шивает вакуоли в черный цвет, эозин — в розовый, при окраске азаном часть из них красная, часть — синяя. При окраске толуидиновым спнич в подобных включениях наблюдается пурпурная и сине-фиолетовая ме- тах ромазия, которая свидетельствует о наличии в вакуолях не только гемоглобина, но и других веществ — мукополисахаридов. В гипертрофи- рованных клетках I I a подтипа содержатся небольшие запасы гликогена, выявляемые при о<1работке срезов по методу ШИК. Они представляют собой россыпь мелких (0,2 — 0,3 мкм) гранул красного цвета, которые отсутствуют на контрольных срезах, обработанных диастазой. В отли- чие от гранул гликогена аргазовых клещей (Grandjean О., 1983) они распределены в клетках диффузно, а пе локализованы только у оазаль- ной мембраны. Кроме описанных выше интенсивно окрашиваемых вакуолей в клет- ках IIa подтипа кишечника гематофага В. chanayi наблюдаются светло- окрашенные и пустые вакуоли. Они значительно уступают по количе- ству и размерам темноокрашенным. Некоторые из пих на полутонких срезах интепсивпо чернятся при осмировании. Это свидетельствует оо их жировой природе. Очевидно, пищеварительные клетки иксодовых кле- щей (Балашов, 1967; Балашов, Райхель, 1978; Grandjean О., 1983) на этой стадии своего цикла усвапвают и липоидное вещество стром эри- троцитов, которое заключено в данном случае в осмиофильных вакуо- лях. Однако существует мнение о другом происхождении подобных об- разований. Предполагается, что осмофильпые вакуоли у иксодовых кле- щей могут образовываться и путем дезаминирования аминокислот бел- ков крови хозяев этих эктопаразитов в цикле клеточного метаболизма (Балашов, 1967). Кроме гемоглобина, заключенного в вакуолп, в цитоплазме клеток IIa ~одтипа кишечника В. chanayi после поступления в него новых пор- ций крови наблюдаются целые неповрежденные эритроциты (рис. 37). Они ничем не отличаются от тех, которые находятся в полости дивер- тикулов (рис. 35). Эритроциты овальной формы (2,4Х6,8 мкм) с плот- ной эритролеммой и крупным ядром (1,7Х5,2 мкм). Они полностью со- 46
ответствуют эритроцитам крови хозяев эктопаразитов, выделенных не- посредственно из кровяного русла птиц. Это показывает способность кле- ток кишечника В. chanayi к прямому фагоцитированию целых неповре- жденных клеток крови хозяев, очень устойчивых к гемолизу (Балашов, 1967; Наумов, 1973; Шубникова, 1981). Следует отметить, что кроме сферических включений, в клетках ки- шечника В. chanayi IIa подтипа присутствуют и кристаллические обра- зования. Наиболее крупные из них (1,4Х1,7 мкм) являются кристалла- ми гематина — конечного продукта переваривания гемоглобина (рис. 36, 37). В более «молодых» клетках эти кристаллы немногочисленны, рас- пределяются диффузно (рис. 36). Кроме них наблюдаются также кри- сталлы, аналогичные кристаллам пуриновых оснований в экскреторном органе клещей (рис. 38). Их размеры 0,4 — 0,5 мкм. Они оптически ак- тивны и обладают интенсивным свечением в поляризованном свете. Весьма вероятно, что пищеварительные клетки Па подтипа кроме пище- варительной функции выполняют и экскреторную. Не исключено, что такие кристаллы образуются п концентрации содержащихся в - крови хозяев эктопаразитов продуктов их экскреции, которые путем эндоцитоза поступают в клетки В. chanayi. Наряду с указанными выше в клетках II» подтипа гематофага В. chanayi присутствуют и другие кристаллы, отсвечивающие в прохо- дящем свете либо желтым, либо зеленым светом. Природа их неизвест- на. Предполагается, что эти образования могут быть кристаллами би- лирубпна или биливердина (Балашов, 1967) или же кристаллами мела- нина (Hughes Т. Е., 1954), которые наблюдаются в полости и клетках кишечника иксодовых клещей. Пищеварительные клетки IIB подтипа могут быть прикрепленными к базальной мембране или отторгаться от нее и свободно плавать в про- свете кишечника (рис. 36). Отторжение клеток происходит на всех участ- ках средней кишки, но не одновременно. В первую очередь отторгаются клетки, перегруженные кристаллами гематина, в состоянии прогрессив- ной деструкции. Такие клетки имеют тонкую оболочку, слой гликока- ликса в ней отсутствует, пищеварительных вакуолей мало, на их месте сосрецоточиваются многочисленные, исчисляемые десятками конкреции гематина (рис. 14). Это косвенно подтверждает тот факт, что вакуоли, наблюдаемые в «молодых» пищеварительных клетках, прошли этапы переваривания и усвоения пищи, после чего в них остается только бал- ластное вещество, не поддающееся дальнейшей утилизации. Конкреции гематина вместе с другимп кристаллами формируются в разрушающихся клетках в плотные фекальные сферы (30 — 40 мкм в диаметре) (рнс. 36) и свободно перемещаются в полости кишечника к сфинктеру, соедпняю- щему среднюю кишку с экскреторным органом. Такие сферы покрыты тонкой слизистой оболочкой, окрашиваемой азаном в синий цвет и со- держащей мукополисахариды. Опа соответствует перптрофической мем- бране, под покровом которой осуществляются процессы полостного пи- щеварепия у описанного выше хищного клеща Ch. eruditus, акароидных клещей (Prasse, 1967; Еио, Nesbitt, 1970; Vijayambil~а, John, 197о; Rho- de. 0emick, 1967; Лкимов, 1977), тетраниховых (Mothes, Seitz, 1981а) и аргазовых клещей (Grandjean О., 1983). У клещей В. chanayi эта обо- лочка, вероятно, играет также роль адгезивной основы для формиро- ВаННН сфер из отдельных гематиновых конкреций, среди которых наблю- даются и одпночныо пищеварительные вакуоли.
В отличие от клеток IIa подтипа, клетки 111) подтипа характе~эизу- ются более коротким периодом функционирования. Они появляются только после полного гемолиза или фагоцитирозанбя эритроцитов клет- ками Ila-ïoäòèïa (рис. 36, 37). Наиболее многочисленны этп клетки в период пика активности клеток I Ia подтипа, а именно при появлении внутри них сферических пищеварительных вакуолей и при малом коли- честве гематина. При деструкции клеток ITa подтипа клетки II6 под- типа также исчезают и не выявляются. Отлпчительной особенностью клеток ? 1б подтипа служит изобилие хаотично переплетенных тяжей цитоплазмы, которые окрашиваются в синий цвет, и мелких грапул гли- копротеинового комплекса. Включений, многочисленных у клеток ?? а подтипа, мало, вакуоли с мукополисахаридами единичны, а эритроциты не наблюдаются вовсе. В то же время в данных клетках количество мелких кристаллических включении больше по сравнению с клеткам11 IIa подтипа (рис. 36) и соответственно меньше кристаллов гематнна. Кроме того, этих клеток в эпителии кишечника В. chanayi сравнительно мало. После деструкции фрагменты клеток Пб подтипа присоединяются к фрагментам клеток IIa подтипа и следуют в направлении к сфинктеру. Экскреторный орган Строение. Экскреторный орган — вторая по вели и~не после средней киш- ки часть пищеварительной системы исследованных видов хейлетид. Это непарное мешковидное образование, расположенное вдоль дорсомедлаль- пой линии тела клещей и прикрывающее среднюю кишку на 2/3 у па- разитических видов — Ornithocheyletia sp. и В. chanayi и 1/3 — 1/4 у хищного клеща Ch. eruditus (рис. 30). Передняя часть экскреторпого органа замкнута слепо, заканчивается над мозгом и экзокринными же- лезами, задняя переходит в ректум в конце опистосомы и открывается наружу расположенным терминально анальным отверстием. На уровне протеро-гистеросомальной границы тела клещей В. chanayi и Ovnitho- cheyletia sp. с вентральной стороны органа существует пилорус, соеди- няющий его со средней кишкой. У хищного клеща Ch. eruditus такая анатомическая связь отсутствует. У всех хейлетид экскреторный орган хорошо дифференцируется на фоне кишечника благодаря присутствию в его полости кашицеобразпой массы кристаллов белого цвета — продуктов конечного белкового обмена клещей — гуанина (Gasser, 1951; McEnroe, 1961) (рис. 38). У эктопаразитов Ornithocheyletia sp. и В. chanayi экскреторпый орган постоянно заполнен гуанином, состояние органа тургорное, опорожнение происходит мелкими порциями, из-за чего форма и размеры его отпосп- тельно неизменны. У хищного клеща СЬ. eruditus в отличие от парази- тических ритм эвакуации содержимого значительно более частый, причем опорожнение ведет к удалению почти всего гуанина, при этом экскретор- ный орган многократно уменьшается в об'ьеме, стенки его спадаютс» и он приобретает вид узкой белой полосы между дивертикулами. У гематофага В. chanayi и лимфофага Ornithocheyletia sp. экскретор- ный орган сверху Т-образный (Акимов, Горголь. 1984) (рис. 30, 38). Его длина у первого представителя составляет 230 — 240, у второго— 90 — 110 мкм. Передняя часть его около '/8 длины, ампуловидно расши- рена, задняя сравнительно ровная. Ширина переднего участка у В. ch a- nayi составляет 120 — 130, у Ornithocheyletia sp. 20 — 30, заднего — 70 — 80 и 15 — 20 мкм соответственно. -48
У хищного клеща Ch. eruditus в заполненном состоянии экскретор- ный орган имеет сравнительно одинаковую ширину — 65 — 75 мкм, при длине — 200 — 210 мкм (рис. 30). Расширение переднего участка незна- чительное — 75 — 85 мкм. У всех исследованных видов хейлетид на поперечном срезе экскре- торный орган треугольный и расположен таким образом, что две его стороны тесно зажаты между внутренними латеральными стенками дивертикулов кишечника, а третья примыкает к внутренней стороне дорсальных покровов (рис. 39). В целом относительные размеры экскретор ного органа хищного клеща Ch. eruditus меньше, чем у паразитических В. chanayi и Ornitho- cheyletia sp. На границе переднего, расширенного участка экскреторного органа у клещей В. chanayi и Ornithocheyletia sp., над пилорусом обнарухсены короткие (33 мкм длиной у В. chanayi) продольные дорсальные мышцы. Визуальные наблюдения за живыми клещами показывают, что эти мыш- цы, сокращаясь, проталкивают содержимое средней кишки в полость экскреторного органа (рис. 38). У Ch. eruditus переход веществ из ди- вертикулов в экскреторный орган не зарегистрирован. Строение стенки экскреторного органа у всех изученных нами хей- летид сходно. Стенка состоит из одного слоя эпителиальных клеток. Они располагаются на базальной мембране, которая сверху оплетена волок- нами гладкой мускулатуры. Сеть мышечных волокон экскреторного орга- на по сравнению со средней кишкой более мощная. Вместе с мышцами идиосомы она обеспечивает более энергичное, чем в средней кишке, сокращение стенок, что особенно хорошо заметно при наблюдениях за живыми клещами. Клеточный состав экскреторного органа изученных хейлетид весьма своеобразен. Дорсальная стенка его широкого заднего участка у всех видов тесно сращена с покровами и представляет собой пассивную в функциональном отношении покровную мембрану, образованную синци- тиальным эпителием (Хем, Кормак, 1983а) . Настоящими эпителиальны- ми клетками выстлана только стенка расширенного переднего участка органа и его вентролатеральные стенки, примыкающие к средней кишке (рис. 39, 40). Функционально-гистологические особенности клеток. Морфологиче- ские особенности экскреторного органа и функциональное состояние его клеток периодически подвергаются значительным изменениям. Это наи- более заметно при сравнении эпителия в период минимального и макси- мального заполнения полости органа экскретами. Однако, как уже указы- валось, в чистом виде такие крайние функциональные состояния экскре- торного органа можно проследить только у хищного клеща Ch. eruditus, в то время как у паразитических хейлетид В. chanayi и Ornithocheyletia sp. переход ме~кду этими состояниями проявляется менее четко. Кроме того, разгрузка органа у эктопаразитов не подчинена четко согласован- ному ритму и совершается произвольно, по мере его наполнения, однако чаще всего она происходит вскоре после очередного акта питания. На фоне однообразной и слабой перистальтики стенок дивертикулов наблюдаются маятникообразные перистальтические движения экскретор- ного органа, при которых содержимое перемещается от одной стенки к другой. Этот тип сокращений особенно характерен для переднего, расши- ренного конца экскреторного органа у хищного клеща Ch. eruditus, у паразитических — В. chanayi и Ornithocheyletia sp. Значительно реже
наблюдаются тонические сокращения. Они характеризуются более дли- тельным по сравнению с предыдущим типом сокращением экскреторного органа в месте его деления на передний и задний участки. Но основное сокращение органа — перистальтическое и антиперистальтическое. Оно связано с движениями, при которых волны сокращения разной длины и скорости пробегают вдоль органа от переднего конца к заднему и в противоположном направлении. Благодаря таким сокращениям происхо- дит существенное перемешивание содержимого этой части кишечника, осуществляется эвакуация непереваренных в средней кишке остатков пищи в орган, блокируется переход экскрементов из передней части экскреторного органа в заднюю в момент дефекации, что обеспечивает, особенно у гематофага В. chanayi, задер~кку в нем недопереваренных Т а блица 3. Размеры клеток экскреторного органа исследованных видов клещей-хейлетид, мкм Пирамидальные Плоские Длина мик- роворсинок Вид клетки ядра клетки ядра Ch. eruditus Ornithocheyletia sp. В. chanayi 9,9 х12,9 7,5Х12,0 8,4 X 10,2 3,5х 5,4 3,3 х4,7 1,7х3,2 1,4х3,4 2,8Х3,5 3,4х5,1 0,7 1,8 0,3 1,0Х1,2 0,7 X 1,4 0,8>< 1,7 50 фрагментов, поступивших из средней кишки для дальнейшей утилизации. В первом случае, когда количество содержимого в полости экскре- торного органа минимально, клетки имеют пирамидальную форму (рис. 39, 40). Их максимальная величина у всех исследованных видов сравнительно одинакова, несмотря на относительно меньшие размеры клещей Ornithocheyletia sp. (табл. 3). Однако у хищного клеща Ch. еги- ЙЫя прослеживается относительное постоянство размеров клеток в пре- делах всего органа, в то время как у В. chanayi и Ornithocheyletia sp. одновременно могут встречаться клетки, различные по величине. Ядра клеток располагаются базально, овальной формы. Они одно- родны, гомогенны, богаты ДНК и содержат по одному ядрышку. Если такие клетки лежат плотным рядом, то границы между ними определя- ются неотчетливо. Они образованы тесно переплетенными выступами (интердигитация) соседних клеток (Хем, Кормак, 1983а) . Клетки шире у основания, где они прилегают к базальной мембране, чем у свобод- ных, выступающих в просвет органа апикальных частей (рис. 39, 40) Цитоплазма клеток гетерогенна. Базальная часть, содержащая ядро, плотная, имеет сетчато-гранулярную структуру. Надъядерная область гипетрофирована, в ней отсутствует гранулированность, но многочислен- ны пустые на срезах вакуоли размером от 0,5 до 2 мкм. Аппкальная часть клеток аморфна, выступает в просвет экскреторного органа глубо- кими (1,7 — 2,6 мкм) выпячиваниями. На первый взгляд они создают впечатление микроворсинок, однако имеют неупорядоченный, прерыви- стый характер, что больше напоминает картины апокриновой экструзии (рис. 39, 40) (Заварзин, 1976; Бабаева, Шубникова, 1979; Герловин, Утехин, 1979; Дин, 1981; Заварзин, Харазова, 1982; Хем, Кормак, 1983а) . Показательно, что у всех исследованных нами клещей-хейлетид строение апикальной поверхности таких клеток в пределах экскреторного органа различно, как различно по этому показателю и количественное соотношение этих клеток у хищного и паразитических видов.
Так, у scen изученных хейлетид клетки переднего участка экскре- торного органа, а также преобладающее большинство клеток латеральных его стенок у хищного клеща Ch. eruditus содержат в углублениях своих выпячиваний и в лежащем ниже слое надъядерной вакуолизированной цитоплазмы мельчайшие (до 0,2 мкм) кристаллы, обладающие интенсив- ным свечением в поляризованном свете. По структуре и оптическим свойствам они соответствуют кристаллам гуанина из просвета этого орга- на (рис. 39 — 40). У гематофага В. chanayi кроме таких кристаллов в цитоплазме клеток наблюдаются также мелкие (1,2 мкм) эозинофильные вакуоли и гематиновые конкреции, выявляемые бензидиновой пробой (рис. 39). В апикальной части клеток эпителия заднего участка экскреторного органа у паразитических хейлетид В. chanayi и Ornithocheyletia sp. по всему органу, а у хищного клеща Ch. eruditus в отдельных клетках наблюдается вакуолизация. Причем вакуоли крупнее, чем в клетках переднего участка (2,5 — 5,7 мкм), не эозинофильны и в них отсутствуют кристаллические включения. В отдельных случаях мелкие вакуоли могут сливаться в одну крупную. В результате этого клетки по форме стано- вятся похожими на секреторные клетки кишечника В. chanayi (I тип клеток) и могут отрываться в просвет. У клещей В. chanayi и Ornitho- cheyletia sp. в отличие от Ch. eruditus такая вакуолизация клеток более регулярна и обильна. Описанные выше клетки окрашиваются гематокси- лином Гейденгайна в различные оттенки голубого и сиреневого цветов, эозином — в розовый, азаном — в розово-фиолетовый, причем в этом слу- чае голубые тона преобладают в апикальной зоне. ШИК-реакция указы- вает на ацидофильные свойства цитоплазиы (лилово-розовая окраска) и особенно базальной мембраны, подстилающей клетки (вишнево-фиоле- товая окраска) (рис. 40). Содержание РНК и базофилия клеток очень низкие, метахромазия при окраске толуидиновым синим указывает на преобладание в клетках мукополисахаридов. По мере накопления в по- лости экскреторного органа экскретов он увеличивается в объеме, а клет- ки по всему периметру уплощаются, уменьшаются в размерах (см. табл. 3) и как бы растекаются по стенке органа (рис. 38), в них исчезает обильная ранее вакуолизация. Тем не менее для клеток по- прежнему характерен, хотя и менее выраженный, чем в предыдущем состоянии, рыхлый, аморфный характер апикального слоя цитоплазмы и содержание кристаллов гуапина (рис. 39). Спустя некоторое время в клетках задней части экскреторного органа апикальные зоны стано- вятся более четко выра~кенными. На их поверхности хорошо дифферен- цируется невысокий равномерный слой микроворсинок (табл. 3; рис. 39), несущий сверху слой гликокаликса. Над последним располагается диф- фузное облако большого количества различающихся по размерам поли- гональных кристаллов гуапина. Они в результате слипания мелких кри- сталлов по направлению к центру просвета органа укрупняются н скреп- ляются мукополисахариднымп тяжами в бесформенные сетчато-гуанп- новые массы (рис. 40). Изложенные выше морфохнмические характеристики клеток экскре- торного органа клещей Ch. eruditus, В. chanayi и Ornithocheyletia sp. свидетельствуют о том, что они принадлежат и нефридиальному типу клеток транспортных эпителиев (Заварзин, 1976; Тыщенко, '1976; Шуб- никова, 1981; Заварзин, Харазова, 1982; Хем, Кормак, 1983а). На свето- оптическом уровне исследований клетки обладают сходным строением в пределах всего органа и не имеют принципиальных различий у изучен-
ных видов хейлетид. Они регенерируют главным образом по морфофизио- логическому типу (Уголев, 1961) и в процессе функционирования спо- собны к значительпым внутриклеточным перестройкам, которые выра- ясаются в изменении формы, размеров и поверхностных, обращенных в просвет органа структур. Сравнительный анализ клеток и их модифика- ций экскреторного органа клещей-хейлетид и клеток мальпигиевых со- судов иксодовых и гамазовых клещей (Coons, Axtell, 1971; Балашов, Райхель, 1973, l975; Райхель, 1975; Балашов, Райхель, '1976) показал, что изменения, наблюдаемые в KJIBTIBx экскреторного органа хейлетид, определяются двумя взаимосвязанными процессами — экскрецией и адсорбцией. При гипертрофии клеток (рис. 39) преобладает экскреция. Она осуществляется путем активного трапспорта продуктов экскреции сквозь базальную мембрану, одновременной их концентрации, кристаллизации и выведения в полость органа способом апокриновой экструзии. Это подтверждается присутствием в апикальной зоне цитоплазмы и базаль- ной мембране клеток кислых мукополисахаридов, которые (Khalil, 1971; Балашов, Райхель, 1976) способствуют транспорту экскреторной жид- кости и оформлению кристаллов гуанипа. Низкий эпителий свидетельствует об обратной направленности про- цессов — адсорбции в основном воды, поскольку в клетках отсутствуют включения экзогенного характера. Однако клетки экскреторного органа гематофагов В. chanayi способны к поглощешпо гемоглобина и эозино- фильного вещества. Поглощение веществ идет активно, чему в значи- тельной степени способствует морфологпчески хорошо выраженный слой микроворсинок и гликокаликс. Кристаллизация экскретов при низком эпителии происходит исключительно в полости экскреторного органа. Проведенные исследования показывают, что у клещей-хейлетид про- цессы экскреции постоянны и более интенсивны в переднем, расширен- ном участке экскреторного органа, в то время как процессы всасывания (адсорбция) — в заднем. Это позволяет дифференцировать его на две зоны различного функционального значения — переднюю (экскрецион- ную) и заднюю (адсорбционную) . Тем не менее у хищного клеща Ch. eruditus, судя по количественному соотношению гипертрофированных (пирамидальных) и плоских клеток, зона постоянной экскреции распро- страняется и на заднюю часть, чего не наблюдается у паразитических видов В. chanayi и Ornithocheyletia sp. Это свидетельствует о смещении функций этого органа у хищных хейлетид преимущественно в направле- нии экскреторных процессов, а у паразитических хейлетид функция его равнозначно экскреторно-адсорбционная. Кроме того, у хищных и пара- зитических хейлетид консистенция, а также качественный состав выде- ляемых продуктов весьма различны. У хищпого клеща Ch. Bruditus выделения жидкие, чисто-белые, состоят из гуанина, слизи и отторгнутых немногочисленных эпителиаль- ных клеток. После дефекации они растекаются по поверхности и быстро (в течение нескольких секунд) высыхают. Исследования таких высохших экскрементов под бинокуляром, а также с помощью растровой электрон- ной микроскопии подтвердили отсутствие в EIHx непереваренных частиц пищи, которые формируются в средней кишке (рис. 40) . У паразитических хейлетидных клещей В. chanayi в отличие от хищного клеща Ch. eruditus кроме перечисленных выше компонентов выделений в полости экскреторного органа содержатся круглые темно- бурые сферы, состоящие главным образом из конкреций гематина и оди- 52
ночных пищеварительных вакуолей клеток средней кишки, не прошедших полный цикл деструкции в дивертикулах (рис. 38). У живых гематофа- гов в экскреторном органе одновременно можно наблюдать от 1 до '12 таких сфер. При окраске азаном вокруг ННх ио>кно дифференцировать тонкий слой гликокаликса. После поступления из средней кишки такие сферы могут находиться в полости органа в течение нескольких часов. В результате этого из них исчезают пищеварительные вакуоли, а сами сферы постепенно инкрустируются кристаллами гуанина и увеличива- ются в размерах. Выделения, покрытые слизистой оболочкой, после эвакуации из организма В. chanayi твердые, почти су«ие, не рассыпаются и сохраняют преrEHIQIQ круглую форму. За исключением быстро высы- хающей слизистой оболочки консистенция выделений этих клещей не изменяется в течение длительного периода, о чем свидетельствуют их многочисленные твердые и компактные находки на теле хозяев. Характер функционирования экскреторного органа лимфофага Orni- thocheyletia sp. и консистенция его выделений практически такие же, как у гематофага В. chanayi. Отличия состоят только в значительно меньшем количестве поступающих из средней кишки балластных веществ, поэтому в составе фекалий Ornithocheyletia sp. преобладает гуанин. Как следует из приведенного фактического материала. экскреторный орган исследованных клещей-хейлетид является интенсивно функциони- рующей, активной частью пищеварительной системы, специализирован- ной на выделении и выведении из организма клещей продуктов мета- болизма. Это обеспечивается его большими размерами, значительной площадью функционально активного эпителия нефридиального типа, непосредственным контактом его стенок с главными системами органов клещей, что имеет очень важное зпачение для транспорта экскреторных продуктов при отсутствии у них распределительной интерстициальиой ткани. Важным моментом в функционировании экскреторного органа является и то, что основные процессы (экскреция и всасывание) осуще- ствляются одним и тем же типом клеток, но ритм и«деятельности неодинаков и приводит к топографической функциональной разобщен- ности работы переднего и заднего участков. В результате этого орган можно дифференцировать на два отдела с различной функциональной специализацией: передний (экскреционный) и задний (адсорбционный) . VipoMe того, экскреторный орган паразитических «ейлетид В. chanayi и Ornithocheyletia sp. благодаря анатомической связи со средней кишкой служит также и для выведения непереваренных в средней кишке остатков пищи. Задняя кишка (ректум) Ректум — конечный участок пищеварительной системы клещей. у всех исследованных нами видов хейлетид он имеет довольно простое строение и служит только для эвакуации из их организма продуктов обмена. Ректум — это короткая, широкая трубка, которая под тупым углом от«о- дит от экскреторного органа (рис. 30) и открывается терминально рас- положенным в конце опистосомы анальным отверстием (см. рис. 4). В месте соединения ректума с экскреторным органом отсутствуют запира- тельные элементы, анальное отверстие окружено складкой склеротизован- ной кутикулы — анальным кольцом (рис. 4). Длина ректума у клещей Ch. eruditus и В. chanayi сравнительно одинакова (25 — 27 мкм), ширина у Ch. eruditus 28, а у В. chanayi 35 мкм. Размеры этой части пищевари-
тельной системы у клещей Ornithocheyletia sp. малы и не поддаются измерению. Стенка ректума состоит из многочисленных мелких (0,8Х Х1,4 мкм) клеток с четкими интенсивно окрашенными ядрами '(0,2Х0,3 мкм). Цитоплазма клеток мелкодисперсная, лишена каких-либо включений. Полость ректума у всех хейлетид выстилает плотный слой кутикулы, окрашивающийся азаном в синий и голубой цвета. Ректум снабжен двумя группами мышц. Первая представлена двумя парами продольных изгоняющих мышц (длина у В. chanayi 25,3 мкм, ширина каждого пучка 1,5 мкм; у Ch. eruditus — 12 — 15 и 1,6 мкм соответствен- но) . Эти мышцы идут параллельно стенке ректума и прикрепляются к кутикуле в начале ректума и к кутикуле анальных клапанов. Второй набор мышц — мышцы-дилататоры анального клапана. Их четыре пары пучков по два мышечных волокна в каждом. Длина мышц 6 — 7 мкм, ширина волокон 0,5 — 0,6 мкм. Крепятся такие мышцы к противополож- ным стенкам анального клапана (рис. 27). При сокращении этих мышц ректум увеличивается в объеме, рас- ширяется анальное отверстие и выворачивается наружу анальное кольцо кутикулы, облегчая дефекацию. При расслаблении мускулатуры аналь- ное отверстие закрыто, оно прикрывается тесно сомкнутыми складками анального кольца кутикулы, просвет ректума также не виден из-за спадения его стенок. При дефекации материал, подвергаемый выведе- нию, в ректуме не задерживается. Активность некоторых пищеварительных ферментов хищного клеща Cheyletus eruditus Рис. 4~1. Влияние рН среды на амило- литическую (1), инвертазную (2) и проте- олитическую (8) активность клещей Д ля выяснения физиологических особенностей пищеварительной системы Ch. eruditus исследовались пищеварительные ферменты (амилазы, инвер- таза, целлюлазы, хитпназа, протеазы) у голодных и сытых клещей, про- теолитическая активность в слюн- ~ ~с~ ных железах и так называемый ю Р' ./ фито литический индекс, который ц9 ф считается показателем степени / l хищничества животных (Уго лев, O,д г 1961) . 07 ° ~1 Анализ рН-оптимумов актив- l ности ферментов показал, что Щ .Ос с амилазы и инвертазы проявляют 0 ~ максимальную активность при рН 5,5, а протеазы — рН 4,0. При- l ~ чем амилолитическая и инвертаз- Ю, 2 ная активность не имеют четко 0 ° выраженного пика (рис. 41) . ~s У протааа обааоаь наиболее оыоо- ~д 30 4,0 50 $0 70 рф кой ВНТНВНОсТН несколько yæe, но все же имеет диапазон рН от 2,0 до 5,0 (рис. 41) . Следовательно, рН-оптимумы активности фермен- тов у Ch. eruditus практически такие же, как у других групп клещей, в частности у хищных клещей- фитосейид (Старовир, 1974), и растительноядных клещей-тетранихид (Акимов, Барабанова, 1977), а карбогидразы имеют такие нее рН-оптиму-
мы, как у большинства акароидных клещей (Акимов, Барабанова, 1976а, 1976б, 1978). Амилолитическая, инвертазная и протеолитическая активность у Ch. eruditus относительно высокие (табл. 4). Из карбогидраз более актив- ны амилазы. Целлюлазная и хитиназная активность не выявлена. Следо- вательно, Ch. eruditus по данному показателю ближе к своих жертвам- акароидным клещам, в частности к A0vaus(АкимовEapa6aH0Ba1976б)Табл и а 4.Активное ь'некото рых пищеварительных ферментов у и отличаетсЯ от дРУгой гРУппы хиЩ — клеп~ей Cheyletus eruditus Клещи Фермент Голодные Сытые 43,5~ 1,51 25,7 ~2,45 0 0 21,8~-1,76 15,0~ 3,220001,6~ 0,55 Лыилаза Инвертаза Целлюлаза Хитиназа Протеазы Лмилаза у клещей Ch. eruditus ' Здесь и в табл. 6 активность вы- МожеТ ОДИНаЕОВО XOpOIIIO pаСщеПЛЯТЬ ражепа в милл1,граммах нродуктов КаК КраХМал, ТаК И ГЛИКОГен, ПрИЧеМ Реакции в пеРесчете на 100 клеЩей гликоген даже лучше. Фитолитический индекс (соотношение активности расщепления гликогена к крахма- лу) у этого клеща больше единицы (1,1), т. е. несколько сдвинут в сторону преобладания хищничества (табл. 5). Не исключено, что амило- литическая активность в какой-то степени направлена на расщепление Т а б л и ц а 6. Протеолитическая активность в гнатосомах и идио-сомах Cheyletus eruditus Ю В| Нв ' о>Н ~02 «~ К 0~05 о Р а. O ~;с Амилолитическаяактивность Активность Части тела вид Фермента суммарная крахмал Глико ген 5,2 ~0,56 Ch. eruditus Ph. per<imilis А. andersoni Т. cinnahavinus А. ovatus 22,8~ 0,99 20, 011- 0,12 22,2~ 0,92 56,9 11- 6,92 172,6 <- 3,66 25,1~ 2,03 19,0 ~ 0,32 19,2~ 0,88 35,9~ 5,84 147,2~ 2,97 1,1 0,95 0,84 0,42 0,83 22,5+- 0,59 17,3~ ~0,63 гликогена жертвы. Таким образом, хеилетид можно считать хищниками физиологически более специализированными, чем фитосейид, что в опре- деленной мере подтверждается и Нх этологией (большей агрессивностью, склонностью к каннибализму). У голодных клещей Ch. eruditus выявлена небольшая нротеолитиче- ская и несколько большая амилазная активность (табл. ~). Принимая во внимание характер питания хейлетид, высасывающих содержимое жертв, можно предположить, что присутствие амилаз, и особенно протеаз, у голодных клещей связано с синтезом этих ферментов в слюнных железах. Такое предположение весьма вероятно, учитывая характерное для сосущих клещей экстраиптестинальное (внекишечное) пищеварение. ников — фитосеиид, у которых инвер- таза активнее амилаз (Старовир, 1974). Вероятно, хейлетиды помимо гемолим- фы и лизированных тканей тела ~керт- вы всасывают и содержимое ее кишеч- ника, завершая таким образом процесс переваривания пищи, немалый процент которой составляют крахмалистые ве- щества. Т а б л и ц а 5. Фитолитический индекс у неко-торых клещей Гнатосо-ма (слюн-ные же-лезы) Идиосома (кишечн-икк)
В связи с этим определялась протеолитическая активность в слюнных железах Ch. eruditus. Как видно из табл. 6, она обнаружена в гомогена- тах гнатосом. Однако большая часть протеолитической активности при- ходилась на кишечник (активность протеаз гнатосом составляла третью часть активности идиосом), а суммарная активность была близка к активности протеаз в гомогенатах целых клещей. Наличие амилолитиче- ской и небольшой протеазной активности у голодных клещей может быть, на наш взгляд, еще одним подтверждением достаточно высокой степени их хищничества — готовности к быстрому нападению и перева- риванию жертвы. Следовательно, пищеварительная система клеща Ch. eruditus функ- ционально адаптирована к характерной для него пище таким образом, что гидролиз пищи осуществляется наиболее соответствующими ее хими- ческому составу ферментами, подтверждая тем самым принцип адаптив- ной диссоциации ферментов (Уголев, 196'1). Морфофункциональные основы специализации пищеварительной системы клещей-хейлетид Анализ сходства и различий морфологии и функций пищеварительной и сопряженных с ней систем органов у хейлетидных клещей позволяет установить, что процесс трофической специализации не в одинаковой мере затрагивает различные стороны организации этих хелицерат. Характер пищи, поглощаемой хищными и паразитическими хейле- тидами весьма различен, но эти различия в большей мере касаются ее качественного состава, так как консистенция пищи и у хищного клеща Ch. eruditus и у паразитических В. chanayi и Ornithocheyletia sp. практи- чески одинаковая — жидкая. Хищник питается в основном гемолимфой жертв. В пищеварительную систему непереваренные остатки жертв по- ступают в незначительном количестве. Клещи В. chanayi — облигатные гематофаги, Ornithocheyletia sp. облигатные лимфофаги (Акимов, Гор- голь, 1984; Горголь, 1986). Они получают пищу путем активного перфо- рирования кровеносных сосудов и межклеточных пространств кожи хо- зяев. При этом наблюдается щадящий для хозяина-прокормителя режим питания эктопаразитов — кратковременное, но многоразовое питание при отсуз ствии патологических последствий. Ротовой аппарат изученных нами хейлетидных клещей обеспечивает добычу, поглощение и первичную обработку пищи. По морфологическим и функциональным особенностям он сходен у хищного клеща Ch. eruditus и у паразитических В. chanayi и Ornithocheyletia sp. (Акимов, Горголь, 1984), а также у других видов семейства, изученных в этом отношении (Summers, ЖЖ, 1971; Haarlov, Morch, 1975; Hallas, 1982) . Ротозей аппарат характеризуется значительным слиянием своих частей и дости- гает, как и у клещей-тетранихид (Беккер, 1935; Andre, Remacle, 1984), высокого уровня специализации к сосущему типу питания. Осповпым морфофункциональным элементом ротового аппарата хейлетид служат стилетообразные хелицеры, которые образуют колюще-сосущую струк- туру. Насасывание пищи осуществляется благодаря активной дилатации и пассивной констрикции глоточного насоса. Последняя облегчается тем, что на вентральной стороне гнатосомы у всех хейлетид расположена декомпрессионное отверстие, благодаря которому стенки расширенной глоточной капсулы могут сжиматься за счет своей эластичности. Пди 56
общем сходстве строения гнатосомы отмечены незначительные отличия в морфологии и функции ротового аппарата хищных и паразитических клещей-хейлетид, связанные с биологическими особенностями этих клещей. Таким образом, паразитические хейлетидные клещи унаследовали ротовой аппарат своих предков (свободно~кивущих хищников) в мало- измененной форме. Это предопределило легкость перехода хейлетид от хищничества к паразитизму, к питанию кровью и лимфой. Такой переход в различных группах клещей совершался неоднократно и самостоятельно (Маркевич, 1943; Павловский, 1946; Беклемишев, 1970). Кишечник у всех исследованных хейлетид принадлежит к тромби- диформному типу. Однако классические представления о таком типе (Renter, 1909) применимы только для хищного клеща Ch. eruditus— средняя кишка на аборальном «онце замкнута слепо и не сообщается с экскреторным органом. У паразитических видов хейлетид В. chanayi и Ornithocheyletia sp. связь между этими отделами существует, она хо- рошо выражена морфологически и функционально (Акимов, Горголь, 1984; Горголь, 1985) . Что касается гистологического строения, то средняя кишка у Ch. eruditus обладает однотипным, но весьма динамичным эпителием. Для него характерны высокая степень обновления, которая осуществля- ется путем марфо-некротической формы регенерации, цикличность функ- ционирования, подчиненная режиму питания, топографическая диффе- ренцировка, определяемая по уровню протекания метаболических процес- сов. Специфической особенностью клеток кишечного эпителия этого вида клещей является их полифункциональность: одновременное участие в процессах секреции, всасывания и пищеварения. Тем не менее потен- циальная возможность клеток в осуществлении каждого из названных выше процессов различна. Наиболее активные и однотипные клетки раз- мещены в определенных местах — на медиальных стенках дивертикулов и криптах. Судя по результатам исследовани~~, способность клеток китпеч- ного эпителия клещей Ch. eruditus к внутриклеточному пищеварению значительно ниже их способности к секреции. Последняя преобладает на всех этапах жизненного цикла клеток, но особенно заметно чисто секре- торная функция проявляется в морфологическом варианте клеток кишеч- ника у длительно голодавших клещей. Как известно (Заварзин, 1976), активная секреторная деятельность кишечного эпителия влечет за собой быстрое освобождение продуктов секреции — ферментов, которое в данном случае осуществляется путем голокринового способа экструзии. Ферменты, поступая в полость кишеч- ника Ch. eruditus, обеспечивают интенсивное полостное пищеварение. В связи с этим, вероятно, количество пищеварительных вакуоле~~, в кото- рых происходит процесс внутриклеточного переваривания пищи у Ch. eruditus, невелико, как незначителен и сам процесс внутриклеточного пищеварения у этих хищников в целом. Характерно, что значительная часть пищеварительными. вакуоле~~, освободившихся после деструкции клеток, завершает свой функциональный цикл в полости дивертикулов, принимая участие в переваривапии пищи в полости кишечника. Перед поступлением в кишечник хищников пища предварительно подвергается гидролитическому расщеплению под действием ферментов слгонных нселез (Горголь, Бараоанова, 1979), а затем дополнительно переваривается в полости дивертпкулов ферментами эпителиальных кле- ток. Это, как указывалось, происходит на фоне незначительного внутри- 57
~сдаточного пищеварения. Поэтому можно предположить, что уже в полости кишечника пища превращается в смесь низкомолекулярных веществ, которые становятся доступными для прямого всасывания сквозь базальные мембраны контактирующих со средней кишкой органов. На возможность и реальность этого процесса маркет указывать ацидофиль- ность мембран контактирующих органов, что характерно для мембран с усиленным транспортом веществ сквозь них (Хем, Кормак, 1983а, б). Таким образом, у хищного клеща Ch. eruditus на основе высоко- дииамичной секреторной деятельности кишечного эпителия преооладает полостное пищеварение. В то же время первичное (Уголев, 1961, 1963; Заварзин, 1976) впутриклеточное пищеварение является второстепенным. Это позволяет хищникам быстро, интенсивно и эффективно осуществить процесс переваривания и утилизации IIHIIIBBbIx продуктов, что характерно для хищничества. В результате того что пища высоко калорийна и содер- жит незначительное количество балластпых веществ, при усвоении даже бо„иыцп х ее объемов количество непереваренных остатков невелико. Кроме того, как следует из наблюдений, эти остатки постоянно и много- кратно вовлекаются вместе с новыми порциями пищи в процессы внутри- клеточного пищеварения, что увеличивает степень их птдролиза. Вероят- но, их предельное накопление в полостп кишечника не превышает допустимого и совпадает с генетически обусловленной продолжитель- ностью жизни этих хищников. С этим, вероятно, связано также и отсут- стви е у Ch. eruditus явления шизокинеза, которое описано у клещей- тромбикулид с аналогичным строением кишечника, но другим xBpBIcTepoM пищп (Mitchell, Nadchatram, 1968). Эпителий клеща-гематофага В. chanayi в отличие от эпителия кишеч- ника хищного клеща Ch. eruditus и лимфофага Ornithocheyletia sp. представляет собой оолее сложную и по морфологической дифференци- ровке клеток более гетерогенную систему, включающую два типа функ- ционально-специализированных клеток (Акимов, Горголь, 1984). В свою очередь внутри II типа наблюдаются две функциональные разновидности клеток, названные lla и Иб подтипами, аналогичные фагоцитозному и пиноцитозпому комплексам пищеварптельных клеток кишечника клещей- иксодид (Балашов, 1967; Райхель, 1975). Клетки 1 типа (секреторные) осуществляют начальные стадии полостного пищеварения (Уголев, 1961) путем гемолиза форменных элементов крови хозяев, в то время как клетки Il типа участвуют в утилизации питательных веществ. Процессы пищеварения у постоянных эктопаразитов — гематофагов В. cl>BnByi — растяпуты на продолжительный период, и различия между строением и свойствами кишечного эпителия в период покоя (после IInTaHHsJ в течение недели), а также в период активной фазы пищеваре- ния выражены менее четко, чем у хищных клещей Ch. eruditus. Динами- ка циклических изменений в кишечном эпителии В. спапау~ также незна- чительная. Несмотря на морфонекротический тип регенерации, пищева- рительные клетьи (клетки II типа) функционируют асинхронно, с различной скоростью обновления и дифференцировки. Кроме того, клетки кишечника В. chanayi обеспечивают не только функцию расщеп- ления и всасывания, но и вторичпую переработку и хранение запасных питательных веществ в виде гликогена и жировых включений. Важным моментом переработки пищи у них служит осуществление его завершающего этапа в виде полостного (дистантного) пищеварения (Уголев, 1961, 1963) под покровом перитрофпческой мембраны, что было отмечено в последнее время для клещей-тетранихид (Mothes, Seitz,
1981а) и аргазовых клещей-орпитодорин (Grandjean О., 1983). С одной стороны, этот способ пищеварения указывает на более совершенное усвоепие питательных веществ из пищевого субстрата, содержащего не- переваренные остатки, а с другой — перитрофическая мембрана служит защитой для активного, функционирующего эпителия кишечника от механического повреждения его непереваренными остатками, значитель- ную часть которых составляют кристаллические вещества (Заварзин, 1976) . Основная роль в переработке пищи у клещей В. chanayi принадле- жит внутриклеточному пищеварению. Ведущий элемент эпителия сред- ней кишки этого гематофага — пищеварительпые клетки. Как и у Ch. eruditus, они полифункциональны, но в отличие от последних обла- дают способностью экскретировать продукт конечного белкового обмена клещей — гуанин. Не исключено, однако, что пищеварительные клетки В. chanayi всего лишь концентрируют эти вещества, поступившие в их кише и~ик вместе с кровью хозяев. В морфофункциональном отношении средняя кишка другого изучае- мого нами эктопаразита — облигатного лимфофага Ornithocheyletia sp. в основном сходна с таковой у В. chanayi. Однако, хотя качественный состав пищи этих клещей близок, в лимфе отсутствуют ядерные эритро- циты. Вероятно поэтому и роль полостного пищеварения у Ornithocheyle- tia sp. меньше, чем у В. chanayi. Об этом свидетельствует отсутствие дифференциации клеток на подтипы, а также отсутствие ярко выражен- ных признаков полостного пищеварения. Весь процесс, в том числе m утилизация питательных веществ, осуществляется в однотипных пище- варительных клетках. Количество непереваренных веществ у Ornitho- cheyletia sp. после завершения пищеварения невелико, однако, как и у В. chanayi, они выводятся из полости средней кишки через сфинктер в экскреторный орган. Последний у всех трех изученных нами видов клещей-хейлетид в общем плане однотипен и может рассматриваться морфологически, а час- то и функционально, как видоизмененная часть кишечника, хотя в пекоторых случаях, например у Ch. eruditus, прямой связи между ним и средней кишкой нет. Тем не менее в процессе специализации клещей-хейлетид к п аразитизму II« дкскреторный орган претерпевает значительные морфологические и функциональные перестройки, что видно oplI сравнении свободноживущего хищника Ch. eruditus с паразитиче- скими видами В. chanayi и Ornithocheyletia sp. Зто выражаетсл прежде всего в появлении у гематофага В. chanayi и лимфофага Ornithocheyletia sp. четкой анатомической связи со средней кишкой, отсутству1ощей у хищного клеща Ch. eruditus, в связи с необхо- димостью удаления из Нх органов большого количества не подлежащих дальпейптей утилизации балластных веществ. Кроме того, это влечет за собой увеличение относительных размеров экскреторного ' органа и интенсификацию его деятельности у эктопаразитов по сравнению с хищниками. Последнее может быть связано с переработкой В. chanayi и Ornithocheyletia sp. пищи, содер~кащей значительно больше по сравне- нию с пищей «ицника Ch. eruditus количество белковых компонентов. У паразитических хейлетид наблюдается также интенсификация функ- ции вторичной адсорбции путем более четкой, чем у хищника Ch. егцй- tus, дифференцировки органа на два отдела различного функционального значения. Это является одним из наиболее важных механизмов специа- >g
лизации выделительных органов в связи с экологическими особонпостями этих животных (Гиляров, 1970; Заварзин, 1976). У клещей В. chanayi и Ornithocheyletia sp. в связи с характерным для них постоянным режимом питания, исчезает цикличность функцио- нирования экскреторного органа, обычная у хищников Ch. eruditus или таких паразитов, у которых чередуются периоды питания и голода (Балашов, 1967, 1982) . Кроме того, у гематофага В. chanayi значительно расширяются функции экскреторного органа, вплоть до возможности осуществления в нем внутриклеточного и полостного (под покровом перитрофической мембраны) пищеварения (Акимов, Горголь, 1984). Спе- цифические направления процессов пищеварения у хищных хейлетид хорошо прослеживаются не только на морфологическом, но и на био- химическом уровне при исследовании активности пищеварительны с фер- ментов клеща Ch. eruditus (Горголь, Барабанова, 1979). К сожалению, пищеварительные ферменты паразитических видов хейлетид нами не изучались. Однако литературные данные по исследо- ванию иксодовых и аргазовых клещей, характер пищи которых, в целом, такой же, как и у В. chanayi и Ornithocheyletia sp. (Балашов, 1982), показывают, что активность основных пищеварительных ферментов у них и у хищного клеща Ch. eruditus значительно различается. Так, в спектре ферментов кишечника иксодид отсутствуют доминирующие у Ch. eruditus карбогидразы, в частности амилаза и инвертаза, и превалируют протеазы. Такая разнокачественность ферментного состава указывает, вероятно, на адаптацию пищеварительной системы хищных клещей преимущественно к углеводному типу питания, и, возможно, обмена, а лимфа- и гематофа- гов — к белковому. Учитывая принцип адаптивной диссоциации ферментов (Уголев, 1961), согласно которому гидролиз пищи осуществляется соответствую- щими ее химическому составу ферментами, этот вывод, несомненно, можно экстраполировать и на паразитических хейлетид, поскольку со- став их пищи, как и у иксодовых клещей, отличается высоким содержа- нием белковых компонентов (Балашов, 1982). Характерно, что у некото- рых кровососущих насекомых, в частности у комаров Aedes aegyptii (Gooding, 1975), при переходе их в процессе онтогенеза от углеводного к белковому типу питания наблюдается идентичное соотношение фермен- тов: при углеводном доминируют карбогидразы и отсутствуют протеазы, при питании кровью протеолитическая активность резко возрастает. ПРОПОДОСОМАЛЬНЫЕ ЖЕЛЕЗЫ У различных тромбидиформных клещей, к которым принадлежат и хей- летиды, в проподосоме обнаружены экзокринные железы, топографически связанные с пищеварительной системой. Однако функция таких желез Бе ограничивается, как полагали до недавнего времени, участием в про- цессах пищеварения. Считают, что кроме этого железы могут функциони- ровать как ядовитые, шелкопрядильные, адгезивные (выделяющие склеи- вающие вещества), репугнаторные (отпугивающие), осморегуляторные и др. (Hafiz, 1935; Blauvetl, 1945; Moss, 1962; Mitchell, 1964; Voigt, 1971; Alberti, Storch, 1973; Mills, 1973; Alberti, Storch, 1974; Петрова, Петров, 1975; Brody, McGrath, Wharton, 1976; Mothes, Seitz, 1981b; Шатров, 1982, 1983а). Следует отметить, что наиболее распространенные оптиче- ские методы в исследованиях перечисленных авторов не дают надежных критериев для определения функциональной роли отдельных желез. Это 60
приводит к тому, что из-за отсутствия избирательной окраски железистой ткани, необходимой для определения ее функциональной направленности, оптически различные по строению железы могут тем не менее выполнять одну и ту хсе функцию (Alberti, Storch, 1973). Кроме того, количество желез, их расположение и строение значительно варьируют не только в пределах отряда, но и отдельных семейств. Более того, значительные отличия отмечены в железах даже на различных стадиях онтогенеза клещей (Brown, 1952; Mitchell, 1964). Все это значительно усложняет задачу и не позволяет в ряде случаев сделать однозначные выводы. Поэтому при решении вопроса о функции отдельных желез исследован- ных видов клещей кроме результатов их гистологического изучения привлекались данные об экологии исследуемых видов, а также литера- турные сведения о морфохимических свойствах этих органов у клещей со сходным стереотипом питания. Морфология Экзокринные железы клещей Ch. eruditus, В. chanayi и Ornithocheyletia sp. (рис. 42) локализованы в проподосоме и представляют собой обособ- ленные экзоэпителиальные органы, которые состоят из железистых кле- ток и нежелезистых экскреторных протоков кутикулярной природы (Шуб- никова, 1981). По строению все железы простые, многоклеточные и при- надлежат, согласно классификации по форме их терминальных отделов, к двум типам — альвеолярному и трубчатому (Заварзин, 1976; Шубни- кова, 1981; Хем, Кормак, 1983, 1983б). Как и у других тромбидиформ- ных клещей (Moss, 1962; Mitchell, 1964; Alberti, Storch, 1973; Mills, 1973; Alberti, Storch, 1974; Петрова, Петров, 1975; Березанцев, 1980; Mothes, Seitz, 1981b; Шатров, 1982), но в отличие от иксодовых (Балашов, 1967; Binnington, 1978; Binnington, Stone, 1981), они не имеют камбиальных или малодифференцированных элементов, за счет которых могла бы пополняться клеточная популяция альвеол. В связи с этим секреция желез изученных хейлетид совершается по морфостатическому типу (Уголев, 1961, 1963; Заварзин, 1976; Ченцов, 1978; Хем, Кормак, 1982, 1983б). Железы лишены обкладки из дополнительных клеток и окруже- ны только плазматической мембраной. Это в значительной степени обусловливает зависимость формы большинства (особенно альвеолярных) нселез не только от их функционального состояния, но и от расположения окружающих органов (Шатров, 1982). Альвеолярные железы. Клещи Ch.eruditus обладают одной парной альвеолярной железой (рис. 42, 43). Она располагается в центре перед- ней части идиосомы, над и впереди синганглия, между передними дивертикулами кишечника и передней частью экскреторного органа, про- стирается на некоторое расстояние в гнатосому и по положению может быть названа медиальной. Альвеолы железы простые, неразветвленные, лежат компактно и образуют одну железистую массу. В прошлом это дало повод рассматривать указанную железу как многоклеточную непар- ную (Hughes Т. Е., 1959). Топографически медиальная хселеза Ch. eru- ditus соответствует альвеолярной слюнной железе хейлетидного клеща Ch. cacahuamilpensis (Summers, ШЖ, 1971). Альвеола образована пятью однотипными пирамидальными клетками (29><48 мкм), широкие основа- ния которых ориентированы к средней линии тела клещей, где альвеолы соприкасаются, а апикальные вершины сходятся радиально вокруг не- большой (3,5 мкм в диаметре) округлой альвеолярной полости, обращен-
ной латерально (рис. 43). Макроморфология медиальной железы Ch. eru- ditus такая же, как и у большинства желез других тромбидиформных клещей, в частности клещей-тромбикулид, тромбидиид, бделлид и анистид (Brown, 1952; Moss, 1962; Mitchell, 1964; Alberti, Storch, 1973, Шатров, 1982) . Выведение секрета из альвеол медиальной железы Ch. eruditus осуществляется по прямым (50 —:55 мкм в длину), узким (4,2 мкм в диаметре), трубковидным и одинаковым по строению на всем протяже- нии протоков кутикулядной природы. Протоки идут самостоятельно Рис. 42. Схема пасположения проподосомальных желез хейлетид: А — Ch. eruditus, В. chanayi, Ornithocheyletia sp.; dg — дорсальные альвеолярные железы, gn — гнатосома, Ы — идиоеома, mg — медиальная альвеолярная железа, рр — педипальпа, tg — трубчатая железа, vig — медиовентральная железа внутрь гнатосомы латеродорсально и, возможно, открываются наружу парой круглых отверстий по бокам у вершины рострума (рис. 13). У основания протоков железы, а также в их конце запирательных струк- тур, подобных двулопастным клапанам протоков «слюнных» желез иксо- довых клещей (Binnington, 1978; Binnington, Stone, 1981), у хейлетид не обнаружено. Протоки лишены также внутренних гребневидных струк- тур, сходных с аналогичной тенидиальной нитью в стенках трахей тт выводных протоков желез некоторых тромбидиформных клещей (Moss, 1962; Березанцев, 1980; Горголь, 1984). При гистологическом исследовании другие альвеолярные железы в просоме Ch. eruditus не былп выявлены. Однако при изучении внешних структур гнатосомы этих хищников с помощью растровой электронной микроскопии у основания когтя педипальп были обнаружены гранулы (рис. 44), сходные с каплями секрета тарсальных желез иксодид (Бала- шов, 1981) . Природа этих гранул и источник их формирования неизвест- ны. В доступной нам литературе подобный факт у хейлетид и вообще у тромбидиформных клещей описан не был. Возможно, что в педипаль- пах этих клещей имеются не обнаруженные нами железы, аналогичные тарсальным железам иксодовых клещей (Балашов, 1967, 1981). Возмож- 62
но также, что это секрет ядовитых желез Ch. eruditus, при помощи которых хищник способен мгновенно парализовать свою добычу, или секрет, при помощи которого хищник при яйцекладке склеивает отдель- ные яйца в компактную группу (Mumcuogly, Cuggenheim, Henking, 1974) . У паразитических хейлетид альвеолярное строение имеют дорсальные и медиовентральные железы. Причем клещи В. chanayi обладают и теми и другими, в то время как Ornithocheyletia sp. только дорсальными. Оба вида желез парные, более массивны из них дорсальные. Они зани- мают значительную часть проподосомы у обоих видов (рис. 43, 44) . Располагаются сразу под интегументом, латерально и вентрально прилежат к кишечнику, а впереди доходят до уровня гнатосомы. Альвео- лы желез тесно соприкасаются друг с другом по дорсомедиальной линии основаниями своих клеток. У В. chanayi каждая альвеола дорсальных желез состоит из двух идентичных по строению гигантских каплевидных клеток (50X140 мкм) (рис. 42, 43). Клетки имеют довольно плоскую дорсальную поверхность и вытянуты антеровентрально (Акимов, Гор- голь, 1984). У Ornithocheyletia sp. альвеолы дорсальной железы пяти- клеточные. Клетки пирамидальной формы, однотипны, но значительно меньших размеров, чем у В. chanayi (17 X 23 мкм) и ориентпровапы латеровентрально. У обоих видов клещей ядра клеток, как и сами клетки дорсальных желез, относительно очень круппые (у В. chanayi — 17 X Х23 мкм, у Ornithocl>eyletia sp.— 6X8,5 мкм), овальной или звездчатой формы, с 1 — 2 ядрышками и соразмерными им многочисленными глыб- ками хроматина (2,8 мкм у В. chanayi и 0,7 мкм у Ornithocheyletia sp.). Располагаются ядра, как правило, у основания клеток (рис. 43, 44). У обоих видов клещей альвеолы дорсальных желез дренируются таки- ми же простыми трубковидпыми протоками, как и медиальные железы Ch. eruditus (рис. 43). Они также направлены к гнатосоме и по своему ходу в толще гипостома не сливаются с протоками других желез. Однако в отличие от Ch. eruditus выходы протоков дорсальных желез на поверх- ность рострума в виде кутикулярных пор обнаружены не были. Как указывалось выше, медиовентральные железы обнаружены только у В. chanayi. Они расположены между синганглием и дорсальны- ми железами и к гнатосоме выдвинуты значительно дальше последних (рис. 42, 43). Как и дорсальные железы, медиовентральные ориентпро- ваны в передне-заднем направлении, их альвеолы обращены латеровен- трально и тесно сомкнуты по средней линии тела. Альвеолы желез состоят из пяти единоструктурных пирамидальных клеток (ÇÇX66 мкм), которые сходятся в центре альвеолярной полости радиально (рис. 43). Ядра желез богаты хроматином, круглые (12,8 мкм в диаметре), распо- лагаются у основания клеток, содержат по одному крупному я„"рышку. Как и другие альвеолярные железы, медиовентральная железа В. ehanayi имеет хорошо развитый простой трубковидный проток. Hpè его выходе из альвеолярной полости на вершинах секраторных клеток наблюдаются плотные замыкающие контакты (tight junktion) (Хем, Кормак, 1982), которые укрепляют положение протока в альвеоле (рис. 43). Протоки медиовептральных желез В. chanayi, как и протоки его дорсальных желез, направлены к гнатосоме, но идут ближе к средней линии тела. Заканчиваются они на внутренней дорсальной поверхности гипостома на уровне ротового отверстия. Трубчатые (вентролатеральные) железы. Вентролатеральные железы у всех исследованных в настоящей работе видов клещей однотипны. Они
представляют собой пару извитых в виде двойной петли трубок одина- кового на всем протяжении диаметра (рис. 42, 43, 45). Расположены симметрично по бокам проподосомы на вентральной стороне тела и на значительном расстоянии друг от друга. В передней части тела клещей железы тесно прилежат к альвеолярным железам и синганглию, но на большем своем протяжении контактируют со средней кишкой и органа- ми репродуктивной системы. Размеры желез прямо коррелируют с раз- мерами самих клещей (табл. 7). В вентролатеральных железах различа- ются два участка — выводной (дистальный) и слепо замкнутый (про- ксимальный) . Т а б л и ц а 7. Размеры трубчатых желез исследуемых видов клеще~~, мкм Длина Размеры Диаметр протока железы Ширина железы Вид дисталь- ного уча- стка ядер клеток клеток железы 128 — 135 217 — 230 90 — 95 256 — 280 12 — 15 21,1 — 25 10,2 — 13 57 — 60 2,5 — 3 3,2 — 3,4 1,7 — 2,5 25 — 30 5 — 6307 — 914 — 17 Cheyletus eruditus Bakericheyla chanayi Ornithocheyletia sp. Anystis baccarum 2,5 3,4 1,6 6,2Х3,2 7Х511Х156х740Х 35 64 Дистальный участок короткий, прямой, его можно интерпретировать как выводной проток железы. Он образован мелкими уплощенными клетками, сидящими на базальной мембране и интенсивно окрашиваю- щимися основными красителями. Ядра клеток располагаются центрально, цитоплазма мелкодисперсная, однородная, лишена каких-либо оформлен- ных включений. Над апикальными поверхностями клеток лежит хорошо развитая интима, которая почти полностью заполняет просвет участка. У всех изученных нами видов ориентация дистального участка сходна. Слегка поднимаясь в дорсальном направлении, он заканчивается на уров- не кокс первой пары ног (рис. 45). У гаматофага В. сЬапау1 конечная часть дистального участка трубчатых желез ампуловидно вздута (рис. 45), как это наблюдалось у Arrenurus (Alberti, Storch, 1977) . У клеща Anystis Ьассагит (Alberti, Storch, 1977) на границе с гнатосо- МоН проток впадает в подоцефалический канал. По нашим данным, эти железы у А. bacearum имеют изолированные протоки, которые откры- ваются экскреторными порами между коксами I I и I I I пар ног. При исследовании дистальных участков вентролатеральных желез ни у одного вида не были выявлены запирательные структуры, как и у других, изученных в этом отношении клещей (Alberti, Storch, 1977) . В целом можно отметить, что строение дистального участка этих желез указывает на его слабую физиологическую активность, которая может ограничива- ться только формированием кутикулярной полости выводного протока железы. Проксимальный участок вентролатеральных желез исследованных видов клещей имеет четкое трубчатое строение. Он петлевидно изогнут, на уровне синганглия на срезах можно одновременно наблюдать 3 — 4 его поперечных сечения (рис. 45). Следует отметить, что у лимфофага Orni- th0cheyletia sp. по сравнению с другими клещами изогнутость прокси- мального участка выражена меньше (см. рис. 42). Проксимальный участок (рис. 45) состоит из одного ряда много- численных пирамидальных клеток, которые на поперечных срезах железы
Рис. 2. Паразитические хейлетиды (дорсально) (РЭМ): r1. — самка Bakericheyla chanayi (X 200), Б — самка Ornithocheyletia sp. ()( 320), В — самец Ornithocheyleltia sp. (X 450); cL — когти педипальп, gn — гнатосома, prs — продосомальный щпт, id — идиосома, ор — опистосома
Рис. 3. Свободнонсивущие кейлетиды (РЭМ): ,Л — самка Cheletomorpha lepidopterorum (X 70), Б — то же, дейтонимфа-хризалидц ()< 100), В — самец Cheyletus polymorphus ()< 200), Г — самка Сheyletus ро!уп1огphus ()< 200) Обозначепия, как иа рис. 1 и 2.
Рис. 4. Окоцчапие опистосомьт самки В. chanayi (РЭМ): an — анус, де — гспитальнос отвсрстис, vge — клапа-ны гсннтального отверстии
Рис. 6. Гнатосома самок клещей рода Cheyletus (РЭМ): А — Ch. euditus ( X 700). Б — Cheyletus malaccensis (Х 600); cl,— коготь педипальп, сз — гребневидные щетинки, gp — гнатосомальнал пора, ре — перитремы, рр — педипальпы, зр — етилофор
Рис. 7. Гнатосома самок Ch. lepidopterorum (РЭМ): A — ()< 1000), Б — (0< 940); cL — коготь педипальп, ре — псритремы, рр-педлпальпы, sp — стилофор, spe — стигмы
Рис. 8. Детали строения сгиба тосомы х нщпых B паразити ч ослах хейлетид (РЭМ): А — рострум Cheyletus sp. jХ 700), Ь — рострум самц» Ch. ро1ymorphus (>( 1500), В — гнатосома самки В. chanayi (Х 780), 1 — гнатосома самки Ornithocheyletia sp. (X 1000), Д — рострум гпатосомы самки В. chanaói (У. 2400); с/ — коготь пели- пальп. ~уз — гнатосомальиап поря, ре — псрпремы, з1 — ротовые лопасти, sp— стплофор, st — стилет, рр — педипальпы
Рис. 9. Поверхность кутикулы ш.которых хейлетид (РЭМ): Л — самка В. chanayi, вентрально (X 650), Б — то же (X 6000), В — самка Ornitho- cheyletia sp., дорсально (0< 3000), 1 — самка СЬ. eruditus, поверхность сочленовной мембраны между 1натосомой и ндтiосомой (0< 1000), Д — то >ко, сочленовнан мембра -a между члсннками 1 пары пог (X 700), Е — Ch. 1ер lopterorum, дорсальные покровы (Х 450)
Рис. 40. Кутикулярные структуры гнатосоыы хищных хейлетид (РЭМ): А — Ch. lepidopterorum (Х f 500). Б — Ch. erudi tus ()< 1500); ch — щетинки, cl — коготь педипальп, cs — гребневидные щетинки, ct — зубцы когтя педи- пальп, gn — гнатосома, pp — псдппальпы, sL — ротовые лопасти, st — стилет
Рис. 11. Некоторые кутикулярные структуры самок Ch. 1ерк1орСегогцш (РЭМ): A — коготь псдппальи (Х 4800), Б — опушснныс щст1ип'и в псрсписй части про подосомы (>( 4800), В — дорсальиая повсрхность гнатосомы ()< 2200), Г — структур'~ покровов члспика 1V пары ног (>( 1500); Ьс — осповапис щстипки, с/~ — щстиш<а, ch — коготь псднпальп, ct — зубсц когтя исдипальп, gn — гиатосома, lgn — выросты гнатосоиы
Рпс. 12. Кучикулнриы» органь~ чувств самок Ch. lepicioptvr'o> ш11 (РЭМ): я — солснидий на голсни ног I (У. 500). В — глаз (Х 2000), В — дорсальнал понсрк- цость педипа;1ьп с покру -pirri~iI' полоколовидной < снсиллои (X 1500). Г — такяп ны сснсилла у осиоваиил иог 1 ()с 2000), ch — щс гпнка, еа — глаз, pp — псдппальцьt, зи — иоло!'олов11.'.~из;! сс1н'илл», N — солсп!1.!llll
Рнс. 13. Органы чувств самок хищного клеща Cli. erudiLus (РЭМ): A — погруженная колоколовидная сенсилла у вершинного членика пернтрем (Х 2400), Б — то >re (X 10 000), В — элементы покровов рострума гнатосоми (Х 10 000), Г — колоколовидная сенсилла и окскреторнал пора трубчатой железь) (); 2000); ch — щетинка, qn — гиатосома, др — гнатосомяльиап пора, ре — перитре- мы, рр — педнпальпы, зи — колоколовидная сеисилла, з. — стылофор, 1р — экскрс- торнан пора трубчатой железы
Рис. 19. Срезы рострума гнатосомы паразитических и хищных хейлетид (Х40): В. chanayi (A, И — фронтальные, Z — поперечный), Ch. eruditus (Б — сагитталь- ный, В — Ж, 3 — фронтальные); bch — основания хелицер, chs — футляр хелицер, do — декомпрсссионное отв 'pcTIIe, dph — дилататоры глотки, es — эпистом, hc— гипостомальнал полость, !а — лаорумм, or> — псрвичное ротовое отверстие, or>— вторичное ротовое отверстие, рб — предротовая полость, ре — перитремы, ph — глот- ка, spe — стигма
Рис. 20. Срезы в области глотки и пищевода хейлетид: ~ — Ch. eruditus, поперечный срез оспования рострума гнатосомы ()< 40), Б — В. cha- nayi, сагиттальный срез гнатосомы (0< 40), В — то >ке, провентрикулярный клапан пищевода ()< 40), Г — то н' е, поперечный срез пищевода в синганглии ()( 90), Д— Ornithocheyletia sp., сагиттальный срез пищевода при выходе из синганглия ()< 40); es — эпистом, np — сипганглий, oe — пищевод, ре — перптремы, ph — глотка, vpr— провентрикулярньш клапан пищевода, tr — трахси, ts — трахейпый ствол, ve — и'елу- до Li
Рис. 24. Концевые участки конечностей хейлетид (РЭМ): А — Ch. егцс1 йць. педи пал ьпа и нога I (0< 600), Б — Д — Ch 1 epidopterorum, (5 — нога ()< 200), В — нога II (X. 2000), Г — нога TV (Х 3000), Д — нога I ()< 1000); апг — амбула-Брум, cl — коготь, cs — грсбневидные щстиики
Рис. 25. Лмбулаирумы I пары ног паразитических кейлетид (РЭ.'11): A — Ornithocheyletia sp. (X 4000), В — В. rhanayi ()( 4000).
Рис. 28. Структуры ротовых органов хейлетнд (РЭМ): А. — Ch. eruditus, рострум гнатосомы спереди (X 2000), Б — Ch. eruditus, сомкнутые стилеты при выкоде из рострума (X G000), В — ротовые лопасти В. chanayi (X 3000); cl — когти педппальп, do — декомпрессионное отверстие, ol — ротовые лопасти, рр-педипальпы, зр — стилофор, st — стилеты
Рис. 29. Ьоршвна рострума п стилетов Н. chanayi (РЭМ): A (X 4000), Б (X f 0 000) — сбокУ, В — (X 4400) спсРсди, sf — стдлсты
Рнс. 31. Декоыирессионнв1е отверстия некоторых хейлетид (РЭМ): ;1 — самец Ornithocheyletia sp. (Х 3000), Б — Ch. eruditus (Х 2000), В — Ch. lepidopteroru»z (X 2000), Г — В. chanayi ()( 3000); do — декомирсссиоцнос отверстие
Рис. 32. Декомпресснонное отверстие у некоторых сосущих клещей (РЭМ): Ь — Sch izotetranychus гесс (Х 3000), Б — Sch. bamb ucae ( Х 3000), В — Sch. celarius ()< 3000), Г — Tydeus sp. (X 4000); do — декомирсссиониое отверстие
Е Рис. 34. Гистологпческие особепностн кпйечви ка Ch. erudite us (А — Д) и Ornithochcylelia яр. (Е — Щ: А — клетки Опистосомальной ча 'Tll кllшсчп11ка в Период активного цище- варения (X 20), Б — В — секреториые и пищеварительнь1е вакуоли клеток дивертикулов кишечника (X 20), Г — п ищеварительиая клетка в иериод активного фупкциопироваиия (Х 40), Д — пищсваритель(1ыс вакуоли в просвете кишечника после деструкции клеток (Х 40). E — дивертикулы кишечник» иа поперечном среза (Х 40), i~le' — и ищев»рительньн. клеткц ()( 90); 6M — базальиая мембрана, (.(. — полост1;1инертикулов, еx- экскреторш.1е граиулы, и — ядро, og — осмиофильиые граиулы, оо — д11цц, vt.' — с('.кретор11ые в»1;уол11 кишечник», 'Ucl — пи1цыарительныс вакуол11, са — дивертикулы
Рис. 35. На~альные этапы переваривапия крови птиц в кишечнике В. chanayi: A — Б — ядерные эритроциты птиц в полости кишечника (X 20, )< 40), В — гемолиз эритро- цитов ()< 40), l — Д — секреторные клетки клшечника (X 20, )( 90); Ьт — базальная мембрана, са — дивсртикулы кишечника, сс — полость цивертикулов, dc — пищеваритель- ные клетки, er — эритроциты, ex — экскреторные гранулы, hp — граиупы гематина, зс- секрсториыс клетки, vc — сскрсторные викуоли, vd — пищсварительныо вакуолц
Рис. 36. Гистологическая картина процесса псреваривания пищи в к1пцечнд- ке В. сЬапау1: A. — содсржпмсс полости дпьсртш'улов (Х О), L — ппщсваритсл»па» вакуоль b пищеваритсл»пой клетки I подтипа с эритроцптамн (Х 90), В — поперечпьш срез дивертикулов кишсчника в период дсструкцпи клеток (Х 20), !' — пищеварительные клетки I подтппа в псрпод активного пищсварснпя, ~ — сагнттальный срез »l»>cpz и- кулов кишечника в период активной фазы пищеварения (Х 20); сс — полость дцвертп- кулов, dct — rrпщеварител»ньюс ~~~eTh~~ T по~~типа, de, — ппп~сварптел»ные fi~eT~~и П подтипа. er — эритроциты ez — э1'скрсторныс гра1~~.п ~. i — гликокаликс h. — гщ~-у- тин, оо — оонпты, vc — секрсторные вакуолп, ed — ппщеварптсльные вакуоч~т, ео- экскреторн»п1 орган
Рис. 37. завершение процесса переварива1.и» крови у В. chanayi: Л — — поглощение гемоглобина пищеварительной клеткой I подтипа (X 90), Б— отторгнутая ии цсваритсльная клстк» ! подтипа в полости дивсртикулов (Х 40). 13 — Г — деструкции пищеварительным клеток (X 40),,( — поперечный срез задник дивсртикулов кишечника на последними этаиак пищев ]реник ()( 40), Е — пищевари- ~сльнь с клетки П подтипа (X 40); cc — полость дивсртикулов, clc> — пищевари- тсльиь;с клетки I иодтипа, clc ° — пиц~сваритсльныс клетки Ii подтипа, ех — экскре- торныс граиулы, fc — фскальпьи1 шарик. ~I — глшли'аликс, ha — гемоглобин, hg— гсматын, юЛ — пищсваритсльиыс вакуоли, оо — ооцит
Рис. ЗЬ. Морфологические особенности экскреторного органа хейлетид: .~ — общий вид (фронтально) с фекальным шариком в ироевете (X 20) В. chana Б — оптически активные коикреции гуанина в просвете (ноляризованный свет) ()< 2 Я. chanayi, В — сагиттальны й срез экекреториого органа Ch. erudi tus; ca — диверти~ лы кшпечника, ео — экскреторный орган, fc — фекальный шарик, gu — гуанин, оИ пищеварительные вакуоли
Рис. 39. Гнстологическне особенности экскреторного органа хейлетид: А. — задняя часть эксиреторного органа В. cllanayi продольпый срез срез ()( 40); Б — В, Г — поперечные срезы лередпего участка экскреторного органа В. chanayi в различные перподы фупкцпонпрования (Х 90), Д — поперсчпый срез переднего участ- ка экскреторпого органа Ch. eruditus; Ьпг — базальная мембрана, ео — экскреторный орган, gu — гуанип, 1~р — гсматиповые гранулы, и — ядро, са — дивертикулы кишеч- ника, пи — мпкронорспнки клеток экскрсторного органа
Рис. 40. ч~ункц:-1онадьные осооенпостц дкскреторного органа хейле-тид: A. — поперечный срсз экскрсторного органа Ornithocheyletia sp. (Х 90), Б— тяжи слизи с гуанииом в полости экскрсторного органа Ch. erurlitus (> 40), В — я ццлоф ил ьность б;1 злл 1-.иой мсмбра иы экскрсториого орга ия Ch. erucl i iud ()( -~0), I11c — ~'й.~~и CJ<IIJll 0CT<lilblf I~le 00Q31I<l~ltlIIIJJ> Halli 110 plIC. 3~,
Рис. 43. Лльвеолярные проподосомальиые железы хищны~ и паразитическими хейлетид: ,) — (.h. pt uditus. мсдцальпа» железа (Х 40), Б — Ь. с11аиау~, мсдиовсптральпая желе- з» (X 90), В — 13. cl>anayi, грапулы секрета v и1стгак topcaльной н<слсзы (X 90), Г — 13. 'IIana yi, дорсальная и медионснтральпая железы па сагиттальном срезе (X 40), Д — В. chanayi, лвуклсточная альвеола дорсальио "t железы (X 40); ис — клет- ки альвеолярны i жс лез, cl ' — ~ц)оток железы, и — ядро, рас — ириальвсолярная полость, sg — секрсторныс грапулы
Рис. 44. Некоторые особенности альвеолирных желез паразитических и хцщ- EIhIx хейлетид: д — агранулярное состояние клеток дорсальных жслез В. chanayi (X 40), Б — грану- лярное состояние клеток дорсальных желез В. chanayi (Х 40), В — возможный выход гранул секрета под основанием когтя педипальп Ch. eruditus (РЭМ, )< f 500); cl— коготь педипальп, d<~ — дорсальнаи железа, ео — акскреторный орган, gs — секретор- ные гранулы, и — ядро, sg — гранулы секрета альвеолярных желез
рис. 45. Трубчатые железы хойлотид и некоторых других тромепдиформных клещои: '1 — продольный срез железы Ch. егuditus (X 40), Б — то же, В. chanayi (X 40), В— то хе, Ornithocheyletia sp. ()< 30), 1 — поперечный срез 'келезы ОгпШ1оспеу1ейа sp. ()< 90), Д — дистальный участок железы В chanayi, Е — дистальный участок и выход протока трубчатой н<елезы Anystis Ьассагum между коксами П и Ш пар ног (> 40); аю — апикальные иивагинации, bin — базальные инвагинациц. ас — клетки желез, сгс- кутикула; halo — проток железы, n — ядро, ta — тубулярная ампула, tg — секреторные гранулы трубчатой железы
Рис. 46. О~верстня протоков трубчатых желез (РЭМ): A — А. baccarum ()( 10 000), Б — Ch. eruditus ()< 15 000)
Рис. <8. 11оритремальпый ыоыплекс хе11лстид (1'ЭМ}: ,~ — В. cha»ayi (х 2000), Б — Ornithocheyletia sp. (х 2000), В — (х 1300), Г — (Х 4000), Д — Qlx. lepidopter î~'um (Х 18 000), Е — Ch. eruditus (X 30 000); ch — щетинки, ре- Иер!ГГРСМЫ 8pe — СЧ1ШЪМЫ
Д с Рис. 19. Траншеи гна1осомы и идиосомы лейлетид: il — Р — Ch. er~1ditus (Х 40, Х 40, )< 00, )< 40) Д, E — С11. lepidopieãîãu111 ()< 20, )( O0); Qt7' — 11тр11 1л1э11ы11 y~1ñ1ñ'ãÎÅ, Ы7' — встви1ЦЯ)!с)1 Tp11xc>f, '~71 — 1'11атосомй, Ы — ид110сом», ш — псреЕОд11оп y~1ист01ъ, !1T — .1!онал11'30вя11ня)1 трйж1[, p8— псритремы, spe — стигмы, t7 — траксп, ts — траксй11ы11 ствол
Рис. 50. Ветвление трахей в теле СЬ. lepidopteroruru. ,А, B ()( 40), В ()( 90) — идиосома, Г — конечность; tr — трахеи, ts — трахей- НЫЙ СТВОЛ
1 }~ис.-52. Гистологические.. особенности" репродуктивной системы самок -хищ- .-ных и- паразитических хейлетид: A — общий вид ..Рей9одЯл'ивной- .системй В. chanayi на продольном срезе (у. g0) Б — гермарий и йередний отдел яйцевода В. chanayi на поперечном срезе (у. pg> В — поперечный срез яичника С6. егцййцв на границе гермария и зоны роста ( >( 40), Г — зона роста яичника Cb. eruditus на продольном срезе ()< 40), Д— растущие ооциты В. chanayi в яичнике (зона роста) (X 40); ger — германий, ic— питающие -клетки; и — ядро, ~d2 —. задняя, железистая' часть яйцевода; оо,— оо,— -ооциты на различных стадиях развития, оо яичник, tð — оболочка яичника, «у — желтоЕс, og — оогонии.
Рис. 53. Рост и созреваиис ооцитов хейлетид: A — ооциты Ch. eruditus па различных атапах роста ()< 20), Б — «питающие» но'Бки ~яычник Ch. eruditus) (X 90), В — ооцит В. chanayi в период вителлогенеза (X 40), Г — то же, Ch. crud itus (Х 40); ex — экскреторпые гранулы, ger — герма- рпй, ди — гуанин, if — «пнтаюп1,ие» ножки, hg — гематин, и — ядро; оо,— оо.-— ооциты на различпых стадиях раазвнтп» и созревания, ою — «йцевод, tp — оболочка «цчнпка, 7/ — il(''лток, 0g — оогоннц
Рис. 54. Яйцевод хейлетид. A — продольный срез стенки яйцевода Ch. eruditus (X 20), Б — задний (секретор- ный отдел яйцевода) В. chanayi на продольном срезе (X 20), В — поперечный срез яйцевода Ch. eruditus в петлевидно изогнутой железистой части ()< 20), Г — по- перечный срез яйцевода В. chanayi (Х 40); cod — клетки яйцевода, ти — слизь, и — ядро, od, — передний участок яйцевода, od2 — задний участок я~~цевода, sg— гранулы секрета, vc — секреторные вакуоли
Рис. 55. Дистальные отделы репродуктивной системы хейлетид: A — яйцсвод В. chanayi с гематиновыми конкрециями в просветс (> 20), Б— яйцсвод Ch. eruditus, заполненный экскрсторным материалом ()< 20). В — вагина В. chanayi на продольном срезе (X 20), Г — то нсе, Ch. crud itus (0< 20); са- дивертикулы кишечника, ех — экскреторный материал, ger — гермарий, hg — гема- тин, it — интима, ооз — ооцит в стадии вителлогенеза, od~ — пере..~ниЙ участок яйцевода, od> — задний участок яйцсвода, va — вагина, age — вагинальные клапапы
Рнс. 60. Серия фронтальных срезов синiанглин санки В. chanayi: ст — коыиссуры. сп — коннективы, ст — кортскс, деl~ — гаиглии хслицер; pop — описто- сомальньш гапгли11, р — педальные гаигли~и, ое — пицсвод, дрр — псдипальиа,чьные гяыг- лии, up — исйропиль
Рис. 61. Хищные хейлетиды и ик яйца: A — Cl>. егц0йия с жсртвой — акароидным клещем Cteacglyphiы canestrinii (РЭЪ| Х X, l 00), b —: i ii цекладка Cll. lepidopterorum (мцкрофото), В — то же, отделывае яйцо в нитях си утицы (1 ЭМ )< 400); оо — яйцо, fs — нити iiayr «iu r
Рис. 62. Локализация паразитических хейлетид иа теле птиц: Схема располо'кения чехликов В. chanayi n Ornithocheylctia sp. на брюшной (l) и спин- ной (П) стороне хозяина, А — чехлики В. chanayi на брюшной стороне тела зяблика, Б — чехлики Ornithocheyletia sp. па брюшной стороне пеночки-веснички. Большие точ- ки — расположение чехликов В. chanayi, малые — Огпй11 cheyletia sp. Птерилии: 1— плечевая, 2 — брюшная, 8 — бедрена», 4 — хвостовая, 5 — шейная, 6 — ко>кистые пере- понки плеча и предплечья, 7 — спинная птерилия
Рис. 63. Чехлики В. chanayi: A — функционирующий чехлик (микрофото) на теле зяблика, Б — разрушающийся чехлик на теле зяблика (микрофото), В — чехлик на теле чижа (микрофото), Г— нити паутины чсхлика (РЭМ X 2000); еп — входное отверстие, ех — экскременты, fs— нити паутины
Рис. 64. Ч.склиги Orni(l>nchcyletia sp.: .4 — чеклики Огш(11ос1и:у1Ии ü~ð. на 1'отсс 'пеночки-веснички (микрофото) Б — от- дельный чеклик с самкой (P33I )< 200), Г — нити паутины (РЭМ g 2000); fs — иитц паутины, "f — споры гр~юоц
Рис. 65. Паразитические клещи В. chanayi (микрофото): 4 — мигрирующие самки на консе зяблика, вне чехлика, Б — вскрытый чехлик. В— яйцекладка в чехлике; ех — экскременты, оо — яйцо, Я — самка
Рис. 60. 11аутххххоирядетхххе у х;лещехх-тетраххихххд рода Srhizntelcanychvs (РЭМ): A — самка Sch. се1аг1цз под групповым пологом (x 700), Б — закрепление паутинных нитей полога hach. celarius на нижней стороне листьев курильского бамбука ()< 10000), В — нити разрушающейся паутинной пряжи в пологе Sch. celarius (X 2000). Г— паутинный полог Sch. гес11 соору>кепный для защиты «пц (Q 200), Д — то же, фрагмент (Х 200); fs — нити паутины
Ch. eruditus и Ornithocheyletia sp. расположены по 3, а у В. chanayi— no 4 радиально, вокруг срединного канала (рис. 45). Собственно канал (проток) образован аиикальными поверхностями клеток и тянется вдоль всей железы. Клетки расположены на базальной мембране, которая хорошо дифференцируется на прямых участках железы, но в местах соприкосновения петель не просматривается, а по некоторым данным (Alberti, Storch, 1977) отсутствует. Латеральные границы клеток нечет- кие, так как образуют сложные переплетения — интердигитации (Завар- зин, 1976) — ио всей высоте клеток (рис. 45). Апикальные поверхности клеток неровные, однако микроворсинки, как у клещей Т. urticae (Mills, 1973), нами не обнаружены. Смыкаясь, они образуют в просвете железы лабиринты, которые отчетливо видны на срезах (рис. 45). Между ними у соседних клеток отмечаются уплотненные интенсивно окрашиваемые полоски. Они представляют собой плотные замыкающиеся контакты (tight junction) или зоны слияния (Хем, Кормак, 1982) соседних клеток, как это наблюдалось в медиовентральных железах В. chanayi. При таких контактах плазм атические мембраны клеток максимально сближены (Ченцов, 1978; Шубникова, 1981) и их роль заключается прежде всего в усилении соединения внешних поверхностей клеток железы. Наиболее характерной особенностью тубулярного участка вентрола- теральных желез являются многочисленные впячивания цитоплазмати- ческой мембраны клеток. Они влияют на расположение ядер в клетках и локализацию внутриклеточных включений. По степени превалирования инвагинаций в апикальной и базальной частях клеток тубулярный участок мох<но разделить на две группы. Первая группа (Ch. eruditus) имеет преимущественно апикальные инвагинации цитомембраны (рис. 45), вторая (В. chanayi, Ornithocheyletia sp.) — базальные. Апикальные инвагинации тубулярного участка вентролатеральных желез Ch. et'uditus наблюдаются во всех клетках, вдоль всей железистой ткани. Они простираются на '/з высоты клеток и направлены к базаль- ной мембране, образуют обширную и равномерную сеть. Компартменты инвагинаций тесно прилежат друг к другу, особенно на верхушках кле- Toh, и по ходу к основанию их расширяются. Цитоплазма клеток между впячиваниями эозинофильна, к основанию — становится умеренно базо- фильной. В компартментах инвагинаций и базальной части клеток обна- ру>кены многочисленные пустые вакуоли (0,5 — 0,6 мкм в диаметре), мелкие темные гранулы (митохондрии) (Alberti, Storch, 1977) и много- численные розетки гликогена. Апикальные поверхности клеток заполнены плотным, весьма обширным и интенсивно осмиофильным слоем плотного вещества (рис. 45). Этот слой сопровождает весь канал, за исключением эктодермальной (дистального отдела) части. Оксифилия слоя, а также морфологическое сходство его с подобными структурами клеток реабсорб- ционнык отделов осморегулирующих и выделительных эпителиев других членистопогик свидетельствует о том, что этот плотный слой является мощно развитым гликокаликсом, который выполняет роль ионных (<лову- шек». обеспечивающих повышение концентрации ионов в участке IIQBBpx- постного аппарата (Заварзин, Харазова, 1982). Это, вероятно, связано с реализациеЙ клетками вентролатеральных желез Сй,. егийСии реабсорб- цпонной функции. Ядра клеток проксимального участка трубчатых желез Ch. eruditlls круглые, располагаются базально, имеют диффузно распре- деленньш хроиатин и одно гомогенное ядрышко. Просвет протока железы заполнен слабо эозинофильным матриксом, мелкими вакуолями и свобо- ден от «аких-либо гранулярных образований.
У клещей В. chanayi и Ornithocheyletia sp. в тубулярпом участке вентролатеральных желез преобладают инвагинации базальной цито- мембраны. Инвагинации эти довольно глубоко (на '/2 — '/3 высоты клеток)' проникают в цитоплазму и направлены к апикальной поверхности. При этом базальная мембрана, на которой располагаются клетки, не следует впячиваниям цитоплазматической и остается ровной (см. pIIC. 45) . Компартменты инвагинаций сужены в апикальном направлении и запол- нены митохондриями, как и у Ch. eruditus или А. Ьассагит (Alberti, Storch, 1977) . При окраске гематоксилин-эозином цитоплазма клеток изменяет окраску от розовой до фиолетово-синей от основания клеток к протоку железы, т. е. полярно противоположна окраске клеток железы Ch. eruditus. Ядра клеток тубулярного участка при базальных ипваги- нациях располагаются центрально или ближе к поверхностп клеток (рис. 45). Они имеют овальную форму, перихроматическую структуру и содержат 1 — 2 ядрышка, которые окрашиваются очень интенсивно на фоне слабобазофильной цитоплазмы. У клещей В. chanayi и Ornithocheyletia sp. па большем протяжении тубулярного участка железы структура клеток однотипна. Однако при сохранении оксифильных участков цитоплазмы в базальной части клеток и базофильных в апикальной кроме упомянутых выше компонентов толь- ко у клещей В. chanayi обнаружены интенсивно чернящиеся гематокси- лином мелкие, ограниченные мембранами вакуоли секреторной природы величиной 0,6 — 0,8 мкм. Они многочисленны, рассеяны диффузно в цент- ральной ядросодержащей части клеток (рис. 45). Заслуживает внимания также и то, что в клетках этой части трубчатой железы В. сЬапау1 и Ornithocheyletia sp., как и у А. Ьассагит (Alberti, Storch, 1977), наряду с базальными инвагинациями имеются и апикальные, но выражены сла- бее (рис. 45), так же как и осмиофильный слой гликокаликса, характер- ный для Ch. eruditus. Вопрос о выходе протоков трубчатых желез в настоящее время остается открытым. Результаты показывают, что их дистальная часть заканчивается на уровне первой пары ног. Считается, что протоки тубу- лярных желез являются основными, куда впадают проток~т прочик экзо- кринных желез (Mills, 1973; Alberti, Storch, 1973, 1974, 1977; clothes, Seitz, 1981Ь), объединенных подоцефалическим каналом. Однако при исследовании поверхностных структур просомы хищного клеща Ch. а1цй- tus при помощи растровой электронной микроскопии нами были обнару- жены на вентральной стороне клеща симметричные парные отверстия у основания I кокс, к которым подходят трубчатые железы (рнс. 46). В связи с этим весьма вероятно, что Ch. eruditus обладает трубчатыми железами с изолированными от других проподосомальных хселез прото- ками, которые у Т. urticae впадают в подоцефалический канал (Mills, 1973), а обнаруженные отверстия служат их экскреторными порами. Функциональные особенности Альвеолярные железы. Клетки медпальной железы функционируют син- хронно, однако их строение значительно изменяется у Ch. eruditus npn различных фазах пищеварения. При голодании клещей (от 1 до 14 сут) клетки железы гипертрофируются и занимают значительную часть гнато- сомы, простираясь вперед от глотки. Одновременно они оттесняют назад переднюю часть экскреторного органа и дивертикулы кишечника. В таком состоянии они заполнены многочисленными, простыми по строепп1о гра- 66
нулами секрета (рис. 43, 44). Гранулы состоят из гликопротеинов, азаном красятся в фиолетовый, а эозином — в красный цвет, что отражает различные консистенцию и степень созревания (прежде всего процесса соединени т белков с углеводами) при оформлении гранул. В клетках гранулярный секрет сосредоточен в виде равномерно плотной массы по всему объему хселезы, промежутков между гранулами нет. Следует отметить, что размеры гранул убывают по направлению к альвеолярной полости (от 3,4 до 2 мкм) . Наряду с ~ранулами обычьых размеров (p«. 43) встречаются и гигантские (22 — 25 мкм и дахсе 52 — 70 мкм в диаметре). Структура и окраска гранул обычных размеров и гигантских идентична. Вероятно, гигантские гранулы представляют собой продукт слияпия мелкик при сильной концентрации секрета. Ядра, а также другие органеллы клеток при большом количестве секрета в хселезах маскируют- ся ими и пе наблюдаются. Во время питания железы клещей освобождаются от секрета и зна- чительно уменьшаются в размерах. У хищников, акт питания которых после 6-суточного голодания длился 45 мин, цитоплазма становится полярной. Лпикальная часть клеток заполнена зрелыми гранулами секре- та, а базальная — свободна от них и имеет сетчато-гранулярную структу- ру. В этот момент в апикальной части клеток четко вырахсена эозино- филия, и в базальной — базофилия. Видны овальные (3,5 Х 10 мкм) я'чра у основания клеток (рис. 43). Они имеют по одному круглому (3,2 мк;.< в диаметре) ядрышку, расположенному ацентрично, хроматин сосредото- чен у стенок нуклеолеммы. При увеличении сроков питания (от 1 до 1,5 ч) тенденция к миграции секрета в приальвеолярную полость усили- вается. С убыванием гранул эозинофильная зона сокращается, уступая место базофильной. Четче проявляется структурированность цитоплазмы у основания клеток. Сетчатость превращается в ячеистость, наблюдаются отдельные гранулы базофильного секрета, в которых накапливасотся белки. Ядра имеют четкую овальную форму, хроматин в них распределен более диффузно, чем в ядрах клеток железы прп малых сроках питания клещей Ch. eruditus. При максимальном в наших опытах времени насыщения Ch. eruditus (2,5 ч) клетки медиальной железы у основания содержат незрелые, с преобладанием белкового компонента гранулы. В апикальной зоне, занимающей около половины объема клетки, цитоплазма менее струк- турированная, базофильная (рис. 43) . Спустя 1 — 1,5 ч после такого длительного питания клещей медпаль- ные железы приходят в состояние, аналогичное состоянию голодающих клещей-хищников. Они содержат вполне сформированные ацидофильные секреторные гранулы по всему периметру клеток. В этот период среди них видны и базофильные тяхси цитоплазмы. В гомогенатах гнатосом, содержащих медиальные хселезы cbITbIx, взятых из лабораторной культуры клещей Ch. eruditus (Горголь, Бара- банова, 1979), была выявлена высокая протеолитическая активность, составлявшая до '/3 протеолитической активности кишечника этик хищ- ников (табл. 6). Это показывает, что указанные железы Ch. eruditus обладают способностью синтезировать протеолитические ферменты, кото- рые, вероятно, участвуют во внекишечной переработке пищи. Клетки альвеол дорсальных желез В. chanayi и Ornithocheyletia sp. функционируют синхронно и, несмотря на некоторое количественное несоответствие, сходно у обоих видов. Для клеток дорсальных желез этих видов хейлетид были выявлены два хорошо морфологически дифферен-
цируемьхх фуххкциональньхк состояния — гранулярное и агранулярное. При первом из них железы содержат многочисленные, окруженные мем- бранами, сложные белковые гранулы (рис. 43, 44). Их размеры у клещей В. chanayi составляют 3,5 — 14 мкм в диаметре, у Ornithocheyletia sp.— 0,5 — 1,2. Азаном и кххслым гематоксилином они окрашиваются в раз- личные оттенки красного и фиолетового цветов, а с толуидиновым синим дают метахромазию. Это указывает на присутствие в гранулах кроме белковых компонентов и углеводов. Гранулы распределены в клетках свободно, пе деформируют друг друга. Между ними в незначительных HoJIH~IecTBax наблходаются тяхси умеренно базофхильной цитоплазмы. El@pa при этом овальной формы, содержат '1 — 2 кругльхк ядрышка, соразмерньхк конденсированному возле нуклеолеммы хроматину. При аграпулярном состоянии желез оформленный секрет в Вх клет- как отсутствует, цитоплазма имеет крупносетчатую структуру (рис. 44) длнноп грани у В. chanayi — 6,4 Ornithocheyletia sp.— 1,7 мкм. Эти грани окрашиваются значительно интенсивпее, чем промежутки между нимхх хх воспрххнххъхахот главным образом геиатоксххлхххх. Цитоплазма содер- жит, судя по окраске, Р11К и диффузно рассеянные вкрапления белка. Некоторые из вкраплений обладают кристаллической структурой и соот- ветствуют кристаллам экскретов. Такие кристаллы неоднократно наолю- дались в эпителип железххстьхк органов другххк к:хещей (Райхель, 1975; Шатров, 1982), п в частности у клещей анистид (Горголь, 1984). Вероятно, они представляют собой результат автолиза coocTBBHHbIx цито- плазмати хескххк структур клеток в процессе ххах функционирования (Дин, 1981) . При агранулярном состоянии дорсальных желез их ядра становятся звездчатыми. При этом нуклеолемма неровная, вдавлепа внутрь ядра. Следует отметить, что такая форма ядер встречается в немногих типах желез и характерна в основном для шелковыделительных желез пауков и насекомьх~ (Гиляров, 'l960). Обращает на себя внимание и тот факт, что в клетках дорсальньхк желез В. chanayi n Ornithocheyletia sp. одновременное присутствие грану- лярного секрета и сетчатости не наблюдалось. Это указывает на то, что процессы синтеза и накопления секрета, с одной стороны, и его экстру- зии — с друго~т, пестсолько разобщены и не синхронизированы в такой степени, как это происходит в медпальной железе Ch. eruditus. Анализ агранулярного состояния дорсальных желез у многих особей паразити- ческих хеххлетидньхх клещей, изучеххххьхк нами, показал, что оно форми- руется в виде ряда последовательных этапов, которые можно определить по усиливающейся четкости обрамления сетчатости и уплотнению веще- ства в них. Это свидетельствует о том, что агранулярное состояние дор- сальных желез предшествует гранулярному и представляет собой период синтеза секрета и оформления его в гранулы. Исследования показали, что гранулярное и агранулярное состояния дорсаххьньхх желез клещей В. chanayi и Ornithocheyletia sp. не зависят от приема и переработки пищи и наблюдаются на различных этапах пищеварения. Вместе с тем четкая сопряжепность этих состояний про- слежена на примере другой системы органов — репродуктивной. Так, гранулярное состояние желез всегда сопровождало преовипозиционный период самок, а агранулярное — постовипозиционный. Отличительной особенностью медиовеххтральньхк желез В. chanayi является то, что продуцируемый ими секрет не оформляется в гранулы, как это наблюдается в медиальных железах Ch. eruditus, дорсальных—
В. chanayi и Ornithocheyletia sp., большипства экзокринных желез А. Ъас- carum и других тромбидифориных клещей (Moss, 1962; Mills, 1973; Alber- ti, Storch, 1974; Mothes, Seits, 1981b; Шатров, 1982; Горголь, 1984) . На всех этапах пищеварения цитоплазма клеток этих желез мелкодисперс- ная, волокнистая, слабо вакуолизирована, богата белками и РНК. Интен- сивность окраски медиовентральной железы по сравнению с дорсальной в 2 — 3 раза слабее, но, в отличие от нее, зависит от пищеварительного процесса. У клещей, давно принимавших пищу, медповептральная железа имеет однотипно базофильную окраску клеток, фиолетово-синяя окраска частиц цитоплазмы равномерно распределена по всему объему клеток. В момент питания окраска цитоплазмы клеток дифференцируется. Ее базальная часть остается базофильной, а апикальная ('/q часть высоты клеток) — гетерофильна и эозинофильна (рис. 43). Сопряженность функционирования этих желез с приемом пищи (кровососанием), а также соответствие их некоторым слюнным железам из набора экзокринных желез тетраниховых клещей (Molhes, Seitz, 1981) позволяют считать медиановентральные железы В. chanayi слюнными. Трубчатые железы. Прежде всего следует подчеркнуть, что в процес- се питания и голодовки клещей характер внутриклеточных структур труб- чатых желез у Ch. eruditus не изменяется. Относительно функций труб- чатых желез в целом можно отметить, что их строепие аналогично строению осморегулирующих органов (Mills, 1973; Woodring, 1973; Alberti, Storch, 1974; 1977; Mothes, Seitz, 1981Ь) и нефридиальных орга- нов (Coons, Axtell, 1971; Заварзин, 1976; Заварзин, Харазова, 1982; Хем, Кормак, 1983а, 1983б) беспозвоночных хсивотных, в том числе и клещей (Джафаров, 1964; Балашов, 1967; Балашов, Райхель, 1975; Шатров, 1983а). Это не оставляет сомнения в том, что вентролатеральные железы изученных нами хейлетид являются аналогами трубчатых желез других клещей (Mills, 1973; Alberti, Storch, 1977; Mothes, Seits, 1981b; Шатров, 1983). В основе деятельности таких желез лежат процессы активного транспорта ионов. Эффективность этой функции в данном случае обеспе- чивается сильным развитием структурных инвагинаций цитоллазматиче- ской мембраны, которые многократно увеличивают полезную площадь клеток. Весомое значение, на наш взгляд, приобретают латеральные ин- тердигитации и отсутствие, как полагают (Alberti, Storch, 1977), базаль- ной мембраны между петлевидными изгибами железы, что позволяет транспортировать вещества более кратким путем. Исходя из отличий, имеющихся в строении рассмотренного типа желез, можно отметить, что у хищного клеща Ch. eruditus, у которого преобладают апикальные инвагинации плазматической мембраны, прева- лируют процессы реабсорбции веществ из полости протока внутрь кле- ток. Убеждает в этом также и осмиофильньш слой гликокаликса на апи- кальньтх поверхностях клеток, который, как уже указывалось, играет роль ионных ловушек. Реабсороционная функция трубчатых желез Ch. eruditus подтверждается и тем, что, несмотря на питание жидкой пищей, этот вид клещей очень чувствителен и дефициту влаги (Hoczek, 1959), а экскреторный орган весьма посредственно всасывает жидкость их экскретов. Таким ооразом, морфология трубчатых желез паразитических хейле тид свидетельствует о том, что кроме функции реабсорбцип они выполня- mT и функцию адсорбции. Наличие гранулярного секрета в клетках этой железы у В. chanayi указывает на выработку секрета — дополнительную секреторную функцию.
Специализация проподосомальных желез хейлетид Проподосомальные экзокринные железы объединены нами лишь по топо- графическому признаку — размещению в передней части идиосомы- проподосоме. По происхождению, строению, принадлежности к той иной системе органов, а следовательно, и по функциям железы эти весьма различаются. Поэтому, чтооы проследить, какие черты в строении и функциях данных желез наиболее специфичны, следует рассматривать их в составе соответствующих систем органов и с учетом экологического своеобразия изучаемых видов хейлетид. Так, учитывая, что определяющей для Ch. eruditus чертой трофики служит хищничество, важным, на наш взгляд, свойством медиальной железы является способность заблаговременно депонировать секрет. Это делает ее постоянно готовой к немедленному функционированию в каче- стве слюнной. Гранулы секрета не реутилизируются даже при длитель- ном голодании. Более того, при голодании они увеличиваются в разме- рах и становятся гигантскими. Убедительным доказательством участия медиальной железы Ch. Cruditus в процессе пищеварения служит также путь транспорта секрета к месту его действия, к вершине рострума гнато- сомы. Таким образом, к ротовым органам осуществляется прямая достав- ка ферментов хищников, способных к внекишечной обработке пищи. Дорсальные железы паразитических хейлетидных клещей В. chanayi и Ornithocheyletia sp. обладают значительной функциональной активно- стью, которая выражается не только в крупных размерах самих желез, но и в продуцировании ими большого количества гранулярного секрета. Эти железы функционируют циклично и иенсду процессами синтеза, оформления секрета и его экструзии существуют длительные перерывы. Выделение секрета у этих видов совпадает с периодом яйцекладки и не связано с приемом и переработкой пищи. Следует отметить, что при откладке яиц эти клещи в большом количестве выделяют паутин ную пряжу, которую используют для прикрепления яиц к телу хозяев, а так- же для сооружения на коже птиц защитных паутинных чехликов (Горголь, 1982; Лкимов, 1орголь, 1984; Акимов, Горголь, 1986). Харак- терно, что другие клещи-хейлетиды, например Cheyietiella yasguri, при- клеивают свои яйца у основания волосков на покровах хозяев, а затем над каждым плетут паутинный кокон (г'охх, Fwing, 1969). Клещ Che- letomorpha lepidoplerorum, как указывает А. М. Хьюз (Hughes А. М., 1957), покрывает паутинной сетью всю яйцекладку. Наши наблюдения процесса паутинопрядения у хейлетид также подтверждают эти сведения. Все это дает основание полагать, что дорсальные железы В. chanayi и Ornithocheyletia sp. являются шелковыделительными, которые продуци- руют паутинный секрет для сооружения чехликов-тентов на теле их хозяев — птиц. Предположение о том, что дорсальные железы паразитических хейлетид шелкопрядильные, в значительной степени подтверждается глу- бокой аналогией формы и функции их и латеровентральных хселез кле- щей А. baccarum (Горголь, 1984), которые в процессе онтогенеза перед каждой последующей стадией развития сооружают из паутины так называемые «линочные гнезда» (Ланге, Дроздовский, Бушковская, 1974). Как и дорсальные яселезы В. chanayi и Ornithocheyletia sp., латеровен- 70
тральные железы А. baccarum имеют в составе альвеол пять клеток и функционируют циклично, переходя из четко выраженного агранулярного состояния в период линьки клещей в гранулярное в период сооружения «гнезд». Следует отметить, что цикличность функционирования паутин- HbIx желез у паразитических хейлетид и их сопряженность с яйцеклад- кой отмечается нами впервые. Выделение паутины у некоторых исследованных в этом отношении тромбидиформных клещей связывают с деятельностью желез различных типов — альвеолярных (Blauvelt, 1945; Alberti, Storch, 1974, 1979; Пет- рова, Петров, 1975; Alberti, Ehrnsberger, 1977; Mothes, Seitz, 1981Ь) и трубчатых (Mills, 1973). Вопрос этот в значительной степени остается дискуссионным. Надо полагать, что способность к выделению паутины, как это следует из работы о способности к шелкопрядению у клещей-бде- лид и кунаксид (Alberti, Ehrnsberger, 1977), могла возникнуть на морфо- функциональной основе различных типов желез, обладающих достаточно высокой активностью синтеза белкового секрета. Во всяком случае похо- же, что у изученных хейлетидных клещей выделение паутины независимо возникло в железах, расположение и строение которых различно. Сопряженность функционирования медиовентральной железы клещей В. chanayi с приемом пищи (кровососанием) и морфологическое соответ- ствие этой железы некоторым экзокринным железам Te TpaHHxoBI Ix клещей (Alberti, Storch, 1974; Mothes, Seitz, 1981Ъ) позволяют считать ее слюнной и аналогичной по функции медиальной железе хищного кле- ща Ch. eruditus. Маловероятно, что такие железы принимают участие во внекишечной обработке пищи или в образовании дополнительных элементов — цементных футляров и стилостомов, как это наблюдается у иксодовых и краснотелковых клещей. (Балашов, 1967; Шатров, 1982). Нельзя также предположить участие их в возникновении капиллярных дерматитов и других видимых нарушений кожных покровов хозяев, что характерно для некоторых паразитических хейлетидных клещей (Ewing, Nosier, 1'охх, 1967; Foxx, Ewing, 1969), поскольку у птиц — хозяев В. chanayi таковые отсутствуют. Наиболее узнаваемы и едины по форме не только для хейлетид, но и для других тромбидиформных клещей трубчатые (тубулярные) желе- зы. Анализ их строения и функций показывает, что у хищника Ch. erudi- tus в основе деятельности этих желез лежат процессы эндоцитоза. С переходом хейлетид к паразитическому образу жизни (клещи В. cha- nayi и Ornithocheyletia sp.) функции желез значительно расширяются, и они кроме эндоцитоза способны к экзоцитозу и даже секреции. У клещей-тетранихид (Alberti, Storch, 1974; Mothes, Seitz, 1980) конечная часть тубулярной железы (собственно фильтрационный ее аппарат — sacculus) редуцирована, в связи с чем предполагается возмож- ность модификации этих желез в слюнные, паутинные и т. д., тем более что протоки этих желез выходят в подоцефалический канал вместе с протоками других экзокринных желез. Исследования тубулярных желез хищных клещей Ch. eruditus с помощью электронной микроскопии (Al- berti, Storch, 1977) показывают, что они также в значительной степени редуцированы. Поэтому можно ожидать изменения функции этих желез и у Ch. eruditus. К сожалению, данные электронно-микроскопических исслсдований тубулярных желез паразитических хейлетид отсутствуют, а потому неизвестно, редуцирован у них sacculus или нет. Однако одно- .ги п ность строения тубулярного участка желез у паразитических хейлетид и клещей-тетранихид может служить признаком отсутствия sacculus 71
и у этих видов. Во всяком случае следует считать весьма вероятным, что функция тубулярных желез изученных нами паразитических хейлетид даже шире, чем у хищного клеща Ch. eruditus. Анализируя особенности локализации строения и возможных функ- ций желез с точки зрения специализации их у хищных и паразитических хейлетид, следует отметить, что названия альвеолярных желез не отра- жают их гомологию и функциональную идентичность. Дело в том, что единая классификация иросомальных желез вообще отсутствует, а вы- явление гомологичных структур затруднительно. Относительно просто этот вопрос может быть решен для тубулярных желез. У всех трех изученных нами видов хейлетид трубчатые железы по строению едины и гомологичны, по всей видимости, кокс альным железам (Беклемишев, 1964; Гиляров, '1970). Сложнее обстоит вопрос с альвеолярными железами. По локализации и строению альвеолярные железы, образованные пятью секреторными клетками, медиальная железа у Ch. eruditus, медиовентральная у В. chanayi n дорсальная у Ornitho- cheyletia sp. весьма сходны. По этим признакам опи похожи на перед- ние железы Т. urticae (Alberti, Storch, 1974; iMothes, Seitz, 1981Ь) и на ростральные, гипостомальные медиовентральные и латеродорсальные хселезы клеща А. baccarum (Горголь, 1984). Достаточно ли вески морфо- логические признаки для гомологии указанных желез, сказать пока затруднительно, так как в функциональном отношении они весьма сильно отличаются друг от друга. Так, у Ch. eruditus и частично у А. baccarum они слюнные, а у Ornithocheyletia sp. паутинные. С другой стороны, у В. chanayi и Т. urticae существуют специальные (дву- и одноклеточ- ные) паутинные железы. Еще больше усложняется вопрос при анализе желез клеща А. baccarum, у которого, судя по нашим данным, в течение онтогенеза может происходить смена функций латеродорсальных желез. Поэтому, до проведения дальнейших исследовани~т, вопрос о гомоло- гии отдельных желез клещей-хейлетид и других тромбидиформных кле- щей не может быть решен окончательно. МоНсНо лишь указать, что у паразитических хейлетид чрезвычайно мощное развитие получили пау- тинные железы. Анализ показывает, что, по-видимому, функция шелко- выделения может возникнуть в различных типах желез. Наконец, следует также учитывать, что проподосомальпые железы, и прежде всего трубча- тые, относятся к системе органов выделения. Трубчатые железы, как коксальные органы — наиболее древние органы выделения членистоногих. Поэтому их взаимодействие с выделительной функцией ипщеварительной системы и ее специализированного отдела — экскреторного органа— несомненно. При этом трубчатые железы специализируются на осмо- регуляции и реабсорбции воды. На значение трубчатых желез как органов выделительпой системы косвенно указывает разобщенность их выводных протоков от подоцефалического канала, объединяющего протоки всех проподосомальных желез у тетранихид ( Iills, '1973). Менее существенна. в этом отношении роль альвеолярных желез, хотя и они могут служить местом, где в процессе метаболизма откладываются кристаллы гуапина. РЕСПИРАТОРНАЯ СИСТЕМА Подобно другим клещам когорты Prostigmata, хейлетиды (Fiughes, 1959; Summers, ЪУЖ; 1982; Hall as, 1982) обладают респираторной системой трахейного типа, которая начинаетс» перитремами и стигмами на гнато- соме. Преимущества трахейной респираторной системы, обеспечивающей
в условиях наземного образа хсизни членистоногих газообмен непосред- ственно в тканях и клетках, достаточно подробно обсуждены в известной работе М. С. Гилярова (1970). Как и у других членистоногих (Заварзин, 1985), респираторная система хейлетид эктодермальна по происхождению. р нию. Она парная, состоит из двух взаимоподчиненных, симметрично расположенных, однако весьма различных по строению, функции и топографии участков — наружного и внутреннего. К наружному отно- сятся перитремы, к внутрен- нему — внутренние дыхательные отверстия — стигмы и система трахей различного ранга (от тра- хейных стволов до трахеол). gn Перитремы хейлетид в целом сходны с перитремами большин- spe ства изученных в этом отношении тромбидиформных клещей (Blau- Ъ velt, 1945; Hughes, 1959; Беккер, 1935; Alberti, Crooker, 1985; Бе- М,»у» кер, Уартон, 1955) и представля- ют собой пару довольпо IIpocTbIx, узких (ширина 3,4 мкм), незамк- нутых склеротизованных желоб- ков. Они начинаются латеродор- сально у основания кокс педи- пальп и сходятся на внешней по- верхности гнатосомы в центре сти- лофора (р»ис. 47, 48). У всех»»с- й 1~ следованных нами и другими авторами хейлетид (Волгин, 1959; Summers, Witt, 1971; IIallas, 1982) перитремы членистые (сегменти- р в нные). Количество сегментов рис. 47. Схема строен я» атоса;,»аль- в пе итремах, как и форма пери- ного отдела респираторно»» спстемь» в перит тремального комплекса, видоспе- ~~~~л~т~д на р ° р п име е Cli. lepi(loplero- цифичны. Так, у у Ch. eruditus чис- ™ш: atr — атриальный отдел, 1tr — локализован- ло ceI'MBHTQB IQJIeGJIBTcH oT 11 д 12, у В. chanayi, Ornithocheyletia»с1»»'ч~стс<, ~ — ст~~»м~~, » — тржс1~ны11 яр. Ch. lepidopterorum 5 — 6 пар. У Ch. eruditus перитремальный комплексе М-образный, у В. сна и а~ ~, Ornithocheyletia sp. и Ch. lepidopterorum — дугообразнь»»». и с непо вижностыо Перитремы хейлетид открытого типа. В связи с д стилофора и отсутствием у хейлетид хелицеральной воропкп, в которую с»илофор мог бы втягиваться (Акимов, Горголь, '1984), их перитремь» не прикрыты дорсально складкой, как это характерно, например, для тетра- нихид (Blauvelt, 1945; Alberti, Crooker, 1985). Кроме того, на поверх- б рем у всех изученных нами представителей семейства, %о как зто наблюдалось и у Cheyletus cacahuamilpensis (Summers, 1971), поверхностная кутпкулярная мембрана не об»»ару»»сена. тсут- и клещей Ch. er uditus, хотя Т. Е. Хьюз (Hughes, '1958 описал ее. Учитывая данные, полученные нами с помощью РЭМ, следует отметить, что Т. Е. Хьюз вероятно, за внешнюю мембрану принял интегумент внутренней поверхности желоба иеритрем (рис. ) . .о '73
нашим наблюдениям, такая выстилка весьма рельефна и практически однотипна как у паразитических, так и у хищных видов хейлетид. Однако у Ch. eruditus она, соответственно членению перитрем на сегменты, пре- рывиста и представляет собой ступенчатую гребневидную пленку с чере- дующимися параллельно большей оси члеников утолщенными валиками (рис. 48). У В. chanayi, Ornithocheyletia sp., Ch. Iepidopterorum выстилка характеризуется продольными, непрерывными вдоль всей линии перитрем кутикулярными гребнями (см. рис. 48). Противополо'кные боковые края желобов перитрем у всех изученных хейлетид тесно сомкнуты и соедине- ны короткими поперечными перемычками (рис. 48). Внутренние стигмальные отверстия респираторной системы хейлетид расположены параксиально между базальными члениками хелицер в основании сближенных медиально проксимальных члеников перитрем (см. рис. 47). Они представляют собой узкие (0,8 мкм), окрухсенные кутикулярными кольцами вертикально расположенные полулу нные (высота 5,1 мкм) щели. Открываются стигмы в дорсолатеральные участ- ки гнатосомального комплекса трахейной системы. Структур, регулирую- щих просвет стигмальных отверстий хейлетид, не обпаружено (Горголь, Ястребцов, 1986). Не были выявлены нами, как и другими исследова- телями (Summers, Witt, 1971), и четко дифференцированные, стационар- ные внешние отверстия дыхательной системы, которые, по мнению Т. Е. Хьюза (EIughes, 1958), у Ch. eruditus находятся в последних чле- никах перитрем. Учитывая члепистость перитрем, а также их открытое расположение, воздухообмен трахейной системы хейлетид может, на наш взгляд, осуществляться вдоль всей длины желобов перитрем, как это предполагается и у других клещей-простигмат с аналогичным строе- нием наружных отделов дыхательной системы (Blauvelt, 1945; Бекер, Уартон, 1955) . Собственно трахейная система у хейлетид начинается внутри гна- тосомы дорсолатеральными стволами, соответствующими Go строению атриальным отделам респираторной спстемы членистоногих (Тыщенко, 1986; Гиляров, 1970) (рис. 49). Эти дорсолатеральные (атриальные) стволы представляют собой пару изолированных друг от друга, коротких (около 25 — 30 мкм), мешковидных (диаметр мо>кет колеоаться от 2,1 до 4,2 мкм) кутикулярных трубок. Начинаясь от стигмальпых отверстий внутри стилофора, они сразу расходятся в upoTHBorroJIo)IcHbIe стороны, изгибаясь сначала за линию перитремальпого желоба, а затем — вентро- каудально (в обратном направлении). Яостигнув внутри гнатосомы передней трети рострума, они резко сужаются и, делая зигзагообразный изгиб, латерально (этот участок значительно отличается от предыдущего и может быть интерпретирован как переходный) раздваиваются на нерав- ноценные по величине ветви гнатососомально&о и идиосомального направ- ления. Основания дорсолатеральных (атриальпых) стволов хейлетид поддер)киваются в гнатосоме стилостомом, проксимальные участки укреп- ляются пластинообразными латеральными аподемами, отходящими o T .гребня эпистома, так называемой горизонтальной септой (Summers, Witt, 1971) . Дорсолатеральные (атриальные) стволы в отличие от других участ- .ков собственно трахейной системы не имеют тенидиальной выстилки (рис. 50). Она появляется только в су кевных (переходных) участках и распространяется на все последующие, включая трахеи и, как было доказано на уровне трансмиссионной микроскопии у насекомых — тра- хеолы (Тыщенко, 1986) . ;74
Трахея гнатосомального направления представляет собой y3KyIo (1,2 мкм), петлевидно изогнутую и по своему строению локализованную, т. е. неветвящуюся (Гиляров, 1970) трубку. Отходя от переходного участ- ка атриального ствола латерально, она направлена вентрально (рис. 47). Достигнув средины рострума, она резко изгибается на уровне базальных члеников хелицер и идет в обратном направлении, разветвляясь на две одинаковые нисходящие трахеи (рис. 47, 49). У основания гнатосомы последние уменьшаются вдвое в диаметре и переходят в трахейный учас- ток идиосомального направления. Локализованная трахея (рис. 47, 49) и ее дериваты лежат в гнатосоме в одной плоскости латеровентрально и параллельно друг другу. Они имеют типичное для трахей членистоно- гих строение с иорфологически хорошо вырахсенной тенидиальной кути- кулярной выстилкой. Идиосомальный трахейный ствол (рис. 49) — наиболее мощная часть трахейной системы. Простираясь от переходного участка до основа- ния кокс III пары ног, он на всем протяжении имеет постоянный диаметр (2,5 мкм — 3 мкм) н четко выраженную тенидиальную нить со спираль- ным расположением трабекул. Передний отрезок этого ствола (длина 51 мкм) лежит в гпатосоме. По сравнению с атриальным он смещен медиальнее и не имеет вторичных ответвлений трахей. Этот отрезок про- ходит над пластинообразпыми латеральными аподемами эпистома дор- сальнее расположенной там же гнатосомальной трахеи. При переходе из гнатосомы в идиосому трахейные стволы петлевидно изгибаются, обра- зуя латеральные выступы, затем выравниваются и, на уровне внутренних краев кокс ходильных конечностей, располагаются в идиосоме вентраль- но. При выходе из гнатосомы трахейный ствол сразу же дает многочис- ленные ответвления трахей, а также и трахеол по всей своей длине, что позволяет классифицировать его как расходящийся (ветвистый) трахей- ный ствол (Гиляров, 1970). Вторичныо ответвления (трахеи и трахеолы), не образуя анастомозов между собой, располагаются между внутренними органами, заходят внутрь их, а также в конечности (рис. 50). Трахейпые стволы заканчиваются па уровне I I I кокс, расчленяясь на трахеи, обеспе- чивающие газообмен в опистосомальном отделе хейлетид. Наиболее густая сеть трахей наблюдается в вантролатеральных частях идиосомьт и центральной части гистеросоиы. В целом респираторная система хейлетид по морфологическим при- знакам и топографии соответствует аналогичной системе органов других тромбидиформных клещей, наиболее изученными из которых в этом отно- шении являются представители сем. Tetranychidae. Несмотря на это, имеется ряд принципиальных различи~т, связанных со взаимным располо- жением отдельных участков внутренне~~, гнатосомальной части респира- торного комплекса. Это вызвано в свою очередь различиями морфологии ротового аппарата тетранихид и хейлетид (Акимов, Горголь, 1984). По-видимому, для хейлетид, как и для большинства членистоногих животных, в том числе и клещей (Гиляров, 1970; Тыщенко, 1986), обладающих респираторной системой трахейного тина, характерен диф- фузный тип газообмена, доказанный в начале 20-х годов А. Крогом (Kroght, 1920) . Согласно ему, транспорт кислорода и углекислоты по трахейпой системе осуществляется благодаря газовой диффузии, двих'у- щей силой которой служит разность парциальных давлений газа в атмосфере и в концевых разветвлениях трахей. Парциальное давление кислорода выше в атмосфере и нихсе в тканях, испытывающих потреб- ность в этом газе. В результате возникают воздушные потоки, направлен-
ные внутрь тела (Тыщенко, 1986) . Бесперебойность диффузного типа газообмена у хейлетид, обладающих развитой трахейной системои, в зпа- чительной степени поддерживается за счет округлой формы трахей, обес- печивающей максимальное сопротивление с~катию. Другим, более совер- шенным приспособлением является укрепление внутренних стенок трахей и трахейных стволов тенидиальпой интимой. Она повышает упругость трахейных трубок, а также способствует увеличению сопротивления на сжатие трахейной трубки (Гиляров, 1970). У хейлетид отсутствуют активные дыхательные движения, равно как и отсутствуют специальные механизмы, которые их обеспечивают (Горголь, Ястребцов, 1986) . Однако строение гнатосомального отдела респираторной системы хейлетид (рис. 47, 49), указывает на то, что газовую диффузию в их трахейной системе может усиливать и допол- нять трахейная вентиляция — обмен воздуха в трахеях за счет неспе- циализированных дыхательных движений. Как указывалось выше, атри- альные стволы, отходящие от проксимальных члеников перитрем, не имеют тенидиальной выстилки и могут изменять свой объем и конфигу- рацию. Так как значительную роль в движениях хейлетид, как и у дру- гих паукообразных (Manton, 1958), играет гидравлическое давление в идиосоме, создаваемое сокращением дорсовентральных мышц, то всякое изменение этого давления, неизбежное при активном передвижении кле- щей, вызывает и активное выталкивание и засасывание воздуха в трахей- ную систему. О механизмах регуляции дыхания у хейлетид известно мало. Наблю- дения за хейлетидами при содержании их в различных условиях гидро- термического режима и различной плотности лабораторных микропопуля- ций, свидетельствуют о том, что при снижении содержания кислорода клещи активно мигрируют к источнику атмосферного воздуха. У хищных клещей Ch. eruditus у внешних латеральных краев последних члеников перитрем, а у Ch. lepidopterorum — на дорсальных поверхностях трохан- тера педипальп обнаружены не описанные ранее у представителей этого семейства погруженные ампуловидные сенсиллы (см. рис. 12). Распола- гаясь в непосредственной близости от наружных участков дыхательной системы — перитрем, они, вероятно, служат органами чувств, возможно, индикаторами гигроусловий. При обсуждении респираторной системы нельзя обойти вниманием наружную часть — перитремы, которые у клещей в целом часто хорошо развиты и их используют как один из важнейших таксономических при- знаков. Функциональное значение перитрем как у хейлетид, так и у других клещей окончательно не установлено. Существуют лишь различ- ного рода предположения (Акимов и др., 1988), основанные на особен- ностях строения этих участков дыхательной системы. Для перитрем хей- летид, на наш взгляд, наиболее вероятной представляется функция обеспечения наименьшей потери влаги при дыхании за счет ее улавлива- ния в лабиринтах кутикулярной выстилки перитрем. Кроме того, пери- тремы хейлетид, благодаря погруженности в покровы и желобообразно- му строению, при котором боковые края скреплены перемычками, а иногда и погружены под интегумент (рис. 48), имеют минимальный контакт с окружающей средой, предотвращая тем самым потерю влаги. С другой стороны, если основываться на диффузном принципе функ- ционирования трахейной системы хейлетид, то при таком механизме газообмена потеря воды с дыхательных поверхностей этих клещей будет минимальной, поскольку в трахейных стволах устанавливается градиент 76
концентрации водяного пара (Гиляров, 1970). Роль перитрем при этом может бь~ть лишь дополнительной. Но в этом случае первостепенное значение при прэхохсдении воздуха во внутренние отделы респираторной системы хейлетид может иметь фильтрационная функция перитрем. Ведь эти клещи в большинстве случаев — обитатели ниш с мелкодисперс- ными пылеобразными веществами (субстратами) . РЕПРОДУКТИВНАЯ СИСТЕМА Морфология и оогеиез Существующие в литературе сведения о репродуктивной системе клещей- хейлетид очень кратки и касаются в основном общей морфологии ее органов (Hughes, '1959) и некоторых особенностей строения яичника (Iiafiz, 1935) . Мы исследовали репродуктивную систему самок двух видов хищных (Ch. eruditus, Ch. lepidopterorum), а также паразитических хейлетид В. chanayi и Ornithocheyletia sp. У всех этих клещей репродуктивная система самок однотипна. Она непарна, состоит из яичника, яйцевода и вагины, открывающейся на вентральной стороне тела клещей гениталь- ной щелью (рис. 51). В состав репродуктивной системы некоторых тром- бидиформных клещей (Blauvelt, 1945; Hughes, 1959; Alberti, Crooker, 1985) входит также семяприемник, однако нами ни у одного изучавше- гося вида он не был обнарухсен. Органы репродуктивной системы самок хейлетид локализуются в вепгральной части идиосомы, занимают пространство между синганглием и анальной областью опистосомы. Придаточные половые железы, столь разнообразные у некоторых других клещей (Hughes, 1959), у хейлетид отсутствуют. Объем тела, занимаемый органами репродуктивной системы, у самок хейлетид второй после объема, занимаемого пищеварительной системой, и зависит от количества развивающихся ооцитов. В преовуля- ционный период последних он максимальный (рис. 52). Наиболее крупным отделом является яичник. Он представляет собой мешковидны~~, располохсе нный непосредственно за синганглием, орган. Латерально окружен дивертикулами кишечника, дорсально — экскретор- ным органом, вентрально — степкой тела (рис. 52). Снаружи яичник покрыт тонкой фибриллярной мембраной (tunica propria), под которой располагается клеточпая стенка, определяемая по веретеновидным «драм последней. У Ch. eruditus их размеры составляют 0,8 Х '1,7, у В. cha- nayi — 0,6 Х 1,2 мкм. По степени продвинутости оогенеза яичник у всех изученных нами хейлетид может быть подразделен на три зоны: переднюю (гермарий), среднюю (роста) и заднюю (вителлярий) (рис. 51). Однако это деление не является абсолютным, поскольку на конечных этапах созревания, а также в период роста ооциты могут занимать произвольное положение в этом отделе репродуктивной системы, располагаясь даже н его герми- нативной зоне. Гермарий (рис. 52) представляет собой подковообразную, вершин- ную часть яичника, которая по сравнению с его другими зонами зани- мает наименьший объем (у Ch. eruditus — 25X60, у В. chanayi — 25X48, у Ornithocheyletia sp.— 8,5 Х 17 мкм). В гермарии происходит размноже- ние первичных зародышевых клеток и их последующая дифференцировка на соматические и герминативные (Alberti, Crooker, 1985). Первые 77
из них многочисленны, включены в стенку гермария, и локализуются среди герминативных элементов и растущих ооцитов в зоне роста яичника. Их форма разнообразна — от круглой до полигональной, размеры варьи- руют от 3 до 5 мкм. Клетки с крупными ядрами, часто неправильной формы, нуклеолемма образует нерегулярные выступы. Несомненно, что соматические клетки гермария хейлетид, представляют собой так назы- ваемые питающие клетки — распространенный элемент эпителия репро- дуктивных систем органов членистоногих в целом (Заварзин, 1986; Рис. 51. Скема строения репродуктивной системы паразитического хей- летидного клеща В. chanayi: ,. ет — гермарий, od~ — передний участок яйцевода, od~ — задний участок яйце- вода, og — оогопии, оо,— оо, ооциты ila различных стадиях развития, ою- ничник, tp — оболочка яичшпса, юа — вагина, иг — вителлярий, у — желток, zi— зона роста, ~с — питающие клетки Тыщенко, 1986), описанные у преимущественного большинства изучен- ных в этом отношепии тромбидиформных клещей (ЪЧеуйа, 1980; Mothes, Seitz, 1981; Alberti, Crooker, 1985) . Предполагают, что соматические (питающие) клетки имеют общее происхождение в герминативными и являются абортированным вариантом последних (Равен, 1964; Langen- scheidt, 1973; Петрова, Петров, 1977; Weyda, 1980). Герминативные клетки, так же как и соматические, располагаются в яичнике хейлетид произвольно, однако значительно крупнее последних (у Ch. eruditus и Ch. lepidopterorum от 6 до 8 мкм) и преобладают над ними в количественном отношении. Они круглые, имеют плотную базо- фильную цитоплазму и большие, богатые ДНК ядра. Размнохсаясь мито- тически (Петрова, Петров, 1977; Alberti, Crooker, 1985) оогонии впослед- ствии превращаются в ооциты и постепенно продвигаются в следующую зону гермария — зону роста. Зона роста по размерам в несколько раз превосходит гермарий и окру>кает его латеровентрально. Она содержит небольшое количество описанных выше соматических клеток, которые здесь претерпевают деге- неративные изменения (Mothes, Seitz, 1981), и ооциты, проходящие I и I I фазы периода цитоплазматического роста. Растущие в зоне роста ооциты, как и предшествующие им оогонии, преимущественно круглой формы. Наиболее молодые из них, находящиеся в I фазе роста, у хищных клещей Ch. eruditus и Ch. Iepidopterorum имеют диаметр 7,5 — 22,5 мкм, у В. chanayi — 12 — 22 мкм и располагаются в непосредственной близости с оогониями (рис. 52). Молодые ооциты характеризуются высокими ядер- 78
но-плазменными отношениями, при которых соотношение размеров ядер и клеток составляет 1: 2. Цитоплазма таких ооцитов гомогенная, плот- ная, интенсивно окрашивается различными типами гематоксилинов п плотно окружает ядра. Литературные данные свидетельствуют, что в аналогичных ооцитах других тромбидиформных клещей (Петрова, Пет- ров, 1977) такая цитоплазма слабо базофильна и бедна РНК, в ней установлено наличие ocHQBHbIx и кислых белков, а также кислых муко- полис ахаридов. Более зрелые ооциты (II фаза цитоплазматического роста) крупнее, их размеры у Ch. eruditus и Ch. lepidopterorum составляют 20 — 40 мкм, у B. chanayi — 16 — 22 мкм в диаметре. В зоне роста яичника хейлетид они занимают пограничное положение, окружая или располагаясь над молодыми, пребывающими в I фазе ооцитами. Для них также характерен высокий ядерно-плазменный коэффициент, однако соотношение размеров ооцита и ядра иное — 1: 4. Количество ДНК в их ядрах ооцитов значи- тельно убывает, но одновременно увеличивается количество РНК в цито- плазме. Кроме того, оболочки ооцитов на II фазе роста приобретают неровные (пористые) очертания, что, вероятно, является следствием интенсификации процессов перфорирования их ядерных оболочек, как это описано для клещей-тетранихид (Mothes, Seitz, 1981; Alberti, Crooker, 1985) и иксодид (Балашов, 1979) . Нуклеоплазма в этот период развития ооцитов изобилует вакуолями различного диаметра и плотности. Вокруг ядер наблюдаются свободные от каких-либо клеточных элементов округлые зоны — околоядерные кольца, ширина которых колеблется от 0,5 мкм до величины диаметра самих ядер (рис. 52). Считают, что появление таких околоядерных колец является результатом интенсивных синтетических процессов и структур- ного обмена мехсду компонентами цитоплазмы и ядра. Сама цитоплазма ооцитов, находящихся во II фазе цитоплазматического роста, менее плот- ная, чем цитоплазма наиболее ранних (I фаза) ооцитов, однако более вакуолизирована, в ней появляются отдельные гранулярные отложения. Она хорошо прокрашивается различными гистологическими красителями и содержит, как уже упоминалось, много РНК. Растущие молодые ооциты на 1 и II фазах роста окружены оболоч- кой яичника. Кроме того, с последней они связаны так называемыми «нутриментарными», или «питающими», ножками (рис. 53), представ- ляющими собой клеточные тяжи, тянущиеся от ооцита в соматическую строму герминативной зоны этого отдела репродуктивной системы хейле- тид. Такие образования обнаружены у целого ряда тромбидиформных клещей (Langensheidt, 1973; Mothes, Seitz, 1981; Коорег, Pinacker, 1982) и выполняют, по всей видимости, трофическую функцхпо. Несмотря на общую для всех изученных нами хейлетид картину, наблюдаемую в зоне роста яичника, количество ооцитов, одновременно пребывающих в периоде цитоплазматического роста, у различных пред- ставителей семейства неодинаково. У хищного клеща Ch. eruditus ux около 30, у геиатофага В. chanayi до 9, а у лимфофага Ornithocheyletia ~р.— до 5. Вителлярий — наиболее обширная, расположенная под зоной роста область яичника хейлетид. В ней отсутствуют имеющиеся в предыдущих отделах этой части репродуктивной системы соматические клетки и содер- жатся только ооциты, прошедшие стадию цитоплазматического роста и вступившие в телотрофический рост (вителлогенез). Развивающиеся в вителлярии ооциты имеют преимущественно овальную форму и довольно
крупные размеры (у Ch. eruditus 96Х102 мкм, у В. chanayi — 128)< ><192 мкм, у Ornithocheyletia sp. 42Х76 мкм), прп этом, однако, умень- шается прежде высокий, наблюдаемый у ооцитов на I и II стадиях цито- плазматического роста, ядерно-плазменный коэффициент, поскольку диаметр ядра у Ch. eruditus в этот период составляет всего 25, а у В. cha- nayi — 22 мкм (рис. 53). Кроме того, такие ооциты теряют «нутриментар- ную» ножку, связывающую их со стенкой яичника. Наиболее характерпой особенностью развивающихся в вителлярии ооцитов является пакопление в них желтка — дейтоплазмы (Равен, 1964) . Желток представляет собой запас питательных веществ, накапливаю- щихся в ооцитах для развития будущего эмориона. Он формируется в виде шаровидных, различных в диаметре (от 3 до 9 мкм) глобул. Судя по сравнительно большему количеству, а так".ке более круппым размерам глобул, местом наиболее активного накопления и отложения желтка .является поверхностная зона ооцитов. Особенно четко это заметпо на первых этапах вителлогенеза (рис. 53). На завершающих этапах вели- чина желточных глобул в периферийной и центральной зонах выравни- вается. Желток яиц хейлетид, в отличие от цитоплазмы растущих ооци- тов, характеризуется интенсивной эозинофилией, при этом большую часть накопленных в нем веществ составляют белковые соединения. Значительно меньше в желтке содержится липидных включении, а также гликогена. В вителлогенетических ооцитах собственно цитоплазматиче- ских структур мало, наибольшая их коицентраци» наолюдается ь цепт- ральной (околоядерной) зоне, значителы~о меньше их между глооулами желтка в виде базофильной диффузной сетки. Ядра ооцитов в период вителлогенеза весьма компактны, имеют плотную оболочку, небольшое количество нуклеоплазмы и четкое, гомогенное ядрышко (рис. 53). Кроме описанных выше компонентов, в вителлогенетических ооцитах хейлетид появляются гранулы различного рода веществ, сопоставимые с балластными. У гематофага В. chanayi это гематин, у Ch. eruditus и Ch. lepidopterorum, вероятно, хромолипнды (Жг1д)й, Хече11 1964) (рис. 53). На начальных этапах вителлогенеза и почти до его завершения оболочка ооцитов рыхлая, вероятно, пористая, как у клещей-тетранихид (Alberti, Crooker, 1985). Затем она становится гомогенной, слоистой и более плотно~~, обладает слабым лучепреломлением в поляризованном свете. Образование такой оболочки завершает созревание ооцитов, и они после этого готовы к откладке. Следует отметить, что под такой оболоч- кой, которая является, вероятно, хорионом, дифференцируется рыхлая цитоплазматическая субкортикальная зона. На животных, принадлежа- щих к различным систематическим группам, было показано, что эта зона служит носителем полярности и дорсовентральной ориентации яйца и зародыша. Она несет кортикальное поле, организованное в вертикальном и поперечном направлениях, и как бы создает в яйце некоторую систему координат, по отношению к которой ориентированы все процессы разви- тия (Равен, 1964) . Эта зона, по-видимому, послужила поводом для утверждения (Hofiz, 1935), что ухсе в организме самок хищных клещей Ch. eruditus начинает- ся дробление яиц, т. е. собственно эмбриогенез. Нами процесс внутри- утробного эмбриогенеза у всех изученнык хейлетид не зарегистрирован. В вителлярии, так же как и в зоне роста яич ника, количество ооцитов у различных видов хейлетид неодинаково. У хищных клещей СЬ. eruditus оно равно количеству ооцитов 11 фазы цитоплазматического роста. У паразитических В. chanayi и Ornithocheyletia sp. в период вител- .80
логенеза вступает, как правило, только 1 яйцо, чрезвычайно редко 2 (в неодинаковом состоянии физиологической готовности). Яицевод — вторая по величине после яичника часть репродуктивной системы самок (рис. 51, 54, 55), соединяющая медиовентральную часть последнего с вагиной. Он трубчатого строения (Петрова, Петров, 1977), подразделяется на две части — переднюю, расположенную ближе к яич- нику, изаднюю, , соединяющую его с вагиной. Соединение яйцевода с яичником у хейлетид сквозное, простое, с вагиной — сфинкторное. Перед- няя часть яйцевода представляет собой короткую узкую трубку (p«. 54), по своему строению соответствующую вставочному отделу яйцепроводя- щей системы клещей-фитоптипальпид — Brevipalpus obovatus (Pijnacker, Perwerda, Не11е, 1981) или же нежелезистой части яйцевода клещей- тетраннхид (Петрова, Петров, 1977; Mothes, Seitz, 1981; Alberti, Crooker, 1985). Клетки стенок этого отрезка яйцевода (рис. 54, 55) небольшие, пирамидальные, имеют мелкогранулярную, слегка базофильную и нере- гулярно вакуолизированную цитоплазму, ядра продолговатые, интенсивно окрашивающиеся. Ширина базальной части таких клеток у Ch. eruditus 1,7, у В. cha~iayi — 2,2 мкм, они не обладают гистологически вырахсенной секреторной активностью. Несмотря на то что этот отдел репродуктивной системы предназначен для транспорта ооцитов, последние в его просвете не наблюдались. Задпя» часть яйцевода хеилетид в несколько раз превосходит по размерам переднюю. Она представляет собой многократно извитую меш- ковидную трубку, смещенную в левую латеральную часть опистосомы, и соединяет вставочный отдел яйцевода с вагиной (рис. 54). Латерально задняя часть яйцевода всех исследованных видов окружена дивертикула- ми кишечника, а дорсально — стенкой экскреторного органа. Длипа ее у Ch. eruditus достигает 120 мкм при ширине от 20 до 30 мкм, а у В. chanayi — 90 мкм при ширине 30 мкм. Стенка этой части яйцевода у хейлетид имеет хорошо дифферепци- руемую па уровне световой микроскопии базальную мембрану и довольно плотный по сравнению со стенкой средней кишки наружный слой мышеч- ных клеток, изнутри выстлана однослойным многорядным железисть~м эпителием. Клетки многочисленны, цилиндрической формы, значительно деформируются из-за тесного расположения и значительно крупнее кле- ток вставочного отдела яйцевода. Их высота достигает 7 — 8, ширина— 4 мкм. Цитоплазма клеток умеренно базофильна и, скорее всего, гетеро- фильна, вакуолизирована, содержит мукополисахариды и большое коли- чество мелких, шаровидных секреторных гранул (рис. 54). Наибольшее количество секрета наблюдается в апикальных частях клеток, которые отличаются рыхлой структурой и глубокими инвагинациями цитоплазма- тическоЙ мембраны. ТIросвет задпей части яйцевода, так же как и передней, свободен на гистологических срезах от яиц. Чаще всего он заполнен тяжами слизи. мукополисахариды которой секретируются его эпителием. Кроме того, периодически в процессе оогенеза просвет задней части яйцевода иссле- дованных нами клещей-хейлетид заполняется многокомпонентной массой, в которой превалируют балластные вещества (рис. 55). У гематофага В. chanayi это гематин, скрепленный мукополисахаридами, у Ch. eruditus, вероятно, хромолипиды. В состав этой массы в незначительном количе- стве входит также и гуанин. Поскольку в работах по изучению репро- дуктивной системы других тромбидиформных клещей этот факт отмечен не был, возможно предположить, что клетки задней части яйцевода
пример у Ch. eruditus) при формировании групповой яйцекладки (Hafiz, 1935) элементом, но также и предохраняет яйца от высыхания в усло- виях наземного образа жизни этих клещей (Гиляров, 1970). Яйца всех изученных нами хейлетид содержат большое количество желтка, равномерно распределенного по цитоплазме, и относятся к типу изолецитальных или центролецитальных яиц (Равен, 1964) . Оболочка их без морфологически выраженных микроскульптурных особенностей, гладкая. Форма яиц у хищных и у паразитических хейлетид овальная. Учитывая морфофункциональные особенности органов репродуктив- ной системы хейлетид, можно заключить, что развитие ооцитов у этих клещей проходит по алиментарному типу, нутриментарному подтипу (Равен, 1964; Айзенштадт, 1984) при участии соматических клеток яич- ника и «нутриментарных» ножек. При вителлогенезе (телотрофическом росте) исходный материал для образования желтка ооциты хейлетид, несомненно, получают от кишеч- ника, который у тромбидиформных клещей выполняет функцию распре- делительной системы (Hughes, 1959) . ЭМБРИОНАЛЬНОЕ РАЗВИТИЕ ХЕЙЛЕТИД Изучение эмбрионального развития клещей связано с большими техни- ческими трудностями, в связи с чем сведения по этому вопросу немного- численны и, как правило, носят фрагментарный характер (Иванова-Казас, 1979) . Однако хейлетиды в этом отношении представляют исключение, поскольку еще в 1935 г. (Hafiz, 1935) были проведены скрупулезные исследования и дано описание эмбриогенеза одного из представителей этого семейства — хищного клеща Ch. erudilus. К сожалепию, указанная работа была малодоступной отечественным специалистам, в связи с чем сведения, изложенные в ней, мало повлияли на изучение хейлетид в СССР. Однако и до нашего времени она не потеряла актуальности, хотя некоторые выводы, сделанные ее автором, требуют критического анализа. Настоящий раздел был подготовлен на основе литературны~ данных, прежде всего работы Х. А. Хафиза (Hafiz, 1935) и краткой»уо:шкации А. Р. Эдвардса (Edvards, 1958) по эмбриональному развитию Ch. eruditus, а также современных работ по общей эмбриологии (Иванова-lia;sac, 1979; Токин, 1987), которые позволили более корректно интерпрет»ровать ре- зультаты предшествующих исследований. Как уже указывалось, яйца Ch. eruditus слабооваль»ь» (0,1X Х0,15 мм). Поверхность их хорпона гладкая, свободна от как»х-либо скульптуровок и лишена микропиллярных зон. Яйца непрозрачные и при откладке прикрепляются к субстрату с помощью тонкими нтттей клейкого вещества, выделяемого яйцеводами самок (Hafiz, 1935). Оп»»мен>т ти- пичное центролецитальное строение (Иванова-Казас, 1979; Ток»», 1987) с концентрическим расположением своих ocHQBHbIx компоненто». В центре яйца лежит ядро, окруженное скоплением цептроплазмы, далее следует желток, а на поверхности располагается слой ретикулоплазмы. Развитие яиц Ch. егцйЫя происходит без оплодотворения, поскольку для этого вида, как и для большипства представителей семейств», харак- терен партеногенез (Найк, 1935; Волгин, l959). По данных Х. А. Хафиза (Hafiz, 1935), наиболее рапппе стадии развития яиц Ch. eruditus проис- ходят в яичнике яйцекладущей самки и поэтому яйца откладываются во внешнюю среду на стадии бластодермы.
Весь процесс эмбрионального развития Ch. eruditus осуществляется в течение 92 — 96 ч и делится на 13 этапов, отражахощххх наиболее суще- ственные у членистоногих животных три основных его периода: дробле- ние, гаструляцию и органогенез (Иванова-Казас, 1979) . Последовательность этапов эмбрионального развития по Х. A. Х~- физу (IIafiz, 1935) следующая (ч): 1 — 4 10 — 14 Образование бластодермы Ооразование средней пластинки и латеральнык пласти-нок Пролиферация оптодермальных клеток н обрастание средней пластипки Образование мезодермы и эктодермы, внешние измене-ния Развитие придатков и ипвагинация стомодеума Дифференциация ххервнык х;леток Завершение формирования нервной системы и установле-ние связи стомодеума со средней кишкой, алимептарная система Начало развития дорсального экскреторного органа Период задер>кки в развитии эмбриопа и завершение формирования дорсального ох'сх реторного органа Начало формирования генитальххых органов и появление «кровянык» клеток Появление тракейной системы Появление клеток (<cJIIQIIIIblx» желез Финальная стадия: появление 6-ногой личинки 20 — 26 28 — 32 36 — 40 40 — 42 42 — 43 43 — 44 44 — 62 62 — 66 58 — 72 80 — 90 92 — 96 Дробление у Ch. eruditus начинается как полное (Edwards, 1958), но очень рано, как и у иекоторьхх других клещей (Иванова-Казас, 1979), переходит к поверхностххому. По данныи Х. А. Хафиза (Ilafiz, 1935), оно длится около ~ ч, проходит в ТрН, характерные для центролецитальных яиц (Токихх, 1987) фазы и завершается образованием бластодермы, бла- годаря чему превращается в первую эмбриональную стадию развития будущего организма — оластулу (рис. 56), а в данном случае — пери- бластулу. Судя по даххххьхи Х. А. Хафиза (Hafiz, 1935), в формировании бластодермы участвуют все энергиды дробления, а специализированные первичные вителлофаги отсутствуют. После периода дроблония следует период образования основных заро- дышевых листков (гаструляция) и переход бластулы в следующую ста- дию развития — гаструлу. Как и у большинства изученных членистоно- гих (Иванова-Казас, 1979), у Ch. eruditus образование зародышевых листов (пластов) сосредоточено в ограпиченпой (вентро-латеральххохх) области бластодермы — зародышевой полоске. В работе Х. А. Хафиза (Hafiz, 1935) она описана как пара утолщехпхй, образованных в резулх тате срастаххия двух латера.хьххьхх и одной срединной (middle plate) пластинок. Процесс гаструляцххп у Ch. eruditus состоит из трех этапов (Hafiz, 1935). На первом этапе путем выселения (иммиграцин) из зародышевой полоски впутрь бластулы некоторых клеток образуется эптодерма. Им- мигрирухощие к.летки сначала выполняют роль вителлофагов, участвуя в резорбции желтка, а затем используются как пластический материал при формировапихх стенки кишечника. На втором этапе медиальная часть зародышевой полоски (middle plate) целым пластом погру>кается внутрь бластулы и дает начало мезодерме. На заверхххахощем этапе гаструляции Ch. eruditus за счет разрастания латеральххьх~ хх дорсального участков бластодермы образуется эктодерма (рххс. 56).
Ер Рис. 56. Этапы развития яйца Ch. eruditus после нача начала ямб иогенеза до образова- р ни» зародышевых слоев (по Hafiz, 1935): — ьш1х стенок и средней стенки эмбриона спуст я 26 ч после начала — о11 пластинки В — завершение обрастания срединной Г — олпос об азова пие за о ыип~ы~ — пс1с1 — энтодсрмальные клетки 1р — латеральные слоев; abc — дорсальна» чость бластулы, endcl — энтодсрма пластинки, mp — срединная пластинка, у — кслток 1Э После гаструляции наступает последнии период эморионального развития ~~1. eru I us — пери d't — од органогенеза. Как следует из описания (Hafiz, 1935), сначала из впячивапия зктодермы на переднем 1'опце заро- дышевои полоски воз и возникает стомодеум, а на вентральной дис с ерен и- ется группа эктодермальнык клеток, которая, перс-.двигаясь в пепеднкою часть зародыша, дает начало нервпоп системе,'ри . ый к тому в емени в за одышев евой полоске под и сзади стомодеума, которь ', у величивается в длину, возпикает пять па1 у щ -, р- 3 тол ений представляющих собой рудименты придатков головной части эмбриона — белицер, педи- алт пейшие этапы пальп и трек п р. р рок пар ларвачьпы| бродильных конечностей. Д..- органогенеза характеризуются у Cli. eiuditus ростом стомодеума и пере- ходом его в пип щевод который сначала пропизывает первную массу, а затем соединяется с ооширн Г рной желточной полостью»вибриона. Послед- няя постепенно приоо приобретает свойства средней hlILLIIcN и разделяется на три части — две передиик и одну задпюю (рис. 57).. атем становится заметной иейромерия нервпои массы, в IIe р у ° У й об аз ется пять пар лопастей
Og Cq 5 , ° ° ° съ~.'~%Фс'Л ! Q е~д ° ° ° st ~ ~°, ° ° ° ° ° ° ° ° ° ° ° ° ' м \ ° СС Г г dec r ° "\ ю ,ОС 1".. ( ...А:л:.' ~ .' 'е Ю Ф v "Ú~:~ " с ( ч--.. л.; 1 / с p&l ~ { '.". "'.ч-- / ° у 1 . / Ъ 1 а Рис 57 Эмбриогенез Ch eruditus от инвагинации стомодеума до образования массы нервных клеток: А — сагиттальный срез эмбриона со стомодеумом, Б — то же, на фронтальном срезе, В— сагиттальный срез переднеи ч ~ а'ти эмбриона с рудиментом нервного ганглия, Г — сагитталь- м Д — попе ечный ны срез эм ри Й б она с развивающимся дорсальным экскреторным органом, Д — п р — ские срез эмбриона на то11 же стадии через нервную массу и дивертикулы; сс — целомичес . ного о гана, dexg— мешки, ch — рудимент хелицер, dec — рудимент дорсального экскретор~ р зародышевой полоски, 11 — 1з — рудименты ходильных оконечностей, ~~р~~~~~~~ р~~~~ кение зар lng — область нервного ганглия, ng — нервныи ганглий, рс — рудим st — рудимент стомодеума, ped — рудименты педипальп (нервнык ганглиев), соответствуloujnx по расположению пяти парам DGHcBHHbIx BbIIJT('. придатков головной части эмбриона. Синхронно с нейромерией нервной массы происходит целомизация (расщеплепие па пять целомическик мешков) мезодермы, которая пред- ставляет собой не что иное, как свидетельство метамерной сегментации тела Ch. eruditus, существующей лишь в эмбриональный период (Hafiz, 1935) (рис. 57). После окончательного формирования пищеварительной системы обра- зуется дорсальный экскреторный орган, который у Ch. eruditus, согласно Х. А. Хафизу (Hafiz, 1935), гомологичен проктодеуму и закладывается в виде глубокого продольного желоба в эктодерме на дорсальной сторопе эмбриона. Спустя некоторое время противоположные боковые края этого желоба срастаются в трубку, слепо замыкая передний конец и оставляя щелевидное отверстие в заднем (рис. 59). Во время органогенеза экскре-
Рис. 58. Эмбриогенез QQ. eruditus в период развития гонад и «кровяных» клеенок: А — задняя часть эмбриона (при большем увеличении) с развивающимис» к.~ тками гонад; Б — В — поперсчпые срезы эмбриона при более позднем развитии гонад; а — амебоциты, ар- придатки,,"on — гонады, des — дорсальный экскреторныц канал, тез — мезодерма, у- желток торный Oprau с энтодермальным зачатком средней кишки не сообщается и остаатся в таком состоянии в гечение всей дальнейшей жизни клещей. К концу формирования экскреторного органа происходит некоторая задер'кка (до 18 ч) в развитии эмбриона, после которой, как считает Х. Л. Хафиз, сбрасывается первая яйцевая оболочка. Завери1оиио образования экскреторного органа у Ch. eruditus совпа- дает также и с оформлением членистости конечностей эмбриона и с за- кладкой генеративных органов у этих клещей (Hafiz, 1935). Последние возникают как парная группа мезодермальных клеток в задней части эмбриона на уровне Il I пары ларвальных ходильных конечностей, а затем сливаются в единый яичник. Наряду с этим в полости дивертикулов средней кишки, а также внутри мезодермального листа над генитальны- ми клетками автору удалось наблюдать большие ((амебоидные» клетки с плохо дифференцируемыми ядрами, которые Х. А. Хафиз отнес к эле- ментам кровяной (васкулярной) системы. Судя по описанию, существо-
ng eh@ ° ° ° ° еВе ее 'е 4Ь ' ° ° / ° еа г. ° ° ° ° ° ° ° ° 1 се 'л. Ю ае ° ° ° ° ее ° ° е еа ° ° ° ° ° ° ° ~еее ° ° ° 1! ° ° ° ° ° ° ° 1r ° ° ° ° ° ° ° е е ° ° ° ° ° ° еа ° ° °,ее ° ° ° ° ° ° ае в е ° 1а ° ~ ° ° ° 1 ° ° ° ° ° ° ° е Ф' ' ° ° ое ° ° Pà ° ° ° ° ° ° ° ° ° ° а ° ° ° 1 ааа ° ~ .,;::.~~ю~~~~:::.-:.:, ° ее ° ° ° ° ° в ° ° ° 1 ° ° ° ° ~ ° ° ° 1 ° ° ° ° фе ° \ее ее ее ° ° ° \ ° 1 ° ° е ° ° ° °,sr е1 ° ° ° ° ° ° ° ° еее аа L е В~ ° ° ° ° °, Ъв ° ° Ю ° I K ° S. ° е ° ° ° 1 ° ° ° ° ° ~е ° ° е ,е .~ ° ° \ ввчй:и еф~ "4~~ì ° ° ° ° е (Ff 11%~/ее/ ц О..е <v ев ° ° ° Ф gun асс ее ° ае ° ° ° Ъ, t ~а~.�6ф Ж в@ е~ е ~~~~Щ~~ . Ь 'о ~,~~~ pe.- е Ю р акоп а СЬ. е~'~"~~"~. ие этапы заори(н енез ' . ныл органом, Рис. 59. Завершающие э азвитым дор о ным орг сальным эьскреторным вылупле кием личи з эмбриона перед вы ьный акскреторный ка ттальный срез й ое пищевод, ы~ конечн остей пд — сингангли, — о ес л желто чно ма задний дивертикул рудимент трахеи взрослых о эмб иогенезом, поскольку их клеток ограничено эм ри в ание таких к нные> .. гцЮця закла- ей они отсутствуют. нные» железы Ch, его 1ця з клещей Т ахейная система, только в конце эмбриогенеза р .. еи ~жр жа ощихс нутрь эм ных постепенно ной сто опе его и ется (Hafiz, а а т ахейных зачатков вп и т ахейная система— "'Р'"'" Р Р Ch eruditus, о е мы. Они закладывают ост ма эмбриона. ~~~~~ ~~~~ы~ ~к~~щр~ СТВОЛОВ И, погружаясь вниз, занимаю ,;~;/ ~вr (1 е~а ° ~ ° ° . ° ° аа 'У ° ° ° r ° г ° ",r ° ° ° ° ° ° ° ° ° с r ° ° ° ° ° е ° ° ° ° ° ° аа ° ° ° ° ° ° l ° ° ° 1 ° Фе \ ° ° ° ° ° ° 1 ° ° ° ° ° ° у ее С ° ее ° ° е~ ° ° , ° ее ,~е ее ° ' 'еее ° 1 ° ° ° е ° ° ° ° ° ° ° Ф ° ° ° 11 ° ° r ° е е ° ° ° ° ° ° ° ° ° ° ° ° е ° ° ° ° ° ° ° ° ~ ~° ° е ° е ° ° ° е ° ° ° ° ° а ° ° ° ° ° е, ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° а ° ° е ° ° ° ° ° ° ° ° ° е ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ае ~ ° ° ° ю Ф ° ее,е ю ° ° ° r rs ° ° ° ° ° ° ° ° ° ° ° е а ° е ° ° ° ° е ° ° ° ° ° ° ° ° ° ° à ° ° ' ° ° ° ° ° ° ° ° ° ° е ° ° ° ° ° ° е ° ° ° ° ° ° ° ° ° е ° ° ° ' ° ° °, ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° 1 ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° ° °
Эти железы по строению и способу развития Х. А. Хафиз считает не «слюнными», а ядовитыми, характерными для пауков. К концу эмбриогенеза Ch. eruditus, который завершается через 92— 96 ч, настуххает вторая задержка в развитии, после чего эмбрион окон- чательно освобождается от второй яйцевой оболочки — дейтовума и пред- стает как подвижная шестиногая личинка, габитуально соответствующа» взрослым клещам. Таковы основные сведения о эмбриональном развитии хейлетид. Весьма трудно, не имея собственного эмбриологического материала, интерпретировать данные, приведенные в единственной на сегодпяшний день работе полувековой давности. Тем не менее, учитывая современные иредставления об эмбриологии клещей, а также результаты проведенно- го нами изучения осповных систем органов взрослых особей Ch. erudi- tus, необходимо дополнить описание Х. А. Хафиза некоторымп замеча- ниями. В первую очередь наши данные не подтверждают мнения Х. Л. Ха- физа о том, что начальные стадии эмбрионалх.пого развития Ch. evuditus происходят внутриутробно. Вероятно, этот исследователь принял за на- чальньпх период эмбриогенеза (дроб,ление) субх;ортххххальньххх слой цххто- плазмы, хорошо выраженный в яйцах хейлетид в процессе вителлогене- за. Не совпадают также опххсанихх морфологхххх репродуктивной системы самки Ch. eruditus, выполненные пами и аь гором цитируемой ра~~о- ты, что более подробно рассмотрено в разделе «Репродуктивттая си- стема». Следует также отметить, что выводы Х. А. Хафиза относительно образования зародышевой полоски и зародышевьтк листков у Ch. егuditiis, и у всех клещей в целом в настоящее время вызыватот большие сомнения, поскольку больше напоминают соответствующие процессы у пасекомых, чем у других паукообразньхх (Иванова-Казас 'l979). В обсугденххи своей работы автор (IIafiz, 1935) сам указывал на то, что образование мезо- дермы у Ch. eruditus напоминает аналогичный процесс у пасекомьтк, поэтому клещи в целом являются в этом отношетши промежуточным звеном (!) между паукообразными и насекомымп. Нельзя обойти вниманием также и происхождение дорсального экскреторного органа, который, согласно Х. А. Хафизу, развивается из эктодермы и гомологичен задней кишке — проктодеуму. С этим нельзя согласиться, так как ни у одного из исследованных впдов тромоидиформ- пых, в том числе хейлетидных т'леще1~, в экскреторном органе не обна- ружена интима — самый характерный признак эктодерм аль ного проис- хождения проктодеума. Она появляется в виде кутикулы лххшь в ректуме, который и следует гомологизировать с проктодеумом. Кроме того, у поко- торых хейлетхххх (например, у В. chanayi, см. раздел «Пихцеварххтельххая система») экскреторный орган служит прямым продолнхеххххем кхххххо хнххх1Й и участвует в пищеварительном процессе. Вызывает также сомнение и существование у Ch. eruditus васкуляр- ной системы в виде «амебоидных» клеток, описание hoTopbIx. приведено в обсуждаемой работе Х. А. Хафиза. Вероятно, последние представляют собой балластный материал, оставшийся после утилизации желтка, либо хсе это клетки мезехххимьх, ххз которых формируется оболочка яични- ка и некоторые другие органные структуры. Нельзя также согласиться и с тем, что передняя пара трахейнык стволов у Ch. eruditus после эмбрионального развития редуцируется. Оиа реально существует у взрослых форм этих клещей (рис. 47).
Следует также отметить, что проподосомальные «слюнные» ~келезы, ко- торые Х. А. Хафиз считает ядовитыми, судя по их строению, функциони- рованию и топографии — все же слюнные железы. НЕРВНАЯ СИСТЕМА Для хейлетид, как и в целом для клещей, характерна высокая степень концентрации нервной системы, приведшая к cJIHJIIIHIQ отдельных мета- мерных ганглиев (рис. 60) в единую центральную нервную массу — мозг, или синганглий (Blauvelt, 1945; Иоффе, 1963; Tsvileneva, 1964; Бекле- Mnmea, 1964; Kaestner, 1968). On представляет собой компактный округ- лый орган, расположенный в передней части проподосомы вентрально, на уровне I — II пар кокс. Впереди простирается до границы с гнатосо- htoIi, сверху прикрыт экзокринными железами и передней частью экскре- торного органа, латерально окружен дивертикулами кишечника, вентраль- ная поверхность синганглия контактирует с герминати вной частью ре- продуктивной системы. Топография синганглия у хейлетид ничем не отличается от расположенпя этого оргапа у других клещей (Blauvelt, 1945, Mills, 1974; Балашов, 1979; Alberti, Crooker, 1985). Длина сипган- глия у Ch. eruditus, В. chanayi, Ch. 1epidopterorum составляет 102, шири- на — 80 — 90 мкм соответственно. Как и у других клеще~~, синганглий хейлетид пронизан пищеводом, который проходит в нем антеродорсально под углом 45' и подразделяется на два отдела — пре- и постэзофагеальный. В состав первого, который соответствует головному мозгу членистоногих (Иоффе, 1963), входят парные ганглии пальп, хелицер, оптические центры (у Cheletomorpha lepidopterorum) и непарные ганглии — ростральный и стомодеальный. Второй отдел синганглия — постэзофагеальный, соответствует туловищ- ному мозгу членистоногих и включает 4 пары педальны х ганглиев, а также непарный опистосомальный. У хейлетид сохраняются общие для клещей пропорции указанных выше отделов синганглия: преэзофагеальный отдел несколько уже и ниже вытянутого в длину постэзофагеального (Blauvelt, 1945; Alberti, Crooker, 1985) . Снаружи синганглий хейлетид, как и все периферические нервы, отходящие от его ганглиев, покрыты неклеточной оболочкой — неври- леммой (рис. 60), которая соответствует базальной мембране (Crooker, 1981) . Она очень тонкая и при гистологической обработке утрачивает свою целостность. Под неврилеммой располагается кортикальная зона мозга — кортекс, составляющая основу синганглия. Она состоит из рас- положенных в несколько слоев тел нервных клеток — перикарионов, включающих ядра клеток с их цитоплазмой. Высота кортикальной зоны синганглия у хейлетид не превышает 10 мкм, однако в местах слияния ганглиев она глубже, чем в самих ганглиях, внедряется в глубь мозга. 11ерикарионы хейлетид сферической, иногда овальной формы, их диаметр ° варьирует от 1,5 до 2 мкм. Перикарионы располагаются в кортексе рыхло, отдалены друг от друга равномерно, менсперикариальные пространства выражены довольно четко. Ядра перикарионов круглые (0,2 — 0,3 мкм), богаты расположенным периферийно хроматином. Перикарионы харак- теризуются неглубокими инвагинациями плазматической мембраны, кото- .рые, как предполагают (Заварзин, 1985), выполняют трофическую функ- цию. Наиболее морфологически выраженной характеристикой перикарио- нов служит наличие так называемого тигроидиого вещества базофильных
скоплений цитоплазмы. По данным электронной микроскопии оно содер- жит хорошо развитую сеть каналов шероховатого эндоплазиатического ретикулюма и свободные рибосомы (Заварзин, 1985) . Глыбки тигроидно- го вещества скреплены тонкими тяжами, которые имиитируют pbIxJIûå оболочки вакуолей. Вокруг ядер перикарионов наблюдается анастомози- рующая цитоплазматическая сеть. Бероятно, она является ни чем иным, как скоплением элементов аппарата Гольджи диффузного типа (Завар- зин, 1985) . При гистохимическои исследовании синганглия хищного клеща Ch. eruditus в кортикальной зоне был выявлен гликоген. В связи с этим резонно предположить, что в состав кортекса хейлетид помимо перика- рионов нервных клеток входят и глиальные клетки, обнаруженные при исследовании центральной нервной системы других клещей, в тои числе и тромбидиформных (iMills, 1974; Alberti, Crooker, 1985). Как полагают, они выполняют специфические трофические, защитные и изолирующие функции, обеспечивая нормальное функционирование основных клеточ- ных элементов кортекса. Идентификация обнаруженных у многих групп клещей специализи- рованных нейросекреторвых клеток у клещей-хейлетид не проводилась. Однако в кортексе стомодеального ганглия перикарионы нескольких нервных клеток имеют большие по сравнению с основной массой пери- карионов размеры. Возможпо, они и являются элементами нейроэндо- кринной системы. Под кортикальным слоем синганглия хейлетид, в его внутренней области, расположен ганглионарный нейропиль (рис. 60). Он представ- ляет собой зону переплетения связанных синаптическими контактами отростков нейронов, которые отходят от перикарионов коркового слоя. Отростки нейронов, локализованные в нейропиле, дают начало перифе- рическии нервам, которые выходят из слившихся ганглиев и идут к соответствующим органам. Кроме того, внутри нейропиля хейлетид имеются внутринейропиальные перв ные тяжи — комиссуры, осуществ- ляющие связь между отдельными ганглиями пре- и постэзофагельного отделов, а также конпективы — односегментные нервные тяжи (рис. 60).
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ НЕКОТОРЫХ ХЕЙЛЕТИД В семейство Cheyletidae входят свободноживущие хищпые формы и виды, перешедшие и обитанию на теле других животных, но оставшиеся хищ- кхками и, наконец, настоящие эктопаразиты, питающиеся кровью, лим- фой или экссудатами кожи хозяина. В. И. Волгин (1969) проводит эколого-фаунистические группировки хейлетид, приуроченные к определеыыым местам обитания. Перечень этих мест дает наглядное представление о широкой экологической валентности хейлетид. Хейлетиды встречаются в растительных остатках и в поверхностноАт слое почвы; в хранилищах продовольственных запасов; на деревьях и кустарниках (дендрофилы), в том числе под щитками поедаемых ими щитовок и в ходах короедов; на насекомых (энтомофилы), пре>кде всего па клопах, жуках-чернотелках, которых используют взрослые особи этих хищных клещей для переселения, а также в гнездах перепончатокрылых пасекомых — шмелей, ос, муравьев; в норах и гнездах мелких млеко- питающих (как хищники); на млекопитающих (как паразиты); в гнездах птиц (как хищники); в очинах перьев птиц (как хищники); на птицах (как паразиты). Некоторые из хейлетид входят сразу в несколько фаунистических группировок, например Ch. eruditus, обитающий в скоплениях раститель- ных остатков, в хранилищах и продовольственных запасах, дуплах деревьев, муравейниках, норах и гнездах MBJIIcHx млекопитающих и птиц. Другим хейлетидаи, жизнедеятельность которых связана с животным- хозяином, присуща строгая приуроченность к тому или иному местооби- танию. Например, хищные клещи трибы Cheyletosomatini обитают в очииах перьев чайковых, питаясь перьевыми клещалпт сем. Syringophili- dae, а клещи рода IUIyrmicocheyla — в муравейниках и на древесных клопах. Но особепно это касается эктопаразитов, таких, например, как В. chanayi, Ornithocheyletia sp. и др. Специфичность, особенно парази- ти веских видов, служит ва)кной, котя далеко Бе полной экологической характеристикой. К сожалению, сведений о влиянии внешних факторов на питание, развитие, размножение и продолжительность жизни хейле- тид, о их трофическом и репродуктивном поведении опубликовано мало. Фактически лишь один вид — Ch. eruditus — был объектом специального исследования (Boczel~, 1959). Некоторые экологические и этологические наблюдения проведены на других видах хейлетид — Bakericheyla chanayi (Волгин, Николаева, 1965; Furman, Sousa, 1969), Cheyletie! la jasguri (Nosier, Foxx, 1967; гохх, Ewing, '1969), Ornithocheyletia hallae (Haarlov, Morch, 1975). Упомянутые публикации, а также наши паблюдения за питанием, плодовитостью, паутинопрядеиием, специфичностью и некото- рыми другими биологическими особенностями клещей Ch. eruditus, Ch 92
lepidopterorum, В. chanayi и Ornithocheyletia sp. послужили основой дан- ной главы. При этом сравнение проводилось прежде всего между хищны- ми (Ch. eruditus, Cheletomorpha lepidopterorum) и паразитическими (Bakericheyla chanayi, Ornithocheyletia sp.) видами. ХИЩНЫЕ ХЕЙЛЕТИДЫ CHEYLETUS ERUDITUS И СНЕЕЕТОМОВРНА LEPIDOPTERORUM Клещи Ch. eruditus и Ch. lepidopterorum — наиболее типичные предста- вители хищных клещей семейства Cheyletidae. Они характеризуются всесветным распространением и встречаются во всех природно-климати- ческих зонах мира в различных природных и искусственных биотопах (Волгин, 1969). Тем не менее Ch. eruditus выделяется среди других видов таксона своей массовостью, большой экологической пластичностью и ши- ротой трофических связей. Благодаря этому он наиболее изучен среди хейлетид в экологическом отношении. Питание и пищевое поведение Хищные хейлетиды (рис. 61) питаются клещами других групп, в том числе вредителями пищевых запасов и растений, мелкими насекомыми и их яйцами (Волгин, 1969). Клещи Ch. eruditus истреоляют тем больше хсертв, чем плотнее популяция последних, чем больше происходит у хищника с ними встреч за определенный промежуток времени (Родионов, Фурман, 1940). Существует оптимальное количественное соотношение между хищниками H жертвами, при котором уничтожение последних протекает наиболее интенсивно (Смарагдова, 1936; Boczek, 1959). Наи- более благоприятным соотношением хищник — жертва «вляется соотно- шение 1: 20. динамика взаимодействия жертв и хищников зависит от среды обитания: чем плотнее среда, тем лучше развивались жертвы, и тем медленнее их уничтожали хищники, т. е. кроме достаточного коли- чества пищи клещи Ch. et'uditus нуждаются в крупнозернистых, доступ- ных для поиска и нападепия на жертв субстратах. Опыты по скармливанию в лабораторных условиях Ch. erudit»s и Ch. lepidopterorum различных видов акароидных, гамазовых клещей- нидиколов, а также клещей-уроподин показали, что наиболее предпочи- таемыми из них являются клещи амбарного комплекса. Причем взрослые формы хищников питались преимущественно взрослыми акароиднымн клещами, на личинок и нимф нападали только при отсутствии имаго. Личинки и нимфы Ch. eruditus и Ch. lepidopterorum питались исключи- тельно неполовозрелыми формами вредителей. Однако несомненно, что в природе эти хищники питаются всеми попадающимися на их пути и доступными им объектами, в том числе и нидиколами и гамазидами- гематофагами. Это подтверждается наличием в полости кишечника и клетках эпителия гематина. На основании изложенных выше фактов мо;кно предположить, что условиями, определяющими выбор жертв Ch. eruditus и Ch. lepidoptero- rum, являются, в первую очередь, малая толщина и незначительная степень склеротизации их покровов, а также соразмерность жертв xHIH,— никам. В меньшей степени выбор жертв определяется подвижностью объектов питания, однако зависит от условий обитания хищников, по- скольку Ch. erudit»s и Ch. lepidopterorum обладают повышенной двига- тельной активностью. Следует отметить, что для этих видов хейлетид 9Ü
характерно явление каннибализма, которое особенно проявляется при отсутствии обычного для них корма. С точки зрения стереотипа питания, форма поведения изучаемых нами хейлетид полностью укладывается в определение хищничества. Акт питания представляет собой цепь автоматических реакций в виде таких последовательных и направленных действий, как приближение, осязание, захват, прокалывание, обездвиживание и высасывание. При этом на одну жертву, как правило, нападает только один хищник. Однако в лабораторных условиях мы наблюдали поедание (высасывание) одной самки паразитического клеща Varroa jacobsoni сразу 5 самками Ch. eru- ditus, которые голодали перед этим 4 сут. Осязание у хейлетид осуществляется при помощи 1 пары ног, воору- женных в базальной части лапки небольшим, заостренным к вершине соленидием, а захват — при помощи хорошо развитых у этих хищников гипертрофированных по сравнению с другими конечностями педипальп (рис. 5). Жертва хватается преимущественно за конечность, которая затем прокалывается хищником в области межсегментной оболочки ее члеников. Конвульсивные двихсенпя жертвы свидетельствуют о том, что она после этого в течение нескольких секунд парализуется хищником, а вскоре и обездвиживается. После этого педипальпы хищников отводят- ся в стороны и больше не ударживают добычу на протяжении всего акта питания. Остаются в теле жертвы только сомкнутые в трубочку стилеты хелицер. Они в дальнейшем служат каналом, по которому поступает в кишечник содержимое жертв. Небольшой участок этого канала всегда виден под бинокуляром (рис. 28). При питании хищников положение жертвы может быть различным. Они могут лежать возле или под хищ- никами на субстрате, могут находиться на весу — наколотыми и припод- нятыми над ними стилетами. Акт питания начинается спустя несколько секунд после обездвпжи- вания жертвы (объекта питаппя). Оп непрерывный и может длиться от 5 — 10 мнн до 2 ч. Преимущественное время насыщения при соразмерной жертве 25 — 30 мин. Скорость насыщения, колпчество поглощаемой ппщп зависят от физиологического состоянпя хищников: истощенные голода- нием особи питались значительно дольше сытых, извлеченных из лабо- раторной культуры. При искусственпом и естественном прерывании питания хищники повторно не возвращались к жертве, а начинали поиск новых особей — подвижных и живых. Пораженные хпщниками клещи, если даже они пе были высосаны, погибали, что противоречит наблюдениям Р. Е. Бира (Beer, 1956). У клещей Ch. eruditus отмечена высокая устойчивость к голоданию, особенно при низкой температуре H высокой влажности (Boczek, 1959). Она значительно выше, чем у Ch. lepidopterorum, и прп оптимальных условиях температуры и влажпости отдельные особи в изолированных условиях сохраняли жизнеспособность без обычной пищи в течение двух месяцев. Наблюдения за процессом питания клещей Ch. eruditus и Ch. lepi- dopterorum показали, что в их кишечник, кроме лимфы, поступают и непереваренные остатки пищи жертвы. Однако количество последних незначительно, и основу Нх составляет гемолимфа. Поступая в кишечник хищника, пища равномерно заполняет весь его объем. При этом сам кишечник и надлежащие ткани (покровы) значительно растягиваются. Клещи становятся тургорными, и форма их тела из ромбовидной пре- вращается в каплевидную.
Влияние температуры и влажности Клещ Ch. eruditus относительно гпгрофильпый и умеренно термофильный' вид. Развитие этих клещей начинается прп температуре 8 — 31 'С и влажности воздуха 52 о/о. Ниже 50 о/о развитие клещей оказывается невозможным. С повышением температуры п влажности срок развития Ch. eruditus сокращается, но температура оказывает большее влияние, чем влажность (Boczek, 1959). Длительность жизни Ch. eruditus в при- родных условиях изменяется в зависимости от температуры от 84 сут (при 9,4 'С) до 10 сут (прп 31,5 'С). В общем взрослые клещи в благо- приятных условиях наживут 1 — 2 мес, в отдельных случаях 7 мес (Волгин, 1969). Оптимальная влажность для этих хищников — 85 — 100 о/о, опти- мальная температура 23 — 25'С. Наименьшая смертность наблюдается 8 пределах 17 — 23 'С. Данпые по изучению влияния гидротермического режима на жизне- деятельность другого изучаемого нами вида — Ch. lepidopterorum — ~ ли- тературе отсутствуют, специальные исследования ло этому вопросу Бв проводились и нами. Однако успешное ведение лабораторной культуры этик клещей для морфологических исследований свидетельствует о том, что оптимальные для ~кизнеобеспечения Ch. егий~;я условия вполне приемлемы и для них. Размножение и репродуктивное поведение Оба изучаемых вида хейлетид бисексуальны и обладают достаточно хорошо выраженными признаками полового диморфизма. Однако (Boczek, 1956) у Ch. eruditus в связи с факультативным партеногенезом самцы чрезвычайно редки. Некоторые авторы (Mumcuogly, Gugenchein, Hen- ning, 1974), работавшие с местной популяцией этого вида в Швейцарии, сообщают, что у Ch. eruditus соотношеппе самцов и самок достигало 1: 3. У нас эти результаты вызывают сомнение, так как в указанной работе на сделанпои с помощью Р3М фотографии с подписью Ch. erudi- tus фигурирует изображение совсем другого вида хейлетид. У Ch. lepidopterorum присутствие самцов постоянно, соотношение самцов и самок в среднем составляет 1: 5. Оплодотворение у этого вида совершается сразу после ококчательной линьки самок, так как самцы с самого начала развития «ризалидной стадии последних находятся возле них безотрывно. Как и другие представители семейства (Волгин, 1969), Ch. eruditus и Ch. lepidopterorum яйцекладущп. Яйцекладка циклическая, с чередова- нием периодов активности и временных перерывов. Самки Ch. eruditus откладывают яйца в трещины, щели и другие укрытия, по несколько в день (Восхе1', 1959), приклеивая их к субстрату и друг к другу с по- мощью специальных выделенпй (Hafiz, 1935; Смарагдова, 1936) . В ре- зультате за несколько суток накапливается комнактная группа, состоя- щая обычно из 20 — 30 яиц. Общее количество яиц во всех кладках одной самки Ch. eruditus, как правило, равняется 70 — 90, достигая в отдельных случаях 120, по реализуемая плодовитость значительно меньше (Boczek, 1959). Окончание периода откладки яиц самкой наступает за несколько суток до смерти (Волгин, '1969). Интересным является факт заботы о потомстве у Ch. eruditus. Самки этого вида хейлетид все время, вплоть до появления личинок, постоянно охраняют яйцекладку: стоят над ней 95
или передвигаются от яйца к яйцу. l! ри попытках потревожить или отогнать самок, они постоянно возвращаются на свое место, а при при- ближении других хищников — прогоняют их. Насколько известно (Вол- гин, 1969; Michael, 1878), это второй случай охраны отложенных яиц среди таких низкооргапизованных животных, как клещи. Как показали наши наблюдения, такое поведение самок Ch. огuditus связано, в первую очередь, с предохранением яиц от поедания дочерними личинками из этой же яйцекладки. В отличие от Ch. eruditus яйцекладка у Ch. lepidopterorum носит не групповой, а одиночный характер. Кроме того, самки этого вида каждое из отложенных ими япц оплетают изящной паутинной сеточкой (рис. 61), при этом они пе проявляют никакого внимания к будущему потомству в дальнейшем. Следует отметить, что факт паутипопрядепия у Ch. lepi- dopterorum был установлен ранее (Hughes А., 1957) . Однако в этом сообщении были упущены интересные подробности процесса паутино- прядения и содержались весьма приици~птальпые, по нашему мнению, неточности. П оэтому следует остановиться HB паутинопрядении более подробно. Сооружение защитной сеточки начинается не позже чем через l мин после откладки яйца. При этом самки Ch.. lepidopterorum менее требовательны по сравнению с Ch. eruditu~ в выборе мест для яйцекладки и откладывают яйца не только в укрытиях, по и на открытых площадках. При паутинопрядении Ch. lepidopterorum манипулируют лишь кончиком рострума гнатосомы, отводя пальпы широко в стороны. А. М. Хьюз (Hug- hes, 1957) указывает, однако, и на участие в этом процессе педипальп, чего мы не наблюдали. Сначала самка изгибает рострум вниз и, выделяя на его вершине каплю секрета, несколько раз прикасается им к субстра- ту, закрепляя будущую паутинку возле яйца. Затем она поднимает рострум вверх и протягивает не прекращающий выделяться и «па глазах» застывающий в нитевидную паутину секрет сначала над яйцом, а затем на субстрате возле него. После этого гнатосома снова изгибается «низ: самка закрепляет противоположный конец протянутой паутины. Такие движения при пепрерывпом выделении секрета повторяются многократно в различных, относительно яйца, направлениях, с разных. точек на суб- страте и в довольно быстром темпе. В результате за 2 — 3 мип самка полностью сооружает зам кнутую сеточку и больше к этому яйцу не возвращается. После откладки нового яйца все повторяется в той же последовательности. Следует отметить, что в момент вытягивания отдель- ные паутинки некоторое время остаются вязкими и, накладываясь друг на друга, сливаются, образуя в местах пересечения бифуркации и апасто- мозы. Вскоре они уплотняются, однако остаются упругими и эластич- ными. Благодаря этому паутипная сеть надежно прикрепляет яйца Ch. lepidopterorum к субстрату и предохраняет их от не келательпых перемещений (рис. 61). В отличие от яйцекладкп Ch. eruditus их можно исследовать с помощью РЭМ даже в прижизненном состоянии, не при- бегая к дополнительной фиксации и обработке. Кроме того, паутпнная сеть отпугивает приближающихся к яйцам хищников, однако не может полностью гарантировать яйцо от уничтожения, поскольку имеет рыхлую структуру. Но последнее обстоятельство наряду с недостатками имеет и преимущества — вылупившиеся из яиц лпчинки могут, не предпринимая никаких дополнительных усилий, покинуть полог, в то время как, напри- мер, личинки клещей-бделлид (Alberti, 1973) вынуждены растворять аналогичные сооружения специальными выделениями желез. В течение суток одна самка Ch. lepidopterorum может отложить от S6
3 до 18 яиц, в течение недели — от 14 до 50. Периодичность откладки колеблется от 20 мин до нескольких часов и находится в прямой зави- симости от питания яйцекладущих самок, хотя, как указывают некоторые авторы (Mumcuogly, Gugencheim, Henning, 1974), самки Ch. eruditus в этот период пищи не принимают. ПАРАЗИТИЧЕСКИЕ ХЕИЛЕТИДЫ ВАКЕИ? СНЕУТ.А СНАХАУ? ORNITHOCHEYLETIA SP. Гостальная специфичность Данные ~ИД ПТИП литера- ориги-турные нальныс Coracii formes Meropidae Merops apiaster Passeri for mes Hirundinidae Hirundo rustica Delichor urbica M otacillid ae Motacilla f lava Anthus trivialis Turdidae Turdus pilaris Oenanthe picata Sylviidae Sylvia atricapilla S. borin Phyllozcopus trochilus Paridae Parus majior Muscicapidae Muscicapa cyanomelana М. striata Emberizidae ЕтЬег1г~а citrinel!a f P 9-3893 97 Согласно концепции о жизненной схеме видов (Беклемишев, 1945; 1954), клещи В. chanayi и Ornithocheyletia sp. принадлежат к постоянным, кругложизненным и однохозяинным эктопаразитам птиц. Первый вид распространен довольно широко (Волгин, Николаева, 1965; Furman, Sou- sa, 1969; Горголь, 1980, 1982; Мадалов, 1965) и является наиболее массовым среди всех паразитических представителей семейства (Волгин, 1969) . Как показали наши массовые прижизненные обследования птиц с помощью специальных сетчатых ловушек, установленных для изучения их миграций, хозяевами клещей В. chanayi являлись птицы 14 видов отряда Passeriformes, принадлежащие к 8 из 16 обследованных семейств Ниже приведен список видов птиц, на которых обнаружены клеши В. chanayi и Ornithocheyletia sp. (по оригинальным и литературным данным):
Продолжение табл Данные вид птиц литера- турные ориги-нальные Zonotrichia leucophrus nuttali Z.1. gambali Z.l. pugetensis Zonotrichia atricapilla Fringillidae Fringilla coelebs Fr. montifringilla Spinus spinus Corduelis corduelis Pillipo enthrophthalmus Ploceidae Passer montanus P. indicus '" Хозяева В. chanayi. ** Хозяева Ornithocheyletia sp, 98 Клещи Ornithocheyletia sp. были отмечены лишь на двух видах птиц. Однако при совместном лабораторном содержании зябликов, зарансенных В. chanayi, и пеночек-весничек, зарансенных Ornithocheyletia sp., пара- зиты успешно переходили и обживались на нехарактерных, по-видпмому, для них в природных условиях хозяевах. Это дает возможность дополни- тельно в круг хозяев В. chanayi внести пеночку-весничку, а Ornithochey- letia sp. зяблика. Следует отметить, что при весенней и осенней миграциях видовой состав птиц, служивших хозяевами изучаемым эктопаразитам, был раз- личен. Так, весной заражение клещами В. chanayi было отмечено только на двух видах — зябликах и вьюрках, в то время как осенью круг их хозяев был значительно богаче и объединял уже 14 видов птиц. Клещи Ornithocheyletia sp. были отмечены нами только на осеннем пролете птиц (на пеночке-весничке), а также летом (на ласточке деревенской в Кир- гизской CCP) . Результаты проведенных наблюдений показывают, что главными про- кормителями и основными хозяевами клещей В. chanayi в периоды миграций служили зяблики (Fringilla coelehs) и вьюрки (Fringilla mon- tifringilla). Заражение других видов птиц не носило массового характера и наблюдалось лишь у единичных особей. В целом можно отметить, что изучаемые нами виды паразитическими хейлетид обладают относительной (Догель, 1947) гостальной специфич- ностью. При этом круг хозяев В. chanayi достаточно широк и в настоя- щий момент представлен 23 видами птиц из отряда воробьиных и ракше- вых (Волгин, Николаева, 1965; Волгин, 1969; Furman, Sousa, 1969; Meg- nin, 1878; Горголь, 1982; Горголь, Полуда, 1984; Мадалов, 1985), а Orni- thocheyletia sp.— только тремя видами птиц из отряда воробьиных (Гор- голь, 1983а; 1986). Однако, судя по активному переходу в зкстремаль- HbIx ситуациях на новые виды птиц, можно предполагать, что видовой состав хозяев клещей В. chanayi и Ornithocheyletia sp. реально монсет быть значительно шире по сравнению с установленным. Тем не менее клещи все же отдают предпочтение птицам отряда воробьиных (Passe- riformes), а из них в основном представителям семейства Fringillidae.
Бе только видовой состав птиц, но также экстенсивность и интенсив- ность их заражения паразитами при весенней и осенней миграциях были весьма различными. Так, при весеннем пролете экстенсивность зараже- ния зябликов (основных хозяев В. chanayi) составляла 1,5 — 3 %, у вьюр- ков она была крайне незначительной — 0,4 %. Интенсивность заражения варьировала от 5 до 30 особей экзопаразитов. В период осенней миграции (1982 г.) экстенсивность инвазии зябли- ков составляла 8,4 % (1970 г.— 167), а вьюрков — 7,2 % (1982 г. — 13). При относительно равном соотношении полов у обследованных зябликов (998 Я, 972 о ) клещи отдают предпочтение самцам — 67,7 % (103 из 167), а у вьюрков — самкам — 62,5 % (8 из 13), хотя при осмотре коли- чество самцов преобладало (102 о и 80 q). При этом паразиты пора- жают преимущественно молодых птиц — у зябликов почти 75 % (125 из 167), а у вьюрков — 93,3 % (12 из 13) (Горголь, Полуда, 1984). Интенсивность заражения предпочитаемых и дополнительных хозяев В. chanayi в период осенней миграции значительно варьировала, хотя существенно превышала соответствующий показатель при весенней миг- рации и составляла от 10 до 560, а в отдельных случаях — более 900 осо- бей эктопаразитов. Она зависела главным образом от возраста птиц: у молодых была в 4 — 5 раз выше, чем у старых, и составляла в среднем 100 — 250 особей клещей. Подобные взаимоотношения эктопаразитов с хозяевами отмечены и' для других хейлетидных клещей (например, Cheyletiella yasguri), паразитирующих на мелких домашних животных (гохх, Ewing, 1969). Экстенсивность заражения основных хозяев клещей Ornithocheyle- tia sp. пеночек-весничек — в период обнаружения и исследования со- ставляла 2,3 %. Однако общее количество эктопаразитов на теле каждой особи хозяев было огромным. Так, на четырех из восьми обследованных пеночек-весничек их было 1200 — 1300, на одной — около 10 000 и только на трех — от 30 до 150. Как и в случае с клещами В. chanayi, птицы, пораженные Ornithocheyletia sp., были молодого возраста. Обращает на себя внимание и тот факт, что в периоды проводимых наблюдений возрастной состав популяции эктопаразитов отличался пест- ротой. Неполовозрелые стадии значительно преобладали над взрослыми и состаилялп 60 — 70 % общего количества клещей. В осенне-зимнпй ) ериод при изолированном содержании зябликов, инвазированных клещамн В. c1>anayi, в лабораторных условиях числен- ность эктопаразито» на иихф постоянно снижалась и к началу весны была минимальной. В то же время при подсадке к таким птицам особей, свободньп от паразитов, последние уже через месяц были одинаковы с н11мп по интенсивности заражения. Это в определенной мере не совпа- дает с имеющимися сведениями (Гпгп1ап, Sollsa, '1969) о крайне редком перекоде В. сйа11а~1 от зараженпых овсянок к свободным от паразитов осооям этиx птиц. При гибели хозяе» поло»озрелые особи клещей В. chanayi и Ornitho- сЬе~1ейа sp., оставшись в покровах птиц, могут сохранять жизнеспособ- ность 3 — 4 сут, в то время как неполовозрелые погиоают в течение 1 сут. Наблюдается низкая выживаемость эктопаразитов всех стадий развития и орн содержании и~ в иск~ ccTHBHIibIx, максимально приближенных к естественным, условиях (при 40 'С и относительной влажности 70 % ) . Таким образом, пз совокупности факторов, определяющих госталь- ную специфичность хейлетидных клещей В. chanayi и Ornitl>ocheyletia sp., наиболее существенны следу1ощие: доминирование воробьиных IITH!I, 10*
в исследуемом регионе (99,03 O), из которых зяблик составляет 41,29 о/о' и является его фоновым видом (Полуда, Шкапа, 1978; Полуда, 1978); частый контакт близкородственных хозяев изучаемых клещей в одно- родной экологической обстановке (преимущественное большинство хозяев В. chanayi и Ornithocheyletia sp. принадлежит к кустарнико-лесному комплексу птиц); сходство экологических ниш неродственных хозяев и легкость перехода паразитов с одной особи хозяина на другую и т. д. Все эти факторы создают условия, при которых наблюдается приурочен- ность изучаемых эктопаразитов преимущественно к мигрирующим видам птиц (дневным мигрантам). Достаточно отметить, что оседлые виды, например синицы, которые по численности преобладают над зябликами (Полуда, 1978), имеют чрезвычайно низкую экстенсивность варан~ения (1: 2830). Условия обитания на теле птиц и топическая специфичность Клещи В. chanayi и Ornithocheyletia sp. весь жизненный цикл проходят под своеобразными, в форме пологих конусов, чехликами-тентами. Соткан- ные из многочисленных, однотипных, взаимно переплетающихся паутин- ных нитей (рис. 62 — 64), они имеют белый цвет, хорошо заметны на поверхпости кожи хозяев и легко опознаются при продувании перьевого покрова птиц. При умеренном заражении птиц чехли ки эктопаразитов располагаются диффузно, при сильном — зрительно сливаются и обра- зуюr сплошной паутинный покров, однако индивидуальная изоляция чехликов сохраняется. Экто паразиты преимущественно предпочитают брюшную сторону птиц, однако участки обитания В. chanayi и Ornitho- cheyletia sp. в основном разобщены и лишь изредка перекрываются на бедренных и хвостовых птерилиях. Клещи Ornithocheyletia sp. осваивают значительно боль|путо, чем В. chanayi поверхность тела хозяина, посе- ляясь даже на кожистых перепонках между плечом и предплечьем кры- ла, а также на спинной, плечевой и шейной птерилиях (рис. 62). Как правило, чехлики клещей В. chanayi располагаются между складками кожи (рис. 63), а Ornithocheyletia sp.— строго у основания бугорков фолликулов перьев (рис. 64), но у обоих видов они наблюда- ются на теле хозяев в двух состояниях — функционирующем и разру- шающемся. Первое характеризуется четкой конусовидной формой чех- ликов, эластичностью паутины, хорошей прикрепленностью к покровам птицы и благодаря этому присутствием под ними экзопаразитов (рис. 63). Разрушающиеся чехлики теряют форму, эластичность и прочность пау- типы, в которой появляется большое количество спор низших грибов. Под такими чехликами почти не бывает клещей. Наблюдения показы- вают, что состояние чехликов у клещей В. chanayi сопряжено с интен- сивностью заражения хозяев и с их возрастом. На молодых птицах, как правило, чехлики функционирующие, причем интенсивность заражения таких особей в 4 — 5 раз выше, чем у старых (Горголь, Полуда, 1984). Несмотря на одинаковую исходную организацию, чехлики В. cha- nayi и Ornithocheyletia sp. имеют ряд принципиальных различий. Это касается прежде всего размеров, количества особей паразитов под чехли- ками и способа их сооружения. Так, чехлики клещей В. chanayi на большинстве хозяев достигают в высоту 0,5 мм, а ширина их колеблется от 1,5 до 2,5 мм. В целом размеры чехликов В. chanayi прямо коррели- руют с размерами хозяев (рис. 63) Например. соотношение спепних 100
площадей чехликов на коже чижа (Spinus spinus) и зяблика (Fr. coe- lebs) составляет 0,22: 1. Различия между средними статистически досто- верны (t=12,16 при п=20) (Горголь, 1982). У основания чехлика В. chanayi всегда имеется входное отверстие, а внутри — однослойная паутинная выстилка, которая скреплена по окружности с краями кони- ческой части. К телу птиц конусы надежно прикреплены путинными тяжами, которые простираются на сравнительно значительное расстояние от периферической зоны основания чехликов. Чехлики этого вида клещей групповые, под ними может находиться от 1 до 15 особей эктопаразитов всех стадий развития (рис. 65). Все неполовозрелые особи прикреплены к внутренней стенке чехлика и друг к другу паутинками и практически не могут покидать свои убежища. Мигрируют только взрослые особи (см. рис. 65). Сооружение чехлика у В. chanayi начинается с того, что взрослые самки сначала строят над собой тонкий паутинный полог, прикрепляя его одновременно к телу хозяина. Затем под таким первичным пологом они откладывают яйца, уплотняя чехлик новыми паутинными нитями, затем опять следует яйцекладка и т. д. При этом сооружение -чехлика растягивается на весь период яйцекладки, оно последовательное и не одновременное. Чехлики клещей Ornithocheyletia sp., в отличие от чехликов В. cha- пау1 индивидуальные, в каждом живет только одна (неполовозрелая или взрослая) особь эктопаразита. Эти чехлики малозаметные, мелкие, плос- кие, продолговатые, длиной 0,3 — 0,4 мм, полностью закрыты и не имеют постоянного входного отверстия (см. рис. 64) . Оно появляется только при выходе половозрелых особей. Весьма отличен от В. chanayi и способ сооружения чехликов у Ornithocheyletia sp. Взрослые самки сооружают первичный чехлик над отложенными ими на коже птиц яйцами, покры- вая каждое сразу полным слоем паутины. По мере роста клещей паути- на разрыхляется, полог истончается и лишь при достижении половой зрелости клещи, разрывая полог, покидают убежища. На птицах клещей В. chanayi n Ornithocheyletia sp. всегда обнару- живали сидящими под чехликами, но они, вероятно, могут активно пере- мещаться по телу хозяев. Об этом можно судить по скорости перехода клещей на новых хозяев и закладки на них чехликов. Так, при благо- приятных условиях лабораторного содержания пеночки-веспички, зара- женной Ornithocheyletia sp., и зяблика, зараженного В. chanayi, обмен птиц паразитами произошел- в течение 4 ч, причем эктопаразиты за это время на новых хозяевах успели соорудить чехлики и напитаться. Результаты проведенных наблюдений и изучение чехликов показы- вают, что они являются морфологическол основой стабилизации условий развития и размножения клещей, а также единственно падежным меха- низмом фиксации их на теле JIBTBIoIIjHx хозяев. Следует отметить, что кроме изучаемых нами видов клещей-хейле- тпд (В. chanayi и Ornithocheyletia sp.) способностью к выделению паути- ны обладают и другие паразитические виды семейства Cheyletidae — кле- щи Cheyletiella yasguri, обитающие в волосяных покровах мелких домаш- них животных (Foxx, Ewing, 1969) . У них паутина используется для прикрепления яиц к волосяным покровам хозяина или для защиты яйцекладки. 103
Питание По чисто внешним признакам и в первую очередь по окраске кишечника эктопаразитов, а также при микроскопическом исследовании его содер- жимого установлено, что клещи В. chanayi являются облигатными гема- тофагами, а клещи Ornithocheyletia sp.— облигатными лимфофагами. Кровь воробьиных птиц, служащая источником пищи для клещей В. chanayi, в качественном отношении существенно не отличается от крови других позвоночных животных. Она представляет собой высоко- калорийный полноценный пищевой субстрат, который в натуральном виде состоит из 75 — 85 о/о воды, 14 — 16 о/о гемоглобина, 6,6 — 8,5 о/о бел- ков плазмы и 0,7 — 0,9 о/о углеводов, липидов и неорганических веществ. После удаления воды она представляет собой концентрированную белко- вую пищу (80 — 90 о/о протеинов), а удельный вес жира и углеводов в ней ничтожен. Этим кровь в значительной степени превосходит другие впды пищи эктопаразитов, включая гемолимфу насекомых (Балашов, 1967) . В морфологическом отношении кровь птиц, и в частности хозяев В. chanayi, имеет свои особенности (Наумов, 1973; Шубникова, 1981). Главные форменные элементы крови птиц — эритроциты — ядерные. В них содержится большая часть белкового компонента крови — гемогло- бина. Эритроциты птиц очень устойчивы к гемолизу и поступают в ки- шечник изучаемых эктопаразитов, как и у других гематофагов — аргазо- вых клещей, неповрежденными (Балашов, 1967, 1982), без следов агглютинации. Лимфа — пища клещей Ornithocheyletia sp.,— является жидкой частью крови — плазмой, вышедшей из кровеносной системы в межкле- точное пространство (Ярослав, Ананенко, 1971). Количество белка в ней более низкое, чем в крови (6 — 8 о/о — Шубникова, 1981; 6,5 — 9,5 о/о- Балашов, 1982), что определяется отсутствием в ее составе эритроци- тоц — основного резерва белков крови. Количество углеводов и минераль- пых веществ в пей такое же, как и в крови (Ярослав, Ананенко, 1971). Ряд экспериментов по искусственному кормлению кровососущих насекомых и клещей показал, что многие из них нормально развиваются как на цельпой крови, так и на отдельных ее компонентах, из которых наибольшее значение имеет плазма (Friend, Smith, 1977; Балашов, 1982). Из этого следует. по качественный состав пищи паразитическими хейле- тидных клещей В. chanayi n Ovnithocheyl etia sp. сходен. Различия состоят только в содержании белка, который определяется наличием в крови и отсутствием в лпмфе эритроцптов. Как и другпе постоянные паразиты с подобным типом питания (Ба- laIIIoB, 1982), изученныо виды получают пищу путем активного про- никновения poTQBblx органов к ее источнику — кровеносным и лимфати- ческим сосудам. При этом отсутствуют различные патологические изме- нения покровов птиц — гемморагии, папиллы, инфильтрация тканей. 1-iроме того, при шп ании клещей В. chanayi и Omit}>ocheyletia sp. не образуется, как у иксодовых и краснотелковык клещей, обладатощц~ идентичпым характером диеты дополнительнык ооразоваиий — стилосто- мов п цементных футляров (Балашов, 1967; Chinery, 1973; Шатров, 1980, Балашов, 1982). Не наблюдается также m выпадения перьевого покрова итпц, что имеет место при паразитировапии перьевых клехцей (Дубинин, 1!147}. Неполовозрелые особи клещей обоих изучаемыми видов принимают j02
пищу однократно — в начале соответствующего этапа онтогенеза, взрос- лые — многократно. Среди клещей одного возраста наблюдаются значи- тельные индивидуальные вариации в количестве единоразового приема пищи, на что указывает пестрота окраски кишечника у В. chanayi (от красно-бурого до буро-черного цвета) и у Ornithocheyletia sp. (от желто- го до оранжевого). В среднем единоразовый прием пищи клещами не- велик. При питании личинок В. chanayi кровь заполняет весь кишечник (1,2 X 10 ~ им'), нимф — '/2 его часть (3,2 X 10 ' мм'), самок — '/s (2Х10 ' ммз). Такие же пропорции в заполнении кишечника лиифой наблюдаются и у Ornithocheyletia sp. Следует отметить, что умеренное количество поглощаемой пищп не влечет за собой увеличения размеров эктопаразитов при питании. У из- учаемых хейлетид, в отличие от иксодовых клещей (Балашов, 1967), не наблюдается также и явления прогона крови и продуктов ее пере- работки сквозь кишечник (Горголь, 1983б). Характерной особенностью питания клещей В. chanayi и Ornitho- cheyletia является также и то, что в периоды миграций хозяев они воздерживаются от питания. В окраске кишечника преобладают темные тона, гистологический анализ указывает на поздние этапы переварива- ния. Летом, в период гнездования, а также при прерывании миграций птиц и содержании их в лабораторных условиях зимой активность клещей к питанию резко возрастает. Особенно наглядно это демонстрируется на примере гематофага В. chanayi, кишечник которых при заполнении кровью становится алым. Изучение освоения хейлетидами различных экологических ниш, характер- ных для хищных и паразитических форм, может оказаться полезным в поисках путей возникновения паразитизма в семействе. Хищные хейле- тиды, особенпо такие, как широко распространенный в различных местах обитания Ch. eruditus (Волгин, 1969), часто концентрируются в гнездах и убежищах животных, в которых на пищевых запасах хозяина или на других органических остатках поселяются мелкие членистоногие. особен- но клещи амбарного комплекса (акароидные) — основная питца этого хищника. Для некоторых видов хищных хейлетид, например, из рода' Eucheyletia, такое обитание в гнездах других животных (нпдиколия) стало единственно возможным. Естественпо, что стаповление болес тес- ных связей нидиколов с хозяином гнезда, переход к временному и ли постоянному обитанию на его теле — это следующий шаг в специа ",èçà- ции клеща. Клещи трибы CheIetosomatini остановились как бы на пол- пути. Этп хейлетиды, обитая IIa теле чайковых (в очинах их перьев), остались тем не менее хищниками, поедающими мелких перьевы~ кеиле- тидных клещей сем. Syringophilidae (Волгин, 1959; Балашов, 1982}. Выбор хозяина (гостальная специфичность} и иеста па его теле (специфичность топическая} плзпострпруется уже предыдущим прп.т ром. но особенно характерны эти обе формы специфичности настоящим пара- зитам, таким, как изучаемые пами В. chanayi и Ornithocheyletia . р. иan описанньп| в литературо парязитам домашних млекопитающих — О~еу1е- tiella yasguri (Foxx, Ewing, И69) и др. Паразитические виды. ",àíèìàÿ такие предельно узкие места ооитания, как определенные точки ца теле животного-хозяина, избегают конкуренции с экологически близкими видами. У хейлетпд два экологически близких клеща — В. chanayi и O~ni-
tbocheyletia sp. при совместном заражении одного хозяина занимают на его теле тем не менее пе совпадающие области. Да и питаются они не одной и той же пищей — кровью и лимфой. Характерно, что оба вида не вызывают на коже птиц ярко выраженных патологических изменений. По-видимому, углубление специфичности паразитических хейлетид идет по пути уменьшения патологического воздействия на хозяина. Этому, вероятно, способствует и режим питания клещей на хозяине, вернее, его щадящий характер, поскольку в наиболее напряженные моменты жизни птиц — при перелетах — клещи, судя по окраске их кишечника, питают- ся редко. Цаконец, заслуживают внимания такие стороны специфичности паразитических хойлетид, как поражение ими преимущественно молодых птиц кустарнико-лесного комплекса, переход клещей с одной взрослой особи на другую, освобождение птиц от паразитов в период зимовки и нарастание численности клещей в гнездовый период. В целом сезонная динамика плсленности В. chanayi и Ornithocheyletia sp., круг их хозяев, экстенсивность и интепсивность заражения последних, указывают па то, что развитие, размножение и питание этих клещей связано с гнездовым периодом птиц и сроками, предшествующими ему или следовавшими за ним, но не с периодом зимовки. Последняя служит важным моментом, регулирующим гостальпую специфичность на не характерных для из- учаемых паразитов хозяевах. Следует также подчеркнуть, что переход хейлетид к нидиколил (обитанию в гнездах), синойкии (обитанию на хозяине) и паразитизму предполагают и различное отношение ni к термогигроусловиям обитания. Для свободноживущих хейлетид (Ch. ei'uditus, Ch. lepidopterorum и др.) эти условия, наряду с доступностью объектов питания, служат опреде- ляющими ф>акторами размножения и развития. У аразитов и сожителей эти параметры срецы в значительной мере регулируются самим хозяином, хотя пе последпюю роль в этом играют и паутинные тенты-чехлики, под защитой которых живут, питаются, раз- множаются и развиваются некоторые клещи. Значение и роль их рас- сматриваются более подробно ниже. В популяциях хищного клеща Ch. eruditus крайне редко встречают- ~я самцы, что отражает общую для семейства тендепцию партеногенети- ческого развития видов (Boczek, 1956; Волгин, 1969), а в данном случае, вероятнее всего,— факультативного партеногенеза. Д. Х. Оливер (Oliver, 1971) отмечал, что первое детальное сообщение о партеногенезе у клещей было сделано в 1886 г. (Reck, цит. по: Oliver, 1971) на основании изуче- ния трех генераций Cheyletus sp., в которых отсутствовали самцы. В даль- нейшем эти наблюдения подтвердились, что послужило признанием того, что в данном случае имеет место агамное размножение. Партеногенез у свободноживущих видов подкрепляется отбором, если он дает популяции какие-либо весомые преимущества (Смит, 1981). На наш взгляд, одним из факторов, направляющих отбор у Ch. eruditus по этому пути, служит не столько редкость встречи половых партпоров, сколько, прежде всего, чрезвычайно развитый у Ch. eruditus каннибализм. B лабораторпых культурах Ch. егий1из значительный процент жертв B3poc JIbIx самок составляют неполовозрелые особи своего вида. В усло- виях, когда объектом питания самок становятся любые более мелкие особи своего вида, партеногенетические популяции получают безусловное преимущество. По-видимому, с каннибализмом Ch. eruditus связан у этого вида 104
и такой элемент репродуктивного поведения, как активная охрана своих яйцекладок от хищников, в том числе и от особей своего вида. У Ch. lepi- dopterorum, у которых каннибализм менее развит, а каждое яицо укрыто, самки не охраняют яйцекладку, а их забота о потомстве ограничивается пассивным укрытием яиц. Такая пассивная форма заботы о потомстве у хищных и паразити- ческих хейлетид обеспечивается присущим им паутинонрядением, строи- тельством из паутины укрытий для яиц, а иногда и неполовозрелых фаз развития п даже для взрослых особей (например, у В. chanayi и Ornitho- cheyletia sp.). Причем активная и пассивная забота о потомстве допол- HHIoT друг друга. Может быть выстроен сравнительный ряд по нараста- нию сложности паутинных сооружений и одновременно по снижению уровня активной охраны яйцекладки: Ck. eruditus — яйца без паутины, приклеиваются, охраняются самкой; Eucheyletia flabelttfera — яйце- кладка покрыта паутинной сетью, охраняется (Michael, 1886); СЙ. lepi- dopterorum — индивидуальные сеточки над каждым яйцом, не охраняют- ся; Cheyletiella yasguri — яйцевой кокон в шерсти млекопитающих (вре- менный), пе охраняется (Foxx, Ewing, 1971); Ornithocheyletia sp.— индивидуальные постоянные чехлики для яйца, развивающегося клеща и взрослой особи без охраны; Bakerickeyla сйапау~ — чехлики групповые, постоянные для всех фаз развития и для взрослых особей, не охраняются (см. рпс. 39, 40). Сооружаемые укрытия для яиц играют важную роль в жизни этих клещей и молоди. Конечно, сооружение таких укрытий возможно благо- даря способности свободноживущих хищных и особенно паразитических хейлетид к паутинопрядению. Выделение паутины было отмечено и у других тромбидиформных клещей (Grandjean F., 1948; Alberti, 1973: Ha- zan, Gesson, Tahori, 1974; Ланге, Дроздовский, Бушковская, 1974; Alberti, Ehrnsberger, 1977). В перечне функций, которые приведены в наиболее подробной работе по паутинопрядению у них (Alberti, Ehrnsberger, И77), указывается, что у хищных клещей-бделлид паутина служит для защиты неполовозрелых стадий развития, а также для опутывания превосход»- щей по размерам хищника жертвы. Что касается паразитирующих па теле животных тромбидиформных клещей, то выделение ими паутины рассматривалось скорей как любопытный парадокс (Foxx, Ewing, 1969; Furman, Sousa, 1969). Действительно, строительство из паутины своеобразных тентов или чехликов па поверхности другого организма чаще всего наблюдается у растительноядных клещей, например, тетранихид (рис. 66). Причем аналогия формы и функция чехликов клещей рода Schizotetranychus, с одной стороны, п В. chanayi и Ornithocheyletia sp.— с другой, заходит очень далеко (Вайнштейн, 1960). Как следует из наших наблюдений, че~л1и;и клещей ~chizotetranychus bambusae, как и В. chanayi,— группо- вые, лод ними обитают неоольшие колонии этих фитофагов (рис. 66). Другой вид — Schizotetranychus recki — сооружает чехлики, которые больше соответствуют чехликам клещей Ornithocheyletia sp. (рис. 66). Выявление способности у клещей В. chanayi и Ornithocheyletia sp. выделять паутину и строить из нее групповые и индивидуальные чехлики заставляет рассмотреть паутинопрядение клещей семейства Cheyletidae с точки зрения адаптации их к паразитическому образу жизни. Простое сравнение конечностей представителей родов Bakericheyla и Ornithochey- letia (Волгин, 1969) показывает, что у этих клещей отсутствуют какие- либо хорошо развитые морфологические структуры фиксации на теле 11 9 — 3893 105
птиц, как, например, у перьевых клещей (Дубинин, 1951) . Коготки (амбулакры), судя по их строению, также не могут служить этой цели, а обеспечивают хождение и фиксацию на паутине, подобно такой же функции у тетраниховых клещей (Вайнштейн, 1960) (см. рис. 25) . Вопрос о функции онихиального аппарата подробно рассмотрен на при- мере клещей Ornithocheyletia hallae (Haarlov, Morch, 1975), однако ука- занные авторы не обнаружили паутинную пряжу, полагая, что коготки и амбулакры обеспечивают свободное перемещение клещей по много- численным гифам симбиотического гриба, поразившего кожу птиц. Не исключено, что в данном случае гифы гриба Micromonospora chalcea, обнаруженные на сильно пораженном экземпляре голубя, маскировали наличие паутинной пряжи, хорошо заметной при умеренном поражении. Таким образом, паутинные чехлики изученных нами хейлетидных клещей В. chanayi и Ornithocheyletia sp. слунсат защитой неноловозрелым фазам развития, позволяют стабилизировать термогигроренсим. Кроме того, под ними живут и питаются взрослые особи эктопаразитов, не имеющие органов прикрепления на поверхности тела хозяина. для кото- рых характерна высокая двигательная, в том числе и полетная актив- ность. Не исключено, что чехлики могут играть определенную роль и в защите эктопаразитов от очистительной деятельности хозяев птиц, одна- ко эта их функция представляется второстепенной.
ЗАЕЛЮЧЕНИЕ Анализ мест обитания изучаемых клещей свидетельствует о чрезвычайно широкой адаптивной зоне семейства Cheyletidae. Действительно, среди этих клещей-саркофагов (Беклемишев, 1970), т. е. питающихся псивот- ной пищей, есть свободноживущие, нидикольные и обитающие на других животных формы, часть же видов стала настоящими эктопаразитами. В то же время внешне, да и по особенностям строения и функциониро- вания ряда систем внутренних органов все хейлетиды весьма однообраз- ны. Казалось бы, если в качестве примера мы возьмем это семейство, идея Э. Майра (1974) о том, что каждый, дансе крупный, четко очерчен- ный таксон имеет определенный экологический смысл, может быть под- вергнута сомнению. Вероятно, поэтому в последнее время единое семей- ство Cheyletidae было подразделено на два самостоятельных семейства хищников и паразитов (Smiley, 1960). Однако даже такое деление не устраняет это сомнение, так как два новых семейства остаются тем не менее систематически весьма близкими. По-видимому, в семействе Chey- letidae переход от хищничества к паразитизму, переход, который у целого ряда клещей (Беклемишев, 1970; Балашов, 1982) совершался неодно- кратно и самостоятельно, не носил столь принципиального в смысле освоения новой адаптивной зоны значения, как у другик животных, поскольку в большой степени был облегчен целым рядом морфофункцио- нальных черт преадаптивного характера. К таким чертам относится, прежде всего, универсализм колюще-сосущего ротового аппарата, что позволяет хищникам и паразитам использовать в качестве п~пцп любые жидкие ткани животных (гемолимфу членистоногих, кровь п лимфу позвоночных) . Учитывая, что обладание таким ротовым аппаратом сопряжено у хейлетид с малыми размерами тела, т. е. со свойством, которое во многом, как считают (Ланге, 1962; Bernini, 1986), определило эволюционную судьбу клещей в целом, следует признать, что однотипная специализа- ция в способе поглощения пищи не ограничила все же освоение койлс- тпдам весьма различных экологических ниш. В то же время обладание практически неизменной морфофункциональной органп~ацпей ие позво- лило хейлетидам, рассматриваемым в рамках единого семейства, или двук блпзких семейств, выйти в принципиально новые адаптивные (С11мпсон, 1948) зоны. Как показывает анализ представителей всего надсемейства Cheyletoidea освоение таких зоп требовало существенных морфофункцио- нальных перестроек внешних и внутренних органов. В результате пред- ковые формы хейлетоидных клещей и дали ряд паразитическпх форм, группируемых в настоящее время в 8 семейств надсемейства Cheyletoidea, из которых лишь рассматриваемое (сем. Cheyletidae) включает и свобод- ноживущих клеще~~, а все остальные представлены паразитами. Среди 107
последних встречаются, согласно классификации В. Н. Беклемишева (1970) и Ю. С. Балашова (1982), постоянные эктопаразиты, вкохсные, полостные и даже тканевые эндонаразиты змей, птиц, сумчатых, насеко- моядных, рукокрылых, грызунов и хищных млекопитающих. В семействе Chey1etidae паразиты, по той же классификации, представлены времен- ными и отчасти постоянными эктопаразитами, а хищники — свободно- живущими и нидикольными формами, а также комменсалами. Это пока- зывает, что во взаимоотношениях с другими животными клещи сем. Cheyletidae не продвинулись так далеко, как это сделали представители других семейств надсемейства. По-видимому, переход некоторых хейле- тид к паразитическому ооразу жизни наступил позже, чем это совершили пре;и;и други«семейств надсемейства. В результате основные системы органов паразитов пе претерпели значительных изменений по сравнению со свободноживущими «оилотидами. Тем ие менее определенные, хотя и не принципиальные изменепи я в организации паразитических хейле- тид все же произошли. В скелетно-мышечной системе паразитически«хейлетид изменения коснулись прежде всего формы и размеров ходильных конечностей, а также QTIiocHTeJIbIIbI« усилий па и«вершинах. У паразитов становятся короче членики не только базального, но и терминального комплекса (см. табл. 2), а в ряде случаев — развиваются скелетные кутикулярные образования педипальп, обеспечивающие закрепление клещей иа теле хо- зяев. Кроме того, у паразитических видов уменьшается количество дор- сальных щитов идиосомы (остается лишь передний). Ротовой аппарат, как уже упоминалось выше, у паразитических форм изменился мало. Так же мало изменилась передняя кишка. Что касается средней кишки, то у кровососущих паразитических хейлетид появляется анатомическая связь ее с экскреторным органом, который помимо экскреторной функции обеспечивает такнсе удаление из кишеч- ника непереваренных остатков крови позвоночных. По сравнению с хищными «ейлетидами у кровососущих хейлетид морфологически и функционально разнообразнее клетки эпителия средней кишки, специализированные для выполнения определенных функций— начальных этапов полостного пищеварения, фагоцитоза, пиноцитоза, а также вторичной переработки и хранения запасных вешеств в виде гликогена и липидов. Экскреторный орган паразитических хейлетид также функционально более дифференцирован, он объемнее, чем у хищных, обеспечивает кроме функции выделения реадсорбцпю нутрпентов и даже переваривание пищи под покровом перптрофической мембраны. В связи с переходом к паразитизму у некоторых хейлетид активи- зируется паутинопрядение за счет развития дополнительных проподосо- мальных желез, выполняющих роль паутинных. Характерно, что исполь- зование паутины в качестве средства фиксации на теле хозяина парази- тическими видами семейства Cheyletidae является, по-видимому, тупико- вым, эволюционно мало перспективным, так как развития у постоянных экто- и эндопаразитов других хейлетоицных клещей пе получает. Что касается функциональной специализации отдельных ироподосомальных желез хейлетид к паразитизму, то она весьма разнообразна и у предста- вителей даже близких родов гомологичные железы часто выполняют различные функции — слюнных, паутинных, а возможно, и ядовитых желез. Трубчатые железы, являющиеся по происхождению коксальными, не претерпевают при переходе хейлетид к паразитизму каких-либо зна- i08
чительных изменений. Практически неизменными остаются при этом респираторная и репродуктивная, а также некоторые другие системы органов. Весьма интересны в связи со становлением паразитизма экология и этологические особенности представителей семейства Cheyletidae. На их примере прослеживаются не только все большая специализация, сужение экологических ниш, но и как закономерное завершение этого процесса— переход хейлетид к паразитированию. Правда, переходом к обитанию на теле других животных специализация экологических ниш хейлетид не завершается, а становится все оолее дробной, захватывая, например, определенные участки тела или определенный возраст ~кивотных. В то же время по сравнению с паразитами из целиком паразитических семейств хейлетоидных клещей с присущей им узкой специализацией к отдельным видам хозяев, постоянные эктопаразиты из сем. Cheyletidae отличаются более широкой гостальной специфичностью, встречаясь не на одном, а на ряде видов и дах'е родов теплокровных позвоночных. Кстати, на холоднокровных позвоночных паразитические клещи семейства Cheyle- tidae не обитают. Морфофункциональный анализ адаптации хейлетид показывает, что, во-первых, эволюция их органов проис«одила по типу различных модусов органогенеза и, во-BTopbIx, по многим признакам она вела не к упро- щенихо, а к углублению их организации и функции. Примерами модусов органогенеза «ейлетнд прп переходе их к пара- зитизму могут быть; расширение и пххтенспфикацпя функций экскретор- ного органа, средней кишки, проподосомальных желез; субституция функ- ций альвеолярных желез, ставших паутинными и т. д. По содержанию эти модусы первичны, элементарны (Тимофеев-Ресовский, Воронцов, Яблоков, 1977) и связаны с менее значительными качественными изме- нениями. Характерно, что специализация затронула преимущественно проиодосомальные железы и органы пищеварительной системы, приведя их строение и функции к усложнению у паразитических видов семейства. Таким образом, по направленности путей эволюционных изменений Cheyletidae — одно из центральньхх семейств тромбидххформньхх клещей в целом. В этом семействе прослеживаются начальные этапы тенденций, которые были реализованы в других более специализировапных и освоив- хпих новые адаптивные зоны семеххствах тромоххдиформньхх клещей. У хейлетид хорошо представлепы свободноживущие и иидикольныс хищники, комменсалы, обитающие на теле други«животных, постоянные эктопаразиты — кровососы. У них памечается направление к обитанию в экссудате поврежденной кожи (у клещей рода Cheyletiella), осуществ- ленное вкожными паразитами из семейства 0emoclecidae. 8 то ~ке время HH одно из этих направлений эволюционных преобразований у предста- вителей семейства Cheyletidae не доведено до логического заверсцения, т. е. до освоения принципиально новой адаптивной зоны. В этом уникаль- ность рассматриваемого семейства, его немаловажное значение для пони- мания путей эволюции многих тромбидиформных клещей. Завершая обзор хищных и паразитически««ейлетид, следует оста- новиться на практическом зпачении, которое имеет или может иметь эта группа клещей. Хищные «ейлетиды давно привлекали впимание иссле- дователей как возможные регуляторы численности вредны«насекомы~ и особенно клещей амбарного комплекса. Предварительные исследования по этому вопросу, а также прямые опыты по регулирова~ппо численности акароидных клещехх хищньхъххх вххдами (Смарагдова, 1936; Родионов, Фур- 409
ман, 1940; Norris, 1958; Boczeli, 1959; Solomon, 1969) показали, что, напри- мер, Ch. eruditus обладает значительными потенциальными способностями для уничтожения вредителей продовольственных запасов, не усугубляя при этом гигиенических норм хранения последних. Возможность успешного уничтожения акароидных клещей Acarus siro и Glycyphagus destructor с помощью Cb. eruditus стала даже основой технологических принципов и рекомендаций биологического метода борьбы с вредителями в зернохранилищах Чехо-Словакии (Pulpan, Verner, 1965). Однако мы не думаем, что в больших масштабах этот метод может быть конкурентноспособным и заменит эффективные и давно вошедшие в практику газовые обработки и сушку зерна. На наш взгляд, применение Ch. eruditus будет более оправдано в тех случаях, когда в борьбе с акароидными клещами ни химические препараты, ни термическую обработку использовать нельзя. Такие об- стоятельства, как показывает наша практика, постоянно возникают при хранении кипофотоматериалов, в которых вредители повреждают жела- тиновый слой, и музейных экспонатов. Пока же вопрос о широком внедрении в практику Ch. eruditus оста- ется открытым, несмотря на то что эти активные хищники обладают большой агрессивностью к своим жертвам — акароидным клещам. Оцеиивая практическое значение хейлетид, нельзя также забывать, что многие»ищные хейлетиды — естественное звено цищевых цепей в сообществах животных. Устранение такого звена, чаще всего случайное, может нарушить соотношение численности отдельных видов и привести к вспышке размножения мелких фитофагов или акароидных клещей, численность которых регулируется хейлетидами. По сравнению с эффективной деятельностью в качестве хищника, весьма парадоксальными выглядят сообщения о случаях паразитирования Cb. eruditus на человеке, обнаруженного в ушных раковинах и в верхних дыхательных путях (Pierse, 1921; Riley, Johansen, 1938; Carter, Wedd, D'ÀÜrårà, 1944). Этп случаи можно было бы рассматривать как примеры крайней степени запущенности и антисанитарии, но, по мнению авторов указан- ных наблюдений, Ch. егийЫя были причиной развития дерматитов и приводили к затруднению дыхан:1я у пациентов. Вероятнее всего, упомянутые выше патологии представляют собой последствия индивидуальных аллергических реакций людей ыа контакт с любыми клещами, в том числе и с Ch. eruditus. Возможно, что указан- ные явления связаны с деятельностью других (паразитических) видов хейл етид. Как паразиты млекопитающих хорошо известны виды рода Cheyleti- ella. У домашних кивотных (кошек, собак, кроликов) и часто у нахо- дящихся с ними в контакте людей они вызывают острые дерматиты- хейлетиэллезы (Волгин, 1969; Wikerhauser, 1986) . Практическое значение клещей В. chanayi, Ornithocheyletia sp. и других паразитов вытекает из способа Нх существования — кругложиз- ненвого и постоянного паразитизма. Помимо непосредственного воздей- ствия этих членистоногих на организм хозяев они, по всей видимости, вполне могут участвовать в циркуляции возбудителей различных забо- леваний. Прежде всего, следует отметить, что характер пищи этих эктопара- зитов ведет к потере крови и лимфы хозяев. Особенно неблагоприятный эффект это производит при высокой интенсивности заражения птиц. 110
3 также в периоды их перелетов, когда энергетические ресурсы миграп- тов и без того истощены. Обладая колюще-сосущим ротовым аппаратом, В. chanayi и Ornithocheyletia sp. способны получать пищу непосредствен- но из кровяного русла и тканевой жидкости хозяев. Это вызывает беспо- койство птиц и они пытаются освободиться от эктопаразитов, что неодно- кратно наблюдалось при лабораторном содержании птиц. Однако степень патогенного воздействия этих клещей все же меньше, чем других лимфо- и гематофагов. Места контактов изученных нами видов хейлетид с покровами хозяев лишены видимых патологических изменений. Не наблю- дается инфильтрации тканевой жидкости, отсутствуют папиллы, не раз- виваются дерматиты, что характерно для жизнедеятельности иксодовых, краснотелковых, а также некоторых других хейлетидных клещей — Chey- letiella parasitivorax, Ch. yasguri (Cooper, 1946; Olsen, Roth, 198 ). Такой щадящий прокормителя режим питания и его биологический эффект являются, по всей видимости, одной из форм адаптации В. chanayi и Ornithocheyletia sp. к длительному и постоянному паразитизму, а также свидетельствует о том, что характер связи разных видов хейлетид- постоянных эктопаразитов позвоночных — неодинаков. Что касается эпидемиологического значения изученных нами пара- зитически«видов, то в литературе такие сведения отсутствуют, а нами этот вопрос не исследовался. Однако потенциальное участие клещей В. chanayi n Ornithocheyletia sp. в циркуляции возбудителей различных заболеваний теоретически возможно, поскольку в настоящее время все кровососущие членистоногие (Павловский, 1946; Балашов, 1982) подозре- ваются в хранении и переносе патогенных возбудителей. На реальность такой возможности указывают также результаты сравнительно-морфоло- гического анализа (Беклемишев, 1970) экологических и функциональ- ных особенностей изученных нами хейлетид и известных переносчиков возбудителей ряда заболеваний — иксодовых клещей (Балашов, Дайтер, 1978; Балашов, 1982). К тому же клещи В. chanayi и Ornithocheyletia sp. паразитируют на таки«видах птиц, которые являются хранителями мно- жества возбудителей болезней вирусной, хламидийной, риккетсиозной и бактериальной природы (Павловский, Токаревич, 1966; Воинов, 1979).
СПИСОК ЛИТЕРАТУРЫ Айзенштадт Т. Б. Цитология оогенеза.— М.: Наука 1984.— 247 с. Акимов И. А. Строение пищеварительной системы корневого клеща Rhizoglyphus echinopus Fum et Rob. (Acariformes АсагоЫеа) // Вести. зоол.— 1975.— Х 3.— С. 66 — 72. А к имо в B. А. Биологические основы вредоносности акароидных клещей.— Киев: Наук. думка, 1985.— 160 с. А кимов И. А., Барабанова В. В. Некоторые особенности пищеварения клещей Cosmoglyphus absoloni, Samsinali, 1961 и Coleochaeta molitor, Volgin et Akimov// Докл. АН УССР. Сер. Б.— 1976а.— K 7.— С. 643 — 644. Акимов 11. А., Барабанова В. В. Пищеварительные ферменты некоторых акароидных клещей // Там же.— 1976б.— _#_ 6.— С. 547 — 549. Акилсов И. А., Барабанова В. В. Морфологические и функциональные особенности пищеварительной системы тетраниховых клещей (Trombidiformes, Tetrauycboi- dea) // Энтомол. обозрение.— 1977.— 56.— С. 912 — 922. Акимов B. А., Барабанова В. В. Влияние особенностей питания акароидных клещей на активность их пищеварительных ферментов // Экология.— 1978.— N f.— С. 643 — 644. Акимов И. А., Горзоль В. Т. Строение и функции пищеварительной систелсы клеща BakericheyIa chanayi (Trombidiformes, CheyIetidae) — зктопаразита птиц,/ Па- разитология.— 1984.— 18 вып. 1.— С. 15 — 23. Акимов И. А., Горголь В. Т. Паутипопрядение у клещей-хейлетид — паразитов птиц (CheyIetidae, Ornithocheyletini) // Паразитология.— 1986.— 20, вып. 3.— С. 214— сЧ9. Акилсов И. А., Горзоль В. Т. Морфологические и функциональные основы трофиче- ской специализации к хищничеству клеща Cheyletus eruditus (Trombidiformes, Cheyletidae) // Вестн. зоол.— 1987.— R 5.— С. 49 — 53. Акилсов И. А., Старовир И. С. Морфофункциональные особенности пищеварительной системы клеща Phytoseiulus persimilis Athias-Henriot // Там же.— 1974.— М 4.— С. 60 — 64. Акимов И. А., Старовир И. С. Строение пищеварительной системы клещей Arnbly- seius andersoni и Amblyseius reductus (Parasitiformes, Phytoseiidae) // Гам же.— 1976.— _#_ 4.— С. 7 — 13. Акимов И. А., Старовир Л. С., Ястребцов А. В., Горголь В. Т. Клещ Варроа — возбу- дитель варроатоза пчел (морфологический очерк). — Киев: Наук. думка, f988.— 120 с. А кимов И. А., Ястребцов А. В. Строение и функции мышц рогового аппарата я конечностей обьнсновенного паутинного клеща С. L. КосЬ (Trombidiformes, Tetranychoidea) // Вестн. зоол.— 1981.— R 3.— С. 54 — 59. Амосова Л. Л. Ультратонкое строение покровов клеща Hyalomma asiaticus Р. Sch. et Е. Schl. при голодании и питании // Паразитология.— 1975.— 9, вып. С. 412 — 418. Бабаева А. Г., Шубникова Е. А. Структура, функция и адаптивный рост слсонных желез.— М.: Изд-во Моск. ун-та 1979.— 192 с. Балашов Ю. С. Гистологические особенности пищеварения у иксодовых и аргасовых клещей // Паразитол. сб.— 1957.— 17.— С. 137 — 167. Балашов I0. С. Строение органов пищеварения и переваривание крови аргасовыми клещами // Там же.— 1961.— 20.— С. 185 — 225. Балашов Ю. С. Кровососущие клещи (Ixodoidea) — переносчики болезней человека и животных.— Л.: Наука, 1967.— 318 с. Балашов Ю. С. Атлас электронно-микроскопической анатомии иксодовых клещей.— Л.: Наука, 1979.— 256 с. Балашов Ю. С. Паразито-хозяинные отношения членистоногих с наземными позво- ночными.— Л.: Наука, 1982.— 251 с. 112
Балашов Ю. С., Дийтер А. Б. Кровососущие членистоногие и риккетсии.— 3.: Наука„ 1973.— 261 с. Балашов IO С., Райхель А. С. Электронно-микроскопическое исследование мальпи- гиевых сосудов клеща Нуа1ошма asiaticum Р. sch. et Е. Schl. Е Голодающие самки // Паразитология.— 1973.— 7 вып. 3.— С. 231 — 237. Балашов Ю. С., Райхель А. С. Электронно-микроскопическое исследование экскретор- ной системы голодающих самок клеща Hyalomma asiaticum P. Sch. et Е. Schl. II сообщение //Там же.— 1975.— 9, вып. 3.— С. 252 — 259. Бала шов Ю. С., Райхель А. С. Ультратонкое строение эпителия среднего отдела кишечника нимф Нуаlошта asiaticum (Acarina, Argasidae) во время питания// Там же.— 197о.— 10 вып. 3.— С. 201 — 209. Балашов Ю. С., Райхель А. С. Ультратонкое строение среднего отдела кишечника нимф Ornithodorus papillipes (Acarina, Argasidae) во время питания//Там же.— 1978.— 12, вып. 1.— С. 21 — 26. Барабанова В. В. Морфологические и функциональные особенности пищеваритель- ной системы некоторых тетраниховых клещей (Trombidiformes, Tetranychoidea) в связи с характером питания: Авгореф. дис.... канд. биол. наук.— Киев 1973.— 23 с. Бей-Биенко Г. Я. Общая энтомология.— М.: Высш. шк. 1980.— 416 с. Беккер Э. Г. Челюстной аппарат паутинного клещика Tetranychus telarius Ь. и его отправления в связи с вопросом о химической борьбе с клещиком // Зоол. журн.— 1935.— 14, вып. 4.— С. 637 — 654. Беккер Э. Г. Родственные связи клещей по анатомическим данным//Вестн. Моск. ун-та.— 1957.— М 4.— С. 3 — 16. Беккер Э. Г. К вопросу о естественности отряда Асаппа//Вопросы морфологии и филогепии беспозвоночных.— М.: Изд-во Ail СССР, 1959, вып. 5.— С. 151 — 163. Беклел~ишев В. П. Паразитизм членистоногих на наземных позвоночных. 2. Основ- ные направления его развития// Л[ед. паразитология и паразитарные заболева- ния.— 1954.— K 1.— С. 3 — 20. Беклел~ишes В. Н. Основы сравнительной анатомии беспозвоночных. Т. 2. Органо- логия.— М.: Наука, 1964.— 446 с. Бек ze~~ u uc e s В. И. био цепологи ческтте основы сравнительной паразитологии.— М.: Наука, 1970.— 502 с. Белозеров В. Н. К биологии и анатомии клеща Poecilochirus necrophori Vitzt. (Para- sitiformes, Parasitidae) // Зоол. хсурн.— 1957.— 36, вып. 12.— С. 1802 — 1812. Березинцев А. Ю. Анатомия взрослых фаз клещей Campylothrombium Ьогеае Вег1. и Echinothrombium spinosum Can. (Acarina, Trombidiidae) // Вести. Ленингр. ун-та.— 1980.— М 37.— С. 14 — 21. Бэккер Э., Уар тон Г. Введение в акарологию.— М.: Изд-во иностр. лит.— 195Æ— 476 с. Вайкштейк Б. А. Тетраниховые клеши Казахстана (с ревизией семейства) //Тр. НИИ защиты растений Каз. Акад. с-х наук.— 1960.— 5.— 375 с. Воинов И. Н. Вирусологические ас пекты медицинской орнитологии.— Минск: Вишэттж шк., 1979.— 127 с. Волаик В. И. Клещи семейства Cheyletidae мировой фауны.— Л.: Наука, 1969.— 432 с. Волгии В. П. Семейство Cheyletidae// Определитель обитатощих в почве клещей.— М.: Наука, 1978.— С. 17i — 172. Вол г1с и 8. O., Н ц кол Певи .О. И. О ла р;1зптизме хищных клещей рода iVeochc.ylotiella Ва~ег (Асаг~па, Cheyletidae) // T1i. Зоол. ин-та ЛН СССР.— 1965.— 35.— С. 300— 304. Герловии Е. Ш., Утех~~к В. П. Секреторные клетки.— М.: Знание (новое в жизни, науке и технике. Сер. 1~).— 1979.— X 9.— 69 с. Гиляров Л. С. Закономерности приспособлепий членистоногих к жизни на суше.— М.: Наука.— 1970.— 276 с. Горголь В. Т. Находка клетца Bakevicheyla chanayi на мелких воробьиных в Киев- ской области // IX конф. Укр. респ. науч. о-ва паразитол.: Тез. сообщ.— Львов 1980. Киев: Наук. цумт"а, l980.— С. 160 — 161. Горголь В. Т. Специализация к паразитизму клещей Bakerichoyla chanayi (Trombi- diformes, Cheyletida0) // Вестн. зоол.— 1982.— М 4.— С. 48 — 51. Горголь В. Т. Паразитические клещи Ornithocheyletia sp. (Trombidiformes, Cheyleti- dae) //Там же.— 1983a.— № 3.— С. 71. Горголь В. Т. Некоторые особенности трофической специализации клеща Bal;eri- cheyla сЬапау~ // И Всесотоз. съезд паразитоцеол.: Тез. сообщ.— Киев: Наук. думка, 1983б.— С. 82. 113
Горголь В. Т. Железы просомы клеща Anystis bnccarum // 1Х съезд Всесо1оз. энто- мол. о-ва: Тез. сообщ.— Киев: Наук. думка.— 1984.— С. 119. Горголь В. Т. Особенности строения и фупкционирования пищеварительной систе- мы некоторых клещей-хейлетид в связи с их хищничеством и паразитизмом: Автореф. дис.... канд. биол. наук.— Киев 1985.— 23 с. Горголь В. T. Пути специализации пищеварительпой системы клещей семейства Cheyletidae // V Всесоюз. акарол. совещ.: Тез. докл. Фрунзе: Илим, 1985. Горголь В. Т. Специализация к паразитизму клещей Ot nithocheyletia sp. (ТгошЫ- diformes, СЛеу1е1Ыае) //Х конф. Укр. о-ва паразитол.— Киев: Наук. думка, 1986.— Ч. 1.— С. 152. Горголь В. Т., Барабапова В. В. Активность некоторых пищеварительных ферментов как показатель хищничества клеща Cheyletus eruditus (Trombidiformes, Chey- letidae) //Докл. АН УССР.. Сер. Б.— 1979.— N 10.— С. 855 — 858. Горголb В. Т., Полуда А. N. Гостальная специфичность хейлетпдных клещей Ba- kericheyla снап ayi (Trombidi form es, Cheyle tid ае) облигатных паразитов птиц // Весты. зоол.— 1984.— М 1.— С. 68 — 69. Горголь В. Т., Ястребцов А. В. Мышечная система клеща Cheyletus eruditus (Trombi- diformes. Cheyletidae) //Там же.— 1987.— М 2.— С. 60 — 67. Горголь В. T., Ястребцов А. В. Скелетно-мышечная система некоторых «лещей- хейлетпч (Тrombidiformes, Cheyletidae) // Вестп. зоол.— 1989.— Л 4.— С. 74— 82. Джафаров Г. Э. Электропно-микроскопическое исследование пирамидальных альвеол слюнных желез некоторых клещей // Электронная и флтооресцентяая микро- скопия клетки.— М.: Изд-во AH СССР.— 1964.— С. 31 — 37. Дин Р. Процессы распада в клечке.— М.: Мир 1981.— 120 с. Догель В. А. Курс общей паразитологии.— Н.: Учпедгиз 1947.— 372 с. Дубинин Б. Б. Особенности линьки оперения «рыльев у некоторых воробьиных // Природа 1947.— K 12.— С. 61 — 62. Дубинин 8. Б. Перьевые клещи (Analoesoidea) . Ч. 1. Введение в их изучение.— М.; Л.: Изд-во AEI СССР, 1951.— 364 с. Заварзин А. А. Осповы частпой цитологии и сравнительной гистологии многоклеточ- ных животных.— Л.: Наука 1976.— 411 с. Завар зин А. А. Основы сравнительной гистологии.— Л.: Изд-во Ленинград. ун-та 1985.— 182 с. Заварзии А. А., Харазови А. Д. Основы общей цитологии: Учебное пособие.— Л.: Изд-во ЛГУ, 1982.— 240 с. Х1ваиоsa-Газас О. М. Сравнительная эмбриология беспозвоночных животных. Члени- стоногие.— М.: Наука. 1979.— 223 с. Иоффе 11. Д. Строение мозга Dermacentor pictus //Зоол. журн.— 1963.— 42 Кп 10.— С. 1472 — 1484. Ланге А. Б. Строение ротовых органов и система клещеобразных (Chelicerata) // Вопр. общ. зоологии и медицинской паразитологии.— М.: Медгиз 1962. С. 455. Ланге А. Б., Дроздовский Э. М., Бушкоггкая Л. М. Клещ анистис — эффективный хищник мелких фитофагов // Защита растений.— 1974.— г е 1.— С. 26 — 28. Л1аоилов И. Л1. Фауна клещей воробьев и их гнезд в Киргизии//V Всесоюз. акарол. совещ.: Тез. докл. Фрунзе: Илим.— 1985.— С. 195 — 196. Ми йр 3. Принципы зоологической систематики.— М.: Мир 1971.— 441 с. .Чайр Э. Популяций, виды, эволюция.— М.: Мир, 1974.— 460 с. Маркевич А. П. Происхождение и эволюция паразитизма//Тр. Башкир. н.-и. còàü- ции. Уфа 1943.— С. 3 — 68. Г1аул~ов Р. Л. Накармливается ли таежный клещ на обыкновенной и белошапочной овсянках // Зоол. журн.— 1963.— 42.— Вып. 4.— С. 513 — 517. наумов С. П. Зоология позвоночных.— М.: Просвещение 1973.— 424 с. Павловский Е. Н. Условия и факторы становления организма хозяином паразита в процессе эволюции // Зоол. журн.— 1946.— 25.— Вып. 4.— С. 290. Павловский Е. П., Токарегич К. Н. Птицы и инфекционная патология человека.— Л.: Наука 1966.— 227 с. Лаифилова И. М. Отношение иксодовых клещей Ixodes persulcatus, Dermacentor si]viarum, Наешорйуяа)В coricinua к свету//Зоол. журн.— 1976.— 55 вып. 3. Петрова В. И., Петров В. М. Локализация и гистохимическая характеристика пря- дильных нселез у паутинных клещей//Пути повышения продуктивности живот- ных и растений.— Рига: Зиватве. 1975.— С. 146 — 148. Петрова В. Л., Петров В. Л1. Гистологическое и цитохимическое исследование Tetra- nychus urticae (Koch.) (Acariformes, Tetranychidae) // Энтомопатогенные микро- организмы и их использование 8 борьбе с вредителями растений.— Рига: Зинат- не, 1977.— С. 29 — 45. 114
Полуда А. 31. Влияние ветра на высоту полета зяблика (Fringilla coelebs) //Вести. зоол.— 1978.— K 2.— С. 42 — 45. Полуда А. N., Шкапа С. В. Пролет воробьиных птиц в районе Киевского водохра- нилища // Симпоз. по изуч. трансконтинентальных связей перелетных птиц и их роли в распространении арбовирусов: Тез. докл. Новосибирск, 1976.— С. 51 — 52. Равен Х. Оогенез.— М.: Наука 1964.— 306 с. Райхель А. С. Ультраструктурные особенности пищеварения и выделения у иксодо- вых клещеи: Автореф. дис.... канд. биол. наук.— Л., 1975.— 23 с. Родионов 3. С., Ф~рман А. В. Взаимоотношение растительноядных и хищных кле- щей // Уч. зап. Моск. ун-та. Зоология.— М.: Изд-во Моск. ун-та 1940.— 42.— С. 197 — 201. Сил1псоп Д. Г. Темпы и формы зволюции.— М.: Изд-во иностр. лит. 1948.— 358 с. Смарагдова Н. П. Взаимодействие растительноядных и хищных клещей в зависимо- сти от концентрации и среды обитания // Зоол. журн.— 1936.— 15, вып. 4.— С. 720 — 730. Смит Л. Эволюция полового размножения.— М.: Мир 1981.— 272 с. Старовир 11. С. Морфологические и функциональные особенности пищеварительной системы клещей-фитосейид Phytoseiulus persimilis, Amblyseius andersoni и А. re- ductus: Автореф. дис.... канд. биол. наук.— Киев 1975.— 27 с. Тимофеев Ресовский В. Н., Воронцов Н. Н., Slo~oroe А. В. Краткий очерк теории эволюции.— М.: Наука, 1977.— 297 с. Токин В. П. Общая эмбриология.— М.: Высш. шк. 1987.— 480 с. Тыщекно В. П. Основы физиологии насекомых.— Л.: Изд-во ЛГУ 1980.— Ч. 1.— 362 с. Уголев А. N. Пищеварение и его приспособительная эволюция.— M.: Высш. шк., 196i.— 172 с. Уголев А. N. Пристеночпое (контактное) пищеварение.— М.; Л.: Изд-во АН СССР, 1963.— 170 с. Хелс А., Кормак Д. Гистология: В 5 т.— М.: Мир, 1982.— Т. 1.— 272 с. Хем А., Ьормак Д. Гистология: В 5 т.— М.: Мир 1983а.— Т. 2.— 254 с. Хем А., Кормак Д. Гистология: В 5 т.— М.: Мир 1983б.— T. 5.— 294 с. Ченцов JO. С. Общая цитология.— М.: Изд-во Москв. ун-та 1978.— 344 с. Чеснова Л. В. Эволюционная концепция в паразитологии (очерки истории).— М.: Наука, 1978.— 160 с. Шатров А. Б. Патологические изменения кожи красно-серых полевокприпаразитиро- вании личинок краснотелкового клеща Neotrombicula pomeranzevi (Trombiculi- dae) // Паразитология.— 1980.— 14 вып. 1.— С. 220 — 228. Шатров А. Б. Строение и функциональные особенности слюнных желез личинок краснотелковых клещей (Trombiculidae) //Там же.— 1982.— 16 вып. 4.— С. 315— 326. Шатров А. Б. Морфофункпиональная специали..ация тубулярных желез личинок краснотелковых клещей (Trombiculidae) //Там же.— 1983a.— 17 вып. 2.— С. 134— 139. 1Патрое .4. Б. Морфофу~кциональные адаптации личинок краснотелковых клещей (Tromhiculidae) к паразитизму: Автореф. дис.... канд. биол. наук.— Л. 1983б.— 2> с. П1г от~ к ова Е. А. Функциональная морфология тканей.— М.: Изд-во Моск. ун-та 19S1.— 326 с. Ярослав С. Ю., Ананенко Л1. T. Ф1з1олог1я людини i тварин.— К.: Вища школа 1971.— 448 с. Ястребцов А. В. Скелетно-мышечная система гамазовых клещей: Автореф. дис. канд. биол. наук.— Киев, ]986.— 23 с. >Aimov I. А., Уastrebtsov А. V. Spesialisation of locomotory system of soil dwelling gamasid mites (Meso.-tigmata, Gamasina) //Soil Fauna and Soil Fertility: Proc. of the 9 lnt. congr. оп ~oil Zoology.— moscow: Nauka 1987.— P. 531 — 534. А1Ь его G. Егпа Ь гы Ыйио1ор1е und Spin пчегтооеа der Schna belmilben (Bdellidae, Trombidiformes) // l. Morphol. Tier.— 1973. 76, N 4.— S. 285 — 338. Alberti G., Crooker А. R. Spider Mites. Internal Anatomy. 1.1.2//Spider Mites. Their Biology, Natural Епоп11е and Control/Ed. by W. Helle and М. W. Sabelis.— Am- sterdam: Elsevier Sci. Publ., 1985.— Vol. 1Л.— P. 29 — 62. @alberti G., Ehrnsberger R. Rasterelectronenmikroskopische untersuchungen sum Spinn Vermogen der Bdelliden und СппахЫеп (Acari, Prostigmata) // Acarologia.— 1977.— 19, N 1.— P. 55 — 61. Alberti G., Starch V. Zur Feinstructur der „Munddrusen" von Scbnabelmilben (Bdelli- dae, Trombidiformes) // Z. %Ья. Zoo).— 1973.— 186, N 1/2.— S. 149 — 160. Лйегй G., Storch V. СЬег Bau und Funktion der Prosoma-Drusen von Spinnmilben (Te- tranychidae, Trornbidiformes) // Z. Morphol. Tier.— 1974.— 79 iV 2.— S. 133 — 153. 115
Л lberti G.. Storch V. Zur Ultrastructur der Cozaldrusen actinotricher Milben (Acari, Actinotrichida) // Zool. 1аЬгЬ. Anat.— 1977.— 98. N 3.— S. 394 — 425. Alberti G., Storch V., Renner Н. Uber den feinstrukturellen Aufbau der Milbencuticula (Acari Aracbnida) // Zool. Jahrb. Abt. Anat. Ontog. Tiere.— 1981.— 105.— Р. 183— 236. Лпдге И. М.. Remacle U. Comparative and functional morphology of the gnatosoma of Те1гапусЬця цгФ1cae (Acari: Tetranychidae) // Acarologia.— 1984.— 25 N 2.— Р. 179 — 191. Bader С. Beitrage zur Kenntnis der verdauungavorgande bei Hydrocarinen//Âåv. suis- se. гоо1.— 1938.— 45.— S. 721 — 806. Baker H. А. The food of Riccardoella limacum (Schrank) (Acari, Trombidiformes) and its relationship with pulmonate molluscs // J. Natur. Hist.— 1970.— 4.— Р. 521 — 530. baker R. А. Observation on aspects of nutrition in Xenopacarus africanus (Ereynetidae, Trombidiformes) // J. Мед. Entoinol.— 1971.— 8, N 3.— Р. 307 — 313. Balcer R. Л. Notes on the internal anatomy, the food reguirements and development in the family Ereynetidae (Trombidiformes) // Acaroiopia.— 1973.— 15, N 1.— Р. 43 — 52. Ва/-er R. Л. ГЬе structure and function о1 alimentary canal in Histiogaster carpio (Кгатег, 1881) (Acari — Sarcoptiformes) // Ibid.— 1975.— 17, N 1.— г=. 126 — 138. Dalcer R. А. Nutrition of the mite Unionikola intermedia, Koentike and its relationship to the inflammatory response induced in its molluscan host Anodonta anatina L., 1976 // Pa rasi tolooy.— 1977.— 75. — Р. 301 — 308. Beer R. E., байеу D. 'Г. Biological a»d systcinatic studies of two species of clieyletid mites а descriptio» of а new species (Acarina, Cheyletidae) // Univ. Капв. Sci. Bull.— 1956.— 38, N 5.— Р. 393 — 437. Bernini I'. Сиггеп~ ideas on the phylogeny and the adaptive radiations of Acarida// Boll. Zool.— 1986.— 53.— P. 279 — 313. Binnington Л'.. С. Seguential changes in salivary gland structure during attachment and feeding of the са Ше tick, Boophilus microplus // In t. J. Parasitiol.— 1978.— 8, N 2.— - Р. 97 — 115. Binni~cgton К. С. The distribution аш1 morphology of probable photoreceptors in eight species of 11с1гв (Ixodoidea) // Z.— l aiaiienlcunde.— 1972.— 40 iN 4.— $. 321 — 332. Binnington E. С., Stone В. F. Developm»ntal changes in niorphology and (ох1п content of the salivary gland of йе А ~~tralian parallysis ticl~ Ixodes holocyclus//Int. J. Pa- rasitol.— 1981.— 11, N 5.— Р. 343 — 351. Иаиией W. Е. The internal тогрулology of the common red spider mite Tetranychus telarius//Mem. Cornell. Un. Agric. Exp. St.— 1945.— 270.— Р. 1 — 36. Boczelñ 1. Biologia i ecologin sierposza rozl<ruszisowca (Cheyletus eruditus) (Schrank, 1781) (Acarina. Cheyletidae) //Рг. na»1'. Inst. ochr. rosl.— 1959.— 1, N 2.— Р. 175— 229. Brody А., 31cGrath ./., 8'harton 6. Derrnatophagoides farinae: supracoxal glands // J. N. Y. Entomol. Soc.— 1976.— 84, 'i 1.— Р. 34 — 47. Bronvicг/г 1. Е. М.. ireek E 1. Cheyletiella (Acari: Chcyletidae) of dog cat and domesticated тasht, Areview // J. Illed. Entomol.— 1976.— 13, N 3.— Р. 315 — 327. Brown 1. В. S. Th» feeding organs of (he adult of the со~лшоп "Chigger" // J. Mor- phol.— 1952.— 91 N 1.— Р. 15 —..")2. Carter H. F., IVedd G., D'Abrera V. The occurence of mites (Acarina) in human sputum and their possible significance // Indian Alag. Gas.— 1944.— 79.— Р. 163. Coons L. В. Fine structure of the digestive system of Macrocheles muscaedomesticae (Scopoli) (Асаг1»а, Mesostigmata) // lnt. J. Insect. Morphol. and Embriol.— 1978.— 7, N 2.— Р. 137 — 153. Coons L. 8. Astell R. С. Ultrastructure of the excretory tube~ of the mite Macrocheles rnuscaedomesticae (Mesostigmata, Масгochelidae) with notes on altered mitocbon- dria // J. МогрЬо1.— 1971.— 133, N 3.— Р. 319 — 338. Сooper K. W. The occurence of mite Cheyletiella parasitivoraz in North America with notes on its synonyma and parasitic habits // J. parasitol.— 1946.— 32.— Р. 480— 482. Chinåró W. H. The nature and origin of the "cement" substance at the site of attach- ment and feeding of adult Наетор)1ува1гв spinigera (Ixodidae) //3. Med. Entomol.— 1973.— N 10.— Р. 355 — 362. Descry С. E., Nutting W. В. Morphology and functionale anatomy of Demodex folliculo- гит (Simon) of гиап //Acarologia.— 1977.— 19, N 3 — Р. 422 — 426. posse G., Lungensckeidt N. Morphologische. biologische und histologische Untersuchun- gen an FIybriden aus dern Tetranychus urticae — Котр1ех (Acari, Tetranychidae) /j Z. Angew. Entornol.— 1964. 54.— Р. 349 — 359. 116
Edwards А. R. Clavage in Cheyletus eruditus (Acarina) // Nature.— 1958.— 181.— P. 1409 — 1410. Ld мапср A. R. Support for the view that Cheyletus eruditus Schrank (Acarina, Trombidiformes) has heteromorphic males // Entomol. Mon. Mag.— 1952.— 88.— P. 107. ~>«a S. Comparative studies on the internal anatomy of three japonese Trombidiform acarinids//J. Fac. Sci. Hokkaido Univ.— 1960.— 14 N 3.— P. 410 — 434. E The life-history and habits of Cheyletus seminivorus // Pack J. Econ. Entomol.— 1912.— 5, N 5.— P. 416. Lwing S. А., Nosier У. Е., Foxx Т. S. Occurrence of Cheyletiella on dog with Skin lesions//J. Amer. Vet. Med. Assos.— 1967.— 141 N 1.— P. 64 — 68. Fain A. Observation on cheyletid mites parasitic on mammals (Acari, Cheyletidae and Cheyletiellidae) // Acarologia.— 1980.— 21, N 3/4.— P. 408 — 422. Favati N., Galliano J. Infestione da Cheyletiella parasitivorax (Мешп, 1878) nel cane// Parasitol.— 1962.— 4, N 1.— P. 69 — 73. Feiertag-Koopen С. С. 3I., Pijnacker L. P. Development of the female germ cells and process of internal fertilization in the two-spotted spider mite Tetranychus urticae КосЬ (Acariformes Tetranychidae) // Int. I. Insect. МогрЬо1. and ЕшЬгуо1.— 1982.— 11.— Р. 272 — 284. Рохх Q., Ewing S. А. Morphologic features, behavior and Не history of Cheyletiella yasgiiri//Amer. J. Vet. Res.— 1969.— 302.— P. 269 — 285. Friend W. У., S mi:tk У. У. 8. Factors affecting by blood-sucking insects // Ann. Rev. En tomol.— 1977.— 22. — P. 309 — 331. Fu~man D. P., S0usa Е. Morphology and Biology of а nestproducing mite Bakericheyla chanayi (Acarina: Cheyletidae) // Ann. Entomol. $ос. Ашег.— 1969.— 62, N 4.— P. 858 — 863. Gasser R Zur kenntnis der ~епье1пеп spinnmilbe Tetranychus urticae КосЬ 1. Mittei- lung; morphologic, anatomic, biologic und ecologic // Mitt. Schweiz. entomol.— Ges.— 1951.— 24. — S. 217 — 262. Gooding В. H. 01oеяйче ensymes and control in haematophagus // Acta trop.— 1975.— 32.— P. 96 — 111. Grand/can F. Quelques characteres des Tetranyques // Ви11. Mus. яег. 2.— 1948.— 20, N 6.— P. 517 — 524. Сrandjean F. Sur le. Grandj ean F. $цг le teoument des oribates // Bull. Mus. nat. hist. natur. ser 2.— 1951.— 23.— P. 497 — 504. Gran jean О. В tood digestion in Ornithodorus moubata Murray sensu tricto Walton femaIes (Ixodidae: Argasidae) //Ann. Parasitol. hum. et comp.— 1983.— 58, N 5.— P. 493 — 514. Grandjeau О. Blood digestion in Ornithodorus moubata Murrary sensu stricto Walton (Ixodidae: Argasidae) females. 1. Biochemical changes in the midgu lumen and ultrastructure of the rnidg»t cell, related to intracellular digestion // Acarologia.— 1984.— 25, N 2.— P. 147 — 167. Grandjean О., Aessklimann А. Contribution to the study of digestion in ticks: histology and fine structure of the midgut ephithelium of Ornithodous шоиЬа1а Murray (Ixo- doidea, Argasidae) //Acta trop.— 1973.— 30, N 3.— P. 193 — 211. Haarlov At. 1., Morc& l. Interaction beetwen Ornitbocheyletia Ла11ае Smiley 1970 (Aca- rina, Cheyletiellidae) and Micromonospora chalcea (Fonverton, 1905) Orskov, 1923 (Streptomycetaceae, Actinomycetales) in the tick of pigeon // Acarologia.— 1975.— 12, N 2.— P.. 284 — 299. Hackman R. N. Structure and functions in tick cuticle//Ann. Rev. Entomol.- — 1982.— 27.— P. 75 — 95. Hafiz А. Embryological development of Cheylet»s eruditus//Proc. Rev. Soc. Еопдоп.— 1935.— ser. В.— 117.— Р. 174 — 201. Hallas Т. Е. Functional mouthparts in the dog Fur mite Cheyletiella yasguri Smiley, 1965 (Acari, Prostigmata) I/Acta Zool.— 1982.— 63, N 3.— P. 147 — 152. Hazan А., Gesson U., Tahori А. S. Spider mite webbing 1. The production of webbing under various environmental conditions//Acarologia.— 1974.— 16, N 1.— Р. 68 — 84. Hughes А. N. Silk production in the Cheyletidae (Асаппа, Arachnida) // Nature.— 1957.— 180. — P. 815 — 816. Hughes Т. E. ТЛе physiology of the alimentary canal of Tyroglyphus farinae//Qart. J. Microsc. Sci.— 1950.— 91.— P. 45 — 61. Hughes Т. Е. The morphology of the gut of Bdellonyssus bacoti // Ann. Trop. Med. and Parasitol.— 1952.— 46, N 1.— P. 54 — 60. Hughes T. E Some histological changes which occur in the g»t epithelium of Ixodes ricinus females duri n g gorging and up to oviposi tiou // Ibid.— 1954.— 48, N 4.— P. 397 — 404. 117
Hughes Т. E. The respiratory system of the mite Cheyletus eruditus//Proc. Zool. Soc.— 1958.— 130, N 2.— Р. 231 — 239. Hughes Т. E. Mites or the Acari//London: Athlone press 1959.— 225 р. Jakeman L. А. В. The internal anatomy of the spiny rat mite Echinolaelaps echidni- nus // J. parasitol.— 1961.— 47 N 2.— P. 329 — 362. Johnston .О. Е. 1965 Comparative studies of the mouth — parts of the mites of the Suborder Acaridei (Acari): Dis. D-ra phil. Sci.— Ohio State Univ.— 1965.— 189 р. Kaestner А. Lehrbuch der Speziellen Zoologic. Bd. 1. Wirbellose 1. Teil Fischer, Stutt- gart, 1968.— 898 р. КйаИ G. M. Biochemical and physiological studies of certain ticks (Ixodidae) incor- poration of tritiated tyrosine in the excretory system of nymphal Argas (Persi- cargas) arboreus (Argasidae) // Ann. Entomol. $ос. Amer.— 1971.— 64 N 6.— P. 1155 — 1159. Кио J. S., Nesbitt H. H. J. The internal morphology and histology of adult Caloglyphus mycophagus (Megnin) (Acarina: Acaridae) // Can. J. Zool.— 1970.— 48, Х 3.— P. 505 — 518. Krogh Л. Ober Gasdiffusionen in den Tracheen//Pflugers Arch.— 1941.— P. 179 — 195. Langenscheidt М. Zur Wirkungsweise von Sterilitat erzeugenden Stoffen hei Tetrany- chus urticae КосЬ (Acari, Tetranychidae). 1. Entwicklung der weiblichen Genita- lorgane und Ogenese bei unbehandelten Spinnmilben // Z. angew. cutomoI.— 1973.— 73.— $. 103 — 106. Lees А. D. Transpiration and the structure of epicuticle in tick// J. Exp. Biol.— 1947.— 23.— P. 379 — 410. Ъ1апсоп S. М. Hydrostatis pressure and extension in arthropods with special reference to arachnid //Ann. Mag. Nat. Hist.— 1958.— 1, N 3.— P. 116 — 118. Negni:n P. Мел. sur les cheyletides parasites // J. Anat. Physiol.— 1878.— 14, N 3.— P. 416 — 441. МеЕптое W. D. The control of water loss by the two-spotted spider mite (Tetranychus telarius) //Ann. Entomol. $ос. Ашег.— 1961.— 54 N 6.— P. 883 — 887. 1l1ichael А. D. The internal anatomy of Bdella // Trans. Linn Soc. London ser. 2.— 1896.— 6.— Р. 477 — 528. Michael А. D. On the species of Acarus of genus Cheyletus, belived Со be new//J. Roy. Microsc. Soc.— 1878.— 1.— Р. 133 — 138. Mills L. В. Morphology of glands and ducts in the two-spotted spider mite, Tetrany- chus urticae КосЬ // Acarologia.— 1973.— 15 N 2.— P. 218 — 236. Mills L. В. Structure of dorsal setae in the tivo spotted spider mite Tetranychus urticae КосЬ 1836 // Ibid.— 1973.— 15.— P. 649 — 658. Mills L. R. Structure of the vizual system of the two-spotted spider mite Tvtranychus urticae // J. Insect. Physiol.— 1974.— 20.— P. 795 — 808. Miriam В. Cheyletiella parasitivorax feeding upon the rabbit flea // Entomol. Mon. Mag.— 1969.— 105, N 1262/1264.— P. 216. Mitchell В. The musculature of а trombiculid mite, В1ап 1'aartia acuscutellaris (Walch.) //Ann. Entomol. $ос. Amer.— 1962.— 55.— P. 106 — 119. Mitchell В. D. The anatomy of an adult chigger mite Blankaariia acuscutellaris (Walch) // J. Morphol.— 1964.— 114.— P. 373 — 391. Mitchell В. D., Nadchatram М. Schizeckenosy: ТЬе substitute for defecation in chigger mites // Natur. Hist.— 1969.— 3.— P. 121 — 124. Mitchell R D. The evolution of а blind gut in trombiculid mite // J. Natur. Hist.— 1970.— 4.— P. 221 — 229. Moss W. W. Studies on the morphology of the trombidiid mite Allotrombium lerouxi Moss (Acari) //Acarologia.— 1962.— 40, N 3.— P. 314 — 345. Моthes U., Seitz K А. Licht und electronenmikroskopishe Untersuchungen zur Funktionsmorphologie von Tetranychus urticae (Acari, Tetranychidae) // Fxcretion- sorgane // Zool. Jahrb.— 1980.— 104.— S. 500 — 529. Nothes U., Seitz Х. А. Functional microscopic anatomy of the digestive system of Tetranychus urticae (Acari, Tetranychidae) // Acarologia.— 1981а.— 22, N 3.— P. 257 — 270. Mothes U., Seitz ~i. Л. Fine structure and function of the prosomal glands of the two spotted spider mite, Tetranychus urticae (Acari, Tetranychidae) //Cell Tissue.— 1981Ь.— 1, N 2.— P. 339 — 349. Mothes U., Seitz K. А. Lich- und elektronenmikroskopische Untersuchungen zur FunktionsmorphoIogie von Tetranychus urticae (Acari, Tetranychidae) I I. Weibli- ches Geschlechtssystem und Oogenese // Zool. Jahrb. Anat. Ontog. Tiere.— 1981с.— 105.— S. 106 — 134. Mu mcuogly Х., Guggenheim L., He n1ci n g E. Raster electronalmik roskopisch e Unter- 118
suchungen von Cheyletus eruditus (Schranl', 1781) (Acarina, Cheyletidae) //Acaro- logia.— 1974.— 15 N 4.— $. 644 — 649. Norris У. D. Observation on the control of the mite infestation in stored wheat by. Cheyletus spp. (Acarina, Cheyletidae) // Ann. Appl. Biol.— 1958.— 46, N 3.— P. 411 — 422. Nuzzaci G., Lillo Е. de. Fine structure and functions of the mouthparts involved in the feeding mechanism in Cenopalpus pulcher (Canestrini & Fanzago) (Tetrany- choidea: 7 enuipalpidae) //1 ' EURAAC $ушр. (Graz Aug. 1988).— $. 1., $. а.— 5 р.— Repr. Oliver J. H. Parthenogenesis in mites and ticks // Amer. Zool.— 1971.— 11 N 2.— P. 283 — 299. Olsen S. 1., Roth Н. On the mite Cheyletiella parasitivorax occuring on cats, as а facultative parasite of man // J. parasitol.— 1947.— 33.— P. 444 — 445. Pierse W. D. Sanitary Entomology.— London: Gorhan press 1921.— 518 р. Pijnacker L P., Регшегйа ЛХ. Л., Helle W. Cytological investigations on the female and male reproductive system of the parthenogenetic privet mite Brevipalpus obovatus Donnadieu (Phytopalpidae, Acari) // Acarologia.— 1981.— 22, N 2.— P. 157 — !63. Prasse 1. Zur Anatomic und Histologic der acaridae mit besonderer Berucksichtigung von Caloglyphus herlesei und С. michaeli. 1. Das darmsystem // Wiss. Z. Univ. Halle.— 1967.— 16.— S. 789 — 812. Ри1рап J., Verger P. Н. Control of Tyrophagus mites in stored grain by predatory mite Ch. eruditus ($chrank) //Can. J. Zool.— 1965.— 43 N 3.— P. 417 — 433. Renter E. Zur Morphologic und Ontogenie der Acariden//Act. Sci. Fenu.— 1909.— 36 М 4.— S. 1 — 228. Rhode С. J., Oemick D. А. Anatomy of the digestive апй reproductive systems in an acarid mite ($arcoptiformes) // Acarologia.— 1967.— 9 N 4.— P. 608 — 616. Riley W. А., Johansen D. А. Medical Entomology.— New-York: McGraw-Hill Book Com- pany, 1938.— 438 р. Schmidt U. Beitrage zur Anatomic und Histologic der Hydracarinen, besonders von Diplodontus despiciens // Z. Morphol. Okol. Tier.— 1935.— 30.— $. 99 — 176. Smiley R. L. А review of the family Cheyletiellidae (Acarina) // Ann. Entomol. $oc. Ашег.— 1970.— 63, N 4.— P. 1056 — 1078. Smiley R. L. Further studies on the family Cheyletiellidae (Acarina) // Acarologia.— 1978.— 19, N 2.— P. 225 — 241. Solo mon Л1. E. Experiments on predator prey interaction of storage mites // Ibid.— 1969.— ii, N 3.— P. 484 — 503. Summers F. ЛХ., Gonzttles R., Witt R. L. The mouthparts of Bryobia rubrioculus ($CH.) (Acarina, Tetranychidae) // Proc. Entomol. $oc. Wash.— 1973.— 75, N 1.— P. 96— 101. Summers F. М., Price D. W. Review of the mite family Cheyletidae // Univ. Calif. Pubis. Ent.— 1970.— 61.— P. 1 — 153. Summers F. M., Witt R. S. The gnatosoma of Cheyletus cacahuamilpensis Baker // Proc. Entomol. Soc. Ъ7аяЬ.— 1971.— 73.— P. 158 — 168. Tsvilenev0. V. A. The nervous structure of the Ixodid ganglion//Zool. Jahrb. Anat.— 1964.— 8i.— P. 579 — 602. И'eyda F. Reproductive system and oogenesis in active females of Tetranychus urticae (Acari Tetranychidae) // Acta Entomol. Bohemoslov.— 1980.— 77.— P. 375 — 377. 1Уйегйаи~ег T. Parasitske grinje Cheyletiella blakei u шас1iе: prikaz prvog slucaja u nasoj zmelji // Pinterljiljana "Vet arch". 1986 (1987).— 57, N 2.— P. 63 — 70. Witalinsjci W. Fine structure of the respiratory system in the mite from the female Parasititae // Acarologia.— 1980.— 21, N 3/4.— P. 330 — 339. Woodri~p >. P. Comparative morphology, 1цгсйоп and homologies of the coxal glands in Oribatid mites (Arachnida: Acari) //J. Morphol. 1973.— 139.— P. 407 — 429. Woodring У. P., Gabraith С. А. The anatomy of the adult uropodid mite Fuscouropoda agitans, with comparative observations on other acari//Ibid.— 1976.— 150, N 1.— P. 19 — 58. %Рпдг K А., Nemell J. М. Some observations on the fine structure of the midgut of the mite Anystis sp. // Ann. Entomol. Soc. Amer.— 1964.— 57.— P. 684 — 693. Vijayambika V., John P. А. Internal morphology an а histology of the fish mite Lardoglyphus konoi. Digestive system // Acarologia.— 1975.— 16 N 4.— P. 709 — 719. Vistorin 0. E. Ernahrungebiologie und anatomic des verdanungstrakmes der Nicole- tiellidae (Acari, ТготЫо1Еогтев) // Ibid.— 1980.— 21, N 2.— P. 204 — 215. Vi<z<hum II. E. Acarina.— In: Bronns Н. G. Klassen und ordnungen des Tierrei.— 1943.— 5, N 4/5.— 1011 р. V oi g t B. Anatomic und Histologic der Drusen bei Trombiculiden milben — larveak Zoll. Anz.— 1971.— 186, N 5/6.— S. 403 — 417.
ОГЛАВЛЕНИЕ Предисловие ° j ° Ф ° ° Общая характеристика хейлетид Внешнее строение и тагмозис Биологические особенности Систематическое положение ~7l 810 Морфология и функции систем органов 11 14 14 26 "(Ч 29 32 32 37 48 53 Покровы Скелет! о-мышечная система Гнатосома Ходильиые конечности Идиосома Особенности функций Пищеварительная система Ротовой аппарат и передняя кишка Средняя кишка Экскреторный орган Задняя кишка (ректул1) Активность некоторых пищеварительных Cheyletus eruditus Морфофункциональные основы специализа мы клещей-хейлетид 'Проподосомальпые железы Морфология Функциопальные особенности Специализация проподосомальных желез Респираторпая система Репродуктивная система Морфология и оогенез Сравнительная характеристика Эмбриональное развитие хейлетид Нервная система O ферментов хишпого ° ° ° клеща 54 ции пищеварительнои систе- 56 60 е 66 70 72 77 77 82 83 90 хеилетид 92 93 (Я 95 95 97 97 100 102 'Биологические особенности некоторых хейлетид Хищные хейлетиды Cheyletus eruditus и Cheletomorpha lepidopterorum Питание и пищевое поведение Влияние температуры и влажности Размножение и репродуктивное поведение Паразитические хейлетиды Bakericheyla chanayi и Ornithocheyletia sp. Гостальная специфичность Условия обитапия на теле птиц и топическая специфичность П итание Заключение.......................... 107 320 Список литературы....,................., 112