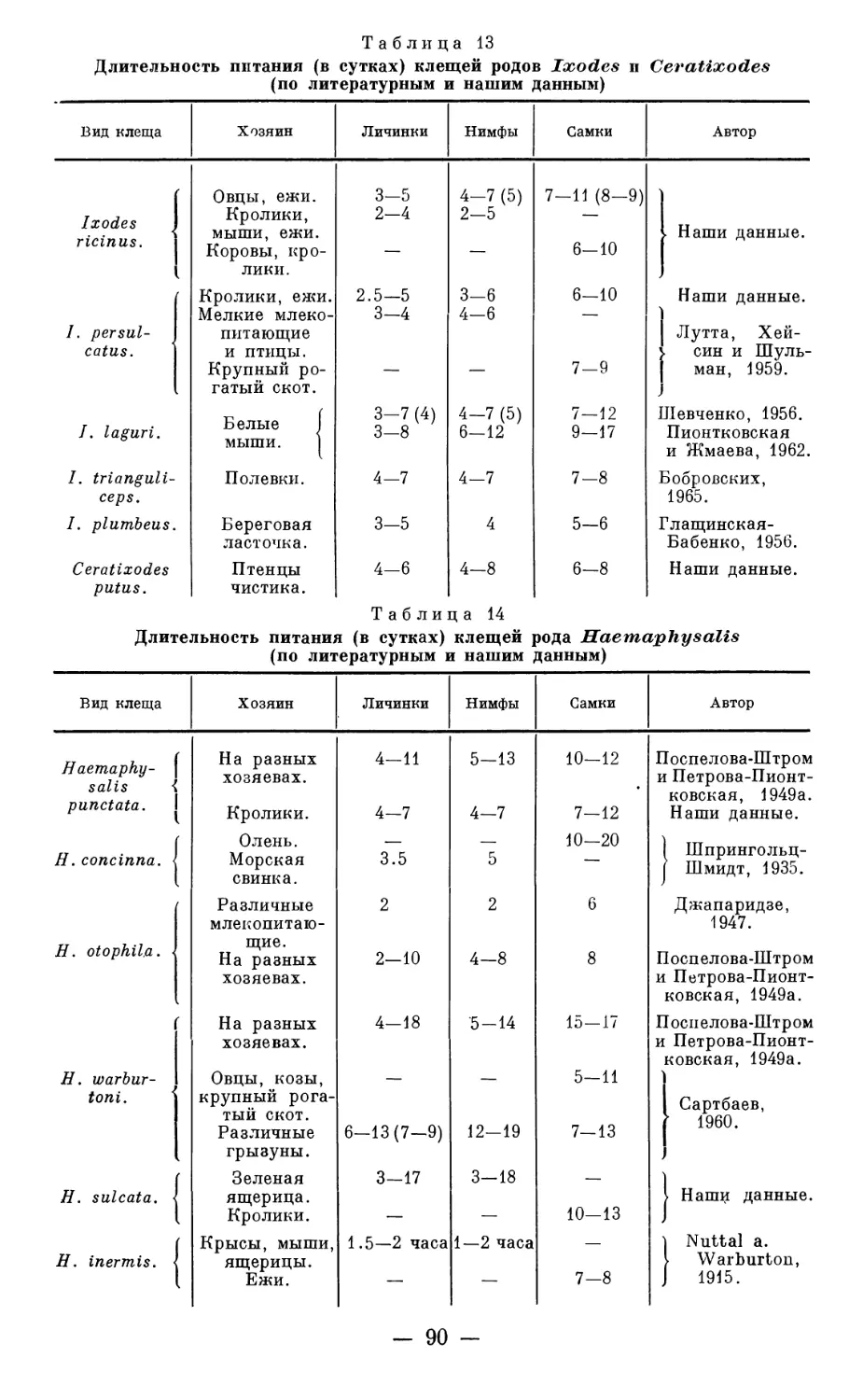
Текст
АКАДЕМИЯ НАУК СССР
Ю. С. БАЛАШОВ
КРОВОСОСУЩИЕ
ПЕРЕНОСЧИКИ БОЛЕЗНЕЙ
ЧЕЛОВЕКА И ЖИВОТНЫХ
АКАДЕМИЯ НАУК СССР
ЗООЛОГИЧЕСКИЙ ИНСТИТУТ
Ю. С. БАЛАШОВ
КРОВОСОСУЩИЕ
КЛЕЩИ
(1X0 DO IDEA) —
ПЕРЕНОСЧИКИ БОЛЕЗНЕЙ
ЧЕЛОВЕКА И ЖИВОТНЫХ
ИЗДАТЕЛЬСТВО «НАУКА»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
ЛЕНИНГРАД-1967
УДК 595.421 : 591.1 : 591.5 : 591.67
Кровососущие клещи (Ixodoidea) — переносчики болезней человека
и животных. Балашов Ю. С. 1967. Изд. «Наука», Ленинградское отд.,
Л. 1—320.
Монография посвящена морфо-физиологическим особенностям группы
кровососущих клещей, переносящих возбудителей важнейших массовых
трансмиссивных болезней домашних животных и человека. Дан всесто-
ронний анализ акта кровососания клещей, при котором происходит
передача возбудителей от больных животных и людей к здоровым. Издание
рассчитано на зоологов, паразитологов, энтомологов, врачей-инфекцио-
нистов, ветеринарных врачей, работников санитарно-эпидемиологических
служб. Илл. — 464 табл. — 53, библ. — 592 назв.
Ответственный редактор
А. А. СТРЕЛКОВ
427-67 (I пол.)
2-10-6
ВВЕДЕНИЕ
Клещи надсемейства Ixodoidae представляют группу высоко специа-
лизированных кровососущих членистоногих — временных облигатных
паразитов млекопитающих, птиц и рептилий. Эта группа объединяет
представителей двух семейств. Иксодовые клещи (Ixodidae) насчитывают
не менее 700 видов, относящихся к подсемействам Ixodinae (роды Ixodes
и Ceratixodes) и Amblyomminae (роды Haemaphy satis, Boophilus, Rhipicen-
tor, Dermacentor, Amblyomma, Aponomma, Rhipicephalus, Hyalomma).
В СССР встречается около 70 видов. Аргасовые клещи (Argasidae) на-
считывают примерно 100 видов, относящихся к подсемействам Ornitho-
dorinae (роды Ornithodoros, Otobius, Alveonasus, Antricola) и Argasinae
(род A r gas). В СССР встречается 17 видов. Исключительное практическое
значение иксодоидных клещей как эктопаразитов сельскохозяйственных
животных, но особенно как переносчиков возбудителей многих зоонозов
и зооантропонозов превратило изучение этой группы в самостоятель-
ный раздел паразитологии, в разработке которого наряду с зоологами
активное участие принимают специалисты в области медицины, вете-
ринарии и микробиологии.
Наибольшее количество исследований посвящено выяснению эпи-
демиологической и эпизоотологической роли клещей в природных очагах
инфекций, причем особенно много в этом направлении выполнено
акад. Е.Н. Павловским и его школой. Исходя из практических потребно-
стей здравоохранения и ветеринарии, были детально изучены экологические
особенности важнейших переносчиков среди Ixodoidea и в первую оче-
редь их жизненные циклы, регуляция последних факторами внешней
среды, активность клещей в природных биотопах и их связь с различ-
ными хозяевами — позвоночными. Большое число исследований, осо-
бенно в последние годы, посвящено изучению анатомических, физиоло-
гических и биохимических особенностей клещей в плане выяснения
морфолого-физиологических адаптаций к паразитизму или в связи с пере-
живанием неблагоприятных условий среды. В то же время морфолого-
физиологические особенности клещей представляют исключительный
интерес для понимания процессов циркуляции в их организме различ-
ных групп микроорганизмов и механизма их передачи позвоночным.
Клещи надсемейства Ixodoidea наряду с кровососущими двукрылыми
служат специфическими переносчиками основных групп возбудителей
трансмиссивных инфекций человека и животных, включая вирусы, рик-
кетсии, бактерии, спирохеты, анаплазмы, пироплазмиды, тейлерии и филя-
рий. Не исключено их участие в передаче некоторых видов грибов, токсо-
плазм и жгутиконосцев. Столь тесные и многообразные связи кровосо-
сущих клещей с различными микроорганизмами обычно объясняют
древностью их паразитизма и разнообразием биоценологических связей
с хозяевами — наземными позвоночными (Беклемишев, 1948, 1955).
— 3 —
1*
Важным фактором, объясняющим исключительную способность иксо-
доидных клещей к передаче возбудителей многих инфекций, служат
своеобразные анатомические, физиологические и биохимические особен-
ности этой группы членистоногих, значительно отличающейся от крово-
сосущих насекомых.
В основу настоящей монографии положены многолетние оригиналь-
ные исследования морфолого-физиологических адаптаций кровососущих
клещей к паразитированию на наземных позвоночных и связей строения
клещей с их способностью к восприятию и последующей передаче воз-
будителей (на примере риккетсий). Особое внимание при этом было уде-
лено процессам питания, метаморфоза и размножения. Эти процессы
определяют не только характерные особенности жизненного цикла кле-
щей и типы взаимоотношений с хозяевами, но и в определенной степени
обусловливают возможности циркуляции возбудителей в природных
очагах.
Идея осуществления настоящей работы возникла под влиянием тру-
дов и ценных личных советов выдающихся паразитологов, ныне покой-
ных В. А. Догеля, Е. Н. Павловского и В. Н. Беклемишева, которым
автор, к большому прискорбию, уже не имеет возможности принести
сердечную благодарность. Работа выполнена в лаборатории пара-
зитологии Зоологического института АН СССР при повседневной под-
держке и неоценимой помощи со стороны заведующего лабораторией
проф. А. С. Мончадского, которому приношу искреннюю благодарность. От
всей души автор благодарен проф. А. А. Стрелкову, сделавшему много
ценных замечаний при прочтении рукописи. Очень признателен автор
А. Б. Дайтеру, Ю. Л. Горощенко, Н. А. Филипповой и Т. Э. Джафарову
за совместную работу над отдельными разделами исследования и
Л. К. Ефремовой за огромную помощь в повседневной работе и техни-
ческом оформлении монографии.
МОРФОЛОГО-АНАТОМИЧЕСКИЙ ОЧЕРК
ВНЕШНЕЕ СТРОЕНИЕ
Иксодоидные клещи — наиболее крупные формы среди Acarina, и
размеры тела у напитавшихся особей отдельных видов (роды АтЫуотта,
Hyalomma, Ornithodoros savignyi) достигают 20—30 мм. Форма тела го-
лодных клещей — от овальной до почти округлой и сильно уплощенная,
а у напитавшихся — линзовидная, яйцевидная или каплевидная
(рис. 1—7).
На основании исследований сегментального строения тела у разных
групп клещей А. А. Захваткин (1952) считает, что в основе организации
иксодоидных клещей, как и других представителей отряда Parasitiformes,
лежит арахноидный тип расчленения на просому (головогрудь) и опи-
стосому (брюшко). Просома включает акрон (первичная головная ло-
пасть) и 6 сегментов (хелидеральный, пальпальный и 4 ножных). Опи-
стосома лишена конечностей и включает 9 сегментов и анальную лопасть.
Из них прегенитальный сегмент в значительной степени редуцирован
и отходит к просоме, а 3 последних сегмента остаются в зачаточном со-
стоянии и объединены в один анальный макросомит. В результате брюшко
клещей фактически состоит только из 6 сегментов.
У иксодоидных клещей произошло слияние просомы с идиосомой,
и границы между ними исчезли. Следы первичной метамерии обнаружи-
ваются у них только в эмбриональном развитии (Вагнер, 1894; Aeschli-
— 4 —
mann, 1958) и в расположении хет у личинок. Взамен этого первичного
тагмозиса у них развилось вторичное расчленение тела на лишенное
сегментации туловище, или идиосому, и головку, или гнатосому
(рис. 4, 10, И).
В состав гнатосомы входят часть акрона, хе лидера льный и паль-
пальный сегменты, но границы между ними неразличимы в силу высокой
степени интеграции головки и общей для паукообразных тенденции
изгибания главной оси тела на спинную сторону. Граница между гнато-
Pnc. 1—3.
1 — голодная самка Alveonasus lahorensis; 2 — закапчивающая пита-
ние самка Ornithodoros papillipes\ 3 — голодная самка Argas persicus.
сомой и идиосомой проходит внутрисегментально, так что в состав по-
следней входит часть акрона, несущая глаза. Это послужило поводом
для отрицания самостоятельного существования гнатосомы как части
тела (Ланге, 1962), что не имеет достаточных морфологических оснований.
Внешнее строение клещей надсем. Ixodoidea и особенно структуры,
имеющие таксономическое значение, достаточно подробно описаны
в сводке по систематике этой группы (Nutall a. oth., 1908; Nutall a. War-
burton, 1911, 1915; Robinson, 1926; Cooley a. Kohls, 1944; Галузо,
1946—1953; Померанцев, 1950; Поспелова-Штром, 1953; Arthur, 1960,
1962; Филиппова, 1966, и др.). В настоящем разделе рассматриваются
лишь наиболее существенные особенности внешнего строения клещей,
необходимые для характеристики группы в целом и затрагиваемые в по-
следующих разделах монографии.
Идиосома. Среди аргасовых клещей различают два главных типа
строения идиосомы. У представителей подсем. Argasinae она сильно
уплощена, а дорсальная и вентральная поверхности резко отграничены
друг от друга боковым швом (рис. 3). У Ornithodorinae боковой шов, за
5
немногими исключениями, отсутствует, тело более выпуклое, и хорошо
развиты его боковые поверхности (рис. 9). Поверхность идиосомы голод-
ных особей покрыта системой борозд, наиболее развитых у видов рода
Ornithodoros (рис. 8—10). У них различают следующие борозды: дор-
сальную, маргинальную, парные дорсо-вентральные и продольные супра-
коксальные, 2 пары продольных субкоксальных, околоанальные (пре-
анальную, поперечную постанальную и срединную аномаргинальную).
У видов рода Ar gas число борозд значительно меньше.
Рис. 4—7.
4 — голодная и 5 — напитавшаяся самка Hyalomma asiaticum; 6 — самка
Ixodes persulcatus в позе ожидания (по Померанцеву и Сердюковой, 1948);
7 — спаривание клещей Ixodes ricinus.
Большая часть идиосомы аргазид покрыта растяжимой кутикулой.
Твердая кутикула представлена мелкими участками — дисками, слу-
жащими для прикрепления мышц (рис. 8) и особенно развитыми у видов
рода Argas. Остатки спинного щитка (дорсальная пластинка) сохраня-
ются только у личинок родов Argas, Alveonasus и некоторых видов рода
Ornithodoros, тогда как у нимфальной и имагинальной фаз он полностью
редуцирован. На вентральной стороне лежат поперечная щель полового
отверстия и далее назад — анальное отверстие. Последнее состоит из
двух полукруглых створок и окружающего их кольца из склеротизован-
ной кутикулы. В заднелатеральном направлении от III—IV пар кокс
лежат небольшие дыхательные пластинки — перитремы, на которых
открываются дыхательные отверстия — стигмы. Между I и II парами
кокс открываются щелевидные отверстия коксальных желез. Передняя
часть идиосомы прикрывает смещенную вентрально гнатосому и образует
вокруг нее футляр — камеростом (рис. 10).
— 6 —
Рис. 8—10. Схема внешнего строения самки Ornithodoros papillipes.
8 — вид сверху, 9 — сбоку, 10 — снизу (по Филипповой, 1966).
дн — анус; аб — аномаргинальная борозда; ге — генитальная щель; ди — диски; двб — дорсо-вентральная борозда; ка — камеростом; кл —
клюв; коп — коксальная пора; кс — коксы; мб — маргинальная борозда; огн — основание гнатосомы; п — пальпы; ппб — поперечная преанальная
борозда; ппсб — поперечная постанальная борозда; слб — субкоксальная латеральная борозда; смб — субкоксальная медиальная борозда; спб —
супракоксальная борозда; ст — стигма; гцк — щеки.
У иксодовых клещей наблюдаются заметные различия в строении
идиосомы у самок и самцов. У голодных особей идиосома сильно упло-
щенная, но после питания она сильно растягивается и становится на по-
перечном разрезе почти округлой.
У самок около трети дорсальной поверхности идиосомы голодных
особей занимает спинной щиток (скутум) из твердой кутикулы. Спереди
он имеет глубокую вырезку для причленения гнатосомы, а его передне-
боковые выступы называют скапулами. На скутуме различают парные
боковые и цервикальные борозды. Растяжимая часть спинной поверх-
ности по бокам и сзади от скутума называется аллоскутумом (рис. 11),
и она лишена каких-либо склеритов. Задний край идиосомы, исключая
виды родов Ixodes и Haemaphysalis, несет 9—11 краевых фестонов. На
вентральной стороне лежат половое и анальное отверстия, а по бокам
позади IV кокс — крупные перитремы. На аллоскутуме различают наи-
более глубокую дорсальную краевую борозду, парные задне-срединные,
задне-боковые, внешние и внутренние добавочные и непарную задне-
срединную борозды. С вентральной стороны развиты генитальная, аналь-
ная и средняя постанальная борозды (рис. 12). У разных видов наблю-
даются значительные вариации в расположении и числе описываемых
борозд (рис. 11—20).
Внешнее строение идиосомы нимф и личинок в основных чертах
сходно с самками. У них лишь относительно большие размеры спинного
щитка, меньшее количество борозд, а на вентральной стороне отсутствует
половое отверстие. У личинок, кроме того, неразвиты перитремы.
У самцов иксодид спинной щиток покрывает всю дорсальную поверх-
ность идиосомы, так что растяжимая кутикула занимает только узкую
латеральную зону (рис. 21, 22). Вентральная сторона покрыта группой
щитков. У видов рода Ixodes щитки занимают всю вентральную часть
идиосомы, и среди них различают парные аданальные, эпимеральные и
непарные прегенительный, срединный и анальный (рис. 13). У АтЫуот-
minae различают парные аданальные и добавочные щитки, одну или
две пары субанальных (рис. 14). Между щитками находятся значительные
участки из растяжимой кутикулы.
Гнатосома. Гнатосома сильно склеротизована и состоит из прокси-
мального кольца — основания гнатосомы (basis capituli) и сильно вытя-
нутой дистальной половины — хоботка, или ротового конуса. Хоботок
образован гипостомом и наружными хелицеральными футлярами, прок-
симально переходящими в сплошное склеротизованное кольцо основания
гнатосомы (рис. 23, 24 и 197), которое сужается в проксимальном на-
правлении и входит в широкое камеростомальное отверстие идиосомы.
С последней гнатосома сочленяется изогнутой камеростомальной складкой.
В ней отсутствуют склеротизованные слои, и она состоит только из эпи-
кутикулы и хорошо развитой слоистой эндокутикулы. Дорсо-медиально
в камеростомальной складке открывается щелевидное отверстие органа
Жене (рис. 27). Основание гнатосомы широким затылочным отверстием
открывается в полость тела. К заднему дорсальному и вентральному
краям основания у иксодид прикрепляются две группы мышц, идущие
назад и вверх и прикрепляющиеся к спинному щитку в области церви-
кальной борозды (рис. 25). У аргазид выдвижение и втягивание гнатосомы
в камеростомальную складку происходит с помощью группы мышц,
идущих от гнатосомы к дискам дорсальной поверхности идиосомы.
Нижняя половина хоботка образована вытянутым вперед выростом
основания гнатосомы — гипостомом. Снаружи он покрыт направленными
назад зубцами, образующими правильные продольные ряды. Зубцы
на вершине гипостома наиболее мелкие и у некоторых видов образуют
характерную структуру, называемую короной. У самцов гнездово-норо-
— 8 —
Рис. 11 — 15. Схема внешнего строения иксодовых клещей.
11 — самка Hyalomma asiaticum со спинной и 12 — с брюшной стороны;
13 — самец Ixodes ricinus] 14 — самец Hyalomma asiaticum с брюшной
стороны; 15 — передняя нога самки Н. asiaticum.
спщ — спинной щиток; гл — глаза; ал — аллоскутум; црб — цервикальная и бкб —
боковая борозды спинного щитка; зсб — заднесрединная, збб — заднебоковая и мрб —
маргинальная борозды аллоскутума; ф — фовеа; по — половое отверстие; ан — анус;
кс — коксы; пр — перитрема; ст — стигма; генб — генитальная борозда; анб —
анальная и спб — срединная постанальная борозды; фст — фестон; щитки: прщ —
прегенитальный, эпщ — эпимеральный, срщ — срединный, анщ — анальный, адщ —
ад анальный, анщ — акцессорный и сбщ — субанальный; вер — вертлуг; бд — бедро;
кч — коленный членик; гол — голень; лап — лапка; прл — предлапка; ог — орган
Галлера.
вых видов Ixodinae гипостом в ряде случаев полностью лишен зубцов
{Ixodes vespertilionis, Ceratixodes putus). Верхняя половина хоботка
образована хелицеральными футлярами — парными трубкообразными
которые окружают снаружи хелицеры.
выростами основания головки,
Рис. 16—20. Поперечные срезы через голодную
самку Ixodes ricinus.
Поверхность хелицеральных
футляров также несет мно-
гочисленные мелкие зубцы.
Хелицеры иксодоидных
клещей двучлениковые и пол-
ностью утратили свойствен-
ную паукообразным клешне-
видную форму (рис. 26).
Проксимальный членик стер-
жневидной формы с бульбо-
образно расширенной базаль-
ной частью. В ней заключены
мощные пучки мышц-антого-
нистов, посылающих два сухо-
жилия к подвижному пальцу
хелицеры. У видов рода Ixo-
des сухожилия проходят в
трубчатых каналах в стенках
стволов хелицер, а у осталь-
ных уродов (свободно лежат
в их полости.
Подвижный палец пред-
ставлен треугольной, сильно
склеротизованной пластин-
кой (внутренний членик), на
внешней поверхности кото-
рого причленяется наружный
членик. По своему наруж-
ному краю оба членика несут
мощные режущие зубцы.
К внутреннему членику с его
внутренней поверхности не-
подвижно прикреплен зазуб-
ренный дорсальный отросток,
а от ею сочленения со ство-
16 — на уровне спинного щитка, 17 — на уровне
перитрем, 18 — позади перитрем, 19 — на уровне
ануса, 20 — позади ануса.
сщ — спинной щиток; пр — перитрема; ак — аналь-
ное кольцо и створки анального клапана; дкб — дорсаль-
ная краевая борозда; г б — генитальная борозда; аб —
анальная борозда.
лом отходит утолщенная в
дорсальной и латеральной
частях мембрановидная
складка-плащ. Она целиком
окружает подвижный палец,
исключая режущие концы
зубцов (рис. 26).
На дистальных концах наружного и внутреннего члеников, а также
на дорсальной поверхности последнего под плащом у Hyalomma asiaticum
находятся три сравнительно крупные поры, сообщающиеся с внутренней
полостью стволов. Подобные отверстия были найдены и у других видов
иксодовых и аргасовых клещей (Robinson a. Davidson, 1913—1914;
Gregson, 1960), но их происхождение и функции остаются неясными.
Д. Грегсон (Gregson, 1960) предполагает, что они служат для выхода
полостной жидкости, обеспечивающей расправление или спадение скла-
док плаща. Возможно, что они представляют рудиментарные отверстия
протоков хелицеральных желез, свойственных многим паукообразным.
— 10 —
В задней трети стволов на уровне глоточного отверстия значительные
участки дорсо-латеральной поверхности стенок представлены сильно
складчатой двойной мембраной (рис. 192). Физиологическое значение
подобных продольных окон в сильно склеротизованных трубках стволов
также остается неясным.
От передне-боковых сторон основания гнатосомы отходят 4-членико-
вые пальпы, гомологичные педипальпам остальных паукообразных.
У аргазид членики пальп сохраняют цилиндрическую форму и подвиж-
ные сочленения (рис. 197).
У иксодовых клещей наи-
более крупные II и III чле-
ники неподвижно сраста-
ются между собой. IV чле-
ник значительно меньше
остальных и лежит в углу-
блении на вентральной
стороне III членика (рис.
24). Пальпы не принимают
непосредственного участия
в прикреплении к покро-
вам хозяина и несут сен-
сорные функции.
У голодных иксодовых
клещей гнатосома зани-
мает терминальное поло-
жение, а у напитавшихся
особей, исключая самцов,
в связи с неравномерным
ростом кутикулы на вен-
тральной и дорсальной
сторонах идиосомы она
смещается на брюшную
сторону и занимает перед-
невентральное положение.
Главная ось гнатосомы при
этом перестает совпадать с
таковой идиосомы. У имаго
Рис. 21, 22. Поперечные срезы через голодного
самца Hyalomma plumbeum.
На уровне: 21 — второй пары ног, 22 — позади
анального отверстия.
сщ — спинной щиток; вщ — вентральные щитки; скб — суп-
ракоксальная борозда; гб — генитальная борозда; аб —
анальная борозда; рк — растяжимая кутикула вентро-
латеральных участков идиосомы.
и нимф большинства видов
аргасовых клещей гнатосома смещена вентрально и занимает передне-
вентральное положение. Первичное терминальное положение сохраняется
у личинок большинства видов, а в ряде случаев и у нимф (Alveonasus
lahorensis и Otobius megntni).
По эмбриологическим данным Ю. Вагнера (1894) и А. Эшлимана
(Aeschlimann, 1958) основная часть гнатосомы построена за счет разра-
стания кокс пальп. Дорсально они соединяются над хелицерами с остат-
ком первичной головной лопасти и образуют верхнюю стенку головки —
тектум. Сливаясь вентрально между собой, они завершают формирова-
ние кутикулярного кольца. Медиально-дорсальные выросты кокс, кроме
того, как и у других паукообразных, соединяются с эпистомом и форми-
руют так называемую субхелицеральную пластинку. От дистального
конца эпистома отходит верхняя губа у аргазид, видоизмененная в сильно
вытянутый отросток, называемый стилетом (Sen, 1935), или язычковидным
отростком (Bertram, 1939). Вентрально вытянутые передние отростки
кокс сливаются по средней линии и образуют гипостом. Наконец, в по-
строении вентральной поверхности основания гнатосомы несомненно
принимают участие стерниты хелицерального и пальпального сегментов.
— 11 —
Функциональная анатомия гнатосомы рассматривается в связи с меха-
низмом питания клещей (см. стр. 127—135).
Конечности. Нога клеща состоит из следующих 6 члеников: кокса,
вертлуг, бедро, коленный членик, голень и лапка (рис. 15). Коксы сра-
стаются со стенками идиосомы, но благодаря сохранению мембрановидных
пограничных участков они сохраняют ограниченную подвижность (под-
тягивание и отхождение от вентральной поверхности тела). Все остальные
членики обладают высокоподвижными сочленениями. Лапка клещей
заканчивается парой коготков с перепончатой присоской, и эту структуру
называют предлапкой.
ПОКРОВЫ ТЕЛА
Общие особенности кутикулы. Как и у остальных членистоногих,
покровы тела клещей состоят из слоя гиподермальных клеток и секрети-
руемой ими кутикулы, образующей наружный скелет. Изучению строе-
ния кутикулы членистоногих, в основном насекомых, посвящено зна-
чительное число исследований, выполненных с применением современных
морфологических и физиологических методов (Richards, 1951 и др.).
Установлено, что она состоит из двух основных слоев — наружной эпи-
кутикулы и внутренней прокутикулы. Толщина первого слоя обычно
не превышает 1—4 мк. Он состоит из нескольких химически отличных
слоев (цементный, восково-липоидный, кутикулиновый), часто не диффе-
ренцируемых обычными гистологическими методами. В целом для него
характерно отсутствие хитина и нерастворимость в щелочах и неорга-
нических кислотах. Несмотря на незначительную толщину, он играет
основную роль в обеспечении водонепроницаемости покровов.
Прокутикула составляет основную толщу покровов, и ее толщина
варьирует от 1—2 до 100 мк и более. Прокутикула построена из глико-
протеиновых макромолекул — мицелл, часто обладающих упорядочен-
ной ориентацией. Последние представляют прочное соединение хитина
с белком.
В зависимости от химического состава и степени склеротизации раз-
личают три типа прокутикулы: экзокутикулу, мезокутикулу и эндо-
кутикулу. Экзокутикулой называют наружный твердый, полностью
склеротизованный слой, часто обладающий собственной янтарно-желтой
окраской. Этот слой очень плохо красится большинством гистологических
красителей, и в нем обычно неразличимы следы продольной слоистости.
Эндокутикула представляет наименее измененную линочную про-
кутикулу, лишь в незначительной степени импрегнированную белками
и липоидами. В ней очень четко выступает горизонтальная слоистость,
обусловленная чередованием слоев различной оптической плотности.
При окраске по Маллори или азокармином по Гейденгайну она стано-
Рис. 23—27. Строение гнатосомы самки Hyalomma asiaticum.
23 — внешний вид гнатосомы с дорсальной стороны; 24 — то же с вентральной сто-
роны; 25 — сагитальный срез через гнатосому; 26 — дистальный конец ствола и палец
хелицеры; 27 — поперечный срез через сочленение гнатосомы со спинным щитком.
пл — пальпа; плт — терминальный пальпальный членик; сх — ствол хелицеры; пх — палец хели-
церы; нч — наружный и вч — внутренний членики пальца хелицер; пщ — плащ; по — пора; до —
дорсальный отросток пальца; нхдб — наружный, кхф — конический и вхф — внутренний хелицераль-
ный футляры; рх — мышцы-ретракторы хелицер; схм — сухожилия внутрихелицеральных мышц;
гп — гипостом; гпз — гипостомальные зубцы; гпк — внутригипостомальные каналы; гпм — мембрана
пищевой борозды гипостома; пп — предротовая полость; ср — слюнной резервуар; сп — главные
слюнные протоки; кг — клиновидный гребень; ко — крыловидный отросток; дкм — дорсальные и
вкм — вентральные мышцы крыловидных отростков; г — глотка; дрг — дорсальные, лрг — лате-
ральные и врг — вентральные мускулы-расширители глотки; п — пищевод; эщ — экзокутикула
спинного щитка; эт — экзокутикула тектума; экс — эндокутикула камеростомальной складки;
кс — камеростомальная складка; схп — субхелицеральная пластинка; л — лабрум; ож — отверстие
органа Жене; гд — гиподермальный слой; поп — поровые поля; р — ротовое отверстие; т — тек-
тум; хб — хоботок; огн — основание гнатосомы; мышцы гнатосомы: лгн — леваторы, дгн — депрессоры.
— 12 —
вхф
вится интенсивно синей. Мезокутикула по своим свойствам занимает
промежуточное положение между экзо- и эндокутикулой. Этот слой
импрегнирован ароматическими и липопротеиновыми соединениями, но
процессы склеротизации в нем еще не завершены. Он не имеет собственной
окраски, обычно весьма гибок и эластичен. При окраске по Маллори или
азокармином мезокутикула приобретает различные оттенки красного цвета.
Прокутикула членистоногих пронизана многочисленными поровыми
канальцами, идущими от гиподермальных клеток к эпикутикуле. Диа-
метр их составляет десятые доли микрона, а число может превышать
несколько тысяч на 1 мм2 поверхности. На границе между кутикулой и
гиподермальными клетками лежит очень тонкий (до 1 мк) слой, сходный
по строению с базальной мембраной и называемый субкутикулой.
По времени образования принято различать первичную кутикулу,
отлагающуюся до окончания линьки, и вторичную, которая образуется
после линьки. По степени развития трех главных слоев прокутикулы
различают три основных типа строения покровов. На участках подвиж-
ных сочленений кутикула исключительно гибка и эластична. Прокути-
кула здесь не подвержена склеротизации и представлена одной эндоку-
тикулой «каучукового» типа (Weis-Fogh, 1961). Твердые склериты пост-
роены в основном из экзокутикулы, тогда как мезо- и эндокутикула
в них развиты слабо или вообще отсутствуют. Третий тип кутикулы
занимает промежуточное положение. Наружная зона прокутикулы пред-
ставлена здесь мезокутикулой и сохраняет значительную эластичность,
а внутренняя зона — хорошо развитой эндокутикулой.
Покровы A carina в основных особенностях строения сходны с тако-
выми остальных членистоногих. Затруднения связаны лишь с гомологи-
зацией отдельных слоев кутикулы у представителей разных системати-
ческих групп. Немецкие исследователи (Ruser, 1933; Yalvac, 1939а;
Schulze, 1942а), в частности, описали в кутикуле иксодовых клещей
4 слоя: наружные тонкие эпиостракум и тектостракум, гомологичные
эпикутикуле в современном понимании, и эктостракум и гипостракум,
соответствующие экзокутикуле и эндокутикуле. После исследований
А. Лиса (Lees, 1947, 1952) при описании покровов кровососущих клещей
получила распространение современная терминология, и в склеротизо-
ванных участках покровов различают экзокутикулу, а в гибких и растя-
жимых областях наружную эндокутикулу (мезокутикулу) и внутреннюю
эндокутикулу. Электронной микроскопией срезов растяжимой кутикулы
напитавшихся самок иксодид подтверждена правильность выделения
в ней 2 слоев. Наружная зона (мезокутикула) более гомогенная, а внут-
ренняя (эндокутикула) образована чередующимися слоями со различной
плотностью. Эти слои состоят из волокон диаметром 700 А, располо-
женных во взаимно перпендикулярных направлениях (Цвиленева и Ма-
шанский, 1965). В дальнейшем мы пользуемся общепринятой термино-
логией и различаем в покровах эпикутикулу, экзокутикулу, мезокути-
кулу и эндокутикулу.
Эпикутикула. На парафиновых срезах через покровы иксодовых и
аргасовых клещей эпикутикула представлена кутикулиновым слоем
толщиной 1—3 мк, обладающим собственной янтарно-желтой окраской.
Он интенсивно красится железным гематоксилином и азокармином,
но не окрашивается по Миллоту. Снаружи от кутикулинового лежат
очень тонкий полифеноловый и далее более толстый восково-липоидный
слои. Последний представляет обязательный компонент эпикутикулы
иксодид и аргазид, но обнаруживается только на срезах, изготовленных
на замораживающем микротоме. Наконец, у аргасовых клещей снаружи
от восково-липоидного слоя располагается еще особый цементный слой
толщиной менее 0.5 мк. На срезах он часто отслаивается от кутикулы
— 14 —
и очень слабо окрашивается световым зеленым или эозином (рис. 47).
Предполагается, что цементный слой предохраняет восково-липоидный
слой от механических и химических повреждений.
Восково-липоидный слой эпикутикулы клещей, как и у других на-
земных членистоногих, играет главную роль в поддержании водонепрони-
цаемости покровов. Он, по данным новейших исследований (Beament,
1961), обладает упорядоченной молекулярной ориентацией, усиливающей
его гидрофобность.
У аргасовых клещей в зависимости от поверхностной структуры
эпикутикулы (вместе с прилегающими к ней слоями прокутикулы) раз-
личают три типа строения растяжимых покровов идиосомы (Поспелова-
Штром, 1953). У нимф и имаго родов Ornithodoros и Argas с бугорчатым
типом покровов поверхность кутикулы образована из многочисленных
бугорков, боковые ребра которых переходят в складки, имеющие сверху
вид сильно изломанных линий (рис. 28—31). У голодных особей бугорки
сближены, а изломы складок увеличиваются, так что общая поверхность
тела уменьшается. У напитавшихся клещей складки растянуты, а вер-
шины бугорков уплощены (рис. 48—49). У Alveonasus lahorensis, обладаю-
щего ямчато-гребенчатым типом покровов, от многочисленных ямок и
углублений на поверхности радиально расходятся сильно изгибающиеся
складки кутикулы, называемые гребешками (рис. 32, 33). У голодных
клещей гребешки сильно сближены, и кутикула имеет морщинистую
поверхность, а у напитавшихся особей они расправляются и обеспечивают
значительное увеличение поверхности тела.
У личинок поверхность идиосомы, за исключением рудимента спин-
ного щитка у видов родов Argas, Alveonasus, Antricola и некоторых под-
родов рода Ornithodoros, собрана в правильные ряды параллельных друг
другу складок кутикулы (рис. 35, 36, 50). Описанные складки идут преи-
мущественно перпендикулярно к продольной оси тела, но делают много-
численные изгибы, увеличивающие возможности их растяжения. У Or-
nithodoros papillipes высота складок составляет в среднем 3 мк, у Alveo-
nasus lahorensis 5—6.5 мк и у Argas persicus — 5—6 мк. Расстояние
между соседними складками составляет 2—4 мк.
У самок, нимф и личинок иксодовых клещей эпикутикула растяжимых
областей идиосомы собрана в правильные ряды складок, плотно приле-
гающих друг к другу (рис. 37 и 39). Сверху кутикула голодных особей
кажется покрытой системой из правильных неглубоких борозд, представ-
ляющих границы между соседними складками. Последние располагаются
параллельными друг другу рядами, которые идут преимущественно
перпендикулярно к продольной оси тела и образуют крупные зигзаго-
образные изгибы (рис. 37). По бокам идиосомы и вокруг полового и аналь-
ного отверстий — местах, подверженных максимальному растяжению, —
описываемые складки располагаются теснее, а высота их больше, чем
на ровных дорсальной и вентральной поверхностях. У более крупных
самок Hyalomma asiaticum они выше, чем у Ixodes ricinus, достигая
у первых 14—18, а у вторых 6—12 мк. У нимф и личинок они значительно
ниже, чем у самок (для Hyalomma asiaticum соответственно 8 и 2 мк).
Кроме эпикутикулы, в состав складок входит и прокутикула. Напри-
мер, у самок Н. asiaticum толщина складок достигает 6—9 мк при
собственной толщине эпикутикулы около 1 мк. У остальных изученных
видов также наблюдаются близкие соотношения.
Растяжимая кутикула идиосомы. Покровы идиосомы иксодоидных
клещей, исключая склеротизованные участки, отличаются значительной
гибкостью и эластичностью. Эти особенности определяются строением
прокутикулы, причем между аргасовыми и иксодовыми клещами наблю-
даются определенные различия.
— 15 —
Аргасовые клещи. При значительном разнообразии поверх-
ностной структуры покровов внутреннее их строение однородно в преде-
лах всего семейства, исключая длительно питающихся личинок и нимф
некоторых видов. На гистологических срезах наружная поверхность
кутикулы зубчато-гребенчатая (рис. 34, 45—49). Зубцы и гребни отве-
чают бугоркам и складкам поверхности, а углубления — впадинам между
ними. У напитавшихся особей вследствие растяжения покровов зубцы и
гребни выравниваются, а местами полностью сглаживаются.
Строение прокутикулы одинаково при бугорчатом и гребенчатом типах.
Она представляет гомогенный слой, достигающий у имаго толщины в 15 —
30 мк, и в ней неразличима горизонтальная слоистость. Только на границе
с гиподермой сохраняется узкая зона с пластинчатым строением. На
неокрашенных препаратах в фазовом контрасте в прокутикуле видны
тончайшие поровые канальцы, неразличимые лишь в самом внутреннем
слое и заканчивающиеся в кутикулиновом слое эпикутикулы.
При окраске азокармином прокутикула приобретает красный цвет,
и лишь на границе с гиподермой сохраняется узкая синяя зона толщиной
в 1—3 мк. Лучше всего она развита у Alveonasus lahorensis, тогда как
у половозрелых Ornithodoros papillipes толщина ее значительно меньше.
У нимф младших возрастов она выражена лучше, чем у старших. При
окраске по Миллоту она становится зеленоватой, а железный гематок-
силин ее почти не окрашивает. По особенностям окраски и наличию гори-
зонтальной слоистости она несомненно представляет эндокутикулу.
Основная толща прокутикулы сходна с мезокутикулой других члени-
стоногих. Она достаточно твердая и обеспечивает надежную механи-
ческую защиту тела. При постепенной дифференцировке азокармина или
железного гематоксилина узкая наружная зона (в несколько микрон)
сохраняет более интенсивную окраску, так же как и слой на границе
с эндокутикулой. Возможно, эта особенность связана количественными
различиями в градиенте концентрации импрегнирующих компонентов.
В отличие от насекомых, после непродолжительной обработки диафано-
лом мезокутикула сохраняет способность краситься в красный цвет
азокармином, а после длительной вообще перестает краситься.
На границе между кутикулой и гиподермой лежит очень тонкий суб-
кутикулярный слой (0.2—0.4 мк), который при обработке по Миллоту
становится зеленым, а при окраске азокармином по Гейденгайну — синим.
Кутикулу пронизывают протоки дермальных желез и каналы сенсилл,
выстланные изнутри продолжением кутикулинового слоя эпикутикулы.
У Ar gas persicus в ней, кроме того, резко выделяются склеротизованные
участки мышечных дисков (рис. 29, 45).
Гиподерма состоит из уплощенных клеток с неясными границами
высотой в 3—5 мк. Ядра слабо овальные, размером 3x5 мк и содержат
небольшие рибонуклеиновые нуклеолы. Митотические деления, за исклю-
чением периода линьки, не наблюдаются. Цитоплазма свободна от вклю-
чений и лишь слабо базофильна. Около протоков располагаются парные
более крупные клетки дермальных желез (рис. 47) с почти сферическими
ядрами диаметром 5—6 мк. Внутри отдельных клеток иногда удается
рассмотреть следы спавшейся полости. У закончивших линьку особей
дермальные железы находятся в покоящемся состоянии.
Иксодовые клещи. Среди иксодовых клещей наблюдаются
определенные различия в строении прокутикулы между подсемействами
Ixodinae и Amblyomminae, рассмотренные на примере клещей Ixodes
rtcinus и Hyalomma asiaticum. У недавно перелинявших особей обоих
видов покровы образованы одной недифференцированной прокутикулой,
которая интенсивно окрашивается анилиновым синим (после окраски
по Маллори или азокармином по Гейденгайну). В дальнейшем на стадии
— 16 —
Рис. 28—36. Строение дорсальной поверхности идиосомы.
28, 29 — самка Argas persicus', 30, 31 — самка Ornithodoros papillipes', 32—36 — Alveo-
nasus lahorensis’. 32, 33 — самка, 35 — личинка, 34 — поперечный срез через покровы
самки, 36 — то же личинки. Микрофотографии в падающем свете: 28, 30 и 32 — Х20;
29, 31, 33 — Х110; 34 — Х600; 35 — Х600; 36 — Х1350.
а — бугорки; б — складки; в — мышечные диски; г — щетинки.
Рис. 37—44. Покровы тела, мышцы и трахеи самки Hyalomma asiaticum.
37 — участок поверхности аллоскутума голодного клеща; 38 — место сочленения
коксы с идиосомой; срезы через растяжимую кутикулу клеща: 39 — голодного,
40 — питающегося и 41 — закончившего питание; 42 — митотическое деление гипо-
дермальной клетки на стадии питания; 43 — участок субкоксальной мышцы; 44 — от-
хождение пучка трахеол от трахейного ствола. Микрофотографии: 37 — Х20; 38 и
44 — Х200; 39—41, 43 — Х400; 42— Х2000.
эп — эпикутикула; эн — эндокутикула; эк — экзокутикула; мз — мезокутикула; гп — гиподерма;
дж — дермальная железа I типа; тс — трахейный ствол; тр — трахеолы.
Рис. 45—53. Строение покровов Argas persicus (срезы).
45— мышечный диск; 46 — отдельный бугорок; 47 — растяжимый участок идио-
сомы самки; 48 — голодная нимфа; 49 — напитавшаяся нимфа I; личинка: 50 — голод-
ная, 51 — недавно начавшая питаться, 52 — заканчивающая стадию роста и 53 — пол-
ностью напитавшаяся.
цс — цементный, влс — восково-липоидный, кс — кутикулиновый слои эпикутикулы; ап — эпи-
кутикула; эк — экзокутикула мышечных дисков; мз — мезокутикула; эн — эндокутикула; гп —
гиподерма; дж — дермальная железа; пр — проток дермальной железы; м — дорсо-вентральные
мышцы; х — хета.
послелиночного доразвития первичная прокутикула Hyalomma asiaticum
подвергается частичной склеротизации и превращается в первичную
мезокутикулу, которая интенсивно окрашивается кислым фуксином или
азокармином (рис. 39). У Ixodes ricinus на стадии послелиночного дораз-
вития первичная прокутикула также превращается в мезокутикулу,
но одновременно под ней откладывается слой эндокутикулы, красящийся
анилиновым синим и другими кислыми красителями (рис. 177). Слой
субкутикулы у голодных клещей очень тонкий (меньше 1 мк) и в боль-
шинстве случаев обычными гистологическими методами не выявляется.
Мезокутикула голодных особей имеет сходное строение у обоих видов.
Она весьма однородна и состоит из нескольких слоев общей толщиной
в 14—18 мк у самок Hyalomma asiaticum и несколько тоньше у Ixodes
ricinus. Эти слои идут либо параллельно поверхности, и тогда видно,
что прокутикула образована 3—4 подобными макроструктурными еди-
ницами, или же под некоторым углом к поверхности. У только что пере-
линявших особей в самом нижнем слое при использовании фазового
контраста удается рассмотреть следы более тонкой слоистости. Позднее
пластинчатое строение становится неразличимым. Противоположная
картина наблюдается с поровыми канальцами. В первом случае они не-
различимы, а во втором, напротив, выступают очень отчетливо. Поровые
канальцы в мезокутикуле неразветвленные и слабо волнистые, а в эн-
докутикуле сильно изогнутые и ветвящиеся.
Эндокутикула у голодных особей I. ricinus имеет хорошо развитую
горизонтальную слоистость. Отдельные слои слабо волнистые, толщиной
около 1 мк. По аналогии с таковыми у насекомых, их, вероятно, следует
считать правильно чередующимися участками различной оптической
плотности, создающими видимость псевдопластинчатой структуры.
С началом питания иксодовых клещей наряду с растяжением покровов
идиосомы происходит отложение новых слоев кутикулы и изменение
строения слоев, образовавшихся во время линьки. Эти процессы, как
и секреторная активность гиподермальных клеток, описываются в раз-
деле «Приспособления к увеличению объема тела во время питания»
(см. стр. 117—126).
Склеротизованная кутикула. У иксодовых клещей из твердой кутику-
лы построены гнатосома, спинной щиток, конечности, анальный кла-
пан, вентральные щитки самцов и ряд других мелких склеритов (рис. 38).
Описанные участки отличаются значительной твердостью и очень малой
эластичностью. К растяжению они не способны, и в период кровососания
их линейные размеры практически не меняются. Эпикутикула гладкая,
обычного строения. Прокутикула целиком склеротизована, так что ее
следует считать построенной из одной экзокутикулы. Последняя, как
и у насекомых, без предварительной обработки диафанолом вообще не
окрашивается и имеет на срезах естественный янтарно-желтый оттенок.
После размягчения диафанолом она начинает краситься кислым фуксином
или азокармином. На срезах видно, что вся ее толща пронизана тон-
чайшими, слабо извитыми поровыми канальцами. Какие-либо следы
продольной слоистости в ней неразличимы. При наблюдении в поляри-
зованном свете экзокутикула дает очень сильное двойное лучепреломле-
ние, вероятно, за счет высокой степени ориентации белково-хитиновых
мицелл.
В спинном щитке нижний слой кутикулы бывает часто окрашен зна-
чительно сильнее верхнего. Так, у самок Hyalomma asiaticum нижний,
интенсивно пигментированный слой составляет 10—12 мк, а верхний
около 30 мк. По гистохимическим особенностям оба описанные слоя,
однако, идентичны. Поэтому от гомологизации нижнего слоя с эндоку-
тикулой, распространенной во многих работах, следует отказаться.
- 18 -
У аргасовых клещей из твердой кутикулы построены покровы конеч-
ностей, гнатосомы, перитремы, дорсальная пластинка у личинок неко-
торых видов (Argas persicus, Alveonasus lahorensis, Ornithodoros coniceps
и др.) и диски для прикрепления мышц, особенно развитые у видов рода
Argas (рис. 45).
В конечностях и гнатосоме аргазид эндокутикула и мезокутикула
отсутствуют и они состоят из одной экзокутикулы янтарно-желтого
цвета, пронизанной поровыми канальцами и почти не окрашивающейся
железным гематоксилином и азокармином. Красится лишь очень узкая
(2 мк) зона на границе с гиподермой. Общая толщина экзокутикулы
составляет 15—30 мк. Гиподермальный слой немного толще обычного.
В дорсальной пластинке личинок, достигающей у Alveonasus lahorensis
5—6 мк толщины, экзокутикула неоднородна и состоит из наружной и
внутренней зон, различающихся по интенсивности окрашивания азо-
кармином. Под ними располагается эндокутикула в 1.5—2 мк. В дисках
Argas persicus также сохраняется тонкий слой эндокутикулы.
Субкутикула в твердых участках не выявляется. Гиподермальные
клетки, подстилающие экзокутикулу, мелкие, границы между ними почти
неразличимы. Во время питания гиподермальный эпителий не проявляет
каких-либо признаков усиления функциональной активности. Толщина
твердой кутикулы значительно варьирует в зависимости от локализации
и видовой принадлежности. Однако во время кровососания она всегда
остается постоянной.
Кутикула сочленений. Особый тип кутикулы встречается в суставах
конечностей, камеростомальной складке и других подвижных сочлене-
ниях у иксодовых клещей. По своему строению она очень сходна с сочле-
новными мембранами у других членистоногих (рис. 38). Снаружи она
ограничена хорошо развитым кутикулиновым слоем эпикутикулы, ин-
тенсивно красящимся азокармином или кислым фуксином. Непосредст-
венно под ним располагается эндокутикула, достигающая местами тол-
щины в 60—100 мк. Последняя состоит из отдельных горизонтальных
слоев толщиной в 1—2 мк. Поровые канальцы в ней неразличимы. При
обработке азокармином по Гейденгайну или по Маллори она окрашива-
ется анилиновым синим в ярко-голубой цвет, а после обработки по Мил-
лоту прокрашивается световым зеленым. Субкутикула развита слабо и
с трудом выявляется. Под ней располагается тонкий слой гиподермальных
клеток. Местами они исчезают, а сохраняющиеся лежат отдельными
небольшими островками.
Сходным строением обладают и сочленовные мембраны аргасовых
клещей. Они также не подвержены склеротизации и построены из отно-
сительно толстой (3—4 мк) эпикутикулы со слегка зубчатой поверхно-
стью и однородной эндокутикулы (20—30 мк). В последней очень четко
выступает пластинчатая структура. Отдельные слои связаны между
собой слабо, так что иногда при фиксации происходит их расслоение.
Гистохимические особенности кутикулы. Одним из основных разли-
чий в химическом составе эпикутикулы и прокутикулы клещей оказалось
отсутствие в первой хитина, как и у остальных членистоногих. В проку-
тикуле хитин легко выявляется хитозановой реакцией, тогда как обыч-
ные методы окраски срезов на хитин раствором иода в хлористом цинке
(после предварительной обработки диафанолом) или по методу ШИК
не дают положительного результата (табл. 1). Лишь в отдельных слу-
чаях слабое окрашивание наблюдалось в гнатосоме, конечностях и скле-
ритах, построенных из экзокутикулы. По-видимому, молекулы хитина
в кутикуле иксодовых клещей очень прочно связаны в гликопротеиновых
комплексах и выявляются только после разрушения последних, как
в случае с хитозановой реакцией.
- 19 -
2*
Таблица 1
Гистохимические реакции растяжимой и твердой кутикулы иксодовых и аргасовых клещей
Присутствие белков в про-
кутикуле легко выявляется
окраской бромфеноловым синим
и биуретовой реакцией. Осо-
бенно четкие результаты дает
первый метод. Интенсивность
окраски максимальна в мезоку-
тикуле. При этом в бугорках
и гребнях аргазид часто разви-
вается не обычное синее, а яр-
кое фиолетовое окрашивание,
связанное с метахромазией. По-
следняя свойственна и мезоку-
тикуле иксодид, особенно у на-
чавших питаться особей. Эндо-
кутикула красится только в
синий цвет и значительно сла-
бее, а экзокутикула практиче-
ски не окрашивается, приобре-
тая лишь очень слабый синева-
тый оттенок. Окраска эпикути-
кулы всегда дает отрицательный
результат. Отрицательная реак-
ция в склеротизованных участ-
ках и эпикутикуле связана не
с отсутствием в них белков,
а с блокированием их реактив-
ных групп в сложных комплек-
сах вследствие процессов хими-
ческого дубления.
Значительный интерес пред-
ставляет распределение в кути-
куле веществ, содержащих
ароматические группы. Очень
интенсивную окраску приобре-
тают по миллоновой и ксанто-
протеиновой реакциям кутику-
линовый слой, эпикутикулы,
экзокутикула и наружная зона
мезокутикулы. От эпикутикулы
к гиподерме окраска мезокути-
кулы убывает, вероятно, отра-
жая градиент концентрации
этих веществ. Эндокутикула
дает отрицательный резуль
тат.
Аргентаффиновая реакция
дает результаты, сходные с
двумя предыдущими. Аммиач-
ный раствор серебра особенно
интенсивно восстанавливается
до металлического в кутикули-
новом слое эпикутикулы и зна-
чительно слабее в экзокутикуле
и наружной зоне мезокутикулы.
Во внутренней зоне мезокути-
- 20 -
кулы и эндокутикуле, за исключением протоков дермальных желез и
хет, почернения не наблюдается.
На срезах, изготовленных на замораживающем микротоме после
формалиновой фиксации, липоиды окрашиваются Суданом черным лишь
в восково-липоидном слое эпикутикулы. Судя по их высокой критической
точке, они несомненно обладают высокой температурой плавления.
В прокутикуле липоиды выявляются лишь после обработки диафанолом.
Последний наряду с разрушением ароматических колец освобождает
также связанные липоиды. После подобной обработки они начинают
окрашиваться Суданом в кутикулиновом слое, экзокутикуле, и в меньшей
степени в мезокутикуле.
Характерную особенность кутикулы представляет высокое содержа-
ние серы, что свойственно и акариформным клещам (Hughes, 1959).
Нитропруссидная реакция на дисульфидные группы дает особенно интен-
сивное окрашивание в кутикулиновом слое и экзокутикуле. Мезокутикула
дает неопределенный, а эндокутикула отрицательный результат.
Ни в одном из слоев кутикулы Hyalomma asiaticum и Ixodes ricinus,
вопреки утверждениям Г. Фрика (Frick, 1936) и П. Шульце (Schulze,
1955), нам не удалось обнаружить гуанин. Мурексидная реакция всегда
давала отрицательный результат. П. Шульце идентифицировал присут-
ствие гуанина в покровах по наличию двойного лучепреломления. Однако
в рассматриваемых случаях указанный критерий неприменим, так как
белково-хитиновые мицеллы и кутикулин эпикутикулы отличаются
сильной собственной анизотропией.
Субкутикула дает положительную реакцию на полисахариды и белки
и отрицательную на хитин и, вероятно, как и у насекомых, построена
из мукопротеидов.
Из приведенных данных видно, что химический состав кутикулы
аргасовых и иксодовых клещей в основном сходен с насекомыми и изу-
ченными паукообразными. Прокутикула построена из хитино-протеино-
вых макромолекул-мицелл, в которых хитин прочно связан с белком,
так что без их разрушения он обычно не выявляется. Прокутикула
импрегнируется липоидами и белками, соединяющимися в липо-протеи-
новый комплекс. Существенный компонент кутикулы составляют арома-
тические вещества. Максимальная их концентрация в кутикулиновом
слое и экзокутикуле, представляющих наиболее склеротизованные зоны,
указывает на сходство процессов затвердевания покровов у клещей и
насекомых. Вероятно, при соединении свободных аминокислотных групп
липо-протеинового комплекса с хинонами происходит химическое дуб-
ление кутикулы — завершающий этап склеротизации. Возможно, что
у клещей, как и у скорпионов, в затвердевании покровов, и особенно
кутикулинового слоя, определенную роль играет образование дисуль-
фидных мостиков.
МУСКУЛАТУРА
Клещи надсем. Ixodoidea обладают хорошо развитой мускулатурой,
строение которой с различной степенью подробности описывается в не-
скольких общеанатомических работах (Robinson a. Davidson, 1913—
1914; Ruser, 1933; Douglas, 1943). По местоположению и функциям раз-
личают четыре основные группы мышц. Мускулатура тела представлена
несколькими группами дорсо-вентральных мышц (краевые, генитальные
и анальные), места прикрепления которых к покровам идиосомы обозна-
чены соответствующими бороздами у иксодовых клещей и мышечными
дисками у аргазид (рис. 54, 55). Сокращения дорсо-вентральной мускула-
туры обеспечивают изменения объема и формы идиосомы и играют важ
- 21 -
ную роль в движениях гнатосомы (за счет изменения внутриполостного
давления), при актах дефекации и откладки яиц. Мускулатура ног пред-
ставлена мощными косыми пучками коксальных и субкоксальных групп
мышц, а в каждом членике конечности — антогонистически действующими
сгибателями и разгибателями (рис. 56, 57). Мускулатура гнатосомы рас-
сматривается при описании ротового аппарата, а мускулатура внутрен-
Рис. 54—57. Мускулатура идиосомы самки Hyalomma plurn-
beum и ноги личинки Ixodes ricinus (но Ruser, 1933).
Места нрикренления дорсо-вентральных мышц: 54 — на дор-
сальной стороне идиосомы, 55 — на вентральной стороне
идиосомы; 56 — коксальные и субкоксальные мышцы Н. plum-
beum; 57 — сгибатели и разгибатели члеников ноги I. ricinus.
км — краевые, ам — анальные, гм — генитальные пучки дорсо-
вентральных мышц; а — анус; по — половое отверстие; к — кокса;
ск — субкокса; цб — цервикальная борозда.
них органов — в разделах, касающихся строения органов пищеварения,
размножения и выделения.
Цитологические и физиологические особенности мышц клещей совер-
шенно не изучены. На основании наших гистологических препаратов
и наблюдений над отпрепарированными органами в фазовом контрасте
можно лишь указать, что, как и у насекомых, мышечные волокна клещей
поперечнополосатого типа. Пучки миофибрилл занимают центральное
положение внутри волокон, а саркоплазма с ядрами окружает их с пери-
ферии (рис. 43, 359).
- 22 -
ОРГАНЫ ПИЩЕВАРЕНИЯ
Органы пищеварения клещей представлены ротовым аппаратом с об-
ширной предротовой полостью (рассматриваются в отдельном разделе),
парой слюнных желез, глоткой, пищеводом, средней кишкой (желудок
и боковые дивертикулы), тонкой кишкой, ректальным пузырем и прямой
кишкой, открывающейся анальным отверстием (рис. 58, 59). Слюнные
железы, глотка, пищевод
и прямая кишка являются
эктодермальными произ-
водными; средняя и тон-
кая кишка, ректальный
пузырь и открывающиеся
в него мальпигиевы сосу-
ды — эндодермальные про-
изводные.
В литературе накоплен
обширный фактический ма-
териал об анатомическом
строении пищеваритель-
ного тракта клещей Ixodes
ricinus (Pagenstecher, 1861;
Bonnet, 1907; Суворов,
1908; Nordenskiold, 1908,
1911; Samson, 1909aj, Boop-
hilus annulatus (Williams,
1905; Dennis, 1932), Der-
macentor andersoni (Dou-
glas, 1943), Haemaphysa-
lts jlava (Saito, I960), Rhi-
picephalus appendiculatus
(Till, 1961), Ornithodoros
savignyi (Christophers,
1906), O, coriaceus (True,
1932), Argas persicus (Ro-
binson a. Davidson, 1913—
1914), A. vespertilionis
(Roshdy, 1961a), A, boueti
(Roshdy, 1962), A. transga-
riepinus (Roshdy, 1963).
Сведения о строении ки-
шечника аргасовых кле-
щей приводятся также у
Е. Н. Павловского (1935),
а сравнительно-анатомиче-
ский анализ расчленения
средней кишки вместе
Рис. 58. Вскрытая со спинной стороны самка Orni-
thodoros papillipes, левая половина кишечника уда-
лена.
ан — анус; ая — ампуловидное расширение яйцевода; гл —
глотка; жд — желудок; ма — матка; мс — мальпигиев сосуд;
мг — мозг; пщ — пищевод; пж — придаточная железа;
рп — ректальный пузырь; сж — слюнная железа; дк —
дивертикулы средней кишки; трахейные стволы: тд — дор-
сальный, тз — задний и тп — передний; я — яйцевод;
яч — яичник.
с описанием ее строения
для многих видов иксодовых и аргасовых клещей дается П. Шульце
(Schulze, 1942а) и в наших работах (Балашов, 1957в, 19616).
Слюнные железы. У клещей надсем. Ixodoidea слюнные железы пред-
ставлены парой гроздевидных, вытянутых в передне-заднем направлении
по бокам идиосомы органов, построенных из альвеол нескольких типов
(см. стр. 135—152), сидящих на сильно ветвящихся выводных протоках,
связанных между собой рыхлой соединительной тканью и разветвлениями
трахей. У аргасовых клещей (рис. 58) слюнные железы весьма компактны
- 23 -
и лежат над коксами первых трех пар ног. Размеры их у голодных или
недавно напитавшихся особей примерно одинаковы. У иксодовых клещей,
и особенно в подсем. Amblyomminae, слюнные железы значительно круп-
нее, их задние концы заходят за IV коксы и в них более четко проступает
тенденция к расщеплению на отдельные грозди. Размеры их определяются
физиологическим состоянием клещей. У питающихся особей слюнные
железы значительно крупнее, чем у голодных (рис. 109—110).
Рис. 59. Вскрытая со спинной стороны самка Hyalomma
asiaticum, левая половина кишечника удалена.
гл — глотка; мг — мозг; ж — желудок; дк — дивертикулы средней
кишки; тк — тонкая кишка; рп — ректальный пузырь; ан — анус;
мс — мальпигиев сосуд; яч — яичник; сж — слюнная железа; сп —
семеприемник; я — яйцевод; пж — придаточная железа; вл — вла-
галище; пр — проток слюнной железы.
Выводные протоки слюнных желез, являющиеся производными гипо-
дермы, представляют глубокие внутренние впячивания стенок тела.
Начинающиеся от слюнного резервуара парные главные выводные про-
токи почти округлые на поперечном разрезе. Войдя в слюнные железы,
они дают многочисленные разветвления. Альвеолы сидят и на главных
протоках, но основная их масса локализуется на вторичных разветвле-
ниях. Изнутри главные протоки и их разветвления выстланы сравни-
тельно толстой кутикулой из тонкой наружной кутикулиновой эпикути-
кулы и внутренней эндокутикулы. В последней на всем протяжении про-
токов проходит более плотная спиральная нить, напоминающпя
тенидиальную нить трахейных стволов. Она выполняет чисто механи-
ческие функции, предотвращая спадение внутреннего просвета выводных
протоков (рис. 64), и этим, по-видимому, можно объяснить ее конвер-
- 24 —
гентное сходство с аналогичными структурами трахейных стволов. Кути-
кулиновый слой выстилки протоков заходит и внутрь альвеол, где по-
крывает короткий внутриальвеолярный выводной проток, сообщающийся
с внутренней полостью альвеолы. Границы между отдельными гиподер-
мальными клетками выстилки выводных протоков плохо различимы
в световом микроскопе,ч но очень четко видны на электронных фотогра-
фиях (Джафаров, 19656). Ядра их средних размеров, овальные, а плазма
не содержит каких-либо включений, напоминающих продукты секре-
торной активности. Мышечные волокна в их стенках обнаружить не
удалось.
Глотка. У иксодовых клещей глотка сильно вытянута в передне-
заднем направлении и веретеновидной формы (рис. 25). На уровне рото-
вого отверстия просвет глотки еще сохраняет характерную для пищевой
борозды треугольную форму (рис. 193), но по мере удаления от лабрума
на ее потолке появляется сильно склеротизованный гребень, приобретаю-
щий клиновидную форму и глубоко вдающийся в просвет (рис. 194).
Снизу глотка поддерживается хитиновым полукольцом так называемых
глоточных опор. Последние представляют вентро-латеральные выросты
межкоксального моста, срастающиеся между собой по средней линии.
На уровне клиновидного гребня они сливаются с вентро-латеральными
стенками глотки и теряют связь с межкоксальным мостом. Еще дальше
назад клиновидный гребень начинает понижаться и исчезает в медиальной
части, тогда как его вилкообразно расщепленные латеральные части
расходятся в стороны и вниз и образуют крыловидные отростки (рис. 25,
194, 195). Дорсально от них отходят мощные мышечные пучки, прикреп-
ляющиеся противоположными концами к краям субхелицеральной плас-
тинки, а вентрально — мышцы к вентро-латеральным углам гнатосомы.
Обе группы мышц действуют антагонистически, и их попеременное со-
кращение обеспечивает поднятие или опускание клиновидного гребня
в просвете глотки. На этом же уровне от вентрально-латеральных стенок
глотки отходят пучки мышц-расширителей, а их внутреняя поверхность
несет косые ряды мелких зубчиков. Судя по расположению мышц и скле-
ротизованных элементов, передний отдел глотки, по-видимому, выпол-
няет функции переднего глоточного клапана.
Вентральные несклеротизованные утолщения глоточных стенок,
выполняющие, по мнению Д. Грегсона (Gregson, 1960), функции второго
глоточного клапана, у изученных нами видов развиты значительно слабее.
Они находятся на уровне слияния стенок глотки с глоточными опорами
и окрашиваются при азановой методике в синий цвет. Ввиду их незна-
чительных размеров они вряд ли могут замыкать глоточный просвет и
скорее обеспечивают некоторую гибкость сочленения глотки с аподемаль-
ными структурами гнатосомы.
Собственно глоткой следует считать отдел, расположенный позади
от клиновидного гребня (рис. 195, 196). От вентрального угла первично
треугольного просвета отходят два луча в вентро-латеральном направле-
нии; дорсо-латеральные углы глотки также вытягиваются, и на попереч-
ном разрезе орган приобретает характерную форму двух букв Y, соеди-
ненных основаниями. Стенки глотки образованы парой длинных, изо-
гнутых внутрь хитиновых латеральных лопастей и двумя парами более
коротких вентральных и дорсальных лопастей. Постоянное положение
глотки в полости тела обеспечивается главным образом латеральными
мышцами-расширителями. Пучки последних идут от средней линии
латеральных лопастей к боковым стенкам основания гнатосомы. В перед-
ней трети органа он поддерживается также несколькими парами дорсаль-
ных расширителей. Они отходят от концов дорсальных лучей и прикреп-
ляются снизу к субхелицеральной пластинке (рис. 194). От наружной
- 25 -
поверхности вентральных лучей на всем их протяжении отходят пучки
вентральных мышц-расширителей. Антагонисты расширителей глотки
представлены группой кольцевых мышц-сжимателей, отходящих от
концов лучей и окружающих глотку мощным мышечным слоем (рис. 195,
196). Места прикрепления мышц-расширителей и сжимателей чередуются
в правильном порядке. В местах, где отсутствует прикрепление мышц,
хитинизированные стенки глотки окружены слоем паренхиматозной
ткани гиподермального происхождения.
У аргасовых клещей глотка такого же строения, что и у иксодид,
и лишь несколько короче и толще. Ротовое отверстие и самая дистальная
часть глотки на поперечных срезах имеют форму перевернутого треу-
гольника (рис. 203). Несколько далее назад появляется срединный вент-
ральный вырост, а затем два дорсо-латеральных, а глотка принимает
характерную трехлучевую форму (рис. 204—205). У вершины каждый
из лучей в свою очередь вилкообразно расщепляется. При расширении
глотки форма ее просвета приближается к мальтийскому кресту. Каких-
либо морфологически оформленных клапанов на ее переднем и заднем
концах нам обнаружить не удалось. Возможно лишь, что клиновидный
выступ нижней лабральной стенки, расположенный на дорсальной по-
верхности рта, может замыкать вход в глотку при ее сокращении.
Снаружи, как и у иксодид, она окружена кольцами мышц ретракторов,
правильно чередующихся с пучками дилататоров. Дорсальные мышцы-
расширители начинаются на утолщенных латеральных гребнях эпистома,
а вентральные и вентро-латеральные — на нижних стенках гнатосомы.
Кроме описанных мощных дорсальных дилататоров, от переднего конца
глотки отходят несколько коротких мышечных пучков. Они идут к са-
мому переднему концу эпистома, формирующему пол слюнной полости,
и, вероятно, контролируют объем последней (рис. 198).
Пищевод. В задней части глотки ее диаметр и толщина склеротизован-
ных стенок постепенно уменьшаются, расширители исчезают, и она пере-
ходит в трубчатый пищевод. Последний представляет короткую, тонкую
трубку, соединяющую глотку со средней кишкой. От конца глотки он
сперва делает небольшой изгиб в нижне-переднем направлении, а затем
круто поворачивает вперед и вверх, впадая в желудок с вентральной
стороны у его переднего конца. На своем пути он проходит сквозь мозг,
входя в него в передневентральной части и выходя в заднедорсальной
(рис. 60). Задний конец пищевода впячивается в просвет желудка напо-
добие телескопической трубки. Образующуюся при этом кольцевую
складку называют провентрикулярным клапаном и считают, что она
препятствует вытеканию содержимого средней кишки в глотку. При
движении крови вперед стенки его отгибаются и закрывают вход в пищевод.
На поперечных срезах пищевод почти округлый. Он построен из
слабо вытянутых эпителиальных клеток, тесно прижатых друг к другу
Рис. 60—66. Строение пищевода, ректального пузыря и задней кишки.
Ornithodoros papillipes: 60 — соединение пищевода с глоткой и средней кишкой,
61 — соединение ректального пузыря с мальпигиевыми сосудами, тонкой и задней
кишками, 62 — задняя кишка самки, 63 — участок стенки ректального пузыря самки
Ixodes ricinus; Hyalomma asiaticum: 64 — место впадения вторичного выводного про-
тока в главный выводной проток слюнной железы, 65 — передняя часть пищевода,
66 — место впадения пищевода в среднюю кишку самки.
гл — глотка; мг — мозг; пщ — пищевод; срк — средняя кишка; рп — ректальный пузырь; тк —
тонкая кишка; зк — задняя кишка; мс — мальпигиевы сосуды; ан — анальное отверстие; мр —
мышцы-расширители анального отверстия; анс — створки анального клапана; к — кутикулярная
выстилка; эн — эндокутикулярный слой; сп — спиральная кутикулярная нить стенки выводного
протока; мшс — мышечный слой и соединительнотканная оболочка; тп — телескопическое впячи-
вание пищевода в полость средней кишки; г — клетки стенки средней кишки; мсф — мелкие, ссф —
средние и ксф — крупные сфериты гуанина; кр — клетки стенки ректального пузыря; гп — гипо-
дермальные клетки.
- 26 -
и образующих многочисленные мелкие складки. Клетки не проявляют
каких-либо признаков секреторной активности или образования слизи.
Плазма их бедна включениями. Ядра довольно мелкие, овальные. За
исключением периодов личиночной и нимфальной линек, они всегда
находятся в покоящемся состоянии. Апикальные концы клеток выстланы
кутикулярным слоем, окружающим весь просвет пищевода, базальные
покоятся на очень тонкой базальной мембране. Снаружи пищевод окру-
жен сплошным слоем кольцевой и отдельными пучками продольной
мускулатуры (рис. 65).
Стенки складок провентрикулярного клапана относятся к произ-
водным первичной передней кишки. Клетки их сильно вытянуты и сжаты,
так что местами создают впечатление многослойного эпителия. Они не
выполняют ни секреторной, ни пищеварительной функций и плазма
их не содержит включений. Снаружи они покрыты тонкой кутику-
лой, резко обрывающейся на границе с клетками средней кишки.
Мышечный слой пищевода в провентрикулярной складке отсутствует
(рис. 66).
Средний отдел кишечника. Средняя кишка клещей эндодермального
происхождения и занимает значительную часть полости идиосомы, при-
крывая с дорсальной стороны внутренние органы. Она подразделяется
на центральный отдел, или желудок, и отходящие от него парные трубко-
видные или лопастевидные дивертикулы (рис. 58, 59). Форма и число
последних кажутся, на первый взгляд, весьма изменчивыми. Однако
на основании сравнительного изучения строения кишечника различных
видов и на разных фазах развития выявляются особенности, свойствен-
ные как всему надсем. Ixodoidea в целом, так и отдельным группировкам
внутри него. При этом в строении средней кишки следует различать
весьма постоянное первичное расчленение и очень изменчивое вторичное
расщепление первичных отростков. Первичные отростки (дивертикулы)
образуются на ранних стадиях эмбриогенеза в виде симметричных не-
расчлененных выростов первичной средней кишки. Ю. Вагнер (1894)
показал, что у эмбрионов Boophilus calcaratus первоначально образуются
дивертикулы 2—7-й пар, а отростки 1-й пары появляются значительно
позднее. У Ixodes ricinus они развиваются у перелинявших личинок
(Falke, 1931). Однако, по более новым наблюдениям (Aeschlimann, 1958).
у эмбрионов Ornithodoros moubata сразу же закладываются все 7 пар
дивертикулов. Возможно, что запаздывание закладки 1-й пары диверти-
кулов связано с ее значительной редукцией у многих видов иксодид и
имеет вторичный характер. В этом случае следует принять за исходное
число дивертикулов для всего надсемейства 7, а отклонения от него
считать вторичными изменениями.
Аргасовым клещам в целом свойственно сохранение относительно
развитой, часто мешковидной центральной части средней кишки и очень
сильное вторичное расщепление первичных отростков, наблюдающееся
уже на личиночной фазе. У Ornithodoros papillipes сохраняются все семь
пар первичных отростков (рис. 67 и 68). Из них первые четыре пары,
называемые передне-боковыми отростками, отходят латерально одним
общим основанием от переднего конца желудка, а уже далее они разде-
ляются на самостоятельные дивертикулы. В ряде случаев, возможно,
в зависимости от степени растяжения кровью, создается впечатление,
что от общего основания сперва отходит лишь пара отростков, вскоре
в свою очередь дихотомически расщепляющихся. Передне-боковые от-
ростки тесно связаны с пальпами и первыми тремя парами ног. У личинок
и нимф часто наблюдается их вхождение в конечности. Пятую пару при-
нято называть срединными отростками. Они отходят почти перпендику-
лярно к продольной оси тела, а дойдя до боковых стенок, подгибаются
- 28 -
вентрально и возвращаются к средней линии, «где круто поворачи-
вают вперед и заканчиваются под передним концом желудка. Две по-
следние пары, называемые задне-боковыми, отходят общим основанием
от заднего конца желудка и заканчиваются у задней стенки тела. Они,
Рис. 67—75. Расчленение средней кишки аргасовых клещей.
67 — личинка и 68 — самка Ornithodoros papillipes', 69 — ли-
чинка и 70 — самка Alveonasus lahorensis, 71 — личинка и
72 — самка Argas persicus; 73 — самка Ornithodoros alactagalisy
74 — самка О. coniceps\ 75 — самка A rgas vespertilionis.
жд — желудок; отростки средней кишки: по — переднебоковые, со —
срединные и зо — заднебоковые.
как правило, бывают наиболее сильно развиты. Дистальные их концы
обычно неглубоко расщеплены многочисленными складками.
Сходный тип расчленения средней кишки на небольшой центральный
отдел и длинные трубчатые дивертикулы со сравнительно слабым вторич-
ным ветвлением имеется у О. verrucosus, О. tartakovskyi, О. alactagalis,
О. coniceps и О, moubata. Для этих видов характерно также подгибание
пятой пары отростков на брюшную сторону. Видовые отличия связаны
- 29 -
со степенью слияния основании отростков и их вторичным ветвлением.
У Ornithodoros tartakovskyi, О. dlactagalis и О. coniceps срединный отрос-
ток дает недалеко от основания короткий вторичный дивертикул (рис. 73
и 74). Для О. coniceps характерна также значительная редукция 6-й пары
отростков.
Иной тип расчленения мы наблюдаем у Alveonasus lahorensis. От мас-
сивного мешковидного центрального желудка у него отходят 4 пары
коротких и толстых переднебоковых отростков и 2 пары заднебоковых.
От 5-й пары остались лишь зачаточные выросты (рис. 69, 70).
Для видов рода Ar gas, отличающихся сильно уплощенным телом
с краевым рантом, характерно сплющивание кишечника и очень сильное
вторичное расщепление лопастевидных боковых отростков. Центральный
отдел обычно развит слабо. У A. persicus еще можно различить 7 пар
исходных стволов (рис. 71, 72). У A. vespertilionis дивертикулы расщеп-
ляются вторично до самого основания, а желудок очень сильно укорочен
(рис. 75).
Личинки и нимфы всех изученных видов по характеру расчленения
кишечника в основном сходны со взрослыми. Для них типичны лишь
более сильное развитие центральной части, меньшая длина дивертикулов
и часто захождение их в конечности (рис. 67, 69, 71).
У представителей сем Ixodidae в большинстве случаев также имеются
7 пар первичных отростков, из которых 1-я пара может быть недоразвита.
Желудок у иксодид обычно значительно короче и тоньше, а боковые
дивертикулы длиннее и реже подвергаются вторичному расщеплению.
Кроме того, у дивертикулов наблюдается тенденция к заворачиванию
на брюшную сторону с образованием по ходу значительных изгибов
(рис. 59). Типичным строением средней кишки обладает клещ Hyalomma
asiaticum. У самок этого вида (рис. 83) 1—5-я пары передне-боковых
отростков отходят общими основаниями от передних углов желудка.
Из них 1-я и 3-я пары отростков следуют в переднем направлении, а 4-я
и 5-я пары отходят каудально. Особенно сильно развитая 5-я пара от-
ростков доходит почти до заднего конца тела, а затем подгибается на
вентральную сторону и возвращается вперед до основания гнатосомы.
6-я и 7-я пары заднебоковых отростков также отходят общими основа-
ниями. Из них сильнее развита 7-я пара, вентральная ветвь которой
также почти доходит до гнатосомы.
У самцов Н. asiaticum, как и у большинства других Amblyomminae,
расчленение кишечника то же, что и у самок, но отростки значительно
тоньше и короче (рис. 84). У личинок и нимф желудок массивнее, чем
у половозрелой фазы, и от него отходят более короткие и толстые отростки.
У видов рода Boophilus наблюдается тенденция ко вторичному расщеп-
лению переднебоковых отростков и захождение их концов внутрь ко-
нечностей (рис. 81). Последняя особенность встречается довольно часто
у неполовозрелых фаз и самцов рода Hyalomma.
У самцов Ixodinae, в частности у Ixodes ricinus (рис. 77), наблюдается
редукция части отростков средней кишки, так что от вытянутого трубча-
того желудка отходят лишь две пары поперечных отростков, передняя
из которых заканчивается двумя вертикальными ответвлениями, вероятно,
гомологичными отросткам 2—3-й пар.
Желудок и дивертикулы имеют сходное гистологическое строение,
и стенки их построены из пищеварительных, секреторных и недифферен-
цированных клеток. Их тонкое строение и функциональная активность
рассматриваются в разделе «Пищеварение» (см. стр. 161).
Тонкая кишка. Многие исследователи считали, что у иксодовых кле-
щей тонкая кишка представлена слепым клеточным тяжем, идущим от
средней кишки к ректальному пузырю и лишь в редких случаях имеющим
- 30 -
внутренний капиллярный просвет, так что сообщение между средней
кишкой и анальным отверстием отсутствует, равно как и выделение
фекалий (Вагнер, 1894; Bonnet, 1907; Mudrow, 1932). Это мнение возникло,
Рис. 76—84. Расчленение средней кишки у иксодовых клещей.
76 — самка и 77 — самец Ixodes ricinus; 78 — самка Derma-
centor pictus; 79 — самец и 80 — самка Нaemaphysalis sulcata;
81 — самка Boophilus calcaratus; 82 — самка Rhipicephalus
turanicus; 83 — самка и 84 — самец Hyalomma asiaticum.
жд — желудок; отростки средней кишки: по — переднебоковые, зо —
заднебоковые; I—VII — порядковые номера боковых отростков.
по-видимому, при работе исключительно с голодными клещами, у кото-
рых стенки тонкой кишки действительно довольно часто спадаются,
а акты дефекации сравнительно редки.
Большинство исследователей, основываясь на присутствии в испраж-
нениях клещей продуктов переваривания крови, признавало существо-
вание сообщения между средней кишкой и ректальным пузырем, а в ряде
работ приводились доказательства существования анатомически полно-
- 31 -
акм
Рис. 85—93. Коксальные железы, сердце и ткани внутренней среды иксодоидных
клещей.
85 — сагиттальный разрез тела Alveonasus lahorensis на уровне коксального отверстия
(по Сидорову, 1960в); 86 — отпрепарированная коксальная железа Ornithodoros
moubata (вид сверху; по Lees, 1946b); 87 — кровеносная система Hyalomma asiati-
cum} 88 — трофоцит, 89 — фагоцит и 90 — прогемоцит в капле гемолимфы самки
Boophilus calcaratus (по Цвиленевой, 1961а); 91 — пленка аморфного вещества соеди-
нительной ткани с десмобластами и мышечными волокнами; 92 — участок тяжа жи-
рового тела; 93 — эноцит, прикрепленный к тяжу жирового тела самки В. calcaratus
(по Цвиленевой, 19616).
акж — акцессорная железа; вкп — внутренняя коксальная пора; мик — интеркоксальная мышца;
мкж — мышцы коксальной железы; фкм — фильтрационная камера с системой каналов; сд —
сердце; ар — аорта; пне — периневральный синус; сн — стволы к ногам; га — головная аорта.
Рис. 94—100. Органы чувств самки — Hyalomma asiaticum.
94 — хета; 95 — аурикулярия; 96 — копьевидная сенсилла; 97 — стреловидная
сенсилла голодной и 98 — питающейся особи; 99 — фовеа; 100 — пальпа сам-
ки перед освобождением от линочной шкурки. Микрофотографии: 94—97 —
Х1200; 98, 99 — Х600; 100 — X 120.
Рис. 109—115. Слюнные железы и женская половая система пксодоидиых клещей.
Отпрепарированные слюнные железы самки Hyalomma asiaticum: 109 — голодной,
110 — питающейся; 111 — половая система напитавшейся самки Н. anatolicum\
112 — то же Dermacenlor pictus; 113 — половая система голодной самки Alveonasus
lahorensis: 114 — то же Arinas vespertilionis] 115 — то же Argas persicus. Фотографии:
109, 110 — 7.12: 111—115 — Х7.
ценной тонкой кишки (Pagenstecher, 1861; Nordenskiold, 1908; Суворов,
1908; Roesler, 1934; Enigk u. Grittner, 1952). У всех исследованных нами
видов иксодид мы также обнаружили нормально функционирующую
тонкую кишку.
Существование тонкой кишки у аргасовых клещей вообще не вызывало
сомнений и исключение составляет лишь Ornithodoros moubata, у которого,
по наблюдениям В. Бургдорфера (Burgdorfer, 1951), постоянно отсутст-
вует сообщение между средней кишкой и ректальным пузырем.
На основании анатомического изучения О. papillipes, О. verrucosus,
О. tartakovskyi, Alveonasus lahorensis и Argas persicus мы установили, что
у этих видов всегда имеется хорошо развитая тонкая кишка. Изучение
строения Ornithodoros moubata подтвердило данные В. Бургдорфера
об отсутствии сообщения между средней кишкой и ректальным пузырем
у этого вида. Тонкая кишка у него заканчивается слепо и содержимое
кишечника не может выводиться наружу в виде экскрементов.
Тонкая кишка представляет сравнительно короткую трубку, сужаю-
щуюся в направлении ректального пузыря. Она отходит медио-вентрально
от заднего конца желудка перед его расщеплением на задне-боковые
дивертикулы, опускается в задневентральном направлении и, немного
не доходя до вентральной стенки тела, изгибается вверх и входит вместе
с мальпигиевыми сосудами в передневентральную часть ректального
пузыря (рис. 61). Диаметр тонкой кишки в значительной степени варьи-
рует в зависимости от фазы развития и стадии пищеварения. У личинок
пксодиД она наиболее тонкая и по существу представляет клеточный тяж
с очень узким внутренним просветом. У половозрелых особей она особенно
хорошо видна во время питания вследствие заполнения ее полости
кровью хозяина. В этом состоянии тонкая кишка мало отличается от
концов дивертикулов средней кишки.
Являясь продолжением средней кишки, тонкая кишка и по гистоло-
гическому строению, особенно в передней части, очень сходна с первой.
Ее стенки построены из эпителиальных клеток, лежащих на базальной
мембране и окруженных сплетением продольных и кольцевых мышечных
волокон. В зависимости от степени растяжения тонкой кишки эпители-
альные клетки могут глубоко вдаваться апикальными концами в ее по-
лость или же принимают кубическую и уплощенную форму. Цитоплазма
клеток нормально свободна от пищевых включений, но иногда в ней
обнаруживаются мелкие конкреции гематина. Последнее подтверждает
потенциальную возможность клеток этой части кишечника принимать
участие в процессах внутриклеточного пищеварения. В месте впадения
тонкой кишки в ректальный пузырь кольцевая мускулатура образует
уплотнение, напоминающее сфинктер. Он, возможно, контролирует
выход содержимого средней кишки в ректальный пузырь.
Ректальный пузырь. Ректальный пузырь представляет непарный
мешок, форма и размеры которого в значительной степени зависят от
заполнения гуанином и фекалиями (рис. 61). У аргасовых клещей он
расщепляется сзади на две лопасти. Слабо заполненный гуанином и эк-
скрементами, он сохраняет почти шаровидную форму, и задние лопасти
плохо различимы, тогда как при сильном растяжении последние выдаются
далеко назад. Стенки ректального пузыря построены из плоского эпи-
телия с крупными ядрами и бедной включениями плазмой. Снаружи
они окружены базальной мембраной с сетью тончайших мышечных воло-
конец. В зависимости от степени заполнения пузыря форма его клеток
меняется от почти кубической до листовидной, причем в последнем слу-
чае клеточные границы становятся неразличимыми (рис. 63).
^Прямая кишка. Медио-вентрально пузырь открывается в прямую
кишку. Она опускается почти под прямым углом вниз и открывается
3 Ю. С. Балашов
- 33 -
анальным отверстием (рис. 62). На всем протяжении она выстлана до-
вольно толстой, сильно складчатой кутикулой. Границы отдельных
эпителиальных клеток неразличимы. У иксодид она может сильно рас-
тягиваться фекалиями или экскретами, которые затем с силой выталки-
ваются из анального отверстия при сокращении мускулатуры стенок
кишки.
Анальное отверстие представляет продольную щель, прорезающую
анальную пластинку. Последняя состоит из двух створок и окружена
так называемым анальным кольцом — участком склеротизованной кути-
кулы. Между створками находится эластичная сочленяющая мембрана.
От стенок прямой кишки к анальной пластинке идет пара мышечных
пучков. При их сокращении анальная щель раскрывается, а нижняя
часть прямой кишки увеличивается в объеме и немного выворачивается
наружу, облегчая дефекацию. При расслаблении мускулатуры анальная
щель закрыта, а просвет прямой кишки почти исчезает из-за спадения
стенок.
ОРГАНЫ ВЫДЕЛЕНИЯ
Выведение продуктов азотистого обмена и, в меньшей степени, ос-
морегуляторная функция осуществляются мальпигиевыми сосудами.
У аргасовых клещей существуют, кроме того, специализированные осмо-
регуляторные органы — коксальные железы.
Мальпигиевы сосуды. Строение и функции мальпигиевых сосудов
рассматриваются в специальных исследованиях (Enigk u. Grittner,
1952; Schulze, 1955; Балашов, 1958в; Till, 1961; Ефремова, 1967). Маль-
пигиевы сосуды клещей представлены парой тонких трубок, впадающих
в передневентральную часть ректального пузыря по сторонам от места
отхождения прямой кишки (рис. 61). Их длина в 2—5 раз превышает
общую длину тела, и по своему ходу они образуют несколько петель
(рис. 58, 59). От места впадения в ректальный пузырь мальпигиевы со-
суды поворачивают назад и по вентральной стороне тела доходят почти
до заднего конца идиосомы. Затем они поворачивают круто вверх и по
дорсальной поверхности внутренних органов продолжаются до уровня
передней трети тела, вновь поворачивают назад и в задней трети тела
загибаются на вентральную сторону под отростки кишечника. После
этого они уже не делают новых петель и проходят вдоль внутренней
стороны слюнных желез до уровня центральной нервной массы, где их
концы иногда бывают заметно утолщены и изогнуты внутрь. У аргасовых
клещей относительная длина мальпигиевых сосудов меньше, чем у ик-
содид, а у личинок и нимф они соответственно короче, чем у самок.
Гистологическое строение мальпигиевых сосудов одинаково у иксо-
довых и аргасовых клещей и различия определяются главным образом
их функциональным состоянием. Снаружи они окружены тонкой соедини-
тельнотканной оболочкой с многочисленными пучками внутренностных
мышц. У прижизненно вскрытых особей удается наблюдать перисталь-
тические движения органов, обеспечивающие проталкивание их содер-
жимого в сторону ректального пузыря. Стенки сосудов образованы одним
слоем эпителиальных клеток, форма которых может варьировать от почти
уплощенной до кубической или столбчатой (рис. 342—348). У видов
с неравномерным распределением заселенных риккетсиями клеток по
ходу сосудов наблюдаются определенные различия в строении клеток
с микроорганизмами или без них (см. стр. 272). Так, у голодных самок
Hyalomma asiaticum передние концы сосудов, заселенные риккетсиями,
содержат более высокие и крупные клетки, тогда как в задних концах,
свободных от риккетсий, клетки более уплощенные. У напитавшихся
особей подобные различия стираются.
— 34 —
Местами на апикальной цитоплазматической мембране наблюдается
поперечная исчерченность, напоминающая рабдориум насекомых. На
электронномикроскопических фотографиях срезов мальпигиевых сосудов
Argas persicus в работе М. Рошди (Roshdy, 1961b) отчетливо видны мно-
гочисленные микроворсинки, так что в этом отношении мальпигиевы
сосуды клещей и насекомых имеют сходное строение. Ядра клеток крупные,
интенсивно красящиеся на ДНК. В цитоплазме выявляется большое
количество гликогена и мелких жировых вакуолей. В апикальных кон-
цах клеток цитоплазма сильно вакуолизирована. Содержание РНК и
базофилия цитоплазмы очень низкие.
Коксальные железы. У аргасовых клещей значительная часть воды
и солей, поступивших с кровью позвоночного, удаляются из организма
еще во время питания или сразу после его окончания в форме коксальной
жидкости (см. стр. 164). Последняя выводится из пары щелевидных от-
верстий — наружных коксальных пор, расположенных между I и II
парами кокс. У клещей Ornithodoros moubata, О. savignyi, Argas persicus
(Robinson a. Davidson, 1913—1914; Lees, 1946b) с коксальной порой
сообщается проток небольшой акцессорной железы, функции которой
неизвестны, и сложно устроенной собственно коксальной железы.
Последняя состоит из системы тонкостенных фильтрационных камер и
отходящей от них системы каналов, открывающихся в воронку коксаль-
ной поры (рис. 86). Коксальная жидкость при этом образуется в процессе
ультрафильтрации сквозь полупроницаемые стенки камер и отличается
по своему составу от гемолимфы.
У клещей Alveonasus lahorensis, по данным В. Е. Сидорова (1960в),
фильтрационные коксальные железы отсутствуют и коксальные воронки
открываются непосредственно в полость тела (рис. 85). Соответственно
этим анатомическим особенностям коксальная жидкость у них не должна
существенно отличаться от гемолимфы.
КРОВЕНОСНАЯ СИСТЕМА
Органы кровообращения клещей развиты слабо. Сердце представ-
ляет небольшой треугольный, сплющенный дорсо-вентрально мешок,
который подвешен тонкими мышечными пучками к дорсальной поверх-
ности идиосомы (рис. 87). С вентральной стороны в сердечную полость
открываются две (Ixodes ricinus и Hyalomma asiaticum) или одна (Argas
persicus) пара остиальных отверстий с клапанами, по которым поступает
кровь из лакунарных пространств. Передний конец сердца переходит
в короткую аорту. Она заканчивается у мозга, окружая его периневраль-
ным кровеносным синусом. От последнего вокруг педальных нервов
отходят к ногам 4 пары крупных сосудов. Спереди периневральный синус
переходит в окологлоточный синус, от которого идут кровеносные сосуды
к пальпам и гнатосоме.
ТКАНИ ВНУТРЕННЕЙ СРЕДЫ
Полость тела паразитиформных клещей, как и у других членисто-
ногих, имеет смешанное происхождение («миксоцель») и образуется
в результате распада целомических закладок зародыша и слияния их
со схизоцельным пространством (Беклемишев, 1964). У иксодовых кле-
щей полость тела в значительной степени заполнена тканями внутренней
среды, которые включают гемолимфу, элементы рыхлой соединительной
ткани, базальные мембраны и другие оболочки соединительнотканного
происхождения.
Гемолимфа. Сведения о гемолимфе клещей ограничиваются в основном
описанием морфологии и в меньшей степени функций ее форменных эле-
- 35 -
3*
ментов. В. А. Цвиленева (1961а, 19616, 1961в) на основании исследований
гемолимфы клещей Boophilus calcaratus, Hyalomma detritum, H. anato-
licum, Dermacentor daghestanicus, Rhipicephalus sanguineus выделила три
типа гемоцитов. Крупные клетки, диаметром до 20—25 мк с ядрами около
8 мк, цитоплазма которых почти полностью забита крупными включе-
ниями до 4 мк, объединяются в группе трофоцитов (рис. 88). Более под-
вижные клетки меньших размеров (диаметр в среднем 14—18 мк), но с бо-
лее крупными ядрами (9—11 мк), базофильной цитоплазмой и меньшим
числом включений в последней относятся к группе фагоцитов (рис. 89).
Наиболее мелкие формы с ядрами в 5—6 мк, окруженными узкой по-
лоской цитоплазмы, рассматриваются как юные камбиальные элементы
и называются прогемоцитами (рис. 90). Все три типа гемоцитов подвижны
и образуют нитевидные или лопастевидные псевдоподии. Последнее
особенно характерно для фагоцитов. Митотические деления наблюдаются
главным образом среди прогемоцитов. Деление клеток на трофоциты и
фагоциты относительно, так как встречаются промежуточные формы и
возможны превращения клеток одного типа в другой.
У напитавшихся самок и нимф, кроме того, встречаются гигантские
клетки диаметром 40—45 мк, сидящие на соединительнотканных пленках
и тяжах жирового тела. Их называют эноцитами, но пока еще отсутст-
вуют доказательства о родстве их с эноцитами насекомых (рис. 93).
Сходные форменные элементы описаны и в гемолимфе аргасовых
клещей (Теравский, 1957; Сидоров, 19606), но им даны другие наимено-
вания. В частности, у клещей Ornithodoros papillipes, Alveonasus lahoren-
sis и Ar gas persicus В. E. Сидоровым (19606) также найдены три типа
гемоцитов, размером от 5—7 до 20—25 мк. Из них юные амебоциты,
по-видимому, гомологичны прогемоцитам иксодовых клещей, зрелые
амебоциты — фагоцитам и старые амебоциты — трофоцитам. Для зрелых
амебоцитов доказана способность к фагоцитозу посторонних частиц и
микроорганизмов (бруцелл вакцинного штамма и спирохет).
Количество гемоцитов в единице объема крови очень непостоянно.
По данным И. К. Теравского (1957), у аргасовых клещей оно колеблется
от 1000—2000 до 80 000—100 000 на 1 мм3 гемолимфы. У личинок и го-
лодных нимф иксодид количество гемоцитов меньше^ чем у напитавшихся
нимф и имаго, и среди них преобладают прогемоциты (Цвиленева, 1961а).
По нашим наблюдениям, непостоянство числа гемоцитов в мазках гемо-
лимфы отчасти можно объяснить способностью их к временной утрате
подвижности и прикреплением к соединительнотканным тяжам и пленкам.
Соединительнотканные образования. Соединительная ткань иксодо-
вых клещей, по наблюдениям В. А. Цвиленевой (19616, 1961в), сохраняет
клеточное строение, и в пленках ее аморфного вещества встречаются
ядра всех типов клеток десмобластического ряда. Кроме того, в ее тяжах
и пленках обнаружены многочисленные тонкие пучки внутренностных
мышц, лишенных сарколеммы (рис. 91). Подобные же мышечные воло-
конца образуют сплетения на поверхности кишечника, мальпигиевых
сосудов и других внутренних органов и ответственны за их перисталь-
тические сокращения.
К соединительнотканным образованиям иксодовых клещей относится
также система из сетеобразно ветвящихся тяжей, которую В. А. Цвиленева
(1961а) называет жировым телом. Толщина тяжей варьирует от 1 до 5
клеток в ряду, а местами они могут формировать и более массивные
скопления. Жировое тело наиболее развито по бокам тела, в промежут-
ках между дивертикулами кишечника, вдоль крупных трахейных ство-
лов. У голодных особей оно развито значительно слабее, чем у напитав-
шихся. В состав жирового тела входят несколько типов клеток. Преоб-
ладают клетки с небольшими ядрами и базофильной цитоплазмой,
- 36 -
а также с более крупными ядрами и цитоплазмой, заполненной крупными
включениями, сходными с таковыми трофоцитов (рис. 92). Местами
клетки жирового тела образуют отростки и становятся не отличимыми
от типичных клеток соединительной ткани.
ОРГАНЫ ДЫХАНИЯ
Дыхание клещей осуществляется трахейной системой, кутикулярная
выстилка которой сменяется при линьках. У личинок иксодовых и многих
видов аргасовых клещей трахейная система не обнаружена, тогда как
у некоторых личинок аргазид она достаточно развита [Alveonasus laho-
rensis, Argas persicus, A. vulgaris, A. reflexus, Ornithodoros coniceps,
0, capensis (Остроумова, 1939; Theodor a. Costa, I960)]. У нимф и имаго
всех видов парные дыхальца открываются на сложно устроенных стиг-
мальных пластинках, которые лежат по вентро-латеральным сторонам
идиосомы несколько позади IV пары кокс. Дыхальце снабжено замыка-
тельным аппаратом, находящимся под контролем центральной нервной
системы (Mellanby, 1935). Оно открывается в дыхательную (атриальную)
полость. Последняя переходит в короткий общий трахейный ствол и
к месту их соединения прикрепляется группа мышц-расширителей
(рис. 101, 108). При повышении внутриполостного давления общий тра-
хейный ствол спадается, а сокращение описанных мышц вызывает рас-
ширение его полости (Falke, 1931). От общего трахейного ствола отхо-
дят 8 главных трахейных стволов, дающих вторичные разветвления
ко всем частям тела (рис. 58). По гистологическим особенностям трахеи
клещей сходны с таковыми насекомых и их кутикулярная выстилка
несет нитевидное спиральное утолщение, идентичное тенидиальной нити
(рис. 367). Многократно ветвясь, каждый трахейный ствол заканчива-
ется пучком тончайших трахеол (рис. 44), которые густой сетью оплетают
внутренние органы.
ОРГАНЫ ЧУВСТВ
Кожные органы чувств. В кутикуле иксодоидных клещей обнаружены
многочисленные сенсиллы, которые называют кожными органами чувств,
а совокупность их хетомом. Строение их было исследовано только у иксо-
довых клещей (Schulze, 1942b). Наиболее распространенным типом сен-
силл оказались осязательные волоски, или хеты (sensyllum trichoidea).
Они встречаются по всей поверхности тела и конечностей. У взрослых
клещей число и расположение хет на теле, исключая отдельные группы
(анальные, постпальпальные, постгипостомальные и др.), непостоянно
(неотрихия). На личиночной фазе набор этих хет отличается значитель-
ным постоянством (ортотрихия) и используется в качестве таксономиче-
ских признаков всех рангов (Филиппова, 1958, 1966).
Размеры осязательных хет в зависимости от видовой принадлежности,
фазы развития и местоположения варьируют от нескольких микронов
у личинок до 100 мк и более у имаго. Хета представляет полый кутикуляр-
ный вырост со сравнительно толстыми стенками (рис. 94). Она подвижно
сочленена с кутикулой благодаря тонкому мембрановидному кольцу
вокруг основания. Это кольцо в свою очередь окружено снаружи эпику-
тикулярным валиком, так что основание хеты оказывается погруженным
в чашеобразное углубление. Хета образуется во время линьки трихоген-
ной клеткой, отросток которой по внутрикутикулярному каналу продол-
жается в полость хеты. К основанию хеты, кроме того, подходит отросток
чувствительной биполярной клетки, тогда как сама клетка лежит под
кутикулой в гиподермальном слое. Отдельным, более коротким, хетам
- 37 -
ног приписывается способность к восприятию температуры (Lees, 1948;
Arthur, 1962), но строение их не изучено.
Проприорецепторами изменений напряжения самой кутикулы слу-
жат ауриформные сенсиллы, или аурикулярии (sensyllum auriformes).
Последние представляют короткие внутрикутикулярные каналы диамет-
ром в несколько микронов, заканчивающиеся кутикулярным диском и,
по-видимому, не сообщающиеся с внешней средой (рис. 95). В канал
заходит отросток чувствительной клетки, заканчивающийся в кутикуляр-
ном диске. Сенсиллы этого типа встречаются по всему телу как в твердой,
так и в растяжимой кутикуле. Функции проприорецепторов приписы-
вают также, по аналогии с другими членистоногими, лировидным орга-
нам, но строение их остается неизвестным.
Только иксодовым клещам свойственны так называемые железисто-
чувствительные органы, среди которых П. Шульце (Schulze, 1942b) вы-
деляет три следующих типа: копьевидные (sensyllum hastiformes), стрело-
видные (s. sagittiformes) и фонаревидные (s. laterniformes). Два первых
типа несомненно несут железистую функцию и их каналы служат вывод-
ными протоками дермальных желез. Особенности строения и секреторной
активности последних описаны в литературе (Yalvac, 1939а; Lees, 1947;
Балашов, 1960в) и рассматриваются нами в разделе о росте и линьке
кутикулы. Сенсорная функция этих органов окончательно не доказана,
но в их состав входят типичные чувствительные клетки, отростки кото-
рых подходят к их концевым аппаратам. Предполагается (Wilkinson,
1965), что стреловидные сенсиллы могут служить гигрорецепторами,
тогда как функции двух других типов неизвестны.
По данным изучения этих органов у клещей Hyalomma asiaticum
(рис. 96), канал копьевидной сенсиллы имеет внутренний диаметр в 1 мк
у личинок, 2 мк у нимф и 4—5 мк у самок. Диаметр канала стреловидной
сенсиллы у личинок и нимф — 6—8 мк и у самок — 10—12 мк (рис. 97).
Наиболее крупные фонаревидные сенсиллы имеют канал диаметром
в 12—20 мк, причем он сильно расширяется в дистальной части. Канал
на всем своем протяжении выстлан кутикулиновым слоем эпикутикулы,
который образует характерные для каждого типа сенсилл внутренние
выросты. Концевые аппараты также представляют кутикулярные образо-
вания, напоминающие дужки или булаву, и помещаются в специальных
расширениях каналов. На поверхности кутикулы описываемые органы
имеют вид кольцевых кутикулярных валиков, в центральных отверстиях
которых видны дистальные части концевых аппаратов.
Наиболее многочисленны копьевидные сенсиллы, встречающиеся по
всей поверхности растяжимой кутикулы идиосомы, на спинном щитке и
основании гнатосомы. На дорсальной стороне основания гнатосомы самок
они образуют пару крупных скоплений, называемых поровыми полями
(рис. 23), каждое из которых включает по нескольку десятков сенсилл
Рис. 101 —108. Строение перитрем, органов чувств и мозга иксодоидных клещей.
101 — вертикальный разрез перитремы самки Ixodes ricinus в области дыхальца (по
Falke, 1931); 102 — орган Галлера самки Argas vulgaris (по Филипповой, 1966);
103 — орган Галлера самки Dermacentor andersoni (по Arthur, 1962); 104 — попереч-
ный срез через орбитальный глаз Hyalomma sp. (по Schulze, 1951); 105 — мозг самки
Dermacentor pictus, вид сбоку; 106 — то же, вид сверху (по Иоффе, 1963); 107 — аф-
ферентные нервные волокна и чувствительный невропиль постэзофагеального отдела
мозга самки Hyalomma asiaticum (по Цвиленевой, 1965); 108 — поперечный срез через
перитрему Argas persicus (по Robinson a. Davidson, 1913—1914).
дх — дыхальце; атр — атриальная полость; атрм — атриальные мышцы; прт — перитрема^
глтр — главный трахейный ствол; трет — трахейные стволы к ногам и внутренним органам; пя —
передняя чувствительная ямка; чб — чувствительный бугорок; зк — задняя чувствительная камера;
бе — бутылковидпая сенсилла; глл — глазная линза; фрк — фоторецепторные клетки; глн —
глазной нерв; ное — оэзофагеальный нерв; нх — хелицеральпый нерв; нп — пальпальный нерв;
нн — ножные нервы; ноп — опистосомальный нерв; глм — гломерулы; опт — оптические центры;
про — преэзофагеальпый отдел мозга; пето — постэзофагеальный отдел мозга; пщ — пищевод.
- 38 -
ноп
этого типа. У самок подсем. Amblyomminae сходные парные скопления
копьевидных сенсилл, называемые дорсальными ямками, или фовеа,
находятся на аллоскутуме позади спинного щитка (рис. 99). У нимф на
их месте также обнаружены группы из нескольких копьевидных сенсилл.
Стреловидные и более редкие фонаревидные сенсиллы обнаружены
только на растяжимой кутикуле идиосомы и отсутствуют на склеротизо-
ванных частях тела. Они бывают одиночными или же входят в группы из
двух копьевидных и одной стреловидной или фонаревидной сенсиллы.
Распределение железисто-чувствительных органов на поверхности тела
клещей детально прослежено только для личнок 4 видов (Dinnik a. Zumpt,
1949), причем выявлены определенные видовые различия в их топографии.
Органы обоняния. Хеморецепторами клещей считают группу из
крупных тонкостенных хет на конце последнего пальпального членика
(рис. 100), хеты тарзуса и претарзуса I пары ног п орган Галлера.
После удаления сенсилл на концах пальп голодные клещи Ornithodoros
erraticus и Ixodes ricinus теряли способность прикрепления к хозяевам
даже после помещения, на тело последних. Хеты концевых члеников
I пары ног также относятся к контактным хеморецепторам, тогда как
сенсиллы органа Галлера воспринимают запахи на значительном рас-
стоянии. Степень развития разных типов сенсилл во многом опреде-
ляется особенностями нападения у разных групп иксодид. Так, по ха-
рактеру реагирования на репелленты установлено, что у клещей
7. persulcatus преобладает хеморецепция контактного типа, а у Hya-
lomma asiaticum — дистантного. Соответственно у последнего вида силь-
нее развиты задние камеры органа Галлера (Totze, 1933; Lees, 1948;
El-Ziady, 1958; Золотарев и Елизаров, 1964а, б).
Наиболее сложно устроены органы Галлера, расположенные на дорсаль-
ной поверхности лапок первой пары ног. У аргасовых клещей они пред-
ставляют мешковидные впячивания кутикулы, дно и стенки которых
покрыты характерными тонкостенными хетами хеморецепторного типа
(рис. 102). У некоторых видов рода Argas от проксимальной части камеры
в глубь лапки отходит характерный бутылковидный вырост, функции
которого неизвестны. Спереди и позади ямки органа Галлера располо-
жены пучки из крупных хет трихоидного типа (Филиппова, 1966).
У иксодовых клещей (Lees, 1948; Arthur, 1962, Золотарев и Сини-
цына, 1965) орган Галлера более сложного строения и подразделяется
на переднюю открытую ямку с несколькими типами тонкостенных хет
и заднюю камеру. Последняя сообщается с внешней средой узким кана-
лом в ее крыше. Дно и стенки камеры покрыты длинными тонкостен-
ными хетами (рис. 103). Сенсиллы ямки и камеры связаны с располо-
женными под ними самостоятельными группами чувствительных клеток.
Детали строения органов Галлера значительно варьируют, и они часто
используются в качестве диагностического признака.
Глаза. У иксодовых клещей, исключая виды родов Ixodes и Наета-
phy salts, по краям спинного щитка лежит пара простых глаз, строение ко-
торых описано П. Шульце (Schulze, 1951). Глаза клещей плоские или же
выступают над поверхностью кутикулы, как у видов рода Hyalomma.
Глаз состоит из прозрачного хрусталика, под которым располагается
группа чувствительных клеток, связанных с подходящим к ним оптиче-
ским нервом (рис. 104). У большинства аргасовых клещей глаза отсут-
ствуют.
НЕРВНАЯ СИСТЕМА
Для клещей характерна высокая степень концентрации центральной
нервной системы, приведшая к почти полному исчезновению следов ее
наружной сегментации и слиянию в одной нервной массе, называемой
- 40 -
мозгом, или синганглием. Строение последнего детально исследовано
у клещей Dermacentor ptctus на срезах (Иоффе, 1963) и у Hyalomma ana-
tolicum, Н. detritum, Boophilus calcaratus — с применением нейрогистологи-
ческих методик суправитального окрашивания метиленовой синькой
(Цвил енева, 1965).
Мозг представляет округлый компактный орган, лежащий в передней
трети тела на уровне I—II пар кокс над кишечником и выводными путями
половой системы (рис. 58, 59). У взрослых Dermacentor pictus он дости-
гает в длину около 400 мк, в ширину — 350 мк и в толщину — 250 мк.
Пищевод, проходящий сквозь мозг, делит его на меньшую, переднедорсаль-
ную половину, называемую преэзофагеальным отделом, и большую,
задневентральную половину — постэзофагеальный отдел (рис. 105, 106).
Преэзофагеальный отдел соответствует головному мозгу членистоногих.
В его состав входят протоцеребрум, оптические центры (у безглазых
видов в значительной степени редуцированы), ганглии хелицер (у иксо-
дид сливаются), стомодеальный мост и ганглии пальп. От этого отдела
отходят парные оптические нервы, нервы хелицер, пальп и с вентраль-
ной стороны от стомодеального моста — непарный эзофагеальный нерв,
идущий к пищеводу и глотке.
Постэзофагеальный отдел отвечает туловищному мозгу. В его состав
входят четыре пары ножных ганглиев, сохраняющих метамерное располо-
жение и дающих четыре пары ножных нервов. Задняя часть этого отдела
представлена одним непарным ганглием, соответствующим опистосомаль-
ному отделу брюшной нервной цепочки, но полностью утратившим следы
метамерии. От него отходят две пары нервов к внутренним органам.
По данным В. А. Цвиленевой (1965), в ганглиях иксодид, как и у дру-
гих членистоногих, находятся только тела двигательных и ассоциативных
нейронов, тогда как тела чувствительных нейронов расположены в нейро-
пиле. Центральный чувствительный нейропиль всех туловищных сег-
ментов слился в одно подковообразное сплетение, которое в передней
"части сохраняет метамерию, соответствующую расположению педаль-
ных ганглиев, а в задней части ее полностью утрачивает (рис. 107).
В постэзофагеальном отделе обнаружены только двигательные и при-
митивные ассоциативно-двигательные нейроны, тогда как чисто ассоциа-
тивные элементы отсутствуют. В результате у клещей еще сохраняется
простейшая двухнейронная дуга (чувствительный-{-двигательный или
ассоциативно-двигательный нейроны). В преэзофагеальном отделе имеются
и чисто ассоциативные нейроны, образующие несколько пар гломеруляр-
ных ядер. Специфическая особенность иксодоидных клещей — наличие
гломерул ганглиев I пары ног. Они связаны с органами Галлера и пред-
ставляют обонятельные центры.
С мозгом иксодоидных клещей тесно связан и их нейроэндокринный
аппарат. У имаго Dermacentor pictus (Иоффе, 1964), найдены 14 групп
нейросекреторных клеток (протоцеребральные, хелицеральные, педипаль-
палные, стомодеальные, ножных ганглиев, опистосомальные, постэзофа-
геальные) и у Hyalomma dromedarii (Dhanda. 1967) —18 групп, причем
наибольшее их количество сосредоточено в преэзофагеальном отделе.
От обычных нейронов эти клетки отличаются большим объемом перину-
клеарной цитоплазмы. В различные периоды жизни клещей концентра-
ция нейросекрета в цитоплазме значительно вариирует. У Н. drome-
darii установлено его интенсивное накопление у напитавшихся нимф
при подготовке к линьке и затем с началом питания имаго. По окон-
чании линьки или питания количество нойросекрета во многих груп-
пах клеток заметно уменьшается. У голодных имаго Dermocentor pictus
накопление нейросекрета происходит параллельно с развитием состоя-
ния потенциальной диапаузы.
- 41 -
ОРГАНЫ РАЗМНОЖЕНИЯ
Более или менее подробное описание половой системы клещей дается
в работах, посвященных анатомическому строению отдельных видов,
а именно Ixodes ricinus (Nordenskiold, 1908; Суворов, 1908; Samson,
1909а, 1909b; Ruser, 1933), /. melicola (Yalvac, 1939b), Boophilus annulatus
(Williams, 1905), Dermacentor andersoni (Douglas, 1943), Hyalomma aegyp-
tium (Bonnet, 1907), Rhipicephalus appendiculatus (Till, 1961), Ornitho-
doros savignyi (Christophers, 1906), Argas persicus (Robinson a. Davidson,
1913—1914; Горощенко, 1960), A. vespertilionis. A, boueti и A. transgariepi-
nus (Roshdy, 1961a , 1962, 1963). Строение и физиологические функции
органа Жене и придаточных желез половой системы описаны у клещей
Ixodes ricinus и Ornithodoros moubata (Lees a. Beament, 1948), Ixodes
hexagonus (Arthur, 1953), Argas persicus (Tatchell, 1962b), Haemaphysalis
spinigera (Chinery, 1965a). E. H. Павловским (1940a) приводится описа-
ние анатомии женской половой системы нескольких видов иксодовых и
аргасовых клещей, а в работе Ю. С. Балашова (19646) рассматриваются
анатомические, цитологические и физиологические особенности половой
системы 24 видов иксодоидных клещей на разных стадиях жизненного
цикла.
Женская половая система
Органы размножения самок иксодовых и аргасовых клещей построены
по одному плану (рис. 111—115, стр. 33). Значительные морфологические
различия связаны только с характером функциональной дифферен-
цировки влагалища. Наибольшая расчлененность половой системы —
в подсем. Amblyomminae. Так, у самок Hyalomma asiaticum (рис. 116—128)
она состоит из непарного яичника и пары яйцеводов, сливающихся в не-
парную матку. Последняя открывается в эктодермальное влагалище,
разделенное на вестибулярный и цервикальный отделы. Последний сооб-
щается с маткой с вентральной стороны мускулистой соединительной
трубкой. Дорсо-каудально во влагалище открывается обширный пузыре-
видный семеприемник. На границе обоих отделов влагалища в него дор-
сально впадает пара придаточных половых желез. Кроме того, во время
кровососания, как и у других Ixodidae, из эпителия вестибулярного
отдела формируется лопастевидная придаточная половая железа (рис. 122).
В подсем. Ixodinae обособленный семеприемник отсутствует и его
функции выполняет расширенный цервикальный отдел (рис. 129). У Аг-
gasidae в семеприемник превратилась сильно гипертрофированная матка
и, кроме того, у них отсутствует лопастевидная железа (рис. 130).
Яичник. У голодных самок иксодовых клещей яичник представляет
подковообразно изогнутую трубку. Задняя часть его лежит перпенди-
кулярно к продольной оси тела сразу же позади ректального мешка и
вентрально от дивертикулов кишечника. Медиально яичник образует
небольшой, направленный вперед выгиб. Боковые части яичника про-
должаются вперед и доходят, в зависимости от видовой принадлежности
клещей, до уровня II—IV пары кокс, за которыми его дистальные концы
делают короткий изгиб назад и открываются в яйцеводы. В подсем. Ixo-
dinae относительные размеры яичника значительно меньше, чем у Ambly-
omminae, Эти различия особенно выступают с начала кровососания,
когда длина яичника увеличивается в несколько раз. При этом он обра-
зует многочисленные изгибы и перед началом яйцекладки занимает боль-
шую часть полости тела, тогда как объем дивертикулов кишечника зна-
чительно уменьшается.
У аргасовых клещей яичник значительно короче, чем у иксодовых,
ио толще и имеет форму вытянутого мешка, от концов которого отходят
- 42 -
яйцеводы (рис.-ИЗ—115). Он также лежит в поперечном направлении
позади ректального мешка, но не образует переднелатеральных рукавов.
Поверхность яичника, в зависимости от стадии гонотрофического цикла,
гладкая или же гроздевидная от массы выступающих над ней зрелых яиц.
Исключение составляет лишь Argas vespertilionis (Roshdy, 1961а), у ко-
торого яичник парный и образован двумя гроздевидными группами ооци-
тов, лежащих позади ректального пузыря ближе к его боковым краям
(рис. 114). У прошедших несколько гонотрофических циклов старых
самок Л. persicus яичник также часто выглядит парным, однако обе его
половины связаны между собой тонкой полоской соединительной ткани
и опорных эпителиальных клеток. Последнее объясняется исчерпанием
запаса ооцитов в центральной части органа во время предшествующих
яйцекладок. У молодых самок подобной парности яичника нам наблю-
дать не приходилось.
Яйцеводы. У иксодид яйцеводы представляют пару тонких трубок,
отходящих от концов яичника и делающих несколько (чаще три) глубоких
петлеобразных изгибов в передне-заднем направлении. Дистальные концы
яйцеводов несут слабо выраженные расширения, гомологичные таковым
аргазид (рис. 111—112). У Amblyomminae сразу позади места соединения
семеприемника с влагалищем яйцеводы соединяются в один непарный
орган, называемый маткой. В нее телескопически впячивается соедини-
тельная трубка, связывающая матку с цервикальным отделом влагалища
(рис. 388).
У Ixodinae яйцеводы также образуют петлеобразные изгибы, а на
уровне границы цервикального и вестибулярного отделов влагалища
заворачивают назад и вниз. Пройдя небольшое расстояние вдоль боковых
стенок влагалища, они круто заворачивают вперед и открываются в матку.
Последняя связана соединительной трубкой с задневентральной частью
цервикального отдела (рис. 129).
У аргасовых клещей яйцеводы спирально извитые по всему своему
ходу, а в их дистальных половинах постоянно наблюдаются ампуловид-
ные расширения. Форма и величина последних зависят как от видовой
принадлежности, так и от физиологического состояния клещей. Перед
откладкой яиц эти расширения значительно толще, чем у голодных осо-
бей. Для аргазид характерны очень крупные размеры матки. Она имеет
форму треугольного мешка с заднемедиальным вырезом и лежит между
центральной частью средней кишки и вентральной стенкой тела. На дис-
тальном конце перед впадением во влагалище матка обычно сильно су-
жается. Последний отдел называют шейкой матки (рис. 130).
Влагалище. Наиболее сложно устроенная часть половой системы кле-
щей — влагалище, состоящее из вестибулярного и цервикального отде-
лов. Первый представляет уплощенную трубку, идущую от наружного
полового отверстия в заднедорсальном направлении к цервикальному
отделу. У иксодид во время питания гиподерма вестибулярного отдела
отделяется от кутикулярной выстилки, сильно разрастается и образует
массивную лопастевидную придаточную железу (рис. 122).
Цервикальный отдел называют иногда вентральным клапаном (Yal-
vac, 1939b) в связи с тем, что в нем соединяются все части половой
системы. У Amblyomminae он относительно невелик и с вентральной сто-
роны продолжается в виде мускулистой соединительной трубки, изгибаю-
щейся назад и вдвинутой в матку. В заднедорсальную часть цервикаль-
ного отдела открывается шейка семеприемника, а далее вперед на границе
с вестибулярным отделом лежит пара трубчатых придаточных желез.
Вентральная стенка вестибулярного отдела вдается в полость влагалища
и расширяется на конце, напоминая своими очертаниями сапог, который
образует клапан, способный попеременно замыкать доступ в вестибуляр-
- 43 -
Рис. 116—128. Строение половой системы самки Hyalomma asiaticum,
116 — внешний вид органов размножения напитавшейся особи; поперечные
срезы: 117 — вестибулярный и 118 — цервикальный отделы влагалища до начала
питания; 119 — трубчатая придаточная железа голодного клеща; 120 — то же на-
питавшегося клеща; 121 — выводной проток трубчатой железы; 122 — лопастевид-
ная придаточная железа напитавшейся особи; 123 — яйцевод до начала питания;
124 — проксимальный и 125 — дистальный участки яйцевода после питания;
126 — яичник голодного клеща; 127 — яичник напитавшегося клеща; 128 — сое-
динительная трубка.
к — кутикулярная выстилка; гп — гиподерма; со — соединительнотканная оболочка; эпк —
епителиальные клетки стенок яичника и яйцеводов; мшс — мышечный слой; оц — ооциты;
соц — стебельки ооцитов; св — секреторные вакуоли.
ный отдел или соединительную трубку (рис. 388). Семеприемник АтЫуотп-
minae представляет непарный тонкостенный мешок. Он лежит над маткой,
а с его боков проходят изгибающиеся вниз парные яйцеводы. Перед-
ний конец его сильно сужен и называется шейкой семеприемника. У го-
лодных неоплодотворенных особей стенки семеприемника собраны в мно-
гочисленные складки и его размеры относительно невелики. После опло-
дотворения он сильно растягивается сперматодозами и увеличивается
в несколько раз (рис. 116).
Рис. 129, 130. Сагиттальные срезы.
129 — выводные пути половой системы голодной самки Ixodes ricinus; 130 —
то же Ornithodoros papillipes.
нпо — наружное половое отверстие; во — вестибулярный отдел влагалища; цо — церви-
кальный отдел влагалища; тпж — трубчатая придаточная железа; ст — соединительная
трубка; ju — матка; шм — шейка матки; ня — непарный яйцевод.
У Ixodinae цервикальный отдел служит семеприемником. Он имеет
форму овального мешка, лежит параллельно продольной оси тела и
расширяется каудально. С маткой цервикальный отдел соединяется корот-
кой соединительной трубкой. У оплодотворенных особей последняя це-
ликом прикрыта сильно растянутым цервикальным отделом (рис. 129),
У аргасовых клещей цервикальный отдел относительно короток и
имеет боченковидную форму. Задний конец его вдвинут внутрь матки и
образует соединительную трубку. Размеры цервикального отдела у ар-
газид относительно постоянны и он увеличивается только в момент про-
хождения яиц или сперматодоз (рис. 130).
- 45 -
0.03 мм
Рис. 131 —141. Орган Жене самки Hyalomma asiaticum.
131 — внешний вид; поперечные срезы на уровне: 132 — камеростомальной складки,
133 — сразу позади камеростомальной складки, 134 — расширенной части органа,
135 — рогов органа; поперечные срезы: 136 -— участка стенки стебелька, 137 — рас-
ширенной части органа, 138 — железистой ткани рогов голодного, 139 — начавшего
питание и 140 — заканчивающего питание клеща, 141 — то же в период яйцекладки.
ст — стебелек; рч — расширенная часть; рг — рога; ж — железы; спм — стержень для прикрепле-
ния мышц; мр — мускулы-ретракторы рогов; хц— хелицеры; кс— камеростомальная складка;
к — кутикулярная выстилка; гп — гиподерма; по — полость органа; пр — пространство между
гиподермой и кутикулярной выстилкой; мт — митотические деления гиподермальных клеток;
св — секреторные вакуоли.
Орган Жене. Важная роль в процессе яйцекладки принадлежит органу
Жене (рис. 131—141). Он находится в передней части тела непосред-
ственно под спинным щитком и представляет двух- или четырехлопастный
двухслойный мешок, способный выворачиваться наружу через щелевидное
отверстие (рис. 131). Последнее у иксодовых клещей расположено ме-
диально в камеростомальной складке между передним краем спинного
щитка и заднедорсальным краем основания гнатосомы (рис. 132). У арга-
зид щелевидное отверстие находится в камеростомальном углублении.
Орган Жене состоит из широкого дорсо-вентрально сплющенного
стебелька, расширяющегося назад и расщепляющегося в задней части на
два (Argasidae, Amblyomminae) или четыре (Ixodinae) рога, и обособлен-
ных желез или складок железистой ткани. Отверстие и передняя часть
стебелька окружены снаружи очень толстой эндокутикулой камеросто-
мал ьной складки. Пройдя ее, орган сильно расширяется, а кутикулярная
выстилка отходит от гиподермы (рис. 133). Внутренний кутикулярный
мешок образован тонкими эпикутикулой и эндокутикулой, толщина
которых уменьшается в направлении к рогам. В эпикутикуле, начиная
с середины стебелька и далее назад, отсутствует поверхностный цемент-
ный слой. Между кутикулой и гиподермой находится обширное свободное
пространство, заполненное жидкостью (рис. 134, 135).
Задняя часть гиподермального мешка представляет железистое обра-
зование. У голодных особей признаки секреторной активности отсут
ствуют и дифференцировка желез органа Жене происходит во время
кровососания.
У Hyalomma asiaticum существуют две пары желез — передняя и зад-
няя. До начала питания это небольшие карманы складчатой гиподермы на
концах рогов и несколько ближе к их основанию. Во время кровососания
они вырастают в пучки пальцеобразных желез, сидящих на удлиненных
протоках. Последние открываются во внутреннюю полость органа. У Ixo-
des ricinus на каждом из четырех протоков находится по одной трубчатой
железе. У Ornithodoros papillipes, Alveonasus lahorensis и Argas persicus
обособленные железы отсутствуют и секреторную функцию, как и у Orni-
thodoros moubata (Lees a. Beament, 1948), выполняет складчатая гиподерма
на концах рогов.
От задней стенки и рогов органа Жене отходят пучки мышц-ретракто-
ров, прикрепляющихся к спинному щитку. Гладкая мускулатура в стен-
ках органа не обнаружена. Под органом Жене от заднего края основания
гнатосомы проходит толстый кутикулярный стержень, вилкообразно рас-
щепляющийся на конце (рис. 131). Он служит местом прикрепления ретрак-
торов гнатосомы и при их сокращении, возможно, облегчает выворачива-
ние органа.
Мужская половая система
Мужская половая система Ixodoidea состоит из двух трубчатых се-
менников, полностью разделенных у Amblyomminae, частично сливаю-
щихся вдоль медиальной поверхности у Ixodes ricinus и соединяю-
щихся задними концами у аргасовых клещей, парных семепроводов,
семеизвергательного канала и комплекса придаточных желез (рис. 142)
Семенники. Парные семенники самцов Hyalomma asiaticum располо-
жены по бокам тела от заднего края центральной нервной массы до уровня
концов стигмальных пластинок. В задней трети они изгибаются внутрь
и заметно утолщаются (рис. 142).
У Argas persicus, Alveonasus lahorensis и Ornithodoros papillipes семен-
ники сливаются своими концами и образуют подковообразную гонаду.
У старых особей место соединения представляет тонкий соединительно-
тканный тяж, лишенный половых элементов. Ряд исследователей (Chri-
- 47 -
stophers, 1906; Robinson a. Davidson, 1913—1914; Roshdy, 1961a) не-
правильно называет его семенником, а настоящие семенники считает
семенными пузырями. На самом деле описываемый центральный участок
гонады несомненно образуется в связи с исчерпанием в нем половых
элементов. У нимф и молодых самцов семенники соединяются непосред-
ственно своими толстыми концевыми участками (рис. 430—431).
По своему строению семенники Ixodoidea относятся к типу трубчатых
гонад. Снаружи их окружает тонкая соединительнотканная оболочка,
а толстая стенка вокруг небольшого центрального просвета состоит из
сперматоцист различной стадии зрелости. Каждая из сперматоцист обла-
дает собственной тонкой стенкой эпителиального происхождения (рис. 435).
Половые элементы созревают в строго определенном направлении
сзади-наперед. Впервые задне-передний градиент сперматогенеза был
описан у аргасовых клещей (Горощенко, 1960; Wagner-Jevseenko, 1958).
По нашим наблюдениям, он свойствен и всем изученным видам иксодовых
клещей.
В вытянутом семеннике Hyalomma asiaticum и Ixodes ricinus от его
переднего конца каудально располагаются зоны первичных спермато-
гониев, вторичных сперматогониев, сперматоцитов I порядка на стадиях
малого и затем большого роста, сперматоцитов II порядка, сперматид на
различных стадиях спермиогистогенеза и проспермиев. Зрелые проспермии
передвигаются по центральному просвету от заднего конца в направлении
семепроводов. Они лишены способности к активным самостоятельным
движениям, и их проталкивание вперед облегчается перистальтическими
сокращениями стенок семенника.
Выводные пути. Семепроводы представлены короткими парными труб-
ками, которые соединяются перед впадением в непарную половую по-
лость — atrium genitale. Последняя эктодермального происхождения и
выстлана тонкой кутикулой. Половая полость служит местом соединения
основных частей полового аппарата. В нее открываются придаточные
половые железы, а в передневентральном направлении она переходит
в семеизвергательный канал (рис. 428).
Свободные от проспермиев или слабо растянутые последними семе-
проводы представляют тонкие трубки диаметром в 25—40 мк, стенки ко-
торых образованы внутренним слоем столбчатых или кубических эпите-
лиальных клеток высотой в 15—20 мк с небольшими сферическими ядрами
диаметром в 5—6 мк. Снаружи эпителиальный слой окружен тонкой сое-
динительнотканной оболочкой с одиночными тонкими мышечными во-
локнами (рис. 145). При заполнении проспермиями стенки семепроводов
могут очень сильно растягиваться и превращаются в тонкую мембрану
(толщиной в 2—3 мк). Клеточные границы в мембране неразличимы,
а сильно уплощенные ядра лежат на значительном расстоянии друг от
друга. В описываемом состоянии семепроводы часто называют семенными
пузырьками.
Семеизвергательный канал образован короткой дорсо-вентрально
уплощенной трубкой, идущей от половой полости в передневентральном
направлении. Под центральной нервной массой канал открывается на-
ружным половым отверстием. Последнее спереди прикрыто выдающейся
назад лопастью кутикулы вентральной стенки тела — апроном.
Внутри семеизвергательный канал покрыт кутикулой. В передней
половине канала на дорсальной стороне кутикула склеротизована, а на
вентральной — гибкая и собрана в складки. В гибких участках она
состоит из эпикутикулы и слоистой эндокутикулы. В склеротизованных
частях к ним добавляется мезокутикула. В задней части канала мезоку-
тикула утончается и продолжается до половой полости тремя узкими
ветвями — медиальной и боковыми. Эпителий семеизвергательного канала
- 48 -
Рис. 142—151. Строение половой системы самцов иксодоидных клещей.
142 — половая система Hyalomma asiaticum, вид сверху; 143 — придаточ-
ная железа Н. asiaticum, вид сбоку; 144 — придаточная железа Ornithodoros
papillipes, вид снизу; 145 — поперечный срез семепровода Hyalomma asiati-
cum', Argas persicus'. 146 — участок стенки главной медиальной лопасти,
147 — то же передней губчатой лопасти, 148 — то же I пары латеральных
лопастей, 149 — то же II пары латеральных лопастей и 150 — сперматофор
на продольном разрезе (Tatchell, 1962b); 151 — зрелый спермиофор Hyalom-
ma asiaticum.
ск — семеизвергательный канал; гмл — главная медиальная лопасть придаточной же-
лезы; пел — передневентральная лопасть; лвл — вентро-латеральная лопасть; нвл — не-
парная вентральная лопасть; длм — дорсо-латеральная лопасть; злл — заднелатеральная
лопасть; звл — задневентральная лопасть; пгм — передняя губчатая лопасть; згл — зад-
няя губчатая лопасть; лл! — первая пара латеральных лопастей; лл11 — вторая пара ла-
теральный лопастей; ллШ — третья пара латеральных лопастей; здл — заднедорсальная
лопасть; сп — семепровод; см — семенник; св — секреторные вакуоли; ок — отторгаю-
щиеся апикальные концы секреторных клеток; я — клеточные ядра; нмс — наружный му-
циновый слой; флс — фосфолипопротеиновый слой оболочки спе рматофора; пс — протеи-
новый слой оболочки сперматофора; мос — мукопротеиновая оболочка сперматодозы;
пре — проспермии; вш — вершина шейки сперматофора; вэ — вакуоль с эстеразой;
сШ — секрет III пары латеральных лопастей.
образован кубическими или плоскими клетками, строение которых
у половозрелых особей не меняется.
Придаточные железы. Многолопастная мужская придаточная железа
прикрывает сверху семеизвергательный канал, располагаясь позади от
мозга и под отростками средней кишки. Она сильно расчленена, причем
форма и размеры отдельных ее лопастей значительно варьируют в преде-
лах надсемейства.
У аргасовых клещей анатомические особенности придаточной поло-
вой железы описаны для Argas persicus (Robinson a. Davidson, 1913—
1914; Tatchell, 1962b), A. vespertilionis (Roshdy, 1961a), A. boueti (Roshdy,
1962), A. transgariepinus (Roshdy, 1963), A. brumpti (Roshdy, 1966) и
Ornithodoros moubata (Wagner-Jevseenko, 1958). Нами исследовано ее
строение у клещей А г gas persicus, Alveonasus lahorensis к Ornithodoros papil-
lipes, У всех изученных видов были обнаружены одни и те же лопасти,
и различия были связаны лишь с их взаимным расположением и соот-
ношением размеров. У самцов Ornithodoros papillipes наиболее массивна
непарная главная медиальная лопасть придаточной железы, передний
конец которой непосредственно переходит в стенки семеизвергательного
канала. Дистальная половина этой лопасти изгибается на спинную
сторону и вперед, прикрывая сверху проксимальную часть лопасти
и семеизвергательный канал (рис. 144).
Сразу же позади места соединения железы с семеизвергательным
каналом с боков главной медиальной лопасти отходят небольшие парные
передняя и задняя губчатые лопасти, а снизу — непарная вентральная
лопасть. Далее назад с боков отходят три пары латеральных лопастей
и парная заднедорсальная лопасть. Третья пара латеральных лопастей
продолжается дальше остальных в сторону заднего конца тела и отли-
чается молочно-белой окраской, тогда как другие лопасти полупрозрачные.
В работе О. Вагнер-Евсеенко (Wagner-Jevseenko, 1958) лопасти придаточ-
ной железы обозначены буквами латинского алфавита от А до Н, из ко-
торых А отвечает главной медиальной лопасти, В — заднедорсальной паре,
С, D и Е — III—I парам латеральных лопастей, F — непарной вентраль-
ной лопасти, a G и Н — задней и передней парам губчатых лопастей.
У иксодовых клещей анатомические особенности мужских прида-
точных желез достаточно подробно описаны для Hyalomma anatolicum
(Yalvac, 1939а), Н. asiaticum (Балашов, 19646), Dermacentor andersoni
(Douglas, 1943), Rhipicephalus appendiculatus (Till, 1961) и Haemaphy-
salis spinigera (Chinery, 1965a). Как и у аргазид, наиболее массивна глав-
ная медиальная лопасть, которая может раздваиваться на дистальном
конце и давать парные боковые выросты в месте соединения ее дорсальной
и вентральной ветвей. У Н. asiaticum (рис. 142, 143) размеры вентральной
ветви главной медиальной лопасти немногим меньше, чем дорсальной
ветви, так что в сагиттальном сечении орган напоминает букву V, направ-
ленную углом назад. От переднего конца вентральной ветви главной
медиальной лопасти до ее изгиба на спинную сторону отходят следующие
лопасти: передневентральные, вентро-латеральные, непарная вентраль-
ная, дорсо-латеральные, заднелатеральные и задневентральные. У го-
лодных самцов наиболее массивны, не считая главной медиальной лопасти,
задневентральная пара лопастей, а у напитавшихся — заднелатеральные.
Последние могут достигать уровня заднего конца ректального мешка.
Гомологизация лопастей придаточных желез у аргасовых и иксодовых
клещей затруднительна в связи с различным клеточным составом и ха-
рактером секреции в анатомически сходных частях желез у представите-
телей этих двух семейств. Цитологические особенности и секреторная
активность этих органов подробно рассматриваются в разделе «Размноже-
ние» (см. стр. 243).
- 50 -
ЖИЗНЕННЫЕ ЦИКЛЫ
Все иксодовые и аргасовые клещи — облигатные временные пара-
зиты позвоночных животных и отличаются сложным циклом развития.
У аргасовых клещей он слагается из фаз яйца, личинки, нимфы, включаю-
щей от 2 до 7 возрастов, и имаго. У иксодовых клещей количество ним-
фа льных возрастов сократилось до одного. Как правило, клещи питаются
однократно на каждой активной фазе или в каждом нимфа льном возрасте.
Исключение составляют многократно питающиеся имаго аргасовых
клещей, а также случаи афагии у личинок Ornithodoros moubata, нимф
1-го возраста некоторых видов рода Ornithodoros и самок родов Otobius
и Antricola этого же семейства. Общая продолжительность и фенологиче-
ские особенности жизненных циклов иксодоидных клещей отличаются
большим разнообразием и в значительной степени зависят от особенностей
ареала, территориальной приуроченности внутри него, типов местообита-
ний, а также от особенностей связей этих паразитов с хозяевами.
СМЕНА ХОЗЯЕВ
По характеру связей с хозяевами и типам местообитаний среди 1хо-
doidea на основании предложенной В. Н. Беклемишевым (1945, 1954)
классификации различают виды с пастбищным подстерегающим и гнез-
дово-норовым (убежищным) типами паразитизма. Аргасовым клещам
свойствен гнездово-норовый паразитизм, и весь их жизненный цикл,
включая питание на хозяине, осуществляется внутри нор, гнезд и дру-
гих заселяемых ими микробиотопов. Только у видов рода Otobius и
у Alveonasus lahorensis в связи с паразитированием на животных, не
имеющих постоянных убежищ (зайцы и копытные), наблюдается развитие
ряда экологических морфолого-физиологических адаптаций, свойственных
пастбищным подстерегающим кровососам.
Среди иксодовых клещей, по мнению Б. И. Померанцева (1948), от-
дельные виды вторично вернулись к гнездово-норовому типу парази-
тизма, но в целом для большинства Amblyomminae и Ixodinae характерен
пастбищный подстерегающий тип паразитизма. Специфической особен-
ностью некоторых видов иксодовых и, реже, аргасовых клещей служит
тенденция перехода от временного к стационарному паразитизму. Она
проявляется в пребывании клеща на теле теплокровного на большей
части жизненного цикла и достигает максимального развития у видов
родов Boophilus и Otobius, когда тело хозяина покидают лишь насосав-
шиеся самки или нимфы последнего возраста и единственной активной
фазой развития вне хозяина являются голодные личинки.
С питанием клещей кровью на личиночной, нимфальной и имагиналь-
ной фазах связаны закономерное чередование периодов «свободного» и
паразитического существования, смена хозяев и значительное усложнение
жизненных циклов. По числу сменяемых хозяев и месту линек жизнен-
ные циклы клещей, вслед за Г. Наттелом (NuttaD, 1911), подразделяются
на четыре группы: многохозяинные, трех-, двух- и однохозяинные.
Многохозяинный тип развития свойствен большинству аргасовых
клещей, исключая «однохозяинные» виды рода Otobius и «двуххозяинного»
Alveonasus lahorensis. Он связан с непостоянным и довольно значительным
(до 5 и более) числом питающихся нимфальных возрастов и несколькими
гонотрофическими циклами у половозрелых особей. Соответственно
количество позвоночных-прокормителей по ходу жизненного цикла мо-
жет быть весьма значительным, и они могут принадлежать к одному или
разным видам.
- 51 -
4*
У иксодовых клещей количество приемов крови по ходу развития
сократилось до трех (личиночное, нимфальное и имагинальное питание)
и максимальное число сменяемых хозяев наблюдается при треххозяинном
типе развития. Последний свойствен всем Ixodinae и значительной части
Amblyomminae. Клещи находятся на хозяине только во время питания.
При гнездово-норовом паразитизме возможности встречи с хозяевами
ограничены пространством норы или гнезда и клещи большей частью
питаются на всех фазах развития на особях одного вида. Примерами мо-
Рис. 152. Треххозяинный цикл развития клеща Ixodes persulcatus.
1 — отпадение напитавшихся самок; 2 — уход самок в растительную под-
стилку, яйцекладка, гибель самок и развитие личинок; з — переход активных
личинок на растительность и подстерегание хозяев; 4 — нападение на хозяина;
5 — личиночное питание; 6 — отпадение напитавшихся личинок; 7 — уход на-
питавшихся личинок в растительную подстилку и линька на нимф; 8 — пере-
ход активных нимф на растительность и подстерегание хозяев; 9 — нападение
па хозяина; 10 — нимфальное' питание; 11 — отпадение напитавшихся нимф;
12 — уход напитавшихся нимф в подстилку и линька на имаго; 13 — переход
активных имаго на растительность и подстерегание хозяина; 14 —нападение
на хозяина; 15 —имагинальное питание.
гут служить Ixodes plumbeus (I. lividus по Глащинской-Бабенко, 1956)»
паразитирующий на ласточках-береговушках, I. crenulatus, связанный
в Тянь-Шане с сурками (Афанасьева, 1951), или Rhipicephalus schulzei,
паразитирующий на различных видах степных грызунов и мелких хищ-
ников (Нельзина и Данилова, I960). У пастбищных треххозяинных видов
личинки и нимфы обычно питаются на мелких млекопитающих, птицах
или, реже, рептилиях, а половозрелые особи на более крупных живот-
ных. Классическим примером подобного цикла служит развитие Ixo-
des ricinus и I, persulcatus (рис. 152), питающихся в неполовозрелых
фазах на мелких грызунах, насекомоядных и птицах, тогда как взрослые
клещи особенно часто встречаются на скоте, диких копытных, зайцах и
ежах. Сходно чередование хозяев у обитателя пустынных стаций Нуа-
- 52 -
lomma asiaticum, а также у приуроченных преимущественно к степным и
луговым стациям видов рода Dermacentor, где хозяевами личинок и нимф
служат грызуны, а половозрелых форм — скот и дикие копытные.
При двуххозяинном цикле личинка, закончив кровососание, остается
прикрепленной к хозяину, линяет здесь же на нимфу и клещ отпадает по
окончании нимфального питания. Двуххозяинное развитие чаще всего
наблюдается у паразитов копытных животных (Rhipicephalus bursa,
Hyalomma detritum, H, anatolicum), причем как неполовозрелые фазы,
Рис. 153. Двуххозяинный цикл развития клеща Rhi-
picephalus bursa.
1 — отпадение напитавшихся самок; 2 — уход клещей в рас-
тительную подстилку, яйцекладка, гибель самок и развитие ли-
чинок; 3 — переход активных личинок на растительность и под-
стерегание хозяев; 4 — нападение на хозяина; 5 — питание ли-
чинок, линька на нимф и питание нимф на теле одного и того же
хозяина; 6 — отпадение напитавшихся нимф; 7 — уход нимф в
растительную подстилку и линька на имаго; 8 — переход имаго
на растительность и подстерегание хозяев; 9 — нападение на хо-
зяина; Ю — имагинальное питание.
так и взрослые клещи паразитируют на одном или близких видах (рис. 153).
Из этого правила наблюдаются исключения, как например в случае
питания личинок и нимф двуххозяинного клеща Н. plumbeum на птицах
и грызунах, а имаго — на копытных.
Наиболее приспособлены к паразитированию на бродячих животных
клещи с однохозяинным циклом развития, когда на теле хозяина проис-
ходят обе линьки и отпадает напитавшаяся самка. Подобный тип развития
свойствен всем видам рода Boophilus (рис. 154), но встречается и в роде
Hyalomma (Н. scupense). Однако у последнего вида большое число нимф
по насыщении отпадает с хозяина и нормально линяет на имаго, так что
у Н. scupense части особей может быть свойствен и двуххозяинный тип
развития.
- 53 -
Рис. 154. Однохозяинный цикл разви-
тия клеща Boophilus calcaratus.
1 — отпадение напитавшихся самок; 2 — уход
клещей в растительную подстилку, яйцеклад-
ка, гибель самок и развитие личинок; «3 —
переход активных личинок на растительность
и подстерегание хозяев; 4 — нападение личи-
нок на хозяина; 5 — питание личинок, линька
на нимф, питание нимф, линька на имаго и
питание взрослых клещей на теле одного и
того же хозяина.
Следует отметить, что типы развития у некоторых видов изменяются
под влиянием окружающих условий, и граница между трех-, двух- и
однохозяинным развитием может быть довольно условна. Большой интерес
представляет отмеченная у некоторых видов сравнительная легкость
перехода от одного типа питания к другому. Особенно часто подобные
случаи наблюдаются среди видов рода Hyalomma. Среди типично двух-
хозяинных видов почти всегда небольшое количество насосавшихся личи-
нок отпадает с хозяина и в дальнейшем развивается по треххозяинному
циклу. Например, у Н. plumbeum
при кровососании на кролике отвали-
вается и успешно линяет вне орга-
низма хозяина 10—15% насосавших-
ся личинок. У Rhipicephalus bursa
в тех же условиях по треххозяин-
ному циклу развивалось 5—10% по-
мещенных на хозяине личинок.
Важным фактором, определяющим
тип питания, может быть видовая
принадлежность хозяина. Типичным
примером в этом отношении служит
Hyalomma anatolicum, развивающий-
ся на крупном рогатом скоте по трех-
хозяинному циклу, а на кроликах —
по двуххозяинному. Как правило,
в наших опытах при кормлении на
мышах и крысах двуххозяинные виды
имели типично треххозяинный цикл
развития (Н. plumbeum, Н. detritum
и Rhipicephalus bursa). Сходные дан-
ные для Hyalomma plumbeum при-
водятся также И. М. Ганиевым (1956).
На ежах, напротив, наблюдается
тенденция увеличения процента кле-
щей с двух- и даже однохозяинным
развитием (Н. plumbeum, Н. drome-
darii). Даже у треххозяинного
Н. asiaticum при питании на еже
значительное количество личинок не
отпадает и линяет на нем.
Значительное влияние на измене-
ние типа питания оказывает темпера-
тура. При кровососании на кролике большинство посаженных на него
личинок Н. anatolicum проявляет двуххозяинный тип питания. При этом,
чем ниже температура воздуха, тем больший процент развивается по
двуххозяинному типу. При 20—22° до 80% клещей имело двуххозяинный
цикл и лишь 20%' треххозяинный. При 30° первый тип развития был
у 60% клещей, "а-второй уже у 40%. Интересно, что и у Н. asiaticum
с преимущественно треххозяинным циклом развития при понижении
температуры до 5—6° примерно 5—10% личинок оставалось на кролике
и линяло на нем. При 18—20° все клещи в тех же условиях имели только
треххозяинный цикл. У треххозяинного клеща Н. aegyptium, питающе-
гося на степных черепахах, при понижении температуры до 10—15°
часть личинок также линяет на хозяине. Л. Дельпи (Delpy, 1946) счи-
тает, что Н. dromedarii при достаточно высокой температуре всегда имеет
треххозяинный цикл развития. Отклонения от нею связаны с кровососа-
нием на несвойственных хозяевах или при низких температурах.
- 54 -
Среди видов-рода Boophilus отклонения от однохозяинного типа раз-
вития наблюдаются значительно реже. Так, у В. decoloratus часть клещей
развивалась по двуххозяинному типу даже при кормлении на крупном
рогатом скоте (Ammah-Attoh, 1966а). При кормлении этих клещей на
кроликах (Ammah-Attoh, 1966b) уже большая часть из опытной партии
личинок развивалась по трех- и двуххозяинному типам. Однако ни одна
из полученных в этих опытах самок не смогла достигнуть нормального
насыщения на кроликах и все они отпали сильно недопитавшимися.
В наших опытах принудительно удаленные с телят напитавшиеся ли-
чинки и нимфы В. calcaratus лишь в небольшом проценте случаев линяли
на следующую фазу вне тела хозяина. В описываемых случаях отклоне-
ние от нормального для рода Boophilus однохозяинного типа развития,
вероятно, было вызвано защитными реакциями со стороны организма
хозяина или же явной непригодностью кроликов в качестве прокормителей
для этих клещей. Отпадение напитавшихся личинок и нимф представляло
существенное нарушение нормального для этих видов цикла развития и
сопровождалось очень высокой смертностью на стадии линьки.
Резко различаются представители двух указанных родов и по способ-
ности к голоданию в нимфальной фазе. Нимфы Hyalomma anatolicum,
развивающиеся по двуххозяинному циклу и снятые сразу после линьки
с хозяина, голодали в наших опытах при 20° и 70% относительной влаж-
ности свыше 3 месяцев, а у Boophilus calcaratus не дольше 1—2 недель.
Переход к двух- и однохозяинности рассматривается как одно из
важнейших приспособлений к паразитированию малоподвижных пастбищ-
ных кровососов на крупных бродячих животных (Померанцев, 1948;
Беклемишев, 1954). Наибольшая смертность у иксодид приходится на
голодающих клещей, не сумевших найти прокормителя. С переходом
к питанию на копытных в открытых степных и пустынных ландшафтах
возможности встречи с потенциальным хозяином значительно умень-
шаются и тогда приобретение способности к линьке на теле позвоночных,
уменьшая число необходимых встреч с последними, увеличивает шансы на
выживание. Кроме того, Б. И. Померанцев (1948) считает, что переход
к облигатной однохозяинности в роду Boophilus завершил специализацию
в одном из возможных направлений развития, но в то же время закрыл
возможности эволюции в других направлениях, ограничив круг потен-
циальных хозяев копытными. Более прогрессивен двуххозяинный тип
питания в родах Hyalomma и Rhipicephalus, допускающий как возможность
перехода к однохозяинности (Hyalomma scupense), так и возвращение
к треххозяинности с питанием преимагинальных фаз на мелких живот-
ных (Н. asiaticum).
Совершенно противоположная трактовка эволюции жизненных циклов
иксодовых клещей предложена В. Б. Дубининым (1958), который счи-
тает исходным и наиболее примитивным однохозяинный тип развития,
сохранившийся в настоящее время у видов Boophilus, а треххозяинный
тип — вторичным. Переход от однохозяинности к треххозяинности был
вызван распространением клещей из тропиков в районы с умеренным
климатом и необходимостью питания на животных с резкими сезонными
колебаниями в толщине кожных покровов. Рассматриваемая гипотеза
вряд ли может быть принята. Известно, что наиболее примитивную группу
среди иксодовых клещей представляет подсем. Ixodinae, но в то же время
ему свойствен исключительно треххозяинный цикл развития как в тро-
пических, так и в умеренных широтах, а у Ceratixodes putus даже за
полярным кругом. Напротив, двух- и однохозяинность ограничена только
наиболее продвинувшимися в эволюционном отношении родами подсем.
Amblyomminae, а сходные с ними типы развития неоднократно возни-
кали и в других группах пастбищных паразитов как адаптации к пита-
- 55 -
нию на «бездомных» животных (Otobius и Alveonasus lahorensis среди
аргасовых клещей и род Vermipsylla у блох). Климатические факторы и
сезонность в жизни хозяев сказались не столько на типе питания, сколько
на продолжительности и сезонной регуляции жизненных циклов.
РАСПРОСТРАНЕНИЕ
Аргасовые клещи встречаются во всех странах мира. В северном полу-
шарии их распространение ограничено областями к югу от 50° (род Ar-
gas), 47° (род Ornithodoros), 45° с. ш. (род Alveonasus), Отдельные виды
заходят и севернее. Так, Argas persicus, A. rejlexus и A. vulgaris найдены
несколько севернее 50°. В целом, по данным Н. А. Филипповой (1966),
распространение видов рода Argas на север ограничивается среднесуточ-
ными июльскими изотермами в 15—20°, а рода Ornithodoros в Европе
июльскими изотермами в 20—25° и в Азии — 25—30°. В пределах своего
ареала на территории СССР аргасовые клещи связаны с пустынными,
полупустынными и, в меньшей степени, степными ландшафтами. В южной
части страны они особенно многочисленны в предгорных ландшафтах,
где, в частности, встречаются переносчики клещевого возвратного тифа
О, papillipes и О. verrucosus. Верхняя граница распространения клещей
достигает в антропургических очагах Памира высоты в 2900 м.
Аргасовые клещи, за немногими исключениями, обитатели открытых
ландшафтов, внутри которых они, однако, заселяют различные природ-
ные или искусственные закрытые места обитания (пещеры, ниши под
камнями и скалами, норы и гнезда, хозяйственные и жилые постройки),
где относительно стабильные микроклиматические условия благоприятны
для существования клещей.
Иксодовые клещи еще в большей степени характеризуются всесветным
распространением и встречаются во всех природно-климатических зонах
мира, включая даже районы к северу от полярного круга и острова вокруг
Антарктиды, но наибольшее видовое разнообразие свойственно тропиче-
ским и субтропическим районам. В Советском Союзе за полярным кругом
встречается только один вид — Ceratixodes putus, связанный с поселе-
ниями морских птиц. В таежных лесах набор видов также очень огра-
ничен. В подзоне северной и средней тайги встречаются только виды
рода Ixodes (/. apronophorus, I. persulcatus, I. trianguliceps, I. ricinus),
а в подзоне южных таежных лесов и особенно в хвойно-широколиствен-
ных лесах гор юга Сибири, Дальнего Востока и в европейской части
страны к ним добавляются представители родов Haemaphysalts (Н. соп-
cinna, Н. neumanni, Н. japonica douglasi) и Dermacentor (D. pictus и D. sil-
varum). Несмотря на небольшое видовое разнообразие, иксодовые клещи
лесной зоны местами достигают очень высокой численности, a Ixodes
persulcatus и I. ricinus приобретают исключительное эпидемиологическое
значение, как главные переносчики и резервуары вируса в очагах кле-
щевого энцефалита. Для степной зоны характерны несколько видов рода
Dermacentor, из которых в восточных районах важное эпидемиологическое
значение имеют переносчик клещевого тифа Северной Азии D. nuttalli,
a D. pictus и D. marginatus — повсеместно как переносчики туляремии.
В южных степях появляются Rhipicephalus rossicus, R. sanguineus, Нуа-
lomma scupense, H. plumbeum, Boophilus calcaratus, а в норах встречается
несколько видов рода Ixodes (I. laguri, I. crenulatus). Кроме того, в ста-
циях с древесной растительностью многочисленны I. ricinus и другие лес-
ные виды.
Наибольшим разнообразием отличается фауна пустынь и предгорий
Средней Азии и Закавказья. В аридных районах доминируют виды родов
Hyalomma и Rhipicephalus, а в более увлажненных стациях по долинам
56 -
рек, в оазисах и предгорьях распространены Ixodes kazakstani, Boophilus
calcar atus, Haemaphysalts punctata, H. sulcata, Rhipicephalus bursa, R. pu-
milio, Dermacentor daghestanicus. Многие пустынные виды являются
обитателями нор на всех фазах жизненного цикла (Rhipicephalus schul-
zei, Haemaphysalts numidiana turanica, Ixodes occultus, I. subterranus)
или только на личиночной и нимфальной фазах (Hyalomma asiaticum).
Весьма своеобразна фауна гор Средней Азии и Кавказа, где в распро-
странении клещей четко проявляется вертикальная зональность, свя-
занная со сменой ландшафтов. В целом распространение иксодовых кле-
щей определяется как климатическими факторами, и в первую очередь
температурой и влажностью в теплое время года, так и пищевыми свя-
зями с определенными видами хозяев: Н. aegyptium и степные черепахи,
Ixodes plumbeus и ласточка-береговушка и др. Определенные видовые раз-
личия между сходными природно-климатическими комплексами связаны
с историческими условиями формирования фауны в различных областях.
СЕЗОННОСТЬ И ПРОДОЛЖИТЕЛЬНОСТЬ
ЖИЗНЕННЫХ циклов
Жизненные циклы клещей, обитающих в разнообразных климатиче-
ских зонах и заселяющих разные биотопы, значительно отличаются по
общей продолжительности и сезонности нападения на хозяев, размноже-
ния и линек. Как и у других групп наземных беспозвоночных, они обе-
спечивают адаптацию вида к циклическим изменениям климата путем
синхронизации с последними сезонных проявлений своей жизнедеятель-
ности. Вопросы сезонности жизненных циклов клещей в связи с их исто-
рическим развитием рассмотрены Г. В. Сердюковой (I960), определяющей
продолжительность цикла развития как адаптацию к ландшафту с опре-
деленным чередованием сезонов года и набором экологически близких
групп хозяев. В цитируемой работе выделяются непрерывный, одно-,
двух- и трехгодичные циклы развития иксодовых клещей, но благодаря
исследованиям Е. М. Хейсина с сотрудниками (1955а, 19596) доказана
возможность и более продолжительных циклов в северной части ареалов
клещей Ixodes ricinus и I. persulcatus. Наиболее простым и примитивным
Г. В. Сердюкова считает непрерывный цикл, когда отсутствует синхро-
низация отдельных стадий развития с определенными сезонами года.
Предполагалось, что подобный тип развития был свойствен предкам
современных видов иксодид, обитавшим в районах с влажным тропиче-
ским климатом, а в настоящее время встречается у норовых видов. К со-
жалению, недостаточная изученность тропических видов клещей не дает
возможности судить о характере жизненных циклов в тропиках, тогда
как у всех изученных в этом отношении гнездово-норовых видов умерен-
ных широт обнаружены различные сезонноциклические адаптации, так
что нет оснований говорить о существовании видов с непрерывным циклом
развития.
При одно- и многолетних циклах синхронность развития с сезонностью
климата у многих изученных в этом отношении видов, как и у насекомых,
обеспечивается возникновением диапаузы. Она впервые была обнаружена
Н. И. Алфеевым (1948, 1954) у клещей Dermacentor marginatus, D. pic-
tus, Ixodes ricinus и I. persulcatus. В дальнейшем особенности диапаузы
и механизм ее возникновения изучался многими исследователями (Нец-
кий и Ольшевская, 1950; Разумова, 1960, 1965, 19666; Белозеров, 1963,
1965а, 19656, 19666; Белозеров и Михайлова, 1966). Диапауза прояв-
ляется в форме задержки метаморфоза напитавшихся личинок и нимф
I. ricinus и I. persulcatus или остановке оогенеза у напитавшихся в летне-
осенний период самок Dermacentor. У голодных имаго рода Dermacentor
- 57 -
и в меньшей степени у нимф Ixodes ricinus наблюдается так называемая
поведенческая диапауза, проявляющаяся в угнетении агрессивности.
Роль внешних факторов в возникновении диапаузы рассматривается
в связи с особенностями жизненных циклов клещей родов Ixodes и Derma-
centor (см. стр. 60—65).
У гнездово-норовых видов аргасовых клещей, живущих в условиях
относительно стабильного микроклимата, сезонность основных процессов
жизнедеятельности (сроки питания, размножения и линек) выражена
слабее, чем у обитателей открытых биотопов. В тропических районах
нападение на хозяев и размножение, судя по наблюдениям над Ornithodo-
ros moubata, происходит круглогодично, но при чередовании периодов
засухи и дождей также наблюдается определенная сезонность жизненного
ритма (Walton, 1957, 1959). В субтропических и умеренных широтах
в зимние месяцы активность клещей обычно прекращается вследствие
воздействия низких температур. Размножение происходит в летне-
осенний период, а в зимнее время у некоторых видов отмечено торможе-
ние развития яичников (Остроумова, 1936). За теплый период самки
проходят один (О. papillipes, О. verrucosus), а при благоприятных усло-
виях до двух (О. tartakovskyi) и более гонотрофических циклов (Argas
persicus). Линька неполовозрелых стадий также происходит в теплое
время года. Нападение различных возрастных групп голодных клещей на
хозяев наблюдается в различные сроки. По наблюдениям М. В. Поспело-
вой-Штром (19596), в одном из горных кишлаков Таджикистана весной
на хозяев нападали главным образом личинки, нимфы Ornithodoros pa-
pillipes младших возрастов, взрослые и, реже, нимфы старших возрастов.
Летом при общем снижении числа нападений питались преимущественно
нимфы средних возрастов, а осенью интенсивность нападения увеличива-
лась за счет личинок и нимф младших возрастов нового поколения. В этих
условиях значительная часть популяции завершила цикл развития за
1 год.
Отличительной особенностью жизненных циклов аргазид служит
неравномерность развития особей одного поколения. Последнее обуслов-
лено непостоянством числа нимфальных возрастов и исключительной
способностью к многолетнему голоданию. По данным лабораторного
разведения клещей и наблюдениям в природных биотопах, развитие боль-
шинства видов фауны СССР в оптимальных условиях продолжается от
полугода до 2 лет, но у части особей таких видов, как Ornithodoros papil-
lipes при недостатке прокормителей может затягиваться до 20 лет (Пав-
ловский и Скрынник, 1956, 1960).
Весьма четко сезонность проявляется в жизненном цикле Alveonasus
lahorensis. Вылупившиеся летом личинки не способны к питанию и напа-
дают на овец или, реже, других сельскохозяйственных животных только
в осенне-зимний период. Питание личинок и нимф трех возрастов за-
нимает 3—6 недель, а отпавшие насосавшиеся нимфы III линяют на взрос-
лых особей только весной. Первый гонотрофический цикл самки проходят
за счет пищевых резервов от нимфального питания. Последующие гоно-
трофические циклы связаны с имагинальным питанием и яйцекладкой
в весенне-летний сезон (Поспелова-Штром, 1953; Кусов, 1957).
Среди иксодовых клещей фауны СССР наиболее близок к непрерыв-
ному циклу характер развития однохозяинного Boophilus calcaratus.
В тропических странах у видов этого рода наблюдается круглогодичное
паразитирование на скоте, тогда как в южных районах СССР (республики
Средней Азии, Закавказье, Северный Кавказ, Южная Украина) в зависи-
мости от климатических условий за год успевают развиться 2—3 генера-
ции, а в зимний период нападение клещей прекращается (Марков и Бо-
городицкий, 1935; «Потоцкий, 1945; Галузо, 1949). Число поколений в год
— 58 -
лимитируется условиями, необходимыми для развития яйцекладущих
самок, яиц и личинок. В зимний период развитие яиц и нападение личинок
тормозится низкими температурами, что связано с переходом их в холодо-
вое оцепенение, тогда как диапауза не обнаружена. Отсутствием диапаузы
в жизненном цикле можно объяснить обнаруженную И. Г. Галузо (1949)
значительную асинхронность в развитии особей одной популяции В. cal-
caratus, так что потомство одной самки может давать за год различное
число поколений. В то же время в умеренных широтах у В. calcaratus
уже существует определенная приспособленность жизненного цикла
к климатическому ритму, проявляющаяся в повышенной холодостой-
кости у зимующих личинок и яиц.
Продолжительность паразитической жизни на теле хозяина в значи-
тельно меньшей степени зависит от климатических факторов. По данным
многих авторов, от нападения голодных личинок до отпадения напитав-
шихся самок В. calcaratus проходило в среднем 20—30 дней. Сходные
данные были получены для близких видов: В, microplus в Австралии —
22 дня (Hitchcock, 1955b) и В. caudatus в Японии — 22—24 дня (Kitaoka
a. Yajima, 1958а), причем понижение температуры воздуха лишь в незна-
чительной степени удлиняло эти сроки.
Детальные исследования жизненных циклов гнездово-норовых иксо-
дид, выполненные за последние годы, не подтвердили существования
у них примитивных «непрерывных» циклов развития. Как и у пастбищ-
ных видов, жизненные циклы этой биологической группы характери-
зуются четко выраженными сезонно-циклическими адаптациями, об-
щая продолжительность развития одной генерации занимает не менее
года.
По наблюдениям Л. В. Глащинской-Бабенко (1956), жизненный цикл
Ixodes plumbeus — паразита ласточек-береговушек согласован с сезон-
ными явлениями в жизни хозяина. В покинутых гнездах зимуют голод-
ные личинки. Весной они нападают на прилетевших ласточек и отпадают
с них внутри гнезда. Высокая температура в жилом гнезде (30—32°)
обеспечивает быстрое протекание метаморфоза, так что через 15—18 су-
ток после отпадения напитавшихся личинок появляются активные голод-
ные нимфы. Последние через 12—15 дней после питания на птенцах линяют
на имаго. Самки тоже успевают напитаться на заканчивающих гнездовой
период птенцах и через 3—8 дней после отпадения приступают к яйце-
кладке. Отложенные яйца в том же сезоне дают уходящих на зимовку
неактивных личинок, хорошо переносящих переохлаждение и длительное,
до 9 месяцев, голодание. В результате все развитие — от нападения
голодных личинок на хозяина до появления неактивных личинок следую-
щего поколения — занимает 4—4.5 месяца — время гнездования пере-
летных птиц, а за год развивается одно поколение со строгой сезонной
последовательностью стадий развития.
Довольно сходен с описанным и жизненный цикл Bhipicephalus schul-
zei — обитателей нор грызунов (преимущественно сусликов) сухих сте-
пей и полупустынь (Нельзина и Данилова, 1960). Нападение клещей на
хозяев, метаморфоз неполовозрелых фаз, яйцекладка и развитие яиц
ограничены теплым периодом года (с апреля по август). В этот промежуток
наблюдается последовательная смена нападающих фаз (максимум для
личинок в мае, нимф — в июне и имаго — в июле), и на зимовку уходят
голодные личинки, остающиеся неактивными весь осенний период, не-
смотря на достаточно высокую температуру внутри норы.
У обитателей нор с холодным микроклиматом, как в случае с Ixodes
crenulatus — паразитом сурков Marmota baibacina centralis в горах Тянь-
Шаня на высоте 1800—3200 м над ур. м., жизненный цикл даже при наи-
более благоприятных условиях продолжается не менее 3 лет (Кошеч-
- 59 -
кина, 1950; Афанасьева, 1951). За летний период успевает развиться
только одна фаза и одновременно в гнезде встречаются особи нескольких
поколений.
Значительная часть иксодовых клещей с пастбищным типом парази-
тизма, включая однохозяинных Hyalomma scupense и двуххозяинных
Н. plumbeum, Н. detritum, Н. anatolicum, Rhipicephalus bursa, имеет
одногодичные циклы. Наиболее детально особенности одногодичного
жизненного цикла изучены у Dermacentor pictus (Олсуфьев, 1953), D. таг-
ginatus (Покровская, 1951, 1953) и D. nuttalli (Меринов, 1964). Для этих
трех видов характерны зимовка и весенняя волна паразитирования имаго,
тогда как в летние месяцы у особей, не сумевших найти прокормителей,
развивается состояние «неактивности» (Яшкуль, 1960). Напитавшиеся
весной самки вскоре приступают к яйцекладке и уже с июня начинается
вития клеща Dermacentor pictus в Московской обл.
1 — средняя численность личинок на пяти полевках; 2 — то же для
нимф; з — средняя численность половозрелых клещей на одной корове
(по Олсуфьеву, 1953).
массовое нападение личинок. Напитавшиеся личинки быстро линяют на
нимф, паразитирующих на грызунах с конца июля по август и уже в ав-
густе начинающих линять на имаго (рис. 155). Большая часть последних
приступает к питанию после перезимовки, но в некоторых районах наблю-
дается и осенняя волна паразитирования клещей на скоте. В этом случае
откладка яиц происходит только у перезимовавшпх особей (Нецкий и
Ольшевская, 1950; Ламанова, 1962).
Общей особенностью видов рода Dermacentor служит короткий период
существования в природе голодных личинок и нимф, не способных к дли-
тельному голоданию, и исключительная долговечность взрослых клещей.
У D. pictus, по наблюдениям Н. Г. Олсуфьева (1953), пмаго при отсутствии
хозяев переживает в природных биотопах 3—4 года. Вследствие этого
активизирующаяся весной или осенью популяция клещей представляет
смесь из особей не менее трех поколений.
Сезонная регуляция одногодичного цикла обеспечивается существова-
нием летней неактивности у голодных и диапаузы у напитавшихся самок,
изученных экспериментально у D. pictus (Разумова, 1960, 1965, 19666)
и у D. marginatus (Белозеров, 1963, 1965а, 19656). Впадение клещей этих
видов в состояние летней неактивности и возникновение несколько позд-
нее потенциальной способности к диапаузе у напитавшихся самок служит
надежной биологической адаптацией, предотвращающей появление в конце
лета и осенью не способных к зимовке неполовозрелых фаз развития.
По данным трехлетних наблюдений над природной популяцией имаго
D. pictus в Московской обл. (Разумова, 19666), развитие неактивности и
- 60 -
потенциальной. способности к диапаузе у напитавшихся самок проис-
ходило независимо. Первый процесс происходил с первой-второй де-
кады июня, т. е. на 1—2 недели ранее возникновения потенциальной
диапаузы. В то же время летняя неактивность исчезала в первой половине
августа — за 1—2 месяца до прекращения состояния потенциальной
диапаузы.
Описанный двойной контролирующий механизм, с одной стороны,
предотвращает нежелательное для вида насыщение самок в начале лета,
когда у них еще не развилось состояние потенциальной диапаузы. С дру-
гой стороны, исчезновение
летней неактивности в кон-
це августа также не ведет к
неблагоприятным послед-
ствиям, так как напитав-
шиеся осенью самки пере-
зимовывают в состоянии
диапаузы и приступают к
яйцекладке вместе с осо-
бями, напитавшимися вес-
ной следующего года.
Возникновение диапау-
зы у напитавшихся самок
контролируется световым
режимом содержания го-
лодных имаго. Так, в ус-
ловиях эксперимента без-
диапаузная откладка яиц
происходила только у са-
мок D. marginatus, содер-
жавшихся до питания в
условиях короткого дня
(9—12 час. света), а после
Рис. 156. Средние сроки от насыщения до начала
яйцекладки (при 18°) у самок Dermacentor margina-
tus (волгоградская популяция) в зависимости от
возраста и фотопериодических условий их содер-
жания до кормления (по Белозерову, 1965а).
Черные столбики — 9 час. света; белые столбики — 18 час.
света.
нахождения при длитель-
ном дне (16—24 часа) на-
чало яйцекладки задержи-
валось на несколько меся-
цев (рис. 156). Сходный
короткодневный тип фото-
периодической реакции
был свойствен и самкам
D. pictus. На прочность диапаузы влияли также температурный режим
содержания голодных имаго и возраст самок после линьки. Снятие диа-
паузы к весеннему периоду обеспечивалось реактивацией самок низкими
температурами во время зимовки.
При бездиапаузном развитии сезонность жизненных циклов выражена
слабее и возможно частичное налегание последовательных поколений.
Подобный тип развития свойствен клещу Hyalomma asiaticum. В пу-
стынях Туркмении, по многолетним наблюдениям А. В. Кочкаревой-
Бахаевой (1964) над численностью клещей на хозяевах и в их основном
биотопе — норах песчанок, а также на основании наших исследований воз-
растного состава имаго в природных популяциях (табл. 2), можно счи-
тать, что основная масса Н. asiaticum развивается по одногодичному
циклу, несмотря на круглогодичное нахождение всех фаз развития на
хозяевах и в норах (рис. 157).
В марте—мае наблюдается массовое паразитирование имаго Н. asia-
ticum на скоте (особенно верблюдах). В июне—августе численность поло-
- 61 -
возрелых клещей на животных и на поверхности почвы становится очень
низкой. Основную их массу составляют сильно истощенные особи (табл. 2).
Несомненно, что с наступлением летней жары и увеличением дефицита
насыщения в припочвенном слое воздуха не нашедшие хозяев клещи
в основном погибают. Лишь незначительная часть популяции продолжает
нападать на скот в течение всего летнего периода и доживает до осени.
Месяцы / П Ш IV V VI VII УШ IX X .XI XII
Нахождение на хозяевах
и 8 норах
---------► имаго
—--------»- нимфы
.........личинки
Сезон массового
паразитирования
Рис. 157. Цикл развития клеща Hyalomma asiaticum в Южной Туркмении.
Напитавшиеся в апреле—мае самки в условиях высоких средних
температур без задержки приступают к яйцекладке. В июне—августе
наблюдается годовой максимум численности активных личинок в норах
и на хозяевах. Напитавшиеся личинки уже с августа линяют в нимф и
обеспечивают позднелетний подъем численности последних на песчанках.
Паразитирование неполовозрелых фаз на песчанках продолжается весь
осенне-зимний период, прекращаясь только в наиболее холодное время
года — в декабре—январе. Значительная часть популяции нимф, однако,
Таблица 2
Возрастной состав голодных самок Hyalomma asiaticum, собранных
на поверхности почвы в Каракумах в 1955 н 1958 гг.
Степень истощения клещей % особей определенной степени истощения по месяцам
I II III IV V VI VII VIII IX X XI XII
2-я 70 58 24 6 4 22 58 59
3-я — — 11 42 49 19 13 22 25 12 — —
4-я — — 19 — 27 75 83 56 17 29 — —
Всего со- брано кле- щей . — — 27 159 87 65 23 9 12 17 — —
- 62 -
переживает осенне-зимние месяцы в голодном состоянии и обеспечивает
весенний пик численности на грызунах.
Нимфы весеннего питания линяют в течение лета на имаго, но послед-
ние в значительной массе остаются в норах до весны. Лишь часть их
активизируется и нападает на скот осенью того же года. Нимфы, напитав-
шиеся в конце лета, вероятно, также успевают перелинять в имаго в том же
сезоне или же при осеннем питании их линька может задерживаться низ-
кими температурами до следующей весны. Таким образом, сезонность
паразитирования определенных фаз развития Н. asiaticum на хозяевах
находится под непосредственным воздействием климатических факторов,
а наличие активных голодных особей зависит от доступности прокорми-
Месяцы IVVVIVIIVIHIX IV VVIVJIVHI1X IVVVIVIIVIHIX IVVVIVIIVIHIX IVV VIVIiyiHIX IVVVIVIiyilllX
Календарный год 1~й 2-й 3-й Ь-й 5-й 6-й
Рис. 158. Цикл развития клеща Ixodes persulcatus в Карелии (по Хейсину, Павловской,
Малаховой и Рыбак, 1955).
1 — голодные самки; 2 — сытые самки; 3 — яйцекладка; 4 — эмбриональное развитие; 5 — вылуп-
ление личинок; 6 — переход личинок в активное состояние; 7 — голодные личинки; 8 — питание и
метаморфоз личинок; 9 — выход нимф; 10 — переход нимф в активное состояние; 11 — голодные
нимфы; 12 — питание и метаморфоз нимф; 13 — выход имаго; 14 — переход имаго в активное со-
стояние.
телей — позвоночных и способности к многомесячному голоданию не только
на имагинальной, но и на неполовозрелых фазах (Афанасьева, 1956).
В связи с этими биологическими особенностями наблюдается частичное
смешение особей двух последовательных генераций в составе одной по-
пуляции при сохранении синхронности развития и одногодичном цикле
развития у основной массы клещей.
Наиболее сложные и продолжительные жизненные циклы свойственны
клещам Ixodes persulcatus и I. ricinus, продвинувшимся на север дальше
других видов с пастбищным типом паразитизма. В серии исследований
Е. М. Хейсина с сотрудниками (Хейсин, 1955а, 19556; Хейсин и Лебе-
шева, 1955; Хейсин, Бочкарева, Лаврененко и Михайлова, 1955; Хей-
син, Бочкарева и Лавренко, 1955; Хейсин, Павловская, Малахова и
Рыбак, 1955) установлено, что на территории Карелии развитие каждой
фазы этих видов занимает не менее 1 года, но может продолжаться и до
2 лет. Минимальная продолжительность жизненного цикла составляет
3 года, но может достигать 6 лет.
Развитие I. persulcatus протекает следующим образом (рис. 158).
Имаго нападают на скот с конца апреля до конца июля с максимумом
- 63 -
паразитирования во второй половине мая—первой половине июня.
Отпавшие в мае—июне самки через 2—3 недели приступают к яйцекладке,
которая продолжается 1—3 месяца. Из яиц, отложенных до середины
июля, в августе—сентябре того же сезона успевают вылупиться личинки,
а яйца, отложенные в более поздние сроки, перезимовывают и дают личи-
нок на следующий год. Личинки и нимфы паразитируют на мелких жи-
вотных в продолжение всего весенне-летнего периода с максимумом чис-
ленности в конце июня—июля. Неполовозрелые особи, напитавшиеся до
середины июля, успевают перелинять в том же сезоне, а отпавшие с хо-
зяев в более поздние сроки впадают в диапаузу и линяют на следующий
год. Активация личинок и нимф позднелетнего вылупления или линьки
происходит только после перезимовки весной следующего года, а нимфы
ранне летней линьки могут активизироваться в том же сезоне. Имаго,
перелинявшие в летне-осенний период, остаются неактивными до весны
следующего года. Большая часть популяции имеет трехгодичный цикл
развития, так как большинство кладок дает личинок в том же году, а для
личиночного и нимфального метаморфоза требуется еще по одному году.
Однако в более холодных микробиотопах и особенно в неблагоприятные
в климатическом отношении годы развитие одной или даже двух фаз не
укладывается в 1 год и соответственно развитие части популяции может
продолжаться 4 или 5 лет. В Московской обл. (Бабенко, 1956) и Красно-
ярском крае (Бабенко и Рубина, 1961), несмотря на более жаркое лето,
минимальная продолжительность развития также составляет 3 года,
тогда как на юге Хабаровского края (Моисеенко, 1957) и в Приморском
крае (Сердюкова, 1960) личинки могут питаться в год яйцекладки и жиз-
ненный цикл сокращается до 2 лет.
Развитие I. ricinus протекает сходным образом, но в связи с его боль-
шей теплолюбивостью развитие каждой фазы в Карелии продолжается
в основном по 2 года при общей продолжительности цикла в 5—6 лет.
При продвижении на юг сроки развития соответственно сокращаются и
в Ленинградской обл. большая часть популяции имеет 4-летний цикл
(Сердюкова, 1960), хотя возможно и более длительное развитие (Алфеев,
1948). В Московской обл. (Бабенко, 1956) и в Англии (Lees a. Milne,
1951) развитие продолжается 3 года и не исключено, что в южной части
ареала оно проходит в еще более сжатые сроки.
Обращает внимание совершенство сезонной регуляции жизненного
цикла, обеспечивающей синхронность жизненных явлений у особей
одной фазы развития, несмотря на возможную принадлежность к разным
поколениям. Последнее обеспечивается существованием яйцевой, личи-
ночной и нимфальной диапауз (Алфеев, 1948; Сердюкова, 1951, 1952), из
которых изучены только личиночная и нимфальная (Белозеров, 1964а,
19666; Белозеров и Михайлова, 1966). Температурный порог бездиапауз-
ного развития для ленинградской популяции близок к 18°. В условиях
длинного дня (18—24 час. света) напитавшиеся личинки без задержки
линяют в нимф, а при коротком дне (9—14 час. света) у всех личинок воз-
никала диапауза и метаморфоз заканчивался через 150—200 дней. При
25° наблюдается бездиапаузное развитие независимо от светового режима.
Длина дня и температура детерминируют возникновение диапаузы на
стадии голодных личинок, но чувствительность к этим факторам сохра-
няется и у напитавшихся особей, так что в условиях длинного дня и вы-
соких температур всегда наблюдалось бездиапаузное развитие. У ли-
чинок из Ленинградской обл. и из Молдавии порог фотопериодической
реакции оказался различным и соответствовал особенностям климата
этих двух районов. Наряду с другими факторами на возникновение диа-
паузы влиял и возраст клещей. С увеличением возраста личинок наблю-
далось усиление тенденции к возникновению диапаузы.
- 64 -
У нимф, в* отличие от личинок, диапауза характеризуется сменой
механизмов регуляции. До питания она детерминирована в соответствии
с нормами короткодневной реакции, а после питания — нормами длинно-
дневной реакции. Описанный механизм возникновения диапаузы делает
понятным задержку метаморфоза при позднелетнем питании личинок и
уход на зимовку большинства напитавшихся за летний сезон нимф. Пе-
резимовка диапаузирующих особей не вызывала их реактивации, и они
линяли в нимф или имаго одновременно с особями весеннего кормления
текущего года. Последнее обеспечивало сохранение сезонности паразити-
рования при многолетнем цикле и разновозрастных популяциях. У нимф
сезонность паразитирования, возможно, регулируется угнетением агрес-
сивности в условиях короткого дня. Однако подобная реакция наблюда-
лась только у особей не старше 5—(^месячного возраста.
ПЕРИОДИЗАЦИЯ ЖИЗНЕННЫХ ЦИКЛОВ
Из приведенной выше характеристики жизненных циклов некоторых
видов иксодовых клещей видны недостатки их классификации на основе
числа сменяемых хозяев или общей продолжительности цикла. Несмотря
на определенные преимущества в отношении простоты применения, де-
ление циклов на одно-, двух-, трех- и многолетние или же одно-, двух-
и треххозяинные довольно условно. Главным недостатком существующих
подразделений служит их односторонность. Они опираются на внешние
особенности развития группы, но не отражают специфики индивидуаль-
ного развития иксодид, связанной с закономерным чередованием свобод-
ного существования и паразитизма. При переходе от свободного существо-
вания к паразитизму в организме клещей происходят значительные
анатомо-физиологические перестройки. При этом в отличие от парази-
тических насекомых типа блох или кровососущих двукрылых суще-
ствование в двух различных средах обитания совмещается и закономерно
повторяется на каждой морфологической фазе (личиночной, нимфальной
и имагинальной) и поэтому процессы анатомо-физиологической пере-
стройки наблюдаются в межлиночный период. В результате у иксодовых
и некоторых длительно питающихся аргасовых клещей существуют глу-
бокие анатомические, физиологические и экологические различия между
свободноживущей и паразитической стадиями одной морфологической
фазы. Эти две стадии отличаются не только размерами тела, но и строением
ряда внутренних органов, направлением и интенсивностью процессов
обмена веществ, роста и развития, характером поведения, что подробно
рассматривается в последующих главах. С последними моментами свя-
зано обычно не учитываемое определенное несоответствие между морфоло-
гической и эколого-физиологической периодизацией жизненных циклов
клещей.
Правильная периодизация циклов развития должна опираться в пер-
вую очередь на общие для всех иксодовых клещей особенности линоч-
ного и гонотрофического ритмов, определяющих закономерную повторяе-
мость морфологических, физиологических и экологических изменений
на каждой фазе развития. Лишь выработав эту общую основу, можно
вести дальнейшую классификацию циклов по характеру трофических
связей, продолжительности развития или какому-либо другому признаку.
На основании собственных исследований и анализа литературных данных
мы предложили (Балашов, 1959а) подразделить каждую из морфологиче-
ских фаз на следующие стадии: 1) послелиночного доразвития, 2) актив-
ности, 3) питания и 4) линьки или 5) яйцекладки. Каждая из этих основ-
ных стадий в свою очередь слагается из различного числа более мелких
периодов, рассматриваемых при характеристике соответствующих стадий.
5 Ю. С. Балашов
- 65 -
ПОСЛЕЛИНОЧНОЕ ДОРАЗВИТИЕ
Вылупившиеся из яиц личинки или недавно перелинявшие нимфы и
имаго некоторое время остаются малоподвижными и не покидают места
вылупления или линьки. Личинки обычно в этот период находятся в до-
вольно плотных скоплениях, объединяющих прикрепившихся друг к другу
особей из одной кладки. Характерная особенность описываемого состоя-
ния — отсутствие комплекса поведенческих реакций, обеспечивающих
нападение на хозяина. В условиях эксперимента при раздражении соот-
ветствующих хемо-, термо- и механорецепторов личинок Ixodes ricinus
у них не развивались «позы ожидания» и комплекс поисковых реакций
(Lees, 1948). Эти клещи обычно отказывались прикрепляться к хозяевам
даже после принудительного помещения под наклейку на теле.
Подобное отсутствие активности свойственно как иксодовым, так и
аргасовым клещам и продолжается в зависимости от видовых особенностей
от нескольких дней (личинки и нимфы рода Dermacentor) до нескольких
недель или даже месяцев в случае ухода на зимовку (Ixodes ricinus,
I. persulcatus, личинки Alveonasus lahorensis). Активизация имаго всегда
требует большего времени, чем неполовозрелых фаз. У нимф двуххозяин-
ных или нимф и имаго однохозяинных видов состояние пассивности про-
должается всего несколько часов, после чего клещи вновь приступают
к питанию. Продолжительность послелиночного доразвития определяется
окружающими условиями и в первую очередь температурой.
На основании проведенных нами гистологических исследований уста-
новлено, что в организме клещей завершаются линочные изменения,
более подробно рассматриваемые в связи с соответствующими системами
органов. В первую очередь бросаются в глаза процессы затвердевания
кутикулы. Покровы клещей сразу после вылупления пли линьки мяг-
кие, полупрозрачные и приобретают нормальную прочность лишь спустя
3—5 суток. Изучение срезов показало, что в этот период происходит ин-
тенсивная склеротизация мезокутикулы идиосомы и экзокутикулы скле-
ритов, а у видов рода Ixodes, кроме того, отложение тонкого слоя эндо-
кутикулы.
В стенках кишечника происходит постепенное замещение гипертро-
фированных клеток предшествующей морфологической фазы характерным
для голодающих клещей сравнительно невысоким, недифференцирован-
ным эпителием. Значительные запасы питательных веществ остаются
в кишечнике и по окончании послелиночного доразвития, обеспечивая
энергетические потребности до нахождения хозяина.
Альвеолы слюнных желез на этой стадии еще не достигают своих
окончательных для голодных особей размеров и не заполнены готовым
секретом. Мальпигиевы сосуды разгружаются от больших количеств
гуанина, накопленных в предшествующий период интенсивного морфо-
генеза. В кишечнике и яичнике продолжается деление эпителиальных
клеток стенок.
Основываясь на неспособности недавно перелинявших клещей приса-
сываться и нападать на хозяев, Г. В. Сердюкова (1952) предложила на-
зывать подобное состояние «периодом физиологического доразвития».
Учитывая сложный комплекс не только физиологических, но и морфоло-
гических изменений, происходящих в это время в организме клещей и
являющихся, по существу, завершением линьки, мы полагаем, что правиль-
нее будет называть этот важный отрезок в жизненном цикле стадией
послелиночного доразвития.
Различия между стадиями послелиночного доразвития и активности
проявляются также в особенностях дыхания и динамике весовых изме-
нений голодных клещей (Белозеров, 1966а). По интенсивности дыхания
- 66 -
у самок Dermacentor marginatus после линьки были выявлены два хорошо
обособленных периода, отвечающих стадиям послелиночного доразвития
и активности (свободного существования). При содержании клещей при
25° первые 20—25 дней после линьки наблюдалось постепенное и равно-
мерное уменьшение потребления кислорода с 220 до 55 мм3/час на 1 г
веса тела клеща. В последующие 7 месяцев (срок наблюдений) клещи
характеризовались низким уровнем и стабильностью дыхания. Вес тела
клещей уменьшался за первые 20 дней на 31.5% главным образом за
счет опорожнения ректального пузыря и кишечника. За следующие
20 дней вес тела уменьшался всего на 4.7 %, а скорость его уменьшения на
более поздних сроках была еще меньше. У Ixodes ricinus также наблюда-
лось аналогичное уменьшение веса и интенсивности дыхания после
линьки, но эти изменения были намного слабее. Более высокий уровень
газообмена у самок I. ricinusna. стадии активности (185—236 мм3/ на 1 г/час)
по сравнению с таковым у Dermacentor marginatus (20—80 мм3/на 1 г/час)
объясняется различным характером реакции этих видов на высокие тем-
пературы. У D. marginatus температура 25° в сочетании с длинным днем
вызывала состояние потенциальной диапаузы, а у Ixodes ricinus, наоборот*
усиление агрессивности.
СТАДИЯ АКТИВНОСТИ
ОСОБЕННОСТИ ПОВЕДЕНИЯ
Окончание стадии послелиночного доразвития проявляется в приобре-
тении клещами способности к нападению на хозяев или, как часто гово-
рят, в возникновении у них агрессивности. На предшествующей стадии,
как уже было отмечено, клещи обычно не реагируют на хозяев и даже
в условиях эксперимента прикрепление и начало кровососания у подоб-
ных особей можно было наблюдать только в единичных случаях и после
нескольких дней нахождения на теле позвоночного.
В связи со значительным биологическим разнообразием группы Ixo-
doidea у клещей различают три основных типа нападения на позвоночных
животных. У подавляющего большинства аргасовых клещей и гнездово-
норовых видов иксодид нападение осуществляется в замкнутом простран-
стве норы, пещеры или других сходных местообитаний. По наблюдениям
над поведением Ornithodoros papillipes (Павловский, 1960; Поспелова-
Штром, 1953; Петрищева и Жмаева, 1962), клещи наползают на хозяина,
ориентируясь с помощью высокоразвитых органов обоняния (хеморецеп-
торы пальп и органов Галлера). В частности, в последнее время установ-
лено, что аргасовые (О. coriaceus) и иксодовые клещи (Dermacentor occi-
dental's и Ixodes pacificus) возбуждаются и движутся в направлении источ-
ника углекислоты (Garcia, 1962). Не исключено также участие термо- и
механорецепторов, реагирующих на тепловой градиент воздуха и сотря-
сения субстрата, хотя специальные исследования в этом направлении не
проводились. Фоторецепция не может обеспечивать ориентации в усло-
виях темноты нор и пещер, чем можно объяснить полную редукцию глаз
у аргасовых клещей и в пределах подсем. Ixodinae. В то же время у кле-
щей сохраняется общая световая чувствительность, проявляющаяся
у Ornithodoros papillipes в реакции отрицательного фототаксиса (Павлов-
ский, 1950; Неуймин, 1954). Соответственно с характером нападения
способности норовых видов к активным перемещениям весьма ограни-
чены и распространение их осуществляется пассивно, на теле хозяев во
время миграции последних. Тем не менее в отдельных случаях, ориенти-
- 67 -
5*
руясь на запах хозяев, клещи могут выходить в ночное время из норы и
нападать на животных и человека, находящихся вблизи от входа в нору
(Петрищева и Жмаева, 1962).
Большинство видов иксодовых клещей с пастбищным типом парази-
тизма пассивно ожидает встречи с подвижными хозяевами, располагаясь
в определенных ярусах растительности. Наиболее детально подстерегаю-
щий тип нападения изучен у клещей Ixodes persulcatus и I. ricinus (Миро-
нов, 1939; Померанцев и Сердюкова, 1948; Хейсин, 1953; Бабенко и
Хижинский, 1964), личинок Boophilus microplus (Wilkinson, 1953) и
имаго Dermacentor pictus (Олсуфьев, 1953). Готовые к нападению имаго
Ixodes persulcatus поднимаются на травянистую растительность (особенно
стебли злаков) или кусты. Наибольшее количество клещей сидит на вы-
соте 25—50 см от поверхности почвы и лишь немногие поднимаются
до 1 м. Клещи размещаются вблизи концов стеблей и ветвей в вертикаль-
ном положении, а на листьях — параллельно их поверхности с нижней
или верхней стороны. При приближении хозяина клещ принимает харак-
терную позу «активного ожидания». Передняя пара ног, наиболее богато
снабженная органами чувств, при этом выставлена вперед, вторая и
третья пары обхватывают стебель снизу, а четвертая пара отведена назад
и цепляется за растение сверху (рис. 6). При отсутствии раздражителей
клещи находятся в «пассивной позе» и передние ноги поджаты.
Встреча и прикрепление к хозяину обеспечиваются тремя типами
поведенческих реакций (Lees, 1948) 1) реакции ориентации определяют
нахождение клещей в определенных ярусах растительности и занятие
ими выгодной позиции для подстерегания; 2) реакции непосредственного
реагирования на приближение хозяина, связанные с принятием «актив-
ной позы»; 3) реакции, связанные с прицеплением к хозяину и выбором
на его теле места для присасывания. Приближение хозяина определяется
по раздражению механорецепторов (неожиданные колебания раститель-
ности), рецепторов общей световой чувствительности (внезапное затене-
ние), а главное по запаху и теплу, исходящим от хозяина. При длитель-
ном воздействии двух последних раздражителей с расстояния в несколько
метров возможно и активное переползание клещей в направлении хо-
зяина.
Радиус активных горизонтальных перемещений клещей с подстерегаю-
щим типом нападения, по данным наших опытов с Ixodes persulcatus
и Rhipicephalus turanicus (Балашов, 1958а, 19596) и наблюдений над пове-
дением Ixodes ricinus (Lees a. Milne, 1951), оказался весьма ограниченным.
Для выяснения подвижности имаго /. persulcatus в кедрово-широко-
лиственных лесах Южного Приморья отлавливались партии голодных
самцов и самок, метились быстро сохнущей водонесмываемой белой краской
и выпускались в определенных пунктах тех же стаций. Самки выпускались
в подстилку партиями по, 500 особей на расстоянии 10, 25 и 50 мот тропы,
по которой постоянно ходили люди. В общей сложности было выпущено
7500 клещей в сроки между 1 и 10 июня 1956 г. Через месяц вся территория
в радиусе 50 м от мест выпуска тщательно несколько раз облавливалась
флажком.
Результаты опытов сведены в табл. 3. Из нее видно, что количество
выловленных меченых самок было очень велико и достигало 37.07% от
общего числа выпущенных. Меченые клещи через месяц после начала
опыта в основной массе оставались в радиусе 5 м от точки выпуска. Плот-
ность их постепенно снижалась от центра к периферии. На расстояние
свыше 5 м переместилось всего 106 самок (3.45%). Несколько клещей
был:о поймано в 10—40 м от места выпуска, но остается неясным, прошли
ли они это расстояние активно или же были пассивно перенесены каким-
либо зверем или птицей.
- 68 -
«Притягиватощее» действие
тропы проявлялось только на
расстоянии до 10 м. В сторону
тропы здесь переместилось 560
особей (22.4% от общего числа
выпущенных), а от тропы только
222 (8.88%). Еще важнее, что
количество клещей, переполз-
ших в сторону тропы больше
чем на 5 м, составляло 75 осо-
бей (3.0%), а от тропы — 3
(0.12 %). Таким образом, в дан-
ном случае приходится конста-
тировать направленное, хотя и
очень медленное, активное дви-
жение клещей в сторону тропы.
Привлекающим фактором в дан-
ном случае, вероятно, является
запах хозяина. Интересно, что
в опытах Б. И. Померанцева и
Г. В. Сердюковой (1948) при
выпуске клещей в 5 м от тропы,
по визуальной оценке, большая
часть их переместилась к самой
тропе. Вероятно, чем интенсив-
нее раздражающий стимул, тем
сильнее активное перемещение
в его сторону.
При удалении точки выпуска
на 25 и 50 м от тропы картина
меняется. Клещи расползаются
более или менее равномерно по
всем направлениям от центра.
Количество особей, переместив-
шихся дальше чем на 10 м,
очень невелико.
Сходные данные были полу-
чены и для клещей 7?. turantcus.
В фисташковом редколесье Бад-
хызского заповедника (Турк-
менская ССР) были отловлены
на флажок и повторно выпуще-
ны после мечения сухой жиро-
растворимой краской 1000 сам-
цов и самок. Отлов и выпуск
клещей осуществлялись в ти-
пичных для вида биотопах и
в сезон их максимальной ак-
тивности — в апреле месяце
1958 г. Сбор меченых клещей
проводился через 5, 10 и 15 су-
ток после выпуска (табл. 4).
Возврат клещей был достаточно
высок и достигал 50—80%.
Основная масса клещей (до 80 %)
была поймана в радиусе не бо-
Таблица 3 Способность голодных самок Ixodes persulcatus к активному горизонтальному перемещению (по данным повторных поимок меченых клещей) Количество кле- щей, переместив- шихся на расстоя- ние свыше 5 м ом о о хг оо О ч-н СМ ХГ см см СО о о о о о 3.62
| абс. | ю со ю о со г- 106
Количество пойманных клещей о оо CD CD 00 CM хГ ОС СП Ю ОО СМ 00 СО 00 СО Xf СМ СМ СМ -тн -г-н о со
| абс. | О см СП х^ см со CD СМ О -г-i СО Ю lQ CM lO L'- СО СО 2780
Количе- ство вы- пущен- ных клещей ООО LQ LO Ю см см см 7500
Количество клещей, переместившихся на расстояние, м 41—50 | О | о оо о
I | О | о о -г-<
21-30 | о о о о
11-20 | | см о см о
s т-to о о см со 34
о ^о о о о т—< сч 't-г
оо гг-н -г-н о О О см 23
Г- О О О О О со со
CD см О СО О СМ -г- т—1 см
1Г5 х^ О- со о со оо LD СМ 117
СО СО ХГ ^-н со о ХГ -гч CM m ИЗ
СО CM CM CM lQ СО 00 ХГ Xf СО со СО -г-1 232
xf -г-н -сн СО СП О О со О Г- СО 618
СМ СО -гн СО ОО -г-н Xf L'- СО О О ю СМ хг СО -г- см 1594
Направление перемещения а я 3 Ф Д Ф Д ф Д Я о 5 о До о си о Он 2 л Он н Он Еч Дн Н ко ко Всего клещей
Удаление места выпуска от тропы, м О иО о -с-1 СМ ио
- 69 -
Таблица 4
Подвижность голодных Rhipicephalus turanicus
(по данным повторно пойманных меченых клещей)
лее 2 м от точки выпуска. Лишь одиночные особи расползались на 5—
10 м. На расстоянии свыше 10 м не было поймано ни одного клеща.
Большая часть клещей оставалась вблизи от точки выпуска. Заметные от-
личия в подвижности самцов и самок отсутствовали.
Приведенный фактический материал заставляет с очень большой
осторожностью говорить о способности голодных клещей к значительным
активным горизонтальным перемещениям. Клещи действительно способны
к направленному переползанию, но лишь под воздействием привлекаю-
щих химических стимулов. Вероятно, последние связаны со специфиче-
скими запахами хозяев. В случае присутствия подобного химического
раздражения клещи начинают довольно медленно двигаться в его сторону
в зону максимальной интенсивности раздражителя. Радиус восприятия
этих раздражений относительно невелик и, вероятно, немною превышает
10 м. Примерно такой же величины достигали в наших опытах и активные
горизонтальные перемещения одиночных особей. На небольших расстоя-
ниях, порядка 1—2 м от хозяина клещ уже принимает позу активного
ожидания, а в ряде случаев может даже активно и довольно быстро дви-
гаться в его направлении. Направленные перемещения клещей в сторону
максимальной интенсивности запаха хозяев несомненно следует рассмат-
ривать как хорошо выраженную реакцию хемотропизма. При отсутствии
соответствующих стимулов расползание клещей в горизонтальной плос-
кости очень невелико, а его направления беспорядочны.
У некоторых видов иксодовых клещей подстерегающий тип нападе-
ния совмещается с активным преследованием обнаруженных хозяев.
Подобный тип нападения свойствен имаго Hyalomma asiaticum и, вероятно,
другим видам Hyalomma, широко распространенным в пустынных и полу-
пустынных районах Средней Азии и Закавказья. Большую роль в обнару-
- 70 -
жении позвоночных и ориентации при их преследовании играют достаточно
сложно устроенные глаза. По нашим наблюдениям в закрепленных бархан-
ных песках пустыни Кара-Кум, голодные имаго Н. asiaticum обычно не-
подвижно сидят на поверхности почвы и, реже, на невысокой злаковой
растительности, выбирая затененные участки, или совершают беспорядоч-
ные перемещения во всех направлениях. При обнаружении крупного позво-
ночного животного или человека клещи сразу же бегут к нему и могут
преследовать на расстоянии до нескольких десятков метров.
Для выяснения подвижности клещей Н. asiaticum мы выпустили в при-
родных биотопах этого вида в сезон активности (апрель 1958 г.) 2500 го-
лодных самцов и самок, меченных порошком сухого красителя Судан III,
и затем повторно отлавливали их через 5, 10 и 30 дней. Полученные дан-
ные свидетельствуют о весьма значительной способности этого вида к гори-
зонтальным перемещениям (табл. 5). Несколько клещей были пойманы
в 500 м от точки выпуска. Расстояние в 100—400 м прошли 10—25%
пойманных меченых клещей. Наибольшее количество выпущенных особей
оставалось в радиусе 25—100 м от места выпуска, но в непосредственной
близости от него (в радиусе до 10 м) осталось лишь несколько клещей.
Фактическая подвижность голодных Н. asiaticum может быть значительно
выше, так как по мере удаления от точки выпуска шансы поимки всех ме-
ченых особей все время уменьшаются, а на расстоянии свыше 200 м пол-
ный отлов выпущенных клещей становится нереальным. Косвенно о высо-
кой подвижности свидетельствовали также невысокий процент возврата
(12—16%) при низкой смертности. Зависимость пройденного расстояния
от времени была особенно заметна в первые дни после выпуска. Это, ве-
роятно, было связано с активными поисками подходящих микростаций,
Таблица 5
Подвижность голодных Hyalomma asiaticum
(по данным повторно пойманных меченых клещей)
Номер опыт- ной пло- щадки Время рас- полза- ния, в сутках Пол Количество клещей, переместившихся на расстояние, м Всего выпу- щено Всего поймано
0-10 10-25 25—50 50-75 75—100 100—150 150—200 200—300 300-400 400-500 абс.
Самцы 5 23 24 19 2 0 0 1 0 0 400 74 18.5
1 Самки 3 17 36 22 9 1 2 1 0 0 600 91 15.2
1 5 1
1 Всего 8 40 60 41 И 1 2 2 0 0 1000 165 16.5
Самцы 0 2 4 6 3 1 1 0 0 0 150 17 11.3
2 10 Самки 0 6 5 14 И 2 0 2 1 0 350 41 11.7
Всего 0 8 9 20 14 3 1 2 1 0 500 58 11.6
Самцы 0 2 10 13 15 5 1 0 1 0 375 47 12.5
3 30 | Самки 1 15 11 19 9 20 3 1 2 2 625 83 13.3
Всего 1 17 21 32 24 25 4 1 3 2 1000 130 13.0
— 71 -
так как пойманные особи всегда концентрировались вблизи кустов сакса-
ула, кандыма и других растений, обеспечивающих некоторое затенение.
Заметные различия в подвижности самцов и самок отсутствовали.
В связи с весьма ограниченной способностью к активным перемещениям
расселение клещей надсем. Ixodoidea во многих случаях обеспечивается
пассивным переносом питающихся особей на теле хозяев. Естественно,
что виды с продолжительными сроками питания, паразитирующие на пти-
цах, имеют большие возможности расселения по сравнению с паразитами
малоподвижных млекопитающих или видами, не имеющими в цикле раз-
вития стадии многодневного кровососания. Этим можно объяснить широ-
кие области распространения некоторых видов рода Argas или Ornitho-
doros capensis (паразиты птиц с многодневным питанием личинок) и более
ограниченное распространение некоторых видов рода Ornithodoros
с кратковременным питанием личинок (Филиппова, 1966). Виды, парази-
тирующие на перелетных птицах, в период осеннего и весеннего пролета
могут переноситься на многие сотни и тысячи километров от своего ареала.
Так, на территории Финляндии были найдены клещи Hyalomma plum-
Ъеит plumbeum, а в Болгарии — Amblyomma hebraeum, занесенные на ми-
грировавших с юга птицах (Nuorteva a. Hoogstraal, 1963; Pavlov a. Po-
pov, 1951).
В дельте Нила во время весеннего пролета на теле перелетных птиц
постоянно обнаруживались личинки и нимфы африканского подвида
Hyalomma plumbeum rufipes и, в меньшем количестве, других видов родов
Hyalomma, Amblyomma и Haemaphysalis, которые, по мнению Г. Хог-
страала с сотрудниками (Hoogstraal a. oth., 1961, 1963, 1964), постоянно
транспортируются в Европу и Северную Азию. Напротив, во время осен-
него пролета на тех же видах хозяев найдены в большом количестве ли-
чинки и нимфы Hyalomma plumbeum plumbeum, Ixodes frontalis, I. rici-
nus, Haemaphysalis punctata, H. otophila, H. sulcata, занесенные в Египет,
из Европы и Азии.
Поведение голодных клещей в период их активности определяется мно-
гими факторами внешней среды и зависит от физиологическою состоя-
ния членистоногих. Детальные исследования поведения имаго клещей
Ixodes ricinus и I. persulcatus, выполненные в различных частях их ареала и
различными методами, установили существование периодических верти-
кальных миграций из подстилки на растительность и в обратном направле-
нии (Lees a. Milne, 1951; Хейсин, 1953; Лутта и Шульман, 1958; Бабенко
и Хижинский, 1964). Подъем клещей на растительность обеспечивается
существованием у них отрицательного геотаксиса, но при неблагоприят-
ных условиях температуры и влажности, уменьшающих нормальное со-
держание воды в организме, у клещей развивается положительный геотак-
сис и они уходят в подстилку. Важную роль при этом играет и непосред-
ственная реакция на градиент влажности в различных слоях припочвенного
воздуха. В связи с этой особенностью поведенпя период фактического
пребывания клещей на растительности значительно короче, чем весь
период их активности — от начала приобретения способности к нападе-
нию на позвоночных и до окончательного исчезновения. Так, по наблюде-
ниям А. Лиса и А. Мильна (Lees a. Milne, 1951), общая продолжительность
индивидуальной активности имаго I. ricinus в Англии составляет в сред-
нем 30 суток, но из них на растительностп клещи проводят всего 9 дней,
а остальное время находятся в подстилке, совершая четыре вертикальные
миграции. В зависимости от климатических особенностей местности про-
должительность индивидуальной активности может значительно варьи-
ровать и, в частности, в Карелии (Лутта и Шульман, 1958) интервалы
между последовательными вертикальными перемещениями, как и общая
продолжительность индивидуальной активности, значительно короче.
- 72 -
Еще короче время индивидуальной активности для I. persulcatus,
обитающих в районах с континентальным климатом. В Пермской обл.
индивидуальная активность имаго продолжалась в среднем — в молодом
березовом лесу 7 дней и в старолесье 15 дней (Морозов, 1963), а в Крас-
ноярском крае от 1 до 61 дня (Хижинский, 1963), включая и время ухода
в подстилку. Соотношение между числом активных клещей в подстилке
и на растительности, а также степень «агрессивности» последних опреде-
ляется погодными условиями и в первую очередь температурой и отно-
сительной влажностью воздуха. При этом, учитывая огромные размеры
ареалов обоих видов, нельзя ожидать однотипности поведения в различ-
ных географических областях. Активность клещей может быть кругло-
суточной, но максимум ее всегда приходится на светлое время. В Карелии
наибольшее число активных самцов и самок Z. persulcatus наблюдалось
при температуре 5 — 15° и относительной влажности воздуха в 55—80%.
Температура выше 20° и относительная влажность ниже 50% вызывают
снижение активности и уход клещей в подстилку (Хейсин, 1953). В Красно-
ярском крае (Бабенко и Хижинский, 1964) за сезон наблюдений наиболь-
шее количество активных клещей обнаружено при сочетании температуры
в 0—15° и относительной влажности в 60—100% и наименьшее при 16—
30° и той же относительной влажности. Наименьшее количество актив-
ных клещей наблюдалось в предутренние и раннеутренние часы, а в осталь-
ное время суток активность зависела от погоды: в солнечные дни она была
в прямой зависимости от относительной влажности и в обратной от тем-
пературы, в пасмурные дни картина была обратной.
Аналогичное чередование периодов собственно активного подстерега-
ния хозяев на поверхности почвы и пребывания в норах грызунов и дру-
гих сходных микробиотопах было обнаружено и у имаго клещей Hyalomma
asiaticum в пустыне Каракумы (Балашов, 1960а). Наши наблюдения охва-
тывали переходный период окончания весны и начала лета 1959 г. в окрест-
ностях ст. Репетек. В апреле поверхность почвы была покрыта богатой
травяной растительностью, выгоревшей в начале мая. Температура воздуха
в дневные часы достигала в апреле 25—35°, а в мае повысилась до 30—40°.
Незащищенная поверхность почвы нагревалась до 60—70° В утренние и
вечерние часы температура воздуха колебалась в пределах 18—30°,
а поверхности почвы — 20—35° Относительная влажность воздуха
составляла днем 10—20%, а перед рассветом поднималась до 40—
60%.
До выгорания травяной растительности клещи довольно равномерно
распределялись по всей описываемой зоне, отсутствуя лишь в разбитых,
не закрепленных песках. Особенно часто они встречались вблизи колоний
большой песчанки — основного прокормителя их личинок и нимф. По
мере повышения средних дневных температур и выгорания растительности
наблюдалась закономерная концентрация клещей вокруг деревьев сак-
саула, крупных кустов ревеня, нор грызунов и других укрытий, создаю-
щих затенение от прямых солнечных лучей.
В начале апреля, в относительно нежаркие дни, клещи бегают по песку
и активно преследуют человека или животных в течение всего дня. При
повышении дневной температуры воздуха до 30° и почвы до 45—50° их
активность переместилась на утро с рассвета до 10 час. ина вечер с 6 час.
и до наступления темноты. Ночью нападение клещей обычно не наблю-
дается. Днем они прячутся в различные убежища с менее высокими тем-
пературами. Особенно часто Н. asiaticum скрывались в норах большой
песчанки.
Наблюдения над поведением клещей "в садках (табл. 6) позволили нам
точно выяснить влияние окружающей температуры и влажности на их
суточную активность.
- 73 -
Таблица 6
Влияние температуры и влажности на поведение голодных самцов и самок
Hyalomma asiaticum в сезон их активности в песчаной пустыне
в Туркменской ССР (средние температуры и относительные влажности
за апрель—первую половину мая 1959 г.; всего в опытах использовано
600 клещей)
Время суток, час. Температура Относитель- ная влажность воздуха, % Процент активных клещей на поверх- ности песка
открытые биотопы убежища
воздух на высоте 2 м припоч- венный слой воз- духа поверх- ность почвы нора пес- чанки на глубине 50 см от входа почва под листьями ревеня расти- тельная подстил- ка в тени саксаула 1 на высоте 2 м припоч- венный слой
5 17.0 16 23 16 17 45 3
8 18.5 19.8 23 22 18 18 49 49 59
9 — 25.0 36 23 24 22 — 31 84
10 — 29.0 43 24 26 24 — 23 78
11 — 31.0 50 24 30 27 — 20 4
14 30.9 35.2 62 24 37 32 20 16 0
18 — 31.0 37 24 25 31 — 20 36
19 — 28.0 30 24 23 28 — 26 81
20 26.8 25.5 28 24 21 25 29 29 62
23 — 23.0 22 24 19 19 — 39 2
Как видно из табл. 6, до восхода солнца клещи неактивны. Темпера-
тура воздуха в 19—20° является нижним порогом активности, и клещи
в основном неподвижно сидели на поверхности почвы или находились
в убежищах. С восходом солнца температура воздуха и особенно поверх-
ности почвы быстро поднимается и клещи начинали двигаться по садку.
В 8 час. утра при температуре воздуха 20—21° и почвы 23° в активном со-
стоянии находилось 59% клещей. Между 8 и 10 час. они проявляли мак-
симальную активность (до 84% в 9 час.). Температура почвы при этом
колеблется от 23 до 43°, а относительная влажность припочвенного слоя
воздуха — от 20 до 50 %. С 10 час. при дальнейшем повышении температуры
почвы и воздуха клещи начинали прятаться в различные убежища.
К 11 час. при температуре почвы около 50° на ее поверхности оставалось
только 4% клещей, да и те сидели в полутени. В дневные часы все клещи
находились в убежищах. Активность их возобновлялась с 18 час., когда
температура почвы опускалась до 35—40° при 20% относительной влаж-
ности. С наступлением полной темноты они вновь становились неподвиж-
ными, хотя температура почвы и воздуха была еще достаточно высокой.
Дневные убежища клещей отличаются значительным постоянством
микроклимата. Особенно стабильны температура и влажность в норе
большой песчанки. На глубине 50 см от входа в апреле—мае средняя су-
точная температура составляла 22—24°. Относительная влажность дер-
жится на этой глубине в пределах 84—100% (Ширанович и др., 1959).
В подстилке под деревьями саксаула и на почве под листьями ревеня су-
точные колебания температуры значительно больше, но ее максимальные
значения никогда не превышали 40° при нагреве рядом расположенных
незащищенных участков почвы до 70°.
Из приведенного материала видно, что основным фактором, ограничи-
вающим суточную активность Н. asiaticum, служит температура. Нижний
порог активности этого вида составляет 19—20° и верхний — 40—45°.
При нагреве почвы в дневные часы до 70° клещи, спасаясь от перегрева,
уходят в различного рода убежища. Температура в последних относи-
тельно стабильна и не превышает днем 40°. Изменения относительной
влажности воздуха не оказывают заметного влияния на их поведение.
- 74 -
Наконец, прекращение нападения клещей в ночные часы, вероятно,
можно объяснить ведущей ролью зрительного анализатора в нахождении
хозяев у описываемого вида.
Наряду с суточным ритмом активности у Н. asiaticum существует также
закономерное чередование более продолжительных периодов преимуще-
ственного нахождения на поверхности или в убежищах. В опытах с ме-
чением клещей сухим Суданом III удалось установить, что 10—20-дневные
периоды активности чередуются у них с 2—4-суточным нахождением
в убежищах с высокой относительной влажностью. В наших садках по-
стоянно от 10 до 20% от общего числа клещей по нескольку суток не вы-
лезало на поверхность.
У клещей Dermacentor variabilis, многочисленных в открытых стациях
Виргинии (США), активность голодных личинок и имаго находится в пря-
мой зависимости от интенсивности солнечного освещения, но на нее мало
влияет температура воздуха. В пасмурную погоду активность клещей
сильно снижается даже при высоких температурах (Atwood a. Sonen-
shine, 1967).
ПРИСПОСОБЛЕНИЯ К УМЕНЬШЕНИЮ
ПОТЕРЬ ВОДЫ ОРГАНИЗМОМ
Описанные ранее закономерные чередования периодов активного
подстерегания хозяев в биотопах с повышенным дефицитом насыщения и
нахождения в растительной подстилке, норах, почве и других микробио-
топах с достаточно высокой относительной влажностью воздуха опреде-
ляются необходимостью поддержания в организме определенного уровня
содержания воды. Наземные членистоногие приспособились к жизни
в условиях низкой относительной влажности как за счет различных ана-
томо-физиологических приспособлений, уменьшающих испарение (высокая
водонепроницаемость покровов, трахейная дыхательная система, образо-
вание малорастворимых конечных продуктов азотистого обмена), так и
путем выработки комплекса поведенческих реакций, позволяющих избе-
гать неблагоприятных условий (Гиляров, 1959). Все эти приспособления
свойственны и клещам надсем. Ixodoidea, сталкивающимся с опасностью
высыхания в период подстерегания хозяев. Устойчивость к высыханию
связана с экологическими особенностями вида. Среди аргасовых и иксо-
довых клещей удалось обнаружить несколько групп видов, значительно
различающихся по способности переживания при высоком дефиците
насыщения в лабораторных условиях (Балашов, 1960а; Балашов и Филип-
пова, 1964; Lees, 1946а, 1947), причем эта способность находится в пря-
мой зависимости от степени увлажненности их природных биотопов.
В наших опытах при содержании имаго семи видов аргасовых клещей
при 20, 40, 60 и 80% относительной влажности и температуре 18 и 28°
установлены значительные различия в среднесуточных потерях веса
за счет испарения (табл. 7). Наибольшей засухоустойчивостью отлича-
лись Alveonasus lahorensis, Argas persicus и Ornithodoros papillipes. Клещи
A. vulgaris, Ornithodoros tartakovskyi и О. capensis оказались более гигро-
фильными и теряли в весе в среднем в 1.5—2 раза больше, чем виды пер-
вой группы, а О. verrucosus занимал в этом отношении промежуточное поло-
жение. Устойчивость к высыханию в значительной степени определялась
активными биологическими процессами в организме, а не только механи-
ческими защитными приспособлениями. Живые клещи всегда теряли воды
в 2—3 раза меньше, чем убитые особи тех же видов, несмотря на сохране-
ние у последних целостности покровов и исключение потерь сквозь стиг-
мальные отверстия трахейной системы. В целом всем изученным видам
аргасовых клещей была свойственна значительная устойчивость к высыха-
- 75 -
Таблица 7
Среднесуточные потери веса живыми клещами (в мг/г/сутки) при различной
температуре (в °C) и относительной влажности (в %)
Вид клеща 18° 28°
20% 40% 60% 80% 20% 40% 60% 80%
Argas persicus 5.1 4.4 2.9 0.8 5.3 5.2 3.2 1.4
A, vulgaris 6.4 5.9 5.6 3.2 10.6 9.8 5.8 4.5
Alveonasus lahorensis 2.8 2.1 2.4 1.2 4.8 3.2 3.3 1.7
Ornithodoros papillipes 4.7 4.7 4.1 2.5 6.2 3.0 2.8 2.5
O. verrucosus . 7.4 5.7 3.5 2.8 6.8 5.8 5.2 0.8
0. tartakovskyi 11.0 9.7 4.8 1.5 11.6 10.9 5.9 1.6
O. capensis 8.6 7.5 6.6 0 10.6 9.1 8.6 3.5
нию, несомненно связанная с существованием в аридных ландшафтах.
В условиях низкой относительной влажности клещи могут терять без
видимых повреждений в организме до 20% содержания воды. При даль-
нейшем высыхании начиналась массовая гибель, хотя одиночные особи
выдерживали 30% потери в весе.
Все изученные виды длительное время переживали при относительной
влажности 60%, которая, вероятно, служит экологическим порогом, выше
которого величина испарения уже относительно невелика и не представ-
ляет угрозы для существования организма. Относительная влажность
80% и выше представляет уже физиологический порог, за которым вод-
ный баланс относительно постоянен и изменения веса связаны преимуще-
ственно с метаболическими потерями.
При содержании нескольких видов иксодовых клещей в сухой атмо-
сфере при 25° (Lees, 1946а) их устойчивость к высыханию оказалась в
целом ниже, чем у аргасовых клещей. Наименее устойчивым был Ixodes
ricinus, терявший в этих условиях до 50% веса за суткп и выживавший
не более 1—2 дней. I. canisuga и I. hexagonus выживали 4—5 дней и
АтЫуотта cajennense —10 дней при 5% потерях веса за сутки. Наи-
большая устойчивость была свойственна клещам Rhipicephalus sanguineus
и особенно Dermacentor andersoni и D. marginatus, которые теряли за сутки
всего 2—3% исходного веса и выживали 17—27 дней.
Среди иксодовых клещей наиболее приспособленным к существованию
при низкой относительной влажности оказался Hyalomma asiaticum (Бала-
шов, 1960а). Голодные имаго Н. asiaticum могут довольно безболезненно
терять до 30% воды, содержащейся в их организме (примерно 20% от веса
клеща). При дальнейшей потере воды в организме наступают необратимые
изменения, скорость испарения резко возрастает и клещ очень быстро
погибает. К моменту гибели обычно теряется до 50% воды (30—3596 веса
клеща).
В первой серии опытов (рис. 159, А), проведенных при температуре,
близкой к верхнему порогу активности (36°) при 10% относительной влаж-
ности, клещи погибали через 10—15 дней после начала опыта, при 25% —
через 15—20 и при 50 % — через 20—25 суток. При 75 и 95 % относительной
влажности они выживают по нескольку месяцев, а за 20 дней опыта их
вес уменьшился соответственно на 11 и 4%.
При 26° скорость испарения воды в тех же условиях относительной
влажности значительно уменьшается (рис. 159, Б). За 20 дней опыта клещи
не погибали даже при 0, 10 и 25 % относительной влажности, теряя 13,
10 и 7% своего веса. При 50, 75 и 95% относительной влажности потери
веса за указанный период достигали всего 2—5%.
- 76 -
Из механических приспособлений, ограничивающих испарение, ре-
шающая роль принадлежит самому поверхностному слою покровов тела —
эпикутикуле и особенно ее восково-липоидным компонентам. При подъеме
температуры кутикулы выше определенного значения («критическая тем-
пература») межмолекулярная структура восково-липоидного слоя нару-
шается и проницаемость покровов для воды резко возрастает. С последним
связаны общие для наземных членистоногих особенности изменения ско-
рости испарения с повышением температуры. Вначале потери воды за счет
Рис. 159. Изменения веса тела голодных самцов и самок
Hyalomma asiaticum в условиях различной относительной
влажности при температуре 36 (Л) и 26° (Б). Средние
от взвешиваний 20 клещей для каждой точки. За 100%
принят вес клещей до начала опытов.
испарения увеличиваются очень медленно, но после достижения опре-
деленного «критического» значения скорость потери воды возрастает
скачкообразно в несколько раз. Считается, что критическая температура
эпикутикулы может служить видовым признаком; чем выше ее значение,
тем большей устойчивостью к высыханию отличается членистоногое
(Lees, 1947; Beament, 1959).
У исследованных нами 8 видов аргасовых клещей с повышением тем-
пературы на 10° испарение возрастало всего в 1.5—2 раза. Напротив,
при повышении критической температуры на 1° потери воды сразу же
увеличивались в 8—10 раз (табл. 8). У Hyalomma asiaticum при повыше-
нии температуры с 35 до 50° потери воды увеличивались с 0.16 до
0.24 мг/час на одного клеща. При 52° («критическая температура») про-
исходило внезапное увеличение испарения и при 55° скорость испарения
увеличивалась в 4 раза (1.05 мг/час). С дальнейшим повышением темпера-
- 77 -
туры скорость испарения вновь увеличивалась более или менее равно-
мерно (рис. 160).
Критическая температура в целом хорошо коррелирована с устойчи-
востью исследованных видов к высыханию. Среди аргасовых клещей са-
Температуро
Рис. 160. Потери воды голодными
самцами и самками Hyalomma asi-
aticum, убитыми парами аммиака,
при разной температуре воздуха.
Средние от взвешивании 20 кле-
щей для каждой точки.
мая высокая критическая температура (61°)
свойственна Alveonasus lahorensis. Осталь-
ные виды по этому показателю можно
разделить на две группы. У Argas vesper-
tilionis, A. persicus, Ornithodorospapillipes,
О. verrucosus она лежит между 49—54°
а у О. capensis, О. tartakovskyi и Argas
vulgaris — 42—48° (табл. 8).
Для иксодовых клещей в целом ха-
рактерны более низкие значения критиче-
ских температур, которые также отражают
экологические особенности видов. Наибо-
лее низкие показатели получены для вы-
соко влаголюбивых видов, как Ixodes rici-
nus (32°) и I. canisuga (42°). У умеренно
мезофильных Dermacentor andersoni, Rhipi-
cephalus sanguineus и Haylomma anatoli-
cum критическая температура была около
44—45°, а у наиболее устойчивого к вы-
сыханию клеща Н. asiaticum она была
выше (52°), чем у многих видов аргасо-
вых клещей. Можно также отметить, что
у ксерофильного вида Н. asiaticum кри-
тическая температура выше верхнего тем-
пературного порога жизни (48—50°), что
предотвращает возможность высыхания
даже в условиях перегрева. Голодающие
клещи, несмотря на совершенство их мор-
фологических и физиологических адаптаций к консервации воды в орга-
низме, непрерывно, хотя и медленно, теряют воду за счет испарения че-
рез покровы и трахейную систему. Так, во время активности клещей
Hyalomma asiaticum температура припочвенного слоя воздуха колеблется
в пределах 20—30° и поверхности почвы — 20—40°. Относительная
Таблица 8
Влияние температуры на скорость испарения воды через покровы
клещей, убитых парами аммиака (потери веса в мг/г/час)
Вид клеща Критичека температура эпикутикулы, °C Скорость испарения воды при температуре
на 11° ни- же крити- ческой на 1° ниже критиче- ской ! на 1° выше критиче- ской
Argas persicus 52 3.3 5.0 58.3
A. vulgaris 47 3.7 6.9 47.8
A. vespertilionis 54 2.9 4.3 50.9
Alveonasus lahorensis 61 2.8 3.8 69.3
Ornithodoros papillipes 50 2.6 4.9 52.7
O. verrucosus . 49 3.1 4.4 51.5
O. tartakovskyi 48 3.5 5.2 41.7
O. capensis 42 3.2 8.3 35.3
— 78 -
влажность воздуха составляет 15—50%. При 30—40° скорость испарения
очень велика и существует угроза быстрого высыхания. Снижение темпе-
ратуры до 26° в несколько раз увеличивает продолжительность жизни
клещей и значительно уменьшает скорость испарения. Однако даже
при наиболее благоприятной комбинации температуры и влажности,
возможной в природных условиях (20—25° и 40—50% относительной
влажности), они неизбежно должны погибнуть от высыхания через 3—
4 месяца. Между тем голодные Я. asiaticum могут переживать в природе
свыше года.
Сходная ситуация складывается и для лесных видов (Ixodes ricinus
и I. persulcatus), фактическая продолжительность периода активности
которых значительно дольше, чем можно предполагать, исходя из скорости
потери воды во время нахождения на растительности. Насколько известно
в настоящее время, аргасовые клещи не пьют воду, а иксодовые клещи,
если и могут в отдельных случаях восполнять этим способом потери воды
(Wilkinson, 1953), то не всегда им пользуются из-за отсутствия капельной
влаги в их микробиотопах. Главным источником поступления воды в орга-
низм голодающих клещей, как установлено экспериментальными иссле-
дованиями со многими видами (Lees, 1946а, 1947; Browning, 1954; Балашов,
1960а; Белозеров и Серавин, 1960; Балашов и Филиппова, 1964), служит
активное поглощение водяных паров из атмосферы с высокой относитель-
ной влажностью.
В наших опытах предварительно «подсушенные» особи большинства
видов аргазид адсорбировали водяные пары при относительной влажности
воздуха в 80% и выше. Как видно из табл. 9, если потери за счет испаре-
ния не превышали допустимой для организма клеща нормы в 20% от ис-
Таблица 9
Адсорбция водяных паров аргасовыми клещами, предварительно
выдержанными в течение 10 суток при 20% относительной влажности
(средние от взвешиваний 10 клещей для каждой точки, вес в мг)
Вид клеща Температура, °C Потери веса (в %) после 10 суток при 20% относительной влажности Вес «подсушенных» клещей Вес через 10 су- ток при 80% относительной влажности Вес «подсушенных» клещей Вес через 10 су- ток при 100% относительной влажности
абс. прирост, % абс. прирост, %
Argas persicus. 18 8.1 14.5 14.9 2.8 11.7 12.6 7.8
28 5.2 13.8 14.1 1.2 13.5 14.8 9.6
A. vulgaris. 18 6.0 12.6 12.9 2.4 8.1 8.7 7.4
28 12.4 11.8 12.2 3.4 7.8 9.0 15.4
Alveonasus lahoren- 18 3.5 33.0 32.4 -1.8 34.9 34.7 -0.6
sis. 28 6.6 38.4 37.4 -2.6 36.8 36.3 -1.3
Ornithodoros papilli- 18 8.6 6.7 7.2 7.5 6.5 7.0 7.7
pes. 28 7.5 7.1 7.4 4.2 7.4 8.1 9.5
O. verrucosus. 18 11.3 6.2 6.6 6.5 6.2 7.4 19.4
28 7.6 6.7 7.4 10.5 6.6 7.3 10.6
O. tartakovskyi. 18 17.8 6.1 6.9 13.1 6.0 7.1 18.3
28 11.8 4.7 5.2 10.6 5.9 7.2 22.0
O. capensis. 18 7.8 7.2 8.6 19.4 7.4 8.5 14.9
28 11.1 7.4 8.5 14.9 6.6 8.5 28.8
Примечани е. При 80 и 100% относительной влажности у Alveonasus lahorensis наблюда-
лось дальнейшее уменьшение веса, отмеченное в таблице знаком минус.
- 79 -
Таблица 10
Адсорбция воды из воздуха голодными самцами и самками Hyalomma asiaticum, предварительно выдержанными 10 суток
при нулевой относительной влажности (средние от взвешиваний 20 клещей для каждой точки,
температура 26°)
СП -гЧ СО г— о сп см см Г- СП 00 СП о -гЧ
мг | о сю о ю см см со чг< со
а Ф о о СМ СО ЧГ о сп -гч со со Г- СП 00 СП о -ч-Ч
:ия во влажную ат! мг см О О см С© см со чг чр со
o' Ю ОО ч^ 4f О О см о со со ОО СП СП СП о
к Ф о Ф К Ф р. Ф й мг 4f ^ч -г-н СМ со см СО чГ чР со
ей после 1 0/° 1 СМ о ЧГ чГ ОО -гч со о ю со СО СП СП СП о -гЧ
ез 1—6 дн мг lQ СМ -гл Ю1> см со чр чг со
Вес клещей чер см со о г* со ^ч --ч* -^ч СМ чГ ОО СП Oi СП о -гЧ
ю о см оо СМ СО чг чр СО
00 'гч СМ 00 СО -гч О 00 СМ 00 СП 00 00 О Т"Ч
мг 1 со оо со ю ю см см со со со
Вес через 10 дней при нулевой относительной влажности СМ СО СМ Ш -гЧ оо оо оо 00 СП
мг | С- СО СП о -гЧ см см см со см
начала 10Q 100 100 100 100
Вес до ОП1 ч^ см со см см Ю 4t< LO ю со
Относитель- И влажность воздуха, % ЮОЮОЮ Г- ОО 00 СП СП
ходного веса, то клещи в 10-дневный
период полностью или частично вос-
станавливали вес, которым обладали
до начала подсушивания. При этом
поглощение водяных паров в общем
было пропорционально потерям воды
за счет испарения. Виды, терявшие
в сухой атмосфере большое количе-
ство воды (Ornithodoros capensis и
О. tartakovskyi), интенсивнее адсор-
бировали влагу из воздуха и силь-
нее увеличивались в весе (на 10—
29 % по сравнению с весом подсохших
клещей). Напротив, более устойчивые
к высыханию Argas persicus и Orni-
thodoros papillipes в тех же условиях
увеличивались в весе всего от 1.2
до 9.6%. Только ксерофильный Al-
veonasus lahorensis вообще не адсор-
бировал водяные пары после пред-
варительного выдерживания в сухой
атмосфере. Можно, однако, предполо-
жить, что в условиях опыта умень-
шение веса особей этого вида на 3.5 —
6.6% существенно не меняло содер-
жания воды в тканях и не вызывало
потребности в восстановлении вод-
ного баланса.
Относительная влажность 80%
оказалась достаточной для восстанов-
ления водного баланса и поддержа-
ния его на относительно постоянном
уровне. Дальнейшее повышение
влажности воздуха до точки насыще-
ния не привело к резкому возраста-
нию скорости поглощения паров и
соответственно увеличению в весе.
По-видимому, выше точки равнове-
сия, лежащей где-то между 60—80%
относительной влажности, клещи спо-
собны поддерживать нормальную
концентрацию воды в организме в
значительной степени безотноситель-
но к дефициту насыщения. Сходным
образом вели себя и клещи Hyalom-
ma asiaticum (табл. 10). Минимальная
относительная влажность, при кото-
рой потери воды на испарение ком-
пенсируются ее адсорбцией из воз-
духа, составляет для них 80%. С по-
вышением относительной влажности
увеличиваются как скорость погло-
щения водяных паров, так и общее
количество адсорбированной воды.
При 80% относительной влажности
клещи, потерявшие перед этим до
- 80 -
14% своего первоначального веса, увеличивались в весе в первые 4 дня,
а затем вес их стабилизировался или даже несколько уменьшался, не
достигнув исходной величины. При 95% относительной влажности клещи
уже за 1 сутки не только восстанавливали исходное содержание воды
в организме, но в ряде случаев оно было даже несколько выше, чем перед
началом опытов. Общий вес воды, поглощенной клещами за это время,
достигал 12% от веса тела «подсушенных» особей.
Точка равновесия, при которой потери воды на испарение полностью
восполняются ее активным поглощением из воздуха, служит важным эко-
логическим показателем, характеризующим степень гигрофильности раз-
ных видов. Для сравнения можно указать, что у Ixodes ricinus (Lees, 1946а)
она близка к 92%, у Hyalomma asiaticum к 80% и у аргасовых клещей
к 60—80% относительной влажности.
Предполагается, что водяные пары поглощаются гиподермальными
клетками (Lees, 1946а). Этот процесс подвержен значительным индиви-
дуальным отклонениям и, вероятно, зависит от общего физиологического
состояния организма, так что в одинаковых физических условиях и после
одинакового обезвоживания организма скорость адсорбции воды неоди-
накова даже среди особей одного вида. У недавно перелинявших или на-
питавшихся особей способность к поглощению водяных паров временно
исчезает. Анестезия клещей высокими концентрациями СО2 (Browning,
1954) или замазывание дыхалец (Белозеров и Серавин, 1960), вызывавшие
резкие нарушения физиологических процессов, также приводили к пре-
кращению адсорбции воды.
Особенностями регулирования водного баланса можно объяснить
периодические вертикальные миграции многих видов иксодовых клещей,
а также описанные в литературе сезонные перемещения аргасовых клещей
внутри нор (Ушакова, 1956; Бусалаева, 1960). Подстерегание хозяев на ра-
стительности, поверхности почвы или в верхних отделах нор связано с не-
избежными потерями воды на испарение. После понижения содержания
воды в организме до определенного критического уровня характер поведен-
ческих реакций изменяется и клещи перемещаются в растительную под-
стилку, трещины почвы или в норы. Здесь, в условиях высокой относи-
тельной влажности, происходит активное поглощение водяных паров и
содержание воды в организме восстанавливается до нормального уровня.
После этого клещи вновь переходят в более сухие стации, где имеются
наибольшие шансы на встречу с хозяином.
ИНДИВИДУАЛЬНАЯ ДОЛГОВЕЧНОСТЬ
И ФИЗИОЛОГИЧЕСКИЙ ВОЗРАСТ
Важной эпидемиологической особенностью иксодовых и аргасовых
клещей служит их исключительная индивидуальная долговечность по
сравнению с кровососущими двукрылыми. Е. Н. Павловским и А. Н. Скрын-
ник (1960) приводятся данные о выживании без пищи отдельных особей
клещей Ornithodoros papillipes в течение 11 лет, Alveonasus lahorensis —
10 лет, а более мелких Ornithodoros nereensis, О. alactagalis и О. tartakovs-
kyi — 1.5—4 лет. В наибольшей степени эта способность развита у нимф
старших возрастов крупных видов и в наименьшей у личинок. Послед-
ние выживают без пищи от нескольких недель (О. tartakovskyi) до не-
скольких месяцев (Alveonasus lahorensis, Argas persicus, Ornithodoros
papillipes).
Многие виды иксодовых клещей также отличаются значительной долго-
вечностью в голодном состоянии. Например, в условиях лабораторного
содержания взрослые Ixodes ricinus выживали до 27 месяцев (Nuttall а.
Warburton, 1911), Hyalomma dromedarii — свыше 420 дней (Поспелова-
6 Ю. С. Балашов
- 81 -
Штром, 1955), a Ixodes apronophorus — 454 дня (Голов, 1933). В природ-
ных условиях сроки выживания голодных клещей также исключительно
велики. И. В. Разумова (1966а) установила, что из меченых имаго Dermacen-
tor pictus, выпущенных весной в нормальных для этого вида природных
биотопах, до осени того же сезона доживало 49 % клещей, а до весны следую-
щего года — 37%. Таким образом, учитывая зимовку неактивизировав-
шихся клещей, перелинявших из нимф в конце лета и осенью, голодные
имаго этого вида дважды зимуют и могут быть активны в течение двух
сезонов. Клещи Z). marginatus могут выживать до 2 лет (Покровская,
1953), a Ixodes texanus — несколько лет (Gregson, 1956). Выживание голод-
ных клещей зависит как от их физиологических особенностей, так и от фак-
торов внешней среды и в первую очередь температуры и влажности.
Как правило, температура, близкая к 0°, и высокая относительная влаж-
ность благоприятствуют выживанию. Так, в наших опытах голодные самки
I. persulcatus выживали приО—3°и относительной влажности 98% — 1.5—
2 года, при 25° и той же влажности — 3—4 месяца, а при 25° и 80% от-
носительной влажности — меньше месяца. Сходная картина наблюдается
и в природных условиях, где голодные клещи этого вида, не сумевшие
найти хозяина, погибают в основном ко второй половине лета.
Непостоянство сроков развития даже в потомстве, одной самки или
способность голодных клещей переживать в природе два и более сезонов
активности обусловливают разновозрастность активных клещей. Между
тем знание возрастного состава природных популяций эпидемиологически
важных видов иксодид имеет большое практическое значение. По нему
можно судить о фактической продолжительности жизненного цикла
в данной местности и сроках активности клещей, а также учитывать эф-
фективность истребительных мероприятий. К сожалению, объективные
методики определения возрастного состава голодных клещей до послед-
него времени отсутствовали. Сведения об индивидуальной долговечности
клещей в природе основывались в основном на косвенных данных из ра-
бот по определению продолжительности циклов развития или сроков
выживания голодных клещей в лабораторных условиях. Эти сведения,
однако, не могли быть достаточно точными, так как известно, что расходо-
вание пищевых резервов голодных клещей идет далеко не равномерно.
Так, у Ixodes ricinus (Lees a. Milne, 1951) при пассивном пребывании
в растительной подстилке пищевых запасов хватает на несколько меся-
цев, а во время активного подстерегания хозяев они расходуются за не-
сколько дней или недель.
Методика определения возраста у кровососущих членистоногих доста-
точно подробно разработана в группе двукрылых главным образом бла-
годаря работам В. Н. Беклемишева и его сотрудников. У самок кровосо-
сущих двукрылых различают календарный и физиологический возрасты.
Первый характеризует продолжительность жизни насекомого в днях,
а второй — число проделанных им яйцекладок. Зная среднюю про-
должительность одного гонотрофического цикла, по физиологическому
возрасту самок легко судить и об их календарном возрасте. В качестве
критериев для определения физиологического возраста используют изме-
нения в половой системе, связанные с повторными яйцекладками (расшире-
ния на яйцевых трубочках, состояние их трахейной системы, количество
желтых тел и др.; Детинова, 1962).
С совершенно иной ситуацией мы сталкиваемся у иксодовых клещей.
Анатомическое строение и физиологические особенности иксодид, отно-
сящихся к классу паукообразных (подтип хелицеровых), во многом прин-
ципиально отличаются от принадлежащих к другому подтипу насекомых.
Весьма существенно также, что иксодовые клещи проходят лишь один
гонотрофический цикл и затем погибают. Эти две особенности не позво-
- 82 -
Рис. 161—164. Участки поперечных срезов через голодных самок Ixodes ricinus на
1-й (161), 2-й (162), 3-й (163) и 4-й (164) степенях истощения (схематизировано).
к — кутикула; г — гиподерма; дк — дивертикулы средней кишки; мс — мальпигиевы сосуды;
5м — дорсо-вентральные мышцы; гб — пищевые включения из гемоглобина;
гм — гематин; гн — гуанин.
6*
ляют применить к ним критерии физиологического возраста кровососу-
щих двукрылых.
Изучение гистологических и гистохимических изменений в кишечнике
и мальпигиевых сосудах голодных клещей позволило нам использовать
их для определения возраста этой группы кровососов. Они характеризуют
физиологический возраст клещей, который в отличие от кровососущих
двукрылых отражает не число пройденных гонотрофических циклов,
а состояние запасных питательных веществ в организме. Зная скорость
их расходования в естественных условиях, можно довольно точно уста-
новить время, прошедшее после линьки (Балашов, 1961а, 1962а, 19626).
В качестве критериев для определения физиологического возраста
клещей сем. Ixodidae мы предложили использовать следующие признаки:
степень заполнения отростков кишечника, количество включений гемогло-
бина и гематина в пищеварительных клетках, степень загрузки мальпигие-
вых сосудов. Из этих трех показателей только для определения содержания
гемоглобина и гематина в клетках требуется применение гистолохи-
ческих методов. При этом, однако, нет необходимости проводить специаль-
ные гистохимические реакции. Кристаллы гематина обладают характер-
ной собственной буро-черной окраской, а включения гемоглобина хорошо
окрашиваются железным гематоксилином, эозином и азокармином, ши-
роко используемыми в гистологической технике. Для фиксации клещей
пригодно большинство фиксаторов, удовлетворительно сохраняющих
анатомические и цитологические структуры (смеси Буэна, Карнуа, Цен-
кера, Суза). Как дополнительные признаки может быть также использо-
вано содержание гликогена и жиров в клетках средней кишки, выявляе-
мых гистохимическими методиками. При определении возраста клещей
необходимо одновременно учитывать все три основных признака, так как
даже исключение одного из них может привести к ошибочным вы-
водам.
По состоянию пищевых резервов в организме голодных клещей мы
различаем четыре степени истощенности.
1-я степень. Недавно перелинявшие особи, находящиеся на стадии
послелиночного доразвития. Отростки кишечника слегка растянуты, и
при разрыве из них вытекает буро-черная кашеобразная масса. Полость
кишечника занята дистальными концами гипертрофированных пищевари-
тельных клеток. Плазма последних полностью заполнена включениями
гемоглобина, а между ними лежат мелкие кристаллики гематина. Маль-
пигиевы сосуды беловатой окраски и содержат в просвете много средних
и крупных сферитов гуанина (рис. 161).
2-я степень. Особи недавно закончили послелиночное доразвитие.
Отростки кишечника не имеют перетяжек. Внутри них — хорошо развитый
просвет. Размеры пищеварительных клеток значительно уменьшаются.
Внутри последних много включений гемоглобина, располагающихся
преимущественно в их дистальных концах и обычно не соприкасающихся
между собой. Кристаллов гематина мало и они лежат диффузно. Мальпи-
гиевы сосуды прозрачные. В их просвете отсутствуют средние и крупные
сфериты гуанина (рис. 162).
3-я степень. Клещи находились продолжительное время в состоянии
активности. На отростках кишечника появляются многочисленные пере-
тяжки, а диаметр их заметно уменьшается. Внутри них обширный про-
свет. Пищеварительные клетки свободны от включений гемоглобина или
содержат их в очень небольшом количестве. Число кристаллов гематина
в клетках значительно увеличивается, но они по-прежнему лежат диф-
фузно. Мальпигиевы сосуды часто имеют четковидную внешность. Их
беловатые участки заполнены средними и крупными конкрециями гуа-
.нина (рис. 163).
- 84 -
4-я степень. Длительно голодавшие, сильно истощенные особи. От-
ростки кишечника крайне истонченные с многочисленными глубокими
перетяжками. Стенки их местами спадаются и просвет исчезает. В пище-
варительных клетках никогда не встречаются включения гемоглобина,
а кристаллики гематина местами образуют значительные скопления.
Мальпигиевы сосуды сильно растянуты заполняющими их сферитами
гуанина и имеют на всем протяжении молочно-белую окраску (рис. 164).
Приведенная шкала оценки составлена на основе изучения половозре-
лых особей и нимф Hyalomma asiaticum и Ixodes ricinus. В основных чертах
она подтвердилась и для остальных изученных нами видов иксодо-
вых клещей. Видовые различия проявляются преимущественно в раз-
личной скорости расходования запасных питательных веществ, их внутри-
клеточной локализации, форме и размерах пищеварительных клеток и
других особенностях. В связи с этим мы считаем возможным рекомендо-
вать использованные нами признаки при изучении возрастного состава
природных популяций иксодовых клещей. Запасные питательные вещества
в организме личинок представлены эмбриональным желтком и его про-
изводными, в связи с чем они занимают особое положение и требуют спе-
циального дополнительного изучения.
Практическую применимость разработанной шкалы подтверждают
наши исследования физиологического возраста голодных самок Ixodes
ricinus и I. persulcatus в Ленинградской обл. Клещи первого вида собира-
лись в Лужском районе с мая по сентябрь в 1958—1960 гг., а второго —
в Киришском районе в мае—августе. Всего были собраны и подвергнуты
гистологическому изучению 781 самка I. ricinus и 330 — I. persulcatus.
Полученные результаты сведены в табл. 11. Среди пойманных активных
Таблица 11
Физиологический возраст голодных самок Ixodes ricinus и I. persulcatus^
собранных в Ленинградской обл.
Месяц сбора I. ricinus I. persulcatus
процент клещей 2—4-й степеней истощенности всего собрано процент клещей 2—4-й степеней истощенности всего собрано
2-я 3-я | 4-я 2-я 3-я | 4-я
Май 60 34 6 283 69 31 0 165
Июнь 24 62 14 159 27 70 3 119
Июль 3 53 44 81 0 41 59 46
Август 33 32 35 146 0 0 100 5
Сентябрь 45 33 22 112 0 0 0 0
самок отсутствовали особи 1-й степени истощенности, что подтверждают
данные о пассивности и неспособности к нападению на хозяев клещей,
не закончивших стадии послелиночного доразвития.
У I. ricinus в Ленинградской обл. большинством исследователей от-
мечается два периода максимальной численности клещей на хозяевах:
весенний в мае—июне и осенний в конце августа—сентябре, хотя они
встречаются в течение всего теплого сезона (Алфеев, 1948; Померанцев,
1935).
Как видно из наших наблюдений, основную часть майских самок со-
ставляли особи 2-й (60%) и 3-й (34%) степеней истощенности. Они несом-
ненно происходят от особей, перелинявших со второй половины лета
прошлого года. Особи 2-й степени истощенности, вероятно, впервые акти-
визировались после зимовки, так как подобное состояние, за исключе-
- 85 -
нием периода зимнею оцепенения, обычно продолжается не более ме-
сяца. Из самок 3-й степени истощенности часть, по-видимому, была активна
уже в прошлом сезоне и они просто возобновили активность, выйдя из зим-
него оцепенения весной следующего года. Наконец, самки 4-й степени
истощенности, вероятно, перелиняли из нимф, активизировались с начала
второй половины лета и растратили к зимовке большую часть запасных
питательных веществ.
В июне процент недавно активизировавшихся самок заметно умень-
шается (24%). Последнее связано с уменьшением запаса взрослых клещей,
перелинявших в прошлом сезоне. Основную массу в этот период составляют
очень агрессивные самки 3-й степени истощенности (62%). Одновре-
менно наблюдается увеличение числа сильно истощенных особей.
В июле наряду с общим снижением численности клещей почти пол-
ностью исчезают недавно активизировавшиеся самки и половину пойман-
ных клещей составляют особи 4-й степени истощенности.
В конце августа заметно увеличивается количество активных голод-
ных клещей, а среди них особей 2-й степени истощенности (33%). В сен-
тябре последние составляют уже почти половину от общего числа пойман-
ных самок (45%). Они несомненно перелиняли из нимф в конце июля—
начале августа и закончили послелиночное доразвитие при высоких
летних температурах менее чем за месяц. Одновременно в августе—сен-
тябре наблюдается уменьшение числа истощенных особей (до 22%).
Однако отдельные клещи 4-й степени истощенности попадаются даже
в конце сентября, так что вполне возможен их уход на зимовку. Проис-
ходят ли они от нимф, перелинявших в прошлом году, или же перелиняли
во второй половине лета и после активизации растратили большую часть
пищевых резервов — решить трудно, хотя вероятнее последнее. Несом-
ненно лишь, что очень небольшое число подобных особей способно перези-
мовать и возобновить активность в следующем сезоне.
Приведенные наблюдения вскрывают причины летнего снижения и
осеннего подъема численности голодных клещей. Большинство авторов
(Алфеев, 1948; Сердюкова, 1952; Хейсин, 19556) считает, что линька нимф
происходит в основном во второй половине* лета и осенью. Значительное
число клещей 2-й степени истощенности в конце лета и осенью связано с за-
вершением послелиночного доразвития и активизацией части перелиняв-
ших особей в том же сезоне. За их счет происходит осенний подъем числен-
ности. На зимовку уходят как активные, так и не завершившие послели-
ночного доразвития клещи. Основная их масса становится активной сразу
после зимовки. Однако в связи с тем, что часть клещей уходит на зимовку,
не закончив послелиночного доразвития, эта стадия заканчивается уже в
следующем весенне-летнем сезоне. Разновременность ее завершения в связи
со сроками линьки нимф прошлой осенью, разницей в микроклимате мест
развития и другими экологическими факторами обусловливает растяну-
тость активизации клещей до конца июня. К началу июля численность
голодных клещей в природе заметно уменьшается как за счет нахождения
ими прокормителей, так и от естественной гибели от истощения. В июле
обычно встречается максимальное количество особей 4-й степени исто-
щенности. Достигнув этого состояния, клещи довольно быстро погибают.
Тем не менее в связи с растянутостью весенне-летней активизации часть
клещей, перелинявших в прошлом году, доживает до конца сезона актив-
ности следующего года. В результате осенняя популяция половозрелых
Ixodes ricinus состоит из особей, принадлежащих к двум генерациям. В се-
верной части ареала (Карельская АССР) летнего снижения численности
клещей вообще не наблюдается (Хейсин, Бочкарева и Лаврененко, 1955),
а осенняя активизация перелинявших в том же сезоне самцов и самок,
вероятно, отсутствует. Напротив, в южной части ареала (Бабенко, 1958)
- 86 -
взрослые клещи летом встречаются очень редко и во время осеннего подъ-
ема их численности, по-видимому, встречаются только особи, перелиняв-
шие в том же сезоне.
Иную картину мы наблюдаем при анализе активности голодных взрос-
лых /. persulcatus. На всем протяжении ареала они активны весной и в пер-
вой половине лета, а затем очень быстро исчезают. Линька нимф, как и
у /. ricinus, происходит только во второй половине лета и осенью (Хейсин,
Павловская, Малахова и Рыбак, 1955; Бабенко, 1956). Неясными остаются
причины исчезновения клещей в середине лета.
Изучение физиологического возраста самок этого вида показывает,
что в мае все клещи были 2-й (69%) и 3-й (31%) степеней истощенности.
Они перелиняли из нимф во второй половине лета и осенью прошлого года.
Часть из них закончила послелиночное доразвитие уже осенью того же
года, но активизация произошла только после перезимовки. У некоторых
клещей описываемая стадия завершается после зимовки, и активизация
подобных особей растягивается на июнь. Расходование запасных питатель-
ных веществ у I. persulcatus идет быстрее, чем у I. ricinus. В июле 59%
пойманных клещей составляли сильно истощенные особи, а к августу
большинство из не сумевших найти хозяина клещей погибало от истоще-
ния. Переживание голодными клещами этого вида двух сезонов активности
невозможно. Пользуясь предложенной нами методикой, были изучены
изменения возрастного состава имаго I. persulcatus в Карельской АССР,
Красноярском крае и в Пермской обл., и во всех случаях главной
причиной смертности среди голодных клещей в конце сезона актив-
ности было израсходование запаса питательных веществ (Хижинский,
1963; Князева, 1964; Лыков, 1966).
ПИТАНИЕ
Специфическую особенность всех фаз развития иксодовых клещей и
личинок (редко — нимф) некоторых видов аргазид представляет много-
дневное питание на теле позвоночного и поглощение в этот период огром-
ного количества крови и продуктов лизиса тканей, в десятки раз превы-
шающих исходный вес голодного клеща. С момента прикрепления к хо-
зяину и до окончания кровососания на протяжении нескольких суток
клещи ведут эктопаразитический образ жизни, и организм позвоночного
служит для них не только источником пищи, как в случае с кровососу-
щими двукрылыми или другими кратковременно питающимися кровосо-
сами, но и подлинной средой обитания. Переход от свободного существо-
вания к паратизму на одной фазе развития связан с глубокими морфоло-
гическими и физиологическими изменениями в организме клеща, а также
со значительной перестройкой поведенческих реакций, что и определяет
правомерность выделения питания клещей в самостоятельную стадию раз-
вития.
Различные стороны проблемы питания иксодид затрагиваются в весьма
обширной литературе. В большинстве работ вопросы питания, однако, ос-
вещаются лишь попутно при описании биологии видов. Имеющиеся све-
дения поэтому в основном ограничиваются списками хозяев, описанием
мест прикрепления, продолжительности кровососания и отдельными на-
блюдениями о влиянии различных факторов на сроки последнего. С боль-
шей или меньшей детальностью подобный фактический материал и соот-
ветствующая обширная библиография собраны в систематических сводках
и монографиях (Nuttall a. Warburton, 1911, 1915; Robinson, 1926; Cooley
a. Kohls, 1944; Галузо, 1946, 1947, 1948а, 1950, 1953; Павловский, 1948;
Померанцев, 1950; Поспелова-Штром, 1953; Arthur, 1960, 1962; Филип-
- 87 -
нова, 1966). Значительно меньшее число работ посвящено непосредственно
изучению особенностей питания клещей. Данные, накопленные в этой
области, наиболее подробно рассмотрены в обзорах К. Энига и И. Грит-
нера (Enigk u. Grittner, 1953) и Д. Артура (Arthur, 1965). Новая концеп-
ция питания иксодовых клещей как особой стадии развития на теле
хозяина, связанной с интенсивными процессами роста кутикулы, была впер-
вые выдвинута А. Лисом (Lees, 1952) и получила подтверждение и разви-
тие в работах других исследователей (Хейсин и Лаврененко, 1956; Kita-
oka a. Yajima, 1958а, 19586,1958с; Kitaoka, 1962). Нами начиная с 1954 г.
проводилось всестороннее изучение экологических и физиологических
особенностей питания кровососущих клещей, главным образом в связи
с взаимодействием организмов клеща и хозяина, факторов, определяю-
щих продолжительность нахождения на хозяине, и изменений веса и
размеров тела в этот период (Балашов, 1954, 1956а, 1957а, 19586, 19606,
1964а). Материалы этих работ легли в основу данного раздела монографии.
Для экспериментальных исследований были использованы следую-
щие виды клещей, большая часть которых разводилась в лаборатории:
Argas persicus, Alveonasus lahorensis, Ornithodoros papillipes, 0. moubata,
0. tartakovskyi, Ixodes ricinus, I. persulcatus, Ceratixodes putus, Haema-
physalis concinna, H. sulcata, Boophilus calcaratus, Dermacentor pictus,
D. marginatus, Rhipicephalus bursa, R. turanicus, Hyalomma asiaticum,
H. aegyptium, H. anatolicum, H. plumbeum.
Из этого списка видно, что исследованиями были охвачены представи-
тели всех родов иксодовых и аргасовых клещей, встречающихся на тер-
ритории СССР, и главные биологические группы в пределах надсем.
Ixodoidea. Клещи культивировались по общепринятой методике, доста-
точно подробно описанной в литературе (Олсуфьев, 1941; Поспелова-
Штром, 1941, 1953; Enigk u. Grittner, 1953). Для кормления всех фаз раз-
вития иксодовых клещей использовались кролики. Половозрелые клещи,
а также личинки и нимфы двуххозяинных видов питались под наклейкой
на спине, а личинки и нимфы треххозяинных видов — на ушах животных.
В отдельных опытах для кормления служили морские свинки, белые мыши,
белые крысы, ежи, собаки, овцы, коровы, верблюды, степные черепахи и
различные виды ящериц. Для кормления неполовозрелых фаз Alveonasus
lahorensis использовались кролики, птичьи виды аргазид кормились на
курах, а виды рода Ornithodoros главным образом на морских свинках и
белых мышах.
ПРОДОЛЖИТЕЛЬНОСТЬ ПИТАНИЯ
Для имаго, нимф, а также личинок многих видов аргасовых клещей
характерно сравнительно непродолжительное нахождение на теле хозя-
ина, и весь акт кровососания — от прикрепления голодной особи и до от-
падения насосавшегося клеща — занимает от нескольких минут до 1 —
2 час. У нимф младших возрастов время насыщения несколько короче,
чем у нимф старших возрастов и имаго, а у самцов короче, чем у самок.
При лабораторном кормлении партий клещей одного возраста наблю-
даются значительные вариации в сроках питания отдельных особей при
отпадении основной массы в сравнительно сжатые сроки (табл. 12). Боль-
шая часть нимф и имаго изученных видов питались не более 1 часа, но
отдельные клещи оставались прикрепленными к хозяину до 2 час. и более.
В большинстве случаев задержка была вызвана ненормальными условиями
для приема крови из-за образования отека и других нарушений в местах
прикрепления больших партий клещей. Как правило, особи, заканчиваю-
щие питание последними, отпадали не полностью насосавшимися.
В опытах В. Н. Кусова (1962) с кормлением самок Ornithodoros tarta-
kovskyi на белых крысах отдельные особи задерживались даже от 8 час.
- 88 -
Таблица 12
Длительность питания клещей сем. Argasidae (в мин.)
Вид клеща Хозяин Личинки Нимфы Самцы Самки
Alveonasus laho- rensis. Кролики для неполовозре- лых фаз и морские свин- ки для имаго. От присасывания личи- нок до отпадения нимф III 22—35 дней. 14-50 (24) 32-70 (60)
Argas persicus. Куры. 5—9 дней. 20-40 20-30 30-60
Ornithodoros pa- pillipes. Морские свин- ки. 10-150 (25) 12-180 (40) 10-50 (25) 15-120 (45)
0. tartakovskyi. Белые мыши,- 5-180 (25) 10-240 (45) 15-120(35) 20-240 (50)
Примечая и[е.|23десь и в табл. 13—16 в скобках даются средние сроки кровосссания.
до 2 суток, но это уже следует считать редким исключением. Многочасовое
прикрепление к хозяину было отмечено и для личинок О. alactagalis
(Филиппова, 1966).
У значительной части видов рода Ornithodoros личиночное питание
продолжается 20—60 мин. при задержках до нескольких часов. В то же
время у представителей подродов Alectorobius и Reticulinasus (род Ornitho-
doros) и всех видов рода Argas питание личинок занимает от 3 до 11 дней
(Филиппова, 1966). У Alveonasus lahorensis, Argas brumpti и видов рода
Otobius многодневное питание вместе со способностью к линьке на теле
хозяина свойственно не только личиночной, но и нимфальной фазам.
Так, у Alveonasus lahorensis от прикрепления голодных личинок и до
отпадения напитавшихся нимф III проходит 22—35 дней, и все это время
клещи остаются прикрепленными к хозяину (Кусов, 1949; Поспелова-
Штром, 1953). Напротив, питание взрослых клещей занимает не более
1—2 час.
Сроки насыщения до некоторой степени определяются окружающей
температурой. По наблюдениям И. В. Неуймина (1954), температура тела
питающихся нимф и имаго Ornithodoros papillipes была промежуточной
между температурами воздуха и поверхности кожи хозяина. Наиболее
быстрое насыщение (20—40 мин.) происходило при температуре тела
клещей в 28—34°, при 22—23° кровососание резко замедлялось.
Скорость насыщения может меняться в зависимости от физиологиче-
ского состояния клещей. В наших опытах очень сильно истощенные или,
наоборот, сравнительно недавно напитавшиеся клещи наряду с меньшим
процентом присасывания к хозяину всегда питались дольше, чем голодные,
но не истощенные особи. Сроки кровососания также зависели от видовой
принадлежности хозяина и мест прикрепления на теле последнего. На
участках тела с недостаточным кровоснабжением питание всегда несколько
замедлялось.
Для всех фаз развития иксодовых клещей типично многодневное
кровососание при однократном приеме крови на каждой фазе. Наши и
литературные данные о сроках питания наиболее распространенных видов
фауны СССР сведены в табл. 13—17. В большинстве случаев личинки опи-
сываемого семейства питаются 3—5 суток, нимфы родов Ixodes и Rhi-
picephalus — 3—4 и родов Haemaphysalts, Dermacentor и Hyalomma —
5—8 суток. Самки большинства видов находятся на хозяине 6—12 суток.
Приведенные сроки наиболее обычны и соответствуют нормальному ходу
кровососания. Однако из сводных таблиц видно, что часто наблюдаются
заметные отклонения — как индивидуальные, так и видовые.
- .89 -
Таблица 13
Длительность питания (в сутках) клещей родов Ixodes и Ceratixodes
(по литературным и нашим данным)
Вид клеща Хозяин Личинки Нимфы Самки Автор
Ixodes ricinus. Овцы, ежи. Кролики, мыши, ежи. Коровы, кро- лики. 3-5 2-4 4-7 (5) 2-5 7—11 (8—9) 6-10 . Наши данные.
I. persul- catus. Кролики, ежи. Мелкие млеко- питающие и птицы. Крупный ро- гатый скот. 2.5-5 3-4 3-6 4-6 6-10 7-9 Наши данные. Лутта, Хей- син и Шуль- ман, 1959.
I. laguri. Белые 1 мыши. | 3-7 (4) 3-8 4-7 (5) 6-12 7-12 9-17 Шевченко, 1956. Пионтковская и Жмаева, 1962.
I. trianguli- ceps. Полевки. 4—7 4-7 7-8 Бобровских, 1965.
I. plumbeus. Береговая ласточка. 3-5 4 5-6 Глащинская- Бабенко, 1956.
Ceratixodes putus. Птенцы чистика. 4-6 4-8 6-8 Наши данные.
Таблица 14
Длительность питания (в сутках) клещей рода Haemaphysalis
(по литературным и нашим данным)
Вид клеща Хозяин Личинки Нимфы Самки Автор
Haemaphy- salis punctata. Н. concinna. | Н. otophila. < ( Н. warbur- toni. Н. sulcata. | Н. inermis. | На разных хозяевах. Кролики. Олень. Морская свинка. Различные млекопитаю- щие. На разных хозяевах. На разных хозяевах. Овцы, козы, крупный рога- тый скот. Различные грызуны. Зеленая ящерица. Кролики. Крысы, мыши, ящерицы. Ежи. 4-11 4-7 3.5 2 2-10 4-18 6-13(7-9) 3-17 1.5—2 часа 5-13 4-7 5 2 4-8 5—14 12-19 3-18 1—2 часа 10-12 7—12 10-20 6 8 15—17 5-11 7-13 10-13 7-8 Поспелова-Штром и Петрова-Пионт- ковская, 1949а. Наши данные. 1 Шпрингольц- | Шмидт, 1935. Джапаридзе, 1947. Поспелова-Штром и Петрова-Пионт- ковская, 1949а. Поспелова-Штром и Петрова-Пионт- ковская, 1949а. Сартбаев, 1960. | Наши данные. ) Nuttal а. > Warburton, J 1915.
- 90 -
Таблица 15
Длительность питания (в сутках) клещей рода Dermacentor
(по литературным и нашим данным)
Вид клеща Хозяин Личинки Нимфы Самки Автор
Dermacentor pictus. ( D. margi- natus. । I D. silvarum. D. nuttalli. D. pavlov- | skyi. Мелкие гры- зуны, ежи. Морские свин- ки, кролики. Грызуны, ежи. Коровы. Коровы. Кролики, мыши, ежи. Кролики. Кролики, мор- ские свинки. Суслики, белые мыши. Коровы. Кролики. Кролики, белые мыши, суслики. Коровы, овцы, козы. 2.5-5.5 2.7 (3-4) 2—3 2-4 4-5 2.5-3 3.5 3-8 о- СО 00 ll^lllll 11^1 1 1 ю со ю * ю 7-12 6-10(7) 6-11 (7) 8-12 7-10 6-12 8-13 11.6 6-29 1 Олсуфьев, f 1953. | Наши данные. Галузо, 1948. Покровская, 1953. Наши данные. Шпрингольц- Шмидт, 1935. 1 Пионтковская, | 1951. Меринов, 1964. Гребенюк, 1966.
Таблица 16
Длительность питания (в сутках) клещей рода Rhipicephalus
(по литературным и нашим данным)
Вид клеща Хозяин Личинки Нимфы Самки Автор
Rhipicepha- lus bursa (двуххо- зяинный). Коровы, овцы. Овцы, коровы. Кролики. 8 7-10 3-4 10 8-14 4-6 7-8 5—12 (6—8) 7—10 Nuttall, 1913. Курчатов, 1938. Наши данные.
1 R. sangui- neus. f Лабораторные животные. Ежи. Крысята. Морские свинки. Кролики. 3-10 (5-6) 2-5 4-11 (5-6) 4-8 4-10 7-15 7-15 ] Петрова- } Пионтковская, J 1947. । Srivastava \ a. Varma, 1964.
R. turani- cus. Лабораторные животные, ежи. Кролики. 2-Ц (3-4) 2-6 (4) 7-14 3-8(6) 6-16 (8-11) 6-10 Петрова-Пионт- ковская, 1947. Наши данные.
R. rossicus. Кролики. 3-4 3-5 7—9 Наши данные.
R. pumilio. Кролики. 2.5-4 3-5 7—11 Наши данные.
Малый суслик. 3-5 3-6 5-8 Кондрашкина,
R. schulzei. * Малый суслик. 2-3 3-4 4—6 1951. Нельзина и Да- нилова, 1960.
- 91 -
Таблица 17
Длительность питания (в сутках) клещей рода Hyalomma
(по литературным и нашим данным)
Вид клеща Хозяин Личинки Нимфы Самки Автор
Кролики 7-8 9-10 6 Поспел ова-Штром
Н yalomma asiati- и морские и Петрова-Пионт-
сит (треххо- свинки. ковская, 19496.
зяинный). Коровы. 3-4 5-6 7—10 Вернадская, 1938.
Кролики и ежи. 3-5 6-9 7—12 Наши данные.
Н. anatolicum Кролики. Коровы. 6 4 8-12 «Потоцкий, 1945.
(трех- и двух- 2-4 4.5-6 — Сердюкова, 1946.
хозяинный). Кролики. 3.5-5 3.5-6 7-9 Наши данные.
Греческие 6-15 8 6-8 Nuttall, 1913.
Н. aegyptium (треххозяинный). черепахи. Степные черепахи. То же. 5-15 7-17 — Оганджанян, 1950.
4-20 7-24 9-35 Наши данные.
Кролики. 8-10 12 — «Потоцкий, 1945.
Н. detritum (двуххозяинный). Телята. 6-8 12-20 — Галузо, 1947.
Кролики и морские 2£ 1* 8 Поспел ова-Штром и Петрова-Пионт-
свинки. ковская, 19496.
Н. scupense Бычки. 6-7 3-6 — Марков, Абрамов
(однохозяинный). и Дзасохов, 1940.
Н. dromedarii (двух- и трех- хозяинный) . Ежи. Кролики. 4-10 6 до 20 7—8 5-8 1 Поспелова- J Штром, 1935.
Коровы. 4-9 5-7 7-13 Delpy a. Gouchey, 1937.
Кролики, мор- 22 7—27 Поспелова-Штром
Н. plumbeum (двуххозяинный). ские свинки. Кролики. 12- 27 * 10-14 и Петрова-Пионт- ковская, 19496. Ганиев, 1956.
» 3-6 5-9 7—12 Наши данные.
Примечание. Цифры, отмеченные звездочкой (*), означают средние суммарные срока
личиночного питания, линьки и нимфального питания.
Прежде всего следует отметить необычайно быстрое кровососание у ли-
чинок и нимф Haemaphysalis inermis. Они нормально насасываются и от-
падают через 1—2 часа после прикрепления (Nuttall a. Warburton, 1915).
По продолжительности питания они резко выделяются среди иксодид и
скорее напоминают аргасовых клещей. У самок этого вида кровососание
протекает нормально, и они отпадают на 7—8-е сутки.
У двух- и однохозяинных видов продолжительность питания отдельных
фаз развития та же, что и у треххозяинных клещей. Так, по нашим наблю-
дениям, при кормлении на телятах личинки Boophilus calcaratus питались
3.5—6, нимфы — 5—9 и самки — 6—10 суток. Близкие сроки приводятся
в табл. 16 и 17 для двуххозяинных клещей Rhipicephalus bursa, Hyalomma
plumbeum, H. anatolicum. Завышенные сроки кровососания двух- и одно-
хозяинных видов, приводящиеся в работах многих исследователей, объ-
ясняются трудностью точного определения моментов начала и прекраще-
ния питания, ввиду чего к последнему прибавляется и часть времени
линьки.
Заметные различия существуют лишь в продолжительности сроков
отпадения напитавшихся клещей и периода послелиночного доразвития.
Последний у большинства одно- и двуххозяинных видов сведен до мини-
- 92 -
мума. В наших опытах нимфы начинали кровососание на 1—3 сутки после
линьки. Фактически эта стадия развития сливается у них с подготови-
тельным периодом собственно кровососания, а четко отграниченный пе-
риод активности вообще отсутствует. Исключение составляют лишь самки
однохозяинного клеща Н. scupense, длительное время ползающие по телу
хозяина (Марков, Абрамов, Дзасохов, 1940). Однако этот вид можно счи-
тать однохозяинным вообще лишь с определенными оговорками.
Сроки отпадения напитавшихся нимф двуххозяинных видов или же
самок однохозяинных, наоборот, очень сильно растянуты. У треххозяин-
ных видов период отпадения окончивших питание личинок и нимф обычно
не превышает 3—7 суток. У двуххозяинного клеща Н. plumbeum он нор-
мально продолжается 10—16, а иногда затягивается до 20—25 суток;
у Rhipicephalus bursa он составляет 11 суток. Отпадение напитавшихся
самок Boophilus calcaratus идет не менее 2—3 недель. У Hyalomma ana-
tolicum при треххозяинном цикле насосавшиеся нимфы отпали в течение 6,
а при двуххозяинном уже за 12 суток. По литературным данным, отпаде-
ние насосавшихся нимф двуххозяинного Н. detritum продолжалось 21
(Поспелова-Штром и Петрова-Пионтковская, 19496), а самок Boophilus
microplus — 15—16 дней (Hitchcock, 1955b). Индивидуальные отклонения
в сроках питания в большинстве случаев связаны с удлинением последних.
Так, сильное замедление или даже полная приостановка питания харак-
терны для неоплодотворенных самок. Это явление подробно рассматри-
вается в разделе «Размножение» (см. стр. 251—253).
Даже в лабораторных условиях для многих видов иксодид отмечено
влияние сезона кормления на быстроту присасывания и, в несколько мень-
шей степени, на продолжительность кровососания. Как правило, при про-
чих равных условиях клещи охотнее всего питаются во время их массовой
активности в природе. Так, самки Dermacentor pictus, D. marginatus,
Rhipicephalus turanicus, Hyalomma asiaticum, H. anatolicum и Я. plumbeum
в весенние месяцы обычно присасывались к хозяину в первые сутки,
а в осенне-зимний период прикрепление растягивалось до 2—3 суток.
Кровососание в осенне-зимний период на 1—2, а у Dermacentor pictus
и D. marginatus даже на 3—4 суток дольше, чем весной. Задержка часто
бывает связана с началом питания лишь через 1—3 дня после прикрепле-
ния. При разведении клещей на протяжении нескольких поколений
в лабораторных условиях описанные различия выражены слабее и могут
полностью исчезнуть. Напротив, у самок Ixodes ricinus, нападающих
в природе весною и осенью, сроки кровососания в любые сезоны года при-
мерно одинаковы.
У некоторых видов иксодид отмечена зимовка на хозяевах. Клещи
с осени и до весеннего потепления остаются прикрепленными, но не пи-
таются. Особенно распространено это явление в роде Dermacentor. На
сельскохозяйственных животных в осенне-зимний период неоднократно
находили взрослых D. pictus, D. marginatus (Алфеев, 1948; Дюсембаев,
1963), D. silvarum (Касьянов, 1947) и D. nuttalli (Пионтковская, 1951).
Зимовка на крупном рогатом скоте представляет составную часть жизнен-
ного цикла Hyalomma scupense (Галузо, 1947). Отсутствие питания у кле-
щей в зимний период нельзя объяснить только действием низкой темпера-
туры воздуха, так как в весенний период питание иногда наблюдается и
при более низких температурах.
Скорость питания иксодовых клещей, как и других процессов, свя-
занных с ростом и развитием организма, в значительной степени зависит
от температуры окружающей среды. При этом, в отличие от аргасовых
клещей, температура не только определяет скорость кровососания, но
главным образом влияет на сложные процессы развития, происходящие
на стадии питания, и поэтому ее воздействие более сложно и многосто-
- 93 -
ронне. Как уже отмечалось, температура тела клеща зависит от темпе-
ратур тела хозяина и воздуха. У млекопитающих в большинстве слу-
чаев изменения температуры внешней среды мало влияют на темпера-
туру тела. Колебания температуры воздуха в пределах от 5 до 40°
могут изменить температуру тела млекопитающего лишь на 1.0—1.5°
Сравнительно постоянна у них и температура покровов, особенно в
участках, покрытых густой шерстью, или же в паховых, локтевых и
других складках. Для каждого вида существуют закономерные разли-
чия в температурах отдельных участков кожи. Обычно они не пре-
вышают 3—6°, колеблясь в пределах 26—32° (Слоним, 1952). Клещ,
прикрепившийся к млекопитающему или птице, находится в условиях
довольно постоянного микроклимата покровов хозяина и соответственно
этому развивается на нем с постоянной скоростью. Так, в наших опытах
при температурах воздуха 15, 20, 25 и 30° продолжительность питания
личинок Ixodes ricinus на белых мышах была одной и той же. Насосав-
шиеся личинки всегда отпадали в основной массе на 3—4 сутки (табл. 18).
Таблица 18
Длительность питания личинок и нимф Ixodes ricinus
па белых мышах и прытких ящерицах
при различных температурах воздуха
(количество отпавших напитавшихся клещей)
Белые мыши
Прыткие ящерицы
Время
крово-
соса-
ния,
в
сутках
личинки
личинки
нимфы
15° 20°
30°
30°
20° 25°
30°
абс.
абс.
абс.
абс,
абс.
абс. %
абс. %
абс.
% абс. %
абс. %
2
3
4
5
6
7
8
9
10
И
12
13
14
15
20 13 26 14
120 77 156 83
16 10 6 3
50 38
64 48
18 14
24 16
58 38
0
0
0
0
0
0
4
22
86
64
8
0
0
о
о
о
о
2
12
47
35
0
0
0
0
34
120
72
62
18
2
0
о
о
о
и
39
23
20
6
1
0
4
126
16
2
0
3
85
И
1
0
0
о
о
о
о
о
о
о.
4
52
32
12
8
0
0
0
0
0
0
0
0
0
4
0
0
0
0
4
28
48
16
8
0
0
0
0
4
27
46
15
8
0
0
20
60
16
8
0
0
19
58
15
8
48
29
И
8
%
7 о
В определенных условиях при сильном понижении окружающей тем-
пературы, воздействии прямой солнечной радиации или же понижении
температуры тела хозяина микроклимат прилежащего к покровам слоя
воздуха также испытывает закономерные отклонения. С ними, в частности,
вероятно, связаны наблюдавшиеся нами в условиях Ленинградской обл.
случаи удлинения на 3—4 суток кровососания самок I. ricinus в конце
сентября. А. Каррик и В. Буллоуф (Carrik a. Bullough, 1940) наблюдали,
что в период зимней спячки ежей I. ricinus питались на них несколько
дольше, чем на активных животных. Они также склонны объяснять это
замедление понижением температуры тела спящих ежей. Сходное удли-
нение периода паразитирования на скоте отмечено и для клеща Boophilus
caudatus в зимние месяцы в Японии (Kitaoka a. Yajima, 1958с). Напротив,
температура тела рептилий в значительной степени зависит от внешних
- 94 -
условий и в .первую очередь от температуры окружающего воздуха. Со-
ответственно и температура тела прикрепившихся к ним клещей находится
в непосредственной зависимости от температуры воздуха. Проведенные
опыты подтвердили прямую связь продолжительности кровососания
иксодид на рептилиях с температурным режимом окружения. При 20°
личинки Ixodes ricinus питались 8—12, а нимфы 11—15 суток, при 25°
соответственно 6—11 и 6—10 и при 30° — 3—6 и 4—7 суток (табл. 18).
Аналогичные данные получены в тех же условиях для Haemaphysalis
sulcata (табл. 19). У этого вида кровососание личинок и нимф при 20°
продолжалось в 2—3 раза дольше, чем при 30° Заметное удлинение
сроков кровососания для всех фаз отмечено при понижении температуры
и у Hyalomma aegyptium, питавшегося на степной Черепахе.
Значительная часть треххозяинных видов с пастбищным типом пара-
зитизма имеет широкий круг естественных хозяев, включающих млекопи-
тающих, птиц и в ряде случаев рептилий. В опытах с кормлением относя-
щихся к этой биологической группе клещей Ixodes ricinus, Dermacentor
pictus, Rhipicephalus turanicus и Hyalomma asiaticum продолжительность
питания личинок и нимф на кроликах, морских свинках, белых мышах и
ежах, а самок — на кроликах, морских свинках, ежах, собаках, овцах,
коровах и верблюдах при прочих равных условиях варьировала в преде-
лах 1—3 суток (Балашов, 19586). Сходные данные приводятся для Der-
macentor pictus (Олсуфьев, 1963), Rhipicephalus sanguineus (Srivastava
a. Varma, 1964) и D. variabilis (Sonenshine a. Atwood, 1967).
У норовых видов иксодид с более узкой пищевой специализацией
кормление на необычных хозяевах в ряде случаев вызывает удлинение
времени нахождения на позвоночном и другие нарушения питания. Так,
по наблюдениям Л. В. Глащинской-Бабенко (1956), клещ Ixodes plum-
beus нормально развивается только на береговых ласточках. Сроки пита-
ния личинок на ласточках составляют 3—5 суток, тогда как на мышах —
12 и на чечетках 5—30 суток. Напротив, у обитателей нор грызунов
7. crenulatus, I. laguri и Rhipicephalus schulzei в связи с частым посещением
Таблица 19
Длительность питания личинок и нимф Haemaphysalis sulcata
на зеленых ящерицах при разных температурах воздуха
(количество отпавших напитавшихся клещей)
Время крово- соса- Личинки Нимфы
20° 25° 30° 20° 25° 30°
НИЯ, в сутках абс. % абс. % абс. % абс. % абс. абс. %
3 0 0 0 0 6 3 0 0 0 0 48 25
4 0 0 0 0 110 51 0 0 0 0 128 67
5 0 0 0 0 97 45 0 0 0 0 16 8
6 0 0 0 0 3 1 0 0 0 0 — —
7 0 0 16 9 — — 0 0 0 0 — —
8 0 0 50 28 — — 0 0 8 5 — —
9 6 3 64 35 — — 0 0 37 25 — —
10 22 13 40 22 — — 20 13 91 62 — —
И 34 20 10 6 — — 28 18 12 8 — —
12 26 15 — — — — 0 0 — — — —
13 28 18 — — — — 68 45 — — — —
14 24 14 — — — — 20 13 — — — —
15 20 12 — — — — 0 0 — — — —
16 4 2 — — — — 4 3 — — — —
17 4 2 — — — — 12 .8 — — — —
18 2 1 — — — — — — — — — —
- 95 -
их биотопов различными видами позвоночных пищевая специализация
выражена значительно слабее и питание протекает нормально на мно-
гих необычных хозяевах (Кошечкина, 1950; Кондрашкина, 1961; Жмаева,
1953; Нельзина и Данилова, 1960).
У двух- и особенно однохозяинных видов возможности в выборе про-
кормителей значительно уже и, исключая такой вид, как Hyalomma
plumbeum, они нормально развиваются только на копытных. Многие из
двуххозяинных видов в лабораторных условиях могут питаться на кроли-
ках и других видах лабораторных грызунов (Я. anatolicum, Rhipicephalus
bursa). Последнее, однако, наряду с другими нарушениями развития
может вызвать и некоторое удлинение сроков питания. Еще большие на-
рушения в развитии при питании на грызунах наблюдаются у Boophilus
calcaratus. В немногих случаях успешного прикрепления к кроликам
личинки питались 6—8, нимфы 8—11 и самки 10—19 суток, т. е. в 1.5 —
2 раза дольше, чем на телятах. При этом следует отметить, что немногие
закончившие питание и отпавшие самки весили в 2—3 раза меньше нор-
мальных.
Во многих случаях удлинение сроков питания и другие ненормаль-
ности в развитии бывают вызваны прикреплением клещей к неподходя-
щим местам на теле позвоночного (ороговевшие участки покровов, недо-
статочное кровоснабжение, густой шерстный покров и обильные выделения
жиропота), патологическими изменениями в участках с присосавшимися
клещами и защитными реакциями организма хозяина.
У иксодовых клещей отмечено также своеобразное явление задержки
их в напитавшемся состоянии на хозяине. Они остаются прикрепленными и
не отпадают, хотя кровососание уже давно прекратилось. За исключением
отдельных патологических случаев, эта особенность зависит от наличия
у ряда видов четкого суточного ритма отпадения. Благодаря ему клещи
отваливаются преимущественно в местах, пригодных для их дальнейшего
развития. В средней полосе европейской части СССР в существующих ти-
пах помещений для скота размножение клещей невозможно, и у них вы-
работался ряд приспособлений, обеспечивающих отпадение на пастбище.
По нашим наблюдениям в Ленинградской обл. (Балашов, 1954), напитав-
шиеся самки Ixodes persulcatus отпадают при дневном выпасе стада в ут-
ренние часы, а при ночном — в вечерние. При переходе от дневного вы-
паса к ночному и обратно происходит быстрая перестройка ритма, так
что клещи всегда отпадают вне хлева. Подобным же образом ведут себя
и напитавшиеся самки I. ricinus (Хейсин и Лаврененко, 1956), Boo-
philus margaropus (Hitchcock, 1955b) и Haemaphysalis bispinosa (Kitaoka,
1962), у которых отпадение с хозяина приурочено ко времени выпаса скота.
Напротив, в Средней Азии, где очаги массового размножения Hyalomma
anatolicum создаются внутри примитивных хлевов и загонов, массовое
отпадение нимф и самок этого вида наблюдается в ночные часы при на-
хождении скота в помещениях (Сердюкова, 1945).
При круглосуточном выпасе скота четкий суточный ритм отпадения
может отсутствовать. В Ленинградской обл. при лагерном содержании
коров напитавшиеся самки Ixodes ricinus отпадали круглые сутки. Более
интенсивное отпадение обычно происходило при передвижении скота.
В Туркмении в апреле и в мае при круглосуточной пастьбе овец насосав-
шиеся самки Rhipicephalus turanicus, напротив, отваливались преимуще-
ственно ночью и ранним утром, до наступления жары. Здесь наличие
определенных часов массового отпадения, видимо, предотвращает гибель
самок от высыхания на раскаленной почве днем.
Суточный ритм отпадения напитавшихся клещей связан с приурочен-
ностью периода наиболее интенсивного кровососания к последним 12—
16 час. нахождения на хозяине. Так, у самок Ixodes ricinus (Хейсин и
96 -
Лаврененко/1956) и Haemaphysalis bispinosa (Kitaoka, 1962) последняя, но
наибольшая по объему порция крови поглощалась при нормальном днев-
ном выпасе скота в ночные часы перед отпадением. В результате ко
времени утреннего выгона скота на животных были только полностью
напитавшиеся особи или же самки, которым для окончания питания тре-
бовались одни сутки и более. Напротив, у особей, достигших последней
стадии питания, во время выпаса хозяев в день накануне отпадения ско-
рость кровососания даже несколько замедлялась, что уменьшало шансы
случайного отрыва частично напитавшихся клещей.
Сигналами к отпадению полностью напитавшихся особей могут слу-
жить изменения факторов внешней среды или физиологического состояния
хозяина. В случае с нимфами Hyalomma detritum (Галузо и Львова, 1940)
или самками Haemaphysalis bispinosa (Kitaoka, 1962) отпадение стимули-
ровалось освещением клещей солнцем или же просто воздействием днев-
ного света после выхода животных из слабо освещенных помещений.
У клещей, развивающихся в норах, — Н. leporis palustris (Nuttall a. War-
burton, 1915), Ixodes plumbeus и внутри помещений для скота — Hya-
lomma anatolicum функции подобного раздражителя, напротив, выполняет
наступление темноты. Ixodes persulcatus и 7. ricinus, судя по быстроте пе-
рехода от дневного к ночному ритму отпадения, возможно, реагируют на
переход хозяев от состояния покоя к интенсивной двигательной активности
во время выпаса (Балашов, 1954; Хейсин и Лаврененко, 1956). Подтверж-
дением последнему служат случаи многодневной задержки напитавшихся
особей.
При отсутствии необходимого стимула напитавшиеся клещи могут
держаться на хозяине несколько суток. Например, весной 1954 г. в Оре-
дежском районе Ленинградской обл. нам пришлось наблюдать необычную
задержку насосавшихся самок I. ricinus на коровах. В результате резкого
похолодания и снегопада коровы, успевшие до этого набрать значитель-
ное количество клещей, не выгонялись на пастбище двое суток. Все это
время полностью напитавшиеся самки не отпадали, активно удерживаясь
в местах прикрепления. После же выгона стада в поле на третьи сутки
они сразу же отваливались.
ВЕС НАПИТАВШИХСЯ КЛЕЩЕЙ
И КОЛИЧЕСТВО ПОГЛОЩЕННОЙ КРОВИ
За короткое время питания вес аргасовых клещей увеличивается
в 5—12 раз целиком за счет поглощенной крови хозяина. С каждой после-
дующей линькой относительный объем принимаемой крови обычно умень-
шается и достигает минимальных значений у самцов (табл. 34). Особенно
большое количество крови высасывают личинки Argas persicus, Alveonasus
lahorensis, Ornithodoros coniceps и других видов с многодневным питанием.
Вес их тела увеличивается в 15—20 раз, фактический же вес поглощенной
крови значительно больше, но часть ее переваривается еще во время пита-
ния. Подробные данные о количестве крови, поглощаемой отдельными ви-
дами подсем. Ornithodorinae фауны СССР, приводятся в сводке М. В. По-
спеловой-Штром (1953). В целом в этом отношении большинство аргасовых
клещей сходно с такими гнездово-норовыми кровососами, как клопы-
триатомиды, постельный клоп и некоторыми из наиболее специализирован-
ных облигатных гематофагов среди гамазовых клещей (роды Dermanys-
sus, Ornithonyssus, Sauronyssus, Ophionyssus), вес которых при крово-
сосании увеличивается от 2 до 10 раз.
За время кровососания у иксодовых клещей происходит необычайно
сильное увеличение размеров тела, связанное с поглощением огромных
количеств крови. В большинстве случаев насосавшиеся хамки крупных
7 Ю. С. Балашов — 97 —
видов этого семейства весят 600—1200 мг (роды Hyalomma и АтЫуотцга),
а мелких — 200—600 мг (роды Ixodes, Haemaphysalis, Rhipicephalus)
и лишь у немногих норовых видов (Ixodes laguri, I. plumbeus) — меньше
100 мг, тогда как голодные особи весят, в зависимости от видовой принад-
лежности, от 2—3 до 10—15 мг. Подобные абсолютные показатели увели-
чения в весе во время питания во много раз превышают аналогичные ве-
личины для других групп кровососущих членистоногих. Разница в весе
голодных и напитавшихся иксодовых клещей не отражает фактического
веса крови, поглощенной во время питания, так как значительная ее
часть успевает перевариться и усвоиться еще на стадии питания и весьма
значительное количество прогоняется через кишечник в мало измененном
виде и выделяется с фекалиями, когда клещи еще находятся на хозяине.
Точный объем высасываемой крови был известен только для самок 4 видов
(Dermacentor andersoni, Ixodes ricinus, Haemaphysalis bispinosa, Boophi-
lus microplus), причем он в несколько раз превышал вес полностью напи-
тавшихся особей (Jellison a. Kohls, 1938; Heath, 1951; Kitaoka, 1961).
По разнице содержания железа в организме голодных и напитавшихся
клещей 5 видов (Ixodes persulcatus, Haemaphysalis punctata, Dermacentor
pictus, Rhipicephalus turanicus, Hyalomma asiaticum), а также в выделен-
ных ими за время питания фекалиях нами был рассчитан объем крови,
поглощаемый при личиночном, нимфальном и имагинальном питании
(табл. 20—22; Балашов, 1964а).
Содержание железа в организме полностью напитавшегося клеща и
его фекалиях, за вычетом его содержания в голодной особи, служит объ-
ективным показателем всей массы поглощенной во время питания крови,
так что можно считать, что практически почти все железо поступает в ор-
ганизм клеща извне, с кровью хозяина. Незначительная концентрация
железа в поглощенной клещом лимфе и лизированных тканях существенно
не меняет полученных результатов. На основании расчетов содержания
железа оказалось, что личинки выпивают крови в 6.5—10 раз больше,
чем они весят по отпадении; у нимф это отношение составляет 4—6 и
у самок 3—7.5 (табл. 20—22). Однако из огромной массы полученных кле-
щом пищевых материалов значительная часть не используется организмом.
Таблица 20
Количество крови, поглощаемой личинками иксодовых клещей
при питании на кролике
Ixodes persul- catus Haema- physalis pun- ctata Derma- centor pictus R hi pice- phalus turanicus Hyalomma asiaticum
Средний вес одной личинки, мг: голодная 0.034 0.028 0.023 0.025 0.037
напитавшаяся 0.431 U. 456 0.385 0.269 0.595
Содержание железа в одной ли- чинке, мг: голодная 0.000024 0.000019 0.000015 0.000018 0.000021
напитавшаяся 0.000332 0.000525 0.000421 0.000250 0.000690
фекалии 0.000719 0.000815 0.001042 0.000415 0.001055
Содержание железа в 1 мл кро- ви кролика, мг 0.392 0.411 0.405 0.389 0.374
Объем крови, эквивалентный со- держанию железа, мкл: в напитавшемся клеще 0.785 1.207 1.002 0.596 1.789
в фекалиях суммарный 1.834 1.983 2.572 1.067 2.821
2.619 3.190 3.574 1.663 4.610
98 -
Таблица 21
Количество крови, поглощаемой нимфами иксодовых клещей
при питании на кролике
Ixodes persul- catus Haema- physalis punctata Derma- centor pictus Rhipice- pha lus turanicus Hyalomm a asiaticum
Средний вес одной нимфы, мг:
голодная 0.21 0.15 0.12 0.10 0.24
напитавшаяся 4Т19_ 3.60 12.10 6.05 22.51
Содержание железа в одной нимфе, мг: голодная 0.00029 0.00020 0.00017 0.00015 0.00034
напитавшаяся 0.00360 0.00357 0.00873 0.00466 0.02325
фекалии 0.00299 0.00292 0.01451 0.00375 0.01699
Содержание железа в 1 мл кро- 0.402 0.362
ви кролика, мг 0.398 0.421 0.371
Объем крови, эквивалентный со- держанию железа, мкл: в напитавшемся клеще 8.327 8.001 23.081 11.229 63.112
в фекалиях суммарный 7.534 6.924 39.102 9.322 46.821
15.86JL 14.925 62.183_ 20.551 119.933
Таблица 22
Количество крови, поглощаемой самками иксодовых клещей
при питании на кроликах и бычках
Ixo des persul - cat us Haema- physalis punctata Derma- centor pictus Rhipice- phalus turanicus Hyalomma asiaticum
Средний вес одной самки, мг: голодная 2.2 3.0 8.2 3.5 14.2
напитавшаяся 262.4 186.5 510.5 291.3 1480.6
Содержание железа в одной самке, мг: голодная 0.0005 0.0007 0.0017 0.0011 0.0059
напитавшаяся 0.1985 0.1486 0.6278 0.3121 1.3008
фекалии 0.0391 0.1479 0.9142 0.2091 1.0253
Содержание железа в 1 мл кро- ви хозяина, мг: бычка 0.324
кролика — 0.411 0.421 0.395 0.262
Объем крови, эквивалентный со- держанию железа, мкл: в насосавшемся клеще 612.3 406.3 1486.2 786.5 4943.6
в фекалиях 120.5 359.2 2171.0 529.2 3912.5
суммарный 732.8 865.5 3657.2 1315.7 8856.1
Для иксодовых клещей характерен исключительно интенсивный «про-
гон» крови и продуктов ее переваривания через пищеварительный тракт
на стадии питания. Вес фекалий, выделенных во время питания, особенно
у Dermacentor pictus, может превышать вес тела насосавшегося клеща.
Ни у какой другой группы кровососущих членистоногих, исключая, может
быть, блох, мы не наблюдаем подобной картины. У нимф и самок боль-
шинства видов до 50% железа крови хозяина находится в фекалиях, а у ли-
чинок даже до 75%. Только самки Ixodes persulcatus составляют исклю-
чение, содержание железа в их фекалиях около 20%.
- 99 -
Железо, выявляемое в фекалиях, имеет двойственное происхождение.
Часть его связана с основным компонентом непереваренной крови —
гемоглобином, а другая — с конечным продуктом переваривания по-
следнего — гематином. Первая отражает интенсивность прогона мало
измененной крови, а вторая — эффективность процессов пищеварения на
стадии питания. К сожалению, мы не располагаем возможностями диф-
ференцированного определения концентрации гемоглобина и гематина,
и наши данные о соотношении между двумя указанными компонентами
имеют чисто качественный характер.
Выделение фекальных масс наблюдается с самого начала питания,
причем они состоят как из белых крупинок гуанина, формирующихся
в мальпигиевых сосудах и представляющих конечный продукт азотистого
обмена, так и из содержимого средней кишки. Смешение этих двух компо-
нентов происходит в ректальном пузыре. Окраска фекалиев меняется от
желтоватой или почти белой в первые 1—3 дня после прикрепления у са-
мок и первые сутки или даже часы у личинок и нимф (абсолютное преоб-
ладание гуанина) до красно-коричневой или почти чисто красной в после-
дующие дни. Интенсивность дефекации очень непостоянна, но, как правило,
она увеличивается с начала прикрепления и до середины периода роста,
затем держится несколько дней на одном высоком уровне и резко падает
в последние сутки.
У Rhipicephalus turanicus и Hyalomma asiaticum фекалии выделяются
в виде относительно сухих агломератов мелких частиц, которые по высы-
хании становятся пылевидными. У Ixodes persulcatus, Haemaphysalis
punctata и особенно у Dermacentor pictus фекалии жидкой консистенции
и застывают на воздухе. В первые 1—2 дня после прикрепления содержа-
ние воды в фекальных массах у всех видов ниже, чем в последующий пе-
риод более интенсивного кровососания.
Качественный анализ спектра поглощения растворенных фекалий
свидетельствует об очень незначительном содержании гемоглобина и ге-
матина в первые дни питания. Напротив, в выделяемых позднее красно-
коричневых фекалиях наблюдаются очень четкие и интенсивные полосы
поглощения гематина и гемоглобина. Последний был представлен в ос-
новном оксигемоглобином с небольшой примесью метгемоглобина. Ин-
тересно, что у личинок, судя по интенсивности поглощения, содержание
гемоглобина было значительно выше, чем гематина.
По соотношению содержания железа в фекалиях и организме клещей
наблюдаются определенные различия как между отдельными видами, так и
между фазами развития. Из 5 изученных в этом отношении видов наиболь-
шее абсолютное и относительное количество крови поглощается всеми
фазами Hyalomma asiaticum и Dermacentor pictus. Остальные виды и осо-
бенно Ixodes persulcatus значительно уступают в этом отношении. Клещ
Dermacentor pictus отличается также наиболее интенсивным выделением
фекалий, причем это, по-видимому, характерная особенность всех видов
данного рода.
В целом наиболее интенсивное выделение фекалий во время питания
отмечено у личинок. Если учесть, что интенсивность процессов роста и
пищеварения на этой стадии у них ниже, чем у нимф и самок, а их фека-
лии наиболее богаты непереваренной кровью, то очевидно, что на этой
фазе развития наименее экономно используется кровь хозяев.
Поглощение огромной массы крови, в несколько сот раз превышающей
вес голодного клеща и в несколько раз вес полностью напитавшейся особи,
составляет одну из характерных особенностей сем. Ixodidae. При этом
нельзя недооценивать и других компонентов в рационе клещей — лимфы
и продуктов гистолиза тканей хозяина. Количествецное соотношение
этих компонентов в пищевом балансе клеща остается не изученным. По
- 100 -
чисто внешним признакам и
микроскопическому исследо-
ванию содержимого среднего
отдела кишечника несомнен-
но, что у полностью напитав-
шихся особей пищеваритель-
ный тракт заполнен кровью,
тогда как в первую половину
питания в нем преобладают
лимфа и фрагменты тканей.
Подтверждением этому слу-
жат данные Е. Саттон и
Р. Артура (Sutton a. Arthur,
1962), показавших, что в на-
чале питания в содержимом
кишечника самок Ixodes rici-
nus много свежей крови, а
затем вплоть до начала бы-
строго насыщения в нем пре-
обладают лимфа и другие
некровяные компоненты. На
последней стадии насыщения
кишечник заполнялся пре-
имущественно кровью. Таким
образом, иксодовые клещи
в отличие от истинных крово- S3
сосов наряду с кровью по- Л
глощают значительное коли- »
чество лимфы и продуктов *
лизиса кожи позвоночных.
Увеличение веса тела £
иксодовых клещей за время
питания лишь косвенным
образом отражает фактиче-
ский объем поглощенной па-
разитом пищи. Часть ее вы-
водится из организма клеща
в виде фекалий еще во время
питания, большое количество
пищевых компонентов успе-
вает перевариться и идет на
построение тканей клеща;
кроме того, следует учиты- g
вать значительное обезвожи- g
вание крови и выведение из
организма избыточной воды g
(все эти моменты подробно ф
рассматриваются в последу- §
ющих разделах). На основа- $
нии данных для многих видов ч
клещей мы пришли к заклю- £
чению, что вес тела напитав-
шихся особей в определенной
степени пропорционален ко-
личеству поглощенной пищи.
Таким образом, путем про-
1 По Глащинской-Бабенко, 1956.
2 По Шевченко, 1956.
3 По Нельзиной и Даниловой, 1960.
101 -
стых взвешиваний можно получить объективные данные об интенсивности
питания у разных видов и фаз развития. Результаты наших исследова-
ний и литературные данные об увеличении в весе на разных фазах разви-
тия и у разных видов иксодовых клещей сведены в табл. 23.
У личинок изученных видов вес в период кровососания увеличивается
в 10—20 раз и видовые различия в размерах и сроках насыщения относи-
тельно невелики. Иная картина наблюдается у нимф. У Ixodes ricinus,
Haemaphysalis punctata и Я. sulcata вес нимф за время кровососания уве-
личивается в 20—30 раз, а у Dermacentor pictus, D. marginatus, Hyalomma
asiaticum, H. anatolicum и H. aegyptium — в 50—100 раз. Rhipicephalus
bursa и R. turanicus увеличиваются в 20—50 раз и занимают промежуточ-
ное положение. Подобные различия отчасти связаны с соотношением раз-
меров тела голодных особей нимфальной и половозрелой фаз. Вес голод-
ных нимф разных видов варьирует в 1.5—2 раза, а половозрелых клещей
уже в 3—6 раз. В связи с этим у крупных видов нимфы питаются обычно
дольше и их размеры по отпадении крупнее, чем у быстро насасывающихся
мелких видов. Особенно справедливо это правило для родов Hyalomma
и Dermacentor со сравнительно небольшими нимфами и очень крупными
самцами и самками.
Увеличение веса у самок пастбищных видов было довольно однородно.
Абсолютное увеличение веса у них колебалось в пределах 8000—12 000%.
Все эти виды относятся к группе подстерегающих пастбищных кровососов.
У иксодид с норовым типом паразитизма вес за период питания увеличи-
вается значительно меньше. Например, напитавшиеся самки Ceratixodes
putus весят лишь в 20—30 раз, a Ixodes plumbeus в 40—60 раз больше, чем
голодные. Как видно из табл. 23, огромные размеры напитавшихся самок
рода Hyalomma обусловлены их большими размерами и в голодном состоя-
нии. Относительное увеличение веса у них не отличается от других паст-
бищных иксодид.
Индивидуальные различия между напитавшимися клещами одного
вида при нормальном завершении питания обычно невелики, но при нару-
шениях кровососания отпавшие клещи могут быть в несколько раз мельче
нормальных. Недососавшиеся самки способны к повторному присасыванию
или откладывают уменьшенное количество яиц, а личинки и нимфы могут
перелинять на карликовых индивидов следующей фазы развития.
У представителей рода Ixodes резкие различия в размерах напитав-
шихся нимф представляют норму. Например, среди нимф 7. ricinus четко
различаются две весовые группы: в 3.4—6.5 мг (среднее 4.7 мг) и 2—3 мг
(среднее 2.6 мг). После линьки первая группа нимф давала только самок,
а вторая самцов. Здесь различия в размерах нимф были связаны с половым
диморфизмом имаго клещей. Самцы указанного вида весят обычно 0.9—
1.1 мг, а самки 1.9—2.4 мг. У представителей родов Hyalomma, Rhipi-
cephalus, Dermacentor и Haemaphysalis различия в размерах голодных сам-
цов и самок не столь резки. Тем не менее для Hyalomma anatolicum (Ar-
thur a. Snow, 1966) было доказано существование статистически достовер-
ных различий в весе тела между будущими самцами и самками, начиная
с личиночной фазы.
На степень упитанности отпавших напитавшихся клещей значитель-
ное влияние оказывают внешние условия и в первую очередь физиологи-
ческие и морфологические особенности строения организма хозяина.
У мало специализированных в выборе прокормителей треххозяинных
пастбищных иксодид различия в весе тела напитавшихся личинок и нимф
после кормления их на широком круге позвоночных животных обычно
сравнительно невелики. В наших опытах (Балашов, 19586) средний вес
личинок и нимф Ixodes ricinus, Haemaphysalis punctata, Dermacentor
pictus, D. marginatus, Rhipicephalus turanicus, Hyalomma asiaticum no
- 102 -
отпадении их с белых мышей, крыс, морских свинок, кроликов, ежей,
собак, коз и крупного рогатого скота существенно не отличался. Кормле-
ние личинок и нимф Ixodes ricinus на ящерицах и цыплятах также не дало
заметной разницы в весе с клещами, напитавшимися на млекопитающих.
Для самок средних и крупных клещей существенное значение могут
иметь размеры тела хозяина. Например, при кровососании очень крупных
самок Hyalomma asiaticum на морских свинках и кроликах вес тела на-
питавшихся особей был значительно меньше, чем после питания на круп-
ном рогатом скоте, овцах и верблюдах.
У двуххозяинных видов нимфы, отпавшие с необычных хозяев, на-
пример с морских свинок или ежей, часто бывают несколько мельче, чем
насосавшиеся на копытных. Особенно резко это выражено у однохозяин-
ного Boophilus calcaratus. Немногие успешно напитавшиеся на кролике
самки этого вида были в несколько раз мельче нормальных и весили
в среднем 50—70 мг. У некоторых норовых иксодид нормальное насыщение
возможно лишь на немногих животных. Ixodes plumbeus достигает пол-
ного насыщения лишь на береговой ласточке. При кормлении на других
видах птиц клещи обычно отпадали недопитавшимися (Глащинская-
Бабенко, 1956).
Вес отпавших напитавшихся клещей во многом зависит от места при-
крепления. При питании на необычных участках тела вес их обычно меньше
нормального. Так, самки I. persulcatus и Hyalomma asiaticum, питавшиеся
на коровах у корня хвоста, после отпадения весили в 1.5—2 раза меньше
нормально упитанных. Самки Rhipicephalus turanicus, насосавшиеся на
хвосте у овец, всегда были мельче, чем с мест обычного прикрепления —
ушей. Никогда не достигали полного насыщения клещи, присосавшиеся
на сильно ороговевших или же воспалившихся участках покровов. Зна-
чительные различия в весе отпавших клещей получаются в зависимости
от того, питаются ли на ограниченном участке кожи хозяина один или не-
сколько видов (Павловский, Первомайский и Чагин, 1954). Наконец,
вес тела напитавшихся особей в значительной степени зависит от того,
в первый раз или повторно используется хозяин для кормления клещей,
что подробно рассматривается в разделе «Взаимоотношения клещей с ор-
ганизмом хозяина» (см. стр. 109).
Таким образом, хотя окончательные размеры напитавшегося клеща
являются до некоторой степени видовым признаком, они могут варьировать
в значительных пределах в зависимости от условий питания.
ПИТАНИЕ САМЦОВ
По характеру питания самцы иксодовых клещей резко отличаются от
самок, нимф и личинок. Самцы многих видов рода Ixodes вообще не пи-
таются и не найдены на хозяевах (Ixodes plumbeus, I. trianguliceps, I. he-
xagonus, I. canisugd). Отсутствие кровососания отмечено преимущественно
для видов с гнездово-норовым типом паразитизма (Nuttall a. Warburton,
1911). У самцов некоторых видов этого рода кровососание, видимо, фа-
культативно. Хорошим примером в этом отношении служат I. ricinus и
I. persulcatus. В опытах при попытках кормления на кроликах самцы этих
видов не питаются и в их кишечниках при вскрытиях не удается обнару-
жить следов свежей крови. Однако в природных популяциях иногда при-
ходится наблюдать кратковременное присасывание клещей к человеку
с типичным погружением гипостома и хелицер в кожные покровы.
П. Шульце (Schulze, 1942а) указывает, что ему удалось проследить не-
сколько несомненных случаев кровососания у I. ricinus. Возможно, у этих
видов при вторичном переходе к пастбищному паразитизму появилась
- 103 -
тенденция к восстановлению питания у самцов, утраченная при норовом
паразитизме (Померанцев, 1948).
У самцов Hyalomma asiaticum, Н. plumbeum, Н. anatolicum, Н. aegyp-
tium, Rhipicephalus bursa, R. turanicus, Dermacentor pictus, D. margina-
tus, Haemaphysalis punctata, H. concinna, H. sulcata всегда существует
период кровососания на хозяине (табл. 24).
Таблица 24
Изменения веса (в мг) самцов иксодовых клещей
в период питания
Время прикреп- ления на хозя- ине, в сутках Hyalomma plumbeum Rhipicephalus turanicus Haemaphysalis punctat a Dermacentor pictus
Голодные 7.2-17.0(11.8) 3.0—5.0(3.9) 1.8—3.0 (2.0) 5.8-8.8 (7.5)
1 8.6—19.0(14.0) 4.2-4.8 (4.5) 2.1—2.9 (2.4) 6.5-12.0(10.1)
2 14.8-22.5(19.2) 4.4-5.6 (5.2) 2.4-3.2 (2.9) 9.0-16.4(13.0)
3 17.0-23.1 (21.4) 4.8-8.2(6.1) 2.8-3.5 (3.1) J 10.8-19.4(15.2)
4 18.1—25.2 (20.9) 4.6-8.0(6.4) 2.9—3.4 (3.0) 10.6—14.8(20.2)
5 14.3—23.4(21.3) 4.5-8.1 (6.1) 2.7—3.6 (3.0) 12.4-18.8(15.6)
20 13.1-24.0(20.3) 4.9-7.9 (6.3) 2.8-3.5 (3.1) 13.0-19.1 (15.0)
Примечание. В скобках дается средний вес клещей.
Самцы указанных видов насасывались за 3—5 суток, а вес их увеличи-
вался в 1.5—2 раза. После этого кровь поглощалась лишь незначитель-
ными порциями по мере переваривания старой, вес клещей при этом за-
метно не менялся. На хозяине они обычно остаются от нескольких недель
до 2—3 месяцев, а у Hyalomma aegyptium иногда до года. За этот период
они способны многократно менять место своего прикрепления в поисках
самок. Благодаря длительному периоду прикрепления к хозяину их часто
можно встретить на животных после того, как сезон активности данного
вида в природе уже давно закончился. В Туркмении в июне 1955 г. нам
неоднократно приходилось находить на овцах прикрепившихся к ушам
самцов Rhipicephalus turanicus. Самки же исчезли с хозяев еще в сере-
дине мая.
Отмеченные различия в питании самцов иксодовых клещей связаны
с особенностями их сперматогенеза. Самцы рода Ixodes способны к опло-
дотворению сразу же после линьки и без кровососания, тогда как у Hy-
alomma, Rhipicephalus, Dermacentor и Haemaphysalis они нуждаются в
приеме крови для завершения сперматогенеза (Балашов, 19566).
ДИНАМИКА ВЕСОВЫХ ИЗМЕНЕНИЙ
НА СТАДИИ ПИТАНИЯ
Для характеристики весовых изменений на стадии питания мы ввели
специальные показатели: абсолютное увеличение веса и удельный привес
(Балашов, 19586). Абсолютное увеличение веса по отношению к голодной
стадии для любого дня питания дается в процентах и вычисляется по фор-
муле
а = 4” 100,
^0
где а — абсолютное увеличение веса для n-го дня кровососания, РГ1 —
вес в n-й день питания и Ро — вес голодного клеща в миллиграммах.
- 104 -
Величина удельного привеса характеризует скорость изменений веса
в процентах за любые дни кровососания и вычисляется по формуле
где d — удельный привес за сутки, Рп+1 и Рп — вес за последовательные
дни питания и t — время между двумя измерениями в сутках. При умень-
шении веса клеща по сравнению с исходным величина удельного привеса
меньше 100%-, а при увеличении веса — больше 100%.
Абсолютное увеличение веса и удельный привес отчасти сходны с аб-
солютной и удельной скоростями роста. Однако они включают в себя как
изменения в весе за счет роста
в дивертикулах кишечника.
Удельный привес до некоторой
степени соответствует средней
скорости кровососания.
Неравномерность скорости
увеличения размеров и веса тела
иксодовых клещей во время
питания была впервые обнару-
жена А. Лисом (Lees, 1952)
у самок Ixodes ricinus. В первые
5—6 суток питания вес их тела
увеличивался довольно равно-
мерно и достигал 50 мг, тогда
как за последние сутки кровосо-
клеща, так и простое накопление крови
сания их вес сразу же увеличи- ~ тт
F J J Рис. 165. Изменения величины удельного при-
вален ДО 200 МГ. Универсаль- веса в период питания у Ixodes ricinus.
ность этой особенности питания , _ личинки; 2 _ нимфы; 3 _ самки.
была в дальнейшем подтвер-
ждена не только на самках, но
и на неполовозрелых фазах развития представителей большинства родов
мировой фауны (Балашов, 1956а, 19586; Хейсин и Лаврененко, 1956;
Kitaoka a. Yajima, 1958а). В то же время на основании полученных нами
данных мы считаем, что стадию питания по характеру изменений в весе
и размерах и особенно в связи с морфо-физиологическими изменениями
в организме следует подразделять не на два, а на три периода.
Первые 6—24 часа с момента прикрепления первоначальный вес клеща
уменьшается или же остается без заметных изменений. Особенно значи-
тельная потеря веса в первые сутки прикрепления наблюдается у личинок
и нимф. Обычно она не превышает 10—20%, но в исключительных слу-
чаях, как например у личинок Hyalomma anatolicum, достигает почти
30—40% от исходного веса. У личинок и нимф Ixodes ricinus этот период
заметно укорочен, а иногда полностью отсутствует (рис. 165), чем, ве-
роятно, и объясняется игнорирование его Лисом (Lees, 1952). У Hyalomma
asiaticum и Haemaphysalis punctata он может растягиваться на 2—3 суток
(рис. 166). У самок первоначальное уменьшение веса незначительно,
хотя они иногда не питаются несколько дней после прикрепления.
Уменьшение веса в первые часы или даже сутки после прикрепления
связано с интенсивной потерей воды за счет роста испарения при тем-
пературе прикожного слоя воздуха в 26—36°. При кормлении клещей на
рептилиях при температуре не выше 25—30° уменьшение веса в первые
дни прикрепления вообще может отсутствовать или бывает очень незна-
чительным. Вероятно, переход клещей от свободного существования к па-
разитированию на теле хозяина наряду с другими перестройками в ор-
ганизме нарушает водонепроницаемость покровов тела. В пользу этого
- 105 -
косвенно свидетельствует малая устойчивость к высыханию у недопитав-
шихся клещей после их удаления с хозяина.
Отсутствие питания или очень медленное поступление пищи в кишечник
сразу после прикрепления связано с некоторой недоразвитостью органов
пищеварения у голодных особей. Клещам требуется некоторое время для
морфо-физиологических перестроек в их организме, лишь после этого они
становятся способными к нормальному питанию. Длительность этого пе-
риода, названного нами подготовительным, определяется видовыми осо-
бенностями клещей, фазой развития, физиологическим состоянием при-
крепляющихся особей и характером воздействия факторов внешней среды.
Быстрее всего он заканчивается у клещей
—3-й степеней истощения,
проявляющих значитель-
ную агрессивность.
Собственно питание
клещей на теле хозяина по
скорости принятия пищи и
физиологическим процес-
сам в организме подразде-
ляется на два периода.
Большую часть времени
кровососания занимает пе-
риод роста. В это время
происходит быстрое пере-
варивание крови хозяина
и за счет ее ассимиляции
интенсивный рост покро-
вов и внутренних органов.
Ветви кишечника, несмо-
тря на значительное общее
увеличение веса, растяну-
ты умеренно, сохраняют
Рис. 166. Изменения величины удельного привеса
в период питания у Hyalomma asiaticum,
1 — личинки; 2 — нимфы; 3 — самки.
многочисленные перетяжки и имеют морщинистую наружность. Оконча-
нием этого периода можно считать начало быстрого растяжения тела клеща
поступающей кровью за 0.5—1.5 суток до отпадения.
У самок на этом этапе в первые сутки происходит быстрое возрастание
величины удельного привеса, а затем эта величина 4—6 дней держится на
достигнутом уровне, колеблясь в пределах 170—220%. Примером подобного
идеального случая могут служить самки Ixodes ricinus (рис. 165). Послед-
нее также отмечено для самок Boophilus caudatus (Kitaoka a. Yajima,
1958а), у которых выделяются три периода роста: от 3 до 10 мг, от 10 до
80 мг и от 80 до 450 мг (рис. 167), причем первый период занимает большую
часть времени питания. Исследования других видов иксодид и особенно
питания личинок и нимф, включая и данные указанных выше авторов по
личинкам Haemaphysalis bispinosa, не подтверждают постоянства сущест-
вования двух периодов в росте иксодовых клещей до начала периода
растяжения (3-я стадия в работах японских исследователей). У самок не-
которых видов в период роста часто наблюдаются заметные подъемы и па-
дения скорости кровососания. Наблюдавшееся в наших опытах законо-
мерное падение величины удельного привеса до 110—130% и последующий
резкий подъем до 300—350%, вероятно, были связаны с торможением кро-
вососания у неоплодотворенных самок и быстрым ее возрастанием после
оплодотворения. Особенно типично в этом отношении питание половозре-
лых Hyalomma asiaticum. У неоплодотворенных самок этого вида задержка
питания начинается уже на 4-е сутки прикрепления. Самцы же становятся
способными к оплодотворению лишь на 5-е сутки. В связи с этой особен-
ностью при одновременной посадке самцов и самок на хозяине у послед-
- 106 -
Время, В днях
Рис. 167. Изменения длины (И) и веса (Б) тела
у самок Boophilus caudatus во время питания.
Стрелки обозначают время отпадения напитав-
шихся особей (по Kitaoka a. Yajima, 1958а).
них всегда наблюдается кратковременное замедление кровососания
(рис. 166).
Незначительное уменьшение величины удельного привеса, отмеченное
для большинства видов перед началом быстрого насыщения клеща в по-
следние 0.5—1 сутки кровососания, вероятно, связано с определенной фи-
зиологической перестройкой в организме перед сильным растяжением
покровов идиосомы.
Изменения величины удельного привеса у нимф имеют ряд своих осо-
бенностей. У Dermacentor pictus, D. marginatus, Hyalomma asiaticum и
H. anatolicum, обладающих длительным нимфальным питанием и значи-
тельным увеличением веса,
изменения величины удель-
ного привеса во многом сход-
ны с таковыми у самок
(рис. 166). У них хорошо
выражен 2—4-дневный пе-
риод с относительно постоян-
ным удельным привесом в
150—250%. Наоборот, у Ixo-
des ricinus, Haemaphysalis
punctata, Rhipicephalus turani-
cus и Rh. bursa с коротким
периодом питания и сравни-
тельно небольшим увеличе-
нием веса все время проис-
ходит постоянное нарастание
удельного привеса (рис. 165).
Для личинок с их корот-
ким питанием и еще меньшим
увеличением в весе постоян-
ный рост величины удель-
ного привеса представляет
уже общую отличительную
черту. Однако и у личинок,
и у нимф после первоначаль-
но быстрого подъема скоро-
сти кровососания всегда су-
ществует продолжительный
период с более медленным
ее увеличением.
При кровососании у личинок и нимф наблюдаются значительно боль-
шие индивидуальные колебания в удельном привесе по сравнению с сам-
ками. Возможно, что меньшие размеры прикрепительного аппарата не
позволяют им достаточно глубоко внедриться в покровы хозяина, а это
ставит их в большую зависимость от различных местных реакций в об-
ласти прикрепления.
Таким образом, для питания личинок и нимф мелких видов иксодовых
клещей характерен период роста с относительно постоянным умеренным
увеличением удельного привеса, а для самок и нимф крупных видов —
постоянство величины удельного привеса в этот период. У самок период
роста занимает 5—7, у нимф 2—4 и у личинок 1.5—3 суток. За это время
вес самок увеличивается в 10—20, нимф в 5—20 и личинок в 3—5 раз,
что составляет от Ч* до г/4 веса полностью напитавшегося клеща.
За счет непрерывного переваривания крови хозяина происходят ин-
тенсивные процессы роста, и к концу этого периода сильно увеличившийся
в размерах клещ приобретает способность к быстрому поглощению огром-
- 107 -
ной массы крови, обеспечивающей его дальнейшее развитие по отпаде-
нии.
После продолжительного периода с относительно постоянным приро-
стом в весе за 12—24 часа до отпадения начинается необычайно быстрое уве-
личение размеров клеща. К концу его, перед отпадением, клещ буквально
раздувается от поглощенной крови хозяина. За последние сутки питания
клещи увеличиваются в весе больше, чем за весь предшествующий много-
дневный период. В дальнейшем мы будем называть его за столь быстрое
увеличение размеров периодом растяжения. Вес самок в эти последние
часы увеличивается у мелких видов с 60—100 до 200—600 мг и у крупных
с 150—200 до 600—1200 мг (табл. 23). Нимфы крупных видов увеличи-
ваются с 2—4 до 10—30 мг и мелких — с 0.5—1 до 3—5 мг; личинки боль-
Рис. 168. Изменения величины удельного при-
веса в период кровососания у личинок Hae-
maphysalis sulcata, питавшихся на зеленой
ящерице {Lacerta viridis) при различной тем-
пературе.
1 — 20°; 2 — 25°; 3 — 30°.
шинства изученных видов —
с 0.1—0.2 до 0.3—0.6 мг.
Величина удельного привеса
достигает 400—700% против
150—200% в предшествующий
период. У самок последний этап
кровососания обычно растянут
несколько дольше и соответ-
ственно удельный привес мень-
ше, чем у личинок и нимф.
Интересно, что у самок Ixo-
des persulcatus и Z. ricinus окон-
чание периода насыщения обыч-
но тесно связано с суточным
ритмом отпадения и происходит
во время нахождения коровы
в хлеву на покое. При пастьбе
лишь немногие клещи заканчи-
вают насыщение. Вероятно,
энергичные движения животного на пастбище, способствуя отпадению
насосавшихся клещей, в то же время до некоторой степени препятствуют
окончанию кровососания.
Последний период кровососания иксодовых клещей можно с известными
основаниями сравнивать со всем актом питания других кровососв. На
первое место теперь выступают процессы растяжения покровов идиосомы
и стенок кишечника. Клещ поглощает гигантские количества крови по
сравнению с его первоначальным весом. Фактически, однако, растяжение
покровов и кишечника не выходит в это время из рамок, свойственных дру-
гим кровососущим членистоногим, так как растяжению подвергается ор-
ганизм клеща, успевший до этого значительно увеличиться в размерах.
Вес клеща по сравнению с достигнутым к концу предшествующего этапа
увеличивается не больше чем в 4—10 раз. Это довольно близко к увели-
чению веса у насосавшихся орнитодорин, не имеющих особого периода
роста.
При кормлении на холоднокровных животных соотношение в продол-
жительности отдельных периодов кровососания в известных границах
определяется температурой. У личинок и нимф Haemaphysalis sulcata,
питавшихся на зеленых ящерицах при 20, 25 и 30°, наблюдалось заметное
удлинение первых двух периодов при понижении температуры. Пропор-
ционально удлинению периода роста происходило уменьшение величины
удельного привеса, тогда как продолжительность периода растяжения
менялась в значительно меньшей степени (рис. 168). Сходные данные были
получены при кормлении личинок и нимф Ixodes ricinus на прытких яще-
рицах и кавказских агамах.
— 108 —
ВЗАИМООТНОШЕНИЯ КЛЕЩЕЙ
С ОРГАНИЗМОМ ХОЗЯИНА
По встречаемости на одном или многих видах хозяев среди иксодовых
и аргасовых клещей различают три биологические группы. Лишь незна-
чительной части иксодовых клещей свойственна строгая специфичность
в выборе позвоночных-прокормителей, когда нормальное развитие воз-
можно только при кормлении всех активных фаз на одном виде хозяина.
Подобные отношения, по-видимому, существуют между ласточками-берего-
вушками и клещом Ixodes plumbeum, который плохо питается на других
видах птиц.
Значительно чаще клещи одного вида паразитируют на группе видов
хозяев, близких в систематическом отношении или же встречающихся
в одних и тех же местах обитания и контактирующих с клещами. При-
мером специфичности клещей к определенным систематическим группам
могут служить паразиты летучих мышей (Argas vespertilionis, виды рода
Antricola, Ixodes vespertilionis, 7. simplex'), копытных животных (Al-
veonasus lahorensis, виды родов Otobius и Boophilus, многие одно- и двух-
хозяинные виды рода Hyalomma, Rhipicephalus bursa), некоторых групп
рептилий (Amblyomma silvaticum, Л. тагтогеит и другие виды этого
рода с черепах, Аропотта oxornatum с нильского варана и других круп-
ных ящериц, A. latum с крупных видов африканских змей). Некоторые
представители родов Ixodes, Ceratixodes putus, а также Ornithodoros capensis
(Филиппова, 1963) паразитируют на морских птицах — обитателях
птичьих базаров или постоянных гнездовых колоний.
Многие норовые виды рода Ornithodoros и некоторые иксодиды (Rhi-
picephalus schulzei, Ixodes crenulatus, I, subterranus, Haemaphysalis
numidiana turanica) заселяют норы нескольких видов позвоночных с бла-
гоприятным для клещей микроклиматом. Хозяин норы служит для них
главным прокормителем, но клещи охотно питаются и успешно разви-
ваются также на широком круге животных, относящихся к различным
систематическим группам, которые периодически или случайно .посещают
норы их главных хозяев.
У значительной части треххозяинных видов с пастбищным типом пара-
зитизма хозяева неполовозрелых фаз и имаго во многих случаях принад-
лежат к разным систематическим группам и часто резко отличаются сво-
ими экологическими особенностями. Количество возможных видов хозяев
может быть весьма значительным. Так, в случае с Ixodes ricinus, I. per-
sulcatus и Haemaphysalis punctata списки видов позвоночных, на которых
клещи были собраны в природе, насчитывают по нескольку десятков на-
званий. Преимущественная встречаемость личинок и нимф этих видов
на сравнительно мелких млекопитающих и птицах, а в ряде случаев и на
рептилиях, а имаго — на хозяевах средних и крупных размеров объяс-
няется не различной пищевой специализацией, а нахождением активных
клещей разных фаз в различных ярусах растительности.
В целом потенциальные способности клещей к питанию на разных ви-
дах позвоночных животных значительно шире фактического круга их про-
кормителей в природе, что подтверждается возможностью их кормления
в лабораторных условиях на необычных видах хозяев. Во многих случаях
нам просто остаются неизвестными многие важные виды естественных
прокормителей, как например в случае с Hyalomma aegyptium. До по-
следнего времени считалось, что этот вид паразитирует на черепахах и,
реже, на некоторых других видах рептилий, но оказалось, что в про-
кормлении его неполовозрелых фаз важную роль играют многие виды
млекопитающих (Hoogstraal a. Kaiser, 1960).
Голодные особи (чаще нимфы или самцы) некоторых видов аргасовых
клещей могут прокалывать покровы и высасывать содержимое кишечника
- 109 -
и гемолимфу напитавшихся особей своего или других видов сем. Argasi-
dae. Подобные случаи каннибализма описаны у Ornithodoros papillipes,
О. verrucosus, О. tartakovskyi, О. coniceps, О. capensis, О. alactaga-
lis, О, nereensis, Argas persicus, A. vulgaris, A. tridentatus (Поспелова-
Штром, 1953; Филиппова, 1966). По наблюдениям Н. А. Филипповой
(1966), каннибализм особенно часто встречается у клещей Ornithodoros
coniceps — обитателей птичьих гнезд. В эксперименте одни и те же особи
этого вида отказывались присасываться к птицам, но охотно высасывали
содержимое напитавшихся самок нескольких видов рода Argas. Подобный
способ питания обеспечивал возможность нормальной линьки нимф на
следующую фазу развития и даже прохождение полного жизненного цикла.
Каннибализм может иметь определенное значение в циркуляции спи-
рохет внутри клещевой популяции (Петрищева, 1947), но особенно ин-
тересно это явление в эволюционном плане. В. Н. Беклемишев (1948)
рассматривает каннибализм аргасовых клещей как рудимент энтомофагии,
свойственной предкам этой группы кровососущих членистоногих.
В последнее время случаи каннибализма описаны и среди иксодовых
клещей. Голодные самцы австралийского вида Ixodes holocyclus прокалы-
вают покровы частично или полностью напитавшихся самок своего вида
и питаются их гемолимфой. Процесс питания продолжается от 25 мин.
до 6 час. Чаще всего самцы прикрепляются вдоль половой борозды, при-
чем на одной самке может последовательно питаться несколько самцов.
Паразитирование самцов не вело к гибели самок и они в дальнейшем нор-
мально откладывали яйца. Описываемый случай представляет пример
облигатного каннибализма, так как самцы этого вида ни разу не были об-
наружены питающимися на позвоночных животных (Moorhouse, 1966).
У других видов присасывание самцов к самкам описано для Hyalomma
detritum, где оно представляет исключение (Узаков, 1961). Как правило,
самцы этого вида прикрепляются к позвоночным животным и питаются
их кровью.
Разная степень пищевой специализации иксодовых клещей чаще про-
является не в отказе от питания на необычных видах хозяев, а в различных
последующих нарушениях в развитии. Например, виды рода Hyalomma,
Rhipicephalus bursa и из аргасовых клещей Alveonasus lahorensis, па-
разитирующие на копытных животных, при лабораторном культивирова-
нии на кроликах на протяжении нескольких поколений мельчают из-за
невозможности полного насыщения имагинальной и нимфальной фаз на
необычном хозяине. Еще резче это проявляется в случае однохозяинных
видов рода Boophilus и Hyalomma scupense. В то же время такие виды кле-
щей, как Ixodes ricinus, Haemaphysalis punctata или Ornithodoros papil-
lipes, обладающие широким кругом естественных хозяев, нормально пи-
таются на различных лабораторных животных без последующих нару-
шений в цикле развития.
Для большинства изученных в этом отношении видов иксодовых кле-
щей обнаружено существование мест преимущественного прикрепления
к телу хозяев, тогда как на других частях тела они встречаются значи-
тельно реже или вообще отсутствуют. Так, в Ленинградской обл. самки
Ixodes ricinus прикрепляются на коровах главным образом в паховой
области, a I. persulcatus — на шее и подгрудке (Оленев, 1954; наши на-
блюдения). Имаго Dermacentor pictus в Московской обл. прикрепляются
на коровах к ушам, у корня хвоста, в затылочной ямке, сверху и по бокам
шеи, а на подгрудке встречаются лишь одиночные особи (Олсуфьев, 1953).
В Западной Сибири этот же вид прикрепляется главным образом на под-
грудке (Олсуфьев, 1947). По наблюдениям И. Г. Галузо (1947), имаго
Hyalomma detritum в Средней Азии, паразитирующие на скоте в жаркое
время года, прикрепляются преимущественно к паху, на вымени и в об-
- 110 -
пасти молочного зеркала. Эти места не подвергаются прямому действию
солнечной инсоляции, и максимальные дневные температуры прикожного
слоя воздуха не превышают здесь 37°. Личинки и нимфы того же вида,
паразитирующие на скоте в весеннее время, напротив, питаются главным
образом на холке, спине, хвосте, наружных сторонах бедер и лопаток.
По нашим наблюдениям над имаго R. turanicus в Туркмении, последние
прикрепляются на овцах преимущественно к ушам и, реже, на внутрен-
ней стороне хвоста, в паховой области и на других частях тела, где нет
густого шерстного покрова и обильных выделений жиропота. Однако
сразу же после стрижки клещи прикрепляются по всему телу. Неравно-
мерное распределение клещей на теле хозяев связывают с длиной хоботка
и толщиной кожи позвоночного (Дубинин, 1958; Arthur, 1962), микрокли-
матом прикожного слоя воздуха на разных частях тела (Галузо, 19486)
и со способностью животных к самоочищению от паразитов.
Наиболее детально влияние способности к самоочищению на локализа-
цию паразитов на теле позвоночного изучено у мелких млекопитающих.
По наблюдениям В. В. Кучерука с сотрудниками (1955, 1956), у обыкно-
венного ежа личинки клеща Dermacentor marginatus довольно равномерно
распределены по телу, так как его способность к скусыванию или счесы-
ванию клещей весьма ограничена. Наоборот, у лесной мыши 96% личинок
того же вида прикреплялись на ушах и лишь немногие — на других частях
головы, что связывается со способностью этого грызуна к удалению клещей
почти со всего тела. В опытах тех же авторов при свободном выпуске нимф
D. marginatus на 5 видов грызунов домовые мыши не выкормили ни одного
клеща, на лесных мышах напиталось 9—28%, на серых хомячках — 36—
49%, на дагестанских хомяках — 63—70% и на обыкновенных хомяках —
65% от общего числа запущенных клещей. В другой серии опытов, когда
на мышей были одеты воротнички, затрудняющие счесывание паразитов,
процент напитавшихся личинок увеличивался в несколько раз. Кроме
того, изменялись места прикрепления клещей. На ушах находилось уже
70% личинок, а остальные распределялись на мордочке, передних и зад-
них лапах, хвосте.
Как и на других группах позвоночных, места прикрепления клещей
к грызунам определялись также видовой принадлежностью кровососов.
Личинки и нимфы D. marginatus прикреплялись главным образом к уш-
ным раковинам мышей и хомяков, тогда как личинки Ixodes persulcatus
и особенно Haemaphysalis otophila распределялись по телу более равно-
мерно. Описанные различия объясняются неодинаковой скоростью приса-
сывания личинок и болезненностью их прикрепления и питания для
хозяина.
Из других групп хозяев способность к самоочищению от клещей исклю-
чительно эффективна у птиц, уничтожающих паразитов с помощью клюва.
В результате на их теле места прикрепления иксодовых и личинок аргасо-
вых клещей ограничены головой, верхней частью шеи и, реже, внутренними
сторонами основания крыльев. У крупных животных, в частности у коров,
также развиты оборонительные реакции против иксодовых клещей. Так,
в наших опытах при выпуске на коров имаго Hyalomma asiaticum живот-
ные сразу же проявляли сильное беспокойство и старались сбросить па-
разитов ударами хвоста, счесать о твердые предметы или слизнуть их.
По наблюдениям Н. Г. Олсуфьева (1953), коровы пытаются освободиться
от клещей Dermacentor pictus и после прикрепления последних.
Гибель части клещей, напавших на позвоночное животное, может быть
связана не только с активным уничтожением части паразитов благодаря
различным поведенческим реакциям хозяина, но и в связи с различными
изменениями в организме последнего, препятствующими нормальному пи-
танию клещей. Известно, что из числа прикрепившихся клещей, несмотря
- 111 -
на отсутствие механических травм, далеко не все особи успешно заканчи-
вают питание и отпадают с хозяина. При этом наблюдаются значительные
различия как между особями прокормителей разных видов, так и индиви-
дуальные различия внутри вида. Различная степень видовой врожденной
невосприимчивости к нападению иксодовых клещей в простейших случаях
может быть связана с особенностями строения покровов, но, скорее, при-
чины ее следует искать в остающихся не изученными специфических био-
химических и физиологических свойствах отдельных видов хозяев. Врож-
денная индивидуальная устойчивость к нападению клещей также имеет
лишь относительный характер и, по-видимому, может быть объяснена
теми же факторами, что и видовая невосприимчивость.
Так, по наблюдениям П. Вилкинсона (Wilkinson, 1962) над заклещев-
ленностью крупного рогатого скота в Австралии между коровами одного
стада наблюдались значительные постоянные различия в проценте клещей
Boophilus microplus, успешно заканчивающих развитие на их теле.
Р. Райк (Riek, 1962) установил, что в Австралии при выпасе на одних
пастбиищах скот европейского происхождения (шортгорны) был поражен
клещами В. microplus в несколько раз сильнее, чем гибриды шортгорнов
с индийским зебувидным скотом. В опытах со свободным выпуском на
животных обеих пород партий по 20 000 личинок В. microplus на шорт-
горнах до полного насыщения развивался значительно больший процент
самок по сравнению с гибридами зебувидной породы. В первом слу-
чае средний вес самок был несколько выше, а продолжительность разви-
тия клещей на скоте короче, чем во втором. При изучении строения
покровов животных обеих породных групп не удалось установить какую-
либо связь различий в степени заклещевленности с толщиной кожи,
глубиной залегания волосяных фолликулов или количеством потоцых
желез.
В опытах с кормлением на белых мышах с ограниченной способно-
стью к самоочищению личинок Bhipicephalus sanguineus различная пора-
женность самцов и самок определялась их гормональными особенностями
и характером воспалительной реакции в местах прикрепления. При этом,
инъекция кортизона самцам и неполовозрелым самкам увеличивала про-
цент их пораженности клещами, а у половозрелых самок уменьшала за-
клещевленность (Sami a. Sweatman, 1966).
Приобретенная устойчивость животных к нападению клещей отме-
чена как в лабораторных экспериментах, так и в естественных условиях.
В частности, этот фактор играет существенную роль в регуляции числен-
ности клещей Boophilus microplus на крупном рогатом скоте в Австралии
(Riek, 1962) и в сезонной встречаемости личинок и нимф Ixodes persulcatus
на осрбях разных видов и разных возрастных группах одного вида среди
мелких млекопитающих (Никитина и Аристова, 1964). Процент напитав-
шихся и отпавших личинок I, persulcatus был значительно ниже при корм-
лении их на грызунах, отловленных из природных стаций с высокой чис-
ленностью этого вида клещей, по сравнению с опытами кормления их на
грызунах из мест с низкой численностью паразитов.
Приобретенная устойчивость позвоночных к нападению клещей, как
и врожденная устойчивость, не бывает абсолютной. Она проявляется
в форме меньшей заклещевленности животных, подвергающихся повтор-
ным нападениям иксодид, в угнетенном развитии клещей на подобных
животных, в значительно большей смертности, меньшем весе напитав-
шихся особей и в более низкой яйцевой продуктивности самок (Trager,
1939а, 1939b, 1940; Мусатов, 1957, 1965, 1966, 1967; Riek, 1962).
В. А. Мусатов (1965, 1966, 1967) детально исследовал влияние по-
вторных кормлений клещей Bhipicephalus bursa, В. sanguineus, Hyalomma
plumbeum, H. asiaticum на одном животном на питание и последующее
- 112 -
развитие этих видов. При кормлении клещей на кроликах и овцах спустя
3—4 недели после питания на них партий клещей того же вида вес напи-
тавшихся личинок и нимф был ниже, чем при первичном кормлении, на
25—45% и самок — на 28—35%. Одновременно наблюдалось удлинение
сроков питания и последующего развития всех фаз. Потомство самок от-
личалось пониженной жизнеспособностью. У напитавшихся самок наряду
с общим уменьшением веса наблюдались изменения в пропорциях идиосомы
в сторону ее большей уплощенности. У многих самок, отпавших с повторно
используемых животных, содержимое кишечника было более светлой,
иногда желтовато-серой окраски, тогда как при первом кормлении оно
обычно темно-бурого цвета. Различия в составе принимаемой клещами
пищи проявлялись и в химическом составе тела напитавшихся особей.
При повторных кормлениях на овцах содержание сухого вещества в ор-
ганизме самок снижалось в среднем с 37—39% в контроле до 34.5—36%,
а в аналогичных опытах с кроликами — с 34—35 до 26—30%. При по-
вторных кормлениях содержание белка в клещах уменьшалось на 3—
4%, но одновременно наблюдалось некоторое увеличение содержания ли-
поидов и минеральных веществ.
Ненормальные условия питания клещей на повторно используемых
для кормления животных связывают с изменением характера реакции
кожи хозяина в местах прикрепления паразитов. В опытах Г. С. Перво-
майского с сотрудниками (1963) при повторных кормлениях самок Hya-
lomma asiaticum на кроликах в местах прикрепления клещей преобладали
процессы лейкоцитарной инфильтрации, отека дермы и быстрого разра-
стания соединительной ткани, вызывающие нарушения нормального акта
питания. Напротив, при первичном кормлении доминировали явления
общей воспалительной реакции с геморрагическим синдромом, благопри-
ятствующие насыщению клещей кровью хозяина.
Нарушения в питании и гибель значительной части клещей Boophilus
microplus на «устойчивых» животных также объясняются особенностями
кожной реакции в местах прикрепления (Riek, 1962). При кормлении кле-
щей на крупном рогатом скоте, до этого уже подвергавшемся нападению
паразитов, через 48 час. после прикрепления личинок развивались силь-
ные местные отеки с интенсивной эозинофильной инфильтрацией, захваты-
вающей и внутренние слои дермы. Вследствие этих процессов значитель-
ная часть клещей гибла еще в личиночной фазе. В случае питания клещей
на «чувствительных» животных типичным было развитие зоны дегенера-
ции и некроза клеток у основания хоботка и геморрагических излияний
в дермальном слое. В то же время явления отечности были выражены сла-
бее, лейкоцитарная инфильтрация не охватывала внутренние слои дермы
и вместо эозинофилов в коже доминировали полиморфоядерные эле-
менты.
В ряде случаев интенсивная пролиферация росткового слоя эпидермиса
и дермы ведет к инкапсуляции ротовых частей клеща и полностью исклю-
чает поступление крови и лимфы в организм последнего. Примером этого
типа защитной реакции может служить инкапсуляция хоботка личинок
и нимф Ixodes persulcatus в коже овсянок (Наумов, 1963). В литературе
описаны случаи, когда наружный отек и разрастание кожи могут привести
к окружению всего клеща своеобразной цистой, так что паразит как бы
врастает в кожу хозяина (Лотоцкий и др., 1959; Arthur, 1962). При пер-
вичном кормлении, по нашим наблюдениям, регенерационные явления
вокруг места прикрепления остаются незавершенными из-за постоянного
выделения токсичной лизогенной слюны и вследствие этого недостаточной
интенсивности регенерационных процессов.
Предполагается, что кожная реакция при повторном питании клещей
представляет лишь одно из проявлений защитных реакций организма по-
8 Ю. С. Балашов
- 113 -
звоночного, возникающих при его сенсибилизации антигенами слюны кле-
щей. В. Трегером (Trager, 1939а) показано, что после кормления личинок
Dermacentor variabilis на морских свинках в организме последних выраба-
тывались антитела, делающие, по мнению этого автора, невозможным нор-
мальное насыщение последующих партий клещей того же вида.
Сенсибилизация животных происходила и после их искусственной вак-
цинации растертыми слюнными железами клещей. Сыворотка крови кро-
ликов, иммунизированных подобным образом, давала специфическую
реакцию связывания комплемента (Trager, 1939а). Р. Райк (Riek, 1962)
наблюдал повышение устойчивости крупного рогатого скота к нападению
клещей Boophilus microplus после повторных инъекций животным растер-
тых личинок этого вида. Наконец, В. А. Мусатов (1967) получил кожную
аллергическую реакцию в ответ на повторное введение антигена из слюн-
ных желез клещей.
В пользу иммуногенной природы защитной реакции позвоночных про-
тив нападения иксодовых клещей свидетельствуют также определенные
сдвиги в крови, наблюдающиеся только при повторных нападениях этих
паразитов. В крови животных отмечено резкое повышение содержания
гистамина, увеличение в сыворотке а- и P-фракций глобулинов, а также
ускорение РОЭ.
Иммуногенная теория устойчивости позвоночных к нападению клещей
была впервые выдвинута В. Трегером (Trager, 1939а, 1939b) и в настоя-
щее время разделяется многими исследователями (Brumpt et Chabaud,
1947; Chabaud, 1950; Мусатов, 1957, 1965, 1967; Riek, 1962). Можно счи-
тать установленным, что защитные реакции позвоночных, связанные с их
сенсибилизацией слюной кровососущих членистоногих, достаточно эф-
фективны лишь против длительно питающихся иксодовых клещей и личи-
нок некоторых видов аргазид. Напротив, для быстро питающихся фаз раз-
вития аргасовых клещей, как и для многих кровососущих насекомых, не
имеет существенного значения, использовался ли хозяин для кормления
в первый раз или же многократно. Для иксодид в то же время остаются
неясными вопросы о видовой или групповой специфичности защитной ре-
акции хозяина и о времени ее сохранения.
Наряду с антигенным воздействием слюна несомненно вызывает и об-
щую интоксикацию организма. У некоторых видов иксодовых клещей в ней
содержится очень сильный токсин, вызывающий параличи сельскохозяй-
ственных животных и человека. Наиболее часты случаи клещевых пара-
личей в Северной Америке при паразитировании самок Dermacentor
andersoni, D, variabilts и Amblyomma maculatum, в Южной Африке —
Ixodes rubicundus и в Австралии — /. holocyclus (Arthur, 1962; Gregson,
1962b). В Южной Европе, Средней Азии и Закавказье наблюдаются слу-
чаи клещевых параличей при паразитировании на овцах неполовозрелых
фаз клеща Alveonasus lahorensis, тогда как питание имаго этого вида не
вызывает паралитических явлений (Кусов, 1962).
В патологическом воздействии клещей на хозяев трудно провести гра-
ницу между интоксикацией организма слюной и поглощением значитель-
ных количеств крови. В литературе описаны многочисленные случаи ане-
мии животных вследствие паразитирования иксодовых клещей (Марков
и Курчатов, 1949; Riek, 1957). Легко подсчитать (см. табл. 22), что только
за счет выпитой крови при паразитировании 100 самок D, pictus одно
животное теряет не менее 400 мл крови. В Белоруссии при массовом пара-
зитировании клещей на коровах среднее снижение удоев достигало 2—
3 л на одно животное (Дылько, 1953). По наблюдениям В. А. Мусатова
и Т. В. Шаховой (1961), при паразитировании на овцах имаго клещей
Н, plumbeum содержание гемоглобина в крови уменьшалось на 12—
15%, число эритроцитов на 1.5—2 млн, лейкоцитоз возрастал в 2—3 раза
- 114 -
и был связан со-значительной эозинофилией. Изменения состава крови на-
блюдались с первого дня кровососания, когда кровопотери были незна-
чительны и не могли вызвать столь резкие нарушения.
ИЗМЕНЕНИЕ РАЗМЕРОВ ТЕЛА
ПРИ КРОВОСОСАНИИ
Даже при простом сравнении размеров тела голодных и напитавшихся
иксодовых клещей бросается в глаза огромная разница в их величине.
В целом изменения размеров тела во время питания отвечают увеличению
веса в этот же период, но отдельные части тела при этом увеличиваются да-
леко не равномерно.
Нами были исследованы изменения размеров тела при кровососании
у следующих видов иксодовых клещей: Ixodes ricinus, Haemaphysalis
punctata, Dermacentor pictus, Rhipicephalus turanicus, Hyalomma asiati-
cum, Все измерения проводились на двух, различных по строению кути-
кулы, участках тела — аллоскутуме и спинном щитке. На аллоскутуме
измерялись его длина вдоль средней линии от заднего края спинного
щитка до заднего конца тела, а в поперечном направлении — ширина на
уровне переднего края перитрем, обычно совпадающая с максимальной.
Для спинного щитка измерялись его максимальная длина по средней ли-
нии и максимальная ширина. В отдельных случаях, кроме того, измеря-
лись ширина и длина кокс, бедер и голеней I пары ног у голодных и напи-
тавшихся особей.
На основании полученных данных для всех фаз Ixodes ricinus было вы-
числено (в %) абсолютное увеличение размеров по сравнению с исходным,
причем размеры голодного клеща принимались за 100%, и удельный при-
рост размеров за последующие дни питания.
Абсолютное увеличение размеров для любого дня питания вычислялось
по формуле
а = -^-100,
*0
где а — абсолютное увеличение длины или ширины для n-го дня питания;
Zn — длина или ширина в n-й день; Zo — длина или ширина голодного
клеща.
Удельный прирост характеризует скорость изменений длины или ши-
рины измеряемой части тела (в %) за любые дни питания и вычисляется
по формуле
,3=fi +Zn+1 ~ /пЛ юо,
\ tl'Il /
где р — удельный прирост длины или ширины за сутки, Zn+1 и Zn — длина
или ширина за последовательные дни питания и Z — время между двумя
последовательными измерениями в сутках. Как видно из приведенных
формул, абсолютное увеличение размеров аналогично абсолютному уве-
личению в весе, а удельный прирост размеров — удельному привесу.
Результаты проделанных измерений свидетельствуют, что у всех изу-
ченных видов линейные размеры идиосомы насосавшихся клещей в не-
сколько раз больше, чем у голодных. Напротив, длина и ширина спин-
ного щитка практически не меняются (табл. 25).1 Точно так же не увели-
чиваются во время питания размеры гнатосомы, конечностей и других
участков, построенных из склеротизованной кутикулы. Например, у го-
лодной самки Ixodes ricinus длина голени первой пары ног в среднем
1 Некоторое уменьшение длины и ширины спинного щитка у напитавшихся осо-
бей связано с его изгибанием во время питания.
— 115 — 8*'
Таблица 25
Изменение размеров тела (в мм) иксодовых клещей при кровососании (средние от измерений 25 особей для каждой точки)
1 шой [ТОК внийиш CM St со со о о S 5 о о 1.83 2.13
СПИ1 щь вникЯ м оз 03 03 СО О ю со .81 .12
е в о о оо хН ОЗ
£ В о е За S £ внийиш LO St st оэ оо 0.74 3.52 2.68 10.84
о о Ч Ч св ВНИ1ГН 00 03 03 s-ч о 0.62 3.93 2.22 13.94
§ CJ СПИННОЙ щиток внийиш St О со оз оо хм ст LQ st О о СТ оо со со Х-< х?Ч
g О ВНИ1ЙГ СТ) г- хМ тН ст ст st St О оо СО оз
icephalus fi о о О о х—1 х-Ч
г ;>* к внийиш 0.38 0.77 0.76 2.12 St СО 00 О sM [s-
а ё о ч ч св BHHirtt О 03 03 о о й со о оз 1.45 9.08
т спинной щиток внийиш St со со со о о х—< Х-Ч uO Ю о о’ L-O CO CO 00 тЧ Х-Ч
5 i вншгя со со 03 оз со о st St 03 CT lQ st
о о о о о M M
£ <и 1 1 внийиш СО st st 00 03 ST4 СО St CO О C- uO
О) & о о о оз 03 CT
о ч R св ВНИ1Г1Г О st СО СТ) о о се хн St СТ о’ оз 2.35 10.71
nctata « м О * Д g внийиш St СО со со о о о о Ю st о о 00 CD О CT xJ О
Р. «3 к в о вншгИ 0.23 0.23 О 00 St St о о’ Ю о хм хМ
сд р, внийиш ио 00 st 00 со оз о 00.со
s S оэ в tq X 5J о 2 о о о х-Ч (s.
о н ₽» св вншсИ оз оз со о СО st со со О 03 1.55 8.90
2 « м н внийиш 0.36 0.35 0.55 0.50 1.17 1.26
вншгИ СО со о г- со ю .45 .34
о о о’ о М х-Ч
Ixodes а л лоск у- тум внийиш 0.44 0.91 0.76 1.87 st с2
вншш о St см ст 00 со St со .16 .96
о о О хН оо
Фаза развития и физиологическое состояние Личинка: голодная насосавшаяся Нимфа: голодная насосавшаяся Самка: голодная насосавшаяся
равна 0.57 мм и ширина
0.19 мм, а у полностью напи-
тавшейся — соответственно
0.55 и 0.20 мм.
Характер увеличения раз-
меров идиосомы до некоторой
степени зависит от видовой
принадлежности. Для самок
/. ricinus типичен в основном
ее умеренный рост в длину
и ширину при весьма значи-
тельном относительном уве-
личении веса. У самок Hya-
lomma asiaticum или Derma-
centor pictus рост аллоскутума
в длину и ширину значи-
тельно больше при относи-
тельно меньшем увеличении
в весе. Подобные различия,
видимо, связаны с формой
тела клещей. Напитавшиеся
самки Ixodes ricinus в попе-
речном сечении почти круг-
лые и по форме тела при-
ближаются к капле. Самки
Hyalomma asiaticum или Der-
macentor pictus заметно вытя-
нутые и уплощенные. Рост
аллоскутума в длину и ши-
рину также различен у раз-
ных фаз одного вида. У са-
мок Ixodes ricinus увеличение
его длины в среднем состав-
ляло 772% и ширины 442%,
у нимф 339 % и 246 %, а у ли-
чинок соответственно 376%
и 207 % по отношению к пер-
воначальным размерам.
Большой интерес пред-
ставляет динамика изменения
размеров аллоскутума за по-
следовательные дни питания
(рис. 169). Длина и ширина
его у всех фаз 7. ricinus не-
прерывно увеличивается с
момента окончания подгото-
вительного периода и до кон-
ца кровососания. Лишь в
первые сутки или часы при-
крепления, в подготовитель-
ный период, у самок и нимф
из-за очень сильной потери
воды происходит некоторое
сморщивание покровов идио-
сомы и вследствие этого не-
значительное уменьшение ли-
116 -
нейных размеров. У различных видов величина описываемого сжатия за-
метно варьирует, но никогда не превышает 5—10% от исходных величин.
У некоторых видов Ixodidae из-за кратковременности подготовительного
периода уменьшения размеров вообще не зарегистрировано.
С поступлением крови в кишечник начинается непрерывное увеличение
размеров тела. Ход изменений удельного прироста длины и ширины ал-
лоскутума во многом совпадает с удельным привесом. В первые 1.5—
2 суток периода роста у личинок, 2 суток у нимф и 3—4 суток у самок на-
блюдалось его постоянное увеличе-
ние. К концу этого периода обычно
достигались его максимальные зна-
чения. Затем наступало незначитель-
ное снижение и новый подъем за
12—24 часа до отпадения. Послед-
ний, однако, редко превышал мак-
симальные значения, достигнутые
в предшествующий период. Таким
образом, динамика изменений удель-
ного привеса и удельного прироста
идентичны в подготовительный и
в первую половину периода роста.
Позднее удельный прирост несколько
снижается при сохранении постоян-
ной величины или даже увеличении
удельного привеса. В период растя-
жения сравнительно небольшое уве-
личение удельного прироста сопро-
Рис. 169. Изменения линейных разме-
ров аллоскутума самок Ixodes ricinus
в период питания.
вождается резким подъемом удель- Прерывистая линия — логарифм удельного
прироста; сплошная линия — абсолютное уве-
НОГО Привеса. личение размеров; 1 — длина; 2 — ширина.
Приведенные различия объясня-
ются особенностями роста и растяже-
ния покровов в различные периоды питания. В период роста покровы идио-
сомы растут быстрее, чем происходит накопление крови в полости кишеч-
ника, так что отростки последнего свободно располагаются в полости тела и
не оказывают давления на другие внутренние органы и стенки тела. В ре-
зультате у клещей сохраняется общий уплощенный габитус и рост тела
в длину и ширину происходит значительно быстрее, чем увеличение вы-
соты идиосомы. Напротив, к концу периода роста и на протяжении всего
периода растяжения увеличение размеров кишечника идет значительно
быстрее роста стенок тела. Последнее приводит к увеличению внутрен-
него давления, в свою очередь вызывающего расправление борозд и складок
поверхности идиосомы и растяжение кутикулы. Одновременно происхо-
дит существенное изменение пропорций тела клеща благодаря быстрому
увеличению высоты идиосомы, у полностью напитавшихся особей на
поперечных разрезах она имеет почти круглую или овальную форму.
Этот период обычно отвечает второму подъему скорости удельного при-
роста за 12—36 час. перед окончанием питания (рис. 169).
ПРИСПОСОБЛЕНИЯ К УВЕЛИЧЕНИЮ РАЗМЕРОВ ТЕЛА
ВО ВРЕМЯ ПИТАНИЯ
Расправление борозд и складок. Одним из способов увеличения объема
тела иксодовых клещей служит расправление борозд аллоскутума и вент-
ральной стороны идиосомы во время кровососания. На поперечных срезах
через голодных и напитавшихся клещей видно, что роль отдельных борозд
в расширении тела далеко не одинакова. У личинок со слабо развитыми
- 117 —
бороздами их значение в увеличении объема идиосомы вообще ничтожно.
Лучше других обычно бывают выражены вентральная краевая в передней
части тела и генитальная. Последняя, однако, целиком сохраняется и
у напитавшегося клеща, так что некоторое участие в расширении тела
может принимать лишь первая (рис. 170—174).
У нимф и самок значение отдельных борозд в увеличении объема тела
в основном сходно. Лежащие на аллоскутуме борозды, за исключением
краевых, очень мелкие и сохраняются у полностью напитавшихся кле-
Рис. 170—174. Поперечные срезы через голодных (170—173)
и насосавшихся (174) личинок Ixodes ricinus. Схематизиро-
вано.
На уровне: 170 — второй пары пог, 171 — заднего края спин-
ного щитка, 172, 174 — позади спинного щитка и 173 — на
уровне анального отверстия.
сп — спинной щиток; ак — анальное кольцо и створки анального кла-
пана; гб — генитальная борозда.
щей. У Ixodes ricinus и I. persulcatus в голодном состоянии они неразли-
чимы и выявляются как места прикрепления мускулатуры лишь у доста-
точно напитавшихся индивидов. Напротив, у представителей родов Нуа-
lomma, Dermacentor и Rhipicephalus они довольно глубокие и при их
расправлении достигается определенное увеличение объема тела.
Наибольшее значение при расширении имеют дорсальная и вентраль-
ная краевые борозды, достаточно хорошо развитые у большинства изу-
ченных видов. Они представляют значительные углубления внутрь тела
с многочисленными более мелкими складками кутикулы. У напитав-
шихся клещей они полностью исчезают (рис. 16—20).
У самцов иксодовых клещей мягкий аллоскутум неразвит и вся спин-
ная сторона покрыта сильно склеротизованным щитом. Лишь по краям
— 118 -
тела и снизу между вентральными щитками сохраняется мягкая и растя-
жимая кутикула. Увеличение объема тела возможно здесь за счет растя-
жения этих ограниченных участков. Значительная роль в увеличении
объема тела принадлежит расправлению боковых борозд. Последние
очень сильно развиты и, начинаясь от гнатосомы, идут до заднего конца
тела. Кроме того, небольшие борозды имеются между вентральными
щитками. В бороздах расположены многочисленные неправильные складки
кутикулы (рис. 21—22). При насыщении происходит расправление опи-
санных борозд и растяжение мягких участков покровов, и вес самцов
увеличивается в 1.5—2 раза.
В роде Hyalomma, где особенно
сильно развиты латеральные
участки мягкой кутикулы, по-
следние после насыщения кле-
щей выдаются в виде двух мас-
сивных мешков по бокам спин-
ного щитка.
Пример с самцами иксодовых
клещей показывает, что одно
лишь расправление борозд и
складок идиосомы, даже в сое-
динениц с ограниченным рас-
тяжением кутикулы, может
обеспечить только очень незна-
чительное увеличение объема
тела. Огромное увеличение
размеров личинок некоторых
видов аргазид обеспечивается
редкой среди членистоногих
способностью к межлиночному
Рис. 175. Изменения сухого веса и толщины
кутикулы идиосомы самок Boophilus caudatus
во время питания (по Kitaoka a. Yaiima,
1958а).
росту кутикулы.
У быстро питающихся нимф
и имаго аргасовых клещей уве-
личение объема тела при крово-
сосании происходит преимуще-
ственно за счет расправления радиальных складок эпикутикулы, образую-
щих систему локальных очагов растяжения. Несмотря на меньшие возмож-
ности в увеличении объема (количество однократно поглощаемой крови пре-
вышает вес тела всего в 5—12 раз), подобный механизм растяжения по-
кровов имеет определенные преимущества по сравнению с расправлением
системы эпикутикулярных складок во время роста кутикулы иксодид. Рас-
правившиеся при кровососании радиальные складки и гребни в силу ме-
ханической эластичности легко возвращаются к исходной структуре и мо-
гут находиться в любом промежуточном состоянии. Расправление доста-
точно развитых параллельных складок иксодид, напротив, необратимо
и возможно только при однократном питании на данной фазе.
Изменение веса кутикулы. Увеличение сухого веса кутикулы во время
питания иксодовых клещей было впервые установлено А. Лисом (Lees,
1952) и в дальнейшем подтверждено и детализировано в наших исследова-
ниях (Балашов, 19576, 19606) и работе С. Китаока и А. Яйма (Kitaoka
a. Yajima, 1958а). В наших опытах изменения сухого веса кутикулы
во время питания прослежены для самок Hyalomma asiaticum и Ixodes
ricinus.
У голодных самок Hyalomma asiaticum сухой вес кутикулы составлял
в среднем 3.1 мг, у частично насосавшихся к концу периода роста —
33.2 мг и у полностью насосавшихся — 34 мг (табл. 26). Для Ixodes rici-
- 119 -
nus аналогичные показатели были 0.5, 6.2 и 6.4 мг и совпадали с дан-
ными А. Лиса (Lees, 1952).
Как видно из приведенных цифр и рис. 175, увеличение сухого веса
кутикулы за время кровососания достигает весьма внушительных размеров.
Отложение новых слоев кутикулы происходит в основном в период роста,
а затем почти полностью прекращается. Интенсивность роста кутикулы
во время питания до некоторой степени пропорциональна увеличению
в весе тела и последующей яйцевой продуктивности клещей. Так, самки
/. canisuga, поглощающие по сравнению с /. ricinus значительно меньше
крови, отличались также меньшим увеличением сухого веса кутикулы
(табл. 26).
Рост и растяжение кутикулы. С самого начала питания иксодовых
клещей вместо уменьшения толщины кутикулы от растяжения мы, наобо-
рот, наблюдаем ее значительное утолщение, соответствующее приросту
сухого вещества в этот период. Например, у голодной самки Ixodes ri-
cinus толщина мезокутикулы 54 и эндокутикулы 5 мк, а к концу периода
роста уже соответственно 120 и 48 мк (табл. 27 и рис. 178). У самок Нуа-
Таблица 26
Изменения веса кутикулы у самок иксодовых клещей
во время кровососания
Вид клеща Вес клеща, мг Сухой вес кутикулы, мг
голод- ный конец периода роста насосав- шийся голод- ный конец периода роста насосав- шийся
Ixodes ricinus 2.2 60-70 286 0.5 6.2 6.4
I. canisuga1 . . 2.2 — 59 0.6 — 3.9
Hyalomma asiaticum 12.0 100-200 1711 3.1 33.2 34.0
H. savignyi 1 10.7 — 812 2.0 — 33.1
Таблица 27
Изменения толщины (в мк) прокутикулы аллоскутума и спинного щитка
Ixodes ricinus в период кровососания
(средние от 100 промеров для каждой точки)
Фаза развития и степень насыщения Аллоскутум Спинной щиток
прокутикула гипо- дерма
мезоку- тикула эндокути- кула общая толщина
Личинка: голодная 10 3 13 2 11
перед началом растяжения 8 5 13 9 и
полностью напитавшаяся 3 5 8 3 и
Нимфа: голодная 24 6 30 5 16
перед началом растяжения 28 8 36 18 16
полностью напитавшаяся 11 8 19 3 16
Самка: голодная 54 5 59 8 29
перед началом растяжения 120 48 168 50 29
полностью напитавшаяся 42 28 70 21 29
1 По Lees, 1952.
— 120 —
lomma asiaticum в этот период в прокутикуле образуются два новых слоя —
внутренний слой мезокутикулы в 90 и эндокутикулы в 20 мк, компенси-
рующие уменьшение толщины покровов за счет растяжения (табл. 28
и рис. 39, 40).
Таблица 28
Изменения толщины (в мк) прокутикулы аллоскутума и спинного щитка
Hyalomma asiaticum в период кровососания
(средние от 100 промеров для каждой точки)
Фаза развития и степень насыщения Аллоскутум Спинной щиток
внешняя зона мезоку- тикулы прокутикула общая толщина гипо- дерма
внутрен- няя зона мезоку- тикулы эндоку- тикула
Личинка: голодная 9 9 2 3
перед началом растяже- ния 5 3 3 И 6 3
полностью напитавшаяся 3 4 3 10 3 3
Нимфа: голодная 16 — 16 3 и
перед началом растяже- ния 16 34 8 58 29 и
полностью напитавшаяся 8 14 6 28 16 и
Самка: голодная 80 — — 80 7 40
перед началом растяже- ния 45 90 20 155 30 40
полностью напитавшаяся 19 44 8 71 14 40
Утолщение кутикулы в период роста происходит, несмотря на по-
стоянное и значительное ее растяжение. О величине последнего можно
вполне объективно судить по заметному увеличению расстояний между
соседними поровыми канальцами. У голодной самки Ixodes ricinus они
отстоят друг от друга на 0.7—0.9 мк. К концу периода роста эти интер-
валы увеличиваются до 1.5—2 мк, а у полностью напитавшегося клеща
до 3 мк и более. По данным А. Лиса (Lees, 1952), у голодных самок того же
вида на 1 мм2 кутикулы приходится в среднем 1 400 000 поровых каналь-
цев, а у частично насосавшейся лишь 405 000. В связи с растяжением
ниже лежащих слоев гибкая, но нерастяжимая эпикутикула, собранная
в складки, постепенно расправляется и складки сглаживаются.
Примерно за 1—2 суток до отпадения утолщение кутикулы почти пре-
кращается. Этому моменту обычно соответствует и отмеченное ранее пре-
кращение увеличения ее сухого веса. Идущее ускоренными темпами об-
щее увеличение размеров клеща обеспечивается теперь главным образом
за счет растяжения. Эластичная кутикула идиосомы, достигшая к периоду
роста своей максимальной толщины, начинает быстро утоньшаться
(табл. 27 и 28).
У самок Ixodes ricinus в последний период кровососания толщина
мезокутикулы снижается со 120 до 42 мк и эндокутикулы — с 48 до 28 мк.
У самок Hyalomma asiaticum толщина наружной зоны мезокутикулы па-
дает с 45 до 19 мк, внутренней зоны — с 90 до 44 мк и эндокутикулы
с 20 до 8 мк. Таким образом, общая толщина прокутикулы уменьшается
в этот период в 2—2.5 раза. Однако вследствие наличия периода пред-
шествующего роста она не меньше или даже больше, чем у голодного
клеща, и обеспечивает достаточную механическую защиту (табл. 28).
- 121 -
Толщина эпикутикулы, как и раньше, не меняется, но ее складки пол-
ностью расправляются. У насосавшегося клеща она становится почти
гладкой (рис. 41, 180).
У личинок и нимф Н, asiaticum процессы роста кутикулы в основном
сходны с описанными для самок. У первых утолщение покровов идет
достаточно интенсивно, так что у насосавшихся особей она примерно
той же толщины, что и у голодных.
Рис. 176—180. Рост и растяжение кутикулы самок Ixodes ricinus при кровососании.
176 — сразу после линьки; 177 — голодавшая 1 год; 178 — 4 суток прикрепления,
вес 36 мг; 179 — 6 суток прикрепления, вес 80 мг; 180 — сразу по отпадении, вес
294 мг.
э г — эпикутикула; мз — мезокутикула; эн — эндокутикула; гп — гиподерма; д — дермальные
железы; пд — протоки дермальных желез; эпс — эпикутикулярные складки.
Напротив, у личинок и нимф Ixodes ricinus, поглощающих по сравнению
с самками относительно небольшие количества крови, рост кутикулы
менее интенсивен. У них перед началом периода растяжения сохраняется
исходная толщина кутикулы 13 мк, а у полностью напитавшихся она
уменьшается до 8 мк (табл. 27). У напитавшихся нимф к моменту отпадения
толщина покровов также несколько меньше, чем у голодных. О росте
кутикулы в данном случае можно судить в основном по значительному
увеличению гиподермальных клеток и усилению их синтетической ак-
тивности.
Среди аргазид рост кутикулы обнаружен нами на стадии многоднев-
ного питания у личинок Argas persicus (рис. 51—53), а также у личинок
- 122 -
и нимф Alveonasus lahorensis. Процессы роста кутикулы обеспечиваются
отложением новых слоев эндокутикулы на границе с гиподермой. В се-
редине питания общая толщина кутикулы личинок превышает таковую
у голодных особей в два раза (табл. 29). За последние 12—24 часа питания,
Таблица 29
Толщина (в мк) кутикулы аллоскутума аргасовых клещей
(средние от 100 промеров для каждой точки)
Вид клеща Состояние Общая тол- щина кути- кулы без скла- док Экзо- кути- кула Мезо- кути- кула Эндо- кути- кула Вы- сота скла- док Гипо- дерма
Ornithodoros pa- Голодные С а 30 м к и 2 27 1 36 3
pillipes. Насосавшиеся 25 2 22 1 17 3
Alveonasus laho- Голодные 41 3 35 3 44 5
rensis. Насосавшиеся 39 3 33 3 23 5
Argas persicus. Голодные 21 2 17 2 32 4
Насосавшиеся 20 2 16 2 19 4
Ornithodoros pa- Голодные Лич 5.5 инки 0.5 2.0 3.0 3.0 2.0
pillipes. Насосавшиеся 4.5 0.5 2.0 2.0 0.5 2.0
Alveonasus laho- Голодные 5.5 0.5 2.0 3.0 6.0 2.5
rensis. В середине кровососа- ния 12.5 0.5 4.0 8.0 3.0 12.0
Насосавшиеся 9.0 0.5 4.0 4.5 1.0 5.0
Argas persicus. Голодные 5.0 0.5 3.0 1.5 5.0 3.0
В середине кровососа- ния 12.5 0.5 4.0 8.0 3.0 19.0
Насосавшиеся 8.5 0.5 6.0 2.0 1.0 5.0
как и у иксодовых клещей, начинается быстрое растяжение покровов,
толщина их заметно уменьшается и одновременно заканчивается расправ-
ление системы эпикутикулярных складок. Последние у личинок арга-
совых клещей, как и у иксодид, образуют систему из взаимно параллель-
ных рядов по всей поверхности идиосомы.
Несомненно, что у иксодовых клещей и личинок некоторых аргазид
наблюдается строгая координация процессов роста и растяжения покро-
вов. Эпикутикула не способна к растяжению, но обладает высокой гиб-
костью и собрана на растяжимых участках в правильную систему складок.
При растяжении прокутикулы эпикутикулярные складки расправляются,
предотвращая нарушение целостности покровов. Чрезмерное утоньшение
прокутикулы при растяжении компенсируется интенсивным отложением
новых слоев. Большую часть периода кровососания процессы роста ку-
тикулы доминируют над растяжением и толщина ее постоянно увеличи-
вается. Лишь в самом конце питания, когда происходит резкое увеличение
скорости кровососания, процессы роста уже не успевают за исключительно
быстрым увеличением объема. Решающую роль с этого периода начинают
играть процессы механического растяжения. Однако вследствие созданного
на предшествующем этапе «резерва кутикулы» толщина последней даже
- 123 -
после максимального растяжения обеспечивает достаточную прочность
покровов.
Секреторная активность гиподермы во время питания. Росту кутикулы
на стадии питания предшествует возобновление секреторной активности
гиподермальных клеток. У голодных самок Hyalomma asiaticum они очень
мелкие, границы между отдельными клетками почти неразличимы
(рис. 181). Общая высота гиподермального слоя составляет 5—8 мк.
Цитоплазма умеренно вакуолизирована и слабо базофильная. При окраске
метилгрюн-пиронином по Браше она остается прозрачной и в ней не вы-
являются участки с высоким содержанием РНК. Ядра мелкие, слабо
Рис. 181 — 184. Изменения в гиподермальных клетках самки Hyalomma asiaticum
на стадии питания.
181 — голодная; 182 — начало периода роста; 183 — конец периода роста; 184 — конец
кровососания.
я — ядро в интерфазе; пр — ранняя профаза; мф — метафаза митоза; н — нуклеола; эн.— эндо-
кутикула; мз — мезокутикула; сб — субкутикула.
овальные, размером 5—6x3.5—4 мк. Внутри каждого ядра содержится
по одной интенсивно красящейся нуклеоле, богатой РНК. Митотические де-
ления или другие внешние проявления ядерной активности отсутствуют.
Во время питания иксодовых клещей картина быстро меняется. Раз-
меры гиподермальных клеток начинают увеличиваться. Они сильно вы-
тягиваются, принимая столбообразную форму (рис. 182). К концу пе-
риода роста высота гиподермального слоя у самок Н. asiaticum достигает
в среднем 30 мк, увеличиваясь в 3—4 раза (рис. 183). Цитоплазма клеток
становится сильно базофильной. При окраске метилгрюн-пиронином
она принимает розовый оттенок за счет высокого содержания РНК.
По данным А. Лиса (Lees, 1952), в этот период в ней также резко увели-
чивается содержание щелочной фосфатазы. Увеличение количества двух
последних компонентов указывает на наличие очень интенсивного син-
теза белков, идущих на построение новых слоев прокутикулы. Содер-
жание полисахаридов, как и у голодных клещей, остается на низком
уровне.
- 124 -
Размеры ядер в период роста сильно увеличиваются, достигая 9—
10x7—8 мк. Внутри ядра заметно увеличиваются размеры нуклеолы.
Среди основной массы покоящихся ядер появляется значительное коли-
чество их на разных фазах митотической активности (рис. 42, 182). Таким
образом, среди иксодовых клещей мы наблюдаем довольно редкое среди
членистоногих размножение гиподермальных клеток в межлиночный
период и даже в имагинальной фазе (табл. 30).
Таблица 30
Изменение количества ядер гиподермальных клеток и интенсивность
митотических делений у Hyalomma asiaticum при кровососании
(по данным подсчета ядер на поперечном срезе сразу позади последних кокс)
Фаза развития и этапы питания Вес клеща, в мг Количество ядер на од- ном попереч- ном срезе Количество митозов на 10 000 ядер
Личинка:
голодная 0.037 74 + 3 0
подготовительный период 0.035 73 + 5 0
начало периода роста . 0.048 108+ 5 139
середина периода роста 0.065 176 + 13 80
конец периода роста 0.140 219+ 9 7
окончание кровососания Нимфа: голодная 0.571 247 + 11 0
0.23 273+ 5 0
подготовительный период 0.20 286+ 7 0
начало периода роста 0.9 483 + 11 291
середина периода роста 2.4 698+ 9 201
конец периода роста 4.6 861 + 17 9
окончание кровососания Самка: 30.2 914 + 15 0
голодная 14.6 1164 + 23 0
подготовительный период 13.9 — 0
начало периода роста 21.2 — 120
середина периода роста 50.4 — 40
конец периода роста . 146 — 1
окончание кровососания 1711 — 0
Вследствие интенсивного прироста клеток, несмотря на очень сильное
увеличение поверхности кутикулы, гиподермальные клетки не только
не уплощаются, но, наоборот, вытягиваются в высоту. В табл. 30 пред-
ставлены результаты подсчетов количества ядер гиподермальных клеток
на поперечных срезах через идиосому клеща Н. asiaticum, проходящих
на одном и том же уровне позади последней пары кокс. Из таблицы видно,
что наиболее интенсивная митотическая активность наблюдается в на-
чале периода роста, а к моменту окончания питания деление клеток гипо-
дермы прекращается. На личиночной и нимфальной фазах процент деля-
щихся клеток выше, чем у самок, так что к концу питания количество
ядер (на один поперечный срез) увеличивается почти в 3 раза. У самок об-
щий подсчет гиподермальных клеток в конце питания становится затруд-
нительным из-за невозможности получения хороших срезов через клещей
с кишечником, растянутым кровью.
С началом последнего периода питания иксодид наряду с растяжением
кутикулы происходит быстрое уплощение гиподермы. Высота ее умень-
шается в два раза и больше (рис. 184). В гиподермальных клетках самок
наблюдается заметное уменьшение содержания РНК. У нимф и личинок
содержание рибонуклеиновой кислоты остается на достаточно высоком
уровне и у полностью напитавшихся особей. Параллельно с уплощением
- 125 -
клеток происходит уменьшение размеров ядер, правда, незначительное —
до 8x6 мк.
Рост кутикулы аргасовых клещей в период питания также связан
с подъемом секреторной активности гиподермальных клеток. Высота
их увеличивается с 3 до 19 мк у личинок Argas persicus и с 2.5 до 12 мк
у Alveonasus lahorensis (табл. 29). Уплощение клеток происходит лишь
в самом конце кровососания. Диаметр ядер увеличивается в 2—2.5 раза,
а рибонуклеиновых ядрышек еще больше. На высокую секреторную ак-
тивность указывает также повышение содержания РНК в цитоплазме.
У голодных личинок ода лишь слегка базофильна, а во время питания на-
чинает интенсивно окрашиваться пиронином. На контрольных срезах,
обработанных рибонуклеазой, окраска отсутствует. В начале кровосо-
сания наблюдается волна митотических делений гиподермальных клеток
и в них часто видны различные стадии митозов.
МЕХАНИЗМ ПРИЕМА ПИЩИ
Акт питания иксодоидных клещей представляет сложный физиологи-
ческий процесс, определяющийся специфическими анатомо-физиологи-
ческими особенностями их ротового аппарата и слюнных желез, а также
характером механизмов всасывания крови и выделения слюны в этот
период. В литературе с различной степенью подробности описано строе-
ние и, в меньшей степени, функционирование ротового аппарата у клещей
Ixodes ricinus (Sen, 1935; Arthur, 1946), I. persulcatus (Никонов, 1958),
I. hexagonus (Arthur, 1951, 1953), Dermacentor andersoni (Gregson, I960),
D. parumapertus (Arthur, 1957), Rhipicephalus evertsi (Arthur, 1962), Orni-
thodoros papillipes (Sen, 1935) и О. moubata (Bertram, 1939). Несмотря на
значительное количество исследований, до сих пор оставались спорными
такие принципиальные вопросы, как положение ротового отверстия
в глубине предротовой полости или на конце особого стилета, разделение
предротовой полости на слюнной и пищевой каналы, существование гло-
точных клапанов, происхождение и строение футляров хелицер. При от-
сутствии единой точки зрения на анатомическое строение ротового ап-
парата существующие объяснения его функционирования носят сугубо
гипотетический характер. Существует лишь несколько работ, где при-
водятся прижизненные наблюдения над присасыванием, питанием и вы-
делением слюны у клещей Dermacentor andersoni и видов Ornithodoros
(Gregson, 1957, 1960, 1962а, 1967; Lavoipierre a. Riek, 1955).
До настоящего времени проведено значительное количество исследо-
ваний строения слюнных желез отдельных видов клещей (Pagenstecher,
1861; Christophers, 1906; Bonnet, 1907; Nordenskiold, 1908; Суворов, 1908;
Kunssberg, 1911; Samson, 1909a; Robinson a. Davidson, 1913—1914;
True, 1932; Остроумова, 1939; Douglas, 1943; Till, 1961; Chinery, 1965b),
противосвертывающего действия слюны и присутствия в ней других био-
логических активных или токсических компонентов (Nuttall a. Strick-
land, 1908; Cornwall a. Patton, 1914; Павловский и Ходукин, 1929; Та-
лызин и Пчелкина, 1949; Gregson, 1957; Markwardt u. Landmaim, 1958,
1961; Markwardt, 1963). В то же время в связи с глубокими цитологи-
ческими изменениями, претерпеваемыми железистыми клетками слюн-
ных желез в процессе секреторной активности, и значительными ва-
риациями их строения в пределах различных систематических групп
существует большая путаница в гомологизации типов железистых кле-
ток и даже самих альвеол у немногих изученных в этом отношении
видов. Вопрос о связи известных типов железистых клеток с опреде-
- 126 -
ленными компонентами слюны по-прежнему оставался открытым ввиду
отсутствия специальных гистологических исследований.
Наиболее подробно изучены гистопатологические изменения кожи
в местах прикрепления клещей. Эти работы в нашей стране впер-
вые были начаты Е. Н. Павловским и в дальнейшем превратились
в самостоятельное направление исследований (Павловский и Алфеева,
1941, 1949; Talice, 1930; Hoeppli a./Feng, 1931; Олсуфьев и Каграманов,
1947; Берлин, 1956а, 19566, 1957; Кузнецова, 1957; Лотоцкий и др.,
1959; Foggie, 1959; Первомайский и др., 1963). Тем не менее оставался
неясным целый ряд существенных вопросов, в частности о происхождении,
составе и функции гомогенного эозинофильного слоя, окружающего по-
груженный в ткани хоботок иксодид, а также об участии определенных
компонентов слюны в этих изменениях.
Учитывая недостаточность, а в ряде случаев и ошибочность материалов
о строении ротового аппарата и слюнных желез кровососущих клещей,
а также почти полное отсутствие данных о механизме приема пищи и слюно-
отделения, мы провели детальное изучение этих вопросов, главным об-
разом на клещах Ixodes ricinus, Hyalomma asiaticum и Ornithodoros pa-
pillipes, а в ряде случаев и на других видах. Материалы этих исследований
(Балашов, 1957в, 19616, 1965а, 19656; Балашов и Джафаров, 1966) вместе
с данными из цитированных выше работ легли в основу настоящего раз-
дела монографии.
РОТОВОЙ АППАРАТ
Строение ротового аппарата было изучено на серийных срезах самок
Ornithodoros papillipes и Hyalomma asiaticum и участков покровов хозяев
вместе с прикрепившимися к ним нимфами Н. asiaticum в разной степени
насыщения, а также на тотальных препаратах отдельных отпрепарованных
частей гнатосомы. Анатомическое строение гнатосомы было рассмотрено
ранее (см. стр. 8—11), и в настоящем разделе рассматриваются ее функцио-
нально-морфологические особенности, необходимые для понимания ме-
ханизма приема пищи.
Hyalomma asiaticum. Нижняя половина хоботка образована вытяну-
тым вперед выростом основания гнатосомы — гипостомом. Последний
имеет слегка ложковидную форму, расширяясь и уплощаясь к дисталь-
ному концу (рис. 185—188). Его вентральная поверхность выпуклая и
покрыта рядами мощных зубцов, отогнутых назад. Дорсальная поверх-
ность гипостома слегка вогнутая и медиально несет пищевую борозду.
В дистальной части она представлена сравнительно мелким U-образным
углублением. Проксимально борозда углубляется, фланкируется с бо-
ков двумя продольными гребнями эпикутикулы, и просвет ее на попе-
речном разрезе становится V-образным. В дистальной части пищевой
борозды кутикулиновый слой плотно прилегает к экзокутикуле (рис. 188),
а в проксимальной отходит от нее и образует так называемую гипостомаль-
ную мембрану, так что между ними создается свободное пространство
(рис. 189-190).
В работах Р. Артура (Arthur, 1951, 1953, 1957, 1962) эта гипостомаль-
ная мембрана ошибочно трактуется как эпифаринкс, сросшийся по краям
с гипостомом, а прикрываемая им сверху полость — как пищевой канал.
Наши наблюдения заставляют отказаться от подобного толкования, так
как пищевой канал проходит не под, а над гипостомальной мембраной
и расположенная под ней полость отсутствует в передней половине хо-
ботка, не открываясь наружу. Подобного же мнения придерживается
Д. Грегсон (Gregson, 1960). У Hyalomma asiaticum и других изученных
нами видов поднятия и опускания мембраны оказались очень незначи-
- 127 -
тельными, чисто пассивными и вряд ли существенно влияют на изменения
объема предротовой полости во время питания.
Внутри гипостома по всей его длине прослеживается дорсо-вентраль-
ный шов, свидетельствующий о первично парном происхождении гипо-
Рис. 185—190. Строение передней половины гнатосомы самки Hyalomma asiati-
cum на поперечных срезах.
Срезы на уровне: 185 — концов пальцев хелицер, 186 — начала наружных хе-
лицеральных футляров, 187 — середины наружных хелицеральных футляров,
188 — слияния медиальных стенок хелицеральных футляров, 189 — начала
замкнутой предротовой полости, 190 — передней части основания гнатосомы.
т — тектум; пл — пальпы; плт — терминальный пальпальный членик; сх — ствол хелицеры;
мо — мембрановидное окно; пх — подвижный палец хелицеры; пщ — мембрановидный плащ;
нхф — наружные и кхф — конические хелицеральные футляры; вхф — внутренние хелице-
ральные футляры; хм — внутрихелицеральные мышцы; схм — их сухожилия; гп — гипостом;
гпз — гипостомальные зубцы; гпк — внутригипостомальные каналы; гпм — мембрана пищевой
борозды гипостома; гпб — пищевая борозда; пп — предротовая полость; р — рот; ср — слюн-
ной резервуар; сп — главные слюнные протоки; схп — субхелицеральная пластинка; мм —
межкоксальный мост; кг — клиновидный гребень; ко — крыловидные отростки; дкм — дорсаль-
ные мышцы крыловидных отростков; вкм — то же вентральные; г — глотка; го — вентральные
опорные глоточные склериты; дрг — дорсальные, лрг — латеральные и врг — вентральные
расширители глотки; ксг — кольцевые сжиматели глотки; пт — переднее продолжение полости
тела; не — направляющие выросты стволов хелицер.
стома в результате слияния передних выростов кокс педипальп. В каждой
из половин проходит канал. Оба канала сливаются в проксимальной части
гипостома в один непарный, представляющий продолжение полости тела
(рис. 190). У недавно перелинявших особей в этих внутренних полостях
еще сохраняется гиподерма л ьная выстилка.
- 128 -
У клещей Ixodes ricinus, I. hexagonus и I. persulcatus (Arthur, 1946,
1951; Никонов-, 1958) в гипостомальной полости описаны группы дорсо-
вентральных мышц, идущих от боковых стенок пищевой борозды к вентро-
латеральным углам полости. При детальном исследовании полных серий
срезов мы обнаружили подобные мышцы лишь в самом проксимальном
участке гипостома I. persulcatus, но они отсутствовали у Hyalomma asia-
ticum, Dermacentor pictus и Rhipicephalus turanicus. По-видимому, ги-
постомальные мышцы свойственны только видам рода Ixodes, и в этом
отношении они сходны с аргасовыми клещами.
Дорсальная половина хоботка образуется хелицерами. Стволы хелицер
окружены двойными трубчатыми кутикулярными футлярами, происхо-
ждение и строение которых до сих пор вызывает споры. Наиболее мощ-
ные наружные футляры несомненно представляют передний вырост крыши
гнатосомы (тектума). Он расщепляется на переднем конце и дорсально
доходит при втянутых хелицерах до оснований пальцев. С вентральной
стороны они несколько короче и тоньше, так что в передней части хоботка
на поперечных срезах они вначале выглядят как крыша стволов (рис. 186).
Загибаясь вентрально, они заключают последние в твердые трубки.
Гребневидные медио-дорсальные выросты стенок стволов входят в соот-
ветствующие борозды футляров и предотвращают нежелательные боковые
перемещения при скольжении хелицер в передне-заднем направлении
(рис. 187). В дистальной части хоботка наружные хелицеральные фут-
ляры самостоятельны, но плотно прилегают друг к другу почти прямыми
внутренними стенками. Не доходя до основания головки, они сливаются
сперва по дорсальной и позднее по вентральной границе, так что форми-
руется твердое полукольцо, разделенное вертикальной перегородкой
(рис. 189, 189). Нижняя стенка наружных хелицеральных футляров про-
должается в погруженную в основание гнатосомы субхелицеральную
пластинку.
В дистальной части наружная дорсальная поверхность хелицеральных
футляров покрыта многочисленными мелкими зубчиками, облегчающими
фиксацию на хозяине во время питания. Дистальные концы наружных
хелицеральных футляров заворачиваются внутрь и в виде мембрано-
видной оболочки идут назад, прикрепляясь к стволам хелицер спереди от
глоточного отверстия (рис. 187—188). Аналогичные образования описаны
у Dermacentor andersoni (Gregson, 1960) и названы коническими футлярами
хелицер. По-видимому, они играют существенную роль в выдвижении
хелицер, предотвращая проникновение крови и посторонних частиц в хе-
лицеральную полость во время питания.
Позади от конических футляров стволы хелицер вновь окружены
мембрановидной оболочкой, отходящей дорсально от внутренней поверх-
ности тектума, а вентро-латерально — от субхелицеральной пластинки
(рис. 189—196). Морфологическая трактовка этих образований затруд-
нительна, и обычно их называют внутренними хелицеральными футлярами.
Наибольшей сложностью строения отличается передняя часть осно-
вания гнатосомы. Слияние наружных хелицеральных футляров и гипо-
стома в плотное хитиновое кольцо происходит на значительном расстоя-
нии спереди от ротового отверстия, так что образуется обширная морфо-
логически целостная трубка предротовой полости (рис. 189, 190) шириной
0.32 и высотой 0.04—0.08 мм. Ее крышей служит вентральная стенка
наружных хелицеральных футляров, а дном — дорсальная поверхность
гипостома; стенка и поверхность соединяются между собой латерально-
вентральными выростами кокс пальп. В передней трети хоботка морфо-
логическое слияние между его компонентами отсутствует, но благодаря
их тесному прилеганию друг к другу предротовая полость фактически
продолжается до дистального конца гипостома (рис. 25).
9 Ю. С. Балашов — 129 —
По средней линии дорсальной стенки гипостома (дну предротовой
полости) проходит пищевая борозда. В дистальной части она сравнительно
мелкая (ширина 0.07 и глубина 0.02 мм), а в проксимальном направлении
Рис. 191—196. Строение основания гнатосомы самки Hyalomma asiaticum.
Поперечные срезы на уровне: 191 — конца предротовой полости, 192 — ротового
отверстия, 193 — начала глотки, 194 — переднего глоточного клапана, 195 — сере-
дины субхелицеральной пластинки, 196 — заднего конца субхелицеральной пластинки.
Условные обозначения те же, что и на рис. 185—190.
постепенно углубляется до 0.04—0.06 мм и приобретает V-образное по-
перечное сечение (рис. 190). Ротовое отверстие находится в глубине пред-
ротовой полости в месте, где пищевая борозда прикрывается сверху ко-
ротким конусовидным лабрумом (рис. 192).
- 130 -
Часть предротовой полости, продолжающаяся назад над лабрумом
и дорсальной поверхностью субхелицеральной пластинки, называется
слюнным резервуаром (рис. 192—193). Он сильно уплощен дорсо-вент-
рально (высота 0.03 и ширина 0.35 мм), и в его заднебоковые углы откры-
ваются главные выводные протоки парных слюнных желез размером
0.07x0.03 мм. Последние сперва идут в толще субхелицеральной пла-
стинки, а затем отделяются от нее в вентральном направлении (рис. 194—
196). Потолок слюнного резервуара образован вентральной стенкой на-
ружных хелицеральных футляров, переходящей в месте впадения слюн-
ных протоков в субхелицеральную пластинку.
Субхелицеральная пластинка служит главной опорной структурой
для хелицер и глотки. В передней части она соединяется вентро-лате-
ральными выростами со стенками основания гнатосомы и образует меж-
коксальный мост (рис. 190). Далее назад она теряет связь со стенками гна-
тосомы и сильно утолщается (рис. 193—194). После слияния с вентральной
стенкой наружных хелицеральных футляров по ее дорсальной поверх-
ности проходит высокий вертикальный гребень. Он представляет продол-
жение слившихся медиальных стенок наружных хелицеральных футляров
и дорсально переходит во внутренние хелицеральные футляры (рис. 194).
С вентральной стороны к утолщенным краям субхелицеральной пластинки
прикрепляются пучки мышц, идущие от крыловидных отростков, и дор-
сальные расширители глотки (рис. 194, 195). Передний конец субхели-
церальной пластинки продолжается в короткий лабральный вырост
(рис. 25).
Ornithodoros papillipes. Строение ротового аппарата рассматриваемого
вида по общему плану строения очень сходно с таковым иксодовых кле-
щей, но имеется и ряд отличий, связанных с различными способами
поглощения крови в обеих группах. Хоботок аргасовых клещей более
тонкий и не приспособлен к длительному закреплению клеща на теле
хозяина, тогда как пальцы хелицер, напротив, более мощные и приспо-
соблены к быстрому прорезанию покровов (рис. 197, 206).
Степень развития зубцов гипостома, величина подвижных пальцев
хелицер и терминальное или вентральное положение гнатосомы во многом
связаны с продолжительностью питания. Гипостом, вооруженный пра-
вильными рядами направленных назад зубов, служит основным органом
закрепления в покровах хозяина. Чем дольше продолжается кровососание,
тем прочнее должен удерживаться клещ на теле хозяина и тем сильнее
должно быть развито вооружение гипостома. Для быстро питающихся
видов закрепление не столь важно и на первое место выдвигается задача
максимально быстрого поглощения полной порции крови. Поэтому для
них существенную роль играет степень развития пальцев хелицер, обес-
печивающих внедрение в покровы хозяина.
Внутри хоботка, так же как и у иксодовых клещей, имеется трубко-
образная предротовая полость. На поперечных срезах видно, что она
сжата в дорсо-вентральном направлении в уплощенный канал. В дисталь-
ной части этот канал ограничен тесно прилегающими друг к другу ото-
гнутыми краями хелицер и слегка вогнутым уплощенным гипостомом
(рис. 199). На уровне начала хелицеральных футляров трубчатый канал
сохраняется за счет соответствующих изгибов вентральной поверхности
наружных футляров и увеличивающейся вогнутости гипостомального
желоба вместе с его краевыми выростами (рис. 200). Далее назад он, в от-
личие от иксодид, подразделяется вытянутой верхней губой — «стиле-
том» на дорсальную и вентральную половины, представляющие самостоя-
тельные каналы (рис. 201).
Нижняя половина предротовой полости снизу и с боков ограничена
дном медиального гипостомального желоба, постепенно переходящего
- 131 -
9*
в более глубокий канал. Сверху она прикрыта верхней губой. Дорсаль-
ная поверхность последней вместе с латеральными зонами дорсальной
стенки гипостома формируют дно верхней половины предротовой полости.
Потолок последней образуют слившиеся вентрально наружные футляры
хелицер (рис. 202). Нижний канал заканчивается почти треугольным ро-
товым отверстием (рис. 203), ведущим в глотку. Верхняя трубка откры-
вается в сильно уплощенный слепой мешок слюнного резервуара. Его ниж-
ней стенкой служит эпистомальная пластинка, а верхней — вентральная
поверхность наружного футляра хелицер (рис. 204). В заднебоковые
углы описанной полости открываются протоки слюнных желез. В лите-
ратуре ее необоснованно называют буккальной, т. е. ротовой, хотя она
не имеет никакого отношения к ротовому отверстию. Функционально
она представляет резервуар, в котором скапливается слюна, вытекаю-
щая из протоков слюнных желез.
Эволюция ротового аппарата. Ротовой аппарат иксодовых клещей пред-
ставляет среди паразитических клещей крайнюю степень специализации
к питанию кровью. Тем не менее в нем можно выявить основные струк-
турные компоненты, свойственные остальным паукообразным. Деталь-
ный морфологический анализ ротового аппарата арахнид, выполненный
Р. Снодграссом (Snodgrass, 1948), позволил ему воссоздать исходный
прототип, общий для всех отрядов (рис. 207).
У взрослых особей часть просомы, происходящая из акрона, вклю-
чает лабрум, эпистомальный район и узкую медиальную полоску пе-
редней стенки тела, соединяющую эпистом с панцирем между основаниями
хелицер. Сомиты хелицер остаются посторально, но сами хелицеры в ре-
зультате преорального перемещения занимают переднее положение, а их
стернальные участки почти полностью редуцируются. Педипальпы, исклю-
чая Palpigradi, также сдвигаются вперед по бокам рта и дорсально соеди-
няются с эпистомом, формируя межкоксальный мост. Стернальная пла-
стинка педипальпального сегмента образует дейтостернум, выступающий
перед ротовым отверстием и формирующий нижнюю губу. Рот погружен
в предротовую полость, ограниченную с боков коксами педипальп, снизу
разрастаниями кокс педипальп или дейтостернумом и сверху лабрумом,
и ведет в глотку сосательного типа.
Ротовой аппарат клещей претерпел по сравнению с приведенной схемой
значительные видоизменения, в основных чертах сводящиеся к следующему
(рис. 208). Хелицеры и педипальпы объединяются в самостоятельном от-
деле тела — гнатосоме (капитулуме, головке). В его же состав входит
большая часть сохранившегося акрона, тогда как глазная область послед-
него, как у остальных паукообразных, значительно смещается назад
и сливается с тергитами просомальных сегментов (идиосомы иксодовых
клещей). Дорсальная поверхность гнатосомы склеротизуется над основа-
ниями хелицер и образует крышу, или тектум. Латерально последний
сливается с дорсальными разрастаниями гнатококс педипальп, которые
одновременно сливаются между собой вентрально по средней линии.
В результате образуется характерное для большинства Parasitiformes,
а по мнению Снодграсса вообще для всех клещей твердое хитиновое кольцо
основания гнатосомы.
Вентрально передние коксальные отростки педипальп вытягиваются
вперед, сливаются по средней линии и образуют гипостом, представляю-
щий дно предротовой полости. Сверху ротовое отверстие прикрыто лаб-
румом, прикрепляющимся задним концом к субхелицеральной пластинке.
Последняя гомологична эпистому других арахнид, так как она всегда
участвует в образовании межкоксального моста, а к ее нижней поверх-
ности прикрепляются дорсальные дилататоры глотки. Эмбриологические
- 132 -
Рис. 197—206. Строение гнатосомы самки Ornithodoros papillipes.
197 — вид снизу гнатосомы и окружающих ее частей идиосомы, пальпа слева удалена;
198 — продольный разрез; поперечные срезы на уровне: 199 — дистального конца
гипостома, 200 — переднего конца лабрума, 201 — средней части гипостома,
202 — слияния наружных хелицеральных футляров, 203 — ротового отверстия,
204 — слюнного резервуара и переднего конца глотки, 205 — эпи стома и оснований
хелицеральных стволов; 206 — отдельная отпрепарованная хелицера.
кл — клюв идиосомы; гцк — щеки идиосомы; п — пальпа; г — гипостом; ог — основание гнатосомы;:
рж — рог органа Жене; пх — подвижный палец хелицеры; сх — ствол хелицеры, к — камеросто-
мальная складка; ох — основания стволов хелицер; нф — наружные, кф — конические и вф — внут-
ренние хелицеральные футляры; т — тектум; ex — внутрихелицеральные мышцы; кн — каналы
сухожилий внутрихелицеральных мышц; скн — слюнной канал предротовой полости; пкн — пище-
вой канал предротовой полости; лб — лабрум; пк — передняя лабральная камера; зк — задняя
лабральная камера; ср — слюнной резервуар; эп — эпистом; эпг — боковые гребни эпистома;
гпб — гипостомальная борозда; гк — внутригипостомальные каналы; ргж — мышцы-расширители
гипостомального желоба; р — рот; кле — клиновидный вырост; гл — глотка; дргл — дорсальные,
лргл — латеральные и вргл — вентральные мышцы-расширители глотки; пс — главные выводные-
протоки слюнных желез; х — хелицера.
наблюдения над формированием гнатосомы в основном подкрепляют
главные положения Снодграсса.
Ближе всего к гипотетическому прототипу ротового аппарата клещей
приближается гнатосома некоторых свободноживущих гамазид, как на-
пример Poecilochirus carabi, детально изученной В. Винклером (Winkler,
1886). Усложнения в ее строении связаны с появлением мембрановидных
футляров хелицер, с различными модификациями гипофаринкса и лабраль-
ных отростков, а также с развитием парных передних гипостомальных
выростов.
Рис. 207—210.
207 — схема строения передней части просомы паукообразного; 208 — то
же гнатосомы клеща (по Snodgrass, 1948); 209 — строение гнатосомы
клеща Sauronyssus saurarum (по Лагутенко, 19626); 210 — то же Orni-
thodoros papillipes (по Балашову, 19616).
т — тектум;^кс — камеростомальная складка; х — хелицера; хф — хелицеральный
футляр; рх —мышцы-ретракторы хелицер; эх — мышцы-экстензоры хелицер; лгн —
мыпщы-леваторы гнатосомы; эп — эпистом; л — лабрум; гп — гипостом; пп — пред-
ротовая полость; ппп — пищевой канал предротовой полости; спп — то же слюнной
канал; р — рот; г — глотка; врг — вентральные расширители глотки; дрг — дор-
сальные расширители глотки; п — пищевод; пс — педипальпальный стернит; тр —
тритостернум.
Недавно А. Б. Ланге (1962), опираясь на взгляды А. А. Захваткина
(1952) о полифилетическом происхождении клещей, выдвинул новую трак-
товку сегментального состава их ротового аппарата. А. Б. Ланге считает,
что в состав гнатосомы в разных отрядах клещей входит различное число
сомитов, а четкая интерсегментальная граница между этим отделом и про-
сомой отсутствует. В связи с этим он предлагает пользоваться более нейт-
ральным термином — гнатемой.
Не затрагивая весьма дискуссионный вопрос о филогенетических
взаимоотношениях разных групп клещей, нам кажется, что в отношении
отряда или подотряда Parasitiformes нет никаких оснований отказы-
ваться от общепринятого термина гнатосома, независимо от систематиче-
ского ранга этой группы. Морфологический состав ее у всех Parasitifor-
- 134 -
mes однороден, а отсутствие интерсегментальной границы с просомой
не имеет принципиального значения. Задняя граница просомы с описто-
сомой у многих паукообразных также не интерсегментальна, но это не вы-
зывает сомнения в самостоятельности данных тагм.
Переход к питанию кровью внес существенные изменения в строение
гнатосомы клещей, причём исключительно специализированный ротовой
аппарат иксодид можно понять лишь при сопоставлении с таковым более
примитивных кровососущих гамазид, детально исследованных в этом
отношении (Hughes, 1949; Gorirossi, 1950; Лагутенко, 1962а, 19626).
Для ротового аппарата Haemagamasus nidi характерно сохранение мно-
гих примитивных черт, в частности массивных клещевидных хелицер
с грубыми зубцами по краям обоих пальцев, а также широкий и короткий
ротовой конус с незамкнутой предротовой полостью. Этот вид еще не спо-
собен получать кровь путем активного прокола кожи хозяина, и ему
свойствен смешанный тип питания, включающий подъедание высохшей
или полужидкой крови вокруг ранок, схизофагия и энтомофагия (Нель-
зина и Данилова, 1956).
Dermanyssus gallinae, Sauronyssus saurarum и Ornithonyssus bacoti —
представители группы облигатных кровососов. Их хелицеры преобразуются
из грызущих в колюще-режущие органы. Стволы их становятся тоньше
и значительно удлиняются. Одновременно происходит вытягивание рото-
вого конуса и образуется почти замкнутая с боков трубковидная предро-
товая полость (рис. 209). Эти виды уже самостоятельно прорезают по-
кровы позвоночных и пьют вытекающую из ранок кровь.
Клещи надсем. Ixodoidea относятся к числу наиболее совершенных
кровососов и их ротовой аппарат приспособлен к поглощению крови не-
посредственно в толще кожи хозяина, куда он погружается на время пи-
тания (рис. 210). Длинные стержневидные хелицеры полностью утратили
первичную клешневидную форму, а число их члеников уменьшается
до двух. Подвижность их пальцев с режущими зубцами ограничена медио-
латеральной плоскостью, и они превратились в исключительно эффектив-
ный режущий орган, легко проникающий сквозь твердый роговой слой
эпидермиса.
Наружные хелицеральные футляры и гипостом с боков тесно приле-
гают друг к другу и формируют сильно вытянутый в переднем направле-
нии хоботок с внутренней трубковидной предротовой полостью. Послед-
няя служит проводящим каналом, обеспечивающим откачку крови или
инфильтрата непосредственно из внутренних слоев дермы, очень богатых
кровеносными сосудами.
Наряду с этими общими чертами между иксодовыми и аргасовыми кле-
щами наблюдаются значительные различия в строении гнатосомы. Они
преимущественно адаптивного характера, связаны с различными типами
паразитизма в этих семействах; детально они рассмотрены в предшествую-
щем разделе. По ряду морфологических признаков ротовой аппарат
аргазид менее специализирован по сравнению с иксодовыми клещами.
Хоботок у них вытянут меньше и внутри его сохраняется длинный эпи-
стом, разделяющий предротовую полость на значительном протяжении
на вентральный пищевой и дорсальный слюнной каналы. Все четыре
пальпальных членика хорошо развиты и подвижно соединены между
собой.
СТРОЕНИЕ СЛЮННЫХ ЖЕЛЕЗ
По своему составу слюнные железы клещей представляют гетероген-
ные образования и сформированы из разных типов альвеол — пирамидаль-
ных и нескольких разновидностей секреторных.
- 135 -
Пирамидальные альвеолы. Альвеолы этого типа первоначально счита-
лись одноклеточными образованиями с несколькими ядрами и были наз-
ваны пирамидальными клетками — Pyramidenzellen (Christophers, 1906;
Bonnet, 1907; Nordenskiold, 1908; Samson, 1909a, и др.). Нашими иссле-
дованиями и электронной микроскопией ультратонких срезов (Джафа-
ров, 1964, 19656) было показано, что они построены из одинаковых клеток
и представляют многоклеточные органы (рис. 211—213). Границы между
отдельными клетками плохо различимы на обычных гистологических
срезах в световом микроскопе, но очень хорошо выявляются при электрон-
номикроскопическом исследовании. Пирамидальные альвеолы встречаются
в передней половине слюнной железы и сидят только на главных вывод-
ных протоках. Форма альвеол варьирует от почти правильной пирамиды
до грушевидной или неправильно многоугольной с вершиной, направлен-
ной в сторону выводного протока. Размеры альвеол колеблются в преде-
лах 40—60 мк у Ornithodoros papillipes, 35—45 мк у Ixodes ricinus и 26—
35 мк у Hyalomma asiaticum. Характерной особенностью альвеол этого
типа служит присутствие периферической зоны из ориентированных почти
перпендикулярно к базальной мембране волокнистых структур. В элект-
ронном микроскопе было установлено, что эти волокна представляют
глубокие внутренние впячивания базальной цитоплазматической мем-
браны. Между ними располагается основная масса митохондрий (рис. 237).
Ядра лежат в центральной, относительно гомогенной цитоплазматической
зоне и имеют округлую или, реже, неправильно многоугольную форму.
У Ornithodoros papillipes все ядра одной альвеолы примерно одинаковых
размеров, тогда как у иксодовых клещей одно или два ядра значительно
крупнее остальных (рис. 211—213). Апикальные концы клеток тесно
прилегают друг к другу и внутриальвеолярная полость не выражена.
Кутикулярная выстилка выводных протоков постепенно истончается
в центральной части альвеол.
Заметных изменений в строении и размерах пирамидальных альвеол
с момента окончания их дифференцировки на стадии линьки до оконча-
ния питания выявить не удалось, равно как в них не обнаружены и какие-
либо вакуоли с продуктами секреции. В них отсутствуют белковые, муко-
идные и липоидные включения, а цитоплазма бедна РНК. Только между
впячиваниями базальной; цитоплазматической мембраны находится значи-
тельное количество мелких гранул гликогена (диаметром 1—2 мк). При
обработке тотальных препаратов пирамидальных альвеол Ornithodoros
moubata нитросиним тетразолем с избытком янтарнокислого натрия в ка-
честве субстрата в них была выявлена высокая сукцинатдегидрогеназная
активность.
Значительное сходство субмикроскопического строения пирамидаль-
ных альвеол с клетками солевых желез птиц и высокое содержание в них
фермента сукцинатдегидрогеназы, обычно участвующего в транспорте
натрия, представляют косвенные доказательства осморегуляторной функ-
ции этих органов у клещей.
На стадии питания из организма иксодового клеща выводится весьма
значительное количество воды и солей, и кровь позвоночного, поступаю-
Рис. 211—216.
211 — пирамидальная альвеола слюнной железы самки Hyalomma asiaticum;
212 — то же Ixodes ricinus; 213 — то же Ornithodoros papillipes; 214 — секреторная
альвеола самки О. papillipes в стадии максимального заполнения секретом; 215 — то же
в стадии выведения секрета во внутриальвеолярную полость; 216 — то же в начале
накопления секрета в железистых клетках.
впр — выводной проток альвеолы; вап — внутриальвеолярная полость; я — ядра клеток; вс — ва-
куоли с секретом; м — митохондрии; цм — внутренние впячивания наружной цитоплазматической
мембраны; с — секрет в полости альвеолы; эн — эндокутикула; эп — эпикутикула; гп — гиподерма;
сп — спиральная нить.
- 136 -
щая в среднюю кишку, подвергается сильному сгущению. Так, по данным
А. Лиса (Lees, 1946а, 1947), самки Ixodes ricinus к концу питания теряли
до?/3 воды и солей,«содержавшихся в крови хозяина. В то же время у иксо-
дид отсутствуют специализированные осморегуляторные органы типа
коксальных желез, а роль мальпигиевых сосудов в выведении избыточ-
ной воды из организма весьма ограничена. Эти факты вместе с данными
об очень большом объеме слюны, выделяющейся на стадии питания
(табл. 32), говорят в пользу осморегуляторной функции слюнных желез.
Внутри последних специализированными органами водно-солевого обмена
могут быть лишь пирамидальные альвеолы, так как в специализированных
секреторных альвеолах происходит накопление белковых, углеводных
и других высокомолекулярных компонентов слюны.
Осморегуляторные функции слюнных желез были экспериментально
показаны для питающихся самок Boophilus microplus (Tatchell, 1967).
В полость тела питающихся особей инъецировалась вода, меченная три-
тием, а по окончании кровососания определялось содержание трития
в организме клеща и в хозяине.
Установлено, что за время питания вместе со слюной клещом выделя-
лось до 60—70% воды, поглощенной с кровью хозяина, и значительная
часть избыточного NaGl.
У аргасовых клещей главными осморегуляторными органами служат
коксальные железы (см. стр. 164). Объем слюны, выделяемой во время
питания, у них значительно меньше, чем у иксодид, так что слюнные железы
не могут иметь существенного значения в осморегуляции. Следует отме-
тить, что и количество пирамидальных альвеол в слюнных железах аргасо-
вых клещей много меньше, чем у иксодовых.
Секреторные альвеолы. Аргасовые клещи. Аргасовым кле-
щам свойственно наиболее примитивное строение секреторных альвеол,
образованных из одного типа железистых клеток (рис. 214—216). Секре-
торные альвеолы Ornithodoros papillipes сферической формы, слегка вытя-
нутые в направлении выводного протока, диаметр их в зависимости от фазы
секреции колеблется от 70 до 150 мк; состоят из одинаковых конических
клеток, тесно прилегающих друг к другу. Их основания покоятся на тон-
кой неклеточной оболочке — базальной мембране 0.2—0.5 мк толщины,
окружающей каждую альвеолу. Внутри альвеол находится межклеточная
полость, открывающаяся в выводной проток. В альвеолах, целиком за-
полненных секретом, апикальные концы клеток почти полностью запол-
няют просвет. Клетки содержат крупные сферические вакуоли с секретом
размером 2—5 мк, иногда достигающие диаметра 5—15 мк. В наиболее
крупных вакуолях иногда наблюдаются границы между отдельными
более мелкими вакуолями, сливающимися между собой. Заполняя всю
клетку, вакуоли тесно прилегают друг к другу и принимают многогранную
форму. В дальнейшем границы между отдельными вакуолями исчезают
и содержимое их сливается в единую массу секрета, готового к выведению
из клетки. У недавно напитавшихся клещей в клетках, закончивших секре-
цию и свободных от вакуолей, плазма довольно рыхлая, сетевидная и
иногда содержит пустые вакуоли. Ядра крупные, часто принимающие не-
правильную форму. В каждом ядре содержится по одной рибонуклеино-
вой нуклеоле. Дезоксирибонуклеиновая кислота образует сетевидную
структуру с отдельными глыбовидными скоплениями.
Секреторные вакуоли интенсивно чернятся гематоксилином Гейден-
гайна. При азокарминовой окраске одиночные вакуоли бывают оранжево-
красными, а после слияния между собой становятся синими. При обра-
ботке бромфеноловым синим в сулеме они становятся сине-фиолетовыми,
т. е. дают положительную реакцию на белки. Реакция Шифф-иодная
кислота на углеводы обычно не дает отчетливого положительного резуль-
- 138 -
тата с одиночными вакуолями. Однако в клетках, где отдельные вакуоли
сливаются между собой, а их содержимое изливается в просвет железы,
наблюдается общая интенсивно красная окраска. Она не исчезает и на об-
работанных амилазой контрольных срезах. При окрашивании толуиди-
новым синим одиночные вакуоли и слюна в протоках дают интенсивную
метахромазию, характерную для мукоидов. Обработка на липоиды черным
Суданом дает отрицательный результат. Таким образом, основываясь
на проделанных гистохимических реакциях, можно считать, что секрет
альвеол этого типа, представляющий основной компонент слюны,
содержит белково-мукоидные вещества. Свойства их, вероятно, значи-
тельно изменяются в процессе самой секреции. Секрет выделяется сквозь
стенки клеток. Разрушения последних в процессе секреции, подобно
описанному ниже у иксодовых клещей, не наблюдается. Секрет скапли-
вается в полостях альвеол, а затехМ по протокам слюнных желез выводится
в слюнную полость. Заметные количества слюны в протоках слюнных
желез и внутренних полостях альвеол можно наблюдать лишь во время
кровососания или сразу после его окончания (рис. 215). У голодных кле-
щей они остаются пустыми.
В зависимости от фазы секреции размеры и строение альвеол резко
меняются. У голодных клещей большая их часть целиком забита круп-
ными, сливающимися между собой вакуолями с секретом. После оконча-
нияйкровососания появляется значительное число спавшихся альвеол,
свободных от секрета или содержащих лишь одиночные вакуоли (рис. 216).
Однако в целом в слюнной железе после питания всегда остается значитель-
ный процент альвеол, не принимавших участия в образовании слюны и
сохранивших вакуоли с секретом. Через несколько дней после питания
в «пустых» альвеолах вновь начинается образование секрета. Процессы
накопления или выделения секрета в клетках, составляющих одну аль-
веолу, очень часто происходят разновременно и они находятся на разных
фазах секреции.
Иксодовые клещи. У самок Ixodes ricinus и других видов
подсем. Ixodinae имеется один тип секреторных альвеол. Каждая альвеола
образована 7—9 устьевыми клетками, занимающими базальную половину
вокруг альвеолярного выводного протока и расположенных над ними
15—2D заполняющих клеток. У недавно перелинявших особей продукты
секреции не выявляются, цитоплазматическая зона вокруг ядер узкая,
а размеры последних близки в обоих типах клеток. Устьевые и заполняю-
щие клетки можно различать на этой стадии лишь по их положению
в альвеоле.
По окончании послелиночного доразвития устьевые клетки и их ядра
становятся несколько крупнее заполняющих. Цитоплазма устьевых кле-
ток сильно вакуолизирована и плохо окрашивается гистологическими
красителями (рис. 217). В ней появляются одиночные сферические вакуоли,
окрашивающиеся азокармином в красный цвет. Ядра подобных клеток
увеличиваются в размерах с 6 до 8 мк и часто приобретают неправильно
многоугольную форму. В цитоплазме заполняющих клеток внешние про-
явления секреторной активности не выявляются (рис. 218).
Прикрепление к хозяину служит стимулом к началу секреции. Раз-
меры альвеол быстро увеличиваются, причем созревание их не синхронно
для железы в целом. У питающейся особи одновременно обнаруживаются
альвеолы на всех фазах секреторной активности. Размеры заполненных
секретом альвеол достигают 160 X140 мк. Многие из них, особенно в начале
питания, освобождаются от секрета при значительно меньших размерах
(рис. 219, 220).
Цитоплазма зрелых устьевых клеток заполнена вакуолями с секретом.
Они достигают в поперечнике 2—4 мк, окрашиваются азокармином в крас-
- 139 -
ный цвет и чернятся железным гематоксилином. Перед самым опорожнением
содержимое отдельных вакуолей сливается в более крупные капли. Послед-
ние, как и секрет в полости альвеол или в выводных протоках, приобретают
после азокарминовой окраски различные оттенки синего цвета. Ядра
сморщиваются, и в них прослеживаются пикнотические изменения
(рис. 221).
Заполняющие клетки также заметно увеличиваются и принимают пира-
мидальную форму с вершиной в просвет альвеолы. Сферические ядра уве-
личиваются с 5—7 мк у голодных особей до 9 — 11 мк, а внутри них хорошо
выявляются крупные ядрышки. В цитоплазме в большом количестве по-
являются базофильные волокнистые структуры, по-видимому, являющиеся
элементами эндоплазматической сети. В петлях последней, особенно
в апикальной части клетки, появляется большое количество мелких
вакуолей (не более 1 мк), окрашивающихся азокармином в синий цвет.
Освобождение от секрета зрелой альвеолы происходит очень быстро,
так что на срезах редко встречаются промежуточные этапы этого процесса.
В первую очередь изливается секрет устьевых клеток, после чего они
быстро сморщиваются и дегенерируют. В заполняющих клетках выведе-
ние секрета сопряжено с отторжением апикальных участков цитоплазмы.
Базальные половины клеток, содержащие ядра, напротив, продолжают
увеличиваться в размерах, сильно уплощаются и как бы наползают в на-
правлении выводного протока, занимая место дегенерировавших устье-
вых клеток. В результате формируется обширная центральная полость
и альвеола приобретает вид тонкостенного пузырька диаметром 190 X
Х130 мк (рис. 222). В дальнейшем альвеолы спадаются, ядра перестают
окрашиваться и происходит быстрая дегенерация всех клеточных струк-
тур.
У самцов /. ricinus строение слюнных желез сходно с самками, они
отличаются лишь значительно меньшими размерами. В них обнаружены
пирамидальные и секреторные альвеолы, причем последние образованы
из устьевых и заполняющих клеток (рис. 246). Однако в отличие от са-
мок секреторные альвеолы полностью развиты уже у недавно перелиняв-
ших голодных особей, а их цитоплазма заполнена продуктами секреции.
У самок Hyalomma asiaticum и других изученных представителей
подсем. Amblyomminae наблюдается усложнение строения слюнных желез
по сравнению с Ixodinae. В слюнных железах самок мы обнаружили,
включая пирамидальные, три типа альвеол, которые, как и в работе В. Тилл
(Till, 1961), в дальнейшем будут обозначаться римскими цифрами, а входя-
щие в их состав клетки — буквами латинского алфавита. В передней части
желез непосредственно на стенках главных выводных протоков находятся
альвеолы I типа («пирамидальные альвеолы»). Альвеолы II типа встре-
чаются в передних двух третях железы и открываются преимущественно
в первичные разветвления главных выводных протоков, а альвеолы III
типа, составляющие основную массу железистой ткани, встречаются
по всей железе и открываются как в первичные, так и в концевые разветвле-
ния выводных протоков.
Альвеолы II типа у голодных особей почти правильной сферической
формы или слегка суживаются в направлении выводного протока. Диа-
метр их составляет 28—42 мк. Снаружи они, как и альвеолы других ти-
пов, одеты базальной мембраной соединительнотканного происхождения
толщиной 400—700 ммк. Она очень хорошо видна на электронномикроско-
пических фотографиях, тогда как при световой микроскопии даже при
максимальных увеличениях выглядит едва различимой одноконтурной
линией. Внутри альвеолы находится центральный щелевидный просвет,
окруженный цитоплазматической зоной с 17—22 ядрами трех типов
(рис. 223).
Проксимальную-половину альвеолы занимают 4—5 крупных клеток,
забитых множеством вакуолей секреторной природы («устьевые клетки»
Рис. 217—222. Секреторные альвеолы слюнных желез самки Ixodes ricinus.
217 — начальная и 218 — конечная стадии дифференцировки альвеол у
голодной особи; 219 — заполненная секретом альвеола в начале периода
роста; 220 — опорожненная альвеола в начале периода роста; 221—222 —
то же в конце периода роста.
уъ — устьевые клетки; зк — заполняющие клетки; вап — внутриальвеолярная полость;
к — кутикулярная выстилка выводных протоков; вбс — вакуоли с белковым секретом.
в прежних исследованиях и тип «а» в настоящей работе). Диаметр секре-
торных вакуолей колеблется от 1 до 3 мк. Они тесно прилегают друг
к другу наоставляют лишь узкие прослойки цитоплазмы. Азокармином
они красятся в темно-красный цвет, а железным гематоксилином — в чер-
- 141 -
ный или темно-коричневый. Ядра клеток «а» чаще всего неправильной
угловатой или лопастевидной формы, хотя встречаются и почти правиль-
ные сферические. Диаметр их составляет 9—14 мк, и они содержат очень
большое количество мелких и средних глыбок ДНК, а также крупные
сферические нуклеолы.
В дистальной половине альвеолы голодного клеща клеточные границы
в световом микроскопе обычно неразличимы, но хорошо выявляются
при электронной микроскопии. В этой части альвеолы находятся 6—9
более крупных ядер (диаметр 6.5 — 12 мк) сферической формы, принадле-
жащих клеткам типа «Ь», и 7—9 более мелких (3.5—7 мк) слегка овальных
ядер клеток типа «с» (рис. 223).
С началом питания размеры альвеол II типа начинают быстро увели-
чиваться и они достигают даметра 100—160 мк (рис. 224, 225). Объем
внутреннего щелевидного просвета также значительно увеличивается,
и в нем, как и в близлежащих частях выводных протоков, на гистологиче-
ских срезах часто приходится наблюдать коагулировавшую массу секрета.
При азокарминовой окраске она приобретает синий оттенок.
Рост альвеол происходит исключительно за счет увеличения размеров
клеток «Ь». Диаметр их ядер, сохраняющих сферическую форму, увеличи-
вается в несколько раз и достигает 30—50 мк. Ядра интенсивно окраши-
ваются различными красителями, а при реакции Фельгена в них выяв-
ляется большое количество мелких и средних глыбок ДНК. Особенно
характерно для них сильное увеличение и частая фрагментация нуклеол.
Клеточные границы внутри альвеол на этой стадии выявляются очень отчет-
ливо. В цитоплазме большое количество волокнистых элементов с высо-
кой базофилией. В ячейках образуемой ими сети появляется множество
секреторных вакуолей диаметром до 2—4 мк. Во вполне созревших клет-
ках они заполняют значительную часть цитоплазмы и местами, сдавлирая
друг друга, могут приобретать полигональную форму (рис. 225). При аза-
новой методике окраски, в отличие от секреторных вакуолей клеток «а»,
они приобретают различные оттенки синего цвета, тогда как цитоплазмати-
ческая сеть между ними становится фиолетово-розовой.
Клетки типа «а» с началом питания, напротив, начинают быстро умень-
шаться в размерах и сморщиваться в связи с исчезновением в них секретор-
ных вакуолей. Ядра их проявляют дегенеративные изменения, сильно
сжимаются и приобретают способность к сплошному диффузному прокра-
шиванию по Фельгену (рис. 225). С середины стадии питания клетки опи-
санного типа вообще не обнаруживаются или же выглядят небольшими
комочками дегенерирующего материала на границе с выводными прото-
ками (рис. 226).
Форма и размеры клеток типа «с» в период питания существенно не ме-
няются, так же как и структура их цитоплазмы. В полностью созревших
альвеолах они оказываются сильно сжатыми между гипертрофированными
клетками «Ь». В цитоплазме их не удается выявить никаких вакуолей
или включений секреторной природы, ядра приобретают овальную форму
и почти полностью теряют способность окрашиваться по Фельгену.
По мере освобождения от секрета альвеолы II типа заметно сжи-
маются. В клетках «Ь» внутри цитоплазмы появляются обширные пустые
полости, ядра приобретают неправильную форму и постепенно раство-
ряются. В дальнейшем клетки подвергаются полному лизису, причем
из-за разновременности созревания клеток даже в пределах одной аль-
веолы у заканчивающих питание клещей в слюнных железах можно видеть
все стадии секреторной активности и конечные этапы дегенерации (рис. 226).
Разрушение альвеол II типа завершается в первые дни после окончания
питания. Внутри желез в этот период появляется большое количество
фагоцитов, захватывающих продукты лизиса клеток.
- 142 -
Рис. 223—226. Секреторные альвеолы II типа слюнных желез самки Нуа-
lomma asiaticum.
223 — голодный клещ; 224 — через двое, 225 — через пять суток после
прикрепления к хозяину; 226 — полностью напитавшийся клещ сразу по
отпадении.
спр — стенки выводных протоков; вап — внутриальвеолярная полость; а — клетки
типа «а»; б — клетки типа «Ь»; в — клетки типа «с»; вс — вакуоли с секретом.
У голодных особей альвеолы III типа почти правильной сферической
формы, диаметром в 30—40 мк. Внутри их находятся небольшие полости,
сообщающиеся с выводными протоками слюнных желез. В проксималь-
ной половине альвеолы полость окружают 4—5 крупных клеток типа «d»
(рис. 227). Они заполнены сферическими вакуолями с секретом, окраши-
вающимися азокармином, в отличие от клеток «а», в оранжево-красный
цвет. Ядра сравнительно крупные (диаметр 9—12 мк), округлые или ло-
пастевидные со сферическими нуклеолами и большим числом мелких и
средних глыбок ДНК.
Остальная часть альвеолы занята сравнительно мелкими клетками
типа «е». Они пирамидальной формы, с вершиной, направленной в сторону
просвета, и правильными сферическими ядрами диаметром в 6—9 мк.
Объем цитоплазмы невелик, и в ней не удается обнаружить какие-либо
секреторные вакуоли или гранулы.
Во время питания размеры альвеол III типа также значительно увели-
чиваются и их диаметр достигает 75—95 мк. Характерной их особенностью
будет обширная внутренняя полость, формирующаяся за счет роста
и уплощения клеток «е» (рис. 228, 229). На гистологических срезах в клет-
ках данного типа начинают четко выявляться волокнистые структуры,
а по достижении полного развития их апикальные концы, выступающие
в просвет, приобретают зубчатую или неправильно изорванную форму
(рис. 229). Местами происходит отторжение небольших участков апикаль-
ной цитоплазмы в полость альвеолы. Однако морфологически оформленные
гранулы или вакуоли секрета в клетках «е» не обнаруживаются. По-види-
мому, продуктом их секреции служит основное вещество цитоплазмы,
поступающее в процессе медленного разрушения клеток в выводные
протоки слюнных желез. Величина ядер в активно секретирующих клет-
ках несколько увеличивается, они приобретают овальную форму и раз-
меры их составляют 9—14x6—10 мк. Ядра хорошо прокрашиваются
различными основными красителями, содержат много мелких и средних
глыбок ДНК и сравнительно крупные овальные нуклеолы.
В клетках типа «d» основная масса секрета образуется еще до начала
питания, но, в отличие от клеток «а», эти процессы продолжаются и в пер-
вые дни после прикрепления к хозяину. Объем цитоплазмы несколько уве-
личивается, и в ней продолжают появляться новые секреторные вакуоли.
Выделение секрета в просвет железы продолжается на протяжении всего
периода питания. Даже у заканчивающих кровососание самок в некоторых
клетках сохраняются секреторные вакуоли (рис. 230). В цитоплазме та-
ких клеток появляются обширные пустые полости, а ядра сморщиваются
и подвергаются пикнотическим изменениям.
В заканчивающих цикл секреторной активности альвеолах клетки «е»
сильно истончаются за счет излияния протоплазмы во внутренний про-
свет, ядра сморщиваются и почти полностью теряют способность окраши-
ваться по Фельгену. Стенки альвеолы спадаются, внутренняя полость
уменьшается, а в дальнейшем, как и у альвеол II типа, происходит полная
дегенерация.
У Rhipicephalus appendiculatus (Till, 1961) и Haemaphysalis spinigera
(Chinery, 1965b), как и у H. asiaticum, в слюнных^ железах самок вы-
явлены два аналогичных типа секреторных альвеол. Различия прояв-
ляются лишь в том, что у этих видов в альвеолах II типа только
2 разновидности секреторных клеток («а» и «Ь»), а в альвеолах
III типа, наоборот, 3 («с», «d» и «е»). В то же время тонкое строение
этих клеток и особенности их функционирования сходны у 3 изучен-
ных видов.
У самцов Hyalomma asiaticum, а также Rhipicephalus appendiculatus и
Haemaphysalis spinigera обнаружены 4 типа альвеол. Альвеолы I типа, или
- 144 -
Рис. 227—230. Секреторные альвеолы III типа слюнных желез самки
Hyalomma asiaticum.
227 — голодный клещ; 228 — через двое и 229 — через пять суток
после прикрепления к хозяину; 230 — полностью напитавшийся клещ
сразу по отпадении.
спр — стенки выводных протоков; вап — внутриальвеолярная*полость; д — клет-
ки типа «d»; е — клетки типа «е»; вс — вакуоли с секретом; с — секрет в по-
лости альвеол.
пирамидальные, обычного для иксодоидных клещей строения. Альвеолы
II типа Hyalomma asiaticum образованы 2 клетками типа «а», 4—5 —
типа «Ь» и 4—7 типа «с». Размеры альвеол голодных особей достигают
40x50 мк, а во время питания увеличиваются до 60x70 мк.
У голодных самцов клетки «а» заполнены вакуолями с секретом. Клетки
«Ь» и «с» не содержат включений секреторной природы и практически
не отличимы. Они занимают дистальную половину альвеолы, причем гра-
ницы между клетками плохо различимы. Ядра сферические, диаметром
5—6 мк (рис. 231).
С началом питания клетки «а» освобождаются от секрета и спадаются.
Большую часть альвеолы занимают гипертрофированные клетки «Ь».
Их цитоплазма заполнена сетью волокнистых эндоплазматических струк-
тур, между которыми лежат многочисленные секреторные вакуоли,
окрашивающиеся при азановой методике в синий цвет (рис. 232). Ядра
увеличиваются до 18—19 мк, сохраняя сферическую форму. Клетки «с»
представлены узкими прослойками цитоплазмы с мелкими вытянутыми
ядрами. В процессе освобождения от секрета альвеолы сморщиваются,
а цитоплазма клеток «Ь» перестает окрашиваться.
Альвеолы III типа, в отличие от таковых у самок, наряду с клетками
«d» и «е» обладают еще одним типом железистых клеток — «f». Последние
в количестве от 3 до 5 лежат между 1—2 клетками «d» и 5—8 клетками «е».
Клетки «f» занимают большую часть альвеолы и, как и «d», заполнены
уже у голодных особей крупными секреторными вакуолями (рис. 233).
Последние, в отличие от клеток «d», окрашиваются азокармином не в крас-
ный, а в оранжевый цвет и не чернятся железным гематоксилином. Клетки
«е» занимают узкий сектор вершины альвеолы. Цитоплазма их сильно
волокнистая, но в ней не выявляются секреторные вакуоли.
Во время питания размеры альвеол III типа увеличиваются с 45 X 50 мк
до 60 х70мк, главным образом за счет клеток «f». Объем клеток «е» увели-
чивается незначительно, а диаметр ядер достигает 9 мк по сравнению
с 6 мк у голодных. Превращение альвеол III типа в процессе освобожде-
ния от секрета в тонкостенные пузырьки, как у самок, не наблюдается
(рис. 234).
Только у самцов найдены альвеолы IV типа. У голодных особей они
имеют вид мелких пузырьков размером 28x31 мк из 7—10 кубических
клеток, окружающих небольшую центральную полость, сообщающуюся
с альвеолярным выводным протоком (рис. 235). Ядра сферические диамет-
ром 7 мк. Какие-либо проявления секреторной активности на этой стадии
отсутствуют.
Во время питания альвеолы этого типа достигают наиболее крупных
размеров (230x240 мк). Клетки приобретают пирамидальную форму и
тесно прижаты друг к другу, так что внутриальвеолярная полость исче-
зает. Большая часть цитоплазмы заполнена крупными сферическими секре-
торными вакуолями диаметром 3—6 мк, окрашивающимися азокармином
в темно-красный цвет. Ядра увеличиваются до 32x45 мк и располагаются
в узкой базальной цитоплазматической зоне, свободной от секреторных
вакуолей (рис. 236). По окончании накопления секрета в цитоплазме
ядра сморщиваются и подвергаются пикнотическим изменениям.
Рис. 231—236. Секреторные альвеолы слюнных желез самца Hyalomma asiaticum.
231 — альвеолы II типа у голодного клеща; 232 — то же у питающейся особи;
233 — альвеола III типа у голодного клеща; 234 — то же у питающейся особи;
235 — альвеола IV типа у голодного клеща; 236 — то же у питающейся особи.
а — клетки типа «а»; б — клетки типа «Ь»; в — клетки типа «с»; г — клетки типа «g»; д — клетки
типа «d»; е — клетки типа «е»; ж — клетки типа «Г»; вбс — вакуоли с белковым секретом;
вус — вакуоли с углеводно-белковым секретом; к — кутикулярная выстилка стенок выводных про-
токов; вап — внутриальвеолярная полость.
- 146 -
Ультраструктура секреторных клеток. При электронномикроскопиче-
ском исследовании ультратонких срезов слюнных желез Н. astaticum и
Ornithodoros moubata в описанных выше нескольких типах секреторных
клеток обнаруживаются глубокие различия в субмикроскопическом
строении цитоплазмы, связанные с различными типами образующегося
в них секрета и способами его выведения (Джафаров, 1964, 1965а, 19656;
Балашов и Джафаров, 1966).
Клетки типов «а» и «d» очень сходны по своему строению. У голодных
особей в их цитоплазме находится масса крупных вакуолей, каждая
из которых окружена тонкой мембрановидной оболочкой. По характеру
внутреннего содержимого их можно подразделить на два типа (рис. 238):
одни вакуоли заполнены гомогенным веществом с высокой электронноопти-
ческой плотностью («простые вакуоли»), а другие представляют совокуп-
ность из тесно упакованных в общей оболочке более мелких вакуолек,
диаметром 0.1—0.2 мк («сложные вакуоли»). Местами наблюдается слия-
ние отдельных пузырьков сложных вакуолей между собой и превращение
их в простые вакуоли. Пространственно оба типа вакуолей перемежаются
между собой и можно предположить, что они представляют последователь-
ные этапы образования секрета, причем сложные вакуоли представляют
более раннюю стадию развития.
В прослойках цитоплазмы между вакуолями с секретом находятся
узкие канальцы и пузырьки эндоплазматической сети и многочисленные,
преимущественно продолговатые митохондрии с внутренними гребнями.
У питающихся клещей секрет в вакуолях приобретает мелкозернистую
консистенцию или бывает представлен скоплениями отдельных осмиофиль-
ных частиц в 300—400 А, разделенных светлыми промежутками. Разруше-
ния клеточных стенок в процессе секреции у описываемых клеток не на-
блюдается.
Для клеток «Ь» характерно заполнение цитоплазмы шероховатыми
элементами эндоплазматической сети в виде многочисленных канальцев
и пузырьков. Они равномерно распределены по всей цитоплазме и тесно
прилегают к ядерной оболочке. Особенно сильного развития достигают
эргастоплазматические структуры у питающихся особей, когда они зани-
мают большую часть цитоплазмы (рис. 239). В петлях канальцев лежат
многочисленные вакуоли с хорошо различимыми оболочками и с содержи-
мым низкой электроннооптической плотности. Диаметр вакуолей варьи-
рует от 0.1—0.2 до 1—4 мк. Мелкие вакуоли часто сливаются в более
крупные, выявляющиеся на обычных гистологических препаратах и окра-
шивающиеся при азокарминовой методике в синий цвет. Особенно много-
численны секреторные вакуоли в апикальной зоне цитоплазмы. Апикальная
цитоплазматическая мембрана несет многочисленные субмикроскопиче-
ские выросты — микроворсинки, не различимые в световом микроскопе.
Способ выведения секрета из клеток «Ь» остается не выясненным, но, по-ви-
димому, он не связан с разрушением апикальной цитоплазматической
мембраны или отторжением микроворсинок.
Наибольшее количество митохондрий обнаруживается в апикальной
половине клетки. Они преимущественно продолговатой формы (толщина
0.1—0.3 и длина 1.5—2 мк), содержат большое количество расположен-
ных близко друг к другу гребней, узкие промежутки между которыми
заполнены очень гомогенным матриксом.
Клетки типа «с» отличаются обилием гладких мембранных структур
эндоплазматической сети в виде системы узких трубочек и бедностью
шероховатыми элементами эргастоплазмы. Многочисленные митохондрии
относительно равномерно распределены по всей клетке, а апикальная
цитоплазматическая мембрана несет многочисленные микроворсинки.
В период питания заметных изменений в описываемом типе клеток вы-
- 148 -
Рис. 237—240. Электронномикроскопические фотографии ультратонких срезов
альвеол слюнных желез самки Hyalomma asiaticum.
237 — участок «волокнистой» цитоплазматической зоны пирамидальной аль-
веолы, X 62 000; 238 — участок клетки «а» альвеолы II типа голодной особи
с ядром и секреторными вакуолями, Х16 800; 239 — участок клетки «Ь» альве-
олы II типа на третьи сутки питания, видны эргастоплазматическая сеть и
вакуоли с секретом, Х21 200; 240 — участок апикальной цитоплазматической
зоны клеток «е» альвеол III типа на третьи сутки питания, видно отторжение
микроворсинок, X 12 000 (фот. Т. Э. Джафарова).
я — ядро; м — митохондрии; цм — впячивания цитоплазматическойя мембраны; св — секре-
торные вакуоли; эс — эргастоплазматическая сеть; мв — микроворсинки.
Рис. 241—246. Альвеолы слюнных желез Hyalomma asiaticum (241—245)
и Ixodes ricinus (246). Микрофотография, X 400.
241 — секреторные вакуоли в клетках «а» и «d» самки после окраски БФС; 242 —
эргастоплазматическая сеть в клетках типа «Ь» питающейся самки после окра-
ски метиловым зеленым — пиронином; 243 — углеводно-белковый секрет в
клетках типа «Ь» питающейся самки после окраски по методу ШИК; 244 —
участок слюнной железы питающегося самца после окраски по ШИК; 245 —
то же, после окраски метиловым зеленым пиронином; 246 — секреторные
альвеолы самца после окраски железным гематоксилином.
а — устьевые клетки; б — заполняющие клетки; в — пирамидальные альвеолы; г — аль-
веолы II типа; д — альвеолы III типа, е — альвеолы IV типа; ж — пиронинофильные волок-
на^ — ШИК-положительное вещество; и — ядра; к — вакуоли с белковым секретом.
Рис. 247—254. Хоботок нимфы Hyalomma asiaticum в коже белой мыши
на четвертые сутки прикрепления.
247 — место прикрепления после удаления клеща и 248 — то же с хо-
ботком, погруженным в ткани на продольном разрезе. Поперечные срезы
через ротовые органы на уровне: 249 — основания гнатосомы, 250 — се-
редины наружных хелицеральных футляров, 251 — пальцев хелицер,
252 — дистального конца гипостома, 253 — окончания цементного фут-
ляра; 254 — геморрагий в дермальном слое кожи. Микрофотографии:
247 и 248 — Х110, 249—254 — Х250.
а — цементный футляр; б — внутритканевая полость с воспалительным инфильтра-
том; в — хоботок; г — отпечатки зубцов гипостома; д — роговой слой эпидермиса;
е — мальпигиев слой эпидермиса; ж — дермис; з — тектум; и — субхелицеральная
пластинка; к — стволы хелицер; л — передний глоточный клапан; м — наружные
хелицеральные футляры; н — гипостом; о — предротовая полость; п — пальцы хе-
лицер; р — продолжение пищевого канала в дистальной части цементного футляра;
с — геморрагии.
Рис. 258—265. Содержимое средней кишки самок Ornithodoros papillipes (258—
263) и Hyalomma asiaticum (264, 265) на разных сроках после питания.
258 — неповрежденные эритроциты морской свинки из только что напитавше-
гося клеща; 259 — агглютинация эритроцитов морской свинки через несколько
часов после кровососания; 260 — эритроциты степной черепахи из кишечника
клеща вскоре после кровососания; 261 — лейкоциты курицы на 10-е сутки после
кровососания; 262 — кристаллы гемоглобина морской свинки через несколько
недель после кровососания; 263 — конкреции гематина через несколько месяцев
после питания; 264 — капли гемоглобина в кишечнике сразу после окончания
питания; 265 — лейкоциты крови кролика через сутки после окончания питания
клеща. Фотографии с фазовым контрастом: 258—260, 262—264 — Х400; 261 и
265 — Х800.
явить не удалось, а в их цитоплазме постоянно отсутствуют секреторные
вакуоли.
В клетках типа «е» голодных самок эндоплазматическая сеть представ-
лена многочисленными пузырьками и единичными трубочками из гладких
мембран. Преимущественно продолговатые митохондрии очень многочис-
ленны и равномерно распределены по всей цитоплазме. Апикальная
цитоплазматическая мембрана собрана в систему микроворсинок длиной
в 1.1—1.6 и толщиной в 0.2—0.3 мк. Во время питания общая струк-
тура цитоплазмы существенно не меняется, несмотря на значительное
увеличение размеров клеток. Характерно для клеток описываемого
типа питающихся клещей массовое отторжение микроворсинок с под-
стилающей их зоной цитоплазмы в просвет альвеолы (рис. 240).
Вероятно, этим путем осуществляется выведение из клетки продуктов
секреции, представляющих разжиженную цитоплазму апикальной зоны
клетки. Морфологически оформленные гранулы и вакуоли не обнаружи-
ваются в цитоплазме даже при максимальных увеличениях.
СОСТАВ СЛЮНЫ
Результаты гистохимических исследований (табл. 31) позволили уста-
новить значительные различия в составе слюны аргасовых и иксодовых
клещей. У аргазид был найден только один тип секрета, исключая воз-
можное существование анестезирующих компонентов. Он образуется
в железистых клетках одного типа и, по-видимому, относится к классу
муко- или гликопротеидов, но может быть и другим комплексным соеди-
нением белков и углеводов.
В слюнных железах иксодид обнаружены два различных компонента
слюны — белковый и углеводно-белковый. Судя по разнообразию типов
железистых клеток в секреторных альвеолах, особенно среди АтЫуот-
minae, в пределах этих основных компонентов можно в свою очередь
выявить еще несколько групп веществ, что и было сделано для кле-
щей Haemaphysalts spinigera (Chinery, 1965b).
Чисто белковые продукты секреции образуются в форме крупных вакуо-
лей в устьевых клетках Ixodes ricinus и гомологичных им клетках «а»,
«d» и «f» у Hyalomma asiaticum. Накопление этого типа секрета у самок
Н. asiaticum заканчивается на стадии послелиночного доразвития, и
соответствующие типы клеток голодных клещей целиком забиты круп-
ными вакуолями, дающими интенсивное окрашивание на белок с БФС
(рис. 241). Невысокое содержание РНК в узких прослойках цитоплазмы
между секреторными вакуолями, небольшой объем ядрышка и признаки
пикнотических изменений в ядре свидетельствуют о завершении цикла
секреторной активности до прикрепления к хозяину.
У Ixodes ricinus и самцов Hyalomma asiaticum накопление белкового
секрета продолжается и в первые дни после прикрепления. Однако уже
у голодных особей в клетках обнаруживается достаточное количество
белковых вакуолей, содержимое которых может выводиться уже в про-
цессе прикрепления.
В заполняющих клетках Ixodes ricinus и клетках «Ь», «е» и «g» Hyalomma
asiaticum образуется секрет, представляющий соединение белков с угле-
водами. Содержащиеся в них секреторные вакуоли дают интенсивную
реакцию ШИК, не снимающуюся после предварительной обработки пре-
паратов диастазой (рис. 243, 244), и |3-метахроматическое окрашивание
средней интенсивности с толуидиновым синим. В клетках «g» альвеол
IV типа крупные секреторные вакуоли дают очень интенсивную реакцию
одновременно на белки и углеводы. В других клетках альвеол II —III ти-
пов окрашивание на белки с БФС средней или слабой интенсивности.
- 149 -
Таб
Гистохимические реакции цитоплазмы и секрётор
Вещества Гистохимические реакции Ornithodoros papillipes 22 Ixodes ricinus
железистые клетки устьевые клетки заполняющие клетки
Ц Ц Ц
Углеводы. Белки. Липоиды. РНК. | ШИК ШИК после обработки диастазой Метахромазия с толуи- диновым синим БФС .... Нингидрин-ШИК на свободные NH2 Щелочная тетразолие- вая реакция на SH- и SS-группы Судан черный Окраска пиронином Окраска пиронином после рибонуклеазы + 1 1 + + +1+1 ++ +++ + ++ 1 1 1 + + +1+1 +++ + ++ + + + + + ++ +++ ++ ++ + +
Примечание, ц — цитоплазма, в — секреторные вакуоли, -f- слабая, -Ц- средняя,
+4+ ИН
Углеводно-белковый секрет на основании характера гистохимических
реакций, вероятно, можно считать веществом, близким к глико- или муко-
иротеидам, но он может быть и другим типом соединений из белков и нейт-
ральных мукополисахаридов. Окончательное решение вопроса о его хими-
ческом составе пока затруднительно. Углеводно-белковый секрет отсут-
ствует в альвеолах голодных особей, и его образование начинается после
прикрепления. В начале питания для образующих его железистых клеток
характерно наряду со значительным увеличением размеров ядер и ядры-
шек также очень высокое содержание цитоплазматической РНК, что сви-
детельствует об интенсивных процессах белкового синтеза (рис. 242 и 245).
Выяснение морфологических и гистохимических особенностей слюнных
желез клещей надсем. Ixodoidea позволяет сделать первый шаг в направле-
нии установления связи определенных типов железистых клеток с обра-
зованием в них известных компонентов слюны.
Введение слюны в ранку во время кровососания предотвращает сверты-
вание крови при движении ее в предротовой полости и усиливает кровоте-
чение из поврежденных капилляров. У иксодовых клещей, питающихся
кровью и продуктами лизиса тканей, слюна должна не только препятство-
вать свертыванию крови хозяина, но и обеспечивать лизис окружающих
клеток и тканей, так как ротовой аппарат клещей не приспособлен к при-
нятию твердой пищи или слишком крупных фрагментов во взвеси. Кроме
того, слюна участвует в образовании цементного футляра вокруг хоботка
клеща, который обеспечивает более прочное закрепление паразита в по-
кровах хозяина.
О слюне кровососов мы знаем в основном по ее действию на кровь
позвоночных, тогда как данные о ее химическом составе очень скудны.
Наиболее изучены в этом отношении кровососущие двукрылые, в слюне
которых найдены антикоагулины с высокой активностью. Последние, как
- 150 -
п иц a 31
и гирудин пиявок, сходны по противосвертывающему действию с гепари-
ном. Они блокируют превращение фибриногена в фибрин, инактивируя
тромбин (Markwardt, 1963).
Детальными биохимическими и фармакологическими исследованиями
(Markwardt, 1963) было установлено, что антикоагулины слюны клещей,
в отличие от таковых насекомых и пиявок, представлены ингибиторами
тромбокиназы и блокируют превращение протромбина в тромбин. Пре-
параты антикоагулина клещей сохраняли активность после 10-минутного
нагревания при 80°, но разрушались при 100° Переваривание пепсином
или трипсином вело лишь к частичной потере активности.
На основании физико-химических исследований Ф. Марквардта (Mark-
wardt, 1963), а также наших данных о строении и гистохимических особен-
ностях слюнных желез клещей мы предполагаем, что активные антикоагу-
лины слюны могут быть глико- или мукопротеидами или же какими-нибудь
другими комплексами углеводов с белками, тормозящими ферментатив-
ную активность тромбокиназы и одновременно отличающимися высокой
термостабильностью. У аргазид антикоагулины, по-видимому, продуци-
руются единственным типом железистых клеток и входят в состав содер-
жимого крупных углеводно-белковых вакуолей.
У иксодовых клещей с несколькими типами железистых клеток секре-
торных альвеол в под сем. Ixodinae антикоагулины и, вероятно, лизирую-
щие факторы слюны могут образовываться лишь внутри заполняющих
клеток. У Amblyomminae, по-видимому, продуцируется несколько видов
углеводно-белкового секрета, и какой из них является антикоагулином,
установить затруднительно.
Наконец, чисто белковый секрет устьевых клеток Ixodes ricinus и
сходных с ними трех типов клеток Hyalomma asiaticum, возможно ,*уча-
ствует в построении цементного футляра. Наряду со сходством цемент_
- 151 -
ного вещества с содержимым белковых вакуолей в пользу этого предполо-
жения говорит также опорожнение большей части клеток этого типа в на-
чале питания, когда происходит формирование футляра.
ВЫДЕЛЕНИЕ СЛЮНЫ ВО ВРЕМЯ ПИТАНИЯ
Прижизненные наблюдения над прикреплением и питанием клещей
выполнены по методике, разработанной для кровососущих двукрылых
(Griffiths a. Gordon, 1952), в которую внесены лишь небольшие изменения
(Балашов, 19656).
Для количественного определения интенсивности слюноотделения
в различные периоды питания использовалась техника получения слюны
в капилляр, описанная Д. Грегсоном (Gregson, 1957).
Прижизненные микроскопические наблюдения над прикреплением
и питанием иксодовых клещей на ушах кроликов позволили установить
выделение двух внешне различных типов слюны. После внедрения в рого-
вой слой на поверхности кожи вокруг хоботка появляется капелька смоло-
видной жидкости молочно-белого цвета. Она обволакивает хоботок напо-
добие цилиндрического футляра, проникает сквозь ранку под роговой
слой и через 5—15 мин. застывает. Наблюдения над прикрепляющимися
клещами в бинокулярный микроскоп не вызывают сомнений в том, что
эта капля жидкости выделяется из предротовой полости и представляет
продукт секреции его слюнных желез, а не выделения из ранки хозяина.
Погружение хоботка в кожу сопровождается выделением больших коли-
честв описанного типа слюны. В результате погруженный в кожу хоботок
оказывается окруженным со всех сторон застывшим секретом слюнных
желез. Такая трубка, названная цементным футляром, детально описана
в литературе. Многие исследователи считают цементный футляр продук-
том взаимодействия слюны с содержимым разрушенных клеток кожи
позвоночного (Hoeppli a. Feng, 1931; Павловский и Алфеева, 1941, 1949;
Лотоцкий и др., 1959, и др.), но непосредственные прижизненные наблюде-
ния над его образованием не оставляют сомнений в его чисто секреторном
происхождении (Балашов, 1965а; Moorhouse a. Tatchell, 1966).
У Ixodes ricinus и особенно у видов р. Hyalomma большая часть
цементного футляра погружена в кожу хозяина, а над ее поверх-
ностью остается лишь небольшой сильно уплащенный конус (рис. 255).
Утолщение цементного футляра было особенно интенсивным в пер-
вые дни после прикрепления. В этот период у конца хоботка иногда
удавалось наблюдать выделение клейковидного, медленно растекаю-
щегося секрета молочно-белого цвета. В конце питания секреция описан-
ного типа резко ослабевает и утолщение цементного футляра идет очень
незначительно или полностью прекращается. Вполне сформированный
цементный футляр этих видов продолжается в глубь кожи хозяина
дальше дистального конца хоботка, так что пища поступает сперва во
внутренний канал футляра и уже из него в предротовую полость. Тол-
щина цементного футляра, особенно в его дистальной части, в 2—3 раза
больше диаметра хоботка (рис. 247).
У обладающих коротким хоботком клещей родов Haemaphy salts,
Dermacentor, Rhtpicephalus и Boophtlus значительная часть цементного
футляра остается над поверхностью кожи и в виде конуса окружает
даже дистальную часть основания гнатосомы. Часть хоботка, погружен-
ная в кожу, также окружена цементным футляром, причем его дисталь-
ный конец заходит в покровы значительно дальше самого хоботка. Особен-
но интенсивные утолщения и удлинения цементного футляра были отме-
чены перед началом последнего периода питания, когда застывающий
секрет слюнных желез заполнял часть образовавшейся к этому времени
внутритканевой полости у конца хоботка (Moorhouse a. Tatchell, 1966).
- 152 -
Цементный футляр отличается достаточной прочностью, и после от-
падения или насильственного удаления клещей в нем сохраняются отпе-
чатки зубцов гипостома и наружных хелицеральных футляров (рис. 248).
Гистохимическими методами выявлено двуслойное строение цементного
футляра. Его наружный слой отличается большей плотностью и образо-
ван из полисахаридно-белковых комплексов (положительное окрашивание
по ШИК и БФС). Внутренний слой дает слабую положительную реакцию
на белки, интенсивно окрашивается черным Суданом и, вероятно, обра-
зован из липопротеинов. На упорядоченность расположения молекул
в наружном слое указывает его способность к двойному лучепреломлению
в поляризованном свете.
Второй тип секрета представлен прозрачной, легко растекающейся
жидкостью, выделяющейся на протяжении всего периода питания. Вы-
деления ее можно наблюдать и в первые 20—30 мин. после насильственного
удаления недопитавшихся клещей, если их хоботок вставить в стеклян-
ный капилляр соответствующего диаметра. Можно предполагать, что
в ней содержатся компоненты, вызывающие лизис тканей и предотвра-
щающие свертывание крови, хотя проведенных специальных исследо-
ваний в этом направлении явно недостаточно (Павловский и Ходукин,
1929; Талызин и Пчелкина, 1949; Markwardt, 1963).
У питающихся особей из дистального конца, погруженного в покровы
хоботка, периодически выделяется облачко слегка мутноватого секрета
слюнных желез. Он быстро растекается и смешивается с жидким содержи-
мым очага воспаления. Акт слюноотделения обычно занимает не более
1 сек., после чего начинается фаза всасывания крови и лизированных
тканей.
Серии опытов с искусственной стимуляцией выделения слюны в ка-
пилляры у недопитавшихся клещей, результаты которых представлены
в табл. 32, позволяют судить об интенсивности слюноотделения в разные
Таблица 32
Количество слюны, выделенной самками клещей Ixodes ricinus и
Hyalomma asiaticum за 30 мин. после удаления с хозяина
(средние от 25 измерений для каждого срока)
Дни после прикрепления Вес клещей, в мг Количество выделенной слюны, в мкл
Ixodes ricinus
Голодные 1.7— 2.2 (1.9) 0
1-й . 2.4- 3.8 (3.1) 0—<0.5
2-3-й 5.1— 11.4(8.2) 0.5- 1.5 (1.0)
4—5-й 16.7- 52.6 (36.5) 1.5- 3.0 (2.0)
6-й 49.2- 101.3 (67.8) 1.0- 4.0 (2.5)
7-й (заканчивающие кровососа- ние) 119.4-286.2 (196.5) 0—<0.5
Hyalomma asiaticum
Голодные 10.4— 15.2 (12.5) 0
1-й 10.7— 20.5 (13.9) 0.5- 2.0 (1.5)
2—3-й 14.1— 39.0 (22.8) 0.5- 4.0 (2.0)
4—6-й 31.6- 97.3 (51.6) 2.5— 9.5 (6.0)
7—8-й 96.8— 319.4 (236.7) 3.0—17.5 (9.0)
9-10-й 297.3— 916.1 (490.5) 1.0-10.5 (6.5)
11-й (заканчивающие кровососа-
ние) 863.5- 1347.1 (1085.2) 0- 3.0 (0.5)
Примечание. В скобках дано среднее количество слюны.
- 153 -
периоды питания. Конечно, они не дают представления об истинных объе-
мах слюны, вводимых в организм хозяина, но анализ значительного числа
индивидуальных измерений объективно отражает динамику процесса
слюноотделения. В результате наших опытов с самками Ixodes ricinus
и Hyalomma asiaticum установлено, что выделение слюны можно вызвать
только у недопитавшихся особей сразу по удалении с хозяина. У голодных
или закончивших питание клещей выделение слюны отсутствовало.
Количество собранной в капиллярах слюны было очень непостоянно
даже для особей одинаковой степени насыщения. Однако на основании
суммирования данных индивидуальных измерений несомненно, что макси-
мальное выделение слюны происходит во второй половине периода роста.
У Н. asiaticum это наблюдалось на 7—8-е сутки после прикрепления при
весе самок в 97—319 мг, а у Ixodes ricinus — на 4—6-е сутки при весе
37—68 мг. Обращают внимание весьма значительные объемы слюны, по-
ступившей в капилляр, по сравнению с весом тела клеща. По данным при-
жизненных наблюдений при ненарушенном акте питания в организм хо-
зяина вводится значительно меньшее количество слюны, чем при капил-
лярной методике. Тем не менее даже в этом случае за период многодневного
питания в организм хозяина вводится не менее нескольких десятков микро-
литров слюны, что несравнимо больше, чем во время питания кровососущих
двукрылых. Укажем, что самки комара Aedes aegypti выделяют в среднем
за весь период кровососания 4.72 мкг слюны (Devine a. oth., 1965). Отсюда
становятся понятными причины интоксикации организма хозяина, так
как вместе со слюной паразита в его организм вводится не только боль-
шое количество чужеродного белка, но и различные токсины и биологи-
чески активные вещества (Талызин и Пчелкина, 1949).
У особей, заканчивающих питание, на стадии растяжения происходит
резкий спад интенсивности слюноотделения. У полностью напитавшихся
клещей попытки стимулировать выделение слюны всегда заканчивались
неудачей. В целом наши данные об особенностях слюноотделения у
2 видов иксодид совпадают с результатами изучения этого процесса
у клещей Dermacentor andersoni (Gregson, 1957).
У аргасовых клещей перед началом прорезания покровов хозяина
на месте будущей ранки иногда также наблюдается выделение капельки
слюны, но последняя, в отличие от иксодид, сравнительно жидкая и не
застывает. При наблюдениях за питающимися Ornithodoros papillipes
в бинокулярный микроскоп в ряде случаев удавалось увидеть, как в очаге
кровоизлияния у конца хоботка происходит выделение слюны в форме
полупрозрачных и быстро рассеивающихся капель с размытыми краями.
Их образование всегда связано с временным прекращением всасывания
крови из гематомы.
ПРОЦЕССЫ ПРИКРЕПЛЕНИЯ,
ПРИЕМА ПИЩИ И СЛЮНООТДЕЛЕНИЯ
Иксодовые клещи. После прицепления к телу хозяина клещи неко-
торое время, иногда до нескольких часов, ползают по нему в поисках
места для прикрепления. Выбрав подходящее место, клещ раздвигает ноги
и фиксирует ими положение своего тела под углом, близким к 45—60°
к поверхности тела хозяина. После этого сокращением дорсо-вентраль-
ной мускулатуры повышается внутриполостное давление и хелицеры
выдвигаются в переднее положение. Пальцы их прижимаются к поверх-
ности кожи и совершают режущие движения в медио-латеральной плос-
кости, углубляясь в поперечную ранку в роговом слое эпидермиса.
Этот первый этап собственно прикрепления занимает не более 3—5 мин.,
- 154 -
причем на этой стадии клещ часто может переходить на соседний участок
и весь процесс повторяется занаво. Более прочной фиксации клеща на
поверхности кожи хозяина способствует также уже описанное выделение
клейковидной слюны.
После того как «приклеивание» ротовых частей клеща к покровам
хозяина заканчивается, вновь наблюдаются режущие движения хелицер.
Вместе с ними колебательными движениями всей гнатосомы в ранку
постепенно вводится гипостом. Погружение хоботка в кожу сопрово-
ждается интенсивной секрецией слюны, так что с клетками хозяина со-
прикасается лишь дистальный конец хоботка, а с боков он на всем своем
протяжении заключен в цементный футляр из застывшего секрета слюн-
ных желез, который продолжается над поверхностью рогового слоя в виде
бугорка вокруг основания гнатосомы.
Весь процесс прикрепления занимает от 10—30 мин. до часа и более
и обычно заканчивается после того, как хоботок углубляется в кожу до
разошедшихся в стороны пальп. П. И. Мариковский (1954) считает, что
у клещей Haemaphysalis concinna и Dermacentor silvarum пальпы участ-
вуют в удержании паразитов на теле хозяина, сжимая с боков бугорок
кожи, окружающий хоботок. По нашим наблюдениям, у всех изученных
в этом отношении видов, включая и короткохоботных представителей
родов Dermacentor и Haemaphysalis, пальпы прикрепившихся клещей не
имеют отношения к фиксации на теле хозяина. Последняя обеспечивается
мощными, отогнутыми назад зубцами гипостома, более мелкими зубчи-
ками наружных хелицеральных футляров и раздвинутыми в стороны паль-
цами хелицер. Тесно вдаваясь в стенки цементного футляра, они обеспе-
чивают исключительно прочное заякоривание клеща в коже хозяина
(рис. 247, 248). Вследствие быстро развивающегося отека ткани вокруг
места прикрепления могут образовывать кольцевой валик, плотно обле-
гающий все основание гнатосомы, включая и пальпы, так что над поверх-
ностью выступает лишь идиосома.
У длиннохоботковых видов, из которых изучены многие представи-
тели рода Hyalomma, Ixodes ricinus и I. persulcatus, хоботок прикрепив-
шихся клещей проходит сквозь всю толщу эпидермиса и его дистальные
части находятся в дермальном слое (рис. 248), а иногда даже достигают
подкожной клетчатки. У короткохоботковых видов (роды Haemaphysalis,
Dermacentor, Rhipicephalus, Boophilus) большая часть хоботка остается
над поверхностью кожи в конусе цементного футляра, а его дисталь-
ный конец обычно не проникает глубже основания мальпигиева слоя,
как было показано для всех фаз В. microplus (Moorhouse a. Tatchell,
1966).
Проникновение хоботка в кожу приводит к повреждениям встречаю-
щихся на его пути кровеносных сосудов, но одни мехнические факторы
не могут обеспечить образования значительного некротического очага
и множественных кровоизлияний в местах прикрепления иксодид. Ги-
стопатологические исследования (Павловский и Алфеева, 1941, 1949;
Talice, 1930; Hoeppli a. Feng, 1931; Берлин, 1956а, 19566, 1957; Foggie,
1959; Riek, 1962) свидетельствуют о быстром увеличении небольшого
очага механического повреждения у конца хоботка за счет некроза
окружающих тканей, включая мышечные волокна и стенки расположен-
ных вблизи кровеносных сосудов. Предполагается, что токсическое и
лизирующее действие слюны иксодид ведет к образованию воспалитель-
ного очага в месте прикрепления (рис. 247, 254 и 255).
В зависимости от видовых особенностей паразита и хозяина, гисто-
логических особенностей кожи в месте прикрепления, первичного или
вторичного питания клещей на данном хозяине и многих других недоста-
точно изученных факторов гистопатологическая картина места прикреп-
- 155 -
ления может сильно варьировать. При питании длиннохоботковых видов
часто наблюдаются признаки острой воспалительной реакции с геморра-
гическим синдромом. В очаге воспаления при этом может образовываться
внутритканевая полость, заполненная эксудативной жидкостью с высоким
содержанием эритроцитов и лейкоцитов. При питании Boophilus micro-
plus формирование внутритканевой полости в очаге воспаления отсут-
ствовало и кожная реакция варьировала от образования обширной зоны
клеточной дегенерации у конца хоботка до множественных геморрагиче-
ских излияний в глубже лежащем дермальном слое.
В отдельных случаях, особенно у личинок и нимф, воспалительный
очаг не столь велик, ограничен мальпигиевым слоем эпидермиса и лишен
геморрагий, так что клещи вынуждены питаться одной лимфой и фрагмен-
тами лизированных тканей.
Рис. 255. Участок покровов млекопитающего с прикрепившимся иксодо-
вым клещом. Схематизировано.
огн — основание гнатосомы; пл — палыты; нхф — наружные хелицеральные фут-
ляры; цф — цементный футляр; пх — пальцы хелицер; дкг — дистальный конец
гипостома; рэ — роговой слой эпидермиса; мэ — мальпигиев слой эпидермиса; дэ —
дермис; не — кровеносные сосуды; гр — геморрагии; вп — внутритканевая половть
с воспалительным инфильтратом.
Вокруг места прикрепления может происходить пролиферация маль-
пигиева слоя эпидермиса и дермы. Регенерационные явления обычно
остаются незавершенными из-за постоянного выделения токсичной слюны
и недостаточной продолжительности периода прикрепления. В литературе
описаны случаи образования защитной капсулы вокруг хоботка личинок
п нимф Ixodes persulcatus при питании на овсянках, делающей дальней-
шее кровососание невозможным (Наумов, 1963). Наружный отек и раз-
растания кожи могут привести к окружению всего клеща своеобразной
цистой, так что паразит как бы врастает в кожу хозяина (Лотоцкий и
др., 1959; Arthur, 1962).
Сопоставление прижизненных наблюдений над питающимися клещами
со срезами через погруженные в кожу ротовые органы дает возможность
понять механизм кровососания. У присосавшихся клещей наружные фут-
ляры хелицер тесно прилегают к латерально-дорсальным сторонам ги-
постома, так что между ними образуется замкнутая с боков трубка пред-
- 156 -
ротовой полости (рис. 250, 251). Непроницаемость последней обеспечи-
вается окружающим хоботок цементным футляром, продолжающимся
в глубь кожи значительно дальше дистального конца хоботка. Внутри
футляра остается центральный канал, обеспечивающий беспрепятственное
всасывание пищи и выведение слюны (рис. 253). Вход в этот канал несет
функции ротового отверстия, тогда как настоящий рот находится на прок-
симальном конце предротовой полости.
Основное назначение цементного футляра — обеспечение прочного
и длительного закрепления ротовых частей клеща в коже хозяина. На пер-
вых этапах прикрепления это достигается приклеиванием хоботка быстро
застывающим секретом к поверхности кожи и распространением этого
секрета под роговым слоем эпидермиса вокруг ранки. У закончившего
прикрепление клеща цементный футляр предотвращает преждевременное
выпадение хоботка из кожи, ограничивая лизогенное действие слюны
основанием мальпигиевого слоя и дермой. Само вещество цементного
футляра, по-видимому, не обладает антигенными свойствами, вследствие
чего отсутствует воспалительная реакция в зоне его непосредственного
контакта с клетками кожи позвоночного. Кроме того, изолируя концы
хелицер и зубцы гипостома, цементный футляр предотвращает развитие
воспаления в ответ на механические раздражения клеток ротовыми ча-
стями паразита.
Процесс питания иксодовых клещей, по данным наших наблюдений
над самками Hyalomma asiaticum и Ixodes ricinus на ушах крольчат, а также
опытов с кормлением самок Dermacentor andersoni на оттянутых защечных
мешках анестезированных хомяков (Gregson, 1967), оказался сходным
у всех трех видов. Он складывается из чередующихся актов всасывания
жидкого содержимого гематомы или воспалительного очага у конца
хоботка и выпрыскивания в ткани хозяина слюны. В зависимости от пе-
риода питания акты всасывания продолжаются от 1—2 до 10—30 сек.,
а слюноотделения — от долей секунды до 1 сек. Интервалы между ними
составляют от нескольких секунд до нескольких минут. Четкое разделение
во времени актов выпрыскивания слюны и всасывания пищи предотвра-
щает столкновение встречных потоков жидкости в общей предротовой
полости, несущей одновременно функции пищевого и слюнного каналов.
Решающая роль в акте кровососания принадлежит глотке, представ-
ляющей мощный нагнетательный насос. Судя по имеющимся в нашем рас-
поряжении срезам через питающихся особей, а также по наблюдениям
И. Грегсона (Gregson, 1960) k&r Dermacentor andersoni, глотка сокращается
или расширяется одновременно на всем своем протяжении, а не перисталь-
тически, как считала М. Русер (Ruser, 1933). На срезах она всегда бы-
вает одинаково растянутой или спавшейся на всем своем протяжении.
На фазе всасывания расширители глотки сокращаются и разводят
в стороны кутикулярные пластинки стенок, так что образуется обшир-
ная внутренняя полость (кольцевые сфинктеры при этом расслаблены).
Клиновидный дорсальный выступ поднят благодаря сокращению мышц,
идущих от крыловидных отростков к субхелицеральной пластинке, и пе-
редний вход в глотку открыт. В процессе расширения глоточной полости
внутри нее создается значительное отрицательное давление, распростра-
няющееся вдоль предротовой полости и втягивающее жидкое содержимое
из внутритканевой полости. Объем предротовой полости в процессе пи-
тания существенно не меняется из-за сильной склеротизации стенок и от-
сутствия специальной мускулатуры, так что эта полость выполняет чисто
пассивные функции проводящего пути.
После заполнения глоточной полости начинается нагнетание ее со-
держимого в кишечник. Расширители глотки расслабляются, а кольцевые
мышцы сокращаются и сближают пластинки стенок. Просвет быстро умень-
- 157 -
щается, и на поперечном разрезе глотка вновь приобретает характерную
форму двух соединенных основаниями букв Y. Содержимое глотки при
этом проталкивается по тонкому пищеводу в кишечник. Функции перед-
него глоточного клапана выполняет клиновидный выступ. При сокраще-
нии сжимателей глотки он опускается вниз и вместе с зубчиками латераль-
ных стенок закрывает вход в глотку. Обратному вытеканию жидкости
из средней кишки в глотку препятствует кольцевая складка при впадении
пищевода в желудок. Существование глоточных клапанов не исключает
возможности отрыгивания части заглоченной крови обратно в ранку,
что довольно часто наблюдается у питающихся клещей.
Механизм введения слюны в организм хозяина во многом неясен
из-за невозможности наблюдений над процессом ее накопления в протоках
желез и в слюнном резервуаре. По данным прижизненных наблюдений,
слюна с силой выпрыскивается из предротовой полости и даже может
временно оттеснять кровь от конца хоботка. На основании изучения ана-
томических деталей на срезах мы считаем, что важная роль в проталкива-
нии слюны в предротовую полость принадлежит слюнному резервуару.
Объем последнего может регулироваться сокращением группы мышц,
идущих от дна резервуара к крыльям клиновидного выступа и дорсальной
стенке глотки (рис. 25). При сокращении мускулатуры дно опускается,
объем резервуара увеличивается, и в него втягивается слюна из выводных
протоков. При расслаблении мускулатуры гибкое кутикулярное дно
поднимается и выталкивает слюну в предротовую полость. Функции пе-
реднего клапана резервуара, возможно, несет лабрум, объем которого
может изменяться благодаря перемещениям жидкости в его внутренней
полости. Задними клапанами могут служить утолщения кутикулы вент-
ральной стенки резервуара, закрывающие входы в выводные протоки
при поднятии пола и открывающие при опускании.
Выведение слюны из резервуара в предротовую полость представляется
рефлекторным актом. Механизм, контролирующий эти процессы, дей-
ствует антагонистически по отношению к всасывающему насосу глотки.
В результате предотвращается столкновение встречных потоков слюны
и пищи в общей предротовой полости.
Закончившие питание клещи или недососавшиеся особи в случае со-
здания неблагоприятных условий в месте прикрепления сравнительно
легко извлекают свой хоботок из кожи хозяина. Открепляющийся клещ
совершает легкие колебательные движения всей гнатосомой, пальцы хели-
цер сдвигаются медиально, а один из стволов может втягиваться в фут-
ляр. В результате этих движений объем, занимаемый хоботком внутри
затвердевшего цементного футляра, несколько уменьшается и клещ без
особого сопротивления вытаскивает свои ротовые органы. Напротив,
при искусственном снятии недососавшихся клещей, особенно в начале
питания, приходится прилагать значительные усилия, а ротовые органы
часто повреждаются.
Цементный футляр при отпадении клеща остается в коже (рис. 247)
и удаляется лишь в процессе дальнейшего развития воспалительной реак-
ции. В отдельных случаях, вероятно, в связи с интенсивной воспалитель-
ной реакцией вокруг всего футляра, он удаляется вместе с хоботком
и остается на нем некоторое время в виде воротничка. Однако вскоре
клещ освобождается от футляра и пальпы нормально складываются, при-
крывая с боков гипостом и наружные хелицеральные футляры.
Аргасовые клещи. Процесс прикрепления аргасового клеща к хозяину
в основных чертах сходен с описанным для иксодид, но занимает всего
несколько минут. Первоначальный резрез кожи производится зубцами
пальцев хелицер, а затем в него чередующимися движениями взад и впе-
ред вводится весь хоботок.
- 158 -
Первоначально клещ удерживается на месте прикрепления только
с помощью ног. В дальнейшем закрепление зубчатого гипостома в ране
и раздвижение в ней в стороны пальцев хелицер обеспечивает более проч-
ное заякоривание, и для удаления присосавшегося клеща требуется уже
определенное усилие. Пальпы не принимают непосредственного участия
в прикреплении. Они лишь раздвигаются в стороны от гипостома и при-
легают к коже хозяина. В месте внедрения гипостома и хелицер в связи
с разрывом мельчайших капилляров образуется небольшое местное кро-
воизлияние. В большинстве случаев клещи всасывают кровь из подобных
геморрагических очагов и
значительно реже из более
крупных кровеносных со-
судов при случайном их
повреждении ротовыми
частями. У прикрепивше-
гося клеща, как правило,
периоды быстрого всасы-
вания крови чередуются
с короткими паузами,
когда кровососание пол-
ностью прекращается.
Причины подобной ритми-
ки пока не вполне ясны.
Можно предположить, что
во время пауз облегчается
вытекание слюны в рану.
При насасывании крови
она смешивается с послед-
ней еще в предротовой по-
лости и сразу же втяги-
вается в глотку.
Реакция кожи человека
на укус клещей Ornitho-
doros papillipes была впер-
вые
Е.
256
3
5—4
5
6
7
257
Рис. 256, 257. Срез участка кожи белой крысы
через 1 час после кормления на этом месте клещей
Ornithodoros moubata (256) и О. coriaceus (257).
1 — геморрагий; 2 — роговой слой эпидермиса; 3 — маль-
пигиев слой эпидермиса; 4 — наружный и 5 — сосочковый
слой дермы; 6 — внутренний слой дермы; 7 — мышечньГ
слой (по Lavoipierre a. Riek, 1955).
гематома, остающаяся на месте прикрепления
детально изучена
Н. Павловским и
К. Штейном (1963).
Небольшая кровоточащая
ротовых частей, превращается первоначально в небольшую, вишневого
цвета папулу, а через несколько часов размеры расширяющегося крас-
ного пятна достигают 1—2 см в диаметре. Снаружи пятно окружено зна-
чительной областью с интенсивным покраснением кожи. Рассасывание
папулы длится до нескольких недель.
По характеру патологических изменений в коже хозяина при питании
клещей среди орнитодорин различают три группы (Lavoipierre a. Riek,
1955). Клещи Ornithodoros moubata, О. arenicolus, О. brasiliensis, О. dugesi,
9. gurnevi, О. graingeri, О. hermsi, О. parkeri, О. puertoricensis, 9. rostra-
tus, О. rudis, О. salahi, О. turicata, относимые к группе О. moubata, срав-
нительно медленно приступают к кровососанию на теле хозяина и для
полного насыщения им требуется около 1.5 часа, но у некоторых видов
оно может заканчиваться и в более короткое время (15 мин.). В местах
прикрепления клещей наблюдаются многочисленные поверхностные ге-
моррагии диффузионного типа, приводящие к инфильтрации дермального
слоя (рис. 256).
При поражении типа О. erraticus (О. erraticus, О. coriaceus, О. delanoei,
9. talaje, О. papillipes, Alveonasus lahorensis, A. canestrini) первоначально
- 159 -
небольшое кровоизлияние вокруг хоботка достигает к моменту отпадения
3 мм в диаметре, а в первые часы после отпадения увеличивается еще в не-
сколько раз. Оно захватывает нижние слои кожи и даже подкожную муску-
латуру и сопровождается отеком окружающих тканей, а иногда, в тяжелых
случаях, и реакцией в близлежащих лимфатических узлах (рис. 257).
Крупные особи О. savignyi (третья группа) также вызывают значительное
кровоизлияние, но оно, в отличие от второй группы, сохраняет местный
характер.
Механизм кровососания у аргасовых клещей в основных чертах сходен
с таковым у иксодид. Однако в связи со сравнительно непродолжительным
временем насыщения всасывание крови из ранки происходит у них зна-
чительно быстрее. Возможно, что этому способствует разделение трубки
предротовой полости проксимально на половину или две трети ее длины
на вентральный пищевой и дорсальный слюнной каналы.
Окончательное решение вопроса о механизме насасывания крови ар-
гасовыми клещами требует прямых наблюдений над функционированием
ротового аппарата и глотки во время питания, что практически трудно
осуществимо. Однако уже на основании одних анатомических данных
бесспорно отсутствие описанного С. Сеном (Sen, 1935) особого ротового
стилета с ротовым отверстием на конце. На самом деле последнее откры-
вается на проксимальном конце трубкообразной предротовой полости
под основанием лабрума, ошибочно рассматриваемого как ротовой конус.
Все гипотетические объяснения механизма всасывания крови исходят
из образования при расширении глотки отрицательного гидростатического
давления, оттягивающего кровь из гематомы, а при ее сокращении —
положительного давления, проталкивающего кровь в среднюю кишку.
Расхождения существуют лишь в трактовках положения и функциони-
рования глоточных клапанов.
В настоящее время для кровососущих насекомых известны два способа
получения крови из организма позвоночных, не считая подсасывание
ее с поверхности покровов из кровоточащих ран. У клопов, блох и ко-
маров с исключительно тонким и высоко специализированным ротовым
аппаратом ротовые части вводятся внутрь кровеносных сосудов без серьез-
ных повреждений их стенок и всасывание крови происходит непосред-
ственно из их полости (Dickerson a. Lavoipierre, 1959а; Lavoipierre, 1965).
У насекомых с массивными ротовыми частями, как например слепни
и мухи цеце, кровь всасывается из гематомы, образующейся при механи-
ческом повреждении кровеносных сосудов (Dickerson a. Lavoipierre,
1959b). Сходным типом питания обладают и аргасовые клещи. При этом,
несмотря на принципиально иной план строения ротового аппарата, они
не только не уступают, но даже превосходят многих кровососущих на-
секомых по способности к быстрому поглощению больших количеств
крови из тела хозяина при минимальном раздражении последнего в мо-
мент прикрепления и кровососания.
Тип питания иксодовых клещей не имеет аналогии среди насекомых.
Определенные сходные черты можно, вероятно, найти лишь у некоторых
длительно питающихся блох (Echidnophaga, Vermipsylla, Tunga), но
особенности их питания остаются не изученными. У длительно питаю-
щихся иксодид в месте прикрепления клещей образуется мощный воспали-
тельный очаг, содержимое которого служит пищей паразита. В связи
с этим (особенно в первые дни питания) их даже нельзя считать истинными
кровососами, так как значительную часть пищи составляют лимфа и про-
дукты дизиса тканей. Питание иксодид происходит значительно медлен-
нее, чем у насекомых, и акты всасывания пищи могут прерываться дли-
тельными паузами. Однако благодаря многодневному нахождению на
хозяине и приобретению способности к интенсивному пищеварению и росту
- 160 -
в этот период они поглощают воспалительный инфильтрат и кровь в ко-
личествах, в десятки и сотни раз превышающих исходный вес тела го-
лодной особи, так что в этом отношении несравненно превосходят даже
наиболее специализированных кровососущих насекомых.
По особенностям питания иксодовые клещи наиболее близки к ли-
чинкам клещей-краснотелок сем. Trombiculidae. Последним свойственно
многодневное питание на позвоночных животных и их ротовые органы
удерживаются в коже с помощью специальной трубки — стилостома.
Стилостом представляет застывший секрет слюнных желез, полностью
окружает погруженные в кожу ротовые органы и его длина значительно
больше таковой хоботка клеща. Внутри стилостома проходит тонкий ка-
нал, по которому клещ всасывает жидкую часть лимфы, но его диаметр
недостаточен для поглощения целых клеток позвоночного (Schumacher
a. Hoeppli, 1963; Arthur, 1965). Сходство функций и строения стилостома
клещей-краснотелок с цементным футляром иксодид, по-видимому, объяс-
няется сходным характером паразитизма в этих двух группах. При мно-
годневном питании исключительно важно ограничить воспалительную
реакцию на границе ротовых частей клеща и клеток хозяина, которая в ко-
нечном итоге ведет к отторжению паразита, как любого чужеродного тела.
Цементный футляр и стилостом поэтому следует рассматривать как не-
зависимо возникшие адаптивные приспособления, нейтрализующие за-
щитную воспалительную реакцию кожи позвоночного. Кроме того, у крас-
нотелок и мелких неполовозрелых фаз развития иксодид эти образования
обеспечивают возможность отсасывания пищи из внутренних слоев кожи,
куда не может непосредственно проникнуть их короткий хоботок.
ПИЩЕВАРЕНИЕ
Особенности строения и функционирования пищеварительного тракта
кровососущих клещей и биохимические особенности пищеварения во мно-
гом определяют дальнейшую судьбу возбудителей инфекций позвоночных,
попавших вместе с кровью или лизированными тканями хозяина в ор-
ганизм членистоногого. Процессы пищеварения иксодоидных клещей
во многом отличны от таковых кровососущих насекомых, но наши зна-
ния в этой области весьма ограничены.
Внутриклеточное переваривание крови позвоночных и происходящие
при этом гистологические изменения пищеварительного тракта клещей,
включая отторжение части клеток в полость средней кишки, было впер-
вые описано для Ixodes ricinus (Roesler, 1934), а позднее подтверждено
для этого вида (Hughes, 1954), а также для Haemaphysalis spinigera (Ghi-
nery, 1964), Rhipicephalus appendiculatus (Till, 1961) и среди аргазид —
для Alveonasus lahorensis, Argas persicus и Ornithodoros papillipes (Си-
доров, 1960a). В то же время P. Татчелл (Tatchell, 1962a, 1964), исследо-
вавший переваривание крови у Argas persicus, отрицает возможность нор-
мального отторжения части клеток кишечника, хотя и не приводит до-
статочно убедительных доказательств.
Еще отрывочнее сведения о физиологических и биохимических осо-
бенностях процесса пищеварения, включая последовательные этапы пе-
реваривания и усвоения поглощенной пищи. Имеющиеся материалы огра-
ничиваются данными об изменениях в спектрах поглощения содержимого
кишечника Ixodes ricinus (Roesler, 1934; Sutton a. Arthur, 1962) и Argasper-
sicus (Tatchell, 1964) и результатами биохимических анализов содержа-
ния общего и белкового азота, железа и стеролов у питающихся и гото-
11 Ю. С. Балашов
- 161 -
вящихся к яйцекладке самок Boophilus microplus и Haemaphysalis bispi-
nosa (Kitaoka, 1961a, 1961b, 1961c).
Несмотря на ряд специальных исследований, связанная картина про-
цесса пищеварения от момента поступления крови в кишечник и до за-
вершения ее внутриклеточного переваривания оставалась невыясненной.
Неясными были такие принципиальные вопросы, как соотношение между
полостным и внутриклеточным пищеварением, степень специализации
пищеварительных клеток и возможность их отторжения в полость ки-
шечника, механизм прохождения гигантских молекул гемоглобина сквозь
цитоплазматическую мембрану и последовательные этапы его расщепления.
Многие из этих вопросов рассмотрены в серии наших статей (Балашов,
19576, 1957в, 1961а, 19616, 1962а, 1962в, 19636, 1963в), где приводятся
результаты исследований строения пищеварительного тракта и особен-
ностей процессов пищеварения у следующих видов иксодовых и арга-
совых клещей: Ixodes ricinus, Dermacentor pictus, Hyalomma asiaticum,
Rhipicephalus turanicus, Boophilus calcaratus, Alveonasus lahorensis,
Argas persicus, Ornithodoros papillipes, 0. tartakovskyi, 0, moubata,
0. coniceps (преимущественно Ixodes ricinus, Hyalomma asiaticum, Orni-
thodoros papillipes).
ОСОБЕННОСТИ КРОВИ позвоночных животных
КАК ПИЩИ КЛЕЩЕЙ
Как мы уже ранее отмечали (см. стр. 97—ЮЗ), аргасовые клещи погло-
щают преимущественно одну кровь, тогда как у иксодид существенное
значение в питании имеют продукты лизиса тканей и лимфа, скапливаю-
щиеся в воспалительном очаге в месте прикрепления. В целом аргасо-
вым клещам и в несколько меньшей степени иксодовым свойственно от-
сутствие строгой специфичности в выборе хозяев. В лабораторных усло-
виях, за немногими исключениями, клещи развивались после питания
на необычных для них видах хозяев. Так, в наших опытах при кормлении
клещей на млекопитающих, птицах и рептилиях нам ни разу не приходи-
лось наблюдать сколько-нибудь заметных нарушений в процессе пище-
варения. Несмотря на резкие внешние различия в состоянии содержимого
кишечника, связанные с физико-химическими особенностями крови хо-
зяев, как например устойчивостью эритроцитов к гемолизу или раство-
римостью гемоглобина, основные этапы пищеварения, включая внутри-
клеточное усвоение белков, существенно не менялись.
Возможность питания кровью далеко отстоящих друг от друга по си-
стематическому положению животных связана со значительной ста-
бильностью химического состава крови наземных позвоночных. В табл. 33
суммированы данные о содержании главных компонентов в крови не-
которых видов млекопитающих, птиц и рептилий, наиболее часто исполь-
зовавшихся для кормления клещей. Кровь позвоночных представляет
весьма концентрированный полноценный пищевой субстрат. Она содержит
в среднем 75—85% воды, 14—16% гемоглобина, 6.5—8.5% белков плазмы,
0.7—0.9% минеральных веществ и большое количество различных микро-
компонентов, включая витамины и биологически активные вещества.
Основным компонентом пищи клещей служат белки крови, тогда как
удельный вес жиров и углеводов ничтожен. Процессы пищеварения, как
и у других кровососов, специализированы в направлении наиболее пол-
ного усвоения белков. Альбумины и глобулины сыворотки усваиваются
полностью, тогда как в гемоглобине преимущественно усваивается гло-
булин, а простетическая группа — гем (3.38% гемоглобина) в значитель-
ной степени выводится вместе с фекалиями. Тем не менее определенное
- 162 -
Таблица 33
Содержание белков (%), холестерина (мг%) и сахара (мг%)
в крови некоторых позвоночных, на которых питаются иксодоидные клещи
(Балаховский и Балаховский, 1953; Никитин, 1956)
Хозяин Гемоглобин Общий белок сыворотки Альбу- мин Глобулин Холесте- рин Сахар
Человек . . Крупный рогатый 13.7—15.7 7-8 4.5—5.5 2.5-3.5 150-200 75—150
скот 11.2 7.3-9.5 3.5-4.5 3.3—5.6 53-137 43- 71
Кролик 11.4-14.5 6-8.3 4.1-5 1.9-3.6 15—67 112-156
Морская свинка 15-17.3 5-5.6 2.8-3.9 1.8-2.5 18-67 95—151
Белая крыса 16—18 6.9-7.6 2.6-3.5 3.3-5 52-82 91-124
Белая мышь 14.5-17.7 5.2-5.7 1.6-1.7 3.5-4.1 93-140 147-171
Курица 7.7—16.3 3.3-6.0 1.3-4.9 1.2-2.9
количество гема, заключающего в себе железо крови, по-видимому, жиз-
ненно необходимо для развития клещей.
В литературе неоднократно упоминаются случаи успешного развития
неполовозрелых фаз после питания одной лимфой. Мы также наблюдали
нормальное завершение линьки у личинок, выглядевших после питания
почти прозрачными или бледно-желтыми. Тем не менее на основании по-
добных чисто визуальных наблюдений нельзя делать вывод о возможности
развития клещей при отсутствии в пище железосодержащей части ге-
моглобина. Учитывая интенсивный гемолиз эритроцитов в воспалитель-
ном очаге в месте прикрепления клеща, последний вместе с воспалитель-
ным эксудатом неизбежно поглощает определенное количество растворен-
ного гемоглобина. В опытах с кровососущими клопами Triatoma infestans
(Lwoff e. Nicolle, 1947) было установлено, что развитие насекомых не-
возможно на рационе без гема. В то же время из приведенной таблицы
видно, что колебания в содержании белков крови между отдельными
видами могут достигать 20% и более. Соответственно в тех же пределах
может варьировать и общая калорийность крови на единицу веса. Еще важ-
нее могут быть, как показано в опытах с комарами (Clements, 1963),
различия в аминокислотном составе белков крови у разных видов хозяев.
Данные о влиянии крови разных видов хозяев на последующее раз-
витие или яйцевую продуктивность клещей крайне ограничены. Имеется
только одно специальное исследование о влиянии недостаточности содер-
жания витаминов в крови на развитие клещей (Meillon a. Golberg, 1947).
После кормления Ornithodoros moubata кровью крыс с искусственно вы-
званной недостаточностью по тиамину наблюдалось измельчание клещей
и удлинение сроков развития. Большинство сообщений о влиянии крови
необычных хозяев на снижение плодовитости или замедление развития
сводится к единичным наблюдениям без соответствующего эксперименталь-
ного анализа (Глащинская-Бабенко, 1956; Кнышевич, 1963) и не может
быть использовано для выяснения биохимических и физиологических
факторов пищевой специализации у кровососущих клещей. К тому же
в литературе очень часто смешиваются явления экологической приурочен-
ности к определенному кругу хозяев и немногие случаи действительной
неспособности или неблагоприятных последствий питания на отдельных
видах позвоночных животных. В результате на современном этапе знаний
можно лишь в самой общей форме говорить о значении главных компонен-
тов крови в питании клещей, а количественные и качественные потреб-
ности их в пище остаются неизвестными и требуют специальных иссле-
дований.
- 163 -
И*
ПЕРЕВАРИВАНИЕ ПОГЛОЩЕННОЙ КРОВИ
У кровососущих клещей, как будет показано далее, основные этапы
пищеварения (удаление избыточной воды крови, разрушение форменных
элементов, расщепление гемоглобина на гем и глобин, гидролиз белков)
и степень использования пищевых компонентов крови близки к таковым
у насекомых. В то же время наблюдаются значительные различия в ме-
ханизмах пищеварения в связи с особенностями строения пищевари-
тельного тракта, количеством одновременно поглощаемой крови, но глав-
ным образом вследствие полостного переваривания белков у насекомых
и внутриклеточного у клещей.
Удаление избыточной воды и разрушение эритроцитов. У аргасовых
клещей процессы сгущения крови в кишечнике и последующего разру-
шения эритроцитов протекают в полости кишечника и имеют много об-
щего с насекомыми. Процессы переваривания крови подразделяются
у них на три стадии. Первая стадия продолжается от 2—3 до 10—15 дней
и связана со сгущением и гемолизом крови; вторая стадия — от несколь-
ких недель до нескольких месяцев — начинается с завершения гемолиза
и заканчивается после усвоения основной массы гемоглобина; третья ста-
дия свойственна истощенным особям и отличается очень экономным рас-
ходованием сохранившейся в кишечнике полупереваренной крови.
Перед аргасовыми клещами, как и другими кровососами, после окон-
чания питания встает задача выведения из организма излишней воды и
солей, поглощенных вместе с кровью хозяина. Процентное содержание
воды в кишечнике аргазид сразу после питания заметно не отличается
от цельной крови хозяина. Функцию удаления избыточной воды несут
коксальные железы. В первые же минуты после отпадения с хозяина,
а в отдельных случаях еще на нем {Ornithodoros moubata, Alveonasus
lahorensis, Argas persicus) коксальные железы выводят большие количе-
ства прозрачной жидкости. Из табл. 34 видно, что у нимф Ornithodoros
papillipes она составляет 43—48% от веса поглощенной крови, у самок
39 и у самцов 17 %. Кроме воды, коксальная жидкость содержит много хло-
ристого натрия. У О. papillipes его содержание обычно колеблется в пре-
делах 0.8—0.9% (определение по точке замерзания). После удаления
коксальной жидкости уменьшается гипертрофическое растяжение покровов
и стенок кишечника. Кровь заметно сгущается и приобретает значитель-
ную вязкость.
Свертывание крови отсутствовало на всех этапах пищеварения, так же
как и в каплях содержимого средней кишки. Последнее свидетельствует
Таблица 34
Количество поглощаемой
у Ornithodoros papillipes
крови и удаляемой коксальной жидкости
(средние от взвешиваний 25 клещей; в мг)
Стадия развития Вес голодных Вес напитав- шихся до удаления коксальной жидкости Вес напи- тавшихся после удаления коксальной жидкости Вес поглощаемой крови Вес удаляемой кок- сальной жидкости
абс. в % к весу крови
Нимфы I 0.29 2.83 1.70 2.54 1.13 45
» II . 0.99 11.22 6.85 10.23 4.37 43
» III 4.44 22.93 14.0 18.49 8.93 48
» IV 7.04 56.21 33.93 49.17 22.28 45
Самки от нимф IV Самцы от нимф 17.65 85.75 59.39 68.09 26.35 39
IV 12.55 28.0 25.27 15.45 2.73 17
- 164 -
о длительном сохранении активности антикоагулинов слюны в полости
кишечника. В то же время эритроциты склеиваются в крупные скопле-
ния. Образование последних может быть связано как с изменением их
поверхностного заряда, так и с присутствием специфических агглюти-
нинов, сходных с таковыми из слюнных желез комаров (Clements, 1963).
Эритроциты крови составляют ее важнейший пищевой компонент для
кровососов, так как содержащийся в них гемоглобин нормально удовлет-
воряет значительную часть энергетических и метаболических потребностей.
Переваривание гемоглобина, если исключить случаи прямого фагоцитоза
кровяных клеток, начинается с его выхода из стромы эритроцитов в по-
лость кишечника. В связи с этим гемолиз следует считать неотъемлемым
этапом пищеварения кровососущих членистоногих. Темне менее специаль-
ные исследования особенностей гемолиза в организме кровососов отсут-
ствовали, причем это касалось не только клещей, но и лучше изученных
двукрылых.
На основании подсчетов форменных элементов крови в содержимом
кишечника клещей на разных сроках после питания, витальных микро-
скопических наблюдений и измерений гемолитической стойкости эритро-
цитов в полости кишечника нами описаны физико-химические изменения
крови позвоночных в организме клещей. Независимо от видовой принад-
лежности хозяев, в пищеварительный тракт аргасовых клещей при кро-
вососании поступает, не гемолизированная кровь с эритроцитами нормаль-
ной формы без видимых повреждений (рис. 258, стр. 149). По-видимому,
слюна аргазид не обладает значительной гемолитической активностью
и гемолиз происходит после окончания питания. Эритроциты хозяина
в первые часы после питания заметно не меняются. Лишь за счет повы-
шения осмотического давления в кишечнике наблюдается их некоторое
сжатие и они могут приобретать характерные зубчатые контуры. Одно-
временно идет их быстрая агглютинация в крупные скопления (рис. 259).
Количество эритроцитов в единице объема содержимого кишечника Orni-
thodoros papillipes и других видов аргазид увеличивается после удаления
коксальной жидкости более чем в два раза по сравнению с их содержанием
в цельной крови (табл. 35).
Таблица 35
Количество эритроцитов (в млн)
в 1 мм3 содержимого средней кишки самок Ornithodoros papillipes
после питания при различной температуре воздуха
18° 28°
Время после питания, в сутках § к а х gS ф я л ЕГ S ft сб а X сб сб К Й С £ Ф ft Е- Ф а сб сб X X О д S’» 2 со № X сб а ф я сб а я ft р» сб а и сб Сб X К а 2 Ф ft Н Ф
S о ю S X О F S о ю S X О X
Цельная кровь. 5.0 9.1 3.2 0.7 5.1 9.1 3.3 0.7
Сразу после пи- 5.1 9.2 3.2 0.8 5.2 9.1 3.4 0.8
тания. 1 10.7 20.4 5.9 2.1 7.4 10.1 3.7 1.2
3 6.6 19.0 4.7 2.3 6.3 3.3 3.9 0.9
5 5.9 21.9 4.3 2.4 1.5 2.6 4.1 0
8 6.2 15.1 4.1 2.0 1.4 2.5 1 .6 —
10 6.7 10.2 3.9 1.5 0.5 1.2 0.8 —
15 5.5 7.2 2.1 0.5 0 1.1 0 —
20 0.2 4.1 2.0 0.4 — 0 — —
25 0 1.2 0.4 0 — — — —
30 — 0 — — — — —
- 165 -
Гемолиз становится заметным обычно к концу первых суток после пи-
тания. В поле зрения микроскопа появляются белковые стромы полностью
гемолизированных эритроцитов — «тени», имеющие вид темных дисков,
Особенно хорошо они видны у птиц и рептилий благодаря сохранению
в них ядер (рис. 260). Одновременно с гемолизом в первые дни питания
продолжается дальнейшее сгущение содержимого кишечника, так что
в отдельных случаях количество эритроцитов в 1 мм3 может почти не ме-
няться в течение 1—2 дней. В большинстве случаев значительная часть
эритроцитов разрушается в первые 1—3 дня после кровососания (табл. 35).
Гемолиз сохранившихся после этого эритроцитов продолжается значи-
тельно медленнее и может растягиваться на несколько недель.
Решающее влияние на скорость гемолиза оказывает окружающая тем-
пература. Из табл. 35 видно, что при 18° он заканчивается у О, papil-
lipes через 30, а при 28° — через 12 суток после питания. Сходные резуль-
таты получены и для остальных видов. Видовая принадлежность погло-
щенной крови оказывает значительно меньшее воздействие. Известно,
что стойкость эритроцитов птиц и рептилий при кислотном гемолизе
приблизительно в 5 раз выше, чем у млекопитающих (Гительзон и Тер-
сков, 1959). В кишечнике же клеща О. papillipes гемолиз эритроцитов
белой мыши и курицы заканчивался примерно в одно время, а крови
черепахи шел даже быстрее. Скорость разрушения эритроцитов может
не зависеть от их суммарной осмотической стойкости и при питании на
хозяевах, принадлежащих к близким систематическим группам. Напри-
мер, у морской свинки суммарная стойкость несколько больше, чем
у белой мыши, а разрушение эритроцитов в кишечнике О. papillipes^
напротив, происходит быстрее (табл. 35 и 36).
Таблица 36
Суммарная осмотическая стойкость эритроцитов
в содержимом кишечника кровососущих членистоногих
(гемолитик — 0.004 н. НС1, 24°)
Время после питаны в сутках Клещ Ornithodoros papillipes на морской свинке Постельный клоп на белой мыши Слепень Tabanus bromius на лошади
Цельная кровь. 224 203 545
Сразу после питания. 306 123 169
1 275 121 107
3 241 115 104
8 304 — —
В зависимости от свойств крови хозяина и физиологических особен-
ностей кровососов перевариваемая кровь может оставаться жидкой (после
питания на белой мыши) или же вязкость ее значительно увеличивается
(после питания на морской свинке) и она может приобретать желеобразную
консистенцию (после питания на курице). В дальнейшем после окончания
гемолиза содержимое кишечника может вновь разжижаться (куриная
кровь) или же становиться кашеобразным в связи с кристаллизацией
гемоглобина (морская свинка и белая крыса).
Хорошим критерием состояния эритроцитов в кишечнике аргасовых
клещей служат их антигенные свойства. Сохранение антигенных свойств
эритроцитов свидетельствует об отсутствии существенных изменений
в их внутренней структуре. На основании изучения этого показателя для
эритроцитов крупного рогатого скота в кишечнике клещей Ornithodoros
savignyi было подтверждено медленное и постепенное разрушение формен-
- 166 -
ных элементов крови в кишечнике этих кровососов (Osterhoff a. Gothe,
1966). В кишке самцов антигенные свойства эритроцитов сохранялись
в течение 1 суток, а самок — в течение 5 суток после питания при тем-
пературе 26—27°.
Об изменениях свойств эритроцитов в кишечнике можно судить и по
сдвигам в их кислотных эритрограммах. При этом выявляются значитель-
ные различия между клещами и насекомыми. Суммарная стойкость эри-
троцитов морской свинки после поступления в кишечник О. papillipes и
Alveonasus lahorensis значительно возрастает по сравнению с цельной
кровью (табл. 36), а эритрограмма сдвигается вправо, в область повышен-
Рис. 266. Эритрограммы крови морской свинки из полости кишечника клещей Orni-
thodoros papillipes (Л) и Alveonasus lahorensis (Б),
1 — цельная венозная кровь морской свинки; 2 — на первые и 3 — на четвертые сутки после крово-
сосания.
ной стойкости (рис. 266). Подобный характер распределения по осмотиче-
ской стойкости сохраняется и на 8-е сутки после питания.
Механизм переваривания эритроцитов клещами в то же время остается
не выясненным. Предполагается, что их гемолиз связан с активностью
каких-то еще не идентифицированных компонентов полисахаридного кол-
лоидного вещества секреторных клеток средней кишки (Tatchell, 1964).
Разрушение лейкоцитов. Хорошими индикаторами первых этапов
пищеварения могут служить также морфо-физиологические изменения
в поглощенных лейкоцитах. Нами были изучены сроки переживания и
особенности разрушения белых кровяных телец степной черепахи, ку-
рицы, белой мыши, морской свинки, кролика, крупного рогатого скота,
лошади и человека в пищеварительном тракте клещей: Ornithodoros papil-
lipes, Alveonasus lahorensis и Argas persicus,
У аргасовых клещей в кишечник поступает мало измененная кровь
хозяев, содержащая наряду с эритроцитами и целые неповрежденные
лейкоциты. В первые минуты после питания до начала сгущения содер-
жимого кишечника количество лейкоцитов в 1 мм3 и соотношение между
их отдельными типами близко к таковому в кровяном русле хозяев
(табл. 37). Так, при питании на черепахе доминировали очень крупные
эозинофилы, на курице — псевдоэозинофилы и лимфоциты и на млеко-
питающих — полиморфоядерные нейтрофилы и лимфоциты (рис. 261).
При микроскопическом исследовании лейкоциты распределены равно-
мерно по всему полю зрения и обычно не образуют местных скоплений.
В первые сутки после питания, несмотря на начавшееся разрушение лейко-
цитов, концентрация их в 1 мм3 содержимого кишечника, как и в случае
с эритропитами, увеличивается в 1.5—2.5 раза в связи со сгущением
- 167 -
Таблица 37
Количество лейкоцитов в 1 мм8 содержимого средней кишки
кровососущих членистоногих при различной температуре воздуха
Время после питания, в сутках Ornithodoros papillipes на морской свинке Постельный клоп на белой мыши Слепень Tabanus bromius на человеке
18° 28° 18° 28° 18° 28°
Цельная кровь. 10500 11600 9300 10800 6400 6300
Сразу после 11300 12100 12300 11900 5800 6100
питания.
1 24700 26600 15000 18600 15820 11200
2 24200 17500 12800 10500 9000 4000
3 21500 9800 6300 5100 3300 Единичные.
4 20900 6200 4200 3400 2500 0
5 20100 3400 3700 1800 Единичные. 0
7 14800 3200 1100 0 0 0
10 10300 900 0 0 0 0
15 3200 Единичные. — — — —
20 Единичные. 0 — — — —
крови хозяина после выделения из организма избыточной воды (табл. 37).
В последующие дни происходило постепенное уменьшение концентрации
белых кровяных телец, подвергающихся лизису. Скорость их разрушения
в первую очередь зависела от интенсивности процессов пищеварения и от
окружающей температуры. Интересно, что у насекомых с более прогрес-
сивным полостным типом пищеварения лейкоциты, как и эритроциты,
исчезают из кишечника значительно быстрее, чем у аргасовых клещей
с более примитивным внутриклеточным пищеварением (Балашов, 19636,
1963в). Например, при 28° разрушение лейкоцитов в кишечнике слепня
заканчивается через 3 суток после кровососанйя, у постельного клопа —
через 5, а у клеща Ornithodoros papillipes — через 15 суток. При 18°
разрушение лейкоцитов у тех же трех видов шло значительно медленнее
иуд. papillipes они сохранялись даже на 20-е сутки.
Видовые особенности крови хозяев, включая млекопитающих, птиц
и рептилий, в условиях эксперимента оказывали значительно меньшее
влияние на сроки сохранения белых кровяных клеток в кишечнике. Так,
у самок О. papillipes при кормлении на морских свинках, белых мышах,
курах и черепахах и последующем содержании при 28° разрушение лей-
коцитов заканчивалось за 12—17 суток и достоверные различия в ско-
рости их переваривания в зависимости от видовой принадлежности хо-
зяев выявить не удалось.
При исследовании содержимого пищеварительного тракта после
подкраски акридиновым оранжевым в люминесцентном микроскопе
хорошо видны последовательные этапы разрушения лейкоцитов. В пер-
вые часы после кровососанйя большинство лейкоцитов внешне мало отли-
чается от взятых непосредственно из кровяного русла хозяина. Ядра их
имеют зеленоватую окраску, цитоплазма почти не окрашивается и только
в гранулоцитах наблюдаются оранжево-красные включения. Ненормаль-
ные условия окружающей среды (повышенное осмотическое давление,
присутствие пищеварительных ферментов и продуктов разрушения кле-
ток), однако, сразу же подавляют их фагоцитарную активность. Клетки
выглядят округлыми и теряют способность к распластыванию на плоских
поверхностях. На 3—5-е сутки после питания характер люминесценции
значительной части лейкоцитов изменяется. Ядра становятся зеленовато-
желтыми или почти оранжевыми и тонкие внутренние структуры в них
- 168 -
больше не выявляются. Цитоплазма начинает светиться желто-зеленым
светом, так что иногда трудно бывает выявить ее границу с сегментиро-
ванными ядрами. Постепенно все больший процент лейкоцитов претерпе-
вает подобные изменения. Следующие этапы дегенерации связаны уже
с растворением цитоплазмы и ядер. Лизису лейкоцитов часто предшествует
склеивание их в группы, в которых границы между отдельными клетками
часто становятся неразличимыми.
Сроки сохранения различных типов лейкоцитов в кишечнике неодина-
ковы. Быстрее всего разрушаются гранулоциты (особенно нейтрофилы)
и наиболее устойчивы лимфоциты. Клетки одного типа также разрушаются
далеко не одновременно, в связи с чем в последующие дни после питания
можно наблюдать все стадии разрушения лейкоцитов. Различная устой-
чивость гранулоцитов, моноцитов и лимфоцитов по мере переваривания
поглощенной крови приводит к изменению в соотношении этих трех
групп клеток по сравнению с организмом хозяина. Лейкоцитарный про-
филь смещается в сторону лимфоцитов, а к концу разрушения форменных
элементов в кишечнике сохраняются только они одни.
Лейкоциты с изменившимся характером свечения в люминесцентном
микроскопе, по-видимому, следует считать нежизнеспособными. Однако
своеобразные условия среды в кишечнике кровососов обеспечивают их
консервацию в течение многих суток. В результате в кишечнике аргасо-
вых клещей лейкоциты позвоночных сохраняются значительно дольше
их нормального существования в кровяном русле, обычно составляющего
3—4 суток. Длительные сроки сохранения целых лейкоцитов в пищевари-
тельном тракте аргасовых клещей связаны с постепенным усвоением
огромной массы крови, поступившей в организм в период питания,
и низкой активностью протеаз в полости кишечника.
Иксодовые клещи по составу их пищи значительно отличаются от
большинства других кровососущих членистоногих. При многодневном
питании иксодид под влиянием лизирующих факторов слюны и воспали-
тельного процесса в месте прикрепления происходит интенсивный гисто-
лиз тканей, лейкоцитарная инфильтрация и образование значительного
отека. Вследствие этих процессов в кишечник, особенно в первые дни
питания, поступает содержимое эксудата, состоящее из лимфы, большого
количества лейкоцитов, фрагментов тканей и различного количества
крови. Последняя становится главным компонентов пищи лишь в конце
питания — на стадии растяжения, когда по мере лизиса стенок крове-
носных сосудов резко усиливается поступление крови в воспалительный
очаг. Содержимое кишечника иксодид, таким образом, определяется
особенностями воспалительного очага в месте прикрепления и может
сильно варьировать в зависимости от места прикрепления на теле хо-
зяина, видовых особенностей паразита и прокормителя и многих других
факторов.
В содержимом кишечника самок Ixodes ricinus и Hyalomma asiaticum
эритроциты, как правило, отсутствуют даже во время питания. При
вскрытиях и прижизненном изучении в фазовом контрасте видно, что он
заполнен темно-красными сферическими каплями гемоглобина диаметром
до 0.1 мм, образовавшимися после разрушения эритроцитов (рис. 264).
Только у личинок и, в меньшей степени, у нимф в последние сутки питания
и первые 1—2 дня после его окончания в кишечнике содержится значи-
тельное количество эритроцитов и их «теней». Таким образом, в отличие
от других кровососов, иксодидам свойствен преимущественно внекишеч-
ный тип гемолиза.
Количество лейкоцитов в кишечнике, равно как и соотношение между
их отдельными типами, очень непостоянно и значительно отличается от
крови хозяев. Так, при кормлении самок иксодовых клещей на кроликах
- 169 -
в одних случаях в среднем отделе кишечника преобладали полиморфо-
ядерные нейтрофилы, а в других — лимфоциты (рис. 265). Лейкоциты
часто склеиваются в значительные скопления и находятся на различных
стадиях разрушения. Наряду с лейкоцитами встречаются фрагменты
клеток разрушающихся тканей хозяина. Среди личинок часто наблюдаются
случаи поглощения одного почти лишенного гемоглобина содержимого
отека в месте прикрепления. Иногда, напротив, в кишечнике преобладает
кровь хозяев, и лейкоциты в этих случаях повреждены меньше.
Усвоение гемоглобина. Вторая стадия пищеварения аргасовых клещей
начинается по окончании гемолиза эритроцитов и заканчивается после
усвоения основной массы крови и заполнения кишечника гематином.
В свою очередь она может быть подразделена на периоды быстрого пере-
варивания и усвоения крови при подготовке к яйцекладке или линьке
и сравнительно медленного пищеварения по завершении этих процессов.
По данным спектрального анализа содержимого средней кишки са-
мок Alveonasus lahorensis на различных сроках после питания кровью
морских свинок, в первые несколько дней спектры поглощения каче-
ственно близки к таковым цельной крови хозяина (рис. 267). Абсолютно
преобладает оксигемоглобин. Примесь метгемоглобина, судя по незначи-
тельному уменьшению максимумов поглощения а и р и сохранению ми-
нимума при длине световой волны 520 ммк, весьма незначительна и не
превышает 1—2%. Обращает внимание исключительно высокая концен-
трация гемоглобина, достигающая при максимальном сгущении крови
40—50 г%. Превышение нормальной растворимости гемоглобина объяс-
няется нахождением его значительной части в кристаллической форме
или же в сосостоянии пересыщенного раствора. В дальнейшем, особенно
после окончания гемолиза, концентрация гемоглобина на единицу объема
содержимого кишечника непрерывно снижается, но даже у закончив-
ших откладку яиц самок она достигает 4—7 г % (табл. 38). Одновременно*
наблюдается выравнивание пиков поглощения гемоглобина за счет повы-
шения примеси растворенного гематина и метгемоглобина. Основная
масса гематина находится в кристаллической форме и растворяется при
добавлении щелочей. Исследуя оптическую плотность щелочных растворов
содержимого кишечника, мы обнаружили непрерывное увеличение содер-
жания гематина, идущее параллельно со снижением количества окси-
гемоглобина.
Таблица 38
Концентрация гемоглобина (г%) в содержимом средней кишки самок
Ornithodoros papillipes и Alveonasus lahorensis
в последовательные дни после питания на морской свинке
(температура 19—20°)
Время после питания, в сутках Ornithodoros papillipes Alveonasus lahorensis
свобод- ный в эритро- цитах суммар- ная свобод- ный в эритро- цитах суммар- ная
Кровь морской свинки до начала кормления клещей. — — 15.1 — — 15.6
Содержимое кишечника сразу после пита- ния. 1.6 17.4 19.0 2.3 16.6 18.9
1 6.8 34.0 40.8 18.3 31.8 50.1
3 17.2 24.4 41.6 15.2 32.2 47.4
10 30.2 9.1 39.3 18.8 3.4 22.2
20 26.5 0 26.5 21.0 0 21.0
90 12.7 0 12.7 17.0 0 17.0
180 (после окончания яйцекладки). 4.1 0 4.1 6.9 0 6.9
- 170 -
Количественная сторона усвоения гемоглобина была детально иссле-
дована Р. Татчелом (Tatchell, 1964) на клещах Argaspersicus после кормле-
ния куриной кровью. При этом было обнаружено, что в первые три дня
после питания переваривание гемоглобина отсутствовало или шло очень
медленно, а затем до окончания яйцекладки или образования новой кути-
кулы у нимф уменьшение содержания гемоглобина в полости кишечника
происходило с максимальной скоростью. Снижение метаболической ак-
тивности по окончании яйцекладки или линьки сразу же приводило
400 20 40 60 80 500 20 40 60 80 600 20 40 60 80 700 20 40750
Длина световых волн (в ммк)
Рис. 267. Спектры пропускания содержимого кишечника самок Al-
veonasus lahorensis на разных сроках после питания.
1 — цельная венозная кровь морской свинки; 2 — содержимое кишечника
сразу после питания на морской свинке, 3 — через 10 дней, 4 — через 3 ме-
сяца после питания, 5 — через 6 месяцев.
к резкому уменьшению потребления оставшегося в кишечнике гемогло-
бина. В результате сохранившееся количество обеспечивало поддержа-
ние основного обмена клещей на протяжении нескольких месяцев до
нового кровососания (рис. 268, А). У самцов и неоплодотворенных самок
усвоение гемоглобина происходило значительно медленнее и четкая
граница между периодами с высокой и низкой пищеварительной актив-
ностью отсутствовала. Скорость пищеварения находилась в прямой за-
висимости от температуры (рис. 268, Б) при Qiq=2.
Сопоставление приведенных наблюдений с нашими данными о пище-
варении у клещей Ornithodoros papillipes, Alveonasus lahorensis, а также
у того же вида Argas persicus свидетельствует о совпадении результатов,
полученных разными методиками и на разных объектах. Л. persicus
- 171 -
отличается от Ornithodoros papillipes и Alveonasus lahorensis значительно-
меньшей продолжительностью гонотрофического цикла, а соответственно и
сроки отдельных стадий пищеварения у первого вида значительно короче.
В связи с этим первая стадия с минимальной скоростью усвоения гемо-
глобина, соответствующая по времени гемолизу эритроцитов, продол-
жается у Ar gas persicus 2— 3 суток, а у двух других видов — 1—2 недели.
Откладка яиц начинается у A. persicus при 28—30° через неделю после
питания и заканчивается через 2—3 недели, тогда как % Ornithodoros
papillipes и Alveonasus lahorensis яйцекладка начинается не ранее чем
через месяц и продолжается до месяца. Соответственно и стадия интен-
сивного пищеварения занимает в первом случае 3—4 недели, а во втором
ками (Б) A rgas persicus после кормления на курице, стрелки обозначают момент линьки
(по Tatchell, 1964).
выражена слабее и продолжается 2 месяца и более. Стадия с медленным
расходованием пищевых резервов была сходна у всех трех видов, и сроки
переживания клещей определялись как запасами гемоглобина, остав-
шимися после яйцекладки или линьки, так и интенсивностью их по-
требления. При этом наблюдались очень сильные индивидуальные ко-
лебания.
Содержимое средней кишки на второй стадии пищеварения имеет
черно-красную или коричнево-красную окраску. По консистенции оно
либо жидкое, либо кашеобразное. В последнем случае в жидкости пла-
вают крупные кристаллы гемоглобина (рис. 262). Подобные различия
определяются физико-химическими особенностями гемоглобинов разных
видов хозяев. Гемоглобин, освободившийся после гемолиза эритроцитов,
остается в растворе или кристаллизуется. Его способность к кристалли-
зации в кишечнике аргазид совпадает с константой растворимости
(Коржуев, 1964) и, следовательно, представляет чисто физический процесс.
Видовые особенности клещей не играют здесь существенной роли. На-
против, гемоглобины разных видов хозяев-позвоночных значительно
отличаются по способности к кристаллизации. В наших опытах почти
сразу же после гемолиза выпадали кристаллы гемоглобина морской
свинки, белой крысы и несколько медленнее — собаки. Гемоглобины
человека, коровы, овцы, козы, белой мыши, кролика, курицы и степной
черепахи остаются в растворе и не переходят в кристаллическую форму.
Однако и в этих случаях легко доказать присутствие гемоглобина в со-
держимом кишечника, осадив его добавлением подкисленного этилового
спирта. Обнаруживаемые в кишечнике кристаллы представляют смесь
- 172 -
-окиси гомо глобина и его окисленной формы — метгемоглобина. Несмотря
на незначительные химические различия, они могут заметно отличаться
по форме. Например, после питания на морской свинке, кроме основной
массы тетраэдрических кристаллов гемоглобина, встречаются и одиноч-
ные призматические кристаллы метгемоглобина. У длительно голодавших
клещей процентное содержание последних немного увеличивается.
Учитывая значительную видовую специфичность кристаллов гемогло-
бина и его длительное сохранение в кишечнике, можно довольно точно
определять хозяев клещей (Pick, 1965). При этом в случае жидкого содер-
жимого кишечника можно вызвать искусственную кристаллизацию гемо-
глобина. Следует, однако, учитывать различия во внешнем виде кристал-
лов, связанные со способом кристаллизации. П. А. Коржуев (1964) ука-
зывает, что, хотя кристаллы гемоглобина, полученные из одной пробы
крови, принадлежат к одной и той же системе по соотношению осей, рни
могут быть различными по виду, если кристаллизация вызвана разными
методами. Возможно, что с последним связана различная форма кристал-
лов крови одного и того же вида хозяина в кишечнике клещей Orni-
thodoros papillipes и Alveonasus lahorensis, описанная В. Е. Сидоровым
(1960а). Кишечник клещей, способных к новому кровососанию, обычно нахо-
дится на второй стадии пищеварения. Вновь поступающая кровь смеши-
вается с не успевшими перевариться остатками старой. У истощенных
индивидов, голодавших значительно большие промежутки времени, со-
держимое кишечника окрашено в буро-черный цвет. Количество гемо-
глобина в нем уменьшается до десятых долей процента и основную массу
составляют мелкие сферические частицы гематина, обусловливающие
его темную окраску (рис. 263). Резкого перехода между второй и третьей
стадиями пищеварения обычно не наблюдается.
У представителей сем. Ixodidae спектрофотометрический анализ пи-
щеварения по изменениям в концентрации гемоглобина и его дериватов
дает менее ясные результаты в связи с поглощением больших количеств
других типов белков. Е. Саттон и Р. Артуром (Sutton a. Arthur, 1962)
было исследовано содержание гемоглобина и его производных в содержи-
мом средней кишки самок Ixodes ricinus, различающихся по весу и окраске,
сразу после удаления с хозяина. В результате этой работы доказаны
значительные колебания в количестве гемоглобина, поглощенного осо-
бями одного веса. Гемоглобин преобладал в содержимом кишечника
темно окрашенных особей, тогда как у светло окрашенных клещей его
было значительно меньше.
Второе отличие пищеварения иксодовых клещей от аргасовых свя-
зано с быстрым переходом большей части гемоглобина и других белков
крови из полости кишечника в пищеварительные клетки. Содержимое
средней кишки уменьшается в объеме, а значительную часть ее полости
занимают дистальные концы гипертрофированных пищеварительных кле-
ток (рис. 316). Сохраняющаяся в кишечнике кровь претерпевает те же
изменения, что и у аргазид. В случае низкой растворимости гемоглобина
он кристаллизуется, а при достаточной растворимости сохраняется в рас-
творе. Концентрация его, по данным спектроскопии или качественной
бензидиновой реакции, быстро уменьшается и к концу яйцекладки в по-
лости кишечника остаются лишь следы гемоглобина. Сходные результаты
получены при определении присутствия белков плазмы серологическими
методами (Roesler, 1934). Интенсивность реакции преципитации содержи-
мого средней кишки самки Z. ricinus уменьшалась в последующие дни
после питания, а у особей, заканчивающих откладку яиц, специфичность
белков хозяина уже полностью утрачивалась.
Количественная характеристика процесса пищеварения была получена
лишь для самок Boophilus microplus (Kitaoka, 1961b, 1961c). На основании
- 173 -
определения содержания в их организме связанного и растворимого'
железа, а также общего и растворимого азота на различных сроках пи-
тания и после него установлены из-
Рис. 269. Скорости переваривания по-
глощенной крови, накопления гуани-
на, изменений в содержании азота и
перехода растворимого железа из орга-
низма напитавшихся самок Boophilus
microplus в откладываемые яйца. За
100% принято суммарное содержание
железа (растворимая и нерастворимая
фракции в организме клеща).
1 — общий азот; 2 — азот гуанина; 3 — рас-
творимый азот; 4 — растворимое железо; 5 —
железо, перешедшее в отложенные яйца.
менения в содержании железа в орга-
низме, скорости усвоения поглощен-
ной крови и накопления экскретов и
фекалиев. У только что напитавших-
ся самок растворимые железо и азот*
характеризовавшие еще не перева-
ренную часть пищи, составляли соот-
ветственно 68.7 и 69.2% от их общего
содержания в организме (рис. 269).
Весь последующий период подготов-
ки к яйцекладке и откладки яиц
наблюдалось быстрое уменьшение
доли этих двух компонентов, пока
не достигался постоянный мини-
мальный уровень. Последний, по-
видимому, соответствует окончанию
переваривания поглощенной пищи
незадолго до завершения яйцекладки.
Параллельно происходило увеличе-
ние доли азота гуанина и связанного
железа, которое почти целиком вхо-
дило в состав гематина и оставалось
в организме клеща до его гибели.
Уменьшение общего содержания же-
леза в организме на 5—10% было
связано с перемещением его в откла-
дываемые яйца.
В целом процессы пищеварения
у иксодовых клещей во многом сход-
ны с таковыми у аргазид, но при этом их клетками захватывается вся
поглощенная пища, так что полость кишечника не содержит запасных пи-
тательных веществ даже у заканчивающих линьку личинок и нимф.
ЦИТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ПИЩЕВАРЕНИЯ
Аргасовые клещи. Между желудком и отдельными дивертикулами
среднего отдела кишечника аргазид в процессе пищеварения обнаружи-
ваются некоторые функциональные различия. Они связаны с наличием
у средней кишки двух различных функций. Последняя одновременно
служит и органом пищеварения, и резервным депо больших количеств
непереваренной крови. У напитавшихся клещей до удаления коксальной
жидкости все отделы средней кишки растянуты до предела. После ее
удаления желудок, срединные отростки и, в меньшей степени, основания
переднебоковых растянуты кровью значительно слабее, чем дистальные
концы переднебоковых и особенно заднебоковые дивертикулы (рис. 270).
Последние служат основным местом хранения непереваренной крови и
сохраняются в сильно растянутом состоянии даже у голодавших не-
сколько месяцев и способных к повторному питанию клещей (рис. 271, 277).
Лишь у очень истощенных особей они запустевают, а их стенки спадаются.
Процессы пищеварения первое время после питания сосредоточены
преимущественно в желудке и проксимальных частях переднебоковых и
срединных отростков. Дистальные концы последних и заднебоковые
отростки растянуты в этот период до состояния тонкой мембрановидной
- 174 -
оболочки, окружающей массу крови хозяина, и не могут играть суще-
ственной роли в ее переваривании. У истощенных особей они, напротив,
играют решающую роль в усвоении сохранившихся в них небольших за-
пасов крови.
Форма и размеры эпителиальных клеток средней кишки аргазид
сильно варьируют в зависимости от физиологического состояния клеща и,
в меньшей степени, от видовой принадлежности. Эпителиальные клетки
средней кишки покоятся на тонкой базальной мембране. Снаружи она
оплетена сетью взаимно пересекающихся кольцевых и продольных мы-
шечных волокон, не образующих сплошного слоя. Сокращения муску-
латуры стенок кишечника обусловливают его постоянные перистальтиче-
ские движения, хорошо заметные на живых клещах, вскрытых в физиоло-
гическом растворе.
По морфологическим особенностям, характеру внутриклеточных вклю-
чений и функциональной активности, мы различаем три типа клеток: секре-
торные, пищеварительные и недифференцированные резервные, сходные
с таковыми скорпионов (Павловский и Зарин, 1926), пауков (Millot,
1949; Иванов, 1965) и изученных в этом отношении групп клещей (Ba-
der, 1938; Hughes, 1950, 1952).
Соотношение между тремя описанными типами клеток до сих пор не
вполне ясно. Несомненно, что пищеварительные и секреторные клетки
образуются из резервных. У неполовозрелых фаз их массовое размноже-
ние обычно наблюдается вскоре после питания при подготовке к линьке.
У половозрелых особей митотические деления недифференцированных
клеток встречаются значительно реже, но обычно также связаны с окон-
чанием кровососанйя. Скорее всего у аргасовых клещей существует один
тип резервных клеток, из которых в зависимости от фазы пищеварения
дифференцируются в большем числе секреторные или пищеварительные
клетки. В то же время возможность прямого взаимного превращения
двух последних типов после завершения их дифференцировки, как счи-
тает Р. Татчелл (Tatchell, 1964), маловероятна. Еще менее правдоподобно
предположение того же автора о возможности развития клетки противо-
положного типа из сохранившегося после отторжения апикальной части
проксимального конца клетки. По нашим наблюдениям, апикальные
концы клеток чаще всего отрываются в просвет вместе с участком цито-
плазмы, включающим ядро, тогда как сохранившаяся проксимальная
часть клетки вскоре дегенерирует.
Наиболее детально нами были исследованы цитологические особен-
ности кишечника самок Ornithodoros papillipes. У голодных клещей,
готовых к питанию, но еще сохранивших в полости средней кишки зна-
чительное количество полупереваренной крови от прошлого кровососа-
ния, в стенках кишечника преобладают клетки секреторного и резерв-
ного типов. Секреторные клетки выдаются апикальными концами в про-
свет и имеют столбчатую форму при высоте 60—120 мк и максимальной
ширине 20—30 мк (рис. 281). Овальные или почти правильные сфериче-
ские ядра диаметром 6—7 мк лежат посередине или несколько ближе
к проксимальному концу клетки. Проксимальнее ядер цитоплазма мелко-
зернистая, с тонкими фибриллярными структурами, по-видимому, пред-
ставляющими элементы эндоплазматической сети, и большим количеством
митохондрий. В апикальной половине клетки располагаются вакуоли,
обычно не красящиеся ни кислыми, ни основными красителями. Их
содержимое дает интенсивную ШИК-положительную реакцию, сохраняю-
щуюся после обработки срезов диастазой. По характеру гистохимических
реакций их содержимое, вероятно, является полисахаридом, тогда как
более мелкие ШИК-положительные гранулы в проксимальной цитоплаз-
матической зоне — гликогеном.
- 175 -
Резервные клетки более мелкие, и их форма приближается к кубиче-
ской или клиновидной. Их дистальные концы часто прикрыты смыкаю-
щимися сверху соседними пищеварительными или секреторными клетками
(рис. 280, 281). Пищеварительные клетки у голодающих особей относи-
Рис. 276—281. Строение клеток средней кишки самки Ornithodoros
papillipes.
276 — участок заднебокового отростка сразу после питания; 277 — тоже
через несколько месяцев голодания; 278 — стенка желудка в растянутом
состоянии; 279 — отшнуровывание глыбовидных пищеварительных клеток
в полость кишечника; 280 — пищеварительные клетки и 281 — секретор-
ные клетки через несколько месяцев после кровососания.
я — ядра; мв — мышечные волокна; ко — клетки, оторвавшиеся в просвет; в — ваку-
оли с секретом; гб — включения гемоглобина; гм — включения гематина; кн — недиф-
ференцированные эпителиальные клетки.
тельно немногочисленны и разбросаны вперемежку с секреторными и
резервными. Они имеют вытянутую форму с расширенной апикальной
половиной или же почти кубическую, но значительно крупнее резервных
и с выдающейся в просвет апикальной поверхностью. Ядра занимают
центральное положение, а в цитоплазме содержится большое количество
различных включений (рис. 279, 280). Среди последних в апикальной
половине клетки преобладают вакуоли диаметром от 1 до 3—6 мк, крася-
- 176 -
270 211
21b
Рис. 270—275. Строение средней кишки аргасовых клещей.
Поперечные срезы: 270 — через голодную самку Ornithodoros papillipes, 271 — то же
через напитавшуюся, 25; участки стенки средней кишки самок: 272 — О. papil-
lipes, 273 — Alveonasus lahorensis, 274 — Argas persicus, X 600; 275 — отторгнутая
пищеварительная клетка Ornithodoros papillipes, прижизненная подкраска акридино-
вым оранжевым, Х900, люминесцентный микроскоп.
Рис. 303—310. Клетки средней кишки самки Hyalomma asiaticum.
303 — голодная сразу после линьки; 304 — истощенная, через 8 месяцев после линьки,
окраска железным гематоксилином-эозином; 305 — гранулы пурпурного пигмента
в клетках голодной особи; 306 — пищевые включения из гемоглобина (окраска бен-
зидином-сафранином); 307 — жировые вакуоли (окраска черным Суданом);
308 — ШИК-положительные вещества в клетках кишечника голодного клеща;
309 — секреторные клетки кишечника во время дифференцировки; 310 — то же в пе-
риод массового отторжения в полость кишечника в начале питания (окраска ШИК-
гематоксилин Эрлиха). Микрофотографии: 305— X 1350; 307 — Х400; 303, 304, 306,
308—310 - Х600.
пв — пищевые включения из гемоглобина; же — жировые вакуоли; шв — ШИК-положителыюе ве-
щество; пг — пигментные гранулы; нк — недифференцированные клетки; ск — секреторные клетки.
щиеся азокармином и железным гематоксилином. Они дают интенсивную
положительную реакцию на белок с БФС и на гемоглобин с бензидином,
так что их следует считать гемоглобином крови хозяина, поглощенным
в мало измененной форме клеткой клеща.
Второй тип включений представлен мелкими (до 1 мк) и средними гра-
нулами гематина, разбросанными по всей цитоплазме. Более крупные
гематиновые включения (2—4 мк) имеют форму правильных сферокристал-
лов интенсивной буро-черной окраски. При обработке срезов методом
ШИК или кармином по Бесту в цитоплазме выявляется также очень
большое количество мелких (до 1 мк) гранул гликогена, а на замороженных
Рис. 282—287. Типы включений в пищеварительных клетках Ornithodoros papillipes,
282, 284, 286 — недавно напитавшиеся особи; 283, 285, 287 — истощенные особи.
я — ядра; вж — вакуоли с жиром; вг — включения гликогена; гб — гемоглобин;
гм — гематин.
срезах после окраски Суданом черным или III — средних и крупных
жировых вакуолей (рис. 282—287). Последние также интенсивно чернятся
при осмировании. Среди пищеварительных клеток, сильно загруженных
гематином, часто наблюдается их отторжение в просвет кишечника, где
они округляются и приобретают сходство с амебоцитами (рис. 275, 279).
В дальнейшем они подвергаются полной дегенерации, а гематин смеши-
вается с содержимым кишечника.
При заполнении кишечника свежей кровью наблюдается массовое
разрушение секреторных клеток, а содержащееся в них полисахаридное
вещество освобождается в просвет; часть секреторных клеток при этом
сперва отшнуровывается и лишь затем подвергается растворению
(рис. 281). Резервные и пищеварительные клетки могут очень сильно
растягиваться и превращаются в тонкую мембрану с небольшими утол-
щениями в местах нахождения ядер, границы между отдельными клетками
становятся неразличимыми (рис. 276, 278). Истончение стенки кишечника
местами достигает такой степени, что создаемся впечатление, что она обра-
зована одной базальной мембраной, опирающейся на мышечное сплетение.
Постепенно растяжение желудка и проксимальных концов передне-
боковых отростков уменьшается, а клетки начинают выдаваться в просвет.
В первое время после питания основную массу клеток составляют пище-
варительные. Вначале они имеют глыбовидную или кубическую форму.
12 Ю. С. Балашов — 177 —
Группы подобных клеток высотой в 30—50 мк обычно бывают окружены
уплощенными участками (рис. 279). Очень часто эти клетки целиком
отрываются в просвет, формируя крупные сферы с ядрами. Число куби-
ческих клеток продолжает увеличиваться, они вытягиваются внутрь
полости кишечника и форма их приближается к столбчатой. Параллельно
все в большем количестве появляются секреторные клетки с вакуолизи-
рованными дистальными концами.
Внутри пищеварительных клеток начинают появляться мелкие ва-
куоли (до 1 мк), дающие положительную реакцию с БФС и бензидином.
При их слиянии образуются более крупные пищевые вакуоли, уже опи-
санные у голодающих особей. Вакуоли с гемоглобином могут заполнять
значительную часть апикальной цитоплазматической зоны. В дальнейшем
они начинают исчезать, а на их месте формируются буро-черные конкреции
гематина. Внутриклеточное переваривание гемоглобина не идет синхронно
во всех вакуолях одной клетки, так что в цитоплазме одновременно встре-
чаются как крупные пищевые вакуоли, так и конечный продукт перева-
ривания их содержимого — гематин. Важно также отметить, что с нача-
лом внутриклеточного переваривания гемоглобина в клетке перестают
появляться новые пищевые вакуоли, а по окончании переваривания всех
вакуолей пищеварительные клетки сильно загружаются гематином и
большей частью подвергаются дегенерации.
Поглощение огромных молекул гемоглобина происходит главным обра-
зом путем пиноцитоза, но недостаточная разрешающая способность
светового микроскопа не позволяет провести непосредственные наблюде-
ния этого явления. В результате о существовании пиноцитоза в пищева-
рительных клетках мы может судить лишь по его конечным результатам,
т. е. по появлению в цитоплазме вакуолей с гемоглобином. Прохождение
их сквозь цитоплазматическую мембрану невозможно объяснить на основа-
нии нормального механизма клеточной проницаемости. Определенную
роль в поглощении гемоглобина, а иногда и целых эритроцитов играют
процессы истинного фагоцитоза. На поверхности пищеварительных кле-
ток при прижизненных наблюдениях иногда удается наблюдать образо-
вание нитевидных или даже лопастевидных отростков, вытянутых в про-
свет. Сближаясь своими дистальными концами, они охватывают часть
содержимого кишечника, так что оно оказывается заключенным
во внутриклеточную вакуоль.
На апикальной цитоплазматической мембране иногда выявляется
узкая наружная зона с поперечной исчерченностыо, ширина которой
обычно не превышает 1 мк. Татчелл (Tatchell, 1964) наблюдал аналогич-
ное образование в клетках Argas persicus и считает его зоной микроворси-
нок. Окончательные доказательства существования микроворсинок в пи-
щеварительных клетках аргазид, однако, могут быть получены только
с помощью электронной микроскопии.
Наряду с гемоглобином пищеварительные клетки усваивают и липоид-
ное вещество стром эритроцитов. В цитоплазме клеток на этой стадии
Рис. 288—298. Участки кишечника в разные периоды переваривания крови личинками
и нимфами Alveonasus lahorensis и Ornithodoros papillipes.
Alveonasus lahorensis: 288 — голодные личинки; 289 — 2 суток прикрепления;
290 — полностью напитавшиеся; 291 — через 3 суток по окончании кровососания;
292 — нимфы III возраста вскоре после линьки; 293 — к концу питания; 294 — через
3 суток после окончания питания. Ornithodoros papillipes: 295 — голодные личинки;
296 — напитавшиеся личинки; 297 — голодные нимфы I возраста; 298 — напитав-
шиеся нимфы.
пк — пищеварительные клетки; нк — недифференцированные клетки; лпг — митотические деления
клеток стенки кишечника; ок — отторгнутые пищеварительные клетки в полости кишечника; э —
эритроциты крови хозяина; гб — внутриклеточные включения гемоглобина; гм — гематин; кгб —
кристаллы гемоглобина в полости кишечника.
- 178 -
12*'
накапливаются липоидные вакуоли (рис. 282). Последнее, однако, не
исключает и возможность их формирования путем дезаминирования
аминокислот белков крови хозяина в цикле клеточного метаболизма.
Весь описанный цикл изменений свойствен не только клеткам, при-
крепленным к базальной мембране, но и их ядерным амебовидным фраг-
ментам, плавающим в содержимом кишечника. На основании этого можно
предположить, что отторжение клеток средней кишки связано не только
с завершением их цикла развития и началом дегенерации, но и имеет
прямое отношение к механизму переваривания крови.
Описанная схема справедлива для нимф и имаго Ornithodoros papil-
lipes. Несколько отличаются лишь гистологические изменения в кишеч-
нике личинок. У голодных личинок он построен из небольших, почти
кубических клеток, слабо выдающихся в просвет. В пищеварительных
клетках в этот период неразличимы какие-либо включения и внешне они
не отличаются от секреторных (рис. 295). У напитавшихся клещей стенки
кишечника бывают очень сильно растянуты (рис. 296). Размеры отдель-
ных клеток постепенно увеличиваются, они вдаются в просвет, а часть
их открывается и свободно плавает в содержимом кишечника. Внутри
клеток появляются многочисленные пищевые включения. Параллельно
идет очень быстрое размножение недифференцированных клеток, пре-
вращающихся в дальнейшем в секреторные и пищеварительные. Деление
клеток всегда только митотическое. У перелинявших нимф I гистологи-
ческое строение кишечника уже такое же, как и у взрослых особей
(рис. 297).
У быстро насасывающихся нимф и имаго Argas persicus, Ornithodoros
moubata, а также взрослых Alveonasus lahorensis гистологические изме-
нения кишечника при пищеварении в основных чертах сходны с Ornitho-
doros papillipes, хотя имеются и определенные отличия.
Для Argas persicus характерна значительно большая вытянутость
эпителиальных клеток, особенно у голодных клещей. Проксимальные
концы клеток собраны в многочисленные мелкие складки и отличаются
значительной фибриллярной исчерченностью (рис. 274). У истощенных
клещей кишечник, как правило, содержит один гематин, его стенки спа-
даются и просвет исчезает. Интересная особенность пищеварения A. per-
sicus связана с питанием птичьей кровью. Ядерные эритроциты птиц
весьма устойчивы к гемолизу и многие из них непосредственно фагоцити-
руются пищеварительными клетками, так что здесь мы имеем классиче-
ский пример внутриклеточного переваривания целой, неповрежденной
клетки.
У Ornithodoros moubata в связи с отсутствием сообщения средней
кишки с ректальным мешком и анальным отверстием дистальные концы
клеток и полость кишечника обычно очень сильно загружены гематином,
лишенным выхода наружу (рис. 272).
У голодных половозрелых Alveonasus lahorensis стенки кишечника
собраны в правильную систему, складок, придающих ему характерную
морщинистую внешность (рис. 273). Во время кровососания за счет их
расправления объем кишечника значительно увеличивается. Параллельно
с этим происходит и сильное растяжение клеток. Процессы пищеварения
происходят значительно медленнее, чем у Ornithodoros papillipes и особенно
у Argas persicus.
У питающихся несколько суток личинок и нимф Alveonasus lahoren-
sis гистологические изменения кишечного эпителия при пищеварении
очень сходны с одно- и двуххозяинными иксодовыми клещами. У голод-
ных личинок кишечник построен из однородных кубических клеток,
бедных включениями (рис. 288). С началом кровососания они вытяги-
ваются в просвет, а в их дистальных концах появляются секреторные
- 180 -
вакуоли и’пищевые включения (рис. 289). Часть клеток или их дисталь-
ные концы отшнуровываются и плавают в просвете. Примерно со вторых
суток питания среди резервных клеток наблюдается значительное коли-
чество митотических делений. К концу питания заметно выросший за
счет размножения клеток кишечник начинает растягиваться (рис. 290).
В его полость вдаются лишь отдельные глыбовидные пищеварительные
клетки (рис. 291). Число их увеличивается, они смыкаются и принимают
нормальную вытянутую форму. За короткое время подготовки к линьке
на нимф I, а затем на нимф II и III успевает перевариваться лишь незна-
чительная часть крови, поглощенной на предшествующих стадиях.
Однако клещи сразу же после окончания линьки вновь приступают к кро-
вососанию, так что свежая кровь смешивается с непереваренной старой и
конечными продуктами пищеварения. Стенки кишечника нимф в зави-
симости от степени растяжения выдаются в просвет (рис. 294) или упло-
щены (рис. 293). Почти всегда удается обнаружить значительное количество
митозов, которые происходят в недифференцированных клетках, приле-
гающих к базальной мембране. Таким образом, с момента прикрепления
личинок и до отпадения напитавшихся нимф III происходит непрерывное
переваривание крови хозяина. Многодневные периоды кровососанйя
чередуются с короткими периодами линьки. Во время кровососанйя
кровь поглощается относительно небольшими порциями и часть ее сразу же
переваривается. Поэтому растяжение стенок всегда слабее, чем у быстро
питающихся видов.
Иксодовые клещи. У иксодовых клещей с однократным питанием на
каждой фазе развития циклические изменения в строении кишечного
эпителия выражены резче, чем у аргазид. Они связаны не только с пере-
ходом от состояния относительного «покоя» при голодании к интенсивной
функциональной активности во время питания и при подготовке к линьке
или яйцекладке, но также определяются физиологическим возрастом
голодных клещей или периодом питания.
В связи со сложностью и разнообразием гистологических изменений
во время пищеварения описание этих процессов приводится отдельно
для самок, самцов, личинок и нимф Hyalomma asiaticum и Ixodes ricinus,
а в необходимых случаях рассматриваются наиболее существенные откло-
нения у других видов.
У иксодовых клещей процессы пищеварения протекают интенсивнее,
чем у аргазид, так как поглощенная пища в первые дни питания пол-
ностью захватывается пищеварительными клетками, а их гипертрофирован-
ные дистальные концы заполняют значительную часть просвета кишеч-
ника (рис. 300). В результате различия в характере пищеварения
в центральной части кишечника и боковых дивертикулах практически не
выражены или же связаны с различной степенью заполнения пищей и
растяжением стенок отдельных отростков с начала питания до стадии
растяжения. В период растяжения быстрое увеличение размеров клеща
происходит в основном за счет растягивания йокровов тела и стенок сред-
ней кишки. Полость кишечника заполняется массой непереваренной крови
хозяина, а клетки стенок необычайно уплощаются или же отторгаются
в просвет. Подобная крайняя степень растяжения свойственна всем
частям средней кишки полностью напитавшейся особи (рис. 301). В даль-
нейшем на стадии линьки или яйцекладки растяжение стенок кишечника
заметно ослабевает за счет усвоения части поглощенной пищи, а просвет
почти полностью занят гипертрофированными пищеварительными клет-
ками (рис. 302).
Самки. Гистологические различия между отдельными дивертику-
лами практически отсутствуют, но в зависимости от степени заполнения
клеток запасами питательных веществ у голодных особей или полости
- 181 -
кишечника пищей во время питания наблюдаются заметные различия
в их строении, связанные с нахождением на разных стадиях пищеварения.
У недавно перелинявших самок Hyalomma asiaticum строение средней
кишки мало отличается от нимф в конце линьки. Гипертрофированные пище-
варительные клетки, сохранившиеся от нимфальной фазы, достигают 200—
260 мк высоты и обычно занимают весь просвет (рис. 303 на стр. 177).
Их цитоплазма заполнена сферическими пищевыми включениями диа-
метром от 2 до 20 мк. Они полупрозрачны и имеют естественную желто-
вато-коричневую окраску. Железный гематоксилин окрашивает их в чер-
ный цвет, а эозин — в розовый. При тройной окраске азокармином они
в большинстве случаев красные, но часть из них всегда синяя. Между
ними лежат мелкие сферические включения гематина диаметром в 1—2 мк
буро-черного цвета. Границы между отдельными клетками на этой ста-
дии обычно неразличимы, а ядра часто маскируются описанными включе-
ниями. В гипертрофированных клетках они неправильной многоугольной
формы диаметром 10—12 мк. Ядра недифференцированных клеток, ле-
жащие вблизи базальной мембраны, круглые или овальные и меньшего
размера (5 мк). К концу стадии послелиночного доразвития количество
пищевых включений заметно уменьшается, гипертрофированные клетки
спадаются, а часть их разрушается и стенки кишечника приобретают
нормальный для голодных клещей вид.
У особей, недавно закончивших послелиночное доразвитие, среди
столбчатых эпителиальных клеток высотой в 30—50 мк встречаются
отдельные гипертрофированные клетки, целиком заполненные пищевыми
включениями. Однако большая часть пищеварительных клеток, сохра-
нившихся от нимфальной фазы, содержит пищевые включения диаметром
2—20 мк преимущественно в апикальных частях, а ядра размером в 5—
6 мк занимают базальные части цитоплазмы (рис. 306). Наиболее много-
численны у голодных особей недифференцированные клетки. Кроме того,
встречаются и типичные секреторные клетки. Их апикальные части вы-
даются в полость кишечника, сильно вакуолизированы и заполнены
ШИК-положительным веществом. Внутри отростков всегда существует
достаточно обширная полость. Она бывает пустой или же содержит кри-
сталлики гематина и фрагменты разрушенных клеток.
В процессе голодания гипертрофированные пищеварительные клетки
полностью исчезают и белковые пищевые включения выявляются в не-
многих сохранившихся пищеварительных клетках (рис. 304). В то же
время в их цитоплазме очень многочисленны включения гематина. Цито-
плазма подобных клеток выглядит оптически пустой и очень слабо окра-
шивается эозином или световым зеленым. В стенках средней кишки
образуются многочисленные складки, а в ее полости увеличивается масса
из гематина и остатков клеток. Внешний вид недифференцированных
клеток остается прежним.
У истощенных особей отростки кишечника обычно спадаются. Внутри
их сильно суженного просвета местами встречаются очень крупные
скопления гематина. Пищеварительные клетки становятся крайне ред-
кими. В их цитоплазме отсутствуют пищевые включения, но много ге-
матина.
У самок Ixodes ricinus строение кишечника у голодных особей в основ-
ных чертах сходно с описанным для Hyalomma asiaticum. У только что
перелинявшего клеща клетки кишечника заполнены вакуолями с пище-
выми включениями, размеры которых сильно варьируют. Вакуоли за-
ключены в нормальных и в гипертрофированных пищеварительных клет-
ках, сохранившихся от нимфальной фазы, но границы между отдельными
клетками, как и их ядра, в первые дни после линьки обычно не видны.
Лишь на более поздних стадиях, по мере потребления пищевых включений,
- 182 -
Рис. 299—302. Поперечные срезы нимф Hyalomma asiaticum.
299 — голодная; 300 — середина питания; 301 — полностью напитавшаяся
сразу по отпадении; 302 — в середине стадии линьки.
г — гиподерма; к — кутикула; дк — дивертикулы средней кишки; кэ — эпителиальные
клетки стенки средней tкишки; мс — мальпигиевы сосуды; дм — дорсо-вентральные мышцы;
лп — линочная полость.
начинают выступать границы отдельных гипертрофированных клеток.
Они обычно находятся на различных стадиях дегенерации. Между пище-
выми включениями внутри клеток и в полости кишечника заключено боль-
шое количество буровато-черных мелких гранул гематина. Последний при-
дает среднему отделу кишечника клещей характерную бурую или почти
черную окраску.
К концу стадии послелиночного доразвития пищевые резервы в клет-
ках резко сокращаются, а значительная часть гипертрофированных кле-
ток, сохранившихся от нимфальной фазы, подвергается разрушению.
У голодных, способных к нападению клещей стенки средней кишки по-
строены из столбчатых или почти кубических недифференцированных
клеток высотой 10—20 мк с небольшими сферическими ядрами и бедной
включениями цитоплазмой (рис. 318, 119). Местами между ними вкли-
ниваются более крупные (высота 30—40 мк) булавовидные секреторные
клетки с сильно вакуолизированной цитоплазмой и пищеварительные
клетки нимфальной фазы. Количество последних зависит от времени,
прошедшего после линьки. В цитоплазме нимфальных клеток содер-
жатся сравнительно крупные пищевые включения и значительное коли-
чество мелких гранул гематина. В отличие от Н. asiaticum недифферен-
цированные клетки Ixodes ricinus имеют более правильную столбчатую
форму и резко выраженные межклеточные границы. В сохранившихся
пищеварительных клетках всегда скапливается большое количество гема-
тина. Различия между недифференцированными и секреторными клетками
выражены резче.
Изучение динамики резервных белков, гликогена и жиров у обоих
видов показывает, что описанные нами гистологические изменения объек-
тивно отражают процессы расходования запасных питательных веществ,
накопленных на нимфальной фазе. Красящиеся железным гематоксили-
ном, эозином и азокармином сферические включения диаметром от 2
до 20 мк приобретают интенсивную сине-фиолетовую окраску при обра-
ботке бромфеноловым синим в сулеме. Это указывает на их белковую
природу. Вместе с тем они всегда дают положительный результат при
бензидиновой реакции на гемоглобин (рис. 306). В пользу того, что они
представляют мало измененный гемоглобин крови хозяина, говорят
и косвенные данные. При их внутриклеточном переваривании в цитоплазме
увеличивается содержание гематина — конечного продукта расщепления
гемоглобина членистоногими. Интенсивность окраски различными гисто-
логическими красителями или бромфеноловым синим неодинакова во всех
описываемых включениях. Последнее, вероятно, отражает различные
этапы их переваривания и усвоения. Следует отметить, что подобные вклю-
чения, кроме гемоглобина, вероятно, содержат и другие вещества. В их
состав входят мукополисахариды. Они дают слабую положительную
реакцию на углеводы по методу ШИК и пурпурно-фиолетовую метахрома-
зию при обработке толуидиновым синим.
В клетках средней кишки находятся значительные запасы гликогена.
После обработки по методу ШИК внутри клеток кишечника выявляется
значительное количество мелких (до 1 мк диаметром) красных гранул,
отсутствующих на контрольных срезах, обработанных амилазой. Очень
часто в дистальных концах клеток они образуют крупные скопления.
Последние, вероятно, не отражают истинную локализацию гликогена и
образуются вследствие диффузионных токов при фиксации (рис. 308).
При обычных методах фиксации и заливки в парафин вследствие обез-
воживания и экстракции липоидов клетки кишечника сильно сжимаются,
а внутри них появляются многочисленные оптически пустые пространства.
Фиксация осмием (смесь Шампи) не устраняет отмеченные недостатки,
хотя в клетках и сохраняется часть чернящихся жировых вакуолей.
- 184 -
Только при фиксации формалином и изготовлении срезов на замораживаю-
щем микротоме сжатие сводится до минимума и экстракция липоидов
отсутствует. Пищеварительные клетки при этой методике выглядят упру-
гими, а на месте прозрачных участков мы видим многочисленные жировые
вакуоли (рис. 307). Подобные вакуоли интенсивно красятся Суданом
черным или III и занимают значительную часть цитоплазмы. Размеры их
колеблются от 4 до 40 мк (основная масса 10—20 мк).
Содержание рибонуклеиновой кислоты в недифференцированных клет-
ках голодных клещей относительно невелико и не проявляет заметных
колебаний. Последнее, вероятно, связано с отсутствием процессов
роста и органогенеза в этот период. В пищеварительных клетках со-
держание плазматической РНК ничтожно и она выявляется с большим
трудом.
Вариации в длительности периода послелиночного доразвития и спо-
собности к голоданию связаны с различным количеством запасных пита-
тельных веществ и скоростью их расходования у разных видов. Самки
Ixodes ricinus и Hyalomma asiaticum обладают продолжительным периодом
доразвития, большой устойчивостью к голоданию и соответственно очень
большим количеством запасных питательных веществ. У быстро развиваю-
щихся Н. anatolicum, Boophilus calcaratus и Rhipicephalus turanicus пище-
вых включений значительно меньше. Совсем мало их у довольно эфемер-
ных личинок и нимф рода Dermacentor. У нападающих самок в кишечнике
содержится еще значительное количество пищевых веществ, расходуемых
по мере дальнейшего голодания. Лишь после очень длительного голодания
у самок Ixodes ricinus, в наших опытах достигавших 1.5 лет, кишечник
совершенно пустой. У Dermacentor pictus, способного, поданным Н. Г. Ол-
суфьева (1953), к активности в продолжение двух и более сезонов, мы
обнаружили особенно значительное количество клеток с пищевой зерни-
стостью в кишечнике нападающих самок.
В отношении клеточного состава средней кишки иксодид мнения
до сих пор расходятся. Ряд исследователей считает, что уже у голодных
особей в ее состав входят три типа клеток: недифференцированные резерв-
ные, дегенерирующие пищеварительные и секреторные (Roesler, 1934;
Hughes, 1954). С другой стороны, распространено мнение, что стенка кишеч-
ника построена из одного типа клеток, форма и строение которых могут
очень варьировать в зависимости от стадии пищеварения (Till, 1961;
Chinery, 1964). На основании изучения цитологических и гистохимических
особенностей эпителия средней кишки мы считаем, что все входящие
в его состав клетки имеют общее происхождение. Исходным типом, как
и у аргасовых клещей, мы считаем недифференцированные резервные
клетки, причем у голодных особей этот тип клеток наиболее многочислен,
а секреторные клетки встречаются реже. Пищеварительные клетки,
заполненные различного типа включениями, образуются в результате
дифференцировки резервных клеток. При этом специализация в направле-
нии образования секретов для полостного пищеварения («секреторные
клетки») или накопления в цитоплазме и внутриклеточного переварива-
ния крупных белковых или жировых вакуолей («пищеварительные клетки),
вероятно, имеет необратимый характер и, закончив цикл функциональ-
ной активности, клетка подвергается дегенерации. Тем не менее исключе-
ния не столь редки, так как нам неоднократно приходилось наблюдать
появление в клетках с крупными секреторными вакуолями включений
с гемоглобином, т. е. превращение секреторных клеток в пищеваритель-
ные. Таким образом, с определенными оговорками мы также признаем
существование в среднем отделе иксодовых клещей трех типов клеток:
недифференцированных резервных, пищеварительных и секреторных,
гомологичных таковым аргасовых клещей.
- 185 -
Для иксодид характерна определенная физиологическая недоразви-
тость эпителия средней кишки у голодных особей. В нем еще отсутствуют
готовые к функционированию пищеварительные клетки, тогда как пище-
варительные клетки от нимфальной фазы служат депо запасных питатель-
ных веществ и не способны к участию в новом пищеварительном цикле.
Сразу же после прикрепления к хозяину происходит быстрый рост
секреторных клеток. Отдельные недифференцированные клетки также на-
чинают увеличиваться в размерах, их дистальные концы выдаются в про-
свет и они превращаются в клетки секреторного типа (рис. 309 и 320).
В отличие от еще сохраняющихся местами пищеварительных клеток
нимфальной фазы, в сильно вакуолизированной цитоплазме секреторных
клеток отсутствуют пищевые включения и гранулы гематина. В то же
время в их апикальной цитоплазматической зоне появляется большое
количество ШИК-положительного вещества в форме мелких гранул
(менее 1 мк), местами образующих довольно плотные скопления в про-
странстве между прозрачными вакуолями. Эта зернистость сохраняется
и на срезах, обработанных диастазой, так что ее следует считать поли-
сахаридом, отличным от гликогена.
Повышение содержания РНК в резервных клетках — первый признак
начала их дифференцировки. Последняя обнаруживается еще до поступ-
ления жидкой пищи в полость кишечника («подготовительный период
питания»). На срезах через клещей в первые часы после прикрепления
местами хорошо видны отдельные сильно увеличенные вакуолизирован-
ные клетки, вдающиеся в пустой, не содержащий никаких следов пищи
кишечник. В дальнейшем образование новых секреторных клеток про-
исходит на протяжении всего времени питания. В первые 1—2 дня после
прикрепления количество секреторных клеток еще сравнительно невелико
и они не образуют сплошного слоя, а как бы вклиниваются в толщу не-
дифференцированных резервных. По мере усвоения пищи их число резко
увеличивается, они тесно соприкасаются дистальными концами и как бы
создают второй клеточный слой над лежащими базальнее резервными
клетками. Размеры последних существенно не меняются по сравнению
с таковыми у голодных особей (высота 10—15 мк).
Секреторные клетки могут достигать весьма значительных размеров:
у Hyalomma asiaticum их высота составляет 70—100 мк при ширине в 25—
30 мк в дистальной части, а у Ixodes ricinus — 50—70x30—40 мк. Форма
клеток чаще всего бывает булавовидной или столбообразной, но с суже-
нием к базальному концу. На первых этапах дифференцировки они чаще
бывают глыбовидными. Ядра располагаются ближе к середине клетки.
В то время как в апикальной половине цитоплазма сильно вакуолизиро-
вана, в базальной половине она содержит большое количество базофиль-
ных волокнистых структур. При окраске метиловым зеленым—пирони-
ном последние дают интенсивную положительную реакцию на присут-
ствие РНК и, по-видимому, их следует считать элементами эргастоплазмы.
Параллельно с увеличением содержания РНК происходит значительный
рост ядер, достигающих у Hyalomma asiaticum диаметра 15—20 мк и
у Ixodes ricinus — 13—20 мк против 7—9 мк в недифференцированных
клетках. Форма ядра при этом может становиться неправильно много-
угольной. Рибонуклеиновое ядрышко также значительно увеличивается
и часто фрагментируется на 2—3 части. Параллельно с ростом ядра умень-
шается интенсивность его окрашивания по Фельгену, а на конечных
этапах развития они начинают окрашиваться кислыми красителями и
перестают давать специфические реакции на ДНК.
С поступлением первых порций жидкой пищи в полость кишечника
начинается разрушение дистальных концов или отторжение целых клеток
в просвет кишки (рис. 310 и 321). Ядерные фрагменты при этом округляются
- 186 -
пг
бм 324
Рис. 318—324. Недифференцированные, секреторные и пищеварительные клетки
самки Ixodes ricinus на стадии активности и во время питания.
318 — голодная особь в начале и 319 — в конце стадии активности; 320 — диф-
ференцировка секреторных клеток; 321 — отторжение секреторных клеток в по-
лость кишечника в начале питания; 322 — «крипта» с делящимися недифферен-
цированными клетками; 323 — гипертрофированная пищеварительная клетка;
324 — растянутый участок стенки бокового отростка.
нк — недифференцированные клетки; пкн — пищеварительные клетки нимфальной фазы;
ск — секреторные клетки; св — вакуоли с секретом; бм — базальная мембрана и мышечные
волокна; пв — пищевые включения; пг — пигментные гранулы; гпк — гипертрофирован-
ные пищеварительные клетки.
и приоб ретают некоторое сходство с гемоцитами. В дальнейшем они, однако,
также подвергаются разрушению. Содержимое секреторных .клеток при
этом смешивается с пищей, так что в белковой массе последней обнаружи-
ваются как бы островки ШИК-положительного коллоидного вещества.
Ряд исследователей (Hughes, 1954; Chinery, 1964) считает, что полисахарид-
ный коллоидный секрет обеспечивает гемолиз эритроцитов. Процесс
отторжения секреторных клеток может идти столь интенсивно, что местами
на базальной мембране сохраняются лишь отдельные изолированные
группы резервных клеток и может создаться впечатление, что пища
отграничена от полости тела только тонкой базальной мембраной.
В первые дни после прикрепления поглощаются относительно неболь-
шие количества пищи, большая часть ее сразу же усваивается клещом,
так что заметного растяжения стенок кишечника обычно не наблюдается.
В то же время диаметр дивертикулов сильно увеличивается и это про-
исходит несмотря на непрерывное разрушение значительного числа секре-
торных клеток. Источником замещения разрушающихся клеток и роста
дивертикулов служит интенсивное размножение недифференцированных
клеток. Митотические деления наблюдаются уже на вторые сутки прикреп-
ления и в продолжении всего времени питания, но особенно многочисленны
они в начале периода роста клеща (рис. 313 на стр. 192). Сперва размно-
жение клеток происходит по всей поверхности кишечника, но примерно
с середины периода роста оно особенно часто наблюдается в складках
между гипертрофированными специализированными клетками (рис. 322).
Эти складки внешне очень сходны с криптами насекомых и представляют
собой скопления недифференцированных эпителиальных клеток, глубоко
вдающихся в полость тела сквозь редкое сплетение мускульных волокон.
Переваривание и усвоение жидкой пищи начинается сразу же по по-
ступлении первых ее порций в полость кишечника. Однако в первые дни
питания эти процессы не сопровождаются появлением крупных пищевых
включений или продуктов их разрушения в цитоплазме клеток. Тем не ме-
нее процессы пищеварения уже с самого начала питания протекают с боль-
шой интенсивностью. О переваривании и адсорбции белкового содержи-
мого средней кишки в этот период можно судить по изменению его окраски
в узкой зоне, граничащей с поверхностью клеток, и по появлению мелких
белковых гранул (диаметром менее 1 мк) в периферической зоне цито-
плазмы сравнительно крупных глыбовидных клеток, встречающихся
в стенке кишки наряду с секреторными и резервными. К сожалению, до-
ступные гистохимические методики не позволяли выявить более тонкие
изменения, связанные с разрушением и всасыванием белков, отличных
от гемоглобина. Косвенным доказательством эффективного использования
поступающей пищи было в основном очень быстрое увеличение размеров
тела питающегося клеща, связанное с ростом кутикулы идиосомы, гонады,
кишечника и других внутренних органов.
Гистологические изменения, связанные с поступлением в клетки и
внутриклеточным перевариванием белков, четко прослеживаются лишь
при питании кровью. Гемоглобин из разрушенных эритроцитов хозяина
легко выявляется бензидиновой реакцией. При его переваривании обра-
зуются характерные буро-черные кристаллы гематина. Последние часто
склеиваются в более крупные включения. Кроме того, следует отметить,
что внутриклеточные вакуоли с гемоглобином хорошо окрашиваются мно-
гими гистологическими красителями, включая железный гематоксилин,
азокармин и эозин. Поступление крови в кишечник в значительных коли-
чествах происходит обычно не ранее середины периода роста, и к этому
периоду относится и приводимое ниже описание пищеварительных клеток.
Приблизительно с 4—5-го дня питания, по достижении веса 50—150 мг
у Hyalomma asiaticum и 30—40 мг у Ixodes ricinus, в глыбовидных или
- 188 -
булавовидных пищеварительных клетках появляются мелкие и средние
белковые в'акуоли (диаметром 1—2 мк), дающие положительную реак-
цию на гемоглобин. Вначале они немногочисленны и локализуются пре-
имущественно в краевой цитоплазматической зоне, но на более поздних
стадиях могут заполнять всю апикальную половину клетки (рис. 323).
Специальными методами окраски на липоиды в цитоплазме выявляются,
правда, еще немногочисленные жировые вакуоли. Внешне пищеваритель-
ные клетки питающихся клещей во многом сходны с секреторными. Оба
типа клеток претерпевают сходный процесс дифференцировки из резервных
и на конечных этапах развития приобретают булавовидную или столбчатую
форму. Пищеварительные клетки отличаются более крупными размерами,
достигая у Hyalomma asiaticum величины 90—130x20—40 мк и у Ixodes
ricinus — 100—140x30—50 мк.
Ядра располагаются ближе к центру клетки и достигают диаметра
20—30 мк. Базальная половина, как и у секреторных клеток, более узкая
и заполнена пиронинофильными волокнистыми структурами. В апикаль-
ной цитоплазматической зоне отсутствуют крупные прозрачные вакуоли
и ШИК-положительная зернистость.
По мере заполнения клетки гемоглобином более мелкие вакуоли,
по-видимому, сливаются между собой, так как в цитоплазме появляются
пищевые включения диаметром 3—5 мк. Появление кристалликов гема-
тина обычно наблюдается лишь в клетках, загруженных пищевыми ва-
куолями и, вероятно, прекративших захватывание новых порций белка.
Первоначально гранулы гематина немногочисленны, но по мере исчезно-
вения пищевых вакуолей они в значительной степени загружают апикаль-
ные концы клеток и придают им характерную буро-черную или коричне-
ватую окраску.
Пищеварительные клетки часто отторгаются в полость кишечника и
плавают в ее содержимом в виде крупных сфер с ядрами и цитоплазмой,
забитой различного рода включениями (рис. 314). В свободных клетках
наблюдается нормальное продолжение процессов внутриклеточного пере-
варивания гемоглобина, сопровождающееся исчезновением пищевых ва-
куолей и загрузкой цитоплазмы гематином. С окончанием усвоения содер-
жимого пищевых вакуолей загруженные гематином свободные клетки
разрушаются и их содержимое поступает в полость кишечника. Сходные
процессы дегенерации наблюдаются и в пищеварительных клетках, свя-
занных со стенкой кишки, по окончании в них цикла внутриклеточного
пищеварения.
В первую половину периода роста среди гипертрофированных клеток
преобладают секреторные, но постепенно количество пищеварительных
клеток увеличивается и к началу периода растяжения они доминируют
над остальными клеточными элементами. Тесно соприкасаясь своими ди-
стальными концами, они, как и в случае с секреторными клетками на пред-
шествующей фазе, образуют сплошной клеточный слой над вклиниваю-
щимися между их основаниями резервными клетками (рис. 323).
В период растяжения в связи с быстрым поступлением в кишечник
большой массы крови хозяина происходит очень сильное растягивание
стенок (рис. 312 и 324). Большая часть пищеварительных и секреторных
клеток в конце питания разрушается или отторгается в просвет, а в стен-
ках кишечника остается тонкий слой сильно уплощенных недифференци-
рованных клеток высотой от 3 до 10 мк. Ядра также заметно уплощаются
и на срезах имеют овальные или почти веретеновидные профили размером
20—30x4—8 мк. Границы между клетками на этой стадии становятся
неразличимыми (рис. 324), а складки базальной мембраны и мускулатуры
стенок полностью расправляются. Перед отпадением кишечник напитав-
шегося клеща находится в состоянии максимального растяжения и его
- 189 -
стенки имеют вид тонкой мембрановидной оболочки, окружающей огром-
ную массу непереваренной крови.
У отпавших клещей степень растяжения отростков кишечника не-
сколько уменьшается за счет удаления из пищи излишней воды. Одно-
временно уже в первые сутки по отпадении отдельные растянутые клетки
начинают увеличиваться в размерах и выдаются в просвет кишечника,
приобретая сперва форму выпуклого свода, а затем обычную для гипер-
трофированных клеток форму дубинки или булавы (рис. 325, 326). По
существу, этот процесс ничем не отличается от дифференцировки специали-
зированных клеток из резервных во время питания и первыми его призна-
ками по-прежнему служат появление в цитоплазме волокнистых элемен-
тов, богатых РНК, и рост ядер. У напитавшихся клещей дифференцировка
резервных клеток идет в направлении пищеварительных, тогда как секре-
торные становятся сравнительно немногочисленными. В первые 1—2 дня
по отпадении еще можно наблюдать отторжение отдельных, преимуще-
ственно секреторных клеток в просвет. Однако по мере исчезновения кле-
ток этого типа процессы отторжения полностью прекращаются. Пищевари-
тельные клетки напитавшихся клещей постоянно сохраняют связь со стен-
кой кишечника.
Образование новой «генерации» пищеварительных клеток связано с про-
должением размножения недифференцированных клеток, среди которых
в первые дни по отпадении наблюдаются многочисленные митотические
деления. В результате уже к концу 2—3-х суток по отпадении стенка ки-
шечника вновь образована сплошным слоем высоких пищеварительных
клеток, между основаниями которых вклиниваются более мелкие резерв-
ные. Они сильно сжаты с боков пищеварительными клетками и приобре-
тают клиновидную форму с широким основанием и заостренной вершиной
(рис. 315 и 327). По-видимому, большая часть резервных клеток по окон-
чании питания и во время яйцекладки находится на различных стадиях
дифференцировки в пищеварительные клетки, так как их цитоплазма бо-
гата волокнистыми пиронинофильными элементами, а ядра увеличиваются
в размерах. Некоторые исследователи (Till, 1961; Chinery, 1964) на основа-
нии высокой базофилии цитоплазмы выделяют их в самостоятельный
тип железистых или печеночных клеток, но нам это кажется неоправдан-
ным. Такие же клетки, но в меньшем количестве встречаются и во время
питания, причем можно проследить все этапы их превращения в специа-
лизированные пищеварительные или секреторные. Необходимо отметить,
что после окончания яйцекладки у погибающих самок в стенках кишеч-
ника остается еще значительное количество не израсходованных в про-
цессе пищеварения резервных клеток (рис. 329). К началу яйцекладки
пищеварительные клетки необычайно увеличиваются, достигая высоты
400—500 мк при ширине 10—150 мк, т. е. в 40—50 раз превышают линей-
ные размеры резервных клеток голодной особи. Ядра округлые или, реже,
неправильной формы и достигают диаметра 20—35 мк, но часто не видны
из-за многочисленных пищевых включений. Последние в виде средних и
крупных вакуолей с гемоглобином крови хозяина имеют округлую или
многоугольную форму на срезах и достигают в поперечнике 5—20 мк.
Они заполняют всю цитоплазму, включая и апикальные концы клеток.
Кроме белковых включений, на срезах, изготовленных на замораживаю-
щем микротоме и окрашенных Суданом черным, выявляется большое коли-
чество жировых вакуолей в виде капель различного размера (от 1 до 30—
40 мк).
После заполнения цитоплазмы белковыми включениями между ними
появляются сперва одиночные, а затем в массе кристаллы гематина. По-
степенно они заполняют всю апикальную половину клетки, после чего
она разрушается, а гематин поступает в полость кишечника. Процессы
- 190 -
Рис. 325—329. Пищеварительные клетки отпавшей напитавшейся самки Ixodes
ricinus.
325 — начало дифференцировки пищеварительной клетки в растянутом участке
стенки кишечника; гипертрофированные пищеварительные клетки: 326 —
в первые дни по отпадении с хозяина; 327 — перед началом яйцекладки,
328 — в конце яйцекладки и 329 — у закончившей откладку яиц и погибаю-
щей особи.
пв — пищевые включения; гм — гематин; нк — недифференцированные клетки.
пищеварения в отдельных клетках, даже расположенных поблизости
друг от друга, не синхронизированы, так что одновременно встречаются
как клетки, содержащие только пищевые вакуоли, так и полностью за-
груженные гематином (рис. 328).
Гипертрофированные пищеварительные клетки к началу яйцекладки
поглощают всю кровь из полости кишечника. В результате просвет по-
следнего сильно сужается, тогда как стенки дивертикулов необычайно
утолщаются и в них концентрируются основные запасы питательных ве-
ществ, полученных во время питания. У заканчивающих откладку яиц
самок большая часть пищеварительных клеток загружена гематином и
подвергается разрушению. При этом полость кишки вновь несколько
увеличивается и бывает заполнена буро-черной кашеобразной массой
кристаллов гематина. Общий объем кишечника на этой стадии заметно
уменьшается за счет частичного спадения стенок дивертикулов и послед-
ние свободно лежат в полости тела.
Самцы. Клеточный состав средней кишки у самцов тот же, что
и у самок. У большинства непитающихся самцов рода Ixodes цикл изме-
нений в средней кишке связан с постепенным расходованием пищевых
резервов, накопленных на нимфальной фазе.
Процессы пищеварения у самцов с облигатным кровососанием рас-
смотрены на примере Hyalomma asiaticum и другого близкого вида —
Н. plumbeum. У только что перелинявших самцов в клетках кишечника
содержится значительное количество пищевых включений в виде округ-
лых гранул различного размера (рис. 330). Постепенно запасные питатель-
ные вещества исчезают и у клеща, голодавшего длительное время, остаются
единичные пищевые гранулы, а клетки уплощаются (рис. 331). Границы
между отдельными клетками видны плохо, что вообще характерно для
представителей этого рода.
После прикрепления к хозяину начинается интенсивный рост секретор-
ных клеток в просвет кишечника, предшествующий началу кровососанйя
(рис. 332). При поступлении крови отдельные клетки отрываются от сте-
нок и перемешиваются с нею. Они бывают обычно сильно вакуолизированы
и содержат зернистость полисахаридной природы (рис. 333). Одновременно
начинается быстрое накопление пищевой зернистости в пищеварительных
клетках. При ее переваривании, в отличие от самок, образуется мень-
шее количество гематина (рис. 334). В описанном состоянии кишечник
самца находится до его гибели. Образование новых пищеварительных кле-
ток непрерывно происходит за счет деления недифференцированных эпи-
телиальных. Значительного растяжения стенок или образования «крипт»
не отмечено.
Личинки и нимфы. Личинки Ixodes ricinus питаются 2—3 су-
ток. Клетки кишечника голодной стадии очень мелкие и заметно упло-
щены. В период кровососанйя размеры их несколько увеличиваются.
Рост их, однако, незначителен, и образующиеся глыбковидные клетки
лишь в 2—4 раза выше нормальных. Этих размеров они обычно достигают
через 24—36 час. кровососанйя. В боковом отростке на поперечном срезе
бывает видно не больше 4—6 подобных клеток. Содержимое их сильно
вакуолизировано.
За 10—12 час. до отпадения наступает быстрое растяжение стенок
кишечника кровью и отрыв части пищеварительных клеток в просвет.
У напитавшейся личинки стенки кишечника очень тонкие и состоят из не-
многих растянутых клеток. Накопления пищевых включений в период
кровососанйя не отмечено. После отпадения среди оставшихся клеток
наблюдаются митотические деления. Часть образующихся клеток выра-
стает в просвет и загружается пищевыми включениями, другие остаются
- 192 -
Рис. 311—317. Клетки средней кишки самки (311—315) и нимфы (316, 317)
Hyalomma asiaticum на стадии питания.
311 — включения гемоглобина в пищеварительных клетках; 312 — уча-
сток стенки бокового отростка, заполненного кровью; 313 — митотиче-
ское деление недифференцированной клетки; 314 — отторгнутая в полость
кишечника пищеварительная клетка; 315 — пищеварительные клетки на-
питавшейся особи; 316 — участок стенки бокового отростка в середине
питания; 317 — то же у недавно напитавшейся особи. Микрофотогра-
фии: 314 — Х900, люминесцентный микроскоп после подкраски акриди-
новым оранжевым; 311, 312, 315— Х600; 313— Х2000; 316, 317 —
Х400; окраска железным гематоксилипом-эозином.
Рис. 335—341. Мальпигиевы сосуды Ornithodoros papillipes {335, 336) и Hyalomma
asiaticum {337—341) на разных стадиях жизненного цикла.
335 — загруженный участок сосуда длительно голодавшей самки и 336 — участок
сосуда вскоре после кровососания; 337 — нимфа на стадии линьки; 338 — голодная
самка; 339 — самка в начале питания; 340 — в середине и 341 — в конце питания.
Прижизненно в фазовом контрасте, Х200.
в недифференцированном состоянии и позднее образуют кишечный эпите-
лий нимфы.
Для личинок Hyalomma asiaticum, Rhipicephalus turanicus и Dermacen-
tor pictus характерно накопление крупных пищевых включений еще в пе-
Рис. 330—334. Изменения кишечного эпителия у самца Hyalomma plumbeum во
время питания.
330 — сразу после линьки; 331 — на стадии активности; 332 — на 1-е сутки
прикрепления к хозяину; 333 — па 2-е сутки и 334 — на 12-е сутки.
се — вакуоли с секретом; пв — пищевые включения; ок — оторвавшиеся в полость кишечника
пищеварительные клетки; гк — гипертрофированные пищеварительные клетки;
гм — гематин.
риод кровососанйя. Большая быстрота пищеварения у них связана с ко-
ротким периодом превращения в нимф.
У нимф пищеварение протекает в основном сходно с самками. Кишеч-
ник только что перелинявшей нимфы содержит много запасных питатель-
ных веществ в сохранившихся пищеварительных клетках личинки. В то же
время пищеварительные клетки нимфальной фазы еще не обособились.
У голодной нападающей нимфы клетки с пищевыми включениями почти
полностью израсходованы. Пищеварительные клетки образуются в пе-
риод кровососанйя и принимают глыбовидную форму. Содержимое их
13 Ю. С. Балашов — 193 —
сильно вакуолизировано и многие из них отрываются в полость кишеч-
ника. Перед отпадением происходит быстрое растяжение стенок. У видов
с быстрой линькой на взрослые фазы (Hyalomma, Rhipicephalus, Dermacen-
tor) образование пищевых включений происходит уже в период кровососа-
ния (рис. 316, 317), у видов с длительным периодом линьки, как Ixodes
ricinus, — лишь после отпадения. Роет кишечника происходит за счет
размножения недифференцированных резервных клеток. Митотические
деления последних наблюдаются с начала периода роста и продолжаются
всю первую половину линьки.
К концу стадии линьки между базальной мембраной и гипертрофиро-
ванными пищеварительными клетками располагаются мелкие недифферен-
цированные клетки — источник будущих секреторных и пищеварительных
клеток половозрелой фазы.
СООТНОШЕНИЕ МЕЖДУ ВНЕКИШЕЧНЫМ.
ПОЛОСТНЫМ И ВНУТРИКЛЕТОЧНЫМ
ТИПАМИ ПИЩЕВАРЕНИЯ
Кровососущим клещам надсем. Ixodoidea, как видно из приведенных
выше данных, свойственно сочетание полостного и внутриклеточного ти-
пов пищеварения. У иксодовых клещей к ним еще добавляется третий
тип, так называемого внекишечного пищеварения. Первые этапы пищеваре-
ния происходят у них вне организма клеща и связаны с литическим дей-
ствием слюны на ткани и кровь хозяина. В этом отношении они сходны
с пауками, у которых внекишечное пищеварение достигает особенно силь-
ного развития и в организм жертвы впрыскивается большое количество
высокоактивных протеаз (Millot, 1949; Иванов, 1965). У иксодовых кле-
щей ферментативные свойства лизирующих веществ не изучены, но не-
сомненно, что они могут вырабатываться только в слюнных железах. Ана-
томические особенности переднего отдела кишечника иксодид исключают
возможность регулярного отрыгивания содержимого кишечника.
Важную роль в переваривании крови несомненно играют процессы
полостного пищеварения, которые обеспечивают не только гемолиз,
но и первые этапы расщепления пищевых компонентов. При окрашивании
азокармином сразу же после окончания гемолиза вся масса крови имеет
равномерную интенсивную красную окраску. Однако вблизи стенок кишеч-
ника или свободных клеток она вскоре начинает бледнеть и сменяется
на синюю. Процессы переваривания крови сконцентрированы сперва
в узкой периферической зоне сгустившейся массы крови, прилегающей
к сильно растянутым стенкам желудка и проксимальных участков передне-
боковых и срединных отростков. Исключение составляют лишь процессы
гемолиза, идущие довольно равномерно во всем содержимом кишечника.
Незначительное перемешивание крови вызывают также волны перисталь-
тических сокращений. Постепенно, по мере уменьшения растяжения сте-
нок процессы переваривания начинают затрагивать и внутреннюю часть
пищевой массы. Очень важная роль в увеличении активной пищевари-
тельной поверхности кишечника и более равномерном воздействии на всю
массу поглощенной крови принадлежит процессам отторжения пищевари-
тельных и секреторных клеток в полость средней кишки.
В связи с преимущественной локализацией видимых изменений погло-
щенной пищи в узкой зоне, граничащей с клетками средней кишки, воз-
можно допустить существование пристеночного типа пищеварения. В на-
стоящее время пристеночный тип пищеварения обнаружен не только
у млекопитающих, но и в ряде групп беспозвоночных (Уголев, 1963).
Наличие структур, напоминающих микроворсинки, на апикальной цито-
плазматической мембране и высокая концентрация щелочной фосфатазы
- 194 -
в этой зоне служат дополнительными аргументами в пользу наличия
у иксодид и аргазид пристеночного пищеварения, но окончательное реше-
ние вопроса возможно только после проведения специальных биохимиче-
ских и электронномикроскопических исследований.
Несомненно, что внекишечное и полостное пищеварение играет
у клещей лишь вспомогательную роль и обеспечивает первые этапы под-
готовки пищи для усвоения организмом. Окончательное же расщепление
белков и липоидов, как и у других изученных в этом отношении пауко-
образных (Millot, 1949; Wright a. Newell, 1964; Иванов, 1965), происхо-
дит внутриклеточно. Изучение локализации и активности эстераз и лей-
цинаминопептидазы у клещей Argas persicus (Tatchell, 1964) выявило оба
фермента только в определенных участках цитоплазмы пищеварительных
клеток, чаще всего граничащих с пищевыми включениями. С другой
стороны, слабокислая реакция содержимого средней кишки A. persicus
(pH 6.3—6.5) или слабощелочная (pH 7.2—7.6) у Ixodes ricinus исключают
участие лейцинаминопептидазы в полостном расщеплении белков, так
как активность фермента ограничена зоной pH от 2.0 до 4.5. К сожалению,
в силу ограниченности материала эти исследования не дают возможности
сделать окончательный вывод об отсутствии протеолитической активности
в полости кишечника.
Представления о механизме внутриклеточного пищеварения у клещей
пока имеют лишь характер рабочей гипотезы и основываются главным
образом на микроскопических наблюдениях над судьбой поглощенного
гемоглобина, все стадии разрушения которого хорошо выявляются бла-
годаря собственной интенсивной окраске простетической группы. Поступ-
ление гемоглобина в клетки кишечника в форме крупных агрегатов моле-
кул обеспечивается процессами пиноцитоза (эндоцитоза). Размеры обра-
зующихся при этом фагосом лежат в пределах разрешающей способности
светового микроскопа, в дальнейшем они сливаются между собой в еще
более крупные вакуоли. Более крупные капли гемоглобина или даже це-
лые эритроциты, как уже было ранее отмечено, могут захватываться апи-
кальными цитоплазматическими выростами, т. е. подвергаться настоя-
щему фагоцитозу.
В дальнейшем переваривание гемоглобина, по аналогии с известными
случаями внутриклеточного пищеварения в фагоцитах млекопитающих,
должно осуществляться с помощью специальных внутриклеточных орга-
нелл — лизосом, представляющих вместилища комплекса гидролитических
ферментов (Де Дюв, 1964). Можно предположить, что внутриклеточное
переваривание гемоглобина начинается после излияния содержимого лизо-
сом в фагосомы, после чего последние превращаются в пищеварительные
вакуоли. Внутри последних гемоглобин расщепляется на гем и глобин.
Дальнейшему расщеплению и усвоению подвергается лишь белковая
часть молекулы гемоглобина — глобин. Простетическая же группа в ос-
новной своей массе бесполезна для организма. Она остается в цитоплазме
в форме многочисленных конкреций гематина и попадает в просвет кишеч-
ника только после разрушения пищеварительных клеток. Непосред-
ственное образование гематина в полости кишечника никогда не наблю-
далось и в этом проявляется принципиальное различие между крово-
сосущими клещами и насекомыми с полостным типом переваривания
гемоглобина.
От 5 до 10% гема поглощенной крови переходит у самок Boophilus
microplus в развивающиеся ооциты и придает им характерную красно-ко-
ричневую окраску (Вгешпег, 1959; Kitaoka, 1961с). Обнаруженный
в яйцах гем входит в состав сложного белка, не идентичного гемоглобину
хозяина. Железо находится в нем в трехвалентной форме, а собственно
белковая часть отлична от глобина позвоночных. Предполагается, что
- 195 -
13*
после расщепления гемоглобина на гем и глобин часть молекул гема в не-
измененной форме, если не считать окисления железа до трехвалентного
состояния, проходит сквозь базальную мембрану в гемолимфу и соеди-
няется в ней со специфическими белками клеща. В результате образуется
новый тип железосодержащего белка, названный гемиксобовином (Вгеш-
пег, 1959). Сходное с ним соединение еще раньше было обнаружено в гемо-
лимфе и яйцах клещей Ixodes ricinus и Ornithodoros moubata (Wiggles-
worth, 1943). Вероятно, он свойствен и другим видам кровососущих
клещей, так как в надосадочной жидкости гомогенатов яиц Hyalomma asia-
ticum, Rhipicephalus turanicus, Dermaxentor pictus, Argas persicus, Alveo-
nasus lahorensis при спектрофотометрировании мы постоянно обнаружи-
вали характерный для гемиксобовина максимум поглощения при длине
волн между 615—620 ммк.
В процессе эмбрионального развития гемиксобовин оказывается в по-
лости первичной средней кишки, где он в дальнейшем подвергается внутри-
клеточному перевариванию. При его разрушении образуется гематин и
небольшое количество какого-то другого, неидентифицированного дери-
вата гема. Последний, возможно, близок к пурпурно-фиолетовому пиг-
менту из клеток средней кишки. По-видимому, и найденные В. Тредже-
ром (Trager, 1939с) сферические пурпурно-фиолетовые включения в клет-
ках кишечника голодных особей Dermacentor variabilis также представляют
какие-то еще не идентифицированные дериваты гемоглобина, а не симбио-
тические микроорганизмы, как считал Треджер. Сходные конкреции были
найдены нами в цитоплазме клеток средней кишки голодных личинок,
нимф и самок всех изученных в этом отношении иксодид (рис. 305), что
служит дополнительным доказательством в пользу их родства с пурпурно-
фиолетовым пигментом, образующимся при метаболических превращениях
гемиксобовина у клещей Boophilus microplus.
Функции гемиксобовина окончательно не выяснены, но, по-видимому,
значительная часть его используется в качестве резервного белка в эмбрио-
генезе и для покрытия энергетических потребностей голодающих личи-
нок. Кроме того, не исключено его участие в построении железосодержа-
щих энзимов клещей. Отщепление от гема железа и образование желчных
пигментов у кровососущих клещей, в отличие от изученных в этом отноше-
нии клопов Rhodnius и Triatoma (Wigglesworth, 1943), по-видимому, от-
сутствуют. В клетках кишечника и жирового тела обнаруживаются лишь
следы свободного железа, а желчные пигменты вообще не найдены.
СРЕДНЯЯ КИШКА
КАК ДЕПО ЗАПАСНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ
Основные запасы питательных веществ аргазид находятся в полости
средней кишки. Они представлены непереваренным гемоглобином и,
в меньшей степени, белками плазмы крови хозяина. Заднебоковые от-
ростки кишечника превратились в постоянные резервные депо и обычно
играют незначительную роль в переваривании крови. Процесс пищеваре-
ния протекает довольно медленно и не затрагивает одновременно всей
массы крови. По данным Б. Вейтца и П. Бакстона (Weitz a. Buxton, 1953),
у Ornithodoros moubata содержимое кишечника дает четкую реакцию
преципитации на белки крови хозяина спустя 6 месяцев после последнего
питания. Даже у особей, голодавших несколько лет, в задне-боковых
отростках всегда содержится небольшое количество жидкости, дающей
положительную реакцию на гемоглобин. Если последний раз клещ пи-
тался кровью с плохо растворимым гемоглобином, то вместо жидкости
в них находятся характерные для данного вида хозяина кристаллы гемо-
глобина. Внутриклеточные включения гемоглобина, в отличие от иксодо-
- 196 -
вых клещей, не выполняют резервной функции. Жировые и гликогеновые
включения, возможно, представляют подвижную, легко усваиваемую
часть пищевых резервов. Вероятно, они постоянно обновляются за счет
медленного усвоения белков крови. Содержание их в клетках заметно
снижается лишь после длительного голодания, когда переварена и усвоена
почти вся кровь от предшествующего питания.
У иксодовых клещей поглощенная кровь и лизированные ткани хо-
зяина сравнительно быстро исчезают из полости кишечника и переходят
внутрь гипертрофированных пищеварительных клеток. Содержание гемо-
глобина внутри последних после питания увеличивается параллельно
уменьшению массы крови в полости кишечника. Оно достигает максимума
к концу линьки, когда исчезают остатки непереваренной крови, и за-
тем начинает уменьшаться. Наибольшее количество жировых включений
мы, наоборот, видим к концу стадии послелиночного доразвития, когда
содержание гемоглобина в организме значительно уменьшается. Запасы
жира при голодании уменьшаются значительно медленнее, чем резервных
белков. Большое количество жировых вакуолей постоянно наблюдается
у особей, уже не имеющих в клетках включений гемоглобина. Из приве-
денных данных видно, что гемоглобин крови хозяев скорее всего лишь
промежуточный продукт незаконченных процессов пищеварения в орга-
низме иксодид. Постепенно он превращается в более устойчивую форму
энергетических резервов — жиры. Однако в силу примитивности и боль-
шой замедленности процессов внутриклеточного пищеварения значитель-
ные количества гемоглобина выявляются в пищеварительных клетках
спустя много времени после питания и линьки.
Анализ распределения и динамики запасных питательных веществ
в организме иксодовых клещей свидетельствует о полифункциональ-
ности клеток средней кишки. Последние наряду с выполнением своей
основной пищеварительной функции служат также главным депо резерв-
ных белков, жиров и углеводов. При этом они не только служат местом
отложения этих веществ, но п обеспечивают сложную цепь их метаболи-
ческих превращений. Косвенным подтверждением очень высокой мета-
болической активности клеток средней кишки служит высокое содержа-
ние в них митохондрий, буквально заполняющих всю их цитоплазму.
Таким образом, пищеварительные клетки средней кишки выполняют
и функции жирового тела насекомых, и печени, и подкожной жировой
клетчатки позвоночных. Постоянство описанных выше изменений пище-
варительных клеток голодающих особей позволило использовать их
в качестве основного критерия физиологического возраста голодных
клещей (см. стр. 81).
ВЫДЕЛЕНИЕ
Процессы выведения из организма конечных продуктов обмена ве-
ществ у иксодовых и аргасовых клещей, как и в других группах перио-
дически питающихся кровососущих членистоногих, подчинены периодике
гонотрофического ритма имаго и линочных циклов неполовозрелых фаз.
Кроме продуктов выделения, в ректальный пузырь, за исключением
некоторых видов аргазид {Ornithodoros moubatd), поступают продукты
переваривания крови хозяина и разрушающиеся клетки средней кишки,
а во время питания в значительном количестве мало измененная кровь.
В результате фекалии клещей представляют смесь из нескольких веществ,
соотношение между которыми меняется в разные периоды жизненного-
цикла.
- 197 -
Состав экскретов. Конечный продукт азотистого обмена клещей —
гуанин (Schulze, 1955; Kitaoka, 1961в), и в этом отношении они сходны
с другими паукообразными (Schmidt a. oth, 1955). Гуанин отличается
очень низкой растворимостью и выпадает в осадок уже при небольших
концентрациях. В результате в мальпигиевых сосудах и ректальном
пузыре он находится преимущественно в виде взвеси или кашеобразной
массы кристаллов, на выведение которых из организма расходуется
небольшое количество воды. В период эмбриогенеза, линьки или дли-
тельного голодания, когда клещи лишены возможности получать доста-
точное количество воды извне, плохая растворимость гуанина обеспе-
чивает возможность его прогрессирующего накопления в мальпигиевых
сосудах и предотвращает повышение его концентрации в гемолимфе
до токсических значений.
Кристаллы гуанина имеют ярко-белую окраску и обладают интен-
сивным свечением в поляризованном свете. В содержимом мальпигиевых
сосудов и ректального пузыря по внешнему виду можно различить мелкие
(2—4 мк), не имеющие правильной формы, средние (10—20 мк) и крупные
(40—80 мк) сфериты. Последние отличаются хорошо выраженной кон-
центрической слоистостью и бывают простыми, двойными или сложными,
т. е. склеенными из нескольких простых (рис. 63). Кроме сферитов гуа-
нина, в мальпигиевых сосудах питающихся особей довольно многочис-
ленны шаровидные тела размером до 100 мк, образованные из более
мелких эозинофильных шаров. Последние достигают диаметра в 1—3 мк
и одновременно встречаются в цитоплазме клеток.
Функционирование мальпигиевых сосудов. Биохимические пути син-
теза гуанина, как и место его образования в организме клещей, требуют
дальнейших специальных исследований. В то же время прижизненные
наблюдения над отпрепарованными мальпигиевыми сосудами и просмотр
серийных срезов клещей Argas persicus, Ornithodoros papillipes (нимфы,
самки и самцы), Hyalomma asiaticum и Ixodes ricinus (личинки, нимфы
и самки) позволили выявить ритмику работы органов выделения.
Аргасовые клещи. У недавно перелинявших или длительно
голодавших аргасовых клещей просвет мальпигиевых сосудов содержит
большое количество сферитов гуанина, а клетки стенок умеренно упло-
щенные (рис. 335 стр. 193). После линьки происходит лишь частичная
разгрузка сосудов от гуанина и в дальнейшем до питания вновь идет
их постепенное заполнение экскретом. Сразу после питания наблюдается
почти полное выведение гуанина из полости сосудов (фаза разгрузки;
рис. 336). Одновременно увеличивается высота эпителиальных клеток
стенок, вероятно, активно участвующих в выведении продуктов обмена,
которые должны в большом количестве накапливаться по мере перева-
ривания свежей порции белковой пищи. В течение нескольких дней
после питания выделение гуанина в просвет сосудов не приводит к их
заполнению сферитами благодаря быстрому вымыванию последних в рек-
тальный пузырь и частым дефекациям. Позднее запас воды, полученный
с кровью хозяина, исчерпывается, интенсивность дефекации ослабевает
и просвет сосудов вновь постепенно заполняется гуанином (фаза за-
грузки) вплоть до следующего кровососания.
Иксодовые клещи. У только что перелинявших самок
Hyalomma asiaticum и Ixodes ricinus мальпигиевы сосуды бывают запол-
нены большим количеством сферитов гуанина. Разгрузка их от накоплен-
ных в период подготовки к линьке экскретов осуществляется в течение
1—3 дней после линьки. В дальнейшем на стадии послелиночного дораз-
вития в просвете сосудов содержится небольшое количество одиночных
мелких и средних сферитов, не образующих местных скоплений. Диаметр
сосудов колеблется от 50 до 70 мк и они выглядят почти прозрачными.
- 198 -
Эпителиальные клетки умеренной величины, кубические или слегка
уплощенные (рис. 342).
У голодающих особей до прикрепления к хозяину наблюдается мед-
ленная загрузка полости сосудов сферитами гуанина. Последние образуют
Рис. 342—348. Поперечные срезы мальпигиевых сосудов самки Ixodes ricinus на раз-
ных стадиях жизненного цикла.
342 — на стадии послелиночного доразвития; 343 — через 1 год голодания; 344 — на
третьи сутки прикрепления, вес 10 мг; 345 — то же, участок, загруженный гуанином;
346 — напитавшаяся сразу после отпадения; 347 — перед началом яйцекладки;
348 — перед окончанием яйцекладки.
я — ядра эпителиальных клеток; мв — мышечные волокна; в — вакуоли; г — сфериты гуанина.
по ходу сосудов местные скопления (рис. 338), так что происходит чередо-
вание оптически пустых и белых (с гуанином) участков. Диаметр сосудов
при этом существенно не изменяется. Клетки стенок сохраняют прежние
размеры (рис. 343).
- 199 -
После прикрепления клещей к хозяину в первые 1—3 дня наблюда-
ется освобождение сосудов от накопленных при голодании экскретов и
они становятся полупрозрачными на всем своем протяжении (рис. 339).
В то же время размеры эпителиальных клеток заметно увеличиваются
и их апикальные концы местами вдаются в просвет (рис. 344—345).
Диаметр сосудов увеличивается в 1.5—2 раза. Протоплазма в апикальной
зоне вакуолизируется и местами в ней появляются эозинофильные вклю-
чения. Размеры ядер заметно увеличиваются. Возобновляются митоти-
ческие деления, но количество их меньше, чем при подготовке к линьке.
Размеры клеток продолжают увеличиваться до конца питания и иногда
по их апикальной границе выявляется палочковидная исчерченность.
Некоторые клетки подвергаются частичному разрушению (отторжение
апикальных участков цитоплазмы) или даже полному.
Постепенно, в связи с интенсификацией пищеварения, скорость отло-
жения гуанина в мальпигиевых сосудах начинает превышать темпы его
выведения в ректальный пузырь. Сфериты гуанина начинают вновь
образовывать местные скопления (рис. 340). Ко времени окончания пита-
ния просвет сосудов уже на всем протяжении заполнен гуанином и органы
приобретают характерную для них молочно-белую окраску. Стенки
сосудов еще не подвергаются заметному растяжению, а сфериты гуанина
свободно плавают в их жидком содержимом. Диаметр сосудов напитав-
шихся особей в 3—4 раза больше, чем у голодных (рис. 346). Подобный
прирост достигается почти исключительно за счет роста и размножения
эпителиальных клеток.
После отпадения с хозяина процесс загрузки сосудов гуанином про-
должается с еще большей интенсивностью. Диаметр их на этой стадии
может увеличиваться в 10 раз по сравнению с голодными особями. Они
буквально на всем протяжении заполнены сплошной массой гуанина,
который сильно растягивает их стенки (рис. 346—348). Ректальный пу-
зырь на этой стадии также необычайно увеличен и забит одним гуанином.
У личинок и нимф процессы функционирования мальпигиевых сосудов
протекают сходно с самками. Однако у них отсутствует столь сильное
заполнение их гуанином благодаря периодическому освобождению от
экскретов во время и после питания. При подготовке к линьке прямой
кишки сообщение ректального пузыря с внешней средой прерывается.
С этого момента и до окончания линьки дефекация отсутствует. Связь
между мальпигиевыми сосудами и ректальным пузырем, напротив, не
нарушается и в него непрерывно поступают большие количества гуанина.
Размеры ректального пузыря к концу линьки необычайно увеличиваются
и он занимает большую часть задней половины полости тела. Скапливаю-
щиеся в нем в огромном количестве сферокристаллы гуанина растягивают
стенки до состояния мембрановидной оболочки с беспорядочно разбро-
санными уплощенными ядрами.
Растяжение стенок мальпигиевых сосудов и во время линьки, в отли-
чие от напитавшихся самок, остается весьма незначительным (рис. 337).
Перистальтические сокращения сосудов проталкивают скапливающийся
в них гуанин в ректальный пузырь. Длина и диаметр сосудов значительно
увеличиваются за счет делений и роста клеток их стенок (рис. 382). В ре-
зультате число ядер, приходящихся на один поперечный срез через
мальпигиев сосуд, увеличивается с 1—2 у личинок до 3—4 у нимф и
5—8 у самок.
У аргасовых клещей, по наблюдениям Л. К. Ефремовой (1967) над
нимфами Alveonasus lahorensis, деления клеток мальпигиевых сосудов
и рост органов наблюдаются на стадии линьки. Однако, в отличие от
иксодид, последняя линька на имагинальную фазу не связана с делением
клеток мальпигиевых сосудов. У взрослых аргазид размеры мальпигие-
- 200 -
вых сосудов уже не меняются и клеточные деления в их стенках отсут-
ствуют. Увеличение размеров клеток у питающихся особей, возможно,
связано с процессами их полиплоидизации. О полиплоидном характере
ядер этих органов можно судить по появлению тетраплоидных наборов
хромосом в делящихся клетках, но механизм этого процесса не исследован.
Ритмика дефекации. Освобождение ректального пузыря от скапливаю-
щихся в нем гуанина ,.и продуктов переваривания крови происходит
с определенной цикличностью. У имаго аргасовых клещей наибольшее
количество продуктов выделения выводится в первые дни после линьки
и затем в течение 1—5 дней после кровососания. В то же время акты
дефекации не прекращаются на протяжении всего гонотрофического
цикла и сопровождаются выделением небольшой массы фекалий, со-
стоящих, без особой закономерности, из гуанина (белая окраска), гема-
тина или смеси обоих (черная окраска). Личинки и нимфы ведут себя
сходным образом, но выделение фекалий у них постоянно прерывается
на период от нескольких дней до нескольких недель перед линькой.
У имаго иксодовых клещей максимальные по объему количества
гуанина выводятся в первые дни после линьки и во время питания, а у ли-
чинок и нимф и в первые несколько дней после его окончания. У самок
после отпадения с хозяина дефекация сразу же прекращается и скапли-
вающиеся экскреты остаются в организме до самой смерти клеща.
У напитавшихся личинок и нимф дефекация прерывается с началом
отделения гиподермы от старой кутикулы.
Консистенция фекалий меняется в зависимости от содержания воды
в организме. Во время питания или сразу после него они более жидкие,
тогда как у голодных особей почти пылевидные. По-видимому, как и
у некоторых других представителей членистоногих, клетки ректального
пузыря способны к частичной реадсорбции воды.
ЛИНЬКА
Клещам надсем. Ixodoidea, как и другим группам высокоспециализи-
рованных кровососов, свойственны гонотрофическая гармония у самок
и строгая согласованность питания и линек у предимагинальных фаз
развития. Поступление в организм клещей крови хозяев приводит в дей-
ствие цепь еще не изученных нейрогенных и эндокринных реакций. Они
в свою очередь активизируют в организме неполовозрелых особей разно-
образные морфо-физиологические процессы, в конечном итоге ведущие
к линьке, а у самок — к развитию и откладке яиц. У аргасовых клещей,
за немногими исключениями, благодаря кратковременности акта питания
последний представляет естественный рубеж между состояниями отно-
сительного физиологического покоя у голодающих особей и интенсивного
гистогенеза у напитавшихся клещей.
У иксодовых клещей в связи с многодневностью стадии питания
процессы интенсивного размножения клеток и быстрого роста тканей
начинаются с поступлением первых порций пищи в кишечник и, не преры-
ваясь, продолжаются до завершения линьки или яйцекладки. Для голо-
дающих клещей характерны низкие показатели газообмена, а соответ-
ственно и невысокий уровень процессов основного обмена веществ в ор-
ганизме. Напротив, у напитавшихся особей эти показатели резко
возрастают (у личинок и нимф Ixodes ricinus и Dermacentor marginatus
увеличение в 10—30 раз) в связи с интенсификацией процессов роста и
развития (Маклыгин и Алексеев, 1960; Белозеров, 19646). В связи с этим
началом процессов подготовки к линьке или яйцекладке следует считать
не время окончания питания, как у других кровососов, а его начало.
- 201 -
СОГЛАСОВАННОСТЬ ПИТАНИЯ И ЛИНЕК
Способность к линьке или повторному питанию. Цикл развития клещей
включает личиночную, нимфальную (у Parasitiformes обычно с двумя и
у Acariformes — с тремя возрастами) и имагинальную фазы. У иксодовых
клещей число нимфальных возрастов уменьшается до 1, а у аргасовых
клещей оно может быть непостоянным. У мелких норовых видов аргазид
их число колеблется от 2 до 4 (Ornithodoros tartakovskyi, О. alactagalis),
у более крупных О. papillipes и О. verrucosus от 3 до 5, у Argas persicus
их 2 или 3 и у Alveonasus lahorensis их всегда 3. Как отдельные виды,
80
нимфы!
нимфы II
нимфы III нимфы IV
20
10
Рис. 349. Способность нимф Ornithodoros papillipes
к линьке в зависимости от количества поглощенной
крови. Питание на морской свинке.
Знак плюс — перелинявшие нимфы; знак .минус — неперелиняв-
шие нимфы. За 100% принят средний вес полностью насосав-
шихся нимф.
так и подвиды или локальные популяции наряду с другими признаками
могут характеризоваться и числом нимфальных возрастов в развитии.
Большинству видов аргасовых клещей свойственна строгая согласо-
ванность питания и линек. Личинкам и нимфам любого возраста для
линьки бывает достаточно одного кровососания. Случаи линьки голодных
личинок (Ornithodoros moubata, О. savignyi), а также выпадение питания
у нимф I (Alveonasus canestrini, Ornithodoros coniceps) представляют
исключение и связаны с сохранением значительных запасов питательных
веществ от предшествующей фазы развития.
Необходимость в повторном питании для линьки на следующий воз-
раст, за исключением О. hermsi (Павловский и Скрынник, 1959), наблю-
дается редко и связана с нарушением развития при неблагоприятных
окружающих условиях. Так, в наших опытах (Балашов, 1963д) у напи-
тавшихся нимф Argas persicus при температуре ниже 20°, а у Ornithodo-
ros papillipes выше 30° обнаруживалась задержка линьки при сохранении
жизнеспособности. Для поддержания основного обмена в этот период
- 202 -
клещи расходуют пищевые резервы и после перенесения в нормальные
условия для их линьки требуется повторное кровососание.
В отдельных случаях потребность в повторном питании можно вызвать
содержанием нимф при низкой относительной влажности (20—30%).
В этих условиях они теряют повышенное количество воды в результате
испарения и питание необходимо для восполнения ее дефицита.
Значительно чаще потребность в повторном кровососании бывает
вызвана недостаточным насыщением. Различные нарушения акта крово-
сосания приводят к отпадению недопитавшихся клещей, не способных
к линьке на следующий возраст без дополнительного питания. Экспери-
ментальное изучение соотношений между объемом поглощенной крови
и способностью к линьке показало, что аргасовые клещи обладают весьма
широкими регуляционными способностями. На рис. 349 видно, что сня-
тые с морской свинки недопитавшиеся нимфы Ornithodoros papillipes
способны к линьке, если они получили 30—35% от среднего объема крови,
выпиваемого на данной стадии. У О. tartakovskyi этот критический пока-
затель еще меньше и составляет 20—25%. При получении меньшего
объема клещи не способны к линьке и нуждаются в новом питании.
Сходным образом вели себя и недопитавшиеся иксодовые клещи
(табл. 39). Личинки и нимфы клещей Ixodes ricinus и Hyalomma asiaticum
насильственно удалялись с хозяина в последующие дни после прикреп-
ления. Особи, снятые в первые дни питания, не были способны к линьке,
но охотно повторно прикреплялись к лабораторным животным и нормально
заканчивали питание. Клещи, снятые с хозяев в конце питания (примерно
с последней трети периода роста и на протяжении всего периода растяже-
ния), напротив, утрачивали способность к повторному прикреплению
и большей частью успешно линяли на следующую фазу развития. При
Таблица 39
Способность к линьке или повторному присасыванию
у личинок и нимф иксодовых клещей
в зависимости от времени нахождения на хозяине и степени насыщения
Время питания, в сутках Ixodes ricinus Hyalomma asiaticum
вес, в мг повторное присасы- вание линька вес. в мг повторное присасы- вание линька
л [ и ч и н к и
1 0.04-0.06 + — 0.03-0.05 + —
П/2 0.07-0.09 + — 0.04-0.06 + —
2 0.10—0.20 — 0.05—0.07 + —
2V2 0.30—0.50 — 0.06-0.09 + +
3 — 0.10—0.15 +
4 — 0.40-0.70 — +
Нимфы
1 0.4-0.5 + 0.20—0.30 + —
1х/2 0.4-0.7 + — 0.20—0.35 —j— —
2 0.5—1.5 + + 0.25-0.40 —
21/2 2.1-5.2 — + 0.30-0.55 + —
3 — 0.35—0.75 + —
4 — 0. GO—2.45 +
5 — 2.1-3.4 — +
6 — 3.1—16.5 — +
Примечание. Знак плюс означает наличие, знак минус — отсутствие линьки или повтор-
ного питания. В каждом опыте использовалось от 20 до 50 клещей.
- 203 -
этом удавалось получить нимф или взрослых клещей, линейные размеры
которых были в 2—3 раза меньше нормы. Важно отметить существова-
ние непродолжительного периода в питании, когда насильственно уда-
ленные клещи сохраняли как способность к повторному присасыванию,
так и к линьке в случае отсутствия возможностей возобновления пи-
тания.
Минимальный вес тела недопитавшихся особей, обеспечивавший
возможность линьки без дополнительного приема пищи, составлял
в ряде случаев до 20% от веса нормально напитавшихся клещей. Несколько
меньший «критический» вес тела иксодовых клещей по сравнению с арга-
зидами, вероятно, был связан с усвоением значительной части поглощен-
ной крови уже в самом начале питания личинок и нимф иксодид.
Случаи повторного прикрепления недопитавшихся иксодовых клещей г
по-видимому, имеют распространение и в природе и могут представлять
определенное эпизоотологическое значение, допуская возможность меха-
нической передачи возбудителей некоторых инфекций (миксоматоз).
При самоочищении грызунов или же при их гибели недопитавшиеся клещи
могут нападать на новых прокормителей и завершать на них питание.
Следует, однако, отметить, что жизнеспособность подобных недопитав-
шихся особей значительно ниже, чем у не начинавших питаться клещей,
и они быстро гибнут от чрезмерной потери воды за счет испарения. В слу-
чае поглощения определенного минимума пищи недопитавшиеся клещи
линяют на ненормально мелких нимф и имаго, которые неоднократно
обнаруживались при массовых сборах клещей. Особенности строения
таких измельчавших клещей подробно описываются Г. С. Первомайским
(1954).
Линька клещей, как и у насекомых, должна находиться под контролем
эндокринных органов, представленных у иксодид группами нейросекре-
торных клеток мозга (Иоффе, 1964). У клещей Hyalomma dromedarii
(Dhanda, 1967) по интенсивности окраски этих клеток паральдегид-
фуксином установлено, что наиболее низкая концентрация нейросекрета
в их цитоплазме наблюдается у только что перелинявших особей.
В период подготовки линьки нимф в имаго его концентрация достигает
максимального уровня.
Влияние количества поглощенной крови. Значительные колебания
числа нимфальных возрастов в природных популяциях аргасовых клещей
наряду с наследственными факторами несомненно зависят и от прямого
воздействия внешней среды. Вычленить влияние отдельных факторов
возможно лишь при работе со строго определенными наследственными
линиями, допускающими сравнимость результатов.
Влияние количества поглощенной крови на число нимфальных воз-
растов в развитии было изучено нами на примере Ornithodoros papillipes
при кормлении на морской свинке (табл. 40). В нормальных условиях
(контроль) вес нимф этого вида увеличивается после питания и выделения
коксальной жидкости в 5—8 раз. В первом варианте опытов после погло-
щения нимфами I, II или III возраста примерно половины нормального
объема крови они осторожно удалялись пинцетом с морской свинки.
Необходимая степень насыщения определялась визуально по общему
растяжению покровов. Во втором варианте опытов голодные клещи недо-
питывались на всех нимфальных возрастах. Они удалялись с тела хозя-
ина после увеличения в весе в 2.5—3 раза. Полученный объем крови был
достаточен для линьки, но перелинявшие нимфы были значительно
мельче нормальных.
При нормальном питании 62% нимф III линяло на нимф IV возраста,
а остальные на половозрелых клещей. Подавляющую массу последних
составляли самцы (76% от их общего числа). Нимфы IV давали в основ-
- 204 -
Таблица 40
Влияние недостаточного питания на число нимфальных возрастов
у Ornithodoros papillipes
(развитие при температуре 25°; данные в %)
Получили неполную порцию крови
на следующих нимфальных возрастах,
после чего питались нормально
Перелиняли
на имаго из нимф
следующих возрастов
III
Неполное
насыщение
при каждом
кормлении
с I по VIII
нимфальный
возраст
самцы самки
самцы самки
самцы
самки
самцы
самки
II
III
IV
V
VI
VII
VIII
Всего в опыте
(абс.)
104 132 114
0
5
81
14
0
0
0
32
59
9
0
112 118 103
0
0
0
0
41
38
21
128
Примечание. Знак
раста в цикле развития.
минус означает отсутствие нимф определенного воз-
ном самок, в меныпем количестве самцов и лишь 2% их — нимф V воз-
раста. Последние всегда линяли только на половозрелых клещей.
При неполном насыщении (табл. 40) на одном из нимфальных возра-
стов результаты были довольно сходны. Лишь небольшая часть нимф
III возраста превращалась в половозрелых клещей, а количество нимф
V значительно увеличивалось. Из нимф III перелиняли одни самцы,
а самки линяли только из нимф IV возраста и старше. Таким образом,
уже неполное насыщение на одном из нимфальных возрастов значительно
увеличивает процент нимф на один возраст старше контроля.
При недостаточном питании на протяжении всего развития появля-
ется несколько лишних нимфальных возрастов. Первые самцы линяют
лишь из нимф V, а основная масса половозрелых особей происходит от
VI и VII возрастов, вообще отсутствующих в контроле. 13% нимф VII
возраста превращается в нимф VIII, а последние дают одних самок.
Таким образом, в развитии Ornithodoros papillipes появляется три лиш-
них нимфальных возраста. Интересно отметить, что нимфы VI возраста
очень редки у аргасовых клещей, а VII и VIII возраста вообще ранее
были неизвестны.
Влияние питания на различных хозяевах. Видовая принадлежность
хозяев лишь в незначительной степени влияла на количество нимфаль-
ных возрастов в цикле развития видов, обладавших достаточно широкой
естественной полифагией. В наших опытах развитие клещей Ornithodoros
papillipes и О. tartakovskyi протекало нормально при кормлении всех фаз
на морских свинках, белых мышах, курах и степных черепахах. Видовые
особенности прокормителей при этом не вызывали математически досто-
верных изменений в числе нимфальных возрастов в случае использования
в опытах одних и тех же линий клещей (табл. 41). Напротив, какие-то
особенности крови млекопитающих были неблагоприятны для развития
клеща Argas persicus — высоко специализированного, паразита птиц.
После кормления на белых мышах развитие нимф этого вида сильно
затягивалось, наблюдалась очень высокая смертность и лишь небольшой
- 205 -
Таблица 41
Влияние видовых особенностей крови хозяев
на число нимфальных возрастов у аргасовых клещей
(для самцов и самок % вычислен от числа всех особей данного пола,
развитие при 25°)
Хозяин Перелиняли на имаго из нимф следующих возрастов Ornithodoros papil- lipes О. tartakovskyi
самцы самки самцы самки
II 0 0 3 0
Морская III IV 76 23 5 93 76 21 13 87
свинка. V 1 2 0 0
Всего в опыте (абс.) 93 112 89 75
II 0 0 16 0
Белая III IV 77 23 16 83 82 2 68 32
мышь. V 0 1 0 0
Всего в опыте (абс.) 123 148 93 84
II 0 0 73 0
III 89 25 27 98
Курица. IV И 75 0 2
V 0 0 0 0
Всего в опыте (абс.) 172 126 106 ИЗ
II 0 0 81 0
С т епная III 70 9 19 96
IV 30 88 0 4
г ер епаха. V 0 3 0 0
Всего в опыте (абс.) 56 70 102 74
процент особей успешно линял на нимф следующего возраста или имаго.
У некоторых нимф возникала потребность в повторном питании. В целом
при кормлении на млекопитающих среди немногих особей, достигших
фазы имаго, подавляющее большинство происходило от нимф III и IV воз-
растов и только немногие от нимф II. Напротив, после питания птичьей
кровью большая часть самцов и самок линяла из нимф II возраста.
Влияние температуры развития. В наших опытах клещи Argas per-
sicus, Ornithodoros papillipes и О. tartakovskyi развивались при постоян-
ных температурах в 20, 25 и 30° (табл. 42).
Четче всего температурный фактор сказывается на развитии Argas
persicus. При 20° лишь 37% нимф II давали половозрелых клещей,
остальные — нимф III возраста. 17% последних превращались в нимф
IV возраста, не описанных в литературе, которые линяли на взрослых
клещей. При 25° уже 90% нимф II линяло на самцов и самок и только
10% на нимф III. Нимфы IV возраста отсутствовали. Наконец, при 30°
у 3% особей число нимфальных возрастов сокращалось до одного; ос-
новная масса взрослых клещей линяла на нимф II возраста, и лишь 1%
последних превращался в нимф III. Таким образом, при пониженных
температурах в развитии A. persicus появляется лишний, IV, нимфаль-
ный возраст, а при повышенных температурах, напротив, почти исче-
зают нимфы III возраста, а часть самцов и самок линяет непосредственно
из нимф I возраста.
У Ornithodoros papillipes с повышением температуры развития процент
старших нимфальных возрастов в цикле, наоборот, несколько увеличи-
вался, а процент имаго, перелинявших из нимф младших возрастов,
уменьшался. Соответственно при 20, 25 и 30° из нимф III перелиняло
- 206 -
Таблица 42
Влияние температуры на число нимфальных возрастов
у аргасовых клещей (в %)
Вид клеща Перелиняли на имаго из нимф следующих возрастов 20° 25° 30°
самцы самки самцы самки самцы самки
Ar gas persicus
(питание на ку-
рице).
Ornithodoros papil-
lipes (питание
на морской свин- '
ке).
Ornithodoros tarta- (
kovskyi (пита- I
ние на белой
мыши). |
I 0 0 0 0 4 2
II 60 30 93 89 96 96
III 31 63 7 И 0 2
IV 9 7 0 0 0 0
Всего в опыте (абс.) 75 166 103 107 109 121
III 91 23 76 5 77 0
IV 9 71 23 93 23 98
V 0 6 1 2 0 2
Всего в опыте (абс.) 128 103 93 112 79 117
II 32 0 16 0 55 0
III 62 67 82 68 37 94
IV 6 33 2 32 8 6
Всего в опыте (абс.) 99 100 140 124 126 140
в имаго 60, 38 и 27% от общего числа самцов и самок, а остальные проис-
ходили от нимф IV и V возрастов.
У О. tartakovskyi определенная тенденция в сторону увеличения или
уменьшения числа нимфальных возрастов в цикле развития в зависимости
от температуры не обнаружена.
Несмотря на неопределенность понятия температурного оптимума
развития членистоногих, большинство исследователей согласно, что
в известной температурной зоне наблюдается наименьшая смертность и
существуют оптимальные условия для обмена веществ и других процес-
сов жизнедеятельности. У некоторых видов аргасовых клещей в подоб-
ных температурных условиях, вероятно, проявляется тенденция к умень-
шению количества нимфальных возрастов в развитии и увеличению
процента половозрелых особей, перелинявших от нимф младших воз-
растов. Например, у теплолюбивого Ar gas persicus зона минимальной
смертности и наименьшего числа нимфальных возрастов находится при
30° Напротив, использованная в опытах линия Ornithodoros papillipes
была адаптирована к жизни в более прохладных и увлажненных микро-
биотопах предгорий и ее температурный оптимум был ближе к 20—22°
Отсутствие определенной реакции на температуру у О. tartakovskyi,
вероятно, связано с большой легкостью изменения цикла развития этого
вида под воздействием самых различных факторов, трудно контролируе-
мых в эксперименте.
Различия между половозрелыми клещами от нимф разных возрастов.
Нимфы, перелинявшие после недостаточного питания, естественно, зна-
чительно мельче нормальных. Способность аргазид к линьке после по-
глощения трети нормальной порции крови приводит к появлению особей
следующего возраста в два и более раз меньше нормальных (табл. 43).
Однако пределы вариации размеров тела половозрелых клещей имеют
определенные верхнюю и нижнюю границы. Эта регуляция достигается
благодаря появлению одного или нескольких дополнительных нимфаль-
ных возрастов. В связи с этим в опытах с недостаточным питанием даже
наиболее мелкие нимфы, способные к линьке в половозрелых особей,
обычно лишь немногим мельче нормальных. Вероятно, у аргасовых кле-
щей существуют определенные минимальные размеры нимф, допускающие
- 207 -
достижение половой зрелости и
связанные с наличием определен-
ного уровня клеточной организа-
ции.
Верхняя граница размеров
тела нимф также имеет предел,
при достижении которого суще-
ствование в неполовозрелой фазе
невозможно. Во всяком случае
при максимальном удлинении раз-
вития Ornithodoros papillipes и
появлении нимф VI, VII и VIII
возрастов размеры последних были
немногим крупнее нимф IV и V воз-
растов в контроле, и гигантские
особи отсутствовали.
Самцы и самки, перелинявшие
от нимф разных возрастов, замет-
но различаются по размерам тела,
весу, половой продуктивности и
некоторым другим морфологиче-
ским и физиологическим особен-
ностям. Значительные колебания
в размерах тела определяют и
различную яйцевую продуктив-
ность самок. Так, более крупные
самки О. papillipes от нимф IV по-
глощали больше крови (средний
вес после питания 62 мг) и откла-
дывали больше яиц (в среднем
268), чем перелинявшие из нимф
III возраста (соответственно 56 мг
и 222 яйца). У первой группы са-
мок пищевых резервов нимфаль-
ного питания достаточно для авто-
генного развития яиц, а у второй
оно не наблюдается. Еще сильнее
подобные отличия между самками
Argas persicus. Самки от нимф II
весили после питания 67 мг и от-
кладывали 153 яйца, а от нимф
III — соответственно 104 мг и
284 яйца.
Взрослые клещи различного
нимфального происхождения четко
отличаются по характеру хетотак-
сии (Филиппова, 1959). Хетом
самцов и самок, перелинявших от
нимф II возраста, соответствует
таковому нимф III, перелинявших
от нимф III возраста — таковому
нимф IV и т. д. Таким образом,
непостоянство числа нимфальных
стадий, связанное с легкостью
смещения гормонального равнове-
сия, контролирующего развитие
- 208 -
имагинальных признаков, обусловливает полную гамму переходов в сте-
пени имагинации половозрелых клещей.
Исключительная легкость изменения числа нимфальных возрастов
в жизненном цикле аргасовых клещей представляет ценное приспособ-
ление для выживания вида в случае непостоянства контактов с прокорми-
телями. Нимфам аргазид для линьки достаточно поглощения трети
нормальной порции крови. Обладая исключительной индивидуальной дол-
говечностью, они часто оказываются в незаселенных или редко посещае-
мых позвоночными норах или других микробиотопах. При их посещении
случайными хозяевами контакт позвоночных с клещами может быть
очень непродолжительным. В связи с этим часть клещей не успевает
нормально закончить питание и поглощает неполную порцию крови,
которая обеспечивает возможность линьки клещей, а появление в подоб-
ных условиях карликовых самцов и самок предотвращается включением
в цикл развития одного или нескольких нимфальных возрастов.
ВНЕШНИЕ ИЗМЕНЕНИЯ
ПРИ ПОДГОТОВКЕ К ЛИНЬКЕ
Напитавшиеся и отпавшие с хозяина клещи (особенно иксодиды)
обладают ограниченной подвижностью вследствие очень сильного уве-
личения размеров идиосомы при сохранении прежних размеров конеч-
ностей. Благодаря отчетливо выраженной реакции отрицательного фото-
таксиса и положительного тигмотаксиса особи, оказавшиеся на поверх-
ности почвы, сразу же стремятся скрыться в растительной подстилке,
щелях и трещинах почвы и других возможных укрытиях. Вскоре после
этого личинки и нимфы постепенно полностью утрачивают подвижность и
остаются в подобном состоянии, до некоторой степени сходным с кукол-
кой насекомых, до окончания линьки. У двух- и однохозяинных видов
(Boophilus calcaratus, Rhipicephalus bursa, Alveonasus lahorensis) напитав-
шиеся личинки и нимфы также утрачивают подвижность и остаются
прикрепленными к участку кожи, где они закончили питание, до оконча-
ния линьки. После линьки они иногда меняют место прикрепления.
Продолжительность периода от конца питания до линьки на следу-
ющую фазу развития находится в прямой зависимости от температуры.
У одно- и двуххозяинных видов при линьке на теле хозяина он занимает
всего несколько дней, при линьке вне тела хозяина — от одной до не-
скольких недель, а в случае впадения в диапаузу может затягиваться
до нескольких месяцев (Ixodes ricinus и I. persulcatus).
По нашим наблюдениям над развитием клещей Hyalomma asiaticum,
закончившие питание личинки линяют в нимф на 7—8-е сутки, а нимфы
в самцов и самок — на 12—14-е. В первые сутки они подвижны, выде-
ляют много гуанина и имеют эластичные покровы. На второй день у личи-
нок и третий у нимф подвижность теряется, выделение гуанина прекра-
щается, а кутикула становится твердой и хрупкой. Затем на переднем
конце тела появляется постепенно увеличивающееся пятнышко. Это
просвечивающая сквозь покровы линочная полость, заполненная жид-
костью. В нее впячиваются отделившиеся от старой кутикулы закладки
гнатосомы и ног. Отделение гиподермы, начавшееся с гнатосомы, рас-
пространяется назад, причем с вентральной стороны быстрее, чем с дор-
сальной (рис. 350). После завершения отслоения гиподермы выделяется
новая кутикула. Она прозрачная и мягкая, но уже содержит полный
набор склеритов, протоков дермальных желез и щетинок данной морфо-
логической фазы. Пигментация и затвердевание кутикулы происходят
только после линьки. Собственно линька занимает всего несколько
14 Ю. С. Балашов
- 209 -
минут. Старая кутикула у видов родов Hyalomma. Dermacentor и Rhi-
picephalus трескается в момент линьки по линии позади и в бок от
скутума, аур. Ixodes — между скутумом и гнатосомой.
МОРФО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ЛИНЬКИ
Анатомические и гистологические особенности линьки клещей изу-
чены недостаточно, как, впрочем, и у других групп паукообразных.
Для аргасовых клещей подобные исследования вообще отсутствуют,
а для иксодовых клещей известны всего две работы (Falke, 1931; Yalvak,
1939а), в которых разбираются, в основном, особенности линьки покро-
вов тела. Учитывая недостаточность данных о линьке иксодовых клещей,
нами были исследованы линочные изменения у клеща Hyalomma asiaticum
(Балашов, 1963г). Материалы этой работы легли в основу настоящего
раздела монографии.
Линька покровов тела. Линочные изменения в покровах иксодовых
клещей были исследованы у напитавшихся личинок и нимф Hyalomma
asiaticum. содержавшихся при температуре 28°. У закончивших питание
клещей за счет гиподермальной секреции продолжается утолщение ста-
рой кутикулы. Толщина ее увеличивается к концу 2—3-х суток у личи-
нок с 10 до 15—18 мк и у нимф с 30 до 90 мк. Утолщение происходит
за счет отложения новых слоев эндокутикулы и мезокутикулы. Увели-
чение прочности покровов неподвижной стадии, вероятно, обеспечи-
вается и изменением их химического состава, усиливающего степень
склеротизации.
На 2—3-и сутки рост старой кутикулы прекращается, а в гиподермаль-
ных клетках возобновляются митотические деления (рис. 351). Волна
их распространяется с переднего конца тела назад, а максимальное число
наблюдается в закладках гнатосомы и конечностей. Одновременно гипо-
дерма начинает отделяться от старой кутикулы, которая к этому времени
полностью затвердевает и теряет пластичность. Дольше всего сохраняется ее
содинение с кутикулой в местах прикрепления дорсо-вентральных мышц.
Растворения освободившейся старой кутикулы длительное время не наблю-
дается. Она, напротив, немного утолщается, вероятно, за счет набухания
эндокутикулы. У нимф ее общая толщина может достигать местами 120
и у личинок 20 мк. На 10—12-е сутки, т. е. перед самым началом линькиг
наблюдается расслоение и последующее частичное растворение эндокути-
кулы и, в меньшей степени, вторичной мезокутикулы (рис. 354). Самый
внутренний слой эндокутикулы, толщиной в 1—1.5 мк, сохраняет свою
целостность, так что между ним и мезокутикулой местами образуется
свободное пространство. В отличие от остальной эндокутикулы этот слой
начинает краситься железным гематоксилином и азокармином и дает
положительную реакцию на полисахариды. По этим особенностям он
очень сходен с линочной мембраной, описанной у насекомых. Интенсив-
нее всего растворение старой кутикулы происходит по переднебоковой
линии, соответствующей месту линочного шва. На остальных участках
даже эндокутикула растворяется не полностью, а мезокутикула лишь
слегка сжимается от дегидратации.
Линочная жидкость, заполняющая пространство между старой кути-
кулой и отслоившейся от нее гиподермой, слегка окрашивается эозином
и световым зеленым и дает положительные реакции на белки и полисаха-
риды. Последние, вероятно, попадают в нее при растворении старой кути-
кулы. В небольшом количестве в ней встречаются свободные фагоциты
и трофоциты. Участие их в растворении старой кутикулы, как это описано
для краснотелковых клещей и пауков (Jones, 1954; Browning, 1942),
маловероятно из-за незначительной концентрации. Перед освобождением
- 210 -
Рис. 350—354. Образование экзувиалыюй полости и покровы идиосомы
нимфы Hyalomma asiaticum, линяющей на самку.
350 — сагиттальный срез через целого клеща на 5-е сутки после
кровососания; 351 — участок покровов на 2-е сутки после окончания
питания; 352 — то же на 5-е сутки; 353 — то же на 8-е сутки; 345 —
то же на 11-е сутки.
гп — гиподерма; к — кутикула; гн — гнатосома; н — ноги; гл — глотка и пище-
вод; рп — ректальный пузырь; вл — влагалище; нг — нервный ганглий; кш — сред-
няя кишка с непереваренной кровью хозяина; мш — дорсо-вентральные мышцы;
ак — задняя кишка; эп — эпикутикула; пм — первичная мезокутикула; вм —
вторичная мезокутикула; эн — эндокутикула; пр — недифференцированная про-
кутикула; вгл — вакуоли с гликогеном.
от старой кутикулы линочная жидкость всасывается и экзувиальная
шкурка сбрасывается сухой.
Митотическая активность гиподермы прекращается у личинок через
4 и у нимф через 7 суток после питания. Высота гиподерма л ьных клеток
к этому времени увеличивается в несколько раз. Так, в особенно интен-
сивно утолщающихся закладках гнатосомы и ног она увеличивается
у нимф с 10—14 до 40—70 мк. Ядра лежат в срединных базофильных
частях, а базальные концы заполнены очень крупными, не окрашиваю-
щимися красителями вакуолями (рис. 353). На поверхности клеток пер-
вым выделяется тонкий кутикулиновый слой эпикутикулы (рис. 352).
В ногах, гнатосоме, спинном щитке и других затвердевающих в даль-
нейшем частях эпикутикула сохраняет ровную поверхность. Прокути-
кула формируется путем уплотнения и химической перестройки апикаль-
ных слоев базофильной цитоплазмы. Склеротизация твердых частей
начинается во время линьки, как и у насекомых, от поверхности эпи-
кутикулы и распространяется по поровым канальцам к гиподерме
(рис. 356), но заканчивается лишь на стадии послелиночного доразвития.
В растяжимой части идиосомы апикальные концы клеток превраща-
ются в непрерывные ряды вертикальных гребней — будущую систему
эпикулярных складок (рис. 352). На их поверхности откладывается
эпикутикула, а расположенная под ней цитоплазма постепенно превра-
щается в прокутикулу (рис. 353—354). Склеротизация и дифференци-
ровка ее в мезокутикулу начинается после линьки. В сочленовных мем-
бранах клетки располагаются косо к поверхности сочленения. При пре-
вращении их дистальных концов в прокутикулу последняя сразу же
приобретает характерную для этих участков горизонтальную слоистость.
Отложению новой кутикулы предшествует накопление в гиподермаль-
ных клетках огромных количеств гликогена, заполняющего всю базаль-
ную вакуолизированную зону. В процессе формирования кутикулы
его содержание быстро уменьшается и у закончивших послелиночное
доразвитие особей и цитоплазме сохраняются только одиночные мелкие
гранулки. Другой биохимической особенностью гиподермы линяющих
клещей является очень высокая концентрация цитоплазматической РНК,
обусловливающей крайнюю базофилию клеток. К концу линьки высота
гиподермального слоя значительно уменьшается, вакуолизированная
зона исчезает, но повышенное содержание РНК сохраняется до окончания
послелиночного доразвития.
Дермальные железы. Со стадиями питания и линьки связана функцио-
нальная активность специализированных железистых клеток гиподермы,
называемых дермальными железами. П. Шульце (Schulze, 1942b) назы-
вает их железисто-чувствительными органами и приписывает им сенсор-
ные функции, но не исключено, что дермальные железы клещей связаны
пространственно с определенными типами сенсилл в сложно устроенных
выводных протоках (см. стр. 37—40). У напитавшихся иксодовых кле-
щей давно было известно выделение на поверхности покровов многочис-
ленных капелек жидкости (Falke, 1931), которые образуются у отверстий
выводных протоков желез. А. Лис (Lees, 1947) считает, что эти выделе-
ния участвуют в формировании восково-липоидного слоя эпикутикулы.
Несомненно, что дермальные железы играют важную роль в сложных
преобразованиях кутикулы иксодид и их активность ограничена време-
нем роста старой и отложения новой кутикулы с начала питания и до
конца линьки. У клещей Ixodes ricinus и I, persulcatus, по нашим наблю-
дениям, имеются дермальные железы одного типа, сходные по строению
с железами I типа Hyalomma asiaticum (рис. 178, 179). У аргасовых кле-
щей также обнаружен только один тип дермальных желез. Протоки
последних сходны с таковыми желез I типа у иксодовых клещей, но раз-
- 212 -
меры железистых клеток значительно мельче и они функционируют
только в ограниченный период после линьки (рис. 47).
У клещей Hyalomma asiaticum мы обнаружили два типа дермальных
желез, строение которых резко меняется в зависимости от функциональ-
Рис. 355—359. Поперечные срезы ног и дорсо-вентральных мышц нимфы Hyalomma
asiaticum на стадии линьки.
355 — третья пара ног сразу после окончания питания; 356 — то же на 5-е сутки после
питания; 357 — место прикрепления дорсо-вентральной мышцы к покровам на
3-и сутки после питания; 358 — то же на 7-е сутки; 359 — то же на 10-е сутки.
г — гиподерма; м — мезокутикула; эк — экзокутикула; эн — эндокутикула; мб — миобласты;
лдб — миофибриллы; тф — трофоциты; т — трахейный ствол.
ного состояния (Балашов, 1960в). Наиболее многочисленны дермальные
железы I типа. Каждая железа образована парой железистых и несколь-
кими более мелкими клетками, связанными с выводным протоком. У го-
лодных клещей железистые клетки мелкие с интенсивно окрашивающимися
небольшими ядрами. Внешние проявления секреторной активности на
этой стадии отсутствуют (рис. 360).
- 213 -
С началом питания размеры желез быстро увеличиваются и у напитав-
шихся нимф и самок достигают диаметра в 80—100 мк. Размеры ядер
увеличиваются до 30—40 мк и в них наблюдается фрагментация нуклеол.
В цитоплазме появляется обширная полость, заполненная секретом
(рис. 361, 362). У напитавшихся особей происходит быстрое разжижение
цитоплазмы, ведущее к дегенерации железы. У нимф обычно еще до на-
чала отслоения гиподермы от старой кутикулы все дермальные железы
первого типа исчезают. У личинок циклические изменения желез этого
типа идентичны вышеописанным, но размеры их значительно мельче.
При подготовке к линьке напитавшихся личинок и нимф вместе с от-
ложением новой кутикулы формируются и протоки дермальных желез.
Одновременно среди нормальных гиподермальных клеток дифференци-
руются парные железистые клетки, которые отличаются от остальных
клеток только несколько большими размерами ядер и связью с вывод-
ными протоками в кутикуле. На описанной стадии развития дермальные
железы I типа остаются до начала питания.
Дермальные железы II типа также образованы двумя железистыми
и несколькими клетками протока. У голодных клещей этот тип желез
уже резко отличается от окружающих гиподермальных клеток. В каждой
железистой клетке хорошо развита внутренняя полость, а цитоплазма
образует вокруг нее тонкую клеточную стенку. Диаметр желез колеблется
от 11—12 мк у нимф, до 18—20 мк у самок и ядер соответственно в преде-
лах 4—6 и 7—8 мк (рис. 364).
С начала кровососания дермальные железы II типа быстро увеличи-
ваются, достигая у полностью напитавшихся клещей огромных размеров
(до 100 мк у нимф и 200—250 мк у самок). Соответственно и диаметр ядер
увеличивается у нимф до 30 и у самок до 50—60 мк. Они принимают
неправильную форму и образуют боковые выросты. Сильно увеличив-
шаяся нуклеола фрагментируется на 20—30 более мелких ядрышек раз-
мером от 1 до 5—6 мк. Цитоплазма образует лишь тонкую стенку огром-
ной внутриальвеолярной полости (рис. 98, 365, 366). Внутреннее содер-
жимое полости выглядит на срезах слабо красящейся рыхлой массой
сетевидной структуры, заполненной многочисленными вакуолями. По-
следние дают слабую положительную реакцию на присутствие белков
и липоидов.
После отпадения клеща величина желез продолжает еще некоторое
время увеличиваться, достигая своих предельных размеров в 300—400 мк
при диаметре ядра в 40—80 мк (рис. 366). Затем начинается их быстрая
дегенерация, полость спадается и железа исчезает. У нимф дегенерация
желез обычно совпадает с отслоением гиподермы от старой кутикулы и
образованием экзувиальной полости.
Одновременно с отложением новой кутикулы среди гиподермальных
клеток обособляются железистые клетки дермальных желез II типа
следующей фазы развития. Железы быстро увеличиваются в размерах и
достигают на 9-е сутки по отпадении напитавшихся нимф 70—80 мк.
Диаметр ядер — 20—25 мк и они часто приобретают неправильную форму.
Цитоплазма заполнена многочисленными вакуолями с секретом. Перед
Рис. 360—366. Дермальные железы Hyalomma asiaticum.
360 — дермальная железа I типа у голодной самки; 361 — то же в середине питания;
362 — то же у напитавшейся самки; 363 — дермальная железа II типа у напитавшейся
нимфы на стадии формирования имагинальной кутикулы; 364 — дермальная железа
II типа голодной самки; 365 — то же в середине стадии питания и 366 — у напитав-
шейся особи вскоре после отпадения.
кг/тп — кутикула; гип — гиподерма; яж — ядра железистых клеток; пр — протоки дермальных
желез; япр — ядра клеток протоков дермальных желез; нук — нуклеолы; пол — внутренняя по-
лость железы; сек — секрет.
- 214 -
364
самой линькой секрет поступает из клеток в экзувиальную полость (рис. 363).
В процессе секреции значительная часть цитоплазмы разрушается,
внутренняя полость клеток спадается и ядра сжимаются. Диаметр же-
лезы уменьшается до 18—20 мк и в этом состоянии она сохраняется до
начала питания, после чего вновь приступает к секреторной активности.
Функции дермальных желез клещей окончательно не выяснены.
Предполагается, что, как и у насекомых, они участвуют в формировании
восково-липоидного слоя эпикутикулы (Балашов, 1960в). Секрет дермаль-
ных желез II типа растекается по поверхности идиосомы напитавшихся
особей и, вероятно, обеспечивает восстановление водонепроницаемого
слоя эпикутикулы. Справедливость этого предположения подтверждают
наши данные о скорости потери воды в организме голодных, недо-
питавшихся и напитавшихся самок Hyalomma asiaticum. У неполностью
напитавшихся особей наблюдалось значительное возрастание скорости
потери воды по сравнению с голодными клещами. Напротив, у закончив-
ших питание самок относительные потери воды были даже несколько
ниже, чем у голодных. Интересно, что у напитавшихся клещей отмечено
также резкое повышение устойчивости к инсектицидам (Мусатов, 1958;
Kitaoka a. Yajima, 1957), проникновение которых в организм также за-
висит от свойств эпикутикулы. Не вызывает сомнений важная роль дер-
мальных желез в процессе линьки, так как в этот период их секрет выво-
дится непосредственно в линочную полость и, возможно, участвует в рас-
творении внутренних слоев старой кутикулы.
Трахейная система. При подготовке личинок Hyalomma asiaticum
к линьке на нимф в области будущих стигмальных пластинок наблюдается
очень сильное утолщение отслоившейся от старой кутикулы гиподермы.
Клеточные границы в ней исчезают, а ядра располагаются в несколько
рядов, создавая впечатление многослойности. От сформировавшейся
эктодермальной закладки внутрь тела врастают клеточные шнуры. Цито-
плазма их сильно вакуолизирована, а сферические ядра делятся митотиче-
ским путем. На следующем этапе путем расхождения клеток последова-
тельно формируется просвет атриальной полости, главных трахейных
стволов и их боковых разветвлений. На внутренней поверхности трахей-
ного эпителия выделяется кутикулярная выстилка — интима со спи-
рально утолщенной нитью — тенидией.
У только что напитавшихся нимф эпителиальная стенка трахейных
стволов сильно уплощена и ядра слегка веретеновидные (рис. 367). В пер-
вые дни после окончания кровососания высота клеток увеличивается
в 2—5 раза, цитоплазма вакуолизируется, ядра становятся сферическими
и начинают делиться (рис. 368). На 5-е сутки клетки отделяются от старой
кутикулярной выстилки. За счет интенсивного роста и размножения
клеток трахей диаметр стволов увеличивается в несколько раз. Сморщив-
шаяся старая интима свободно лежит в обширном просвете. Трахейный
эпителий выделяет новую кутикулярную выстилку, после чего высота
клеток быстро уменьшается и они приобретают нормальную уплощенную
форму (рис. 369). Наряду с полной сменой выстилки старых трахей за
счет размножения клеток последних формируются новые стволы со своей
сетью трахеол. Во время линьки трахейная система заполнена жидкостью.
Она появляется в полости стволов при отслоении гиподермы от кутикулы
и исчезает только при окончании линьки. В это время вместе с кутикулой
предшествующей фазы через стигмальные отверстия вытягиваются и
остатки старой интимы.
Мускулатура. Топографическая анатомия мускулатуры у преимаги-
нальных и имагинальных фаз развития в основных чертах одинакова и
при подготовке к линьке многие группы мышц лишь увеличиваются
в размерах путем добавления новых пучков миофибрилл. Подобным
- 216 -
образом, в-частности, ведут себя дорсо-вентральные мышцы (рис. 357).
У готовящихся к линьке нимф после разъединения миофибрилл со старой
кутикулой дорсо-вентральные мышечные пучки сильно сокращаются.
На границе между их концами и гиподермой образуются стебельки из
миобластической ткани с большим числом митозов. Вместе с ростом в длину
мышечные пучки также значительно утолщаются и ядра периферической
саркоплазмы делятся митотическим путем (рис. 358). Поперечная полоса-
тость дорсо-вентральной мускулатуры во время ее роста, в отличие от
таковой клещей-тромбикулид (Jones, 1954), не исчезает. При формирова-
нии новой кутикулы между ней и мышечными пучками в плазме гиподер-
мальных клеток появляются вертикально идущие волокнистые струк-
туры. Они продолжаются во вновь образующуюся прокутикулу и к концу
линьки приобретают нормальное для голодных особей строение (рис. 359),
обеспечивая прикрепление мышц к покровам тела.
Наиболее значительную перестройку претерпевают во время линьки
гнатосома и ноги. Линейные размеры тела клеща увеличиваются у каждой
последующей морфологической фазы в 2—3 раза. Покровы идиосомы
вырастают в этих пределах в период кровососанйя, так что при линьке
в старой кутикулярной оболочке относительно свободно умещается тело
следующей фазы. Напротив, размеры гнатосомы, ног и других частей,
построенных из твердой кутикулы, увеличиваются только во время линьки.
Формирование нового ротового аппарата и конечностей, отличающихся
сложной морфологической расчлененностью наружного скелета и увели-
чивающихся в размерах в 2—3 раза, возможно только благодаря втяги-
ванию их зачатков в линочную полость. При этом они подвергаются
частичному гистолизу, дедифференцируются и напоминают свои эмбрио-
нальные закладки. Мышцы теряют поперечную полосатость и редуци-
руются. Вместо них остаются лишь очаги размножающихся миобластов.
От сегментации сохраняются только наружные перетяжки, соответствую-
щие будущим сочленениям (рис. 355).
На 4-е сутки у личинок и 7-е у нимф деления миобластов прекращаются
и начинается дифференцировка дефинитивной мускулатуры и трахей,
а на поверхности гиподермы откладывается новая кутикула. В мышечных
волокнах развивается поперечная полосатость, а саркоплазма с ядрами
удлиненной формы располагается по их периферии. Одновременно вос-
станавливается соединение мышечных пучков с кутикулой (рис. 356).
Своеобразной особенностью личиночной линьки служит развитие
4-й пары ног. Последние представлены у голодной личинки парными
закладками недифференцированных клеток. Они располагаются позади
3-й пары ног непосредственно под гиподермой. Во время линьки после
отслоения старой кутикулы они выпячиваются наружу и быстро увеличи-
ваются в размерах. На поверхности в местах будущих суставов появляются
кольцевые борозды, а внутри образуется полость. Образование кутикулы,
мускулатуры и трахей происходит сходно с остальными ногами.
Ткани внутренней среды. При подготовке к линьке ткани внутренней
среды претерпевают очень сильные циклические изменения. У голодных
особей Hyalomma asiaticum объем гемолимфы невелик и она содержит,
особенно у личинок и нимф, очень мало свободных гемоцитов. Последние
представлены главным образом еще недифференцированными прогемоци-
тами диаметром в 6—8 мк и фагоцитами в 12—16 мк. Цитоплазма фаго-
цитов базофильна, содержит умеренное количество мелких и средних
включений и образует ветвистые псевдоподии, обеспечивающие высокую
фагоцитарную активность клеток данного типа (рис. 373).
Значительное количество гемоцитов заключено на этой стадии в рых-
лой соединительной ткани. Последняя занимает по сравнению с другими
внутренними органами очень небольшой объем и образована клеточными
- 217 —
тяжами жирового тела и пленками основного вещества с одиночными
десмоцитами.
С начала кровососания наблюдается интенсивное размножение про-
гемоцитов путем митотических делений, которые продолжаются всю
первую половину стадии линьки. Довольно часты митозы в этот период
и среди клеток соединительной ткани. У недавно закончивших питание
клещей все внутреннее пространство идиосомы заполнено растянутыми
кровью дивертикулами кишечника, а количество гемолимфы и соединитель-
нотканных элементов по-прежнему невелико. На 2—4-е сутки объем ки-
шечника значительно уменьшается благодаря удалению воды из погло-
щенной крови, а количество гемолимфы, напротив, сильно увеличивается.
Значительно меняется и состав ее форменных элементов. Общее число их
во много раз больше, чем у голодных особей данной фазы. Доминируют
среди них трофоциты — крупные овальные клетки диаметром 18—25 мк
(рис. 374). Цитоплазма их заполнена крупными базофильными включе-
ниями.
Особенно много трофоцитов скапливается внутри закладок гнатосомы и
конечностей. Часть из них внедряется между гиподермальными клетками
и выходит в линочную полость. Количество гемоцитов в линочной жид-
кости, однако, значительно меньше, чем у пауков (Browning, 1942), и они
никогда не образуют сплошного слоя под старой кутикулой.
При отложении новой кутикулы трофоциты, располагаясь непосред-
ственно под гиподермой, местами образуют непрерывный клеточный слой.
Там они постепенно растворяются, а содержимое их включений, вероятно,
участвует в формировании новой базальной мембраны. Сходную картину
мы наблюдаем вокруг мышц, трахейных стволов, половой системы и дру-
гих внутренних органов, обладающих соединительнотканными оболоч-
ками (рис. 372). Трофоциты, участвующие в образовании их основного
вещества, полностью растворяются или же превращаются в типичные
клетки соединительной ткани. В дальнейшем в описываемых оболочках
внутренних органов дифференцируется система мышечных волокон.
Местами трофоциты склеиваются в крупные скопления гроздевидного или
шнуровидного типов, свободно лежащие в полости тела (рис. 370). При
освобождении от включений они не разрушаются, а лишь вакуолизируются
и превращаются в тяжи жирового тела (рис. 371).
Из приведенных наблюдений видно, что в процессе линьки часть гемо-
цитов нормально превращается в соединительнотканные структуры кле-
точного и неклеточного типов. В свою очередь жировое тело в первые дни
после питания сильно вакуолизируется и распадается на отдельные
клетки. Плазма последних заполняется крупными сферическими включе-
ниями и они становятся не отличимыми от нормальных трофоцитов.
Несомненно, что клетки крови и соединительной ткани иксодовых клещей,
как и у насекомых, наряду с общим происхождением обладают широкими
потенциальными способностями к взаимным превращениям и в постэмб-
риональный период. При отложении новой кутикулы объем гемолимфы
постепенно уменьшается и к моменту линьки становится немногим больше,
чем у голодной особи. Число трофоцитов относительно невелико и про-
должает постепенно сокращаться в послелиночный период. Доминирую-
щими элементами гемолимфы вновь становятся юные гемоциты и фаго-
циты. Параллельно уменьшается и вакуолизация клеток тяжей жиро-
вого тела.
На стадии линьки трофоциты, по-видимому, осуществляют транспорт
веществ для построения кутикулы и соединительнотканных оболочек.
Крупные сферические включения, заполняющие их цитоплазму, интен-
сивно окрашиваются при реакции на белки с бром-феноловым синим.
Кроме того, они дают слабую положительную реакцию на полисахариды,
- 218 -
Рис. 376—382. Органы пищеварения и выделения нимфы Hyalomma asiaticum
во время линьки.
376 — слюнные железы на 3-и сутки после питания; 377 — то же на 10-е
сутки; 378 — глотка на 5-е сутки после питания; 379 — то же на 10-е сутки;
380 — участок стенки средней кишки сразу после окончания кровососания;
381— то же во вторую половину линьки; 382 — поперечный срез через мальпи-
гиев сосуд в первую половину линьки.
к — кутикулярная выстилка; са — секреторные альвеолы; впр — выводной проток слюнной
железы; ов — отделившаяся выстилка выводного протока; экг — эпителиальные клетки
стенки глотки; мс — мускулы-сжиматели глотки; мр — мускулы-расширители глотки; пк —
пищеварительные клетки; нк — недифференцированные клетки средней кишки; гб — ге-
моглобиновые включения; мк — мышцы стенки кишечника; тр — трофоциты; гн — гуа-
нин; гм — гематин.
отличные от гликогена при обработке по методу иодная кислота—реактив
Шиффа. Вероятно, они представляют комплексные образования глико-
протеинового типа. В первую половину линьки, перед началом отложения
кутикулы трофоциты также очень богаты гликогеном. Последний в виде
мелких (размером до 1—2 мк) и средних глыбок (3—5 мк) заполняет
пространство между крупными гликопротеиновыми включениями. Коли-
чество гликогена в трофоцитах уменьшается параллельно с его накопле-
нием в гиподермальных клетках. Содержание жира в клетках гемолимфы
и соединительной ткани относительно невелико. Характерные элементы
крови линяющих клещей представляют крупные овальные клетки диамет-
ром до 40—50 мк — эноциты (рис. 375). У недавно напитавшихся особей
плазма их свободна от включений и почти не окрашивается азокармином,
гематоксилином и эозином. На 3—4-е сутки в ней появляются буроватые
включения. Количество их быстро увеличивается, на 6—9-е сутки они
заполняют всю цитоплазму и маскируют ядро. Дальнейшую судьбу
подобных клеток проследить не удалось, но несомненно, что они разру-
шаются до окончания линьки. У недавно перелинявших голодных особей
они встречаются в очень незначительном числе и свободны от включений.
Возможно, что подобные клетки несут какую-то экскреторную функцию,
служа местом накопления продуктов обмена.
Органы пищеварения. У напитавшихся личинок и нимф подготовка
к линьке не приводит к существенным преобразованиям в среднем отделе
кишечника, где в этот период особенно интенсивно протекают процессы
пищеварения (рис. 380). Замена старых клеток кишечника новыми про-
исходит постепенно, начиная со стадии питания и до конца линьки. Рост
осуществляется за счет размножения мелких недифференцированных
клеток, прилежащих к базальной мембране. Их апикальные концы сверху
прикрыты гипертрофированными пищеварительными клетками, часть
которых сохраняется до начала питания следующей фазы развития
(рис. 381).
Значительной перестройке во время линьки подвергаются эктодер-
мальные производные пищеварительного тракта — слюнные железы,
глотка, пищевод и задняя кишка. У личинок и нимф, закончивших крово-
сосание, секреторные и пирамидальные альвеолы полностью разрушаются
на 2—3-и сутки. До конца линьки сохраняются немногие секреторные
альвеолы, не приступавшие к секреции во время кровососанйя. У не-
давно слинявших половозрелых особей их легко отличить от вновь обра-
зовавшихся альвеол благодаря более крупным размерам (диаметр до
90—100 мк и ядер 15—20 мк) и сильно вакуолизированной цитоплазме.
Секреторные клетки в них слегка расходятся и округляются, придавая
альвеоле морулообразный вид. Дальнейшая судьба их не прослежена,
но они несомненно дегенерируют до начала кровососанйя.
В целом альвеолы слюнных желез Hyalomma asiaticum формируются
при каждой линьке заново. На 1—2-е сутки после питания у личинок и
3—4-е у нимф высота клеток эпителиальной выстилки выводных прото-
ков заметно увеличивается и они принимают столбчатую форму. Ядра из
овальных становятся сферическими и среди них наблюдаются многочислен-
ные митотические деления. Эпителиальный слой отделяется от старой
кутикулярной выстилки. Благодаря быстрому размножению и росту кле-
ток стенок диаметр просвета главных выводных протоков увеличивается
у личинок с 3 до 7—8 мк и у нимф с 10 до 40 мк. Одновременно стенки
образуют много боковых выростов — будущих вторичных выводных
протоков. Стенки протоков покрываются многочисленными небольшими
выпячиваниями — зачатками альвеол. Постепенно они становятся сфери-
ческими, достигают диаметра 12—15 мк и одним концом открываются
в выводной проток (рис. 376).
- 220 -
В середине линьки эпителиальные клетки выделяют кутикулярную
выстилку протоков со спирально утолщенной опорной нитью. Эти про-
цессы протекают сходно с образованием интимы трахей и других кутику-
лярных выстилок внутренних органов эктодермального происхождения.
Митотические деления прекращаются с началом формирования кутику-
лярной выстилки. Среди сформировавшихся альвеол какая-либо морфоло-
гическая дифференцировка сперва отсутствует, а их клетки сходны с та-
ковыми выводных протоков. Лишь за несколько дней до окончания линьки
среди альвеол, непосредственно открывающихся в главные выводные
протоки, развиваются железки пирамидального типа. Одно из центрально
расположенных ядер становится более крупным, а в периферической
цитоплазме появляются характерные волокнистые структуры. Размеры
секреторных альвеол увеличиваются, они достигают диаметра 22—25 мк.
Различить альвеолы II и III типов на этой стадии невозможно. В них
можно обнаружить лишь два типа ядер: более крупные, диаметром 6—
9 мк, располагаются ближе к выводному протоку, а мелкие, диаметром
4—5 мк, занимают дистальную половину. Деления ядер на этой стадии
никогда не наблюдаются (рис. 377). Вакуоли с секретом появляются уже
после линьки. Размеры альвеол продолжают при этом увеличиваться;
наиболее крупные из них достигают у особей, закончивших послелиноч-
ное доразвитие, диаметра 40—50 мк.
При втягивании гнатосомы в линочную полость глотка и пищевод
освобождаются от кутикулярной выстилки, остающейся соединенной
с твердым скелетом старого ротового аппарата. Размеры эпителиальных
клеток увеличиваются и они становятся столбчатыми. Дистальные концы
клеток базофильные, а базальные — сильно вакуолизированные. Кле-
точные границы временно неразличимы. Среди сферических ядер наблю-
дается множество митозов. Мускулы-сжиматели и расширители глотки
дедифференцируются до состояния отдельных групп размножающихся
миобластов. Характерная трехлучевая форма просвета глотки исчезает
и он выглядит на поперечных срезах округлым, как и пищевод (рис. 378).
После прекращения клеточных делений на их внутренней поверхности
выделяется кутикулярная выстилка, а полость глотки вновь восстанав-
ливает свою трех лучевую структуру. Мышечные пучки соединяются
сухожилиями с кутикулярными лучами и внутри их развивается попереч-
ная полосатость (рис. 379). До окончания линьки высота эпителиальных
клеток значительно уменьшается, так что под кутикулярным слоем
остается лишь узкая полоска цитоплазмы с овальными ядрами. Сходным
образом протекает и линька задней кишки. В связи с этим большую часть
времени линьки сообщение между ректальным пузырем и внешней средой,
включая экзувиальную полость, отсутствует.
ОБЩИЕ ОСОБЕННОСТИ ЛИНЬКИ КЛЕЩЕЙ
Как мы уже отмечали, толчком к началу линочных изменений у крово-
сосущих клещей служит поступление крови хозяина в кишечник. При
многодневном питании иксодовых клещей процессы интенсивного роста
покровов, кишечника, гонад и других внутренних органов происходят
параллельно с поступлением новых порций пищи в организм клеща, а у ар-
гасовых клещей, за отдельными исключениями, после окончания крово-
сосания. У иксодид пауза между ростом тканей во время питания и при
подготовке к линьке отсутствует, так что в их жизненном цикле зако-
номерно чередуются периоды с повышенной метаболической активностью
и интенсивным органогенезом и гистогенезом (питание, линька и послели-
ночное доразвитие) с периодами полного отсутствия роста и размножения
тканей при низком уровне обмена веществ (голодающие особи).
- 221 -
Гистологические и морфологические перестройки во время линьки,
особенно у иксодид, весьма значительны, что отчасти связано с 2—3-крат-
ным увеличением размеров тела и наличием сложного внутреннего ске-
лета гнатосомы. Описанные изменения в основном охватывают эктодер-
мальные производные. Ротовой аппарат и конечности, включая их муску-
латуру, подвергаются значительной дедифференцировке. Характерные
циклические изменения претерпевают также ткани внутренней среды.
В системах органов, не подвергающихся заметным перестройкам (кишеч-
ник, мальпигиевы сосуды, нервная система), клеточные деления и рост
также наиболее интенсивны во время линьки.
В целом гистологические изменения в организме иксодовых клещей
на стадии линьки значительно глубже, чем у пауков (Browning, 1942),
и во многом приближаются к таковым у краснотелковых клещей (Jones,
1954). Интересно, что, как и у последних, линька Hyalomma asiaticum
сопровождается длительной утратой подвижности, хотя морфологически
специализированная стадия «куколки» у иксодид отсутствует. Подобное
конвергентное сходство несомненно связано со значительными линоч-
ными изменениями в двигательной мускулатуре, включая ее частичную
дедифференцировку.
Стадию линьки грубо можно разделить на две половины. В первый
период преобладают процессы отделения клеток гиподермы от старой
кутикулы и их очень интенсивных делений. В гиподерме накапливаются
большие количества гликогена, а в трофоцитах — гликопротеинов. Со
второй половины линьки, начинающейся вместе с отложением новой
кутикулы, клеточные деления прекращаются и происходит интенсивная
дифференцировка органов и тканей. Резервы гликогена в гиподерме и
гликопротеинов в трофоцитах быстро уменьшаются. Возможно, что
V-образная кривая потребления кислорода напитавшимися личинками и
нимфами иксодид (Белозеров, 19646) непосредственно отражает особен-
ности метаболизма во время описанных выше периодов подготовки
к линьке. Минимальные значения уровня потребления кислорода при
этом, по-видимому, соответствуют времени максимальной дедифферепци-
ровки мускулатуры, когда несомненно нарушается нормальный газо-
обмен.
С отсутствием процессов гистолиза в большинстве органов, возможно,
связана исключительная способность иксодовых клещей к трансфазовой
передаче широкого круга возбудителей болезней человека и животных.
Можно считать правилом, что если микроорганизм может существовать
в клеще, то он способен и к трансфазовой передаче от личинки к нимфе
и от нимфы к имаго. В этом отношении иксодовые клещи существенно
отличаются от насекомых с полным превращением, где случаи трансфазо-
вой передачи возбудителей, исключая некоторые вирусы, крайне редки.
РАЗМНОЖЕНИЕ
Различным сторонам размножения иксодоидных клещей посвящено
значительное число исследований. Наиболее подробно изучены цитологи-
ческие особенности оогенеза, включая процессы оплодотворения (Nor-
denskiold, 1910; Lees and Beament, 1948; Соколов, 1956; Geigy a. Wagner,
1957; Wagner-Jevseenko, 1958; Горощенко, 1960, 1965; Sareen, 1965),
сперматогенеза (Samson, 1909b; Nordenskiold, 1920; Warren, 1933; Tu-
zet e. Millot, 1937; Соколов, 1958; Wagner-Jevseenko, 1958; Горощенко,
1960, 1965; Rothschild, 1961; Reger, 1963) и придаточных желез, связан-
ных с половой системой (Tatchell, 1962b; Chinery, 1965а). Значительно
- 222 -
меньше нам известно о развитии половой системы в онтогенезе. Ю. Ваг-
нер (1894) дает краткое описание закладки яичников и семенников у Boo-
philus calcaratus во время эмбрионального развития, а С. Ялвак (Yalvac,
1939а) — дифференцировки половой системы у напитавшихся нимф кле-
щей рода Hyalomma. Кроме того, имеются краткие описания зачатков
органов размножения голодных личинок Ixodes ricinus (Nordenskiold,
1910; Mudrow, 1932) и их дифферецировки у клеща Rhipicephalus appen-
diculatus (Till, 1961). Ритмика процессов размножения клещей в связи
с питанием и воздействием внешних факторов рассматривалась в немногих
исследованиях (Остроумова, 1936; Павловский, 1940а, и др.), и проблема
гонотрофических отношений в этой группе кровососов оставалась до
начала наших исследований (Балашов, 19566, 1957а, 1962в, 1963е, 19646:
Балашов и Горощенко, 1960) практически не изученной.
ЦИТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ РАЗМНОЖЕНИЯ
У САМОК
Развитие женской половой системы. В период эмбрионального разви-
тия яичник закладывается в виде парного скопления клеток. Эти зачатки
вытягиваются назад и сливаются позади ректального пузыря (Вагнер,
1894). У только что вылупившихся личинок Hyalomma asiaticum, Ixodes
ricinus и Ornithodoros papillipes яичник был всегда представлен непарным
зачатком из группы вытянутых в поперечном направлении клеток, тесно
прилегающих к задней стенке ректального пузыря. У голодных и на-
питавшихся личинок в зачатке различимы более крупные, почти сфериче-
ские или неправильно многоугольной формы оогонии с пузыревидными
ядрами (рис. 395). Между ними лежат многочисленные более мелкие ядра
эпителиальных клеток. Границы между самими клетками неразличимы.
У личинок эпителиальные клетки не только вклиниваются между оого-
ниями, но и могут окружать их снаружи. Снаружи яичник покрыт тон-
кой соединительнотканной оболочкой с одиночными, сильно уплощенными
ядрами.
Эктодермальные зачатки выводных путей у голодных личинок еще
отсутствуют. Стимулом к их образованию, так же как и к росту яичника,
служит питание. У иксодид эти процессы начинаются уже на стадии
кровососания, а у быстро насасывающихся аргазид — на стадии линьки.
В первые дни линьки после отделения гиподермы от старой кутикулы по-
зади нервной массы на вентральной стороне тела гиподермальные клетки
выпячиваются внутрь в заднедорсальном направлении и формируют за-
чаток влагалища (рис. 383). За время линьки влагалище приобретает
форму конуса, суженный конец которого вклинивается между гиподер-
мальными клетками (рис. 384).
Митотические деления многочисленны на этой стадии линьки также
среди оогониев и эпителиальных клеток яичника. Размеры яичника
заметно увеличиваются, а у иксодовых клещей концы его заворачивают
вперед и он приобретает подковообразную форму. От концов яичника
в сторону зачатка влагалища вытягиваются очень тонкие клеточные тяжи
диаметром 3—7 мк. Слияние их с эктодермальным влагалищем происходит
в самом конце линьки личинок, а непарная матка формируется уже на
нимфальной фазе. Полость внутри яйцеводов неразличима, а клеточные
границы их стенок не видны (рис. 385).
У голодных нимф Hyalomma asiaticum и Ixodes ricinus яичник подково-
образный, а его концы достигают уровня IV пары кокс. В поперечном
сечении он округлый, причем местами уже различим щелевидный централь-
ный просвет. Последний окружен многочисленными ядрами эпителиаль-
- 223 -
ных клеток, а по периферии лежат более крупные оогонии. От концов
яичника отходят тонкие и почти прямые парные яйцеводы, соединяющие
его с задне-боковыми концами зачатка влагалища. Последний уже яв-
ственно изгибается параллельно главной оси тела и сплющен дорсо-
вентрально. Внутри зачатка образуется небольшая полость (рис. 386).
Стимулом для дальнейшего развития половой системы у нимф служит
кровососание. В клетках возобновляются митотические деления и раз-
меры закладок значительно увеличиваются. У I. ricinus задний конец
влагалища продолжает вытягиваться каудально и одновременно сильно
утолщается. Соприкасающиеся с ним концы яйцеводов сливаются между
собой и образуют короткую непарную трубку — будущую матку. Длина
яйцеводов значительно увеличивается и они образуют характерные петле-
образные изгибы. В матку вдается задний конец влагалища, но полости
этих органов остаются разделенными клеточной перегородкой. Последняя
исчезает лишь в конце линьки, когда устанавливается сообщение между
полостями матки и влагалища.
У Hyalomma asiaticum задний конец зачатка влагалища еще во время
кровососания расщепляется на вентральную и дорсальную половины
(рис. 387). Первая из них в дальнейшем превращается в цервикальный
отдел и соединительную трубку. Дорсальный мешок представляет за-
чаток семе приемника. Он сильно разрастается в задневентральном
направлении, сохраняя суженный участок только в месте отхождения
от влагалища. Стенки дорсального мешка образуют многочисленные
складки. Одновременно с образованием семеприемника и соединительной
трубки в месте горизонтального изгиба влагалища с дорсальной стороны
образуются два вытянутых выроста — будущие трубчатые придаточные
железы.
Во время питания и в первую половину линьки преобладают процессы
клеточных делений и роста закладок выводных путей. Границы эктодер-
мальных клеток на этой стадии неразличимы, а ядра лежат на разных
уровнях, создавая впечатление многослойности (рис. 389). Строение
клеток во всех частях закладки совершенно идентично.
Во вторую половину линьки число митозов быстро уменьшается,
ядра располагаются базально в один слой и между ними появляются
клеточные границы. Обнаруживаются первые признаки гистологической
дифференцировки отделов влагалища и формирования кутикулярной
выстилки. Высота клеток при этом значительно увеличивается и они
становятся столбчатыми. Ядра перемещаются к центру, основания клеток
заполнены очень крупными прозрачными вакуолями, тогда как апикаль-
ные концы сильно базофильны. Вакуоли заполнены гликогеном, а базо-
филия цитоплазмы обусловлена высоким содержанием РНК (рис. 390).
Первой откладывается очень тонкий кутикулиновый слой эпикути-
кулы, а затем прокутикула. Высота клеток постепенно уменьшается и
ядра вновь занимают базальное положение. В вестибулярном отделе
поверхность цитоплазмы образует правильные ряды выростов. Отклады-
вающаяся на них эпикутикула сразу же образует систему вертикальных,
тесно прилегающих друг к другу складок. Под ними располагаются
горизонтальные слои прокутикулы (рис. 391). Сходным образом форми-
руются кутикулярные складки цервикального отдела и передней стенки
семеприемника; поверхность эпикутикулы соответствует первоначальным
выростам цитоплазмы, а нижние слои прокутикулы лежат горизонтально
(рис. 392). На большей части семеприемника и в соединительной трубке
отложению кутикулы предшествует образование глубоких гиподермаль-
ных складок, содержащих ядра. На их поверхности также появляются
многочисленные цитоплазматические выросты. В результате кутикуляр-
ная выстилка сразу же приобретает очень сложную конфигурацию и
- 224 -
Рис. 367—375. Прижизненные микрофотографии (фазовый контраст) трахейных стволов и тканей
внутренней среды нимф Hyalomma asiaticum на стадии линьки. Х500.
367 — трахейный ствол на 1-е сутки после питания; 368 — то же на 5-е сутки; 369 — то же
на 10-е сутки; 370 — группа склеивающихся трофоцитов; 371 — тяж жирового тела в конце
линьки; 372 — растворение трофоцита; 373 — фагоцит; 374 — трофоцит с гликопротеиновыми
включениями; 375 — эноцит.
я — ядра; гв — гликопротеиновые включения; ит — отслоившаяся интима трахей нимфальной фазы; тф — слой
трофоцитов, прилегающих к трахейному стволу.
Рис. 400—405. Микрофотографии ооцитов самки Argas persicus.
400 — II стадия; 401 — III стадия; 402 — IV стадия; 403 — V стадия; 404 — ядро
ооцита II стадии: 405 — ядро ооцита III стадии. Фазовый контраст: 400, 401 — Х250,
402, 403 — Х40 и 404, 405 — Х800.
а — ядро; б — нуклеола; в — вакуоль; г — желточные шары.
Рис. 383—388. Развитие женской половой системы Hyalomma asiaticum.
383 — личинка в начале линьки; 384 — личинка в середине линьки; 385 — ли-
чинка в конце линьки; 386 — голодная нимфа; 387 — линяющая нимфа; 388 —
голодная самка.
зв — зачаток влагалища и придаточных желез; зя — зачаток яйцеводов; во — вестибулярный
и цо — цервикальный отделы влагалища; тпж — трубчатая придаточная железа; ст — со-
единительная трубка; кл — клапан; сп — семеприемник; нпо — наружное половое отверстие;
яц — яйцевод; к — кутикула; няц — непарный яйцевод.
в состав ее складок входят прокутикула и подстилающие ее гиподермаль-
ные клетки с ядрами (рис. 393).
В зачатках трубчатых придаточных желез клетки очень тесно приле-
гают друг к другу, границы между ними не заметны и объем цитоплазмы
невелик. Деление ядер продолжается до конца линьки. Дифференцировка
на крупные ядра железистых клеток и более мелкие синцитиального
вещества еще отсутствует. Секреторная зернистость в цитоплазме не
выявляется. В суженных протоках стенки состоят из нормального куби-
ческого эпителия, секретирующего тонкую кутикулу.
В образовании соединительнотканной оболочки половой системы
важная роль принадлежит трофоцитам гемолимфы. Во время линьки
они сплошным слоем окружают влагалище. В конце линьки значительная
часть их растворяется и освобождающиеся гликопротеиновые гранулы^
вероятно, используются для построения основного вещества наружных
оболочек. Некоторые из трофоцитов в дальнейшем непосредственно
превращаются в десмоциты (рис. 412). Внутри оболочки происходит
дифференцировка пучков волокон кольцевой и продольной мускулатуры.
Последние особенно сильно развиты в соединительной трубке и шейке
семеприемника.
В закладке яичника с началом нимфального питания возобновляются
митотические деления оогониев и эпителиальных клеток. Со второй
половины стадии линьки наряду с продолжающимся размножением поло-
вых элементов часть оогониев начинает превращаться в ооциты. У нимф
их развитие ограничивается первыми стадиями малого роста (лептонема,
зигонема и пахинема). У заканчивающих линьку особей в яичнике уже
хорошо различим центральный щелевидный просвет, а на дорсальной
поверхности благодаря вворачиванию стенки внутрь формируется дор-
сальная складка.
У аргасовых клещей формирование органов размножения в основном
сходно с иксодовыми, но органогенез растянут на несколько нимфальных
стадий. Развитие половой системы у аргазид происходит только после
кровососания во время линьки и прерывается в период голодания. У Orni-
thodoros papillipes основные отделы половой системы различимы уже у нимф
II возраста, но для их окончательного развития требуется еще от 2 до
4 линек. У личинок и голодных нимф какие-либо зачатки органа Жене
отсутствуют. Он формируется при линьке в половозрелую особь после от-
деления гиподермы от старой кутикулы. У напитавшихся нимф Hyalomma
asiaticum клетки стенок камеростомальной складки очень интенсивно
делятся и впячиваются в полость тела в виде дорсо-вентрально уплощен-
ного кармана. Первоначально толщина его, особенно в боковых частях,
очень велика и достигает 100—140 мк. Границы клеток неразличимы,
ядра лежат в несколько рядов. К моменту отложения кутикулы орган
Жене достигает своих окончательных размеров и клеточные деления
прекращаются. Клетки становятся столбчатыми, ядра лежат в один
ряд. Базально цитоплазма содержит крупные прозрачные вакуоли,
а апикально сильно базофильна. На ее поверхности откладывается тон-
кая и слоистая эндокутикула. Отделение гиподермы от кутикулы начи-
нается от камеростомальной складки в сторону рогов и завершается перед
окончанием линьки.
У голодных самок гиподермальные клетки уплощенной формы с не-
большими овальными ядрами в 4—5 мк. В закладках будущих желез
строение клеток то же, что и в остальных частях органа Жене (рис. 138).
С началом кровососания клетки железистых выпячиваний начинают
делиться и увеличиваться в размерах, образуя трубчатые железы
(рис. 139). У закончивших питание Hyalomma asiaticum железы достигают
диаметра 60—100 мк (рис. 140), а у Ixodes ricinus — 100—120 мк. К на-
- 226 —
чалу яйцекладки железы утолщаются соответственно до 120—150 it
200 мк (рис. 141). Клетки становятся столбчатыми и достигают высоты
50—70 мк. Ядра увеличиваются в несколько раз и диаметр их достигает
Рис. 389—394. Гистогенез женской половой системы Hyalomma asiaticum.
389 — эпителиальные клетки зачатка влагалища в конце пимфального пи-
тания; 390 — то же в начале линьки перед отложением кутикулы; образова-
ние кутикулярной выстилки: 391 — вестибулярного отдела влагалища, 392 —
цервикального отдела влагалища и 393 — соединительной трубки; 394 — стенка
семеприемника голодной самки.
я — ядра клеток зачатка влагалища; ск — складки апикальной поверхности клеток; стк —
соединительнотканные клетки; кв — кутикулярная выстилка; вп — вакуоли с полисахари-
дом.
25—30 мк. Базальная часть клеток содержит волокнистые пиронинофиль-
ные структуры, а апикальная заполнена мелкими эозинофильными ва-
куолями, дающими интенсивное окрашивание на белки. Просвет желез
увеличивается до 20—30 мк и содержит эозинофильный секрет. Он отделен
— 227 -
15*
от клеток тонкой, сильно светопреломляющей оболочкой, слегка окраши-
вающейся железным гематоксилином. Местами она отделяется от клеточ-
ной поверхности (рис. 417). Железистые клетки в процессе секреции не
разрушаются, а лишь сморщиваются, теряют эозинофильные вакуоли,
а ядра начинают интенсивно прокрашиваться. Строение клеток протоков
желез и стенок органа Жене не меняется.
У аргасовых клещей орган Жене развивается только у нимф последнего
возраста при линьке в самок. У взрослых особей железистая ткань в зад-
ней части рогов проявляет признаки секреторной активности только перед
яйцекладкой. Высота клеток увеличивается до 50—60 мк и в их апикаль-
ных концах появляются многочисленные эозинофильные вакуоли. После
окончания яйцекладки высота клеток быстро уменьшается и секреторные
вакуоли исчезают до следующего гонотрофического цикла. Ядра желе-
зистых клеток постоянно крупнее, чем в гиподерме стенок мешка, а у го-
лодных или яйцекладущих особей размеры их существенно не отличаются.
Строение яичника, оогенез и оплодотворение. На поперечном разрезе
яичник голодной самки овальный или почти круглый. Снаружи он окру-
жен тонкой соединительнотканной оболочкой — tunica propria. Оболочка
построена преимущественно из основного вещества с тончайшими пере-
секающимися волокнами и представляет неклеточное образование. Внутри
яичника по всей его длине проходит щелевидный просвет, сообщающийся
с полостями парных яйцеводов и выстланный слоем эпителиальных клеток.
Границы между отдельными эпителиальными клетками неразличимы,
а ядра их мельче, чем таковые ооцитов (рис. 396). Пузыревидные ядра
молодых ооцитов, исключая область дорсальной складки, занимают
периферийное положение и окружены сравнительно узкими цитоплазма-
тическими ободками с хорошо различимыми клеточными границами.
На основании цитологического изучения особенностей оогенеза клещей
Argaspersicus, Hyalomma asiaticum и Ixodes ricinus мы считаем возможным
различать пять стадий роста ооцитов.
I стадия. Ооциты, образующиеся при размножении оогониев, минуя
период интеркинеза, сразу же переходят в профазу первого деления
созревания (рис. 396). Первая стадия, начинающаяся с прелептонемы
мейоза и заканчивающаяся растворением хромосом в ядре, точно соответ-
ствует периоду малого роста ооцитов I порядка. Размеры последних за
это время обычно увеличиваются очень незначительно. Диаметр их дости-
гает у Argas persicus 12—15 мк и у Ixodes ricinus 10—14 мк, а диаметр
ядер соответственно 8—10 и 7—11 мк. Цитоплазма слабо базофильна и
бедна РНК. Внутри ядра отсутствует рибонуклеиновое ядрышко. В на-
чале этой стадии в ядре Argaspersicus появляются Фельген-положительные
глыбки хроматина (стадия пролептонемы). Образовавшиеся прохромо-
сомы начинают деспирализироваться и образуют клубок нитей, заполняю-
щих ядро (стадия лептонемы). После конъюгации хромосом происходит
утолщение нитей (стадия пахинемы), но в дальнейшем в начале стадии
диплонемы хромосомы теряют способность к окраске и их не удается
больше выявить внутри ядра. По данным Ю. Л. Горощенко (1960), во
времени растворения хромосом в ядре между изученными видами кле-
щей наблюдаются определенные различия, но этот процесс никогда не
происходит позднее начала диакинеза. Ооциты I стадии всегда заклю-
чены внутри яичника.
II стадия. Период с начала большого роста и до появления первых
желточных гранул в цитоплазме ооцита мы называем II стадией (рис. 400
на стр. 217). К концу ее размеры ооцитов увеличиваются у Argas persicus
до 60—100 мк и Ixodes ricinus до 60—80 мк, а ядер до 20—25 и 25—30 мк.
Плазма почти прозрачная и не содержит включений. Она хорошо прокра-
шивается различными гистологическими красителями и содержит много
- 228 -
РНК. Ядрышко обычно сферической формы и относительно гомогенно. Раз-
меры его быстро увеличиваются и к концу этой стадии оно достигает диа-
метра в 6—12 мк. Биваленты быстро разрыхляются и исчезают, ядро вы-
Рис. 395—399. Оогенез и распределение риккетсий Wolbachia sp. в оого-
ниях и ооцитах Hyalomma asiaticum.
395 — зачаток яичника у недавно напитавшейся личинки; 396 — уча-
сток яичника голодной самки; 397 — ооцит питающейся самки на II ста-
дии развития; 398 — то же в начале III стадии и 399 — в конце III
стадии развития.
рик — риккетсии, яст — ядра соединительнотканной оболочки стенки яичника;
яэп — ядра эпителиальных клеток яичника; яоог — ядра оогониев; яооц — ядра
ооцитов; ястпб — ядра стебелька; нук — нуклеола; пяич — полость яичника; жз —
желточные зерна; хор — «хорион»; амт — анафаза митоза.
глядит оптически пустым и не окрашивается по Фельгену (рис. 404). В цито-
плазме подобных ооцитов постоянно присутствует Фельген-положительная
зернистость. На определенных стадиях из нее образуются характерные
- 229 -
сферические или грибовидные скопления (рис. 397). По данным электрон-
ной микроскопии (Roshdy, 1961b), Фельген-положительная зернистость
не связана с ядром и представляет группы из симбиотических риккет-
ский, а не частицы вышедшей из ядра ДНК, как предполагали некоторые
исследователи (Wagner-Jevseenko, 1958 и др.). К концу второй стадии
ооциты выпячиваются над поверхностью яичника.
III стадия. Третья стадия начинается с появлением первых желточных
включений в наружной зоне цитоплазмы (рис. 398) и заканчивается с за-
полнением крупными желточными шарами всего ооцита (рис. 399, 401).
Его размеры увеличиваются у Argas persicus до 150—200 мк и Ixodes
ricinus — 200—250 мк, а ядер до 25—30 и 40—45 мк. В цитоплазме вокруг
ядра образуются гранулы желтка диаметром в 2—5 мк, постепенно рас-
пространяющиеся к периферии. В цитоплазме по-прежнему сохраняется
высокая концентрация РНК. Ядра достигают своих максимальных раз-
меров и образуют боковые лопасти и выросты (рис. 405). В ядрышке,
достигающем диаметра 15—20 мк, хорошо видны одна или несколько
вакуолей. Иногда от него отпочковываются небольшие фрагменты, рас-
творяющиеся в кариолимфе. ДНК в ядре не выявляется, а в цитоплазме
сохраняется Фельген-положительная зернистость. Вокруг ооцита начи-
нает формироваться яйцевая оболочка, достигающая полного развития
на IV стадии. Это плотная и гомогенная двухконтурная структура, ли-
шенная какого-либо отверстия, сходного с микропиле. Она образуется
самим ооцитом и называть ее, по аналогии с насекомыми, хорионом можно
лишь с оговорками, помня об их различном происхождении.
IV стадия. Для четвертой стадии характерно завершение отложения
желтка в виде крупных шаров диаметром в 20—30 мк. Они полностью
маскируют ядро, которое к этому времени приобретает неправильно
угловатую форму и перемещается в периферийную зону ооцита. Крупное
ядрышко и ядерная оболочка на этой стадии растворяются. Сохраняю-
щиеся диакинетические биваленты образуют одно компактное тело,
называемое кариосферой (Горощенко, 1965), в котором неразличимы
отдельные хромосомы. Кариосфера окружена узкой цитоплазматической
зоной и сохраняется на протяжении всего дальнейшего роста ооцита
вплоть до оплодотворения. Цитоплазма в ооцитах IV стадии представлена
в виде тонкой сети между глыбами желтка и относительно бедна РНК
(рис. 402). На этой стадии заканчивается рост ооцитов, которые дости-
гают своих окончательных размеров в 600—800 мк у Argas persicus или
700 мк у Ixodes ricinus, выдаются в полость тела и связаны со стенкой
яичника стебельком из эпителиальных клеток.
V стадия. Зрелые яйца, потерявшие связь со стенками яичника и на-
ходящиеся в его просвете или в яйцеводах, мы относим к пятой стадии.
Овуляция, по-видимому, связана с усиливающимся по мере роста яйце-
клеток натяжением tunica propria, так что под его воздействием зрелый
ооцит раздвигает клетки стебелька и выпадает в полость яичника. Раз-
меры и внешний вид ооцитов после овуляции не меняются и их дальнейшее
развитие связано с завершением делений созревания и оплодотворением
(рис. 403).
Предложенная схема позволяет объективно оценивать состояние яич-
ника по внешним признакам, строго соответствующим цитологическим
изменениям в развивающейся яйцеклетке. I стадия совпадает с периодом
малого роста, II стадия — с цитоплазматической фазой большого роста
и III и IV — отвечают периоду отложения желтка (трофоплазматическая
фаза), часто называемому третьим периодом роста ооцита. После оконча-
ния профазы мейоза и образования кариосферы наблюдается остановка
в подготовке к I делению созревания, которое возможно только после
окончания роста ооцита и, по данным Ю. Л. Горощенко (1965), стимули-
- 230 -
руется процессом оплодотворения. Таким образом, весь период большого
роста и отложения желтка протекает в ооцитах первого порядка, а пре-
вращение их в ооциты второго порядка происходит уже во вполне сфор-
мированных яйцах.
Процесс оплодотворения у клещей до последнего времени оставался
неизвестным и был впервые описан Ю. Л. Горощенко (1965) у аргасовых
клещей. Оплодотворение происходит в ампуловидных расширениях яйце-
водов, где скапливаются зрелые спермин — спермиофоры, проникающие
сюда из семеприемников. После поступления яйца в ампуловидное рас-
ширение яйцевода его толстая наружная оболочка («хорион») растворяется
спермиофором, но внутрь ооцита входит только маленькое ядро спермия.
Остающиеся трубчатые части спермиофора не участвуют в оплодотворении
и растворяются железистым эпителием стенок яйцевода и матки. После
оплодотворения мужской пронуклеус занимает в ооците строго централь-
ное положение и стимулирует возобновление хода I деления созревания
ооцита. II деление созревания и слияние мужского и женского пронук-
леусов происходило уже в отложенных яйцах.
У иксодовых клещей специализированные ампуловидные расширения
яйцеводов отсутствуют, но спермиофоры также скапливаются лишь в
передних третях яйцеводов. Оплодотворение ооцитов Hyalomma asiaticum
происходит только после их овуляции и поступления в передние части
яйцеводов. Весь дальнейший ход делений созревания и слияния пронук-
леусов сходен с описанным для аргасовых клещей.
Яичники недавно перелинявших самок аргазид содержат оогонии
и ооциты I и II стадий. На этом их рост обычно приостанавливается и во-
зобновляется лишь после имагинального кровососанйя. У видов, обла-
дающих способностью к автогенному развитию яиц, последние без за-
держки заканчивают свой рост за счет нимфального питания. После окон-
чания яйцекладки незакончившие развития ооциты III—IV стадий де-
генерируют и яичник вновь содержит одни оогонии и молодые ооциты.
Следующая волна размножения оогониев и роста ооцитов обычно на-
ступает только после нового питания.
У иксодовых клещей на стадии послелиночного доразвития в яич-
нике еще встречаются митотические деления эпителиальных клеток и ма-
лый рост ооцитов I порядка. Однако мейотические изменения не заходят
дальше диакинеза и приостанавливаются до начала кровососанйя. Исчез-
новение митозов среди эпителиальных клеток стенок по времени совпа-
дает с окончанием послелиночного доразвития.
У голодных самок ооциты, лежащие по периферии яичника, крупнее
и находятся на более поздних стадиях мейоза (преимущественно диакинез
и в меньшей степени диплонема), тогда как внутри дорсальной складки
они отстают в развитии (не старше диплонемы) и среди них встречаются
даже оогонии. У видов рода Ixodes значительная часть ооцитов на стадии
послелиночного доразвития успевает закончить период малого роста.
Они останавливаются в развитии в начале цитоплазматической стадии
большого роста и слегка выступают над поверхностью яичника. У изу-
ченных представителей Amblyomminae ооциты обычно не приступают
к цитоплазматическому росту и поверхность яичника у голодных клещей
бывает лишь слегка волнистой или даже гладкой (рис. 396).
Стимулом к возобновлению процессов оогенеза служит начало крово-
сосания. Ооциты быстро заканчивают цитоплазматическую фазу большого
роста и в них начинается отложение желтка (трофоплазматическая фаза).
Благодаря очень значительному увеличению в размерах ооциты растя-
гивают тонкую tunica propria и выдаются над поверхностью яичника.
У иксодид ооциты дорсальной складки яичника развиваются медленнее,
чем на вентральной и боковых стенках, в результате чего они оказываются
- 231 —
как бы погруженными внутрь полости органа (рис. 127). У аргазид наибо-
лее быстро развиваются яйцеклетки, лежащие ближе к задней стенке
Рис. 406—411. Строение яйцеводов и семеприемника самки Hyalomma asiaticum.
406 — стенка яйцевода голодного клеща; 407 — проксимальная часть яйцевода
в конце питания; 408 — дистальный участок яйцевода, почти свободный от спер-
миев; 409 — то же, растянутый спермиями; 410 — стенка яйцевода во время
яйцекладки; 411 — стенка семеприемника напитавшейся особи.
эп — эпителиальные клетки яйцевода; ст — соединительнотканная оболочка; я — ядра;
сп — спермиофоры.
яичника. С разновременностью развития яйцеклеток связана большая
растянутость яйцекладки, особенно у иксодовых клещей.
Среди эпителиальных клеток стенок яичника в этот период наблюдаются
многочисленные митотические деления, прекращающиеся после отпадения
с хозяина. Выдающиеся в полость тела ооциты соединены со стенкой
- 232 -
Рис. 412—417. Женская половая система напитавшейся нимфы Hyalomma
asiaticum (412) и самки Ixodes ricinus перед началом Яйцекладки (413—411).
412 — закладка семеприемника и соединительной трубки; 413 — вестибуляр-
ный отдел влагалища; 414 — впадение соединительной трубки в цервикаль-
ный отдел; 415 — дистальный участок яйцевода; 416 — трубчатая прида-
точная железа; 417 — участок железы органа Жене. Микрофотографии:
412—414 — Х125, 415—417 — Х250.
а — недифференцированные гиподермальные клетки полового зачатка; б — вестибуляр-
ный отдел влагалища; в — цервикальный отдел влагалища; г — клетки лопастевидной
придаточной железы; д — соединительная трубка; е — спермин; ж — трофоциты.
Рис. 418—423. Половая система! самки Ornithodoros papillipes.
418 — вестибулярный отдел влагалища; 419. — цервикальный отдел влагалища;
420 — шейка матки и трубчатые придаточные железы; 421 — участок рога
матки; 422 — амупловидное расширение яйцевода; 423 — проксимальная часть
яйцевода. Микрофотографии: 418—421 — X 125, 422, 423 — Х250.
а — нервный ганглий; б — полость влагалища; в — кутикулярная выстилка влагалища;
г — дивертикулы кишечника; д — мускулатура влагалища; е — трубчатая придаточная же-
леза; ж — железистые клетки стенки матки; э — эпителиальные клетки стенок яйцеводов;
и — спермиофоры.
яичника стебельком или ножкой из эпителиальных клеток. Клетки ножки
увеличиваются в размерах и претерпевают определенные циклические из-
менения, возможно, связанные с секрецией или передачей веществ расту-
щей яйцеклетке. Ядра этих клеток также увеличиваются, а в цитоплазме
появляются мелкие базофильные включения (рис. 397). Эти клетки, воз-
можно, выполняют часть функций фолликулярных или трофических кле-
ток насекомых, тогда как соединительнотканная неклеточная оболочка,
окружающая яичник снаружи, может осуществлять лишь опорную и,
в меньшей степени, барьерную функции. Клетки, выстилающие просвет
яичника при подготовке к овуляции, вероятно, несут секреторную функ-
цию. В их цитоплазме появляется значительное количество слабо базо-
фильных зернистых включений, встречающихся и в просвете яич-
ника.
В яичниках закончивших яйцекладку и погибающих самок иксодовых
клещей всегда сохраняются отдельные ооциты I и II стадий, не присту-
павшие к росту, а также не закончившие его и сморщившиеся ооциты
III—V стадий. Они лежат в массе дегенерирующих эпителиальных клеток,
окруженных спавшейся tunica propria. У аргазид не закончившие раз-
вития ооциты III—IV стадий также дегенерируют и яичник, как и у мо-
лодых особей, вновь содержит одни ооциты I—II стадий и оогонии. Но-
вый период роста ооцитов, так же как и размножения эпителиальных
клеток, начинается только после следующего кровососания.
Выводные пути, придаточные железы и яйцекладка. У голодных са-
мок иксодид яйцеводы представляют тонкие трубки, слегка утолщающиеся
к дистальным концам. У Hyalomma asiaticum диаметр их 25—30 мк,
а в расширенных окончаниях до 40—50 мк. У Ixodes ricinus — соответ-
ственно 15—18 и 25—30 мк. На поперечном разрезе они почти круглые
и небольшой центральный просвет различим лишь в дистальной части.
Небольшие овальные ядра эпителиальных клеток, диаметром в 5—7 мк,
образуют сплошной базальный слой. Снаружи яйцеводы окружены соеди-
нительнотканной оболочкой. Ее ядра располагаются по самой периферии
и очень тесно прилегают друг к другу (рис. 123 и 406).
С первых дней кровососания наблюдаются многочисленные деления
ядер эпителиальных клеток, размеры которых очень сильно увеличи-
ваются. Различия в строении дистальных и проксимальных участков при
этом усиливаются. Так, у Hyalomma asiaticum диаметр первых достигает
к концу питания 200 мк при высоте клеток в 60—70 мк, в проксимальных
частях диаметр обычно не превышает 100—150 мк и высота клеток 30—
60 мк. К началу яйцекладки диаметр растянутых спермиофорами дисталь-
ных участков может иногда увеличиваться до 400 мк (рис. 415),
Апикальные концы клеток дистальных отделов яйцеводов выдаются
в просвет, а между ними внедряются многочисленные спермиофоры,
вышедшие из сперматодоз (рис. 408). Клетки стенок яйцеводов на этой
стадии приобретают железистый характер. Ядра их занимают центральное
положение и сильно гипертрофированы (диаметр 16—22 мк). В базаль-
ной части клеток появляются волокнистые структуры, интенсивно кра-
сящиеся на РНК, а цитоплазма апикальных частей заполнена
ШИК-положительной зернистостью.
Местами спермиофоры целиком заполняют полость яйцеводов, так
что толщина их растянутых стенок уменьшается до 20—40 мк, а клетки
заметно уплощаются (рис. 409). После внедрения ядер спермиев в про-
ходящие по яйцеводам ооциты сохраняющиеся трубчатые части спермио-
фор могут поглощаться эпителиальными клетками стенок. Подробное
описание этого интересного явления впервые было дано И. И. Соколовым
(1958). В иностранной литературе до последнего времени было распро-
странено неправильное представление о томг что фагоцитоз спермиофор
- 233 -
представлял особую форму оплодотворения и был связан с последующей
диффузией вещества мужской гаметы в проходящие по яйцеводу ооциты
(Geigy a. Wagner, 1957; Wagner-Jevseenko, 1958).
По направлению к яичнику высота эпителиальных клеток уменьшается,
причем одновременно они становятся более узкими. Стенки яйцевода
образуют продольные складки, так что клетки оказываются собранными
в подушки, вдающиеся в просвет (рис. 407). Цитоплазма их слегка во-
локнистая, но признаки секреторной активности выражены слабее, чем
в дистальных отделах.
В период яйцекладки сильно растягиваются и проксимальные отделы
яйцеводов, так что их диаметр достигает 300 мк и более. Толщина их сте-
нок при этом уменьшается до 10—12 мк (рис. 410). Внутри оболочки
в продольном и кольцевом направлениях дифференцируются многочислен-
ные гладкие мышечные волокна. Они обеспечивают непрерывные волны
перистальтических сокращений, хорошо различимых на отпрепарованных
переживающих органах. После окончания яйцекладки стенки яйцеводов
спадаются, сморщиваются, ядра становятся пикнотическими и клетки
быстро дегенерируют.
Деления или увеличения размеров ядер соединительнотканной обо-
лочки яйцеводов во время кровососания не происходит. В связи с этим
по мере утолщения яйцеводов расстояния между описываемыми ядрами
значительно увеличиваются.
У аргасовых клещей дистальный и проксимальный отделы яйцеводов
более резко обособлены друг от друга и отличаются гистологическим
строением. Начинающиеся от рогов матки дистальные концы яйцеводов
расширяются в ампуловидные образования. Клетки эпителиальных стенок
дистальных отделов в зависимости от степени заполнения яйцеводов спер-
миофорами столбчатые (высота 30—40 мк) или уплощенные (20—25 мк).
Ядра сильно гипертрофированные, неправильно многоугольные или ло-
пастевидные, диаметром около 20 мк. Апикальные концы клеток часто
заполнены крупными вакуолями с секретом, которые напоминают та-
ковые в матке, но значительно меньших размеров и никогда не заполняют
всей клетки (рис. 422). Между эпителиальными клетками внедряются
спермиофоры, причем часть из них несомненно подвергается фагоцитозу.
Ампуловидные расширения у самок Ornithodoros papillipes могут дости-
гать 400—600 мк в диаметре, тогда как суживающиеся к матке концы —
150-200 мк.
Проксимальные отделы телескопически вдвинуты в ампуловидные
расширения, так что создаются клапанообразные структуры. Диаметр
этих отделов обычно составляет 80—100 мк, клетки столбчатые высотой
30—40 мк. Признаков секреторной активности в них не наблюдается
и ядра не превышают в поперечнике 9—10 мк (рис. 423).
У иксодовых клещей строение матки сходно с дистальными концами
яйцеводов, от которых она отличается лишь большим диаметром и силь-
нее развитым мышечным слоем. Матка аргазид представляет исключи-
тельно сильно развитое железистое образование. Толщина ее стенок, по-
строенных из одного слоя сильно вытянутых клеток, составляет от 100
до 200 мк. Секрет в виде крупных вакуолей (15—20x30—60 мк) занимает
большую часть клеток. Ядра диаметром 6—8 мк лежат базально на гра-
нице с соединительнотканной оболочкой. Последняя образует многочис-
ленные и глубокие внутренние впячивания, обеспечивающие возможность
увеличения объема органа при нахождении в нем сперматодоз или яиц.
Обширная полость матки после копуляции содержит крупные спермато-
дозы и большое количество секрета. После выхода спермиофоров стенки
матки слегка спадаются, а внутри она содержит аморфную массу из секрета
и разрушающихся спермиофор (рис. 421).
- 234 -
Соединительная трубка Hyalomma asiaticum отличается очень глу-
бокими складками кутикулярной выстилки, причем внутри складок на-
ходятся многочисленные ядра гиподермальных клеток (рис. 128). У го-
лодных особей концы кутикулярных складок соприкасаются и просвет
трубки напоминает сильно извитый лабиринт. Снаружи соединительная
трубка окружена очень толстым слоем кольцевой мускулатуры, который
во время кровососания значительно увеличивается. Просвет трубки в это
время также расширяется благодаря расхождению складок. При яйце-
кладке стенки трубки сильно растягиваются проходящими яйцами и ку-
тикулярные складки полностью расправляются. У Ixodes ricinus и Orni-
thodoros papillipes соединительная трубка обладает сходным гистологи-
ческим строением и лишь несколько короче (рис. 414).
Полость вестибулярного отдела влагалища на поперечных срезах
имеет вид щелевидного пространства, сплющенного в вертикальной части
органа в передне-заднем и в горизонтальной — в дорсо-вентральном
направлениях (рис. 117 и 418).
Кутикулярная выстилка очень сходна с таковой вентральной поверх-
ности тела и, по существу, представляет ее внутреннее впячивание. Под ней
лежит гиподермальный слой из столбчатых или кубических клеток вы-
сотой 8—10 мк с небольшими овальными ядрами в 5—6 мк. Снаружи ги-
подермальный слой окружает соединительнотканная оболочка, а ближе
к цервикальной части кольцевая мускулатура (рис. 117).
С началом питания иксодовых клещей гиподерма вестибулярного от-
дела отделяется от кутикулы и, разрастаясь, образует многочисленные
складки лопастевидной придаточной железы. Рост последней осущест-
вляется за счет многочисленных митотических делений, обычно прекра-
щающихся к моменту отпадения с хозяина. У напитавшегося клеща кути-
кулярная трубка вестибулярного отдела связана с гиподермой лишь на
границе с половой щелью и цервикальным отделом, а в основной своей
части окружена обширной полостью вновь образовавшейся железы
(рис. 413).
Клетки этой железы достигают высоты 40—60 мк и в их апикальной
части появляются многочисленные мелкие эозинофильные вакуоли с сек-
ретом. Последний выводится в полость железы и максимальное его коли-
чество скапливается к началу яйцекладки. По строению клеток, свой-
ствам и времени накопления секрета лопастевидная железа напоминает
железы органа Жене (рис. 122).
Цервикальный отдел влагалища Hyalomma asiaticum невелик и выст-
лан толстой кутикулой, образующей складки неправильных очертаний
(рис. 118). Снаружи он окружен сильно развитой кольцевой мускулату-
рой. Кроме того, от его наружной поверхности отходят мышечные пучки,
идущие в передневентральном направлении и прикрепляющиеся к стенке
тела спереди от половой щели. Они сокращаются во время яйцекладки
синхронно с дорво-вентральной мускулатурой и обеспечивают выпячи-
вание наружу вестибулярного отдела. В цервикальном отделе АтЫуот-
minae и Argasidae заметных изменений во время яйцекладки не обна-
ружено. У Ixodinae обширный цервикальный отдел по своему гистологи-
ческому строению и функциям идентичен семеприемнику Amblyomminae
(рис. 129).
Шейка и прилегающая к ней передняя стенка семеприемника Hyalomma
asiaticum, как и цервикальный отдел, выстланы толстой кутикулой и ку-
бической гиподермой, а снаружи окружены хорошо развитой кольцевой
мускулатурой. Стенки большей части семеприемника собраны в глубокие
складки. Кутикулярная выстилка тонкая (около 3 мк). Высота клеток
составляет 5—7 мк и диаметр ядер — 3—4 мк (рис. 394). После оплодотво-
рения стенки семеприемника растягиваются сперматодозами и кутику-
- 235 -
лярные складки расправляются. Высота клеток увеличивается местами
до 30—40 мк, а размеры ядер до 10—12 мк. Базальная часть цитоплазмы
становится волокнистой, а в апикальной появляются мелкие вакуоли
с эозинофильным секретом. После выхода спермиофор из сперматодоз
кутикулярная выстилка во многих участках отслаивается от гиподермы
(рис. 411). Полость семеприемника наряду с остатками сперматодоз
содержит большое количество эозинофильного вещества.
Трубчатые придаточные железы у голодных самок Hyalomma asiaticum
и Ixodes ricinus имеют диаметр в 30—40 мк. Высота клеток — 13—15 мк,
а клеточные границы неразличимы. Мелкие сферические или овальные
ядра в 5—6 мк очень тесно прилегают друг к другу и на срезах кажутся
лежащими в несколько рядов. Секреторные гранулы в цитоплазме от-
сутствуют, а просвет железы очень мал (рис. 119).
За период кровососанйя диаметр желез увеличивается до 200 мк.
Железистые клетки приобретают пирамидальную форму, достигают вы-
соты 70—80 мк и их свободные концы вдаются в увеличивающийся в раз-
мерах просвет (рис. 120). Ядра подобных клеток достигают диаметра
в 20—25 мк. Цитоплазма базальной зоны волокнистая, с высоким содер-
жанием РНК. Между железистыми клетками ближе к просвету обнару-
живаются одиночные мелкие ядра в 5—6 мк, сходные с таковыми голодных
особей. В апикальных концах появляются многочисленные секретор-
ные вакуоли белковой природы. К началу яйцекладки вакуоли запол-
няют всю цитоплазму и местами прикрывают ядра (рис. 416). Во время
яйцекладки апикальные концы клеток разрушаются и секрет изливается
в полость железы. Остающаяся цитоплазма спадается, а ядра подвергаются
пикнотическим изменениям.
У Ornithodoros papillipes диаметр трубчатых придаточных желез
в процессе секреции меняется меньше и обычно составляет 80—120 мк.
У недавно перелинявших особей секреторные вакуоли в цитоплазме от-
сутствуют, а клеточные границы неразличимы. Ядра двух типов: мелкие —
диаметром 5—7 мк и крупные — 10—14 мк. Перед яйцекладкой четко
выявляются границы железистых клеток, а в их цитоплазме накапливаются
мелкие и средние вакуоли с секретом. Содержимое вакуолей изливается
в просвет железы, но разрушения клеток при этом не происходит. Опи-
санные вакуоли сохраняются у голодных особей, а при повторных гоно-
трофических циклах число их нарастает и содержимое выводится в по-
лость железы (рис. 420).
Процесс яйцекладки у иксодовых и аргасовых клещей протекает
сходным образом. Он был прослежен нами на самках Hyalomma asia-
ticum. Перистальтическими сокращениями стенок яичника и яйцеводов
яйца продвигаются в сторону влагалища. В то время как в яйцеводах
одновременно находится множество яиц, придающих яйцеводам четко-
видную внешность, в вестибулярном отделе влагалища может находиться
только одно яйцо. При сокращении дорсо-вентральной мускулатуры
и пучков мышц, идущих от влагалища к вентральной стенке тела, вести-
булярный отдел выпячивается вместе с яйцом через наружное половое
отверстие. Одновременно орган Жене выворачивается над дорсальной
поверхностью гнатосомы. Последняя подгибается на брюшную сторону,
а пальпы при этом слегка раздвигаются. Рога органа Жене соприкасаются
и охватывают яйцо, лежащее на конце вестибулярного отдела. Яйцо
приклеивается к поверхности рогов и обволакивается восково-липоидным
водонепроницаемым секретом. При изгибании гнатосомы дорсально
благодаря выступающему краю спинного щитка яйцо переносится на
спинную поверхность клеща. После этого весь цикл повторяется сна-
чала, так что на дорсальной стороне скапливается комок яиц.
- 236 -
ЦИТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ РАЗМНОЖЕНИЯ
У САМЦОВ
Развитие мужской половой системы. У голодных личинок Hyalomma
asiaticum зачатки семенников представлены двумя компактными группами
клеток, расположенными между центральной нервной массой и передней
стенкой ректального мешка. Они содержат по нескольку первичных спер-
матогониев с крупными сферическими ядрами диаметром 5—6 мк и эпи-
телиальных клеток с овальными ядрами в 4—5 мк. Снаружи зачатки окру-
жены соединительнотканной оболочкой. Зачатки семепроводов и эктодер-
мальные производные полового аппарата на этой стадии отсутствуют.
С началом кровососания и во время линьки ядра эпителиальных клеток
и первичных сперматогониев начинают делиться. Зачатки семенников
удлиняются, причем их передние концы более узкие и состоят в основном из
недифференцированных эпителиальных клеток. Они вытягиваются вперед
и слепо заканчиваются у боковых стенок образовавшегося к этому вре-
мени гиподермального зачатка. Семепроводы на этой стадии представляют
сплошные клеточные тяжи, просвет в них еще не развит. В семенниках
внутренняя зона занята вторичными сперматогониями, а снаружи и между
ними лежат более мелкие овальные ядра эпителиальных клеток.
Во время питания сразу же позади центральной нервной массы на
вентральной стороне происходит утолщение гиподермального слоя.
Во время линьки этот участок образует небольшое впячивание. Размеры
его увеличиваются за счет многочисленных клеточных делений. Образо-
вавшийся зачаток эктодермальных производных половой системы рас-
ширяется в заднедорсальном направлении и сужается в месте соединения
с гиподермой стенки тела (рис. 424).
У голодных нимф рост и развитие половой системы приостанавливаются
и возобновляются только с началом кровососания (рис. 425, 426). Раз-
меры семенников быстро увеличиваются, они приобретают трубчатое
строение и к концу линьки достигают размеров, свойственных голодным
самцам. Внутри семенников в это время наблюдаются характерные изме-
нения. Начиная с задних концов вторичные сперматогонии окружаются
эпителиальными клетками. В результате клеточных делений образуются
сперматоцисты, заполненные первичными сперматоцитами и окруженные
клеточной оболочкой. У закончивших линьку самцов задняя половина
семенника содержит сперматоциты I порядка, готовые к большому росту,
а передняя — вторичные сперматогонии.
Длина и диаметр семепроводов значительно увеличиваются, а внутри
появляется просвет. Передние слепые концы парных семепроводов лежат
бок о бок и дорсально к выросту стенки половой полости. В середине
линьки они сливаются в короткий непарный семепровод. Клетки на кон-
цах семепровода и выроста стенки половой полости расходятся и между
ними устанавливается сообщение.
В эктодермальном половом зачатке голодной нимфы дифференцировка
железистых клеток еще не началась (рис. 425) и наблюдается лишь со
второй половины линьки. Во время питания передний конец зачатка вы-
тягивается и превращается в толстостенную дорсо-вентрально уплощен-
ную трубку с узким щелевидным просветом (рис. 426). На заднем конце
просвет слегка расширяется в небольшую половую полость. До середины
линьки в зачатке семеизвергательного канала многочисленны митотичес-
кие деления. Затем они прекращаются, ядра располагаются в один ряд
и занимают середину клеток. Базальные половины клеток содержат круп-
ные вакуоли, а апикальные сильно базофильны. На их поверхности фор-
мируется кутикулярная выстилка и к концу линьки высота клеток за-
метно уменьшается. Задняя половина гиподермального впячивания слу-
- 237 -
жит зачатком комплекса придаточных желез, который сильно разрастается
на спинную сторону и вперед, образуя главную медиальную лопасть
(рис. 427). Несколько позднее от нее в виде выростов формируются осталь-
ные лопасти придаточной железы. Клеточные границы в них на этой ста-
дии еще не различимы, ядра лежат в несколько рядов и среди них очень
много делящихся. В конце линьки деления прекращаются, а в вентро-
латеральных лопастях появляется слой из базальных более крупных ядер.
Рис. 424—428. Развитие мужской половой системы Hyalomma
asiaticum. Сагиттальный разрез.
424 — напитавшаяся личинка; 425 — голодная нимфа; 426 —
напитавшаяся нимфа; 427 — линяющая нимфа; 428 — голодный
самец.
зсп — зачаток семеизвергательного канала и придаточных желез; ск —
семеизвергательный канал; пп — половая полость; пж — придаточная
железа; сп — семепровод; см — семенник; нпо — наружное половое от-
верстие.
На этом развитие придаточных желез приостанавливается до начала
питания. У Ixodes ricinus развитие мужской половой системы протекает
сходным образом, но процессы сперматогенеза и дифференцировки же-
лезистой ткани придаточных желез заканчиваются на нимфальной фазе.
У аргасовых клещей зачаток семенника у личинок имеет вид дугооб-
разно изогнутого валика, в котором еще невозможно обнаружить при-
знаков половой дифференцировки (рис. 429). Он образован двумя типами
клеток: более крупными первичными половыми клетками с пузыревидным
ядром и более мелкими клетками будущих семенных фолликулов. Сна-
ружи зачаток гонады покрыт одним слоем плоских эпителиальных клеток
и неклеточной соединительнотканной оболочкой (рис. 432). У напитав-
шихся личинок размеры зачатка семенника быстро увеличиваются. Он вы-
тягивается своими передними концами к формирующемуся в это же время
мешковидному эктодермальному зачатку семеизвергательного канала
- 238 -
и придаточных желез. У нимф I возраста зачатки семепроводов соеди-
няются с эктодермальной закладкой и дальнейшая дифференцировка по-
ловой системы растягивается на несколько нимфальных возрастов
(рис. 430). Процессы роста и развития ограничены периодами линек и
у голодных особей отсутствуют. Дифференцировка придаточных желез
заканчивается во время последней линьки.
Рис. 429—431. Развитие мужской половой системы Argas persicus.
429 — личинка после питания, в проксимальных сросшихся отделах семенников спер-
матоциты в фазе малого роста; 430 — нимфа I возраста, в проксимальных отделах
семенников сперматоциты в фазе большого роста; 431 — самец 4—5-дневного возраста,
в проксимальных отделах закончен сперматогенез, готовые проспермии выходят из
семенников и скапливаются в семенных пузырьках.
прж — придаточные половые железы; сп — семенной пузырек; пре — проксимальный отдел семен-
ника; дс — дистальный отдел семенника; прос — проспермии.
Сперматогенез. Цитологические особенности сперматогенеза достаточно
подробно описаны в литературе (Nordenskiold, 1920; Samson, 1909b; War-
ren, 1933; Tuzet a. Millot, 1937; Соколов, 1958; Wagner-Jevseenko, 1958;
Горощенко, 1960, 1965; Rothschild, 1961; Reger, 1963). В связи с этим мы
лишь кратко остановимся на некоторых особенностях этого процесса,
необходимых для характеристики физиологического состояния самцов.
Уже после питания личинок Hyalomma asiaticum первичные спермато-
гонии в зачатке семенника начинают делиться и превращаются во вторич-
ные. У нимф наряду с образованием вторичных сперматогониев многие
из них продолжают развитие и проходят 5—6 последовательных делений.
В результате внутри сперматоцист содержится по 32—64 сперматоцита
- 239 -
J порядка (рис. 435). Последующие стадии сперматогенеза наблюдаются
только с началом имагинального питания.
Сперматогонии имеют небольшие сферические ядра диаметром 4—5 мк,
окруженные узким кольцом цитоплазмы. Диаметр сперматоцитов I по-
рядка до начала фазы большого роста составляет 5—8 мк, а после ее
окончания — 26—30 мк. Размеры ядер увеличиваются до 11—12 мк,
а внутри них появляются нуклеолы в 3—4 мк (рис. 436). Большой рост
сперматоцитов связан не только с очень значительным увеличением объема
цитоплазмы и ядер, но и значительными изменениями во внутренней
структуре последних. Ядро сперматоцита на этой стадии обладает боль-
шим сходством с зародышевым пузырьком ооцита. Почти сформировав-
шиеся к началу этой фазы биваленты разрыхляются и способность ядра
давать положительную реакцию Фельгена временно исчезает. ДНК хро-
мосом вновь начинает выявляться в самом конце большого роста, когда
заканчивается образование бивалентов и исчезает ядрышко. В результате
первого деления созревания, которое Ю. Л. Горощенко (1960) считает
редукционным, образуются сперматоциты II порядка диаметром 18—
22 мк. Они проходят второе деление созревания (эквационное) и превра-
щаются в сперматиды диаметром 15—17 мк (рис. 437).
Гистогенез спермиев начинается с вытягивания сперматид, достигаю-
щих длины 100—110 мк. В результате этого процесса образуется трубка
с терминально расположенным ядром и основной массой цитоплазмы.
Из дна трубки в свою очередь формируется внутренний трубчатый вырост.
Затем происходит вворачивание трубки проспермия и длина его умень-
шается до 50—60 мк. Дальнейшее развитие проспермиев заканчивается уже
в выводных путях женской половой системы, где происходит их деваги-
нация и превращение в трубчатые спермиофоры длиной в 100—120 мк
(рис. 151). Передний конец проспермиев расширен, а задний более узкий
и несет небольшое ядро в виде компактного Фельген-положительного
тельца (рис. 437). Собственно спермием у клещей служит ядро (Tuzet е. Mil-
lot, 1937; Соколов, 1958), так как только оно участвует в оплодотворении.
Огромная трубчатая часть спермия осуществляет лишь перенос и защиту
.ядра и поэтому ее называют спермиофорой.
У аргасовых клещей процессы сперматогенеза в основных чертах сходны
с иксодовыми (рис. 429—431 и 433). Сперматогонии у изученных видов
(Ornithodoros papillipes, О. moubata, Argas persicus, A. reflexus) проходят
четыре последовательных деления, так что сперматоцисты содержат
по 16 сперматоцитов I порядка. Во время большого роста величина по-
следних увеличивается значительно больше, чем у Hyalomma asiaticum.
Размеры ядер достигают 30—38 мк. Объе^м их увеличивается в 60 раз,
а самой клетки — в 400 раз. Таким образом, аргасовые клещи обладают
наиболее крупными «спермиями» среди членистоногих. Так, у Ornithodoros
papillipes длина спермиофоров в половых путях самок составляет 850—
980 мк (Соколов, 1958).
У аргасовых клещей (Балашов и Горощенко, 1960) созревание части
сперматоцист заканчивается уже во время последней нимфальной линьки.
Однако в большинстве случаев аргазиды становятся способными к спари-
ванию лишь через несколько дней после окончания линьки (табл. 44).
Вероятно, требуется некоторое время и для окончания превращения спер-
матид в проспермии и накопления последних в семенных пузырьках.
У самцов О. papillipes (Feldman-Muhsam a. Havivi, 1967) стерильность
недавно перелинявших голодных особей связана с отсутствием проспер-
миев внутри сперматофоров. Подобные клещи спариваются с самками,
но не способны к оплодотворению. Нормальные сперматофоры образуются
у них спустя несколько дней или недель после линьки, и питание значи-
тельно ускоряет их созревание.
- 240 -
' dos'
Рис. 432—434. Семенники Argas persicus на разных стадиях жизненного цикла.
432 — участок зачатка семенника личинки; 433 — части трех фолликулов из дистального отдела семенника самца;
434 — участок семенника самца, голодавшего больше двух лет.
спр — сперматогонии; фк — фолликулярные клетки; сто — соединительнотканная оболочка; дем — дорсовентральный мышечный пучок; сп! —
сперматоциты I порядка в конце роста; cnll — сперматоциты II порядка; спд — молодые сперматиды; сф — семенной фолликул; дф — деге-
нерировавший фолликул.
Таблица 44
Способность самцов аргасовых клещей к спариванию и оплодотворению
в первые дни после линьки
Время после линьк в сутках Количество клещей
Argas persicus (от нимф II) Alveonasus lahorensis Ornithodoros papilli- pes (от нимф IV) Ornithodoros tarta- kovskyi (от нимф III)
нормальное спаривание и оплодотво- рение отсутствие спаривания нормальное спаривание и оплодотво- рение отсутствие спаривания нормальное спаривание и оплодотво- рение отсутствие спаривания нормальное спаривание и оплодотво- рение отсутствие спаривания
1 0 10 1 9 1 9 0 10
2 0 10 2 8 0 10 0 10
3 0 10 1 9 1 9 0 10
4 0 10 5 5 2 8 0 10
5 2 8 9 1 3 7 1 9
6 7 3 10 0 10 0 4 6
7 9 1 9 1 10 0 8 2
В зависимости от количества нимфальных возрастов в жизненном
цикле первые сперматоцисты образуются в задних концах семенников
уже у напитавшихся личинок или нимф I —II возрастов (рис. 429, 430).
Наряду с ростом уже образовавшихся сперматоцитов на нимфальной
фазе после каждого питания наблюдается новая волна размножения спер-
матогониев, дающих новые порции сперматоцитов. У нимф, готовящихся
к линьке в самцов, задние концы семенников содержат молодые сперма-
тиды, которые в первые несколько дней после линьки превращаются в зре-
лые проспермии и выводятся из семенников в семенные пузырьки (рис. 431).
В некоторых случаях сперматогенез заканчивался на нимфальной фазе
и в семенных пузырьках у только что перелинявших самцов Alveonasus
lahorensis и Ornithodoros papillipes в большом количестве обнаруживались
готовые проспермии.
Сперматогенез продолжается у самцов в течение нескольких месяцев
после линьки, пока не пссякнет запас необходимых для его поддержания
веществ и энергии, полученных от нимфальной фазы. Этого запаса, по-
видимому, достаточно для того, чтобы большая часть имеющихся в се-
менниках сперматоцитов закончила свое развитие и превратилась в про-
спермии.
Голодание вначале вызывает прекращение размножения сперматогоний
и остановку образования новых сперматоцитов. Приостановка роста спер-
матоцитов приводит к прекращению делений созревания. Более длительное
голодание приводит к дегенерации крупных сперматоцитов, цитоплазма
и ядра которых превращаются в бесструктурную массу. Наиболее стойки
к длительному голоданию готовые проспермии, находящиеся в семенных
пузырьках, сперматогонии и сперматоциты в, начале роста (рис. 434).
Эти элементы сохраняют жизнеспособность несколько лет. После принятия
крови в семенниках начинается новая волна сперматогенеза.
У легко переносящих длительное голодание самцов - AIveonasus la-
horensis и Ornithodoros papillipes подавляющая часть особей сохраняла
в наших опытах способность к спариванию и нормальному оплодотворению
самок даже после четырехлетнего голодания. У самцов Argas persicus
способность к оплодотворению самок утрачивалась черёз 2 года после
последнего питания и у Ornithodoros tartakovskyi уже в конце первого
года голодания (табл. 45), т. е. несколько раньше гибели клещей от исто-
- 242 -
Таблица 45
Способность голодающих самцов аргасовых клещей
к спариванию и оплодотворению
Количество клещей
.•"Г
со
о "
Е- -
S К
Й S
§ Е
1
2
3
4
Argas persicus Alveonasus lahorensis Ornithodoros papillipes Ornithodoros tartakovskyi
нормальное спаривание и оплодот- ворение отсутствие спаривания нормальное спаривание и оплодотво- рение отсутствие спаривания нормальное спаривание и оплодотво- рение отсутствие спаривания нормальное спаривание и оплодотво- рение отсутствие спаривания
9 1 10 0 10 0 6 4
4 6 10 0 9 1 — —
— — 8 2 7 3 — —
— — 7 3 8 2 — —
Примечание. Знак минус (—) означает отсутствие жизнеспособных клещей в указанные
сроки голодания.
щения. Питание приводило к быстрому (через 2—5 суток) восстановлению
нормальной способности к оплодотворению у истощенных особей.
Степень зрелости цоловых элементов у самцов иксодовых клещей за-
висит от их физиологического состояния (Балашов, 19566). У Ixodes ri-
cinus и I. persulcatus сперматогенез заканчивается еще на стадии линьки.
В половых путях недавно перелинявших самцов содержатся зрелые про-
спермии, а в сперматоцистах видны все этапы большого роста и спермио-
гистогенеза. Самцы способны к оплодотворению, и копуляция может
происходить как на теле хозяина, так и в норах, гнездах и других есте-
ственных биотопах с голодными самками. Интересно, что среди Ixodinae
широко распространена афагия самцов, так что кровососание уже не
играет роли в завершении сперматогенеза (см. стр. 103).
У Amblyomminae голодные самцы не способны к оплодотворению.
В их семенниках сперматоциты I порядка останавливаются в развитии
перед началом фазы большого роста. Во время кровососания от задних
концов семенников распространяется волна большого роста и спермио-
гистогенеза. Зрелые проспермии появляются в семепроводах не ранее,
чем через 3—5 суток с начала питания, после чего самцы приступают
к копуляции. Количество сперматогоний и молодых сперматоцитов по-
степенно уменьшается, а проспермии растягивают стенки семепроводов,
превращающихся в семенные пузырьки.
Строение п функции придаточных желез. Мужские придаточные железы
иксодоидных клещей представляют гетерогенные органы, в состав ко-
торых входит несколько типов секреторных клеток. Л. Робинсон и Д. Де-
видсон (Robinson a. Davidson, 1913—1914) на основании гистологических
особенностей описали в придаточных железах Argas persicus два типа
железистой ткани — губчатый и гранулярный. Новейшие цитологические
и гистохимические исследования (Wagner-Jevseenko, 1958; Till, 1961;
Tatchell, 1962b; Балашов, 19646; Chinery, 1965), однако, не подтвердили
правомочности классификации лопастей по этому признаку. В зависи-
мости от фазы секреторной активности определенные лопасти или части
одной и той же лопасти могут приобретать гранулярную или губчатую
структуру. Кроме того, в составе желез выявлено исключительное много-
образие типов секреторных клеток, сгруппированных в компактные
массы и ограниченных одной лопастью или перемешанных между собой.
- 243 -
16*
Наиболее детально изучены тонкое строение и химический состав
продуктов секреции придаточных желез самцов Argas persicus (Tatchell,
1962b). Как и у других видов аргазид, развитие входящих в их состав
секреторных клеток завершается во время последней линьки и у недавно
перелинявших особей в их цитоплазме содержится большое количество
секреторных вакуолей. Различия между длительно голодавшими или не-
давно напитавшимися и спаривавшимися самцами определяются глав-
ным образом соотношением числа освободившихся от секрета и заполнен-
ных последним клеток.
Передние и задние губчатые лопасти самцов Argas persicus построены
из крупных клеток с небольшими ядрами. Цитоплазма имеет вид тонкой
сети, занимающей узкие пространства между крупными вакуолями, со-
держимое которых дает положительные реакции на кислые мукополи-
сахариды (рис. 147).
Непарная вентральная и I пара латеральных лопастей образованы
узкими столбчатыми клетками. Ядра последних расположены в базальной
зоне, а большую часть клеток заполняют эозинофильные вакуоли диамет-
ром 3—5 мк (рис. 148). В I паре латеральных лопастей вакуоли содержат
основные белки, а в непарной вентральной лопасти их содержимое наряду
с интенсивным окрашиванием бром-феноловым синим дает положительную
реакцию на фенолы и сульфгидрильные группы.
II пара латеральных лопастей содержит два типа железистых клеток.
В более крупных клетках с большими сферическими ядрами в процессе
секреции происходит отшнуровывание апикальных участков цитоплазмы
в виде капель диаметром 4—8 мк (рис. 149). Последние интенсивно окра-
шиваются гистохимическими реактивами на белки. Цитоплазма более
узких и высоких клеток заполнена мукопротеиновыми вакуолями диамет-
ром до 2 мк.
III пара латеральных лопастей образована очень высокими столбча-
тыми клетками, заполненными белковыми вакуолями диаметром до 5 мк.
Содержимое этих вакуолей дает также положительные реакции на при-
сутствие фенолов, дисульфидных групп и полисахаридов. Железистые
клетки заднедорсальных лопастей по строению сходны с вышеописанными,
но значительно отличаются от них продуктами секреции. В дистальных
концах этих лопастей образуется неспецифическая эстераза, в средней
части — белки с высоким содержанием триптофана и фенолов и в прок-
симальных частях — ШИК-положительные вещества.
В главной медиальной лопасти выявлено несколько типов секреторных
клеток, которые без определенной закономерности встречаются на всем
протяжении лопасти. Клетки с различными секреторными продуктами
могут быть перемешаны между собой или собраны в небольшие однород-
ные группы. Морфологически все они довольно однородны. Ядра их ле-
жат в базальной зоне, а цитоплазма заполнена секреторными вакуолями.
Часть последних чернится железным гематоксилином, но основная масса
интенсивно окрашивается эозином. Гистохимическими реакциями выяв-
лены следующие типы секреторных вакуолей: мукопротеиновые, муко-
полисахаридные, белковые с высоким содержанием дисульфидных или
фенольных групп.
У иксодовых клещей, исключая непитающихся самцов многих видов
подсем. Ixodinae, клетки мужских придаточных желез голодных особей
не проявляют признаков секреторной активности. Лишь в некоторых клет-
ках главной медиальной лопасти Hyalomma asiaticum на этой стадии были
обнаружены эозинофильные вакуоли секрета. Все лопасти придаточных
желез голодных самцов этого вида, исключая пару вентро-латеральных,
имеют сходное строение. Границы образующих их клеток плохо различимы,
объем цитоплазмы невелик и стенки лопастей образованы из массы оваль-
— 244 -
ных ядер размером 5—6x3—4 мк, которые тесно прилегают друг к другу
и расположены в несколько слоев (рис. 438). Лишь внутренние полости
лопастей ограничены узкой цитоплазматической зоной, свободной от
ядер. Толщина стенок лопастей на превышает 40—50 мк. В дистальных
половинах вентро-латеральных лопастей'уже у голодных особей различимы
два типа клеток. Одни более крупные, с ядрами размеров 13—15x7—8 мк,
лежат в базальных частях клеток. Между ними вклиниваются более
узкие клетки с мелкими ядрами, размером 6—7x4—5 мк, лежащими
в центре или в апикальной зоне цитоплазмы (рис. 438).
За первые 3—4 суток питания секреторные клетки придаточных желез
самцов Н. asiaticum достигают состояния зрелости. Размеры их увеличи-
ваются в несколько раз главным образом за счет роста объема цитоплазмы,
так что толщина стенок лопастей достигает 120—150 мк. Цитоплазма бы-
вает заполнена массой секреторных вакуолей диаметром от 1 до 4—5 мк,
содержимое которых выводится в полости лопастей. Многообразие типов
секреторных клеток придаточных желез удается выявить только с помощью
гистохимических методик, так как на обычных гистологических препаратах
клетки с разными продуктами секреции могут выглядеть одинако-
выми.
Наиболее гетерогенна по своему клеточному составу главная медиаль-
ная лопасть. Высота ее клеток варьирует от 50 до 150 мк; они преимуще-
ственно вытянутой формы, с ядрами в базальной и секреторными вакуо-
лями в апикальной половинах (рис. 439). Ядра в соседних клетках могут
лежать на разных уровнях и часто могут содержать различные типы секре-
торных вакуолей. В то же время в одной клетке встречаются вакуоли
лишь одинакового химического состава. Гистохимическими методами
выявлены следующие типы вакуолей: мукопротеиновые или гликопротеи-
новые, мукополисахаридные, белковые с высоким содержанием дисуль-
фидных групп и липопротеиновые.
Передневентральные лопасти образованы высокими столбчатыми клет-
ками с ядрами на границе с базальной мембраной. Цитоплазма их запол-
нена мукопротеиновыми вакуолями, так что клеточные границы плохо
различимы (рис. 440). Участки лопастей описываемого типа, освободив-
шиеся от секрета, приобретают губчатое строение.
Секреторные клетки непарной вентральной лопасти столбчатые, и их
цитоплазма заполнена белковыми вакуолями с высоким содержанием
тирозина.
В вентро-латеральных лопастях, сходных по строению со II парой
латеральных лопастей Argas persicus, были выявлены два типа клеток.
Более крупные клетки со сферическими ядрами в базальной зоне были
заполнены очень мелкими вакуолями. Последние концентрировались
в апикальных концах клеток, дававших интенсивную положительную
реакцию на белки. В процессе секреции наблюдалось отшнуровывание
апикальных концов этих клеток в полости лопастей (рис. 441). В более
мелких и вытянутых клетках небольшие ядра располагались в центральной
зоне, а в цитоплазме были выявлены мукопротеиновые вакуоли. У Haema-
physalis spinigera (Chinery, 1965а) в описываемом типе лопастей были
обнаружены только клетки с белковым секретом.
Дорсо-латеральные и заднелатеральные пары лопастей отличались
одинаковым строением. Стенки их были образованы преимущественно
из высоких клеток с белковыми вакуолями. Местами в них встречались
также группы из мелких клеток с гомогенной цитоплазмой.
В задневентральных лопастях проксимальные участки были образо-
ваны из клеток, заполненных белковыми вакуолями. Последние давали по-
ложительное окрашивание по ШИК на полисахариды, а также содержали
связанные с белками липоиды и дисульфидные группы. Средняя часть.
- 245 -
лопастей была построена из столбчатых клеток с крупными ядрами и
гомогенной цитоплазмой. Они секретировали белки, связанные с липои-
дами и дисульфидными группами. Их секрет в виде крупных капель по-
ступал в просвет лопастей, вероятно путем отторжения апикальных участ-
ков цитоплазмы (рис. 442). Кроме того, в этой же зоне обнаружены узкие
и вытянутые клетки, заполненные крупными вакуолями, дающими поло-
жительные реакции на белки и полисахариды. Дистальные концы лопа-
стей были образованы из крупных столбчатых клеток с мелкими вакуо-
лями. Последние содержали белки, связанные с полисахаридами и липои-
дами.
Строение сперматофора. Иксодоидным клещам, как и другим группам
наземных хелицеровых, свойственно сперматофорное оплодотворение.
Зрелые проспермии клещей переносятся в половые пути самок упакован-
ными в специальные пакеты — сперматофоры.
Сперматофор представляет сферический мешок с узкой шейкой, кото-
рая может быть ввернута внутрь шара.
Тонкое строение сперматофора известно только для Argas persicus
(Tatchell, 1962b). У этого вида стенка сперматофора представляет двух-
слойную кожистую оболочку. Наружный слой, толщиной 1 мк, образован
из фосфолипопротеинов, а внутренний слой, в 7 мк, — из белков (рис. 151).
Снаружи оболочка сперматофора покрыта тонким слоем муцина. Внутри
сперматофора находится очень большое количество проспермиев, которые
заключены во внутреннем мешке — сперматодозе, стенки которой образо-
ваны тонкой мукопротеиновой мембраной. Вершина шейки состоит из муко-
протеинов и муцинов. Под ней лежит пара окруженных белковыми оболоч-
ками скоплений эстеразы, а на границе с проспермиями расположена
зона из секрета III пары латеральных лопастей придаточной железы.
Формирование сперматофора прослежено у нескольких видов арга-
совых клещей, включая и Ornithodoros papillipes (Feldman-Muhsam,
1967). В начале спаривания из полового отверстия самца выталкивается
наружная кожистая оболочка сперматофора (эктосперматофор). Затем
в нее в течение нескольких секунд поступают сперма, семенная жид-
кость, протеиновые гранулы и симбиотический грибок Adlerocystis sp.
После этого в шейку в виде пробки вводится оболочка сперматодозы
(эндосперматофор). Выворачивание и расправление сперматодозы и за-
полнение ее содержимым сперматофора происходит уже после перене-
сения последнего к влагалищу самки.
Спаривание. Процесс копуляции аргасовых клещей достаточно под-
робно описан в литературе (Павловский, 1940а; Соколов, 1956; Wagner-
Jevseenko, 1958). При спаривании партнеры соединяются своими вент-
ральными поверхностями, причем самцы активно удерживаются на самках
с помощью ног. Затем самец вводит свой хоботок через наружное половое
отверстие во влагалище и медленными движениями взад и вперед расши-
ряет его просвет. После этого самец выдвигает свой хоботок, подгибает
его на вентральную сторону и захватывает сперматофор, выступающий
к этому времени из мужского полового отверстия. Сперматофор перено-
сится на хоботке к половому отверстию самки, и его вытянутый носик
вводится во влагалище при погружении в последнее хоботка. Процесс
спаривания продолжается несколько минут, и самки способны к копуля-
ции в любое время после линьки.
При переносе сперматофора пальцами хелицер делается надрез у конца
его шейки. Сквозь него тонкостенная сперматодоза проталкивается во вла-
галище и сразу же заполняется спермой и семенной жидкостью. Ко-
жистая оболочка сперматофора остается снаружи женского полового
отверстия и может сохраняться здесь в течение нескольких дней. Сперма-
тодоза проталкивается в матку перистальтическими сокращениями мус-
- 246 -
кулатуры влагалища и соединительной трубки. В матке может находиться
несколько сперматодоз, так как самки аргасовых клещей способны к мно-
гократным спариваниям. Проспермии остаются внутри сперматодозы
от нескольких дней до нескольких недель или даже месяцев, и в этот пе-
риод происходит завершение их созревания и превращения в спермиофоры.
Из сперматодозы выходят зрелые спермиофоры, активно мигрирующие
в яйцеводы.
Детальное описание процесса копуляции иксодовых клещей отсут-
ствует. Как и у аргазид, партнеры во время спаривания соединяются
своими вентральными поверхностями и самцы удерживаются в этом поло-
жении с помощью ног (рис. 7). Перед переносом сперматофора в женское
половое отверстие вводится хоботок самца. Однако сам сперматофор,
по наблюдениям над Ixodes holocyclus (Moorhouse, 1966), перемещается
к женскому половому отверстию благодаря скользящим движениям
самца вдоль вентральной стороны идиосомы самки. Хоботок участвует
лишь в подрезании конца шейки и введении ее в женское половое от-
верстие.
Процесс спаривания занимает от 10—15 мин. до нескольких часов.
Самцы Ixodes ricinus, по нашим наблюдениям, могут оставаться прикреп-
ленными к самкам по нескольку суток. Голодные самки Amblyomminae
не способны к спариванию, a Ixodinae хотя и могут спариваться, но раз-
рыв сперматодоз и выход спермиофоров в яйцеводы наблюдаются в конце
созревания ооцитов. Имеющегося в семенных пузырьках запаса готовых
проспермиев достаточно для последовательного оплодотворения несколь-
ких самок. В опытах Г. С. Первомайского (1954) один самец Hyalomma
plumbeum последовательно оплодотворил 25 самок. В наших опытах
самцы родов Hyalomma, Dermacentor и Rhipicephalus во время совместного
с самками кормления на кроликах последовательно спаривались с не-
сколькими самками. При одиночном содержании недавно перелинявших
самцов Ornithodoros papillipes и Argas persicus с девственными напитав-
шимися самками 1 самец в течение нескольких дней оплодотворял от 4
до 9 самок.
ГО НОТРОФИЧЕСКИЕ ОТНОШЕНИЯ
Теоретические обобщения В. Н. Беклемишева (1940, 1942, 1951, 1954,
1957) о гонотрофическом цикле и гонотрофической гармонии1 у низших
кровососущих двукрылых послужили стимулом к сравнительно-парази-
тологическому анализу других групп кровососущих членистоногих, вклю-
чая и клещей. Имевшиеся работы ограничивались в основном описанием
влияния внешних условий на возможность яйцекладки и общую яйцевую
продуктивность у отдельных видов (Остроумова, 1936; Поспелова-Штром,
1935, 1953; Хейсин и Лебешева, 1955; Kitaoka a. Yajima, 1958b; Филип-
пова, 1966, и др.). В нормальных условиях однократное питание клещей
обеспечивает развитие и откладку полной, а у иксодовых клещей к тому же
единственной порции яиц, так что клещам надсем. Ixodoidea, как и крово-
сосущим двукрылым, свойственна гонотрофическая гармония. Ввиду об-
щепрй’знатптостп этого факта на него обращают меньше внимания, чем
на различные отклонения, а иногда просто забывают и специальные
1 Под гонотрофическпм циклом понимается период между двумя последователь-
ными приемами крови, обеспечивающими яйцекладку. Гонотрофическая гармония
представляет согласованность между процессами переваривания крови и развития
яичников, так что прием одной порции крови обеспечивает созревание одной порции
яиц. Автогенное развитие яиц — яйцекладка без имагипального питания за счет пище-
вых резервов, накопленных на личиночной или нимфальной фазах.
- 247 -
исследования в этом направлении отсутствовали. В результате этого
до последнего времени характер гонотрофических отношений у аргасовых
и иксодовых клещей оставался неясным. Опираясь на изложенные ранее
результаты наших исследований морфо-физиологических особенностей
процессов питания и размножения клещей, мы провели эксперименталь-
ное изучение гонотрофических отношений у иксодовых и аргасовых кле-
щей (Балашов, 1957а, 1962в).
Аргасовые клещи. В нормальных условиях самки большинства видов
аргазид обладают гонотрофической гармонией. Прием одной полной пор-
ции крови обеспечивает у них созревание и откладку 50—200 яиц, а не-
полное насыщение соответственно снижает их яйцевую продуктивность.
Случаи частых нарушений гонотрофической гармонии ни в коей мере не мо-
гут служить основанием для отрицания ее существования у аргазид.
Чаще всего нарушения гонотрофической гармонии связаны с сезон-
ностью размножения. Большинство аргасовых клещей нашей фауны
откладывают яйца в летне-осенние месяцы за счет весеннего кормления
(Поспелова-Штром, 1953; Филиппова, 1966). Исключение — Argas
persicus, проходящий за теплый сезон несколько гонотрофических
циклов, а в лаборатории размножающийся круглый год. Круглогодич-
ным размножением отличаются, по литературным данным, также многие
тропические и субтропические виды. Лишь при длительном разведении
в лаборатории сезонная ритмика нарушается. Легче всего это происхо-
дило у Ornithodoros tartakovskyi, труднее у Ornithodoros papillipes и
очень редко наблюдалось у Alveonasus lahorensis.
Во всех случаях задержки яйцекладки у самок, накормленных в не-
обычный сезон (поздняя осень—зима), большая часть ооцитов оставалась
на II стадии. Лишь в одиночных яйцеклетках начиналось отложение желтка
и они переходили на III стадию. В этих случаях процессы пищеварения
были сильно замедлены. В связи со значительным удлинением периода
между питанием и яйцекладкой даже на поддержание сравнительно невысо-
кого уровня основного метаболизма использовалась значительная доля
пищевых резервов. В связи с этим число яиц, откладываемых в подобных
случаях, всегда было меньше нормального.
У неоплодотворенных самок яйцекладка после питания обычно отсут-
ствует. Описаны случаи партеногенеза у Ornithodoros verrucosus, О. papil-
lipes (Поспелова-Штром, 1953) и О. moubata (Davis, 1951), но все они пред-
ставляют отдельные исключения, а отложенные яйца в большинстве
случаев были нежизнеспособны. Самки способны к спариванию как до,
так и после кровососания. Оплодотворение у аргасовых клещей несом-
ненно представляет необходимый стимул для завершения оогенеза. На-
пример, в наших опытах насосавшиеся неоплодотворенные самки О. papil-
lipes, Alveonasus lahorensis и Argas persicus несколько месяцев не присту-
пали к яйцекладке из-за торможения образования желтка. Сразу же
после спаривания в их ооцитах началось отложение желтка и вскоре они
приступили к яйцекладке.
Случаи размножения голодных клещей распадаются на две группы:
автогенное развитие яиц за счет нимфального питания и яйцекладка у дли-
тельно голодавших самок. Автогенное развитие представляет определен-
ную линию эволюции среди аргазид. Оно направлено на уменьшение числа
встреч с хозяином в жизненном цикле. Эта способность обнаружена у мно-
гих видов аргазид фауны СССР в условиях их лабораторного культивиро-
вания (Alveonasus lahorensis, Argas persicus, Ornithodoros papillipes, 0. tar-
takovskyi и др.). У большинства исследованных видов автогенное развитие
яиц факультативно. У самок, не питавшихся после линьки, при благо-
приятной температуре и влажности происходит яйцекладка. Яйца раз-
виваются за счет пищевых резервов, накопленных на нимфальной фазе,
- 248 -
но число их при этом всегда меньше нормального (табл. 46) и яйца от-
кладываются далеко не всеми особями. В то же время недавно перелиняв-
шие самки охотно питаются на подходящих хозяевах, после чего их яйце-
вая продуктивность заметно увеличивается. Напротив, у Alveonasus
lahorensis автогенное развитие первой порции яиц облигатно. Последую-
щие гонотрофические циклы обеспечиваются уже имагинальным крово-
сосанием. Количество отложенных яиц в обоих случаях примерно одина-
ково. Наконец, представители рода Otobius, паразитирующие на копыт-
ных или зайцах, сохранили один гонотрофический цикл. Они проходят
его за счет автогенного развития, а половозрелые особи вообще не спо-
собны к питанию и после яйцекладки погибают.
Случай откладки яиц самкой Ornithodoros papillipes, голодавшей 4 года,
был описан Е. Н. Павловским и А. Н. Скрынник (1946). Нам также не-
однократно приходилось наблюдать откладку 6—20 яиц голодными сам-
ками этого вида через год после того, как они прошли нормальный гоно-
трофический цикл и больше не питались. При вскрытии крупных партий
подобных клещей в яичниках отдельных особей удавалось обнаружить не-
большое число ооцитов на III и IV стадиях. Вероятно, под влиянием
каких-то неизвестных нам внешних или внутренних стимулов у некоторых
самок начинается развитие небольшого числа яиц. Процессы оогенеза обе-
спечиваются за счет мобилизации запасных питательных веществ орга-
низма. Особенно часто подобные случаи наблюдаются у Alveonasus laho-
rensis (Кусов, 1957).
Особого внимания заслуживает вопрос о влиянии внешних и внутрен-
них факторов на соотношение между объемом поглощенной к’рови и чис-
лом отложенных яиц. Для аргасовых клещей характерны весьма значи-
тельные индивидуальные различия в количестве откладываемых яиц.
Оно может быть пропорциональным объему поглощенной крови, или же
подобная связь нарушается.
Примерами влияния эндогенных факторов служат значительные разли-
чия в количестве откладываемых яиц и массе поглощенной крови в зави-
симости от происхождения самок. При прочих равных условиях оба от-
меченных показателя выше у самок, перелинявших из нимф более старших
возрастов (табл. 46). У видов с типичной гонотрофической гармонией,
имеющих небольшой «страховой резерв» запасных питательных веществ,
эти различия в большинстве случаев статистически достоверны (Argas
persicus). У видов, сохраняющих в кишечнике после прохождения гоно-
трофического цикла значительные количества неусвоенной крови, они
выражены слабее (Ornithodoros papillipes). У О. tartakovskyi нивели-
рующим фактором служат значительные различия в размерах тела и ко-
личестве поглощаемой крови у нимф одного возраста. Четче всего они
проявляются в первых гонотрофических циклах, а затем могут стираться.
Индивидуальное содержание и кормление самок позволило просле-
дить изменения в яйцевой продуктивности на протяжении пяти последо-
вательных гонотрофических циклов. Для О. papillipes и О. tartakovskyi
наблюдения продолжались пять лет, причем за один год клещи проходили
только один гонотрофический цикл. Argas persicus проходил в наших
опытах за год два гонотрофических цикла. Из табл. 46 видно, что значи-
тельные различия в яйцевой продуктивности между последовательными
гонотрофическими циклами не обнаружены или же они статистически
недостоверны. Можно лишь отметить, что начиная с IV цикла значи-
тельно увеличивается смертность среди закончивших яйцекладку самок.
Часть из них быстро высыхает, а другие долго остаются в живых, но от-
казываются питаться. Чем меньше гонотрофических циклов пройдено
самкой, тем она устойчивее к длительному голоданию. Вероятно, с каждым
последующим гонотрофическим циклом ускоряется физиологическое ста-
- 249 -
Таблица 46
Влияние происхождения и физиологического возраста самок аргасовых клещей
на объем поглощенной крови и число отложенных яиц (средние для 25 клещей в каждом опыте, вес в мг)
Вид клеща Хозяин Самки перелиняли от нимф Вес голодных самок I гонотрофи- ческий цикл II гонотрофи- ческий цикл III гонотрофи- ческий цикл IV гонотрофи- ческий цикл V гонотрофиче- ский цикл
вес после питания количество от- ложенных яиц вес после питания количество от- ложенных яиц вес после питания количество от- ложенных яиц вес после питания количество от- ложенных яиц вес после питания количество от- ложенных яиц
Морская свинка. | III 21 56 222+17 51 181 + 17 51 111 + 12 57 172 + 16 52 146+15
IV 34 62 268 + 15 63 177 + 17 64 107+11 62 178 + 13 61 160 + 14
Ornithodoros papil-
lipes. Автогенное развитие IV 43 39 163 + 16 — — — — — — — —
за счет нимфаль-
I ного питания. III 9 28 238+15 26 85 + 6 25 108 + 5 26 171 + 13 34 210+19
Ornithodoros tarta- Белая мышь. |
kovskyi. IV 12 30 207 + 11 31 244 + 15 33 116 + 8 34 231+15 37 186 + 19
Argas persic Курица. | II 16 67 153 + 11 80 200+13 84 183 + 17 86 134 + 10 88 152 + 15
III 24 104 284 + 20 105 258 + 10 104 190+14 110 247 + 30 118 228 + 17
Примечание. В случае автогенного развития яиц указывается вес клещей сразу после линьки и затем перед началом яйцекладки.
рение клещей. Напротив, при низком уровне основного метаболизма
во время голодания оно происходит значительно медленнее.
Весьма спорен вопрос о влиянии питания на разных видах хозяев
на яйцевую продуктивность. Широкий круг хозяев, использованных в на-
ших опытах, показал, что питание на систематически далеких видах млеко-
питающих, птиц и рептилий весьма незначительно влияет на количество
поглощаемой крови и размножение. Как видно из табл. 47, различия
в количестве принятой крови и числе отложенных яиц в большинстве
случаев оказались статистически недостоверными.
Таблица 47
Влияние питания на разных хозяевах на яйцевую продуктивность аргасовых
клещей (средние для 25 клещей в каждом опыте, вес в мг)
Ornithodoros
papillipes
от нимф IV
Ornithodoros
tartakovskyi
от нимф III
Alveonasus lahorensis
Хозяин
Морская свинка
Кролик
Белая мышь
Овца
Курица
Степная черепаха
Горная агама
Автогенное развитие за счет
нимфального питания:
на морской свинке или
кролике
на овце
31
34
33
31
32
35
32
40
62
59
56
61
72
58
60
37
262 + 13
256±9
289 + 11
278+14
232+18
223 + 33
211 + 21
109 + 5
8 19
9 20
7 21
8 21
8 29
7 27
121 + 10
234 + 14
196 + 17
187 + 11
233 + 17
227 + 24
66 129
71 189
75 197
114 10о
134 121
123 + 23
204 + 5
243 + 27
211 + 10
252 + 17
Примечание. В случае автогенного развития яиц указывается вес клещей сразу после
линьки и затем перед началом яйцекладки.
Значительное влияние на число откладываемых яиц оказывают окру-
жающие условия после окончания питания. Неблагоприятные темпера-
тура и влажность всегда снижают яйцевую продуктивность. В этих слу-
чаях вес самок перед началом яйцекладки всегда меньше, чем в нормаль-
ных условиях.
Подводя итог приведенным наблюдениям, можно отметить, что число
яиц, откладываемых аргасовыми клещами, как и у других кровососов,
обладающих гонотрофической гармонией, в определенной степени соот-
ветствует весу поглощенной крови. Однако в связи с особенностями их
пищеварения, значительной продолжительностью отдельных гонотрофи-
ческих циклов и наличием в организме значительного резерва запасных
питательных веществ число яиц в одной кладке может сильно варьировать,
а гонотрофическая гармония иногда нарушается.
Иксодовые клещи. Самкам иксодовых клещей свойственна жесткая
гонотрофическая гармония, так как необратимые морфо-физиологические
изменения в их организме во время питания и подготовки к яйцекладке
делают невозможным прохождение повторных гонотрофических циклов.
Нормальное прохождение гонотрофического цикла связано с оплодотво-
— 251 -
рением самок до начала питания или во время последнего. Самки I. rici-
nus, I. persulcatus и, вероятно, других видов этого рода способны к копу-
ляции в голодном состоянии, что неоднократно наблюдалось как в природе,
так и в лабораторных культурах клещей. У видов подсем. Amblyomminae,
по нашим наблюдениям, голодные самки не способны к копуляции. Не-
смотря на месячное пребывание с напитавшимися самцами, в половых
путях самок четырех видов этой группы отсутствовали сперматодозы.
Способность к копуляции развивалась у них на 3—4-е сутки питания.
Отсутствие копуляции вело к значительному удлинению сроков пита-
ния или даже полной его приостановке. Из табл. 48 видно, что ни для од;
ного из изученных видов иксодовых клещей не отмечено нормального
питания при отсутствии самцов. Приводимые в таблице сроки удлинения
питания до 20 суток не были предельными. Отдельные недопитавшиеся
самки оставались на кроликах до 1—2 месяцев и часто погибали в прикреп-
ленном состоянии. Нормальные же сроки‘питания для этих видов состав-
ляли в контроле (вместе с самцами) всего 7—8 суток. Несмотря на необы-
чайное удлинение сроков нахождения на хозяине, ни одна из неоплодотво-
ренных самок не достигла нормальной степени насыщения. Даже наиболее
упитанные неоплодотворенные самки весили по окончании питания значи-
тельно меньше, чем особи, нормально копулировавшие с самцами.
Первые 3—4 дня питание неоплодотворенных самок протекало нор-
мально и не отличалось от контроля. По достижении определенной сте-
пени насыщения дальнейшее увеличение в весе, однако, прекращалось
или шло в очень замедленном темпе. Этот переломный момент обычно
наступал на 4—6-е сутки питания, по достижении веса в 40—60 мг. Наобо-
рот, у оплодотворенных особей в это время скорость кровососанйя заметно
увеличивалась, они вступали в период растяжения и отпадали с хозяина
через 1—3 суток. В случае продолжения питания неоплодотворенных
особей (Dermacentor pictus и Haemaphysalis punctata) у них отсутствовал
четко выраженный период растяжения, а период отпадения с хозяина
недопитавшихся клещей растягивался на несколько недель.
Если к подобным недопитавшимся самкам, остающимся прикреплен-
ными к хозяину, подсадить самцов того же вида, то через несколько дней
происходит нормальное насыщение и отпадение. У Ixodes ricinus, у кото-
рого самцы способны к оплодотворению без питания, отпадение нормально
упитанных самок наблюдалось уже спустя 1—2 суток после подсадки
самцов. У остальных видов, где самцы приобретали способность к оплодо-
творению только после 2—5-дневного питания, спаривание происходило
на 3—4-е сутки после подсадки самцов, а отпадение напитавшихся самок
начиналось через 3—6 суток. В опытах с подсадкой к самкам Hyalomma
plumbeum предварительно напитавшихся самцов для полного насыщения
неоплодотворенных особей требовалось всего 1—3 суток.
Откладка жизнеспособных партеногенетических яиц неоплодотворен-
ными самками описана для клещей Hyalomma anatolicum, Н. plumbeum, Rhi-
picephalus bursa, R. sanguineus (Первомайский, 1949, 1954), Amblyomma
dissimile (Bodkin, 1918), нескольких видов рода Haemaphysalis (Жмаева,
1950; Лаптев, 1963) и Boophilus microplus (Stone, 1963). Для островной
расы Haemaphysalis bispinosa из Японии партеногенез представляет нор-
мальный способ размножения и самцы встречаются крайне редко (Ki-
taoka, 1961d). У остальных видов (в наших опытах Н. punctata, Derma-
centor pictus и Rhipicephalus turanicus) неоплодотворенные недопитавшиеся
самки откладывали небольшое количество яиц. Лишь немногие из них
развивались и давали личинок, тогда как большая часть вскоре высыхала.
Описанное явление торможения питания неоплодотворенных самок
несомненно представляет приспособление для обеспечения встречи полов
и оплодотворения. Шансы встречи малоподвижных и часто значительно
- 252 -
Таблица 48
Влияние оплодотворения на питание самок иксодовых клещей
(по 10 клещей для опыта, вес в мг)
Продолжительность прикрепления, в сутках Самки с момента прикрепления вместе с самцами Самки без самцов Самцы подсажены на 10-е сутки прикрепления Голодные самки с самцами, а с начала питания без самцов
Ixodes ricinus Haemaphysalis punctata Dermacentor pictus Rhipicephalus turanicus Hyalomma plumbeum Ixodes ricinus H aemaphysa lis punctata Dermacentor pictus Rhipicephalus turanicus Hyalomma plumbeum Ixodes ricinus Haemaphysalis punctata Dermacentor pictus Rhipicephalus turanicus Hyalomma plumbeum Ixodes ricinus Haemaphysalis punctata Dermacentor pictus Rhipicephalus turanicus Hyalomma plumbeum
Голодные 2.1 3.0 7.9 3.4 14.0 2.0 3.0 8.3 3.4 15.2 2.0 3.0 8.2 3.3 16.0 2.0 3.1 7.6 3.2 14.8
1 3.0 2.8 8.1 3.2 14.1 2.8 2.9 10.2 3.3 16.0 2.9 3.1 11.6 3.6 16.1 2.9 2.7 8.6 3.0 14.3
2 5.2 3.0 11.0 3.5 18.0 4.6 3.6 15.0 4.0 22.0 5.6 3.2 17.0 4.3 19.0 5.7 3.5 14.8 4.5 17.5
3 9.8 4.5 14.5 4.5 21.0 11.0 7.0 19.0 5.1 26.5 10.3 5.0 29.0 5.1 24.2 10.1 8.1 18.9 7.1 20.4
4 20.0 8.0 34.5 10.0 43.0 19.2 12.1 26.0 10.5 30.4 21.6 9.8 46.0 9.8 31.5 22.4 14.0 31.2 12.6 28.5
5 41.3 17.0 63.0 21.0 64.0 39.6 25.4 52.3 20.0 38.5 43.5 20.1 68.0 20.5 37.0 40.5 27.5 48.5 22.0 36.2
6 64.6 35.0 97.0 39.0 110.0 49.2 51.4 62.8 37.0 39.0 60.0 47.0 94.0 29.0 34.6 78.6 49.1 57.9 30.5 39.4
7 247.6 61.0 530.0 58.0 222.0 56.7 81.0 74.0 45.0 37.6 49.4 76.0 89.0 34.0 36.0 272.1 63.6 78.8 38.9 28.5
8 — 270.0 — 242.0 1180.0 51.4 78.0 98.0 59.0 41.0 56.3 84.0 114.0 42.0 35.0 — 75.4 103.1 37.2 35.5
9 — — — — — 62.0 89.0 109.0 64.0 50.2 61.6 69.0 126.0 47.0 38.4 — 80.3 108.2 40.9 41.8
10 — — — — — 59.4 84.0 121.0 49.0 43.0 59.5 73.0 157.0 49.0 31.0 — 79.5 129.6 51.5 40.6
И — — — — — — 76.0 149.0 56.0 39.5 198.0 71.0 146.0 46.0 33.6 — 69.7 165.7 42.1 37.2
12 — — — — — 82.0 256.0 61.0 34.0 259.0 75.0 195.0 48.0 38.4 — 81.3 208.1 39.8 42.1
13 — — — — — — 84.0 267.0 54.0 — — 195.0 396.0 82.0 80.5 — 78.4 249.5 43.5 —
14 — — — — — — — 229.0 56.5 — — — — 209.0 105.2 — — 256.2 47.2 —
15 — — — — — — — — 67.0 — — — — — 230.5 — — — 35.4 —
16 — — — — — — —— — — — — — 780.0 — — — — —
20 52.5 89.6 245.0 62.0 36.8 82.8 235.1 29.8 27.5
удаленных друг от друга самцов и самок иксодид вне организма хозяина
очень малы. Задержка неоплодотворенных недопитавшихся самок на про-
кормителях, как и длительное нахождение на их теле самцов — одна из
своеобразных адаптаций к пастбищному типу паразитизма.
Превращение первоначально непродолжительного акта кровососания
в многодневную стадию развития на теле хозяина обеспечивает не только
максимальное использование прокормителя как источника пищи, но и
создает исключительно благоприятные условия для быстрого развития
яиц. Рост яичников начинается с первых же часов питания. У напитав-
шихся и готовых к отпадению самок линейные размеры яичника увеличи-
ваются в 10—12 раз (рис. 443—445) и в них в небольшом числе содержатся
уже готовые к овуляции ооциты. После отпадения с хозяина клещам тре-
буется всего несколько дней до начала откладки яиц. У неоплодотворен-
ных самок рост яичников в период нахождения на хозяине происходит
значительно медленнее и у отпавших недопитавшихся особей они значи-
тельно меньше, чем при нормальном питании. После удаления с хозяина
размеры яичника у подобных особей обычно почти не увеличиваются и
лишь немногие ооциты достигают нормальных размеров и выводятся
в яйцеводы. Торможение яйцекладки у неоплодотворенных питающихся
самок проявляется уже на стадии накопления желтка.
Полностью напитавшимся самкам иксодовых клещей принадлежат
абсолютные рекорды плодовитости среди кровососущих членистоногих.
Так, самки наиболее крупных видов (роды Hyalomma и АтЫуотта)
откладывают в среднем 15 000—20 000 яиц, средних по размерам тела
видов (роды Dermacentor, Rhipicephalus, Boophilus) — 3000—6000 яиц
и наиболее мелких норовых видов родов Ixodes и Haemaphysalis — около
1000 яиц. Для сравнения можно указать, что суммарная яйцевая продук-
тивность самок аргасовых клещей обычно не превышает 1000 яиц (Поспе-
лова-Штром, 1953), а для Ornithonyssus bacoti — высоко специализирован-
ного кровососа из гамазовых клещей — составляет всего около 100 яиц
(Нельзина, 1951).
У недопитавшихся оплодотворенных самок иксодид яйцекладка про-
исходит только по достижении определенного минимального веса тела,
но количество откладываемых яиц в этих случаях бывает много меньше
нормального. Среди более мелких Rhipicephalus turanicus и Ixodes ricinus
яйцекладка наблюдается у самок весом не менее 20—30 мг, а у более круп-
ных Dermacentor pictus, Hyalomma asiaticum и H. anatolicum — при весе
не менее 45—73 мг (табл. 49, 50). Из приведенных цифр видно, что яйце-
кладка у иксодовых клещей возможна уже при достижении веса тела,
близкого к 10% от такового нормально напитавшихся особей. Инте-
ресно, что среди кровососущих двукрылых и клопов минимальный объем
поглощенной крови, обеспечивающий возможность яйцекладки, должен
быть не меньше 30—50% от нормы (Детинова, 1962; Friend a. oth.,
1965).
Количество откладываемых яиц с увеличением веса тела клещей обычно
быстро возрастает как в абсолютных цифрах, так и в пересчете числа яиц
на 1 мг веса тела самки. Последний показатель особенно важен, так как
он отражает эффективность использования поглощенной при питании пищи.
Максимальная яйцевая продуктивность на 1 мг веса бывает у полностью
напитавшихся самок (табл. 49), тогда как у недопитавшихся особей она
снижается в несколько раз. Так, у нормально напитавшихся самок Ixodes
ricinus, весящих 204—298 мг, на 1 мг веса откладывалось 9 яиц, а у недо-
питавшихся особей весом 29—47 мг — всего 3 яйца. У недопитавшихся
Rhipicephalus turanicus при весе 19—26 мг на 1 мг приходилось 2 яйца,
а у нормально упитанных — 16. У напитавшихся Hyalomma asiaticum
яйцепродукция на 1 мг в 10 раз больше, чем у недопитавшихся.
- 254 -
Таблица 49
Зависимость плодовитости самок иксодовых клещей от веса (в мг) тела (по 10 клещей в каждом опыте)
и сб а Ixodes ricinus Rhipicephalus turanicus Hyalomma asiaticum
Продолжительность прикрепления, в суп количество отложенных яиц количество отложенных яиц количество отложенных яиц
одной самкой на 1 мг веса тела вес тела одной самкой на 1 мг веса тела | одной самкой на 1 мг веса тела
5 29-47 (36) 112-156(119) 3 — — — — — —
51/2 50-70(62) 190—234(207) 3 19—26 (22) 6-118(39) 2 — — —
6 81-102 (89) 380-475 (428) 5 31-40 (36) 267-365 (298) 9 109-136(123) 69—214(127) 1
61/2 107-184 (135) 768—1103 (897) 7 42—50 (44) 382-536 (447) 10 161-197 (187) 1017—1425(1200) 6
7 204—298 (257) 1370—2695 (2344) 9 51—70 (61) 564—1108 (719) 12 209-270 (242) 1362—2114(1742) 7
7V2 — — — 71—100 (82) 1067-1207(1121) 14 298—361 (321) 2237-3416(2914) 9
8 — — — 101-202 (178) 2111-2954(2520) 14 389—680 (568) 4156—6259 (5396) 10
«1/2 — — — 207-304 (262) 3129-4205 (4185) 16 863—997 (922) 7315—9735 (8928) 10
9 — — — — — 1300—1986(1711) 12253—21204 (17486) 10
Примечая и е. В скобках даются средний вес одного клеща и среднее количество яиц, приходящиеся на 1 самку.
Значительные различия в яйцевой продуктивности на единицу веса
в зависимости от степени упитанности клещей объясняются особенностями
развития ооцитов. У недопитавшихся особей начинает развиваться зна-
чительно больше яйцеклеток, чем могут закончить свой рост за счет
поглощенных питательных веществ. Даже у самок, поглотивших пищи
меньше, чем требуется для начала яйцекладки, наблюдается заметное
увеличение размеров яичников, а многие ооциты находятся на разных
стадиях заполнения желтком. У недопитавшихся особей, способных
к яйцекладке, размеры яичников и число ооцитов, нормально заканчиваю-
щих развитие, значительно меньше, чем после нормального насыщения
(рис. 446, 447). При этом многие приступившие к отложению желтка
ооциты так и не заканчивают роста из-за недостатка пищевых резервов.
В то же время они поглощают значительную долю белков крови хозяина
и вызывают общее снижение яйцевой продуктивности на 1 мг веса тела.
Следует отметить, что чем выше степень насыщения клеща, тем в меньшем
числе встречаются подобные (не закончившие развития) ооциты в яичниках
самок после окончания яйцекладки.
В яичниках закончивших яйцекладку и погибающих самок, до этого
нормально напитавшихся на хозяине, всегда сохраняется значительное
количество не приступивших к росту ооцитов I—II стадий и небольшое
число ооцитов III—IV стадий, не успевших закончить своего развития
(рис. 448). Последнее, вероятно, отражает утраченную иксодидами способ-
ность к прохождению нескольких гонотрофических циклов, которая была
свойственна их примитивным предкам.
Наиболее полное использование поглощенной крови и тканей хозяина,
очевидно, достигается у нормально напитавшихся особей. По данным
С. Китаока (Kitaoka, 1961с), у напитавшихся самок Boophilus microplus
и Haemaphysalis bispinosa в отложенные яйца, главным образом в форме
желтка, переходит 33.2—46.8% белкового азота и 6.7—12.8% железа*
(в виде гомопротеидов) от поглощенной крови хозяина. При неблагоприят-
ных внешних условиях эти показатели снижаются и большая доля пита-
тельных веществ идет на поддержание основного обмена веществ в орга-
низме. Так, при бездиапаузном развитии напитавшихся самок Derma-
centor marginatus (яйцекладка через 7 дней после отпадения) на 1 клеща
приходилось 6200 яиц, а при» яйцекладке после 6-месячной диапаузы —
только по 2500 яиц (Ламанова, 1965).
Снижение числа отложенных яиц или отсутствие яйцекладки у недо-
питавшихся самок отчасти компенсируется их способностью к повторному
прикреплению и окончанию питания на новом хозяине. В наших опытах
(табл. 50) осторожно снятые с кролика недопитавшиеся самки 5 видов
охотно прикреплялись к новому хозяину и нормально продолжали пита-
ние. Общая продолжительность питания в этих случаях, за вычетом вре-
мени перерыва, практически не отличалась от нормальной. Вес их после
отпадения также заметно не отличался от нормально питавшихся клещей.
Сходные результаты были получены Д. Грегсоном (Gregson, 1962а) при
докармливании недопитавшихся самок Dermacentor andersoni на изолиро-
ванном ухе кролика с искусственно поддерживаемым кровотоком консерви-
рованной крови.
С определенного момента питания недопитавшиеся клещи одновременно
обладают способностью как к повторному прикреплению к хозяину, так
и к яйцекладке. Этот период обычно продолжается 1—2 суток. Затем спо-
собность к повторному возобновлению питания утрачивается, а число
откладываемых яиц начинает заметно увеличиваться. Потеря способности
к возобновлению питания после насильственного открепления клеща
обычно совпадает с началом периода растяжения. К этому времени Ixodes
ricinus и Rhipicephalus turanicus достигают веса не менее 60—75 мг,
— 256 -
Рис. 435—442. Участки срезов семенников и лопастей половой придаточной
железы самца Hyalomma asiaticum.
425 — делящиеся сперматогонии; 436 — сперматоциты в конце периода
большого роста; 437 — сперматиды и зрелые проспермии; 438 — придаточ-
ная железа голодного клеща; 439 — участок стенки главной медиальной ло-
пасти через несколько дней после начала питания; 440 — участок передне-
вентральной лопасти; 441 — участок вентро-латеральной лопасти; 442 —
участок задневентральной лопасти. Микрофотографии: 435—437 — X1600,
438 — Х250, 439—442 — Х600.
я — ядра; — отторгнутые концы железистых клеток; св — секреторные вакуоли; ст —
соединитель потканная оболочка.
Рис. 443—448. Половая система самок Ixodes ricinus.
443 — голодная; 444 — 4 суток питания, вес 16 мг; 445 — напитавшаяся, перед отпа-
дением, вес 165 мг; 446 — недопитавшаяся, вес 32 мг, через 15 суток после удаления
с хозяина; 447 — полностью напитавшаяся в начале яйцекладки; 448 — то же, по
окончании яйцекладки. \7.
Ь53
Рис. 449—455. Риккетсии Бернета (449—452) и Wolbachia sp. (453—455) в организме
иксодоидных клещей.
449 — клетки средней кишки напитавшейся нимфы Hyalomma asiaticum через 4 суток
после окончания инфицирующего кормления; 450 — то же у голодной самки на
23-й день после заражения на нимфальной фазе; 451 — отторгнутая клетка средней
кишки питающейся самки Н. asiaticum на 60-е сутки заражения; 452 — ооцит инфи-
цированной самки Ornithodoros papillipes', 453 — мальпигиев сосуд нимфы Hyalomma
asiaticum', 454 — то же, самка A rgas persicus; 455 — участок ооцита питающейся
самки Hyalomma asiaticum. Микрофотографии: 449—453 — Х900, 454,455 — X 1350.
Таблица 50
Способность к яйцекладке или повторному присасыванию у самок иксодовых клещей в зависимости от веса тела (вес в мг,
по 10 клещей в каждом опыте)
Л S о Ixodes ricinus Dermacentor pictus Rhipicephalus turanicus Hyalomma asiaticum Ну alomm а anatolicum
ф S сб сб съ сб
д 2? flj Сб а ф 5 а ф 2 а а а
Й д И а ф «5 О к* г*» BTOpHOi исасыв е н: сб R а ф ЕГ о « а S fto о ей Рн О да S ф цеклад с да к 3 go a S ф к сб а а ф И" о о « « S ОчО о a д В Ф д. сб а ф д о да К 3 о. о О сб о да s ф и сб а а ф Д’
ф о ан ф О Q.S ф К В« эД ф О ЛД « о ад ’S
ЙИд да иви К Д вви а да а а ЗЕВ а д к а а а
1 2.5—3.5 + — 6.5—10 + — 2.5-3.5 + — 10—17 + — 6.5—9 +
2 4-6 + — 9—13 + — 3-4 + — 12—23 + — 8—10 + —
3 8—11 + — 14—20 + — 4—6 + — 17—32 + — 11—17 + —
4 15-21 + — 25—40 + — 7—12 + — 25-39 + — 15-30 + —
5 23—50 + + 41—64 + — 14-25 + — 40—76 + — 32—45 + —
6 62-91 — + 73—122 + + 31-47 + + 81—119 + + 46—70 + +
7 98-156 — + 125-300 — + 40-72 + + 120—206 + + 73—104 + +
8 — 210-406 — 4- 75—110 — + 310-507 — + 109—301 — +
9 — — 150-346 — + 600—1700 — + 305—650 — +
Примечание. Плюс обозначает наличие, а минус — отсутствие яйцекладки или повторного прикрепления.
a Hyalomma anatolicum, H. asiaticum и Dermacentor pictus — 110—
125 мг.
Способность к повторному прикреплению сохраняется у насильственно
удаленных особей до их гибели. Однако их жизнеспособность значительно
ниже, чем у не начинавших питаться клещей, и немногие из них выживают
дольше 1—2 месяцев. Резко различаются недопитавшиеся и нормально
упитанные самки и по своему поведению. У первых по удалении с хозяина
сохраняется значительная подвижность и комплекс реакций, связанных
с подстереганием хозяина (подъем на растительность, поза ожидания и др.).
Напротив, у напитавшихся особей или недопитавшихся самок, способных
к откладке значительного числа яиц и утративших способность к повтор-
ному питанию, хорошо выражены реакции положительного геотропизма
и отрицательного фототаксиса и они стремятся скрыться в щелях, трещи-
нах и других убежищах. Инстинкт нападения на хозяев у них полностью
утрачен.
Эволюция гонотрофических отношений. Гонотрофическая гармония
служит признаком высокой специализации и свойственна лишь периоди-
чески нападающим кровососам. Для правильного понимания гонотрофи-
ческих отношений аргасовых и иксодовых клещей большой интерес пред-
ставляют некоторые гамазовые клещи (сем. Laelaptidae), характери-
зующие различные этапы перехода от энтомофагии к гематофагии. Они
поглощают за один прием очень небольшое количество крови, не имеют
гонотрофической гармонии и откладывают одиночные яйца по мере их со-
зревания (Мэн Ян-цунь, 1959). Облигатные норово-гнездовые кровососы
типа Ornithonyssus bacoti (Нельзина, 1951) или Dermanyssus gallinae и Orni-
thonyssus variabilis (сем. Dermanyssidae; Земская, 1951a, 19516) погло-
щают уже значительные объемы крови, в несколько раз превышающие
их исходный вес, и обладают гонотрофической гармонией. Плодовитость
их значительно выше, чем у Laelaptidae, но много меньше, чем у аргазид
и иксодид.
Два последних семейства являются наиболее специализированными
кровососами среди Parasitiformes и обладают совершенной гонотрофиче-
ской гармонией. Сходство между ними связано с возникновением ряда
адаптаций, общих для пастбищных и норово-гнездовых периодически на-
падающих кровососов, на единой морфолого-анатомической основе,
а отличия обусловлены специализацией к двум различным типам парази-
тизма.
Аргасовые клещи — преимущественно норово-гнездовые кровососы.
Усиление связей с хозяином и тенденция перехода к эктопаразитизму в ро-
дах Otobius и Alveonasus, вероятно, являются вторичной линией развития
и связаны с переходом к питанию на бродячих копытных животных.
Жизнь аргасовых клещей в различного рода убежищах целиком зависит
от частоты посещения последних подходящими хозяевами, так как многие
норы могут длительное время оставаться незаселенными. В связи с этим
у клещей развился ряд приспособлений, гарантирующих длительное вы-
живание без пищи. После питания для завершения линьки нимф или про-
хождения гонотрофического цикла самками потребляется лишь часть
поглощенной крови. Остающаяся в кишечнике неусвоенная кровь слу-
жит основным источником запасных питательных веществ, поддерживаю-
щих жизнедеятельность клеща во время голодания. В некоторых случаях
ее хватает и на развитие у голодающих клещей небольшого числа жизне-
способных яиц, обеспечивающих обновление возрастного состава популя-
ции. Таким образом, гонотрофическая гармония аргасовых клещей ослож-
няется способностью к прохождению повторных гонотрофических циклов
голодающими самками. Суммарная плодовитость аргазид значительно
меньше, чем у иксодовых клещей. Однако наличие нескольких гонотрофи-
- 258 -
ческих циклов способствует поддержанию устойчивой численности кле-
щей в замкнутых микробиотопах.
Иксодовые клещи с пастбищным подстерегающим типом паразитизма
постоянно сталкиваются с весьма изменчивыми микроклиматическими
условиями открытых стаций, и смертность среди голодных клещей, не су-
мевших найти прокормителя, весьма велика. Для увеличения выживае-
мости в подобных условиях у них развилась максимальная для клещей
индивидуальная плодовитость (до 20 000 яиц на особь), произошло умень-
шение числа необходимых встреч с хозяином за счет сокращения числа
нимфальных возрастов до одного, возникли тенденции к переходу от трех-
хозяинности к однохозяинности, строгой согласованности питания и линек
у неполовозрелых фаз, а также совершенной гонотрофической гармонии
у самок.
Гигантская плодовитость иксодид при однократном питании связана
с превращением первоначально непродолжительного акта кровососания
в многодневную стадию питания и поглощением в этот период массы крови
и лизированных тканей, в 100 и более раз превосходящих вес тела голод-
ного клеща. Своеобразные особенности питания иксодид привели к вы-
работке несколько необычного типа гонотрофической гармонии, отличаю-
щейся от таковой у кровососущих двукрылых.
У комаров однократного приема крови бывает достаточно для разви-
тия одной порции яиц. Количество развивающихся при этом ооцитов
определяется весом поглощенной крови у видов родов Aedes и Culex или же
яйцекладка возможна только при полном насыщении (род Anopheles).
У иксодовых клещей с однократным питанием последнее обеспечивает
развитие большинства ооцитов, находящихся в яичнике. При нормальном
насыщении количества приступивших к отложению желтка и завершив-
ших развитие ооцитов довольно близки, так что обеспечивается высокая
степень утилизации поглощенной крови позвоночного. При неполном на-
сыщении наряду со снижением абсолютного числа отложенных яиц на-
блюдается также уменьшение относительной плодовитости (число яиц
на 1 мг веса тела). Наконец, при еще меньшем насыщении яйцекладка
вообще отсутствует, хотя и начинается развитие ооцитов. Очевидно, что
при полном насыщении наблюдается совершенная гонотрофическая гармо-
ния, а при неполном насыщении она в значительной степени нарушается
в связи с отсутствием согласованности между количеством поглощенной
пищи и числом развивающихся ооцитов.
КЛЕЩИ И ВОЗБУДИТЕЛИ
ТРАНСМИССИВНЫХ ИНФЕКЦИЙ ПОЗВОНОЧНЫХ
Иксодоидные клещи — важнейшие биологические переносчики возбу-
дителей многих заболеваний человека и животных, включая вирусы, рик-
кетсии, анаплазмы, бактерии, спирохеты, пироплазмы и тейлерии. За по-
следние годы доказана передача клещами Ornithodoros talaje возбудителя
филяриоза питонов Macdonaldius oschei (Frank, 1964) и клещами Ornithodo-
ros tartakovskyi филярии песчанок Dipetalonema witei (Baltazard a. oth.,
1953; Worms a. Terry, 1961). Клещи получали микрофилярий при питании
кровью инфицированных хозяев. Паразиты мигрировали из кишечника
в полость тела, мальпигиевы сосуды и мускулатуру клеща, а по достиже-
нии инфекционной для позвоночных стадии локализировались в основном
в мышцах гнатосомы и глотки. Во время кровососания личинки филярий
проникают в полость глотки и из нее в организм позвоночного животного.
- 259 -
17*
В гемолимфе и яйцах клещей родов Hyalomma и Boophilus calcaratus
часто встречается жгутиконосец Crithidia hyalommae (Муратов и Хей-
син, 1959а; Арифджанов и Никитина, 1961; Муратов, 1966) и из их
организма выделено 13 видов грибов родов Aspergillus, Penicillum и др.
(Муратов, 1965).
Литература об эпидемиологической и эпизоотологической роли кле-
щей насчитывает многие сотни названий. Учитывая обширность про-
блемы, в настоящем разделе мы ограничиваем свою задачу лишь
рамками анализа биологических взаимоотношений клещей с наиболее
изученными в этом отношении видами микроорганизмов и простейших.
ВИРУСЫ
За последние годы опубликовано несколько обзорных статей, касаю-
щихся различных сторон передачи арбовирусных инфекций иксодовыми
клещами (Smith, 1962, 1964; Rehacek, 1965; Hoogstraal, 1966). На 1964 г.
в различных странах установлена спонтанная инфицированность иксо-
дид и, значительно реже, аргазид 22 арбовирусами, из которых для 12
доказано существование биологической передачи (табл. 51). Наиболее
полно исследованы отношения иксодовых клещей с вирусами группы
клещевых энцефалитов и в первую очередь с весенне-летним энцефалитом
и двухволновым менингоэнцефалитом (Павловский, 19406; Павловский
и др., 1960; Blaskovic a. Rehacek, 1962; Левкович и др., 1967).
Вирус весенне-летнего энцефалита многократно выделялся в различ-
ных районах СССР от клещей Ixodes persulcatus, I. ricinus и, значительно
реже, от Haemaphysalis concinna, Н. japonica douglasi, Dermacentor sil-
varum, D. marginatus. Спонтанная инфицированность Ixodes persulcatus
в природных очагах варьировала от долей процента до 10—50%. Возбуди-
тель двухволнового менингоэнцефалита связан почти исключительно
с клещом I. ricinus. Клещи получают вирус во время питания на многих
видах диких млекопитающих и, реже, птиц. В опытах при инфицирую-
щем кормлении удавалось заразить от 60 до 90% клещей. Успешность
инфицирования обеспечивалась высоким уровнем виремии крови —
не ниже 10-3 для белых мышей в опытах А. П. Думиной (1958) — и доста-
точной ее продолжительностью.
Кормление клещей на иммунных животных приводило к освобождению
от вируса личинок I. ricinus, но не нейтрализовало его в организме нимф
и самок (Думина, 1958; Ильенко, 1960). В опытах Р. Бенда (Benda, 1958а)
были получены несколько иные результаты, в частности, наблюдалось
значительное снижение титра вируса в нимфах после питания иммунной
кровью. У самок защитное действие антител крови хозяина проявлялось
в исчезновении способности к трансовариальной передаче вируса.
Прямые микроскопические наблюдения над циркуляцией вируса
в организме клещей отсутствуют. По данным раститровки отпрепарован-
ных органов самок I. persulcatus и Haemaphysalis concinna на разных сро-
ках после инфицирующего кормления установлена преимущественная
локализация вируса весенне-летнего энцефалита внутри клеток средней
кишки и, в меньшей степени, в слюнных железах, яичнике, нервном ганг-
лии и мальпигиевых сосудах. Заражение вирусом слюнных желез и дру-
гих внутренних органов свидетельствует об его проникновении из кишеч-
ника в полость тела (Павловский и Соловьев, 1940, 1941).
В клещах установлено интенсивное размножение вируса, так что
в самках Ixodes persulcatus его концентрация увеличивалась в 1000 раз
на 40-й день после заражения (Шубладзе и Сердюкова, 1939). После инфи-
цирующего кормления нимф I. ricinus в первые 2—4 недели количество
вируса возрастало на 1—3 логарифмические единицы. Трансфазовая пере-
- 260 -
Таблица 51
Сведения об основных арбовирусах, передаваемых иксодоидными клещами
в природных очагах
Заболевание Распространение Основные переносчики Транс- фазо- вая пере- дача Транс- овари- альная пере- дача Дикие позвоноч- ные — резервуары ифекции
Весенне-летний энцефалит. Лесная зона евро- пейской и азиат- ской части СССР. Ixodes persul- catus, Ixodes ricinus и др. + + Многие виды млекопитаю- щих и птиц.
Двухволновой ме- нингоэнцефалит (центральноев- ропейский энце- фалит). Лесные районы европейской ча- сти СССР, стран Восточной и Центральной Европы. Ixodes ricinus. + + То же.
Шотландский эн- Англия. To же. + — Овцы и козы.
цефалит, или вертячка овец.
Вирус Повассан. Канада и США. Dermacentor andersoni. + — Мелкие млеко- питающие.
Омская геморра- гическая лихо- Лесостепь Запад- ной Сибири. Dermacentor pictus. + + Грызуны.
радка.
Кизанурская ли- хорадка. Лесные районы Индии. Haemaphysalis spinigera и другие виды этого рода. + + Обезьяны и мелкие лес- ные млеко- питающие.
Малайский вирус (Лангат). Джунгли Малай- ского полуост- рова. Ixodes granu- latus. + — Грызуны.
Крымская и сред- неазиатская ге- моррагические лихорадки. Степные районы юга европей- ской части СССР и Сред- няя Азия. Hyalomma plumbeum, H. anatoli- cum. + Грызуны и, возможно, птицы.
Колорадская кле- щевая лихорад- ка. США. Dermacentor andersoni и другие виды иксодид. + — Грызуны.
Лихорадка Запад- ного Нила. Африка, Ближний Восток и Среди- земноморье. Виды родов Argas, Orni- thodoros и Hyalomma. + — Птицы.
Болезнь овец Най- роби. Восточная Аф- рика. Rhi picephalus appendicula- tus. + — Циркуляция между овца- ми и козами.
Кемеровский ви- рус. Юг Центральной Сибири. Ixodes persul- catus. Дан- ных. нет — —
дача представляет правило для вирусов группы клещевого энцефалита,
но при подготовке нимф I. ricinus к линьке в них происходило уменьшение
титра вируса. У голодавших самок его величина существенно не менялась,
а питание приводило к значительному росту титра. Последнее объясняется
как повторным заражением клещей во время их кормления, так и интен-
сификацией размножения возбудителя в их организме в этот период (Benda,
1958а).
- 261 -
Следует отметить, что линька клещей необязательно связана с умень-
шением концентрации арбовирусов в их организме. Например, при транс-
фазовой передаче вируса колорадской клещевой лихорадки клещами
Dermacentor andersoni вскоре после питания титр вируса не менялся или
даже слегка уменьшался, а при подготовке к линьке увеличивался на
0.2—3.7 логарифмические единицы (Rozeboom a. Burgdorfer, 1959).
Интенсивность размножения вируса в клещах определяется также вели-
чиной исходной дозы, полученной при питании, как установлено для нимф
Ixodes ricinus и вируса двухволнового менингоэнцефалита (Benda, 1958а)
и для Haemaphysalis spinigera и вируса кизанурской лихорадки (Varma
a. Smith, 1960).
Пожизненное носительство вируса клещевого энцефалита обеспечи-
вает возможность его перезимовки в организме как голодных, так и напи-
тавшихся клещей (Левкович и Скрынник, 1940; Rehacek, 1960). Важную
роль в циркуляции и сохранении вируса в природных очагах играет спо-
собность клещей к его трансовариальной передаче. Последняя отмечена
для нескольких видов иксодид и различных штаммов вируса клещевого
энцефалита как в потомстве спонтанно инфицированных клещей, так и
после их лабораторного заражения. Однако специальные количественные
исследования этого феномена весьма немногочисленны.
Трансовариальная передача вируса клещевого энцефалита, по-види-
мому, непостоянна. Вирус передается не всеми инфицированными сам-
ками, а в положительных случаях — лишь части потомства. Так после
инфицирующего кормления самок Ixodes ricinus вирус двухволнового
менингоэнцефалита обнаруживался у 3—6% личинок, а при очень силь-
ной виремии или после внутриполостного введения возбудителя — у 20—
21%. Считается, что в природных очагах трансовариальная передача
этого вируса не может превышать 10% (Benda, 1958а; Rehacek, 1962а).
В. И. Ильенко и Т. С. Горжанкина (1964) отмечают неравномерность
зараженности потомства у самок 7. persulcatus и I. ricinus, собранных
в природе или инфицированных в лаборатории. Эти различия объясняются
различной продолжительностью питания на больных животных и напря-
женностью виремии в это время. Роль исходной дозы вируса при после-
дующей трансовариальной передаче выяснена для клещей Haemaphysalis
spinigera и возбудителя кизанурской лихорадки (Singh a. oth., 1963).
После инфицирующего кормления этих клещей возбудитель постоянно
проникал в гемолимфу, но его концентрация была недостаточной, чтобы
вызвать заражение развивающихся ооцитов. Последнее удалось осуще-
ствить только после внутриполостного введения вируса.
Уже в первых исследованиях о роли клещей в эпидемиологии весенне-
летнего энцефалита была установлена передача возбудителя со слюной
при питании клеща на восприимчивом позвоночном (Павловский, 19406).
Для заражения белой мыши, согласно П. А. Петрищевой и Е. Н. Левкович
(1949), достаточно 2—3-дневного кормления на ней 2—5 личинок Ixodes
persulcatus или 3—7 личинок I. ricinus. Наибольшее количество вируса
выделяется при питании самок, меньше у нимф и наименьшее количество
личинками (Benda, 1958b), что соответствует общему его содержанию в ор-
ганизме клещей. В эксперименте передача вируса была получена и при
прерывистом кормлении клещей одной фазы развития сперва на больных,
а затем на здоровых животных (Чумаков, 1944). Весьма значительные
количества вируса выделяются в испражнениях питающихся клещей,
но эпидемиологическое значение этого факта пока не исследовано (Benda,
1958b).
У иксодовых клещей, по-видимому, отсутствует строгая видовая спе-
цифичность к заражению арбовирусами. Так, вирус весенне-летнего эн-
цефалита не только длительные сроки сохранялся в клещах родов Нуа-
- 262 -
lomma и Rhipicephalus, но передавался ими позвоночным и трансовариально
(Чумаков и др., 1945). В организме клещей успешно размножаются и даже
передаются трансовариально многие комариные вирусы (группа лошади-
ных энцефаломиэ литов, японский энцефалит и др.). Последнее отсут-
ствует даже у их специфических переносчиков — комаров. Напротив,
клещевые вирусы, как правило, не способны к длительному сохранению
в кровососущих двукрылых (Smith, 1964).
Заражение клещей арбовирусами не влияло на их жизнеспособность,
и в организме членистоногого не были обнаружены какие-либо патологиче-
ские изменения. Не удалось выявить и изменений свойств вируса двух-
волнового менингоэнцефалита после его многомесячного нахождения в кле-
щах Erodes ricinus, включая зимовку и трансовариальную передачу (Benda,
1958а, 1958b; Rehacek, 1960).
РИККЕТСИИ
Иксодовые клещи служат не только переносчиками большинства пато-
генных для теплокровных риккетсий, но и резервуарами последних,
обеспечивая возможность трансовариальной передачи возбудителя на
протяжении по крайней мере двух-трех поколений. Кроме того, с клещами
связана исключительно обширная, но почти не изученная группа так
называемых симбиотических риккетсий, по-видимому, не патогенных для
организма позвоночных.
В современных руководствах риккетсии объединяются в сем. Rickett-
siaceae, входящее в отряд Rickettsiales (Здродовский и Голиневич, 1956).
К. Филип (Philip, 1956, 1963b) выделяет среди риккетсий, связанных с кле-
щами, 3 трибы. В трибе Rickettsieae объединяются все патогенные для чело-
века виды родов Rickettsia и Coxiella. Виды рода Rickettsia на основании
серологических особенностей и по поведению в позвоночных и членисто-
ногих относят к подродам Rickettsia, Dermacentroxenus и Zinssera. Иногда
этим подродам придается родовой ранг. С иксодовыми клещами особенно
тесно связаны представители подрода Dermacentroxenus — возбудители
риккетсиозов группы пятнистых лихорадок, и Coxiella burneti — возбу-
дитель лихорадки Ку. При искусственном инфицировании и остальные
представители группы, исключая Zinssera tsutsugamushi, успешно разви-
ваются в организме иксодовых и аргасовых клещей (Weyer, 1964). В по-
следнее время появились сообщения (Reiss-Gutfreund, 1961) о спонтанной
инфицированности клещей Amblyomma variegatum, A. lipidum к Hyalomma
rufipes возбудителем эпидемического сыпного тифа Rickettsia prowazeki
в Эфиопии. Одновременно доказана восприимчивость нескольких видов
клещей к этим риккетсиям при лабораторном заражении (Kordova a. Re-
hacek, 1964; Гроховская и др., 1966), что, возможно, прибавит риккетсий
Провачека к кругу видов, связанных с клещами.
В трибу Ehrlichieae входят возбудители риккетсиозов низших обезьян,
копытных и хищных, относимые к родам Ehrlichia и Cowdria. Иксодовые
клещи являются резервуаром и переносчиками обоих родов. Наиболее
известны Cowdria ruminantum — возбудитель водянки сердца у крупного
рогатого скота в Африке, передаваемый видами рода Amblyomma, Ehrli-
chia canis, паразитирующий в моноцитах собак и передаваемый Rhipice-
phalus sanguineus, и Ehrlichia phagocytophila — возбудитель болезни овец
в Англии, передаваемый Ixodes ricinus.
В группе Wolbachieae объединяются виды, встречающиеся только в на-
секомых и клещах, причем многие из них весьма патогенны для своих
хозяев. В иксодовых и аргасовых клещах встречаются только виды рода
Wolbachia, часто называемые «симбионтами».
- 263 -
Группа клещевых пятнистых лихорадок. Среди риккетсий подрода
Dermacentroxenus наиболее детально взаимоотношения с клещами про-
слежены для возбудителя лихорадки Скалистых гор — Rickettsia {Der-
macentroxenus) rickettsi. Этот возбудитель и вызываемое им заболевание
широко распространены в США, ряде районов Мексики и Канады.
Основными переносчиками этих риккетсий служат клещи Dermacentor
variabilis и D. andersoni, спонтанная инфицированность которых колеб-
лется от 1 до 3%. В циркуляции возбудителя среди грызунов важная роль
принадлежит клещам Haemaphysalis leporis-palustris, Dermacentor paruma-
pertus и АтЫуотта americanum. В лабораторных условиях доказана вос-
приимчивость к инфекции у нескольких десятков видов иксодовых и ар-
гасовых клещей. Для Dermacentor variabilis и D. andersoni установлены
три возможных пути заражения возбудителем: инфицирование «чистых»
клещей при питании на животных с риккетсиемией, трансовариальная
передача и передача риккетсий самкам вместе со спермой инфицирован-
ных самцов.
Передача инфекции легко осуществляется при совместном кормлении
инфицированных и «чистых» клещей на восприимчивых животных. В оп-
тимальных условиях (Price, 1954а) при инфицирующем кормлении на
полевках Microtus pennsylvanicus удавалось заразить 76% питавшихся
личинок и 81% нимф, а на собаках — 82% половозрелых особей. Если
«чистые» клещи подсаживались через 10 дней и позже начала кормления
инфицированных особей, то их заражения не наблюдалось в связи с быст-
рым исчезновением риккетсий из кровяного русла позвоночного.
Трансовариальная передача наблюдалась в опытах В. Прайса (Price,
1954а) у 30—40% от общего числа самок Dermacentor variabilis, инфици-
рованных в личиночной или нимфальной фазах. Риккетсии обнаружива-
лись далеко не во всех яйцах или полученных из них личинках. В клад-
ках 50 % самок (из числа обеспечивших трансовариальную передачу)
инфицированным оказалось 1 яйцо на каждые 5—10 исследованных,
в 35% — 1 на каждые 20—40 и в 15% — 1 на каждые 2—4.
В опытах В. Бургдорфера (Burgdorfer, 1963), пользовавшегося иммуно-
флуоресцентной методикой определения R. (Dermacentroxenus) rickettsi
на срезах через клещей Dermacentor andersoni, риккетсии обнаруживались
в 100% ооцитов инфицированных самок материнского поколения, а также
у 100% полученных от них особей Fx и F2. Риккетсии были обнаружены
в цитоплазме ооцитов и эпителиальных клеток яичников голодных кле-
щей, у питающихся особей количество риккетсий в растущих ооцитах
заметно увеличивалось. 100% трансовариальная передача была обнару-
жена и у спонтанно инфицированных самок, накормленных в лаборатории.
Несоответствие между 100 % трансовариальной передачей возбудителя
в экспериментах и сравнительно невысокой зараженностью клещей в при-
родных очагах Бургдорфер объясняет различной степенью интенсивности
инфицирования клещей после кормления их на лабораторных животных
с высокой риккетсиемией и на диких животных с большей частью низкой
концентрацией риккетсий в крови.
Распространение риккетсий внутри популяций клещей возможно также
в процессе оплодотворения инфицированными самцами «чистых» самок
во время спаривания на теле копытных и других крупных позвоночных,
не восприимчивых к R. (Dermacentroxenus) rickettsi (Philip a. Parker,
1933). Риккетсии при этом переносятся со спермой в оплодотворяемые
яйца и в дальнейшем из последних развиваются инфицированные клещи
следующего поколения. В связи со способностью одного самца к последо-
вательному оплодотворению нескольких самок этот путь может быть до-
статочно эффективным, хотя процент инфицированности потомства остается
не исследованным.
- 264 -
Риккетсии, поступившие в организм клеща при инфицирующем кор-
млении, вскоре обнаруживаются в клетках средней кишки, где происхо-
дит их интенсивное размножение. Из кишечника часть риккетсий прони-
кает в гемолимфу, а из нее в слюнные железы, яичник, мальпигиевы со-
суды, мышечную и нервную ткани. Значительное количество риккетсий
выделяется из клещей вместе с фекалиями, но этот способ передачи возбу-
дителя, по мнению К. Филипа (Philip, 1959а), не имеет существенного
эпидемиологического значения. Вне организма клеща инфицирующая
способность риккетсий быстро теряется, так что главным путем передачи
служит введение возбудителя со слюной непосредственно в органпзм
хозяина.
Пребывание риккетсий в организме клеща оказывает определенное
влияние на свойства возбудителя. В. Прайсом (Price, 1954а) установлено,
что обязательным условием существования риккетсий в организме клещей
служит периодическое питание последних на теплокровных животных,
вероятно, стимулирующее размножение возбудителя. Напротив, длитель-
ное голодание может привести к полной утрате возбудителя. Так, в голо-
дающих самках и самцах Dermacentor variabilts, инфицированных в ли-
чиночной или нимфальной фазах, быстрое уменьшение количества риккет-
сий в организме началось на 8-м месяце голодания, а через 14—16 месяцев
они отсутствовали у всех исследованных особей.
Перезимовывание риккетсий в организме клещей, а в ряде случаев
и трансфазовая передача приводили к утрате вирулентности, так что при
инфицировании ими морских свинок возникало лишь бессимптомное но-
сительство. Изменения вирулентности имели обратимый характер. Ис-
ходная вирулентность штаммов легко восстанавливалась в процессе пи-
тания клещей на теплокровных животных или при нахождении их в те-
чение 48 час. при 37° (Parker a. Spencer, 1926; Price, 1954b).
От клещей Dermacentor andersoni из различных географических точек
США были изолированы 4 штамма риккетсий, различающихся по виру-
лентности для морских свинок. При этом клещам приписывается важная
роль в поддержании в природе штаммов с высоким уровнем вирулентности,
хотя причины этого явления неизвестны. Установлено, что длительное
пассирование риккетсий непосредственно от позвоночного к позвоночному
приводило к снижению их вирулентности, тогда как пассирование через
клещей восстанавливало вирулентность.
Из других видов риккетсий группы клещевых пятнистых лихорадок
очень широко распространена R, (Dermacentroxenus) conori. Переносчи-
ками этого вида в странах Южной и Восточной Африки служат клещи
Rhipicephalus sanguineus, R, appendiculatus, R. simus, Haemaphysalis
leachii, Amblyomma hebraeum и некоторые другие виды, в Средиземноморье,
включая Черноморское побережье СССР,—преимущественно Rhipicepha-
lus sanguineus, в Индии и странах Юго-Восточной Азии — еще недо-
статочно изученные виды родов Haemaphysalis, Rhipicephalus, Ixodes
(Hoogstraall, 1967). В клещах Rhipicephalus sanguineus риккетсии были об-
наружены в клетках кишечника, слюнных желез, гиподермы и яичника.
Установлено длительное сохранение риккетсий в переносчике, включая
феномены трансфазовой и трансовариальной передачи.
Во многом сходны с описанными для предыдущих видов взаимоотно-
шения с клещами риккетсий R, (Dermacentroxenus) sibiricus — возбуди-
теля клещевого сыпного тифа Северной Азии. Вызываемое этим видом рик-
кетсий заболевание распространено на огромной территории от Дальнего
Востока до Казахстана и Киргизии преимущественно в лесостепных и
степных ландшафтах. В качестве переносчиков R, (Dermacentroxenus)
sibiricus известны клещи Dermacentor nuttalli, D. silvarum, D. marginatus,
D, pictus, Haemaphysalis concinna и H, punctata, а из позвоночных резер-
- 265 -
вуарами могут быть многие виды грызунов. Многочисленными опытами
показана передача риккетсий через укус клещей и инфицирование по-
следних при питании на животных с риккетсиемией в крови (Здродов-
ский и Голиневич, 1956; Пионтковская и Коршунова, 1960: Лысковцев,
1963).
В природных очагах этого риккетсиоза возбудитель перезимовывает
в организме взрослых клещей. Весной клещи питаются на крупных ди-
ких животных или домашнем скоте, обычно не восприимчивых к R. (Der-
macentroxenus) sibiricus. Зараженные личинки и нимфы питаются на гры-
зунах, среди которых в летний период высок процент восприимчивого
к инфекции молодняка. Заболевшие после нападения зараженных клещей
животные в свою очередь обеспечивают инфицирование новых линий кле-
щей, поддерживая таким образом непрерывность циркуляции возбуди-
теля в очаге (Лысковцев, 1963). Питание клещей на иммунных животных^не
приводило к исчезновению в них риккетсий (Гроховская и др., 1964). Уста-
новлено многомесячное сохранение возбудителя в организме клещей,
а также его трансфазовая и трансовариальная передача. Так, от полово-
зрелых Dermacentor marginatus третьего поколения удалось выделить
риккетсий, спустя 4 года после инфицирующего кормления родительского
поколения. Пребывание риккетсий в клещах не нарушало жизненные
функции последних и в то же время не сказывалось на свойствах возбу-
дителя (Пионтковская и Коршунова, 1951, 1953). В клещах D. marginatus
после заражения их инфицирующим кормлением или парэнтерально рик-
кетсии обнаруживались преимущественно в клетках соединительноткан-
ных элементов и гемолимфы. Кроме того, их много в клетках средней кишки
и в слюнных железах. В полости кишечника отмечено исчезновение рик-
кетсий вскоре после питания, а затем повторное появление при разруше-
нии заселенных ими клеток (Крючечников, 1966).
Лихорадка Ку. Возбудитель лихорадки Ку — Coxiella burneti по ряду
биологических и эпидемиологических особенностей (способность к филь-
трации, исключительная устойчивость к абиотическим факторам среды,
полиадаптивность и многообразие путей передачи) заметно отличается
от других риккетсий.
В природных очагах среди различных групп кровососов наиболее
тесные связи с риккетсиями Бернета наблюдаются у иксодовых и, в мень-
шей степени, у аргасовых клещей. В настоящее время известно не менее
62 видов кровососущих клещей, для которых установлено естественное
риккетсионосительство и в том числе в СССР более 20 видов иксодовых
и 3 вида аргасовых клещей (Тарасевич, 1957; Дайтер, 1966; Weyer, 1953;
Rehn, 1958; Philip a. Burgdorfer, 1961).
Для иксодид установлено пожизненное сохранение возбудителя, его
трансфазовая и трансовариальная передача, выделение на протяжении
всего периода наблюдений вместе с фекалиями, а также отсутствие инак-
тивации риккетсий в голодающих особях или во время зимовки. Макси-
мальные сроки переживания риккетсий в клещах и их выделения в фе-
калиях достигали для Ixodes ricinus 572 дней, а для Hyalomma asiaticum,
включая особей дочернего поколения, 737 дней, что не является пределом
(Дайтер, 1963а). Еще более длительные сроки переживания риккетсий
прослежены для клещей рода Ornithodoros. Половозрелые особи О. pa-
pillipes сохраняли возбудителя более 6 лет, причем голодание в течение
2090 дней не вело к их самоочищению (Дайтер и Громова, 1966). В сухих
погибших клещах того же вида риккетсии сохранялись на протяжении
И лет (Петрищева и др., 1964). Из клещей О. hermsi они были выделены
спустя 979 дней после заражения (Davis, 1943), из О. gurneyi — через
538 дней (Smith, 1942), О. turicata — через 1001 день (Davis, 1940) и
из О. moubata — через 1301 день.
- 266 -
Судьба риккетсий Бернета в различных видах иксодоидных клещей
была прослежена как после поступления их в организм вместе с инфици-
рованной кровью хозяина (Smith, 1940, 1941, 1942), так и после внутрипо-
лостного заражения (Weyer, 1953; Тарасевич, 1957) преимущественно
путем исследования мазков из отпрепарованных органов. В этих работах
было установлено размножение возбудителя в организме клещей, его
проникновение в гемолимфу и последующее распространение во многие
органы. Более полная картина циркуляции риккетсий Бернета в клещах
была получена исследованием серийных гистологических срезов через
клещей Hyalomma asiaticum и Ornithodoros papillipes на разных сроках
после их заражения инфицирующим кормлением на морских свинках
(Балашов и Дайтер, 1963, 1965).
В наших опытах нимфы Hyalomma asiaticum заражались во время их
питания на лихорадящих морских свинках. Риккетсии могли поступать
в их кишечник в течение всех 6—8 дней питания клещей. Уже в первые
дни после отпадения напитавшихся нимф, судя по результатам биопроб,
в них содержалось достаточное количество риккетсий, чтобы вызвать за-
ражение восприимчивых животных, но на срезах и мазках в этот период
они еще сравнительно немногочисленны (табл. 52). В содержимом кишеч-
ника выявлялись лишь одиночные риккетсии. В небольшом числе они
были найдены внутри клеток средней кишки, причем были расположены
одиночно или мелкими группами. В остальных тканях и органах риккет-
сии в первые трое суток после окончания питания не обнаружены.
Интенсификация гистогенеза при подготовке к линьке не только не
препятствует, но, по-видимому, даже благоприятствует размножению
риккетсий. Последние довольно быстро (на 3—4-е сутки) исчезают из
полости кишечника, но зато накапливаются в пищеварительных клетках.
Уже через 5 суток после отпадения клеща от инфицированного хозяина
в них можно обнаружить значительные скопления риккетсий Бернета.
Последние чаще занимают базальные части клеток между ядрами и ба-
зальной мембраной (рис. 449).
В сильно инфицированных клетках риккетсии Бернета рассеяны по
всей цитоплазме, включая весьма вакуолизированную и богатую пищевыми
включениями дистальную зону. Довольно часто риккетсии образуют
сферические скопления диаметром в 15—20 мк. Инфицированные клетки
также распределены более или менее равномерно по всему среднему отделу
кишечника. После окончания питания (1—5-е сутки) одна зараженная
клетка приходится на 80—120 незараженных, а к концу линьки (20—
25-е сутки) — на 10—20.
Размножение риккетсий в полости средней кишки клещей отсутствует,
хотя в ней, особенно на поздних сроках после заражения (15—20-е сутки),
постоянно обнаруживаются одиночные формы или небольшие группы воз-
будителя. Поступление их в полость кишечника в этот период связано
с процессом постоянного разрушения части клеток кишечника, включая
и инфицированные.
На первой неделе после инфицирующего кормления клещей часть
риккетсий проникает через стенки кишечника в гемолимфу, где они рас-
полагаются преимущественно внеклеточно, но могут быть обнаружены
также и в гемоцитах. В гемолимфе наблюдается интенсивное размножение
возбудителя. Первые одиночные риккетсии определяются в крови нимф
на 5-е сутки после инфицирования последних, а на 20-е сутки риккетсии
становятся многочисленны и местами образуют скопления. Из гемолимфы
они могут заселять все системы внутренних органов, но в значительном ко-
личестве встречаются только в рыхлой соединительной ткани тяжей жиро-
вого тела и в яичнике. Возможно, что они также многочисленны в гиподер-
мальных клетках, но очень сильная базофилия последних затрудняет
- 267 -
Таблица 52
Локализация риккетсий Бернета в организме клеща Hyalomma asiaticum (по материалам исследования срезов)
Фаза развития и физиологическое состояние Срок после инфици- рующего кормления, в днях Средний отдел кишечника Содержимое рек- тального пузыря Мальпигиевы сосуды Слюнные железы LJ Гемолимфа Жировое тело Гиподерма Мышцы Нервная система Яйцеклетки
полость пищевари- тельные клетки отторгнутые клетки плазма гемоциты
Нимфа: напитавшаяся, сразу по от- падении 1 + +
начало линьки 1-3 + + — — — — — —. — .— —
» » 4—10 — Н—F — — — — ± — — — — — —
середина линьки 13-15 — Н—F + — — — + + — — — — —
конец линьки 15—23 + -]—|—р ++ — — — ++ + ± — — — ±
Имаго: стадия послелиночного до- развития 22-31 ++ +++ +++ +++ + + + + +
после окончания послели- ночного доразвития 39—55 ± ++ + — — — + + + ± — — +
пятые сутки кормления на здоровой морской свинке 60 ++ + ++ ++ — — + + + + — — +4
Дочернее поколение (FJ: голодные личинки голодные нимфы 200—240 300-330 — +1+1 — — — — — — — — — — —
нимфы на четвертые сутки кормления на здоровой морской свинке 332 + __
самки на стадии послели- ночного доразвития 360-389 ± + + + — — ± — + — — — —
Примечание, — отсутствие риккетсий; ± одиночные, + десятки, ++ сотни и +++ количество риккетсий не поддается подсчету.
выявление возбудителя (табл. 52). В то же время они отсутствовали в цито-
плазме мышечных и нервных клеток, а также внутри клеток и в полости
альвеол слюнных желез. Напротив, на поверхности соединительноткан-
ных оболочек, окружающих эти органы, часто наблюдались значитель-
ные скопления риккетсий Бернета, занесенных из гемолимфы. Возбуди-
тель лихорадки Ку часто встречается внутри клеток мальпигиевых
сосудов и в ооцитах, но здесь их трудно с достаточной достоверностью
отличить от «симбиотических» форм рода Wolbachia.
У половозрелых клещей, перелинявших из зараженных нимф, ло-
кализация возбудителя в организме та же, что и у нимфальной фазы.
Основная масса риккетсий находится внутри клеток кишечника (рис. 450).
Кроме того, они достаточно многочисленны в клетках жирового тела,
в гемоцитах и, реже, в других органах и тканях. Внеклеточные риккетсии
в гемолимфе клещей у голодных особей встречаются значительно реже,
чем на стадии питания и линьки. С началом имагинального питания общее
распределение риккетсий в организме существенно не меняется. Интен-
сификация процессов пищеварения связана с массовым отторжением се-
креторных и пищеварительных клеток, так что поступление возбудителя
в полость кишечника значительно увеличивается. В то же время количе-
ство инфицированных клеток кишечника в этот период может даже не-
сколько уменьшаться (1 зараженная на 70—80 «чистых» в середине стадии
питания и на 15—25 у голодных особей). Последнее можно объяснить тем,
что образование новых клеток в этот период идет значительно быстрее,
чем их заражение риккетсиями. К концу питания и у напитавшихся самок
количество зараженных клеток вновь увеличивается до 1 на 30—40 не-
зараженных и многие из них содержат огромное количество возбудителя.
Общие особенности циркуляции риккетсий Бернета в организме клещей
Hyalomma asiaticum после инфицирующего кормления представлены
на рис. 456. Сходные особенности в локализации и диссеминации этого воз-
будителя установлены и для клещей Ornithodoros papillipes (Балашов
и Дайтер, 1965).
Характер распределения возбудителя в организме иксодоидных кле-
щей предопределяет и пути его передачи позвоночным животным. Главным
местом локализации риккетсий Бернета служат пищеварительные клетки
средней кишки. При разрушении их возбудитель выводится в просвет
кишечника, а физиологические особенности питания клещей сем. Ixodidae
облегчают его дальнейшее выделение из организма. Многодневное крово-
сосание клещей связано с интенсивным перевариванием крови и выделе-
нием в этот период в виде фекалий больших количеств экскретов и полу-
переваренной крови. Вместе с фекалиями наружу выводятся и риккетсии
Бернета, весьма многочисленные в этот период в полости кишечника и
ректального пузыря.
Высокая инфекциозность фекалий зараженных клещей Hyalomma asia-
ticum подтверждена биологическими пробами (Дайтер, 1963а), причем
была установлена их инфекциозность для морских свинок в разведении
до 10“10. Хранение фекалий в течение 635 дней не привело к полной гибели
возбудителя. Сходные данные приводятся и для других видов. Так,
К. Филипом (Philip, 1948) было показано присутствие возбудителя в фе-
калиях клеща Dermacentor andersoni, спустя 586 дней после инфицирова-
ния. По данным Д. Смита (Smith, 1941), в 1 г сухих испражнений Rhipi-
cephalus sanguineus через 65 дней после их сбора было 100 000 000 инфек-
ционных доз для морских свинок.
У закончивших питание клещей выделение фекалий почти полностью
прекращается и возобновляется только после линьки на нимф или имаго.
При этом сразу же после линьки и до окончания стадии послелиночного
доразвития с фекалиями выносится большое количество инфицированного
— 269 —
Рис. 456. Циркуляция риккетсий Бериета в организме клеща Hyalomma asiaticum.
А — нимфа в первые дни после насыщения на инфицированном хозяине, переход риккетсий из полости кишечника в клетки его стенок; Б — нимфа в середине
стадии линьки, размножение риккетсий в клетках средней кишки, миграция части их в гемолимфу или поступление в полость кишечника при разрушении инфи-
цированных клеток; В — голодная самка, риккетсии из гемолимфы проникли во многие внутренние органы, из полости кишечника часть риккетсий. выво-
дится наружу вместе с фекалиями; Г — самка, питающаяся на здоровом хозяине, интенсивное размножение возбудителя и выведение его из организма клеща
вместе с фекалиями и полупереваренной кровью, заселение риккетсиями части развивающихся ооцитов.
гл — глотка; нг — нервный ганглий; пв — пищевод; гм — гемолимфа; гп — гиподермальные клетки; ск — средняя кишка; ;ис — мальпигиев сосуд;
зя — зачаток яичника; рп — ректальный пузырь; зк — задняя кишка; ан — анальное отверстие; тк — тонкая кишка; сж — слюнная железа; я — яичник;
ок — отторгнутые в полость кишечника пищеварительные клетки; вл — влагалище; лп — линочная полость; тж — тяжи жирового тела; рк — риккетсии;
звл — зачаток влагалища.
содержимого средней кишки. Таким образом, по крайней мере на двух
стадиях жизненного цикла (питание и послелиночное доразвитие) клещи
могут быть эффективными рассеивателями возбудителя (по терминологии
В. fl. Беклемишева, 1955) во внешней среде. При питании зараженных кле-
щей поврежденные покровы теплокровных хозяев в местах прикрепления
членистоногих служат входными воротами для возбудителя, попадающего
вместе с фекалиями на поверхность кожи в таких участках. Кроме того,
пылевидность высохших испражнений клещей облегчает возможность рес-
пираторного или алиментарного путей передачи этой инфекции.
У аргасовых клещей наряду с фекалиями возбудитель может выво-
диться во внешнюю среду вместе с коксальной жидкостью. Достаточно
высокая инфекциозность коксальной жидкости у зараженных клещей
Ornithodoros papillipes была доказана экспериментально (Дайтер и Амо-
сенкова, 1961), причем этому пути передачи благоприятствуют частые
случаи выделения коксальной жидкости во время питания на теле хозяина.
С другой стороны, у О. moubata и некоторых других видов сообщение сред-
ней кишки с ректальным пузырем отсутствует, испражнения свободны
от риккетсий и значение коксальной жидкости в их выведении из орга-
низма соответственно увеличивается (Weyer, 1953).
Значительно сложнее проблема передачи риккетсий Бернета со слю-
ной. По-видимому, возбудитель далеко не постоянно проникает внутрь
клеток слюнных желез и далее в слюну. Случаи обнаружения риккетсий
этого вида в мазках из слюнных желез (Weyer, 1953; Тарасевич, 1957)
могут быть объяснены загрязнением их инфицированной гемолимфой
или же особенно интенсивной инфекцией после внутриполостного зара-
жения в опытах этих исследователей. Таким образом, для окончательного
решения вопроса о возможности инокулятивной передачи риккетсий Бер-
нета со слюной требуются дополнительные эксперименты, исключающие
возможность заражения хозяев фекалиями клещей, а также исследования
слюнных желез после введения в организм переносчика различных доз
возбудителя.
Трансовариальная передача риккетсий Бернета иксодовыми клещами
непостоянна. У части инфицированных клещей Hyalomma asiaticum и
Ornithodoros papillipes в растущих ооцитах наряду с характерными груп-
пами более крупных «симбионтов» встречаются и более мелкие риккетсии
Бернета (рис. 452). У личинок, получивших возбудителя подобным путем,
риккетсии очень немногочисленны и встречаются только в клетках кишеч-
ника. Подобная же локализация свойственна и голодным нимфам. На
стадиях питания и линьки нимф в имаго в их клетках несомненно наблю-
дается накопление Coxiella burneti. В конце линьки и у недавно перели-
нявших самок Hyalomma asiaticum (389-й день после заражения) наряду
с пищеварительными клетками группы риккетсий обнаруживаются в по-
лости кишечника и ректального пузыря. Часть риккетсий (далеко не
у всех инфицированных клещей) проникает сквозь базальную мембрану
кишечника в гемолимфу и инфицирует тяжи жирового тела и развиваю-
щиеся ооциты. Однако даже в основном месте их накопления — пищева-
рительных клетках — риккетсий всегда много меньше, чем при трансфа-
зовой передаче после инфицирующего кормления. В этом случае одна ин-
фицированная клетка приходится на 100—150 незараженных. Дальнейшие
наблюдения (свыше 389 суток) над судьбой возбудителя по циклу разви-
тия клещей нами не проводились. Тем не менее несомненно, что обнаруже-
ние риккетсий в гемолимфе отдельных клещей первого дочернего поколения
создает возможность инфицирования ооцитов и передачи возбудителя сле-
дующей генерации.
«Симбиотические» риккетсии. Впервые мелкие микроорганизмы, по-
стоянно обитающие в клещах рода Rhipicephalus из Южной Африки, были
- 271 -
обнаружены еще в конце прошлого века Р. Кохом. В дальнейшем сходные
формы были найдены в организме многих видов иксодовых и аргасовых
клещей из разных стран. В первом специальном исследовании (Gowdry,
1925), посвященном этой группе, описываемые микроорганизмы были най-
дены во всех особях 17 видов клещей, установлен феномен их трансова-
риальной передачи и высказано предположение об их принадлежности
к риккетсиям. Локализация, диссеминация и особенности морфологии
микроорганизмов из разных видов клещей были подробно описаны не-
мецкими исследователями (Mudrow, 1932; Jaschke, 1933) и ими же была
выдвинута гипотеза об их симбиотической природе.
Принадлежность этих микроорганизмов к риккетсиям была оконча-
тельно установлена на основании детального изучения ультратонкого
строения, гистохимических особенностей и метаболизма «симбионтов»
клеща Argaspersicus (Roshdy, 1961b, 1964a, 1964b; Suitor, 1964). В настоя-
щее время их объединяют вместе с другими риккетсиями членистоногих
в род Wolbachia (Krieg, 1963; Philip, 1963b). В целом систематика «симбио-
тических» риккетсий клещей совершенно не разработана и до сих пор ждет
решения вопрос о том, представляют ли риккетсий из близких видов кле-
щей самостоятельные виды или же они относятся к одному виду.
В настоящее время можно считать установленным постоянное нахо-
ждение «симбиотических» риккетсий в организме изученных в этом отно-
шении видов иксодовых и аргасовых клещей. Нами (Балашов, 1967)
были исследованы на присутствие «симбионтов» мазки или срезы мальпи-
гиевых сосудов и яичников следующих видов клещей: Ixodes ricinus,
I. persulcatus, Haemaphysalis sulcata, H. concinna, Dermacentor marginatus,
Rhipicephalus turanicus, R. sanguineus, R. bursa, Hyalomma asiaticum,
H. marginatum, Argas persicus, Alveonasus lahorensis, Ornithodoros papil-
lipes, 0. tartakovskyi, Boophilus calcaratus, полученных из различных пунк-
тов СССР. Риккетсии были обнаружены, за немногим исключением, во
всех исследованных особях независимо от географического происхожде-
ния материала и предшествующего питания на самых различных хозяе-
вах. Лишь у голодных особей Ixodes ricinus и I. persulcatus риккетсии не
выявлялись, но они обнаруживались во время питания и после его окон-
чания. У голодных особей первого вида они были выявлены методами элек-
тронной микроскопии (Roshdy, 1964b).
Пространственная локализация риккетсий в мальпигиевых сосудах
определяется видовой принадлежностью клещей. У видов родов Ixodes
(рис. 461) и Argas (рис. 458) они располагались по всему протяжению ор-
ганов, у родов Haemaphysalis, Dermacentor, Rhipicephalus, Hyalomma,
Alveonasus и Ornithodoros — в дистальных половинах (рис. 457, 459, 460,
462) и у Boophilus calcaratus — в слепых концевых участках мальпигие-
вых сосудов (рис. 463). В яичнике риккетсии встречаются как в ооцитах
и оогониях, так и внутри эпителиальных клеток.
В клетках клещей эти риккетсии встречаются только в цитоплазме,
но никогда не выявлялись внутри ядер. В мальпигиевых сосудах они
иногда буквально заполняют всю цитоплазму отдельных клеток (рис. 453),
тогда как в других бывают сравнительно немногочисленны. Присутствие
риккетсий, вероятно, не влияет на функции зараженных клеток и даже
при заселении их большим количеством микроорганизмов не вызывает
заметных разрушений. В процессе нормального физиологического оттор-
жения апикальных концов части клеток мальпигиевых сосудов риккетсии
поступают в просвет органа и вместе со сферокристаллами гуанина выно-
сятся в ректальный пузырь. Однако о способности их к переживанию вне
организма клеща ничего не известно.
Характерную особенность «симбиотических» риккетсий представляет
образование микроколоний, в состав которых входит от нескольких до 30—
— 272 —
50’Микроорганизмов, связанных между собой веществом капсулы (рис. 454).
Форма и размеры микроколоний очень сильно варьируют, но можно отме-
тить и определенное постоянство, связанное с родами и более крупными
систематическими подразделениями клещей.
Соотношение между колониальными и одиночными формами риккетсий
зависит от физиологического состояния клещей (Roshdy, 1964а). Поступле-
ние в организм клещей крови теплокровных стимулирует риккетсий к раз-
множению и в этот период преобладают одиночные формы. Микроколонии
Wolbachia persica, по мнению того же автора, могут образовываться путем
множественного деления одной особи. По нашим наблюдениям, во время
питания личинок и нимф Hyalomma asiaticum и после питания у Ornitho-
doros papillipes количество микроколоний в клетках мальпигиевых сосу-
дов было значительно меньше, чем до начала питания. Напротив, коли-
чество одиночных риккетсий значительно увеличивалось, и среди них
преобладали палочковидные и гантелевидные формы, свидетельствующие
о процессе интенсивного деления микроорганизмов.
Постоянное присутствие «симбиотических» риккетсий в клещах обеспе-
чивается 100% облигатной передачей возбудителя трансовариальным пу-
тем. Попытки искусственного заражения клещей Argas arboreus, которые
предварительно были освобождены от риккетсий путем длительного вы-
держивания при температуре 40°, инфицирующим кормлением культурой
тех же «симбионтов» или их внутриполостным введением, закончились
неудачей, хотя риккетсии длительные сроки сохранялись в полости ки-
шечника.
Процесс трансовариальной передачи «симбиотических» риккетсий де-
тально прослежен у клещей Rhipicephalus sanguineus, Boophilus annulatus
и Argas persicus с помощью светового микроскопа (Mudrow, 1932; Jaschke,
1933) и методами электронной микроскопии ультратонких срезов у A. per-
sicus (Roshdy, 1961b, 1964а). Уже у голодных клещей A. persicus, а по на-
шим наблюдениям, и у исследованных видов иксодовых клещей оогонии
и молодые ооциты заселены риккетсиями, беспорядочно разбросанными
в цитоплазме (рис. 395, 396). В растущих ооцитах происходит концентра-
ция симбионтов в крупные скопления, располагающиеся вблизи ядра.
Образованию последних часто предшествует фаза из двух скоплений по
сторонам ядра (рис. 398), которые в дальнейшем сливаются в одно (рис. 399).
С началом отложения желтка околоядерное скопление риккетсий рас-
сеивается и последние перемещаются в периферическую зону ооцита,
где лежат в тонких прослойках цитоплазмы между желточными Шарами.
В развивающихся эмбрионах симбионты оказываются внутри бластодер-
мальных клеток, а с началом обособления зародышевой полоски локали-
зация их ограничена хвостовыми долями последней. Позднее часть микро-
организмов вместе с отделяющимися бластодермальными клетками
попадает в эндодермальный зачаток мальпигиевых сосудов, а оставшиеся
в периферической зоне впоследствии оказываются в зачатке гонады. Сле-
дует отметить, что уже на фазе личинки, когда можно различить мужской
и женский зачатки гонады, риккетсии встречаются только в последнем,
но причины этого явления установить не удалось. Неясным остается и
вопрос, возможно ли заселение симбионтами новых клеток по окончании
эмбрионального развития путем перехода из инфицированных клеток
или же они передаются только потомству зараженных клеток в процессе
клеточного деления. Е. Мудрова (Mudrow, 1932) считала, что заселение
ооцитов аргасовых клещей происходит из мальпигиевых сосудов уже
у взрослых особей. М. Рошди (Roshdy, 1964а) обнаружил заселение поло-
вых клеток на стадии оогоний, но в то же время он допускает и возможность
заселения ооцитов у голодных самок иксодовых клещей из зараженных
эпителиальных клеток яичника. По нашим наблюдениям над Hyalomma
18 Ю. С. Балашов
- 273 -
asiaticum, половые клетки оказываются заселенными симбионтами уже
на стадии первичных оогоний (рис. 395), так что заселение новых клеток
в постэмбриональном развитии, по-видиМому, возможно лишь в процессе
Рис. 457—463. Локализация риккетсий рода Wolbachia в маль-
пигиевых сосудах самок аргасовых и иксодовых клещей.
457 — Alveonasus lahorensis', 458 — Argas persicus; 459 —
Ornithodoros papillipes; 460 — Hyalamma asiaticum', 461 —
Ixodes ricinus; 462 — Rhipicephalus turanicus; 463 — Bo-
ophilus calcaratus.
клеточного деления уже инфицированных клеток. При этом следует до-
пустить, что все зараженные симбионтами клетки взрослого клеща
являются прямыми потомками клеток зачатка мальпигиевых сосудов
и яичника, инфицированных на ранних стадиях эмбриогенеза. В пользу
этого предположения говорит и безуспешность попыток реинфицирования
освобожденных от симбионтов клещей путем внутриполостной инокуля-
ции последних (Suitor, 1964).
- 274 -
В заключение следует остановиться на характере взаимоотношений
между риккетсиями рода Wolbachia и клещами. В литературе общепринято
считать эту группу риккетсий симбионтами, находящимися в мутуалисти-
ческих отношениях с хозяевами-членистоногими (Buchner, 1953). Однако
подобное утверждение в основном априорно и основывается на косвенных
данных, как-то: облигатное присутствие риккетсий в организме клещей,
отсутствие патологического воздействия на организм хозяина и невоз-
можность культивирования риккетсий вне организма членистоногого.
Предполагается, что риккетсии восполняют потребности клещей в неко-
торых витаминах группы В и метаболитах, содержание которых в крови
позвоночных не обеспечивает потребностей членистоногого.
Подобная гипотеза не подтвердилась при строгой экспериментальной
проверке. Э. Суйтору (Suitor, 1964) удалось не только выделить куль-
туру W persica из клещей Argas arboreus, но и освободить клещей от
риккетсий воздействием высокой температуры. В двух партиях потом-
ства, полученных от «чистых» самок, мальпигиевы сосуды были свободны
от риккетсий, но это не влияло на жизнеспособность клещей. Учитывая
способность клещей, свободных от риккетсий, к нормальному развитию,
автор отрицает существование мутуалистических отношений. Риккет-
сии рода Wolbachia являются, как и другие представители этой группы,
облигатными внутриклеточными паразитами, но в силу ограниченной
способности к размножению в организме хозяина служат для последнего
относительно безвредными комменсалами.
В литературе по микробиологии членистоногих вслед за Е. Штейнхау-
зом (1950, 1952) принято называть симбиозом совместное существование
двух различных организмов, причем их взаимоотношения могут быть
паразитического, мутуалистического или индифферентного характера.
В то же время термин симбиоз часто употребляется (особенно немецкими
исследователями) в его узком значении для обозначения взаимовыгодных
отношений двух совместно существующих организмов, т. е. как синоним
понятия мутуализм. В применении к видам рода Wolbachia термин сим-
бионты может быть оправдан лишь в широком значении при сопоставлении
их с патогенными для позвоночных риккетсиями, учитывая, что первые
постоянно присутствуют в организме клещей, но не развиваются в тепло-
кровных, тогда как вторые обнаруживаются лишь у части особей и не
передаются всем 100% потомков инфицированной самки. В то же время
по характеру воздействия на организм хозяина обе группы ведут себя
довольно сходно и не вызывают, за редкими исключениями, внешних
патологических изменений в организме членистоногого.
АНАПЛАЗМЫ
Иксодовые клещи считаются важнейшими переносчиками анаплазм
(род Anaplasma) — возбудителей кровепаразитарных лихорадочных за-
болеваний крупного рогатого скота (Л. marginale), овец и коз (Л. ovis),
широко распространенных на территории СССР. В настоящее время по
совокупности морфологических и биохимических особенностей анаплазм
в ранге сем. Anaplasmataceae объединяют в одном отряде с риккетсиями.
Эпизоотологические особенности этого заболевания и связь его с клещами
детально рассматриваются в специальных обзорах (Piercy, 1956; Ristic,
1961; Абрамов и др., 1965). В качестве переносчиков анаплазм известны
21 вид иксодовых и 1 аргасовых клещей и этот список несомненно далеко
не полон.
Клещи получают возбудителя при питании на больных животных;
в дальнейшем он может длительные сроки сохраняться в их организме,
передаваться трансфазно и трансовариально. В то же время механизм
- 275 -
передачи анаплазм от клещей позвоночным животным во многом неясен.
Клещи передавали анаплазм во многих опытах при условии прерывистого
питания сперва на больных, а затем на здоровых животных. Однако,
в отличие от случаев простой механической передачи, при этом существо-
вал определенный инкубационный период, в течение которого передача
отсутствовала. В то же время опыты с передачей анаплазм клещами,
получившими возбудителя трансфазово или трансовариально, во многих
случаях заканчивались неудачей.
Циркуляция анаплазм в организме клещей после инфицирующего
кормления пока неизвестна. Установлена лишь их способность к размно-
жению в организме переносчика, которое особенно интенсивно в мальпи-
гиевых сосудах (Ristic, 1965).
БАКТЕРИИ
В отношении бактериальных инфекций наиболее известна роль иксо-
довых клещей в хранении и передаче туляремийного микроба Francisella
tularensis. Обширная литература по этому вопросу приводится в обзоре
Н. Г. Олсуфьева и Т. Н. Дунаевой (1960). Только на территории СССР
спонтанное носительство туляремийного микроба установлено для 17 ви-
дов иксодид (Петров, 1966). В эксперименте способность к сохранению и
передаче этого возбудителя установлена для многих видов иксодид и
5 видов аргасовых клещей. Наиболее эффективными переносчиками
служат виды рода Dermacentor. К заражению оказались способными
все фазы развития при условии их кормления на животных с достаточно
высоким уровнем бактериемии крови. Напротив, при кормлении личинок
Dermacentor marginatus на мало чувствительных к инфекции животных
клещи поглощали незначительное количество микробов, недостаточное
для последующей трансфазовой передачи (Петров и Дунаева, 1955).’
При поступлении в организм достаточного количества возбудителя он
передается трансфазно по всему циклу развития. Экспериментально
доказано его сохранение в клещах D. marginatus в течение 710 дней
(Петров, 1966), а в Alveonasus lahorensis и Ornithodoros papillipes соответ-
ственно4 2147 и 787 дней (Ершова, 1964).
В организме клеща происходит размножение туляремийного микроба,
интенсивность которого определяется физиологическим состоянием пере-
носчика. Так, у клещей Dermacentor pictus, инфицированных на личиноч-
ной фазе, количество возбудителя в организме увеличивалось на стадии
нимфального питания в 1000 раз и питания самок — в 1000—10 000 раз.
В то же время на стадии линьки личинок в нимф количество возбудителя
в организме уменьшалось в 100—1000 раз и линьки нимф в имаго —
в 10 раз. У напитавшихся самок этого вида в организме содержалось до
10 млрд туляремийных микробов, что в 1000—10 000 раз превосходило
их количество в напитавшихся личинках (Петров и Олсуфьев, 1953).
Сходный рост численности туляремийного микроба в процессе трансфазо-
вой передачи (нарастание при питании и уменьшение при линьке) отме-
чен и для клещей Alveonasus lahorensis и Ornithodoros papillipes (Ершова,
1964).
В литературе длительное время считалась возможной трансовариаль-
ная передача Francisella tularensis иксодовыми клещами. В. Г. Петров
(1962) в опытах с клещами Dermacentor marginatus установил отсутствие
трансовариальной передачи у этого вида. Он считает, что сообщения
о выделении микроба у личинок дочернего поколения объясняются по-
верхностным загрязнением яиц при их откладке.
На основании микроскопического исследования срезов клещей D. an-
dersoni (Francis, 1927) и нескольких видов аргазид (Burgdorfer a. Owen,
- 276 -
1956) установлено интенсивное размножение и фактически пожизненное
сохранение туляремийного микроба в клетках стенки средней кишки. При
разрушении этих клеток Francisella tularensis поступают в полость кишеч-
ника и вместе с фекалиями выводятся из организма. Возбудитель про-
никает и в гемолимфу клещей, где размножается и заселяет слюнные и
коксальные железы, нервный ганглий, мальпигиевы сосуды и другие
внутренние органы. Данные о проникновении туляремийного микроба
в полость тела клещей приводятся также Л. С. Ершовой (1964) и В. Г. Пе-
тровым (1966).
Существование возбудителя в слюнных железах предопределяет
возможность его инокулятивной передачи, что было экспериментально
установлено для клещей Dermacentor marginatus (Петров, 1966). В то же
время интенсивное размножение возбудителя в средней кишке и мальпи-
гиевых сосудах и выделение его вместе с фекалиями обеспечивает воз-
можность контаминативной передачи (Кондрашкина и др., 1967). У ар-
гасовых клещей, кроме того, важную роль может играть выделение
больших количеств возбудителя вместе с коксальной жидкостью. На-
конец, известны случаи алиментарного пути заражения животных при
поедании ими инфицированных клещей.
Длительное пребывание в организме клещей не влияло на свойства
туляремийного микроба, включая его вирулентность. В то же время
возбудитель может оказывать патологическое действие на организм
клеща. Так, в инфицированной на личиночной фазе партии D. margi-
natus имагинальной фазы достигали 1.3% особей против 98% в контроле,
причем все они оказались нежизнеспособными. У Rhipicephalus rossicus
в тех же условиях имагинальное питание заканчивали 1.4% инфициро-
ванных клещей против 60% в контроле (Петров, 1958). У зараженных
аргасовых клещей патологические явления не наблюдались (Burgdorfer
a. Owen, 1956; Ершова, 1964).
На основании многочисленных успешных экспериментов с передачей
возбудителя при кормлении клещей, его интенсивного размножения в пе-
реносчике и возможности длительного хранения в организме последнего,
а также учитывая многочисленные случаи обнаружения спонтанно ин-
фицированных клещей, Н. Г. Олсуфьев считает эту группу членистоно-
гих наиболее эффективными переносчиками и хранителями туляремийного
микроба в природе.
Значительное число работ посвящено вопросу о возможности хранения
и передачи клещами чумного микроба Bacterium pestis (см. обзор: Афа-
насьева и Микулин, 1959). Установлено спонтанное носительство чум-
ного микроба многими видами иксодовых и аргасовых клещей, собран-
ными в природных очагах этой инфекции. В эксперименте клещи Ixodes
crenulatus, Hyalomma asiaticum, Rhipicephalus schulzei, Ornithodoros
tartakovskyi и другие заражались при кормлении на животных с бактерие-
мией крови. У этих же видов доказана способность возбудителя к транс-
фазовой передаче, но в ограниченной степени. Предельные сроки хранения
микроба в клещах Ixodes crenulatus достигали 509 дней и в Ornitho-
doros tartakovskyi — 171 день. В то же время большинство опытов с зара-
жением грызунов путем кормления на них инфицированных клещей за-
канчивалось неудачей. Успешное заражение было осуществлено с клещами
О. tartakovskyi при их прерывистом кормлении сперва на инфицированных,
а затем на восприимчивых животных (Бурлаченко, 1958).
В клещах Rhipicephalus schulzei обнаружено размножение чумного
микроба в недавно напитавшихся нимфах и самках. В то же время голод-
ные имаго, перелинявшие из инфицированных нимф, теряли большую
часть возбудителя при дефекации (Кондрашкина и др., 1964). У инфици-
рованных R. schulzei возбудитель был обнаружен только в кишечнике,
- 277 -
но никогда не проникал в полость тела, что исключает возможность
инокулятивной передачи (Нельзина и др., 1960).
За последние двадцать лет обширная литература посвящена роли
клещей в природной очаговости бруцеллеза. Для 18 видов иксодовых и
аргасовых клещей установлена спонтанная инфицированность бруцел-
лами. В эксперименте клещи легко заражались этим возбудителем на
стадии питания, сохраняли его длительные сроки и осуществляли транс-
фазовую передачу (Галузо и Ремнецова, 1956; Тимофеев, 1966; Ремнецова
и Хрущева, 1966). В то же время опыты с передачей бруцелл клещами
при кормлении их на восприимчивых животных далеко не всегда ока-
зываются положительными. В результате роль иксодовых клещей в очагах
этой инфекции нельзя считать окончательно выясненной.
Сведения о связи клещей с другими видами бактерий, патогенных
для человека и позвоночных, весьма ограничены и в основном сводятся
к опытам по их лабораторному заражению различными возбудителями
или к выявлению случаев спонтанного носительства.
СПИРОХЕТЫ
Аргасовые клещи служат переносчиками значительного числа пато-
генных для позвоночных и человека спирохет рода ВоггеИа, рассматривае-
мых в литературе в качестве сильно видоизмененной группы бактерий.
Для иксодид известна лишь передача клещами родов Boophilus и Rhipi-
cephalus evertsi возбудителя спирохетоза крупного рогатого скота Bor-
relia thetleri. Различным сторонам взаимоотношений клещей со спирохе-
тами посвящена обширная литература, библиография которой приводится
в ряде последних обзоров (Поспелова-Штром, 1953; Москвин, 1960;
Петрищева и Жмаева, 1962; Павловский и Скрынник, 1965; Burgdorfer,
1951; Varma, 1962, и др.). Заболевания людей клещевым спирохетозом,
по данным ВОЗ, регистрируются во многих странах. Особенно часты
они в Восточной и Центральной Африке (переносчик Ornithodoros moubata
и возбудитель Borrelia duttoni), странах Средиземноморья и Ближ-
него Востока (главный переносчик Ornithodoros erraticus и возбудитель
Borrelia hispanica), а также в центральных и западных штатах США,
в Мексике и в Южной Америке до северной части Аргентины (несколько
видов клещей рода Ornithodoros и спирохет).
На территории СССР в республиках Средней Азии клещ Ornithodoros
papillipes передает Borrelia sogdiana и в Закавказье клещ Ornithodoros
verrucosus—спирохету Borrelia caucasica. Отдельные очаги спирохетозов из-
вестны и за пределами этих районов (юг Казахстана, Украины и Северный
Кавказ). Второстепенное значение имеют клещи Ornithodoros tartakovskyi,
О. nereensis и О. alactagalis, которые передают грызунам спирохет Bor-
relia latyschevi, В, nereensis и В. armenica. Клещи Argas persicus на всем
протяжении своего ареала передают возбудителя птичьего спирохетоза
Borrelia anserinum, который местами причиняет существенный ущерб
птицеводству.
Систематика спирохет рода Borrelia остается весьма запутанной из-за
отсутствия надежных морфологических и иммунобиологических критериев
вида. Чаще всего при установлении видовой принадлежности спирохет
исходят из вида клеща-переносчика. Метод ксенодиагностики был успешно
использован с клещами Ornithodoros turicata, О. parkeri и О. hermsi из
Северной Америки, отличающимися высокой специфичностью к опреде-
ленным видам спирохет (Davis, 1943). На основании многочисленных
опытов с И видами клещей-орнитодорин и 5 видами спирохет А. Н. Скрын-
ник (1966) также считает, что нормально клещи могут передавать только
свойственные им виды спирохет. Передача «чужих» спирохет наблюдалась
-- 278
мс
Рис. 464. Циркуляция и передача спирохет Borrelia duttoni клещом Ornithodoros moubata.
А — поглощение инфицированной крови; Б — миграция спирохет из полости кишечника в полость тела; В — размножение спирохет в гемолимфе,
заселение ими слюнных и коксальных желез, нервного ганглия, мальпигиевых сосудов и других внутренних органов при почти полном исчезновении
из кишечника; Г — питание инфицированного клеща; видно выделение спирохет вместе со слюной и коксальной жидкостью.
гл — глотка; пщ — пищевод; срк — средняя кишка; мс — мальпигиев сосуд; рп — ректальный пузырь; я — яичник; яц — яйцевод; мтп — матка;
слж — слюнная железа; кж — коксальная железа; нг — нервный ганглий (по Burgdorfer, 1951).
у немногих особей опытных партий. Несмотря на высокую специфичность
отношений клещей и спирохет, этот критерий нельзя переоценивать.
Известно, что штаммы Borrelia duttoni, В. hispanica и В. crocidurae уда-
лось успешно культивировать не только в необычных для них видах кле-
щей, но даже во вшах (Haberkorn, 1963), так что эта проблема требует
дальнейшего изучения.
В организм клеща спирохеты поступают вместе с кровью инфициро-
ванного хозяина. Дальнейшая судьба возбудителя длительное время
была предметом дискуссий в связи с гипотезой о существовании у них
гранулярных или фильтрующихся стадий развития. Эти взгляды, однако,
не получили подтверждения в новейших исследованиях по циркуляции
Borrelta duttoni в клещах Ornithodoros moubata (Burgdorfer, 1951), Bor-
relia sogdiana в Ornithodoros papillipes (Теравский, 1959) и Borrelia an-
serinum в Argaspersicus (Никитина, 1964, 1965). В этих работах приводятся
убедительные данные об обнаружении морфологически нормальных спи-
рохет на любых сроках после инфицирования и о размножении их путем
простого поперечного деления. Представления о циркуляции и передаче
спирохет клещами Ornithodoros moubata суммированы на рис. 464.
Поглощенные спирохеты в первые дни после питания обнаруживаются
преимущественно в среднем отделе кишечника. Вначале они встречаются
по всему содержимому полости кишки, а на более поздних сроках кон-
центрируются на поверхности эпителиальных клеток стенок, проникают
между ними в межклеточные пространства и к базальной мембране. Зна-
чительное уменьшение количества спирохет в полости кишечника наблю-
далось у Ornithodoros moubata через 12—16, а у О. papillipes — через
10—12 и у Argas persicus — через 13—20 дней после заражения. Отдель-
ные спирохеты были обнаружены и на более поздних сроках. В первые
дни после инфицирующего кормления у A. persicus наблюдалось даже
размножение спирохет в полости кишечника. Исчезновение спирохет из
кишечника на более поздних сроках, вероятно, связано с неблагоприят-
ными изменениями его среды по мере переваривания поглощенной крови.
Уже в первые часы или даже минуты после поступления инфициро-
ванной крови в кишечник спирохеты обнаруживаются в гемолимфе.
Проникновение их в полость тела клеща не связано с разрывами стенки
кишечника, как считали некоторые исследователи (Аракчеева, 1963),
и обеспечивается активными движениями и, возможно, лизирующими
факторами самих спирохет. Количество спирохет в гемолимфе в первые
дни после заражения увеличивается за счет их миграции из кишечника.
На более поздних сроках их содержание в гемолимфе может сильно варьи-
ровать. У зараженных голодных клещей присутствие возбудителя в гемо-
лимфе далеко не постоянно (у Argas persicus только у 12—16% особей)
и зависит как от видовых особенностей переносчика-возбудителя, так и
от физиологического состояния клеща. Питание обычно стимулирует
размножение спирохет и количество их в этот период может увеличиваться.
Из гемолимфы спирохеты проникают во многие внутренние органы,
причем в распределении их в организме клеща наблюдаются определен-
ные видовые различия. У Ornithodoros moubata спирохеты Borrelia dut-
toni чаще всего встречались в нервном ганглии, а затем по частоте обна-
ружения шли коксальные железы, слюнные железы, органы размножения
и мальпигиевы сосуды. Наиболее интенсивное размножение и накопление
возбудителя наблюдалось в стенках мальпигиевых сосудов и в нервном
ганглии. В то же время, по наблюдениям М. Вармы (Varma, 1962), при
заражении нимф этого же вида клеща спирохетами В. turicata последние
наиболее часто обнаруживались в слюнных железах. У зараженных
Argas persicus возбудитель был обнаружен в нервном ганглии в 67—76%
случаев, в слюнных железах — в 71%, в мальпигиевых сосудах — в 41 —
- 280 -
47% й в органах размножения — в 23—27%. Как правило, у видов рода
Ornithodoros слюнные железы половозрелых особей заражены спирохе-
тами значительно слабее и реже, чем у нимф. Преимущественную лока-
лизацию спирохет в определенных органах клещей связывают с органо-
тропизмом возбудителя к определенным тканям клеща, что было доказано
в опытах in vitro (Sarasin, 1959). Нервные ганглии и коксальные железы
клещей притягивали к себе значительно большее количество спирохет по
сравнению со слюнными железами, мальпигиевыми сосудами и органами
размножения. Установлено, что привлекающим фактором служат олиго-
сахариды, выделяемые этими органами (Griin u. Blatter, 1960). Важную
роль в распределении спирохет в организме может играть и разная спо-
собность их к размножению в различных тканях.
Особенности локализации спирохет в организме клещей предопреде-
ляют и пути их передачи позвоночным во время питания. Клещ приобре-
тает инфицирующую способность только после того, как спирохеты
проникнут в его гемолимфу и из нее в коксальные и слюнные железы.
Возбудитель может быть обнаружен в слюне и коксальной жидкости
подобных особей, но участие их в передаче инфекции различно у разных
видов. У клещей (Ornithodoros moubata), регулярно выделяющих большое
количество коксальной жидкости во время акта питания на теле хозяина,
последняя содержит значительное количество спирохет и представляет
основной путь передачи инфекции. У половозрелых особей О. moubata
слюнные железы редко содержат спирохеты и передача их с коксальной
жидкостью становится единственным путем заражения позвоночных.
Напротив, у О. papillipes, Argas persicus и других видов, выделяющих
коксальную жидкость по окончании питания и оставлении тела хозяина,
передача спирохет возможна только со слюной (Теравский, 1959; Ники-
тина, 1965; Varma, 1962). Передача спирохет с экскретами клещей, по
наблюдениям над Ornithodoros moubata (Burgdorfer, 1951), отсутствует,
несмотря на сильное инфицирование мальпигиевых сосудов. Маловероятна
и возможность непосредственного проникновения спирохет из переднего
отдела кишечника в ранку на теле хозяина без предшествующей внутри-
полостной миграции и заселения слюнных желез, как ошибочно считает
С. Г. Аракчеева (1963).
Аргасовые клещи способны к заражению спирохетами при кормлении
на больных животных на всех фазах жизненного цикла и к последующей
передаче возбудителя по ходу метаморфоза. Значение отдельных фаз
развития клещей в передаче спирохет, как показали опыты Е. Н. Павлов-
ского и А. Н. Скрынник (1939, 1952, 1965), неодинаково. Личинки Orni-
thodoros papillipes передают их лишь в исключительных случаях незави-
симо от того, получили ли они возбудителя трансовариально или при
прерывистом кормлении. Легче всего передача спирохет позвоночному
происходит на нимфальной фазе. У половозрелых особей иногда наблю-
далась утрата способности к передаче. Последнее чаще встречается у мно-
гократно питавшихся самок, тогда как длительное голодание (до 10 лет)
не приводило к исчезновению спирохет из организма клещей. При корм-
лении на морских свинках подобные истощенные клещи нормально осу-
ществляли передачу инфекции. Снижение инфицирующей способности
отмечено также для имаго О. moubata (Burgdorfer, 1951) и О. turicata
(Varma, 1962), причем у этих видов наблюдалось снижение процента
заражения спирохетами слюнных желез по сравнению с нимфальной фазой.
Важную роль в циркуляции спирохет в природных очагах играет
исключительная способность клещей к трансовариальной передаче спи-
рохет. Так, у клещей О. papillipes это явление наблюдалось примерно
у трети зараженных самок. К трансовариальной передаче были способны
и самки дочерних поколений, питавшиеся только на здоровых животных.
- 281 -
В результате удалось поддерживать Borrelia sogdiana исключительно
за счет циркуляции в организме клещей на протяжении 3 поколений
в течение 26 лет (срок наблюдений; Павловский и Скрынник, 1951, 1965).
В опытах с Ornithodoros moubata трансовариальная передача прослежена
для 5 поколений (Geigy u. Aeschlimann, 1964) и выяснены ее цитологиче-
ские особенности (Aeschlimann, 1958). Спирохеты были обнаружены у 2—
98% потомства инфицированных самок и из них до 60% передавали их сле-
дующему дочернему поколению. Возбудитель внедряется из гемолимфы
только в молодые ооциты до образования вокруг них «хориона». После
этого они уже не могут быть инфицированы. В ооцитах спирохеты со-
храняют нормальную морфологическую форму и располагаются в цито-
плазме между желточными шарами. С началом дифференцировки цен-
тральной нервной системы они сразу же мигрируют в ее эмбриональную
закладку и остаются в ней до окончания эмбриогенеза. Заселение спиро-
хетами других внутренних органов, включая и слюнные железы, проис-
ходит уже на личиночной фазе. Частота трансовариальной передачи
определяется видовой принадлежностью клещей. Например, у Ornitho-
doros turicata (Varma, 1962) или Argas persicus (Никитина, 1964) она была
значительно реже, чем у Ornithodoros papillipes и О. moubata.
В связи с заражением семенников спирохеты вместе с проспермиями
могут проникнуть внутрь сперматофоров и во время оплодотворения
поступить в организм незараженной самки. Подобный путь передачи был
обнаружен в 1.8% опытов спаривания «чистых» самок с зараженными
самцами О. moubata (Wagner-Jevseenko, 1958).
Заражение клещей спирохетами, по-видимому, не отражается на
жизнеспособности переносчика. В то же время имеются наблюдения об
изменениях вирулентности спирохет при циркуляции их только в клещах.
Так, Borrelia duttoni, находившиеся в организме клещей на протяжении
3—5 поколений, теряли инфекциозность для белых мышей (Aeschlimann,
1958; Geigy u. Aeschlimann, 1964). Наоборот, спирохеты того же вида, на
протяжении нескольких лет пассировавшиеся через белых мышей, не
могли заражать клещей Ornithodoros moubata при инфицирующем кормле-
нии. Заражение в этом случае наблюдалось только после внутриполост-
ного введения возбудителя (Varma, 1962). Таким образом, клещи могут
служить резервуарными хозяевами спирохет в природе, но для поддержа-
ния достаточной вирулентности штаммов необходима их регулярная
циркуляция между восприимчивыми позвоночными и клещами.
Иксодоидные клещи, возможно, связаны и с лептоспирами рода Lepto-
spira, очень близкими к роду Borrelia. Удалось выделить лептоспир из
собранных в природе клещей Dermacentor marginatus (Крепкогорская и
Ремнецова, 1957), Ornithodoros tartakovskyi (Благодарный, 1959) и некото-
рых других видов. После экспериментального заражения Leptospira
icterohaemorrhagiae сохранялись в клещах Hyalomma asiaticum 22—
27 дней, a Leptospira canicola в Rhipicephalus sanguineus — 36 дней (Со-
лошенко, 1959). Этому же автору удалось осуществить передачу возбу-
дителя восприимчивым животным путем кормления на них зараженных
клещей. При инфицировании Leptospira ротопа клещей Ornithodoros
turicata (Burgdorfer, 1956) возбудитель сохранялся в них 232—518 суток.
Кормлением подобных клещей на морских свинках удалось осуществить
передачу инфекции и было доказано выделение больших количеств лепто-
спир с коксальной жидкостью. После поступления в кишечник клещей
крови с лептоспирами последние вскоре проникали сквозь его стенки
в полость тела. Установлено интенсивное размножение возбудителя
в гемолифме и заселение им слюнных и коксальных желез, нервного
ганглия, мальпигиевых сосудов и органов размножения. В то же время
трансовариальная передача Leptospira ротопа клещами отсутствовала.
- 282 -
Несмотря на случаи успешного лабораторного заражения и последующей
передачи возбудителя клещами, редкость находок спонтанно инфициро-
ванных клещей не дает оснований рассматривать эту группу членисто-
ногих эпидемиологически важными переносчиками лептоспир.
ПИРОПЛАЗМИДЫ
Иксодовые клещи наносят огромный экономический ущерб как пере-
носчики кровепаразитарных заболеваний сельскохозяйственных живот-
ных. Возбудителей этих инфекций в настоящее время относят к классу
Sarcodina (подкласс Rhizopoda) в ранге отряда Piroplasmida с семейст-
вами Babesiidae ( = Piroplasmidae, роды Piroplasma., Babesiella и NuttalUa)
и Theileridae (род Theileria) (Хейсин, 1963; Марков и Абрамов, 1965).
В иностранных и некоторых отечественных работах иногда применяется
другая номенклатура, связанная с иной трактовкой родов и отнесением
группы в целом к споровикам. Только на территории СССР переносчи-
ками пироплазмид зарегистрированы 19 видов иксодовых клещей (Мар-
ков, 1957; Марков и Абрамов, 1958), причем этот список (табл. 53) нельзя
считать окончательным.
Клещи — биологические переносчики пироплазмид и в их организме
простейшие проходят сложный цикл развития, связанный с миграцией из
кишечника в полость тела и интенсивным размножением. В слюнных же-
лезах многих видов клещей были обнаружены инвазионные стадии пиро-
плазмид, передача которых позвоночным осуществляется во время пита-
ния только инокулятивным путем.
Пироплазмам и бабезиеллам свойственна исключительная способ-
ность к трансовариальной передаче в организме клеща. А. А. Марковым
и И. В. Абрамовым (1965) установлена передача Babesiella ovisb 33 поко-
лениях клеща Rhipicephalus bursa и Piroplasma caballi — в 13 поколениях
клеща Hyalomma plumbeum при кормлении этих видов клещей на кроли-
ках, не восприимчивых к возбудителям этих видов.
Успешность инфицирования клещей пироплазмидами может опреде-
ляться количеством возбудителя в крови прокормителя. Так, при высо-
ком уровне пораженности эритроцитов крупного рогатого скота паразитом
Piroplasma bigeminum отмечено заражение всех питавшихся на этих живот-
ных самок Boophilus microplus. В дальнейшем возбудитель был обнаружен
в 90% отложенных ими яиц. В то же время при низком уровне поражен-
ности эритроцитов при кормлении было инфицировано от 4 до 25% самок
и возбудитель был обнаружен только в 5% яиц зараженных особей (Riek,
1964).
Заражение клещей возможно на всех фазах развития. Передача пара-
зитов однохозяинными и двуххозяинными видами обычно осуществляется
имагинальной или нимфальной фазами. В то же время для некоторых ви-
дов клещей инфицирование позвоночных возможно и на стадии личиноч-
ного питания при условии трансовариальной передачи возбудителя.
У треххозяинных видов, личинки и нимфы которых питаются на мелких
млекопитающих, циркуляция простейших между клещами и сельскохо-
зяйственными животными чаще всего обеспечивается комбинацией тран-
совариального и трансфазового способов передачи возбудителя по циклу
развития переносчика. Заражение восприимчивых позвоночных осуще-
ствляется во время имагинального питания клещей. Подобный цикл мы
наблюдаем в случае с Ixodes ricinus и Babesiella bovis.
У нутталий трансовариальная передача наблюдается крайне редко,
а у тейлерий, по мнению большинства исследователей, отсутствует (Neitz,
1956, 1959), так что сохранение возбудителя в клещах осуществляется
благодаря трансфазовой передаче. Инвазирование клещей происходит на
- 283 -
Таблица 53
Кровепаразитарные заболевания сельскохозяйственных животных, передаваемые
иксодовыми клещами на территории СССР (по Маркову, 1957; Маркову
и Абрамову, 1958)
Возбудитель Поражаемые животные Клещи-переносчики Распространение
Piroplasma bige- minum. Крупный рогатый скот. Boophilus calcaratus и, реже, Rhipicephalus bursa, R. rossicus, Haemaphysalis punc- tata. Юг и юго-восток СССР (Северный Кавказ, Закавказье, Крым, Средняя Азия, Ка- захстан, местами в Воронежской и Кур- ской областях).
Babesiella bovis. То же. Ixodes ricinus и, реже, I. persulcatus. Европейская часть СССР (Прибалтий- ские республики, Бе- лоруссия, Украина, северо-западная, цен- тральная и чернозем- ная зоны РСФСР).
В. colchica. » Boophilus calcaratus. Юг и юго-восток СССР.
В. caucasica. » Ixodes ricinus. Европейская часть СССР.
Theileria annulata и T. mutans. » Hyalomma detritum, H. anatolicum, H. asi- aticum, H. scupense. Юг и юго-восток СССР (особенно Закавказье, Средняя Азия и Ка- захстан).
T sergenti. » Haemaphysalis neu- manni. Приморский край.
Piroplasma ovis, Babesiella ovis, Theileria ovis, T recondita. Овцы и козы. Rhipicephalus bursa, Haemaphysalis oto- phila, H. sulcata и, вероятно, другие виды. Крым, Дагестан, За- кавказье, Средняя Азия и Казахстан.
Piroplasma caballi я Nuttalia equi. Лошади и ослы. Dermacentor pictus, D. marginatus, D. sil- varum, D. nuttalli, Hyalomma plumbeum, H. scupense, Rhipice- phalus bursa, R. tura- nicus. Средняя и южная зоны СССР.
Piroplasma traut- manni. Свиньи. Rhipicephalus turanicus. Украина и Азербай- джан.
P. canis. Собаки. Dermacentor pictus, в пограничных с СССР районах Rhipicepha- lus sanguineus. Многие районы средней и южной зон СССР.
стадии личиночного или нимфального питания, а передача возбудителя
позвоночному — на имагинальной или, реже, нимфальной фазах разви-
тия. Возможна и передача в цределах одной фазы развития в случае
прерывистого кормления.
Исследования циклов развития нескольких видов пироплазм, нутта-
лий и тейлерий в клещах (Муратов и Хейсин, 19596; Полянский и Хей-
син, 1959; Martin a. oth., 1964; Крылов, 1965) позволяют считать, что эти
паразиты размножаются в клещах только бесполым путем. Результаты
этих работ ставят под сомнение данные о прохождении несколькими
- 284 -
видами пироплазмид полового цикла в клещах (Dennis, 1932; Петров,
1939; Цапрун, 1957; Riek, 1964, и др.).
По наблюдениям Е. А. Муратова и Е. М. Хейсина (19596), внутри-
эритроцитарные стадии Piroplasma bigeminum, поступившие вместе
с кровью хозяина в средний отдел кишечника самок Boophilus calcaratus,
покидают разрушающиеся эритроциты и некоторое время размножаются
в полости кишечника простым или множественным делением. На более
поздних сроках они исчезают из полости кишечника, но зато инвазируют
эпителиальные клетки его стенок. Внутри последних наблюдается не-
сколько циклов множественных делений. Часть образующихся при этом
булавовидных или сигаровидных стадий паразита поражает новые клетки
кишечника. Другие проникают в гемолимфу, где часто наблюдаются
их простые деления надвое. Из гемолимфы булавовидные стадии могут
инвазировать большинство внутренних органов, где также наблюдается
их размножение. Однако во взрослом напитавшемся клеще заселение
паразитами соматических органов представляет тупик в развитии. Лишь
пироплазмы, сумевшие проникнуть в развивающиеся яйца, обеспечи-
вают себе дальнейшие возможности развития путем перехода в дочернее
поколение клещей. В инвазированных яйцах были отмечены простые и
множественные деления пироплазм, а позднее заселение ими эмбриональ-
ных закладок будущих органов личинки. Р. Райк (Riek, 1964), работав-
ший с этим же видом пироплазм, наблюдал заселение булавовидными
формами эпителиальных клеток кишечника личинки. В них они размножа-
лись множественными делениями и уже позднее проникали в гемолимфу
и в слюнные железы. В альвеолах слюнных желез инфекционные формы
паразита обнаруживались, начиная с нимфальной фазы, через 8—10 дней
после начала питания личинок.
У Babesiella bovts в клещах Ixodes ricinus (Полянский и Хейсин, 1959)
цикл развития был в основных чертах сходен с описанным для предыду-
щего вида. Отличия были связаны с отсутствием размножения бабезиелл
в кишечнике. Паразиты сразу же проникали в полость тела, где и про-
исходило их размножение простым делением или же шизогонией, но
с образованием ограниченного числа агамонтов при каждом делении.
У Nuttallia tadzhikistanica в клещах Hyalomma anatolicum (Крылов,
1965) трансовариальная передача отсутствует. Циркуляция паразита
обеспечивается инвазированием личинок и передачей паразита песчанкам
на нимфальной фазе. У нутталий было обнаружено весьма интенсивное
размножение в полости кишечника напитавшихся личинок и отсутствие
такового в клетках его стенок. Часть паразитов проникает в гемолимфу,
а из нее во внутренние органы и подвергается здесь множественным де-
лениям. К концу линьки у голодных нимф количество нутталий в орга-
низме клещей значительно уменьшается и они находятся в покоящемся
состоянии. У только что прикрепившихся к хозяину нимф в слюнных
железах еще отсутствуют инвазионные стадии паразита. Переход покоя-
щихся стадий к делению и формированию инвазионных стадий в слюнных
железах стимулируется питанием клещей. Сходное явление отмечено и
для Piroplasma caballi в клещах рода Dermacentor (Цапрун, 1957), так что
переносчик приобретает способность к передаче возбудителя не ранее,
чем через 2—3 суток с начала питания на позвоночном.
Цикл развития Theileria parva в клещах Bhipicephalus appendiculatus
прослежен не полностью (Martin a. oth., 1964). Установлена миграция
поглощенных при личиночном питании тейлерий из полости кишечника
в полость тела. При этом достаточно интенсивно бывают инвазированы и
пищеварительные клетки средней кишки. Из гемолимфы паразиты про-
никают во многие внутренние органы, включая и альвеолы слюнных
желез. В последних они были обнаружены только в клетках «а» и «d»
- 285 -
альвеол II и III типов, заполненных крупными вакуолями белкового
секрета еще у голодных особей (см. стр. 140—146). Размножение тейлерий
в слюнных железах происходит с началом имагинального питания. Коли-
чество паразитов в инвазированных клетках сильно увеличивается за
счет множественных делений. В результате происходит разрушение не
только пораженной клетки, но всей альвеолы, а освободившиеся паразиты
проникают в выводные протоки слюнных желез и со слюной вводятся
в организм хозяина. Таким образом, как в случае с нутталиями или
некоторыми пироплазмами, инвазионные стадии появляются только через
несколько дней с начала питания переносчика.
Пироплазмид следует рассматривать истинными паразитами клещей.
В процессе их размножения происходит разрушение пораженных ими кле-
ток средней кишки и слюнных желез. Поглощение клещами Boophilus
microplus вместе с кровью хозяина чрезмерно большого числа Piroplasma
bigeminum вело к гибели 90% напитавшихся самок. У погибших особей
отмечено нарушение целостности средней кишки вследствие разрушения
клеток ее стенок внедрившимися в них паразитами. У немногих выживших
самок наблюдалось значительное снижение плодовитости (Riek, 1964).
В свою очередь защитные реакции клеща приводят к гибели значи-
тельной части паразитов еще в полости кишечника (Полянский и Хейсин,
1959; Riek, 1964), а позднее в полости тела при подготовке к линьке
(Крылов, 1965). Продолжительность жизни тейлерий в клещах оказа-
лась значительно короче таковой хозяина. При длительном голодании
Rhipicephalus appendiculatus полностью освобождались от паразитов
(Martin a. oth., 1964).
Весьма ограничены сведения о специфичности в отношениях клещей
с этими паразитами. Наряду со случаями строгой видовой специфичности
системы паразит—хозяин известны многочисленные примеры, когда
один вид возбудителя передается несколькими видами клещей или один
вид клеща может служить средой обитания для нескольких видов пиро-
плазмид (табл. 53). Специфичность пироплазмид к их хозяевам — позво-
ночным, по-видимому, также не столь жестка, как это считалось в лите-
ратуре. Так, при кормлении клещей Boophilus microplus на лошадях,
козах и овцах удалось инфицировать этих животных паразитом крупного
рогатого скота Piroplasma bigeminum. Клинические проявления заболева-
ния у лошадей, коз и овец отсутствовали, но в их крови содержалось
достаточное количество пироплазм для инфицирования клещей Boo-
philus microplus. Потомство напитавшихся на этих животных самок клещей
также было инфицировано пироплазмами (Callow, 1965; Arthur, 1966).
ОСОБЕННОСТИ ВЗАИМООТНОШЕНИЙ КЛЕЩЕЙ
С МИКРООРГАНИЗМАМИ
Организм иксодовых и аргасовых клещей, по-видимому, представляет
весьма благоприятную среду для существования многих возбудителей
болезней позвоночных животных. В отношении вирусов, риккетсий и
бактерий у них отсутствует жесткая специфичность хозяинно-паразитар-
ных отношений. Последнее проявляется как в существовании значитель-
ного числа переносчиков у одного возбудителя (особенно велико их число
в случае риккетсий Бернета, туляремийного микроба или анаплазм),
так и в способности одного вида клеща к передаче нескольких видов;
возбудителей.
Исключительно демонстративны в этом отношении эксперименты
Ф. Вейера (Weyer, 1964), которому удалось успешно культивировать
в организме клещей Ornithodoros moubata все патогенные для человека
виды риккетсий, исключая Zinssera tsutsugamushi и Rickettsia quint ana.
- 286 -
Неспособность этих видов к развитию в иксодовых клещах объясняется
далеко зашедшей специализацией к существованию в краснотелковых
клещах или на поверхности клеток кишечника вшей. В остальных случаях
видовая специфичность хозяинно-паразитарных отношений обнаружива-
лась в различной интенсивности размножения возбудителя и частоте
трансовариальной передачи. В этом отношении наблюдается большое*
сходство с арбовирусами, хотя последним свойственна несколько большая
специфичность. Во многих видах клещей, не являющихся естественными
переносчиками, развиваются не только вирусы из группы клещевых энце-
фалитов, но и многие из арбовирусов группы А, нормально передаваемых
кровососущими двукрылыми (Hurlbert a. Thomas, 1960; Smith, 1964;
Rehaeek, 1965). Напротив, кровососущие двукрылые даже в условиях
экспериментального заражения оказались не подходящими хозяевами
для риккетсий и клещевых вирусов. Это служит дополнительным доказа-
тельством большей пригодности организма клещей для развития риккет-
сий и вирусов по сравнению с насекомыми. В то же время для пироплазмид
и спирохет, как правило, свойствен весьма узкий круг видов клещей-
переносчиков, что, вероятно, связано с прохождением в клеще более слож-
ного цикла развития и большими трудностями в преодолении различных
биологических барьеров в организме членистоногого.
В природе инфицирование клещей микроорганизмами возможно в пе-
риод питания на позвоночных с достаточно высокой концентрацией возбу-
дителя в крови за счет трансовариальной передачи и, в отдельных случаях,
путем трансспермальной передачи возбудителя самцами во время копуля-
ции с «чистыми» самками (у некоторых риккетсий и спирохет). В лабора-
торных условиях наряду с инфицирующим кормлением очень широкое
распространение приобрела методика заражения клещей внутриполост-
ной инокуляцией. Реже практикуется непосредственное кормление клещей
на зараженных куриных эмбрионах (Burgdorfer a. Pickens, 1954) или корм-
ление культурой возбудителя с помощью капилляров (Burgdorfer,
1957).
Введение возбудителя в организм восприимчивого клеща не всегда
обеспечивает заражение членистоногого. Основываясь на исследованиях
с арбовирусами и пироплазмами (Думина, 1958; Burgdorfer, 1960; Riek,
1964), можно предположить, что и для других микроорганизмов должна
существовать определенная минимальная инфекционная доза, ниже ко-
торой заражение членистоногого невозможно.
Полость кишечника клещей, по-видимому, не представляет достаточно
благоприятную среду для существования возбудителей инфекций позво-
ночных. Даже в случае размножения в первые дни после питания (не-
которые пироплазмиды и спирохеты) на более поздних сроках после зара-
жения возбудители не обнаруживаются в полости кишечника. Их дальней-
шее размножение и развитие протекают в клетках стенки средней кишки
или других внутренних органов. В прошлом предполагалось существова-
ние в кишечнике активных бактерицидных веществ, но в опытах И. Ржега-
чека (Rehaeek, 1962b) это не подтвердилось. Суспензия из кишечника кле-
щей не действовала in vitro на сальмонелл, вирус восточного лошадиного
энцефаломиэлита и вирус клещевого энцефалита. Уход из полости кишеч-
ника или гибель остающихся в нем микроорганизмов, вероятно, можно
объяснить созданием там неблагоприятных физико-химических условий
среды по мере переваривания поглощенной крови.
Проникновение возбудителя в клетки средней кишки облегчается
отсутствием перитрофической мембраны. Известно, что у насекомых она
представляет серьезный биологический барьер, как, в частности, показано
на примере кровососущих двукрылых и трипанозом, микрофилярий, возбу-
дителей малярий и лейшманий (Stohler, 1961). У клещей поглощенные
- 287 -
с кровью возбудители не сталкиваются с необходимостью прохождения
сквозь перитрофическую мембрану и сразу же соприкасаются с поверх-
ностью пищеварительных клеток.
Однако сама стенка средней кишки представляет серьезный барьер
на пути проникновения возбудителей в полость тела. Опыты с внутри-
полостной инокуляцией риккетсий (Weyer, 1953, 1964), арбовирусов
(Hurlbert a. Thomas, 1960; Rehacek, 1962а) и спирохет (Varma, 1962)
свидетельствуют о легкости заражения клещей при меньших дозах возбу-
дителя по сравнению с инфицирующим кормлением. Первое механическое
препятствие создается апикальной цитоплазматической мембраной кле-
ток средней кишки. Прохождение сквозь нее в значительной степени
облегчается исключительной способностью клеток кишечника клещей
к пиноцитозу и фагоцитозу.
Поступлению возбудителя в гемолимфу может предшествовать стадия
его интенсивного размножения и накопления в клетках кишечника, как
в случае с риккетсиями. У спирохет и некоторых пироплазмид {Babesiella
bovis) возбудитель сразу же мигрирует в полость тела и период его накопле-
ния в клетках средней кишки отсутствует.
Барьером к проникновению в гемолимфу служат базальная цитоплазма-
тическая мембрана пищеварительных клеток и неклеточная базальная
мембрана стенки кишечника. Во всяком случае, как например для Cowd-
ria ruminantum постоянно и для Coxiella burneti в некоторых необычных
переносчиках, риккетсии не способны к проникновению в гемоцель, не-
смотря на успешное размножение в клетках средней кишки (Bertram,
1962).
Гемолимфа членистоногих обеспечивает не только возможность пере-
живания, но и внеклеточного размножения риккетсий, пироплазмид, спиро-
хет и, возможно, других возбудителей. Последнее, вероятно, связано
с биохимическими свойствами гемолимфы членистоногих, которая отли-
чается очень высоким содержанием свободных аминокислот и некоторых
жизненно важных метаболитов. Наряду с пребыванием в плазме большое
количество возбудителей встречается и внутри гемоцитов. Защитные реак-
ции со стороны плазмы или форменных элементов гемолимфы клещей
остаются неизученными.
Локализация в организме клеща определяется видовыми особенно-
стями возбудителя, причем инвазируется большинство внутренних орга-
нов переносчика. Важную роль в преимущественной локализации микро-
организмов в определенных тканях приписывают как их миграции в эти
органы в связи с отчетливой реакцией хемотропизма (Sarasin, 1959; Griin
u. Blatter, 1960), так и условиям для последующего размножения пара-
зита в тканях хозяина.
Важная биологическая особенность иксодовых и аргасовых клещей
как переносчиков — их исключительная способность к трансфазовой
передаче многих групп возбудителей, тогда как у кровососущих насеко-
мых даже в условиях эксперимента передача возбудителей от личинки
до имаго представляет редкое исключение (Smith, 1964; Burgdorfer а.
Varma, 1967). Переживанию возбудителей в организме клещей на стадии
линьки благоприятствуют незначительные по сравнению с насекомыми
линочные изменения. Во время линьки гистолизу подвергаются преиму-
щественно эктодермальные производные и некоторые группы мышц, тогда
как средний отдел кишечника, мальпигиевы сосуды и другие органы,
в наибольшей степени заселенные микроорганизмами, характеризуются
постепенной заменой клеток на протяжении всего жизненного цикла.
Лишь полная замена альвеол слюнных желез в этот период, в случае ино-
кулятивной передачи, требует их регулярного повторного инвазирования
при каждой линьке.
- 288 -
Характер воздействия линочных изменений в организме клеща на
микроорганизмы изучен недостаточно. Часто наблюдается значительное
уменьшение количества возбудителя в переносчике, как например у Fran-
cisella tularensis в клещах Dermacentor pictus (Петров и Олсуфьев, 1953),
вируса клещевого энцефалита в Ixodes ricinus (Benda, 1958b), западного
нильского вируса в Ornithodoros moubata (Whitman a. Aitken, 1960) и
Nuttallia tadzhikistanika в Hyalomma anatolicum (Крылов, 1965). В то же
время для вируса колорадской клещевой лихорадки (Rozeboom a. Burg-
dorfer, 1959), вируса кизанурского леса (Varma a. Smith, 1960) и лихо-
радки Ку (Rehn, 1958) отмечено увеличение титра вируса во время линьки.
Представляют интерес данные К. Филипа (Philip, 1959b) об осуществи-
мости трансфазовоп передачи Ehrlichia canis только в организме специфи-
ческого переносчика Rhipicephalus sanguineus и отсутствии ее у Derma-
centor andersoni.
Трансовариальная передача вирусов, риккетсий, спирохет и пиро-
плазмид, по-видимому, Ограничена клещами, тогда как у насекомых
наблюдается очень редко даже в условиях эксперимента (Burgdorfer
a. Varma, 1967). При этом клещам свойственна истинная трансовариаль-
ная передача, связанная с проникновением возбудителей внутрь разви-
вающегося ооцита, а не с загрязнением поверхности яиц микроорганиз-
мами при яйцекладке, как у некоторых клопов. Для пироплазмид она
прослежена на протяжении многих поколений клещей (Марков и Абра-
мов, 1965) и, вероятно, подобные же результаты можно ожидать с виру-
сами, риккетсиями и спирохетами.
Д. Бертрам (Bertram, 1960) объясняет различную способность кле-
щей и насекомых к трансовариальной передаче микроорганизмов особен-
ностями строения яйцевых оболочек у этих двух групп членистоногих.
У клещей развивающиеся ооциты отделены от гемолимфы неклеточной
tunica propria и собственно желточной оболочкой ооцита, а у насекомых
яйцевой фолликул окружен клеточной стенкой овариолы, tunica propria,
фолликулярным эпителием и желточной оболочкой. В зрелом яйце в обеих
группах проницаемость уменьшается до минимума благодаря формирова-
нию плотной кутикулярной оболочки яйца — «хориона». Методами элек-
тронной микроскопии, однако, было показано, что не все оболочки вокруг
яиц насекомых представляют одинаковую преграду для микроорганизмов
(Teffer, 1965). Клеточная стенка яичника в период вителлогенеза крайне
истончается и представлена сетью из клеточных отростков, а в фолликуляр-
ном слое от tunica propria к ооциту проходят многочисленные межклеточ-
ные полости. В результате, как и у клещей, серьезной преградой для про-
хождения возбудителя могут служить лишь tunica propria, желточная
оболочка и позднее «хорион».
Различная способность к трансовариальной передаче возбудителей
у клещей и насекомых, по нашему мнению, не может быть объяснена раз-
личным числом яйцевых оболочек — механических барьеров на пути
в яйцо. Объяснение следует искать в биохимических факторах существо-
вания микроорганизмов. В частности, Ф. Вейером (Weyer, 1962) экспе-
риментально показано для вшей и риккетсий и Г. Саразином (Sarasin,
1959) для клещей и спирохет, что заселение ооцитов микроорганизмами
связано с хемотропизмом в ответ на химические факторы, вырабатывае-
мые в яичниках.
Для успешности трансовариальной передачи существенно время
появления возбудителя в гемолимфе. По нашим наблюдениям над самками
Hyalomma asiaticum, инфицированными риккетсиями Бернета, возбуди-
тель может проникнуть в развивающиеся ооциты только до образования
вокруг них плотной кутикулярной оболочки — «хориона». Аналогичные
результаты были получены в опытах с клещами Ornithodoros moubata
19 IO. С. Балашов
- 289 -
и спирохетами Borrelia duttoni (Aeschlimann, 1958). Важную роль играет
и концентрация риккетсий в гемолимфе. После внутриполостного введе-
ния в клещей вируса клещевого энцефалита (Rehaeek, 1962а) и кизанур-
ской лихорадки (Singh a. oth., 1963) процент трансовариальной пере-
дачи возбудителей был выше, чем после обычного инфицирующего корм-
ления.
Многие экологические, морфологические и физиологические особен-
ности иксодовых и аргасовых клещей исключительно благоприятны для
биологической передачи инфекций. В то же время значительные про-
межутки времени между последовательными приемами пищи затрудняют
механическую передачу инфекции, хотя в условиях эксперимента послед-
няя была осуществлена при прерывистом кормлении для вируса клещевого
энцефалита и некоторых других инфекций (Чумаков и Гладких, 1939;
Gresikova a. Rehaeek, 1959; Varma a. Smith, 1960). В большинстве случаев
возбудители выделяются вместе со слюной, но для риккетсий и, возможно,
бактерий важную роль приобретает выведение их из организма клеща
вместе с фекалиями. Для риккетсий Бернета контаминативный путь пере-
дачи от клещей теплокровным, вероятно, является основным ввиду высо-
кой инфекциозности фекалий и многомесячного переживания в них возбу-
дителя.
Инокулятивной передаче возбудителей благоприятствует многоднев-
ное питание иксодовых клещей, сопровождающееся выделением в ранку
очень большого количества слюны. В то же время в период питания выде-
ляется большая масса фекалий и полупереваренной крови, что создает
высокую концентрацию возбудителя не только на теле хозяина, но и
на окружающих предметах.
Физиологические и цитологические особенности клещей благоприят-
ствуют как длительному переживанию и размножению микроорганизмов,
так и их поступлению в слюну и фекалии. Отторжение апикальных участ-
ков секретирующих клеток слюнных желез и непрерывное разрушение*
части пищеварительных клеток создают возможность беспрепятственного
выхода риккетсий из инфицированных клеток без необходимости актив-
ного преодолевания механического барьера цитоплазматической мембраны.
Наконец, важная роль клещей как переносчиков в эпидемиологии
и эпизоотологии трансмиссивных болезней усиливается в связи с тем, что
они одновременно служат природными резервуарами возбудителя. В силу
большой индивидуальной долговечности, полифагии и исключительной
способности к трансовариальной и трансфазовой передачам микроорганиз-
мов клещи обеспечивают устойчивое поддержание природных очагов ин-
фекции как при непрерывной циркуляции возбудителя между клещами
и позвоночными, так и при длительном отсутствии восприимчивых позво-
ночных животных.
Типы взаимоотношений клещей с патогенными для позвоночных
микроорганизмами отличаются исключительным многообразием. В пред-
шествующих разделах этой главы приведены примеры как настоящего
паразитизма, ведущего к гибели клеща (заражение туляремийным микро-
бом, пироплазмами или филяриями), так и относительно безвредного
комменсализма в случае с риккетсиями, арбовирусами и спирохетами.
В свою очередь еще неизвестные защитные реакции организма ведут к по-
степенному освобождению клеща от возбудителя или наблюдается по-
жизненное носительство последнего.
Пребывание в организме клещей на различных стадиях жизненного
цикла может влиять не только на сроки переживания и интенсивность
размножения возбудителей, но в ряде случаев видоизменяет биологические
свойства последних. Так, для пятнистой лихорадки Скалистых гор описаны
как обратимые изменения вирулентности под влиянием зимовки в клещах
- 290 -
или их линьки, так и более сложные явления интерференции между
штаммами возбудителя. По приводимым в литературе данным опытов
В. Бургдорфера (по Rehacek, 1965), наблюдалась интерференция в клещах
также между вирусом колорадской клещевой лихорадки и риккетсиями —
возбудителями лихорадки Скалистых гор. При лабораторном заражении
клещей Ornithodoros papillipes возбудителем клещевого спирохетоза и
риккетсиями Бернета в их организме часто наблюдалось полное вза-
имоподавление обоих микроорганизмов. Напротив, в Ixodes persulcatus
наблюдалось длительное и устойчивое сосуществование риккетсий
Бернета и вируса клещевого энцефалита (Петрищева и Пчелкина, 1966).
Трансовариальная передача спирохет клещами Ornithodoros moubata
приводила к утрате вирулентности возбудителя для белых мышей уже
в третьем—пятом дочерних поколениях (Geigy u. Aeschlimann, 1964).
В то же время много более продолжительная циркуляция некоторых
видов пироплазм в иксодовых клещах не вела к заметному изменению
их вирулентности (Марков и Абрамов, 1965).
Совершенно недостаточно изучено влияние внешних условий на судьбу
возбудителя в организме переносчика. В большинстве исследований при-
нимается как само собой разумеющееся, что в случае удачного инфицирую-
щего кормления сроки до следующего кровососания достаточны для завер-
шения инкубационного развития возбудителя и появления его в слюне,
фекалиях или коксальной жидкости. В то же время наблюдения над раз-
витием пироплазм и тейлерий в слюнных железах или реактивацией Rickett-
sia (Dermacentroxenus) rickettsi после зимовки свидетельствуют об отсут-
ствии инфицирующей способности в начале питания клещей и требуют
проведения специальных исследований в этом направлении с другими груп-
пами возбудителей.
По аналогии с поведением вирусов в организме насекомых (Smith,
1964) возможно существование температурных порогов развития микро-
организмов и в клещах. В частности, уже известно существование верх-
него температурного порога для симбиотических риккетсий (Suitor, 1964),
тогда как патогенные для человека виды остаются в этом отношении не
изученными. Низкие температуры, по-видимому, не приводят к необрати-
мой инактивации или полной гибели возбудителей в клещах, что обеспе-
чивает возможность их перезимовывания в организме переносчика в уме-
ренных широтах. Питание на иммунных хозяевах, вероятно, также не при-
водит к освобождению клещей от микроорганизмов, как уже установлено
в опытах с Coxiella burneti (Rehn, 1958; Дайтер и Громова, 1966) и Ricket-
tsia (Dermacentoxenus) sibiricus (Гроховская и др., 1964). В то же время
в опытах с вирусом клещевого энцефалита питание иммунной кровью
не влияло на его судьбу в организме нимф и имаго, но вызывало нейтра-
лизацию в личинках (Benda, 1958а; Думина, 1958; Ильенко, 1960).
Из рассмотренных в настоящей главе материалов очевидно, что мы
еще очень далеки от понимания сложных взаимоотношений клещей
с микроорганизмами. Накопленные данные явно недостаточны для созда-
ния широких обобщений и на данном этапе исследований особенно важно
получение новых данных, а не создание в значительной степени умозри-
тельных гипотез.
ЗАКЛЮЧЕНИЕ
Клещи надсем. Ixodoidea — группа высоко специализированных крово-
сосущих членистоногих. Филогенетические связи иксодоидных клещей
с другими паразитиформными клещами в связи с древностью их происхо-
ждения и отсутствием менее специализированных переходных форм
- 291 -
19*
остаются неясными. В то же время, пользуясь методами сравнительно-
паразитологического анализа, разработанными В. Н. Беклемишевым
(1942, 1945, 1951, 1954), можно понять основные направления адаптаций
этих клещей к паразитизму. Многие недостающие звенья в эволюции иксо-
доидных клещей можно восстановить на основании результатов исследо-
вания параллельных рядов морфо-физиологических адаптаций к подсте-
регающему типу паразитизма среди гамазовых клещей — гематофагов.
По сравнению со свободноживущими паразитиформными клещами
или гематофагами гамазидами иксодоидные клещи отличаются гигантскими
размерами тела, поглощением огромных объемов крови и лизированных
тканей позвоночных животных, строгой согласованностью процессов
питания с линькой или размножением и исключительной плодовитостью.
Совершенство адаптаций аргасовых и иксодовых клещей к временному па-
разитизму на наземных позвоночных не уступает таковым у кровососу-
щих насекомых. В настоящее время эти клещи несомненно представляют
процветающую группу, представители которой нападают на млекопитаю-
щих, птиц и рептилий, отличаются всесветным распространением и часто
достигают высокой численности.
Для сравнительно малоподвижных кровососущих клещей, особенно
при пастбищном типе паразитизма, наибольшие трудности связаны с оты-
сканием позвоночного-прокормителя. Максимальная смертность среди
клещей приходится на особей, не сумевших найти хозяина. Одним из глав-
ных направлений эволюции иксодоидных клещей было совершенствова-
ние адаптаций для преодоления этого наиболее опасного периода в их
жизненном цикле путем максимального использования крови позвоноч-
ных в качестве источника пищи, уменьшения числа необходимых встреч
с хозяином в жизненном цикле, роста плодовитости и увеличения инди-
видуальной долговечности. ,
У аргасовых клещей, большей части видов которых свойствен гнез-
дово-норовый тип паразитизма, количество однократно поглощаемой крови
и плодовитость значительно превышают аналогичные показатели среди
гамазид-гематофагов, но уступают иксодовым клещам с более совершенным
пастбищным типом паразитизма. По-видимому, поддержание существова-
ния популяций аргазид в различного типа убежищах сопряжено с меньшей
смертностью, чем при подстерегании хозяев в открытых биотопах. В ка-
честве «страховых приспособлений» для выживания в случае длительного
отсутствия подходящих хозяев у аргасовых клещей выработалась способ-
ность к исключительно длительному выживанию без пищи. Переживанию
клещей в подобных неблагоприятных условиях способствуют также воз-
можность линьки и после неполного насыщения при соответствующем уве-
личении количества нимфальных возрастов в жизненном цикле, а также
способность к автогенному развитию яиц. По особенностям паразитизма
аргасовыё клещи во многом сходны с кровососущими клопами сем. Cimi-
cidae и Reduviidae. Конвергентные сходства наблюдаются у них не только
во многих биологических особенностях (способ нападения на хозяев,
количество однократно поглощаемой крови, характер гонотрофического
ритма и гонотрофических отношений), но и в некоторых морфологических
чертах, как например форма тела и приспособления к его растяжению
при питании.
Наибольшее совершенство адаптаций к временному паразитизму на по-
звоночных наблюдается у иксодовых клещей. Необычайное увеличение раз-
меров тела во время питания достигается у них уже в основном не растя-
жением покровов тела и кишечника, но и их интенсивным ростом в этот
период. В результате первоначально непродолжительный акт кровососа-
ния превращается в многодневную стадию развития на теле хозяина.
Клещ в этот период превращается в истинного паразита, для которого
- 292 -
организм хозяина служит не только источником пищи, но и средой обита-
ния в подлинном смысле этого слова. За время питания вес клеща увели-
чивается в 100 и более раз, что обеспечивает откладку у наиболее крупных
видов до 20 000 яиц.
Наряду с максимальным использованием организма хозяина в качестве
источника пищи при пастбищном типе паразитизма отчетливо проявляется
тенденция к уменьшению числа встреч с хозяином в жизненном цикле.
В результате количество нимфальных возрастов сокращается у иксодид
до одного, количество гонотрофических циклов также уменьшается до од-
ного, а гонотрофическая гармония и согласованность питания и линек
обеспечивают однократность питания на каждой фазе развития. Наконец,
в некоторых родах неоднократно возникает способность к линькам на теле
хозяина, так что у однохозяинных видов число жизненно необходимых
встреч с позвоночным в цикле развития сокращается до одной и, по су-
ществу, происходит переход от временного паразитизма к эктопарази-
тизму. Клещ вынужден покидать тело хозяина только для откладки яиц,
а свободное существование сохранилось лишь на личиночной фазе. Ин-
тересно, что сходная тенденция перехода от многоотрывного к одноотрыв-
ному паразитизму (термины В. Н. Беклемишева, 1954) наблюдается у
некоторых аргасовых клещей и также связана с возникновением у них паст-
бищного типа паразитизма (род Otobius и Alveonasus lahorensis). В раз-
витии морфо-физиологических адаптаций к паразитизму, включая способ-
ность к росту в межлиночный период, эти аберрантные аргазиды также
приобретают много общих особенностей с иксодовыми клещами.
Среди кровососущих насекомых пастбищный подстерегающий тип
паразитизма независимо возник у некоторых групп блох (родов Echid-
nophag, Vermipsylla, Tunga) и мух-кровососок. Несмотря на принци-
пиально иной план строения и тип метаморфоза, у них также наблюдается
значительное конвергентное сходство с пастбищными иксодидами, разви-
вается способность к росту во время питания и наблюдаются все этапы
перехода от пастбищного подстерегающего паразитизма к типичному
эктопаразитизму (овечий рунец).
Переход свободноживущих предков иксодоидных клещей к облигат-
ной гематофагии и превращение их в подстерегающих гнездово-норовых
или пастбищных паразитов были связаны с освоением новой, весьма узкой,
но достаточно сложной жизненной ниши. Сохранение в их жизненном
цикле длительной стадии свободного существования и необходимость
активного нападения на позвоночных-прокормителей (особенно у видов
с пастбищным типом паразитизма) привело к совершенствованию локо-
моторных органов, органов чувств, центральной нервной системы и к раз-
витию комплекса «сложных поведенческих реакций. Наконец, общее уве-
личение размеров тела вызвало коррелятивное развитие дыхательной
системы и совершенствование органов пищеварения как в направлении их
большей специализации к питанию кровью, так и за счет общей интенси-
фикации процессов пищеварения. В результате этих процессов иксодоид-
ные клещи по сложности своей организации не только не уступают, но
даже несколько превосходят свободноживущих паразитиформных кле-
щей.
Только на стадии питания иксодид и некоторых аргазид, когда клещи
становятся стационарными паразитами, происходит значительная пере-
стройка их организации, так что к концу питания тело клещей приобретает
сходство с мешком, заполненным кровью хозяина. Последнее возможно
благодаря сравнительно редкой среди членистоногих способности к возоб-
новлению роста в межлиночный период. Этим обеспечивается совмещение
на одной морфологической фазе жизненной формы, хорошо приспособлен-
ной к свободному существованию и нападению на позвоночных, и гипертро-
- 293 -
фированной формы развития, обеспечивающей поглощение огромной массы
пищи и ее последующей утилизации для быстрого роста или разви-
тия яиц.
При сравнении морфо-физиологических адаптаций кровососущих кле-
щей со сходными по типам паразитизма группами насекомых наряду
с уже отмеченными конвергенциями хорошо видно, что они возникли
на основе различных типов морфо-физиологической организации. В част-
ности, у клещей сохранился более примитивный тип внутриклеточного
пищеварения, а пищеварительные клетки кишечника полифункциональны
и наряду со своей основной функцией служат так же депо запасных пи-
тательных веществ и местом их разнообразных метаболических превра-
щений. В результате интенсивность усвоения поглощенной крови у кле-
щей ниже, чем у насекомых с полостным типом пищеварения. Ротовой
аппарат сосущего типа у клещей по степени совершенства не уступает
таковому насекомых и обеспечивает возможность получения крови не-
посредственно из поврежденных сосудов в толще кожи хозяина. Однако
он построен на основе видоизменения арахноидного типа ротового аппа-
рата и не гомологичен хоботку блох или клопов. В обеих группах в слюне
содержатся эффективные антикоагулины, предотвращающие свертыва-
ние крови в организме паразита, но их биохимический состав и механизм
действия принципиально отличны. На основе проведенного исследования
адаптаций иксодоидных клещей к паразитизму можно было бы привести
еще значительное число аналогичных примеров. Все они представляют
убедительное подтверждение принципов необратимости эволюционного
процесса и сохранения главных морфо-физиологических особенностей
у крупных систематических единиц даже при возникновении многих
конвергенций на основе использования одной и той же жизненной ниши.
Своеобразные экологические и морфо-физиологические особенности
иксодоидных клещей, как паразитов наземных позвоночных животных,
определяют и характер их взаимоотношений с возбудителями. В частности,
в литературе в последнее время отмечены значительные эпидемиологиче-
ские различия между трансмиссивными заболеваниями, связанными с кле-
щами или комарами, причем их в первую очередь объясняют экологиче-
скими различиями между этими группами переносчиков (Павловский,
1964; Smith, 1965). Для природных очагов «клещевых инфекций» обычно
характерна высокая стабильность во времени и пространстве, тогда как
для «комариных инфекций» типичнее быстрое распространение на новые
районы и временное затухание в старых очагах. Эти различия связывают
с тем, что клещи питаются значительно реже комаров и это замедляет
циркуляцию возбудителя в очаге, но зато клещи длительное время нахо-
дятся на теле хозяина и имеют большие шансы на заражение даже при
низком титре возбудителя в крови. Кроме того, исключительная индиви-
дуальная долговечность клещей вместе со способностью к трансфазовоп
и трансовариальной передачам возбудителей предопределяют возмож-
ность переживания возбудителей в их организме в межэпизоотические
периоды. Наконец, питание очень многих видов клещей на мелких млеко-
питающих и птицах с высокой скоростью обновления популяций умень-
шает шансы автономного затухания очага вследствие чрезмерного накоп-
ления иммунной прослойки среди восприимчивых позвоночных.
Наряду с экологическими особенностями клещей их важная роль в ка-
честве переносчиков многих групп возбудителей инфекций определяется
некоторыми чертами их морфо-физиологической организации. В частности,
в отличие от насекомых, на пути микроорганизмов из полости кишечника
в клетки его стенок отсутствует механический барьер перитрофической
мембраны, а исключительная способность пищеварительных клеток кле-
щей к пиноцитозу обеспечивает пассивную транспортировку возбудителей
— 294 —
внутрь клеток. Длительное питание клещей, связанное с постоянным вве-
дением в организм хозяина свежих порций слюны и выделением из аналь-
ного отверстия большого количества фекалий и полупереваренной крови,
а у аргазид — и с выделением коксальной жидкости, создает исключи-
тельно благоприятные условия для инокулятивной или контаминативной
передач возбудителей инфекций восприимчивым позвоночным. Наконец,
особенности линочных изменений в организме клещей и строения их яич-
ника обеспечивают легкость трансфазовой и трансовариальной передач
микроорганизмов.
В заключение следует оценить возможности применения методов морфо-
физиологического и экологического анализов для разрешения проблемы
взаимоотношений возбудителей инфекций с членистоногими-переносчи-
ками. На примере иксодоидных клещей очевидно, что этот метод позволяет
вскрыть специфику взаимоотношений только на уровне крупных система-
тических подразделений макроорганизмов с микроорганизмами. В то же
время он недостаточен для объяснения причин видовой или внутривидо-
вой специфичности, когда близкие виды или даже популяции внутри вида
обладают различной способностью к заражению и последующей передаче
одного и того же микроорганизма. Объяснение этим явлениям следует
искать в генетических, биохимических и цитологических различиях
на межвидовом и внутривидовом уровне. Для их разрешения недостаточны
усилия одних зоологов-паразитологов и они должны привлечь внимание
специалистов — биохимиков, цитологов и генетиков, вооруженных новей-
шими методами исследования. Вскрытие взаимоотношений членистоно-
гих-переносчиков с микроорганизмами исключительно важно не только
ввиду теоретической значимости этой проблемы, но и для дальнейшего
совершенствования мероприятий по борьбе с природно-очаговыми заболе-
ваниями.
ЛИТЕРАТУРА
Абрамов И. В., Н. И. Степанов, Л. П. Дьяконов и О. Ф. Гробов.
1965. Анаплазмозы животных. Изд. «Колос», М. : 1—240.
Алфеев Н. И. 1948. О диапаузе у иксодовых клещей. Тр. Военно-мед.
акад. им. С. М. Кирова, 44 : 50—60.
Алфеев Н.И. 1954. О длительности и формах диапаузы иксодовых клещей в связи
с условиями среды. Тр. Военно-мед. акад. им. С. М. Кирова, 58 : 121 — 138.
Аракчеева С. Г. 1963. К вопросу о механизме передачи Spirochaeta sogdiana
клещами Alectorobius tholozani. Мед. паразитол. и паразитарн. болезни,
32 (6) : 665—667.
Арифджанов К. А. и Р. Е. Никитина. 1961. Обнаружение Critidia hya-
lomma О’Farrell, 1913 в клещах Hyalomma anatolicum (Koch, 1844). Зоолог,
журн., 40 (1) : 20—24.
Афанасьева О. В. 1951. Цикл развития клещей Ixodes crenulatus Koch. Тр.
Ср.-Аз. н.-иссл. противочумн. инет., 1 119—127.
Афанасьева О. В. 1956. Экологические особенности иксодовых клещей. Со-
общение 1. Hyalomma asiaticum asiaticum Р. Sch. et E. Schl. 1929. Тр. Ср.-Аз.
н.-иссл. противочумн. инет., 2 : 19—29.
Афанасьева О. В.иМ. А. Микулин. 1959. Современное состояние вопроса
о роли клещей надсем. Ixodoidea в природной очаговости и эпизоотологии чумы.
В сб.: Природная очаговость и эпидемиология особо опасных инфекционных
заболеваний, Саратов : 181—187.
Бабенко Л. В. 1956. К вопросу о сезонных явлениях в жизни клещей Ixodes
ricinus L. и Ixodes persulcatus P. Sch. Мед. паразитол. и паразитарн. болезни,
25 (4) : 346—352.
Бабенко Л. В. 1958. О географической изменчивости сезонного хода активности
Ixodes ricinus и Ixodes persulcatus и о причинах многолетних колебаний их
численности. Мед. паразитол. и паразитарн. болезни, 27 (6) 639—653.
Бабенко Л. В. и М. А. Рубина. 1961. О сроках развития Ixodes persulcatus
Р. Sch. в Красноярском крае и прогнозах его обилия. Мед. паразитол. и
паразитарн. болезни, 30 (4) : 409—416.
Бабенко Л. В. и П. Г. Хижин скип. 1964. О суточном ходе активности кле-
щей Ixodes persulcatus Р. Sch. в лесах Красноярского края. Пробл. мед. пара-
зитол. и профилактики инфекций, М. 521—541.
Балаховский С. Д. и И. С. Балаховский. 1953. Методы химического
анализа крови. Медгиз, М. : 1—746.
Балашов Ю. С. 1954. Особенности суточного ритма отпадения насосавшихся
самок Ixodes persulcatus с коров. Докл. АН СССР, 98 (2) : 317—319.
Балашов Ю. С. 1956а. Изменения веса скотского клеща Ixodes ricinus при крово-
сосании. Зоолог, журн., 35 (1) 29—31.
Балашов Ю. С. 19566. Питание и ход сперматогенеза у самцов иксодовых клещей.
Докл. АН СССР, 110 (6) 1133—1136.
Балашов 10. С. 1957а. Гонотрофические отношения у иксодовых клещей (Acarina,
Ixodidae). Эитомол. обозр., 36 (2) 285—299.
Балашов Ю. С. 19576. Некоторые приспособления к принятию больших масс
крови у иксодовых клещей. Зоолог, журн., 36 (6) : 870—873.
Балашов Ю. С. 1957в. Гистологические особенности пищеварения у иксодовых
и аргасовых клещей. Паразитол. сб. ЗИН АН СССР, 17 : 137—167.
Балашов 10. С. 1958а. К вопросу об активных горизонтальных перемещениях
таежного клеща Ixodes persulcatus Р. Sch. Мед. паразитол. и паразитарн. бо-
лезни, 27 (4) : 481—484.
- 296 -
Балашов К). С. 19586. Особенности питания иксодовых клещей. Паразитол.
сб. ЗИН АН СССР, 18 78—109.
Балашов Ю. С. 1958в. Процессы выделения и функционирование мальпигиевых
сосудов у иксодовых клещей. Паразитол. сб. ЗИН АН СССР, 8 : 120—128.
Балашов ГО. С. 1959а. Периодизация циклов развития иксодовых клещей. Мед.
паразитол. и паразитарн. болезни, 28 (4) : 469—476.
Балашов Ю. С. 19596. Применение массовой маркировки иксодовых клещей для
изучения их подвижности. Зоолог, журн., 38 (7) : 1028—1031.
Балашов Ю. С. 1960а. Водный баланс и поведение Hyalomma asiaticum в пустыне.
Мед. паразитол. и паразитарн. болезни, 29 (3) : 313—320.
Балашов Ю. С. 19606. Рост и растяжение покровов тела иксодовых клещей при
кровососании. Паразитол. сб. ЗИН АН СССР, 19 : 263—290.
Балашов Ю. С. 1960в. Дермальные железы Hyalomma asiaticum. Зоолог, журн.,
39 (9) : 1328—1334.
Балашов Ю. С. 1961а. Динамика запасных питательных веществ и определение
возраста у голодных иксодовых клещей. Зоолог, журн., 40 (9) : 1354—1363.
Балашов IO. С. 19616. Строение органов пищеварения и переваривание крови
аргасовыми клещами. Паразитол. сб. ЗИН АН СССР, 20 : 185—225.
Балашов Ю. С. 1962а. Определение физиологического возраста и возрастной
состав голодных самок Ixodes ricinus и Ixodes persulcatus в Ленинградской обл.
Мед. паразитол. и паразитарн. болезни, 31 (1) : 47—55.
Балашов Ю.С. 19626. Методы анализа возрастного состава популяций иксодовых
клещей. В сб.: Вопросы экологии, 4, Киев : 84—86.
Балашов Ю. С. 1Ц62в. Гонотрофические отношения у аргасовых клещей. В кн.:
Вопросы общей зоологии п медицинской паразитологии, Медгиз, М. 380—
401.
Балашов Ю.С. 1963а. Строение покровов аргасовых клещей (Parasittformes,
Argasidae). Энтомол. обозр., 42 (2) 351—368.
Балашов Ю.С. 19636. Разрушение эритроцитов в пищеварительном тракте крово-
сосущих членистоногих. Докл. АН СССР, 151 (6) : 1470—1473.
Балашов Ю.С. 1963в. Переживанпе лейкоцитов позвоночных в кишечнике крово-
сосущих насекомых и клещей. Докл. АН СССР, 153 (4) 981—983.
Балашов 10. С. 1963г. Анатомо-гпстологические особенности линьки клеща
Hyalomma asiaticum (Acarina, Ixodoidea). Зоолог, журн., 42 (3) : 345—358.
Балашов Ю. С. 1963д. Влияние внешних факторов на число шшфальных стадий
у аргасовых клещей. Паразитол. сб. ЗИН АН СССР, 21 28—38.
Балашов Ю. С. 1963е. Перподпзацпя оогенеза у аргасовых и иксодовых клещей.
Паразитол. сб. ЗИН АН СССР, 21 39—43.
Балашов Ю. С. 1964а. Количество крови, поглощаемой иксодовыми клещами
(Acarina, Ixodidae) во время питания. Зоолог, жури., 43 (3) : 418—423.
Балашов Ю.С. 19646. Строение п развитие половой системы клещей надсем. Ixo-
doidea. Паразитол. сб. ЗИН АН СССР, 22 : 28—60.
Балашов Ю.С. 1965а. Строение ротового аппарата и механизм кровососания
иксодовых клещей. Тр. ЗИН АН СССР, 35 : 251—271.
Балашов Ю. С. 19656. Механизм слюноотделения и морфолого-гистохимические
особенности слюнных желез иксодовых клещей (Acarina, Ixodoidea). Энтомол.
обозр., 44 (4) 785—802.
Балашов Ю.С. 1967. Взаимоотношения клещей надсем. Ixodoidea и риккетсий
рода Wolbachia. Паразитол. сб. ЗИН АН СССР, 23 8—18.
Балашов Ю. С. иЮ.Л. Горощенко. 1960. К развитию и функционированию
мужской половой системы аргасовых клещей. Паразитол. сб. ЗИН АН СССР,
19 16—25.
Балашов Ю. С. и А. Б. Д а й т е р. 1963. К вопросу о роли клещей надсем. Ixo-
doidea прп Ку-риккетсиозе. Сообщение V. Локализация и диссеминация рик-
кетсий Бернета в организме клеща Hyalomma asiaticum Р. Sch. et Е. Schl. Тр.
Инет, эппдемпол. и микробиол. им. Пастера, 25 135—153.
Балашов Ю. С. п А. Б. Дайтер. 1965. Локализация и диссеминация риккет-
сий Бернета в организме клеща Ornithodoros papillipes Bir. Сб.: Чтения пам.
Н. А. Холодковского. Доклады, прочитанные на XVII чтениях. Изд. АН СССР,
М.—Л. : 34—49.
Балашов Ю. С. и Т. Э. Джафаров. 1966. Строение слюнных желез клеща
Hyalomma asiaticum (Acarina, Ixodoidea). Зоолог, журн., 45 (8) 1134—1143.
Балашов Ю. С. и II. А. Филиппова. 1964. Водный баланс и критическая
температура эпикутикулы у аргасовых клещей (Parasitiformes, Argasidae).
Энтомол. обозр., 43 (4) : 823—834.
Беклемишев В. Н. 1940. Гонотрофпческий ритм как один из основных прин-
ципов биологии малярийного комара. В сб.: Вопр. физиологии и экологии
малярийного комара, 1, М. : 3—22.
Беклемишев В. Н. 1942. О сравнительном изучении жизненных схем крово-
сосущих членистоногих. Мед. паразитол. и паразитарн. болезни, 11 (3) : 32—44.
- 297 —
Беклемишев В. Н. 1945. О принципах сравнительной паразитологии в при-
менении к кровососущим членистоногим. Мед. паразитол. и наразитарн. бо-
лезни, 14 (1) : 3—11.
Беклемишев В. Н. 1948. О взаимоотношениях между систематическим положе-
нием возбудителей и нереносчиков трансмиссивных болезней наземных позво-
ночных и человека. Мед. паразитол. и наразитарн. болезни, 17 (5) : 385—400.
Беклемишев В. Н. 1951. Паразитизм членистоногих на наземных позвоночных,
пути его возникновения. Мед. паразитол. и наразитарн. болезни, 20 (2) : 151 —
160; (3) : 233-241.
Беклемишев В. Н. 1954. Паразитизм членистоногих на наземных позвоночных.
II. Основные направления его развития. Мед. паразитол. и наразитарн. болезни,
22(1) : 3—20.
Беклемишев В. Н. 1955. Круг естественных переносчиков трансмиссивных
болезней, поражающих человека. Зоолог, журн., 34 (1) : 3—16.
Беклемишев В. Н. 1957. Некоторые общие вопросы биологии кровососущих
двукрылых. Мед. паразитол. и наразитарн. болезни, 25 (5) : 562—566.
Беклемишев В. Н. 1964. Основы сравнительной анатомии беспозвоночных,
т. II. Изд. «Наука», М. : I—446.
Белозеров В. Н. 1963. Длина дня как фактор, определяющий задержку яйце-
кладки у самок Dermacentor marginatus Sulz. Мед. паразитол. и наразитарн.
болезни, 32 (5) : 521—526.
Белозеров В. Н. 1964а. Диапауза личинок клеща Ixodes ricinus L. и ее зависи-
мость от внешних условий. Зоолог, журн., 43 (И) : 1626—1637.
Белозеров В. Н. 19646. Динамика газообмена во время развития иксодовых
клещей. Энтомол. обозр.. 43 (3) 568—576.
Белозеров В. Н. 1965а. Диапауза у иксодовых клещей. Сб.: Чтения
пам. Н. А. Холодковского. Доклады, прочитанные на XVII чтениях.
Изд. АН СССР, М.—Л. : 12—33.
Белозеров В. Н. 19656. Стадия развития, чувствительная к фотопериодическим
воздействиям у Dermacentor marginatus Sulz. Мед. паразитол. и наразитарн.
болезни, 34 (1) : 52—57.
Белозеров В. Н. 1966а. Динамика газообмена во время развития иксодовых
клещей (A carina, Ixodoidea). II. Дыхание взрослых клещей Dermacentor margi-
natus Sulz. и Ixodes ricinus L. (сем. Ixodidae). Энтомол. обозр., 45 (3) : 509—
522.
Белозеров В. Н. 19666. Нимфальная диапауза у клеща Ixodes ricinus L. I. За-
висимость поведения голодных и развития сытых нимф от фотопериодических
условий. Мед. паразитол. и наразитарн. болезни, 35 (6) : 723—729.
Белозеров В. Н. и 3. А. Михайлова. 1966. Диапауза личинок клеща
Ixodes ricinus L. и его зависимость от внешних условий. 2. Взаимовлияние
условий содержания до и после питания в процессе регуляции диапаузы насо-
савшихся личинок. Зоолог, журн., 45 (4) : 543—550.
Белозеров В. Н. и Л. Н. Серавин. 1960. Регуляция водного баланса
у Alectorobius tholozani (Laboulb. et. Megn., 1882) в условиях различных влаж-
ностей воздуха. Мед. паразитол. и наразитарн. болезни, 29 (3) 308—313.
Берлин Л. Б. 1956а. Изменения эндотелия кожных сосудов под воздействием пи-
тания пастбищных (иксодовых) клещей. Докл. АН СССР, 109 (4) : 859—861.
Берлин Л. Б. 19566. Об изменениях поперечнополосатых мышечных волокон
кожи под воздействием питания па ней клещей Hyalomma asiaticum Р. Sch.
et Е. Schl. (Ixodidae). Докл. АН СССР, 111 (6) 1348-1351.
Берлин Л. Б. 1957. Гистологические изменения кожи кроликов и морских свинок,
вызываемые питанием на них клещей Hyalomma asiaticum Р. Sch. et Е. Schl.
(сем. Ixodidae). Докл. АН СССР, 112 (2) : 340—343.
Вернадская 3. М. 1938. Изучение биологии клещей Hyalomma в условиях
песчаной пустыни. Тр. Узбекск. н.-иссл. опытной станции Наркомзема УзССР,
10 : 18-35.
Благодарный Я. А. 1959. Клещи Ornithodoros tartakovskyi 01. и степные чере-
пахи Testudo horsfieldi — носители патогенных лептоспир в пустыне Муюн-
Кум. В кн.: X совещание по паразитологическим проблемам и природноочаго-
вым болезням, 1, М.—Л. : 120—121.
Во бровских Т. К. 1965. Биология и экология Ixodes trianguliceps Bir. в усло-
виях Карелии. Автореф. канд. дисс. Петрозаводск : 1—23.
Бурлаченко Т. А. 1958. К возможной роли клещей Ornithodoros tartakovskyi
Olen. в эпизоотологии чумы. Тр. Туркменск. противочумной станции, I : 59—73.
Б'у с а л а е в а Н. Н. 1960. К распространению клещей Ornithodoros tartakovskyi
Olen., 1931 в Прибалхашье. Сб.: Паразиты животных Казахстана. Тр. Инет,
зоол. АН КазССР, 11 173—176.
Вагнер Ю. 1894. История эмбрионального развития Ixodes calcaratus Bir. Тр.
Зоотом. каб. СПб. унив., 5 : 1—246.
Волкова А. А., Р. В. Г р е б е н ю к и А. Ф. TJhJm о ф е е в. 1962. Изучение
- 298 -
роли иксодовых клещей в эпизоотологии бруцеллеза. Изв. АН КиргССР, сер.
биол., 4 (5) : 5—13.
Галузо И. Г. 1943. Физические условия развития клещей на поверхности тела
хозяина. Изв. Казахск. фил. АН СССР, сер. зоол., 2 : 97—105.
Галузо И. Г. 1946—1953. Кровососущие клещи Казахстана. I. Введение в изуче-
ние клещей, 1946 : 1 —145; II. Род Hyalomma, 1947 : 1—281; III. Роды Derma-
centor и Rhipicephalus, 1948а : 1—371; IV. Роды Boophilus, Haemaphysalis и
Ixodes, 1949 : 1—388; V. Род Argas, 1953 1—106. Изд. АН КазССР, Алма-Ата.
Галузо И. Г. 19486. Физические факторы местообитания иксодовых клещей. Изв.
АН КазССР, сер. паразитол., 43 (5) : 3—12.
Галузо И. Г. и В. И. Л ь в о в а. 1940. Материалы по экологии Hyalomma detri-
tum Р. Sch. Тр. Таджикск. фил. АН СССР, 14 : 131—159.
Галузо И. Г. и М. М. Ремнецов а. 1956. Переносчики и хранители бруцел-
лезной инфекции в природе. Энтомол. обозр., 35 (3) 560—569.
Ганиев И. М. 1956. К биологии клеща Hyalomma plumbeum plumbeum Panzer,
1795, в условиях Южного Дагестана. Тр. Инет, животн. Дагестанск. фил.
АН СССР, 3 : 27—33.
Гиляров М. С. 1959. Закономерности изменений морфологических и физиологи-
ческих особенностей членистоногих при переходе к наземному образу жизни.
Сб.: Вопросы морфологии и филогении беспозвоночных. Тр. Инет, морфологии
животных им. А. Н. Северцева, 27 118—133.
ГительзонИ. И. иН. А. Терсков. 1959. Эритрограхммы как метод клиниче-
ского исследования крови. Изд. Сибирск. отд. АН СССР, Красноярск : 1—247.
Г л ащинск ая - Б а б е и к о Л. В. 1956. Ixodes lividus Koch как представитель
норовых клещей — иксодид. В сб.: Эктопаразиты, 3 : 21—105.
Голов Д. А. 1933. О видовом составе п биологии клещей близ г. Алма-Аты в связи
с эпидемиологией туляремии. Мед. журн. Казахстана, 2—3 : 32—38.
Горощенко Ю. Л. 1960. О строении мужской гонады и особенностях спермато-
генеза и оогенеза у аргасовых клещей. В сб.: Вопросы цитологии и протистоло-
гии, Изд. АН СССР, М.—Л., 1 187—196.
Горощенко Ю. Л. 1965. Цитологическое исследование некоторых особенностей
гаметогенеза и кариологическое обоснование систематического подразделения
аргасовых клещей. Докл. на соиск. учен. степ. канд. биол. наук, Л. : 1—28.
Гребенюк Р. В. 1966. Иксодовые клещи Киргизии. Изд. «Илим», Фрунзе:
1-328.
Гроховская И. М., В. Ф. Игнатович и В. Е. Сидоров. 1966. Воспри-
имчивость клещей надсемейства Ixodoidea к риккетсиям Провачека. Мед.
паразитол. и паразитарн. болезни, 35 (3) : 299—304.
Гроховская И. М. и В. Е. Сидоров. 1966. О взаимной адаптации клещей
Ornithodoros lahorensis Neum. и возбудителя клещевого сыпного тифа (Der-
macentroxenus sibiricus). Журн. микробиол., эпидемиол. и иммунобиол.,
6 : 133-138.
Гроховская И. М., В. Е. Сидоров и О. С. Коршунова. 1964. Вли-
яет ли на Rickettsia sibirica питание клещей на иммунных животных. Мед.
паразитол. и паразитарн. болезни, 32 (2) : 178—181.
Дайтер А. Б. 1963а. К вопросу о роли клещей над сем. Ixodoidea при Ку-риккет-
сиозе. Сообщение III. Экспериментальпое заражение клещей Ixodes ricinus L.
и Hyalomma asiaticum Sch. et Schl. риккетсиями Бернета. Тр. Инет, эпи-
демиол. и микробиол. им. Пастера, 25 : 101—122.
Дайтер А. Б. 19636. К вопросу о роли клещей надсем. Ixodoidea при Ку-риккет-
сиозе. Сообщение IV. Сохранение риккетсий Бернета в перезимовавших клещах
Ixodes ricinus L. в эксперименте. Тр. Инет, эпидемиол. и микробиол. им. Па-
стера, 25 : 123—124.
Дайтер А. Б. 1966. Биологические взаимоотношения риккетсий Бернета с крово-
сосущими членистоногими и перспективы изучения паразитологии Ку-риккет-
сиоза. В сб.: Первое акарологическое совещание.5Тезисы докладов, изд. «Наука».
М.—Л. : 80—81.
Дайтер А. Б. и Н. И. Амосенкова. 1961. К вопросу о роли клещей
надсем. Ixodoidea при Ку-риккетсиозе. Сообщение II. Инфицирование клеща
Ornithodoros papillipes Bir. риккетсиями Бернета в условиях эксперимента.
Тр. Инет, эпидемиол. и микробиол. им. Пастера, 23 : 166—180.
Дайтер А. Б. и М. И. Г р о м о в а. 1966. К изучению влияния питания клещей
Ornithodoros papillipes на риккетсий Бернета в их организме. Тр. Инет,
эпидемиол. и микробиол. им. Пастера, 29 187—194.
Де Д ю в К. 1964. Лизосома. В кн.: Структура и функции клетки, изд. «Мир»,
М. : 90—103.
Дет и нова Т. С. 1962. Методы установления возрастного состава двукрылых
насекомых, имеющих медицинское значение. Изд. ВОЗ, Женева : 1—220.
Джапаридзе К. И. 1947. Биологические наблюдения над клещом Haemaphy-
salis otophila Р. Sch. Сообщ. АН ГрузССР, 8 (1—2) : 61—68.
- 299 -
Джафаров Т. Э. 1964. Электронномикроскопическое исследование пирамидаль-
ных альвеол слюнных желез некоторых клещей. Сб.: Электронная и флюорес-
центная микроскопия клетки. Изд. АН СССР, Л. : 31—37.
Джафаров Т. Э. 1965а. Электронномикроскопическое исследование секреторных
альвеол слюнной железы клеща Ornithodoros moubata. Цитология, 7 (2) : 233—
236.
Джафаров Т. Э. 19656. Электронномикроскопическое исследование слюнных
желез при их различных функциональных состояниях у клещей Ornithodoros
moubata (Murray) и Hyalomma asiaticum P. Sch. et E. Schl. Автореф. капд. дисс.,
Л. : 1-17.
Дубинин В. Б. 1958. К вопросу о происхождении и развитии типов жизненных
циклов у иксодовых клещей. Изв. Казапск. фил. АН СССР, сер. биол., 6 95—
126.
Д у м и п а А. П. 1958. Экспериментальное изучение зараженности клеща Ixodes
persulcatus вирусом клещевого энцефалита при кровососапии па иммунных жи-
вотных. Всщр. вирусологии, 3 : 156—158.
Д ы л ь к о Н. И. 1953. Материалы по бабезиеллозу крупного рогатого скота (горын-
ского), распространенному вдоль пижпего течения р. Горынь. Автореф. канд.
дисс., Л. 1—13.
Дюсембаев Е. Б. 1963. О зимовке клещей Dermacentor marginatus Sulz. на сель-
скохозяйственных животных в Карагандинской обл. В сб.: Паразиты с.-х. жи-
вотных Казахстана, Изд. АН КазССР. Алма-Ата : 114—115.
Ершова Л. С. 1964. Клещи Ornithodoros lahorensis и Ornithodoros papillipes как
хранители п переносчики туляремийного микроба (в эксперименте). Автореф.
капд. дисс., Алма-Ата : 1—21.
Ефремова Л. К. 1967. Функционирование мальпигиевых сосудов клеща Alveo-
nasus lahorensis (Ixodoidea, Argasidae). Зоолог, журн., 46 (1) : 48—54.
Жмаева 3. М. (1950). Партеногенетическое развитие Haemaphysalis bispinosa
Neum. (Acarina, Ixodidae). Энтомол. обозр., 31 (1—2) 121 —122.
Жмаева 3. M. 1953. О животных-хозяевах клеща Ixodes laguri laguri Olen. Вопр.
краевой, общей, эксперим. паразитол. и мед. зоологии. Изд. АМН СССР, М.,
8 : 99-101.
Жмаева 3. М., П. А. Петрищева и А. А. Пчелкина. 1964. Кровососу-
щие клещи — хранители возбудителя лихорадки Ку в. различных ландшафтных
зонах СССР. Журн. микробиол., эпидемиол. и иммунобиол., 5 28—33.
Захваткин А. А. 1952. Разделение клещей (Acarina) на отряды и их положение
в системе Chelicerata. Паразитол. сб. ЗИН АН СССР, 14 : 5—46.
Здродовский П. Ф. и Е. М. Го л и и е в и ч. 1956. Учение о риккетсиях и
риккетсиозах. Медгиз, М. 1—492.
Земская А. А. 1951а. Биология и развитие клещей сем. Dermanyssidae, парази-
тирующих на рептилиях, в связи с проблемой возникновения пастбищного
паразитизма. Бюлл. Московск. общ. испыт. природы, 56 (3) : 42—57.
Земская А. А. 19516. Биология и развитие куриного клеща Dermanyssus galli-
пае в связи с эпидемиологическим значением. Зоолог, журн., 30 (1) 51—62,
Золотарев Е. X. и 10. А. Елизаров. 1964а. Исследование хеморецепции
насекомых и клещей: поведение клещей Ixodes persulcatus Р. Sch. при
действии репеллентов. Мед. паразитол. и наразитарн. болезни, 33 (I) 47—53.
Золотарев Е. X. и 10. А. Елизаров. 19646. Исследования хеморецепции
насекомых и клещей. Особенности функционирования хеморецепторов клещей
Hyalomma asiaticum Р. Sch. et Е. Sch. при действии репеллентов. Зоолог,
журн., 43 (4): 549—559.
Золоторев Е. X. и Е. Е. С и н и ц ы н а. 1965. Хеморецецторцые органы на
передних ногах иксодовых клещей. Вести, моек, унив., сер. 6, Биология,
Почвоведение, № 1: 17—25.
Князева Н. И. 1964. Физиологический возраст и возрастной состав природной
популяции голодных самок Ixodes persulcatus Р. Sch. в Красноярском крае
и Карельской АССР. В кп.: К природной очаговости паразитарных и транс-
миссивных заболеваний в Карелии, М.—Л. 84—91.
Иванов А. В. 1965. Пауки, их строение, образ жизни и значение для человека.
Изд. ЛГУ : 1—304.
Ильенко В. И. 1960. Влияние на судьбу вируса двухволнового меппнго-эпце-
фалита питания клещеп-перёносчиков этого вируса на иммунных животпых.
Вопр. вирусологии, 5 : 521—525.
Ильенко В. И. и Т. С. Г о р ж а н к и н а. 1964. Материалы к изучению законо-
мерностей трансовариальной передачи вируса клещевого энцефалита у иксо-
довых клещей. В сб.: Клещевой энцефалит, кемеровская клещевая лихорадка,
геморрагические лихорадки и другие арбовирусные инфекции, М. : 208.
Иоффе И. Д. 1963. Строение мозга Dermacentor pictus Herm. (Chelicerata, Acarina).
Зоолог, жури., 42 (10) 1472—1484.
Иоффе И. Д. 1964. Распределение нейросекреторных клеток в центральном нерв-
- 300 -
пом аппарате Dermacentor pictus Herm. (Acarina, Chelicerata). Докл. АН СССР,
154 (1) : 229-232.
Иоффе И. Д. 1965. Сезонные изменения содержания нейросекрета в нейросекретор-
ных клетках Dermacentor pictus Herm. (Ixodoidea, Acarina). Мед. паразитол.
и паразитарн. болезни, 34 (1) 57—63.
Касьянов А. Ф. 1947. Зимнее паразитирование клещей сем. Ixodidae на сель-
скохозяйственных животных в Хабаровском крае. Ветеринария, 10 : 14—16.
К н ы ш е в и ч Н. А. 1963. Развитие клещей Ornithodoros hermsi в зависимости от
питания на различных животных. Тр. Военно-мед. акад. им. С. М. Кирова,
149 162—165.
Копдрашкина К. И. 1951. О биологии клещей Rhipicephalus schulzei. Тр.
Ипст. «Микроб», 1 : 206—219.
К о н д р а ш к и п а К. И., Г. А. 3 а х а р о в и Л. И. Г л у ш к о. 1964. Способ-
ность чумного микроба размножаться в организме клеща Rhipicephalus schul-
zei 01. В сб.: Природная очаговость болезней и вопросы паразитологии, 4,
Фрунзе 99—100.
.Кондрашкина К. И., А. Д. Лукьянова, В. П. Чудесова, Г А. К on-
fl р а ш к и и и Г. М. Б а р а е в а. 1967. Эффективность разных механизмов
передачи возбудителя туляремии теплокровным животным иксодовыми кле-
щами. Паразитология, I (5) : 405—411.
К о р ж у е в П. А. 1964. Гемоглобин. Изд. «Наука», М. 1—287.
Кочкарева-Бахаева А. В. 1964. Клещи Ixodoidea Туркмении. Автореф.
капд. дисс., Ашхабад : 1—25.
К о ш е ч к п н а Г. В. 1950. Положение в биоценозе клещей Ixodes crenulatus. Изв.
АН КазССР, сер. паразитол., 8 : 80—93.
Крепкогорская Т. А. иМ. М. Ремнецов а. 1957. О выделении штаммов
лептоспир из клещей Dermacentor marginatus S., снятых с крупного рогатого
скота. Журп. микробиол., эпидемиол. и иммунобпол.. 2 93—94.
Крылов М. В. 1965. Развитие Nuttallia tadzhikistanica в клеще Hyalomma апа-
tolicum. Acta protozool., 3 {35) 369—382.
Крючеч ников В. И. 1966. Риккетсии Dermacentroxenus sibiricus в клещах
Dermacentor marginatus и Ornithodoros lahorensis. В сб.: Первое акарологическое
совещание. Тезисы докладов, изд. «Наука», М.—Л. 114—115.
Кузнецова Г. М. 1957. Морфологические изменения кожи крупного рогатого
скота при паразитировании пастбищного- клеща Hyalomma scupense. Тр.
Московск. вет. акад., 19 (1) 304—317.
Курчатов В. И. 1938. Бпоэкология клещей Rhipicephalus bursa в связи с пиро-
плазмозом овец. Сов. ветеринария, 3 : 52—54.
Кусов В. Н. 1949. К жизненному цпклу Ornithodoros lahorensis Neum. 1908. Изв.
АН КазССР, сер. парзптол., 7 55—59.
Кусов В. Н. 1957. Некоторые вопросы размножения клещей Ornithodoros lahoren-
sis. Тр. Инет. зоол. АН КазССР, 7 : 81—91.
Кусов В. Н. 1962. Значения разных стадий метаморфоза кошарных клещей в этио-
логии клещевого паралича. В сб.: Паразиты сельскохозяйственных животных
Казахстана, I, Изд. АН КазССР, Алма-Ата : 232—246.
К у ч е р у к В. В., И. Н. Н е ф е д о в а, Т. Н. Д у н а е в а. 1956. К вопросу о зна-
чении самозащиты мелких млекопитающих от личинок и нимф иксодовых кле-
щей. Зоолог, журн., 34 (11) 1723—1727.
Кучерук В. В., Г. А. Сидорова, 3. М. Ж м а е в а. 1955. О самозащите
мелких грызунов от личинок иксодовых клещей. Зоолог, журн., 34 (4) : 948—950.
Лагутенко Ю. П. 1962а. Функциональная анатомия ротового аппарата кури-
ного клеща Dermanyssus gallinae Redi, 1674 (Gamasoidea, Dermanyssidae).
Энтомол. обозр., 41 (4) : 827—838.
Лагутенко 10. П. 19626. Функционально-морфологические адаптации некоторых
гамазовых клещей к паразитизму. Капд. дисс., Л. : 1—160.
Ламанова А. И. 1962. О задержке яиц у клещей Dermacentor marginatus. Мед.
паразитол. и паразитарн. болезни, 31 (4) : 407—412.
Ламанова А. И. 1965. О характере торможения овогенеза при имагинальной диа-
паузе у Dermacentor marginatus. Мед. паразитол. и паразитарн. болезни, 34 (1)
63-68.
Ланге А. Б. 1962. Строение ротовых органов и система клещеобразных Chelicerata.
В сб.: Вопр. общ. зоол. и мед. паразитол., Медгиз, М. 155—188.
Лаптев В. II. 1963. К биологии клеща Haemaphysalis neumanni Donitz, 1905
(партеногенез). Тр. Всесоюзц. инет, эксперим. ветеринарии, 28 : 129—136.
Л е в к о в и ч Е. Н., В. В. Погодина, Г Д. 3 а с у х и н а и Л. Г. Карпо-
вич. 1967. Вирусы комплекса клещевого энцефалита. Изд. «Медицина»,
Л.: 1-246.
Лев кович Е. Н. nA. Н. Скрынник. 4940. О сохранении вируса весенне-
летнего энцефалита в перезимовавших клещах. Арх. биол. наук, 59 (1—2)
118-121.
— 301 —
«Потоцкий Б. В. 1945. Материалы по фауне и биологии клещей надсем. Ixodoidea
в Гиссарской долине Таджикистана в связи с обоснованием мер профилактики
пироплазмов крупного рогатого скота. Тр. Таджикск. фил. АН СССР, 14 :
64—120.
«Потоцкий Б. В., Е. Ф. Соснина иВ. А. Цвиленева. 1959. О случаях
глубокого погружения иксодовых клещей в кожу грызунов. Зоолог, журн.,
38 (3) : 401—417.
Лутта А. С., Е. М. Хейсин и Р. Е. Шульман. 1959. Иксодовые клещи
КАССР и меры борьбы с ними. Изд-во КАССР, Петрозаводск : 1—68.
Лутта А. С. и Р. Е. Шульман. 1958. Влияние микроклиматических условий
луга и леса на выживаемость и активность клеща Ixodes ricinus L. Зоолог,
журн., 37 (12) : 1813—1822.
Лыков В. А. 1966. Влияние температуры на интенсивность расходования за-
пасных питательных веществ у Ixodes persulcatus Р. Sch. Уч. зап. Перм-
ского гос. унив., 130:149—157.
Лысковцев М. М. 1963. Клещевой риккетсиоз. Медгиз, М. : 1—275.
Маклыгин М. В. и А. Н. Алексеев. 1960. Изменения газообмена у клещей
Hyalomma asiaticum Р. Sch. et Е. Schl., 1929 в зависимости от условий внешней
среды. Зоолог, журн., 39 (2) : 297—299.
Мариковский П. И. 1954. Механизм присасывания некоторых иксодовых кле-
щей к покровам человека. Сообщ. ДВ фил. им. В. Л. Комарова АН СССР,
6 : 80—82.
Марков А. А. 1957. Кровепаразитарные заболевания сельскохозяйственных жи-
вотных (пироплазмозы, бабезиеллезы, нутталиоз, тейлериозы, анаплазмозы)
и принципы борьбы с ними в СССР. Тр. Всесоюзн. пнет, эксперим. ветеринарии,
21 : 1-33.
Марков А. А. и И. В. Абрамов. 1958. Краткая сводка возбудителей гемоспо-
ридиозов сельскохозяйственных животных и их переносчиков в СССР. Ветери-
нария, 5 : 31—34.
Марков А. А. и И. В. Абрамов. 1965. О систематике и номенклатуре крове-
паразитов семейства Babesiidae (=Piroplasmidae) домашних животных. Progress
in Protozoology. Abstr. papers read at II Internat. conference Protozoology,
London : 35.
Марков А. А., И. В. Абрамов и Г. С. Дзасохов. 1940. К биологии Hya-
lomma volgense. Тр. Всесоюзн. инет, эксперим. ветеринарии, 15 122—125.
Марков А. А. и А. В. Богородский. 1935. К биологии клеща Boophilus
calcaratus. Тр. Всесоюзн. инет, эксперим. ветеринарии, 9 : 115—123.
Марков А. А. и В. И. Курчатов. 1949. Мероприятия по борьбе с иксодовыми
клещами. Ветеринария, 3 : 4—6.
Меринов В. А. 1964. Экология клеща Dermacentor nuttalli и его значение в эпизо-
отологии североазиатского риккетсиоза. Пробл. мед. паразитол. и профилактики
инфекций, М. : 621—643.
Миронов В. С. 1939. О поведении таежного клеща. Мед. паразитол. и паразитарн.
болезни, 8 (1) : 123—137.
Моисеенко Н. М. 1957. О жизненном цикле клеща Ixodes persulcatus в разных
частях ареала. В сб.: Вопр. географии Дальнего Востока, 3, Хабаровск :
157—162.
Морозов Ю. В. 1963. Выявление индивидуальной активности клещей Ixodes
persulcatus Sch. с помощью методики мечения. Мед. паразитол. и паразитарн.
болезни, 32 (6) : 736—738.
Москвин И. А. 1960. Клещевые спирохетозы. Медгиз, Л. 1—164.
Моульдер Д. 1965. Биохимия внутриклеточного паразитизма. Изд. «Мир»,
М. : 1—196.
Муратов Е. А. 1965. О грибках иксодовых клещей. Докл. АН ТаджССР,
8 (12) : 49-51.
Муратов Е. А. 1966. Критидии в яйцах клеща Boophilus calcaratus Bir. Докл.
АН ТаджССР, 9 (2) : 37-39.
Муратов Е. А. и Е. М. Хейсин. 1959а. Обнаружение Crithidia hyalommae
0’Farrell в клещах Hyalomma detritum и Н. anatolicum Таджикистана.
Докл. АН ТаджССР, 2 (I) 33-37.
Муратов Е.А. иЕ.М. Хейсин. 19596. Развитие Piroplasma bigeminum в клеще
Boophilus calcaratus. Зоолог, журн., 38 (7) 970—986.
Мусатов В. А. 1957. Повторное кормление клещей на одном и том же животном,
как фактор, ведущий к ослаблению культуры клещей Rhipicephalus bursa Can.
et Fanz. В кн.: IX совещание по паразитологическим проблемам. Тезисы докла-
дов, Изд. АН СССР, М.—Л. 175.
Мусатов В. А. 1958. О строении хитинового покрова клещей. Тр. Московск.
вет. акад., 22 (1) : 230—237.
Мусатов В. А. 1965. К вопросу об иммунитете против иксодовых клещей. Тр.
Великолукск. с.-х. инет., 5 : 168—174.
— 302 —
Мусатов В. А. 1966. Химический состав тела иксодовых клещей при различных
условиях питания на животных. В сб.: Первое акарологическое совещание.
Тезисы докладов, изд. «Наука», М.—Л. : 137—138.
Мусатов В. А. 1967. Изменение физиологии и размеров иксодовых клещей при
кормлении на повторно используемых животных. Паразитология, I (4):
288—292.
Мусатов В. А. и Т. В. Шахова. 1961. Влияние паразитирования иксодовых
клещей на морфологический состав крови у сельскохозяйственных животных.
Докл. Великолукск. с.-х. инет. : 158—165.
Мэн Ян-цунь. 1959. К вопросу о питании клещей Haemolaelaps casalis (Gamasoidea,
Parasitiformes). Мед. паразитол. и наразитарн. болезни, 28 (5) : 603—
608.
Наумов Р. Л. 1963. Накармливается ли таежный клещ на обыкновенной и бело-
шапочной овсянках? Зоолог, журн., 42 (4) : 513—517.
Нельзина Е. Н. 1951. Крысиный клещ. Изд. АМН СССР, М. : 1—100.
Нельзина Е. Н. и Г. М. Данилова. 1956. Материалы к биологии клещей
сем. Haemogamasidae (Gamasoidea, Parasitiformes). 1. Питание Haemogamasus
citelli Breg. et Nelz. п H. nidi Mich. Мед. паразитол. и паразитами. болезни,
25 (4) 352-358.
Нельзина Е.Н. п Г. М. Данилова. 1960. Rhipicephalus schulzei 01. (сем. Ixo-
didae) — норовый паразит малого суслика. Мед. паразитол. и наразитарн.
болезни, 29 (3) : 291—300.
Нельзпна Е. Н., М. С. П ы л е н к о, В. П. Ч у д е с о в а, К. И. К о н д р а ш-
к и н а п Л. Т. Б ы к о в. 1960. Материалы к роли Rhipicephalus schulzei 01.
(Ixodidae, Parasitiformes) в природных очагах чумы. Сообщение 1. Локализация
чумного микроба в организме клеща. Мед. паразитол. и наразитарн. болезни,
29 (2) : 202—207.
Неуймин И. В. 1954. Состояние физических факторов в биотопах клещей рода
Ornithodoros. В сб.: Возбудители и переносчики паразитарных болезней.
Тр. Военно-мед. акад. им. С. М. Кирова, 58 : 47—57.
Нецкий Г. И. и Н. А. Ольшевская. 1950. Об осеннем торможении созрева-
ния и развития яиц у клеща Dermacentor pictus. Мед. паразитол. и наразитарн.
болезни, 19 (6) : 521—524.
Никитин В. Н. 1956. Гематологический атлас сельскохозяйственных и лаборатор-
ных животных. Сельхозгпз, М. 1—259.
Никитина Р. Е. 1964. Вопросы бпологии возбудителя спирохетоза птиц Spiro-
chaeta anserinum, Sacharoff, 1891. Автореф. канд. дисс., Алма-Ата, : 1—19.
Никитина Р. Е. 1965. О механизме передачи возбудителя спирохетоза птиц
клещамп Argas persicus (Oken, 1818). Зоолог, журн., 44 (2) : 294—295.
Никитина Н. А. п В. А. Аристова. 1964. О защитных реакциях к клещам
у грызунов. Мед. паразптол. п наразитарн. болезни, 33 (2) : 141—149.
Никитина Н. А. и 3. М. Ж м а е в а. 1963. Факторы, определяющие поражен-
ность клещамп разных видов прокормителей. Мед. паразитол. и наразитарн.
болезни, 32 (1) : 39—43.
Н п к о н о в Г. И. 1958. Ротовой аппарат клеща Ixodes persulcatus. Тр. Ижевск,
мед. пнет., 17 : 262—273.
ОгапджанянА. М. 1950. О цикле развития клеща Rhipicephalus turanicus В. Pom.
Докл. АН АрмССР, 12 (4) 125—126.
Оленев Н.О. 1954. К паразитологии природных очагов клещевого и двухволнового
менинго-эпцефалита на северо-западе СССР. В сб.: Нейровирусные инфекции,
Медгпз, Л. : 148—162.
Олсуфьев Н. Г. 1941. К методике лабораторного разведения иксодовых клещей.
Мед. паразптол. и наразитарн. болезни, 10 (3—4) : 436—439.
Олсуфьев Н. Г. 1947. Заметка о животных-хозяевах молодых стадий клеща
Dermacentor pictus Негш. в условиях Западной Сибири. Зоолог, журн., 26 (3) :
291-292.
Олсуфьев Н. Г. 1953. К экологии лугового клеща Dermacentor pictus Негш.,
о происхожденпи его очагов и путях их ликвидации в средней полосе европей-
ской частп РСФСР. Вопр. краевой, общей, эксперим. паразитол. и мед. зоол.,
8 : 49-98.
Олсуфьев Н. Г. п Т. Н. Дунаева. 1960. Эпизоотология (природная очаго-
вость) туляремии. В кн.: Туляремия, Медгиз, М. : 136—206.
Олсуфьев Н. Г. и С. В. К а г р а м а н о в. 1947. О патогенном действии клеща
Dermacentor pictus Негш. (Acari, Ixodidae) на мышевидных грызунах. Энтомол.
обозр., 29 (3—4) : 256—259.
Остроумова М. В. 1936. К биологии клещей рода Ornithodoros. Функциональное
состояние половых органов и развитие яиц. Узбекск. паразитол. сб., Ташкент,
1 : 270-288.
Остроумова М. В. 1939. К морфологии клещей рода Ornithodoros. Описание
личинки Ornithodoros lahorensis. II. Слюнные, коксальные железы и органы ды-
— 303 —
хания клещей имаго Ornithodoros papillipes и Ornithodoros lahorensis. Узбекск.
паразитол. сб., Ташкент, 2 : 252—281.
Павловский Е. Н. 1935. Клещи надсемейства Ixodoidea. В кп.: Практикум ме-
дицинской паразитологии, под ред. Е. Н. Павловского, Изд. биол. и мед. лит.,
Л. : 246—269.
Павловский Е. Н. 1940а. О сперматофорном оплодотворении и женском половом
аппарате у клещей Ixodoidea. Паразитол. сб. ЗИН АН СССР, 7 : 45—70.
Павловский Е. Н. 19406. Переносчики и резервуары вируса клещевого (ве-
сенне-летнего) энцефалита. Арх. биол. наук, 59 (1—2) 58—71.
Павловский Е.Н. 1947. Микроорганизм, переносчик и внешняя среда в их
соотношениях. Зоолог, журн., 26 (4) : 297—312.
Павловский Е.Н. 1948. Руководство по паразитологии человека. Изд. АН СССР,
М.—Л., 2 : 527—1022.
Павловский Е.Н. 1950. О реагировании клещей Ornithodorus papillipes Bir.
на некоторые физические факторы среды. Паразитол. сб. ЗИН АН СССР, 12
3—12.
Павловский Е.Н. 1960. Клещевой возвратный тиф. В сб.: Природноочаговые бо-
лезни человека, Медгиз, М. : 126—168.
Павловский Е. Н. 1964. Природная очаговость трансмиссивных болезней.
Изд. «Наука», М.—Л. : 1—211.
Павловский Е. Н. и С. П. Алфеева. 1941. Патолого-гистологические из-
менения кожи крупного рогатого скота при укусе клеща Ixodes ricinus. Тр.
Военпо-мед. акад. им. С. М. Кирова, 25 : 153—160.
Павловский Е. Н. и С. П. А л ф е е в а. 1949. Сравнительная патология кожи
млекопитающих при укусе клещами. Действие укуса клещей Hyalomma на
кожу быка, коровы, козы и собаки. Изв. АН СССР, сер. биол., 6 : 709—
715.
(Павловский Е. Н. иЕ. Я. Зарин). Pavlovsky Е. N. and Е. I. Z а-
r i п. 1926. On the structure and ferments of the digestive organs of Scorpions.
Quart. J. Microscop. Sci, 70 (2) : 221—261.
Павловский E. H., Г. С. Первомайский, E. П. Чагин. 1954. Ин-
тенсивность питания одного и одновременно двух впдов пастбищных клещей
(Ixodidae) на кроликах. Зоолог, журн., 33 (3) : 497—506.
Павловский Е. Н., П. А. Петрищева, М. В. Ш е х а н о в и
3. М. Ж м а е в а. 1960. Клещевой энцефалит. В сб.: Природноочаговые бо-
лезни человека, Медгиз, М.: 41—89.
Павловский Е. Н. и А. Н. Скрынник. 1939. Экспериментальное исследо-
вание над передачей спирохет клещевого рекурренса по ходу метаморфоза
Ornithodorus papillipes и при других условиях. Тр. Военно-мед. акад,
им. С. М. Кирова, 18 : 25—42.
Павловский Е. Н. иА. Н. Скрынник. 1946. О размножении голодающих
Ornithodorus papillipes. Зоолог, журн., 25 (5) : 439—440.
Павловский Е. Н. иА. Н. Скрынник. 1951. Трансовариальная передача
спирохет клещевого возвратного тифа у клещей Ornithodorus papillipes. (Сооб-
щение II). Тр. Военно-мед. акад. им. С. М. Кирова, 46 19—28.
Павловский Е. Н. и А. Н. Скрынник. 1952. Экспериментальный анализ
значения различных фаз превращения Ornithodorus papillipes в передаче спиро-
хет клещевого возвратного тифа. Паразитол. сб. ЗИН АН СССР, 14 : 47—52.
Павловский Е. Н. иА. Н. Скрынник. 1956. К биологии клещей Ornitho-
dorus papillipes. Докл. АН СССР, 111 (6) 1403—1405.
Павловский Е. Н. и А. Н. Скрынник. 1959. Лабораторные наблюдения
над клещами Ornithodorus hermsi Wheeler, 1935. Докл. АН СССР, 128 (4)
863-864.
Павловский Е. Н. и А. Н. Скрынник. 1960. Сравнительные данные по
биологии некоторых видов клещей рода Ornithodorus. Докл. АН СССР, 133 (3)
734—736.
Ща в л ов ск ий Е. Н. и А. Н. Скрынник. 1965. Клещи Ornithodoros papilli-
pes Birula как резервуар спирохет-возбудителей клещевого спирохетоза. В сб.:
Чтения пам. Н. А. Холодковского. Доклады, прочитанные на XVII чтениях,
Изд. АН СССР, М.—Л. : 3—11.
Павловский Е. Н. и В. Д. Соловьев. 1940. Экспериментальное исследо-
вание над циркуляцией вируса клещевого энцефалита в организме клеща-пере-
носчика (Ixodes persulcatus). Арх. биол. наук, 59 (1—2) 11 — 117.
Павловский Е. Н. и В. Д. С о л о в ь е в. 1941. О циркуляции вируса весенне-
летнего энцефалита в организме клеща-переносчика Haemaphysalis concinna.
Тр. Военно-мед. акад. нм. С. М. Кирова, 25 • 9—18.
(Павловский Е» Н. и Н. И. Ходукин) Pavlovsky Е. N. und
N. 1. С h о d u k i п. 1929. Uber die Anticoaguline und andere wirksame Bestand-
teile der Zecke Ornithodorus papillipes Bir., Z. Parasitenkunde, 2 (1) : 90—96.
Павловский E. H. нА. К. Штейн. 1936. Действие укуса Ornithodorus pa-
— 304 —
pillipes во всех фазах его метаморфоза на покровы человека. В сб.: Патогенные
животные. Тр. Отд. паразитол. ВИЭМ, 2 89—96.
Первомайский Г. С. 1949. О партеногенетическом развитии у клещей
сем. Ixodidae. Зоолог, журн., 28 (6) : 523—526.
Первомайский Г. С. 1954. Изменчивость пастбищных клещей (Acarina, Ixodi-
dae) и значение ее для систематики. Тр. Всесоюзн. энтомол. общ., 44 : 62—201.
Первомайский Г. С. иМ. В. Маклыгин. 1959. Активность присасывания
клещей Hyalomma asiaticum asiaticum в лабораторных условиях. Зоолог, журн.,
38 (3) : 394—400.
Первомайский Г. С., М. В. Маклыгин и Ю. С. Писаревский.
1963. Патолого-гистологические изменения кожи кролика при первичном и
повторном питании клещей Hyalomma asiaticum Р. Sch. et Е. Schl. Тр. Военно-
мед. акад. им. С. М. Кирова, 149 176—181.
Петрищева П. А. 1947. Каннибализм у клещей Ornithodorus как возможный путь
передачи спирохет клещевого возвратного тифа. Новости медицины, 5 24—26.
Петрищева П. А., 3. М. Ж м а е в а. 1962. Аргасовые клещи (сем. Argasidae).
В сб.: Переносчики возбудителей природноочаговых болезней. Медгиз, М.
263—290.
Петрищева П. А.,3. М. Жмаева п А. А. Пчелкина. 1964. О длительном
сохранении риккетсий Бернета в клёщах из природных очагов. Пробл. мед.
паразитол. п профилактики инфекций, М. : 644—649.
Петрищева П. А. иЕ. Н. Левковпч. 1949. О спонтанном вирусоноситель-
стве клещей Ixodes persulcatus и Ixodes ricinus в новых очагах клещевого энце-
фалита. В сб.: Вопр. краевой, общей, эксперим. паразитол. и мед. зоол., 4,
Изд. АМН СССР, М. 42-45.
Петрищева П. А. и А. А. Пчелкина. 1966. Биологические взаимоотноше-
ния между клещами и возбудителями некоторых природноочаговых болез-
ней человека. В сб.: Первое акарологическое совещание. Тезисы докладов,
изд. «Наука», М.—Л.: 154—155.
Петров В. Г. 1939. К вопросу о развитии Babesiella bovis в организме клеща Ixo-
des ricinus. Тр. Ленингр. пироплазмозной станции, 1 : 17—29.
Петров В. Г. 1958. Экспериментальное изучение клещей Dermacentor marginatus
Sulz. и Rhipicephalus rossicus Jak. et Jak. как переносчиков туляремии. В сб.:
Вопросы эпидемиологии п профилактики туляремии, Медгиз, М. 117—123.
Петров В. Г. 1962. О трансовариальной передаче возбудителя туляремии у клещей
Dermacentor marginatus Sulz. Мед. паразитол. и паразитарн. болезни, 31 (1)
62—66.
Петров В. Г. 1966. Иксодовые и гамазовые клещи как переносчики возбудителя
туляремийной инфекции. В сб.: Первое акарологическое совещание. Тезисы
докладов, изд. «Наука», М.—Л. : 155—156.
Петров В. Г. и Т. Н. Дунаева. 1955. Зависимость инфицирования иксодовых
клещей от особенностей течения туляремии у животных-доноров. В сб.: Вонр.
краевой, общей, экснерим. наразитол. и мед. зоол., 9, Изд. АМН СССР, М.
153-161.
Петров В. Г. иН. Г. Олсуфьев. 1953. О размножении Bacterium tularense
в клещах Dermacentor pictus Негт. в процессе их метаморфоза. В сб.: Вопр.
краевой, общей, эксперим. паразитол. и мед. зоол., 8, Изд. АМН СССР, М. :
149-156.
Петрова-Пионтковская С. П. 1947. Сравнительные данные по биологии
Rhipicephalus sanguineus Latr. и Rhipicephalus turanicus В. Pom. в лабораторных
условиях. Зоолог, журн., 26 (2) : 173—176.
Пионтковская С. П. 1951. К экологии Dermacentor nuttalli 01. В сб.: Вопр.
краевой, общей, эксперим. паразитол. и мед. зоол., 7, Изд. АМН СССР, М. :
176-183.
Пионтковская С. П. иЗ. М. Жмаева. 1962. Иксодовые клещи (Acarina,
Parasitvformes, Ixodidae). В сб.: Переносчики возбудителей ириродноочаговых
болезней, Медгиз, М. : 196—262.
Пионтковская С. П. и О. С. Коршунова. 1951. Способность некоторых
видов иксодовых клещей воспринимать и сохранять возбудителей алтайского
клещевого риккетсиоза и марсельской лихорадки. В сб.: Вопр. краевой, общей,
эксперим. паразитол. и мед. зоол., 7, Изд. АМН СССР, М. : 163—175.
Пионтковская С. П. и О. С. Коршунова. 1953. Клещ D. marginatus
Sulz. — стойкий хранитель возбудителя алтайского клещевого риккетсиоза.
В сб.: Вопр. краевой, общей, эксперим. паразитол. и мед. зоол., 8,
Изд. АМН СССР, М. 15—18.
Пионтковская С. П. и О. С. Коршунова. 1960. Клещевой сыпной тиф
Азии. В сб.: Природноочаговые болезни человека, Медгиз, М. : 90—125.
Покровская Е. И. 1951. К экологии личинок и нимф клеща Dermacentor margi-
natus Sulz. в условиях Воронежской области. Зоолог, журн., 30 (3) : 224—228.
20 Ю. С. Балашов — 305 —
Покровская Е.И. 1953. К экологии клеща Dermacentor marginatus Sulz. в усло-
виях Воронежской области. Зоол. жури., 32 (3) : 435—440.
Полянский 10. И. и Е. М. Хейси н. 1959. Некоторые наблюдения над раз-
витием Babesiella bovis в клеще-переносчике. В сб.: Вопросы паразитологии
Карелии. Тр. Карельск. фил. АН СССР, 14 : 5—13.
Померанцев Б. И. 1935. К вопросу о происхождении клещевых очагов в Ленин-
градской области. В сб.: Вредители животноводства, Изд. АН СССР, М.—Л.
32—110.
Померанцев Б. И. 1937. О паразитических адаптациях у Ixodoidea (Acarina).
Изв. АН СССР, Отд. естеств. и математ. наук, 4 : 1423—1436.
Померанцев Б. И. 1947. К построению системы Ixodoidea (Acarina, Parasitifor-
mes). Паразитол. сб. ЗИН АН СССР, 9 : 13—38.
Померанцев Б. И. 1948. Основные направления эволюции Ixodoidea (Acarina).
Паразитол. сб. ЗИН АН СССР, 10 : 5—19.
Померанцев Б.И. 1950. Иксодовые клещи (Ixodidae). Фауна СССР. Паукообраз-
ные, 4 (2). Изд. АН СССР, Л. : 1—224.
Померанцев Б. И. и Г. В. Сердюкова. 1948. Экологические наблюдения
над клещами сем. Ixodidae — переносчиками весенне-летнего энцефалита на
Дальнем Востоке. Паразитол. сб. ЗИН АН СССР, 9 : 47—67.
Поспелова-Штром М. В. 1935. Биологические наблюдения над клещами
Hyalomma yakimovi 01. в лабораторных условиях. В сб.: Вредители животно-
водства, Изд. АН СССР, Л. : 195—233.
Поспелова-Штром М. В. 1941. К методике кормления клещей Ixodidae
в лаборатории. Мед. паразитол. и наразитарн. болезни, 10 (3—4) : 433—434.
Поспелова-Штром М. В. 1953. Клещи-орнитодорины и их эпидемиологиче-
ское значение. Медгиз, М. : 1—236.
Поспелова-Штром М. В. 1959а. Фауна и географическое распространение
клещей-орнитодорин в странах мира. В сб.: Паразитарные болезни п борьба
с ними в зарубежных странах, Медгиз, М. : 260—289.
Поспелова-Штром М. В. 19596. Поселковый очаг клещевого спирохетоза
горного типа (структура, генезис, эпидемиологический анализ, пути ликвида-
ции). Тр. Инет. мед. паразитол. и тропическ. медицины им. Е. И. Марцинов-
ского : 389—469.
Поспелова-Штром М. В. и С. П. Петрова-Ппонтковская.
1949а. К биологии некоторых видов клещей рода Haemaphysalis. В сб.: Вопр.
краевой, общей, эксперим. паразитол. и мед. зоол., 4, Изд. АМН СССР, М. :
58-64.
Поспелова-Штром М. В. и С. П. Петрова-Ппонтковская
19496. К биологии Hyalomma marginatum, Н. detritum и Н. asiaticum в лабо-
раторных условиях. В сб.: Вопр. краевой, общей, эксперим. паразитол. и мед.
зоол?, 6, Изд. АМН СССР, М. : 87-97.
Разумова И. В. 1960. Юный возраст самки как фактор задержки яйцекладки
у Dermacentor pictus Негш. и D. marginatus Sulz. Мед. паразитол. и наразитарн.
болезни, 29 (3) : 300—308.
Разумова И. В. 1965. Сезонный ход развития диапаузы у клещей Dermacentor
pictus (Негш.) и факторы, ее стимулирующие. Мед. паразитол. и наразитарн.
болезни, 34 (1) : 46—52.
Разумова И.В. 1966а. Длительность жизни природной популяции голодных поло-
возрелых клещей Dermacentor pictus Негш. Мед. паразитол. и наразитарн.
болезни, 35 (3) : 293—298.
Разумова И. В. 19666. К вопросу о летней неактивности голодных имаго и диа-
паузе сытых самок Dermacentor pictus Негт. В сб.: Первое акарологическое
совещание. Тезисы докладов, изд. «Наука», М.—Л. 169—170.
Ремнецова М. М. иН. Ф. Хрущева. 1966. Итоги изучения кровососущих
клещей как возможных переносчиков бруцеллеза. В сб.: Первое акарологическое
совещание. Тезисы докладов, изд. «Наука», М.—Л. : 174—175.
Сартбаев С. К. 1960. Сравнительные данные по экологии клещей рода Hae-
maphysalis в Киргизии. Изв. АН КиргССР, сер. бил., 2 (6) : 73—85.
Сер дюков аТ. В. 1945. Случай локального массового размножения клещей Hya-
lomma anatolicum anatolicum Koch в Таджикистане и их причины. Изв. Таджикск.
фил. АН СССР, 6 : 60—63.
Сердюкова Г. В. 1946. О цикле развития клеща Hyalomma anatolicum Koch.
Изв. АН СССР, сер. биол., 2—3 : 202—206.
Сердюкова Г. В. 1951. Зимовка яиц Ixodes ricinus L. в условиях Карельского
перешейка. Докл. АН СССР, 81 (6) : 1171-1173.
Сердюкова Г. В. 1952. Новые данные о развитии личинок и нимф Ixodes ricinus L.
в природных условиях. Докл. АН СССР, 83 (5) 769—772.
Сердюкова Г. В. 1960. Цикл развития клещей сем. Ixodidae. Тр. Всесоюзн.
энтомол. общ., 47 : 273—289.
— 306 -
Сидоров В. Е. 1960а. Кишечник аргасовых клещей как среда обитания борре-
лий (Borrelia sogdianum). Зоолог, журн., 39 (9) : 1324—1327.
Сидоров В. Е. 19606. Полость тела аргасовых клещей как среда обитания спиро-
у хет и бруцелл. Журн. микробиол., эпидемиол. и иммунобиол., 6 : 91—97.
Сидоров В. Е. 1960в. О природе коксальной жидкости аргасовых клещей Ornitho-
doros lahorensis, О. papillipes и Argas persicus. Докл. АН СССР, 130 (5) 1161 —
1164. -
Скрынник А. Н. 1966. Специфичность видов Ornithodoros как переносчиков кле-
щевого снирохетоза. В сб.: Первое акарологическое совещание. Тезисы докла-
дов, изд. «Наука», М.—Л. : 194—195.
СлонимА. Д. 1952. Животная теплота и ее регуляция в организме млекопитающих.
Изд. АН СССР, М.-Л. : 1-327.
Соколов И. И. 1956. К вопросу оплодотворения у иксодовых клещей. Зоолог,
журн., 35 (4) : 511-528.
Соколов И. И. 1958. Цитологические исследования развития мужских половых
элементов у Ornithodoros papillipes Bir. (Acari, Ixodoidea). Энтомол. обозр.,
37 (2) : 260—281.
Солошенко И. 3. 1959. Роль кровососущих членистоногих в поддержании эпизо-
отий лептоспироза в очагах заболевания. В кп.: X совещание но паразитологи-
ческим проблемам и нриродноочаговым болезням, 1, Изд. АН СССР, М.—Л.
139—140.
Соснина М. Ф. 1961. Некоторые данные о распределении личинок иксодовых кле-
щей на теле хозяина в лабораторных условиях. Изв. АН ТаджССР, 2 (5) :
61-73.
Суворов Е. К. 1908. Ixodes reduvius. Анатомический очерк. Тр. СПб. общ.
естествоисп., 38 (4) : 139—239.
Талызин Ф. Ф. и А. А. П ч е л к и н а. 1949. О токсическом действии слюнных
желез клеща Hyalomma asiaticum. Изв. АН СССР, сер. биол., № 6 : 716—718.
Тарасевич И. В. 1957. Изучение экспериментального Ку-рпккетспоза у Hya-
lomma plumbeum plumbeum Panz. Журн. мпкробпол., эппдемпол. п пммунобпол.,
6 : 45-51.
Т е р а в с к и й И. К. 1957. О форменных элементах гемолимфы клещей сем. Arga-
sidae. ^Зоолог, журш, 36 (10) : 1448—1454.
Т е р а в с к^ГТМГГЙ? 1959? ТГвопросу о циркуляции возбудителя клещевого рекур-
рейса в организме переносчика — Ornithodorus papillipes Bir. Тр. Военно-
мед. акад. нм. С. М. Кирова, 105 : 135—141.
Тимофеев А. Ф. 1966. Эпизоотологическая роль кровососущих членистоногих
прп бруцеллезе. Изд. «Илим», Фрунзе : 1—212.
Уголев А. М. 1963. Пристеночное (контактное) пищеварение. Изд. АН СССР,
М.—Л. : 1—170.
У з а к о в У. Я. 1961. Омовампиризм у иксодовых клещей. Зоолог, журн., 40 (4)
608—609.
Ушакова Г. В. 1956. Клещи надсем. Ixodoidea пустыни Бетпак-Дала и прилегаю-
щих к ней районов. Тр. Инет. зоол. АН КазССР, Алма-Ата, 5 : 129—151.
Филиппова Н. А. 1958. Материалы по личинкам и нимфам подсем. Ixodinae
Banks, 1907. Паразитол. сб. ЗИН АН СССР, 18 : 10—77.
Филиппова Н. А. 1959. К возрастной и видовой диагностике нимф некоторых
клещей-орнитодорин. В сб.: X совещание по паразитол. пробл. и прпродпооча-
говым болезням, 2, Изд. АН СССР, М.—Л. : 130.
Филиппова Н. А. 1960. Возрастные особенности нимфальных стадий клеща
Ornithodoros tartakovskyi 01., 1931 и видовая диагностика некоторых нимф рода
Ornithodoros. Паразитол. сб. ЗИН АН СССР, 19 : 7—15.
Филиппова Н. А. 1963. О клещах рода Ornithodoros Koch., паразитирующих
на птицах. Паразитол. сб. ЗИН АН СССР, 21 : 16—27.
Филиппова Н. А. 1966. Аргасовые клещи (Argasidae). Фауна СССР, Паукообраз-
ные, 4 (3). Изд. «Наука», М.—Л. : 1—251.
X е й с и н Е. М. 1953. Поведение взрослых Ixodes persulcatus Р. Sch. в зависимости
от температуры и влажности окружающей среды. Зоолог, журн., 32 (1) : 77—87.
X е й с и н Е. М. 1955а. Продолжительность развития личинок и нимф Ixodes ricinus
и I. persulcatus в разные сезоны года (к вопросу о диапаузе). Тр. Карело-Финск.
гос. унив., 6, Петрозаводск : 28—44.
X е й с и н Е. М. 19556. Продолжительность цикла развития Ixodes ricinus в природ-
ных условиях Карело-Финской ССР. Тр. Карело-Финск. гос. унив., 6, Петро-
заводск : 92—101.
Хейсин Е.М. 1963. О положении пироплазм в системе простейших. Тр. Всесоюзн.
инет, эксперим. ветеринарии, 28 : 40—50.
Хейсин Е. М., К. Бочкарева иЛ. Лаврененко. 1955а. К вопросу
о сезонной активности взрослых Ixodes ricinus L. в Карело-Финск ССР.
Тр. Карело-Финск. гос. унив., 6, Петрозаводск : 72—91.
— 307 —
20*
Хейсин Е. М., К. Бочкарева, Л. Лаврененко и Т. Михайлова.
19556. Яйцекладка и развитие Ixodes ricinus L. в природных условиях Карело-
Финской ССР. Тр. Карело-Финск. гос. унив., 6, Петрозаводск : 45—71.
Хейсин Е.М. и Л. Е.Лаврененко. 1956. Продолжительность сосания крови
и суточный ритм питания и отпадения самок Ixodes ricinus L. Зоолог, жури.,
35 (3) : 379-383.
Хейсин Е. М. и М. А. Л е б е ш е в а. 1955. Яйцекладка и развитие Ixodes rici-
nus L. и Ixodes persulcatus P. Sch. при разной температуре и влажности окружаю-
щей среды. Тр. Карело-Финск. гос. унив., 6, Петрозаводск : 5—27.
Хейсин Е. М., О. Павловская, Р. П. Малахова и В. Ф. Рыбак.
1955. Продолжительность цикла развития Ixodes persulcatus в природных усло-
виях Карело-Финской ССР. Тр. Карело-Финск. гос. vhiib., 6, Петрозаводск :
102—123.
X и ж и н с к и й П. Г. 1963. Активация, численность п продолжительность активной
жизни клещей Ixodes persulcatus в лесах Красноярского края. Мед. паразитол.
и паразитарн. болезни, 32 (1) 6—13.
Ц а п р у н А. А. 1957. Материалы по развитию' Piroplasma caballi в клещах рода Der-
macentor. Тр. Всесоюзн. инет, эксперим. ветеринарии, 21 221—240.
Цвиленева В. А. 1961а. К сравнительной гистологии крови и соединительной
ткани. Форменные элементы гемолимфы иксодовых клещей. Арх. анатомии,
гистол. и эмбриол., 90 (6) 91 — 100.
Ц в и л о н е в а В. А. 19616. Рыхлая соединительная ткань иксодовых клещей.
Арх. анатомии, гистол. и эмбриол., 91 (12) 79—88.
Ц в и л е н е в а В. А. 1961в. О жировом теле у иксодовых клещей. Докл. АН ТаджССР,
4 (2) 57—60.
Цвилеиева В. А. 1963. К морфологии соединительной ткани иксодовых клещей.
Тр. Инет. зоол. и паразитол. АН ТаджССР, 24 : 171—177.
Ц виленова В. А. 1965. Архитектоника нервных элементов в мозге иксодовых
клещей (Acarina, Ixodidae). Энтомол. обозр., 44 (2) : 241—257.
Ц в п л е н е в а В. А. и В. Ф. М а ш а н с к и й. 1965. Структура кутикулы не-
которых иксодовых клещей. Изв. АН СССР, сер. биол., 5 : 787—792.
Чумаков М. П. 1944. Передача вируса клещевого энцефалита потомству у иксо-
довых клещей и вопрос о природных резервуарах этой инфекции. Мед. парази-
тол. и паразитарн. болезни, 13 (6) 38—41.
Чумаков М. П., С. П. Петрова и В. А. С о н д а к. 1945. Искусственная
адаптация вирусов клещевого и японского энцефалитов к различным видам кле- .
щей семейства Ixodidae. Мед. паразитол. и паразптарн. болезни, 14 (1) : 18—24.
Шевченко С. Ф. 1956. Роль иксодовых клещей в природных очагах туляремии
в низовьях Дона. Канд, дисс., Ростов-на-Дону : 1—217.
Шир апо вич П. И., А. В. М о л о д о в с к и й, К. И. Деревянченко
и Е. Г. Самарин. 1959. О микроклимате нор большой песчанки. Научн.
копфер. по природной очаговости и эпидемиологии чумы в северо-восточном и
восточном Прпкасппи в пределах Гурьевской обл. Тезисы докладов, г. Шахты :
43-45.
Ш п р и н г о л ь ц - Ш м и д т А. И. 1935. К познанию экологии и систематики кле-
щей Дальнего Востока. В сб.: Вредители животноводства, Изд. АН СССР,
Л. 137—186.
Ш т ейнхауз Э. 1950. Микробиология насекомых. Изд. иностр, лит., М. : 1—766.
Ш т ейнхауз Э. 1952. Патология насекомых. Изд. иностр, лит., М. : 1—838.
Шубладзе А. К. и Г. В. Се р^д ю к о в а. 1939. Клещ lx. persulcatus как пере-
носчик таежного энцефалита. Арх. биол. наук, 56 (2) : 121—131.
Я ш к у л ь Б. К. 1960. О причинах летней неактивностп половозрелых клещей Der-
macentor marginatus Sulz. Зоолог, журн., 39 (1) : 45—52.
Aeschlimann А. 1958. Developpement embryonnaire (Р Ornithodoros moubata
(Murray) et transmission transovarienne Borrelia duttoni. Acta tropica, 15 (1) :
15-64.
A m m ah -At t oh V. 1966a. Development of Boophilus decoloratus (Koch, 1844)
on the ox. Nature, London, 209 : 629—630.
Amm‘ah-Attoh V. 1966b. Laboratory rearing of the parasitic stages of Boophi-
lus decoloratus (Koch, 1844) on the European rabbit (Oryctolagus cuniculus).
Nature, London, 210 : 43—44.
Arthur Don R. 1946. The feeding mechanism of Ixodes ricinus. Parasitology,
37 (3-4) 154-162.
Arthur Don R. 1951. The capitulum and feeding mechanism of Ixodes hexagonus.
I. Parasitology, 41 (1—2) 66—81.
Arthur Don R. 1953. The capitulum and feeding mechanism of Ixodes hexagonus
Leach. II. Parasitology, 42 (3—4) 187—191.
Arthur Don R. 1957. The capitulum and feeding mechanism of Dermacentor paru-
mapertus Neumann, 1901. Parasitology, 47 (1—2) 169—184.
— 308 —
Arthur Don R. 1960. Ticks: A monogiaph of the Ixodoidea, Pt. V. Dermacentor,
Anocentor, Cosmiomma, Boophilus and Margaropus. Cambr. Univ. Press : 1—251.
Arthur Don R. 1962. Ticks and disease, Pergamon Press, Oxford 1—445.
Arthur Don R. 1965. Feeding in ectoparasitic Acari with special reference to ticks.
Advances parasitology, 3 : 249—298.
Arthur Don R. 1966. The ecology of ticks with reference to the transmission of Pro-
tozoa. Biology of parasites, Acad. Press, N. Y. 61—84.
Arthur Don R. and K. S n о w. 1966. The significance of size in the immature stages
of the Ixodoidea. Parasitology, 56 (2) : 391—397.
Atwood E. L. a. D. E. Sonenshine. 1967. Activity of the american dog tick,
Dermacentor variabilis (Acarina: Ixodidae) in relation to solar energy changes.
Ann. Entomolog. soc. of America, 60 (2) : 354—362.
Bader C. 1938. Beitrage zur Kenntnis der Verdaungsvorgange bei Hydracarinen.
Rev. suisse zool., 45 (2) 721—806.
Baltazard M., A. G. Chabaud, Ch. M о f i d i et A. M i n о u, 1953. Une
nouvelle filaire «de laboratoire». Ann. parasitol. humaine et comparee, 28 (5—6)
387—391.
Beament J. W. L. 1959. The waterproofing mechanism of arthropods. I. The effect
of temperature on cuticle permeability in terrestrial insects and ticks. J. ExptL
Biol., 36 (2) : 391—422.
Beament J. W. L. 1961. The water relations of insect cuticle. Biol. Revs., 36 (3) :
281—320.
Benda R. 1958a. The common ticks Ixodes ricinus L. as a reservoir and vector of tick-
borne encephalitis. I. Survival of the virus (strain B3) during the development
of the tick under laboratory conditions. J. Hyg., Epidemiol., Microbiol., Immunol..
Prague. (Издание на русском языке), 2 (4) : 449—466.
Benda R. 1958b. The common tick Ixodes ricinus L. as a reservoir and vector of tick-
borne encephalitis. II. Experimental transmission of encephalitis to laboratory
animals by ticks at various stages of development. J. Hyg., Epidemiol., Microbiol.,
Immunol., Prague. (Издание на русском языке). 2 (4) : 467—480.
Bertram D. S. 1939. The structure of the capitulum in Ornithodoros: a contribution
to the study of the feeding mechanism in ticks. Ann. Trop. Med. and Parasitol.,
33 (3) : 229—258.
Bertram D. S. 1960. Contribution to the Discussion on the Symposium on the evolu-
tion of arborvirus diseases. Trans. Roy. Soc. Trop. Med. and Hyg., 54 (2) : 130.
Bertram D. S. 1962. Rickettsial infections and ticks. Symp. Zool. Soc. London,
6 179—197.
В 1 a s k о v i c D., J. Rehacek. 1962. Ticks as virus vectors in eastern Europe.
Biol. Transmiss. Disease Agents. N. Y.—London : 135—157.
Bodkin G. E. 1918. The biology of Amblyomma dissimile Koch with an account of
its power of reproducting parthenogenetically. Parasitology, II (1) : 10—17.
Bonnet A. 1907. Recherches sur Panatomie comparee et le development des Ixodides.
Ann. Univ. Lyon, N. ser., 1 (20) : 1 — 171.
Bremner К. C. 1959. Studies on «Haemixodovin», the pigment in the eggs of the
cattle tick Boophilus microplus (Acarina, Ixodidae). Austral. J. Biol. Sci., 12 (3)
263—273.
В r e z i n a R. and J. A. Rehacek. 1961. Study of the phase variation phenomenon
by experimental infection of the tick, Dermacentor marginatus Sulzer, with Coxiella
burneti. Acta Virol., 5 (4) : 250—254.
Browning H. C. 1942. The integument and moult cycle of Tegenaria atrica (Ara-
neae). Proc. Roy. Soc., 131 (862) 65—86.
Browning T. O. 1954. Water balance in the tick Ornithodorus moubata Murray with
particular reference to the influence of carbon dioxide on the uptake and loss of
water. J. Exptl. Biol., 31 (3) : 331—340.
Brumpt E. et A. Chabaud. 1947. L’infestation par des ixodines provoque-t-elle
une immunite chez Phote? Ann. parasitol. humaine et comparee, 22 (5—6)
348—356.
Buchner P. 1953. Endosymbiose der Tiere mit pflanzlichen Microorganismen.
Lehrbuch. und Monograph, aus dem Gebiete der Exakten wissenschaften Reine
der exper. Biolog., 12 : 1 — 771.
Burgdorfer W. 1951. Analyse.des Infektionsverlaufer bei Ornithodorus moubata
(Murray) und der natiirlichen Ubertragung von Spirochaeta duttoni. Acta tropica,
8 (3) : 194—262.
Burgdorfer W. 1956. The possible role of ticks as vectors of leptospirae. I. Trans-
mission of Leptospira pomona by the argasid tick, Ornithodoros turicata and the
persistence of this organism in its tissue. Exptl. Parasitol., 5 : 571—579.
Burgdorfer W. 1957. Artifical feeding of ixodoid ticks for studies on the transmis-
sion of disease agents. J. Infect. Diseases, 100 : 212—214.
Burgdorfer W. 1960. Colorado tick fever. II. The behavior of Colorado tick fever
virus in rodents. J. Infect. Diseases, 107 : 384—389.
— 309 —
Burgdorfer W. 1963. Investigation of «transovarial transmission» of Rickettsia
rickettsii in the wood tick, Dermacentor andersoni. Exptl. Parasitol., 14 (2) :
152—159.
Burgdorfer W. and C. R. Owen. 1956. Experimental studies on Argasid ticks
as possible vectors of Tularemia. J. Infect. Diseases, 98 : 67—74.
Burgdorfer W. and E. G. Pickens. 1954. A technique employing embryonated
chicken eggs for the infection of argasid ticks with Coxiella burnettii, Bacterium
tularense, Leptospira icterohaemorrhagiae, and western equine encephalits virus.
J. Infect. Diseases, 94 : 84—89.
Burgdorfer W. a. M. G. R. V a r m a. 1967. Transstadial and transovarial develop-
ment of disease agents in Arthropods. Ann. Rev. Entomol., 12 : 347—376.
Gallow L. L. 1965. Babesia bigemina in ticks grown on non-bovine hosts and its trans-
mission to these hosts. Parasitology, 35 (2) : 375—381.
G a r r i к A. and W. В u 1 1 о u g h. 1940. The feeding of the tick Ixodes ricinus L.
in relation to the reproductive condition of the host. Parasitology, 32 (3): 313—
317.
Ghabaud A. G. 1950. L’infestation par des ixodines provoque-t-elle-une immunite
chez I’hote? Ann. parasitol. humaine et comparee, 25 (5—6) : 474—479.
Ghinery W. A. 1964. The mid-gut epithelium of the tick Haemaphysalis spinigera
Neumann 1897. J. Med. Entomol., 1 (2) : 206—212.
Ghinery W. A. 1965a. Studies on the various glands of the tick Haemaphysalis spi-
nigera Neumann 1897. Acta tropica, 22 (3) : 235—266.
Ghinery W. A. 1965b. Studies on the various glands of the tick Haemaphysalis
spinigera Neumann, 1897. Acta tropica, 22 (4) : 321—349.
Christophers S. R. 1906. The anatomy and histology of ticks. Sci. Mem. Offic.
Med. and Sanit. Depts, govt. India, new ser., 23 : 1—55.
Clements A. N. 1963. The physiology of mosquitoes. Pergamon Press, Oxford
1—393.
Cooley R. A. and G. Kohls. 1944. The Argasidae of North America, Central Ame-
rica and Cuba. Amer. Midland Naturalist Monogr., 1 : 1—152.
Cornwall J. and W. P a t t о n. 1914. Some observations on the salivary secretion
of the commoner blood-sucking insects and ticks. Indian J. Med. Res., 2 (2) :
568-593.
Gowdry E. V. 1925. A group of microorganisms transmitted hereditarily in ticks
and apparently unassociated with disease. J. Exptl. Med., 41 : 817—830.
Gowdry E. V. and W. C. D a n к s. 1933. Studies on East Coast fever. II. Behavior
of the parasite and the development of distinctive lesions in susceptible animals,
Parasitology, 25 (1) : 1—63.
Davis G. E. 1940. Bacterium tularense: its persistence in the tissues of the argasid
ticks Ornithodoros turicata and O. parkeri. Publ. Health Repts., (U. S), 55 :
676-680.
Davis G. E, 1943. American «Q» fever. Experimental transmission of the Argasid
ticks Ornithodoros moubata and O. hermsi. Publ. Health Repts., (U. S.), 58 :
984-987.
Davis G. 1951. Parthenogenesis in the Argasid tick Ornithodoros moubata. J. Para-
sitol., 37 (1) 99—101.
Davis G. E. 1956. The identification of spirochetes from human cases of relapsing
fever by xcnodiagnosis with comments on local specificity of tick vectors. Exptl.
Parasitol., 5 (3) : 271-275.
D e 1 p у L. P. 1946. Revision par des voies experimentales du genre Hyalomma Koch,
1844. Ann. parasitol. humaine et comparee, 21 (3—4) : 267—293.
D e 1 p у L. P. et S. H. G о u c h e у. 1937. Biologie de Hyalomma dromedarii Koch,
1844. Ann. parasitol. humaine et comparee, 15 (6) : 487—499.
Dennis E. W. 1932. The life cycle of Babesia bigemina (Smith and Kilbourne) of
Texas cattle-fever in the tick Margaropus annulatus (Say) with notes on the embryo-
logy of Margaropus. Univ. Calif. Publ. ZooL, 36 : 263—298.
Devine T. L., С. E. V e n ar d and W. С. M у s e r. 1965. Measurement of saliva-
tion by Aedes aegypti (L.) feeding on a living host. J. Insect Physiol., 11 (3) :
347-353.
Dhan da V. 1967. Changes in neurosecretory activity at different stages in adult
Hyalomma dromedarii Koch, 1844. Nature, London, 214 : 508—509.
Dickerson G. and M. M. J. L a v о i p i e г r e. 1959a. Studies on the methods
of feeding of blood-sucking arthropods. II. The method of feeding adopted by
the bed-bug (Cimex lectularius) when obtaining a bloodmeal from mammalian
host. Ann. Trop. Med. and Parasitol., 53 (3) : 347—357.
Dickerson G. and M. M. J. Lavoipierre. 1959b. Studies on the methods
of feeding of blood-sucking arthropods. III. The method by which Haematopota
pluvialis (Diptera, Tabanidae) obtains its blood-meal from the mammalian host.
Ann. Trop. Med. and Parasitol., 53 (4) : 465—472.
— 310 —
D i n n i к I. and F. Z u m p t. 1949. The integumentary sense organs of the larvae
of Rhipicephalinae (Acarina). Psyche, Cambridge, 56 (1) : 1—17.
Douglas J. K. 1943. The internal anatomy of Dermacentor andersoni Stiles. Univ.
Calif. Pubis. Entomol., 7 (10) : 207—272.
El-Ziady S. 1958. The behavior of Ornithodoros erraticus (Luces, 1849), small form
(Ixodoidea, Argasidae), towards certain environmental factors. Ann. Entomol.
Soc. Amer., 51 (4) : 317—336.
Enigk K. und I. Grittner. 1952. Die Exkretion der Zecken. Z. Tropenmed.
und Parasitol., 4 (17) : 77—94.
Enigk K. und i. Grittner. 1953. Zur Zucht und Biologie der Zecken. Z. Para-
sitenk., 16 (1) : 56—83.
F a 1 к e H. 1931. Beitrage zur Lebensgeschichte und zur postembryonalen Entwiclung
von Ixodes ricinus L. Z. Morphol. und Okol. Tiere, 21 (3—4) : 567—607.
Feldman -Muhsam B. 1967. Spermatophore formation and sperm transfer in
Ornithodoros ticks. Science, 156, № 3779 1252—1253.
Feldman-Muhsam B. a. Y. Havivi. 1967. Juvenile sterility in male ticks
of Ornithodoros tholozani. Nature, London, 213 : 422—423.
F о g g i e A. 1959. Studies on the Relationship of Tick-Bite to Tick Pyaemia of Lambs.
Ann. Trop. Med. and Parasitol., 53 (1) : 27—34.
Francis E. 1927. Microscopic changes of tularaemia in the tick Dermacentor ander-
soni and the bedbug Cimex lectularius. Publ. Health Repts. (U. S.) 42 : 2763—2772.
Frank W. 1964. Die Ubertragung der Filarien-Infectionsstadien von Macdonaldius
oschei Chabaud et Frank, 1961 (Filarioidea, Onchocercidae) durch Ornithodoros
talaje. (Ixodoidea, Argasidae) auf den endwirt; zugleich ein beitrag zur biologie
des Ubertragers. Z. Paras it enkunde, 24 (4) : 415—441.
Frick G. 1936. Das Zeichnungsmuster der Ixodiden. Versuche der Analyse einer Tier-
zeichnung. Z. Morphol. und Okol. Tiere, 31 (2) : 411—430.
Friend W. G., С. T. U. C h о у and E. Cartwright. 1965. The effect of nut-
ruient intake on the development and the egg production of Rhodnius prolixus
Stahl (Hemiptera: Reduviidae). Canad. J. Zool., 43 (6) : 891—904.
Garcia R. 1962. Carbon dioxide as an attractant for certain ticks (Acarina: Argasidae
and Ixodidae). Ann. Entomol. Soc. Amer., 55 (5) : 605.
Geigy R. und. A. Aeschlimann. 1964. Langfristige Beobachtungen uber trans-
ovarielle Ubertragung von Borrelia duttoni durch Ornithodorus moubata. Acta
tropica, 21 (1) : 1—4.
Geigy R. and O. Wagner. 1957. Ovogenese und Chromosomenverhaltnisse bei
Ornithodorus moubata. Acta tropica, 14 (1) : 88—91.
Gorirossi F. 1950. The mouth parts of adult female tropical rat mite, Bdellonyssus
bacoti (Hirst, 1913), with observations on the feeding mechanism. J. Parasitol.,
36 (4) : 301-318.
Gregson J D. 1956. The Ixodoidea of Canada. Canad. Dept. Agric. PubL, 930,
Ottawa, : 1—92.
Gregson J. D. 1957. Experiments on the Oral Secretion of the Rocky Mountain
Wood Tick, Dermacentor andersoni Stiles (Acarina'. Ixodidae). Canad. Entomologist,
89 (1) 1—5.
Gregson J. D. 1960. Morphology and Functioning of the Mouthparts of Dermacentor
andersoni Stiles. Acta tropica, 17 (1) : 48—79.
Gregson J. D. 1962a. Observations on the feeding of Dermacentor andersoni Stiles
on perfused preparations. XI Internationales Kongress fur Entomologie, Wien,
1960. Sonderdruck aus den Verhandlungen, 2 : 463—466.
Gregson J. D. 1962b. The enigma of tick paralysis in North America. Canad. Dept.
Agric., 3 : 97—101.
Gregson J.D. 1967. Observations on the movement of fluids in the vicinity of the
mouthparts of naturally feeding Dermacentor andersoni Stiles. Parasitology,
57 (1) : 1—8.
Gresikova M. and J. Rehacek. 1959. Isolierung des Zeckenenzephalitisvirus
aus Blut und Milch von Haustieren (Schaf and Kuh) nach Infektion durch Zecken
der Art Ixodes ricinus L. Arch. ges. Virusforsch., 9 : 360—364.
Griffiths R. B. and R. M. G о r d о n. 1952. An apparatus which enables the pro-
cess of feeding by mosquitees to be observed in the tissues of a live rodent; together
with an acount of the ejection of saliva and its significance in malaria. Ann. Trop.
Med. and Parasitol., 46 (4) : 311—319.
G £ji n F. und Ch. Blatter. 1960. Zur Organotropie der Riickfallfieber-Spirochate
Borrelia duttoni Novy et Knapp in der Zecke Ornithodorus moubata Murray. Ver-
such einer Kennzeichnung der substanz, welche die Organotropie verursacht.
Helv. chim. acta, 43 (6), № 208 : 1690-1699.
Haberkorn A., 1963. Untersuchungen uber das Verhalten von Riickfallfieberspi-
rochaeten ins besondere der Borrelia crocidurae-Grwppe in der Kleiderlaus. T. 2.
Z. Tropenmed. und Parasitol., 14 (2) : 209—239.
— 311 —
Heath G. В. S. 1951. The sheep tick Ixodes ricinus L., eradication by dipping sheep.
Parasitology, 41 (3—4) : 209—223.
Hitchcock L. F. 1955a. Studies on the parasitic stages of the Cattle Tick Boophilus
microplus (Canestrini) (Acarina, Ixodoidea). Austral. J. Zool., 3 (2) : 145—155.
Hitchcock L. F. 1955b. Studies of the non-parasitic stages of the Cattle Tick Boophi-
lus microplus (Canestrini) (Acarina : Ixodidae). Austral. J. Zool., 3 (3) : 295—311.
Hoeppli R. and L. C. Feng. 1931. Histological reactions in the skin due to ecto-
parasites. Nat. Med. J. China, 17 : 548—550.
Hoogstraal H. 1966. Ticks in relation to human diseases caused by viruses. Ann.
Rev. Entomol., 11 : 261—308.
Hoogstraal H. 1967. Ticks in relation to human diseases caused by Rickettsia
species. Ann. Rev. Entomol., 12 : 377—420.
Hoogstraal H. and M. N. Kaiser. 1960. Some host relationships of the tor-
toise tick, Hyalomma (Hyalommasta) aegyptium (L.) (Ixodoidea, Ixodidae) in Tur-
key. Ann. Entomol. Soc. Amer., 53 (4) : 457—458.
Hoogstraal H., M. N. Kaiser, M. A. Traylor, S. G a b e r and
E. G u i n d y. 1961. Ticks (Ixodoidea) on Birds Migrating from Africa to Europe
and Asia. Bull. World Health Org., 24 197—212.
Hoogstraal H., M. N. К a i s e г, M. A. T г а у 1 о r, E. G u i n d у and S. G a-
b e r. 1963. Ticks (Ixodidae) on Birds Migrating from Europe and Asia to Africa,
1959—61. Bull. World Health Org., 28 : 235—262.
Hoogstraal H., M. A. Traylor, S.Gaber, G. Malakatis, E.Guindy
and J. H e 1 m y. 1964. Ticks (Ixodidae) on Migrating Birds in Egypt, Spring
and Fall 1962. Bull. World Health Org., 30 355—367.
Hughes T. E. 1949. The functional morphology of the mouthparts of Liponyssus
bacoti. Ann. Trop. Med. and Parasitol., 43 (3—4) 349—360.
Hughes T. E. 1950. The physiology of the alimentary canal of Tyroglyphus jarinae.
Quart. J. Microscop. Sci., 91 (1) 45—61.
Hughes T. E. 1952. The morphology of the gut in Bdellonyssus bacoti (Hirst, 1913).
Ann. Trop. Med. and Parasitol., 46 (1) : 54—60.
Hughes T. E. 1954. Some histological changes wich occur in the gut epithelium of
Ixodes ricinus female during gorging and up to oviposition. Ann. Trop. Med. and
Parasitol., 48 (4) 397—404.
Hughes T. E. 1959. The cuticle of Acaris siro L. (Tyroglyphus). J. Exptl. Biol.,
36 (2) : 363—368.
Hurlbert H. S. and J. I. Thomas. 1960. The experimental host range of the
arthropod-borne animal viruses in arthropods. Virology, 12 (3) : 391—407.
J a s c h к e W. 1933. Beitrage zur Kenntnis der Symbiotisches Einrichtungen bei
Hirudinen und Ixodiden. Z. Parasitenkunde, 5 (3—4) : 515—541.
Jellison W. L. and С. M. Kohl s. 1938. Tick-Host anemia: A secondary anemia
induced by Dermacentor andersoni Stiles. J. Parasitol., 24 (2) : 143—154.
Jones В. M. 1954. On the role of the integument in Acarina development and its be-
aring on pupa-formation. Quart. J. Microscop. Sci., 95 (2) : 169—181.
К i t а о к a S. 1961a. Physiological and ecological studies on some Ticks. IV. Physiolo-
gical stage and lipid deposit during the blood-sucking process in the tick. Nat.
Inst. Animal Health Quart., Tokyo, 1 (2) : 85—95.
Kitaoka S. 1961b. Physiological and ecological studies on some ticks. V. Nitrogen
and iron excretion and amount of blood meal ingested during the blood-sucking
process in the tick. Nat. Inst. Animal Health Quart., Tokyo, 1 (2) : 96—104.
Kitaoka S. 1961c. Physiological and ecological studies on some ticks. VI. Rate of
digestion of blood meal and nitrogen, iron, and sterol economy during the ovipo-
siting process in the tick. Nat. Inst. Animal Health Quart., Tokyo, 1 (2) 105—
112.
Kitaoka S. 1961d. Physiological and ecological studies on some ticks. VII. Parthe-
nogenetic and bisexual races of Haemaphysalis bispinosa in Japan and experimen-
tal crossing between them. Nat. Inst. Animal Health Quart., Tokyo, 1 (3)
142—149.
Kitaoka S. 1962. Physiological and ecological studies on some ticks. VIII. Diurnal
and nocturnal changes in feeding activity during the blood-sucking process of
Haemaphysalis bispinosa. Nat. Inst. Animal Health Quart.. Tokyo, 2 (2) 106—
111.
Kitaoka S. and A. Y a j i m a. 1957. Effects of insecticides on ticks. I. Inhibitory
dosage to the development and Change of the resistance during blood-sucking.
Japan. J. Appl. Entomol. and Zool., 1 (4) : 254—258.
Kitaoka S. and A. Y a j i m a. 1958a. Physiological and ecological studies on tome
ticks. I. Process of Growth by blood-sucking Bull. Nat. Inst. Animal Health,
Tokyo, 34 : 135—147.
Kitaoka S. and A. Y a j i m a. 1958b. Physiological and ecological studies on some
ticks. II. Phase Change of Ovipositing Ability with blood-sucking Quantity.
Bull. Nat. Inst. Animal Health, Tokyo, 34 : 149—162.
— 312 —
К i t а о к a S. and A. Y a j i m a. 1958c. Physiological and ecological studies on some
ticks. III. Parasitic duration of Boophilus caudatus. Bull. Nat. Inst. Animal Health,
Tokyo, 35 : 181 — 188.
Kordova N. and J. ftehacek. 1964. Microscopical investigations of organs from
ticks infected with Rickettsia prowazeki. Acta Virol., 8 (5) : 465—469.
Krieg A. 1963. Rickettsiae and Rickettsioses. В кн.: Insect Pathology. An Advanced
Treatise. Acad. Press. N. Y. and London, 1 : 577—617.
Kunssberg K. 1911. Eine Anticoagulindruse bei Zecken. Zool. Anz., 38 (3) :
263—268.
L a v о i p i e г r e M. M. J. 1965. Feeding mechanism of blood-sucking arthropods.
Nature, London, 208 : 302—303.
Lavoipierre M. M. J. and M. H a m a c h i. 1961. An apparatus for observations
on the feeding mechanism of the flea. Nature, London, 192 998—999.
Lavoipierre M. M. J. and R. F. R i e k. 1955. Observations on the feeding habits
of argasid ticks and on the effect of their bites on laboratory animals, together
with a note on the production of coxal fluid by several of the species studied.
Ann. Trop. Med. and Parasitol., 49 (1) : 96—113.
Lees A. D. 1946a. The water balance in Ixodes ricinus L. and certain other species of
ticks. Parasitology, 37 (1—2) : 1—20.
Lees A. D. 1946b. Chloride regulation and the function of the coxal glands in ticks.
Parasitology, 37 (3—4) : 172—184.
Lees A. D. 1947. Transpiration and the structure of the epicuticle in ticks. J. Exptl.
Biol., 23 (3—4) 379—410.
Lees A. D. 1948. The sensory physiology of the sheep ticks Ixodes ricinus L. J. Exptl.
BioL, 25 (2) : 145—207.
Lees A. D. 1952. The role of cuticle growth in the feeding process of ticks. Proc. Zool.
Soc. London, 121 (4) : 759—772.
Lees A. D. and G. W. В e a m e n t. 1948. An egg-waxing organ in ticks. Quart.
J. Microscop. Sci., 89 (3) : 291—332.
Lees A. D. and A. M i 1 n e. 1951. The seasonal and diurnal activities of individual
sheep Ticks (Ixodes ricinus). Parasitology, 41 (3—4) : 189—208.
L w о f f M. et P. N i с о 1 1 e. 1947. Recherches sur la nutrition des reduvides hemopha-
ges. VI. Necessite de Thematine pour la nutrition de Triatoma infestans Klug.
Bull. Soc. pathol. exot., 40 (11—12) : 467—479.
Mac-Leod G. 1932. The bionomics of Ixodes ricinus L. the «sheep tick» of Scotland.
Parasitology, 24 (2) : 382—400.
Markwardt F. 1963. Blutgerinnungshemmende Wirkstoffe aus blutsaugenden
Tieren. G. Fischer Verlag, Jena : 1—122.
Markwardt F. und H. Landman n. 1958. Untersuchungen uber den blutgerin-
nungshemmenden Wirkstoff der Zecke Ixodes ricinus. Naturwissenschaften, 45 (16) :
398-399.
Markwardt F. und H. Landman n. 1961. Uber einen Hemmstoff der Thrombo-
kinase aus der Lederzecke Ornithodorus moubata. Naturwissenschaften, 48 (11) :433.
Martin R. M., S. F. Barnett and В. О. V i d 1 e r. 1964. Cyclic development
and longevity of Theileria parva in the tick Rhipicephalus appendiculatus. Exptl.
Parasitol., 15 (6) : 527—555.
M e i 1 1 о n de B. and L. G о 1 b e r g. 1947. Preliminary studies on the nutritional
requirements of the bedbug (Cimex lectularius L.) and the tick Ornithodoros moubata
Murray. J. Exptl. Biol., 24 (1—2) : 41—63.
Mellanby K. 1935. The structure and function of the spiracles of the tick, Ornitho-
dorus moubata Murray. Parasitology, 27 (2) : 288—290.
M i 1 1 о t J. 1949. Ordre des Araneides (Araneae). В ku.: Traite de zoologie, 6. Publ.
P.-P. Grasse. Paris : 589—743.
Moorhouse D. E. 1966. Observations on copulation in Ixodes holocyclus Neumann
and the feeding of the male. J. Med. Entomol., 3 (2) : 168—171.
Moorhouse D.E. and R. J.Tatchell. 1966. The feeding processes of the cattle-
tick Boophilus microplus (Canestrini): A study in host-parasitic relations. P. I.
Attachement to..the host. Parasitology, 56 (4) : 623—632.
M u d г о w W. 1932. Uber die intrazelliilaren simbionten der Zecken. Z. Paras it enkunde,
5 (1) : 138—183.
N e i t z W. O. 1956. Classification, transmission and biology of Piroplasms of domestic
animals. Ann. N. Y. Acad., Sci., 64 (2) : 56—111.
N e i t z W. O. 1959. Theilerioses. Advances Veterin Sci., 5 : 241—297.
Nordenskiold E. 1908, 1909, 1911. Zur Anatomie und Histologie von Ixodes
reduvius. Zool. Jahrb., Abt. Anat., I, 1908. 25 (4) 637—674; II, 1909, 27 (3) :
449—464; III, 1911, 32 (1) : 77—106.
Nordenskiold E. 1910. Zur Ovogenese und Entwicklungsgeschichte von Ixodes
reduvius. Zool. Anz., 35 (1) : 30—35.
Nordenskiold E. 1920. Spermatogenesis in Ixodes ricinus Linn. Parasitology,
12 (2) 159—166.
— 313 —
Nuorteva P. and H. Hoogstraal. 1963. The incidence of ticks (Ixodoidea,
Ixodidae) on migratory birds arriving in Finland durig the spring of 1962. Ann.
med. exptl. fenniae, 41 (4) : 457—468.
Nuttall G. H. F. 1911. Notes on ticks. 1 (2). Types of parasitism in ticks, illustrated
by diagram together with some remarks upon longevity in ticks. Parasitology.
4 (3) : 175-182.
Nuttall G. H. F. 1913. Observations on the biology of Ixodidae, Parasitology,
6 (1) : 68-118.
Nuttall G. H. F. and C. Strickland. 1908. On the presence of an anticoagulin
in the salivary glands and intestines of Argas persicus. Parasitology, 1 (4) :
302—310.
Nuttall G. H. F., Warburton C.,W. F. Cooper and L. E. R о b i n s о n.
1908. Ticks: a monograph of the Ixodoidea. Pt. I: Argasidae. Cambridge Univ.
Press : 1—103.
Nuttall G. H. F. and C. Warburton. 1911. Ticks: a monograph of the Ixodoidea,
Pt. II: The genus Ixodes. Cambridge Univ. Press : 105—348.
Nuttall G. H. F. and C. Warburton. 1915. Ticks: a monograph of the Ixodoi-
dea. Pt. Ill: The genus Haemaphysalis. Cambridge Univ. Press : 349—550.
Osterhoff D. R. and R. G о t h e. 1966. The use of red cell antigens for a timing
break-down of erythrocytes during digestion in Ornithodoros savignyi (Audouin,
1827). Parasitology, 56 (4) : 613—618.
Pagenstecher H. А. 186Г. Beitrage zur Anatomie der Milben. II. Ixodes ricinus.
Leipzig : 1—45.
Parker R. and R. Spencer. 1926. Rocky Mountain Spotted fever. A study of
the relationship between the presence of Rickettsialike organism of tick smears
and the infectiveness of the same ticks. Publ. Health Repts., (U. S.), 41 : 461—469.
Pavlov P. and A. P о p о v. 1951. Presence de la tique Amblyomma hebraum (Koch,
1844) en Bulgarie. Bulgar. Akad. Nauk. Inst. Exper. Vet. Med. Izv., 1 : 211—216.
Philip С. B. 1948. Observations on experimental Q fever. J. Parasitol., 34(6):
457-464.
Philip С. B. 1956. Comments on the classification of the order Rickettsiales. Canad.
J. Microbiol., 2 (3) : 261—270.
Philip С. B. 1959a. Some epidemiological considerations in Rocky Mountain spotted
fever. Publ. Health Repts., (U. S.), 77 : 595-600.
Philip С. B. 1959b. Canine rickettsiosis in western United States and comparision with
a similar disease in the Old World. Arch. Past. Inst. Tunis, 36 : 595—603.
Philip С. B. 1963a. Ticks as Purveyors of animal ailments: A Review of Pertinent
Data and of Recent Contributions. Advances Acarology, 1 285—325.
Philip С. B. 1963b. Recent advances in knowledge of tick-associated rickettsialike
organisms. J. Egyptian Publ. Health Assoc., 38 (2) : 61—99.
Philip С. B. and R. R. Parker. 1933. Rocky Mountain Spotted fever, Investiga-
tion of sexual transmission in the wood tick Dermacentor undersoni. Publ. Health
Repts.. (U. S.), 48 : 266—272.
Philip С. B., W. Burgdorfer. 1961. Arthropod vectors as reservoirs of micro-
bial disease agents. Ann. Rev. Entomol., 6 : 391—412.
Pick F. 1965. L’utilisation du principe de xenodiagnostic de E. Brumpt pour des re-
cherches port ant sur la crist all is at ion biologigue et pathologigue de Themoglobine
sanguine du Cobaye. Ann. parasitol. humaine et comparee, 40 (1) : 1—12.
Piercy P. L. 1956. Transmission of anaplasmosis. Ann. N. Y. Acad. Sci., 64 (2) : 40—48.
Price W. H. 1954a. The epidemiology of Rocky mountain spotted fever. II. Studies
on the biological survival mechanism of Rickettsia rickettsii. Amer. J. Hyg., 60 :
292—319.
Price W. H. 1954b. Variation in virulence of Rickettsia rickettsii under natural and
experimental conditions. «The dynamics of virus and rickettsial infections». In-
ternational symposium held at Henry Ford Hospital, Detroit, Mich.. Oct. 21—23,
1953, 10 : 164-183.
Reger J. F. 1963. Spermiogenesis in the tick, Amblyomma dissimilli, as revealed by
electron microscopy. J. Ultrastruct. Res., 8 (5—6) : 607—621.
ftehacek J. 1960. Experimental hibernation of the tick-borne encephalitis virus
in engorged larvae of the tick Ixodes ricinus L. Acta Virol., 4 (2) : 106—109.
ftehacek J. 1962a. Transovarial transmission of tick-borne encephalitis virus by
ticks. Acta Virol., 6 (3) : 220—226.
ftehacek J. 1962b. Prispevek к dukazu antibakterialniho a antivirusoveho ucinku
latek z klistat. Biologia, 17 (1) : 55—59.
ftehacek J. 1965. Development of animal viruses and rickettsiae in ticks and mites.
Ann. Rev. Entomol., 10 : 1—24.
Rehn F. 1958. The relationship between Coxiella burneti and some Ticks with special
reference to the species, Ixodes ricinus. J. Hyg., Epidemiol., Microbiol., Immunol.,
Prague, 2 (3) : 300—313.
— 314 —
Reiss-Gutfreund R. J. 1961. Nouveaux isolements de R. prowazeki a partir
d’animaux domestiques et de tiques. Bull. Soc. pathol. exot., 54 (2) : 284—297.
Richards A. G. 1951. The integument of Arthropods (The chemical components and
their properties, the anatomy and development and the permeability). Univ. Min-
nesota Press : 1—411.
Riek R. F. 1957. Studies on the reactions of animals to infestation with ticks. I. Tick
anemia. Austral. J. Agric. Res., 8 (2) : 209—214.
Riek R. F. 1959. Studies on the reactions of animals to infestation with ticks. V. La-
boratory animals as hosts for the cattle tick Boophilus microplus (Ganestrini).
Austral. J. Agric. Res., 10 (4) : 614—619.
Riek R. F. 1962. Studies on the reactions of animals to infestation with ticks. VI.
Resistance of cattle to infestation with the tick Boophilus microplus (Ganestrini).
Austral. J. Agric. Res., 13 (3) : 532—550.
Riek R. F. 1964. The life cycle of Babesia bigemina (Smith a. Kilborne, 1893) in the
tick vector Boophilus microplus (Ganestrini). Austral. J. Agric. Res., 15 (5) :
802—821.
R is tic M. 1961. Anaplasmosis. Advances Vet. Sci., 6:112—192.
R i s t i с M. 1965. Anaplasma marginale — a non-protozoon blood parasite. Progress
in Protozoology. Abstr. papers read at the II Internal, conference Protozoology,
London : 32—33.
Robinson A. 1926. Ticks: a monograph of the Ixodoidea. Pt. IV: The Genus Am-
blyomma. Gambr. Univ. Press : 1—302.
Robinson L. E. and L. Davidson. 1913—1914. The anatomy of Argas per-
sicus (Oken, 1818). I—III. Parasitology, 6 (1) : 20—48, (3) : 217—256, (4):
382-424.
Roesler R. 1934. Histologische, physiologische und serologische Untersuchungen
fiber die Verdauung bei der Zeckengattung Ixodes, Latr. Z. Morphol. und. Okol.
Tiere, 28 (3) : 297—317.
R о s h d у M. A. 1961a. Comparative internal morphology of subgenera of Argas ticks
(Ixodoidea, Argasidae). I. Subgenus Carios'. Argas vespertilionis (Latreille, 1802).
J. Parasitol., 47 (6) : 987—994.
R о s h d у M. A. 1961b. Observations by electron microscopy and other methods on
the intracellular Rickettsia-like microorganism in Argas persicus Oken (Ixodoidea,
Argasidae). J. Insect. Pathol., 3 (2) : 148—166.
R о s h d у M. A. 1962. Comparative internal morphology of subgenera of Argas ticks
(Ixodoidea, Argasidae). 2. Subgenus Chiropterargas'. Argas boueti, Roubaud and
Golas-Belcour, 1933. J. Parasitol., 42 (4) : 623—630.
R о s li d у M. A. 1963. Comparative internal morphology of subgenera of Argas ticks
(Ixodoidea, Argasidae). 3. Subgenus Secretargas'. Argas transgariepinus, White,
1846. J. Parasitol., 49 (5) 851—856.
R о s h d у M. A. 1964a. The structure and distribution of Rickettsia-like microorga-
nism Wolbachia persica Suitor and Weis in the immature stages of the tick Argas
persicus Oken. J. Insect. Pathol., 6 (2) : 170—185.
R о s h d у M. A. 1964b. Rickettsia-like symbiotes in ticks. Acarologia, 6, Hors ser : 279.
R о s h d у M. A. 1966. Comparative internal morphology of subgenera of Argas ticks
(Ixodoidea, Argasidae). Subgenus Ogadenus: Argas brumpti Neumann, 1907.
J. Parasitol., 52 (4) : 776—782.
Rothschild L. 1961. Structure and Movements of tick Spermatozoa (A rachnida,
Acari). Quart. J. Microscop. Sci., 102 (2) : 239—247.
Rozeboom L. E. and W. Burgdorfer. 1959. Development of Colorado tick
fever virus in the Rocky Mountain wood tick, Dermacentor andersoni. Amer.
J. Hyg., 69 (2) : 138-145.
R u d a 1 1 К. M. 1963. The chitin protein complexes of insect cuticles. Advances Insect.
Physiology, 1 : 257—313.
R u s e r M. 1933. Beitrage zur Kenntnis der Chitins und der Muskulatur der Zecken
(Ixodidae). Z. Morphol. und Okol. Tiere, 27 (2) : 199—261.
Saito J. 1960. Studies on Ixodid ticks. P. IV. The internal anatomy in each stage of
Haemaphysalis flava. Acta med. biol., Niigata, 8 (3) : 189—239.
Sami Ali R. and G. K. S w e a t m a n. 1966. Effect of age, sex and hormone treat-
ment of the mouse on the level of infestation by Rhipicephalus sanguineus larvae.
J. Parasitol., 52 (2) : 407—412.
Samson K. 1909a. Zur Anatomie und Biologie von Ixodes ricinus L. Z. wiss. Zool.,
93 (2) : 185-236.
Samson K. 1909b. Zur Spermiohistogenese der Zecken. Sitzungsber. Ges. naturf.
Freunde, 8 : 486—499.
Sarasin Q. 1959. Zum Organotropismus der Spirochaeta B. duttoni gegeniiber der
Ubertragenden Zecke. Acta tropica, 16 (3) : 218—243.
S a r e e n M. L. 1965. Morphological and cytochemical analysis of the female germ cells
of the ticks Argas persicus (Oken) and Hyalomma aegyptium (Linn.). Res. Bull.
Panjab Univ., 16 (1—2) : 31—44.
— 315 —
Schmidt G., M. L i s s and S. Thannhauser. 1955. Guanine, the principal
nitrogenous of the excrements of certain spiders. Biochim. et biophys. acta, 16 (4) :
533-535.
Schulze P. 1942a. Die Gestaltung des Mitteldarmes bei den Zecken und die E inrich-
tungen fur die Korperdehnung bei der Blutaufnahme (nebst Beitragen zur Lebens-
geschichte der Ixodoidea). Z. Morphol. und Okol. Tiere, 39 (2) : 320—368.
Schulze P. 1942b. Uber die Hautsinnesorgane der Zecken, besonders fiber einer bishei
unbekannte Art von Arthropodensinnesorganen die Krobylophoren. Z. Morphol.
und. Okol. Tiere, 38 (2) : 379—419.
Schulze P. 1951. Vergleichend-morphologische Untersuchungen uber die Augen
der Schildzecken. . Zool. Jahrb., Abt. Anatom, und Ontogen., 71 (3) : 289—324.
Schulze P. 1955. Uber Ausscheidungsvorgange und Ablagerung von Stoffwechsel-
produkten bei den Zecken. Z. Parasitenkunde, 17 (3) 217—236.
Schumacher H. H. and R. H о e p p 1 i. 1963. Histochemical reactions to Trombi-
culid mites with special reference to the structure and function of the «stylostome».
Z. Tropenmed. und Parasitol., 14 (2) : 192—208.*
Sen S. K. 1935. The mechanism of feeding in ticks. Parasitology, 27 (3) 355—368.
Singh K. R. P., К. M. P a v r i and C. R. A n d e г s о n. 1963. Experimental trans-
ovarial transmission of Kysanur forest disease virus in Haemaphysalis spinigera.
Nature 199 513
Smith С. E. G. 1962. Ticks and viruses. Symp. Zool. Soc., London., 6 199—221.
Smith С. E. G. 1964. Factors influencing the behaviour of viruses in their arthropodan
hosts. In: Host-parasite relationships in inverterbrate hosts, ed. A. E. R. Taylor,
Oxford, : 1—31.
Smith С. E. G. 1965. Contrast in the ecology of mosquito- and tick-borne infections.
Theor. Quest. Natural Foci Diseases, Prague, Czechosl. Acad. Sci. 165—171.
Smith D. J. W. 1940. Studies in the epidemiology of Q fever. 3. The transmission of
Q fever by the tick Heamaphysalis humerosa. Austral. J. Exptl. Biol, and Med.
Sci., 18 (2) : 103-118.
Smith D. J. W. 1941. Studies in the epidemiology of Q fever. 8. The transmission of
Q fever by the tick, Rhipicephalus sanguineus. Austral. J. Exptl. Biol, and Med.
Sci., 19 (2) : 133—136.
Smith D. J. W. 1942. Studies in the epidemiology of Q fever II. Experimental in-
fection of the tick Haemaphysalis bispinosa and Ornithodoros sp. with Rickettsia
burneti. Austral. J. Exptl. Biol, and Med. Sci., 20 (4) : 295—296.
Snodgrass R. E. 1948. The feeding organs of Arachnida incluging mites and ticks.
Smithsonian miscellaneous collections, 110 (10) 1—93.
Sonenshine D. E. a. E. L. Atwood. 1967. Dynamics of feeding of the Ame-
rican dog tick Dermacentor variabilis (Acarina: Ixodidae). Ann. Entomolog.
soc. of America. 60 (2) : 362—373.
Srivastava S. C. and M. G. R. V a r m a. 1964. The culture of the tick Rhipice-
phalus sanguineus (Latreille) (Ixodidae) in the laboratory. J. Med. Entomol., 1 (2)
154—157.
Stohler H. R. 1961. The Peritrophic membrane of blood sucking Diptera in rela-
tion to their role as vectors of blood parasites. Acta tropica, 18 (3) : 263—266.
Stone B. F. 1963. Parthenogenesis in the cattle tick, Roophilus microplus. Nature,
200 (4912) : 1233.
Suitor E. G. J. 1964. The relationship of Wolbachia persica Suitor and Weiss to its
host. J. Insect. Pathol., 6 (1) : 111 — 124.
Sutton E. and Don R. Arthur. 1962. Tick feeding in relation to disease
transmission. Symp. Zool. Soc., London, 6 223—252.
T a 1 i c e R. V. 1930. Etude histologique de la piqure de Dermacentor reticulatus (Fabri-
cius, 1794). Ann. parasitol. humaine et comparee, 8 (2) : 173—178.
Tatchell R. J. 1962a. The digestion of blood proteins by the tick, Argas persicus.
Parasitology, 52 (3—4) : 13—14.
Tatchell R. J. 1962b. Studies on the male accessory reproductive glands and the
spermatophore of the tick, A rgas persicus, Oken. Parasitology, 52 (1—2) : 133—142.
Tatchell R. J. 1964. Digestion in the tick, Argas persicus Oken. Parasitology,
54 (3) : 423-440.
Tatchell R. J. 1967. Salivary secretion in the cattle tick as a means of water eli-
mination. Nature, London, 213 940—941.
T e f f e r W. H. 1965. The mechanism and control of yolk formation. Ann. Rev. Entomol.,
10 161 — 184.
Theodor Q. and M. С о s t a. 1960. New species and new records of Argasidae from
Israel. Observations on the rudimentary scutum and the respiratory system of the
larvae of the Argasidae. Parasitology, 50 (3—4) : 365—385.
Till W. M. 1961. A contribution to the anatomy and histology of the Brown Ear Tick
Rhipicephalus appendiculatus Neumann. Mem. Entomol. Soc. S. Africa, 6 1—124.
T о t z e R. 1933. Beitrage zur sinnesphysiologie der Zecken. Z. vergl. Physiol., 19 (1) :
110-161.
— 316 —
Trager W. 1939a. Acquired immunity to ticks. J. Parasitol., 25 (1) : 57—81.
Trager W. 1939b. Further observations on acquired immunity to the tick Dermacentor
variabilis Say. J. Parasitol., 25 (2) : 137—139.
Trager W. 1939c. Intracellular microorganism-like bodies in the tick Dermacentor
variabilis Say. J. Parasitol., 25 (3) : 233—239.
Trager W. 1940. A note on the problem of acquired immunity to argasid ticks. J. Pa-
rasitol., 26 (1—3) : 71—74.
True G. N. 1932. Studies on the anatomy of the Pajaroella tick, Ornithodoros coriaceus
Koch. The alimentary canal. Univ. Calif. Publ., 6 (3) : 21—48.
T u z e t 0. et J. M i 1 1 о t. 1937. Recherches sur le spermiogenese des Ixodes. Bull,
biol. France et Belgique, 71 (2) 190—205.
Varma M. G. R. 1962. Transmission of relapsing fever spirochaetes by ticks. Symp.
Zool. Soc., London, 6 61—82.
Varma M. G. R. 1964. The acarology of louping ill. Acarologia, 6, Hors. ser.
241—254.
Varma M. G. R. and С. E. G. Smith. 1960. Studies on Langet virus (TP21) in
Haemaphysalis spinigera Neumann. Proceedings of a Symposium. Biology of vi-
ruses of the tick-borne encephalitis complex. Czechoslov. Acad. Sci. Press.:
397-400.
W agner-J e.v s e e n к о О. 1958. Fortpflanzung bei Ornithodoros moubata und
genitale Ubertragung von Borrelia duttoni. Acta tropica, 15 (2) : 117—168.
Walton G. A. 1957. Observations on biological variation in Ornithodoros moubata
(Murr.) (Argasidae) in East Africa. Bull. Entomol. Res., 48 (4) : 669—710.
Walton G. A. 1959. A biological variant of Ornithodoros moubata Murray (Ixodoidea,
A rgasidae) from South Africa. Proc. Roy. Entomol. Soc. London, 34 (4—6) :
63—72.
Warren E. 1933. On a typical modes of sperm development in certain Arachnids.
Ann. Natal. Museum. 7 (2) : 151—194.
Weis-Fogh T. 1961. A rubber-like protein in insect cuticle. J. Exptl. Biol., 37 (4)
889—907.
Weitz B. and P. A. В u x t о n. 1953. The rate of digestion of blood meals of various
haematophagous arthropods as determined by the preciptin test. Bull. Entomol.
Res., 44 (3) : 445-450.
Weyer F. 1963. Die Bezichungen des Q-Fieber Erregers (Rickettsia burneti) zu Arthro-
poden. Z. Tropenmed. und Parasitol., 4 (3) 344—382.
Weyer F. 1962. Beitrage zur Frage der Bedeutung von Bettwanzen als Ubertrager
von Rickettsien. Z. angew. Zool., 49 (1) : 61—78.
Weyer F. 1964. Experimentalle Ubertragung von Rickettsien auf Arthropoden. Z.
Tropenmed. und Parasitol., 15 (2) 131 — 138.
Whitman L. and T. H. G. Aitken. 1960. Potentiality of Ornithodoros moubata
as a reservoir-vector of West Nile virus. Ann. Trop. Med. and Parasitol., 54 (2)
192—204.
Wigglesworth V. B. 1943. The fate of haemoglobin in Rhodnius prolixus and
other blood sucking arthropods. Proc. Roy. Soc., B, 131 (865) : 313—339.
Wigglesworth V. B. 1954. The physiology of insect metamorphosis. Cambridge :
1—151.
Wilkinson P. R. 1953. Observations on the sensory Physiology and Behaviour of
Larvae of the cattle tick Boophilus microplus (Ixodidae). Austral. J. Zool., 1 (3)
345-356.
Wilkinson P. R. 1962. Selection of cattle for tick resistance and the effect of herds
of different susceptibility on Boophilus populations. Austral. J. Agric. Res.,
13 (5) : 974-983.
Wilkinson P. R. 1965. Permeability of the sagittiform sensilla in ixodid ticks,
and their possible relation to hydroreception. Canad. Entomologist., 97 (10) :
1116—1118.
Williams S. R. 1905. The anatomy of Boophilus annulatus Say. Proc. Boston Soc.
Nat. Hist., 32 (3) : 313—334.
Winkler W. 1886. Anatomie der Gamasidae. Arb. Zool. Univ., 7 : 317—354.
Worms M. J. a. R. J. T e r r y. 1961. Dipetalonema witei, filarial parasite of jird,
Meriones libycus. I. Maintenance in the laboratory. J. Parasitol., 47 (6) : 963—970.
Wright K. A. and I. M. N e w e 1 1. 1964. Some observations on the fine structure
of the midgut of the mite Anystis sp. Ann. Entomol. Soc. Amer., 57 (6) : 684—693.
Y a 1 v a c S. 1939a. Histologische Untersuchungen fiber die Entwicklung der Zecken
Adultus in der Nymphe. Z. Morphol. und Okol. Tiere, 35 (4) 535—585.
Y a 1 v a c S. 1939b. Der weibliche Geschlechtsapparat von Ixodes. Z. Morphol. und
Okol. Tiere, 36 (2) : 310—314.
Zebrowskyi G. 1926. A preliminary report on the morphology of the American
dog tick. Trans. Amer. Entomol. Soc., 51 (4) : 331—369.
ОГЛАВЛЕНИЕ
Стр.
Введение ............................................................... 3
Морфол ого-ан атомический очерк ........................................ 4
Внешнее строение.................................................... 4
Идиосома (5). — Гнатосома (8). — Конечности (12).
Покровы тела....................................................... 12
Общие особенности кутикулы (12). — Эпикутикула (14). — Растя-
жимая кутикула идиосомы (15). — Склеротизованная кутикула
(18). — Кутикула сочленений (19). — Гистохимические особен-
ности кутикулы (19).
Мускулатура ....................................................... 21
Органы пищеварения ................................................ 23
Слюнные железы (23). — Глотка (25). — Пищевод (26). — Средний
отдел кишечника (28). — Тонкая кишка (30). — Ректальный пу-
зырь (33).—Прямая кишка (33).
Органы выделения .................................................. 34
Мальпигиевы сосуды (34). — Коксальные железы (35).
Кровеносная система ............................................... 35
Ткани внутренней среды............................................. 35
Гемолимфа (35). — Соединительнотканные образования (36).
Органы дыхания..................................................... 37
Органы чувств.................................................... 37
Кожные органы чувств (37). — Органы обоняния (40). — Глаза (40).
Нервная система ...............................,................... 40
Органы размножения................................................. 42
Женская половая система ....................................... 42
Яичник (42). — Яйцеводы (43). — Влагалище (43). — Орган
Жене (47).
Мужская половая система........................................ 47
Семенники (47). — Выводные пути (48). — Придаточные же-
лезы (50).
Жизненные циклы........................................................ 51
Смена хозяев....................................................... 51
Распространение.................................................... 56
Сезонность и продолжительность жизненных циклов .......... 57
Периодизация жизненных циклов ..................................... 65
Послелиночное доразвитие .............................................. 66
Стадия активности...................................................... 67
Особенности поведения.............................................. 67
Приспособления к уменьшению потерь воды организмом................. 75
Индивидуальная долговечность и физиологический возраст............. 81
Питание................................................................ 87
Продолжительность питания ......................................... 88
Вес напитавшихся клещей и количество поглощенной крови ...... 97
Питание самцов..................................................... 103
Динамика весовых изменений на стадии питания....................... 104
Взаимоотношения клещей с организмом хозяина....................... 109
Изменение размеров тела при кровососании........................... 115
Приспособления к увеличению размеров тела во время питания .... 117
— 318 —
Расправление борозд и складок (117). — Изменение веса кутикулы
(119). — Рост и растяжение кутикулы (120). — Секреторная актив-
ность гиподермы во время питания (124).
Механизм приема пищи .................................................. 126
Ротовой аппарат.................................................... 127
Hyalomma asiaticum (127). — Ornithodoros papillipes (131). — Эво-
люция ротового аппарата (132).
Строение слюнных желез............................................. 135
Пирамидальные альвеолы (136). — Секреторные альвеолы (138). —
Ультраструктура секреторных клеток (148).
Состав слюны....................................................... 149
Выделение слюны во время питания................................... 152
Процессы прикрепления, приема пищи и слюноотделения .............. 154
Иксодовые клещи (154). — Аргасовые клещи (158)
Пищеварение............................................................ 161
Особенности крови позвоночных животных как пищи клещей........... 162
Переваривание поглощенной крови.................................... 164
Удаление избыточной воды и разрушение эритроцитов (164). —
Разрушение лейкоцитов (167). — Усвоение гемоглобина (170).
Цитологические особенности пищеварения............................. 174
Аргасовые клещи (174). — Иксодовые клещи (181).
Соотношение между внекишечным, полостным и внутриклеточным типами
пищеварения ....................................................... 194
Средняя кишка как депо запасных питательных веществ............... 196
Выделение ............................................................. 197
Состав экскретов (198).—Функционирование мальпигиевых сосу-
дов (198). — Ритмика дефекации (201).
Линька................................................................. 201
Согласованность питания и линек.................................... 202
Способность к линьке или повторному питанию (202). — Влияние
количества поглощенной крови (204). — Влияние питания на раз-
личных хозяевах (205). — Влияние температуры развития (206). —
Различия между половозрелыми клещами от нимф разных возра-
стов (207).
Внешние изменения при подготовке к линьке.......................... 209
Морфо-физиологические особенности линьки .......................... 210
Линька покровов тела (210). — Дермальные железы (212). —
Трахейная система (216). — Мускулатура (216). — Ткани внутрен-
ней среды (217). — Органы пищеварения (220)
Общие особенности линьки клещей.................................... 221
Размножение ........................................................... 222
Цитологические особенности размножения у самок.................... 223
Развитие женской половой системы (223). — Строение яичника,
оогенез и оплодотворение (228). — Выводные пути, придаточные
железы и яйцекладка (233).
Цитологические особенности размножения у самцов.................... 237
Развитие мужской половой системы (237). — Сперматогенез (239).—
Строение и функции придаточных желез (243). — Строение спер-
матофора (246). — Спаривание (246).
Гонотрофические отношения ......................................... 247
Аргасовые клещи (248). — Иксодовые клещи (251). — Эволюция
гонотрофических отношений (258).
Клещи и возбудители трансмиссивных инфекций позвоночных.............. 259
Вирусы............................................................. 260
Риккетсии.......................................................... 263
Группа клещевых пятнистых лихорадок (264). — Лихорадка
Ку (266). — «Симбиотические» риккетсии (271).
Анаплазмы.......................................................... 275
Бактерии .......................................................... 276
Спирохеты ................................... 278
Пироплазмиды....................................................... 283
Особенности взаимоотношений клещей с микроорганизмами.............. 286
Заключение............................................................. 291
Литература............................................................. 296