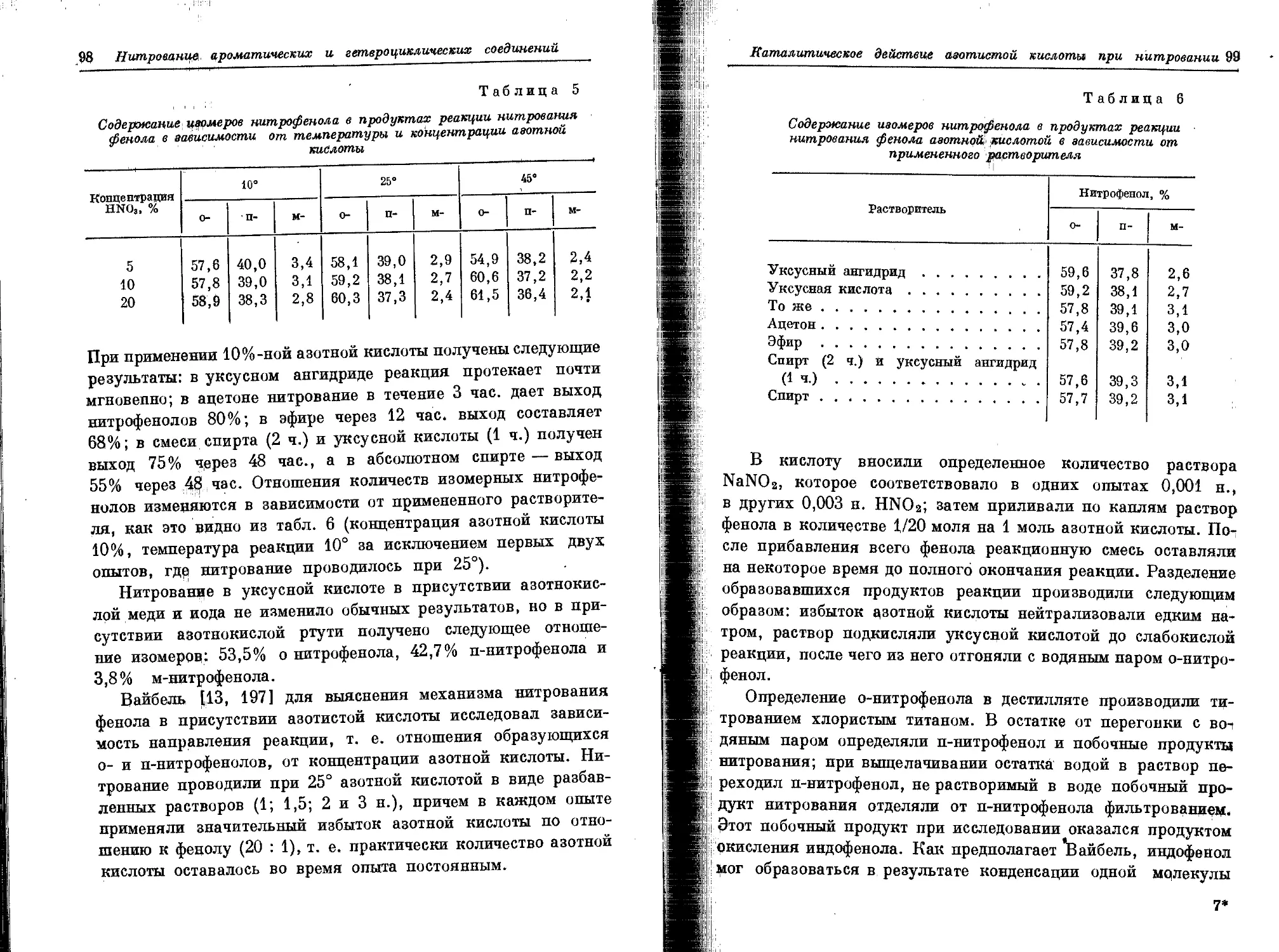
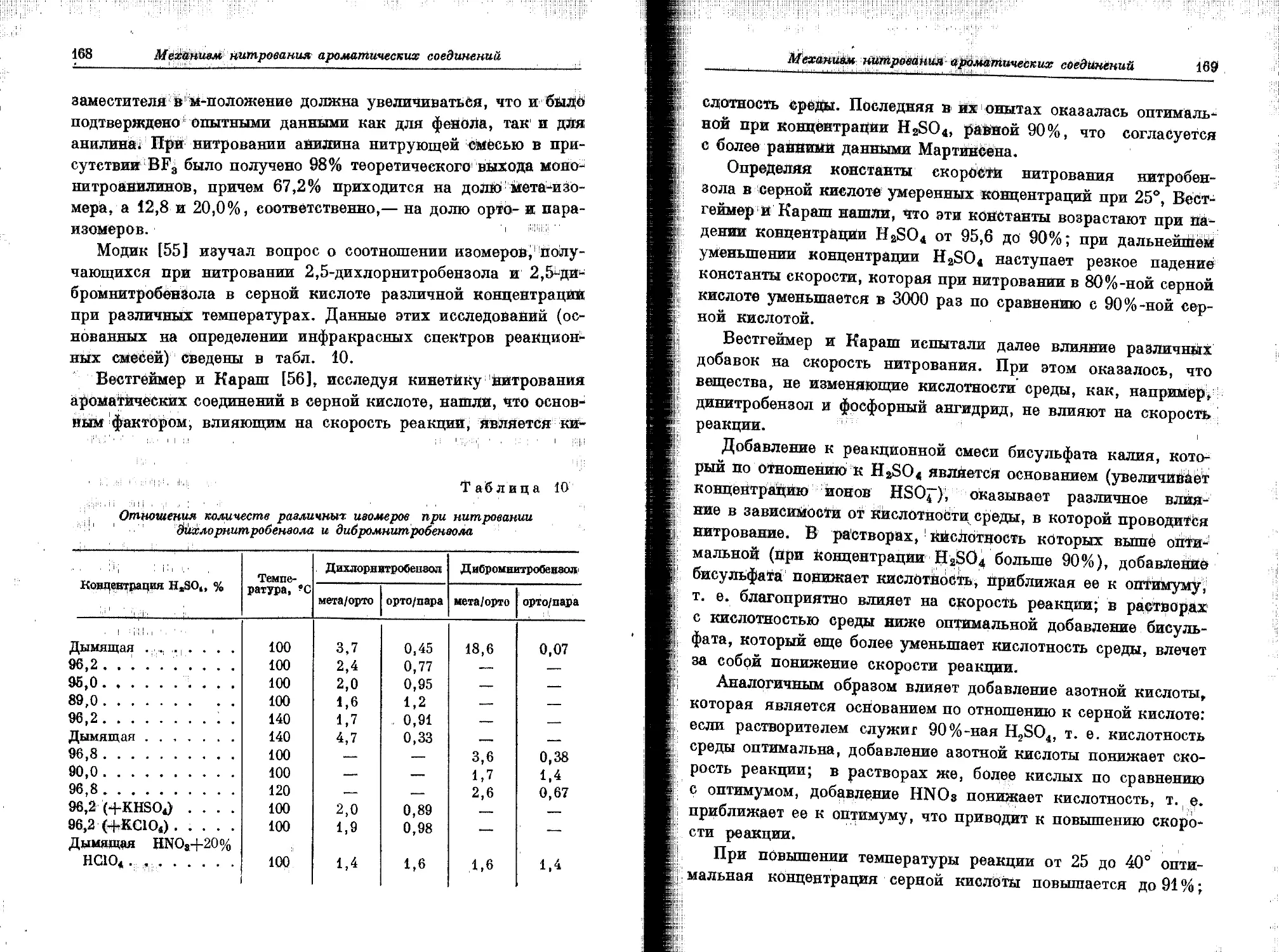
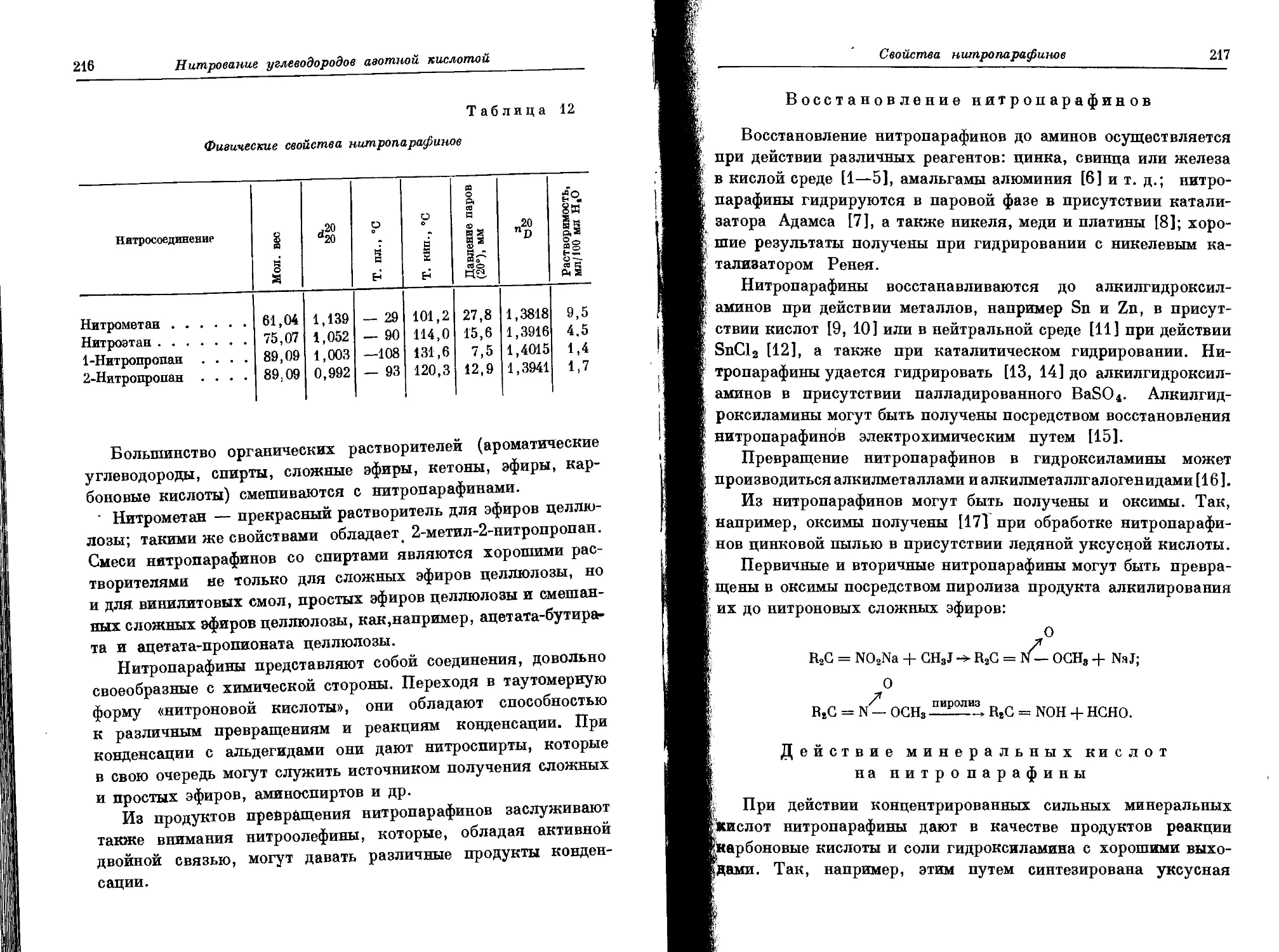
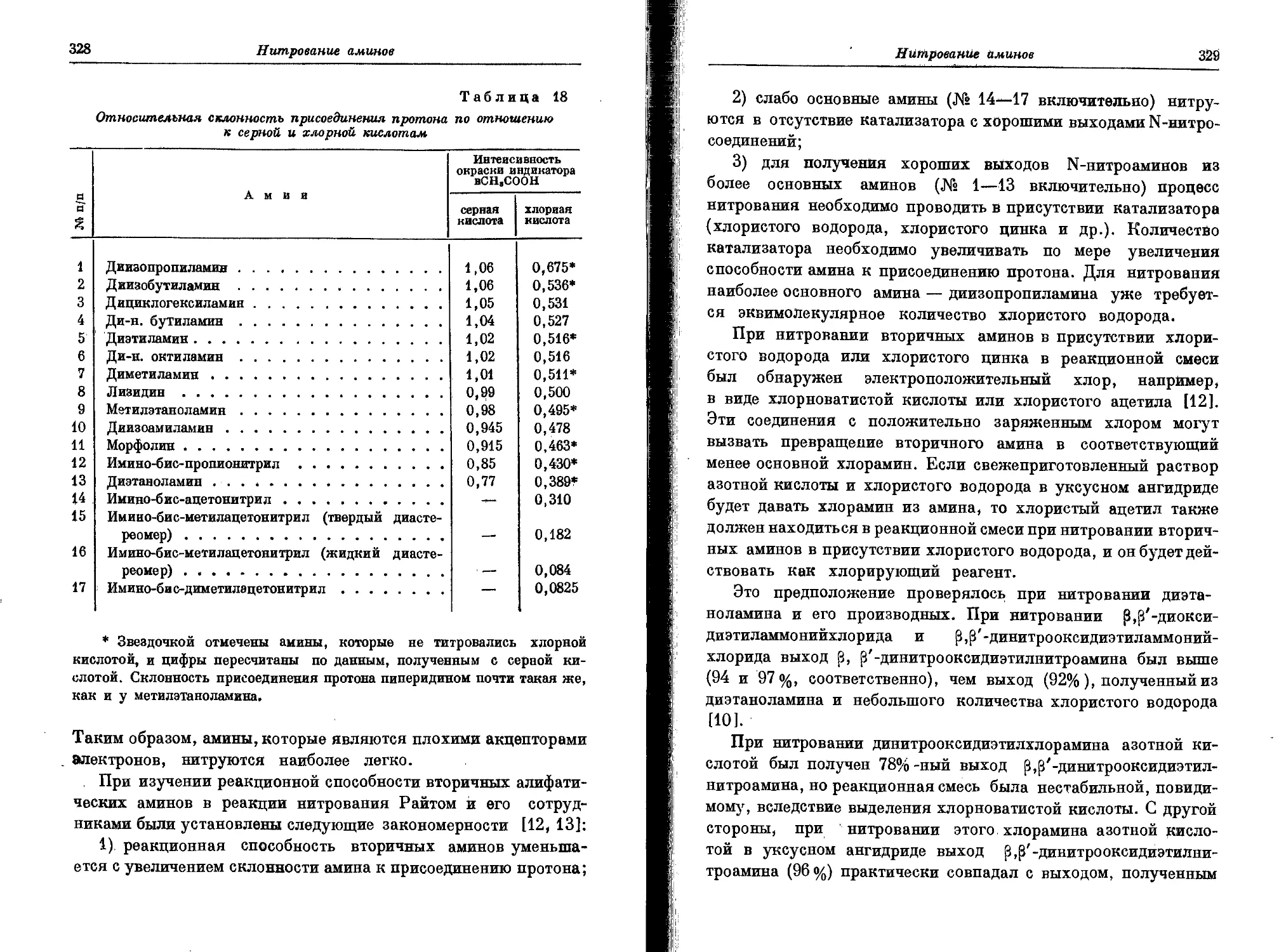
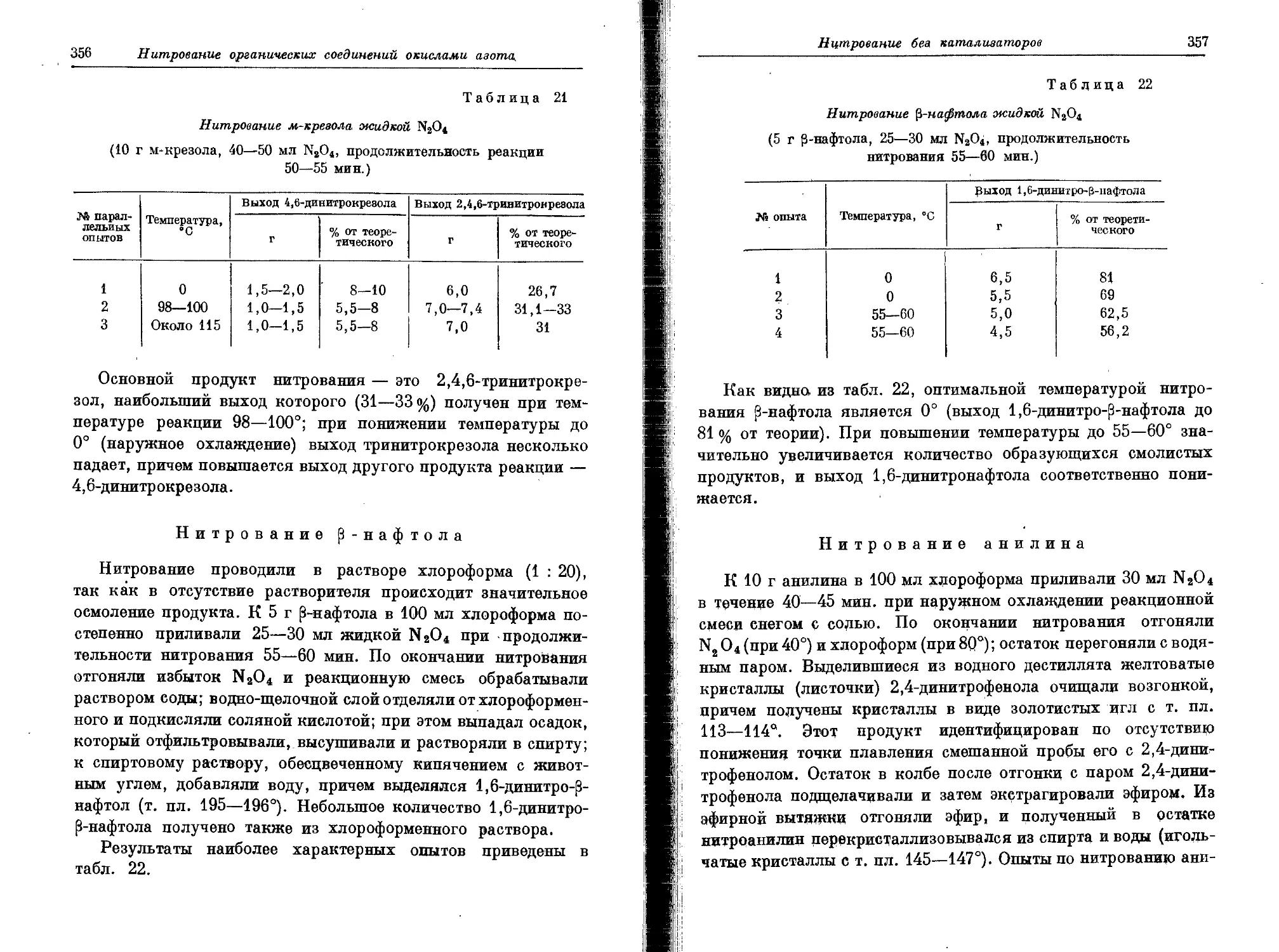
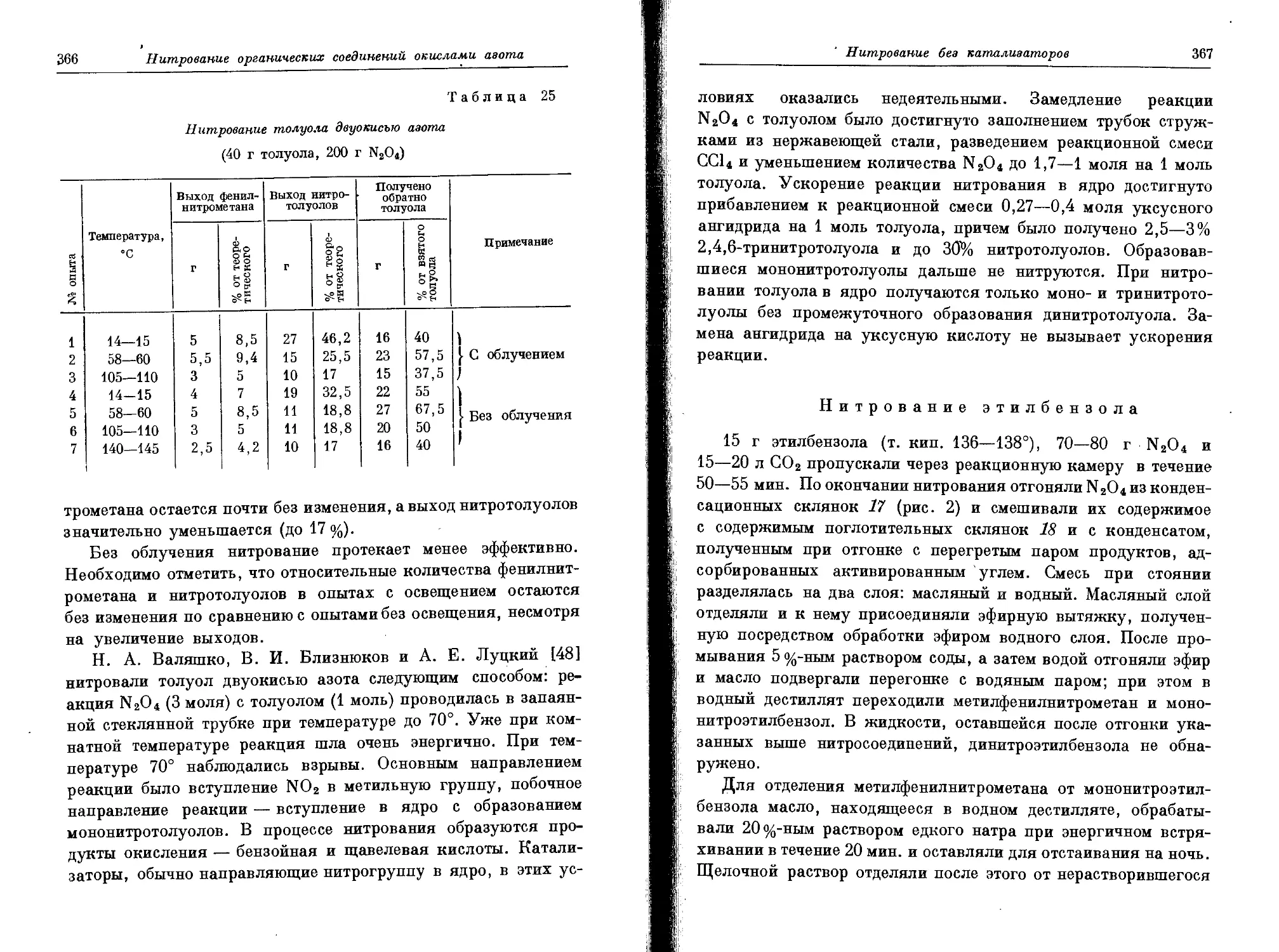
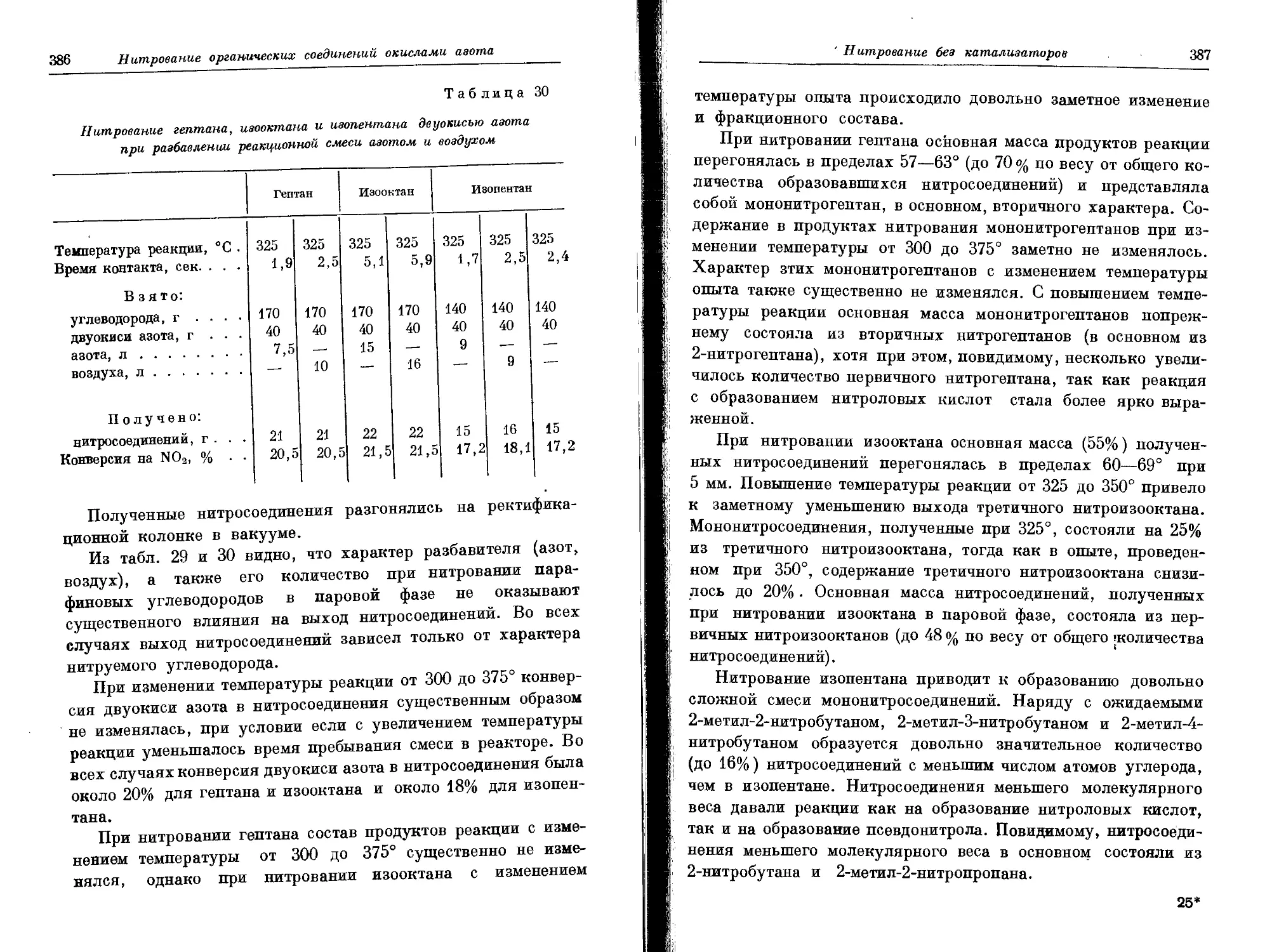
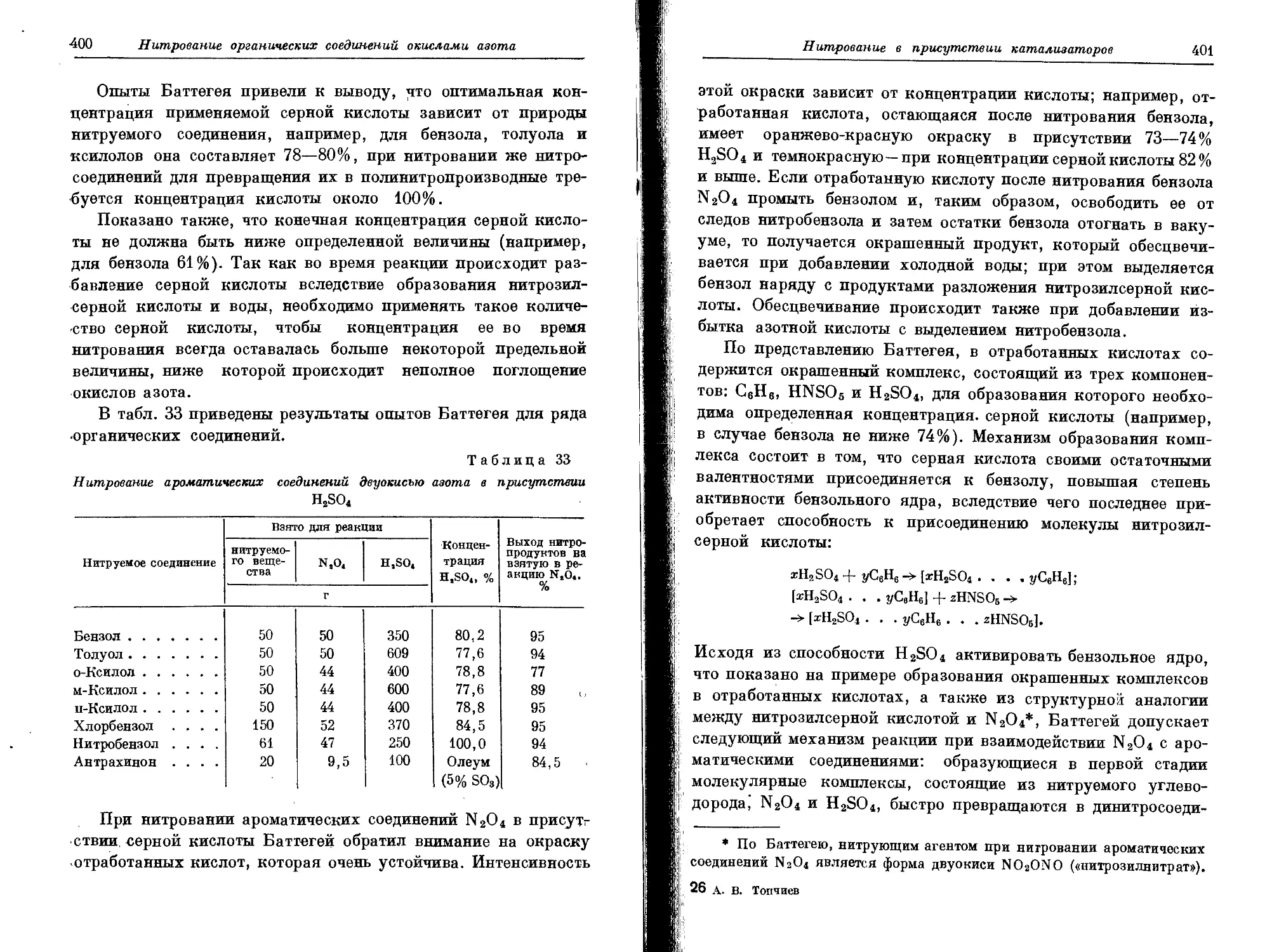
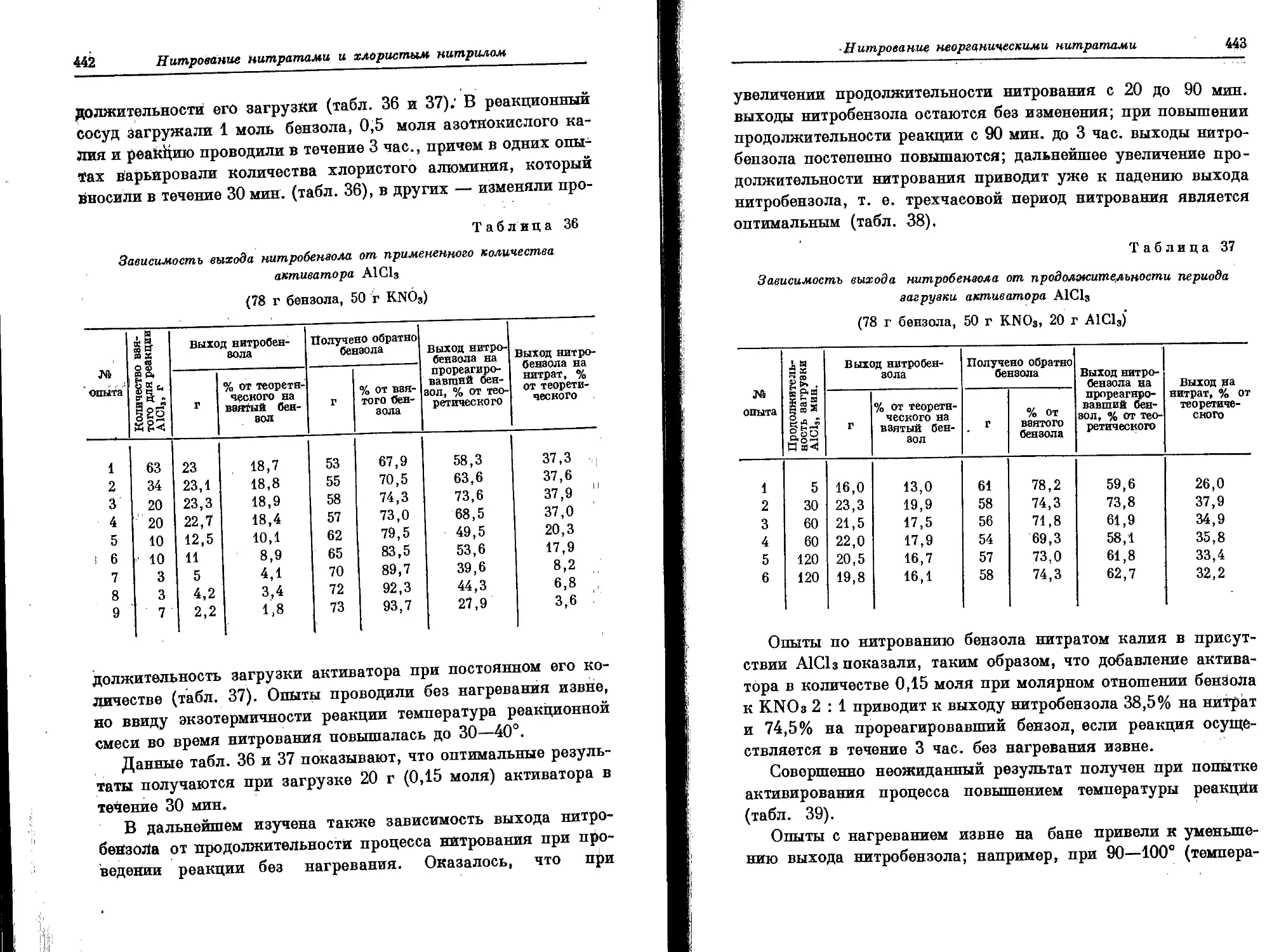
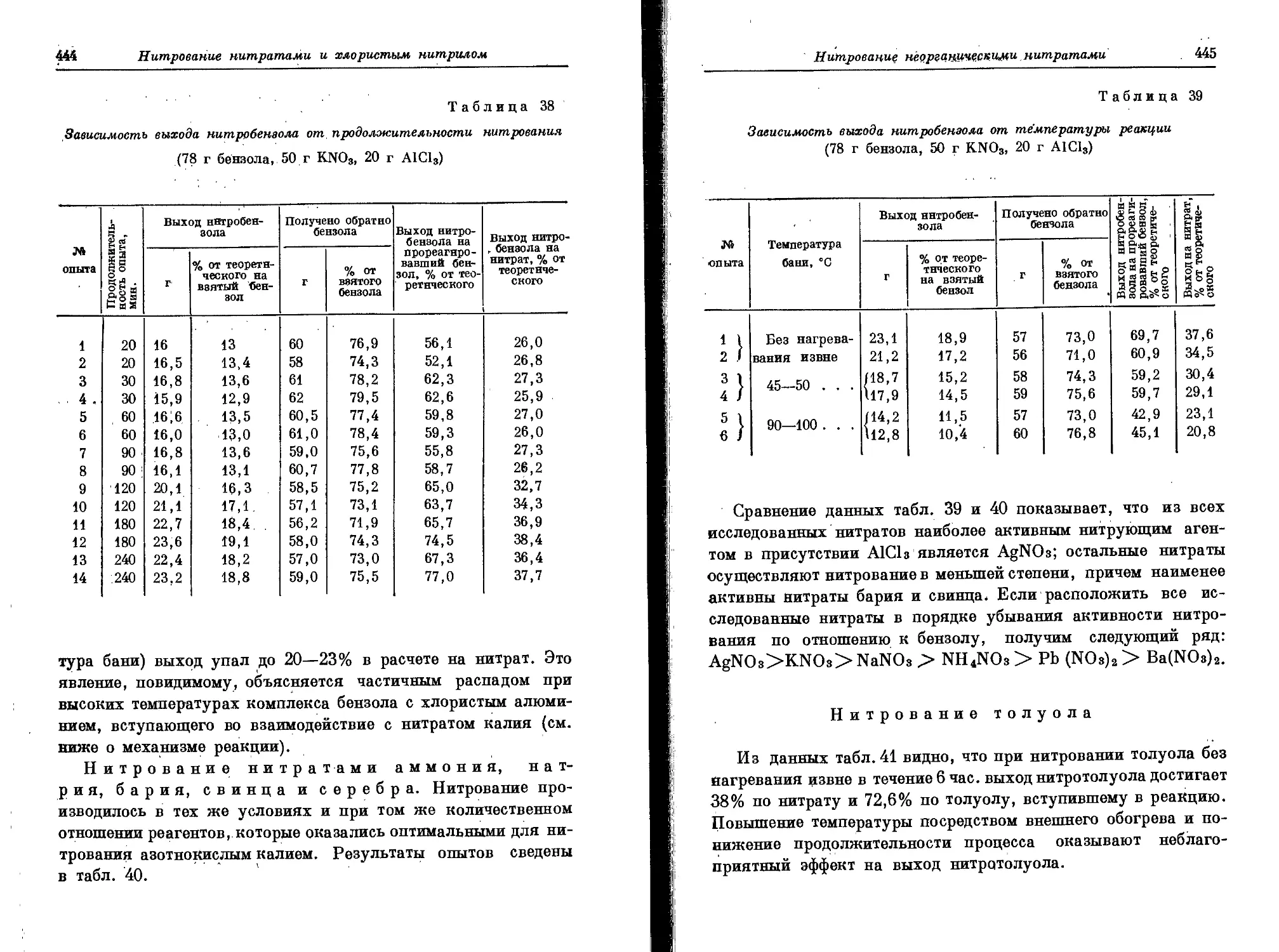
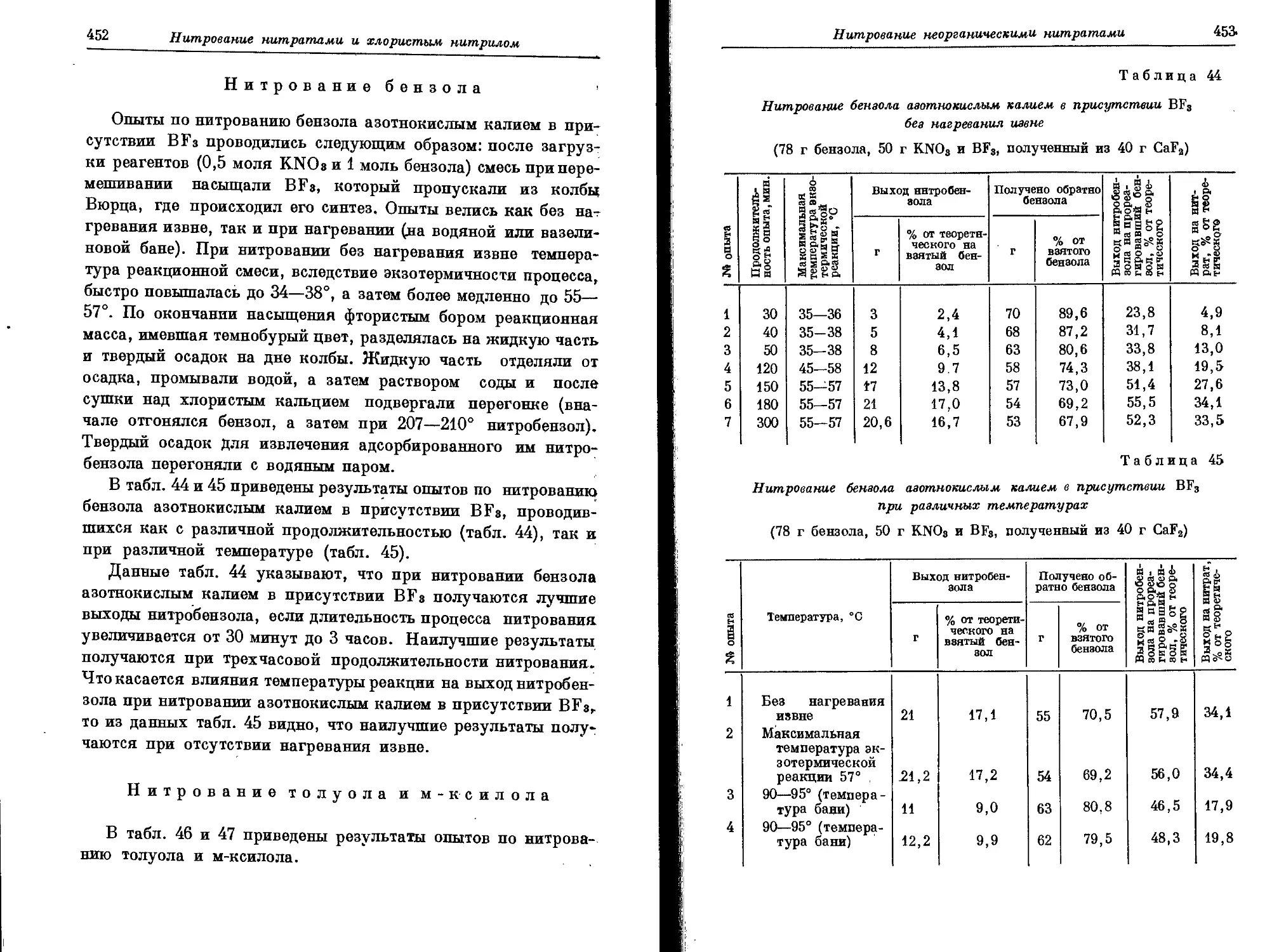
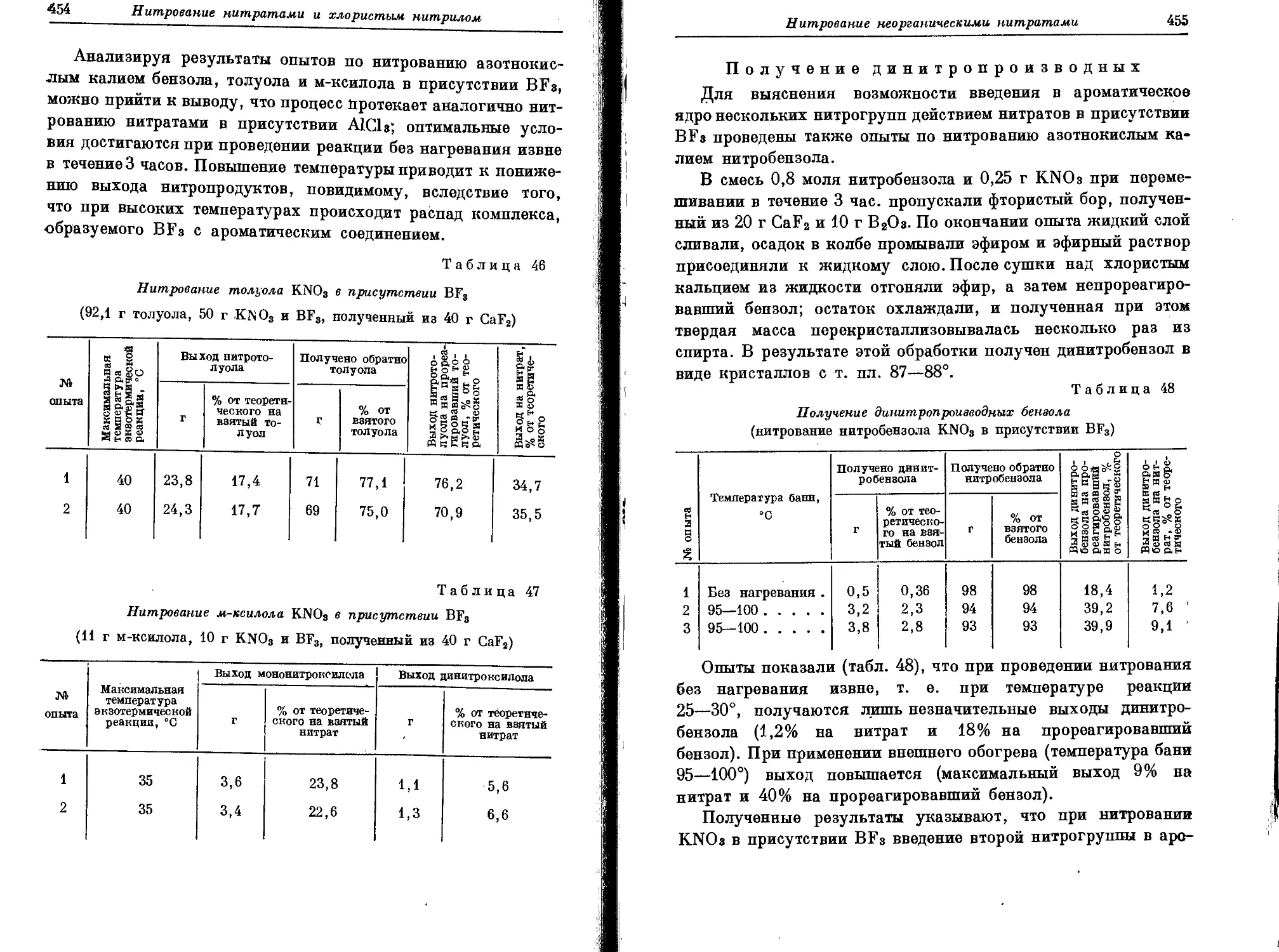
Текст
J7T <
АКАДЕМИЯ НАУК СССР
Академик
А. В. ТОПЧИЕВ
НИТРОВАНИЕ
УГЛЕВОДОРОДОВ
И ДРУГИХ
ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Издание второе,
переработанное и дополненное
ИЗДАТЕЛЬСТВО АКАДЕМИИ НАУК СССР ,
Москва —19 6 6
БИБЛИОТЕКА
[ Филиала ВНИИПП
50 I
Li
ВВЕДЕНИЕ
Реакция нитрования органических соединений, открытая
в 1834 г. (Митчерлих, синтез нитробензола), является одной
из важнейших и наиболее распространенных реакций в органи-
органической химии.
Цель нитрования — замена одного или нескольких атомов
водорода ароматического или гетероциклического ядра, либо
предельного углеводорода одной или несколькими нитрогруп-
пами.
Нитросоединения содержат одновалентную нитрогруппу
NO2 (одну или несколько), у которой атом азота непосредствен-^
но связан с атомом углерода органического 'радикала. Нитро-
Нитросоединения изомерны эфирам азотистой кислоты RONO, в ко-
которых азот связан с углеродом не непосредственно, а через квхь
лород; например
H.C-N
/
О
Н„С — О — N = О
метиловый эфир
азотистой кислоты
нитрометан
В настоящее время нитрогруппе приписывается строение
Таким образом, принимается существование в нитрогруппе
одной семиполярной связи.
Следует отметить, что такая формула не отражает экспе-
экспериментально доказанной симметричности нитрогруппы.
Введение
Равноценность обоих атомов кислорода в нитросоединениях
лучше отражает следующее строение:
Названия нитросоединений производятся от названий со-
соответствующих углеводородов добавлением приставки «нитро».
Например: нитрометан, нитропропан, нитробензол, нитротолуол
и т. д. (по женевской номенклатуре положение нитрогруппы
обозначается не буквой, а цифрой).
В зависимости от характера углеводородного радикала,
с которым связана нитрогруппа, различают первичные, вторич-
вторичные и третичные нитросоединения.
Нитросоединения играют очень важную роль в качестве
исходных и промежуточных продуктов химической промыш-
промышленности, в качестве взрывчатых веществ (например, дй-
и тринитробензол, тринитротолуол, тетранитротолуол, пи-
пикриновая кислота и др.), в качестве душистых веществ (напри-
(например, нитробензол, тринитро-трет. бутилтолуол). Нитропроиз-
водные — необходимые промежуточные продукты в произ-
производстве анилиновых красителей и различных синтетических
препаратов.
Нитросоединения оказывают сильное действие на микро-
микроорганизмы (нитрофенолы [1], хлорпикрин). Хлорпикрин при-
применялся в качестве отравляющего вещества во время первой
мировой войны. Он является очень ценным инсектисидом и
фунгисидом и применяется для обработки зернохранилищ и
посевных материалов.
Большое количество различных нитросоединений, в том
числе нитрокрасителей, подвергалось химико-терапевтиче-
химико-терапевтическому испытанию при ряде трипанозомных инфекций (возврат-
(возвратный тиф и др.) и в качестве дезинфекционных средств на ста-
стафилококках и бактериях кишечной группы [2].
Некоторые ароматические оксинитросоединения могут при-
применяться для борьбы с вредителями сельского хозяйства. Вы-
Высокой активностью против яиц некоторых насекомых — сель-
Введение
скохозяйственных вредителей—обладает раствор динитро-о-
циклогексилфенола в керосине [3].
Низшие нитропарафины, особенно в смеси со спиртами,
являются хорошими растворителями для эфиров целлюлозы
и винилитовых смол.
Полинитропарафины находят применение в качестве доба-
добавок к различным видам жидкого топлива [4].
Некоторые нитроолефины являются активными фунгисидами.
Широкое применение нитросоединений для получения раз-
различных органических веществ стало возможным лишь после
того, как выдающийся русский химик Н. Н. Зинин в 1842 г.
сделал замечательное открытие, значение которого в истории
органической химии вряд лц можно переоценить. Им было по-
показано, что при восстановлении сернистым аммонием нитро-
нитробензол превращается в анилин. Благодаря найденному Зини-
ным переходу от нитросоединений к первичным аминам химики
получили возможность применить нитросоединения для син-
синтеза самых разнообразных органических соединений. Аромати-
Ароматические амины являются в настоящее время важнейшими полу-
полупродуктами анилокрасочной, фармацевтической и многих дру-
других отраслей промышленности органической химии, а исходя
из первичных аминов, через диазосоединения можно получить
фенолы, простые эфиры, галоидопроизводные, нитрилы и т. д.,
которые в свою очередь находят применение в разных обла-
областях промышленности органической химии.
Для введения нитрогруппы в органические соединения при-
применяют главным образом азотную кислоту.
Схематически реакцию нитрования можно изобразить сле-
следующим образом:
RH + HONO2 - RNO2 +H20,
где RH — предельный или ароматический углеводород, ге-
гетероциклическое соединение, либо их производные, обмени-
обменивающие свой атом водорода на нитрогруппу.
Необходимо отметить, что указанная схема не отображает
течения реакции, а дает лишь общее представление о ее резуль-
результате. В действительности реакция протекает через ряд проме-
Введение
жуточных стадий, при этом в реакцию с органической молеку-
молекулой нередко вступает не сама азотная кислота, а продукты
ее превращения.
Число вступающих в органическую молекулу нитрогрупп
зависит от концентрации применяемой кислоты, от температу-
температуры и продолжительности процесса, от природы нитруемого ве-
вещества и от других факторов. В процессе нитрования, наряду
с основной реакцией, протекают также и побочные процессы,
которые приводят к уменьшению выхода основного продукта —
нитросоединения. К числу таких нежелательных побочных про-
процессов относится окислительное действие азотной' кислоты
на органическую молекулу. Эта окислительная способность
увеличивается при повышении температуры реакции и при уве-
увеличении содержания воды в реакционной смеси и окислов азо-
азота в азотной кислоте. При очень жестких условиях нитрования
может произойти даже распад органической молекулы, напри-
например: при получении тринитробензола в качестве побочного
продукта образуется тетранитрометан.
Из приведенной выше схемы реакции нитрования видно,
что вступление нитрогрушш в органическую молекулу сопро-
сопровождается выделением молекулы воды. Накопление воды в реак-
реакционной смеси понижает концентрацию азотной кислоты.
В случае применения в качестве нитрующего агента одной азот-
азотной кислоты при снижении концентрации ее ниже определен-
определенной величины реакция практически прекращается, и, таким
образом, полное использование азотной кислоты не представ-
представляется возможным. Поэтому на практике для нитрования при-
применяют смесь азотной и серной кислот или так называемую
нитрующую смесь. Однако, как показано ниже, реакция ни-
нитрования протекает с наибольшей скоростью при применении
не 100%-ной, а приблизительно 90%-ной серной кислоты.
Это свидетельствует о том, что в процессе нитрования серная
кислота служит не только дегидратирующим агентом.
Применение вместо одной азотной кислоты нитрующей
смеси имеет большое техническое преимущество. Нитрующая
смесь не разъедает железа и ее можно длительно хранить в же-
железной аппаратуре и передавать по железным трубам. Необ-
Введение
ходимо отметить, что присутствие воды оказывает значитель-
значительное влияние и на самый характер действия азотной кислоты.
Как правило, чем концентрированнее применяемая азотная
кислота,.тем выше ее нитрующая способность и тем в меньшей
степени проявляется ее окислительное действие. В некоторых
же случаях наблюдается обратное явление, т. е. ослабление
окислительных свойств азотной кислоты в присутствии воды.
Так, например: при действии раствора азотной кислоты в уксус-
уксусной кислоте на антрацен, наряду с 2,7-динитроантраценом,
получается и антрахинон. При этом присутствие воды способ-
способствует образованию динитроантраценапри одновременном умень-
уменьшении количества образующегося антрахинона. Удаление во-
воды из реакционной смеси (применением смеси азотной кислоты
с ледяной уксусной кислотой и уксусным ангидридом) приво-
приводит к полному подавлению реакции нитрования и к количе-
количественному образованию антрахинона [5].
Образование в процессе нитрования, наряду с нитросоеди-
нениями, ряда побочных продуктов отмечалось уже давно.
Обычно в результате побочных процессов при нитровании
получаются оксинитросоединения, что указывает на одновре-
одновременное вхождение в органическую молекулу окси- и нитро-
группы. Так, например, при нитровании нитробензола в
качестве побочного продукта образуется 2,4,6-тринитрорезор-
цин [6], а при нитровании нафталина в качестве примеси обра-
образуется 2,4-динитро-а-нафтол [7]. При нитровании бензола
наблюдалось образование в качестве побочного продукта ди-
нитрофенола и пикриновой кислоты [8]. Беннет [6] предпола-
предполагает, что при нитровании нитробензола сначала образуется
нитрофенол в результате взаимодействия с ароматическим со-
соединением не азота нитрующего агента, а его кислорода, имею-
имеющего положительный заряд. В результате последующего ни-
нитрования нитрофенола получается 2,3,4,6-тетранитрофенол,
в котором, как известно, нитрогруппа в положении 3 отли-
отличается большой подвижностью, и при замене ее на оксигруппу
образуется 2,4,6-тринитрорезорцин. Однако, исходя из изло-
изложенного выше, нельзя объяснить образования м-хлорфенола
при нитровании хлорбензола и ряд других реакций.
Введение
Получение побочных оксисоединений (например, при ни-
нитровании бензола), по мнению А. И. Титова [9], объясняется
первоначальным взаимодействием бензола с нитрозилсерной
кислотой с образованием нитрозобензола. Полученный нитрозо-
бензол присоединяет протон, затем присоединяет в пара-по-
пара-положение к азотсодержащей группе ион гидроксила, при этом
образуется п-оксиарилгидроксиламин. Последний окисляется
в п-нитрозофенол, а затем в п-нитрофенол, который в процессе
нитрования превращается в динитро- и тринитрофенол. Однако
этот механизм не пригоден для объяснения образования 2,4,6-
тринитрорезорципа из нитробензола. Установление механизма
образования побочных продуктов в процессе нитрования нель-
нельзя считать окончательно установленным, и этот вопрос должен
быть предметом дальнейшего исследования.
В качестве нитрующего агента, кроме азотной и серной
кислот, в некоторых случаях применяются и другие реагенты.
Так, например, смесью азотной и уксусной кислот удобно поль-
пользоваться в тех случаях, когда необходимо получить те или иные
мононитропроизводные, а применение концентрированной
азотной кислоты в смеси с серной кислотой приводит к более
глубокой степени нитрования, т. е. дает ди- или полинитро-
производные.
При смешении азотного и уксусного ангидрида образуется
ацетилнитрат — эфир строения CH3COONO2, который также
применяется в качестве нитрующего агента [10]. В литературе
имеется много работ, в которых описывается применение Этил-
нитрата и бензоилнитрата в качестве нитрующих агентов. Так,
например: при действии этилнитрата в присутствии этилата
натрия на циклопентадиен получается нитроциклопентадиен[11].
Бензол энергично реагирует с этилнитратом в присутствии
хлористого алюминия. При нитровании в этих же условиях
толуола получается преимущественно о-нитротолуол (отно-
(отношение в смеси орто-изомер: пара-изомер = 5 : 1) [12].
При помощи этилнитрата в присутствии этилата натрия
можно синтезировать фенилнитрометан из цианистого бензи-
бензила [13]. В лабораторной практике в качестве нитрующего
средства находит применение бензоилнитрат. Посредством это-
Введение
го реагента удается получить о-нитропроизводные в тех случаях,
когда другими способами получаются преимущественно соот-
соответствующие п-производные. Так, при взаимодействии бензоил-
бензоилнитрата с анизолом и фенетолом получается с теоретическим
выходом о-нитроанизол или,соответственно, о-нитрофенетол [14].
Интересно отметить, что полиалкилзамещенные бензолы
при взаимодействии с бензоилнитратом образуют с хоро-
хорошим выходом соответствующие нитропроизводные, в которых
нитрогруппа содержится не в ядре, а в боковой цепи; на-
например: дурол превращается в 1'-нитродурол [15].
В последнее время появились работы [15а] по нитрова-
нитрованию некоторых органических соединений ацетоциангидрин-
нитратом в щелочной среде.
Вместо обычной нитрующей смеси (смесь азотной и серной
кислот) для нитрования может быть применена смесь серной
кислоты с солью азотной кислоты (обычно с натриевой селит-
селитрой). Процесс проводится при нагревании; при этом серная
кислота выделяет из селитры свободную азотную кислоту.
Неудобство применения такой смеси состоит в том, что при этом
в качестве отхода образуется значительное количество бисуль-
бисульфата, который не находит широкого применения.
При замене натриевой селитры на аммиачную в качестве
отхода получается сульфат аммония, который может быть
использован как удобрение. Однако, благодаря высокой стои-
стоимости аммиачной селитры, применение ее в качестве нитрую-
нитрующего агента весьма ограничено.
Автором настоящей книги исследовалось применение фто-
фтористого бора в качестве катализатора при нитровании органи-
органических соединений солями азотной кислоты. На основе этих
исследований выдвинута теория механизма нитрования арома-
ароматических соединений неорганическими нитратами в присут-
присутствии А1С13 и BF3.
Давно известно каталитическое влияние ртути или ее солей
при сульфировании ароматических соединений. Однако первые
опыты по изучению влияния ртутных солей при нитровании
не дали положительных результатов. Но уже в 1913 г. Воль-
фешптейн и Бетерс [16] нитрованием бензола разбавленной
10
Введение
азотной кислотой в присутствии солей ртути получили нитро-
нитробензол и нитрофенол. При этой реакции одновременно идут
процессы нитрования и окисления. Течение реакции зависит
от концентрации азотной кислоты.
Катализаторами при реакции нитрования могут служить
также соединения хрома, вольфрама, молибдена, тантала,
ниобия, ванадия, галлия и индия [17]. Особо следует отме-
отметить применение фтористого бора как катализатора при реак-
реакции нитрования ароматических соединений [18].
В некоторых случаях нитрования азотистая кислота также
может обладать каталитическим действием. Так, например,
при нитровании фенола [19], алифатических кетонов [20],
нафталина [21] азотистая кислота ускоряет реакцию.
Иногда нитрование приходится проводить в среде раство-
растворителя. В технике в качестве растворителей при нитровании
применяется, в частности, о-дихлорбензол или хлорбензол.
В качестве примера можно привести 3-нитроализарин, который
получают нитрованием ализарина азотной кислотой в среде
о-дихлорбензола. В качестве растворителей в процессе нитро-
нитрования могут применяться и хлорпроизводные этана. При ни-
нитровании фенола в пикриновую кислоту может быть применен
этиловый спирт [22] или, еще лучше, метиловый спирт [23],
который значительно устойчивее к действию азотной киелоты.
На примере нитрования фенола в среде различных раство-
растворителей было показано влияние растворителей на ход про-
процесса [24].
Температура нитрования — также весьма важный фактор,
влияющий на ход процесса. Нитрование является реакцией
экзотермической, а в случае применения смеси азотной и сер-
серной кислот (при нитровании ароматических соединений) боль-
большое количество тепла выделяется дополнительно в результате
разбавления серной кислоты водой, образующейся в процессе
реакции. Поэтому, как правило, при нитровании ароматиче-
ароматических соединений приходится прибегать к внешнему охлажде-
охлаждению и постепенному смешиванию реагентов. Изменение тем-
температуры нитрования оказывает влияние как на количество
вступающих в молекулу нитрогрупп, так и на место вступления
Введение
И
нитрогруппы. Само собой понятно, что для каждой отдельной
реакции нитрования существует своя оптимальная темпера-
температура.
В то время как химия нитросоединений ароматического
ряда успешно развивалась и нашла широкое промышлен-
промышленное применение уже много лет назад, удобные методы получе-
получения нитросоединений жирного ряда разработаны лишь в по-
последние десятилетия. •
Отсутствие до недавнего времени удобных и дешевых ме-
методов получения нитросоединений жирного ряда было основ-
основным препятствием широкого внедрения этого класса соеди-
соединений в практику. Причиной этих трудностей является боль-
большая инертность парафиновых углеводородов по сравнению
с ароматическими углеводородами к действию азотной кислоты.
В течение многих лет попытки ввести нитрогруппу в ацикли-
ациклические углеводороды прямым действием азотной кислоты не
давали положительных результатов (это также относится к ни-
нитрованию боковой цепи ароматических углеводородов). Однако
широкая доступность парафиновых углеводородов (особенно
СССР богат естественными газами, которые и представляют
источники низших парафиновых углеводородов) заставила
многих химиков обратиться к изучению вопроса переработки
предельных углеводородов в нитропарафины. Этот класс
соединений может быть использован в различных областях
химической промышленности. Кроме того, нитропарафины
являются весьма реакционноспособными веществами, и на
их основе можно синтезировать многие новые, весьма ценные
химические продукты, из которых некоторые уже нашли себе
применение.
Нитроспирты — продукты конденсации нитропарафинов
с альдегидами — имеют большое практическое применение. Их
производные и продукты взаимодействия с различными реа-
реагентами применяются как пластификаторы для эфиров целлю-
целлюлозы и могут употребляться в качестве взрывчатых веществ [25]
и др.
Галоидопроизводные нитропарафинов применяются как
инсектисиды и как растворители для очистки смазочных масел.
Введение
Для осуществления синтеза нитропарафинов приходилось
прибегать к обходным путям, иногда довольно сложным.
В 1872 г. В. Мейер впервые осуществил синтез нитропара-
нитропарафинов действием солей азотистой кислоты на галоидные ал-
килы
C2H5ONO + AgJ
C2H5J + AgNO2<^
C2H5NO2 + AgJ
Одновременно с нитропарафином получается эфир азоти-
азотистой кислоты.
В конце прошлого столетия крупному русскому химику
М. И. Коновалову [26] впервые удалось показать возможность
введения нитрогруппы в углеводороды жирного ряда и в бо-
боковую цепь жирноароматических углеводородов прямым нитро-
нитрованием азотной кислотой. На основе этих работ и возникли
современные методы промышленного нитрования парафиновых
углеводородов, • которые привели к созданию новой отрасли
промышленности органической химии — производству нитро-
нитропарафинов и их многочисленных производных.
М. И. Коновалов установил ряд закономерностей хода реак-
реакции нитрования парафинов. Он указал на значение для про-
процесса нитрования концентрации азотной кислоты, температу-
температуры реакции, давления. Работами Коновалова было установ-
установлено, что изопарафины нитруются легче, чем парафины нор-
нормального строения, что увеличение давления способствует
повышению выхода нитропродуктов, а повышение температуры
увеличивает выходы первичных нитропродуктов по отношению
ко вторичным. При нитровании пропана, бутанов, пентанов
получаются смеси изомерных нитросоединений со значитель-
значительным (иногда больше 50%) содержанием вторичных нитросоеди-
нитросоединений.
Работы М. И. Коновалова послужили стимулом к изучению
парафинов, олефинов и нафтенов. Реакцией Коновалова часто
пользуются для характеристики отдельных продуктов, входя-
входящих в состав нефти при процессах ее переработки.
Метод М. И. Коновалова был в дальнейшем подробно изучен
другим русским ученым В. В. Марковниковым [27], который
Введение
13
установил зависимость реакции нитрования от концентрации
азотной кислоты и других условий. Марковников использовал
реакцию нитрования предельных углеводородов для определе-
определения состава нефти но характеру нитропроизводных.
Ири действии азотной кислоты на предельные углеводо-
углеводороды, как показал С. С. Наметкин с сотрудниками [28], в пер-
первоначальной стадии получается изонитросоединение, которое,
в зависимости от условий реакции, может либо превращаться
в устойчивую форму нитросоединений, либо разлагаться
с образованием альдегида, кетона, карбоновых кислот:
он
О
2RCH =
Ч
+H2O + N2O
о
Н
Исследование С. С. Наметкиным и его сотрудниками дей-
действия азотной кислоты на октадекан С18Н38 и гексатриаконтан
СзвН47 подтвердило выводы, сделанные Коноваловым. Един-
Единственным продуктом реакции нитрования октадекана оказался
вторичный нитрооктадекан СНз(СН2IбСН(КО2)СНз, а при
нитровании гексатриаконтана была получена смесь вторич-
вторичного мононитропродукта со вторичным р,[3'-динитропродук-
том [29].
При нитровании азотной кислотой бициклических углево-
углеводородов предельного характера получаются структурно изо-
изомерные нитросоединения со вхождением нитрогруппы в различ-
различные циклы системы. Например, при нитровании фенхана по-
получаются 2-нитрофенхан и 6-нитрофенхан [30].
Вопрос о механизме реакции нитрования уже давно является
предметом многочисленных исследований.
Интерес различных исследователей к вопросу о механизме
нитрования несомненно связан с огромным значением нитро-
нитросоединений в различных отраслях промышленности и со
стремлением при помощи теории процесса способствовать раз-
разрешению практических вопросов. В случае нитрования арома-
ароматических углеводородов теория, объясняющая процесс нитро-
нитрования, тесно связана со строением бензольного ядра и меха-
механизмом его реагирования.
14
Введение
Многочисленные (подчас и противоречивые) работы по во-
вопросу о механизме реакции нитрования разбросаны по страни-
страницам советской и иностранной журнальной литературы, что
в значительной мере затрудняет ознакомление с ними. Поэто-
Поэтому ниже, в отдельной главе, нами систематизированы основные
работы по механизму нитрования ароматических соединений.
Хотя реакция азотной кислоты с олефинами изучена зна-
значительно менее подробно, чем реакция между азотной кисло-
кислотой и предельными углеводородами, все же имеется ряд работ
и в зтом направлении.
Ненасыщенные соединения алифатического ряда легче
подвергаются нитрованию, чем предельные углеводороды. Срав-
Сравнительно легко нитруется изобутилен [31]. Ненасыщенные
боковые цепи ароматических соединений нитруются легче,
чем сами ароматические ядра. Также легко нитруются
ацетиленовые углеводороды. Из ацетилена при действии кон-
концентрированной азотной кислоты получается, наряду с дру-
другими продуктами, тринитрометан [32].
При нитровании концентрированной азотной кислотой изо-
изомерных октенов [33] получаются непредельные нитросоедине-
ния первичного характера. Вступление нитрогруппы в молеку-
молекулу олефина сопровождается перемещением кратной связи
в р-положение.
Большое значение приобрел способ нитрования углеводо-
углеводородов и их производных в паровой фазе. Особенно зто от-
относится к алифатическим углеводородам. Некоторые пара-
парафины лучше нитруются в паровой фазе, чем в жидкой.
Нитрование в газовой фазе было осуществлено Хэссом,
Ходжеми Вандербильтом [34], Хзссом и Александером [35],
Данцигом и Хзссом [36], Буллоком и Митчелом [37] и др.
Этот способ нашел большое практическое применение, так как
дал возможность работать без применения давления. При по-
повышенных температурах нитрования (до 400—500°) наблю-
наблюдается Деструктивный распад исходных углеводородов на сво-
свободные радикалы, которые присоединяют нитрогруппы и дают
нитроиарафины с меньшим числом углеродных атомов, чем
в исходном углеводороде. Это наблюдение не распространяется
Введение
15
на ряд нафтенов. В процессе нитрования полинитросоединения
не образуются.
Особенный интерес представляют работы последних двух
десятилетий по нитрованию окислами азота.
Нитрование органических соединений окислами азота иссле-
исследовалось многими химиками, как, например, Виландом,
Н. Я. Демьяновым, П. П. Шорыгиным, А. В. Топчиевым,
A. И. Титовым и др. При изучении механизма реакции нитро-
нитрования непредельных соединений окислами азота было установ-
установлено, что двуокись азота присоединяется, подобно галоидам,
по двойной связи, давая динитропродукты.
Последние дри действии щелочей с отщеплением азотистой
кислоты (в виде соли) переходят в мононитрозамещенные эти-
этиленовые углеводороды:
— НС — СН— — С = СН —
I I - I +HNO2
NO2 NO2 NO2
При действии двуокиси азота на ароматические соединения
также получаются нитропродукты. Так, например, бензол,
толуол, нафталин, фенантрен, нафтол, хлорбензол, фенол,
крезол образуют нитросоединения. Хорошие результаты по-
получаются при применении вспомогательных реагентов, таких,
как концентрированная серная кислота, хлористый алюминий,
хлористое железо. Низшие нормальные парафины от метана до
пентана нитруются в газообразной фазе двуокисью азота с обра-
образованием моно- и динитропроизводных, причем получаются
исключительно первичные нитросоединения. Однако наряду
с нитрованием парафинов происходит их расщепление. Из про-
пропана получаются: нитрометан, нитрозтан, 1-нитропропан и
2-нитропропанол [38].
Нитрование окислами азота было осуществлено П. П. Шоры-
Шорыгиным и А. В. Топчиевым [39], А. В. Топчиевым и В. П. Ала-
Алания [40], Мак-Ки и Вильгельмом [41], Н. А. Валяшко,
B. И. Близнюковым и А. Е. Луцким [42] и др.
Большое практическое применение имела работа П. П. Шо-
рыгина и А. В. Топчиева A935) по нитрованию углеводородов
окислами азота при низких температурах. В дальнейшем зта
Введение
работа дала возможность автору настоящей книги разработать
оригинальный метод нитрования предельных углеводородов
в газовой фазе посредством одновременного воздействия хлора
и окислов азота [40].
Для нитрования органических соединений может примевять-
ся также пятиокись азота [43].
При нитровании парафинов азотным ангидридом при тем-
температуре ниже 0° образуются алкилнитраты (основной про-
продукт), нитроалканы и карбоновые кислоты [44].
Использование окислов азота для нитрования имеет боль-
большое промышленное значение, так как этот способ дает возмож-
возможность применять газовую смесь, получающуюся при окислении
азота воздуха или аммиака. По этому вопросу имеется ряд
патентов [45, 46].
Дальнейшее развитие, усовершенствование и техническое
освоение методов нитрования предельных углеводородов,
а также нитрование в газовой фазе относятся к актуальным
вопросам современной прикладной химии.
ЛИТЕРАТУРА
1. С, III, 252, 288 A922).
2. С, II, 800 A934); С, II, 79, 2234, 2539, 2545 A935).
3. С, II, 831 A934); С, II, 3348 A936).
4. Амер. патент 2590009 A952); С. А., 46, 5823а A952); амер. патент
2542193 A951); С. А., 45, 10545а A950).
5. G. Odd а. С, I, 1671 A901).
6. G. M. Bennet, Р. V. J о u I e. J. Chem. Soc, 1816 A938); G. M.
В en net, j. P. Grove. J. Chem. Soc, 378 A945).
7. H. E. Fierz-David, R. Spoilage 1. Helv. Ghim. Acta,
26, 98 A943).
8. А. И. Титов. Журн. общ. химии, 17, 382 A947).
9. А. И. Титов. Н. Г. Лаптев. Журн. общ. химии, 18, 741
. A948); 19, 267 A949).
10. A. Pictet, E. Khotinsky. Вег., 40, 1163 A907).
11. J. Tiele. Вег., 33, 760 A900).
12. Boedtker. Bull. Soc. China. France, [4], 3, 726 A908).
Литература
17
13. J. Meisenheimer. Ann., 355, 284 A908).
14. F. Franci s. Ber., 39, 3801 A906).
15. R. Willstatter, H. К и b i 1. Ber., 42, 4152 A909).
15a. W. D. Em mo us, J. R. Freeman. J. Am. Chem. Soc.; 77, 4387,
4391, 4673 A955).
16. R. Wolfenstein, O. Boters. Ber., 46, 586 A913); C, I,
1106 A913).
17. Франц. патент 821767 A937).
18. R. J. Thomas, W. F. Anzilotti, С F. H e n n i о n.
Ind. Eng. Chem., 32, 408 A940).
19. H. M a rt in s en. Z. phys. Chem., 59, 605 A909).
20. R. Behrend, J. Schmitz. Ann., 277, 313 A893).
21. А. И. Титов. Журн. общ. химии, 11, 1125 A941).
22. Франц. патент 345441; Frdl., 8, 131 A908).
23. Е. Plazek. С, 1,1427A931).
24. F. Arhall. J. Chem. Soc, 125, 811 A924).
25. F. Hof wimmer. Schiess- und Sprengstoffwesen, 7, 43 A912);
J. Soc. Chem. Ind., 31, 204 A912).
26. M. И. К о н о в а л о в. ЖРХО, 25, 472 A893); 31, 57 A898).
27. В. В. Марковников. Ann., 302, 15A898); Вег., 32, 1444
A899); ЖРХО, 31, 47, 530 A899); 32, 1441 A900); 35, 1033 A903).
28. С. С. Наметкин и А. С. Забродина. Докл. АН СССР,
75, № 5, 701 A950).
29. С. С. Наметкин, С. С. Нифонтова, Р. Я. Сущин.
Докл. АН СССР, 70, № 2, 241 A950).
30. С. С. Наметкин. ЖРХО, 47, 1596 A915).
31. L. Haitinger. Ann., 193, 366 A878).
32. G. Testoni, L. M a s с а г e 11 i. C, II, 177 A901).
33. А. Д. Петров, М. А. Б у л ы г и н а. Докл. АН СССР, 77,
1031 A954).
34. Н. В. Hass, Е. В. Hodge, В. V a n d е г b i 11. Ind. Eng.
Chem., 28, 339 A936).
35. H. B. Hass, L. G. Alexander. Ind. Eng. Chem., 41, 2266 A949).
36. M. H. Danzig, H. B. Hass. J. Am. Chem. Soc, 66, 2017
A944).
37. J. L. Bullock, E. T. Mitchell. J. Am. Chem. Soc, 65,
2426 A943).
38. С Gabriel. Ind. Eng. Cbem., 32, 887 A940).
39. П. П. Шорыш, А. В. Топчиев. Журн. общ. химии,
№ 5, 549 A935); № 7, 193 A937); № 8, 981 A938).
2 а. в. Топчиев
I БИБЛИОТЕКА |
40 А В Топчиев, В. П. Алания. Докл.АНСССР,67,297а949).
4l" R Н М с К е е, R. H. W i I h e I m. Ind. Eng. Chem., 28, 662 A936).
42*. Н. А. Валяшко.-В. И. Б л и з ц » ко в А. ЕЛ У К *и ¦",
Тр. Харьковского технология. ин-ra, вып. 4, стр. 48 A948).
T Л-.АНОССР.8,.» .
45. Англ. патепт 262097 A926).
46. Патент СССР 9294 A929).
Глава первая
НИТРИРОВАНИЕ АРОМАТИЧЕСКИХ
И ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
АЗОТНОЙ КИСЛОТОЙ И НИТРУЮЩЕЙ СМЕСЬЮ
Введение нитрогруппы в ароматические и гетероцикличе-
гетероциклические соединения, обладающие ароматическим характером,
обычно осуществляется действием азотной кислоты или ни-
нитрующих смесей.
При нитровании одной азотной кислотой удалось получить
ряд нитросоединений, хотя в большинстве случаев нитрующая
смесь и другие нитрующие агенты дают лучшие результаты.
Даже в случае применения для нитрования ароматических и
гетероциклических соединений безводной азотной кислоты из-
за разбавления ее водой, образующейся в процессе реакции,
повышается окислительная способность азотной кислоты и
соответственно понижается ее нитрующее действие. Тем не
менее для получения некоторых нитросоединений применение
азотной кислоты имеет преимущество перед другими нитрующи-
нитрующими агентами. При нитровании одной азотной кислотой приходит-
приходится употреблять ее в большом избытке против теории (обычно из-
избыток азотной кислоты составляет 50%). После отделения ни-
тропродукта отработанную азотную кислоту подкрепляю^
концентрированной ЕШОз и используют для повторного ни-
нитрования.
В отдельных случаях нитрования легко нитрующихся со-
соединений (например, фенолов, эфиров фенолов, ализарина Ц.
др.) применяют разбавленную азотную кислоту; при этом
Ч'
20 Нитрование ароматических и гетероциклических соединений
нитрование иногда проводят в растворителе, как, например,
в хлорбензоле, полихлорбензолах и др.
Ниже мы даем обзор описанных в литературе важнейших
экспериментальных данных, относящихся к нитрованию азот-
азотной кислотой ароматических и гетероциклических соединений
как в отсутствие, так и в присутствии активаторов.
§ 1. Нитрование азотной кислотой
Нитрование бензола, хлорбензола, бромбензола и толуола
азотной кислотой различной концентрации исследовано Шпинд-
лером [1]. Нитрование производилось посредством медленного
цриливания нитруемого соединения к азотной кислоте, взятой
в избытке (на 1 г-моль нитруемого соединения взято грамм-
молей азотной кислоты: для бензола 3,8, толуола 4,6, хлорбен-
хлорбензола 4;4, бромбензола 4,6). Опыты по нитрованию углеводо-
углеводородов азотной кислотой различной концентрации (одно и то
же количество кислоты разбавляли различными количествами
воды) показали, что с увеличением разбавления выход нитро-
соединений падает сначала очень быстро, затем медленно;
начиная с концентрации, соответствующей объемному отно-
отношению азотной кислоты (уд. в. 1,5) и воды 10 : 6, выход нитро-
производных опять быстро падает с дальнейшим разбавлением,
и при объемном отношении 2 : 1 нитрование полностью пре-
прекращается.
При нитровании разбавленной азотной кислотой E—10
объемов воды на 1 объем азотной кислоты) в течение 120 час.
при нагревании на водяной бане не обнаружено образования
нитропроизводных; анализ полученных продуктов показал, что
при этих условиях реакция направляется в сторону окисления.
Сравнивая экснериментальные данные по нитрованию бензола,
толуола, хлорбензола и бромбензола кислотой одной я той же
концентрации, Шпиндлер приходит к выводу, что присутствие
галоида и метильной группы в ароматическом ядре при нитро-
нитровании концентрированной и мало разбавленной азотной кисло-
кислотой повышает выход нитропродуктов. При нитровании же раз-
разбавленной кислотой средних концентраций влияние замести-
заместителей в ядре йа нитрование менее заметно, так как оно отчасти
Нитрование рвотной кислотой
24
компенсируется влиянием разбавления (с увеличением разбавт
ления азотной кислоты выход нитропроизводныж толуола, хлор-
хлорбензола и бромбенэояа понижается в большей степени, чем это
наблюдается у самого бензола)*
При нитровании бензола концентрированной азотной кисло-
кислотой при комнатной температуре основным продуктом реакции
является мононитробензол; при длительном нагревании с ки-
кипящей азотной кислотой образуется м-динитробензол [2].
Предварительное введение алкильньы групп в ароматиче-
ароматическое ядро способствует более легкому вступлению нитрогруп-
пы. Так, например: толуол нитруется азотной кислотой даже
при комнатной температуре, причем основными продуктами
реакции являются мононитротолуолы, а именно: о- и п-нитро-
толуолы (м-нитротолуол образуется лишь в небольшом ко-
количестве) [2—4J. Если нитрование производить дымящей
азотной кислотой при высоких темрературах, то основным
продуктом реакции оказывается 2L*динитр!отолуол [2].
Голлеман [5] исследовал нитрование 'толуола азотной
кислотой уд. в. 1,475 при различных температурах. Опыты по-
показали, пто, несмотря на варьирование температуры в широких
пределах (от —30 до 60°), отношение количеств получении»
изомеров нитропрОИзводных изменяется незначительно (табл.!)*
Как видно из приведенных в Мой таблице данных* с вош-*
шением температуры выходы о- и м-нитротолуолов повышаются s
а выход п-нитротолуола понижается.
При нитровании п-хлортолуола при 0° азотной кислотой
уд. в. 1*48, взятой в отношении к углеводороду 4:1, получек
на смесь нитропродуктов, которая содержала 58% 4-хлор-З^
нитротолуола и 42% 4-хлор-2-нитротолу0ла. ;
Нитрование при более высоких температурах C0 и 60°)
приводит к образованию, кроме указанных выше нитропроиз-*
водных, еще полинитро-4-хлортолуолов.
Ксилолы также легко нитруются концентрированной азот-
азотной кислотой уже при комнатной температуре. При дейетвин
дымящей азотной кислоты на м-ксилол образуются 4-иитро-
м-неилол и 4,6-динитро-м-ксилол [6, 7]; если же нитрование
и-ксилола производить избытком концентрированной HNOs
22 Нитрование арбШмических и гетероциклических соединений
при нагревании на водяной банЪ, ТО продуктами реакции явля*1
ются 4,6-дийитро-м-ксшюл м! 2,4-динитро-м-ксииод [8].
п-Кеилол дает при нитрований Дымящей ЬШОзпри охлаждении
льдом 2-нитро-п-ксилол [9]; если же нитровать п-ШйлШ при
Нагревании, то продуктами реакции являются 2,3Адшдатро-
п-ксилол и 2,6-динитро-н-ксилол 110].
Таб лица 1
Содержание изомеров нитротолуола в продуктах реакции
нитрования толуола HNO3 в зависимости от температуры
реакции
ЙитроМпие' азотной кислотой
Температура
реакции, °С
—30
. ¦:;,: 0 .
30
..,; ,ео,
' i j , ';
Содержание в продуктах реакции (в lt> к общему
: ; количеству нитросоединеиий)
о-нитроталуойа'
55 ;6
56,0
56;9 :
Ж 57>5 :i
п-нитротолуола |' м-йитротолуола
41,7
40,9
39,9
38,5
¦1 ¦ %1 :
,...';.iSjl ;
3,2 , ,.
¦.Г ..'¦ . :.'¦ :
При нитровании о-кснлола дымящей азотной кислотой при
комнатной температуре получены ^нитро-очксилол и 3«питро-
о-ксилол [11 ]. о-Ксилол E0 г) нитровали [121 азотной кислотой
C00 -*•), охлаждённой до —15°, причем углеводород приливали
по каплям в азотную кислоту; во время реакции поддерживали
температуру —4°. Продуктами реакции оказались: 4-uiifpo-o-
йсйлол, 3-нитро-о-ксилол, 3,4-динитро-о-ксилол, 4,6-ди4Йтро-
о-ксилол и 4,5-динитро-о-ксилол. При нитровании о7ксилола
B5 г) ёблыпим избытком дымящей азотной кислоты B50 г)
при температуре 20—25° получается смесь ЗД-динитро^о-кси-
лола, 4,6-динитро-о-ксилола и 4,5-динитро-о-ксилола с общим
выходом динитроксилолов, близким , к теоретическому!
Мезитилен при нитровании азотной кислотой (уд. И. 1,38)
при нагревании дает мононитромезитилены; если же
нитрование производить избытком азотной кислоты {уд. в.
1,5) при нагревании на водяной бане в течение 2 час,
то получается смесь дй- и тринитромезитиленов, которые можно
выделить посредством разбавления продукта реакции водой;
Для разделения этих нитропроизводных смесь полинитромези-
тиленов обрабатывают спиртом, в котором растворяется лишь
2,4-динитромезитилен (т, пл. 87,5°) [8].
Рри нитровании фенола разбавленной азотной кислотой
образуется смесь о- ид-нитрофенола. Изучение вопроса об
отиосительном содержании изомерных нитрофенолов и витрог
крезолов в продуктах нитрования нашло отражение в работе
Вайбеля [131. Лучшие результаты при нитровании фенолов бы-
были получены [141 при применении азотной кислоты средней
концентрации. Процесс проводился следующим образом:
к охлажденной до 8-t-9° азотной кислоте (уд. в. 1,35) при энер-
энергичном перемешивании прибавляют по каплям федол (предва-
(предварительно превращенный в жидкость добавлением небольшого
количества воды). Реакционная масса тотчас окрашивается,
и чере& Ю™20 мин, начинайся выделение желтого продукта
реакции. По окончании приливания фенола реакционную мас-
массу перемешивают еще 30 мин., поддерживая ту же температуру,
а смесь охлаждают до +^40°^ Полученную смесь о- и п-нитро-
фенола отсасывают досужа; При 0° и при помощи водяного пара
отгоняют о-нитрофенол. Выход составляет приблизительно
40% "щ теории. Остаток от перегонки с водяным паром несколь-
несколько раз экстрагируют на кипящей водяной бане 2%1-ной соляной
кислотой, слегка охлаждают и фильтруют. При охлаждении
фильтрата выпадают пластинчатые кристаллы п-нитрофенола.
Выход >^40% от теорий. Из фильтрата можно выделить не-
небольшое количество 2,4-дияитрофевола. При нитровании
В-рщсиберзойной кислоты8 н. HNOs была, получена пикриновая
кислота с выходом 95% от теории [15].
¦ Динитро-о-крезол может быть получен непрерывным спо-
способом по следующей методике [16]: 12,9 кг Q-крезола и 34; да
70%-ной азотной кислоты пропускают в течение 1 часа через
калиброванные сопла в охлаждаемую водой металлич€ЗД?ро
трубу длиной 1 м и диаметром 38 мм. Выход динитро^рвдйла
80% от теории;
Что касается эфиров фенола (например, анизол, фенетол),
то зти соединения легче нитруются при применении концентри-
концентрированной азотной кислоты.
._,
24 Нитрование ароматических и гетероциклических соединении
м-Нитроацетофенон можно получить о хороший выходом
следующим образом [171. В охлажденную азотную кислоту
(уд. в. 1,51) приливают по каплям ацетофенон. Процесс про-
проводят при охлаждении @—8°) и перемешивании. Продукт
реакции выливают на лед, фильтруют и перекристаллизовы-
вают из метилового спирта. Выход м-нитрокрезола состав-
составляет <~90% от теории.
Нитрованием! пропиофенона дымящей азотной кислотой
ерш охлаждении получена смесь о- и м-ннтропропиофеноыа,
которая разделяется 95 %-ным этиловым спиртом [18].
При обработке фенилуксусной кислоты избытком дымящей
азотной кйслоти образуется 2,4-динитрофенилукеуеная кисло-
кислота [19].
Гансбергер [20] применял нитрование азотной кислотой для
получения нитропронзводных днфенилуксусной кислоты. При
прибавлении дифенилуксусной кислоты к избытку азотной кис-
кислоты (уд. в. 1,5) при 30°, выливании реакционной массы на воду
я кристаллизации и» уксусной кислоты автор получил с не-
незначительным пыходом G,4% от теории) 3,4'-динитрьдифенил-
уксусн ую кислоту. -
При нитровании алкилированных производных бензола
разбавленной ааотной кислотой в запаянной трубке нитроируи-
па вступает не в ядро, а в боковую цепь. Тан, например, при
нагревании этилбеиаола с 5—6-кратным количеством разбав-
разбавленной азотной кислоты (уд. в. 1,075) в запаянной трубке при
105° образуется а-нитроэтилбензол CeHeCH(NQ^)GHs с Щжо-
дом 44% от теории. Изоиропилбензол в этих же условиях
дает фениднитроизопроран e,jHsC(NOj)(CH8L [21]*
Легге [22] изучал действие азотной кислоты на 1,4"ди*ед>ет.
бутилбензол. При постепенном прибавлении 100 г 1,4«ди~
трет, бутилбейэола при 15^-30° к 300 мл 96%*ной азотной
кислоты и последующем нагревании реакционной с меси в те-
течение 5 часч идеи 60° мм бый« получено 2,6-дйнитропроиавод-
ное с выходом 53% от теории. При охлаждении фильтрата
удается выделить некоторое количество 2,5-диия?грапрои8Вод-
ного. При нитровании 1,4*ци*трет.бутилбензола азотной кис-
кислотой в смеси с уксусным ангидридом и уксусной кислотой
Нитрование азотной киЬАотой
25
'Щт> же йВ*Ю|1*Й1Л0!йу%йЙи 'да1' 2,@йдШитро-, ' а 2-нитропроизвод-
2-нитропроизводимое с выходом 80% от теории.
I Нитрованием диэтилбензолфосфата СвН5РО(ОСгНеJ ды~
Цмящей азотной кислотой при $Ь*— 35° Косолапов [231 получил
ритропроизводное с выходом'-^67% от теории. Автор предпо-
предполагает, что нитропроизводное представляет собой смесь
РО (ОСаН6)а
При нитровании же соответствующего бензильного произ-
производного CeH6CHaPO(OCHaCeH6)a при 0° дымящей азо*ной
кислотой (или смесью азотной и серной кислот) тот же автор
{24J получил п-нитропроизводйое:
{'/•-:•
Прн действии разбавленной азотной кислоты на анилин
и другие ароматические амины происходит не нитрование,
а окисление. Однако есть указание, что при действии на ани-
анилин азотной кислоты различной Концентрации получается
смесь о-нитрофенола и 2,4- и 2,6-дини*рофенола. п-Нитрофе-
нол при этом не образуется [25].
Действием азотной кислоты (концентрация <J7O%) на ди-
йотиланилин Ланг [26J Получил
II i
¦/\/\
O,N | ]
NO,
0N^ СНа
N
ON CH8
I
26 Нитрование ароматических и гетероциклических соединений
Если же применить азотную кислоту концентрадии выше
70%, то получается
NOa :, ¦
Далее Ланг установил, что эти нее соединения получаются
при действии азотной кислоты концентрации выше 70% на
2,4-дйнитрометйланилин и 2,4,6-трйнйтрдметйланилйн.
В случае ацилированных ароматических аминов наблю-
наблюдается нитрование ароматического ядра с одновременным омы-
омылением ацильной группы 127]. ^ [ '
Арилсульфонияьные производные ароматических аминов
легко нитруются разбавленной азотной,, кислотой. Так, на-
например, при действии на п-толуолсу,ль<$анилид разбавленной
азотной кислоты образуется мононитропроизводное [28].
При нитровании [29] 1-метокси-2-п-тЙЛилсульфамидобен-
зола ' г ' . ¦ ' : ¦ ~:] :¦;¦¦ '"'.:'
ОСНа
'\_NHSOa_f
CHS
азотной кислотой (уд. веса 1,055) в течение 6 час. при темпера-
температуре 80—85° получен 1-метокси-2-п-толилсульфамидо-5-ни-
тробензол. Аналогично получаются соответствующие этильные
и пропилыше производные. При нитровании о-метоксиацета-
нилида концентрированной азотной кислотой был получен
п-нитро-о-метоксианилин.
Полициклическиё ароматические соединения нитруются
азотной кислотой уже при комнатной температуре. Нафталин
при нитровании концентрированной азотной кислотой (уд. в.
Нитрование азотной кислотой
27
1,33) при 20° дает а-штронафтадин [30]. При действии на наф-
нафталин дымящей азотной кислоты при температуре кипения
последней образуются 1,5-динитронафталин и 1,8-динитро-
нафталин [31].
Кроме а-нитронафталина при нитровании нафталина в ка-
качестве побочных продуктов удалось выделить 4,5% [3-нитро-
нафталина и 0,5—3,5% 2,4-динитро-1-нафтола [32].
Я. Я. Макаров-Землянский и В. П. Бибишев [33] показали,
что при нитровании тетралина азотной кислотой получаются
1,2- и 1,3-динитротетралин, в то время как при применении
нитрующей смеси продукт реакции не удается выделить ввиду
значительного осмоления.
Нитрование алкилпроизводныж нафталина изучали С: И. Сер*
гиевская и Г. Я. Уредкая [34]. При нитровании 1-про-
пилнафталина азотной кислотой при 40° авторы получили
4-нитро-1-пропилнафталин с .выхрдом 35% от теории.
Получение нитропро^звоДных) 1-хлор-2-метоксинафталина
ОСНа
описано в английском патенте [35].
1-Хлор-2-метоксйнафталин медленно прибавляется к 2,5-
кратному против теории количеству 62%-ной азотной кислоты
при 40° в растворе хлорбензола. При этом получают смесь
изомеров 4-, 6- и 8-нитро-1-хлор-2-метоксинафталина.
При нитровании 6-хлор-1-нафтойной кислоты [36]
28 Нитрование аромйШических и гетероциклических соединений
избытком азотной кислоты (уд. в. 1,49) в течение 5—10 мин. на
водяной бане Получена 5-нитро~6-хлор-1-нафтойная кислота
соон
Нитрование азотной кислотой
29
с выходом 27,5% от теории (после очистки). Если исходить
из метилового эфира &-хлор-1-нафтойной кислоты, то в этих
нее условиях получают с выходом 30% от теории 5-нитро-6-
хлор-1тметиловый эфир нафтойной кислоты:
СООСН,
При нитровании дифенила дымящей азотной кислотой обра-
образуются 4,4'-динитродифенил и 2,4'-динитродифенил [37, 38].
Белл и Кеньон [39] при нитровании дифенила дымящей
азотной кислотой получили 4,4'-динитродифенил, 4,2'~динит-
родифенил (т. пл. 70—80°) и 2,2'-динитродифенил (т. пл. 127—
128°). Они синтезировали также 2-нитродифенил и 4-нитро-
дифенил по методу Гюбнера и Людденса [40J (обработка ди-
дифенила дымящей азотной кислотой в растворе уксусной ки-
кислоты при 60°). При нитровании 20 г 2-нитродифевила 14 мл
дымящей азотной кислоты, разбавленной 2 мл воды, в течение
получаса продуктами реакции являются 4,2'-динитродифенил
и 2,2'-динитродифенил; 4-нитродифенил в этих же условиях
дает 4,2'-динитродифенил.
При действии азотной кислоты на антрацен происходит
окисление его в антрахиаон. Концентрированная азотная кис-
кислота уже на холоду превращает диацетилализарин в нитропро-
изЕодное
О OCOCHg
A
0 OGOCHg
/\/\/\/
0CQCH3
¦^s
I I
О NOa
Довольно хорошо изучено нитрование фенантрена. Еще
в 1879 г. Г. А. Щмидт [41], действуя на фенантрен большим
избытком дымящей азотной кислоты, цолучил смесь ос-, C-
и f-нитрофенантренов; из этой смеси ему удалось затем вы-
выделить отдельные изомерные нитрофенантрены. Впоследствии
Ю. Шмидт [42], нитруя фенантрен при комнатной температуре
азотной кислотой (уд. в. 1,56), синтезировал 3-иитрофеиантрен
с т. пл. 170—171°, идентичный тхиитрофенантрену, описан-
описанному Г. А. Шмидтом.
Ю. Шмидт [43] нитровал азотной кислотой также фенан-
тренхинон до следующему методу: смесь 30 г чистого фе-
нантренхинона и 900 мл концентрированной азотной кислоты
(уд. в. 1,4) нагревали до полного растворения фенантренхинова,
после чего кипячение смеси продолжали еще в течение 20 мин*
При вливании продукта реакции в 2 л воды нитропроизвод-
ные выделялись в виде желтых хлопьев, осадок отфильтровы-
отфильтровывали от жидкой части, промывали водой и обрабатывали ки-
кипящим спиртом; при этом в раствор переходил 4-нитрофе-
нантренхинон, который выкристаллизовывался из спирта при
охлаждении. После перекристаллизации из ледяной уксусной
кислоты получен чистый 4-нитрофенантренхинон с т. пл, 176—
177°. Нерастворившийся в спирту остаток после извлечения
4-нитрофенантренхинона растворяли в ледяной уксусной кис-
кислоте, из которой при охлаждении выделен 2-нитрофеиантрен-
хинон в виде желтых игольчатых кристаллов с т. пл. 256—260°.
Из новых нитросоединений, нашедших значительное при-
применение для борьбы с вредителями виноградников и фрукто-
фруктовых садов, следует отметить 1,3,6,8-тетранитрокарбаэол [44]*
Нитрованием флуоренона дымящей азотной кислотой при ки-
кипячении в течение 3 час. получается 2,7-динитрофлуоренон 145].
30
Нитрование ароматических и гетероциклических соединений
Взаимодействием дибензантрона с 70%-ной азотной кисло-
кислотой в присутствии о-нитротолуола при нагревании получается
мононитропроизводное [46].
И. С. Иоффе и А. С. Эфрос [47] описывают нитрование
дибензпирена азотной кислотой. Нитрование ведется в среде
нитробензола при 25—30° азотной кислотой (уд. в. 1,52). Для
получения 5,10-динитродибензпирена приходится применять
значительно больший избыток азотной кислоты. При нитровании
дибензпирена и его монозамещенных производных нитрбгруп-
пы вступают в наиболее реакционноспособные положения
E и 10), независимо от характера заместителя, содержащегося
в молекуле.
Брукнер и Витт [481 применяли нитрование азотной кисло-
кислотой для получения динитробензидина, исходя из диацетобен-
зидйна: 10 г диацетобепзидина вносили в 100 г дымящей азот-
азотной кислоты при комнатной температуре; полученное динитро-
соедйнение осаждали ледяной водой, отфильтровывали И про-
промывали горячей водой. Выход динитродиацетобензидина со-
составлял 12,5 г (93% от теоретического). При умеренном нагре-
нагревании динитродиацетобензидина с 1,5-кратным количеством
концентрированного раствора едкого кали в присутствии нё^
болыпого количества спирта получен с количественным выхо-
выходом динитробензидин
Динитробензидин нерастворим в воде, растворим в феноле и
мало растворим в спирту; при восстановлении дает тетраами-
нодифенил
H2N NH2
При растворении динитробензидина в серной кислоте и после-
последующей обработке нитритом получается диазосоединение; ки-
кипячение последнего в растворе абсолютного спирта приводит
Нитрйейнив смесью азотной и серной кислот
3f
к разрушению диазогрупп с выделением азота, вследствие
чего образуется 3,3'-динитродифенил (т. пл. J197—198°)
OaN NOa
Гетероциклические соединения, обладающие ароматическим
характером, при действии азотной кислоты могут быть превра-
превращены в соответствующие нитроыроизводные. Мейер и Штад-
лер [49] получили нитротиофен посредством пропускания воз-
воздуха, насыщенного парами тиофена, через дымящую азотную
кислоту, причем на 1 объем тиофена затрачивалось 4 объема
азотной кислоты. По окончании опыта реакционную смесь
разбавляли водой и собравшееся над водным слоем масло отде--
ляли и перегоняли с водяным паром. Продуктами реакции
оказались мононитротиофен (т, пл. 44°) и два изомерных ди-
нитротиофена, из которых один (получающийся с большим
выходом) плавился при 52°, а другой — при 75—76°.
Нитрование хинолина азотной кислотой при нагревании
дает 5- и 8-нитрохинолин с почти одинаковыми выходами на-
наряду с незначительным количеством 6,8- и 5,7тдинитрохино-
лина [5,0], Значительно труднее нитруется азотной кислотой
пиридин; пр данным Фридля [51], при кипячении пиридина
с концентрированной азотной кислотой в течение 24час. обра-
образуются лишь незначительные количества нитропиридина.
§ 2. Нитрование смесью азотной и серной кислот
Наиболее распространенным методом нитрования аромати-
ароматических соединений является нитрование смесью азотной кис-
кислоты с ковцентрированной серной кислотой («нитрующей сме-
смесью»). Нитрующая смесь — более энергичный нитрующий
агент, чем сама азотная кислота.
Помимо водуотнимающих свойств серной кислоты (точно
так же, как и смеси ледяной уксусной кислоты с уксусным
ангидридом), присутствие серной кислоты способствует усиле-
усилению нитрующего действия азотной кислоты при одновремен-
одновременном уменьшении ее окислительных свойств. Кроме того, сер-
да»... wfjoipx
благоприяядеиде
,,,,, Ш'Шр-цамнщ; .<Mi
, ц, #рртй
Процесс нитрования бензола на мононитропроизводное
оевоё!Й!:||*е мнощ1!1, десятка»! лет назад а осуществляется
ДЩ того чтобы избежать образования днвитро-
^ берется с некОто|Р4 E%)
^ 144}. Льюис и другие ШЙ'^вошаа-
лн, что даже елабое перемешивание реагентов достаточно для
достижения наибоШ высоких 'выходов. При нитровании бен-
бенf
зола в более жес
условиях (температура 75—80е, койцеи*
кислоты 86%) получается смесь изомеров
* содержит 90% ме*а-, 8^-9% орто- и
E81.¦¦!¦¦! ¦¦' '¦ ' ¦!¦'' ; '¦¦''¦;}'¦¦ '
провели детальное исследование по на*
условии иол учений Hi
me на выход п
слоты, количества
процесса 40 мин.
обрабатыва
ный'
99% ot теЬрии.
Мак-Кормак
посредственно из
из 617 т азотной
кйсяга|га (олеум с
ливают из капель:
прилива
e«iHero на»|
деления тепла
ты (84%*иой). Нйт^укщая смесь A80 г
тшя 'кислота ¦й!1.иШтком
подаемся в реактор При
равва 60р при
окончании нитрования реакционная мас-
тёльной воронке 400 г льда. Получен-
нйётся с паром и сУпгйт*ся. Выхёй 98—
осуществил синтез м-динитробензола не-
ола. К нагретой до 70° смеси, состоящей
;оты E9;9%-ной) и 836 г дымящей серной
^-нйм содержанием SO а), медлейнЙ при-
воронки 69 т бензола; через 2 часа после
температура реакционной смеси
Достигает 109". По окончании вы-
выпри сильном размешивании нагревают
2 час.
динит]|)о0«йЙ1Ола
[56] ^^штро
тем^е(|а*уре, если вести
заканчивать при 80°. ^
температуру ,109°. Выход
'г^даории!. .Можно получить
^ Йеадвола пр« 'более .низкой
сначала нри 30—60°, а потом
реагентов;
^ ^ . 2,1 /1.
Прямое нитрование $ензола дЪ |рин,ртробензола протекает
значительно труднее, чем нитроваййё его гомологов, напри-
например толуола, .При;|ни^р9вааидч^йй|Ч;||эбензола даже в осоЙр
жестких условиях удается нолучить Яиль очень низкие вы-
выходы трищтробензола. Поэтому* зтот процесс не получил
тического применения. !
Наличие мерильной группы к ж толуоле значительно
чает его нйройнйе. 'Ч1 ¦¦|-'i-'1 '¦
Нитрование толуола на мо^б&тротолуол протекает
ив те Ш 'условиях, что и щй^оваййе бензола. При этом по-
'^ЙЙЙЬ ;йзомёр(^в ^лшЩЩ^г'о1' "состава: ; :
С ^шйегаш'теад^ увеличивается йо*»1"
J^iEife 'Ц смеси Me'Ta-ljfe6taepJJi!;y|*f,]. ''Нитрование' тЬлу6да:'на
мЬмЬщТ'ропроизводное можно^'^йуПюствить и непрерывным
Способом. Смесь нитротолуолои йри дальнейшем нитровании
)вре1йращается в динитротОлуЙл. Щтрование ведется при тем-
гре 75° и концентрации О^аботанной кислоты -~,80%;
; йтом получается смесь диш^млуолор, в которой содер-
\"тщщ.г-^7^%.1^.,А-тощр&ь: —21% 1,2J-изрмера, наряду с не-*
большими примесяйи других изомеров [58]. Тринитротолуол!
долучается нитрованием нитротолуол^ й одну или более ста^
дий, в зависимости от того, что являете^ исходным продуктом?
моно- или Динитрртолуой, Из трех изомерных иитротолуодев
о- и я-нитротолу^йл превращают то^>рко в
i л,уол. Превраще|$р диндтротолуола «тринитротолуол
йодится безводной смесью азотной и верной кислот с
нием азотнрй..едйл^Ш 20—25%
8 А. в. Топчиев
34 Нитрование ароматических и гетероциклических соединений
лота : динитротолуол=1 :4 или 1:5.Реакция вачинаетсяуже при
обыкновенной температуре, которая вначале медленно, а за-
затем быстро повышается [59]. Нитрование ксилола протекает
легче, чем нитрование толуола, так как накопление в ядре
алкильпых групп облегчает нитрование.
Нитрование изомерных дгаштротолуолов исследовано Бил-
Биллем [60]. При обработке 2,5-динитротолуола смесью концен-
концентрированной азотпой кислоты A часть) и олеума с 20%-ным со-
содержанием свободного SO a B части) в течение длительного вре-
времени при нагревании до 95° автор получил ^-тринитротолуол
СН3
OaN ! NO2
Y
NO,
Если исходить из 3.4-дгаштротолуола, то получается смесь
¦^-тринитротолуола G5%) и ^-тринитротолуола
СП3
NO2
:о2
N0»
При действий нитрующей смеси, состоящей из 5 ч. азот-
азотной кислоты уд. в. 1,52 и 12 ч. олеума, в течение 3 дней при
95° получается чистый ^-тринитротолуол.
Шульц и Флашледдер [61] нитровали нитрующей смесью
эгайбензол. Нитрующая смесь, состоявшая из 82,5 г азотной
кислоты (уд. в. 1,456) и 107,6 г серной кислоты (уд. в. 1,842),
приливалась к 100 г этилбензола при 30°. По окончании при-
ливания реакционная смесь нагревалась сначала на водяной
бане в течение двух часов, а затем на песчаной бане до 135°.
Выход нитроэташбёнзола 94,6% от теоретического.
Нитрование смесью азотной и серной кислот
35
2,4-Дрзштроэтилбенаол был получен Вёйевейлером [62]
при медленном приливании 30 г отилбензола к смеси 2 ч. кон-
концентрированной серной кислоты (уд. в. 1,88) и 1 ч. концентри-
концентрированной азотной кислоты (уд; в. 1,43). Затем смесь нагрева-
нагревалась в течение 10 мин. до 125—130°. Строение 2,4-динитроэтда*-
бензола было доказано его окислением азотной кислотой
в 2,4- диннтробензойную кислоту.
Вейсвейлер Получил симметричный трииитроэтилбеизол
с 70%-ным выходом при прибавлении 10 г этилбензола в смесь
40 г азотной кислоты (уд. в. 1,525) и четырехкратного объема
дымящей серной кислоты (SO8-2H2SO4), охлаждаемую льдом,
с последующим нагреванием реакционной смеси до 100°. Про-
Продукты реакции состоят почти исключительно из тривитроэтил-
бензола, содержащего следы динитропроизводного [62}.
Нитрование этилбензола нитрующей смесью изучали
Б. И. Долгови Н. А. Кучумова [63]. Прибавлением 25 г этилбен-
этилбензола к смеси 20,5 г азотной кислоты (уд. в. 1,5) и 27 г серной ки-
кислоты (уд. в. 1,86) на холоду и последующим нагреванием до 135°
авторы получили главным образом 2-нитроэтилбензол. Подобным
же образом м-джэтилбдазол дает 2,4,6-тринитропроизводное.
Нитрование изопропилбензола детально изучено Хауном
и Кобом 164]. При обработке 250 г кумола, эмульгированного
в 300 г 97%-ной серной кислоты и 34,2 г воды, нитрующей
< иесьго, состоящей из 215,5 г 97%-ной серной кислоты и 225 г
70%-ной азотной кислоты:, было получено 323,7 г нй?р0кумола.
Лыходнитр оку мола 94,5% от теоретического. Авторы установи-
установили, что нитрокумол, полученный при температуре нитрования
«г 0 до 45°, на 24% состоит из орто-и на 76% из параизомерач
Ханш и Хельмкамп [65] получили 2,4-динитроизопропил~
бензол с выходом 96% при нитровании 253 г п-нитрокумола ни-
нитрующей смесью, состоящей из 542 г концентрированной aSot3-
пой кислоты и 800 г концентрированной серной кислоты, при
томпературе 45—60°.
При нитровании трет, бутилбенэола нитрующей смесью (со-
(состава 22,3% HNOs, 65,6% H2SO4 и 12,1% Н2О) образуется
t1 96?^-ным выходом смесь о-, м- и п-нитро-трет.
ЛОВ [66].
36 Нитрование ароматических и гетероциклических соединений
Браун и Боннер [67 ] изучали распределение изомеров в сме-
смесях мононитропроизводных, полученных при нитровании этил-
и изопропилбензола. Углеводороды нитровались нитрующей
смесью состава: 22,3% HNOe, 65,6% H2SO4 и 12,1% Н2О.
Продукты реакции перегонялись на высокоэффективной ректи-
ректификационной колонке. Состав мононитропроизводных этилбен-
эола и изопропилбензола, вместе с составом мононитропроиэ-
водных толуола и трет.бутилбензола [66], приведен в табл. 2.
Таблица 2
Содержание (%) изомеров в мононитропродуктах, получен-
полученных при нитровании ряда ароматических углеводородов
Углеводород
Толуол
Этилбензол . . . .
Изопропилбензол
Трет, бутялбензол
Игомер
орто-
58,45
45,4
30,0
15,8
4,1
6,5
7,7
11,5
пара-
37,15
48,2
62,3
„72,7
Мэ таблицы видно, что количество орто-изомера заметно
снижается с увеличением углеводородного радикала за счет
значительного увеличения содержания пара-изомера. Коли-
Количество мета-изомера с увеличением боковой цепи заметно уве-
увеличивается. Такое изменение содержания орто-изомера свя-
связано, повидимому, с сильным стерическим влиянием алкиль-
ной группы на замещение в орто-положение.
Нитрование о-ксилола нитрующей смесью изучалось Кросс-
леем и Ренуфом [68]. Нитрующая смесь, состоящая из 25 г
азотной кислоты и 100 г концентрированной серной кислоты,
медленно приливается к охлажденному до 0° о-ксилолу. В ка-
качестве основных продуктов реакции получаются 3-нитро-о-
ксилол и 4-нитро-о-ксилол наряду с небольшим количеством
динитро-о-ксилолов. Если же нитровать о-ксилол C0 г) из-
избытком азотной кислоты, приливая углеводород к смеси, со-
состоящей из 50 г азотной кислоты и 100 г серной кислоты, т. е,
в обратном, чем в предыдущем синтезе, порядке, то образуются
динитро-о-ксилолы с теоретическим выходом.
Нитрование смесью азотной и серной кислот
37
Маркерол и Лориет [69] нитровали о-ксилол C5 г) в раство-
растворе серной кислоты F5 г 70%-ной серной кислоты), постепенно
приливая нитрующую смесь (85 г), содержащую 56% H2SO4,
28% HNO3 и 16% Н2О. Нитрование проводилось при переме-
перемешивании реакционной массы, при этом температура поддержи-
поддерживалась ниже 30°. Выход мононитроксилола составил 45,2 г.
При нитровании м-ксилола смесью азотной и серной кислот
при температуре ниже 0° образуется 4-нитро-м-ксилол и 2-
нитро-м-ксилол [70].
Нитрование п-ксилола описано в работе Боуэна [71].
К 1 молю п-ксилола при 25—30° прибавляется по каплям
смесь 133 г концентрированной азотной и 212 г концентриро-
концентрированной серной кислот. После отделения органического слоя и
его нейтрализации продукт реакции перегоняют с паром, экстра-
экстрагируют бензолом и после отгонки бензола получают нитро-п-
ксилол с выходом 78—87% от теории.
Максимальный выход (90%) мононитро-п-ксилола получи-
получили Коб и Левин [72] при применении избытка азотной кислоты
11% (при обезвоживающем значении серной кислоты — 3,0),
температуре 30° и продолжительности реакции 30 мин. В ка-
качестве примесей обнаружены 2,3- и 2,6-динитро-п-ксилол и
п-толуиловая кислота.
Из трех изомеров ксилола наиболее легко нитруется м-кси-
лол [73]. Максимальный выход мононитро-м-ксилола (98%)
получается при нитровании в следующих условиях: к 1 молю
м-ксилола при 30° прибавляется 1,08 моля H2SO4 (81%-ной)
и 10%-ный избыток НГЮз. Реакция продолжается 1 час.
Для нитрования м-ксилола применяется вдвое меньшее ко-
количество серной кислоты, чем при нитровании орто- и пара-
изомеров. Данные по мононитрованию изомерных ксилолов
сведены в табл. 3.
Полинитроксилолы получаются при обработке ксилолов
нитрующей смесью. Нельтинг и Гейсман [74] при нитровании
п-ксилола смесью, состоящей из 80 г дымящей азотной кисло-
кислоты и 40 г серной кислоты, в течение 24 час. при нагревании
на водяной бане получили смесь двух динитро-п-ксилолов:
2,3-динитро-п-ксилола (т. пл. 24°) и 2,6-динитро-п-ксилола
38 Нитрование ароматических и гетероциклических соединений
(т. пл. 124°). Смесь удается разделить дробной кристаллиза-
кристаллизацией из толуола. При нагревании 20 г п-ксилола на водяной
бане в течение 16 час. с 80 г дымящей азотной кислоты и 120 г
серной кислоты авторы получили 2,3,5-тринитро-п-ксилол
(т. пл. 139-140°).
Таблица 3
Молярное отношение
HjSOj : ксилол
о-Ксилол, 2,22 . . .
п-Ксилол, 2,2 . . .
м-Ксилол, 1,08 . . .
Температура, "С
допусти
мая
6-35
20-40
5—55
i
оптимал'
ная
25
30
30
6
Я
g
ё
15,8
5,0
10
Концентрация
H,SO4> %
i
оптимал
ная
80
85
81
допусти
мая
78—82
77—85
77—85
ции,
X
as
(D
Время р
мин.
60
30
60
«9
в =
Максима
выход, 7
90
92
98
При нитровании п-ксилола при 80° избытком A0%) азотной
кислоты (при обезвоживающем значении серной кислоты 8,0)
и продолжительности реакции 15 мин. Коб и Левин [72] по-
получили с выходом 95% смесь динитро-п-ксилолов, состоящую
из 60—80%, 2,3-динитро-п-ксилола и 40—20?^ 2,6-динитро-п-
ксилола.
В работе Лекорша и Аубертейна [75] описано получение
тринитро-м-ксилола. 53 г м-ксилола медленно прибавляют
к 365 г смеси серной и азотной кислот F2,5?4 H2SO4, 14,5%
HNO3, 23% НаО) при 50°. Продолжительность реакции 1,5—
2 часа. В результате реакции получают 85 г смеси равных ча-
частей моно- и динитроксилола. Полученную смесь в растворе
320 г серной кислоты (92%-ной) приливают к 65 г смеси азот-
азотной и серной кислот (86,7% HNO3, 8,4% H?SO4, 4,9% Н2О)
при 70°. В дальнейшем постепенно повышают темлературу до
100°, а затем быстро до 120°. Получают 100—108 г тринитро-
ксилола хорошего качества.
Большой практический интерес представляют нитропроиз-
водные хлорбензола. При нитровании хлорбензола получается
смесь п- и о-нитрохлорбензола. Мак-Кормак [55] изучал нитро-
Нитрование смесью азотной и серной кислот
39
вание хлорбензола смесью азотной и серной кислот различных
концентраций. Предварительно охлажденный до —5° хлор-
хлорбензол частями добавлялся в нитрующую смесь при сильном
охлаждении. Оптимальные результаты получены при поддер-
поддержании температуры реакционной смеси 10°. Продолжительность
нитрования около 4 час. Для повышения производительности
процесса Мак-Кормак проводил нитрование хлорбензола так-
также при нагревании в интервале температур 80—95°. Общая
продолжительность нитрования 2,5 часа. В последнем случае
он применял нитрующую смесь, состоящую из 106,5 ч. азотной
кислоты F5,5%-ной) и 107,9 ч. серной кислоты (93,6%-ной)
на 100 ч. хлорбензола. В обоих случаях выход нитрохлорбен-
зола составлял 98% от теоретического, при этом 7% азотной
кислоты оставалось без изменения. Продукт реакции представ-
представлял собой смесь, состоящую из 66% п-нитрохлорбензола и
34% о-нитрохлорбензола. При дальнейшем нитровании смеси
изомеров нитрохлорбензола получается смесь динитрохлор-
бензолов, в которой преобладает 2,4-динитрохлорбензол на-
наряду с заметным количеством 2,6-динитрохлорбензола. В ка-
качестве небольших примесей смесь содержит и другие изомеры.
При нитровании п-дихлорбензола получается главным обра-
образом 2,6-динитро-1,4-дихлорбензол наряду с двумя другими
возможными изомерами [76].
Нитрованием о-дихлорбензола получают 3,5-динитро-1,2-
дихлорбензол [77], в случае же м-дихлорбензола образуется
преимущественно 4,6-динитро-1,3-дихлорбензол наряду с не-
некоторым количеством 2,4-динитро-1,3-дихлорбензола [78],
При взаимодействии 1,2,4-трихлорбензола со 100 мл смеси
серной кислоты (уд. в. 1,82) и азотной кислоты (уд. в. 1,52) в от-
отношении 3 : 1, в течение 24 час. при комнатной температуре
и 8 час. при 50—60° получено 11 г 1,2,4-трихлор-3,5-динитро-
бензола с т. пл. 101—103° [79].
Получение динитрофторбензола онисано в работе Цана
и Вюрца [80]. 40 г фторбензола приливают по каплям к смеси
120 г азотной кислоты (уд.в. 1,52) и 280 г серной кислоты (уд. в.
A,84) при температуре 0—20°. По окончании приливания смесь
в течение 2 час. нагревают на водяной бане, охлаждают,
40 Нитрование ароматических и гетероциклических соединений
выливают на лед. Кристаллический продукт содержит некоторое
количество кислоты, для удаления которой его расплавляют
в теплой воде, затем фильтруют, повторяя эту операцию до
тех пор, пока промывные воды не станут совершенно нейтраль-
нейтральными. Продукт окончательно очищают перегонкой в глубо-
глубоком вакууме (при этом происходит частичная полимеризация).
Выход 65,8 г, т. пл. 25,8°.
Фингер и другие [81 ] рекомендуют при нитровании бензотри-
фторида применять следующие условия: избыток концентри-
концентрированной азотной кислоты 10% против теории; начальная тем-
температура реакции 30—35°, а к концу 60°. Выход 90% от теории.
Ходжсон и Бэрд [82] пользовались нитрующей смесью для
получения нитропроизводных ароматических альдегидов. Ни-
тробензальдегид был ими получен следующим образом. К смеси
160 мл азотной кислоты (уд. в. 1,4) и 700 мл концентрированной
серной кислоты добавляют в течение 2,5 часов 180 г бензальде-
бензальдегида, при этом температура реакции не должна превышать 10°.
После внесения бензальдегида перемешивание продолжают еще
в течение 45 мин. Выделившийся продукт реакции — м-нитро-
бензальдегид отфильтровывают от жидкой части (масла). Для
удаления остатков маслянистого .продукта промывают по-
последовательно водой, а затем водным раствором соды, снова
водой и, наконец, сушат. Выход сырого м-нитробензальдегида
составляет 152 г. Маслянистый фильтрат экстрагируют эфиром,
вытяжку отфильтровывают, сушат над хлористым кальцием и
эфир отгоняют. При этом в остатке получается смесь о- и п-
нитробензальдегидов. Общий выход технических нитробензаль-
дегидов составляет 215 г. Из содовой вытяжки получают 10 г
смеси бензойной кислоты и о- и п-нитробензойных кислот.
С. Н. Ушаков и Е. Н. Фрейдберг [83] получили из толуола
смесь нитробензальдегидов. Реакция проводилась следующим
образом: 106 г толуола в течение 4—5 час. приливались к рас-
раствору 110 г азотнокислого калия в 325 мл концентрированной
серной кислоты при 5°. Был получен м-нитробензальдегид
с выходом 46—61% от теории. Из маточного раствора выде-
выделяли 25% орто-изомера. Если вести реакцию при 25—35°, то
выход мета-изомера повышается до 75—78%.
Нитрование смесью азотной и серной кислот
41
При взаимодействии 25 мл толуола со смесью 18 мл дымящей
азотной кислоты и 63 мл серной кислоты в течение 3 час. при
температуре 40°, а затем 90° (при температуре выше 100° реак-
реакция протекает со взрывом) Ниши и Токи [84] после очистки
сырого продукта получили 18 г м-нитробензойной кислоты.
С высокими выходами получаются нитробензальде-
гиды из коричной кислоты [85]. 30 г коричной кислоты в
250 мл концентрированной серной кислоты обрабатывается
при температуре ниже 20° 11 мл азотной кислоты (уд. в. 1,52).
После соответствующей обработки получают о-нитробензальде-
гид с выходом 50% от теории и 39% п-нитробензальдегида.
Нитрованием фталевого ангидрида А. А. Пономаренко [86]
получил 3-нитрофталевую кислоту с выходом 25% от теории.
Нитрующую смесь применяют для получения динитрофе-
нилуксусной кислоты [87] с высоким выходом. К 163 г фенил-
уксусной кислоты при 0° постепенно приливают смесь 260 мл
дымящей азотной кислоты и 600 мл концентрированной серной
кислоты с такой скоростью, чтобы температура реакции была
60°. Получают 2,4-динитрофенилуксусную кислоту с выходом
95% от теории.
Нитропроизводные диарилсульфата [88] получают при обра-
обработке 16 г его смесью азотной кислоты уд. в. 1,48 A1 г) и сер-
серной кислоты уд. в. 1,84 A4,3 г). После перекристаллизации
полученного сырого продукта B1 г) получают чистый п-нитро-
фенилсульфат G г). При обработке последнего смесью азотной
кислоты и олеума B0% SOe) получают 2,4-динитрофенилсуль-
фат, который после гидролиза дает 2,4-динитрофенол.
Постепенным прибавлением 1 мл п-бромтолуола к смеси
4 мл серной кислоты (98 % -ной) и 2 мл азотной кислоты G0 % -ной)
при 90° получают 2,3-динитро-4-бромтолуол [89]. Нитро-
Нитрование 2,3,5-трибромтолуола смесью дымящей азотной и кон-
концентрированной серной кислот дает 3,5,6-трибром-2,4-дини-
тротолуол [90].
Для получения нитроаминов обычно предварительно за-
защищают аминогруппу, замещая атом водорода в аминогруппе
на ацильную группу. При постепенном внесении раствора
100 ч. ацотанилида в 400 ч. серной кислоты в смесь из 76 ч.
42 Нитрование
ы евмфщиклтескш соединений
серной киелоти @1%-ной) и 73 ч. азотной кислоты F1,3% »ной)
Мак-Кормаж |5$] получил п-нитраацетанилид с выходом 83,5%
от теории.
Взаимодействие м-хлорацетайилида со смесью азотной кис-
кисло ли (уд. в. 1,52) и серной кислоты (уд. в. 1,8) при О9 приводит
[91] к образованию З-хлор-4-нитроацетанилида (выход 10%
от теории) и 3-хлор-4,6-ди11итроацетанилида (выход 10% от
теории):
ШСОСНз
O3N
Если же вместо серной кислоты применить олеувд A2% SO»),
то получается только 3-хлор-4,6-динитроап;етанйлид с выходом
20% от теории. м-Хлорацетанилид со смесью калиевой селитры
и концентрированной серной кисЛоты образует З-хлор-4-штро-
ацетанилид
ШС0СН3
с выходом 54% от теории [92]. Если же вести нитрование
центрированной азотной кислотой, то получается 3-хлор-
-6-нитроацеташлид
NHCOCH3
\/\
CI
Нитрование орто-замещенных ароматических аминов рписьь
вается в американском патента [93]. Нитрование ведут в серио-
Яитрование смесью азотной и серной кцслот
43
кислом растворе амина при 0—5°. В качестве примера приво-
приводятся нитрование о-анизидина, который дает 5-нитро-о-ани-
зидин.
Весьма гладко протекает нитрование ацильных производ-
производных дифениламина нитрующей смесью. При этом получают 2,4-
динитродифениламин [941 с теоретическим выходом. Если же
вести нитрование смесью дымящей азотной кислоты и концен-
концентрированной серной, то получается 2,4,6-тринитродифениламин.
Получение нитропроизводных дифенилмочевины было изу-
изучено И. М. Коганом и Д. Ф. Кутеповым [95]. При нитровании
дифенилмочевины смесью 68,3%-ной азотной кислоты и кон-
концентрированной серной кислоты при 0° получается 4,4'-ди-
нитродифенилмочевина
>— NHGONH— <
n—NO,
гГетранитропроизвоДное при этом обнаружить не удалось.
Изучение влияния концентрации азотной кислоты показало,
что наилучшие выходы получаются при использовании 48—
67%-ной HNOe. Оптимальная температура реакции "^15°.
Интересно отметить, что концентрация серной дислоты в ряде
случаев оказывает большое влияние и на положение вступаю-
вступающей в ядро нитрогрунны. Так, например, при нитровании ацет-
анилида нитрующей смесью замена моногидрата 78,8%-ной
серной кислотой приводит к увеличению выхода орто-изомера
<а счет пара-изомера [96].
Большой практический интерес представляют нитропроиз-
нодные нафталинового ряда. Нитрование нафталина при 25°
(месыо 83 ч. азотной кислоты F1,3%-ной) и 233 ч. серной
кислоты (91%-ной) приводит к образованию а-нитронафталина
с выходом 85% от теории.
В. А. Ленхольд (лаборатория Кинешемского ззвода) до-
доказал образование в этих условиях очень незначительной при-
примеси C-нитронафталина.'
При действии нитрующей смеси на нафталин (в более жест-
жестких условиях) получается смесь 1,5- и 1,8-динитронафталина.
44 Нитрование ароматических и гетероцикличееких соединений
Получение динитронафталина обычно проводят в две ста-
стадии: вначале одной азотной кислотой (~62%-ной) при охла-
охлаждении превращают нафталин в а-мононитронафталин, а за-
затем к полученной реакционной массе медленно при размеши-
размешивании и охлаждении приливают смесь 3 ч. серной кислоты
(92%-ной), 1 ч. олеума F0% SOa) и 1,5 ч. азотной кислоты
('—62%-ной). После соответствующей обработки получаются
1,5-динитронафталин с выходом 27% от теории и 1,8-динитро-
нафталин с выходом 67% [97]. При последующем нитровании
смеси динитронафталинов получается смесь три- и тетранитро-
нафталинов [98], которые находят применение в качестве взрыв-
взрывчатого вещества.
Если нитровать 2-метилнафталин [99], то получается смесь
изомеров, причем основным продуктом реакции является
1-нитро-2-метилнафталин. Наибольший выход E7%) получается
при применении 70%-ной HNOa с избытком 70% при темпера-
температуре от 0 до 30°. Если применять 15%-ный избыток смеси, со-
состоящей из 25% HNOa, 55% H2SO4 и 20% Н2О, то в качестве
основного продукта реакции также получается 1-нитро-2-ме-
тилнафталин. Если же применять при нитровании уксусный
ангидрид, то 2-метилнафталин дает динитропроизводное.
Нитрование а-нафтола протекает гладко: при зтом полу-
получается 2,4-динитро-а-нафтол. А. А. Пономаренко и Т. Е. Ма-
циевич [100] нитрованием 1 моля тетрагидронафталина смесью
170 г азотной кислоты (уд. в. 1,48) и серной кислоты (уд. в. 1,83)
получили 1,2,3,4-тетрагидро-6,8-дюштронафталин с выходом
33% от теории.
При нитровании 5-нитро-1-нафтойной кислоты нитрующей
смесью реакция идет уже при 0°, при зтом получается 4,5-
динитро-1-нафтойная кислота с выходом 52% от теории [101].
Отмечается, что если вместо серной кислоты применять ледя-
ледяную уксусную кислоту, то нитрование не идет даже при нагре-
нагревании.
Из других нитропродуктов полициклических соединений
следует отметить динитроантрахинон, который получается ни-
нитрованием растворенного в крепкой серной кислоте антрахи-
нона нитрующей смесью при 70—80°. При зтом образуется
Нитрование смесью азотной и серной кислот
45
смесь, содержащая главным образом 1,5- и 1,8-динитроантра-
хинон наряду с другими изомерами [102]. При нитровании
фенантрена получается смесь 9-, 2-, 4- и 3-мононитрофенантре-
на, и в небольшом количестве A%) образуется 1-нитрофенан-
трен [103].
Смесь азотной и серной кислот применяется также для ни-
нитрования труднонитрующихся соединений, например, пири-
пиридина. По мнению ряда исследователей, содержащийся в пири-
пиридине третичный атом азота оказывает тормозящее действие
на нитрование; при нейтрализации отрицательного влияния
третичного азота введением амино- или гидроксильной группы
нитрование пиридина протекает удовлетворительно.
Фридль [104] осуществил нитрование пиридина, действуя
на него смесью серной и азотной кислот (последняя получилась
in statu nascendi при взаимодействии азотнокислого калия
с серной кислотой). В раствор 20 г пиридина в 120 г олеума
A8% SOa), который нагревали на песчаной бане, вносили ча-
частями 110 г азотнокислого калия и одновременно через реак-
реакционный сосуд и приемник пропускали сильный ток воздуха.
Нитрование производили в течение 1 часа при 330°. Дестиллят,
состоящий из азотной кислоты, пиридина и нитропиридина,
выпаривали на водяной бане для освобождения от большей ча-
части азотной кислоты и после нейтрализации содой обрабаты-
обрабатывали зфиром (в эфир переходили нитропиридин и избыток пи-
пиридина). После отгонки зфира и пиридина остаток раство-
растворяли в азотной кислоте. Из раствора при стоянии выделялись
кристаллы нитропиридин-нитрата; последний растворяли в раз-
разбавленной азотной кислоте и, добавляя соду, выделяли нитро-
нитропиридин. Очистку сырого продукта производили растворе-
растворением его в бензоле или спирте и осаждением из этих растворов
лигроином или водой. Нитруя пиридин указанным методом,
Фридль получил нитропиридип (т. пл. 41°) с выходом 15% от
теоретического.
Восстановлением в аминопиридин, который был иденти-
идентифицирован как C-аминопиридин, Фридль доказал, что продук-
продуктом нитрования является ^-нитропиридин. В данном случае
подтвердилось правило, что присутствие третичного атома
,46 Нитрование ароматических и гетероциклических соединений
азота ориентирует заместители отрицательного характера пре-
прежде всего в ^-положение.
При нитровании 1-оксипиридина смесью концентрирован-
концентрированной серной и азотной кислот при 100° получается 4-нитро-1-
оксиииридин [105]. Выход продукта увеличивается при при-
применении дымящей серной кислоты и при температуре 130°.
Дальнейшее увеличение температуры до 140° приводит к умень-
уменьшению выхода.
Нитрованием 1-оксипириджна смесью дымящей серной киело-
тм и калиевой селитры получают 4-нитро-1-оксипиридин с вы-
выходом 52,4% от теории [106].
При прибавлении 4,5 г 3,5-диэтокеипИриднна в 10 мл кон-
концентрированной серной кислоты к смеси 11 мл крепкой азот-
вМ и 2 мл дымящей HNOs В течение 30 мйй: при 70° получают
3,5-дйэтокси-2-нитропиридин с выходом 45% от теории [107].
Если!*Ш вести нитрование при более высокой температуре (80°)
и с большим избытком дымящей азотной кислоты, получают
3,5-д«этокси-2,6-дйНйТропиридин с выходом 40% от теории:.
4-Нитропиридин-Н~оксид [108J с выходом 85—90% от теорий
получается при прибавлении по каплям 1,5 г пиридин-N-
оксйда в 3 мл концентрированной серной кислоты к смеси
5 мл дымящей азотной (уд. в. 1,52) и 3 мл концентрированной
серной кислоты. По окончании приливания реакционную Мас-
Массу нагревают 1,5 часа при 90е, выливают на лед, подщелачивают;
экстрагируют эфиром и после удаления эфира выделяют пь
товый продукт.
Главным продуктом реакции при действии нитрующей сме-
смеси на хинолин [109] являются два изомера мононитропродукта^
которые образуются в равных Количествах, а именно:
,, i ,
5-шгарохинолин 8-нитрохинолвв
NOa
\.
О.
Нитрование смесью азотной и серной кислот
Введение в хинолиповое ядро второй нитрогруппы с по-
помощью нитрующей смеси представляет значительные трудно-
трудности и не всегда возможно.
Кауфман и Деккер [110] разработали метод получения ди-
нитропроизводных хинолина из соответствующих мононитро-
производных. 6-Нитрохинолин не нитруется смесью азотной
и Серной кислот даже при кипячении в течение многих дней.
Нитрование же 6-нитрохинолина рассчитанным количеством
KNCb и H2SO4 в запаянной трубке в течение 10 час. при 130—
140° дает Два дипитропроизводных: 6,8-дипитрохинолин
с т. пл. 154° (идентичный полученному синтезом из 2,4-дини-
троанилина) и 5,6-динитрохинолин с т. пл. 185°. Значительно
легче протекает нитрование 7-нитрохинолина. При нагрева-
нагревании 5 г последнего смесью 100 мл азотной кислоты (уд. в. 1,5)
и 150 мл концентрированной серной кислоты в течение 6 час.
С обратным холодильником Кауфман и Деккер получили два
нитропроизводных: одно ст. пл. 225° и другое с т. пл. 175°(по
форме кристаллов и другим физическим свойствам последнее со-
соединение представляло собой, невидимому, 5,7-дшщтрохинолин).
8-Нитрохинолин при действии нитрующей смеси в течение
20 час. при нагревании дал с почти количественным выходом
б|#-Динитрохинолин с т. пл. 154°, идентичный продуктам,
йбйучающимся при нитровании 6-нитрохинолина (см. выше),
а йкже синтезом из 2,4-динитроанилина. 6,8-Динитрохинолин
^6>Йет быть получен в чистом виде (без примеси 5,6-динитрохи-
дашйиа), если 6-нитрохинолин A ч.) нитровать смесью 1 ч.
SOs с 2 ч. концентрированной азотной кислоты при переме-
перемешивании и постепенном повышении температуры до 100° в те*
чение 2 час. F-йитрохийЬлин вДОсиТсй в нитрующую смесь).
При нитровании З-нйтроХинолина йо 'Этому'же'методу получен
5,8-диниТрохинолЙН [111]. 1-ОксйхиНолин при1 Действии смеси
H2SO4+ KNO* при 70° дает 1-окёи4-нитрохинолин с хоропшм
i выходом [105].
При прибавлении раствора 10 г 4-оксихинолина в 45 мл конц.
HaSO4 при 0—5° к смеси 10 мл айЬтной кислоты (уд. в. 1,5) и
10 мл концентрированной серной кислоты Адаме [112] получил
I 0,9 г 6-нитро-4-оксихинолина.
48 Нитрование ароматических и гетероциклических соединений
При нитровании 2,4-диметилхинолина получается, наряду
с 8-нитро-2,4-диметилхинолином, также 6-нитро-2,4-диметил-
хинолин [113], разделение которых производится при помощи
разбавленной горячей серной кислоты. 4,6-Диметилхинолин
с нитрующей смесью при температуре ниже 0° дает с очень хо-
хорошим выходом 5-нитро-4,6-диметилхинолин [114].
По вопросу нитрования 4-аминохинолина см. оригиналь-
оригинальную литературу [106, 115, 116].
С очень хорошим выходом и в качестве единственного про-
продукта реакции получается 4-хлор-6-метокси-8-нитрохинальдин
[117] при обработке 4-хлор-6-метоксихинальдина смесью
серной кислоты и калиевой селитры.
При нитровании бензотиазола смесью азотной кислоты
(уд. в. 1,5) и концентрированной серной кислоты при 0° полу-
получают смесь 6-нитробензотиазола и мононитропроизводного
бензотиазола, в котором положение нитрогруппы точно не
установлено [118].
Предполагают, что это нитропроизводное является моле-
молекулярным соединением 6-нитро- и 7-нитропроизводного бензо-
бензотиазола.
Нитрование 5-метил-2-тиофенкарбоноьой кислоты нитрую-
нитрующей смесью при —5° приводит к образованию 4-нитро-5-ме-
тил-2-тиофенкарбоновой кислоты [119] с хорошим выходом
наряду с образованием в небольшом количестве динитро-2-
метилтиофена. Если проводить реакцию при более высокой
температуре, то выход мононитропроизводного тиофенкарбо-
новой кислоты падает и увеличивается количество динитропро-
изводного тиофена.
Клоза [120] осуществил нитрование 4-оксикумарина смесью
серной и азотной кислот. При этом получается нитрооксику-
марин с плохим выходом. Нитрование 4-оксикумарина в среде
хлороформа протекает с лучшим выходом по схеме:
ОН ОН
HNO,
\/\/\0
Нитрование азотной кислотой в ледяной уксусной кислоте 49
Азотсодержащие производные кумарина представляют инте-
интерес в физиологическом отношении (связь с антибиотиками).
§ 3. Нитрование азотной кислотой в ледяной уксусной кислоте
или в уксусном ангидриде '
Довольно распространенным методом нитрования арома-
ароматических соединений является нитрование смесью азотной
кислоты с уксусной кислотой, а также с уксусным анги-
ангидридом.
Систематическое исследование процесса нитрования аро-
ароматических углеводородов смесью азотной и уксусной кислот
проведено М. И. Коноваловым и К. Гуревичем [121]. Авторы
изучали нитрование толуола, ксилолов (орто-, мета-и пара-изо-
пара-изомера), этилбензола, дизтилбензола и других, применяя азот-
азотную кислоту уд. в. 1,495 и ледяную уксусную кислоту. Во
всех случаях, за исключением этилбевзола и диэтилбензола,
реакция проводилась при кипячении с обратным холодиль-
холодильником в течение 1,5—2 час.
В случае же этилбензолов реакция осуществлялась при лег-
легком нагревании. По окончании нагревания реакционную массу
выливали на воду, промывали содой и обрабатывали водно-
спиртовым раствором щелочи для удаления продуктов нитро-
нитрования боковой цепи. Соединения с нитрогруппрй в боковой
цепи выделялись пропусканием углекислоты и экстрагирова-
экстрагированием эфиром. Продукты нитрования в ядро извлекались
эфиром, а затем фракционировались.
На основе своих исследований авторы приходят к следую-
следующим выводам.
1. Уксусная кислота при разбавлении ею азотной кислоты
играет ту же роль, что и вода. Она ослабляет действие азот-
,-, ной кислоты на ароматическое ядро и направляет это действие
(при нагревании) на боковую цепь.
2. Способность реагировать с азотной кислотой, смешан-
смешанной с уксусной, для различных углеводородов в общем анало-
аналогична способности реагировать с разбавленной азотной
кислотой.
4 А. В. Топчиев
50 Нитрование ароматических и гетероциклических соединений
3. Одновременно с нитрованием в боковую цепь происходит
и окисление ее (особенно при проведении реакции в жестких
условиях) с образованием соответствующих карбоновых
кислот.
Благодаря тому, что ледяная уксусная кислота является рас-
растворителем, можно избежать применения избытка азотной
кислоты. Кроме того, ледяная уксусная кислота, а еще в боль-
большей степени уксусный ангидрид при нитровании служат для
связывания образующейся в процессе реакции воды. При ни-
нитровании смесью азотной и ледяной уксусной кислот наблю-
наблюдаются те же закономерности, что и при нитровании водной
азотной кислотой [122]. Замена при нитровании концентриро-
концентрированной серной кислоты уксусным ангидридом представляет
интерес в том отношении, что при этом исчезает свойственная
серной кислоте способность направлять нитрогруппу в опре-
определенное положение.
Основными условиями, определяющими течение реакции
при нитровании ароматических углеводородов смесью азотной
кислоты с уксусным ангидридом, являются отношения количе-
количества азотной кислоты к количествам воды и нитруемого соеди-
соединения.
Нитрование толуола азотной кислотой, взятой в избытке
по отношению к углеводороду C—4 моля HNOa на 1 моль то-
толуола), в отсутствие уксусного ангидрида приводит лишь
к небольшому A7—18%) выходу нитропроизводных (отношение
азотной кислоты к воде, имеющейся в растворе и образующей-
образующейся при нитровании, составляет 2,66 : 1). При проведении реак-
реакции в присутствии уксусного ангидрида получается количе-
количественный выход нитропроизводных (смесь о- и п-нитротолуолов)
1.123].
Смесь азотной и уксусной кислот с успехом применяется
для нитрования мезитилена.
Нитромезитилен получают с выходом 50% при нагревании
до кипения в течение 1,5 часа 1 ч. мезитилена, растворен-
растворенного в 4 ч. ледяной уксусной кислоты, с 1 ч. дымящей азотной
кислоты. Продукт реакции осаждают водой и, после отделения
от последней, подщелачивают едким натром и перегоняют
Нитрование азотной кислотой в ледяной уксусной кислоте 51
с водяным паром. Из водного дестиллята отгоняют мезитилен
и оставшийся нитромезитилен перекристаллизовывают из спир-
спирта; при охлаждении нитромезитилен выделяется из спиртового
раствора в виде призматических кристаллов [124].
Бамбергер и Ризинг [125] для получения мононитромези-
тилена применяли следующий метод нитрования: 100 г кон-
концентрированной азотной кислоты (уд. в. 1,51) вносят в смесь
100 г мезитилена и 400 мл ледяной уксусной кислоты, при
этом происходит энергичная реакция с выделением тепла, и
жидкость начинает кипеть; кипение жидкости поддерживают
еще в течение 50 мин. По окончании нитрования охлажденную
реакционную массу вливают в 1 л воды со льдом; выделившееся
при этом тяжелое масло отфильтровывают от взвешенных кри-
кристаллов мезитиленовои кислоты и обрабатывают эфиром; эфир-
эфирную вытяжку несколько раз встряхивают с 20%-ным раство-
раствором поташа и затем с 15%-ным раствором едкого кали для извле-
извлечения мезитиленовои кислоты и ксилилнитрометана (последний
из щелочных растворов выделяется при насыщении СО2). Из
эфирной вытяжки отгоняют зфир и остаток подвергают фрак-
фракционированной перегонке (с паром); сначала отгоняется мези-
мезитилен, а затем нитромезитилен; последний при охлаждении вы-
выделяется в виде кристаллов с т. пл. 125°. Основным продуктом
реакции при этом способе нитрования служит нитромезити-
нитромезитилен в отличие от нитрования по М. И. Коновалову [126], когда
преобладающим продуктом является ксилилнитрометан,
т. е. замещение группой NO2 происходит преимущественно
в боковой цепи.
Нитрование мезитилена может быть проведено смесью
азотной и ледяной уксусной кислот и уксусного ангидри-
ангидрида [127]. Смесь 31,5 г дымящей азотной кислоты (уд. в. 1,51),
20 г ледяной уксусной кислоты и 20 г уксусного ангидрида
постепенно приливают к охлажденной до 10° смеси 40 г мези-
мезитилена и 60 г уксусного ангидрида. Скорость приливания и
охлаждение регулируют таким образом, чтобы температура
была не выше 20°. По окончании приливания реакционную мас-
массу оставляют при комнатной температуре в течение 2 час, на-
нагревают до 50°, а затем по охлаждении выливают при переме-
4*
52 Нитрование ароматических и гетероциклических соединений
шивании в 800 мл ледяной воды. Затем прибавляют 40 г хло-
хлористого натрия, продукт отделяют, извлекают эфиром водный
слой и вытяжку присоединяют к основной массе продукта.
Далее эфирную вытяжку промывают 10—15%-ным раствором
едкого натра (до явно щелочной реакции), эфир отгоняют, при-
прибавляют к остатку 150 мл 10%-ного раствора едкого натра и
¦ отгоняют нитромезитилен с водяным паром. В полученном
дестилляте отделяют маслянистый слой, который растворяют
в эфире. После отгонки на водяной бане эфира перегоняют оста-
остаток при температуре 243—250°. Полученный сырой продукт
очищают перекристаллизацией из метилового спирта и полу-
получают нитромезитилен с выходом 75—76% от теории.
Нитрование о-ксилола постепенным прибавлением его к сме-
смеси дымящей азотной кислоты с половинным по объему количе-
количеством ледяной уксусной кислоты при 20—25° после соответ-
соответствующей обработки реакционной массы приводит к образо-
образованию 4-нитро-о-ксилола [128] в виде желтых призм с т. пл. 30°.
Из фильтрата можно выделить 3-нитро-о-ксилол. о-Ди-
этилбензол нитруется смесью азотной и уксусной кислот при
температуре 10—20° с образованием 1,2-дизтил-4-нитробензола.
Выход 41% от теории [129].
Синтез нитрофенолов также осуществляется обработкой
фенолов смесью азотной и уксусной кислот. Например, нитро-
нитрование м-крезола можно проводить следующим образом: смесь
140 г м-крезола и 140 г ледяной уксусной кислоты охлаждают
до 5° и медленно вливают в охлажденную до —15° смесь, со-
состоящую из 200 г азотной кислоты (уд. в. 1,5) и 400 г ледяной
уксусной кислоты. После добавления всего количества м-кре-
м-крезола реакционную смесь оставляют еще на 1,5 часа (темпера-
(температура не должна опускаться ниже —1°). Для выделения продук-
продуктов реакции массу выливают в воду со льдом; при этом
отделяется вязкая жидкость, которая через некоторое время
закристаллизовывается; при перегонке с паром получаются
4-нитро-м-крезол (т. пл. 56°) и 6-нитро-м-крезол (т. пл. 129°)
[130].
При прибавлении о-пропилфенола B0,4 г) в уксусной кисло-
кислоте B0,4 г) к смеси 40,8 г азотной кислоты (уд. в. 1,42) и 61,2 г
Нитрование азотной кислотой в ледяной уксусной кислоте 53
уксусной при температуре от —4 до —6° получается 2-витро-6-
иропилфенол с выходом 39% от теории [131].
2,6-Ди-трет. бутилфенол нитруется смесью концентрирован-
концентрированной азотной и уксусной кислот A : 1) с образованием 4,6-
динитро-2-трет. бутилфенола [132].
Хлористый бензил нитруется смесью азотной кислоты и
уксусного ангидрида при 25° с образованием 32% орто-, 15,5%
мета- и 52,5% пара-нитробензилхлорида [133].
5-Нитропроизводное о-метоксифенола (гваякола) полу-
получается [134] прибавлением раствора 135 г ацетильного про-
производного гваякола в 120 мл уксусной кислоты к раствору 115 мл
азотной кислоты (уд. в. 1,5) в 180 мл уксусной кислоты. При
этом температура поднимается до кипения. Полученный про-
продукт гидролизуют 50 мл 10%-ного едкого натра. Выход 5-нитро-
лроизводного, считая на исходное ацетильное производное,
составляет 42% от теории.
Базани и Пианка [135] предлагают улучшенный метод ни-
нитрования ароматических о-оксикарбоновых кислот и их зфи-
ров, который состоит в следующем: 1 моль соответствующего
соединения в небольшом количестве уксусной кислоты быстро
обрабатывается смесью 1 моля азотной кислоты с 9 объемами
уксусной при комнатной температуре и затем нагревается до
тех пор, пока раствор станет коричневым. Полученное нитро-
соединение высаживают водой. Салициловая кислота дает при
этом 5-нитропроизводное
ОН
СООН
с выходом 41% от теории. Метиловый и этиловый эфир сали-
салициловой кислоты дают 5-нитропроизводное с выходом соответ-
соответственно 51 и 64% от теории.
Нитрование п-оксибензальдегида [136] смесью азотной и
ледяной уксусной кислот приводит к образованию 2-нитро-
54 Нитрование ароматических и гетероциклических соединений
4-оксибензальдегида:
ОН
А
\
NO,
сно'
Нитрованиерастворап-оксибензалъдегидавледянойуксусной кис-
кислоте ведется при слабом нагревании с азотной кислотой уд. в. 1,4.
При нитровании бензойной кислоты смесью азотной кисло-
кислоты и уксусного ангидрида получается с хорошим выходом
м-нитробензойная кислота.
Смесь азотной и уксусной кислот с успехом применяют для
превращения анилина и его производных в соответствующие
нитросоединения. Как известно, при нитровании азотной кисло-
кислотой обычно обрабатывают ею не анилин, а ацетанилид. В этом
случае происходит образование преимущественно п-нитроаце-
танилида и лишь в незначительных количествах о-нитроаце-
танилида. Витт и Утерман [137] показали, что применение
вместо азотной кислоты смеси ее с уксусной кислотой суще-
существенно изменяет отношения образующихся изомеров.
По методу Витта и Утермана, в раствор 45 г ацетанилида
в 22 г ледяной уксусной кислоты при охлаждении вливают
раствор 23 г азотной кислоты (уд. в. 1,5) и 1 г мочевины в 23 г
ледяной уксусной кислоты; смесь оставляют на 24 часа. Вы-
Выделение сырого продукта реакции и разделение изомеров про-
производят следующим образом: к реакционной смеси добавляют
360 г льда и выпавший осадок, состоящий из смеси о- и п-ни-
троацетанилидов, обрабатывают спиртовым раствором едкого
кали; при этом омылению подвергается лишь о-нитроацетани-
лид, а п-изомер остается без изменения. Основным продуктом
реакции (в отличие от нитрования азотной кислотой в отсутствие
уксусной кислоты) является о-нитроацетанилид(отношениеколи-
честв о- и п-изомера равно 3:1). Общий выход нитропроизвод-
ных (в виде сырого продукта) составляет 87% от теоретического.
Нитрование производных анилина для получения нитро-
аминосоединений осуществляется также с хорошими резуль-
результатами при применении смеси азотной кислоты с уксусным
Нитрование азотной кислотой в ледяной уксусной кислоте 55
ангидридом; так, например, триброманилин этим путем может
быть количественно превращен в трибромнитроаминобензол
B,4,6-трибромфенилнитроамин CeH2Br3NHNO2) [123]. Метод
заключается в следующем. Нитруемое производное анилина
растворяют в 98—99 %-ной ледяной уксусной кислоте и к рас-
раствору при охлаждении приливают азотную кислоту в отно-
отношении 2—3 моля на 1 моль нитруемого соединения. К получен-
полученной смеси, также при охлаждении, медленно добавляют уксус-
,ный ангидрид, следя за тем, чтобы температура не превышала
25°. Для получения хорошего выхода нитроаминов необходимо
применять азотную кислоту, не содержащую HNO2, так как
последняя может диазотировать нитроамин
C6H2Br3NHNO2 + HNO2 = C6H2Br3N = NNOS + Н2О.
Освобождение азотной кислоты от азотистой достигается пере-
перегонкой в вакууме при 20—30 мм. Лучшие результаты дает обра-
обработка азотной кислоты нитратом мочевины.
Нитрование аминосоединений, которые содержат мало замес-
заместителей и поэтому легче могут подвергаться ацетилированию
{например, 2,4-дихлоранилин), можно производить, раство-
растворяя нитруемое соединение в ледяной уксусной кислоте и мед-
медленно приливая раствор к смеси, состоящей из азотной кислоты,
уксусной кислоты и уксусного ангидрида; нитрование осуще-
осуществляется в этом случае при низких температурах (реакцион-
(реакционный сосуд охлаждают водой со льдом). Этот метод дает превос-
превосходные выходы нитросоединений при нитровании производных
анилина, у которых не замещены одно или оба о-положения по
отношению к аминогруппе. В качестве побочных продуктов
при нитровании этих соединений образуются в незначитель-
незначительных количествах изомерные нитроаминам нитроаиилины.
При нитровании диалкиланилинов по этому методу обна-
обнаружено, что азотистая кислота активирует процесс, т. е. оказы-
оказывает действие, противоположное тому, которое она проявляет
при нитровании других производных анилина. Смесь уксусного
ангидрида с азотной кислотой, предварительно освобожденной
от азотистой кислоты, не реагирует с диалкиланилинами.
Если нитрование последних производить смесью уксусного
56 Нитрование ароматических и гетероциклических соединений
ангидрида с обычной азотной кислотой, содержащей азо-
азотистую кислоту, то реакция протекает с выделением тепла, и
получаются динитропроизводные. Из N-диметиланилина, на-
например, образуется 2,4-динитро-]Ч-диметиланилин.
Ацетанилид и п-хлорацетанилид нитруются смесью азот-
азотной кислоты с уксусным ангидридом в соответствующие нитро-
производные- с количественными выходами (оптимальное отно-
отношение реагентов: 4 моля азотной кислоты, не содержащей
HNO2, на 1 моль нитруемого соединения). С другой стороны,
2,4-дихлорацетанилид при обработке смесью азотной кислоты
и уксусного ангидрида не подвергается нитрованию.
Бамбергер [138], изучавший реакцию нитрования анили-
анилинов смесью азотной кислоты с уксусным ангидридом, высказал
предположение о механизме этой реакции. По его представ-
представлениям, анилин при действии азотной кислоты образует ани-
линнитрат, который затем превращается в фенилнитроамин
с потерей одной молекулы воды
Н Н Н
!6H5n/ + H2O A)
• NO2
c6h5n/-
Н
н
ONO,
Уксусный ангидрид при этом играет роль дегидратирующего
агента. Дальнейшие исследования показали, что у ароматиче-
ароматических нитроаминов нитрогруппа, соединенная с атомом азота,
переходит в ядро в присутствии минеральных кислот, являю-
являющихся катализаторами этой перегруппировки. Например, из
фенилнитроамина при каталитическом действии минераль-
минеральных кислот образуются о- и п-нитроанилины
NH2
L*gXl5 IN XI—INO2—^^-*6С \^/
NO2
Таким образом, применяя две указанные выше реакции A)
и B), можно осуществить нитрование ароматических оснований
в две стадии, из которых первая состоит во вступлении нитро-
группы в боковую цепь (получение ароматических нитроами-
нитроаминов), а вторая — в переходе нитрогруппы в ядро (получение
нитроанилинов).
Нитрование азотной кислотой в ледяной уксусной кислоте 57
Нитрованием раствора трифениламина в ледяной уксусной
кислоте смесью азотной кислоты (уд. в. 1,49) и уксусной кисло-
кислоты П. М. Бугай [139] получил 4-нитротрифениламин с выходом
20—25%,4,4'-динитротрифениламин с выходом 30% и 4,4',4"-
тринитротрифениламин с выходом 40% от теории.
Дифенилмочевина [140] нитруется смесью азотной кислоты
(уд. в. 1,50) с ледяной уксусной при 40° с образованием п,п'-
ш динитродифенилмочевины:
s,O2N-<;
^—NH— CO—NH — /'
— NO2
Интересно протекает взаимодействие 4-ацетамидодифенил-
сульфида со смесью азотной кислоты (уд. в. 1,4) и ледяной
уксусной; при этом образуются п-нитроацетанилид и бензол-
|. сульфокислота [141]:
• ch3conh - /==Ъ—s—/==^> —%.
Л / Л / СНзСООН
CH3CONH — /С==^>, — NO2 + CeH5SO3H
Подобное же расщепление молекулы происходит, если
исходить из
При нитровании п,п'-дихлоразобензола смесью дымящей
йзотной и уксусной кислот при —10° получают 4,4'-дихлор-2-
нитроазоксибензол [142]:
С1 —:
HN0,
СНзСООН
-/о2 у
ь — С1
58 Нитрование ароматических и гетероциклических соединений
Это же соединение можно получить нитрованием п,п'-дихлор-
азоксибензола.
Синтез нитродифенилов проводят также в среде уксусной
кислоты. Например, нитруют 1 моль дифенила 2 молями азот-
азотной кислоты (уд. в. 1,5) в присутствии уксусной кислоты при
нагревании; при этом образуются п-нитродифенил (бесцветные
иглы, т. пл. 113°), о-нитродифенил (т. пл. 200—201°) и 3,5,4'-
тринитро-4-оксидифенил (т. пл. 202°) [143].
При нитровании окиси дифенилена смесью азотной и уксус-
уксусной кислот получается окись 2-нитродифенилена с выходом
56% от теории [144].
Томсон и другие [145] описывают получение с высокими вы-
выходами моно- и динитропроизводных 1,5-диметоксинафталина.
10 г 1,5-диметоксинафталина в 400 мл уксусной кислоты мед-
медленно нагревают со смесью 4 мл азотной (уд. в. 1,42) и 4 мл
уксусной кислот. Реакционную массу выдерживают 30 мин.
при 80°. При этом получается 4-нитро-1,5-диметоксинафталин
в виде желтых кристаллов с т. пл. 167° и выходом 89% от тео-
теории. Если взять больший избыток азотной кислоты (8 мл вместо
4 мл) и кипятить реакционную массу,- то получается 4,8-ди-
нитропроизводное 1,5-диметоксинафталина с выходом 84%
от теории. Это соединение B г) в 150 мл уксусной кислоты при
нагревании его с обратным холодильником в течение 1 часа
с 15 мл азотной кислоты дает 2,4,8-тринитро-1,5-диметокси-
нафталин с выходом 43% от теоретического. Этот продукт при
прибавлении его малыми порциями в азотную кислоту (уд. в.
1,5) при 0° дает 2,4, 6,8-тетранитропроизводное с выходом 23%
от теории.
С хорошим выходом G0—77% теоретического) протекает
нитрование 1-окси-2-нафтойной кислоты и ее метилового эфира
смесью азотной и уксусной кислот. При этом получается
4-нитро-1-окси-2-нафтойная кислота [135].
Галоидные производные нафталина также нитруются азот-
азотной кислотой в смеси с ледяной уксусной. Так, например,
нитрованием 2 г 1,5-дифторнафталина (в 8 мл ледяной уксус-
уксусной кислоты) 8 г азотной кислоты (уд. в. 1,52) при нагревании
на водяной бане в течение 4 час. получают 1,5-дифтор-4-нитро-
Нитрование азотной кислотой в ледяной уксусной кислоте
59
нафталин с выходом 82%. Более энергичное нитрование при-
приводит к смеси трудноразделимых изомеров [146]. Нитрованием
1'-хлор-1-метилнафталина В. А. Измаильский и А. И. Ко-
Козин [147] получили его нитропроизводное (8-нитро-1-хлор-
метилнафталин).
Нитрование ацетил-^-нафтиламина приводит к образованию
1-нитро-2-ацетилнафтиламина [148]. 200 г азотной кислоты
(уд. в. 1,4) медленно и при постоянном перемешивании до-
добавляют к смеси 300 г ацетил-^-нафтиламина в 500 мл ледяной
уксусной кислоты. При помощи охладительной смеси поддер-
поддерживают температуру реакционной массы не выше 40°. После
прибавления всей азотной кислоты перемешивают еще в тече-
течение 10 мин. и затем реакционную массу оставляют в ледяной
воде в течение 3 час. Полученные кристаллы отсасывают, про-
промывают 50%-ной уксусной кислотой и эфиром и перекристал-
лизовывают сначала из бензола, а затем из 95%-ного спирта.
Полученный нитропродукт имеет т. пл. 123—124°. Выход
~50% от теории.
Смесь азотной и уксусной кислот может быть применена
также для нитрования антрацена. При действии 63%-ной азот-
азотной кислоты на антрацен, суспендированный в ледяной уксус-
уксусной кислоте, при температуре не выше 30—35° получается
антрацен-нитроацетат
Н NO,
ОСОСНз
При добавлении воды к этому соединению выделяется вязкая
масса, которая при нагревании с разбавленным раствором
едкого натра постепенно переходит в нитроантрацен. Нитро-
антрацен может быть получен также обработкой реакционной
смеси, содержащей антрацен-нитроацетат, концентрированной
серной кислотой при комнатной температуре [149].
Мейзенгеймер и Коннераде [150] исследовали действие азот-
азотной кислоты на антрацен в присутствии уксусной кислоты и
¦ 60 Нитрование ароматических и гетероциклических соединений
уксусного ангидрида. К взвеси 50 г антрацена в 200 мл ледя-
ледяной уксусной кислоты медленно приливали 20 мл азотной кис-
кислоты (уд. в. 1,4); реакцию проводили при охлаждении, причем
температура поддерживалась в интервале 30—35°. По исте-
истечении 15 мин. в реакционной колбе образовался прозрачный
раствор, который выливали тонкой струей в холодную воду;
выделившуюся при этом желтую массу промывали водой и
после сушки в вакууме растворяли в эфире. Из раствора после
долгого стояния выделялись кристаллы антрацен-нитроаце-
тата
Выход составлял 45% от теоретического.
При применении избытка азотной кислоты Мейзенгеймером
и Коннераде были получены другие продукты реакции. К 20 г
смеси антрацена с 80 мл ледяной уксусной кислоты медленно
приливали при охлаждении 20 мл концентрированной азотной
кислоты (уд. в. 1,4), разбавленной 40 мл уксусной кислоты.
Температура реакции поддерживалась в интервале 30—35°.
По истечении двух часов из реакционной смеси начали выделять-
выделяться кристаллы. После двухдневного стояния выделившиеся кри-
кристаллы были отфильтрованы от жидкой части, промыты уксус-
уксусной кислотой и высушены. Из этих кристаллов исследователи
выделили следующие продукты:
динитроантрацен (т. пл. 294°)
NO2
/\/\S
Нитрование азотной кислотой в ледяной уксусной кислоте 61
тринитродигидроантрацен (т. пл. 139—140")
Н NO2
нитроантрон (т. пл. 148°)
О
. II
Н NO2
Нитро- и динитроантрацены могут быть получены и прямым
нитрованием антрацена, если в качестве нитрующего агента
применять смесь азотной кислоты с уксусным ангидридом и
уксусной кислотой. Метод нитрования состоит в следующем:
10 г тонко измельченного антрацена вносят в 40 мл ледяной
уксусной кислоты и к этой смеси медленно приливают из ка-
капельной воронки при сильном охлаждении смесь 10 мл не-
содержащей окислов азота азотной кислоты (уд. в. 1,5), 6 мл
уксусного ангидрида и 15 мл ледяной уксусной кислоты. Тем-
Температуру реакции поддерживают в интервале 15—20°. Через
некоторое время из реакционной смеси начинают выделяться
кристаллы, которые отфильтровывают через 24 часа по оконча-
окончании реакции, промывают спиртом и обрабатывают кипящим
спиртом; при этом в раствор переходит нитроантрацен, который
выкристаллизовывается при охлаждении (т. пл. 145—146°).
Нерастворившиеся в спирту кристаллы представляют собой
динитроантрацен, который очищают перекристаллизацией из
ксилола.
Нитрование фенантрена смесью азотной кислоты и уксус-
уксусного ангидрида изучено Шмидтом и Гейнле [151]. 80 г чистого
фенантрена растворяли в 160 мл горячей уксусной кислоты и
к раствору при нагревании на водяной бане медленно добавляли
смесь 120 мл уксусного ангидрида и 60 мл концентрирован-
концентрированной азотной кислоты (уд. в. 1,45). После добавления смеси
62 Нитрование ароматических и гетероциклических соединений
азотной кислоты и уксусного ангидрида реакционную жидкость
еще некоторое время нагревали на водяной бане до полного
прекращения выделения нитрозных газов. Продукт реакции
выливали в холодную воду, при этом выделялся осадок нитро-
фенантренов; последний отделяли от жидкой части и промывали
водой до полного удаления азотной кислоты и уксусного анги-
ангидрида. Для очистки сырого продукта от смолистых примесей
его растворяли в спирте. Из этого раствора посредством дроб-
дробной кристаллизации выделено четыре мононитрофенантрена:
2-нитрофенантрен с т. пл. 99°, 3-нитрофенантрен с т. пл. 170—
171°, 4-нитрофенантрен с т. пл. 80—82° и 9-нитрофенантрен
с т. пл. 116—117°. Основным продуктом реакции оказался 9-
нитрофенантрен F0% общего количества мононитрофенантре-
нов, содержащихся в сыром продукте). Общий выход моно-
нитрофенантренов составляет 60—61% от теории.
Для превращения галоидных производных фенантренов
в соответствующие нитрогалоидопроизводные можно также
пользоваться смесью азотной кислоты с уксусным ангидридом.
Например, к смеси 9-бромфенантрена B0 г), уксусной кислоты
B0 мл) и уксусного ангидрида (8 мл) медленно приливают 5 мл
азотной кислоты (уд. в. 1,45) при нагревании на водяной бане
в течение 20 мин. При охлаждении реакционной смеси выде-
выделяется твердый продукт, который перекристаллизовывают из
толуола и затем из ацетона. Выход нитропроизводного (с т. пл.
175—190°) составляет 8 г [1521.
С более высоким выходом G9% от теории) удается провести
нитрование флуорена [153] азотной кислотой (уд. в. 1,42)
в ледяной уксусной кислоте. Реакция ведется при перемеши-
перемешивании и температуре 50°, которая затем поднимается до 65°,
а под конец до 80°. Получается 2-нитрофлуорен в виде желтых
игл, который плавится при 156°.
При нагревании 4-оксипиридин-1Ч-оксида в ледяной уксус-
уксусной кислоте с азотной кислотой (уд.в. 1,36) на водяной бане
в течение короткого времени получается 3,5-динитропроизвод-
ное с выходом 80% от теоретического.
Карбазол нитруется азотной кислотой в смеси с ледяной
уксусной кислотой с образованием динитрокарбазола [154].
Нитрование азотной кислотой в ледяной уксусной кислоте 63
Смесь 5 ч. ледяной уксусной кислоты и 1 ч. карбазола нагре-
нагревают до 80° и медленно прибавляют при перемешивании 1,3
части азотной кислоты (уд. в. 1,38). Реакционную массу затем
нагревают в течение 30 мин. при 100°, охлаждают и выделяют
3,6-динитрокарбазол.
При нитровании N-фенилпиррола азотной кислотой в уксус-
уксусном ангидриде получаются 1-фенил-2-нитропиррол и 1-фенил-З-
нитропиррол [155]:
-NO,
N
11 (СН3СО),О\
-NO2
\/
\/
N
А
U
Если же N-фенилпиррол нитровать смесью азотной и серной
кислот, то нитрогруппа вступает в фенильное ядро с образо-
образованием 1-D-нитрофенил)-пиррола
При нитровании N-фенилпирролидина азотной кислотой
в смеси с ледяной уксусной кислотой Ю. К. Юрьев и другие [156]
получили 1Ч-(п-нитрофенил)-пирролидин с выходом 52% от
теории. Так как N-фенилпирролидин менее устойчив, чем,
например, диметиланилин, то нитрование протекает в более
мягких условиях (при температуре —20°).
К 10 г N-фенилпирролидина в 70 мл ледяной уксусной кис-
кислоты при —20° прибавляют по каплям 13 мл азотной кислоты
64 Нитрование ароматических и гетероциклических соединений
(уд. в. 1,35). Реакционную смесь перемешивают частым встря-
встряхиванием колбы. После суток стояния выпадает осадок
К-(п-нитрофенил)-пирролидина; выход 6,9 г, что составляет
52% от теории. При температуре нитрования выше —20°
получается меньший выход A2—20%).
\/
N
HNO,
сн.соон
/
N02
С высоким выходом протекает нитрование тиофена с обра-
образованием 2-нитротиофена [157]. Раствор 42 г тиофена в 170 мл
уксусного ангидрида медленно прибавляют к смеси 40 г ды-
дымящей азотной кислоты (уд. в. 1,51) в 300 мл ледяной уксусной
кислоты при перемешивании и энергичном охлаждении реак-
реакционной массы так, чтобы температура была не выше 10°.
По окончании реакции оставляют стоять реакционную массу
в течение 2 час. при комнатной температуре и затем выливают
на лед. Нитротиофен выделяется в виде светложелтых кристал-
кристаллов. Его отсасывают, промывают ледяной водой, отжимают и
сушат в эксикаторе. При перекристаллизации из петролейного
эфира получают 2-нитротиофен с т, пл. 44—45° с выходом 85%
от теории.
Производные кумарина нитруются смесью азотной и уксус-
уксусной кислот с образованием динитропроизводных кумарина.
Так, например, при обработке азотной кислотой 7-окси-3,4-
димети л кумарина, суспендированного в уксусной кислоте при
нагревании на водяной бане, получают 7-окси-3,4-диметил-
6,8-динитрокумарин [158].
Механизм нитрования азотной кислотой в смеси с уксус-
уксусным ангидридом или уксусной кислотой изучен сравнительно
мало. Как предполагают, нитрующим агентом в этих смесях
является соединение, образующееся посредством взаимодей-
взаимодействия уксусного ангидрида (или уксусной кислоты) с азотной
Нитрование азотной кислотой в ледяной уксусной кислоте 65
кислотой (диацетилортоазотная кислота, или, по другому пред-
представлению, ацетилнитрат).
Пикте и Женекан [159] нашли, что при смешении азотной
кислоты с уксусным ангидридом или уксусной кислотой обра-
образуется смешанный ангидрид уксусной и ортоазотной кислот —
диацетилортоазотная кислота, имеющая строение
СНоСОО
ОН
">N — ОН
СНоСОО
ОН
Если азотную кислоту (уд. в. 1,4) добавлять к равному объему
уксусного ангидрида, то происходит энергичная реакция с вы-
выделением тепла, приводящая к кипению жидкости. При фрак-
фракционированной перегонке продукта реакции удается выделить
основную фракцию, которая перегоняется при 127,7° (при
730 мм). Тот же продукт образуется при смешении ледяной
уксусной кислоты с дымящей азотной кислотой (уд. в. 1,52),
но в этом случае реакция протекает менее энергично. Если на
1 моль азотной кислоты брать 2 моля уксусной, то продукт
реакции почти полностью перегоняется при 127—128°.
Элементарный анализ показал, что полученный продукт
соответствует формуле G4H9NO3, т. е. содержит элементы одной
молекулы азотной кислоты и двух молекул уксусной кислоты.
Выделение тепла во время реакции, а также тот факт, что тем-
температура кипения получаемого продукта выше температур
кипения исходных веществ, свидетельствуют об образовании
в данном случае нового соединения, а не смеси компонентов.,
Диацетилортоазотная кислота представляет собой дымя-
дымящую на воздухе бесцветную жидкость со следующими констан-
константами: уд. в. 1,197 (при 15°), п%= 1,38432, т. кип. 127,7° (при
730 мм) и 45° (при 17 мм). В водных растворах диацетилорто-
диацетилортоазотная кислота полностью диссоциирует на две молекулы
уксусной кислоты и одну молекулу азотной кислоты. На орга-
органические соединения диацетилортоазотная кислота действует
очень энергично ацетилирующим, окисляющим или нитрующим
образом в зависимости от условий проведения реакции и при-
природы вещества, подвергающегося ее действию.
б А. В. Топчиев
66 Нитрование ароматических и гетероциклических соединений
Пикте и Женекан полагают, что в смесях азотной кислоты
с уксусным ангидридом или уксусной кислотой нитрующим
агентом является диацетилортоазотная кислота. Она была при-
применена Пикте [160] для нитрования ряда ароматических соеди-
соединений. При этом выяснилось, что как нитрующий агент диаце-
диацетилортоазотная кислота приближается к разбавленной азот-
азотной кислоте, так как она проявляет слабое нитрующее и до-
довольно сильное окисляющее действие. Анилин, фенол, нитро-
нитробензол диацетилортоазотной кислотой не нитруются.
Коген и Вибо [161] изучили кинетику нитрования аромати-
ароматических соединений в присутствии уксусного ангидрида, при-
причем предварительно ими исследована реакция взаимодействия
азотной кислоты с уксусным ангидридом в отсутствие нитруе-
нитруемого соединения. Скорость последней реакции измерялась по
изменению титра азотной кислоты (в молях на 1000 мл раство-
раствора). Найдено, что при небольших начальных концентрациях
азотной кислоты скорость реакции несоразмерно меньше по
сравнению с опытами с более высокими начальными концент-
концентрациями.
Результаты кинетических измерений показали также, что
в первые 75—100 мин. в реакционной смеси еще имеется сво-
свободная азотная кислота, которая в дальнейшем вступает в реак-
реакцию с уксусным ангидридом с образованием ацетилнитрата
HNO3 + (СН3СОJО ^± CH3CONO3 + СН3СООН.
Через 150 мин. после начала реакции становится заметной
убыль ацетилнитрата, который вступает во взаимодействие
с уксусным ангидридом с образованием нитропроизводных
последнего (нитроацетатов).
Для изучения кинетики взаимодействия бензола с азот-
азотной кислотой в присутствии уксусного ангидрида ставились
опыты, которые отличались друг от Друга различными началь-
начальными концентрациями азотной кислоты, причем варьировались
также и количественные отношения компонентов. При неболь-
небольших концентрациях азотной кислоты и бензола нитрования
практически не происходит. Реакция протекает с заметной
скоростью лишь при следующих начальных количествах реа-
Нитроеание азотной кислотой в ледяной уксусной, кислоте 67
гентов: азотной кислоты 0,8 мол. и бензола 1,2 мол. Для по-
получения более ясной картины течения процесса произведены
одновременные измерения концентраций азотной кислоты и
нитробензола. Оказалось, что нитрование бензола вначале про-
протекает быстро, но с течением времени замедляется, причем
общий расход азотной кислоты и ацетилнитрата превышает то
количество этих реагентов, которое затрачивается, на образова-
образование нитробензола. Полученные результаты указывают, что про-
процесс нитрования ароматического соединения сопровождается
побочной реакцией взаимодействия между ацетилнитратом и
уксусным ангидридом (см. выше).
Сравнение обеих исследованных реакций дает следующее
представление о реакции нитрования бензола азотной кислотой
в присутствии уксусного ангидрида: в начале процесса един-
единственным нитрующим агентом является азотная кислота, и
лишь в дальнейшем происходит образование другого нитрую-
нитрующего агента — ацетилнитрата. Последний не только нитрует
ароматическое соединение, но и вступает в реакцию с уксус-
уксусным ангидридом, образуя нитроацетаты.
Изучено также влияние на реакцию нитрования азотистой
I кислоты; опыты с добавлением мочевины, разрушающей азо-
азотистую кислоту, показали заметное снижение скорости реакции
по сравнению с опытами в присутствии HNO2, что указывает
I на каталитическое действие азотистой кислоты. В опытах без
", добавок мочевины обнаружено, что концентрация азотистой
[кислоты возрастает со значительной скоростью по мере тече-
|ния реакции, повидимому, в связи с окислительным действие!*
азотной кислоты на бензол, приводящим к образованию новых
¦ количеств HNO2. С повышением концентрации азотистой кис-
поты повышается ее каталитическое действие. Однако это
происходит лишь до известного предела, после которого даль-
даейшее образование азотистой кислоты уже не отражается за*
'иетным образом на скорости реакции.
Кинетика нитрования ароматических углеводородов и их
(Галоидных производных азотной кислотой в уксусном ангидри-
ангидриде исследована также Б. В. Троновым, Г. X. Камай и А. Г. Ко-
Коваленко [162].
б*
68 Нитрование ароматических и гетероциклических соединений
Смесь эквимолекулярных количеств азотной кислоты, уксус-
уксусного ангидрида и испытуемого вещества нагревали при темпе-
температуре от 0 до 20°. Через определенные промежутки времени
смесь оттитровывали раствором едкого натра. Относительную
скорость нитрования различных соединений вычисляли по
времени, в течение которого происходило одинаковое умень-
уменьшение кислотности, т. е. реагировало одно и то же количество
азотной кислоты (при этом принимали в расчет и количество
щелочи, пошедшее на титрование уксусного ангидрида). Опыты
показали, что скорость нитрования углеводородов повышается
в следующем порядке (скорость нитрования бензола принята
за единицу): бензол A)<м-ксилол G)<Смезитилен B5)<псевдо-
кумол B8). Галоидные соединения могут быть расположены
в следующий ряд по возрастанию относительной скорости их
нитрования:
С„Н6С1 @,15) < CeH5Br @,25) < СвН5СН2С1 @,4) <
< м-СН3СвН4С1 @,5)<п-СН3СвН4С1 A,15) <
<о-СН3СвН4С1A,2).
§ 4. Нитрование в присутствии катализаторов
Еще в 1906 г. обнаружено каталитическое действие азотно-
азотнокислой ртути (закисной) при нитровании антрахинона и метил-
антрахинона [163]. Несколько позднее найдено своеобразное
каталитическое действие солей ртути при нитровании бензола.
Установлено, что реакция нитрования бензола в присутствии
Hg(NO3J, при определенной концентрации азотной кислоты,
направляется в сторону образования нитрофенолов. При дей-
действии на бензол концентрированной азотной кислоты или сме-
смеси азотной и серной кислот в присутствии ртути получают
только нитробензол; для образования нитрофенолов необхо-
необходимо соответствующее разбавление азотной кислоты, при ко-
котором она может проявить свое окислительное действие.
Образование нитрофенолов при нитровании ароматических
углеводородов разбавленной азотной кислотой в присутствии
азотнокислой ртути в значительной степени зависит от темпе-
Нитрование в присутствии катализаторов
69
ратуры реакции и концентрации применяемой кислоты; при-
присутствие в реакционной смеси серной кислоты в количестве,
которое фактически не оказывает влияния на концентрацию
азотной кислоты, не отражается на выходе нитрофенолов.
Для получения нитрофенолов нагревают на водяной бане
смесь 100 г бензола, 800 г азотной кислоты (уд. в. 1,31) и 15 г
азотнокислой ртути при сильном перемешивании. В качестве
продуктов реакции, наряду с незначительным количеством
нитробензола, получаются 2,4-динитрофенол и пикриновая
кислота:
ОН
NO,
он
. ..
/V\
O2N NO»
Согласно данным Кормака [164], оптимальные условия
окислительного нитрования с целью получения динитрофено-
ла сводятся к применению 50—55%-ной азотной кислоты, со-
содержащей в 1 л 0,2—0,5 моля азотнокислой ртути, при темпе-
температуре реакции 50°. При этом выход динитрофенола достигает
85% от теоретического (другие исследователи [105] указывают
более низкий выход), а в качестве побочных продуктов
получаются нитробензол и пикриновая кислота.
Проведение реакции при более высокой температуре уве-
увеличивает образование пикриновой кислоты за счет динитро-
динитрофенола.
Бахман и другие [165], изучавшие состав продуктов, по-
получающихся при окислительном нитровании фенола, прово-
проводили реакцию следующим, образом: 50 г бензола при 50° при-
прибавлялись в течение 3,3 часа к смеси 750 мл 10,65 М азотной
кислоты, 0,37 М Hg(NO3J * и 0,1 г NaNO2 при 50°. Реакцион-
Реакционная смесь перемешивалась'~ 2,5 часа, охлаждалась, и выделял-
выделялся динитрофенол. Из фильтрата извлекались побочные про-
продукты. Выход динитрофенола составлял 68,4%. Кроме дини-
* 60 г HgO прибавляется к 541 мл 70%-ной Н1МОз и разбавляется
до 750 мл. '. 'i' . !
70 Нитрование ароматических и гетероциклических соединений
трофенола выделены
%
Пикриновая кислота 4
Нитробензол. . 7,8
СО2 9,7
Щавелевая кислота 2,5
Нитрофенолы образуются в результате комбинирования
двух процессов: окисления и нитрования, причем окисление,
повидимому, предшествует нитрованию. Последнее допущение
подтверждается тем, что при действии азотной кислоты на ни-
нитробензол он остается без изменения или же переходит в ди-
нитробензол, но не в нитрофенол. Реакция образования пи-
пикриновой кислоты из бензола протекает по следующему урав-
уравнению, выражающему конечный результат нитрования:
С„Нв + 4HNO3 = С„Н2 (ОН) (NO2K + ЗНаО + HNOa.
Предполагается, что вначале в качестве промежуточного
продукта образуется комплекс бензола со ртутью, который рас-
распадается под влиянием избытка азотной кислоты {166].
Показано также, что азотнокислая ртуть оказывает катали-
каталитическое действие и на процесс нитрования бензойной кислоты
азотной кислотой, направляя реакцию в сторону образования
тринитрооксибензойной кислоты (в обычных условиях нитро-
нитрования, т. е. без катализатора, бензойная Кислота дает, как
известно, нитробензойные кислоты). Образующаяся тринитро-
оксибензойная кислота, переходящая при нагревании с отщеп-
отщеплением СО2 в пикриновую кислоту, представляет собой 2,4,6-
тринитро-3-оксибензойную кислоту
СООН
O2N.
он
Таким образом, и в данном случае присутствие ртути спо-
способствует вхождению гидроксильной группы в ароматическое
ядро 11671.
Нитрование в присутствии катализаторов
71
Действие азотной кислоты в присутствии ртути на арома-
ароматические соединения и их производные исследовали также
Блехта и Патек [1681. При нитровании толуола 50%-ной азот-
азотной кислотой, в которой растворено 2% ртути, образуются
. нитротолуолы и п-нитробензойная кислота с выходом 10% от
теории (т. пл. п-нитробензойной кислоты 237—238°). В про-
продуктах реакции обнаружен также тринитро-м-крезол. Эти авто-
авторы не подтверждают образования нитросалициловой кислоты,
наблюдавшегося другими исследователями [1671.
При нитровании бензола смесью азотной и серной кислот
в присутствии 2% ртути получены нитробензол и тринитрофе-
нол. Нитрование этой же смесью толуола дает нитротолуолы,
нитрокрезол и п-нитробензойную кислоту, т. е. те же продук-
продукты, которые образуются и при нитровании азотной кислотой.
Эти результаты указывают, что добавление серной кислоты не
влияет на нитрование ароматических соединений азотной кисло-
кислотой в присутствии ртути. Далее показано, что нитрование нитро-
нитробензола 80—85%-ной азотной кислотой в присутствии ртути
приводит к большим выходам динитробензола, чем нитрова-
нитрование без активатора.
Механизм нитрования ароматических соединений в при-
присутствии ртути объяснен Блехтой и Патеком следующим обра-
образом: ртутная соль образует промежуточный ртутьорганический
комплекс с бензолом CeH5HgNO8, который разлагается при
действии азотной кислоты, выделяя углеводород in statu
nascendi; активированный таким образом углеводород легко
нитруется азотной кислотой. Авторы изображают схемати-
схематическое течение реакции следующим образом:
2С6Н5 — Hg — NO3 + 4HNO3 - 2С„Н6ОН + 2Hg (NO3J + N2O3 + H2O.
Образующийся при этом фенол тотчас же вступает в реакцию
|' ,»с азотной кислотой с образованием нитрофенола.
Для объяснения образования пикриновой кислоты из бен-
при нитровании его в присутствии ртутных солей пред-
следующий механизм реакции [169].
Ш w В первой стадии процесса предполагается образование
Т' 'ртутного соединения бензола, в котором ртуть непосредствен-
-72 Нитрование ароматических и гетероциклических соединений
но связана с бензольным ядром:
г—0 — N02
0 —NO2
—NO,
/Ч
+ HONO2
A)
Далее допускается, что азотистая кислота в форме ангид-
ангидрида реагирует со ртутным соединением бензола с образова-
образованием диазобензолнитрата B), который при гидролизе рас-
распадается на фенол, азот и азотную кислоту:
—o — N02
N = N — О — NOa
2N2Oa
N03 B)
'4N0,
HONO2
C)
4/
Последней стадией процесса является нитрование фенола
азотной кислотой, приводящее к конечному продукту реакции —
пикриновой кислоте;
ОН ОН
O2N\/'\/N°2
+ 3HN0»
\S
+ ЗН2О
D)
Нитрование бензола в присутствии ртутных солей изучено
также Виньоном [170]. При нагревании смеси 100 г бензола,
800 г азотной кислоты C6° Б оме) и 20 г азотнокислой ртути в те-
течение 5 час. при 70° Виньон получил пикриновую кислоту
A38 г) и нитробензол C2 г). При дальнейшем исследовании
им найдено, что нитрование бензола в присутствии ртутных
солей отличается следующими особенностями:
Нитрование в присутствии катализаторов
73
,1) При концентрации выше определенного предела пикри-
пикриновая кислота, по мере своего образования, полностью окис-
дяется азотной кислотой до двуокиси углерода.
,..,. 2) Избыток бензола по отношению к азотной кислоте, со-
создавая благоприятные условия для образования динитрофено-
лов, за счет частичного уменьшения выхода пикриновой кисло-
кислоты, повышает общий выход оксинитропроизводных. Так, на-
например, применяя 5 ч. бензола на 10 ч. азотной кислоты, можно
получить выход нитрофенолов около 85% от теории, в то время
как при отношении реагентов 1 ч. бензола на 10 ч. азотной
кислоты выход составляет только 34%. ,'
Варьируя условия процесса нитрования бензола в присут-
присутствии Hg(NOsJ, Виньон получил оптимальные результаты при
следующем способе проведения реакции: смесь 100 г азотной
кислоты C6° Боме), 50 г бензола и 2,5 г азотнокислой ртути
нагревают (с обратным холодильником) в течение 6 час. при
75—80°. Избыток бензола облегчает поддержание температуры
смеси на этом уровне и растворяет нитрофенолы, которые,
таким образом, меньше подвергаются окислительному дей-
действию азотной кислоты. По окончании нитрования отделяют
бензол, содержащий в растворе нитрофенолы, от водного слоя;
последний промывают бензолом, после чего оба бензольных
раствора соединяют и отгоняют сначала бензол и затем нитро-
нитробензол (с водяным паром). Остаток представляет собой смесь
нитрофенолов E2% динитрофенола и 48% пикриновой кислоты).
В случае необходимости обрабатывают смесь нитрофено-
нитрофенолов азотной кислотой или NaNCb и серной кислотой, в резуль-
результате чего динитрофенол переходит в пикриновую кислоту.
* Бродером [171] проведено тщательное исследование всех
газообразных продуктов, образующихся при реакции ни-
нитрования бензола азотной кислотой в присутствии нитрата
ртути. Ему не удалось обнаружить среди них азота, а найдены
i Лишь окислы азота (NO2 и N2O4). Далее Бродер показал, что
'Ш при нитровании бензола образуется некоторое количество о- и
П-динитробензолов, появление которых может быть объяснено
, Окислением азотной кислотой соответствующих промежуточ-
промежуточных продуктов — нитронитрозобензолов.
74 Нитрование ароматический и гетероциклических соединений
Бродер проводил также нитрование бензола слабыми рас-
растворами а8О*ноЙ кислоты в присутствий ртути при низких тем-
температурах, причем в Качестве промежуточных продуктов ему
удалой*» выделить нитробензол и соединение, которому он
придает строение
Это соединение (тетранитродифенилртуть) при гидролизе раз-
лагается с образованием динитрофенола
ОН
/NO, X yNOa
+ HgO+2Ha
3H2O-2
о2гч/
fto.
Основываясь на данных Бродера, а также на работ© Бамбер-
гера [172], который показал, что соединение бензола с ртутью
(дифенилртуть) реагирует с NSO4 с образованием нитробензола
и; фенилнитрата ртути, Девернье [173] представляет механизм
нитрования бензола в присутствии нитрата ртути следующим
образом: азотнокислая ртуть при действии на бензол дает ди-
фенилртуть A); последняя реагирует с азотной кислотой с обра-
образованием тетранитродифенилртути B), которая полностью
переходит щ водную фазу; тетранитродифенилртуть — неустой-
неустойчивое соединение и быстро разлагается азотной кислотой
ла динитрофенол и N2O4 с регенерацией азотнокислой ртути C).
Л
A I + Hg/ - С V-He— f > 4- 2Ш©« A)
4Н2О
B)
Нитрование в присутствии катализаторов
75
-<* ^--
4HNO3
\/J
NOa
N03
C)
Появление в продуктах реакции нитробензола Девернье
объясняет действием N2O4, образующегося по уравнению C),
на дифенилртуть с последующим окислением азотной кислотой
нитрозобензола в нитробензол D):
-HgNO3 +
Девернье также полагает, что азотная кислота может дей-
действовать и нитрующим образом на нитрозобензол, превращая
его в нитронитрозобензол E); при дальнейшем окислении
последнего образуется п-динитробензол F), также найденный
в продуктах реакции.
N0 N0
E)
76 Нитрование ароматических и гетероциклических соединений
Для выяснения оптимальных условий реакции нитрования
бензола в присутствии Hg(NOs)» Девернье поставил ряд опы-
опытов, в которых он варьировал концентрацию азотной кислоты,
отношения реагентов, температуру и продолжительность ни-
нитрования. В некоторых опытах нитрование проводилось по-
посредством пропускания паров бензола через реактор с азотной
кислотой и катализатором. Эти опыты дали менее благоприят-
благоприятные результаты по сравнению с опытами, в которых нитрова-
нитрованию подвергался жидкий бензол. Оптимальные результаты
(выход нитрофенолов около 70% теории) получены при следую-
следующих условиях: отношение реагентов — 1,4 ч, бензола, 3 ч.
азотной кислоты F1%-ной), 0,06 ч. Hg(NOs)a; темпера-
температура реакции 75—80°; продолжительность нитрования
6 час.
Девернье показал также, что при нитровании бензола в при-
присутствии нитратов марганца, алюминия, меди и цинка полу-
получается небольшой выход нитросоединений.
А. И. Захаров [174] приводит следующие возражения про-
против предложенных Девернье схем образования динитрофенола
и нитробензола: 1) превращение бензола в динитрофенол, по
Девернье, сопровождается выделением водорода; между тем
при исследовании продуктов реакции Захарову не удалось обна-
обнаружить образования водорода даже при нитровании больших
количеств бензола; 2) образование нитробензола посредством
взаимодействия дифенилртути с N2O4 с последующим окисле-
окислением нитрозобензола (см. выше) маловероятно. По мере те-
течения реакции количество окислов азота должно постепенно
возрастать, достигая наибольшего накопления к концу процес-
процесса. Если принять схему Девернье, следовало бы ожидать к кон-
концу нитрования преимущественного образования нитробензола
за счет понижения выхода нитрофенолов, чего в действитель-
действительности не наблюдается; даже при дополнительном насыщении
реакционной массы N2O4 выход нитробензола заметно не по-
повышается.
А. И. Захаров выдвигает другую схему нитрования, исходя
из допущения, что основная роль катализатора сводится
к ослаблению общей стойкости бензольного ядра посредством
Нитрование в присутствии катализаторов
77
разрыва двойных связей. Это ослабление ядра может происхо-
происходить в двух разных местах (схемы I и И),
OaN
\
+
о
О
н о
\/
— ONOj
\
¦NO,
02N
Н О— Hg — 0N02
+ HNO8 ==
шли
ОН
Vno2 но
+ HNO2 + ^
O2N
И)
OaN
Опыты Захарова показали, что образование нитрофенолов
происходит лишь при низких концентрациях азотной кислоты
(ниже 60%), при которых ее окислительная . способность выра-
выражена наиболее ясйо. Если же применять кислоту сравнительно
высокой концентрации F5—70%), то при температуре 60—65°,
не благоприятствующей окислительному действию азотной
78
Нитрование ароматических и гетероциклически» соединений
Нитрование в присутствии- катализаторов
79»
кислоты, в начале реакции будет получаться только нитро-
нитробензол; появление нитрофенояов наблюдается лишь через
некоторое время после начала процесса вследствие Понижения
концентрации азотной кислоты в реакционной смеси.
Таким образом Захаров приходит к выводу, что введение
гидроксильной группы при этой реакции зависит не от при-
присутствия катализатора, а только от концентрации применяе-
применяемой азотной кислоты и температуры реакции.
Далее Захаров считает, что образование нитробензола
исходит по следующей схеме:
\ 4-Hg(NOsJ.
•NO,
НО
При повторном использовании отработанной кислоты, как
показал Захаров, увеличиваются и скорость реакции и выход
динитрофенола. Так, например, при нитровании свежепри-
свежеприготовленным раствором, содержащим 59—60% HNO3) яри
30%-ном содержании катализатора и температуре 35—40°,
выход динитрофенола составляет ~40%. При вторичном
использовании отработанной кислоты (при сохранении осталь-
остальных условий) выход динятрофееола увеличивается до 50—55°/0.
При последующем использовании отработанной кислоты
в 3, 4 и 5-й раз выход динитрофенола соответственно дости-
достигает 65, 75 и 80%. Автор объясняет это тем, что в отработанной
кислоте катализатор находится в более активном состоянии.
А, И. Захаров исследовал также каталитическое нитрование
производных бензола в присутствии Hg(NOs)a. Оказалось,
что эти соединения дают только нитропроизводные, т. е. у них
отсутствует способность подвергаться одновременному окис-
окислению, как это наблюдается у бензола. Например, фенол при
нитровании его в присутствии Hg(NOs)a разбавленной азот-
ной кислотой C—4%) при низких температурах (до —5°)
дает почти чистый п-иэомер нитрофенола с выходом 60%.
Оптимальные условия нитрования фенола: загрузка неболь-
небольшими порциями фенола E0 г) в разбавленную азотную кисло-
кислоту (из расчета 36 г моногидрат»), содержащую катализатор
E г). При нитровании салициловой кислоты 10—12%-ной азот-
азотной кислотой в присутствии Hg(NOs)a получена смесь изомер-
изомерных мононитропрризводньщ с общим выходом 92—93%;
преобладающий продукт нитрования п-нитросалициловая
кислота. Реакцию необходимо проводить при сильном охла-
охлаждении (оптимальная температура 44—47°).
Ускоряющее действие азотнокислой ртути на процесс
нитрования нафталина отмечали Энц и Пфистер [175]. При
этом, по утверждению авторов, увеличивается выход 2,4-ди-
нитро-а-нафто да.
В противоположность этому Захаров утверждает, что поди-
циклическне ароматические углеводороды (нафталин, антрацен)
и их производные при иитровакю ааотной кислотой в при-
присутствии Hg(NOsJ дают толь» рнтропродукты (а ие окси-
нитропроизводные);щ притом мононитропроизводные. Нитрова-
Нитрование fS-нафтола приводит исключительно к «гнитрон-нафтолу.
Захаров рекомендует, следующий метод нитрования р-нафтола;
50 г (Зкнафтола загружают в 2)-г4%-ную адагную кислоту (из
расчета 44 г моногидрата), содержащую катализатор; реакцию
ведут при 30—35° с перемешиванием. Выход а-нитро-р-нафтола
достигает при этих условиях 84~$5% от теоретического.
Е. И. Орлов [176] исследовал нитрование м-ксилола раз-
разбавленной азотной кислотой в присутствии ртути. Смесь
м-ксилола с 45—50%-ной азотной кислотой кипятили в присут-
присутствии 2% ртути с обратным холодильником в течение 6 час.
Продукт нитрования подвергался перегонке с водяным паром,
при этом отогналось небольшое количества масла с запахом
нитробензола. Остаток состоял из смеси двух веществ, из
которых одно представляло собой желтые кристаллы, раство-
растворимые при нагревании в воде, эфире» спирте, бензоле и ксилоле,
а второе имело вид оранжевых комков. Исследование показа-
показало, что второе вещество является таутомерией формой иервого.
Нитрование ароматических и гетероциклических соединений
Для определения содержания нитрогрупп в желтых кристал-
кристаллах последние восстанавливались SnCI2 в солянокислой среде;
после удаления НС1 образовавшийся амин разрушался серной
кислотой и азот определялся по методу Кьельдаля.
Данные анализов на содержание карбоксильных групп и
азота показали, что продукт нитрования представляет собой
оксинитробензолдикарбоновую кислоту.
Нитрование ксилола азотной кислотой в присутствии ртути
изучено также Н. А. Холево и И. И. Эйтингтоном [177]. В круг-
лодонную колбу, снабженную обратным холодильником и
мешалкой, загружали 800 г азотной кислоты E0,2% НГЮз)
и 16 г металлической ртути (или соответствующее количество
азотнокислой соли); содержимое колбы нагревали при переме-
перемешивании до 75° и постепенно приливали (по каплям) 100 г
м-ксилола; после введения всего ксилола нагревание при тем-
температуре G5—80°) продолжали еще в течение 5 час. при переме-
перемешивании. Во всех опытах продуктами реакции оказались
4-нитро-м-ксилол и 4-нитро-З-метилбензойная кислота. Окси-
нитросоединений получено не было.
При проведении нитрования м-ксилола в указанных выше ус-
условиях, но без катализатора, Холево и Эйтингтон получили те
же соединения и с теми же выходами; например, выход моно-
нитроксилола из 100 г м-ксилола составлял 35 г, независимо
от того, проводилась ли реакция с катализатором или без
него.
Холево и Эйтингтон проводили также нитрование м-ксило-
м-ксилола в условиях, указанных в работе Е. И. Орлова [176].
Полученные результаты не подтвердили, однако, данных по-
последнего об образовании оксинитробензолдикарбоновой кисло-
кислоты в качестве основного продукта реакции. Холево и Эйтинг-
Эйтингтоном выделены при этом мононитроксилол и, в преобладающем
количестве, 4-нитро-З-метилбензойная кислота.
На основании экспериментальных данных Холево и Эйтинг-
Эйтингтон приходят к выводу, что ртуть не оказывает каталитическо-
каталитического действия на реакцию нитрования м-ксилола в отличие от
нитрования бензола. Это объясняется, по их мнению, способ-
способностью ксилола к легкому образованию мононитрокарбоновых
Нитрование в присутствии катализаторов
81
кислот, которые уже в дальнейшем не дают возможности рту-
ртути проявить каталитическое действие. В этом случае карбо-
карбоксильная группа как бы противодействует вступлению в ядро
оксигрущщ, подобно тому как это наблюдается в случае
присутствия в ядре некоторых других остатков, например
группы NO2.
Реакция нитрования ароматических соединений азотной
кислотой детально исследовалась также Дэвисом с сотрудни-
сотрудниками [178, 179]; в этих работах выяснялись механизм реак-
реакции и роль добавок азотнокислой ртути.
Опыты с бензолом производились этими авторами в круг-
лодонной колбе из стекла пирекс с пришлифованным холо-
холодильником. В колбу загружали сначала азотную кислоту,
в которой растворялась окись ртути или Hg(NOsJ, затем при-
приливали бензол и смесь нагревали на песчаной бане до умерен-
умеренного кипения и легкого выделения окислов азота. По оконча-
окончании реакции добавляли равный объем воды и смесь подверга-
подвергали перегонке с водяным паром. При этом в дестиллят в первую
очередь переходили непрореагировавший бензол и нитробен-
нитробензол; последний содержал довольно значительное количество
данитрофенола, от Которого его освобождали взбалтыванием
с раствором соды. Во вторую очередь отгоняли динитробензолы
и 2,4-дишм?рофенол. Было выделено два динитробензола,
которые отделялись один от другого фракционированной кри-
кристаллизацией. Остаток после перегонки с паром, содержавший
в осадке соль ртути, подвергали горячему фильтрованию. Из
фильтрата при охлаждении выделялись кристаллы пикриновой
кислоты. Найдено, что для получения хороших результатов
необходимо применять относительно большее количество азот-
азотной кислоты, чем зто указано в сообщении Вольфенштейна и
Бетерса [166].
При нитровании в течение 7 час. 200 г бензола 600 мл азот-
азотной кислоты уд. в. 1,42, в которой растворено ДО г окиси ртути,
получено: 41 г исходного бензола, 61,3 г нитробензола, 105 г
пикриновой кислоты и 4 г смеси, состоящей из равных частей
м-динитррбензола и 2,4-динитрофенола и некоторого количе-
количества п-динитробеязола.
6 А. В. Топчиев
82 Нитрование ароматических и гетероциклических соединений
Далее показано, что в зависимости от концентрации азотной
кислоты (от 100 до 20,6%) изменяются количественные отно-
отношения и характер получаемых продуктов реакции- При кон-
концентрации азотной кислоты 70% и выше получаются удовле-
удовлетворительные выходы моно- и динитробензолов, но пикриновая
кислота образуется лишь в незначительных количествах^ Ни-
Нитрование толуола азотной кислотой в присутствии ртута про-
протекает значительно более энергично, чем нитрование бензола.
Реакцию проводили в тление длительного периода при посте-
постепенном повышении температуры A2,5 час. при 65^-85°,
2 часа при 85—95°, 1 час при 95° и, наконец, 7 час. при нагре-
нагревании на песчаной бане). При нитровании 200 г толуола 600 мл
азотной кислоты (уд. в. 1,4), в которой растворено 10 г HgO,
долучены следующие продукты: 48 г непрореагировавшего то-
толуола» 15 г о-нитротолуола, 12 г п-нитротолуола, 8,8 г п-нитро-
бензрйцой кислоты и 6 г тринитро-м-крезола. Образование ббль-
щвд; количеств п-нитробензойной кислоты, невидимому! объяс-
объясняется окислением азотной кислотой п-нцтротолуола,
Влщпие различных окислов металлов и их нитратов на
соотношение изомерных нитротолуодов, получающихся
при нитровании толуола, изучали Дзудзуми и др. 1180]. При
нитровании (без добавок) 60 г толуола 66 г НМОз F5%-ной)
в течение 8 час. при 30° соотношение о-, м- и п-нитротолуола
составляет: 63,1 : 3,7 : 33,2. При проведении нитрования
в этих же условиях, но с добавкой одного из окислов (AgO,
РЬО, CuO, WO8, PtO2) или нитратов (Pd, Cu, Ba, Cd, Co, Mg,
Zn, Cr, Fe, Mn, Al или Bi) соотношение изомеров почти не ме-
меняется. Если же вести нитрование с добавкой HgO B г),
Hg(NO3J или Ni(NO3J (в количестве, эквивалентном 2 г соот-
соответствующей окиси металла), то получается следующее соот-
соотношение изомеров:
HgO Hg(NOa), Ni(NOa),
Орто 50,5 40,5 58,1
Мета 3,7 3,4 3,9
Пара 45,8 56,1 38,0
Таким образом, применение этих добавок сказывается лишь
на изменении соотношений орто- и пара-изомера. Что касает-
касается м-нитротолуола, то его содержание ИОчти не меняется.
I
Нитрование » присутетвии каталиваторов
83
Эти же авторы [181] изучали влияние добавок различных
нитратов на'соотношение изомеров, получающихся при нитро-
нитровании хлористого бензила. Нитрование проводилось ими В ук-
уксусном ангидриде азотной кислотой (82—94%-ной). При ни-
нитровании без добавок отношение орто- и пара-изомера состав-
составляет 0,55—0,6 (при содержании мета-изомера 3,9—4,1%).
В присутствии нитратов ртути, серебра, меди, бария или свин-
свинца отношение орто- н пара-изомеру достигает ~-0,92 при со-
сохранении того же содержания мета-изомера.
В отличие от толуола хлорбензол в присутствии ртути реа-
реагирует с азотной кислотой значительно медленнее, чем бензол.
Нитрование хлорбензола A00 г) в течение 10 час. азотной
кислотой уд. т. 1,4 C00 мл), в которой растворено 5 г HgO,
дало следующие продукты реакции: 57,6 г ненрореагировав*
шего хлорбензола, 7,6 г п-нитрохлорбензола и 1,5 г тринитро-
м-хлорфенола.
Дэвис [178, 179] проводил также нитрование нафталина/
в условиях, близких к тем, которые оказались оптимальными
для бензола. 5 г HgO растворяли в 300 мл азотной кислоты
(уД. в. 1,42) и раствор небольшими порциями приливали к 100 г
нафталина. По окончании первоначальной бурной реакций
реакционную смесь нагревали на кипящей водяной бане при
постоянном перемешивании. Продукт нитрования (в виде
масла) отделяли от азотной кислоты, промывали горячей водой
и обрабатывали горячим раствором соды; щелочной раствор
подкисляли соляной кислотой и взбалтывали с эфиром. Из
эфирного раствора выделен нитронафтол в количестве 1,5% от
общего веса иитропроизводных. Из остатка после экстракции
эфиром получены фракционированной кристаллизацией из
спирта, этилацетата и ацетона: ос-нитронафталин B0%),
1,3-динптронафталин (т. пл. 144°; 35%) и 1,5-динитронафталин
(т, пл. 213—213,5°; 40%). В отработанной азотной кислоте
найден еще один кристаллический продукт, который оказался
витронафтойиой кислотой (т. пл. 207—208°).
Дэвис проводил нитрование нафталина и в более мягких
условиях, а именно: разбавленной азотной кислотой при низ-
низких температурах. Опыты показали, что в этих условиях
84
Нитрование ароматических и гетероциклических соединений
образуются преимущественно нитронафтолы, т. е. реакция
направляется в сторону образования гидроксилированных
нитропроизво дных.
Например, смесь 1 моля нафталина с 1 л раствора, содер-
содержавшего 600 мл азотной кислоты (уд. в. 1,35) и 1 моль азотно-
азотнокислой р*ути, нагревали до 35° при перемешивании в течение
37 час. Основным продуктом реакции оказался 2,4-динитро-а-
нафтол (т. пл. 138°); кроме того, получено небольшое количе-
количество 2-нитро-а-нафтола (т. пл. 128°). Общий выход нитронафто-
лов составлял 55 г.
. Для выяснения роли азотнокислой ртути Дэвис и сотруд-
сотрудники кипятили нитробензол с азотной кислотой в присутствии
Hg(NO3J в течение 4 час. При этом образования пикриновой
кислоты не обнаружено. Единственным продуктом реакции
оказался динитробензол в небольшом количестве. При кипяче-
кипячении с азотной кислотой и Hg(NO3J м-динитробензола 82% его
осталось без изменения, а остальная часть окислилась до щаве-
щавелевой кислоты; не найдена также пикриновая кислота ири
кипячении с азотной кислотой 1,3,5-тринитробензола, который
при действии других окислителей дает пикриновую кислоту.
Из этих опытов сделан вывод, что ртуть не играет роли катали-
катализатора, способствующего окислению атомов водорода аромати-
ароматического ядра, содержащего группы NO2, т. е. образование пи-
пикриновой кислоты из бензола не проходит через предшествую-
предшествующую стадию нитрования бензола.
Дэвис предполагает, что роль ртутной соли заключается в
образовании промежуточного комплекса с бензолом, который в
дальнейшем окисляется, повидимому, в ртутную соль динитро-
фенола; последняя при действии азотной кислоты превращает-
превращается в пикриновую кислоту с регенерацией ,азотнокислой ртути.
Присоединение Hg(NO3J к ароматическому ядру в первой
стадии реакции происходит, повидимому, таким образом, что
группа —NOj присоединяв!ся к одному из атомов углерода,
а остаток —О—Hg—QNO2 к другому.
При нитровании толуола и хлорбензола в присутствии
Hg(NO8J образуются фенолы с гидроксильпой группой, на-
находящейся в м-положении до отношению к метильной группе
Нитрование в присутствии катализаторов
85
или к атому хлора, которые обычно ориентируют в о- и п-по-
ложения. Этот неожиданный результат может быть удовлетво-
удовлетворительно объяснен, если предположить, что группа —NO2
нитрата ртути присоединяется в о- или п-положении по отно-
отношению к метильной группе или к атому хлора, а остаток
—О—Hg—ONO2 занимает соседнее, т. е. мета-положение
по отношению к метильной группе или, соответственно,
к атому хлора. Таким образом, благодаря образованию
комплекса с нитратом ртути нитрование и гидроксилирование
ароматического ядра происходят одновременно.
Мак-Ки [182] исследовал действие Hg(NO3J при нитрова-
нитровании азотной кислотой или нитрующей смесью ряда аромати-
ароматических соединений: ксилола, нафталина, бромбензола, фенан-
трена, фенола, хлорфенола, ос-нафтола, бензальдегида и др.
Опыты Мак-Ки показали, что в большинстве случаев азотно-
азотнокислая ртуть оказывает благоприятное действие на нитрование,
повышая общий выход нитропроизводных, в том числе гидро-
ксилированных нитросоединений. При нитровании фенантре-
на азотной кислотой уд. в. 1,5 в присутствии Hg(NO3J получен
выход нитрофенантрена на 13% больше, чем при нитровании
без катализатора; выход нитрофенола при нитровании фенола
разбавленной азотной кислотой повышается от добавления
ртутной соли на 22—25 %; а-нафтол при нитровании бмесый
азотной и серной кислот в присутствии ртути дает выход
а-нитронафтола на 10% больше, Чем при нитровании без ката-
катализатора.
Основные причины, затрудняющие использование солей
ртути в качестве катализатора при нитровании, следующие:
1) необходимость Значительного расхода дефицитной ртути;
2) трудность регенерации ртути;
3) нежелательность загрязнения нитросоединений солями
ртути.
При нитровании фенола в присутствии азотнокислого свин-
свинца при 20° наблюдается увеличение количества п-нитрофенола
за счет орто-изомера; Если же вести нитрование при более
высокой температуре, то соотношение обоих образующихся
изомеров становится обычным [183].
. 86
Нитрование ароматических и нтероциплическш соединений
Как показали А. М. Володарский и В. С. Калинина [184],
в присутствии сернокислой меди нитрование оетвафталинсуль-
фоновой кислоты в 1,8-нитрОнафталинсульфоновую кислоту
протекает с более высоким выходом, чем без добавления
катализатора.
Сдгласйо французскому патенту [185], в качестве катали-
•затбров при нитровании могут быть применены соединения хро-
хрома, вольфрама, молибдена, тантала, ниобия, ванадия, галлия
•я индия. По утверждению патента, при применении одного из
зтих катализаторов можно легко получить с малым расходом
крепких кислот тетранитронафталин и другие полйнитропроиз-
водные.
Как катализатор [186] применяется также трехфтористьш
¦бор. Схематично реакцию нитрования ароматических соеди-
соединений в присутствии BF3 можно представить так:
RH + HNO3 + BFS "-?¦ BNOa + BFS H20.
Нитрование нитробензола в присутствии BFs проводилось сле-
следующим образом: к 31 г @,25 М) нитробензола прибавляют
Г19 г @,3 М) дымящей HNOa (уд. в. 1,5) й пропускают при Пе-
.ремепшвании 17 г BFs. Температура'реакции не должна быть
.выше 80°. Затем ведут нагревание при ЮО6 в течение 30 мин.
Дродукт реакции выливают в 500 мл горячей воды и переме-
перемешивают до охлаждения. Полученный динитробензол фильтруют
и перекристаллизовывают из спирта. Выход 36,5 г (87% от
теории). Аналогично ведут нитрование бензойной кислоты,
фталевого ангидрида и других соединений (табл. 4).
Фтористый бор можно регенерировать добавлением, по окон-
окончании реакции, достаточного количества воды для превра-
превращения BF3-H2O в BF3-2H2O. Последний выделяют отгонкой
в вакууме в виде тяжелой прозрачной жидкости. Обработкой
фтористым кальцием удается регенерировать BFb по схеме
2BF8- 2НаО + CaF2 -» Са (BF4J + 4Н8О;
Ca(BF*J->2BF3 + CaFa.
По вопросу о механизме каталитического нитрования аро-
ароматических соединений to присутствии солей ртути особого
внимания заслуживают работы А. И. Титова.
Нитрование в присутствии катализаторов
87
Таблица '4
Нитрование ароматических соединений в присутствии BFs
Исходное
соединение
й
«в»
юн
,&
Полученный продукт
Нитробензол
Бензойная кис-
кислота
п-Толуолсуль-
фокислота
Метиловый
эфир бензой-
бензойной кислоты
Фталевый ан-
ангидрид
0,25
0,25
0,10
0,10
0,10
0,30
0,30
0,15
0,15
0,15
0,25
0,37
0,12
0,12
0,28
0,5
0,5
0,5
1,0
13,0
80-1001
80
100
0-10
100
м-Динитробенаол
м-Нитробензойная кис-
кислота
2-Нитро-4-толуолсуль-
фокислота
Метиловый эфир м-ни-
тробензойной кис-
кислоты
3-нитрофталевая кис-
кислота
87
82
92
77
81
В своей работе совместна с А. М. Барышниковой [187] и
несколько позднее с Н. Г- Лаптевым [1881 А. И. Титов пока-
показал» что при взаимодействии ароматического соединения с азотг
нокислой ртутью в среде азотной кислоты вначале происходит
меркурирование ароматической молекулы с образованием
ртутьор11аничесного соединения; причём эта реакция является
обратимой:
Аг — Н + Hg (NO3J ^t Ar — HgNO3 + HNO3.
В отсутствие окислов азота реакция исчерпывается этой схе-
схемой. Из бензола, таким образом, получается фенилмеркури-
нитрат, который и был выделен из реакционной массы.
В связи С — HgNOs углерод поляризован несколько более
отрицательно, чем в обычной связи С — Н, и с точки зрения
общей теории активности ароматических соединений в реак-
реакциях электрофидьного замещения он может быть в известной
мере уподоблен ордо- и пара-атомам углерода таких реакцион-
носпособных соединений, как фенолы и амины, остаток же
HgNOs соответствует так называемому подвижному водороду.
¦88 Нитрование ароматических и гетероциклических соединений
Вместе с тем несомненно, что в превращениях групп С — HgNOe
будет проявляться известная специфичность химического по-
поведения ртути. Установлено, что с увеличением концентрации
азотной кислоты глубина меркурирования уменьшается.
Азотная кислота до известной степени ее концентрации
при отсутствии окислов азота действует на арилртутное соеди-
соединение только расщепляющим образом, приводя к регенериро-
регенерированию исходного углеводорода. Авторы изображают механизм
обратимой реакции мёркурирования следующей схемой:
АгН + Hg (NO3)+
8+
н
Аг
HgNOs
«+
Расщепление 40—50%-ной азотной кислотой идет, очень
медленно при обыкновенной температуре и быстрее при 100°.
Совершенно по-другому относится ртутноароматическое
соединение к азотной кислоте, содержащей окислы азота, или
к одной двуокиси айота. Фенилмеркуринйтрат или ацетат взаи-
взаимодействует с 50—60%-ной азотной кислотой, содержащей
окислы азота, очень быстро с разогреванием даже при понижен-
пониженной температуре.
При медленном прибавлении арилртутного соединения и
механическом перемешивании реакция протекает довольно
гладко и приводит к образованию той же смеси продуктов, что
и при нитровании бензола в присутствии солей ртути, т. е. ни-
трофенолов, нитробензола и п-динитробенэола.
На основе своих экспериментальных данных авторы при-
приходят к выводу, что каталитическое действие солей на реак-
реакцию окислительного нитрования ароматических углеводородов
проявляется лишь в присутствии окислов азота. В азотной
кислоте, содержащей окислы азота, арилмеркуринитрат бы-
быстро реагирует с образованием нитроэосоединения, что было
доказано выделением его Из реакционной массы.
Образование нитрозосоединений из ртутных" производных
при взаимодействии с N2O4 в ее нитроэилнитратной форме,
Нитрование в присутствии катализаторов
89
по предположению А. И. Титова и Н. Г. Лаптева, протекает
по схеме
Аг- -Hg
ArHgNO8+ O=N — О — NO2-> N 6 -» ArNO + Hg (NO3J B)
II I
O — O —NO
Дальнейшие превращения полученного нитроэобенэола
в ди- и тринитрофенол представляются авторами следующим
образом.
В результате присоединения протона с последующим при-
присоединением гидроксил-иона в пара-положении к азотсодержа-
азотсодержащей группе происходит образование таутомера п-оксифенил-
гидроксиламина по схеме
Полученный таким образом п-оксифенилгидроксиламин
окисляется вначале в п-нитрозофенол, а затем в п-нитрофенол,
который и подвергается в дальнейшем нитрованию до ди- и
тринитрофенола по схеме
NHOH
C)
O2N | NO2
ОН
90 НитрованШ1 арШютических и геМроЦЛклйчеекигХ соединений
При этом трупий ОН оказывается в mpa-положеиии к месту,
которое занимала нитро зогруппа.
Следует отметить, что реакция образования бензолмер-
куринитрата является наиболее медленной, определяющей ско-
скорость всего процесса превращения бензола в ди- и трннитро-
фенол, и зависит от концентрации азотной кислоты (о умень-
уменьшением концентрации HNOs скорость меркурирования резко
падает). Кроме приведенного главного направления реккции
превращения нитрозобензола в нитрофенолы,, возможна и Дру-
Другая схема реакции, которая состоит в первоначальном взаимо-
взаимодействии нитрозобензола с окисью азота с образованием нитра-
нитрата диазония [1891 по схеме
CeH5NO + 2NO -» ArN =. N — NOS.
Полученное диазониевое соединение разлагается с образо-
образованием фенола, который легко, нитруется разбавленной азот-
азотной кислотой до ди- и *ринитрофейола с оксигруппой в том
месте, где была 1 группа —NO:
Ar — N = N — NO3
Образование при окислительном нитровании бензола в при*
сутствии Hg(NOsJ в качестве побочных продуктов ййтробен»
зола и п-динитробензода также объясняется соответствующим
превращением нитрозобензола по схеме
NO NO*
E)
Нитрование в Mfiuicytnctneuu катализаторов
91
В случае замещенных производных нитрозобензола, не со-
содержащих сильно электрофильных заместителей типа иитро-
группы и обладающих свободным пара-положением, например
в случае о-нитрозотолуола, происходят те же реакция, что и
В случае бензола. При этом, как правило, в обычных условиях
нитрование в присутствии солен ртути приводит к образо-
образованию соответствующих нитрофенолов [уравнение C)J и нитро-
углеводорода [уравнение E)].
Нитроэосоединеийя, содержащие сильно электрофильный
заместитель, например
N0
или в которых пара-положение к нитрозогруппе занято, На-
Например
в условиях нитрования более стойки, и для них возможны лишь
реакции по уравнениям D) и E).
Отсутствие заметного ускоряющего действия добавок солей
ртути и увеличения количества образующихся нитронафтолов
при нитровании нафталина А. И. Титов и Н. Г. Лаптев объяс-
объясняют тем, что нитрование этого углеводорода при наличии в
сфере реакции окислон азота протекает очень быстро, с не-
несравненно большей скоростью, чем его меркурирование. То же
явление наблюдается и с другими веществами, быстро реаги-
реагирующими с окислами азота (например, с аминами и фенолами).
Авторы приходят к выводу, что ускоряющее действие и
увеличение количества образующихся нитрофенолов при до-
добавках солей ртути при нитровании могут наблюдаться лишь
для тех соединений, у которых скорость меркурирования если
92 Нитрование ароматических и, гетероциклических соединений
не выше, то по крайней мере соизмерима со скоростью непо-
непосредственного взаимодействия с NO2.
Подбирая соответствующие условия (например, увеличи-
увеличивая концентрацию ртутных солей и уменьшая содержание дву-
двуокиси азота),можно добиться выявления каталитического эффек-
эффекта от добавок солей ртути.
В другой своей работе А. И. Титов и Н. Г. Лаптев [190}
показали, что а- и р-нафтилмеркуринитраты при действии; кон-
концентрированной азотной кислоты в присутствии окислов азота
превращаются в 2,4-динитро-а-нафтол с выходом свыше 50%
от теории:
HgNO,
Каталитические действие азотистой кислоты при нитровании 93
§ 5. Каталитическое действие азотистой кислоты
• при нитровании
Фенол принадлежит к числу наиболее легко нитруемых
веществ. При действии на фенол сильно разбавленной азотной
кислоты получаются мононитропройзводные.
Рядом исследований , было установлено, что нитрование
фенола представляет собой сложную автокаталитическую реак-
реакцию.
Мартинсен [8] при изучении нитрования фенола азотной
кислотой различных концентраций нашел, что присутствие
азотистой кислоты каталитически действует на процесс нитро-
нитрования. Дальнейшее исследование показало, что концентрация
азотистой кислоты в растворе повышается по мере течения
реакции вследствие частичного восстановления азотной Кислоты
при побочных окислительных процессах. Скорость Превраще-
Превращения азотной кислоты в азотистую значительно уменьшается
в присутствии ртути, серебра или их солей. Применением этих
веществ удается регулировать процесс нитрования [191J.
Таким образом, нитрование фенбла является автокаталитиче-
автокаталитическим процессом, протекающим без внесения катализатора из-
извне. Мартинсен установил, что нитрование ускоряется с повы-
повышением концентрации азотной кислоты й замедляется с повы-
повышением концентрации фенола.
А. В. Карташев [1921 при исследовании нитрования фенола
разбавленной азотной кислотой (уд. в. 1,010—1,060) нашел, что
нитрование протекает с удовлетворительными результатами
лишь при избытке азотной кислоты. Варьируя концентрацию
азотной кислоты, ее избыток и Температуру, А. В. Карташев
установил, что влияние этих факторов на нитрование заклю-
заключается в следующем: 1) избыток азотной кислоты понижает
начальную температуру реакции значительно более резко, чем
увеличение ее концентрации; 2) понижение температуры реак-
реакции уменьшает окислительные процессы; 3) азотная киелота
дейстЬует на фенол при концентрации не ниже 2,8% (уд. в.
1,015); 4) высокая температура выбывает сильные Окисли-
Окислительные процессы даже при концентрации азотной кислоты
около 2 %.
94 Нитрование ароматических и гетероциклических соединений
По наблюдениям А. В. Карташева, первоначальное дей-
действие азотной кислоты на фенол в слабых водных растворах
(уд. в. 1,015—1,045) является окисляющим, что приводит
к образованию азотистой кислоты, играющей определенную
роль в процессе нитрования. При действии на фенолы в эфир-
эфирном равтворе чистой азотной кислоты, не содержащей двуокиси
азота и азотистой кислоты, нитрование фенола не происхо-
происходит [193]. А. В. Карташев допускает следующий механизм реак-
реакции: фенол реагирует с азотистой кислотой с образованием
нитрозофенолов (хиноноксимов), последние же при действии
азотной кислоты легко окисляются в нитрофенолы
но он
\/
Н N0
-н2о
ОН .
О
/
N-OH
ОН
A)
B)
/
..C)
Для экспериментальной проверки указанного механизма
реакции А. В. Карташев проводил опыты с добавкой в реак-
реакционную среду азотистой кислоты и п-нитроэофенола. Опыты
показали, что при нитровании фенола азотной кислотой уд. в.
1,015 и 1,030 в присутствии азотистой кислоты можно вести
процесс при более низкой начальной температуре. реакции.
Такой же эффект производит и добавление п-нитрозофенола.
Окислительное действие слабой азотной кислоты на нитрозофе-
нол доказано опытами, в которых из п-нитроэофенола при обра-
обработке азотной кислотой уд. в. 1,030 и 1,015 получен п-нитро-
фенол, а при более длительном нагревании (до 1 часа) ос-ди-
нитрофенол.
Каталитическое действие ааотистой кислоты при 'нитровании 95
А. В. Карташев исследовал также процесс нитрования фе-
фенола в растворе уксусноэтилового эфира. Произведенные им
наблюдения показали, что в ходе процесса можно выделить
Два периода: начальный период, проходящий без изменения
температуры реагирующей смеси, и второй период экзотерми-
экзотермической реакции, причем подъем температуры происходит вна-
вначале медленно, а затем более быстро. Такое течение реакции
указывает, что при взаимодействии между фенолом и азотной
кислотой имеет место автокаталитический процесс, развитие
и протекание которого происходят за счет некоторой проме-
промежуточной реакции, являющейся источником образования ка-
катализатора.
Влияние азотистой кислоты на процесс нитрования фенола
показано опытами с добавкой мочевины, а именно найдено,
что, несмотря на незначительную растворимость в уксуонот
этиловом эфире, мочевина вызывает заметное замедление про-
процесса.
При проведении нитрования в среде СО2, т. е. при отсутствии
окислительного действия кислорода воздуха на HNOa» ко-
которое наблюдается в обычных условиях нитрования, реакция
протекала с большей скоростью.
Другие исследователи [194] поддерживают точку зреяия
А. В. Карташева о механизме каталитического действия азо-
азотистой кислоты при нитровании фенола. Однако это объясне-
объяснение нельзя считать достаточно обоснованным. Относительное
значение реакции образования нитрозофенола (при обычно
малой концентрации азотистой кислоты в реакционной массе)
вряд ли может быть большим. Кроме того, необходимо отметить,
что при нитровании фенола азотной кислотой получается смесь
почти равных количеств о- и п-нитрофенола. Если бы механизм
реакции нитрования сводился лишь к окислению нитроэофе-
йола азотистой кислотой до нитрофенола, то следовало ожи-
ожидать образования не'смеси нитрофенолов, а лишь одного пара-
изомера (как известно, при взаимодействии азотистой кислоты
и фенола получается лишь п-нитрозофенол). При нитровании
фенола в присутствии больших концентраций азотистой кис-
поты образование нитрофенолов может протекать через; нитро-
96 Нитрование ароматических и гетероциклических соединений
зофенол. Однако, как было показано в этом случае (например,
при нитровании фенола в присутствии 2 молей азотистой кисло-
кислоты на 1 моль азотной кислоты), вместо обычного соотношения
о-нитрофвнол : н-нитрофенол=1 : 1 получается соотношение
1 : 9. Как и следовало ожидать, количество пара-изомера рез-
резко увеличивается [195].
Кинетика нитрования фенола в растворе абсолютного спир-
спирта исследована Арналлем [196]. Он проводил нитрование экви-
эквивалентным количеством азотной кислоты при 25,5°, Скорость
реакции измерялась по количеству свободной кислоты, найден-
найденной в растворе через определенные промежутки времени; при
этом установлено, что реакция ускоряется автокаталитически,
а это объясняется, по мнению Арналля, влиянием азотистой
кислоты, образующейся при побочных реакциях. Для выясне-
выяснения правильности этого допущения Арналль добавлял к ни-
нитрующей смеси небольшие количества азотистой кислоты
@,02%); опыты показали значительное повышение скорости
реакции по сравнению с контрольными, особенно заметное в том
случае, когда HNO2 добавляли с самого начала реакции.
В другой серии опытов Арналль применял избыток азотной
кислоты как в отсутствие азотистой кислоты, так и в при-
присутствии последней; оказалось, что 100%-ный избыток азотной
кислоты повышает скорость реакции, но в начальном периоде
реакция протекает относительно медленно, ускоряясь лишь
позднее; при нитровании же 50%-ным избытком азотной кис-
кислоты, но в присутствии азотистой кислоты, скорость реакции
быстро возрастает уже в начальном периоде, причем повышение
скорости происходит более равномерно, чем в первом случае.
Полученные результаты подтвердили, таким образом, допуще-
допущение, что образование нитрофенолов ускоряется автокаталити-
чески по мере течения реакции под влиянием азотистой кисло-
кислоты; каталитическое действие последней доказано также опыта-
опытами с добавкой мочевины @,5%), гидразинсульфата и соляно-
солянокислого фенилгидразина; в этих опытах наблюдались значи-
значительное замедление нитрования в присутствии мочевины и
полвое прекращение реакции в присутствии двух последних
агентов.
Каталитическое действие азотистой кислоты при нитровании 97
Далее Арналль нашел, что добавление п-нитрозофенола
пе влияет на реакцию нитрования фенола. Он приходит к вы-
выводу, что при нитровании фенола реакция протекает не через
стадию образования нитрозофенола, а другим путем. По его
мнению, возможен следующий механизм нитрования фенола:
HNO3 + HNOa -> N А + НаО;
H + N2O4 -» O2NCeH4OH + HNOa.
Опыты Арналля по нитрованию фенола в растворе уксусной
кислоты показали, что применение этого растворителя приво-
приводит к почти количественным выходам нитрофенола, причем
реакция протекает гладко и быстро, не сопровождаясь обра-
образованием смол; при 45° нитрование 20%-ной азотной кислотой
дает выход мононитрофенолов 98,7%; реакция может быть
осуществлена и при комнатной температуре.
Анализ продуктов реакции производился Арналлем сле-
следующим образом: сначала определяли общее количество м-,
о- и п-нитрофенолов посредством титрования хлористым
1 итаном, затем отгоняли с водяным паром о-нитрофенол и в остат-
ье по хлористому титану определяли общее содержание м- и
и-нитрофенолов; посредством обработки бензилхлоридом по-
последние переводились в соответствующие м- и п-нитрофенил-
Пензиловые эфиры; состав смеси зфиров устанавливали опре-
определением понижения точки замерзания при добавлении взве-
взвешенного количества этой смеси к определенному количеству
чистого п-производного.
При нитровании фенола в растворе уксусной кислоты Арналль
обнаружил некоторые изменения в отношениях полученных
питрофенолов в зависимости от температуры проведения реак-
реакции и концентрации азотной кислоты, как это видно из табл. 5.
Наилучшие выходы нитрофенолов получены при нитрова-
пии 10%-ной азотной кислотой при 25°; Арналль применял сле-
следующие весовые отношения реагентов: 23,5 г @,25 моля) фе-
фенола, 15,75 г @,26 моля) азотной кислоты (уд. в. 1,42) и 157,5 г
уксусной кислоты.
Кроме уксусной кислоты, исследовано также влияние
некоторых других растворителей на нитрование фенола.
А. В. Топчиев
i Нитрования ароматических и гетероциклических соединений
Таблица 5
Содержание, цурмеров нитрофенола в продуктах реакции нитрования
фенола в аависимости от температуры и концентрации азотной
кислоты
Концентрация
HNO3> %
5
10
20
10°
0-
57,6
57,8
58,9
п-
40,0
39,0
38,3
м-
3,4
3,1
2,8
25°
0-
58,1
59,2
60,3
ц-
39,0
38,1
37,3
м-
2,9
2,7
2,4
45°
0-
54,9
60,6
61,5
п-
38,2
37,2
36,4
м-
2,4
2,2
2.!
При применении 10%-ной азотной кислоты получены следующие
результаты: в уксусном ангидриде реакция протекает почти
мгновепно; в ацетоне нитрование в течение 3 час. дает выход
нитрофенолов 80%; в эфире через 12 час. выход составляет
68%; в смеси спирта B ч.) и уксусной кислоты A ч.) получен
выход 75% через 48 час, а в абсолютном спирте — выход
55% через 4§ час. Отношения количеств изомерных нитрофе-
нитрофенолов изменяются в зависимости от примененного растворите-
растворителя, как это видно из табл. 6 (концентрация азотной кислоты
10%, температура реакции 10° за исключением первых двух
опытов, где) нитрование проводилось при 25°).
Нитрование в уксусной кислоте в присутствии азотнокис-
азотнокислой меди и иода не изменило обычных результатов, но в при-
присутствии азотнокислой ртути получено следующее отноше-
отношение изомеров: 53,5% о нитрофенола, 42,7% п-нитрофенола и
3,8% м-нитрофенола.
Вайбель A3, 197] для выяснения механизма нитрования
фенола в присутствии азотистой кислоты исследовал зависи-
зависимость направления реакции, т. е. отношения образующихся
о- и п-нитрофенолов, от концентрации азотной кислоты. Ни-
Нитрование проводили при 25° азотной кислотой в виде разбав-
разбавленных растворов A; 1,5; 2 и 3 н.), причем в каждом опыте
применяли значительный избыток азотной кислоты по отно-
отношению к фенолу B0 : 1), т. е. практически количество азотной
кислоты оставалось во время опыта постоянным.
Каталитическое действие аттистой кислоты при нитровании
Таблица 6
Содержание изомеров нитрофенола в продуктах реакции
нитрования фенола азотной; кислотой в зависимости от
примененного ^артеорителя
Растворитель
Нитрофенол, %
Уксусный ангидрид ,
Уксусная кислота ,
То же
Ацетон
Эфир
Спирт B ч.) й уксусный ангидрид
Aч.)
Спирт
59,6
59,2
57,8
57,4
57,8
57,6
57,7
37,8
38,1
39,1
39,6
39,2
39,3
39,2
2,6
2,7
3,1
3,0
3,0
3,1
3,1
В кислоту вносили определенное количество раствора
NaNO2, которое соответствовало в одних опытах 0,001 н.,
в других 0,003 н. HNO2; затем приливали по каплям раствор
фенола в количестве 1/20 моля на 1 моль азотной кислоты. По-г
еле прибавления всего фенола реакционную смесь оставляли
на некоторое время до полного окончания реакции. Разделение
образовавшихся продуктов реакции производили следующим
образом: избыток цзотной кислоты нейтрализовали едким на-
натром, раствор подкисляли уксусной кислотой до слабокислой
реакции, после чего из него отгоняли с водяным паром о-нитро-
фенол.
Определение о-нитрофенола в дестилляте производили ти-
титрованием хлористым титаном. В остатке от перегонки с вот
дяным паром определяли п-нитрофенол и побочные продукты
нитрования; при выщелачивании остатка водой в раствор пе-
переходил п-нитрофенол, не растворимый в воде побочный про-
продукт нитрования отделяли от п-нитрофенола фильтрованием.
Этот побочный продукт при исследовании оказался продуктом
окисления индофенола. Как предполагает Вайбель, индофенол
мог образоваться в результате конденсации одной молекулы
100 Нитрование ароматических и гетероциклических соединений
фенола с одной молекулой нитрофенола или же с промежу-
промежуточным продуктом реакции.
Опыты Вайбеля показали, Что при нитровании фенола азот-
азотной кислотой концентрации в пределах от 1 до 3 н. образуются
почти одинаковые количества о- и п-нитрофенола. Отношение
о-нитрофенол: п-нитрофенол повышается с увеличением кон-
концентрации азотной кислоты, но в незначительной степени.
Выход продукта конденсации понижается от 12 до 3% при
увеличении концентрации азотной кислоты от 1 до 3 н.
Вайбелем изучено также нитрование о- и м-крезолов. Ни-
Нитрование м-крезола йротекает медленнее, чем нитрование фе-
фенола и о-крезола. Скорость образования продукта конденса-
конденсации такая же, как у фенола и о-крезола; таким образом, при
нитровании м-крезола получается больше продуктов конден-
конденсации по сравнению с другими фенолами. Нитрование м-кре-
м-крезола приводит к образованию 6-нитро- и 4-нитро-м-крезолов
в весовом отношении 2:3, причем это отношение не зависит
от концентрации азотистой и азотной кислот. При нитрова-
нитровании о-Крезола продуктами реакции являются 6-нитро- и
4-нитро-о-крезолы в отношении 1 : 1.- Это отношение остается
постоянным, независимо от начальной концентрации азотистой
кислоты; с другой стороны, оно незначительно возрастает при
повышении концентрации азотной кислоты. При дальнейшем
нитровании 6-нитро- и 4-нитро-о-креголы дают динитропройз-
водные в равных отношениях. При нитровании 6-нитро- и
4-нитро-м-крезолов образуются динитропродукты с преоблада-
преобладанием производных 6-нитро-м-крезола.
Вайбель исследовал также реакцию нитрозирования фено-
фенола, причем установил, что отношение о-нитрозофенол:
п-нитрозофенол не соответствует отношению о-нитрофенол:
п-нитрофенол, полученному при нитровании фенола.
На основании экспериментальных данных Вайбель до-
допускает следующий механизм нитрования фенола: фенол
образует с азотистой кислотой комплекс, который при действии
азотной кислоты дает нитрофенол (схема 1). Наряду с этой
основной реакцией нитрования происходит побочная реакция
превращения комплекса в о-нитрозофенол, окисляющийся
Каталитическое действие ааотистой кислоты при нитровании 101
далее азотной кислотой в нитрофенол (схема 2). Другая по-
побочная реакция — это образование продукта конденсации
комплекса с фенолом, который при действии азотной кислоты
дает окисленный продукт конденсации (схема 3).
HNO,
+ HNO8
ОН
HNOj
о-иитровофенол
II I
H.HNO2
п-пнтровофенол
о-питрофепол
ОН ОН
•HNO2 H-HNO2
Y
NO2
п-нитрофепол
нитрование
ОН
¦HNOS-
—NO.
A)
HNO2
OH OH
о-нитрофеиол
OH
нитроаирование
HNO8 -> I +HNO,
Y
NO NO2
пг-н*грофенол
окисление
B)
102 Нитрование ароматических и гетероциклических соединений
ОН
I
\h.hno2
он
\
о-продукт . о-продукт +HNQ. окисленный
¦.nnfimra • «ПЯГГР.НПЯПИИ ' *" "8 П13ОДУКТ
¦ конденсации ' конденсации
продукт
конденсации
+HNO2
C)
он
он
^продукт . п-продукт , HNO _. окисленный
конденсации' конденсации
• HNO2
продукт
конденсации
+ HNO2
конденсация
о кисление
Этот механизм удовлетворительно объясняет: 1) установ-
установленное рядом исследователей каталитическое действие азо-
азотистой кислоты при нитровании фенола, 2) несоответствие
между отношением о-нитрозофенол : п-нитрозофенол и о-нитро-
фенол: п-нитрофенол. Образование нитрофенолов только
частично происходит по схеме B) (нитрозирование и окисление);
основная часть о- и п-нитрофенолов образуется по схеме A),
т. е. по реакции нитрования.
Сравнение схем A), B) и C) показывает, что только ско-
скорость реакции нитрования A) находится в прямой зависимо-
зависимости от концентрации азотной кислоты, что подтверждается
экспериментально; эта зависимость не одинакова для о- и п-
нитрофенолов, поэтому отношение орто : пара варьирует с из-
изменением концентрации азотной кислоты. Реакция образо-
образования нитрофенолов из нитрозофенолов B) не находится в пря-
прямой зависимости от концентрации азотной кислоты; в коли-
количественном отношении выход нитрофенолов по этой реак-
реакции, однако, значительно меньше, чем по реакции A), вслед-
вследствие чего указанная зависимость отношения орто : пара от
концентрации азотной кислоты не подвергается значительным
изменениям.
Скорость реакции образования окисленных продуктов кон-
конденсации по схеме C) также не находится в зависимости от
концентрации азотной кислоты, что согласуется с экспери-
экспериментальными данными (при концентрации HNOs, равной 3 н.,
Каталитическое действие азотистой кислоты, при нитровании 103
образуется меньше продуктов конденсации, чем при концен-
концентрации 1 н., в то время как константы скорости других реак-
реакций возрастают с повышением концентрации кислоты).
Дальнейшие работы Вайбеля имели задачей изучить в от-
отдельности механизм основной реакции нитрования и процесса
образования нитрофенолов из нитрозофенолов. Произведен-
Произведенные Вайбелем кинетические измерения скорости реакции ни-
трозирования фенола показали, что при варьировании кон-
концентрации фенола и азотной кислоты в одном направлении из-
изменение констант скорости было неодинаковым. Вайбель объяс-
объясняет это явление тем, что при избытке азотной кислоты, наря-
наряду с нитрозированием, происходит динитрозирование, что
приводит к более высоким константам скорости. При избытке
фенола образуется больше продуктов конденсации, и поэто-
поэтому наблюдается уменьшение констант скорости.
При изучении кинетики реакции окисления п-нитрозофе-
нола в п-нитрофенол Вайбель нашел, что скорость реакции
сильно возрастает с увеличением концентрации азотной кисло-
кислоты, но, с другой стороны, не зависит от концентраций нитро-
зофенола и азотистой кислоты. Опыты показали, что окисле-
окисление протекает нормально лишь в том случае, если имеется
минимальная концентрация азотистой кислоты. Окисление
о-нитрОзофенола протекает значительно быстрее, чем окисление
п-нитрозофенола (в 25 раз).
Измерения скорости реакции нитрования фенола при при-
применении азотной кислоты концентраций 1, 1,5 и 2 н. показа-
показали, что для концентрации 1 н. константа скорости оставалась
постоянной в течение опыта, при концентрациях же 1,5 и 2 н.
в начале опыта величина константы возрастала и только спустя
определенное время становилась постоянной. Это явление
объясняется недостатком азотистой кислоты; при увеличении
вдвое начальной концентрации последней нитрование проте-
протекало нормально уже с самого начала реакции, т. е. константа
скорости реакции оставалась постоянной в течение всего
опыта.
Скорость реакции нитрования фенола также зависит от
концентрации последнего; повышение концентрации фенола
104 Нитрованце ароматических и гетероциклических соединений
вдвое (от 0,2 до 0,4 н.) при достоянных концентрациях азот-
азотной и азотистой кислот приводит к резкому падению скорости
реакции. Это объясняется особенностью реакции нитрования*
которая состоит из двух стадий; 1) образования комплекса
с азотистой кислотой и 2) собственно нитрования. При двойной
по отношению к фенолу начальной концентрации азотистой
кислоты относительно большее количество фенола вступает
в реакцию с азотистой кислотой, образуя комплекс, участвую-
участвующий в дальнейшем процессе.
В отсутствие окислов азота при комнатной температуре
нафталин не реагирует с азотной кислотой уд. в. 1,17 и 1,36,
а с концентрированной азотной кислотой реакция протекает
очень медленно. При внесении в реакционную смесь неболь-
небольшого количества азотнокислого калия прои ходит бурная
реакция с образованием омэштронафталина [19 ]h
Таким образом, изучение реакций нитрования фенола и
других ароматических соединений азотной кислотой показы*
вает, что эти реакции безусловно катализируются азотистой
кислотой. При определенной концентрации азотной кислоты
скорость реакции прямо пропорциональна концентрации азо-
азотистой кислоты.
Предположение Н. Н. Ворожцова (младшего), что катали-
тическое влияние нитрозофенола при нитровании фенола сво-
сводится к образованию из азотной кислоты двуокиси азота (за
счет окисления нитрозофенола в нитрофенол), представляется
вполне вероятным, так как NOS катализирует нитрование фе-
фенола гораздо сильнее, чем азотистая кислота [199].
ЛИТЕ РАТУРА
1. P. Spin dler. Ann., 224, 283 A884).
2. D e v i 11 e. Ann. chim. phys., 3, 187.
3. Ф. Ф. Б е й л ь ш т е й н, А. А. Курбатов. Ann., 155, 1
A870).
4.0. Witt, E. No el ting. Ber., 18, 1337 A885).
5. A. Holleman. Chem. Rev., 1, 187 A925).
6. W. H a r m s e n. Ber., 13, 1558 A880).
7. ф. ф. Бейльштб1в. Ann., 144, 274 A867).
8. H. M a r t i n s e n. Z. phys. Chem., 50, 425 A905); 59, 605 A907).
Литература
105-
9. P. Jannasb. Ann., 176; 5 A875).
10. R. Fittig. Geinzer, Ann., 144, 17 A867).
11.0. Jacob son. Ber., 17, 160 A884).
12. A. W. Gross ley, N. R e в о u f f. J. Chem. Soc, 95, 215
A909).
13. S. Veibel. Ber., 63, 1582, 2074 A930).
14. K. Beaucourt, E. H a m m e г 1 e. J. prakt. Ghem. [2], 120,
185 A928).
15. С A., 4471b A947).
16. Герм, патент 805645 A951); С. А., 1041с A952).
17. N. I. Leonard, S. N. В о у d. J. Org. Ghem., 11, 405 A946);
A. Spada, Eiio Casini. Gazz. chim. ital., 80, 642 A950).
18. B. L. Z e n i t z, W. H. H а г f u n g. J. Org. Chem., 11, 444 A946).
19. G. Machek, РЖХим., № 3, 83, реферат 14477 A954);
J. Blanchard, Go ©ring. J. Chem. Soc, № 8, 2977 A954).
20.1. M. Hunsberger. J. Am. Chem. Soc, 71, 2635 A949).
21. M. И. Коновалов. Ber., 28, 1856 A895).
22. D. I. L egge. J. Am. Cbem. Soc, 69, 2079 A947).
23. G. M. К о з о 1 a p о f f. J. Am. Chom. Soc, 71, 4021 A949).
24. G. M. Ко а о 1 a p о f f. J. Am. Chem. Soc, 71, 1876 A949).
25. E. M а с с i о 11 a. C, 1, 3054 A932).
26. Fr. M. L a n g. Gompt. rend., 226, 1381 A948).
27. F. Rewerdin. Helv. Chim. Acta, 12, 1053 A929).
28. И. Губен. Методы органической химии, т. IV, кв. 2. М., Гос-
химиздат, 1949, стр. 1094.
29. С. Bosma, W. Meerburg, Р. Е. V е г k a d e. R ее tray,
chim., 67, 235 A948).
30. G. S t a e d e 1 е г. Ann., 78, 32 A851).
31. F. Beilstein, A. Ku.hlberg. Ann., 169, 85 A874).
32. H. E. F i e r z-D a v i d. Helv. Chim. Acta, 26, 98 A943).
33* Я. Я. M а к а р о в-3 е м л я н с к и й, В. П. Б и б и ш е в.
Журн. общ. химии, № 7, 1280 A937); ср. также A. Schroeter.
Ann., 426, 1, 17, 83 A922).
34. С. И. Сергиевская, Г. Я. У р е ц к а я. Журн. общ. химии,
23, 1522 A953).
35. Англ. патент 635635; С. A., 6438g A950); Швейц. патент 265838 и
271563; С. А., 183 A951), 1045 A952).
36. С. С. Price, Т. I. Bard оз. J. Am. Ghem. Soc, 70, 1978
A948).
37. R. Fittig. Ann., 124, 276 A862).
38. R. Wills tatter. Ber., 39, 3478 A906).
39. F. Bell, I. К en у on. J. Chem. Soc, 2705 A926).
40. H. Hubner, H. L ud d e n s. Ber., 8, 871 A875).
41. G. A. Schmidt. Ber., 12, 1153 A879).
106 Нитрование ароматических и гетероциклических соединений
42. J. Schmidt. Вег., 34, 3531 A901).
43. J. Schmidt, О. S р о и п. Вег., 55, 1194 A922).
44. Н. Н. Воронцов (младш.). Журн. хим. пром., № 6, 21 A947).
45. J. Schmidt, К. Bauer. Вег., 38, 3758 A905).
46. Амер. патент 2052614; С., I, 438 A937).
47. И. С. Иоффе, А. С. Эфрос. Журн. общ. химии, 16, 111
A946).
48. Р. В г u n n е г, О. Witt. Вег., 20, 1023 A887).
49. V. Meyer, О. S t a d 1 е г. Вег., 17, 2648 A884).
50. A. Glaus, H a г t m a n n. J. prakt. Chem., 53, 198 A851).
51. Fr. Fried 1. Monatsh. Chem., 34, 766 A913).
52. W. K. Lewis, T. Y. S u e n. Ind. Eng. Chem., 32, 1095 A940).
53. Fr. E. Pounder. J. M a s s о n. J. Chem. Soc, 1352 A934).
- 54. А. К о h e, Mills. Ind. Eng. Chem., 45, 287 A953).
55. H. M с С о r m a с к. Ind. Eng. Chem., 29,1933 A937); С. А., 153
A947).
56. G. Taylor, L. R u s s e. Амер. патент 2643271 A953).
57. W. W. Jones, M. R u s s e 1. J. Chem. Soc, 921 A947).
58. W. H. Gibson. J. Chem. Soc, 121, 270 A922).
59. А. Ш т e т б a x e p. Пороха и взрывчатые вещества. М., ОНТИ,
1936, стр. 379.
60. W. Will. Вег., 47, 704 A914).
Schultz, J. Flaschlander. J. prakt. Chem., 66,
A902).
Weisweiller. Monatsh. Chem., 21, 39 A900).
И. Долгов, Н. А. К у чу мое а. Журн. общ. химии,
445 A950).
W. H a u n, A. Kobe. Ind. Eng. Chem. 43, 2355 A951).
Hansh, G. H elm к am p. J. Am. Chem. Soc, 73, 3080
61. G.
153
62. G.
63. Б.
20,
64. J.
65. G.
A951).
66. K. L. Nelson, H. G.
A951).
67. H. C. Brown, W. H.
A954).
68. A. W.
A909).
69. Marqueroll,
Crossley, N.
В г о w o. J. Am. Chem. Soc, 73, 5605
В о n n e r. J. Am. Chem. Soc, 76, 605
Renouff. J. Chem. Soc, 95, 215
L о r i e 11 e. Bull. Soc. chim. France, 27, 424
A920).
70. E. Noel ting, S. For el. Ber., 18, 2674 A885).
71. D. M. Bowen, R. W. В e 1 f i t, R. A. W a 1 s e r. J. Am.
Chem. Soc, 75, 4307 A953).
72. A. Kobe, H. Levin. Ind. Eng. Chem., 42, 352 A950).
73. A. Kobe, В r e n n e с к e. Ind. Eng. Chem., 46, 728 A954).
74. E. No el ting, С G e i s m a n. Ber., 19, 144 A886).
Литература
107
75.
76.
7?.
78.
79.
80.
81.
82.
85.
84.
85.
86.
8?.
88.
89.
90.
91.
«2.
93.
, 94.
95.
96.
j; 97.
I 98.
b 99.
lj, 100.
LlOl.
102.
103.
104.
105.
Lecorche, P. Aubertein. C. A., 919a A952)
Hollander, E. H a e f f e n. C, 111,338A920).
Nietzki, A. Konwaldt. Ber., 37, 3892 A904).
S u h h а и др. С, I, 2866 A931).
К 1 о s а. РЖХим., № 16, реферат 38639 A954).
Z a h в, A. W ii r z. Angew. Chem., 63, 147 A951).
G. Finger, N. H. N а с h t r i e b, E. H.
Reed.
J. Soc. Chem. Iud., 45, 91
Фрейдберг. Изв. АН СССР, ОХН,
Н.
А.
R.
Н.
J.
Н.
G.
С, I, 1009 A940).
Н. Н. Hodgson, H. Cr. Beard.
A926).
С. Н. Ушаков, Е. Н.
268 A950).
Т. Nishi, H. Toki. С. А., 11099, A950); J. Soc Chem. Ind.,
Japan, 45, 37 A942).
W. D a v e у, J. R. G w i 11. J. Chem. Soc, 204 A950).
A. А. Пономаренко. Журн. общ. химии, 20, 469 A950).
I. F. Me Ghie, С Morton, B. L. Reynolds,
J. W. S p e n с e. J. Soc. Chem. Ind., 68, 328 A949).
L. J. В ol linger. С. А., 173A949).
R. К 1 e e n e. J. Am. Chem. Soc, 71, 2259 A949).
Walter Qvist. С A., 2397 A947).
B. B. Dey, R. K. Mailer, B. P a i. С A., 5755 A949).
B. B. Dey, R. K. Mailer, B. P a i. С A., 4668 A951).
Амер. патент 2525508; С. А., 2504 A951).
I. Forrest, D. Lid dell, S. H. Tucker. J. Chem.
Soc, 454 A946).
И. М. Коган, Д. Ф. К у т е п о в. Журн. общ. химии, 21, 1297
A951).
А. П. Терентьев, Б. М. Кедров. Уч. зап. МГУ, 6, 213
A936).
И. Г у б е н. Методы органической химии, т. IV, вып. 1. М.—Л.,
Госхимиздат, 1949, стр. 260.
Н. Н. Hodgson, E. R. Ward. J. Chem. Soc, 533A946).
J. Brink, S. N orris. Ind. Eng. Chem., 46, 694 A954).
А. А. Пономаренко и Т. Е. Мациевич. Журн. общ.
химии, 20, 1845 A950).
C. F. Koelsch, D. О. Hoffmann. J. Am. Chem. Soc,
65, 989 A943).
M. А. Ильинский. Полупродукты и красители антрацено-
антраценового ряда. М.— Л., Госхимтехиздат, 1932, стр. 68.
Р. М. Bavin, M. J. Dewar. Chem. and Ind., 53, № 22, 543
A953). РЖХим., № 3, реферат 14492 A954).
F. Friedl. Ber., 45, 428 A912).
E. Ochiai, M. К a t a d a. C. A., 9541 A951).
108 Нитрование ароматических и гетероциклических соединений
106.
107.
108.
109.
НО.
111.
112.
113.
114.
115.
116.
117.
118.
119
120
121.
122.
123.
124.
125.
126.
127,
128.
129.
130.
131
132
133
Е. Ochiai, M. К a t a d а. С. А., 9538 A951).
Н е г t о g van We'eren. Rec. trav. cbim., 67, 984 A948).
I. Oberhoff, H. Y. ¦ Hertog. Rec. trav. chim., 69,
A950); С. А., 6418 A950).
A. Claus, Th. Kramer. Ber., 18, 1243 A885).
A. Kaufmann, H. Decker. Ber., 39, 3648 A906).
А. К a uf maun, H. Hussy. Ber., 41, 1735 A908).
468
A. Adams, D. H. H ey. J. Chem. Soc, 255 A949).
С. С. Price, В. Н. Welz en, D. В. G u t r i e. J. Org.
Chem., 12, 203 A947); Ochiai, S с h i m i z u. С A., 3502 A950).
J. L. С Marais, 0. G. Backeberg. J. Chem. Soc, 2207 A950).
H. Jensch. Ann., 568, 73 A950).
Simpson, G. F. Wright. J. Chem. Soc, 2023 A948).
В a z u С h a n d г а п. С A., 7573 A951).
H. N ishiz a wa. С A., 609 A951).
E. E. С a m p a i g n e, H. G. Grose.
73, 3812 A951).
J. К 1 о s a. Pharmazie, 8, № 3 A953).
И. Коновалов, К. Гуревич. JKPXO, 37, 537 A905)
И. Коновалов. ЖРХО, 25, 389, 472 A893).
J. Or ton. Ber., 40, 370 A907).
Schultz. Вег., 17, 477 A884).
Bamberger, A. Rising. Ber., 33, 3625 A900).
И. Коновалов. Ber., 29, 2201 A896).
препаратов, т. IV. M,—Л.,
J. Am. Chem. Soc,
М.
м.
к.
G.
Е.
М.
Синтезы органических
ОНТИ, 1936,
J. Chem. Soc, 95, 202 A909).
стр. 68.
A. W. С г о s s I е у, N.Renouff. .. ~~— , ~
J. P. Lamboy. J. Am. Chem. Soc, 71, 3756 A949).
W. S t a e d e 1, А. К о 1 b. Ann., 259, 208 A890).
, B. D. Tiffany. J. Am. Chem. Soc, 70, 592 A948).
. J. Am. Chem. Soc, 73, 3779 A951); С A., 930d A952).
. С. К. In gold, F. R. Shaw. J. Chem. Soc, 575 A949); С A.,
7454f A949).
134. N. L. Drake, H. С H a r r i s, С. В. Jaeger. J. Am.
Chem. Soc, 70, 168 A948).
. H. С. В a z a n у, M. P i a n к a. J. Chem. Soc, 956 A946).
, И. Г у б е н. Методы органической химии, т. IV, вып. 1. М.— Л.,
Госхимиздат, 1949, стр. 277.
Witt, A. Utermann. Ber., 39, 3901 A906).
Bamberger. Вег., 27, 585 A894); 28, 399 A895).
М. Бугай. Журн. общ. химии, 4, 605 A953).
-. G s u d a, S. S a k a m a t о. С. А., 2887 A951).
R. Passerini. С. А., 7976с A951).
С. D. Houghton, A. Waters. J. Chem. Soc, 1018 A950).
135
136
137
138
139
140
141
142
О.
E.
П.
К.
Литература
109
143. Van Н о v e. Bull. Aoad. Belg., 8, 505 A922).
144. W. Borsch e, W. Bothe. Ber., 41, 1940 A908); W. В о r-
s с h e, Schaeke, Ber., 56, 2498 A923).
145. R. H. Thomson, E. Race, F. M. R о w e. J. Chem. Soc,
350 A947).
146. РЖХим., стр. 134, реферат 10558 A954).
147. В. А. Измаильский и А. И. Козий. Докл. АН СССР,
28, 621 A940).'
148. Синтезы органических препаратов, т. III. M.— Л., ОНТИ, 1935, стр. 58.
149.0. Dimroth. Ber., 34, 219 A901).
150. J. Meisenheimer, E. Connerade. Ann., 330, 133 A904).
151. J. Schmidt, E. Heinle. Ber., 44, 1488 A911).
152. R. K. Callow, J. M. G u 11 a n d. J. Chem. Soc, 2424 A929)'.
153. Синтезы органических препаратов, т. III. М.— Л.,ОНТИ, 1935, стр. 64.
154. Е. Т a u b e г. Вег., 25, 128 A892).
155. D h о n t, I. P. Wibaut. Rec. trav. chim., 62, 177 A943).
156. Ю. К. Юрьев, М. С. Корсакова, А. В. Арбат-
Арбатский. Изв. АН СССР, ОХН, № 2, 166 A951).
157. Синтезы органических препаратов, т. IV. М.— Л., ОНТИ, 1936, стр. 69.
158. N a i k, J a d n a v. С. А., 2519 A950).
159. A. Pictet, P. Genequand. Ber., 35, 2526 A902).
160. A. Pictet. Ar. Science Phys. et Nature, Geneve, D), 16, 191.
16*1. F. H. С о h e d, J. P. W i b a u t. Rec. trav. chim., 54, 409 A935).
162. Б. В. Тронов, Г. X. Камай, А. Г. Коваленко.
ЖРХО, 60, 1013 A928).
163. Н. Holdermann. Вег., 39, 1250 A906).
164. М. С а г m а с k. J. Am- Chem. Soc, 69, 785 A947).
165. W. E. Bachman, J. M. С h e m e г d a, N. С D e n о,
E. С Horning. J. Org. Chem. 13, 390 A948); см. также Do-
n a 1 d Simms. С A., 10213c, A951).
166. R. Wolffenstein, O. Boeters. Ber., 46, 586 A913).
167. R. Wolffenstein, W. P a a r. Ber., 46, 589 A913).
168. F. В 1 e с h t a, K. P a t e k. Schiess- und Sprengstoffwesen, 22
A927); C, I, 780 A928).
169. G. D а г z e n s. Nitration du benzene en presence de mercure. Com-
mun. priv., Paris, 1914.
170. L. V i g n о n. Bull. Soc. Chim., 27, 547 A920).
171. Broders. Trav. effect au laborat. de recherches de la Paudrerie de
Saint-Fous, 1919.
172. E. Bamberger. Ber., 30, 506 A897).
173. L. Desvergens. Chim. et Ind., 22, 451 A929).
174. А. И. Захаров. Журн. хим. пром., 8, 31 A931).
175. W. Enz, K. Pfister. Helv. Chim. Acta, 13, 194 A930).
176. E. И. Орлов. Укр. хим. журн., 2, 370 A926).
110 Нитрование ароматических и гетероциклических соединений
177. Н. А. X о л е в о, И. И. Э й т и н г т о н. Журн. прикл. химии,
5, 612 <1932).
178. Т. L. Davis, D. E. Worral, N. L. Drake. J. Am.
Chem. Soe., 43, 594 A921).
179. T. L. Davis. J. Am. Ghem. Soc, 44, 1588 A922).
180. S. Tsutsumi, E. I w a t a. C. A., 6604a A952).
181. S. Tsutsumi, E, Twata. С A., 11126c A951).
182. R. V. Me Ke e. J. Soc. Chem. Ind., 46, 261T*A927).
183. B. B. Dey, T. R. G о v i n d а с h а г i, M. T. G ovi па-
raj a n. С. А., 38, 3264 A944).
184. A. M. Володарский, В. С. Калинина. Патент
СССР 55967.
185. Франц. патент 821627 A937).
186. R, L Thomas, W. F. A n z i 1 о 11 i, G. F. H e n n i о п.
Ind. Eng. Chem., 32, 3, 408 A940)*
187. А. И. Титов, А. М. Барышникова. Журн. общ. химии,
17, 829 A947).
188. А. И. Титов, Н. Г. Л а п т е В. Журн. общ. химии, 19, 267
A949).
189. Е. Bamberger. Вег., 30, 512 A897); 51, 634 A918); см. так-
также А. Н. Несмеянов, i С. Т. Иоффе. Журн. общ.
химии, 11, 392 A941).
190. А. И. Титов, Н. Г. Лаптев. Докл. АН СССР, 66, 1101
A949).
191. A. Klemenz. С, II, 442 A922).
192. А. В. К а р т а ш е в. ЖРХО, 59, 819, 833 A927); 62, 2129 A930).
193. A, Klemenz. Monatsch., 39, 641 A918).
194. R. M. S с h r a m m, F. H. W e s t h e i m e r. J. Am. Chem.
Soc.y 70, 1782 A948).
195. С A. Bunt on, E. D. Hughes, G. J. Mink off,
Y. Reed. Nature, 158, 514 A946).
196. F. Am all. J. Chem. Soc, 123, 311 A923); 125, 811 A924).
197. S. Veibel. Z. phys. Chem. 13, 10, 22 A930).
198. А. И. Титов. Журн. общ. химии, И, 1125 A941).
199. Н. Н. Воронцов (старщ.). Основы синтеза промежуточных
продуктов и красителей. М.—Л., Госхимиздат, 1950, стр. 115.
I
I
Глава вторая
МЕХАНИЗМ НИТРОВАНИЯ
АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ АЗОТНОЙ КИСЛОТОЙ
И НИТРУЮЩЕЙ СМЕСЬЮ
Настоящая глава посвящена теоретическим работам, осве-
освещающим кинетику и механизм реакции нитрования азотной
кислотой и нитрующей смесью (HNO3+ H2SO4).
Следует отметить, что этому вопросу посвящено большое
число работ как отечественных, так и иностранных авторов.
Мы остановимся лишь на важнейших из этих работ.
В 20-х годах текущего столетия Виландом [1, 2] была
предложена теория, которая рассматривает нитрование как
реакцию присоединения нитрующего агента (в данном
случае азотной кислоты) по двойной связи нитруемого
соединения.
Виланд исходит при этом из выдвинутого еще Тиле [3] и
Голлеманом [4] положения, что всякое замещение в аромати-
ароматическом ряду есть результат первичного присоединения. На-
Например, реакция бромирования ароматических соединений,
приводящая к замене атома водорода ароматического соедине-
соединения бромом, протекает, согласно такому представлению, че-
через первичное присоединение по схеме
сн
+ НВг
\/
СВг
112
Механизм нитрования ароматических соединений
При реакции нитрования по его воззрениям происходит
присоединение азотной кислоты по двойной связи аромати-
ароматического ядра с последующим отщеплением воды:
Изучение нитрования непредельных соединений привело
Виланда к допущению, что первичным продуктом нитрования
является нитрогидрин (нитроспирт), образующийся в резуль-
результате присоединения элементов азотной кислоты к двойной
связи нитруемого непредельного соединения
СНа: СН2 + HONO2 -> HOCH2CH2NO2.
Нитрование первого члена ряда олефинов — этилена осу-
осуществлено еще в 1869 г. Кекуле [5]: при обработке этилена
смесью азотной и серной кислот он получил масло, которое,
по его мнению, представляло собой нитрит-нитрат этиленгли-
коля
CH2(ONO)CH3(ON03).
Виланд, повторив этот синтез, применил более еовершен-
<ный метод очистки (перегонка с паром и последующая много-
многократная перегонка в вакууме). Он нашел, что масло, получаю-
получающееся при нитровании этилена, состоит из смеси двух продук-
продуктов, из которых один (с более низкой точкой кипения) иденти-
идентичен динитрату гликоля CH2(ONO2)CH2(ONO2), a другой, образу-
образующийся в меньшем количестве, представляет собой эфир азот-
азотной кислоты и ^-нитроэтилового спирта CH2(ONO2)CH2(NO2).
По мнению Виланда, последнее соединение образуется в
результате этерификации азотной кислотой первичного про-
продукта реакции р-нитроэтилового спирта (C-нитрогидрина)
CH2(NO2)CH2(OH). Для проверки этого предположения
Виланд подвергал чистый нитроэтиловый спирт действию ни-
нитрующей смеси; продукт этой обработки оказался идентич-
идентичным нитроэтилнитрату, полученному при нитровании этилена.
Механизм нитрования ароматических соединений
ИЗ
I Строение ^нитроэтилового спирта доказано Вияандом син-
синтезом ©го по В. Мейеру из этилениодгидрина иазотистокислого
<?еребра: ,
CH2J , CH2NO2 .
+ AgNO8 -* I . ¦ + AgJ
CH2QH CH2OH
При перегонке нитроэтилового спирта над фосфорным ан-
ангидридом или безводным бисульфатом Виланд получил с хо-
хорошим выходом нитроэтилен
GH2NO2
CHjOH
CHNOo
+ Н2О
СН,
Этот продукт может быть получен также из ннтроэтилнитрата
CH2NO2
C'MoONO,
HNO3
На основании приведенных выше экспериментальных данных
Виланд допускает следующий механизм,. реакции , нитрования
этилена азотной кислотой:
СН2 NO» CH2NO2
;Н2 ОН ' ' "СН?ОЙ
рдр
(^-ннтррэтиповый спирт)
GH3OH
N02 CH2NO2
,| -* | . +н,о
ОН CH2ONO2 .
нитроэтилнйтрат ¦
Образование второго продукта реакции— динитрата гликоля1—
Виланд объясняет следующим образом: остатки азотной кисло-1-
ты (NOj, и ОН) присоединяются по месту двойной связи нйтруе-*
1|и мого олефина, причем группа NOa связывается с олё|Ннном
8 А. В. Топчиев ¦I,1
114 Мезцтмрш нитрования ароматических соединений
¦ —"I г: ~ ¦ ' ' ~~—_______
не через атом азота, а через атом кислорода; образовавшийся
таким обравдм мононитрит гликоля при дальнейшем действии
нитрующей смеси переходит в динитрат:
СН2 ОН
:н2
присоединение
СН2ОН
CH2jOH"
:h«ono
Н|О
этерификация
HNO3+H2SO,
:h2ono
моиоиитрит
этилеигликоля
CH,0N02
NO,
CH2ONO
нитрит-нитрат
этипенгпиколя
CH,ONO2
:h2ono
CH2ONO2
окисление
CH2ONO2
динитрат гликоля
При нитровании а,а-дифенилэтилена азотной кислотой
в растворе CG14 получен а,а-дифенил-р-нитроэтиловый спирт [61
(т. пл. 106°):
(СвН5J С = СН2 —2l (C6H5J С (ОЙ) CHaNO2.
«,а-двфевилэтилеи
При этом осуществляется лишь первая фаза реакции, а имен-
именно процесс присоединения.
При действии раствора безводной азотной кислоты в че-
тыреххлористом углероде на изоамилен Виланд получил, по-
помимо других продуктов, нитроизоамилен, который является,,
таким образом, продуктом замещения
(СН3J С = СН — СНа ~% [(СН3J С (ОН) — СН (N0,) — СН8] -»
-*• (СН3J С = С (NO2) — СН3 + Н2О.
нитроиаоамилен
Колер и Дрэйк [7] показали, что нитрование а,а-дифенил-
этилена осуществляется с хорошими выходами, если к угле-
углеводороду постепенно добавлять азотную кислоту при низкой
температуре и хорошем перемешивании. В качестве продукта
реакции в этом случае получаются а,а-дифенилнитроэтилен и
а,а-дифедилнитроэтиловый спирт.
Механизм нитрования ароматических соединений
115
Из ароматических соединений Виланд исследовал нитро-
нитрование фенантрена, который легко присоединяет азотную кисло-
кислоту, причем происходит одновременное отщепление элементов
воды от нитроспирта с образованием соответствующего просто-
простого эфира. Нитрование осуществлялось им следующим образом:
в раствор 20 г фенантрена в 100 мл СС1«, охлажденный до —15°,
медленно приливали по каплям 10 мл концентрированной азот-
азотной кислоты при перемешивании. Продукт реакции, имевший
вид смолистого осадка, перекристаллизовался из бензола.
После втрричной перекристаллизации из ацетона получен,
по мнению автора, эфир, образовавшийся из двух молекул
8-окси-9-нитрофенантрена (т. пл. 167°). Виланд предполагает,
что при нитровании ароматических соединений, как и при взаи-
взаимодействии этиленовых соединений с концентрированной азот-
азотной кислотой, первоначально происходит присоединение мо-
молекулы азотной кислоты к двойной связи ароматического ядра
с образованием неустойчивого нитрооксипроизводного, ко-
которое разлагается на соответствующее ароматическое нитро-
соединение и воду. Например, при нитровании бензола в
качестве первичного продукта реакции образуется нитрокси-
циклогексадиен — весьма неустойчивое соединение, которое
затем распадается на нитробензол и воду
,NO2
+ hono2-> x;gH; -* | I +н2о
\/ \/\h~'
Признак существования промежуточного продукта Виланд
видит в коричневой, быстро исчезающей окраске, появляю-
появляющейся при смешении азотной кислоты с бензолом. Однако Ви-
Виланд не приводит никакого прямого доказательства сущест-
существования промежуточного продукта присоединения азотной кис-
кислоты к бензолу. •
В связи с работами Виланда по нитрованию непредельных
соединений, на основе которых этот исследователь построил
«вою теорию нитрования ароматических соединений, упомя-
|йем так»» о работах Аншютда и Гильбе]#№ [8].
8*
М'ехШШм нитрования ароматических соединений
Эти авторы нитровали &,а-дафенилэтилен р растворе уксус-
уксусной кислоты равномолекулярным количеством азОтной кисло-
кислоты сначала при обыкновенной температуре, а затем при 100°
до тех нор, пока в пробе раствора при разбавлении водой вы-
выделялся не маслянистый, а кристаллический продукт; по окон-
окончании нитрования добавляли воду, причем получался осадок1.
Посредством дробной кристаллизации последнего из спирта
авторы выделили три продукта: ас,ос-дифенил-3-нитроэтйлошй
спирт (т. пл. 106-^107o), ос,«-дифенил-^-нитроэтилен (т. пл.
87—88°) и а,вс-дйфенил-^1,3-динитр0этилен (т. пл. 146—147аI
Образование этих трех продуктов реакции объяснено следую-
следующим образом:
-¦¦'¦ ¦" (CeHs'JgC ?= GHji-f- i.
он.
¦ ' ЭТИЛч^ВЫЙ СПИРТ
i)s?.(OH)'c'HjNOj ~^*X (CeH6J Cl == СЩ0*
: а,а-дифенил-|5-нйтро-
' '¦ этадея, •;¦ ¦;:
ОН
.(GJHe),C@H)CH(NO1I
—Н2О
(CJI«),C -CHNO.+
-дюштроэтилен
Образование нитроспйрта наблюдалось также при действии
азотной кислоты на «,а-ди-п-толилэтилен.
В литературе встречаются указания о получении некоторы-
некоторыми авторами- продуктов присоединений при нитроваййи арома-
ароматических соединений. Так, Например, Одда1 19} при нитровании
Нафталина ' аЙотнОй кислотой получил маслянистый-продукт,
"Который, по мйёнйю автора, представлял1 собой молекулярный
Шййплек'с нафталина :с азотной кислотой1.1 Этот комплекс ока-
оказался весьма неустойчивым соединением и очень быстро коагу-
iSipdisan: с отщеплением воды и образованием а^мононитронаф-
%1ййнк^'ДЙя объяснения механизма1 нитрованиями образований
"йрйЙ^та^прйсОедийенйя Одда принимает, чтО0|ц^ольн]ме ядра
молекулы нафталина^ не1 облада1от'"йдйнакой<Щ! ^ей«циён^ёй
. нитрования ароматических соединений
117
: одно из них имеет ароматический, другое
фатический характер:; (алициклйдеское ядро); последнее болое
рсакционноспособно, содержит две; конъюгированные двойные
связи и обладает наибольшей реакционной способностью
в ос,ос'-положении. В этом положении и происходит присоеди-
присоединение HONOa при смешении нафталина с азотной кислотой
с образованием комплекса, который отщепляет воду и дает
йс-мононйтронафталин.г При дальнейшем нитровании нафтали-
нафталина, т. е. При введении1 второй нитрогруппы, Одда допускав*
предварительную перегруппировку ядер с переходом алифа-
алифатических свойств к другому ядру, причем присоединение
НЖ>,
происходит в положениях 5,8. Образовавшиеся комплексы
далее отщепляют воду и дают динитроеоединенйя A,5- и
1,8-динитронафтйлины):
Помимо работ; Одда, имеются указания на присоединение
азотной кислоты к бензальфталимидину и к бензальдифенйй-
малеиду [10]. Кроме того, показано, что при действии смеси
азотпой и ледяной уксусной кислот на N-ацшшроизвоДные ку-
мароно-B,3,2',3')-ипдола происходит присоединение групп
—NOa и — ОСОСНз к двойной1 связи и образование соответст-
соответствующих питроацетатов [11]
,NO2 I [ ' .
О ...
Ч/У"
о
ОСОСНз
N ОСОСНз
ОСОСНз
Мейзейгеймер [12] получил продукт присоединения
ной кислоты к антрацену — дигидронитроантранол Gi4H10NO3H
v
/\/\/\
NO2
118
Механизм нитрования ароматических соединений
При обработке этого продукта щелочью выделено соответствую-
соответствующее нитросоединение — мезонитроантрацен
NO2
строение которого доказано восстановлением цинком и НС1
в мезоантрамин C14H9NH2; последний оказался идентичным
продукту, получающемуся действием водного аммиака на ан-
транол.
Предложенная Виландом схема образования ароматических
нитросоединений отщеплением воды от первично возникаю-
возникающего продукта присоединения молекулы HNO3 к двойной свя-
связи ароматического ядра встретила ряд возражений, из которых
заслуживают внимания следующие:
1) образующиеся после присоединения азотной кислоты про-
производные циклогексадиена должны быть крайне нестойкими,
и последующее превращение их только в направлении отщеп-
отщепления воды является мало вероятным;
2) против присоединения молекулы азотной кислоты к двой-
двойным связям ароматического ядра говорят несоответствие ско-
скоростей различных реакций замещения, например, чрезвычай-
чрезвычайная трудность бромирования бензола (без катализаторов), и
легкость нитрования.
Считая на зтом основании концепцию Виланда неудовле-
неудовлетворительной, Б. В. Тронов [13, 14], а также С. С. Наметкин
и А. С. Забродина [15] выдвинули другую схему нитрования
ароматического ядра, согласно которой ароматическое ядро
присоединяется к атому азота азотной кислоты путем обра-
образования связи с С — N и одновременной миграции атома во-
водорода, до того соединенного с атомом углерода, к одному из
кислородных атомов молекулы азотной кислоты.
RH
О
N = O •
\
ОН
о
# _
R_N_|OH
\|
OiH
A)
Механизм нитрования ароматических соединений
119
При таком допущении промежуточный продукт реакции со-
сохраняет свой ароматический характер, что делает понятным
отсутствие у него склонности к различным превращениям,
свойственным производным циклогексадиена.
Образование азотнокислых зфиров нитроспиртов при дей-
действии азотной кислоты на непредельные алифатические соеди-
соединения объясняется, по мнению зтих авторов, предварительным
нитрованием:
О О
О
ОН
= CH — N— ОН
ОН
СН2 = CHNO2
Н20
Вторая молекула азотной кислоты присоединяется к двойной
связи с образованием азотнокислого эфира нитроспирта
СН2 = СИ N02 + HNO3 -*¦ 02N — О — GH2 — СН2 — N02.
В противоположность мнению Виланда, согласно которому
азотная кислота может присоединяться к двойной связи толь-
только с разрывом по связи НО — N02, Михазль и Карлсон [16]
предполагают, что азотная кислота при действии на непредель-
непредельные соединения при низкой температуре может присоединять-
присоединяться по схеме Б. В. Тронова и С. С. Наметкина с разрывом по
связи Н — 0N02. Образование нитросоединений есть резуль-
результат вторичной реакции. Таким образом, процесс нитрования
ароматических соединений должен протекать по схеме
О О
— Н + N =
;. Cells — H + N = О -> С6Н6 — N-ОН -> CeH6NO2+H2O,
ОН ОН
а при нитровании циклогексана реакция должна идти так:
О
N
о
Г С6Н12 + N' = О -> CeHu — N'— ОН - С6Н10 = NOOH + Н20
\ \ \
J: ОН ОН
j;':, изонитроциклогексан
i Согласно этой схеме можно предположить, что нитрование
Ароматических углеводородов должно идти так же, если
120
Механйлм" Нитрования ароматических соединений
вместо ааоФНОЙ кислоты взять эфиры азотной кислоты. В этом
случае^ следовало бы ожидать следующей реакции:
:!¦¦,¦¦:. 0 ¦ " О ' ¦¦ ¦ V ¦¦ ' ¦¦¦¦
¦'¦¦¦ ' OR OR , : ;
но в действительности нитросоединение не образуется.
В отношении нитрования непредельных соединений зти же
авторы считают, что при действии азотной кислоты происходит
присоединение по двойной связи согласно схеме
\
н
ONO2
н
V
— с
ONO,
Таким образом^ схема В. В. Тронова^С. С. Наметкина и
Л. С. Забродипрй не могла объяснить ОЩШЪЪШ нитрующих
свойств по отношению к ароматическим соединениям у эфиров
азотной кислоты. При смешении бензола и его гомологов
(ксилола и псевдокумола), а также легко нитрующегося ани*-
йола с этилжитратом и изоамилнитратом не наблюдалось ни-
никаких изменений даже при стоянии зтйх смесей в течение 4 —
5 лёт. Трудно допустить, чтобы замена водорода в азотной кис-
кислоте на углеводородный остаток сама по себе могла оказать
влияние на распад молекул HNO3 на NO2 и ОН или на разрыв
двойной связи азота с кислородом. Скорее всего можно было
прийти к выводу, что в реакции нитрования принимает уча-
участие атом водорода азотной кислоты.
Исходя из указанных выше фактов, атакже данных Гирш-
баха и Кесслера [17], которые при изучении действия азот-
азотной кислоты на бензол в нитробензольном растворе нашли,
что эта реакция по отношению к HNO3 является бимолекуляр-
бимолекулярной, Б. В. Тронов допускает, что в реакции нитрования арома-
ароматических соединений азотной кислотой принимают участие
две молекулы последней;, цричем одна из них является, катали-
катализатором и действует, невидимому, своим подвижным атомом
,Щ
лОдорода. Меканиэм реакции соадрг fl том, чт?р HNOg ирисоедиг
няехся к атому углерода ароматического ядра, рбраэуя комплекс
(Л). Этим расшатывается связь между углеродом и связанным
( ним водородом; последний ожаиовится подвижным и дерко
отщепляется, вследствие чего создаются условия для присоеди-
присоединения комплекса (А) к новой молекуле кислоты с образованием
комплекса (Б); далее происходит распад комплекса (Б) с отще-
отщеплением одной молекулы азотной кислоты и молекулы воды,
что и приводит к образованию нитробензола:
СН
СН
H-HNO,
н
С—HNO3
II
НС СН
СН
НС СН
СН. (/I)
СН, N—оГЙ]
СН
СН Ш
СН
Отсутствие у эфиров азотной кислоты нитрующей способности
по: оетдапению к ароматщ^екщ соединедиям, В, р. ,
объясняет тем* что реакция Mp^t протевдть, толь^й р
ствии катализатора, каковым в случае нитрования азОтной
кислцтрй является она сама. ;
Основываясь на данных Бедткера [18], который показал,
что , этилнитрат энергично нитрует бензол В: присутствии
A1C1S, Б. В. Тронов исследовал влияние ряда хлоридов (ВС13,
SnCl4, PC13, FeCl3, A1C13, SiCl4, ЙШ5) На реакцию нитрова-
нитрования бензола зтилнитратом. К эквимолекулярным количествам
компонентов добавляли 0,5 моля испытуемого в качестйе ка~
тализатора вещества (опыты с А1С13 производили и с варьиро-
варьированием количества катализатора). Смеси выдерживали при
комнатной температуре в течение 48 час, затем разбавляли
водой и зфиром. Эфирный раствор суихили хлористым ЗДЦЬЦИем
и гвыдариваяи в учение 1 часа при 105—110° для ..удаления,
122
Механизм нитрования ароматических соединений
Механизм нитрования ароматических соединений
123
этилнитрата и бензола (нитробензол определяли в остатке).
Опыты показали, что из исследованных веществ лишь А1С13,
S11CI4, SbCle и FeCl3 обнаружили каталитическую активность
и притом в различной степени, как это видно из табл. 7.
Таблица 7
Сравнительная каталитическая активность
А1С18, SnCl4) SbCl5 и FeCl3
Каталиватор
А1С13
А1С18
А1С13
SnCl4
SbCl5
FeCl3
Количе-
Количество ката-
ливатора,
моли
0,1
0,3
0,5
0,5
0,5
0,5
Выход нитро-
бенвола. % от
теории
12,0
39,5
50,8
35,0
7,1
9,8
Исходя из данных Вернера [19] и Пфейфера [20], которые
показали, что эти четыре хлорида обладают способностью
к образованию разнообразных комплексов, Б. В. Тронов
объясняет их каталитическое действие при нитровании этил-
нитратом присущими им комплексообразующими свойствами
(в отличие от ВС13, S1CI4 и РС13). Так как известно, что А1С13
и SnCl4, которые оказались наиболее активными катализа-
катализаторами (см. табл. 7), энергично реагируют с этилнитратом,
Б. В. Тронов допускает, что А1С1з(ЗпС14) образует комплекс
с этилнитратом, который затем вступает в реакцию с бензолом.*
С2И5О — N = О + А1С18 -» С2Н5О — N = О ... А1С1» A)
о о
С2Н6О — N = О ..
/\
но свн6
С2Н5ОН + О = N = О + AlCi;
сйн5
С2Н5О — N = О . . . А1С13 + СвНв
II
о
. А1С1,-»
B)
* Данная схема построена Б. В. Троновым по типу реакции об-
образования кетонов при взаимодействии хлоранпидридов с ароматиче-
По аналогии с указанной выше схемой нитрования этилнитра-
гом в присутствии с А1С13 Б. В. Тронов предполагает, что нитро-
иание ароматических соединений азотной кислотой протекает
не по схеме A), как он допускал ранее (см. выше, стр. 118),
:i по схеме C) (нитрование ароматического соединения осуще-
осуществляется комплексом из двух молекул HNOS, из которых одна
является нитрующим агентом, а другая комплексообразова-
гелом)
НО —N = 0
II
о
НО О... HONO2
HONOS-)-СвН„-> N
НО — N = О .
/\
НО С«Ни
о свн6
. HONO2 ->¦ Н2О + О =N = О
HONO2
Н2О + CeH5NO3 + HNO3.
C)
Как указано выше, нитрование, по представлению Вилан-
да, протекает через первичную стадию присоединения HNOs,
11 результате чего образуются насыщенные нитрогидрины.
У алифатических соединений нитрогидрины разлагаются далее
на нитроолефины и воду или, подвергаясь этерификации, дают
• оответствующие эфиры азотной кислоты (оба эти процесса мо-
могут происходить также и одновременно). Нитрование аромати-
ароматического ядра Виланд представляет себе как присоединение
* кими углеводородами в присутствии А1С1а; как известно, для этой ре-
реакции обычно принимается первичное образование комплекса из 1 мо-
.ч я хлорангидрида и 1 моля А1С13:
13 СбН5-С=О...А]С13 4-c8h6j
С1
с6н4— с-оГн!
AiCi3 ССН5— С=0...А1С13
с„н5
124
Механизм, нитрования ароматических соединении
остатков НО и ЖJ к атомам углерода ядра ио двойной связи
с дальнейшим разложением полученного таким образом ком-
комплекса на иитропроизводное и воду.
Михаэль и Карлсон [21] считают эту схему не доказанной
экспериментально; в тех условиях, в которых Вилавдом про-
производилось нитрование непредельных соединений азотиой кие*
лотой и нитрующей смесыо, процесс нитрования значительно
усложняется побочными реакциями, приводящими к о®|»азо+
ванию соединений, которые могут играть роль нитрующих
агентов. При нитрований этилена нитрующей смесью Вилавд,
наряду с продуктами окисления, получил азоишй эфир нитро-
спирта (нитронитрат) CH2(ONO2)CH2NO2) образование ко-
которого он объясняет этерификацией азотной кислотой нитро-
спирта — первичного продукта прямого присоединения мо-
молекулы HNOs к этилену.
По мнению Михазня и Карлсона, в данном случае более
вероятен другой механизм реакции, так как в смеси серной
и азотной кислот нитрующим агентом является не HNOa,
а смешанный ангидрид Н08Ог(Ж02, который обладает, как
все смешанные ангидриды, большой способностью к присоеди-
присоединению. При присоединении этого ангидрида к этилену обра-
образуется промежуточный продукт реакции CH2(OSO3H)CH2N02,
в котором остаток SO8H может быть легко замещен более отри-
отрицательным радикалом NO2, что нриводит к нитронитрату
СН2 CH2OSO8H
+ HOSO2ONO2-> |
:н2 . . .. ' GHe.NGa
' CH2ONO2
O2NOSO3H -> I ' "' + H2S2O7
:h2no2
ПИрОСврИаЯ ¦
кислота
A)
Далее, с появлением в реакционной смеси в результате
окислительных процессов окислов азбта, создается возмож-
возможность для вступления в реакцию N2O3.:ri! N2t)|: Взаимодействие
Механизм нитрования ароматических соединений
125
•этих окислов с этиленом (присоединение) также приводит
« образованию нитроиитрата,
1 Как указывалось выше, при нитровании изоамилена в рас-
творе GG14 Виланд в качестве основного продукта реакции
нолучиа омнйтроизоамйлен йаряду с некоторым количеством
нитронитрата
(CH3KC(ONOS/CH(NO2)CH3.
Исходя из правила положительно-отрицательного присоеди-
присоединения, Михаэль и Карлсон полагают, что если бы реакция про-
протекала по схеме Виланда, то в качество первичного продукта дол-
жен был бы получиться главным образом (CH3JC(NO2)CH(OH)CH3
и лишь небольшое количество (CII.{JC(OH)CH(NO2)CIl3
Этерификация первого продукта азотной кислотой
должна была бы привести к конечному продукту
(СЛ3JС(КОг)СН(ОКОг)СН3, а не к тому изомеру, который
Виланд получил в действительности. Если же допустить, что
реакция происходила посредством присоединения N2C>4, может
наблюдаться образование полученных Виландом продуктов:
>'
н3с
= СН — CFf3 -|
\с — сн — сн.
П,С С^3
\С — С —N0,
СН3
/
CHS
;=з= С—.СИ,
I
N0.
сы3
/
С — СН-СН8-г.
N0,
= c-cii,
HNO2-!-CH3
питровзоамплеп
СНз
\Cn-CH—CHS
(-¦и I I
Шй ОН N02
cu8
C1I
/
СИ — CH3
13 ONO2 NO2
A)
C)
D)
126
Механизм нитрования, ароматических соединений
Анализируя экспериментальные данные Виланда по нитрова-
нитрованию азотной кислотой а,ос-дифеНилэтилена, Михаэль и Карл-
Карлсон приходят к выводу, что в данном случае наблюдалось
участие в процессе нитрования окислов азота, возникающих
в результате побочных окислительных реакций (как известно,
с N2O3 ос,а-дифенилэтилен дает маслообразный продукт, ко-
который затем легко разлагается на нитрогидрин и производные
нитроэтилена; с N2O4, в присутствии воды, дифенйлэтилен
образует <х,р-нитрогидрин).
Для экспериментальной проверки высказанных ими взгля-
взглядов о действии азотной кислоты и нитрующей смеси на непре-
непредельные углеводороды Михаэль и Карлсон проводили нитро-
нитрование олефинов в условиях, при которых устранялись окис-
окислительные процессы, приводящие к образованию окислов азо-
азота, а именно в присутствии растворителей (хлороформа, че-
тыреххлористого углерода и хлористого метилена) и при низ-
низкой температуре и сильном перемешивании.
Нитрование этилена азотной кислотой (98,6% -ной) они
осуществляли или посредством барботирования этилена через
азотную кислоту в растворе хлористого метилена при —25°,
или же добавляя HNO3 в растворитель, через который при —28°
пропускали этилен при сильном перемешивании; в обоих слу-
случаях получен маслянистый продукт реакции, который разла-
разлагался даже при умеренном нагревании. Отходящие газы состоя-
состояли из окислов азота.
Нитрование бутилена, который обладает большей способ-
способностью к присоединению НВг и воды, чем этилен, привело лишь.
к образованию продуктов окисления. Из последних выделен
метилэтилкетон, который мог бы образоваться при окислении
азотнокислого эфира вторичного бутилового спирта.
При нитровании изоамилена и изобутилена получены бо-
более удовлетворительные результаты, что объясняется большей
способностью этих углеводородов к присоединению кислот
по сравнению с этиленом и бутиленом, а также большей устой-
устойчивостью эфиров с третичным радикалом по отношению к й§шс~
лению сравнительно с соответствующими вторичными произ-
производными.
Механизм нитрования ароматических соединений
127
В противоположность указанию Виланда и Рана [2], при
нитровании изоамицена в качестве основного продукта реакции
Михаэль и Карлсон получили азотнокислый эфир третичного
амилового спирта. Нитрование проводили добавлением 98,6%-
ной азотной кислоты в раствор изоамилена при—20°. При
таких же условиях авторы нитровали изобутилен, причем по-
лучев; азотнокислый эфир третичного бутилового спирта. Авто-
Авторы объясняют образование нитратов присоединением молеку-
молекулы азотной кислоты к молекуле олефина по схеме
CHg СН3
Н2С = С — СН3 + Н—ONO8 -^ Н3С — С — СНз
I
ONO2
При нитровании а,а-дифенилэтилена, которое Михаэль и
Карлсон проводили в растворе хлороформа или СС14 при 0е,
обнаружено, что углеводород не реагирует с азотной кислотой
с образованием нитропроизводного, но частично превращается
в полимер. В рцстворе ледяной уксусной кислоты полимер не
реагировал с йштнрй кислотой при комнатной температуре; при
проведении яке реакции при нагревании из реакционной смеси
удалось выделить а,«-дифенил-р-нитроэтиловый спирт. Эти дан-
данные подтверждают, что полученные Виландом соединения мог-
могли образоваться в результате взаимодействия углеводорода с
окислами азота, а не прямым присоединением азотной кислоты.
Переходя далее к нитрованию ароматических углеводоро-
углеводородов, Михаэль и Карлсон указывают на неправильность пред-
предложенной Виландом схемы процесса нитрования бензола по
следующим причинам: в обычных условиях бензол обладает
слабой способностью к реакциям присоединения (по отноше-
отношению, например, к галоиду), но благодаря внутримолекуляр-
внутримолекулярным энергетическим изменениям присоединение к одной паре
атомов углерода влечет за собой передачу способности к при-
присоединению двум оставшимся парам атомов углерода. Анало-
Аналогичные отношения должны наблюдаться и при нитровании азот-
азотной кислотой. Отсюда можно сделать вывод, что если бы ни-
хрование бензола азотной кислотой происходило по схеме
:i28
нитрования араматичвеаыя; соединений
Виланда, оно должно было бы привести к образованию исклю-
исключительно ' тринитробеняола.
При нитровании фенантрена азотной кислотой Виланд по-
получил эфир 8-окси-9-питрофенантрена, образовавшегося, по
его миепию, в результате конденсации двух молекул 8-окси-
9-нитропроизводного с выделением одной частицы воды. 8-окси-
9-нйтр0пр6йзвоДйоё фёнантрёна является йёрМчным продук-
продуктом прямого присоединения групп НО— и МОз— к атомам
углерода в положениях 8 и 9 (по Виланду, только эти атомы
углерода обнаруживают способность к црисоединению, ана-
аналогичную этиленовым углеводородам). Более "ранние литера-
литературные данные [22] не подтверждают этих положений Вилан-
Виланда, так как при нитровании фенантрена в растворе уксусной
кислоты получены не только 9-нитро-, но также 3-, 2- и 4-ни-
трофенантрены. Эфир, выделенный Виландом, невидимому,
образовался при действии нитрозных газов на фепантрен (по
данным Шмидта [23], нитрование фенантрена нитрознымл га-
газами приводит к тому же эфиру, который получен Виландом).
Михаэль и Карлсон при обработке фонантрена 98,6%-ной HNO.,
п растворе хлороформа при —20° получили продукт реакции,
представлявший собой смесь нитрофеиантренов с выходом 25%.
Основываясь на экспериментальных данных, полученных
ими при изучении нитрования олефинов и ароматических со-
соединений, Михаэль и Карлсон выдвигают теорию «альдолиза1-
цпи», которая исходит из следующих принципов: ки^лОроД
азотной кислоты, связанный двумя валентностями с азотом,
должен обладать значительно большей химической энергией,
чем частично гидрогенизированный кислород группы ОН, и,
¦следовательно, большей способностью «притягивать» водОроД
бензольного кольца, отделяя его тем ¦ самым от связанного
е ним углерода. Основные силы, которые определяют нитрую-
нитрующую способность азотпой кислоты,: это химические потепциалы
кислорода по отношению к водороду ароматического ядра и
азота-по отношению к фепилыюму радикалу (арилу). С этой
точки зрения нитрование бепзола может быть представлено
¦ следующей ' схемой: '¦¦'¦¦ 'а;!*?rhl ь^ ¦х ¦п" '•' ¦' • -•¦¦¦'~:-:';- '-: '¦' ¦¦
свно -
нитрования ароматических соединений
129
Как эта, так и другие ранее изложенные теории нитрова-
нитрования ароматических соединений исходят из допущения, что
нитрующим агентом является молекула азотной кислоты,
соединяющаяся с ароматическим соединением в первичный комп-
комплекс, в дальнейшем распадающийся на нитросоединение и
воду. При этом предполагается, что присоединение HNOe может
происходить или к двойным связям ароматического ядра (Ви-
(Виланд), или же, наоборот, ароматическое ядро присоединяется
к молекуле азотной кислоты (Б. В. Тронов, С. С. Наметкин и
А. С. Забродина, Михаэль и Карлсон).
Оригинальный взгляд на механизм < процесса нитрования
ароматических углеводородов и на природу нитросоединений
выдвинут А. М. Беркенгеймом [24].
По мнению автора, в случае нитрования, например, бензола
имеют место слабо выраженная диссоциация молекулы бензола
на ионы Н' и CgHe' и амфотерная диссоциация молекулы азот-
азотной кислоты, с одной стороны; на Н'+ ГЮз' (I) и, с другой
стороны, на NOj'+ ОН' (II). Диссоциация азотной кислоты
в первом направлении происходит в значительно большей сте-
степени. Однако большая концентрация ионов Н*, препятствую-
препятствующая слабо выраженной диссоциации молекулы бензола, при-
приводит к тому, что диссоциация азотной кислой.! в направ-
направлении (I) не может вызвать образование нитроеоединений.
Диссоциация азотной кислоты в направлении (II), вследствие
образования Н2О за счет ионов Н" и ОН', усиливает диссоциацию
молекулы бензола и приводит к образованию плохо „ионизи-
„ионизированного нитросоединения.
В своих взглядах на природу нитросоединения А. М. Бер-
кенгейм исходит из предположения, что молекула бензола cqr
стоит из попеременно заряженных четырьмя отрицательными
и тремя положительными с одним отрицательным зарядами
атомов углерода, согласно следующей схеме:
С""
'Сч С""
C"v
9 А. в, Топчиев
130
Механизм нитрования ароматических соединений
При нитровании бензола атом азота азотной кислоты, имею-
имеющий пять положительных зарядов, связан с атомом углерода,
имеющим четыре отрицательных заряда, что приводит к обра-
образованию нормального нитросоединения.
Ниже мы остановимся на теориях нитрования, в основу
которых положено допущение, что в системе ароматическое
соединение — азотная кислота нитрующими агентами являют-
являются несколько форм азотной кислоты в ионизированном и не-
иониэированном состояниях.
Ганч [25, 26] при изучении физических и химических свойств
растворов азотной кислоты в воде, серной кислоте и органи-
органических растворителях пришел к выводу о существовании в рас-
растворах различных форм азотной кислоты, количественные
отношения которых друг к другу меняются в зависимости от
концентрации растворителя.
До появления работ Вернера все кислородные кислоты
рассматривались как гидрокеильные соединения, а соли кислот
и эфиры — как производные гидроксильного соединения
O2N-OH; O2N.OMe; O2N-OCnH2n+1.
Эти структурные формулы не могли объяснить основных раз-
различий между электролитами и неэлектролитами и между соля-
солями и сложными эфирами кислот. Вернер, исходя из принципов
своего учения о координационных связях и о строении компле-
комплексных соединений, пришел к другой концепции, согласно ко-
которой лишь сложные эфиры имеют строение производных гидро-
гидроксильного соединения; соли же и кислоты, являющиеся элек-
электролитами, представляют собой комплексы с комплексным
анионом и ионогенпо связанным катионом металла или водоро-
водорода, находящимися во второй сфере притяжения центрального
атома, в частности азота
N-O-CnHan+1
Г О] Г
ON СН3
L О] L
H
Механизм нитрования ароматических соединений
131
Исследования Шеффера [27J, который определял спектры
поглощения гомогенной азотной кислоты и ее растворов в не-
ионизирующих средах, а также соответствующих солей и эфи-
ров, показали, однако, что спектры поглощения азотной кис-
кислоты и ее эфиров имеют определенное сходство; лишь в водных
растворах при сильном разбавлении спектры поглощения
азотной кислоты аналогичны спектрам ее солей.
Ганч при исследовании спектров доглощения различных
кислот, их солей и сложных эфиров обнаружил, что соли и
сложные эфиры одной и той же кислоты отличаются друг от
друга по своим оптическим свойствам, кислоты же занимают
промежуточное положение и, в зависимости от их природы
и растворителя, являются оптически идентичными либо солям,
либо сложным эфирам. Ганч также установил, что ионизация
не изменяет оптических свойств. Действительно кислоты, даю-
дающие такой же спектр поглощения, что и их соли, идентичны
последним не только в недиссоциированном состоянии, но и
в виде ионов.
Для объяснения полученных результатов Ганч допускает,
что оптические свойства исследованных соединений находят-
находятся в зависимости от их строения. Например, те кислоты, ко-
которые оптически идентичны сложным эфирам, построены ана-
аналогично последним, т. е. содержат гидроксил, соответствую-
соответствующий алкоксильной группе сложных эфиров
О.
>-о.с„н2,
1П+1
OH
Эти кислоты, не являющиеся электролитами, представляют
собой, по Ганчу, «псевдокислоты». К истинным кислотам от-
относятся кислоты, идентичные солям, т. е. содержащие водород,
соответствующий металлам солей; в отличие от псевдокислот
истинные кислоты обладают свойствами электролитов, так
как атомы водорода, образующие катионы, связаны ионо-
генно (во второй сфере притяжения центрального атома
азота) с несколькими (по крайней мере с двумя) атомами
кислорода.
9*
132
Механизм нитрования ароматических соединений
Указанные выше отношения в общем виде могут быть пред-
представлены следующим образом (НХО2— кислота):
.о
I. Сложные эфиры Хч
неэлектролиты
Псевдокислоты
О
ЧОН
II. Истинные
кислоты
/О]
х/ н
4oj
гидроксильные формы
Л
Соли Х< \ Me
электролиты комплексные формы
Соединения, входящие в каждую из этих групп, имеют
сходные структуры.
Для изучения строения кислот Ганч пользовался также
химическим методом, основанным на различном характере взаи-
взаимодействия истинных кислот и псевдокислот с диазоуксусным
вфиром.
Как известно, диазоуксусный эфир реагирует с кислотами
с выделением азота по следующему уравнению;
(COOC2HS) CHN2 + НХ - (СООС2Н6): СЩХ + N2.
Кислородные кислоты, содержащие лишь один атом кислоро-
кислорода, инертны по отношению к диазоуксусному эфиру или реа-
реагируют с ним лишь очень медленно. Кислоты же, содержащие
более одного атома кислорода (ХО^Н, ХОзН и т. д.), даже в не-
диссоциированном состоянии легко вступают в реакцию с ди-
диазоуксусным эфиром с выделением азота, но лишь в том слу-
случае, если они содержат ионогенно связанный водород, т. е.
ведут себя в растворе, как истинные кислоты. Если же они
представляют собой псевдокислоты, т. е. являются гидроксиль-
ными соединениями ОХ-ОН, они не реагируют с диазоуксус-
диазоуксусным эфиром или реагируют очень слабо, подобно другим гидро-
ксильным соединениям.
Пользуясь реакцией с диазоуксусным эфиром, Ганч уста-
установил, что азотная кислота в эфирном растворе легко пере-
переходит из формы истинной кислоты (NOg)'H' в псевдокислоту
О
О — N— ОН. Эти результаты совпадают с данными Шеф-
Механизм нитрования ароматических соединений
133
фера [27], который показал, что в эфирном растворе азотная
кислота оптически идентична ее сложным эфирам.
При изучении водных растворов азотной кислоты оптиче-
оптическим методом Ганч подтвердил данные Шеффера, указываю-
указывающие на присутствие в этих растворах истинной кислотной фор-
формы H(NOs), и показал, что по мере увеличения концентрации
азотной кислоты спектры ее водных растворов все более и бо-
более приближаются к спектрам сложных эфиров, что служит
доказательством постепенного перехода истинной формы
H(NOs) в гидроксильную форму псевдокислоты O2N-OH.
Дальнейшие исследования Ганча привели его к выводу,
что в водных растворах азотная кислота находится не в сво-
свободном состоянии, а в виде соли гидроксония. Вода представ-
представляет собой очень слабое Основание, которое вступает в реак-
реакцию с азотной кислотой с образованием соли. Переход псевдо-
псевдоформы азотной кислоты в соль гидроксония при разбавлении
азотной кислоты водой может быть представлен следующим
уравнением: ¦ ¦-.
O2NOH 4-Н80-* (НзО/(N03)', или
азотнокислая соль
гидроксония
= (N03)' (И*) (Н20)п.
Сравнительное изучение поглощения ультрафиолетовых
лучей гомогенной (абсолютной) азотной кислотой и ее сложны-
сложными эфирами показало, что азотная кислота поглощает заметно
слабее эфиров (это явление не может быть приписано столь не-
незначительной разнице в строении, которая возникает вслед-
вследствие замены гидроксила псевдоазотной кислоты алкоксиль-
ной группой). Для объяснения этой оптической аномалии, ко-
которая вызвала резкую критику теории Ганча со стороны Галь-
бана [28], Ганч допускает существование в гомогенной азот-
азотной кислоте, наряду с псевдокислотой O2NOH, еще и другой
формы азотной кислоты, которая поглощает ультрафиоле-
ультрафиолетовые лучи в меньшей степени по сравнению с псевдокис-
псевдокислотой и является электролитом (последнее допущение объ-
объясняет сравнительно высокую электропроводность гомоген-
гомогенной азотной кислоты, несмотря на то, что псевдокислота не
является электролитом). Ганч считает, что эта форма азот-
134
Механизм нитрования ароматических соединений
ной кислоты образуется посредством ассоциации трех
молекул псевдоазотной кислоты с внутримолекулярным пере-
перемещением атомов водорода:
O2NOH О NO3 г НО -|
+ \v — ОН - \n — ОН
O2NOH О NO3LHO J
Полученный комплекс, имеющий солеобразный характер,
который Ганч назвал нитронийдинитратом, диссоциирует на
отрицательные нитрат-ионы и положительный ион нитрония *:
(NO3J IN (OHK] 71 2NO^ + H3NO++.
Если исходить из позднейших работ Ганча, его теория строе-
строения гомогенной азотной кислоты и ее водных растворов сво-
сводится к следующему.
Абсолютная (гомогенная) азотная кислота представляет
собой раствор обладающего электропроводностью нитрацидий-
динитрата (N03J [(НО)sN] в псевдокислоте, не обладающей
электропроводностью. Эти две формы азотной кислоты нахо-
находятся между собой в равновесии
3O2N-OHr(NO3J[(HOKN].
В 98,6%-ной азотной кислоте концентрация псевдоазотной
кислоты составляет 80%, остальная часть кислоты находится
в форме нитрацидийдинитрата. При разбавлении азотной кис-
кислоты водой происходит перегруппировка псевдокислоты в соль
гидроксония и истинной кислоты, т. е. наступает новое равно-
равновесие
O2NOH +в
(NO3)' [Н-• (ОН2)„].
Нитрацидийдинитрат при этом исчезает. Начиная с концен-
концентрации HNOs 77% в растворе содержатся псевдокислота и
истинная кислота (в недиссоциированном состоянии в виде
соли гидроксония и в виде ионов). При дальнейшем разбавле-
* Ганч называет ионы H2NO2' и H3NO3 ионами нитрония. Позднее
эти ионы получили название питрациднй-ионов, а нитронием стали на-
называть ион NO2 ¦ В дальнейшем мы будем придерживаться этой термино-
терминологии (позднейшей).
Механизм нитрования ароматических соединений
135
нии содержание псевдокислоты уменьшается, а содержание
истинной кислоты повышается; при концентрации 31,6%
НГЮз, т. е. после добавления 8 молей воды, перегруппировка
псевдокислоты в форму истинной кислоты полностью закан-
заканчивается, причем около 40% истинной кислоты находится
в диссоциированном состоянии, а остальная часть — в виде
педиссоциированной соли гидроксония.
Ганч дает для водных растворов азотной кислоты таблицу,
показывающую взаимоотношения между псевдоформой и формой
истинной кислоты в зависимости от содержания воды (табл. 3).
Таблица 8
Соотношение лсеедокислоты и истинной кислоты в водных
растворах HNOs в зависимости от содержания в ней воды
Коннвйт
трация
HNO,, %
77,3
.49,3
31,6
Молей Н,0
на 1 моль
HNO,
1,0
3,75
7,5
Псевда-
нислота
Недиссоции-
роианная
истинная
кислота
Иония ирован-
ная истинная
кислота
(NO,' + H-)
%
70
50
2
25
32
60
5
18
38
Ганч исследовал также систему азотная кислота т— серная
кислота, Причем установил, что эта система отличается значи-
значительно более высокой электропроводностью, чем азотная кисло-
кислота, а также аномально большим понижением точки замерзания.
Для объяснения этих явлений Ганч допускает существование
в смеси H2SO4-f HNO3 электролитов, образование которых
происходит в результате взаимодействия молекулы азотной кис-
кислоты с одной или с двумя молекулами серной кислоты (так как
псевдоазотная кислота имеет два ненасыщенных атома кислоро-
кислорода, возможно возникновение двух солеобразных комплексов):
O2NOH + HSOJl -¦ [NO (OHJ] [SO^H];
нитрацидийсульфат
[NO (ОНЫ [SO4H] ~ H2NO+ 4. HSO^;
O2NOH + 2HSO4H ^ [ОДОНдеОаНк;
нитраиидийдиоульфат
136
Механизм нитровпния ароматических соединений
[N (ОН),] [SO4H]2 - H3NO3++ + 2HSO-
Подобным же образом, как показал Ганч, происходит и взаимо-
взаимодействие азотной кислоты с хлорной кислотой с образованием
солей (нитрацидийперхлоратов)
OaNOH + НСЮ4 -«¦ [NO (ОНJ] СЮ4;
O2NOH + 2НСЮ4 - [N (ОН)з] (СЮ4)а.
Эти соединения, являющиеся очень стойкими, выделены Ган-
чем при смешении азотной кислоты с безводной хлорной кис-
кислотой в виде бесцветных твердых продуктов. Реакция про-
проводилась при сильном охлаждении и перемешивании. После
перекристаллизации моноперхлората (из азотной кислоты)
и диперхлората (из хлорной кислоты) Ганч получил эти про-
продукты в чистом виде в форме игольчатых кристаллов.
Используя данные Ганча и Шеффера о строении азотной
кислоты Фармер [29] приписывает этерифицирующую и ни-
нитрующую функцию азотной кислоты ее псевдоформе. Азотная
кислота легко переходит в псевдоформу. Это свойство резко
отличает ее от других сильных кислот, например от серной
кислоты, так как, согласно Ганчу, способность перехода
в псевдоформу у сильных кислот, в противоположность сла-
слабым кислотам, выражена менее заметно. Из всех состояний
азотной кислоты нитрующая функция присуща только псевдо-
псевдоформе.
Максимальное значение константы скорости нитрования
при определенном содержании воды в серной кислоте Фармер
объясняет следующим образом: при увеличении относительного
содержания серной кислоты в нитрующей смеси (H2SO4+
+ НРГОз) содержание псевдоформы вначале возрастает, но
начинает уменьшаться при значительном избытке серной кис-
кислоты вследствие образования за счет этой псевдоформы неко-
некоторого количества нитрацидийсульфата. Поэтому нитрующая
активность смеси по мере возрастания содержания в ней сер-
серной кислоты вначале увеличивается, но, достигнув известного
максимума, начинает уменьшаться.
Механизм нитрования ароматических соединений
137
Кинетика реакции нитрования изучалась рядом исследо-
исследователей. Мартинсен считает, что реакция нитрования аромати-
ароматических соединений эквимолекулярным количеством азотной
кислоты в избытке серной кислоты является бимолекулярной
и что скорость ее прямо пропорциональна концентрации как
азотной кислоты, так и нитруемого соединения [30].
Лауэр и Одда [31] при изучении кинетики реакции нитро-
нитрования антрахинона азотной кислотой в водных растворах сер-
серной кислоты в пределах концентраций последней от 87 до
95,6% нашли, что максимальная скорость реакции соответ-
соответствует концентрации 89%. Это связано с наличием в нитрую-
нитрующей смеси различных форм азотной кислоты в зависимости
от концентрации серной кислоты. Как мы увидим дальше,
концентрация серной кислоты и воды не является единственным
решающим фактором для скорости нитрования.
Исходя из полученных результатов, Лауэр и Одда допу-
допускают, что в смесях азотной кислоты с серной в присутствии
воды нитрующим агентом является форма азотной кислоты
иная, чем в смесях азотной кислоты с безводной серной
кислотой.
Анализируя полученные результаты, Лауэр и Одда при-
приходят к следующим выводам:
1) при концентрациях серной кислоты ниже 89% азотная
кислота состоит из двух модификаций: истинной (Н—РГОз)
и псевдоазотной (НО — NO2) кислот, причем нитрующим аген-
агентом является только псевдоазотная кислота, содержание ко-
которой уменьшается с разбавлением водой;
2) при концентрациях серной кислоты от 89 до 98% азот-
азотная кислота состоит в основном из псевдокислоты наряду с не-
некоторым количеством нитрацидийсульфата [NO(OHJ](SO4H)r
содержание которого повышается с увеличением концентрации
H2SO4;
3) при повышении концентрации серной кислоты от 98
до 100% содержание нитрацидийсульфата в смеси сильно
возрастает;
4) в смеси азотной и дымящей серной кислот нитрующим
агентом является исключительно нитрацидийсульфат.
138
Механизм нитрования ароматических соединений
Тот факт, что реакция нитрования в безводной серной кис-
кислоте протекает с меньшей скоростью, чем в водных растворах
этой кислоты, авторы объясняют тем, что азот в ионе нитра-
цидия, являющемся в данном случае нитрующим агентом, бо-
более «защищен», чем в псевдоазотной кислоте, а именно: тремя
гидроксильными группами.
В водных растворах с концентрацией серной кислоты ниже
89% понижение скорости нитрования по мере дальнейшего
разбавления кислоты водой объясняется уменьшением содер-
содержания псевдоазотной кислоты, являющейся нитрующим аген-
агентом. Понижение скорости нитрования при переходе к более
высоким концентрациям серной кислоты объясняется умень-
уменьшением содержания псевдоазотной кислоты вследствие ча-
частичной замены последней нитрацидийсульфатом.
Таким образом, интенсивность нитрования в водных ра-
растворах серной кислоты определяется содержанием псёвдо-
азотной кислоты, которое максимально при концентрации,
равной 89%.
Лауэр.и Одда изучили также реакцию нитрования нитро-
нитробензола азотной кислотой в 90 и 100%-ной серной, кислоте.
Опыты показали, что основным продуктом реакции является
м-динитробензол; при увеличении концентрации серной кис-
кислоты выход о-динитробензола повышается, а выход м- и
п-изомеров понижается.
Механизм реакции нитрования ароматических соединений
азотной кислотой в водных растворах серной кислоты, по мне-
мнению авторов, состоит в том, что молекула псевдоазотной кисло-
кислоты, предварительно распадающаяся на NO2 и ОН, присоеди-
присоединяется к двойной связи ароматического ядра (причем группа
NO2 присоединяется к анионоидному атому углерода). Нитро-
производное образуется во второй стадии нитрования посред-
посредством отщепления воды от комплекса НГЮз с ароматическим
соединением.
При нитровании в безводных растворах серной кислоты
механизм реакции состоит в присоединении нитрацидийсуль-
фата по двойной связи с последующим отщеплением воды и
серной кислоты:
Механизм нитрования ароматических соединений
139
-MH2NO3)+ (HS04r
О NO2
+ H20 4- H2SO4
Оригинальную точку зрения на механизм реакции нитрова-
нитрования ароматических соединений выдвигает в своих работах фран-
французский исследователь Ланц [32]. Он рассматривает нитрование
как процесс, связанный с кислотно-основным равновесием
в системе, исходя при этом из представлений Бренстедта.
Бренстедт [33] определяет «кислоту» как вещество, способ-
способное дать протоны другому веществу, которое он называет
«основанием». Обратимая реакция, которая при этом возни-
возникает, дает начало новому «основанию» и новой «кислоте».
Кислота A) + основание A) ±; основание B) + кислота B).
По Бренстедту, свойства «кислоты» и «основания» про-
проявляются только в том случае, если кислота и основание на-
находятся вместе. Некоторые вещества в присутствии некоторых
кислот имеют свойства оснований, а в присутствии некоторых
оснований обнаруживают свойства кислот. Например, органи-
органические карбоновые кислоты, фосфорная и азотная, которые
являются кислотами по отношению к обычным основаниям,
становятся уже «основаниями» в присутствии более энергич-
энергичных кислот — серной, пиросерной и хлорной.
При действии серной кислоты на азотную возникает равно-
равновесие, которое, принимая концепцию Ганча, можно изобра-
изобразить следующим образом:
2H2SO4 + HNO3 -Z_ 2HSO7 +(ОНK N++.
Иногда вещества могут дать равновесие кислота — осно-
основание без участия других соединений, т. е. в гомогенном
140
Механизм нитрования ароматических соединений
состоянии или в индифферентном растворителе: вещество одно-
одновременно может быть и акцептором и донором протонов.
Хорошо известным примером таких веществ является вода, ко-
которая может дать равновесную систему с участием двух ее
молекул
Н2О + Н2О п ОН" + Н3О+.
Такими же свойствами обладает и аммиак
NH3 + NH3 Z
NH+.
Установленные Ганчем равновесия в гомогенной серной кис-
кислоте, определяющие ее химические свойства, можно также
рассматривать с точки зрения Бренстедта — Ланца, предпо-
предполагая, что они возникли в результате взаимодействия двух мо-
молекул («кислоты» и «основания»); при этом образуются отри-
отрицательный ион HSO4 и положительный ион H3SO4+
H2SO4 + H2SO4 -Z HS07 + H3S°4~
HSOji
Взаимодействие молекул может происходить и по другому
уравнению
H2SO4 + 2H2SO4 ~ 2HSO~ + H4SO4+"+
2HSO4H
Влияние добавления воды на реакции, происходящие в сре-
среде серной кислоты, Ланц объясняет тем, что вода образует
гидратированные ионы, например ион (SO4H3-H2O)+ или
S(OHM+. Посредством потери протона этот ион превращается
в кислоту H2SO4-H2O, существование которой доказывается
кривыми температур плавления для системы H2SO4 — Н2О.
Образование гидратированных ионов вызывает уменьшение
количества ионов H3SO4+.
Переходя к реакции нитрования азотной кислотой в среде
серной кислоты, Ланц предполагает следующий механизм
этой реакции в зависимости от изменений концентраций воды
и серной кислоты.
В моногидрате азотная кислота находится полностью в фор-
Механизм нитрования ароматических соединений
141
ме соли нитрацидия, что может быть изображено уравнением,
которое мы уже приводили выше:
2H2SO4 + HNO3 ~ 2 (HSO4)" + (OHKN++. A)
При добавлении воды образуется гидратированная серная
кислота H2SO4-wH2O (вероятно, п = 1); последняя, являясь
основанием по отношению к серной кислоте, приводит к воз-
возникновению нового равновесия основание — кислота, которое
может быть выражено уравнением
H2SO4 + iH2SO4-H2O -
¦nH2SO4-H3O+.
B)
В результате последней реакции происходит образование
нового количества ионов HS04~, что вызывает сдвиг равно-
равновесия в уравнении A) слева направо и, соответственно, уве-
увеличение количества ионов (OH)sN++ и уменьшение количества
свободной (недиссоциированной) кислоты. При введении но-
нового количества воды может наступить момент, когда среда
будет содержать сильно гидратированную серную кислоту или
даже свободную воду, являющиеся веществами, относительно
сильно основными. Последние вызывают новое равновесие,
в котором свободная (недиссоциированная) азотная кислота
действует, как кислота, образуя ионы 1Ч0з~. Например, в при-
присутствии свободной воды имеет место следующий процесс:
HNO3
Н3О+,
C).
который приводит к уменьшению количества неионизирован-
ной свободной кислоты.
Как показывают уравнения A)—C), недиссоциированная
кислота не может существовать в среде как слишком «кислой»,
т. е. содержащей мало воды [уравнение A)], так и слишком
«щелочной», т. е. с содержанием большого количества воды
[уравнение C)].
Исследуя реакции нитрования нафталинсульфоновых кис-
кислот нитрующей смесью при различных концентрациях серной
кислоты, Ланц установил, что при концентрации H2SO4 90%
и достаточном избытке ЕВДОз у нафталиндисульфоновых кис-
кислот вступают в ядро две нитрогруппы, у нафталинтрисульфо-
142
Механизм нитрования ароматических соединений
новых — только одна нитрогруппа, а нафталинтетрасульфо-
новые кислоты в этих условиях не нитруются. Скорость реак-
реакции нитрования при вступлении последней нитрогруппы
максимальна при концентрации серной кислоты от 85 до 90%
в зависимости от природы нитруемого соединения и условий
проведения нитрования. При повышении содержания HjSO*
скорость реакции очень быстро убывает и при концентрации
100% практически равна нулю (при нормальной температуре).
Анализируя результаты своих опытов и применяя к ним
представления Бренстедта, Ланц приходит к следующим вы-
выводам .
1. Нитруемые соединения не пассивны и участвуют в рав-
равновесии кислота — основание посредством присоединения про-
протона или положительного иона. Скорость реакции нитрования,
по этой причине, зависит не только от активности нитрующего
агента, но и от строения нитруемого соединения: чем больше
последнее содержит групп, сообщающих ему основной харак-
характер, тем оно более реакционноспособно по отношению к «кис-
«кислоте» (в данном случае нитрующему агенту).
2. При нитровании азотной кислотой в водном растворе
серной кислоты нитрующим агентом является недиссоцииро-
ванная молекула HNCh; при нитровании в безводной серной
кислоте нитрующим агентом является ион нитрацидия.
Гезерингтон и Мессон [34] на основании кинетических
данных также пришли к выводу, что в нитрующей смеси актив-
активным нитрующим агентом является недиссоциированная моле-
молекула азотной кислоты, однако, в отличие от Ланца, они по-
полагают, что азотная кислота вступает в реакцию не с иони-
ионизированным ароматическим соединением, а с комплексным
катионом, образуемым из ароматического соединения и азот-
азотной кислоты. Изучая реакцию нитрования нитробензола
смесью серной и азотной кислот при различных концентрациях
компонентов этой смеси (H2SO4, HNO3 и Н2О), Гезерингтон
и Мессон установили, что реакция прекращается еще до мо-
момента полного израсходования нитробензола и азотной кисло-
кислоты в реакционной смеси, если количество находящейся в по-
последней серной кислоты недостаточно для образования с водой,
Механизм нитрования ароматических соединений
143
присутствующей в начале реакции и возникающей в резуль-
результате нитрования, гидрата состава H2SO4H2O. Критической
точкой нитрующей смеси является содержание серной кислоты
по отношению к смеси кислот (в молях), равное 0,5. При со-
содержании H2SO4, меньшем этого количества, азотная кислота
участвует в нитровании только частично; при более высокой
концентрации H2SO4 азотная кислота полностью нитрует
нитробензол. Нитрование нитротолуола, которое в общем
протекает со значительно большей скоростью, чем нитрование
нитробензола, характеризуется аналогичной зависимостью ско-
скорости нитрования от концентрации H2SO4.
Полученные Гезерингтоном и Мессоном результаты при-
привели их к выводу, что первое условие, необходимое для того,
чтобы реакция приобрела заметную скорость,— это сдвиг
равновесия между компонентами нитрующей смеси, опреде-
определяемого уравнением A), вправо
H2SO4 + (H3O)++NO- zl (H3O)++(HSO4)" + HNO3.
A)
Основываясь далее на опубликованных ранее работах
одного из них [35], Гезерингтон и Мессон полагают, что ни-
нитробензол может образовать комплексы с H2SO4 и HNO3 [см.
уравнения B) и C)]; дальнейший механизм реакции состоит
в том, что катион этих комплексов (CeH5NO2H)+ вступает
во взаимодействие с HNO3, образуя динитробензол [урав-
[уравнение EI:
H2SO4 + C6H5NO2 Z. (C6H5NO2-H)* (HSO4)'; B)
HNO3 + CeH5NO2 t- (C6H5NO2.H>* (NO3)'; C)
(CeH6NO2-H)- + H2O ^ CeH5NO2 + (H3O)\- D)
(CeH5NO2• H)- + HNO3 -X C6H4 (NO4J + (HSO)\ E)
При израсходовании серной кислоты равновесие, выра-
выражаемое уравнением A), сдвигается влево, что приводит к по-
понижению концентрации безводной азотной кислоты. Сильно
замедляющее действие воды, обнаруживаемое эксперимен-
экспериментально, объясняется тем, что вода не только гидратирует
кислоты, но и реагирует с органическим катионом комплексов
нитробензола с безводными кислотами (CeH5NO2H)' [урав-
144
нитрования ароматических соединений
нение D)],, удаляя этот ион из сферы; реакции и тем самым
препятствуя образованию динитробензола по уравнению E).
Таким образом, по представлению Гезерингтона и Мессона,
нитрующим^ агентом является недиссоциированная молекула
азотной кислоты, которая не только вступает в реакцию с обра-
образованием комплекса с нитробензолом, но и реагирует 6 актив-
активным ионом этого комплекса (CeH6NO2H)', давая соответствую-
соответствующее динитросоединение, Роль серной кислоты заключается
в том, что она препятствует диссоциации азотной кислоты и
участвует, наравне о ааотной кислотой, в возникновении актив-
активного иона (CeHUNOaH)'.
М. Усанович с сотрудниками [36], исследуя электропровод-
электропроводность двойных систем, одним из компонентов которых является
HNOs, нашел, что действие этих смесей определяется амфо-
терной природой азотной кислоты и кислотно-основными функ-
функциями компонентов. Так, например, по отношению ц воде
HNOs проявляет свойства сильной кислоты, по отношению
же к H2SO4 она ведет себя, как вещество с резко выраженными
основными функциями. Опыты показали, что HNO? образует
двойное соединение с СНзСООН и CClsCpOH, представляя,
невидимому, кислоту по отношению к СНзСООН и основание
по отношению к ССЬСООН; с СН2С1СООН и СНС12СООН
азотная кислота совсем не реагирует, что указывает на
отсутствие у этих моно- и дихлорзамещенных уксусных кис-
кислот кислотно-основных функций по отношению к HNQs.
При рассмотрении действия нитрующих смесей на арома-
ароматические углеводороды обнаруживается интересный факт, что
нитрованию этих соединений способствует прибавление к HNO3
таких веществ; Как НгЭО^ или H3PO,i, т. е. веществ, по отно-
отношению к которым HNO3 является основанием; наоборот, при-
прибавление к HNO3 веществ,, по отношению к которым она являет-
является кислотой, как, например, воды, нитробензола и других,
препятствует нитрованию ароматических соединений.
Так как HNO8 при взаимодействии с кислотами образует
катионы нитрацидия JNO(OHJ] и [N(OH)sl" , а с основа-
основаниями— нитрат-анион, указанный выше факт свидетельствует
о том, что нитрующим агентом при нитровании ароматических
Механизм нитрбриния ароматических соединений
145
соединений служат катионы нитрацидия, нитрат^-аннои же
является инертным. Обратные отношения наблюдаются при
нитровании алифатических соединений, а именно: разбавле-
разбавление водой ИЛи уксусной кислотой, т. е. веществами, для ко-
которых HNOe является кислотой, способствует нитрованию
этих углеводородов. Это указывает, что нитрующим агентом
по отношению к алифатическим соединениям является анион
:
Для проверки высказанного им взгляда относительно дей-
действия нитрующих смесей М. Уеанович исследовал в трех се-
сериях опытов нитрование ароматических углеводородов (на при-
примере толуола) в присутствии растворителей трех родов, из
которых одни — основания, другие—кислоты, третьи—ин-
третьи—индифферентны по отношению к HNOa.
В первой серии опытов нитрование толуола производилось
в присутствии уксусной кийлоты и нитробензола, причем
варьировались отношения компонентов нитрующей смеси.
Опыты, проводившиеся на водяной бане при 90—92° в Течение
3,5 часа, показали, что при действии HNOe в присутствии
СНзСООН и CflHiNp^ нитруется не только ароматическое
ядро, но и боковая цепь (ср. с данными М. И. Коновалова и
П. П, Щорыгина, гл. III, § 2)/ Образование фенилнитро-
метана увеличивается (и, соответственно, уменьшается выход
нитропродуктов, замещенных в ядре) с увеличением концен-
концентрации растворителей. В растворе уксусной кислоты наиболь-
наибольший выход фенилнитрометана получен с нитрующей смесью,
состоящей иэ 20% HNOj и 80% СНзСООН, а в растворе нитро-
нитробензола максимальный выход фенилнитрометана дает смесь
30% НШз и 70% CeH6NO2. Одновременно с фенилнитроме-
таном получаются также ди- и полинитросоединения. При
нитровании толуола смесями, содержащими 80—90% СНзСООН
и 5—10% азотной кислоты, образуются почти исключительно
нитропродукты, замещенные группой NO2 в ядре. Это объяс-
объясняется тем, что в первом случае нитрование концентрированной
азотной кислотой ядра идет со значительно большей скоростью,
чем боковой цепи; во втором случае,; при наличии 5—0%
HNOej относительное количество азотной кислоты недостаточно
10 А. В. Топчиев
146
Механизм нитрования ароматических соединений
для нитрования боковой цепи. При действии на толуол
азотной кислоты в присутствии уксусной кислоты или нитро-
нитробензола получается, кроме нитропродуктов, также и бензой-
бензойная кислота; это свидетельствует о том, что азотная кислота
при этих условиях является также окислителем, особенно при
большом избытке растворителя.
Во второй серии опытов нитрование толуола проводилось
в присутствии серной и трихлоруксусной кислот (при нагре-
нагревании на водяной бане до 90—95° в течение 3,5 часа). Эти опы-
опыты показали, что в присутствии указанных выше раствори-
растворителей, играющих роль кислот по отношению к HNOs, проис-
происходит главным образом нитрование ядра, причем выходы ни-
нитротолуола и динитротолуола (последний образуется только
при нитровании смесью HNOs и H2SO4) повышаются с увели-
увеличением относительного количества растворителя.
При нитровании смесью HNO3— H2SOa максимальный
выход нитротолуола получается при содержании в смеси от 60
до 40% HNOs. При дальнейшем понижении концентрации
азотной кислоты выход нитротолуола резко падает, и при кон-
концентрации 15% и ниже единственным продуктом реакции яв-
является динитротолуол. При нитровании смесью HNOe—
CClsCOOH динитротолуол не образуется (выход нитротолуола
цри этом выше, чем при нитровании смесью HNOe и H2SOi).
Влияние растворителей на процесс нитрования очень зна-
значительно, и сопоставление опытов первой и второй серий, та-
таким образом, приводит к выводу, что растворители, являющиеся
кислотами по отношению к HNOe, направляют реакцию в бен-
бензольное ядро (нитрование катионами нитрацидия), а раство-
растворители, имеющие основные свойства по отношению к HNO3,
способствуют нитрованию боковой цепи (нитрование анио-
анионом no;,).
Опыты третьей серии по нитрованию толуола в присутствии
индифферентных растворителей — монохлоруксусной кисло-
кислоты и этилнитрата — показали, что при этих условиях ни-
нитруется не только ядро, но и боковая цепь. При увеличении
относительного количества растворителя нитрующая способ-
способность азотной кислоты падает и притом в большей степени,
Механизм нитрования ароматических соединений
147
чем это соответствует уменьшению концентрации HNO» в рас-
растворе. Это указывает на то, что нитрование идет за счет ионов
N0^", H2NO^" и H3NO++, концентрация которых с разведением
быстро убывает, а не за счет недиссоциированной молекулы
азотной кислоты (в последнем случае абсолютные выходы ни-
нитропродуктов должны были быть прямо пропорциональны
концентрации азотной кислоты).
М. Усанович объясняет механизм реакции нитрования аро-
ароматических соединений следующим образом. Ароматические
соединения, вследствие координационной ненасыщенности
атомов углерода, могут присоединять HNOs, причем коорди-
координационная связь осуществляется за счет пары электронов
координационно ненасыщенных атомов углерода. Ион N0^
не будет присоединяться к бензолу вследствие своего отри-
отрицательного заряда. Молекулы азотной кислоты и катионы
нитрацидия могут присоединяться к ароматическому ядру,
причем с увеличением положительного заряда при переходе
от HNOs к N(OH)++эта способность должна возрастать. При-
Присоединение HNO3, NO(OH)^ и N^OH).,*" к одному из атомов
углерода бензольного кольца должно увеличить подвижность
водорода, стоящего при этом атоме углерода. Этот водород
отщепляется вместе с одним из гидроксилов, входящих в со-
состав иона нитрацидия, и образует молекулу воды, например:
СН
СН
не"
СН
НС!,
СН
"+н2о
A)
СН
СН
Второй продукт этой реакции [уравнение A)] — комплексный
катион C6HBN(OH)++ при разбавлении реакционной смеси водой
дает нитробензол [уравнение B)]:
CeH5N
2Н2О - CeH5NO2 + 2 (Н3О)+.
B)
При нитровании же алифатических углеводородов, не имею-
имеющих координационно ненасыщенных атомов углерода, ион
может присоединиться к RCHs, но при этом он должен*
10*
148
Механизм нитрования ароматических соединений
предварительно вытеснить водород и занять его место
RCH3 + NO7 Z- RCH2NO2 (
Ввиду большой затраты энергии на эту перегруппировку обра-
образовавшееся соединение неустойчиво и распадается в обратном
направлении. Но в кислой среде реакция может стать необра-
необратимой, так как образующиеся комплексные анионы могут
отщеплять гидроксил, который связывается ионом гидроксония
RCH2NOa (ОН)" + Н8О+ -v RCH2NO2 + 2Н2О.
Предлагаемая М. Усановичем трактовка реакции нитрования
разъясняет известный факт, что водные растворы нитратов,
несмотря на содержащиеся в них ионы NCb", не способны всту-
вступать с углеводородами в реакцию Коновалова.
В связи с представлениями о роли нитрат-иона в реакции
нитрования следует отметить также работу Гальбана и Эйзен-
бранда [28], исследовавших спектры поглощения нитратов и
растворов азотной кислоты различных концентраций в воде и
других растворителях (серной, хлорной, фосфорной, уксусной
кислотах).
По данным этих авторов, спектры сильно разбавленных
водных растворов HNOe обнаруживают большое сходство со
спектрами нитратов, т. е. светопоглощение разбавленных рас-
растворов обусловливается присутствием ионов NO3".
При дальнейшем повышении концентрации HNO3 спектры
сохраняют свое сходство со спектрами нитратов до концентра-
концентрации 10 н. F0% HNOs); при зтой концентрации происходит
существенное изменение характера спектра, что указывает
на переход нитратной (ионной) формы азотной кислоты в дру-
другую форму. Изучение парциального давления паров
азотной кислоты над водными растворами последней
показывает, что при концентрациях около 10 н. содержание
недиссоциированных молекул азотной кислоты еще очень
незначительно. Гальбан и Эйзенбранд поэтому предполагают,
что изменение спектра При концентрации 10 н. обусловливается
образованием ассоциированных или же комплексных ионов.
Механизм нитрования ароматических соединений
149
Если принять первое допущение, которое более вероятно, то
в водных растворах HNOe средней концентрации должно су-
существовать равновесие, которое выражается уравнением
Н3О* + NO3 Z H3O*NO; %. HNO3 + Н2О
ассоци-
ассоциированная
ионная пара
Изучение спектров растворов HNOs в эфире и уксусной кисло-
кислоте привело авторов к выводу, что в зтих растворах азотная
кислота состоит главным образом (на 60%) из оптически одно-
однородных ассоциированных ионов (HsO+NOs~) или комплексных
ионов (H2NO3+); остальная часть азотной кислоты находится
в недиссоциированной форме («псевдокислота»).
При исследовании спектров растворов HNOs в серной кисло-
кислоте Гальбан и Эйзенбранд обнаружили, что если исходить из
водных растворов серной кислоты и постепенно повышать
концентрацию последней, то наблюдаются такие же законо-
закономерности, как и в водных растворах азотной кислоты. При
приближении к более высоким концентрациям серной кислоты
спектры становятся аналогичными спектрам эфиров. В момент
перехода к безводной серной кислоте (если, например, повы-
повышать концентрацию H2SO4 постепенным добавлением ЭОз)
происходит внезапное падение поглощения. В этом
случае спектр, по мнению Гальбана и Эйзенбранда, соответ-
соответствует не нитрацидийсульфату, а смешанному ангидриду сер-
серной и азотной кислот. Следует отметить, что В. В. Марков-
ников [37] значительно ранее высказывал соображения о роли
в процессе нитрования смешанного ангидрида серной и азотной
кислот (раствор нитрооерной кислоты в избытке серной кис-
кислоты), образующегося при нитровании в нитрующей смеси:
H2S04 + HNO8 - HOSOaONOa + H2O.
Вследствие высокой реакционной способности остатка азотной
кислоты, содержащегося в нитросерной кислоте, нитрующая
смесь является сильнодействующим реагентом нитрования.
Образование смешанного ангидрида доказывается выделением
тепла при смешении кислот и действием нитрующей смеси на
ISO
Мвтгниат нитрования ароматических соединений
органические соединения. В те> время как азотная кислота
реагирует с третичными углеводородами Жирного ряда уже при
0°, нитрующая смесь действует на последние лишь при нагре-
нагревании. С другой стороны, ароматические соединения значитель-
значительно легче нитруются смесью кислот, чем азотной кислотой.
В. В. Марковников объясняет это большей по сравнению
с азотной кислотой способностью нитрогруппы смешанного
ангидрида вступать в реакции двойного обмена.
Нитрование нитросерной кислотой ио В. В. Марковтимову
протекает согласно схеме
ОН
2
RH — RN02
ONOj
Однако образование промежуточного лродукта им не было
доказано.
Совершенно своеобразно подошли к вопросу о механизме
нитрования ароматических соединений азотной кислотой Кие-
менц и Шеллер [38]* которые рассматривают нитрование как
окислительно-восстановитеЛыиый процесс (этой же точки зре-
зрения придерживается Фергюсш [39]). При этом они исходят
ИЗ сравнения двух следующих процессов:
HN03 + 2Н - HNO2 + Н2О;
HNO8 + RH -+ RNO2 + Н20.
При изучении кинетики нитрования фенола азотной кисло-
кислотой в водных растворах, а также в среде эфира они нащли, гато
реакция каталитически ускоряется не только азотистой кисло-
кислотой, как показали Мартинсен [30] и другие исследователи, но
и окислами азота, и притом последними в значительно боль-
большей степени. На основании изучения электропроводности
нитрующих растворов Клеменц и Шеллер пришли к выводу,
что каталитическое действие окислов азота объясняется их
участием в образовании: промежуточного соединения (s-кисло-
ты), которое и является нитрующим агентом (при этом реакция
протекает с регенерацией NOZ):
2HNO3 + Щ^ H2N3OS (в-КйСлбтй); A)
Механизм нитрования ароматическгсх соединений
2RH + HaN3O8
NO2 + 2HaO.
B)
По мнению авторов, этот же промежуточный продукт, играю-
играющий роль активного агента, образуется и при участии азоти-
азотистой кислоты, которая является источником NO2.
Таким образом, с точки зрения Клеменца и Шеллера нитро-
нитрование фенола в водном и эфирном растворах представляет
собой автокаталйтический процесс *: наряду с нитрованием
происходят Окислительные реакции, которые приводят к воз-
возникновению окислов азота и азотистой кислоты; последние
участвуют в образовании собственно нитрующего агента —
s-кислоты. Этот автокаталитический процесс аналогичен реакции
окисления органических соединений перманганатом в при-
присутствии H2SO4.
Клеменц и Шеллер решили экспериментально проверить
допущение некоторых исследователей о том, что роль азоти-
азотистой кислоты заключается в нитрозировании фенола; по этому
представлению, образующийся таким образом нитрозофенод
окисляется далее в нитрофенол, причем одновременно про-
происходит регенерация HNO2
CeHsOH + HNO2 -+ CeH4 (NO) ОН + Н2О;
СвН4 (N0) ОН
CeH4 (NO) ОН
нитровофеяол
- CeH4 (NO2) ОН 4- HlNO2.
Опыты Клеменца и Шеллера по окислению нитроэофенола
азотной кислотой показали, однако, что эта реакция носит
автокаталитический характер, а имейно: процесб вначале про-
протекает медленно, затем скорость реакции быстро возрастает,
посйе чего опять наступает замедление. С другой стороны,
при нитровании фенола в Присутствии нитрозофенола они не
могли обнаружить положительного влияния Последнего на
реакцию нитрования. На основании этих результатов Кле-
Клеменц и Шеллер пришли к выводу, что нитрование фенола не
проходит через стадию нитрозофенола.
При исследовании нитрования фенола азотной кислйтой
в растворе концентрированной серной кислоты эти авторы на-
нашли, что реакция не ускоряется каталитически при добав-
• См. выше гл. I о нитровании фенолов.
152
Механизм нитрования ароматических соединений
лении к нитрующей смеси азотистой кислоты и окислов азота;
это указывало, что нитрование в данном случае осуществляется
не s-кислотой, а каким-то другим нитрующим агентом.
Клеменц и Шеллер установили, что константы скорости
реакции одинаковы при нитровании в серной кислоте как азот-
азотной кислотой, так и азотным ангидридом, если в последнем
случае расчет вести на N2Os/2. В обоих случаях реакции являют-
являются бимолекулярными. Дальнейшие исследования привели этих
химиков к выводу, что нитрование в концентрированной сер-
серной кислоте осуществляется нитрующим агентом X, который
находится в равновесии с HN03 и N2O6:
N2O5/2
U
H
it
HNO3
Основываясь на данных Вибо [40], КлемеНц и Шеллер при-
принимают такой же механизм реакции для нитрования и в среде
уксусной кислоты и в среде уксусного ангидрида *.
В связи с выдвинутым Клеменцом и Шеллером механиз-
механизмом нитрования азотной кислотой в растворе серной кислоты
отметим более ранние работы А. В. Сапожникова [41 ], который
объясняет нитрующее действие смеси HNO3 -j- H2SO4 при со-
содержании H2SO4 от 70 до 90% присутствием в реакционной
среде азотного ангидрида, образующегося в результате де-
дегидратации азотной кислоты.
При исследовании упругости паров смесей серной и азотной
кислот с различными концентрациями компонентов (HaSO4,
HNOs и Н2О) А. В. Сапожников нашел, что упругость паров
азотной кислоты постепенно повышается при увеличении кон-
концентрации H2SO4 в нитрующей смеси, достигая своего макси-
максимального значения при содержании H2SO4 около 60%. А. В. Са-
Сапожников объясняет это повышение упругости паров азотной
кислоты увеличением числа частиц свободной HNOs, образую-
образующейся в результате дегидратирующего действия серной кисло-
• См. выше, гл. 1, § 3.
Механизм нитрования ароматических соединений
153
ты на гидраты азотной кислоты
HNOs-to Н2О + H2SO4 -+ HNO8-(m — n) H2O + H2SO4-n H2O.
При дальнейшем повышении содержания серной кислоты про-
происходит понижение упругости паров азотной кислоты, особен-
особенно заметное при концентрации H2SO4 около 90%, что вызы-
вызывается, по мнению А. В. Сапожникова, более глубоким деги-
дегидратирующим действием серной кислоты на молекулу азотной
кислоты, приводящим уже к превращению последней в азот-
азотный ангидрид. На примере нитрования целлюлозы А. В. Са-
Сапожников установил, что нитрующая смесь, соответствующая
максимальной упругости паров азотной кислоты, обладает
максимальной нитрующей способностью.
'По Шааршмидту [42], механизм нитрования смесью
HNO3 + H2SO« заключается в дегидратации азотной кислоты
до азотного ангидрида, который затем присоединяется к бен-
бензольному ЯДРУ' Образующееся при зтом дигидропроизводаое
бензола
представляет собой неустойчивое соединение и распадается на
нитробензол и азотную кислоту. Последняя снова подвергается
действию серной кислоты с образованием ангидрида. Шаар-
шмидт дает следующую схему нитрования азотной кислотой
ароматических соединений в растворе серной кислоты:
I-
N02 -i
HNOs
\
¦II
¦ C,H4NOS
Допущение, что азотная кислота, а не N2O5, присоединяется
154
Механизм нитрования ароматических соединений
к бензольному ядру, является, по мнению ШааршШдта;
вероятным, так как оно не объясняет роли в этом процессе
серной кислоты, которая не участвует, по его мнению, в обра-
образований комплекса с беНЗОлом. Для Доказательства влияния
окислов аЗОта на процесс нитрования Шааршмидт> в качестве
примера приводит нитрование фенола, которое ускоряется
окислами азота и, наоборот, замедляется азотнокислой р^тью.
Тормозящее действие азотнокислой ртути вызывается, iku его
мнению, тем, что они препятствует образованию ОкиСлШ Шб-
та. При нитровании же в водных растворах и в эфире йёабхд-
дймо добавлять извне окислы аЗОта или HNO2, так как в этих
условиях они, в Отличие о* нитрования в концентрированной
серной кислоте, не могут Образоваться из HNO» ввиду Отсут-
Отсутствия дегидратирующего агента *.'
А. Й. Титов [433, на оснований многочисленных исследо-
исследований нитрования ароматических соединений аЗотЙОЙ ШсМ-
тОЙ, разработал интересную гипотезу о механизме этого нитро-
нитрования. Согласно этой гипотезе, нитрование ароматических
углеводородов протекает через стадию первичного взаимодей-
взаимодействия ароматического ядра с различными кислородными соеди-
соединениями азота, находящимися в сфере реакции и возникаю-
возникающими из них катионами. В обычной азотной кислоте имеются,
по его мнению, следующие частицы, обладающие электро-
фильНостью: . i ,
О О
— О—
о
ч
* Позднейшие Исследований Брннёта, Бранда й Вильямса [44] ие
подтвердили данных Клеменца й Шеллера о существовании в нитрующей
смеси N 2О5 в виде недиссоциировапной молекулы (что соответствует также,
как мы видели выше, взглядам А. В. Сапожникова и Шяаршмидта). При
изучении электролиза раствора N2O5 в Олеуме Беннет и Бранд установили,
что N2O5 находится в этом растворе в ионизированном состоянии. Ре-
Результаты опытов Клеменца и Шеллера могу* быть объяснены тем, что
в среде HaSO4 диссоциация азотного ангидрида приводит к образованию
тех яке ионов, производящих нитрующее действие, что и диссоциация
авотйой кислоты. . ,
нитрования арвматичесИш соединений
155
О
ВО — N [N =» О]
Движущей силой реакций нитрозирования я нитрАалия,
способствующей образованию промежуточных комплексов, eB"
ляется, согласно представлению А. И. Титова» энергетический
выигрыш при переходе электронов от ароматического соеди-
соединения к атомам азота нитрозиру^мцих и щитрующих агейтов
через соответствующие атомы углерода ядре.
Необходимо© для образования промежуточного, кОмпАекок
различие в срсщстве к электроду зависит О* дростр«нс#»енной
доступности и координационной ненасыщеннсхспи -жшЩщщвж
я нитрозируюцдах агентов. i ;
Так как по оиытным данным координационное число азота
в его кислородных соединениях и© превышает 3, атом азота
в молекуле аэдтной кислоты является координационно насы-
насыщенным, обладающим лишь слабой способностью к проявле-
проявлению эдектрофицьиостщ что, по мнению A. Hi Титайа,
няет образование комплексов азотной кислоты с
ми соединениями.
С другой (чтгороны, атомы азота в указанных выше.;'
ниях, обладающие координационными числами iw^y^ify* Дей-
Действенно проявлять свой электрофильный характер ж вступать
во взаимодействие с соответствующими нуклеофильными ато-
атомами углерода ароматических ядер. На этом оСНЬвайиидсобен-
но высокой активностью должны обладать нитрозил-катион
JN = О] и нитрозилнитратная форма димера двуокиси азота
.0
— О —
Высокой реакционной способностью должен также обладать
мономер двуокиси аэота О = N -» О (при образовании первич-
первичных комплексов этого мономера с $р>матйческими щщтъ-
ниями получается дополнительный; выигрыш энергии; \0 счет
обменного взаимодействия электрода • N0& с
электронами ^-связей
156
Механизм нитрования ароматических соединений
На основании указанного выше теоретического анализа
А. И. Титов пришел к выводу, что при нитровании азотной
кислотой реакция протекает через стадию взаимодействия аро-
ароматического соединения с нитрозилнитратной или мономерной
формой двуокиси азота или с возникающими из них катионами.
Азотная кислота служит лишь источником двуокиси азота,
а также регенерирует последнюю из низших окислов азота,
образующихся во время реакции.
Такое течение реакции нитрования через образование про-
промежуточных комплексов с двуокисью азота, по мнению
А. И. Титова, наблюдается лишь до известной концентрации
азотной кислоты. При дальнейшем повышении концентрации
азотной кислоты процесс нитрования происходит при участии
других агентов, возникающих из азотной кислоты и обладаю-
обладающих большей активностью, чем N02- По представлению автора,
к таким энергично нитрующим агентам принадлежит «сухой»
нитроний-катион [О — N = О]', обладающий высокоэлек-
трофильным и координационно ненасыщенным атомом азота,
а также соединения, содержащие в своих молекулах группу
N02, которая легко отщепляется (например, O2N—ОЭОзН,
02N— 0N02 и т. д.).
Наиболее энергично нитрующие агенты (N02, ON—0N02>
[О = N]') будут находиться в равновесии
2NO
О
/\
О = N N = О:
V
В
:0 = N —0-
С
¦NO,
[О = N]" + N0-
D
Повышение температуры и разбавление во всех случаях будут
сдвигать равновесие в пользу мономера А.
Увеличение полярности среды будет также способствовать
диссоциации димера В, переходу его в полярную нитрозилни-
тратную форму С, возникновению нитрозил-катиона D.
Учитывая, что азотная кислота значительно менее реакцион-
носпособна, чем указанные выше кислородные соединения
азота, А. И. Титов предполагает, что непосредственное взаимо-
¦If
Механизм нитрования ароматических соединений
157
действие HNCh с ароматическими соединениями может иметь
место лишь при высоких температурах.
Пользуясь обычными представлениями о механизме реак-
реакций замещения в ароматических соединениях, он дает следую-
следующую схему процесса:
Аг —
2) Аг — Н + О = N — О —
3) Аг— N =
[а<н Г.
L XN = Oj
О
о
Аг<
'"N — 0
II
О
\
ArN = О + Н+
. ArN=O + HNO8
N = O
Аг—N02 + HNOa
Аг — Щ -* ArNO2 + NO
ЧО — N = О
Реакция нитрования соединений типа нафталина идет через
промежуточное взаимодействие с окислами азота при относи-
относительно высокой концентрации нитрующих агентов даже при
применении сильно разведенной азотной кислоты.
Реакция протекает по уравнению
Н NOS
О
О'
0
"О
Н N02
N0,
\/\S
HNO2 + HNO8 = N2O4 + H20 и т. д.
или, если пользоваться нитрозилнитратной формулой строения
N2O4:
I
158
Механизм нитрования ароматических соединений
Н N0
\/\s
0 = N - О - N/
о У\/\
-HNOj
0 ч/\/
N0
Н 0N02
N02
I
\
+ N2O3
+N20,
N208 + 2HNO3 - 2N2O4 + H20.
Экспериментальная проверка теоретических предпосылок
производилась А. И. Титовым посредством сравнения дей-
действия азотной кислоты, содержащей известное количество окис-
окислов азота, с действием кислоты, в которой при помощи различ-
различных добавок предварительно производилось разрушение
окислов азота. В качестве таких добавок им обычно применялись
соли аммония и азотнокислая мочевина. В случае аромати-
ароматических соединений очень большой реакционной способности,
как, например, метилнафталинов и антрацена, для более пол-
полного удаления окислов азота применялись соли гидразина.
Опыты с а- и fi-метилнафталинами показали, что при добав-
добавлении азотной кислоты (уд. в. 1,357) реакция наступала очень
быстро, в то время как в присутствии гидразинсульфата даже
спустя 4 часа не было заметно никаких признаков реакции. Та-
Таким образом, было установлено, что нитрование азотной ки-
кислотой (уд. в. 1,4) и ниже идет только в присутствии азотистой
кислоты.
Опыты с фенолом, крезолом, анизолом, метиловым эфиром
м-крезола, нафтолами и их эфирами, резорцином, диметил-
анилипом, фенантреном, антраценом и их гомологами произво-
производились с азотной кислотой (уд. в. 1,357) без добавки и с добавкой
гидразинсульфата. Экспериментальноустановлено, что во втором
случае реакция не наступала даже после длительного времени.
Л. И. Титовым и Н. Г. Лаптевым [45] изучалось окисли-
МеханивЛ нитрования ароматических соединении
159
тельное нитрование ароматических нитрозосоединений и арил-
гидроксиламинов (см. гл. I; стр. 87—92).
А. И. Титов [46] установил ряд закономерностей процесса
нитрования ароматических соединений азотной кислотой и
нитрующей смесью, которые заключаются в следующем.
Бензол и его гомологи медленно реагируют с N02 и со слабой
азотной кислотой, но легко нитруются крепкой азотной кисло-
кислотой или нитрующей смесью, причем присутствие в нитрующей
смеси N02 не играет существенной роли.
При проведении реакции с азотной кислотой нитрование
ароматических соединений протекает не в органическом слое,
а в нитрующей смеси. Значительно ускоряет реакцию нитро-
нитрования ароматических соединений добавление к азотной кисло-
кислоте сильных протонных и апротонных кислот (А1С1з, TiCl4,
BF3, H2SO4). Положительная роль активаторов процесса нит-
нитрования — сильных протонных и апротонных кислот — заклю-
заключается в том, что они способствуют усилению координационной
ненасыщенности и электрофильности атома азота нитрующих
средств. Эти соединения легко отщепляют нитроний-катион при
химическом взаимодействии;
N02.. .OSO3H
Н
NOa.. .0'
,CoH=
N0».. .0
/
\
N02.. .ONO. . .AlClo
4A1C13
ONO.. .A1CL
По наблюдениям А. И. Титова, скорость нитрования в парах
сильно уменьшается по сравнению с реакцией в жидкой фазе.
Нитрование ароматических соединений азотной кислотой
умеренной концентрации ускоряется в присутствии солей
ртути.
А. И. Титов рассматривает реакцию нитрования аромати-
ароматических соединений как ионно-комплеКсную реакцию.
Для реакции нитрования ароматических соединений нитрую-
нитрующей смесью им предложена следующая схема:
HONOj + 2H2SO
¦ N =» 0)+ + Ц30+ + 2HSO7
160
Механизм нитрования ароматических соединений
N0*
2N — OSO3H
Н
АгН + (О = N = О)+ ^± Аг
\
N
HSO,
ArNOa + Hs,SO4
или
(NOa)+(HSO4r
Ar—H + OaN —OSO8H ¦?
H —- О
s
О
Аг S'C TI -> ArNOa + HaSO4
•. | OH
-8N=O-o
0
H N02 H N02
/\ /\
+ N02 ¦
\S
|+N02
H
ЛЛ
0,N NO
ONO
H. H. Ворожцов [47] рассматривает нитрование азот-
азотной кислотой в среде серной кислоты как первично адди-
аддитивный процесс, однако, в отличие от большинства авторов, он
предполагает, что, наряду с азотной кислотой, и серная кислота
также обладает способностью к присоединению. По мнению
Н. Н. Ворожцова, в первой стадии реакции нитрования обра-
образуется продукт присоединения серной кислоты к ароматиче-
ароматическому ядру; этот продукт присоединения в дальнейшем либо
Механизм нитрования ароматических соединений
161
меняет свою сульфогруппу на группу N02 (схема А), либо
присоединяет еще одну молекулу азотной кислоты (схема Б);
полученный в последнем случае двойной комплекс в дальней-
дальнейшем стабилизируется с потерей воды и серной кислоты:
он
I
SO3H
н
ОН
Н
У\
HN03
Н
ОН
I
SO,H
\/\
\
\/\
ОН
н
SO3H
н
ОН -
н
N0,
SO3H
н
Н20
(Б)
\/\
N0,
В качестве примера, показывающего, что сульфогруппа мо-
может уступить место нитрогруппе, особенно при наличии акти-
активирующей ядро группы ОН, Н. Н. Ворожцов приводит реак-
реакцию образования пикриновой кислоты при нитровании сульфо-
и дисульфокислот фенола.
Из работ, посвященных кинетике процесса нитрования азот-
азотной кислотой, заслуживают внимания работы Мартинсена
и более поздние Б. В. Тронова и Г. Я. Бера.
Мартинсен [30] исследовал кинетику нитрования азотной
кислотой в среде серной кислоты ароматических соединений,
трудно поддающихся действию HN03 (к ним относятся, в част-
частности, нитросоединения). На примере нитробензола Мартин-
Мартинсен показал, что скорость нитрования в концентрированной
серной кислоте зависит от концентрации последней. Достигая
максимума при концентрации H2SO4 около 90%, скорость
11 А. В. Топчиев
162
Механизм нитрования ароматических соединений
реакции затем быстро падает при переходе к безводной серной
кислоте (скорость реакции в 95%-ной H2SO4 в три раза больше,
чем в 100%-ной).
Скорость нитрования повышается при замене водорода в мо-
молекуле нитробензола метильной группой и понижается, если
заместителем является карбоксильная группа; при этерифи-
кации карбоновой кислоты замедляющее действие, ранее вызы-
вызываемое карбоксильной группой, уменьшается. Нитрогруппа
понижает скорость реакции еще более значительно, чем кар-
карбоксильная.
п-Нитроаншшн нитруется смесью HNO3-4-H2SO4 с одновре-
одновременным вступлением двух нитрогрупп, причем образуется пик-
рамид. ос-Нитронафталин нитруется легче нитробензола. Нитро-
Нитрование фенола в водном растворе HNO3 представляет собой
сложную автокаталитическую реакцию; скорость реакции по-
повышается с повышением концентрации азотной кислоты и по-
понижается с повышением концентрации фенола. При добавле-
добавлении веществ, содержащих ион NOjf (нитратов), скорость ни-
нитрования повышается.
Азотистая кислота является положительным катализатором
реакции нитрования фенола. Применением колориметрического
метода Мартинсену удалось доказать образование азотистой
кислоты во время нитрования фенола, чем и объясняется, по
его мнению, автокаталитический характер этой реакции.
Нитрование п-крезола — также автокаталитическая реак-
реакция, протекающая с образованием нитрита.
При дальнейших исследованиях реакций нитрования раз-
различных производных бензола в присутствии H2SO4 найдено,
что наблюдаемое повышение скорости реакции при переходе от
моногидрата к серной кислоте уд. в. 1,839 зависит от природы
нитруемого вещества.
Мартинсен, исследуя влияние концентрации серной кислоты
на скорость нитрования, при температуре 25° для различных
соединений получил следующие данные (табл. 9).
Указанные в таблице вещества могут быть распределены на
две группы.
Первая группа — это те соединения, для которых скорость
Механизм нитрования ароматических соединений
163
Таблица 9
Зависимость константы скорости нитрования от концентра-
концентрации серной кислоты
Наименование вещества
К, (для
H.SO. •
0,3 Н„О)
0,0040
0,18
0,39
7,15
1,50
0,17
0,85
~ 26
—100
К, (для
HjSO.)
0,0014
0,050
0,14
2,18
0,37
0,053
0,39
2,3
-5,4
К,1К,
2,86
3,60
2,78
3,28
4,05
3,21
2,18
-11,30
—18,50
4,6-Д инитро-м-ксилол
п-Хлорнитробензол .
м-Хлорнитробензол .
о-Хлорнитробензол .
Нитробензол
2,4-Динитроанизол . .
2,4-Динитрофенол . .
Бензолсульфокислота
Бензойная кислота
реакции увеличивается приблизительно втрое при переходе от
моногидрата A00%-ная H2SO4) к серной кислоте состава
H2SO40,3H2O (95%-ная H2SO4). Вторая группа веществ
характеризуется тем, что для них скорость реакции при этих
условиях значительно больше, чем скорость реакции соедине-
соединений первой группы. Первая группа — нитропроизводные
и хлорнитропроизводные ароматических углеводородов; вто-
вторая группа — карбоксильные и сульфопроизводные аромати-
ароматических углеводородов.
Данные табл. 9 подтверждают положение, что в определен-
определенных пределах концентрации серной кислоты скорость нитро-
нитрования резко уменьшается с повышением этой концентрации.
Величина константы скорости реакции нитрования нитро-
нитробензола уменьшается при переходе от среды H2SO40,3H2O
к среде H2SO40,4SO3 пропорционально уменьшению количе-
количества воды.
Различные заместители по характеру и степени их влияния
на скорость нитрования могут быть расположены в. следую-
следующий ряд:
NO2 > SO3H > СООН > С1 < СН3 < ОСН3 < ОС2Н5 < ОН.
11'
164
Механизм нитрования ароматических соединений
Хлор занимает серединное положение, так как он действует
иногда замедляющим, а иногда ускоряющим образом. Справа
от хлора расположены заместители, повышающие скорость
реакции, слева — уменьшающие ее. При этом оказалось, что
заместители, замедляющие реакцию, ориентируют нитрогруп-
пу в м-положение, заместители же, повышающие скорость ре-
реакции, а также хлор, ориентируют группу N0^ в о- или
л-положение.
На основании кинетических данных установлено, что ни-
нитрование азотной кислотой нитробензола и 2,4-динитротолу-
ола в сернокислой среде представляет собой реакцию второго
порядка.
Для проверки высказываемого некоторыми авторами (Шаар-
шмидтом, А. В. Сапожниковым и др.) взгляда, что серная ки-
кислота играет в реакции нитрования нитрующей смесью роль де-
дегидратирующего агента, Мартинсен проводил ряд опытов в при-
присутствии фосфорного ангидрида. Опыты показали, что послед-
последний не влияет на скорость реакции, из чего можно заключить,
что дегидратирующее действие серной кислоты не является
фактором, определяющим скорость реакции.
Боннер и другие [48], изучая нитрование нитробензола
и п-хлорнитробензола, нашли, что относительные скорости
нитрования этих соединений мало меняются с изменением кон-
концентрации серной кислоты. Оптимальная концентрация
H2SO4 при нитровании этих соединений равна 90,4%.
Изучением реакционноспособности различных ароматиче-
еких соединений при нитровании занимался Огата [49]. Им
установлено, что при нитровании 2-фенилантрахинона, 1-ан-
трахинонкарбоновой кислоты и нафтантрахинона нитрогруп-
па направляется в бензольное или нафталиновое ядро. Некото-
Некоторые из исследованных соединений по своей реакционноспособ-
реакционноспособности располагаются в следующий ряд:
С6Н5СН2СООН > CeHsSOaH > CeH5NO2 > 2,4-(NO2JCeH3CH3.
Б. В. Тронов и Г. Я. Вер [50] исследовали кинетику нитро-
нитрования ароматических соединений в растворе нитробензола при
молярном отношении HNO3: CeH5NO2 = 1:2.
Механизм нитрования ароматических соединений
165
Опыт проводился следующим образом: вещество растворя-
растворялось при 0° в смеси 2 молей нитробензола и 1 моля азотной
кислоты, после чего раствор оставлялся на некоторое время
при 16—18°. Через определенные промежутки времени отби-
отбирались пробы жидкости и титрованием устанавливалось коли-
количество непрореагировавшей азотной кислоты.
Относительная скорость нитрования различных соедине-
соединений вычислялась по промежутку времени, в течение которого
затрачивается одинаковый процент НГЮз, причем скорость
реакции измерялась трижды, а именно после вступления
в реакцию 5,15 и 25% азотной кислоты. Опыты Б. В. Тронова
и Г. Я. Бера показали, что заместители влияют на скорость
реакции ускоряющим или замедляющим образом, причем на
разных стадиях нитрования ускоряющее (или замедляющее)
действие заместителя неодинаково.
При расположении заместителей в ряд по их влиянию на ре-
реакцию нитрования Б. В. Тронов и Г. Я. Бер получили три сле-
следующих ряда, соответствующих моментам вступления в реак-
реакцию 5, 15 и 25% азотной кислоты (справа от водорода, соответ-
соответствующего незамещенному бензолу, находятся замедляющие,
слева — ускоряющие заместители):
1) для момента вступления в реакцию 5% НГЮз
СНзСО > С1 > СН2С1 > Вг > С2Н8 > Н <
< СН3 < CeH5CH2 < CH2CN < CN < CeH5CO < NO2; ). '
2) для момента вступления в реакцию 15% НГТОг
СН3СО > СН2С1 > Вг > Н < С2Н5 < СН3 < СвН8СН2;
3) для момента вступления в реакцию 25% НГЮз
СН3 СО > • • • > С2Н5 > Н < СН3 < Вг < С1.
Опыты Б. В. Тронова и Г. Я. Бера показали отсутствие
цростой зависимости между скоростью реакции и ориентирую-
ориентирующим влиянием заместителей, как это обычно принималось ра-
ранее. Например, метильная группа, ориентирующая в о- и
п-положение, замедляет нитрование; замена в метальной группе
m
Мезсантм нитрования ароматических
водорода на жлор, который вызывает увеличение выхода
м-производного, ускоряет реакцию. Дифенилметан дает почти
исключительно о-« и п-нитроеоединения, причем реагирует
медленнее, чем толуол. Галоиды вначале ускоряют нитрование,
но е течением времени их влияние переходит в противополож-
противоположное.
Только группы, сильно ориентирующие в «-положение,
вполне подчиняются правилу и очень сильно замедляют реак-
реакцию (NO2,CN, CH2CN, GeHsCO). Ацетильная группа, ориенти-
ориентирующая менее определенно, оказалась сильным ускорителем.
Вторая и особенно третья метальная группы влияют противо-
противоположно первой, заметно ускоряя нитрование: о-, м- и п-кси-
лолы нитруются соответственно в 1,6—1,9; 4>5-*-»4,9; 5,7—¦
10,5 раз быстрее толуола. Значительно скорее нитруются мези-
тилен и псевдокумол.
При нитровании бром- и нитропроизводных бифёиилоксида
{51] введение нитрогруппы в положение 4 Притекает легче,
чем в положение 1.
Нитрование фенилтиазолов азотной и серной кислотами
приз 0° дало исключительно пннитропроизводное, тогда как
нитрование бензилового спирта дает только м-нитроироизвод-
ное [52].
Концентрация применяющейся при нитровании серной
кислОты, по исследованию А. П. Терентьева и Б. М. Кедрова
{53}, играет большую роль в смысле направления вступающей
в ядро нитрогруппы. Так, при нитровании ацетанилида нитрую-
нитрующей смесью они нашли, что если применять не 100%-ную сер-
серную кислоту, а 73,8%-ную, то выход п-нитроацетанилида пада-
падает при одновременном увеличении выхода орто-изомера.
Изучением влияния фтористого бора как катализатора реак-
реакции нитрования фенола и анилина занимались А. В. Топчиев,
В. П. Алания, Г. С. Шнайдер [54].
Исследование проводилось следующим образом: фенол пред-
предварительно Насыщался фтористым бором до постоянного веса,
пойле чего комплекс фенола с BF3 загружался в круглодонную
колбу> куда прибавлялась азотная кислота при температуре
от 5''до 20° при постоянном^ перемешивании. По окончании ре-
Меканиэм нитрования арол^атических соединений
167
акции полученная смесь нитрофенолов обрабатывалась 20%-ным
раствором щелочи с целью разрушения комплекса.
Нитрование фенола в присутствии BF3 проводилось азотной
кислотой безводной, 20, 10 и 5%-ной в растворителе и без
растворителя.
В результате проведенных опытов выяснилось, что в при-
присутствии BF3 образуется до 9,4% м-нитрофенола, в то время
как нитрование фенола разбавленной HNO3 без BF3 приводит
к получению лишь о- и п-изомеров.
Таким образом фтористый бор оказывает влияние как на
место вступления группы NO2 в ядро, так и на увеличение вы-
выхода нитропродуктов.
Отступление от правила ориентации в данном случае ав-
авторы объясняют следующим образом: гидроксильная группа
в бензольном кольце увеличивает плотность электронного об"
лака о- и п-атомов углерода бензольного кольца. При действии
на однозамещенный бензол электрофильным реагентом электро-
фильная группа реагента (в случае нитрования фенола это
будет группа NO2) при реакциях замещения направляется к то-
тому атому бензольного кольца, у которого имеется повышенная
электронная плотность. Образование комплекса BF3 с фе-
фенолом будет сказываться на распределении электронной плот-
плотности в бензольном кольце. Плотность электронного облака
у о- и п-атомов углерода должна быть уменьшена, а следова-
следовательно, и орто- и пара-положения должны быть пассивиро-
пассивированы в связи с образованием трехвалентного положительно
заряженного атома кислорода в комплексе с BF3 по схеме
Н—О—BR
Так как положение, занимаемое вновь вступающим замести-
заместителем, определяется относительными скоростями трех одновре^
менно конкурирующих между собой реакций, а орто- и пара-
положения пассивированы, то вероятность вступления нового
168
Механизм нитрования ароматических соединений,
заместителя в м-положение должна увеличиваться, что и
подтверждено опытными данными как для фенола, так и для
анилина. При нитровании анилина нитрующей смесью в при-
присутствии ВFg было получено 98% теоретического выхода моно-
нитроШйлинов, причем 67,2% приходится на долю йета-изо-
мера, а 12,8 и 20,0%, соответственно,— на долю орто- и нара-
иэомеров.
Модик [55] изучал вопрос о соотношении изомеров, полу-
получающихся при нитровании 2,5-дихлорнитробензола и 2,5^ди-
бромнитробёнйола в серной кислоте различной концентраций
при различных температурах. Данные этих исследований (ос-
(основанных на определении инфракрасных спектров реакцион-
реакционных смесей) Сведены в табл. 10.
Веетгёймер и Карата [56], исследуя кинетику нитрования
ароматических соединений в серной кислоте, нашли, что основ-
основным фактором, влияющим на скорость реакции, является ки-
t: ' '!'i:': :i'"!: ' ' Т аблица 10
Отношения количеств различных изомеров при нитровании
дйхлорнитробенаола и дибрвмнитробензода
Концентрация Н*ЗО„ %
Дымящая ...... ..| . . . .
96,2
96 0
89 0
96 2 .
Дымящая
96,8
90 0
96 8
96,2 (+KHSO4) ....
96,2 (фКС1О4) . . . . .
Дымяпадя HNOa+20%
НСЮ-
Темпе-
Температура, 'С
100
100
100
100
140
140
100
100
120
100
100
100
ДихлорнитроОешзол
мета/орто
3,7
2,4
2,0
1,6
1,7
4,7
2,0
1,9
1,4
орто/пара
0,45
0,77
0,95
1,2
. 0,91
0,33
0,89
0,98
1,6
Дибромнитробензол
мета/орто
18,6
3,6
1,7
2,6
1,6
орто/пара
0,07
0,38
1,4
0,67
1.4
Механизм нитрования ароматических соединений
160
слотность среды. Последняя в МЖ опытах оказалась оптималь-
оптимальной при концентрации H2SO4, равной 90%, что согласуется
с более ранними данными Мартинсена.
Определяя константы скорОШй нитрования нитробен-
нитробензола в серной кислоте умеренных концентраций при 25°, Вест-
геймер и Караш нашли, что эти константы возрастают при Шу
денви концентрации H2SO4 от 95,6 до 90%; при дальнейшем
-уменьшении концентрации H2SO4 наступает резкое падение
константы скорости, которая при нитровании в 80%-ной серной
кислоте уменьшается в 3000 раз по сравнению с 90%-ной сер-
серной кислотой.
Веетгёймер и Караш испытали далее влияние различий*
добавок на скорость нитрования. При этом оказалось, что
вещества, не изменяющие кислотности среды, как, например»
динитробензол и фосфорный ангидрид, не влияют на скорость
реакции.
Добавление к реакционной смеси бисульфата калия, кото-
который По Отношению к HaSO« является основанием (увеличивает
концентрацию ионов HSO^), оказывает различное влия-
влияние в зависимости от кислотности среды, в которой проводился
нитрование. В растворах, кислотность которых выше опти-
оптимальной (йри концентрации НгЗО^ больше 90%), добавлений
бисульфата понижает кислотность, приближая ее к оптимум^;
т. е. благоприятно влияет на скорость реакции; в растворах
с кислотностью среды ниже оптимальной добавление бисуль-
бисульфата, который еще более уменьшает кислотность среды, влечет
за собой понижение скорости реакции.
Аналогичным образом влияет добавление азотной кислоты,
которая является основанием по отношению к серной кислоте:
если растворителем служиг 90%-ная H2SO4) т. е. кислотность
среды оптимальна, добавление азотной кислоты понижает ско-
скорость реакции; в растворах же, более кислых по сравнению
с оптимумом, добавление HNO3 понижает кислотность, т. е.
приближает ее к оптимуму, что приводит к повышению скоро-
скорости реакции.
При повышении температуры реакции от 25 до 40° опти-
оптимальная концентрация серной кислоты повышается до 91 %;
170
Механизм нитрования ароматических соединений
наоборот, понижение температуры реакции сдвигает оптимум
в сторону более низких концентраций серной кислоты.
Исследована также реакция нитрования динитромезитилена
и динитроксилола, причем найдено, что кривые изменения ско-
скорости реакции в зависимости от концентрации серной кислоты
для этих соединений имеют максимумы при тех же концентра-
концентрациях, которые соответствуют максимуму для нитробензола
(сравнение опытов, проведенных при одной и той же темпера-
температуре).
При решении вопроса о механизме ионизации, определяющем
нитрующее действие азотной кислоты в растворе серной кисло-
кислоты, рассматривались два, возможных механизма:
HNO3 + H2SO
HNOa + 2H,SO4 5* N0+
H3O+ + 2HSO~ .
A)
B)
Чтобы выяснить, происходит ли ионизация азотной кислоты по
-схеме A) или по схеме B), была исследована ионизация в ра-
растворе серной кислоты двух индикаторов, из которых один
ионизирует по типу, соответствующему уравнению A), а вто-
второй — по типу уравнения B). Половина перврго индикатора —
антрахинона — переходила в 89,7%-ной серной кислоте в ок-
окрашенную ионную форму
H2SO4 ¦
о
¦+
HSO7
он
В качестве индикатора, ионизирующего по уравнению B),
авторы применили тринитротрифенилкарбинол (тринитротри-
танол), который переходил в окрашенную ионную форму в 90%-
яой H2SO4:
(O2NCeH4KCOH + 2H2SO4 - (OaNCeH«)eC+
+ 2I1SO" .
Механизм нитрования ароматических соединений
171
Исследование ионизации этих двух индикаторов производи-
производилось при различных концентрациях серной кислоты, причем
степень превращения в окрашенную форму определялась коло-
колориметрически.
Сопоставление кривых, представляющих ионизацию антра-
хинона и тринитротританола в растворах серной кислоты в пре-
пределах концентраций ее от 80 до 90%, с кривой зависимости кон-
константы скорости реакции нитрования нитробензола в растворах
серной кислоты от ее концентрации показало полное совпа-
совпадение последней кривой с кривой ионизации тринитротританола.
Авторами сделан вывод*, что ионизация при нитровании нитро-
нитробензола происходит по уравнению B), т. е- нитрующим агентом
в этой реакции является ион NO2+.
Согласно взглядам Беннета [57] и ряда других исследова-
исследователей, роль серной кислоты заключается в том, что она:
1) необходима для образования нитрующего агента (NOa+)
из азотной кислоты, при этом предполагается, что образование
иона нитрония протекает в две стадии:
2HNO3 ? H3NOg + NO~ ;
ЩЧОз -* N0+ + Н2О;
2) является наиболее сильным донором протона;
3) служит растворителем для углеводорода.
Кинетику нитрования азотным ангидридом исследовали
Голд, Хьюз и др. [58]. Нитрование азотным ангидридом изуча-
изучалось в апротонных растворителях (СС14), причем авторы счи-
считают, что, с одной стороны, идет нитрование ароматической
молекулы азотным ангидридом, а с другой стороны, благодаря
ионизации N2O5 по схеме
2ШОз-+ N2O6 + H2O; N2O6 ~* N0+ + Щ ,
нитрующим агентом является нитроний-ион.
Вильяме и Лоуэн [59] исследовали реакцию нитрования
* Данные авторов не дают основания для этого сделанного ими заклю-
заключения.
172
Механизм нитрования аромапшчеспих соединений
соединений, содержащих активное ароматическое ядро; в част-
частности, овги измерили скорость нитрования иона тримбтил-п-
толиламмония в серной кислоте (при концентрациях 75—82%)
в пределах температур 17,5—45°. Они нашли, что при 25° ско-
скорость нитрования быстро растет, если концентрация H2SO4
больше 80%, и приближается к нулю при концентрации HaSCU,
равной 75%. Нитроний-ион образуется в этих условиях в коли-
количестве, достаточном, чтобы действовать как нитрующий агент,
хотя этого количества недостаточно, чтобы он был открыт по
раман-спвктру. Беннет, Бранд и другие [44] установили, ЧТО
при электролизе раствора азотной кислоты в дымящей серной
кислоте азотная кислота находится в растворе в виде катиона
(это обнаруживается ее движением к катоду). В дымящей еер-
ной кислоте азотная кислота диссоциирует, давая ион N0^,
который является активным нитрующим агенток. Отсутствие
свободной азотной кислоты в нитрующей смеси подаверждается
низким "давлением паров азотной кислоты, уменьшающимся
с уменьшением содержания воды. При прибавлении воды в смесь
новая активная форма переходит в об^ную с уменьшением
нитрующей способности. Диссоциацию азотной кислоты
в HjSO* можно представить уравнением
HNOs + 2H2SO4 -* NO* + Н»0+ -f 2HS0~ .
Реакция образования нитроний-иона [60],. невидимому, проте-
протекает через присоединение протона к HNOa по уравнений)
но
\
N
Растворы азотной кислоты в серной кислоте подвергались
также спектральному анализу [61],
Вильяме и Симкинс [62] исследовали кинетику обратимого
превращения нитрата гуанидина в нитрогуанидин в 71,5—
83%-ной серной кислоте при температуре 14,8—35°. Общее
кинетическое уравнение реакции имеет вид:
Механизм нитрования ароматических соединений
173
d [HNO8]
¦ К* [CH+] X IHNO3] -Kx [PH+],
где СН+ и РН+ — ионы гуанидония и нитрогуанидония.
Первый член уравнения соответствует прямой, а второй—обрат-
второй—обратной реакции. Константы К2 и К^ увеличиваются с повыше-
повышением кислотности, причем К% зависит от кислотности в значи-
значительно большей степени, чем К\. Определяемая зависимость
скорости нитрования приводит к следующему: для 78,3%-ной
HaSO« К* = 1,6-107ехр(— 13230/Я71), для 74,5%-ной H2SO4
К% = 7,71 -10' ехр:(— 13790/ДГ), для 81,1%-ной H2SO4 K% =
= 8,15-lO8 ехр (—8940/-R71), Изменение концентрации HNO3
почти не влияет на величину К*. Цри повышении концентра-
концентрации гуанидина константа К2 несколько падает. Это влияние,
как и влияние добавок неорганических солей, также понижаю-
понижающих величину К2, повидимому, связано с изменением кислот-
кислотности среды.
Беннот, Бранд и другие [63] исследовали кинетику нитро-
нитрования 2,4-дипитротолуола азотной кислотой в среде серной
кислоты различных концентраций, начиная от водных раство-
растворов с содержанием 87,4% серной кислоты и до олеума с со-
содержанием 29,1% свободного БОз. Температура реакции пит-
рования варьировалась от 60 до 120°. Нитрование проводилось
в гомогенных средах. При проведении реакции в водных ра-
растворах серной кислоты брали различные количества серной
кислоты и воды, в которых были растворены в небольших кон-
концентрациях динитротолуол и азотная кислота. Из компонентов
нитрующей смеси серная кислота и вода были взяты в боль-
большом избытке, вследствие чего создавалась постоянная среда
для нитрования. Например, в опытах, где нитрование прово-
проводилось с 95,7%-ной серной кислотой, исходный состав системы
был следующим: 0,04 моля динитротолуола, 1,8 моля H2SO4,
0,02 моля HNOa @,7% всей нитрующей смеси), 0,44 моля воды.
Таким образом, количества образовавшихся во время реакции
воды и азотистой Кислоты (последняя является продуктом
побочной реакции окисления) были настолько незначительны,
что они не могли существенно влиять на состав системы и ско-
174
Механизм нитрования ароматических соединений
Механизм нитрования ароматических соединений
17 5
рость реакции. Была исследована зависимость скорости реак-
реакции от следующих факторов: 1) состава среды, в которой про-
происходило нитрование; 2) концентраций реагентов (азотной ки-
кислоты и динитротолуола); 3) добавки различных количеств
бисульфата калия и нитрозилбисульфата.
При постоянных начальных концентрациях нитруемого ве-
вещества и азотной кислоты @,4 моля динитротолуола и 0,2 моля
HNO3) и изменении состава среды от 87% -пой H2SO4 до олеума
с содержанием 29% SO3 авторы нашли максимум скорости ре-
реакции в среде, состоявшей из 92% серной кислоты и 8% воды
(оптимальная среда). При изучении кинетики реакции в гетеро-
гетерогенной среде установлено, что практически реакция идет толь-
только в кислотном слое, в органическом же слое скорость реакции
мала. .
Опыты показали, что влияние концентрации нитруемого ве-
вещества и азотной кислоты и добавки бисульфата па скорость
реакции различны в зависимости от того, содержала ли среда
серную кислоту в количестве, большем или меньшем оптималь-
оптимальной концентрации. В средах с содержанием серной кислоты
больше оптимального бимолекулярная константа скорости ре-
реакции возрастала: 1) с повышением начальной концентрации
азотной кислоты (при постоянной начальной концентрации
динитротолуола); 2) с повышением начальной концентрации
динитротолуола (при постоянной начальной концентрации
азотной кислоты); 3) с повышением концентрации бисульфата,
который добавлялся или в виде бисульфата калия, или в виде
нитрозилбисульфата (при постоянных концентрациях азотной
кислоты и динитротолуола). Отношения, указанные в пп. 1 и 2,
наблюдались также в среде олеума.
В средах с содержанием серной кислоты меньше оптимального
бимолекулярная константа скорости убывала: 1) с повышением
начальной концентрации азотной кислоты; 2) с повышением
начальной концентрации динитротолуола; 3) с повышением кон-
концентрации добавляемого бисульфата.
Для объяснения этих результатов сделаны допущения, что
нитрующим агентом во всех исследованных сернокислотных
средах, от олеума до эквимолекулярных смесей серной кисло-
кислоты и воды, является ион NO+. В среде серная кислота - вода
концентрация иона N0+ находится в зависимости от равнове-
равновесий A) и B)*:
HONO2 + 2H2SO4
Н3О+ + 2HSO4~ ;
A)
н2о + н so, ^ н„о+ + hsoT
Далее было сделано допущение, что полнота нитрования
достигается лишь в том случае, если, наряду с присоединением
иона N0^ к ароматическому ядру, происходит и Отдача про-
протона от ядра специальному акцептору, т. е. среда проявляет
и кислотные, и основные функции. Таким образом скорость ни-
нитрования определяется частотой столкновений между моле-
молекулой динитротолуола, ионом N0^ и молекулой акцептора
протона.
Наиболее активным акцептором в среде серная кислота —
вода может быть бисульфат-ион. Однако он не единственный
акцептор, так как константа скорости нитрования в 100%-ной
серной кислоте только в три раза меньше ее максимального зна-
значения для 92%-ной серной кислоты. Наиболее вероятным ак-
акцептором протона считается молекула серной кислоты, которая,
как показал Ганч, способна к автоионизации; возможный ме-
механизм участия серной кислоты в нитровании следующий:
Н+
-2H2SO4.
Исходя из указанного выше, нитрование динитротолуола мо-
может быть представлено следующими уравнениями:
CH3CeH3 (NO2J + N0+
CH3CeH3 (NO2J
CH3QH2 (NO2K + H2SO4;
H2SO4 - CH3CeH2 (NO2K
C)
D)
* В смесях серной кислоты с водой с молярным отношением
H2O/H2SO4= 1 концентрация ионов N0^ падает до нуля и нитрование
прекращается (нитрование имеет место лишь при молярных отношениях
H2O/HaSO4<l).
176
Механизм нитрования ароматических соединений
Причина уменьшения скорости реакции с увеличением ки-
кислотности среды выше оптимальной может быть объяснена
с этой точки зрения падением концентрации бисульфат-иона
за счет увеличения концентрации серной кислоты. Поэтому
добавление бисульфата в реакционную смесь при кислотности
среды выше оптимальной дает положительный эффект, так как
оно восстанавливает необходимую для реакции концентрацию
активного акцептора протона (бисульфат-иона).
Падение скорости реакции при понижении кислотности сре-
среды ниже оптимальной, согласно этим представлениям, вызы-
вызывается понижением концентрации ионов NOjj", образующихся
по уравнению A) (см. выше). Добавление бисульфат-ионов
должно приводить к падению скорости реакции, так как оно
способствует сдвигу равновесия в уравнении A) справа налево,
т. е. еще большему понижению концентрации ионов N0^".
Влияние начальной концентрации азотной кислоты на скорость
реакции определяется концентрацией в системе бисульфат-
иона, так как повышение начальной концентрации HNO3
влечет за собой, как это видно из уравнения A), повышение
концентрации бисульфат-иона. Поэтому в тех случаях, когда
повышение концентрации бисульфат-иона оказывает положи-
положительное действие на скорость реакции, повышение начальной
чконцентрации НГЮз приводит к такому же результату, а в тех
случаях, где влияние бисульфат-иона оказывается отрицатель-
отрицательным, скорость реакции с повышением начальной концентрации
HNO3 понижается.
При действии азотной кислоты на ароматическое соединение
в среде олеума основными акцепторами протона являются мо-
молекула серной кислоты и пиросульфат-ион. Нитрование
в этом случае может быть представлено следующими уравне-
уравнениями:
CH3CeH3 (NO2J + N0* + H2SO4 - CH3CeH2 (N02)s + HgSO*;
СН3СвН3 (NO2J + NO* + HS2O~ ? CH3CeH2 (NO2K + H2S2O,.
В отсутствие серной кислоты ион N02+ может образовываться
согласно уравнению
3HNO3 ^ N0* + Н30+ +2 N0" .
Механизм нитрования ароматических соединений
ill
Другое объяснение максимума скорости реакции при опре-
определенной концентрации серной кислоты дает А. И. Титов [46].
Он указывает, что катионы, образующиеся при соединении
ароматических веществ с протоном, например C6H6NO2H+,
должны вступать в реакцию замещения значительно труднее,
чем соответствующие нейтральные молекулы.
Уравнение скорости реакции было дано Н. Н. Ворожцовым
[64J. Суммарная скорость реакции соответствует уравнению
Л '™Т] = К [ДНТ] X [NO* 1 X [HSO; I + К' [ДНТ] X [NO* ] X [H,SO«].
где [ТНТ] и [ДНТ] — концентрации тринитротолуола и ди-
нитротолуола, К ж К' — константы скорости, величины кото-
которых не зависят от среды (концентрации серной кислоты).
Так как концентрация NO2 может быть найдена из выражения
для константы равновесия
Ш03 + 2H2SO4 Z N0* + Н30+ + 2HS0;
Ке ~ [HONO2] [H2SO4]2 '
причем [НГЮз] = [NOa+]+ [HONO2] (концентрация азот-
азотной кислоты равна сумме концентраций нитроний-катиона и
оставшейся недиссоциированной НОГЮ2), то доля Q азотной
кислоты, превращенной в N0^", равна
[HNO3]
1 +
[Н,0*| [HSOJ ]•
. [H2SO4]
Откуда [NO*] = Q [HNO3]
и уравнение скорости нитрования может быть написано в виде
dt = К JHSO^I + К' [H2SO4] [ДНТ1 [HNO3]Q.
Уравнение бимолекулярной реакции соответствует скорости
реакции при постоянной концентрации серной кислоты:
d [ТНТ]
ТНТ]
dt =* К, [HNO3] [ДНТ].
12 а. В. Топчиев
178
Механизм нитрования ароматических соединений
Следовательно, константа скорости бимолекулярной реакции
равна
К^ = К [HSO' 1 + К> lH2SO4]/Q-
При нитровании в серной кислоте и в олеуме акцепторами про-
протона могут являться H2SO4 и ион HS2O7 . Поэтому уравнение
скорости реакции нитрования в общем виде (как в разведенной
H2SO4, так и в олеуме) может быть.изображено так:
d [THT]
dt
= (К [HSO; ] + К' [H2SO4] + К" [HS2O; ]) [ДНТ] [Ш03] Q.
Концентраций HS2O7 Вычислялась исходя из допущения, что
константа равновесия реакции
H2SO4 + H2S2O,
O* + HS2O~
равна 1.
Большое влияние на процесс нитрования оказывает раство-
растворитель, о чем мы вкратце упоминали и ранее. Из работ, заслу-
заслуживающих внимания в этом отношении, отметим исследование
Холстеда и Ламбертона [65]. Они изучали реакцию нитрования
в различных растворителях без серной кислоты. Ими показано,
что реакция нитрования уретана, метилуретана и мочевины не-
необратима в среде уксусная кислота — уксусный ангидрид.
При нитровании уретана, метилуретана и мочевины в среде
с отношением (СН3СОJО : СНзСООН = 24 : 1 при 25° в те-
течение 1 часа выходы нитросоединений достигают 60—80%. При
нитровании уретана при 25° в течение 20 час. в средах с отноше-
отношением (СН3СОJО : СН3СООН = 1:1 и 1 : 19 выходы нитро-
нитросоединений составляли, соответственно, 80 и 40%. В системе
уксусная кислота — вода с отношением СНзСООН : Н2О =
= 199 : 1 нитрование не происходит. При растворении соответ-
соответствующих нитрамидов в указанных выше растворителях сво-
свободной азотной кислоты не обнаружено. Реакция нитрования
уретана в 60%-ной НСЮ4 обратима. Положение равновесия
для уретана при 70° достигается через 20 мин. Выход нитро-
уретана 53%.
Механизм нитрования ароматических соединений
179
В приведенных выше работах Беннета и др. [63] предпо-
предполагается, что реакция нитрования протекает как тримолеку-
лярный процесс:
- NO* + АгН + HSO~ - ArNO2 + H2SO4.
В таком процессе удаление протона из ароматического ядра:
должно иметь существенное значение для кинетики реакции,
поскольку оно требует для своего осуществления наличия
основания.
С целью проверки этого предположения Меландер [66]
исследовал нитрование толуолов, содержащих тритий в различ-
различных положениях, и на основе полученных результатов пришел
к заключению о несостоятельности основного предположения
Беннета и соавторов.
При динитровании 2-Т-толуола Меландером был получен
2,6-динитротолуол, причем количества активного и неактив-
неактивного производных оказались одинаковыми. Подобный факт
можно объяснить лишь тем, что в общем процессе нитрования
стадия отщепления протона является очень быстрой и потому
II не определяет общую скорость реакции. В случае же течения
реакции как одностадийного тримолекулярного процесса из-за
Наличия изотопного эффекта количества активного и неактив-
неактивного динитротолуолов оказались бы различными.
Этими опытами Меландер подтвердил, что процесс нитро-
нитрования протекает не как тримолекулярная реакция.
Обширное исследование кинетики и механизма нитрования
ароматических соединений было проведено Ингольдом и со-
сотрудниками.
В работах этих авторов [67, 68] было изучено нитрование
нитрующей смесью (HNO3 -f H2SO4), одной азотной кислотой,
а также азотной кислотой в органических растворителях (нит-
рометане и уксусной кислоте). Основные экспериментальные
факты, найденные при этом, сводятся к следующему.
В случае нитрования ароматических Соединений нитрующей
Смесью реакция протекает по второму порядку
Скорость в H2SO4 = К [НА*] [НМО3
A)
12*
180
Механизм нитрования ароматических соединений
Это установлено при нитровании нитрозамещенных бензолов,
бензойной и бензол су льфоновой кислот и антрахинонов-
При нитровании одной азотной кислотой имевзр место реак-
реакция первого порядка:
Скорость в ШО3 = Кг [НАг] ([HNO3] = const) B)
(установлено при нитровании нитробензола, шжлорнитро-
бензола и 1-нитроантрахинона).
В случае применения в качестве растворителей нитрометра
или уксусной кисиоты нитрование достаточно реакциовжо-
способвых к электрофильным замещениям ароматических со-
эдиневий протекает по нулевому порядку, а мало реакционно-
«дасобиых н таким замещениям — по первому порядку:
Скорость в CHSNO2 — Ко
([HNO3] = const)
C)
(установлено при нитровании бензола, толуола и этил-
бензола).
Скорость в CH8NO» = Кг [НАг] ([HNO3| — const) D)
(установлено при нитровании п-дихлорбензола и 1,2,4-
трихлорбензола).
При нитровании в органических растворителях аромати-
ароматических соединений с промежуточной реакционноспособ-
ностью реакция Протекает по дробному порядку (от 0 до 1):
Скорость в CH.NO»: средняя между скоростями, приведенными в уравне-
уравнениях C) и D) E)
(установлено для галоидзамещенных бензола).
Далее было показано, что нитрование ароматических со-
соединений азотной кислотой и особенно в органических раствори-
растворителях ускоряется добавками серной кислоты и замедляется до-
добавками диссоциирующих нитратов металлов. При этом наб-
наблюдается линейная зависимость как между добавками серной
кислоты и скоростью реакции нитрования, так и между добав-
добавками нитрата и обратной величиной скорости реакции, Сле-
Следует подчеркнуть, что влияние добавок серной кислоты и нит-
нитратов сказывается только на скоррсщ реакции, не меняя ее
Механизм нитрования ароматических соединений
181
порядка (первого при нитровании азотной кислотой и нуле-
нулевого шш первого при нитровании в растворителях GH3NOa или
Было изучено также влияние воды. Оказалось, что добавка
незначительного количества воды уменьшает скорость нитро-
ксшия в растворителях также без изменения самого порядка
реакции. При этом, как и в случае добавок нитрата, обратная
не личина скорости изменяется линейно о концентрацией воды.
И общем, по сравнению с эффектом, оказываемым сорной кисло-
юн и нитратом, влияние добавки относительно небольших ко-
количеств воды очень невелико. Необходимо отметить, что сохра-
сохранение порядка реакции наблюдается только при небольших до-
добавках воды. Прибавление же больших количеств воды пере-
переводит реакцию нулевого норядка (например, нитрование бея-
•юла азотной кислотой в органическом растворителе) в реа«т
цию первого порядках
При исследовании яого> как влияет изменение состава сре-
среды на скорость нитрования в органических растворителях» было
найдено, что увеличение содержания азотной кислоты резко
увеличивает константу скорости как нулевого, так и первого по-
порядка и что константы скорости нитрования обоих этих поряд-
порядков при употреблении в качестве растворителя нитрометана
значительно выше, чем при употреблении уксусной кислоты*
Далее было показано влияние изменения состава среды и на
порядок реакции. Уменьшение концентрации азотной кислоты
приводит к переходу от кинетики реакции нулевого к первому
порядку. При сохранении постоянной концентрации азотной
кислоты и замене растворителя ййтрометана уксусной кисло-
кислотой порядок реакция изменяется от нулевого к первому.
На основании полученных экспериментальных данных Ин-
гоньд с сотрудниками пришли к ряду заключений относительно
механизма нитрования ароматических соединений азотной ки-
кислотой как в присутствии органических растворителей, так
и без них.
Первое заключение авторы делают в связи с нулевым по-
порядком нитрования в органических растворителях аромати-
ароматических соединений, достаточно способных к электрофиль-
182
Механизм нитрования ароматических соединений
ным замещениям. Такая кинетика нитрования в данном
случае оэнйчает, 4to скорость реакции зависит от некоторого
предварительного процесса, происходящего без учайтия нит-
нитруемого соединения и могущего из-за наличия растворителя
протекать достаточно медленно, чтобы явиться той стадией,
которая определит скороеть общей реакции. Этот предваритель-
предварительный процесс не включает в себя и самого растворителя, так как
различные по своей химической природе растворители оказы-
оказывают одинаковое действие. Таким образом, этот предваритель-
предварительный процесс Долвйен происходить только с еамой азотной кисло^
той. Изменение, которое она при- этом претерпевает, происхо-
происходит с измеримой скоростью, определяющей общую скороеть
нитрования нулевого порядка. Такое изменение не мознет по-
поэтому заключаться только в перемещении протона, которое в ки-
кислородных кислотах происходит мгновенно. Авторы приходят,
таким образом, к выводу, что предварительный процесе, про-
протекающий с известной энергией активации, должен включать
в себя разрыв связи. Исходя далее иэ того у что уетайавйеяшае
при! нитровании ароматических соединений законы ориента-
ориентации и влияния заместителей на реакционную» енособноеть явно
подтверждают электрофильный характер этой реакции, авторы
заключают, что разрыв связи в молекуле азотной кислоты дол-
должен иметь гетеролитическую природу. Только в этом случае
возникнет электрофильный нитрующий агент, т. е. атомная
группировка с атомом азота, несущим неполное число элек-
электронов. Наиболее простое осуществление этого можно било бы
видеть в следующей реакции:
O2N _!_ ОН - O2N+ + НО".
A)
Однако тот факт, что добавки кислот более сильных, чем
азотная, значительно увеличивают скорость нитрования,
привел авторов к предположению, что гетеролитическому рас-
распаду предшествует захват молекулой азотной кислоты одного
протона с превращением ее в ион НгМОз+. Последующий рас-
распад этого иона произойдет по уравнению
Мешниам нитрования ароматических сае&инений
183
O2N 1 ОН*
оагг + он2
B)
и приведет к возникновению нитроний-иона NO2+.
Таким образом, протон, присоединяющийся к молекуле
азотной кислоты, поставляется, очевидно, наиболее сильной
кислотой, имеющейся в системе, и весь механизм первого эта-
этапа реакции нитрования — образование нитроний-иона — может
быть изображен уравнениями C):
а) HN03 + H2SO4
б) НгЖ>з^ NOg
ц) НгО
HSO~
H2SO4 ;± Н30+ + HSO"
C)
Прд отсутствии кислоты более сильной, чем азотная, по-
последняя сама является датчиком протонов, при этом образует-
образуется нитрат-ион:
а) HN03 + HN03 ? H^NO
б) H2NO+^NO* +H2O;
В)
+ NO
3 ;
D)
Такая схема образования нитроний-иона, предложенная Ин-
гольдом с сотрудниками, дает возможность объяснить установ-
установленную этими авторами кинетику нитрования ароматических
соединений.
Второй порядок нитрования в серной кислоте является
следствием того, что в ее присутствии нитронийтиои образует-
образуется быстро, т. е. равновесие стадии б) процесса C) сильно сдви-
сдвинуто слева направо.
В случае, если нитрование проводят одной азотной кислотой
(т. е. более сильной кислоты не имеется), то нитроний-ион хо-
хотя тоже образуется с большой скорортью, но уже только в не-
небольшой равновесной концентрации. Эта концентрация будет
сохраняться в процессе нитрования постоянной, что и при-
приведет к первому порядку реакции по нитруемому соединению.
По той же самой причине при еттровании в органических
растворителях мало реакционношоеобных ароматических
184
Механизм нитрования ароматических соединений
соединений кинетика реакции будет также первого порядка по
этим соединениям. Действительно, даже если в этих условиях
малая равновесная концентрация нитроний-ионов создается
медленно, все же можно думать, что скорость этого процесса
гораздо больше скорости их вхождения в реакцию с нитруе-
нитруемыми ароматическими соединениями. В результате концентра-
концентрация нитроний-иона будет стационарной и близкой к равно-
равновесной, а это и обозначает кинетику первого порядка по нит-
нитруемому соединению.
Особенное значение имеет возможность нахождения на ос-
основе предложенной схемы причины протекания в органических
растворителях нитрования достаточно реакционноспособных
ароматических соединений по кинетике нулевого порядка.
Такая кинетика будет определяться тем фактом, что относи-
относительно медленна образующийся в органическом растворителе
айтронйй-ион будет немедленно реагировать с высокфреанцйон-
ньш ароматическим соединением. Таким образом.скоростьдатрО*
вания будет равна скорости образования нитроний-иона.
Эта же последняя постоянна, если азот^аая, кислота присут-
присутствует в постоянном избытке. Нитрование, следовательно, бу-
будет реакцией нулевого порядка.
Дальнейшим серьезным экспериментальным подтвержде-
подтверждением предложенной схемы образования нитроний-иона является,
по мнению авторов, уменьшение скорости нитрования н нулевого
и первого порядков, происходящее при добавлении нитратов
металлов^ Замедление нитрования при добавке нитратов указы-
указывает, что реакция, приводящая к образованию нитронийтвона,
включает в себя образование также и нитрат-иона и что эта
реакция может быть сдвинута в обратную сторону добавлен-
добавленными извне нитрат-ионами.f Действительно, предложенная
схема образования нитроний-иона вполне удовлетворяет этому
требованию, поскольку обратимая стадия а) процесса D) вклю-
включает в себя возникновение нитрат-иона.
Особенно существенным представляется авторам факт
уменьшения нитратами металлов скорости нитрования нуле-
нулевого порядка, без изменении при этом самого порядка реакции.
Нулевой порядок нитрования означает, что весь образующийся
Механизм шытроешия ароматических соединений
185
нитронганиов расходуется на нитрование ароматического со-
соединения. Согласовать ато с фактом уменьшения скорости нит-
нитрования при добавке нитрата металла можно лишь в предпо-
предположении, что процесс образования нитроний-иона, являющий-
являющийся стадией, определяющей скорость всей реакции нитрования
нулевого порядка, в свою очередь сам состоит из двух стадий.
При этом та его стадия, на которой происходит образование
иитрат-ионов, должна быть, как мы выше видели, обратимой;
вторая же стадия, являющаяся конечной стадией образова-
образования нитроний-иоиа, должна быть необратимой. Только в этом
случае добавка нитрат-ионов сможет уменьшить скорость
нитрования нулевого порядка, не меняя при этом самого по-
порядка.
Таким образом» специально для случаев нитрований нуле-
нулевого порядка в схемы C) и D) достаточно внести лишь то яз*
менение, что стадии б) в них протекают необратимым путем.
Образование нитроний-иона будет происходить теперь по урав-
уравнениям C°) и D°):
а) HNOg + HaSQ4 Si HaNOj -f HSO~ ;
б) H*NOg -» NO* + HaO;
в) HjO + H2SO« S- H3O+ + HSO~ ;
а) HNO3 + HNO3:?H2NO3-bNO3 ; \
б) H2NO*-» N0++ H2O; \ D*j
в) H20 + HNO8 ;± HN<VH2O. j
Из этих уравнений непосредственно следует пропорциональ-
пропорциональность между концентрацией нитроний-иона и равновесной кон-
концентрацией иона H2NOg. Таким образом, предложенная авто-
авторами схема объясняет наблюденный на опыте для нитрования
нулевого порядка линейный прирост скорости при добавках
серной кислоты и линейный прирост обратной величины скоро-
скорости при добавках нитратов металлов. Следует отметить, что,
нахождение линейного, а не квадратичного эффекта обозначает»
что на стадии а) процесса C°) молекулой азотной кислоты за-
захватывается только один протон, а на стадии а) процесса D°),
возникает только один нитрат-ион. Иначе говоря, в реакции
нитрования; возникает ион H2NO3, а не I
186
Механизм нитрования ароматических соединений.
Механизм
4раматичеекш соединений
187
Согласно схемам C°) и (Щ\ вода появляется только на
обратимых стадиях, и уже по одному этому ее действие при нит-
нитровании нулевого порядна не может быть значительным. Для
объяснения наблюденного на опыте незначительного тормовя-
щего влияния добавон воды авторы формулируют наличие еще
одного процесса распада иона Н2МОд в обратимой реакции
a) HNO3 + Н36* ^ H2NO* + Н2О; 1
б) h2no;-h2o+no;. j
При этом предполагается, что равновесие стадии а) процесса E°)
столь сильно сдвинуто слева направо, что отдаеИФййьно не-
небольшие добавки воды способны только незначительно сдви-
сдвинуть это равновесие влево и, следовательно, только очень
не намного уменьшить стационарную концентрацию иона
Н2РЮз. Следствием этого явится лишь незначительное
уменьшение скорости образования нитроний-иона и отсюда
слабое тормозящее действие добавок воды. Линейный
эффект добавок воды вполне согласуется с уравнениями
Переход к нитрованию, протекающему по первому порядку,
увязан, по мнению авторов, с тем, что в последнем случае об-
обратное взаимодействие нитроний-иона с водой [т. е. обратная
реакция стадии б) в процессах C°) и D°)] протекает значительно
быстрее, чем взаимодействие этого роца с нитруемым аромати-
ароматическим соединением. В этом случае, следовательно, обе стадии
а) и б) процесса образования нитроний-иона должны рассмат-
рассматриваться как обратимые, И мы приходим к уравнениям C) и D).
Нитрование первого порядна определяется тем, что на всем
его протяжении поддерживается стационарная концентрация
нитроний-иона, которой и пропорциональна константа скоро-
скорости первого порядка. Как ясно из уравнений C) и D), эта ста-
стационарная концентрация нитроний-иона пропорциональна до-
добавкам серной кислоты и обратно пропорциональна добавкам
нитратов металлов. Отсюда и следует наблюдаемая на опыте
линейная зависимость скорости нитрований первого порядка
от этих добавок.
Вторым этапом реакций нитрования как Одйой азётМй ки-
кислотой, так и в присутствии органических растворитёшй явля-
ется, по мнению авторов, взаимодействие иоиа нитрония с нит-
нитруемым ароматическим соединением. Для этого взаимодействия
они дают следующую схему:
а) N0* + АгН
медленная
стадия
Н
NOa
б) Аг+/
Н
быстрая
стадия
ArNOa
N0,
Такой механизм предполагает, что очень скоро после со-
соединения нитроний-иона с ароматическим атомом углерода
протон, соединенный с этим атомом, отщепляется. Таким обра-
образом этим механизмом исключается тримолекулярная реакция]
Подтверждение этому авторы видят в том, что, исходя из всей
предложенной ими схемы нитрования, удается вывести кинети-
кинетические аффекты, которые были экспериментально найдены при
изменении растворителей. Вывод этот сводится к следующему.
Первый wan реакции нитрования — образование нртро-
ний-иона, например, по схеме D)— состоит из прямых и обрат-
обратных процессов.
В результате прямых процессов три нейтральные молекулы
превращаются в одну нейтральную и два иона. Обратим® про-
процессы приводят к противоположному результату. (Зледова-
тельно, такой процесс образования нитроний-иомадолжен
значительно ускоряться при переходе к нитрованию в более
полярной среде, так как увеличение сольватирующей способ-
способности среды будет ускорять прямые процессы и замедлять об-
обратные.
Второй этан реакции нитрования, протекающий по схеме
F), не включает в себя ни образования, ни исчезновения иони
ных зарядов. Поэтому его скорость не будет зависеть от поь
лярности среды.
Теперь можно предсказать, как скажется на скорости и по-
порядке реакции нитрования изменение растворителя.
Выше было показано, что скоройть нитрования нулевого
порядка зависит только от прямых процессов образования нит-
188
Механизм нитрования ароматических соединений
Механизм нитрования ароматических соединений
189
роний-иона, а последние сильно зависят от полярности среды*
Поэтому увеличение содержания азотной кислоты или замена
уксусной кислоты на нитрометан (что увеличивает? полярность
среды) должны ускорить нитрование, что и было установлено
на опыте. , , :
Скорость нитрования первого порядка зависит от двух
факторов: стационарной концентрации нитроний-иона и кон-
константы скорости взаимодействия нитроний-иона с нитруемым
соединением. Первый фактор — стационарная концентрация
NC>2 соответствует равновесной концентрации, в свою оче-
очередь определяемой обратимым превращением трех нейтральных
молекул в два иона и одну молекулу. Отсюда ясно, что стацио-
стационарная концентрация нитроний-иона будет расти с увеличе-
увеличением полярности среды. Второй фактор не чувствителен к из-
изменению полярности среды, так как взаимодействие NO4*
с нитруемым соединением не сопровождается возникновением
или исчезновением ионных зарядов. В итоге нитрование пер-
первого порядка должно существенно ускоряться при увеличении
полярности среды. Это также было констатировано на опыте.
Что касается порядка реакции, то, как ясно иа предшествую-
предшествующего, он будет определяться тем, по какому пути -г- в обрати-
обратимых ли стадиях процесса образования NOg или при взаимо-
взаимодействии NOg с нитруемым соединением — будет расходо-
расходоваться подавляющая часть нитроний-иона. Расход до первому
пути приведет к кинетике первого порядка, расход по вто-
второму — к кинетике нулевого порядка. Как было доказано
выше, скорость процессов, осуществляющихся на первом пути,
может быть уменьшена ростом полярности среды; на скорости
процессов второго пути изменение полярности среды влияния
не окажет. Отсюда результатом увеличения полярности среды
должно быть установленное на опыте уменьшение порядка ре-
реакции от первого к нулевому.
Распространение выдвинутого Ингольдом с сотрудниками
механизма С-нитрования реакционноспособных ароматиче-
ароматических соединений в органических растворителях на N- и О-нит-
рование было произведено Блэкколлом и Хьюзом 169]. Основ-
Основным предположением этих авторов было то, что в случае, если
N- и Q-нитрование происходят также при помощи нитроний-
иона, то нитрование нулевого дорядка должно протекать с оди-
одинаковой скоростью независимо от природы нитруемого соеди-
соединения. Скорость нитрования будет определяться только ско-
скоростью образования нитронийниона, которая при прочих рав-
равных условиях не будет зависеть от того, происходит ли N-,
С- или О-нитрование.
Экспериментальные результаты Блэкколла и Хьюза по про-
проверке этого предположения приведены в табл, 11,
Таблица И
Скорости нитрования нулевого порядка
D М Н1Ч0з в нитрометане при 24,9°)
Нитруемое
соединение
Толуол
Метилпикрамид .
Метиловый спирт
Начальная
концен-
концентрация,
г-мовь/л
0,099
0,119
0,491
Скорость,
г-моль/л-сек.
10,3x10-'
10,4x10"'
10,2х10-5
Как ясно из данных таблицы, скорости С-, М- и О-нитрований
нулевого порядка действительно оказались одинаковыми, и,
следовательно, предположение авторов об одинаковом меха-
механизме С*, N- и О-нитрований при помощи нитроний-иона полу-
получило некоторое экспериментальное обоснование.
Дальнейшим развитием работ Ингольда с сотрудниками
было изучение нитрования ароматических соединений водной
азотной кислотой с добавкой более сильной кислоты (серной
или хлорной) [70]. В этих условиях нитрованию были подверг-
подвергнуты 2-фенилэтилсульфоновая и бензилсульфоновая кислоты.
Авторы считают наиболее вероятным, что в водных растворах
нитрованию подвергаются анионы этих сульфоновых кислот,
причем их реакционная способность (к нитрованию) сравнима
с реакционной способностью ароматических соединений, нит-
нитрующихся в органических растворителях по кинетике нуле-
нулевого порядка.
190
Механизм нитрования ароматических соединений
Было найдено, что нитрование указанных сульфановых
кислот водной азотиой кислотой (с примесью хлорной кислоты)
является реакцией первого порядка по ароматическому соеди-
соединению. Кроме того, было установлено очень решав влияние
изменения состава среды на скорость реакции. Действительно,
уже небольшое изменение в определенных узких пределах
концентрации либо азотной, либо хлорной кислот, лйб<| воды
сразу переводит реакцию от очень малой к очень большой
скорости. Существуют, таким образом, пороги концентраций
компонентов среды, при переходе через которые медленная
реакция становится очень быстрой. Вблизи таких порогов
добавка NaCIO4 ускоряет, а добавка МаМО3 замедляет нитро-
нитрование.
Переходя к установлению механизма нитрования водными
растворами азотной кислоты, авторы в первую очередь под-
подвергают обсуждению возможные изменения при образова-
образовании нитроний-иона [по схеме D°), относящейся К кинетике
нулевого порядка], при переходе от нитрования в органических
растворителях к нитрованию в водных растворах.
Согласно этой схеме, вода образуется одновременно с
нитроний-ионом. Это означает, что при добавлении до-
достаточного количества воды эта стадия должна стать обрати-
обратимой с сильным сдвигом равновесия влево. В этом случай, сле^
довательно, подавляющая часть образующегрся нитроний-
иона хнова превратится в ион H2NQ3, и лишь незначительная
часть пойдет на нитрование ароматического соединения. Та-
Таким образом переход к водным растворам должен быть связан
с переходом кинетики реакции от нулевого к первому порядку,
что и наблюдается на опыте.
Возможно, однако, и другое объяснение перехода нитро-
нитрования под действием воды от нулевого к первому порядку.
Можно предположить, что наличие больших количеств воды
полностью подавляет образование нитроний'-ионй, в резуль-
результате чего нитрование будет уже осуществляться Mfeae© актив-
активным ионом НгМОз+. Чтобы такое нитрование протекало ВО пер-
первому порядку, достаточно» чтобы из двух воамоишых реакций
расходования иона НгМОз" (отрыва протона и взаимодействия
МеямМШм нитрования ароматических аое&шнений
194
с ароматическим соединением) пёрдаая Происходила значительно
быйтрее второй:
Дополнительные данные, необходимые для установления
механизма нитрования Водной аЗй+ной кислотой, были полу-
получены при исследований раман-еиектров нитрующей смеси, упот-
употреблявшейся авторами в этих опытах. Состав смеси был следую-
следующий: В2О 72 мол.%, HNO3 17 мол.%, СЮ~ 11 мол.%.
Исследование раман-снектров показало, что практически
вся хлорная кислота присутствует в виде ионов Н+ и С1О4,
азотнай же Кислота в подавляющей своей части (до 96%) не-
ионизирована, и лишь 4% ее (т. е. 0,68% от всей смеси) нахо-
находится в виде Иитрат-ионоВ. Необходимо, однако, учитывать, что
исследование раман-спектров не Мйжет дать ответа ни на во-
вопрос о том, в какой мере молекулы азотной кислоты, проявляя
основную функцию, присоединяют к себе протоны (отщеплен-
(отщепленные от НСЮ4) и существуют в Виде ионов Н2МОз+, ни на во-
вопрос о том, в какой мере происходит присоединение протонов
к молекулам воды с образованием гидроксониевыхионов*. Тем
не менее тот факт, что только 4% имеющейся в рассматриваемом
случае азотной Кислоты находятся в йонизйроваяйом состоя-
состояний, Приводит К заключению, что значительная часть ее при-
присутствует в виде молекул HNOs. Действительно, если Даже
править, что все 11% протонов, образующиеся при иониза-
ций хлорной кйслЪты, Нрйсоедйийются к молекулам азотной
кислоты, давая ионы HaNO*; то и тогда все я«е Сохранится
свыше 5% (в расчете на всю смесь) молекулярной азотной кис-
ЛотЫ, Это является важным фактом, если принять во внимание,
что даже небольшие изменения состава нитрующей смеси, ко-
ТЬрые Не могут сколько-нибудь существенно повлиять на кон-
концентрацию молекулярной азотной кислоты, Вызывают очень
значительное изменение Скорости нитрования. Из этого несом-
несомненно следует заключение о том, что в опытах с водной азотной
кислотой нитрование молекулами HNOs не происходит.
* Это объясняв» Обычно тем, что такие Ионы {HaN03 , Нвб+) ^>
йввают свои протонй со столь большой %ЙЙ01ой, которая преа«*вует
сойдаяию точно определейвйго вйбрацййМйзм» уровня энергия-
'192
Механизм нитрования ароматических соединений
Второе заключение, которое можно вывести из спектральных
данных, сводится к тому, что если нитрующим агентом являет-
является ион HaNO3+, то ои должен присутствовать лишь в относи-
относительно малых концентрациях: иначе говоря, не может проис-
происходить преимущественное присоединение протонов, получаю-
получающихся из хлорной кислоты, к молекулам азотной кислоты,
а не к молекулам воды. Действительно, если бы это происхо-
происходило на самом деде, то концентрация иона Н^МОз нв могла
бы быть столь чувствительной функцией состава нитрующей
смеси: она должна была бы, например, меняться пропорцио-
пропорционально введенному количеству хлорной кислоты, в то время
как даже незначительное увеличение концентрации этой ки-
кислоты сверх некоторого значения вызывает очень резкое уве-
личение скорости нитрования.
Указанное вьипе наличие порогов концентраций, при пере-
переходе черев котОрьИ© скорость резко возрастает, авторы, приняв
ион Н2ИО»+ в качестве нитрующего агента в водных раство-
растворах азотной кислоты, объясняют следующим образом, рас-
сматривая три возможных случая.
1. Концентрации азотной кислоты и воды сохраняются
неизменными, содержание же хлорной кислоты увеличивается.
¦Образующиеся Ери диссоциации хлорной кислоты протоны вза-
взаимодействую? главным образом с водой с образованием гидро-
ксониевых ионов Н8О+. К молекулам азотной кислоты в при-
присутствии воды протоны присоединяются лишь в слабой степе-
степени, так как вода обладает бблыпими основными свойствами по
сравнению с азотной кислотой. Следует учитывать, что вода,
помимо соединения с протонами, гидратирует еще и молекулы
азотной кислоты, присоединяясь к положительно заряженному
центру последних. Авторы отражают это следующей формулой
гидрата азотной кислоты: Н2О... НОМО2. Следует думать, что
и протон, и молекула азотной кислоты, невидимому, способны
давать не только моно-, но и более высокие гидраты. В резуль-
результате постепенного увеличения концентрации хлорной кислоты
наступит момент, когда вся имеющаяся в системе вода окажется
связанной в виде гидратов. Начиная с этого момента, все до-
добавляемое количество протонов (из НСЮ4) будет уже реагиро-
Механизм нитрования ароматических соединений
193
вать с азотной кислотой, образуя ион H2NO3. Поскольку этот
ион является нитрующим агентом, постольку скорость нитро-
нитрования с этого момента начнет резко возрастать.
2. Концентрации воды и хлорной кислоты постоянны, уве-
увеличивается содержание азотной кислоты. Как и в предыдущем
случае, вода связывает протоны и гидратирует молекулы
азотной кислоты. Постепенное увеличение содержания
азотной кислоты приведет в некоторый момент к связыванию по-
подавляющей части воды. Начиная с этого момента, прибавляемая
азотная кислота будет взаимодействовать с протонами, обра-
образуя ионы H2NO3, т. е. резко увеличивая скорость нитрова-
нитрования.
3. Концентрации хлорной и азотной кислот постоянны,
увеличивается содержание воды. В этом случае в самом начале
реакции (в отсутствие воды) скорость нитрования максимальна,
так как все образующиеся протоны соединяются с азотной
кислотой, давая ионы H2NO3- Постепенное прибавление во-
воды приводит ко все более увеличивающемуся расходованию
протонов на образование ионов Н3О+. и, следовательно,
к постепенному уменьшению скорости реакции. При до-
достижении некоторого содержания воды количество про-
протонов, присоединяющихся к азотной кислоте, резко умень-
уменьшается, и, начиная с этого момента, скорость нитрования резко
упадет.
При дальнейшем изучении нитрования различных арома-
ароматических соединений азотной кислотой в органических раство-
растворителях Ингольд с сотрудниками [71, 721 показали, что нитро-
нитрование фенолов, ароматических аминов и их алкилированных
производных отличается от нитрования других ароматических
соединений. Это отличие проявляется в различном влиянии
азотистой кислоты на скорость нитрования. Как мы видели,
нитрование в органических растворителях, достаточно ре4-
акционноспособных к электрофильным замещениям аромати-
ароматических соединений (бензола, толуола и др.), протекает по кине-
кинетике нулевого порядка, причем добавление азотистой кислоты
несколько снижает скорость реакции. Выражение для скорости
в этом случае имеет следующий вид:
13 а. В. Топчиев
194
Механизм нитрования ароматических соединен ий
= К [АгНГ {а+Ь [HNOJ'/.}
'/.}-!
Иначе действует азотистая кислота при нитровании фенолов,
ароматических аминов и их алкилированных производных.
Прибавление азотистой кислоты в этом случае увеличивает
скорость реакции, причем порядок реакции из нулевого стано-
становится вторым
Если при нитровании этих соединений азотистая кислота
образуется при сопутствующем нитрованию окислении, реакция
носит автокаталитический характер.
Таким образом при нитровании фенолов, ароматических
аминов и их алкилированных производных мы встречаемся
с иным механизмом реакции, названным Ингольдом «специ-
«специальным» механизмом. При этом оказалось, что для нитрования
этих высоко реащионноспособных соединений возможен пере-
переход от обычного нитрования нитроний-ионом к этому специаль-
специальному механизму. Такой переход можно осуществить измене-
изменением концентраций азотной и азотистой кислот. При низких
концентрациях азотной кислоты реакция сильно катализи-
катализируется присутствующей азотистой кислотой и протекает по
кинетике второго порядка (см. выражения скорости). Посте-
Постепенное повышение концентрации азотной кислоты приводит
сначала к уменьшению каталитического действия азотистой
кислоты, затем к полному его исчезновению, когда порядок
реакции становится нулевым, и, наконец, к появлению незна-
незначительного тормозящего действия азотистой кислоты.
При установлении механизма действия азотистой кислоты
Ингольд с сотрудниками в первую очередь исходят из того,
что нитрование фенолов и ароматических аминов, подчиняясь
обычным законам ориентации, является эледарофильным за-
замещением. Следовательно, механизм его должен включать
электрофильный реагент. Учитывая, что скорость реакции при
нитровании в присутствии азотистой кислоты зависит от кон-
концентрации последней (и не зависит от концентрации азотной
Механизм нитрования ароматических соединений
195
кислоты), авторы делают естественный вывод, что веществом,
поставляющим этот электрофильный реагент, должна быть
сама азотистая кислота.
В цитируемых работах Ингольда азотистая кислота для боль-
большинства опытов приготавливалась растворением чистого N2O4
в азотной кислоте. При этом было показано, что растворенный
в азотной кислоте N2O4 является сильным электролитом. При-
Природа образующихся при этом ионов была установлена опытами
Гульдена и Миллена [73], изучавших раман-спектры раство-
растворов N2O4 в азотной кислоте. Оказалось, что N2O4 диссоциирует
не только гомолитически, но и гетеролитичееки по уравнению
N2O4 Z NO+
N07
В результате авторы приходят к заключению, что электро-
фильным реагентом при нитровании в присутствии азотистой
кислоты является нитрозоний-ион NO+.
Принятие нитрозоний-иона в качестве нитрующего агента
сразу же дало возможность Ингольду сформулировать меха-
механизм нитрования, ускоряемого азотистой кислотой, по анало-
аналогии с ранее выдвинутым им механизмом нитрования при по-
помощи нитроний-иона. Первым этапом нитрования, ускоряе-
мбго азотистой кислотой, является образование нитрозоний-
иона NO+:
HNO2 + HNO3
NO~
H2NC>2 ^ NO" + H2O;
NO+ + NO~ ~ NaO4.
Второй этап этой реакции — присоединение нитрозоний-
Цйона к нитруемому соединению (что представляет собой медлен-
ррую стадию реакции), последующее очень быстрое выделение
Вротона с образованием нитрозосоединения, которое далее
[Какже быстро окисляется в нитросоединение:
АгН + N0+
медленная
стадия
Н
N0+
13*
196
Мвзмтщмг нитрования ароматических соединений
Н
Аг
быстрая
стадия
/
¦— ArNO + H+
N0+
быстрая
стадия
ArNO + HNO3 * ArNO2 + HNO,
Школой Ингольда был также рассмотрен давно известный
экспериментальный факт влияния на скорость нитрования кон-
концентрации присутствующей серной кислоты.
Как уже указывалось выше, различными исследователями
было констатировано, что скорость нитрования максимальна
при концентрации серной кислоты около 90%. Снижение ско-
скорости нитрования при уменьшении концентрации серной кисло-
кислоты ниже 90% объясняется в настоящее время сопутствующим
уменьшением концентрации нитроний-иона. Причина же паде-
падения скорости нитрования при увеличении концентрации сер-
серной Кислоты сверх 90% до сих пор остается неясной. Выдвину-
Выдвинутое Беннетом и другими [63] объяснение, основанное на приня-
принятии Тримолекулярной реакции в качестве определяющей ста-
стадии процесса нитрования, оказалось, как установил Меландер
|р0], несостоятельным. Выше было показано, что наличие три-
тримолекулярной реакции при нитровании ароматических соеди-
соединений отрицает и Ингольд. В литературе, однако, имеется
и Другое предположение о причине замедления скорости нит-
нитрования с ростом кбнцентрации серной кислоты свыше 90%,
которое связывает этот факт с основным характером нитруе-
нитруемого соединения.
С целью проверки этого предположения и установления
истинной причины рассматриваемого явления Гиллеспи и Нор-
Нортон [74] провели изучение влияния состава нитрующей смеси
на скорость нитрования при 25° триметилфениламмоний-иона
и п-хлорфенилтримбтиламмоний-иона (обоих в виде нитратов)
й п-хлорнитробенёскйа, обладающего основным характером.
Нитрование проводилось в сернокислой среде как водной (до
12% Н2О), так и содержащей свободный серный ангидрид (до
13% SOs). Было найдено, что скорость нитрования всех трех
изученных соединений уменьшается с увеличением концентра-
Механивм нитрования ароматических соединений
197
ции серной кислоты от 90 до 100%. Из этого следует, что в ос-
основности нитруемого соединения нельзя видеть главную при-
причину уменьшения скорости реакции.
При переходе к олеуму оказалось, что с увеличением со-
содержания в нем серного ангидрида скорость нитрования ио-
ионов растет, а скорость нитрования п-хлорнитробензола про-
продолжает падать. Последнее, по мнению авторов, вызывается
основным характером п-хлорнитробензола, т. е. способностью
его нитрогруппы присоединять протон. Такая протонирован-
ная нитрогруппа оказывает более сильное дезактивирующее
действие, чем обычная нитрогруппа.
Основной же факт падения скорости нитрования всех трех
изученных соединений при изменении концентрации серной
кислоты от 90 до 100% и последующий рост скорости при церв*-
ходе к олеуму авторы объясняют изменением при этом ди-
диэлектрической постоянной растворителя и связанным е этим
изменением его сольватирующей способности. Авторы считают,
чго при нитровании в момент переходного состояния проис-
происходит распространение заряда, сконцентрированного в ни-
троний-ионе, на ароматическое ядро. Поэтому уменьшение
диэлектрической постоянной растворителя, которое, по пред-
предположению авторов, происходит из-за образования ионов
при добавке воды или серного ангидрида к 100%-ной серной
кислоте, действительно должно увеличить скорость нитрования
при переходе как от 100 к 90%-ной серной кислоте, так и при
увеличении содержания серного ангидрида в олеуме.
Примером гемолитического, а не гетеролитического меха-
механизма нитрования является открытая Робинсоном [75, 76]
реакция нитрования и гидроксилирования надазотистой кисло-
кислотой. Робинсон с сотрудниками показал, что при взаимодей-
етвии азотистой кислоты с перекисью водорода образуется над-
азотистая кислота, которая способна нитровать и гидроксилиро--
вать ароматические соединения. По мнению авторов, надазо-
тистая кислота распадается гомолитически на два свобод-
свободных радикала:
HOONO -> НО" + NO*.
198
Механизм нитрования ароматических соединений
Наличие свободных радикалов доказывается тем, что над-
азотистая кислота способна инициировать процесс полимери-
полимеризации метилакрилата. Кроме того, при действии надазотистой
кислоты на бензол образуется фенол.
Реакция нитрования надазотистой кислотой проводится
в следующих условиях: ароматическое соединение в, количестве
100 г смешивается со 100 мл 5%-ной НаО2, 5 мл 3 н. HGI и 250 мл
Ы2О; в течение 30 мин. при комнатной температуре прибав-
прибавляется при постоянном перемешивании 150 мл 5%-ного
NaNO2.
Робинсон с сотрудниками изучил нитрование надазотистой
кислотой ряда ароматических соединений; бензола, толуола,
хлорбензола, нитробензола, фенола, диметиланилина, фене-
тола, фенилпропилового эфира и ацетофенона. Выход нитро-
и гидроксилированных производных невелик (порядка 10%).
Обсуждая возможный механизм нитрования надазотистой
кислотой, авторы приходят к выводу, что гетеролитический
механизм в этом случае должен быть отвергнут. Действительно,
в таких слабокислых растворах, в которых проводится это
нитрование, маловероятно образование иитроний-иона N0^.
Кроме того, образующиеся продукты отличаются по своему
Строению от продуктов, получающихся при нитровании тех
ж© веществ нитрующей смесью. Так, при электрофильном за-
замещении группа NO2 вступает обычно в орто- или пара-положе-
пара-положение при наличии в молекуле соответствующих ориентантов (на-
(например, С1, ОН, СНзи др.). При нитровании надазотистой кисло-
кислотой нитрогрушха в присутствии тех же ориентантов встает в ме-
га-положение (например, хлорбензол превращается в м-нитро-
хлорбензол и т. п.).
К идентичным выводам пришли и Уотерс с сотрудниками
[77], показавшие, что при нитровании хинолина надазотистой
кислотой получаются 6- и 7-нитрохинолины. Обычно при гете-
ролитическом нитровании (смесью HNO3 + H2SO4) образуются
5- и 8-нитрохинолины. Такое различие авторы объясняют гомо-
литическим механизмом нитрования надазотистой кислотой:
радикал ОН присоединяется в а-положение, открывая при
этом р-положение для взаимодействия с
Механизм нитрования ароматических соединений
199
но н
н ч/
но н
н ч/
-н2о OSN
/\
O2N
' У\/
N N
Следует отметить, что 6- и 7-нитрохинолины были полу-
получены ранее А. В. Топчиевым и П. П. Шорыгиным [78] при дей-
действии NO2 на хинолин при 100°. Повидимому, и в этом случае
нитрование протекает по гомолитическому механизму.
На основе полученных результатов Робинсон и сотрудники
предложили следующий детализированный механизм нитро-
нитрования надазотиотой кислотой. Первой стадией является распад
надазотистой кислоты на радикалы ОН и NO2. Первый присоеди-
присоединяется к ароматическому соединению, образуя аряльный ради-
радикал (стадия 2), который, реагируя с NO2, дает нестабильное мо-
молекулярное образование (стадия 3), распадающееся с выделе1-
нием либо воды, либо HNO2, либо Н2 (стадия 4):
1) HOONO -<• ОН + NO2
X X
I I ОН
2)
ОН-
он
U
-н
н
X
он
3)
X X
I он
~н > I II +Н2О
Ч/\ N0\ \/\
Н \ X NO2
\ I
l ^ V- он
X
\/
+ на
fV0H
I +HNO2
зоо
Механизм нитрования ароматических соединений
Для выяснения вопроса, является ли потеря протона в про-
процессе нитрования стадией, определяющей скорость реакции,
Лауэр я соавторы [79] изучали нитрование монодейтеробензола.
При нитровании монодейтеробенаола, содержащего 91,5 ±
±1»7 мод.% GeHBD, образуются нитробензол, содержащий
74,9 ± 0,7 мол.% монодейтеронитробензола, и м-динитробензол,
содержащий 60,9 ± 2,0 мол. % монодейтеро-м-динитро$ензола.
Уменьшение содержания дейтерия не является, как показы-
показывают опыты, следствием реакции дейтерообмена, так как При
обработке обычных CeHe> CeH6NO2, и м-динитробензола дэй-
теросерной кислотой происходит лишь ничтожное введение
D в эти молекулы. При обработке CeH5D концентрированной
HaSO^ при 50—60° менее чем за 1 час происходит уменьшение
содержания СeH6D до 76,7 мол.%. Если бы реакция изотопного
обмена дошла до равновесия, содержание CeH6D должно было
уменьшиться до 41 мол.%. Следовательно, реакция детейро-
обмена проходит с меньшей скоростью, чем реакция нитрова-
нитрования. В результате проведенных опытов авторы пришли к заклю-
заключению, что отщепление протона от реакционного комплекса не
является стадией, определяющей скорость реакции нитрования.
Из работ по механизму нитрования ароматических соедине-
соединений заслуживает внимания также работа Джонса, Торна, Лайна
и Тейлора [80]. Эти авторы при исследовании спектров погло-
поглощения азотной кислоты, начиная с 80%-ного водного раствора
до раствора, содержащего 24% избыточного N2O5, нашли,
что максимум поглощения находится вблизи 2650 А и что ин-
интенсивность этого максимума изменяется в зависимости о* со-
состава раствора.
Спектроскопические измерения показали, что интенсивность
поглощения повышается с увеличением концентрации ки-
кислоты, достигая максимального значения при содержании воды,
равном 7% (для водных растворов); при последующем увели-
увеличении концентрации азотной кислоты поглощение резко па-
падает (минимум при содержании воды 5%). При дальнейшем
уменьшении содержания воды интенсивность поглощения снова
возрастает, однако при переходе к безводной азотной кислоте
максимум поглощения становится размытым.
Механизм нитрования ароматических соединений
201
Добавление азотного ангидрида приводит к возрастанию
интенсивности поглощения, но Максимум становится все ме-
менее и менее заметным (при содержании 12% N2O6 (максимум
исчезает).
Эти результаты были объяснены наличием в системе сле-
следующих равновесий:
+Н.0
NO3
-H,0
+2Н.0
s + Н20 -z 2HNO3^II12H3O+ + 2NO" .
-2H,0
Растворы с содержанием 7% воды, дающие наибольшую
интенсивность поглощения, соответствуют, по мнению этих
исследователей, наибольшей концентрации недиссоциирован-
ной азотной кислоты. При дальнейшем уменьшении содержания
воды, которое приводит к размыванию максимума, азотная
кислота переходит в М2О5, причем создается равновесие
2HNO4 г N2O« + НаО
(азотный ангидрид частично ионизирует по ' схеме
no-no;+no;)
Н. С. Спасокукоцкий [81] дает обнаруженным указан-
указанными выше исследователями закономерностям другое толкова-
толкование. Он исходит из предположения, что в водном растворе, кро«-
ме обычной ионизации по схеме
HNO3 + Н2О ?. Н8О+ + NO",
одновременно происходит в некоторой степени и автоионизация
ло схеме
ЗШОа t. NO+ + Н3О+ + 2NO~.
Максимум поглощения 2650 А, по мнению Спасокукоцкого,
можно приписать присутствию иона NO?. При дальнейшем
^увеличении концентрации кислоты процесс автоионизацйи
елается все более и более заметным. Усиление автоиониза-
+нии идет, однако, медленнее, чем уменьшение нормальной
шизации с водой, вследствие чего количество недиссоцииро-
¦ ванной азотной кислоты увеличивается.
202
Механизм нитрования ароматических соединений
До достижении концентрации, отвечающей 7%-ному со-
содержанию воды, начинается образование азотного ангидрида
по схеме
Так как этот процесс протекает с выделением воды, то попол-
пополнение количества недиссоциированной кислоты йрбисходит
за счет равновесия автоионизации, что сопровождается исчез-
исчезновением из системы некоторого количества ионов NO2+.
По этой причине наблюдается падение интенсивности по-
поглощения. Когда содержание воды достигает 5%, наступает ио-
ионизация азотного ангидрида, в связи с чем начинает увеличи-
увеличиваться поглощение для длин волн около 2650 Д. Таким обра-
образом, общая схема протекающих процессов выражается, по
Спасокукоцкому, следующей системой уравнений:
+знко
N2O5 + HSO+ + NO3 ^ 3HNO3 ~ * ЗНзС^ + 3NO3
¦It t^ —ЗН,0 (нормальная ионизация)
N0^ + NOj 2NO; + Н3О+ + NOg
автоионизация
В настоящей главе был приведен обзор механизмов, предло-
предложенных за последние три десятилетия для реакции нитрования
ароматических соединений азотной кислотой или нитрирующей
«месью. Из обзора видно, что господствовавшее вначале пред-
представление о протекании этой реакции путем последовательных
процессов присоединения и отщепления сменилось в дальней-
дальнейшем признанием того, что истинным содержанием нитрования
является процесс замещения.
Нитрование, как процесс присоединения-отщепления,
в трактовке Виланда A920—1921 гг.) заключался в присоеди-
присоединении элементов азотной кислоты по двойной связи аромати-
ароматического ядра и в последующем отщеплении воды с восстанов-
восстановлением двойной связи, а в трактовке Б. В. Тронова A924—
1929 гг.), С. С. Наметкина и А. С. Забродиной A925 г.), а также
Михаэля и Карлсона A935 г.) — в присоединении молекулы азот-
азотной кислоты целиком к одному из атомов углерода ароматиче-
ароматического ядра с одновременным переходом атома водорода от этого
атома углерода к одному из атомов кислорода присоединяющей-
Механизм нитрования ароматических соединений
203
ся азотной кислоты и в последующем отщеплении воды. В даль-
дальнейшем представление о нитровании как о процессе присоеди-
присоединения-отщепления, длительное время (до конца 40-х годов)
было общепринятым — менялись только взгляды на природу
нитрующего агентаi причем всегда принималось отщепление
многоатомного соединения (воды, серной кислоты и т. п.),
а не одного лишь атома водорода, на место которого в резуль-
результате нитрования должна встать нитрогруппа.
Развитие представлений о природе нитрующего агента, от-
отличной от природы недиссоциированной молекулы азотной
кислоты, ведет свое начало от работ Ганча A906—1909 и 1917—
1926 гг.). Как указывалось, Ганч на основании криоскопиче-
¦ских измерений и измерений электропроводности пришел к вы-
выводу, что в сильных кислотах в отсутствие воды происходит
нережй^ протона от одной молекулы кислоты к другой. В ре-
результате молекула, явившаяся донором протона, превра-
щаетсЙ в отрицательный ион, а молекула, играющая роль ак-
акцептора протона,— в положительный ион. В азотной кислоте
такой процесс приведет к образованию нитрацидий-иона
{H2N(|3^ НзГЮ^) и нитрат-иона (ГТОз )¦ В случае смеси двух
кисло||, например азотной и серной, донором протона явится
более сильная кислота, и, следовательно, возникнут ионы
H2NO^f (или НзГТОз+) и HSO4 . Серьезным подтверждением
этих Заключений явилось получение Ганчем в кристалли-
кристаллической виде перхлоратов нитрацидия [H2NO3]+[C1O4] и
1НШ>]+[СЮ]-\
t Ганч не изучал нитрования ароматических соединений,
однанЧ» его теория строения гомогенной азотной кислоты и ее
«месей с серной кислотой оказала, как мы видели, сильное
влияние на все последующее развитие исследований этого
¦процесса. Теперь при вскрытии механизма нитрования арома-
ароматических соединений уже нельзя было игнорировать наличия
в нитрующей смеси ионных образований и сводить реакцию
воздействию только нейтральных молекул азотной кислоты
а нитруемое соединение. Большая реакционная способность
ihmSI образований заставляла предполагать их несомненное
№ в реакции, и не учитывать их стало невозможным.
Механизм нитрования ароматических соединений
Одним иа первых отражений этого были взгляды Гезеринг*-
тона и Меосона, которые, изучая нитрование нитробензола»
пришли в 1933 г. к заключению о первоначальном образовании
в этой реакции комплекса [СеН6]ЧО2-Н]+ЩОаГ, катион
которого при взаимодействии с недиссоциированной молеку-
молекулой азотной кислоты превращается в CeH4(NOa)a и ШаОГ.
Таким образом, эти авторы хотя и рассматривают нитрова-
нитрование как ионно-комплексную реакцию, однако принимают, что
ионизированным образованием является само нитруемое со-
соединение, превращающееся в катион в результате присоедине-
присоединения протона, а нитрующим агентом — недиссоциированная мо-
молекула азотной кислоты.
Такой же точки зрения придерживался Дани, A939 г.).
Он также приходит к выводу, что при нитровании в водном
растворе серной кислоты нитруемое ароматическое соединение
путем присоединения протона превращается в кдтион, который
в дальнейшем взаимодействует о недиссоциированной моле^
кулой азотной кислоты.
Двойственную позицию заняли Лауэр и Одда. В работе
1936 г., посвященной нитрованию нитробензола и антра-
хинона, они проводят резкое различие между механизмами
реакции в зависимости от того, протекает ли она в водных или
безводных средах. В первом случае нитрующим агентом яв-
является, по мнению авторов, недиссоциированная молекула азот-
азотной кислоты, элементы которой присоединяются по двойной
связи с последующим отщеплением воды. Следовательно, для
этого сдучая полностью принимается механизм Виланда.
Во втором сдучае, т. е. при нитровании в безводных раство-
растворах серной кислоты, авторы считают уже, что нитрующим аген-
агентом является нитрацидий-сульфат [H2NOa]+ [ИБО*]", ко-
который, присоединяясь по двойной связи ароматического ядра,
дает промежуточно© соединение. Последнее, отщепляя воду
и серную кислоту, переходит в нитросоединение. Такой меха-
механизм уже полностью отвечает представлению Ганча о строении
азотной кислоты.
Ионный механизм нитрования ароматических соединений
выдвигал в 1940 г. и М. И. Усанович. Принимая по Ганчу на-
Механизм нитрования ароматических соединений
205
личие в нитрующей смеси нйтраиидий-иона, М. И. Усанович
сватает, что первым актом нитрования является присоедине-
присоединение этого иона к одному из атомов углерода ароматического
ядра. Образовавшееся промежуточное соединение, отщепляя
молекулу воды и протон, дающие HgO+, превращается в нит-
] осоединение.
Помимо Лауэра и Одда и Усановича к началу 40-х годов
1ругие авторы также присоединились к точке зрения, соглас-
согласно которой нитрующим агентом при нитровании ароматиче-
i ких соединений Является нитрацидий-ион. Следует при
• том отметить, что такая «замена» нитрующего агента (нитра-
нидий-ион вместо недиссоциированной молекулы азотной
кислоты) вполне укладывалась в представление о нитровании
как о процессе присоединения — отщепления.
Однако уже в середине 40-х годов предположение, что ни»*
рующим агентом является нитрацидий-ион, не могло считаться
общепринятым. Более того, в работах второй половины 40-х
1 одов были получены объективные доказательства того, что
истинным Нитрующим ароматические соединения агентом слу-
служат не нитрацидий-ион H2NO3 или Н3ГЮз+, а нитроний-
чон NO2+.
Впервые мысль о существовании иона NO2 еще в 1903 г.
ныоказал Эйлер [82]. В работе 1922 г. [83] он снова возвра-
возвращается к ней. Этот ион упоминался в литературе и в последую-
последующие годы [84—86], однако вплоть до работ Ингольда и сотруд-
сотрудников [87] в 1946 г., в которых были изучены влияние азотной
кислоты на точку замерзания серной кислоты, а также спектры
комбинационного рассеяния смесей азотной кислоты с другими
кислотами, объективные подтверждения действительного су-
существования нитроний-иона отсутствовали.
В обзоре механизмов нитрования ароматических соедине-
соединений, данном в этой главе, из соображений цельности изложе*
1ния не рассматривались эта работа Ингольда, а также другие
работы, хотя и надежно подтверждавшие существование нит-
нитроний-иона, но не путем изучения процесса нитрования,
& на основе криоскояичеоких и спектроскопических измерений
смесей азотной кислоты с другими кислотами. В заключение
206
Механизм нитрования ароматических соединений
обзора целесообразно, однако, привести и эти доказательства
наличия нитроний-ионов в нитрующих смесях.
В 1946 г. Ингольд с сотрудниками [87], применив улучшен-
улучшенную по сравнению с использовавшейся Ганчем криоскопическую
технику, смогли показать, что понижение точки замерзания
серной кислоты, вызываемое растворением в ней азотной ки-
кислоты, в четыре раза больше понижения в случае идеального
раствора. Ганч, наблюдавший в 1908 г. трехкратное по вели-
величине понижение точки замерзания серной кислоты при раство-
растворении в ней азотной, объяснил его превращением азотной ки-
кислоты в нитрацидий-ион:
HNO3 + 2H2SO4
2HSO~.
Протонирование азотной кислоты, предположенное Ганчем, пол-
полностью принимается и Ингольдом. Объяснение же четырех-,
а не трехкратного понижения точки замерзания Ингольд на-
находит в дальнейшем распаде нитрацидий-иона на ионы нит-
рония N0* и гидроксония Н3О+. Суммарное уравнение, сле-
следовательно, приобретает следующий вид:
НКГОз + 2H2SO4 - N0+ + Н3О+ + 2HS0".
Ингольд считает, что нельзя предложить никакого другого
объяснения четырехкратного понижения точки замерзания для
системы HNO3 — H2SO4. С таким выводом, действительно,
трудно не согласиться.
Второе объективное доказательство реального существо-
существования нитроний-иона было получено при изучении спектров
комбинационного рассеяния смесей азотной с другими, глав-
главным образом с серной, кислотами. В спектрах этих смесей
всегда наблюдаются две линии с частотами 1400 и 1050 см,
причем их интенсивность исключает предположение о том, что
источником этих линий является неизмененная молекула азот-
азотной кислоты. Шедэн [88], однако, смог показать присутствие
этих частот в спектре комбинационного рассеяния гомогенной
азотной кислоты. Следовательно, их источником является
какой-то продукт, образующийся из азотной кислоты. Шедэну
удалось далее открыть, что такой продукт получается в резуль-
Механизм нитрования ароматических соединений
207
тате дегидратирования азотной кислоты и что он разрушается
при добавлении воды, приводящем к регенерации молекулярной
азотной кислоты. В то же время Сусц и Бринер [89] нашли
частоты 1400 и 1050 см в спектре комбинационного рассея-
рассеяния раствора азотного ангидрида M2OS в азотной кислоте, после
чего стало несомненным, что их источником является особая фор-
форма азотного ангидрида. В цитированной выше работе Беннет,
Бранд и Вильяме [44] предположили, что такая форма возник
кает при ионизации азотного ангидрида; частота 1400 см
отвечает нитроний-иону, а 1050 см — нитрат-иону. Решаю-
Решающее подтверждение этого взгляда было получено Ингольдом
с сотрудниками [87] в работе 1946 г. В ней были изучены спектры
комбинационного рассеяния смесей азотной и хлорной, а так-
также азотной и селеновой кислот. В обоих случаях была обнару-
обнаружена частота 1400 см1, частота же 1050 см отсутствовала,
а вместо нее появлялись частоты, отвечающие анионам хлорной
и селеновой кислот. Дальнейшее исследование этих авторов
установило, что появление линии с частотой 1400 см вы-
вызвано источником, который кроме нее не дает никаких других.
Известно, что одну основную линию в спектре комбинацион-
комбинационного рассеяния могут давать только двухатомные и линейные
трехатомные частицы с одинаковыми конечными атомами. В рас-
рассматриваемом случае такой частицей может быть только нитро-
ний-ион NOg.
Можно, наконец, привести еще одно доказательство суще-
существования нитроний-иона. Ингольд с сотрудниками [90], ис-
используя улучшенную методику, повторили эксперимент Ганча
по получению твердых продуктов взаимодействия азотной
и хлорной кислот. Как уже выше сказано, Ганч приписал этим
продуктам состав и строение перхлоратов нитрацидия, Ин-
Ингольд же показал, что на самом деле они представляют собой
смесь перхлоратов нитрония и гидроксония (NO2)+ (СЮ4)~
и (НзО)+(СЮ4)".
Подводя итог приведенным результатам криоскопическшс
и спектроскопических измерений самой азотной кислоты и глав-
главным образом ее смеоей с другими кислотами, можно конста-
констатировать, что в конце 40-х годов реальность существования
208
Механизм нитрования ароматических соединений
в этих средах нитроний-иона уже не могла подвергаться со-
сомнению. Это естественно сказалось на предложенных в даль-
дальнейшем механизмах нитрования ароматических соединений.
Действительно, все механизмы этого процесса, появившиеся
в литературе, начиная с конца 40-х годов, принимают нитро-
нийгион в качестве нитрующего агента.
Характерной и положительной чертой исследований, про-
проведенных в эти годы (Титова, Вестгеймера и Карата, Вилльям-
са и Лоуэна, Беннета, Бранда и Вилльямса, Томменсона и
Гроггинса и особенно Ингольда с сотрудниками), является то,
что в них, наряду с изучением химизма реакций, все ббльшую
роль начинает играть установление ее кинетических особенно-
особенностей. При этом, как следует из приведенного выше обзора этих
работ, оказалось, что ббльшая часть кинетических данных о
яитровании ароматических соединений получила удовлетвори-
удовлетворительное объяснение при принятии нитроний-иона в качестве
нитрующего агента. Это в первую очередь относится к такой
важной кинетической характеристике, как изменение порядка
реакции в зависимости от состава нитрующей смеси и раствори-
растворителя. Следует признать, что Ингольд и его школа блестяще
разрешили эти казавшиеся мало понятными кинетические
особенности реакции.
Таким образом можно считать, что в конце 40-х и в начале
50-х годов было не только констатировано реальное существо-
существование нитроний-иона в нитрующих средах, но и осуществлено
посредством его нитрование ароматических соединений*. Та-
Такая замена в механизме реакции нитрацидий-иона на нитро-
ний-ион означает переход к представлению о нитровании как
о процессе замещения. Действительно, теперь реакцию нитро-
нитрования представляют как присоединение нитроний-иона к атому
¦ Следует напомнить, что, по Ингольду, в определенных условиях
нитрующим агентом не всегда является ион нитрония. Так, при нитрова-
нитровании разбавленной азотной кислотой нитрующим агентом будет нитра-
цидий-ион (см. стр. 190), а при нитровании фенолов, аминов и алкилиро-
ванных производных в присутствии азотистой кислоты возможен переход
от обычного нитрования нитроний-ионом к нитрованию ионом нитрозо-
ния (см. стр. 194).
Межаниэм нитрования ароматических соединений
209
углерода ароматического ядра о последующим или одновремен-
одновременным отрывом от этого атома углерода связанного с иди* атома
водорода в виде протона. Здесь нет, следовательно, образования
нового вещества соединением отщепляющегося протона с ка-
какой-то частью присоединившегося Нитрующего агента.
Определение такого механизма как процесса замещения еще
не устанавливает того, осуществляется ли он в один акт или
в стадийной последовательности двух актов. Беннет, Бранд
и Вилльямс предположили первое, Ингольд с сотрудниками —
второе. Как указывалось, вопрос был решен опытами Мелан-
дера, воспользовавшегося методом меченых атомов и показав-
показавшего, что процесс нитрования иротекает в две стадии, иэ ко-
которых первая — присоединение нитроний-иона к ароматической
молекуле — происходит с относительно небольшой скоростью,
а вторая — отщепление протона — с очень большой скоростью.
В результате скорость первой стадии определяет скорость всего
процесса нитрования.
Как ясно из всего материала этой главы, основным выводом
длительного исследования реакции нитрования ароматических
соединений следует считать установление для нее ионного ме-
механизма. Такое нитрование, следовательно, является гетероли-
тической реакцией. Как будет Показано в следующей, главе;
имеется много оснований предполагать совершенно иной, свох
бодно радикальный механизм для нитрования алифатических
соединений, которое поэтому представляет собой гемолити-
гемолитическую реакцию. До недавнего времени можно было считать,
что нитрование ароматических и алифатических соединений
принципиально различается дменно в этом. В последние годы,
однако, появились первые работы, которые заставляют пред-
иолагать возможность пересмотрач такого резкого и принци-
принципиального разграничения процессов нитрования этих двух клас-
классов соединений. Эти изложенные выше работы Робинсона
с сотрудниками и Уотерса с сотрудниками свидетельствуют о
том, что в известных условиях нитрование ароматических
соединений может осуществляться iab свободно радикальному
механизму. Авторам удалось показать, что при нитровании
ряда ароматических соединений азотистой кислотой в
14 а. в. топчиев
210
Механизм нитрования ароматический соединений
присутствии перекиси водорода процесс протекает томолитиче-
оки. Никакого механизма такого нитрования ароматических со-
соединений при этом выдвинуто не было, за исключением пред-
предположения, что образующаяся надазотистая кислота распа-
распадается на радикалы ОН и NO2, которые и «веду» процесс:
HOONO — ОН + NO2.
Можно, однако, предположить, что в данном случае образо-
образование свободных радикалов происходит так же, как и в реак-
реакциях с участием перекиси водорода и ионов переменной валент-
валентности. Известно, что Н. Н. Семенов [91], воспользовавшись
данными Ури [92] об изменении свободной энергии в следую-
следующих двух процессах:
Ге3+ + Н2О2 г Гё2+ + Н+ + НО2
и
Си2+ + Н2О2 "* Си+ + Н+ + НО2,
рассчитал равновесные концентрации радикала НО2, возни-
возникающего в указанных системах. Эти реакции оказались вполне
достаточными для инициирования цепной реакции.
Аналогично образование свободных радикалов ОН и NO2
в системе азотистая кислота — перекись водорода можно пред-
представить следующим образом:
1) HONO Z ОН- + NO+;
2) N0+ + Н2О2 ^ NO2 + Н+ + ОН;
3) ОН + H0NO ^ Н2О + N02;
4) NO2 + Н2О2 Z. NO" + Н+ + ОН;
5) O
В основе такой схемы лежит предположение о возможной дис-
диссоциации азотистой кислоты на ионы ОН" и N0+ (реакция 1).
Нитрозоний-ион NO+, реагируя далее с перекисью водорода
по типу приведенных выше реакций ионов Fe3+ и Си2+
с Н2Оа, превращается в свободный радикал NOa, причем од-
одновременно возникает радикал ОН (реакция 2), В отсутствие
ароматического соединения в такой системе будут протекать
Дитературй
211
реакции 3, 4 и 5, и суммарное уравнение всего процесса будет
иметь следующий вид:
2HNO2 + 2Н2О2 -» 2HN03 + 2Н2О.
Если же к такой системе добавить ароматическое соедине-
соединение, то свободные радикалы ОН и NO2, помимо взаимодействия
по реакциям 3, 4 и 5, частично будут вступать в реакции
6) АгН + ОН ¦*' Аг + Н2О,
7) Аг + NO2 -* ArNO2,
приводящие к образованию нитропроизводных.
Таким образом, в тех случаях, когда в системе создается
возможность образования свободных радикалов, нитрование
ароматических соединений может протекать и по радикальному
механизму.
ЛИТЕРАТУРА
l.H. Wieland, E. Sakellarios. Ber., 52, 898 A919); 53t
201 A920).
2. Н. Wieland, F. R a h n. Ber., 54, 1771 A921).
3: J. Tiehle. Ann., 306, 128 A899).
4. A. Hollemann. Die direkte Einfiihrung von Substituenten in
den Benzolkern. Leipzig, 1910.
5. А. К e k u 1 e. Ber., 2, 329 A869).
6. Сравни С, III, 618 A923).
7. E. P. К о h 1 e r, N. L. Drake. J. Am. Chem. Soc, 45, 1281
(*923); C, III, 618 A923).
S. R.1 Ansshutz, A. Gilbert. Ber., 54, 1854 A921); 57, 1697
A924).
9. G. О d d о. С, II, 1598 A925).
1Э. S. Gabriel. Ber., 18, 2442 A885).
¦il. S. R. Cawley, S. G. Plant. J. Chem. Soc, 1214 A938).
12. J. Meisenheimer. Ber., 33, 3547 A900).
И. Б. В. Тронов. Изв. Томск, технол. ин-та, 45, № 3 A924). Труды
IV Менделеевского съезда, 157 A925); ЖРХО, 61, 2388 A929); Изв.
Сиб. химико^гехнол. ин-та, № 2 A931); Б. В. Тронов,
Н.Х. Сибгатуллин. ЖРХО, 62, 2267 A930).
IS. Б. В. Тронов, Л. В. Ладыгина. Укр. хим. журн., 7,
55 A932).
14*
212
Литература
15. С. С. Наметкин, А. С. Забродин». ЖРХО, 57, 87
A925).
16. A. Michael, G. H. Carlson. J. Am. Chem.Soc, 57,1268A935).
17. J. Glerschbach, А. К e s s 1 e r. Z. phys. Chem., 2, 676 A888).
18. Boedtker. Bull. Soc Chim. France, 726 A908).
19. A. Werner. Neue Anschaungen auf dein Gebiete der anorgani-
sehe Chemie.
20. P. Pfeifer. Organisthe Molektilverbindun gen. Stuttgart, 1922.
21. A. Mich a el, С. Н. С а г 1 s о n. Ber., 29,1795 A896); J. Am. Chem.
Soc, 57, 1268A935).
22.1. Schmidt, E. Heinle. Ber., 44, 1488 A911).
23. I. Schmidt. Ber., 33, 3251 A900).
24. A. M. Б е р к е н г е й м. Журн. общ. химии, 3, 381 A933).
2.5- A- Hantzsch. Z. phys. Chem., 61, 257 A907); 62, 178, 626 A907);
65, 41 A908); 68, 204 A909).
26. A. Hantzsch. Z. Elektrochem., 24, 201 A918); 29, 221 A923);
&>, 194, 397 A924); 31, 167, 455 A925); Ber., SO, 1413, 1422 A917);
52, 1544 A919); 58, 612, 941 A925); 59, 1096 A926).
27. E. Schaeffer. Z. Wiss. Phot., 8, 312 A910); 17, 193 A913);
Z. angew. Chem., 97, 285 A916); 98, 70 A916).
28. H. H alb an, J. В i s en Ъ г a n d. Z. phys. Chem., 132, 433 A928).
29. E. Farmer. J. Soc. Chem. Ind., 50, 75 A931).
30. H. M artinsem. Z. phys. Chem., 50, 385 A9Q4); 59, 605 A907).
31. K. Lauer, R. О d d a. J. prakt. Chem., 144, 176, A936).
32. R. L a n t z. Bull. Soc. Chim. France, [5], 6, 280 A939).
33. I. N. Bronsted, Rec trav. chim., k%, 718 A923); Ber., 61, 2049
{1928).
34. J. A. H et h e г i n g t о n, J. M a s s о ». J. Chem. Spc, 105 A933).
35. J. Mas son. J. Chem. Soc, 3200 A931). Ср. А. И. Титов.
Журн. общ. химии, 18, 140, 733 A948).
36. М. И. Уса но вич. Журв. общ. химии, 219 A940); М. И. У с а-
нович, Ш. Абпдов. Журн. общ. химии, 10, 224 A940);
М. И. Усанович, И.Глухов. Журн. общ. химии, Юр 227 A940);
М. И. Усановнч, Т. Сушкевич. Журн. общ. химии,
Ю, 230 A940).
В. В. Марковнико». ЖРХО, 31, 48 A899).
A. Klemenz, R. S с h о 11 е г. Z. anarg. allg, Chem., 141, 231
A924).
L. N. Fergus so n. J. Chem.,
J. P. W i b а и t. Rec. trav. chim.
37.
38.
,39.
40.
41.
42.
43.
Kduc, 23, 550 A946).
34, 241 A915).
А. В. Сапожников. ЖРХО, 36, 1098 A903); 37, 374 A905);
38, 1192 A906).
A. Schaarschmi й t. Z. angew. Chem., 39, 1457 A926).
А. И. Титов. Журн. общ. химии, 17, 382 A947).
НЙ I':1 ' i |'|l!||'|!l|l!!!|j|ll||l!ili:lill ^ а в р1 и ii \»s ч1.: i;, ¦ j.
Литература
л&,
G. M. B^flSe^if-ll/hS. D. Brand, G. W ill i а ш s. ,
Soc, 869 til946).
i 45. А. И. T alee,1 H, Гг Л a n t e в. Журн. общ. химЯ*, 18, № 4, 741
A948).
,46. А. И. Титов. Жури. общ. химии, 18, Яа 2, 190 A948); \%, 733
A948), ,
47. Н. Н. Ворожцов. Основы синтеза промежуточных продуктов
и И|Мдаелей, гл. Ш, М., Госхимиадат, 1940. .;
48. Т. G. Войаег, М<. Е. James, A. M. L о w e n, G.Wil-
G.Williams. NatttM, Ш, 955 A949).
|[,| 49. Ogata. С. А., 1557е A947).
50. Б. В. Тронов, Г. Я. Б ер. ЖРХО, 62, 2357 A930).
51. С. A., 4487dA947).
52. Н. Erlenmeyer. Helv. Chim. Acta, 30, 2058 (Ш7).
53. А. П. Терептьев, Б. М. Кедров. Уч. зйп. МГУ,
213 A936); С, II, 1993 A937).
54. А. В. Топчиев, В. ITi Алания, Г. С. Шнайдер.
Докл. АН СССР, 195, № 1, 89 A954).
I: 55. F. I. Modi с Jowa State Coll. J. ScL, 27, No 2, 219 A953).
56. F. U. Westheimer, M. S. KharaSch. J. Am. Chem. Soc,
68, 1871 A946).
f 57. G. M. В en n et. Chem. and Ind., 235 A949).
58. V. Gold, E. D. Hughes. Ji Chem. Soc, 2452 A950).
K. W. Dunning, С W» Nutfc. Trans. Faraday Soc, 47, 15
A951); E. S. Halbftrstadt. Nature, 158, 448 A946).
G. Williams, A. M. L о w e n. J. Chem. Soc, 3312 A950).
M. Tomlinson, P. H. G hoggins. Chfem. Eng., 57, Ks 12,
131 A950).
C. K. In gold, D. Mill'en, H. G. P 0 11 e. Nature, 158,
480 A946).
G. Williams, R. Simkins. J. Chem. Soc, 1386 A953).
G. M. В en net, J. С D. Brand, t). M. James, G.Wil-
G.Williams, T. G. S a u n d e r s. J. Cftem, Soc, 464 ^947).
64. II. H. Ворожцов. Основы синтеза промежуточных продуктов
и красителей, Мч Госхимивдат, 1950, стр. 151.
,, 65. С. Hoisted, А. Н. L a m Ъ е г t о п. J Chem. Soc, 3349 A953).
66.1 Mel and er. Nature, 163, 599 A949).
67. G A. pen ford, C. K. In gold. J. Chem. Soc, 929 A938);
E. D. Hughes, C. K. In go Id, R. Reed. Nature, 488,
448 A946),
68. E. D. Hughes, C. K. In gold, R. Reed. J. Chettt. Soc,
2400A950).
69. E. В lack all, E. D. Hughes. Nature, 170, 972 A952).
ft11
59.
! 60.
!
61.
62.
63.
214
Литвратурй
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
92.
Е. S. Н а 1 Ь ers t a d t, E.
J. Chem. Soc, 2441 A950).
С. А. В u n t on, E. D.
M.
D. Hughes, C. K. Ingold.
Hughes,
G- K.
Ingold,
B. Jacobs, R. N. Jones, G. J. M i n к Q f f, R. Reed.
J. Chem. Soc, 2628 A950).
J. G 1 a z e r, E. D. Hughes, С. К. Ingold, R. N. Jones,
D. M. James, E. Roberts. J. Ghem. Soc, 2657 A950).
L. D. S. Gould en, D. J. Mi 11 en. J. Chem. Sqc, 2620 A950).
R. J. Gillespie, L. Norton. J. Ghem. Soc, 971 A953).
E. Halfpenny, P. L. R о b i n s о n. J. Ghem. Soc, 939 A952).
W. Heslop, P. L. Robinson. J. Ghem. Soc, 1271A954).
W. A. Waters, J. R. Laville, J. Ghem. Soc, 411
A954).
A. В. Топчиев, П. П. Ш о р ы г и н. Вег., 69, 1874 A936).
W. M. Lauer, W. E. Noland, J. Am. Chem. Soc, № 15,
3689 A954).
R. N. Jones, G. D. Thorn, M. L у n e, E. C. Taylor.
Nature, 159, 163 A947).
H. С. Спасокукоцкий. Усп. химии, 17, № 1A948).
H. Е u 1 е г. Ann., 330, 280 A903).
Н. Euler. Z. angew. Ghem., 35, 580 A922).
P. W a Id en. Z. angew. Ghem., 37, 390 A924).
Tj R i, H. Eyring. J. Ghem. Phys,, 8, 433 A940).
G. C. Price. Ghem. Rev.; 29, 51 A941).
E. D. Hughes, G. K. I n g о 1 d, R. I. Reed. Nature, 158,
488 A946).
J. Gh ed i д. Gompt. rend., 200, 1397 A935); 201, 552, 714 A935);
202, 220, 1067 A936); 203, 772, 1509 A936); Ann. Chim.. 8,: 243
A937).
B. Susz, E. Briner, Helv. Chim. Acta, 18, 378 A935).
D. R. Goddard, E. D. H n g h e s, С. К. Ingold. Na-
Nature, 158, 480 A946); J. Chem. Soc, 2559 A950).
H. Н.Семенов. О некоторых проблемах химической кинетики
и реакционной способности. М., Изд-во АН СССР, 1954.
N. Uri. Chem. Rev., 50, 375 A952).
Глава третья
НИТРОВАНИЕ ПРЕДЕЛЬНЫХ, ЖИРНОАРОМАТИЧЕСКИХ
И НЕНАСЫЩЕННЫХ УГЛЕВОДОРОДОВ АЗОТНОЙ
КИСЛОТОЙ
В связи о успехами, достигнутыми дри синтезе нитропара-
финов, появился ряд работ по изучению свойств нитропарафи-
|| ов для ишш&ния различных путей их применения в орга-
материалы о свойствах нитропарафинов раз-
щ соседской; и f ностранной журнальной ди-
;»чадаем вдлесробрааным дать краткий обзор их
В B
11 росанэд №5j
jMliji! ... ... ii.f.M.,,1.:..1., :¦: fi .s ...r:..'. . i,!1 . ..;... , . , .. , .., ,
jl1""';" |i":'1"" ';i1 ¦''"''""'% 1. Свойства нитропарафинов ' :':
li"!1/1 '¦|1|ll!l41 - "' ¦¦¦ ' ¦'¦¦ ¦-¦'¦ ¦' ,¦!
Р^к^^гЙотШ^йСд^ононитроИйрафйай: представляют собой бесцвет-
'Ныек^йЛммийг© т. кип. от 101,7° и выше. Нитрометан раство-
|фяется в воде в объемном отношении 1:10 при 20°; растворимость
| Остальных нитропарафинов уменьшается с повышением моле-
!&5шярмого веса (табл. 12).
lljjjfei" |'"Т; —¦:
В! * По нитропарафинаы смотри:
!||. А. Й. Якубович. Усп. химии, 15, вып. 5, 577 A946).
||f P. F 0 да ft Дпй т е й я. Химическая Переработка нефти, стр. 74—81;
||1?:' М., 1952,: ,.
!. G. E g 1 о f f, М. А 1 е х a n d е г. Oil a. Gas J., 41, 23, 39, 49 A942).
li, О.., S chic k hr Angew. Chem., 62, 527—556 A950).
I W, Craber: Ind. Eng. Chem., 40, 1631 A948); 43, 1989 A951); 44,
1|!Ш1 A952); I,1 1098 A953). ' :'! : J '"'
Ш'Шб1 ййтр^йПёфина'м'^мотри: ;'1;1 . ¦ м'
i| p. П e p e к а м и н, А. С. С о п о в а. Усп. химии, 24, вып. 5 A955).
216
Нитрование углеводородов азотной кислотой
Таблица 12
Физические свойства нитропарафиное
Нитросоединение
Нитрометан . .
Нитроэтан . . .
1-Нитропропан
2-Нитропропан
В
61,04
75,07
89,09
89.09
.20
d20
1,139
1,052
1,003
0,992
— 29
— 90
—108
_ 93
101,2
114,0
131,6
120,3
27,8
15,6
7,5
12,9
„20
1,3818
1,3916
1,4015
1,3941
ЛЯ
9,5
4.5
1,4
1,7
Большинство органических растворителей (ароматические
углеводороды, спирты, сложные эфиры, кетоны, эфиры, кар-
боновые кислоты) смешиваются с нитропарафинами.
¦ Нитрометан — прекрасный растворитель для эфиров целлю-
целлюлозы; такими же свойствами обладает 2-метил-2-нитропропан.
Смеси нитропарафинов со спиртами являются хорошими рас-
растворителями не только для сложных эфиров целлюлозы, но
и для виншштовых смол, дростых эфиров целлюлозы и смешан-
смешанных сложных эфиров целлюлозы, как.например, ацетата-бутира-
та и ацетата-пропионата целлюлозы.
Нитропарафины представляют собой соединения, довольно
своеобразные с химической стороны. Переходя в таутомерную
форму «нитроновой кислоты», они обладают способностью
к различным превращениям и реакциям конденсации. При
конденсации с альдегидами они дают нитроспирты, которые
в свою очередь могут служить источником получения сложных
и простых эфиров, аминоспиртов и др.
Из продуктов превращения нитропарафинов заслуживают
также внимания нитроолефины, которые, обладая активной
двойной связью, могут давать различные продукты конден-
конденсации.
Свойства нитропарафинов
217
Восстановление нитропарафинов
Восстановление нитропарафинов до аминов осуществляется
при действии различных реагентов: цинка, свинца или железа
в кислой среде [1—5], амальгамы алюминия [6] и т. д.; нитро-
нитропарафины гидрируются в паровой фазе в присутствии катали-
I аатора Адамса [7], а также никеля, меди и платины [8]; хоро-
хорошие результаты получены при гидрировании с никелевым ка-
катализатором Ренея.
Нитропарафины восстанавливаются до алкилгидроксил-
аминов при действии металлов, например Sn и Zn, в присут-
присутствии кислот [9, 10] или в нейтральной среде [11] при действии
| SnCl2 [12], а также при каталитическом гидрировании. Ни-
Нитропарафины удается гидрировать [13, 14] до алкилгидроксил-
аминов в присутствии палладированного BaSO4. Алкилгид-
роксиламины могут быть получены посредством восстановления
нитропарафинов электрохимическим путем [15].
Превращение нитропарафинов в гидроксиламины может
производиться алкилметаллами и алкилметаллгалогенидами [16].
Из нитропарафинов могут быть получены и оксимы. Так,
| например, оксимы получены [171 при обработке нитропарафи-
нитропарафинов цинковой пылью в присутствии ледяной уксусной кислоты.
Первичные и вторичные нитропарафины могут быть превра-
превращены в оксимы посредством пиролиза продукта алкилирования
| их до нитроновых сложных эфиров:
R2G = NO2Na + GH3J -^ R2C = N — OGH3 + Na J;
О
71
RSG = N — OGH3 ПИр°ЛИ1 RSG = NOH + HGHO.
Действие минеральных кислот
на нитропарафины
При действии концентрированных сильных минеральных
Цкислот нитропарафины дают в качестве продуктов реакции
¦сарбоновые кислоты и соли гидроксиламина с хорошими выхо-
выходами. Так, например, этим путем синтезирована уксусная
¦218
Нитрование у&леводородав азотной кислотой
кислота из нитроэтана [18] с выходом 90%, пропионовая из
1-нитропропана с выходом 96% и изомасляная из 1-нитроизо-
бутана с выходом 90%. Одновременно при этой же реакции по-
получены соли гидроксиламина с выходом 86—90%.
Для осуществления этого процесса смесь 1 моля нитро-
парафина и 1 моля 85%-ной серной кислоты нагревали с об-
обратным холодильником при перемешивании до наступления
экзотермической реакции, по окончании которой нагревание
продолжали еще в течение 8 час.
Как предполагают, механизм указанной выше реакции ео-
стоит в предварительной таутомеризации нитропарафинов в аци-
форму (нитроновую кислоту), которая присоединяет по двой-
двойной связи минеральную кислоту; полученное соединение пере-
переходит, теряя воду, в нитрозопроизводное; нитрозопроизводное
перегруппировывается в смешанный ангидрид серной и гидро-
ксаМовой кислот, который, подвергаясь гидролизу, дает гидро-
ксамовую (алкилгидроксамовую) кислоту:
О
/
RCH = NO2H + H2SO2 -=> RCH — N — ОН -* RGH — N = О -»
А
\
«Or, "Н OSO3H
нитрозопронэводное
: = noh
OSO3H
смешанный ангидрид
серной и гидроксамо-
вой кислот
он
гидроксамовая
кислота
Гидроксамовая кислота в свою очередь подвергается гидро-
гидролизу с образованием конечных продуктов реакции — карбо-
новой кислоты и соли гидроксиламина:
RC = NOH+H2O + H2SO4-> RCOOH + NH2OH-H2SO4.
U
Некоторым авторам при действии минеральных кислот на
нитропарафины удалось выделить алкипгидроксамовую кисло-
кислоту, которая, согласно указанной схеме, является промежуточ-
Сеойстеа нитропарафинов
219
ным продуктом реакции *. Бамбергер и Рюст [18] получили со-
соответствующую алкилгидроксамовую кислоту из фенилнитро-
четана с выходом 2%. Липпинкот и Хэсс [19] синтезировали
пропангидроксамовую кислоту из 1-нитропропана с выхо-
юм 44%.
Действие разбавленных сильных минеральных кислот на
нитропарафины приводит к синтезу альдегидов и кетонов [20]:
2RCH = NO2Na + 2H2SO* -»• 2RCHO + 2NaHSO4 + N2O + H3O;
2R2C = NO2Na + 2H2SO* -» 2R2CO + 2NaHSO4 + N2O + H2O.
Кальциевые соли аци-нитропарафинов реагируют с раз-
разбавленными кислотами с лучшими выходами, чем натриевые
юли. Применяя кальциевые соли, Джонсон и Дегеринг [21]
( существили превращение нитропарафинов в альдегиды и ке-
юны с выходом 80—85%.
Действие оснований на нитропарафины
При действии оснований на нитропарафины получаются
|риалкилизоксазолы [22]; например, при действии щелочи на
иитроэтан получается триметилизоксазол:
4GH3GH2NO2 -»•
СН -С
+ CH3CN + 2HNO2 + ЗН3О
\
О
I В отличие от других нитропарафинов нитрометан дает при дей-
действии оснований метазоновую кислоту. Последняя реакция,
! Как предполагают, протекает по следующей схеме:
|, CH2CH2NO2
!i;l: CH2 CH2NO2 | СНСН = NO2K
i':' II + I -*N -HI +H2O
Hi NO2K H /\ NOH
f. HO OK
* Гидроксамовые кислоты применяются в качестве флотаднонного
та для некоторых медных руд.
С алкоксидакли натрия титропарафипы реагируют е образова-
образованием продукта присоединения основания к нитрогруппе
R' О ¦ ' R' О ¦' ' '
R —С — N + R*ONa-»R — С — N— О — Na
Н OR"
1
Н
4
О
приме-
примеПолучение галоидопроизводных
йитронарафинов
Г а лоиднитросоедияения содержат галоид при том же угле-
углеродном атоме, что и нитрогруппа. Они могут быть использрт
ваны в качестве овдсзгитетейприразлвчны:х^еа^пиях. Нежотог
рые вещества такого тира могут быть вдноль^рв^ш как фуми-
фумиганты для борьбы с различными а
Для получения хлорпроизводных р
няются весьма разнообразные методы. Н|>И
йоды на натриевую соль йи^рометана Й^
метан 123]. Хлорированием нитромат^тз;^
сусцензии Ca(j;t)8, которую, добавляли для ^оддр^^
бокислой реакции, получен с количествеииым выходом хлор-
хлорпикрин [24]. Последний продукт может быть также получен из
нитрометана при действии гйпохлоритОв Щелочных и щелочно-
щелочноземельных металлов [25].
Монохлорпроизводные нитроэтана, 1-нитропропана, 2-ни-
тропропана и 1-нитро-2~метилпропана получают посредством
пропускания газообразного хлора в водный раствор натриевой
соли али-нитропарафина 126, 27]. Хлорнитропарафины полу-
получаются нри действий хлористого нитрозила NOaCl на ненасы-
ненасыщенные углеводороды 128]. Хлорнитропарафины могут быть
получены и другими, »ес>ма разнообразными путями, напри-
например нитрованием хлорпарафинов азотной кислотой [29, 30],
хлорированием нитроолефинов [31, 32], действием хлористого
нитрозила или гипохлоритов на оксимы [33], действием РС15
на нитроспирты 1261, и т. д. Разработан метод получения
дихлорнитропарафинов посредством хлорирования иитропа-
рафинов или же их монохлорпроизводных 134].
Свойства нитропарафинов
221
При фотохимическом хлорировании нитроалканов в без-
безводных средах хлор замещает водород, стоящий у атома угле-
углерода, не содержащего NO2. Так натроэтан дает почти исклю-
исключительно 2-хлор-1-нитроэтан [35].
Из хлорнитропроизводных 1,1-дихлор-1-нитроэтан является
инсектисидом; другие хлорнитропарафины применяются в каче-
качестве селективных растворителей для очистки смазочных ма-
масел [36].
Бромирование нитропарафинов хорошо изучено; эта реак-
реакция протекает настолько быстро, что ее применяют как спо-
способ определения превращения нитропарафинов в таутомерную
нитроновую кислоту.
Иодпроизводные также легка получаются прямым иоди-
иодированием вжгроиарафинав, но эти соединения неустой-
неустойчивы [37].
Механизм реакции галоидирования нитропарафинов
(в шриоутотвии основания) заключается, как иредпоиагают,
в присоединении галоида X к нитроновой кислоте или к соли
последней © последующей шотерей НХ или МеХ:
'НзС *з ^CiaH + Х2-> R2C — NO2H-^ R2GNb2 + НХ
Г , , 1 ¦'¦' f ¦ I I
!: .. х , х
I
х
RaC .
Конденсация нитропарафинов с альде-
альдегидами (образование нитроспиртов)
Реакция конденсации нитропарафинов с альдегидами, ко-
которая впервые бмла открыта Анри [38], приводит к образовав
нию весьма интересных соединений — нитроспиртов, имеющих
большое практическое применение. Эта реакция в общем виде
может быть иредставлена следующей схемой:
Шг NO2
— С — <
R -rr- С — ,Н
R"CHO-*R
- СЩОН) - R"
R'
222
Нитрование углеводородов ааотной кислотой
или для случая конденсации нитропарафинов с формальдеги-
формальдегидом
NOa
RCHaNO2 + 2НСНО -* R — С — СН2ОН
СН2ОН
Конденсация нитропарафинов с альдегидами относится
к альдольному типу и состоит в том, что один, два или три
атома водорода, связанных с атомом углерода, при котором
находится нитрогруппа, присоединяются к кислороду аль-
альдегида с образованием оксиалкилзамещенных нитропарафи-
нитропарафинов. Необходимое условие для осуществления этой реакции
заключается в предварительной таутомеризации нитропара-
нитропарафина в нитроновую кислоту (аци-форму). Значение оснований,
применяющихся в очень слабых концентрациях в качестве ка-
катализаторов этой реакции, заключается в том, что они повы-
повышают концентрацию нитроновой кислота, сдвигая равнове^
сие между нитропарафином и его ацинформой (нитроновйй
кислотой) в сторону образования последней во мере того, как
имеющаяся в наличии нитроновая кислота прореагирует с аль-
альдегидом. Эта реакция может быть осуществлена с большей эф-
эффективностью [39], если альдегид заменить его бисульфитным
соединением, а нитропарафин — соответствующей натриевой
солью: бисульфитное соединение освобождает нитроновую ки-
кислоту без повышения концентрации водородных ионов, которые
действуют отрицательно, превращая аци-форму нитроцарафина
в его нейтральную форму.
В качестве катализаторов при указанном выше синтезе
нитроспиртов, по данным Вандербильта и Хэсса [40], могут
быть применены основания, карбонаты, метилат и этилат нат-
натрия, сульфит натрия, ацетат натрия и бура. Исследования этих
авторов показали также, что активность щелочного катализа-
катализатора в большей мере зависит от его рН, чем от концентрации его
в реакционной смеси. Так, например, 0,9%-ный NaOH более
активен; чем Na2GO3 более высокой концентрации.
При конденсации нитропарафинов с альдегидами основной
процесс образования нитроспиртов сопровождается следующими
Свойства цищропарафинов
223
побочными реакциями; 1) альдольной конденсацией; 2) поли-
полимеризацией реагирующего адьдещца; 3) превращением нитро-
нитропарафина в изоксазолили, в случае нитрометана, в метазоновую
кислоту (см. выше, стр. 219); 4) образованием соответствую-
соответствующего нитроолефина и продукта его полимеризации. Для устра-
устранения первых трех побочных реакций необходимо применять
минимальное количество щелочного катализатора. Последняя
реакция доводится до минимума посредством применения низ-
низких температур, которые не благоприятствуют возникновению
нитроолефинов (по данным Вандербильта и Хэсса, оптимальной
температурой при синтезе нитроепиртов является 30—35°).
Кроме того, для уменьшения полимеризации поддерживают
низкую концентрацию альдегида, добавляя его к нитропара-
фину постепенно, что одновременно устраняет и возможность
образования океиальдегидов.
При конденсаций формальдегида с нитропарафинами ре-
реакционная способность последних уменьшается в гомологи-
гомологическом ряду о повышением молекулярного веса. Нитрометан
может легко конденсироваться с тремя молекулами формаль-
формальдегида с образованием (HQCH^gCNOa. При конденсации нитро-
нитрометана с другими альдегидами реакция протекает труднее,
особенно edini альдегид содержит более пяти атомов углерода;
в последнем случае реакция ^acio останавливается после при-
присоединения одной или двух молекул альдегида.
При конденсации гомологов нитрометана с уксусным аль-
альдегидом и следующими по гомологическому ряду альдегидами
I только одна молекула альдегида присоединяется сравнительно
легко, другие молекулы присоединяются значительно труднее.
Вторичные нитропарафины реагируют намного медленней,
чем первичные, а третичные, которые не имеют атомов водоро-
водорода в а-положении, не реагируют с альдегидами.
Очистка нитроепиртов от обычной примеси нитроолефинов
не представляет никаких трудностей, Так как нитроолефины
яегко полимеризуются и могут быть удалены в виде
EМ0Л [40].
Другой интересный метод получения нитроспиртов — зто
юндеисация окисей олефинов с нитритами [41—43].
224
Нитрование углеводородов азотной кислотой
Алифатические полинитроеоединения также легко вступают
в реакцию конденсации с альдегидами с образованием поли-
нитроопнртов. Так, при добавлении калиевой соли динитро-
динитрометана к раствору формалина образуется калиевая соль
2,2-динитропропандиола-1,3, из которой при иодкислении
уксусной кислотой получается с выходом 66% 2,2-динитро-
пропандиол-1,3 [44].
При конденсации 1,4-динитробутана с формальдегидом в при-
присутствии Са(ОН)» образуется 2,5-бис-(оксиметил)-2,5-дини-
трогександиол-1,6 (I) с выходом 40%. При конденсации тем
же методом 1,5-динитропентана с формальдегидом образуется
с выходом 50% 2,6-бис-(оксиметил)-2,6-динитрогептандиол-1,7
(II). Наконец, при взаимодействии 1,6-динитрогексана
с формальдегидом образуется 2,7-бис-(оксиметил)-2,7-динитроок-
тандиол (III) [45].Реакция протекает по следующему уравнению:
СНОН
носн2 сн2он
ЧС-(СН2)„-С
СН2ОН
N02 N02
III. га = 4.
O2NCH2 (CH2)nCH2NO2 + 4CH2O -*¦
носн/
I. га = 2; II. га = 3;
Тринитроспирты можно получить взаимодействием нитро-
формы CH(NO3K с альдегидами или кетонами. Например:
тринитроэтиловый спирт (NO2KCGH2OH получается при вза-
взаимодействии нитроформа с формальдегидом [46] или с пара-
формальдегидом [47]. При конденсации уксусного альдегида
с нитроформом образуется вторичный тринитропропиловый
спирт CH3CH(OH)C(NO2K [46].
Тетранитрогликоли получаются при взаимодействии кали-
калиевой соли динитрометана с диальдегидами [48]. Так, при кон-
конденсации калиевой соли динитрометана с глиоксалем образует-
образуется дикалиевая соль 1,1,4,4-тетранитробутандиола-2,3, кото-
которая при действии разбавленной серной кислоты дает 1,1,4,4-
тетранитробутандиол-2,3:
NO2 NO2
КНС (NO2J + CHO — CHO -¦> КС — CH (OH) CH (ОН)
!
NO2
I
N
O2
Свойства нитропарафинов
225
NO2 NO2
-HC — CH(OH) CH (OH)—CH
NQ2 NO2
Подобным же образом из соли динитрометана и диальдегида
янтарной кислоты получается 1,1,6,6-тетранитрогександиол-2,5.
Из нитроспиртов промышленное применение получили
(HOCH2KCNO2;J (HOCH2J C(CH3) NO2; (HOCH2; C(CH3J NO2;
(НОСН2J C(C2H6)NO2 и (НОСН2) СН(С2Н6) NO2.
Среди соединений, получаемых из нитроспиртов, наибольшее
значение имеют их сложные эфиры и аминоспирты. Сложные
эфиры азотной кислоты могут быть получены при действии на
нитропарафины охлажденной (от 0 до —20°) концентрирован-
концентрированной азотной кислоты в присутствии серной кислоты, например:
(HOCH2KGNO2 + 3HNO3 —zi (O2NOGH2K CNO2 + 3H2O.
Эфир азотной кислоты и нитроспирта (HOCH2KCNO2 обладает
большей взрывчатой способностью (на 7% больше нитрогли-
нитроглицерина) [49].
Нитроспирты реагируют с хлорокисью фосфора с образо-
образованием соответствующих сложных эфиров фосфорной, кислоты
| [50]. Сложные эфиры фосфорной кислоты и нитроспиртов на-
| ходят применение в качестве пластификаторов для эфиров
? целлюлозы. Эфиры органических кислот и нитроспиртов полу-
i чаются при действии на последние кислот, ангидридов кислот
хлорангидридов в присутствии серной кислоты. Эти эфиры
|применяются в качестве пластификаторов. :
Аминоспирты могут быть получены из нитроспиртов посред-
посредством восстановления водородом in statu nascendi при действии
Цоловэ и соляной кислоты или же железа и уксусной кислоты,
также посредством гидрирования. Аминоспирты были приго-
приготовлены гидрированием нитроспиртов при применении в ка-
качестве катализатора палладия в растворе щавелевой кислоты
51 ]; они могут быть также получены в присутствии никелевого
анализатора Ренея [521.
И0 А. В. Топчиев
226
Нитрование углеводородов азотной кислотой
Из аминоспиртов применяются
(HOCH2KCNH2; (HOCH2J C(CH3)NH2; (HOCH2)C(CH3JNH2;
(HOCH2JC(C2H5)NH2 и (OHCH2)CH(C2H5)NH2.
Эти соединения дают с высшими жирными кислотами мыла,
обладающие высокой эмульгирующей способностью, что де-
делает их особенно ценными.
Можно предполагать, что алифатические нитроспирты, так
же как и их сложные и простые эфиры, в дальнейшем приобре-
приобретут большое техническое значение.
Как указано выше, ароматические альдегиды в присутствии
неорганических оснований конденсируются с нитропарафи-
нами с образованием нитроспиртов. Если же конденсацию
проводить, применяя в качестве катализатора амины [53],
то продуктом реакции будут нитроолефины:
ArCHO + RNH2 -=> ArCH = NR + Н20;
АгСН = NR + RCH2NO2 н* RNH2 + АгСН = C(NO2)R.
Этим путем можно, например, из бензальдегида и нитроме-
тана [54J легко получить со-нитростирол:
CeH5CHO + CH3NH2 -* CeH5CH = NCH8 + Н20;
CeH5CH = NCH3 + HCH2NO2 -* CftCH = CHNO2 + CH3NH2.
Если конденсация проводится в присутствии алкоголята,
то в первую стадию реакции образуется щелочная соль аци-
формы нитроспирта, при подкислении которой слабой кисло-
кислотой выделяется нитроспирт:
ArCHO + CHsNOj + КОН -» ArCH(OH)CH = NO2K + Н20.
При действии на соль нитроспирта минеральной кислоты
образуется непредельное нитросоединение [55, 56]:
АгСН(ОН)СН = NO8K + HC1 -» АгСН = CHNO2 + Н20;
ArCH(OH)CH = NO2R + СН3СООН -» ArCH(OH)CH2NO2 + СН3СООК.
Нитроолефины могут быть получены также из ацетатов ни-
нитроспиртов при нагревании этих соединений в присутствии
Свойства нитропарафинов
227
карбонатов [57]:
Н ОСОСН3
2RC — CR +
NO2 R
Na2CO3 -» 2RC = CR2 + 2CHsCOONa + С02 + Н20
N 02
Действие на нитроспирты водуотнимающих средств также при-
приводит к нитроолефинам [58]:
(HOCH2) CH2NO2 i^2f^4 CH2 = CHNO2 + H20.
В качестве водуотнимающего средства рекомендуется при-
применять фталевый ангидрид, а также сложный катализатор,
состоящий из орто-фосфатов Са и Mg A0%) [591.
Нитроолефины могут быть получены из нитроспиртов при
действии щелочи на нитронитраты, содержащие группы NO2
и ONO2 у соседних атомов углерода [60L
Нитроолефины в свою очередь могут подвергаться различным
превращениям; так, например, они могут быть восстановлены
в соответствующие амины. 1-фенил-2-нитропропен-1 при гидри-
гидрировании в присутствии никелевого катализатора Ренея дает
соответствующий амин с выходом 40% [61]. Из со-нитростирола
посредством гидрирования в присутствии окиси платины иожет
быть получен р-фенетиламин с выходом 93%, а 3,4-метилендибК'
си-со-нитростирол и 3-нитро-со-нитростирол в присутствии этого
же катализатора гидрируются в соответствующие амины GJ.
Каталитическим гидрированием нитроолефинов в присут-
присутствии окиси платины можно получить также предельные
нитросоединения [62].
Действием на нитроолефины железных стружек и соляной
кислоты [31 ] получены кетоны (при избытке НС1) и кетоксимы
(при минимальном количестве НС1). Оксимы были получены
также при восстановлении нитроолефинов цинковой пылью
и уксусной кислотой [63].
Подробнее о свойствах нитроолефинов см. ниже", гл. III,
§ 4.
16*
228
Нитрование углеводородов азотной кислотой
Конденсация нитропарафинов с альде-
альдегидами и аминами (получение нитроаминов)
Реакция конденсации нитропарафинов с альдегидами
и аминами, которая представляет собой частный случай реакции
Манниха, приводит к образованию нитроаминов — весьма
интересных органических соединений, содержащих одновре-
одновременно и амино- и нитрогруппу. Эту реакцию в общем виде мож-
можно представить следующей схемой;
R R
СНШ2 + СН2О + R'NH2 —?, С — GH2NH — R*
/ /I
R' R' N02
. При конденсации первичного нитропарафйна, обладающего
двумя подвижными атомами водорода, реакция протекает
с.образованием или нитроамина, или нитродиамина:
' RCH2NO2 -f СН2О + R'NH2 -» RGH(NO2)CH2 NHR' + Н20;
RCH2NO2 + 2GH2O + 2R'NH2 -> R'NHCH2 — CR — CH2 NHR' + 2H2O.
N02
и Третичные нитропарафины или третичные амины, не имею-
имеющие подвижного атома водорода, в реакцию Манниха не ВСТу-
ЮТ.
Конденсацию первичных или вторичных нитропарафинов
с формальдегидом и первичными или вторичными аминами мож-
можно проводить двумя способами [64, 65].
.1 \ .Л; Формальдегид вначале смешивается с амином, затем к об-
образующемуся N-метилольному производному амина доба-
добавляется нитропарафин:
СН2О + RNH2 -> RNH — СН2ОН
R
CHNO2
R
С —CH2NHR"
1
,i IE..Вначале при конденсации нитросарафина с формальдеги-
формальдегидом получается нитроспирт в случае вторичного нитропарафйна
Свойства нитропарафинов
229
или нитрогликоль в случае первичного нитропарафйна. Долу-
ченный нитроспирт или нитрогликоль вводится затем в кон-
конденсацию с амином:
R R
\ \
CHNO2 + СН2О -> С — СН2ОН
R'
R' N02
R
С — СН2ОН + R"NH2 —X С — СН2 — NHR"
/I /I
R' N02 R' NO2
RCH2NO2 + 2СН2О '-> СН2ОН — С R—СН2ОН
N0.
СН2ОН — GR — СН2ОН + 2R'NH2 -^Ц. R'NHCH2 — CR — CH2NHR'
N02 N02
Ароматические амины также вступают в реакцию конден-
конденсации с формальдегидом и первичными или вторичными нитро-
парафинами. Реакция проводится в присутствии сильно основ-
основного катализатора [66].
В случае вторичного нитропарафйна, обладающего одним
подвижным атомом водорода, реакция протекает с образова-
образованием ароматического нитроамина, тогда как в случае первич-
первичного нитропарафйна, обладающего двумя подвижными ато-
атомами водорода, в реакцию с нитропарафином вступают по две
молекулы ароматического амина и формальдегида с образова-
образованием ароматического нитродиамина:
ArNH2 + СН2О + RR'CHNO2 -» ArNHCH2
R
— С —
N02 + H20
R
2ArNH2 + 2CH2O + RCH2NO2 -*¦ ArNHCH2 — С — GH2NHAr + 2HaO
N02
-230
Нитрование углеводородов азотной кислотой
Ароматические диамины вступают в реакцию конденеации
с формальдегидом и нитропарафином по обеим аминогруппам:
NH2 ArNH2 + 2CH2O + 2RR'CHNO2 —»
R R
—>¦ NO, — С— CH2NHAr NHCH2 — C—NO2 +2H2O
i I
Нитроамины, полученные из ароматических аминов, форм-
формальдегида и нитропарафина, представляют собой твердые
вещества, обычно нерастворимые в воде и ограниченно раство-
растворимые в насыщенных углеводородах. Они хорошо растворимы
в спирте, бензоле и кетонах.
2,4,6-Тринитротолуол, подобно нитропарафинам, способен
вступать в реакцию Манниха с образованием тринитрофенил-
зтиламинов [67]:
O2N —
N02
NO2
R'
СН2О
-Н,0
\
Выходы продуктов конденеации в большинстве случаев близки
к теоретическим.
Подобно 2,4,6-тринитротолуолу, 2,4-динитротолуол также
способен вступать в реакцию Манниха [68].
Нитропроизводные гетероциклических оснований (нитро-
гексагидропиримидины) также можно получить при помощи
реакции конденсации первичного нитропарафина, формаль-
формальдегида и первичного амина, взятых в отношении 1:3:2
169-71]:
Свойства нитропарафинов
231
RCH2NO2 + ЗСН2О + 2R'NH2
-3H,o /ч
R'N
Н2С
NR'
ch,
R NO2
Реакция конденсации нитропарафинов с аминами и форм-
формальдегидом открыла возможность синтеза ряда нитроаминов,
получение которых другими методами связано с огромными экс-
экспериментальными трудностями, а в отдельных случаях едва
ли вообще возможно.
Восстановление полученных по реакции Манниха нитро-
нитроаминов приводит к образованию полиаминов.
При пиролизе солянокислых солей нитроаминов, полут
ченных конденсацией первичных нитропарафинов с формаль-
формальдегидом и аминами, образуются соответствующие нитроолефи-
ны [72]:
RCH — CH2NR'R" -НС1 -»¦ RC = СН2 + R'R"NH-HC1
NO2 NO2
Выход нитроолефинов по этой реакции можно увеличить до
80—90%, заменив хлористоводородные соли нитроаминов мо-
молекулярными соединениями нитроаминов с фтористым бором
1731.
При нагревании 1- и 2-нитропропана с 1-(диметиламино)-
2-нитробутаном (I) образуются 3,5-динитрогептан (II) и, со-
соответственно, 2,4-динитро-2-метилгексан (III) с 34% - и 22%-ным
выходом. Образование указанных динитропарафинов Снай-
дер и Хамлин [74] объясняют дезаминированием нитроамина
с последующим присоединением к получающемуся при этом
2-нитроолефину 1- или 2-нитропропана:
-HN(CH3),
I. С2Н5СН - CH2N(GH3J н* ГС2Н6С = СН2"
NO2
NO2
232
Нитрование уелевв&ородай авотной кислотой
СН
N02:
—
J
!»CaH5CH —CHa —CHR'
: N02 N02
И. R = С2Н6; R' = Н
III. В = R' = СН3
Предложенный Снайдером и Хамлином механизм реакции
подтверждается тем, что 1-(диметиламино)-2-нитро~2-метил-
нропан
СН3
CH3-C-CH2N(CH3J
I
N02
йе содержащий атома водорода у р-атома углерода, не способен
вследствие этого к дезаминированию и не алкилируется нитро-
парафином. г ¦ ¦
§ 2. Получение мононитропарафиыов и нитросоединений
жирноароматического ряда
Нитрование парафинов и других алифатических соединений
обычно производится не концентрированной, а разбавленной
азотной кислотой. Это объясняется тем, что с концентрирован-
концентрированной азотной кислотой нитрование парафиновых углеводородов
происходит менее гладко, а в основном протекают окислительные
процессы, Смесь верной и азотной кислот, которая применяется
для нитрования ароматических соединений, непригодна при
нитровании парафинов, так как первичные нитропарафины,
быстро гидролизуются горячей серной кислотой, а вторичные
и третичные изомеры осмоляются.
В 1888 г. выдающемуся русскому химику Ц. И. Коновалову
впервые удалось успешно осуществить нитрование предельных
углеводородов разбавленной азотной кислотой на примере
нонанафтена — одного из, циклических углеводородов, вхо-
входящих в состав кавказской нефти. Нонавафтен имеет следующую
-структурную формулу: т
Получение питросве&иненцй жирноароматического ряда
СН — СНЭ
СН -*, СН3
Н2С
г
GH-CH4
До М. И, Коновалова изучением реакции нитрования Цик-
Циклических предельных углеводородов занимался ряд исследовав
телей (Байер, Вреден, В. В. Маркрвников, Ф. ф, Бейл&я
штейн, А. А. Курбатов и др.). Применяя в качестве нитрую-
нитрующего агента концентрированную азотную кислоту (удель-
(удельный вес не ниже 1,38), эти исследователи получали при нит-
нитровании главным образом продукты окисления углеводородов:
при небольших выходах нитросоединений. '
В отличие от этих авторов М. И. Коновалов нитровал нона^-
нафтен разбавленной азотной кислотой различных концентра»
ций (уд. в. 1,155; 1,075 и 1,036) в запаянных трубках при
120—130°. Оптимальный выход нитропроизводных E1%) получен
М. И. Коноваловым [75] при нагревании до 120—130° нонанаф-
нонанафтена с азотной кислотой уд. в. 1»075< взятой в объемном ofHonre*
нии к углеводороду 4:1. Преобладающими продуктами ре-
реакции нитрования нонанафтена по методу Коновалова оказались
третичные нитропроизводные, образовавшиеся посредством
замещения нитрогруппой атомов водорода в группаЦс ]>СН^
«роме третичных в небольшом количестве обнаружены и вто-
вторичные нитросоединения.
Опыты по нитрованию нонанафтена, доказавшие возможность-
ведения нитрогрушш в предельные циклические угдеводоро-
ДЫ, навели М. И. Коновалова на мысль исследовать действие
збавленной азотной кислоты и на предельные углеводороды!
рного ряда (синтез нитропарафинов прямым нитрованием*
¦леводородов азотной кислотой считался в то время неосу^
ествимым).
В 1893 г. М. И. Коновалов сообщил о результатах своих
[тов по нитрованию алифатических углеводородов райбав-
;ой азотной кислотой, которые дали вполне удовлетв#ри»
льные выходы нитропарафинов. Так* при нитровании в> тек-
а азотной кислотой уд. в. 1,075 при 140° и продошиитель-
Получение нитросоедишний жирноароматическоео ряда
235
ности нагревания 4—6 час. получен нитрогексан с выходом
около 40%, а н. гептан и н. октан при действии азотной ки-
кислоты той же концентрации в течение 5—9 час. при 125—130°
дали соответствующие нитросоединения с выходом 47% (для
гептана) и 49—52% (для октана) [76].
При нагревании диизобутила с азотной кислотой уд. в.
1,075 в запаянной трубке при 105—110° М. И. Коновалов [77],
наряду с другими продуктами, получил мононитродиизобутил
(CH3JC(NO2)CH3CH2CH(CH3J.
При проведении этой реакции при более высокой температуре
A20—125°) им был получен кристаллический динитродиизобу •
тил
(CH3JC(NO2)CH2CH2C(NO2)(CH3J.
Аналогично протекает образование нитронроизводных при ни-
нитровании диизопропила и диизоамила, причем в случае ди-
изоамила реакция протекает при более высокой температуре.
Имеется указание, что нитропроизводные н. гексана и н. геп-
гептана и наиболее легко н. октана получаются при нитровании
и более концентрированной азотной кислотой (уд. в. 1,42).
Выход моно- и динитрооктана составляет 60—70% от тео-
теории [78].
2-Нитропроизводные высших парафиновых углеводородов
легко получаются при пропускании через нагретый углеводо-
углеводород паров азотной кислоты [79].
В дальнейшем М. И. Коновалов показал, что разработан-
разработанный им метод нитрования разбавленной азотной кислотой мо-
может служить и для введения нитрогруппы в жирную цепь аро-
ароматических углеводородов, вопреки установившемуся взгляду,
что елабая азотная кислота при нагревании действует на жирно-
ароматические соединения слишком энергично, окисляя боко-
боковую цепь, но не нитруя ее.
М. И. Коновалов [80] не только блестяще доказал
возможность нитрования жирной цепи ароматических углево-
углеводородов слабой азотной кислотой, но, варьируя основные фак-
факторы, влияющие на течение реакции нитрования (концентра-
(концентрацию азотной кислоты, температуру и продолжительность про-
процесса), выяснил также оптимальные условия этой реакции
для ряда жирноароматических углеводородов. Им было уста-
установлено, что при нагревании алкилированных производных
бензола с разбавленной азотной кислотой в запаянной трубке
нитрогруппа вступает не в ядро, а в боковую цепь. Так, на-
например, этилбензол при нитровании 12,5%-ной азотной кисло-
кислотой (уд. в. 1,075) в течение 9—11 час. при 105—108° дает выход
фенилнитроэтана 44%. Уменьшение концентрации азотной
кислоты до 6,5% (уд. в. 1,036) приводит к снижению выхода
¦фенилнитроэтана до 26%. Опыты Коновалова также показали,
что азотная кислота очень низких концентраций @,25—0,14%)
еще обладает способностью нитровать этилбензол, тогда как
при применении концентрированной азотной кислоты нитро-
нитрование происходит лишь при стоянии смеси кислоты с этил-
бензолом при комнатной температуре в запаянной трубке в те-
течение 45 час. Более эффективно по сравнению с этилбензолом
протекает нитрование пропилбензола: при действии азотной
кислоты уд. в. 1,075 при 105° и продолжительности реакции
4—5 час. этот углеводород дает выход фенилнитропропана 74%.
Пропилбензол нитруется даже 1%-ной азотной кислотой ири
100—105° и продолжительности нагревания 90 час. При нитро-
нитровании псевдокумола азотной кислотой уд. в. 1,075 при 110°
и продолжительности реакции 5 час. получена смесь ксилил-
нитрометанов с общим выходом нитропроизводных 33%.
Интересные результаты дали опыты М. И. Коновалова [80]
tio нитрованию алкилбензолов (толуола, м- и п-ксилолов, ме-
аитилена и трет, бутилтолуола) слабой азотной кислотой уд.
в. 1,075 (при объемном отношении азотной кислоты к углево-
углеводороду 4:1). Для уменьшения окислительного действия азот^
ной кислоты М. И. Коновалов проводил нитрование алкилбен-
золов при температурах около 100°.
Из указанных выше углеводородов наиболее высокий выход
¦нитропроизводных (около 74%) дал трет, бутилтолуол при
проведении реакции в течение 4—5 час. при 105°. При нитро-
нитровании м-ксилола получен выход нитросоединения 51% (сред-
(средняя продолжительность реакции 16 час). п-Ксилол, мезити-
236
Нитрование углеводородов азотной кислотой
лен и толуол нитруются в указанных уеловиях с меньшими вн>-
ходами йитропроизводных (около 30%). М, И. Коновалов
в дальнейшем нитровал толуол аэотной кислотой уд. в. 1,2
при продолжительности реакции 48 час. Выход февилнитроме-
тана при этих условиях достигал 43%,
Несколько более высокий выход фенилнитрометана полу-
получается при применении большого избытка разбавленной азот-
азотной кислоты, Процесс! проводится следующим образом. На-
Нагревают толуол с шестикратным количеством разбавленной
азотной кислоты уд. в. 1,075 в запаянной трубке при 105° в те-
течение 5 час. Для выделения фенилнитрометана реакционную
смесь обрабатывают раствором едкого кали и экстрагируют
эфиром. При обработке щелочного раствора соли фенилнитро-
фенилнитрометана током углекислоты образуется желтое масло фенил>-
нитрометана. Полученный продукт извлекают и после отгон-
отгонки растворителя перегоняют в вакууме.
М. И. Коноваловым проводились также опыты, по изучении»
скорости нитрования алкилбензолов азотной кислотой уд. щ.
1,075 при осуществлении реакции в открытых сосудах с обрат-
обратным холодильником (отношение HNOa к углеводороду 4 : 1).
Оказалось, что быстрее других углеводородов при кипячении
с азотной кислотой нитруется мезитилен, за ним следует
п-кеилол; сравнительно медленно реагируют бутилтолуол в
м-ксилол и очень медленно толуол.
При нитровании жирной цепи ароматических углеводородов
во всех указанных случаях образуются преимущественно моно-
нитропроизводные. Для получения полинитропроизводных не-
необходимо применять концентрированную азотную кислоту
и проводить реакцию при охлаждении. М. И. Коновалов ре-
рекомендует, например, следующий способ проведения реакции
для получения динитромезитилена с хорошим выходом; моно-
нитромезитилен A ч.) постепенно вносят в охлажденную до
—10° азотную кислоту уд. в, 1,48 E ч.); по окончании реакции
продукт вливают в ледяную воду. Для синтеза тринитро-
мезитилена обрабатывают динитромезитилен (или мононитро-
мезшзщген) большим избытком концентрированной азотной
кислоты уд. в. 1,51.
Получение нитросведшнений жирноароматическоео ряда
237
Проведением параллельных опытов также было показано,
что нитрование жирноароматических и алифатических углево-
углеводородов в открытых сосудах дае* меньшие выходы нитропро-
изводных, чем нитрование под давлением (в запаянных трубках),
причем в наибольшей степени это различие заметно у али-
алифатических углеводородов. С азотной кислотой уд. в. 1,2 нит-
нитрование парафинов в открытых сосудах протекает очень слабо;
с азотной кислотой уд. в. 1,42 реакция идет более энергично,
но приводит лишь к небольшим выходам нитропроизводных
(смеси моно- и динитросоединений) *.
Основные выводы, вытекающие из классических работ
М. И. Коновалова по нитрованию предельных углеводородов
и жирной цепи ароматических углеводородов, сводятся к сле-
следующему.
1. При действии разбавленной азотной кислоты можно
вводить нитрогруппу как в насыщенные алифатические и цикли-
циклические углеводороды, так и в жирную цепь ароматических
углеводородов.
2. Основными факторами, влияющими на скорость реакции
нитрования и выход нитросоединений, являются концентрация
азотной кислоты, температура реакционной смеси, а также
продолжительность процесса, причем степень влияния этих
факторов зависит ет природы! и строения нитруемого углево-
углеводорода. Опыты по нитрованию Предельных углеводородов и
жирной Цепи ароматических углеводородов в общем Показали,
что чем слабее азотная кислота, тем труднее протекает образо-
образование нитросоединений, и для осуществления реакции требуют-
ц «я более высокая температура и ббльшая продолжительность
вроцесса.
3. Нитрование предельных и жирноароматических углево-
углеводородов наиболее благоприятно протекает при повышенном
давлении. Нитрование в открытых сосудах приводит к сравни-
* Эти результаты не совпадают с опубликованными ранее данными
Уорстолла [81J, который при проведении реакции в открытых сосудах
I получил сравнительно высокие выходы нитропарафинов, а именно:
70% ив нонаиа, SS% иа октана и 40% ив гептана (ошибочность этих
ультатов признал впоследствии ж сам Уорстолл).
238
Нитрование углеводородов азотной кислотой
тельно более низким выходам нитросоедииений (жирноарома-
тические соединения), или же реакция протекает в очень слабой:
степени (алифатические углеводороды). С другой стороны, при
взаимодействии углеводородов с азотной кислотой в запаянных,
трубках в течение продолжительного времени нитросоединения
образуются даже в том случае, если процесс проводится при
комнатной температуре.
4. При нитровании углеводородов разбавленной азотной кис-
кислотой наблюдаются следующие закономерности в зависи~
мости от строения нитруемого углеводорода:
а) Нитрование ароматических углеводородов в ядро про-
протекает значительно труднее, чем нитрование предельных угле-
углеводородов. Так, например, бензол не нитруется азотной кисло-
кислотой уд. в. 1,075 при 130°, т. е. в условиях, при которых про-
происходит нитрование парафинов.
б) Циклические предельные углеводороды, содержащие-
в молекуле третичные атомы водорода, относительно легка
нитруются разбавленной азотной кислотой. Так, например,,
нонанафтен нитруется при 120—130° азотной кислотой уд. в.
1,075 с выходом 51% ; незамещенные полиметилены, у которых
отсутствует группа !> GH, по позднейшим данным В. В. Мар-
ковникова, нитруются значительно труднее,
в) Жирная цепь ароматических углеводородов нитруется
легче предельных углеводородов как при проведении реакции
в открытых сосудах, так и под давлением (в запаянных трубках),
так как соседство ароматического ядра активирует, невиди-
невидимому, реакцию нитрования жирной цепи.
5. Оптимальные результаты как по выходу, так и по чистоте
продуктов получаются при нитровании углеводородов азотной
кислотой уд. в. 1,075 в запаянных трубках при температурах
в интервале НО—140°.
6. Легкость замещения нитрогруппой повышается при пе-
переходе от первичного водорода (в группе — СН3) ко вторич-
вторичному (в группе > СН2)*, еще легче происходит замещение тре-
третичного водорода (в группе-^:СН). С повышением концентра-
концентрации азотной кислоты наблюдается увеличение образования вто-
вторичных и первичных нитросоединений.
Получение нитросоединений жирноароматичесхого ряда
239
7. У алифатических углеводородов нормального строения
замещение нитрогруппой при нитровании азотной кислотой
происходит у второго атома углерода.
8. Нитрование разбавленной азотной кислотой сопровож-
сопровождается побочными реакциями окисления. М. И. Коновалов рас-
рассматривает эти реакции как процессы вторичного характера
(действие азотной кислоты на первично образовавшиеся ни-
нитросоединения). В подтверждение своего взгляда М. И. Конова-
Коновалов приводит следующие факты:
а) при перегонке а-фенилнитрозтана СвН5СНСН3 наблюдается
превращение его в бензойную кислоту;
NO,
б) при уменьшении выхода нитросоединений с повьь
шением температуры реакции, продолжительности нитрования
или концентрации азотной кислоты соответственно увеличи-
увеличивается выход тех кислот, которые могут возникнуть из перво-
первоначально образующихся нитросоединений. Так, например,
при нитровании мезитилена азотной кислотой уд. в. 1,155 при
100° образуется ксилилиитрометан (CH3JCeH3CH2NOa; при
продолжительном кипячении мезитилена с азотной кислотой
получается главным образом мезитиленовая кислота. Послед-
Последняя может быть также получена из ксилилнитрометаяа при дли-
длительном нагревании этого соединения с азотной кислотой
уд. в. 1,155. Другим примером может служить образование трет,
бутилтолуиловой кислоты при нитровании трет, бутилксилола
[82]; эта же кислота получается и при непосредственном дей-
действии окислителей на калиевую соль первичного нитросо-
нитросоединения трет, бутилксилола.
М. И. Коноваловым [83] исследовано также нитрование
жирноароматических соединений азотной кислотой в растворе
уксусной кислоты, причем реакция велась при кипячении
с обратным холодильником в течение 1,5—2 час. При нитро-
вании этилбензола реакция протекает очень бурно, поэтому
реакционную смесь лишь умеренно нагревают до легкого выде-
выделения окислов азота. Опыты М. И. Коновалова показали, что
240
Нитрование углеводородов азотной ¦кислотой
исследованные им алкилбензолы обладают различной реакцион-
реакционной способностью, причем по легкости вступления в реакцию
они располагаются в том .же порядке, как и при нитровании их
водными растворами азотной кислоты. Труднее всего реагирует
трет, бутилбензол, за которым следуют, в порядке повышения
легкости нитрования, ожеилол, п-ксилол, псевдокумол, этил-
бензол и диэтилбензол. По мнению М. И. Коновалова, уксус-
уксусная кислота ослабляет действие азотной кислоты на аромати-
ароматическое ядро, направляя это действие на боковую цепь. Нитро-
Нитрование м-ксилола и мезитилена показало, что чем сильнее раз-
разбавлена азотная кислота уксусной, тем больше получается пер-
первичных и других нитросоединений, замещенных группой NO2
в боковой цепи. При слабом разведении реакция нитрования
направляется главным образом в ядро. Также установлено,
что и в присутствии уксусной кислоты (как и в водном раство-
растворе) реакция нитрования сопровождается окислительными про-
процессами. Так, например, при нитровании п-ксилола и п-диэтил-
бензола в продуктах реакции обнаружена терефталевая кис-
кислота.
Наличие в изобутане нескольких первичных атомов водо-
водорода и лишь одного третичного давало основание надеяться по-
получить моноиитроизобутан с хорошим выходом, так как, цо
М. И. Коновалову, наиболее легко замещается на нитрогруппу
третичный водородный атом, в то время как первичные менее
склонны к этому. Опыт подтвердил ожидания, и, таким образом,
нитроиаобутан впервые был получен нитрованием изобутана
азотной кислотой в запаянной трубке при 150° по методу
М. И. Коновалова [84].
Нитрование предельных циклических и алифатических уг-
углеводородов изучалось также В. В. Марковниковым [85]. На
основе своих многочисленных исследований он показал, что
нормальные парафиновые углеводороды и особенно парафины,
содержащие четвертичные атомы углерода, лишь с трудом под-
подвергаются нитрованию ири взаимодействии с разбавленной азот-
азотной кислотой. Так, например [86], для превращения изогек-
сайа .(СН3)зССН2СНз а нитроизогексан (СНзKССН(Ш2)СН3
и изогептана (СН3)зССН2СН2СН3 • в нитроизогептан
Получение нитросоединений жирно ароматического ряда
241
{CH3KCCH(NO2) CH2CH3 приходится в течение длительного
времени B7 час.) нагревать углеводород с азотной кислотой
уд. в. 1,235 при 110—115°.
В 1926 г. был опубликован патент [87], согласно которому
моно- или динитросоединения алифатических углеводородов
получаются из соответствующих углеводородов при нагрева-
нагревании с азотной кислотой при температуре ~ 115° в присутствии
азотнокислого алюминия. Однако, как было установлено впо-
впоследствии [88], азотнокислый алюминий при этом не является
катализатором, и роль его сводится лишь к повышению темпе-
температуры кипения азотной кислоты.
При нитровании циклических предельных углеводородов
В. В. Марковниковым показано, что слабой азотной кислотой
нитруются не только соединения, у которых имеются алкилза-
мещенные метиленовые группы, но и незамещенные полимети-
лены. Однако в последнем случае нитрование протекает зна-
значительно труднее, вследствие чего требуется применение более
концентрированной азотной кислоты. При нитровании азот-
азотной кислотой уд. в. 1,235 гексанафтена по методу М. И. Коно-
Коновалова в течение 9,5 час. при 100° получено около 18% нитро-
гексанафтена C6HnNO2, считая на взятый в реакцию угле-
углеводород. Одновременно с нитрованием наблюдается реакция
окисления (в продуктах реакции обнаружено большое коли-
количество адипиновой кислоты).
Изучая действие дымящей азотной кислоты уд. в. 1,52 на
парафины и нафтены, В. В. Марковников [85] установил, что
азотная кислота этой концентрации действует медленно на
нормальные парафины и очень энергично на парафины, со-
содержащие группу -^5?СН. Азотная кислота уд. в. 1,52 реаги-
реагирует относительно быстро с пента- и гексаметиленом и очень
быстро — с замещенными циклическими углеводородами, на-
например с гомологами циклопентана. При обработке азотной
кислотой этой концентрации циклических и алифатических
гредельных углеводородов получены лишь незначительнее ко-
количества полинитросоединений; основными же продуктами ре-
1Кции оказались продукты окисления: СО2, летучие жирные
кислоты (при нитровании парафинов), двухосновные кислоты
16 а. В. Топчиев
242
Нитрование углеводородов азотной кислотой
(при нитровании парафинов и в большем количестве при нитро-
нитровании полиметиленов).
В. В. Марковников показал также, что нитрующая смесь
(HNOs-j- H2SO4) не действует на предельные углеводороды
(парафины и нафтены) при обыкновенной температуре и лишь
очень медленно реагирует при нагревании.
В. В. Марковников 189] посвятил ряд работ изучению угле-
углеводородов, входящих в состав нефти; в этих работах он поль-
пользовался реакцией Коновалова как методом исследования, ко-
который дает возможность легко идентифицировать отдельные
углеводороды, руководствуясь при этом в качестве критерия
отмеченной выше различной реакционной способностью этих со-
соединений к замещению нитрогруппой в зависимости от строения-
Изучение реакции нитрования н. гептана и 2,7-диметилок-
2,7-диметилоктана сравнительно недавно проводилось А. И, Титовым [90].
Автором было показано, что даже азотная кислота уд. в. 1,42
сама по себе не реагирует с парафинами. Нитрование .азотной
кислотой происходило лишь при наличии ощслов азота. Были
поставлены параллельные опыты нитрования н. гептана в труб-
трубках как в присутствии, так и в отсутствие окислов азота при
нагревании в течение 3 час. В первом случае было получено
(из 5,8 г гептана, 10 мл азотной кислоты уд. в. 1,2 и 1 г N^O*)
2,52 г сырого 2-нитрогептана (после очистки 1,37 г). Во втором
случае при такой же загрузке, но без добавления NaO4 не на-
наблюдалось избыточного давления, и получены лищь^ следы
нитросоединения.
На примере, нитрования 2,7-диметилоктана автор показал,
что азотная кислота уд. в. 1,42 не оказывает ускоряющего влия-
влияния на взаимодействие N2Oi с этим углеводородом.
Новые стороны реакции Коновалова были выявлены в ре-
результате глубоких исследований С. С. Наметкина.
С. С. Наметкин [91 ] при исследовании нитрования предель-
предельных углеводородов слабой азотной кислотой обратил внимание
на значение в этом процессе относительного количества азотной
кислоты. Этот факт в отличие от концентрации азотной кисло-
кислоты и температуры, влияющих на скорость реакции, определяет
главным образом направление реакции, т. е. характер обра-
Получение нитроеоединечий жирноароматического ряда 243
ующихся продуктов. С. С. Наметкин показал, что подбором
количества азотной кислоты можно значительно снизить эф-
' т побочных реакций окисления и повысить выход нитро-
>динений.
Нитруя гексагидропсевдокумол азотной кислотой уд. в.
,3 в открытых сосудах при различных отношениях кислоты
углеводороду, С. С. Наметкин нашел оптимальные условия
«акции для получения нитропроизводных гексагидропсевдо*
- лола с хорошим выходом.
Нитрование производилось в соединенной с холодильником
|рленмейеровской колбе, которую нагревали на песчаной бане
\о слабого кипения (для устранения толчков и перегревов
жидкость вносили алюминиевую проволочку). По оконча-
~ реакции, которая обычно продолжалась 6 час, верхний
юй, содержавший смесь углеводорода и нитропродукта, отде-
1ли от кислотного слоя, промывали последовательно водой,
|Одой и затем снова водой и после сушки над хлористым каль-
[ием подвергали перегонке с дефлегматором.
Опыты по нитрованию гексагидропсевдокумола дали сле-
^ющие результаты: при отношении углеводорода к азотной
1слоте 1 : 0,75 выход нитропродукта составляет 65°/0; при
">личении относительного количества азотной кислоты вдвое
од падает до 58—59% ; дальнейшее повышение относительно-
количества азотной кислоты (отношение углеводорода
ijsHNOs = 1 : 2,5) приводит к понижению выхода до 45—46% .
Для определения относительных количеств образовавшихся
:~ нитровании моно- и полинитросоединений С. С. Наметкин,
юле отгонки не вошедшего в реакцию углеводорода, подвер-
|ji продукт реакции фракционированной перегонке в вакууме
(и. 40 мм; мононитросоединения при этом давлении перегоня-
перегонять в интервале 140—445°, полинитропроизводные определяв
(Ьь в остатке.
^Сравнение опытов с различными относительными количе-
к1ми азотной кислоты показало, что с увеличением отноше-
азотной кислоты к углеводороду количество полинитро-
1ВЗВОДНЫХ повышается и, соответственно, понижается вы-
мононитросоединений.
16*
Щитрованив углеводородов авотной кислотой
Сопоставление полученных результатов с литературными
данными привело С, С. Наметкина к следующим выводам,
1, Действие азотной кислоты является сметанным , т, е.
наряду с продуктами нитрования образуются продукты окисле-
окисления.
2. При одной и той же действующей массе азотной кислоты
эффективность нитрования не зависит от ее концентрации
(при соответствующем подборе температуры и давления).
Так, например, с кислотой уд. в. 1,3 D7,5%) в опытах
С. С. Надеткина получен такой же выход мононитросоедине-
ний, как и в опытах М. И. Коновалова в запаянных трубках
с кислотой уд. в. 1,075 A3,5%).
3, Скорость реакции нитрования зависит от трех факторов:
температура, давления и концентрации кислоты, которые в из-
известных пределах не влияют на направление реакции. С по-
повышением температуры и давления реакция ускоряется и тем
сильнее, чем концентрированнее кислота. С азотной кислотой
уд. в. 1,3 реакция протекает при атмосферном давлении с прак-
практически приемлемой скоростью; при меньшей концентрации
(уд. в. 1,075^-1,055) реакция идет медленно, вследствие чего
требуется применение давления,
4. Относительное количество азотной кислоты и продолжи-
продолжительность процесса влияют главным образом на направление
реакции, т, е. на характер получающихся продуктов. При про-
продолжительном кипячении с большим избытком азотной Кисло-
Кислоты реакция приводит к преобладанию продуктов окисления.
С уменьшением относительного количества азотной кислоты
я продолжительности нагревания выход нитропродуктов повы-
повышается,
Исходя из найденной им зависимости течения реакции
нитрования предельных углеводородов от указанных факторов,
С. С. Наметкин в дальнейшем успешно осуществил нитрование
гексаметилена (гексанафтена) *. При проведении реакции под
давлением посредством кипячения в грушевидной запаянной
колбе равных объемов углеводорода и азотной кислоты уд. в. 1,3
• Гексанафтен представляет собой основную часть фракции кав-
кавказской нефти с т. кип. 80—82*.
Получение нитросоединений жирноароматического ряда
245
( С. Наметкин получил выход нитрогексаметилена 58,6% от
1 еретического.
С. С. Наметкин проводил также нитрование синтетического
i жсаметилена, приготовленного гидрированием из бензола,
тгревая его с азотной кислотой уд, в. 1,2 при 105—110° под
ивлением (в запаянных трубках). Опыты показали, что при
\ зеличении относительного количества азотной кислоты в 4 ра-
i (в первой серии опытов отношение количеств азотной кислоты
и углеводорода составляло 1,5 : 1, во второй 6 : 1) выход ни-
I ропроизводных падает с 49 до 36 %, причем соответственно
II эвышается выход продуктов окисления (органических кислот).
Для выяснения правильности положения, высказанного
«ще М. И. Коноваловым, что окисление является процессом
игоричного характера, С. С. Наметкин изучил действие окисли-
i злей, в частности азотной кислоты, на продукт описанной выше
[ вакцин — нитрогексаметилен. Оказалось, что при действии
аютной кислоты уд. в. 1,3 на нитрогексаметилен реакция про-
i зкает довольно медленно, причем выход адипиновой кислоты
нэлучается в 2 раза меньше, чем при непосредственном дей-
( свии азотной кислоты на гексаметилен. С другой стороны,
t ум вносить в кипящую азотную кислоту нитрогексаметилен
i слабощелочном растворе, в котором это соединение находится
i виде соли соответствующей аци-формы (изонитросоединения),
I закция протекает очень быстро, приводя к выходу адипино-
i эй кислоты 83,3%. Из этих фактов С. С. Наметкии делает
i явод, что окислению подвергается не нитрогексаметилен,
а продукт его превращения — изонитрогексаметилен, который
нвляется очень нестойким соединением.
Окисление нитропроизводного в виде аци-формы (изонитро-
< эединения) в органическую кислоту происходит, невидимому,
чзрез промежуточное образование альдегида (если лабильная
форма соответствует первичному нитропроизводному) или ке-
"Юна (в случае вторичного нитросоединения):
2RCH = N — ОН -э- 2RC
о
+ HSO + NSO
246
Нитрование углеводородов азотной кислотой
2R2C = N —ОН -^ 2R2C = О + N2O + Н2О
II
О
B)
По представлениям С. С. Наметкина, при действии азотной
кислоты на предельные углеводороды в первой фазе образуют-
образуются изонитросоединения, являющиеся нестойкими в кислой среде
я при высоких температурах. Эти изонитросоединения либо
переходят в стабильную форму нитросоединений, либо через аль-
альдегиды и кетоны, образующиеся по приведенному выше уравне-
уравнению, окисляются в соответствующие карбоновые кислоты.
Образование промежуточных продуктов окисления наблю-
наблюдалось М. И. Коноваловым [92], который выделил альдегид
1,6,6-триметилгептиловой кислоты при нитровании диизо-
амила крепкой азотной кислотой, а также С. С. Наметкиным
при нитровании кавказской нефти (фракция с т. кип.
142-144°).
Промежуточные изонитросоединения образуются лишь при
нитровании углеводородов, содержащих водород, связанный
с первичным или вторичным атомом углерода:
RGH3 + О = N == О •» RCH = N = О + Н2О -»• RGH2NO2 <i)
он
R2CH2 + О = N =
ОН
ОН
(лабильное ияо-
нитросоединение,
или аци-форма)
= N = О -* R2CHNO2
I (стабильная
Aw форма нитросо-
un единения)
B)
Углеводороды, содержащие водород, связанный с третич-
третичным атомом углерода, при нитровании образуют сразу
соответствующее стабильное нитросоединение:
RaCH + HONO2 -^ R3GNO2 + Н2О.
С. С. Наметкин и А. С. Забродина [93] изучали нитрование
изооктана [2,2,4-триметилпентана (СНKССН2СН(СН3J] по
методу Коновалова в запаянных трубках. В каждую трубку
загружалось 5 г углеводорода, 35 мл азотной кислоты уд. в.
1,075 и нагревалось при температуре 143—147° в течение
20 час. с перерывом через каждые 5 час. для спуска давления.
Получение нитросоединений жирноароматического ряда
24^7
Верхний масляный слой промывался раствором бикарбоната.
Из 315 г 2,2,4-триметийЯенхана ММшучёно:
¦ i ! i
нитрометан и изооктан, не вошедший в реакцию. 138 г
2,2-диметилпентанон-4 (СН3KССН2СОСН3 1,7»
2,2,4-триметилпентанон-З (СН3KССЪСН(СН3J ...... 5»
(образование этого кетона рассматривается как результат рас-
распада, получающегося в качеств© промежуточного продукта,
вторичного изонитрооктана).
ацетон , . . . . небольшое количество
вторичный нитроизооктан (CH3)8GCH(NO2)CH(CH3)a. . 2Д г
третичный нитроизооктан (CH3KCGH2C{NO2)(GH3J. - • . 60 »
динитроизооктан (CH3KCCH(NQ;s)C(NO2)(CH3)g. , . 5Д »
Ранее уже упоминалось, что при нитровании нормальных
парафинов слабой азотной Кислотой A3,15%) на примера* 1*ё-
ксана, гептана и октана М. И. Коновалов показал, что един-
единственными продуктами этих реакций являются вторичные
Р-нитросоединения. Изучая Действие слабой азотной кислоты йа
октадекан (С18Н38) при нагревании в запаянных трубках (по
Коновалову) С. С. Наметкин, G. С; Нифонтова Я Р. Я. Сущик
[94] установили, что единственным продуктом реакции оказа-
оказалось вторичное Р-нитрЧ)Шдннеийе CH3(CH2)i5CH(NO2)GH3,
т. е. образуется соединение, аналогичное соединению, получен-
полученному М. И. Коноваловым из гекСана. При действии разбавлен-
разбавленной азотной кислоты на гекс&трйаконтан (С3вН74) в аналогич-
аналогичных условиях главным продуктом реакции оказалось двувто-
ричное р,р'-динитросоедйнение CH3CH(NO2)(CH2K4GH(NO2)GH3,
т.е. нитрование идет с обоих концов молекулы, причем обе ни-
трогруппы становятся в ^-положение.
Выход динитропроиЗводного в два раза больше выхода монб-
нитропроизводного. На основании своей работы указанные ав-
авторы высказывают предположение, чтЪ до известного предела
молекулярного веса единственным продуктом реакции нитро-
нитрования нормальных парафиновых углеводородов является tib-
ответствующее вторичное (З-нитросоединение. В случае йф#Йы-
шения некоторого преДельяого мёйекулярного веса Главным
продуктом реакции нитрования по М. И. Коновалову а
248
. р,^'-динитропроизводное, ядаядащееся, вдв:й!«шому,,продзй«том
дальнейшего нитрования мононитропроизводного.
Однако, как было показано Пони и Костаческу 1951, изопен-
тан при нитровании HNOe (уд. в. 1,38—1,42) в запаянной трубке
при 140° дает, наряду с 2-нитро-2-метилбутаном, 2>3-динитро-
2-метилбутан (CH3JC(NO2)CH(NO2)CH8) а также с незначи-
незначительным выходом 1,2,3-тринитро-З-метилбутан (CH3JC(NO2)
CH(NQ2)CH2NO2 (с т. пл. 189-190°).
При нитровании изооктана разбавленной азотной кислотой
уд. в. 1,075 по методу Коновалова- (в запаянных трубках)
С. С. Наметкин и А. С. Забродина [96] выделили из кислотного
слоя: уксусную, изомасляную, триметилуксусную, трет, бутил-
уксусную, а,ос-диметилянтарную кислоты и следы щавелевой.
Эти же авторы [97, 98] на примере изооктана изучали взаимо-
взаимосвязь между реакцией нитрования и окислением азотной кисло-
кислотой углеводородов предельного характера.
Основываясь на том, что предельные нитросоединения весь-
весьма устойчивы к азотной кислоте даже при кипячении и окисля-
окисляются значительно медленнее соответствующих предельных угле-
углеводородов, авторы приходят к выводу, что промежуточными
продуктами при окислении предельных углеводородов азотной
кислотой являются не нитро-, а изонитросоединения. Послед-
Последние очень неустойчивы в кислой среде. Образуясь в качестве
начальных продуктов реакции, изонитросоединения либо тот-
тотчас же изомеризуются в соответствующие нитросоединения,
либо разлагаются с образованием закиси азота и альдегидов,
которые в свою очередь окисляются в карбоновые кислоты.
В случае иадрщава образуется изонитроизооктан, затем
вторичный нитроизооктан B,2,4-триметил-З-нитропентан),
кетон -— 2,2,4-триметилпентацон-З и продукты егд окисления.
Бели же действие азотной кислоты направлено на третичный
водород» то сразу образуется третичное нитросоединение.
Третичные алифатические нитросоединения мо;гут являться
промежуточными продуктами при переводе к продуктам окис-
окисления.
С. С. Наметкиным была впервые детально исследована ре-
реакция нитрования азотной кислотой предельных бициклических
Получение цитросовфыНений stoj
ряда
2Ш
углеводородов. Вследствие трудной доступности эти соединения
оставались долгое время совершенно не изученными.
С. С, Наметкин установил, что бициклические углеводороды
Обладают некоторыми особенностями) отличающими их от па-
парафинов и моноциклических нафтенов.
Как уже упоминалось выше, при нитровании парафинов
и нафтенов, содержащих третичный атом водорода, основным
продуктом реакции является третичное^ нитросоединение. Боль-
Большинство бициклических углеводородов содержит третичный
атом водорода, стоящий у атома углерода, общего обоим циклам
системы. Исследования С. С. Наметкина показали, что при
нитровании елкбой азотной кислотой бициклических углево-
углеводородов, состоящих из двух сочлененных пятичленных циклов,,
эти атомы водорода никогда tie замещаются на нитрогруппу.
Третичные нитросоединения могут быть получены только из-
углеводорода, содержащего группу > СН— СН3. Например*
при нитровании изоборнилана [99] был получен 2-нитроизобор-
нилан следующего строения: ;
¦HiO
Интересно отметить, что при нитровании бициклических
нафтенов, состоящих из двух шестичленных циклов или из
одного шестичленного и одного пятичйеиного, образуются тре-
третичные нитросоединения с нитрогруппой у атома углерода,.
общего обоим циклам. В результате нитрования декалина
С. С, Наметкин [100] получил третичный нитродекалин, а при
нитровании гидриндана [101 ] — третичный нитрогидриндан.
Другая характерная особенность бициклических угле-
углеводородов, установленная С. С. Наметкиным,заключается в их
сдособности к образованию структурно-изомерных нитросо-
единений. При нитровании парафинов и моноциклических
нафтенов замещающее действие азотной кислоты имеет.строго»
определенное направление, так что из числа возможных вто-
вторичных нитрОсоединений образуете^ веегда только одно.
550
Нитрование углеводородов азотной кислотой
Нитрование нормальных парафиновых углеводородов приводит
к образованию р-нитросоединений. В жирноароматичёских уг-
углеводородах нитрогруппа становится в «-положение по отно-
отношению к бензольному кольцу. При нитровании бйциклическйх
углеводородов замещающее действие азотной кислоты направ-
направлено одновременно на оба цикла системы. В результате нит-
нитрования фенхана [102] было получено два нитросоеддаешя —
2-нитрофенхан и 6-нйтрОфенХан:
-СЙ-
I*
сн2
/
\
СН8
Н2С-
5
-СН — NOe O2N —НС
/СН„
_сн с<
. с СИ»
I'
сн8
Два вторичных структурно-изомерных нитросоединения бы-
были получены также при нитровании камфенилана [103].
Нитрование бйциклическйх углеводородов иногда приводит
к возникновению смеси стереоизомерныж нитросоединений.
При нитровании симметрично построенного углеводорода кам-
фана [104] были получены а-и ос'-нитрокамфаны, которые при
окислении дали один и тот же кетон—недеятельную камфару.
Смесь стереоизомерных нитросоединений получалась также при
действии азотной кислоты на изокамфан [105].
Интересные результаты были получены С. С. Наметкиным
и А. С. Забродиной [106] ври действии азотной кислоты на пре-
предельный трициклический углеводород — трициклен. Един-
Единственным азотсодержащим продуктом нитрования трициклена
неожиданно оказалось непредельное нйтросоедийешв а-ни-
трокймфен. Образование а-нитрокамфена из трицинлена объ-
объясняется С. С. Наметкиным при помощи следующей схемы:
1. Первоначально происходит размыкание трехчленного
цикла по связям 1^2 или 1—6, и азотная Кислота присоеди-
присоединяется по месту освободившейся валентности, образуя ни*ро-
спирт.
2. Затем неустойчивый нитроспирт дегидратируется, пре-
превращаясь в а-нитрокамфон.
Получение тттроаоеёинений жирноароматического ряда
251
Процесс выражается уравнением:
HNOj
Приведенная схема реакции была распространена С. С. На-
Наметкиным на процесс нитрования углеводородов, не содержа-
содержащих трехчленного цикла.
Реакция протекает в две стадии:
1) присоединение углеводорода к азотной кислоте, :?'•
2) отщепление воды от промежуточного продукта.
Например, в случае присоединения азотной кислоты к ЦИК'-
логексану отщепление воды может идти в двух направлениях:
а) с образованием вторичного нчтросоединения, б) с образова-
образованием изонитросоединения, которое затем разлагается на кетон
и закись азота:
+HNO3
Циклогексан
и~*он
%0
с„й10С "Soiil-
С&Н,г
HNO,
c6hhn-o[hj
о
Изонитроцикло-
гексан
C6H,,NO2
Аналогичные превращения Наблюдаются при присоеди-
присоединении азотной кислоты к метилдиклогексану.
Отщепление воды от продукта присоединения азотной кисло-
кислоты к третичному атому углерода может привести к образований
только третичного нитросоединения:
а;
+ HNO»
Трет, иетил-
нитроинклогекса|Г
252
Нитрование углеводородов азотной кислотой
С. С. Наметкин высказал предположение, что нитрование-
ароматических углеводородов также проходит через стадии>
присоединения углеводорода к азотной кислоте. Ароматические
нитросоединения образуются при отщеплении воды от проме-
промежуточного продукта
^0 Ж)
У
¦ CeHBN — ОН
-н,о
Изучением нитрования жирноароматических соединений
занимались также П. П. Шорыгин и А. М. Соколова [107],
которые в качестве нитрующего агента применяли азотную
кислоту в растворе уксусной кислоты.
Работа этих авторов имела своей задачей найти наиболее
благоприятные условия нитрования жирной цепи толуола для
получения фенилнитрометана. Опыты производились как
в запаянных трубках, так и в открытых сосудах. В первом
случае смесь 10 мл толуола, 10,7 мл азотной кислоты уд. в.
1,5 и 29,3 мл ледяной уксусной кислоты нагревали в течение
24 час, причем был получен фенилнитрометан с выходом 14,5%.
Опыты при атмосферном давлении проводили следующим
образом: смесь 150 мл A30 г) толуола, 120 мл азотной кислоты
уд. в. 1,5 и 480 мл ледяной уксусной кислоты нагревали в колбе
с обратным холодильником на масляной бане до 110° в течение
3,5 часа. При этих условиях, которые на основании предва-
предварительных исследований оказались оптимальными, выход фе-
фенилнитрометана составлял 14JX>. Одновременно происходят
также нитрование ядра (выход нитротолуолов 24%) и образо-
образование продуктов окисления (выход бензойной кислоты 31,5%).
Обработка продуктов реакции производилась П. П. Шоры-
гиным и А. М. Соколовой следующим способом. Выделившийся
при вливании реакционной смеси в воду маслянистый слой
взбалтывали с 5%-ным раствором соды для извлечения бензой-
бензойной кислоты. Оставшееся масло, содержавшее фенилнитро-
фенилнитрометан и нитротолуолы, перегоняли с водяным паром. Пере-
Перегнанное масло обрабатывали 20%-ным раствором NaOH для из-
извлечения фенилнитрометана, после чего оно подвергалось пе-
Получение нитросоединений жирноароматического ряда 253
регонке, причем сначала переходил толуол A09^-111°), а за-
затем о- и п-нитротолуолы B17—238°). Из щелочного раствора
'фенилнитрометан выделяли при подкислении 20%-ным раство-
Зром соляной кислоты.
Подробное исследование и раскрытие механизма нитрова-
нитрования предельных и жирноароматических углеводородов принад-
принадлежит А. И. Титову.
Рассматривая механизм нитрования предельных углеводоро-
углеводородов и их производных, А. И. Титов 1108] приходит к следующим
выводам.
1. При нитровании парафинов азотная кислота не проявляет
самостоятельного химического действия, но служит лишь
источником возникновения и регенерации окислов азота-
2. Активным химическим агентом в этой реакции служит
исключительно лишь радикалоподобная молекула мономерной
формы двуокиси азота NO2.
В противоположность бесцветной и диамагнитной N2O4
мономерная форма NO2 парамагнитна и окрашена, что и дока-
доказывает радикалоподобный характер структуры ее молекулы.
3. Начальным элементарным химическим процессом нитро-
нитрования парафиновой цепи является возникновение углеводо-
углеводородного радикала при взаимодействии мономерной формы
.двуокиси азота с исходным органическим соединением по схеме
На основе экспериментальных данных А. И. Титов считает,
что предельные углеводороды и их остатки в других соедине-
соединениях, как правило, реагируют со свободными радикалами (А)
с незначительной энергией активации (не больше 10 ккал/моль)
• с отрывом атома водорода и образованием углеводородного
радикала по схеме
Тот факт, что скорость реакции нитрования возрастает
параллельно увеличению относительнрй стабильности ради-
,,кала R и параллельно уменьшению энергии активации отрыва
254
Нитрование углеводородов азотной кислотой
атома водорода, является подтверждением начального возник-
возникновения радикалов.
4. Образовавшиеся в первой стадии реакции алкильные ра-
радикалы быстро реагируют с радикалоподобными молекулами
окиси ж двуокиси азота с образованием нитрозо- и нитросо-
единений и алкилнитритов по схеме
R-+NO->RNO; (ly
*RNO2
К + NO2<Q B>
Наиболее вероятными превращениями и взаимодействиями
свободных радикалов с другими компонентами реакционной
системы, по мнению Титова, являются:
а) К + NaO4 -> RONO + NO2;
б) R- + N2Oa->RNO + NO2;
в) F + N2OS -> RONO + NO;
r) R- + N2OS -> RNO2 + NO;
д) К + HONO2 -> ROH + NO2.
Однако осуществление таких превращений углеводород-
углеводородных радикалов маловероятно и приобретает значение лишь при
очень значительных концентрациях NgO*, N2O3, HNO3 или при
высокой температуре.
Автор утверждает, что все разнообразие конечных продук-
продуктов взаимодействия окислов азота и азотной кислоты с предель-
предельными углеводородами и их производными есть результат даль-
дальнейшего превращения в условиях нитрования нитрозосоедине-
ний, эфиров азотистой кислоты, спиртов и в меньшей степени
нитросоединений.
Особенности нитрования азотной кислотой в первую оче-
очередь определяются состоянием равновесия, которое выражается
схемой 2HNOs + NO i± 3NOa + НгО. и факторами, от кото-
которых зависит установление этого равновесия.
На основе экспериментальных данных А. И. Титов доказал,
что азотная кислота в отсутствие окислов азота практически не
реагирует ни с нормальными парафинами, ни с изопарафинами,
ни с циклопарафинами, ни с боковой цепью алкилбензолов.
Получение нитросоединекцй жцрноаромати^сщого ряда ,25&
f " ¦ ^ ' ' ——г~, — —
В присутствии окислов азота химическое действие возрастало
Параллельно увеличению содержания двуокиси аарта. Изу-
Изучением действия разнообразных смесей окислов азота (N0,
NOa, N2Os, NaO*), азотистой и азотной кислот автор установил,
что химически активную роль при нитровании предельных
углеводородов играет только мономер двуокиси азота NQb*
Насыщение реакционной смеси окисью азота уменьшает
скорость реакции в соответствии со сдвигом равновесия
NO2+NO ^±J4aO3 слева направо.Если же вводить в реакционную
смесь кислород с целью удаления окиси азота из сферы реак-
реакции, то это приводит к ускорению реакции.
Скорость нитрования парафиновых углеводородов опреде-
определяется скоростью начальной стадии образования углеводород-
углеводородного радикала. Эта реакция относится к молекулярно-ради-
кальному типу, что доказывается тем, что увеличение Объема
кислотной фазы не сказывается на течении реакции; при уве-
увеличении объема углеводородной фазы степень прохождения
реакции увеличивается. Отсюда следует, что нитрование пара-
парафинов азотной кислотой протекает не в кислотной фазе, а в уг-
углеводородной. Это дает объяснение известным фактам того, что-
а) скорость реакции заметно не меняется в зависимости от сте-
степени иолярности среды, б) присутствие сильных протонных
и апротонных кислот (HaSO4, A1C13, TiCl4)He ускоряет иитро^
вания парафиновой цепи.
А. И. Титов [109, 110] предполагает, что аналогично е пре-
предельными углеводородами основными агентами, нитрующими
жирную цепь ароматических углеводородов при действии азот-
азотной кислоты, являются окислы азота (NOa и N0), находя-
находящиеся в сфере реакции. Роль азотной кислоты сводится
лишь к регенерации двуокиси азота и повышению ее концен-
концентрации посредством окисления низших окислов азота, образую-
образующихся во время реакции.
В начальной фазе нитрования под влиянием нитрующего
агента происходит первичный распад углеводородов с образо-
образованием свободных радикалов:
CeHBCHs + NOS -> CeHBCH-2 + HNO2.
256
Нитрование углеводородов азотной кислотой
Правильность предположения о возникновении свободных
радикалов при действии N0$ на жирноароматические угле-
углеводороды подтверждается наблюдением автора [111] о сильном
возрастании скорости реакции в ряду: толуол, дифенилметан,
трифенилметан — параллельно легкости образования соответ-
соответствующих радикалов. Свободные радикалы далее реагируют
с радикалоподобными молекулами окиси азота и двуокиси
азота
C6H5CH'+NO -^CeH5CH2NO; (i)
СвНвСН!2
С6Н5СН" + NOa -*. CeH5CH2OW О.
(II)
(III)
Образующиеся по схеме (I) нитрозосоединения дают в дальней-
дальнейшем динитропроизводные, причем реакция проходит через про-
промежуточную стадию превращения нитрозосоединений в оксимы
C6H5CH2NO -> С6Н5СН = NOH; - A)
+N,0,
CeH5CH = NOH-
B)
с Изучая продукты реакции, полученные нитрованием то-
толуола только N02, с одной стороны, и азотной кислотой (со-
(содержащей N02), с другой, А. И. Титов получил следующие
данные (табл. 13).
Таблица 13
Нитрование толуола N02 и азотной кислотой
Продукт реакции
Фенилнитрометан . . .
Фенилдинитрометан . .
Бензойная кислота . .
Остаточное масло . . .
Содержание, мол. %
Нитрование
N0,
52,5
2,7
11,2
33,6
Нитрование
HNOS
55,2
3,7
11,9
29 2
Получение1 нштросоедыненгш жирно ароматического ряда 257
Таким образом, в обоих случаях получается смесь практи-
практически одного ж того же состава.
Опыты А-И. Титова доказали, что при нитровании жирной
цепи ароматических углеводородов в зависимости от условий
образуются преимущественно либо ю-мононитросоединения,
либо w-динитросоединения. Образование обоих соединений про-
протекает по двум совершенно различным путям, и, таким образом,
мононитросоединения не являются промежуточной ступенью
образования гем. динитросоединений. Это доказывается тем,
что при действии двуокиси азота на фенилнитрометан он ос-
остается без измешения, действие разбавленной азотной кислоты
приводит к образованию бензилового спирта и бензойной кис-
кислоты, а в результате действия крепкой азотной кислоты про-
происходит нитрование в ядро. При низких температурах полу-
получаются главным образом динитропроизводные. Например,
смесь 100 мл азотной кислоты (уд. в. 1,42), содержавшей 0,3 г
двуокиси азота, и 1 л толуола оставляли стоять в неплотно
закрытой колб© при температуре около 25° на 20 дней. При
этих условиях основным продуктом реакции оказался фенил-
динигрометан. Повышение температуры до 50° приводит к уве-
увеличению выхода фенилнитрометана и к понижению выхода фе-
фенил динитрометана. При температуре около 100° из продуктов
нитрования боковой цепи обрадуется лишь фенилнитрометан.
Например, к 500 мл толуола при нагревании в колбе с обрат-
обратным холодильником на кипящей водяной бане в течение 2,5 ча-
часа прибавляли 300 мл азотной кислоты (уд. в. 1,38). В резуль-
результате реакции получен фенилнитрометан с выходом 52% наряду
с продуктами окисления: бензойной кислотой (выход 24,5%)
и бензальдегидом (выход 3%).
Понижение выхода фенилдинитрометана с повышением тем-
температуры объясняется, по А. И. Титову, понижением раствори-
растворимости окиси азота, необходимой для образования нитрозо-
нитрозосоединений, и повышением диссоциации N2O«, превращающей
оксимы в динитропроизводные (см. выше схему образования
последних).
Другим фактором, отрицательно влияющим на выход фенил-
фенилдинитрометана, является высокая концентрация NO2, которая
17 а В. Топчиев
258
Нитрование углеводородов азотной кислотой
приводит к уменьшению возможности столкновения свободных
радикалов с N0 и к понижению концентрации последней вслед-
вследствие сдвига равновесия слева направо в уравнении
С другой стороны, повышение концентрации окиси азота, на-
например, при специальном насыщении ею реакционной смеси
приводит к повышению выхода фенилдинитрометана.
Образование w-мононитросоединений происходит при дей-
действии мономерной молекулы NO2 (при применении большого
избытка нитруемого углеводорода N02 растворяется в послед-
последнем). В начальной стадии нитрования присутствуют лишь
незначительные количества двуокиси азота, растворенные
в азотной кислоте (для повышения этой начальной концентра-
концентрации А. И. Титов обычно добавлял к реакционной смеси триокси-
метилен, который при взаимодействии с азотной кислотой лег-
легко образует N02).
Приводим описание некоторых опытов А. И. Титова по
нитрованию толуола на фенилнитрометан, давших хорошие
результаты.
В реакционную колбу загружали толуол, 0,5 г триоксимети-
лена и буферную смесь из 8 г азотной кислоты уд. в. 1,38 и 40 г
50%-ной серной кислоты. Затем при нагревании на водяной
бане в течение 3,5 часа в нитрующую смесь приливали из ка-
капельной воронки 50 мл азотной кислоты уд. в. 1,5. Таким обра-
образом, крепкая азотная кислота не соприкасалась с толуолом,
чем устранялась возможность нитрования ядра,
В этих опытах при варьировании количественного отно-
отношения толуола к азотной кислот© оптимальные результаты (вы-
(выход 54,6 %) получены при употреблении 1750 мл толуола на
50 мл азотной кислоты.
Обработка продуктов реакции по окончании опыта произ-
производилась следующим образом. После промывки водой угле-
углеводородный слой энергично перемешивали 4 часа с 200 мл
20% -ного раствора бикарбоната калия, причем в течение второго
и третьего часа дополнительно было прибавлено 50 мл 50% -ного
раствора поташа. Выпавшую при этой операции калиевую соль
Получение нитросоединений жирноароматическога ряда 259
фенилдинитрометана отсасывали и затем промывали водой,
спиртом и эфиром. Из раствора оставшийся фенилдинитроме-
тан выделяли бромом в виде фйнилдинитробромметана. После
отделения последнего выделяли из маточного раствора бен-
бензойную кислоту.
Для извлечения фенилнитрометана реакционную массу
перемешивали 4 часа со 100 мл 10% -ной щелочи.
I А. И. Титов приходит к выводу, что для успешного нитро-
нитрования толуола азотной кислотой в боковую цепь требуются:
1) начальное присутствие в сфере реакции окислов азота,
2) накопление их до известного предела при помощи азотной
кислоты,
3) создание условий, препятствующих нитрованию азотной
кислотой ароматического ядра и деструктивному действию
на образующийся фенилнитрометан.
Окисление парафиновой цепи окислами азота и азотной
кислотой при нитровании предельных углеводородов нередко
является одной из основных реакций. Механизм этих реакций
А. И. Титов представляет следующим образом:
RONO + Н2О ^t ROH + HNO2;
ROH
5± RONOS + Н2О.
алквлввтрат
Создавая благоприятные условия для сохранения спиртов,
их азотисто- и азотнокислых эфиров, можно направить ре-
реакцию в сторону получения этих продуктов в значительном ко-
количестве. Так, например, при применении большого избытка
углеводорода, водуотнимающих средств и при введении кисло-
кислорода для устранения окиси азота из сферы реакции можно на-
направить взаимодействие между толуолом и NO2 при обычной тем-
температуре в сторону преимущественного получения бензил-
нитрата, бензилового спирта, а из него кислоты (схема,
стр. 260).
Свою теорию нитрования парафиновых и жирноароматиче-
ских углеводородов А. И. Титов [112] подтвердили на опыте
нитрованием дифенилметана и циклогексана.
17*
260
Нитрование углеводородов азотной кислотой
RNO
NO, ,/NO,,N,O,
RH —*- R — RONO
окснмы
RONO,
ROH
-кетоны и альдегиды
В зависимости от применяющихся условий реакции глав-
главным продуктом нитрования дифенилмет&на является дифенил-
мононитрометан или дифенилдинитрометан. Основные пути об-
образования этих продуктов автор представляет следующим обра-
образом. Вначале из дифенилмет&на и ТЧОг образуется бензгидрил:
(CeH5JCH' + NO2 -> (C6H5JCHNO2l
(CeH5)aC ~ NOH -»• (C6H5)!!C(NO2)i.
далее
ИЛИ
(С6Н5JСН- + N0
Наряду с нитропродуктами автор доказал образование про-
продуктов окислительного направления реакции, как то: бенз-
гидрилнитрата, бензгидрола, дибензгидрилового эфира и бен-
зофенона, по схемам
ONO, N,Oa, N,O»
а) (С6Н5JСН- > (СвН6JСН — 0N0 -»•
+Н.0 HN0,
—--> (G,H5JCHOH ^zr±
-HN0, Н,0
тт*
б) 2(С6Н6JСНОН ^Г± (С6Н5JСН _ О — СН (C6H6,i2;
N0,
в) (С6Н5JСНОН > (С6Н5JСО + N0 + НаО.
В одной из работ последнего времени на :примере нитро-
нитрования циклогекеана азотной кислотой и окислами азота
Получение ттросоединенйй жир ноарематического ряда 261
А: И. Титов [113] показывает, что при увеличении отношения
NaO4 : NOa все бблыпую роль при реакции гексильного ради-
радикала с димером двуокиси азота играет образование циклогек-
силнитрита
A)
Образовавшийся циклогексилнитрит в кислой среде реа-
реагирует с водой с образованием циклогексанола, который легко
окисляется в циклогексанон и затем при более глубоком окисле-
окислении дает адипиновую кислоту. При применении большого из-
избытка циклогекеана и продолжительности процесса 1 чао автор
получил смесь следующего состава:
МОП. % ;
витроциклогексан 50
циклогексанол 8
циклогексилнитрит 8
другие эфиры 14
адипиеовая Кислота 20
,,, , , ,_ __
С увеличением общей концентрации димера двуокреи азота
Выход продуктов окисления в соответствии с возрастанием рода
реакции циклогексила с N2Q4 п0 уравнению A) повышается
значительно больше, чем выход нитроциклогексана. Прложи-
тельная роль повышенного давления нри нитровании предель-
предельных и ширдаароматических углеводородов наблюдалась
М. И. Коноваловым, который отмечал резкое падение выхода
нитроооединений при проведении процесса в открытых сосу-
сосудах. А, И. Титов провел интересную работу по изучению
роли герметизации реакторов и процессов диффузии при нит-
нитровании предельных углеводородов азотной кислотой в жидкрй
фазе. Активно нитрующий агент — двуокись азота при нитрр?-
вании углеводородов по методу Коновалова остается преиму-
преимущественно в углеводородном слое, где и протекает реакция.
Скорость реакции, следовательно, определяется содержанием
NOj в этом слое. Газообразная окись азота, которая также остает-
остается в сфере реакции, способствует поддержанию необходимой
262
Нитрование углеводородов азотной кислотой
концентрации двуокиси азота благодаря ее участию в равно-
равновесии
2HNO3 + NO^± 3NO2 + H2O. w,, (I)
В начале реакции содержание двуокиси азота в углеводород-
углеводородном слое, особенно при нитровании разбавленной азотной
кислотой, очень незначительно. По мере течения реакции
RH + NO2 -> R- + HNO2 (II)
содержание NO2 в углеводородном слое падает, и для поддер-
поддержания реакции необходимо постоянное пополнение расхода
NO2. Таким источником пополнения NO2 является кислотный
слой, куда проникает N0 из углеводородного слоя. Регене-
Регенерация двуокиси азота в прилегающем к углеводороду верх-
верхнем кислотном слое связана с расходом азо^ой кислоты и,
следовательно, требует ее поступления из более глубоких
слоев. Из-за отставания процессов диффузщй при отсутствии
перемешивания концентрация N02 в углеводородном слое ста-
становится ниже, чем требуется согласно уравнению (I). Недоста-
Недостаточность концентрации NO2 сказывается тем больше, чем больше
скорость реакции углеводорода с NO2. Отсутствие достаточного
пополнения углеводородного слоя двуокисью азота ведет к за-
замедлению скорости нитрования. В конце реакции нитрования
по М. И. Коновалову, когда велика концентрация N0 вслед-
вследствие побочных окислительных процессов и сильно понижена
концентрация азотной кислоты, роль N0 как регулятора содер-
содержания N02 особенно велика.
При нитровании по Коновалову малоактивных углеводо-
углеводородов (например, диизоамила, циклогексана) При обыкновенной
температуре отставания диффузионных процессов от реакции
нитрования практически не наблюдается. В случае нитрования
таких углеводородов, как, например, дифенилметан, это отста-
отставание становится весьма значительным, так *jto реакция про-
происходит только в тонком слое на поверхности раздела слоя
углеводорода и кислоты.
При повышении температуры скорость диффузионных про-
процессов несколько увеличивается (при повышении температуры
Получение нитросоединений жирноароматического ряда
263
на 1° коэффициент диффузии увеличивается на 2—3%), но при
этом скорость реакции увеличивается в гораздо большей сте-
степени. Таким образом, нитрование при повышенной темпера-
температуре влечет за собой еще большее отставание диффузии от ско-
скорости реакции.
Влияние диффузии на скорость реакции изучалось
А. И. Титовым при нитровании м-ксилолав реакторах различного
сечения. При этом оказалось, что степень прохождения реакции
в сосуде сечения 100 см2 в 2,6 раза больше, чем в сосуде сечения
20 см2. Точно так же в горизонтальных трубках выход в 2—3
раза выше, чем в вертикальных трубках.
При изучении влияния перемешивания оказалось, что во
вращающемся автоклаве выход продуктов реакции в 1,5 раза
выше, чем без перемешивания.
На основе своих опытов А. И. Титов приходит к следующим
выводам.
1. При нитровании парафиновой цепи по методу Коновалова
роль герметизации реактора (применение запаянных трубок)
сводится к обеспечению сохранения двуокиси и окиси азота
в сфере реакции.
2. При нитровании парафинов азотной кислотой в жидкой
фазе наблюдается отставание диффузионных процессов от хода
реакции, что приводит к замедлению реакции и к изменению
соотношения продуктов реакции в сторону увеличения выхода
моно- и динитросоединения и уменьшения выхода продуктов
окисления.
3. Отставание диффузионных процессов и Связанные с ним
явления становятся более заметными с увеличением химической
активности углеводорода и повышением температуры, а также
зависят от аппаратурного оформления процесса.
Рассматривая различия нитрования ароматических и пре-
предельных углеводородов, А. И. Титов [114] приходит к следую-
следующим заключениям:
1. Ароматические соединения легко нитруются концентри-
концентрированной азотной кислотой или нитрующей смесью, причем
присутствие в них NO2 не имеет значения, в то же время NO2
является активным нитрующим агентом при нитровании пре-
Нитрование углеводородов азотной кислотой
дельных углеводородов. При их нитровании азотная кислота
сама по себе не оказывает заметного влияния.
2. При гетерогенном проведении реакции нитрование аро-
ароматических соединений протекает в кислотном слое; нитрование
предельных углеводородов протекает в углеводородном слое.
3. Добавка к реакционной смеси сильных протонных и апро-
тонных кислот (А1С18, TiCl4, BF3) сильно ускоряет нитрование
ароматических соединений и не влияет заметным образом в слу-
случае парафиновых углеводородов.
4. Скорость нитрования ароматических углеводородов
в парах значительно меньше, чем в жидкой фазе; в случае пре-
предельных углеводородов скорость нитрования в парах и жидкой
фазе почти одинакова.
5. Добавка ртутных солей при нитровании ароматических
углеводородов азотной кислотой умеренной концентрации уско-
ускоряет реакцию, а при нитровании предельных углеводородов
не влияет на ход процесса.
6. При нитровании ароматических соединений (азотной
кислотой, нитрующей смесью) выход нитропроизводных, как
правило, близок к теоретическому, в то время как при нитро-
нитровании предельных углеводородов выход соответствующих
мононитропроизводных составляет не более 60% от теории на-
наряду со значительным количеством образовавшихся продуктов
окисления.
7. Благодаря координационной ненасыщенности и наличию
кратных связей в ароматических ядрах реакция их нитрования
начинается со взаимодействия нитрующего агента с атомом
углерода; в случае предельных углеводородов действие нитрую-
нитрующего агента (NO2) направлено на атом водорода.
8. Нитрование ароматических соединений в ядро представ-
представляет ионно-комплексную реакцию, а нитрование предельных
углеводородов — радикально-молекулярную реакцию.
В своей работе А. И. Титов и Н. В. Щитов [115] показали,
что в ряде случаев нитрования парафинов азотной кислотой
и NOj, особенно при высокой температуре, необходимо допу-
допустить участие в реакции радикала NOg, который образуется
из азотного ангидрида по схеме
Получение' нитросоединений жирноароматичеекого ряда
265
O2N — О — N02 ^± NO2
ONOJ.
Авторы исследовали взаимодействие нормальных парафинов
и циклопарафинов с азотным ангидридом. Реакция идет с доста-
достаточной скоростью даже при 0° в среде инертных раствори-
растворителей. При смешении реагентов взаимодействие происходит
быстро и с разогреванием.
Авторы считают, что NOj , образовавшийся из азотного ан-
ангидрида, реагирует с углеводородом с образованием углево-
углеводородного радикала по схеме
RH + ONO'3 -> R- 4- HONO3.
Авторы предполагают, что образование весьма активного
радикалоподобного остатка NO3 и объясняет наблюдаемую в не-
некоторых случаях более высокую, чем с NO2, скорость нитрова-
нитрования азотной кислотой.
Фенилтринитрометан был впервые получен в 1952 г. А. И. Ти-
Титовым и В. В. Смирновым [116] действием N2O4 на калиевую
соль фенилдинитрометана по схеме
NO2
N,0,
свн6сто2K
NOOK
К суспензии калиевой соли фенилдинитрометана в четырех-
хлористом углероде при—12° приливают раствор N2O4 в том
же растворителе из расчета 2,4 моля NaO4 на 1 моль соли.
Реакция протекает почти мгновенно. Реакционную смесь обра-
обрабатывают водой и раствором соды и после отгонки раствори-
растворителя в вакууме очищают сырой фенилтринитрометан концентри-
концентрированной серной кислотой. Выход 70% от теории.
Попытка получить фенилтринитрометан действием N2O4
не на соль, а на свободный фенилдинитрометан не увенчалась
успехом. Реакция идет лишь при прибавлении основания (даже
такого, как пиридин). Это указывает, что фенилдинитрометан
реагирует с N2O4 только в виде аци-формы.
При действии азотной кислоты уд. в. 1,4, содержащей окислы
266
Нитрование углеводородов азотной кислотой
азота, на фенилдинитрометан также получается фенилтринитро-
метан с выходом 50% от теории. Кроме того, при этом обра-
образуется п-нитробензойная кислота с выходом 35% от теории.
В отсутствие окислов азота эта реакция не идет.
Интересный метод введения двух нитрогрупп в боковую цепь
ароматического ядра был предложен итальянским химиком
Пончио [117]. Метод основан на действии N2O4 на бензальдок-
•сим по схеме
CeH6CH = NOH —LI*. СвНвСН(Ша)а.
При этой реакции существенное значение имеет избыток N2O4.
Если вести процесс с эквимолекулярным количеством N2O4, то
развиваются побочные реакции. Пончио предложил следующую
методику проведения реакции. К эфирному раствору бензаль-
доксима добавляют N2O4 в количестве 2 молей на 1 моль ок-
«има. Процесс ведут вначале при охлаждении, а затем при ком-
комнатной температуре. Полученный фенилдинитрометан извле-
извлекают 5%-ным водным раствором щелочи, а затем выделяют его
подкислением щелочного раствора 10% -ной серной кислотой.
Выход фенилдинитрометана 75% от теории.
Исследовалось превращение оксимов в нитросоединения
[118] посредством окисления гипобромитом с последующим
восстановительным дебромированием. С альдоксимами и кето-
ксимами алифатических и ароматических кетонов реакция
совершенно не удается.
Лишь алициклические кетоксимы дают соответствующие
нитросоединения. В качестве бронирующего реагента реко-
рекомендуется N-бромимид янтарной кислоты. В качестве восста-
восстановителей наилучшие результаты дает борогидрид натрия
NaBH4.
Уместно будет отметить действие крепкой азотной кислоты
на фенилнитрометан и фенилдинитрометан.
При нитровании фенилнитрометана его медленно прибав-
прибавляют к 7—10-кратному весовому количеству азотной кислоты
уд. в. 1,49—1,53 при температуре 10—15° (реакционную массу
приходится охлаждать). Реакционную массу выливают на
лед и выпавший осадок м-нитрофенилнитрометана
Получение нитросоединений жирноароматического ряда 267
-CH2NO3
N02
перекристаллизовывают из спирта или ледяной уксусной кис-
кислоты. Выход — 40% от теории. Необходимо отметить, что при
нитровании одной крепкой азотной кислотой в ядро вступает
лишь одна нитрогруппа и притом преимущественно в мета-по-
мета-положение. Для введения второй нитрогрупны в ядро требуется
применение смеси азотной кислоты уд. в. 1,5 и олеума с 20—
25% -ным содержанием свободного ЭОз:
HNO3 + HSSO, .ч
),-CH2NO3 => O2N—^\—CHgNOg
NO3
NO2
Нитрующую смесь берут в 8—10-кратном весовом количестве
и реакцию ведут при 65—70°. Выход составляет ~ 75% от тео-
теории [119].
При нитровании фенилдинитрометана [120] концентриро-
концентрированной азотной кислотой получается м-нитрофенилдинитро-
метан по схеме
O,N
HNO3
\
\-
~ V- CH(NO2
Реакция проводится следующим образом: охлажденную до
—15° азотную кислоту уд. в. 1,5 приливают к фенилдинитро-
метану (весовое отношение HNCb к фенилдинитрометану
10:1) и выдерживают 1 час при комнатной температуре. Затем
реакционную смесь выливают на воду. Полученный осадок филь-
фильтруют, промывают водой и перекристаллизовывают из метило-
метилового спирта. Получают м-нитрофенилдинитрометан в виде
желтых кристаллов. Выход составляет 93% от теории.
За последние 15—20 лет опубликованы работы, в которых
приведены данные о нитровании предельных углеводородов
азотной кислотой по так называемому парофазному методу.
268
Нитрование углеводородов азотной кислотой
Особенностью этого метода, который осуществляется при атмо-
атмосферном давлении, являются высокие температуры реакции,
значительно превышающие температуры нитрования по методу
Коновалова.
Эта особенность парофазного метода придает ему своеобраз-
своеобразный характер, так как в этих условиях, наряду с нитрованием
парафинов, происходит пиролиз последних (или свободных ра-
радикалов, см. ниже) с образованием соединений (или радикалов)
меньшего молекулярного веса, которые, подвергаясь нитро-
нитрованию, дают нитропродукты с меньшим числом атомов углерода,
чем в исходном парафине.
Промышленное производство нитропарафинов нитрованием^
парафинов непрерывным методом в газовой фазе, начатое
в 1940 г., открыло новую область органической химии.
Для увеличения выхода нитропарафинов и во избежание
опасности взрыва весьма важно регулировать соотношения ре-
реагентов таким образом, чтобы соотношение углеводорода к азот-
азотной кислоте равнялось по крайней мере двум.
Кроме смеси нитропроизводных с различным числом атомов
углерода, при нитровании по парофазному методу образуются
также продукты окисления.
В работе Хэсса, Ходжа и Вандербильта [121] имеются дан-
данные по нитрованию парафинов: этана, пропана, н. бутана и изо-
бутана. Синтез соответствующих нитропарафинов осуществлялся
этими авторами посредством пропускания паров углеводо-
углеводорода через азотную кислоту со скоростью 150 л/час (молярное
отношение углеводорода к азотной кислоте 2 : 1); образовав-
образовавшаяся таким образом смесь поступала далее в реактор, который
нагревали на нитрит-нитратной бане до 420° (реактор
представлял собой стеклянную трубку диаметром 10 мм).
При нитровании этана получены в качестве продуктов реакции
нитрометан и нитроэтан; нитрование пропана дало уже четыре
продукта: нитрометан, нитроэтан и в преобладающем коли-
количестве F5% общего выхода нитропарафинов) 1- и 2-нитропро-
паны. При нитровании бутана основными продуктами реакции
оказались 1- и 2-нитробутаны G7% общего выхода нитропара-
нитропарафинов); кроме того, получены 1-нитропропан, нитроэтан и
Получение цитросоединений жирноароматического ряда
269
нитрометан, образовавшиеся в результате нитрования продук-
продуктов пиролиза.
Нитрование ивобутана привело к следующим результатам:
из двух образовавшихся нитропроивводных, соответствующих
по числу атомов углерода нитруемому парафину, первичный
1-нитроивобутан получен с выходом 65% общего выхода нитро-
нитропроизводных, третичный же 2-нитроизобутан — с выходом все-
всего 7% ; кроме того, в продуктах реакции обнаружен 2-нитро-
пропан (выход 20%) и нитрометан. Результаты этих опытов
сведены в табл. 14.
Таблица 14
Парофааное нитрование парафинов
Углеводород
Продукт реакции, %
я
s
§
I*
в
А а
*3
feC И
Я-
Этан . .
Пропан .
Бутан . .
Изобутан
10—20
9
6
3
80—90
26(?)
12
32
5
33
20
27
50
65
9
21
28
25
При нитровании изобутана по методу Коновалова при 150°
эти же исследователи получили в качестве единственного про-
продукта реакции кристаллический 2-нитроизобутан, который
при нитровании по парофазному методу, как мы видели выше,
образуется с выходом всего 7% . Сравнение этих двух методов
наглядно указывает на особенности парофазного нитрования:
благодаря высоким температурам реакция становится менее
селективной и дает изомеры, из которых первичный, полу^
ченный со значительно бблыпим выходом, чем третичный, явля-
является, повидимому, более устойчивым в условиях реакции. Как
уже было отмечено выше, высокие температуры приводят
также к образованию, вследствие пиролитических реакций,
нитросоединений с меньшим числом атомов углерода, чем в ни-
нитруемом парафине.
270
Нитрование углеводородов азотной кислотой
Обстоятельное исследование парофазного нитрования про-
пропана и бутана азотной кислотой провел в 1952 г. Бахман с со-
сотрудниками [122—125], установивший, что в результате реакции
нитрования, наряду с нитросоединениями, получаются и кисло-
кислородсодержащие соединения и непредельные углеводороды. При
температуре 425° (оптимальная температура) и времени кон-
контакта 1,6 сек. конверсия достигает 36% . Этими авторами было
изучено влияние добавок кислорода и галоидов на выход и со-
состав продуктов нитрования бутана [123] и пропана [124, 125].
Было найдено, что добавка двух молей О г на моль HNO8 не
меняет оптимальной температуры D25°) нитрования бутана,
увеличивает выход нитропродуктов в расчете на пропущенную
HNOg, но понижает выход в расчете на превращенный бутан.
Было также найдено, что при последовательном введении 1,
2 и 3 молей кислорода содержание карбонильных соединений,
олефинов и СО в общем увеличивается, количество же СО2
достигает минимума при максимальном количестве нитропара-
финов, полученном при содержании 1—2 молей О2 на моль
HNOs.
Бахман следующим образом истолковывает результаты, по-
полученные с добавками кислорода. Добавки кислорода увели-
увеличивают концентрацию свободных радикалов, которые, соеди-
соединяясь с двуокисью азота, дают нитропарафин. В нитропарафины
всегда превращается только часть алкильных радикалов,
а остальные алкильные радикалы взаимодействуют с кислоро-
кислородом. С увеличением количества кислорода выше оптимального
скорость окисления растет, и в эту реакцию вовлекается до-
дополнительная часть радикалов, превращавшихся при мень-
меньшем количестве кислорода в нитропарафины. Наличие олефи-
олефинов в опытах, проведенных без кислорода, подтверждает уча-
участие свободных радикалов в нитровании.
Добавки 0,015 моля брома на моль HNOs увеличивали вы-
выход нитропарафинов от 23 до 28% в расчете на пропущенную
HNO3 и от 23 до 50% в расчете на превращенный бутан [124].
Добавки кислорода повышали положительное влияние брома.
Так, выход нитропарафинов, рассчитанный на пропущенную
HNOs, достигает максимальной величины 48% при содержании
Получение нитросоединений жирноароматического ряда
271
2 молей О2 на моль HNOs, а выход нитропарафинов, рассчи-
рассчитанный на прореагировавший бутан, достигает максимальной
величины 57% при наличии 1 моля О2 на моль HNOs.
По мнению авторов, положительное влияние брома связано
с его способностью генерировать радикалы по схеме
2)
3)
+ Вт";
+ СпН;п+1 + НВг + Вт';
5) НВг + [О] -» НО" + Вг".
Преимущество брома по сравнению с кислородом Бахмав
объясняет легкостью распада галоидных алкилов с регенера-
регенерацией атомов брома. Положительное влияние добавок кислорода
при нитровании в присутствии брома объясняется, по мнению
Бахмана, окислением НВг до Вг".
По данным Бахмана, для достижения максимального вы-
выхода нитропродукта (в присутствии 0,1 моля О2 на моль пропана)
хлора необходимо в два раза больше@,05 моля С12 на MonbHNOg),
чем брома @,025 моля Вг2 на моль HNOs). Этот резуль-
результат объясняется Бахманом следующим образом. Хлор и бром,
реагируют по схеме
2) RH + X" -> R" + НХ;
3) R"+NO2-»RNO2;
5) НХ + NOj -*¦ Ха + Н20 + низшие окислы азота;
6) RX + NOj -*¦ Ха + продукты окисления R + низшие окислы азота.
Бромистый водород и бромистый алкил окисляются быстрее,
чем соответствующие производные хлора. Поэтому количества
молекул галоида, способное превратиться в свободные радикалы,
больше в случае брома, чем для хлора. Падение выхода нитро-
нитропродуктов с повышением концентрации галоида выше опти-
оптимальной объясняется расходованием NO2 по уравнениям 5 и 6.
272
Нитрование углеводородов азотной кислотой
В работах Бахмана было также исследовано влияние па-
параметра SfV (отношение величины поверхности реактора к его ¦
объему) на выход нитропарафинов при нитровании бутана в при-
присутствии кислорода [1231. Кривая зависимости выхода RNO2,
рассчитанного на пропущенную HNOs, от количества кис-
кислорода, проходила через максимум при всех исследо-
исследованных величинах SfV B0, 28 и 300). Максимальный вы-
выход D3% RNO2) оставался постоянным при всех трех значе-
значениях SfV, но в зависимости от параметра S/V достигался при
различном содержании кислорода, причем при максимальном
выходе наибольшему значению SfV соответствовало наимень-
наименьшее количество кислорода A моль О2 на моль HNOs). Увели-?
чение параметра S/V вызывало понижение отношения проре-
прореагировавший бутан—пропущенный бутан. Бахман привадит
¦следующее объяснение найденным фактам. Пощюкение коли-
количества прореагировавшего бутана с увеличением SfV объяс-
объясняется исчезновением части радикалов на поверхности. Однако,
несмотря на исчезйовение части радикалов, количество нитро-
царафинов, получающихся из радикалов, не падает (сохраняется
высота максимума). Следовательно, увеличение S/V позволяет
получить большее количество натропарафинов за счет обрыва
цепей окислительной цепной реакции, т. е. благодаря подавле-
подавлению окислительного направления.
Бахман и Поллак [126] изучали парофазное нитрование про-
пропана в присутствии хлора в качестве катализатора и сопостав-
сопоставляли полученные результаты с опубликованными в 1952 г.
данными по парофазному нитрованию в присутствии кислорода
и хлора.
Как указывают эти авторы, при обычном парофазном ни-
нитровании пропана получается смесь нитропарафинов, состоя-
состоящая из 25% 1-нитропропана, 40% 2-нитропропана, 10% нитро-
этана и 25% нитрометана.
Если при нитровании применять в качестве катализатора
смесь кислорода и хлора, то превращение в нитропарафины
увеличивается на 32% , а при применении одного хлора проис-
происходит увеличение на 46% . Бром действует так же, как и хлор,
но недостаток его применения состоит в том, что образующаяся
Получение нитросоединений жирноароматического ряда
273
НВг восстанавливает нитросоединения с образованием аммо-
аммониевых и гидроксиламмониевых Солей.
При парофазном нитровании природного газа состава:
75,56% СН4,6,36% С,Н,-,3,45% С8Н8,13,65% N2,.0,69%
С4Н1о и при отношении природный газ: HNO3: Н2О: С12 =•
=13,6 : 1 : 1,6 :0,4, времени контакта 1,7—1,8 сек. и темпера*
туре 450° оптимальное превращение составляло 13% .
Такое же превращение получается при молярном отношении
С3Н8 : HNOs : Н2О : СН4 = 0,483 : 1 ; 1,6 : 14,0 при нитро-
нитровании без хлора. Таким образом, если в смеси преобладает
метан, то хлор не оказывает каталитического влияния.
Согласно американскому патенту [127], пропан нитруется
40—70 %-ной азотной кислотой при температуре 190° и давле-
давлении —9 атм. На 2 моля пропана берут 1 моль кислоты и
получают смесь нитропропанов [(CH3JCHNO2 и (CH3JC(NO2J
с выходом 8—10%, считая на азотную кислоту].
Нитрованию пропана азотной кислотой уделялось боль-
большое внимание как в отношении аппаратурного оформления
процесса (создание условий изотермического протекания ре-
реакции), так и в отношении применения катализаторов (кисло-
(кислород, воздух) для интенсификации процесса [128].
Хэсс и Александер [129] изучали влияние кислорода при
нитровании пропана азотной кислотой при температуре 410°.
При этом им удалось увеличить превращение пропана от 28
до 62% . .
При температуре 395° и введении 3,8 моля кислорода на
1 моль HNO3 превращение пропана в нитропродукты увеличи-
увеличивается от 20 до 76%. .: !
В недавно опубликованном патенте- [130] указывается на
значительное увеличение выходов нитроалканов и ценных
побочных продуктов окисления, получающихся при парофаз-
парофазном нитровании алифатических углеводородов СН4, С2Щ;
СдН8, С4Н10 (нормальный и изо-) в присутствии кисло-
кислорода. ¦
Добавление кислорода незначительно влияет на нитрова-
нитрование метана.
При температуре 435° изменение молярного отношения
18 а. В. Топчиев
274
Нитрование углеводородов азотной кшлеюно
O2/HNOe w 0 до 5 увеличивает конверсию азотной кислот
в нитрометан с 17,6 до 24,2% [129].
При проведении процесса иод давлением ими присутствии
кислорода конверсия HNO3 й CH8NO2 резно падает по мере
увеличения концентрации кислорода. Это видно из приводи-
приводимых ниже данных табл. 15 [131], полученных при температуре
444° и давлении 7,8 атм.
Таблица 15
Конверсия HNO3 e GH&NOa под давлением в присутствии кислорода
СН4/НШ3 ....
O8/HNQS
Концентрация О2
Конверсия ....
Выход
11,8
0,0
0,0
21,1
21,3
12,0
0,38
2,4
18,1
21,2
12,3
0,37
2,4
20,4
23,6
11,9
0,60
3,9
!..:«.?
¦'-¦ 22',4
,""N|' ''
10,5
1,30
¦8,8
0,0
0,0
яе
При высоком содерщанищ кислррода
чается; образуется главным образом
Изучением реакции нитрования з^вдких дестидаатов
в паровой фазе занимались Б. Н. Тютюнников, Н. П. Мань-
ковская и Т. Д. Явлинский [132]. Смесь углеводородов содао-
яда из 24,2% нафтеновых и 72,6% парафиновых углеводородов.
Выход нитропродуктов аа один проход составлял 60-г*65%
от смеси углеводородов. Полученные нитропродунты содержа-
содержали: 90% мононитросоединений, состоящих из 20% первичных
нитросоединений, 40% вторичных и 40% третичных. Приме-
Применялась 67%-ная ааотная кислота в отношении к Лигроину
1:1, продолжительность контакта 4—5 сек., температура
нитрования 330—350°. Как указывают авторы, при просасы-
вании паров углеводородов при помощи тока воздуха выход
нитропродуктов повышается на 90%, что, поэидимому, связано
с каталитическим действием кислорода воздуха.
Хэсс и Паттерсон [133] исследовали реакцию нитрования
пентана. Пары пентана поступали со скоростью 260 мл/час
в реактор, где их перемешивали с параши азотной кислоты,
которую пропускали со скоростью 70 мл/час (молярное отноше-
отношение пентана к азотной кислоте 2,3:1). Нитрование производили
Получение Mtrnpocfbedmemft
ряда
275
при 400°. В результате ШЩШШШ получаны следующие
продукты: 1~, 2~, З^татропеитшим (с выходом 65% от
общего количества нитропарафинов), 1-нитробутан, 1-иитро-
пропан, вШтроэтан и нитрометан. Общий выход нитрйиарвфи-
нов иа азотную кислоту, вступившую в реакцию, составляв 31% .
Сейгль и Хэсс [1341 разработали здртодтарофазного нитрова-
нитрования изоиентана. При молярном отношении углеводородов
к кислоте 1,7 : 1 и температуре нитрования 420 авторы полу^
чили 9 нитропарафинов: 3-метиЛг1-нитробутан, 2-метил-1-ни-
тробутан, З-метил-2-нитробутан, 2-метил-2-нитробутан, 2-ни-
тробутан, 2-метил-1-вдтропроиан» й-нитропропаи* нйтроэтан
и нитрометав. При 380° получеян те же продукта^ во с
меньшими выходами.
На парофазный метод нитрования 1,1,1-трифторпроиаца
указывают Хэсс и Робинсон [1351, которые вводили в реактор
трифторюропан и азотную кислоту при температуре $95° со
скоростью 0,42 и 0,52 мол/час при продояжитшьносчги нонТйкта
2,5—3,5 еек. Получается 39% смеси 1,1,1^трифторвштроэ*ана
и 1,1,1-трифтор-З-нитропропана в отношении 2 : 3. В нитропро-
дукты превращается 11,9% исходного продукта.
Если действовать азотной кислотой на хлорираизводные
ушеводородов в газойоЙ? фаве; w "П©яучаютвя хяорнитро»
углеводороды, применяющееся кай растворители инсектисидов,
а также как промежуточные продукты 11361.
Иа работ, относящихся к нитрованию парафинов в газовой
фазе» о»меФим еще работу Данцига й Хэоса [137] по изучению
реакции нитрования 2,3-диметилбутана. Эти авторы поставили
задачу выяснить на примере 2,3-диметилбутаиа, происходит
ли в условиях парофазного нитрования образование динитро-
парафинов (наряду с мононитрМарафинами), как это
наблюдается при проведении реакции по Методу Коновалова.
При нитровании 2,3-диметилбутана в запаянной трубке при
125° М. И. Коновалов [138] получил, кроме 2C-диметил-2-
нигробутана, также 2,3-диметил-2,Э-дий1итро6утан, образова-
образование которого МойШ^йть объяснено аамещеняем нитрогруй
третичшдх а^ймйв водорода при втором и третьем
углерода.
18*
276
Цитрование углеводородов азотной кислотой
Опыты Данцига и Хэсса проводились при температуре
400—430°И молярном отношении углеводорода к азотной кислоте,
равном 1,58 : 1. Найдено, что оптимальная конверсия 2,3-
диметиябутана в нитропарафнны происходит при 410° и про-
продолжительности контакта 1—2 сек. При дальнейшем повыше-
повышении температуры конверсия уменьшается, причем наблю-
наблюдается образование побочных продуктов окисления, выход ко-
которых достигает наибольшей величины при 430°. При 408°
конверсия по азотной кислоте, вступившей в реакцию, со-
составляет 17,5% .
В отличие от нитрования по методу Коновалова динит-
ропарафины в опытах Данцига и Хэсса не обнаружены. Полу-
Получены лишь мононитропарафины B,3-диметил-1-нитробутан,
2,3-диметил-2-нитробутан, З-метил-2-нитробутан, 2-нитропро-
пан и нитрометан) наряду с продуктами окисления (кетоны)
и крекинга B,3-диметил-1-бутен и 2,3-диметил-2-бутен).
; На примере нитрования бутана Мак-Клирли [139] показал
влияние температуры на состав продуктов реакции (табл. 16).
Таблица 16
_ , Выход продуктов нитрования бутана (в %) в зависимости
от температуры
Темпера-
Температура, °С
395v
393
393
445 ,
450
Нитрометан
2,1
6,1
5,0
5,9
9,0
Нитроэтан
12,7
19,0
11,0
18,2
25,0
1-Нитродро-
пан
4,9
7,0
5,0
6,5
7,0
2-Нитробутан
49,0
41,0
46,0
37,0
28,0
1-Нитробутан
30,5
27,0
32,0
31,8
31,0
Как видно из этой таблицы, увеличение температуры ре-
реакции, ведет к уменьшению образования нитробутанов и со-
соответствующему увеличению количества низших нитропара-
финов, в том числе нитрометана.
Получение тштросоединениЩ жирноароматическога ряда
277
Следует отметить, что полу*10вие нитрометана прямым
нитрованием метана—довольно "Грудная проблема из-за не-
небольшой конверсии и трудности; регенерации непрореаги-
ровавшего углеводорода. Имеется Патент, согласно которому
рекомендуется нитровать метан, разбавленный инертным га-
газом, например азотом, с рециркуляцией. При этом выход
нитрометана увеличивается по мире разбавления его азотом.
Такг конверсия 100% -ного метана составляет 2,2%, в елучае
же нитрования 10%-ного метана конверсия увеличивается
почти в 3 раза [140].
В связи с большими трудностями нитрования метана, нитро-
нитрометан в основном получают при нитровании пропана азотной
кислотой. .
В зависимости от условий проведения реакции сОДефжййиё
нитрометана в продуктах реакции может колебаться от 9 ДЬ
49% [141]. Для удаления нитрометана из смеси продуктов
реакции рекомендуется применять перегонку с н. гексажом.
Последний дает азеотропную смесь с CH3NO2, низшими алифа-
алифатическими спиртами и водой.
Алифатические эфиры, спирты, кетоны и карбоновые кислоты
при парофазном нитровании азотной кислотой дают выходы
нитропроизводных не выше 20% (от 5 до 20%); температура
реакции 400° [142].
Парофазному нитрованию подвергались и жирноаромати-
ческие углеводороды. Так Булок и Митчелл [143] при нитро-
нитровании толуола азотной кислотой в паровой фазе получили емесь
изомерных нитропроизводных, которая содержала 55% о-нит-
ротолуола, 5% м-нитротолуола и 40% п-нитротолуола. В про-
продуктах реакции обнаружены незначительные количества поли-
нитропродуктов и продукты окисления. Соотношение изомеров
примерно такое же, которое получается при обычном нитро-
нитровании.
Парофазное нитрование бициклических нафтенов исследо-
исследовано на примере норкамфана. Действуя на норкамфан азотной
кислотой при температуре 400—4Ю% Хэсс и Бликенет^фф
[144] получили третичный нитронорадмфан
278
Нитрование углеводородов азотной кислотой
— GH — CH2
ha.
H2G — С —
Образование этого продукта показало, что при парофазном
нитровании исчезает инертность третичного водорода, стоящего
у атома углерода, общего обоим циклам.
Обзор опубликованных экспериментальных данных по нитро-
нитрованию парафинов в газовой фазе приводит к следующим заклю-
заключениям об особенностях парофазного метода.
1. Нитрование в газовой фазе осуществляется при обыкно-
обыкновенном давлении и высоких температурах от 250 до 600°;
в большинстве случаев синтез нитропарафинов проводят при
температурах 400—450°, которые являются, повидимому, оп-
оптимальными.
2. В отличие от нитрования по методу Коновалова, которое
дает один или два продукта реакции, нитрование по парофаз-
ному методу приводит к образованию ряда изомерных нитро-
соёдинений (при высоких температурах реакция становится
менее селективной).
3. Нитрование в газовой фазе, наряду с нитропроизвод-
ными, соответствующими нитруемому углеводороду, дает в ка-
качестве продуктов реакции ряд нитропарафинов с меньшим
числом атомов углерода, чем в исходном парафине.
Дли ббъяснения этого факта допускают образование из
парафинов свободных радикалов, которые, подвергаясь Даль-
Дальнейшему пиролизу, дают радикалы с меньшим молекулярным
весом; продукты пиролиза, присоединяя группу N0^, образуют
нйтропарафины с различным числом атомой углерода. При
повышении температуры относительный выход нитропарафи-
нитропарафинов, появляющихся в результате нитрования продуктов пиро-
пиролиза, повышается.
4. При парофазном нитровании образуются исключительно
монойитронарафины, причем преобладают первичные нитро-
производные. С повышением температуры выход первичных
Получение нитросоединений жарноароматического ряда
279
нитросоединений повышается, а вторичных и третичных —¦
понижается. Из этих данных можно сделать следующие выводы:
а) полинитропарафины легко подвергаются пиролизу, вследствие
чего они не могут существовать при высоких температурах
парофазного нитрования; б) из мононитропарафинов наиболее
устойчивыми являются первичные нитропроизводные.
5. Конверсия (количество образовавшихся нитропарафинов
по отношению к азотной кислоте, пропущенной через реактор)
является постоянной в довольно широких температурных пре-
пределах при соответствующем подборе времени контакта. При
одинаковом времени контакта кривая зависимости конверсии
от температуры проходит через максимум; при температурах
ниже оптимальной нитрование является неполным, а при более
высоких температурах происходит пиролиз нитропарафинов.
6. Реакция нитрования сопровождается процессами окисле-
окисления парафинов и их нитропроизводных, в результате которых
получаются спирты, альдегиды, кетоны, карбоновые кислоты,
а также СО и СО2. Оптимальное использование азотной кислоты
при синтезе нитропарафинов достигает 40%. Посредством
регенерации окислов азота, образующихся при реакциях
окисления, выход нитропарафинов по азотной кислоте может
быть повышен (на больших установках промышленного синтеза
нитропарафинов, где производится регенерация окислов азота
до азотной кислоты, выход нитропарафинов составляет
90 молей на 100 молей азотной Кислоты).
7. Из парафинов наиболее трудно нитруется метан, который
при более высоких температурах и болыпем времени контакта
дает меньшую конверсию в нитропроизводные сравнительно
с другими гомологами (при 450° и времени контакта 0,42 сек.
выход нитрометана составляет 15%). Далее, До пропана вклю-
включительно, наблюдается последовательное повышение легкости
нитрования. Однако углеводороды, следующие за пропаном;
не обнаруживают при нитровании заметных различий в реак-
реакционной способности.
8. Механизм реакции нитрования в газовой фазе недостаточно
изучен. По представлениям Мак-Клирли и Дегеринга [139],
сначала происходит расщепление азотной кислоты на двуокись
280
Нитрование углеводородов азотной кислотой
азота и радикал ОН [уравнение A)]; при действии последнего
на углеводороды образуются свободные радикалы [уравнение
B)], которые реагируют с NO2 или с азотной кислотой [уравнения
C) и D)]:
HONOa - NO2 + HO'
R R
v \
+ H2O
R' — СН + НО'
R"
. R' _
R"
A)
B)
R R
\ \
R' — С + NO2 — R' — СШ2
/ /
R"
R"
R R
R' — С + HONO2 - R' — CNO2 + HO'
R* R"
D)
Таким путем возникают нитросоединения с числом атомов
углерода, соответствующим нитруемому парафину. Для объ-т
яснения образования нитросоединений с меньшим числом
атомов углерода Мак-Клирли и Дегеринг допускают дальней-
дальнейшее расщепление радикалов под влиянием высоких температур
и последующее нитрование продуктов пиролиза двуокисью
азота или азотной кислотой.
Другая теория,автором которой являетсяЭвелл[145],основана
на предположении, что углеводороды, соединяясь с азотной
кислотой, образуют промежуточные комплексы двух видов.
Последующее расщепление комплексов первого вида дает
в качестве продуктов реакции спирты инитропарафины с мень-
меньшим числом атомов углерода, чем в нитруемом соединении;
расщепление комплексов второго вида приводит к образованию
воды и нитропарафинов, соответствующих исходному углеводо-
углеводороду. Например, нитрование этана проходит, согласно взгляду
Эвелла, через образование следующих промежуточных комплек-
комплексов;
Получение нцтросоединений :^ирноароматического ряда
281
HO
r
H\ j
h—d
— N
j
i
C-
I
0 L',
U
m
HO
j
j
1
I
H
H
0
—nCo
1
1 H
...
\
: —н
н
II
При дальнейшем течении реакции первый комплекс распа-
распадается на нитрометан и метанол, а второй — на нитроэтан и воду.
Подтверждение теории комплексов мы находим в работе
Бертона [146], который показал, что при нитровании оптиче-
оптически активного 3-метилгексана образуется также оптически
активный 2-нитробутан.
Нитрование в газовой фазе, как мы указывали, обычно
осуществляется при атмосферном давлении. В некоторых
случаях, однако, для повышения эффективности реакции при-
применяется нитрование под давлением. Хэсс, Гибсман и Пирсон
[147] при нитровании этана под давлением 7 атм. получили
нитропарафины с выходом 33% при одном проходе через
реакционную камеру (при атмосферном давлении конверсия
составляет 9%).
В патентной литературе последнего времени имеются со-
сообщения о проведении нитрования азотной кислотой в газовой
фазе в присутствии катализаторов. Норман Леви [148] пропу-
пропускал смесь парафинов с азотной кислотой при 300—450°чере&
реакционную камеру с катализатором, состоявшим из соединений
мышьяка или сурьмы, смешанных с силикатами. Оптимальная
конверсия получена при отношении парафинов к азотной
кислоте 0,5 : 1 и времени контакта 1—5 сек.
Имеются также предложения [149] проводить реакцию-
парофазного нитрования алифатических, а также и аромати-
ароматических углеводородов в реакторе с пылевидным контактом
(размер частиц 5—600 р), находящимся во взвешенном состоянии
в струе реагентов.
282
Нитрование углеводородов азотной кислотой
Опубликованы данные [150] по исследованию непрерыв-
непрерывного процесса нитрования циклогексана азотной кислотой.
Применяется стеклянная аппаратура, через которую жидкость
проходит с определенной, регулируемой в широких пределах
объемной скоростью. Рабочее давление равно 7 атм. Как ис-
исходные вещества, так и продукты реакции нигде не соприка-
соприкасаются с металлическими частями и подаются под давлением ,
азота. Оптимальными условиями процесса нитрования оказа-
оказались: температура 120° и отношение HNO3/C6H12 = 0,91.
Выход нитроциклогексана 13,9%.
Необходимо отметить, что синтез ряда низших нитропара*
финов парофазным методом в настоящее время осуществлён
в промышленном масштабе.
§ 3. Получение полинитропарафинов
Б отличие от синтеза мононитропарафинов получение поли-
полинитропарафинов прямым нитрованием азотной кислотой
не так распространено. В настоящем разделе мы даем
краткий обзор различных методов получения полинитро-
полинитропарафинов.
Олефины при действии N2O4 присоединяют группы NOa
с образованием полинитропарафинов. Например, 2,3-диметил-
2-бутен, реагируя с NaO4, дает 2,3-диметил-2,3-динитробутан
NO2 NO2
! I
СН3— С = С — СН3 + NSO4 ->¦ СН3—С — С — СН3
II II
CHj СНз СНз СНз
По разработанному Сейглем и Хэссом [151] методу, динит-
ропарафины могут быть получены из вторичных нитропарафн-
нов при последовательной обработке их основанием и галоидом.
Сущность метода состоит в конденсации натриевых солей
¦аци-формы нитропарафинов с продуктом взаимодействия этих
солей с галоидом, причем выделяется натриевая соль по-
последнего:
R2CHNO2 + NaOH — R2C — NO2Na + H2O;
A)
ЩЪлучений подинитропарафиное
283
hNaCI; B)
R^CCINO, + R2C = NO2Na -* R^ — С - С — R2+NaCl
NG2 NO2
C)
Например, натриевая соль аци-формы нитропронана
(СН3)зС = NO2Na ^ при нагревании в течение 7 час. с
дает 2,3-диметил-2,3-динитробутан (выход 9%):
(СН3JС = NOaNa + (СН3JССШО2 -
—• С "-* С
NO2NO2
Реакция протекает более эффективно, если вместо хлор-
производного действовать на натриевую соль аци-формы бром-
производным (выход динитропарафина 29%); еще лучшие
результаты получаются при взаимодействии (СН3)аС = NOaNa
с иодопроизводным (CHg^CJNOa (выход 43%). Подобным
же образом из натриевой соли аци-формы цитробутана
(С2Н5)(СН3)С = NO2Na и (CaH5)(CH3)CBrNO2 получен
3,4-диметил-3,4-динитрогексан с выходом 16%:
CHSCH2 — С = NGsNa + СН3СН2 — CBrNO2 —
СН3 . СН3
СН3 СН3
I I
— СН8СН2— С — С — СНаСН3 + NaBr
NO2 NO2
Натриевая соль нитроциклогексана при нагревании (с об-
обратным холодильником) в течение 3 час. в растворе 80% -ного
спирта с (CHs)aCBrNO2 дает 1-нитро-1-B-нитроизопронил)-
циклогексан с выходом 19%. .
Первичные нитросоединения не дают этой реакции.
Анджели и Алессандри [152] нашли, что серебряная соль
нитрозтана способна самопроизвольно разлагаться е по-
последующей конденсацией продуктов распада в 2,3-динитро-
бутан:
284
Нитрование углеводородов азотной кислотой
СН3СН = NO2Ag СН3 - СН - СН - СН3
NO2Ag~* N02 N02
¦2Ag
Этот синтез, повидимому, имеет общий характер и может слу-
служить для перехода от моно- к полинитропарафинам. Например,,
из серебряных солей нитропентана и фенилнитрометана по-
получаются, соответственно, 5,6-динитродекан и 1,2-динитро-
1,2-дифенилэтан.
Динитропарафины могут быть синтезированы и электро-
электрохимическим путем, а именно: электролизом солей аци-нитро-
парафинов [153, 154]
электролиз
2R2C = NO2Me > R2C — CR2
NO, NO.
'-f 2Me
Электролиз проводится в ячейке с катодом из меди и анодом
из полированной платины при напряжении 6—10 в и темпера-
температуре 23—27°. В этих условиях из 2-нитробутана образуется
в основном 3,4-динитро-3,4-диметилгексан и в небольшом
количестве 2,2-дянитробутан [155].
Динитросоединения могут быть также получены действием
различных окислителей на соли аци-форм вторичных нитро-
парафинов. Наилучшие результаты дает применение персуль-
персульфатов. Были получены: из 2-нитропропана 2,3-диметил-2,3-
динитробутан (выход 51%), из 2-нитробутана 3,4-диметил-3,4-
динитрогексан C7%), из нитроциклогексана 1,1-динитро-
бициклогексил C0%). В то же время неудачными оказались
попытки превратить методом окислительной димеризации 1,1-
динитроэтан в тетранитробутан и тринитрометан в гексанитро-
этан. В отличие от вторичных первичные нитроалканы реаги-
реагируют с персульфатом лишь с образованием производных изо-
ксазола [156].
Синтез динитропарафинов, у которых обе нитрогруппы
находятся при одном и том же атоме углерода, может быть
осуществлен по методу, который заключается в окислении псев-
донитролов R2C(NO)(NO2) хромовой кислотой; псевдонитролы
[157] получают действием N2O4 на оксимы:
Получение полинитропарафинов
285
R2C = NOH + N2O4 -* HNO2
NO
12*-"ч
NO.
NO
R2C-
H.CrO.
NO,
/
NO2
c/
A)
B)
NO,
По патентным данным [158], при обработке псевдонитро-
лов в растворе СС14 окислами азота или 70% -ной азотной ки-
кислотой получается 2,2-динитропропан с выходом 27—36%.
При нитровании парафинов при температуре 180° удается
получить смесь соответствующих моно- и динитропроизвод-
ных наряду с продуктами окисления и вепрореагировавпшм
углеводородом. Соотношения продуктов реакции зависят от
соотношения количеств углеводорода и азотной кислоты.
Так, например, нитрование додекана [159] при 180—190° азот-
азотной кислотой уд. в. 1,4 дает следующие продукты (табл. 17),
Нитрование додекана
Таблица 17
Отноше-
Отношение доде-
каи/Н1ЧОз
1 :4
1 :2
1 :1
2 :1
Продукт реакции, %
додекан
24
33
43
58
нитродеканы
4
25
10
36
полинитро-
деканы
47
38
15
5
жирные
кислоты
25
4
2
1
Как видно из таблицы, при большом избытке азотной ки-
кислоты (углеводород: HNOs = 1:4) получаются главным об-
образом динитропроизводные и жирные кислоты, при недостатке
азотной кислоты (углеводород: HNO3 = 2:1) только 42%
додекана вступает в реакцию, при этом основным продуктом
реакции являются мононитропроизводные.
Парафины, имеющие более 8 атомов углерода, хорошо
нитруются в токе NO2, воздуха и СО2 при температуре 160—
286
Нитрование углеводородов азотной кислотой
190°. В 300 г Додекана пропускают NO2, CO2 и воздух при •
175—180° в течение 110 мин. Продукт реакции фракционируют
и получают 130 г мононитродекана, 40 г высших нитропара-
финов, 20 г жирных кислот и 130 г непрореагировавшего
додекана.
Так же нитруют углеводороды, содержащие 12—20 ато-
атомов углерода, и получают соответствующие нитропара-
фины [160].
При использовании в качестве нитрующего агента двуокиси
азота, большом времени реакции и температуре 200—250°
наблюдается образование полинитросоединений с меньшим
числом атомов углерода. Так, при реакции изобутана с N02
при 200—250°, наряду с 2-метил-2-нитропропаном и 2-метил-
1,2-динитропропаном, получается 2,2-динитропропан [161].
Нитропа'рафины конденсируются с кетонами с образованием
динйтропарафинов. Так, например, реакция между нитроме-
таном и ацетоном протекает по схеме
CHs СНЭ С Н3
| J CH.NO, I
С = О + H3CNO2 -* С = CHNO2 >¦ O2NCH2 — С — CH2NO2
СН3 CHS СНз
Реакция проводится в присутствии основных катализаторов,
предпочтительно вторичных аминов. В продуктах реакции,
наряду с динитроалканами, содержатся нитроолефины. Пони-
Понижение температуры реакции и увеличение концентрации ке-
тона благоприятствуют образованию динитроалканов [162].
Конденсация калиевой соли динитрометана с диальдеги-
дами приводит, по патентным данным [163], к получению
тетранитродиолов общей формулы:
(NO2JCHCH(OH) (СН2)„ (OH)CHCH(NO2J, где п = 1-2. ;
Тетранитродиолы могут быть исходными веществами для
синтеза различных полинитросоединений.
Полинитропарафины общей формулы
NOjj H NO2
С —С—R4,
I I I
Н R, R3
Получение полинцтропарафинов
287
где Rlt Ra, R8 = Н или алкил, a R4= алкил, нитроалкил,
алкоксил, подучаются [164] взаимодействием щелочных солей
нитропарафинов общей формулы
R3 О
R4
OMe
гдеМе=№, К, с нитроолефинами общей формулы О2NCH=CHR
с последующим разложением полученного продукта конденсации
слабой кислотой, например, уксусной. Так, из К-соли 2-нитро-
пропана и 1-нитро-1-бутена получается 1,3-динитро-2-зтил-
3-метилбутан. Взаимодействием К-соли 2-нитропропана с 2-
нитробутеном-i получен [165] 3,5-динитро-З-метилгексан с
выходом около 90% .
Щелочные соли полинитропарафинов также способны ре-
реагировать с нитроолефинами с образованием полинитросо-
полинитросоединений. По литературным данньш[166], 1,1,1,3-тетранитро-
пропан получается конденсацией нитроформа с нитрозтиленом.
Взаимодействием К-соли 1,1-динитрозтана с 2-нитро-
пропиленом был получен [163 и 167] 2,2,4-тринитропентан с
выходом 93% ,
Другой метод получения полинитросоединений заключается
в обменной реакции Ag-соли тринитрометана с галоидалкилами
и галоиднитроалкилами. Реакцию в основном удается провести
с галоидкетильнымипроизводными ароматического ряда [168]:
О
абс. эфнр
(NO4JC = N •
\
*OSN
— СНаС (NO2K + AgX
OAg
т. пл. 135°
Аналогично получается 2,4,6-тринитро-2,2,2-тринитрозтил-
бензол C8H4Oi2N6 (т. пл. 153°). Из алифатических полинитро-
полинитросоединений в литературе описано получение 1,1,1,2- и
1,1,1,3-тетранитропропана [169].
Взаимодействием 1-бром-1-нитрозтана или 1-бром-2-нитро-
этана с AgC(NO2)s в среде эфира получается 1,1,1,2-тетра-
288
Нитровсние углеводородов азотной кислотой
нитропропан^-жидкость с уд. весом около 1,6 и т. кип. ~-/235°.'
Наконец, полинитропарафины в отдельных случаях могут
быть получены нитрованием солей нитропарафинов. Так,
дикалиевая соль тетранитрозтана при действии смеси концен-
концентрированных серной и азотной кислот превращается в гекса-
яитрозтан с т. пл. 142°.
Согласно американскому патенту [170], мононитропара-
фины с 3—5 атомами углерода с нитрогруппой, стоящей у
вторичного углерода, при обработке азотной кислотой при
температуре 150—250° и давлении приблизительно 10 атм. дают
динитропарафины с группой NO2 у вторичного атома угле-
углерода. Так, например, (CH3JCH(NO2) в этих условиях образует
(CH3JC(NO2J, в то время как первичный нитропропан
O2NCH2CH2CH3 не образует динитросоединения.
По данным других патентов [171] нитрованию подвергается
¦смесь мононитропарафина и исходного углеводорода. Концен-
Концентрация применяемой HNO3 составляет 40—70%. Реакция
проводится под давлением 56—85 атм. отношение HNOs :
{RNO2 + RH) = 0,5-^1,0. Для лучшего контроля процесса
рекомендуется применение разбавителей N2, Н2О, СО2.
§ 4. Свойства йитроолефинов *
Известны два типа нитроолефинов: а-нитроолефины, со-
содержащие нитрогруппу у непредельного атома углерода, и
нитроолефины с цитрогруппой в аллильном положении.
Нитроолефины представляют собой слегка желтоватые
прозрачные жидкости с резким раздражающим запахом. При
хранении нитроолефины полимеризуются, превращаясь в тем-
темные вязкие смолы. Склонность к полимеризации уменьшается
с увеличением молекулярного веса. В присутствии щелочей
скорость полимеризации резко увеличивается.
«-Нитроолефины присоединяют спирты, амины, нитро-
парафины и другие вещества. Эта способность обусловлена на-
наличием в молекуле нитроолефина сопряженной системы двой-
• Некоторые свойства нитроолефинов см. также § 1 данной главы
Свойства нитроолефинов
12 3 4
ных связей ]>С = С — N = О. Вещества, содержащие подвиж-
I
ный атом водорода, присоединяются к нитроолефинам в поло-
положение 1,4. Возникающая при этом псевдокислота изомери-
зуется в соответствующее нитропроизводное:
О
С = CHNO2
А С — С = N
7
I I
R Н
\
Л
С ~ CH2NO2
ОН
Способность нитроолефинов к реакциям присоединения
позволяет использовать их в качестве исходных веществ для
синтеза нитро- и аминокетонов, динитропарафинов, эфиров
нитроспиртов и других соединений.
Восстановлением нитроолефинов можно получить амины,
оксимы, кетоны и нитропарафины. Характер продуктов вос-
восстановления определяется условиями реакции (см. § 1 данной
главы).
Действие минеральных кислот
на нитроолефины
При действии концентрированной соляной кислоты на
нитроолефины образуются солянокислый гидроксиламин и
х-окси-или а-хлоркарбоновая кислота [172]. Эти же продукты
можно получить при обработке нитроолефинов эфирным ра-
раствором хлористого водорода. Взаимодействие низших нитро-
нитроолефинов с эфирным и водным растворами НС1 Гыло изучено
Хисом и Розе [173]. Авторы предполагают, что в первую
стадию реакции хлористый водород присоединяется к нитро^
олефинам в положение 1—4. Образовавшаяся при этом аци+
форма хлорнитропарафина превращается под действием соля-
соляной кислоты в солянокислую соль гидроксиламина и а-хлор-
или а-оксикарбоновую кислоту. Реакция протекает по схеме,
аналогичной схеме превращения первичного нитропарафина
в карбоновую кислоту:
19 А. В. Топчиев
290
Нитрование углеводородов азотной кислотой
О О
+НС1 ' / +НС1 /
RaC = CHNO2 > R2CC1CH = N к R2CC1CHC1N НОН ¦
\
ОН
—'° R2CC1CHC1NO - R2CC1CC1 = NOH —'Z R2CC1COOH + NH2OH-HC1
Такой механизм реакции авторы подтверждают следующими
фактами.
При действии эфирного раствора НС1 на 1-нитропропён-1
и 1-нитро-2-метилпропен-1 в качестве промежуточных продук-
продуктов были выделены соответствующие 1,2-дихлороксимы.
2-Хлор-1-нитропропан (продукт присоединения НС1 к
1-нитропропену в положение 1,2) не взаимодействует с эфирным
раствором НС1, тогда как 1-нитропропен в тех же условиях
превращается в а-хлорпропионовую кислоту и гидрохлорид гид-
роксиламина. Это обстоятельство исключает возможность
присоединения НС1 к нитроолефину в положение 1,2 в первую
стадию реакции.
При действии соляной кислоты или эфирного раствора
НС1 на нитроолефины, не содержащие атома водорода у угле-
углерода, несущего нитрогруппу, авторы получили темносиние
жидкости, обладающие свойствами лакриматоров; предполагает-
предполагается, что это дихлорнитрозосоединения, образующиеся по схеме
О
+НС1 / +НС1
RR'C = CR"NO2 > [RR'CCICR" = NOH] >
О
/ -Н2О
- [RR'CC1CC1R"NHOH] > RR'CC1CC1R"NO
Нитроолефины легко растворяются в серной кислоте
C объема H2SO4 на 1 объем Н2О). Растворение сопровождается
разложением, в результате которого образуются нитропара-
фин и альдегид. Нитропарафин под действием серной кислоты
превращается в карбоновую кислоту и сернокислую соль
гидроксиламина [174]:
RCH = С (NO2) R' + Н2О
R'CH2NO2 + Н2О
HjSO
RCH (ОН) CHNO2R'
H2SO4- R'COOH + N
RCHO + R'CH2NO2;
Свойства нитроолефинов
291
Взаимодействие нитроолефинов
со спиртами
Присоединение к нитроолефину молекуды спирта приводит
к образованию простого эфира нитроспирта:
N С = CHNO2 + ROH - \ С
CH2NO2
Реакция протекает при комнатной температуре в присутствии?
щелочного катализатора.
Впервые конденсация спиртов с нитроолефинами была
осуществлена Мейзенгеймером и Геймом [175]. Авторы полу-
получили метиловый и этиловый эфиры <х-фенил-|3-нитроэтиловогО'
спирта, действуя спиртовым раствором алкоголята на
о>-нитростирол и насыщая затем реакционную смесь углекис-
углекислотой. В данном случае реакция идет в две стадий:
сначала образуется натриевое производное аци-формы эфира
ос-фенил-|3-нитроэтилового спирта, из которого углекислота
выделяет свободный эфир:
О
\
CeH6CH =s CHNO2 + CH3ONa - С6Н5 — СН — СН == N
ОСН3
ОСН3
• С — CH2NO2
Н
Присоединение алкоголята к арилзамещенным гомологам
нитроэтилена описано в некоторых работах [176].
Конденсация алкоголятов с низшими нитроолефинами была
проведена Ламбертом и другими [177]. При действии на нитро^
этилен, нитропропилен и нитроизобутилен спиртового раствора
метилата и бутилата натрия и подкислении реакционной смеси
уксусной кислотой были получены соответствующие эфиры
нйтросниртов. Взаимодействие 2-нитропропена-1 с метилатом
натрия, наряду с метиловым эфиром 2-нитропропилового спирта,
292
Нитрование углеводородов азотной кислотой
приводит к образованию метилового эфира 2,4-динитро-2-ме-
тиламилового спирта. Последний образуется в результате
присоединения нитропропена к первоначальному продукту
дгонденсация — эфиру мононитроспирта:
?Н3С (Ша) = СН2 + СН3ОН - СН3СН (NOa) СН2ОСНз -
^¦CHSCH (NO,) CHSC (CH3) (NOa) CH2OCHS
Взаимодействие алкОГОлятов с нитрооктеном описано в
работе Банера [178].
Взаимодействие нитроолефинов
с нитро п а р а ф и н а м и
Нитроолефины присоединяют первичные и вторичные нитро-
парафины с образованием 1,3-Динитропарафинов. Реакция
протекает по уравнению
RR'CHNO2 + CHR" = CR'"NOa -> RR'C (NO,) CHR"CHR1I'NO,.
Несмотря на то, что эта реакция представляет собой удоб-
удобный метод синтеза динитропарафинов, ей посвящено лишь
незначительное число работ.
Ламберт и Пиггот [179] исследовали реакцию присоедине-
присоединения нитроэтана и 2-нитропропана к 2-нитропропену-1, 2-нитро-
бутену-2 и нитроциклогексену. Авторы пришли к выводу, что
реакция имеет общий характер, но выходы сильно колеблются
при работе с различными нитропроизводными. Так, при вза-
взаимодействии 2-нитробутена-2 с 2-нитропропаном в присутствии
этилата натрия образуется 2,4-динитро-2,3-диметилпентан с вы-
выходом 47% , а при взаимодействии 2-нитропропана с 2-нитропро-
пеном-1 выход продукта присоединения составляет 26%.
г 1 Наряду с динитропарафинами часто получаются высоко-
высокополимерные побочные продукты, так как нитроолефины легко
пчшшвризуются под действием щелочных агентов.
: Продукт присоединения нитрометана к 1-нитро-2-метил-
продфшуЧ описан в работе Хэсса [180].
.» эштературе имеются также сведения о присоединении
фенииамтромвтана к нитростильбену [181].
Свойства нитроолефинов
293
Банер и Кайт [182] нашли, Что При конденсации щелочных
солей нитропарафинов с нитроолефинами динитросоединения
получаются со значительно более высоким выходом, чем при
конденсации нитропарафинов с нитроолефинами в присутствии
щелочного катализатора.
Взаимодействие нитроолефинов с ами-
аминами и другими органическими основа1
н и я м и
Присоединение первичных и вторичных аминов к нитро-
олефинам приводит к образованию нитроаминов. Впервые
эта реакция была проведена Виландом и Саккеларнусом [183],
которые действием анилина на эфирный раствор нитроэтилена
получили кристаллический продукт присоединения —
N-(a-HHTpo этил)-анилин:
СНа = CHNO2 + CeH6NH2 -* CeH6NHCH2CH2NO2.
Подробное исследование реакций взаимодействия <*-нитро-
стирола с органическими основаниями было проведено Уорре-
лом [184]. В работе этого автора было испытано действие на
«о-нитросифол 40 различных органических оснований. В ре-
результате исследования было установлено, что нитростирол
взаимодействует со следующими основаниями: анилином,
п-толуидином, фенилгидразином, дифенилгидразином, р*нафтил-
гидразином, п-толилгидразином, семикарбазидом и пипери-
пиперидином. Согласно данным Уоррела, наиболее активно взаимо-
взаимодействуют с нитростиролом производные гидразина. Введение
в молекулу ароматического амина или арилзамещенного
гидразина отрицательного заместителя понижает реакционную
способность основания. Так, например, анилин и фенилгид-
разин энергично взаимодействуют с нитростиролом, а п-хлор*
анилин, п-нитроанилин и п-бромфенилгидразин не образуют
продуктов присоединения.
Продукты конденсации аминов о а^нитростильбеном были
получены Дорноу и Робергом [185J. :
294
Нитрование углеводородов азотной кислотой
Присоединение низших нитроолефинов к алифатическим
и ароматическим аминам описано в работе Ламберта и других
[177J.
Получены также продукты присоединения нитроцикло-
гексена к фенилгидразину, семикарбазиду [186], тиосемикар-
базиду и п-толуидину.
Взаимодействие нитроолефинов с сое-
соединениями, содержащими метиленовые
группы, активированные карбонильными
и карбоксильными группами
Нитроолефины конденсируются с веществами, содержащими
подвижные атомы водорода в метиленовых и метильных группах.
Так, например, при конденсации «-нитростирола с натрие-
натриевым производным малонового эфира был получен этило-
этиловый эфир 1-нитро-2-фенил-3-карбэтилмасляной кислоты [187]:
CeH6CH = CHNOS + NaCH (COOC2H6J -* С6Н5
СН (COOCSH6)S
/ кислота
— СН >
СН = NO2Na
СН (COOCjHsJ
-* с6н5сн
CHSNOS
Продукты конденсации ы-нитростирола с ацетоуксусным
эфиром, бензоилацетоном и ацетилацетоном были получены
В. В. Перкалиным и А. С. Соповой [188]. Реакция проводи-
проводилась при комнатной температуре в бензольном растворе. В ка-
качестве катализатора применялся триэтиламин. Выход продуктов
конденсации 77—98 %.
Авторы отмечают, что <*-нитростирол не взаимодействует
с матилэтилкетоном, в котором метиленовая группа акти-
активирована только одной карбонильной группой.
В обзорной статье Хэсса [189] имеется указание, что при
конденсации ацетона с 1»нитро-2-метилпропеном-1 был полу-
получен 5-нитро-4,4-диметилпентанон-2:
Свойства нитроолефинов
295
СН3
СН3СОСН3 + (СН3JС = CHNO2 -* O2NCHSC — CHSCOCH3
СН3
Условия реакции в работе не приводятся.
Дорноу и Роберг [190] осуществили присоединение а-нитро-
стильбена к малоновому эфиру, ацетоуксусному эфиру, ацетил-
ацетону, бензоилацетону и фенилацетону. Малоновый эфир
вводился в реакцию в виде натриевого производного. Другие
кетоны присоединялись к а-нитростильбену только в присутствии
этилата натрия. Выход продуктов конденсации был невысоким
(не более 29%).
Присоединение нитроолефинов к диенам
Так как нитроолефины содержат активную двойную связь,
они могут конденсироваться по реакции Дильса — Альдера.
При обработке нитроэтилена, 1-нитропропена-1 и 1-нитропен-
тена-1 циклопентадиеном получаются продукты конденсации
по следующей схеме [191]:
СН
/\ * CHR
НС
НС
N
)СН8 +
СН
1"HNO2
СН
/I \
НС CHR
II СН2 |
НС I CHNO2
i-
1-Нитропентен-1 конденсируется также с бутадиеном, метил-
бутадиеном и 2,3-диметилбутадиеном.
Моно- и бициклические нитросоединения были получены
при конденсации 2-нитробутена-2 и 2-нитропропена-2 с бута-
бутадиеном и циклопентадиеном [192].
Фенилзамещенные нитропроизводные циклогексена были
получены Вилдманом при конденсации со-нитростирола с
бутадиеном и метилбутадиеном [193].
Полимеризация нитроолефинов
Нитроолефины обладают большой склонностью к реакции
полимеризации [183, 194]. Так, нитроэтилен СН2 = CHNO2,
296
Нитрование углеводородов азотной кислотой
полученный дегидратацией нитроэтилового спирта над Н3РО4,
полимеривуётея при комнатной температуре в течение 2—3
дней в прозрачную вязкую жидкость. В то же время продукт,
полученный дегидратацией нитроэтилового спирта надКНЭО4,
не полимеризуется [195].
В присутствии водного раствора бикарбоната калия 2-нитро-
пропеЯ полимеризуется 1196] с образованием растворимого
в органических растворителях высокомолекулярного продукта
CHS
п CHjC (NO2) = СН2 — (— С — СН2— )п
NO2
Этот полимер при гидрировании в присутствии катализатора
Ренея дает соответствующий поливйниламин
который хорошо растворим в воде, но в отличие от полимера
2-нитропропена нерастворим в большинстве органических
растворителей.
§ 5. Нитрование ненасыщенных углеводородов *
Ненасыщенные соединения нитруются довольно легко,
причем в нятропродуктах преобладают мононитросоединения.
Нитрование непредельных углеводородов слабой азотной
кислотой было впервые исследовано М. И. Коноваловым.
Реакция проводилась в условиях, выработанных для нит-
нитрования парафинов. Объектами исследования служили: мен-
тен, октен-1, триметилэтилен [197], борнилен, пинен [198J
и камфен [199].
• Некоторые способы получения нитцоолефиров см. также в § 1 дан-
иой главы.
Нитрование ненасыщенных углеводородов
297
При нитровании ментена азотной кислотой (уд. в. 1,075)
в запаянных трубках было получено два изомерных мононитро-
мононитросоединения. Нитроментены растворялись в щелочи. Щелоч-
Щелочной раствор при добавлении хлорного железа давал красные,
растворимые в эфире осадки (реакция, характерная для пер-
первичных й вторичных нитрогрупп).
При нитровании октена-1 в условиях, аналогичных условиям
нитрования ментена, было получено нитросоединение состава
G8Hi5NO2- Нитросоединение растворялось в щелочи и давало
с хлорным железом резкую реакцию на первичное или вторич-
вторичное нитросоединение.
Триметилэтилен нитруется слабой азотной кислотой значи-
значительно труднее ментена и октена. Образовавшиеся нитропро-
дукты растворялись в щелочи.
Растворимые в щелочи нйтросоединения были получены
также при нитровании непредельных бициклических углево-
углеводородов — борнилена, камфена й гщнена.
На основании полученных результатов М. И. Коновалов
пришел к выводу, что нитрующее действие азотной кислоты
направлено не на углеводородные группы, связанные двой-
двойной связью, а на соседние с ними.
Работы М. И. Коновалова остались незаконченными. Не
все нйтросоединения были выделены в чисток состоянии, не
было окончательно установлено положение нитрогруппы в мо-
молекуле углеводорода.
Позднее было показано, что при нитрований камфена [2001
азотной кислотой (уд. в. 1,075) образуются два структурно-
изомерных нйтросоединения: вторичный а-нитрокамфен и
«-нитрокамфен с расположением нитрогруппы у атома угле-
углерода, связанного двойной связью.
При нитровании диизобутилена [201] получается смесь
изомерных мононитросоединений. Нитрование проводилось
крепкой азотной кислотой при температуре немного выше 60°.
Нитрование диизобутилена 70-% ной азот/ной кислотой прово-
проводится при температуре 70—90°. Это же нитрование может быть
осуществлено и разведенной азотной кислотой B0%) В случае
применения избытка азотной кислоты, добавления в нее окислов
Нитрование углеводородов азотной кислотой
•азота и проведения реакции при температуре 70°. Последнее
указывает на то, что в приведенных условиях реакции оле-
финов с HNOg они нитруются окислами азота, генерируемыми
азотной кислотой, т. е., вероятно, реакция идет по тому же ме-
механизму, что и нитрование предельных углеводородов.
2-Этилгексен-1 нитруется так же легко, как диизобутилен.
При нитровании 2-этилгексена-1 80%-ной азотной кислотой
лри температуре 70—75° получается 1-нитро-2-этилгексен-2
-с выходом около 85,9%:
СН2= ССН2СН2СН2СН3 NO2CH2 — С = СНСН2СН2СН3
СН2СНз
сн2сн3
Для нитрования октена-1 в 1-нитрооктен-2 требуются бо-
более жесткие условия (температура 90—100°).
Нитрование олефинов в этих условиях, как мы видим,
аналогично хлорированию олефинов, т. е. введение в молекулу
нитрогруппы сопровождается передвижением кратной связи
в р-положение.
Мак-Ки [202] исследовал реакцию взаимодействия эти-
этилена с концентрированной азотной кислотой. Работа была
предпринята с целью найти источник получения тетранитро-
метана. В результате исследования было установлено, что основ-
основным азотсодержащим продуктом реакции этилена с концентри-
концентрированной азотной кислотой является тринитрометан. Наряду
с тринитрометаном были получены также р-нитро этиловый
спирт, щавелевая кислота и двуокись углерода. Тринитрометан
не выделялся в чистом состоянии, а подвергался дальнейшему
нитрованию в тетранитрометан (при нагревании в присутствии
•серной кислоты).
В работе Мак-Ки ток сухого этилена пропускался через
•склянку Дрекселя с концентрированной азотной кислотой.
В различных опытах концентрация азотной кислоты изменя-
изменялась в интервале 95—100%. При пропускании этилена через
азотную кислоту наблюдались незначительное разогревание
и обильное выделение двуокиси углерода. Реакционная масса
выливалась в воду, нейтрализовалась и извлекалась эфиром.
Нитрование ненасыщенных углеводородов
299
При разгонке продуктов нитрования в вакууме был выделен
(З-нитроэтиловый спирт.
Р-Нитроэтиловый спирт и тринитрометан получались в
отношении 1 : 2,4. При добавлении к реакционной смеси нит-
нитрата ртути выход нитросоединения повышался почти в полтора
раза. По мнению авдоров, нитрат ртути подавляет конкури-
конкурирующую реакцию окисления этилена.
Образование тринитрометана из этилена и азотной кислоты
Мак-Ки объясняет при помощи следующей схемы:
HN0,
СН2 = СН2 >- СН2 (ОН) — CH2NO2 -* СН2 (NO2) С:
О
H
-C02 HN03
-* CH2 (NO2) COOH > CH3NO2 > CH (NO2) = NOH -*
HN03
- CH2 (Ш2)г > (NO2J С = NOH - CH (NO2K.
При действии концентрированной азотной кислоты на изо-
бутилен Гайтингер [203] получил небольшое количество непре-
непредельного нитросоединения состава C4H,NO2.
Нитросоединение растворялось в щелочи, а при нагревании
с водой в запаянной трубке распадалось на ацетон и нитрометан.
При восстановлении нитроизобутилена были получены
смесь нейтральных соединений, небольшое количество амина
и аммиак.
Гутри [204] пропускал амилен через нагретую до кипения
дымящую азотную кислоту. Основным продуктом реакции яв-
являлось кристаллическое вещество состава C5Hi0(NO2J, природа
которого установлена не была. Это же соединение образовы-
образовывалось при действии на амилен двуокиси азота [205].
Повидимому, это было динитросоединение.
В работе Д. П. Коновалова [206] исследовалось взаимодей-
взаимодействие с азотной кислотой диизобутилена и триизобутилена.
Диизобутилен реагировал с азотной кислотой (уд. в. 1,4) очень
бурно, и опыт неизменно заканчивался взрывом.
Нитрование в среде уксусной кислоты также не дало поло-
положительного результата, так как углеводород полимеризовался.
При нагревании диизобутилена с азотной кислотой уд. в.
300
Нитрование углеводородов азотной кислотой
1,28 на водяной бане образовалась зеленая жидкость, частично
растворимая в щелочи. При восстановлении ее железом и уксус-
уксусной ншло/ЗДЙ была получена смесь аминов, из которой удалось
выделгангв шиин состава СвНцвГШг. Наряду с аминами было
получено вещество кетонного характера. Моно» и диамины об-
разовывались также при восстановлении продукта нитрования
триизобутилена.
i Буис 1207 ] действовал концентрированной азотной ниеиотой
на наприден: Реакция протекала очень энергично, поэтому
реакционную смесь приходилось охлаждать или же сначала
приливать разбавленную азотную кислоту. В результате реак-
реакции образовался жидкий продукт, содержание азота в котором
было средним между отвечающим моно- и динитрокап-
рилену.
При нитровании циклогексена [186] азотной кислотой
уд. в. 1,2 при температуре 60—65° в течение 3 час. были полу-
ч©нм' ^йитропйклогейсен^, вторичный нйтрОЦиклойексен
И ишвдбвитрозйт цйклогексена. В кислотном слбе присутство-
присутствовала адипиновая Кислота. Средний выход смеси изомерных
ИЙт|*ощййЙог©ЙсёНов, Считая на вошедший в реакцию цикло-
равей 16°/о- При взаимодействии этилена [208]
-ной азотной кислотой (без окисйов азота) при темпера-
0-l-25p можно было предположить образование тринитро-
метана, р-нитроэтилового спирта или его эфира. Однако эти
Соединения не были обнаружены, а полученные продукты
реакции из-за неустойчивости не могли быть определены.
При йрбпускании ацетилена [209] в концентрированную
азотную кислоту можно получить тринитрометан, из кото-
которого дальнейшим нитрованием получается тетранитрометан.
При нитрований бутадиена [210] азотной кислотой При 30°
A ч. азотной Кййлоты уд. в. 1,49—1,50 медленно приливается
при перемешивании К 3,5 ч. бутадиена) получается нитробута-
д№»н (лакриматор)* содержащий в качестве примеси димер.
Нитрованием ретена CigHi8 можно Получить смесь Моно-
с выходом до 75°/0 от теории [211]. Процесе осу-
следующим образом: в концентрированную азот-
азотную ЙдаЙоту G5 мл) прибавляли 20 г ретена в 200 мл ледяной
Нитрование! ненасыщенных углеводородов
301
уксуеной кислоты при температуре не ниже 6-*~7°. Полученное
масло выливается в 1,5 л воды И экстрагируется педролейным
эфиром.
Продукты реакции при нитровании ретена можно разделить
хроматографированием на А12Оз« Главные продукты реакции:
9-нитроретен B8—31%), 3-нитроретен A7—18%), 4-нитро-
ретен A1—13%).
Получаются также с небольшим выходом 5(?)- или 8(?)-
нитроретен. Такие ненасыщенные соединения, как, например,
стирол, коричная кислота и их производные, нитруются
так же, как и чисто ароматические соединения.
При нитровании стирола концентрированной азотной киг
слотой Симов 1212] получил смолистое вещество, при перепонке
которого с водяным паром был выделен кристаллически^
ю-нитростирод.
Влит и Гофман [213] тэлучили нитростирол с болэе вып
соким выходом, вводя стирол в р^лажденную льдом дымящую
азотную кислоту.
Механизм нитрования ненасыщенных соединений изучался
А. И. Титовым [214], который считает, что в зависимости от
условий реакции нитрование олефинов, как и ароматических
соединений, протекает по типам ионной или радикальной
реакций. Взаимодействие в обоих случаях начинаемся с атаки
электрофильных \ нитрующих агентов на подвижные и
нространственно доступные гс-электроны. Подвижность и-злек-
тронов обусловлена их сравнительно малой энергией свяаи
е ядрами атомов углерода, а доступность—периферическим
расположением их орбит относительно связей между атомами
углерода.
При действии окислов азота на олефины образуются свог
бодные радикалы, что было доказано А. И. Титовым опытными
данными.
* * *
В заключение настоящей главы, посвященной нитрованию
азотной кислотой парафинов и жирной цепи жирноаромати-
чвских углеводородов, необходимо дать оценку достоверности
предложенных для атой реакции схем механизма.
,302
Нитрование углеводородов азотной кислотой
Все описанные в литературе современные схемы такого
нитрования (А. И. Титова, Мак-Клирли и Дегеринга, Бахмана
с сотрудниками) совпадают в том, что оно представляет собой,
по терминологии Титова, молекулярно-радикальный процесс.
В этот термин Титов вкладывает представление о реакции,
происходящей путем образования из исходных веществ сво-
свободных радикалов (R и NO2) и последующей рекомбинацией
последних. Процесс, являясь радикальным, не приводит
к возникновению цепной реакции, поскольку рекомбинация
алкильного радикала с двуокисью азота, как и всякая реком-
рекомбинация, не сопровождается появлением новых, свободных
радикалов и, следовательно, представляет собой обрыв цепи.
Таким образом согласно современным взглядам, существует
принципиальное различие механизмов нитрования азотной
кислотой ароматических и жирных (в том числе и жирной
цепи ядарноароматичееких) углеводородов: нитрование первых,
как ясно из обзора главы II, представляет собой ионную ре-
реакцию, нитрование же вторых — молекулярно-радикальную.
Столь резкое отличие механизмов, несомненно, должно отра-
отражаться в значительных экспериментальных различиях. И дей-
действительно, выше было показано, что, во-первых, двуокись
азота, являясь активным нитрующим агентом для жирных
углеводородов, не оказывает влияния на процесс нитрования
ароматических углеводородов азотной кислотой или нитрую-
нитрующей смесью; во-вторых, добавка сильных кислот значитель-
значительно увеличивает скорость нитрования ароматических соедине-
.ний и мало сказывается на нитровании жирных углеводородов
и, в-третьих, скорость парофазного нитрования аромати-
ароматических соединений значительно меньше скорости жидкофаз-
ного, в то время как в случае жирных углеводородов скоро-
скорости нитрования в парах и в жидкой фазе почти одинаковы.
К этому можно прибавить еще одно различие, наблюденное
различными авторами и заключающееся в положительном
каталитическом воздействии некоторых окислов металлов и
солей^ на нитрование ароматических соединений и практиче-
практически полное отсутствие влияния этих же веществ на паро-
фазное нитрование жирных углеводородов.
Нитрование ненасыщенных углеводородов
303-
Ионный механизм нитрования ароматических соединений
может считаться общепринятым и обладающим значительной
степенью достоверности. Что касается нитрования жирных
углеводородов, то приведенные выше экспериментальные
отличия свидетельствуют лишь о неприменимости ионного меха-
механизма течения процесса. Нужно^ однако, подчеркнуть, что,
опровергая ионный механизм, эти экспериментальные отличия
еще не определяют, является ли нитрование жирных углево^
дородов молекулярной или молекулярно-радикальной или
цепной реакцией.
Однозначно решить, протекает ли этот процесс по чисто-
молекулярному механизму или же по одному из двух свободно-
радикальных (молекулярно-радикальному или цепному), мо-
можно было бы, если бы имелись прямые, объективные методы
констатирования (и идентификации) свободных радикалов
в ходе такой сложной химической реакции. К сожалению,
слабое еще развитие химии свободных радикалов исключает
в настоящее время решение этого вопроса таким путем.
Другая, правда более косвенная возможность для суждения
о природе (молекулярной или своббдно-радикальной) реакции
могла бы возникнуть при рассмотрении кинетических за-
закономерностей нитрования жирных углеводородов. Сюда от-
относятся такие экспериментально определяемые характеристики
реакции, как ее порядок по каждому из исходных веществ г
энергия активации, изменение скорости в зависимости от
времени, температуры и давления, действие поверхностиг
добавок и т. д.
Приходится, однако, констатировать, что исследование нит-
нитрования жирных углеводородов до настоящего времени раз-
развивалось главным образом по линии синтетической, т. е. в на-
направлении изыскания методов получения ценных азотсодержа-
азотсодержащих и других промежуточных и конечных продуктов, возни-
возникающих в ходе этой реакции. Изучение же ее формально-
кинетических характеристик сильно отстало от этих синтети-
синтетических исследований и находится лишь на самой начальной
стадии, что исключает возможность установления таким путем
природы процесса с достаточной степенью достоверности.
2jG4
Нитрование углеводородов азотной кислотой
В результате, принятые в литературе представления о мо-
лекулярноградикальной, а не чисто молекулярной природе
реакции нитрования жирных углеводородов не могут считаться
однозначно доказанными. Наглядной иллюстрацией этого мо-
может, например, служить следующее. Бахман с сотрудниками
[215], подыскивая подтверждения свободно радикальной при-
природы парофазного нитрования жирных углеводородов мак азот-
азотной кислотой, так и двуокисью азота, вынуждены признать,
что до сих пор наиболее убедительным доказательством какого
механизма является самый факт протекания этого процесса
в газовой фазе. Понятно, что доказательная сила такого ар-
аргумента не может считаться значительной.
Несмотря на все это, автор настоящей книги также скло-
няется к принятию свободно радикальной природы нитрования
жирных углеводородов. При проводившемся им изучении этой
реакции среди прочих был получен один экспериментальный
факт, наиболее естественное объяснение которого предпола-
предполагает, как считает автор, участие свободных радикалов в ходе
превращения. Автор имеет в виду открытое в работе совместно
с 13, П. Алания 1?16] быстрое протекание термической реакции
одновременного нитрования и хлорирования метана в его сме-
смесях с двуокисью азота и хлором в условиях, когда в отсутствие
вдбо двуокиси азота, либо хлора реакция практически не идет.
Это может быть объяснено образованием при совместном при-
присутствии двуокиси азота и хлора нитро зил хлорида NOC1. Послед-
Последний, вследствие малой энергии связи N—С1 (~38 ккад/моль),
может относительно легко распадаться с образованием
окиси азота и атома хлора, дающего при взаимодействии с
исходным углеводородом алкильные радикалы (RH i+ Cl —s-
->R'+HC1) при более низкой температуре, чем двуокись азота.
Таким образом, процесс нитрования должен включать в себя
образование "и последующее превращение алкильных радикалов.
Важными и также утверждающими свободно радикальную
природу нитрования жирных углеводородов представляются
автору книги данные Хэсса и Рилея [217], показавших, что при
аарофазном нитровании тетразтилсвинца азотной кирлотой
получаются азотнокислый свинец, нитроэтан и зтилнитрат.
Ицтроеание ненасыщенных углеводородов
305
Термический распад тетразтилсвинца с возникновением зтиль-
ных радикалов сейчас хорошо изучен и, как известно, представ-
представляет собой один из широко распространенных методов получе-
получения свободных алкильных радикалов. Поэтому вряд ли можно
сомневаться в том, что в опытах Хэсса и Рилея нитрозтан и
зтилнитрат образовались в результате взаимодействия дву-
двуокиси азота с зтильными радикалами. Образование при зтом
нитрозтана не требует объяснения, образование же зтилнитрата
можно представить себе в результате первичного возникнове-
возникновения этилнитрита по схеме С2Н5+ ONO—*-C2H6ONO с последую-
последующим окислением в этилнитрат.
В общем, цитируемые работы свидетельствуют о несомнен-
несомненной реальности образования нитропродуктов при взаимоДей-
ствии алкильных радикалов с нитрующим агентом.
Таким образом несмотря на то, что до настоящего времени
не удалось прямым и объективным методом обнаружить сво-
свободные радикалы при нитровании жирных углеводородов,
их действительное участие в ходе этой реакции все же может
быть принято на основании некоторых косвенных доказательств.
Более детальное рассмотрение двух основных схем нитрова-
нитрования жирных углеводородов (Титова и Бахмана) позволяет
сформулировать следующие замечания.
1. Доказательства, приведенные авторами этих молекулярно-
радикальных схем в подтверждении их достоверности,
сводятся к наличию именно тех стабильных промежуточных
и конечных веществ, которые действительно найдены в каче-
качестве продуктов нитрования жирных углеводородов.
Методологически такое подтверждение схемы является,
конечно, обязательным, но не однозначным. Действительно,
при той степени проникновения в истинный механизм нитро-
нитрования жирных углеводородов, которая существует в настоящее
время, образование одних и тех же стабильных продуктов
реакции может быть объяснено не одной, а несколькими схе-
схемами с различными свободными радикалами.
2. Необходимо подчеркнуть, что образование основных,
включенных в схемы промежуточных веществ — нитрозосое-
20 А. В. Топчиев
306
Нитрование углеводородов азотной кислотой
динений и алкилнитритов, остается в известной мере гипоте-
гипотетическим. Нитрозосоединения в числе продуктов нитрования
обнаружены не были, и потому образование из них через
стадию оксимов динитросоединений является лишь предпо-
предположением; что же касается алкилнитритов, то они, вероятно,
образуются, но их промежуточная роль никем объективно
доказана не была.
Здесь стоит отметить, что, согласно рассматриваемым схе-
схемам Титова (главньш образом для жидкофазного) и Бахмана
(для парофазного нитрования), алкилнитрит представляет
собой тот промежуточный продукт, дальнейшее превращение
которого приводит к образованию продуктов окисления —
спиртов, карбонильных соединений. При этом, как мы видели,
Титов предполагает, что в рамках жидкофазной реакции, проте-
протекающей при низкой температуре, начальная стадия превращения
алкилнитрита представляет собой его гидролиз; для высоко-
высокотемпературной же парофазной реакции этой стадией, по Бах-
ману, является мономолекулярный распад с образованием
алкоксильного радикала, инициирующего цепь с небольшим
числом звеньев. Такое предположение было сделано Бахма-
ном на основе имеющихся в литературе работ по изучению
термического распада алкилнитритов, происходящего в от-
отсутствие воды,— условия, которое никак нельзя считать осу-
осуществляющимся при парофазном нитровании азотной кислотой.
Таким образом, если принять предположение Титова о
гидролизе алкилнитрита в ходе жидкофазного нитрования,
то становится сомнительным отсутствие такого гидролиза
в условиях парофазной реакции. Возникает, следовательно,
вопрос, можно ли, принимая промежуточную роль алкилнит-
алкилнитритов, считать естественным такое совершенно различное
(в зависимости от температурных условий) их дальнейшее пре-
превращение, постулируемое обеими схемами.
3. Схема Бахмана не расшифровывает путей образования
олефинов, получающихся при парофазном нитровании жирных
углеводородов; путь же, предлагаемый для этого схемой Ти-
Титова, не может, как будет сейчас показано, считаться удовлет-
удовлетворительным.
Нитрованы е ненасыщенных углеводородов
307
Для вскрытия истинного механизма реакции нитрования
вопрос об образовании олефинов значительно более серьезен,
чем это может показаться с первого взгляда. Проще всего
предположить образование непредельных углеводородов пу-
путем распада алкильных радикалов с разрывом либо связей
С—С, либо связей С—Н:
СН„СН2СН2 -+ CHY+ С2Н4;
GH3CHCH3 —* Н -f- Cglljj.
Известно, однако, что такой крекинг предельных углево-
углеводородов происходит с измеримыми скоростями лишь при тем-
температурах, значительно превышающих температуры парофаз-
парофазного нитрования, и, следовательно, не может служить источ-
источником олефинов в этом случае. Отсюда следует, что в ходе
нитрования создаются условия, благоприятствующие образо-
образованию олефинов.
Можно предположить, что таким благоприятным условием
могло бы явиться возникновение олефинов не из алкильного
радикала, а на одной из стадий его дальнейшего превращения.
При этом, разумеется, каждая из стадий такого превращения,
включая и окончательное возникновение олефина, должна
протекать с большей легкостью, чем распад алкильного
радикала.
Именно это, повидимому, предполагает Титов, приводя
следующую последовательность стадий:
N0, Н,0 HNO,
R > RONO ;r:t ROH —ГГ RONO2 t олефины + HN03.
HNo,
Здесь алкильный радикал после ряда превращений переходит
в алкилнитрат, последний же, отщепляя азотную кислоту,
дает соответствующий олефин.
Трудно оценить, является ли такой путь более вероятным,
чем образование олефинов непосредственно из алкильных
радикалов, тем более, что ни в одной яз опубликованных
работ по исследовании? термического распада алкилнитратов
[218] ни разу не констатировалось образование олефинов.
20*
308
Нитрование углеводородов азотной кислотой
Не предрешая вопроса о том, правильно ли предположение
об образовании олефинов не непосредственно из алкильного
радикала, а на одной из стадий его дальнейшего превращения,
и возможно ли найти более удачную, чем это сделал Титов,
химическую конкретизацию такого предположения, автор
настоящей книги хочет обратить внимание читателя на хорошо
известный факт значительного понижения температуры кре-
крекинга жирных углеводородов (с образованием олефинов) в при-
присутствии кислорода. Механизм такого действия кислорода до
сих пор неясен, однако самый факт не подлежит сомнению и
представляется автору возможной причиной образования
олефинов с измеримыми скоростями уже при температурах
парофазного нитрования.
Если бы такое объяснение оказалось верным, это означало
бы наличие свободного кислорода в зоне реакции парофазного
нитрования. Трудно переоценить значение такого обстоятель-
обстоятельства для протекания всего процесса, особенно ввиду многочис-
многочисленных экспериментальных подтверждений положительного
влияния добавок кислорода на нитрование жирных углево-
углеводородов. В частности, несколько по-иному, чем это сделано
в рассматриваемых схемах, можно представить образование
алкильного радикала, инициирующего нитрование (см.
ниже, п. 5).
4. Схемы парофазного нитрования Бахмана и Титова не
предусматривают также путей образования получающихся при
этом процессе СО и СО2.
В рамках этих схем образование продуктов глубокого окис-
окисления и деструкции парафиновой цепи, какими являются
окислы углерода, естественнее всего рассматривать как ре-
результат дальнейшего воздействия нитрующего агента на полу-
получающиеся в ходе нитрования альдегиды и олёфины. Можно
думать, что оба эти класса соединений легче подвергаются
воздействию со стороны, например, двуокиси азота, чем жир-
жирные углеводороды.
Жз современных работ по исследованию взаимодействия
двуокиси азота с альдегидами можно назвать работу Мак-
Доуэлла и Томаса 1219], которые изучали реакцию двуокиси
Нитрование ненасыщенных углеводородов
азота с ацетальдегидом (окислы углерода найдены не были),
и работы Полларда и Виатта [220], исследовавших взаимодей-
взаимодействие двуокиси азота с формальдегидом при температурах
118—184°. При этом констатировано образование окиси азота,
воды и окислов углерода (СО и СОа)- Авторы предлагают сле-
следующий механизм реакции, включающий возникновение про-
промежуточного бинарного комплекса между формальдегидом и
двуокисью азота:
1) НСНО + NO2 -i (HCHO-NQa);
2) (HCHONOa) + NO2 -* GO + H2O + NO + NO2;
3) (HCHO.NO2) + NO2 -* CO2 + H2O + 2NO.
Хотя авторы считают, что экспериментальные результаты
объясняются предложенной ими схемой, следует, Однакб,
признать, что она носит скорее характер стехиометрических
уравнений^ чем совокупности истинных элементарных процес-
процессов. Действительно, осуществление, например, стадии 3) в один
элементарный акт включает разрыв шести и образование четырех
валентных связей. Трудно предположить наличие столь слож-
сложного элементарного акта.
Исследованию взаимодействия двуокиси азота с непредель-
непредельными углеводородами посвящены появившиеся в последние
годы две работы — Котрела и Грехема [2211 и Томаса [222].
В обеих работах (в первой исследовалась реайция Двуокиси
азота с этиленом, а во второй с ацетиленом) в числе продуктов
превращения были обнаружены окислы углерода. Механизм
их образования в первой работе не предложен, а во второй
сводится к следующему:
Г СН = СН СН — СН
1) С2Н2 + 2NO2 -И | | I — || || + 2NO;
L ONO ONOJ О О
2) ОНО — CHO + NO2-CO — CHO + HNO2;
3) СО — ОНО + NO2 -* СО2 + НСО + N0;
4) СО — СНО -* СО + НСО;
5) НСО + HNO2 -* Н2О + СО + N0.
310
Нитрование углеводородов азотной кислотой
. Предложенный механизм сводится к первоначальному об-
образованию альдегида (глиоксаля) и последующему его окислению
кислородом двуокиси азота, превращающейся При этом в азотис-
азотистую кислоту и окись азота. Схема этого окисления довольно
сложна и мало убедительна. Если еще стадия 2) отщепления
атома водорода из карбонильной группы с образованием
свободного радикала СО — СНО и HNO2 может считаться ве-
вероятной, то предположение о стадиях 3) и 5) представляется
пока мало обоснованным.
Таким образом в современных механизмах, предложенных
для реакции двуокиси азота с альдегидами и непредельными
углеводородами и предполагающих прямое и непосредственное
воздействие двуокиси азота как на исходные вещества, так
и на все промежуточные образования, мы не находим серьезно
обоснованных путей образования окислов углерода. Такое
положение этого вопроса в настоящее время может, конечно,
иметь временный характер. Не исключена возможность выдвиг
жения в дальнейшем других схем, хотя и основанных на том
же принципе непосредственного воздействия двуокиси азота,
но с другими промежуточными лабильными образованиями
и с более вероятными при этом путями образования окислов
углерода.
Автор настоящей книги, однако, не считает исключенным
образование в условиях парофазного нитрования окислов
углерода путем окисления альдегидов не двуокисью аэота, а
свободным кислородом. Хотя такой механизм возникновения
окислов углерода пока является лишь предположительным,
все же необходимо отметить, что, предположив наличие в зоне
реакции парофазного нитрования свободного кислорода (см.
п. 3), трудно оправдать дальнейшую окислительную
деградацию альдегидов взаимодействием с двуокисью азота,
а не с кислородом. Легкая окисляемость альдегидов кислородом
хорошо известна, а предложенные для этого радикально-цеп-
радикально-цепные схемы вполне логичны. Поэтому автор считает необходи-
необходимым при вскрытии механизма нитрования жирных углеводо-
углеводородов иметь в виду и такую возможность образования окислов
углерода.
Нитрование ненасыщенных углеводородов
311
5. Отсутствие цепного механизма реакции, утверждаемое
схемами Титова и Бахмана, не может считаться окончательно
установленным. Действительно, как уже было сказано, кине-
кинетические характеристики нитрования пойа еще мало изучены,
а ведь именно они являются основньш материалом для решения
вопроса о цепной природе химической реакции.
К этому можно добавить, что предположение о наличии в
зоне реакции нитрования свободного кислорода заставляет
с особой осторожностью отнестись к отрицанию цепной при-
природы этого процесса. Возможно, разумеется, что цепная природа
присуща не стадиям получения азотосодержащих продуктов,
поскольку образование последних скорее всего является, как
справедливо принимают обе схемы, следствием реакции реком-
рекомбинации радикалов (R и NO2), а окислительному направлению,
приводящему к дальнейшему превращению уже с помощью
кислорода таких промежуточных продуктов, как альдегиды,
спирты и др. В этом случае в рамках общей реакции нитрования
мы имели бы интересный случай одновременного протекания
как чисто радикальной, так и цепной реакции.
Не следует думать, что оба эти направления реакции дол-
должны развиваться независимым образом,не влияя друг на друга.
Свободные радикалы, ведущие, например, цепное окисление
альдегидов, несомненно способны взаимодействовать и с ис-
исходным углеводородом, хотя, возможно, и с меньшей эффек-
эффективностью. В результате такого взаимодействия естественно
предположить образование алкильного радикала (RH + А'—>
IV+AH, где А'—свободный радикал), который путем рекомбина-
рекомбинации с двуокисью азота будет поддерживать чисто радикальное
направление реакции.
Таким образом совсем не обязательно представлять себе,
как это делает Титов, первичное образование алкильных ра-
радикалов только в результате реакции исходного углеводорода
с двуокисью азота:
RH + NO2 -*¦ R + HNO2.
Необходимо, кстати, отметить, что такой элементарный про-
процесс вообще егЦе никем не был констатирован .[По крайней мере
312
Нитрование углеводородов азотной кислотой
на него нет ни одной ссылки в книге Стиси «Реакции атомов
и свободных радикалов» B-е издание, 1954 г.).
Предположение о наличии кислорода в зоне реакции
нитрования дает еще и другую возможность возникновения
алкильного радикала
2- R4-HO2.
Такой элементарный акт предполагается в ряде современных
схем окисления углеводородов; его принимает также и
Н. Н. Семенов [223].
Вся совокупность развитых в этом заключении соображений
о возможном протекании нитрования жирных углеводородов,
включая Я критические замечания в отношении некоторых
частей схем Титова и Бахмана, привели автора настоящей
книги к постановке в его лаборатории соответствующего ис-
исследования, имеющего целью получение дополнительного
экспериментального материала, необходимого для более
детальногр и оправданного раскрытия истинного механизма
этой реакции. Это исследование включает в себя: 1) выяснение
всей формально кинетической картины протекания нитрования
жирных углеводородов, 2) установление кинетики по из-
расхрдованию исходных и накоплению промежуточных и ко-
конечных продуктов по всему ходу превращения и, наконец,
3) изучение в чистых условиях некоторых из основных элемен-
элементарных процессов, осуществление которых предполагается
в реакции.
ЛИТЕРАТУРА
1. I. I. «Bevad. J. prakt. Chem., 48,345 A893); 63, 193 A901).
2. Н. Prins. Rec. trav. chim., 44, 1051 A925).
3. V. M e у е г. Bey., 5, 203 A872).
4. H. К г a u s e. Chem. Ztg., 40, 810 A916).
5>R. Lyons, L. Smith. Вел, 60, 13, 173 A927).
6. M. Montmollin, Achermann. Helv. Cbim. Acta, 12,
873 A929).
7. O. Shales. Ber., 68, 1579 A935).
8. P. Sabatier, J.Senderens. Compt. rend., 135, 225 A902);
Ann. Опйь et Phys., 4, 414 A905).
9. J. L ti blein. Ber., Ю, 2083 A877); 34, 284 A901).
Литература
313
10. V.Meyer, Hoffmann. Ber., 27.. 1347 A894).
11. E. В а щ b e г g e r. Ber., 27, 1347 A894).
12. А. К i г p a 11. Ber., 25, 1714 A,892).
13. W. T ran be, A. S с h u 1 z, Ber., 56, 1856 A923).
14. E.S chmid t, A. Ascb erl, L. Meyer. Ber., 58,2430A925).
15. P. P i e г г о n. J. Chem. Soc, 76, 844 A899).
16. И. Б ев ад. ЖРХО, 39, 947 A907).
17. К. Johnson, E. Degering. J.Am. Chem. Soc, 61, 3194 A939).
18. E. Bamberger, Rust. Ber., 35, 45 A902).
19. S. B. L i p p i n с о t, H. В. Н a s s. Ind. Eng. Chem., 31, 119
A939).
20. J. N ef., Ann., 280, 263 A894).
21. K. J о hn s о n, E. Degering. J. Org. Chem., 8, 7A943).
22. S. B. L i p p i n с о t. J. Am. Chem. Soc, 62, 2604 A940).
23. J. T s с h e г n i a k. Ber., 8, 609 A875).
24. W. D. R a m a g e. Амер. патент 1996388 B/IV 1935).
25. В. Vanderbilt. Амер. патент 2181411 B8/XI 1939).
26. L. H e n г у. Bull. Acad. Belg., 34, 547 A898).
27. F. R. S ch aw. Bull. Acad. Belg., 34, 1019 A898).
28. W. S t e i n k 0 p f, M. К u h n e 1. Ber., 75, 1323 A942).
29. M. И. Коновалов. ЖРХО, 38, 607, A906).
30. E. Mills. Ann., 160, 117 A871).
31. A. S u s i e. Thesis, Purdue Univ. A939); H. B. H a s s, A. G. S v-
sie, С W. Scaife. J. Otg. Cbem., 15, 8 A950).
32. P о n z i o. Gaz. Chim. Ital., 36, 2, 100, 338 A905).
33. Rein bold. Ann., 451, 161 A927).
34. W. S t e i n k о р f. Ber., 42, 3925 A927).
35. H. Hass, E. R i 1 e y. Chem. Rev., 32, 373 A943).
36. Амер. патент 2138166 B9/XI 1938).
37. V i 11 i e г s. Bull. Soc. Chim., 43, 323 A928).
38. L. Henry. Compt. rend., 120, 1265 A895).
39. К a m 1 e t. Амер. патент 2151517 B1/Ш 1939).
40. В. Vanderbilt, H. В. Hass. Ind. Eng. Chem., 32, 34 A940).
41. Японск. патент 156256 A949); С. А., 48, 2008 d A950).
42. Японск. патент 6910 A951); С. А., 48, 1412 d A950).
43. Darzens. Compt. rend, 229, 1148 A949).
44. H. Feuer, G. В. В а с h m a n, J. P. Kispersky.
J. Am. Chem. Soc, 73, 1360 A951).
45. Амер. патент 2387019; С. А., 40, 1171 A946).
46. Шведск. патент 195832 B7/V 1952); С. А., 6974 A953).
47. N. S. М а г a n s, R. R. Z е 1 i n s k i. J. Am. Chem. Soc, 72»
5329 A950).
48. Амер. патент 2544103 A951); С. А., 49, 7587f A951).
49. F. Hofwimmer. Schiess-und Sprqngstoffwesen, 7, 43 A912);
314
Нитрование углеводородов азотной кислотой
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
«0,
61
62,
63
64.
65.
66.
67.
68.
69.
70.
.71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
J. Soc. Chem. Ind., 31, 204 A912).
В. Vanderbilt. Амер. патент 2177757 C1/Х 1939).
Е. Schmidt, R. Wilkendorf. Ber., 52, 391 A919).
Н. В. Н a s s, E. В; Hodge, В. Vanderbilt. Ind. Eng.
Chem., 28, 339 A936).
E. Knoevenagel, Walter. Ber., 37, 4507 A904); G г a u d,
H a p p i n. J. Org. Chem., 18, 1 A953).
D. E. W о г a 11. Organie Synthesis, New York, vol. I, 405 A932);
vol. IX, 662 A929).
K. W. Rosenmund. Ber., 46, 1034 A913).
H. B. Hass, E. F. R i 1 e y. Chem. Rev., 32, 410 A943).
E.Schmidt, G. R u t z, M. T г e n e 1. Ber., 61, 472 A928).
Sakkelarios. Ber., 52,898A919).
Sk aif e. J. Chem. Soc. 1471 A947); С. А.,
I, 1910 A950).
В. Н ass, E.
F.
[3], 29, 517 A903);
Am. Chem. Soc, 66,
H. Wiel and, E.
G.Buckley, С
44, 653e A950).
С S с d i f e. Амер. патент 2460243 {1945); С,
J. T i n d a 11. Private communication; H.
R i 1 e y. Chem. Rev., 32, 410 A943).
Cerf de Mauny. Bull. Soc. Chim., [5], 7, 133 A940).
Bouveault, W a hi. Bull. Soc. Chim.,
D. N a igh t iu g a 1 e, J. R. Janes. J.
352 A944).
M. Sen к us. J. Am. Chem. Soc, 68, 10 A946).
H. J о h n s о n. J. Am. Chem. Soc, 68, 12 A946).
H.Johnson. J. Am. Chem. Soc, 68, 14 A946).
H. В г u s о n, G. Butler. J. Am. Chem. Soc, 68, 2348 A946).
W. Kermack, W. M u i r. J. Chem. Soc, 300 A933).
Амер. патент 2465958 B9/Ш 1949); С. А., 5424 A949).
Амер. патент 2391847 B5/ХП 1945).
М. S en к u s. J. Am. Chem. Soc, 68, 1611 A946).
A. Blomquist, J. Shelley. J. Am. Chem. Soc,
A948).
W. Emmonds, W. Сапьои, J. D a w s о n, R.
J. Am. Chem. Soc, 75, 1993 A953).
H. S n i d e r, W. H a m 1 i n. J. Am. Chem. Soc, 72, 5082 A950).
M. И. Коновалов. ЖРХО, 25, 389 A893).
M. И. Коновалов. ЖРХО, 25, 472 A893); Ср. также
B. В. Марковников. Вег., 33, 1906 A900).
М. И. Коновалов. Вег., 28, 1855 A895).
R. A. W о г s t а 11. С, I, 926 A898).
C. Grundmann. Ber., 77, 82 A944).
М. И. Коновалов. ЖРХО, 31, 255 A899).
R. A. W о г s t а 11. J. Am. Chem., 202, 664 A898).
М. И. К о н о в а л о в. ЖРХО, 36, 232 A904).
70, 147
Ross.
Литература
315
83
84
85
«6
87
88.
89.
90.
91.
92.
93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
105.
106.
107.
108.
109.
110.
111.
112.
113.
114
АН СССР, 75,
Я. Сущик.
. М. И. Коновалов, X. Г у р е в и ч. ЖРХО, 37,537 A905).
.Hopkins, Buc. Амер. патент 1694097 A928).
, В. В. Марковников. Ann., 302, 15 A898); В. В. М а р к о в-
ников. ЖРХО, 31, 47, 530 A899); 32, 1441 A900); 35, 1033 A903).
, В. В. Марковников. Вег., 33, 1906 A900).
Амер. патент 1588027; С, II, 1189 A926).
Н. В. Н ass, E. Т. R il ey. Chem. Rev., 32, 377 A943).
B. В. Марковников. ЖРХО, 20, 118 A888); 27, 174 A895);
28, 125 A896); 30, 151 A898); 31, 215 A899); 32, 302 A900).
А. И. Т и т о в. Журн. общ. химии, 19, № 8, 1464 A949).
C. С. Н а м е т к и н. ЖРХО, 40, 184, 1570 A908).
М. И. Коновалов. ЖРХО, 38, 134 A906).
С. С. Наметкин, А. С. Забродина. Докл.
№ 3, 395 A950).
С. С. Наметкин, С. С. Нифонтова, Р.
Докл. АН СССР, 70, № 2, 241 A950).
P. Poni, N. Costachescn. С, I, 624 A903).
С. С. Наметкин, А. С. Забродина. Докл. АН СССР,
75, № 4, 543 A950).
С.С.Наметкин, А.С.Забродина. Докл. АН СССР, 75,
№ 5, 701 A950).
С. С. Наметкин, А. С. Забродина. Докл. АН СССР,
81, № 1, 55 A951).
С. С. Н а м е т к и н.
С. С. Наметкин,
57, 382 A925).
С. С. Наметкин, М. Г. Р у д е н к о, В. Н. Громова.
Изв. АН СССР, серия хим., 61 A941).
С. С. Н а м е т к и н. ЖРХО, 47, 1596 A915).
С. С. Наметкин, А. М. Хухрикова. ЖРХО, 47, 425 A915).
С. С. Наметкин. ЖРХО, 47, 409 A915).
С. С. Наметкин, Л. Н. Абакумовская. ЖРХО,
47, 414 A915).
С. С. Наметкин, А. С. 3 а б р о д и н а. ЖРХО, 57, 87 A925).
П. П. Ш о р ы г и п, А. М. Соколова. ЖРХО, 62, 673
A930).
А. И. Т и т о в. Журн. общ. химии, 16, № И, 1897 A946).
А. И. Т и т о в. Журн. общ. химии, 7, 1695 A937).
А. И. Т и т о в. Журн. общ. химии, 8, 465, 473, 534 A938).
А. И. Титов. Усп. хим., 21, 881—914 A952).
А. И. Т и т о в. Журн. общ. химии, 18, 1312 A948).
А. И. Титов, М. К. Матвеева. Сборник статей по общей
ЖРХО, 47, 405 A915); 47, 1609 A915).
О. С. Мадаева-Сычева. ЖРХО,
химии, I, 247 A953), Изд-во АН СССР.
А. И. Т и г о в. Журн. общ. химии, 18, № 2, 190 A948).
316
Нитрование углеводородов азотной кислотой
115. А. И. Т и т о в, Н. В. Щ и т о в. Докл. АН СССР, 81, 1085 A951).
116. А. И. Т и т о в, В. В.Смирнов. Докл. АН СССР, 83, 243 A952).
117. Р о n z i о. Gazz. Chim. Ital., 36, 588 A906).
118. D. Iff land, G. Griner. J. Am. Chem. Soc, 75, 4074A953).
119. A. F. H о 1 1 e m a n n. Rec trav. chim., 14, 121 A895); W. В a k e г
O.K. In go Id. J. Chem. Soc, 2462 A926); С Urbanski
и др. С. А., 33, 1528 A939).
120. L. Fieser, D о е г i n g. J. Am. Chem. Soc, 68, 2252 A946);
M. Mil one, A. Mass а. С. А., 34,4571A940).
121. H. B. H a s s, E. B. Hodge, B. V a n d e г b i 11. Ind. Eng.
Chem., 28, 341 A936).
122. G. В. В а с hm a n n, L. M. Add is on, J. V. Hewett,
L. К о h n, A. M i 1 1 i k a n. J. Org. Chem., 17, 906 A952).
123. G. В. В а с h m a n n, H. B. H a s s, h. M. Addison. Ibid.,
17, 914 A952).
124. G. В. В а с h m a n n, J. V. Hewett, A. G. M i 11 i k a n.
Ibid., 17, 933 A952).
125. G. B. Bachmann, L. К о h n. Ibid., 17, 942 A952).
126. G. Bachmann, M. Pollack. Ind. Eng. Chem., 46, № 4,
713 A954).
127. Амер. патент 2489320; С. А., 44, 2545в A950).
128. L. Stengel. Амер. патент 2575855; С. А., 46, 1308 A952); Амер.
патент 2512587; С. А., 44, 8942 d A950).
129. Н. В. Hass, L. G. Alexander. Ind. Eng. Chem., 41, 2266
A949).
130. Амер. патент 2609401; С. А., 48, 2758 A954).
131. R. К i г k, D. О t h m е г. Encyclop. Chem. Technol., 9, 441 A952).
132. Б. Н. Тютюнников, Н. П. Маньковская, Т. Д.
Явлинский. Укр. хим. журн., 8, № 1, 87 A954).
133. Н. В. Hass, Patterson. Ind. Eng. Chem., 30, 67 A938).
134. Seigle, H. B. Hass. Ind. Eng. Chem., 31, 648 A939).
135. H. B. Hass, Robinson. J. Am. Chem. Soc, 72, 3579 A950).
136. H. Hep ft, O. Schickk. C, II, 5105 A953).
137. M. H. Danzig, H. B. Hass. J. Am. Chem. Soc, 66, 2017
A944).
138. M. И. Кововалов. ЖРХ0, 37, 1119 A905).
139. M с Clearly, Degering. Ind. Eng. Chem., 30, 64 A938).
140. Амер. патент 2291345 A942); С. А., 47, 2766c A953).
141. G. Bachmann, M. Atwood, M. Pollack. J. Org.
Chem., 19, 3A954); G. T ind all. Амер. патент 2465959 A946).
142. H.B. H ass, H nd gin. J. Am. Chem. Soc, 76, № 10, 2692 A954).
143. J. L. Bullock, E. T. Mitchell. J. Am. Cbem. Soc, 63,
3230 A941); 65, 2426 A943).
Литература
317
40, 2454 A946).
48, 11479i
144. R. T. Blickenstaff, H. B. Hass. J. Am. Chem. Soc, 68, 1431
A946).
145. Ewell. Ber., 35, 3554 A902); 41, 2219 A908).
146. Burton. Thesis, Purdue University.
147. H. Hass, H. Hibsmann, E. Pierson. lni. Eng. Chem.,
32, 427 A940).
148. Norman Levy. Амер. патент 2394315; С. А.
149. W. Marschall. Амер. патент 2654788 A953); С. А.
A954).
150. О. Wichterle, M. Kolinsky, S. Svastal. РЖХим.
№ 17, реферат 40439 A954).
151. Seigle, H. Hass. J. Org. Chem., 5, 100 A940).
152. A. An gel i, Z. Alessandri. С A., 2634 A910).
153. Амер. патент 2181531 A939).
154. H. Д. Зелинский. ЖРХО, 26, 610 A894).
155. С. Р a h n е г. Ind. Eng. Chem., 44, 317 A952); С. А., 44, 2876 A950).
156 Н. S h е с h t е г, R. К а р 1 а п. J. Am. Chem. Soc, 75, 3980а'A953).
157. G. Born. Ber., 29, 9 A896).
158. Амер. патент 2469396 A949); С. А., 43, 6646 A949); амер. патент
2489122 A949); С. А., 44, 1526 A950).
159. P. H. G- г о g g i n s. Unit processes in organic synthesis. New York,
стр. 6 A947).
160. Герм, патент 956547 A950); С. А., 1024е A952).
161. М. L ev у, J. R os e. Quart. Rev., 2, 358 A948).
162. М. L arris on, H. Hass. С. А., 40,3475 A946); H. H a s s,
J. Bourland. С A., 44, 2969 A950).
163. H. P 1 a n t. Амер. патент 2544103 A951); С. А., 45, 7587 A951).
164. С. В ah пег, Н. Kite. Амер. патент 2477162 A948); С, I, 2031
A950).
165. С. В ahn ег, Н. Kite. J, Am. Chem. Soc, 71, 3597 A949).
166. R. Kirk, D. Othmer. Encyclop. Chem. Technology 9, 451
A952).
167. H. S h e с h t e r, L. Z e 1 d i n. J. Am. Chem. Soc, 73, 1276 A951).
168. W. R e i с h, G. Rose, W. W i 1 s о n. J. Chem. Soc, 1235 A947).
169. J. H ann urn. Амер. патент 2583048; С. А., 46, 3735 A952).
170. Амер. патент 2425367; С. А., 7409 A947).
171. W. Den to п. Амер. патент 2538298; С. А., 45, 3862 A951);
герм, патент903453; С, 5170 A954); С, 2026 A953).
172. Priebs. Ann., 225, 319A884); Н. Н. Haitinger. Monatsh.
Chem., 2, 287 A881).
173. R. H. Heath, J.D.Rose. J. Chem. Soc, 1485 A947).
174. H. Hass, A. Susie, H e i d e r. J. Org. Chem., 15, 8 A950).
175. J. M e i s enh ei m e r, F. Helm. Ber., 38, 466 A905).
176. J. Meisenheimer, H. J о h о n s о n. Ann., 355, 293 A907).
318
Нитрование углеводородов ааотной кислотой
A. Do mow, F. R о b е г g. Ber., 83, 261A950); амер. патент
2562151; С. А., 46, 3565 A952).
177. A. Lambert, С. W, S с a i f e, A. E. Wilder-Smith.
J. Chem. Soc, 1474 A947).
178. С. Bahner.I. Tenn. Acad. Sci., 23, 281 A948); С. А., 43, 17Ш
A949).
179. A. Lambert, H. A. Piggott. J. Chem. Soc, 1489A947).
180. H. B. Hags. Ind. Eng. Chem., 35, 1151 A943).
181. F. Heim. Ber., 44, 2019 A911); D. W о г г а 1. J. Am. Chem.
Soc, 57, 2299 A935).
182. С. Т. В a h n e г, H. T. Kite. J. Am. Chem. Soc, 71, 3597A949).
183. H. Wieland, E. Sakkelarious. Ber., 52, 898 A919).
184. D. W о г г a 1. J. Am. Chem. Soc, 49, 1598 A927).
185. A. Dornow, F. Roberg. Aim., 578, 95 A952).
186. А. В. Т о п ч и е в, Е. Л. Ф а н г а л о в а. Докл. АН СССР, 88,
№ 1, 83 A953).
187. Е. Р. К о h 1 е г, Н. Е n g е 1 Ь г е с h t. J. Am. Chem. Soc, 41,
366 A919).
188. В. В. Перекалин, А. С, С о п о в а. Журн. общ. химии, 24,
513 A954).
189. Н. В. Hass, Е. Т. R i I e yj Слеш. Rev., 32, 414 A943).
190. A. Dornow, F. Roberg. Апд., 578, 101 A952).
191. К. A d 1 e г, H. F. R i с k о г ty E. W i n d e m u t h. Ber., 71;
2451 A938).
192. D. V. Naightingal, M. Maintal, A. J. G a 11 h e r.
J. Am. Chem. Soc, 73, 4852 A953).
193. W. С Wild m an, R. B. Wild man. J. Org. Chem., 17,
581 A952).
194. Schmidt, Rutz. Ber., 61, 2142A928).
195. Kaishi Noma. Chem. High. Polymers, 5, 99—103 A948); С. A.,.
46, 4471 A952).
196. В 1 о m q u i's t, Topp, Johnson. J. Am. Cbem. Soc, 67,
1519 A945).
197. M. И. Коновалов. ЖРХ0, 26, 380 A894).
198. M. И. Коновалов. ЖРХ0, 31, 57 A899).
199. M. И. Коновалов. ЖРХ0, 34, 121, 43 A902).
200. С. С. Наметкин, Е. Л. Фантапова. Докл. АН СССР, 87,
№ 6, 979 A952).
201. А. Д. Петров, М. А. Б у л ы г и и а. Докл.АН СССР, 77, № 6,
1031 A951).
202. М с К ее. J. Chem. Soc, 962 A927); Orton, Me Kee.
J. Chem, Soc, 117, 283 A920).
203. H. H ait in ger. Ann., 193, 366 A878); Monatsh., 2, 286 A881).
204. F. Quthrie. Ann., 116, 248 A860).
Литература
319
205. F. Guthrie. Ann., 119, 83 A861).
206. Д. П. Коновалов. Bull. Acad. Sci. St. Peterab., 27, 38 A888).
207. J. Bouis. Ann. Chim. phys., 44, 118 A855).
208. Michael, К a r 1 s о n. J. Am, Chem. Soc, 57, 1268 A935).
209. K. F. H a g e r. Ind. Eng. Cbem., 41, 2168 A948).
210. Clearens, Cok, Doumani! Амер. патент 2478243 A950).
211. Karrman, Berqkwist. С A., 5447b A948).
212. E. Simon. Ann., 31, 269 A839).
213. J. В 1 у t h, A. H о f m a n. Ann., 63, 289 A845).
214. А. И. Т и т о в, А. М. Б а р ы ш н и к о в а. Докл. АН СССР, 91,
№ 5, 1099 A953).
215. В а с h m a n, Addison, Hewett, К о h n, Millikan.
J. Org. Chem., 17, 906 A952).
216. А. В. Т о п ч и е в, В. П. А л а н и я. Докл.АН СССР, 67,297A949).
217. Hass, R iley. Chem. Revs., 32, 383 A943).
218. S t e а с i e. Atomir and radical reactions. 2d edition, New York» 1954.
219. M с D о well, Thomas. Trans. Farad. Soc, 46, 1030 A95O>.
220. Pollard, Wyatt. Trans. Farad., Soc, 45, 760 A949).
221. С о 11 г el 1, Graham. J. Chem. Soc, 556 A953).
222. Thomas. Trans. Farad. Soc, 48, 1142 A952).
223. H. H, Семенов. Некоторые проблемы химической кинетики в
реакционной способности. М., Изд-во АН СССР, 1954.
Глава четверти я
НИТРОВАНИЕ АМИНОВ
В течение последнего десятилетия большое значение полу-
получили нитропроизводные первичных и вторичных аминов —
N-нитроамины, которые в небольших количествах были по-
получены еще в прошлом столетии. Однако методы нитрования
аминов детально разработаны лишь недавно. Разработка но-
новых методов нитрования аминов сделала N-нитроамины вполне
доступными соединениями и некоторые из них производятся
в промышленном масштабе (динитрооксидиэтилнитроамин,
этилендинитроамяп и др.).
Третичные амины, не имеющие водородного атома, связан-
связанного с азотом аминогруппы, N-нитросоединений, естествен-
естественно, не образуют.
В отличие от аминов, обладающих основными свойствами,
первичные нитроамины имеют характер кислот, причем их
кислотность выше, чему соответствующих карбоновых кислот.
Способность N-нитроаминов к солеобразованию объясняется
тем, что они изомеризуются аналогично нитропарафинам.
Например, строение калиевой соли фенилнитроамина можно
выразить формулой C6H5N = NOOK.
Нитроамины по внешнему виду представляют собой бе-
белые довольно стабильные кристаллические вещества. Некоторые
арилнитроамины, пронитрованные в ядро, окрашены в слабо-
слабожелтый цвет. Однако интенсивность их окраски заметно ниже
интенсивности окраски соответствующих нитропроизводных ани-
анилина. Некоторые нитроамины разлагаются со взрывом при
нагревании. Вместе с тем многие вторичные алифатические
нитроамины перегоняются в вакууме [1].
Нитрование аминов
321
Алифатические первичные нитроамины быстро разлагаются
концентрированными кислотами и вследствие этого не могут
быть получены прямым нитрованием соответствующих аминов.
Общий препаративный метод получения таких N-нитроаминов
заключается в ацетилировании амина с последующим нитро-
нитрованием полученного вторичного амида в нитроамид и разло-
разложением последнего щелочами с образованием соли нитроамина.
Нитроамины получаются при осторожном подкислении их со-
солей [1].
Часто в качестве промежуточных продуктов получения
нитроаминов применяются уретаны. При обработке эфирного
раствора сырого алкилнитроуретана газообразным аммиаком
(или алифатическим амином) получаются соль нитроамина
и растворимый в эфире уретан. Так, метилнитроамин можно
получить по следующей схеме [2]:
С1СООС.Н, HNO,
CHsNH2 > Ctt,NHCOOC2H6 > СН3 — N — СООС2Н6 -
2NH.
NO2
— NO2 + H2NCOOC2H6 —-- CH3NHNO2
Недавно Смартом и Райтом [3] был разработан новый
метод нитрования первичных аминов. По этому методу первич-
первичный амин при взаимодействии с хлором превращается в
N-дихлорамин,который в дальнейшем подвергается нитрованию
нитрующей смесью, состоящей из 98—99% -ной азотной кислоты
и уксусного ангидрида. В результате такого нитрования обра-
образуется N-xnop-N-нитроамин — очень нестабильное соединение,
которое при гидролизе в восстановительной среде (например,
раствором бисульфита натрия) дает нитроамин.
Типичный пример получения первичных нитроаминов —
нитрование этилендиамина. В первой стадии реакции при
взаимодействии хлора и этилендиамина получают N-тетрахлор-
1,2-диаминоэтан (I), при нитровании которого азотной кисло-
кислотой и уксусным ангидридом образуется N,N'-flHxnop-N,N'-
динитро-1,2-диаминоэтан (III). Последнее соединение при
21 А. В. Топчиев
322
Нитрование аминов
обработке бисульфитом натрия превращается с хорошим выходом
в этилен-Г^,№-динитроамин (IV).
Нитрование' аминов
323
CH2 NCI2 2HN0.,
СН2—NC12
I
:ci: o:h
сн,—n : n : o:
:ci:o:
:ci: 0:
сн2—n : n : о:
:ci:o:h
n
CH2—NH —NO2
CH2—NH—NO2
IV
CH2—NH—NO2
CH2—NH—NO2
CH2
>
CH2
+¦ 2HC1 +
+ 2C10K
:ci:
—n : н : 0:
:o:
: 0:
—n:n:p:
:ci:
111
2NaHSO4 )
+ 2 :c'i:'6:h
..
По мнению авторов, при нитровании 1М-тетрахлор-1,2-
диаминоэтана азотной кислотой первоначально образуется
N, N'-координационное соединение (II), которое можно рас-
рассматривать как соль слабого донора электронов. Это соедине-
соединение самопроизвольно теряет хлорноватистую кислоту с обра-
образованием Н,Н'-дихлор-Н,Н'-динитро-1,2-диаминоэтана (Ш),
который, повидимому, является слишком слабым донором
электронов и вообще не может образовать соли. Это подтвер-
подтверждается тем, что тетранитроамин совершенно не образуется.
Приведенная схема не отражает роли уксусного ангидрида
при нитровании. Присутствие уксусного ангидрида необ
ходимо для поддержания продуктов реакции в безводном
состоянии. Действительно, при применении большого избытка
азотной кислоты в отсутствие уксусного ангидрида реакцион-
реакционная смесь получалась очень нестабильной.
При гидролизе N, №-дихлор-]М, №-динитро-1,2-диамино-
этана (III) водой вместе с нитроамином образуется хлорнова-
хлорноватистая кислота. Это разложение водой представляет собой,
невидимому, обратимую реакцию. Поэтому для получения
хорошего •выхода этилендинитроамйна авторы предложили
проводить разложение N, РГ-дихлор-Г^,]У-динитро-1,2-диами-
ноэтана в этилен-N, N'-динитроамин восстанавливающими
реагентами (например, бисульфитом натрия), которые разлагают
хлорноватистую кислоту при проведении гидролиза.
Описанным выше методом Смартом и Райтом были полу-
получены и охарактеризованы следующие N-нитроамины: этилен-
динитроамин, втор, бутилнитроамин, н. бутилнитроамин,
н. октилнитроамин, изопропилнитроамин и циклогексилнит-
р о амин.
В промышленном масштабе этилендинитроамин получают
нитрованием этиленмочевпны (имидазолидона-2) с последую-
последующим гидролизом этилендинитромочевины кипячением с во-
дой [4]:
NO2
СН» — NH
[\
СН, -
i3CH2 —N4 H,o CH2NHNO2
¦I >co— 1 +co2
CH2 — N/ CH2NHNO2
NO,
Нитрование этиленмочевины производят нитрующей смесью,
состоящей из 74% серной кислоты, 15,4% азотной кислоты
и 10,6% воды. К 10 вес. ч. нитрующей смеси, охлажденной
ниже 10°, небольшими порциями прибавляют 1 вес. ч. эти-
этиленмочевины с такой скоростью, чтобы температура не подни-
поднималась выше 10°. По окончании реакции смесь выливают йа
лед, и выпавшую этилендинитромочевину отфильтровывают
и промывают водой. Полученная этилендинитромочевина
кипятится с водой до прекращения выделения газа. При
охлаждении раствора до комнатной температуры этилендини-
этилендинитроамин выделяется в виде блестящих кристаллов, которые
отфильтровывают, промывают водой и высушивают.
Этиленмочевина в свою очередь получается многими мето-
методами: конденсацией двуокиси углерода с этилендиамином,
взаимодействием этилендиамина с мочевиной, конденсацией
диэтилкарбоната или фосгена с этилендиамином, и др. [5].
Разработаны и другие методы синтеза этилендинитроамйна,
например: нитрованием и последующим гидролизом этйяен-
324
Нитрование аминов
бис-уретана (I) и N.N'-этиленоксамида (II) 16]:
N02
CHaNH. n CHaNHCOaC2H5 CHa - N - CO2C2H5 гидр0лиз
CHaNH2 * CHaNHCO2CaH5 * CHa - N- СОаС„Н5 н,0
1 k
CH2NHNO2
CHaNHNOa
N02
I I 5?Д I I
CH2 — NH — CO CH2 — N — CO
II I
NO2
н3о, NH
I
CH2 —
NHNOo
Однако эти методы не имеют промышленного значения.
Из нитропроизводных первичных аминов отметим еще
получение весьма интересного соединения — метилендинит-
роамина, который первоначально был выделен из продуктов
нитрования уротропина [7].
Метилендинитроамин получается при нитровании в ук-
уксусном ангидриде и последующем гидролизе метилен-бис-N-
ацетамида, который в свою очередь образуется при конденсации
ацетамида с параформальдегидом. Реакция проводится по
следующей схеме:
4CH3CONH2 + НСНО -* 2CH3C0NHCHaNHC0CH3 + 2Н2О
метилен-бис-Ы-ацетамид
2HN03
CH3CONHCH2NHCOC,H3 > CH3CON—
I
NCOCH3 + 2НаО
I
I I
N02 NOa
метилен-бис-Ы-(К-нвтро)-ацетамид
гидролиз
CH3CON - CHa - N — COCH3 ——--> O2NNHCH2NHNO» + CH3COONH4
NO,
NOa
метилендииитроамин
Метилендинитроамин выделяется из реакционной смеси
осаждением его в виде бариевой соли с последующим разло-
разложением соли соляной кислотой.
Нитрование аминов
325
Нитрование вторичных аминов — диметиламина и пипери-
пиперидина — было изучено еще в прошлом столетии Бамбергером
[8, 9]. N-нитродиметиламин и N-нитропиперидин получались
действием уксусного ангидрида на азотнокислые соли диметил-
диметиламина и пиперидина. Выходы нитропроизводных авторы не
сообщают.
Райт с сотрудниками [10] повторил синтез Бамбергера
и получил N-нитропиперидин с выходом 22 % и N-нитродиме-
N-нитродиметиламин с выходом лишь 5%.
С другой стороны, было установлено, что ряд вторичных
алифатических аминов легко нитруется безводной азотной
кислотой с образованием N-нитроаминов [11]. Этим способом
были получены N-нитропроизводные имино-бис-ацетонитрила
(I), имино-бис-уксусной кислоты (II), диамида имино-бис-
уксусной кислоты (III) и 2,6-диоксопиридазина (IV)
О
= C —СНа НООС —СН2 H2N —С—СН2
I /
NH HN
NH
NH
О
II
с—сна
NH
N = C —CH2 HOOC —CH2 HaN— С — СН2 С—CHa
II
О
III
О
IV
По сравнению с диметиламином и пиперидином указанные
соединения представляют собой очень слабые основания.
Нитрование по этому методу очень невыгодно, так как
требует применения довольно большого избытка безводной
азотной кислоты. Кроме того, метод нитрования безводной
азотной кислотой не является общим, и многие вторичные
амины в этих условиях N-нитросоединений не образуют.
Райт с сотрудниками [10] разработали новый метод катали-
каталитического нитрования вторичных аминов азотной кислотой
в среде уксусного ангидрида. При нитровании диэтаноламина
им было установлено, что хлористый водород, введенный в ре-
реакционную смесь в небольшом количестве, чрезвычайно
активный катализатор нитрования вторичных аминов азотной
326
Нитрование аминов
кислотой в среде уксусного ангидрида и резко увеличивает
выход р,р'-динитрооксидиэтиднитроамина.
Первоначально р,р'-динитрооксидиатилнитроамин с вы-
выходом 98 % авторы получали взаимодействием нитрата динитро-
оксидиэтиламмония с уксусным ангидридом в присутсгвии
хлористого цинка, хлористого ацетила или хлорида динитро-
оксидиэтиламмония как катализаторов. Однако этот метод
оказался неудобным вследствие необходимости получения и
выделения нитрата динитрооксидиэтиламмония.
В связи с этим был разработан метод нитрования диэтанол-
амина в одну стадию. В качестве катализатора в этом процессе
применялась солянокислая соль диэтаноламина.
Для получения хорошего выхода [},[}'-динитрооксидиэтил-
нитроамина диэтаноламйи, азотную кислоту, уксусный ангид-
ангидрид и солянокислый диэтаноламин брали в молярном отношении
1 : 3,2 : 3,4 : 0,05. Азотную кислоту и диэтаноламин добав-
добавляли к перемешиваемому уксусному ангидриду в течение
45 мин. при 5—15° с такой скоростью, чтобы предотвратить
накопление в реакционной смеси свободного диэтаноламина.
По окончании добавления реагентов реакционную смесь на-
нагревали до 40° в течение 40 мин. Затем продукты реакции
выливали в холодную воду. Осадок [},[}'-динитрооксидиэтил-
нитроамина отфильтровывали и промывали разбавленным
раствором аммиака. Выход сырого ^.^'-динитрооксидиэтил-
нитроамина был равен 90% , т. пл. 49,5—51,5°.
Для очистки р,р'-динитрооксидиэтилнитроамина его су-
суспензию в воде обрабатывали паром (для удаления [},C'-динитро-
оксидиэтилнитрозоамина), и продукт перекристаллизовывали
из ацетона.
Каталитический метод был успешно применен и для нитро-
нитрования других вторичных аминов. Нитраты вторичных аминов
обрабатывали уксусным ангидридом, содержащим хлористый
цинк. Превращение нитратов диметиламина, диэтиламина,
пиперидина и морфолина в нитроамины было, соответственно,
равно 65, 60, 58 и 65 % от теоретического. Солянокислый
ди-н. бутиламин также нитровался азотной кислотой в среде
уксусного ангидрида [10, 12].
Нитрование аминов
327
Райт с сотрудниками установил [13], чю легкость нитрова-
нитрования вторичных аминов зависит от основности аминогруппы.
Было найдено, что основные свойства аминов, которые нитру-
нитруются в отсутствие катализатора с хорошим выходом, значительно
слабее, чем у морфолина. Для очень сильных аминов (например,
ди-н. бутиламина) катализатор лучше всего применять в экви-
эквимолекулярном количестве.
Относительная основность некоторых вторичных амиыов
определялась колориметрическим титрованием. В качестве
индикатора авторы применяли о-нитроанилин, который в ле-
ледяной уксусной кислоте не диссоциирует в значительной сте-
степени и имеет оранжево-желтую окраску. В серной и хлорной
кислотах при их концентрации, достаточной для превращения
индикатора в ион аммония, о-нитроанилин почти бесцветен. Если
добавить один эквивалент вторичного амина к одному экви-
эквиваленту раствора серной или хлорной кислоты в уксусной
кислоте, содержащей индикатор, то отношение недиссоцииро-
ванных (окрашенных) молекул индикатора ко всему количе-
количеству индикатора будет наибольшим, когда исследуемый амин
будет иметь максимальную способность к присоединению про-
протона.
Авторы не пытались оценить степень ассоциации инди-
индикатора в уксусной кислоте в виде нитррфениламмоний-
ацетата и поэтому выражали результаты титрования только
в виде отношения интенсивности окраски индикатора в при-
присутствии определенного количества амина и серной (или хлор-
хлорной) кислоты к интенсивности окраски того же количества ин-
индикатора в уксусной кислоте.
В табл. 18 дана относительная способность присоединения
протона некоторыми аминами по отношению к серной и хлор-
хлорной кислотам (см. стр. 328). Эта таблица показывает, что
все амины (№ 14—17 включительно), которые нитруются е
хорошим выходом в отсутствие хлористоводородного ката-
катализатора [И], являются наиболее плохими акцепторами
электронов. Напротив, диметиламин и пиперидин (сильно
основные амины) в отсутствие катализатора дают крайне низкий
выход нитросоединений (соответственно, 6 и 22%) [10].
328
Нитрование аминов
Таблица 18
Относительная склонность присоединения протона по отношению
к серной и хлорной кислотам
Интенсивность
окрасив индикатора
вСН.СООН
10
И
12
13
14
15
16
17
Дииаопропиламин .
Диизобутиламин .
Дициклогексиламин
Ди-н. бутиламин .
Диэтиламин ....
Ди-н. октиламин .
Диметиламин . . .
Лизидин
Метилэтаноламин .
Диизоамиламин
Морфолин
Имино-бис-пропионитрил
Диэтаноламин
Ииино-бис-ацетонитрил
Имино-бис-метилацетонитрил (твердый диасте-
реомер)
Имино-бис-метилацетонитрил (жидкий диасте-
реомер)
Имино-бис-диметилэцетонитрил
1
1
1
1
1
1
1
0
0
0
0
0
0
06
,06
,05
,04
,02
,02
,01
,99
,98
,945
,915
,85
,77
0,675*
0,536*
0,531
0,527
0,516*
0,516
0,511*
0,500
0,495*
0,478
0,463*
0,430*
0,389*
0,310
— | 0,182
0,084
0,0825
* Звездочкой отмечены амины, которые не титровались хлорной
кислотой, и цифры Пересчитаны по данным, полученным с серной ки-
кислотой. Склонность присоединения протона пиперидином почти такая же,
как и у метилэтаноламина.
Таким образом, амины, которые являются плохими акцепторами
адектронов, нитруются наиболее легко.
При изучении реакционной способности вторичных алифати-
алифатических аминов в реакции нитрования Райтом и его сотруд-
сотрудниками были установлены следующие закономерности [12, 13]:
1) реакционная способность вторичных аминов уменьша-
уменьшается с увеличением склонности амина к присоединению протона;
Нитрование аминов
329
2) слабо основные амины (№ 14—17 включительно) нитру-
нитруются в отсутствие катализатора с хорошими выходами N-нитро-
соединений;
3) для получения хороших выходов N-нитроаминов из
более основных аминов (№ 1—13 включительно) процесс
нитрования необходимо проводить в присутствии катализатора
(хлористого водорода, хлористого цинка и др.). Количество
катализатора необходимо увеличивать по мере увеличения
способности амина к присоединению протона. Для нитрования
наиболее основного амина — диизопропиламина уже требует-
требуется эквимолекулярное количество хлористого водорода.
При нитровании вторичных аминов в присутствии хлори-
хлористого водорода или хлористого цинка в реакционной смеси
был обнаружен электроположительный хлор, например,
в виде хлорноватистой кислоты или хлористого ацетила [12].
Эти соединения с положительно заряженным хлором могут
вызвать превращение вторичного амина в соответствующий
менее основной хлорамин. Если свежеприготовленный раствор
азотной кислоты и хлористого водорода в уксусном ангидриде
будет давать хлорамин из амина, то хлористый ацетил также
должен находиться в реакционной смеси при нитровании вторич-
вторичных аминов в присутствии хлористого водорода, и он будет дей-
действовать как хлорирующий реагент.
Это предположение проверялось при нитровании диэта-
ноламина и его производных. При нитровании ^'-диокси-
диэтиламмонийхлорида и ^.^'-динитрооксидиэтиламмоний-
хлорида выход $, ^'-динитрооксидиэтилнитроамина был выше
(94 и 97%, соответственно), чем выход (92%), полученный из
диэтаноламина и небольшого количества хлористого водорода
[10].
При нитровании динитрооксидиэтилхлорамина азотной ки-
кислотой был получен 78% -ный выход р,р'-динитрооксидиэтил-
нитроамина, но реакционная смесь была нестабильной, повиди-
мому, вследствие выделения хлорноватистой кислоты. С другой
стороны, при нитровании этого хлорамина азотной кисло-
кислотой в уксусном ангидриде выход ^,^'-динитрооксидиэтилни-
троамина (96 %) практически совпадал с выходом, полученным
330
аминм
при использовании дивитродиэтиламмонийжлорида, и реак-
ционная смесь была совершенно стабильна. Это увеличение
выхода и стабильности реакционной смеси, невидимому, свя-
связано с тем, что уксусный ангидрид превращает, хлорноватистую
кислоту в хлористый ацетил. Довольно высокий выход р,^'-
динитроокоидиэтилнитроамина, полученный при нитровании
хлорамина азотной кислотой, напоминает нитрование слабых
аминов типа иминотбис-адетонитрила [12, 14]. Следовательно,
уксусный ангидрид при каталитическом нитровании является
стабилизирующим реагентом.
Присутствие хлорамина в реакционной смеси, однако, не было
обнаружено, хотя наличие электроположительного хлора и
било установлено. Райт о сотрудниками [15] определили коли-
количество электроположительного хлора, который выделяется из
хлористого цинка и азотной кислоты в уксусном ангидриде,
и нашли, что его образуется 39% от количества, ожидаемого
согласно нижеследующему уравнению:
I. ZnCIa-f 2HNOS+ 3 (CHSCQJQ
+ 2СЮСОСН3 + 2HOCOCHS.
На основании изложенного можно полагать, что хлорамин
может быть выделен из нитрационной смеси, которая, согла-
согласно уравнению I, будет содержать количество азотной кислоты,
достаточное для образования хлорацетата, но недостаточное,
чтобы вызвать последующее нитрование. Такая смесь была
приготовлена согласно уравнениям II и III и дала 30% -ный
выход предполагаемого хлорамина.
II. 2НС1 + 2HNO3 + 3 (СН3СОJО -* 2СЮСОСН3 + N2OS + 4HOCOCH,.
III. (NO3 — СН2 - CHaJNH + СЮСОСН3 - (NO3 — СН2 — CHa)aNCl +
+НОСОСН3.
Наряду с хлорамином был получен р,р'-динитрооксиди-
этилнитрозоамин с выходом 36% от теории. Повидимому,
реакция протекала по уравнениям
331
IV, (CHsCO)aO -J- N2O3,-f 2HQ -* 2NOC1 + 2HOCOCH8
V. NOCl + (NQ8 — GHa — CH2JNH -» (NOa — CH; — CH8), Ji — NO + HC1,
Следовательно, хлорамин может превращаться в нитро-
амин согласно уравнению VI:
VI. (NOj — СНг— .CHg)sNCI+HNO8-».^O,-f СНц— CHaJN -NO2+HOC1.
Так как ни азотистая KHG^otft, н^ азотистый ангидрид по
реакции VI не образуются, можно полагать, что эти соединения
не будут присутствовать в продуктах реакции. Действительно,
ни азотистая кислбта, ни азотистый ангидрид в продуктах
реакции не обнаружены.
Согласно уравнению VI, при нитровании хлорамина об-
образуется хлорноватистая кислота. Если хлорноватистая ки-
кислота стабилизируется превращением в хлорацетат, то она
может использоваться для получения большего количества
хлорамина. Таким образом, каталитическое нитрование вто-
вторичных аМинов можно рассматривать как цепную реакцию,
так как электроположительный хлор регенерируется в про-
процессе реайции.
Хотя нитрование вторичных аминов можно проводить в
отсутствие уксусного ангидрида, выход N-нитросоедннений
заметно увеличивается в присутствии этого реагента. Приме-
Применение уксусного ангидрида особенно необходимо при ката-
каталитическом нитровании сильно основных аминов. Это объ-
объясняется тем, что хлорноватистая кислота быстро разрушается
азотной кислотой и, следовательно, не успевает прореагировать
с амином в том случае, когда скорость реакции хлораминиро-
вания будет относительно низкой.
Райт и сотрудники считают, что нитрование вторичных
аминов происходит через образование, комплекса амина и азот-
азотной кислоты. Рви цолагают, что такие комплексы не образуются
с сильно основными аминами, которые дают нормальные элек-
электровалентные соли. Поэтому при каталитическом нитровании
сильно основные свойства амина ослабляются превращением
его в соответствующий хлорамин»
332
Нитрование аминов
Первая стадия реакции каталитического нитрования
вторичных аминов заключается, следовательно, в образовании
хлорамина. Присоединение хлорацетата в активном состоянии
к амину происходит согласно такой схеме: !
н
R:>n :
R
1,3
*-
С1
Cl
1
О
I
CH3
r : n : с: о: h
н: о: _
r : n : с: о
R CHJ'
1,3
н
R
;
:n :
R
с:
сн
.:'
о:
!¦'-
н
Cl • у,:
r:'n: + Ь'.О'.н
R
В продукте присоединения хлорацетата к fty
жет затем цроиаойти 1,3-перегруппировка водорода и |^j
перегруппировка хлора. При разложении комИ ^
перегруппировок водорода и хлора, образуются хлорамин 1у
уксусная кислота.
Во второй стадии реакции происходит образование
лентной связи между атомами азота хлорамина и азотной
кислоты. Это соединение самопроизвольно выделяет
новатистую кислоту с образованием нитроамина.
ватистая кислота, таким образом, выделяется в авоб
состоянии и стабилизируется ацетилированием
? HONO, ?:.?:.. -НОС1 ?:?.:..
R : N: ——* R: N: N: О : *¦ R: N: N: :О
:С1: :9^:Я:
Н .,,.'', ::¦. ¦
Исследование побочных продуктов реакции, полученных при
нитровании хлораминов, показало, что нитрование хлорамина
притекает медленнее образования его в реакционной смеси.
ЛИТЕРАТУРА г
1. А. Й. L am Ъ er t on. Quart. Rev., 5, № 1, 75 A951).
2. P. N. Franchimont. Rec. trav. chim, 13, 1308 A894J.
Литература
333
3. G. N.R. Smart, G. F. W right. Canad. J. Res., 26 B, 284A948).
4. Encyclop, Ghem. Technol. (New York), 6, 23 A952).
5. J. F. M u 1 v a n e y, R. L. Evans. Ind. Eng. Chem., 40, 393 A948).
W. F. В а с h m a n n, W. J. Morton, E.
6.
L.
E. Maxwell. J.
N. W. Mac N aught on, E.
Soc. ,72, 3132 A950).
7. F. Charm an. J. Chem. Soc, 1633 A949).
Bamberger. Ber., 28, 399 A895).
Bamberger, A. Kirpal. Ber., 28, 553 A895)
J. Chute, K. G. Herring, L. E.
F.Wright. Canad. J. Res., 26B, 89 A948).
P. N. F r a n с h i n m о n t, J. V. Dabsky.
36, 70 A916).
Chute, G. E. Dunn, J. E
J e n n e r,
Am. Chem.
8. E.
9. E.
10. W.
G.
11. A.
chim.,
12. W. J.
Tombs,
Rec. trav.
M а с К en z i e, G. S.
J. W. Suggit, G. W rigbt.
G. F. Wright. Canad.
Myers, G. N. R. Smart,
Canad. J. Res. 26B, 114 A948).
13. G. R. Dunn, J. С MacKenzie,
J. Res. 26B, 104 A948).
14. J. V. Dabsky. Ber., 49, 1045 A916).
15. G- S.Myerp, G. F. W r i g h t. Canad. J. Res., 26B, 257 A948).
Г лава п ятпа я
НИТРОВАНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ОКИСЛАМИ АЗОТА
А. НИТРОВАНИЕ ОКИСЛАМИ АЗОТА БЕЗ КАТАЛИЗАТОРОВ
Метод нитрования окислами азота, который начал разра-
разрабатываться еще в 70-х годах прошлого столетия, приобрел
актуальное значение лишь с 1910—1915 гг. в связи с освое-
освоением химической промышленностью синтетических методов
получения азотной кислоты из атмосферного азота через
окислы азота. Начиная с этого периода, проблема использо-
использования окислов азота (нитрозных газов) для нитрования орга-
органических соединений привлекает усиленное внимание иссле-
исследователей, которые посвящают ей значительное число работ.
Это объясняется главным образом тем, что метод нитрования
окислами азота обладает определенным техническим пре-
имуществом перед обычно принятыми методами нитрования
азотной кислотой и нитрующими смесями, так как при его
применении устраняется необходимость в переработке окислов
азота в азотную кислоту (как известно, синтез азотной кислоты
из окислов азота представляет собой довольно сложный про-
процесс и состоит в окислении кислородом низших окислов азота
до азотного ангидрида в присутствии воды и получении, таким
образом,слабой азотной кислоты,которая затем концентрируется
при помощи H2SO4).
Обычно применяемую для нитрования N2O4 (температура
кипения 21,3° при 760 мм) рассматривают как равновесную
смесь согласпо уравнению
N2O41- 2NO2.
Нитрование бее катализаторов
335
При низких температурах преобладает димерная форма
двуокиси азота. Измерение плотности пара показывает, что при
температуре выше 140° наблюдается полная диссоциация
N2O4, а при 27° около 20% N2O4 находится в форме мономера.
Внешний вид N2O4меняется в зависимости от температуры и,
следовательно, состояния равновесия от бесцветных кристал-
кристаллов при температуре —50° до черных паров при 183°.
Структуру N2Q4 нельзя считать точно установленной.
Из всех предложенных формул наибольшего внимания заслу-
заслуживают
О
= N — О —
/
и O =
-О —
В пользу такой формулы говорит ряд химических реакций
N2O4, в частности, реакция с водой по уравнению
ХВО4 + Н2О -* HNO8 + HNO2.
Клузиус и Векчи [1] на основании исследования взаимо-
взаимодействия меченого тетраметиламмонийнитрата (CH3LN16NO3
е жидкой N2O4, считают, что N2O4 частично существует в форме
нитрозилнитрата NO-NOe, способного в свою очередь к иони-
ионизации
ЛТ2О4 ^ NO-NO, Z N0 + N0".
Образование трехокиси азота NOe допускается некоторыми
авторами. Так, Уэлш [2], объясняя механизм окисления раз-
различных соединений двуокисью азота, считает, что кислород
образуется в результате диссоциации NOs по следующей схеме:
N2O4 - N03 + NO;
N03 - NO + О,.
А. А. Баландин [3], Т. В. Заболоцкий 14], Блэсет [5] рассматри-
рассматривают NOe в качестве первичного Продукта окисления окиси
азота озонированным кислородом.
336
Нитрование органических соединений окислами азота
.Нитрование беэ катализаторов
337
I. Нитрование в жидкой фазе
§ 1. Нитрование непредельных соединений
Из работ,посвященных нитрованию органических соединений
окислами азота, необходимо прежде всего отметить работы
по получению нитросоединений из непредельных соединений
жирного ряда. Обычно продукт реакция представляет собой
нестойкое твердое вещество или масло, из которого подчас
бывает очень трудно выделить чистое вещество.
Виланд [6, 7] исследовал реакцию взаимодействия алифа-
алифатических непредельных соединений с N2O4 и нитрозными
газами *. Им найдено, что продуктами этой реакции являются
динитросоединения («динитрюры»), которые образуются по
схеме
R — СН = СН — R' + N2O4 -* R — CHNO2 — CHNO2 — R',
где R и R' —¦ насыщенные углеводородные радикалы. По-
Подобные динитросоединения получаются и при нитровании N2O4
смешанных жирноароматических непредельных углеводородов,
имеющих общую формулу СвН5 — СН = СН — R, а также
соединений общей формулы Аг — СН = СН — Аг.
Так, например, стильбен при действии N2O4 даетдифенил-
динитроэтан.
СвН5СН = СНСвН5 + NaO4 - СвН5 — СН — СН — С6Н5
NO2 NO2
Строение этого динитросоединения доказано Виландом
синтезом этого соединения из фенилбромнитрометана при вза-
взаимодействии последнего с серебром:
/н
2С„НВ — Cf-Вг + 2Ац -* СвН5 — СН — СН — CeH5 + 2AgBr
4NO2 ¦ I I
NO2 NO2
* Вилапд рассматривает нитрозные газы как смесь N2Os и N2O4;
. активную роль в этой смеси играют, по его мнению, свободные радикалы
I _
Продукт взаимодействия стильбена с N2O4 оказался идентич-
идентичным дифенилдинитроэтану, полученному из фенилбромнитро-
фенилбромнитрометана. Виланд исследовал также реакцию нитрования N2O4
непредельных углеводородов с сопряженными двойными свя-
связями следующего строения:
R — СН = СН — СН = СН — R'.
При обработке суспензии 1,4-дифенидбутадиена в абсолютном
эфире раствором N2O4 в смеси эфира с газолином при охлажде-
охлаждении Виланд получил 1,4-дифенил-1,4-динитробутен-2
СвН5 — СН = СН — СН = СН — СвН5 + N204 -*
->¦ C6H5CH(NO2) — СИ = СН — СН (N02) CeH5.
Таким образом, у 1,4-дифенилбутадиена присоединение нитрон
групп происходит не к двум соседним атомам углерода (в по*
ложениях 1,2), а к двум крайним атомам системы сопряженных
связей A,4), что согласуется с правилом Тиле.
При действии спиртовой щелочи дифешгадинитробутен от-
отщепляет молекулу HNC и дает 1,4-дифенил-1-нитробутадиен
CeH5CH(NO2) — СН = СН — CH(NO2)CeH5 •-+.
-* CeH5C(NO2) = СН — СН = CHCeH5 + HNO2.
1 I ; I '
Далее Виланд показал, что при действии нитрозных газов
на непредельные соединения, содержащие карбонильную группу
и имеющие общую формулу
Р а
CfiHg — С = С — С — R
N0' и NOj.
получаются следующие три тида соединений.
1) Нитрогрудпа присоединяется к а-атому углерода,
а нитрозогруппа ^—к C-атому углерода (I); при дальнейшем
течении реакции в результате внутримолекулярных пере-
22 А. В. Топчиев
338
Нитрование органических соединений окислами азота
группировок соединение (I) переходит в оксим (II), последний
легко теряет воду и дает азоксазол (III)
Н Н NO2 NO2
СвН5— С — С — С — R-^CeHs — С— С = С —R-»CeH5 —С—С = С —R
I NO N02 О II NOH ОН III N О
2) Нитрогруппы присоединяются по месту двойной связи
к атомам углерода аир, образуя динйтро со единение:
Н Н
I I I!
N02 N02 О
3) Происходит прямое нитрование в радикале, связанном;
с кетогруппой (R), которое приводит к ненасыщенному нитро-
кетону:
СвН5 — СН = СН — СО —1?н + N204 - СвН5
СН = СН — СО — Rj-f HNO2
N02
Взаимодействие N2O4 с тетраметилэтиленом изучалось,
некоторыми исследователями. Шмидт [8] утверждает, что при
применении эфира в качестве растворителя основным про-
продуктом реакции является динитрит строения:
СНз СНз
Н3С — С — С — СН3
I I
ONO 0N0
Это утверждение было в дальнейшем опровергнуто Н. Я. Демья-
Демьяновым и К. В. Сидоренко [9, 10], которые также занимались
изучением реакции нитрования непредельных соединений окис-
окислами азота. При нитровании тетраметилэтилена До остающегося
небольшого избытка углеводорода эфирным раствором окислов,
азота, полученных при действии азотной кислоты на Аз2Оз„
эти исследователи получили динйтро соединение состава
Нитрование без катализаторов
339
СН3
Н3С
><
НзС Ш2ГТОаСНз
I
и продукт с эмпирической формулой C6Hi2N2O5 (II), имевший
т. пл. 101—104°. Строение динитросоединения (I) доказано
восстановлением его в диамин; второй продукт реакции (II)
давал при восстановлении смесь диамина и оксамина, на осно-
основании чего Н. Я. Демьянов и К. В. Сидоренко приписывают
ему следующее строение:
НзС i СН3
o2n6
\
и
Этими же исследователями, при применении в качестве
нитрующих агентов N2OS, N2O4 и N2O3, получены продукты
присоединения NO2 к изобутилену, гексилену, диаллилу
и другим непредельным углеводородам жирного ряда.
Взаимодействие тетраметилэтилена с N2O4 подробно изу-
изучали Михаэль и Карлсон [11]. При проведении реакции в эфир-
эфирном- растворе авторы получали до 22% 2,3-динитро-2,3-диме-
тилбутана, в отсутствие же растворителя или в растворе пет-
ролейного эфира динитропродукт получается лишь с небольшим
выходом. Во всех своих опытах авторы отмечают получение
нитронитрата, которому Н. Я. Демьянов и К. В. Сидоренко
приписывали строение II.
По данным этих авторов, этот продукт получается в результа-
результате присоединения N2O4 и последующего окисления. Михаэль
и Карлсон приходят к выводу, что динитрит не образуется.
Эти же авторы изучали взаимодействие N2O4 с изобутиленом
в различных условиях. При проведений процесса в эфирном
растворе продукты реакции восстанавливались, и по составу
полученных продуктов восстановлений можно было судить
о первоначальном составе продукта Взаимодействуя с N2O4.
Таким образом, было определено, что в растворе серного
22*
340
Нитрование органических соединений окислами 'азота
эфира получаются соединения
СН8Н
Н3С — С — СН с выходом 16—23% от теории;
ONO NO,
. . СН3
Н3С — С = СН с выходом 5—12% от теории;
N0,
сн8
Н3С — С — СН2 с выходом 12% от теории.
02N0 NO,
При проведении реакции в отсутствие растворителя или
в петролейном эфире, получается нитрозонитрат с выходом
~13% от теории
СН„
s • HgC —— С — GHg
OaNO NO
. Если вместо изобутилена исходить из триметилэтилена [12],
¦то в эфирном растворе получается
-:::¦¦¦¦ ¦ ' ¦ СН3
igC —— С — СН — СНз
н3
ON
O
С выходом 35% от теории,
Шаарщмидти Гофмейер [13, 14] нашли, что при действии
Жидкой N2O4, на непредельные углеводороды получается смесь
продуктов .различного характера, причем состав этой смеси
в каждом отдельном случае зависит от природы данного оле-
фина и температурных условий проведения реакции. По
пре\дст.авленшо этих ..химиков, в результате присоединения
"*т ~* к одефинам возможно образование следующих четырех
Нитрование без катализаторов
341
типов соединении:
— СН —N0
— СН — 0N02
— СН —N02
— СН — 0N0
I. Нитроваты
(нитровонв-
траты)
II. Азотистые
эфиры нитро-
спиртов (нитро-
нитриты)
— СН — N02
— СН —N02
III. Динитро-
соединения
(«динитрюры»)
— СН — 0N0
— СН — 0N0
IV. Авотистые
эфиры гликолей
(динитриты)
Иа этих соединений устойчив лишь динитрюр (III), у которого
оба атома азота непосредственно связаны с атомами углерода;
соединения остальных типов (I), (II) и (IV) легко подвергаются
превращениям и дают другие продукты реакции. '
Соединение типа I (нитрозонитрат), аналогично отщеп-
отщеплению НС1 у продуктов присоединения хлора, отщепляет
HNOe; последняя окисляет образовавшийся нитрозоолефин.
Соединение типа II (нитронитрит) может распасться на нитро-
олефин и азотистую кислоту, которая далее разлагается по урав-
уравнению 3HNO2 = ЕШОз-Ь Н2О4- 2N0. Азотистая кислота
и, вероятнее, азотная, полученная по указанному выше уравне-
уравнению, действуют на нитроолефин, окисляя последний. Ди-
нитрит (IV) легко отщепляет азотистую кислоту с одновременным
образованием весьма нестойкого олефин-нитрита.
При пропускании чистого этилена в очищенную жидкую
двуокись азота при 0° Смит [15] получил с хорошим выходом
а, ^-динитроэтан. Согласно этому же автору, при пропускании
N2O4 в эфирный раствор тетраметилэтилена получается 2,3-
динитро-2,3-диметилбутан с выходом —22% . Аналогичным
образом получаются 1,2-динитропропан и 1,2-динитроизо-
бутан [16].
Описан процесс получения 1,2-динитроциклогексана из
N2O4 и циклогексена при 300° и давлениях до 100 атм. [17].
Леви [18] получал динитроэтан одновременным пропуска-
пропусканием этилена (со скоростью 30 л/час) и кислорода (со скоростью
8 л/час) в жидкую N2O4 C л) при 0° в течение 10,5 часа. За
время реакции адсорбировалось 228,5 л этилена и 24,4 л кисло-
кислорода. После удаления сухим воздухом избыточной N2O4 из
полученного масла при сильном охлаждении (твердая
342
Нитрование органических соединений окислами азота
СО2+СН3ОН) выделяют—400 г 1,2-динитроэтана,что составляет
—33% от теории, считая на этилен, и —40%, считая на N2O4.
Левй с сотрудниками [19] исследовали также реакцию
взаимодействия пропилена, бутилена, циклогексена, 2,4,4-
триметилпентена-1 и 2,4,4-триметилпентена-2 с N2O4. При
работе с газообразными олефинами ток углеводорода про-
пропускался через раствор N2O4 в эфире. Жидкие олефйны при-
приливались к N2O4, или же, наоборот, эфирный раствор N2O4
добавлялся к углеводороду. Реакция проводилась при невы-
невысоких температурах (от —5 до 0°). Во избежание образования
азотистого ангидрида в некоторых опытах через реакционную
смесь пропускался слабый ток кислорода.
В результате исследования было установлено, что взаи-
взаимодействие N2O4 с олефинами приводит к образованию двух
веществ: динитросоединения и нитронитрита. В случае несим-
несимметричной молекулы олефина группа ONO всегда присоеди-
присоединяется к атому углерода, связанному с меньшим числом атомов
водорода. Так, например, при присоединении четырехокиси азота
к пропилену образуются динитропропан CH8CH(NO2)CH2NO2
и а,р-нитроизопропилнитрит CH3CH(ONO)CH2NO2.
Ввиду неустойчивости нитронитритов они не выделялись в
чистом виде, а подвергались гидролизу с образованием нитро-
спиртов. В некоторых опытах в смеси продуктов реакции были
обнаружены нитронитраты, которые возникли в результате
окисления нитронитритов.
Согласно наблюдениям Леви и Скейфа, при взаимодействии
олефинов с N2O4b отсутствие растворителя, наряду с реакцией
присоединения, происходит также окисление олефина. В ка-
качестве растворителей использовались простые и сложные
эфиры: диэтиловый эфир, диоксан, этилацетат и др. Авторы
полагают, что эфиры образуют комплекс с молекулой N2O4, что
подавляет окислительное действие последней [20].
Действием двуокиси азота (NO2) на окись этилена [21] по-
получается 2-нитроэтиловый спирт, если реакцию вести следу-
следующим образом: к 92 г NO2 и 1000 г СНСЬ при 0° медленно
прибавляют 50,г окиси этилена и 250 г СНСЬ, охлажденных
до 0°. Оставляют стоять на 12—15 час. при комнатной темпера-
* Нитрование бее катализаторов
343
туре, после чего отгоняют СНСЬ при 50° и получают 135 г
нитроэтилнитрата, который после омыления 10% -ным раствором
Na2C(>3 дает 2-нитроэтиловый спирт.
[З-Нитроэтиловый спирт получается также при обработке
окиси этилена нитритом натрия [22] при одновременном про-
пропускании углекислого газа: в раствор 200 г NaNOa в 1 л воды
пропускаются СО2 и окись этилена при 25—30°. Выпадающий
ТЧаНСОз отфильтровывается. Фильтрат перегоняется, давая
235 г O2N — СН2 — СН2 — ОН (85%) с т. кип. 107—110°
при 20 мм.
Кроме того, [3-нитроэтиловый спирт получается при про-
пропускании окиси этилена в раствор нитрита бария. 130 г окиси
этилена барботируют через раствор 400 г Ba(NO2J в 100 мл
Н2О; 2-нитроэтанол получается с выходом 93% .
Нагреванием тетрахлорэтилена (или тетрабромэтилена) с
N2O4 в запаянной трубке при 100° в течение 3 час. Бильц
[23] получил симм. динитротетрахлорэтан с хорошим выхо-
выходом. В этих же условиях ос,а-дифенил-р,р-дихлорэтан
(С6НбJС = СС1а образует дифенилдинитродихлорэтан
(C6HBJC(NO2) — C(NO2)C12.
При взаимодействии этилена с двуокисью азота(NО2), со-
содержащей примесь NO, при температуре 20—60° и давлении
выше 50 атм.получаются неустойчивый продукт присоединения,
легко разлагающийся при 50—100° в присутствии пара, и
2-нитроэтанол, который выделяется обычным способом
[24].
При взаимодействии N2O4 с углеводородами, содержащими
•систему сопряженных двойных связей, происходит присоеди-
присоединение в положение 1,4. Так, например, при проведении реакции
с 1,3-бутадиеном как в различных растворителях, так и в па-
паровой фазе образуется 1,4-диннтро-2-бут?н [25].
Как указывалось выше, аналогичное течение реакции
отмечалось Виландом [6, 7].
В некоторых случаях наблюдается присоединение NO2
в положение 1,2 конъюгированной системы. Так, например,
при действии N2O4 на 1-циано-1,4-дифенил-1,3-бутадиен полу-
получается 1-циано-1,4-дифенил-3,4-динитро-1-бутен [26].
344
Нитрование органических соединений окислами азота
CeH5 — С = СН — СН = СН — СвН5 --5- СвН5 — С = СН — СН — СН — С„Н5
CN . CN N02 1ЧОа
Наряду с этим Аллен [27] отмечает присоединение как в по-
положение 1,2 так и в положение 1,4 сопряженной системы.
Так, Например, действие N2O4 на 2,3-дифенил-1,3-бутадиен
выражается уравнением:
¦Ю2№СНгС = ССН2ЫОг
,-Г™1
I
С6Н3 CBHS
NO2
Н2С=С С—CH2NO2
I I
QHS ссн5
§2. Нитрование ароматических и гетероциклических
соединений
Нитрование ароматических соединений окислами азота
изучается сравнительно давно. Еще в 1871 г. Газенбах [28]
нашел, что При взаимодействии N2O4 с бензолом в течение 7
дней При комнатной температуре образуется нитробензол
наряду со Щавелевой кислотой.
Азотистый ангидрид, легко присоединяясь к непредельным
соединениям; вступает в реакцию с ароматическими углеводо-
углеводородами лишь в результате разложения на окись и двуокись
азота по уравнению [29]:
N2OS->
Лидс [30] насыщал двуокисью азота бензол в течение мно-
многих дней на холоду; при этом получены нитробензол, щаве-
щавелевая и пикриновая кислоты. Повидимому, при этом бблыпая
часть бензола- остается без изменения. При действии же NOa
на кипящий бензол, кроме указанных выше продуктов, обра-
образуются еще два соединения, из которых Лидсом идентифици-
идентифицировало только одно (моПооксипроизводное с т. пл. 205°). Этот
же автор Нитровал двуокисью азота толуол, ксилол, цимол,
Нитрование бее катализаторов
345-
нафталин, антрацен и фенол. При насыщении толуола дву-
двуокисью азота на холоду в течение 3 мес. получены о-нитро-
толуол и другие продукты окисления: метилдинитродиоксибен-
зол CeH(CH3)(NO2J(OHJ (игольчатые кристаллы с т. пл.
110°), щавелевая и диоксибензойная кислоты. При проведении,
реакции аналогично нитрованию толуола ксилол дает о-нитро-
ксилол и продукты окисления: Щавелевую, п-толуиловую
и фталевую кислоты, а цимол дает а-нитроцимол, щавелевую^
и п-толуиловую кислоты. При нитровании нафталина дву-
двуокисью азота получены: мононитронафталин, динитронафталин,
тетраоксинафталин и нафтодихинон. Фенол, который нитруется
очень легко, дает пикриновую кислоту. При насыщении
двуокисью азота раствора антрацена в ледяной уксусной кис-
кислоте в качестве единственного продукта реакции образуется
антрахинон с выходом 58 г при загрузке 50 г антрацена.
Фридбург [31] видоизменил метод Лидса, проводя нитро-*
вание бензола при повышенной температуре. Окислы азота
предварительно растворялись в сероуглероде и полученный
раствор смешивался с бензолом; при этом была получена смесь
нитро- и п-динитробензола.
Нитрование антрацена двуокисью азота исследовано также
Либерманом и Линдеманом [32] и Мейзенгеймером [33], ко-
которые, в отличие от Лидса, получили при этой реакции нитро-
соединения. Либерман и Линдеман пропускали двуокись азота
медленной струей в антрацен, смешанный с 4 ч. ледяной ук-
уксусной кислоты, причем температура реакции поддерживалась
не выше 10—15°. Полученное нитросоединение отделялось
от избыточного антрацена посредством обработки кипящим
бензолом, в котором это соединение нерастворимо (в раствор
переходил только антрацен). Мейзенгеймер получил 9,10-
динитро-9,10-дигидроантрацен при действии жидкой N2O4
на антрацен, смешанный с хлороформом. В то же время при
действии N2O4 на антрацен, суспендированный в бензоле или
растворенный в нитробензоле, образование нитропроизводных
антрацена не наблюдается [34]. В первом случае образуются
лишь следы антрахинона.а во втором случае получается высокий
выход антрахинона.
346
Нитрование органических соединений окислами азота
На этих примерах ясно видна зависимость получающихся
продуктов реакции цри нитровании N2O4 от характера раство-
растворителя. 1-Хлорантрацен [35] с сухой N2O4 в среде четырех-
хлористого углерода образует продукт присоединения, который
при нагревании с пиридином превращается в 1-'Хлор-9(или
10)гвитроантрацен.
, 1,5-Дихлорантрацен дает 1,5-дихлор-9,10-динитро-9,10-
дигидроантрацен, который при нагревании с пиридином пре-
превращается в 1,5-дихлор-9-нитроантрацен.
Виланд [36] нитровал двуокисью азота ароматические
углеводороды, фенолы и амины. Нитрование бензола, которое
проводилось в запаянных трубках при 80°, дало лишь неболь-
небольшой выход нитробензола. При применении эквимолекулярных
количеств бензола и NO2 получены, наряду с продуктами
окисления (СО2, щавелевая кислота и др.), главным образом
1,3,5-тринитробецзол и пикриновая кислота, причем часть
бензола осталась без изменения. Опыты цо нитрованию нитро-
нитробензола показали, что последний не нитруется при проведении
реакции аналогично нитрованию бензола. Анализируя эти
результаты, Виланд приходит к выводу, что нитрование бен^
зола не является ступенчатой реакцией. Автор полагает, что
•бензол сразу присоединяет 6 частиц NQ2 (аналогично присо-
присоединению к бензолу хлора и брома на солнечном свету) с об-
образованием гексанитроциклогексана; последний распадается
далее на тринитробензол и 3 молекулы азотистой кислоты:
O2NHC
O2NHC
CHNO,
3N2O4
O2NHC
CHNO2
CHNO2
CH
GHNO2 N02—Cj
CHNO2 HC
CHNO2
:-no2
CH
C —N02
+ 3HNO2
Нитрование нафталина в растворе эфира на холоду приводит
лишь к небольшому выходу нитросоединений, в то время как
Нцтравание беа катализаторов,
347
¦без применения растворителя реакция протекает энергично
с образованием а-нитронафталииа.
Фенолы легко реагируют с ГЮа со значительно лучшими
выходами, чем при нитровании их азотной кислотой. Для
нитрования этих соединений Виланд применял растворы
двуокиси азота в смесях бензола с цетролейным эфиром или
газолином и проводил реакцию при хорощем охлаЗДвднда Щ
сильном перемешивании. Им получены следующие результаты:
фенол дает в качестве продуктов реакции н- и о-нитрофедолы
с преобладанием первого, причем общий выход нитропродуктов
ло отношению к фенолу составляет 125% от веса взятого фе-
фенола. При нитровании о-, п- и м-крезолов получается смесь
изомерных нитросоединений. При действии NOa на 1, 3,4-кси-
ленол образуется с хорошим выходом 5-нитропроизводноо
(т. пл. 72°), а а-нафтол дает цри нитровании смесь 2-нитро-
нафтола и 2,4-динитронафтола.
При нитровании ацетанилида N2Q4 в среде эфира
на холоду Виланд получил диазобензоилнитрат и ук-
суеиую кислоту. Следует отметить, что при действии NaO*
на анилин в бензольном растворе Витт [37] таюке Получил
бензолдиазонитрат с количественным выходом (ср. с рабо-
работами автора настоящей книги по изучению взаимодействия
анилина и ацетанилида с N2O4 в хлороформе, см. стр. 357).
Нитрование дифениламина проводилось Виландом в рас-
растворе абсолютного эфира или же смеси бензола с петролей-
ным эфиром в отношении 4 : 1. В первом случае в качестве
основного, продукта реакции получен дифенилнитрозоамин
(кристаллическое соединение с т. пл. 66°), во втором случае —
п-нитродифенилнитрозоамин. Для объяснения образования
дифенилнитрозоамина Виланд допускает, что у N2O4, наряду
с молекулами со структурой O2N — NO2, существуют молекулы,
имеющие строение О = N — О — NO2, с которыми дифенил-
дифениламин реагирует по следующему уравнению:
(CeH5J NH + О = N — О — NO2 -* <GeH6JN— NO + HQNO2.
I 'и ' :
Взаимодействие ди-п-толилгидроксиламина с NjOj в хо-
холодном эфирном или бензольном растворе приводит н образо-
348
Нитрование органических соединений окислами азота
ванию о,о'~динитро-п-толиламина [38]. В этой же работе-
Виланд указывает, что дифениламиноксид с Na04 образует
п, п' -динитродифенил амин оксид.
Относительное количество применяемой для нитрования
NaO* оказывает значительное влияние на течение реакции.
С большой убедительностью это было показано в работе Бат-
Баттегей и Керна 139], которые исследовали реакции нитрования
N2O4 монометиланилина и диметиланилина. При взаимодей-
взаимодействии монометиланилина с эквимолекулярным количеством
N2O4 в бензольном растворе в течение 5 дней получается с вы-
выходом 55,4% п-нитро-ДО-нитрозомонометиланилин (т. пл. 100°).
Если же при указанных условиях применять избыток N2O4,
то основным продуктом реакции будет 2,4-динитромонометил-
анилин с т. пл. 175° (выход 50—60%). При нитровании ди-
метиланилина, которое проводилось N2O4, растворённой в бен-
эоле, при температуре реакции не выше 10° (молярное отно-
отношение реагентов 1 :1) получены п-нитродюивтиланилин и
п-нитрозодиметиланилин (в виде нитрата). Образование этих
продуктов Баттегей и Керн объясняют следующими реакциями*
CeH5N (CHS}2 + N2O4 -* O2NCAN (СН3J + HNO2;
CeH5N (СН3)„ + HNOa -» ONCAN (CH,J + Н2О;
N2O4 + Н2О -* HNO2 + HNO3;
„J + HNO3-* HON = СД = N (CHSJNO3.
При увеличении относительного количества N2Q4 до 2 мо-
молей на 1 моль диметиланилина образуется главным образом
s 2,4-динитро диметил анилин наряду с небольшим количеством
п-нитродиметиланилина.
Шааршмидт и Смолла [40] нитровали некоторое аромати-
ароматические соединения жидкой N2O4 на холоду при соотношении:
1 ч. N2O4 на 3 ч. углеводорода. В этих условиях бензол дает
нитробензол, пикриновую кислоту и в небольшом количестве
динитробензол; при действии N2O4 на толуол продуктами
реакции оказались нитротолуол, динитрокрезол, нитрофенол,
бензальдегид, щавелевая и бензойная кислоты. ,,С увеличением
продолжительности реакции значительно повышается отно-
Нитрование беа катализаторов
349
сительный выход бензойной кислоты, а выход нитропроизвод-
ных несколько уменьшается.
Ксилол и мезитилен реагируют с N2O4 весьма энергично
с выделением тепла. При этом вместо нитросоединений полу-
получаются смолистые массы, которые, по данным анализа, содер-
содержат азот и значительные количества кислорода. Эти результаты
указывают, что при действии N2O4 на ксилол и мезитилен
преобладают реакции окисления.
Шааршмидт, Бальцеркевич и Ганте [41] нитровали ди-
метиланилин раствором N2O4 в четыреххлористом углероде.
Раствор 9,3 г N2O4 @,1 моля) в 20 г четыреххлористого уг-
углерода вливали постепенно в раствор 12,3 г диметиланилина
@,1 моля) в 100 г четыреххлористого углерода при перемеши-
перемешивании и наружном охлаждении смесью льда с поваренной
солью. После прибавления всего количества N2O4 реакцион-
реакционную смесь оставляли в охлаждающей смеси еще в течение
3 час. По окончании нитрования реакционную массу разме-
размешивали с водой и извлекали органическую часть эфиром. После
отгонки растворителей и перекристаллизации остатка из спир-
спирта получен с выходом 86% от теории п-нитро-N-диметил-
анилин (желтые иглы с т. пл. 162°).
Нитрование галоидированных ароматических соединений
в отсутствие серной кислоты, А1СЬ и других катализаторов
протекает недостаточно удовлетворительно. Фторбензол не
реагирует с N2O4 в растворе четыреххлористого углерода
даже после длительного G2 часа) взаимодействия. Иодбензол
в этих же условиях дает смесь о- и п-иоднитробензола с выхо-
выходом 45% от теории. Хлорбензол и бромбензол образуют со-
соответствующие хлорнитро- и бромнитропроизводные, но с мень-
меньшим выходом.
Обширно)е систематическое исследование реакции нитрон
вания органических соединений окислами азота проводилось
с 1934 г. автором настоящей книги (до 1939 г. совмести©
с П. П. Шоршгиным [42]). Эта реакция была изучена как вядаД-
кой, так и в газообразной фазах на многочисленных приме-
примерах разнообразных органических соединений (ароматических
углеводородов, фенолов, аминов, гетероциклических соеди-
350 Нитрованы органических соединений окислами ааота
нений и др.). причем установлено влияние различных факторов
(облучения, температуры, соотношения реагентов и т. д.) на
Рйс. 1. Сгейа нитрования углеводородов
двуокисью азота в жидкой фазе
процесс нитрования. Ниже приведены полученные нами экс-
экспериментальные данные с подробным описанием опытов и
методики исследования продуктов реакции.
Нитрование в жидкой фазе проводили в специальном ап-
аппарате (рис. 1), который состоял из реакционной коябы 1,
соединенной на шлифах с охлаждаемой снаружи водой бю-
'реткой 2 для жидкой N2O4 и с холодильником 3, наполненным
смесью льда с поваренной солью. Конденсация продуктов
реакции происходила в трубках 4, также охлаждаемых смесью
льда с солью. В реакционный сосуд, который в зависимости
от температуры реакции в одних опытах охлаждали, в других
нагревали на металлической бане> наливали нитруемое соеди-
Нитрование без катализаторов
351
нение и затем из бюретки постепенно, по каплям, прибавляли
N2O4.
Нитрование нафталина
Опыты проводили при различных температурах и раз-
различных соотношениях реагентов» NjOj прибавляли по каплям
из бюретки в продолжение 30-"~40 мин. По окончании реакции
содержимое колбы и приемников переносили в колбу Вюрца
и при 22—40° отгоняли непрореагировавпгую N2O4. Остаток
выливали в насыщенный раствор соды, причем выпадал гряз-
ножелтый осадок; последний отфильтровывали, промывали
водой и обрабатывали холодным бензолом (или сероуглеродом),
который растворял «-мононитронафталин. После отгонки рас-
растворителя и перекристаллизации остатка из горячего спирта
получен а-мононитронафталин (удлиненные желтые иглы с
т. пл. 57—58,5°). Полинитронафталины, нерастворившиеса
в • бензоле, экстрагировали кипящим ацетоном, в который
переходили 1,8-динитронафталин и 1,3,8-тринитронафталин.
A,5-динитронафталин в ацетоне не растворяется).
Ацетонную вытяжку после отгонки ацетона обрабатывали
горячим спиртом, из которого при охлаждении выкристалли-
выкристаллизовывался 1,8-динитронафталин; последний очищался повторной
перекристаллизацией из спирта (т. пл. 172°). Нерастворив-
шийся в спирте 1,3,8-тринитронафталин растворяли в горячем
хлороформе, из которого выделяли при охлаждении в виде
ромбических табличек желтого Цвета продукт с т. пл. 218°.
1,5-Динитронафталин (см. выше) после перекристаллизации из.
бензола и ледяной уксусной кислоты выделен в чистом виде-
(желтые кристаллы с т. пл. 215°).
Приводим результаты наиболее характерных из проведен-
проведенных опытов по нитрованию нафталина (табл. 19).
Как видно из данных табл. 19, при 18—20° нафталин дает
как с теоретическим, так и с избыточным количеством NjO&
а-мОнонитроИафталин с выходом 90—96% от теории по взя-
взятому в реакции нафталину. При 60° нафталин нитруется тео-
теоретическим количеством N2O4 с образованием исключительно-
352
Нитрование органических соединений окислами азота
а-мононитронафталина (выход 92,6% от теории); при избытке
же N2O4, наряду с а-мононитронафталином (выход 78—90% от
теории), получается также 1,5-динитронафталин (выход 12%).
При 150° нитрование теоретическим количеством ^О4
дает исключительно а-мононитронафталин; если же приме-
применять большой избыток N2O1 (в 7—8 раз больше теоретического
количества), то продуктами реакции оказываются также по-
линитронафталины: 1,5-динитронафталин (выход 36%), 1,8-
динитронафталин (выход 18%) и небольшое количество 1,3,8-
тринитронафталина (выход 2%),
Таблица 19
Нитрование нафталина A0 г) жидкой N2O4
СО
i
1
2
з
4
5
6
7
8
9
Температура,
"С
18—20
18—20
18—20
60
60
60
150
150
150
1 '
о
Я
Е- р.
6
12
20
6
12
20
6
¦ 40
50
а-МОЕОВИТрО-
вафталвна
г
13,0
12,0
12,5
12,5
11,0
10,5
12,0
4,0
4,0
% от
теорети-
теоретического
96
90
92,6
92,6
80
78
90
30
30
в ы
х о д
1,5-дннитро-
нафталина
г
—
—
—
2,0
2,0
—
6,0
6,0
%от
теорети-
теоретического
—
—
—
12
12
—
36
36
1,8-динитро-
нафталива
г
—
—
—
—
—
3,0
3,0
% от
теорети-
чесвого
—
—
—
—
—
—
18
18
Анализ указанных выше результатов приводит к заключе-
заключению, что для получения оптимального выхода а-мононитро-
нафталина (96% от теории) необходимо проводить реакцию
дри 18—20°, применяя теоретические количества N2O4. Боль-
Большой избыток последней и высокая температура реакции (выше
150°) способствует преимущественному образованию поли-
нитропроизводных.
•Нитрование бее катализаторов
353
Нитрование дифенила
Нитрование проводили при комнатной температуре в тече-
течение 1—2 час. избытком N2O4. По окончании опыта, после уда-
удаления N2O4, не вошедший в реакцию дифенил отгонялся с во-
водяным паром. Остаток растворяли в ледяной уксусной кислоте,
из которой дробной кристаллизацией выделены о- и п-нитро-
дифенил: при охлаждении раствора выкристаллизовывался
п-изомер, при разбавлении маточного раствора водой выде-
выделялся о-изомер. Для очистки этих продуктов они несколько
раз были перекристаллизованы из снирта, причем получены
п-нитродифенил с т. пл. 113—114° и о-изомер с т. пл. 37°.
Нитрование антрацена
Нитрование антрацена проводили в растворе хлоро-
хлороформа (в отсутствие растворителя реакция протекает
очень энергично, сопровождаясь осмолением). К 5 г антрацена
в 100 мл хлороформа прибавляли по каплям в течение 45—
50 мин. 30 мл N2O4 при температуре около 0° (охлаждение
льдом). В результате нитрования получен 9,10-динитроантра-
цен, который очищен многократной перекристаллизацией сы-
сырого продукта из уксусной кислоты и спирта. Выход 9,10-
динитроантрацена составлял 6 г, что соответствует 80% от
теории.
Нитрование фенантрена
5 г фенантрена в 100 мл хлороформа обрабатывали 30 мл
жидкой N2O4 в течение 45 мин. при 0°. Избыток N2O4 удаляли
из реакционной смеси продуванием сухой СО2. После отгонки
хлороформа остаток выливали в холодную воду и выделив-
выделившееся при этом масло растворяли в спирту при нагревании.
Для разделения продуктов реакции (мононитрофенантренов)
применен метод дробной кристаллизации. Спиртовый раствор
масла охлаждали и выделившиеся на стенках стакана кристал-
кристаллы отделяли от масла. Масло растворяли в спирту, охлаждали,
причем выделялась вторичная фракция кристаллов; оставшееся
23 А. В. Топчиев
354
Нитрование органических соединений окислами азота
масло после отделения от кристаллов опять растворяли в спир-
спирту и т. д. В результате такой обработки получены 2-монони-
трофенантрен в виде светложелтых кристаллов с т. пл. 99° (выход
1,7 г, что соответствует 32% от теории), 9-мононитрофенантрен
с выходом 0,7 г A1% от теории) в виде оранжево-желтых кри-
кристаллов с т. пл. 116—117°, 4-мононитрофенантрен в виде жел-
желтых игл с т. пл, 80—82° (выход 3%) и в незначительном количе-
количестве 3-мононитрофенантрен (т. пл. 170—171°).
Необходимо отметить, что метод дробной кристаллизации,
примененный для разделения нитрофенантренов, приводил к
значительным потерям исходного продукта; при выходе сырого
продукта 7—7,5 г общий выход перекристаллизованных продук-
продуктов составлял 2,6 г. (Следует отметить, что Шмидт и Гейнле
[43], нитровавшие фенантрен смесью азотной кислоты и уксус-
уксусного ангидрида, получили выход сырого нитропродукта в
2—2,5 раза меньше.)
Нитрованиефенола
Для выяснения оптимальных условий реакции опыты про-
проводили при различных температурах. 5 г фенола обрабаты-
обрабатывали 20—30 мл жидкой N2O4 в течение 30 мин. По окончании
нитрования отгоняли не вошедшую в реакцию N2O4 и реак-
реакционную смесь подвергали перегонке с водяным паром; при
охлаждении из водного дестиллята выделялись кристаллы
в виде желтоватых листочков. Остаток обрабатывали эфиром;
экстрагированный продукт, после отгонки зфира, извлекали
спиртом и спиртовый раствор обесцвечивали животным углем
при кипячении; при прибавлении воды к спиртовому раствору
выделен 2,4-динитрофенол, который при возгонке дал кристал-
кристаллы в виде золотистых игл с т. пл. 113—114°.
Кристаллы, выделившиеся из водного дестиллята, иденти-
идентифицированы как 2,4-динитрофенол (после возгонки они плави-
лис?ь при 113—114°). Мононитрофенолы в продуктах реакции
не обнаружены.
Необходимо отметить, что нитрование фенола N2O4 яв-
Нитроеание без катализаторов
355
ляется экзотермической реакцией: при отсутствии охлаждения
температура поднимается до 100—105°.
Результаты опытов по нитрованию фенола приведены в
табл. 20.
Таблица 20
Нитрование фенола жидкой N2O4
E г фенола, 25 мл N2O4)
Jft опыта
1
2
3
4
Температура,
°С
0
58—60
98—100
150—154
Выход 2,4-дивитрофенола
г
7,5
7.0
6,0
4 0
% от теоре-
теоретического
76
71
61
41
Как видно из данных табл. 20, оптимальной является тем-
температура реакции 0° (наибольший выход 2,4-динитрофенол а
76%).
Нитрование м-крезола
Нитрование проводили аналогично обработке фенола. Из
водного дестиллята, полученного при перегонке продукта реак-
реакции с водяным паром, выделен 4,6-динитро-м-крезол (т. пл.
63—65°).
Остаток после отгонки 4,6-динитрокрезола с водяным паром
экстрагировали эфиром, который затем отгоняли; полученный
таким образом 2,4,6-тринитро-м-крезол очищали от примеси смо-
смолистых веществ многократной перекристаллизацией из горячего
лигроина (т. пл. 107—109°). Реакция нитрования м-крезола
сопровождается значительным выделением тепла (при отсут-
отсутствии охлаждения температура в реакционной колбе подни-
поднимается до 115°).
Варьирование температур реакции дало следующие резуль-
результаты (табл. 21).
23*
356
Нитрование органических соединений окислами азота,
Таблица 21
Нитрование м-креаола (жидкой N2O4
A0 г м-крезола, 40—50 мл N2O4, продолжительность реакции
50—55 мин.)
J* парал-
параллельных
опытов
1
2
3
Температура,
"С
0
98—100
Около 115
Выход 4,6-динитрокре8ола
г
1,5—2,0
1,0—1,5
1,0-1,5
% от теоре-
теоретического
8—10
5,5-8
5,5—8
Выход 2,4,6-трвнитроврезола
г
6,0
7,0-7,4
7,0
% от теоре-
теоретического
26,7
31,1—33
31
Основной продукт нитрования — это 2,4,6-тринитрокре-
зол, наибольший выход которого C1—33 %) получен при тем-
температуре реакции 98—100°; при понижении температуры до
0° (наружное охлаждение) выход тринитрокрезола несколько
падает, причем повышается выход другого продукта реакции —
4,6-динитрокрезола.
Нитрование {3-нафтола
Нитрование проводили в растворе хлороформа A : 20),
так как в отсутствие растворителя происходит значительное
оемоление продукта. К 5 г р-нафтола в 100 мл хлороформа по-
постепенно приливали 25—30 мл жидкой N2O4 при продолжи-
продолжительности нитрования 55—60 мин. По окончании нитройания
отгоняли избыток N2O4 и реакционную смесь обрабатывали
раствором соды; водно-щелочной слой отделяли от хлороформен-
ного и подкисляли соляной киелотой; при этом выпадал осадок,
который отфильтровывали, высушивали и растворяли в спирту;
к спиртовому раствору, обесцвеченному кипячением с живот-
животным углем, добавляли воду, причем выделялся 1,6-динитро-р-
нафтол (т. пл. 195—196°). Небольшое количество 1,6-динитро-
р-нафтола получено также из хлороформенного раствора.
Результаты наиболее характерных опытов приведены в
табл. 22.
Нитрование беа катализаторов
357
Таблица 22
Нитрование ^-нафтола жидкой N2O4
E г р-нафтола, 25—30 мл N2O<j, продолжительность
нитрования 55—60 мин.)
Ш опыта
1
2
3
4
Температура, °С
0
0
55—60
55—60
Вьдод
6,5
5,5
5,0
4,5
1,6-дшштро-З-нафтола
% от теорети-
теоретического
81
69
62,5
56,2
Как видна из табл. 22, оптимальной температурой нитро-
нитрования {3-нафтола является 0° (выход 1,6-динитро-{3-нафтола до
81 % от теории). При повышении температуры до 55—60° зна-
значительно увеличивается количество образующихся смолистых
продуктов, и выход 1,6-динитронафтола соответственно пони-
понижается.
Нитрование анилина
К 10 г анилина в 100 мл хлороформа приливали 30 мл N2O4
в течение 40—45 мин. при наружном охлаждении реакционной
смеси снегом с солью. По окончании нитрования отгоняли
N2 О4 (при 40°) и хлороформ (при 80°); остаток перегоняли с водя-
водяным паром. Выделившиеся из водного дестиллята желтоватые
кристаллы (листочки) 2,4-динитрофенола очищали возгонкой,
причем получены кристаллы в виде золотистых игл с т. пл.
113—114°. Этот продукт идентифицирован по отсутствию
понижения точки плавления смешанной пробы его с 2,4-динш-
трофенолом. Остаток в колбе после отгонки с паром 2,4-дини-
2,4-динитрофенола подщелачивали и затем экстрагировали эфиром. Из
эфирной вытяжни отгоняли эфир, и полученный в остатке
нитроанилин перркристаллизовывался из спирта и воды (иголь-
(игольчатые кристаллы с т. пл. 145—147°). Опыты по нитрованию ани-
358
Нитрование органических соединений окислами азота
лина при указанных выше условиях проведения реакции дали
5 г 2,4-динитрофенола, что соответствует 25% от теории, и
около 1 г п-нитроанилина, что соответствует 7% от теории.
При нитровании анилина без охлаждения выходы обоих про-
продуктов понижаются приблизительно в 2 раза.
Полученные результаты совпадают с данными Ринкса [44].
Однако необходимо отметить, что этот автор не обнаружил
образования п-нитроанилина при нитровании анилина N2O4.
Варма и Кришамурти [45] при изучении действия окислов
азота (из смеси HNOs и As2Os) на ароматические амины нашли,
что последние подвергаются диазотированию с последующим
нитрованием, в результате чего происходит образование нитро-
фенолов. При нитровании хлористоводородного анилина в
водном растворе при 0° они получили 2,5-динитрофенол.
Ринке, однако, показал, что при нитровании анилина дву-
двуокисью азота получается не 2,5-, а 2,4-динитрофенол.
Нитрование диметиланилина
К 5 г диметиланилина в 50 мл хлороформа приливали 30 мл
N2O4 в течение 45—50 мин. По окончании реакции отгоняли
N2O4 и хлороформ, а остаток растворяли в ледяной уксусной
кислоте;, раствор выливали в холодную воду, причем выпадал
светложелтый осадок п-нитродиметиланилина; после пере-
перекристаллизации из спирта выделен чистый п-нитродиметил-
анилин в виде желтых игл с т* пл. 164—166°. Кроме п-нитроди-
п-нитродиметиланилина получен в незначительных количествах м-изо-
мер.
Варьирование температуры реакции показало, что опти-
оптимальной температурой является 0° (выход п-нитродиметил-
п-нитродиметиланилина 4,7 г, что соответствует — 70% от теории). При повы-
повышении температуры до 55—60° выход п-нитродиметиланилина
снижается до ~ 55%.
По литературным данным [46], при действии NO2 на диме-
тиланилин в четыреххлористом углероде (молярное отношение
диметиланилина к NO2 = 1,6) наблюдается преимущественное
замещение в ядро с образованием п-нитродиметиланилина.
Нитрование без катализаторов
359
Условия реакции были следующие: к взвеси 0,05 моля диметил-
диметиланилина в 50 мл четыреххлористого углерода прибавляют по
каплям раствор NO2 в СС14. Начальная температура реакции 15°,
продолжительность опыта 2,5 часа, конечная температура 5°.
Выход п-нитродиметиланилина не указан. Реагируя с избыт-
избытком NO2, п-нитродиметиланилин превращается в 2,4-динитро-
диметиланилин и далее в 2,4-динитро-]Ч-нитрозомонометил-
анилин. Выход последнего продукта 62% от теории. 2,4,6-
тринитродиметиланилин не реагирует с NO2. Из 2,4,6-три-
хлордиметиланилина и NO2 в описанных условиях реакции
получен 2,4,6-трихлор-М-нитрозомонометиланилин с выхо-
выходом 86%. Из N.N-диметил-п-толуидина и NO2 образуется про-
продукт одновременного замещения в ядро и в боковую цепь, а
именно: 4-метил-2,6-динитро-]Ч-нитрозомонометиланНлин с
выходом 44% *
Нитрование ацетанилида
Раствор 5 г ацетанилида в 150 мл хлороформа нитровали
30—40 мл N2O4 в течение 35—40 мин. при 60—70°. По окон-
окончании реакции отгоняли избыток N2O4 и хлороформ, и остаток
подвергали перегонке с водяным паром. Водный дестиллят
экстрагировали эфиром. После отгонки эфира получен о-нитро-
ацетанилид, который был перекристаллизован из горячей
воды и спирта (т. пл. 91—92°).
Остаток в колбе после отгонки с паром о-нитроацетанилида
экстрагировали эфиром; нерастворившийся в эфире продукт
промывали холодной водой и раствором двууглекислой соды,
а затем растворяли в горячей воде: из горячего водного рас-
раствора выделен п-нитроацетанилид, который был перекристал-
перекристаллизован из спирта (т. пл, 204—206°).
Из эфирной вытяжки получено еще некоторое дополнитель-
дополнительное количество о-нитроацетанилида с т. пл. 92—93°. „
Ацетанилид при нитровании в указанных выше условиях
дал выход п-нитроацетанилида 3,5—4 г, что соответствует
53—60% от теории; о-нитроацетанилид получен с выходом 2 г
C0% от теории).
360
Нитрование органических соединений окислами азота
Опыты по нитрованию аминов N2O4 дали, таким образом,
следующие результаты: анилин, кроме небольшого количества
п-нитроанилина, дает в качестве основного продукта реакции
2,4-динитрофенол (предполагаемый механизм реакции — ди-
азотирование аминогруппы с последующим нитрованием ядра);
амины же с защищенной аминогруппой (диметиланилин и ацет-
анилид) образуют лишь замещенные в ядре нитросоединения,
т. е. ацил- и диалкиламиногруппа, как и следовало ожидать,
остается без изменения.
Нитрование хинолина
Из гетероциклических соединений изучено нитрование хи-
хинолина в жидкой фазе. Опыты проводили при весовом отноше-
отношении N2O4 к хинолину 5:1, причем варьировалась температура
реакции.
По окончании реакции содержимое колбы выливали в воду
(туда же прибавляли остаток из конденсационных трубок по-
после отгонки из них N2O4); выделившийся при этом осадок от-
отфильтровывали от кислого фильтрата, в котором находились
растворенные мононитрохинолин и хинолин (в виде солей), и
обрабатывали 40%-ным раствором КОН; из щелочной жидко-
жидкости динитрохинолин экстрагировали бензолом. Бензольный
раствор, по'сле сушки над твердым КОН, кипятили в течение
нескольких часов с животным углем для осветления перво-
первоначально темной жидкости, затем из него отгоняли раствори-
растворитель и продукт очищали многократным осаждением водой из
спиртового раствора и лигроином из бензольного. В результате
указанной обработки выделен динитрохинолин в виде желто-
желтоватых игл с т. пл. 170—180°. Повидимому, этот продукт пред-
представлял собой смесь 5,7-динитрохинолина с другими нитро-
производными (по Кауфману и Гюсси [47] чистый 5,7-дини-
трохинолин плавится при 180°). К кислому фильтрату добав-
добавляли NaOH и щелочной раствор экстрагировали смесью эфира-
с бензолом. После сушки эфирно-бензольной вытяжки над
КОН отгоняли эфир и бензол и затем в вакууме — хинолин.
Остаток — сырой 7-мононитрохинолин был очищен двукрат-
Нитрование без катализаторов
361
ной перегонкой с водяным паром (т. пл. очищенного 7-монони-
трохинолина 130—131°); смешанная проба последнего продукта
с 7-мононитрохинолином, приготовленным по методу Скраупа
из м-нитроанилина, глицерина, серной и мышьяковой кислот,
плавилась при 130—131°.
Результаты опытов по нитрованию хинолина N2O4 при раз-
различных температурах приведены в табл. 23.
Таблица 23
Нитрование хинолина
B0 г хинолина, 100 мл N2O4)
се
Я
о
?
1
2
3
4
5
6
7
8
Температура,
"С
14—16
95—100
100—105
150—155
155—160
150—160
155-160
150
Л
8 и
Л g
Is
°1
Вш
55
60
60
65
60
55
90
95
В ы
мононитрох ино-
г
(
3
3
1
0,5
1
0,5
1
% от тео-
ретиче-
ретического по
взятому
хинолину
?леды
11
11
3,7
1,85
3,7
1,85
3,7
ход
динитрохинолина
г
—
—
3,5
3,5
4
3
2
% от тео-
ретиче-
ретического по
взятому
хинолину
—
10,3
10,3
11,8
9
5,9
Получено обрати
хинолина
г
18
15
14
13
14
12
12
12,5
% от
взятого
хинолин я
90
75
70
65
70
60
60
62,5
Как видно из этих данных, нитрование хинолина N2O4
протекает с небольшим выходом нитропроизводных (по взятому
хинолину); при температуре реакции около 100° образуется
только мононитрохинолин (выход 11%); при более высоких тем-
температурах A50—160°) основной продукт реакции — динитро-
динитрохинолин (выход 10—12%), выход же мононитрохинолина зна-
значительно уменьшается. Несмотря на применение большого из-
избытка N2O4 (пятикратное количество по отношению к хино-
хинолину), основная часть взятого хинолина не вступает в реакцию
(при 155—160° до 60—70%). При комнатной температуре нит-
нитрование хинолина не происходит.
362
Нитрование органических соединений окислами азота
II. Нитрование в газовой фазе
Нитрование органических соединений двуокисью азота в
газовой фазе проводилось нами в специальном аппарате (рис. 2),
снабженном ртутной лампой, что давало возможность изучать
влияние освещения ультрафиолетовыми лучами на протекание
V7I
20
Рис. 2. Схема нитрования углеводородов двуокисью азота
в газообразной фазе:
этой реакции. Аппарат состоял из вертикальной кварцевой
ртутной лампы 7 системы Гереус-Ханау, окруженной двумя кон-
концентрическими кожухами, из которых наружный 5 служил
реакционным сосудом, а внутренний б (ближайший к лампе) —
холодильником или нагревателем (смотря по температурным
условиям опыта); через внутренний кожух посредством отса-
отсасывания воздуха водоструйным насосом из конической колбы
16 пропускали нагреваемую или охлаждаемую жидкость (из
колбы 1 на бане 2, наполненной водой или вазелиновым маслом);
температуру этой жидкости измеряли двумя термометрами
Нитрование без катализаторов
363
Зи 15. Испарение углеводорода и N2O4, которые приливали по
каплям из бюреток 10 и 14, происходило в колбах 8 и 12, нагре-
нагревавшихся в банях 9 и 13 до необходимой температуры (бюрет-
(бюретка 14с N2O4 окружена водяной рубашкой для предотвращения
испарения N2O4).
Для регулирования скорости поступления в реакционную
камеру паров углеводорода и N2O4 через колбы 8 а 12 пропу-
пропускали ток СО2, которую предварительно обезвоживали пропу-
пропусканием через скляяки 11 с серной кислотой. Пары продуктов
реакции конденсировали сначала в холодильнике 4, затем в
охлаждаемых снаружи конденсационных склянках 17 и погло-
поглотительных склянках 18 с раствором соды и, наконец, остатки
улавливали активированным углем в турмах 19. Для облег-
облегчения прохождения газов и паров через конденсационно-по-
глотительную систему их отсасывали насосом 20, помещенным
в конце системы. Все части аппаратуры соединены шлифами
или спаями.
Нитрование бензола
40 г бензола, 180 г N2O4 и 40—50 л СО2 пропускали в тече-
течение 2 час. через реакционную камеру. По окончании опыта
отгоняли при 25—40° невошедшую в реакцию N2O4, а остаток
подвергали перегонке для отделения нитробензола от непрореа-
гировавшего бензола. Как и при нитровании толуола, динитро-
производных бензола в продуктах реакции не обнаружено.
Результаты наиболее характерных опытов приведены в табл. 24.
Из данных табл. 24 видно, что облучение ультрафиолето-
ультрафиолетовым светом не улучшает выхода нитробензола по сравнению
с опытами без облучения. Это указывает на то, что ультрафиоле-
ультрафиолетовые лучи влияют на нитрование положительным образом
лишь в тех случаях, когда полная симметрия молекулы нару-
нарушена наличием боковой цепи, благодаря которой возможно
таутомерное превращение с образованием таутомернои системы
конъюгированных двойных связей (как это имеет место в слу-
случае толуола, см. ниже).
Оптимальные результаты (выход нитробензола около 32%
от теории) получены при 55—60°.
364
Нитрование органических соединений окислами азота
Таблица 24
Нитрование бензола двуокисью азота
D0 г бензола, 180 г
ев
3
§
1
2
3
4
5
6
7
8
Темпера-
Температура, °С
10-12
25—30
55—60
80—85
10-12
25—30
55—60
80—85
Выход нитро-
нитробензола
г
8
18
20
8
8
17
20
8
% от тео-
ретиче-
ретического
12 7
28,6
31,7
12,7
12,7
27,0
31,7
12,7
Получено обратно
бензола
г
33
25
20
22
32
25
22
20
% от тео-
ретиче-
ретического
82,5
62,5
50,0
55,0
80,0
62,5
55,0
50,0
Примечание
)
\ С облучением
)
)
1 Без облучения
)
В другой серии опытов по нитрованию бензола варьирова-
варьировалось отношение N2O4 к бензолу. Эти опыты показали, что при
применении 100 г N2O4 на 40 г бензола (что соответствует мо-
молярному отношению 2 : 1), выход нитробензола остается без
изменения, по сравнению с выходами в предыдущей серии опы-
опытов (см. табл. 24), где это отношение равнялось 4:1. При
уменьшении же количества N2Oi до 50 г (отношение 1 : 1) вы-
выход нитробензола значительно понижается (до 6,5%). Таким
образом для получения оптимальных результатов необходимо
применять избыток N2O4 B моля N2O4 на 1 моль бензола).
Нитрование толуола
Опыты по нитрованию толуола двуокисью азота произво-
производились нами как с облучением ультрафиолетовым светом, так
и без облучения.
Нитрование толуола двуокисью азота проводилось следую-
следующим образом. Через реакционную камеру в течение 2 час. про-
пропускали 40 г толуола, 200 г N2O4 и 40—45 л СО2. По окончании
Нитрование без катализаторов
365
опыта содержимое конденсационных склянок 17 (рис. 2) пе-
переливали в колбу, соединенную (на шлифах) с холодильником,
через который пропускали охлажденную до 0° воду, и при
25—40° отгоняли непрореагировавший избыток N2O4 для ис-
использования в дальнейших опытах. Остаток выливали в боль-
большое количество воды, куда добавляли промывные воды от спо-
ласкивания всех частей аппарата, содержимое поглотительных
склянок 18 и конденсат, полученный при отгонке с перегретым
паром продуктов, адсорбированных в турмах 19 активирован-
активированным углем. После стояния продукты реакции разделялись на
два слоя: масляный и водный. Масляный слой отделяли, вод-
водный слой обрабатывали эфиром и эфирную вытяжку присоеди-
присоединяли к масляному слою. Масло с эфирной вытяжкой промы-
промывали раствором соды и водой и после отгонки растворителя пе-
перегоняли с водяным паром. Масло перегналось полностью, что
указывало на отсутствие динитротолуолов. Выделившееся в вод-
водном дестилляте масло отделяли от воды и обрабатывали 20% -ным
раствором NaOH. После стояния в течение ночи отделяли
щелочной раствор от нерастворившегося в NaOH масла и об-
обрабатывали последнее эфиром (эфирный раствор А). При ней-
нейтрализации щелочной вытяжки соляной кислотой выделялась
кристаллическая аци-форма фенилнитрометана, которая по-
постепенно приобретала маслообразную консистенцию вследствие
перехода в нейтральную форму. Последнюю экстрагировали
эфиром (эфирный раствор Б). После отгонки эфира из раствора Б
получен чистый фенилнитрометан с т. кип. 140—142° при
35 мм.
Нерастворившееся в NaOH масло и эфирный раствор А
дали смесь изомерных мононитротолуолов с т. кип. 217—238°.
Результаты наиболее характерных опытов по нитрованию
толуола двуокисью азота приведены в табл. 25.
Данные табл. 25 показывают, что при нитровании толуола
двуокисью азота образуются главным образом мононитро-
толуолы наряду с фенилнитрометаном. Оптимальные резуль-
результаты при освещении ультрафиолетовыми лучами получены при
14—15° (выход мононитротолуолов 46% , фенилнитрометана9% ).
С повышением температуры до 58—60° выход фенилни-
366
Нитрование органических соединений окислами азота
Таблица 25
Нитрование толуола двуокисью азота
D0 г толуола, 200 г N2O4)
g
t.
1
2
3
4
5
6
7
Температура,
°C
14—15
58—60
105—110
14-15
58—60
105—110
140—145
Выход
фенил-
нитрометана
г
5
5,5
3
4
5
3
2,5
к
а> о
si
8,5
9,4
5
7
8,5
5
4,2
Выход
нитро-
толуолов
г
27
15
10
19
И
11
10
к
2°
si
46,2
25,5
17
32,5
18,8
18,8
17
Получено
обратно
толуола
г
16
23
15
22
27
20
16
штого
1
% ОТ В!
толуола
40
57,5
37,5
55
67,5
50
40
Примечание
[ С облучением
;
]
\ Вез облучения
1
1
J
трометана остается почти без изменения, а выход нитротолуолов
значительно уменьшается (до 17%).
Без облучения нитрование протекает менее эффективно.
Необходимо отметить, что относительные количества фенилнит-
рометана и нитротолуолов в опытах с освещением остаются
без изменения по сравнению с опытами без освещения, несмотря
на увеличение выходов.
Н. А. Валяшко, В. И. Близнюков и А. Е. Луцкий [48]
нитровали толуол двуокисью азота следующим способом: ре-
реакция N2O4 C моля) с толуолом A моль) проводилась в запаян-
запаянной стеклянной трубке при температуре до 70°. Уже при ком-
комнатной температуре реакция шла очень энергично. При тем-
температуре 70° наблюдались взрывы. Основным направлением
реакции было вступление NO2 в метильную группу, побочное
направление реакции — вступление в ядро с образованием
мононитротолуолов. В процессе нитрования образуются про-
продукты окисления — бензойная и щавелевая кислоты. Катали-
Катализаторы, обычно направляющие нитрогруппу в ядро, в этих ус-
Нитрование без катализаторов
367
ловиях оказались недеятельными. Замедление реакции
N2O4 с толуолом было достигнуто заполнением трубок струж-
стружками из нержавеющей стали, разведением реакционной смеси
CCl* и уменьшением количества NgO^ до 1,7—1 моля на 1 моль
толуола. Ускорение реакции нитрования в ядро достигнуто
прибавлением к реакционной смеси 0,27—0,4 моля уксусного
ангидрида на 1 моль толуола, причем было получено 2,5—3%
2,4,6-тринитротолуола и до 30% нитротолуолов. Образовав-
Образовавшиеся мононитротолуолы дальше не нитруются. При нитро-
нитровании толуола в ядро получаются только моно- и тринитрото-
луолы без промежуточного образования динитротолуола. За-
Замена ангидрида на уксусную кислоту не вызывает ускорения
реакции.
Нитрование этилбензола
15 г этилбензола (т. кип. 136—138°), 70—80 г N2O4 и
15—20 л СО2 пропускали через реакционную камеру в течение
50—55 мин. По окончании нитрования отгоняли N2O4 из конден-
конденсационных склянок 17 (рис. 2) и смешивали их содержимое
с содержимым поглотительных склянок 18 ш с конденсатом,
полученным при отгонке с перегретым паром продуктов, ад-
адсорбированных активированным углем. Смесь при стоянии
разделялась на два слоя: масляный и водный. Масляный слой
отделяли и к нему присоединяли эфирную вытяжку, получен-
полученную посредством обработки эфиром водного слоя. После про-
промывания 5%-ным раствором соды, а затем водой отгоняли эфир
и масло подвергали перегонке с водяным паром; при этом в
водный дестиллят переходили метилфенилнитрометан и моно-
нитроэтилбензол. В жидкости, оставшейся после отгонки ука-
указанных выше нитросоединений, динитроэтилбензола не обна-
обнаружено.
Для отделения метилфенилнитрометана от мононитроэтил-
бензола масло, находящееся в водном дестилляте, обрабаты-
обрабатывали 20%-ным раствором едкого натра при энергичном встря-
встряхивании в течение 20 мин. и оставляли для отстаивания на ночь.
Щелочной раствор отделяли после этого от нерастворившегося
368
Нитрование органических соединений окислами азота
в NaOH масла, промывали эфиром для извлечения остатков
нитроэтилбензола и подкисляли 20 %-ной соляной кислотой до
кислой реакции на конго; при этом из раствора выделялась
в виде беловатых хлопьев аци-форма метилфенилнитрометана,
которая даже при долгом стоянии не превращалась в нейтраль-
нейтральную форму.
Через 10—12 час. метилфенилнитрометан экстрагировали
эфиром и после сушки эфирной вытяжки над хлористым каль-
кальцием отгоняли эфир и очищали продукт возгонкой в вакууме.
Полученный таким образом метилфенилнитрометан представ-
представлял собой бесцветные кристаллы с т. пл. 97—99°*. К нераство-
рившемуся в щелочи маслу добавляли эфирную вытяжку, по-
полученную обработкой щелочного раствора эфиром (см. выше),
отгоняли эфир и подвергали остаток дробной перегонке. При
этом сначала отгоняли этилбензол при 136—138°, а затем пе-
перегонялась смесь нитроэтилбензолов в интервале 223—246°.
Результаты наиболее характерных опытов по нитрованию
этилбензола приведены в табл. 26.
Таблица 26
Нитрование этилбепзола двуокисью азота
A5 г этилбензола, 70—80 г N2O4)
3
и
о
¦?
1
2
3
4
Темпера-
Температура, °С
10-12
78—80
10—12
78—80
Выход метил-
фенилнитро-
фенилнитрометана
г
4,5
8
3
6
% от
теорети-
теоретического
21,4
40
14,3
28,6
Выход нитро-
э тплбензолов
г
5
5
3
4,5
% от
теорети-
теоретического
24
24
14,3
21,4
Получено обратно
этилбензола
г
7
2,5
8
2
% от
взятого
этил-
этилбензола
46,7
16,7
53,3
13,4
Примечание
1 С облу-
/ чением
1 Без облу-
/ чения
* Эти результаты но согласуются с данными М. И. Коновалова
[49]: полученный последним при нитровании этилбонзола азотной кислотой
(уд. в. 1,075) метилфенилнитрометан не затвердевал даже при —1Ь и
имел т. кип. 135° при 25 мм.
Нитрование без катализаторов
369
Из данных этой таблицы видно, что нитрование этилбен-
этилбензола двуокисью азота приводит к образованию мононитроэтил-
бензолов наряду с продуктом замещения группой NO2 в боко-
боковой цепи — метилфенилнитрометаном. При 10—12е и прове-
проведении реакции при освещении ультрафиолетовыми лучами
выход нитроэтилбензолов несколько превышает выход метилфе-
метилфенилнитрометана (общий выход нитросоединений 45%); при
повышении температуры до 78—80° общий выход нитросоеди-
нитросоединений достигает 64% , причем выход метилфенилнитрометана
повышается почти вдвое (до 40%), выход же нитроэтилбензо-
нитроэтилбензолов остается без изменения. Такая же закономерность (увели-
(увеличение выхода с повышением температуры главным образом
нитросоединений, замещенных в боковой цепи) наблюдается
и в опытах без облучения, которые в общем дали более низкие
выходы нитропроизводных сравнительно с опытами, проводив-
проводившимися при облучении.
Нитрование м-ксилола
Нитрование м-ксилола двуокисью азота и разделение про-
продуктов реакции проводили аналогично нитрованию толуола и
этилбензола.
20 г м-ксилола с т. кип. 139—140°, 140—150 г N2O4 и 20—
25 л СО 2 пропускали через реакционную камеру в течение 50—
60 мин. при 12—14°. В результате нитрования выделены: толил-
нитрометан (желтоватое масло с т. кип. 128—132° при 19 мм),
смесь мононитроксилолов, которые перегонялись при 225—
245°, и небольшое количество динитро-м-ксилолов.
Опыты с освещением ультрафиолетовыми лучами дали 21 г
мононитроксилолов G3,9% от теории по взятому м-ксилолу),
7 г толилнитрометаиа B4,6% от теории); кроме того, получено
незначительное количество @,5 г) динитро-м-ксилолов. Опыты
без облучения дали более низкие выходы мононитропроизвод-
ных: 16 г мононитроксилолов, что соответствует выходу 56,3%
от теории, и 6 г толилнитрометана B1% от теории); выход
24 л. В. Топчиев
370
Нитрование органических соединений окислами азота
динитро-м-ксилолов оказался несколько больше, чем в опытах
с облучением C,5% от теории).
Эти результаты указывают, что нитрование м-ксилола
двуокисью азота в газовой фазе протекает вполне удовлетво-
удовлетворительно уже при 12—14°, причем основным продуктом реакции
являются мононитроксилолы. При применении освещения уль-
ультрафиолетовыми лучами получен почти количественный общий
выход нитропроизводных м-ксилола, при нитровании же без
освещения общий выход этих соединений составляет 81% .
Нитрование пиридина
Нами изучено также нитрование двуокисью азота пиридина,
который, по литературным данным, нитруется с большим тру-
трудом. Так, например, Фридль [50] действовал на пиридин
смесью 18% -ной дымящей серной кислоты с нитратом калия при
330°, пропуская одновременно через реакционную смесь силь-
сильную струю воздуха. В результате нитрования им получен
,8-нитропиридин (т. пл. 41°) с выходом 15% от теоретического.
Шааршмидт, Бальцеркевич и Ганте [41] нитровали пири-
пиридин N2O4 как без катализаторов, так и в присутствии А1С13,
но не получили положительных результатов.
Нитрование пиридина осуществлялось нами следующим об-
образом: 20 г пиридина (предварительно высушенного и пере-
перегнанного над В аО), 100—150 г N2O4 (т. кип. 22—25°) и 15—20 л
GO2 пропускали в течение 1 часа через реакционную камеру.
По окончании нитрования все части аппарата промывали чи-
чистой N2O4, промывную жидкость смешивали с содержимым
конденсационных склянок и выливали в колбу с пришлифован-
пришлифованным термометром и с пришлифованным либиховским холодиль-
холодильником, через муфту которого пропускалась ледяная вода. При
слабом нагревании при температуре 25—40° отгоняли непрореа-
гировавшую N2O4- Остаток в колбе обрабатывали раствором
соды и экстрагировали эфиром; из эфирного раствора отгоняли
эфир, а затем не вошедший в реакцию пиридин; оставшуюся
бурую массу растворяли в азотной кислоте (уд. в. 1,4). После
долгого стояния в этом растворе образовались кристаллы азот-
- Нитрование без катализаторов
371
нокислой соли ^-нитропиридина. При добавлении соды к вод-
водному раствору этой соли выделялось свободное основание, ко-
которое перекристаллизовали из смеси бензола с лигроином; по-
полученный таким образом р-нитропиридин представлял собой
бесцветные иглы с т. пл. 41—42°.
Опыты при более высоких температурах B00—300°) прово-
проводили в тугоплавкой стеклянной трубке (трубке для сожжения),
наполненной стеклянными бусами [51].
Попытки осуществить нитрование пиридина N2O4 в газо-
газовой фазе при температурах выше 300° привели к сильному
взрыву, разрушившему аппаратуру. Очень сильные взрывы
наблюдались также при смешивании пиридина с жидкой N2O4
при комнатной температуре.
В табл. 27 приведены результаты опытов по нитрованию
пиридина двуокисью азота при различных температурах. •
Таблица 27
Нитрование пиридина двуокисью азота
B0 г пиридина, 100—150 г N2O4)
ь
и
о
?.
1
2
3
4
5
6
7
Температура,
"С
14—15
58—60
115—120
14—15
58—60
115—120
220—230
Выход |
>-нитро-
пиридина
г
1,0
1,5
2,0
1,0
1,5
2,0
2,0
% от
теории
3,2
4,8
6,4
3,2
4,8
6,4
6,4
Получено обратно
пиридина
г
13
12
12
И
13
12
10
% 01
взятого
пиридина
65
60
60
55
65
60
50
Примечание
\ С облучением
1
Без облучения
Из указанных опытов по нитрованию пиридина можно сде-
сделать следующие выводы: 1) освещение ультрафиолетовым све-
светом не оказывает влияния на выход нитросоединений, что
24*
372
Нитрование органических соединений окислами ааота
объясняется симметричным строением молекулы пиридина (ана-
(аналогия с бензолом и нафталином); 2) оптимальной температурой
нитрования является 115—120°; повышение температуры до
220—230° не изменяет выхода нитропиридина; 3) при вит-
ровании большая члсть пиридина не вступает в реакцию
F0-65% )•
При нитровании пиридина двуокисью азота в продуктах
реакции обнаружена также азотнокислая соль пиридина
GeH5N.HNO3, образование которой может быть объяснено
действием на пиридин азотной кислоты, получающейся по
уравнению
N2O4 + Н2О -» HNO2 + HNO8
(пиридин, благодаря свойственной ему гигроскопичности, со-
содержит воду, которая и реагирует с N2O4).
Азотнокислый пиридин образуется также при действии па-
паров N2O4 на жидкий пиридин при комнатной температуре или
при приливании по каплям жидкой N2O4 к хорошо охлажден-
охлажденному (смесью льда с поваренной солью) пиридину, выделяясь
в обоих случаях в виде красного кристаллического осадка;
при перекристаллизации этого осадка из горячего спирта ни-
нитрат пиридина получается в чистом виде (бесцветные кристал-
кристаллы с т. пл. 117—118°).
III. Нитрование ароматических соединений
нитрозными газами
Для выяснения возможности использования для нитрова-
нитрования ароматических соединений окислов азота (нитрозных га-
газов), получающихся в больших масштабах при производстве
азотной кислоты из атмосферного азота, проведены опыты с
искусственной газовой смесью, которая по своему составу соот-
соответствовала промышленным нитрозиым газам A0% N2O4, 80%
N,, 5% О2 и 5% Н,О).
Эта смесь приготовлялась следующим образом: из бюрет-
бюретки, охлаждаемой водяной рубашкой, приливали жидкую
N2O4 в колбу Вюрца, которую нагревали на водяной бане;
образовавшиеся пары N2O4 переходили во вторую колбу, где
Нитрование без катализаторов
373
происходило смешение их с газовой смесью, поступавшей из
газометра и составленной в определенных объемных отношениях
из N2, О2, Н2О; из смесителя газы направляли в реакционную
камеру-нйтратор, куда поступали пары нитруемого соединения
(из испарителя).
Нитрование бензола
В служившую испарителем колбу Вюрца, которую нагре-
нагревали до температуры кипения бензола, приливали по каплям
бензол из пришлифованной к колбе бюретки, охлаждаемой во-
водяной рубашкой; пары бензола через отводную трубку направ-
направляли в колбу-нитратор емкостью 500 мл, где они встречались
с нитрозными газами, поступавшими из смесителя. Продукты
реакции вместе с непрореагировавшим бензолом и избытком
N2O4 конденсировали сначала в холодильнике, затем в системе
соединенных друг с другом (на шлифах) приемников, которые
охлаждали сухим льдом до —80°. По окончании опыта содер-
содержимое приемников сливали вместе и отгоняли при 25—40° из-
избыток N2O4; остаток подвергали перегонке для разделения нс-
прореагировавшего бензола и нитробензола.
Результаты наиболее характерных опытов по нитрованию
бензола нитрозными газами, проводившихся при различных
температурах (в каждом опыте смесь 40 г бензола и нитроз-
нитрозных газов в количестве, содержащем 47 г N2O4, пропускали
через реакционную камеру в течение 2 час), приведены
в табл. 28.
Как видно из этих данных, оптимальные результаты (вы-
(выход нитробензола по взятому бензолу около 13% ) получаются
при 55—60°, причем значительная часть (80% ) бензола остается
без изменения (выход по бензолу, вступившему в реакцию,
65%).
Нитрование нафталина
10 г нафталина и нитрозные газы в количестве, отвечающем
8 г N2O4, пропускали через реакционную камеру в течение
374
Нитрование органических соединений окислами азота
Таблица 28
Нитрование бензола нитрозными газами
D0 г бензола, 47 г N2O4)
J* опыта
2
3
Температура,
-С
15—18
55—60
90—100
Выход нитробензола
г
5
8
4,5
% от теоре-
теоретического
8
12,9
7,25
Получено обратно бензола
г
35
32
35
% от взятого
бензола
87,5
80,0
87,5
2 час. при 18—20°. В результате нитрования получено 13 г
а-мононитронафталина, что соответствует выходу 96% от тео-
теории. Динитросоединений в продуктах реакции не оказалось.
ВЫВОДЫ
Анализируя результаты наших исследований по нитрова-
нитрованию окислами азота ряда ароматических и гетероциклических
соединений, можно прийти к следующим основным выводам.
1) При нитровании бензола, нафталина и фенантрена по-
получаются главным образом мононитропроизводные; наиболее
легко нитруется нафталин; выход а-мононитронафталина при
температуре реакции 18—20° составляет 96% (без примеси
полинитропроизводных). При температурах выше 60° обра-
образуются также полинитропроизводные. Нитрование фенантре-
фенантрена при 0° приводит к смеси мононитрофенантренов с общим вы-
выходом 48% . Бензол нитруется труднее, чем предыдущие соеди-
соединения; выход нитробензола составляет 32% при температуре
реакции 55—60°.
2) В отличие от указанных углеводородов, при нитровании
антрацена основным продуктом реакции является 9,10-динит-
роантрацен с выходом 80% от теории (оптимальная темпера-
температура 0°).
3) Освещение ультрафиолетовыми лучами не оказывает ни-
никакого влияния на реакцию нитрования ароматических угле-
Нитрование без катализаторов
375
водородов с симметричным строением молекулы (бензол, наф-
нафталин и др.).
4) Нитрование ароматических соединений с боковой цепью
(жирноароматические соединения) приводит к одновременному
образованию мононитропроизводных, замещенных как в бо-
боковой цепи, так и в ядре, с преобладанием последних. Напри-
Например, при освещении ультрафиолетовыми лучами толуол
дает 46% мононитротолуолов и 9% фенилнитрометана (при
температуре реакции 14—15°), а этилбензол — 40% нитроэтил-
бензолов и 24% метилфенилнитрометана (при 78—80°).
5) Освещение ультрафиолетовыми лучами при нитровании
ароматических соединений несимметричного строения приводит
к повышению выхода нитропроизводных сравнительно с опы-
опытами без освещения (например, м-ксилол нитруется с общим
выходом нитропроизводных 99% при освещении и 81% без
освещения).
6) Нитрование фенолов протекает сравнительно легко,
причем образуются динитро- и тринитропроизводные. Фенол
дает 2,4-динитрофенол с выходом 76% , м-крезол—смесь 2,4,6-
тринитро- и 4,6-динитро-м-крезолов с общим выходом 41% ,
а ^-нафтол — 1,6-динитро-^-нафтол с выходом 81% . Оптималь-
Оптимальные температуры нитрования: для фенола 0°, м-крезола 98—
100°, ^-нафтола 0°.
7) Нитрование аминов протекает различно в зависимости
от того, защищена аминогруппа или нет. Нитрование анилина
при незначительном выходе п-нитроанилина приводит к пре-
преимущественному образованию 2,4-динитрофенола, что указывает
в качестве возможного механизма реакции на диазотирование
аминогруппы с последующим нитрованием ядра; нитрование
аминов с защищенной аминогруппой — диметиланилина и ацет-
анилида — протекает значительно легче, причем диметил-
анилин нитруется с образованием п-нитродиметиланилина с вы-
выходом 72% при температуре реакции 0°, а ацетанилид дает
смесь п- и о-нитроацетанилида; выход п-изомера 60% и о-изо-
мера 30% при температуре 60—70°.
8) Нитрование гетероциклических соединений протекает
значительно труднее соединений ароматического ряда;
376
Нитрование органических соединений окислами азота
хинолин при 95—100° нитруется с образованием мононитрохино-
лина с выходом 11% ; при 155—160° образуется главным обра-
образом динитрохинолин с выходом 10—12% ; нитрование пири-
пиридина приводит к небольшому выходу F%) [3-нитропиридина
(оптимальная температура 115—120°). При нитровании как
хинолина, так и пиридина, значительная часть нитруемого
соединения F5—70%) не вступает в реакцию и может быть
регенерирована. Необходимо отметить, что пиридин нитруется
двуокисью азота в газовой фазе уже при комнатной темпера-
температуре, тогда как по методу Фридля нитрованием НГЮз в смеси
с дымящей серной кислотой реакция осуществляется лишь
при 330°. .
9) Опыты по нитрованию газовой смесью, соответствующей
по составу промышленным нитрозным газам, показали, что
последние могут быть использованы для нитрования аромати-
ароматических соединений; например, нафталин нитруется нитрозными
газами при температуре 18—20° аналогично нитрованию чи-
чистой N2O4 с выходом 96% от теории.
Нитрование окислами азота
жирмоа рома тич еских
и алифатических углеводородов
А. И. Титов [52], посвятивший ряд работ нитрованию дву-
двуокисью азота органических соединений, установил, что при
соответствующих условиях нитрование жирноароматических
соединений может привести к вполне удовлетворительным вы-
выходам ы-нитропроизводных, причем отношение выходов нитро-
и динитропроизводных находится в зависимости от концентра-
концентрации NO и NO2 в реакционной смеси и температуры нитрования.
Влияние первого фактора доказано им экспериментально сле-
следующим образом: он смешивал одни и те же количества двуг
окиси азота B5 мл) и безводной CuSO4 B0 г) с различными ко-
количествами толуола и выдерживал эту смесь при 20° в течение
30 дней. Результаты оказались следующими:
Нитрование без катализаторов
37Т
Выход фенилдинитрометана, г .
Выход фенилнитрометапа, г . .
Количество толуола, мл
1000
23,5
5,0
250
7,3
3,9
50
2,6
2,1
Эти данные показывают, что с увеличением разбавления,
т. е. с уменьшением концентрации NO2 (при низких темпера-
температурах), выход динитропроизводных, в данном случае фенил-
фенилдинитрометана, повышается, что согласуется с выводами
А. И. Титова. Действительно, понижение концентрации N02
создает более благоприятные условия для соединения радика-
радикалов с NO, т. е. для образования нитрозосоединений, которые,
по мнению Титова, являются источником возникновения дини-
динитропроизводных:
NO2 . NO
С6Н5СН3 —> С6Н5СН2 -> C6H5CH2NO -»
+NSO,
-*• С6Н5СН = NOH > С6Н6СН (NO8)8.
Влияние температуры установлено А. И. Титовым опытами,
в которых последняя варьировалась от 20 до 95°.
Температура реакции
20° 40° 70° 95°
Выход фенилдинитрометана, г . . . 23,5 18,4 6,8 1,4
Выход фенилнитрометана, г .... 5,0 7,2 15,9 13,4
Увеличение выхода фенилдинитрометана с понижением тем-
температуры объясняется А. И. Титовым увеличением раствори-
растворимости окиси азота и уменьшением диссоциации на NO2 димер-
ной формы N2O4, присутствие которой необходимо для превра-
превращения нитрозосоединения в фенилдинитрометан (см. выше
схему реакции).
Выход фенилдинитрометана по отношению к фенилнитроме-
тану может быть повышен посредством насыщения реакцион-
реакционной смеси окисью азота. Например, смесь 18,4 г двуокиси азота
с 2 л толуола была предварительно насыщена окисью азота и
затем оставлена при комнатной температуре на 6 дней (опыт
№ 2). В сравнении с контрольным опытом (№ 1) без насыщения
окисью азота получены следующие результаты:
378 Нитрование органических соединений окислами азота
Опыт Опыт
№1 №2
Выход фенилнитрометана, г 3,7 2,3
Выход фенилдинитрометана, г 14,8 11,7
Отношение количеств динитро- и моно-
ннтросоединения 4:1 5:1
Приводим описание одного из опытов А. И. Титова по нит-
нитрованию толуола двуокисью азота на фенилдинитрометан,
давшего хорошие результаты: смесь 1500 мл толуола, 10 г дву-
двуокиси азота и 30 г безводной CuSO*, предварительно насыщен-
насыщенная при охлаждении окисью азота до привеса 1 г, была остав-
оставлена на 15 дней при температуре около 25—30°, причем в те-
течение первых 9 дней через каждые 3 дня прибавлялось по 10 г
двуокиси азота. В результате опыта получены следующие вы-
выходы продуктов реакции:
г %
Фенилнитрометан 4,6 10,3
Фенилдинитрометан 28,1 46,7
Бензойная кислота 4,3 10,6
В противоположность ы-динитросоединениям, образование
которых происходит благодаря взаимодействию с NO, со-моно-
нитросоединения возникают при действии на боковую цепь
жирноароматического углеводорода мономерной формы дву-
двуокиси азота (применяющаяся обычно для нитрования жидкая
N2O4 представляет собой равновесную смесь мономерной NO2
и димерной N2O4 форм двуокиси азота и, кроме того, некото-
некоторого количества NO).
Важнейшим фактором, определяющим направление реак-
реакции в сторону образования ы-мононитропроизводных; является
достаточно высокая температура реакции (оптимальная темпе-
температура 100°), способствующая сдвигу равновесия
N2O4 X 2NO2
слева направо, что создает высокую концентрацию NO2 в реак-
реакционной смеси.
Образованию ы-мононитросоединений благоприятствует
введение в сферу реакции кислорода, переводящего окись азота
Нитрование без катализаторов 379
в двуокись. Например, смесь 1750 мл толуола с 20 г безводной
CuSO4 насыщали в течение 4 час. двуокисью азота при нагре-
нагревании на кипящей водяной бане. Одновременно через смесь
пропускали кислород (опыт № 2). В сравнении с контрольным
опытом № 1, без введения кислорода, получены следующие
результаты:
Выход в % от теоретического
на прореагировавший толуол
Опыт W» 1 Опыт № 2
Фенилнитрометан 51 52,5
Фенилдинитрометан , 2,7 2,7
Бензойная кислота 7,1 11,2
Выход по связанному азоту с учетом регенерированной N2O4
составлял в опыте с введением кислорода (№ 2) 93%, в опыте
без применения кислорода (№ 1) 63% от теоретического.
Другим фактором, благоприятствующим выходу ы-моно-
нитропроизводных (в данном случае фенилнитрометана), яв-
является уменьшение концентрации раствора (при высоких тем-
температурах). При прочих равных условиях (температура 100°,
количество NO2 43 г, продолжительность насыщения 2 часа,
расход кислорода 8 л) опыт, где было взято 1750 мл толуола,
дал абсолютный выход фенилнитрометана в 3 раза выше, чем
при использовании 175 мл толуола.
Нитрование бензола двуокисью азота А. И. Титовым также
рассматривается как свободно-радикальный процесс. Роль пер-
первичного радикала, по мнению А. И. Титова, выполняет ради-
калоподобный комплекс — продукт присоединения электро-
фильной и радикалоподобной молекулы NO2 к бензольному
ядру
Н NO2
\/
-NO,
При этом по мере увеличения разведения бензолом одного
я того же количества окислов азота (N2O4) выход нитропроиз-
380
Нитрование органических соединений окислами азота
водных возрастает. Из продуктов реакции А. И. Титовым вы-
выделены нитробензол, м-и п-динитробензолы, симм. тринитро-
бензол, 2,4-динитрофенол, 2,4,6-тринитрофенол и щавелевая
кислота.
После опубликования работ П. П. Шорыгина и А. В. Топ-
Топчиева по нитрованию ароматических соединений двуокисью
азота Урбанский и Слон [53, 54] исследовали реакцию нитро-
нитрования алифатических предельных углеводородов двуокисью
азота в газовой фазе. Смесь паров N2O4 и углеводорода пропу-
пропускали через стеклянную трубку, наполненную стеклянными
кольцами, которую нагревали в электропечи до температуры
около 200°. Летучие продукты реакции конденсировались.
Избыток N2O4 удаляли на холоду током воздуха и остаток,
состоявший из нитропродуктов и непрореагировавшего углево-
углеводорода, промывали водой. После сушки над Na2SO4 из этой
смеси отгоняли углеводород. Оставшуюся смесь нитропродук-
нитропродуктов фракционировали в вакууме.
Экспериментальные данные показали, что выходы нитро-
нитропродуктов варьируют от 30 до 80% в зависимости от условий
нитрования и размеров реактора. Отношение между моно- и
динитропроизводными обычно составляет 60 : 40.
При нитровании пропана .получены нитропропан (т. кип.
31—34°) и <х,а'-динитропропан (т. кип. 42°) с общим выходом
нитропроизводных до 70% от теории; нитрование пентана дало
смесь 60% моно- и 40% динитропентана, из которой выделены
нитропентан (т. кип. 164—165° при 750 мм) и динитропентан
(в остатке). Гексан и гептан нитруются с образованием соот-
соответственно мононитрогексана (т. кип. 66—72° при 14 мм) и моно-
нитрогептана (т. кип. 199—200° при 750 мм) и динитросоедине-
ний. При нитровании метана в качестве продуктов реакции
получены нитрометан (с небольшим выходом) и полинитросо-
единения до тетранитрометана включительно.
Показано также, что при нитровании предельных углево-
углеводородов в указанных выше условиях основными продуктами
реакции являются первичные нитросоединения, содержащие
группу CH2NO2 (эти продукты идентифицировались по образо-
образованию нитроловых кислот и восстановлению последних до
.Нитрование без катализаторов
381
'^альдегидов при действии цинка и уксусной кислоты). Наряду
•с мононитропродуктами, отвечающими общей формуле
O2NCH2— (СН2)П— СН3, нитрование дает также динитропроиз-
водные общей формулы O2NCH2 — (СН2)П — CH2NO2.
Исходя из анализа жидких и газообразных продуктов реак-
реакции, Урбанский и Слон дают следующую схему нитрования
алифатических углеводородов:
2RCH3 + 4NO2 -> 2RCH2NO2 + H2O + NaO8
Кроме нитропроизвддных в продуктах реакции найдены аль-
альдегиды и жирные кислоты, образующиеся в результате окисли-
окислительного действия окислов азота.
Нитрование алифатических углеводородов двуокисью азота,
по данным авторов, представляет собой взрывоопасный про-
процесс (при проведении опытов в некоторых случаях наблюда-
наблюдались взрывы, сопровождавшиеся разрушением аппаратуры).
Хэсс и другие [55] при нитровании пропана окислами азота
К^гОа) при температуре 790—795° получили примерно равные
количества нитроэтана, 1- и 2-нитропропана. Более низкая
температура благоприятствует образованию 2-нитропропана.
Кроме нитропарафинов образуются различные продукты окис-
окисления: альдегиды, кислоты. Значительная часть исходного
вещества остается без изменений.
А. И. Титов [56] при нитровании н. пентана двуокисью
.азота при температуре 260—270° получил почти исключитель-
исключительно вторичный нитропентан и следы первичного.
Нитрование парафиновых углеводородов, согласно патент-
лым данным [57], можно осуществить, так же как и нитрование
-ароматических углеводородов, нитрозными газами, полу-
получающимися при каталитическом окислении аммиака. Продукты
реакции окисляются кислородом или воздухом с образованием
литропарафинов (предполагается, что первичная стадия
процесса состоит в образовании нитрозосоединений).
П. П. Шорыгин и А. В. Топчиев [58] установили, что при
взаимодействии н. гексана с N2O4, разбавленной углекислотой,
оолучается небольшой выход 2-нитрогексана. Реакция
382
Нитрование органических соединений окислами азота-
проводилась при температуре 10—80° в течение 1 часа. Цикло-
гексанв этих условиях дает около 15% мононитроциклогексана.
Эти же авторы [42] еще в 1935 г. показали возможность ни-
нитрования парафиновых углеводородов окислами азота при низ-
низких температурах. В последнее время автором настоящей книги
разработан оригинальный метод нитрования предельных угле-
углеводородов в газовой фазе посредством одновременного воздей-
воздействия хлора и окислов азота. Пользуясь этим методом, удалось
осуществить с хорошими результатами нитрование метана,
который, как известно, нитруется азотной кислотой и окислами
азота лишь при довольно высоких температурах с небольшим
выходом нитропроизводных.
Работа проводилась с природным саратовским газом, со-
содержащим 92—93% метана, 2,8% этана, 1,49% пропана, 0,56%
бутана и др. Для очистки от примеси высших гомологов метана
газ перед поступлением в реактор пропускали через колонку,
наполненную активированным углем. Опыты по изучению
реакции взаимодействия двуокиси азота и хлора на метан [59]
проводились в газообразной фазе в интервале температур от
комнатной B5—30°) до ~ 300° при отношении метан • окислы
азота = 4:1 и метан :хлор=1 : 3. Жидкие продукты реакции
растворяли в зфире, эфир промывали водой, затем 2%-ным рас-
раствором двууглекислой соды и сушили над хлористым кальцием.
После отгонки зфира на водяной бане масло переносили
в колбу с дефлегматором и подвергали фракционированной пе-
перегонке, в результате которой выделены фракции с температу-
температурой кипения 100—103° D5—49° при 22 мм), 120—124°, 128—132°
и 133—137°. Полученные фракции очищали вторичной перегон-
перегонкой. Опыты показали, что при 150—230° и отношениях
хлор : метан=1 : 3 и метан : окислы азота=4 : 1 получаются нит-
рометан, нитроформ, хлорнитрометан и хлортринитрометан с
общим выходом 77—93% по отношению к окислам азота, во-
вошедшим в реакцию. При 230°, кроме перечисленных продуктов,
образуются также хлороформ, метиловый спирт и муравьиная
кислота.
Полученный нитрометан имел т. пл. —29°. Взаимодействие
метана и хлора в этих условиях (без NaO4) не наблюдалось;
Нитрование без катализаторов
383
также не наблюдалось нитрование метана в отсутствие хлора.
При температуре 150—230° без повышенного давления реак-
реакция идет главным образом в сторону окисления.
На основании другой работы, проведенной в лаборатории
автора настоящей книги [60], было установлено, что при нитро-
нитровании циклогексана двуокисью азота в паровой фазе в присут-
присутствии галоидов при низких температурах A40—200°) реакция
идет значительно быстрее, чем без галоидов. Роль галоида за-
заключается, с одной стороны (при малых концентрациях), в ка-
каталитическом ускорении реакции циклогексана с NO2 по урав-
уравнению
СвН12 + 1,5 NO2 -2 C6HUNO2 + 0,5 NO + 0,5 Н2О,
и, с другой стороны, в активном участии в реакции
CeH12 + NO2 + 1,5 Х2 -> CeHuNO2 + НХ + Х2.
В присутствии больших концентраций галоида увеличиваются
выходы по двуокиси азота. Термодинамические расчеты ука-
указывают на крайне малую вероятность возникновения свобод-
свободного радикала циклогексила в качестве промежуточного про-
продукта при реакции циклогексана с NO2. Очевидно, роль актив-
активных центров в изучаемой цепной реакции должны выполнять
не радикалы, а сложные радикалоподобные промежуточные
комплексы [61]. Небольшой выход нитроциклогексана объяс-
объясняется тем, что наряду с основной реакцией протекают побоч-
побочные процессы, при которых происходит разложение нитро-
нитроциклогексана (при более высоких температурах). Продукты
разложения вступают в реакцию с NO2 и галоидом.
Бахман и сотрудники [62] исследовали влияние хлора, бро-
брома и иода на нитрование пропана окислами азота и азотной
кислотой.
При нитровании пропана двуокисью азота в присутствии
брома при температуре 325°, времени контакта 2 мин. и составе
смеси С3Н8 : NO2 : О2 : Вг2 = 4,2 : 1,0 : 0,5 : 0,031 выход ни-
тросоединений возрастает с 41,7 до 50,2% . Такое же возраста-
возрастание выхода наблюдается и в присутствии иода (NOa : J2 =
= 1 : 0,0085).
384
Нитрование органических соединений окислами азота
Концентрация галоида не должна быть чрезмерно большой,
так как в противном случае выход и конверсия уменьшаются,
С другой стороны, по литературным данным [63], для активи-
активирования реакции фотохимического нитрования насыщенных
углеводородов рекомендуется содержание хлора в смеси, рав-
равное 33—50%.
В лаборатории автора настоящей книги было проведено
термопара
Рис. 3. Схема нитрования углеводородов двуокисью|азота
¦ паровой фазе
изучение нитрования н. гептана, изооктана B,2,4-триметил-
пентана) и изопентана двуокисью азота в паровой фазе [64].
Реакция проводилась при разбавлении реакционной сме-
смеси азотом, воздухом и кислородом при 300, 325, 350 и 375°
в приборе, изображенном на рис. 3. Смесь углеводорода с дву-
двуокисью азота загружалась в капельную воронку 1, откуда она по
каплям подавалась в испаритель 2. Температура в испарителе
поддерживалась электрообогревом несколько выше температуры
кипения углеводорода. В испаритель 2 из газометра 3 подавались
азот, воздух или кислород. Смесь паров углеводорода, дву-
двуокиси азота и газа-разбавителя поступала в реактор 4, погру-
погруженный в расплавленную смесь нитрита натрия с нитратом
калия. Из реактора 4 реакционная смесь быстро 'выводилась в
холодильник 5, а затем в дополнительный холодильник 6, со-
соединенный с приемником 7. Жидкие продукты реакции собира-
собирались в приемнике 7, а газообразные продукты через отводную
Нитрование без катализаторов
385
трубку 8 поступали в систему поглотительных склянок 9, охлаж-
охлаждаемую смесью льда и соли. В первых двух склянках соби-
собирались унесенные с газом жидкие продукты реакции, а в двух
последующих, заполненных водой, поглощалась не вошедшая
в реакцию двуокись азота. Газы, не вступившие в реакцию
с водой, собирались в газометре. В газах определялось содер-
содержание двуокиси углерода и окиси азота.
Жидкие продукты реакции разделялись в делительной воронке
на углеводородный слой с растворенными в нем продуктами реак-
реакции и на водно-кислотный слой. Углеводородный слой промы-
промывался водой, обрабатывался 5% -ным раствором бикарбоната
натрия и вновь промывался водой. Промытые продукты реакции
высушивались над безводным сульфатом натрия и затем отго-
отгонялись с дефлегматором не вошедшие в реакцию углеводо-
углеводороды. Остатки не вошедшего в реакцию углеводорода отгоня-
отгонялись под вакуумом.
Результаты опытов по нитрованию гептана и изооктана
двуокисью азота в паровой фазе приведены в табл. 29, а при
разбавлении — в табл. 30.
Таблица 29
Нитрование гептана и изооктана двуокисью азота в паровой фазе '
Гептан
Изооктан
Температура реакции, °С
Время контакта, сек. . . .
Взято:
углеводорода, г . . . .
двуокиси азота, г . . .
азота, л
Получено:
углеводорода, г ....
водного слоя, г
газа, л
нитросоединений, г ...
Конверсия на NO2, % , .
26 а. в. Топчиев
300
3,7
170
40
13
146
10
28
20
19,81
325
1,9
170
40
148
8,5;
24
21
20,51
350
1,2
170
40
10
142
7,5
26
21
20,5
375
0,7
170
40
15
143
9,4
33
21
20,5
!зоо
6,0
170
40
10
146
12
23
22
2.1,5
|325
5,1
170
40
15
144
10
27
22
21,5
350
2,8
170
40
И
142
10
27
21 '
20,8!
375
1,8
170
40
14,6
10'
32"
18
17, ?
386 Нитрование органических соединений окислами
азота
Нитрование гептана, изооктана и изопентана двуокисью
при разбавлении реакционной смеси азотом и воздухом
Таблица 30
азота
Температура реакции, °С .
Время контакта, сек. . . .
Взято:
углеводорода, г ....
двуокиси азота, г ...
Получено:
нитросоединений, г . . .
Конверсия на NO2, % • ¦
Гептан
325
1,9
170
40
7,5
21
20,5
325
2,5
170
40
10
21
20,1
Изооктан
325
5,1
170
40
15
22
21.Е
325
5,9
170
40
16
22
21,Е
Изопентав
325
1,7
140
40
9
15
17,;
325
2,5
140
40
9
16
18,1
325
2,4
140
40
—
15
17,2
Полученные нитросоединения разгонялись на ректифика-
ректификационной колонке в вакууме.
Из табл. 29 и 30 видно, что характер разбавителя (азот,
воздух), а также его количество при нитровании пара-
парафиновых углеводородов в паровой фазе не оказывают
существенного влияния на выход нитросоединений. Во всех
случаях выход нитросоединений зависел только от характера
нитруемого углеводорода.
При изменении температуры реакции от 300 до 375° конвер-
конверсия двуокиси азота в нитросоединения существенным образом
не изменялась, при условии если с увеличением температуры
реакции уменьшалось время пребывания смеси в реакторе. Во
всех случаях конверсия двуокиси азота в нитросоединения была
около 20% для гептана и изооктана и около 18% для изопен-
изопентана.
При нитровании гептана состав продуктов реакции с изме-
изменением температуры от 300 до 375° существенно не изме-
изменялся, однако при нитровании изооктана с изменением
' Нитрование без катализаторов
387
температуры опыта происходило довольно заметное изменение
и фракционного состава.
При нитровании гептана основная масса продуктов реакции
перегонялась в пределах 57—63° (до 70 % по весу от общего ко-
количества образовавшихся нитросоединений) и представляла
собой мононитрогептан, в основном, вторичного характера. Со-
Содержание в продуктах нитрования мононитрогептанов при из-
изменении температуры от 300 до 375° заметно не изменялось.
Характер зтих мононитрогептанов с изменением температуры
опыта также существенно не изменялся. С повышением темпе-
температуры реакции основная масса мононитрогептанов попреж-
нему состояла из вторичных нитрогептанов (в основном из
2-нитрогептана), хотя при этом, повидимому, несколько увели-
увеличилось количество первичного нитрогептана, так как реакция
с образованием нитроловых кислот стала более ярко выра-
выраженной.
При нитровании изооктана основная масса E5%) получен-
полученных нитросоединений перегонялась в пределах 60—69° при
5 мм. Повышение температуры реакции от 325 до 350° привело
к заметному уменьшению выхода третичного нитроизооктана.
Мононитросоединения, полученные при 325°, состояли на 25%
из третичного нитроизооктана, тогда как в опыте, проведен-
проведенном при 350°, содержание третичного нитроизооктана снизи-
снизилось до 20% . Основная масса нитросоединений, полученных
при нитровании изооктана в паровой фазе, состояла из пер-
первичных нитроизооктанов (до 48 % по весу от общего количества
нитросоединений).
Нитрование изопентана приводит к образованию довольно
сложной смеси мононитросоединений. Наряду с ожидаемыми
2-метил-2-нитробутаном, 2-метил-З-нитробутаном и 2-метил-4-
нитробутаном образуется довольно значительное количество
(до 16%) нитросоединений с меньшим числом атомов углерода,
чем в изопентане. Нитросоединения меньшего молекулярного
веса давали реакции как на образование нитроловых кислот,
так и на образование псевдонитрола. Повидимому, нитросоеди-
нитросоединения меньшего молекулярного веса в основном состояли из
2-нитробутана и 2-метил-2-нитропропана.
26*
388 Нитрование органических соединений окислами азота
При нитровании окислами азота в паровой фазе гептана,
изооктана и изопентана, наряду с мононитросоединениями,
образуются динитросоединения указанных углеводородов.
При нитровании гептана в паровой фазе динитросоединений
было получено около 25% от общего веса нитросоединений.
Полученные при нитровании гептана динитросоединения об-
обладали свойствами первичных нитросоединений.
Выход динитросоединений при нитровании изооктана был
равен 40% от общего веса полученных нитросоединений. Ди-
Динитросоединения изооктана также обладали первичным ха-
характером.
Наконец, при нитровании изопентана выход динитросоеди-
динитросоединений составлял 35% от общего веса нитросоединений.
Как видно из приведенных результатов, при нитровании
углеводородов в газовой фазе выход динитросоединений зави-
зависит от строения нитруемого углеводорода. Выход динитросо-
динитросоединений для углеводородов изостроения значительно выше,
чем для углеводородов нормального строения.
Нитрование углеводородов изостроения в паровой фазе про-
протекает со значительно меньшей скоростью, чем нитрование
нормальных углеводородов. При нитровании в присутствии
воздуха требуется приблизительно в полтора раза большее
время контакта, чем при нитровании в присутствии азота.
При нитровании в паровой фазе лишь около 20% двуокиси
азота идет на образование нитросоединений, остальная часть
действует, как окислитель. Окисляя углеводород, двуокись
азота в основном восстанавливается до окиси азота. При нит-
нитровании с введением в зону реакции кислорода или воздуха
количество окиси азота в газообразных продуктах реакции
резко уменьшается. Одновременно с уменьшением количества
окиси азота в газообразных продуктах реакции увеличивается
содержание высших окислов азота, улавливаемых в поглоти-
поглотительной системе.
При нитровании в паровой фазе около 50% углеводорода
расходуется на образование нитросоединений, остальная часть
углеводорода окисляется. Процессы окисления при нитрова-
нитровании в паровой фазе идут значительно глубже, чем при нитро-
¦ Нитрование без катализаторов
389
в ании в жидкой фазе. При нитровании в паровой фазе полу-
получается очень мало кислот, плохо растворимых в воде. В про-
продуктах окисления в основном присутствуют низшие карбоно-
вые кислоты, дикарбоновые кислоты и вода.
Наряду с этим образуется небольшое количество карбониль-
карбонильных соединений. Детально продукты окисления не исследо-
исследовались.
При нитровании с введением в зону реакции кислорода или
воздуха получается несколько больше продуктов окисления,
чем при нитровании с введением в зону реакции азота. Повиди-
мому, часть кислорода расходуется на окисление углеводорода.
Нитрование парафиновых углеводородов двуокисью азота
в паровой фазе с введением в зону реакции азота или воздуха
протекает спокойно. Напротив, нитрование с введением в зону
реакции кислорода представляет довольно опасный, в отноше-
отношении образования взрывчатых смесей, процесс.
В той же работе [64] было изучено нитрование н. гептана
и изооктана B,2,4-триметилпентана) окислами азота в жидкой
фазе. Реакция проводилась как при атмосферном, так и при
повышенном давлениях. Реакция при атмосферном давлении
проводилась в приборе, изображенном на рис. 4.
Кислород из газометра 1 подавался в склянку 2 с окислами
азота. Смесь кислорода с окислами азота из склянки 2 посту-
поступала в подогреватель 3. Подогретая до температуры 250—400°
смесь окислов азота с кислородом поступала в реактор 5 через
капилляр 4. В реакторе находился кипящий углеводород. Пары
углеводорода конденсировались в холодильнике 6, и конден-
конденсат стекал обратно в реактор. Газообразные продукты реакции
отводились в поглотительную систему 7. В склянках с водой
поглощалась двуокись азота. Непоглотившиеся водой газы
собирались в газометр. В них определялось содержание дву-
двуокиси углерода и окиси азота. В поглотительных склянках ти-
титрованием щелочью определялось количество не вошедпшх-
в реакцию окислов азота.
Результаты опытов по нитрованию н. гептана и изооктана
двуокисью азота при атмосферном давлении в присутствии кис-
кислорода приведены в табл. 31.
390 Нитрование органических соединений окислами азота
Таблица 31
Нитровацие н. гептана и иаооктана двуокисью азота при атмосферном
давлении в присутствии кислорода при 100°
Температура нагрева NO2, °C . . •
Продолжительность опыта, часы . .
Взято:
углеводорода, г
двуокиси азота, г
кислорода, л
Получено:
углеводорода, г
водного слоя, г
газа, л
нитросоединений, г
двуокиси азота, г
Мононитросоединений, %
Динитросоединений, %
Конверсия на NOa, % •. .
Выход на прореагировавшую NO2, °/
Гептан
Изоонтан
300
12
170
60
7,5
147
6
4
20
50
66
34
12,5
75
250
12
170
40
5
149
6
7
21
30
27
73
21,5
86
400
12
170
40
5
145
7
7
23
28
35
65
22,8
76
Нитрование изооктана и н. гептана при повышенном да-
давлении проводилось в запаянных трубках. В каждую трубку
помещалось 4 г двуокиси азота и 15 мл углеводорода. Запаян-
Запаянные трубки помещались в металлические карманы, которые за-
затем погружались в баню с кипящей водой. Нагревание трубок
продолжалось до тех пор, пока вся двуокись азота не вступала
в реакцию. Как при нитровании н. гептана, так и при нитро-
нитровании изооктана этот момент наступал через 90 мин. после
погружения запаянных трубок в кипящую воду. По окончании
реакции трубки охлаждались в ледяной воде и вскрывались.
В газообразных продуктах реакции определялось содержание
двуокиси углерода и окиси азота. При нитровании и ы. гептана
и изооктана окислы азота использовались практически на-
Нитрование беа катализаторов
391
Рис. 4. Схема нитрования углеводородов двуокисью азота
в жидкой фазе
цело. Количество двуокиси углерода достигало 10% от газооб-
газообразных продуктов реакции (по объему).
Результаты опытов по нитрованию н. гептана и изооктана
двуокисью азота при повышенном давлении приведены в
табл. 32.
Из таблиц 31 и 32 видно, что выход нитросоединений,
считая на окислы азота, взятые в реакцию при нитрова-
нитровании под давлением, значительно выше, чем при нитрова-
нитровании без давления. Это различие в выходе можно объяснить
значительно большей концентрацией реагирующих веществ
при нитровании под давлением. Выход же нитросоедине-
нитросоединений, считая на окислы азота, вступившие в реакцию, был
выше при нитровании без давления в присутствии кисло-
кислорода. Это можно объяснить тем, что окись азота, образу-
образующаяся в процессе реакции, окислялась кислородом до
двуокиси азота, а не вступала в реакцию окисления угле-
углеводорода .
Жидкие продукты реакции, полученные при нитровании
н. гептана и изооктана, переносились в делительную воронку,
392
Нитрование органических соединений окислами азота
Таблица 32
Результаты опытов по нитрованию н.гептана и изооктана двуокисью
азота под давлением при 100"
Гептан
Изооктан
Взято:
углеводорода, г
двуокиси азота, г
Молярное отношение углеводород : N02 . .
Получено:
углеводорода, г
водного слоя, г
потери с газом, г
нитросоединений, г
мононитросоединений, %
динитросоединенпй, %
Выход нитросоединений на окислы азо-
та, о/о
Выход нитросоединений на углеводород, %
160
64
1,15
105
20
17
60
50
50
37
66
189
58
1,3
140
18
15
57
50
50
39
70
222
92
0,975
140
22
10
112
32
50
82:
где водный слой отделялся от углеводородного слоя, содержав-
содержавшего нитросоединения и часть продуктов окисления. Углево-
Углеводородный слой затем промывался водой, 5% -ным раствором
бикарбоната натрия и вновь водой и высушивался над безвод-
безводным сульфатом натрия. Невошедший в реакцию углеводород
отгонялся с дефлегматором. Полученные после отгонки углево-
углеводорода нитросоединения разгонялись на ректификационной
колонке в вакууме.
При нитровании н. гептана введение кислорода в зону ре-
реакции привело к значительному уменьшению выхода динитро-
соединений. Однако введение кислорода в зону реакций при
нитровании изооктана существенно не влияло на выход ди-
нитросоединений. Выход динитросоединений во всех случаях
при нитровании изооктана оставался высоким (около 70%).
Выход нитросоединений, считая как на окислы азота, так
. Нитрование без катализаторов
395
и на углеводород, вступивший в реакцию, достаточно высок
и мало отличается от выхода, который получается при нитро-
нитровании азотной кислотой.
Основная масса нитросоединений, полученных при нитро-
нитровании изооктана двуокисью азота в жидкой фазе, состояла из
динитросоединений. При разгонке продуктов реакции на рек-
ректификационной колонке в вакууме динитросоединения остава-
оставались в перегонной колбе и затем перегонялись с небольшим де-
дефлегматором. Полученный динитроизооктан представлял собой
тяжелое масло светложелтого цвета с т. кип. 117—123° при
3 мм, df 1,117 и п2о 1,4744. Определение азота по Дюма
дало значения, соответствующие вычисленным для динитроизо-
октана.
Полученные при нитровании изооктана динитросоедине-
динитросоединения обладают свойствами первичных нитросоединений.
Около 25% по весу от общего количества нитросоединений,
полученных при нитровании изооктана, выкипало в пределах
63—69° при 5 мм рт. ст. Эта фракция нитросоединений пред-
представляла собой масло слегка желтого цвета с tff 0,9584 и
показателем преломления п1^ 1,4360. Оно не растворялось в
щелочи. Определение для этого масла азота по Дюма дало зна-
значения, соответствующие мононитроизооктану. Это нитросоеди-
нение может быть лишь третичным нитроизооктаном B,2,4-три-
метил-4-нитропентаном).
При нитровании гептана двуокисью азота в жидкой фазе под
давлением около 50% нитросоединений выкипало в пределах
64—66° при 6 мм. При нитровании н. гептана без давления в
присутствии кислорода в этих пределах выкипало около 66%
нитросоединений.
Определение азота, восстановление в амин и положитель-
положительная реакция на образование псевдонитрола свидетельствуют
о том, что это нитросоединение является 2-нитрогептаном.
При нитровании гептана двуокисью азота в жидкой фазе
образуется довольно значительное количество динитросоеди-
динитросоединений, выкипающих в пределах 85—90° при 5 мм. Определе-
Определение азота в этих соединениях дало значения, соответствующие
вычисленным для динитрогептана.
394
Нитрование органических соединений окислами азота
Динитросоединения гептана на 2/з растворялись в растворе
щелочи. Нерастворимая в щелочи часть динитросоединений
гептана может быть лишь динитросоединением с нитрогруп-
пами у одного вторичного атома углерода. Поскольку при ни-
нитровании углеводородов нормального строения в основном об-
образуются нитросоединения с нитрогруппой у второго атома
углерода, можно полагать, что нерастворимая часть динитро-
динитросоединений является 2,2-динитрогептаном. Строение раство-
растворимых в щелочи динитросоединений не установлено.
При нитровании н. гептана и изооктана двуокисью азота
в жидкой фазе происходило образование значительного коли-
количества продуктов окисления. В продуктах окисления гептана
были найдены двуокись углерода, вода, уксусная, валериано-
валериановая, капроновая и щавелевая кислоты, а также некоторое ко-
количество карбонильных соединений. В продуктах окисления
изооктана обнаружены двуокись углерода, вода, триметилуксус-
ная, трет.-бутилуксусная и уксусная кислоты, дикарбоновая
кислота неустановленного строения и некоторое количество
карбонильных соединений.
Процесс нитрования циклогексана окислами азота изу-
изучался А. И. Титовым [61]. На основании своих опытов (взаи-
(взаимодействие циклогексана с двуокисью азота при температурах
от 20 до 330° в запаянных трубках или открытых сосудах, в
жидкой или газовой фазе) А. И. Титов пришел к следующим
выводам.
1. Взаимодействие циклогексана с двуокисью азота в на-
начальной стадии окисления и нитрования протекает сравни-
сравнительно быстро и дает те же продукты нитрования, что и при
действии азотной кислоты (по методу Коновалова — Намет-
Наметкина):
СвНГ2 + NO2 -» СвН„ + НРГО2
s
О
CeHuONO
О = N
C6HUONO + NOj
О
Нитрование бея катализаторов
395
2. Отсутствие заметного ускорения реакции между NO2
Я циклогексаном при добавлении сильных протонных и апро-
тонных кислот (HaSO4, TiCl4, AlCb) указывает на радикальный
характер первичной стадии реакции и свидетельствует о малой
роли ионного характера этой стадии.
3. При высокой концентрации димера двуокиси азота воз-
возможно развитие достаточно длинных цепей по схеме
RH + NO2'-»r'+HNO2;
R + N2O4 -*- RONO + NO2;
и т. д.
4. Нитрование и окисление циклогексана протекают по
•схеме, предложенной ранее для нитрования парафинов.
Согласно литературным данным [65], осуществлено нитро-
нитрование насыщенных углеводородов четырехокисью азота в жид-
жидкой фазе в проточной системе.
Реакция проводится при температуре 150—200° и давлении
выше 20 атм. в аппаратуре из нержавеющей стали. Основная
часть аппаратуры реактор — стальная трубка длиной 1 м и
внутренним диаметром 4 мм, обогреваемая водой (под давле-
давлением).
Получены следующие результаты.
1. Нитрование н. додекана:
1000 г додекана и 300 г N2O4 пропускают при 190°, 40 атм.
и объемной скорости 204 объема реакционной смеси на единицу
•объема реактора в час. После обработки продуктов реакции
получено 560 г нитродекана и 12 г жирных кислот.
2. Нитрование н. гептана:
1000 г С,Н1в и 380 г N2O4,взаимодействуя при 170° и 40 атм.
{объемная скорость 155), дали 630 г сырого нитрогептана и 8 г
кислот.
3. Нитрование 2,2,4-триметилпентана:
1000 г С8Н18 и 400 г N2O4 при 170° и 40 атм. дали 645 г сы-
сырого нитроизооктана.
4. Нитрование циклогексана:
396
Нитрование органических соединений окислами азота
1500 г CeHi2 и 500 N2O4 при 150° и 40 атм. (время реакции
30 сек.) дали 570 г сырого нитроциклогексана. В свою очередь
продукты нитрования могут быть вновь аналогичным образом
подвергнуты нитрованию с получением ди- и полинитропро-
дуктов.
Из опытных данных получены значения энергии активации
процесса. Они составляют для н. гептана 5850 кал/моль и для
изооктана 7500 кал/моль.
Нитрованием циклопропана Хэсс и другие [66] получили
нитроциклопропан по следующему методу: избыток циклопро-
циклопропана B396 г) и 316 г N2O4 пропускали через трубку при 420—
455°. Время контакта было равно 2,36—2,44 сек. Из конден-
конденсатов, собранных при 0—80° (после удаления окислов азота и
Циклопропана), обработанных водой, нейтрализованных и экст-
экстрагированных эфиром, фракционированием выделяют ' 45 г
нитроциклопропана. Выход 15% , считая на ^О4.
Б. НИТРОВАНИЕ ОКИСЛАМИ АЗОТА В ПРИСУТСТВИИ
КАТАЛИЗАТОРОВ
В предыдущем разделе было показано,, что двуокись азота
(в мономерной и димерной формах) легко присоединяется к
непредельным алифатическим соединениям с образованием
соответствующих нитропродуктов, но, с другой стороны, реа-
реагирует довольно медленно с ароматическими соединениями.
Причина такой инертности последних заключается, повиди-
мому, в их относительно большей насыщенности по сравнению
с непредельными соединениями жирного ряда. Для повыше-
повышения реакционной способности ароматических соединений к при-
присоединению группы NO2 обычно ведут нитрование в при-
присутствии катализаторов, активирующих ароматическое ядро.
Например, при пропускании смеси паров бензола, толуола,
нафталина или хлорбензола с нитрозными газами, содержа-
содержащими окислы азота, через серную кислоту (катализатор) при
повышенной температуре получаются нитропроизводные [67].
Пинк [68] предложил при нитровании ароматических со-
соединений окислами азота добавлять серную кислоту, которая.
Нитрование в присутствии катализаторов
397
по его мнению, не только играет роль дегидратирующего аген-
агента, но и активирует процесс нитрования, выделяя HNO3:
ОН
N2O4 + H2SO4 Л SOa
/
\
+ HNO3
ON О
При применении избытка серной кислоты реакция практиче-
практически протекает слева направо, так как азотная кислота, вступая
во взаимодействие с углеводородом с образованием нитросо-
единений, постоянно удаляется из сферы реакции.Нитрозилсер-
ная кислота и избыток серной кислоты, не вступивший в реак-
реакцию с N2O4, являются дегидратирующими агентами.
По представлению Пинка, реакция взаимодействия арома-
ароматических углеводородов с N2O4 в присутствии серной кислоты
протекает по следующему уравнению (на примере бензола):
ОН
С6Н6 + N2O4 + H2SO4 —» CeHjNOa + S02 / + H20
ONO
Как видно из уравнения, только 50% окислов азота исполь-
используются в этом процессе для превращения углеводородов в ни-
тросоединения, остальные 50% вступают в реакцию с серной
кислотой, образуя нитрозилсерную кислоту.
Практическое применение двуокиси азота в присутствии
серной кислоты для нитрования ароматических соединений за-
зависит от того, насколько полно возможно регенерировать дву-
двуокись азота, связанную в нитрозилсерной кислоте.
В одном из американских патентов [69] предложено анод-
анодное окисление нитрозилсерной кислоты с применением пори-
пористой диафрагмы для регенерации окислов азота в процессе
нитрования. В результате реакции образуются азотная и сер-
серная кислоты. Выход на азотную кислоту 92% .
Окисление нитрозилсерной кислоты протекает по уравне-
уравнению
2 ONOSOgH + О + Н2О -» H2SO4 + HNO3. A)
Отработанную нитрозилсерную кислоту подвергают действию
сернистого газа по уравнению
2 ONOSO3H + SO2 + 2Н2О -» 3H2SO4 + 2NO, B)
398
Нитрование органических соединений окислами азота
Выделившуюся окись азота окисляют воздухом в двуокись
азота и применяют для нитрования. Получается серная кис-
кислота более высокой концентрации, чем в отработанной
кислоте, за счет воды, вступающей в реакцию [уравнение B)].
Нитрование бензола проводилось Пинком следующим обра-
образом: к раствору 1,05 моля N2O4 в 1,25—1,75 моля серной кис-
кислоты приливали из капельной воронки при постоянном пере-
перемешивании бензол A моль), причем температуру реакции под-
поддерживали в интервале 5—15°; по окончании добавления бен-
бензола температуру повышали до 40—60е. Общая продолжи-
продолжительность нитрования 5 час.
Варьируя температуру от 40 до 60°, количество серной кис-
кислоты от 1,25 до 1,75 моля на 1 моль бензола и концентрацию ее
от 85 до 95% при постоянном молярном отношении N2O4:6eH-
зол=1,05 : 1, Пинк показал, что оптимальный выход нитробен-
нитробензола (94,4%) достигается при температуре 55—60е, применении
большого избытка H2SO4 A,75 моля) и концентрации ее
около 95%.
Основным фактором, способствующим получению высоких
выходов нитропроизводных при нитровании по методу Пинка,
является большой избыток серной кислоты, который не благо-
благоприятствует побочным окислительным процессам; при этом
условии нитрование может быть осуществлено при более высо-
высоких температурах (до 60е), что приводит к повышению скоро-
скорости этой реакции.
Для синтеза нитротолуола реакционную смесь, получен-
полученную посредством приливания 1 моля толуола к раствору 1,05
моля N2O4 в 1,6 моля 95%-ной серной кислоты, перемешивают
в течение 3,5 часов при 50—55° и по окончании реакции избыток
толуола отгоняют в вакууме (выход нитротолуола 87,5%
от теории).
При нитровании нафталина N2O4, которое проводилось по-
посредством добавления 1 моля нафталина к раствору 1,1 моля
N2O4 в 1,5 молях серной кислоты получен выход чистого а-ни-
тронафталина88,4% от теоретического. Пинк применил разра-
разработанный им метод и для синтеза динитросоединений из моно-
нитропроизводных. Так, например, при медленном прилива.
Нитрование в присутствии катализаторов
399"
нии 1 моля нитробензола к раствору 1,05 моля N2O4 в 2,8 моля
дымящей серной кислоты с содержанием 4,28% свободного
серного ангидрида получен динитробензол с выходом 93,4%
от теоретического.
При нитровании антрахинона окислами азота в присут-
присутствии олеума, содержащего 5% БОз, Шааршмидт, Бальцер-
кевич, Ганте получили нитропроизводное антрахинона [41].
Баттегей [70], исследовавший реакцию нитрования арома-
ароматических соединений N2O4 в присутствии серной кислоты, при-
пришел к заключению о существовании известного параллелизма
между указанной выше реакцией и реакцией Фриделя —
Крафтса. Активирование ароматического ядра в первой реак-
реакции достигается, по его представлению, присоединением
H2S04k ароматическому ядру с образованием неустойчивого ком-
комплекса, аналогичного комплексу с А1СЬ, который, как пола-
полагают, является промежуточным продуктом реакции Фриделя —
Крафтса. Для доказательства этого параллелизма Баттегей хло-
хлорировал (и бромировал) бензол в присутствии относительно
небольших количеств 90%-ной серной кислоты, причем реак-
реакция протекала так же легко, как и при применении в качестве
активаторов А1С13 и FeCh; даже при низких температурах хло-
хлорирование в присутствии серной кислоты приводит к количе-
количественным выходам хлоропроизводных (при температурах ниже
0° основным продуктом реакции является CeHeCle). В отличие
от Пинка (см. выше), который добавлял углеводород к раствору
N2O4 в серной кислоте, Баттегей приливал жидкую N2O4 к
нитруемому соединению или же насыщал углеводород NO 2 в при-
присутствии концентрированной серной кислоты. Поглощение
окислов азота происходило быстро, сопровождаясь некоторым
повышением температуры. Температура реакции поддержи-
поддерживалась в пределах 15—20° посредством наружного охлаждения.
Для нитрования ароматических соединений окислами азота
Баттегей применял предпочтительно жидкую N2O4, которую
приливали из сосуда, охлаждаемого льдом, в реакционный ап-
аппарат, где находилась смесь нитруемого соединения с серной
кислотой. Во время нитрования реакционную смесь хорошо-
перемешивали.
400
Нитрование органических соединений окислами азота
Опыты Баттегея привели к выводу, что оптимальная кон-
концентрация применяемой серной кислоты зависит от природы
нитруемого соединения, например, для бензола, толуола и
ксилолов она составляет 78—80%, при нитровании же нитро-
соединений для превращения их в полинитропроизводные тре-
требуется концентрация кислоты около 100%.
Показано также, что конечная концентрация серной кисло-
кислоты не должна быть ниже определенной величины (например,
для бензола 61%). Так как во время реакции происходит раз-
разбавление серной кислоты вследствие образования нитрозил-
нитрозилсерной кислоты и воды, необходимо применять такое количе-
количество серной кислоты, чтобы концентрация ее во время
нитрования всегда оставалась больше некоторой предельной
величины, ниже которой происходит неполное поглощение
окислов азота.
В табл. 33 приведены результаты опытов Баттегея для ряда
¦органических соединений.
Таблица 33
Нитрование ароматических соединений двуокисью азота в присутствии
H2SO4
Нитруемое соединение
Бензол . . .
Толуол . . .
о-Ксилол . .
м-Ксилол . .
п-Ксилол . .
Хлорбензол
Нитробензол
Антрахинон
Взято для реакции
нитруемо-
нитруемого веще-
вещества
H.SO,
50
50
50
50
50
150
61
20
50
50
44
44
44
52
47
9,5
350
609
400
600
400
370
250
100
Концен-
Концентрация
H,SO4> %
80,2
77,6
78,8
77,6
78,8
84,5
100,0
Олеум
E% SO3
Выход нитро-
продуитов ва
взятую в ре-
реакцию N,O«.
95
94
77
89
95
95
94
84,5
При нитровании ароматических соединений N2O4 в присутг
ствии серной кислоты Баттегей обратил внимание на окраску
отработанных кислот, которая очень устойчива. Интенсивность
Нитрование в присутствии катализаторов
401
этой окраски зависит от концентрации кислоты; например, от-
отработанная кислота, остающаяся после нитрования бензола,
имеет оранжево-красную окраску в присутствии 73—74%
H2SO4 и тёмнокрасную—при концентрации серной кислоты 82 %
и выше. Если отработанную кислоту после нитрования бензола
N2O4 промыть бензолом и, таким образом, освободить ее от
следов нитробензола и затем остатки бензола отогнать в ваку-
вакууме, то получается окрашенный продукт, который обесцвечи-
обесцвечивается при добавлении холодной воды; при этом выделяется
бензол наряду с продуктами разложения нитрозилсерной кис-
кислоты. Обесцвечивание происходит также при добавлении из-
избытка азотной кислоты с выделением нитробензола.
По представлению Баттегея, в отработанных кислотах со-
содержится окрашенный комплекс, состоящий из трех компонен-
компонентов: CeH6, HNSO5 и H2SO4, для образования которого необхо-
необходима определенная концентрация, серной кислоты (например,
в случае бензола не ниже 74%). Механизм образования комп-
комплекса состоит в том, что серная кислота своими остаточными
валентностями присоединяется к бензолу, повышая степень
активности бензольного ядра, вследствие чего последнее при-
приобретает способность к присоединению молекулы нитрозил-
нитрозилсерной кислоты:
[a;H2SO4. . .
Исходя из способности H2SO4 активировать бензольное ядро,
что показано на примере образования окрашенных комплексов
в отработанных кислотах, а также из структурно"! аналогии
между нитрозилсерной кислотой и N2O4*, Баттегей допускает
следующий механизм реакции при взаимодействии N2O4 с аро-
ароматическими соединениями: образующиеся в первой стадии
молекулярные комплексы, состоящие из нитруемого углево-
углеводорода, N2O4 и H2SO4, быстро превращаются в динитросоеди-
* По Баттегею, нитрующим агентом при нитровании ароматических
соединений N2O4 является форма двуокиси NOaONO («нитрозилнитрат»).
26 А. В. Топчиев
402
Нитрование органических соединений окислами азота
нения или в нитронитриты, которые, будучи весьма неустой-
неустойчивыми производными дигидробензола, распадаются далее с
образованием соответствующего нитропроизводного и нитро-
зилсерной кислоты:
CeH6 + N2O4 + H2SO4 -> CeHe.. . N2O4. . . H2SO4; '
NO2
H2SO4 4- CeHe / -» C6H5NO2 4 HNSO5 4- H2O.
ONO
А. И. Титов и А. Н. Барышникова [71] полагают, что нитро-
нитрование ароматических соединений двуокисью азота в присут-
присутствии H2SO4 протекает по следующей схеме:
RH + N204-»RN024-HN02; A)
N2O4 + H2SO4 ^ HNO3 4 HNSO5; B)
2HNSO5 + H2O -Z N20g 4 2H2SO4; C)
2HN034N203^2Na044H20; D)
H2SO4-?H2O 4H20 ^ H2SO4-(? 4 1) H2O. E)
Общая схема:
RH 4- N2O4 + rcH2SO4-mH2O -> RNO2 4 ONOSO3H 4
4(n —l)H2SO4-(m + l)H2O. F)
Нитрование идет за счет азотной кислоты, образующейся при
взаимодействии двуокиси азота с серной кислотой. Главную
роль в процессе активирования реакции играет огромная спо-
способность концентрированной серной кислоты передавать про-
протон бензольному кольцу и активировать его. Выдвигая такой
механизм реакции, указанные выше авторы исходят из пред-
представления, что нитрование ароматических соединений связано
с насыщением силового поля серной кислоты элементами азоти-
азотистой кислоты и воды. Для достижения наиболее полного исполь-
использования N2O4 отношение между количествами свободной серной
кислоты и воды [(«— 1)/(т+1) по уравнению F) ] к концу нитро-
нитрования не должно быть ниже некоторого минимального значе-
значения, характерного для каждого соединения (как показали экспе-
экспериментальные данные, для бензола это отношение равно при-
приблизительно 4:1, для хлорбензола 5:1, для толуола 1,8 : 1).
Степень использования серной кислоты, как это следует из
уравнений B) — F), может быть повышена при увеличении
концентрации NO2 или удалении из сферы реакции 1Ч2Оз.
Нитрование в присутствии катализаторов
403
Нитрование ароматических соединений N2O4 в присутствии
серной кислоты осуществлялось А. И. Титовым и А. Н. Барыш-
Барышниковой посредством добавления раствора N2O4 в серной
кислоте к углеводороду, взятому в избытке, что давало возмож-
возможность автоматически поддерживать необходимую концентра-
концентрацию серной кислоты без применения большого избытка послед-
последней. Нитрование бензола N2O4 проводили следующим образом:
к 29,2 г углеводорода приливали при перемешивании пропеллер-
пропеллерной мешалкой раствор 13,8 г N2O4 в 39,2 г 94%-ной серной кис-
кислоты при температуре около 40° в течение 20 мин. По добавле-
добавлении всего количества N2O4 нагревание продолжали еще в те-
течение 1 часа при 50°, после чего нитробензольный слой сливали
и фракционировали. Оптимальные результаты (выход нитро-
нитробензола 98,4% от теории) получаются при температуре нитро-
нитрования 40—50° и концентрации серной кислоты к концу нитро-
нитрования 80,6%. При повышении остаточной концентрации H2SO4
до 89,5% выход нитробензола понижается вследствие усиления
побочных реакций.
Скорость нитрования хлорбензола раствором N2O4 в серной
кислоте значительно меньше по сравнению со скоростью ни-
нитрования бензола особенно при низких температурах; при 0°,
продолжительности процесса 5 час. и остаточной концентра-
концентрации серной кислоты 69% выход нитрохлорбензола составляет
72% (при этих же условиях бензол дает выход нитробензола
90%). Опыты показали, что для повышения скорости нитро-
нитрования хлорбензола необходимо после проведения первой фазы
реакции с раствором N2O4 в 95%-ной серной кислоте посте-
постепенно добавлять концентрированную серную кислоту, чтобы
к концу нитрования концентрация свободной H2SO4 была не
ниже 82—84% (общий расход серной кислоты составляет 2,5
моля на 1 моль нитропродукта). При этом условии выход нитрс-
хлорбензола может быть повышен до 98—99% при проведе-
проведении реакции в температурном интервале 40—50°.
Нитрование толуола раствором N2O4 в серной кислоте про-
протекает очень энергично даже при 10° и невысоких концентра-
концентрациях серной кислоты. Хорошие результаты получаются при
нитровании толуола 36,3%-ным раствором N2O4 в 94%-ной
26*
404
Нитрование органических соединений окислами азота
серной кислоте при 0—15° и остаточной концентрации серной
кислоты 64,5%; при этих условиях выход чистого нитропродук-
та составляет 98% от теоретического.
При нитровании толуола, кроме нитротолуолов, обнаружен
еще один продукт реакции, который, при исследовании, ока-
оказался 2,6-динитрокрезолом. Образование последнего А. И. Ти-
Титов объясняет следующими реакциями:
СНз СНз СНз
j +HNOa
/\
+N,0.
/\
O2N
NO,
N=NOH
ОН
он
В подтверждение этого механизма А. И. Титов ссылается на
имеющиеся в литературе данные [72, 73] о получении диазопро-
изводных при действии азотистой кислоты на ароматические
соединения; кроме того, установлено, что при нитровании
толуола в больших количествах происходит образование диазо-
Соединений, которые даже удалось выделить из реакционной
смеси.
А. И. Титов [74] также показал, что при нитровании раство-
раствором N2O4 в серной кислоте мононитропроизводных ароматиче-
ароматических соединений они могут быть превращены в соответствую-
соответствующие полинитросоединения. Например, к 12,3 г нитробензола
при интенсивном перемешивании в течение 3 час. при 5—7°
приливали из капельной воронки раствор 10,1 г N2O4 в 25 г
45%-ного олеума. По окончании добавления всего количества
нитрующей смеси реакционную массу, после выдержки в те-
течение 1 часа при той же температуре, подвергали нагреванию,
причем температуру постепенно повышали до 100° в продолже-
продолжение 1 часа. После этого температуру снижали до 40° и к реак-
реакционной смеси приливали 100 мл воды. Не охлаждая, перево-
переводили содержимое реакционной колбы в стакан и отфильтровы-
отфильтровывали динитробензол после его затвердевания. Сырой динитро-
бензол очищали обработкой водой и затем слабым раствором
соды при температуре около 80°. Оптимальные результаты (вы-
Нитрование в присутствии катализаторов
405
ход динитробензола 97—98%) получены при температуре реак-
реакции 5—15° и соотношении реагентов 0,14—0,15 моля Н2§О4
и 0,11 моля N2O4 на 0,1 моля CeH5NO2.
При нитровании нитротолуолов, которое производилось
аналогично нитрованию нитробензола, оптимальные резуль-
результаты (выход 2,4-динитротолуола 98% от теории) достигаются
при применении олеума из расчета 1 моль серного ангидрида на
1 моль N2O4. При нитровании 2,4-динитротолуола получен
85%-ный выход 2,4,6-тринитротолуола. Опыты по нитрованию
нитрохлорбензолов показали, что для получения оптимальных
результатов (выход динитропродукта 98,5% от теории) необ-
необходимо применять некоторый избыток N2O4, равный около
10%.
Шааршмидт [75] для активирования бензольного ядра при
нитровании ароматических соединений N2O4 применял в ка-
качестве катализатора хлориды металлов А1С13 и FeCl3. Нацри-
мер, к смеси 3 молей углеводорода и 2/3- моля А1С13 добавляли
жидкую N2O4 при охлаждении и сильном перемешивании или
же насыщали эту смесь газом, содержащим NO2 при обыкно-
обыкновенной температуре. При этом, после постепенного растворе-
растворения А1С13, получался интенсивно окрашенный в красный цвет
раствор комплекса, состоящего из А1С13, С6Нв и N2O4 в избытке
углеводорода. В отличие от непредельных соединений, кото-
которые образуют весьма неустойчивые продукты присоединения
(см. выше), продукт взаимодействия N2O4 с ароматическим угле-
углеводородом состоит в основном из весьма устойчивого нитронит-
рита. При нагревании этого продукта в бензольном растворе
на водяной бане не наблюдается никаких заметных признаков
разложения. При дальнейшем исследовании Шааршмидт на-
нашел, что комплекс, состоящий из хлористого алюминия, угле-
углеводорода и N2O4, при действии воды разлагается очень легко
уже на холоду с образованием небольшого количества хлор-
замещенного нитруемого углеводорода (например, хлорбен-
хлорбензола). Образование последнего Шааршмидт объясняет следую-
следующим образом: вода разлагает незначительное количество хло-
хлористого алюминия, что вызывает отщепление HNO2; последняя
далее гидролизует еще некоторую часть А1СЬ и окисляет соля-
Нитрование органических соединений окислами азота
ную кислоту, являющуюся продуктом частичного гидролиза
А1С13, до хлора, который и хлорирует углеводород.
Шааршмидт на примере бензола доказал, что комплекс из
СвН3, А1С13 и N2O4 является насыщенным: N3O4, хлор и бром
не реагируют с этим комплексом. Экспериментальные данные
показали, что при нитровании 1 моля бензола 1 молем N2O4
получают 1 моль нитробензола, если применяют не менее 2/3
моля А1С13. При нитровании хлорбензола A моль) также мож-
можно получить выход нитрохлорбензола, близкий к теоретиче-
теоретическому, если молярное отношение А1С13 к N2O4 составляет
2/3 : 1. На основании этих результатов Шааршмидт принимает,
что комплексы, образующиеся при нитровании, имеют состав
2AlCl3-3CeH6.3N2O4 для бензола и 2A1C13-3C6H5C1-3N2O4 для
хлорбензола.
Влияние А1С13 на реакцию нитрования N2O4 зависит от
природы нитруемого соединения. Реакция нитрования хлор-
хлорбензола протекает при обыкновенной температуре и может
быть осуществлена и при более низких температурах. Реакция
нитрования бензола состоит из двух фаз: образование про-
продукта присоединения N2O4 происходит при температурах ниже
10°, для разложения же комплекса, т. е. получения нитро-
соединения, необходимо умеренное нагревание выше 10°. FeCl3
действует менее энергично, но дает более благоприятные ре-
результаты. При реакции с толуолом наряду с нитрованием
наблюдаются и окислительные процессы, в результате кото-
которых образуются нитрокрезолы (в виде эфиров азотной и
азотистой кислот).
По Шааршмидту, механизм реакции нитрования ароматиче-
ароматических соединений N2O4 в присутствии А1СЬ состоит в следую-
следующем: А1С13 присоединяется к ароматическому соединению, ак-
активируя бензольное ядро, которое далее присоединяет N2O4
с образованием тройного комплекса; при разложении послед-
последнего водой А1С13 отщепляется; оставшийся продукт присоеди-
присоединения N2O4 к бензолу, являющийся весьма неустойчивым про-
производным дигидробензола, распадается на нитросоединение,
которое остается растворенным в избытке углеводорода, и азо-
азотистую кислоту, переходящую в водную фазу; азотистая кис-
Нитрование в присутствии катализаторов
407
лота разлагается далее по уравнению 3HNO2—HNO3+ H2O +
+ 2NO.
Указанный выше процесс может быть представлен в виде
следующей схемы (на примере нитрования хлорбензола):
+3N2O.
2 А1С13 + ЗСвНбС1 -» [2А1С13 ... ЗС6Н6С1] >
- 2A1C13-3C6H5C1-3N2O4 -*-» 2 A1C13-H2O + 3(С6НБС1 -N204)
(петстойчивое прои
NO2
(неустойчивое произ-
производное дигидробензопа)
- 3CeH4
/
+ 3HONO
Cl
HNO3+ Н2О + 2NO
Нитрование бензола N2O4 в присутствии А1С13 проводилось
Шааршмидтом следующим образом. В суспензию 140 г субли-
сублимированного AlClg в 200 г бензола медленно приливали тонкой
струей раствор 92 г N2O4 в 100 г бензола при температуре 10—
15°. После внесения всего количества нитрующего агента реак-
реакционную смесь нагревали до 30—35° и медленно выливали
струей на мелкораздробленный лед. При этом получены нитро-
нитробензол (в бензольном растворе вместе с А1С13). Бензольный
раствор отделяли от водной фазы, промывали водой и затем раз-
разбавленным раствором NaOH и подвергали перегонке для отде-
отделения нитробензола от бензола* Выход сырого нитробензола
(с примесью смолистых продуктов) составлял 118 г.
Галоидозамещенные производные бензола [76] дают при
нитровании окислами азота в присутствии катализаторов
(А1С13 или FeCl3) следующие количества о- и п-изомеров (в %):
п о
CeH4NO2F 91 9
CeH4NO2Cl 78 22
CeH4NO2Br 95 5
CeH4NO2J 95 5
При нитровании хлорбензола двуокисью азота в присутствии
концентрированной серной кислоты главным продуктом реак-
реакции является п-нитрохлорбензол.
Нитрование органических соединений окислами азота
А. И. Титов [74] при изучении реакции нитрования арома-
ароматических соединений двуокисью азота в присутствии А1С13
пришел к следующим выводам:
1) А1С13 переходит в раствор в 3 раза меньшем количестве,
чем это требуется для образования комплекса Шааршмидта;
2) при дальнейшем прибавлении N2O4 реакция протекает
менее энергично;
3) действие воды на комплекс, которое Шааршмидт считает
необходимым для образования нитросоединений, не обязатель-
обязательно.
По наблюдениям А. И. Титова, при нагревании в отсутствие
воды реакция протекает по уравнению
2А1С13 + 3RH + 3NA -* 3RNO2 + 3NOC1 + А12С13 (ОНK.
А. И, Титов выдвигает механизм постадийного протекания
реакции нитрования двуокисью азота в присутствии А1С13,
причем первая фаза, окончание которой совпадает с моментом
полного перехода хлористого алюминия в раствор, соответ-
соответствует наиболее интенсивному координационному насыщению
силового поля атома алюминия в А1С13:
RH + N2O4+ 2A1C1;H-RN<V A1C1S+ A1C12 (OH)-NOCl ? RNO2- А1С12 (ОН) +
+ A1C13-NOC1. A)
На следующих стадиях насыщение силового поля атомов алю-
алюминия происходит менее энергично:
+ RH^A1C12(OH)-2RNO2-NOC1; B)
« + RH-»AlCI(OHJ-RNOa-2NOCl. C)
При нагревании комплекс диссоциирует на компоненты. Меха-
Механизм активирующего действия хлористого алюминия А. И. Ти-
тов представляет следующим образом. Алюминий, благодаря
своей резко выраженной координационной ненасыщенности
в галоидных солях, производит глубокое поляризующее дей-
действие на молекулы, способные подвергаться деформации, и
может даже вызвать их ионизацию
А1С13 + N2O4-> C13AI • NO2 — NOa
Нитрование в присутствии катализаторов
409
(O2N-AlCl3r
Н -J
В образовавшемся соединении водород, связанный с тем ще
углеродом, что и нитрогруппа, обладает большой подвижно-
подвижностью и легко отщепляется в виде иона, что и приводит к обра-
образованию нитробензола.
Хорошие результаты получены при нитровании хлорбен-
хлорбензола, бензола и толуола N2O4 в присутствии А1С13,
Смесь 55 г хлорбензола @,35 моля) и 10,7 г А1С13 @,08 моля)
при постоянном встряхивании насыщали двуокисью азота, что
сопровождалось энергичной экзотермической реакцией. После
полного растворения А1С13 реакция протекала с меньшей ин-
интенсивностью. Насыщение окислами азота продолжали до по-
поглощения 10,5 г N2O4 @,114 моля), что соответствует 95% тео-
теоретического количества. Реакционную смесь, превратившуюся
в студнеобразную массу, постепенно нагревали до кипения,
одновременно пропуская через нее СО2. После кипячения от-
отделяли жидкую фазу от осадка основных солей алюминия и
подвергали ее фракционированной разгонке, причем было вы-
выделено 17,2 г смеси нитрохлорбензолов, что соответствует 96%
от теории, Аналогичные результаты получены при нитровании
бензола.
Нитрование толуола, которое в опытах Шааршмидта про-
проходило неудовлетворительно и с образованием продуктов окис-
окисления, А. И, Титов осуществил с выходом нитротолуолов 88%
от теории, изменив порядок смешивания компонентов:
А1С13 прибавляли к смеси N2O4h толуола, что уменьшало веро-
вероятность возникновения побочных реакций с азотистой кисло-
кислотой.
М. И. Богданов [77], исследовавший реакцию нитрования
ароматических соединений N2O4 в присутствии FeCl3, прищел
к выводу, что одновременное пропускание хлора активирует
реакцию нитрования. По его мнению, хлор при действии на
тройной комплекс, состоящий из FeCl8, C6H6 и N2O4, лишает
410
Нитрование органических соединений окислами азота
хлорное железо его дополнительных валентностей и переводит
в соединение с более высоким содержанием хлора. Благодаря
этому происходит разрушение тройного комплекса с образо-
образованием неустойчивого производного дигидробензола С6Н6• N2O4,
в дальнейшем разлагающегося на нитробензол и азотистую
кислоту. Образовавшийся из FeCl3 продукт с высоким содер-
содержанием хлора также неустойчив и распадается на хлор и хлор-
хлорное железо, которое затем снова вступает в реакцию с бензолом
и N2O4.
По представлению М. И. Богданова, при нитровании бен-
бензола в присутствии FeCl3 в начале реакции образуется комплекс
•состава
Fed,
\
Н
ONO
который в дальнейшем распадается на хлорное железо, нитро-
нитробензол и азотистую кислоту.
При; нитровании и одновременном хлорировании 53,32 г
бензола в течение 5 час. при 20° в присутствии 5,6 г железа
М. И. Богданов получил выход нитробензола на взятый бензол
35,&% от теоретического.
Дальнейшим развитием работ по нитрованию органических
соединений двуокисью азота в присутствии катализаторов были
работы А. В. Топчиева, который использовал в качестве ката-
катализатора трехфтористый бор.
Необходимая для опытов чистая N2O4 получалась взаимодей-
взаимодействием нитрозилсерной кислоты с азотнокислым калием. Кри-
Кристаллическую нитрозилсерную кислоту, синтез которой осуще-
осуществлялся насыщением SO2 раствора крепкой азотной кислоты
в дихлорэтане при 25—30°, перемешивали с порошком нитрата
«алия в фарфоровой чашке и смесь быстро переносили в широ-
когорлую круглодонную колбу, соединенную с конденсацион-
но-поглотительной системой, состоявшей из холодильника Ли-
Нитрование в присутствии катализаторов
411
биха и двух широких U-образных трубок, помещенных в
¦охладительную смесь. Колбу подвергали нагреванию на водя-
водяной бане до 50—60°, причем происходило образование N2O4
до уравнению
NO2SO3 Н + KNO3 -*¦ N2O4 + KHSO4.
Реакция протекала равномерно и достаточно быстро и закан-
заканчивалась обычно через 1,5—2 часа. При избытке нитрата
{2 моля на 1 моль нитрозилсерной кислоты) выход N2O4 дости-
достигает 85%.
Нитрование бензола N2O4 в присутствии ВF3 осуществля-
осуществлялось приливанием N2O4 по каплям из бюретки в реакционную
колбу с бензолом, через который одновременно пропускали
BF3*.
Нитрование производили без наружного нагревания; вви-
ввиду экзотермичности реакции температуру в начале нитрования
повышали до 55—60° и затем поддерживали в этих пределах
в течение 1,5—2 час.
Через 10—15 мин. после начала опыта реакционная масса
приобретала темножелтый цвет, который через некоторое время
переходил в темнобурый, причем на стенках колбы выделялся
осадок.
По окончании опыта непрореагировавшие N2O4 и бензол
отгоняли на водяной бане. Остаток перегоняли с водяным па-
паром и перешедший в дестиллят нитробензол экстрагировали
эфиром, из которого он выделен фракционированной перегон-
перегонкой (после отгонки растворителя).
При отношении реагентов 0,5 моля N2O4 на 1 моль бензола
получено 22 г нитробензола, что соответствует 18% от теорети-
теоретического выхода на взятый бензол.
Мак-Ки и Вильгельм [78] при нитровании ароматических
соединений двуокисью азота применяли в качестве катализа-
катализатора силикагель. Нитрование бензола проводилось следую-
следующим образом. Окислы азота, полученные при взаимодействии
As2O3 с HNO3, проходили через реометр, а из последнего
Метод получения фтористого бора описан ниже в гл. VI.
412
Нитрование органических соединений окислами азота
в испаритель, где происходило испарение бензола, поступавшего
с определенной скоростью из сборника. Образовавшуюся в ис-
испарителе смесь паров бензола и двуокиси азота направляли в
реакционную камеру (стеклянную трубку со слоем катализа-
катализатора длиной 110 см), которую нагревали в длинной электро-
электропечи. Жидкие продукты реакции и непрореагировавший бен-
бензол собирали в приемнике, соединенном с обратным холодиль-
холодильником и охлаждаемом льдом, а окислы азота, образовавшиеся
во время реакции, вместе с избыточной двуокисью азота про^
ходили через поглотительную систему с водой, далее через рас-
растворы окислителей, где окись азота N0 окислялась до NO2,
которая затем улавливалась 10%-ным раствором NaOH.
Опыты, в которых варьировались объемная скорость, от-
отношения реагентов и температура реакции, показали, что кон-
конверсия бензола в нитробензол возрастает с повышением темпе-
температуры (но не выше 310°), уменьшением объемной скорости и
увеличением отношения NO2 к бензолу. При повышении тем-
температуры выше 310° конверсия уменьшается вследствие усиле-
усиления побочных реакций окисления, которые становятся особен-
особенно заметными при 380°. Падение выходов при температурах
выше 310° объясняется также понижением активности катали-
катализатора.
Найдено, что при 310° и скорости поступления бензола
0,5 мл/мин конверсия в нитробензол составляет 30,1% (на взя-
взятый в реакцию бензол), если в течение 1 часа пропускать через-
реакционную камеру 31,1 г NO2 и 26,4 г СвН6 (молярное отно-
отношение двуокиси азота к бензолу 2 : 1). При увеличении моляр-
молярного отношения NO2 : С6Н6 до 7 : 1 E4,5 г NO2 на 13,2 г бен-
бензола) конверсия при той же температуре достигает 83,6%.
Интересно отметить, что при действии окислов азота на бен-
бензол, наряду с нитробензолом, образуется также нитрофенол,
который при температурах выше 330° представляет собой пре-
преобладающий продукт реакции. Исходя из данных анализа жид-
жидких и газообразных продуктов, получающихся при нитрова-
нитровании бензола двуокисью азота, Мак-Ки и Вильгельм предпола-
предполагают, что эта реакция протекает по следующему уравнению:.
2С6Н6 + 3NOa -> 2CeH6NO2 + NO + Н2О.
Нитрование в присутствии катализаторов
413
По мнению этих исследователей, действие силикагеля объяс-
объясняется отчасти его дегидратирующими свойствами (как из-
известно, силикагель успешно применяют в качестве катализа-
катализатора при синтезах сложных эфиров, алкилировании в паровой
фазе аммиака и анилина действием спиртов и других реакциях,
яри которых, как и в данном случае, происходит выделение
воды).Несомненно, однако, что силикагель обладает также спе-
специфичностью действия при реакции нитрования NO2 аромати-
ароматических соединений, так как другие дегидратирующие катали-
катализаторы, как, например, окись магния и другие, не оказывают
на эту реакцию никакого каталитического действия.
Опыты по нитрованию толуола дали, сравнительно с бен-
бензолом, менее благоприятные результаты. При пропускании
через каталитическую камеру при 275° в течение 1 часа 31 г
NO2 и 31 г толуола, что соответствует молярному отношению
первой ко второму 2:1, Мак-Ки и Вильгельм получили нитро-
нитротолуол с выходом всего 6,8% от теоретического.
Леви [79] разработал метод нитрования парафинов сухой
ТЮ2 в присутствии катализатора, содержащего соединения
мышьяка или сурьмы. Например, смесь 30% изобутана и 70%
•бутана пропускали в количестве 5 л в течение 1 часа через сме-
смесительную камеру, в которую поступала NO2 со скоростью
10 л/час. Смесь реагентов проходила через сушильную колонку
•с Р2О5 в конвертор, в котором находился катализатор, состояв-
состоявший из мышьяковистокислого натрия, смешанного со стеклом.
Нитрование проводили при 200° и времени контакта 120 сек.
После удаления избыточной NO2 выделен продукт, который
состоял из смеси триметилнитрометана (CH3)gCNO2 F0%),
2-нитробутана B0%), 2,3-динитробутана B0%).
Общий выход нитросоединений составлял 45% на пропу-
пропущенный или 90% на вошедший в реакцию бутан. По этому же
способу Леви нитровал нормальный бутан (без примеси изобу-
изобутана) и пропан.
При пропускании метана и окислов азота (N2O4) через
трубку из стекла пирекс при температуре 440—680° в присут-
присутствии различных катализаторов (платина, пятиокись ванадия,
пемза и никель) Фрелих [80] получил формальдегид с выходом
414
Нитрование органических соединений окислами азота
25%, считая на использованный метан. Среди продуктов
ции метанол не обнаружен.
Согласно американскому патенту [81], смесь равных объе-
объемов пропана и N2O4 пропускали при температуре 270° в тече-
течение 80 сек. (время контакта) через катализатор, состоящий
из А1 с 1,7% Си и 1,3% Fe. Получаются нитропарафины и про-
продукты окисления.
Другой американский патент [82] указывает, что при нит-
нитровании ароматических углеводородов окислами азота при
температуре 130—430° в присутствии таких катализаторов, как
метафосфат металла, фосфорная кислота, фтористый бор,
получаются мононитропроизводные ароматических углеводоро-
углеводородов.
Следует отметить, что в отличие от двуокиси азота ни за-
закись, ни окись азота не реагируют с ароматическими углеводо-
углеводородами.
ЛИТЕРАТУРА
1. К. Clusius, M. Veechi. Helv. Chim. Acta, 36, 930 A953).
2. A. D. Walsh. Fuel, 33, 243 A954).
3. А. А. Баландин, Я. Т. Э й д у с, Н. 3 а л о м и н. Журн-
физ. химии, 6, 389 A935).
4. Т. В. Заболоцкий. Журн. общ. химии, 20, 1992 A950).
5. F. Blacet. Ind. Eng. Chem., 44, 1341 A952).
6. H. Wieland. Ann., 328, 154 A903); 329, 225 A903); 340, 63
A905); 360, 299 A908); 424, 71 A921).
7. H. Wieland, H. Stenzel. Ber., 40, 4825 A907).
8. J. Schmidt. Ber., 36, 1775 A903).
9. H. Я. Демьянов, К. В. Сидоренко. ЖРХО, 41, 832
A909).
10. Н. Я. Демьянов. ЖРХО, 36, 15 A904); Анило-красочн. пром.,
4, 132 A934).
И. А. М i с h a e I, G. Н.
12. А. М irh a el, G.
A937).
13. A. Schaarschmidt, Hoffmeier. Ber., 58, 1047 A937).
14. A. Sr.haarschmidt. Z. angew. Chem., 36, 535, 565 A923).
15. A. Smith. Амер. патент 2384087; С. А., 40, 347 A946).
16. H. В al dock, A. Smith. Ind. Eng. Chem., 44, 2041 A952).
17. T. Doumani. Амер. патент 2621205; С. А., 47, 10552b A953).
Carlson. J.Org. Chem., 5, 1—23 A940).
H. Carlson. J. Am. Chem. Soc, 59, 843
Литература
415
18. N. L evy, С W. S с a i f e, A. E. Wilder. J. Chem. Soc, 1093
A946).
19. N. L e v у, С W. S с a i f e, A. E. Wilder. J. Chem. Soc, 52
A948).
20. H. Baldock, N. Levy, С W. Scaife. J. Chem. Soc,
2627 A949).
21. G. D a r z e n s. Compt. rend., 229, 1148 A949).
22. S. M i u г а. С A., 48, 1412d A954); С A., 2208d A950).
23. H. В i 1 t z. Ber., 35, 1528 A902); В u г г о e, Wurtter.' J. Chem.
Soc, 134, 1357 A932).
24. Патент СССР 66299 A946).
25. Franklin, W i 1 k i n s. Англ. патент 532686 A940).
26. P. W. Neber, S. Paeschke. Ber., 5,9, 2140 A926).
27. С F. Allen, С G. Eliot, A. Bell. С. А., 33, 6284
A939).
28. H as en bach. J. prakt. Chem., 4, 17 A871).
29. И. Г у б е н. Методы органической химии, т. IV, кн. 1. М., Госхимиз-
дат, 1949, стр. 303.
30. A. Leeds. Ber., 13, 1993 A880); 14, 482 A881).
31. F r i e d b u r g, M a n d e 1. J. Am. Chem. Soc., 12, 7 A890).
32. С Liebermann, L. Lindenmann. Ber., 13, 1584 A880).
33.1. M e is enh e i m er. Ann.. 330, 149 A904); Barnetl.
J. Chem. Soc, 127, 2040 A925).
34. L. W. В a s s, M. B. Johnson. J. Am. Chem. Soc, 46, 456
A924); M. А. Ильинский, Журн. общ. химии, 5, 469 A928).
35. Burnett. J. Chem. Soc, 127, 2040 A925).
36. H. Wieland. Ber., 54, 1776 A921).
37. O. Witt. C, II, 226 A880).
38. H. Wieland. Ber., 53, 210 A920).
39. M. Battegay, Kern. Bull. Sec. Chim., 43, 114 A928).
40. A. Schaarschmidt, E. S m о 1 1 a. Ber., 57, 32A924).
41. A. Schaarschmidt, H. Balzerkewicz, J. G a n t e.
Ber., 58, 499 A925).
42. П. П. Ш о р ы г и н, А. В. Топчиев. Журн. общ. химии,
5, 549 A935).
43. J. Schmidt, E. Heinle. Ber., 44, 1488 A911).
44. I. J. R ink es. Rec. trav. chim., 46, 506 A937).
45. V a r m а, К r i s b a m u r t y. J. Indian Chem. Soc, 3, 323 A926).
46. L. Horner, F. H u b e n e t t. Ann., 579, 193 A953).
47. A. Kaufmann, H. Hussy. Ber., 41, 1736 A908).
48. H. А. Валяшко, В. И. Б л и з н ю к о в, А. Е. Л у п, к и и.
Тр. Харьковского технологич. ин-та, вып. 4, 48 A944).
49. М. И. Коновалов. ЖРХО, 25, 514 A893).
50. Fr. Fried 1. Ber., 45, 428 A912).
416
Нитрование органических соединений окислами азота
51. П. П. Шорыгин, А. В. Топчиев. Бег., 69, 1874 A936).
52. А. И. Титов. Журн. общ. химии, 18, 465, 473 A948).
53. М. U г b a n s к у et al. Compt. rena., 203, 620 A936).
54. M. U r b a n s к у et al. Compt. rend., 204, 870 A937).
.55. H. B. Hass, J. D о г s к у, Е. В. Hodge. Ind. Eng. Chem.,
33, 1138 A941).
56. А. И. Титов. Журн. общ. химии, 19, № 8, 1471 A949).
57. Амер. патент 2597027 A952); С. А., 47, 1726f A953).
58. П. П. Шорыгин, А. В. Топчиев. Вег., 67, 1362 A934).
59. А. В. Топчиев, В. П. Алания. Докл. АН СССР, 67,
297 A949).
60. Н. Капцов. Диссертация. Москва, 1949.
61. А. И. Т и т о в, М. К. Матвеева. Журн. общ. химии, № 2,
238 A953).
62. G. В а с h m a n n, L. К о h n. J. Org. Chem., 17, 942—54 A952);
G. Bachmann, J.Hewett, A. Millikan. J. Org.Chem.,
17, 935 A952).
63. H. W e g о f e г. Герм, патент 841287 A952); С, I, 7570 A952).
•64. Л. К. Мухин. Диссертация. Москва. 1954.
•65. G. G e i s е 1 е г. Angew. Chem., 67, № 9/10, 270 A955).
66. Н. В. Н a ss et al. J. Am. Chem. Soc, 75, № 6, 1382 A953).
67. Фокин. Патент СССР, 9294 A929).
68. L. A. Pinck. J. Am. Chem. Soc, 49, 2536 A927).
69. Амер. патент 1640737 A927).
70. M. В a 11 e g а у. Bull. Soc. Chim., 43, 109 A928).
71. А. И. Титов, А. Н. Барышникова. Журн. общ. химии,
6, 1800 A936).
72.. В. М. Родионов, В. К. Матвеев. Вег., 57, 17Н A924).
73. Weselsky. Вег., 8, 98 A875).
74. А. И. Титов. Журн. общ. химии, 7, 667 A937).
75. A. Sch a arschm id t. Вег., 57, 2065 A924).
76. I. R i e b s о m e r. Chem. Rev., 36, 178 A945).
77. M. И. Богданов. Анило-красочн. пром., 4, 133 A933).
78. R. H. McKee, R. H. Wilhelm. Ind. Eng. Chem., 28, 662
A936).
79. N. Levy. Амер. патент 2382241 A945).
80. F г 6 1 i с h. J. Am. Chem. Soc, 50, 3216 A928).
•81. Амер. патент 2464572 A949); С. А., 43, 4285e A949).
-82. Амер. патент 222994 A947); С. А., 1605 A948).
Глава шестая
НИТРОВАНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ОРГАНИЧЕСКИМИ И НЕОРГАНИЧЕСКИМИ
НИТРАТАМИ И ХЛОРИСТЫМ НИТРИЛОМ
I. Нитрование органическими нитратами
О применении органических нитратов в качестве нитрую-
нитрующих агентов в литературе имеется сравнительно мало данных.
Наибольшее число работ по применению органических нитра-
нитратов для нитрования относится к использованию этилнитрата,
бензоилнитрата и ацетилнитрата.
Этилнитрат или азотноэтиловый эфир C2H5ONO2 представ-
представляет собой жидкость уд. в. 1,105 (при 20°), растворимую в
воде, спирте и эфире. Температура кипения этилнитрата 87,5°.
Этилнитрат получается из азотной кислоты и этилового спирта
в присутствии азотнокислой мочевины. При перегреве этил-
этилнитрат разлагается со взрывом.
Подобно многим эфирам органических кислот, этилнитрат
конденсируется в присутствии натрия или этилата натрия с
соединениями, содержащими активную метиленовую группу.
При этом образуется натриевая соль изонитросоединения. На-
Например [1]:
СвН5СН2 + C2H6ONO2 + C2H5ONa -» CeH5C = NOONa + 2С2Н5ОН
цианистый L.. I
беадил CN CN
СвНбС = NOONa -> С,Н5 С = NOONa -» CeH5 CH = NOOH
COONa
CN
27 д. в. Топчиев
CeH5CH2NO2
фенилизонитрометан фенилиитрометан
418
Нитрование нитратами и хлористым нитрилом
При действии этилнитрата на циклопентадиен Тиле [21
получил нитроциклопентадиен. В 25 г абсолютного спирта рас-
растворяют 2,3 г натрия и к раствору прибавляют 1,1 г этилнит-
этилнитрата. По охлаждении до комнатной температуры в смесь вно-
вносят 6,6 г циклопентадиена и образовавшуюся прозрачную
бурую жидкость оставляют стоять несколько часов. Выделив-
Выделившуюся в виде мелких красновато-бурых пластинок натриевую
соль отсасывают и промывают эфиром. Свободный нитроцикло-
нитроциклопентадиен выделяется при подкислении из не слишком разбав-
разбавленного раствора соли в виде почти бесцветных быстро затвер-
затвердевающих капелек масла. Вещество, однако, очень легко раз-
разлагается.
Пиррол и его производные [3], а также индол при нитро-
нитровании этилнитратом дают соли соответствующих нитроловых
кислот, например:
СН СН c2h,ono2
СН СН Na
Y
н
пиррол
нс-
II
НС
NOONa
натриевая соль ииррол-
(j-нитроловой кислоты
При обработке бензотиазола этилнитратом в концентриро-
концентрированной серной кислоте при 0—5° получается 6-нитробензотиа-
зол в виде желтых игл с т. пл. 173—174°. 2-Аминобензотиазол
при обработке в концентрированной серной кислоте этилнитра-
этилнитратом дает 2-амино-6-нитробензотиазол [4].
Мононитротолуолы можно получить нитрованием этилни-
этилнитратом [5] по следующему методу: к перемешиваемой смеси то-
толуола и этилнитрата при температуре 40° постепенно прили-
приливают 98%-ную серную кислоту. Температура реакции поддер-
поддерживается не выше 60°, после чего прибавляют еще этилнитрат
и перемешивают 10 мин. После охлаждения разбавляют водой,
отделяют водный слой, верхний слой промывают водой, раство-
растворяют в растворе углекислого натрия и перегоняют. Получают
мононитротолуолы с выходом 94,5% от теории. При фракцио-
фракционированном разделении можно выделить п-нитротолуол. В при-
Нитрование органическими нитратами
419
сутствии хлористого алюминия этилнитрат энергично реаги-
реагирует с бензолом с образованием нитробензола (подробнее см.
гл. I).
Бензоилнитрат представляет собой смешанный ангидрид
бензойной и азотной кислот. Бензоилнитрат получается по ме-
методу Френсиса действием хлористого бензоила на азотнокис-
азотнокислое серебро при температуре 15°:
С6Н5СОС1 + AgONO2 — AgCl -f CeH6COONO2.
Полученный этим методом бензоилнитрат всегда содержит при-
примесь 15—20% бензойного альдегида и представляет собой мас-
маслянистую жидкость уд. в. 1,3° (при 0°). При действии воды бен-
бензоилнитрат легко разлагается на бензойную и азотную кислоты:
C6H6COONO2 + Н2О — С6НбСООН + ШО3.
Подобно другим смешанным ангидридам, бензоилнитрат
при перегонке распадается на соответствующие простые анги-
ангидриды:
2CeH6COONO2 - (С6НбСОJО + N2O6 - (СвНбСОJО
О.
Исследования Френсиса [6] показали, что нитрование бен-
зоилнитратом дает хорошие результаты, если его добавлять
при охлаждении к избытку нитруемого соединения. В тех слу-
случаях, когда реакция протекает слишком энергично, нитруемое
соединение растворяют в четыреххлористом углероде. Иногда
растворяют в этом растворителе также и бензоилнитрат, так
как при этом условии удается поддерживать достаточно высо-
высокую температуру реакционной смеси, необходимую для полу-
получения оптимальных выходов нитросоединений. Например, тио-
фен при проведении нитрования в растворе СС14 дает соответ-
соответствующее мононитропроизводное с теоретическим выходом.
О нитрующей способности бензоилнитрата свидетельствует
его отношение к спиртам и ароматическим аминам. Так, на-
например: бензоилнитрат легко превращает этиловый спирт в
этилнитрат, а при действии на вторичные ароматические ами-
амины дает с прекрасными выходами соответствующие нитроамины.
Бензоилнитрат энергично реагирует и с ароматическими угле-
28 А. В. Топчиев
420
Нитрование нитратами и хлористым нитрилом
водородами. Бензол, толуол и особенно легко м-ксилол дают
соответствующие мононитропроизводные. При нитровании то-
толуола, ксилола и мезитилена нитрогруппа вступает в ядро,
а не в боковую цепь. Мезитилен в растворе четыреххлористого
углерода уже при низких температурах нитруется бензоилни-
тратом в мононитромезитилен с теоретическим выходом. С дру-
другой стороны, бромбензол и бензоилхлорид реагируют с бензо-
илнитратом с большим трудом и дают лишь следы соответствую-
соответствующих п-нитропроизводных.
При действии бензоилнитрата на фенол образуется смесь
о- и п-нитрофенолов с преобладанием о-изомера. Еще легче
протекает нитрование при взаимодействии бензоилнитрата с
эфирами фенола — анизолом и фенетолом, причем получаются
соответствующие о-нитропроизводные с выходами, близкими
к теоретическим. Следует отметить, что при нитровании фенола
и его эфиров другими, обычно применяющимися нитрующими
агентами в преобладающем количестве образуются п-нитро-
производные.
В отличие от фенола нитрование бензоилнитратом а- и р-
нафтолов приводит лишь к незначительным выходам 2,4-ди-
нитро-а-нафтола (т. пл. 138—139°) и 1,6-динитро-р-нафтола
(т. цл. 195°). Эфиры же а- и р-нафтолов в растворе четырех-
четыреххлористого углерода легко нитруются бензоилнитратом; при
действии последнего на этиловый эфир а-нафтола образуется
4-нитропроизводное этого эфира; метиловый и этиловый эфиры
р-нафтола нитруются в положение 1, т. е. дают соответствую-
соответствующие эфиры Г-нитро-2-нафтола. По отношению к большинству
ароматических альдегидов (бензальдегиду, анисовому альде-
альдегиду, салициловому альдегиду и др.) бензоилнитрат действует
главным образом как окислитель; нитросоединения образуются
в этих реакциях лишь в ничтожных количествах. С другой сто-
стороны, при обработке бензоилнитратом р-нафтальдегид количе-
количественно превращается в соответствующее нитропроизводное
(т. пл. 194—195°), а ванилин также с количественным выходом
дает 3-нитрованилин (т. пл. 178°). Кумарин нитруется бензо-
бензоилнитратом с образованием 5-нитрокумарина (т. пл. 185°).
Полученные Френсисом экспериментальные данные показы-
Нитрование органическими нитратами
421
вают, таким образом, что бензоилнитрат как нитрующий
агент обладает следующими особенностями: 1) реакция проте-
протекает при полном отсутствии воды, что особенно важно при нит-
нитровании тиофена; 2) в некоторых случаях нитрование бензоил-
бензоилнитратом приводит, в отличие от обычно применяющихся
методов нитрования, к исключительному образованию о-нитро-
производных или к преобладанию последних (анизол, фенетол,
фенол).
Действие бензоилнитрата на амины исследовано Батлером
[7]. С первичными аминами бензоилнитрат реагирует, давая
бензоильные производные:
C6H6COONO2 + 2RNH2 - C6H6CONHR + RNH2-HNO8.
При действии бензоилнитрата на м-хлоранилин образуется
м-хлоранилид бензойной кислоты (т. пл. 120°); аналогичным об-
образом п-хлоранилин дает п-хлоранилид бензойной кислоты
(т. пл. 190°). При обработке бензоилнитратом Пганизидина,
о-толуидинаи ксилидинов получаются соответствующие анизи-
диды, толуидиды и ксилидиды бензойной кислоты.
Вторичные амины при действии бензоилнитрата дают также
соответствующие бензоильные производные:
C6H6COONO2
R
4 R4
>NH-*C6H5CONRR'+ >NH.HNO3.
/ R'/
В некоторых случаях, однако, бензоилнитрат реагирует со
вторичными аминами с образованием соответствующих нитро-
аминов. Так, например, N-метил-п-толуидин дает при дей-
действии бензоилнитрата N-метил-п-толилнитроамин (т. пл. 74,5°)
с теоретическим выходом:
H3CNNO2
Вильштеттер [8], применив метод Френсиса, получил
«-мононитродурол из дурола.При нитровании дурола в растворе
28*
422
Нитрование нитратами и хлористым нитрилом
хлороформа 100%-ной азотной кислотой в присутствии сер-
серной кислоты получается, как известно, только динитропроиз-
водное. Вилыптеттер обрабатывал бензоилнитратом дурол в ра-
растворе четыреххлористого углерода при сильном охлаждении
(экзотермическая реакция). Продукт реакции разбавляли эфи-
эфиром и промывали растворами соды и затем едкого натра для
удаления бензойной кислоты. После отгонки эфира и четырех-
четыреххлористого углерода (в вакууме) нитросоединение перегнано
с паром и затем перекристаллизовано из метилового спирта.
В результате этой обработки получен мононитродурол в виде
бесцветных длинных призм с т. пл. 52,5°:
CH2NO2
СН3
I
н3с-
Л-сн,
V
СН3
дуро
Н3С-\/
l'-нитро дурол
Исследованием строения этого продукта установлено, что при
действии бензоилнитрата на дурол нитрогруппа вступает не в
ядро, а в боковую цепь.
"Интересно отметить, что полученное Вилыптеттером to-мо-
нонитропроизводное дурола при действии смеси азотной и сер-
серной кислот количественно нитруется в ядро с образованием
1',3,6-тринитродурола (шестиугольные призмы с т. пл. 139°):
CH2NO2
I
O2N—/V- СНз
СН3
Ацетилнитрат как нитрующий агент имеет некоторые пре-
преимущества перед бензоилнитратом; при его применении
выделяется не вода или минеральная кислота, а летучая
уксусная кислота, которая может легко удаляться из реакцион-
реакционной смеси:
RH + СНзСООЖ)., -* RNO2 + СН3СООН.
Нитрование органическими нитратами
423
Ацетилнитрат получают из азотного ангидрида (приготов-
(приготовленного перегонкой азотной кислоты с фосфорным ангидри-
ангидридом) и уксусного ангидрида
CH3COS
СНзСС)/
'Ч
,NO2
NO2
2CH3COONO2.
Ацетилинитрат представляет собой очень гигроскопичную бес-
бесцветную жидкость, дымящую на воздухе; уд. в. 1,24 A5°).
Синтез ацетилнитрата осуществлен Пикте и Хотинским сле-
следующим образом [9]: азотный ангидрид, полученный посред-
посредством перегонки концентрированной азотной кислоты над
РгО5, вносили равными частями в уксусный ангидрид, причем
он растворялся в последнем без заметного повышения темпе-
температуры реакционной смеси. Для отделения ацетилнитрата от
избытка уксусного ангидрида продукт реакции перегоняли
в вакууме при 70 мм и 22° (если перегонку производить при
обыкновенном давлении, то ацетилнитрат взаимодействует с
уксусным ангидридом с образованием тетранитрометана).
При действии воды ацетилнитрат быстро разлагается на
уксусную и азотную кислоты с выделением тепла.
По своему действию на органические соединения ацетил-
ацетилнитрат обнаруживает большое сходство с бензоилнитратом.
Он реагирует со спиртами е. образованием соответствующих
сложных эфиров азотной кислоты.
По отношению к ароматическим соединениям ацетилнит-
ацетилнитрат — очень энергичный нитрующий агент (его обычно при-
применяют при низких температурах и в виде сильно разбавлен-
разбавленных растворов в четыреххлористом углероде или уксусном
ангидриде). Высокая нитрующая активность ацетилнитрата
объясняется тем, что нитрование протекает без выделения воды
и образования сильных минеральных кислот.
Исследовано действие ацетилнитрата на некоторые арома-
ароматические соединения. Бензол, толуол, бензилхлорид, бензой-
бензойная кислота, фенол, анизол, ацетанилид, нафталин, хинолин
дают при нитровании соответствующие мононитросоедйнения
с теоретическими или почти теоретическими выходами. При
действии ацетилнитрата на производные бензола получаются,
424
Нитрование нитратами и хлористым нитрилом
как и при нитровании бензоилнитратом (см. выше), главным
образом о-нитропроизводные. Так, например, нитрование то-
толуола, фенола и бензилхлорида приводит к смеси о- и п-нитро-
производных.
В табл. 34 дано содержание о- и п-нитропроизводных в про-
продуктах реакции при нитровании ацетилнитратом.
Таблица 34
Нитруемое ве-
вещество
Толуол ....
Фенол ....
Бензилхлорид
Ацетанилид .
Содержа-
пие 0-И80-
мера
Содержа-
Содержание П-И80-
мера
%
88
52
60
100
12
48
40
0
Как видно из таблицы, ацетанилид дает в качестве продукта
реакции исключительно о-нитропроизводное. На амины аце-
тилнитрат также действует ацетилирующим образом. При взаи-
взаимодействии ацетилнитрата с анилином в растворе четыреххло-
ристого углерода при сильном охлаждении (смесью льда с
поваренной солью) получаются с теоретическим выходом эквимо-
эквимолекулярные количества ацетанилида и анилин-нитрата.
6-нитро-о-толуидин получен нитрованием ацетилнитратом
ацетил-о-толуидина по следующему методу: к смеси 66 г ацетил-
нитрата и 150 г ледяной уксусной кислоты при —10° прибав-
прибавляют 85 г ацетил-о-толуидина и оставляют на ночь. По прибав-
прибавлении раствора поваренной соли из реакционной Смеси выпа-
выпадает нитропродукт (92 г), который омыляют соляной кислотой
и подвергают перегонке с водяным паром. Выход
6-нитро-о-толуидина 53%.
Тиофен реагирует с ацетилнитратом без применения рас-
растворителей с образованием нитротиофена (т. пл. 44°); реакцию
необходимо проводить при сильном охлаждении. Антрацен с
•Нитрование органическими нитратами
425
ацетилнитратом также дает нитропроизводное. При действии
ацетилнитрата на хлороформ получается хлорпикрин. При
действии уксусного ангидрида и уксусной кислоты на ацетил-
нитрат получается тетранитрометан.
Следует, однако, отметить, что трудно нитрующиеся соеди-
соединения, как, например, нитробензол, хинон и пиридин, не нит-
нитруются ацетилнитратом даже при высоких температурах. Вме-
Вместо готового ацетилнитрата можно с успехом применять смесь
концентрированной азотной кислоты с уксусным ангидридом
[10]. В. А. Измаильский и А. И. Козин [11] получили таким
путем из 1'-хлор-1-метилнафталина его 8-нитропроизводное.
Введение одного атома хлора в метильную группу а-метил-
нафталина уже настолько снижает активирующее действие ме-
тильной группы, что реакция направляется главным образом
на незамещенное второе кольцо нафталина. Нитрованием
1'-хлор-1-метилнафталина смесью уксусного ангидрида и азот-
азотной кислоты (уд. в. 1,52) при температуре 5—10° получают
8-нитро-1'-хлор-1-метилнафталин.
Адетилнитрат рекомендуется применять для нитрования
легкоомыляющихся сложных эфиров, когда необходимо избе-
избежать действия воды, например для получения метилового
эфира нитроопиановой кислоты и других эфиров.
Ингольд и другие [12] проводили нитрование бензола и то-
толуола в различных условиях (различные температуры и кон-
концентрация уксусного ангидрида), а также изучали кинетику
нитрования ацетилнитратом галоидбензолов совместно с бен-
бензолом при применении различных растворителей и различных
температур нитрования.
Эммонз и Фриман [12а] применяли в качестве нитрующего
агента нитрат ацетонциангидрина.
Авторы установили, что нитрат ацетонциангидрина является
единственным в своем роде нитрующим агентом аминов в щелоч-
щелочной среде.
Нитрат ацетонциангидрина легко получается нитрованием
ацетонциангидрина дымящей азотной кислотой в уксусном
ангидриде. Этим методом нитрозфир ацетонциангидрина был
получен с выходом 65—67%:
426
Нитрование нитратами и хлористым нитрилом
он
СНз — С — СНз
CN
ONO2
(СН,С0),0 |
¦ HNOS » СНз — С — СНз
CN
Нитрат ацетонциангидрина—подвижная бесцветная жидкость,
легко перегоняющаяся в вакууме.
Нитрат ацетонциангидрина в щелочной среде легко всту-
вступает в реакцию с первичными и вторичными аминами, образуя
нитроамины.
Первичные алифатические и алициклические нитроамины
были получены с 50—60 %-ным выходом, а вторичные нитроами-
нитроамины с 55—80%-ным выходом. Реакция протекает по схеме:
ONO2
С — СН3 — R2NNO2 + (СН3J СО + HCN.
R2NH + CH3!
Эммонз и Фриман показали также, что цианистый водород
и ацетон, образующиеся в продуктах реакции, в свою очередь
реагируют с избытком амина с образованием соответствующего
а-аминонитрила:
СНз
I
R2NH + HCN + (СН3J СО - R2N — С — CN
СНз
Авторы исследовали влияние различных растворителей
на реакцию нитрования аминов нитратом ацетонциангидрина.
Вторичные амины сами по себе являются хорошими раствори-
растворителями, хотя реакция может также производиться в растворе
ацетонитрила и тетрагидрофурана. Амин применялся в 5-крат-
5-кратном избытке и нагревался в течении 5 час. с нитратом
ацетонциангидрина.
При применении растворителя с низкой диэлектрической
постоянной или избытка амина выход нитроамина был лишь
20—25 %. При нагревании 3-кратного избытка первичного амина
с нитратом ацетонциангидрина в течение 6 час. в растворе аце-
ацетонитрила или тетрагидрофурана получался хороший выход
нитроаминов.
Нитрование органическими нитратами
427
Для нитрования аминов авторы применяли также нитроэфи-
ры циангидринов циклопентанона и циклогексанона:
/\
/
/\
O2NO CN
¦ (СН3J СО + NaCN + СН (СО2СаН6J.
O2NO CN
В другой работе [126] Эммонз и Фриман изучали реакцию
нитрования малонодого, ацетоуксусного эфиров и их алкильных
производных нитратом ацетонциангидрина в щелочной среде.
В качестве основания авторы применяли гидрид натрия.
Малоновый эфир первоначально превращался в его натриевое
производное и затем к полученному соединению добавлялся
нитрат ацетонциангидрина. Реакция протекает по уравнению:
NaH
СН2(СО2С2Н5J—- Na[CH(CO2C2H5J]
Na [СН (СОаСаН5J] + (СН3J CONO2 ¦
CN NO2
Реакция обычно проводилась в избытке натриевого произ-
производного малонового эфира в растворе тетрагидрофурана. При
применении 3-кратного избытка натриевого производного мало-
малонового эфира выход нитропроизводного диэтилмалонового эфира
был равен 45 %.
При проведении реакции нитрования натриевых производ-
производных малонового и ацетоуксусного эфиров и их алкильных
производных в избытке гидрида натрия образующиеся нитро-
производные тут же в реакционной массе подвергались расщеп-
расщеплению с образованием а-нитроэфиров:
RCH(CO2C2H6J
или
RCHCO2C2H5
СОСНз
Выход а-нитроэфиров, в зависимости от применяемого
производного малонового или ацетоуксусного эфира, изменялся
в пределах 42—70%.
Авторы считают, что разработанный ими метод нитрования
малонового и ацетоуксусного эфиров и их алкильных произ-
производных с одновременным щелочным расщеплением полученных
2 NaH
+ (СН3J CONO2 *¦ R СН СО2С2Н5
CN NO2
428
Нитрование нитратами и хлористым нитрилом
нитропроизодных является наиболее общим методом синтеза
а-нитроэфиров и протекает в одну стадию. Этот метод может
применяться для нитрования производных малонового и ацето-
уксусного эфиров, содержащих группы (например, ароматические
кольца), которые взаимодействуют с обычными нитрующими
смесями.
Арилацетонитрилы также нитруются нитратом ацетонциан-
гидрина с образованием соответствующих нитроацетонитриль-
ных производных.
Нитроацетонитрильные производные авторы не выделяли
в чистом виде, а превращали в арилнитрометаны обычным
способом:
NaH NaOH
ArCH2CN + (CHSJ CONO2 —> ArC = NO2Na —->- ArCH2NO2.
I j I HOI
CN CN
Этим способом фенилацетонитрил превращался в фенилнит-
рометан с 70%-ным выходом, а о-хлорфенилнитрометан был
получен из о-хлорфенилацетонитрила с 42 % -ным выходом.
Эммонз и Фриман изучали также реакцию нитрования нит-
нитратом ацетонциангидрина ряда алкоголятов спиртов [12в].
Ими установлено, что эта реакция приводит к образованию двух
соединений—нитроэфира и соответствующего эфира ос-оксиизомас-
ляной кислоты:
NaOR + (CH3J CONO2 -^* RONO2
| Н,0
CN
CCOOR.
ОН
II. Нитрование неорганическими нитратами
Нитрование ароматических углеводородов в боковую цепь,
а также нитрование нафтеновых и парафиновых углеводоро-
углеводородов неорганическими нитратами в литературе освещено очень
слабо. Имеется всего лишь несколько работ об этой реакции.
В 1894 г. М. И. Коновалов [13] показал, что азотнокислая
медь (без прибавления воды) энергично взаимодействует с изо-
октанафтеном в запаянных трубках при 160—170° или при
кипячении в открытом сосуде. При этом получаются нитропро-
дукт и кислоты.
Нитрование неорганическими нитратами
429
В 1901 г. М. И. Коноваловым [14] опубликована работа по
нитрованию в боковую цепь дифенилметана и этилбензола раз-
различными неорганическими нитратами. Опыты проводились в
запаянных трубках.
Для каждого опыта бралось 5 мл углеводорода (этилбен-
(этилбензола или дифенилметана), 40 мл воды и к смеси прибавлялась
азотнокислая соль в таком количестве, чтобы при полном гид-
гидролизе соли получался 12%-ный раствор азотной кислоты.
В некоторых опытах М. И. Коновалов применял 10%-ный ра-
раствор соли.
Нитрат висмута Bi(NO3K, а также его основная соль
Bi(NO3)(OHJ, нитрат серебра AgNO3, нитрат ртути Hg(NO3J,
смесь алюминиевых квасцов и нитрата алюминия нитруют ди-
дифенилметан при нагревании (с водой) до 110—125° в течение
6 час.
Нитрат висмута и смесь алюминиевых квасцов с нитратом
алюминия нитруют дифенилметан даже при нагревании (с во-
водой) до 100—106° в течение 6 час. Нитрат серебра и нитрат
ртути при этой температуре нитросоединений с дифенилметаном
не образуют. Нитрат свинца не образует нитросоединений с
дифенилметаном при нагревании до 125°.
При нитровании дифенилметана неорганическими нитра-
нитратами ни в одном опыте не наблюдалось выделения газообраз-
газообразных продуктов. Это указывает на Отсутствие заметного окис-
окисления углеводородов в процессе нитрования.
Нитраты натрия и калия (которые применялись в виде
10%-ных растворов) не образуют нитросоединений с этилбен-
аолом при нагревании реакционной смеси до 125° в течение
7 час.
Как показали опыты М. И. Коновалова, на нитрующую спо-
способность нитрата калия оказывает большое влияние добавле-
добавление в реакционную смесь небольшого количества нитрита ка-
калия. Так, например, взаимодействие этилбензола с 10%-ным
раствором нитрата калия с небольшой примесью нитрита ка-
калия приводит к образованию нитроэтилбензола.
На основании проведенных исследований М. И. Коновалов
пришел к следующим выводам.
430
Нитрование нитратами и хлористым нитрилом
1. Нитраты щелочных металлов и аммония при температу-
температурах до 125° или совсем не гидролизуются водой или гидроли-
зуются очень слабо, так что концентрация получающейся азот-
азотной кислоты будет очень низкой, вследствие чего эти соли не
дают нитросоединений при нагревании их растворов с углево-
углеводородами.
2. Нитраты висмута, алюминия, ртути, серебра при темпе-
температуре 125° и ниже значительно гидролизуются, вследствие
чего эти азотнокислые соли (особенно висмута и алюминия)
можно применять для нитрования углеводородов при нагре-
нагревании.
3. При нитровании углеводородов водными растворами нит-
нитратов металлов не наблюдается заметного окисления углево-
углеводородов, что имеет определенные преимущества перед нитро-
нитрованием в тех же условиях разбавленной азотной кислотой.
С. С. Наметкин [15] применял азотнокислый алюминий для
нитрования нафтеновых углеводородов.
Смесь 78 г циклогексана и 210 г азотнокислого алюминия
нагревалась в запаянных трубках при температуре 110—115°.
В -трубках развивалось сильное давление. После обычной об-
обработки продуктов реакции было получено 27 г мононитропро-
дукта, т. е. 56,7% от теоретического выхода. При нитровании
азотной кислотой такого высокого выхода нитроциклогексана
получить не удается, и этот спосиб нитрования С. С. Наметкин
считает наилучшим для получения нитроциклогексана.
Метилциклогексан в запаянных трубках нитруется легко
как азотной кислотой уд. в. 1,2, так и сухим азотнокислым алю-
алюминием. Основным продуктом реакции в обоих случаях яв-
является третичное нитросоедипение. При нитровании азотной
кислотой в получающемся небольшом количестве смеси первич-
первичного и вторичного нитросоединений преобладает вторичное
нитросоединение, тогда как при нитровании азотнокислым
алюминием преобладает первичное. Выход сырого нитропро-
дукта достигает при нитровании азотной кислотой 58%, при
нитровании нитратом алюминия — 72%, считая на углеводо-
углеводород, вошедший в реакцию.
Циклопентан нитровался нитратом алюминия в запаянных
Нитрование неорганическими нитратами
431
трубках при 110—115°. В каждую трубку загружалось 10 мл
углеводорода и 20 г соли. В результате было получено 2 г чи-
чистого нитроциклопентана (из трех трубок). В продуктах реак-
реакции обнаружена глутаровая кислота.
Как и М. И. Коновалов, С. С. Наметкин объясняет нитрую-
нитрующее действие нитрата алюминия гидролизом при температуре
реакции нитрата алюминия с образованием азотной кислоты.
Азотнокислый алюминий A1(NO3K-9H2O плавится, не разла-
разлагаясь, при 73°. При более высокой температуре начинается
гидролиз. При 140° происходит полный распад нитрата алюми-
алюминия на гидроокись алюминия и азотную кислоту. При темпе-
температурах выше 73° и ниже 140°, очевидно, будет наблюдаться
некоторое равновесие между солью и продуктами ее гидролиза.
В присутствии углеводорода это равновесие, вследствие вступ-
вступления HNO3 в реакцию, будет постепенно нарушаться, и для
восстановления его гидролиз должен будет идти все дальше
и дальше. Таким образом, при нитровании азотнокислым алю-
алюминием кислота действует не сразу всем своим количеством,
а постепенно. Поэтому выходы на нитросоединения в этом слу-
случае получаются лучше, чем при нитровании азотной кислотой,
если последнюю взять с таким расчетом, чтобы относительное
количество ее было равно количеству кислоты, которое может
образоваться при полном гидролизе нитрата алюминия, взя-
взятого для реакции.
Из парафиновых углеводородов М. И. Коновалов [16] изу-
изучал нитрование неорганическими нитратами диизоамила
(СН3JСНСН 2СН 2СН 2СН 2СН (СН8),.
Нитрование диизоамила нагреванием углеводорода до тем-
температуры кипения в течение 8 час. с 32%-ным раствором нитра-
нитрата ртути дало отрицательные результаты.
При кипячении диизоамила с 13%-ным раствором нитрата
алюминия в течение 10 час. в продуктах реакции обнаружены
нитросоединения, растворимые в щелочи.
При нагревании 60 г диизоамила до 110° с 60 г сухого нит-
нитрата висмута в течение 8 час. получается 63 г масла, из кото-
которого около 40 г растворяется в щелочи. В этом растворе обна-
обнаружены первичные и вторичные нитросоединения. Нераство-
432
Нитрование нитратами и хлористым нитрилом
римая в щелочи часть состоит главным образом из диизоамила.
Из нее было выделено около 1 г третичных нитросоединений.
М. И. Коновалов изучал также нитрование диизоамила нит-
нитратом алюминия в запаянных трубках. Нитрование произво-
производилось как с раствором нитрата алюминия, так и с сухой солью.
Диизоамил нагревался с 13%-ным раствором нитрата алюми-
алюминия при 130—150° в течение 8 час. В результате реакции полу-
получалось небольшое количество смеси первичного, вторичного
и третичного нитросоединений. Из 10 г углеводорода 7 г не всту-
вступило в реакцию.
При нитровании диизоамила сухим азотнокислым алюми-
алюминием в течение 8 час. при 130° получалась в основном смесь
первичного и вторичного нитросоединений. Из 10 г углеводо-
углеводорода 5 г в реакцию не вступало. Третичного нитропродукта было
получено всего лишь 0,5 г.
Возможность применения неорганических нитратов для по-
получения нитросоединений как жирного, так и ароматического
ряда изучалась автором настоящей книги. Так, была исследо-
исследована реакция нитрования п.гептана и изооктана B,2,4-три-
метилпентана) солями азотной кислоты*. Нитрование указан-
указанных углеводородов производилось азотнокислым алюминием
A1(NO3K.9H2O, азотнокислым висмутом Bi(NO3K.5H2O, азот-
азотнокислой медью СиAЧОзJ-6Н2О, азотнокислым железом
Fe(NO3K • 9НаО и азотнокислым цинком Zn(NO3J. 6H2O. Реакция
проводилась в запаянных трубках при температуре 140° и
лишь в опытах по нитрованию азотнокислым цинком — при
температуре 160°.
При нитровании изооктана и н. гептана азотнокислыми
солями висмута, меди и железа продолжительность опытов
равнялась 8 час., а с солями алюминия и цинка — 20—40 час.
При проведении опытов с солями висмута, меди и железа на-
наблюдалось выделение окислов азота.
По окончании опыта ампулы охлаждались, цосле чего вскры-
вскрывались. Углеводородный слой, в котором содержались раство-
растворенные нитросоединеяия, отделялся от водного слоя, содержа-
* Неопубликованные данные.
Нитрование неорганическими, нитратами
433
щего не вошедшую в реакцию соль. Углеводородный слой про-
промывался водой, 5%-ным раствором бикарбоната натрия, вновь
водой и высушивался над безводным сульфатом натрия. Не
вошедший в реакцию углеводород отгонялся при атмосферном
давлении, а остатки отгонялись в вакууме.
Продукт, полученный после отгонки углеводорода, пред-
представлял собой нитросоединения с небольшой примесью карбо-
карбонильных соединений.
Результаты опытов по нитрованию н.гептана и изооктана
солями азотной кислоты приведены в табл. 35.
Таблица 35
Нитрование н.гептана и изооктана солями азотной кислоты
Углеводород
Соль
Взято:
углеводорода, г . .
Молярное отношение
углеводород: NO2.
Температура опыта,
°с
Продолж ительность
опыта, часы . . .
Получено нитросое-
нитросоединений, г . . . •
Выход на NO2, % .
Изооктан
AV
124
117
1,2: 1
140
20
32
25
• и.Гептав
А1-
109
104
1,34:1
140
20
22
20
и,-
109
104
1,7:1
140
8
24
28
Си"'
109
104
1,58:1
140
8
26
36
Fe"
109
104
1,02:1
140
8
45
45
Zn"
109
104
1,58:1
160
40
5
—
Полученные нитросоединения разгонялись на ректифика-
ректификационной колонке в вакууме. Основная масса продуктов нитро-
нитрования н.гептана (85—90%) перегонялась в пределах 59—62°
при 6 мм. Относительное количество зтой фракции не зависело
от характера применяемой для нитрования соли. Продукты
нитрования изооктана на 75% перегонялись в пределах 60—
63° при 5 мм. Перегнанные продукты реакции исследовались
обычными методами.
При изучении реакции нитрования н.гептана и изооктана раз-
различными солями азотной кислоты было установлено следующее.
434
Нитрование нитратами и хлористым нитрилом
1. Нитрование изооктана азотнокислым алюминием про-
происходит с несколько большей скоростью, чем нитрование
н.гептана. Например, при нитровании изооктана азотнокислым
алюминием выход нитросоединений составлял 25%, считая на
азотнокислый алюминий, тогда как при нитровании н.геп-
тана выход был равен 20%.
2. Скорость реакции в большей степени зависит от харак-
характера применяемой соли, точнее от характера катиона, чем от
характера нитруемого углеводорода. Из изученных азотно-
азотнокислых солей наибольшей активностью в реакции нитрования
н.гептана обладает азотнокислое железо. Азотнокислый цинк
давал наименьший выход нитросоединений.
3. При нитровании различными солями азотной кислоты
получаются одни и те же продукты реакции. При нитровании
н.гептана основная масса продуктов реакции состояла из вто-
вторичного нитрогептана, а при нитровании изооктана — из тре-
третичного нитроизооктана. Наряду с этим образуется небольшое
количество первичных нитросоединений.
4. При нитровании н.гептана и изооктана солями азот-
азотной кислоты, помимо мононитросоединений, образуется неболь-
небольшое количество динитросоединений. При нитровании н.геп-
н.гептана образуется значительно меньше динитросоединений (около
10% по весу), чем при нитровании изооктана (около 18% по
весу). Как в случае нитрования н.гептана, так и в случае нит-
нитрования изооктана образуются динитросоединения первич-
первичного характера. При нитровании н.гептана получается также
небольшое количество вторичных динитросоединений.
5. Нитрование н.гептана и изооктана солями азотной кис-
кислоты сопровождалось окислением нитруемого углеводорода.
Продукты окисления подробно не исследованы.
Нитрование ароматических соединений азотнокислыми со-
солями металлов обычно осуществляется в смеси с другими компо-
компонентами, которые, как предполагают, играют роль активаторов.
Менке [17], анализируя действие на ароматические соеди-
соединения нитрующих смесей азотной кислоты с уксусным ангид-
ангидридом, пришел к выводу, что последний не только служит во-
дуотнимающим средством, но и каталитически ускоряет процесс.
Нитрование неорганическими нитратами
435
Предполагая, что при замене азотной кислоты ее солями
нитрующая смесь все же будет достаточно активной ввиду
каталитических свойств уксусного ангидрида, Менке изучил
нитрование ароматических соединений смесями уксусного ан-
ангидрида с нитратами, имеющими достаточно низкие темпера-
температуры разложения (к числу этих нитратов относятся нитраты же-
железа, меди, никеля, кобальта, алюминия, церия и ряд нитра-
нитратов других металлов I, И, III, IV и VIII групп периодической
системы). Опыты Менке показали, что из этих соединений нит-
нитраты щелочных металлов не обладают нитрующим действием
или же реагируют лишь в слабой степени.
Нитрование анилина проводилось Менке следующим обра-
зом:к смеси 10Bec.4.Cu(NO3J-3H2O и 30ч.уксусного ангидрида
добавляли по каплям 8 ч. анилина при перемешивании и охлаж-
охлаждении льдом (температура реакции не должна превышать 30°).
Через полчаса, считая от начала приливания анилина, реакци-
реакционную смесь вливали в 150 ч. воды. Образовавшуюся при этом
кристаллическую массу отделяли от воды, измельчали в по-
порошок и промывали водой для освобождения от включенной
азотнокислой меди. После кристаллизации сырого продукта
из 50%-ного спирта получено 11ч. чистого о-нитроацетанилида
с т. пл. 92°.
Так как уксусный ангидрид с анилином уже при обыкно-
обыкновенной температуре образует ацетанилид, то реакцию нитро-
нитрования анилина смесью Cu(NO3J с уксусным ангидридом можно
рассматривать как нитрование ацетанилида. Полученный ре-
результат указывает на различие между нитрованием ацетани-
ацетанилида смесью уксусного ангидрида и нитрата и смесью азотной
и серной кислот (в последнем случае образуются одновременно
о- и п-нитроацетанилиды).
Для нитрования фенола его растворяют в уксусном анги-
ангидриде в количестве 5 г и раствор вливают по каплям в смесь
15 г азотнокислого железа и 25 г уксусного ангидрида при
70—85°. Продукт реакции — пикриновая кислота.
Подобным же образом при нитровании бензола при 80°
получается нитробензол, а из хлорбензола при 40—45° п-ни-
трохлорбензол. Толуол дает при действии смеси ГеAЧОз)з
436
Нитрование нитратами и хлористым нитрилом
с уксусным ангидридом о-нитротолуол (при температуре реак-
реакции 40°).
Далее показано, что если нитрат применять в смеси не с
уксусным ангидридом, а с ацетилхлоридом (или ацетилброми-
дом), то, наряду с нитрованием, происходит и галоидирование
ароматического соединения. Так, например, при действии на
фенол Cu(NOsJ и ацетилхлорида (реакция проводится при
охлаждении смесью льда с солью) получается 4,6-дихлор-2-
нитрофенол.
Смесь азотнокислой меди и уксусного ангидрида может
также служить для получения нитроацетоуксусного эфира из
ацетоуксусного эфира.
Ароматические соединения нитруются также смесью нитра-
нитрата с уксусной кислотой. Следует, однако, отметить, что эта
смесь является менее активным нитрующим средством, чем
смесь нитрата с уксусным ангидридом. Для объяснения этого
различия предполагают, что в первой смеси в качестве проме-
промежуточного продукта, играющего роль нитрующего агента, об-
образуется не ацетилнитрат, как в смеси с уксусным ангидридом,
а ацетилортоазотная кислота (Менке).
Некоторые соединения (фенол, о-нитрофенол, диметилани-
лин) нитруются смесью нитрата с уксусной кислотой даже при
комнатной температуре. С другой стороны, нафталин нитруется
азотнокислой медью или азотнокислым железом в смеси с уксус-
уксусной кислотой лишь при 105°, а ацетанилид — при 75° (в смеси
с уксусным ангидридом нитраты реагируют с двумя послед-
последними соединениями уже при 30°).
В качестве примера нитрования ароматических соединений
смесью нитрата с уксусной кислотой укажем на нитрование фе-
фенола. Раствор фенола E г) в ледяной уксусной кислоте A0 г)
добавляют по каплям при сильном перемешивании к смеси 8 г
Cu(NOsJ и 25 г ледяной уксусной кислоты (реакцию необхо-
необходимо проводить с охлаждением, поддерживая температуру 26°).
Через 20 мин. после первого приливания раствора фенола реак-
реакция заканчивается. При вливании реакционной смеси в 10 мл
воды выделяется продукт реакции в виде кристаллической
массы, которую отфильтровывают и промывают холодной во-
Нитрование неорганическими нитратами
437
дой. В результате этой обработки получается чистый о-нитро-
о-нитрофенол с т. пл. 44—45° (как указано выше, при нитровании фе-
фенола смесью нитрата с уксусным ангидридом образуется не
о-нитрофенол, а пикриновая кислота). Таким образом нитро-
нитрование фенола нитратом металла в смеси с уксусным ангидри-
ангидридом или уксусной кислотой дает в том или другом случае раз-
различные продукты реакции в зависимости от второго компонента
нитрующей смеси.
Реакция нитрования ароматических соединений нитратами
металлов в присутствии уксусного ангидрида обстоятельно
исследована Бахарашем [18—20]. Он поставил своей задачей
выяснить экспериментально: 1) является ли этот метод нитро-
нитрования общим для всех ароматических соединений или же он
применим только к определенной группе этих соединений и
2) существует ли известная зависимость между природой ни-
нитрата и строением полученного нитросоединения, т. е. ориен-
ориентируется ли нитрогруппа в то или иное положение в зависимо-
зависимости от применяемого нитрующего агента.
Для разрешения первого вопроса исследовано действие
азотнокислой меди и азотнокислого железа в присутствии
уксусного ангидрида на бензальдегид, бензойную кислоту,
нитробензол и п-толуидин. Опыты с бензальдегид ом, бензой-
бензойной кислотой и нитробензолом, которые проводились при раз-
различных температурах, дали отрицательный результат. С дру-
другой стороны, п-толуидин нитровался чрезвычайно легко.
Исходя из полученных им результатов и данных других
исследователей*, Бахараш приходит к выводу, что нитрова-
нитрование ароматических соединений неорганическими нитратами
дает положительный результат лишь в том случае, если нитруе-
нитруемые соединения содержат о- и п-ориентирующие заместители;
соединения же, у которых заместители ориентируют в м-поло-
жение, не нитруются неорганическими нитратами в смеси с
уксусным ангидридом.
* Менке [17], Шпигеля и Гаймана [21]; последние два автора при
нитровании анилина, фенола и апизола азотнокислым висмутом в присут-
присутствии уксусного ангидрида получили во всех случаях смеси о- и п-нитро-
производных.
29 д. В. тспчнев
438
Нитрование нитратами и хлористым нитрилом
Для выяснения зависимости строения образующегося нит-
росоединения от природы применяемого нитрата Бахараш ни-
тровал п-толуидин азотнокислыми солями железа, марганца,
кобальта, никеля, меди, ртути, серебра, натрия и лития в при-
присутствии как уксусной кислоты, так и уксусного ангидрида.
Опыты показали, что п-толуидин сначала реагирует с уксус-
уксусным ангидридом или уксусной кислотой с образованием ацето-
толуидида, после чего наступает нитрование. Все указанные
выше азотнокислые соли дали в качестве продукта реакции
3-нитро-п-ацетотолуидид
СН3
I
/\
Y
HNCOCH3
за исключением нитратов натрия и серебра, которые оказались
неактивными.
Показано также, что наибольшая скорость реакции наблюдает-
наблюдается при применении нитрата меди (продолжительность процесса
10 мин. при 30°). Продолжительность нитрования п-толуидина
нитратами металлов группы железа составляет 15—20 мин. в ин-
интервале температур 65—85° (аналогичные результаты получены
и при нитровании азотнокислой ртутью). Наименее активным
оказался нитрат лития; нитрующее действие его обнаружено
лишь при кипячении реакционной смеси с обратным холодиль-
холодильником в течение 2 час.
При нитровании анилина нитратом лития продуктом реак-
реакции оказался п-нитроацетанилид (а не о-изомер, который, по
данным Менке, получается при нитровании анилина нитратами
тяжелых металлов). Сопоставляя эти результаты, Бахараш
приходит к заключению, что нитраты, которые реагируют при
относительно низких температурах (например, нитраты тяже-
тяжелых металлов), приводят к образованию о-нитросоединений,
в то время как нитраты, действующие лишь дри высоких тем-
температурах, например нитрат лития, дают п-нитропроизводные.
Однако 3ia закономерность наблюдается не во всех случаях;
Нитрование неорганическими нитратами
439
например, п-толуйдин со всеми нитратами дает одно и то же ни-
тропроизводное.
Бахараш изучил также действие нитратов на некоторые
двуядерные соединения. При нитровании Cu(NОзJ- ЗН2О этот
нитрат сначала Обрабатывали уксусным ангидридом до полу-
получения зеленой аморфной массы, после чего к последней добав-
добавляли при перемешивании раствор нитруемого соединения в
уксусном ангидриде. Нитрование азотнокислым литием произ-
производили при кипячении в течение нескольких часов, причем
для повышения активности добавляли 4% нитрата меди.
При действии азотнокислой меди на дифенил получены
п-нитро- и п,п'-дйнитродифенил; дибензил дал п,пл-динитр6ди-
бензил. Нитрат лития не реагировал ни с дифенилом, ни с ди>-
бензилом. Вензий И стильбен не нитровались нитратами лития
и меди, а бензоин лишь окислялся ими в бензил. Опыты с
ядерными Соединениями подтвердили, таким образом, указан-
указанные выше выводы, что смесью нитрата с уксусным ангидридом
нитруются to.ji-.ko те ароматические ядра, которые содержат
заместители, ориентирующие в о- и д-положения, но не в
м-положениё. ,. ¦
Дальнейшие исследования Бахараша, однако, показали,
что в некоторых случаях соединения, содержащие заместители,
ориентирующие в ^-положение, также могут подвергаться нит-
нитрований смесью нитрата с уксусным ангидридом. Так, напри-
например, хИнЬлин, который при действии азотной кислоты или
смеси азотной и серной кислот дает только 5- и '8-нитропроиз-
водные, нитруется азотнокислым литием с образованием
7-нитрохийолинй.При нитровании фенилуксусной кислоты азот-
азотнокислой медью в уксусном ангидриде получены м-нитрофенил-
уксусйая кислота с выходом 50% от теоретического и о-нитро-
фенилуксусная с выходом 10% (как известно, при действии
азотной кислоты фенилуксусная кислота дает смесь м-нитро-
фёнилуксуснёй кислоты с выходом 14 % и о- и п-нитропроизвод-
нтлх фенилуксусной кислоты с выходом 80%).
Механизм реакции нитрования нитратами металлов в при-
присутствии уксусного ангидрида и уксусной кислоты состоит,
по мнению Бахараша, в образовании промежуточного соёдине-
30 А. В. Топчиев
440
Нитрование нитратами и хлористым нитрилом
ния — диацетилортоазотной кислоты, которая является нит-
нитрующим агентом. Эта кислота получена им следующим обра-
образом: смесь 20 ч. Cu(NO3V3H2O и 50 ч. уксусного ангидрида
оставлена на 20 мин. при 30-35°. Продукт реакции .состоявший
Рис. 5. Прибор для нитрования органических
соединений нитратами в присутствии А1С13
из жидкой части и зе-
зеленой аморфной массы
(уксуснокислой ме-
меди) , разделен фильтро-
фильтрованием.-Из фильтрата
посредством двукрат-
двукратной перегонки в ваку-
вакууме выделено соедине-
соединение, свойства которо-
которого совпадали со свойст-
свойствами описанной Пик-
Пикте диацетилортоазот-
диацетилортоазотной кислоты (т. кип.
45°, nf» 1,37542).
Обработка диацвг
тилортоазотной кис-
кислотой эквивалентно-
эквивалентного количества анили-
анилина в течение несколь7
ких минут при 35° да-
дала смесь нитропроиз-
водных, состоявшую
из п-нитроацетанили-
да и соответствую-
соответствующего о-изомера.
В результате си-
систематического иссле-
исследования автором зтой книги разработан метод нитрования арома-
ароматических соединений неорганическими нитратами в присутствии
некоторых активаторов, Ниже дается описание опытов по нит-
нитрованию органических соединений нитратами в присутствии сле-
следующих активаторов: А1С13, FeCl3, SiCl4 и BF8?.
• Попытки осуществить нитрование ароматических углеводородов
Нитрование неорганическими нитратами,
§ 1. Нитрование в прцсутствии А1С13
Нитрование проводили (рис. 5) в круглодонной колбе jf
емкостью 0,5 л, снабженной трехгорлым форштоссом 3, через
центральный канал которого проходила ось мешалки 2; боко-
боковые трубки форштосса соединялись с обратным холодильни-
холодильником 5 и с мерным сосудиком 4, из которого производили за-
засыпку активатора.
При проведении опыта в колбу загружали безводный ни-
нитрат в виде порошка, затем нитруемый углеводород и после
пуска мешалки через боковую трубку форштосса постепенно
вносили активатор (из мерного сосудика). Опыты производи-
производили как на холоду, так и при нагревании.
Изучено действие на ароматические • углеводороды в при-
присутствии хлористого алюминия следующих нитратов: KNO3,
NaNO3, NH4NO3, Ba(NO3J, Pb(NO3J и AgNO3.
Нитрование бензола
Для нитрования применяли бензол, предварительно очи-
очищенный от тиофена и других примесей тщательной обработкой
концентрированной серной кислотой. Нитраты перед употреб-
употреблением обезвоживали, расплавляли и полученный плав подвер-
подвергали измельчению.
Нитрование азотнокислым калием. В
первоначальных опытах молярное отношение нитрата к бензолу
составляло 1:1; эти опыты, однако, показали, что при указан-
указанном отношении реагентов происходит загустевание реакцион-
реакционной массы, что затрудняет перемешивание. Поэтому в даль-
дальнейшем нитрование проводили в присутствии избытка бензола,
который, таким образом, играл роль растворителя. Обработку
продуктов реакции, полученных после нитрования бензола
азотнокислым калием, производили так же, как и при нитрб-
вании бензола окислами азота (см. гл. V).
Первая серия опытов имела своей задачей выяснение зави-
зависимости процесса нитрования от количества активатора и Пиро-
Пиробензола, толуола,, ксилола и мезитилена) в отсутствие активаторов! Дали
отрицательный результат: даже при продолжительности нитрования 3 чгц-
са при различных температурах исходные углеводороды не подверглись
никаким изменениям.
30*
442
Нитрование Нитратами и хлористым нитрилом
цолжительности его загрузки (табл. 36 и 37).' В реакционный
сосуд загружали 1 моль бензола, 0,5 моля азотнокислого ка-
калия и реакцию проводили в течение 3 час, причем в одних опы-
опытах варьировали количества хлористого алюминия, который
вносили в течение 30 мин. (табл. 36), в других — изменяли про-
Таблвца 36
Зависимость выхода нитробензола от примененного количества
активатора А1С1з
<78 г бензола, 50 г KNO3)
II
(В «С
выход нитробен-
нитробенвола
% от теоретн-1
ческого на
взятый бен-
эоя
Получено обратно!
бензола
% ОТ В8Я-
того бен-
вола
Выход нитро-|
беявола на
прореагиро-
вавганй оен-
80л, % от тео-1
ретического
Выход нитро-
Оензола на
нитрат, %
от теорети-
теоретического
1
2
3
4
5
6
7
8
9
63
34
20
20
10
¦ 10
3
3
7
23
23,1
23,3
22,7
12,5
И
5
4,2
2,2
18,7
18,8
18,9
18,4
10,1
8,9
4,1
3,4
1,8
53
55
58
57
62
65
70
72
73
67,9
70,5
74,3
73,0
79,5
83,5
89,7
92,3
93,7
58,3
63,6
73,6
68,5
49,5
53,6
39,6
44,3
27,9
37,3
37,6
37,9
37,0
20,3
17,9
8,2
6,8
3,6
должительность загрузки активатора при постоянном его ко-
количестве (табл. 37). Опыты проводили без нагревания извне,
но ввиду экзотермичности реакции температура реакционной
смеси во время нитрования повышалась до 30—40°.
Данные табл. 36 и 37 показывают, что оптимальные резуль-
результаты получаются при загрузке 20 г @,15 моля) активатора в
течение 30 мин.
В дальнейшем изучена также зависимость выхода нитро-
нитробензола от продолжительности процесса нитрования при про-
проведении реакции без нагревания. Оказалось, что п][)и
¦Нитрование неорганическими нитратами
443
увеличении продолжительности нитрования с 20 до 90 мин.
выходы нитробензола остаются без изменения; при повышении
продолжительности реакции с 90 мин. до 3 час. выходы нитро-
нитробензола постепенно повышаются; дальнейшее увеличение про-
продолжительности нитрования приводит уже к падению выхода
нитробензола, т. е. трехчасовой период нитрования является
оптимальным (табл. 38).
Таблица 37
Зависимость выхода нитробенвола от продолоюгтелъности периода
вагруаки активатора А1С1з
G8 г бензола, 50 г KNOS, 20 г AlClJ
опыта
1
2
3
4
5
6
|ь.
Us
pj щ «
5
30
60
60
120
120
Выход нитробен-
г
16,0
23,3
21,5
22,0
20,5
19,8
вола
% от теорети-
теоретического на
ваятый бен-
80Л
13,0
19,9
17,5
17,9
16,7
16,1
Получено обратно
бенвола
г
61
58
56
54
57
58
% от
взятого
бенвола
78,2
74,3
71,8
69,3
73.0
74,3
Выход нитро-
нитробенвола на
прореагиро-
прореагировавший бен-
бензол, % от тео-
теоретического
59,6
73,8
61,9
58,1
61,8
62,7
Выход на
нитрат, % от
теоретиче-
теоретического
26,0
37,9
34,9
35,8
33,4
32,2
Опыты по нитрованию бензола нитратом калия в присут-
присутствии Aids показали, таким образом, что добавление актива-
активатора в количестве 0,15 моля при молярном отношении бензола
к KNOs 2 : 1 приводит к выходу нитробензола 38,5% на нитрат
и 74,5% на прореагировавший бензол, если реакция осуще-
осуществляется в течение 3 час. без нагревания извне.
Совершенно неожиданный результат получен при попытке
активирования процесса повышением температуры реакции
(табл. 39).
Опыты с нагреванием извне на бане привели к уменьше-
уменьшению выхода нитробензола; например, при 90—100° (темпера-
444
Нитрование нитратами и хлористым нитрилом
Таблица 38
Зависимость выхода нитробензола от продолжительности нитрования
G8 г бензола, 50 г KNO3, 20 г А1С13)
опыта
1
2
3
4 .
5
6
7
8
9
10
11
12
13
14
А
II
III
20
20
30
30
60
60
90
90
120
120
180
180
240
240
Выход ннтробен-
г
16
16,5
16,8
i5,9
16,6
16,0
16,8
16,1
20,1
21,1
22,7
23,6
22,4
23,2
вола
% от теорети-
теоретического на
ввятый Сен-
зол
13
13,4
13,6
12,9
13,5
13,0
13,6
13,1
16,3
17,1.
18,4 .
19,1
18,2
18,8
Получено обратно
бензола
г
60
58
61
62
60,5
61,0
59,0
60,7
58,5
57,1
56,2
58,0
57,0
59,0
% от
В8ЯТОГ0
бензола
76,9
74,3
78,2
79,5
77,4
78,4
75,6
77,8
75,2
73,1
71,9
74,3
73,0
75,5
Выход нитро-
нитробензола на
прореагиро-
прореагировавший бен-
бензол, % от тео-
теоретического
56,1
52,1
62,3
62,6
59,8
59,3
55,8
58,7
65,0
63,7
65,7
74,5
67,3
77,0
Выход нитро-
- бензола на
нитрат, % от
теоретиче-
теоретического
26,0
26,8
27,3
25,9
27,0
26,0
27,3
26,2
32,7
34,3
36,9
38,4
36,4
37,7
тура бани) выход упал до 20—23% в расчете на нитрат. Это
явление, невидимому, объясняется частичным распадом при
высоких температурах комплекса бензола с хлористым алюми-
алюминием, вступающего во взаимодействие с нитратом калия (см.
ниже о механизме реакции).
Нитрование нитратами аммония, нат-
натрия, бария, свинца и серебра. Нитрование про-
производилось в тех же условиях и при том же количественном
отношении реагентов, которые оказались оптимальными для ни-
нитрования азотнокислым калием. Результаты опытов сведены
в табл. 40.
Нитрование неоргашчв.скцми нитратами
445
Таблица 39
Зависимость выхода нитробензола от температуры реакции
G8 г бензола, 50 г KNO3, 20 г А1С13)
№
опыта
Температура
бани, "С
Выход нитробен-
нитробензола
% от теоре-
теоретического
на взятый
бензол
Получено обратно
бензола
% от
взятого
бензола
аа
3
4
5
6
Без нагрева-
вания извне
45—50 . . .
90—100 . . .
23,1
21,2
[18,7
117,9
[14,2
112,8
18,9
17,2
15,2
14,5
11,5
10,4
57
56
58
59
57
60
73,0
71,0
74,3
75,6
73,0
76,8
69,7
60,9
59,2
59,7
42,9
45,1
37,6
34,5
30,4
29,1
23,1
20,8
Сравнение данных табл. 39 и 40 показывает, что из всех
исследованных нитратов наиболее активным нитрующим аген-
агентом в присутствии Aids является AgNOs; остальные нитраты
осуществляют нитрование в меньшей степени, причем наименее
активны нитраты бария и свинца. Если расположить все ис-
исследованные нитраты в порядке убывания активности нитро-
нитрования по отношению к бензолу, получим следующий ряд:
AgNOs>KNOs> NaNOs > NH4NOs > Pb (NOsJ > Ba(NOsJ.
Нитрование толуола
Из данных табл.41 видно, что при нитровании толуола без
Нагревания извне в течение 6 час. выход нитротолуола достигает
38% по нитрату и 72,6% по толуолу, вступившему в реакцию.
Цовышение температуры посредством внешнего обогрева и по-
понижение продолжительности процесса оказывают неблаго-
неблагоприятный эффект на выход нитротолуола.
446
Нитрование нитратами и хлористым нитрилом
Нитрование неорганическими нитратами
447
Таблица 40
Нитрование бензола нитратами аммония, натрия, бария, свинца
и серебра в присутствии А1С1»
G8 г бензола, 20 г А1С13)
опыта
1
2
3
4
5
6
7
8
Нитрат
NH4NOS
NH4NOS
NaNOs
NaNOs
Ba(NO8J
Ba(NOsJ
Pb(NOsJ
AgNOa
AgNOs
Выход нитробен-
нитробензола
16,3
16,0
20,7
21,0
25,0
26,0
27,0
34,3
35,7
% от теорети-
теоретического на
взятый бен-
бензол
13,2
13
16,8
17,1
20,3
21,1
21,9
27,9
29,0
Получено обратно
бензола
60
58
60
59
60
57
58
45
48
% от ¦
взятого
бензола
76,8
74,2
76,8
75,5
76,8
73,0
74,2
57,6
61,5
I
Hi!
57,4
50,7
72,9
70,1
83,5
78,6
85,6
65,9
75,5
•it
26,5
26,0
33,6
34,1
20,3
21,1
21,9
55,7
58,0
Таблица 41
Нитрование толуола ааотнокислым калием в присутствии А1С1з
(92 г толуола, 50 г KNO8, 20 г А1С1»)
I
С и
180
240
300
360
600
№\
360/
360 \
360/
Температура
банн, "С
Без нагревания
извне
45—50
105—110
Выход нитрото-
нитротолуола
% от теорети-
теоретического на
взятый то-
толуол
19,0
21,0
22,5
26,0
25,8
18,0
17,3
15,
14,9
13,7
15,3
16,4
18,9
18,8
13,4
12,6
11,1
10,8
Получено об-
обратно толуола
% от
В8ЯТ0Г0
толуола
77,2
75,0
76,0
73,9
72,8
71,7
69,5
68,4
66,3
60,6
61,1
68,4
72,6
69,1
46,4
41,4
35,1
32,2
28
30,6
32,8
37,9
37,6
26,2
24,7
22,1
21,7
Нитрование м-ксилола
При нитровании м-ксилола применяли следующие количе-
количества реагентов: 0,2 моля м-ксилола, 0,1 г-моля KNOs и 0,03-
г-моля А1СЬ; отделение продуктов реакции от непрореагировав-
шего м-ксилола и разделение монанитроксилолов от динитро-
м-ксилола производили таким же путем, как и при нитровании
окислами азота (см. гл. V).
Опыты по нитрованию ксилола (табл. 42) показали, что
оптимальный выход изомерных мононитроксилолов B9%, считая
на нитрат) получается при проведении реакции без нагре-
нагревания извне. При повышении температуры выход мононитро-
мононитроксилолов понижается, выход динитро-м-ксилола, наоборот,
повышается, достигая максимальной величины A0—11%) при
105—110°.
Таблица 42
Нитрование м-ксилола KNOj в присутствии AlCls
B1 г м-ксилола, 10 г KNOS, 4 г А1С13)
Температура
бани, "С
Без нагренания
извне
45—50
105—110
Выход мононнтроксилола
4,1
4,2
3,4
2,4
2,6
13,6
13,9
11,3
7,9
8,6
5s- 0* « Pi
27,0
27,8
22,5
15,9
17,2
Выход динитроксилола
1,5
1,2
1,8
2,0
2,1
Й
3,8
3,1
4,6
5,1
5,3
7,65
6,2
9,2
10,2
10,6
§ 2. Нитрование в присутствии F eCl 3 и SiCI4
Нитрование бензола в присутствии SiCl4 производили при
тех же количественных отношениях реагентов, как и в при-
присутствии А1СЬ; при нитровании в присутствии FeCls количе-
448
Нитрование нитратами и хлористым нитрилом
ства реагентов были уменьшены в 4 раза против обычных
@,25 моля бензола, 0,125 моля KNOs и 0,037 моля FeCls).
Результаты опытов приведены в табл. 43.
Таблица 43
Нитрование бензола KNO3 в присутствии FeCl3 « SiCl4
Активат ор
FeCl3
FeCl3
SiCl4
SiCl4
Выход нитробен-
вола
3,1
3,3
5,2
4.8
% от теорети-
теоретического на
взятый бен-
бензол
10,3
11,0
3,3
3,8
Получено обратно
бенвола.
16
15
69
72
% от
взятого
бензола
84
80
88,4
92,2
я к;
65,3
52,5
36,6,
50,7
PI
H
I!
20,2
21,4
8,45
7,8
Сравнивая эти результаты с данными, полученными при
нитровании в присутствии AlCls (см. табл. 37), можно прийти
к выводу, что FeCls менее активный катализатор, чем Aids,
который дает выход нитробензола около 38% на нитрат и 70%
на прореагировавший бензол. Еще менее активный катализа-
катализатор SiCl4 (выход на нитрат в 5 раз меньше, чем в присутствии
Aids).
§ 3. Нитрование в присутствии BFS :
Как известно, фтористый бор широко применяется в каче-
качестве катализатора в органическом синтезе, что объясняется его
способностью к образованию промежуточных комплексов с аро-
ароматическими соединениями, обладающих активными свой-
свойствами. Так, например, Ньюланд и сотрудники [22] пользова-
пользовались BFs как катализатором при конденсации пропилена с ор-
органическими кислотами (уксусной, хлоруксусной, дихлоруксус-
ной, бензойной и др.) в соответствующие эфиры. Реакцию про-
проводили при 70° и давлении на 25 мм выше атмосферного (без
катализатора эта реакция протекает лишь при высоких темпе-
температурах и давлениях).
Нитрование неорганическими нитратами
449
- По данным того же исследователя [23], олефины в присут-
присутствии BFs конденсируются также с оксикислотами (салицило-
(салициловой, п-оксибензойной, м-оксибензойной и др.). Например, про-
пропилен конденсируется с салициловой кислотой с образованием
изопропилсалицилата и алкилированных в ядре сложных эфи-
ров салициловой кислоты. Процесс протекает таким образом,
что пропилен вначале конденсируется с салициловой кислотой
с образованием изопропилсалицилата, который затем подвер-
подвергается изомеризации, причем изопропильная группа вступает
в бензольное ядро. Механизм действия фтористого бора в дан-
данном случае, вероятно, состоит в том, что он образует комплекс
,с салициловой кислотой, присоединяясь к атому кислорода
гидроксила группы СООН; водород карбоксильной группы
делается при этом более подвижным, чем и обусловливается
возможность конденсации кислоты с олефином. Образовав-
Образовавшийся сложный эфир соединяется далее с BFs. Это ослабляет
связь между кислородом и углеводородным радикалом, что
облегчает изомеризацию.
При помощи фтористого бора может быть осуществлена кон-
конденсация олефинов е ароматическими углеводородами [24].
Например, бензол конденсируется с пропиленом в сернокислой
среде с образованием моно- и диизопропилбензола; при этом,
в отличие от реакции в присутствии AlCls, которая дает пре-
имущеетвенно м-диизопропилбензол, конденсация в присутствии
BFe приводит к п-диизопропилбензолу. Бензол конденсируется
также с этиленом и бутиленом.
Фтористый бор применяется в качестве катализатора также
при конденсации олефинов с фенолами, причем, как и в случае
салициловой кислоты, при взаимодействии олефина с фенолом
происходит конденсация с последующей изомеризацией [25].
В присутствии фтористого бора ацетилен коденсируется с одно-
одноатомными спиртами [26], гликолями и оксикислотами [27],
а также с карбоновыми кислотами [28].
Механизм конденсации спиртов с ацетиленом, приводящий
к синтезу ацеталей, заключается, как полагают, в следующем:
образовавшийся в результате соединения спирта с BFs молеку-
молекулярный комплекс вступает в реакцию в ионизированной форма
450
Нитрование нитратами и хлористым нитрилом
с ацетиленом; при этом возникает новый комплекс, который
распадается на ацеталь и фтористый бор;
2ROH + 2BFS -» 2ROH-BFS -» 2Н+ + 2 (RO-BFS)"
НС == СН + 2Н+ + 2 (RO -BFS) - HSC — С—Н
\
/OR
-Н3С —С—H + 2BFS
ORBFS
Подобным же образом в присутствии BFs оксисоединени»
конденсируются и с производными ацетилена [29, 30].
Необходимо также отметить, что фтористый бор, ввиду его
склонности к образованию комплексов с органическими соедине-
соединениями, с успехом применяют вместо Aids в реакции Фриделя—
Крафтса. Так, например, при помощи фтористого бора полу-
Рис-^6. Установка для нитрования органических соединений нитратами
в присутствии BF3
Нитрование неорганическими нитратами
451
чают гомологи бензола, конденсируя его с алкилгалогенидами;
из бензола, толуола и анизола при взаимодействии с уксусным
ангидридом в присутствии BFs синтезируются соответствую-
соответствующие кетоны [31].
Основываясь на указанных выше каталитических свойствах
фтористого бора и его способности заменить А1СЬ в реакции
Фриделя — Крафтса, автором этой книги сделана попытка при-
применить фтористый бор в качестве катализатора при нитровании
органических соединений солями азотной кислоты. Ниже при-
приводятся результаты некоторых из проведенных в этом направ-
направлении опытов.
В качестве нитратора применяли круглодонную трехгорлую
«олбу 1 (рис. 6), снабженную трехрогим форштоссом 3, цен-
центральный канал которого служил для прохождения оси мешал-
мешалки 4; одна из боковых трубок форштосса соединялась с конден-
«ационно-поглотитёльной системой, состоявшей из холодиль-
холодильника 5 и склянки Тищенко 6 с эфиром, в котором происходило
поглощение не вошедшего в реакцию фтористого бора. Фтори-
Фтористый бор поступал в реакционную колбу из аппарата 7, где
производили его синтез, по трубке 2, проходившей через ле-
левое горло колбы 1. Необходимый для опытов фтористый бор
получался смешением 20 г В2Оз, 40 г CaF2 и 200 г H2SO4 уд. в.
1,84. Реакция происходит по следующему уравнению:
3CaFa -f 3H2SO4 + B2OS - 3CaSO4 + 3H2O + 2BFS.
В качестве исходных веществ для синтеза фтористого бора
применяли чистый кристаллический CaF2 (флюорит) и борный
ангидрид, полученный прокаливанием технической борной
кислоты при 800—1000° (в муфельной печи) до прекращения вы-
выделения пузырьков Н2О. Флюорит и борный ангидрид измель-
измельчали в порошок и затем хорошо перемешивали друг с другом.
Смесь вносили в колбу Вюрца емкостью 500 мл и заливали сер-
серной кислотой. Во время реакции колбу Вюрца время от вре-
времени встряхивали, чтобы облегчить прохождение фтористого
бора через реакционную кашицеобразную массу. Образовав-
Образовавшийся фтористый бор перед направлением в нитратор прохо-
проходил предварительно через склянку Тищенко с серной кисло-
кислотой.
452
Нитрование нитратами и хлористым нитрилом
Нитрованиебензола
Опыты по нитрованию бензола азотнокислым калием в при-
присутствии BFs проводились следующим образом: после загруз-
загрузки реагентов @,5 моля KNOs и 1 моль бензола) смесь при пере-
перемешивании насыщали BFs, который пропускали из колбщ
Вюрца, где происходил его синтез. Опыты велись как без на-г
гревания извне, так и при нагревании (на водяной или вазели-
вазелиновой бане). При нитровании без нагревания извне темпера-
температура реакционной смеси, вследствие экзотермичности процесса,
быстро повышалась до 34—38°, а затем более медленно до 55—
57°. По окончании насыщения фтористым бором реакционная
масса, имевшая темнобурый цвет, разделялась на жидкую часть
и твердый осадок на дне колбы. Жидкую часть отделяли от
осадка, промывали водой, а затем раствором соды и после
сушки над хлористым кальцием подвергали перегонке (вна-
(вначале отгонялся бензол, а затем при 207—210° нитробензол).
Твердый осадок для извлечения адсорбированного им нитро-
нитробензола перегоняли с водяным паром.
В табл. 44 и 45 приведены результаты опытов по нитрованию
бензола азотнокислым калием в присутствии BFs, проводив-
проводившихся как с различной продолжительностью (табл. 44), так и
при различной температуре (табл. 45).
Данные табл. 44 указывают, что при нитровании бензола
азотнокислым калием в присутствии BFs получаются лучшие
выходы нитробензола, если длительность процесса нитрования
увеличивается от 30 минут до 3 часов. Наилучшие результаты
получаются при трехчасовой продолжительности нитрования.
Что касается влияния температуры реакции на выход нитробен-
нитробензола при нитровании азотнокислым калием в присутствии BFs,.
то из данных табл. 45 видно, что наилучшие результаты полу-
получаются при отсутствии нагревания извне.
Нитрование толуола и м-ксилола
В табл. 46 и 47 приведены результаты опытов по нитрова-
нитрованию толуола и м-ксилола.
Нитрование неорганическими нитратами
453.
Таблица 44
Нитрование бензола азотнокислым калием в присутствии BFS
без нагревания извне
G8 г бензола, 50 г KNOS и BFS, полученный из 40 г CaF2)
si
ЦК
ill
Выход нитробен-
нитробензола
% от теорети-
теоретического на
взятый бен-
80Л
Получено обратно1
бензола
% от
В8ЯТ0ГО
бензола
"° 8
30
40
50
120
150
180
300
35—36
35-38
35—38
45—58
55—57
55—57
55-57
3
5
8
12
t7
21
20,6
2,4
4,1
6,5
9.7
13,8
17,0
16,7
70
68
63
58
57
54
53
89,6
87,2
80,6
74,3
73,0
69,2
67,9
23,8
31,7
33,8
38,1
51,4
55,5
52,3
4,9
8,1
13,0
19,5
27,6
34,1
33,5
Таблица 45
Нитрование бензола азотнокислым калием в присутствии BF3
при различных температурах
G8 г бензола, 50 г KNOS и BFS, полученный из 40 г CaF2)
Температура, °С
Выход нитробен-
нитробензола
% от теорети-
теоретического на
взятый бен-
зол
Получено об-
обратно бенвола
% от
взятого
бензола
«о
-< о.
р
Без нагревания
извне
Максимальная
температура эк-
экзотермической
реакции 57°
90—95° (темпера-
(температура бани)
90—95° (темпера-
(температура бани)
21
„21,2
11
12,2
17,1
17,2
9,0
9,9
55
54
63
62
70,5
69,2
80,8
79,5
57,9
56,0
46,5
48,3
34,1
34,4
17,9
19,8
454
Нитрование нитратами и хлористым нитрилом
Анализируя результаты опытов по нитрованию азотнокис-
азотнокислым калием бензола, толуола и м-ксилола в присутствии BFs,
можно прийти к выводу, что процесс Протекает аналогично нит-
нитрованию нитратами в присутствии Aids; оптимальные усло-
условия достигаются при проведении реакции без нагревания извне
в течение 3 часов. Повышение температуры приводит к пониже-
понижению выхода нитропродуктов, повидимому, вследствие того,
что при высоких температурах происходит распад комплекса,
образуемого BFs с ароматическим соединением.
Таблица 46
Нитрование толуола RNOs в присутствии BFS
(92,1 г толуола, 50 г KNOS и BFS, полученный из 40 г CaF2)
опыта
и ?
И а 5
§•0 O.S
S S?
S 0.5
сз о) Ц
III
40
40
Выход нитрото-
луола
% от теорети-
теоретического на
взятый то-
толуол
Получено обратно
толуола
% от
В8ЯТОГО
толуола
Я ез Е езс
23,8
24,3
17,4
17,7
71
69
77,1
75,0
76,2
70.9
34,7
35,5
Таблица 47
Нитрование м-ксилола KNO8 в присутствии BFS
(Иг м-ксилола, 10 г KNOS и BF3, полученный из 40 г CaF2)
опыта
1
2
Максимальная
температура
экзотермической
реакции, "С
35
35
Выход мононитрокоилола
г
3,6
3,4
% от теоретиче-
теоретического на взятый
нитрат
23,8
22,6
Выход динитроксилола
г
1,1
1,3
% от теоретиче-
теоретического на взятый
нитрат
5,6
6,6
Нитрование неорганическими нитратами
455
Получение динитропроизводных
Для выяснения возможности введения в ароматическое
ядро нескольких нитрогрупп действием нитратов в присутствии
BFe проведены также опыты по нитрованию азотнокислым ка-
калием нитробензола.
В смесь 0,8 моля нитробензола и 0,25 г KNOs при переме-
перемешивании в течение 3 час. пропускали фтористый бор, получен-
полученный из 20 г CaF2 и 10 г B2Os. По окончании опыта жидкий слой
сливали, осадок в колбе промывали эфиром и эфирный раствор
присоединяли к жидкому слою. После сушки над хлористым
кальцием из жидкости отгоняли эфир, а затем непрореагиро-
вавший бензол; остаток охлаждали, и полученная при этом
твердая масса перекристаллизовывалась несколько раз из
спирта. В результате этой обработки получен динитробензол в
виде кристаллов с т. пл. 87—88°.
Таблица 48
Получение динитропроиаводных бенаола
(нитрование нитробензола KNOS в присутствии BF3)
Температура банн,
-С
Получено динит-
робензола
% от тео-
ретическо-|
го на В8я-
тый бензол1
Получено обратно
нитробензола
% от
взятого
бензола
as 81
Яш ё
Без нагревания
95—100 . . . .
95—100. . . .
0,5
3,2
3,8
0,36
2,3
2,8
98
94
93
94
93
18,4
39,2
39,9
1,2
7,6
9,1
Опыты показали (табл. 48), что при проведении нитрования
без нагревания извне, т. е. при температуре реакции
25—30°, получаются лишь незначительные выходы динитро-
бензола A,2% на нитрат и 18% на прореагировавший
бензол). При применении внешнего обогрева (температура бани
95—100°) выход повышается (максимальный выход 9% на
нитрат и 40% на прореагировавший бензол).
Полученные результаты указывают, что при нитровании
KNOs в присутствии BFs введение второй нитрогрушш в аро-
456
Нитрование нитратами и хлористым нитрилом
матическое ядро протекает значительно труднее, чем введение
первой.
§ 4. Механизм нитрования ароматических соединений неорга-
неорганическими нитратами в присутствии активаторов
(A1C1S и BF3)
Автором настоящей книги выдвинута следующая трактовка
механизма реакции нитрования ароматических соединений не-
неорганическими нитратами в присутствии А1С1з, сближающая
эту реакцию с реакцией Фриделя — Крафтса. Принимая пред-
представление Ганча о структуре азотной кислоты, можно предпо-
предположить существование равновесия между псевдоформой и истин-
истинной формой соли азотной кислоты, причем равновесие сдвинуто
в сторону истинной формы, т. е. последняя находится в преоб-
преобладающем количестве
Na /
i 0 N
L O
\
0
Проведение реакции в присутствии А1С18 изменяет условия
равновесия, сдвигая его в сторону образования псевдоформы
благодаря тому, что эта форма способна реагировать с активи-
активированной хлористым алюминием молекулой бензола (с ком-
плексомСвНвАЮЬН). При взаимодействии псевдоформы нитрата
« этим комплексом водород из внешней сферы комплекса пере-
переходит к кислороду нитрата, связанному с азотом семиполярной
связью [уравнение B)]; возникающий при этом продукт при-
присоединения в дальнейшем распадается по уравнению C) с об-
образованием нитропроизводного
Na I О N I - NaO — N.
СвН„ + А1С13 -* (СвН5А1С13) Н
A)
NaO — N/ + (СвН5А1С13) Н ¦
,0
— N—ОН B)
ll
.0
<СвН5А1С13)- N—ОН -+ C6H5NO2 + А1С130Н+ NaCl
N)Na
Нитрование неорганическими нитратами
457
Нами также экспериментально проверена возможность про-
протекания реакции и по другой схеме, в основу которой положено
допущение об образовании в системе свободной азотной кислоты
вследствие гидролиза А1С13 под действием влаги, проникающей
в реакционный сосуд извне, и последующего разложения нит-
нитрата действием НС1. В этом случае нитрующим агентом могла
бы быть азотная кислота
А1С13 + ЗНОН - А1@НK + ЗНС1;
НС1 + KNOS - HNOS + КС1;
CeHe + HNOs - CeH5NO2 + H20.
II
Для выяснения правильности схемы (II) проведены опыты
по нитрованию ароматических соединений нитратами в присут-
присутствии НС1. Реакционную смесь A моль бензола+ 0,5 моля KNOs)
насыщали сухим хлористым водородом при 40—45°, т. е. при
той температуре, которая создается в реакционной смеси при
проведении реакции в присутствии AlCls (без нагрева извне).
Опыты показали, что в присутствии НС1 образуются лишь не-
незначительные количества нитробензола.
В другой серии опытов реакцию проводили с применением
А1С13 в качестве активатора и с одновременным насыщением
реакционной смеси хлористым водородом. Оказалось, что вве-
введение хлористого водорода значительно понижает выход нитро-
нитробензола. Таким образом, опыты с насыщением реакционной
смеси хлористым водородом показали, что принятие в данной
реакции в качестве нитрующего агента свободной азотной кис-
кислоты, образующейся из нитрата, не соответствует действитель-
действительному течению реакции.
Механизм нитрования азотнокислыми солями в присутствии
BFs протекает, по нашему мнению, согласно схеме, предло-
предложенной нами для нитрования в присутствии AlCb. Например,
для случая нитрования бензола при помощи KN08 реакцию
можно представить следующим образом.
Как показывают уравнения I и III, механизм реакции в
присутствии активаторов (BFs и А1СЬ) состоит из следующих
стадий:
31 А. В. Топчиев
458
Нитрование нитратами и хлористым нитрилом
1) переход истинной формы азотнокислой соли в нсевдо-
форму;
2) образование комплексного соединения нитруемого веще-
вещества с активатором;
3) образование тройного комплекса ароматическое соеди-
соединение — активатор — нитрат;
4) разложение тройного комплекса, приводящее к образо-
образованию нитробензола и регенерации активатора (при этом в ка-
качестве одного из продуктов реакции выделяется гидрат окиси
металла, нитрат которого является нитрующим агентом).
КО—-N
C6He + BF3
(CeH5BF3)H
A)
B)
,0
III
KO-N' + (CeH;,BF3)H-*-(CeH5BF3)-N^-OK C)
^O X0H
CBH5NO2 + BF3 + КОН D)
На основании полученного нами экспериментального мате-
материала можно прийти к следующим выводам об особенностях
метода нитрования неорганическими нитратами.
1. Нитрование азотнокислыми солями в присутствии акти-
активаторов (А1СЬ и BFs) протекает с достаточно хорошими выхо-
выходами, причем непрореагировавшее ароматическое соединение
может быть легко регенерировано посредством отгонки из ре-
реакционной массы.
2. Из нитратов наиболее активен AgNOs; менее активные
нитраты щелочных металлов (KNOs и NaNOs) дают, однако,
удовлетворительные результаты. Так, например, при нитро-
нитровании бензола KNOs в присутствии Aids получен выкод на
прореагировавший бензол 70% C8% на нитрат); с NaNOs
выход составляет 73% C4% на нитрат). Менее активны нитраты
аммония, бария и свинца.
Нитрование хлористым нитрилом
3. Из катализаторов наиболее активны А1С13 и BF8 (po-
следний несколько уступает А1С18 в активности), менее активен
FeCl8 и мало активен как катализатор SiCl4.
4. Реакция нитрования азотнокислыми солями протекает
более удовлетворительно при нормальной температуре и избыт-
избытке ароматического соединения, которое играет роль раствори-
растворителя; нитрат применяется в твердом виде, поэтому при проведе-
проведении реакции необходимо перемешивание.
5. Нитрование неорганическими нитратами не сопровож-
сопровождается реакцией окисления.
Ни в одном опыте по нитрованию ароматических соединений
неорганическими нитратами (по нашему методу) образования
продуктов окисления не обнаружено. Этот метод более удобен,
чем нитрование органическими нитратами, при котором обра-
образуются побочные продукты вследствие разложения нитрата
при взаимодействии с нитруемым соединением.
Вопрос практического применения нитрования неорганиче-
неорганическими нитратами требует дальнейшей разработки.
III. Нитрование хлористым нитрилом
Хлористый нитрил C1NO2 можно рассматривать как хлоран-
гидрид азотной кислоты.
Хлористый нитрил получают следующим образом [32]:
к 400 г дымящей азотной кислоты при 0° добавляют по каплям
644 г 30%-ного олеума, а затем 370 г хлорсульфоновой кислоты
в течение 12 час; выдерживают 1 час при 20°. В приемнике
(охлажденном сухим льдом) собирают хлористый нитрил с
т. кип. 15—16°. Выход продукта 91% от теории.
Хлористый нитрил можно применить для нитрования аромати-
ароматических соединений средней активности, обычно в присутствии
катализаторов (HF, Aide, BFs). Высокоактивные аромати-
ароматические соединения сильно окисляются хлористым нитрилом;
так, фенол дает следы о- и п-нитрофенола, анизол — следы
о-нитрофенола, дифениловый эфир— 7% 4-нитродифенилового
эфира, N-диметиланилин образует смолу, нафталин давя
1-нитронафталин с выходом 26—31 % от теории. При нитровании
31*
460
Нитрование нитратами и хлористым нитрилом
нафталина получается смесь а-нитронафталина и а-хлорнитро-
нафталина [32].
Бензойная кислота, хлорбензойная кислота, п-толуиловая
кислота, нитробензол, п-нитротолуол, ацетофенон и бензаль-
дегид с хлористым нитрилом не реагируют.
Нитрование хлористым нитрилом Прайс и сотрудники [33]
осуществляли следующим образом. К 0,2 моля ароматического
соединения в 100 мл СЭг прибавляют 0,25 моля А1С1з при 0°
и 0,25 моля хлористого нитрила. Перемешивают 1—2 часа при
0° и выдерживают при 20° до исчезновения хлористого нитрила.
Выливают на лед и получают из бензола нитробензол с выходом
27—35% (без катализатора; после смешения всех компонентов
кипятят 12 час). При действии катализатора HF или А1С13
и соотношении реагентов 0,5 моля бензола + 0,55 моля хлори-
хлористого нитрила + 250 мл жидкого HF выход нитробензола до-
достигает 70—89%.
Из толуола получают о- и п-нитротолуол D7 и 24%), из бром-
толуола—2- и З-нитро-4-бромтолуол B3 и 16%), из бромбензо-
ла — п- и о-нитробромбензол F7 и 8%), из дихлорбензола —
2,4-дихлорнитробензол C1%) и из салициловой кислоты —
5-нитросалициловую кислоту E8%).
ЛИТЕРАТУРА
1. J. Meisenheimer. Ann., 355, 284 A908).
2. J. T h i e 1 е. Ber., 33, 670 A900).
3. A. Angeli, Z. A 1 e s s a n d г i. C, 1,420A911).
4. M. Col on n а. С. А., 754A947).
5. Амер. патент 2416974; С. А., 3485а A947).
6. F. Francis. Ber., 39, 3798 A906).
7. Т. Н. Buttler. Ber., 39, 3804 A906).
8. R. Wilsttater. Ber., 42, 4151 A909).
9. A. Pictet, E. Khotinsky. Ber., 40, 1163 A907).
10. O. Witt, A. U term an n. Ber., 39, 3901 A906).
11. В. А. Измаильский, А. И. Козин. Докл. АН СССР,
28, 621 A940).
12. С. Ing old, A. L a p w о г t, G. В en ford. J. Chem. Soc,
1959 A931); 918 A938).
12a. W. D. Emmons, I. R. Freeman. J. Am. Cbem. Soc., 77,
43&7 A955).
Литература
461
126. W. D. Emmons, I. R. Freema'n. J. Am. Chem. Soc, 77, 4391,
A955).
12b. W. D. Emmons, I. R. Freeman. J. Am. Chem. Soc, 77,
4673 A955).
13. M. И. Коновалов. ЖРХ0, 26 B), 61 A894).
14. M. И. Коновалов. ЖРХ0, 33, 393 A901).
15. С. С. Наметкин. Избранные труды. М., Изд-во АН СССР, 1949.
16. М. И. Коновалов. ЖРХО, 39, 109—41 A906).
17. J. В. М е n k e. Rec. trav. chim., 44, 141, 269 A925).
18. G. В а с h а г а с h. J. Am. Chem. Soc, 44,1522 A922); Chem. News,
142, 305 A931).
19. G. В а с h а г а с h. Rec. trav. chim., 50, 732 A931); 52, 413 A933).
20. G. В а с h а г а с h. Ber., 64, 2136 A931).
21. L. Spiegel, H. H а у m a n n. Ber., 59, 202 A926).
22. J. A. Nieuwland, D о г г i s, Т. J. Sow a. J. Am. Chem.
Soc, 56, 2698 A934).
23. J. A. Nieuwland, С г о х а 11, Т. J. S о w a. J. Am. Chem.
Soc, 56, 2054 A934).
24. J. A. Nieuwland, Slanona, T. J. Sow a. J. Am. Chem.
Soc, 57, 1547 A935):
25. T. J. Sow a, H. D. H i n t о n, J. A. N i e u w 1 a n d. J. Am.
Chem. Soc, 54, 3694 A932).
26. H. D. H i n t о n, J. A. Nieuwland. J. Am. Chem. Soc, 52,
2893 A930).
27. J. A. Nieuwland. J. Am. Chem Soc, 52, 1018 A930).
28. Ю. C. 3 а л ь к и н д и др. Тр. Ленингр. хим.-технол. ин-та, II,
21 A935).
29. J. A. Nieuwland. J. Am. Chem. Soc, 56, ИЗО, 1786 A934).
30. И. А. Р о т е и б е р г, М. А. Фаворская. Журн. общ.
химии, 4, 185 A936).
31. J. M e er w ei п, V о ss e n. J. pr. Chem., 141, 149 A934).
32. W. S t е i п к о р f, М. К й h п е 1. Бег., 75, 1323 A942).
33. С. С. Price. J. Am. Chem. Soc, 75, № 13, 3277 A953).
ИМЕННОЙ УКАЗАТЕЛЬ
Адаме (Adams A.) 47
Алания В. П. 15, 166, 304
Алейсандер (Alexander L. G.) 14,
273
Алессандри (Alessandri Z.) 283
Аллен (Allen G. F.) 344
Анджела (Angeli A.) 283
Анри (Henry L.) 221
Аншютц (Ansehutz R.) 115
Арналль (Arnall F.) 96 ел.
АуберТейн (Aubertein P.) 38
Базани (Bazany H. С.) 53
Байер (Вавувг А.) 233
Баландин А. А. 335
Бальцеркевич (Balzerkewicz H.)
349, 370, 399
Бамбергер (Bamberger E.) 51,56,
74, 219, 325
Банер (Banner С. Т.) 292 ел.
Барышникова А. Н. 87, 402 ел.
Баттегей (Battegay M.) 348, 399,
401
Бахараш (Bacharach С.) 437
Бахман (Bachmann G. В.) 270 ел.,
302, 311
Бахман (Bachman W. Е.) 69
Бедткер (Boedtker) 121
Бейлыптейн Ф. Ф. 233
Белл (Bell F.) 28
Беннет (Bennet G. М.) 7, 154,
171 ел., 179, 196, 207 ел.
Бер Г. Я. 161, 164 ел.
Беркенгейм А. М. 129
БерЮн (Burton) 281
Бетерс (Boters О.) 9, 81
Бибишев В. П. 27
Бильц (Biltz H.) 343
Блехта (Blechta F.) 71
Близнюкав В, И. 15, 366
Блит (Blyth J.) 301
Блэнкол (Blackall E.) 188
Блэсет (Blacet F.) 335
Богданов М. И. 409 ел.
Боннер (Bonner W. Н.) 36
Боннер (Bonner T. G.) 164
Боуэн (Bowen D. М.) 37
Бранд (Brand G. D.) 154, 172
ел., 207, 208
Браун (Brown H. С.) 36
Бренстедт (Breasted I. N.) 139 ел.
Бликенстафф (Blickenstaff R.T.J77
Бринер (Briner E.) 207
Бродер (Broders) 73, 74
Бруннер (Впшпег Р.) 30
Бугай П. М. 57
Буис (Buois J.) 300
Буллок (Bullock J. L.) 14, 277
Бутлер (Buttler Т. Н.) 421
Бэрд (Beard H. Сг.) 40
Вайбель (Veibel S.) 23, 98 ел.
Валяшко Н. А. 15, 366
Вандербилы (Vanderbilt В.) 14,
222 ел., 268
Именной указатель
463
Варма (Vanaa) 358
Вейсвейлер (Veisweiller G.) 35
Векчи (Veechi M.) 335
Вернер (Werner A.) 122, 130
Вестгеймер (Westbejmer F. U.)
168 ел., 208
Виатт (Wyatt) 309
Вибо (Wibaut J. P.) 66, 152
Виланд (Wieland H.) 15, 111 ел.,
118, 123, 125 ел., 202, 293,
336, 346 ел.
Вилл (Will W.) 34
Вильгельм (Wilhelm R. Н.) 15, 411
Вильдман (Wildman W. С.) 295
Вилыптеттер (WilstStter R.) 421,422
Вилльямс (Williams G.) 154, 171,
172, 207, 208
Виньон (Vignon L.) 72, 73
Витт (Witt О.) 30, 54, 347
Володарский А. М. 86
Вольфенштейн (Wolfenatein R.) 9,
81
Ворожцов Н. Н. 160 ел.
Ворожцов Н. Н. (младший) 104
Вреден 233
Вюрц (Wiirz A.) 39
Газенбах (Hasenbaeh) 344
Гайман (Haymann H.) 437
Гайтингер (Haitinger H.) 299
Гальбан (Halban Н.) 133, 148 ел.
Гансбергер (Hunsberger I. M.) 24
Ганте (Gante J.) 349, 398
Ганч (Hantzsch A.) 130—136, 140,
203, 204, 206, 207
Гезерингтон (Hetherington I. A.)
142 ел., 204
Гейм (Heim F.) 291
Гейнле (Heinle E.) 61, 354
Гейсман (Geisman С.) 37
Гибсман (Hibsmann H.) 281
Гиллесли (Gillespie R. J.) 196
Гильберт (Gilbert A.) 115
Гиршбах (Gierschbach J.) 120
Голд (Gold V.) 171
Голлеман (Hollemann А.) Цу Ш
Гофман (Hofman A-) 301
Гофмейер (Hoffmeier) 340
Грехем (Graham) 309
Гроггинс (Groggias P, Н.) 208
Гульден (Goulden Ь. D. S.) 195
Гуревич К. 49
Гутри (Guthrie F.) 299,
Гюбнер (Hiibner H.) 28
Гюсси (Hussy H.) 360
Данциг (Danzig Н. М. ) 14, 275 ел.
Девернье (Desvergeas L.) 74 сд.
Дегеринг(Degering Е.J19,279ел.,
302
Деккер (Deckgr H.) 47
Демьянов Н. Я. 15, 338 ел.
Джонс (Jones R. N.) 200
Джонсон (Johnson К.) 219
Дзудзуми (Tsutsumi S.) 82
Долгов Б. И. 35
Дорноу (Dornow A.) 293, 295
Дрэйк (Drake N. L.) 114
Дэвис (Davis Т. L.) 81, 83 ел.
Женекан (Genequand P.) 65, 66
Заболоцкий Т. В. 335
Забродина А. 0.118,120,129,20.2,
246, 248, 25
Захаров А. И. 76 мл.
Зинин Н- Н. 5
Измаильский В. А. 59, 425
Ингольд (Ingold С. К.) 179, 183,
188, 189, 194сл.,2О5 ел., 425
Иоффе И. G. 30
Кайт (Kite H. Т.) 293
Калинина В. С 86
Камай Г. X. 67
Kapam(Kharasch M. S.) 168 сЛ.,208
Карлсон (CarlsonG-H.) 119,124ел.,
202, 339
Карташев А. В. 93 ел.
Кауфман (Kaufmann A.) 47, 361
464
Именной указатель
Кедров Б. М.
Кекуле (Kekule A.) 112
Кеньон (Кепуоп I.) 28
Керн (Kern) 348
Кесслер (Kessler A.) 120
Клеменц (Klemenz A.) 150 ел., 154
Клоза (Klosa I.) 48
Клузиус (Glusius К.) 335
Коб (Kobe A.) 32, 35 ел., 37
Коваленко А. Г. 67
Коган И. М. 43
Коген (Cohen F. Н.) 66
Козин А. И. 59, 425
Колер (Kohlef E. Р.) 114
Коновалов Д. П. 299
Коновалов М. И. 12, 13, 49, 51,
232 ел., 239 ел., 245 ел.,
248, 261 ел., 275 ел., 278,
296 ел., 368, 394
Конрад (Connerade E.) 59, 60
Кормак (Karmack M.) 69
Косолапов (Kosolapoff G. М.) 25
Костаческу (Gostachescu N.) 248
Котрел (Kottrell) 309
Кришамурти (Krishamurty) 358
Кроссле (Crossley A. W.) 36
Курбатов А. А. 233
Кутепов Д. Ф. 43
Кучумова Н. А. 35 ¦
Лайн (Lyne M.) 200
Ламбертон (Lamherton А. Н.I78,
291 ел.
Ланг (Lang Fr. M.) 25, 26
Ланц (Lantz R.) 139 ел., 204
Лаптев Н. Г. 89, 91 ел., 158
Лауэр (Lauer W. М.) 200
Лауэр (Lauer К.) 137 ел., 204, 205
Леви (Levy Norman) 281,' 341 ел.,
413
Левин (Levin H.) 37 ел.
Легге (Legge.D. I.) 24
Лекорш (Lecorche H.)' 38
Ленхольд В. А. 43
Либерман (Liebermann С.) 345
Лидс (Leeds A.) 344 ел.
Линденман (Lindenmann L.) 345
Липпинкот (Lippincot S. В.) 219
Лориет (Loriette) 37
Лоуэн (Lowen A. M.) 171, 208
Луцкий А. Е. 15, 366
Льюис (Lewis W. К.) 32
Людденс (Liiddens H.) 28
Мак Доуэлл (Me Dowell) 308
Мак-Ки (Me Kee R. Н.) 15, 85, 298,
411 ел.
Мак-Клирли(МсС1еаг1уJ76,279сл.,
302
Ман-Кормак (Me Gormack H.) 32,
38, 39, 42
Макаров-Землянский Я. Я. 27
Манних 228
Маньковская Н. П. 274
Маркерол (Marqueroll) 37
Марковников В. В. 12, 13, 149 ел.,
233, 238, 240 ел.
Мартинсен (Martinsen H). 93, 150,
161 ел.
Мациевич Т. Е. 44
Мейер (Meyer V.) 12, 31, 112
Мейзенгеймер (Meisenheimer J.) 59,
60, 117, 291, 345
Меландер (Melander L.) 179,
196, 209
Менке (Menke J. В,) 432 ел.
Мессон (Masson J.) 142 ел., 204
Миле (Mills) 32
Миллен (Millen D. J.) 195
Мйтчел (Mitchell Е. Т.) 14, 277
Митчерлих 4
Михаэль (Michael А.) 119,124,202,
339 ; ,
Модик (Modic F. I.) 168
Наметкин С. С. 13, 118 ел., 129,
202, 242 ел., 246, 248 ел.;
394, 427 ел.
Нельтинг (Noelting E.) 37
Именной указатель
465
Нифонтова С. С. 245
Ниши (Niscbi) 41
Нортон (Norton L.) 196
Ньюланд (Nieuwland J. А.) 448
Огата (Ogata) 164
Одда (Oddo G.) 116
Одда (Odda R.) 137 ел., 204 ел.
Орлов Е. И. 79 ел.
Патек (Patek К.) 71
Паттерсон (Patterson) 274
Перекалин В. В. 215, 294
Пианка (Pianka M.) 53
Пиггот (Piggott H. А.) 292
Пикте (Pictet A.) 65, 66, 423
Пинк (Pink L. А.) 396
Пирсон (Pierson E.) 281
Поллак (Pollack M.) 272
Поллард (Pollard) 309
Пони (Poni P.) 248
Пономаренко А. А. 41, 44
Пончио (Ponzio) 266
Прайс (Price С. С.) 460
Пфейфер (Pfeifer P.) 122
Пфистер (Pfister К.) 79
Райт 321, 323, 325
Ран (Rahn F.) 127
Ренуф (Renouff N.) 36
Ризинг (Rising A.) 51
Рилей (Riley) 304 ел.
Ринке (Rinkes I. J.) 358
Роберг (Roberg F.) 293, 295
Робинсон (Robinson P. L.) 197,
199, 209
Розе (Rose J. D.) 289
Рюст (Rust) 219
Саккелариус (Sakkelarious E.) 293
Сапожников А. В. 152 ел., 164
Сейгль (Seigle) 275, 282
Семенов Н. Н. 210, 312
Сергиевская С. И. 27
Сидоренко К. В. 338 ел.
Симкинс (Simkins R.) 172
Симой (Simon E.) 301
Скейф (Scaife С. W.) 342
Скрауп 360
Слон (Slon) 380 ел;
Смарт (Smart G. N. R.) 321, 323
Смирнов В, В, 265
Смит (Smith A.) 341
Смолла (Smolla E.) 348
Снайдер (Snider Н.) 231 ел.
Соколова А. М. 252
Сопова А. С. 294
Спасокукоцкий Н. С. 201
Сусц (Susz В.) 207
Сущик Р. Я. 247
Тейлор (Taylor E. С.) 200
Терентьев А. П. 166
Тиле (Tiehle J.) Ill, 337/418
Титов А. Иь 8, 15, 86 ел., 91 ел.,
154 ел., 177, 208, 242,253сл.,
261, 301 ел., 305 ел., 311 ел.,
376 ел., 394, 402, 408
Токи (Toki H.) 41
Томас (Thomas) 308 ел.
Томлинсон (Tomlinson) 208
Томсон (Thomson R. Н.) 58
Топчиев А. В. 15, 166, 199, 380,
381, 410.
Торн (Thorn CD.) 200
Тропов Б. В. 67, 118 ел., 129, 161
Тютюнников Б. Н. 274
Уоррел (Worral D.) 293
Уорстолл (Worstall R. А.)" 237
Уотерс (Waters W. А.) 198, 209
Урбанский (UrbanskyM.) 380 ел.
Урецкая Г. Я. 27
Ури (Uri N.) 210
Усанович М. И. 144 ел., 204 ел.
Утерман (Utennann A.) 54
Ушаков С. Н. 40
Уэлш (Walsh A. D.) 335
Фармер (Farmer E.) 136
Фергюсон (Fergusson L. N.) 150
466
Именной указатель
Фингер (Finger G. G.) 40
Флашлендер (Flaschlander J.) 34
Фрейдберг Е. Н. 40
Фрелих (Frolich) 413
Френсис (Francis F.) 419 ел.
Фридбург (Friedburg) 345
Фридль (Friedl F.) 31,45,370, 376
399
Фриман (Freeman I. R.) 427, 428
Ханш (Hansh G.) 35
Хамлин (Hamlin W.) 231 ел.
Хаун (Haun J. W.) 35
Хельмкамп (Helmkamp G.) 35
Хис (Heath R. Н.) 289
Ходж (Hodge E. В.) 14, 268,
Ходжсон (Hodgson H. Н.) 40
Холево Н. А. 80
Холстед (Hoisted G.) 178
Хотинский (Khotinsky E.) 432
Хьюз (Hughes E. D.) 171, 188
Хэсс (Hass H. В.) 14, 219, 222,
273 ел., 268, 275, 281, 282,
292, 294, 304 ел., 381
Цан (Zahn H.) 39
Шааршмидт (Schaarschmidt A.) 153
ел., 164, 340, 348, 349, 370,
399, 405 ел.
Шедэн (Ghedin J.) 206
Шеллер (Scholler R.) 150 ел., 154
Шеффег (Shaeffer E.) 130,132 ел.,
136
Шмидт Г. A. (Schmidt G. А.) 29
Шмидт Ю. (Schmidt J.) 29, 61,
128, 338, 354
Шнайдер Г. С. 166
Шорыгин П. П. 15, 199, 252, 349,
380 ел.
Шпигель (Spiegel L.) 437
Шпиндлер (Spindler P.) 20
Штадлер (Stadler О.) 31
Шульц (Schultz G.) 34
Щитов Н. В. 264
Эвелл (Ewell) 280
Эйзенбранд (Eisenbrand J.) 148 ел.
Эйлер (Euler H.) 205
Эйтингтон И. И. 80
Эммонс (Emmons W. D.) 427, 428
Энц (Enz W.) 79
Эфрос А. С. 29
Юрьев Ю. К. 63
Явлинский Т. Д. 274
Якубович А. И. 215
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Адишшовая кислота, получение
245, 261, 300
Азота двуокись
взаимодействие с альдегидами
308 ел.
взаимодействие с непредельными
углеводородами 309
нитрующий агент 15, 261 ел.,
286, 334 ел.
Азота окислы как катализаторы
150
Азота пятиокись (азотный ангид-
ангидрид), нитрующий агент 16,171
Азотистая кислота как катализатор
10, 67, 93, 162
Азотная кислота, нитрующий агент
170, 179
Ализарин, нитрование 10, 19
Алифатические углеводороды, ни-
нитрование 376
АлКилнитраты, получение 16
Алюминиевые квасцы в смеси с ни-
нитратом алюминия, нитрующий
агент 429
Амилен, нитрование 299
2-Аминобензотиазол, Нитрование
418
2-Амино-б-нитробензотиазол, полу-
получение 418
Аминоспирты, получение и при-
применение 225, 226
4-Аминохинолин, нитрование 48
Амины, нитрование 25, 26, 320 ел.
326 ел.
Аммиачная селитра, нитрующий
агент 9
Аиизидиды бензойной кислоты, по-
получение 421
о-Анизидин, нитрование 43
п-Анизидин, нитрование 421
Анизол, нитрование 9, 23, 158,
420, 421, 423, 435, 459
Анилин, нитрование 25, 166,
168, 347, 357 ел., 375, 432,436
Анилин, производные, нитрование
54 ел.
Анисовый альдегид, нитрование 420
Антрахинон, нитрование 44, 45,68,
137, 180, 204, 399, 400
Антрахинон, получение 7, 28, 345
Антрацен, нитрование 7, 28, 59—61,
79, 117, 158, 345, 353, 374,
424 ел.
Антрацен-нитроацетат, получение
59
Арилгидроксилашшы, нитрование
159
Ароматические соединения, нитро-
нитрование 14, 26
азотной кислотой 19
в жидкой фазе 334 ел.
Ароматические соединения, нитро-
нитрование
кинетика 66—68
468
Предметный указатель
механизм 71, 111 ел.
нитратами металлов428 ел.,437
нитрующей смесью 19
скорость нитрования галоидо-
производных 68
хлористым нитрилом 459 ел.
Ароматические углеводороды, кон-
конденсация с олефинами 447
Ароматические углеводороды, нит-
нитрование разбавленной азотной
кислотой 238
Ацетальдегид, нитрование двуоки-
двуокисью азота 308 ел.
4-Ацетамидодифенилсульфид, нит-
нитрование 57
Ацетанилид, нитрование 41—43,54,
56, 166, 347, 359 ел., 375, 423
Ацетилен, нитрование 14, 300
двуокисью азота 309
Ацетиленовые углеводороды, нит-
нитрование 14
Ацетил-Р-нафтиламин, нитрование
59
Ацетофенон, нитрование 24
надазотистой кислотой 198
Ацетилнитрат, нитрующий агент
8, 347, 422 ел.
Ацетил-о-толуидин, нитрование 424
Ацетоциангидриннитрат, нитрую-
нитрующий агент 9
Бензальдегид, нитрование 40, 85,
420, 435
Бензальдифенилмалеид, нитрова-
нитрование 117
Бензальдоксим, нитрование 266
Бензальфталимидин, нитрование
117
Бензиловыйспирт,нитрование азот-
азотной и серной кислотами 166
Бензилхлорид, нитрование 423,424
Бензоилнитрат, нитрующий агент
8, 9, 419—422
Бензоилхлорид, нитрование 420
Бензойная кислота
нитрование 54, 70,86, 87, 180,.
423, 435
образование 40, 146, 239,
252, 256, 259, 348, 366, 37»
Бензол, нитрование 7, 9, 10 ,
15, 20, 21, 31 ел., 66—72, 76,
81, 90, 115, 118, 120 ел., 159,
180, 181, 198, 346, 348, 363 ел.,
373, 374, 379,396,397,400,405,
407 ел., 419, 423, 425, 433, 439,
445, 449, 455, 458
механизм 74
окислами азота 344
при повышенной температуре1
345
схема 76
Бензолдиазонитрат, получение 34Т
Бензолсульфокислота, нитрова-
нитровано 163
Бензолсульфоновая кислота, нит-
нитрование 180
Бензотиазол, нитрование 48, 418
Бензотрифторид, нитрование 4CV
Бензофенон, получение 260
Бифенилоксид
бромпроизводные, нитрование 166'
нитропроизводные ,нитрование 166
Борнилен, нитрование 296, 297
Бром как катализатор 272
Бромбензол, нитрование 20, 85,
349, 420, 458
Бромтолуолы, нитрование 411 458:
9-Бромфенантрен, нитрование 62.
Бутадиен, нитрование 300, 343
Бутан, нитрование 12, 268, 270,
272, 276, 413
трет. Бутилбензол,нитрование 35,
36
Бутилен, нитрование 126, 342
трет. Бутилксилол, нитрование 239
Бутилнитроамины, получение 323
трет. Бутилтолуол, нитрование 235
Ванилин, нитрование 420
Предметный указатель
469
Гваякол, нитрование 53
Гексагидропсевдокумол, нитрова-
нитрование 243
Гексаметилен (гексанафтен), нитро-
нитрование 241, 244, 245
н. Гексан, нитрование 233, 234
Гексанафтен, нитрование 241
Гексанитроциклогексан, получение
346
Гексанитроэтан, получение 288
Гексатриаконтан,нитрование 13,247
Гексилен, нитрование 339
н. Гептан, нитрование 24, 234, 242,
284, 385—389, 395, 432—434
Гидриндан, нитрование 249
Гетероциклические соединения,ни-
соединения,нитрование 31
азотной кислотой 19
в жидкой фазе 344
нитрующей смесью 19
Гликоля динитрат, получение 112
Дейтеробензол,нитросоединения200
Декалин, нитрование 249
Диазобензоилнитрат, получение 347
Диалкиланилины, нитрование 55
Диаллил, нитрование 339
Диамид имино-бис-уксусной кис-
кислоты, N-нитропроизводные 325
Диарилсульфат, нитрование 41
Диацетилализарин, нитрование 28,
29
Диацетилортоазотная кислота
(ацетилнитрат), нитрующий
агент 64—66, 437
Диацетобензидин, нитрование 30
Дибензантрон, нитрование 30
Дибензил, нитрование 436
Дибензпирен, нитрование 30
2,5-Дибромнитробензол, нитрова-
нитрование 168
Ди-н. бутиламин, нитрование 326
1,4-Ди-трет. бутилбензол, нитро-
нитрование 24
2,6-Ди-трет. бутилфенол, нитро-
нитрование 53
Дигидронитроантранол, получе-
получение 117
Диены, присоединение нитрооле-
финов 295
Диизоамил, нитрование 234, 262,
431, 432
Диизобутил, нитрование 234
Диизобутилен,нитрование 297—300
Диизопропил, нитрование 234
Диметиламин, нитрование 325, 326
Диметиланилин, нитрование 25,26,
158, 348, 349, 358 ел., 375,434
надазотистой кислотой 198
N-Диметиланилин, нитрование 56,
459
2,3-Диметилбутан, нитрование 275
2,3-Диметил-2-бутен, нитрование
282
2,3-Диметил-2,3-динитробутан, по-
получение 275, 282—284
3,4-Диметил-3,4-динитрогексан, по-
получение 283, 284
2,3-Диметил-1-нитробутан, получе-
получение 276
2,3-Диметил-2-нитробутан, получе-
получение 275, 276
2,7-Диметилоктан, нитрование 242
N .N-диметил-п -толуидин, нитрова-
нитрование 359
2,4-Диметилхинолин, нитрование 48
4,6-Диметилхинолин,нитрование 48
1,5-Д иметоксинафталин, нитрова-
нитрование 58
2,4-Динитроанизол, нитрование 163
1,5-Динитроантрахинон, получение
45
1,8-Динитроантрахинон, получение
45
Динитроантрацен, получение 60,61
2,7-Динитроантрацен, получение 7
9, 10-Динитроантрацен, получение
353, 374
470
Предметный указатель
Динитробеизидин, получение 30
2,4-Динитробензойная кислота,
получение 35
м-Динитробензол, получение 21,
32, 81, 87, 138, 200
о-и п-Динитробензолы, получение
73, 75, 81, 138, 345
Динитробензолы, получение 32,33,
84, 86, 143, 348, 404,453
1,1-Динитробициклогексил, полу-
получение 284
2,3-Динитро-4-бромтолуод, полу-
получение 41
1,4-Динитробутан, коидеисация с
формальдегидом 224
2,3-Динитробутан, получение 283,
413
1,4-Динитро-2-бутен, получение
343
4,6-Динитро-2-трет. бутилфенол,
получение 53
1,6-Динитрогексан, конденсация с
формальдегидом 224
2,2-Динитрогептан, получение 394
5,6-Динитродекан, получение 284
Дннитродиацетобензидин, полу-
получение 30
п,п'-Дннитроднбензил, получение
436
5,10-Динитродибензпирен, получе-
получение 30
9,10-Динитро - 9-10-дигидр о антра-
антрацен, получение 345
Динитродиизобутил, получение
234
2,4-Дннитро-М-диметиланилин, по-
получение 56
2,4-Дннитродиметиланилин, но-
лученне 348, 359
2,3-Д ннитро-2,3-диметилбутан,
получение 339, 341
2,4-Д ннитро-2,3-диметилпентан,
получение 292
2,2'-Динитродифенил, получение 28
2,4'-Динитродифенил, получение 28
4,2'-Динитродифенил, получение 28
4,4'-Динитродифеннл, получение28
м-Динитродифенил, получение 30
п,п'-Динитродифенил, получение 28
2,4-Дннитродифениламин, получе-
получение 43
п,п' - Динитродифениламинокеид,
получение 348
4,4'-Динитродифенилмочевина, по-
получение 43
п,п'-Динитродифенилмочевина, по-
получение 57
3,4'-Динитродифенилуксусная ки-
кислота, получение 24
1,2-Динитро-1,2-днфеннлэтан,полу-
чение 284
2,4-Динитро-1,3-дихлорбензол, по-
получение 39
2,6-Динитро-1,4-днхлорбензол, по-
получение 39
3,5-Д инитро-1,2-дихлор бензол, по -
лучение 39
4,6-Динитро-1,3-дихлорбензол, по-
получение 39
1,2-Д инитроизобутан, получение
341
Динитроизооктан, получение и
свойства 393
2,4-Динитроизопропилбензол, полу-
получение 35
Динитрокапрнлен, получение 300
3,6-Динитрокарбавол, получение 63
Динитрокарбазолы.получение 62,63
2,6-Динитрокревол, получение 404
4,6-Динитро-м-крезол, получение-
355, 375
Диннтро-о-крезол, получение 23
Диннтрокрезолы, получение 23,
348, 355, 375, 403
Динитро-м-ксилол, получение 369,
444
2,4-Диннтро-м-ксилол, получение
22
Предметный указатель
471
4,6- Д инитро-м-ксилол
нитрование 163
получение 21, 22
3,4-Динитро-о-ксилол,палучевие 22
4,5-Динитро-о-ксилол, получение
22, 36
4,6-Динитро-о-ксилол,получение 22
36
2,3-Диннтро-п-ксилол, получение
22, 37 ел.
2,6-Динитро-п-ксилол, получение
22, 37 ел.
Динитроксилолы, нитрование 170
Динитромезитилен
нитрование 170
получение 22, 236
2,4-Динитрометиланилин, нитро-
нитрование 26
2,3-Динитро-2-метилбутан, получе-
получение 248
3,5-Дннитро-3-метилгексан, получе-
получение 287
Динитро-2-метилтиофен, получение
48
2,4-Динитромонометиланилин, по-
получение 348
1,3-Диннтронафталин, получение 83
1,5-Динитронафталин, получение
27, 43, 44, 83, 117, 351
1,8-Динитронафталин, получение
27, 43, 44, 117, 351
Динитронафталнны, получение 345
4,5-Динитро-1-нафтонная кислота,
получение 44
2,4-Динитро-а-нафтол, получение
7, 27, 44, 79, 84, 92, 347, 420
1,6-Динитро-Р-нафтол, получение
356 ел., 375, 420
2,4-Д инитро-N - нитрозомономети ла-
нилин, получение 359
Р ,Р'-Динитрооксндиэтиламмоний-
хлорид, нитрование 329
Р,Р'-Дииитроокснднэтилнитроамин,
получение 326, 329
Р ,Р'-Динитрооксидиэтилнитрозо-
амин получение 330
Динитрооксидиэтилхлорами», ?ни-
трование 329
Динитропарафины, получение 231
1,5-Динитропентан, конденсация с
формальдегидом 224
1,2-Дииитропропан, получение 341
2,2-Динитропропан, получение 286
Динитропропаны, получение 342 ц
2,2-Динитропропандиол-1,3, полу-
получение 224
1,2-Динитротетралин, получение 27
1,3-Динитротетралии, получение 27
симм. Динитротетрахлорэтан, по-
получение 343
Динитротиофены|изомерные, полу-
получение 31
о,о'-Динитро-п-толиламин, полу-
получение 348
2,4-Динитротолуол,нитрование 405
азотной кислотой 164, 173 ел,.
2,4-Динитротолуол, получение 21,
405
2,5-Динитротолуол, нитрование 34
2,6-Дннитротолуол, получение 179
3,4-Динитротолуол, нитрование 34
Динитротолуолы, получение 146
Динитротолуолы изомерные, нит-
рованне 34
4,4'-Динитротрифениламии, полу-
получение 57
2,4-Динитрофенилсульфат, получе-
получение 41
2,4-Диннтрофенилуксусная кисло-
кислота, получение 24, 41
2,4-Динитрофенол, получение 23,
25, 41, 69, 81, 163, 354, 357,
358, 360, 375
2,5-Динитрофенол, получение 358
2,6-Диннтрофенол, получение 258,
«-Динитрофенол, получение 94
Динитрофенолы, получение 7Г 74,
78
472
Предметный указатель
2,7-Динитрофлуоренон, получение
29
Динитрофторбензол, получение 39
5,6-Динитрохинолин, получение 47
5,7-Динитрохинолин, получение 31,
47, 360
5,8-Динитрохинолин, получение 47
6,8-Динитрохинолин,получение 31,
47
Динитрохинолины, получение 360,
376
1,2,4-Динитрохлорбензол, получе-
получение 39
.2,6,1-Динитрохлорбензол, получе-
вие 393
1,2-Динитроциклогек сан, получение
341
Динитроэтан, получение 341
-а,Р-Динитроэтан, получение 341
2,4-Динитроэтилбензол, получение
35
1,3-Динитро-2-этил-3-метилбутан,
получение 287
«Динитрюры», получение 336, 341
1*,Р'-Диоксидиэтил аммоний-хлорид,
нитрование 329
2,6-Диоксопиридазин, N-нитропро-
изводные 325
Ди-п-толилгидроксиламин, нитро-
нитрование 347
«,а-Ди-п-толилэтилен, нитрование
116
Дифенил, нитрование 28, 58, 353,
436
Дифениламин, нитрование 347
Дифениламин, ацильные производ-
производные, нитрование 43
. Дифениламиноксид, нитрование 348
1,4-Дифенилбутадиен, нитрование
337
2,3-Дифенил-1,3-бутадиен, нитрова-
нитрование 344
:1,4-Дифенил-1,4-динитробутен-2,
получение 337
Дифенилдинитродихлорэтан, по-
получение 343
Д ифенилдинитроэтан .получение 336
а,а-Дифенил-Р,Р-динитроэтилен,
получение 116
а ,а-Д ифенил-Э, Р-дихлор этан, нитро-
нитрование 343
Дифенилметан,нитрование 166,259,
260, 262, 426
Дифенилмононитрометан, получе-
получение 260
Дифенилмочевина, нитрование 43,
57
1,4-Д ифенил-1-нитробутадиен, по-
получение 337
Дифенилнитрозоамин, получение
347
Дифенилнитрометан, получение 260
и.к-Дифенилнитроэтилен, получе-
получение 114, 116
а,а-Дифенилнитроэтиловый спирт,
получение 114, 116, 127
Дифениловый эфир,нитрование459
Дифенилуксусная кислота, нитро-
нитрование 24
«,ос-Дифенилэтилен, нитрование
114, 126, 127
1,5-Дифторнафталин, нитрование
58
1,5-Дифтор-4-нитронафталин, полу-
получение 58
п,п' -Дихлоразобензол, нитрова-
нитрование 57
2,4-Дихлоранилин, нитрование 55
1,5-Дихлорантрацен, нитрование
346
м-Дихлорбензол, нитрование 39
о-Дихлорбензол, нитрование 39
о-Дихлорбензол как растворитель
при нитровании 10
п-Дихлорбензол, нитрование 39,
180
Дихлорбензолы, нитрование 458
N ,N'-flnxnop-N ,]Ч'-динитро-1,2-
Предметный указатель
473
днаминоэтан, получение 321
N ,N '-Д ихлор-N ,N '-дини*ро-1,2-
диаминоэтаи, гидролиз 322
1,5-Днхлор-9,10-динитрО*-б,10-диги-
дроантрацен, получение 346
4,4'-Дихлор-2 -нитроазоК&ибензол,
получение 57
1,5-Дихлор-9-нитроаитрапен, полу-
получение 346
2,4-Дихлорнитробензол, получение
458
2,5-Дихлорнитробензол, нитрова-
нитрование в серной кислоте 168
Дихлорнитропарафины, получение
220
4,6-Дихлор-2-нитрофенол, получе-
получение 433
Диэтаноламии,нитрование 325,326,
329
Диэтаноламин, солянокислая соль,
как катализатор 325
м-Диэтилбенэол, нитрование 35
о-Диэтилбеизол, нитрование 52
Диэтилбензолы, нитрование 49,240
Диэтилбензолфосфат, нитрование 25
1,2-Диэтш1-4-нитробеизол, получе-
получение 52
3,5-Д иэтокси-2,6-динитропиридин,
получение 46
3,5-Диэтоксипиридин, нитрование
46
3,5-Диэтокси-2-нитропиридин, по-
получение 46
Додекан, нитрование 285, 395
Дурол, нитрование 9, 421, 422
Жирноароматические соединения,
нитрование в жидкой фазе 376
Заместители, изменяющие ско-
скорость нитрования 163 ел.
Изоамиден, нитрование 114,
125-^27
Изоборнилан, нитрование 249
32 а. В. Топчиев
Изобутан, нитрование 240, 268,286
Изобутилен, нитрование 126, 299,
339
Изогексан, нитрование 240
Изогептан, нитрование 240
Изокамфан, нитрование 250
Изонитроизооктан, получение 248
Изонитроциклогексан, получение
119, 251
Изооктан B,2,4-триметилпеитан),
нитрование 248, 384 — 386,
432 ел.
Изооктанафтен, нитрование 428
Изопентан, нитрование 248, 275,
384, 386 ел.
Изопропилбензол, нитрование 24,35
Изопропилнитроамин, получение
323
Имино-бис-ацетонитрил, N-нитро-
производные 325
Имино-бис-уксусная кислота,1Я-ни-
тропроизводные 325
Индол, нитрование 418
Иодбензол, нитрование 349 о-и
п-Йоднитробензолы, получение 349
Камфан, нитрование 250
Камфен, нитрование 296 ел.
Камфенилан, нитрование 250
Каирилен, нитрование 300
Карбазол, нитрование 62 ел.
Катализаторы при нитровании 9,
68 ел., 121 ел., 281, 396 ел., 456
основные 286
хлористоводородный 327
Кетоксимы, нитрование 266
Кетоны, нитрование 10, 277
е-Кислота, нитрующий агент 150
Кислоты карбоновые, нитрование
277
Коричная кислота, нитрование 41,
301
м-Крезол, нитрование 52, 355 ел.,
375
474
Предметный указатель
м-К резола метиловый эфир, нитро-
нитрование 100, 158
о-Крезол, нитрование 23, 100
п-Крезол, нитрование 162
Крезолы, нитрование 158, 347
1,3,4-Ксиленол, нитрование 347
Ксилидины, нитрование 421
Ксилилнитрометан, получение 51,
235, 239
м-К силол, нитрование 21, 37, 38,
79, 80, 235 ел., 369 ел., 37,5
400, 420, 444, 451
скорость нитрования 68
о-Ксилол, нитрование 22, 36, 37,
52, 240, 400
п-Ксилол, нитрование 22, 37, 38,
235 ел., 240, 400 Nti
Ксилолы, нитрование 33, 49,85, 349
двуокисью азота 344
Кумарин, нитрование 420
Кумарина производные, нитрова-
нитрование 64
Кумол, нитрование 35
Мезитилен, нитрование 22, 50, 166,
235 ел., 239, 349, 420
Мезонитроантрацен, получение 118
Ментен, нитрование 296, 297
Метан, нитрование 273, 277, 279,
304, 382
Метилантрахинон, нитрование 68
З-Метилгексан, нитрование 281
'Метйлдинитродиоксибензол, полу-
получение 345
4-Метил - 2,6-динитро-]Ч-нитро-зомо-
нометиламинанилин, получе-
получение 359
2-Метил-1 ,-2-динитропропан, полу-
получение 286
3,4-Метилендиокси-ю-нитро-стирол,
гидрирование 227
Метилендинитроамин, получение
324
Метил ен-бис-N -(N -нитр о)-ацетамид,
получение 324
*- и Р-Метилнафталины, нитрова-
нитрование 44, 158
Метилнитроамин, получение 321
2-Метил-1-нитробутан, получение
275
2-Метил-2-нитробутан, получение
275, 387
2-Метил-З-нитробутан, получение
387
2-Метил-4-нитробутан, получение
387
З-Метил-1-нитробутан, получение
275
З-Мвтил-2-нитробутан, получение
275, 276
2-Метил-2-нитропропан, получение
286, 387
трет. Метилнитроциклогексан, по-
получение 251
Метиловый спирт, нитрование 189'
Метиловый эфир бензойной кис-
кислоты, нитрование 87
Метиловый эфир м-нитробензойной
кислоты, получение 87
Метилпикрамид, нитрование 189
5-Метил-2-тиофенкарбонован кис-
кислота, нитрование 48
N-Метил-п-толилиитроамин, полу-
получение 421
N-Метил-п-толуидин, нитрование
421
Метилуретан, нитрование 178
Метилфенилнитромётан, получение
367, 375
Метилциклогексан,нитрование 251,
427
о-Метоксиацетанилид, нитрование
26
1-Метокси-2-п-толилсульфамидо-5-
нитробензол, получение 26
1-Метокси-2-п-толилсульфамидо-
бензол, нитрование 26
о-Метоксифенол (гваякол), нитро-
вание 53
Предметный указатель
470
Механизм реакции нитрования см.
Нитрование, механизм реакции
Монодейтеробензол, нитрование 200
Монодейтеро-м-динитробенаол, по-
получение 200
Монодейтеронитробензол, получе-
получение 200
Монометиланилин, нитрование 348
Мононитрокаприлен, получение 300
Мононитродиизобутил, получение
234
Монохлоруксусная кислота как ра-
растворитель при нитровании 146
Мочевина, нитрование 178
Надазотистая кислота, нитрующий
агент 197 ел.
Нафталин, нитрование 7, 10, 15,
26, 27, 43, 44, 79, 83, 85, 91,
116, 157, 346, 351 ел., 374,
376, 396, 398, 423, 434, 457
двуокисью азота 345
Нафталиндисульфоновые кислоты,
нитрование 141
«-Нафталинсульфоновая кислота,
нитрование 86
Нафталин сульфоновые кислоты, ни-
нитрование 141
Нафталинтрисульфоновые кислоты,
нитрование 141
Нафталинтетрасульфоновые кисло-
кислоты, нитрование 142
Р-Нафтальдегид, нитрование 420
«-Нафтилмеркуринитрат, нитрова-
нитрование 92
Р-Нафтилмеркуринитрат, нитрова-
нитрование 92
Нафтантрахинон, нитрование 164
а-Нафтол, нитрование 44, 85, 347,
420
Р-Нафтол, нитрование 74, 356 ел.,
375, 420
Нафтолы, эфиры, нитрование 158,
420
Нафтолы, нитрование 15, 158
Непредельные соединения, нитро-
нитрование 14, 296 ел., 301
азотной кислотой 215 ел.
в жидкой фазе 336 ел.
Нитраты металлов (нитрующие
агенты) 347, 425 ел., 437
алюминия 427 ел.
аммония 442
бария 442
висмута 426, 429
железа 429
калия 439
лития 436, 437
меди 429
натрия 422
ртути 426
свинца 442
серебра 426, 442
цинка 429
Нитраты органические как нитру-
нитрующие агенты 347
Нитрацидийдисульфат 134, 135
Нитрацидийперхлораты 136
Нитрацидийсульфат, нитрующий
агент 137
З-Нитроализарин. получение 10
Нитроалканы, получение 16
Нитроалкоголь циклогексадиена,
получение 115
Нитроамины, получение и свойства
228 ел., 320, 321
5-Нитро-о-анизидин, получение 43
о-Нитроанизол, получение 9
п-Нитроанилин
нитрование 162
получение 358, 375
1-Нитроантрахинон, нитрование 180
Нитроантрацен, получение 59, 61
Нитроантрон, получение 61
о-Нитроацетанилид, получение 54,
359, 375, 432, 435
п-Нитроацетанилид, получение 42,
54. 359, 375, 436—417
Нитроацетаты, получение 66, 67
32*
указатель
1-Низуо-2-адетилнафтиламив, по-
получен^ 5$Г
м-Нитроацетофонон, получение 24
Нитробеизадьдегиды, получение 40,
41 '' ' ' '
Нитробвнзид^доридщ изомерные,
получение 53
м-Нитробензойная кислота, полу-
получение 41, 54, 87
о-Нитробензойная кислота, полу-
получение 40
п-Нитробензойная кислота, полу-
получение 40, 71, 82, 266
Нитробензойные кислоты, полу-
получение 70
Нитробензол, нитрование 7, 84,
86, 87, 138, 142, 161 ел., 163,
180, 204, 400, 404, 425, 452 ел.
азотной кислотой 164
ионизация при 171
константа скорости 169
надазотистой кислотой 198
Нитробензол», получение 10,
21, 32, 68—72, 75, 78, 115,
121, 147, 198, 344—346, 348,
363, 373, 398, 400 ел., 403,
405, 407, 408, 411, 419, 433,
.. 445, 450, 458
6-НитробвнзотиаЗОл, получение 48,
. 418
2-Нитро-4-бромтолуол, получение
ч 458
3-Нитро-4-б,ромтолуол, получение
•458
Нитробутадиен, получение ЗОр
1-Нитробутаи, получение 268 ел.,
.275
2-Нитробутаи, нитрование 284
г-НитроЕ^утав;, получение 263 ел.,
275,'281, 4|3
Нитробутаны, получение 268 ел.,
- Щ " ' '
2-Нитробу1$я, конденсация с цик-
лонентадиеном 295
2-Нитррбутев-1, нитрование 287
2-Нитробутен-2, конденсация с бу-
бутадиеном 295 '
Нитро-трет. бутилбензолов изоме-
изомеры, получение 35
Нитрование
в газовой фазе 14—16,281,362
В жидкой фазе 336 ел.
влияние добавок на скорость
реакции 169
кинетика 67, 68, 111 ел., 137,
164 ел., 179
механизм реакции 13 ел., 56,
111 ел., 129, 138 ел. 147, 179,
190, 200 ел., 279, 301, 305 ел.,
406, 453 ел.
нитратами металлов см. Нитра-
Нитраты металлов
окислами азота 334 ел.
парофазный метод 278
скорость' реакции 102 ел., 169
смесью азотной кислоты с уксус-
уксусным ангидридом 49
смесью азотной и уксусной ки-
кислот 49
температура 10
З-Нитрованилин, получение 420
Нитрогексаметилен, нитрование
и получение 245
Нитрогексан, получение 234
Нитрогексанафтен, получение 241
2-Нитрогептан, получение 242, 387,
393
Нитрогептаны, получение 387, 395
а,Р-Нитрогидрин, получение 126
трет. Н итрогидриндан, получение249
Нитрогидряны насыщенные, прлу-
чение 123
трет. Нитродекалин, получение 249
Нитродеканы, получение 285, 286,
395
Нптродиамины, получение 228,
Нитродигидроавтраценацетат по-
получение 6Q
Предметный указатель
4?7
Нитродиизобутил, получение 234
N-НитроДиметйламин, получение
325
п-Нитродиметиланилин, получение
348, 349, 358, 375
5-Нитро-4,4-диметилпентанон-2, по-
получение 294
5-Нитро-4,6-диметилхинолин^ полу-
получение 48
6-Нитро-2,4^диметилхинолин, полу-
получение 48
8-Нитро-2,4-диметилхинолин, полу-
чение 48
4-Нитро-1,5-диметоксинафтайин .по-
.получение 58
2-Нитродифенил, нитрование и по-
получение 28
4-Нитродифенил, нитрование и по-
получение 28
о-Нитродифенйл, получение 58, 353
п-Нитродифенйл,получение 58, 353,
436
2-Нитродифенилена окись, полу-
получение 58
п-Н итродифени лнитрозоамин, полу-
получение 347
4-Нитродифениловый эфир, полу-
получение 459
Нитродифенилы, получение 58
1'-НитродурОл, получение 9, 422
<д-Нитродурол, получение 421
Нитрозилхлорид, образование 304
Нитрозилсерная кислота, образо-
образование 397
Нитрозные газы, нитрующий агент
128, 372 ел.
Нитробензол, нитрование 75
п-Нитрозодиметиланилин, получе-
получение 348
Нйтрозосоединения, нитрование 159
О-Ни^грозотолуол, нитрование 91
о-Нитрозофенол, получение 100 ел.
п-Нитрозофенол, получение 100 ел.
Нитрозофенол как катализатор 104
Нитрозофенолы, получений 94 ¦ 151
Нитроизоамилен, получение il4,125
2-Нитроизоборнилан, получение 249
Нитроизогептан, получение 240; 241
Нитроизобутаны, получение 240,269
Нитроизогексан, получение 240
Н итроизооктаны, получение 38?, 395
а,р-Нитроизопропилнитрйт, полу-
получение 342
а-и«'-Нитрокамфаны,получение 250
ос-Нитрокамфен, получение 250
втор.*-Нитрокамфен, получение 297'
ю-Нитрокамфен, получение 297
Нитрокаприлен, получение 300
4-Нитро-м-крезол, нитрование и
получение 52, 100
6-Нитро-м-Крезол, нитрование и
получение 52, 100
Нитрокрёзолы, поЛучейие 71
2-Нитро-М-ксилол, получение 51
4-Нитро-м-ксилол, получение 21,
37, 80
З-Нитро-о-ксилол, получение 22,
36, 52
4-Нитро-о-ксилол, получение 22,
36, 52,
о-Нитроксилолы, получение 345
2-Нитро-п-ксилол, получение 22
Нитро-п-ксилОлы, получение 37
Нитроксилолы, получение 37; 369,
452
5-Нитрокумарин, получение 420
Нитрокумол, нитрование И пе(луче-
ние 35
Нитромезитилен
нитрование 236
получение 22, 50—52, 420
Нитроментены, получение 297
Нитрометан
взаимодействие с основаниями
219
¦ как растворитель 180 .
конденсация с альдегидами 223,
226
478
Предметный указатель
Предметный указатель
479
получение 15, 268, 272,274—276,
299, 382
хлорирование 220
4-Нитро-З-метилбензойная кисло-
кислота, получение 80
2-Нитро-2-метилбутан, получение
248
1-Нитро-2-метилнафталин, получе-
получение 44
4-Н итро-5-метил-2-тиофенкар боно-
вая кислота, получение 48
п-Нитро -о-метоксианилин, получе-
получение 26
«-Н итронафталин
нитрование 162
получение 27, 43, 44, 83, 104,
116, 347, 351, 352, 374, 398, 457
Р-Нитронафталин, получение 43
Нитронафталины, получение 345
1,8-Нитронафталинсульфоновая
кислота, получение 86
8-Нитро-а-нафтметилхлорид, полу-
получение 59
Нитронафтойная кислота, получе-
получение 83
5-Нитро-1-нафтойнан кислота, ни-
нитрование 44
ос-Нитронафтол, получение 85
2-Нитронафтол, получение 347
2-Нитро-а-нафтол, получение 84
а-Нитро-Р-нафтол, получение 79
1-Нитро-2-нафтолэ эфиры, получе-
получение 420
Нитронафтолы, получение 83, 84
п-Н итро-М-нитрозомонометилани-
лин, получение 348
1-Нитро-1-B-нитроизопропил)- ци-
клогексан, получение 283
Нитронийдинитрат, получение 134
3-Нитро-ь>-нитростирол, гидриро-
гидрирование 227
трет.Нитроноркамфан,получение277
2-Нитро-4-оксибензальдегид, полу-
получение 53 ел.
Нитро-3-оксибензолдикарбоновая
кислота, получение 80
Нитрооксикумарин, получение 48
4-Нитро-1-окси-2-нафтойная кис-
кислота, получение 58
4-Нитро-1-оксипиридин, получение
46
6-Нитро-4-оксихинолин, получение
47
втор. Нитрооктадекан,получение 13
1-Нитрооктен-2, получение 298
Нитроолефины, взаимодействие с
различными соединениями
294 ел.
с аминами 293
с нитропарафинами 292 ел.
с органическими основаниями
293
с щелочными солями полинит-
ропарафинов 287
со спиртами 291
восстановление 227
конденсация с алкоголятами 291
полимеризация 295 ел.
получение 226 ел., 231
присоединение к диенам 295
свойства 288 ел.
Нитропарафины
бромирование 221
взаимодействие с нитроолефина-
ми 292
восстановление 217
галоидопроизводные, получение
220 ел.
действие на них минеральных
кислот 217 ел.
действие на них оснований 219
иодирование 221
конденсация
с альдегидами 11, 221—223
с альдегидами и аминами 228
с кетонами 286
получение и применение 11, 12,.
232 ел., 272
Я
свойства 215 ел.
275
получение
1-Нитропентен-1, конденсация с дие-
диенами 295
N-Нитропиперидин, получение 325
4-Нитропиридин-М-оксид, получе-
получение 46
Э-Нитропиридин, получение 45,
370 ел.
Дитропиридины, получение 31, 45
N-Нитропроизводные
диамида имино-бис-уксусной ки-
кислоты 325
2,6-диоксоииридазина 325
имино-бис-ацетонитрила 325
1-Нитропропан, получение 15, 268,
272, 275
2-Нитропропан
нитрование 284
получение 268, 272, 275, 276
2-Нитропропанол, получение 15
2-Нитропропен, полимеризация 296
2-Нитропропен-2, конденсация с
бутадиеном 295
с циклопентадиеном 295
4-Нитро-1-пропилнафталин, полу-
чевие 27
2-Нитро-6-пропилфенол, получение
53
¦о- и м-Нитропропиофеноны, полу-
получение 24
З-Нитроретен, получение 301
4-Нитроретен, получение 301
9-Нитроретен, получение 301
Нитроретены, получение 300
5-Нитросалициловая кислота, по-
получение 460
л-Нитросалициловая кислота, по-
получение 79
Нитросерная кислота, нитрующий
агент 150
Л итросоединения
жирноароматического ряда 232 ел.
изомерные 13
нитрование 161
общая характеристика 3,4
применение 4 ел.
Нитроспирты
гидрирование 225
их аминоспирты, получение 225
и хсложные эфиры,получение 225
получение 11, 221 ел.
применение 11
Нитростильбен, присоединение к
фенилнитрометану 292
ю-Нитростирол
гидрирование 227
конденсация с бутадиеном 295
конденсация с метилбутадиеном
295
получение 226, 301
6-Нитро-о-толуидин, получение 424
о-Нитротолуол, получение 8, 82,
345, 433, 460
п-Нитротолуол, получение 82, 418,
460
2-Нитро-4-толуолсульфокислота,
получение 87
Нитротолуолы
нитрование 143, 404
получение 21, 22, 33, 50, 71, 146,
348, 365 ел., 375, 398, 403,
413, 443, 452 ел.
Нитротиофен, получение 31, 64, 424
4-Нитротрифениламин, получение
57
Нитроуретан, получение 178
2-Нитрофенантрен, получение 62,
128, 354
З-Нитрофенантрен, получение 29,
62, 128, 354
4-Нитрофенантрен, получение 62,
128, 354
9-Нитрофенантрен, получение 62,
128, 354
2-Нитрофенантренхинон, получе-
получение 29
480
Предметный указатель
4-Нитрофенантренхинон, получение
29
Нитрофенантрены, получение 29,
85, 128
о-Нитрофенетол, получение 9
м-Нитрофенилдииитрометан, полу-
получение 267
1-Нитро-2-феиил-3-карбэтилмасля-
ной кислоты этиловый эфир,
получение 294
м-Н итрофдаилнитрометан, получе-
получение 266
1-D-Нитрофенил)-пиррол, получе-
получение 63
№-(п-НитрофеЯил)-пирролидин, по-
получение 63, 64
п-Нитрофенилсульфат, получение
41
м-НитрофвНилуксуеная кислота,
получение 437
о-НитрофенилуксусИая кислота,по-
кислота,получение 437
м-Нитрофенол, получение 167
о-Нитрофенол, нитрование 23, 25,
347, 434, 459
п-Нитрофенол, получение 23, 94,
347, 459
Нитрофенолы
нитрование 7
получение 7, 10, 68 ел., 70, 71,
85, 91, 94, 97, 100, 151, 277,
348, 400, 412
2-Нитрофенхан, получение 13, 250
6-Нитрофенхан, получение 13, 250
2-Нитрофлуорен, получение 62
Нитроформ
взаимодействие с альдегидами
или кетонами 224
получение 382
З-Нитрофталевая кислота
чение 41, 87
о-Нитрохинолин
нитрование 47
получение 31, 46, 198
полу-
6-Н итрохинолин
нитрование 47
получение 198
7-Н итрохинолин
нитрование 47
получение 198, 360, ел., 437
8-Нитрохинолин
нитрование 47
получение 31, 46, 198
Нитрохинолины,получение 360, 376
м-Нитрохлорбеявол, получение 1*98
о-Н итрохлорбензол,получениё38,39
П'-Нитрохлорбензол, получение 38,
39, 83, 407, 433
Нитрохлорбензолы, получение 403,
425
8-Нитро-1'-хлор'-1-метилнафталин,
получение 425
5-Нитро-6-хлор-1-метиловый эфир
нафтойной кислоты, получение
28
4-, 6- и 8-Нитро-1-хлор-2-метокси-
нафталины, получение 27
5-Нитро-6-хлор-1-нафтойная кис-
кислота, получение 27
Н итроциклогексаи
нитрование 284
получение 261, 282, 383, 396, 427
втор. Нитроциклогексен, получе-
получение 300
1-Нитроциклогексен-1, получение
300
Нитроцнклопентадиен, получение
8, 418
Нитроциклопеитан, получение 428
Нитроциклопропан, получение 396,
428
ос-Нитроцимол, получение 345
Нитроэтан
взаимодействие со щёлочью 219
получение 15, 268, 269, 272, 275,
276, 304 ел., 342
]Ч-(а-Нитроэтил)-анилин, получение
293
Предметный указатель
481
2*-Н1№роэтилбензол, получение 35
о-Нитроэтилбензол, получение 24
Нйгроэтилбензолы, получение 34,
367, 375, 426
1-Нитро-2-этилгексен-2, получение
298
Цитроэти лен, полимеризация 295с л.
Нитроэтилен, получение ИЗ
Нитроэтилнитрат, получение 343
Нитроэтиловые спирты, нитрова-
нитрование Ц2
Р-Нитроэтиловый спирт, получение
1'12, Ш, 342, 343
Нитрующая смесь 31, 179
Нитрующие агенты 8 ел., 19,156
Ионацафтен, нитрование 232 ел.,
Щ
Норкамфан, нитрование 277
Окислы азота, нитрующий агент
15, 16, 334 ел.
Окись дифёнилёна, нитрование 58
п-ОЙсибёнзальдегид, нитрование 54
п-Оксибензойная кислота, нитро-
нитрование 23
7-Окси-3,4-диметил-6,8-динитроку-
мдрия, получение 64
7-0 кси-3,4-диметилкумарин, нитро-
нитрование ,64
о-Оксикарбоновые кислоты арома-
ароматические, нитрование 53
4-Оксикумарин, нитрование 48
2,5-бис-(Оксиметил)-2,5-динитр or е-
ксандиол-1,6, получение 224
2,в-бйс-(Оксиметил^2,6:-динитрогвп-
*андиол-1,7, получение 224
2,7-бис-(Оксиметил)-2,7- динитроок-
таидиол, получение 224
1-Окси-2-нафтойная кислота, нитро-
нитрование 58
Оксинитросоединения, получение 7
8-Окиси-9-нитрофенантрёна эфир,
получение 115, 128
1-Окси-4-нитрохинолин, получение
47
1-ОКсипиридин, нитрование 46
4-Оксипиридин-]Ч-оксид, нитрова-
нитрование 62
1-Оксихинолин, нитрование1 47
4-Оксихинолин, нитрование 47
Октадекан, нитрование 13, 247
Октан, нитрование 234, 247
Октен-1:, нитрование 296 сЛ.
Октены изомерные, нитрование 14
н. Октилнитроамин, получение 323-
Олефины
конденсация
с ароматическими углеводорода-
углеводородами 447
с оксикислотами 446
с фенолами 447
нитрование 126, 282
Парафины, нитрование 12, i&, 16,-
241, 28S, 425
в' газовой фазе 278 ел.
Парофазноё нитрование 277 али-
алифатических углеводородов1 273.
ел., 277
Цента мети лен, нитрование 241!1
ПентаНы, нитрование 1!2, 274
Пикрамид, получение 162
Пикриновая кислота, получение 7,.
10, 23, 69, 70, 81, 84, lei,
344—346, 348, 433
Пикриновая кислота, механизм по-
получения 71 ел.
Пинен, нитрование 296 ел.
Пиперидин, нитрование 325, 327
Пиридин, нитрование 31,45, 370 ел.,.
376, 425
Пиридин азотнокислый, получение
372
Пиридин-Г>?-оксид, нитрование 46-
Пиросерная кислота, получение 124
Пиррол, нитрование 418
Платины окись как катализатор 227
Полиамины, получение 231
Поливиниламин, получение 296
482
Предметный указатель
Полинитрододеканы, получение 285
Полинитропарафины, получение
282 ел.
Полинитропарафины, щелочные
соли, взаимодействие с нитро-
олефинами 287
Полинитроспирты, получение 224
Лолинитро-4-хлортолуолы, получе-
получение 21
.Полихлорбензолы как растворите-
растворители при нитровании 20
Предельные углеводороды, нитро-
нитрование 13, 14, 237, 253 ел.
в газовой фазе 16
механизм 253 ел.
Предельные бициклические угле-
углеводороды, нитрование 248 ел.
Предельные жирно ароматические
соединения, нитрование азот-
азотной кислотой 215 ел.
Пропан, нитрование 12, 15, 268,
273, 277, 383, 413
парофазное 270, 272
Пропилбензол, нитрование 235
Пропилен
конденсация с органическими ки-
кислотами 446
нитрование 342
1-Пропилнафталин, нитрование 27
о-Пропилфенол, нитрование 52 ел.
Пропиофенон, нитрование 24
Псевдоазотная кислота,нитрующий
агент 137
Псевдокумол
нитрование 166, 235, 240
скорость нитрования 68
Разбавление, влияние на нитро-
нитрование 20
Растворители при нитровании 10,
20, 97 ел., 126, 145 ел., 342
Резорцин, нитрование 158
Ретен, нитрование 300
Ртуть и ее соли как катализаторы
9, 10, 68, 70, 78 ел.
Салициловая кислота, нитрование
53, 79, 460
Салициловый альдегид, нитрова-
нитрование 420
Серная кислота
влияние ее концентрации на
скорость нитрования 162 ел.
как катализатор 396 ел.
как растворитель 31
Силикагель как катализатор 411
Спирты, нитрование 277
Стильбен, нитрование 336 ел.
Стирол, нитрование 301
Тетрааминодифенил, получение 30
Тетрабромэтилен, нитрование 343
1,2,3,4-Тетр агидро-6,8-динитронаф-
талин, получение 44
Тетрагидронафталин, нитрование 44
Тетралин, нитрование 27
Тетраметилэтилен, нитрование 338,.
339, 341
1,1,4,4-Тетранитробутандиол-2,3,
получение 224
1,1,6,6-Тетранитрогександиол-2, 5,
получение 225
Тетранитродиолы, получение 286
Тетранитродифенилртуть, получе-
получение 74
1,3,6,8-Тетранитрокарбазол, приме-
применение 29
Тетранитрометан, получение 298,300
Тетранитронафталин, получение 86
Тетранитронафталины, получение
и применение 44
1,1,1,2-Тетранитропропан, получе-
получение 287, 288
1,1,1,3-Тетранитропропан, получе-
получение 287
Тетранитроэтан, дикалиевая соль,
нитрование 288
Предметный указатель
483
Тетраоксинафталин, получение 345
N-TeTpaxnop-l ,2-диаминоэтан, по-
получение и нитрование 321
"Тетрахлорэтилен, нитрование 343
Тетраэтилсвинец, нитрование 304
Тиофен, нитрование 31, 64, 419,
421, 424
Толилнитрометан, получение 369
п-Толуидин, нитрование 435, 436
п-Толуиловая кислота, получение
37, 345
Толуол, нитрование 8, 15, 20—22,
33, 36, 40, 44, 49, 50, 71, 82,
84, 145 ел., 166, 180, 189,
236 ел., 252, 256—258, 277,
348,364сл.,396,398, 400, 403,
408,409,413,418,420,423—425
433, 443, 451, 458
азотной кислотой 258, 259
двуокисью азота 344
надазотистой кислотой 198
о-Толуолсульфанилид, нитрование
26
п-Толуолсульфокислота, нитрова-
нитрование 87
Триалкилизоксазолы,получение 219
Трибромавилин, нитрование 55
3,5,6-Трибром-2,4-динитротолуол,
получение 41
Трибромнитроаминобензол B,4,6-
трибромфенилнитрометан),
получение 55
2,3,5-Трибромтолуол, нитрование
41
Триизобутилен, нитрование 299
Триметилнитрометан,получение 413
2,2,4-Триметил-З-нитропентан
(втор: нитроизооктан), полу-
получение 248
2,2,4-Триметил-4-иитропентан, по-
лучеиие 393
2,2,4-Триметилпентан, нитрование
395
2,4,4-Триметилпентен-2, нитрова-
нитрование 342
2,2,4-Триметилпентанон-З, получе-
получение 248
Триметилэтилен, нитрование 296,
297, 340
1,3,5-Тринитробензол, получение
33, 84, 346
Тринитродигидроантрацен, получе-
получение 61
2,4,6-Тринитродиметиланилин, ни-
нитрование 359
2,4,-8-Тринитро-1,5-диметоксинаф-
талин, получение 58
2,4,6-Тринитродифениламин, полу-
получение 43
1' ,3,6-Тринитродурол,получение422
2,4,6-Трииитро-м-крезол, получе-
получение 355 ел., 375
Тринитро-м-ксилол, получение 38,
71, 92
2,3,5-Трииитро-и-ксилол, получе-
получение 38
Тринитромезитилен, получение 22,
236
Тринитрометан, получение 14,298—
300
2,4,6-Тринитрометиланилин, нитро-
нитрование 26
1,2,3-Тринитро-3-метилбутан,полу-
1,2,3-Тринитро-3-метилбутан,получение 248
1,3,8-Тринитронафталин, получе-
получение 351
Тринитронафталины, получение и
применение 44
Тринитрооксибензойная кислота
B,4,6-тринитро-3-оксибен8ой-
ная кислота), получение 70
2,2,4-Тринитропентан, получение
287
втор. Тринитропропиловый спирт,
получение 224
484
Предметный указатель
2,4,6-Тринитрорезорцин, получе-
получение 7, 8
Тринитроспирты, получение 224
Р-Тринитротолуол, получение 34
Т-Тринитротолуол, получение 34
2,4,6-Тринитротолуол, получение
33, 405
Трияитротолуолы, получение 33
2,4,6-Тринитро-2,2, 2-тринитро-
этилбензол, получение 287
4,4',4"-Тр1янв(тро1|рифеяиламин, по-
получение 57
Триннтрофенилэтиламины, получе-
получение 230
Тривитрофенол, получение 71
Тринитро-м-хлорфенол, получение
83
сими. Тринитроэтилбензол, полу-
получение 35
Тринитроэтиловый спирт, получе-
получение 224
Трифениламнн, нитрование 57
1,1,1-Трифтор-З-нитропропан, по-
получение 275
1,1,1-Трифторнйтроэтан, получе-
получение 275
1,1,1-Трифторпропан, нитрование
275
1,2,4-Трихлорбензол, нитрование
39, 180
2,4,6-Трихлордиметиланилин, нит-
нитрование 359
1,2,4-Трихлор-3,5-динитробензол,
получение 39
24
I,ppHpOOHO
ланилин, получение 359
Трициклен, нитрование 250
ТриЭтиламин как катализатор 294
Уксусная кислота
как растворитель при нитрова-
нитрований 178, 180
образование 248
Уксусный ангидрид как раствори-
растворитель при нитровании 178
Уретан, нитрование 178
Хинолин, нитрование 31, 46, 360
ел., 376, 423, 437
надазотистой кислотой 198
Хинон, нитрование 425
Хлор как катализатор 272 ел.
Хлорамин," получение и нитрование
330 ел.
м-Хлоранилин, нитрование 421
п-Хлоранилин, нитрование 421
1-Хлорантрацен, нитрование 346
м-Хлорацетанилид, нитрование 42
п-Хлорацетанилид, нитрование 56
Хлорбензол
как растворитель при нитрова-
нитровании 10, 20
нитрование 15, 20, 38 ел., 83,
84, 396, 400, 403, 405—408.,
433
надазотистой кислотой 198
З-Хлор-4-динитроацетанилид, полу-
получение 42
З-Хлор-^.б-динитроапетанилид1, по-
получение 42
Хлориды металлов как катализа-
катализаторы 405
Хлористый бензил, нитрование 53,
83
Хлористый водород ййй катали-
катализатор 325
Хлористый нитрил, нитрутощий
агент 447, 459
Хлористый цинк кйн катализатор
329
о-Хлоркарбоновая кислота, полу-
получение 289
Г-Хлор-1-метилнафталин, нитро-
нитрование 59, 425
6-Хлор-1-нафтойной кислоты мети-
метиловый эфир, нитрование 28
1-Хлор-2-метоксинафталин, нитро-
производные 27
Предметный ущаащель
4-Х,лрр-6-метокси-8-нитрохиналь-
дин, получение 48
¦4-Х лор-6-метоксихина льдин, нит-
нитрование 48
¦б-Хлор-1-нафтойная кислота, нит-
нитрование* 27
1Ч-Хлор-1^-нитроамин, получение
321
1-Хлор-9(или 10)-нитроантрацен,
получение 346
З-Хлор-4-нитроацетавилид, получе-
получение 42
З-Хлор-6-нитроацетанилид, получе-
получение 42
л-Хлорнитробензол, нитрование
164, 180
ЬСлорнитробензольг, нитрование
163, 164
Хлорнитрометан, получение 382
*-Хлорнитронафталин, получение
460
Хлорнитропарафины, получение
220
4-Хлор-2-нитротолуол, получение 21
4-Хлор-З-нитротолуол, получение
21
Хлорпикрин, получение 220, 425
п-Хлортолуол, нитрование 21
Хлортринцтрометан, получение 382
Хлорфенол, нитрование 85
Фенантрен, нитрование 15, 29, 45,
61, 85, 114 ел., 128, 158, 353,
374
Фенантренхинон, нитрование 29
fJ-Фенетиламин, получение 227
Фенетол,нитрование 9, 23, 198, 421
2-Фенилантрахинон, нитрование 164
Фенилдинитрометан, получение
256—258, 266, 377
нитрование 265—267
Фенилизонитрометан,получение 347
Фенилнитроизопропан, получение
24
¦Феиилнитрометан
нитрование 266 ел.
получение 9, 145, 236, 252, 258,
347, 365, 375, 377"
Фенилнитрометан
присоединение к нитростиль-
бену 292
1-Фенил-2-нитропиррол, получение
63
1-Фенил-3-нитропнррод,нитрование
63
Феиилнитропропан, получение 235
1-Фенил-2-нитропропен-1, гидриро-
гидрирование 227
а-Фенил-Р-нитроэтилрвый спирт,
эфиры, получение 291
Фенилпропиловый эфир, нитрова-
нитрование надазотистой кислотой 198
Фенилнитроэтан, получение 235
N-Фенилпирролидин, нитрование
63
Фенилтиазолы, нитрование 166
Фенилтринитрометан, получение
265
Фенилуксусная кислота, нитрова-
нитрование 24, 41, 437
2-Фенилэтилсульфоновая кислота,
нитрование 189
Фенол
конденсация с олефинами 447
нитрование 10, 19, 23, 69, 78 ел.,
85, 93 ел., 150, 154, 158, 162,
166, 347, 354 ел., 375, 420,
421, 423, 424, 433, 459
двуокисью азота 345
надазотистой кислотой 198
нитрозирование 100 ел.
Фенола сульфокислоты, нитрова-
нитрование 161
Фенхан, нитрование 13, 250
Флуорен, нитрование 62
Флуоренон, нитрование 29
Фталевый ангидрид, нитрование
41, 86, 87
Фторбензол, нитрование 39, 349
486
Предметный указатель
Фтористый бор как катализатор 9,
10, 86, 166 ел., 410, 446 ел.
1-Цнано-1,4-дифенил-1,3-бутаднен,
нитрование 343
1-Цнано-1,4-дифенил-3,4-динитро-
1-бутен, получение 343
Цианистый бензил, нитрование 8
Циклические предельные углево-
углеводороды, нитрование 238, 241
Циклогексан, нитрование 119, 251,
259, 260, 262, 341, 342, 383,
394 ел., 430
азотной кислотой 260 ел., 282
окислами азота 260 ел.
Циклогексанрл, получение 261
Циклогексан он, получение 261
Циклогексен, нитрование 300
Циклогексена псевдонитрозит,
образование 300
Циклогексилнитрит, получение 261
Циклогечсилнитроамин, получение
323
Циклопентадиен, нитрование 8, 418
Циклопентан, нитрование 430
Циклопропан, нитрование 396
Цимол, нитрование двуокисью азо-
азота 344
Этан, нитрование 268
Этилбензол, нитрование 24, 34-
-36,
49, 180, 235, 239, 240, 367 ел.,
375, 429
2-Этилгексен-1, нитрование 298
Этилен, нитрование 112, 124, 126,
298, 300, 341, 343^
двуокисью азота 309
механизм реакции ИЗ
Этилена окись, нитрование 342
Этилендиамин, нитрование 321
Этилен-N ,N '-динитроамин, получе-
получение 322, 323
Этилендинитромочевина, получе-
получение и гидролиз 323
Этиленгликоля нитрит-нитрат, по-
получение 112
Этиленмочевина (имидазолидон-2),
нитрование 323
N ,М'-Этиленоксамид, нитрование
324
Этилнитрат
как нитрующий агент 8, 121,
347, 417, 418
как растворитель при нитрова-
нитровании 146
получение 304
Этилен-бис-уретан, нитрование 324
Эфиры алифатические, нитрование
277
Эфиры ароматических о-оксикар-
боновых кислот, нитрование 53.
Эфиры фенолов, нитрование 19
ОГЛАВЛЕНИЕ
Введение 3
Литература 16
Глава первая. Нитрование ароматических н гетероциклических
соединений азотной кислотой н нитрующей смесью 19
§ 1. Нитрование азотной кислотой 20
§ 2. Нитрование смесью азотной и серной кислот 31
§ 3. Нитрование азотной кислотой в ледяной уксусной
кислоте или в уксусном ангидриде 49'
§ 4. Нитрование в присутствии катализаторов 68
§ 5. Каталитическое действие азотистой кислоты при ни-
нитровании 93
Литература 104
Глава вторая. Механизм нитрования ароматических соединений
азотной кислотой и нитрующей смесью 111
Литература 211
Глава третья. Нитрование предельных, зкирноароматических и
ненасыщенных углеводородов азотной кислотой 215
§ 1. Свойства нитропарафинов 215
§ 2. Получение мононитропарафинови нитросоединений жир-
ноароматического ряда 232
§ 3. Получение полинитропарафинов 282
§ 4. Свойства нитроолефинов 288
§ 5. Нитрование ненасыщенных углеводородов... . 296
Литература 312
Глава четвертая. Нитрование аминов 320
Литература 332
Глава пятая. Нитрование органических соединений окислами
азота 334
.А. Нитрованке окислами азота без катализаторов 334
I. Нитрование в жидкой фазе 336
I 1. Нитрование непредельных соединений 336
§ 2. Нитрование ароматических и гетероциклических со-
соединений . . . 344
Оглавление
II. Нитрование в газовой фазе 362
III. Нитрование ароматических соединений шггрозньши
газами 372
IV. Нитрование окислами азота жирноароматических и али-
алифатических углеводородов . 376
Б. Нитрование окислами азота в присутствии катализа-
катализаторов 396
Литература 414
Глава шестая. Нитрование органических соединений органическими
и неорганическими нитратами и хлористым нитридом . . 417
I. Нитрование органическими нитратами 417
II. Нитрование неорганическими нитратами 428
§ 1. Нитрование в присутствии А1С13 441
§ 2. Нитрование в присутствии FeCls и SiCl« 447
§ 3. Нитрование в присутствии BFS кШ
§ 4. Механизм нитрования ароматических соединения
неорганическими нитратами в присутствии активаторов
(AlCls и BFS) 46F
III. Нитрование хлористым нитрилом 459
Литература 460
Именной указатель -.-.... 462
Предметный указатель 467
4
Александр Васильевич Топчиев
Нитрование углеводородов
и других органических соединений
Утверждено к печати Отделением химических наук
Академия науж СССР
Редактор издательства Ю. Т. Стручков Технический редактор Е. Н. Симпищ:
РИСО АН СССР Л4 10-6В. Сдано в набор 7/1 1956 г. Подп. в печать 13/iy ,
Формат бум. 60Х921/». Печ. п. 30'/,. Уч.-иад. п. 25,3. Тираж 3*0. Й8Д. X
Т-02654 ЦенЛ 18 р. 70 к. Т«п. ЛИ.
Издательство Академия наук СССР. Москва, Подсосеионий пер., д. 31
2-я типография Издательства АН СССР. Москва, Шубинскни лер., д. 10 !
Опечатки и исправления
Страница
19
180
208
214
218
219
224
229
318
326
329
„
330
466
468
Строка
2 СВ.
2 св.
9 св.
ссылка
79
18 св.
7 сн.
1 сн.
5 св.
ссылка
192
6 св.
15 св.
20 св.
5 св.
1 сн.
21—22 св.
Напечатано
НИТРИРОВАНИЕ
и бензолсульфоновой
кислот
Томменсона
A954)
+ H2SO2
СН — С N
\ /
О
NO2
Ati кислота
1
NO2
\
С
R' NO2
J. Am. Chem. Soc, 73
хлористого ацетила
хлористого ацетила
хлористый ацетил
хлористый ацетил
Якубович А. И.
Бензолсульфоновая кис-
кислота, нитрование 180
Должно быть
НИТРОВАНИЕ
кислоты и бензолсульфо-
КИСЛОТ
Томлинсона
A953)
+ H2SO4
CHs — С N
\ /
О
NO2
1 кислота
N0.2
R
С
R' NO2
J. Am. Chem. Soc., 75
хлорацетата
хлорацетата
хлорацетат
хлорацетат
Якубович А. Я.
исключить
А. В. Топчиев
A.B. ТОПЧИЕВ
НИТРОВАНИЕ
УГЛЕВОДОРОДОВ
И ДРУГИХ
ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ