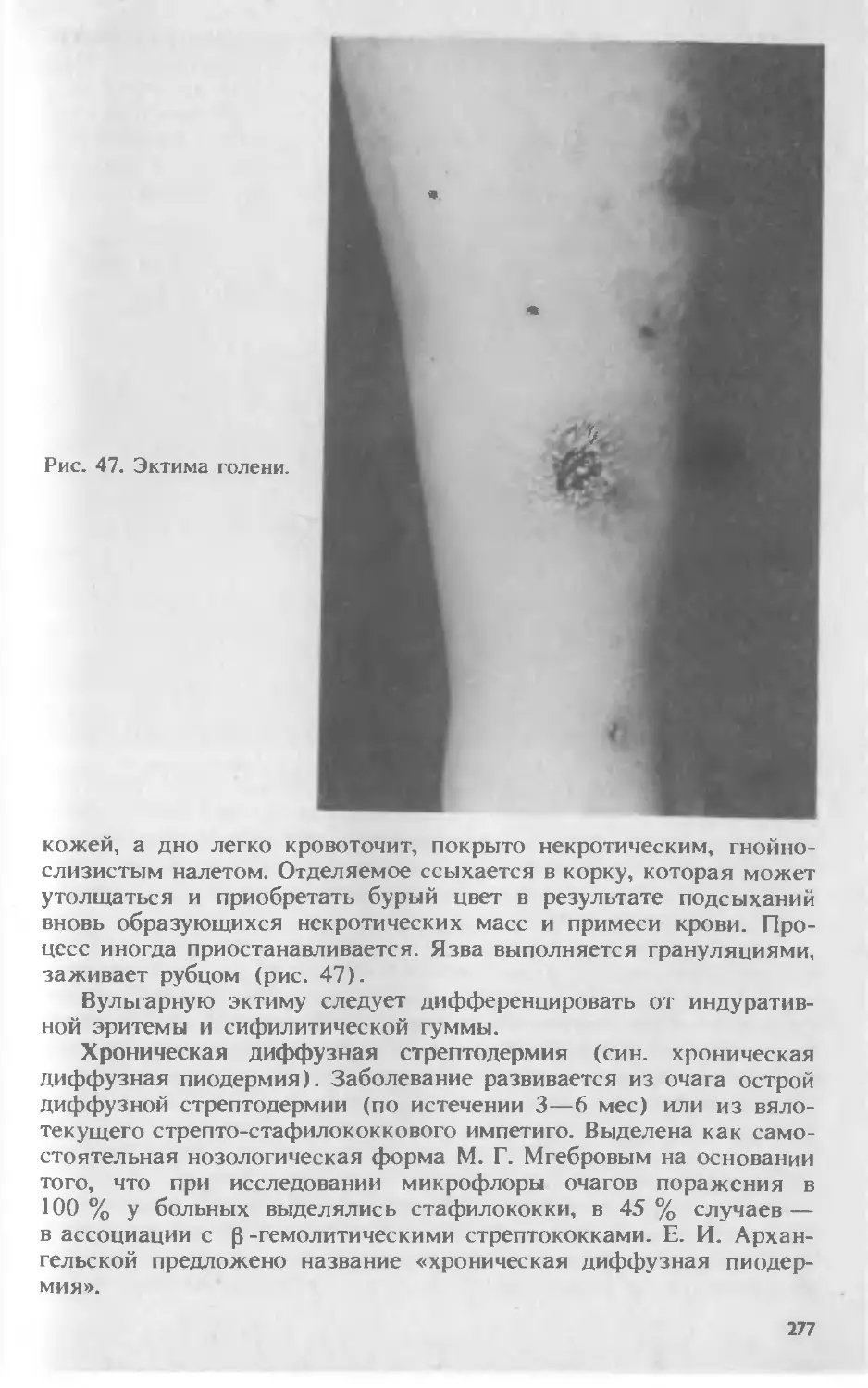
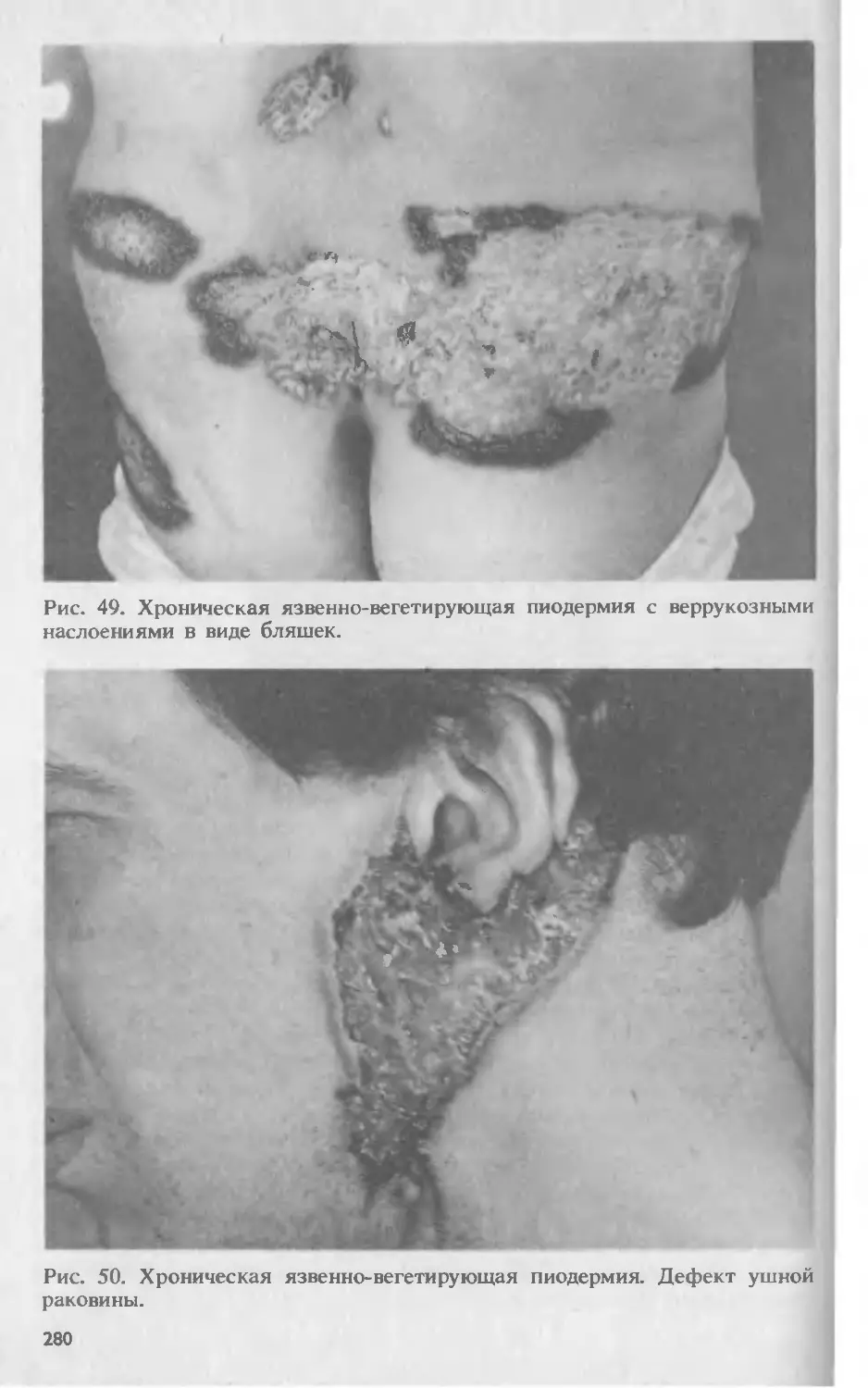
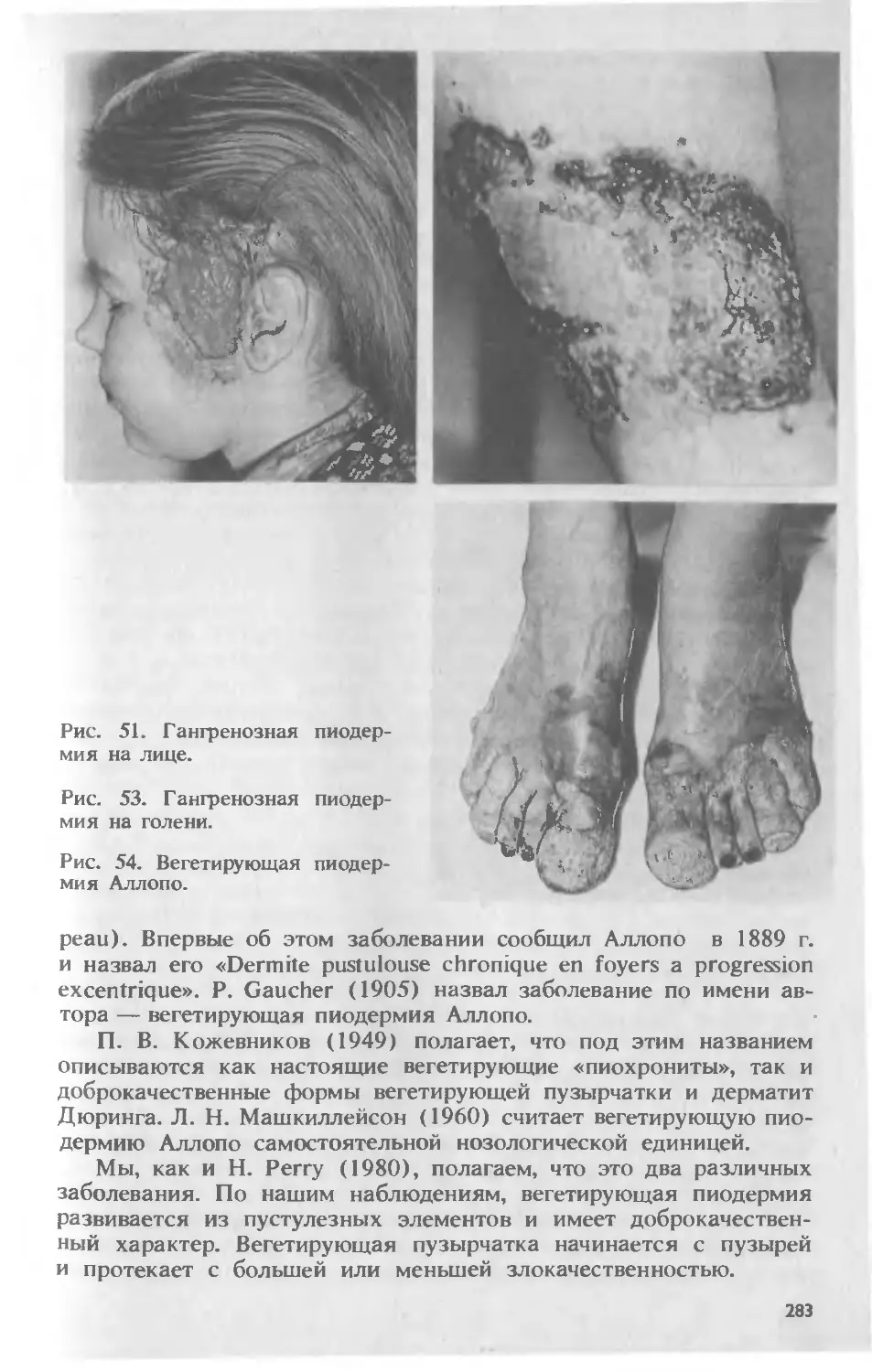
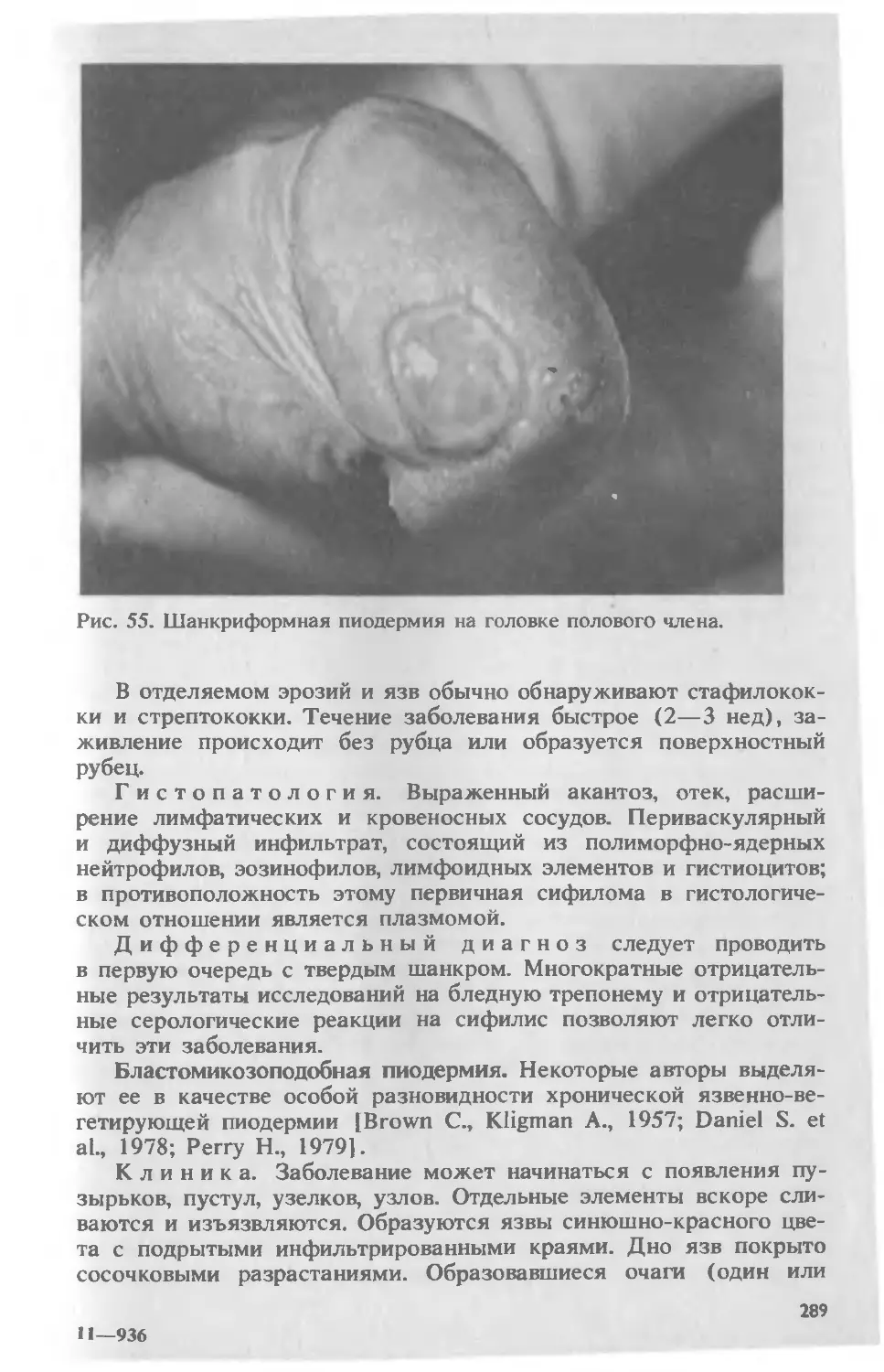
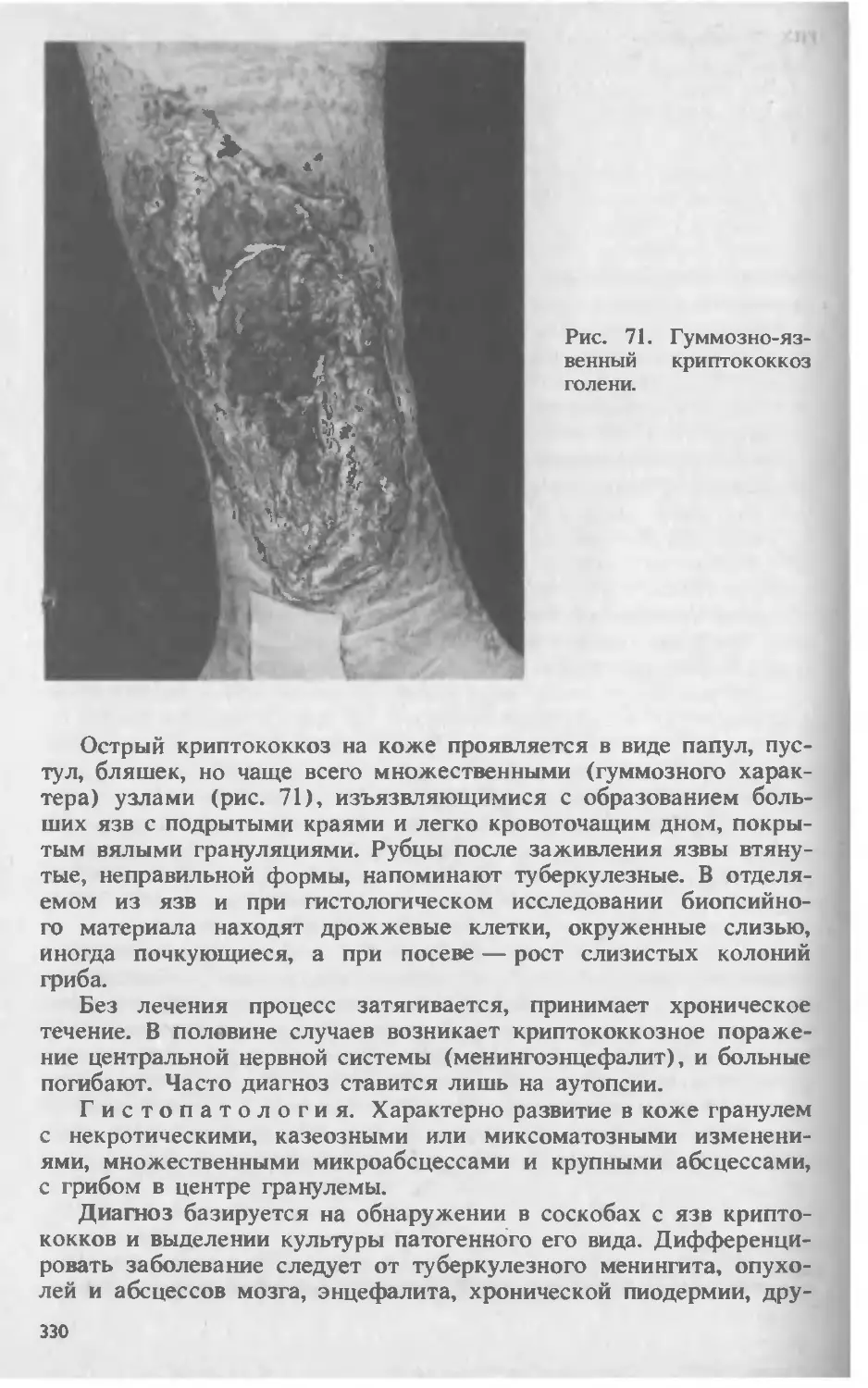
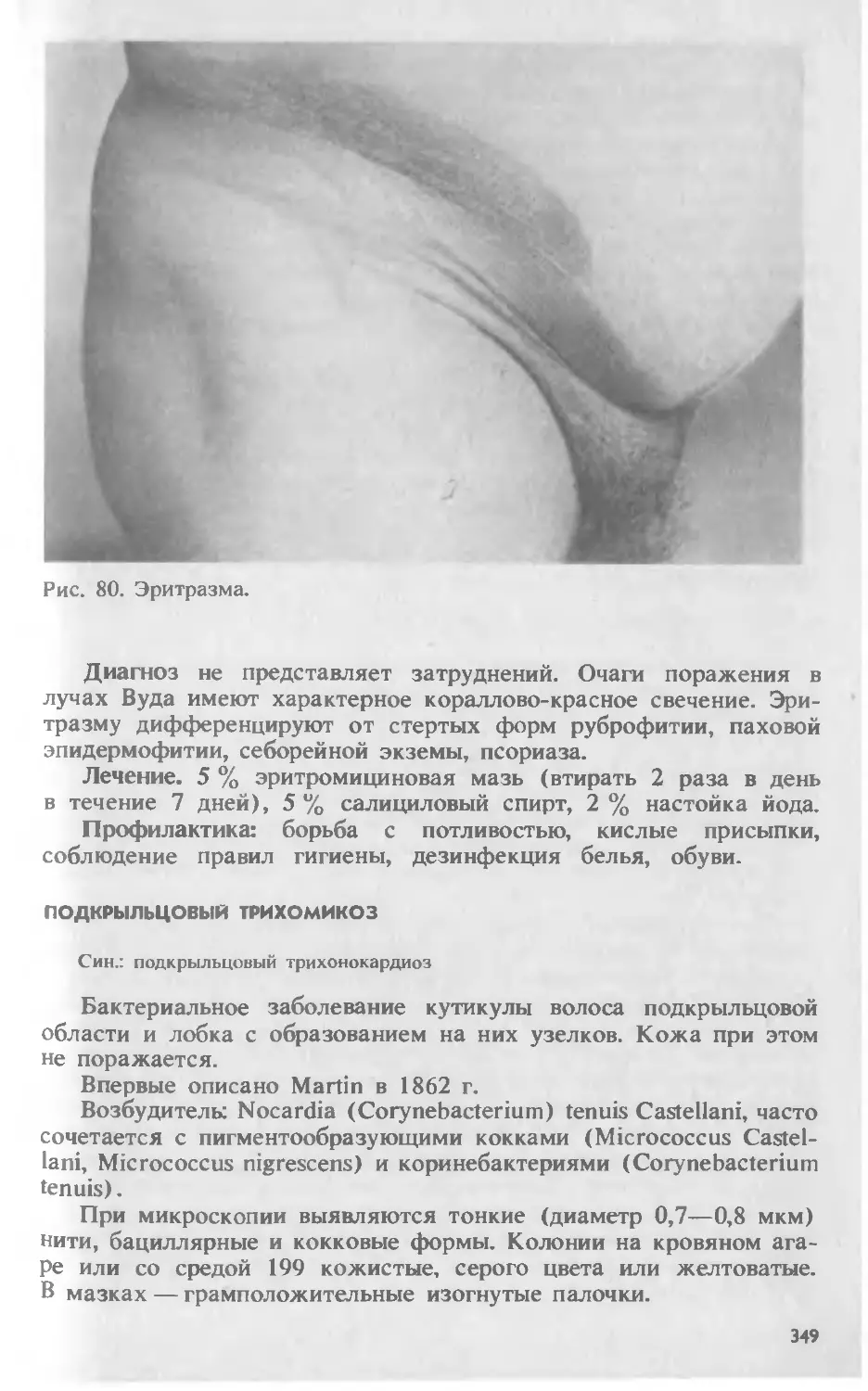
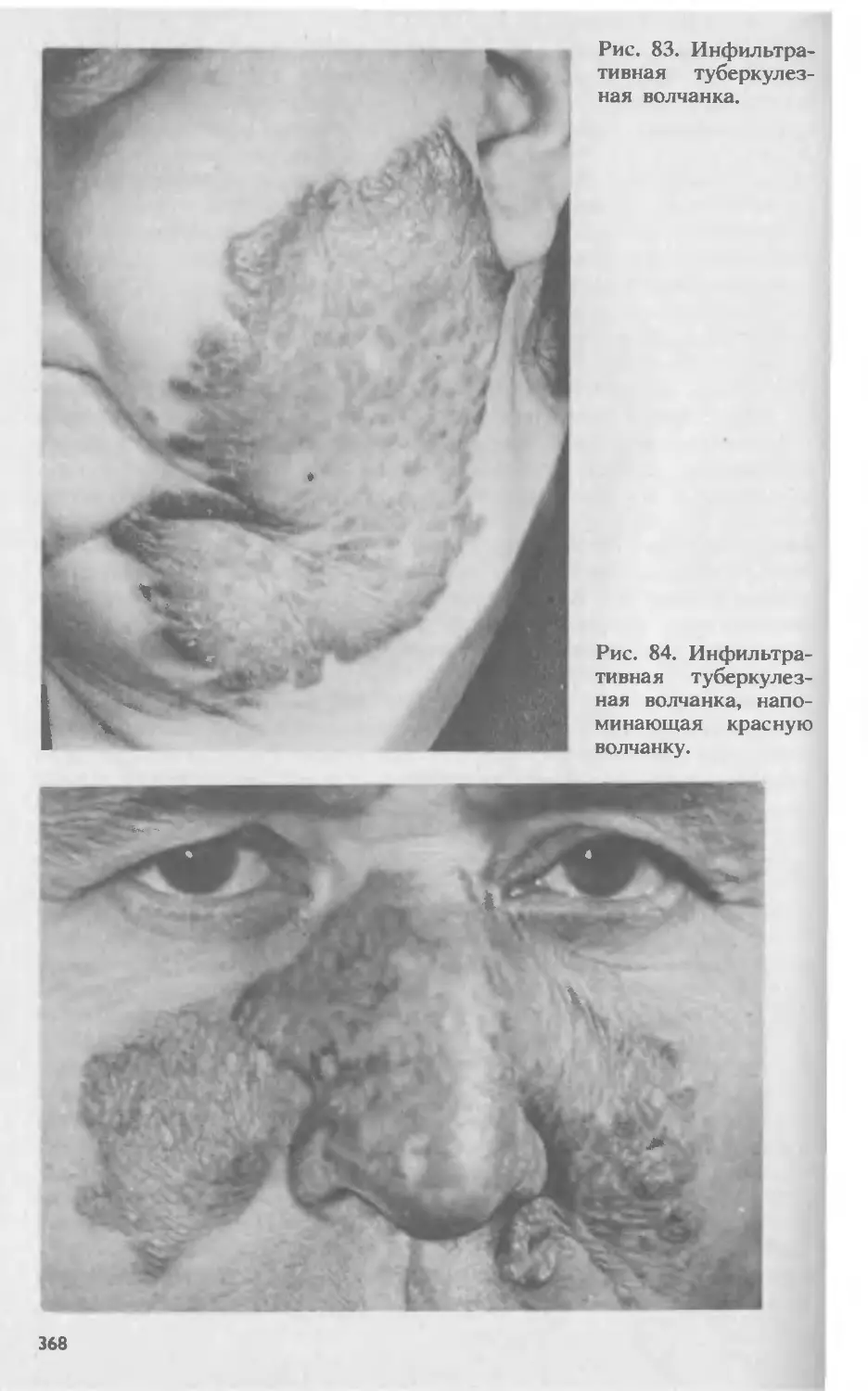
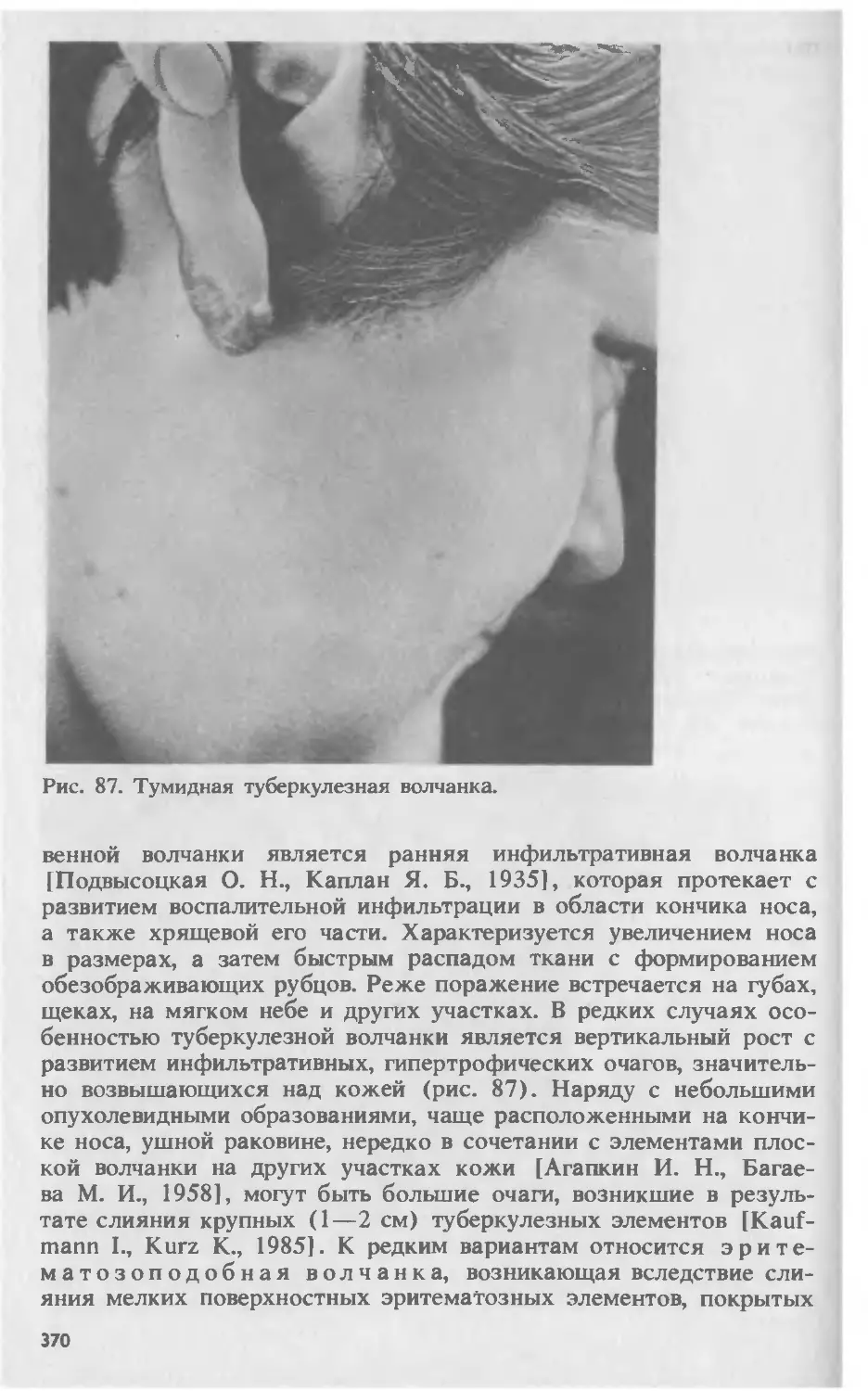
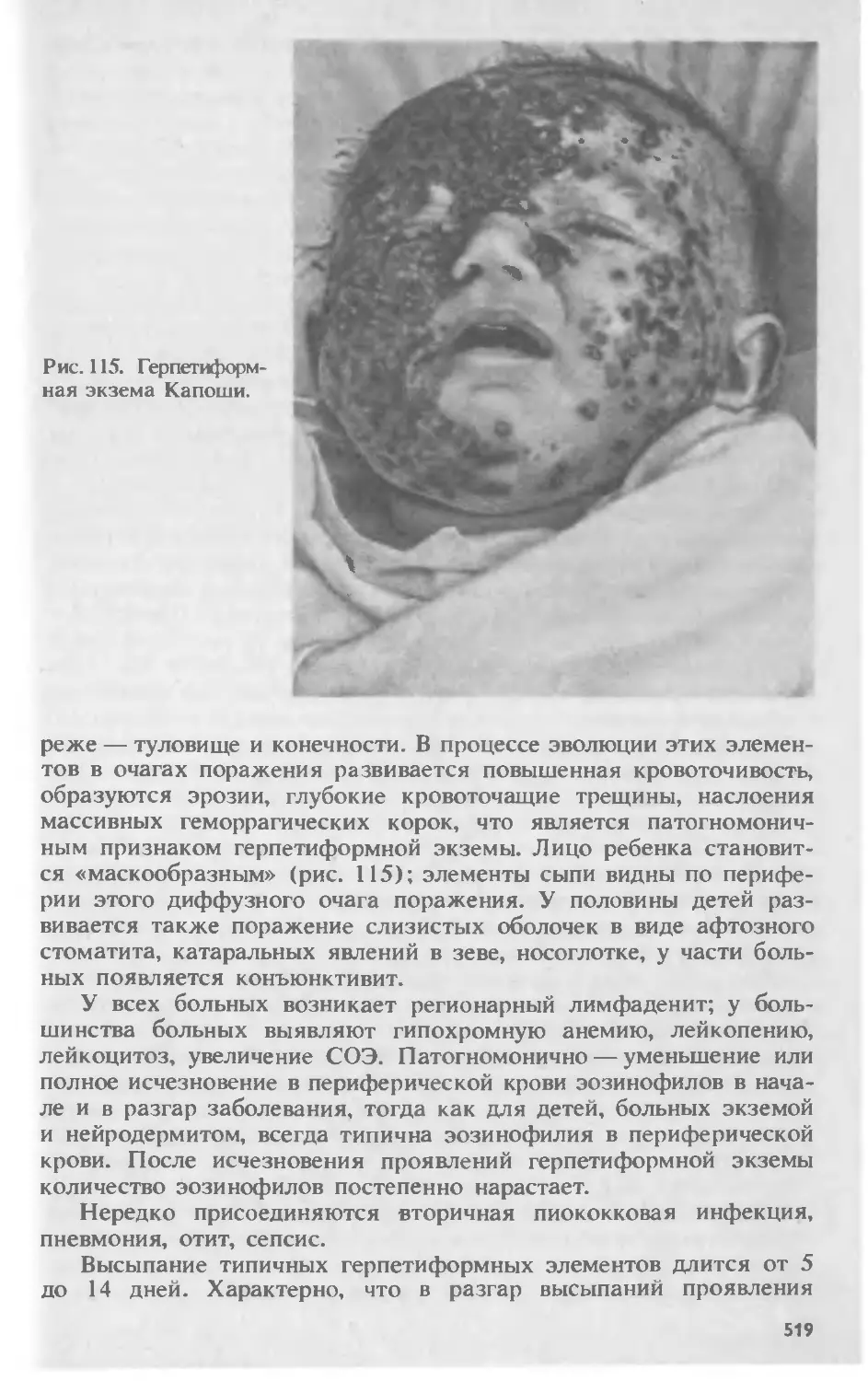
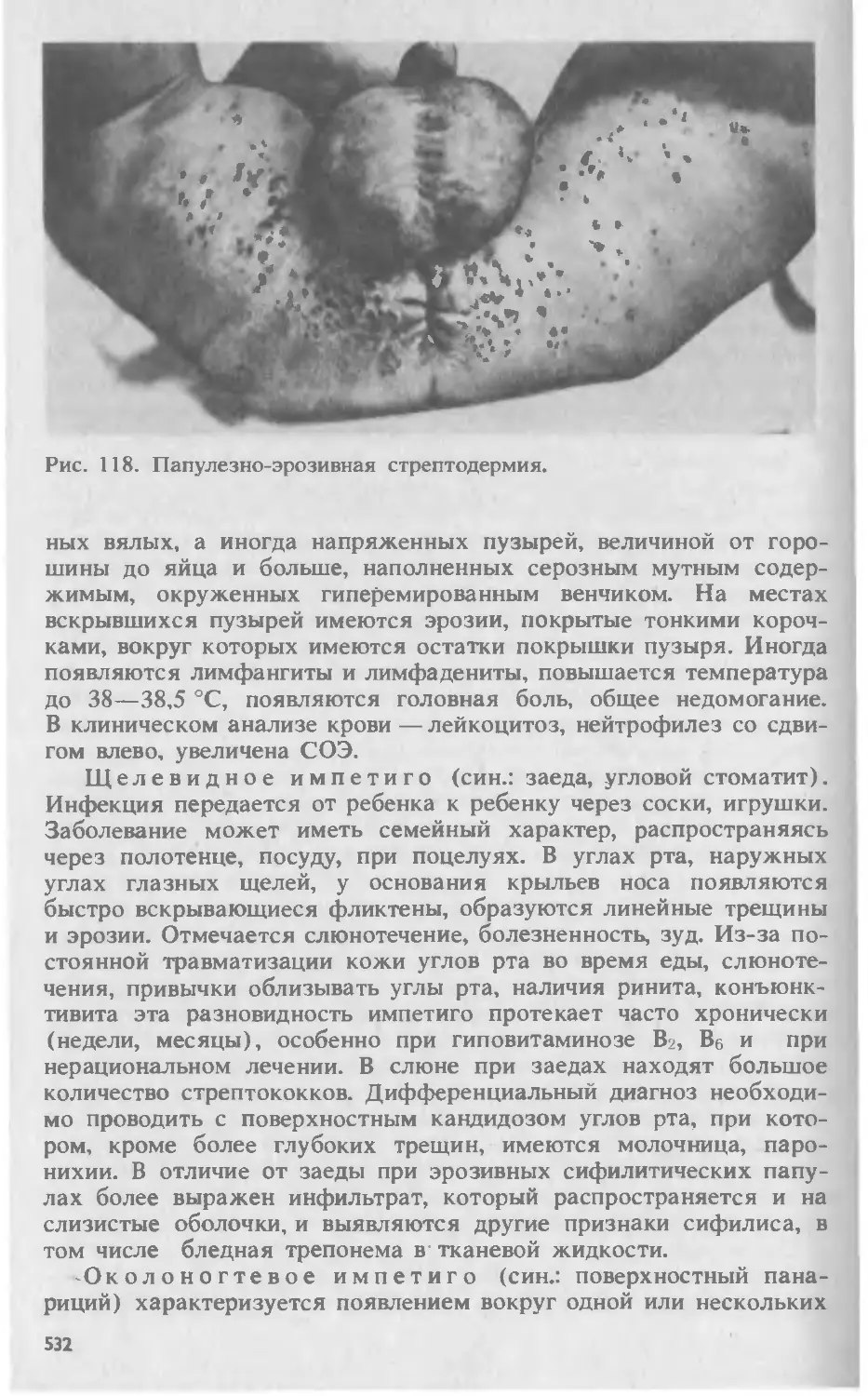
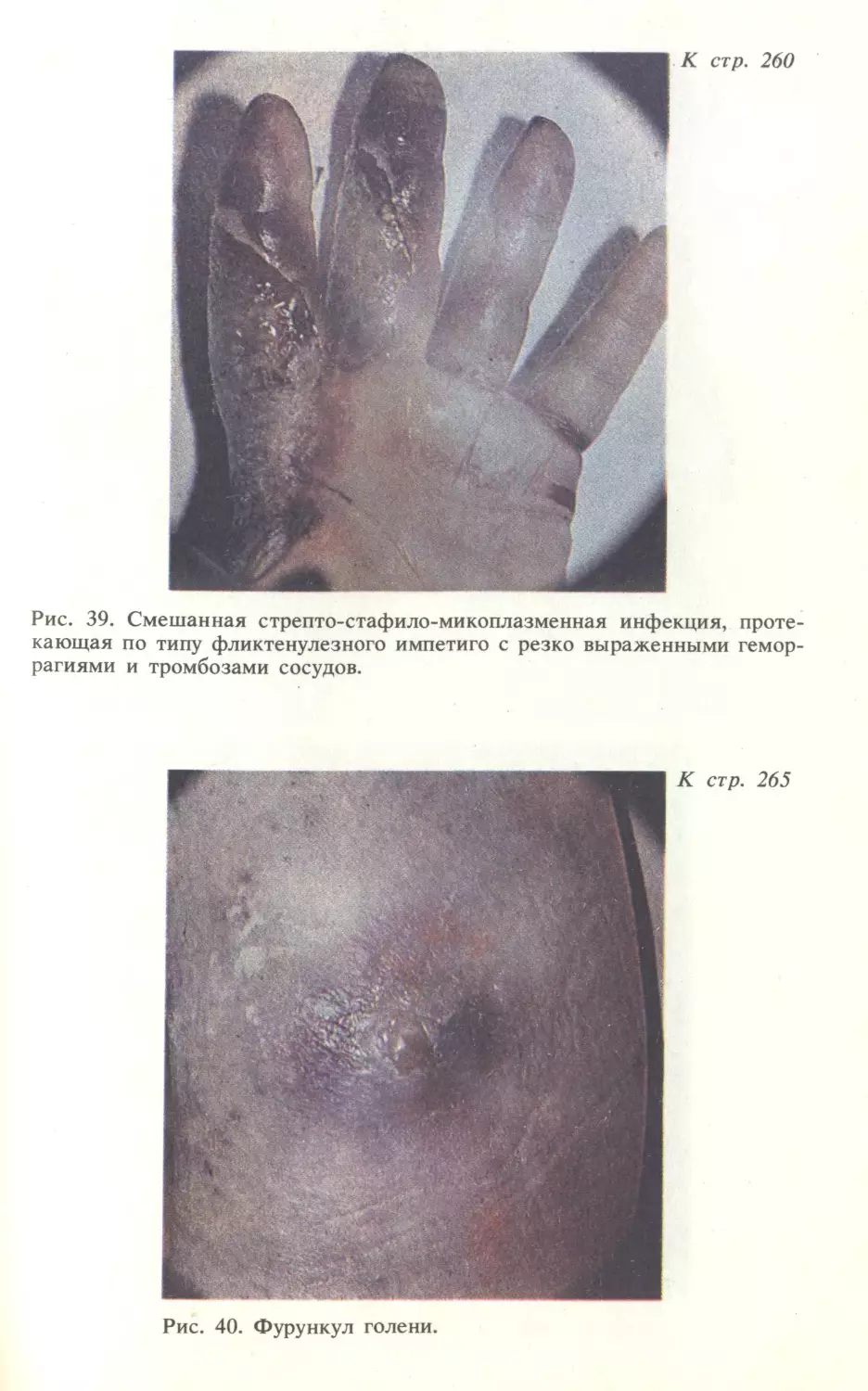
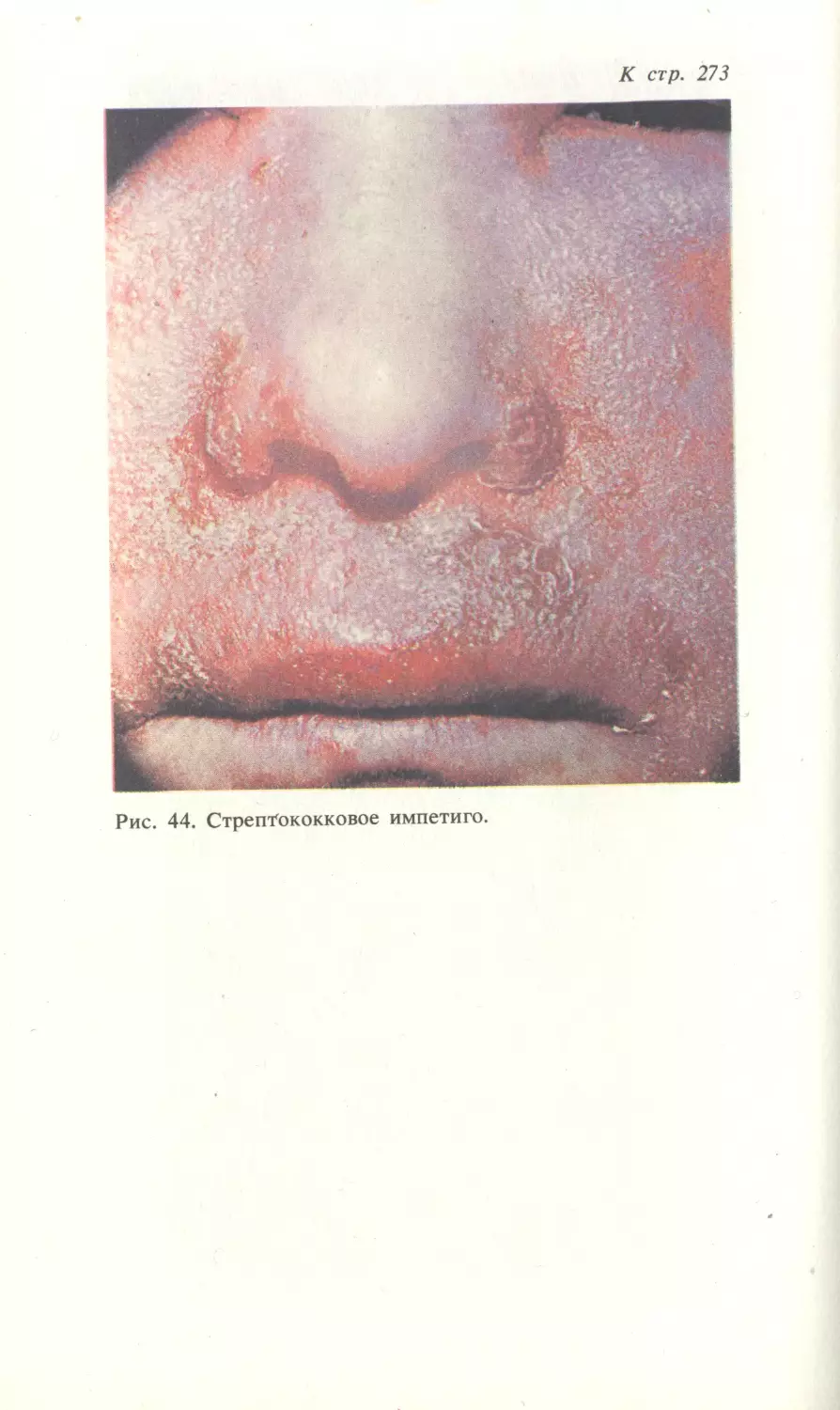
Автор: Скрипкина Ю.К.
Теги: кожа наружные покровы тела дерматология кожные болезни венерология медицина практическая медицина руководство для врачей издательство медицина
ISBN: 5-225-02856-Х
Год: 1995
РУКОВОДСТВО
Под редакцией \ хйёт
Ю.К.Скрипкина 'хх /
КОЖНЫЕ
И ВЕНЕРИЧЕСКИЕ
БОЛЕЗНИ
Том1
’МЕДИЦИНА»
ББК 55.8
K58
УДК 616.5 4-616.97
Редакционная коллегия:
проф. Б. А. Беренбейн , проф. В. Н. Мордовцев,
акад. РАМН Ю. К. Скрипкин,___
акад. АМН СССР |о. К. Шапошников
Рецензент: профессор Т. А. Г ла винская
Кожные и венерические болезни. Руководство для врачей
К58 в 4-х т. — Т. 1 /Под ред. Ю. К. Скрипкина. — М.: Медици-
на, 1995. — 576 с.: ил. [8] л. ил.
ISBN 5-225-02856-Х
В первый том руководства включены важные разделы дерматологии:
история науки, вопросы анатомии, физиологии, общей патологии, диагно-
стики, принципы лечения кожных болезней. Имеются сведения о гнойнич-
ковых, паразитарных, грибковых, вирусных и других дерматозах.
Для дерматовенерологов, терапевтов, педиатров, онкологов
К
4108090000—52
039(01)—95
Без объявл.
ББК 55.8
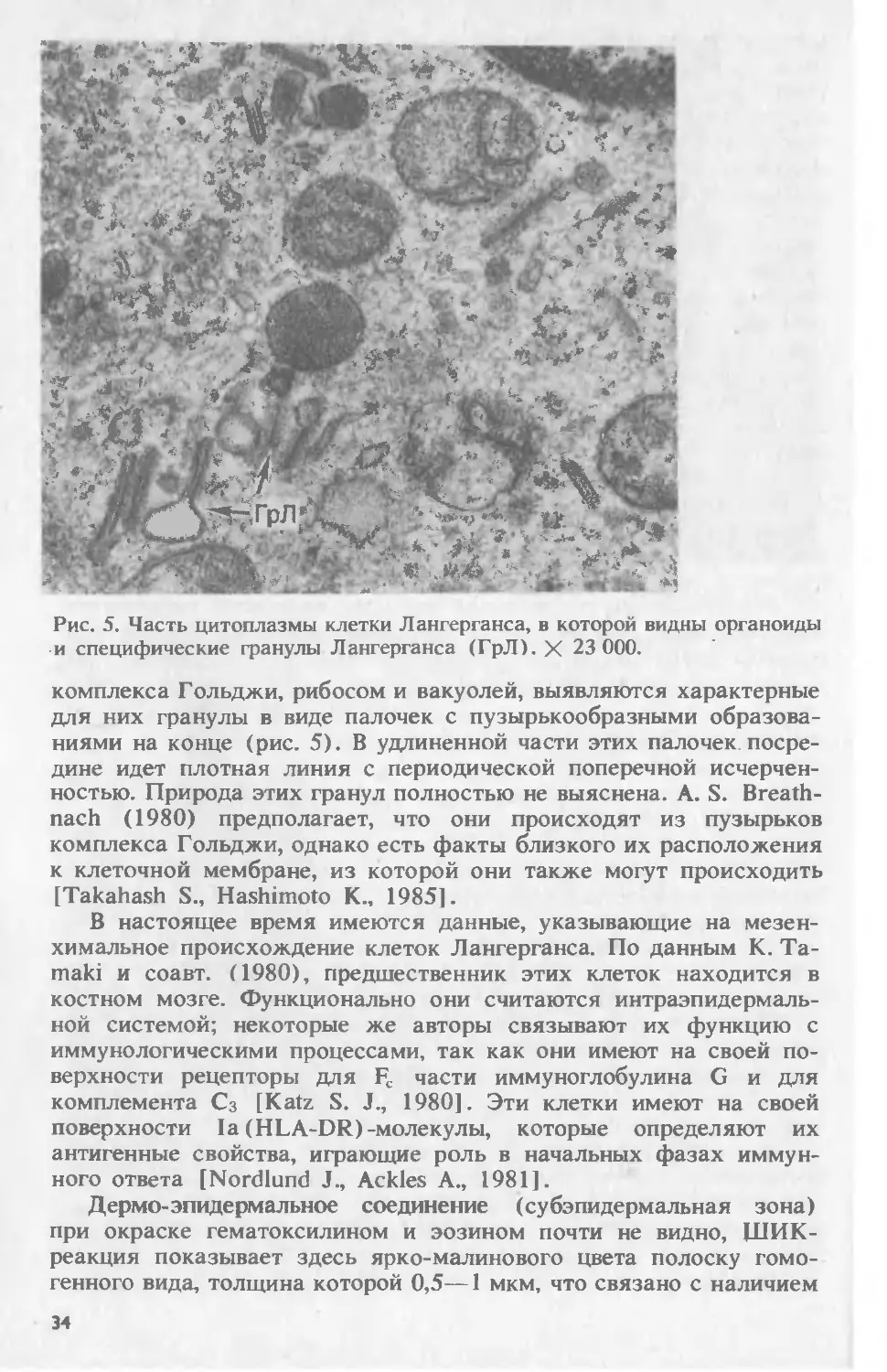
ISBN 5-225-02856-Х
© Коллектив авторов, Москва, 1995
предисловие
Прошло почти 30 лет с момента выхода в свет многотомного
руководства по дерматовенерологии. За эти годы достигнуты
значительные успехи в развитии таких фундаментальных наук,
как иммунология, генетика, микробиология, молекулярная био-
логия. С помощью иммунологических методов исследования
появилась возможность диагностирования целого ряда кожных
заболеваний на ранних этапах их развития (пузырные заболева-
ния, болезни соединительной ткани, злокачественные лимфомы
кожи и др.), доказано наследственное происхождение некоторых
дерматозов, установлена роль вирусов папилломы человека в раз-
витии ряда новообразований кожи, доказана роль хламидий и
микоплазмы в развитии заболеваний, передающихся половым
путем. Дальнейшее развитие получила фармакологическая про-
мышленность, создавшая целый ряд новых лекарственных препа-
ратов (антибиотики, цитостатики, десенсибилизирующие и имму-
нокорригирующие препараты), нашедших широкое применение в
дерматологической практике. Вот почему назрела необходимость
обобщить новые данные, касающиеся клиники, патогенеза, диагно-
стики и лечения кожных и венерических заболеваний с тем, чтобы
они стали достоянием широкого круга врачей-дерматовенерологов
и научных работников.
Большое внимание в руководстве уделяется современной орга-
низации дерматовенерологической службы, методам диспансериза-
ции больных, профилактике кожных заболеваний.
Хорошо известно, что кожные болезни тесно связаны с изме-
нением целого ряда функциональных систем организма, состоя-
нием внутренних органов. Поэтому во многих случаях кожные
изменения являются одним из ранних симптомов поражения внут-
ренних органов (желудочно-кишечный тракт, эндокринная систе-
ма, органы кроветворения, а также злокачественные новообразо-
вания).
Издание 4-томного руководства по кожным и венерическим
болезням является коллективным трудом ведущих ученых нашей
страны. В нем отражены последние достижения в диагностике,
патогенезе, лечении и профилактике различных дерматозов и забо-
леваний, передающихся половым путем.
Ограниченный объем руководства не позволил включить в него
все многообразие кожной патологии и многочисленные сведения
по смежным проблемам медицины. Вместе с тем в первых трех
3
томах, посвященных проблемам дерматологии, изложены с совре-
менных позиций вопросы клиники, патогенеза, диагностики, диф-
ференциальной диагностики и лечения более 500 нозологических
форм дерматозов и синдромов с поражением кожи. Учитывая то,
что издательством «Медицина» выпущено второе издание ру-
ководства «Венерические болезни» под редакцией академика
АМН СССР профессора О. К. Шапошникова, мы сочли целесооб-
разным в четвертом томе, посвященном венерическим заболева-
ниям, изложить лишь наиболее важные достижения в этой обла-
сти, подчеркнув особенности клиники, патогенеза и лечения забо-
леваний, передающихся половым путем.
В основу систематизации дерматозов положен этиопатогене-
тический принцип (паразитарные, микробные, вирусные дермато-
зы, туберкулез кожи, лепра и т. д.). В тех случаях, когда этиология
заболевания не известна, дерматозы объединяются по сходным
клинико-морфологическим изменениям или патогенетическим ме-
ханизмам (например, болезни соединительной ткани, пузырные
дерматозы, лихены и др.).
Руководство призвано, с одной стороны, повысить профессио-
нальный уровень врачей, а с другой — улучшить качество диаг-
ностики и лечения больных, страдающих кожными и венериче-
скими болезнями. Оно рассчитано на врачей-дерматовенерологов.
Однако целый ряд проблем, поднятых в настоящем руководстве,
несомненно заинтересует педиатров, терапевтов, генетиков, патоло-
гоанатомов, онкологов и других специалистов.
Коллектив авторов понимает, что при выполнении такой трудо-
емкой работы нельзя было избежать некоторых недочетов. Поэто-
му все замечания и пожелания читателей будут приняты с благо-
дарностью.
Академик РАМН
профессор Ю. К. Скрипкин
Глава 1
ИЗ ИСТОРИИ РАЗВИТИЯ ДЕРМАТОЛОГИИ
И ВЕНЕРОЛОГИИ
Развитие дерматологии и венерологии тесно связано с развити-
ем естествознания, а следовательно, и развитием общества — его
производительных сил, производственных отношений, с особенно-
стями мышления, свойственными каждой эпохе, что позволяет
рассматривать историю развития дерматовенерологии поэтапно.
Первый этап относится к периоду становления рабовла-
дельческого общества. Первобытный человек несомненно реагиро-
вал на зуд, возникающий при различных патологических процес-
сах, замечал, что одни травы успокаивают, а другие усиливают
его. От поколения к поколению накапливались результаты наблю-
дений за течением различных кожных заболеваний, использова-
нием методов лечения. Постепенно лечением больных начали
заниматься жрецы.
С появлением письменности накопленный опыт стали отражать
в соответствующих медицинских трактатах. В Китае в III—II ты-
сячелетиях до н. э. появились описания некоторых дермато-
зов — чесотки, почесухи, фурункула, карбункула, рожистого вос-
паления, фавуса, ихтиоза, экземы, облысения, витилиго и др., со-
общалось о методах лечения этих заболеваний.
В древних медицинских индийских трактатах (2000—700 лет
до н. э.) обстоятельно описаны многие кожные болезни, свыше
700 лекарственных растений, предназначенных для их лечения,
более 40 средств лечения крапивницы. Большое число гигиениче-
ских рекомендаций по уходу за кожей приводится в египетских
папирусах (2000—1000 лет до н. э.).
В период развития рабовладельческого общества представи-
тели медицины большое внимание уделяли удовлетворению запро-
сов господствующего класса, в частности вопросам косметики.
Изучением дерматологии занимались в Древней Греции и
Древнем Риме. Самый выдающийся из греческих врачей Гиппо-
крат (460—377 гг. до н. э.) является основоположником научной
медицины. Он обобщил собственные и систематизировал извест-
ные до него сведения о кожных заболеваниях, описал лепру,
паршу, чесотку, алопецию, герпес и другие дерматозы (всего более
40 нозологических форм). Гиппократ впервые обратил внимание
на связь заболеваний кожи с изменениями внутренних органов,
неблагоприятным влиянием факторов внешней среды.
Большое внимание изучению заболеваний кожи уделяли рим-
ские врачи. Так, например, Цельз (35 лет до н. э. — 50 лет н. э.)
5
описал фурункул, карбункул, инфильтративно-нагноительную три-
хофитию, псориаз, рожистое воспаление; рекомендовал при лече-
нии дерматозов применять солнечное облучение, тепло, физиче-
ские упражнения. Его последователь Гален (II век н. э.) класси-
фицировал кожные болезни по их локализации — заболевания
головы, рук, ног и т. д.
Второй этап в развитии медицины, в частности дермато-
логии, относится к периоду средневековья (с 300-х годов до вто-
рой половины XVI века). На смену рабовладельческой формации
в европейских странах приходит феодальный строй. Центр изуче-
ния медицины перемещается в арабские страны.
Изучению кожных болезней большое внимание уделял выдаю-
щийся ученый Ибн Сина (Авиценна), который прожил часть
своей жизни в Узбекистане, в Бухаре. Он описал пузырчатку,
ришту, лейшманиоз, крапивницу, умел дифференцировать лепру от
слоновости, почесуху от чесотки, занимался вопросами косметики,
уделял большое взимание лечебной практике.
Третий этап в развитии медицины, в частности дермато-
логии, начинается со второй половины XVI века; он связан с
распадом феодального общества, уступившего место капиталисти-
ческой социально-экономической формации. В этот период разви-
ваются естествознание, физика, химия, медицинские науки, осо-
бенно анатомия и физиология, появляются врачи, хорошо знаю-
щие заболевания кожного покрова (Парацельс, Фаллопий и др.).
В 1671 г. выходит в свет первое руководство по кожным болезням,
написанное итальянским врачом Heronimus Mercurialis. Однако
как самостоятельная наука дерматология выделяется лишь в
XVIII веке, причем на первый план выступает морфологическое
направление, что диктуется необходимостью систематизации, уни-
фикации описания и трактовки проявлений дерматозов — морфо-
логических элементов сыпи.
КРАТКИЕ ДАННЫЕ
О ЗАРУБЕЖНЫХ ДЕРМАТОЛОГИЧЕСКИХ ШКОЛАХ
В XVIII веке формируется английская научная дерматологиче-
ская школа, основанная Willan (1757—1812), Bateman (1778—
1821), имеющая морфологическое направление. Используя ботани-
ческий принцип систематики, Plenck (1738—1807) предложил
классификацию болезней кожи с учетом особенностей проявлений
сыпи: пятен, узелков, пузырьков, корочек и т. д. Это позволило
унифицировать описание симптомов кожных болезней, уточнить
дерматологическую терминологию, что способствовало взаимопо-
ниманию дерматологов разных стран. В последующем английская
дерматологическая школа была представлена многими выдающи-
мися учеными. Так, Wilson (1809—1884) создал ряд монографий
и руководств для врачей по дерматологии, изучал красный плоский
лишай; Hutchinson (1828—1913) описал триаду симптомов при
6
позднем врожденном сифилисе, язвенную форму индуративной
эритемы и др.
Однако морфологическое направление, обеспечившее развитие
дерматологии на первом этапе, не могло способствовать дальней-
шему прогрессу науки. Без достаточного обобщения наблюдений,
выявления связи между поражением кожи и состоянием организ-
ма больного, изучения этиологии и патогенеза кожных заболева-
ний не представлялось возможным дальнейшее развитие дермато-
логии.
Такое направление в изучении кожных болезней впервые
появилось во французской дерматологической школе. Ее осново-
положник Alibert (1766—1837) в начале XIX века возглавлял
дерматологическое отделение в госпитале Св. Людовика в Париже.
Он считал, что возникновение тех или иных дерматозов связано
с общими расстройствами организма больного. Alibert издал
руководство для врачей и атлас по заболеваниям кожи, подробно
описал туберкулезную волчанку, келоид и другие дерматозы,
впервые предложил такие термины, как «дерматоз», «сифилид».
Он создал крупную дерматологическую школу, представленную
такими известными дерматологами, как Biett (1781 —1840),
Cazenave (1795—1877), Bazin (1807—1878), Gibert (1797—
1866), Devergie (1798—1879), Vidal (1825—1893), Besnier (1831 —
1909). Постепенно в дерматологии стали использовать биохими-
ческие методы исследования, изучалась роль эндокринной системы
в патогенезе заболеваний кожи.
В 80-е годы XIX века, опираясь на работы Пастера и его
учеников, обстоятельно изучают инфекционные дерматозы, вклю-
чая грибковые заболевания кожи, реактивность организма боль-
ных, аллергические механизмы патогенеза кожных заболеваний.
В дальнейшем французскую дерматологическую школу представ-
ляли такие известные ученые, как Brocq, Pautrier, Gougerot, Tou-
raine, Civatte, Darier, Degos, Graciansky и др.
В середине XIX века в Вене появляется новая дерматологиче-
ская школа, представители которой не разделяли взглядов фран-
цузских дерматологов на роль конституции в патогенезе дермато-
зов и связь кожных заболеваний с состоянием внутренних органов
и различных физиологических систем организма больного. Осново-
положник немецкой дерматологической школы Hebra (1816—
1880) строил свои концепции с учетом исследований патолого-
анатома Virchow (1821 —1902), уделял большое внимание гистоло-
гическим исследованиям в дерматологии. Кроме того, его деятель-
ность совпала с бурным развитием промышленности. Hebra за-
нялся изучением влияния факторов внешней среды, в частности
профессиональных вредностей, на развитие патологических изме-
нений кожи. Это новое направление в последующем широко
развивается. Так, Kaposi (1837—1902) создает целый ряд руко-
водств и атласов по кожным и венерическим болезням, описывает
такие дерматозы, как пигментная ксеродерма, идиопатическая
геморрагическая саркома, варицеллиформная детская экзема и др.
7
Немецкие дерматологи изучали аллергические механизмы па-
тогенеза дерматозов (Jadassohn, Bloch), вирусную этиологию забо-
леваний кожи (Lipschutz), недержание пигмента (Sulzberger,
Bloch), липоидный некробиоз (Urbach) и др.
Наряду с указанными выше дерматологическими школами, воз-
никшими в Англии, Франции, Германии, во второй половине
XIX века центры по изучению заболеваний кожи появляются и в
других странах. Так, например, в США Duhring издал руководство
по кожным болезням, в котором описал герпетиформный дерма-
тоз; Mitchel описал эритромелалгию, Meige — трофедему, Osler —
наследственный геморрагический ангиоматоз, Schamberg — пиг-
ментный дерматоз голеней и др. Дерматологи США изучали фи-
зиологию и биохимию кожи, профессиональные и вирусные дер-
матозы, глубокие формы дерматофитий.
Большой вклад в развитие учения о болезнях кожи внесли
итальянские дерматологи (Majocchi, Mibelli), швейцарские
(Mischer, Lutz), скандинавские (Boeck, Schaumann).
На современном этапе развитие дерматологии в капиталисти-
ческих странах характеризуется стремлением к детализации
морфологических особенностей дерматозов, описанию новых мно-
гообразных синдромов, включающих и поражения кожи, к иссле-
дованию морфологических, биохимических, иммунологических,
генетических сдвигов на субклеточном уровне. Пересматривается
подход к сложной проблеме пролиферативных поражений лим-
фоидной ткани, уделяется большое внимание системным пораже-
ниям соединительной ткани.
Существенный вклад в развитие дерматологии внесли польские
ученые, уделявшие большое внимание диагностике дерматозов,
изучению функциональных методов исследования при кожных
заболеваниях. В настоящее время в Польше проводятся исследо-
вания иммунологических изменений при различных заболеваниях
кожи, особенно при пузырных дерматозах (Jablonska). Чехо-
словацкие дерматологи (Kreibich, Konopik) занимаются углублен-
ным изучением аллергических реакций и обменных нарушений
при тяжелых кожных заболеваниях. В центре внимания болгар-
ских дерматологов (Попов Л. X., Попхристов П. К. и др.) посто-
янно находились проблемы профессиональных дерматозов, тубер-
кулеза кожи, детских дерматозов. Изданные здесь руководства
по кожным болезням были переведены на русский язык. На высо-
ком научном уровне находятся исследования в области дерматоло-
гии в Германии. Венгерские дерматологи занимаются углублен-
ным изучением аллергии в патогенезе заболеваний кожи (Rajka),
клиникой, диагностикой, терапией опухолевых процессов (Venkei
Sugar). Вопросам микологии, дерматоонкологии, биологическим
методам лечения уделяют внимание румынские дерматологи
(Nicolau). Проблемами клинической дерматологии, патогистоло-
гии кожи занимается югославский дерматолог Kogoj.
Анализу и обсуждению результатов исследований, оценке эф-
фективности новых методов диагностики и терапии, рассмотрению
8
новых аспектов патогенеза дерматозов, выбору основных направ-
лений дальнейших исследований были посвящены международ-
ные конгрессы дерматологов, которые проводятся с 1889 г. Первый
из них состоялся в Париже (1889), 13-й — в Мюнхене (1967),
14-й — в Милане (1972), 15-й — в Мехико (1977), 16-й — в То-
кио (1982), 17-й — в Берлине (1987). Наряду с этим проводятся
тематические международные конференции, симпозиумы, посвя-
щенные актуальным проблемам дерматовенерологии, в частности
дерматомикозам, профессиональным дерматозам, хламидийной ин-
фекции и др.
РАЗВИТИЕ ДЕРМАТОЛОГИИ В РОССИИ
В России дерматология как медицинская специальность была
выделена лишь в 80-е годы XIX века. До этого периода она явля-
лась частью общей медицины, а лечением кожных и венерических
болезней занимались врачи общего профиля. В университетах
студенты не изучали подробно кожные болезни; отдельные лекции
читали преподаватели различных кафедр. В частности, в Петер-
бургской медико-хирургической академии курс кожных болезней
с 1827 г. читал фармаколог И. Ф. Калинский. Сведения о кожных
и венерических болезнях сообщали студентам в процессе изуче-
ния хирургии. Некоторые вопросы физиологии кожи (рефлексы
кожных сосудов, рефлекторное потоотделение) были включены в
лекционный курс С. П. Боткиным, лечение телеангиэктазий из-
лагал хирург И. В. Буяльский, черные точки при поверхностной
трихофитии волосистой части головы описал видный терапевт
Г. А. Захарьин; склереме новорожденных посвящена работа аку-
шера С. Ф. Хотовицкого. Лекции о венерических болезнях читал
Н. И. Пирогов. Лишь в 1863 г., когда был утвержден новый устав
университетов, в учебную программу медицинских факультетов
был включен курс кожных (при кафедре специальной патологии и
терапии) и венерических (при кафедре теоретической хирургии)
болезней. В Московском университете этот курс возглавил доцент-
дерматолог Н. П. Мансуров, в Петербургской медико-хирургиче-
ской академии — Г. К. Кулаковский, в Киевском университете —
Л. К. Горецкий, в Казани — И. С. Дмитриевский.
Становление дерматологии в России происходило в период
мощного развития отечественной медицины, начавшегося в 60-е го-
ды XIX столетия, когда крепостная Россия делала шаг к превра-
щению в буржуазно-капиталистическую страну. В России труди-
лись такие замечательные ученые, как Д. И. Менделеев, А. М. Бут-
леров, К. А. Тимирязев, И. М. Сеченов, оказавшие огромное
влияние на развитие естественных наук, медицины вообще и дер-
матологии в частности.
Развиваясь под влиянием передовой русской клинической ме-
дицины, отечественная дерматология избежала ошибок и крайно-
стей, свойственных французской и немецкой дерматологическим
школам того периода и с самого начала приобрела черты ориги-
9
нальной, самостоятельной школы, характеризующейся следую-
щими направлениями: клиническим, требующим глубокого изуче-
ния пациентов и применения современных методов исследований,
физиологическим, функциональным, профилактическим с примене-
нием комплексной терапии для обеспечения лечебного воздейст-
вия на все патологические изменения в организме больного.
Изучив работы дерматологических клиник в Германии, Австрии,
Швейцарии, М. И. Манассеин в 1900 г. в «Русском медицинском
вестнике» так изложил свои впечатления: «Мы, насколько это от
нас зависело, не только догнали и сравнялись с нашими учителя-
ми, но даже многих перегнали не только в чисто медицинской
постановке дела, но и по гуманности отношения к больному».
К этому времени в России сформировались крупные дерматоло-
гические школы при ряде кафедр кожных и венерических бо-
лезней.
Петербургская (Ленинградская) дерматологическая школа.
При Петербургской медико-хирургической академии в 1869 г.
была организована кафедра кожных и венерических болезней.
Ее возглавил Ф. В. Подкопаев, который вскоре умер. С 1871 г.
в кожном отделении работает Алексей Герасимович Полотебнов
(1838—1907), который по праву считается основоположником
отечественной дерматологии. Еще будучи студентом четвертого
курса, он написал свою первую научную работу о воздействии на
кожу ртутных препаратов (1864). После окончания университета
А. Г. Полотебнов остается в клинике С. П. Боткина, где защи-
щает докторскую диссертацию, а затем в течение 3 лет работает
в дерматологических клиниках Парижа и Вены под руководством
Гебры, Арди, Базена, Фурнье. В 1871 г. А. Г. Полотебнов полу-
чает звание приват-доцента, а в 1876 г. — профессора, первого
русского профессора-дерматолога. Он был блестящим клиници-
стом, поражения кожи рассматривал в тесной взаимосвязи с пора-
жением внутренних органов и нервной системы, влиянием факто-
ров внешней среды, выступал противником только наружного
лечения заболеваний кожи (экземы, псориаза и др.), рекомендуя
применять и общую терапию, климато-, гидро-, электролечение.
А. Г. Полотебнов большое значение придавал сочетанию морфо-
логических и функциональных исследований в дерматологии, что
не потеряло своего значения и сегодня. Основные научные мысли
и результаты исследований он изложил в сборнике «Дерматологи-
ческие исследования» (1886—1887).
А. Г. Полотебнов подготовил ряд видных учеников: А. Я. Бруе-
ва (первый профессор-дерматолог в Харьковском университете),
И. Ф. Зеленева, М. И. Стуковенкова (организатор’ Киевской дер-
матологической школы).
Одновременно с А. Г. Полотебновым в Петербургской медико-
хирургической академии трудился Вениамин Михайлович Тарков-
ский (1837—1906). Если отцом отечественной дерматологии
признан А. Г. Полотебнов, то основоположником русской венеро-
логии является В. М. Тарновский. Он возглавлял кафедру сифили-
10
дологии и после ухода на пенсию А. Г. Полотебнова объединил
обе кафедры в одну — дерматологии и сифилитических болез-
ней (1894—1897 гг.). Окончив медицинский факультет Москов-
ского университета в 1859 г., В. М. Тарковский переезжает в
Петербург и здесь, в Калинкинской больнице, занимается научной
работой. В 1863 г. он издает оригинальную книгу «Распознавание
венерических болезней у женщин и детей». В 1868 г. В. М. Тар-
новский становится приват-доцентом, а с 1869 г. возглавил ка-
федру сифилидологии. В. М. Тарковский убедительно доказал
несостоятельность унитарной теории венерических болезней, опре-
делил степень заразительности различных проявлений сифилцса,
убедительно доказал на основании клинических данных излечи-
мость сифилиса (1899), первый установил связь психических и
дистрофических изменений с врожденным сифилисом, изучил
злокачественные формы сифилиса, рекомендовал профилактиче-
ское лечение беременным, страдавшим сифилисом, дополнил
представления о патогенезе врожденного сифилиса. Он широко
освещал в своих трудах зависимость заболеваемости сифилисом от
социального уклада и политической системы общества. В 1885 г.
В. М. Тарновский организовал в Петербурге первое в Европе науч-
ное сифилидологическое и дерматологическое общество. По его
инициативе в 1868 г. при Калинкинской больнице создана школа
для обучения повивальных бабок лечению венерических болезней
у женщин и детей. В 1897 г. В. М. Тарновский добился открытия
Женского медицинского института (ныне Ленинградский меди-
цинский институт), в котором кафедру кожных и венерических
болезней возглавил его ученик Т. П. Павлов (1901 —1903), а затем
С. Я. Кульнев (1903—1924). Его ученики возглавляли кафедры в
различных городах страны (В. И. Зарубин — в Одессе, Харькове,
С. Я. Кульнев — в Петрограде, С. П. Томашевский — в Киеве,
С. Я. Яковлев — в Одессе).
После В. М. Тарковского кафедру кожных и венерических бо-
лезней с 1898 по 1924 г. возглавлял Тимофей Павлович Павлов
(1860—1932), ученик С. П. Боткина, последовательно проводив-
ший «идеи нервизма» в дерматологии. Т. П. Павлов — один из ос-
нователей функционального направления в дерматологии. Его
работы посвящены этиологии и патогенезу экземы, круговидной
алопеции. Им описан характерный для почесухи симптом — отсут-
ствие подошвенного рефлекса (симптом Т. П. Павлова). Под его
руководством выполнено было 20 докторских диссертаций; учени-
ки Т. П. Павлова возглавили кафедры кожных и венерических
болезней в ряде вузов страны.
С 1926 по 1928 г. кафедрой кожных и венерических болезней
в Ленинградской военно-медицинской академии руководил
П. А. Великанов (1876—1929), большое внимание уделявший
гистопатологии и рентгенотерапии кожных болезней, а с 1929 по
1940 г. М. Г. Мгебров (1878—1940), успешно разрабатывавший
проблему патогенеза экземы и уделявший большое внимание лече-
нию дерматофитий, организации борьбы с венерическими и за-
разными кожными заболеваниями.
С 1940 по 1968 г. эту кафедру возглавляет заслуженный
деятель науки РСФСР, член-корреспондент АМН СССР, профес-
сор С. Т. Павлов (1897—1971). Он уделяет большое внимание
изучению патогенеза экземы и других дерматозов. С. Т. Павлов
создает учебник по кожным и венерическим болезням (1960).
Под его руководством было выполнено более 30 кандидатских и
докторских диссертаций.
С 1968 по 1989 г. кафедрой кожных и венерических болезней
Ленинградской военно-медицинской академии им. С. М. Кирова
руководит действительный член АМН СССР, профессор О. К. Ша-
пошников. Он проводит углубленные исследования нарушений про-
ницаемости и резистентности сосудов в патогенезе крапивницы
и сифилиса, изучает особенности патоморфологических и иммуно-
морфологических изменений сосудов при аллергических васкули-
тах кожи, издает в соавторстве с С. Т. Павловым, В. И. Самцовым
и другими учебник по кожным и венерическим болезням, опубли-
кованы монографии «Крапивница», «Аллергические васкулиты ко-
жи». Под его руководством было защищено более 20 диссертаций,
издано руководство «Венерические болезни» (1980, 1991).
С 1988 г. кафедрой кожных и венерических бблезней Ленин-
градской военно-медицинской академии руководит ученик О. К. Ша-
пошникова профессор А. Н. Родионов, успешно разрабатывающий
патогенез эритродермий.
В Ленинградском медицинском институте им. И. П. Павлова
(Женский медицинский институт) кафедру кожных и венериче-
ских болезней возглавляли Т. П. Павлов (1901—1903), С. Я. Куль-
нев (1903—1924), А. А. Сахновская (1924—1938) —первая в
СССР женщина-профессор дерматовенеролог, под ее редакцией
был издан перевод руководства Ж. Дарье «Основы дерматологии».
С 1938 по 1957 г. эту кафедру возглавляла действительный
член АМН СССР член-корреспондент АН СССР заслуженный дея-
тель науки РСФСР профессор Ольга Николаевна Подвысоцкая
(1884—1958) —виднейший советский дерматовенеролог. В тече-
ние многих лет она руководила советской дерматологической
школой. О. Н. Подвысоцкая разработала ряд методов функцио-
нальной диагностики заболеваний кожи, обосновывала патофи-
зиологический принцип лечения некоторых дерматозов, организо-
вала люпозорий вблизи Ленинграда.
С 1956 по 1972 г. кафедру возглавлял видный советский дер-
матомиколог профессор А. Н. Аравийский, известный работами,
посвященными фавусу, кокцидиоидозу, висцеральным микозам.
Затем кафедру возглавляет профессор Е. А. Досычев, а с 1980 г.—
профессор И. М. Разнатовский, занимающийся углубленным ис-
следованием парапсориаза и лимфом кожи.
В Ленинградском санитарно-гигиеническом институте кафед-
рой кожных и венерических болезней с 1913 по 1917 г. заведовал
профессор В. В. Иванов, внесший большой вклад в разработку
ряда разделов гистопатологии кожи, клиники папулонекротиче-
ского туберкулеза кожи. На кафедре изучали пиодермиты, про-
12
фессиональные заболевания кожи. С 1978 г. кафедру возглавляет
ученик О. К. Шапошникова профессор М. Е. Старченко.
Изучению вопросов детской дерматологии много внимания
всегда уделяли на кафедре кожных и венерических болезней
Ленинградского педиатрического медицинского института, которую
возглавляли Л. И. Эрлих (1928—1939), С. Я. Голосовкер (до
1961 г.), Л. А. Штейнлухт (1962—1972), Ф. А. Зверькова (с
1972 г. и по настоящее время).
Ленинградский государственный ордена Ленина институт для
усовершенствования врачей им. С. М. Кирова (Еленинский клини-
ческий институт) всегда славился кафедрой кожных и венери-
ческих болезней. С 1886 по 1919 г. ее возглавлял почетный про-
фессор О. В. Петерсон, внесший большой вклад в изучение мяг-
кого шанкра, лепры, лейшманиоза, туберкулезной волчанки. Здесь
читали свои лекции Т. П. Павлов (1920—1926), О. Н. Подвысоц-
кая (1927—1948). С 1948 по 1969 г. кафедрой руководил член-
корреспондент АМН СССР, заслуженный деятель науки, профес-
сор Петр Васильевич Кожевников (1898—1969). Он выделил 2 ти-
па кожного лейшманиоза, разработал методику профилактических
прививок против этого заболевания, изучал атипические формы
пиодермитов, был инициатором (1954) диспансеризации кожных
больных. П. В. Кожевников в течение многих лет редактировал
журнал «Вестник дерматологии и венерологии». С 1980 г. кафедру
возглавляет профессор В. И. Самцов, занимающийся клиникой,
патогенезом и лечением пузырных и других дерматозов.
Московская дерматологическая школа является одной из веду-
щих в стране. Впервые кафедра кожных и венерических болезней
была организована в Московском университете в 1869 г. доцентом
Д. И. Найденовым, который возглавлял ее до 1884 г. С 1884 по
1892 г. кафедрой заведует профессор Н. П. Мансуров.
Алексей Иванович Поспелов (1846—1919) был фактическим
основателем Московской дерматологической школы. Он заведо-
вал кафедрой с 1892 по 1910 г. В 1891 г. А. И. Поспелов
организовал Московское общество дерматологов и венерологов
(с 1918 г. — общество имени А. И. Поспелова). А. И. Поспелов
является автором первого русского оригинального учебника по
кожным и венерическим болезням (1905); он описал симптомы
«зонда» при туберкулезной волчанке, «скомканной папиросной
бумаги» при идиопатической прогрессирующей атрофии кожи, ами-
лоидоз кожи, стойкую папулезную крапивницу, разработал ориги-
нальный метод массажа кожи лица (1895), большое внимание
уделял организации борьбы с венерическими болезнями. А. И. Пос-
пелов воспитал много учеников, которые в последующем стали
профессорами (С. Л. Богров, Г. И. Мещерский, Н. А. Черногубов,
Е. С. Главче и др.).
С 1911 по 1916 г. кафедрой руководил И. Ф. Зеленев, с 1917
по 1925 г. — В. В. Иванов, который в 1923 г. был председателем
I Всесоюзного съезда по борьбе с венерическими болезнями.
В. В. Иванов большое внимание уделял изучению профессиональ-
13
ных заболеваний кожи. Среди его учеников такие известные дер-
матологи, как Н. С. Ведров, А. П. Долгов.
С 1925 по 1936 г. кафедрой кожных и венерических болезней
при Московском университете заведует заслуженный деятель
науки РСФСР профессор Герман Иванович Мещерский (1874—
1936), принимавший активное участие в организации борьбы с
венерическими заболеваниями. Он впервые в России описал
острую красную волчанку, ранний сифилис почек, предположил, что
идиопатическая прогрессирующая атрофия кожи и склеродермия
представляют единый патологический процесс. Г. И. Мещерский
издал учебник по кожным и венерическим болезням.
С 1936 по 1940 г. кафедру возглавляет заслуженный деятель
науки профессор Павел Семенович Григорьев (1879—1940). Он
проводит глубокие исследования в области экспериментального
сифилиса, издает учебник по кожным и венерическим болезням.
Его ученики возглавили кафедры в Куйбышеве (А. С. Зенин),
Саратове (А. Ф. У хин), Воронеже и Москве (Л. Н. Машкил-
лейсон).
С 1941 по 1942 г. кафедрой руководит Н. А. Черногубов, кото-
рый впервые в СССР описал хроническую вегетирующую пиодер-
мию, разработал методику активной модификации количественной
реакции Вассермана. С 1943 по 1944 г. кафедру временно воз-
главляет О. Н. Подвысоцкая, а с 1945 по 1969 г. — член-коррес-
пондент АМН СССР, заслуженный деятель науки РСФСР профес-
сор Виктор Александрович Рахманов (1901—1969), который про-
водит серьезные исследования по профилактике профессиональ-
ных заболеваний кожи, изучению патогенеза экземы, нейродер-
мита и усовершенствованию методов лечения сифилиса.
С 1970 по 1983 г. кафедрой руководит Р. С. Бабаянц, с 1984 по
1989 г. кафедру возглавляет член-корреспондент РАМН Н. С. По-
текаев, углубленно изучающий патогенез и лечение злокачест-
венных лимфом кожи. С 1989 г. кафедру возглавляет профессор
О. Л. Иванов, внесший большой вклад в изучение васкулитов
кожи.
Во II Московском медицинском институте им. Н. И. Пирогова
(Высшие женские медицинские курсы) кафедру кожных и венери-
ческих болезней возглавляли А. И. Лянц (1910—1920), Г. И. Ме-
щерский (1920—1925), А. П. Иордан (1925—1932), Н. А. Черно-
губов (1933—1941), С. П. Либерман (1941 —1945), заслуженный
деятель ндуки РСФСР профессор Ф. Н. Гринчар (1946—1952),
М» М. Желтаков (1952—1968), а с 1968 г. — академик РАМН
профессор Юрий Константинович Скрипкин. Ю. К. Скрипкин яв-
ляется автором нескольких учебников по кожным и венерическим
болезням для взрослых и детей, монографии «Нейродермит»
(1970). Он уделяет большое внимание изучению нейроэндокрин-
ных расстройств, иммуноаллергической реактивности в этиологии
и патогенезе хронических дерматозов, совершенствованию методов
лечения кожных и венерических болезней, исследованиям генети-
ческих механизмов.
14
В Московском медицинском стоматологическом институте ка-
федру кожных и венерических болезней с 1939 по 1952 г. возглав-
ляет Е. Я. Хесин, а с 1953 по 1972 г. — заслуженный деятель
науки РСФСР профессор Борис Михайлович Пашков (1899—
1973), внесший большой вклад в изучение врожденного сифилиса,
поражений слизистой оболочки рта при различных дерматозах.
С 1974 г. кафедру возглавляет А. Л. Машкиллейсон, углубленно
изучающий особенности поражения слизистых оболочек при раз-
личных дерматозах. Им опубликованы монография «Предрак сли-
зистой полости рта и красной каймы губ», руководство «Заболева-
ния слизистой оболочки рта», учебник для студентов стоматологи-
ческого факультета.
В Университете дружбы народов им. Патриса Лумумбы кафед-
рой кожных болезней с 1964 по 1970 г. руководит Р. С. Бабаянц,
а с 1970 г. ее возглавляет Л. Д. Тищенко, изучающий обмен
витаминов при различных дерматозах.
В Центральном институте усовершенствования врачей кафед-
рой кожных и венерических болезней с 1934 по 1952 г. заведует
М. А. Розентул (его работы посвящены различным разделам
сифилидологии, вопросам косметологии, им издано руководство
по лечению кожных болезней), с 1953 по 1970 г. — заслуженный
деятель науки УССР профессор А. И Картамышев (автор учеб-
ника по кожным и венерическим болезням, ряда монографий об
основном аргентофильном веществе кожи, о лечении кожных
болезней внушением, гипнозом), с 1970 по 1990 г. — А. А. Ан-
тоньев, автор ряда работ, посвященных профессиональным дерма-
тозам, ге но дерматозам и др., а с 1990 г. — К. Н. Суворова, зани-
мающаяся проблемами атопического дерматоза, наследственных
заболеваний.
В клинике кожных и венерических болезней Московского об-
ластного научно-исследовательского клинического института им.
М. Ф. Владимирского (МОНИКИ) работали видные ученые —
Ф. Н. Гринчар (1935—1943), Н. С. Ведров (1943—1945), уделяв-
шие большое внимание совершенствованию методов лечения боль-
ных сифилисом и проблеме профессиональной патологии кожи.
С 1945 по 1965 г. клинику возглавляет профессор Вардан Яковле-
вич Арутюнов (1899—1988), занимавшийся проблемами лечения
сифилиса, гемодермий, пеллагры, поздней кожной формы порфи-
риновой болезни. С 1965 по 1970 г. клиникой руководил профессор
Георгий Борисович Беленький (1922—1970), который много сде-
лал для развития в нашей стране генетических методов исследова-
ний в дерматологии. Им впервые в СССР опубликована моногра-
фия «Генетические факторы в дерматологии» (1970). Под его
руководством впервые в нашей стране изучены механизмы пато-
генеза и разработаны методы лечения панникулита. С 1970 г.
клинику возглавляет профессор Г. Ф. Романенко, опубликовавший
ряд работ, посвященных уплотненным схемам лечения сифилиса
и методике санитарной пропаганды знаний среди населения, а
затем профессор Б. А. Беренбейн, уделявший большое внимание
15
изучению механизмов патогенеза нейродермита, экземы, пролифе-
ративных заболеваний кожи. Им впервые был внедрен в практику
лечения зудящих дерматозов метод иглорефлексотерапии; под его
руководством на базе клиники впервые в нашей стране создана
лаборатория дерматоонкологии, в которой проводятся исследова-
ния по патогенезу злокачественной трансформации эпидермиса и
злокачественных лимфом кожи, разрабатываются вопросы эпиде-
миологии и безрентгеновских методов лечения новообразований
кожи. Им опубликованы монографии «Нейродерматозы» (1971),
«Псевдорак кожи» (1980), переизданная затем в США (1985); под
его редакцией (совместно с профессором А. А. Студнициным)
издано руководство для врачей «Дифференциальная диагностика
кожных болезней» (1983), переизданное в 1989 г.
Ведущим научным, методическим, организационным центром в
стране является Центральный научно-исследовательский кожно-
венерологический институт Министерства здравоохранения России
(ЦКВИ), основанный в Москве в 1921 г. Первым его директором
был С. Л. Богров (1921 —1923).
В ЦКВИ работали многие советские ученые. М. П. Демьянович
разработал ускоренный оригинальный метод лечения чесотки.
Ю. Я. Финкельштейн широко известен работами по эксперимен-
тальному сифилису. Им издано первое русское руководство по
серологической диагностике сифилиса (1911, 1931). А. А. Брычев
внедрил в практику лечение больных сифилисом препаратами вис-
мута. Л. Н. Машкиллейсон внес большой вклад в изучение дерма-
тофитий, описал симптом «скрытого» шелушения при каплевидном
парапсориазе, опубликовал ряд руководств для врачей «Частная
дерматология», «Инфекционные и паразитарные болезни кожи»,
«Лечение и профилактика кожных болезней». Заслуженный дея-
тель науки РСФСР Н. С. Смелов провел ценные исследования,
касающиеся лечения сифилиса, туберкулеза кожи, гемодермий;
описал первичный ретикулез кожи. А. М. Ариевич внес большой
вклад в развитие микологии, предложил «метод отслойки» для лече-
ния некоторых дерматофитий. Заслуженный деятель науки РСФСР
Н. Д. Шеклаков обстоятельно разрабатывал проблемы дерматоми-
кологии, внес вклад в изучение пузырных дерматозов. Им опублико-
ваны монографии «Пузырчатка», «Буллезные дерматозы», «Руко-
водство по микологии» и др. Р. М. Фронштейн и И. М. Порудомин-
ский издали ряд монографий по вопросам урологии. Заслуженный
деятель науки РСФСР Н. М. Овчинников успешно разрабатывал
вопросы экспериментального сифилиса, серологической диагно-
стики сифилиса, занимался электронно-микроскопическими иссле-
дованиями возбудителей венерических болезней. Заслуженный
деятель науки РСФСР А. А. Студницин, многие годы работавший
заместителем директора ЦКВИ по науке, уделял большое внима-
ние проблеме организации борьбы с заразными кожными и вене-
рическими болезнями, редактированию руководств по дерматоло-
гии, справочников для дерматовенерологов. Н. М. Туранов, будучи
директором ЦКВИ, в течение многих лет возглавлял научно-иссле-
16
довательские работы по изучению кожных и венерических болез-
ней в нашей стране, координировал организационные мероприятия
по снижению заболеваемости кожными и венерическими болез-
нями. В. Н. Мордовцев занимается углубленным изучением раз-
личных аспектов патогенеза псориаза, роли генетических факто-
ров, вирусной инфекции в его развитии, им впервые организован
в институте отдел наследственной патологии кожи. В. Н. Мордов-
цев является автором руководства «Патоморфологическая диагно-
стика заболеваний кожи», редактором и соавтором руководства
«Патология кожи» (1993). Профессор А. А. Каламкарян, опытный
клиницист-дерматолог, долгое время возглавлявший отдел дерма-
тологии ЦКВИ, углубленно исследовал клинику, патогенез и лече-
ние злокачественных лимфом кожи; он описал ряд редких дерма-
тозов, является автором руководства «Клиника и терапия ретику-
лезов кожи» и «Клиническая дерматология. Редкие и атипичные
дерматозы». С 1986 г. отдел дерматологии ЦКВИ возглавляет
профессор В. А. Самсонов, занимающийся изучением аутоиммун-
ных заболеваний кожи. Заведующий отделом электронной микро-
скопии В. В. Делекторский совместно с Н. М. Овчинниковым
изучил на субклеточном уровне возбудители венерических заболе-
ваний, пиококковой инфекции, их взаимоотношений с клетками
организма. В последние годы профессор В. Н. Беднова, возглав-
ляющая отдел микробиологии, успешно разрабатывает новые мето-
ды серодиагностики сифилиса, проблемы иммуноферментного ана-
лиза в венерологии, профессор В. М. Лещенко — организационные
и микробиологические аспекты в дерматомикологии. Профессор
К. К. Борисенко внес большой вклад в разработку ускоренных
методов лечения сифилиса. Заведующий отделом патофизиологии
профессор В. Г. Акимов успешно изучает роль перекисного окисле-
ния липидов при фотодерматозах.
Киевская дерматологическая школа. В Киевском медицинском
институте (ныне Киевский ордена Трудового Красного Знамени
медицинский институт им. А. А. Богомольца) курс кожных болез-
ней возглавляет с 1863 по 1880 г. Л. К. Горецкий, а затем с 1883
по 1897 г. ученик С. П. Боткина профессор Михаил Иванович Сту-
ковенков (1842—1897), который стал основоположником Киев-
ской школы дерматологов и венерологов. По свидетельству про-
фессора П. В. Никольского, М. И. Стуковенков «принадлежал к
многочисленной семье нового направления в дерматологии, кото-
рое имеет огромное значение в поступательном развитии нашей
науки, так как оно вводит дерматологию в родную семью других
медицинских наук, сближает дерматологическую клинику с други-
ми специальностями для совместной и разносторонней разработки
обширной медицинской науки» (1897).
«Дерматология, как и остальные отрасли практической меди-
цины, — указывал М. И. Стуковенков в лекции, прочитанной в
1883 г., — должна пользоваться всеми средствами, даваемыми
нам наукою для исследования не только кожи и ее патологичес-
ких процессов, но и всего человека, и этим путем раскрывать
17
внутреннюю связь организма с дерматозами, а следовательно, и
причину развития последних».
Школа, созданная М. И. Стуковенковым, пропагандировала,
таким образом, необходимость изучения не только «видимых про-
явлений болезни, но и всего больного».
Особое внимание М. И. Стуковенков уделяет изучению состоя-
ния нервной системы больных, одним из первых возглавляет
оригинальные исследования по научному обоснованию лечения
сифилиса ртутными препаратами, обосновывает целесообразность
хронически перемежающего метода лечения сифилиса. Им разра-
ботан точный и удобный способ определения ртути в крови и вы-
делениях больных (моча, пот, слюна). Он уделяет огромное вни-
мание борьбе с распространением венерических болезней.
М. И. Стуковенков впервые ознакомил врачей с листовидной
пузырчаткой, риносклеромой, грибовидным микозом, множествен-
ной идиопатической саркомой Капоши. Возглавив кафедру в
Киеве, М. И. Стуковенков привлек и талантливую молодежь, рабо-
тавшую вместе с ним у профессора А. Г. Полотебнова, —
И. Ф. Зеленева, А. А. Линдстрема, а из клиники профессора
В. М. Тарновского — С. П. Томашевского.
Кафедрой кожных и венерических болезней в Киеве с 1897 по
1916 г. заведует профессор С. П. Томашевский (1854—1916),
основатель Киевского общества дерматологов и венерологов, дока-
завший, что эксцизия твердого шанкра не отражается на дальней-
шем течении сифилиса. Нельзя не отметить плодотворную работу
С. П. Томашевского как пропагандиста высшего женского меди-
цинского образования. Он был первым организатором медицин-
ского отделения на Высших женских курсах в Киеве, много вре-
мени уделял реорганизации женских медицинских курсов в
Киевском женском медицинском институте, который был учрежден
в 1916 г.
С 1916 по 1919 г. кафедрой заведует гистопатолог В. И. Тере-
бинский, ас 1921 по 1941 г. — А. М. Тыжненко, принимавший
активное участие в издании периодического журнала «Дерматоло-
гия», редактируемого В. В. Ивановым.
Под руководством А. М. Тыжненко в 1929 г. А. И. Картамыше-
вым выполнена докторская диссертация «Материалы к изучению
обмена хлористого натрия и воды при пузырчатке». Он возглавляет
кафедру с 1945 по 1953 г.
Научная деятельность А. И. Картамышева была посвящена
изучению эффективности гипно- и тканевой терапии дерматозов,
роли функциональных изменений центральной нервной системы и
кожи в патогенезе дерматозов. Подготовленный им учебник «Кож-
ные и венерические болезни» выдержал ряд изданий в СССР и
зарубежных странах.
С 1953 по 1959 г. кафедрой кожных болезней Киевского
медицинского института заведует профессор М. М. Кузнец (1902—
1959), возглавивший научные исследования по изучению витамин-
ного баланса и состояния внутренних органов при заболеваниях
18
кожи. Его научный труд «Материалы к учению об особенностях
кожной патологии у военнослужащих во время Великой Отечест-
венной войны» был высоко оценен медицинской общественностью.
С 1960 по 1974 г. кафедрой заведет воспитанник Саратов-
ского медицинского института профессор И. И. Потоцкий (1896—
1976), выполнивший под руководством академика Л. А. Орбели
докторскую диссертацию «Роль нервной системы при воспалитель-
ных процессах кожи» (1939). Под руководством И. И. Потоцкого
на кафедре выполнены многочисленные научные исследования по
изучению клиники, патогенеза и лечения ряда кожных и венери-
ческих болезней.
Им написаны «Справочник дерматовенеролога», монографии
«Ретикулезы кожи», «Заболевания кожи при лейкозах», «Ихтиоз»
И др.
И. И. Потоцкий подготовил целую плеяду ученых, которые
сегодня возглавляют кафедры дерматологии в Виннице, Киеве,
Краснодаре, Ростове, Симферополе.
С 1974 г. кафедру дерматовенерологии Киевского медицин-
ского института возглавляет профессор В. Г. Коляденко.
Крупной дерматологической школой считается харьковская.
Среди видных ученых, трудившихся в Харьковском медицинском
институте, — И. Ф. Зеленев (издает «Русский журнал кожных и
венерических болезней»), Л. А. Соболев (возглавляет кафедру с
1924 по 1943 г.). С 1945 по 1966 г. на кафедре работает видный
дерматолог-миколог И. С. Попов, а с 1967 по 1993 г. — Б. А. Задо-
рожный.
В институте усовершенствования врачей с 1930 по 1953 г.
и в научно-исследовательском институте дерматологии и венеро-
логии с 1937 по 1956 г. работу возглавляет профессор А. М. Кри-
чевский — видный клиницист, опытный организатор здравоохра-
нения, уделявший большое внимание инфекционным дерматозам.
Харьковский научно-исследовательский институт дерматоло-
гии и венерологии, организованный в 1924 г., возглавляли
А. Н. Федоровский, Б. А. Задорожный, А. И. Пятикоп, в настоящее
время — И. И. Мавров. Предметом углубленных исследований
его сотрудников были проблемы диагностики, лечения и профи-
лактики хронических дерматозов, инфекционных заболеваний
кожи, диагностики и лечения сифилиса, гонореи и негонококко-
вых уретритов, хламидийной, микоплазменной, уреаплазменной
инфекции, гистопатологии кожи и др.
Крупная дерматологическая школа сформировалась в Ростов-
ском-на-Дону медицинском институте, истоки которой связаны
с медицинским факультетом Варшавского университета, где в
период с 1900 по 1915 г. кафедрой кожных и венерических бо-
лезней заведует крупный русский ученый Петр Васильевич Ни-
кольский (1858—1940). После эвакуации Варшавского универси-
тета в 1915 г. он возглавлял до 1930 г. кафедру в медицинском
институте в Ростове-на-Дону. П. В. Никольский впервые описы-
вает симптом отслойки эпидермиса при акантолитической пу-
19
зырчатке, известный в мировой литературе как «симптом Ни-
кольского», большое внимание уделяет изучению функциональ-
ного состояния кожного анализатора в норме и при патологии,
лечению больных лепрой и др. В период с 1930 по 1941 г. кафед-
рой заведует специалист по гистопатологии кожи 3. Н. Гржеоин,
а с 1944 по 1961 г. заслуженный деятель науки профессор
Николай Александрович Торсуев (1902—1978), опытный клини-
цист, специалист по профессиональным заболеваниям кожи, лепре,
один из авторов учебника по кожным и венерическим болезням
для студентов медицинского института. Им описаны некоторые
дерматозы (шанкриформная пиодермия, новый вариант болезни
Саттона и др.). Уделяя большое внимание вопросам^ истории
развития дерматовенерологии, он издал ряд монографий по этой
проблеме.
Крупными дерматологическими школами стали некоторые
клиники научно-исследовательских, медицинских институтов и
институтов усовершенствования врачей.
Большой вклад в разработку проблем диагностики, терапии,
профилактики профессиональных заболеваний кожи внесли руко-
водители клиники кожных болезней Института гигиены труда и
профессиональных заболеваний РАМН, трудившиеся в разные
годы (В. В. Иванов, Н. С. Ведров, А. П. Долгов, А. А. Антоньев,
Б. А. Сомов и др.). Углубленное изучение лепры проводилось
в Научно-исследовательском институте по изучению лепры
М3 России (Астрахань), где работали Н. Ф. Павлов, И. Н. Пере-
водчиков, В. Ф. Шубин, в настоящее время институт возглавляет
А. А. Ющенко. Вопросы косметологии в Институте косметологии
М3 России разрабатывали А. Ф. Ахабадзе, А. П. Хрунова, А. С. Гу-
сарова, Е. И. Рыжкова и др.
В Горьковском медицинском институте им. С. М. Кирова в
период с 1931 по 1971 г. кафедру возглавлял заслуженный дея-
тель науки РСФСР, профессор М. П. Батунин, который большое
внимание уделял изучению профессиональных заболевании кожи
и организации борьбы с кожными и венерическими болезнями.
С 1971 г. кафедрой руководит Т. А. Главинская, которая одно-
временно является и директором Горьковского научно-исследова-
тельского кожно-венерологического института. Она разрабатывает
комплексные механизмы патогенеза системных поражении сое-
динительной ткани с патоморфологически х, биохимических,
иммунологических позиций и уделяет большое внимание усовер-
шенствованию методов лечения сифилиса и других заболеваний,
передаваемых половым путем.
В Казанском медицинском институте им. С. В. Курашова
трудился один из основоположников отечественной сифилидо-
логии А. Г. Ге (1842—1907), издавший «Курс венерических бо-
лезней» (1870). В последующем здесь работали в разные периоды
такие видные дерматовенерологи, как М. М. Пильнов (описал
розовый оттенок свежих высыпаний при псориазе — «симптом
Пильнова», разработал методику светолечения больных туберку-
20
лезной волчанкой), И. Н. Олесов, Н. Н. Ясницкий, Г. Г. Кон-
дратьев и др. В Куйбышевском медицинском институте трудился
А. С. Зенин, автор учебника по кожным и венерическим болез-
ням (совместно с Н. А. Торсуевым), серьезных исследований
по экземе, профессиональной патологии кожи, эксперименталь-
ному сифилису. В последующем кафедру возглавлял Б. А. Зенин.
В Саратовском медицинском институте работали В. И. Теребин-
ский, П. С. Григорьев, А. С. У хин, известный своими работами,
посвященными пузырчатке и псориазу, С. И. Довжанский (уделяет
внимание проблеме псориаза и курортного лечения дерматозов).
В Челябинском медицинском институте кафедру с 1965 по 1992 г.
возглавлял И. И. Ильин, занимавшийся проблемой венерологии,
гонококковых и негонококковых уретритов. В Днепропетровском
медицинском институте трудились И. С. Мильман, Г. Б. Нестерен-
ко, занимавшийся изучением вопросов иммунологической реактив-
ности у кожных больных и сорбционной терапии дерматозов.
Среди руководителей кафедры кожных и венерических болезней
Одесского медицинского института были С. С. Яковлев, И. А. Ма-
тусис, изучавший обменные процессы в коже, бальнеотерапию
дерматозов, А. П. Лавров — ученик П. В. Никольского, М. В. Бор-
зов — ученик О. Н. Подвысоцкой, занимавшийся историей сифи-
лидологии. В Минском медицинском институте кафедру возглав-
лял действительный член Академии наук БССР, заслуженный
деятель науки А. Я. Прокопчук, предложивший лечение красной
волчанки акрихином, углубленно изучавший действие радиоактив-
ных изотопов на кожу. После него кафедру возглавляли А. Т. Сос-
новский, Н. 3. Яговдик.
В Томском институте усовершенствования врачей (с 1951 г.
Новокузнецкий) с 1928 г. по 1941 г. кафедрой заведует А. А. Бого-
лепов (1874—1941), видный специалист по грибковым заболе-
ваниям кожи, изучавший изменчивость бледной трепонемы и ми-
кобактерии туберкулеза и предложивший оригинальный метод
окраски гистологических препаратов. Признавая его большие за-
слуги в развитии советской дерматовенерологии, клинике в 1941 г.
было присвоено имя А. А. Боголепова. В Белорусском институте
усовершенствования врачей трудились А. Б. Селийский, Н. Ф. Пав-
лов, Ю. Ф. Королев и др.
В кратком очерке истории дерматовенерологии не представ-
ляется возможным отразить весь большой опыт, накопленный
другими кафедрами медицинских институтов и институтов усовер-
шенствования врачей, научно-исследовательских институтов (Ас-
траханский, Башкирский, Волгоградский, Воронежский, Кубан-
ский, Пермский, Свердловский, Донецкий, Крымский, Кишинев-
ский, Рижский, Азербайджанский, Ереванский, Казахский, Таш-
кентский, Туркменский и др.). Результаты их работы нашли
отражение в публикациях (монографии, сборники научных работ,
статьи в журналах, методические рекомендации) и докладах
на съездах (всесоюзных, республиканских), симпозиумах, конфе-
ренциях, пленумах научного совета по дерматологии и венероло-
21
гии АМН СССР и Правления Всесоюзного общества дерматологов
и венерологов.
Всего в нашей стране было проведено 9 всесоюзных съездов
дерматовенерологов: первый — в Москве (1923), второй — в
Харькове (1925), третий — в Ленинграде (1929), четвертый —
в Москве (1937), пятый — в Ленинграде (1959), шестой — в
Харькове (1973), седьмой — во Львове (1979), восьмой — в
Ставрополе, девятый — в Алма-Ате (1991). На них обстоятельно
обсуждались вопросы организации борьбы с венерическими и за-
разными кожными болезнями, новые аспекты этиологии, патогене-
за, диагностики, терапии, профилактики заболеваний кожного
покрова, профессиональных и детских дерматозов, венерических
болезней. Материалы докладов, обзоры обсуждаемых вопросов,
резолюции съездов публиковались в печати, доводились до сведе-
ния всех дерматовенерологов страны.
Большая заслуга в деле развития советской дерматологии и
венерологии принадлежит издаваемому в стране общесоюзному
журналу «Вестник дерматологии и венерологии». С 1924 г. в
СССР издавались два журнала «Русский вестник дерматологии»
и «Венерология и дерматология». В 1932 г. их объединили в один
журнал — «Советский вестник венерологии и дерматологии»,
который был переименован в 1937 г. в «Вестник венерологии и
дерматологии», а в 1957 г. — в «Вестник дерматологии и венеро-
логии». Кроме того, с 1957 г. издается раздел «Дерматология
и венерология» Медицинского реферативного журнала (редактор
академик РАМН Ю. К. Скрипкин), где оперативно публикуются
рефераты основных работ по специальности, издаваемых за ру-
бежом.
На современном этапе дерматологи успешно развивают комп-
лексное клиническое направление, уделяя должное внимание
глубокому, всестороннему обследованию больных, применяя со-
временные методы исследования (биохимические, иммунологиче-
ские, генетические, гистологические, гистохимические, электронно-
микроскопические, энзимологические, иммуноферментные, элект-
рофизиологические, люминесцентные и др.), разрабатывают новые,
эффективные методы лечения, профилактики кожных заболева-
ний, широко внедряют их в практику здравоохранения. Итог этих
исследований — снижение заболеваемости инфекционными, тяже-
лыми хроническими дерматозами, профессиональными заболева-
ниями кожи, сокращение продолжительности временной утраты
трудоспособности и снижение инвалидизации дерматологических
больных.
ИЗ ИСТОРИИ РАЗВИТИЯ ВЕНЕРОЛОГИИ
Сведения о венерических болезнях дошли до нас из глубины
веков. Однако вплоть до 30-х годов XIX столетия представления
об этих болезнях были весьма упрощенными.
22
Первый этап в развитии венерологии начинается в период
древности и продолжается до конца XV столетия. В историческом
памятнике египетской медицины папирусе Эберса сообщается о
воспалениях мочеиспускательного канала. Гиппократ описал наря-
ду с этим поражением и «белые выделения» из влагалища. Во вто-
ром веке нашей эры Galen предложил такие поражения называть
гонореей (gonos — семя, rheo — теку). Затем появились сообще-
ния об осложнениях при воспалении уретры — эпидидимите
(IV век н. э.— Marcellus Empyricus). Арабский врач Абу-Бекр-
Рази (IX век н. э.) предложил лечить уретриты спринцеванием
свинцовыми растворами. К концу XV века имелось много наблю-
дений о таких болезнях, их заразительности, путях заражения,
предлагались способы профилактики.
Второй этап в развитии венерологии начинается с конца
XV века, когда в Европе возникла пандемия ранее неизвестного
заболевания, названного впоследствии сифилисом. Полагали, что
это заболевание обусловлено возбудителем трепонематоза южно-
американских лам, от которых заразились люди вследствие ско-
толожества. Очень быстро заболевание распространилось в Европе,
а затем в Азии и Африке. В России сифилис появился в конце
XV века. Первоначально болезнь называли lues (наказание),
затем ей стали присваивать имя какого-либо святого (болезнь
святого Йоргена), название страны, из которой проникало забо-
левание на другую территорию (испанская, французская, немец-
кая, польская болезнь). В 1530 г. итальянский врач, философ,
поэт Girolomo Fracastoro назвал эту болезнь сифилисом — по
имени пастуха Syphilus (от sys — свинья, philos — друг), героя
его поэмы «Сифилис, или галльская болезнь». Распространение
болезни связывали с разгульным поведением, пьянством. Сущ-
ность заболевания не была известна. Некоторые врачи стали
относить к сифилису ранее известные гонорею и мягкий шанкр.
Возникло учение унитаристов, усматривающих существование од-
ной сифилитической болезни, неодинаково проявляющейся у раз-
ных людей. Эта теория была ошибочно подтверждена видным
английским хирургом J. Hunter в конце XVIII века при экспери-
менте на себе. Он привил на слизистую оболочку своей уретры
отделяемое из мочеиспускательного канала больного. Через 3 дня
у него появились симптомы гонореи, через 3 нед — признаки
внутриуретрального шанкра, а спустя еще 6 нед — розеолезные
и папулезные высыпания. Этот ошибочный эксперимент послужил
поводом для утверждения о том, что сифилис и гонорея.— про-
явления одного заболевания, не было учтено, что источник инфек-
ции одновременно страдал двумя болезнями. Эксперимент стоил
жизни J. Hunter. Он погиб в результате сифилитического пора-
жения нервной системы. Лишь в период с 1831 по 1837 г. Ricor,
проделав большое число экспериментов на здоровых людях, до-
казал, что сифилис и гонорея являются различными заболева-
ниями.
По мере развития микробиологии были выявлены возбудители
23
венерических болезней. С этого начинается третий этап в разви-
тии венерологии. В 1836 г. A. Donne открыл возбудителя трихомо-
ниаза, в 1879 г. A. Neisser установил возбудителя гонореи (гоно-
кокка). О. В. Петерсен (1887), Ducrey (1809), Unna и Krefting
(1892) выявили возбудителя мягкого шанкра (стрептобацилла);
Hoffman, Schaudin (1905)—возбудителя сифилиса (бледная
трепонема), Ch. Donovan (1905) — венерической лимфограну-
лемы. В последующие годы было установлено, что так назы-
ваемые ранее абактериальные уретриты могут быть вызваны ви-
русной, хламидийной, микоплазменной, уреаплазменной инфек-
цией. В СССР исследования возбудителей этих заболеваний
успешно проводились в 80-е годы нынешнего столетия В. В. Де-
лекторским, И. И. Мавровым, Н. М. Овчинниковым, А. А. Шатки-
ным и др.
К числу важнейших открытий в венерологии относят создание
модели экспериментального сифилиса на шимпанзе [Мечни-
ков И. И. и Roux, 1903], а затем на кроликах [Bertarelli, 1906].
Знаменательным событием в развитии сифилидологии явилась
разработка методов серологической диагностики. В 1906 г. Wasser-
mann, Neisser, Bruck предложили реакцию связывания комплемен-
та, которая постепенно усовершенствовалась. В качестве антигена,
кроме органоэкстрактов, стали применять синтетический кардио-
липиновый [Резникова Л. С.], трепонемный озвученный [Овчин-
ников Н. М, Беднова В. Н.], протеиновую фракцию бледной тре-
понемы. Н. А. Черногубов (1908) разработал методику количест-
венной постановки реакции Вассермана. В последующем были
предложены ценные специфические реакции для серологической
диагностики сифилиса — реакция иммобилизации бледных тре-
понем [Nelson, Mayer, 1949], а затем и реакция иммунофлюо-
ресценции с различными разведениями испытуемой сыворотки
и абсорбцией неспецифических антител. В настоящее время раз-
рабатывается метод диагностики сифилиса с применением иммун-
ного ферментного анализа.
Для ускоренной диагностики сифилиса были предложены
осадочные реакции Кана, Закса—Витебского и ориентировочный
экспресс-метод микрореакции на стекле. Параллельно большое
внимание уделялось дальнейшему изучению возбудителя болезни,
его ультраструктуры, взаимоотношений с клетками организма
больного, изменчивости L-форм спирохеты; была установлена воз-
можность персистенции ее в полимембранных фагосомах клеток
[Овчинников Н. М., Делекторский В. В., 1961, 1965].
Для развития этих исследований большое значение имели ра-
боты по выращиванию культуры бледной трепонемы [Шерешев-
ский Я. Г., 1909; Аристовский В. М., 1928; Оганесян П. Г., 1929].
Эти исследования продолжаются и в настоящее время в микробио-
логическом отделе ЦКВИ.
Наряду с изучением возбудителя болезни серьезное внимание
уделялось исследованию реактивности организма больных сифили-
сом, реакциям иммунной системы, динамике этих процессов в
24
результате лечения; на основании полученных данных разрабаты-
ваются методы коррекции выявленных изменений.
На протяжении всей истории развития сифилидологии в цент-
ре внимания исследователей находилось обстоятельное изучение
клинических проявлений заболевания. Фундаментальные работы
Ricord, A. Fournier, В. М. Тарновского, П. С. Григорьева,
К. Р. Аствацатурова, Н. С. Ведрова и многих других позволили
уточнить различные особенности проявления сифилитической ин-
фекции, обеспечить повышение качества клинической диагностики
заболевания. В последние десятилетия при изучении клиники си-
филиса сотрудниками ЦКВИ, а также республиканских кожно-
венерологических научно-исследовательских институтов, кафедр
дерматовенерологии были выявлены некоторые особенности в
проявлениях болезни (малосимптомные формы, длительное ла-
тентное течение болезни после заражения и др.). В центре внима-
ния сифилидологов всегда находилась проблема врожденного
[Райц М. М., Пашков Б. М. и др.], скрытого сифилиса.
Вопросы висцерального сифилиса отражены в обстоятельных
работах О. Н. Подвысоцкой, Р. А. Лурия, А. Л. Мясникова,
М. П. Фришмана и др., а сифилиса нервной системы — М. С. Мар-
гулиса, Р. А. Малыкина, Г. В. Робустова и др., изменений спинно-
мозговой жидкости у больных — 3. Н. Гржебина, Т. В. Васильева,
М. Н. Бухаровича и др., поражений костей и суставов — Б. М. Паш-
кова и др. С помощью этих и других материалов было обосновано
положение о том, что при сифилисе поражаются все органы и
системы организма больного. Поэтому большое значение имеет
своевременное распознавание функциональных расстройств, лече-
ние ранних, малосимптомных форм заболевания для предупрежде-
ния тяжелых последствий, необратимых органических поврежде-
ний.
Лечению сифилиса врачи всегда уделяли пристальное внима-
ние. В конце XV — начале XVI веков, вскоре после возникновения
пандемии сифилиса в Европе, стали испытывать различные методы
и средства лечения, которые применялись в медицине в тот пе-
риод (мочегонные, слабительные, потогонные препараты, крово-
пускание и др.), естественно, без эффекта.
В 1835 г. Уоллес заметил, что при сифилисе, особенно его
поздних формах, целесообразно применять препараты йода.
В конце XIX столетия М. И. Стуковенков, В. М. Тарковский,
А. Г. Ге разработали рациональную методику лечения больных
сифилисом препаратами ртути, которая способствует регрессу
проявлений болезни. В это же время А. И. Поспелов случайно
обратил внимание на то, что при поздних формах сифилиса, когда
препараты ртути недостаточно эффективны, с успехом можно
применять препараты мышьяка (арсенат натрия).
Стремясь разработать метод стерилизующей терапии сифилиса,
Erlich испытывает различные соединения мышьяка. В 1909 г. он
предлагает препарат сальварсан, оказавшийся весьма токсичным.
В дальнейшем эти исследования были продолжены, в результате
25
чего был синтезирован неосальварсан (советский аналог новарсе-
нол), который оказался достаточно эффективным при внутри-
венном его введении больным сифилисом.
В конце XIX века О. В. Петерсен заметил, что хороший эффект
при мокнущих сифилидах оказывают присыпки порошка нитрата
висмута. В 1921 г. Levaditi, Sazerac предложили лечить сифилис
взвесью йодвисмутата хинина в масле (отечественный препарат
бийохинол). Затем был предложен и бисмоверол (взвесь в масле
висмутовой соли моновисмутвинной кислоты), пентабисмол (водо-
растворимая соль висмута). Эти препараты оказались весьма
эффективными и малотоксичными. Таким образом, в 20-е годы
XX века появились эффективные средства для лечения сифилиса.
Однако эти методы не подтвердили мнения Ehrlich о возможности
стерилизующей терапии при сифилисе.
В 1943 г. для лечения больных сифилисом был предложен
пенициллин, оказавшийся весьма эффективным. Первоначально
его применяли небольшими разовыми и курсовыми дозами, затем
постепенно эти дозы повышали. В дальнейшем был разработан
метод однокурсового лечения, а в последние годы успешно приме-
няют новый метод ускоренного, укороченного (14—45 дней в за-
висимости от срока давности процесса) однокурсового лечения
[Зенин Б. А., Павлов С. Т., Главинская Т. А. и др.]. В связи с
появлением сифилиса, резистентного к пенициллину, были разра-
ботаны методы лечения резервными антибиотиками (эритроми-
цин, тетрациклин, и др.). Одновременно изучали и совершенство-
вали методы неспецифической стимулирующей терапии, которые
необходимо применять наряду со специфическими при поздних
формах заболевания у ослабленных пациентов, при серологиче-
ски резистентном сифилисе, поражениях внутренних органов и
нервной системы. Были разработаны методы профилактического и
превентивного лечения, методики лечения детей, страдающих
врожденным сифилисом.
Большое внимание уделяется и изучению гонококковой ин-
фекции.
Серьезные исследования были проведены по изучению методом
электронной микроскопии морфоструктуры гонококка [Овчинни-
ков Н. М., Делекторский В. В.], большое внимание уделялось в
последние годы исследованию иммунологического статуса больных
гонореей, особенно торпидно текущей, латентной, хронической,
осложненной.
Важной вехой в лечении гонококковой инфекции явилось пред-
ложение В. Е. Дембской (1909) применить гоновакцину, которая
успешно используется по сей день в сочетании с другими методами
стимуляции иммунологического статуса пациентов (пирогенал,
продигиозан, метилурацил, диуцифон и др.).
В последнее десятилетие успешно разрабатываются новые
способы лечения уреаплазменной, хламидийной, микоплазменной
инфекции мочеполовых органов (И. И. Мавров, И. .И. Ильин,
В. В. Делекторский, А. А. Шаткин и др.).
26
В нашей стране почти полностью ликвидирована заболевае-
мость мягким шанкром благодаря четкому проведению профилак-
тических мероприятий и наличия высокоэффективных этиотроп-
ных препаратов. Приблизительно так же обстоит дело и с забо-
леваемостью венерической лимфогранулемой (4-я венерическая
болезнь), при которой весьма эффективны сульфаниламиды и
препараты пенициллина.
В 80-е годы XX века стали регистрировать больных, стра-
дающих тяжелым заболеванием, вызванным ретровирусом. Это за-
болевание проявлялось синдромом приобретенного иммунодефици-
та (СПИД). Один из наиболее часто встречающихся путей пере-
дачи инфекции — половой, особенно среди больных гомосексуа-
листов, но она может передаваться и при гетеросексуальных
связях. Вопросы организации борьбы со СПИДом также курируют
и венерологи. Учитывая, что основная тяжесть проявления бо-
лезни связана с поражением нервной системы, органов дыхания
и пищеварения, пациентов курируют инфекционисты, а дермато-
венерологов привлекают к распознаванию поражений кожного
покрова, возникающих при СПИДе.
Развитие венерологии тесно связано с организацией борьбы
с инфекциями, передающимися половым путем. В практическое
и научное решение этой проблемы большой вклад внесли М. И. Сту-
ковенков, Д. К. Заболотный, С. П. Томашевский, И. И. Мечников,
А. И. Поспелов, С. Т. Павлов, М. А. Розентул, В. А. Рахманов,
П. С. Григорьев, Н. А. Торсуев, И. И. Потоцкий, Н. С. Смелов,
Н. С. Ведров, В. М. Тарновский, А. Г. Полотебнов, И. Ф. Зеленев,
Н. М. Туранов, Н. М. Овчинников, И. М. Порудоминский.
В настоящее время различные аспекты проблемы болезней,
передающихся половым путем, разрабатывают в научно-исследо-
вательских институтах дерматологии и венерологии, на многих
кафедрах медицинских вузов и институтов усовершенствования
врачей нашей страны. Координируется эта работа Центральным
научно-исследовательским кожно-венерологическим институтом
М3 России (директор — академик РАМН профессор Ю. К. Скрип-
кин). Результаты научных исследований в области венерологии
обстоятельно обсуждаются на всесоюзных и республиканских
съездах и пленумах дерматовенерологов, находят должное отра-
жение в научных публикациях.
Глава 2
МОРФОЛОГИЯ НОРМАЛЬНОЙ КОЖИ ЧЕЛОВЕКА
Гистологическое исследование нормальной кожи человека по-
казывает, что граница между эпидермисом и дермой неровная;
со стороны дермы в эпидермис вдаются конусовидные участки ее в
виде сосочков, между которыми располагаются эпидермальные
выросты различной длины и толщины.
ЭПИДЕРМИС
Эпидермис представлен эпителием, в котором различают в
зависимости от стадии дифференцировки эпителиальных клеток
следующие слои: базальный, или зародышевый (stratum germinati-
vum), слой шиповатых клеток (stratum spinosum), слой зернистых
клеток (stratum granulosum), элеидиновый, или блестящий (stratum
lucidum), и роговой (stratum corneum). Мальпигиев слой, или
мальпигиева сеть, включает в себя все слои, кроме рогового.
Базальный слой представлен одним рядом клеток цилиндриче-
ской формы, располагающихся перпендикулярно поверхности ко-
жи в виде частокола. Между базальными эпителиоцитами четко
обозначаются межклеточные промежутки, в которых видны меж-
клеточные мостики, или десмосомы. В цитоплазме базальных эпи-
телиоцитов, преимущественно вокруг ядра, располагаются гранулы
меланина, количество которых зависит от цвета кожи и расовой
принадлежности. В базальном слое иногда видят фигуры митоза.
В митотическом цикле базальных клеток можно выделить 4 фазы:
S — фаза, характеризующаяся синтезом ядерной ДНК; G2 — фаза
премитотическая, М — фаза деления, включающая в себя пре-
мета-, ана- и телофазу; G, — фаза постмитотического синтеза
ДНК fMontagna W., Parakkal Р. F., 1974]. Время прохождения
клеток через эпидермис от базального слоя до зернистого в норме
колеблется между 26—42 днями, а время прохождения через
роговой слой составляет около 14 дней. Смена всего эпидермиса
происходит в течение 59—65 дней. Следует отметить, что время
прохождения отдельных клеток может существенно варьировать.
Электронная микроскопия клеток базального слоя показывает,
что каждая клетка ограничена внешней клеточной мембраной,
поверхность которой неровная, складчатая, иногда с пальцеобраз-
ными выростами. Длина ядра базальных эпителиоцитов 5—10 мк,
ширина 3—4 мк. Они ограничены наружной и внутренней мембра-
нами, содержат одно или два ядрышка (диаметр до 1 мк) с не-
ровными контурами, состоящие из компактно расположенных
28
Рис. 1. Клетка базального слоя эпидермиса, в цитоплазме которой
большое количество гранул меланина (М). X 20 000.
плотных гранул и нуклеолонем. В цитоплазме базальных эпи-
телиоцитов значительное количество органоидов [митохондрии,
эндоплазматическая сеть, комплекс Гольджи (внутриклеточный
сетчатый аппарат), рибосомы, центриоли, лизосомы], а также спе-
цифических для них структур (тонофиламенты, диаметр 8—10 нм;
гранулы меланина, капли жира). Тонофиламенты складываются в
пучки (тонофибриллы), располагаются в трех направлениях:
вокруг ядра, по длине клетки и по направлению к ее мембране,
заканчиваясь в зоне десмосом. Меланин в этих клетках находится
в виде комплекса меланосом, представляющих собой округлые
образования диаметром 0,5—1 мк, состоящие из группы мелано-
сом и гранулярного матрикса, окруженные мембраной (рис. 1).
Меланосома представляет собой электронно-плотное образование
удлиненной формы, иногда состоит из многочисленных сфериче-
ских гранул. Контакты между клетками, или десмосомы, имеют
семислойное строение. Они образованы двумя «дисками прикре-
пления», разделенными электронно-прозрачной зоной. В средней
части зоны определяется межклеточный контактный слой, или
центральная пластинка (толщина около 5 нм). По обеим сторонам
межклеточного контактного слоя располагаются менее плотные
промежуточные слои, или наружный слой цитоплазмы. Особенно-
стью клеток шиповатого слоя (рис. 2), в частности его верхних
отделов, является наличие в цитоплазме кератиносом, или телец
Одланда. Располагаются они преимущественно в периферических
отделах цитоплазмы, иногда в межклеточных промежутках.
29
Рис. 2. Клетка шиповатого слоя.
ТФ — тонофиламенты, Д — десмосомы. X 14 400.
Внутренняя их структура представляет собой чередование элек-
тронно-плотных и электронно-прозрачных линий. В последние го-
ды в этих тельцах выявлена активность некоторых ферментов:
кислой фосфатазы, нуклеозидфосфатазы, арилсульфатазы, неспе-
цифической эстеразы [Wolff-Schreiner Е. С., 1977], что прибли-
жает их сущность к лизосомам.
Зернистый, или поверхностный, слой может иметь различную
толщину; она зависит от толщины рогового слоя. Например, в
коже ладоней и подошв толщина зернистого слоя составляет от
3 до 10 рядов клеток. Клетки зернистого слоя имеют форму вытя-
нутого ромба, ядра их располагаются в центре. Последние округ-
лой или овальной формы, уплощены, интенсивно окрашиваются
гематоксилином; хроматин в них под световым микроскопом почти
неразличим. В цитоплазме зернистых клеток находятся керато-
гиалиновые гранулы, различной формы и величины, интенсивно
окрашивающиеся гематоксилином, число которых варьирует в
зависимости от толщины рогового слоя. В большом количестве они
находятся в эпидермисе ладоней и подошв.
При электронно-микроскопическом изучении этого слоя эпи-
дермиса обнаруживается уменьшение межклеточных промежутков
по сравнению с нижележащими слоями, а толщина внешних кле-
точных мембран увеличена до 10—20 нм. Ядра имеют пикнотич-
ный вид с глубокими инвагинациями ядерной оболочки. Ядрышки
округлой формы, имеют ровные контуры, компактно заполнены
30
Рис. 3. Клетка зернистого слоя.
ГК — гранулы кератогиалина, РЧ — роговая чешуйка. X 20 000
гранулярным содержимым. Органоиды в этих клетках выражены
слабее, менее выражена и система тонофиламентов. Гранулы
кератогиалина неправильной формы,. иногда разветвленные, диа-
метром 0,2—0,7 мкм, гомогенные или зернистого вида. Часто они
связаны с пучками тонофиламентов (рис. 3). Химический анализ
этих гранул показал, что 99 % составляют протеазы, остальную
часть липиды и карбогидразы [Jessen Н. et al., 1976]. Происхож-
дение кератогиалиновых гранул не совсем ясно. По данным
Е. В. Виноградовой, И. Н. Михайлова (1974), а также J. Karasek
и соавт. (1974), в образовании кератогиалиновых гранул прини-
мает участие ядро зернистых клеток. Кроме кератогиалиновых
гранул, в цитоплазме зернистых клеток находится большое коли-
чество кератиносом, контактирующих с клеточной мембраной, а
также свободно лежащих в межклеточных промежутках, особенно
на границе зернистого и рогового слоев.
Как гистологическое, так и электронно-микроскопическое ис-
следования показывают четкий переход клеток зернистого слоя в
роговой. Роговой слой отделен от зернистого мембраной (ее тол-
щина до 20 нм), в которой к внутреннему слою клеточной мембра-
ны прилежит уплотненная зона («marginal band»).
Роговые чешуйки являются результатом полной кератинизации
клеток; ядер не имеют, окрашиваются эозинофильно, между ними
можно видеть редуцированные десмосомы. Роговое вещество со-
стоит из нерастворимого белка — кератина, в который входят цис-
тин, аргинин, лизин и гистидин. В роговом слое обычно обнаружи-
31
ваются липиды, играющие роль в выполнении барьерной функции
этого слоя. Толщина рогового слоя на различных участках различна
(9—14мкм). Наибольшей толщины (до 600 мкм) он достигает в
эпидермисе ладоней и подошв. У мужчин толщина рогового слоя
больше, чем у женщин, с возрастом она уменьшается. Роговые че-
шуйки в нижних и средних отделах рогового слоя плотно прилежат
друг к другу, ближе к поверхности они расположены более рыхло и
легко слущиваются.
Под электронным микроскопом видно, что роговые чешуйки
окружены клеточной мембраной (толщина 10—15 нм), их контуры
неровные, друг от друга отделены промежутками, ширина которых
20—30 нм. Между собой роговые чешуйки соединены редуциро-
ванными десмосомами, не имеющими четкого строения. В зависи-
мости от характера распределения кератина в роговых чешуйках
роговой слой можно разделить на 3 отдела: базальный, промежу-
точный и поверхностный. В базальном отделе чешуйки заполнены
компактно волокнистым материалом, в промежуточном и поверх-
ностном наряду с волокнистым кератином выявляются участки
низкой электронной плотности, увеличивающиеся в размерах по
направлению к поверхности. Вопрос об участии отдельных клеточ-
ных компонентов в образовании различных видов кератина до сих
пор дискутируется. A. G. Matoltsy и соавт. (1974) на основании
применения комплекса методов (электронно-микроскопического,
химического, биохимического) пришли к выводу, что в образова-
нии аморфного кератина принимает участие аморфный компо-
нент кератогиалиновых гранул, а тонофиламенты участвуют в
создании кератиновых фибрилл.
Кроме эпителиальных клеток, в эпидермисе имеются дендрити-
ческие клетки: меланоциты, клетки Лангерганса, или внутриэпи-
дермальные макрофаги.
Меланоциты, составляющие 10—25 % всех клеток базального
слоя, имеют светлую окраску и темные ядра. Однако не все мела-
ноциты можно отличить от клеток эпидермиса рутинными мето-
дами, а поэтому существует метод Bloch (ДОФА-реакция) и
импрегнация серебром по методу Массона—Фонтаны. Под элек-
тронным микроскопом меланоциты выглядят отростчатыми клет-
ками, не имеющими десмосом, в результате чего они свободно
распределяются среди эпителиоцитов, отделены от последних
промежутками шириной около 15 нм (рис. 4). Их отростки очень
длинные, простираются между эпителиоцитами на большое рас-
стояние. Ядро меланоцита округлой или неправильной формы с
неравномерным распределением гетерохроматина, сконцентриро-
ванного у ядерной оболочки. Цитоплазма содержит многочислен-
ные митохондрии с четкой структурой крист, хорошо развитую
эндоплазматическую сеть, комплекс Гольджи, много рибосом и
полисом, пиноцитозных пузырьков, а также цитоплазматических
филаментов, расположенных диффузно. Гранулы меланина распо-
лагаются в основном в отростках в виде меланосом — электронно-
плотных образований, ограниченных мембраной. В зависимости от
32
Рис. 4. Меланоцит. X 14 400.
стадии развития меланина структура меланоцита изменяется. Про-
цесс синтеза меланина, по данным электронной микроскопии,
представляется следующим образом [Fitzpatrick Т. В. et al., 1980].
В рибосомах синтезируется фермент — тирозиназа, который через
эндоплазматическую сеть перемещается к зоне Гольджи (пластин-
чатый комплекс), где появляются конденсаты аморфного веще-
ства, дающие начало образованию премеланосом. Затем вещество
последних уплотняется, они превращаются в электронно-плотные
гранулы — меланосомы. В момент активного синтеза в цитоплазме
меланоцита увеличивается число цитоплазматических фибрилл,
особенно в отростках, участвующих в передаче меланина клеткам
эпидермиса [Imbow К., Fitzpatrick Т. В., 1975]. Механизм пере-
дачи меланина эпидермоцитам описан в работах 3. М. Гетлинг
(1969), Р. A. Riley (1978), заключающийся в фагоцитозе гранул
меланина с частью отростка меланоцита клетками эпидермиса.
Клетки Лангерганса, или эпидермальные макрофагоциты, при
рутинных методах окраски представляются как «светлые» клетки,
что придает им сходство с меланоцитами. При импрегнации хлор-
ным золотом они имеют дендритическую форму, так же как и при
окраске цинк-йодид-осмием [Niebauer G. et. al., 1969]. В их цито-
плазме выявляются ферменты: АТФаза, аденозинтрифосфатаза,
аминопептидаза, холинэстераза, неспецифическая эстераза, ще-
лочная и кислая фосфатаза [Wolff К., 1972]. При электронной
микроскопии этих клеток выявляется характерное зубчатое ядро с
равномерными уплотнениями хроматина вблизи ядерной оболочки.
В цитоплазме клеток, кроме митохондрий, хорошо развитого
2—936
33
Рис. 5. Часть цитоплазмы клетки Лангерганса, в которой видны органоиды
и специфические гранулы Лангерганса (ГрЛ). X 23 000.
комплекса Гольджи, рибосом и вакуолей, выявляются характерные
для них гранулы в виде палочек с пузырькообразными образова-
ниями на конце (рис. 5). В удлиненной части этих палочек, посре-
дине идет плотная линия с периодической поперечной исчерчен-
ностью. Природа этих гранул полностью не выяснена. A. S. Breath-
nach (1980) предполагает, что они происходят из пузырьков
комплекса Гольджи, однако есть факты близкого их расположения
к клеточной мембране, из которой они также могут происходить
[Takahash S., Hashimoto К., 1985].
В настоящее время имеются данные, указывающие на мезен-
химальное происхождение клеток Лангерганса. По данным К. Та-
maki и соавт. (1980), предшественник этих клеток находится в
костном мозге. Функционально они считаются интраэпидермаль-
ной системой; некоторые же авторы связывают их функцию с
иммунологическими процессами, так как они имеют на своей по-
верхности рецепторы для Fc части иммуноглобулина G и для
комплемента Сз [Katz S. J., 1980]. Эти клетки имеют на своей
поверхности la (HLA-DR)-молекулы, которые определяют их
антигенные свойства, играющие роль в начальных фазах иммун-
ного ответа [Nordlund J., Ackles А., 1981].
Дермо-эпидермальное соединение (субэпидермальная зона)
при окраске гематоксилином и эозином почти не видно, ЩИК-
реакция показывает здесь ярко-малинового цвета полоску гомо-
генного вида, толщина которой 0,5— 1 мкм, что связано с наличием
34
в ней нейтральных мукополисахаридов. Импрегнация серебром вы-
являет здесь сеть ретикулярных волокон. Если эту зону рассмат-
ривать под электронным микроскопом, то можно увидеть, что она
состоит из нескольких компонентов: клеточной мембраны базаль-
ных эпителиоцитов и ее специализированных участков — полу-
десмосом, базальной пластинки (lamina densa), светлой пластинки
(lamina lucida) и фиброретикулярной пластинки. Плотная базаль-
ная пластинка представляется волокнистой (толщина 25—60 нм),
располагается непосредственно под клеточной мембраной базаль-
ных эпителиоцитов, повторяя все изгибы нижней поверхности
эпидермиса. Электронно-микроскопическое исследование ее с
помощью рутениевого красного показало, что здесь выявляются
гликозаминогликаны [Гетлинг 3. М., 1976]. Базальная мембрана
состоит из коллагеновых белков и неколлагеновых гликопротеидов
| Briggaman R. А., 1981]. Светлая пластинка, ширина которой
30 нм, состоит из тонких филаментов, соединяющих базальную
мембрану с клеточной. В этих местах обнаруживаются электронно-
плотные пластинки, длина которых 30—100 нм, а толщина 10—
15 нм; они располагаются вдоль клеточной мембраны базальных
эпителиоцитов на расстоянии 50—200 нм друг от друга. Эти
образования состоят из двух электронно-плотных слоев, разде-
ленных зоной низкой электронной плотности, в центре которой
проходит менее плотная линия, т. е. имеют ту же структуру, что
и десмосомы, но с половинным числом слоев, в связи с чем образо-
вания и получили название полудесмосомы [Wilgram G. Т. et. al.,
1964]. Фиброретикулярная пластинка состоит из тонких коллаге-
новых фибрилл, пучками подходящих к базальной мембране,
называемых крепящими фибриллами.
ДЕРМА
Как известно, основную массу дермы составляет волокнистая
субстанция, состоящая из коллагеновых, эластических и ретику-
линовых волокон, среди которых находятся клеточные элементы.
Основное вещество дермы представляет собой аморфную суб-
станцию, пропитанную тканевой жидкостью. Оно состоит из раз-
личных мукополисахаридов, преимущественно из гликозаминогли-
канов, находящихся в соединении с белками. Аморфное вещество,
в частности мукополисахариды, белки и сульфатированные поли-
сахариды, вырабатываются фибробластами, гистиоцитами и ткане-
выми базофилами. Наиболее важными гликозаминогликанами,
содержащимися в основном веществе, являются гиалуроновая кис-
лота и хондроитинсерная (А, В, С), кератосульфат, хондроитин
и т. д. Гликозаминогликаны в норме обнаруживаются при окраске
голуидиновым синим в сосочковом слое дермы, непосредственно
под эпидермисом, а также по ходу сосудов и придатков кожи.
В основном веществе находятся также гликопротеиды, выявляемые
ШИК-реакцией. Гликопротеиды и гликозаминогликаны благодаря
изменениям пептидов переходят в форму высокомолекулярных
35
комплексов. Эти протеин-полисахаридные комплексы, называемые
протеогликанами [Winand R., 1972|, влияют на механические
свойства соединительной ткани, а также участвуют в ее репара-
тивной функции [Шехтер А. Б., 19811. Основное вещество имеет
большей частью однородный вид низкой электронной плотности.
Только в отдельных участках выявляется гранулярное или фиб-
риллярное строение.
Коллагеновые волокна в дерме располагаются в виде пучков.
В сосочковом слое дермы пучки тонкие, в небольшом количестве
располагаются перпендикулярно поверхности эпидермиса, а в сет-
чатом слое они толще и располагаются преимущественно парал-
лельно поверхности эпидермиса. Основу коллагеновых волокон
составляет коллаген — сложный белок, относящийся к классу
склеропротеинов. Коллагеновые волокна окрашиваются кислыми
красками — эозином и кислым фуксином в ярко-красный цвет,
гликозаминогликаны в нормальных условиях в них не выявляются,
но выявляется значительное количество гликопротеинов, особенно
в субэпидермальных отделах и сетчатом слое дермы. Под элек-
тронным микроскопом коллагеновые волокна представляются
состоящими из коллагеновых фибрилл (диаметр 45 — 50 нм),
связанных между собой цементирующим веществом. Каждая
фибрилла имеет поперечную исчерченность, представляющую со-
бой чередование электронно-плотных и электронно-прозрачных
линий (стриаций), расположенных определенными периодами
(микропериоды), ширина которых 64 67 нм. Число полос в каж-
дом микропериоде может доходить до 1 4 | Breathnach A. S., 1971 |.
Эластические волокна при обычных методах окраски не видны.
Они окрашиваются в темно-фиолетовый цвет резорцин-фуксином.
в буровато-черный цвет орсеином, состоят из 2 компонентов:
белковых комплексов и содержащих серу мукополисахаридов
(хондроитинсульфата В). На электронограммах эластическое во-
локно состоит из аморфной части низкой электронной плотности
и электронно-плотных фибрилл, располагающихся параллельно
друг другу. Аморфная часть идентична эластину, а филаментоз-
ная часть — гликопротеинам (Volpin D.. 1980].
Кроме коллагеновых и эластических волокон, в дерме выяв-
ляются ретикулярные волокна, которые располагаются преимуще-
ственно субэпидермально вокруг сосудов, сальных и потовых
желез, а также волосяных фолликулов. Они не окрашиваются
обычными методами, а имирегнируются нитратом серебра. Они
состоят из тонких коллагеновых фибрилл (диаметр 0,2--50 нм),
заключенных в аморфный матрикс, как правило, связаны с колла-
геновыми волокнами. Они так же, как и коллагеновые волокна,
имеют поперечную исчерченность с периодом повторяемости, ана-
логичным таковому у последних.
Клеточные элементы в основном представлены фиброцитами,
фибробластами, в меныпей степени гистиоцитами, тканевыми ба-
зофилами, плазматическими и лимфоидными клетками.
Фиброциты и фибробласты имеют различную функциональную
36
Рис. 6. Фибробласт, в цитоплазме которого хорошо развитая гранулярная
эндоплазматическая сеть (ЭС) и комплекс Гольджи (КГ). X 13 370.
характеристику, т. е. фибробласты более активные. В цитоплазме
большинства фибробластов РНК содержится в небольшом коли-
честве, однако в местах пролиферативной активности (вокруг
сосудов, волосяных фолликулов, потовых желез) выявляется в
значительном количестве. Длина фибробласта 15—20 мк, он имеет
очень крупное ядро, в нуклеоплазме которого большое число
нуклеопротеидных компонентов в виде гранул и нитчатых струк-
тур, а также интерхроматиновых гранул высокой электронной
плотности, содержащих РНК. В цитоплазме содержатся мито-
хондрии, имеющие четкую структуру крист, хорошо развитая
гранулярная эндоплазматическая сеть, комплекс Гольджи, рибосо-
мы и полисомы (рис. 6). Характерная черта в структуре фибро-
бластов — наличие в их цитоплазме фибрилл. На поверхности этих
клеток находятся рецепторные белки и гликолипиды. Они синте-
зируют и выделяют гликозаминогликаны, что хорошо видно при
обработке срезов рутением красным. Большинство авторов счи-
тают, что на гранулярной эндоплазматической сети образуются
молекулы тропоколлагена, которые, соединяясь с мукополисаха-
ридами в комплексе Гольджи, образуют молекулы коллагена,
выводящиеся из фибробласта в окружающую среду, в которой
37
происходит сборка первичных фибрилл коллагенового волокна.
Гистиоциты, или оседлые макрофагоциты, находятся в неболь-
шом количестве среди фибробластов по ходу сосудов вокруг
придатков кожи и являются более активными по сравнению с
последними. Гистиоциты имеют различную морфологическую кар-
тину в зависимости от их дифференцировки в том или ином
направлении: фагоцитирующие i истиоциты, или макрофагоциты,
гистиоциты, синтезирующие белки, и гистиоциты, наделенные спе-
циальной функцией секреции или накопления. Эти разновидности
гистиоцитов могут переходить из одной в другую. Гистохими-
ческое исследование показывает, что в цитоплазме гистиоцитов,
особенно синтезирующих белки, имеется значительное количество
РНК. В цитоплазме гистиоцитов, имеющих выраженную фагоци-
тарную деятельность, могут находиться гранулы гемосидерина,
фосфолипиды, липопротеиды, гликоген, липофусцин, иногда ме-
ланин. Ввиду того что гистиоциты представляют собой активную
лабораторию, в их цитоплазме выявляется активность большого
количества ферментов.
Гистиоцит имеет вид клетки неправильной формы с много-
численными псевдоподиями, крупным ядром, глубокими инваги-
нациями ядерной оболочки с равномерным распределением хро-
матина. В цитоплазме, кроме органоидов обычного типа, отмеча-
ются лизосомы и фаголизосомы, особенно при выраженной фаго-
цитарной активности, пиноцитозные пузырьки и вакуоли. Иногда
можно видеть специфические гранулы Лангерганса.
Тканевые базофилы, или тучные клетки, в дерме локализуются
обычно по ходу кровеносных сосудов, вокруг капсул волосяных
фолликулов в строме потовых желез, а также свободно преимуще-
ственно в верхней половине дермы и в ее сосочковом слое. Осо-
бенностью тканевых базофилов является наличие в их цито-
плазме специфических гранул, состоящих из комплексов основно-
го белка и гепарина, а также гистамина и серотонина, в связи с
чем они окрашиваются толуидиновым синим в красный цвет.
В них содержатся также фосфолипиды ILvnas В., 1978).
Из ферментов, имеющих непосредственное отношение к синтезу
гепарина, в тканевых базофилах найдены сульфаттрансферазы
IRingertz N. R., 1963], щелочная и кислая фосфатаза, АТФаза,
неспецифические эстеразы (Игошин Ю. М., 1976], моноаминоок-
сидаза, аминопептидазы и др. Ядро этих клеток округлой формы
с неравномерным распределением хроматина (сгущения вблизи
ядерной мембраны). Структура специфических гранул зависит от
функционального состояния клетки, а также от степени ее зрело-
сти (рис. 7). Одни из них — электронно-плотные, компактного
вида, другие имеют четкую внутреннюю структуру гранулярного
или ламеллярного характера, а также смешанного строения с
кристаллоидными включениями. Подобное разнообразие гранул
тканевых базофилов, возможно, связано с разными стадиями их
созревания или с характером содержимого. По мере созревания
тканевых базофилов выявляются признаки дегрануляции, которая
38
Рис. 7. Тканевый базофил, содержащий большое количество секреторных
гранул. X 4800.
может происходить либо путем выброса клеткой целых гранул
вместе с участками цитоплазмы, либо путем растворения их в
самой цитоплазме с последующим выведением растворенного
вещества за пределы клетки.
Плазматические клетки в нормальной коже встречаются редко,
в виде единичных клеток около сосудов. Они довольно крупные,
овальной формы с округлым, эксцентрически расположенным
ядром. Цитоплазма базофильна, ШИК-положительна в результате
накопления в эндоплазматической сети у-глобулинов. В связи с
синтезом протеинов очень много РНК. Электронная микроскопия
показала характерное расположение ядра в цитоплазме, хроматин
которого находится в виде уплотнений вблизи ядерной оболочки.
Из всех мезенхимальных элементов плазматические клетки имеют
наиболее развитую гранулярную эндоплазматическую сеть, кото-
рая занимает всю цитоплазму, располагаясь концентрическими за-
витками, кроме перинуклеарного пространства.
Лимфоциты представляют собой небольшие клетки округлой
формы, имеющие округлое ядро, размером 7—9 мкм, содержащее
большое количество хроматина. В зависимости от типа реакций
(клеточного или гуморального иммунитета) различают Т-лимфо-
циты, обусловливающие клеточный тип иммунных реакций, и
В-лимфоциты, обусловливающие гуморальный тип иммунного от-
39
вета. С помощью растрового электронного микроскопа и метода
дифференциального интерференционного контраста в цвете обна-
ружено морфологическое различие Т- и В-лимфоцитов: поверх-
ность Т-лимфоцитов гладкая, а В-лимфоцитов ворсинчатая. При
обычной электронной микроскопии Т-лимфоциты содержат боль-
шое количество лизосом, а В-лимфоциты — развитую эндоплаз-
матическую сеть. Однако для более точной идентификации раз-
личных типов лимфоидных клеток необходимо использование
иммуноморфологических методов [Shelby М. G. et al., 1983].
Сосуды кожи в виде поверхностного (сосочковый слой) и
глубокого сплетений (на границе с подкожной клетчаткой) содер-
жат небольшое количество ШИК-положительных, диастазорезис-
тентных веществ, сульфгидрильных групп и РНК. Эндотелий сосу-
дов способен к фаго- и пиноцитозу, обусловливая явления про-
ницаемости, в нем обнаруживается активность многих ферментов,
в частности ферментов энергетического обмена, а также активность
неспецифических эстераз и холинэстеразы.
Что касается системы микроциркуляции кожи, то она пред-
ставляет собой соединение нескольких взаимодействующих друг
с другом компонентов сосудистой системы. A. Jen, J. М. Braverman
(1976) в микроциркуляторном русле кожи выделяют артериальный
капиллярный сосуд, метартериолу, терминальную артериолу, арте-
риолу, венозный капиллярный сосуд, посткапиллярную, собира-
тельную и мышечную венулы. Согласно Т. J. Ryan (1975), в коже
по сравнению с другими органами преобладают капилляры арте-
риального типа, лишь в средних отделах дермы довольно часто
встречаются венулы и артериолы, в сосочковом же ее слое пре-
обладают артериальные сегменты капилляров.
Сосудистая стенка капилляров образована 2—3 эндотелиоци-
тами, соединенными между собой плотными межклеточными кон-
тактами типа zonula occludens или macula occludens. В этих сег-
ментах выявляют 2 типа эндотелиоцитов — светлые и темные,
что отражает их различное функциональное состояние [Чер-
нух А. М. и др., 1984]. В светлых эндотелиоцитах содержится мало
органоидов, но значительное количество цитоплазматических фиб-
рилл, играющих роль сократительных структур, цитоплазма —
низкой электронной плотности. Темные эндотелиоциты, напротив,
имеют много органоидов, рибосом, в результате чего их цито-
плазма кажется более электронно-плотной. По мнению В. М. Altu-
ra (1980), темные эндотелиоциты более активные и молодые.
Базальная мембрана артериальных сегментов представлена тонким
непрерывным слоем тонкофибриллярного вещества, шириной
0,08 мкм, непосредственно прилегающего к клеточной мембране
эндотелиоцитов. Снаружи базальная мембрана окружена слоем
аморфного материала, в который вплетаются коллагеновые фиб-
риллы, образуя базальный слой, по В. А. Шахламову (1971). В пе-
рикапиллярной зоне находятся фибробласты, лимфоциты, ткане-
вые базофилы и волокнистые образования.
Венозные сегменты капилляров так же, как и артериальные,
40
имеют выстилку из 2—3 эндотелиоцитов, соединенных между
собой запирающими зонами. Структура эндотелиоцитов анало-
гична структуре артериальных сегментов, но отличается от послед-
них большим количеством пиноцитозных пузырьков, концентри-
рующихся чаще на люминальной поверхности эндотелиоцитов.
Темные эндотелиоциты встречаются в артериальном сегменте, что
связано с более интенсивным обменом веществ. Базальная мембра-
на этих сегментов образует на отдельных участках несколько сло-
ев. Перителиальные элементы имеют такое же строение, как и. в
артериальных сегментах.
Прекапиллярные артериолы характеризуются преобладанием
эндотелиоцитов с небольшим количеством органоидов (светлые
эндотелиоциты) и однослойной базальной мембраной, кнаружи от
которой располагаются миоциты.
Прекапиллярные венулы отличаются от венозных капилляров
более широким диаметром, наличием нескольких слоев перицитов
и большей шириной базального слоя. Эндотелиоциты в них имеют
в основном темную окраску, содержат большое количество орга-
ноидов и пиноцитозных пузырьков, что указывает на участие этого
звена микроциркуляторного русла в обменных процессах.
Нервы кожи из крупных стволов, расположенных по ходу
кровеносных и лимфатических сосудов, вступают через фасцию в
подкожную клетчатку, где образуют крупное сплетение. От послед-
него они идут в дерму, образуя глубокое сплетение, от которого
в свою очередь нервные волокна направляются в сосочковый слой,
образуя там поверхностное сплетение, иннервирующее сосуды и
придатки кожи.
Нервные стволы построены по общему типу, т. е. сверху покры-
ты соединительнотканной оболочкой — эпиневрием, от которого
вглубь идут прослойки периневрия, а затем эндоневрия, окру-
жающего каждое нервное волокно.
Нервные волокна состоят из осевых цилиндров (аксонов) и
шванновских оболочек. Различают мякотные (миелиновые) и без-
мякотные (немиелиновые) волокна. Если рассматривать аксон под
электронным микроскопом, то можно увидеть, что он состоит из
аксолеммы и аксоплазмы. Аксоплазма светлая, содержит большое
количество энзимов, протеинов и фосфолипидов; в ней распола-
гаются нейрофиламенты, аксоплазматические пузырьки, митохонд-
рии и элементы эндоплазматической сети (рис. 8). Аксоплазма-
тические пузырьки имеют различное строение: одни из них пред-
ставляют собой агранулярные образования, другие имеют элект-
ронно-плотный центр. Пузырьки первого типа G. Niebauer(1980)
относит к холинергическим, а второго типа — к адренергическим.
Аксолемма, или оболочка аксона, представлена шванновскими
клетками. Один или несколько аксонов располагаются на по-
верхности шванновской клетки в изолированных углублениях,
образующихся от вдавления этими аксонами, которые благодаря
этому имеют соответствующую дупликатуру клеточной оболочки,
или мезаксон.
41
Рис. 8. Немиелинизированное нервное волокно.
А — аксоны, Мз — мезаксоны. X 13 300.
Мякотные нервные волокна отличаются от безмякотных нали-
чием миелиновой оболочки. Если рассматривать миелиновую обо-
лочку на электронограммах, то можно увидеть, что она имеет
слоистое строение с определенной периодичностью. На попереч-
ных срезах это концентрически расположенные электронно-плот-
ные линии (толщина 4 нм), чередующиеся с электронно-прозрач-
ными (толщина до 10 нм). В центре электронно-прозрачных ли-
ний в свою очередь проходят плотные линии, толщина которых
2—3 нм. Плотные осмиофильные слои соответствуют слоям белка,
а электронно-прозрачные — слоям липидов [De Robertis Е. Р. et.
al., 1965]. Оболочка миелинизированного волокна через опреде-
ленные промежутки прерывается. Место перерыва называется
перехватом Ранвье, а участок между двумя близлежащими пере-
хватами — междоузлием.
Кожные рецепторы представляют собой концевые приборы
чувствительных (афферентных) волокон. Они воспринимают раз-
дражения из внешней среды, поэтому называются также экстероре-
цепторами. Отдельные виды рецепторов воспринимают различные
виды раздражений, в связи с чем их подразделяют на механорецеп-
торы, хеморецепторы, терморецепторы и болевые рецепторы
(ноцирецепторы). Морфологически рецепторы кожи подразделяют
на свободные (разветвленные), занимающие иногда большие
участки ткани, и инкапсулированные.
42
Свободные нервные окончания являются самыми важными в
функциональном отношении, они многочисленны, представлены во
всех отделах дермы короткими и длинными веточками, сопро-
вождающимися шванновскими клетками. Источником подобных
рецепторов являются безмякотные нервные волокна. В месте раз-
ветвления на терминали их оболочка исчезает, в дерме остаются
свободно лежать «голые» аксоны. Свободные нервные окончания
могут иметь вид свободных терминалей, кустиков со сложными
арборизациями, встречающиеся чаще под эпидермисом. Большин-
ство подобных волокон является окончанием клеток Меркеля
(гладкая кожа конечностей).
Диски Меркеля представляют собой концевые аппараты, со-
стоящие из осязательного мениска и эпителиоцита. Последний
имеет вытянутую форму, располагается параллельно базальной
мембране эпидермиса, по размерам — крупнее клеток эпидермиса;
ядро располагается также параллельно поверхности кожи. Харак-
терной чертой этих клеток является содержание в их цитоплазме
осмиофильных гранул, диаметр которых 70—90 нм, располагаю-
щихся ближе к терминали нервного волокна.
Капсулированные нервные окончания по своей структуре
сходны. Все они состоят из внутренней колбы и окружающей ее
капсулы, имеют специфическую функцию.
Тельца Мейснера являются самыми распространенными кап-
сулированными нервными тельцами, располагающимися в большом
количестве в коже ладоней, особенно пальцев, в коже губ, век, по-
ловых органов, в сосках молочных желез, сосочках слизистой
оболочки языка, т. е. в тех местах, в которых выражена тактиль-
ная чувствительность. Они большей частью имеют вытянутую фор-
му (50Х 100 мкм), располагаются в сосочковом слое дермы, тесно
прилегают к базальной поверхности эпидермиса, соединяясь с ним
эластическими фибриллами. Внутренняя колба тельца представ-
ляет собой скопление клеток, располагающихся поперек тельца,
между которыми проходят тонкие веточки нервов в виде спирали,
заканчивающиеся вздутиями (рис. 9).
Колбы Краузе являются механорецепторами, встречаются в
субпапиллярном слое дермы кожи кистей рук, плеч, предплечий,
коже стоп и голеней. Структурно они состоят из внутренней колбы
в виде небольшого скопления вспомогательных клеток, среди
которых располагаются немиелинизированные нервные волокна,
являющиеся продолжением толстого миелинового волокна. Колба
окружена тонкой соединительнотканной капсулой.
Слизисто-кожные концевые тельца встречаются в верхней тре-
ти дермы, в местах перехода кожи в слизистые оболочки (губы,
язык, веки, перианальная область, наружные половые органы).
Они состоят из сети немиелиновых волокон, окруженных не пол-
ностью сформированной капсулой из вспомогательных клеток.
Тельца Фатера — Пачини локализуются в гладкой коже преи-
мущественно пальцев, наружных половых органов и сосков молоч-
ных желез. Их структура сложна. В центральной части тельца
43
Рис. 9. Тельца Мейснера в сосочковом слое кожи [Cauna W., Mannan J.
Comp. Neurol, 19611.
имеется нервное волокно, которое перед входом во внутреннюю
часть колбы теряет миелиновую оболочку, а затем в самом дисталь-
ном отделе образует клубок нервных ветвей. Нервная терминаль
окружена серией концентрических ламелл, отделенных друг от
друга промежутками, содержащими жидкость, коллагеновые фиб-
риллы, кровеносные сосуды и отдельные клетки. Капсула тельца
непрерывно переходит в эндоневральную оболочку афферентного
волокна.
ПРИДАТКИ КОЖИ
К придаткам эпителиального происхождения относят потовые
и сальные железы, а также волосы и ногти.
Потовые железы по механизму секреции подразделяют на
эккринные, или выделительные, секреция которых происходит без
гибели секреторных элементов, и апокринные, голокринового типа,
у которых в момент секреции разрушается часть секреторной
клетки.
Эккринные, или мерокриновые, потовые железы встречаются
во всех отделах кожного покрова, за исключением красной каймы
губ, кожи малых половых губ, головки полового члена и крайней
плоти. Особенно много их на коже ладоней и подошв, а также —
лба, груди, живота. Они состоят из концевого отдела, который
находится в сетчатом слое дермы на границе с подкожной клет-
чаткой, и выводного протока, идущего перпендикулярно эпидер-
44
Рис. 10. Концевой отдел эккриновой потовой железы; в цитоплазме
экриноцитов большое количество секреторных гранул. X 4800.
мису к поверхности кожи. Концевой отдел представляет собой
спирально закрученный клубочек, выстланный одним слоем куби-
ческих или призматических клеток (в зависимости от стадии
секреции). Различают светлые и темные экзокриноциты. Светлые
экзокриноциты содержат гликоген, а темные — диастазорезис-
тентные протеогликаны и сиаломуцин. Гистохимически в них
выявляется большое количество РНК, активность кислой фосфа-
тазы, карбоксилазы, моноаминооксидазы, фосфорилазы, р-глюко-
рунидазы, аминопептидазы, неспецифических эстераз, АТФазы,
а также ферментов энергетического обмена.
Электронная микроскопия показала, что темные экзокрино-
циты граничат своей поверхностью с просветом железы, она неров-
ная с многочисленными выростами и микровиллями. В местах
соединения этих клеток имеются канальцы и специализированные
контакты типа zonula occludens. Их ядра неправильной формы с
уплотнениями хроматина на периферии, в цитоплазме находятся
рибосомы, эндоплазматическая сеть, пластинчатый комплекс и
специфические для них структуры — секреторные гранулы, пред-
ставляющие собой вакуоли, окруженные мембраной, заполненные
содержимым средней или высокой плотности (рис. 10). Светлые
экзокриноциты лежат на миоэпителиоцитах или непосредственно
на базальной мембране, но иногда граничат с просветом же-
45
лезы. Их основание шире верхушки, между собой они образуют
сложные соединения, состоящие из нескольких слоев клеточных
мембран соседних клеток. В их ядрах равномерно распределен
хроматин, в цитоплазме, кроме органоидов, содержатся гликоген и
пигментные гранулы. Миоэпителиоциты, или контрактильные эле-
менты, лежат между основанием экзокриноцитов и базальной
мембраной. Их ядра удлиненной формы с неровными контурами,
расположены в апикальной части клетки, органоиды располага-
ются в перинуклеарном пространстве. Особенностью этих клеток
является наличие в их цитоплазме большого количества миофи-
ламентов. Концевой отдел эккринной железы окружен базальной
мембраной. Проток железы имеет дермальную и эпидермальную
части, открывается на вершине гребешков кожи. Диаметр потовой
поры колеблется от 60—80, а просветов — до 14—16 мкм. Дермаль-
ная часть протока состоит из двух слоев кубического эпителия с
базофильной цитоплазмой, лежащего на базальной мембране. Клет-
ки поверхностного слоя соединяются друг с другом десмосомами,
структура которых аналогична структуре таковых в эпидермисе.
Ядра клеток неправильной формы, в цитоплазме, кроме органоидов,
содержатся гликоген, лизосомы, микротрубочки. В апикальной час-
ти находится большое количество тонофиламентов. Базальные
клетки имеют удлиненную форму, лежат параллельно базальной
мембране, соединяются с поверхностными клетками десмосомами.
Эпидермальная часть протока выстлана одним слоем внутренних,
или люминарных, клеток и несколькими слоями наружных, соеди-
няющихся между собой десмосомами. Клетки того и другого слоя
имеют аналогичную структуру и соответствуют в основном струк-
туре клеток дермальной части протока, отличаясь наличием в них
тонофиламентов, а по мере приближения их к поверхности в них
появляются кератинисомы и кератогиалиновые гранулы. На уровне
зернистого слоя внутренние клетки полностью кератинизиро-
ваны.
Апокринные железы локализуются в подмышечных впадинах,
в коже половых органов и мошонки, в нижней части живота, на
лобке, в области молочных желез, в окружности ануса и в паховых
складках. Их концевые отделы получают развитие в пубертатном
периоде. Эти железы состоят, так же как и эккринные, из конце-
вого отдела, дермальной и эпидермальной частей протока. Конце-
вой слой апокринной железы состоит из одного слоя секреторных
клеток и слоя миоэпителиоцитов. Секреторные клетки крупные,
со светлой, слабобазофильной цитоплазмой, под электронным
микроскопом представляются с большим количеством микровил-
лей, удлиненными ядрами и выраженными органоидами, среди
которых находятся секреторные гранулы различных размеров и
электронной плотности, окруженные мембраной. Проток апокрин-
ных желез выглядит так же, как и проток эккринных желез.
Сальные железы представляются альвеолярными с голокрино-
вым типом секреции. Они имеются во всех участках тела, за ис-
ключением ладоней и подошв, могут быть связаны со структурами
46
волоса, но могут быть и не связаны (свободные сальные желе-
зы). Последние встречаются в ареоле сосков молочных желез,
малых половых губах, крайней плоти, могут встречаться на
головке полового члена, красной кайме губ, слизистых оболочках
щек и глаз в виде мейбомиевых желез. Секреторные отделы всех
сальных желез построены однотипно. В периферических частях
долек располагаются в один ряд мелкие, кубические клетки, от ко-
торых по направлению к центру располагается несколько рядов
секреторных клеток, имеющих полигональную форму. В ячейках
цитоплазмы последних содержится жир. По мере приближения
секреторных клеток к выводному протоку границы их становятся
нечеткими, размеры жировых ячеек увеличиваются, ядра становят-
ся бледнее, содержимое цитоплазмы однородным, выделяется в
проток в виде секрета. Секреторный отдел окружен базальной
мембраной, толщина которой 25—40 нм. В зависимости от стадии
секреции различают 3 вида клеток: недифференцированные, рас-
полагающиеся на периферии железы, частично дифференциро-
ванные и полностью дифференцированные клетки. Недифференци-
рованные клетки слегка уплощены, имеют ядра неправильной
формы, в которых неравномерно распределен хроматин, в цито-
плазме, кроме органоидов обычного типа, определяют гликоген и
небольшое количество капель жира. По мере развития секретор-
ного процесса в клетках уменьшается объем ядра и количество
органоидов, за исключением эндоплазматической сети. Размер
капель жира, их число, напротив, увеличиваются.
Проток сальной железы состоит из концентрически располо-
женных слоев кератинизированных клеток, в которых иногда
наблюдаются ядра, а цитоплазма заполнена волокнистыми струк-
турами.
Волосяной фолликул состоит из 3 частей: глубокой части,
идущей от сосочка до соединения с мышцей, поднимающей волос,
средней, или istmus, очень короткой части, идущей от соедине-
ния с мышцей, поднимающей волос, до входа протока сальной
железы, и верхней части, или infundibulum, идущей от входа про-
тока сальной железы до устья фолликула (рис. 11). Нижняя
часть фолликула состоит в свою очередь из следующих структур:
сосочка волоса, матрикса; волоса, состоящего из мозгового ^ве-
щества, коркового; кутикулы и корневого эпителиального влага-
лища.
Луковица волоса представлена недифференцированными эпи-
телиальными клетками, в которых происходит пролиферация кле-
ток, рост волоса и обновление клеток внутреннего корневого
влагалища. Электронная микроскопия показывает, что луковица
состоит из клеток, сходных по строению с клетками базального
слоя эпидермиса, отделенных от сосочка базальной мембраной.
Наружное корневое влагалище имеет такое же строение, как и
эпидермис, и является его продолжением. Оно простирается по
направлению вверх от клеток матрикса волосяной луковицы до
входа протока сальной железы. Часть влагалища (от воронки во-
47
Стержень волоса
Рис. 11. Схема продольно-
го разреза волосяного
фолликула.
лосяного фолликула до места впадения протока сальной железы)
по своему строению идентична эпидермису, а ниже стенка его ста-
новится тоньше и ближе к луковице является однорядной, сли-
ваясь с клетками волосяной луковицы. В нижней части наружное
корневое влагалище не подвергается кератинизации. В противопо-
ложность поверхностному эпидермису и воронке фолликула, со-
держащих в базальном слое активные меланоциты, наружное кор-
невое влагалище содержит только инактивные меланоциты. В сред-
ней части фолликула, или истмусе, наружное корневое влагалище
не покрыто внутренним слоем и подвергается кератинизации. Этот
тип кератинизации обозначается как трихолеммальная кератини-
зация, продуцируются крупные, гомогенные кератинизированные
клетки без образования кератогиалина. Клетки внутреннего кор-
невого влагалища, так же как и наружного, друг с другом соеди-
няются посредством десмосом, расположены концентрически,
содержат большое количество трихогиалиновых гранул и тонофи-
ламентов.
Кутикула волоса состоит из 5—10 рядов плоских клеток,
располагающихся концентрически, содержащих ядра и большое
количество тонофиламентов. По мере ороговения этих клеток в их
цитоплазме появляется кератин. К кутикуле волоса прилежит его
корковое вещество, состоящее из большого количества кератини-
зированных клеток, имеющих, однако, ядра. Клетки мозгового
48
вещества располагаются в центре, начиная от луковицы и до конца
стержня, имеют неправильную форму, их ядра соединяются друг
с другом посредством десмосом. По мере ороговения этих клеток
их клеточные оболочки становятся извилистыми, появляются дист-
рофические изменения в ядрах и митохондриях. Меланоциты во-
лоса находятся в верхней части луковицы и наружном корневом
влагалище.
Клетки кутикулы содержат небольшое количество меланосом,
клетки внутреннего корневого влагалища его не содержат, а
в клетках наружного корневого влагалища меланин распреде-
ляется аналогично эпидермису.
Глава 3
ФИЗИОЛОГИЯ И БИОХИМИЯ НОРМАЛЬНОЙ КОЖИ
Кожа является очень сложным органом, выполняющим важные
функции по поддержанию гомеостаза, защищая организм от по-
вреждающего действия механических, физических, химических и
инфекционных агентов; при этом она обладает способностью опе-
ративно устранять возникшие повреждения при помощи процессов
эпителизации. Кожа способствует сохранению постоянной темпе-
ратуры тела, выводит с потом вредные для организма вещества,
но препятствует их попаданию внутрь; осуществляет дыхательную
функцию, поглощая кислород из воздуха и выделяя углекислый
газ; в ней происходят сложные биохимические и биофизические
процессы. Кожа является органом иммунологической защиты, а
огромное рецепторное поле кожи обеспечивает восприятие пери-
ферическим анализатором контакта с окружающей средой. Кожа
служит естественной и постоянной средой обитания для многочис-
ленных микробов, грибов и вирусов, их экологической пищей.
Масса кожи составляет примерно 17 % от массы тела, что делает
ее самым крупным органом человеческого организма, значение и
функциональные возможности которого пока недостаточно изуче-
ны и оценены.
ХИМИЧЕСКИЙ состав кожи
Кроме шести основных элементов (углерод, водород, азот, кис-
лород, сера и фосфор), из которых состоят белки, жиры и углево-
ды, для существования человеку необходимы многие другие хими-
ческие макро- и микроэлементы — кальций, натрий, калий, магний,
хлор, медь, фтор, йод, железо, молибден, селен, цинк и другие.
Все эти элементы принимают активное участие в регуляции водно-
электролитного и кислотно-основного равновесия, играют роль ка-
тализаторов или ингибиторов химических реакций, протекающих в
организме вообще и в коже в частности: в обмене белков, жиров,
углеводов, витаминов, минералов, в газо- и теплообмене, в процес-
сах тканевого дыхания, проницаемости, клеточного деления, им-
муногенеза.
Кожа человека на 69—73 % состоит из воды; у человека, масса
тела которого 70 кг, в коже содержится приблизительно 8 кг воды.
По обеспеченности водой кожа стоит на втором месте в организме
(вслед за мускулатурой). Вследствие большого различия в струк-
туре и функциях различных слоев кожи они резко отличаются
между собой по содержанию воды: в эпидермисе — 10 %, в ба-
50
зальном слое — 71—72 %, в ретикулярном слое — 61 % [Stiit-
tgen G., Schaefer H., 1974].
Количество воды в дерме зависит от общего обмена воды в
организме и поэтому может колебаться в значительных пределах.
Под воздействием факторов, влияющих на содержание воды в
организме (голод, жажда, обильный диурез, усиленное потоотделе-
ние), в первую очередь страдают запасы воды в коже, хотя мышцы
лучше обеспечены водой (Morsches В., 1980].
Разнообразные биологические функции воды связаны с ее фи-
зическими и физико-химическими свойствами (Buddecke Е„ 1971]:
вода является растворителем низкомолекулярных субстанций, со-
ставной частью макромолекул, субстратом или продуктом фермен-
тативных реакций, выполняет важную роль в процессах терморегу-
ляции. За пределами клеток вода служит транспортным средством,
например в системе кровообращения.
Значительная часть внутриклеточного обмена веществ протека-
ет в водных растворах, причем сама вода принимает участие в этих
химических реакциях.
Вода в силу своих физических свойств не является однородной
субстанцией. В молекуле Н2О две пары электронов кислорода не-
сут отрицательный заряд и обусловливают электростатическое
притяжение между данной молекулой воды и атомами водорода
соседних молекул. Структурированные в виде тетраэдров молекулы
воды образуют ассоциации молекул (кластеры), сходные со струк-
турой льда. Эти свойства воды важны для понимания причин хоро-
шей или плохой растворимости различных химических веществ в
воде, содержащейся в биологических жидкостях организма и тка-
нях. Поскольку молекула Н2О является диполем вследствие своей
асимметрии, в ней хорошо растворяются те органические соедине-
ния, которые содержат полярные группы и способны вступать в
диполь-дипольные взаимодействия с молекулами воды или образо-
вывать с ними водородные связи. Таковы, в частности, группы
—ОН, —NH2, >С=О. Напротив неполярные молекулы углево-
дородов плохо или совсем не растворяются в воде ] Деев А. И.,
1983].
Химические элементы, как и вода, являются составной частью
внутренней среды организма. Постоянство ионного состава и pH
жидкостей организма являются необходимым условием для нор-
мальной жизнедеятельности его клеток. Наиболее важное значе-
ние имеют следующие ионы: катионы — натрий, калий, кальций и
магний; анионы — хлорид и фосфат.
Натрий представляет собой основной внеклеточный катион в
организме человека. Вместе с К+ он играет важнейшую роль в
регуляции водно-электролитного и кислотно-основного равновесия.
Na“ содержится преимущественно в виде свободного катиона, но
может быть в форме хлората, бикарбоната или фосфата. В коже
натрий содержится в значительном количестве, преимущественно
в межклеточном пространстве, а внутри клетки его концентрация
ниже.
51
Калий является главным катионом внутриклеточного простран-
ства. Его общая концентрация в обезжиренной человеческой коже
составляет приблизительно 25 ммоль на 1 кг массы тела, причем
доля в эпидермисе выше, чем в дерме. По меньшей мере 75 %
калия локализовано в клетке.
Ионные градиенты натрия и калия создаются специальной
транспортной системой, называемой (Na" -|-К' )-насосом, по-
скольку движение этих ионов взаимосвязано. Активный транспорт
Na+ и К * имеет исключительное физиологическое значение, так
как градиенты этих ионов регулируют объем клетки, обеспечивают
электрическую возбудимость нервных и мышечных клеток и слу-
жат движущей силой для транспорта сахаров и аминокислот. Ак-
тивный транспорт Na~ и К обеспечивается энергией, получаемой
при гидролизе аденозинтрифосфата (АТФ), причем при гидролизе
одной молекулы АТФ происходит перенос трех ионов Na* и двух
ионов К [Страйер Л., 1985].
При воспалительных процессах в коже К* выходит за пределы
клетки и быстро диффундирует из межклеточного пространства,
что ведет к повышению его концентрации в крови. Na~ вследствие
гипотонического состояния клетки замещает вышедший оттуда ка-
лий. Соотношение концентраций Na:К, равное в нормальной коже
2,42, при экземе увеличивается до 2,83, а при пузырчатке, за
счет еще более сильного накопления натрия, — до 4,89 [Cavil I.,
1970, 1972|.
Нарушенный при дерматозах гомеостаз электролитов может
усугубляться самыми различными факторами — избытком или не-
достатком потребления жидкости, измененным уровнем минерало-
кортикоидов и глюкокортикоидов, гипо- или гипертиреозом, прие-
мом лекарственных препаратов (стероиды, антиметаболиты, диуре-
тики), эмоциональными стрессами.
Магний, как и калий, является внутриклеточным катионом.
В коже человека он локализуется преимущественно в эпидермисе.
Одна из главнейших биохимических реакций в организме — фос-
форилирование — катализируется киназами, для проявления актив-
ности которых необходим ион Mg2- [Страйер Л., 1985]. По тако-
му механизму идут начальные процессы гликолиза, в том числе и
в коже: глюкоза внутри клетки фосфорилируется с участием гёк-
сокиназы, в результате чего фосфорильная группа от АТФ
(в присутствии Mg2 или другого двухвалентного иона металла,
например Мп2 ) переносится к шестиуглеродным сахарам — гек-
созам.
Кальций в организме взрослого человека находится преимуще-
ственно в костях и зубах, причем общее количество этого элемен-
та достигает 1 кг. Содержание кальция в коже относительно
невелико, причем в дерме его больше, чем в эпидермисе. Среди
многочисленных функций кальция следует отметить его участие в
активации синтеза простагландинов — высокоактивных веществ,
обладающих свойствами гормонов. Повышенная внутриклеточная
концентрация Са2" активирует фосфолипазу Ао, что ведет к вы-
S2
свобождению из фосфолипидов ненасыщенных жирных кислот —
субстрата биосинтеза простагландинов [Мусил Я., 19851.
Фосфаты играют важную роль в биологических системах орга-
низма. Фосфор входит в состав костей, нуклеиновых кислот, нук-
леотидных коферментов и АТФ-АДФ-фосфатной системы, обеспе-
чивающей сохранение и превращение энергии в организме. Коли-
чество фосфатов в коже колеблется между 1,0—2,1 ммоль/кг.
Хлориды обнаруживают в коже в значительном количестве,
более чем в 2 раза превышающем содержание этого аниона в
мускулатуре. Биологическая значимость такого распределения
хлоридов в организме неизвестна. Можно полагать, что это явля-
ется средством защиты от патогенных микроорганизмов. В присут-
ствии миелопероксидазы (гемопротеида, локализованного в азуро-
фильных гранулах нейтрофилов и моноцитов, катализирующего
реакции между галогенами и НоОо) происходит взаимодействие
хлора с перекисью водорода.
С1- + h2o22HL-С1О- + н2о.
Под действием гипохлорита нарушаются структуры микробной
мембраны, что ведет к гибели микробов [Мусил Я., 1985].
К микроэлементам относят химические элементы, содержащие-
ся в организме в крайне малых количествах. Они подразделяются
[Schmid R.F., Thews G., 1986] на 3 группы.
1. Элементы, выполняющие какую-либо функцию в организме.
В частности, железо, необходимое для синтеза железо-порфири-
новых белков — гемоглобина, миоглобинов, цитохромов и цито-
хромоксидазы. Фтор и йод входят в состав гормонов щитовидной
железы. Медь, марганец, молибден, цинк и др. содержатся в
ферментных системах клетки.
2. Элементы, оказывающие токсическое действие, — свинец,
кадмий, ртуть, таллий, мышьяк и др. Большая часть таких элемен-
тов имеет особое значение для промышленной токсикологии.
3. Элементы, не выполняющие каких-либо физиологических
функций и не являющиеся необходимыми для организма, — бор,
серебро, теллур и др.
Функциональная роль в организме многих определяемых мик-
роэлементов остается либо совсем неизвестной, либо недостаточно
известной. С появлением чувствительных приборов эти исследова-
ния интенсивно развиваются. В частности, недавно стало известно,
что селен является составной частью фермента глутатионперокси-
дазы. Олово, никель, ванадий, хром и кремний необходимы для
нормального роста костей и соединительной ткани. Молибден
входит в состав простатической группы ферментов ксантиноксида-
зы и альдегидоксидазы.
С участием содержащихся в коже ферментов, гормонов, вита-
минов осуществляются многие виды реакций, направленные на
поддержание защитных функций кожи, на сохранение и регенера-
53
цию ее как органа, образование меланина, кожного сала, построе-
ние кератина волос и ногтей, синтез витамина D и другие про-
цессы.
Главным поставщиком энергии для биохимических реакций,
протекающих в коже, служит глюкоза. На долю кожи приходится
около 20 % углеводного обмена всего организма. В эпидермисе
содержится приблизительно 30—60 мг % глюкозы и 70—80 мг %
гликогена [Leonhardi G. et. al., 1980], являющегося резервным
полисахаридом — формой накопления глюкозы.
Для распада глюкозы расходуется лишь 10 % содержащегося
в коже кислорода, для катаболизма протеинов — 25—30 %. Боль-
шая часть кислорода используется для кислородзависимого рас-
пада жирных кислот. В основном гликолиз протекает анаэробно,
что ведет к получению богатых энергией фосфатидов. Источником
энергии в эпидермисе являются процессы аэробного гликолиза,
при котором глюкоза через цикл лимонной кислоты (цикл Кребса)
распадается на СО2 и Н2О. Связующим звеном между анаэробным
и аэробным путями распада глюкозы является пировиноградная
кислота, которая в присутствии кислорода вступает в цикл Кребса.
В состав белков кожи входят аминокислоты, различающиеся
своими углеродными скелетами. При катаболическом расщеплении
аминокислот образуется незначительное количество энергии, не
идущее в сравнение с энергией гликолиза или цикла лимонной
кислоты. Различные катаболические пути (на каждую аминокисло-
ту — свой) в дальнейшем сливаются, в результате чего образуются
продукты, вступающие в цикл лимонной кислоты и здесь окисляю-
щиеся до СОо и Н2О.
Углеродные скелеты десяти из 20 обычно присутствующих в
составе белков аминокислот разрушаются с образованием ацетил-
СоА, который включается в цикл лимонной кислоты. Пять из этих
десяти аминокислот расщепляются через пируват; другие пять
превращаются в ацетоацетил-СоА, а затем уже этот последний
расщепляется до ацетил-СоА [Ленинджер А., 1985].
Фрагменты углеродного скелета фенилаланина, тирозина, лизи-
на, триптофана и лейцина, превращение которых идет через
ацетил-СоА, представляют для дерматологии значительный инте-
рес. Особого внимания в этой группе заслуживают два катаболи-
ческих пути. Путь, ведущий от триптофана к ацетил-СоА, —
самый сложный в аминокислотном катаболизме животных тканей:
он включает 13 этапов. Некоторые промежуточные продукты ката-
болизма триптофана служат предшественником в биосинтезе дру-
гих важных биомолекул, например нейрогормона серотонина
или такого витамина, как никотиновая кислота. Таким образом,
путь, по которому идет катаболизм триптофана, имеет несколько
ответвлений, что создает возможность для образования ряда дру-
гих продуктов из единственного предшественника.
Второй важный для патогенеза ряда дерматозов путь — это
путь, ведущий от фенилаланина. Фенилаланин и продукт его
окисления тирозин распадаются на два фрагмента: оба они могут
54
вступать в цикл лимонной кислоты, хотя и на разных уровнях.
Четыре из девяти углеродных атомов фенилаланина и тирозина
дают свободный ацетоацетат, который затем превращается в аце-
тил-СоА. Второй четырехуглеродный фрагмент тирозина и фенила-
ланина превращается в фумарат — промежуточный продукт цикла
лимонной кислоты.
Три ферментативных этапа фенилаланин-тирозинового пути
особенно подвержены генетическим изменениям, что ведет к появ-
лению врожденных нарушений обмена.
Особое значение липидов для организма заключается в том,
что структурную основу биологической мембраны любой клетки со-
ставляет фосфолипидный биомолекулярный слой: он выполняет в
мембране функцию барьера для ионов и водорастворимых молекул
и функцию основы, матрицы для мембранных ферментов, рецепто-
ров и встроенных в мембраны белков, гликолипидор и гликопроте-
идов.
В эпидермисе из ацетил-СоА цитоплазматическим комплексом
ферментов синтезируются длинноцепочечные жирные кислоты.
Так, одна молекула ацетил-СоА и семь трехуглеродных молекул
малоновой кислоты в виде тиоэфира малонил-СоА последователь-
но соединяются друг с другом, в результате чего образуется 16-
углеродная пальмитиновая кислота и выделяется 7 молекул СО2
[Ленинджер А., 1985]. Жирные кислоты через эфиры и при по-
средстве глицерина превращаются в моно-, ди- и триглицериды.
Эпидермальные липиды имеют следующий жировой состав: сво-
бодные жирные кислоты — 20 %, триглицериды — 17 %, моно- и
диглицериды — 6 %, восковые эфиры — 8 %, сквален — 3 %, хо-
лестерин — 16 %, эфир холестерина — 6 %, парафин — 15 %,
фосфолипиды — 9 % [Leonhardi G. et al., 1980].
Липазы, входящие в состав эпидермиса, могут расщеплять
глицериды снова на глицерин и жирные кислоты с длинными
цепями. В животных клетках пальмитиновая кислота служит пред-
шественником других длинноцепочечных жирных кислот. Она мо-
жет удлиняться путем присоединения ацетильных групп, что ведет
к образованию стеариновой кислоты (18 атомов углерода) или
более длинных насыщенных жирных кислот. Этот процесс проте-
кает в эндоплазматическом ретикулуме и митохондриях. Пальми-
тиновая и стеариновая кислоты являются предшественниками
двух наиболее распространенных в тканях мононенасыщенных
жирных кислот: пальмитоолеиновой и олеиновой. В организме
животных олеиновая кислота не может превращаться в линолевую,
поэтому линолевая кислота является для них незаменимой жирной
кислотой. Линолевая кислота в свою очередь превращается в дру-
гие полиненасыщенные жирные кислоты, в частности в арахидо-
новую кислоту, и простагландины, оказывающие противовоспали-
тельное действие и тем самым играющие важную патогенетиче-
скую роль в развитии многих дерматозов.
Изменение количественного и качественного состава липидов
в зависимости от пола, возраста, времени года, локализации и
55
многих других причин имеет существенное значение для проницае-
мости кожи, а также для возникновения и течения ряда кожных
заболеваний.
Экстрацеллюлярная матрица дермы Состоит из фибриллярных
протеиновых коллагенов и эластина, а также протеогликанов, ко-
торые составляют основу кожи.
На долю коллагена приходится 70 % сухого веса кожи. Колла-
ген является основным элементом кожи, костей, сухожилий, хря-
ща, кровеносных сосудов, зубов. В настоящее время выделяют
5 типов коллагена, но, учитывая разные молекулярные формы
коллагена внутри одного типа, считают, что их существует не
менее десяти.
Кожа эмбриона относится к III типу коллагена, базальная
мембрана — к IV, кожа взрослых — к I типу коллагена [al (I) ] га2
[Страйер Л., 1984].
Коллаген Г типа содержится в организме в наибольшем коли-
честве. В молекуле коллагена примерно одна треть аминокислот-
ных остатков приходится на глицин, что необычайно много для
белков. Количество пролина в коллагене также значительно выше,
чем в большинстве других белков. Кроме того, в коллагене имеют-
ся две аминокислоты, крайне редко встречающиеся в белках: гид-
роксипролин и гидроксилизин.
Эластин обнаруживается в большинстве типов соединительной
ткани наряду с коллагеном и полисахаридами: в стенках сосудов
(особенно в области дуги аорты) и связках. В коже эластина отно-
сительно мало. При дефиците меди блокируется синтез альдеги-
дов, необходимых для образования поперечных связей в эластине
и коллагене.
Кожа богата также протеогликанами, которые состоят из поли-
сахаридных (95 %) и белковых (около 5 %) единиц. Эти полиани-
оны, имеющие очень большие размеры, связывают воду и катионы,
образуя основное вещество соединительной ткани. Полисахарид-
ные цепи протеогликанов, называемые гликозоаминогликанами,
построены из повторяющихся дисахаридных единиц, содержащих
производное аминосахара — глюкозамина или галактозамина. По
крайней мере один из сахаров в дисахариде имеет отрицательно
заряженную карбоксильную или сульфатную группу. Важнейшие
гликозаминогликаны — это гиалуронат, хондроитинсульфат, кера-
тансульфат, гепарансульфат и гепарин.
Протеогликаны действуют как молекулярное сито для веществ,
диффундирующих в экстрацеллюлярной матрице: малые молекулы
могут проникать через сетку, а большие задерживаются.
Незаменимость коллагена для существования самой кожи обус-
ловливает появление болезней и симптомов при нарушении синте-
за или метаболизма коллагена. Группа наследственных или приоб-
ретенных заболеваний, характеризующихся соединительнотканны-
ми нарушениями, включает различные болезни, имеющие среди
прочих и кожные проявления. К ним относится синдром Элерса —
Данло, cutis laxa, эластическая псевдоксантома и др. Под синдро-
56
мом Элерса — Данло известна целая группа нарушения структуры
коллагена I и III типов, связанная с уменьшением стабильности
коллагенового волокна.
ФИЗИОЛОГИЯ кожи
Являясь наружным покровом тела, кожа обладает специфиче-
скими свойствами, направленными на защиту организма от раз-
личных внешних воздействий.
Свет — непременная и обязательная часть окружающего нас
мира, источник тепла и энергии. Кроме солнечного света, человек
подвергается воздействию высокоэнергетического ультрафиолето-
вого излучения, лежащего за пределами видимого человеческим
глазом света (короче 400 нм). Энергия, которой обладают фотоны,
обратно пропорциональна длине волны, поэтому наибольший био-
логический эффект оказывают лучи в коротковолновой части
спектра.
Ультрафиолетовое излучение в зависимости от его физических
свойств и характера биологического действия на организм делят
на 3 отрезка: УФ-А — от 320 до 400 нм; УФ-В — от 290 до
320 нм; УФ-С — от 200 до 290 нм.
Лучи с длиной волны короче 290 нм практически полностью
поглощаются в озоновом слое атмосферы. Уменьшение под влия-
нием ряда причин защитного озонового слоя планеты на 3—5 %,
наблюдаемое в последние годы, является, по-видимому, одной из
причин возросшей частоты регистрации заболеваний раком кожи и
меланомой.
Интенсивное ультрафиолетовое облучение кожи сопровождает-
ся ответной реакцией в виде эритемы, во многом определяющей
объективную и субъективную оценку тяжести поражения. Меха-
низм солнечной эритемы относительно сложен.
В связи с тем что УФ-С не доходит до поверхности Земли,
а способность лучей спектра от 360 нм и выше вызывать эритему
в 1000 раз слабее таковой УФ-В, эритематогенным действием
обладает практически только средневолновая часть ультрафиолето-
вого облучения.
Действие УФ-В основано преимущественно на расширении со-
судов дермы. Сразу после солнечного облучения развивается пре-
ходящая эритема, которая вызывается инфракрасными лучами и
исчезает через 10 мин после окончания облучения. Второй период
покраснения кожи начинается через 2—3 ч, достигает максимума
в течение 24 ч и длится около 48 ч. В течение первых 4—5 ч в по-
красневшей коже преобладает оксигемоглобин, который затем
приблизительно на 5 ч сменяется гемоглобином, а через 10—
12 ч после облучения оксигемоглобина снова становится больше
[Писцов М. Ю„ 1985]. Установлено, что основные изменения, вы-
званные УФ-В, имеют место в эпидермисе: межклеточный отек,
везикуляция, нарушения базальной мембраны. В дерме происходят
незначительные изменения: выявляют периваскулярные лимфоци-
57
тарные инфильтраты с редкими гистиоцитами и полинуклеарами.
Время, требующееся для восстановления нормального состоя-
ния кожи (измеренное по отсроченной эритеме), после воздей-
ствия единственной субэритемной дозы УФ-В составляет 24—30 ч.
Кривая, отражающая этапы восстановления, представляет собой
нисходящую экспоненту. Такой характер изменений, вероятнее
всего, связан с выработкой и накоплением фотопродуктов, имею-
щих биологическое значение [Arbabi L. et al., 1983].
Важная особенность эритемной реакции УФ-В области —
ослабление ее интенсивности под влиянием антиоксидантов. Про-
тивоэритемное действие наиболее выражено при концентрации в
коже антиоксидантов от 2,5 X Ю~10 до 5 ХЮ 9 моль/см2
[Potapenko А. У. et al., 1984]. Ионол и а-токоферол эффективно
подавляют эритему при их аппликации не только до, но и сразу
после облучения. Это свидетельствует о том, что одной из причин,
вызывающих эритему, является темновая окислительная реакция.
По всей вероятности, эта реакция представляет собой перекисное
окисление цепей ненасыщенных жирных кислот [Писцов М. Ю.,
1985].
Отмечается существенная роль комплемента в поддержании за-
поздалой эритемы при УФ-В [Clemmensen О. J., 1984].
В наших экспериментах [Акимов В. Г., Хорсева Н. И., 1986]
изучалось влияние исходного уровня комплемента на степень фо-
точувствительности кожи морских свинок к ультрафиолетовому
облучению в диапазоне 300—400 нм. Минимальное время облуче-
ния, необходимое для вызывания ответной реакции в виде эрите-
мы, сопоставлялось с исходным уровнем комплемента, для чего
животные были распределены на группы в зависимости от степени
их фоточувствительности. Выявлена прямая зависимость высокой
степени достоверности между исходным уровнем комплемента и
степенью фоточувствительности кожи.
Ответная реакция в виде эритемы после облучения ультрафи-
олетом обусловлена, по современным представлениям, 3 механиз-
мами:
1) запуском темнового перекисного окисления липидов, веду-
щим через оксигемоглобиновый компонент к расширению артери-
ол; 2) активацией УФО арахидоновой кислоты, что через систему
простагландинов и гемоглобиновый компонент ведет к расширению
венул; 3) активацией комплемента по альтернативному пути, что
каким-то неизвестным образом может влиять на степень эритемы
[Писцов М.Ю., 1985].
Возможность прогнозирования степени фоточувствительности
кожи по уровню комплемента, выявленная в наших экспериментах,
указывает на существенную роль системы комплемента в формиро-
вании ответной реакции организма на облучение кожи ультрафио-
летом. Можно предполагать, что более высокий исходный уровень
комплемента соответствует и большему количеству образующихся
при активации системы комплемента фрагментов, оказывающих
влияние на формирование ответной реакции.
58
Исключительная роль ультрафиолета связана с его способно-
стью образовывать свободные радикалы. Такие молекулы легко
вступают в химические реакции, поэтому для свободных радикалов
характерна высокая реакционная способность, в том числе вести
цепные реакции. Нарушение функции биологических мембран, по-
строенных преимущественно из белков и липидов, является одним
из важнейших биологических эффектов ультрафиолетового излу-
чения.
При ультрафиолетовом (УФ) облучении в коже начинают про-
исходить процессы, направленные на защиту от повреждающего
действия лучей: утолщается роговой слой, усиливается пигмента-
ция кожи, уроканиновая кислота переходит из трансизомер в цис-
изомер, мобилизуются ферментативные и неферментативные си-
стемы антирадикальной защиты.
Экранизирующий слой пигмента либо поглощает свет всех длин
волн, либо отфильтровывает особо опасные лучи, в частности ме-
ланин поглощает во всем диапазоне видимого и УФ-света« Так
называемая белая кожа у человека почти прозрачна. Загоревшая
белая кожа пропускает лишь 5 % лучей, длина волны которых
300 нм, незагоревшая кожа—25 % [Бриттон Г., 1986]. У лю-
дей негроидной расы почти весь ультрафиолет поглощается боль-
шим количеством меланина в коже, чем обеспечивается адек-
ватная защита от высоких доз лучистой энергии, характерных для
тех областей земного шара, где живут эти расы. В основном же
синтез и отложение меланинов, обусловливающие цвет кожи или
характер распределения пигмента, находятся под генетическим
контролем. Так, люди негроидной расы имеют черную кожу вне
зависимости от окружающей среды. Однако для лиц, имеющих
белую кожу, факторы внешней среды и сезонные изменения могут
быть весьма важными.
В коже происходит быстрое обновление меланинов: они теря-
ются при слущивании эпидермиса и затем вновь синтезируются.
У представителей темных рас меланина синтезируется и накап-
ливается значительно больше, чем у представителей белой расы.
Меланоциты обнаруживаются в коже человеческого зародыша,
принадлежащего к негроидной расе, уже на одиннадцатой неделе
развития [Бриттон Г., 1986].
У людей белой расы увеличивается содержание меланина в
коже под влиянием ультрафиолета. Загар формируется в две ста-
дии. Сначала сразу же после облучения солнечным светом в ре-
зультате обратимого окисления бесцветного предшественника ме-
ланина образуется «заслон», защищающий от солнечных ожогов.
Этот быстрый загар (Immediate pigmental darkenig, IPD) возникает
в основном под действием света с длиной волны 350 нм. Спектр
400—420 нм не вызывает заметных клинических или гистологиче-
ских изменений в коже. Главный и стойкий загар развивается
спустя 2—3 дня после экспозиции на солнце и достигает максиму-
ма примерно через 7 дней. Стойкий загар наиболее эффективно
вызывается светом с длиной волны примерно 300 нм.
59
Различают черные пигменты — эумеланины и желто-коричне-
вые разновидности, известные под названием феомеланинов. Рас-
пространение феомеланинов, по-видимому, ограничивается волоса-
ми и веснушками, которые часто встречаются у лиц с рыжими
волосами. Важное практическое различие между этими пигмента-
ми заключается в том, что эумеланины, имеющие черный цвет,
поглощают свет во всем видимом и в значительной части ультра-
фиолетового спектра, а феомеланины — только в видимом диапа-
зоне (500—550 нм), что и обусловливает их красноватую
окраску.
Синтез меланина в организме очень сложен. Пигменты обра-
зуются в результате последовательных реакций ферментативного
и неферментативного окисления, декарбоксилирования и конденса-
ции. На синтез меланина влияет гормон гипофиза — меланоцит-
стимулирующий гормон. Важную роль играет также тирозиназа,
катализирующая окисление тирозина в диоксифенилаланин
(ДОФА), а также способствующая интенсивному потемнению
ДОФА в присутствии кислорода.
Один из механизмов биологической защиты кожи от поврежда-
ющего действия ультрафиолетового облучения связан с фотопро-
тективными свойствами уроканиновой кислоты — продуктом мета-
болизма гистидина. В эксперименте было установлено, что водный
экстракт кожи морских свинок, содержащий уроканиновую кисло-
ту, абсорбирует до 80 % ультрафиолета [Tabachnick J., 1959].
В нормальном эпидермисе человека уроканиновая кислота при-
сутствует только в форме трансизомера, а после УФ-облучения
обнаруживается также цисизомер [Baden Н. Р., 1966].
Исследования с меченными С14 трансизомерами и цисизомерами
показали, что цисизомер образуется в коже после УФ-облучения,
причем эта реакция носит обратимый характер.
Организм располагает несколькими системами, обладающими
защитным действием против повреждающего действия свободных
радикалов, в том числе индуцированных УФО. При ослаблении
защиты возможны повышение проницаемости клеточных мембран
вследствие изменения их структуры, разобщение и подавление
окислительного фосфорилирования, набухание и разрушение мито-
хондрий, разрушение лизосом, активация гидролитических фер-
ментов и гибель клетки.
Физиологическая система антиоксидантной защиты поддержи-
вает в клетке низкое парциальное давление кислорода — в 100—
1000 раз ниже по сравнению с РО2 в сосудах.
Биохимические механизмы антиоксидантной защиты обеспечи-
вают ингибирование свободнорадикальных реакций на различных
стадиях: инициирования, разветвления и обрыва цепей окисления.
Этой цели служат, в частности, антиокислители (антиоксидан-
ты) — соединения, способные в малых концентрациях тормозить
свободнорадикальное неферментативное окисление энергетических
субстратов, в первую очередь ненасыщенных жирных кислот, угле-
водов, углеводородов и некоторых аминокислот. В нормальных фи-
60
зиологических концентрациях антиоксиданты необходимы для
осуществления функции ферментативного окисления — дыхания,
брожения и пр. [Журавлев А. И., 1975].
Использование антиоксидантов в биологии для торможения
цепного свободнорадикального окисления, создание теоретических
основ этого направления являются приоритетом отечественной на-
уки. Б. Н. Тарусовым была разработана и доказана теория, свиде-
тельствующая о том, что в основе многих поражающих факторов
(в том числе ультрафиолетового облучения и ионизирующей ра-
диации) лежит нарушение стационарности в развитии радикальной
реакции в структурных липидах мембран и переход ее в нестацио-
нарный неуправляемый режим самоускорения, при котором проис-
ходит окисление липидов и расщепление связей липид-белок. Осо-
бенно был важен вывод о том, что стационарность и низкий уро-
вень радикалов в норме обеспечиваются наличием ингибиторов —
антиоксидантов. Они обеспечивают стабильность липидов мембран
и, связывая радикалы, не допускают перехода реакции в нестаци-
онарный цепной режим развития [Тарусов Б. Н., 1970|.
Среди многих химических процессов, протекающих в коже,
следует особо выделить реакции, связанные с синтезом витамина
D, играющего важную роль в поддержании кальциевого, а также
связанного с ним фосфорного гомеостаза.
Витамин D вырабатывается в коже (в мальпигиевом и базаль-
ном слоях) посредством сложного механизма. 7-Дегидрохолесте-
рин под действием УФ-облучения (длина волны 290—320 нм)
претерпевает фотоизомеризацию, превращаясь в провитамин Dj,
который в свою очередь может фотоизомеризоваться в инертные
соединения люмистерол.з и тахистеролз. Эти соединения находятся
в обратимом медленном химическом равновесии с провитамином
D) или термически изомеризуются в витамин D3. Последний вы-
свобождается кожей в кровь, связывается с а-глобулином (вита-
мин D-связывающий белок) и в таком виде транспортируется
в печень [Скрайвер К. Р. и др., 1985|.
На биосинтез витамина D влияют главным образом два факто-
ра. Во-первых, количество образуемого провитамина D3 зависит
от дозы облучения. Во-вторых, меланин конкурирует с 7-дегидро-
холекальциферолом за ультрафиолетовые фотоны. Фотопродукция
провитамина D3 и люминистерола-3 в единицу времени бывает
больше в слабопигментированной коже.
Организм человека получает витамин D в двух формах: вита-
мин D3 (холекальциферол), синтезируемый в коже, и витамин D2
(эргокальциферол растительного происхождения), потребляемый с
обогащенной этим витамином пищей и в виде лекарственных пре-
паратов. Обе формы транспортируются в плазме в виде комплекса
с витамин D-связывающим белком.
Для нормального функционирования организма необходимо
поддерживать температуру тела на постоянном уровне, что дости-
гается сбалансированными величинами теплопродукции и тепло-
отдачи.
61
Теплоотдача с тех частей тела, поверхность которых соприка-
сается с воздухом, осуществляется путем испарения, излучения,
конвекции и проведения.
Перенос тепла путем проведения встречается только в тех слу-
чаях, когда тело контактирует с плотным субстратом, имеющим
другую температуру.
Перенос тепла путем конвекции и излучения часто объединяют
и называют «сухой теплоотдачей», на суммарную долю которой
даже при интенсивной физической нагрузке падает не более 20—
25 % теплоотдачи.
Самым эффективным способом отдачи избыточного тепла яв-
ляется испарение выделяемого пота. Из поступающих в организм
в среднем 2,5 л воды в сутки около 1,4 л воды выводится с мочой,
100 мл — с калом и 900 мл — в виде испарения с поверхности
кожи и через легкие. Вода постоянно испаряется с кожи (скрытое
потоотделение), но величины такой перспирации значительно варь-
ируют в зависимости от наличия или отсутствия кожных или сома-
тических заболеваний.
Испарение воды (пота) — процесс энергоемкий: на 1 л воды
требуется 2400 кДж, что соответствует 1 /з всего тепла, вырабаты-
ваемого в условиях покоя за целый день. Теплоотдача путем испа-
рения продолжается даже тогда, когда относительная влажность
окружающего воздуха достигает 100 %. Это условие сохраняется
до тех пор, пока температура кожи выше температуры окружаю-
щей среды.
Потовыделение регулируется центральной нервной системой
(психогенное потоотделение) и холинергическими симпатическими
волокнами. В связи с этим парасимпатомиметические вещества
(ацетилхолин, пилокарпин и др.) усиливают выделение пота, а
атропин, блокируя этот механизм, тормозит потовыделение.
Основными зонами, в которых активность потовых желез регу-
лируется главным образом температурным фактором, являются
кожа туловища, тыльная поверхность кистей, разгибательная по-
верхность предплечий и плеч, шея, лоб, носогубные складки.
Состав пота может отличаться не только в зависимости от
причин, вызывающих его повышенное выделение (физическая ра-
бота или высокая температура), но и в зависимости от топографии
потовых желез. Пот со лба содержит в 6—7 раз больше железа,
чем пот с кожи рук или ног. Состав пота ладоней варьирует в
зависимости от возраста и пола больного. Содержание хлоридов —
от скорости потоотделения, интенсивности метаболизма, темпера-
туры кожи, а также от возраста больного [Нобл У. К., 1986].
В поте в следовых количествах содержатся многие неорганиче-
ские — бром, хром, кадмий, молибден, рубидий, селен, мышьяк,
самарий, вольфрам [Molin L., Wester Р. О., 1974] и органические
вещества, причем содержание серина, орнитина, цитруллина и ас-
парагиновой кислоты в 10 раз превышает их уровень в сыворотке
[Gitlitz Р. Н. et al., 1974].
Выделение пота носит циклический характер [Beaumont W.,
62
Bullard R. W., 1963; Beaumont W., 1969], но длительность периодов
колеблется от долей секунды до многих часов. Обнаружены
быстрые (47—83 мс) пульсации при выделении пота эккриновой
железой, связанные, по мнению авторов, с сокращением миоэпите-
лиальных клеток [Nicolaidis S., SivadijanJ., 1972]. Более медлен-
ные, периодичностью 3—9 с, выявили Т. Nakayama, К. Takagi
(1959).
G. Е. Nilsson (1977) зарегистрировал период потоотделения в
0,74 с, что коррелирует с близкими по значению ритмами импуль-
сов вазомоторных нервов. Таким образом, имеется достаточно
фактов, указывающих на существование контроля со стороны сим-
патической нервной системы за процессом потоотделения, что
обеспечивает дискретность выделения отдельных порций пота. На-
ложение кратких периодов выделения пота приводит к удлинению
времени их существования.
Терморегуляция может осуществляться также с помощью из-
менения кровотока в коже. Выделяют 3 функционально различ-
ные области [Hensel Н. et al., 1973]: акральные области (кисти,
пальцы, ушные раковины, нос); туловище и проксимальные части
конечностей; лицо и череп.
Кровоснабжение акральных зон контролируется норадренерги-
ческими симпатическими нервами: снижение симпатического тону-
са вызывает расширение кровеносных сосудов и повышает тепло-
отдачу путем конвекции. Симпатическая активность регулирует
диаметр артериовенозных анастомозов в дистальных частях конеч-
ностей, что также сказывается на теплоотдаче.
Температура кожного покрова зависит также от состояния
внутренних органов, так как нервные связи между ними и кожей
реализуются в виде висцерокожных рефлексов, протекающих по
типу аксон-рефлексов, сегментарных рефлексов или проекционных
рефлексов. Импульсы из внутренних органов идут по афферент-
ным путям в передние и боковые рога спинного мозга, а оттуда
через пре- и постганглионарные симпатические волокна на по-
верхность. При патологических состояниях внутренних органов
могут возникать стойко существующие кожные зоны с измененной
температурой, трофикой, чувствительностью.
Общие и местные механизмы терморегуляции оказывают влия-
ние на характер теплоизлучения кожи.
Исследование распределения кожной температуры для выявле-
ния ее асимметрии важно для функциональной диагностики пато-
логических состояний кожного покрова и внутренних органов.
Этим целям служит метод термографии, основанный на регистра-
ции инфракрасного излучения человеческого тела, воспринимаемо-
го через оптическую систему приемников излучения и преобразуе-
мого в нем в электрические сигналы. Различные патологические
состояния характеризуются термоасимметрией и наличием темпе-
ратурного градиента между зоной повышенного или пониженного
излучения и симметричным участком тела, что отражается на тер-
мографической картине и имеет диагностическое и прогностиче-
ское значение.
Неповрежденная кожа выполняет в организме барьерные функ-
ции, направленные на поддержание постоянства биохимического
состава и гомеостаза в целом. Однако кожа не является абсолютно
непроницаемой границей между внутренней и наружной средой.
Говоря о проницаемости кожи, следует иметь в виду, что под
этим собирательным термином понимают совокупность различных
по своим механизмам процессов. Проницаемость (из внешней сре-
ды в кожу и наоборот) может быть различной для водо- или
жирорастворимых веществ, для соединений с малой или большой
молекулярной массой, что во многом ускоряет или замедляет
этот процесс. Кроме того, локализация участка кожи, степень его
гидратации, толщина рогового слоя, наличие или отсутствие ли-
пидной смазки и ее качественный состав вносят значительные
коррективы в скорость проникновения веществ через кожу. Эти
особенности важны с практической точки зрения, так как от них
во многом может зависеть степень резистентности кожи к разно-
образным химическим веществам, контакт с которыми в произ-
водственных или бытовых условиях постоянно расширяется.
Трансдермальный путь введения лекарств может иметь преиму-
щества перед их введением через рот или парентерально, так как
не зависит от pH содержимого желудка, времени последнего при-
ема пищи, возможностей метаболической инактивации. Дозирован-
ное постоянное поступление лекарства через кожу исключает
большие перепады концентрации, неизбежные при парентераль-
ном пути его введения [Shaw J. Е., Chandrasekam S. К., 1979].
Путь введения лекарственных веществ через кожу обладает
важным достоинством — доставкой их непосредственно к больно-
му органу. Большинство вводимых парентерально или через желу-
дочно-кишечный тракт лекарств не являются дерматотропными и
не обладают способностью накапливаться в достаточно высоких
концентрациях в коже. Попытки повышения терапевтических кон-
центраций в коже путем увеличения вводимых парентерально доз
ведет к появлению побочных эффектов. Местное применение ле-
карственных веществ, напротив, лишено многих из перечисленных
недостатков.
При нанесении препаратов на кожу можно ставить различные
задачи: сохранить вещество без проникновения внутрь (репеллен-
ты от насекомых), ввести в роговой слой (фотозащитные сред-
ства), ввести их в эпидермис, дерму, волосяные фолликулы, саль-
ные железы или, не задерживая вещество в коже, ввести его в
организм для оказания системного действия [Stiittgen G. et al.,
1986].
Кожа представляет собой комплексную систему расположен-
ных друг за другом слоев с различными структурными, функцио-
нальными и физико-химическими свойствами. В роговом слое, кро-
ме того, имеются полярные и неполярные слои. Любое вещество,
прежде чем проникнуть через эти барьеры, должно вступить в кон-
такт с водно-липидной пленкой и отслаивающимися роговыми
клетками.
м
Для проникновения в кожу имеются два альтернативных пути:
через тонкий, но относительно непроницаемый роговой слой (так
называемый транс дермальный путь) или проникновение через во-
лосяные фолликулы, включая сальные железы, и (или) эккринные
потовые железы («шунт»).
Многие химические вещества, проникшие в роговой слой, оста-
ются в нем длительное время. Образуется «структура запаса
рогового слоя» [Vickers С. F. Н., 1972]. В таком депо после одно-
кратной аппликации лекарственных веществ с радиоактивной мет-
кой пенициллин может существовать приблизительно 3 сут, гекса-
хлорофен — 8 сут, ацетилсалициловая кислота — 2 нед, корти-
зол — 3 нед, флюорированные кортикостероиды — 4 нед. При
этом 50 % проникшего в кожу пенициллина обнаруживались на
2-е сутки, гексахлорофена — на 4-е, ацетилсалициловой кисло-
ты — на 6-е, кортизола — на 9-е и флюорированных кортикосте-
роидов— на 12-е сутки [Vickers С. F. Н., 1972].
Введение с помощью перкутанного ионофореза преднизолона
здоровым мужчинам и женщинам способствовало образованию
депо преднизолона в. роговом слое. Препарат, меченный радио-
активным изотопом, обнаруживался даже через 2 нед после ло-
кального ионофореза, в то время как при приеме внутрь — только
в течение 24 ч [James М. Р. et al., 1986].
Следует отметить, что через кожу диффундирует незначитель-
ная часть нанесенных антибиотиков. Опыты на изолированных
участках кожи человека показали, что через нее проникает 1,52 %
пенициллина, 0,34 % тетрациклина и совсем незначительное коли-
чество ампициллина [Knight A. G. et al., 1969]. Отмечена зависи-
мость между концентрацией нанесенного антибиотика и его коли-
чеством, проникшим через кожу. Так, при нанесении на кожу кро-
ликов пенициллина (25 000 ЕД в 1 мл изотонического раствора
хлорида натрия) через кожу проникало 0,26 % нанесенной дозы,
при увеличении концентрации до 50 000 ЕД проникало 0,42 %,
а при концентрации 100 000 ЕД — 2,44 % от нанесенной дозы
[Колпаков Ф. И., 1973].
При диффузии через роговой слой, который для всех веществ
является труднопреодолимым барьером, различают внутриклеточ-
ный и межклеточный пути. Межклеточные пространства в гидра-
тированном состоянии занимают приблизительно 1 % объема ро-
гового слоя. Проникновение вещества через клетки требует пре-
одоления сопротивления системы мембранных барьеров, располо-
женных один за другим, что математически может быть представ-
лено как сумма сопротивлений отдельных барьеров.
Через выводные протоки сальных и потовых желез могут про-
никать внутрь некоторые химические вещества, обладающие малы-
ми размерами молекул. На долю волосяных фолликулов и вывод-
ных протоков потовых желез приходится менее 1 % поверхности
кожи, а проникает через них 0,01—0,1 % веществ, проходящих
через роговой слой [Schaefer Н. et al., 1982].
Морфологические изменения рогового слоя ведут к изменению
3—936
65
скорости проницаемости кожи для химических веществ. Этот
принцип используется в так называемых химических ускорителях
проницаемости, служащих для увеличения потока определенных
веществ через кожный покров. Так, например, использование сали-
циловой кислоты в мазях или растворах ведет к снижению связу-
ющей способности роговых клеток между собой [Huber С.,
Christophers Е., 1977] и как следствие — к повышению проницае-
мости эпидермиса.
Диметилсульфоксид (ДМСО, димексид) и подобные вещества,
такие как диметилацетамид и диметилформамид, ускоряют про-
никновение низкомолекулярных веществ [Kligman А. М., 1965].
ДМСО гигроскопичен, смешивается во всех соотношениях с водой
и спиртом, с успехом используется как проводник многих ле-
карств, например наряду с вазоактивными препаратами при лече-
нии системной склеродермии [Балабанова Р. М. и др., 1982].
О непрекращающихся поисках более эффективных средств уси-
ления всасывания свидетельствует появление новых перспектив-
ных препаратов, повышающих скорость проникновения лекар-
ственных веществ в 10—100 раз. Так, азон увеличивает про-
ницаемость кожи для кортикостероидов, антимикотических, проти-
вовирусных и цитостатических средств [Stiittgen G. et al., 1986].
Проницаемость кожи значительно изменяется при развитии
дерматозов. Вещества, которые мало или совсем не проникали че-
рез роговой слой интактной кожи, при его изменении в результате
болезни начинают свободнее преодолевать этот барьер [Stiittgen G.,
1981]. Отмечено, что при псориазе проникновение стероидов в ко-
жу повышено, несмотря на утолщение рогового слоя; поражение
рогового слоя при экземе также сопровождается усиленной
проницаемостью кожи. При стихании патологического процесса
проницаемость кожи для локальных кортикостероидов снижается.
Из этого следует важный в практическом отношении вывод об ис-
пользовании в стадии регрессирования процесса более концентри-
рованных препаратов [Schalla W. et al., 1980].
Липиды играют важную роль в защите кожи. Локальное умень-
шение количества липидов в результате обработки кожи каким-
либо органическим растворителем (ацетоном, хлороформом, диме-
тилсульфоксидом и пр.) существенно повышает ее проницаемость.
Контакт с водой, кроме возможного удаления части липидной
смазки, изменяет барьерные функции кожи в результате ее гидра-
тации, что ведет к увеличению ее проницаемости, например для
гексахлорциклогексана (линдана) [Lange М. et al., 1981]. Гидрата-
ция кожи для повышения накопления в ней лекарственного
вещества послужила основой для способа применения фотосенси-
билизатора 8-метоксипсоралена не в таблетках, а в виде раствора
для ванны в концентрации 0,003 %, которой оказалось достаточно
для проведения фотохимиотерапии [Borne W., 1981].
На проницаемость кожи влияет еще множество факторов, 'на-
пример локализация (в подошве проницаемость в 10 раз меньше,
чем в предплечье, а в мошонке — в 40 раз больше), возраст боль-
66
ного (у детей грудного и раннего возраста кожа отличается
повышенной проницаемостью), влажность кожи (увеличивает про-
ницаемость кожи в 10—100 раз), химический состав вещества
и др.
Известно, что жиры и растворенные в них вещества лучше
проникают через кожу. В связи с этим большое практическое зна-
чение приобретает наблюдение Ф. И. Колпакова (1973) об усиле-
нии проникновения хрома в кожу, предварительно обработанную
различными защитными мазями, кремами и пастами (вазелином,
ланолином, силиконовым кремом, парафиновой мазью, мазью Се-
лисского, вазелиновым, касторовым, подсолнечным маслами, рыбь-
им жиром).
Зуд кожи во многих случаях является отражением тяжести
течения многих дерматозов: нейродермита, экземы, красного плос-
кого лишая, герпетиформного дерматита Дюринга, грибовидного
микоза, крапивницы.
Физиология зуда изучена недостаточно. По мнению большин-
ства исследователей, кожный зуд представляет собой не самостоя-
тельное чувство, а видоизмененное ощущение боли. Лишь отдель-
ные авторы связывают зуд с тактильной чувствительностью. Как
ощущение зуд кожи является корковым процессом, возникающим
при воздействии определенных раздражителей на соответствую-
щий воспринимающий нервный аппарат, состоящий из 3 отделов:
периферического, заложенного в коже; центрального, заложенного
в высших отделах центральной нервной системы, и проводниково-
го, соединяющего оба эти отдела. В соответствии с этим зуд кожи
может возникать под воздействием экзогенных и эндогенных раз-
дражителей на каждый из этих отделов, поэтому различают зуд
кожи периферического и центрального происхождения. Кроме то-
го, зуд может быть физиологическим, возникающим в ответ на
адекватные раздражения (ползание насекомых, например) и пато-
логическим, возникающим в ответ на неадекватные раздражения
{Павлов С. Т., 1959].
В изучении механизмов зуда целесообразно выделить ряд ос-
новных направлений: вещества, вызывающие зуд, рецепторы зуда,
периферические пути нервной проводимости, центральное пред-
ставительство и центральная интерпретация ощущений зуда.
Ощущение зуда может быть вызвано введением в кожу многих
биологически активных веществ, а также некоторых кислот, алка-
лоидов и других неспецифических раздражителей.
Одну из главных ролей в возникновении зуда играет гистамин.
Длительный латентный период (20—50 с) между его аппликацией
на кожу и началом зуда объясняли тем, что гистамин не обладает
способностью непосредственно раздражать нервные окончания, от-
ветственные за возникновение зуда, а действует каким-то косвен-
ным путем, например, высвобождая протеазу. Более поздние рабо-
ты по изучению непосредственного действия гистамина на нервные
окончания показали, что оно происходит без изменения других
веществ, содержащихся в коже. По данным Н. Shimizu и соавт.
3*
67
(1980), биогенные амины, в том числе и гистамин, могут потенци-
ровать ответ нейронов на деполяризующий агент, а также увеличи-
вать интраневральный уровень циклического аденозинмонофосфа-
та (цАМФ). Концентрация цАМФ в клетках увеличивается под
влиянием эпинефрина, простагландинов, гистамина и др.
Из других веществ, способных при введении в кожу вызывать
ощущение зуда, следует назвать калликреин, брадикинин и другие
биологически активные вещества. Калликреин, являющийся проте-
азой, вызывает зуд без развития гиперемии. Такой зуд носит
колющий характер и не поддается влиянию антигистаминных
препаратов. Главным фармакологическим эффектом калликреина
считают его способность активировать брадикинин, который также
вызывает зуд.
Воздействие на кожу простагландином Е| значительно усилива-
ет пруритогенный эффект гистамина и папаина, что происходит
за счет уменьшения порога восприятия зуда в человеческой коже.
Простагландины в то же время не являются пруритогенными
веществами [Lovell С. R. et al., 1976J.
Как отмечают Р. R. Burgess и соавт. (1979), в зудящей коже
увеличена концентрация гистамина, простагландинов, калликреина,
кининов и катепсинов. Высвободившиеся, в частности, под влия-
нием эндопептидаз и пептидаз биологически активные вещества
принимают участие в передаче ощущения зуда.
Нет окончательной ясности и относительно периферической
части воспринимающего нервного аппарата, заложенного в коже.
За вопросом о том, возбуждают ли раздражители «специфические
рецепторы» или непосредственно тонкие сенсорные аксоны, стоит
в корне различное понимание принципов деятельности кожного
анализатора, а следовательно, и механизмов ощущения. Г. Уэделл
и соавт. (1962) выдвинули предположение, согласно которому ор-
ганами кожной чувствительности могут служить свободные нервные
окончания. Р. Артур, У. Шелли (1962) указывают на существова-
ние в коже точек зуда, которые- представляют собой участки кожи
с повышенным количеством тонких свободных нервных окончаний,
расположенных в субэпидермальном слое и в самом эпидермисе.
Большинство волокон, расположенных в этих точках, принадлежит
тонким безмякотным нервам. Однако не было обнаружено никакой
связи между чувствительностью к зуду или плотностью нервных
окончаний в субэпидермальном слое.
J. Н. Herndon (1975) полагает, что клетки Меркеля благодаря
их поверхностному расположению в эпидермисе могут служить
органами кожной чувствительности, воспринимающими зуд
Один из самых крупных авторитетов в вопросах исследования
боли Р. Мелзак (1981) отметил: «В болевых процессах участвует
так много областей и между ними наблюдается столь широкое
взаимодействие, что попытки описать их чаще приводят к путани-
це, чем вносят ясность». Это образное высказывание в полной мере
относится к кожному зуду. Центральный анализ информации, по-
ступающей с рецепторов кожи, генерирующих ощущение зуда, от-
68
личается чрезвычайной сложностью. Возможность подавить зуд с
помощью более сильного раздражения в пределах иннервации од-
ного сегмента указывает на то, что первый этап обработки инфор-
мации, поступающей с периферии, происходит в спинном мозге.
Г. Н. Крыжановский, С. И. Игонькина (1976), создавая генера-
торы патологически усиленного возбуждения в различных систе-
мах головного мозга, смогли воспроизвести нейропатологические
синдромы, характеризующиеся повышенной активностью этих си-
стем. Были воспроизведены синдромы боли и зуда центрального
происхождения. Эти исследования позволили выдвинуть теорию
генераторных механизмов центральных болевых синдромов. Ее ос-
новные положения заключаются в том, что под влиянием тех или
иных эндогенных или экзогенных факторов в определенных отде-
лах центральной нервной системы, составляющих ноцицептивную
систему, возникают генераторы патологически усиленного возбуж-
дения. Такие генераторы могут развивать мощную и длительную
активность вследствие особенностей их функциональной организа-
ции, обусловленных недостаточностью тормозных механизмов в
популяциях нейронов, что и лежит в основе центральных синдро-
мов боли и зуда [Графова В. Н. и др., 1976].
Периферические пути проводимости боли и зуда (учитывая
близость этих ощущений, их объединяют термином «ноцицепция»)
большинство авторов связывают с А-дельта- и С-волокнами аф-
ферентных нервов.
И. В. Ушаков (1984) одновременно регистрировал динамику
субъективных ощущений испытуемого человека, тонуса мышц
предплечья, в кожу которого производили инъекции исследуемых
веществ. Было установлено, что возникновение в месте введения
пруритогена любых по качеству ощущений (боль, зуд, жжение,
пощипывание и т. д.) сопровождалось появлением спонтанного
тонуса мышц исследуемого предплечья, находящегося в состоянии
покоя. Отмечена корреляция между интенсивностью ощущения и
выраженностью мышечного тонуса. На этом основании И. В. Уша-
ков предполагает, что импульсация с рецепторов, ответственных
за восприятие зуда, попадая в спинной мозг, активирует мотоней-
роны передних рогов спинного мозга, что и приводит к появлению
непроизвольного мышечного тонуса (спонтанных мышечных со-
кращений). Чем интенсивнее импульсация с периферии, тем боль-
шее число мотонейронов приходит в активное состояние, тем зна-
чительнее непроизвольный мышечный тонус. Таким образом, не-
произвольный мышечный тонус может характеризовать состояние
периферического звена кожного анализатора.
Результаты функциональных исследований (электроэнцефало-
графических, электромиографических, реовазографических, термо-
графических, скорости проведения импульса по двигательным и
чувствительным волокнам, кожного сопротивления и кожно-галь-
ванического рефлекса), проведенных 3. Г. Фараджевым (1985),
позволили выявить большую частоту изменений в центральной,
периферической и вегетативной нервной системе у больных унила-
теральными дерматозами.
В большинстве случаев клинические неврологические измене-
ния определялись в форме микросимптоматики: различных откло-
нений со стороны черепно-мозговых нервов, асимметрии перио-
стальных и сухожильных рефлексов, нарушений чувствительности.
При этом периферические неврологические сдвиги чаще наблюда-
лись на стороне поражения, а центральные — на противоположной
стороне. Частота центральных нарушений, по данным ЭЭГ, реги-
стрировалась чаще, чем клинические признаки болезни, что указы-
вает на наличие скрытых, субклинических изменений нервной сис-
темы как фрагмента кортико-висцеральной патологии, играющей
роль в патогенезе унилатеральных и линейных дерматозов.
О значении нарушений нервной системы для возникновения и
поддержания патологического процесса на коже было написано
много. Некоторые работы, носящие откровенно спекулятивный
характер, послужили во вред направлению нервизма в изучении
патогенеза дерматозов. Успехи в области биохимии, молекулярной
биологии и иммунологии способствовали переключению интересов
на эти научные дисциплины, в связи с чем еще больше сократилось
число работ, посвященных изучению роли нервной системы в пато-
генезе дерматозов.
В течение ряда лет мы принимали участие в изучении патогене-
за унилатеральных и линейных дерматозов. Интерес к их патоге-
незу заключается в возможности получения ответа на вопрос о
действительной роли нервной системы в возникновении и поддер-
жании дерматоза, расположенного только по ходу нерва. Выявле-
ние электрофизиологическими и другими инструментальными ме-
тодами различий в пораженной и не пораженной процессом конеч-
ности у одного и того же человека при одинаковом содержании
всех гуморальных и клеточных факторов, всех исследованных
биохимических показателей в циркулирующей крови является уни-
кальной моделью изолированного патологического состояния. Вы-
явление общих закономерностей развития кожного процесса при
определенных нарушениях в центральной или периферической
нервной системе проливает свет на участие этих отделов в меха-
низмах развития патологического процесса на коже.
Глава 4
ОБЩАЯ ГИСТОПАТОЛОГИЯ
И ИММУНОПАТОЛОГИЯ КОЖИ
ГИСТОПАТОЛОГИЯ кожи
Гистологическое исследование является ценным методом диаг-
ностики болезней кожи. Некоторые из них, имеющие постоянные
диагностически информативные патологические признаки, распоз-
наются только на основании гистологического исследования. Но
чаще его результаты подтверждают или не подтверждают диагноз
клиницистов, очерчивая, однако, в последнем случае круг возмож-
ных заболеваний, которые следует учитывать при конкретной кли-
нической картине. Поэтому краткая характеристика последней и
сформулированный клинический диагноз или перечень предполага-
емых диагнозов должны сопровождать биопсийный материал, как
и основные сведения из истории заболевания, о поле и возрасте
пациента, месте, откуда был взят биоптат.
Выбор места для взятия биоптата имеет большое значение
для результата гистологического исследования. Небольшой высып-
ной элемент лучше брать целиком. Полостные высыпания следует
брать наиболее свежими, все остальные лучше биопсировать на
высоте развития. Эксцентрически растущие очаги необходимо био-
псировать в краевой зоне. Если имеется несколько очагов пораже-
ния различного характера, а диагноз в большой степени зависит
от результата гистологического исследования, целесообразно биоп-
сировать несколько очагов поражения. Биоптат всегда должен
включать подкожную жировую клетчатку.
Существуют различные способы взятия биоптата.
Наиболее полную информацию содержит ткань, взятая скаль-
пелем эксцизионным методом. При этом способе взятия биоптата
в срез попадают все слои кожи и подкожная клетчатка, а также
все кожные структуры, такие как волосяные фолликулы, сальные
и потовые железы. Эксцизионная биопсия позволяет изготовить
столько срезов, сколько необходимо для получения полного пред-
ставления об изучаемом патологическом процессе.
Техника биопсии проста, доступна каждому дерматологу и лег-
ко может быть произведена в амбулаторных условиях при соблю-
дении элементарных правил асептики и антисептики.
Производят биопсию под местной анестезией 1 % раствором
новокаина, в который для уменьшения кровоточивости целесооб-
разно добавить 0,1 % раствор адреналина (на 30 мл новокаина —
1 мл адреналина). После удаления кусочка ткани накладывают
1—2 шва, которые снимают через 1 нед, если кусочек удален в
71
пределах здоровой ткани, и через 9—10 дней, если биопсию произ-
водили в патологически измененных тканях или если она была глу-
бокой.
Результативность, диагностическая информативность гистоло-
гического метода исследования во многом определяются также
качеством гистологических срезов, в большой степени зависящим
от обработки биоптата. Кожа — один из наиболее трудных объек-
тов для изготовления гистологических препаратов. Общепринятые
методы проводки биоптатов не являются оптимальными для кожи,
так как не учитывают особенностей ее тканей, а применительные
к коже методики в литературе не описаны. Можно рекомендовать
следующие методики.
Для фиксации тканей кожи может быть использован 10 % вод-
ный раствор формалина (1 часть 40 % раствора формальдегида и
9 частей водопроводной воды). В этом растворе биоптат может
сохраняться долго без ущерба для последующей его обработки
(месяцы). В практической работе биоптат в растворе формалина
выдерживают сутки, после чего сутки его промывают в проточной
воде. Последующее обезвоживание тканей производят последова-
тельно в 50, 70, 80 и 96 % спиртах; каждого раствора приготавли-
вают по две порции, в каждой из них биоптат должен находиться
в течение 12 ч. После 96 % спирта биоптат помещается на 2—3 ч
в абсолютный спирт, а затем для просветления на сутки в кедровое
масло, в термостате при температуре 37 °C. Последующее пропи-
тывание биоптата парафином производится в термостате при тем-
пературе 56—57 °C в двух порциях, по 6 ч в каждой. В парафин
обязательно добавляют 5 % пчелиного воска. Затем биоптат зали-
вают в парафин, содержащий 20 % пчелиного воска.
Хорошими и быстро действующими фиксаторами тканей кожи,
дающими возможность использовать после них как гистологиче-
ские, так и гистохимические методы окраски, являются 96 % эти-
ловый спирт и жидкость Карнуа (абсолютный этиловый спирт —
60 мл, хлороформ — 30 мл, ледяная уксусная кислота — 10 мл);
готовят непосредственно перед употреблением. Фиксация в этих
жидкостях не требует длительного последующего обезвоживания
тканей кожи, кроме того, они хорошо сохраняют кислые мукопо-
лисахариды, гликоген, нуклеиновые кислоты и ряд других веществ.
В 96 % этиловом спирте биоптат фиксируется сутки, в жидко-
сти Карнуа 2—3 ч, после чего переносится в абсолютный спирт
на 5—6 ч, а затем в кедровое масло и парафин, как описано выше.
Перед помещением в фиксирующую жидкость биоптат следует
промыть в физиологическом растворе; количество фиксирующей
жидкости должно превышать объем биоптата не менее чем в 20 раз;
необходимо строго соблюдать время фиксации, разумно варьи-
руя им в зависимости от размера биоптата; при переносе биопта-
та из одной среды в другую он обязательно должен быть просу-
шен фильтровальной бумагой. Приготовление срезов кожи, их
окраску осуществляют по общим правилам, излагаемым в руковод-
ствах по гистологической технике.
72
Патоморфологические изменения в коже развиваются по зако-
нам общей патологии. Однако часть из них отличается своеобрази-
ем, зависящим от особенностей строения и функций кожи как
органа. Эти своеобразные изменения возникают при разных болез-
нях кожи, являются общими для многих из них. Различные их
сочетания составляют патоморфологическую основу, присущую
тому или иному заболеванию кожи. Наиболее точно эти изменения
описаны дерматологами с применением терминов, употребляемых
в общей патологии нечасто. Без знания этих терминов, правильно-
го их понимания и применения не может быть взаимопонимания
между клиницистами и патоморфологами.
1. Акантоз — увеличение количества рядов клеток шиповатого
слоя эпидермиса.
Различают простой акантоз — равномерное и умеренно выра-
женное увеличение количества рядов клеток шиповатого слоя над
и между сосочками дермы (юношеские бородавки, акрокератоз
Гопфа); межсосочковый акантоз — увеличение количества рядов
шиповатых клеток преимущественно между сосочками дермы —
псориаз (рис. 12); инфильтрирующий акантоз — резко выраженная
пролиферация шиповатых клеток, в результате которой разрос-
шиеся, анастомозирующие между собой отростки эпидермиса про-
никают в дерму на значительную глубину — бородавчатый туберку-
лез, краевая зона длительно существующих язв (рис. 13).
2. Акантолиз — утрата связи между эпидермальными (эпите-
лиальными) клетками вследствие повреждения их десмосрмальных
контактов, приводящая к образованию интраэпидермальных поло-
стей. Различают глубокий супрабазальный акантолиз (вульгарная
и вегетирующая пузырчатка, болезнь Дарье), высокий (рис. 14)
акантолиз (себорейная и листовидная пузырчатка) и диффузный
акантолиз (хроническая семейная доброкачественная пузырчатка,
вирусные дерматозы).
3. Акантолитические клетки — кератиноциты, утратившие
между собой связь вследствие акантолиза, что может сопровож-
даться изменением формы, размеров и строения этих клеток
(пузырчатка, вирусные дерматозы).
4. Амилоид — гомогенное стекловидное плотное вещество бел-
ковой природы, откладывающееся между тканевыми элементами
вследствие нарушения тканевого метаболизма; выявляется специ-
альными окрасками (амилоидоз кожи).
5. Анаплазия — термин, по современным представлениям не
отражающий сущности определяемого им явления, но широко
используемый морфологами для характеристики, главным образом
атипизма и полиморфизма клеток злокачественных опухолей
(рис. 15). Чем больше клеточные и тканевые структуры опухоли
отличаются от клеток и тканей, послуживших источником опухо-
левого роста, тем выраженнее анаплазия.
6. Баллонирующая дистрофия — сочетание спонгиоза, ретику-
лярной дистрофии и акантолиза, обусловливающее образование
интраэпидермальной полости, в которой находятся свободные эпи-
73
Рис. 12. Акантоз межсосочковый. Количество рядов шиповатых клеток
увеличено преимущественно в отростках эпидермиса. Окраска гематокси-
лином и эозином. X 75.
Рис. 13. Акантоз инфильтрирующий. Резко выражена пролиферация
шиповатых клеток. Анастомозирующие между собой отростки эпидермиса
глубоко проникают в дерму. Гиперкератоз. Гипергранулез. Окраска гема-
токсилином и эозином. X 100.
74
Рис. 14. Акантолиз высокий. Расслоение эпидермиса по зернистому слою.
Окраска гематоксилином и эозином. X 75.
Рис. 15. Анаплазия. Атипизм и полиморфизм лимфоидных клеток. Окрас-
ка гематоксилином и эозином. X 200.
75
дермоциты или их комплексы, а также клетки в состоянии некро-
биоза и некроза (вирусные дерматозы).
7. Вакуолизация (внутриклеточный отек) — образование ваку-
олей в цитоплазме эпидермоцитов (рис. 16). Вакуоли располага-
ются перинуклеарно или эксцентрично. Ядра вакуолизированных
клеток пикнотизированы или отсутствуют. Могут обнаруживаться
мелкие интраэпидермальные полости из слившихся вакуолизиро-
ванных клеток (аллергический дерматит, плоская бородавка).
Вакуолизация может ограничиваться только базальными эпи-
дермоцитами и приводить к недержанию пигмента (пойкилодер-
мия) или, разрушая клетку, обусловливать образование субэпи-
дермальной полости (красная волчанка, красный плоский лишай,
склеротический и атрофический лихен). Эти изменения называют
гидропической дистрофией базальных клеток (рис. 17).
8. Вилли — выступающие в интраэпидермальную полость
удлиненные отечные сосочки дермы, покрытые слоем базальных
эпидермоцитов [хроническая семейная доброкачественная пузыр-
чатка (рис. 18), бородавчатая дискератома, папиллярная гидраде-
нома].
9. Гиалин — полупрозрачное гомогенное эозинофильное веще-
ство неоднородного состава. Может образоваться вне- и внутри-
клеточно, часто в стенках сосудов (туберкулез кожи, сифилис,
риносклерома). Отдельные гиалинизированные эпидермоциты ино-
гда обозначают как коллоидные тельца, или тельца Сиватта.
Не являясь специфическими для какого-либо заболевания, они
чаще встречаются среди клеток нижних рядов эпидермиса или в
верхней части дермы (красная волчанка, красный плоский лишай).
Отложение гиалина в соединительнотканных структурах кожи
обозначается как гиалиноз.
10. Гипергранулез — утолщение зернистого слоя (рис. 19).
Может быть диффузным и очаговым (красный плоский лишай).
11. Гиперкератоз — утолщение рогового слоя чаще вследствие
его избыточного образования, иногда вследствие задержки отшелу-
шивания роговых чешуек (ихтиоз).
12. Гранулематозное воспаление (гранулема) — очаговая хро-
ническая воспалительная реакция на тканевое повреждение, харак-
теризующаяся накоплением и пролиферацией преимущественно
лимфоцитов и клеток системы фагоцитирующих мононуклеаров
(гистиоцит, макрофаг, эпителиоидные и гигантские клетки).
Причины гранулематозного воспаления разнообразны (инород-
ные тела, микроорганизмы), иногда неизвестны (саркоидоз).
13. Грануляционная ткань — незрелая соединительная ткань,
образующаяся при восстановлении открытых или закрытых по-
вреждений собственно кожи. Состоит из вновь образованных ка-
пилляров, фибробластов и новообразованных молодых коллагено-
вых волокон. Если повреждение соединительной ткани было
вызвано воспалительным процессом, то в грануляционной ткани
всегда обнаруживаются лейкоциты, эозинофилы и макрофаги,
иногда плазматические клетки.
76
Рис. 16. Вакуолизация. Перинуклеарные вакуоли в клетках шиповатого
слоя. Окраска гематоксилином и эозином. X 75.
Рис. 17. Гидропическая дистрофия базальных клеток. Вакуоли в клетках
базального слоя. Окраска гематоксилином и эозином. X 75.
77
Рис. 18. Вилли. Внизу препарата поперечные и продольные срезы сосочков
дермы, покрытые слоем базальных эпидермоцитов. Окраска гематокси-
лином и эозином. X 100.
Рис. 19. Гипергранулез. Значительное увеличение количества рядов зерни-
стых эпидермоцитов. Окраска гематоксилином и эозином. X 100.
78
14. Дискератоз — преждевременное автономное ороговение от-
дельных кератиноцитов или их комплексов (рис. 20). Это наруше-
ние процесса рогообразования встречается при доброкачественных
болезнях кожи (болезнь Дарье, псевдокарциноматозная гиперпла-
зия, хроническая семейная доброкачественная пузырчатка, конта-
гиозный моллюск) и опухолях ее (болезнь Боуэна, эритропла-
зия Кейра, болезнь Педжета, плоскоклеточный рак). При неко-
торых дерматозах диСкератоз сочетается с акантолизом (болезни
Боуэна, Дарье, хроническая семейная доброкачественная пузыр-
чатка).
15. Лейкоцитоклазия — распад ядер полинуклеаров (рис. 21).
Один из морфологических признаков реакции гиперчувствитель-
ности немедленного типа (поверхностный полиморфный артерио-
лит Руитера).
16. Метахромазия — феномен окрашивания тканей и клеток в
иной цвет, чем цвет красителя. Метахромазия выявляется в при-
сутствии кислых мукополисахаридов (красная волчанка) и амило-
ида (амилоидоз кожи).
17. Микроабсцессы — небольшие очаговые скопления клеток в
эпидермисе или дерме.
Различают: нейтрофильные микроабсцессы — в роговом слое
или непосредственно под ним (микроабсцессы Мунро) при чешуй-
чатом лишае (рис. 22) и в дермальных инфильтратах при глубоких
микозах; нейтрофильно-эозинофильные — в верхушках сосочков
дермы при герпетиформном дерматите Дюринга; эозинофильные
микроабсцессы — в пролиферирующем эпидермисе при вегетирую-
щей пузырчатке; микроабсцессы Потрие — скопления в эпидерми-
се незрелых лимфоцитов при лимфомах кожи.
18. Мукофанероз—высвобождение из ацидогликопротеидных
комплексов цитоплазмы эпителиальных клеток наружного корне-
вого влагалища волоса и наружных клеток сальных желез кислых
мукополисахаридов (фолликулярный муциноз).
19. Набухание мукоидное — начальная фаза дезорганизации
коллагена и основного межуточного вещества соединительной
ткани, заключающаяся в их набухании вследствие накопления
кислых мукополисахаридов, обнаруживаемых по метахроматиче-
скому окрашиванию (диффузные болезни соединительной ткани).
20. Набухание мутное — дистрофический процесс в паренхи-
матозных элементах, характеризующийся увеличением их размера
вследствие набухания и слабым восприятием ими красителей;
ядра в таких клетках окрашиваются бледно или не выявляются.
Встречаются при многих воспалительных процессах в коже.
21. Набухание фибриноидное — фаза дезорганизации соедини-
тельной ткани, характеризующаяся набуханием, гомогенизацией и
изменением тинкториальных свойств коллагена (диффузные бо-
лезни соединительной ткани).
22. Недержание пигмента — потеря поврежденными базальны-
ми эпидермоцитами меланина и его скопление в верхней части
дермы в меланофагах (недержание пигмента, красная волчанка,
79
Рис. 20. Дискератоз. Круглые тела и зерна в зернистом слое эпидермиса.
Окраска гематоксилином и эозином. X 100.
Рис. 21. Лейкоцитоклазия. Вокруг сосудов распавшиеся ядра полинуклеа-
ров. Окраска гематоксилином и эозином. X 120.
80
Рис. 22. Микроабсцесс Мунро. Очаговое скопление нейтрофилов в роговом
слое. Окраска гематоксилином и эозином. X 75.
красный плоский лишай, пойкилодермия, фиксированная токси-
дермия, меланоз Риля).
23. Некробиоз — процесс умирания ткани или клетки в проме-
жутке между началом действия повреждающего фактора и оконча-
тельной гибелью их. При определенных условиях процесс может
быть обратимым. Встречается при многих заболеваниях кожи.
24. Некроз творожистый — погибшая ткань, утратившая свою
структуру, представляющая собой слабо эозинофильную аморф-
ную мелкозернистую массу; в зоне некроза может встречаться
ядерная пыль (индуративная эритема, сифилитическая гумма).
25. Некроз фибриноидный — фаза дезорганизации соедини-
тельной ткани, характеризующаяся гомогенизацией и глыбчатым
распадом коллагена, приобретающего тинкториальные свойства
фибрина (диффузные болезни соединительной ткани).
26. Папилломатоз — удлиненные, нередко разветвленные со-
сочки дермы, неравномерно приподнимающие над собой эпидер-
мис. Обнаруживаются при вегетирующих процессах, являясь мор-
фологической основой вегетаций.
27. Паракератоз — термин, применяемый для обозначения не-
завершенного, неполноценного ороговения, которое характеризует-
ся наличием ядер в роговом слое и недоразвитием или отсутствием
зернистого слоя. Встречается при многих воспалительных заболе-
ваниях кожи, особенно характерен для чешуйчатого лишая.
28. Пикноз — сморщивание ядра клетки.
81
29. Плеоморфизм — термин, применяемый для характеристики
злокачественной пролиферации, отражающей вариабельность стро-
ения одного и того же типа клеток, характеризующихся выражен-
ным атипизмом.
30. Полиморфизм — термин, обозначающий вариабельность
типов клеток в инфильтрате. Применяется для характеристики
инфильтратов и не указывает на злокачественность.
31. Псевдокарциноматозная гиперплазия — патологическое со-
стояние эпидермиса, напоминающее плоскоклеточный высокодиф-
ференцированный рак. Характеризуется инфильтрирующим акан-
тозом, сочетающимся с гиперкератозом, а также с дискератозом
как отдельных клеток, так и небольших их групп, нередко образу-
ющих подобие раковых жемчужин. Обнаруживается у края хрони-
ческих язв, при бромодерме, бородавчатом туберкулезе и других
дерматозах, склонных к вегетированию.
32. Ретикулярная дистрофия — характеризуется внутриэпидер-
мальными многокамерными полостями, образовавшимися в резуль-
тате разрывов эпидермальных клеток вследствие резко выраженно-
го внутриклеточного отека; перегородками полостей служат сохра-
нившиеся оболочки клеток. Обнаруживается при остром дерма-
тите, вирусных дерматозах, остром каплевидном парапсориазе.
33. Слизистая дистрофия — накопление в клетках эпидермиса
или в соединительной ткани дермы, главным образом кислых му-
кополисахаридов, что обнаруживается мета хроматическим их
окрашиванием. Характерна для миксодермий.
.34 . Спонгиоз (внеклеточный отек) — расширение межклеточ-
ных пространств в эпидермисе вследствие увеличения в них меж-
клеточной жидкости (рис. 23). Встречается при многих острых и
подострых воспалительных процессах в коже. Бывает диффузным
и очаговым. Последний особенно характерен для экземы.
35. Спонгиоформная пустула Когоя — полость в верхней части
эпидермиса, образовавшаяся в результате разрушения эпидермо-
цитов проникающими в них полиморфно-ядерными лейкоцитами
(рис. 24). Характерна для акродерматита Аллопо, герпетиформ-
ного импетиго Гебры и кожных проявлений болезни Рейтера.
36. Экзоцитоз — проникновение клеток дермального инфильт-
рата в эпидермис (рис. 25).
37. Эпидермолиз — утрата связи между эпидермисом и дермой
в области базальной мембраны вследствие повреждения контактов
в полудесмосомах, приводящая к образованию субэпидермальной
полости (рис. 26). Характерен для доброкачественного пемфигои-
да Левера.
38. Эпидермотропизм — термин, обозначающий направлен-
ность распространения патологического процесса из дермы в сто-
рону эпидермиса. Характерен для плоского красного лишая и
лимфом.
При изучении гистологических изменений в коже необходимо
придерживаться единой методики. Следует просмотреть препарат
под малым увеличением микроскопа и определить, какая часть ее
82
Рис. 23. Спонгиоз. Расширенные межклеточные пространства в шипова-
том слое эпидермиса. Окраска гематоксилином и эозином. X 75.
Рис. 24. Спонгиоформная пустула Когоя. В зернистом слое эпидермиса
и в верхней части шиповатого — мелкоячеистая полость, содержащая
нейтрофилы и фрагменты их ядер. Окраска гематоксилином и эози-
ном. X 200.
83
Рис. 25. Экзоцитоз. Лимфоциты инфильтрируют эпидермис. Окраска гем
токсилином и эозином. X ЮО.
Рис. 26. Эпидермолиз. Субэпидермальная полость. Окраска гематоксилг
ном и эозином. X 75.
84
преимущественно вовлечена в патологический процесс (эпидермис,
дерма, подкожная клетчатка), получить общее представление о
его характере, связи с фолликулами и потовыми железами с тем,
чтобы впоследствии сосредоточить внимание на главном.
В части случаев уже при малом увеличении можно решить
вопрос, относится ли данное заболевание к воспалительным дерма-
тозам или представляет собой опухоль. При этих же условиях
можно составить представление и о виде воспалительной реакции:
локализация патологического процесса в пределах сосочкового
слоя и подсосочковой части дермы характерна для дерматозов,
которым присуще простое хроническое воспаление (экзема, псори-
аз, красный плоский лишай и др.); при дерматозах, для которых
характерна гранулематозная воспалительная реакция, патологиче-
ский процесс почти всегда захватывает и сетчатый слой, а при ря-
де заболеваний и подкожную жировую клетчатку. Лишь красная
волчанка и блестящий лишай являются исключением из этого пра-
вила. При красной волчанке воспалительный инфильтрат, не буду-
чи гранулематозным, захватывает большую часть дермы; блестя-
щий лишай, имея морфологической основой патологического про-
цесса гранулематозное воспаление, локализуется в сосочковом
слое. Однако достаточно характерные морфологические признаки
этих заболеваний позволяют довольно легко их диагностировать.
Сравнительно просто диагностировать эпителиальные и мезо-
дермальные опухоли кожи, заболевания, морфологической осно-
вой которых является специфическое гранулематозное воспаление,
с помощью специальных окрасок выявить отложение амилоида,
липидов, кальция, муцинов. Наибольшие трудности для диагности-
ческой интерпретации представляет обнаружение простого хрони-
ческого воспаления, которое составляет морфологическую основу
многих дерматозов, встречающихся в клинической практике. В та-
ких случаях следует прибегнуть к методу исключения, отвергая
дерматозы, гистологическая картина которых не соответствует той,
что имеется в анализируемом препарате. Такой метод с учетом
клинических проявлений диагностируемой болезни позволяет су-
зить круг поиска диагноза.
Анализ гистологического препарата удобно начинать сверху
вниз.
Эпидермис может быть толще и тоньше, чем в норме. Его тол-
щина главным образом определяется количеством рядов шипова-
тых клеток и в меньшей степени их размером.
При патологии отростки эпидермиса могут отсутствовать, быть
короткими и длинными, толстыми и тонкими, булавовидными и
остроконечными.
Роговой слой в различных участках нормальной кожи зна-
чительно варьирует по толщине и компактности. Поэтому необхо-
димо знать, откуда взята биопсия. Рисунок неизмененного рогово-
го слоя на большей части кожного покрова напоминает плетеную
корзину, так как при обзорных окрасках окрашиваются преимуще-
ственно стенки роговых чешуек, а их тела кажутся пустыми. При
85
некоторых дерматозах это сходство особенно выражено (плоские
бородавки). На ладонях и подошвах роговой слой компактен и
хорошо выражен.
Утолщение рогового слоя — гиперкератоз может быть относи-
тельным по сравнению с истонченными нижележащими слоями
эпидермиса и абсолютным. Он может быть ортокератотическим,
состоящим из роговых чешуек, без ядер, и паракератотическим,
содержащим пикнотические ядра. При некоторых заболеваниях
ортокератотические участки чередуются по вертикали или горизон-
тали с паракератотическими. Гиперкератоз может быть диффуз-
ным, фолликулярным, смешанным, что имеет определенное диаг-
ностическое значение при некоторых дерматозах.
При специальных окрасках в роговом слое можно обнаружить
бактерии, грибы, чесоточного клеща.
Зернистый слой нормального эпидермиса состоит из
1—2 рядов клеток, в области ладоней и подошв их больше. Увели-
чение числа рядов клеток (гипергранулез), уменьшение (гипогра-
нулез) или отсутствие зернистого слоя являются патологией. Эти
изменения могут иметь диффузный и очаговый характер (красный
плоский лишай). Гипергранулез и отсутствие зернистого слоя мо-
гут обнаруживаться в одном и том же гистологическом срезе.
Для некоторых заболеваний характерно сочетание отсутствия зер-
нистого слоя с паракератотическим гиперкератозом (псориаз).
Шиповатый слой. Число рядов шиповатых клеток опре-
деляется подсчетом их ядер по вертикали. В неизмененном эпидер-
мисе число рядов этих клеток в отростках не превышает 7—8, над
сосочками — 4. Именно в этом слое обнаруживаются разнообраз-
ные морфологические изменения, существенные для диагностики
многих дерматозов, протекающих с активным участием в патоло-
гическом процессе эпидермиса.
Здесь могут обнаруживаться признаки нарушения кератиниза-
ции (дискератоз), различные экссудативные изменения (мутное
набухание, внутри- и внеклеточный отек, баллонирующая дистро-
фия), признаки нарушения связи между клетками (акантолиз),
мукофанероз; разнообразные полости, микроабсцессы, изменения
атрофического и пролиферативного характера (акантоз), экзоци-
тоз, анаплазия.
Базальный слой состоит из одного ряда клеток, внешне
однообразных только при обзорных окрасках. В этом слое нечасто
обнаруживаются патологические изменения. В большинстве случаев
он бывает интактным. Однако при некоторых дерматозах измене-
ния в клетках этого слоя имеют существенное диагностическое
значение' очаговая вакуолизация, разрушение клеток воспалитель-
ным инфильтратом, приводящее к образованию субэпидермальных
щелей (красная волчанка, красный плоский лишай), нарушение
организации расположения клеток слоя — при некоторых опухо-
лях эпидермиса. Могут быть обнаружены количественные измене-
ния пигмента меланина. Количество меланоцитов в базальном слое
строго постоянное. Необычное уменьшение или увеличение мела-
86
ни на в большинстве случаев свидетельствует о патологии. Однако
окончательное решение следует принимать только с учетом клини-
ческих проявлений.
Базальная мембрана. Для выявления базальной мем-
браны применяют специальные гистохимические методы окраши-
вания. Состояние базальной мембраны имеет ограниченное диагно-
стическое значение, главным образом при дифференциальной
диагностике доброкачественных (базальная мембрана сохраняется)
и злокачественных (базальная мембрана отсутствует) опухолях
эпидермиса, для выявления инвазии у предраковых дерматозов
(базальная мембрана исчезает в местах инвазии).
Дерма. Основу собственно кожи составляет соединительная
ткань, в которой преобладают пучки коллагеновых волокон. Как
и расположенные между ними фиброциты, они хорошо выявляют-
ся при обычных окрасках. Другие структурные компоненты меж-
клеточного вещества соединительной ткани кожи (эластические,
аргирофильные волокна) и основное межуточное вещество выявля-
ются специальными окрасками.
Для оценки волокнистых структур дермы вначале следует
изучить их в неизмененной коже, так как без знания вариантов
нормы трудно бывает выявить патологические изменения этих
структур.
Коллагеновые волокна могут быть отечными, гомогенизирован-
ными, фиброзированными, склерозированными и гиалинизирован-
ными. При выраженном отеке пространства между пучками воло-
кон не только расширяются, но и сами пучки расслаиваются на
более тонкие. Большое диагностическое значение имеет обнаруже-
ние очаговой, в различной степени выраженной дезорганизации
коллагена (кольцевидная гранулема, липоидный некробиоз, ревма-
тоидные узелки). Эти изменения могут сопровождаться отложени-
ем муцина (кольцевидная гранулема) или жировой дистрофией
(липоидный некробиоз).
В ряде случаев существенное значение для диагноза имеет
состояние эластических волокон. Для их обнаружения применяют-
ся специальные окраски. Самой частой патологией эластических
волокон является их исчезновение на ограниченных участках (ане-
тодермия). Их отсутствие чаще всего указывает на прошедшее
воспаление, особенно гранулематозное. Вновь образующиеся эла-
стические волокна значительно тоньше нормальных и располага-
ются параллельно поверхности кожи (стрии) или образуют непра-
вильной формы петли (красная волчанка). Иногда обнаруживают-
ся утолщенные волокна, завитки из них, клубки (эластическая
псевдоксантома). Доказать фрагментацию эластических волокон
трудно, особенно на тонких срезах. В редких случаях эластолиза
эластические волокна представляются короткими фрагментами или
гранулами.
Сосочковый слой дермы вовлекается в патологический
процесс при многих дерматозах, патоморфологическая основа
которых часто локализуется глубже. В этих случаях сосочковый
87
слой может иметь короткие, длинные, узкие, широкие, булавовид-
ные или ветвящиеся сосочки. При ряде заболеваний они могут
быть выражены слабо, отсутствовать или, напротив, значительно
удлиненными и разветвленными, часто сосочки при этом отечны, в
них может обнаруживаться меланин, гемосидерин, амилоид. Ка-
пилляры в сосочках могут быть расширенными или извитыми.
Субпапиллярная часть дермы включает в себя об-
ласть расположения пре- и посткапиллярных сосудов. Она может
не входить в зону основных патоморфологических изменений,
располагающихся ниже. В этих случаях подсосочковая часть дер-
мы может быть диффузно или периваскулярно отечна. О перивас-
кулярном отеке свидетельствуют пустые пространства вокруг сосу-
дов, а при наличии инфильтрата — пустоты, разделяющие его
клетки. Эндотелий сосудов может быть набухшим или тонким, а
сами сосуды расширены в различной степени. Их стенки могут
быть утолщены за счет пролиферации адвентициальных клеток или
гиалинизированы. Застойные явления в коже определяются по
расширенным венулам и капиллярам, просветы которых заполнены
эритроцитами. О нарушении оттока свидетельствуют также расши-
ренные лимфатические капилляры.
На субпапиллярном уровне вне сосудов могут обнаруживаться
эритроциты. Их сочетание с гемосидерином свидетельствует о ге-
моррагическом характере патологического процесса (поверхност-
ный аллергический васкулит, гемосидерозы, острый каплевидный
парапсориаз). Могут обнаруживаться макрофаги, содержащие ге-
мосидерин или меланин (недержание пигмента, пойкилодермия,
меланодермия, красный плоский лишай). Значительное количество
меланофагов в сочетании с отсутствием меланина в базальном
слое диагностируется как недержание пигмента, которое может
быть идиопатическим и симптоматическим (меланодермии, крас-
ный плоский лишай, красная волчанка). Одиночные полинуклеары
и лимфоциты, нередко обнаруживаемые на субпапиллярном уровне
дермы, не имеют диагностической значимости. Вокруг капилляров
в здоровой коже всегда имеются тучные клетки. Диагностировать
их патологическую пролиферацию не всегда легко, так как при
обычных окрасках идентифицировать эти клетки трудно; их вы-
являют специальными методами окрашивания.
В тех случаях, когда основной патологический процесс рас-
полагается в субпапиллярной части дермы, он представляет собой
чаще всего так называемую простую хроническую воспалительную
реакцию, для которой характерна периваскулярная, преимуществен-
но лимфоцитарная, инфильтрация (дерматиты, экзема, токсидер-
мии, нейродермит, псориаз и многие другие). Эта неспецифиче-
ская реакция может иметь определенное диагностическое значение
только с учетом изменений в эпидермисе, которыми она обычно
сопровождается, и клинической картины заболевания.
На субпапиллярном уровне дермы может быть обнаружена
инфильтрация нейтрофилами, эозинофилами, лимфоцитами и
плазматическими клетками; мукоидное набухание, фибриноидные
88
изменения и фибриноидный некроз стенок сосудов и окружающе-
го их коллагена; лейкоцитоклазия, что характерно для поверхност-
ных аллергических васкулитов.
При анализе изменений в сетчатом слое следует обращать
внимание на топографию и клеточный состав инфильтрации, кото-
рая может быть периваскулярной, связанной с придатками кожи
или диффузной, распространяющейся на различную глубину. В сет-
чатом слое преимущественно развиваются болезни, морфологиче-
ской основой патологического процесса которых является острая
(подострая) воспалительная реакция, гранулематозное воспаление
и пролиферация опухолевых клеток. Определяет характер воспали-
тельной реакции клеточный состав инфильтрации.
Острое воспаление характеризуется инфильтрацией из полинук-
леаров. Большое количество нейтрофильных лейкоцитов указывает
на гнойный островоспалительный характер процесса (пиодермии).
Наличие в очаге острого воспаления макрофагов указывает на нача-
ло разрешения воспаления, а значительное количество фиброблас-
тов — на активность восстановительных процессов. Для очага
острого воспаления характерно также резкое расширение сосудов,
стенки которых отечны, а эндотелий находится в состоянии набуха-
ния. Характерен также выраженный отек коллагена и частично его
исчезновение.
Гранулематозное воспаление характеризуется клеточным поли-
морфизмом. Оно развивается либо как аллергическая реакция, либо
как реакция на инородное тело.
При ряде воспалительных дерматозов обнаруживается инфильт-
рат, состоящий преимуществено из клеток, мигрирующих из крове-
носного русла: нейтрофильных и эозинофильных лейкоцитов, лим-
фоцитов, плазматических клеток, а также гистиоцитов и активизи-
ровавшихся из них макрофагов.
Другая разновидность гранулематозного воспаления, представ-
ляющая собой реакцию гиперчувствительности замедленного типа
в большинстве случаев на фагоцитированные микроорганизмы
(туберкулез, сифилис, глубокие микозы), характеризуется инфиль-
трацией из лимфоцитов и гистиоцитов с их дериватами из системы
фагоцитирующих мононуклеаров (эпителиоидные клетки, гигант-
ские клетки типа Лангханса, гигантские клетки типа инородных
тел).
Гранулематозное воспаление на инородные тела («гранулема
инородных тел») характеризуется большими скоплениями гигант-
ских клеток типа инородных тел, различным количеством гистио-
цитов и отсутствием скоплений эпителиоидных клеток. Исключе-
ние составляет гранулематозное воспаление на такие инородные
тела, как цирконий, бериллий и некоторые соли ртути, на которые
развивается эпителиоидно-клеточная гранулема (аллергическая
гранулема инородных тел).
Для некоторых заболеваний (кольцевидная гранулема, липоид-
ный некробиоз, ревматоидные узелки) весьма характерна так на-
зываемая некробиотическая, или палисадная гранулема. Она рас-
89
познается по очаговому повреждению соединительной ткани, пали-
садообразно окаймленному инфильтратом, состоящим преимуще-
ственно из гистиоцитов. Характер повреждения соединительной
ткани в очагах поражения различен: от едва заметной метахрома-
зии до некроза.
Наконец, при некоторых дерматозах (гангренозная пиодермия)
в. дерме обнаруживается инфильтрация, состоящая из элементов
острого, хронического и гранулематозного воспаления: нейтрофи-
лов, эозинофилов, лимфоцитов, гистиоцитов, многоядерных гигант-
ских клеток инородных тел, очагов некроза. В таких случаях диаг-
ностируется смешанно-воспалительная гранулема.
Лимфоциты, являющиеся основными клетками в очагах хрони-
ческого воспаления, распознаются по маленькому круглому резко
базофильному ядру, цитоплазма их почти не выражена.
Плазматические клетки представляют собой округлые или ово-
идные клетки с эксцентрично расположенным ядром, содержащим
грубые частицы хроматина; цитоплазма их базофильная. Наличие
в инфильтрате плазматических клеток всегда указывает на хрони-
ческое течение воспалительной реакции. При некоторых заболева-
ниях отдельные плазматические клетки увеличиваются в размере,
гомогенизируются, становятся эозинофильными. Такие плазмати-
ческие клетки называют тельцами Русселя (риносклерома, сифи-
лис, туберкулез).
Гистиоциты определяются по светлым, овоидной формы ядрам,
похожим на ядро эндотелиальной клетки и фибробласта. Границы
самой клетки не определяются.
Макрофаги — гистиоциты, фагоцитирующие различные веще-
ства, благодаря наличию которых в цитоплазме эти клетки сравни-
тельно легко распознаются. Они могут содержать меланин, гемоси-
дерин, липоиды.
Эпителиоидные клетки — распознаются по крупному овально-
му ядру с пылевидным хроматином и широкому ободку эозино-
фильной цитоплазмы, не имеющей четких границ. Они обычно
тесно прилегают друг к Другу, образуя очаговые скопления (эпите-
лиоидно-клеточные бугорки).
Гигантские клетки типа Лангханса имеют очень крупные раз-
меры (иногда их принимают за поперечный срез сосуда), гомоген-
ную эозинофильную цитоплазму и много ядер, расположенных
кольцеобразно или подковообразно по периферии клетки. Специ-
альными окрасками в цитоплазме этих клеток могут быть обнару-
жены возбудители заболеваний (туберкулез, сифилис), а при хро-
момикозе — без дополнительных окрасок.
Гигантские клетки типа инородных тел отличаются от клеток
Лангханса еще более крупным размером и кучным расположением
многочисленных ядер. Цитоплазма этих клеток может содержать
липоиды (гигантские липофаги Тутона) или особые астероидные
тельца, фрагменты эластических волокон, кристаллические и
аморфные инородные вещества.
Количество тех или иных клеточных элементов, их взаимное
90
расположение при разных дерматозах с гранулематозной морфо-
логической основой различны, что существенно для диагностики.
При некоторых заболеваниях преобладают разной величины скоп-
ления эпителиоидных клеток с вкраплениями лимфоцитов, еди-
ничных гистиоцитов и гигантских клеток типа Лангханса (сарко-
идоз). Сочетание очаговых скоплений эпителиоидных клеток с
инфильтрацией полиморфно-ядерными лейкоцитами, лимфоцитами
и гигантскими клетками типа Лангханса дает основания предпола-
гать туберкулез кожи. Большое скопление гигантских клеток типа
инородных тел характерно для гранулематозной реакции на ино-
родное тело. Часто в этих случаях можно обнаружить само ино-
родное тело, что облегчает диагностику. Определенное диагности-
ческое значение в этих случаях имеет анамнез. Инородными тела-
ми могут быть эндогенные продукты (кератин, волос, жир, кри-
сталлы мочевой кислоты), минералы (соли металлов, татуировка),
растительные и животные продукты (масло, шовный материал,
части насекомых и растений), синтетические вещества.
При диагностике аллергического гранулематозного воспале-
ния следует учитывать не только клеточный состав инфильтрации,
но и состояние инфильтрированной ткани. Образование этого типа
гранулематозного воспаления практически всегда сопровождается
повреждением предсуществующей ткани. Повреждение может
быть казеозным некрозом (туберкулез кожи), фибриноидным не-
крозом (саркоидоз) или абсцессом (глубокие микозы), но может
сразу не обнаруживаться, так как разрушение тканей самим грану-
лематозным инфильтратом временно маскируется продуктивным
воспалением, которое на определенном этапе патологического про-
цесса формирует даже избыток ткани. Недостаток ткани в этих
случаях становится заметным только после разрешения грануле-
матозного процесса.
В пределах собственно кожи могут обнаруживаться различные
опухоли как эпителиального, так и мезодермального происхожде-
ния. Эпидермальные опухоли, исходящие из покровного эпидерми-
са или придатков кожи, а также мезодермальные опухоли кожи
различного гистогенеза распознаются сравнительно легко. Слож-
нее идентифицировать лимфоматозные пролифераты и некоторые
метастатические карциномы.
Подкожный жировой слой. Состоит из жировых долек, разде-
ляемых соединительнотканными перегородками из коллагеновых
и эластических волокон. Жировые дольки объединяют крупные
круглые клетки, содержащие жир. Цитоплазма в виде узкой полос-
ки и овальное сдавленное ядро оттеснены к периферии клетки.
В препаратах, прошедших через спирты, жир экстрагируется и
жировая ткань представляется крупнопетлистой сетью. При необ-
ходимости сохранить жир используется формалиновая фиксация с
последующей резкой срезов на замораживающем микротоме.
Изменения самой подкожной жировой клетчатки могут выра-
жаться увеличением (ожирение), уменьшением (различные «исто-
щающие заболевания»), вплоть до исчезновения, чаще всего после
91
патологических процессов, приводящих к ее гибели (индуративная
эритема, узловатый васкулит Монтгомери), или после ее первично-
го повреждения (панникулиты Вебера — Крисчена и Ротманна —
Макай).
В подкожной жировой клетчатке могут развиваться многие
заболевания, диагностика которых требует гистологического ис-
следования: сифилис, туберкулез, глубокие микозы, пиодермии,
васкулиты, панникулиты, олеогранулема, опухоли.
Преимущественное поражение подкожной клетчатки устанав-
ливается уже при малом увеличении микроскопа, затем следует
определить природу патологического процесса. Опухолевая приро-
да устанавливается сравнительно легко. Затруднения могут воз-
никнуть при гистогенетической верификации некоторых опухолей.
При диагностике воспалительных заболеваний следует учиты-
вать топографическую связь инфильтрации со структурами под-
кожного жирового слоя: сосудами, жировыми дольками, междоль-
ковыми перегородками, волосяными фолликулами, потовыми же-
лезами, что имеет диагностическое значение при некоторых дерма-
тозах. Затем анализируется клеточный состав инфильтрации.
В рассматриваемом слое кожи чаще локализуются заболевания,
морфологической основой которых являются различные типы гра-
нулематозного воспаления, реже острая или хроническая воспали-
тельная реакция, диагностические признаки которых были описа-
ны выше. В подкожной жировой клетчатке, так же как и в собст-
венно коже, могут быть обнаружены очаги обызвествления.
ИММУННАЯ СИСТЕМА, ЕЕ ФУНКЦИЯ
И ПРИНЦИПЫ ИММУНОКОРРЕКЦИИ В ДЕРМАТОЛОГИИ
Современная клиническая иммунология, которая в 1973 г.
признана ВОЗ самостоятельной дисциплиной, возникла на стыке
трех наук: микробиологии, экспериментальной аллергологии и
трансплантологии. В последние 15—20 лет эта медицинская спе-
циальность проникла во все разделы медицинской науки. От ее
развития в настоящее время зависит развитие таких важных на-
правлений практической медицины, как предупреждение и лечение
некоторых инфекционных и паразитарных заболеваний человека;
коррекция первичных и вторичных иммунодефицитных заболева-
ний, их диагностика; профилактика, диагностика и лечение ауто-
иммунных расстройств, аллергических заболеваний; снижение аку-
шерской иммунопатологии и связанной с ней пренатальной гибели
плода и постнатальной детской смертности; создание специфиче-
ской толерантности при трансплантации органов и тканей; имму-
нодиагностика и иммунотерапия опухолей; разработка новых за-
щитных средств для борьбы с повреждающими иммунитет цито-
статическими ядами, ионизирующими видами энергии и други-
ми биологическими, химическими и физическими воздействия-
92
ми, связанными с профессиональными вредностями, предвиденны-
ми и непредвиденными стихийными бедствиями.
Известно, что многие кожные заболевания также связаны с
патологическими процессами, развивающимися в иммунной систе-
ме. К ним относят аллергические кожные заболевания (экзема,
атопический дерматит и др.), пузырные дерматозы, псориаз, скле-
родермия, красная волчанка. До сих пор обсуждаются вопросы о
значении иммунных механизмов в патогенезе псориаза, так как
разные формы этого заболевания влекут различные нарушения в
функции тех или иных звеньев иммунной системы. Остается невы-
ясненной и роль нарушений в иммунной системе при гемодермиях,
несмотря на то что результаты именно иммунологических исследо-
ваний легли в основу современных зарубежных классификаций
лимфом кожи.
Не вызывает сомнения то, как важно на современном этапе
врачу-дерматологу вооружиться знаниями в области клинической
иммунологии, ибо без знания этого предмета невозможны пра-
вильное клиническое мышление, полноценная диагностика и адек-
ватная терапия многих кожных болезней.
Система иммунитета (центральные и периферические органы,
иммунокомпетентные клетки). Иммунная система человека и мле-
копитающих, как и сердечно-сосудистая, пищеварительная, эндо-
кринная, нервная, является самостоятельной системой организма,
взаимосвязанной в процессе жизнедеятельности с другими систе-
мами. Иммунная система осуществляет функцию надзора за гене-
тическим постоянством внутренней среды организма, а также за-
нимается распознаванием и уничтожением проникших извне чуже-
родных субстанций. В целом иммунная система — это совокуп-
ность всех лимфоидных органов и лимфоидных клеток тела; она
распространена по всему организму, а ее клетки через кровоток
и лимфоток постоянно циркулируют по всем органам и тканям.
Общая масса этого диффузного органа у взрослого человека со-
ставляет 1,5—2 кг, а общее число лимфоидных клеток — поряд-
ка 1012.
В иммунной системе имеются центральные и периферические
органы. К центральным органам у человека относятся тимус и
костный мозг, от нормальной деятельности которых зависит пра-
вильное функционирование иммунной системы. К периферическим
органам иммунной системы относятся селезенка, лимфатические
узлы и лимфатические фолликулы пищеварительного и дыхатель-
ного тракта. Центральными действующими агентами иммунной
системы являются клетки крови — лимфоциты. Лимфоциты чело-
века разделяются на Т-лимфоциты (тимусзависимые лимфоциты),
которые реализуют иммунный ответ клеточного типа, и В-лимфо-
Циты (бурсазависимые лимфоциты), которые реализуют иммунный
ответ гуморального типа. Бурса, или сумка Фабрициуса, является
Центральным органом иммунитета у птиц, в ней созревают В-лим-
фоциты. Подобного органа у человека не обнаружено, но термин
«В-лимфоциты» остался. Кроме Т- и В-лимфоцитов, к иммуноком-
93
петентным клеткам относят макрофаги и моноциты. Все лимфоци-
ты происходят из лимфоидных стволовых клеток (LSC) костного
мозга, а моноциты из миелопоэтических стволовых клеток (MSC)
костного мозга.
Стволовые клетки (предшественники Т-лимфоцитов) проника-
ют в тимус и там под влиянием тимических гормонов превращают-
ся в Т-лимфоциты. Эти лимфоциты (пока они не покинули тимус)
называют тимоцитами. После того как эти клетки выходят из ти-
муса, они проникают в тимусзависимые зоны периферических
органов иммунитета и после контакта с чужеродными субстанция-
ми (антигенами) приобретают антигенраспознающие рецепторы,
затем покидают эти зоны, попадают в ток лимфы, а затем — в ток
крови, где возможность контакта с антигенами возрастает.
Дифференцировка стволовых клеток в В-лимфоциты происхо-
дит в печени. Первыми маркерами В-лимфоцитов является появ-
ление на мембране этих клеток рецепторов иммуноглобули-
нов M(IgM); вторым этапом дифференцировки В-лимфоцитов яв-
ляется возникновение на их мембране рецепторов IgG. Другие ре-
цепторные механизмы для синтеза иммуноглобулинов A, D, E(IgA,
IgD, IgE) образуются путем аналогичного переходного механизма.
Когда эти В-лимфоциты мигрируют в кровь и встречаются с анти-
генами, они дифференцируются в зрелые клетки, секретирующие
антитела, эти клетки называются плазматическими, а часть В-лим-
фоцитов превращается в клетки памяти. Запуск превращения
В-лимфоцитов в плазматические или клетки-памяти происходит
при участии Т-лимфоцитов и Т-клеточных факторов либо без них
путем прямого взаимодействия антигенов с рецепторным аппара-
том В-лимфоцитов или с антителами. С этим связано происхожде-
ние таких иммунологических терминов, как «Т-зависимые иммуно-
логические реакции» и «Т-независимые иммунологические реак-
ции».
Дифференцировка таких иммунокомпетентных клеток, как
моноциты, происходит в костном мозге. После проникновения в
кровоток они становятся фагоцитирующими клетками, способными
к делению. Проникая в ткани, моноциты превращаются в незрелые
макрофаги, которые способны к делению, но, созревая, теряют
эти свойства. Сливаясь, зрелые макрофаги образуют гигантские
многоядерные клетки. Кроме этого, в процессе созревания макро-
фаги преобразуются в эпителиоидные клетки, которые в большом
количестве встречаются при гранулематозных процессах.
Три типа зрелых Т-лимфоцитов (Т-помощники, Т-эффекторы,
Т-су прессоры), три типа В-лимфоцитов (продуценты IgM, IgG,
IgA) и макрофаги обеспечивают всю гамму специфических иммуно-
логических реакций. Переработка антигена макрофагами необхо-
дима при первичном иммунном ответе, а вторичный ответ может
протекать и без участия макрофагов. После переработки макрофа-
гами антиген распознается Т-лимфоцитами-помощниками, кото-
рые включают в действие В-лимфоциты либо непосредственным
воздействием на рецепторы В-лимфоцитов, либо опосредованно
94
через макрофаги с помощью факторов, стимулирующих лимфоци-
ты. После этого и происходит трансформация В-лимфоцитов в
антителопродуценты или плазматические клетки. Т-супрессоры
контролируют развитие иммунологических реакций, их функция
заключается в том, чтобы вовремя блокировать цепную иммуноло-
гическую реакцию и на том или ином этапе останавливать продук-
цию антител. Таким образом, неадекватная выработка антител мо-
жет быть следствием не только функциональной или количествен-
ной неполноценности В-лимфоцитов, но и дефектов в работе как
Т-помощников, так и Т-супрессоров, которые являются регулято-
рами иммунологических реакций. Выработка аутоантител может
быть следствием появления аутоагрессивного клона В-лимфоцитов
или связана с недостаточной функцией Т-лимфоцитов супрессоров.
Поэтому лечение аутоиммунных заболеваний весьма сложно, так
как эти патологические состояния могут быть связаны не только
с гиперактивностью В-лимфоцитов, но и с дефектом в функции
Т-супрессоров, а противоопухолевый иммунитет, дефект которого
рассматривается как качественная или количественная неполно-
ценность Т-эффекторов, может быть связан с гиперфункцией
Т-супрессоров. Становится очевидным, как важно для адекватной
терапии оценить иммунный статус больного и рационально подо-
брать иммунокорригирующие препараты.
Неспецифические факторы иммунологической защиты. При
изучении иммунологических реакций было выяснено, что между
началом и окончанием их присходит включение ряда механизмов,
которые не являются специфическими, но без них функция им-
мунной системы неполноценна. Эти эффекторные системы играют
очень важную роль как при аллергических процессах, так и при
аутоиммунных и иммунодефицитных заболеваниях. Эти факторы
иммунологической защиты получили название неспецифических.
К ним относятся фагоцитарная система, система комплемента, ин-
терфероны, ингибиторы вирусной активности, лейкины, (3-лизины.
В процессе филогенеза эти системы возникли раньше Т- и В-систем
иммунитета, однако только взаимодействие и правильная функция
всех этих систем позволяют существовать таким высокоразвитым
организмам, как млекопитающие.
Фагоцитоз — поглощение посторонних частиц клетками.
Это явление было открыто в 1883 г. русским ученым И. И. Мечни-
ковым. К клеткам-фагоцитам у человека относятся моноциты-
макрофаги и гранулоциты (нейтрофилы, эозинофилы, базофилы).
Фагоцитарная реакция состоит из фиксации чужеродных частиц
на мембранах фагоцитирующих клеток, погружения их в цито-
плазму и переваривания или лизиса захваченных частиц. У челове-
ка фагоцитоз связан в основном с защитой от микроорганизмов,
кроме того, фагоцитарная реакция важна для переработки антиге-
на и подачи его в иммуногенной форме лимфоцитам. Фагоциты
играют ведущую роль в эффективной фазе иммуногенеза; они уча-
ствуют в атопических реакциях; дегрануляции базофильных грану-
лоцитов и тучных клеток; в цитотоксических реакциях (собствен-
9S
но фагоцитоз, опсонизация); в реакциях иммунных комплексов и
реакциях клеточного типа (хемотаксис, активация ферментных
систем и их секреция).
Система комплемента состоит из 11 белков сыворот-
ки крови, составляющих 9 компонентов. Это термолабильная фер-
ментная система; ее биологическая активность заключается в уси-
лении бактерицидных свойств сыворотки крови, фагоцитоза и
внутриклеточного переваривания чужеродных субстанций, в акти-
вации цитолиза, хемотаксиса, иммунного прилипания и выделения
клетками гистамина и анафилотоксина.
Интерфероны — группа низкомолекулярных термоста-
бильных белков, которые синтезируются лейкоцитами и обладают
противовирусной активностью. Наибольшую активность интерфе-
роны приобретают в самом начале репродукции вируса.
Кроме интерферонов, в крови имеются ингибиторы
вирусной активности. Они препятствуют контакту виру-
са с восприимчивыми клетками. Люди, в крови которых содержат-
ся в достаточном количестве эти ингибиторы, отличаются высокой
устойчивостью к вирусным инфекциям.
0-Лизины можно обнаружить в сыворотке крови после образо-
вания сгустка. Это термостабильные бактерицидные факторы, вы- .
деляемые тромбоцитами в процессе свертывания крови. Наиболь-
шую бактерицидную активность проявляют в отношении анаэробов
и спорообразующих аэробов.
Лейкины — термостабильные белковые фракции, выделяе-
мые при распаде лейкоцитов. Наибольшую бактерицидную актив-
ность они проявляют в отношении стафиллококков и других грам-
положительных микроорганизмов.
Необходимо помнить, что все эти бактерицидные свойства
сыворотки крови проявляются только в присутствии комплемента,
' его инактивация приводит к резкому снижению, а иногда и полно-
му исчезновению бактерицидной активности.
Методы оценки иммунного статуса человека. К настоящему вре-
мени накопилось большое количество исследований, отражающих
изменение иммунного статуса человека при различных патологиче-
ских состояниях и под влиянием проводимой терапии. Этот боль-
шой научно-практический материал получен благодаря тому, что,
начиная с 1970 г., в клиническую практику вошли методы, позво-
лившие охарактеризовать иммунную систему человека не только с ;
качественной, но и с количественной стороны. Это было достигну-
то с помощью тестов конкретной оценки Т-, В-систем иммунитета
и неспецифических факторов защиты. Было выяснено, что недо-
статочная количественная или функциональная активность того
или иного звена иммунитета вызывает иммунодефицитные заболе-
вания, а гиперфункция одного из звеньев на фоне гипофункции
другого — аутоиммунные процессы. Большую роль в расшифровке
иммунопатологических состояний сыграли клинико-лабораторные
методы функциональной и количественной оценки Т-лимфоцитов ;
супрессоров и Т-помощников, отработанные в 1977—1978 гг.
96 !
Благодаря этим исследованиям внесена ясность в патогенез ряда
хронических инфекционных, аутоиммунных, онкологических и ал-
лергических заболеваний. Однако несмотря на достигнутые успехи,
остается множество нерешенных вопросов, касающихся роли им-
мунной системы при целом ряде заболеваний, в том числе и тяже-
лопротекающих дерматозов. Поэтому для решения вопроса рацио-
нальной и адекватной терапии кожных заболеваний необходимо
проводить комплексную оценку иммунного статуса, включающего
в себя оценку гуморального иммунитета (В-система), клеточного
иммунитета (Т-система) и неспецифических факторов защиты.
Учитывая современный уровень знаний в области клинической
иммунологии, ВОЗ (1981) предлагает следующие тесты для оцен-
ки иммунного статуса человека с учетом количественных и
качественных характеристик иммунной системы.
1. Исследование гуморального иммунитета (определение концентрации имму-
ноглобулинов, величины циркулирующих антител после естественной или искусствен-
ной иммунизации; стимуляция биосинтеза иммуноглобулинов В-лимфоцитами в
системе in vitro; исследование бласттрансформации В-лимфоцитов на специфиче-
ские митогены, определение аутоантител и количественные тесты на содержание
В-лимфоцитов в крови).
2. Исследование клеточного иммунитета (количественные и функциональные
тесты определения в крови Т-лимфоцитов и их субпопуляций — хелперы, супрессо-
ры, киллеры, кожные пробы на гиперчувствительность замедленного типа; изуче-
ние бласттрансформации Т-лимфоцитов с помощью специфических митогенов;
растворимые медиаторы лимфоцитов и цитотоксическая активность лимфоцитов).
3. Исследование неснецифических факторов защиты (активность комплемента
и концентрация его компонентов, фагоцитарная активность нейтрофилов, моноци-
тов, хемотаксический фактор, фактор, угнетающий миграцию макрофагов, нейтро-
филов, определение различных ферментов моноцитов-макрофагов, нейтрофилов).
В соответствии с Меморандумом ВОЗ (1981) группа советских
ученых во главе с академиком Р. В. Петровым предложила разде-
лить иммунологические обследования на два уровня в соответствии
с их практической значимостью, что также должно способствовать
рациональному использованию тестов.
К первому уровню иммунологического обследования отнесены
менее трудоемкие методы, не требующие затрат на дорогостоящие
дефицитные реактивы и позволяющие получить результаты в тече-
ние двух суток (определение относительного и абсолютного числа
лимфоцитов; Т- и В-лимфоцитов; концентрации иммуноглобулинов
трех классов; титров изогемагглютининов и гетерофильных, бак-
териальных антител; прямой тест торможения миграции лейкоци-
тов на ФГА; кожные тесты гиперчувствительности замедленного
типа на туберкулин, стрептокиназу, кандидин и т. д.; определение
общей гемолитической активности комплемента С50; фагоцитар-
ной активности нейтрофилов).
Ко второму уровню специального научно-исследовательского
характера отнесены трудоемкие, доступные только для специали-
зированных лабораторий тесты, требующие дорогостоящей аппара-
туры и дефицитных реактивов (определение субпопуляций Т-лим-
фоцитов — хелперы, супрессоры, киллеры; функциональной актив-
97
4—936
Рис. 27. Розеткообразующие клетки. Окраска азуром и эозином. X 90.
ности регуляторных клеток — хелперов, супрессоров; реакции лим-
фопролиферативного ответа на митогены, антигены и в смешанной
культуре лимфоцитов — СКЛ; определение поверхностных имму-
ноглобулинов на В-лимфоцитах; продукция иммуноглобулинов
В-клетками в культуре in vitro; оценка киллеров, определение ком-
понентов комплемента и стадий фагоцитоза, развитие клеточного
и гуморального иммунного ответа). Результаты перечисленных
тестов второго уровня обследования могут быть получены в течение
4—7 сут.
Авторы указывают на то, что разделение иммунологических
тестов на уровни имеет практическое значение и позволяет диф-
ференцированно подходить к обследованию иммунной системы при
различных патологических состояниях.
С середины 70-х годов нашего столетия появились исследова-
ния, авторы которых доказали, что на мембране нейтрофилов и
других гранулоцитов периферической крови человека имеются ре-
цепторы к Fc-фрагментам иммуноглобулинов и целому ряду компо-
нентов комплемента. Кроме того, эти клетки несут на своей мем-
бране маркеры к эритроцитам барана, подобно Т-лимфоцитам они
способны к спонтанному розеткообразованию. На основании этого
для расширения оценки иммунного статуса человека были разра-
ботаны методы разделения нейтрофилов на 3 основные популяции
по их способности к спонтанному Hs-POK (рис. 27), комплемен-
тарному (Нс-РОК) розеткообразованию и нулевые нейтрофилы
(Но), не образующие розетки. Описанию постановки этих методов
98
посвящен ряд методических рекомендаций. Авторы считают целе-
сообразным включение теста нейтрофильного розеткообразования
в первый уровень обследования больного, так как эти методы не
трудоемки, их проведение не требует дорогостоящих импортных
реактивов. Они могут быть объединены с постановкой тестов
розеткообразования лимфоцитов.
Очень важным при учете количества розеткообразующих кле-
ток оказался пересчет результатов, выраженных в относительных
показателях (процент содержания), на абсолютные. Выводы, сде-
ланные по относительному содержанию розеткообразующих кле-
ток, могут привести к ошибке в интерпретации данных, так как
при наличии у больного лимфоцитоза или лимфопении относитель-
ное число розеткообразующих клеток в пределах нормы, а абсо-
лютные значения этих показателей будут совершенно разными.
Существование большого количества модификаций и огромного
разнообразия методов определения числа Т- и В-лимфоцитов за-
трудняет сопоставление данных, полученных разными лаборатори-
ями. Для решения этих вопросов представляется перспективным
использование моноклональных антител. В настоящее время ис-
пользуются следующие моноклональные антитела: для определе-
ния общего количества Т-лимфоцитов в крови — ОКТ-3, для вы-
явления субпопуляций Т-хелперов — ОКТ-4, для выявления Т-су-
прессоров и цитотоксических лимфоцитов — ОКТ-8. В-лимфоциты
дифференцируют моноклональными антителами ГСМ-1. Монокло-
нальные антитела используются также для типирования лимфоци-
тов по системе HLA. Большое будущее имеет анализ иммуноком-
петентных клеток с помощью лазерного клеточного сортера, кото-
рый анализирует от 103—104 клеток в 1 с.
Иммунокорригирующие средства. Функция иммунной системы,
как и любой другой, может нарушаться под влиянием эндогенных,
экзогенных воздействий, а порой бывает связана с врожденными
дефектами, которые передаются по наследству по рецессивному
типу. Исправление дефектов в функционировании иммунной систе-
мы получило название иммунокоррекции. В целях иммунокоррек-
ции прибегают к хирургическим методам воздействия — пересадке
тимуса, эмбриональной печени, блока тимуса с грудиной, костного
мозга. Все эти мероприятия предпринимают при врожденных де-
фектах иммунной системы, они требуют специально оснащенных
лабораторий для подбора донора и, как правило, дают лишь вре-
менное улучшение.
В настоящем разделе не будут разбираться вопросы иммуно-
коррекции, связанной с врожденной патологией иммунной систе-
мы, несмотря на то что она порой сопровождается кожной пато-
логией. В представленной главе будет заострено внимание читате-
лей на иммунокорригирующих средствах, которые используют для
исправления развившихся на фоне тяжелопротекающих дермато-
зов вторичных иммунодефицитных состояний. Возможно и такое
явление, как хронический дерматоз, возникающий на фоне уже
сформировавшегося вторичного иммунодефицита и зависящий от
4*
99
него, однако когда больной обращается к врачу, выяснить, что пер-
вично, а что вторично, как правило, не представляется возможным,
и врач при назначении иммунокорригирующих средств должен
исходить из тех клинико-иммунологических данных, которые у
него имеются.
Иммунокорригирующие препараты подразделяют на 3 группы:
иммуностимуляторы, иммунодепрессанты, заместительные имму-
нотерапические средства.
К иммуностимуляторам относятся следующие лекарственные
средства: левамизол, тималин, тактивин, натрия нуклеинат, проди-
гиозан, пирогенал, спленин, экстракт и взвесь плаценты, миелопид.
Необходимо помнить, что лечение иммунодепрессантами следу-
ет проводить под тщательным контролем периферической крови.
При снижении числа лейкоцитов (менее 4000 в 1 мкл крови) дозу
препарата уменьшают, а при снижении числа лейкоцитов менее
3000 в 1 мкл препарат отменяют.
Следует отметить, что некоторые лекарственные средства хотя
и не относятся к иммунодепрессантам, но обладают побочным
иммунодепрессивным действием. Длительное их использование в
лечебных целях вызывает развитие вторичного лекарственного им-
мунодефицита.
К препаратам, обладающим побочными иммунодепрессивными
свойствами, получившими название «слабые иммунодепрессанты»,
относят нестероидные противовоспалительные препара-
ты (НПВП) — производные орто-оксибензойной кислоты (сали-
цилат натрия и ацетилсалициловая кислота или аспирин), произ-
водные антрониловой кислоты (мефенамовая и флуфенамовая
кислоты); пиразолона (амидопирин, бутадион, анальгин, стампи-
рин); индолуксусной кислоты (индометацин); пропионовой кисло-
ты (ибупрофен, кетопрофен, супрофен); хинолиновые производ-
ные (делагил, мекаприн, атебрин, квинакрин, резохин, хлорохин,
ниваквин).
По данным некоторых авторов, в опытах на животных, в систе-
ме in vitro и в клинических исследованиях длительное применение
НПВП вызывает развитие вторичного лекарственного иммуноде-
фицитного состояния. Их иммунодепрессивные свойства реали-
зуются в основном за счет воздействия на процессы кооперации
Т- и В-лимфоцитов в иммунном ответе. Наибольшей иммуноде-
прессивной активностью обладают мефенамовая кислота и индоме-
тацин, которые оказывают тормозящее влияние на дифференци-
ровку стволовых клеток. При обследовании больных в динамике
лечения НПВП выяснилось, что через 10 дней после начала приме-
нения этих препаратов происходит уменьшение числа иммуноком-
петентных клеток и снижение розеткообразующей функции ней-
трофилов.
Антибиотики широкого спектра действия, антибиотики тетра-
циклинового ряда, цефалоспорины, полусинтетические пеницил-
лины, антрациклины и рифамицины, при длительном примене-
нии также вызывают развитие вторичных иммунодефицитных
100
состояний. Некоторые из этих антибиотиков, например полусинте-
тическиё пенициллины (ампициллин, карбенициллин), осуществля-
ют иммунодепрессивную активность, препятствуя взаимодействию
Т- и В-лимфоцитов, а цефалоспорины (цепорин, целлоспор) не-
посредственно воздействуют на иммунокомпетентные клетки, вме-
шиваясь в процессы размножения и снижая тем самым их количе-
ство; тетрациклины и антрациклины вызывают уменьшение био-
синтеза антител.
Биологически активное вещество гепарин препятствует взаимо-
действию Т- и В-лимфоцитов в процессе иммунного ответа. Им-
мунодепрессивное действие гепарина осуществляется путем ком-
плексообразования гепарина с рецепторным аппаратом Т-, В-лим-
фоцитов и макрофагов. В результате этого процесса иммуноком-
петентные клетки не распознают друг друга. Клиническое исполь-
зование гепарина при таких аутоиммунных заболеваниях, как сис-
темная красная волчанка и склеродермия, основано именно на его
иммунодепрессивном действии.
Следует помнить, что при назначении длительных курсов ле-
карственных препаратов, обладающих слабой иммунодепрессивной
активностью, возможно развитие вторичного лекарственного имму-
нодефицитного состояния. Поэтому указанную терапию необходи-
мо проводить под постоянным контролем периферической крови,
а при необходимости оценивать иммунный статус для включения
в комплексную терапию иммуностимулирующих средств.
Заместительная иммунокорригирующая те-
рапия включает в себя введение в организм больного готовых
антител. К таким препаратам относят человеческий иммуноглобу-
лин, у-глобулин и противостафилококковый донорский у-глобулин.
Необходимо еще раз подчеркнуть, что многие хронические
кожные заболевания развиваются на фоне патологического состо-
яния иммунной системы, поэтому проведение адекватной иммуно-
коррекции наряду со специфической терапией является необходи-
мым лечебным мероприятием.
Принципиальные подходы к иммунокорригирующей терапии
дерматологических больных. Решение вопроса о применении им-
мунокорригирующей терапии у больных с хронической кожной
патологией необходимо начинать с обследования иммунного стату-
са пациента. Для правильного заключения обычно бывает доста-
точно провести иммунологическое обследование первого уровня,
позволяющее выяснить, какое из звеньев иммунной системы наи-
более сильно пострадало. После этого для адекватной терапии на-
ряду с общепринятыми методами лечения того или иного дерма-
тоза в схему терапии включают иммунокорригирующие препараты.
В целях индивидуального подбора адекватного иммунокорриги-
рующего препарата и прогнозирования его терапевтической эф-
фективности некоторые исследователи рекомендуют использовать
тест определения розеткообразующих свойств лимфоцитов и ней-
трофилов под воздействием лекарственных препаратов в системе
in vitro. Для этого первоначально проводят выделение чистой по-
101
пуляции лимфоцитов и нейтрофилов из венозной крови больного
по следующему методу. Из локтевой вены забирают 3,5—4 мл
крови в пробирку и добавляют 75—100 ME гепарина. После отста-
ивания в течение 40—45 мин при комнатной температуре (+ 18—
20 °C) образовавшуюся плазму отсасывают и разводят средой
199 в 2 раза. Затем с помощью пастеровской пипетки эту разве-
денную плазму наслаивают на градиент фикол-верографин
(а= 1,077) в соотношении 3:1. Для приготовления градиента сме-
шивают 24 части 9 % раствора фикола и 10 частей 34 % раствора
верографина, сразу после наслоения смесь центрифугируют при
1500 об/мин (480g) в течение 30 мин. При таком методе разделе-
ния клеток крови можно проводить исследования как лимфоцитов
чистой популяции, так и нейтрофилов. Для получения чистой по-
пуляции лимфоцитов их после центрифугирования собирают из
кольцевого слоя над фиколом. Нейтрофилы же остаются в осадке,
но так как в нем имеется примесь эритроцитов, то к осадку добав-
ляют несколько капель дистиллированной воды и пипетируют в
течение 20 с. Затем туда наливают 4—5 мл среды 199 и центрифу-
гируют в прежнем режиме в течение 5 мин. «Надосадок» отсасы-
вают, а осадок еще дважды отмывают средой 199 в том же режи-
ме. В полученном осадке — 99 % нейтрофилов, а примесь других
клеток составляет не более 1 %. Изучение розеткообразующих
свойств лимфоцитов и нейтрофилов проводят по общепринятым
методам, добавляя в культуру in vitro лекарственные вещества в
различных концентрациях; время инкубации 30—60 мин. По про-
центу стимуляции розеткообразования или угнетению судят о дей-
ствии препарата на иммунокомпетентные клетки пациента.
Изучение действия препаратов на иммунокомпетентные клетки
больного можно проводить и в тесте бласттрансформации лимфо-
цитов. При этом способе в культуральную среду также добавляют
в различной концентрации иммунокорригирующие препараты и по
их тормозящему или стимулирующему действию на бласттранс-
формацию прогнозируют рациональность применения лекарствен-
ных веществ. Однако сложность постановки реакции бласттранс-
формации, необходимость использования импортных митогенов и
оборудования затрудняют внедрение этого метода в клиническую
практику.
На примере иммунологического обследования больных разны-
ми формами псориаза и проверки эффективности иммунокорри-
гирующих препаратов на розеткообразующие свойства нейтрофи-
лов и лимфоцитов в системе in vitro ниже будут приведены прин-
ципиальные подходы к включению в схему лечения больных имму-
нокорригирующих средств.
Оценка иммунного статуса первого уровня была проведена у
следующих больных псориазом (табл. 1).
В результате проведенного иммунологического обследования
было выяснено (табл. 2), что у больных ограниченным псориазом
(ОП) не обнаружено поражения Т- и В-систем иммунитета, а
наблюдается только снижение розеткообразующих свойств нейтро-
102
Таблица 1. Распределение обследованных больных разными
формами псориаза
Параметр ОП РП АП ПП
Число больных: 26 25 24 25
мужчины 15 16 17 1
женщины 11 9 7 8
Возраст, годы 20—58 18—61 21- 66 24-60
Условные обозначения: ОП ограниченный псориаз, РП — распро-
страненный псориаз, АП — артропатический псориаз, ПП — пустулезный псо-
риаз.
Таблица 2. Оценка иммунного статуса у больных разными
формами псориаза
Группа больных Иммунологические показатели Предполагаемая им мунокоррекния
л т в Л о H Hs He Ho Ф
он tl tl tl tl tl tl II 1 1 Умеренная ИС
РП И II II tl II tl II 1 1 Интенсивная ИС
АП f tl tt 11 tt tt t ИС + ИД
ПП 1 II t t tl II II t II ИС
Условные обозначения: Л — лимфоциты, Т — система иммунитета,
В — система иммунитета, Ло - нулевые лимфоциты, Н нейтрофилы, Hs —
спонтанные розсткообразующие нейтрофилы, Нс комплементарные розеткооб-
разующие нейтрофилы, Но нулевые нейтрофилы, Ф — фагоцитоз: ИС имму-
ностимулирующая терапия, ИД иммунодепрессивная терапия; tl—без изме-
нения, | умеренное угнетение иммунологических показателей, | — умеренная
стимуляция иммунологических показателей, || — интенсивное угнетение иммуно-
логических показателей, ft— интенсивная стимуляция иммунологических пока-
зателей.
филов и некоторое уменьшение их фагоцитарной активности, т. е.
у больных этой группы в основном затронуто звено неспецифи-
ческой иммунологической защиты. У больных распространенным
псориазом (РП) выявлено более глубокое поражение иммунной
системы. У этих пациентов страдают практически все звенья им-
мунологической защиты. При пустулезном псориазе (ПП) на фоне
резкого угнетения Т-звена иммунитета произошло умеренное сни-
жение функции В-системы и увеличение числа нулевых лимфоци-
тов (Ло), которые не несут на своей мембране маркеров ни Т-, ни
В-лимфоцитов. На фоне этих изменений у больных ПП произошло
также резкое угнетение функции неспецифического звена иммуно-
логической защиты, выражающееся в снижении розеткообразую-
щих свойств нейтрофилов и их фагоцитарной активности. У боль-
ных артропатическим псориазом (АП) развился серьезный дисба-
ланс в функции иммунной системы, который проявился в резкой
активации неспецифического звена иммунологической защиты,
103
выражающейся в значительном усилении розеткообразующих
свойств нейтрофилов и их фагоцитарной активности на фоне угне-
тения работы Т- и В-звеньев иммунитета.
Основываясь на полученных данных, вопрос о включении в схе-
му лечения иммунокорригирующих средств однозначно решить
трудно. Учитывая механизм действия известных иммунокорриги-
рующих препаратов, был проверен эффект спленина, тактивина,
экстракта плаценты и метотрексата на розеткообразующие свой-
ства лимфоцитов и нейтрофилов больных в системе in vitro.
Индивидуальное исследование действия иммунокорригирующих
препаратов на розеткообразующие свойства нейтрофилов и лимфо-
цитов в системе in vitro показало, что при РП наиболее рацио-
нальным является включение в комплексную терапию таких им-
муностимуляторов, как тактивин и спленин, при ПП наиболее
рациональным оказалось применение экстракта и взвеси плаценты;
больные АП потребовали сложной иммунокорригирующей терапии
с применением метотрексата и нуклеината натрия. Результаты
иммунокорригирующей терапии у больных разными формами псо-
риаза представлены в табл. 3.
Таблица 3. Иммунокоррекция у больных разными формами псориаза
Группа больн ых Препараты, исследованные в системе in vitro
тактивин спленин экстракт плаценты натрия нуклеинат метотрек- сат
он — — — ++ —
РП ++ + ++ — — —
ПП +- +- +++ — —
АП — — — ++ ++
Условные обозначения: — не оказывает иммунокорригирующего дей-
ствия, иммунокорригирующее действие недостоверно, ++ хорошее иммуно-
корригирующее действие, + + + интенсивная иммунокоррекция.
Подобные подходы к иммунокорригирующей терапии адекват-
ны и оправдали себя во многих ведущих дерматологических кли-
никах.
ИММУНОПАТОЛОГИЯ кожи
В этом разделе приведены наиболее яркие примеры иммуно-
патологических процессов и сопряженных с ними молекулярно-
биологических нарушений структур кожи при дерматологических
заболеваниях, исследуемых с помощью меченых антител.
Применение антител, в частности моноклональных антител,
направленных к одной определенной детерминанте, приближает
исследования к молекулярному уровню, что способствует более
глубокому анализу процессов, происходящих в коже в норме и
при патологии.
104
В коже практически здорового молодого организма фиксиро-
ванные в тканях кожи иммуноглобулины (ИГ) с помощью мече-
ных антител либо вовсе не выявляются, либо выявляются в очень
небольших количествах и только в дерме (Белецкая Л. В. и др.,
1981; Бухова В. П. и др., 1986; Beutner Е. Н. et al., 1973]. В эпидер-
мисе не удается выявить у здоровых лиц иммуноглобулины даже в
растворимой форме, туда он, по-видимому, в норме практически
не проникает. Поскольку среди функций кожи числится и функция
выведения (секвестрации) гранул иммунных комплексов из орга-
низма [Белецкая Л. В., 1986, и др.], то в дерме и эпидермисе при
самых разных заболеваниях, в частности инфекционных (острых,
хронических, очаговых), можно обнаружить небольшие количества
иммуноглобулинов в фиксированной (нерастворимой) форме.
При патологических процессах фиксированные в коже ИГ в ви-
де антител, как правило, входят в состав иммунных комплексов
с антигеном. Однако не исключено отложение агрегированных
белков, причиной агрегации которых являются иные эффекторные
свойства ИГ. Следует различать 2 формы фиксации ИГ в тканях:
связывание ИГ с антигенами структур кожи, к которым направле-
ны антитела, и фиксацию ИГ в гранулах иммунных комплексов
(ИК), где антитела могут быть направлены к чужеродным анти-
генам или антигенам другого органа. Таким образом, в первом
случае кожу следует рассматривать как орган-мишень для ауто-
антител, а во втором случае — как выделительный орган, в ко-
тором при нарушении выделительной функции скапливается боль-
шое количество гранул ИК. Обладая повреждающими свойствами
благодаря входящим в их состав компонентам комплемента, И К
вызывают нарушение обмена и структуры тканей органов. Заболе-
ваниями, при которых кожа выступает в роли органа-мишени,
являются, например, пузырчатка и буллезный пемфигоид; наибо-
лее яркий пример заболеваний с иммунокомплексным синдро-
мом— системная красная волчанка (СКВ). Существуют и сме-
шанные формы процессов.
При исследовании тканей больного из участков клинически
неизмененной кожи с помощью гистологических методов не всегда
удается заметить какие-либо нарушения в структурах органа, в то
время как при использовании антител, направленных к детерми-
нантам отдельных соединений кожи, в этих случаях можно вы-
явить ранние признаки деструкции. Ниже приводятся особенности
иммунопатологических изменений кожи при пузырчатке, васкули-
тах, системных заболеваниях соединительной ткани.
Среди патогенетических факторов при пузырчатке основ-
ную роль отводят аутоагрессии [Ежов Н. Я. и др., 1977; Beutner Е. Н.
et al., 1973, и др.[. Аутоантитела, определяемые с помощью непря-
мого метода иммунофлюоресценции, циркулирующие в крови боль-
ных разными формами пузырчатки (вульгарная, вегетирующая,
листовидная, себорейная), направленные к антигенам (гликопро-
теинам) межклеточной склеивающей субстанции (МСС) много-
слойного плоского эпителия (кожи, слизистой оболочки полости
105
Рис. 28. Локализация иммуноглобулиноа в коже при различных патологи-
ческих процессах.
а — срез кожи человека, обработанный сывороткой больного вульгарной пузырчаткой
(непрямой метод иммунофлюоресценции); реакция в зоне межклеточных промежутков
эпидермиса; б — срез пищевода кролика; обработка та же; реакция в межклеточных
промежутках эпителия.
рта, пищевода и других органов), обладают высокой тканевой спе-
цифичностью и относятся к классу IgG (рис. 28, а, б; 29, а, б, в,
30, 31). Локализация антигенов, к которым направлены антитела,
совпадает с локализацией первичных деструктивных изменений в
эпидермисе [Chorzelski Т. R., Beutner Е. Н., 1971, и др.]. Известно,
что образование внутриэпидермального пузыря при пузырчатке
начинается с нарушения связей между отдельными клеточными
элементами эпителия [Ежов Н. Я., 1975; Левина Е. Н., 1977] и
является результатом токсического действия образовавшихся им-
мунных комплексов. Антитела не реагируют ни с одним из анти-
генов других тканей, кроме антигенов межклеточной склеиваю-
щей субстанции эпителия телец Гассаля тимуса человека и живот-
ных, что служит дополнительным доказательством эпидермальной
природы паренхимы вилочковой железы.
Титры антител при выраженной клинической картине, опреде-
ляемые в реакции иммунофлюоресценции, колеблются от 1:100 до
1:1000. Отмечают прямую зависимость между тяжестью заболева-
ния и количеством в крови аутоантител. Применение современных
методов терапии сопровождается выраженным падением титров
[Бухова В. П. и др., 1986]. При исследовании сывороток больных
другими заболеваниями, в том числе кожными, в подавляющем
большинстве случаев подобные антитела обнаружить не удается.
Лишь у некоторых больных миастенией гравис и ожоговой болезнью
обнаружены антитела к антигенам МСС многослойного плоского
эпителия, однако в этих случаях обращают на себя внимание их
низкие титры (1:8). Известно, что изоантигены в эпидермисе рас-
положены на поверхности эпителиальных клеток, поэтому в слу-
чаях наслоения на срез кожи человека, имеющего группу крови II,
III и IV, сыворотки донора, содержащей антитела к А- или В-изо-
антигенам, картина свечения напоминает таковую при вульгарной
пузырчатке. Для исключения того, что сыворотка больных вуль-
гарной пузырчаткой реагирует с компонентами среза за счет изо-
106
Рис. 29. Срезы кожи больного вуль-
гарной пузырчаткой, обработанные
люминесцирующей сывороткой
против IgG человека (прямой ме-
тод).
а — локализация IgG в межклеточном про-
странстве; б — формирование внутриэпи-
дермального пузыря; в — внутриэпидер-
мальный пузырь.
Рис. 30. Срез кожи здорового человека, обработанный люминесцирующей
сывороткой против иммуноглобулинов человека (прямой метод). Реакция
отсутствует.
Рис. 31. Срез тимуса плода человека; обработка сывороткой больного
пузырчаткой; реакция в зоне межклеточных пространств тельца Гассаля
(непрямой метод).
антител, в контрольных исследованиях сыворотки предварительно
адсорбируют эритроцитами, содержащими А- и В-антигены. Такая
адсорбция не должна влиять на характер реакции. Дополнитель-
ным доказательством того, что реакция при пузырчатке не зависит
от участия в ней изоантител, является положительная реакция на
срезах эпидермиса и эпителия слизистых оболочек органов чело-
107
века группы крови 0 и животных, где антигены, соответствующие
изоантигенам человека, отсутствуют.
Связанные с тканями иммуноглобулины определяют методом
прямой иммунофлюоресценции в срезах, предварительно подверг-
шихся промыванию в физиологическом растворе (pH 7—7,3) в те-
чение 20—30 мин, в целях удаления пропитывающих ткани сыво-
роточных белков.
При исследовании срезов биоптата кожи больных пузырчаткой,
обработанных после промывки люминесцирующей сывороткой
против иммуноглобулинов человека, связанный с тканями иммуно-
глобулин обнаруживают в межклеточных пространствах эпидер-
миса. Он имеется как в участках пораженной кожи, так и в участ-
ках без видимых поражений. Обнаруженный иммуноглобулин от-
носится к классу G [Beutner Е. Н. et al., 19731. Чаще всего свя-
занный иммуноглобулин удается выявить в эпидермисе больных
пузырчаткой в период обострения, иногда же и в период ремиссии
при отсутствии кожных изменений.
В районе образования пузыря в срезах иммуноглобулин нахо-
дят также в цитоплазме эпителиальных элементов эпидермиса и
плавающих в экссудате акантолитических клеток. Положительную
реакцию можно наблюдать в цитоплазме акантолитических эле-
ментов и при использовании мазков-отпечатков [Шапошников О. К.
и др., 1972]. Как в межклеточных пространствах, так и в цито-
плазме акантолитических клеток иммуноглобулин прочно связан
с тканями. Промывка срезов в фосфатном буфере (pH 7—7,3)
в течение 1 —18 ч на характер реакции не влияет. Помещение
срезов в кислый соляно-глициновый буфер (pH 2,8) на 18 ч сопро-
вождается элюцией иммуноглобулина из межклеточных прост-
ранств эпидермиса, однако в цитоплазме клеточных элементов
он сохраняется и при этих условиях.
В местах локализации связанного иммуноглобулина обнару-
жен Сз-компонент комплемента [Beutner Е. Н. et al., 1973, и др.|.
Таким образом, локализация иммуноглобулина, комплемента так
же, как и антигена, к которому направлены антитела, циркулирую-
щие в крови, совпадает с местом первичного поражения эпидерми-
са, характеризующегося, как указывалось выше, разрывом меж-
клеточных связей эпителия и образованием внутриэпидермальных
пузырей. При вульгарной, вегетирующей и листовидной формах
пузырчатки иммунопатологический процесс имеет одинаковый
характер, не позволяющий различить эти формы между собой.
Себорейная, или эритематозная, пузырчатка отличается от осталь-
ных форм менее высокими титрами циркулирующих антител к
межклеточной склеивающей субстанции многослойного эпителия
и более умеренным количеством фиксированного в эпидермисе
больного иммуноглобулина.
Среди патогенетических факторов буллезного пемфи-
гоида важное мрсто занимают аутоантитела [Beutner Е. Н.
et al., 1973, и др.]. Одним из первичных деструктивных изменений
кожи является разрушение базальной мембраны эпидермиса с по-
't 08
Рис. 32. Иммуноморфологические
изменения базальной мембраны,
а — срез кожи здорового человека; обрабо-
тан сывороткой больного буллезным пем-
фигоидом; реакция в зоне базальной мемб-
раны эпидермиса (непрямой метод); б —
срез кожи больного буллезным пемфигои-
дом; обработан антителами против IgG
человека, локализация та же (прямой ме-
тод) ; в — срез кожи больного аллергиче-
ским васкулитом; обработан антителами
против IgG человека: отложение И К в
стенках сосудов сосочкового слоя (прямой
метод), по Т. С. Алиеву.
следующим образованием подэпидермального пузыря. При исполь-
зовании метода непрямой иммунофлюоресценции (рис. 32, а—в)
в сыворотке крови больных буллезным пемфигоидом обнаружены
антитела, реагирующие с компонентом базальной мембраны эпи-
дермиса кожи человека и животных [Левина Е. Н., 1977]. Это
соединение базальной мембраны получило название пемфигоидно-
го антигена. Антитела не являются специфичными только для
базальной мембраны эпидермиса, они взаимодействуют с антиге-
ном базальных мембран эпителия слизистой оболочки полости
рта, пищевода, трахеи, бронхов, желчного пузыря, уретры, мочево-
го пузыря и ряда других органов. Однако реакции с компонентами
каких-либо иных парапластических или клеточных структур тка-
ней, помимо базальных мембран, не обнаружены [Левина Е. Н.,
1977; Beutner Е. Н. et al., 1977, и др.]. Антитела при буллезном
пемфигоиде в основном относятся к иммуноглобулинам класса G.
Существует прямая зависимость между титрами антител и тяже-
стью заболевания. В выраженных случаях титры антител к антиге-
нам базальной мембраны в реакции иммунофлюоресценции дости-
гают разведений 1:1000. В период ремиссии в большинстве случаев
антитела в крови отсутствуют. Лечение кортикостероидами приво-
дит к выраженному снижению количества антител. При слабо-
выраженной клинической картине антитела удается обнаружить не
у всех больных, однако в таких случаях, как правило, помогает
прямой метод иммунофлюоресценции, с помощью которого можно
определить антитела, фиксированные в тканях.
109
Связанный иммуноглобулин обнаруживают практически у всех
больных буллезным пемфигоидом. При нанесении на срезы кожи,
взятой при биопсии из участков пораженной ткани и пограничных
зон, люминесцирующей сыворотки против иммуноглобулинов че-
ловека связанные с тканями белки обнаруживаются в базальной
мембране эпидермиса. Иммуноглобулин содержится как в мембра-
не, сохранившей свою целостность, так и в фрагментах мембраны
в участках деструкции тканей. Связанные с тканью антитела отно-
сятся к классу иммуноглобулинов G. В этой же локализации вы-
явлен комплемент.
Васкулиты. Большинство форм васкулитов, имеющих яр-
кие кожные проявления, является выражением генерализованных
аллергических процессов, при которых ИК играют роль одного из
основных патогенетических факторов [Алиев Т. С., 1980]. Иммун-
ные комплексы, как указывалось, обладая токсическими свойства-
ми, вызывают нарушение обмена в тканях, в которых они локали-
зованы, и оказывают на них деструирующее действие. Антигенным
компонентом таких комплексов могут быть как чужеродные аген-
ты, например антигены стрептококка, стафилококка, вирусов и
других инфекционных факторов, так и соединения организма,
такие как ДНК, ДНП, коллаген, иммуноглобулины и др. С по-
мощью метода иммунофлюоресценции в срезах тканей кожи, взя-
той у таких больных при биопсии, может быть выявлен каждый
из компонентов комплекса. Не у всех больных наблюдаются столь
выраженные иммунопатологические изменения. Для нарушения
метаболизма и развития деструктивных изменений в тканях доста-
точно участия значительно меньших количеств ИК. В местах пора-
жения нередко выявляют также фибриноген, сопутствующий
обычно иммунопатологическому процессу в тканях, и другие сы-
вороточные белки.
Системная красная волчанка (СКВ). Некоторые
исследователи [Насонова В. А., 1972; Левина Е. Н., ХЧ11, и др.]
возможной причиной заболевания считают вирус. Полагают, что
вирус, вызывая первичные поражения тканей, является толчком
развития аутоиммунного процесса. Одним из характерных призна-
ков СКВ является феномен образования LE-клеток. LE-клетки,
обнаруживаясь в крови 75—80 % больных, представляют собой
лейкоциты, фагоцитировавшие ядерный детрит разрушенных кле-
точных элементов (рис. 33, а, б). Воспроизводится феномен с по-
мощью добавления сыворотки больного к взвеси лейкоцитов чело-
века или животного любого вида. Ответственными за образование
LE-клеток являются антитела к компонентам ядра. После адсорб-
ции сыворотки больных взвесью изолированных ядер или выде-
ленным из них нуклеопротеином они теряют способность стиму-
лировать образование в эксперименте LE-клеток. Антитела к раз-
личным компонентам ядра при СКВ относятся в основном к имму-
ноглобулинам класса G. В сыворотках больных обнаружены анти-
тела, реагирующие с однотяжевой, двутяжевой и денатурирован-
ной ДНК, нуклеопротеином, гистонами и другими белками ядра
110
[Корогодин Д. В., Поверенный А. М., 1981; Левина Е. Н., 1977].
Кроме антител к компонентам ядра, в сыворотке больных волчан-
кой находят антитела к антигенам цитоплазмы, рибосом и мито-
хондрий различных клеточных элементов, в том числе эритроци-
тов и тромбоцитов, а также антитела к тромбопластину. В поли-
нуклеарных лейкоцитах при выраженной форме процесса выявля-
ются гранулы ИК (рис. 33, в). При изучении сывороток больных
СКВ непрямым методом иммунофлюоресценции (рис. 33, г) на
первый план выступают антитела к компонентам ядер клеток,
объединенные под названием антинуклеарный фактор (АНФ).
Антитела, входящие в АНФ, не являются видоспецифическими и
могут быть выявлены на срезах тканей животных любого вида. Для
выявления АНФ удобны срезы печени, почек, мазки крови, содер-
жащие лейкоциты, мазки взвеси ядер гемолизированных эритроци-
тов птиц. Однако для получения сравнимых результатов общепри-
нятым является использование срезов печени крысы, фиксирован-
ных в этаноле.
Отмечают несколько типов реакций сыворотки больных СКВ со
структурами ядра: диффузный, кольцевидный, пятнистый, ядрыш-
ковый [Белокриницкий Д. В. и др., 1973]. Имеются данные о том,
что диффузный тип свечения связан с наличием антител к нуклео-
протеину, пятнистый тип — с антителами к гликопротеидам [Ле-
вина Е. Н., 1977]. По данным ряда исследователей, полученным
на материале большой группы больных, антинуклеарный фактор
при СКВ обнаруживается практически в 100 % случаев. Титры
антител в большинстве случаев коррелируют с тяжестью заболе-
вания. В наиболее тяжелых случаях они доходят в реакции имму-
нофлюоресценции до разведения 1:1000. Улучшение состояния
больного сопровождается падением титров; в период ремиссии, хотя
антитела обнаруживаются постоянно, титры их падают обычно до
1:100 и ниже. Имеется также определенная зависимость между
тяжестью состояния больного и характером свечения ядра. До на-
чала лечения, например, реакция сыворотки больных с ядрами
сопровождается сплошным свечением, а после лечения наблюдает-
ся смешанный и пятнистый тип. Сыворотки некоторых больных,
находившихся в состоянии ремиссии, вызывают лишь слабое пят-
нистое свечение; иногда наблюдается реакция, при которой свече-
ние локализовано только в ядрышках. При изучении сыворотки
практически здоровых людей при применении серологических ме-
тодов ни в одном случае из 221 не отмечено положительных ре-
зультатов реакции ни с ДНК, ни с нуклеопротеином. В опыте же
иммунофлюоресценции около 10 % сывороток доноров реагирова-
ли с ядрами срезов тканей в титрах до 1:50. АНФ чаще всего
встречается у пожилых людей в возрасте 60—80 лет (16,3%).
В группе людей в возрасте 20—60 лет положительная реакция
выявляется только в 3,6 % случаев. При исследовании контроль-
ной группы больных в случаях волчаночного гепатита титры АНФ
доходили до разведения 1:1000. При других поражениях печени
(алкогольный цирроз, цирроз, развившийся после инфекционной
111
Рис. 33. Иммуноморфологические изменения крови и кожи при СКВ.
а — мазок крови больного СКВ, обработанный сывороткой, содержащей антитела к
антигенам ядра; в цитоплазме LE-клеток, помимо ядра, выявляются округлые глыбки
ядерного материала погибших клеточных элементов, которые фагоцитировали поли-
нуклеарные лейкоциты (непрямой метод); б — мазок крови здорового человека, конт-
роль; в — мазок крови больного СКВ, обработанный антителами к IgG человека, гранулы
иммунных комплексов в наружной зоне цитоплазмы пол и нуклеарного лейкоцита (прямой
метод); г—препарат соединительной ткани, обработанный сывороткой больного СКВ,
реакция АНФ в зоне ядер клеток (непрямой метод); д — срез кожи больного СКВ,
обработанный антителами к IgG человека; отложение гранул иммунных комплексов в
дермо-эпидермальной зоне (прямой метод); е — срез кожи здорового человека; обработ-
ка антителами к базальному клеточному антигену (непрямой метод); реакция в цито-
плазме клеток базального слоя;
112
Рис. 33. Продолжение.
ж — срез кожи больного СКВ, обработка
та же; синтез базально-клеточного антигена
резко ослаблен; клетки, содержащие анти-
ген, рассеяны по всей толще эпидермиса,
з — срез кожи практически здорового че-
ловека, обработанный сывороткой против
коллагена IV типа; реакция в зоне базаль-
ной мембраны эпителия и сосудов кожи
(непрямой метод); и —.срез кожи больного
СКВ, обработка та же; ослабление реакции
в зоне базальной мембраны эпидермиса.
желтухи) получены отрицательные результаты. В сыворотке поло-
вины обследованных больных дискоидной волчанкой АНФ содер-
жался в невысоких титрах и давал пятнистый тип свечения. Ан-
тинуклеарный фактор в 40 % у больных ревматоидным артритом
выявляется в достаточно высоких титрах (1:100— 1:500). Чаще все-
го он относится к классу ИГО. При ревматизме АНФ, как правило,
не обнаруживают, при миастении гравис положительные реакции
отмечены в 10 % случаев. Наиболее высокие титры антинуклеар-
ного фактора при миастении нередко совпадают с наличием у
больного тимомы. При системной склеродермии титры АНФ не
выше 1:100.
Методом прямой иммунофлюоресценции при системной крас-
ной волчанке в срезах биопсии кожи и почек выявляются связан-
ные иммуноглобулины (в ядрах клеток) и отложения гранул им-
мунных комплексов в тканях. Проведенный рядом авторов анализ
биопсии кожи больных системной красной волчанкой указывает
на наличие в зоне базальной мембраны иммуноглобулинов клас-
са G, иногда в сочетании с IgM и IgA. Свечение в зоне базальной
мембраны имеет неравномерный гранулярный характер, что ха-
рактерно для отложений иммунных комплексов (рис. 33, д). В этих
же местах наблюдается локализация сывороточного комплемента.
Отмечена определенная зависимость частоты выявления иммунных
комплексов от степени активности процесса. Наступление ремис-
сии в результате лечения сопровождается уменьшением количества
И К, их секвестрацией из организма.
113
При других заболеваниях, например, таких как ревматоидный
артрит, гломерулонефрит, язвенная болезнь, дерматомиозит, псо-
риаз, геморрагический васкулит, иммуноглобулины в зоне базаль-
ной мембраны кожи отмечают лишь в небольшом количестве и
малом числе случаев.
Применение метода ИФ в исследовании кожи при обследова-
нии больных СКВ в процессе лечения традиционными методами
и аферентной терапией дает дополнительные возможности опреде-
ления степени остроты заболевания и оценки эффективности ле-
чения [Бухова В. П., 1986].
Свечение отмечают также иногда в ядрах эпителиальных эле-
ментов эпидермиса кожи. Тип свечения при волчанке в зоне ба-
зальной мембраны эпидермиса, как отмечалось, относится к зер-
нистому, характерному для отложений в тканях иммунных комп-
лексов, и резко отличается от линейного типа свечения базальной
мембраны при буллезном пемфигоиде, при котором аутоантитела
направлены к антигенам самой базальной мембраны. При СКВ
правильнее говорить о реакции в зоне базальной мембраны или о
дермоэпидермальной зоне.
Как уже указывалось, молекулярная биология создает методы,
способные углубить клинико-лабораторные исследования. В част-
ности, появление гибридомной техники позволяет получать моно-
клональные антитела, направленные к отдельным детерминантам
соединений организма, и тем самым открывает возможность конт-
роля на молекулярном уровне за их состоянием в процессе разви-
тия заболевания и в период проведения тех или иных лечебных
мероприятий. В настоящее время имеется набор моноклональных
антител к разным детерминантам антигенов клеток эпителия кожи
[Абызов В. Н. и др., 1986; Gelis J. Е. et al., 1984]. Большинство
этих антител направлено к детерминантам прекератинов — белков
тонофибрилл (цитоскелета) клеток покровных тканей эпидермаль-
ного типа [Moll R. et al., 1982]. Д. Г. Силагадзе с помощью элек-
тронного микроскопа и антител, меченных пероксидазой, устано-
вил, что один из базально-клеточных антигенов (БК АГ) связан
с тонофиламентами тонофибрилл и десмосом эпителиальных кле-
ток кожи. В непрямой иммунофлюоресценции при обработке анти-
телами к БК АГ срезов кожи практически здоровых лиц [Аба-
зов В. Н. и др., 1986; Белецкая Л. В. и др., 1976] реакция сосредо-
точена в цитоплазме клеток только базального слоя эпидермиса
и камбиальных элементов придатков кожи (рис. 33, е).
Что же происходит с этим фенотипическим признаком, харак-
терным для наименее дифференцированных клеток многослойного
эпителия в коже больных СКВ, при которой в дермоэпидермаль-
ной зоне сосредоточены большие скопления гранул ИК? Токси-
ческое действие иммунных комплексов должно в первую очередь
распространяться на структуры, лежащие в непосредственной
близости от их локализации. Результаты обработки антителами
срезов кожи больных GKB подтверждают это предположение.
В большинстве клеток базального слоя прекращается синтез
114
БК АГ; реакция наблюдается в ослабленном виде в элементах,
рассеянных по шиповатому слою, что свидетельствует о наруше-
нии процесса дифференцировки клеток эпидермиса (рис. 33, ж).
Можно представить себе, что в норме белок клеток базального слоя
эпидермиса также подвергается дальнейшей дифференцировке, т. е.
трансформации его четвертичной структуры, полимеризации, по-
этому в шиповатом слое исчезают прежние и появляются новые
детерминанты антигенов. В результате лечения традиционными ме-
тодами, а также при применении аферентной терапии наряду с
улучшением клинических показателей и секвестрацией гранул ИК
наблюдается нормализация дифференцировки эпителия кожи, что
отражается и на иммуноморфологической картине. При этом ба-
зально-клеточный антиген снова синтезируется только в клетках
базального слоя эпителия. Сходное явление наблюдается и при
других кожных заболеваниях, о чем будет сказано ниже. Таким
образом, метод с применением антител к БК АГ может служить в
качестве дополнительного способа оценки степени дифференци-
ровки клеточных элементов покровного эпителия эпидермального
типа при патологии и в процессе лечения.
При исследовании состояния базальной мембраны эпидермиса
в зоне отложения иммунных комплексов могут быть также ис-
пользованы антитела к коллагену IV типа и гликопротеину мем-
браны. Установлено, что при СКВ в разных участках кожи наблю-
даются разные степень и характер нарушения синтеза коллагена
IV типа. В одних участках базальной мембраны эпидермиса кол-
лаген практически исчезает, в других количество его уменьшается
(рис. 33, з, и), но материал, реагирующий положительно с антите-
лами, появляется в дифференцированных слоях эпителия. Послед-
нее явление может быть объяснено тем, что поскольку синтез кол-
лагена происходит в клеточных элементах, а сборка его в фила-
менты волокон — внеклеточно, то, помимо нарушения синтеза бел-
ка под влиянием ИК, по-видимому, происходит и нарушение
процесса сборки. В связи с этим наблюдается ослабление его фик-
сации в тканях и секвестрация через эпидермис из организма.
С наступлением ремиссии в результате лечения происходит нор-
мализация синтеза коллагена IV типа и формирования ретикуляр-
ных волокон базальной мембраны эпидермиса [Дмитриев А. А.
и др., 1985]. Нарушение синтеза коллагена базальной мембраны
эндотелия сосудов кожи при СКВ в реакции иммунофлюоресцен-
ции отмечается реже.
Синтез гликопротеина базальной мембраны при СКВ нередко в
коже полностью прекращается, восстанавливаясь после лечения.
Системная склеродермия (ССД) представляет со-
бой истинный коллагеноз, т. е. заболевание, при котором наруше-
ние метаболизма соединительной ткани является первопричиной.
Однако заболевание все же несет в себе также и яркие черты им-
мунопатологического процесса, возможно, вторичного происхожде-
ния. Известно, что в сыворотке больных ССД в достаточно высо-
ких титрах (1:100) обнаружены антитела к различным компонен-
115
б — дис-
в — диф-
Рис. 34. Мазки взвеси клеток опу-
холи животного, обработанные сы-
вороткой больного системной скле-
родермией (непрямой метод).
а — ядрышковый тип свечения;
кретный точечный тип свечения;
фузный тип свечения в ядре
Рис. 35. Срез кожи больного .ССД; обработка антителами к IgG; отложе-
ние ИК в стенке сосуда дермы (прямой метод).
116
там ядра [Sun Т. Т. et al., 1983]. С последним связана различная
иммуноморфологическая картина реакции иммунофлюоресценции.
При ССД отмечаются 4 основных тина свечения ядер: точечный,
диффузный, ядрышковый и дискретный точечный (рис. 34, а—в).
При дискретном точечном типе зоны реакции очень мелкие,
их небольшое число. Установлено, что дискретная точечная реак-
ция часто связана с наличием у больных антител к АГ кинето-
хор — образований, расположенных в зоне центромеров хромосом
клетки [Sun Т. Т. et al., 1983]. В интерфазе антиген сохраняется,
но расположен хаотически, с чем связана дискретная локализация
зон реакции. Антитела к АГ кинетохор появляются у больных при
длительном течении заболевания (15 и более лет) и сочетаются с
CREST формой ССД.
Примечательно то, что обнаружение этих аутоантител, кото-
рое впервые сделано с помощью метода иммунофлюоресценции,
дало возможность биохимикам выделить белок кинетохор (мето-
дом иммунопреципитации), а генетикам с помощью белка выявить
ген, ответственный за его ситез.
При изучении срезов биопсии кожи больных ССД иногда отме-
чается грубая имбибиция стенок сосудов иммунными комплексами
(рис. 35). В эпидермисе гранулы ИК, содержащие IgG, находят в
виде небольших включений между клетками. Чаще фиксация им-
муноглобулинов в стенках сосудов дермы и в базальной мембране
эпидермиса едва уловима, но, несмотря на это, их токсическое
действие достаточно сильно, так как синтез коллагена IV типа в
этих структурах бывает значительно нарушен.
Иммунопатологический процесс при псориазе сосредоточен
в основном в стенках сосудов сосочкового слоя дермы, где чаще
всего обнаруживается отложение небольшого количества иммун-
ных комплексов, в состав которых входят иммуноглобулины ос-
новных классов (G, М, А) и Сз-компонент комплемента. При псо-
риатической эритродермии ИК в составе гранул находят на по-
верхности кожи (рис. 36, а). Иммунопатологические изменения
сочетаются с нарушением структуры сосудистых петель, выражаю-
щимся в расширении сосудов и увеличении их длины. Другой
примечательной чертой изменений в коже при псориазе, как из-
вестно, является нарушение дифференцировки клеточных элемен-
тов эпителия [Копьева Т. Н., Владимиров В. В., 1983]. Результаты
использования антител к базально-клеточному антигену под-
тверждают данные морфологического анализа. Синтез этого диф-
ференцировочного антигена, т. е. антигена, характерного для опре-
деленной стадии дифференцировки клеток, при псориазе ослаблен,
однако антиген обнаруживается в клетках всех слоев эпителия
(рис. 36, б), что говорит о задержке созревания клеток. В процессе
лечения число слоев, клетки которых содержат БК АГ, уменьшает-
ся (рис. 36, в), а в период ремиссии фенотипические свойства кле-
ток эпидермиса восстанавливаются полностью и антиген обнару-
живается уже только в клетках базального слоя (рис. 36, г).
Синтез коллагена IV типа базальных мембран эндотелия сосу-
117
Рис. 36. Срезы кожи больного псориатической эритродермией.
а — обработан антителами к IgG; на поверхности кожи — бородавчатые наложения, со-
держащие гранулы иммунокомплекса; б — обработан антителами к базально-клеточному
антигену (непрямой метод); период до лечения; реакция ослаблена, антиген локализован
во всех слоях эпидермиса, что свидетельствует о нарушении нормальной дифференциров-
ки клеток; в — в процессе лечения число слоев клеток, содержащих базально-клеточный
антиген, уменьшается; г — окончание лечения, локализация базально-клеточного антигена
приближается к норме.
дов и эпидермиса при псориазе практически не страдает. Наблю-
дается некоторое расширение просветов («окон») в базальной
мембране эпителия кожи, в которых коллагеновые волокна не
выявляются.
Дерматоонкология. Несмотря на то что возникнове-
ние новообразований связано с ослаблением функции иммунитета,
при эпидермальных новообразованиях в зоне роста опухолевого
пролиферата отмечают признаки Т- и В-клеточных реакций. Мето-
дом иммунофлюоресценции между клетками инфильтрата обнару-
живают гранулы иммунных комплексов, содержащих основные
классы иммуноглобулинов [Белецкая Л. В. и др., 1981; Берен-
бейн Б. А. и др., 1983]. Гранулы иммунных комплексов нередко
проникают в эпидермис, являясь, по-видимому, одной из причин
деструкции эпидермиса в зоне роста опухоли (рис. 37, а). Кроме
гранул И К, при базально-клеточном раке выявляют плазмати-
ческие клетки (рис. 37, б).
Использование антител к антигенам структур кожи позволяет
118
Рис. 37. Срез кожи из зоны
роста базально-клеточного
рака.
а — обработан антителами к IgG че-
ловека; секвестрация гранул иммун-
ных комплексов из кожи через эпи-
дермис (прямой метод); б—плаз-
матические клетки перифокального
инфильтрата; в — обработка анти-
телами к антигенам базальной мем-
браны (непрямой метод); наруше-
ние базальной мембраны в зоне рос-
та опухоли in situ в эпидермисе; г —
разрыв базальной мембраны и про-
никновение опухолевых клеток в
дерму; д — то же, обработка антителами к базально-клеточному антигену. Базально-
клеточный антиген выявляется в опухолевых клетках базалиомы. В окружающей соеди-
нительной ткани реакция отсутствует
зафиксировать момент выхода клеточных элементов опухоли,
пролиферирующих в эпидермисе in situ, в дерму. Отверстия в
базальной мембране увеличиваются (рис. 37, в), массы опухоле-
вых клеток выходят за пределы эпидермиса в дерму (рис. 37, г).
Позднее опухолевые узлы формируют собственную базальную
мембрану, хотя и не всегда полноценную, имеющую много разры-
вов, по-видимому, особенно при быстром росте новообразования.
119
В настоящее время имеются антитела к антигенам не только
наименее дифференцированных клеток эпителия кожи — базаль-
но-клеточный антиген (БК АГ), но и клеток более дифференциро-
ванных слоев [Абызов В. Н. и др., 1986]. Их нередко называют
антигенами надбазальных слоев. Поскольку объектом опухолевой
трансформации, а следовательно, источником новообразований яв-
ляются активно делящиеся, наименее дифференцированные клет-
ки, было сделано предположение, которое затем эксперименталь-
но подтвердилось. Клетки опухолей покровных тканей эпидермаль-
ного типа синтезируют базально-клеточный антиген [Дробышев-
ская Э. И. и др., 1985; Белецкая Л. В., Беренбейн Б. А., 1986]
и не синтезируют антиген клеток надбазальных слоев. Ни в
клетках, ни в «роговом» материале плоскоклеточного ороговеваю-
щего рака в реакции иммунофлюоресценции не удается обнаружить
антигенов, характерных для зрелых клеток покровного эпителия
эпидермального типа. Аналогичные данные получены с помощью
других иммунологических методов [Moll R. et al., 1982].
Результаты обработки срезов кожи из зоны роста базально-
клеточного, метатипического, плоскоклеточного рака и близких
к ним форм опухолей антителами к базально-клеточному антигену
свидетельствуют о том, что синтез антигена сохраняется в клет-
ках всех видов опухолей, гистогенетически связанных с эпителием
кожи и другими покровными тканями эпидермального типа.
К эпидермальному типу тканей исследователи относят ткани, про-
исходящие из эпидермального эмбрионального зачатка, форми-
рующегося в основном из эктодермы и головного и анального
отрезков эндодермы: эпителий кожи и придатков кожи, полости
рта, пищевода, влагалища, шейки матки, анального отрезка прямой
кишки, воздухоносных путей, тимуса, протоков слюнных и молоч-
ных желез. Клетки паренхимы органов, формирующихся из этого
зачатка, помимо тимуса, БК АГ не имеют [Белецкая Л. В.,
Беренбейн Б. А., 1986|.
При исследовании срезов кожи из очагов поражения больных
базально-клеточным раком после обработки их поликлональными
или моноклональными антителами к базально-клеточному антиге-
ну установлено, что большинство клеточных элементов опухоле-
вых узлов, а также единичные клетки, инфильтрирующие дерму,
синтезируют базально-клеточный антиген. Число клеток опухоле-
вого пролиферата, в цитоплазме которых отмечают реакцию, за-
висит от формы базально-клеточного рака. При поверхностной
форме реакция иммунофлюоресценции отмечена практически во
всех клетках, составляющих опухолевый пролиферат (рис. 37, д).
При язвенной и опухолевой формах выявилась пестрая картина
распространения и локализации в клетках базально-клеточного
антигена. Наблюдаются большие скопления светящихся антипи-
ческих клеток в самом эпидермисе. Клетки таких участков содер-
жат в цитоплазме значительное количество антигена. На участках
погружения опухолевых пролифератов в глубь дермы клетки,
содержащие базально-клеточный антиген, локализуются в основ-
120
Рис. 38. Срезы тканей из зоны роста плоскоклеточного рака; обработка
антителами к базально-клеточному антигену (непрямой метод).
а — базально-клеточный антиген в клетках плоскоклеточного неороговевающего рака;
б — базально-клеточный антиген в цитоплазме клеток, отделившихся в процессе диссе-
минации опухоли (микрометастазы); в— плоскоклеточный ороговевающий рак, базально-
клеточный антиген выявляют в цитоплазме клеток опухоли, в центре ороговения антиген
отсутствует; г — срез тканей плоскоклеточного рака, обработанный антителами к базаль-
но-клеточному антигену и антителами к иммуноглобулину, меченными пероксидазой,
локализация базально-клеточного антигена в цитоплазме клеточных элементов опухоли.
ном по периферии узлов, иногда вокруг округлых или вытянутых
образований, напоминающих измененные структуры придатков
кожи — волосяные фолликулы, железы. Клетки, окружающие эти
структуры, имеют кубическую, цилиндрическую или более слож-
ную форму. Базально-клеточный антиген сосредоточен в них по
периферии цитоплазмы, однако иногда занимает значительную ее
часть.
При исследовании рака самых различных локализаций (рис. 38)
установлено, что при плоскоклеточной его форме большинство
клеточных элементов также синтезирует базально-клеточный ан-
тиген. Имеются некоторые различия между ороговевающей и
неороговевающей формами. При плоскоклеточном раке кожи анти-
ген выявляется в большинстве клеток опухолевого пролиферата
(рис. 38, а) и в цитоплазме отдельных клеток, инфильтрирующих
ткань, окружающую опухоль, отделившихся от основного узла в
процессе диссеминации (рис. 38,6). При плоскоклеточном оро-
121
говевающем раке наиболее дифференцированные клетки очагов
ороговения базально-клеточного антигена не содержат. Нет анти-
гена и в роговом материале центра «жемчужин» (рис. 38, в).
В целях контроля срезы плоскоклеточного рака кожи обраба-
тывали поликлональными или моноклональными антителами к
другим антигенам. При обработке срезов моноклональными анти-
телами к антигенам ядра клеток реакция была локализована толь-
ко в ядре клеток опухоли и в окружающих тканях, а при нанесе-
нии на срезы антител к миозину — только на волокнах скелетных
мышц, в которых прорастает опухолевая ткань.
При обработке срезов опухолей покровных тканей эпидер-
мального типа антителами к базально-клеточному антигену имму-
ноферментным методом получается иммуноморфологическая кар-
тина, аналогичная картине, наблюдаемой при использовании ме-
тода иммунофлюоресценции (рис. 38, г).
С помощью антител к базально-клеточным антигенам может
проводиться контроль за качеством лечения эпидермальных опу-
холей, выявление отдельных сохранившихся в дерме опухолевых
клеток, а также исследование рубцовой ткани, образовавшейся на
месте удаления опухоли, и выяснение причин возникновения ре-
цидивов новообразования. Возможно и включение данного имму-
нологического теста в арсенал цитологического анализа мазков-
отпечатков из мест поражения тканей в дерматоонкологии.
Возможным аспектом применения антител к антигенам кожи,
помимо указанных аспектов, может явиться попытка установления
биологических границ между опухолевым процессом и псевдокар-
циноматозными дерматозами [Беренбейн Б. А., 1980].
Глава 5
ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ
КОЖНЫХ ЗАБОЛЕВАНИИ
Диагностика заболеваний, особенно распознавание клиничес-
кой сущности дерматоза на ранних этапах патологического про-
цесса, во многом определяет успех лечения, а в ряде случаев и
продолжение жизни больного.
Как подчеркивают О. К. Шапошников и соавт. (1987), поста-
новка диагноза базируется на сопоставлении анамнестических,
клинических и параклинических данных, а также существующих
знаний о болезни. Чем тщательнее собрана, обработана и глубже
проанализирована полученная информация, чем больше знаний
и опыта у врача, тем выше вероятность установления правильного
диагноза [А. Я. Браиловский, 1987].
По мнению А. Я. Браиловского (1987), в конечном итоге прин-
цип диагностики базируется на трех тесно взаимосвязанных
аспектах: 1) техническом, включающем анамнез и методы обследо-
вания больного; 2) семиотическом, заключающемся в оценке диаг-
ностического значения отдельных признаков болезни и их сочета-
ний; 3) логическом — на наш взгляд, одном из главных в связи
с тем, что он связан с мышлением врача в процессе постановки
диагноза.
В наше время в связи с огромными достижениями в биологии
и медицине, усовершенствованием старых и разработкой новых
параклинических методов исследований (иммунологических, имму-
номорфологических, биохимических и др.) значительно возросла
информация, необходимая врачу в процессе постановки диагноза.
И тем не менее на первом месте в диагностике кожных заболева-
ний остается клинико-морфологическая оценка изменений кожи и
слизистых оболочек, нередко имеющая характерные особенности,
свойственные тем или иным дерматозам (вульгарная пузырчатка,
псориаз, красный плоский лишай и др.).
Клиническая картина кожных заболеваний складывается из
субъективных и объективных симптомов. К последним относят
многообразные морфологические изменения кожи (экзантемы)
или слизистых оболочек (энантемы), являющиеся внешним выра-
жением патологических процессов в коже и слизистых оболочках.
Все эти изменения, объединяемые терминами «сыпь», «высыпные
элементы», «эксфлорисценции» и др., развиваются под влиянием
разнообразных факторов экзогенного и эндогенного характера.
Особенности морфологических элементов сыпи (цвет, форма, кон-
систенция, локализация и др.), общие свойства кожи (общая
123
окраска, состояние секреторной деятельности, эластичность и др.),
характер воспалительного процесса (серозный, гнойный, пролифе-
ративный, дистрофический) являются важнейшими признаками
того или иного заболевания кожи. Необходимо отметить, что в
одних случаях морфологические элементы сыпи типичны для так
называемых истинно кожных заболеваний (таких как псориаз,
болезнь Дарье, красный плоский лишай, вульгарная пузырчатка
и др.), в других случаях они являются следствием целого ряда
сложных патогенетических механизмов и могут одновременно
характеризовать как самостоятельные дерматозы, так и являться
неспецифическим отражением еще не распознанных (или распоз-
нанных) патологических процессов в отдельных органах и физио-
логических системах. К числу таких элементов можно отнести,
например, волдырь, который может характеризовать крапивницу
как самостоятельную нозологическую форму дерматоза. Вместе с
тем уртикарные элементы могут являться проявлением токсико-
дермии, заболеваний крови, злокачественных новообразований
внутренних органов, заболеваний желудочно-кишечного тракта,
диабета и пр. Некоторые элементы сыпи характеризуют кожные
заболевания, часто возникающие при раке внутренних органов
(пигментно-сосочковая дистрофия кожи, опоясывающий лишай,
токсическая меланодермия, эритемы и др.). В связи с этим для
правильной оценки элементов сыпи с точки зрения диагностики и
особенно дифференциальной диагностики заболевания необходимо
тщательное обследование больного. Прежде всего следует собрать
подробный и углубленный анамнез заболевания
и жизни больного, чтобы можно было выявить возможные этио-
логические факторы, способствующие возникновению дерматоза.
К экзогенным факторам, способствующим возник-
новению морфологических элементов сыпи, относятся следующие.
Механические факторы — давление, трение, растяжение, уши-
бы и т. д., способные при определенной силе и длительности воз-
действия вызвать повреждение кожи, обусловить развитие воспа-
лительного процесса и возникновение кровоизлияний, воспали-
тельных пятен, пузырей, эрозий, трещин, язв и т. д.
Физические факторы — действие высоких и низких темпера-
тур, лучистой энергии (ультрафиолетовая радиация, рентгенов-
ские лучи, радиоактивное излучение), электрического тока и др.
Под влиянием указанных агентов на коже могут возникнуть раз-
личные экзантемы (эритема, пузыри, язвы, эрозии, атрофия
и т. п.), представляющие проявление различной интенсивности
воспалительных и дистрофических процессов, например при ожоге,
обморожении, рентгеновском дерматите, при некоторых формах
крапивницы (световой, холодовой), озноблении, световой оспе,
солнечной (весенней) почесухе и т. д.
Химические факторы могут быть самые разнообразные. Услов-
но их можно разделить на обычные облигатные раздражители,
к которым относят кислоты и щелочи высоких концентраций, спо-
собные при попадании на кожу и слизистую оболочку вызывать
124
развитие химических ожогов; аллергены — отдельные вещества
или группы веществ, при многократных повторных воздействиях
вызывающие повышенную чувствительность к ним кожи или сли-
зистых оболочек и способствующие развитию воспалительного
процесса, сопровождающегося появлением разнообразных мор-
фологических элементов сыпи: эритемы, уртикарных, пузырь-
ковых, папуллезных элементов и т. д. Аналогичные высыпания
на коже и слизистых оболочках могут возникнуть при воздей-
ствии различных лекарственных веществ. Разнообразные хими-
ческие (в том числе лекарственные) вещества могут вызвать появ-
ление сыпи при воздействии их не только в быту, но и в условиях
производства (профессиональные дерматозы).
Инфекционные агенты (патогенные микроорганизмы и вирусы)
при попадании на кожу вызывают различные заболевания (пио-
дермиты, туберкулез, сибирскую язву, ветряную оспу, бородавки,
герпес и т. д.). При многих из этих заболеваний сыпь имеет боль-
шую специфичность и является решающим диагностическим симп-
томом болезни (туберкулезный бугорок, пустулы, оспенные пу-
зырьки, пузырьки при простом герпесе и опоясывающем лишае
и т. д.).
Растительные паразиты — разнообразные грибы при попадании
на кожу вызывают заболевания (трихофитию, микроспорию, рубро-
фитию, кандидоз и др.), характеризующиеся разнообразными мор-
фологическими элементами сыпи (эритема, пузырек и др.).
Животные паразиты — клещи, вши, блохи и другие кровососу-
щие насекомые вызывают зудящие заболевания кожи, а также яв-
ляются переносчиками инфекционных агентов. Их укусы обуслов-
ливают развитие таких морфологических элементов сыпи, как пят-
но, волдырь, папула, пузырек.
Эндогенные факторы, способствующие возникнове-
нию сыпи, еще более разнообразны. Среди них можно выделить
следующие.
Функциональные нарушения центральной и периферической
нервной системы имеют огромное значение в развитии повышен-
ной чувствительности к разнообразным веществам — аллергенам
(пищевым, растительным, лекарственным, химическим и др.),
повторное воздействие которых способствует развитию различных
морфологических элементов сыпи. Нарушение высшей нервной
деятельности, эмоциональное перенапряжение, неврозы могут быть
непосредственной причиной развития таких элементов сыпи, как
эритема, волдырь, пузырьки и др., формирующих симптомокомп-
лекс целого ряда дерматозов. При этом возникшие патологические
изменения в коже в свою очередь посредством рефлекторных и
гуморальных механизмов могут поддерживать или даже усиливать
функциональные нарушения нервной системы. Возникновение раз-
личных морфологических элементов сыпи может быть обусловлено
также и органическими изменениями со стороны нервной системы.
Так, при потере болевой и температурной чувствительности вслед-
ствие органического поражения нервной системы могут развивать-
125
ся пятна, пузыри, эрозии, язвы, различные трофические изме-
нения.
Эндокринные нарушения имеют существенное значение в раз-
витии различных дерматозов. Возникновению высыпаний на коже
способствуют такие заболевания эндокринных органов, как диабет,
гипо- и гипертиреоз, расстройства функций половых желез, угне-
тение функции коры надпочечников и гиперкортицизм и др. Неред-
ко высыпания (угри, пустулы, фолликулиты и др.) возникают в
период половой зрелости и во время беременности (пятна, волды-
ри, пузырьки, пустулы, узелки и др.), являясь объективным симп-
томом хлоазм, крапивницы, герпеса и почесухи беременных, им-
петиго Гебры и др.
Нарушения обмена веществ (углеводный, белковый, жировой,
минеральный, водный) играют большую роль в развитии повышен-
ной чувствительности кожи к различным раздражителям и спо-
собствуют возникновению разнообразных высыпаний (пятен, пу-
зырьков, папул, эрозий, язв и др.) при диабете, ксантоматозных
узелков при нарушении холестеринового обмена, угревидных и
пятнистых высыпаний при гиперкортицизме и т. п.
Гиповитаминозы и авитаминозы также способствуют возникно-
вению разнообразных морфологических элементов сыпи. При этом
в одних случаях недостаток некоторых витаминов (А, С, РР, Р,
группы В и др.) может являться фактором лишь предрасполагаю-
щим к развитию некоторых кожных заболеваний, возникающих
под влиянием других этиологических моментов. В других случаях
гиповитаминоз представляет непосредственную причину развития
дерматозов. Так, недостаток в организме витамина РР приводит к
заболеванию пеллагрой, а недостаток витамина С — цингой. При
этом элементы сыпи (эритема, кровоизлияние, эрозии и др.) воз-
никают не только на коже, но и на слизистой оболочке полости
рта, кишечника и др.
Значительную роль в возникновении сыпи играет интоксика-
ция организма, вызванная нарушением функции отдельных орга-
нов и физиологических систем. Чаще всего интоксикация разви-
вается вследствие дисфункции желудочно-кишечного тракта: изме-
нение секреции желудочного сока, гастрит, язвенная болезнь же-
лудка и двенадцатиперстной кишки, спастический колит, глистная
инвазия, а также нарушения функции печени и почек. В резуль-
тате указанных нарушений на коже и слизистых оболочках поло-
сти рта могут развиться разнообразные высыпания, характеризую-
щие целый ряд кожных заболеваний (крапивницу, красный плос-
кий лишай, почесуху, экзему, нейродермит и др.).
Сосудистые нарушения и заболевания крови являются причи-
ной разнообразных высыпаний. Так, например, при варикозном
расширении вен нижних конечностей на коже появляются пятна,
эрозии, язвы. Облитерирующий эндартериит может привести к
развитию гангренозных язв. Трофические язвы нижних конечно-
стей возникают в ряде случаев как следствие гипертонической
болезни (синдром Марторелла). Глубокие иммуноаллергические
126
процессы могут привести к разнообразным поражениям сосудов
кожи, вследствие чего появляются геморрагические и геморраги-
ческо-язвенные высыпания.
При заболеваниях крови и лимфоретикулярной системы неред-
ко возникают такие морфологические элементы сыпи, как пятна,
эритродермия, волдыри, узелки, узлы, лихенификация и др., часто
сопровождающиеся зудом.
Значительную роль в возникновении сыпи играют общие ин-
фекционные заболевания, как острые (корь, скарлатина и др.),
так и хронические (туберкулез, сифилис, лепра и др.).
Для диагностики инфекционных заболеваний большое значение
имеют сроки развития сыпи. Например, при сыпном тифе появле-
ние розеолезно-петехиальной сыпи происходит на 4—6-й день, а
при вторичном свежем сифилисе — на 7—8-й неделе от момента
заражения и т. п.
При некоторых инфекционных заболеваниях сыпь развивается
на месте проникновения возбудителя. Так, например, при сифили-
се на месте проникновения бледной трепонемы возникает папула,
эрозия, язва (твердый шанкр).
Высыпания на коже или слизистых оболочках могут носить
наследственный характер (ихтиоз, различные формы кератодер-
мий, пигментная ксеродерма и др.). При некоторых дерматозах
высыпания имеют место уже в момент рождения ребенка, т. е.
являются врожденными.
Необходимо подчеркнуть, что возникновению сыпи чаще всего
способствует комплексное влияние экзогенных и эндогенных
причин.
Различные участки кожного покрова у отдельных лиц реагиру-
ют по-разному на воздействие одного и того же фактора. В то
же время различные этиологические моменты могут привести к
сходным морфологическим изменениям на коже. В зависимости от
этиологического фактора, индивидуальных особенностей орга-
низма и характера патологического процесса морфологические
изменения могут развиваться в различных анатомических отделах
кожи — эпидермисе, дерме, подкожной жировой клетчатке.
Все многообразие кожных заболеваний, по сути дела, склады-
вается из того или иного сочетания морфологических элементов
сыпи, специфики их формы, окраски, консистенции и т. п. Поэто-
му одним из главных критериев диагностики и дифференциальной
диагностики кожных заболеваний является анализ морфологи-
ческих элементов сыпи. А. И. Картамышев (1963) образно сравнил
значение знаний элементов сыпи при диагностике заболеваний со
знанием букв, без которых нельзя составить слово. В частности,
он писал: «...Как нельзя предложить читать книгу человеку, не
знающему букв, так нельзя требовать, чтобы врач или студент по-
ставил диагноз той или иной кожной сыпи, если он не разбирает-
ся в составных частях, образующих сыпь».
Отдельные морфологические элементы сыпи принято делить на
первичные элементы, развивающиеся как непосредственный ре-
127
зультат патологического процесса в коже или слизистых оболоч-
ках, и возникающие нередко на неизмененном фоне, и вторичные
элементы, развивающиеся в порядке эволюции первичных элемен-
тов (спонтанно или под влиянием лечения).
ПЕРВИЧНЫЕ ЭЛЕМЕНТЫ СЫПИ
Пятно (macula) клинически характеризуется только измене-
нием цвета кожи. При этом консистенция, рельеф поверхности
и уровень залегания очага поражения практически не отличаются
от окружающей нормальной кожи. Различают пятна воспалитель-
ные и невоспалительные.
Воспалительные пятна образуются вследствие расширения кро-
веносных сосудов поверхностной сосочковой сети в дерме. Цвет
воспалительных пятен бывает от ярко-красного до синюшно-
красного. Последний оттенок чаще возникает при длительном су-
ществовании воспалительного процесса и при наличии замедлен-
ного кровотока (венозного). Ярко-красная или розовая окраска
возникает при артериальной гиперемии. Важным диагностическим
признаком воспалительных пятен, так же как и пятен, обусловлен-
ных неправильным развитием поверхностных кровеносных сосудов
кожи (телеангиэктазий), является полное их исчезновение или
побледнение при надавливании пальцем или предметным стеклом.
После прекращения давления восстанавливается первоначальный
цвет пятна. При длительном существовании воспалительных пятен
через сосудистую систему выходят форменные элементы крови,
вследствие чего пятна приобретают буровато-желтый оттенок.
В зависимости от величины воспалительных пятен различают
пятна небольших размеров (от 2—3 мм до 20—25 мм в диаметре
или немного более). Для их обозначения применяется термин
«розеолы». Последние имеют, как правило, округлую или овальную
форму и являются наиболее часто встречающимся симптомом ин-
фекционных заболеваний. При некоторых инфекционных заболе-
ваниях, таких как сифилис, брюшной и сыпной тиф, розеолезные
пятна никогда не сливаются, в то время как при скарлатине, кори
нередко возникает разлитая эритема вследствие слияния розеол.
Пятна по величине гораздо большие, чем розеола, имеющие
диаметр от 2—3 см и до нескольких десятков сантиметров, обоз-
начаются термином «эритема». В тех случаях, когда множествен-
ные очаги эритемы, сливаясь, захватывают всю кожу, применяется
термин «эритродермия».
Различают активную и пассивную эритему. Активная эритема
чаще всего возникает остро, являясь признаком воспаления и
поэтому наряду с расширением сосудов и увеличением кровенапол-
нения она сопровождается отеком, клеточной инфильтрацией
и т. п. При этом кожа горяча на ощупь; субъективно отмечается
жжение или зуд. Форма и цвет очагов эритемы могут быть раз-
нообразными. Обычно овальной или круглой формы очаги эритемы
могут увеличиваться в размерах, сливаться между собой, образуя
128
гирляндоподобные очертания (erythema gyratum), или величина их
может не изменяться продолжительное время (фиксированная
эритема). Ярко-красная окраска в начале развития очагов эритемы
в дальнейшем может смениться желтовато-розовой, цианоти-
ческой.
В ряде случаев эритема может иметь нервно-рефлекторное
происхождение (эритема стыда, гнева и пр.). В противополож-
ность обыкновенным воспалительным эритемам, иногда сущест-
вующим длительное время, нервно-рефлекторная эритема разре-
шается (так же как и возникает) очень быстро.
Пассивную эритему, чаще всего обусловленную венозным ста-
зом вследствие расширения венозных капилляров и венул, назы-
вают цианозом. Цианотические участки обычно имеют синюшную
или синюшно-красную окраску. Температура этих участков сни-
жена. Очаги цианоза могут иметь диффузный характер (акроциа-
ноз кистей и стоп), древовидную (livedo racemosa — синюха гроз-
девидная) или сетчатую (cutis marmorata — мраморная кожа)
формы. Обычно цианотическая окраска резко усиливается на
холоде.
Результатом спазма или облитерации кровеносных сосудов яв-
ляется анемия — резкое побледнение окраски кожи, сопровож-
дающееся снижением температуры. Анемия, так же как и эритема,
может иметь нервно-рефлекторное происхождение вследствие мо-
ментальной реакции кровеносных сосудов на эмоциональный
стресс (испуг, гнев).
Невоспалительные пятна могут быть обусловлены неправиль-
ным развитием в коже кровеносных сосудов, кровоизлиянием,
изменением содержания пигмента и введением в кожу красящих
веществ.
Среди пятен, обусловленных неправильным развитием в коже
кровеносных сосудов, чаще всего встречаются гемангиомы и теле-
ангиэктазии, представляющие собой порок развития мелких вен
и капилляров, ведущий к утолщению стенок сосудов, стойкому их
расширению или увеличению числа мелких сосудов. Указанные
изменения кровеносных сосудов возникают внутриутробно, т. е.
носят врожденный характер (сосудистый невус), но могут по-
явиться в любой период жизни человека. Они изменяют свой
цвет вплоть до полного исчезновения сосудистой окраски под
влиянием диаскопии и самопроизвольному разрешению, как пра-
вило, не подвергаются. В противоположность телеангиэктазиям
могут иметь место случаи врожденного недоразвития поверх-
ностных кровеносных сосудов кожи, что ведет к образованию
белых сосудистых пятен — «анемический невус».
Пятна от кровоизлияния принято называть геморрагическими.
Последние возникают вследствие выхождения эритроцитов из кро-
веносных сосудов в окружающую соединительную ткань дермы
или подкожной жировой клетчатки в результате повреждения
(разрыва) кровеносного сосуда или повышения проницаемости
сосудистой стенки. Окраска геморрагических пятен в ближайшие
5—936
129
сроки после их появления бывает красной, а затем постепенно
меняет свой цвет, который последовательно переходит в синий,
зеленый, желтый, светло-коричневый, темно-коричневый, грязно-
серый. Через 2—3 нед, иногда раньше (в зависимости от размера
пятен и глубины их залегания), геморрагические пятна исчезают
бесследно. По величине и форме их принято разделять на пете-
хии (petechiae) — точечное кровоизлияние; пурпуру (purpura) —
кровоизлияния величиной до 1—2 см; экхимозы (ecchymoses) —
кровоизлияния больше 2 см; линейные кровоизлияния (vibicis);
кровоподтеки (sugiiiatio). При надавливании на геморрагические
пятна цвет их почти не изменяется.
Пигментные пятна образуются в результате измене-
ния содержания меланина в коже, количество которого может
увеличиваться (гиперпигментированные пятна) или уменьшаться
(депигментированные пятна).
Гиперпигментированные пятна могут быть врожденными (пиг-
ментный невус), возникать самопроизвольно (веснушки, хлоазмы,
пятна при болезни Реклингхаузена и т. п.) или после приема неко-
торых лекарственных препаратов (акрихин, серебро, висмут и др.)
в результате проникновения в эпидермис грибков (отрубевидный
лишай, эритразма), а также оставаться после перенесенных по-
верхностных воспалительных процессов (дерматиты, флеботодер-
мии, сифилиды и др.). Форма гиперпигментированных пятен мо-
жет быть различной: мелкопятнистая при веснушках, после по-
верхностных фолликулитов, укусов площиц; крупнопятнистая —
при хлоазмах, болезни Реклингхаузена и др.; очаговая и раз-
литыми — при варикозном симптомокомплексе, склеродермии,
лекарственной токсидермии, эритематозе и пр. Гиперхромии более
обширных размеров носят название меланодермии (токсическая
меланодермия, меланодермия при пеллагре, болезни Аддисона,
солнечный загар и т.п.). Цвет гиперпигментированных пятен мо-
жет быть от светло-желтого до коричневого или иметь цианоти-
ческую, вплоть до синей, окраску. Например, голубой невус и
монгольские пятна могут иметь синевато-серую или темно-синюю
окраску, а гиперпигментированные пятна от укуса площиц имеют
аспидно-серый цвет. Нередко интенсивность окраски гиперпиг-
ментированных пятен в пределах очага поражения неоднородна,
вследствие чего может наблюдаться точечный или сетевидный
пестрый рисунок.
Что касается пятен, возникающих от отложения в коже окра-
шенных инородных веществ, то цвет их и форма зависят от самого
вещества и характера введения. Например, аргирия или желтая
окраска кожи от каротина иногда поражает значительные участки
кожи. Отложение в коже частиц угля, пороха имеет точечный или
мелкопятнистый характер. То же самое следует сказать и об
искусственном введении в кожу красящих веществ (татуировка),
как известно, формирующих самые разнообразные рисунки на
коже.
Депигментированные или гипопигментиро-
130
ванные пятна, так же как и гиперпигментированные, могут
быть врожденными (альбинизм), возникать самопроизвольно (ви-
тилиго), развиваться в очагах склеродермии, нейродермита, на
рубцах или оставаться на местах бывших очагов поражения,
например при псориазе, сифилидах, отрубевидном лишае и других
дерматозах.
Окраска депигментированных пятен бывает меловидной, цвета
слоновой кости или розовато-белой. Лишенные пигмента очаги
поражения могут быть диффузными и занимать обширные участки
кожи (альбинизм, распространенная форма витилиго) или огра-
ниченными мелкопятнистыми (сифилитическая лейкодерма, мел-
кие пятна при витилиго и пр.).
Волосы в пределах очага депигментации также лишены пиг-
мента и окрашены в белый цвет. Депигментированные пятна, на-
пример при витилиго, или гипопигментированные при отрубевид-
ном лишае особенно четко выступают в летнее время, когда окру-
жающая кожа под влиянием инсоляции становится гиперпигмен-
тированной; в зимнее время эти различия менее выражены. Иногда
депигментированные пятна приходится дифференцировать с ане-
мичным невусом. Последний не бывает чисто белой окраски, а
лишь несколько бледнее окружающей кожи. Для его распознава-
ния целесообразно вызвать гиперемию окружающей кожи (рас-
тиранием кожи щеткой). Что касается локализации депигменти-
рованных пятен, то, за исключением очагов сифилитической лей-
кодермы (задняя часть шеи), никакой закономерности не про-
слеживается.
В заключение необходимо подчеркнуть, что в пределах де-
пигментированных пятен кожный рисунок, температура и другие
физиологические процессы не изменены. Лишь в очагах лейко-
меланодермии при проказе имеется потеря чувствительности, о
чем всегда нужно помнить при проведении дифференциальной
диагностики депигментированных пятен.
Волдырь (urtica) представляет собой бесполостной элемент
островоспалительного характера. Он развивается вследствие рас-
ширения капилляров сосочкового слоя дермы, повышения их про-
ницаемости и выхода через сосудистую стенку безбелкового сероз-
ного экссудата [Шапошников О. К., 1962], который в дальнейшем
сдавливает сосуды. В результате этого на поверхности кожи вне-
запно развиваются ограниченные различной формы и величины
подушкообразные плотноватые образования, возвышающиеся над
уровнем кожи.
Уртикарные элементы вначале имеют розовато-красную окрас-
ку из-за наступающего расширения сосудов сосочкового слоя
дермы, но вскоре они бледнеют вследствие сдавления экссудатом
кровеносных сосудов и развития сложных гистаминергических
и холинергических процессов в зоне развития волдыря. Таким
образом, в типичном случае развивающийся уртикарный элемент
имеет бледную фарфорово-белую окраску, окруженную по пери-
ферии розовато-красным ободком.
5*
131
Волдырь исчезает так же быстро, как и появляется, но в не-
которых случаях может существовать довольно длительное время
(urticaria perstans). Обычно элементы имеют выраженную тен-
денцию к периферическому росту и слиянию между собой с обра-
зованием кольцевидных, гирляндоподобных, извилистых форм, на-
поминающих географическую карту.
В редких случаях вследствие резко выраженного экссудатив-
ного процесса на поверхности волдыря может образоваться пузы-
рек или даже пузырь, наполненный серозным или серозно-гемор-
рагическим содержимым. Возникновение волдыря, как правило,
сопровождается зудом, при этом он не прекращается все время,
пока существует элемент. Нередко развитие уртикарных высыпа-
ний сопровождается подъемом температуры, общим недомога-
нием.
Волдыри являются основным морфологическим элементом кра-
пивницы, возникают при сывороточной болезни, ангионевротиче-
ском отеке Квинке и при целом ряде дерматозов (токсикодермии,
герпетиформном дерматите Дюринга, флеботодермии и др.). У не-
которых лиц волдыри возникают на внешне неизмененной коже
после незначительного механического раздражения (аутографизм,
или urticaria facticta).
При разрешении волдыря изменений на коже не остается, за
исключением в редких случаях пигментации (urticaria cutn pig-
mentatione).
Пузырек (vesicula) — представляет собой полостное образова-
ние, содержащее серозную или серозно-геморрагическую жид-
кость, возвышающееся над уровнем кожи в виде полушаровидного
круглой формы элемента величиной 1,5—5 мм. Однако в ряде
случаев, например при дисгидрозе, пузырьки могут не возвышаться
над уровнем кожи, а как бы просвечивают, находясь с ней на од-
ном уровне. Это зависит от глубины залегания пузырька и анато-
мо-гистологических особенностей кожи (толщины рогового слоя).
Обычно вследствие отека, являющегося особенностью развития
пузырька, он расположен на эритематозном основании (герпес,
экзема и др.). В ряде случаев в силу анатомо-гистологических
особенностей кожи (выраженного рогового слоя в области ладоней
и подошв) и глубины залегания пузырька последний может рас-
полагаться на неизмененной коже или просвечивать сквозь нее
наподобие саговых зерен (дисгидроз). Пузырьки обычно возни-
кают в большом количестве, имеют тенденцию к слиянию между
собой, образуя многокамерные элементы небольших размеров
(в отличие от пузырей). Они могут развиваться группами (герпети-
формные пузырьки), возникать на поверхности узелков (при стро-
фу люсе, почесухе) или быть единичными (при дисгидрозе).
Полость пузырька может располагаться внутриэпидермально
под роговым слоем и внутри шиповатого слоя эпидермиса или
подэпидермально между базальной мембраной и сосочковой ча-
стью дермы. После того как пузырек лопается, на его месте оста-
ется эрозия, по своим размерам соответствующая пузырьку.
132
Содержимое же его быстро ссыхается, превращаясь в корку. В не-
которых случаях, например при экземе, экссудат продолжает
выделяться со дна пузырька, не ссыхаясь, подобно жидкости,
выделяющейся из родника. Это приводит к мокнутию, захваты-
вающему нередко большие участки кожи, на которой имеется
масса слившихся пузырьков.
В других случаях, например при простом герпесе, эрозивные
участки на месте бывших пузырьков образуют полициклические
очертания, а при опоясывающем лишае они располагаются груп-
пами, линейно по ходу нервов, что имеет важное дифференциаль-
но-диагностическое значение. После разрешения пузырька изме-
нений на коже не остается.
Непосредственной причиной образования пузырьков является
межклеточный отек (спонгиоз), который разрывает связь между
клетками шиповатого слоя эпидермиса, подвергающимися дистро-
фическим изменениям. С. Т. Павлов (1969) подчеркивает, что
образованию пузырьков предшествуют изменения клеток эпидер-
миса. Последние округляются, увеличиваются в размерах и под-
вергаются вакуольной или баллонирующей дегенерации.
Пузырь (bulla) — это ограниченное полостное образование,
содержащее жидкость (диаметр 0,5—7 см и более), выступаю-
щее над уровнем кожи, имеющее резкие границы, округлые или
овальные очертания.
В большинстве случаев пузыри бывают однокамерными, о чем
свидетельствует быстрое спадение их после прокола. Однако при
слиянии между собой нескольких пузырей или крупных пузырьков
(например при дисгидрозе, буллезной эпидермофитии) могут воз-
никнуть многокамерные пузыри.
В ряде случаев пузыри имеют неправильные очертания и могут
повторять формы и размеры, соответствующие площади действую-
щего экзогенного раздражителя (например, при ожогах, токсиче-
ском действии некоторых растений и т. д.). Покрышка пузырей
может быть напряженной или дряблой. Содержимое их бывает
серозным, кровянистым или гнойным. Пузыри подобно пузырькам
могут располагаться на воспалительном основании и тогда они
окружены зоной гиперемии (например, при буллезной форме
герпетиформного дерматита Дюринга, буллезной форме рожи, при
многоформной экссудативной эритеме, токсидермии и т.п.).
В других случаях (вульгарная, листовидная пузырчатка, врож-
денный буллезный эпидермолиз, пемфигоид Левера, травматиче-
ские пузыри и т. п.) они возникают на внешне неизмененной
коже. Полость пузыря располагается внутриэпидермально и под-
эпидермально. Внутри эпидермиса пузырь может находиться сразу
же под роговым слоем (субкорнеальный пузырь при листовидной
пузырчатке, субкорнеальном пустулезе) и внутри шиповатого слоя,
в средних или нижних его отделах. Полость подэпидермального
пузыря располагается между базальной мембраной и сосочковым
слоем дермы (герпетиформный дерматит Дюринга, пемфигоид
Левера, врожденный буллезный эпидермолиз и др.). Место распо-
133
ложения пузырей, определяемое при гистологическом исследова-
нии, имеет исключительно важное диагностическое значение, так
как целому ряду дерматозов свойственно определенное располо-
жение полости пузыря (внутри- или подэпидермально); при этом
важное диагностическое значение имеет место расположения по-
лости пузыря и в эпидермисе.
Пузыри могут возникать в результате действия экзогенных
и эндогенных факторов. Однако каковы бы ни были этиологиче-
ские факторы, главное значение в механизмах образования внут-
риэпидермального пузыря принадлежит предварительному дегене-
ративному повреждению эпителиальных клеток (баллонирующая
и ретикулярная дегенерация), утрате связей между клетками, раз-
витию спонгиоза и акантолиза [Машкиллейсон Л. Н., 1961; Пав-
лов С. Т., Торсуев Н. А. и др., 1979, и др.]. Именно акантолиз
и основанный на этом явлении феномен П. В. Никольского (оттор-
жение эпидермиса при механическом действии на него как в зоне
очага поражения, так и вне ее) являются отправным клиническим
дифференциально-диагностическим критерием истинной пузырчат-
ки и других пузырных дерматозов.
Подэпидермальные пузыри образуются вследствие отека в
сосочковой части дермы и нарушения структуры базальной мемб-
раны (изменение основного вещества соединительной ткани и рас-
пад аргирофильных волокон). Именно изменение базальной мемб-
раны позволяет скопившемуся экссудату отслоить эпидермис от
сосочковой части дермы, что наблюдается при многих дерматозах
(экссудативная многоформная эритема, буллезная токсикодермия,
буллезная форма рожи, пеллагра и т. п.).
При разрешении пузыря покрышка его лопается и образуется
эрозия, по краям которой имеются обрывки покрышки пузыря.
Особенно быстро вскрываются пузыри при локализации на сли-
зистой полости рта и в местах естественных складок. Оставшиеся
эрозивные поверхности при тех или иных дерматозах могут долго
не эпителизироваться (вульгарная пузырчатка, врожденный бул-
лезный эпидермолиз и др.). При целом ряде других дерматозов
содержимое пузыря быстро ссыхается в корку, после отторжения
которой никаких следов не остается. Однако в случае подэпи-
дермального расположения пузыря в результате повреждения
сосочкового слоя дермы на месте пузырей могут остаться рубцы
(врожденный буллезный эпидермолиз, пузыри при порфириновой
болезни, при ожогах и т. п.).
Пустула, или гнойничок (pustula), — полостное образование,
заполненное гнойным содержимым. Величина пустулы 1,5—5 мм
в диаметре, форма ее может быть шаровидная, конусообразная,
плоская. По глубине расположения пустулы делятся на поверх-
ностные, расположенные в пределах эпидермиса, и глубокие —
находящиеся в дерме. Поверхностные множественные пустулы,
содержимое которых быстро ссыхается в корочки, по отторжении
которых остается лишь временная пигментация, носят название
импетиго. Пустулы, развивающиеся вокруг волосяного фолликула,
134
называют фолликулитами. Последние имеют вид конусообразного
гнойничка, вокруг которого видна зона эритемы. Если подобные
образования проникают в устье волосяного фолликула и в центре
пронизаны волосом, то оно носит название остиофолликулита.
Фолликулиты могут быть поверхностными, если пустулы распола-
гаются только в верхней части волосяного фолликула, и глубоки-
ми, когда гнойный процесс захватывает глубокие части волосяного
фолликула, находящегося в дерме. В этих случаях на поверхности
кожи образуются яркая краснота и болезненный инфильтрат
(фурункул). Глубокий фолликулит в отличие от поверхностного
оставляет после себя рубец.
Пустулу, развивающуюся в дерме, называют эктимой. Иногда
эктима покрывается улиткообразными слоистыми корками вслед-
ствие продолжающегося нагноительного процесса. Такая эктима
носит название рупии. При разрушении покрышки эктимы или
насильственном отторжении корки рупии образуется глубокий
дефект — язва, при заживании которой, как правило, остается
рубец. Гнойнички, расположенные вокруг сальных желез, назы-
ваются акне. Они имеют конусовидную форму и могут распола-
гаться поверхностно (вокруг выводных протоков сальной железы)
и глубоко в дерме — при вовлечении в процесс сальной железы.
В последнем случае при разрешении акне образуется язва и оста-
ется рубец. Поверхностные акне после разрешения изменений на
коже не оставляют.
Основной причиной возникновения гнойничков являются пато-
генные микроорганизмы — стафилококки и стрептококки.
Развитию пиогенного процесса способствует снижение за-
щитных сил организма больного, обусловленное гиповитаминозом,
нарушением иммунологических процессов и др.
К разновидностям гнойничка с гистологических позиций сле-
дует отнести многокамерную пустулу Когая [Цветкова Г. М., Мор-
довцев В. Н., 1986], встречающуюся при пустулезном псориазе,
болезни Рейтера, акродерматите Аллопо, герпетиформном импе-
тиго, гонорейном кератозе и других патологических процессах.
Узелок, или папула (papula), — это бесполостное, поверх-
ностно расположенное, выступающее над уровнем кожи образо-
вание плотной или мягкой консистенции, обычно подвергающееся
обратному развитию без образования рубца.
Папулы могут быть воспалительными и невоспалительными.
Воспалительные папулы обусловлены развитием инфильтрата в
сосочковом слое дермы, расширением сосудов и ограниченным
отеком. Обычно окраска таких папул при надавливании бледнеет.
Воспалительные папулы встречаются при многих дерматозах: экзе-
ме, псориазе, вторичном сифилисе, нейродермите, красном плос-
ком лишае и др.
Папулы невоспалительного характера обусловлены разраста-
нием эпидермиса (например, обыкновенные бородавки), отложе-
нием в дерме патологических продуктов обмена (холестерин,
амилоид, слизь, кальций и др.) или разрастанием ткани дермы
135
(папиллома). В зависимости от преимущественной локализации
патологического процесса в отдельных слоях кожи принято раз-
личать папулы дермальные, эпидермальные и смешанные — эпи-
дермально-дермальные. Несмотря на то что подобное деление но-
сит условный характер, клинико-морфологический анализ пока-
зывает, что целый ряд дерматозов характеризуется подобной
градацией папуллезных элементов. Например, для большинства
дерматозов, сопровождающихся воспалительными папулами, по-
следние характеризуются изменением как в эпидермисе, так и
в дерме, т. е. являются эпидермально-дермальными (красный
плоский лишай, экзема, нейродермиты и др.). Преимущественные
изменения в дерме (дермальные папулы) характерны для папу-
лезных сифилидов, туберкулидов, многоформной экссудативной
эритемы и других дерматозов, а также при отложении в дерме
патологических продуктов обмена (ксантомы, амилоидный лихен,
микседематозный лихен).
Эпидермальные папулы можно наблюдать при некоторых фор-
мах псориаза, при обыкновенных и плоских бородавках, остро-
конечных кондиломах и т. п. Как указывает Г. М. Цветкова (1983),
в гистологическом отношении в основе эпидермальных папул ле-
жит пролиферация клеток эпидермиса (псориаз, базалиома и др.)
или увеличение их объема в результате отечных или дистрофи-
ческих изменений (экзема). При папулах дермального происхож-
дения (например, сифилитических папулах, папулах при лекарст-
венных сыпях и др.) наблюдается отек дермы, воспалительная
инфильтрация. Примером дермо-эпидермальной папулы может
служить папула при красном плоском лишае, когда гиперпласти-
ческие процессы в эпидермисе, сопровождающиеся гиперкерато-
зом, сочетаются с выраженной инфильтрацией в дерме, имеющей
полосовидный характер. Папулы могут иметь различную величину.
Среди них различают милиарные (диаметр 1 —1,5 мм), лентику-
лярные (диаметр 2—Змм), нуммулярные (диаметр 2—Зсм) и
более крупные по размеру папулы — бляшки. Последние образу-
ются вследствие слияния между собой отдельных папул.
Папулы могут иметь различную форму и очертания: они могут
быть заостренными и иметь конусовидную форму (при болезни
Девержи), уплощенными сверху (красный плоский лишай, нейро-
дермит, плоские бородавки и др.), плоскими, линейно располо-
женными (лентикулярные сифилиды), полигональными (много-
угольными) с пупкообразным вдавлением (красный плоский ли-
шай), округлой, полушаровидной формы и др.
Поверхность папул может быть гладкой или покрытой чешуй-
ками. Последние при некоторых дерматозах плотно прикреплены
и с трудом отторгаются (болезнь Девержи и др.), при других
(каплевидный парапсориаз, псориаз и др.) чешуйки довольно
легко отторгаются.
На поверхности папул может быть вдавление и прослежива-
ются серые полоски (сетка Уикхема при красном плоском лишае)
или поверхность их покрыта плотными гиперкератотическими
136
бородавчатоподобными наслоениями (бородавчатый красный ли-
шай, бородавчатый туберкулез кожи, болезнь Дарье и др.).
В ряде случаев на папулах располагаются другие морфологи-
ческие элементы (пузырьки, пустулы). В подобных случаях гово-
рят о папулах сложного строения: папуло-везикулезных, папуло-
пустулезных элементах. При некоторых дерматозах (папуло-
некротический туберкулез, некоторые формы аллергического вас-
кулита кожи) папулы сопровождаются некротическим процессом
или геморрагическими изменениями и изъязвляются; тогда на их
месте может развиться рубец. При локализации папул в складках,
местах трения отмечается избыточный их рост и на поверхности
папул развиваются вегетации. Вегетирующие папулы имеют тен-
денцию к слиянию, образуя кондиломы.
Ярким примером таких кондилом являются широкие конди-
ломы при вторичном сифилисе.
Наклонность к периферическому росту и слиянию папул —
довольно частое явление при многих дерматозах (псориаз, нейро-
дермит, экзема, красный плоский лишай и др.). В отдельных слу-
чаях папулы, разрастаясь по периферии, в центральной части рас-
сасываются, что приводит к образованию кольцевидных фигур
(сифилис, красный плоский лишай).
Цвет папул может быть самым разнообразным, от розовато-
красного, желтовато-серого, цианотического, ливидного, черного
до цвета нормальной кожи.
Бугорок (tuberculum) — бесполостное образование, возникаю-
щее вследствие развития в дерме воспалительного инфильтрата
гранулематозного строения. При тех или иных заболеваниях
бугорки характеризуются гистологическими особенностями, имею-
щими нередко решающее диагностическое значение для тубер-
кулеза, лепры, сифилиса. Для бугорков характерно наличие грану-
лем, состоящих из эпителиоидных лимфоидных клеток с примесью
гигантских клеток, т. е. туберкулоидное строение бугорка. Для
туберкулезного бугорка характерно образование вокруг эпите-
лиоидно-клеточной гранулемы лимфоцитарного вала и казеозного
некроза в центре бугорка с последующим размягчением и замеще-
нием соединительной тканью. Для сифилитической гранулемы
характерно наличие большого количества плазматических клеток и
фибробластических элементов. При туберкулоидной лепре буго-
рок построен по типу туберкулезного, однако некроз в нем никогда
не развивается [Цветкова Г. М., 1983]. Бугорки, особенно в начале
своего развития, по величине, цвету, консистенции имеют боль-
шое сходство с узелками. Они представляют собой элементы,
незначительно возвышающиеся или находящиеся на одном уровне
с окружающей кожей, при этом залегают глубоко в дерме. Диа-
метр бугорков — от 3—5 мм до 2—3 см. Цвет их бывает от розо-
вато-красного до желто-красного, медно-красного, бронзового,
цианотического. При диаскопии цвет бугорков может изменяться
(туберкулезные бугорки). По консистенции бугорки бывают плот-
ными или тестоватыми. Таким образом, важной характеристикой
137
бугорка с точки зрения диагностики является определение сопро-
тивляемости элемента давлению пуговчатого зонда. Например, при
туберкулезных бугорках вследствие разрушения эластической
ткани пуговчатый зонд легко проваливается, вызывая кровоте-
чение, или при легком надавливании оставляет ямку (симптом
А. И. Поспелова). Цвет и консистенция бугорков так же, как и
гистологическая характеристика, имеют важное диагностическое
значение. Бугорки обычно резко отграничены от окружающей
ткани. Они возникают на ограниченных участках кожного покрова,
имеют тенденцию к группировке. При этом в одних случаях они
располагаются близко друг к другу, но не сливаются между собой
(сифилис), в других (туберкулез) они сливаются, образуя огра-
ниченный инфильтрат. В отличие от узелков на месте бугорков
остается рубец (в случае его распада с образованием язвы) или
рубцовая атрофия (при рассасывании бугоркового инфильтрата).
Узел (nodus) — ограниченное уплотнение размером от лесного
ореха до куриного яйца и более, округлой или овальной формы,
расположенное в глубоких отделах дермы и подкожной жировой
клетчатки. Узлы могут быть обусловлены развитием различных
патологических процессов. Чаще всего они связаны с воспалением
(воспалительные узлы). При этом некоторые дерматозы характе-
ризуются острым развитием узлов (узловатая эритема, инфек-
ционные заболевания). При многих других хронических инфек-
ционных заболеваниях узлы характеризуются подострым или хро-
ническим течением (сифилитические гуммы, скрофулодерма, леп-
рома и др.).
Кожа над узлами воспалительного происхождения окрашена
в различные оттенки красного цвета, за исключением ревматоид-
ных узлов или начальных этапов развития сифилитических гумм,
над которыми цвет кожи может быть не изменен.
При одних дерматозах узлы резко очерчены от окружающей
ткани (сифилитические гуммы, скрофулодерма), при других
(узловатая эритема, панникулиты и др.) они не имеют резких
границ. В начале своего развития, например при сифилитической
гумме, узел может не возвышаться над уровнем кожи, а лишь
определяется при пальпации, но по мере своего развития он четко
контурируется и возвышается, нередко значительно, над уровнем
кожи.
То же самое можно сказать о связи узла с окружающими
тканями. При остром воспалительном течении (например, при
узловатой эритеме) узлы с момента развития плотно связаны с
эпидермисом. При хронических инфекционных процессах (напри-
мер, сифилитические гуммы) в начале своего развития узел может
свободно располагаться в глубоких отделах дермы: он подвижен
при пальпации по отношению к эпидермису. Консистенция узлов
может быть мягкой, например при колликвативном туберкулезе,
или плотноэластической (сифилитические гуммы, лепромы).
Течение воспалительных узлов при различных дерматозах
неодинаковое. Например, при узловатой эритеме, узловатых васку-
138
литах, неизъязвленной форме уплотненной эритемы Базена, при
озноблениях и других дерматозах узлы могут разрешаться бес-
следно. В других случаях, особенно при хронических инфекцион-
ных процессах (сифилитическая гумма, колликвативный туберку-
лез, язвенная форма индуративной эритемы, лепрома, глубокие
микозы и др.), узлы изъязвляются и заживают рубцом. При рас-
сасывании неизъязвившихся, спаянных с кожей узлов, например
при панникулите, могут оставаться участки западения без поверх-
ностной рубцовой атрофии.
Г. М. Цветкова (1983) подчеркивает, что по гистологической
структуре узел, как и бугорок, можно отнести к инфекционным
гранулемам. Однако в отличие от последнего узлы крупнее и рас-
положены гораздо глубже.
Гумма при сифилисе морфологически представляет собой очаг
коагуляционного некроза, окруженного эпителиоидными и гигант-
скими клетками типа клеток Лангханса или инородных тел, лим-
фоидными и плазматическими клетками. Узел колликвативного
туберкулеза гистологически характеризуется образованием неспе-
цифического абсцесса в центре с последующим расплавлением
всех слоев кожи.
Ревматический узел гистологически характеризуется в центре
фокусами фибриноидного некроза с окружающими его полисадо-
образными фибробластами и гистиоцитами.
При узловатой эритеме в подкожной жировой клетчатке имеет
место диффузная инфильтрация лимфоидными клетками с при-
месью нейтрофильных лейкоцитов, но плазматические клетки
отсутствуют. При этой форме узлов происходят значительные
изменения кровеносных сосудов (альтерация, пролиферация эндо-
телия).
Гистологическая картина узлов при спонтанном панникулите
характеризуется инфильтратом в подкожной жировой клетчатке,
состоящим из лимфоидных и гистиоидных элементов. Распола-
гаясь между жировыми клетками, элементы инфильтрата сначала
изолируют их друг от друга, а затем, сдавливая, нарушают функ-
цию жировых клеток, что приводит к их гибели. При этом обна-
руживаются крупные клетки с жировыми каплями в цитоплазме —
пенистые клетки [Вербенко Е. В., 1983].
При некоторых заболеваниях узлы могут носить невоспали-
тельный характер (липомы, фибромы, узловатая микседема). Точ-
нее сказать, некоторые формы соединительнотканных опухолей,
как доброкачественных, так и злокачественных (саркома), имеют
форму узлов. При этом кожа над узлами подобного происхож-
дения не изменена.
ВТОРИЧНЫЕ ЭЛЕМЕНТЫ СЫПИ
Дисхромии кожи (dischromia cutis) — это нарушения пигмен-
тации, возникающие на месте разрешившихся первичных морфо-
логических элементов (узелков, пузырьков, пузырей, гнойничков
139
и т. д.) или вторичных элементов (эрозивно-язвенных очагов).
Различают вторичные гиперпигментации, де- и гипопигментации.
Гиперпигментации на месте бывших первичных элементов
образуются вследствие отложения пигмента меланина и кровяного
.пигмента гемосидерина (при геморрагических пятнах на месте
укусов платяных вшей, вследствие воздействия слюны паразита
на гемоглобин разрушившихся эритроцитов и др.). Уменьшение
меланина в коже лежит в основе вторичных гипо- или депигмен-
тированных пятен, известных под термином «вторичная лейко-
дерма».
Вторичные нарушения пигментации локализуются на участках
бывших первичных элементов и соответствуют их величине и
форме. Вторичные гипер- и гипопигментации исчезают бесследно.
Чешуйка (squama) представляет собой разрыхленные оттор-
гающиеся клетки рогового слоя эпидермиса. Отторжение их про-
исходит постоянно как физиологический процесс в неизмененном
эпидермисе в результате трения одежды, действия мыла, воды
и т. д. В подобных случаях отторжение роговых пластинок проис-
ходит незаметно. При различных патологических процессах, раз-
вивающихся на месте первичных морфологических элементов
сыпи, чаще всего воспалительного характера (пятен, узелков,
бугорков и т. д.), или возможно как основной ведущий симптом
заболевания (ихтиоз), чешуйки становятся хорошо заметны не-
вооруженным глазом. Цвет чешуек может быть от блестяще-бело-
го до буровато-желтого и даже серо-черного цвета в зависимости
от примеси экссудата, пыли, кожного сала, пигмента. Размер
чешуек может быть очень мелким — отрубевидное мелкопластин-
чатое шелушение (desqumatio furfuracea), например при псо-
риазе, отрубевидном лишае. Мелкое отрубевидное шелушение
известно под термином «pityriasis». Крупнопластинчатое шелуше-
ние (desquamatio lamellosa) характерно, например, для скарла-
тины, токсикодермии, дерматита. При этом чешуйки нередко отде-
ляются от поверхности кожи пластами. При синдроме Лайелла
пласты рогового слоя могут отторгаться наподобие перчаток или
чулка.
Чешуйки могут сидеть на поверхности очага поражения рыхло
и легко соскабливаться, например при псориазе. При этом, учи-
тывая их большое количество и многослойность, чешуйки в про-
цессе поскабливания приобретают вид асбеста или стеарина. При
других дерматозах (каплевидный парапсориаз) чешуйки имеют
вид облатки, прикрепленной лишь в центре; она вся легко удаля-
ется при потягивании за свободно лежащий край. Периферическое
шелушение, напоминающее воротничок, наиболее ярко выражено
при папулочешуйчатых сифилидах («воротничок Биэтта»), а также
на месте разрыва пузырьков, пузырей, при отторжении централь-
ной части чешуек при розовом лишае. В последнем случае, как
и при целом ряде других дерматозов, форма чешуек имеет чрез-
вычайно важное значение. В частности, для розового лишая харак-
терны тонкие складчатые чешуйки. При некоторых заболеваниях
140
(красная волчанка) чешуйки плотно прикреплены и с трудом
соскабливаются, вызывая болезненность (симптом Бенье—Мещер-
ского). При этом нижняя сторона их имеет шипики вследствие
проникновения чешуек в устье волосяных фолликулов.
Наслоение плотных, сухих, с трудом удаляемых с поверхности
кожи роговых масс желтоватой или сероватой окраски обозна-
чается термином «кератоз».
Обычно кератоз развивается на ограниченных участках кож-
ного покрова (ладони, подошвы). Он может рассматриваться как
первичный процесс (мозоли) или вторичный (на фоне воспале-
ния).
Корка (crusta) — продукт сгущения и высыхания на поверхно-
сти кожи различного рода экссудата, содержимого пузырьков,
пузырей, распада тканей кожи, отделяемого эрозии и язв. Разли-
чают серозные корки, состоящие в основном из фибрина, среди
волокон которого находится небольшое количество лейкоцитов и
деструктивно измененных клеток эпидермиса; гнойные корки, про-
низанные большим количеством нейтрофильных лейкоцитов, и
кровянистые корки, когда среди масс фибрина, лейкоцитов нахо-
дят большое количество гемолизированных эритроцитов. Величина
корок обычно соответствует величине предшествовавшего ей эле-
мента. Цвет корок зависит от характера ссыхающегося отделяе-
мого и примешанных к ним частиц пыли, лекарственных веществ
и т. д. При серозном отделяемом цвет их бывает серовато-желтым,
желтым, медно-желтым, при гнойном отделяемом — желтым,
серовато- или зеленовато-желтым; при кровянистом отделяемом —
красным, коричневым, черновато-бурым. При смешанном харак-
тере отделяемого окраска корок может иметь различные оттенки.
Характер корок может также зависеть от ведущей в патологиче-
ском процессе микробной флоры. Корки могут быть тонкими,
плоскими, толстыми, слоистыми, плотными, рыхлыми и т. п. На-
пример, корки при стафилококковом импетиго отличаются слоис-
тостью, толщиной, желтой или желтовато-коричневой окраской,
в то время как при стрептококковом импетиго они тонкие, про-
зрачные, лакообразные.
Плотно сидящие корки наблюдаются при вульгарной эктиме,
рупиоидном псориазе, гангренозной пиодермии и т. п. Толстые,
массивные слоистые устрицеподобные корки известны под назва-
нием «рупия». Они встречаются, например, при язвенной форме
вторичного сифилиса (syphilis maligna) и образуются за счет их
прерывистого периферического роста, формирующего концентри-
ческие образования, напоминающие скорлупу устриц. При этом
основание рупий всегда больше вершины. Особая форма корок —
при парше — «скутула», характеризующаяся небольшим размером
(чечевичное зерно), желтоватым цветом, крошковатостью и про-
никновением в устье волосяного фолликула.
Элементы смешанного характера корко-чешуйки возникают в
тех случаях, когда экссудат пропитывает чешуйки. Корко-чешуйки
встречаются при экссудативном псориазе, себорее, себорейной
экземе. ...
Трещина (rhagades, fissura) — это линейные дефекты (разры-
вы), возникающие вследствие потери эластичности и инфильтра-
ции отдельных участков кожи. Чаще всего трещины образуются
в местах естественных складок и участках, подвергающихся растя-
жению (в углах рта, в области заднего прохода, над суставами,
в области пяток). Трещины сопровождаются болезненностью.
Различают поверхностные трещины (fissurae), развивающиеся в
пределах эпидермиса и заживающие бесследно, и глубокие тре-
щины (rhages), возникающие не только в пределах эпидермиса,
но захватывающие глубокие отделы дермы. Последние при зажи-
вании оставляют рубцы. Поверхностные трещины нередко возни-
кают при повышенной сухости кожи, экземе кистей и стоп, осо-
бенно при так называемой тилотической, роговой экземе; при
межпальцевой эпидермофитии стоп, инфекционных и дрожжевых
поражениях углов рта, анального отверстия, при опрелости и т. д.
Примером глубоких трещин является гохзингеровская инфильтра-
ция при раннем врожденном сифилисе. Трещины при этом, как
известно, развиваются на фоне диффузного инфильтрата, чаще
вокруг рта, рубцы, возникшие после них (кисетообразный рот),
всю жизнь напоминают о перенесенном страдании.
Ссадина, или экскориация (excoriatio), представляет собой
нарушение целостности кожного покрова в результате механи-
ческого повреждения. В большинстве случаев экскориации воз-
никают вследствие сильных расчесов ногтями или иными пред-
метами во время интенсивного зуда (нейродермит, экзема и др.).
Экскориации могут быть также нанесены вследствие патомимии.
Обычно они имеют линейный, полосовидный характер или округ-
лую форму. Экскориации могут быть поверхностными, приводя-
щими только к нарушению целостности эпидермиса и сосочкового
слоя дермы, и глубокими, проникающими в глубокие отделы
дермы.
В последнем случае на местах экскориаций образуются кровя-
нистые корки, после отторжения которых образуется рубец.
Если экскориации захватывают какой-либо первичный элемент,
чаще — это пузырек, пустула, узелок, то дефект эпидермиса в этом
случае соответствует величине элемента, подвергающегося экско-
риации. Это особенно хорошо прослеживается на примере чесотки,
когда наряду с линейными расчесами имеются экскориации, соот-
ветствующие по форме пузырькам. Поэтому локализация и форма
экскориации имеют важное диагностическое значение.
Эрозия (erosio) — представляет собой дефект эпидермиса,
образуемый после вскрытия полостных первичных элементов —
пузырьков, пузырей, поверхностных пустул. Дном эрозий является
эпителий или частично сосочковый слой дермы.
Эрозии чаще всего повторяют форму и величину предшество-
вавшего первичного элемента. Однако они могут появляться пер-
вично при механическом раздражении эпидермиса во время рас-
чесов (экскориации), а также вследствие мацерации и трения
соприкасающихся поверхностей эпидермиса (внутренняя поверх-
142
ность бедра, пахово-бедренные складки и т. п.). Эрозии могут
возникать также на поверхности воспалительных папул (эрозив-
ные папулы при сифилисе) или на фоне ограниченного инфильт-
рата (эрозивный твердый шанкр). Дно эрозии обычно ярко-крас-
ного цвета, нередко покрыто серозным отделяемым, корками.
В ряде случаев над краями эрозии нависают обрывки эпидермиса
(при вскрытии пузыря). При экзематозном процессе, дисгдирозе
эрозии могут быть мелкоточечными, в виде колодцев мокнутия, со
дна которых выделяется лимфа. Эрозии на месте простого гер-
песа обычно четко сохраняют форму и количество бывших пузырь-
ков. При заживлении эрозии не оставляют стойких изменений.
Язва (ulcus) представляет собой глубокий дефект кожи, за-
хватывающий эпидермис, дерму и нередко подлежащие ткани.
Язвы развиваются в результате распада первичного патологи-
ческого процесса в глубоких отделах дермы: при вскрытии глубо-
ких пустул, фурункула, карбункула, при распаде бугорков, узлов,
злокачественных новообразований, а также могут возникать пер-
вично вследствие некроза тканей, обусловленного трофическими
нарушениями. При тщательном гистологическом исследовании дна
и краев язвы можно обнаружить опухолевые элементы, инфек-
ционные гранулемы, что имеет большое диагностическое значение.
Язвы следует отличать от ран, которые возникают вследствие
травматизации (механическое, лучевое, температурное и др. по-
вреждения) нормальной кожи. Вместе с тем дальнейшее течение
ран, развившиеся на их фоне воспалительные, гнойные и другие
процессы позволяют рассматривать их в дальнейшем как язвы.
Язвы могут иметь различную величину, форму и глубину.
Обычно остро развивающиеся язвы имеют небольшие размеры, в
то время как язвы при длительно существующих хронических
патологических процессах (варикозные язвы, гуммы, хроническая
язвенная пиодермия и др.) отличаются нередко значительными
размерами. Форма и края язвы имеют важное диагностическое
значение. Так, например, язвенный твердый шанкр, изъязвив-
шиеся гуммы, некоторые типы базалиом кожи имеют круглую, рез-
ко отграниченную форму. Варикозные язвы, язвенные формы
туберкулезной волчанки и т. п. имеют причудливые фестончатые
очертания.
Края язвы бывают подрытыми, отвесными, блюдцеобразными,
развороченными, каллезными, мягкими и т. п. Так, при язвенном
твердом шанкре они ровные, геометрически правильной формы с
постепенным «блюдцеобразным» переходом ко дну язвы. При кол-
ликвативном туберкулезе, некоторых формах пиодермии, глубоких
микозах и др. края язвы мягкие, подрытые, нависающие над
дном. При центральном некрозе воспалительных узлов (сифили-
тическая гумма) язвы имеют отвесные края, как бы штампован-
ные, при этом они в виде валика возвышаются над уровнем кожи.
Валикообразные края имеют место также при плоскоклеточном
раке, изъязвившейся кератоакантоме, распадающихся опухолях
грибовидного микоза и т. д.
143
В некоторых случаях края, выступающие над язвой, отлича-
ются плотностью (раковые язвы, застарелые длительно нерубцую-
щиеся варикозные язвы). При этом поверхность выступающих
краев в ряде случаев покрыта плотными роговыми массами (плос-
коклеточный рак, трофические язвы), в других случаях она глад-
кая и лишена подобных наслоений (кератоакантома, изъязвив-
шиеся опухоли при грибовидном микозе и пр.).
Некоторые язвы, например при сифилитических гуммах, при
распадающихся злокачественных опухолях (рак, саркома, лимфо-
ма), отличаются значительной глубиной, в то время как при целом
ряде других заболеваний (язвенная форма индуративной эритемы
Базена, варикозный симптомокомплекс, липоидный некробиоз
и др.) язвы более поверхностные.
Дно язвы может быть ровным, гладким (твердый шанкр, мяг-
кий шанкр) или неровным, как бы извилистым (колликвативный
туберкулез, карбункул), кратероподобным (сифилитическая гум-
ма). На его поверхности могут быть выражены грануляции (лейш-
маниоз, трофические язвы), вегетации (вегетирующая пиодермия).
В большинстве случаев дно язвы покрыто серозным, гнойным, кро-
вянистым отделяемым, которое придает язве ту или иную окраску.
Нередко отделяемый со дна язвы секрет ссыхается, образуя се-
розные, гнойные или геморрагические корки. Окружность язв мо-
жет быть различна, она зависит от основного патологического
процесса, на фоне которого развилась язва. Так, при распаде
инфекционной гранулемы (сифилитическая гумма) вокруг язвы
выражены резкий инфильтрат и застойная гиперемия; при за-
старелых варикозных язвах по периферии часто наблюдаются
диффузное уплотнение, склероз тканей. При первичной сифиломе
в ряде случаев может отмечаться плотный отек по периферии
(oedema indurativum). При язвенных формах туберкулеза (вуль-
гарная волчанка, колликвативный туберкулез) вокруг язвы имеется
тестоватый, цианотической окраски инфильтрат. При гнойных
воспалительных процессах вокруг язвы наблюдаются отек, гипе-
ремия, в ряде случаев отсевы в виде пустул, фликтен. Совокуп-
ность всех вышеперечисленных признаков язвы имеет нередко
решающее дифференциально-диагностическое значение. Язва
всегда заживает рубцом, характерная особенность которого в ряде
случаев спустя много лет (бугорковые сифилиды, гумма, коллик-
вативный туберкулез и др.) позволяет предположительно устано-
вить диагноз перенесенного ранее заболевания.
Рубец (cicatrix) — грубоволокнистые соединительнотканные
разрастания, замещающие глубокие дефекты кожи (с разруше-
нием дермы и нередко подлежащих тканей). В рубце отсутствуют
придатки кожи (волосяные фолликулы, сальные, потовые железы,
а также сосуды и эластические волокна), поэтому поверхность
рубца лишена столь характерных для эпидермиса бороздок,
пор, пушковых волос. Рубцы развиваются на месте порезов,
ожогов, изъязвления, глубоких пустул, бугорков, узлов и глубоких
трещин.
144
Рубцы могут формироваться и без предшествующего изъязвле-
ния, так называемым сухим путем.
Свежие рубцы имеют розово-красную окраску, их поверхность
блестит. По величине и форме они соответствуют тому поражению,
которое восполняют. Более старые рубцы могут быть гиперпиг-
ментированы или депигментированы. Клинически различают рубцы
плоские, лежащие на одном уровне с нормальной кожей, рубцы
гипертрофические, утолщенные, возвышающиеся над поверхно-
стью окружающей кожи (келлоидные рубцы), рубцы атрофиче-
ские, когда поверхность их истончена и лежит ниже уровня по-
верхности нормальной кожи.
Если глубоколежащий инфильтрат рассасывается без наруше-
ния целостности эпидермиса (без изъязвления), то возникает
рубцовая атрофия. В отличие от обычных рубцов при рубцовой
атрофии развивается в меньшем количестве и более нежная соеди-
нительная ткань. При этом пораженная кожа резко истончается,
она легко собирается в складки наподобие папиросной бумаги
(симптом Поспелова), поверхность ее лишена характерного для
эпидермиса рельефа.
Величина, форма, локализация, цвет и глубина рубцов имеют
важное дифференциально-диагностическое значение. При этом в
одних случаях рубцы помогают диагностировать давно минувший
патологический процесс (сифилис, туберкулезную волчанку, ожоги
и т. п.), в других они являются симптомокомплексом сущест-
вующего в момент обследования больного патологического про-
цесса (склеродермия, эритематоз, атрофическая форма красного
плоского лишая, различные формы идиопатической атрофии кожи
и т. п.).
Так, рубцы на месте фурункула, эктимы имеют незначительную
величину, а рубцы после туберкулеза, ожогов и т. п. могут дости-
гать значительных размеров. Рубцы при гуммозном сифилисе
гладкие, овальной, округлой звездчатой формы, глубоко втянутые,
в то время как рубцы после колликвативного туберкулеза совер-
шенно неправильной формы, как бы изъедены, поверхность их
неровная, покрыта мостиками-перемычками, под которые может
быть введен зонд. Подобного же вида рубцы встречаются при
хронической глубокой пиодермии (acne conglobata). На месте
папулонекротических туберкулоидов остаются как бы штампо-
ванные поверхностные рубцы. Бугорковые сифилиды оставляют
после себя пестрые мозаичные рубцы фестончатых очертаний.
Вегетации (vegetationes) образуются в результате разрастания
сосочков кожи, утолщения шиповатого слоя эпидермиса и пред-
ставляют собой ворсинчатоподобные образования, развивающиеся
на поверхности различных патологических процессов (папул, вос-
палительных инфильтратов, эрозий и др.). Интенсивное развитие
вегетаций по внешнему виду может напоминать цветную капусту.
Поверхность их может быть покрыта роговым слоем, тогда веге-
тации имеют сероватый цвет, сухие и плотные при пальпации (при
бородавках), может быть эрозирована (при вегетирующей пузыр-
145
чатке). В последнем случае вегетации представляют собой мягкие,
сочные, легко кровоточащие, розовато-красной окраски ворсинча-
топодобные образования, покрытые серозным или серозно-гной-
ным отделяемым.
Лихенификация (lichenificatio) представляет собой изменение
кожи, характеризующееся ее утолщением, уплотнением, усиле-
нием рисунка, шероховатостью, что в совокупности напоминает
шагреневую кожу. Чаще всего лихенификация развивается пер-
вично в результате длительных расчесов одних и тех же участков
кожи (нейродермит). При некоторых дерматозах, сопровождаю-
щихся массивной инфильтрацией кожи (экзема, микседематозный
лихен, псориаз), на отдельном этапе развития также наблюдается
лихенификация. Однако в этих случаях она носит вторичный
характер.
* *
*
Как уже указывалось, диагностика кожных заболеваний осно-
вывается на комплексной оценке анамнестических данных, особен-
ностей морфологических изменений на коже и слизистых оболоч-
ках, оценке общего состояния больного и его субъективных жалоб.
Большую помощь нередко оказывают данные лабораторных иссле-
дований и особенно результаты патогистологического исследова-
ния кожи, биопсированной из очага поражения.
Следует отметить, что уже после первого осмотра больного
у врача складывается определенное мнение о характере заболе-
вания. При этом если клиническая картина кожных изменений не
укладывается в рамки определенного дерматоза или вообще вызы-
вает трудности в своей идентификации, врач составляет подробный
план обследования больного, намечает проведение тех или иных
лабораторных исследований. Однако следует помнить, что данные
лабораторных, функциональных, патогистологических и других
методов исследований при всей их важности лишь подтверждают
или отвергают концепцию врача. В конечном итоге именно врач
выносит окончательное решение о диагнозе, руководствуясь глав-
ным образом клинической картиной заболевания и сопоставляя
с ней результаты лабораторных исследований. Поэтому в первую
очередь необходимо детально разобраться в характере морфоло-
гических элементов сыпи, формирующих клиническую картину
дерматоза, их локализации, взаимоотношениях, особенностей эво-
люции и т. п., сопоставляя эти данные с данными об общем со-
стоянии больного и сведениями, почерпнутыми из анамнеза его
жизни и заболевания.
Анамнестические данные имеют исключительно
важное значение в диагностике и дифференциальной диагностике
кожных заболеваний. Сведения о сроках развития, особенностях
течения заболевания, сезонности, склонности к рецидивам и т. п.
нередко оказывают большую помощь в постановке правильного
146
диагноза для таких дерматозов, как экзема, псориаз, нейродермит,
герпетиформный дерматит Дюринга и др., в то время как опоясы-
вающий лишай, розовый лишай почти никогда не повторяются.
При некоторых дерматозах рецидивы возникают в определенное
время года. Например, некоторые формы псориаза склонны к
обострению в летнее или зимнее время года, в связи с чем эти
формы принято обозначать как «летнюю или зимнюю формы
псориаза». В весенне-летнее время возникает обострение хрониче-
ских фотодерматозов, эритематоза, порфириновой болезни и т. п.,
а также развиваются флеботодермии, дерматиты от растений,
рецидивирует эпидермофития стоп и т. п. В осеннее и зимнее
время обостряются диффузный нейродермит, экссудативная мно-
гоформная эритема, ознобления.
При некоторых дерматозах рецидивы заболевания возникают
в зависимости от изменения физиологических особенностей орга-
низма. Так, например, известно, что герпес беременных может
повторяться при каждой беременности, а.прерывание беременно-
сти нередко служит единственным методом лечения этого страда-
ния; менструальный пузырьковый лишай повторяется в период
менструации и т. д.
Анамнестические сведения о пребывании больных в эндеми-
ческих очагах иногда являются решающими в подтверждении
предполагаемого диагноза, например лейшманиоза, лепры, тропи-
ческих трепанематозов и т. п. Особенно важное значение приоб-
ретают анамнестические данные при подозрении на профессио-
нальный характер заболевания. Например, установление факта
соприкосновения больного по роду своей работы с животными
помогают окончательно подтвердить диагноз глубокой трихофи-
тии, эризипелоида, сибирской язвы, узелков доильщиц, а факт ра-
боты больного в контакте с парами углеводородов — диагноз токси-
ческой меланодермии. Подтверждением диагноза профессиональ-
ного аллергического дерматита или экземы являются данные о
контакте больного в условиях производства с химическими раздра-
жителями-аллергенами и клиническом улучшении течения заболева-
ния во время отпуска или при изменении характера работы и т. д.
Трудно переоценить значение анамнестических данных о прие-
ме больным тех или иных лекарственных препаратов при диаг-
ностике и дифференциальной диагностике лекарственных такси-
дермий. Нередко сведения, полученные от больного, являются
решающими не только для диагностики лекарственной болезни,
но и для профилактики этого серьезного заболевания.
Выяснение связи заболевания с приемом тех или иных пище-
вых продуктов имеет важное значение в диагностике крапивницы,
таксидермии, установлении причины обострения некоторых хрони-
ческих аллергических дерматозов (экзема, диффузный нейродер-
мит и др.).
В ряде случаев при опросе больного можно выяснить сведения
о семейном характере заболевания, что имеет важное значение
при дифференциальной диагностике, например чесотки, грибковых
147
заболеваний, семейной доброкачественной пузырчатки Хейли-
Хейли и др. Эти данные позволяют также установить наследствен-
ный, врожденный характер дерматозов (врожденная пузырчатка,
болезнь Дарье, некоторые формы кератозов, ихтиоз и др.). Нали-
чие в анамнезе сведений о перенесенном ранее туберкулезе или
сифилисе помогает установлению диагноза в случаях, если подо-
зрения на эти заболевания имеются в момент обследования боль-
ного. Исключительно важное значение имеют сведения, почерп-
нутые из анамнеза, о половых контактах больного при подозрении
на венерическое заболевание (сифилис, гонорея).
Известно, что некоторые заболевания кожи встречаются пре-
имущественно у женщин или у мужчин. Например, болезнь Фок-
са—Фордайса, узловатая почесуха Гайда, хроническая трихофи-
тия взрослых, уплотненная эритема Базена и некоторые другие
дерматозы встречаются, как правило, у женщин, а ринофима,
шаровидные угри, узелковый хондродерматит ушных раковин,
бляшечный парапсориаз — преимущественно у мужчин. Эти дан-
ные, безусловно, следует учитывать при диагностике некоторых
кожных заболеваний.
Не менее важное значение для диагностики заболевания имеют
сведения о характере изменений очагов поражения в процессе
развития патологического процесса. Например, вторичную лихе-
нификацию при экземе помогают отличить от лихенификации при
диффузном нейродермите сведения, почерпнутые из анамнеза о
том, что на очагах лихенизации в прошлом были пузырьки и мок-
нутие, что не характерно для нейродермита. Или, например, сход-
ные в клиническом отношении очаги опухолевой формы базалио-
мы и кератоакантомы можно ориентировочно различить на осно-
вании анамнестических данных, из которых удается выяснить
сроки существования опухоли и динамику развития патологическо-
го процесса (при кератоакантоме чаще короткие сроки существо-
вания и стадийность развития патологического процесса, а при
базалиоме длительное существование опухоли и неуклонно мед-
ленное прогрессирование патологического процесса). Интерес для
врача в плане дифференциальной диагностики заболевания пред-
ставляют сведения о том, на каких участках впервые появились
признаки того или иного дерматоза, частота, длительность реци-
дива и ремиссий, эффективность проводимой в прошлом терапии
и т. п.
Особенно большое значение для диагностики кожных заболе-
ваний представляют субъективные жалобы больного:
зуд, боль, покалывание, чувство жжения, жара и др. Следует,
однако, иметь в виду, что субъективные признаки заболевания
часто зависят не столько от тяжести или нозологической формы
дерматоза, сколько от индивидуальных особенностей больного,
состояния его реактивности, высшей нервной деятельности и т. п.
Нередко можно наблюдать случаи, когда больные предъявляют
массу субъективных жалоб при умеренно выраженном патологи-
ческом процессе или при нозологических формах дерматозов,
148
которые обычно не сопровождаются выраженными субъективными
страданиями. В то же время иногда при тяжелом течении дерма-
тозов или при заболеваниях, сопровождающихся выраженными
субъективными расстройствами, больные жалоб не предъявляют.
И все же с учетом сказанного следует повторить, что субъектив-
ные жалобы больного нередко оказывают помощь в подтверж-
дении мнения врача в пользу того или иного диагноза. Например,
большое диагностическое значение имеют данные о наличии или
об отсутствии чувства зуда. Известно, что зуд является важным
симптомом целого ряда дерматозов: чесотки, ограниченного и
диффузного нейродермита, почесухи, особенно узловатой почесухи
Гайда, грибовидного микоза, экземы и др. При других дерма-
тозах в типичных случаях зуд отсутствует или является незна-
чительным (чешуйчатый лишай, розовый лишай, болезнь Дарье,
розовые угри, эритематоз, склеродермия и т.п.). О наличии
зуда могут свидетельствовать следы расчесов (экскориации),
а также блестящие, как бы полированные, ногтевые пластинки
и сточенность из свободного края. Наиболее типичны эти изме-
нения при чесотке, вшивости, старческом или других формах
зуда кожи. При других дерматозах (крапивница, красный плос-
кий лишай и др.) подобные объективные признаки зуда отсут-
ствуют, несмотря на его интенсивность. Следует также помнить,
что при некоторых дерматозах зуд может быть локальным,
диффузным, приступообразным; при зудящих дерматозах он
чаще всего усиливается или возникает в ночное время вслед-
ствие согревания кожного покрова. Ощущение жара или жжения
возникает при заболеваниях, сопровождающихся активной гипере-
мией (эритемы, некоторые формы дерматита), при пузырьковых
вирусных заболеваниях, при дерматите Дюринга и т. п.
Самопроизвольная боль или болезненность при надавливании
также имеют важное диагностическое значение. Например, не-
осложненный твердый шанкр, как правило, безболезненный, в то
время как мягкий шанкр, фагеденические, некротические изъязв-
ления, опоясывающий лишай, лейомиома всегда болезненны.
Наиболее важные критерии диагностики и дифференциальной
диагностики, как известно, врач получает при осмотре боль-
ного. Первостепенное значение при этом приобретает объектив-
ная оценка морфологических изменений сыпи. Однако немало-
важное значение принадлежит и особенностям общих свойств
кожи: окраске, эластичности, сухости и т. п. Нормальная кожа
имеет розовато-матовую окраску, она не блестит. Изменение
окраски кожи и слизистых оболочек нередко является важным
диагностическим признаком. Так, например, желтая окраска кожи
и слизистых оболочек полости рта возникает при болезни Бот-
кина, механической желтухе, при длительном приеме акрихина,
при отложении в коже каротина. Темная окраска кожи наблю-
дается при токсической меланодермии, аддисоновой болезни,
сосочково-пигментной дистрофии кожи, пеллагре, ихтиозе и др.
Застойные процессы характеризуются синюшной окраской.
149
Уменьшение эластичности кожи возникает при атрофических
процессах. При этом кожа, собранная в складку, медленно возвра-
щается к исходному положению. Повышенная сухость кожных
покровов имеет место при ихтиозе, сухой себорее, диффузном
нейродермите и т. п.
Исключительно важное значение принадлежит особенно-
стям морфологических элементов сыпи, их
взаимоотношению, распространенности, локализации, окраске,
консистенции, способности к обратному развитию. Принято раз-
личать высыпания мономорфного и полиморфного
характера. Мономорфной сыпь называют в тех случаях, если она
состоит из первичных элементов какого-либо одного вида: напри-
мер, розеолезная сыпь при сифилисе, папулезная — при красном
плоском лишае, псориазе; пузырьки — при ветряной оспе, опоясы-
вающем лишае; волдырь — при крапивнице. В соответствии с
этим и дерматозы, характеризующиеся только одним каким-либо
первичным элементом сыпи, называют мономорфными.
Полиморфной сыпь называют в том случае, если она состоит
из различных элементов. При этом если сыпь состоит из несколь-
ких видов первичных морфологических элементов, то говорят об
истинном полиморфизме, а дерматозы, характеризующиеся такими
высыпаниями, называют полиморфными. К последним относятся:
многоформная экссудативная эритема, герпетиформный дерматит
Дюринга, вторичный сифилис, грибовидный микоз, болезнь Рек-
лингхаузена и др. В отличие от истинного полиморфизма сущест-
вует и так называемый ложный полиморфизм, который харак-
теризуется наличием первичных и нескольких вторичных эле-
ментов сыпи. Это создает пеструю клиническую картину и кажу-
щееся впечатление наличия нескольких видов первичных элемен-
тов. Примером заболеваний, характеризующихся ложным поли-
морфизмом сыпи, являются вульгарная пузырчатка, врожденный
буллезный эпидермолиз, некоторые формы экземы (например,
дисгидротическая) и др.
Важное диагностическое значение имеет распростра-
ненность кожных высыпаний. Сыпь может быть ограничен-
ной, распространенной (диффузной или диссеминированной), уни-
версальной. Кроме того, высыпания, формирующие очаги пора-
жения, могут быть расположены симметрично и асимметрично,
иногда по ходу нервов и в зонах Захарьина—Геда. Поэтому
в интересах своевременной диагностики заболевания необходимо
тщательно осмотреть все кожные покровы, а не ограничиваться
осмотром только тех участков, на которые указывает больной.
Например, предполагаемый диагноз красного плоского лишая
слизистой полости рта легко подтверждается наличием типичных
элементов красного плоского лишая на туловище. При высыпании
на половых органах, суспециозных на сифилис, необходимо осмот-
реть весь кожный покров и слизистые оболочки, где обычно обна-
руживаются и другие проявления болезни. Точно так же при рас-
пространении пятнистых высыпаний на туловище необходимо
150
осмотреть половые органы для исключения первичной сифиломы
или оставшихся после нее рубцовых изменений.
Важным диагностическим критерием являются особенности
взаиморасположения элементов сыпи. Высыпания могут
иметь выраженную тенденцию к слиянию между собой (псориаз,
туберкулезная волчанка и др.) или оставаться изолированными
друг от друга. В последнем случае говорят о фокусном располо-
жении сыпи (заразительный моллюск, бугорковые сифилиды
и др.). Кроме того, элементы сыпи могут группироваться. При
этом если группируются скученно пузырьки на отечном общем
основании, то такую сыпь называют герпетиформной. Группи-
рующаяся сыпь может образовывать различные геометрические
фигуры: круг, овал и т. д. Например, при кольцевидной гранулеме
узелки образуют очаги округлых, овальных очертаний с неизме-
ненным центром. Могут возникать высыпания, концентрически
расположенные в виде круга (многоформная экссудативная эри-
тема, центробежная эритема Дарье и др.). Сливаясь между собой,
кольцевидные высыпания образуют гирляндоподобные очаги, на-
поминающие географическую карту (псориаз, фигурные эритемы,
герпетиформный дерматит Дюринга и др.).
В ряде случаев наблюдается расположение сыпи по ходу сосу-
дисто-нервного пучка: например, при опоясывающем лишае эле-
менты располагаются по ходу нервов. Подобное расположение
очагов отмечается при линеарном невусе, линеарной форме крас-
ного плоского лишая и нейродермита. Такой характер располо-
жения сыпи называют систематизированным.
Большое дифференциально-диагностическое значение имеет
локализация морфологических элементов сыпи.
Прежде всего необходимо установить приуроченность морфоло-
гических элементов сыпи к придаткам кожи. По этому принципу
различают, например, фолликулярные (приуроченные к волося-
ным фолликулам) и перипоральные (приуроченные к выводным
протокам потовых желез) элементы сыпи.
Известно, что морфологические элементы сыпи, формирующие
очаги поражения при ряде дерматозов, имеют излюбленную лока-
лизацию.
Следует отметить, что одна и та же локализация может быть
при различных дерматозах, характеризующихся разнообразными
морфологическими элементами сыпи. Например, локализация оча-
гов поражения на разгибательной поверхности предплечий харак-
терна для таких дерматозов, как псориаз, папулонекротический
туберкулез, почесуха и т. д. Однако указанные дерматозы имеют
настолько индивидуальную клиническую картину, что отличить их
не представляет большого труда, несмотря на то что они имеют
общую излюбленную локализацию. Сложнее диагностировать
сходные по клинике морфологическим элементам сыпи дермато-
зы, имеющие к тому же нередко общую излюбленную локализа-
цию; например, себорея и псориаз волосистой части головы, псо-
риаз ладоней и подошв и болезнь Девержи (ограниченная форма),
151
красные угри и розацеаподобная форма красной волчанки на
лице и др. Как справедливо подчеркивает Л. Н. Машкиллейсон
(1960), «знание излюбленной локализации очагов поражения при
различных дерматозах помогает врачу прежде всего определить
круг дерматозов, в отношении которых следует проводить диффе-
ренциальную диагностику». Что касается значения для дифферен-
циальной диагностики окраски, консистенции элементов, способ-
ности их к обратному развитию, то об этом было уже сказано
в разделе, посвященном характеристике элементов сыпи.
Для более объективной оценки морфологических элементов
сыпи, имеющей важное диагностическое значение в дерматологии,
применяется целый ряд специальных методов иссле-
дования. Метод диаскопии, или витропрессии исполь-
зуется для выяснения истинной окраски морфологических эле-
ментов сыпи, цвет которых может маскироваться гиперемией.
С этой целью стеклянную палочку или предметное, часовое стекло
при хорошем освещении прижимают к поверхности исследуемого
элемента и выявляют его истинную окраску. Этот метод позво-
ляет отличить сосудистые элементы от пигментных, геморраги-
ческих, а также имеет важное значение в диагностике волчаноч-
ного бугорка; последний при диаскопии приобретает буровато-
желтый оттенок (феномен яблочного желе).
Метод поскабливания применяется для уточнения ха-
рактера шелушения и имеет исключительно важное значение в
диагностике таких дерматозов, как псориаз, парапсориаз, эрите-
матоз и др. Например, при псориазе путем поскабливания (дере-
вянным шпателем, скальпелем и др.) удается получить последова-
тельно такие патогномоничные морфологические признаки забо-
левания, как феномен «стеаринового пятна», «терминальной плен-
ки» и «кровяной росы» (симптом Полотебнова и Ауспитца). При
парапсориазе методом поскабливания удается выявить важные
морфологические симптомы: феномен скрытого шелушения и
симптом облатки. При поскабливании поверхности очагов пора-
жения при эритематозе появляется болезненность, так как чешуй-
ки прикреплены плотно. При их отторжении видны шипики, про-
никающие в устье волосяных фолликулов.
В ряде случаев для лучшего проявления нечетко выраженных
особенностей морфологических элементов сыпи можно исполь-
зовать смазывание поверхности элемента вазелиновым маслом
или водой (так называемый метод просветления). Например,
с помощью этого метода хорошо проявляется сетка Уиткема —
патогномоничный признак папул красного плоского лишая.
Феномен, или симптом П. Ф. Никольского, широко используют
при диагностике истинной пузырчатки или других дерматозов,
при которых образование пузыря сопровождается акантолизом.
Этот симптом проявляется в следующем: 1) при потягивании за
обрывок покрышки пузыря роговой слой эпидермиса продолжает
отторгаться, видимо, и на неизмененной коже рядом с пузырем;
2) если потереть с усилием здоровую на вид кожу пальцем или
152
тупым предметом на участках между пузырями или на участках
кожи, расположенных далеко от очагов поражения, происходит
«сдвигание» — отторжение — рогового слоя эпидермиса.
Для выяснения стадии заболевания (чаще всего при псориазе)
используется изоморфная реакция раздражения. Сущность ее
заключается в том, что в зоне раздражения (нанесение царапины,
облучение ультрафиолетовыми лучами) участков неизмененной
кожи через 7—14 дней появляются высыпания, характерные
для данного дерматоза (феномен Кебнера). Изоморфная реакция
раздражения может возникать и спонтанно на местах трения,
солнечного облучения при таких дерматозах, как красный плоский
лишай, псориаз, экзема, герпетиформный дерматит Дюринга
и др.
С целью уточнения диагностики герпетиформного дерматита
Дюринга используют пробу с йодистым калием (проба Ядассона),
основанную на повышенной чувствительности кожи больных
этим дерматозом к йоду. Обычно вначале используют компрессную
пробу с мазью, содержащей 50 % йодида калия, которую наносят
на участок неизмененной кожи больного. В качестве контроля
симметрично ставят пробу с вазелином. При положительной
пробе через 24 ч на месте наложения 50 % мази йодида калия
возникают герпетиформные элементы. При небольшом числе
высыпных элементов в случае отрицательной компрессной пробы
можно применять внутрь 3—4 % раствор йодида калия по 1 сто-
ловой ложке 2—3 раза в день (один день). При положительной
реакции возникают свежие герпетиформные высыпания.
В ряде случаев вспомогательное диагностическое значение
имеет проба с никотиновой кислотой. Вследствие быстрого рас-
ширения периферических кровеносных сосудов после внутри-
венного введения 1 % раствора никотиновой кислоты четко обо-
значаются сосудистые воспалительные пятна. Это может спо-
собствовать, например, выявлению розеолезных высыпаний при
вторичном сифилисе.
Вспомогательные дополнительные диагностические данные
можно получить, изучая характер дермографизма, мышечно-
волоскового рефлекса. Например, при экземе, крапивнице, псо-
риазе и некоторых других дерматозах в ответ на механическое
давление возникает разлитая стойкая краснота, т. е. имеет место
красный дермографизм.
Для диффузного нейродермита характерен стойкий белый
или красный, переходящий в белый дермографизм.
Отсутствие мышечно-волоскового рефлекса свидетельствует о
расстройстве симпатической иннервации, что может иметь место
при некоторых формах почесухи, при ихтиозе.
В ряде случаев с целью подтвердить аллергический, особенно
профессиональный характер дерматоза, диагностики некоторых
инфекционных заболеваний широко используются кожные
аллергические пробы. Они основаны на способности
инфицированного или аллергизированного организма отвечать
153
местной, очаговой или общей реакцией на введение определенных
доз специфического антигена (аллергена). Различают апплика-
ционные (эпикутанные) пробы, скарификационные и внутрикож-
ные. Наиболее широко применяются аппликационные пробы,
осуществляемые при помощи компрессного или капельного мето-
да, предложенного В. В. Ивановым, Н. С. Ведровым. Результаты
реакции регистрируют через 24, 48, 72 ч. Критерием в оценке
аппликационных проб служит развитие реактивного воспаления на
месте наложения раздражителя и отсутствие воспалительной
реакции в контроле. У больных аллергическими дерматозами
пробы ставят после разрешения островоспалительных явлений в
области очагов поражения. Не рекомендуется проводить пробу на
участках склерозированной, атрофической и пигментированной
кожи. Для диагностики профессиональных аллергических заболе-
ваний используют кожные пробы с различными веществами, кото-
рые являются предполагаемой причиной заболевания.
Кожные аллергологические тесты применяются также с целью
дополнительно диагностировать бруцеллез (реакция Бюрне), диф-
терию (реакция Шика), скарлатину (реакция Дика). Широко
известны реакции Пирке и Манту для диагностики туберкулеза.
Однако следует помнить, что положительные внутрикожные реак-
ции с туберкулином не всегда свидетельствуют о наличии тубер-
кулеза, так же как и отрицательные реакции не исключают нали-
чия специфического процесса.
Большое значение в диагностике аллергических заболеваний
отводится так называемым непрямым методам: выявлению эозино-
филии в периферической крови и секрете верхних дыхательных
путей, гаммагиперглобулинемии в крови, серологическим реакциям
(гемагглютинации, преципитации, связывания комплемента, реак-
ции Кумбса и др.), цитологическим феноменам (тест дегрануля-
ции базофилов Шелли, лейкопеническая проба, реакция агломе-
рации лейкоцитов Флекса и др.).
Исключительно важны в диагностическом отношении мето-
ды иммунологического анализа. В настоящее время
иммунологические методы исследования позволяют не только под-
твердить или отвергнуть иммунологические механизмы патогенеза
тех или иных дерматозов, но, что особенно важно, выявить, на-
пример, особенности локализации антигенов в тканях, установить
титр антител в крови, направленных против отдельных микро-
структур эпидермиса и дермы. Иногда эти данные имеют решаю-
щее значение в диагностике некоторых пузырных дерматозов.
Например, для вульгарной пузырчатки характерно отложение
иммуноглобулинов класса G в межклеточном веществе шипова-
того слоя эпидермиса; при буллезном пемфигоиде фиксированные
иммуноглобулины класса G обнаруживаются в области базальной
мембраны, а при герпетиформном дерматите Дюринга имеет место
отложение иммуноглобулинов класса А в дермо-эпидермальной
зоне или сосочковом слое дермы [Бутов Ю. С. и др., 1976; Скрип-
кин Ю. К. и др., 1982, и др.]. Таким образом, иммунофлюорес-
154
центныи метод позволяет уточнить диагноз в тех сложных слу-
чаях, когда клинические и патоморфологические исследования не
позволяют окончательно высказаться в пользу того или иного
дерматоза.
В последние годы в связи с развитием генной инженерии по-
явилась возможность при помощи гибридомной техники получать
антитела к различным клеткам крови и тканей, а также к вирусной
ДНК. Это позволило контролировать состояние клеточного имму-
нитета у больных, определять у них количественное соотношение
субпопуляций Т-лимфоцитов, как в крови, так и в тканях. Указан-
ные методы, а также иммуноферментный анализ оказались исклю-
чительно важными в диагностике ВИЧ (вируса иммунодефицита
человека) и уточнении характера изменения клеточного иммуни-
тета при этом грозном заболевании, который характеризуется
резким снижением количества хелперных клеток и снижением
хелперно-супрессорного коэффициента. При других патологиче-
ских процессах, например при грибовидном микозе, констатиро-
вано значительное увеличение количества Т-хелперов как в крови,
так и в кожных инфильтратах, лимфатических узлах, что послу-
жило основанием к обозначению этой формы системных лимфо-
пролиферативных заболеваний как Т-хелперная лимфома. Исполь-
зование моноклональных антител к базально-клеточному антигену
позволило с высокой степенью достоверности диагностировать
злокачественные опухоли кожи (базально-клеточный и плоскокле-
точный рак), уточнить гистогенез опухоли, ее истинную границу
и осуществить контроль за излеченностью [Белецкая Л. В. и др.,
1981; Коган М. Г., 1984; Белецкая Л. В., Беренбейн Б. А., 1986,
и др.].
Особенно важное диагностическое значение имеют исследо-
вания, позволяющие выявить этиологические факторы
в развитии тех или иных дерматозов. К ним относятся прежде
всего бактериоскопические исследования патологического мате-
риала из очага поражения (чешуйки, обломки волос, содержимое
пузырей, пузырьков, пустул, отделяемое эрозий и язв). Подобные
исследования нередко являются решающими в диагностике сифи-
лиса, мягкого шанкра, грибковых заболеваний, лейшманиоза и др.
При диагностике пузырчатки и злокачественных новообразо-
ваний весьма ценным является метод цитологического
исследования мазков-отпечатков со дна эрозий, язв или
свежих пузырей после удаления покрышек. Исследование
крови играет важную роль в диагностике лейкемических реак-
ций, сопровождающихся изменениями кожи. Большое значение
имеет выявление эозинофилии в случаях подозрения на герпети-
формный дерматит Дюринга, «клеток красной волчанки» (LE-кле-
ток) при системной красной волчанке. Анализ периферической
крови нередко полезен для оценки характера воспалительного
процесса при том или ином дерматозе, а также может иметь диаг-
ностическое значение, напрймер при лимфолейкозе (значительное
увеличение лимфоцитов и лейкоцитов), красной волчанке (уме-
155
ренная лейкопения и лимфоцитоз) и др. Из биохимических иссле-
дований крови диагностическое значение имеют увеличение сахара
в крови при липоидном некробиозе, увеличение порфирина в кро-
ви, моче при кожной форме порфириновой болезни, изменения
липоидов крови, ферментов печени и поджелудочной железы при
панникулите и т. п.
Исключительно важное, а иногда решающее значение в диаг-
ностике кожных заболеваний принадлежит патогистоло-
гическому исследованию кожи и слизистой
оболочки, биопсированных из очагов поражения. Особенно
большое диагностическое значение имеют эти исследования в тех
случаях, когда гистоморфологические особенности того или иного
дерматоза имеют специфическую, свойственную именно этому
дерматозу, картину. К сожалению, специфические гистоморфоло-
гические особенности характерны для небольшого круга дермато-
зов. К ним относятся красный плоский лишай, пигментная кра-
пивница, болезнь Дарье, амилоидоз кожи, эластическая псевдо-
ксантома, липоидный некробиоз, болезнь Боуэна, кератоакантома,
лимфогранулематоз и др.
В большинстве же случаев гистологическая картина может
иметь общие для ряда дерматозов особенности (гранулематозный
характер инфильтрата при глубоких микозах, туберкулезе, сар-
коидозе и др.).
Важное диагностическое значение имеет патогистологическая
оценка расположения пузыря (внутри эпидермиса или под эпидер-
мисом), что позволяет, например, отличить истинную пузырчатку
от пемфигоида Левера или герпетиформного дерматита Дюринга
и др.
В заключение следует еще раз подчеркнуть, что диагностика
кожных заболеваний основывается на комплексной оценке анам-
нестических данных, результатов различных методов исследований
(иммунологических, биохимических, цитологических, микробиоло-
гических, патогистологических и др.) в сопоставлении их с кли-
ническими особенностями патологического процесса. При этом
именно клинико-морфологическая характеристика того или иного
дерматоза является определяющей в диагностике заболевания.
Глава 6
ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
БОЛЕЗНЕЙ КОЖИ
Сложность и многообразие клинико-морфологических функ-
циональных проявлений дерматозов, множество известных и неиз-
вестных этиологических, патогенетических факторов определяют
трудности терапии, многочисленность применяемых средств и
методов. Поэтому больным хроническими рецидивирующими кож-
ными болезнями, как никаким другим пациентам, приходится дли-
тельно и систематически принимать многие лекарства. В процессе
терапии на всех этапах возникают различные деонтологические
ситуации, одна из которых требует особого внимания лечащего
врача. Назначаемые препараты, их сочетания с учетом синергизма
действия имеют очень большое значение. Поэтому пациенты, стра-
дающие кожными заболеваниями, подобно больным диабетом,
должны знать принцип действия назначаемого лекарственного
средства. Одновременно необходимо учитывать социальные и пси-
хологические особенности больных, их фоновую патологию для
того, чтобы учитывать кортико-дермальные и дермо-висцеральные
взаимоотношения. Следует особо подчеркнуть, что лекарственная
терапия — это лишь один из фрагментов лечебных мероприятий.
Часто такое же или большее значение имеют диетическое пита-
ние, экстракорпоральная гемоперфузия, плазмаферез, физиотера-
пия и психотерапия с применением электросна, гипноза.
Кожные болезни в большинстве случаев являются сигналами
внутреннего неблагополучия. Они как бы отражают те патологи-
ческие изменения, первопричина которых кроется в иммунной не-
достаточности, заболевании внутренних органов, нервно-эндокрин-
ных расстройствах. Поэтому основоположник отечественной те-
рапевтической школы М. Я. Мудров писал: «Не должно лечить
болезни по одному только ее имени, а должно лечить самого боль-
ного».
Для общего лечения кожных болезней применяют почти весь
арсенал лекарственных средств и методов, принятых в терапии
нервных, эндокринных и внутренних болезней. Причем следует
особо подчеркнуть, что некоторые лекарственные препараты,
назначаемые для лечения внутренних болезней, в дерматологии
имеют другие показания к применению. Например, синтетические
противомалярийные вещества успешно используют для лечения
красной волчанки, метилурацил или пентоксил, стимулирующие
лейкопоэз, применяют внутрь и в виде 10 % мази для лечения вари-
козного синдрома, трофических язв и лучевых поражений кожи.
157
Таким образом, при выборе средств или методов лекарственной
терапии в дерматологии при рациональном ее назначении требу-
ется весьма индивидуальное комплексное сочетание этиологиче-
ских, патогенетических и экологических показаний.
Неуклонный и повсеместный рост частоты встречаемости хро-
. нических аллергических заболеваний кожи привел к широкому
применению гипосенсибилизирующих препаратов. Причем аллер-
гический генез, формирование гиперергической реактивности
замедленно-немедленного типа играют ведущую роль в патогенезе
многих дерматозов инфекционной природы: вирусных, бактериаль-
ных, грибковых, паразитарных. В основе клинических проявлений
многих хронических рецидивирующих дерматозов — аллергиче-
ское воспаление, которое необходимо учитывать на первом этапе
лечения.
Бурный прогресс аллергологии и клинической иммунологии,
успехи фармакологии позволили за последние годы повысить
эффективность специфической и неспецифической противовоспа-
лительной терапии дерматозов [Скрипкин Ю. К. и др., 1972).
ОБЩИЕ МЕТОДЫ ЛЕЧЕНИЯ
Общее лечение аллергических дерматозов издавна рекомендо-
валось проводить противовоспалительными средствами, поскольку
реакции антиген — антитело всегда сопровождаются воспалением.
Наиболее употребительны до настоящего времени препараты
кальция, поскольку им свойственно противовоспалительное, гипо-
сенсибилизирующее действие, сочетающееся с нормализацией
активности аденилатциклазы и восстановлением соотношения цик-
лического аденозинмонофосфата (цАМФ) и циклического гуано-
зинмонофосфата (цГМФ), уменьшением проницаемости клеточ-
ных мембран и капилляров дермы. Кальция хлорид к тому же еще
обладает и противозудным действием; 10 % раствор хлористого
кальция назначают внутрь (по 3—4 столовые ложки в сутки) и
внутривенно по 5—10 мл через день № 10. Такими же дозами
применяют кальция глюконат. Широко используют и другие
соли кальция — кальция глицерофосфат, лактат, обладающие
также седативным и симпатотоническим влиянием. Более актив-
ным гипосенсибилизирующим и противовоспалительным действием
обладает кальция пантотенат, который при сочетании с пантотено-
вой кислотой стимулирует образование кортикостероидов, устра-
няет атонию кишечника и улучшает периферическую микроцир-
куляцию. Назначают кальция пантотенат внутрь, парентерально
(под кожу, внутримышечно и внутривенно) — внутрь по 0,1 —
0,2 мл 3—4 раза в сутки, парентерально в виде 20 % раствора
по 1—2 мл 1—2 раза в день, 10—15 инъекций на курс. Противопо-
казанием к назначению солей кальция являются гиперкальциемия,
гипертония, гиперкоагуляция и тромбофлебиты. Нецелесообразно
использовать препараты кальция при склонности к запорам.
158
Гипосенсибилизирующее, детоксицирующее и противовоспали-
тельное действие широкого спектра свойственно натрия тиосуль-
фату. По последним сведениям о результатах применения натрия
тиосульфата в лечении больных туберкулезом легких установлено
его редуцирующее, рассасывающее влияние на инфильтративно-
склеротические процессы. Препарат назначают внутрь по 0,5—1 г
3—4 раза в день перед едой при псориазе, нейродермите, экземе,
токсидермиях, эритродермиях. Однако более эффективно его вну-
тривенное введение в виде 30 % гипертонического раствора по 5—
10—15 мл ежедневно или через день в количестве 10—15 влива-
ний. В этих случаях происходит активизация микроциркуляции,
повышается диурез, активно регрессируют воспалительные очаги
кожного покрова [Розентул М. А., 1970].
К активным противовоспалительным и гипосенсибилизирую-
щим веществам относятся салицилаты (натрия салицилат, кислота
ацетилсалициловая), действующие и кортизоноподобно, так как
обладают стимулирующим влиянием на синтез гормонов коры над-
почечников. Им свойственно также ингибирующее влияние на фер-
менты, участвующие в образовании простагландинов в тканях.
Это действие привлекает внимание многих клиницистов, так как
высвобождение простагландинов сенсибилизирует кровеносные со-
суды в отношении действия на их проницаемость медиаторов
реакции антиген — антитело [Харт Ф. и др., 1986]. Натрия сали-
цилат применяют внутрь по 0,5—1,0 г на прием 2—3 раза в день
или в виде 10 % раствора по 1 столовой ложке 3—4 раза после
еды, в течение 10—20 дней. Ацетилсалициловая кислота, так же
как и натрия салицилат, обладает противовоспалительным, жаро-
понижающим влиянием, но ей свойственно более выраженное
ингибирующее действие на активность гиалуронидазы и проста-
гландинсинтетазы. Препараты этой группы тормозят образование
АТФ и вследствие этого уменьшают энергетическое обеспечение
биохимических процессов, поддерживающих воспалительную реак-
цию. По сведениям В. А. Насоновой и соавт. (1972), ацетилсали-
циловая кислота снижает миграцию лейкоцитов и осуществляет
противовоспалительный эффект. Ингибирующее влияние салицила-
тов на агрегацию тромбоцитов способствует улучшению реологи-
ческих свойств крови с увеличением энергетического окислитель-
но-восстановительного потенциала тканей в очагах воспаления.
При приеме салицилатов возможны побочные явления: ослабление
слуха, потливость, аллергические реакции, диспепсические явле-
ния. В целях профилактики осложнений прием внутрь произво-
дится только после еды. Противопоказанием к назначению этой
группы лекарств являются язвенная болезнь желудка и двенадца-
типерстной кишки, желудочно-кишечные кровотечения, нарушения
свертывания крови.
К нестероидным противовоспалительным средствам, особенно
часто употребляемым при разного рода артропатиях, причисляют
антраниловые кислоты — флуфенамовая, мефенамовая и др., а
также производные арилпропионовых и гетероарилуксусных кис-
159
лот: ибупрофен, напроксен, толметин. Индометацин, фепразон —
препараты иного химического строения. Все нестероидные аналь-
гетики антифлогистического действия не излечивают и не вызы-
вают стойкого регресса воспалительного процесса при псориати-
ческом артрите и артропатиях другой природы. Однако уменьшая
отечность, ослабляя боли и активизируя функцию сустава, они
значительно улучшают клиническое состояние больных, способ-
ствуют укорочению периода нетрудоспособности.
Антигистаминные гипосенсибилизирующие препараты часто яв-
ляются ведущими, основными в терапии аллергических дермати-
тов, экзематозного процесса. По определению А. Д. Адо, Ю. А. По-
рошиной (1978), антигистаминные препараты представляют собой
наиболее специальную форму фармакотерапии аллергических
заболеваний, так как гистамин является важнейшим медиатором
для многих реакций антиген—антитело немедленного типа. Уста-
новлено, что многие антигистаминные средства обладают также и
антисеротониновыми, седативными и холинолитическими свойст-
вами. Принцип их действия основан на блокировании гистаминных
рецепторов на клетках, т. е. антигистамины действуют как конку-
рентные фармакологические агенты. В организме существуют спе-
цифические гистаминовые рецепторы (Н-рецепторы), которые
подразделяют на Hi- и Нг-рецепторы. Возбуждение перифериче-
ских Нi-рецепторов сопровождается спастическим сокращением
бронхов, мускулатуры кишечника, активностью реакции антиген—
антитело немедленно-замедленного типа. При возбуждении Нг-ре-
цепторов наиболее характерным является усиление секреции
желудочных желез, нарушение регуляции тонуса гладких мышц
матки, кишечника, сосудов. Известно, что Нг-рецепторы опреде-
ляют развитие аллергических реакций цитотоксического типа.
Физиологическими антагонистами гистамина являются адреналин
и другие симпатомиметические агенты (ацетилхолин, гистаглобин,
интал, кортикостероидные гормоны).
Известно большое количество антигистаминных препаратов,
отличающихся по химической структуре и некоторым особенно-
стям действия. Необходимость в лекарственных антигистаминных
средствах различного действия объясняется их неодинаковыми
реакциями и переносимостью. Кроме того, при длительном при-
менении одного и того же лекарственного препарата из данной
группы не только снижается его лечебный эффект, но нередко
возникают и явления сенсибилизации. В специальных руководствах
рассматриваются десятки антигистаминных веществ [Middlton Е. J.,
1980]. Наиболее употребительны в широкой дерматологической
практике антигистаминные средства, относящиеся к блокаторам
Hi-рецепторов: димедрол, диазолин, дипразин (пипольфен),
тавегил, фенкарол, перитол и др. Основным представителем
блокаторов Нг-рецепторов известен в настоящее время циме-
тидин, применяемый для лечения язвенной болезни желудка и
двенадцатиперстной кишки.
Наиболее низкой токсичностью из группы антигистаминных
160
препаратов обладает сандостен. В связи с широким спектром дей-
ствия он является антагонистом ацетилхолина и серотонина. Дей-
ствие препарата потенцируется ионами кальция, поэтому в
лечебной практике применяется комбинированная лекарственная
форма — сандостен-кальций. Помимо аллергических заболеваний,
анафилактических реакций, препарат успешно применяется при
укусах насекомыми. Назначают его в драже по 0,025—0,05 г 3 ра-
за в день 15—20 дней после еды. Побочные явления весьма ред-
кие, так как наличие кальция предотвращает возможные аллерги-
ческие явления. Лишь при длительном применении возможно раз-
витие анемии или лейкопении.
Новым направлением в лечении аллергических заболеваний
является применение препаратов, блокирующих процесс высво-
бождения гистамина и других медиаторов путем влияния на
клеточные популяции, участвующие в реакции антиген — антитело.
Известно, что в основе развития аллергических процессов лежат
иммунные механизмы. По классификации А. Д. Адо (1978), аллер-
гические реакции подразделяют на истинные, или собственно ал-
лергические, и ложные. Истинные аллергические реакции отлича-
ются от ложных наличием иммунологического механизма, при
котором взаимодействие антигенов происходит с антителами пато-
логического типа и заканчивается продукцией цитотоксических
повреждающих иммунных комплексов с одновременным образова-
нием ряда медиаторов, способствующих разрушению и удалению
патологического иммунного комплекса. В целях торможения
иммунологического механизма аллергических реакций для стаби-
лизации реактивности мембран клеток-мишеней, секретирующих
в избытке медиаторов аллергии, используется ряд препаратов
типа хромогликат натрия (син.: интал, кромолин-натрий).
Противогистаминной активностью по отношению к уже освобо-
дившемуся гистамину препарат не обладает. Кромолин-натрий
(интал) не является бронходилататором и не может применяться
как средство, купирующее бронхоспазм или астматическое состоя-
ние. Механизм действия заключается в торможении дегрануляции
мастоцитов (тучных клеток) и задержки выделения медиаторных
веществ. Полагают, что одновременно происходит блокада рецеп-
торов, специфичных для лимфокинов, а также для холино- и
адреномедиаторов лимфоидных клеток [Быкова А. А. и др., 1980].
Препарат применяют в виде порошка в капсулах по 0,02 г в ком-
плексе с изадрином (изопреналин-сульфат) для ингаляций, кото-
рые назначают индивидуализированно. После улучшения состоя-
ния количество ингаляций постепенно уменьшают, подбирая эффек-
тивную поддерживающую дозу. Особенно широко используется
интал в терапии аллергических конъюнктивитов, ринитов, сопро-
вождающих поллинозы, токсидермии, при аллергических дерма-
титах и экзематозных процессах. При назначении 1—4 % раствора
кромолин-натрия путем инстилляций или в виде 0,5—1 % мази
наблюдают выраженный терапевтический эффект. При этом отме-
чают не только уменьшение зуда, гиперемии, но обнаруживают
6—936
161
разрешение клеточной инфильтрации, лихенизации [Foster L. S.,
1980].
Из других препаратов, обладающих блокирующим действием на
кинины, холинорецепторы и одновременно проявляющих противо-
воспалительное антигистаминное влияние, более часто использу-
ется аминазин (син.: плегомазин, торацин и др.). Он активнее
действует у лиц с вегетоневрозами, невротическими состояниями,
так как основными особенностями аминазина являются его анти-
психотический, противозудный эффект, способность нормализовать
эмоциональное возбуждение [Терехова Н. М., 1975]. Одновре-
менно аминазин уменьшает проницаемость капилляров, снижа-
ет воспалительный потенциал реакции антиген — антитело. Приме-
нение аминазина в комплексной терапии аллергических хронических
рецидивирующих дерматозов с положительным терапевтическим
эффектом констатировали Л. И. Фандеев (1974), И. М. Потоцкий
и соавт. (1979, 1986). Применяют аминазин в виде 2,5 % рас-
твора по 1 мл в 3 мл 0,5 % раствора новокаина или перорально
по 0,025—0,05 г 2—3 раза в день после еды в течение 1—2 нед.
Применение аминазина противопоказано при заболеваниях печени,
почек, выраженном атеросклерозе, тромбоэмболической болезни и
при склонности к аллергическим заболеваниям. К осложнениям
и побочным действиям препарата относятся диспепсические явле-
ния, снижение аппетита, запоры. Иногда при длительном приме-
нении возможны лейкопения, агранулоцитоз, гепатит.
Как противозудное средство, обладающее антисеротониновым
влиянием, блокирующим действием на вегетативные ганглии,
уменьшающее образование ацетилхолина, используется в дермато-
логии новокаин (син.: алокаин, прокаин, хлоргидрат 2-диэтилами-
ноэтилового эстера парааминобензойной кислоты). А. В. Виш-
невский впервые применил новокаин как терапевтическое сред-
ство для лечения воспалительных процессов. Предложенная им
новокаиновая блокада, обкалывание новокаином применяются
многими дерматологами для лечения зудящих дерматозов и
чешуйчатого лишая [Розентул А. М., 1970]. Новокаин вводится
различными путями: внутрь, внутривенно, подкожно, внутримы-
шечно и электрофоретически. При зудящих дерматозах большин-
ство авторов назначают новокаин ежедневно или через день вну-
тривенно. Начинают вливания с 2 мл 0,25 % раствора, постепенно
увеличивая количество до 10—20 мл, на курс 15—20 вливаний
(новокаин рекомендуется вводить внутривенно очень медленно).
В упорных случаях нейродермита или истинной экземы лучший
результат наблюдался при внутримышечном введении 1—2 %
раствора новокаина по 2—3—5 мл через день или 2 раза в неделю,
на курс 10—15 инъекций. При прогрессирующей склеродермии
наблюдается эффект от внутривенного введения 1 % раствора
новокаина в количестве 5—8—10 мл. При ограниченных очагах
нейродермита, экземы, псориаза, склеродермии пораженные участ-
ки обкалывают 0,25—0,5 % раствором новокаина в количестве 50—
100 мл, что также дает значительное улучшение. Больным экземой,
162
красным плоским лишаем новокаин применяется перорально по
15—30 мл 0,5 % раствора 2—3 раза в день за 1 час до еды в тече-
ние 15—30 дней с одновременным приемом аскорбиновой кислоты
по 0,1 г. Весьма благоприятные результаты были получены при
внутрикожном введении в область очагов поражения новокаина
или бенкаина в растворе с метиленовым синим у больных, у кото-
рых наблюдается зуд заднего прохода или при ограниченном
нейродермите [Скрипкин Ю. К., 1964]. Паравертебральная ново-
каиновая блокада применялась Ф. Н. Никитиным (1966, 1967) у
больных диффузным нейродермитом. Клиническое выздоровление
наступило у 46 из 52 больных, страдавших тяжелыми невротиче-
скими расстройствами. В результате лечения прекращались при-
ступы биопсирующего зуда, уменьшались общеневротические
явления, выявлялся вазодилататорный эффект при выраженной
симпатикотонии и быстрее разрешались очаги лихенификации.
Перед началом введения новокаина при всех способах его назначе-
ния следует обязательно определить переносимость препарата, ибо
возможна повышенная чувствительность или непереносимость.
Из осложнений известны аллергические дерматиты, головокруже-
ние, понижение артериального давления. При непереносимости
может развиться коллаптоидное состояние.
Адреноблокирующие препараты. У больных хроническими ре-
цидивирующими дерматозами в результате патологического сос-
тояния нейроэндокринной системы, висцеральных нарушений
бывает необходимо хотя бы кратковременно прервать поток
висцеродермальных и нейродермальных импульсов в кожу, чтобы
способствовать возможности регресса воспалительного процесса в
очагах поражения. В то же время по закону обратной связи при
наличии распространенного воспалительного процесса в коже нер-
вные импульсы из пораженной кожи действуют ирритабельно на
периферическую и ЦНС, функциональное состояние внутренних
органов. В последние годы широко используют а-адреноблока-
торы и Р-адреноблокаторы, тормозящие или блокирующие пере-
дачу нервного возбуждения в вегетативных узлах, в постганглио-
нарных симпатических волокнах или постсинаптических (пери-
ферических) а-адренорецепторах. К ганглиоблокаторам, имеющим
а-адреноблокирующее действие, относят препараты, применяемые
для лечения заболеваний, связанных с нарушением перифе-
рического кровообращения (эндартериит, акроцианоз, синдром
Рейно, склеродермия, атрофодермия и др.). К ним относят
фентоламин, тропафен, пирроксан, празозин и др. В дермато-
логии они находят широкое применение. Так, например, фентола-
мин используют при лечении трофических язв конечностей, скле-
родермии, атрофодермии, гранулематозе Вегенера. Пирроксан по
результатам исследований, проведенных Г. Н. Бурыкиной (1984),
оказывает выраженное периферическое и центральное адренобло-
кирующее действие, особенно на ядра заднего гипоталамуса. Ока-
залось, что данный препарат обладает высокоэффективным дей-
ствием в лечении и профилактике заболеваний, проявляющихся
6*
163
повышением симпатического тонуса, психическим перенапряже-
нием, бессонницей, утомлением и резким снижением работоспо-
собности. Пирроксан уменьшает зуд, оказывает седативное дей-
ствие и интенсифицирует периферическое крово-, лимфообращение
в результате блокирования сосудосуживающих импульсов. Пирро-
ксан применяется внутрь по 0,015 г утром и на ночь перорально,
10—12 дней или парентерально по 1,0 мл 1 % раствора еже-
дневно 1—2 раза в день или через день до 12—15 инъекций.
Г. Н. Бурыкина (1984) констатировала значительное улучшение в
процессе лечения пирроксаном больных диффузным нейродерми-
том, хронической крапивницей, псориазом, псориатической эри-
тродермией. Из побочных явлений возможны понижение артери-
ального давления, брадикардия, усиление у больных стенокардией
болей в области сердца. Противопоказаниями являются тяжелые
формы атеросклероза, нарушения мозгового кровообращения, тя-
желые формы стенокардии. Другие ганглиоблокирующие вещества,
блокирующие Н-холинорецепторы вегетативных узлов и в связи с
этим тормозящие передачу нервного возбуждения с преганглионар-
ных на постганглионарные волокна вегетативных нервов, исполь-
зуются при некоторых формах диффузного нейродермита в соче-
тании с бронхиальной астмой, при крапивнице, гипергидрозе, при
красном плоском лишае и болезни Девержи, протекающих на фоне
диэнцефального синдрома. К ним относятся бензогексоний (син.:
гексоний Б), пентамин, пирилен и темехин.
Транквилизаторы. Общепризнано и широко распространено в
дерматологии применение седативных средств и транквилизаторов.
Несмотря на это, мы в своей многолетней практике не могли убе-
диться в безотказной действенности и эффективности этих средств.
Кроме того, наличие патологических изменений со стороны висце-
ральных органов, нейроэндокринной системы у многих больных
хроническими рецидивирующими дерматозами длительно и упорно
формирует состояние эндогенной интоксикации, сопровождающе-
еся интенсивным зудом. Применение седативных средств снижает
активность волевых действий у таких больных. Они не считают
необходимым придерживаться режима диетотерапии, необходимых
санитарно-гигиенических норм и даже элементарных процедур
физической культуры. Поэтому с нашей точки зрения рационально
назначать седативную терапию или транквилизаторы кратковре-
менно, лишь при наличии выраженных невротических реакций и в
тех случаях, когда антигистаминные средства и ганглиоблокаторы
оказались недостаточно действенными. Удобнее начинать с приме-
нения магния сульфата, который, помимо успокаивающего, дето-
ксицирующего и антиспастического действия, оказывает гипосен-
сибилизирующий, желчегонный, послабляющий, гипотензивный
эффект, способствует уменьшению отечности тканей. Наличие
атома серы обеспечивает стимуляцию Зденилатциклазной систе-
мы с активацией диэстеразы и нормализацией соотношения
цАМФ и цГМФ. Особенно показан магния сульфат больным
псориазом, экземой, диффузным нейродермитом, с нарушением
164
роста волос, страдающим ожирением, хроническим гепатохоле-
циститом, панкреатитом, гипертонией, атонией кишечника, с дли-
тельным торпидным спазмом капилляров кожи — «сосудистой
спазмофилией» кожи. Вводят магния сульфат внутримышечно
или внутривенно в виде 25 % раствора по 3—5—8—10 мл через
1—2 дня, учитывая артериальное давление крови; на курс 10—15
инъекций или вливаний. Больным, страдающим ожирением
II—III степени, гипотиреозом, целесообразно назначать магния
сульфат внутрь по 1 столовой ложке 2—3 раза в день в виде
10—20 % раствора в течение 2—3 нед.
Выраженным седативным действием благодаря холинолитиче-
ским свойствам обладает амизил (син.: актозин, нейробензил
и др.). Для препарата характерна разносторонняя фармакологи-
ческая активность. Он оказывает умеренное спазмолитическое,
противогистаминное, антисеротониновое и местноанестезирующее
действие, уменьшает зуд, купируя невротические реакции и улуч-
шая сон. Применяют амизил перорально в таблетках по 0,001—
0,002 г 3—4 раза в день после еды в течение 4—6 нед. Побочные
явления сходны с атропинизацией: сухость во рту, расширение
зрачков, учащение пульса. Препарат противопоказан при глаукоме
и водителям транспорта.
Как успокаивающие, нормализующие и удлиняющие сон у
больных дерматозами с невротическими реакциями целесообразно
назначать сибазон (син.: реланиум, радедорм, седуксен), мезапам
(син.: рудотель, нобриум), феназепам, нозепам (син.: тазепам)
и др. Положительный результат в лечении невротических состоя-
ний у больных тяжелыми хроническими дерматозами с сопут-
ствующими заболеваниями печени, дискинезией желчевыводящих
путей, хроническими панкреатитами отмечается при добавлении к
комплексу липотропных средств алкалоидов красавки и фенобар-
битала. К ним относится беллатаминал, беллоид, белласпон.
Известно, что фенобарбитал является активным стимулятором
цитохрома печени Р-450, стимулирующим детоксирующую актив-
ность гепатоцитов [Арчаков А. И. и др., 1980; Марокко И. Н. и др.,
19861 • Среди других средств седативного, успокаивающего дей-
ствия используются настойка пустырника, валерианы, бромистые
препараты. Благоприятные результаты седативного эффекта в
процессе лечения электросном и гипнозом больных экземой, нейро-
дермитом, герпетиформным дерматозом Дюринга, красным плоским
лишаем, некоторыми вирусными дерматозами (юношеские плоские
бородавки и вульгарные бородавки) установил Ю. К. Скрипкин
[1962]. Гипноз и электросон в комплексе с целенаправленным
влиянием на содержание и обмен биогенных аминов (антигиста-
минное, антисеротониновое, антихолино-адренолитическое) препа-
ратов раувольфии (резерпин, раунатин) весьма активно умень-
шает кожный зуд.
Иммуномодуляторы и иммуностимуляторы. В процессе форми-
рования воспалительных дерматозов возникают различные нару-
шения биологических процессов, которые в свою очередь обуслов-
165
лены иммунологическими расстройствами. При этом более часто
имеют место не явления классического иммунодефицита, а откло-
няющиеся от нормы чрезмерные или неадекватные иммунологи-
ческие реакции. В качестве примера можно привести аллергию,
аутоиммунитет и различные повреждения, вызванные иммунными
комплексами. Патологические изменения могут произойти даже
тогда, когда иммунологическая реакция начинается как проявле-
ние нормального защитного процесса. Фактически даже в процессе
аллергического и иммунологически вызванного воспаления проис-
ходят иммунопатологические проявления. Вот почему для лечения
различных дерматозов воспалительного характера, а тем более ин-
фекционных и паразитарных заболеваний широко используют
различные виды иммунотерапии, часто подразделяемой на актив-
ную и пассивную. К активной иммунизации относят средства,
способствующие выработке антител. Введение в организм больных
уже готовых антител защитного действия именуется пассивной
иммунизацией.
При пиодермитах, вызванных стафило-стрептококками (фолли-
кулы, вульгарные угри, фурункулез, рожистое воспаление), во мно-
гих случаях применяют активную иммунизацию: стафилококко-
вым антифагином, анатоксином, вакцинотерапией (стафилокок-
ковой или стрептококковой), антистафилококковым у-глобули-
ном, антистафилококковой плазмой. Антибактериальный иммуни-
тет формируется более интенсивно при употреблении адсорбиро-
ванного стафилококкового анатоксина, который применяют под
кожу или внутримышечно, начиная с 0,2, затем по 0,5 мл через
2—4 дня. Курс лечения — 6—8 инъекций. С профилактической
целью адсорбированный стафилококковый анатоксин вводят 2 раза
по 0,5 мл с интервалом 30—45 дней, ревакцинацию производят
через 3 мес и 1 год той же дозой препарата однократно [Федоров-
ская Р. Ф., 1976].
Поливалентную стафилококковую, стрептококковую вакцины
или аутовакцину вводят внутрикожно или под кожу 1 раз в 2—
3 дня, начиная с 200 млн микробных тел (0,2 мл) и увеличивая
каждую инъекцию на 100—200 млн микробных тел (0,1—0,2 мл).
Максимальная доза — 2 млрд микробных тел (2 мл). Курс лече-
ния 10—12 инъекций. Аутовакцина не рекомендуется лицам с
заболеваниями печени, почек, сердечно-сосудистой и эндокринной
систем, с активной формой туберкулеза. Б. Т. Глухеньким и соавт.
[1983] рекомендуется в качестве специфической иммунотерапии
стафилококковый бактериофаг — стерильный фильтрат фаголиза-
та, действующий литически на соответствующие штаммы патоген-
ной микрофлоры и активно стимулирующий продукцию широкого
спектра антител. Назначают препарат внутрикожно от 0,1 до
0,5 мл, каждый раз увеличивая дозу на 0,1 мл в нескольких участ-
ках, заканчивая конечной дозой 0,5 мл. При введении внутримы-
шечно начальная доза увеличивается вдвое. Препарат применяется
от 0,2 по 0,5—1 —1,5 и 2 мл через 2—3 дня в зависимости от
реакции организма в количестве 8—10 инъекций.
166
Антистафилококковый у-глобулин назначается внутримышечно
по 5,0 (120 ME) через 3—4 дня, на курс 3—5 инъекций.
Гистаглобулин (комплекс, состоящий из гистамина и глобули-
на) оказывает выраженное гипосенсибилизирующее действие при
аллергических дерматозах, стимулируя образование антигистамин-
ных антител, нейтрализуя кожно-сенсибилизирующие антитела
(атопические реагины) и повышая гистаминнейтрализующие свой-
ства сыворотки крови. Вводят гистаглобулин внутримышечно или
внутрикожно, начиная с 0,1 мл. Увеличивая дозировку на 0,1 —
0,2 мл, постепенно доводят разовую дозу до 1—2 мл. На курс
назначают 12—20 инъекций. Гистаглобулин применяется не чаще
2 раз в неделю. В каждую точку наружной поверхности плеча
вводят внутримышечно по типу «лимонной корочки» не более
0,25 мл препарата.
Гипериммунная антистафилококковая плазма применяется при
тяжелых стафилококковых заболеваниях типа хронического сеп-
тического состояния, стафилококкового токсического эпидераль-
ного некролиза, именуемого синдромом стафилококковой обож-
женной кожи.
В целях профилактики стрептококковой инфекции В. И..Иоффе
[1968] рекомендует «малую иммунизацию» буквально гомеопати-
ческими дозами стрептотоксина из-за выраженного его антиген-
ного действия. Препарат вводят по 7—8 тыс. кожных доз, разде-
ленных на две инъекции, с последующей ревакцинацией через
4—6 мес.
Метод «малой иммунизации», а более правильно назвать этот
способ специфической гипосенсибилизацией, используют при бак-
териальной инфекции пиококками у ряда больных себорейной,
микробной и истинной экземой, хроническими стафилодермиями,
вульгарными угрями, хроническим фурункулезом, рецидивирующи-
ми эктимами и др. Специфическая гипосенсибилизирующая тера-
пия по методике Г. Г. Нуреева и И. Е. Апатырцевой [1979J про-
водится внутрикожно стандартными растворимыми бактериальны-
ми аллергенами (стафило-стрепто-аллергены, протей, кишечная
палочка и др.). Инъекцию в дозе 0,2 мл для первого введения осу-
ществляют в ничтожно малой концентрации аллергена. Разведение
для первой лечебной дозы равняется 10 6 или 10-5 степени, что
соответствует 0,000001 или 0,00001 диагностической дозы. При
каждой последующей инъекции концентрацию аллергена повы-
шают в 10 раз (10 4, 10 ’, 10 2). Затем вводят неразведенный
антиген по 1, 2, 4 и 8 кожных доз. Полный курс специфической
гипосенсибилизирующей терапии включает 20 введений антигена:
основной курс 10 введений и 10 инъекций поддерживающей тера-
пии. В период основного лечения впрыскивание антигена произ-
водят каждые 3 дня (обычно в стационаре), при поддерживающем
лечении 6 инъекций назначают по 2 дозы 1 раз в месяц и 4 инъек-
ции 1 раз в 3 мес.
В процессе специфической иммунной терапии иногда наблю-
даются побочные реакции. К ним относятся повышение темпера-
167
туры тела, недомогание, озноб, боль в суставах, головная боль,
обострение очага поражения перед полным его разрешением и
отек, болезненность на месте инъекции.
Несколько особняком в дерматологии существует актинолизат,
применяемый для иммунодиагностики и иммунотерапии актино-
микоза. С лечебной целью используют 2 методики. Г. О. Сутеев
назначает актинолизат внутримышечно по 3—4 мл через 3—5 дней
всего 20—25 инъекций. Второй курс, аналогичный первому, прово-
дят через 1'/г—2 мес.
Иммуномодулирующим эффектом на вирусную инфекцию об-
ладает человеческий лейкоцитарный интерферон, образуемый лей-
коцитами донорской крови человека в ответ на воздействие вируса-
интерферогена. Применяется в виде раствора в дистиллированной
или обычной кипяченой воде комнатной температуры для наруж-
ного лечения больных простым и опоясывающим герпесом, гер-
петиформной экземой Капоши.
Среди иммунопотенцирующих агентов в современных условиях
наиболее часто применяется левамизол (декарис), обладающий
широким спектром иммуностимулирующего действия. Способность
левамизола через систему циклических нуклеотидов активировать
фагоцитарные и эффекторные функции иммунокомпетентных кле-
ток, в том числе и супрессорную функцию Т-лимфоцитов, стимули-
ровать созревание незрелых Т-лимфоцитов в функционирующие
иммуноциты позволяет с успехом использовать его в терапии ряда
заболеваний, протекающих с явлениями иммунодефицита. Пред-
полагается, что тимопоэтический эффект левамизола осуществля-
ется in vivo путем образуемого диализуемого сывороточного фак-
тора, обладающего свойствами тимусного гормона. Характер реа-
гирования иммунокомпетентных клеток на левамизол может опре-
деляться чувствительностью иммуноцитов к сывороточному фак-
тору или степенью его выработки. Установлено, что положительная
реакция лимфоцитов крови на левамизол обусловлена активацией
in vitro Т-нулевых клеток [Wybran J., Fudenberg Н., 1973J. Лева-
мизол назначается по интермиттирующей схеме в связи с опасно-
стью развития гранулоцитопений и агранулоцитоза. Поскольку он
оказывает эффект при однократном приеме и выводится через
48 ч, его назначают 1 раз в день по 150 мг в 1, 3 и 5-й дни недели
с последующим перерывом в течение 5 дней. Исследования
А. О. Ляпон (1980), Н. К. Никулина (1982) показали, что левами-
зол выполняет функцию иммуномодулятора, способного усилить
слабую реакцию клеточного иммунитета, нормализовать избыточ-
ную активность и не влиять на нормальную реакцию. Причем
клинический эффект левамизола констатировался независимо от
первоначального содержания факторов клеточного иммунитета
(Т-, В-, а также 0-лимфоцитов) и сопровождался изменением
структуры субпопуляции иммуноцитов.
Специфическим иммунокорректором в настоящее время явля-
ется новый отечественный препарат Т-активин. Он утвержден
Фармакологическим комитетом к клиническому применению
168
07.07.1983 г. В химическом отношении Т-активин представляет
собой 6-ю фракцию гормона вилочковой железы, получаемого из
тимуса телят и состоящую из полипептидов с молекулярной мас-
сой в диапазоне от 1500 до 6000 дальтон. Препарат вводится в
дозировке 100—200 мкг в утренние часы подкожно в подлопаточ-
ную область, через день в количестве 3—5 инъекций на курс и в
виде поддерживающей терапии по 100—200 мкг 1 раз в месяц в
количестве 5—10 инъекций. Ю. М. Лопухин и соавт. (1982) про-
демонстрировали перспективность применения Т-активина у боль-
ных как обычными, так и тяжелыми формами псориаза. Наряду с
Т-активином используется тималин (син. тимарин), получаемый
также из вилочковой железы телят, содержащий полипептидные
фракции, обладающие иммунопотенцирующими свойствами. Метод
применения осложняется- необходимостью предварительного рас-
творения препарата в 1—2 мл изотонического раствора натрия
хлорида. С целью активного иммуностимулирующего действия
вводят по 10—30 мг глубоко внутримышечно ежедневно в течение
5—20 дней. Повторные курсы лечения назначают через 1—2 мес.
В процессе реабилитации для предупреждения рецидива препарат
назначается ежедневно по 10—20 мг в течение 5—7 дней
(50—100 мг на курс). Особенностью тималина является его спо-
собность не только повышать иммунологическую потенцию клеточ-
ных и гуморальных факторов системы Т-лимфоцитов, но и акти-
вировать функциональную активность моноцитов, лейкоцитов, уси-
ливая завершенную дозу фагоцитоза. Тималин также стимулирует
процессы регенерации мягких и костных тканей [Морозов В. Г.,
Хавинсон В. X., 1978; Козлов В. А. и др., 1979].
При хронических гнойничковых болезнях кожи, рецидивирую-
щих аллергических дерматозах наряду с антибактериальной и
специфической иммунотерапией применяются пирогенные средства.
Реализация воздействия на иммунокомпетентные клетки пиро-
генных препаратов обусловлена свойством бактериальных липо-
полисахаридов различного происхождения вызывать поликлональ-
ную активацию В-лимфоцитов вне зависимости от того, к какому
антигену они прекоммитированы, экспрессировать рецепторы для
соответствующих антигенов. Под влиянием пирогенных препара-
тов соответствующие антигены распознаются не только преком-
митированными к ним лимфоцитами, но и клетками других по-
пуляций, не лимфоидного ряда. Пирогенным действием обладают
пирогенал, продигиозан, ацетоксан.
В процессе лечения пирогеналом и продигиозаном наблюда-
ются улучшение функции гипофизарно-надпочечниковой системы,
повышение проницаемости тканей для лекарственных средств,
нормализация периферических функций клеток за счет активи-
зации факторов микроциркуляции.
Поскольку число препаратов, обладающих иммуностимулирую-
щим действием, не ограничивается перечисленными выше сред-
ствами, а постепенно увеличивается в связи с успехами фарма-
цевтической промышленности, следует применять наиболее дейст-
169
венные препараты, оправдавшие себя в практической врачебной
деятельности. Еще в 1966 г. Н. В. Лазаревым было обнаружено
стимулирование иммунных процессов производными пиримидина
(метилурацила и пентоксила), способствующих одновременно
процессам регенерации. Метилурацил и пентоксил стимулируют
гуморальные и клеточные факторы Т-системы, активность фагоци-
тоза и синтез белка. Анаболические и антикатаболические свой-
ства этих препаратов используются для противовоспалительных
и регенерационных целей. Метилурацил в таблетках по 0,5 г, а
пентоксил по 0,2 г назначаются 3—4 раза в день после еды в те-
чение 20—30 дней для метилурацила и 15—20 для пентоксила.
Активным анаболическим свойством обладает калия оротат, так
как оротовая кислота и ее соли входят в состав нуклеиновых
кислот, участвующих в синтезе белковых молекул. Принимают
калия оротат внутрь по 0,5 г 2—3 раза в день за 1 ч до еды или
через 4 ч после еды. Курс лечения 30—40 дней, а при дермато-
миозите, склеродермии до 3—4 мес.
Цернилтон — новый иммунопоэтический препарат, получаемый
при микробиологической ферментации пыльцы лекарственных рас-
тений. В процессе приготовления добавляются кальциевые соеди-
нения типа кальция фосфата, кальция глюконата, вследствие
чего усиливаются не только анаболические свойства, но и прояв-
ляется активное противовоспалительное действие. Принимают пре-
парат длительно, сначала по 6 таблеток 1 раз после завтрака,
затем снижают дозу до 3—4 таблеток через 4—5 дней. Побочных
явлений и осложнений не наблюдалось.
Нуклеинат натрия — особый иммуностимулирующий препарат,
получаемый в результате гидролиза дрожжей. Натриевая соль
нуклеиновой кислоты в пекарских дрожжах сочетается с комп-
лексом витаминов группы В, D, а также с полноценными легко
усвояемыми белковыми компонентами. Нуклеинат натрия стиму-
лирует функциональную активность клеточных и гуморальных
факторов иммунитета с повышением количества лейкоцитов, мак-
рофагов и образованием блокирующих антител вместо антител-
реагинов. Широкий спектр биологической активности натрия
нуклеината включает, помимо вышесказанного, ускорение процес-
сов регенерации, эпителизации и нормализацию функции компле-
мента. Препарат назначается внутрь или внутримышечно. Перо-
рально применяют по 0,25—0,5—1 г 3—4 раза в сутки в течение
3—6 нед, парентерально — в виде 2% раствора по 5—10 мл
1—2 раза в день, на курс 10—15 инъекций.
Нуклеинат натрия показан для профилактики инфекционных
осложнений, так как он обусловливает противовирусный и анти-
стафилококковый иммунитет, обладая интерфероногенной актив-
ностью. При иммунизации беременных стафилоанатоксином в
комплексе с нуклеинатом натрия вырабатывается более значи-
тельное количество а-антигемолизинов, стафилоагглютининов, IgG
и IgM [Земсков А. М., 1981].
Менее активным, чем левамизол и нуклеинат натрия, является
170
дибазол (2-бензилбензимидазола гидрохлорид). Препарат обла-
дает свойствами иммуностимулятора и адаптогена. Его действие
связано со способностью стимулировать гликолиз, усиливать син-
тез белка и нуклеиновых кислот. Как и другие производные
имидазола, дибазол действует в качестве активатора фосфоди-
эстеразы, цАМФ и ингибитора цГМФ. Дибазол снижает вос-
приимчивость к инфекциям, вызываемым стафилококком, пнев-
мококком, сальмонеллами, риккетсиями и повышает эффектив-
ность лечения инфекционных заболеваний антибиотиками. При
введении дибазола перорально по 0,02 г 1 раз в день за 2 ч до завт-
рака в течение 3 нед успешно разрешаются катаральное состояние
верхних дыхательных путей и проявление ангины [Эберт Л. Я.,
Марачев С. И., 1981]. Установлено, что дибазол стимулирует
образование интерферона в клетках, чем объясняется его эффек-
тивность при некоторых вирусных инфекциях, профилактике
гриппа [Токарев Ю. Н., Сапожников И. В., 1961].
Зимозан редко применяется в дерматологии. Препарат явля-
ется биополимером дрожжевой оболочки Saccharomyces cerevisi,
в состав которого входят главным образом полисахариды. Спо-
собность зимозана повышать антиинфекционную и противоопухо-
левую резистентность объясняют индукцией реактивности моно-
нуклеарной фагоцитирующей системы. Под влиянием зимозана
происходят характерные сдвиги, наблюдаемые при становлении
резистентности к инфекции, в частности, наблюдается увеличение
числа лейкоцитов, лимфоцитов и моноцитов. Стимуляция лейко-
поэза, активности макрофагов и лимфоцитов (в меньшей степени
В-системы иммунитета), усиление канцеролитической и компле-
ментарной активности существенно повышают антиинфекционную
и противоопухолевую резистентность. Особенно ценна способность
зимозана стимулировать гемопоэз в условиях химио- и радио-
терапии как в период специфического лечения, так и в перерыве
между курсами. Зимозан назначают в виде 0,1 % суспензии внут-
римышечно по 2—3 мл 2 раза в неделю. Курс лечения включает
10—15 инъекций. Повторные 2—3 курса проводят с интервалом
в 1 — l'/гмес [Векслер X. М и др., 1977].
Успешное развитие иммунологии, применение моноклональных
антител показали, что иммунодефицитные состояния могут фор-
мироваться с нарушением баланса Т- и В-лимфоцитов, с измене-
нием соотношения между субпопуляциями Т-индукторами (Т4) и
цитотоксическими супрессорами (Те), что приводит к возникно-
вению аутоиммунных реакций, при которых аутоантитела оказы-
вают прямое цитотоксическое действие на органы и ткани или
опосредованно через комплекс антиген—антитело.
Применение термина «аутоагрессия» не рекомендуют, так как
по существу основу всех аутоиммунных болезней составляет в
первую очередь иммунодефицит Т-клеток с гиперреактивностью
В-системы. В этих случаях клиницисты используют иммуносупрес-
сивные средства с целью воздействия на последствия сложного
дисбаланса Т- и В-системы лимфоцитов, что и составляет сущ-
ность иммуномодуляции.
Показания к иммуносупрессивной терапии определяются не-
адекватностью и непереносимостью общепринятой терапии. Раз-
личают средства с преимущественно противовоспалительным дей-
ствием и цитотоксические препараты, которые благодаря тормо-
жению пролиферативных процессов препятствуют извращенной
реакции иммунокомпетентных клеток. В большинстве случаев ле-
чения аутоиммунных дерматозов (красная волчанка, пузырчатка
обыкновенная, пузырчатка вегетирующая, пузырчатка листовидная
и эритематозная, псориаз во всех своих разновидностях, грану-
лематоз Вегенера и др.) рациональна комбинация цитостатиков
с глюкокортикостероидами, применяемыми сначала в больших, а
затем в малых дозах.
Поскольку аутоиммунные заболевания имеют выраженную тен-
денцию к рецидивированию, то противопоказания к проведению
иммуносупрессивной терапии относительные. Однако наличие
беременности, недостаточная функция костного мозга, угнетение
гемопоэза, понижение резистентности к инфекциям, вызываемым
бактериями, вирусами или грибами, снижение функции почек и
печени являются основанием для отказа от применения этой тера-
пии риска. К наиболее часто применяемым в дерматологии имму-
носупрессивным препаратам относятся метотрексат, азатиоприн,
меркаптопурин, циклофосфан. Метотрексат тормозит активность
дегидрофолатредуктазы (БНг-редуктаза) и тем самым образование
тетрагидрофолиевой кислоты, которая необходима для ресинтеза
тиминметиловых групп и дезоксиуридиловой кислоты. Решающую
роль для обеспечения терапевтического эффекта имеет внутри-
клеточная концентрация препарата. Однако близость его лечебной
и токсической доз способствует многочисленным осложнениям.
Часто наблюдаются гепатиты, диспепсические явления, эрозивные
очаги на слизистой рта, гениталий, угнетение гемопоэза, гемор-
рагический синдром. Обычно перечисленные побочные явления
разрешаются после отмены препарата. Лучшей переносимости
метотрексата способствует дополнительное применение малых доз
гормонов кортикостероидов, витаминов, иммуностимуляторов [Бо-
рисенко К. К., Родионова Г. В., 1974; Бадокин В. В., 1980]. Соче-
тание дробных доз метотрексата с иммунопотенцирующими сред-
ствами типа натрия нуклеотида, левамизола позволяет резко сни-
зить гепатотоксичность, повысить эффективность лечения чешуй-
чатого лишая до получения клинического излечения у 80—90 %
больных [Кутин С. А. и др., 1980; Дацковский Б. М. и др., 1980].
Помимо метотрексата, широко используют и другие цитоста-
тические средства в целях ингибиции фактора пролиферации кле-
ток, угнетения синтеза белка и метаболизма нуклеиновых кислот.
Одним из первых цитостатиков был применен в дерматологии
аминоптерин — антагонист фолиевой кислоты. Однако вследствие
высокой токсичности и малой эффективности он потерял свое
значение и в настоящее время не используется. Менее токсичны
меркаптопурин, азатиоприн и циклофосфан. Действие этих пре-
паратов заключается в ингибировании фермента фолиевой кис-
172
лоты — редуктазы — катализатора в цепи реакций, превращающих
фолиевую кислоту в тетрагидрофолиевую. Последняя как кофер-
мент принимает участие в переносе молекул углерода, необходи-
мых для синтеза пуринов, пиримидинов и нуклеиновых кислот.
Блокируя биосинтез нуклеиновых кислот, цитостатические сред-
ства выступают как антиметаболиты, препятствующие передаче
информации к иммунокомпетентным клеткам. Механизм иммуно-
супрессивного действия меркапто пурина состоит в следующем:
ингибиция пролиферативной фазы иммунного ответа, торможение
неспецифических воспалительных реакций, торможение гумораль-
ного иммунного ответа (подавление выработки преимущественно
IgG). Собственный опыт применения меркапто пурина в лечении
псориаза [Скрипкин Ю. К., Шарапова Г. Я., 1968] выявил хоро-
шую терапевтическую эффективность при цикловом лечении по
0,05 г 2 раза в день после еды в течение 5 дней с 3-дневным пере-
рывом (по 2—3 цикла). Из осложнений отмечались диспепсиче-
ские явления, быстро исчезающие после снижения дозы или вре-
менной отмены препарата.
Азатиоприн представляет собой имидазольное производное
меркаптопурина. В настоящее время азатиоприн наиболее широко
применяют для лечения больных красной волчанкой, дерматомио-
зита, системной склеродермией. В организме он подвергается
ферментативному расщеплению в присутствии SH-группы (глута-
тиона) на меркаптопурин и тиомидазольное соединение. Таким
образом, азатиоприн по существу действует как меркаптопурин,
хотя тиомидазольному соединению тоже свойственно подавлять
иммунитет. Этим отчасти можно объяснить некоторое различие
свойств азатиоприна и меркаптопурина.
Действие азатиоприна начинается через 2—4 дня после назна-
чения и держится 3—5 дней после отмены. По своему иммуно-
супрессивному действию азатиоприн превосходит меркаптопурин.
При достижении терапевтической концентрации более сильно за-
тормаживаются Т-супрессорные клетки, чем Т-хелперы. Клетки,
ответственные за иммунологическую память, не ингибируются.
При длительном лечении исчезают цитотоксические лимфоциты
(клетки-киллеры). Назначают азатиоприн внутрь, в таблетках
по 4 мг/кг (суточная доза) в течение 1—2 нед. Затем дозу сни-
жают до 1,5—2 мг на 1 кг массы тела в сутки (200—250 мг)
в 2—4 приема. Для достижения стойкого эффекта лечение при-
ходится проводить длительно.
Циклофосфан (син.: эндоксан, Cyclophosphamid, Cytoxan и др.)
более всех других средств подходит для иммуносупрессивной тера-
пии вследствие широкого диапазона действия. Он оказывает имму-
нопрессивное влияние в пролиферативной и непролиферативной
фазе иммунного ответа, ему свойственно торможение гумораль-
ного ответа и неспецифических воспалительных реакций. Препа-
рат обладает широким противоопухолевым спектром и оказывает
более мягкое влияние на гемопоэз и тромбоцитопоэз. Однако
следует учитывать, что, хотя циклофосфан меньше влияет на кро-
173
ветворение, чем другие иммуносупрессанты, он также может вы-
звать угнетение лейкопоэза.
Активным противоопухолевым цитостатиком является проспи-
дин. В отличие от азатиоприна, циклофосфана, меркаптопурина
он не оказывает выраженного угнетающего действия на кроветво-
рение. Проспидин назначается внутримышечно или внутривенно
в дозе 0,1—0,15—0,2 г ежедневно или через день. На курс в общей
дозе 2,5—3,0 г. Спиробромин, так же как и проспидин, обладает
цитостатическим действием, но менее активным и потому исполь-
зуется чаще в сочетании с циклофосфаном, винкристином или
другими противоопухолевыми средствами. Препарату свойственно
выраженное противозудное действие и поэтому при циррозах
печени, когда зуд бывает нестерпимым, спиробромин незаменим.
Доза назначается от 200 до 800 мг в сутки (в среднем 500 мг
в сутки) 7—14 дней. Проводят не менее 2 курсов с промежутком
7—10 дней.
Гормональные средства. Иммунитет как система защиты орга-
низма от генетического чужеродного субстрата формируется и
функционирует в результате различных регуляторных воздействий.
Среди многочисленных эндогенных факторов, влияющих на
активность иммунных механизмов, существенное значение принад-
лежит эндокринной системе. Гормоны контролируют основные
характеристики клетки, включая синтез белка, процесс деления,
функционирование мембран, концентрацию циклических нуклеоти-
дов, определяющихся по закону обратной связи, и деятельность
иммунокомпетентных клеток. Многие гормоны и их аналоги спо-
собны при определенном режиме проявлять иммуностимулирую-
щие свойства.
Соматотропин или соматотропный гормон (СТГ) стимулирует
гуморальные и клеточные реакции Т- и В-системы иммунитета.
Он усиливает синтез белка в клетках, увеличивает массу вилочко-
вой железы, через посредство цАМФ активирует пролиферацию
и дифференцировку тимоцитов [Балаболкин М. И., 1971; Аггеп-
brecht S., Sorkin Е., 1973]. Гормоны щитовидной железы отчетливо
влияют и на иммунный статус. Известно, что у больных с гипо-
тиреозом наблюдается угнетение бактерицидной, комплементарной
и лизоцимной активности сыворотки крови [Коротич О. П., 1974].
Полагают, что иммуносупрессия, развивающаяся в условиях гипо-
тиреоза, происходит не только в связи с дефицитом тиреоидных
гормонов, но и вследствие значительной недостаточности сомато-
тропной функции аденогипофиза [Мартыненко Ф. П., 1977J.
В то же время тироксин и кальцитонин активируют антитело-
генез, повышают фагоцитарную функцию нейтрофильных лейко-
цитов и макрофагов. Полагают, что эффект гормонов щитовидной
железы осуществляется опосредованно через цАМФ, так как в
эксперименте в органах-мишенях тироксин усиливал действие
аденилатциклазы и блокировал фосфодиэстеразу [Туракулов Я. X.
и др., 1976]. Перечисленные гормональные факторы используются
в дерматологии в комплексной терапии как непосредственные
174
эндокринные препараты, применяемые в качестве заместительных
средств при недостаточности той или иной функции гормональной
железы. Но чаще имеет место использование гормонов как стиму-
ляторов, повышающих функцию синергетически действующих же-
лез или понижающих действие антагонистов. В большинстве
случаев эндокринные препараты назначают как неспецифические
факторы, способные нормализовать изменения метаболических
процессов, невротические состояния и, как уже выше сказано,
оказывать положительные влияния и на иммунные механизмы.
Как правило, назначение эндокринных средств производят с учас-
тием специалиста-эндокринолога. Так, тиреоидин используют у
больных различными формами псориаза, склеродермией, ихтио-
зом, экземой, нейродермитом, угревой сыпью. В связи со способ-
ностью тиреоидина активизировать обменные процессы препарат
особенно рекомендуется больным с ожирением, с симптомами
микседематозного статуса, при эритродермиях в стадии прогрес-
сирования процесса. Под влиянием тиреоидина уменьшается гид-
рофильность тканей, повышается диурез, усиливаются окислитель-
ные процессы в жировой ткани. Тиреоидин назначается строго
индивидуализированно под контролем пульса и артериального
давления крови по 0,05 г 1—2 раза в день в первую половину дня
после еды 2—3 раза в неделю в течение 2—3 нед, после чего сле-
дует перерыв 1 мес. Такие циклы повторяют 2—3 раза и более
с учетом общего состояния.
Кальцитонин (син.: кальцитрин) — пептид, состоящий из 32
аминокислотных остатков, способствующих регуляции обмена
кальция и фосфатов. В дерматологии кальцитонин особенно по-
казан больным саркоидозом Бенье—Бека—Шаумана, при котором
имеют место кистозные остеиты (чаще всего в области фаланг
пальцев кистей и стоп), описанные впервые Н. В. Морозовым
в 1905 г. Также используется кальцитонин больным буллезным
эпидермолизом в комплексе с глюкокортикоидными гормонами.
Вводится кальцитонин внутримышечно или подкожно под конт-
ролем определения кальция в крови и с предварительной кожной
пробой на переносимость. Инъекции производятся один раз в день
ежедневно или через день в течение 2—3 мес, с перерывом каждый
7-й день. При системных остеитах кальцитонин назначается по
2—3 ЕД в день, а при неэндокринных заболеваниях, в процессе
длительного применения глюкокортикоидных гормонов для профи-
лактики остеопороза препарат вводится по 1 ЕД в день ежедневно
или через день. Одновременно рекомендуется назначать внутрь
кальция глюконат или глицерофосфат по 2—3 г в сутки. Препарат
противопоказан при гипокальциемии, беременности и в период
лактации.
Кортикотропин и кортикостероидные гор-
моны. Со времени введения в лечебную дерматологическую
практику адренокортикотропного гормона (АКТГ), особенно кор-
тикальных стероидов (гормонов коры надпочечников), применение
их при некоторых кожных болезнях стало находить все большее
17S
распространение. В настоящее время использование данного вида
гормональной терапии имеет обоснованные показания и противо-
показания, определены оптимальные дифференцированные дози-
ровки. Среди множества дерматозов выделяют группы заболе-
ваний, при которых назначение этого вида гормональной терапии
жизненно необходимо даже при наличии у больных тех или иных
относительных противопоказаний к терапии этими гормональными
средствами. При этом обычно одновременно назначают вещества,
устраняющие побочные явления или препятствующие возникнове-
нию как побочных симптомов, так и осложнений. К дерматозам,
при которых назначение кортикостероидных гормонов жизненно
необходимо, относят вульгарную пузырчатку, острую красную
волчанку, дерматомиозит, узловатый периартериит, ангиопатии,
саркоидоз, злокачественные Т-лимфомы кожи, псориатическую
эритродермию, артропатический псориаз и др. Поскольку гормо-
нам гипофиза (АКТГ) и коры надпочечников (глюкокортикоидные
стероидные гормоны) свойственно активное противовоспалитель-
ное, противоаллергическое (гипосенсибилизирующее) действие, их
широко назначают не только по витальным показаниям при тяже-
лых инвалидизирующих заболеваниях, но и при других кожных
патологических состояниях типа экземы, диффузного нейродер-
мита, токсидермиях, многоформной экссудативной эритеме, синд-
роме Стивенса—Джонсона и др., когда их применение является
методом выбора. При перечисленных дерматозах глюкокорти-
коидные гормоны используют кратковременно, часто по альтерни-
рующей схеме в небольших физиологических дозах. Такой под-
ход обусловлен тем, что кортикостероидные гормоны обладают
морбидостатическим действием, вызывая улучшение процесса
только на период их применения, а затем приходится длительное
время прибегать к поддерживающим дозам. В тех случаях, когда
гормоны коры надпочечников показаны в качестве физиологиче-
ской терапии, желательно вначале установить функциональное
состояние коры надпочечников по данным экскреции с мочой
17-гидроксистероидов и 11-оксистероидов, что дает возможность
назначать гормональную терапию обоснованно. С целью стимуля-
ции функции коры надпочечников назначают адренокорти-
котропный гормон (АКТГ). АКТГ усиливает образова-
ние и выделение преимущественно глюкокортикоидов, которые
в свою очередь влияют на гипофиз, угнетая выработку эндоген-
ного АКТГ и нормализуя дальнейшую функцию коры надпочеч-
ников. Известно, что, несмотря на иммуносупрессорное действие
АКТГ и глюкокортикоидов, оптимальный уровень этих гормонов
совершенно необходим для нормального осуществления иммуноло-
гических процессов. Так, например, в ходе лечения больных хро-
ническими заболеваниями печени преднизолоном Л. Я. Эберт,
С. И. Марачев (1981) отметили повышение фагоцитарной и лизо-
сомной активности моноцитов, что коррелировало со степенью
разрешения патологического процесса. Механизм иммуностиму-
лирующего действия малых доз глюкокортикоидов, влияние их
176
присутствия на реализацию иммунного ответа в настоящее время
изучаются. Предполагают, что глюкокортикоиды обеспечивают
пролиферацию и дифференцировку 0-клеток, а также регуляцию
иммунного ответа путем постоянного обновления клеток в лим-
фоидной ткани [Clark W. et al., 1974].
Адренокортикотропный гормон вводят внутримышечно по 10—
20 ЕД 3—4 раза в сутки, на курс 300—2000 ЕД. Препарат пролон-
гированного действия — АКТГ — цинк-фосфат назначается в дозе
40—60 ЕД 1 раз в сутки или через день. В настоящее время созда-
ны безбелковые синтетические аналоги АКТГ, не имеющие анти-
генной активности (гумактид и кортикотропин). Отечественный
кортикотропин, примененный для лечения больных нейродермитом
и экземой, оказался высокоэффективным препаратом. Кортико-
стероидную недостаточность при сохранении наличных и потен-
циальных резервов можно купировать введением адренокортико-
тропного гормона, который имеет определенное место в арсенале
средств дерматологии. Инъекции АКТГ показаны при лечении
больных вульгарной пузырчаткой, герпетиформным дерматозом
Дюринга, пустулезным и артропатическим псориазом, торпидно
протекающим нейродермитом, экземой. При введении АКТГ воз-
можны аллергические реакции, отеки, увеличение содержания
сахара в крови, синдром Кушинга. Вместе с тем такие грозные
осложнения, как язвенная болезнь желудка, остеопороз или мы-
шечная дистрофия, которые нередко возникают в период лечения
синтетическими глюкокортикоидными гормонами, при назначении
АКТГ, как правило, не наблюдаются. В последние годы в связи
с тяжелой глюкокортикоидной недостаточностью у больных хро-
ническими рецидивирующими дерматозами возросла необходи-
мость в применении глюкокортикоидных препаратов: гидрокорти-
зона, преднизолона, урбазона (метилпреднизолона), дексаметазо-
на, триамцинолона и его аналогов — полькортолона, кенакорта,
кеналога. Различные кортикостероидные препараты объединяются
общностью терапевтического действия. Дексаметазон, урбазон,
триамцинолон (полькорталон), кеналог оказывают более выражен-
ное противовоспалительное действие, поэтому их применяют в
меньших дозировках, в связи с чем снижается количество побоч-
ных явлений и осложнений, их тяжесть. Невысокие дозы этих
лекарственных препаратов не вызывают также задержки натрия,
не повышают кровяного давления и в меньшей степени, чем пред-
низолон, способствуют развитию гипергликемии и остеопороза.
Преднизолон и его аналоги (урбазон, метилпреднизолон) назна-
чают внутрь, внутримышечно и внутривенно. Длительность назна-
чения зависит от характера переносимости и терапевтического
действия. При остром прогрессирующем течении дерматоза ле-
чение проводят интенсивно, назначая внутримышечные и внутри-
венные (струйные или капельные) методы введения. Преднизолон
можно применять в этих случаях по 60—100 мг, урбазон по
20—40 мг; метилпреднизолон (пролонгированный препарат) по
1—Змл (0,04—0,12 г соответственно) 1 раз в неделю.
177
Триамцинолон (аналог полькортолон) и триамцинолона ацето-
нид (аналоги кеналог, кенакорт) более эффективны при псориазе
вследствие их эпидермотропного действия, больные лучше пере-
носят эти препараты. При приеме per os первоначально назна-
чают по 4—6 таблеток в сутки (16—24 мг). При положительном
терапевтическом результате дозу постепенно сокращают до под-
держивающей, после чего возможен переход на поддерживающую
эквивалентную дозу кеналога-40, обладающего депонирующей спо-
собностью, постепенным замедленным всасыванием. Поэтому
внутримышечные инъекции кеналога-40 производят 1 раз в 2—
3 нед.
Дексаметазон является фторированным метилпреднизолоном,
действующим более активно противовоспалительно и гипосенси-
билизирующе. По эффективности 1 таблетка преднизолона (5 мг)
эквивалентна 1 таблетке триамцинолона (4 мг), а 1 таблетка
дексаметазона (0,5 мг) эквивалентна 3,5 мг преднизолона. Следо-
вательно, дексаметазон в 7 раз активнее преднизолона. В связи
с тем что быстрая отмена стероидных препаратов приводит к
обострению дерматоза (синдром отмены), прекращение лечения
осуществляют постепенно, медленно снижая лечебную дозу. Чем
выше была назначенная доза, чем продолжительнее применяли
кортикостероидный препарат, тем длительнее осуществляется пе-
реход к отмене лечения.
Назначение глюкокортикоидных гормонов целесообразно соче-
тать с применением салицилатов, препаратов кальция, калия,
витаминов С, А, Е. Одновременно следует ограничить прием
поваренной соли, углеводов, жиров и увеличить в рационе удель-
ный вес животных белков. В процессе лечения кортикостероид-
ными гормонами, особенно если применяют большие суточные
дозы, развиваются тяжелые осложнения и побочные явле-
ния.
Чаще всего возникает так называемый синдром Кушинга.
Вследствие неравномерного отложения жира, высокой гидрофиль-
ности тканей лица формируется лунообразный овал лица. На коже
щек, лба возникают множественные акнеформные элементы. Одно-
временно отмечается отложение жира в надключичных областях,
увеличивается жировая прослойка в области спины и живота.
Мышечная ткань верхних и нижних конечностей атрофируется
(стероидная мышечная дистрофия), усиливается рост волос, обра-
зуются кожные атрофические полосы (stree). Кроме того, может
повыситься артериальное давление (стероидная гипертония), уве-
личиться содержание сахара в крови (стероидный диабет), обост-
риться язвенная болезнь желудка и двенадцатиперстной кишки.
Иногда возникает кровотечение в результате перфорации пептиче-
ской язвы (кортизоновая перфорация), обостряется туберкулез-
ный процесс в легких и активизируются другие очаги фокальной
и общей хронической инфекции вследствие иммуносупрессорного
действия. Может развиться тромбоз сосудов вследствие увеличе-
ния протромбина крови, возникнуть аменорея, психические рас-
178
стройства (вначале эйфория, затем депрессия), остеопороз (чаще
в области позвоночника).
Для профилактики катаболических осложнений кортикостерои-
ды назначают в комплексе с анаболическими препаратами неро-
болилом или нероболом (метандростенолон или метиландростен-
диол) по 0,005 г 2 раза в день под язык в течение 20—25 дней:
детям назначают нероболил по 0,001 г 1—2 раза в день в течение
15—18 дней. Анаболические гормоны оказывают положительное
влияние на азотистый обмен, задерживают выделение калия,
фосфора, серы, необходимых для синтеза белков, способствуют
фиксации кальция в костях. При назначении анаболических гор-
монов отмечают повышение аппетита, улучшение общего состоя-
ния больных. Препараты пролонгированного действия — фенобо-
лин, дураболин, ретаболил — вводят внутримышечно 1 раз в те-
чение 7—10 дней по 50 мг. Анаболические гормоны обладают
слабым андрогенным действием, поэтому они не показаны мужчи-
нам, страдающим аденомой предстательной железы, а также жен-
щинам в фолликулярной (эстрогенной) стадии менструального
цикла. Наш опыт и данные литературы свидетельствуют о необ-
ходимости назначения в комплексе с кортикостероидами иммуно-
стимуляторов, так как под влиянием стероидных гормонов ак-
тивируется стрептостафилококковая и вирусная микрофлора [По-
тоцкий И. И. и др., 1979; Скрипкин Ю. К. и др., 1984]. Наиболее
активными оказались декарис [Ляпон А. О. и др., 1983], метил-
урацил и Т-активин [Скрипкин Ю. К. и др., 1986]. Говоря о гор-
мональной терапии дерматозов, следует назвать «пресоцил», содер-
жащий в одной таблетке 0,75 мг преднизолона, 0,04 г резохина
и 0,2 г аспирина, его назначают внутрь по 1—2 таблетке 3—4 раза
в сутки. При наличии у больных дерматозами дисфункции не
только коры надпочечников, но и высших регуляторных центров —
гипофиза и гипоталамуса — применяется целенаправленная тера-
пия комплекса гормонов (полькортолон, эстрадиола бензоат и
тестостерона пропионат).
Антибиотикотерапия. Многолетний опыт применения тради-
ционных антибиотиков показал не только их удивительные лечеб-
ные свойства, но и недостатки. Группа антибиотиков весьма об-
ширна, но ведущими препаратами, используемыми для лечения
больных, страдающих инфекционными дерматозами (в основном
пиодермиями), остаются пенициллин и его производные. Анти-
биотики применяют также при туберкулезных заболеваниях кожи,
эризипелоиде, венерических заболеваниях, вирусных дерматозах,
в том числе при некоторых кожных болезнях неизвестной этио-
логии (склеродермия, красный плоский лишай, розовый лишай,
саркоидоз и др.). При перечислении различных видов антибиоти-
ков мы не указываем дозы, так как они будут подробно даны в
соответствующих главах.
В последнее время с успехом используют полусинтетические
производные пенициллина (ампициллин, оксациллина натриевая
соль). Для новых полусинтетических препаратов характерен более
179
широкий спектр действия, активность в отношении резистентных
возбудителей (вследствие устойчивости к экземам); они улучшают
всасывание и распределение в организме. Антибиотики тетра-
циклиновой группы обладают широким спектром противомикроб-
ного действия по отношению к грамположительным, грамотрица-
тельным микроорганизмам, спирохетам, риккетсиям, крупным ви-
русам. Тетрациклин назначают внутрь в таблетках, а тетрациклина
гидрохлорид применяют внутримышечно и внутрь. Олететрин,
содержащий 2 части тетрациклина и 1 часть олеандомицина фос-
фата, также можно использовать как внутрь, так и внутримышеч-
но. Пролонгированным действием обладают производные тетра-
циклинов—метациклина гидрохлорид (рондомицин), доксицик-
лина гидрохлорид (вибрамицин). В последние годы наблюдается
возрастание числа стафилококков, устойчивых к полусинтетиче-
ским пенициллинам и производным тетрациклинов. При обнару-
жении таких штаммов рекомендуется применять рифампицин,
фузидин-натрий, сочетание гентамицина с цефалоспоринами. Сре-
ди цефалоспоринов наиболее употребительны кефзол, цепорин,
цефамезин, цефалексин, являющиеся препаратами широкого
спектра действия, превосходящие по антимикробному и противо-
воспалительному действию многие из известных антибиотиков.
При лечении гнойничковых болезней кожи эффективны, удоб-
ны в применении (перорально) макролиды — эритромицин, его
сочетание с тетрациклином (эрициклин) и олеандомицина фосфат
как внутрь, так и внутримышечно и внутривенно. Аминогликозиды
имеют широкий спектр действия на грамположительные и грам-
отрицательные возбудители инфекции. Однако вследствие выра-
женного отонефротоксического действия, а также отрицательного
влияния на свертываемость крови многие из них (неомицина суль-
фат, канамицин, мономицин) не используют для приема внутрь
или парентерального введения. Они положительно себя зарекомен-
довали при наружной терапии (Глухенький Б. Т. и др., 1983].
В терапии больных туберкулезом кожи применяют стрепто-
мицин или дигидрострептомицина пантотенат (сульфат, пантоте-
нат или аскорбинат). Учитывая ототоксическое действие стрепто-
мицина и его соединений, адаптацию микрофлоры, в настоящее
время большее применение получили рифамицины, оказывающие
выраженное антибактериальное действие на грамположительные
бактерии, включая штаммы, устойчивые к другим антибиотикам.
Активны эти антибиотики и в отношении микобактерий тубер-
кулеза. В больших концентрациях они действуют на кишечную
палочку и протей. К этой группе относят рифамицин, применяе-
мый только парентерально, рифампицин (син.: рифадин, бенеми-
цин), используемый для приема внутрь.
В последние годы во всем мире наблюдается увеличение числа
случаев микотической патологии, что объясняют ростом урбани-
зации, развитием промышленности, частым употреблением анти-
биотиков, наличием иммуноэндокринных заболеваний, опухолевых
процессов и болезней крови. Особенностью возбудителей дермато-
180
фитий в настоящее время является частота ассоциативных гриб-
ковых инфекций с быстрой адаптацией возбудителей и высокой их
устойчивостью к противогрибковым препаратам. При этом нередко
в период антимикотической терапии происходит присоединение
аллергического компонента. Поэтому постоянно ведутся поиски и
внедрение в микологическую практику новых лечебных средств.
Применяемые ранее для лечения больных дерматомикозами гри-
зеофульвин, а для лечения больных кандидозами нистатин, лево-
рин, амфотерицин В остаются в арсенале антимикотических средств,
но наряду с ними в последние годы появились имидозольные
соединения. Имидозольные препараты благодаря высокой эффек-
тивности, малой токсичности, возможности как наружного, так и
внутреннего применения выгодно отличаются от используемых
ранее противогрибковых средств; для них характерна высокая
терапевтическая активность в отношении не только дерматофитов,
дрожжеподобных грибов рода Candida, но и возбудителей некото-
рых системных микозов. Из всей группы имидозольных анти-
микотиков наибольшую известность и распространение получили
канестен (клотримазол) и кетоконазол (низорал). Канестен ис-
пользуется в виде крема, раствора или вагинальных таблеток;
особенно хорошо препарат зарекомендовал себя при кандидозных
поражениях гениталий и уретры. Кетоконазол оказался высоко-
эффективным у больных дерматофитиями. Ряд авторов [Heel R.
et al., 1982; Stratigos J. et al., 1983J, применявших кетоконазол
у большого числа больных, считают его более эффективным, чем
гризеофульвин-форте, и утверждают, что кетоконазол представ-
ляет значительное достижение современной фармакологии и меди-
цины [Gotz Н., 1983; Meinhof W., 1983].
Для получения устойчивого терапевтического эффекта необхо-
димо длительное применение кетоконазола (низорала). Так, ле-
чение онихомикоза, вызванного руброфитоном, проводят в течение
6 мес (следует принимать по 1 таблетке утром до еды ежедневно).
При поражении только кожных покровов препарат назначают
принимать в течение 3—4 мес. Наш опыт показал высокую эффек-
тивность низорала в лечении множественных поражений ногтевых
пластинок (онихомикоз), сочетающихся с отслойкой ногтей.
Недостатками антибиотиков любой группы, особенно пени-
циллина, его синтетических аналогов, стрептомицина, являются
осложнения и побочные явления токсико-аллергического генеза —
дерматиты, токсидермии, вплоть до токсического эпидермального
некролиза (синдром Лайелла), крапивница, зуд, анафилактоид-
ные реакции. В этих случаях антибиотики отменяют или соче-
тают с антигистаминными препаратами и витаминами (аскорби-
новая кислота, кальция пантотенат или кальция пангамат).
С целью рационального назначения антибиотиков и получения
гарантированного терапевтического действия рекомендуется перед
применением этого рода лекарств определить антибиотикограмму,
а также провести тест на переносимость.
Химиотерапия. Из химиотерапевтических средств в дермато-
181
логии применяют сульфаниламидные, противомалярийные (произ-
водные хинолинового ряда) препараты гидразида изоникотиновой
кислоты и сульфаниламиды. После введения в арсенал лечебных
средств антибиотиков при инфекционных дерматозах сульфанил-
амидные препараты стали использовать значительно реже, по-
скольку антибиотики не только дают более выраженный терапев-
тический эффект, но и реже вызывают побочные явления и ослож-
нения. В настоящее время сульфаниламиды назначают в основном
при пиодермитах, угревой сыпи, эризипелоиде. Норсульфазол, эта-
зол и сульфадимезин заменяют препаратами пролонгированного
действия — сульфадиметоксином (мадрибон), сульфамонометок-
сином, бактримом (син.: бисептол), сульфатоном. Из осложнений
при приеме сульфаниламидных препаратов наиболее опасны агра-
нулоцитоз, анафилактоидные реакции. Возможно развитие токси-
ко-аллергической фиксированной эритемы (сульфэритемы). Не-
достаточная активность многих антибиотиков в отношении стреп-
тостафилококковой инфекции вследствие резистентности микро-
флоры, а также частота осложнений токсико-аллергического
генеза в процессе лечения антибиотиками и сульфаниламидными
препаратами обусловливают поиск новых терапевтических средств.
Л. Н. Савицкая, Р. Ф. Федоровская (1985) использовали пиперази-
на адипинат для лечения больных фурункулезом как иммуности-
мулирующее средство по аналогии с левамизолом. Препарат
назначали перорально по 0,5 г 2 раза в сутки спустя 30 мин или
1 ч после приема пищи в течение 5 дней с двухдневным переры-
вом. Курс лечения проводили в течение l'/г—2 мес. Одновременно
больные получали декамевит по 2 драже 2 раза в сутки в течение
20 дней. Авторы констатировали положительный ближайший и
отдаленный (более двух лет) терапевтический эффект, коррелиро-
вавший с достоверным улучшением клеточных и гуморальных
факторов. А. М. Бухарович, Н. М. Голощапов [1984], А. А. Кубанова
[1984] применяли димоцифон и диуцифон у больных хронической
пиодермией и экземой. Димоцифон — препарат сульфапирими-
динового ряда, представляющий собой комплекс диаминодифе-
нилсульфона (ДДС) с 6-метилурацилом. Как известно, приме-
нение 6-метилурацила сопровождается стимуляцией лимфоидно-
макрофагальной системы, нормализацией метаболизма, улучше-
нием циркуляторных функций в очагах поражений.
Димоцифон менее токсичен, чем ДДС, применяется для лече-
ния больных лепрой, дерматозом Дюринга, экземой, нейродерми-
том, псориазом, склеродермией и др. Показано назначение димо-
цифона и диуцифона при хронической пиодермии, экземе, ибо
препараты обладают выраженным противовоспалительным дейст-
вием, подавляют рост бактериальных популяций, стимулируют
фагоцитарную активность лейкоцитов. Целесообразно назначение
димофицона в сочетании с антибиотиками, так как при этом уве-
личивается продолжительность циркуляции антибиотиков в крови,
интенсифицируется их бактерицидная активность.
Диуцифон, по данным А. А. Кубановой и соавт. (1983), ока-
182
зался весьма эффективным иммунокорригирующим (иммуномоду-
лирующим) препаратом для лечения хронических аллергодерма-
тозов. Препарат назначают внутрь по 0,1—0,2 г в день 5-дневными
циклами с однодневным перерывом; курс лечения 3—8 циклов.
Внутримышечно препарат вводят в виде 5 % раствора по 4 мл че-
рез день; на курс лечения — 10—12 инъекций. Некоторым боль-
ным при тяжелых формах псориаза, склеродермии диуцифон
назначают внутримышечно по 4 мл 5 % раствора 5-дневными
циклами с однодневным перерывом; курс лечения 3—8 циклов
[Гребенюк В. Н. и др., 1980]. Больным лепрой диуцифон назна-
чается интенсивными циклами как внутрь, так и внутримышечно
в течение 5—6 мес. Другие сульфаниламидные препараты ДДС,
авлосульфон, сульфатон используют преимущественно при лечении
лепрозного процесса, но их также применяют и при герпети-
формном дерматозе Дюринга.
Синтетические противомалярийные аминохинолиновые препа-
раты (резохин, плаквенил, хлорохин, делагил) используются в
дерматологии как фотодесенсибилизирующие средства в лечении
красной волчанки, фотодерматозов, поздней кожной порфирии,
пойкилодерматомиозита и др. Производные гидразида изонико-
тиновой кислоты (фтивазид, изониазид, салюзид, тубазид, мета-
зид и др.) в настоящее время назначают как основное средство
лечения редко встречающихся туберкулезных заболеваний кожи.
Метронидазол (син.: флагил, трихопол, клион и др.) харак-
теризуется широким спектром действия в отношении простейших.
Следует отметить многоплановое действие трихопола (метро-
нидазола). Он активно нейтрализует анаэробную инфекцию, сти-
мулирует факторы гуморального и клеточного иммунитета Т-сис-
темы, усиливает защитные и регенеративные свойства слизистой
оболочки желудка, обладает противовоспалительным и антипара-
зитарным действием на клещевую железницу (Demodex folliculo-
rum) у больных демодикозом. Трихопол используют также для
лечения различных форм розацеа, периорального дерматита,
себореидов, так как препарат снижает интенсивность воспали-
тельных очагов, уменьшает эритему, застойные явления и способ-
ствует исчезновению телеангиэктоидных изменений на лице
[Шахнес И. Е., Крепкер Я. Б., 1985].
Применение методов детоксикации в дерматологии. Научно-
техническая революция, химизация промышленности, сельского
хозяйства и быта привели к существенным преобразованиям в
складывавшейся веками экологической ситуации. Современный
человек подвергается постоянной атаке повреждающих факторов
внешней среды, а поскольку он эволюционно не подготовлен к
новому «синтетическому» окружению, нарушающему адаптацион-
ные механизмы, возможны качественные и количественные изме-
нения функции и даже структуры отдельных органов, кожи.
Многообразие системных патологических изменений, наблюдаю-
щихся у больных красной волчанкой, склеродермией, псориазом,
Диффузным нейродермитом, крапивницей и другими хроническими
183
рецидивирующими дерматозами приводит к увеличению арсенала
применяемых лекарственных средств. Однако полипрогмазия ока-
зывается в части случаев не только неэффективной, но даже пато-
генной. Известно, что многие больные не переносят лекарственные
препараты вследствие сенсибилизации и формирования аутоим-
мунных состояний. Участились случаи лекарственных токсических
синдромов, которые получили название «болезней медицинского
прогресса». По данным ВОЗ, к 1980 г. во внешней среде насчиты-
валось более 4 млн опасных для человека ксенобиотиков. Из них,
как показали исследования, проведенные американской организа-
цией по контролю за лекарственными препаратами и пищевыми
продуктами, во внутреннюю среду человека постоянно попадает
более 60 тыс. чужеродных соединений. Поэтому в настоящее
время весьма актуальной стала проблема защиты внутренней сре-
ды человека. Методы лечения, основанные на удалении из организ-
ма ядовитых, потенциально опасных для жизни веществ экзоген-
ной или эндогенной природы, легли в основу самостоятельного
крупного направления современной медицины, возглавляемого
академиком РАМН профессором Ю. М. Лопухиным, и получили
название эфферентных. Воздействуя непосредственно на кровь,
лимфу или плазму, эти методы отличаются высокой эффектив-
ностью, особенно при оказании помощи больным, находящимся
в условиях высокой степени эндогенного токсикоза или в экстре-
мальных состояниях. На основном принципе почечной экскреции—
диализе построены аппараты для гемодиализа. Механизм фер-
ментативного окисления гидрофобных соединений в печени может
быть воспроизведен с помощью электрохимического окисления,
которое находит уже применение в лечении пиодермитов, микроб-
ной экземы. Третьим механизмом естественной детоксикации
является адсорбция. Именно она лежит в основе функциониро-
вания иммунной системы, мембранной рецепции. Быстрое разви-
тие сорбционных методов детоксикации в последнее десятилетие
объясняется открывающимися новыми возможностями в лечении
тяжелых состояний.
Сорбционная детоксикация основана на непосредственном уда-
лении из крови и других биологических жидкостей токсических
веществ эндогенного и экзогенного происхождения при помощи
сорбентов. Поскольку в механизме «очищения» крови лежат сорб-
ционные процессы, этот вид детоксикационной терапии был на-
зван по аналогии с известным термином «гемодиализ» гемосорб-
цией, а удаление токсических веществ из лимфы, плазмы и лик-
вора соответственно лимфосорбцией, плазмосорбцией и ликворо-
сорбцией.
Несмотря на некоторое внешнее сходство, гемосорбция прин-
ципиально отличается от гемодиализа, прежде всего возможно-
стью прямого извлечения из крови недиализируемых веществ:
гидрофобных соединений и крупных молекул.
К числу таких веществ относятся жирорастворимые ксенобио-
тики, липиды, белковолипидные комплексы, белки или пептиды
184
с токсическими свойствами (ожоговые, ишемические токсины,
«средние молекулы», церебротоксины и др.).
Сорбционным методом можно удалить из крови целый ряд
веществ, используя избирательные (селективные) или относитель-
но селективные сорбенты: активированные угли, ионообменные
смолы, иммуносорбенты, сорбенты природного типа (гаптоглобин,
альбумин) и др.
Другим важным свойством сорбционных методов является
возможность мощного направленного воздействия на иммунореак-
тивность организма путем удаления иммуноглобулинов, компле-
мента, циркулирующих иммунных комплексов антиген—антитело
или элиминации определенных клеточных популяций и субпопу-
ляций Т-системы иммунитета. Эта особенность открывает новые
возможности в лечении аутоиммунных, аллергических заболева-
ний, болезней иммунных комплексов.
Наконец, большой интерес представляет общий постоянно
констатируемый феномен постсорбционного резкого повышения
чувствительности организма к лекарственной терапии. Это явление
не нашло еще удовлетворительного объяснения, но практически
оно в высшей степени значимо при комплексной терапии вульгар-
ной пузырчатки, красной волчанки, диффузного нейродермита,
осложненных форм псориаза, токсидермий, крапивницы и других
тяжелых хронических дерматозов. На протяжении более 10 лет
в дерматологии успешно применяют гемодиализ [Jablonska S. et al.,
1980, 1981], плазмаферез, а также иммуносорбцию [Лопу-
хин Ю. М. и др., 1982; Дмитриев А. А. и др., 1981; Башмаков В. Г.
и др., 1986, и др.]. Особенно показано комплексное применение
экстракорпоральной детоксикации в лечении тяжелых дерматозов
типа системной красной волчанки, диффузного нейродермита,
вульгарной пузырчатки, различных токсидермий, в том числе ток-
сического эпидермального некролиза (синдрома Лайелла), синд-
рома Стивенса—Джонсона и т.п.
В целях воздействия на различные патологически измененные
механизмы обмена веществ В. В. Кулага (1977), а затем Е. В. Вер-
бенко и соавт. (1981) применили детоксицирующий кровезаме-
нитель — гемодез, 300—400 мл препарата вводили внутривенно
капельно со скоростью 80—100 капель в 1 мин с интервалами
в 3—4 дня; на курс 5—8 вливаний. Лучшие результаты получены
при лечении больных, страдающих папулезной и папулезно-бля-
шечной формами распространенного псориаза в прогрессирующей
стадии, а также при начинающейся эритродермии. Собственный
опыт по применению гемодеза у больных крапивницей, диффуз-
ным нейродермитом, токсидермиями, вульгарной пузырчаткой
(более чем у 200 больных) свидетельствует о необходимости его
применения в период прогрессирования процесса, особенно у боль-
ных с явлениями интоксикации, метаболических расстройств,
а также при наличии эритродермии или артропатии.
К неспецифическим противовоспалительным и гипосенсибили-
зирующим средствам, обладающим также широким фармако-
185
терапевтическим действием, относятся витамины, активно влияю-
щие на метаболические функции. Известно, что жизненная потреб-
ность в витаминах обусловлена их участием в построении многих
ферментов в качестве простетических или коферментных групп,
что обеспечивает регуляцию метаболизма, адаптационно-трофиче-
ских механизмов и иммунокорригирующее действие. Для лечения
псориаза широко используют витамины комплекса В, особенно
Bi, В2, В5, Be, B12, Ви, витамины А, Е, С, Р в комбинации с дру-
гими терапевтическими средствами. Включение витамина Bi, а еще
лучше его коферментной формы кокарбоксилазы в комплексную
терапию псориаза способствует регрессу высыпных элементов.
Особое значение кокарбоксилаза имеет для регуляции углеводного
обмена, функциональной активности нервной системы, эндокрин-
ных желез и сердечной деятельности. Витамин В| применяют
для лечения больных экземой, крапивницей, псориазом. Наиболее
показан он в период прогрессирования при нарастании экссудатив-
ного компонента воспалительной реакции. Дозы препарата и про-
должительность терапии зависят от возраста больного, состояния
его сердечно-сосудистой системы и артериального давления.
Витамин Вг (рибофлавин) входит в состав ферментов, регу-
лирующих окислительно-восстановительные процессы, участвует
в углеводном, белковом и жировом обмене, необходим для под-
держания нормальной функции зрительного анализатора. Для ле-
чения псориаза, красной волчанки, себорейной экземы, вульгарной
пузырчатки применяют 1 % раствор рибофлавина мононуклео-
тида, вводимой внутримышечно по 2 мл через день, на курс 10—
15 инъекций. Противопоказаниями служат идиосинкразия и неф-
ролитиаз.
Весьма целесообразно назначать витамин Вз-кальция панто-
тенат, который входит в состав коэнзима А, участвующего в про-
цессах ацетилирования и являющегося одним из важнейших
коферментов сложных ферментативных систем окислительного
декарбоксилирования пировиноградной и а -кетоглутаровой кислот.
В процессе ацетилирования при окислительном распаде углеводов,
жиров и белков под влиянием витамина Вз нормализуется мета-
болизм трикарбоновых кислот — центральный метаболический
процесс в клетках.
Положительное действие при многих хронических рецидиви-
рующих дерматозах оказывает витамин В6 — пиридоксин. Его
кофермент фосфорилированный пиридоксальфосфат необходим
для декарбоксилирования и переаминирования аминокислот (трип-
тофан, метионин, цистеин, глутаминовая и другие аминокислоты).
Участвуя в обмене жиров и липопротеидов, он увеличивает выве-
дение холестерина и триглицеридов.
Витамин Bis (цианокобаламин) широко применяют для лече-
ния больных экземой, красным плоским лишаем, псориазом; он
участвует в синтезе лабильных метиловых групп, холина, метио-
нина, нуклеиновых кислот, благоприятно действует на функцио-
нальное состояние печени, нервной системы. Препарат обладает
186
выраженным антианемическим • действием, нормализует обмен
углеводов и жиров.
Витамин В|3 (оротовая кислота) — один из предшественников
пиримидиновых нуклеотидов, входящих в состав нуклеиновых
кислот, которые участвуют в синтезе белковых молекул. Оротовую
кислоту и ее соли рассматривают как вещества анаболического
действия и применяют при нарушениях белкового обмена, а также
для стимуляции обменных процессов. В дерматологии используют
калиевую соль оротовой кислоты (калия оротат).
Витамин Bis (пангамовая кислота и ее производное — кальция
пангамат) применяют для лечения псориаза, особенно при эрит-
родермии или псориатической артропатии в целях нормализации
липидного обмена, рационального усвоения кислорода тканями,
увеличения энергетических ресурсов в мышцах и печени (креатин-
фосфат, гликоген), а также в целях частичной блокировки патоло-
гических нервных импульсов с кожи на центральную нервную
систему. Благодаря наличию молекулы кальция в витамине В)5 он
обладает значительным противовоспалительным и гипосенсибили-
зирующим действием, его часто назначают больным экземой,
крапивницей, аллергическими дерматитами, токсикодермиями.
Препарат противопоказан при глаукоме, гипертонической болезни.
Побочные явления (бессонница, головная боль, раздражитель-
ность, тахикардия, экстрасистолия) наблюдают редко, преиму-
щественно у лиц пожилого возраста. Хороший терапевтический
эффект отмечают при лечении псориаза фолиевой кислотой, осо-
бенно у больных с продолжительным течением болезни в стацио-
нарной стадии; в период обострения лечебный эффект выражен
мало. Применение фолиевой кислоты в сочетании с витамином В12
стимулирует процесс эритропоэза. Фолиевая кислота является
составной частью коэнзимов, которые осуществляют синтез метио-
нина, серина, холина, урацила, тимина, пурина и нуклеиновых
кислот.
В терапии различных хронических рецидивирующих дермато-
зов широко используют аскорбиновую кислоту (витамин С), участ-
вующую в регуляции окислительно-восстановительных процессов,
способствующую синтезу стероидных гормонов, образованию кол-
лагена, уплотнению клеточных мембран капилляров.
Больным фотодерматозами, красной волчанкой и псориазом
летней формы целесообразно назначать никотиновую кислоту, ко-
торая входит в состав когедраз, принимает участие в окисли-
тельно-восстановительных процессах, снижает содержание порфи-
ринов в крови, положительно действует на липидный обмен, обла-
дает сосудорасширяющим действием. Противопоказанием может
служить индивидуальная непереносимость. Резко ограничивают
применение никотиновой кислоты при тяжелых формах атероскле-
роза, гипертонической болезни, поскольку возможны побочные
реакции — покраснение кожи лица, шеи, плеч, головокружение,
приливы, парестезии. Редко назначают при псориазе витамин D2.
В 1936 г. применение витамина D2 впервые дало хороший резуль-
187
тат у больных туберкулезной волчанкой; М. А. Быховский,
М. К. Павлов рекомендовали его для лечения других дерматозов.
Витамин Da регулирует обмен фосфора и кальция, способствует
уплотнению клеточных мембран, отложению в коже дегидро-
холестерина, оказывает положительное влияние на регенеративные
процессы в эпидермисе. Применяют витамин Da из расчета 2000 ME
на 1 кг массы тела, что в среднем составляет 80 000—160 000 ME
в сутки в течение 20 дней.
Витамин Da противопоказан при активных формах туберкулеза
легких, язвенной болезни желудка и двенадцатиперстной кишки,
заболеваниях печени и почек, органических поражениях сердца и
сосудов. При применении больших доз витамина могут развиться
диспепсические симптомы, полиурия, гипертермия тела, диарея,
кальциноз внутренних органов.
Нарушение процессов ороговения и эпителизации при экземе
и псориазе послужило основанием для применения витамина А,
или ретинола. Этот витамин способствует росту и развитию, обес-
печивает процессы кератогенеза в эпидермисе. Он обладает свой-
ством поддерживать функции кератиноцитов эпидермиса вследст-
вие нормализации пластических метаболических процессов в коже
и слизистых оболочках. Ретинол способствует повышению усвое-
ния белков, жиров и углеводов, интенсифицируя окислительно-
восстановительные процессы и синтез холестерина, необходимого
для построения стероидных гормонов, способствует усилению
фагоцитоза и синтезу защитных антител. При недостатке вита-
мина А возникает кератинизация эпидермиса, проявляющаяся
сухостью кожи, шелушением и ороговением фолликулярного
аппарата, может развиться ксерофтальмия или кератомаляция.
Поэтому витамин А называют антиксерофтальмическим, анти-
инфекционным. Установлено, что собственно витамин А не столь
активен, как его синтетические производные. Исходным продуктом
для некоторых синтетических аналогов витамина А являлась
ретиноевая кислота — третиноин. Наиболее действенными вариан-
тами синтеза третиноина, отличающимися наименьшей токсич-
ностью, являются 13-цис-ретиноевая кислота (изотретиноин),
этретинат Ro 10-9359 (тигазон) и др. Они были проверены экспе-
риментально на животных, а затем внедрены в клинических усло-
виях для лечения ряда дерматозов, в том числе и псориаза. Дока-
зано, что ретиноиды снижают митотическую активность клеток
эпидермиса в псориатических бляшках, стимулируют нормальную
кератинизацию кератиноцитов и оказывают иммуностимулирую-
щее влияние. Весьма успешные результаты лечения распростра-
ненного пустулезного, артропатического псориаза и псориатиче-
ской эритродермии тигазоном наблюдали А. А. Машкиллейсон и
соавт. [1982|, И. Я. Шахтмейстер и соавт. [1982], A. A. Camensind
[1985]. Тигазон назначают перорально из расчета первоначально
1 мг в сутки на 1 кг массы тела больного, а затем через 2—4 нед
дозу уменьшают до 0,75—0,5 мг/(кг-сут). Продолжительность ле-
чения — 1—6 мес. По данным большинства авторов, клиническое
188
выздоровление наблюдается в 70—80 % случаев. Поддерживаю-
щая дозировка составляет 0,25—0,3 мг/кг массы тела в сутки.
Из побочных симптомов, наблюдаемых названными выше авто-
рами, чаще встречались такие, как сухость слизистых оболочек,
хейлиты, очаговое, а иногда и тотальное выпадение волос, паро-
нихии, петехии, рвота, гепатит. Все эти осложнения обратимы
и быстро исчезают после отмены препарата. В целях уменьшения
побочных действий ретиноидов их стали назначать в малых дозах
0,3—0,5 мг/ (кг • сут) в сочетании с ПУВА-терапией, УФО и на-
ружным применением кортикостероидных мазей [Шахтмей-
стер И. Я. и др., 19821. Оказалось, что подобные сочетания обес-
печивают такой же хороший терапевтический эффект, как и боль-
шие дозы ретиноидов. При этом значительно уменьшается вероят-
ность развития побочных явлений и осложнений.
Витамин Е (токоферола ацетат) стимулирует клеточный мета-
болизм, участвуя в биосинтезе ДНК, РНК, в тканевом дыхании
Витамин Е является природным антиоксидантом, защищает об-
менные процессы жиров, белков и стероидных гормонов от пато-
логических реакций окисления, не сопряженных с преобразова-
нием и аккумуляцией энергии. Витамин Е используют внутрь и
внутримышечно. Для приема внутрь выпускают 5, 10 и 30 % рас-
твор токоферола ацетата в масле. В 1 мл содержится соответствен-
но 50, 100 или 300 мг синтетического а-токоферола ацетата. Боль-
ным склеродермией, красной волчанкой, атрофодермией, псориа-
зом, вульгарными угрями, диффузным нейродермитом назначают
15—100 мг витамина Е в сутки в течение 20—40 дней. Поскольку
витамин Е является синергистом витамина А и потенцирует его
действие, применяют комплексный препарат аевит, содержащий
в 1 мл аксерофтола ацетата (витамин А) 35 мг (около 10 000 ME)
и а-токоферола ацетата (витамин Е) — 100 мг.
Витамин Р представляет собой группу соединений флавонои-
дов, влияющих на состояние мембран эндотелия капилляров и
венул. Совместно с аскорбиновой кислотой флавоноиды угнетают
активность гиалуронидазы, действуют как антиоксиданты, осво-
бождая мембраны капилляров и венул от образующихся метабо-
литов окислительно-восстановительных реакций. Наиболее употре-
бительными представителями флавонидов, применяющихся в тера-
пии капилляротоксикозов и других состояний, сопровождающихся
нарушением проницаемости сосудов, — аллергодерматозов и вас-
кулитов кожи являются рутин, кверцетин, венорутон. Так как
одновременно с витамином Р рекомендуется назначать аскорби-
новую кислоту, синтезирован препарат аскорутин, содержащий
дополнительно и глюкозу. Рутин и кверцетин назначаются по
0,02—0,05 г 2—3 раза в сутки, аскорутин (рутин и аскорбиновая
кислота по 0,05 г, глюкоза 0,2 г) — по 2 таблетки 3—4 раза в
день. Кверсалин, синтезированный из кверцетина и ацетилсалици-
ловой кислоты (0,02 и 0,3 г соответственно) обладает Р-витамин-
ной активностью и, кроме того, противовоспалительным действием
за счет ограничения энергетического обеспечения воспалительного
189
процесса путем торможения образования АТФ и ингибирования
простагландинсинтетазы. Применяется кверсалин по 1 таблетке до
еды 3 раза в сутки. Курс лечения, как и всех флавоноидов, 15—
20 дней.
Витамин F условно называется витамином, состоит из комп-
лекса ненасыщенных, незаменимых жирных кислот — линоленовой,
линолевой и арахидоновой. Ненасыщенные жирные кислоты ока-
зывают существенное влияние на функциональную активность ге-
патоцитов печени, участвуя в обмене липидов, углеводов, мине-
ральных солей.
Ненасыщенные жирные кислоты содержатся в линетоле —
препарате, получаемом из льняного масла. Установлено, что у
больных псориазом с гиперхолестеринемией при лечении линето-
лом снижается содержание холестерина в сыворотке крови, умень-
шается коэффициент соотношения холестерин—фосфолипиды,
уменьшается содержание липопротеидов низкой и очень низкой
плотности. Линетол — препарат из льняного масла. Содержит
смесь ненасыщенных жирных кислот. Способствует снижению
холестерина, Р-липропротеинов, Р-глобулинов и увеличению альбу-
минов сыворотки крови, снижает гиперкоагуляцию и повышает
фибринолиз.
Аналогичный препарат — арахидон.
Пармидин (продектин, ангинин) обладает более широким
спектром действия: снижает содержание холестерина в крови,
особенно в интиме артерий, агрегацию тромбоцитов и развитие
воспалительных процессов, улучшает кровообращение в органах,
оказывает антибрадикининовое действие. Препарат назначают по
0,25 г (1 таблетка) 3 раза в день. Курс лечения продолжается
2—6 мес.
В течение многих лет использование витаминов для лечения
дерматозов было необходимым, так как не имелось более дейст-
венных средств. В настоящее время многие витаминные препараты
применяют в лечебных и профилактических целях только как
фармакодинамические средства резерва.
Препараты, нормализующие желудочно-кишечные ферменты.
Различные клинические разновидности ферментопатий среди боль-
ных дерматозами регистрируются редко, так как они протекают
латентно. На них не концентрируется внимание дерматологов,
особенно на амбулаторном приеме. В качестве сопутствующих
заболеваний у больных хроническими аллергическими дермато-
зами типа экземы, диффузного невродермита выявляются функ-
циональная панкреатическая слабость, дефицит энтерокиназы, не-
достаточность амилазы, лактазы и протеиназ, обусловленные у
части больных и генетическими механизмами. Наиболее отчетливо
проявляется роль желудочно-кишечной ферментации у больных
энтеропатическим акродерматитом и герпетиформным дерматозом
Дюринга.
Вот почему в этом разделе данной главы мы перечисляем сред-
ства и препараты ферментного действия с целью расширить
190
информацию о возможной активации гастроэнтерологической сис-
темы у больных кожной патологией.
Пепсин и его аналоги ацидин-пепсин, аципепсол, бетацид
применяют при гипо- и анацидных гастритах, ахилии, диспеп-
сии. Хорошо переносится сок желудочный натуральный, пеп-
сидил (раствор в соляной кислоте продуктов ферментного гид-
ролиза слизистой оболочки желудка), назначаемые при гипо- и
анацидных гастритах, ахилии, диспепсии по 1 — 2 столовые лож-
ки 3 раза в день во время или после еды. Также хорошо перено-
сится и свободен от побочных явлений и осложнений абомин,
представляющий собой экстракт слизистой оболочки новорожден-
ных телят или ягнят. Препарат содержит комплекс активных
протеолитических ферментов. У больных с панкреатической не-
достаточностью, при хронических гастритах и дискинезиях желче-
выводящих путей назначается панкреатин, получаемый из подже-
лудочных желез крупного рогатого скота. Дозируется по 25 ЕД
в 1 г вещества. Назначается 0,5—1 г на прием 3—6 раз в сутки
перед приемом пищи в щелочных водах типа боржома или гидро-
карбоната натрия. В более тяжелых случаях хронических панкреа-
титов с пониженной липолитической активностью применяется
солизим. Он образуется из культуры Penicillium Solitum и выпус-
кается в таблетках по 20 000 ЛЕ (липолитических единиц). Пре-
парат хорошо переносится (без побочных явлений и осложнений).
Назначается по 2 таблетки 3—4 раза в день после еды в течение
3—4 нед. Многокомпонентным ферментным препаратом, содержа-
щим панкреатические экзимы, является ораза, образующаяся при
ферментации гриба Aspergillus oryzae. Для медицинского приме-
нения препарат выпускается в виде гранул, назначаемых по '/г—
1 чайной ложке 3 раза в день во время или после еды. Курс
лечения 2—4 нед. Достоинством оразы является активность энзи-
мологического действия, так как она содержит амилазу, маль-
тазу, протеазу и липазу, способствующие усвоению основных
жизненно важных ингредиентов пищи. Особенно показана ораза
у больных с анацидным и гипоацидным гастритом, хроническим
гепатохолециститом с наличием язвенной болезни желудка и две-
надцатиперстной кишки, подостром и хроническом панкреатите
С нарушенной экскреторной функцией и хроническом спастиче-
ском колите с наклонностью к запорам. В сложных, комплексных
патологических состояниях применяют такие многокомпонентные
энзимологически активные средства, как панзинорм, панкурмен,
фестал, дигестал, котазим-форте, мезим-форте, трифермент и
эссенциале-форте.
НАРУЖНАЯ ТЕРАПИЯ
В связи с наличием в коже нервно-рецепторного аппарата
наружные фармакологические средства в той или иной мере ока-
зывают и общее воздействие на организм больного.
191
Успех наружной терапии зависит от правильного учета леча-
щим врачом многих факторов: характера дерматоза (острый,
подострый, хронический), стадии процесса (прогрессирующая,
стационарная, регрессирующая), глубины и локализации заболе-
вания, фармакологических свойств назначаемого медикамента,
показаний и противопоказаний к его применению, концентрации
лекарственного средства, набора применяемых средств, лекарст-
венной формы наружного средства и других факторов. Наиболее
демонстративным примером является экзема, при которой наруж-
ная терапия проводится различно в зависимости от формы экземы,
ее стадии, локализации и других факторов. Необходимы строгая
индивидуализация наружного лечения и постоянное наблюдение за
больным, так как часто приходится заменять препараты (при их
непереносимости или привыкании к ним) или изменять назначен-
ные дозировки.
Общим правилом является положение о том, что чем острее
воспалительный процесс, тем поверхностнее должны действовать
выбираемая лекарственная форма и противовоспалительные веще-
ства, в нее входящие. Так, примочки, присыпки, взбалтываемые
смеси действуют поверхностнее, чем пасты, а последние — более
поверхностно, чем мази, компрессы и др. Имеет значение и кон-
центрация медикаментов, включенных в лекарственную форму.
Средства наружной терапии по степени действия в глубину можно
расположить следующим образом (начиная с действующих более
поверхностно): присыпки, примочки, взбалтываемые смеси, мази,
компрессы, клеи, пластыри, лаки.
В ряде случаев наружная терапия преследует. более узкую
цель, например назначение дезинфицирующих средств при по-
верхностных грибковых, бактериальных и паразитарных пораже-
ниях кожи.
Перед тем как применить то или иное наружное лекарственное
средство, следует очистить очаг поражения от гноя, корок, чешуек,
обрывков покрышек, оставшихся от пузырьков и пузырей. Однако
насильственно удалять чешуйки, корки, остатки мазей нельзя.
Такие участки обильно смачивают подсолнечным, льняным или
другим маслом, после чего через 15—20 мин повторно обрабаты-
вают очаг или оставляют масляную повязку на более длительное
время. Загрязненные эрозии и язвы обрабатывают 3 % раствором
перекиси водорода. Кожу вокруг очагов при пиодермиях или дру-
гих инфекционных дерматозах протирают камфорным или 2 %
салициловым (либо 2 % борным) спиртом.
Основные способы наружного применения лекарственных
средств в дерматологии. Для местного лечения кожных болезней
лекарственные вещества могут применяться в виде различных
лекарственных форм. Каждая из этих форм обладает свойственны-
ми только ей особенностями терапевтического воздействия. В раз-
деле лечения того или иного дерматоза будут перечислены сред-
ства общего и наружного лечения в общем комплексе. В данном
подразделе мы кратко укажем на основные моменты, которые
192
помогут в выборе формы применения какого-либо средства с уче-
том характера воспалительного процесса. Наружное или местное
действие лекарственных препаратов может быть различным, так
как оно зависит от свойств лекарств и от ответной реакции орга-
низма. Местное воздействие может быть противовоспалительным,
противозудным, раздражающим, прижигающим, охлаждающим,
вяжущим, обволакивающим и т. п. Особенно необходимо учиты-
вать резорбтивную способность, ибо при проникновении через
кожу в сосудистое русло значительного количества борной кис-
лоты, дегтярных препаратов, ртути возникают токсические явле-
ния. Также приходится учитывать раздражающее влияние лекар-
ственного препарата на рецепторы нервных окончаний в коже.
При этом по эфферентным путям подобное раздражение пере-
дается в центральную нервную систему и по закону обратной
связи оказывает соответствующее действие на состояние гомео-
стаза и периферические анализаторы всего организма в целом.
Таким образом, местное или наружное лечение четко отдиф-
ференцировать от общего воздействия не всегда удается, так как
они переходят друг в друга.
Наиболее часто в амбулаторной практике пользуются при-
сыпками. Присыпка состоит из порошкообразных веществ,
которые наносят на участок поражения ровным тонким слоем.
Присыпка высушивает и обезжиривает кожу вследствие гигроско-
пичности, а в результате усиления теплоотдачи может действовать
охлаждающе, противовоспалительно. Оказывая тактильное давле-
ние, способствует сужению поверхностных сосудов кожи. Назна-
чая присыпки при острых воспалительных дерматозах, можно
уменьшить гиперемию, отек, ощущение зуда, жара и жжения.
Однако при наличии в очагах поражения мокнутия присыпки не
применяют, так как вместе с экссудатом они образуют корки,
усиливающие воспалительный процесс и раздражающие кожу.
Присыпки находят применение часто при наличии повышенной
потливости, усиленном салоотделении. Для присыпок используют
минеральные или растительные порошкообразные вещества. Из
минеральных порошкообразных средств в состав присыпок вклю-
чают тальк (силикат магния), окись цинка (Zinci oxydi), белую
глину (Bolus albae), углекислую магнезию (Magnesium carbonicum)
и др. Из растительных препаратов наиболее часто употребляется
пшеничный крахмал (Amyli fritici), лакричный порошок (Pulv.
liquritii). Крахмал может подвергаться брожению, поэтому его не
следует применять при повышенной потливости, особенно в кож-
ных складках. Часто используются в качестве присыпок резорцин,
метилурацил, сульфаниламиды, ксероформ, дерматол, которые вво-
дят в состав лечебных форм для заживления эрозий, язв или для
ликвидации вегетирующих образований типа остроконечных кон-
дилом, контагиозного моллюска, бородавок. Примером присыпок
может быть следующий состав: Talci veneti, Zinci oxydi aa 15,0
Bismithi subnitrici 10,0. MDS. Наружное.
Примочки. Для ликвидации мокнутия при островоспали-
7—936
193
тельных дерматозах используют примочки в форме водных и
спиртовых растворов. Помимо противовоспалительного действия,
примочки оказывают вяжущее, дубящее и дезинфицирующее
влияние. Наиболее распространен такой способ применения:
охлажденными лекарственными растворами смачивают 4—6 мар-
левых салфеток или мягкую чистую ткань, отжимают и наклады-
вают на пораженный мокнущий участок. Примочки применяют
через 5—10—15 мин (по мере высыхания и согревания). Вся
процедура продолжается 1 —1,5 ч. Ее повторяют 2—3 раза в сут-
ки. Чаще всего для примочек используют 1—2 % раствор танина,
0,25—0,5 % раствор нитрата серебра (ляпис), 2—3 % раствор
буровской жидкости (Liquor Alumini acetici, Liquor Burowi),
1—2 % раствор резорцина, 2—3 % раствор борной кислоты и
0,25—0,3 % раствор амидопирина. Если в очагах островоспали-
тельного поражения имеется гнойная инфекция, то показано
применение дезинфицирующих примочек: 0,1 % раствор этакри-
дин лактата, 0,05 % раствор фурациллина или 0,05 % перман-
ганата калия.
Влажно-высыхающая повязка также использу-
ется при островоспалительных процессах с наличием отека, яркой,
сочной гиперемии и мокнутия. Такую повязку готовят по тому же
принципу, что и примочку, но употребляют большее количество
слоев марли (до 8—12) и меняют повязку значительно реже,
по мере высыхания, через 1 —1,5 ч. Сверху влажно-высыхающую
повязку покрывают тонким слоем гигроскопической ваты и при-
бинтовывают. Эти повязки способствуют стиханию проявлений
острого воспаления, так как медленно испаряющаяся жидкость
вызывает охлаждение кожи, хотя и менее активно, чем примочка.
Компрессы в дерматологии применяются реже, чем при-
мочки и влажно-высыхающие повязки, ибо их противовоспали-
тельное действие направлено на резорбцию инфильтративного
субстрата. Экссудативные компоненты воспалительной реакции при
длительном глубоком прогревании могут активизироваться. Поэто-
му компрессы назначают для рассасывания глубоких инфильтра-
тивных морфологических элементов типа узлов у больных узлова-
той эритемой, индуративной эритемой и панникулитом. Компрес-
сы обычно накладывают с борной кислотой, свинцовой водой,
водно-спиртовыми растворами.
Для лечения островоспалительных очагов поверхностно рас-
положенных без мокнутия часто используются взбалтывае-
мые взвеси. Они применяются для уменьшения воспали-
тельных явлений, охлаждения и снижения интенсивности зуда.
Взбалтываемые взвеси, их еще именуют «болтушками», бывают
водными и масляными. Фактически основным компонентом явля-
ются порошки, но взвешенные в водной фазе с добавлением гли-
церина или в масляной среде. Высыхающие взбалтываемые мик-
стуры являются удобной заменой пудр и присыпок в наружном
лечении кожных болезней, так как после испарения и высыхания
жидкой фазы порошкообразные вещества располагаются на коже
194
тонким равномерным слоем. Эта лекарственная форма очень
удобна еще и потому, что не требует повязки и порошок, удержи-
ваясь на коже длительное время, обеспечивает необходимое тера-
певтическое действие. Пропись жидких взбалтываемых взвесей
проста. В случае если требуется поверхностный противовоспали-
тельный эффект, смешиваются в разных количествах порошко-
образные субстанции и__жидкости: Zinci oxydi, Talci veneti, Gly-
cerini, Aquae destillatae aa 30,0. MDS. Наружное.
Глицерин, обладающий большой вязкостью, способствует ак-
тивному смешиванию ингредиентов, равномерному распределению
порошков и закреплению их на коже. Количественные соотноше-
ния порошков и жидкой фазы меняют в зависимости от конкрет-
ной цели. При активной резко выраженной воспалительной реак-
ции добавляют больше жидкости — свинцовой воды, 1 —2 % рас-
твора амидопирина, буровской жидкости или 2 % раствора борной
кислоты. Для ускорения высыхания добавляется спирт в соотно-
шении 10—15 %. В целях усиления антифлогистического дейст-
вия, уменьшения зуда, отечности в жидкие взбалтываемые мик-
стуры с водной фазой добавляют ихтиол, нафталановую нефть,
резорцин, ментол, серу. Взбалтываемые взвеси готовят и на масля-
ной основе. Применяют масляную «болтушку» также при остром
воспалении, но у больных с сухой кожей. Масляные взвеси смяг-
чают кожу, уменьшают чувство напряжения, стягивания. Под
ними быстрее совершается противовоспалительный эффект с от-
торжением чешуи и корок. Готовят масляные «болтушки» из
порошкообразных веществ на жидкой жировой основе из подсол-
нечного, оливкового, кукурузного или персикового масла. Очень
часто пользуются масляной взвесью, называемой «цинковое мас-
ло», которая содержит 30 % окиси цинка и 70 % растительного
масла. Действие масляных «болтушек» можно значительно уси-
лить, добавляя различные активные лекарственные средства типа
салициловой кислоты, серы, дегтя, бисмута. Перед употреблением
водные и масляные взвеси взбалтывают и наносят на очаги воспа-
ления. Не рекомендуется назначать взбалтываемые взвеси при
обильном мокнутии, на участках с волосяным покровом.
Смесь равных частей густого жира и порошкообразных веществ
называют пастой. Имея консистенцию теста, паста вполне
оправдывает свое наименование, так как в переводе с латинского
Pasta означает тесто. Вследствие содержания порошкообразных
веществ пасты отличаются от мазей более плотной консистенцией
и поверхностным менее активным действием. От присыпок и
взбалтываемых смесей они отличаются более выраженным проти-
вовоспалительным эффектом. Наличие жира в пасте способствует
размягчению чешуек, корок, питанию кожи, а содержащиеся по-
рошки типа окиси цинка, талька, крахмала обеспечивают гидро-
тропное действие, перспирацию и дыхание кожи. Всасывая экссу-
дат и испаряя его, пасты анемизируют, охлаждают кожу и вос-
станавливают микроциркуляцию с отчетливым противовоспали-
тельным, эпителизирующим влиянием. Меняя соотношение жира и
7*
195
порошкообразных веществ, можно получать различные варианты
их лекарственного действия. Увеличивая количество жира, можно
готовить мягкие пасты, больше похожие на мази и не высуши-
вающие кожу. Тестовая консистенция паст позволяет наклады-
вать их без повязки 2—3 раза в день. Противовоспалительное и
резорбционное действие паст усиливают, включая дополнительно
серу, деготь, ихтиол, нафталанскую нефть, кортикостероидные
гормоны, настойку валерианы, календулы или боярышника.
Мазь содержит одно или несколько лекарственных веществ,
равномерно смешанных с жировой мазевой основой (вазелин,
ланолин, нафталан, свиное сало, воск, спермацет, масло какао
и др.). При этом лекарственного вещества в мази содержится в
меньшем количестве (до 10 %). Применяют мази в тех случаях,
когда необходимо достигнуть более глубокого и длительного воз-
действия лекарственного вещества на пораженный участок кожи.
Жировые вещества издавна применяют для питания и смягчения
кожи, так как проникая непосредственно в эпидермис, они при-
дают роговому слою эластичность и мягкость. Нанесение жира на
кожу вследствие герметизации прекращает процесс перспирации
дыхания, вызывает застойную гиперемию и вследствие этого ин-
тенсифицируется резорбция инфильтративных скоплений, восста-
навливается тургор и эластичность. Под мазью скапливаются
неиспаряющиеся экскреты сальных и потовых желез, мацерирую-
щие и разрыхляющие поверхность рогового слоя и способствую-
щие проникновению в толщу кожи лекарственных веществ, вхо-
дящих в состав мазей. Мазевая основа в виде животного жира
или растительного масла должна быть химически нейтральной,
чтобы не вызывать раздражение кожи, обладать мягкой, эластич-
ной консистенцией, не изменяющейся под влиянием температуры
тела. Все большее применение находят мазевые основы из синте-
тических веществ: полимеры этиленоксидов, производные целлю-
лозы, эстеры сорбитана, высших жирных кислот и др. Мази с
синтетической основой лучше проникают в кожу, не окисляются,
не разлагаются. Мази оказывают глубокое действие и поэтому их
назначают при хронических и подострых заболеваниях, сопровож-
дающихся инфильтративными морфологическими эффлоресцен-
циями.
В настоящее время существуют многочисленные вариации
мазей, характеризующихся направленностью действия лекарствен-
ного вещества. Достаточно сильным противовоспалительным дей-
ствием обладают мази, содержащие кортикостероидные гормоны.
Наличие их в арсенале дерматолога коренным образом изменило
возможность наружной терапии дерматозов. М. А. Розентул,
А. А. Студницин (1961) с успехом лечили 1—2,5 % гидрокорти-
зоновыми мазями детей, страдающих экземой и нейродермитом.
П. Е. Маслов, П. Д. Затуренская (1962) отмечали высокую эффек-
тивность от 1—2,5 % гидрокортизоновых мазей в лечении боль-
ных, страдающих экссудативными и артропатическими формами
псориаза и псориатической эритродермией: быстро уменьшались
196
воспалительные явления, зуд и чувство боли. Помимо 0,5, 1, 2,5 %
мази гидрокортизона, 0,5 % преднизолоновой мази, широко
используется мазь «фторокорт», содержащая 0,1 % триамцино-
лона ацетонида. Аналогичные мази производства других стран
носят названия «Кеналог», «Кенакорт-А», «Синалар», «Синалар-
Гель», «Синалар-форте», содержащие разное количество одного и
того же гормона — ацетонида флюоцинолона. Мазь, содержащая
0,025 % этого же гормона под названием «Флюцинар» производит-
ся фирмой «Polfa», отечественная аналогичная мазь — «Синафлан»,
хорошо зарекомендовала себя при различных заболеваниях кожи
мазь «Локакортен», содержащая 0,025 % флюметазона пивалата.
Так, Н. С. Смелов (1968) отмечал значительное улучшение про-
цессов с эритемой, мокнутием, отеком, лихенизацией и сильным
зудом под влиянием мази «Локакортен». Эффекта от применения
Локакортена не отмечено у больных вульгарными угрями, псо-
риазом, красным плоским лишаем [Рахманов В. А. и др., 1968].
Дериват преднизолона — деперзолон (хлористоводородный 21-де-
зокси-21-метил пиперазинил — преднизолон), применяемый в
мази (0,25 % — мазь деперзолона), по данным Р. С. Бабаянца
и соавт. (1976), оказался весьма эффективным в лечении псориаза,
красной волчанки и диффузного нейродермита. Преимуществом
деперзолона является плохая всасываемость и поэтому он даже
при длительном применении не оказывает депрессивного влияния
на кору надпочечниковых желез. При микробной экземе и импе-
тигинизированных дерматитах мазь «Деперзолон» не оказывает
заметного улучшения, в таких случаях ее необходимо комбиниро-
вать с антибиотиками. Хорошее противовоспалительное, анти-
аллергическое и противозудное действие мази «Деперзолон» при
аллергических дерматитах, нейродермитах, экземе, псориазе и
круговидной плешивости отмечали Ю. К. Скрипкин и соавт.
(1972). В 1979 г. Ю. К. Скрипкин и соавт. в лечении больных
хроническими рецидивирующими дерматозами применили мазь
«Ультралан» и получили выраженный терапевтический эффект у
93 из 107 больных. Подобные результаты лечебного действия
мази «Ультралан» отмечали Б. А. Сомов и соавт. (1979).
Длительное наружное применение кортикостероидных мазей
опасно вследствие возникновения вторичных бактериальных и
грибковых инфекций. Поэтому промышленностью разных стран
стали выпускаться мази, содержащие кортикостероиды с антибак-
териальными средствами, и антибиотиками типа «Локакортен-
виоформ», «Лоринден С», «Дипрогент», «Геокортон», «Оксикорт».
У нас в последние годы создана мазь «Оксизон», содержащая
гидрокортизон и основу окситетрациклина, и мазь «Гиоксизон»,
в составе которой гидрокортизон сочетается с хлористоводород-
ной солью окситетрациклина. Комбинацией деперзолона с мико-
назолом была создана мазь «Микозолон», обладающая антимико-
тической и антибактериальной активностью. Помимо кортикосте-
роидных гормонов, в мазевой форме используются эстрогенные
и андрогенные гормоны, применяемые наиболее часто при жирной
197
и сухой себорее, угревой сыпи, себорейной экземе, псориазе, роза-
цеа, гнездной плешивости и других дерматозах. Как установлено
работами ряда авторов [Винокуров И. И. и соавт., 1966; Пяти-
коп А. И. и соавт., 1979; Скрипкин Ю. К. и соавт., 1979, и др.],
эстрогенные и андрогенные гормоны регулируют соотношение
свободных жирных кислот, свободного холестерина, парафина,
восковых эфиров, сквалена, липидов эпидермального происхож-
дения, а поэтому осуществляют противовоспалительное, противо-
зудное и регенеративное действие. Широкое применение находят
мази с антибиотиками типа эритромициновой 0,5, 1 и 2 %, тетра-
циклиновой 1 и 2 % и др. При длительно незаживающих трофи-
ческих язвах с целью усиления процессов регенерации тканей и
эпителизации используют 5 % мазь с ацемином (натриевая соль
е, а-ацетиламинокапроновой кислоты), ируксол (содержащая пеп-
син и хлорамфеникол), способствующая энзиматическому очище-
нию ран, мазь Микулича, солкосерил, пропоцеум, гепариновую
мазь (гепароид). Недостатком мазей является необходимость на-
ложения повязок, а также вызываемое ими неприятное ощущение
жирности. Мазевые основы могут прогоркать, избыточно ожирять
кожу и вызывать раздражение. Менее раздражающим действием,
поддерживающим перспирацию, дыхание кожи, микроциркуляцию,
обладает крем. В состав крема наряду с высококачественным пита-
тельным животным жиром и растительным маслом включается
водная фаза и, таким образом, крем как бы представляет собой
эмульсию, в которой в эмульгированном состоянии частицы воды
находятся в масле и, наоборот, частицы масла содержатся в вод-
ной среде.
Действие крема на кожу зависит от сочетания эмульсионных
компонентов. Эмульгированная смесь типа «масло в воде» погло-
щает и испаряет воду и поэтому действует охлаждающе, противо-
воспалительно. В этом случае крем не нарушает перспирации
кожи, но его рассасывающее действие поверхностное и, несмотря
на хорошую переносимость и возможность смягчения и питания
кожи, при глубоких инфильтративных процессах крем не заменит
мазь. Классическим примером эмульсионного крема типа «масло
в воде» является ланолиновый крем, приготовляемый по следую-
щей прописи: Lanolini, vaselini, Aq. Calcis aa. Кремы типа «вода
в масле» меньше охлаждают, не обладают подсушивающим, ре-
зорбционным действием, но хорошо питают кожный покров, вос-
станавливая его трофические свойства. Поэтому такие кремы
назначаются при поверхностных воспалительных дерматозах с вы-
раженной сухостью, изменением процесса кератинизации, как, на-
пример, у больных всеми клиническими разновидностями ихтиоза.
Особенно улучшаются кератопластические свойства крема при
включении лекарственных веществ, таких как салициловая кисло-
та, сера, метилурацил, витамин А, Е в концентрации не более
2—3 % для серы и салициловой кислоты и 5—10 % для метил-
урацила и витаминов А, Е. Из арсенала лекарственных кремов
наиболее часто применяется в клинической практике «клотрима-
198
зол», содержащий 1 % раствор канестена и эффективный против
дерматофитов, дрожжевых грибов, оказывающий одновременно
антибактериальное действие на стафилококки и стрептококки.
Удобны и достаточно эффективны официнальные антисептические
крем «Dermazin», содержащий сульфадимезин, и крем «Hibitanae»,
имеющий в своем составе 1 % раствор Klorheksidin gluconat, крем
«Особый» с наличием мелкодисперсной серы, витамина F и др.
Помимо мазей и кремов, для наружной терапии используют
пластыри, лаки и дезинфицирующие смазывания.
Пластырь — в его основу (Emplastrum), кроме жира, вхо-
дят воск или канифоль, нередко смолы, каучук и другие вещества.
Механизм действия пластыря отличается более глубоким проник-
новением и пролонгированным влиянием антифлогистических рас-
сасывающих ингредиентов. С этой целью в пластырную основу
включают такие препараты, как кортикостероидные гормоны, мо-
чевину, ихтиол, фенол, салициловую кислоту, нафталанскую
нефть. Пластырь по сравнению с мазью имеет более густую и
липкую консистенцию. Перед употреблением его нагревают, он
плотно прикрепляется к коже и прочно удерживается.
Лак — жидкость, которая, быстро высыхая на поверхности
кожи, образует тонкую пленку. Используется в целях глубокого и
ограниченного воздействия на ткани при болезнях ногтей, омозо-
лелостях, вульгарных и подошвенных бородавках. В состав лака
входят коллодий и различные лекарственные вещества, чаще де-
зинфицирующего действия (салициловая, молочная, борная, бен-
зойная кислоты, резорцин, деготь, гризеофульвин, этакридина лак-
тат, фурацилин и др.). Так, для лечения сквамозно-гиперкерато-
тической эпидермофитии и руброфитии стоп используют лак сле-
дующей прописи:
Jodi puri 2,0
Ac. carbolici
Spir. aethylici aa 5,0
Ac. Salicylici 12,0
Ac. lactici
Resorcini aa 6,0
Ac. acetici conc.
01. Rusci aa 10,0
Collodii elastici ad 100,0
MDS. Наружное. Применяют ежедневно в течение 3—4 дней,
затем назначают горячие ванночки с питьевой содой или марган-
цовокислым калием.
Смазывание производят водными или спиртовыми
растворами анилиновых красителей (например,
бриллиантового зеленого), водно-спиртовыми растворами ментола
(1—2 %), карболовой кислоты (1 —1,5 %), водными растворами
нитрата серебра (2—10 %). При пиодермии, экземе и диффузном
нейродермите, осложненных кандидозом, очаги поражения смазы-
вают 1 % линиментом сангвиритрина или его же 0,2 % водно-
спиртовым раствором.
199
В дерматологии в последние годы с успехом используется
сравнительно новая лекарственная форма — аэрозоли. Аэро-
золи представляют собой дисперсные системы с газообразной
дисперсной средой (фреоны, смесь газов, азот). В зависимости от
размера частиц дисперсной фазы аэрозоли делятся на высоко-
(размер частиц 0,5—5 мкм), средне- (размер частиц 5—20 мкм) и
низкодисперсные (размер частиц 20—100 мкм). Аэрозоли позво-
ляют равномерно распределить лекарственное вещество, пре-
дупреждают его кристаллизацию и более устойчивы, чем другие
формы. По сравнению с кремами и мазями они меньше абсорби-
руются через кожу и оказывают более поверхностное действие.
По этим соображениям они в меньшей степени показаны для
лечения псориаза и других инфильтративных процессов. Но зато
им свойственно интенсивное противовоспалительное и противо-
аллергическое действие, особенно при наличии в их составе корти-
костероидных гормонов. Поверхностное действие аэрозолей лишь
в минимальной степени влияет на соединительную ткань, что
позволяет избегать возникновения атрофии. Аэрозоли удобны как
форма применения препаратов в труднодоступных местах. И нако-
нец, основа аэрозолей является нежирной средой и поэтому они
могут применяться у лиц с непереносимостью жировых компонен-
тов мазей и кремов. Из аэрозолей, наиболее широко используемых
в дерматологии, следует назвать «Полизоль», активными вещества-
ми которого являются неомицин-сульфат и полимиксин, «Ола-
золь», в состав которого входят облепиховое масло, анестезин,
левомицетин, борная кислота, «Ливиан», содержащий рыбий жир,
витамин Е (а-токоферола ацетат), анестезин, циминаль, масло
лаванды, линетол, «Винизоль» с цитралем, винилином, линетолом
и пропеллентом и др.
Применение разнообразных лекарственных форм с учетом
характера патологического процесса расширяет арсенал терапевти-
ческих средств и предоставляет возможность своевременно менять
препараты, выбирая формы, наиболее подходящие для каждого
конкретного дерматоза и для соответствующего этапа его течения.
С целью рационального воздействия на патологический про-
цесс в коже необходимо, кроме правильно выбранной лекарст-
венной формы, учитывать характер действия включаемых дейст-
вующих средств, которые условно делятся на несколько групп:
противовоспалительные, гипосенсибилизирующие, дезинфицирую
щие, противозудные, фунгицидные, кератолитические, кератоплас-
тические, прижигающие и др. Такое деление наружных средств
по характеру их действия удобно в дидактических целях, хотя
и является условным, так как одно и то же вещество в зависимо-
сти от формы его применения и концентрации может оказывать
различное действие. Наиболее показательны в этом отношении
салициловая кислота, резорцин, деготь. Так, салициловая кислота
и резорцин в концентрации до 3 % действуют как кератопласти-
ческие препараты, а более 3 % — как кератолитические препара-
ты. К кератолитическим средствам относятся преимущественно
200
различные кислоты — молочная, бензойная, соляная, азотная, но
особенно широко используют салициловую, так как она одновре-
менно является и противовоспалительным веществом.
Группа противовоспалительных препаратов
очень обширна: антибиотики, сульфаниламидные препараты, кор-
тикостероидные гормоны в различных лекарственных формах
весьма эффективны и назначаются больным многими хрониче-
скими рецидивирующими дерматозами как наиболее действенные
средства. В последние годы арсенал противовоспалительных
средств пополнился веществами нестероидной природы, обладаю-
щих антифлогистической активностью. Это — бутадион, анальгин,
напроксен, метилсалицилат, флуфенамовая и мефенамовая кисло-
ты, индометацин и др. Они применяются для общей терапии и
наружно в мазях, кремах, линиментах, как, например, мазь «Бута-
диеновая», мазь «Индометациновая», мазь «Ренерволь», линимент
(бальзам), «Санитас» и др. Противозудные вещества подразделя-
ются на 3 группы. Первую составляют такие средства, которые
(в растворе, мази, креме) проявляют только протцвозудное дейст-
вие — это ментол, анестезин, хлорэтан, тимол, растворы карболо-
вой кислоты и уксуса. Во 2-ю группу входят средства, проявляю-
щие сложное действие. Это — вещества в основном противовос-
палительные, которые, действуя кератопластически и антифло-
гистически, одновременно уменьшают чувство зуда. К ним отно-
сятся деготь, сера, нафталанская нефть, салициловая кислота,
кортикостероидные гормоны в мазях, кремах или аэрозолях.
В 3-ю группу включаются препараты антигистаминного, серотони-
нового, брадикининового действия, влияющие на течение реакции
антиген—антитело как в реакциях немедленного, так и немедлен-
но-замедленного действия. Морфологические проявления реакций
гиперчувствительности в процессе сенсибилизации зависят от осо-
бенностей иммунопатологического механизма и сопряжены с осво-
бождением биологически активных веществ. Наиболее высокий
уровень гистамина и других биогенных аминов констатирован
у больных с преобладанием аллергических реакций немедленно-
замедленного типа на ранних стадиях воспаления, при прогресси-
ровании процесса [Борисенко К. К. и соавт., 1977]. Поэтому,
помимо общего лечения гипосенсибилизирующими средствами и
наружно, используются мази и кремы с димедролом (2—5 %),
кортикостероидными гормонами, с инталом (2—5—10 %), индо-
метацином (0,5—1%), продектином (2—5—10%), гепарином
(2—5 %) и др. С особой осторожностью следует назначать анес-
тезин, наружные лекарственные формы с антибиотиками, анти-
гистаминными препаратами, так как они могут вызвать контакт-
ный аллергический дерматит.
К дезинфицирующим (антисептическим) и
антипаразитарным веществам относится большая
группа средств, оказывающих только дезинфицирующее или де-
зинфицирующее и антипаразитарное действие. В эти группы вклю-
чают йод, спирт, анилиновые красители, перекись водорода, сали-
201
циловую и борную кислоты, резорцин, тимол, препараты серы,
дегтя, антибиотики, сульфаниламиды, дерматол, ксероформ, бен-
зиловый эфир бензойной кислоты (бензил-бензоат).
Прижигающие и разрушающие (некробио-
тические) средства включают подофиллин, пирогаллол,
нитрат серебра, мышьяк, уксусную и трихлоруксусную кислоты,
ферезол, пергидроль, концентрированные растворы салициловой
кислоты, резорцина.
Завершая перечень различных лекарственных форм и препара-
тов, применяемых для наружного лечения дерматозов, следует
выделить особенности клинического применения диметилсульф-
оксида (димексида, или ДМСО). Клиническое изучение димексида
в хирургической, гинекологической практике установило его не
только бактерицидные и бактериостатические свойства, но и спо-
собность восстановления активности антибиотиков по отношению
к резистентным микроорганизмам, усиление действия ряда лекар-
ственных веществ за счет повышения проницаемости через кле-
точные мембраны. Кроме того, димексид обладает противовоспа-
лительным и обезболивающим действием [Даниленко М. В. и
соавт., 1982]. Впервые выраженный терапевтический эффект у
больных различными формами пиодермии констатировали В. А. Рах-
манов и соавт. в 1967 г., применяя димексид с антибиотиками
наружно. Исключительно благоприятные результаты отмечались
от применения мази, содержащей 0,1 % концентрацию дезокси-
рибонуклеазы в димексиде, у больных опоясывающим лишаем,
с синдромом Стивенса—Джонсона, при рецидивирующем простом
герпесе [Лесников Е. П. и соавт., 1971]. Г. Г. Кондратьев, В. П. Сер-
геев (1971) констатировали излечение 36 из 38 больных склеро-
дермией, леченных 40—70 % раствором димексида в виде еже-
дневных смазываний пораженных участков кожи. Продолжитель-
ность лечения 1—3 мес. Срок ремиссии продолжался более 3 лет.
Для лечения рожистого воспаления и трофических язв димексид
используется в 30—50 % водном растворе 2—3 раза в сутки мест-
но, в течение 7—10 дней. При экземе, диффузном нейродермите,
распространенных стрепто-стафилодермиях рекомендуются ком-
прессы с 40—70 % раствором димексида циклами по 3—4 дня.
Противопоказаниями для применения димексида являются бере-
менность, стенокардия, инфаркт миокарда, различные формы
инсульта, тяжелые поражения паренхиматозных органов. Наибо-
лее частым побочным действием димексида является местная
реакция в виде легкого жжения, кратковременной эритемы или
зуда кожи.
ПРИМЕНЕНИЕ НЕКОТОРЫХ ЛЕКАРСТВЕННЫХ ТРАВ
В комплексное лечение больных аллергодерматозами вклю-
чают жидкий экстракт элеутерококка колючего или настойку
женьшеня, заманихи. Кроме того, элеутерококк колючий норма-
202
лизует нарушение углеводного, белкового и липидного обмена,
снижает токсичность ряда медикаментозных препаратов.
При отеках и для ликвидации мокнутия рекомендуются моче-
гонные растительные препараты: настой плодов можжевельника,
петрушки, травы спорыша, хвоща полевого, листьев почечного
чая, цветков василька синего или мочегонный сбор, в состав кото-
рого входят: листья толокнянки — 3 части, цветки василька —
1 часть, корень солодки — 1 часть.
В качестве седативных растительных средств назначаются
препараты корневища с корнями валерианы, травы пустырника,
душицы обыкновенной, тысячелистника, лагохилуса, листья мяты
перечной, настойка пиона или настой успокоительного сбора, в
состав которого входят: листья мяты перечной — 2 части, листья
трилистника водяного — 2 части, корневища с корнями вале-
рианы — 1 часть, соплодий хмеля — 1 часть.
Из растительных лекарственных препаратов с витаминными
свойствами применяют плоды шиповника (содержат до 6 % аскор-
биновой кислоты, витамины Вг, Е, К, каротиноиды, рутин и др.),
листья крапивы, березы. Плоды шиповника обладают также жел-
чегонным, противовоспалительным, мочегонным действием, умень-
шают проницаемость сосудистой стенки, что очень важно при
лечении аллергических васкулитов, экземы, нейродермита и др.
Больным экземой и нейродермитом назначать сироп шипов-
ника не следует, так как последний содержит легковсасываемые
углеводы и может способствовать обострению аллергического
кожного процесса.
При наличии у больных дерматозами очагов хронической
инфекции или когда кожный процесс осложняется пиодермитами,
в комплексное патогенетическое лечение подключаются раститель-
ные препараты, обладающие антисептическим и противовоспали-
тельным действием: отвар травы зверобоя, корневища с корнями
девясила высокого, аира, настой цветов календулы, ромашки,
листьев шалфея, эвкалипта, мяты перечной, крапивы.
Когда тот или иной дерматоз протекает на фоне заболеваний
желудочно-кишечного тракта, печени, в качестве желчегонных
препаратов используются растительные лекарственные вещества.
Из них по показаниям назначаются отвар цветков бессмертника
песчаного, кукурузных рылец или настой желчегонного сбора, в
состав которого входят: цветки бессмертника — 4 части, листья
трилистника водяного — 3 части, листья мяты перечной — 2 части.
Желчегонным эффектом обладают также листья мяты переч-
ной, трава череды, чистотела, спорыша, цветки ромашки, плоды
шиповника и др.
При наличии у больных хронического запора, спастического
колита, метеоризма в комплексное лечение включают слабительный
сбор № 1 или № 2, настой плодов аниса, фенхеля обыкновенного.
В случаях хронического гипацидного гастрита, язвенной бо-
лезни желудка с пониженной секрецией, двенадцатиперстной
кишки с нормальной и пониженной кислотностью, хронического
203
колита в комплексное лечение целесообразно включать настой
листьев подорожника.
В целях регуляции липидного обмена, кроме полиненасыщен-
ных жирных кислот и витамина Е, в комплексное лечение реко-
мендуется включать настой корня одуванчика.
Для нормализации выявленных нарушений углеводного обмена
назначаются препараты листьев крапивы, черники, корня одуван-
чика, лопуха, стручки фасоли.
При тяжелом упорном течении хронических аллергодермато-
зов, протекающих с сильным зудом, когда применение вышеука-
занной терапии не давало должного эффекта, в комплексное
лечение рационально подключить растительные препараты с дезок-
сикортикостероноподобным действием — в виде настоя корня
солодки.
Хорошо себя зарекомендовал при лечении экземы, нейродер-
мита следующий сбор лекарственных растений.
Трава фиалки трехцветной, цветки ромашки, трава череды —
берутся по 10 г, настаиваются. Принимают по 25 мл настоя 3 раза
в день.
Для профилактики старческих изменений кожи целесообразно
использовать настойку элеутерококка, который нормализует рабо-
ту желез внутренней секреции, обмен веществ, уменьшает выра-
ботку адреналина, стимулирует деятельность половых желез,
«обновляет, омолаживает организм».
Для женщин с преждевременным увяданием кожи можно
назначать: настой шишек хмеля — по 40 капель 3 раза в день,
настой шалфея, крапивы двудомной в сочетании с настоем шипов-
ника и липотропными препаратами. В этих случаях применяют
также горячие компрессы с настоем трав (шишки хмеля, листья
шалфея, цветки липы, ромашки в равных количествах) в течение
2—3 мин, затем на 1—2 сек наносят холодный компресс с выше-
приведенными настоями трав. Далее кожу смазывают питательным
кремом, остатки которого через двадцать минут убирают с кожи
бумажной салфеткой. После компрессов кожные покровы выгля-
дят свежими, розовыми, бархатистыми.
Вместо компрессов можно использовать паровые процедуры
(лицо держится над паром кипящей воды) с отварами трав: шиш-
ки хмеля, листья шалфея, цветки липы, ромашки, листья обле-
пихи (в равных количествах).
Если лицо умывать отваром травы тысячелистника, коры кру-
шины или листьев подорожника, то кожа становится матовой,
бархатистой.
При «мешках» под глазами попеременно назначают горячие и
холодные компрессы на ночь перед сном с отваром листьев шал-
фея (1 чайная ложка растения на 0,5 стакана кипятка), затем
питательный крем. Протирания кожи лица, шеи, тыла кистей
кусочками льда или замороженными соками земляники, клубники,
арбуза, огурца, петрушки, настоями трав не только тонизируют,
но и временно отбеливают (сок петрушки и огурца) кожу. Перед
204
протиранием кожу смазывают питательным кремом. Сок или отва-
ры трав оставляют на 15—20 мин, затем смывают холодной водой
и накладывают питательный крем на 20 мин, остатки которого
снимают бумажной салфеткой.
Для наружного лечения мокнутия используют охлаждающие
примочки с отваром корневища лапчатки прямостоячей, коры
дуба, травы хвоща полевого, череды, шалфея, тысячелистника,
зверобоя.
Противозудным, противовоспалительным эффектом обладают
ванны с отваром хвоща полевого, череды, корней лопуха, коры
дуба, настоем травы спорыша, цветков ромашки аптечной, листьев
подорожника большого.
Бактерицидное, противовоспалительное, вяжущее действие ока-
зывают ванны с отваром травы зверобоя, чистотела большого,
цветков календулы, листьев шалфея, березы белой.
Седативным, противозудным свойством обладают ванны с
настоем травы душицы, листьев мяты перечной, настоем или
настойкой корневищ валерианы, отваром травы тимьяна ползу-
чего.
При наружном лечении зудящих дерматозов целесообразны
мази с корнем солодки или лопуха, одуванчика лекарственного,
травой череды трехраздельной, листьями подорожника большого
на свином жире (1:4) под повязку на очаги поражения.
Хороший противозудный, противовоспалительный эффект при
неострой стадии хронических аллергодерматозов оказывает паста
с включением настоек календулы, валерианы, ландыша и соком
подорожника:
01. Helianthi
Ol. Ricini аа 10,0
Picis Liquidae 2,0 *
Sol. Dimexidi 100 % 1,0
Succus Plantaginis 4,0
T-rae Valerianae
T-rae Calendulae __
T-rae Convallarinae majalis aa 2,0
Pasthae Zinci 67,0
MDS. Наружное
Наружно под повязку на очаги поражения.
Применение такой пасты наружно в комплексном лечении
нейродермита способствует более быстрому регрессу патологиче-
ского кожного процесса.
Маски. Применяются с целью предупреждения морщин и
лечения стареющей кожи. Перед маской сухие или нормальные
кожные покровы смазываются питательным кремом (при жирной
коже — не следует). Вещество для маски готовят непосредственно
перед употреблением.
После маски лицо ополаскивают холодной водой, затем на-
кладывают питательный крем.
205
Горчичная маска. В основном ее накладывают на наиболее
увядающие участки кожного покрова. Перед маской кожу обяза-
тельно смазывают питательным кремом. Сухую горчицу разводят
теплой водой и наносят на хлопчатобумажную ткань, а затем на
лицо. Сверху лицо укрывают махровым полотенцем. Вместо сухой
горчицы можно использовать горчичник. Горчичная маска нахо-
дится на лице не больше 4—6 мин. Снимают ее растительным
маслом по кожным линиям, не сдвигая кожу. Применяется гор-
чичная маска не чаще 1 раза в 7—10 дней. При наличии на коже
телеангиэктазий, розацеа, гипертрихоза горчичную маску не при-
меняют.
Широко используют в практике фруктово-ягодные, овощные
маски. Их можно применять ежедневно или через день.
Наиболее популярными являются маски со свежим землянич-
ным или клубничным соком. На чистую кожу наносят питатель-
ный крем, а сверху сок земляники или клубники на 15—20 мин.
После процедуры лицо ополаскивают холодной водой и снова на-
носят питательный крем, эта маска хорошо витаминизирует кожу,
тонизирует, придает ей свежесть, бархатистость.
Маска с соком петрушки. Для этой маски сок петрушки сме-
шивают с молоком для жирной кожи и со сметаной — для сухой,
нормальной кожи в соотношении 1:1 и накладывают на кожу.
Смывают холодной водой. Особенно показана эта маска пациен-
там с морщинистой, вялой кожей и явлениями пигментации.
Маска с соком петрушки хорошо отбеливает, придает коже барха-
тистость, свежесть, молодость.
Хорошо себя зарекомендовала следующая маска: яблоко отва-
ривают в молоке и кашицу накладывают на чистую, смазанную
питательным кремом кожу на 15—20 мин.
Лучше при проведении масок лицо смазывать вместо пита-
тельного крема костным жиром, перетопленным на водяной бане.
Костный жир содержит большое количество биостимулирующих
веществ, хорошо питает, тонизирует, омолаживает кожу. Перед
нанесением на кожу костный жир можно подогреть.
Желтково-медово-масляная маска с соком алоэ. Одну столо-
вую ложку жидкого топленого липового меда растирают с одним
свежим желтком, смешивают с 1 чайной ложкой теплого расти-
тельного масла (лучше кукурузного) и чайной ложкой сока алоэ.
Накладывают полученную массу на кожу и выдерживают 10—
15 мин. Снимают маску теплым растительным маслом, затем
кожу ополаскивают холодной водой. Маска хорошо питает лицо,
тонизирует, уменьшает количество морщин, обладает омолажи-
вающим действием.
Медовая маска с соком алоэ. Одну столовую ложку теплого
жидкого меда (лучше липового) смешивают с 1 столовой ложкой
молока и 0,5 чайной ложки сока алоэ. Накладывают на кожу,
смазанную предварительно питательным кремом, на 10 мин. Сни-
мают маску холодной водой.
Желтково-медово-масляная маска с отваром ромашки. Одну
206
столовую ложку жидкого меда (растопленного) растереть с одним
свежим желтком, смешать с 1 чайной ложкой теплого раститель-
ного масла (лучше кукурузного, персикового) и чайной ложкой
отвара ромашки. Приготовленную массу накладывают на лицо
и выдерживают в течение 20 мин. Смывают маску холодной
водой. Такая маска хорошо тонизирует кожу лица, шеи, делает
ее упругой, разглаживает морщины.
Белково-лимонная маска. Применяется в косметологии очень
давно. Для этого один яичный белок взбивают до пены и посте-
пенно во время взбивания по каплям прибавляют одну чайную
ложку лимонного сока. Выдерживают на коже в течение 10 мин.
Кожу перед нанесением маски смазывают питательным кремом
или растительным маслом.
Белково-лимонная маска хорошо тонизирует, отбеливает, очи-
щает, освежает кожу, обесцвечивает комедоны. Используется
при жирной и морщинистой коже.
Вместо лимонного сока можно использовать для маски 1 чай-
ную ложку сока земляники, клубники или других ягод, овощей,
фруктов.
Дрожжевая маска. Весьма популярна в косметике. 10—15 г
свежих дрожжей растирают с молоком при нормальной коже,
с растительным маслом — при сухой коже или с 3 % раствором
перекиси водорода — при жирной. Приготовленную массу на-
кладывают на кожу на 10 мин. Маска витаминизирует кожу (со-
держит витамины группы В), делает ее более упругой, тонизи-
рует.
Для увядающей, стареющей кожи рекомендуются маски с
айвой, хурмой, редькой, хреном, рябиной. Маски с хреном, редькой
необходимо наносить в смеси со сметаной.
Широко применяются лекарственные растительные препараты
в косметике для отбеливания лица, обесцвечивания веснушек,
осветления пигментных пятен. В частности, соком одуванчика
хорошо выводить веснушки, осветлять пигментные пятна.
С успехом применяется для осветления пигментных пятен
отвар березовых листьев или почек, сок свежего огурца, сок пет-
рушки. Водный настой корней хрена, примочки с настоем корня
любыстка лекарственного также выводят веснушки, пигментные
пятна, осветляют загоревшее лицо.
При жирной коже хорошо протирать лицо отваром хвоща
полевого, коры крушины, настойкой календулы, зверобоя, настоем
цветков василька синего (1 чайная ложка цветков на 1 стакан
кипятка), настоем листьев подорожника (1 чайная ложка листьев
на 1 стакан кипятка).
Подытоживая сведения о принципах общего и наружного ле-
чения дерматозов, следует подчеркнуть необходимость назначения
индивидуализированной терапии с применением подходящих пре-
паратов и приемлемой формы для каждого конкретного больного
с учетом стадии течения, показаний и противопоказаний, воз-
можных осложнений и индивидуальной чувствительности.
207
ЛЕЧЕНИЕ ДЕРМАТОЗОВ ФИЗИЧЕСКИМИ МЕТОДАМИ
Использование физических воздействий как естественных, так
и искусственно получаемых издавно признано необходимым ком-
понентом комплекса лечебных мероприятий у больных хрониче-
скими рецидивирующими дерматозами. Целебное влияние физио-
терапии характеризуется физиологической регуляцией саногенеза
и потому благоприятно как дополнение к средствам общей тера-
пии, а в некоторых случаях и как основной фактор лечения. Физио-
терапия (от греческих слов «физас» — природа и «терапия» —
лечение) — комплекс физических факторов внешней среды в их
естественном и преобразованном виде, широко применяется не
только для лечения, но и для профилактики, и для реабилитации
больных хроническими рецидивирующими дерматозами.
В комплексном применении у больных с заболеваниями кожи
используются многочисленные средства и методы физиотерапев-
тического воздействия. Основные разделы, которые в свою очередь
включают ряд подразделов, составляют 13 разновидностей физи-
ческих факторов. I — электротерапия, II — магнитотерапия, III —
аэроионотерапия, IV — аэрозоль и электроаэрозольтерапия, V —
оксигенотерапия, VI — ультразвуковая терапия и ультрафонофо-
рез, VII — актинотерапия, VIII — гидробальнеотерапия, IX — пе-
лоидотерапия (в этот раздел относится грязелечение, применение
теплоносителей: парафина, озокерита, нафталана), X — криотера-
пия, XI — климатотерапия, XII — механотерапия, включающая
массаж, баротерапию, тракционную терапию, XIII — эстетотера-
пия (лечение музыкой, танцами, художественными произведения-
ми и т. д.).
Физические факторы оказывают рефлекторное, гуморальное и
непосредственное физико-химическое действие на различных
уровнях, начиная от атомов, молекул, клеточных и тканевых сис-
тем, вплоть до органного уровня специализированных и функ-
циональных систем [Анохин П. А., 1975]. При выборе физических
методов лечения дерматозов рекомендуется учитывать диагноз
заболевания, его стадию, форму, характер течения, а также воз-
раст больного, функциональное состояние нервно-эндокринной,
сердечно-сосудистой систем и наличие сопутствующих заболева-
ний.
Электролечение подразделяется в зависимости от типа электри-
ческой энергии на методы с применением тока постоянного на-
правления и тока переменного направления. В дерматологии лечеб-
ное применение постоянного электрического тока малой силы и
низкого напряжения используется для гальванизации, лекарст-
венного электрофореза, терапевтического электролиза. Импульс-
ные токи с низкой частотой малой силы и низкого напряжения
применяются для электросна, диадинамотерапии, электростимуля-
ции и электропунктуры. Лечебное действие электрического тока
переменного направления средних частот, малой силы и низкого
напряжения полезно для амплипульстерапии. Переменный сину-
208
соидальный импульсный ток высокой частоты, высокого напря-
жения и малой силы используется для дарсонвализации, а пере-
менный синусоидальный ток высокой частоты и большой силы —
для диатермии и диатермокоагуляции.
Гальванизация — метод электротерапии, при котором на орга-
низм человека воздействуют постоянным электрическим током
малой силы и низкого напряжения. Применяются способы галь-
ванизации непосредственно на места поражения, на рефлекторно-
сегментарные зоны и метод системного общего лечения.
В дерматологии традиционно используется несколько методик.
Наиболее часто применяется местная гальванизация на очаги
воспаления, затем гальванизация воротниковой зоны по Щербаку,
интраназальная гальванизация, четырехкамерная гальваническая
ванна и общая гальванизация по Вермелю. Гальванизация пока-
зана при нейродермите и других зудящих дерматозах у больных
склеродермией, узловатыми васкулитами, псориазом, красным
плоским лишаем и с келоидными рубцами.
Противопоказаниями к применению гальванизации являются
экзема, дерматиты, пиодермиты, гипертоническая болезнь III ста-
дии, лихорадочное состояние, злокачественные новообразования.
Лекарственный электрофорез — комплексный метод сочетанно-
го действия постоянного тока и лекарственного вещества. В ка-
честве лекарственных веществ чаще всего употребляются 0,5—
2 % раствор кальция хлорида (при аллергических дерматозах,
сопровождающихся выраженной воспалительной реакцией и зу-
дом), 2—3 % раствор магния сульфата, применяемый при лечении
себорейного поредения волос, очагового облысения, себорейного
дерматита. Для рассасывания келоидных рубцов, очагов склеро-
дермии эффективен 5—10 % раствор лидазы в 0,5—1 % растворе
новокаина. При опоясывающем лишае, болевом синдроме исполь-
зуется 2 % натрия бромида или 1—2 % раствор новокаина. Для
более быстрого рассасывания хронических инфильтратов у боль-
ных псориазом, красным плоским лишаем, очаговым невродер-
митом используются 1—3—5 % раствор ихтиола, 2—5 % раствор
димексида или 4 % раствор кислого хлористоводородного хинина.
В связи с тем что показания для назначения лекарственной
терапии в дерматологии весьма многочисленны, а сочетание лекар-
ственных препаратов с электрическим током нередко усиливает
их действие, лечебный электрофорез применяется в лечении дер-
матозов гораздо чаще, чем гальванизация.
Терапевтический электролиз — метод разрушения с терапевти-
ческой целью продуктами, образующимися при прохождении
постоянного тока. Терапевтический электролиз применяется в
дерматологической практике для разрушения небольших кожных
образований (бородавок, остроконечных кондилом, папиллом)
и ангиом.
Электросон — это метод воздействия на центральную нервную
систему импульсного тока низкой частоты, малой силы и низкого
напряжения. По данным М. М. Желткова и соавт. (1964), электро-
209
сон особенно эффективен у больных хроническими рецидивирую-
щими дерматозами, сопровождающимися зудом, парестезиями,
невротическими реакциями. Установлено, что электросон способ-
ствует восстановлению нарушенных нейрососудистых, нейрогумо-
ральных, нейроэндокринных, вегетативных и висцеральных систем
организма и тем самым обеспечивает его гомеостаз [Скрип-
кин Ю. К., 1964]. Процедура электросна значительно снижает
эмоциональное напряжение, оказывает выраженное антистрессовое
и седативное действие. Одновременно уменьшается умственное и
физическое утомление, повышается работоспособность. Насту-
пающий в процессе процедуры сон в отличие от медикаментоз-
ного (фармакологического) приближается к естественному, фи-
зиологическому сну и лишен последействия, к нему нет привы-
кания [Скрипкин Ю. К., 1964].
Диадинамотерапия — метод электролечения с помощью низко-
частотных импульсивных токов, малой силы и низкого напряже-
ния. Диадинамические токи (токи Бернара) оказывают на орга-
низм сложное рефлекторное стимулирующее действие, обусловлен-
ное антиспастическим, сосудорасширяющим влиянием, способ-
ностью их в результате ритмического сокращения мышц ускорять
процессы микроциркуляции в тканях. При диадинамотерапии у
больных заболеванием кожи отмечается уменьшение эритемы,
отека, инфильтрации и зуда. В дерматологии диадинамические
токи применяют для лечения экземы, псориаза, ограниченного
и диффузного нейродермита, почесухи, красного плоского лишая,
опоясывающего лишая. Кроме того, в дерматологии диадинамо-
терапия широко используется для диатермокоагуляции борода-
вок, папиллом, сосудистых невусов, телеангиэктазий, удаления
татуировок, келоидов.
Противопоказания: тромбофлебит, инфекционные лихорадоч-
ные заболевания, злокачественные новообразования, сердечно-
сосудистая недостаточность II—III степени, болезнь Паркинсона,
беременность, психические расстройства.
Электростимуляция — это метод применения различных им-
пульсных токов низкой частоты для восстановления трофических
свойств органов и тканей, утративших нормальную функцию.
По результатам И. Г. Шеметило, М. Г. Воробьева (1980), электро-
стимуляция показана для лечения склеродермии, дерматомио-
зита, атрофодермии Пазини — Пьерини, так как под влиянием
данной процедуры улучшается кровоснабжение мышц и дермы,
снижая накопление молочной кислоты и повышая энергообеспе-
чение за счет увеличения миоглобина, АТФ и гликогена.
Электропунктура — метод электролечения, предусматривающий
воздействие импульсными токами низкой частоты на биологи-
чески активные точки без применения игл. В отличие от электро-
акупунктуры, при которой ток подводится к металлическим иглам
во время сеанса иглотерапии, электропунктура представляет собой !
процедуру электролечения, выполняемую врачом-физиотерапевтом.
Для проведения электропунктуры выпускаются специальные anna- I
210 I
раты «Элап», «Элита», ПЭП, позволяющие обнаружить биологи-
чески активные точки, требующие терапевтического воздействия.
Электропунктура относится к методам рефлекторно-сегментарной
физиотерапии. Электропунктура оказывает нормализующее влия-
ние на биологические точки, поэтому ей свойственно аналгези-
рующее, гипосенсибилизирующее, сосудорасширяющее, противо-
воспалительное влияние, сопровождающееся положительными
адаптационно-трофическими процессами. Электропунктура имеет
ряд преимуществ перед обычным методом иглоукалывания —
нетравматичность, стерильность, возможность дозировки с регули-
ровкой силы тока. Этот метод находит применение в первую
очередь при тех заболеваниях кожи, которые показаны для игло-
укалывания: экзема, нейродермит, псориаз, крапивница, опоясы-
вающий лишай.
Амплипульстерапия — новый метод электролечения, проводи-
мый с помощью синусоидальных импульсных модулированных
токов малой силы и низкого напряжения. Болеутоляющее дейст-
вие, стимуляция периферической микроциркуляции, трофики тка-
ней и улучшение функционального состояния центральных и
периферических отделов нервной системы — основные механизмы
терапевтического действия амплипульстерапии. В дерматологии
основными заболеваниями для лечения являются склеродермия,
дерматомиозит, атрофодермия Пазини—Пьерини, ограниченный
нейродермит, варикозный синдром, опоясывающий лишай.
Дарсонвализация — метод электротерапии, при котором ис-
пользуется импульсный переменный ток высокой частоты, высо-
кого напряжения и малой силы. Метод назван по имени фран-
цузского физиолога д’Арсонваля, который изучил физиологиче-
ское действие высокочастотных токов и предложил использовать
их в лечебной практике.
Дарсонвализация повышает тонус сосудов, улучшая микроцир-
куляцию тканей. Одновременно стимулируются элементы ретикуло-
эндотелиальной системы, улучшается трофика кожи и слизистых
оболочек, усиливаются процессы регенерации. При этом оказы-
вается отчетливо выраженное болеутоляющее, противовоспали-
тельное и противозудное действие, обусловленное непосредствен-
ным влиянием искрового заряда как на чувствительные нервные
окончания, так и на вегетативные нервы кожи и слизистых обо-
лочек. Одновременно осуществляется бактерицидное и бактерио-
статическое действие искрового разряда. Дарсонвализация широко
применяется в дерматологической и косметической практике при
выпадении волос, у больных с угревой сыпью, хронической
экземой, красным плоским лишаем, ограниченным и диффузным
нейродермитом, псориазом, трофическими язвами и варикозным
синдромом, очаговой и системной склеродермией, келоидами.
Индуктотерапия — метод лечебного воздействия электромаг-
нитным полем высокой и ультравысокой частоты с индуктивной
передачей высокочастотного магнитного поля. Индуктотермия сти-
мулирует глюкокортикоидную функцию надпочечников, повышает
211
ферментативные обменно-трофические процессы в тканях, увели-
чивает окислительно-восстановительный потенциал крови, усили-
вает напряжение кислорода в мышечной ткани и иммунологиче-
ские свойства организма. Одновременно улучшает микроциркуля-
цию, оказывает антифлогистическое действие и нормализует
репарационные свойства воспаленных участков. Индуктотермия
применялась успешно в лечении экземы, нейродермита, псориаза,
красного плоского лишая [Шарапова Г. Я. и др., 1962; Корот-
кий Н. Г. и др., 1977].
Индуктотермия противопоказана у больных злокачественными
новообразованиями, сердечно-сосудистой недостаточностью, ост-
рыми инфекционными заболеваниями, гипертонией, стенокардией
и у беременных.
Ультравысокочастотные токи, или УВЧ,— это метод лечения
переменным электрическим полем ультравысокой частоты, которое
имеет диапазон колебаний от 30 до 300 МГц. В основе механизма
действия поля УВЧ лежит первичное действие на электрически
заряженные частицы (ионы, электроны, атомы, молекулы), из ко-
торых состоят ткани организма. Это действие обусловлено как
тепловым, так и нетепловым осцилляторным эффектом высоко-
частотных колебаний. Механизм действия УВЧ-терапии комплек-
сный и складывается из мобилизации деятельности элементов
ретикулоэндотелиальной системы, гипосенсибилизирующего дей-
ствия, усиления тканевого дыхания и интенсификации микроцир-
куляции с уменьшением гидратации тканей и снижением экссуда-
тивного компонента воспаления. Одновременно УВЧ-терапия ока-
зывает выраженное болеутоляющее и противозудное действие со
стимуляцией пролиферативных процессов.
По сведениям И. Г. Шеметило, М. Г. Воробьева (1980), лече-
ние острых гнойно-воспалительных заболеваний кожи и подкож-
ной клетчатки (фурункулы, карбункулы, гидраденит, васкулиты
кожи, трофические язвы) с помощью УВЧ-терапии по быстроте
действия и по эффективности является наиболее надежным и
действенным. После 2—3 процедур резко уменьшаются болезнен-
ность, отечность и гиперемия тканей, значительно улучшается
общее состояние. Эффективность лечебного действия тем выше,
чем раньше начато лечение. Противопоказания: сердечно-сосуди-
стая недостаточность, системные заболевания крови, злокачествен-
ные новообразования, беременность, гипотония.
Ультразвуковая терапия. Ультразвук оказывает механическое,
термическое и физико-химическое действие. Применяют пря-
мое (на кожу, мышцы, суставы) и косвенное (на спинномозговые
корешки, отдельные нервы) озвучивание. Прямое, локальное, озву-
чивание в дерматологии может применяться при гидрадените,
локализованном кожном зуде, ограниченной склеродермии, огра-
ниченном нейродермите, трофических язвах. Сегментарное, кос-
венное, озвучивание показано при лечении хронической рецидиви-
рующей крапивницы, универсальном кожном зуде, диффузном
нейродермите, системной склеродермии. Введение лекарственных
212
препаратов типа витаминов А, Be, гидрокортизоновой эмульсии и
др. с помощью ультразвука получило название фонофореза, кото-
рый с успехом применяют у больных подошвенно-ладонным
псориазом, ограниченными формами нейродермита, локализован-
ной экземы в стационарной стадии.
Ультразвук обладает выраженным противовоспалительным,
аналгезирующим, спазмолитическим, фибринолитическим, расса-
сывающим, противозудным, гипосенсибилизирующим действием.
Под влиянием ультразвука улучшается биоэлектрическая актив-
ность тканей, повышается фагоцитоз. Ультразвук активизирует
механизмы неспецифической резистентности и иммунологической
реактивности.
Противопоказана ультразвуковая терапия при общих инфек-
ционных заболеваниях, при гипертонии, беременности, кахексии,
сердечно-сосудистой недостаточности, при сирингомиелии, болез-
нях крови.
Светолечение (фототерапия) — метод, основанный на приме-
нении коротковолновых лучей солнечного спектра (гелиотерапия)
и искусственных источников ультрафиолетового излучения.
В состав лучистой энергии солнца входит спектр ультрафио-
летовых лучей, которые способны стимулировать биохимические
процессы в организме. Следует учитывать, что длинноволновая
часть ультрафиолетовых лучей угнетает лимфатическую актив-
ность тканей путем подавления синтеза ДНК. Входящие в состав
лучистой энергии солнца инфракрасные и видимые лучи сенсибили-
зируют организм к ультрафиолетовым лучам, повышая тем самым
их восприятие. Существуют разные методики проведения солнеч-
ных лечебных ванн, зависящие от вида дерматоза, состояния
больного, поэтому методы их применения будут представлены
конкретно при описании отдельных заболеваний.
Действие ультрафиолетовых лучей многогранно. Они оказы-
вают положительное влияние на центральную и вегетативную нерв-
ную систему, действуют боле- и зудоутоляюще, обладают бакте-
рицидной и бактериостатической активностью, стимулируют рост
волос, усиливают сало- и потоотделение. Гелиотерапию исполь-
зуют чаще всего в виде общих облучений при фурункулезе, стреп-
тодермиях, псориазе, у больных себорейной, микробной экземой
и при нейродермитах.
Ультрафиолетовое облучение аутокрови. В настоящее время
широко применяются в лечении многих патологических состояний
реинфузии ультрафиолетом облученной собственной крови. Иссле-
дования отечественных и зарубежных ученых еще в 30-е годы по-
казали эффективность данного метода при лечении целого ряда
заболеваний: вирусных пневмоний, пиодермитов, полиомиелита и
др. Однако с открытием антибиотиков и сульфаниламидов У ФО —
аутогемотерапия стала использоваться реже. Новый возврат к
применению этого метода сейчас связан с появлением антибиоти-
коустойчивых штаммов микроорганизмов. Принципиальное отли-
чие действия У ФО крови от обычного воздействия кварцевого
213
облучения заключается прежде всего в том, что при воздействии
У ФО на кожный покров коротковолновое излучение поглощается
в верхних слоях кожного покрова, а до капилляров доходит излу-
чение только с длиной волны, превышающей 300 нм. Непосред-
ственное воздействие У ФО крови оказывает многокомплексное
влияние. Оно проявляется прежде всего повышением бактерицид-
ной активности сыворотки крови вследствие активирования фаго-
цитоза, увеличения числа лейкоцитов, базофильных грануло-
цитов. Одновременно нормализуется количество и соотношение
IgG, IgM, IgA и IgE и происходят положительные динамические
изменения структурно-функциональных свойств иммунокомпетент-
ных клеток, что приводит к интенсификации иммунологической
активности. Выявлено также повышение кислородной емкости
крови, коррелирующей с улучшением реологических свойств крови
и с увеличенной способностью тканей утилизировать кислород.
Применение У ФО крови в лечении больных псориазом (зимней
формой), диффузным нейродермитом, различными клиническими
разновидностями экземы, стрептостафилодермией оказалось весь-
ма эффективным, способствующим интенсивному разрешению
кожного процесса и сокращению койко-дня.
Фототерапия. В качестве источников искусственных ультра-
фиолетовых лучей используют газоразрядные лампы: ДРТ (дуго-
вая, ртутная, трубчатая), ОУТ-1 (облучатель ультрафиолетовый)
и ОПУ-2 (облучатель портативный ультрафиолетовый). Основными
показаниями к фототерапии являются стационарное или регрессив-
ное течение дерматоза и отсутствие фотосенсибилизации. Перед
началом лечения определяют биодозу или эритемную дозу — ми-
нимальный период времени, в течение которого возникает эритема
при облучении на определенном расстоянии (обычно 50 см). При
различных дерматозах на разных участках каждого покрова на-
значают различное количество биодоз облучения. Процедуры
облучения проводят через день, прибавляя через 2—3 сеанса по
'/4—’/г биодозы, доводя дозу до 2—2'/2 биодоз при общем коли-
честве облучений 15—20. При папулезных элементах у больных
псориазом, красным плоским лишаем, ограниченным нейродерми-
том облучение начинают с l’/г—3 биодоз при площади облучае-
мых участков до 100 см2, добавляя в каждое последующее облуче-
ние от 2—3 до 7—8 биодоз. При бугорковых высыпаниях у боль-
ных лейшманиозом, туберкулезом кожи облучение проводят более
интенсивно, непосредственно на очаги поражения в количестве
15—25 эритемных доз.
Солнечное облучение и фототерапия противопоказаны при вы-
раженных заболеваниях сердечно-сосудистой системы, органичес-
ких заболеваниях центральной нервной системы, эпилепсии, забо-
леваниях крови, при злокачественных новообразованиях, тирео-
токсикозе, диабете, вегетодистонии, в период прогрессирования
туберкулезного процесса, а также при фотосенсибилизации и у
кожных больных при наличии прогрессирующей стадии дерма-
тоза.
214
ПУВА-терапия. В последние годы одним из наиболее эффек-
тивных и интенсивно изучаемых методов лечения дерматозов
является сочетанное применение фотосенсибилизирующих препара-
тов (псоралена, метоксалена, пувалена, оксоралена и др.) с облу-
чением длинноволновыми ультрафиолетовыми лучами зоны А. Ос-
нованием для применения данного метода послужили клиниче-
ские наблюдения, свидетельствующие о ремиссии или разрешении
кожного процесса у больных многими дерматозами (псориаз,
экзема, нейродерматозы и др.) под воздействием солнечного облу-
чения или искусственной ультрафиолетовой радиации. Недоста-
точное лечебное действие искусственных методов фототерапии
способствовало дальнейшим поискам. В 1974 г. J. A. Parrich и
соавт. предложили новый метод лечения, названный фотохимио-
терапией, или ПУВА-терапией. Название происходит от началь-
ных букв: П(Р) — псорален, пувален и другие фотосенсибилиза-
торы; yB(UW) —ультрафиолет в английской транскрипции;
А (А) —длинноволновый спектр ультрафиолетовых лучей. Этот
метод предполагал сочетанное назначение препаратов группы 8-
метоксипсоралена и мощного ультрафиолетового воздействия с
максимум эмиссии 365 нм. При этом значительное усиление УФ
воздействия достигается назначением фотосенсибилизаторов, ко-
торые в десятки раз повышают чувствительность кожи к ультра-
фиолетовой радиации. В то же время установлено, что ни фото-
сенсибилизатор, ни УФО, примененные изолированно, сами по
себе эффекта не оказывают, и только их комбинация дает положи-
тельный терапевтический результат. Предполагается, что псорале-
ны действуют в качестве катализаторов, усиливающих действие
на кожу длинноволновых ультрафиолетовых лучей. После того
как впервые были опубликованы обнадеживающие результаты
применения 8-метоксипсораленов внутрь с последующим облуче-
нием длинноволновыми ультрафиолетовыми лучами в лечении
больных псориазом, ПУВА-терапия находит все большее приме-
нение в России и за рубежом при грибовидном микозе, красном
плоском лишае, угревой сыпи, экземе, диффузном нейродермите
и других дерматозах. По мере накопления фактического материа-
ла по применению ПУВА-терапии в дерматологии выяснилось,
что в процессе лечения наблюдаются различные осложнения и
побочные явления. К ним относятся появление кератом, папиллом,
активизация скрытой вирусной инфекции в виде экзацербации и
рецидивирования простого пузырькового лишая, поражение зри-
тельного анализатора, нарушение пигментообразования, старение,
гипертрихоз, сухость кожи, появление злокачественных новооб-
разований (кератоакантомы, базально-клеточные карциномы), а
также непереносимость пувалена.
Лечение лучами Рентгена и лучами Букки. Используя противо-
воспалительное резорбтивное и зудоутоляющее действие лучей
Рентгена, их одно время очень широко применяли в дерматоло-
гии. Лучи Рентгена назначали для лечения нейродерматозов,
псориаза, красного плоского лишая, экзем, вульгарных и юноше-
215
ских бородавок, келоидных рубцов, эпителиом и др. Однако на-
копленный опыт показал, что при воспалительных дерматозах в
одних случаях наступает стойкий и длительный терапевтический
эффект, а в других — дерматоз остается резистентным к лечению.
Но после неудачной терапии рентгеновскими лучами другие ме-
тоды лечения оказываются безрезультатными. Помимо этого, воз-
действие рентгеновских лучей даже в терапевтических дозах
оказывается небезразличным. Их применение сопровождается
частыми осложнениями в виде рентгеновского дерматита, атрофии
кожи, появления папиллом, кератом, кератоакантом, изъязвлений
с малигнизацией. Все это ограничило применение лучей Рентгена
в лечении дерматозов. Лишь в редких случаях, если лечение зло-
качественных новообразований не эффективно другими методами,
используют рентгенотерапию. Чаще применяют пограничные лучи
(лучи Букки), при которых повреждающее действие на кожу прак-
тически отсутствует или менее выражено по сравнению с дейст-
вием, оказываемым лучами Рентгена.
Лучи Букки назначают для лечения сливных, возвышающихся
угрей, хронической, упорно рецидивирующей экземы, келоидных рубцов
ограниченных форм нейродермитов (хронический лишай Видаля) и др.
Криотерапию, или лечение холодом, производят снежной
угольной кислотой. С этой же целью применяют аппликации с
замораживанием жидким азотом. В последние годы эффектив-
ность криотерапии значительно возросла в связи с созданием и
внедрением в практику криогенной техники. Используют ручной
малогабаритный криоаппликатор, автономный азотный аппарат
(криораспылитель), криогенную установку «Криоэлектроника-1»,
криодеструктор с вакуумным отсосом и криодеструктор с про-
граммным регулированием криовоздействия. Дозирование опти-
мальных параметров криовоздействия при использовании различ-
ной аппаратуры регулируют в зависимости от мощности инфиль-
трата и глубины воспаления объекта удаления. При глубоком
залегании папиллом или невоидных образований экспозиция
варьирует от 1 до 2 мин, на месте удаляемого образования возни-
кает некроз. При поверхностном поражении типа ангиомы экспо-
зиция составляет 5—10 с с образованием гиперемии, шелушения,
отечности. В случае залегания папилломы, очага красной волчанки,
кератомы и др. в пределах дермы и подкожной клетчатки экспо-
зиция удлиняется до 30—40 с, а реакция проявляется резкой
гиперемией, отеком, пузырем, ссыхающимся впоследствии в корки
серозно-некротического и геморрагического вида. Дозировка
криотерапии зависит не только от клинической особенности оча-
га поражения, но и от анатомо-топографических свойств места
расположения сыпи, возраста больного и других факторов. Раз-
личные методы криовоздействия применяют для удаления очагов
хронической красной волчанки, кольцевидной гранулемы, вульгар-
ных угрей, ограниченных форм нейродермита, веррукозных высы-
паний псориаза, красного плоского лишая, узловатой почесухи,
216
ангиом, бородавок, кератом и сосудистых невусов и других добро-
качественных новообразований кожи.
Многолетние наблюдения за эффективностью терапии дермато-
зов выявили существенное значение комплексных методов с при-
влечением физиотерапевтических мероприятий и средств. Их
использование удлиняет период ремиссии, предупреждает наступ-
ление рецидива и значительно ускоряет регресс высыпаний, сокра-
щая койко-день и создавая фонд социальной экономии.
САНАТОРНО-КУРОРТНОЕ ЛЕЧЕНИЕ1
Санаторно-курортная помощь — один из важных этапов в
диспансеризации дерматологических больных, так как природные
лечебные факторы оказывают важный оздоровительно-профилакти-
ческий и лечебно-реабилитационный эффект. В отличие от фарма-
кологических препаратов они являются естественными физиологи-
ческими средствами воздействия на организм больных. Поэтому
при рациональном использовании они не оказывают побочных
действий, не вызывают осложнений. Однако эффективность лече-
ния курортными факторами в значительной мере обусловлена
качеством предсанаторного обследования больных, а также отбо-
ра, осуществляемого дерматологом. При санаторно-курортном
отборе необходимо учитывать, с одной стороны, характер и свое-
образие дерматоза у больного, индивидуальные особенности па-
циента, сопутствующие болезни, а с другой — основной профиль
курорта, представленные там природные лечебные факторы, их
физиологическое действие на основные звенья патогенеза дер-
матоза.
ХАРАКТЕРИСТИКА ЛЕЧЕБНЫХ ФАКТОРОВ КУРОРТОВ
Климат. Климатотерапия является неотъемлемым элементом
комплексного лечения дерматологических больных на курорте.
К климатообразующим относят космические (радиация солнца,
космическое излучение, смена времен года, дня или ночи), атмо-
сферные, или метеорологические (температура, влажность, движе-
ние воздуха, его физическая и химическая чистота, атмосферное
давление, осадки, туман, облачность) и земные факторы (геогра-
фическое расположение местности, растительный мир, наличие
водоемов и др.).
Сложная физико-химическая структура климатических факто-
ров определяет многогранность их действия на различные органы
и системы человека. Они обусловливают развитие общих неспе-
Цифических реакций (повышение устойчивости организма в ши-
роком плане) и специфических (влияние отдельных факторов
на системном органном и клеточном уровнях) [Богуцкий Б. В.,
Бокша, 1978; Даниелян Э. Е. 1980, и др.]. Эти климатические
Раздел написан профессором Е. Д. Марьясисом.
217
влияния диалектически едины. К основным видам климатолече-
ния относят аэрогелиоталассотерапию.
Воздушные ванны (аэротерапия) — комплексное воздействие
на организм человека светом и воздухом (температура, влаж-
ность, ионизация, движение). В результате стимулируются защитно-
приспособительные механизмы, улучшается и восстанавливается
естественная резистентность организма, снижается чувствитель-
ность кожи к внешним раздражителям, улучшаются ее кровоснаб-
жение, теплообмен.
Из аэропроцедур используют пребывание на свежем воздухе в
одежде, воздушные ванны на верандах, аэрариях. В зависимости
от общего состояния больного, особенностей дерматоза, а также
эквивалентно-эффективной температуры (ЭЭТ) воздуха назначают
теплые ванны (ЭЭТ выше 23 °C), индифферентные (ЭТТ 21 —
22 °C), прохладные (ЭЭТ 17—20 °C), умеренно холодные (ЭЭТ
13—16 °C).
Длительность воздушных ванн устанавливают с учетом ре-
жима воздействия климатопроцедур: при режиме умеренно интен-
сивного воздействия аэропроцедуры назначаются при ЭЭТ не
ниже 17—18 °C, продолжительность первой ванны 10—15 мин,
затем ежедневно ее продолжительность увеличивают на 3—5 мин,
доводя до 1—2 ч и более (ЭЭТ 21 °C и выше). По окончании воз-
душной ванны следует принять водную процедуру (душ, обтира-
ние).
Солнечные ванны (гелиотерапия) занимают большое место в
оздоровлении дерматологических больных. Выраженное биологи-
ческое действие оказывают ультрафиолетовые лучи. Их влияние
может быть непосредственным, гуморальным и рефлекторным.
В зависимости от общего состояния больного и течения дерма-
тоза рекомендуют: а) общее облучение субэритемными дозами;
б) общее (или местное) облучение нарастающими дозами; в) мест-
ное облучение эритемными дозами. Назначают соответствующий
режим воздействия — слабый (0,25—1 биодоза), умеренный
(0,25—2 биодозы) и интенсивный (0,25—3 биодозы). Чем шире
распространен дерматоз, чем острее его характер, тем больше ог-
раничиваются возможности гелиотерапии. Она противопоказана
при фотодерматозах, красной волчанке, пеллагре, псориазе и
других дерматозах, имеющих склонность к генерализации, обост-
ряющихся в весенне-летнее время. В то же время солнцелечение
особо показано больным, у которых дерматоз имеет ограниченный
характер, сопровождается выраженной инфильтрацией кожи и
регрессирует в весенне-летнее время.
При назначении гелиотерапии следует учитывать не только
положительные, но и отрицательные ее качества (деструкция
белковых образований, повреждение липидных внутриклеточных
мембран и особенно высокочувствительных лизосомных мембран
и др.). В связи с указанным в процессе гелиотерапии необходим
регулярный врачебный контроль. Основанием для отмены солнце-
лечения или уменьшения дозировок является ухудшение обще-
218
го состояния больного, в частности нарушение его сна и функ-
ционального состояния кожи, повышение СОЭ, обострение дер-
матоза.
Солнцелечение детей в возрасте до 3 лет проводят солнеч-
ными ваннами рассеянной радиации; детям в возрасте от 3 до
7 лет можно разрешать солнечные ванны суммарной радиации
по среднему режиму.
Морские купания (талассотерапия) — дозированное лечение
морскими ваннами и климатом. Механизм воздействия на дерма-
тологических больных многообразен: улучшается функциональное
состояние нервной и сердечно-сосудистой систем, обмен веществ,
повышается неспецифическая резистентность организма, сопро-
тивляемость к внешним раздражителям, нормализуется содержа-
ние иммуноглобулинов, холинэстеразы сыворотки крови, увели-
чение содержания витамина В12.
В зависимости от индивидуальных особенностей больного,
состояния кожного покрова назначают соответствующие режимы
воздействия, предусматривающие различную температуру воды и
время процедуры: слабый (температура воды 20—25 °C), умеренно
интенсивный (температура воды 16—26 °C) и интенсивный (тем-
пература воды 16—26 °C).
Морские купания рекомендуют больным, страдающим многими
дерматозами. Противопоказаны они при пиодермитах, острой мок-
нущей экземе, дисгидротическом, экзематизированном микозе
стоп, холодовой крапивнице, коллагенозах.
Детям в возрасте до 3 лет назначают преимущественно обти-
рания морской водой. В дальнейшем режим купания определяется
общим состоянием ребенка: у детей слабой, средней или сильной
группы продолжительность купания должна быть в 2 раза меньше,
чем у взрослых аналогичной группы.
Минеральные воды1. Лечебными минеральными водами назы-
вают природные воды, которые содержат в повышенных концен-
трациях минеральные или органические компоненты, газы (серо-
водород, азот и др.) либо характеризуются специфическими
свойствами (например, радиоактивностью), вследствие чего обла-
дают биологическим действием — физиологическим, лечебным,
иногда токсическим.
Для внутреннего употребления используют лишь воды подзем-
ных источников у мест их естественного выхода или полученные
путем бурения скважины и имеющие общую минерализацию не
менее 2 г/л. Ионно-солевой состав минеральных вод разнообразен.
Основными компонентами являются анионы (хлор, сульфаты, гид-
рокарбонаты, карбонаты) и катионы (натрий, калий, магний,
кальций, железо). По названным составным частям минеральные
Бальнеотерапией (от латинского balneum — купание и греческое therapia —
лечение) принято называть метод лечения минеральными водами как при наруж-
ном, так и при внутреннем применении.
219
воды получают свое название и тип. Минеральные воды могут со-
держать около 50 различных микроэлементов (цинк, молибден,
йод, бром, фтор, медь, марганец и др.).
В качестве основных критериев оценки лечебных минеральных
вод используют их физические и химические свойства: газовый
состав (сульфидные, азотные, углекислые и др.), ионный состав
(хлоридные, натриевые, сульфидные, кальциевые, магниево-каль-
циевые или натриевые), общая минерализация, радиоактивность,
температура, активная реакция, степень газонасыщенности. В за-
висимости от названных качеств минеральные воды применяют
наружно или внутрь в процессе диспансеризации больных различ-
ными дерматозами [Артемьев В. И., 1985; Антоньев А. А., Бело-
ва Л. В., 1985; Many Р. et al., 1984].
Наружное применение. Для общих и местных ванн исполь-
зуют газовые (сульфидные, азотные, углекислые), радиоактивные
(радоновые), термальные (выше 20 °C) и разного состава мине-
ральные воды. Они воздействуют на организм совокупностью сво-
их качеств. Некоторые из этих качеств могут рассматриваться как
неспецифические: а) гидростатический фактор, способствующий
притоку крови к правому предсердию; б) механический фактор,
влияние которого наиболее выражено в условиях применения
душа, душа-массажа, подводного душа-массажа; в) температурный
фактор, действующий на обширное рецепторное поле кожи, про-
цессы терморегуляции. Кроме того, бальнеотерапевтические про-
цедуры обладают и специфическим воздействием. Эта специфич-
ность — в избирательном влиянии процедур на те или иные систе-
мы организма в зависимости от физико-химических свойств, доз
и других качеств [Данилов Ю. Е., 1978].
В механизме действия бальнеологических процедур велика
роль кожи. В. Т. Олефиренко (1977) указывает на то, что интег-
рирование в системах нервной регуляции зависит от биохимиче-
ских, биофизических и других процессов, которые происходят в
месте приложения энергии гидробальнеопроцедуры, т. е. в коже.
В ней высвобождаются и активизируются различные биологиче-
ские вещества — биогенные амины, ферменты, донаторы энергии.
Последние могут оказывать влияние на клетки и ткани, находя-
щиеся в этом локальном участке.
Основные формы наружного применения минеральных вод
при лечении дерматологических больных представлены следую-
щим образом: а) ванны общие, или полные, половинные (полу-
ванны), тазово-поясничные и местные, или частичные; б) подвод-
ный душ-массаж — местный или общий; в) восходящий (проме-
жуточный душ); г) душ-массаж — общий и местный; д) местные
ванны для ног и рук — 1-, 2- и 4-камерные; е) душ лица; ж) душ
шеи; з) орошение головы; и) купание в бассейне.
В зависимости от локализации дерматоза, общего состояния
больного и имеющейся сопутствующей патологии решается воп-
рос о назначении одной из указанных процедур либо о их соче-
тании.
220
Ниже представлена характеристика вод, применяемых для на-
ружного лечения дерматологических больных.
Сульфидные минеральные воды имеются более чем
на 30 курортах (Сочи, Пятигорск, Усть-Качка, Сергиевские
минеральные воды, Талги, Горячий ключ, Ключи, Немиров, Та-
миск, Менджи, Кемери, Кумагорск, Нальчик, Синяк, Серноводск,
Хилово, Арчман, Нижние Серги и др.). В соответствии с сущест-
вующей классификацией к слабосульфидным относят воды, со-
держащие 10—50 мг/л сульфидов, воды средней концентрации
содержат 50—100 мг/л сульфидов, крепкие сульфидные воды —
100—250 мг/л, очень крепкие — 250 мг/л.
Помимо температурного фактора, гидростатического давления
и химического состава, основную роль в механизме воздействия
сульфидных вод на человека отводят сероводороду. Судя по ре-
зультатам радиоизотопных исследований, он проникает в орга-
низм в свободном и диссоциированном виде через дыхательные
пути и кожный покров. Количество сероводорода в крови зависит
от продолжительности ванны, температуры воды, индивидуальных
особенностей больного, в частности от состояния его гистогема-
тических барьеров. Сероводород в крови у дерматологических
больных определяют через 1—2 мин после погружения в ванну,
а у здоровых только через 3 мин. Длительность нахождения серо-
водорода в крови человека после выхода из ванны — 30—40 мин.
Через сосудистую стенку сероводород диффундирует в ткани, где,
в частности, взаимодействует с сульфидными группами белков
дыхательной цепи митохондрий.
Сульфидные воды оказывают нормализующее влияние на
нервную и сердечно-сосудистую системы больных дерматозами.
Под действием сульфидных ванн артериальное давление пони-
жается преимущественно за счет максимального; скорость крово-
обращения у здоровых людей не изменяется, а у больных проис-
ходит ее замедление. Гипотензивный эффект сульфидных ванн
обусловлен не только гидромеханическим действием, но и специ-
фическим влиянием на сердечно-сосудистую систему в целом, в
том числе на капилляры.
Сульфидная бальнеотерапия благоприятно действует на функ-
циональное состояние кожи у больных экземой, псориазом и дру-
гими дерматозами, изменяя проницаемость его рогового слоя,
местную терморегуляционную реакцию, сопротивляемость кожи
воздействию электрического тока [Григорьев Ю. Г., 1973; Беляе-
ва А. А., 1979; Милитенко С. А., 1979, и др.[.
Заслуживают внимания радиоизотопные и другие исследова-
ния, свидетельствующие о положительном влиянии сульфидных
ванн на соединительную ткань, коллагеновые волокна, основное
вещество дермы, в том числе гликозаминогликаны. Кроме того,
сульфидные ванны стимулируют глюкокортикоидную функцию
коры надпочечников, неспецифические факторы защиты — фаго-
цитарную активность лейкоцитов, уровень комплемента. Под влия-
нием бальнеотерапии нормализуется обмен белков, углеводов,
221
жиров. Они обладают выраженным гипосенсибилизирующим
эффектом.
Определяя, однако, наиболее оптимальные показания для дан-
ного вида бальнеотерапии, считаем возможным их рекомендовать
больным, у которых дерматоз характеризуется: 1) значительным
нарушением процессов кератинизации (псориаз, ихтиоз и др.);
2) умеренно выраженным аллергическим фоном; 3) существенным
изменением тонуса периферических сосудов. Сульфидная терапия
особенно показана при наличии сопутствующих заболеваний
нервной системы (сосудистые дистонии, радикулит, вегетативные
полиневриты), хронических воспалительных процессов женской
половой сферы, суставов, болезней сердечно-сосудистой системы
(состояние после перенесенного миокардита, гипертоническая
болезнь I—II стадии, фаза А, атеросклероз, остаточные явления
после флебитов).
Радоновые воды содержат радон (222Rn) —радиоак-
тивный химический элемент, который в процессе распада выде-
ляет а-, 0- и у-частицы, превращаясь в радий А. Последний дает
начало группе дочерних продуктов. Непрерывный распад радио-
активных изотопов, связанное с этим ионизирующее излучение
обусловливают лечебное действие данной процедуры.
Радоновые воды — одна из основных групп бальнеологических
факторов, применяемых в лечении дерматозов. В зависимости от
содержания радона они бывают слабые, средние и сильные (кон-
центрация радона соответственно 5—40; 41—200 нКи/л и более).
В бальнеологическом отношении все известные на территории
России разновидности радоновых вод можно разделить на 2 основ-
ные группы — «простого» состава, в которых единственным ле-
чебным компонентом является радон, и «сложного», в которых
радон сочетается с другими ценными лечебными компонентами
(азотные, углекислые, кремнистые, магниево-кальциевые, хлорид-
ные, натриевые и т. д.). Радоновые источники расположены на
курортах Украины (Житомир, Мироновка, Хмельник), Алтая (Бе-
локуриха), Кавказских Минеральных Вод (Пятигорск), Урала
(Увильды, Липовка, Красноусольск, Березовский), Забайкалья
(Молоковка), Закавказья (Цхалтубо), Средней Азии (Джеты-
Огуз) и Восточной Сибири (Усть-Кут). На указанных курортах
имеются воды с небольшой концентрацией радона; высокое его
содержание отмечено в Хмельнике, Молоковке, Джеты-Огузе, Пя-
тигорске.
Механизм действия радоновых ванн сложен и достаточно под-
робно изучен [Гамиров Р. 3., 1976; Акимочкина Р. Г., 1981; До-
рогина В. М., Першин С. П., 1985; Милитенко С. А., 1985, и др.].
Продукты распада радона, представляющие собой металлы, оседа-
ют на кожу и вступают во взаимодействие с атомами веществ
организма. Около 90 % всей поглощенной энергии смешанного
излучения приходится на долю а-частиц, лечебное воздействие
которых достигается при очень малых интегральных поглощенных
дозах, не вызывающих повреждений кожи при наружном примене-
222
нии. При этом эффект терапии реализуется в основном рефлектор-
но через гипоталамо-гипофизарно-надпочечниковую систему.
Судя по имеющимся публикациям [Писаренко М. Ф., 1975;
Акимочкина Р. Г., 1981, и др.], под влиянием радоновых ванн,
особенно высокой концентрации, у больных аллергическими дер-
матозами, псориазом часто нормализуется электрическая актив-
ность мозга, его гемодинамика, глюкокортикоидная функция над-
почечников, функциональное состояние кожи.
В механизме действия радоновых процедур имеют значение
вызванные ими восстановительно-репаративные функции печени,
улучшение углеводного обмена. Заслуживают особого внимания
исследования [Писаренко М. Ф., 1975; Акимочкина Р. Г., 1978,
и др.], свидетельствующие о благоприятном действии радоновых
ванн на содержание иммуноглобулинов всех классов, о явном ги-
посенсибилизирующем их эффекте.
Положительные качества радоновых ванн с успехом исполь-
зуют в лечении многих кожных заболеваний. Они особо показаны
больным дерматозами, сопровождающимися значительным зудом,
протекающими на фоне выраженной аллергии, изменений нервно-
эндокринной системы, в том числе вторичной недостаточности
глюкокортикоидной функции надпочечников, нарушений тонуса
сосудов, гипертериоза легкой и средней выраженности, мочекис-
лого диатеза, сахарного диабета легкой и средней тяжести, ожире-
ния, болезней сердечно-сосудистой системы, органов движения,
пищеварения.
Водные радоновые ванны нецелесообразно назначать больным
в период обострения экземы и других дерматозов, а также лицам
пожилого возраста, страдающим разнообразной висцеральной па-
тологией, особенно сердечно-сосудистой системы. В этих случаях,
по данным И. Е. Шалыгиной (1986), вполне себя оправдали воз-
душно-радоновые ванны (ВРВ).
Лечение с помощью ВРВ хронических дерматозов не уступает
по своей эффективности лечению обычными радоновыми ваннами.
В то же время ВРВ обладают некоторыми преимуществами: их
можно назначать при обострившихся дерматозах, в частности,
протекающих с умеренной экссудацией, подострых формах псо-
риатических артритов, а также пожилым людям, имеющим об-
щие противопоказания против получения водных радоновых про-
цедур.
Йодобромные воды, содержащие йод (не менее 5 мг/л)
и бром (не менее 25 мг/л), широко используются для лечения
Дерматологических больных. География курортов, имеющих йодо-
бромные термы, обширна — Краснодарский край (Горячий Ключ,
Майкоп, Хадыженск, Анапа, Геленджик, Сочи, Краснодар), Усть-
Качка, Нальчик, Чартак и др.
Механизм воздействия йодобромных вод обусловлен, с одной
стороны, термическими, гидростатическими и механическими
влияниями, с другой — солевыми компонентами минеральной воды
[Ветчинкин В. О., 1983; Сивак В. П., 1985]. Первые 3 фактора
223
опосредуются рефлекторным путем через обширные рецепторные
поля, представленные в коже вегетативными нервными оконча-
ниями. Микроэлементы, в частности ионы йода и брома, поступая
через кожу и слизистые оболочки, принимают непосредственное
участие в метаболических процессах, деятельности нервной и гор-
мональной систем (особенно щитовидной железы).
Йодобромные ванны благоприятно влияют на биоэлектриче-
скую активность и кровообращение мозга, обладают выраженным
седативным, гипотензивным и противовоспалительным действием,
нормализуют тонус сосудов, гепариновую активность плазмы,
улучшают функциональное состояние кожи.
Терапию цельной йодобромной водой рекомендуют назначать
физически крепким людям с малоизмененной реактивностью ор-
ганизма, страдающим дерматозами, протекающими с выраженной
инфильтрацией и лихенификацией кожи. Данная бальнеотерапия
особенно показана больным, у которых дерматоз возник на фоне
заболеваний нервной системы — функциональных и органических
(радикулиты, миелит), сосудов (перенесенные флебит и тромбо-
флебит)), женских половых органов (бесплодие, функциональная
недостаточность яичников), опорно-двигательного аппарата (арт-
рит, полиартрит и др.).
Азотные термы — слабоминерализованные щелочные
минеральные воды имеются на следующих курортах: Нальчик,
Нилова Пустынь, Оби-Гарм, Сухуми, Талая, Уш-Бельдыр, Цхал-
тубо и др.
Азотные термы содержат меньше минералов, чем обычная
пресная вода, что позволило ранее отнести их к «акротермам» или
«простым», т. е. индифферентным. Между тем дальнейшие иссле-
дования установили в азотных термах ряд специфических ком-
понентов, а также процессов выраженной диссоциации ионов,
обусловливающих их значительную активность и особые свойства.
Основная физико-химическая характеристика азотных терм
представлена следующим образом: минерализация — до 2 г/л, ще-
лочность — pH 9,6. В катионном составе преобладает натрий;
высоко содержание кремниевой кислоты (от 5 до 150 мг/л).
В некоторых азотных термах содержатся в повышенном количе-
стве фтор — до 20 мг/л (Памир, Алтай, Тянь-Шань), сульфиды —
до 30 мг/л (Закавказье, Прибайкалье), микроэлементы железа,
алюминия (Кавказ, Тянь-Шань), тяжелые металлы (свинец,
цинк, медь) —до 10~2 мг/л (Приморье, Тува и др.). Температура
азотных терм колеблется в широких пределах от 20 до 40 °C на
Кавказе, в Центрально-Памирской области; от 30 до 60 °C — в
Саяно-Байкальском регионе. Содержание азота в спонтанных га-
зах терм всегда более 90 % по объему, чаще 98—100 %. Выяв-
ляются, хотя и в малых количествах, другие газы — метан, тяже-
лые углеводороды и т. д. Общая минерализация азотных терм
низкая — 0,5—2 г/л. В то же время они содержат 50—150 мг/л
кремниевой кислоты, находящейся в виде высокодисперсного золя,
мономолекулярной недиссоциированной формы, а также фтор
224
(0,7—1,2 мг/л), гидросульфид (10—30 мг/л). Радиоактивность
этих терм в целом слабая (до 3,6 нКи/л).
По мнению Е. Д. Марьясиса и соавт. (1975), В. Т. Олефиренко
(1977), в основе механизма действия азотнотермальной воды
лежит раздражающее действие пузырьков азота, скапливающихся
на коже больного во время процедуры. При этом не исключена
возможность проникновения азота через кожу в организм.
Азотнотермальные ванны оказывают положительное
влияние на нервную, сердечно-сосудистую системы, в том числе
на капиллярную сеть, липидный и белковый обмен, проницаемость
рогового слоя. Следует отметить выявленную нами зависимость
результатов терапии дерматозов от сопутствующих заболеваний
пищеварительной системы больных. Нормализация имеющейся
висцеральной патологии, особенно печени, повышает эффектив-
ность курортного лечения больных дерматозами.
Азотнотермальные ванны наиболее показаны при
лечении аллергических заболеваний кожи с умеренной инфильтра-
цией, сопровождающихся значительным зудом и протекающих на
фоне неврастении, нарушения тонуса периферических сосудов и
других сопутствующих заболеваний.
Кремнистые термальные воды — своеобразная группа слабоми-
нерализованных минеральных вод, содержащих не менее 50—
100 мг/л недиссоциированной коллоидной кремниевой кислоты.
Среди курортов, имеющих кремнистые воды, — Гарм-Чашма,
Кульдур, Алма-Арасан, Арасан-Олпа.
Учитывая то, что кремнистые воды температуры 36—92 °C
содержат азот, механизм их действия и показания во многом ана-
логичны описанным в разделе «Азотные термы». Следует лишь
указать на высушивающее действие кремниевой кислоты, что рас-
ширяет возможности применения данной бальнеопроцедуры при
лечении дерматозов.
Хлоридные натриевые воды — наиболее распро-
страненные минеральные воды. Они имеются в Друскининкае,
Красноусольске, Миргороде, Славянске, Моршине, Старой Руссе,
Усолье.
В основе механизма действия хлоридных натриевых ванн ле-
жит образование «солевого плаща» .на большой рецепторной по-
верхности кожи [Олефиренко В. Т., 1977]. В результате улучша-
ется кровообращение, повышаются функциональные возможно-
сти центральной нервной системы. Имеются данные о нормали-
зующем влиянии хлоридных натриевых вод на функциональное
состояние нервной, симпатико-адреналовой систем, коры надпо-
чечников. Они обладают болеутоляющим, рассасывающим и проти-
вовоспалительным действием, улучшают иммунологическую реак-
тивность, функции кожи, усиливают ферментативные и обменные
процессы [Григорьева В. Д., Новикова Н. В., 1985; Hildebrandt G.,
1984J.
Рапа — высококонцентрированная минеральная вода типа
Рассола озер и лиманов (Тамбуканское, Горькое, Шира, Карачи,
8—936
225
Мойнаки, Медвежье). Имеющиеся наблюдения [Милявский А. И.,
Аскерова М. И., 1975; Лосев В. Б., 1985, и др.] свидетельствуют о
том, что рапные ванны показаны больным, страдающим ограни-
ченными формами нейродермита, а также ихтиозом и псориазом.
Для лечения дерматозов используют полные ванны (темпера-
тура воды 40—42 °C). Процедуры назначают через день, а за-
тем 2—3 дня подряд с последующим одним днем отдыха. Рапу
применяют в виде разводных ванн, концентрация 40—120 г/л.
Внутреннее применение. Известно, что патологические изме-
нения различных органов пищеварительной системы оказывают
отрицательное влияние на функциональное состояние кожи и
создают предпосылки (при наличии дополнительных отрицатель-
ных экзо- или эндогенной «разрешающих» факторов) для разви-
тия аллергических и других дерматозов. Поэтому больные различ-
ными дерматозами при направлении на курорт должны пройти
тщательное гастроэнтерологическое обследование. При выявлении
заболеваний желудочно-кишечного тракта им показаны питье
минеральной воды, ректальные процедуры и др. Это один из основ-
ных путей опосредованного воздействия на функциональное со-
стояние кожи, а следовательно, на течение и прогноз дерматоза.
Ниже приводится краткая характеристика внутренней бальнео-
терапии.
Питьевое лечение минеральной водой необходимо ши-
роко использовать на курортах и во внекурортных условиях для
лечения больных многими дерматозами. Наши наблюдения и со-
трудников [Григорьев Ю. Д., 1973; Филимонов А. Н., 1974] сви-
детельствуют о том, что в тех случаях, когда у больных в процессе
патогенетической терапии на Пятигорском курорте достигается
улучшение состояния желудка и особенно печени, у них наблю-
дается и более быстрый регресс дерматоза. Это обосновывает
важность внутреннего применения минеральной воды1 в комп-
лексном лечении дерматологических больных.
Промывание желудка проводят обычно той же водой,
которую используют для питьевого лечения. Оно нормализует
желудочную секрецию, сократительную деятельность мускулатуры
желудка, освобождает его от остатков пищи, избытка слизи.
Дуоденальное зондирование с одновременным введением мине-
ральной воды усиливает выделение желчи из желчных путей и
желчного пузыря.
Тюбаж (дренажные промывания без зонда) способствует
выделению значительных количеств желчи и уменьшению воспали-
тельного процесса в желчных путях. Для тюбажа используют
подогретую до 40—50 °C минеральную воду (500 мл), обогащен-
ную сульфатом магния.
Ректальные методы внутреннего применения минераль-
1 Можно использовать источники минеральной воды как в условиях курорта, так
и в домашней обстановке (бутылочные минеральные воды «Ессентуки 17»,
«Смирновская», «Боржоми» и др.).
226
ной воды должны найти широкое применение в лечении дермато-
логических больных. Это сифонные промывания кишечника, мик-
роклизмы. Данные процедуры оказывают как местное влияние
(растворение слизи, приток крови к слизистой оболочке), так и
общее вследствие всасывания растворенных в минеральной воде
солей. Наши данные свидетельствуют о целесообразности исполь-
зования ректальных процедур в общем комплексе лечения больных
аллергическими и другими заболеваниями кожи.
Пелоиды, нафталан, озокерит. Г рязелечение является
мощным фактором оздоровления больных хроническими дерма-
тозами. К грязевым курортам относятся Анапа, Актала, Балдоне,
Евпатория, Ейск, Карачи, Кашин, Краинка, Пятигорск, Саки, Сад-
город, Старая Русса, Хилово и др.
Грязь обладает тепловыми качествами — теплоемкостью, теп-
лопроводностью, теплоудерживающей способностью. Принято счи-
тать, что физиологическое и лечебное действие пелоидотерапии
основывается преимущественно на рефлекторном влиянии на ор-
ганизм с вовлечением нейрорегуляторных систем. Важное значе-
ние придается также бактерицидным свойствам грязи, наличию в
ней эстрогенов и простагландинов — биоре[уляторов многих фи-
зиологических процессов. Пелоидотерапия, применяемая сегмен-
тарно (область шеи, паравертебральная зона), повышает (до нор-
мы) содержание 11-ОКС в плазме, оказывает седативный эффект,
снижает в сыворотке крови уровень аутоантител, интенсифицирует
окислительно-восстановительные процессы, улучшает обмен в
коллагеновых фибриллах и основном веществе соединительной
ткани [Литвиненко А. Г., 1979; Лендинский А. Ф. и др., 1985;
Деменева Л. А. и др., 1986].
Описанные особенности общего действия пелоидотерапии обо-
сновывают целесообразность ее широкого применения для оздо-
ровления больных хроническими дерматозами, в патогенезе кото-
рых важную роль играют измененная иммунологическая реактив-
ность организма, функциональные нарушения нервной системы,
обмена веществ и др. Кроме того, значительный диапазон наруж-
ного действия грязи определяет показания к лечению заболеваний,
протекающих со значительной инфильтрацией кожи (нейродермит,
псориаз), а также очаговых облысений, красного плоского лишая,
почесухи, келоидов, пластической индурации пениса. Антибакте-
риальные свойства грязи оправдывают ее применение в виде
аппликаций при угревой сыпи, трофических язвах, микробной
экземе.
Пелоидотерапию используют для воздействия на область оча-
гов поражения. Не следует назначать грязевые процедуры боль-
ным в период прогрессивного подострого или острого течения
патологического процесса.
Торф — один из основных пелоидов органического типа. Он
содержит пектины, дубильные вещества, битумы, целлюлозу, ге-
мицеллюлозу, гуминовые кислоты. Последние обусловливают полу-
жидкую пластическую консистенцию торфа. От них зависят также
8* 227
термофизические особенности кашицеобразной торфяной массы.
Бактериостатические свойства торфа связывают с гуминовыми
кислотами. Через кожу резорбируются лишь растворимые в воде
компоненты торфа. Имеются указания, что аппликации торфяной
грязи температуры 48 °C приводят к усилению местного кровотока
вследствие дилатации кожных сосудов и торможению симпатиче-
ских периферических эффектов.
Торф используется в виде аппликаций либо на очаг поражения,
либо сегментарно.
Нафталановую нефть широко используют для лечения
многих дерматозов. Она обладает свойствами тяжелых нефтей с
относительной плотностью 0,923—0,974, лишена легких фракций,
содержит значительное количество нафтеновых кислот. Нафтала-
новая нефть оказывает положительное влияние на центральную
нервную систему, функцию эндокринных органов, кроветворение,
сердечно-сосудистую систему, обладает гипосенсибилизирующим,
противозудным и противовоспалительным действием.
Лечение нафталаном показано больным псориазом, экземой,
нейродермитом.
Озокерит — воскообразный продукт нефтяного происхож-
дения, светлого, темно-коричневого или черного цвета, представ-
ляющий собой смесь высоковязких и легких масел мелкокристал-
лического парафина. Его получают из особой руды, которая добы-
вается в районе Борислава; по своей консистенции и внешнему
виду напоминает воск. Озокерит содержит 84—86 % углерода и
13—15 % водорода. В его состав входят церезин (69—80 %), па-
рафин (3—7 %), минеральные масла, нефтяные смолы (8—10 %),
асфальтены (0,5%), механические примеси (3—8%). Температу-
ра плавления — 60—80 °C. Озокерит нашел применение в лечении
псориаза, нейродермита, хронической экземы, красного плоского
лишая.
САНАТОРНО-КУРОРТНЫЙ ОТБОР
Для правильного выбора санатория по характеру сопутствую-
щих дерматозу висцеральных заболеваний для детей и взрослых
рекомендуют следующий комплекс обязательных лабораторных
исследований, результаты которых необходимо отразить в сана-
торно-курортной карте: анализ желудочного сока (фракционно),
дуоденальное зондирование с биохимическими исследованиями
желчи, исследование биохимической гепатограммы (белковый
спектр, холестерин, р -липопротеиды, сахар, щелочная фосфатаза,
альдолаза), анализ кала на гельминты, лямблии, описторхии (в
эндемичных районах) — 3—5 раз с интервалом 4—5 дней между
исследованиями, развернутые копрограммы (3-кратно), исследо-
вание кала на дисбактериоз (обязательно для детей), общий
анализ крови и мочи, ЭКГ, исследование органов грудной клетки
(флюорография), для женщин обязательно заключение гинеко-
лога. .
228 '
По показаниям проводят эндоскопическое исследование же-
лудка и 12-перстной кишки, ректосигмоидоскопию, определение
коагулограммы. Обязательным является осмотр ЛОР-врачом, сто-
матологом, гастроэнтерологом (по результатам обследования).
Подобное комплексное обследование обычно позволяет вы-
явить заболевания, патогенетически связанные с дерматозами.
Поскольку у больных аллергодерматозами, особенно у детей, чаще
всего выявляется сочетанная патология органов пищеварения,
первый этап досанаторной подготовки им лучше провести в гастро-
энтерологических отделениях соматических детских больниц.
В полноценной досанаторной подготовке нуждаются также
больные псориазом, склеродермией и другими хроническими дер-
матозами.
Принципы отбора для санаторно-курортного лечения. Первый
принцип. При отборе следует учитывать, что курортное лече-
ние показано больным, страдающим лишь определенными дерма-
тозами: псориаз, нейродермит (ограниченный и диффузный, за
исключением экссудативной формы), экзема (все формы), крас-
ный плоский лишай, склеродермия, почесуха (в легкой степени
выраженности, не осложненная пиодермитом), крапивница, их-
тиоз, различные формы кератодермии, угревая сыпь, алопеция.
Больных дерматозами, обостряющимися летом, направляют на
санаторно-курортное лечение в осенне-зимние месяцы, а больных
дерматозами, обостряющимися зимой, — в летний период.
Второй принцип. При решении вопроса о выборе курор-
та необходимо учитывать описанное выше физиологическое дей-
ствие лечебных факторов курорта, способных нормализовать
патологию кожи и нарушения функций висцеральных органов.
Так, сульфидные воды преимущественно показаны больным, у
которых поражения кожи протекают с выраженным нарушением
рогообразования (ихтиоз, псориаз), гипер- или гипофункцией
сальных желез (угревая сыпь, себорейная экзема, кератодермии)..
На курорты, имеющие радоновые или азотнотермальные воды,
рационально направлять больных, страдающих дерматозами,
склонными к частым и резким обострениям, протекающим на фоне
функциональных изменений нервной системы, гипертиреоза и
других эндокринных нарушений. При отборе больных на курорты,
богатые йодобромными водами, следует учитывать их положи-
тельное влияние на нервную систему. В то же время высокая ми-
нерализация йодобромной воды ограничивает показания для ле-
чения экземы, имеющей склонность к частым обострениям, а так-
же экссудативных форм псориаза. На грязевые курорты целесооб-
разно направлять больных, страдающих ограниченными формами
дерматозов, протекающих с выраженной инфильтрацией кожи
<нейродермит Видаля, псориаз с ограниченными инфильтрирован-
ными бляшками, склеродермия и др.).
Третий принцип. Дифференцированный подход пре-
дусматривает учет сопутствующей висцеральной
патологии, имеющей отношение к развитию кожного за боле-
229
вания либо отрицательно влияющей на его течение (например,
анацидный гастрит и красный угри; диабет и липоидный некро-
биоз и др.).
Лечащий врач должен учитывать основной профиль курорта
(гастроэнтерологический, неврологический и др.), наличие там ле-
чебных факторов, которые могут целенаправленно воздействовать
на висцеральную патологию, лежащую в основе развития дер-
матоза у данного больного. Ниже мы представляем таблицу,
в которой приводятся показания к лечению на том или ином ку-
рорте сопутствующих заболеваний, сочетающихся с дерматозами
(табл. 1).
Таблица 1. Курорты для больных дерматозами, имеющих сопутствующую
патологию
Сопутствующее заболевание Курорты
Нервной системы Ангара, Аяк-Калкан, Белокуриха, Джеты-Огуз, Друс- кининкай, Ейск, Кемери, Краинка, Красноусольский, Кульдур, Курьи, Куяльник, Дюбен Великий, Молоковка, Махинджаури, Нуниси, Нилова пустынь. Нафталан, Оби-Гарм, Озеро Шира, Пятигорск, Сериоводск, Серги- евские минеральные воды, Сочи, Сухуми, Сураханы, Талая, Талги, Тамиск, Усолье, Усть-Качка, Усть-Кут, Хилово, Хмельник, Цаиши, Цхалтубо, Чартак, Черче
Органов кровообра- щения Ангара, Арчман, Балдоне, Белокуриха, Друскининкай, Ключи, Курьи, Дюбен Великий, Менджи, Молоковка, Не- миров, Сериоводск, Сергиевские минеральные воды, Сухуми, Усть-Качка
Пищеварительной системы Арчман, Аяк-Калкан, Горячий Ключ, Ейск, Истису, Кемери, Краинка, Красноусольский, Кульдур, Нальчик, Нижние Серги, Озеро Шира, Пятигорск, Сары-Агач, Сериоводск, Талая, Хилово, Цхалтубо, Чартак
Опорно-двигатель- ного аппарата Ангара, Арчман, Аяк-Калкан, Булокуриха, Горячий Ключ, Джеты-Огуз, Друскининкай, Ейск, Истису, Кемери, Ключи, Краинка, Красноусольский, Кульдур, Куяльник, Дюбен Великий, Менджи, Молоковка, Нальчик, Нафта- лан, Нилова пустынь, Нуниси, Пятигорск
Г инекологические Арчман, Аяк-Калкан, Белокуриха, Горячий Ключ, Дже- ты-Огуз, Ейск, Истису, Кемери, Ключи, Краинка, Красно- усольск, Кульдур, Куяльник, Дюбен Великий, Менджи, Немиров, Нилова пустынь, Нальчик, Нуниси, Оби-Гарм, Озеро Шира, Пятигорск, Сериоводск, Сергиевские мине- ральные воды, Сухуми, Сураханы, Талая, Талги, Усолье, Усть-Качка, Усть-Кут, Хмельник, Цаиши, Цхалтубо, Чартак, Черче
Мочевыводящих путей Истису, Краинка
Четвертый принцип. Следует максимально прибли-
жать назначаемое курортное лечение к месту постоянного житель-
ства пациента. Многие здравницы Дальнего Востока, Сибири,
Урала и Средней Азии не уступают по богатству своих естествен-
ных лечебных факторов курортам Кавказа и в то же время обла-.
230 J
J
<i
дают существенными преимуществами медицинского и экономиче-
ского характера (исключается ряд противопоказаний, обуслов-
ленных возрастом, сопутствующими заболеваниями сердечно-сосу-
дистой системы и т. д.).
В качестве иллюстрации можно привести следующие примеры.
В Сочи нередко прибывают дерматологические больные из При-
волжья и Урала, которым показаны только сульфидные ванны, но
противопоказана гелиоталассотерапия. Естественно, что данную
категорию больных следовало направить не на Черноморское по-
бережье, а на Сергиевские минеральные воды Куйбышевской об-
ласти либо Усть-Качку Пермской области. На этих курортах
имеются сульфидные воды, близкие по составу, механизму дейст-
вия и эффективности мацестинским в Сочи.
По имеющимся наблюдениям [Антоньев А. А., Белова Л. В.,
1985], среди врачей и больных укоренилось неправильное пред-
ставление о том, что наиболее эффективным является курортное
лечение на Черноморском побережье Кавказа и Крыма. Между
тем довольно часто результативность терапии выше на курортах с
привычными для человека климатическими условиями. Кроме того,
больные, получающие санаторно-курортное лечение в непривычных
климато-географических условиях, при возвращении на место по-
стоянного жительства проходят период реадаптации, длительность
которого зависит от индивидуальных адаптационных возможно-
стей организма и степени различия климато-географических усло-
вий. Реадаптацию хуже переносят дети и лица в возрасте старше
50 лет.
Пятый принцип. При санаторно-курортном отборе важ-
но учитывать общие противопоказания, исключающие возмож-
ность курортного лечения. Они изложены в «Методических указа-
ниях по направлению больных (взрослых и подростков) на сана-
торно-курортное лечение».
Помимо общих противопоказаний, следует учитывать специ-
альные. К ним относят все болезни кожи в острой и подострой
стадиях, в том числе острую форму псориаза и эритродермии; все
формы пемфигуса (пемфигоид), болезнь Дюринга, буллезные эпи-
дермолизы, афтозы; все контагиозные грибковые заболевания
волосистой части головы, гладкой кожи, ногтей (трихофития,
микроспория, фавус), кандидозы, глубокие микозы (бластомикоз,
споротрихоз, актиномикоз, хромомикоз, аспергиллез и др.);
чесотка и другие паразитарные заболевания кожи (в том числе
демодекоз); гемодермии (лимфогранулематоз, лейкемиды, фун-
гоидный микоз, ретику лезы, ретикулосаркоматоз), саркоидоз;
острая, подострая, диссеминированная и дискоидная формы крас-
ной волчанки, фотодерматозы1, порфириновая болезнь1, пигмент-
ная ксеродерма; все инфекционные заболевания кожи: туберкулез,
Больных фотодерматозами, порфириновой болезнью, развившихся на фоне
патологии гепатобилиарной системы, целесообразно лечить в Пятигорске, Наль-
чике и других курортах гастроэнтерологического профиля в осенне-зимнее время.
231
лепра, туляремия, сибирская язва, дифтерия, амебиаз; все зло-
качественные новообразования кожи, сенильные изменения кожи,
множественные пигментные невусы; васкулиты, гемосидерозы,
панникулиты, гиподермиты; склеродермия с высокой степенью ак-
тивности, быстропрогрессирующим течением с поражением почек
и гипертензией.
Порядок оформления санаторно-курортного отбора. Установив
на основании клинико-лабораторных исследований, что больной
нуждается в санаторно-курортном лечении, лечащий врач выдает
ему на руки справку (по форме, утвержденной М3 РФ), в кото-
рой рекомендуются тип курорта (санатория), вид лечения (сана-
торное, амбулаторное) и время года, наиболее благоприятное для
лечения. Этот документ представляют по месту получения путев-
ки (профсоюзный комитет, отдел по реализации путевок).
После получения путевки больной обращается в лечебное уч-
реждение, в котором дерматолог проверяет ее соответствие меди-
цинским рекомендациям и заполняет санаторно-курортную карту.
В нее вносят подробные данные об общем состоянии здоровья
больного, результатах лабораторных, функциональных и других
исследований.
Отпуск для курортного лечения обычно представляют на
весь срок путевки и на время проезда (в оба конца). Если для
этого не достаточно очередного и дополнительного отпуска,
выдают листок временной нетрудоспособности на нужное чис-
ло дней при условии: а) если необходимость санаторно-курорт-
ного лечения установлена лечащим врачом совместно с заведую-
щим отделением или главным врачом; б) если путевка выдана
профсоюзной организацией бесплатно за счет средств социаль-
ного страхования или с оплатой 30 % стоимости.
Работающим инвалидам Великой Отечественной войны I и
II групп, инвалидам I и II групп из числа военнослужащих, став-
ших инвалидами вследствие ранения или увечья, полученных при
исполнении служебных обязанностей, отпуск для санаторно-ку-
рортного лечения предоставляется в том же порядке независимо
от того, кем и за чей счет выдана путевка.
Если больной использовал свой отпуск, но нуждается в сана-
торно-курортном лечении, администрация может предоставить ему
отпуск без сохранения заработной платы на число дней, равное
очередному или дополнительному отпускам работника.
Листки временной нетрудоспособности для санаторно-курорт-
ного лечения выдаются ВКК либо лечащим врачом совместно с
главным врачом при условии предъявления больным путевки, вы-
писки из постановления профсоюзной организации о решении вы-
дать ему путевку за счет средств социального страхования, справ-
ки администрации предприятия о длительности очередного и
дополнительных отпусков, санаторно-курортной карты. При
предоставлении отпуска для лечения в санаториях пособия по
листам нетрудоспособности выдаются, как правило, по возвраще-
нии рабочего или служащего из санатория и предъявлении им
232
«Обратного талона к путевке» с отметкой о времени пребывания
в санатории.
В заключение необходимо подчеркнуть, что, если вследствие
невнимательности лечащего врача больной, имеющий противопо-
казания, направляется на курорт, врачебно-консультационная
комиссия санатория составляет об этом акт в 2 экземплярах по
утвержденной форме в течение пяти дней с момента поступления
больного в санаторно-курортное учреждение. В нем дают заключе-
ние о возможности оставить больного на данном курорте либо о
необходимости его эвакуации по месту жительства, либо пере-
воде на стационарное лечение в больницу. Один экземпляр акта
направляют в адрес учреждения, необоснованно выдавшего сана-
торно-курортную карту, а второй экземпляр акта остается в
истории болезни в санатории или в курортной поликлинике.
Особенности отбора детей на курортное лечение. При сана-
торно-курортном отборе детей, страдающих хроническими дерма-
тозами, особое внимание следует уделять досанаторной подготов-
ке больных — обследованию, лечению выявленных общих забо-
леваний, желательно в условиях специализированных отде-
лений.
Ниже приводятся показания для курортного лечения детей в
санаториях преимущественно на бальнеологических курортах с
сульфидными и термальными водами: экзема хроническая (истин-
ная, себорейная, микробная, пруригинозная); нейродермит—ог-
раниченный и диффузный; псориаз, в том числе начальные формы
псориатической артопатии без необходимости постельного режима;
крапивница; склеродермия, кроме системных форм; плешивость
гнездная и тотальная; ихтиоз, кератодермия; нарушения пигмен-
тации кожи; дисгидроз; врожденная пузырчатка (простая
форма).
Лечение в поликлинических условиях на указанных бальнео-
логических курортах показано детям с нераспространенной фор-
мой экземы, нейродермита, псориаза, склеродермии, почесухи,
крапивницы.
Детей, у которых заболевание склонно к обострению в лет-
нее время года, следует направлять на курорт в осенне-зимний
период, а детей, страдающих ихтиозом, зимней формой псориаза,
желательно направлять на курорт в летнее время года.
На лечение в санатории со сроком пребывания 45 дней пред-
почтительнее направлять детей, у которых дерматоз склонен к
частым рецидивам, протекает с выраженным зудом, а также детей
младшего возраста. При отсутствии частых и длительных обост-
рений дети могут лечиться в санатории в течение 24 дней, а
также в амбулаторных условиях с применением щадящих методик
бальнеогрязелечения.
Перед направлением ребенка на санаторно-курортное лечение
врач должен организовать клинико-лабораторное обследование, а
также санацию очагов хронической инфекции, противоглистное
или противолямблиозное лечение.
233
Отбор детей пубертатного возраста (12—14 лет) и подрост-
ков (15—17 лет) для санаторно-курортного лечения должен
проводиться с учетом ряда особенностей течения дерматозов в
этот период.
Санаторное лечение необходимо назначать подросткам только
после предварительного стационарного обследования и лечения,
консультации эндокринолога и обязательно в фазе клинической
ремиссии дерматоза. Для реабилитации подростков с заболева-
ниями кожи имеются российские здравницы — санатории «Вос-
ход», «Радуга» (Сочи), «Маяк» (Анапа). Кроме того, можно ис-
пользовать санатории неврологического профиля. В летнее время
целесообразно формирование специальных отрядов в пионерских
лагерях санаторного типа для детей с дерматозами, так как от
пребывания в обычных пионерских лагерях подростки с пораже-
нием кожи нередко отказываются.
Особо следует остановиться на санаторном лечении детей
дошкольного возраста. Им не показана терапия в условиях ку-
рорта.
Реабилитационные мероприятия им целесообразно осуществ-
лять в специальных санаторных группах детских дошкольных уч-
реждений, положение о которых разработано Свердловским
НИКВИ совместно с кафедрой госпитальной педиатрии Свердлов-
ского Государственного ордена Трудового Красного Знамени ме-
дицинского института [Торопова Н. И. и др., 1984].
Санаторные группы создаются органами здравоохранения и
народного образования на базе существующих яслей и детских
комбинатов санаторного типа. Группы должны функционировать
круглосуточно как учреждения интернатского типа, число детей в
каждой группе не более 15—17.
Оздоровлению в санаторных группах подлежат дети, больные
хроническими дерматозами, подверженные частым респираторным
заболеваниям, имеющие очаги хронической инфекции в ЛОР-орга-
нах, желудочно-кишечном тракте, мочевыводящей системе. Пре-
имущество при направлении в детские учреждения санаторного
типа дерматологи и педиатры должны отдавать детям из небла-
гополучных семей, трудно поддающихся лечению в амбулаторных
условиях, отстающим в физическом развитии, неоднократно ле-
чившимся в стационарах. Длительность оздоровления в указанных
учреждениях индивидуальна, но не менее 6 мес.
ПРИНЦИПЫ КУРОРТНОЙ ТЕРАПИИ
Достижения последних лет в изучении патогенеза хронических
дерматозов, механизма действия естественных и преформиро-
ванных физических факторов, а также значительная специализа-
ция и профилизация здравниц диктуют необходимость усовер-
шенствования старых и разработки новых принципов и методов
курортной терапии дерматологических больных. Это особенно
важно, если учесть наблюдающийся в настоящее время рост забо-
234
леваемости псориазом, экземой, аллергическими дерматозами и
др. Наш опыт позволяет следующим образом сформировать ос-
новные принципы курортного лечения хронических дерматозов
независимо от нозологической формы, клинической картины и
течения заболевания.
Первый принцип. Объем и направленность клинико-лабо-
раторных исследований определяются характером дерматоза, а
также реальными возможностями лечебного учреждения, его лабо-
раторной базы. Так, например, весьма желательно у больных
аллергическими дерматозами стремиться выявить скрытые очаги
фокальной инфекции, состояние пищеварительной системы, пери-
ферического кожного анализатора. При наличии показаний сле-
дует консультироваться с врачами смежных специальностей.
Дерматолог-курортолог должен быть осведомлен не только
об имеющейся у больного патологии, но и о тех качествах фи-
зических курортных факторов, которые необходимо использовать
для устранения патологии или ослабления ее действия.
Второй принцип. Курортное лечение должно быть не
только индивидуализированным, но и комплексным, причем комп-
лексность терапии следует рассматривать как сочетание различ-
ных, но индивидуально подобранных лечебных средств, действую-
щих на патогенетические механизмы, лежащие в основе развития
дерматоза у данного конкретного пациента (очаги скрытой фо-
кальной инфекции, аллергию, болезни пищеварительной системы,
нарушения обмена веществ и т. п.).
При наличии в распоряжении врача определенной гаммы физи-
ческих факторов вполне реально использование по-настоящему
комплексных методов терапии, основанных на положении «лечить
не болезнь, а больного со всеми его индивидуальными особенно-
стями».
Третий принцип. Интенсивность курортной терапии
должна зависеть от течения дерматоза, т. е. быть обратно пропор-
циональной его остроте, а также адекватной реактивности орга-
низма.
Известно, что основным критерием в подборе курортных фак-
торов терапии должны служить клинические данные — учет ста-
дии патологического процесса. Так, например, при прогрессирую-
щих стадиях дерматозов считается целесообразным назначение
радоновых ванн, а при стационарных — сульфидных. Однако толь-
ко клинические проявления дерматоза далеко не в полной мере
отражают уровень реактивности организма. Поэтому, помимо уче-
та нозологической формы дерматоза, остроты процесса, для назна-
чения рациональной курортной терапии необходимо проводить
исследования, объективно отражающие состояние реактивности
организма. Особого внимания заслуживают определение функцио-
нального состояния кожи, терморегуляционные реакции, электро-
сопротивляемость, проницаемость рогового слоя и другие тесты.
Следует помнить, что дозировка, т. е. интенсивность назна-
чаемых бальнеотерапевтических и других процедур, должна быть
235
адекватной состоянию (на данном этапе) реактивности больного
человека, защитно-приспособительных резервов, способствовать
мобилизации саногенетических механизмов, а в конечном итоге —
регрессу дерматоза.
Иначе говоря, интенсивность влияния на дерматологического
больного естественных и преформированных курортных факто-
ров должна быть обратно пропорциональна выраженности клини-
ко-функциональных, лабораторных показателей. Последние долж-
ны лечь в основу как первоначального плана терапии, так и по-
следующего — в процессе приема процедур (для прогнозирования
реакции обострения) и перед выпиской из санатория (при опре-
делении рекомендаций к послекурортной терапии).
В зависимости от показателей клинико-функциональных и дру-
гих тестов мы считаем возможным рекомендовать 3 режима (сте-
пени интенсивности) воздействия различными физическими фак-
торами курортов — слабый, умеренно-интенсивный и интенсивный.
Подбор конкретных бальнеологических и других средств для
построения того или иного режима воздействия определяется те-
рапевтическими возможностями курорта. Это относится и к выбо-
ру клинико-функциональных тестов, контроля за проводимой те-
рапией.
Четвертый принцип. В условиях курорта не следует,
как правило, прибегать к назначению лекарственных средств. Это
обосновывается следующими соображениями. Лечебные факторы
курортов сами по себе обладают выраженным саногенным дейст-
вием, оказывают нормализующее влияние на различные органы и
физиологические системы человека. В то же время они имеют ряд
важных преимуществ перед медикаментозными средствами: при
правильной дозировке не вызывают побочных явлений и ослож-
нений, не угнетают естественные факторы защиты, не обладают
аллергизирующими свойствами. Последнее приобретает особое
значение, если учесть роль аллергии в развитии многих дерма-
тозов.
Вопреки существующим представлениям мы считаем оправдан-
ным применение в условиях курорта лекарственных средств лишь
в следующих случаях: 1) если больной длительное время прини-
мает кортикостероиды, которые не могут быть исключены в усло-
виях санатория во избежание развития «синдрома отмены»;
2) если дерматоз резко обострился еще до поступления пациента
в санаторий, после приема первых процедур либо вследствие
нарушенного им режима; 3) если в процессе обследования возни-
кает необходимость проведения этиологической терапии (напри-
мер, обнаружены лямблии в содержимом желчного пузыря и др.).
Пятый принцип. Рекомендации к послекурортной тера-
пии должны обеспечить преемственность в диспансеризации дер-
матологического больного. Для этого необходимо исключить тра-
фаретный подход, объективно оценить результаты клинико-функ-
циональных, лабораторных исследований, проведенных в санато-
рии, их динамику и на этом основании наметить рекомендации на
236
ближайший период времени. Так, например, если на курорте на-
ступила нормализация или наметилась тенденция к нормализации
функционального состояния кожи (независимо от того, сохрани-
лись ди клинические проявления дерматоза), можно ожидать
дальнейшего благоприятного течения болезни. Поэтому данной
категории пациентов следует рекомендовать по прибытии домой
воздержаться от какой-либо активной терапии (за исключением
случаев обострения вследствие реадаптации). Однако при остаю-
щейся резистентности выявленных на курорте нарушений функ-
ционального состояния кожи следует продолжить активную те-
рапию по месту жительства.
Считаем необходимым указать на целесообразность сочетан-
ного использования приведенных природных лечебных факторов
курортов, а также трансформированных физических факторов. В то
же время подчеркиваем несовместимость некоторых процедур
(табл. 2).
Таблица 2. Несовместные процедуры
Процедуры Процедуры, несовместимые в тот же день
Грязевые аппликации Воздушные ванны Морские и речные купании Лечебные и гигиенические ванны Индуктотермия 311, УВЧ, СВЧ Световые ванны Ультрафиолетовые облучения эритемными дозами Четырехкамерные ванны Подводный душ-массаж
Ванны (радоновые, сульфидные, угле- кислые и др.) Ультразвук Аппликации лечебной грязи Морские и речные купании Ультразвук Индуктотерапия ЭП, УВЧ, СВЧ Четырехкамерные ванны Души: Шарко, циркулярный
Реакции организма на бальнеотерапию. В процессе лечения у
больных дерматозами могут возникать реакции общего характера
(бессонница, слабость, повышенная возбудимость) и очагового —
со стороны кожного патологического процесса (усиление зуда,
эритема). Значимость этих реакций в прогностическом плане
получает различную трактовку.
Мы убедились в существовании определенного параллелизма
между сроками развития тех или иных реакций и показателями,
характеризующими функциональное состояние кожи, выражен-
ность аллергии, неспецифическую резистентность организма. Это
позволяет нам считать, что при дифференциации бальнеотерапев-
гической реакции физиологического характера от патологической
реакции обострения, своевременном их распознавании и про-
237
гнозировании не следует ограничиться только визуальными
наблюдениями. Необходимы анализ динамики электрофизиологи-
ческих показателей, установление их взаимосвязи и параллелизма
с клиническими проявлениями дерматоза. Это должно опреде-
лять терапевтическую тактику дерматолога. Ее можно, с нашей
точки зрения, отнести к следующим трем вариантам.
Первый вариант. До начала лечения дерматоз находится в
фазе ремиссии, функции кожи (проницаемость рогового слоя,
теплообмен и др.) умеренно нарушены. Возникающие при подоб-
ном исходном состоянии и на фоне первых процедур некоторые
ухудшения показателей функции кожи и аллергической реактив-
ности без видимого обострения клинических проявлений дермато-
за могут рассматриваться как физиологическая реакция. Она так-
же естественна, как, например, умеренная эритема после адекват-
ной дозы УФ-облучения. Подобная реакция на прогноз болезни
не влияет, и бальнеотерапию можно продолжать. Следует лишь
опасаться дополнительной нагрузки, назначения новых процедур.
Ко второму варианту можно отнести случаи, когда в первой
половине курса курортной терапии нарушаются основные функ-
ции кожи, усиливается аллергия, ухудшаются субъективные пока-
затели (зуд, чувство стягивания кожи) и объективные (появляют-
ся отдельные свежие морфологические элементы). Это можно
расценивать как бальнеотерапевтическую реакцию, отрицательно
влияющую на течение и прогноз болезни. Совершенно очевидна
в этих случаях тактика врача: отмена бальнеотерапии, включение
медикаментозных гипосенсибилизирующих средств, а также на-
значение ингаляций димедрола, интраназального электрофореза
хлорида кальция.
В случае необходимости используют симптоматическое наруж-
ное лечение, кортикостероидные мази в течение 3—4 дней. После
регресса патологической реакции процедуры выполняются, но
уменьшается их продолжительность, частота; возможна замена
вида бальнеотерапии (например, сульфидных ванн радоновыми
и т. д.).
Третий вариант: во 2-й половине курса бальнеотерапии су-
щественно нарушается функциональное состояние кожи, значи-
тельно усиливается аллергический фон, ухудшается клиника дер-
матоза. Подобные реакции обострения могут быть результатом
назначения процедур высокого порога действия, интенсивность
которых неадекватна реактивности организма больных на данном
этапе наблюдения либо является следствием влияния других отри-
цательных факторов (нарушение режима, отрицательные гелиогео-
физические условия и др.). Эти негативные реакции неблаго-
приятны, их следует опасаться и предупреждать. Это возможно,
если регулярно следить за функциональным состоянием кожи:
реакции обострения, как показали наши наблюдения, предшест-
вует ухудшение показателей электрофизических исследований —
повышение проницаемости рогового слоя, нарушение теплооб-
мена и др.
238
Возникшая реакция обострения служит основанием для пре-
кращения бальнеотерапии и назначения медикаментозных средств.
Возобновление процедур по облегченной методике допускается
только после регресса свежих морфологических элементов сыпи,
относительной нормализации функционального состояния кожи.
Знание и своевременный учет климатических факторов имеют
значение для профилактики метеотропных реакций, которые в
ряде случаев могут, по-видимому, способствовать развитию забо-
леваний, в том числе обострению дерматоза. Особенно важно
прогнозировать погодные гелиогеофизические процессы, обуслов-
ливающие метеопатические эффекты атмосферы у дерматологиче-
ских больных, страдающих гипертонией, ишемической болезнью
сердца, бронхиальной астмой, вегетососудистой дистонией.
Своевременная информация дерматологов-курортологов о ди-
намике погодных условий и гелиогеофизических факторов, влияю-
щих на организм человека, — важная предпосылка для профилак-
тики метеотропных реакций, обострений заболеваний кожи в пе-
риод бальнеотерапии.
Курортное лечение представляет собой лишь один из мощных
факторов оздоровления дерматологического больного в схеме:
стационар — курорт — поликлиника (диспансер). Лишь при соб-
людении этапности достигаются положительные отдаленные ре-
зультаты лечения, реабилитация больных. В целях достижения
позитивных результатов курортной терапии необходимо обеспе-
чение преемственности, т. е. сотрудничества врачей, наблюдающих
больного до, во время и после его пребывания в санатории.
Глава 7
РОЛЬ ДЕРМАТОВЕНЕРОЛОГИЧЕСКИХ УЧРЕЖДЕНИИ
В ОРГАНИЗАЦИИ ЛЕЧЕБНОЙ ПОМОЩИ
И ДИСПАНСЕРИЗАЦИИ БОЛЬНЫХ
Отечественное здравоохранение как система государственных
социально-экономических и медицинских мероприятий, имеющих
целью сохранить и повысить уровень здоровья каждого отдельного
человека и населения СССР в целом, неразрывно связано с соци-
альной и экономической жизнью общества и само является состав-
ной частью народного хозяйства страны. Повышение потенциала
общественного здоровья — одно из существенных условий про-
гресса экономики, который в свою очередь обеспечивает новые,
все расширяющие возможности активного целенаправленного
осуществления комплексных мер по обеспечению и улучшению
уровня здоровья народа.
Генеральная линия отечественного здравоохранения — профи-
лактическое направление, которое выражается в государственных
мероприятиях, направленных на оздоровление окружающей среды,
труда, быта и отдыха, а также на осуществление широких мер
медицинского порядка. Профилактика — основа деятельности
всех медицинских учреждений и органов здравоохранения, основ-
ное направление в развитии медицинской науки и в системе под-
готовки медицинских кадров.
Организационная структура отечественного здравоохранения
обеспечивает необходимую интеграцию и научно обоснованную
специализацию медицинской помощи народу, позволяет вопло-
тить в жизнь основные принципы здравоохранения — государст-
венный характер, бесплатность, общедоступность квалифицирован-
ной медицинской помощи, профилактическую направленность,
единство теории и практики, участие трудящихся в деятельности
органов и учреждений здравоохранения, гуманизм.
Органы здравоохранения осуществляют руководство всеми
лечебно-профилактическими и санитарно-гигиеническими учреж-
дениями, которые и оказывают различные виды медицинской
помощи непосредственно населению. По разряду дерматовенероло-
гии диагностическую, лечебную и профилактическую функции
несут специализированные диспансеры, больницы, отделения и ка-
бинеты в составе больниц и поликлиник общего профиля.
В 1919 г. в Москве была организована первая венерологи-
ческая амбулатория, название которой уже характеризует основ-
ное направление ее деятельности. В 1921 г. эту амбулаторию
реорганизуют в первый в стране кожно-венерологический диспан-
сер. В 1924 г. в стране насчитывалось всего 24 кожно-венероло-
240
гических диспансера. В настоящее время — их 357. Кроме того,
более чем в 2,5 тыс. лечебно-профилактических учреждений обще-
го профиля функционируют кожно-венерологические отделения
или кабинеты.
Широкая сеть профильных диспансеров, отделений и каби-
нетов обеспечивает доступность медицинской помощи больным
кожными и венерическими болезнями как в городской, так и
в сельской местности.
Стационарная помощь больным оказывается кожно-венероло-
гическими диспансерами, специализированными больницами, а
также отделениями больниц общего профиля, в том числе цент-
ральных районных. В сельских участковых больницах для госпи-
тализации больных дерматозами выделяются палаты. Больные за-
разными кожными болезнями получают стационарную помощь в
специализированных отделениях, больные венерическими болез-
нями — в специально организованных для них отделениях и
больницах.
Кожно-венерологические диспансеры — это специализирован-
ные лечебно-профилактические учреждения, Предназначенные
для проведения профилактических мероприятий по предупреж-
дению венерических и кожных заболеваний, оказанию квалифи-
цированной лечебно-диагностической помощи заболевшим и орга-
низационно-методического руководства борьбой с этими болезня-
ми, осуществляемой учреждениями общей сети здравоохранения и
подведомственными профильными учреждениями в обслуживае-
мом районе. В соответствии с этим в функции кожно-венероло-
гических диспансеров входит:
— оказание диагностической и лечебной помощи больным ве-
нерическими и кожными болезнями; диспансерное наблюдение за
больными;
— госпитализация больных;
— организация активного выявления и учета больных венери-
ческими и заразными кожными болезнями;
— диспансерная работа в очаге заболевания (венерического
или заразного кожного), выявление источников заражения и кон-
тактных с больными лиц, привлечение их к обследованию в мак-
симально короткие сроки;
— осуществление контроля за аккуратностью лечения, а также
за излеченностью больных венерическими и заразными кожными
болезнями после его окончания до снятия с учета;
— организация и осуществление профилактического обследо-
вания на венерические и заразные кожные болезни некоторых
контингентов населения;
— контроль за качеством профилактических обследований
на венерические и кожные болезни лиц некоторых профессий,
осматриваемых в соответствии с действующими инструкциями и
приказами органов здравоохранения;
— оказание организационной и методической помощи аку-
шерско-гинекологическим учреждениям, урологическим кабинетам
241
поликлиник, общесоматическим стационарам и другим лечебно-
профилактическим учреждениям территории по вопросам профи-
лактики венерических и кожных заболеваний, контроль за качест-
вом и полнотой осуществления ими профилактических мероприя-
тий;
— проведение мероприятий по повышению квалификации вра-
чей и средних медицинских работников подведомственных кожно-
венерологических диспансеров, отделений и кабинетов, а также
лечебно-профилактических учреждений общего профиля по раз-
личным вопросам диагностики, лечения и профилактики венериче-
ских и кожных заболеваний на рабочих местах или путем органи-
зации краткосрочных курсовых мероприятий с привлечением для
участия в последних научных работников научно-исследователь-
ских институтов или кафедр медицинских вузов;
— пропаганда здорового образа жизни как среди больных,
так и среди населения по профильной тематике, совместная дея-
тельность в этом направлении с Центрами здоровья;
— осуществление прямой связи с территориальными санитар-
но-эпидемиологическими станциями по различным общим вопро-
сам противоэпидемической деятельности в деле профилактики
венерических и заразных кожных заболеваний;
— регулярный анализ состояния дерматовенерологической по-
мощи населению обслуживаемого района, уровня и динамики забо-
леваемости венерическими и кожными болезнями, эпидемиологи-
ческих особенностей их; разработка мер по борьбе с ними;
— оказание помощи органам здравоохранения в планировании
организационных мероприятий по аспектам дерматологии и вене-
рологии; составление отчетов о заболеваемости и деятельности
учреждения; оказание помощи органам здравоохранения респуб-
лик, краев, областей и городов (соответствующими кожно-венеро-
логическими диспансерами) в приеме отчетов подведомственных
специализированных диспансеров и составлении сводных отчетов
по профилю в разрезе республик (краев, областей, городов);
— участие в штабах и междуведомственных комиссиях по
борьбе с венерическими и заразными кожными болезнями на
соответствующем уровне; участие в подготовке материалов для
указанных штабов и комиссий;
— информация вышестоящих органов здравоохранения, а при
необходимости органов управления на местах о состоянии заболе-
ваемости венерическими и заразными кожными болезнями, мерах
борьбы с ними и других вопросов организации дерматовенероло-
гической помощи населению;
— участие в работе филиалов Всесоюзного научного общества
дерм атовенерологов;
— внедрение научных достижений в практику здравоохране-
ния; использование передовых методов работы кожно-венерологи-
ческих учреждений.
Объем работы по каждому функциональному разделу деятель-
ности кожно-венерологического диспансера разный, он больше в
242
разрезе республики, края и т. п. и меньше, естественно, в раз-
резе района.
Оказанию высококвалифицированной помощи по диагностике,
лечению и предупреждению кожных и венерических заболеваний
способствует обширная деятельность специализированных научно-
исследовательских институтов (их в стране 5) и кафедр меди-
цинских вузов (64). Разрабатываемые ими методы лабораторной
диагностики, клинйко-патогенетической характеристики заболева-
ний, методики лечения, меры общественной и индивидуальной
профилактики болезней, критерии оценки качества дерматовенеро-
логической помощи населению, формы учета и отчетности и
другие вопросы обсуждаются на съездах Всесоюзного научного
общества дерматовенерологов и его филиалов, на научно-практи-
ческих конференциях, публикуются в журнале «Вестник дерма-
тологии и венерологии», оформляются в виде инструкций и мето-
дических указаний, утверждаемых Министерством здравоохра-
нения РФ и соответствующими министерствами, приказов этих
министерств. Только Центральным научно-исследовательским
кожно-венерологическим институтом Минздрава РФ за время
своего существования разработано, издано и разослано на места
около 500 инструктивно-методических материалов по актуальным
вопросам дерматовенерологии.
Все это позволяет, во-первых, унифицировать ряд диагностиче-
ских и лечебных мероприятий. Например, унифицированы методы
лабораторной диагностики и терапии больных венерическими бо-
лезнями, методики ПУВА-терапии при псориазе, применения лазе-
ров у больных некоторыми дерматозами и т. п. Во-вторых, издание
массовым тиражом методической литературы по наиболее совре-
менным аспектам дерматологии и венерологии делает возможным
оказание высококвалифицированной помощи больным в самых
отдаленных территориях нашей страны. Способствует этому также
постоянно действующая система специализации и повышения ква-
лификации врачей по дерматовенерологии через институты усовер-
шенствования врачей, клиническую ординатуру на базе научно-
исследовательских институтов и кафедр ведущих медицинских
вузов, курсовые мероприятия (декадники, семинары, курсы стажи-
ровки и информации) на базе НИИ. Большое значение в распро-
странении новых данных в области диагностики, лечения и
профилактики кожных и венерических заболеваний имеют Все-
российское научное общество дерматовенерологов и его филиалы
на местах, научно-практические конференции, проводимые НИИ
и республиканскими (краевыми, областными, городскими) диспан-
серами, рабочие совещания, организуемые министерствами здраво-
охранения РФ, краевыми, областными, городскими органами
здравоохранения.
Хорошо зарекомендовали себя в последние годы выезды ве-
дущих специалистов ЦК В И — профессоров, докторов и канди-
датов наук для оказания практической помощи органам и учреж-
дениям здравоохранения по актуальным вопросам дерматовене-
243
рологии. Проводимые при этом практические занятия с меди-
цинскими работниками по лабораторной диагностике венерических
и кожных заболеваний, консультации больных наиболее тяже-
лыми, трудно диагностируемыми, плохо поддающимися терапии
дерматозами, семинары, беседы, лекции с изложением новых
данных в науке, разноплановые практические рекомендации много
помогают в совершенствовании лечебной помощи больным дерма-
товенерологического профиля. Такие выезды получили одобрение
органов и учреждений здравоохранения в различных регионах
нашей страны.
Широко в стране организована консультативная помощь боль-
ным. В соответствии с приказом Министерства здравоохранения
РФ при ЦКВИ организовано научно-консультативное поликли-
ническое отделение, в котором получают квалифицированную кон-
сультацию тысячи больных из разных районов страны по поводу
неясных диагнозов, трудностей терапии и т. п. Аналогичные отде-
ления создаются и в других научно-исследовательских кожно-
венерологических институтах. Свою значительную долю в повыше-
нии эффективности лечебных мероприятий для дерматологических
больных и профессионального мастерства практических врачей
вносят давно ставшие обыденными постоянно (как правило, еже-
недельно) проводимые консультации больных профессорами и до-
центами кафедр, ведущими специалистами НИИ. На них широко
обсуждаются клинические и терапевтические особенности каждого
консультируемого пациента. Поскольку такие консультации прово-
дятся в присутствии большого числа практических врачей — со-
трудников данного диспансера или других диспансеров (отделений,
кабинетов) города, они являются хорошей школой для повышения
Профессиональной квалификации последних.
В последние годы все большую привлекательность приобре-
тают в медицине научно-практические объединения, т. е. более
тесное слияние научных и практических структур здравоохране-
ния, позволяющее новейшим научным результатам сразу без про-
медления находить базу для своего практического воплощения.
До определенной степени принцип единства учреждений науки и
практики в дерматовенерологии соблюден — все кафедры меди-
цинских вузов, большинство НИИ осуществляют свою деятель-
ность на базе крупных (республиканских, краевых, областных, го-
родских) кожно-венерологических диспансеров или специализиро-
ванных клинических больниц. Но разная ведомственная подчинен-
ность, бюджетная разобщенность, нерешенность ряда организа-
ционных вопросов (о приоритетности основных направлений, о
функциональной сопряженности работы врачей и научных работ-
ников, о рациональной форме управления научно-практическим
комплексом и др.) не позволяют пока говорить о функционально
и структурно едином научно-практическом учреждении. Однако за
такими объединениями будущее. В дерматовенерологии сейчас
направление на создание городских центров преимущественно
консультативного направления: в Москве в 1985—1986 гг. органи-
244
зованы центр по оказанию помощи больным грибковыми болез-
нями кожи и ее придатков; центр по детской дерматологии; центр
по снятию с учета больных венерическими болезнями; центр
по оказанию медицинской помощи больным герпетической
инфекцией. К работе центров активно привлекаются наиболее
квалифицированные по данным вопросам специалисты. Первые
шаги работы таких центров обнадеживают. Из сети кожно-венеро-
логических диспансеров, отделений, кабинетов наиболее совершен-
ным и многосторонним звеном является диспансер. Преобладаю-
щее большинство диспансеров в своем составе имеют стационар-
ное и поликлиническое отделения, клинико-диагностические и
серологические лаборатории, во всех крупных диспансерах развер-
нуты бактериологические лаборатории. Во многих городах и рай-
онах страны организованы централизованные серологические и
бактериологические лаборатории, владеющие постановкой совре-
менных методов лабораторной диагностики венерических заболе-
ваний. Предпринимаются шаги по внедрению в практику методов
лабораторного диагностирования других болезней, передающихся
половым путем.
Прием пациентов в диспансере проводится, как правило, раз-
дельно по профилю больных: для больных сифилисом, для боль-
ных гонореей и негонококковыми воспалительными заболеваниями
мочеполовых органов, для больных дерматомикозами и для боль-
ных другими кожными болезнями. Прием больных гонореей про-
водят раздельно по полу. Детей, больных дерматозами, принимают
дерматовенерологи на базе территориальных детских поликлиник.
Лечение больных кожными и венерическими болезнями в ста-
ционаре и амбулаторных условиях проводится бесплатно.
Не оплачиваются больными все виды лабораторных исследо-
ваний, прием у врача, лечебные процедуры. Все эти виды расходов
берет на себя государство. Бесплатно проводятся и профилакти-
ческие обследования и осмотры, за исключением периодических,
установленных для лиц некоторых профессий. Расходы при этом
несет предприятие (учреждение) по месту работы обследуемых.
В ряде крупных и курортных городов помощь больным дерма-
тозами может быть оказана в поликлиниках, работающих по
хозрасчетному методу.
Кожно-венерологические диспансеры, отделения и кабинеты
организуются по единым штатным нормативам, исходя из нагруз-
ки врача-дерматовенеролога, на амбулаторном приеме — 7,5 чело-
век за час работы и в стационаре — 40 коек на одну должность
врача. В настоящее время, по действующим штатным нормативам,
утвержденным Министерством здравоохранения РФ, в город-
ских диспансерах должности врачей дерматовенерологов для ока-
зания амбулаторной помощи устанавливаются из расчета 0,55
должности на 10 тысяч населения. При обслуживании городским
диспансером сельского населения прилегающих к городу районов
в его штате дополнительно устанавливаются должности врачей из
расчета 0,2 должности на 10 тыс. населения (взрослых и детей)
245
этих районов. Должности врачей для обеспечения амбулаторного
приема и организационно-методической работы в штате республи-
канских (краевых, областных) диспансеров устанавливаются из
расчета 0,3 должности на 100 тыс. населения.
В современных условиях расчет штатных должностей врачей
по дерматовенерологическому профилю на основании единой
нормы нагрузки уже не может удовлетворить. Многопрофильность
патологии требует дифференцированных норм нагрузки врачей —
при приеме больных гонореей и негонококковыми воспалитель-
ными заболеваниями мочеполовых органов работа врачей анало-
гична работе урологов и акушеров-гинекологов, при приеме де-
тей — работе педиатров, при приеме больных сифилисом и дер-
матозами — работе терапевтов. Нормы нагрузки врача-дермато-
венеролога в этих случаях должны соответствовать нормам
нагрузки врачей указанных специальностей. Нагрузка врачей в
кожно-венерологических стационарах также требует пересмот-
ра — в стационарах для взрослых она должна быть одной, в ста-
ционарах для детей — другой, при госпитализации больных вене-
рическими болезнями — иной, чем при госпитализации дермато-
логических больных. В настоящее время руководителям учрежде-
ний здравоохранение предоставлено право устанавливать штатное
расписание в пределах фонда заработной платы и индивидуальные
нормы нагрузки работников. Штатные нормативы имеют только
рекомендательный характер.
Однако было бы неверно для совершенствования дерматовене-
рологической службы в свете поставленных перед нею задач
идти лишь по пути наращивания кадрового потенциала. Необходи-
мо всемерно творчески развивать и более эффективно использо-
вать возможности диспансерного метода. Становление этого
метода имеет свою историю.
Наиболее удачно синтезирующий лечебную и предупредитель-
ную деятельность, являясь оптимальной формой реализации
профилактического направления, ставший в настоящее время
основным в работе всех лечебно-профилактических учреждений
диспансерный метод в стране прежде всего стал применяться в
борьбе с социальными болезнями — туберкулезом и сифилисом.
Борьба с этими инфекциями была поставлена в качестве одной
из первоочередных задач в 1919 г. А для реализации лечебно-
профилактической деятельности в этом направлении стали созда-
вать специальные медицинские учреждения — диспансеры (от
французского слова dispensaire < dispenser раздавать, избавлять,
освобождать).
В 1922 г. был издан специальный циркуляр Наркомздрава
РСФСР, подписанный Н. А. Семашко, в котором были сформули-
рованы задачи работы диспансеров, первоначально включающие в
себя выявление больных социальными болезнями путем регуляр-
ного осмотра рабочих и служащих (а также членов их семей) на
фабриках и заводах, регулярное проведение медосмотров детей в
детских домах, систематическое гигиеническое воспитание боль-
246
ных и населения, оказание квалифицированной врачебной помощи.
Затем диспансерный метод работы нашел применение в облас-
ти охраны материнства и младенчества, в борьбе с профессиональ-
ными заболеваниями, в том числе кожными, стал основным в
борьбе с заразными дерматозами — грибковыми кожными болез-
нями, чесоткой, лепрой, гнойничковыми заболеваниями.
По предложению 3. П. Соловьева, сделанному им в докладе
«О профилактических задачах лечебной помощи» на V Всероссий-
ском съезде здравотделов в 1924 г., съезд принял решение о рас-
пространении диспансерного метода на все лечебные учреждения.
Однако прошло немало времени, прежде чем это решение было
полностью претворено в жизнь. Лишь в 50-х годах диспансерный
метод стал всеобщим, обязательным, ведущим методом работы
всех лечебно-профилактических учреждений.
В дерматологической практике пятидесятые и начало шести-
десятых годов характеризуются интенсивным развитием диспансе-
ризации больных незаразными кожными болезнями — экземой,
нейродермитом, псориазом, красной волчанкой и другими тяжелы-
ми, хронически протекающими дерматозами. Изучались распрост-
раненность этих недугов среди населения, структура заболевае-
мости по данным обращаемости в кожно-венерологические диспан-
серы (отделения, кабинеты), проводился учет соответствующих
больных, разрабатывались методы терапии, в т. ч. противорецидив-
ной, и критерии эффективности диспансеризации; определялось
значение факторов труда и быта в патогенезе дерматозов и реа-
билитации больных; активизировалась санитарно-просветительная
работа среди населения.
Особое внимание диспансеризации больных кожными заболе-
ваниями в то время уделялось кожно-венерологическими учреж-
дениями Москвы и Московской области, Ленинграда и Ленинград-
ской области, Уфы, Иркутска и других городов страны. Однако
критерии отбора больных для диспансеризации были достаточно
суровы и общее число диспансеризированных больных не было
большим. В Москве в 1961 г. на диспансерном учете состояло всего
1500 больных дерматозами, из них более половины составляли
больные экземой, 19 % — псориазом, 5,6 % — красной волчанкой,
4,5 % — нейродермитом.
Уже в первые годы работы по диспансерному наблюдению
больных хроническими болезнями кожи выявилась его значитель-
ная эффективность. Так, в Ленинграде за первый год работы число
дней нетрудоспособности, связанной с указанными дерматозами,
снизилось в 5 раз, за второй год — в 15 раз.
В целом в здравоохранении страны в эти годы диспансериза-
ция развивалась по производственному и территориальному прин-
ципам по двум направлениям: диспансерный метод распространял-
ся на больных хроническими заболеваниями и на здоровых,
объединенных общими производственно-профессиональными усло-
виями. В дальнейшем развитие шло по возрастанию количествен-
ных характеристик — расширялись контингенты больных, увели-
247
чивалось число групп здорового населения, подлежащего диспан-
серному наблюдению.
Современная венерология, кроме классических венерических
болезней (сифилис, гонорея, мягкий шанкр, паховая лимфограну-
лема, донованоз), охватывает ряд нозологических единиц, роль
которых как болезней, передаваемых половым путем (трихомо-
ниаз, хламидиоз, уреаплазмоз, гарднереллез, кандидоз, гени-
тальный герпес, остроконечные кондилома и ДР-)» является зна-
чительной в патологии мочеполовых органов мужчин, женщин
и детей.
При всех болезнях, передаваемых половым путем, важность
проблемы обусловлена не только чрезвычайно широким распро-
странением заболеваний, их опасностью для здоровья заболев-
шего, его окружения, но и тяжелыми последствиями осложнений.
Они являются причиной развивающегося бесплодия, патологии
беременности, родов и новорожденных, детской смертности, не-
полноценного потомства и ряда других патологических состояний
организма, определяющих как здоровье населения в целом, так и
демографическое состояние общества.
Принимая во внимание известную нестабильность социально-
экономических и психологических отношений в целом в стране,
приведших к социальному расслоению населения и повлиявших
на поведенческие реакции людей, их отношение к собственному
здоровью, профессиональной коммерциализации интимных отно-
шений, обусловивших увеличение в обществе рынка секса и прос-
титуции (женской и мужской), наркомании, алкоголизации, гомо-
сексуальных связей, а также резкое увеличение миграции (пере-
селенцы, беженцы, лица без определенного места жительства,
межрегиональный и межгосударственный бизнес), можно пред-
полагать широкое распространение заболеваний, передаваемых
половым путем, медленно развивающиеся эпидемические процессы
среди населения, которые в ближайшие годы приведут к резкому
увеличению числа регистрируемых больных.
Учитывая эти и другие факторы, влияющие на распростране-
ние заболеваний, передаваемых половым путем, Министерство
здравоохранения Российской Федерации издало приказ № 286 от
7 декабря 1993 года «О совершенствовании контроля за заболе-
ваниями, передаваемыми половым путем», которым предусмат-
ривается ряд новых подходов к учету, отчетности, диагностике,
лечению и профилактике заболеваний, передаваемых половым
путем.
Без точного, полного и оперативного учета больных с забо-
леваниями, передаваемыми половым путем, эффективный конт-
роль за их распространением среди населения невозможен. На
всей территории России должен проводиться учет больных по
форме № 089/у—93 г., утвержденной названным приказом. Учет-
ная форма составляется при первичном установлении оконча-
тельного диагноза и при реинфекции. Отчетными формами явля-
ются «Отчет о заболеваниях, передаваемых преимущественно
248
половым путем, грибковых кожных заболеваниях и чесотке»
(форма № 9) и «Отчет о больных заболеваниями, передаваемыми
преимущественно половым путем, грибковыми кожными болезня-
ми и чесоткой» (форма № 34), утвержденные Госкомстатом Рос-
сии 10 июня 1993 года № 83. В учетно-отчетные формы, помимо
ранее учитываемых заболеваний сифилисом, гонореей и трихомо-
ниазом, внесены и другие нозологии заболеваний: хламидиоз,
уреаплазмоз, гарднереллез, кандидоз урогенитальный, герпес уро-
генитальный и остроконечные кондиломы. Предусмотрено, что
больные с названными нозологиями должны быть взяты на дис-
пансерное наблюдение, также как при сифилисе и гонорее.
Отчеты составляются кожно-венерологическими институтами,
имеющими диспансерные отделения, кожно-венерологическими
диспансерами, городскими и сельскими больницами (самостоя-
тельными поликлиниками), имеющими кожно-венерологические
кабинеты, женские консультации, урологические кабинеты. Отчет
составляется также районными больницами (поликлиниками) и
женскими консультациями независимо от наличия кожно-вене-
рологических кабинетов (первыми в случае отсутствия в районном
центре самостоятельного кожно-венерологического диспансера).
В отчеты включаются сведения о всех больных, лечение и
наблюдение за которыми осуществляется данным учреждением,
независимо от места жительства больного, и не включаются сведе-
ния о больных, обратившихся за консультацией и лечением, но
состоящих под диспансерным наблюдением в других лечебно-
профилактических учреждениях.
Лечение больных заболеваниями, передаваемыми половым пу-
тем, проводится в соответствии с прилагаемыми в данном сбор-
нике материалами, а лечение и профилактика сифилиса и гоно-
реи — в соответствии с методами, изложенными в методических
рекомендациях, утвержденных Минздравом России в декабре
1993 г.
Кожно-венерологический диспансер является организационно-
методическим центром по эпидемиологическому надзору за бо-
лезнями, передаваемыми половым путем, в районе, области.
Одним из основных и эффективных мероприятий, направлен-
ных на активное выявление больных названными болезнями,
являются выявление и обследование контактов больного и уста-
новление среди них источника заражения, т. е. работа в очаге
заражения. Из больных, выявленных активно при всех видах
профилактических обследований, самый высокий удельный вес
относится к тем, которые в разных территориях выявляются не-
посредственно в очагах заболевания — от 30 до 60 %.
При работе в очаге надо обращать внимание прежде всего
на установление контактных лиц, их обследование в кратчайшие
сроки. При этом контактным лицом необходимо считать и тех
людей, которые не имеют паспортных данных, разыскивать их и
по сведениям, имеющим относительное значение, или описатель-
ному портрету. Критерием оценки работы каждого врача и учреж-
249
дения в целом по выявлению больных в очаге заболевания должны
быть число половых контактов на одного больного и сроки привле-
чения их к обследованию. Источники заражения устанавлива-
ются из выявленных и обследованных половых контактов и, чем
более полно будут выявляться контакты, тем выше будет процент
установления источников.
Работу в очаге заболеваний проводят врач, установивший
диагноз заболевания, и медицинская сестра амбулаторного прие-
ма, а также оперативные отряды (группы), там вде они органи-
зованы. Врач-дерматовенеролог, работающий в анонимном каби-
нете, не освобождается от работы в очаге заболевания, наоборот,
он должен тактично проявить определенную настойчивость, чтобы
получить сведения о половых (или бытовых) контактах больного,
принять необходимые меры для скорейшего и качественного их
обследования.
В целях охраны здоровья населения, предотвращения распро-
странения заболеваний, передаваемых половым путем, их актив-
ного выявления и в соответствии с п. 2 ст. 24 «Закона Российской
Федерации от 19.04.91 г. № 1034-1 «О санитарно-эпидемиологи-
ческом благополучии населения», значительная роль отводится
медицинским осмотрам и обследованиям лиц, поступающих на
работу и работающих в детских учреждениях, коммунальных и
пищевых предприятиях, шоферов такси и грузовых машин, совер-
шающих междугородные перевозки, и других, проводимым в соот-
ветствии с инструкцией Минздрава РФ, утвержденной в 1993 г.
приказом Минздрава РФ № 286. Обязательные профилактические
осмотры в своем большинстве проводятся в кабинетах при кожно-
венерологических диспансерах или центральных районных больни-
цах, что, несомненно, способствует более квалифицированному про-
ведению освидетельствования. На некоторых территориях (облас-
тях и крупных городах) организованы поликлиники профилакти-
ческих обследований, имеющие свою лабораторную базу и осна-
щенные необходимым оборудованием. Это положительный опыт.
Однако многие контингенты еще осматриваются в учреждениях и
на предприятиях, где они работают, причем в условиях, не соот-
ветствующих требованиям санэпиднадзора. В районах должны
обратить на это особое внимание, так как осмотры проводятся
в таких условиях некачественно, ограничиваясь только осмотром
тела при недостаточной освещенности и отсутствии возможности
взять материал из мочеполовых органов для лабораторных иссле-
дований, что резко снижает выявление больных.
Названная инструкция предусматривает минимум периодич-
ности осмотров и числа осматриваемых контингентов, однако в
настоящее время на многих территориях по решению местных
органов расширяются контингенты осматриваемых: осматриваются
периодически все шоферы и подсобные рабочие магазинов, авто-
слесари, диспетчеры, заправщики автохозяйств, все водители
городского авто- и электротранспорта, кондукторы, контролеры
всех видов общественного транспорта, работники спиртовых,
250
ликеро-водочных и винодельческих заводов, работники овощехра-
нилищ, работники предприятий по санитарно-гигиеническому об-
служиванию населения, спортивных сооружений, гостиниц, лица,
посещающие поликлиники и женские консультации, учащиеся
техникумов, училищ, общеобразовательных школ, студенты вузов
(целевые осмотры и периодические), вступающие в брак, направ-
ляемые на аборт, находящиеся на учете в психоневрологических
учреждениях, поступающие на любую работу, в том числе по
оргнабору и приезжающие на новое место жительства беженцы,
переселенцы; коммерсанты и бизнесмены коммерческих структур;
лица, задержанные органами милиции и находящиеся в заклю-
чении, условно-досрочно освобожденные, условно осужденные,
состоящие на учете в спецкомендатурах и др. При этом указан-
ные осмотры проводятся по нескольку раз в год (2—4 раза) с обя-
зательными лабораторными исследованиями. Чем больше будет
охвачено население осмотрами, тем быстрее будет исчерпан скры-
тый резерв инфекций, тем меньше будет регистрироваться лиц
с заболеваниями, передаваемыми половым путем.
Один из значительных путей уменьшения скрытого резерва
венерических заболеваний — это резкое усиление работы по актив-
ному выявлению населения так называемых групп риска. .На
каждой территории группами риска могут быть различные кон-
тингенты. Устанавливаются эти группы по уровню заболеваемости
на 1000, 10 000, 100 000 лиц в данной группе или по специальной
формуле.
Межведомственные комиссии по эпидемическим показаниям
на своей территории имеют право давать предложения местным
исполнительным органам о принятии решения по расширению кон-
тингентов обследуемых лиц (в том числе и групп риска) и увели-
чению кратности обследования с обязательными лабораторными
исследованиями. Последние резко повышают выявление больных,
так как позволяют устанавливать скрытые, малосимптомные фор-
мы заболеваний, чего не дают только лишь осмотры тела.
Важной задачей органов и учреждений здравоохранения явля-
ется широкое привлечение к противовенерической пропаганде
местной печати, кино, радио, что обеспечит лучшую информацию
широких слоев населения и будет способствовать самостоятельной
явке больных к врачу. Следует шире использовать такие возмож-
ности предприятий, агропромышленных комплексов, местные ра-
диотрансляционные установки.
Большую роль в пропаганде санитарно-гигиенических знаний
и профилактике болезней, передаваемых половым путем, играет
санитарно-просветительная работа, проводимая медицинскими ра-
ботниками. Их задача — не только сообщать населению медицин-
скую информацию, но и воспитывать разумное отношение к своему
здоровью и здоровью других людей, поднимать на высокий уро-
вень санитарную культуру. В этой работе активное участие долж-
ны принимать акушеры-гинекологи, урологи, терапевты, невропато-
логи, педиатры и другие специалисты.
251
Для проведения диспансеризации, кроме амбулаторно-поликли-
нических учреждений города и села, используют также дис-
пансеры, стационары больниц и другие учреждения здравоохране-
ния.
Исполняя свои функции в соответствии с местом и ролью,
отведенными диспансерам в общей системе диспансеризации, кож-
но-венерологические диспансеры осуществляют диспансерное
наблюдение за всеми выявленными и обратившимися самостоя-
тельно больными кожными и венерическими болезнями. И диспан-
серный метод здесь развивается в направлении увеличения числа
нозологических форм, при которых показана диспансеризация, и
расширения контингента лиц, подлежащих диспансеризации в
соответствии с полом, возрастом, физиологическим состоянием,
профессией, степенью риска в отношении возникновения этих
болезней. Поэтапность расширения перечня нозологических форм
дерматозов и болезней, передающихся половым путем, должна
на конечном этапе привести к распространению этого метода
на всех больных данного профиля. Естественно, отпадает необхо-
димость ограничивать число больных, находящихся на диспан-
серном наблюдении у одного врача дерматовенеролога, 80—
120 пациентами. Подвергнутся существенному пересмотру сроки
диспансерного наблюдения больных некоторыми дерматозами,
которые должны будут находиться под таким наблюдением всю
жизнь.
В настоящее время подлежат диспансеризации у врача-дерма-
товенеролога пациенты с заболеваниями, передаваемыми половым
путем, с дерматомикозами, висцеральными и глубокими мико-
зами, лепрой, чесоткой, профессиональными болезнями кожи, хро-
нической пиодермией, рецидивирующим фурункулезом, зудящими
дерматозами (экземой, нейродермитом, пруриго, атопическим дер-
матитом), рецидивирующей крапивницей, псориазом, красной вол-
чанкой, склеродермией, дерматомиозитом, фотодерматозами,
поздней порфирией кожи, красным плоским лишаем, многоформ-
ной эксудативной рецидивирующей эритемой, васкулитами, панни-
кулитами, узловатой эритемой, пузырными дерматозами (всеми
формами пузырчатки, герпетиформным дерматитом Дюринга,
буллезным пемфигоидом), парапсориазом бляшечным и лихеноид-
ным, ретикулезом, грибовидным микозом, ретикулосаркоматозом,
саркомой Капоши, доброкачественными опухолями кожи, предра-
ковыми и предопухолевыми состояниями кожи и слизистых, бо-
лезнью Реклингхаузена (нейрофиброматозом), саркоидозом, оз-
ноблением, туберкулезом кожи, в том числе волчанкой обыкно-
венной, липоидным некробиозом, амилоидозом, микседемой кожи,
муцинозом, алопецией, розовыми угрями, угрями обыкновенными
(пустулезными и конглобатными формами), хейлитами (эксфо-
лиативными, преканкрозными, актиническими, метеорологическими
и другими формами), лейкоплакиями, баланопоститами, крауро-
зом, генодерматозами (дискератозом Дарье, кератодермиями,
ихтиозом и др.).
252
Особое значение при диспансеризации по дерматовенерологи-
ческому профилю имеет определение факторов и групп риска
возникновения венерических и кожных заболеваний. В венероло-
гии вопрос этот достаточно разрешен — к группам риска отно-
сятся половые партнеры заболевших, их члены семьи и близкие
бытовые контакты, лица асоциального поведения (пьяницы, ал-
коголики, тунеядцы, бродяги и т. п.), гомосексуалисты, некоторые
профессиональные группы населения (отдельные категории работ-
ников общепита, торговли, строительных организаций, водители
городского транспорта и др.). При заразных кожных заболеваниях
основные группы риска также известны. Что касается незаразных
кожных заболеваний, то здесь эта сторона вопроса изучена недо-
статочно. Группами риска заболевания профессиональными дерма-
тозами являются лица, имеющие на производстве контакт с вред-
ными веществами (некоторыми смолами, асбоцементом, рядом
химических веществ и т. п.) или работающие в условиях неблаго-
приятных внешних воздействий (температура, влажность, загряз-
ненность воздуха и др.). Группами риска развития некоторых
заболеваний кожи могут считаться лица, работающие в сельском
хозяйстве с дефолиантами, пестицидами. Развитию гнойничковых
болезней кожи способствует микротравматизм, сопровождающий
работу механизаторов, доярок, полеводов, овощеводов, животно-
водов, и поэтому последние также могут быть отнесены к группам
риска по данной патологии.
Дети дошкольного возраста, страдающие экссудативным диа-
тезом, являются группой риска в смысле возможного в дальней-
шем у них развития таких дерматозов, как экзема, нейродермит
и другие аллергические заболевания. К группам риска относятся
члены семьи, в которой имеются больные теми или иными хрони-
ческими болезнями кожи (врожденными, генетически обусловлен-
ными, экземой, нейродермитом, псориазом).
Определению групп риска могут оказать большую помощь об-
наруживаемые при различных лабораторных и инструментальных
обследованиях те или иные изменения во внутренней среде орга-
низма, его иммунологическом, функциональном статусе, фермент-
ной системе и т. п. Так, например, изучение активности в сыво-
ротке крови органоспецифических ферментов эластазы, гистидазы,
уроканиназы позволяет выявлять наиболее угрожаемые в отноше-
нии развития профессиональных дерматозов группы работающих
на химических предприятиях. В дерматологии в настоящее время
накопилось достаточно данных по аллергологическим, функцио-
нальным, иммунологическим, ферментативным, биохимическим
особенностям наиболее распространенных дерматозов, на основа-
нии которых появилась возможность выделить группы риска этих
заболеваний по совокупности признаков. Определение групп рис-
ка, особенно в дерматологии, дело не всегда легкое, однако необ-
ходимое. Группы эти изменчивы и должны быть определяемы в
динамике. Следует иметь в виду и возможное территориальное
различие групп риска кожных и венерических заболеваний, что
253
зависит от краевой патологии, структуры населения, экологических
особенностей региона, промышленной и сельскохозяйственной
специфики народного хозяйства.
В кожно-венерологическом диспансере (отделении, кабинете)
на каждого больного кожным заболеванием, взятого под диспан-
серное наблюдение, кроме оформления амбулаторной карты
(ф. 025/у), заполняется «Контрольная карта диспансерного на-
блюдения (ф. ОЗО/у). Примерная схема динамического диспан-
серного наблюдения у врача дерматовенеролога (по поводу кож-
ных и венерических заболеваний, перечисленных выше) предус-
матривает активный осмотр пациентов от одного до 4 и более
раз в год (вне обострения заболевания, когда показано активное
лечение больного) в зависимости от диагноза, устанавливает
обязательный объем консультативной помощи — другими спе-
циалистами, лабораторной и другой диагностической помощи,
направление основных лечебно-оздоровительных мероприятий.
В качестве критериев оценки эффективности диспансерного
наблюдения больных установлены: уменьшение частоты и тяжести
рецидивов, осложнений, дней временной нетрудоспособности.
При диспансерном наблюдении больных для каждого из них
составляется индивидуальный план лечения (наблюдения) как для
периодов обострения, так и для межрецидивного периода. Подби-
рается оптимальный вариант терапии, учитывающий не только
сиюминутную эффективность применяемых средств и методов
лечения, но и возможные в перспективе осложнения от них (на-
пример, от местного применения кортикостероидных мазей).
В конце календарного года наблюдения должен оформляться
этапный эпикриз и пересматриваться план лечения (наблюдения)
на следующий год. При снятии с диспансерного наблюдения
составляют заключительный эпикриз.
Диспансерное наблюдение начинается с учета и, следовательно,
в диспансерах следует организовать наиболее целесообразную его
форму (различную, по-видимому, в разных учреждениях) на базе
основной учетной документации — амбулаторной карты больного и
карты диспансерного наблюдения. При венерических и заразных
кожных заболеваниях этот вопрос решен, при незаразных дерма-
тозах требует своего решения, поскольку специальной учетной
фррмы для них не предусматривается. Поэтому где и в каком
порядке будет содержаться картотека амбулаторных карт и карт
диспансерного наблюдения больных дерматозами (централизован-
но в регистратуре или по кабинетам, или в специально выделен-
ном для этого помещении), на кого конкретно будет возложена
функция контроля за ее содержанием и использованием (врач,
средний медработник), по какому,принципу она будет составлять-
ся, какие формы взаимодействия между врачами, ведущими
амбулаторный прием больных, и работниками картотеки будут
установлены, формы осуществления информации из стационара,
формы связи с территориальными поликлиниками по вопросам
диспансеризации населения — все эти и многие другие вопросы,
254
связанные с учетом больных дерматозами, могут рационально
реализоваться лишь в конкретных условиях каждого кожно-
венерологического учреждения с учетом материальных и кадровых
ресурсов последних.
Большие перспективы в плане оптимизации проведения массо-
вых профилактических обследований и осмотров населения свя-
заны с применением ЭВМ. Разрабатываемые, а в ряде территорий
уже используемые на их основе автоматизированные системы для
организации и проведения профилактических осмотров («АСУ
диспансеризацией», «АСУ здравоохранением», АСПОН, КАСМОН)
требуют от дерматовенерологов активного участия в разработке
необходимой вводной документации для этих систем, использо-
вания их для диспансеризации в дерматовенерологии (в комплексе
с соответствующими вопросами других медицинских служб) и
контроля за нею, совершенствования управления диспансериза-
цией в пределах профильной дисциплины. Основными критериями
эффективности диспансеризации в дерматовенерологии являются
показатели снижения заболеваемости, уменьшения трудопотерь,
снижения профессиональной патологии, изменения группы дис-
пансерного наблюдения (перевода лиц из группы Д III в группы
Д II или Д I, из группы Д II в группу Д I).
Однако, учитывая длительное хроническое течение почти всех
дерматозов, больные которыми подлежат диспансеризации, сле-
дует постоянно контролировать качество и объем диспансерных
мероприятий у этих больных, а следовательно, оценивать меро-
приятия по различным показателям. При этом контроль осущест-
вляется в разрезе нозологических форм заболевания и в зависимо-
сти от длительности диспансерного наблюдения (1 год, 2, 3...5 и
т. д.). Учитываются здесь число случаев и дней нетрудоспособ-
ности, частота рецидивов заболеваний или их обострений, частота
и продолжительность использования стационарного лечения, ча-
стота изменения условий труда, активность применения санаторно-
курортного лечения, достаточность объема диагностических, лабо-
раторных, консультативных мероприятий, активность диспансер-
ного наблюдения (число активных вызовов пациента) и др. Кроме
того, должны учитываться показатели охвата профилактическими
осмотрами различных контингентов населения врачами дермато-
венерологами.
Глава 8
ГНОЙНИЧКОВЫЕ ЗАБОЛЕВАНИЯ КОЖИ
Гнойничковые заболевания кожи — пиодермиты (от греч.
руоп — гной, derma — кожа) составляют обширную группу раз-
личных по клиническим формам, течению и прогнозу дерматозов,
вызываемых гноеродными кокками — стафилококками и стрепто-
кокками. Возможна этиологическая значимость и ряда других
микроорганизмов (вульгарный протей, синегнойная палочка, мико-
плазмы), выступающих обычно в ассоциациях со стафилококками
и стрептококками. Гнойничковые заболевания могут возникать
первично и как осложнения других заболеваний кожи (чесотка,
диффузный нейродермит, экзема, дерматит, трофические язвы,
лучевые и травматические поражения кожи). Инфицирование
происходит при попадании на кожу пиококков из внешней среды
(экзогенная инфекция) и вследствие активации и внедрения ми-
кробной аутофлоры, обитающей на кожных покровах и слизистых
оболочках.
По данным Комитета экспертов ВОЗ, больные пиодермитами в
экономически развитых странах составляют '/з больных с инфек-
ционной , патологией, более 30 % из них временно утрачивают
трудоспособность [Катханов А. М., 1987]. Имеются указания
(Иванов К. Г., Першин С. С., 1984; Dixons R., 1981] о том, что
'/в всех инфекционных заболеваний этиологически связана со
стафилококками.
Выборочные исследования, проведенные в некоторых регионах
РСФСР и БССР, показали, что на долю гнойно-воспалительных
процессов в общей структуре инфекционной патологии приходится
29 %, а у детей — 37 %. Среди дерматозов пиодермиты занимают
первое место в СССР и за рубежом [Смелов Н. С. и др., 1973;
Федоровская Р. Ф. и др., 1973; Burgoyne В., 1974].
Удельный вес пиодермитов среди всех дерматозов в детском
возрасте — 25—60 % [Скрипкин Ю. К., Зверькова Ф. А. и др.,
1983]. Столь высокая заболеваемость пиодермитами обусловлена
большим распространением пиококков во внешней среде (пыль,
воздух, вода, поверхность окружающих предметов и т. п.), на ко-
же и слизистых оболочках больных и здоровых людей.
При исследовании нормальной микрофлоры кожи и слизистых
оболочек здоровых людей установлено носительство разнообраз-
ных микроорганизмов: стафилококков, стрептококков, сарцин,
дифтероидов, почвенных и грамположительных палочек, кишечной
палочки, плесневых грибов и др. Обсемененность кожи разными
256
микроорганизмами, в том числе стафилококками и стрептококка-
ми, зависит от возраста, индивидуальных особенностей кожных
покровов, условий жизни человека и др.
Частота выявления стафилококков, по данным разных авторов,
составляет 90—100 % от числа обследованных. При этом больше
всего обсеменена кожа складок, подногтевых пространств, сли-
зистые оболочки носа и зева, что может служить источником
эндогенного инфицирования. По нашим данным [Архангель-
ская Е. И., 1973], из числа выделенных от 50 здоровых людей
222 штаммов стафилококков оказалось 40 (18 %) золотистых,
192 (86,5 %) белых. Из этого числа патогенные коагулазопозитив-
ные штаммы составили 11,7 %. Носительство стрептококков встре-
чается значительно реже. Являясь факультативным анаэробом,
стрептококк чаще всего гнездится в крупных складках кожи, где
он был обнаружен у 12 % здоровых людей, а на коже груди —
у 4 %. Половину выделенных штаммов составили гемолитические
стрептококки. В то же время в посевах из зева обнаружен рост
стрептококков, который составил 100 % (50 % — зеленящие
стрептококки, 16 % — не гемолитические и 32 % — гемолитиче-
ские). Обсемененность слизистой оболочки носа стрептококками
была значительно меньше и выявлена у 24 % (из них р-гемоли-
тические — у 16 %). Однако несмотря на большую обсеменен-
ность кожи и слизистых оболочек стафилококками и стрептокок-
ками, последние проявляют свои патогенные свойства только в
случаях нарушения барьерной функции покровов и снижения
сопротивляемости организма.
Этиология. Возбудителями пиодермитов являются стафилокок-
ки и стрептококки, каждому из которых присуща характерная
ответная реакция кожи на внедрившуюся инфекцию. Стафило-
кокки вызывают гнойное воспаление, стрептококки — серозное.
Разнообразие клинических форм зависит от многих факторов —
особенностей возбудителей, сопутствующей флоры в очаге, дейст-
вующей как синергисты или антагонисты, от реактивности орга-
низма.
Стафилококки впервые выделены Пастером в 1878 г. из
гноя фурункула. Они представляют собой клетки правильной ша-
ровидной формы, диаметр которых 0,5—1,5 мкм. Клетки непод-
вижны, располагаются гроздьями, спор не образуют. Стафилокок-
ки хорошо окрашиваются всеми красками, грамположительны.
В старых культурах при t 43—45 °C они могут терять способность
удерживать краску, в гное и экссудатах, внутри лейкоцитов иногда
бывают грамотрицательными. Стафилококки хорошо растут на
питательных средах при t 37 °C, при pH среды 7,2—7,4. Колонии
круглые, блестящие, образуют пигмент темно-золотистого, желтого
или белого цвета, в жидких питательных средах — равномерную
муть и небольшой осадок. На желточно-солевом агаре (ЖСА)
Г. Н. Чистовича колонии стафилококка образуют радужный вен-
чик (лецитиназоположительные), а на средах с кровью — кольца
гемолиза.
9—936
257
В процессе жизнедеятельности стафилококки выделяют экзо-
токсин, обладающий способностью лизировать эритроциты челове-
ка и животных, при внутрикожном введении вызывать некроз
тканей, а при внутривенном — гибель животных. Коагулазу, фи-
бринолизин, лецитиназу, липазу, гиалуронидазу образуют и другие
ферменты.
При электронно-микроскопическом исследовании стафилокок-
ков, выделенных от больных пиодермией, установлено наличие у
них клеточной стенки, цитоплазматической мембраны, мезосом,
нуклеоида и микрокапсулы [Sale L., 1962; Seltman N. et al., 1976).
В препаратах, полученных in vitro, микрокапсула отсутствует.
В цитоплазматической мембране и лизосомах стафилококка
локализуется основная часть ферментных систем [Овчинни-
ков Н. М., Делекторский В. В., 1971; Гельман Н. С. и др., 1972,
1978]. У больных хронической пиодермией наряду с типичными
микроорганизмами обнаруживают атипичные клетки. Существует
мнение, что они возникают в результате применения антибиотиков,
ингибирующих синтез клеточной стенки [Кац Л. Н., 1980]. При
трансформации стафилококков в L-формы тормозится функция их
размножения при сохранности роста. Наряду с этим блокируется
синтез клеточных стенок [Dienes R., 1968], образуются большие
шарообразные клетки [Jterson L. et al., 1964]. При пересеве
материала они принимают исходную форму.
Клетки в состоянии L-формы (форма выживания) обладают
пониженной вирулентностью и могут длительное время не вызы-
вать воспаления, что создает обманчивое впечатление выздоровле-
ния [Овчинников Н. М., Делекторский В. В., 1971, 1973]. Это
необходимо учитывать клиницистам при проведении терапии, про-
филактики рецидивов.
Важнейшей проблемой в изучении инфекций является класси-
фикация микроорганизмов.
Согласно предложению Берда-Паркера (1974), официально
принятому подкомитетом по таксономии стафилококков в 1975 г.
на III Международном симпозиуме по стафилококкам в Варшаве,
род стафилококка включает 3 вида; 1) золотистые стафилококки,
вызывающие заболевание у человека; 2) эпидермальные стафило-
кокки, принимающие участие в патологическом процессе; 3) сап-
рофитные стафилококки (сапрофиты).
Международным комитетом по таксономии в 1965 г. предло-
жено 2 основных теста для дифференцировки золотистого и эпи-
дермального стафилококков — на способность коагулировать плаз-
му и ферментацию манинита в анаэробных условиях.
Ряд авторов [Акатов А. К. и др., 1972, 1983] считают важ-
ным для характеристики золотистого стафилококка также наличие
таких признаков, как способность выделять гиалуронидазу; про-
дуцировать фибринолизин, теллауритредуктазу; золотистый пиг-
мент; хлопьеобразующий фактор, ДНК-активность.
Однако часть признаков, перечисленных выше, может отсут-
ствовать, поэтому вопрос о таксономии стафилококков нельзя
258
считать окончательно решенным. Одно несомненно: патогенность
стафилококковых культур всегда связана с коагулазной активно-
стью.
Существует высокая степень корреляции между патогенностью
стафилококка и его способностью образовывать коагулазу. Коа-
гулаза — экзофермент (фагогруппоспецифичный) легко разруша-
ется протеолитическими ферментами (трипсин, хемотрипсин,
плазмин), инактивируется аскорбиновой кислотой и веществами,
разрушающими белок.
Вопрос о патогенной роли коагулазоотрицательных штаммов
стафилококков, обнаруживаемых при кожных процессах, нельзя
считать решенным. Клинические наблюдения показывают, что ста-
филококки, не обладающие способностью коагулировать плазму,
могут вызывать заболевания кожи. Установлено, что эти штаммы
продуцируют другие ферменты, в частности ДНКазу (она может
также оказывать болезнетворное действие, а в сыворотке крови
обнаруживдются соответствующие антитела). Однако способность
вырабатывать ДНКазу свойственна, как правило, патогенным ста-
филококкам и находится в прямой зависимости от степени про-
дукции коагулазы.
В настоящее время уточняется отношение ДНКазной активно-
сти к другим признакам патогенности с тем, чтобы ввести в прак-
тику этот тест как один из признаков патогенности коагулазоне-
гативных стафилококков, которых принято считать сапрофитами.
В последнее время появились сообщения о том, что высевае-
мость стафилококков из различных патологических очагов у
больных резко снизилась в связи с применением антибиотиков
в неадекватных дозах, которые не убивают стафилококки, а спо-
собствуют их трансформации в L-формы. Такие формы изменчи-
вости утрачивают многие типичные свойства, но сохраняют глав-
ный признак — способность вызывать заболевания.
Считают, что формирование бациллоносительства и хронически
текущих форм пиодермии, появление атипичных форм заболева-
ний и вариантов бактерий с высокой лекарственной устойчиво-
стью обусловлены трансформацией стафилококков в L-формы
[Смирнова А. М. и др., 1977; Агафонова Д. А. и др., 1979; Ака-
тов А. К., Зуева В. С., 1983, и др.].
По данным В. Ф. Имженецкой (1972), при послеоперационных
гнойных процессах (экзогенное инфицирование) были выделены
типичные формы стафилококков у 52 %, а L-формы — у 40 %
больных.
Существует мнение, что белый стафилококк, не коагулирующий
плазму, не типирующийся фагами, часто выделяемый в послед-
нее время при различных гнойных процессах (особенно при
осложнениях после хирургически^ вмешательств), а также из кро-
ви септических больных, есть тоже одна из форм изменчивости
патогенных стафилококков.
Токсические поражения кожи, сопровождающиеся эксфолиа-
цией (синдром Лайелла), имеют разнообразную этиологию, в том
9*
259
числе могут быть вызваны стафилококковой инфекцией. Установ-
лено, что наибольшей способностью вызывать эксфолиативный
процесс обладают стафилококки II фагогруппы, лизирующиеся
фагами ЗА, ЗВ, ЗС, 55, 71 [Lyell et al., 1964].
Особенности течения пузырных и скарлатиноподобных форм и
то, что жидкость в пузырьках стерильна, а фокус стафилококко-
вой инфекции может находиться вдали от места кожного пораже-
ния, позволяют предположить, что эти поражения вызываются
экстрацеллюлярными продуктами, вырабатываемыми патогенными
стафилококками in vivo. Выращивание на средах in vitro не дало
активных препаратов.
Оказалось, что эксфолиативный токсин вырабатывают только
стафилококки II фагогруппы. Гистологические исследования пора-
женных органов показали, что токсин обладает узконаправленным
действием. Он повреждает десмосомы только в зернистом слое
эпидермиса, и как следствие образуются щель и пузырьки. В экс-
перименте эти повреждения развиваются в течение первых 2—
2'/2 ч после инъекции токсина и только в эпидермисе.
Удалось показать, что все 3 формы эксфолиативных пораже-
ний кожи (пузырчатка новорожденных, буллезное импетиго,
скарлатиноподобная сыпь) вызываются только стафилококками
II фагогруппы. Разрабатываются методы определения антител к
эксфолиативному токсину в сыворотке больных.
А. С. Козлюк, И. Г. Шройт (1981) показали, что микоплазмо-
стафилококковая ассоциация обусловливает более интенсивное
размножение, более высокую концентрацию и более длительное
выделение каждого из возбудителей, чем соответствующая моно-
инфекция.
Микоплазмостафилококковая ассоциация приводит к развитию
более тяжелых поражений, чем моноинфекция (воспалительные
процессы имеют выраженный экссудативный компонент, часто с
исходом в фиброзно-некротический процесс, обширные расстрой-
ства микроциркуляции, тромбоз мелких сосудов) (рис. 39).
У таких больных иммунологическая реактивность оказывается в
значительной степени сниженной. По-видимому, это имеет значе-
ние в формировании таких тяжелых форм, как гангренозная пио-
дермия, язвенно-некротическая и др., патогенез которых сложен и
недостаточно ясен.
Особо тяжело и торпидно протекают стафилококковые инфек-
ции у больных диабетом. Больные, у которых хроническое тече-
ние диабета, являются «инкубаторами» патогенных штаммов ста-
филококков, резервуаром сохранения их и диссиминации во внеш-
нюю среду. Малоизученными являются особенности фокальной
гнойной инфекции и ее роли в развитии гнойных заболеваний у
больных диабетом, роли эндогенной и экзогенной инфекции.
Пути передачи стафилококков от основных источников разно-
образны: возможно непосредственно воздушно-капельное инфици-
рование, а также перенос стафилококков загрязненными руками,
через обсемененные предметы, белье.
260
Стафилококки обладают высокой степенью выживаемости во
внешней среде. Они хорошо переносят высыхание, сохраняются в
пыли, распространяются с потоком воздуха на больных, их пос-
тель, белье, передаются через ванны и др. Выживаемость стафи-
лококков в воздухе и на предметах при комнатной температуре
составляет в среднем 35—50 дней.
Особый интерес и значение имеет вопрос о патогенезе так
называемого злостного носителя патогенных стафилококков и
выяснение его роли в распространении инфекции.
В последние годы этому явлению посвящено значительное чи-
сло исследований, но тем не менее многие стороны сложных
взаимоотношений между макро- и микроорганизмом остаются не-
достаточно выясненными.
Известно, что нередко именно «злостные носители» патоген-
ных стафилококков являются основным источником инфицирова-
ния и распространения стафилококковой инфекции в родильных
домах, детских коллективах, больницах, семьях, а также в профес-
сиональной среде.
В целях изучения эпидемиологии стафилококковой инфекции и
более точной идентификации применяют метод фаготипирования,
который позволяет выяснить источники инфицирования и пути пе-
редачи инфекции. Большинство штаммов патогенного стафилокок-
ка типируются с помощью набора специфических бактериофагов
[Чистович Г. Н., 1959].
По мнению Г. Н. Чистовича (1968), потенциальная эпидемио-
логическая опасность присуща патогенным стафилококкам любых
фаготипов и зависит от эпидемиологической ситуации.
Подавляющее большинство стафилококков, выделенных от
больных различными формами стафилококковых и смешанных
стрепто-стафилококковых поражений кожи, имело признаки пато-
генности, обладало резистентностью к антибиотикам и принадле-
жало к III фагогруппе, реже ко II или смешанной фагогруппе в
комплексе с III (при типировании международным набором).
Исследования показали, что циркулирующие в лечебных учрежде-
ниях штаммы стафилококков по некоторым признакам сущест-
венно отличаются от стафилококков, циркулирующих вне лечеб-
ного учреждения. Оказалось, что в стационарах чаще встречаются
стафилококки I и III фагогрупп, а вне стационара — II фаго-
группы. За период пребывания больных в стационаре соответствен-
но увеличивалось число носителей стафилококков I и III фаго-
групп и уменьшалось количество носителей стафилококков II фа-
гогруппы, т. е. происходила замена своего штамма на госпиталь-
ный.
Однако основным лабораторным маркером госпитального
штамма стафилококка является не столько фаготип стафилококка,
сколько полирезистентность его к антибиотикам.
Длительно находящиеся в стационаре больные являются ис-
точниками инфицирования вновь поступивших больных. В этот
процесс включается и персонал больницы.
261
Сопоставление фаготипов стафилококков и групповой принад-
лежности стрептококков, антибиотикограмм и других биологиче-
ских свойств пиококков подтвердило, что у больных пиодермия-
ми первоначальное инфицирование может происходить в результа-
те как аутогенной, так и экзогенной инфекции. В большинстве
случаев возникновение вторичных очагов происходит в основном
вследствие диссеминации пиококков из основных очагов.
Стрептококки (от греч. streptos — цепочка и kokkos —
зерно). Впервые их выделил при роже В. Лукомский (1874), при
сепсисе и гнойных инфекциях — L. Pasteur (1879).
При поверхностных поражениях кожи типа «импетиго» стреп-
тококк впервые выделили Sabouraud (1899), Unna (1900), Jada-
ssohn (1901) и др.
Стрептококки имеют шаровидную форму (диаметр 0,8—1 мкм),
образуют цепи различной длины. Большинство разновидностей
стрептококка — факультативные анаэробы. По характеру роста на
кровяном агаре их подразделяют на гемолитические, зеленящие и
негемолитические [Schothmuller Н., 1903]; по характеру гемоли-
за— на 4 типа: тип 0, образующий прозрачную зону гемолиза
вокруг колонии; тип а, вызывающий зеленоватое свечение и ча-
стичный гемолиз; тип а,, дающий менее выраженный и мутнова-
тый гемолиз; тип У, не вызывающий гемолиза [Smith Т.,
Brown J. Н., 1915; Brown J. Н., 1919]. На основании антигенных
различий группоспецифической С-субстанции их подразделяют на
17 серологических групп [Lancefield R. С., 1928—1941].
P-Гемолитические стрептококки — наиболее часто являются
возбудителями заболеваний у человека. По результатам реакции
агглютинации с антистрептококковыми сыворотками они разде-
лены на 51 серологический тип. Для выделения стрептококков
используют бульоны — сахарный, кровяной, сывороточный, асци-
тический. На твердых питательных средах колонии стрептококка
прозрачные, блестящие, реже — матовые.
С помощью биохимических и иммунологических исследований
установлено, что стрептококки образуют эндо- и экзотоксины,
ферменты.
Экзотоксин обладает цитотоксическим, иммуносупрессивным
и пиогенным действием, эритрогенной активностью, способен вы-
зывать гибель животных, повреждать ткани, подавлять функции
ретикулогистиоцитарной системы, оказывать влияние на проницае-
мость клеточных мембран, повышать чувствительность животных к
эндотоксину. Из экзотоксина стрептококка выделены гемолизин,
лейкотоксин, некротоксин, фибринолизин, токсин летальности, эрит-
рогенный токсин, а из гемолизинов — стрептолизины S, О, G и др.
Стрептококки вырабатывают дезоксирибонуклеазу, гиалурони-
дазу и стрептокиназу, которая растворяет сгусток плазмы, ами-
лазу, вызывающую гидролиз гликогена, крахмала, а также рибо-
нуклеазу, протеиназу и другие ферменты, обеспечивающие
оптимальные условия для питания, роста и размножения микро-
организмов.
262
Вопрос о различии и сходстве стрептококков, вызывающих
разнообразные заболевания, до сих пор является не до конца
выясненным. В научной литературе широко освещены результаты
разносторонних исследований биологических свойств стрептокок-
ков, выделенных при скарлатине, роже, раневых инфекциях,
остеомиелите и др. В то же время совершенно недостаточно изу-
чены стрептококки — возбудители заболеваний кожи. Согласно
нашим данным [Архангельская Е. И., 1979], из 204 штаммов
стрептококков, выделенных из очагов диффузной стрептодермии и
микробной экземы, ft-гемолитические составили 87,2 %, а а-зе-
ленящие— только 12,8 %. Подавляющее большинство штаммов
(95,1 %) были чувствительны к пенициллину. Даже в случаях
полирезистентности к другим антибиотикам чувствительность
стрептококков к пенициллину, как правило, сохранялась; 29,8 %
штаммов были отнесены к серологической группе А, 12 % — к
группе D. Остальные не давали выраженной реакции.
По биологическим свойствам кожные стрептококки характе-
ризуются теми же признаками, что и стрептококки другого про-
исхождения.
Патогенез. Решающую роль в развитии гнойничковых заболе-
ваний кожи играет снижение местной и общей антибактериаль-
ной резистентности организма. Целостность рогового слоя, обла-
дающего большой прочностью и эластичностью, постоянное сбра-
сывание микроорганизмов благодаря слущиванию роговых чешуек,
чему способствует существование положительного электрического
заряда между бактериальными клетками и кожей [Хоронжак Т.
и др., 1975], обеспечивают механическое препятствие для внедре-
ния пиококков. Большое значение имеет так называемая химиче-
ская мантия на коже — отделяемое потовых и сальных желез с
высокой концентрацией водородных ионов (pH 3,5—6,7), обла-
дающая бактерицидными и бактериостатическими свойствами.
Количество секрета и его биохимический состав регулируются
вегетативной нервной системой и эндокринными железами.
К экзогенным факторам, способствующим развитию пиодерми-
тов, относят загрязнение кожи, производственный и бытовой мик-
ротравматизм, сухость кожи, трещины, экскориации кожи при
зудящих дерматозах (нейродермит, чесотка, вшивость и др.),
действие на кожу обезжиривающих и раздражающих химических
веществ (органические растворители, смазочные масла, содовые
охлаждающие эмульсии и др.), мацерацию кожи, переохлаждение
и другие причины, нарушающие барьерные функции кожи по
отношению к бактериальной флоре.
Из числа эндогенных факторов большое значение имеют все
ситуации, ослабляющие сопротивляемость организма, — переутом-
ление, неполноценное питание, гиповитаминоз, хронические ин-
токсикации, диабет, заболевания пищеварительных органов, очаги
хронической гнойной инфекции, нарушения эндокринной регуля-
ции, первичная и вторичная недостаточность иммунокомпетент-
ной системы. Пиодермиты нередко возникают как осложнение при
263
лечении кортикостероидами и цитостатиками, протекая при этом
особенно тяжело.
Если неблагоприятные экзогенные факторы способствуют про-
никновению и активации пиококковой инфекции, то дальнейшее
развитие и течение заболевания определяются взаимоотношения-
ми макро- и микроорганизмов. Благодаря особенностям строения
(капсула, белок А, тейхоевые кислоты и др.) стафилококки спо-
собны противостоять активности фагоцитов и специфических ан-
тител. Выделяемые ими ферменты выполняют функции «агрессии»
и «защиты»: гиалуронидаза способствует инвазии, ДНКаза обеспе-
чивает питательным материалом и препятствует чужеродной ДНК
проникать внутрь микробной клетки, коагулаза вызывает образо-
вание тромбов и фибринозных чехлов вокруг стафилококков,
фибринолизин разрушает сети фибрина, по которым фагоциты
продвигаются к месту скопления микробов, и т. п. [Cohn Z.,
Morsus S., 1959; Kolning M., 1962; Joshida К., 1968, 1971].
При стрептококковой инфекции активно выступает действие
М-протеина, угнетающего хемотаксис нейтрофилов, стрептолизи-
на, усиливающего гемолиз, ДНКазы и гиалуронидазы, обеспечи-
вающих проникновение стрептококков.
Весь перечисленный комплекс агрессии и защиты пиококков
при раздельном или сочетанном действии и формирует патологи-
ческий очаг со всеми его особенностями.
Классификация гнойничковых заболеваний кожи основывается
преимущественно на этиологическом принципе и клинико-морфо-
логических особенностях ответной реакции организма и кожи на
внедрившуюся инфекцию. Однако общепризнанной классифика-
ции, как и уточненного списка заболеваний этой группы в номен-
клатуре ВОЗ, не имеется; этот вопрос до сих пор является пред-
метом дискуссий. В отечественной дерматологии принята класси-
фикация, предложенная Jadassohn (1934), с некоторыми дополне-
ниями и изменениями [Кричевский А. М., 1936; Россиян-
ский Н. Л., 1943; Павлов G Т., 1957; Троицкая А. Д., 1958; Голо-
совкер С. Я., 1960, и др.].
Пиодермиты принято подразделять на стафилодермии, стрепто-
дермии, стрептостафилодермии, вызываемые ассоциациями стреп-
тококка и стафилококка, и атипические формы.
Учитывается локализация по отношению к структурным осо-
бенностям кожи (волосяные фолликулы, потовые железы, складки
кожи, околоногтевые валики), глубина поражения (под роговым
слоем, в толще эпидермиса, вокруг фолликула и др.), ограничен-
ные, диссемированные, диффузные поражения.
СТАФИЛОДЕРМИИ
Остиофолликулит (Impetigo Bockhart, impetigo staphylogenes) —
начальный элемент всех форм стафилодермий с поражением фол-
ликулов, встречается как самостоятельная нозологическая форма.
В устье фолликулов появляется пустула, величина которой колеб-
264
лется от булавочной головки до чечевицы. Она имеет полушаро-
видную форму, пронизана волосом. Покрышка пустулы — плотная,
содержимое ее — гнойное. Вокруг пустулы имеется узкий венчик
гиперемии. Гнойный экссудат ссыхается, образуя желтовато-бу-
рую корочку. Если целостность покрышки нарушается, выделяется
капля густого гноя и обнажается поверхностная эрозия.
Дно пустулы находится в верхних отделах наружного корнево-
го влагалища фолликула волоса. Пустулы не склонны к перифери-
ческому росту и слиянию. Высыпания могут быть единичными и
множественными, чаще возникают в области лица, у мужчин —
в области бороды и усов, реже на коже других участков тела, где
имеются длинные или пушковые волосы. Процесс заканчивается
на 3—4-й день, не оставляя рубца.
Фолликулит (Folliculitis) — острое гнойное воспаление фолли-
кула волоса, характеризуется возникновением ограниченного вос-
палительного инфильтрата в виде узелка (папулы) ярко-красного
цвета, болезненного при пальпации. На 2—3-й день формируется
пустула, в центре которой виден волос или сероватая точка,
обозначающая устье фолликула. Пустула вскрывается с выделени-
ем гноя и образованием эрозии или ссыхается в корочку. Дно
эрозии воронкообразной формы. Иногда фолликулит начинается
по типу остиофолликулита с последующим распространением про-
цесса в глубь фолликула, а также на перифолликулярную ткань.
Исход двоякий: или после отпадения корочки остатки воспали-
тельного инфильтрата постепенно рассасываются и остается
временно легкое шелушение и пигментация, или же при гнойном
расплавлении инфильтрата и выделении гноя формируется язвочка
с исходом в точечный рубец. При этом разрушается и не восста-
навливается сосочек волоса. Длительность течения фолликулита
5—7 дней.
Фурункул (Furunculus) — острое гнойно-некротическое пора-
жение фолликула, сальной железы и окружающей подкожно-жи-
ровой клетчатки, развивающееся из остиофолликулита или фолли-
кулита при условиях, благоприятных для распространения инфек-
ции вглубь. Иногда фурункул, как и фолликулит, в начальной
стадии может иметь вид ограниченного инфильтрата, возникающе-
го в глубине дермы, ярко-красного цвета, с резко выраженной
болезненностью не только при пальпации, но и самопроизвольно
возникающей. В дальнейшем в центре инфильтрата появляется
пустула, одновременно отмечается нарастание воспаления: гипере-
мия, отек, размягчение инфильтрата. После вскрытия пустулы
и отделения гноя отчетливо виден некротический стержень
(рис. 40), отделяющийся постепенно вместе с гноем. На месте
отделившегося некротического стержня формируется язва. По ме-
ре вскрытия и отделения некротического стержня уменьшается
болезненность, стихают явления острого воспаления, рассасывает-
ся инфильтрация, язва выполняется грануляциями и зарубцовы-
вается.
Размеры инфильтрата при фурункуле зависят от реактивности
265
тканей; особенно большие инфильтраты с глубоким и обширным
некрозом наблюдаются при диабете.
Значительная болезненность отмечается при локализации фу-
рункулов в тех местах, где почти отсутствуют мягкие ткани
(передняя поверхность голеней, тыльная поверхность пальцев,
суставы, волосистая часть головы). При возникновении фурунку-
лов на туловище, конечностях нередко развиваются лимфангиты,
лимфадениты, повышается температура тела, отмечаются недомо-
гание, лейкоцитоз, увеличивается СОЭ. В местах с хорошо разви-
той подкожной клетчаткой (ягодицы, бедра, плечи, спина) фурун-
кулы могут достигать больших размеров за счет мощного около-
фолликулярного инфильтрата.
Особую опасность представляют фурункулы при локализации в
области лица (верхняя губа, носогубная складка), где они нередко
приобретают злокачественное течение. О злокачественном течении
болезни свидетельствуют нарастающая боль, увеличивающееся
напряжение и плотность отека, появление тяжей инфильтрата
в направлении угла носогубной складки, внутреннего угла глаза,
синюшно-багровый, темно-синий цвет кожи, повышение темпера-
туры тела до 40—41 °C, головная боль, сонливость, резкое ухудше-
ние общего состояния. В таких случаях возникает опасность
развития сепсиса или тромбоза поверхностных и глубоких вен,
имеющих прямые анастомозы с синусом мозга.
Фурункул в наружном слуховом проходе сопровождается
резкой болью, усиливающейся в ночное время и при надавливании
на козелок ушной раковины. Боль иррадиирует в сосцевидный
отросток, череп, глазницу, в носовую часть глотки. Отек стенок
наружного слухового прохода, особенно при множественных фу-
рункулах, может привести к полному закрытию его и потере слуха.
Ушная раковина при этом гиперемирована, отечна. Выделяющиеся
из вскрывшихся фурункулов некротические массы, содержащие
вирулентные стафилококки, могут вызвать гнойное воспаление
среднего уха. Возможно и обратное явление, когда воспаление
среднего уха, сопровождающееся выделением гноя наружу, спо-
собствует развитию фолликулитов и фурункулов наружного слухо-
вого прохода.
Карбункул (Carbunculus) — конгломерат фурункулов, объеди-
ненных общим инфильтратом. Несколько фолликулов волос могут
поражаться одновременно (рис. 41) или вовлекаться в процесс
последовательно, располагаясь вокруг первоначально развивше-
гося фурункула. Воспалительный инфильтрат увеличивается не
только вследствие периферического роста и вовлечения в про-
цесс новых фолликулов, но и в результате распространения его в
глубь подлежащих тканей (мышцы, фасции, кости). Через 4—
5 дней от начала развития карбункул представляет собой плотный
островоспалительного характера узел (диаметр 5—10 см), нечетко
отграниченный от окружающей здоровой ткани. Поверхность
узла полусферическая, темно-красного или багрового цвета. При
пальпации узел резко болезненный. Боль пульсирующая, «рву-
266
щая», почти постоянная, то усиливается, то несколько ослабевает.
В дальнейшем в нескольких местах вокруг фолликулов волос,
расположенных в центральной части узла, возникает глубокий
некроз кожи. Очаг поражения приобретает аспидно-синюю, чер-
ную окраску, расплавляется в одном или нескольких местах.
Появляются множественные отверстия, из которых вытекает гной-
но-кровянистая жидкость. Образовавшаяся язва с неровными кра-
ями вначале неглубокая, на дне ее видны зеленовато-желтые
некротические стержни, которые отторгаются значительно медлен-
нее, чем при одиночных фурункулах.
Насильственное удаление некротических стержней затрудни-
тельно в связи с неравномерным и неодновременным абсцедиро-
ванием ткани вокруг всех пораженных фолликулов волос и сохра-
нением связи отдельных фолликулов волос с окружающими и под-
лежащими тканями. Через 2 нед, а иногда и позже после развития
карбункула некротические стержни отторгаются легче. Язва, обра-
зовавшаяся после отхождения некротических масс, глубокая, не-
правильной формы, с синюшными, вялыми «подрытыми» краями,
неровным дном со слизисто-гнойным налетом, легко кровоточит.
Вокруг язвы длительное время может сохраняться инфильтрат.
Постепенно язва очищается от налета, выполняется грануляциями
и зарубцовывается в течение 2—3 нед.
При тяжелом течении болезни наблюдаются озноб, повышение
температуры тела до 40—41 °C, разлитой плотный отек, лимфан-
гит, лимфаденит, сильная головная боль. Иногда появляются спу-
танность сознания, бред, менингеальные симптомы.
При локализации фурункула или карбункула по ходу позво-
ночника могут поражаться тела позвонков и спинной мозг, при
расположении за ушной раковиной — сосцевидный отросток, в
затылочной области — кости черепа и мозговые оболочки, при
локализации в подбородочной области наблюдается остеомиелит
нижней челюсти с перфорацией в полоть рта, в промежности —
парапроктит.
Возможные осложнения: флебиты, тромбофлебиты и эмболии,
тромбоз синусов головного мозга, септицемия, общее септическое
состояние, метастазы в мозг, среднее ухо, легкие, в клапаны и
мышцу сердца, печень, почки, околопочечную клетчатку и другие
органы [Ашмарин Ю. Я., Крейнин В. М., 1974; Скрипкин Ю. К.,
1979]. У больных, получающих лечение кортикостероидными пре-
паратами и цитостатиками, карбункулы сопровождаются обшир-
ным некрозом со слабовыраженной инфильтрацией вокруг в виде
валика с множественными вновь возникающими пустулами и не-
кротическими стержнями.
Фурункулез (Furunculosis) — множественные фурункулы, на-
блюдаются на ограниченных участках (местный и локализованный
фурункулез) или носят диссеминированный характер (общий фу-
рункулез), когда фурункулы появляются на различных участках
кожи. Форму заболевания, при которой высыпания появляются
одновременно, называют острой. Возможны рецидивы высыпаний
267
на протяжении какого-то времени — от нескольких недель до не-
скольких лет, как на ограниченных участках, так и типа общего
фурункулеза. Поэтому различают хронический рецидивирующий
местный и общий фурункулез [Павлов С. Т., 1957].
Течение фурункула типично, но при рецидивах наблюдается
пестрая картина: «свежие» высыпания и рубцы разной давности.
Развитию фурункулеза способствуют сенсибилизация к пиококкам,
изменение общей и иммунологической реактивности, наличие со-
матической патологии (диабет, заболевание печени, желудка, ки-
шечника, фокальная инфекция). Большое значение имеют небла-
гоприятные условия труда и быта, циркуляция эпидемических
штаммов стафилококков в семье, в рабочих коллективах, наличие
зудящих дерматозов (чесотка, вшивость) и др.
Псевдофурункулез (pseudofurunculosis) — множественные ми-
лиарные абсцессы у детей, представляют собой воспаление экрин-
ных потовых желез. Возбудителем заболевания является чаще
всего золотистый стафилококк, но могут присоединяться и другие
микроорганизмы. Псевдофурункулез развивается у ослабленных,
плохо ухоженных детей, а также у детей с повышенным потоотде-
лением. Высыпания появляются преимущественно на волосистой
части головы, спине, ягодицах, задней и латеральной поверхности
бедер. Пораженная потовая железа, окруженная воспалительным
инфильтратом, пальпируется в виде болезненного узла, который
по своей величине напоминает чечевицу или вишневую косточку,
иногда крупнее. В начале заболевания узел твердый, при дальней-
шем развитии процесса становится мягким, наблюдается гнойное
расплавление ткани железы и абсцедирование прилежащих тканей.
Покрывающая узел кожа в начале заболевания не изменена,
затем приобретает синюшно-багровый цвет.
В результате расплавления центральной части узла образу-
ется свищ, из которого выделяется сливкообразный гной. Некро-
тического стержня не образуется, течение процесса вялое. При
увеличении свищевого отверстия может образоваться язва. Неред-
ко отмечается увеличение регионарных лимфатических узлов, по-
лиаденит. При улучшении ухода за ребенком под влиянием лече-
ния инфильтраты рассасываются, свищи закрываются, язвы рубцу-
ются. В случае ухудшения общего состояния ребенка появляются
новые воспалительные узлы, абсцессы. Заболевание может ослож-
ниться флегмонами и сепсисом. При таком течении процесса прог-
ноз для жизни неблагоприятный.
Гидраденит (hidradenitis) — гнойное воспаление апокринной
потовой железы. Полагают, что стафилококки из фолликулов во-
лос через потовые протоки попадают в концевую часть апокринных
потовых желез, распространяясь затем лимфогенно. Дети до
периода полового созревания и старики не болеют гидраденитом, ;
так как у них апокринные потовые железы не функционируют.
Локализуется гидраденит чаще в подмышечных ямках, вокруг '
сосков груди, пупка, половых органов и заднего прохода. Заболе- !
вание развивается медленно, иногда подостро и редко — остро. <
268 1
Появляется чувство неловкости в очаге поражения, иногда ощуща-
ются нерезкий зуд, покалывания. В тот период в толще кожи
можно пальпировать узел величиной с горошину, слегка болезнен-
ный. Покрывающая его кожа может сохранять обычную окраску.
При дальнейшем нарастании воспаления диаметр узла увеличи-
вается до 1—2 см. Поверхность кожи над узлом красная, синюш-
но-красная или синюшно-багровая, неровная в результате образо-
вания конгломератов из узлов, иногда сосочками выступает над
уровнем окружающих здоровых участков («сучье вымя»). При
вскрытии узлов образуются один или несколько свищевых ходов
(рис. 42). Некротического стержня не образуется. При регрессе
заболевания формируются втянутые рубцы. Нередко после закры-
тия одного свища и образования рубца рядом открывается новый
свищ. Кожа в подмышечной ямке отечна, болезненна, особенно
при надавливании. Нередко процесс, начавшись в одной подмы-
шечной ямке, позднее становится двусторонним. Иногда заболева-
ние начинается остро, одновременно в обеих подмышечных ям-
ках, температура тела повышается до 38—40 °C. Гидраденит скло-
нен к длительному рецидивирующему течению.
Эпидемическая пузырчатка новорожденных (Pemphigus neonato-
rum). Возбудитель заболевания — золотистый стафилококк, ре-
же — другие штаммы стафилококков, стрептококки и иные микро-
организмы. Заболевание возникает в первые дни жизни ребенка, в
основном в период до 7—10-го дня от момента рождения.
Патогенные стафилококки могут попадать на кожу новорож-
денного из плохо обработанного, инфицированного пупка воздуш-
но-капельным путем при уходе за ребенком. Эпидемическая пу-
зырчатка новорожденных часто начинается с появления полостных
элементов, на фоне гиперемии. Покрышка пузыря — беловатого
цвета, в первые часы заболевания — вялая, дряблая, морщинистая
вследствие незначительного количества экссудата, лишь слегка
приподнимается над уровнем кожи. В дальнейшем полости пузы-
рей увеличиваются в связи с выраженными явлениями акантолиза
в шиповатом слое. Верхние слои эпидермиса легко отслаиваются
даже при незначительном давлении скапливающегося экссудата.
Содержимое пузырей вначале серозное, затем становится серозно-
гнойным.
Тонкая покрышка пузырей легко разрывается, обнажая эрозив-
ную поверхность, диаметр которой от 2—3 мм до нескольких сан-
тиметров; края — неровные, фестончатые, дно — сочное розово-
красное или бледно-розовое (у ослабленных детей), отделяемое —
серозное, серозно-слизистое, мутное. Эрозии окаймлены бахромой
из отслаивающегося эпидермиса. При неблагоприятном течении
заболевания эрозии сливаются между собой при периферическом
росте пузырей и отслойке эпидермиса. Исключительно быстро, за
несколько дней заболевание может поразить большую часть кожи
новорожденного. Иногда после вскрытия пузырей содержимое
изливается, в центре ссыхается в желтоватую корку, а по пери-
ферии вокруг корки образуются новые пузыри, повторяющие тот
же цикл развития.
После эпителизации остаются вторичная временная пигмента-
ция и шелушение. Тяжелые поражения кожи могут сочетаться с
импетигинозным поражением слизистых оболочек полости рта,
глаз, половых органов, тяжелым общим состоянием ребенка.
Тяжесть заболевания обычно пропорциональна площади вовлечен-
ных в процесс кожи и слизистых оболочек, длительности заболе-
вания и глубине поражений. При диссеминации процесса наблю-
дают повышение температуры тела, увеличение лейкоцитоза и
СОЭ. Состояние ребенка становится тяжелым, могут развиваться
стафилококковые пневмонии, отиты, диспепсии, сепсис. В подоб-
ных случаях прогноз для жизни ребенка становится неблаго-
приятным.
Пиококковую пузырчатку новорожденных следует диффе-
ренцировать от сифилитической пузырчатки. При сифилити-
ческой пузырчатке сыпь полиморфная; пузыри локализуются пре-
имущественно в области ладоней и подошв, хотя не исключается
возможность появления их на коже других участков конечностей
и туловища. Наряду с пустулами имеются папулы, папулезные
инфильтраты и др. Пустулы развиваются на папулах, нередко
оставляя свободным периферический венчик папулы.
Сифилитические пустулы полусферические, имеют «напряжен-
ную» толстую покрышку, гнойное густое содержимое, их размеры
почти не увеличиваются, сохраняется фокусное расположение.
Диагноз сифилитической пузырчатки подтверждается обнаруже-
нием бледных трепонем, содержащихся в большом количестве в
пустулах и других сифилидах, а также серологическими исследо-
ваниями крови ребенка и матери.
Пиококковую пузырчатку новорожденных необходимо отличать
также от врожденной пузырчатки. При простой форме врожденной
пузырчатки у новорожденных возникают пузыри с серозным, се-
розно-геморрагическим содержимым в области ладоней и пальцев
кистей, на коже локтевых и коленных суставов, на подошвах, яго-
дицах, реже — на других участках, подвергающихся трению, дав-
лению. Развитию пузырей могут предшествовать эритематозные
высыпания и волдыри.
Эксфолиативный дерматит (болезнь Риттера) — тяжелая фор-
ма эпидемической пузырчатки новорожденных, клинически близ-
кая к синдрому Лайелла, вызываемая стафилококковой инфек-
цией. Заболевание впервые описано в 1878 г. Риттером фон Рит-
терсгайном. Оно характеризуется крайне тяжелым течением.
Вначале на коже в области пупка и вокруг рта возникают пузыри
с дряблой покрышкой. Они быстро увеличиваются, вскрываются,
образуя эрозии, окаймленные отслоившимся эпидермисом. Появ-
ляется положительный симптом Никольского. В течение несколь-
ких дней поражается вся кожа ребенка. Гиперемия, отек, отслой-
ка эпидермиса, обширные эрозии с обрывками покрышек пузырей
по краю их создают впечатление «обваренной кожи» как при
синдроме Лайелла. Состояние ребенка тяжелое: высокая лихорад-
ка, нередко понос, потеря веса, осложнения (пневмония, отиты,
270
гнойный конъюнктивит, сепсис) создают опасность для жизни ре-
бенка. Со стороны крови наблюдаются лейкоцитоз, повышенная
СОЭ, анемия, диспротеинемия. Бывает более мягкое течение с бла-
гоприятным прогнозом.
Везикулопустулез (перипориты) — гнойные воспаления устьев
эккринных потовых желез. Везикулопустулез — наиболее часто
встречающееся заболевание новорожденных, вызываемое стафило-
кокком. Первичный элемент — пустулы величиной с булавочную
головку, окруженные венчиком гиперемии. Покрышка плотная.
Высыпания поначалу единичные, нередко сгруппированные, быстро
распространяются. У ослабленных детей и при отсутствии свое-
временного лечения они могут распространяться вглубь, образуя
инфильтраты, с возможным исходом в абсцессы и флегмоны.
Нередко наблюдаются лимфангиты, лимфадениты, сепсис. Наибо-
лее часто встречающаяся локализация — на волосистой части го-
ловы и в складках кожи. Длительность заболевания при условии
адекватного лечения и ухода — 7—10 дней.
Стафилококковый сикоз (Sycosis staphylogenes, sycosis vulga-
ris) — хроническое рецидивирующее воспаление фолликулов в зо-
не роста коротких толстых волос (борода, усы, брови, лобок, под-
мышечная впадина), реже поражаются фолликулы волосистой
части головы. Заболевание вызывается золотистым стафилококком
или ассоциациями разных штаммов стафилококков. Оно характе-
ризуется следующими особенностями: а) непрерывностью возник-
новения рецидивов в виде остиофолликулитов и фолликулитов,
возникающих в одном и том же фолликуле; б) инфицированием
и заболеванием почти всех фолликулов в пораженной области;
в) торпидным вялым течением.
Клиническая картина формируется постепенно. Появляются
остиофолликулиты и фолликулиты, число их нарастает. Фоллику-
лы в основном поражаются на уровне верхней трети. Появляются
очаги с выраженной инфильтрацией кожи, синюшно-бурого цвета,
на которых видны пустулы, эрозии, серозно-гнойные корки. Воло-
сы не выпадают, но легко выдергиваются. В корневой части вы-
дернутых волос видны набухшие корневые влагалища, создающие
впечатление стекловидной «муфты». После разрешения остиофол-
ликулитов и фолликулитов рубцов не образуется.
Гистологически в эпителии устья фолликула видны мелкие
пустулы в разной стадии развития (по нескольку образований
вокруг одного фолликула). В сосочковом, подсосочковом и рети-
кулярном слоях дермы — клеточный инфильтрат, представленный
плазматическими, лимфоидными клетками. Встречаются единичные
клетки Лангханса. Кровеносные сосуды расширены. Эндотелиаль-
ные клетки гипертрофированы. Иногда глубокие фолликулиты со-
провождаются гнойным расплавлением инфильтрата и процесс
заканчивается рубцом. Болеют, как правило, мужчины. Развитию
заболевания могут способствовать раздражение и инфицирование
кожи во время бритья, насморк, загрязнение кожи.
В патогенезе сикоза имеет большое значение наличие у боль-
271
ных очаговой инфекции (зубные гранулемы, хронический тонзил-
лит, синуситы, холецистит, простатит и т. п.), патология внутрен-
них органов, нервной, эндокринной систем.
Прогноз заболевания для жизни благоприятный. Возможно
спонтанное выздоровление или быстрое полное излечение при ра-
циональной терапии. Однако нередко процесс имеет хроническое
рецидивирующее течение, несмотря на интенсивное лечение, что
неблагоприятно отражается на психике больного, вызывая глубо-
кую и длительную астению.
Диагноз стафилококкового сикоза в типичных случаях не вы-
зывает затруднений. Заболевание необходимо дифференцировать
от глубокой трихофитии (инфильтративная форма, зоонозная, па-
разитарный сикоз). Особой формой вульгарного сикоза является
люпоидный сикоз, который также вызывается стафилококками.
В начале своего развития заболевание сходно с обыкновенным
сикозом. Поражается, как правило, кожа щек. Развиваются оди-
ночные остиофолликулиты и фолликулиты, затем формируется
перифолликулярный инфильтрат, медленно распространяющийся
по периферии и в глубину. Хронический воспалительный процесс
приводит к гибели фолликулов волос, волосы выпадают, в центре
формируется плоский рубец. Обычно он гладкий, округлой формы,
его диаметр 1—2 см. Вокруг рубца периодически появляются
фолликулярные пустулы, которые сливаются и развиваются так
же, как и предыдущие. Заболевание протекает торпидно, трудно
поддается лечению.
СТРЕПТО ДЕРМИИ
Стрептодермии характеризуются поверхностным поражением
гладкой кожи, складок, в том числе крупных (подмышечных, мо-
лочных желез, паховых), и наклонностью к периферическому ро-
сту очагов поражения. Придатки кожи (фолликулы волос, потовые
железы) не поражаются.
Импетиго стрептококковое (impetigo streptogenes, impetigo Til-
bury Fox) отличается высокой контагиозностью, особенно в
условиях детского коллектива. Характеризуется высыпанием по-
верхностых пузырьков (фликтен) на гиперемированном фоне, раз-
мером от чечевицы до 0,5—1 см в диаметре с прозрачным содер-
жимым и тонкой дряблой покрышкой. Спустя короткое время со-
держимое фликтены мутнеет, ссыхается в соломенно-желтую тон-
кую и рыхлую корку, которая имеет такие же размеры, как и
пузырьки. После отпадения корки и восстановления эпителия
временно сохраняются легкая гиперемия, шелушение или гемоси-
дериновая пигментация. Эволюция фликтены занимает 3—4 дня.
Очень редко заболевание ограничивается появлением единичного
элемента и отсутствием его периферического роста. Обычно коли-
чество элементов нарастает. Пузырьки сохраняются лишь по пери-
ферии очага или совсем отсутствуют, особенно у детей и женщин.
У лиц с более толстым роговым слоем фликтены могут сохранять
272
покрышку более длительное время и увеличиваются в размерах
(рис. 43).
Иногда отделяемое из-под корок изливается на их поверх-
ность и ссыхается, вследствие чего корки делаются слоистыми,
бугристыми, крошковатыми, ломкими. Цвет их зависит от харак-
тера отделяемого, примеси пыли, крови, микроорганизмов. В пер-
вые часы и дни корки легко снимаются. При насильственном их
удалении обнажается розовая или розово-красная эрозия, четко
отграниченая от окружающей здоровой кожи, выделяющая про-
зрачный, светлый, опалесцирующий экссудат.
Возможна диссеминация процесса в результате переноса ин-
фекции с одного участка на другой. Нередки осложнения в виде
лимфангита и лимфаденита.
Кроме кожи, стрептококковое импетиго может поражать крас-
ную кайму губ, слизистые оболочки полостей рта, носа, бронхов,
глаз. У некоторых больных стрептококковое импетиго слизистых
оболочек предшествует появлению заболевания на коже [Попхри-
стов П., 1962]. Поражение красной каймы губ сопровождается
покраснением, отеком, трещинами, шелушением, образованием се-
розно-гнойных и геморрагических корок. Движение губами при-
чиняет боль, способствует увеличению трещин и возникновению
кровотечения (рис. 44).
Буллезное стрептококковое импетиго является клинической
разновидностью стрептококкового импетиго. Развивается на кис-
тях, стопах, голенях. Появляются крупные пузыри диаметром
1 см и более с напряженной покрышкой. Периферический рост
их происходит медленно, венчик эритемы у основания пузыря
обнаруживается непостоянно. Характер заболевания определяется
толщиной рогового слоя в очагах поражения.
Заеда (angulus infectiosus, perleche) — стрептококковое импети-
го в углах рта. В ряде случаев заболевание сочетается с пораже-
нием других областей кожного покрова, но может быть и един-
ственным проявлением стрептодермии. Заболевание имеет ха-
рактерную клиническую картину. Кожа углов рта отечная и
гиперемированная, в глубине складки видна болезненная щелевид-
ная эрозия с нависающим белесоватым венчиком отслоившегося
эпителия, ободком гиперемии и инфильтрации. Формирующаяся
на поверхности эрозии корочка и восстанавливающийся эпителий
также легко разрываются при движении губ. Этому способствуют
смачивание слюной, облизывание языком (рис. 45). Заболевание
контагиозно, склонно к хроническому течению и рецидивам.
Аналогичные клинические проявления имеет стрептококковое им-
петиго при локализации у основания крыльев носа, в углах глаз.
Дрожжевые поражения углов рта отличаются от заеды тем,
что возникают обычно у взрослых, страдающих нарушениями угле-
водного обмена, и, как правило, сочетаются с дрожжевыми пора-
жениями слизистых оболочек полости рта, паховых, межягодич-
ных складок и других областей.
Заеды при дрожжевых поражениях обычно не образуют гной-
273
ных корок, а при микроскопическом исследовании соскоба легко
обнаруживаются дрожжевые клетки.
Простой лишай (pityriasis simplex) возникает чаще у детей на
открытых участках кожи (лицо, руки, реже поражаются закрытые
одеждой области кожи). Иногда заболевают взрослые. Простой
лишай чаще встречается среди организованных коллективов детей
в весеннее время. Вызывается малопатогенным стрептококком.
На коже лица появляются пятна округлой формы, розового цвета,
покрытые белесоватыми тонкими чешуйками. При большом коли-
честве чешуек пятно кажется белым или серовато-белым. Заболе-
вание отличается вялым течением, склонно к рецидивам. После
излечения временно остается депигментированное пятно. Депиг-
ментация при сухом лишае отличается от витилиго наличием ше-
лушения и менее четкой границей поражения.
Паронихия поверхностная (paronychia streptogenes) — пора-
жение валика ногтя, встречающееся как у детей, так и у взрослых.
Развитию заболевания способствует нарушение целостности эпидер-
миса при обкусывании ногтей, отрывании заусениц. Кожа валика
ногтя вначале краснеет, становится отечной и болезненной, затем
на ней образуется пузырь с прозрачным, а позднее — мутным со-
держимым. Пузырь превращается в пустулу с напряженной по-
крышкой, которая может занимать часть воспаленного валика ног-
тя, иногда охватывая ноготь с трех сторон в виде подковы, окру-
женной гиперемией.
При хроническом течении кожа валика ногтя синюшно-розо-
вого цвета, инфильтрирована, по периферии расположена бахром-
ка отслаивающегося эпидермиса. Из-под валика ногтя периоди-
чески выделяется капля гноя. Ногтевая пластинка становится де-
формированной, тусклой.
Папулезное сифилоподобное импетиго является разновидно-
стью стрептококкового импетиго у детей первого года жизни
(редко возникает в более позднем возрасте). На коже ягодиц, ре-
же бедер, голеней и других областей возникают ограниченные
эритематозные пятна различной величины. Постепенно на их по-
верхности формируются папулы воспалительного характера, четко
отграниченные от здоровой кожи, величиной от чечевицы до 1 см в
диаметре, розового, красновато-розового, синюшного цвета. На их
поверхности могут возникать фликтены, которые вскрываются с
образованием эрозий. Эрозия по своим размерам меньше, чем
папула, кожа вокруг нее гиперемирована и инфильтрирована.
Папулезное сифилоподобное импетиго следует дифференциро-
вать от сифилитических папул, для которых не характерны об-
разование фликтен и эрозий, рост перифокального воспаления.
Сифилитические папулы плотные, безболезненные. При сифилисе
можно выявить специфическое поражение слизистых оболочек и
кожи. Серологические реакции положительные, в отделяемом эро-
зий обнаруживаются бледные трепонемы.
Острая диффузная стрептодермия (streptodermia acuta diffu-
sa) — острое очаговое диффузное поражение кожи, вызванное
274
Рис. 46. Острая диффузная стрептодермия. Стрептококковые свежие
фликтены вокруг очага; различные стадии развития.
стрептококками. Чаще встречается у взрослых. Процесс локали-
зуется на конечностях, чему способствуют частая травматизация
кожи, нарушения трофики и др. Благодаря наличию более толсто-
го рогового слоя на этих участках кожи возникающие фликтены
имеют прочную покрышку, дольше сохраняются, увеличиваются и
сливаются, образуя диффузные очаги поражения. Диффузную
стрептодермию, возникающую вокруг инфицированных ран, сви-
щей, ожогов и т. п., принято называть «паратравматической», а
возникающую в складках кожи у взрослых и детей — интертриги-
нозной (стрептококковая опрелость). Предрасполагающими при-
чинами являются избыточная потливость, мацерация, раздражение
кожи выделениями в области гениталий, диабет и др. В клиниче-
ской характеристике этой формы наиболее типичными признаками
являются серозный характер воспаления, высыпание первичных
везикулезных элементов (фликтен), склонных к периферическому
росту и слиянию с образованием сплошных поверхностных эро-
зий, окаймленных венчиком отслоившегося рогового слоя эпи-
дермиса с фестончатыми очертаниями. Отмечаются выраженные
явления отека и гиперемии, обильное диффузное мокнутие и участ-
ки, покрытые серозными корками. Нередко по наружному краю
отслоившегося рога возникают кольцевидные фликтены (до 1 —2 см
в диаметре), обусловливающие периферический рост очага пора-
жения (рис. 46).
В отдельных случаях у ослабленных больных, у лиц с сер-
дечно-сосудистыми заболеваниями, диабетом и др. наблюдается
275
возникновение на очагах диффузной стрептодермии поверхност-
ных изъязвлений, покрытых серозно-гнойным отделяемым с при-
месью серозно-гнойно-геморрагических корок. Даже единичные
фликтены могут осложняться лимфангитом и лимфаденитом. При
острой диффузной стрептодермии эти осложнения возникают ча-
сто. что свидетельствует о генерализации инфекции вследствие
большой гиалуронидазной активности экзотоксина стрептококка
и замедленной его способности коагулировать плазму.
Так как стрептококки обладают выраженным сенсибилизирую-
щим действием, острая диффузная стрептодермия может ослож-
няться аллергическими высыпаниями и сенсибилизацией.
СТРЕПТОСТАФИЛОДЕРМИИ
Стрептостафилококковое импетиго (обыкновенное импети-
го) — наиболее часто встречающаяся форма импетиго. Заболева-
ние контагиозно, особенно у детей. В детских коллективах может
принять характер эпидемической вспышки. Стрептостафилокок-
ковое импетиго встречается и у взрослых как самостоятельное
заболевание или как осложнение при чесотке, вшивости и других
зудящих дерматозах.
Наиболее часто поражается кожа лица. рук. На воспаленной,
гинеремированной коже возникает пузырек с серозным содержи-
мым, в котором обычно обнаруживаются стрептококки и стафило-
кокки. Покрышка пузырька тонкая, вялая, реже напряженная.
У основания ее имеется венчик эритемы. Содержимое пузырька в
течение нескольких часов становится гнойным. Кожа в основании
пустулы инфильтрируется, увеличивается венчик гиперемии. Мере?
несколько часов покрышка вскрывается, образуя эрозию, отделяе-
мое которой ссыхается в «медовые корки» (вначале тонкие, плос-
кие. затем более грубые, комковатые, с примесью крови). На 5—
7-й день корки отторгаются, под ними обнаруживается свежеза-
эпителизированное эритематозное, слегка шелушащееся пятно, ко-
торое позднее бесследно исчезает.
Очаги поражения могут расти до периферии (серпигинировать)
и захватывать значительные поверхности кожи.
Вульгарная эктима (ecthyma vtilgare) — глубокое поражение
тканей с изъязвлением на ограниченном участке. Заболевание
вызывается смешанной стрептококковой и стафилококковой ин-
фекцией (Троицкая А. Д., 1957: Бабинцев В. Г.. 1984]. Заболе-
вание развивается у людей со сниженной сопротивляемостью орга-
низма (истощение, хронические заболевания, авитаминоз, алкого-
лизм и т. п.). Может начинаться со стрептококковой фликтены,
стафилококковой пустулы или смешанного импетиго с глубоким
инфильтратом в основании с последующим формированием пу-
зыря в центре его с гнойно-геморрагическим содержимым и рас-
падом тканей. По вскрытии пузыря образуется язва округлой фор-
мы, края которой валикообразно возвышаются над окружающей
276
Рис. 47. Эктима голени.
кожей, а дно легко кровоточит, покрыто некротическим, гнойно-
слизистым налетом. Отделяемое ссыхается в корку, которая может
утолщаться и приобретать бурый цвет в результате подсыханий
вновь образующихся некротических масс и примеси крови. Про-
цесс иногда приостанавливается. Язва выполняется грануляциями,
заживает рубцом (рис. 47).
Вульгарную эктиму следует дифференцировать от индуратив-
ной эритемы и сифилитической гуммы.
Хроническая диффузная стрептодермия (син. хроническая
диффузная пиодермия). Заболевание развивается из очага острой
диффузной стрептодермии (по истечении 3—6 мес) или из вяло-
текущего стрепто-стафилококкового импетиго. Выделена как само-
стоятельная нозологическая форма М. Г. Мгебровым на основании
того, что при исследовании микрофлоры очагов поражения в
100 % у больных выделялись стафилококки, в 45 % случаев —
в ассоциации с 0-гемолитическими стрептококками. Е. И. Архан-
гельской предложено название «хроническая диффузная пиодер-
мия».
277
В области очагов поражения наблюдается выраженная инфиль-
трация кожи, синюшно-буроватой окраски с поверхностными эро-
зиями, покрытыми полупрозрачными, слоистыми (напоминающи-
ми пластины слюды) желтовато-сероватыми корками. Контуры
очагов поражения фестончатые, окаймлены венчиком отслоивше-
гося рогового слоя. У ряда больных хроническая диффузная
стрептодермия имеет сходство с крупными псориатическими бляш-
ками в тех случаях, когда на первый план выступают явления
лихенизации и псориазиформного шелушения. В период обостре-
ния наблюдаются усиление мокнутия, отек, гиперемия, появление
свежих высыпаний, преимущественно в краевой зоне вокруг очагов
поражения.
Как правило, диффузная стрептодермия приобретает хрониче-
ское течение при локализации процесса на коже голеней и стоп,
особенно на фоне варикозного симптомокомплекса, перенесенного
тромбофлебита, рубцовых изменений и др. При микробной экземе
могут одновременно наблюдаться симптомы диффузной стрепто-
дермии и точечные экзематозные «колодцы» с капельным мокну-
тием в виде росы.
ХРОНИЧЕСКАЯ ГЛУБОКАЯ ПИОДЕРМИЯ
Клиническая картина хронической глубокой пиодермии весьма
разнообразна. Наряду с хорошо известными «банальными» фор-
мами в XX столетии были описаны разновидности, встречающиеся
хотя и редко, но имеющие важное значение вследствие длитель-
ности и упорности течения.
Хроническая глубокая язвенно-вегетирующая пиодермия (руо-
dermia chronica profunda ulcerosa et vegetans). При посеве гноя из
очагов хронической пиодермии обычно получают рост стафило-
кокка, стрептококка, нередко — протея, кишечной, синегнойной
палочки и др. Стафилококки вследствие своей распространенности
могут встречаться при самых разнообразных заболеваниях кожи
и их обнаружение само по себе еще не говорит об их этиологи-
ческом значении.
Анализ данных литературы и наши наблюдения дают основа-
ние полагать, что все неблагоприятные факторы, нарушающие
нормальное физиологическое состояние кожи, ослабляющие общее
функциональное состояние организма, активность его иммуно-
биологических реакций, способствуют развитию хронических пио-
дермитов, утяжелению их течения, возникновению рецидивов.
Клиническая картина и течение хронической глубокой пиодер-
мии весьма разнообразны. Это разнообразие только отчасти зави-
сит от характера возбудителя, значительно более важную роль
при этом играют свойства организма и кожи больных.
Для язвенно-вегетирующей пиодермии характерно развитие на
месте пустул или фолликулитов изъязвленных бляшек синевато-
красного цвета мягкой консистенции, резко отграниченных от
окружающей здоровой кожи (рис. 48), приподнятых над ее по-
278
Рис. 48. Хроническая язвенно-вегетирующая пиодермия на стопе.
верхностью и имеющих неправильные округлые или овальные
очертания (рис. 49). Поверхность бляшек полностью или частично
изъязвлена, покрыта папилломатозными разрастаниями с верру-
козными корковыми наслоениями. Бляшки окружены поясом за-
стойной гиперемии (рис. 50). При сдавливании их из межсосоч-
ковых щелей и из отверстий свищевых ходов выделяется гнойная
или кровянисто-гнойная жидкость. Имеется наклонность к серпи-
гинированию. При регрессировании центральная часть бляшки
западает, вегетации уплощаются, ороговевают, отделение гноя пре-
кращается. Заживление происходит с образованием рубцов. Рубцы
неровные, с эпителиальными сосочковидными возвышениями и
мостиками напоминают «лохматые» рубцы после скрофулодермы.
Нередко в центре или с одной из сторон очага поражения идет
рубцевание, в то время как с другой стороны очаг продолжает
расти. Очаги язвенно-вегетирующей пиодермии могут быть еди-
ничными или множественными. В результате их роста и слияния
могут образоваться большие пораженные участки, например за-
хватывающие всю голень.
279
Рис. 49. Хроническая язвенно-вегетирующая пиодермия с веррукозными
наслоениями в виде бляшек.
Рис. 50. Хроническая язвенно-вегетирующая пиодермия. Дефект ушной
раковины.
280
Процесс может локализоваться где угодно, однако имеются
излюбленные места — волосистая часть головы, верхние конеч-
ности, лобок, подмышечные и паховые области, голени.
Течение хронической язвенно-вегетирующей пиодермии очень
длительное (месяцы и даже годы) с периодами улучшения и обо-
стрения процесса.
Язвенно-вегетирующая пиодермия иногда развивается у лиц,
страдающих конглобированными угрями. Своеобразный глютеаль-
ный инфильтративно-фистулезный процесс А. П. Базыка (1975)
и О. Б. Минскер (1977) рассматривают как особый тип хрониче-
ской глубокой пиодермии.
Подробное описание поражения костей при хронической пио-
дермии (osteopathia pyogenica) было сделано С. А. Глауберзоном
в 1934 г. Он наблюдал 2 случая поражения костей типа остеопе-
риостита, однако наиболее пораженной оказывается надкостница.
Язвенно-вегетирующая пиодермия встречается в любом воз-
расте, в том числе и у детей, но чаще в период между 40 и 60 го-
дами жизни.
Гистопатология. При гистологических исследованиях
выявляются дистрофические изменения в эпидермисе и хрониче-
ское воспаление в дерме с очагами гранулематозного строения,
некроза и абсцедирования. Среди клеток инфильтрата преобла-
дают лимфоциты, гистиоциты, фибробласты с примесью нейтро-
филов, эозинофилов и плазматических клеток. Обнаруживаются
различной величины очаги некроза, абсцессы.
Дифференциальный диагноз проводят с колли-
квативным и бородавчатым туберкулезом кожи, глубокими мико-
ими (бластомикоз, споротрихоз).
Гангренозная пиодермия (pyodermia gangrenosum). Син.: язвенно-
вегетирующая гангренозная пиодермия, язвенный дерматит.
Эту весьма редкую форму пиодермии впервые описали L. Bruns-
iirig, W. Goeckerman, O’Leary (1930) у 5 больных, у 3 из которых
наблюдался язвенный колит.
Этиология и патогенез. Длительное время главная
роль в развитии гангренозной пиодермии отводилась особым свой-
ствам стафило- и стрептококков. Некоторые авторы и сейчас при-
держиваются этого мнения. Мы, как и многие другие исследова-
тели, полагаем, что в этиологическом плане при гангренозной пио-
дермии ведущая роль бактерий (стафилококки, стрептококки,
протеи, синегнойная палочка и др.) не доказана.
В последние годы в литературе широкое распространение по-
лучило мнение о том, что в основе гангренозной пиодермии лежит
аллергический васкулит, а различным микроорганизмам отводится
ноль сенсибилизирующего фактора [Ашмарин Ю. Я., 1967]. Во
многих работах указывается на связь гангренозной пиодермии с
иммунными нарушениями [Check R. et al., 1983|.
Многие исследователи подчеркивают, что гангренозная пио-
дермия у 70—80 % больных сочетается с различными системными
281
заболеваниями и хроническими воспалительными инфекционными
очагами (язвенный колит, болезнь Крона, парапротеинемия, лей-
козы, артриты, карциноидные опухоли, злокачественные лимфомы
и др.), которые являются первичным фактором, а кожа поражает-
ся вторично [Harton J. et al., 1984; Ley F., Wurzel M., 1984; Kuhn A.,
1985).
Клиника. Заболевание встречается обычно у взрослых в
период между 30—49 годами жизни или после 60 лет [Odeh F.,
19811; дети болеют редко.
Изменения на коже начинаются с появления пустулы, фурун-
колоподобных высыпаний или пузырей с прозрачным или гемор-
рагическим содержимым. Элементы быстро распадаются или
вскрываются с образованием ширящихся по периферии язв. Язвы
имеют округлые, неправильные или полициклические очертания,
достигают размеров ладони и более. На высоте развития очаг по-
ражения представляет собой обширную язвенную поверхность с
неровными подрытыми краями ливидно-розового цвета с нависа-
ющими обрывками эпидермиса; края приподняты в виде валика
(ширина 1 —1,5 см), окруженного зоной гиперемии (рис. 51).
Дно язвы неровное, выполнено сочными и легко кровоточащими
грануляциями. Отделяемое язв обильное, гнойно-кровянистого
характера с примесью распадающихся тканей, с неприятным гни-
лостным запахом (рис. 52). Язвы увеличиваются в размерах пу-
тем эксцентрического роста или серпигинирования в одном на-
правлении с одновременным рубцеванием в другом (рис. 53). При
пальпации ощущается резкая болезненность.
У половины больных наблюдается только один очаг пораже-
ния, у остальных имеются множественные очаги, расположенные
чаще всего на нижних конечностях, реже на туловище, верхних
конечностях и лице.
Содержимое начальных пустул может быть стерильным. В от-
деляемом язв обнаруживают разнообразную кокковую и бактери-
альную флору. Общее состояние страдает относительно мало.
Может быть преходящая лихорадка. Течение заболевания хрони-
ческое, имеется склонность к рецидивам. Прогноз в значительной
мере определяется часто имеющимися одновременно системными
заболеваниями (язвенный колит, лейкоз и др.).
Г истопатология. Отечность стенок сосудов, вплоть до
закрытия просвета, тромбоз сосудов в верхней части дермы, не-
кроз в глубине кожи и подкожной клетчатке. Гранулематозные
инфильтраты во всей толще дермы, состоящие из лимфоцитов,
нейтрофильных лейкоцитов, плазматических клеток, фибро-
бластов.
Дифференциальный диагноз при сформировав-
шейся картине болезни проводят с глубокими микозами, колли-
квативным туберкулезом кожи, третичным сифилисом, артефак-
тами, йодо- и бромодермой, с хронической язвенно-вегетирующей
пиодермией.
Вегетирующая пиодермия Аллопо (pyodermitis vegetans Hallo-
282
Рис. 51. Гангренозная пиодер-
мия на лице.
Рис. 53. Гангренозная пиодер-
мия на голени.
Рис. 54. Вегетирующая пиодер-
мия Аллопо.
реаи). Впервые об этом заболевании сообщил Аллопо в 1889 г.
и назвал его «Dermite pustulouse chronique ей foyers a progression
excentrique». P. Gaucher (1905) назвал заболевание по имени ав-
тора — вегетирующая пиодермия Аллопо.
П. В. Кожевников (1949) полагает, что под этим названием
описываются как настоящие вегетирующие «пиохрониты», так и
доброкачественные формы вегетирующей пузырчатки и дерматит
Дюринга. Л. Н. Машкиллейсон (1960) считает вегетирующую пио-
дермию Аллопо самостоятельной нозологической единицей.
Мы, как и Н. Perry (1980), полагаем, что это два различных
заболевания. По нашим наблюдениям, вегетирующая пиодермия
развивается из пустулезных элементов и имеет доброкачествен-
ный характер. Вегетирующая пузырчатка начинается с пузырей
и протекает с большей или меньшей злокачественностью.
283
Этиология и патогенез. При бактериологических
исследованиях гноя из очагов поражения вегетирующей пиодер-
мии постоянно высеивают золотистый стафилококк. R. Degos,
A. Carteaud (1953) рассматривают вегетирующую пиодермию Ал-
лопо как стафилококковый пустулез с вторичной вегетацией.
М. Getlik (1980) у 2 пациентов, страдающих вегетирующей
пиодермией, установил снижение клеточного иммунитета с дис-
гаммаглобулинемией.
Клиника. Заболевание одинаково часто поражает мужчин
и женщин. Как правило, хроническая вегетирующая пиодермия
Аллопо возникает у взрослых (рис. 54), очень редко у детей.
Первичным элементом являются пустулы, число которых бы-
стро увеличивается. После вскрытия на их месте постепенно раз-
виваются бородавчатые вегетации, гнойное отделяемое из которых
ссыхается в корки. Мелкие очаги растут по периферии и, сливаясь
с соседними очагами, образуют крупные довольно четко очерчен-
ные бляшки, окруженные эритематозным венчиком. Излюбленная
локализация — волосистая часть головы, лоб, губы, подмышечные
впадины, гениталии, слизистая оболочка щек и носа. Могут уве-
личиваться регионарные лимфоузлы. Общее состояние не страдает.
Г исто патологи я. Характерны интраэпидермальные
эозинофильные абсцессы и псевдоэпителиоматозная гиперплазия
с папилломатозом в сочетании с хроническим гранулематозным
воспалением в дерме. Воспалительный инфильтрат состоит из
лимфоцитов, гистиоцитов, эозинофилов и нейтрофилов.
Дифференциальный диагноз следует проводить
с вегетирующей пузырчаткой, вторичным сифилисом, глубокими
микозами, бородавчатым туберкулезом кожи.
Прогноз в большинстве случаев благоприятный; при рацио-
нальном лечении вегетирующие очаги разрешаются в течение не-
скольких недель или месяцев.
Акне КелоИД (acne keloid). Син.: сосочковый дерматит головы, склеро-
ырующий фолликулит затылка.
М. Kaposi в 1869 г. впервые описал эту форму пиодермии как
самостоятельное заболевание под названием «dermatitis papillo-
matosa capillitii».
Клиника. Заболевание встречается только у мужчин, лока-
лизуется в области затылка, обычно переходя и на заднюю по-
верхность шеи и характеризуется высыпанием мелких, плотных,
болезненных узелков, сначала одиночных, затем сливающихся в
крупные очень плотные бляшки. Кожа над этими элементами
имеет бледно-красноватый или фиолетово-красный цвет. Поверх- i
ность бляшек покрыта глубокими бороздами, между которыми .
имеются «сосочковые» образования. Волосы при этом располага- <
ются в виде кисточек. Весь рубцово-измененный очаг поражения
ограничен сверху пучками волос, выходящих по 10—15 штук из .
одного отверстия и очень трудно удаляемых. Заболевание длится
долго, заканчивается склерозированием пораженных участков
284 1
.1
кожи. Наши наблюдения подтверждают мнения многих авторов
о том, что при бактериологическом исследовании посевов гноя
выделяется золотистый стафилококк.
А. М. Ариевич, 3. Г. Степанищева (1966) высказали предпо-
ложение о том, что поражения кожи, протекающие под клиниче-
ской картиной хронической пиодермии и, в частности, склерози-
рующего фолликулита, могут иметь грибковую этиологию (при
культуральном исследовании гноя, кожных чешуек, а также кусоч-
ков биопсированной кожи авторы выделили культуры грибов Spo-
rotrichum Gougeroti).
Гистопатология. В эпидермисе отмечается небольшой
гиперкератоз, очаговый паракератоз, акантоз с неравномерными
эпителиальными отростками. В толще всей дермы — массивные
очаговые инфильтраты полиморфно-клеточного характера, состоя-
щие из нейтрофильных лейкоцитов, плазматических крупных кле-
ток, гистиоцитов и эозинофилов. В центральной части очагового
инфильтрата — скопление лейкоцитов (абсцесс).
Дифференциальный диагноз следует проводить
с некоторыми формами туберкулеза кожи, глубокими микозами.
Акне фуЛЬМИнанС (acne fulminans). Син.: молниеносная угревая сыпь,
акне конглобата и септицемия.
Впервые на эту разновидность акне обратили внимание
R. Burns, J. Colville (1959), выделив ее в отдельную форму пио-
дермии под названием «акне конглобата с септицемией». Kligman
(1975) предложил термин «акне фульминанс» (от латинского
fulmen — молния), который подчеркивает внезапность начала,
тяжесть заболевания и позволяет избежать упоминания акне кон-
глобата, у которого совсем другие течение, симптоматология и
прогноз.
В отечественной литературе имеется лишь сообщение А. А. Ка-
ламкаряна, Р. С. Топурия (1984), наблюдавших больного с акне
фульминанс в кожной клинике ЦКВИ. За рубежом имеется до
30 подобных описаний [Darley С., 1984].
Этиология и патогенез. До сих пор не существует
единого мнения об этиологии и патогенезе акне фульминанс.
Большинство исследователей рассматривают дерматоз как острей-
шую экзацербацию угрей.
Анализ литературы и наше наблюдение наводят на мысль, что
акне фульминанс не связан непосредственно с акне конглобата.
Вопрос о взаимоотношении этих форм нуждается в дальнейшем
исследовании.
Клиника. Заболевание встречается преимущественно у
мужчин молодого возраста (16—20 лет), хотя описано также и у
женщин. Внезапное появление высыпаний является характерной
клинической особенностью акне фульминанс. Множественные
болезненные покрытые корочками изъязвляющиеся узелковые
элементы с гнойным и геморрагическим отделяемым располага-
ются на спине, груди, боковых поверхностях шеи и плеч. На тех
285
же местах имеются и множественные рассеянные пустулезные
высыпания на эритематозном фоне. Характерно отсутствие высы-
паний на лице, комедонов. Заживление очагов поражения часто
сопровождается образованием множества рубцов, в том числе и
келоидных. Суставные симптомы (боли чаще'в коленных и пле-
чевых суставах) обычно имеют среднюю тяжесть, хотя в ряде
случаев наблюдались акне фульминанс с тяжелой персистирующей
артралгией. Ревматоидный фактор отрицательный. Постоянно от-
мечается лейкоцитоз (до 15—30 тыс.) и резко повышенная СОЭ
(до 40—90 мм/ч). Разлитые боли в животе, нередко тошнота и
рвота.
Г истопатология. Инфильтрат из полиморфно-ядерных
лейкоцитов, вторгающийся в фолликулярный аппарат и вызываю-
щий его разрушение.
Заболевание следует дифференцировать от хронической пио-
дермии и акне конглобата.
РубцуЮЩИЙСЯ фОЛЛИКуЛИТ (folliculitis decalvans). Син.: рубцую-
щееся акне (Lallier), эпилирующий и рубцующийся фолликулит (Darier).
Этиология и патогенез. Многие авторы в гнойном
отделяемом из фолликулитов чаще всего находили стафилококки.
Превалирующее значение в генезе заболевания принадлежит из-
мененному состоянию организма, снижению активности его за-
щитных механизмов.
Клиника. Декальвирующий фолликулит характеризуется
воспалением волосяного фолликула, которое ведет к его деструк-
ции и стойкой алопеции. Воспалительные явления клинически
менее выражены, чем при других формах глубокой пиодермии.
Заболевание отличается длительным вялым течением с периоди-
ческими обострениями. Встречается, как правило, у взрослых муж-
чин, но может наблюдаться у юношей, детей и даже младенцев
[Loewenthal L., 1957].
Очаги рубцовой алопеции различны по величине и форме, мно-
гочисленны, но, как правило, не превышают размеров однокопееч-
ной монеты. В ряде случаев они сливаются, образуя более круп-
ные очаги (2—3 см в диаметре), имеющие четкие, но неправиль-
ные очертания. Локализация — волосистая часть головы, главным
образом височные области и теменная — по границе со лбом.
В редких случаях — подмышечные впадины и лобок.
Гистопатология. В ранней пустулезной фазе заболева-
ния выявляются абсцессы в верхней части фолликула с инфиль-
тратом в окружающей зоне. Перифолликулярный инфильтрат
состоит из многочисленных нейтрофилов, гистиоцитов, лимфоид-
ных и плазматических клеток.
В старых очагах гранулематозная ткань состоит из многочис-
ленных плазматических, а также лимфоидных клеток и фибро-
бластов.
Дифференциальный диагноз следует проводить
286
с красной волчанкой, склеродермией, псевдопеладой, красным
плоским лишаем головы (синдром Лассюэра—Литтла).
Пустулезный и атрофический дерматит голеней (dermatitis
cruris pUStulosa et atrophicans). Син.: сикоз голеней, пустулезный и атро-
фический фолликулит голеней.
Впервые термин «Dermatosis cruris pustulosa et atrophicans»
применил G. Clarke в 1952 г., описав это заболевание в Лагосе.
Следующая работа принадлежит R. Harman, который в 1968 г.
подробно описал характерные клинические черты этого дерматоза.
Частота заболевания связана с географическими особенностями.
В Нигерии и Лагосе она составляет 0,5—4,8 % среди всех дерма-
тозов, но почти не встречается в Восточной и Южной Африке
[Poster J., 1983]. В СССР имеется одно описание заболевания
[Каламкарян А. А., Балтабаев М., 1987].
Этиология и патогенез. При бактериологическом
исследовании почти постоянно выделяют золотистый, реже белый,
стафилококк. В патогенезе пустулезного дерматита существенное
значение имеет наличие на коже ворот инфекции, т. е. микро-
травм.
Клиника. Клиническая характеристика пустулезного дер-
матита голеней неполная и требует дополнительного уточнения и
накопления материала.
Оба пола поражаются одинаково часто; возраст больных ко-
леблется от 14 до 32 лет. Процесс начинается чаще всего с появ-
ления на голенях множественных сикозиформных фолликулярных
узелков, пустул, окруженных узким воспалительным венчиком.
Просуществовав несколько дней, а иногда и несколько недель, эти
высыпания вскрываются и покрываются корками. Наблюдается
тенденция к слиянию пустул, образованию отека, небольшому
зуду. В процессе дальнейшего течения через 3—4 нед на месте
фолликулитов формируются атрофические рубцы. Общее состоя-
ние больных удовлетворительное, лимфатические узлы не вовле-
чены.
Гистопатология. В эпидермисе — акантоз, паракератоз,
внутриклеточный отек, отек сосочков дермы, инфильтрация лим-
фоцитами, плазматическими клетками, эозинофилами, полиморф-
но-ядерными лейкоцитами, гистиоцитами, иногда гигантскими
клетками.
Заболевание следует дифференцировать от декальвирующего
фолликулита.
Длительность заболевания от 3 мес до 4 лет, у большинства
больных 12—20 мес.
Прогноз обычно благоприятный, хотя в отдельных случаях
возможно развитие элефантиаза.
Абсцедирующий и подрывающий фолликулит и перифоллику-
лит головы Гофмана (folliculitis et perifolliculitis capitis abscendens
et suffodiens Hoffmann). E. Hoffmann (1907) предложил термин
«абсцедирующий и подрывающий фолликулит и перифолликулит
287
головы» и дал классическое описание этого редкого заболевания,
которое формирует глубокие и поверхностные абсцессы, образуя
такие рубцы, какие наблюдаются при суппуративных гидраде-
нитах.
Бактериологические исследования, как правило, обнаруживают
грамположительные стафилококки.
Клиника. Заболевание чаще развивается у мужчин моло-
дого возраста. На волосистой части головы, в особенности на те-
мени и затылке, располагаются припухлости округлой, продолго-
ватой или почковидной формы желтовато-белого или синевато-
красного цвета, мягкой или флюктуирующей консистенции. Кожа
над ними лишена волос, натянута, истончена, местами изъязвлена.
Очаги тесно скучены, иногда сливаются в более или менее длин-
ные извилистые тяжи-валики, напоминающие мозговые извилины.
При сдавливании такого образования из фистулезных отверстий
появляется гной. Эти отверстия ведут в систему ходов и карманов,
соединяющихся между собой и глубоко подрывающих кожу.
Мы наблюдали больного 26 лет, у которого имелись активные
очаги абсцедирующего перифолликулита головы, рубцы после акне
конглобата на коже спины, а также фолликулиты и фурункулы
на лице, шее и затылке. Подобные наблюдения подтверждают
пиодермическую сущность акне конглобата и абсцедирующего
перифолликулита головы. Течение заболевания очень длительное,
но в конце концов наступает выздоровление.
Гистологическая картина, по данным целого ряда авторов, не
отличается от таковой при акне конглобата.
Заболевание следует дифференцировать от колликвативного и
бородавчатого туберкулеза кожи, третичных сифилидов, глубоких
микозов.
Шанкриформная пиодермия (pyodermia chancriformis). Забо-
левание описано впервые Е. Hoffmann в 1931 г. как бактериальная
инфекция кожи, напоминающая сифилитический твердый шанкр.
Клиника. Шанкриформная пиодермия может развиваться
как у взрослых, так и у детей независимо от пола. Локализуется
в области гениталий и экстрагенитально.
Заболевание обычно начинается с появления пузырька, после
вскрытия которого остается эрозия или язва округлых или оваль-
ных очертаний, основание которых всегда уплотнено. В большей
части случаев очаги поражения покрываются геморрагической
корочкой разной толщины. По удалении корки обнажается эрозия
или изъязвление с ровным дном, розовато-крас ной окраски с не- ,
значительным гнойным отделяемым и приподнятыми краями
(рис. 55). Отделяемое необильное, серозное. В некоторых случаях;
по периферии очага имеется узкий воспалительный ободок. Изъ- *
язвления могут достигать 1—2 см в диаметре.
Субъективные ощущения отсутствуют. Регионарные лимфати- \
ческие узлы плотные, безболезненные, не спаяны между собой и?
с подлежащими тканями. При шанкриформной пиодермии пора-!
жение чаще всего одиночное, но может быть множественным. ;
288 ]
«
Рис. 55. Шанкриформная пиодермия на головке полового члена.
В отделяемом эрозий и язв обычно обнаруживают стафилокок-
ки и стрептококки. Течение заболевания быстрое (2—3 нед), за-
живление происходит без рубца или образуется поверхностный
рубец.
Г истопатология. Выраженный акантоз, отек, расши-
рение лимфатических и кровеносных сосудов. Периваскулярный
и диффузный инфильтрат, состоящий из полиморфно-ядерных
нейтрофилов, эозинофилов, лимфоидных элементов и гистиоцитов;
в противоположность этому первичная сифилома в гистологиче-
ском отношении является плазмомой.
Дифференциальный диагноз следует проводить
в первую очередь с твердым шанкром. Многократные отрицатель-
ные результаты исследований на бледную трепонему и отрицатель-
ные серологические реакции на сифилис позволяют легко отли-
чить эти заболевания.
Бластомикозоподобная пиодермия. Некоторые авторы выделя-
ют ее в качестве особой разновидности хронической язвенно-ве-
гетирующей пиодермии [Brown С., Kligman А., 1957; Daniel S. et
al., 1978; Perry H., 1979].
Клиника. Заболевание может начинаться с появления пу-
зырьков, пустул, узелков, узлов. Отдельные элементы вскоре сли-
ваются и изъязвляются. Образуются язвы синюшно-красного цве-
та с подрытыми инфильтрированными краями. Дно язв покрыто
сосочковыми разрастаниями. Образовавшиеся очаги (один или
289
П—936
несколько) локализуются чаще на конечностях и имеют весьма ’
большое клиническое сходство с поражениями при бластомикозе
[Su W. et al., 1979]. Обычно по периферии очагов располагаются
многочисленные изолированные пустулы, абсцессы. Имеются ука-
зания на сочетание этой формы пиодермии с язвенным колитом
[Forman L., 1978]. При бактериологическом исследовании из оча-
гов поражения чаще всего выделяется золотистый стафилококк,
гемолитический стрептококк.
Для гистопатологии характерны псевдоэпителиоматоз-
ная гиперплазия и множественные абсцессы в дерме из нейтрофи-
лов и эозинофилов. ।
Дифференциальный диагноз. Ввиду большого
клинического и гистологического сходства с глубокими микозами ,
(североамериканский бластомикоз Gilchrist, европейский бласто-
микоз Busse—Buschke, хромобластомикоз, кокцидиомикоз) необ-
ходимо проводить соответствующие бактериологические и сероло-
гические исследования. Выраженные псевдоэпителиоматозные раз- •
растания следует дифференцировать от плоскоклеточной карци- \
номы.
Пиодермия лица (Pyodermia faciale). Острый воспалительный |
процесс, который характеризуется узелковыми и узловатыми на- •;
гнаивающимися поражениями на коже лица у молодых женщин, \
не страдающих вульгарными угрями. 1
Этиология и патогенез не выяснены. Некоторые i
авторы рассматривают заболевание как тяжелую воспалительную
форму розацеа, но С. Dillah и соавт. (1983) полагают, что акне 1
розацеа может иметь значение лишь как важный предрасполага-
ющий фактор. Заболевание связывают с различными пиококками,
но большей частью с золотистым стафилококком.
Клиника. Эта необычная воспалительная реакция встре-
чается только у молодых женщин в возрасте 20—35 лет, т. е.
начало заболевания более позднее, чем при угрях. Дерматоз
характеризуется внезапным началом, быстрым прогрессиро-
ванием; большинство пациентов до заболевания не принимали
медикаментов (в том числе йод, бром). У всех больных процесс
локализуется в центральной части лица (параназальная и моляр-
ная область), в области лба, висков, подбородка. В отделе дерма-
тологии ЦКВИ мы наблюдали 2 больных в возрасте 22 и 29 лет
с локализованной формой этой болезни. Локализованные формы
пиодермии лица наблюдали также D. Bekker, D. Gould (1978),
М. Massa, S. Daniel (1982) и др.
Заболевание начинается с появления цианотической гиперемии
и выраженного отека кожи лица. Через 2—3 дня появляются мно-
жественные гнойные болезненные узловатые высыпания, немного
напоминающие акне конглобата, но без комедонов; наблюдаются
резкие границы между пораженными участками и нормальной
кожей. Течение процесса от нескольких месяцев до 1 года. Общие
симптомы — недомогание, отсутствие аппетита, плохой сон и др.
Лабораторные показатели не изменены.
290
Гистопатология. Некроз соединительной ткани вокруг
волосяных фолликулов в ранней стадии болезни. Некроз распро-
страняется, захватывая сально-волосяной аппарат, вызывая деге-
нерацию волосяных фолликулов и сальных желез. Поражаются
также коллагеновые и эластические волокна в пределах очагов
поражения.
Дифференциальный диагноз следует проводить
с острой пиодермией, вульгарными и розовыми угрями.
Пиодермия, подобная колликвативному туберкулезу. Под этим
названием И. С. Попов и соавт. в 1941 г. описали заболевание,
которое наблюдали у детей грудного и раннего возраста и которое
чрезвычайно напоминало колликвативный туберкулез.
Очаги поражения локализуются на щеках, реже на шее, где
появляются подкожные узлы фиолетового цвета. Узлы медленно
развиваются, спаиваются с кожей, размягчаются, вскрываются с
образованием мешковидных полостей, после чего быстро разре-
шаются (обычно в течение 1—2 нед), оставляя незначительный
рубчик.
В подобных случаях на основании клинической картины обыч-
но диагностируется колликвативный туберкулез, однако очень
быстрое регрессирование очагов после их спонтанного вскрытия
заставляет усомниться в этом диагнозе.
При микроскопическом исследовании мазков из пунктата узла
обнаруживаются лишь стафилококки.
Вегетирующий пиостоматит (pyostomatitis vegetans). F. McCar-
thy (1949) описал воспалительное заболевание слизистой оболоч-
ки полости рта, характеризующееся появлением на эритематозном
фоне мелких вегетаций с гнойным отделяемым, напоминающих
милиарный абсцесс. Во всех трех случаях вегетирующей пиодер-
мии, сообщенных автором, первично в патологический процесс
была вовлечена слизистая оболочка полости рта. F. McCarthy,
G. Shklar (1963) описали 6 случаев вегетирующих поражений ро-
товой полости и желудочно-кишечных расстройств. Подобные
первичные поражения слизистой оболочки рта под названием
pyostomatitis vegetans наблюдали в 1972 г. G. Banatz, Е. Nelle.
О пустулезном вегетирующем дерматозе с вовлечением слизистой
оболочки рта сообщил в 1983 г. S. Klaus.
Все перечисленные авторы клинически описывают генерализо-
ванный папилломатоз слизистой оболочки рта (особенно десен и
щек), сопровождающийся пустулезом. Пустулы быстро вскрыва-
ются, образуя множественные язвы и обширные мощные вегета-
ции с папилломатозом.
Дифференциальный диагноз проводят с лекар-
ственными экзантемами, многоформной экссудативной эритемой,
туберкулезом, бластомикозом, вегетирующим пемфигусом.
Гангрена полового члена и мошонки (gangrena penis et sero-
tum). В 1883 г. J. Fournier описал редкую и тяжелую формы ган-
грены наружных половых органов у мужчин с неожиданным нача-
лом на фоне полного здоровья, быстрым развитием, отсутствием
291
11*
обычных для гангрены причин (артериальный тромбоз). В лите-
ратуре описано 325 случаев, преимущественно у жителей Европы
и континентальной Африки [Thomas J., 1956; Tan R., 1964;
Singh Sh. et al., 1975; Biswas M. et al., 1979; Bamdini G., 1983].
Этиология и патогенез. Полагают, что заболевание
имеет инфекционную природу (при бактериологическом исследо-
вании обнаруживают золотистый стафилококк, стрептококк и реже
протей). М. Reggiani (1979) указывает на следующие патогенети-
ческие механизмы: инфекционное начало, аллергия и ишемия.
Клиника. Заболевание поражает мужчин чаще в среднем и
более позднем возрасте. Оно начинается внезапно. Появляются
отек полового члена и мошонки, лихорадка (t 38—39 °C), недо-
могание. Спустя 1—2 нед развивается поверхностный некроз, за-
хватывающий всю переднюю часть мошонки и полового члена.
В дальнейшем, несмотря на применение антибиотиков, гангрена
продолжает прогрессировать в течение 2—3 нед, вызывает де-
струкцию тканей. У женщин патологический процесс большей
частью начинается на малых половых губах или в области клито-
ра, переходит на промежность, реже на лобок и бедра.
Наблюдается лейкоцитоз — 9000—12 000. В дальнейшем под
влиянием терапевтических мероприятий очаги поражения очища-
ются от гангренозно-некротической массы, постепенно наступает
выздоровление. У большинства больных интенсивность болей в
очагах поражения выражена в слабой или средней степени. Яички
никогда не вовлекаются в процесс благодаря растяжимости кожи
мошонки и фиброзным оболочкам, защищающим яички. Прогноз
всегда серьезный и зависит от своевременного и правильного ле-
чения. В прошлом смертность при гангрене Фурнье достигала
23—27 %.
Лечение и профилактика. Необходима первичная обработка
очагов (вскрытие покрышек фликтен и пустул, промывание их
3 % раствором перекиси водорода и смазывание анилиновыми
красителями или другими дезинфицирующими средствами).
При наличии обильной экссудации или гнойных корок реко-
мендуют санацию кожи с помощью местной ванны с раствором
перманганата калия 1:5000. Дальнейшее дренирование очагов пу-
тем наложения влажновысыхающих повязок с дезинфицирующими
и вяжущими растворами. Последующая терапия в форме дезин-
фицирующих и противовоспалительных линиментов, масляных
взвесей или мазей.
После первичной обработки глубоких ограниченных очагов
стафилококковой инфекции показано применение дезинфицирую-
щих средств в форме мазей или пластырей, обеспечивающих глу-
бокое проникновение лекарственного препарата и ограничиваю-
щих распространение гноя. В целях санации всей кожи рекомен-
дуется общее ультрафиолетовое облучение или обтирание видимо
здоровой кожи дезинфицирующими средствами.
При тяжелых формах (карбункул, фурункул лица, пузырчатка
новорожденных, буллезное импетиго), а также при распростра-
292
ценных формах пиодермий, осложненных лимфангитом и лимфа-
денитом необходимо назначение антибиотиков или сульфанила-
мидных препаратов и стимулирующих средств (алоэ, аутогемо-
терапия, витамины, у-глобулин и др.). Специфическая иммуноте-
рапия целесообразна при хронических и рецидивирующих формах
пиодермий.
Проблема терапии хронических глубоких пиококковых пора-
жений кожи является одной из наиболее сложных в современной
дерматологии. Это объясняется, по-видимому, двумя основными
факторами: постоянной изменчивостью биологических свойств
пиококков (вирулентных, антигенных, иммуногенных) и сложной
иммуноаллергической перестройкой организма больного.
При лечении хронических глубоких гнойничковых заболеваний
кожи, встречающихся редко, проводится длительная (1—Р/2 мес)
этиотропная терапия антибиотиками. Широко применяют иммуно-
терапию, препараты, стимулирующие неспецифическую реактив-
ность организма больного, биогенные стимуляторы, иммуномоду-
ляторы, витаминотерапию.
Наряду с этим в зависимости от особенностей клинических
проявлений той или иной разновидности хронической глубокой
пиодермии назначают параллельно с антибиотиками широкого
спектра действия кортикостероиды в сочетании с отечественным
цитостатиком проспидином. Последний вводят внутримышечно,
начиная с разовой (суточной) дозы 50 мг (1—2 инъекции), а за-
тем 100 мг. Инъекции делают ежедневно, курсовая доза 1,5—2 г.
Можно пользоваться также циклофосфаном (циклофосфамидом),
который вводят ежедневно внутримышечно по 100 мг в сутки (на
курс 1 —1,5 г).
Кортикостероиды (преднизолон, метилпреднизолон, дексаме-
зон, триамцинолон) назначают в средней суточной дозе, эквива-
лентной 20—40 мг преднизолона в течение 3—6 нед.
Важное значение имеет также хирургическое вмешательст-
во — удаление и выскабливание отдельных очагов поражения, рас-
сечение и электрокоагуляция свищевых ходов.
При acne fulminans успех лечения определяется обязательным
назначением кортикостероидных препаратов (30—40 мг предни-
золона в сутки) в комбинации с антибиотиками.
В тяжелопротекающих случаях абсцедирующего и подрываю-
щего фолликулита показано назначение кортикостероидов (20—
30 мг преднизолона в сутки) в сочетании с проспидином (1 —1,5 г
на курс).
При пустулезном и атрофическом дерматите голеней в неко-
торых случаях хороший эффект наблюдается при длительном
приеме тетрациклина или его сочетания с кортикостероидами.
Возникновение гнойничковых заболеваний зависит не только
от свойств их возбудителей, но и от уровня личной гигиены насе-
ления, бытовых условий, питания, условий труда работающих,
санитарно-культурной грамотности населения. Борьба с гнойнич-
ковыми заболеваниями представляет собой комплекс профилак-
тических мероприятий. т
Особое внимание должно быть \делено борьое с пиодермитами
на нрошводстве. в сельском хозяйстве, медицинских учреждениях.
Начинать работу сле/вет с обучения мерам личной гигиены, со-
блюдения чистоты тела, белья, спецодежды и г. д. В условиях
нроишодетва особое внимание должно быть уделено правильной
работе душевых, стирке спецодежды, соблюдения чистоты на ра-
бочем месте, борьбе с микротравматизмом как одной из ьзавных
причин таболеваний, в цехах и рабочих помещениях должны быть
opi анизованы ап течки и г. д.
Схема обследования патогенетических факторов пиодермитов
па производстве: I ) санитарно-гигиенические условия труда (осве-
щение. вентиляция, температурный режим, захламленность и др.);
2) обеспеченность горячей водой, душевыми установками, мылом,
полотенцем; индивидуальными шкафами хтя хранения домашней
и спецодежды; санитарное состояние бытовых помещений; 3) кон-
троль за химическим составом и чистотой охлаждающих смесей
и эмульсий; 4) паспортизация обтирочного материала; 5) борьба
с микротравматизмом, механизация удаления металлических стру-
жек и опилок; 6) наличие аптечек в цехах, их оснащенность и
подготовленность рабочих для самостоятельной обработки микро-
травм: наличие санитарных дружин; 7) качество санитарного про-
свещения и наглядной агитации по профилактике пиодермий;
8) обеспеченность спецодеждой и организация ее стирки, регуляр-
ность смены; спецодежда для защиты от масел, керосина, бензина
и водно-щелочемасляных эмульсий в форме фартуков и накладок
из текстовинита, кавенита, маслобензостойкой прорезиненной
ткани или искусственной кожи и др.; 9) использование защитных
паст, предохраняющих кожу от действия СОЖ (смазочно-охлаж-
дающих жидкостей) и технических масел. Рекомендуемые сред-
ства защиты: паста «ХИОТ», «МП-1», паста «ЯЛОТ», «Исчезаю-
щий крем», паста «ИЭР-1» НИИ им. Эрисмана и др.; 10) обес-
печенность моющими средствами: 11) учет заболеваемости в %,
случаях и днях нетрудоспособности на 100 застрахованных.
Важное значение имеют меры предупреждения развития гной-
ничковых заболеваний в период новорожденное™: в палатах ново-
рожденных следует постоянно поддерживать необходимые сани-
тарно-гигиенические условия, своевременно изолировать больных
детей и кормящих матерей. Ежедневный телесный осмотр обслу-
живающего персонала и углубленный профосмотр ежеквартально.
Медицинские работники и обслуживающий персонал, болеющие
пиодермитами. ангиной и другими гнойными заболеваниями, ОРЗ,
не должны допускаться к работе с детьми. Дети, больные пиодер-
митами, подлежат изоляции до окончания лечения. Большое вни-
мание в профилактике пиодермитов на всех этапах жизни ребенка
должно уделяться мерам повышения общей сопротивляемости
организма, гигиеническому режиму, правильному уходу за кожей
и рациональному питанию. Санитарное просвещение по вопросам
профилактики iнойничковых заболеваний должно быть в центре
внимания врача.
294
Глава 9
ГРИБКОВЫЕ ЗАБОЛЕВАНИЯ КОЖИ
Грибковые заболевания кожи относят к инфекционным пора-
жениям. Они распространены на всех континентах. В ботаниче-
ской классификации возбудители грибковых заболеваний отнесены
к различным классам низших (зигомицеты) и высших (аскоми-
цеты, деутеромицеты) грибов.
Основным резервуаром антропонозных микозов является чело-
век, зоонозных (зооантропонозных) — больное животное. Воз-
можно инфицирование человека и почвенными (геофильные) гри-
бами.
Грибы могут поражать все слои кожи, гиподерму, кости, внут-
ренние органы, что принимается во внимание при построении со-
временных классификаций грибковых заболеваний.
I. Кератомикозы
Разноцветный лишай
Узловатая трихоспория
II. Дерматофитии
Эпидермофития паховая
Эпидермофития стой
Руброфития
Трихофитии (антропонозная, зоонозная)
Микроспория (антропонозная, зоонозная)
Фавус
III. Кандидоз (поверхностный, хронический генерализованный, висцеральный)
IV. Глубокие микозы
Кокцидиоидоз
Гистоплазмоз
Бластомикозы —
Криптококкоз
Бластомикоз североамериканский
Бластомикоз южноамериканский
Бластомикоз келоидный
Хромомикоз
Споротрихоз
Аспергиллез
Мукороз
Пенициллиоз
Цефалоспориоз
Кладоспориоз
Риноспоридиоз
Мицетома
V. Псевдомикозы
Эритразма
Подкрыльцовый трихомикоз
Актиномикоз
Нокардиоз
295
Материал главы изложен в соответствии с общепринятой в
стране классификации грибковых заболеваний А. М. Ариевича
(1966) с учетом предложения Всемирной организации здравоохра-
нения по терминологии нозологических форм заболеваний и их
возбудителей (1975).
КЕРАТОМИКОЗЫ
Грибковый процесс при этих формах грибковых заболеваний
развивается в роговом слое эпидермиса и на поверхности кутику-
лы волоса; воспалительные явления в глубжележащих слоях кожи
отсутствуют или выражены слабо.
РАЗНОЦВЕТНЫЙ ЛИШАЙ
Син.: отрубевидный лишай (pityriasis versicolor)
Заболевание впервые описал Robin в 1853 г.
Возбудитель заболевания Pityrosporum orbiculare отнесен Gor-
don в 1951 г. к дрожжеподобным грибам. Культура возбудителя
впервые была получена Е. И. Котляром в 1892 г.
Развитию микоза способствуют пониженное питание, повы-
шенная потливость, себорея, уменьшение физиологического ше-
лушения кожи, патология внутренних органов, желез внутренней
секреции. Заболевание хроническое, имеет склонность к рециди-
вам. Чаще болеют лица среднего возраста, дети. Заболевание
контагиозное, однако возникает лишь при благоприятных усло-
виях. Наиболее распространено в тропических и субтропических
странах с повышенной влажностью воздуха. В Индии, Шри-Ланке,
Африке, Индокитае встречаются сходные кератомикозы — шим-
бери, тропические.
Клиника. Типичной локализацией микоза является кожа плеч,
груди, спины и живота, где появляются невоспалительные, розо-
ватые, быстро приобретающие коричневую окраску шелушащиеся
пятна (рис. 56). Шелушение более четко выявляется при доскаб-
ливании, отпавшие чешуйки напоминают отруби. Очаги микоза
часто обнаруживают на шее, волосистой части головы, но без по-
ражения волос. Элементы сыпи располагаются вокруг волосяных
фолликулов, склонны к периферическому росту, слиянию. Встре-
чаются формы, сходные с эритразмой, крапивницей, напоминаю-
щие витилиго, эритематосквамозные, лихеноидные поражения.
На их месте после облучения ультрафиолетом остаются белые
псевдоахромические пятна. В субтропических и тропических зонах
наблюдаются распространенные формы с поражением лица, пахо-
вых областей, конечностей. Субъективные ощущения обычно от-
сутствуют.
Гистопатология. Воспалительная реакция в дерме, как прави-
ло, отсутствует или выражена слабо. В роговом слое и в устьях
296
волосяных фолликулов обнаруживают короткий (5—12 мкм),
изогнутый широкий (до 4 мкм) мицелий и скопления (грозди)
крупных (5—8 мкм в диаметре) округлых двухконтурных спор.
Диапюз ставят на основании характерной клинической симп-
томатики, повышенной восприимчивости шелушащихся пятен к
настойке йода (проба Бальзера) и обнаружения в обработанной
10 % щелочью чешуйке элементов гриба. В лучах люминесцент-
ной лампы выявляется золотисто-желтое или буроватое свечение.
На среде Сабуро с добавлением стрептомицина и пенициллина
(100 ЕД на 1 мл) или хлортетрациклина гидрохлорида и оливко-
вого масла при температуре 35—37 °C на 7—8-й день вырастает
беловато-кремовая блестящая дрожжевая колония с почкующими-
ся клетками. Заболевание дифференцируют от вторичного сифили-
са, псориаза, эритразмы, розового лишая Жибера, витилиго, се-
борейных очагов.
Лечение. Пораженные участки кожи обрабатывают по методу
М. П. Демьяновича (60 % раствором натрия гипосульфита и 6 %
раствором хлористоводородной кислоты); 20 % эмульсией бензил-
бензоата (3 дня); втирают 5—10 % серную или дегтярную мазь;
5 % салициловую мазь (на ночь) и 3—5 % салициловый спирт
(утром); 3—5 % резорциновый спирт и другие противогрибковые
препараты. Важное значение придают устранению потливости и
лечению висцеральной патологии.
Необходимо обследовать и лечить всех больных членов семьи,
подвергать дезинфекции одежду, нательное и постельное белье.
Курс лечения следует повторить 2—3 раза с месячными переры-
вами.
УЗЛОВАТАЯ ТРИХОСПОРИЯ (ПЬЕДРА)
Син.: болезнь Беджеля, узелковый трихомикоз, трихоспория Озори
Узловатая трихоспория (пьедра) — заболевание кутикулы во-
лоса с образованием на нем узелков белого (piedra alba) или чер-
ного (piedra nigra) цвета.
Белая (европейская) пьедра описана отечественными дермато-
логами К. Линдеманом, Ю. Кнохом (1866), а также зарубежными
авторами Beigell, Ozori (1869), «истинную» (черную) пьедру опи-
сал Desenne (1878).
Возбудителем белой пьедры является Trichosporon Beigellii,
а черной — Trichosporon hortai, относящиеся к дрожжеподобным
грибам.
Развитию заболевания способствуют теплый климат, мытье
волос водой из непроточных водоемов, кислым молоком, обработ-
ка волос минеральными маслами.
Белая пьедра спорадически встречается в Средней Азии и За-
кавказье, но в основном выявляется в Великобритании, Венгрии,
Испании, Франции, США, Японии; черная пьедра распространена
преимущественно в странах Центральной и Южной Америки
297
(Аргентина, Чили, Колумбия, Бразилия, Уругвай, Парагвай) и
Африки, а также в Индии, Китае, Бирме, Таиланде.
Клиника. Заболевание характеризуется хроническим тече-
нием. Оно встречается у лиц обоего пола, но чаще у молодых жен-
щин, пользующихся при мытье головы молочнокислыми продук-
тами.
При белой пьедре поражаются волосы на голове, бороде, усах,
а также в области половых органов; при черной пьедре в основном
поражаются волосы на голове. На волосах образуются множест-
венные мелкие, очень твердые (piedra по-испански камень) узел-
ки (до 20—30 и более на каждом волосе) неправильной овальной,
веретенообразной формы, почти полностью охватывающие волос.
Иногда они сливаются, образуя сплошную короткую (до 3—5 мм)
при черной пьедре или длинную (до 10 мм и более) при белой
пьедре муфту, состоящую из крепко склеенного мицелия и спор
гриба. Узелки легко определяются при пальпации. Иногда при
тугом перетягивании волос узелки склеиваются, образуя пучки,
внешне напоминающие снопы злаковых («колумбийский колтун»).
При сгибании таких волос слышен своеобразный хруст, вызывае-
мый разрушением плотной колонии гриба. Волосы при пьедре не
обламываются, так как не только вещество, но и кутикула волоса
в процесс не вовлекаются.
При тропической черной пьедре узелки буроватого или насы-
щенно-коричневого цвета, иногда имеют красноватый или серо-
ватый оттенок, при белой пьедре узелки более светлые, серовато-
желтоватые или молочно-матовые.
Диагноз. Легко устанавливается на основании своеобразия
клинических симптомов. В затруднительных случаях диагноз мо-
жет быть подтвержден микроскопическим и культуральным иссле-
дованиями. В узелках на волосах при микроскопии выявляется
широкий (4—6 мкм) мицелий, распадающийся на овальные, круг-
лые и прямоугольные артроспоры, расположенные мозаично или
скоплениями.
На среде Сабуро образуются серовато-желтые, темно-кремо-
вые, черные колонии- У возбудителя черной пьедры имеются аски
с 2—8 аскоспорами до 50 мкм в диаметре.
Пьедру дифференцируют от так называемой ложной
пьедры, вызываемой бактериями, образующими на среде Сабуро
пористые колонии кремового цвета с фестончатым бордюром по
периферии.
Лечение и профилактика. Голову ежедневно следует мыть го-
рячим раствором сулемы 1:1000—1:2000, 0,01 % сулемовым уксу-
сом или 2 % раствором салициловой кислоты с последующим
тщательным вычесыванием из волос частым гребнем отслаиваю-
щихся узелков с повторным промыванием волос горячей водой с
мылом.
При запущенных формах заболевания волосы сбривают. Внутрь
рекомендуют принимать витамин А.
298
ДЕРМАТОФИТИИ
Дерматофитии объединяют группу заболеваний, вызываемых
дерматофитами — нитчатыми грибами из родов Epidermophyton,
Trichophyton, Microsporum, способными поражать эпидермис, все
слои дермы, волосы и ногти.
ЭПИДЕРМОФИТИЯ ПАХОВАЯ
Син.: eczema marginatum, tinea cruris
Грибковое поражение в основном крупных складок кожи, а в
ряде случаев и ногтей. Впервые под названием «окаймленная эк-
зема» заболевание описал Hebra (1860). П. И. Матчерский (1861)
установил грибковую его природу. В 1907 г. Sabouraud выделил
возбудителя, назвав его Epidermophyton inguinale.
Возбудитель — Epidermophyton floccosum (син. Epidermophyton
inguinale Sabouraua).
В настоящее время термин «эпидермофития» применим только
в отношении микоза, вызываемого единственным патогенным гри-
бом из рода Epidermophyton. Использование термина «эпидермо-
фития» для названия микоза стоп, обусловленного Trichophyton
mentagrophytes var. interdigitale, ранее называвшегося Epidermo-
phyton Kaufmann — Wolf, лишь дань традиции.
Паховой эпидермофитией болеют преимущественно мужчины.
Возникновению заболевания способствуют повышенное потоотде-
ление, нарушение углеводного обмена, повышенная температура
окружающей среды, в связи с чем заболевание чаще встречается
в регионах с теплым влажным климатом. Заражение происходит
при непосредственном контакте с больным, но чаще через пред-
меты, бывшие в употреблении у больного (подкладные судна,
клеенки, мочалки, белье, термометры), если они не были правиль-
но дезинфицированы. При локализации микоза на стопах зараже-
ние чаще происходит в банях и душевых. На долю Epidermophyton
floccosum как возбудителя микозов приходится не более 1,5 %
от числа всех возбудителей дерматофитий.
Клиника. Типичной локализацией очагов поражения явля-
ется кожа складок паховых, межъягодичной, молочных желез,
реже — подкрыльцовых. Проявления микоза могут наблюдаться
часто и на коже туловища, конечностей (возможно поражение
ладоней), полового члена, волосистой части головы. Заболевание
протекает с островоспалительными явлениями. Очаги поражения
представляют собой четко отграниченные пятна округлой формы
(рис. 57), розовой окраски. При слиянии друг с другом они могут
образовывать очаги полициклических очертаний с хорошо выра-
женным сплошным отечным периферическим валиком, на котором
образуются пузырьки, микропустулы, эрозии, корочки, чешуйки,
иногда с мокнутием, имитирующим экзему (рис. 58, а). В центре
очагов наблюдается разрешение патологического процесса, шелу-
шение. Субъективно отмечается зуд. Может развиться хроническое
299
Рис. 57. Паховая эпидермофития.
течение заболевания с обострениями в летнее время года. При
поражении кожи и ногтевых пластинок стоп микоз клинически
сходен с рубро- и эпидермофитией.
При гистологическом исследовании очагов поражения выявля-
ются акантоз, гиперкератоз, умеренно выраженная периваскуляр-
ная инфильтрация дермы лимфоидными клетками, фибробластами
и гистиоцитами. Грибы по окраске по Граму—Вейгерту и Мак-
Манусу (РAS-реакция) обнаруживают во всех слоях эпидермиса,
иногда в инфильтратах и лимфатических щелях.
Диагностика паховой эпидермофии основывается на харак-
терной клинической картине заболевания и обнаружении в чешуй-
ках кожи с очагов поражения и ногтевых пластинок септирован-
ного ветвящегося короткого (2—4 мкм) мицелия, цепочек прямо-
угольных артроспор и выделении культуры Е. floccosum с харак-
терными концевыми микроконидиями, располагающимися груп-
пами в виде гроздьев бананов. Заболевание дифференцируют от
руброфитии, кандидоза крупных складок кожи, эритразмы, опре-
лости, экземы крупных складок кожи, а при локализации на сто-
пах — от эпидермофитии стоп, вызванной Т. interdigitale.
Лечение. При острых явлениях и экзематизации назначают
десенсибилизирующие антигистаминные препараты, наружно —
примочки из 0,25 % раствора нитрата серебра или 1 % раствора
резорцина. После исчезновения островоспалительных явлений на-
значают смазывание очагов поражения в течение 5—6 дней 1 %
йодной настойкой, а затем 2—3 нед 3—5 % серно-дегтярной
мазью или другими противогрибковыми препаратами.
300
Профилактика. Необходима борьба с потливостью, коррекция
нарушений обмена, тщательная дезинфекция предметов общего
пользования, находящихся у больных паховой эпидермофитией
(судна, клеенки, белье, термометры). Очаги поражения после раз-
решения клинических проявлений микоза профилактически в те-
чение 2 — 3 нед рекомендуется смазывать 2 °0 настойкой йода.
ЭПИДЕРМОФИТИЯ стоп
Син.: эпидермофитоз. стопа атлета
Хронически протекающее грибковое заболевание, локализую-
щееся на коже сводов и межпальцевых складок стоп, с частым
поражением ногтевых пластинок. Впервые оно описано Н. П. Ман-
суровым (1890), Desier de Fortune!, Courmont (1890), а затем
M. Kaufmann-Wolf (1914), установившей грибковую природу за-
болевания.
Возбудитель: Trichophyton mentagrophytes (Blanchard, 1895),
var. interdigitale (Pristley, 1917), Син,: Trichophyton Kaufmann-
Wolf; Epidermophyton Kaufmann-Wolf. Принято рассматривать
данный возбудитель как стойкий вариант Trichophyton mentagro-
phytes, Trichophyton gypseum или сокращенно — Trichophyton in-
lerdigitale, а заболевание, вызванное данным грибом, называют
эпидермофитией стоп. На долю Trichophyton interdigitale прихо-
дится 5 —10 % от числа всех возбудителей микозов стоп в городах
и 40—50 % — в сельской местности.
Э п и д е м и о л о 1 и я. Заболевание регистрируется почти во
всех странах мира. Заражение происходит при непосредственном
контакте с больным человеком (общая постель), но чаще опосре-
дованно — при ношении обуви, носков, чулок больного данным
микозом, а также в банях, душевых, бассейнах, спортзалах, где
отшелушившийся эпидермис и отпавшие частицы разрушенных
грибом ногтей больных эпидермофитией могут попасть на влаж-
ную кожу стоп здорового человека. Возникновению заболевания
благоприятствуют гипергидроз стоп, плоскостопие, недостаточный
гигиенический уход за ногтями, ношение тесной обуви.
Проникновению гриба в эпидермис способствуют нарушение
целостности эпидермиса (опрелость, микротравма, потертость),
длительное ношение резиновой обуви, нарушение тонуса сосудов
нижних конечностей, дисфункции нервной, эндокринной и иммун-
ной систем. Иммунитет после перенесенного заболевания не раз-
вивается.
Клиника. Инкубационный период точно не установлен.
Выделяют несколько форм микоза: сквамозную, интертригиноз-
пую, дисгидротическую, острую, описанную О. Н. Подвысоцкой
в 1937 г., и онихомикоз. Возможны вторичные высыпания на ко-
же — эпидермофитиды (микиды), связанные с аллергенными
свойствами гриба.
Сквамозная форма проявляется шелушением кожи свода стоп,
иногда возникающего на гиперемированном фоне. Процесс может
301
распространиться на боковые и сгибательные поверхности паль-
цев стоп.
При сквамозно-гиперкератотической разновидности эпидермо-
фитии стопы могут развиться участки диффузного утолщения
кожи по типу омозоленности, с пластинчатым шелушением. При
стертых формах субъективные ощущения отсутствуют.
Интертригинозная форма начинается с малозаметного шелу-
шения кожи в третьих или четвертых межпальцевых складках
стоп. Затем процесс приобретает вид опрелости с трещиной в глу-
бине складки, окруженной отслаивающимся белесоватого цвета
роговым слоем эпидермиса, сопровождается зудом, иногда жже-
нием. При продолжительной ходьбе трещины могут трансформи-
роваться в эрозии с мокнущей поверхностью. За счет присоедине-
ния пиококковой и дрожжевой флоры развиваются гиперемия,
отечность кожи, усиливается зуд, появляется болезненность. Те-
чение хроническое, обострения наблюдаются в летнее время года.
Дисгидротическая форма характеризуется наличием на сводах,
нижнебоковой поверхности и на соприкасающихся поверхностях
пальцев стоп пузырьков с толстой роговой покрышкой, прозрач-
ным или опалесцирующим содержимым («саговые зерна»). Распо-
лагаются они обычно группами, склонны к слиянию, образованию
многокамерных, порою крупных пузырей с напряженной покрыш-
кой. После их вскрытия образуются эрозии, окруженные перифе-
рическим валиком отслаивающегося эпидермиса (рис. 58, б). Со-
держимое пузырьков (пузырей) может быть гнойным, если при-
соединяется пиококковая инфекция. У некоторых больных воз-
никает лимфангит, лимфаденит, сопровождающиеся болезнен-
ностью, общим недомоганием, повышенной температурой тела.
Острая эпидермофития возникает вследствие резкого обостре-
ния дисгидротической и интертригинозной формы и характеризу-
ется высыпанием значительного количества везикулезно-буллез-
ных элементов на отечной воспаленной коже подошв и пальцев
стоп. Все это сопровождается лимфангитом, лимфаденитом, вы-
раженной местной болезненностью, затрудняющей ходьбу, высокой
температурой и генерализованными аллергическими высыпаниями,
что делает больного временно нетрудоспособным.
Следует иметь в виду условность выделения клинических форм
эпидермофитии стоп — возможно их сочетание, переход одной
формы в другую, что зависит от реактивности организма, физи-
ческой нагрузки и даже характера лечения больного.
Поражения ногтей, преимущественно 1 и 5 пальцев стоп, встре-
чаются у 20—30 % больных. Ноготь становится тусклым, желто-
ватым, неровным, но длительно сохраняет свою конфигурацию.
В его толще появляются пятна желтого цвета или полосы охряно-
желтого, канареечного цвета, развивается подногтевой гиперкера-
тоз с разрушением ногтевой пластинки, «изъеденностью» ее сво-
бодного края. Ногти на кистях не поражаются. Приблизительно
у 60 % больных дисгидротической, реже интертригинозной фор-
мой эпидермофитии возникают микиды — токсико-аллергическая
302
сыпь. В ее возникновении существенная роль принадлежит нервно-
рефлекторным механизмам, лимфогематогенной диссеминации
гриба в сенсибилизированную кожу. Элементы гриба в микидах,
как правило, не обнаруживаются.
Гистопатология. При сквамозной форме эпидермо-
фитии отмечается акантоз, гиперкератоз. Роговой слой в 2—3 раза
по толщине превосходит остальную часть эпидермиса; блестящий
слой обычно отсутствует. При дисгидротической форме наблюда-
ется значительный акантоз, гиперкератоз, очаговый паракератоз.
В мальпигиевом слое — межклеточный отек с большим количе-
ством пузырьков, экзоцитоз. В верхних слоях дермы — отек, пери-
васкулярная воспалительная инфильтрация из лимфоцитов, гис-
тиоцитов, фибробластов и нейтрофильных гранулоцитов. Нити и
цепочки спор гриба обнаруживаются в роговом и шиповатом сло-
ях эпидермиса. При онихомикозе в ногтевом ложе — паракератоз,
сглаженность сосочков дермы, отек в ретикулярном слое, инфиль-
траты из лимфоидных клеток и гистиоцитов вокруг сосудов. В ро-
говых и паракератотических массах ногтевого ложа обнаружива-
ются элементы гриба.
Диагноз эпидермофитии стоп, базирующийся на симптомах,
приведенных выше, должен быть подтвержден обнаружением эле-
ментов гриба в чешуйках кожи, покрышке пузырей и частицах
ногтей при микроскопическом исследовании (септированный или
артроспоровый мицелий) и выделении культуры возбудителя. Диф-
ференцируют дисгидротическую форму микоза от руброфитии,
паховой эпидермофитии, поверхностной пиодермии, контактного
дерматита, интертригинозной формы — от кандидоза и опрелости
мелких складок. Решающая роль принадлежит результатам микро-
скопических и культуральных исследований.
Лечение. При острых воспалительных явлениях назначают
примочки из 1—2 % раствора резорцина, 0,1 % раствора этакри-
дина, 0,25 % раствора нитрата серебра, раствора перманганата
калия 1:6000—1:8000. Покрышку пузырьков (пузырей) прокалы-
вают иглой или срезают ножницами с соблюдением правил асеп-
тики. В последующем применяют растворы анилиновых красите-
лей, пасты и мази с антимикотиками (деготь 2—3 %, сера 3___
10 %, салициловая кислота 2—3 %, настойка йода 2 %), патен-
тованные антимикотические препараты (цинкундан, ундецин, ми-
козолон, микосептин и др.). Учитывая выраженные аллергенные
свойства возбудителя, необходимо назначать (особенно при нали-
чии микидов) средства гипосенсибилизирующей терапии и анти-
гистаминные препараты, седативные средства, витамины группы В,
рутин, аскорбиновую кислоту. При присоединении вторичной пио-
кокковой инфекции — кратковременные курсы антибиотиков ши-
рого спектра действия. Лечение онихомикоза с применением ке-
ратолитических и фунгицидных пластырей проводят, как и при
руброфитии — удаление ногтевой пластинки после размягчения
20 % уреапластом и тщательное лечение ногтевого ложа фунгицид-
ными препаратами.
303
Общая профилактика предусматривает гигиеническое содержа-
ние и регулярную дезинфекцию бань (полы, половики, деревянные
решетки и настилы, скамейки, тазики), душевых и бассейнов,
профосмотры обслуживающего их персонала, своевременное лече-
ние и диспансеризацию больных, санпросветработу. Личная про-
филактика заключается в использовании только своей обуви, со-
блюдении правил гигиены кожи стоп, дезинфекции обуви. В до-
машних условиях это можно сделать по предложенной В. М. Ле-
щенко методике: ватным тампоном, обильно смоченным 25 % рас-
твором формалина, протирают стельку и подкладку обуви. Затем
ее помещают в полиэтиленовый мешок. Через 2 ч обувь проветри-
вают до исчезновения запаха формалина. Носки, чулки, дезинфи-
цируют кипячением в течение 10 мин.
В целях профилактики рецидивов эпидермофитии кожу стоп
после исчезновения проявлений болезни смазывают в течение
2—3 нед антимикотическими средствами.
РУБРОФИТИЯ
Син.: микоз, обусловленный красным трихофитоном; руброфитоз; рубромикоз
Склонное к обострениям и хроническому течению грибковое
заболевание с преимущественной локализацией очагов на коже
стоп, частым поражением ногтевых пластинок стоп и кистей, круп-
ных складок, кожи туловища и конечностей, реже — лица, шеи и
волосистой части головы.
Заболевание впервые описано японским дерматологом Ota
в 1922 г. и длительное время было эндемичным для стран Даль-
него Востока и Юго-Восточной Азии (Япония, Китай, Индия).
В СССР о единичных случаях руброфитии у лиц, прибывших из
этих регионов, сообщали А. А. Боголепов (1930), А. М. Ариевич
(1937). И. М. Щербаков (1938). Однако после второй мировой
войны микоз стал быстро распространяться в странах Европы и
Америки.
Первым внимание отечественных дерматологов на это обстоя-
тельство обратил А. М. Ариевич, представивший в 1945 г. сообще-
ние о подробно изученных им совместно с В. Н. Пентковской
40 больных и предложивший именовать микоз, вызываемый крас-
ным трихофитоном, термином «руброфития», получившим широ-
кое распространение у нас и ряде зарубежных стран.
Возбудитель заболевания Trichophyton rubrum Castellani (Sa-
bouraud, 1910).
Эпидемиология. Болеют только люди. Заражение про-
исходит при длительном общении с больным руброфитией и поль-
зовании различными вещами больного (мочалка, пемза, ножницы,
обувь и др.; при посещении бань, душевых, бассейна, где на полу,
ковриках, лавочках, настилах, в сточных водах могут длительно
сохраняться инфицированные грибом чешуйки кожи и частицы
разрушенных ногтей). Руброфитию часто называют семейной ин-
фекцией.
304
Инкубационный период не установлен. Развитию микоза спо-
собствуют различные экзогенные (повышенная потливость или
чрезмерная сухость кожи стоп, травмирование их обувью, несо-
блюдение гигиенического содержания стоп) и эндогенные (эндо-
кринопатии, иммунодефицитное состояние, обменные нарушения,
снижение естественной сопротивляемости организма за счет при-
менения кортикостероидов, цитостатиков, антибиотиков и др.)
факторы.
Клиника. Проявления руброфитии многогранны — от едва за-
метного шелушения кожи и трещин в межпальцевых складках до
обширных поражений крупных складок и кожи туловища с обра-
зованием фолликулярно-узловатых элементов и крупных очагов по
типу гранулемы; поражений волос и волосяных фолликулов; ног-
тей пальцев стоп и кистей.
По преимущественной локализации поражений различают руб-
рофитию стоп и кистей, руброфитию крупных складок и гладкой
кожи, генерализованную форму руброфитии и онихомикоз. Учиты-
вая условность этого деления, целесообразно выделять руброфи-
тию стоп и кистей и генерализованную ее разновидность.
Руброфития стоп и кистей может проявляться в следующих
клинических формах: интертригинозной, дисгидротической, сква-
мозно-гиперкератотической с одиночными или множественными
поражениями ногтей. Иногда процесс может развиваться бурно,
с образованием пузырей, лимфангитами и лимфаденитами, вто-
ричными аллергидами (микидами).
Заболевание начинается с поражения межпальцевых складок
стоп (интертригинозная форма). Затем процесс распространяет-
ся на кожу подошв, тыльную поверхность стоп и на ногтевые
пластинки. Обычно процесс на стопах предшествует поражению
кожи ладоней и тыла кистей. В глубине межпальцевых складок
часто обнаруживаются трещинки с шелушением вокруг них. На
фоне застойной гиперемии и незначительной инфильтрации в об-
ласти тыльной поверхности стоп видны фестончато расположен-
ные узелки, пузырьки и корочки (рис. 59). Субъективно больных
беспокоит зуд.
При дисгидротической, экссудативной форме, чаще наблюдаю-
щейся у детей, подростков и лиц молодого возраста, в клинической
картине преобладают пузырьки, эрозии, мокнутие.
Сквамозно-гиперкератотическая форма руброфитии встречает-
ся чаще других и характеризуется диффузной застойной гипере-
мией, сухостью, усиленным ороговением кожи подошв, выражен-
ностью кожных борозд, муковидным и мелкоочаговым шелуше-
нием. В связи с частым мытьем рук с мылом проявления микоза
на ладонях могут быть менее выражены, чем на подошвах. Однако
сухость кожи, подчеркнутость рисунка кожных борозд, кольце-
видное шелушение на фоне красновато-синюшного цвета кожи и
здесь отчетливо выражены. Очаги на тыльной поверхности паль-
цев кистей, в области запястья часто имеют выраженный перифе-
рический валик, состоящий из мелких узелков, пузырьков и ко-
Рис. 59. Руброфитии стоп.
При руброфитии в отличие от эпидермофитии могут поражать-
ся все или многие ногтевые пластинки на стопах и кистях. Выде-
ляют 3 типа их поражений: нормотрофический, гипертрофиче-
ский и атрофический.
При нормотрофическом типе конфигурация и толщина ногте-
вой пластинки сохраняются длительное время. В толще ногтя по-
являются пятна и полосы белого (лейконихии), желтого или жел-
то-охряного цвета, сливающиеся в дальнейшем на всей видимой
части ногтя, кроме проксимальной. При гипертрофическом типе
ногтевая пластинка становится тусклой, утолщается за счет под-
ногтевого гиперкератоза, легко крошится как со свободного края,
так и с боков и ноготь приобретает клювовидную форму. Иногда
отмечается значительное утолщение и искривление ногтей, они на-
поминают когти птиц (онихогрифоз).
При атрофическом типе большая часть ногтевой пластинки
разрушается, сохраняется лишь частично у ногтевого валика. Тус-
клая, грязно-серая пластинка иногда отделяется от ногтевого ложа
по типу онихолизиса (рис. 60).
При генерализованной руброфитии процесс распространяется
на кожу туловища, крупных складок, ягодиц, конечностей, шею,
лицо. Этому способствуют висцеральная патология, нейроэндо-
кринные нарушения, особенно сахарный диабет, сопутствующие
хронические инфекционные заболевания, лимфогематогенная дис-
семинация гриба.
Для генерализованных форм микоза характерен полиморфизм
306
Рис. 60. Руброфития
ногтей рук.
клинических проявлений: сходство с экземой, псориазом, пара-
псориазом, кольцевидной гранулемой, рецидивным сифилисом,
герпетиформным дерматитом Дюринга, болезнью Дарье, хрони-
ческой трихофитией.
Очаги в межъягодичной, паховобедренных, подкрыльцовых
складках и под молочными железами, как и на коже туловища,
обычно крупные, желтовато-красной или бурой окраски, окруже-
ны периферическим красновато-синюшным валиком, состоящим
из мелких узелков и корочек, имеют фестончатые очертания
(рис. 61) за счет группировки и слияния мелких очагов с образо-
ванием колец, полуколец, дуг. На их поверхности отмечается раз-
ной степени выраженности шелушение. На коже туловища, но
чаще на ягодицах и голенях могут возникать глубокие фоллику-
лярно-узловатые элементы, напоминающие папул о-некротический
туберкулез, узловатую, индуративную эритему, глубокий васкулит,
бугорковый сифилис, а на лице — красную волчанку, сикоз. В про-
цесс могут вовлекаться пушковые, редко — длинные волосы. Боль-
ных беспокоит зуд. У части больных могут возникнуть аллерги-
ческие пятнисто-везикулезные высыпания на кистях, коже тулови-
ща, в которых элементы гриба не обнаруживаются.
Гистопатология. Гистологические изменения характе-
ризуются в эпидермисе акантозом, гиперкератозом и умеренно
307
Рис. 61. Руброфития ягодиц
и межъягодичной складки.
выраженной периваску-
лярной инфильтрацией
дермы лимфоидными
клетками, фибробластами
и гистиоцитами. По ок-
раске по Мак-Манусу эле-
менты гриба (мицелий,
споры) обнаруживаются в
роговом и нижележащих
слоях эпидермиса, а при
узелково-узловатой фор-
ме — ив гиподерме. При
онихомикозе соедини-
тельнотканная часть ног-
тевого ложа изменяется
незначительно, в эпители-
альном слое нарушено
рогообразование. Под
эпителием ногтевого ложа
среди роговых и параке-
ратотических масс ногтевой пластинки обнаруживаются нити
септированного мицелия и артроспоры гриба.
Диагноз основывается на клинической картине заболевания
и данных лабораторных исследований — обнаружение мицелия
гриба в чешуйках кожи и ногтях. Дифференцируют руброфитию
от эпидермофитии, трихофитии, кандидоза, псориаза и других
дерматозов, имеющих сходные проявления на коже туловища,
лица, конечностей. Онихомикоз следует отличать от красного
плоского лишая, псориаза ногтей, поражений ногтей синегнойной
палочкой (зеленые ногти). Существенное значение для диагнос-
тики имеет микроскопическое исследование.
Лечение руброфитии должно быть симптоматическим, этио-
тропным и патогенетическим. Симптоматическое лечение сходно
с таковым при эпидермофитии: при острых воспалительных явле-
ниях назначают гипосенсибилизирующие и антигистаминные пре-
параты, седативные средства, наружно примочки из растворов нит-
рата серебра (0,25 %), резорцина (2 %), калия перманганата
(1:6000, 1:8000) и др. После исчезновения островоспалительных
явлений применяют нитрофунгин, анилиновые красители, фукор-
цин, 2 % настойку йода, антимикотические пасты и мази. Учиты-
вая то, что в патогенезе руброфитии, особенно при ее генерали-
зованных формах с поражением ногтей, существенное значение
имеют иммунодефицитное состояние, снижение общей реактив-
ности организма, целесообразно назначать иммуномодуляторы
(левамизол, гистаглобулин, пирогенал, метилурацил, натрия нук-
308
леинат и др., биогенные стимуляторы), взвесь плаценты, алоэ,
спленин, апилак, поливитамины, средства, нормализующие мета-
болические процессы и корригирующие эндокринные нарушения.
В качестве этиотропных средств при распространенных фор-
мах микоза с поражением ногтей назначают антибиотик гризео-
фульвин или его имидазольное производное — низорал.
Гризеофульвин (при отсутствии противопоказаний) назначают
из расчета 16 мг на 1 кг массы тела больного 3 раза в сутки с
растительным маслом. В течение первого месяца препарат назна-
чают ежедневно, второго месяца — через 1 день, далее — 1 раз
в 3 дня в той же суточной дозе (всего 8—10 мес).
Низорал применяют по 1 таблетке (200 мг) в сутки в течение
6—7 мес. Возможные побочные явления (тошнота, светобоязнь
и др.) проходят при отмене препарата.
При онихомикозе производят удаление ногтевой пластинки.
Для последующего лечения ногтевого ложа используют фунгицид-
ные препараты.
Профилактика личная и общественная проводится как и при
эпидермофитии.
ТРИХОФИТИЯ
Сип.: стригущий лишай, trichophytiasis, tinea tonsurans и др.
Грибковое заболевание кожи, вызываемое грибами рода три-
хофитон. Впервые его описал Cazenave в 1842 г., грибковую этио-
логию установил Gruby в 1844 г. Известно несколько возбудителей
трихофитии. По экологическому признаку их относят к антропо-
филам (поражают только человека), зоофилам (поражают чело-
века, сельскохозяйственных и диких животных) и геофилам (по-
ражают человека и животных спорадически).
Антропонозная трихофития. Возбудитель Trichophyton tonsu-
rans. Син.: Trichophyton crateriforme, Trichophyton flavum, Tricho-
phyton violaceum и др.
Эпидемиология. Источником инфицирования является
больной трихофитией. Волосы, пораженные грибами, чешуйки,
частицы разрушающихся ногтей могут попасть на кожу здорового
человека при непосредственном контакте или опосредованно через
предметы обихода, которыми он пользовался (головные уборы,
расчески, белье, перчатки и т. д.). Способствуют развитию микоза
травмы рогового слоя эпидермиса, повышенная температура тела,
влажность окружающей среды, эндокринные нарушения, сниже-
ние общей и иммунной реактивности организма. Описаны случаи
лимфогематогенной диссеминации гриба в организме и развитие
генерализованного гранулематозного поражения.
Клиника. Выделяют 3 формы антропонозной трихофитии —
поверхностную трихофитию гладкой кожи (рис. 62), поверхност-
ную трихофитию волосистой части головы и хроническую трихо-
фитию.
309
Рис. 62. Поверхностная
трихофития гладкой
кожи.
Рис. 63. Хроническая
трихофития волосистой
части головы.
310
Поверхностная трихофития гладкой кожи прояв-
ляется наличием преимущественно на открытых участках кожи
хорошо очерченных очагов округлой или овальной формы, харак-
теризуется бледно-розовой окраской и шелушением в центре. Пе-
риферическая зона их окружена бордюром из розовых узелков,
пузырьков и корочек. В результате слияния пораженных участков
могут образовываться очаги причудливых очертаний. Субъективно
больных беспокоит небольшой зуд. Течение острое, при рацио-
нальной терапии разрешение очагов наступает через 2 нед.
Поверхностная трихофития волосистой
части головы проявляется наличием различной величины
очагов округлой, иногда неправильной, формы, имеющих нечет-
кие, расплывчатые границы, слабовыраженным воспалением и ше-
лушением в виде серебристых чешуек. Волосы в очагах поражения
частично обломаны на высоте 1—2 мм или на уровне кожи. В этом
случае образуются, как и при хронической трихофитии, «черные
точки». Извлеченные волосы имеют вид крючков, запятых. Выде-
ляют мелко- и крупноочаговую разновидности этой формы трихо-
фитии. Наблюдается она чаще у детей школьного возраста.
Хроническая трихофития развивается из первых
двух форм в пубертатном периоде, преимущественно у девочек
(у мальчиков к этому времени обычно наступает спонтанное из-
лечение) . Для этой формы характерно наличие «черных точек» —
коротко обломанных (на уровне кожи) волос и атрофических
плешинок в виде мелких очагов на волосистой части головы
(рис. 63) в затылочной и височных областях и очагов поражения
на коже ягодиц, коленных суставов, реже — туловища, предпле-
чий, лица. Очаги поражения синюшной окраски с незначительным
шелушением. На коже ладоней и подошв отмечается пластинчатое
шелушение. Более чем у половины больных поражаются ногтевые
пластинки пальцев кистей. Они тусклые, грязно-серой окраски,
бугристые, легко крошатся, иногда отслаиваются по типу онихо-
лизиса. Течение заболевания хроническое, продолжается многие
годы. Эта форма обычно наблюдается у лиц с эндокринопатиями,
дисфункцией половых желез, пониженной иммунной реактив-
ностью. Иногда у этих же больных возникают глубокие формы
микоза — фолликулярные (фурункулоподобные), гуммозные, гра-
нулематозные очаги поражения с абсцедирующими лимфаденита-
ми, в пунктате которых обнаруживают возбудителя — Т. violaceum
или Т. tonsurans. Описаны случаи поражения опорно-двигательного
аппарата и трихофитийной мицетомы стопы.
Гистопатология. В острой стадии при поверхностных
поражениях кожи отмечают спонгиоз, иногда гиперкератоз, мик-
роабсцессы в эпидермисе с элементами гриба. Последние обнару-
живают в роговом слое и реже — в дерме.
Диагноз ставят на основании клиники и лабораторного иссле-
дования: поражение волоса по типу «эндотрикс», элементы гриба
в чешуйках кожи, частицах ногтей. При постановке диагноза по-
могает также выделение культуры возбудителя. Трихофитию диф-
311
ференцируют от микроспории, руброфитии, фавуса, себорейной
экземы, розового лишая Жибера, паховой эпидермофитии, ин-
. 'ильтративно-нагноительной трихофитии.
Лечение заключается в назначении внутрь гризеофульвина в
суточной дозе 16 мг на 1 кг массы тела больного, наружно —
2—5 % раствор йода, 3 % салициловая мазь, антимикотические
мази. Волосы сбривают. Назначают также общеукрепляющие
средства, витамины. Прогноз при гранулематозной форме небла-
гоприятный, при хронической трихофитии могут быть рецидивы.
Профилактика заключается в соблюдении правил личной ги-
гиены и предупреждении контакта с больными трихофитией.
Зоонозная трихофития. Возбудители: Trichophyton mentagro-
phytes. Син.: Trichophyton granulosum, trichophyton verrucosum
и др.
Эпидемиология. Заражение человека происходит при
контакте с больными животными (обычно телята являются раз-
носчиками Trichophyton verrucosum, а мышевидные грызуны —
Trichophyton gypseum) или с инфицированными возбудителями
предметами. Возможна эпидемиологическая цепочка: мышевидные
грызуны — домашние животные — человек.
Клиника. Различают 3 формы зоонозной трихофитии: по-
верхностную, инфильтративную и нагноительную.
При поверхностной зоонозной трихофитии, обуслов-
ленной Tr. verrucosum, очаги поражения крупные, с фестончатыми
очертаниями за счет слияния друг с другом, располагаются на от-
крытых участках кожи и вокруг естественных отверстий. При воз-
будителе Т. gypseum очаги поражения имеют округлую форму,
розовую окраску; их поверхность покрыта чешуйками, а по пе-
риферии — непрерывный валик из пузырьков и корочек. Эта фор-
ма клинически очень похожа на поверхностную антропонозную
трихофитию.
Для инфильтративной формы характерно разви-
тие инфильтрации в области очагов поражения, появление болез-
ненного регионарного лимфаденита.
Нагноительная форма зоонозной трихофитии харак-
теризуется образованием на открытых участках кожи шеи, лица,
волосистой части головы (рис. 64) болезненных плотных очагов
поражения округлой формы, состоящих из глубоких фолликуляр-
ных абсцессов, при сдавливании которых выделяются капельки
жидкого гноя (керион Цельса). Регионарные лимфатические узлы
увеличены, болезненны. У ряда больных общее состояние бывает
тяжелым. После разрешения патологического процесса на коже
остаются рубцы, а для волосистой части головы характерно оча-
говое облысение.
При наличии очага инфильтративной и нагноительной трихо-
фитии на верхней губе и подбородке процесс напоминает сикоз
(«паразитарный сикоз»).
Г истопатология: при поверхностной форме зоонозной
трихофитии в эпидермисе отмечается спонгиоз с пузырьками под
312
Рис. 64. Инфильтратив-
но-нагноительная три-
хофития.
роговым слоем. При инфильтративной и нагноительной формах —
внутрифолликулярные абсцессы и перифолликулиты, содержащие
нейтрофильные и эозинофильные гранулоциты, в последующем —
единичные гигантские клетки. Полости абсцессов заполняются
грануляционной тканью с эпителиоидными и гигантскими клетками.
Грибы обнаруживают в эпидермисе и в гранулемах.
Диагноз ставят на основании клинической картины и под-
тверждают обнаружением гриба и выделением культуры гриба.
Дифференцируют зоонозную трихофитию от вульгарного сикоза,
руброфитий, инфильтративной формы микроспории, хронического
генерализованного (гранулематозный) кандидоза, глубокой пио-
дермии, фолликулитов.
Лечение аналогично тому, которое проводится при антропо-
нозной трихофитии. На ограниченные инфильтраты накладывают
примочки или повязки из 10 % раствора ихтиола, 0,25—0,5 %
раствора нитрата серебра, раствора этакридина лактата 1 : 1000.
Профилактику проводят в комплексе с ветеринарной службой
по выявлению больных животных. Важное значение придают са-
нитарно-просветительной работе среди населения, особенно среди
лиц, имеющих контакт с животными.
МИКРОСПОРИЯ
Син.: стригущий лишай, microsporosis, tinea microsporica
Грибковое поражение кожи и волос, обусловленное грибами
рода микроспорум. Ногти поражаются очень редко. Впервые забо-
левание описал Gruby в 1843 г.
313
Возбудителей микроспории по экологическому признаку под-
разделяют на антропофилов, зоофилов и геофилов.
Антропонозная микроспория. Возбудители: Microsporum audou-
inii (Gruby, 1843), син.: M. villosum и Microsporum ferrugineum
(Ota, 1922), син.: Trichophyton ferrugineum Langeron.
Заболевание распространено в Западной Европе, США, Япо-
нии, странах Юго-Восточной Азии, в республиках Средней Азии,
Закавказья.
Эпидемиология. Возбудители высококонтагиозны, воз-
можны эпидемии. Источником инфицирования является больной
антропонозной формой микроспории. Заражение происходит при
непосредственном контакте с больным или через его головной
убор, одежду, расческу, машинку для стрижки волос. Наиболее
часто болеют дети; на взрослых приходится приблизительно 10 %
всех больных микроспорией. Инфицированию способствуют гипо-
витаминозы, иммунные нарушения, микротравмы, повышенные
влажность и температура окружающей среды, снижение реактив-
ности организма из-за сопутствующих заболеваний (хронический
тонзиллит, ОРЗ), несоблюдение правил личной гигиены.
Клиника. Инкубационный период длится 4—6 нед.
При поражении гладкой кожи очаги имеют сходство с поверхно-
стной трихофитией: они округлые, четко очерченные, покрыты
чешуйками, узелками и пузырьками по периферии, часто образуют
вписанные кольца, а при слиянии формируют причудливые фигуры
(рис. 65). На волосистой части головы очаги поражения мелкие,
имеют склонность располагаться в краевой зоне роста волос, сли-
ваться и образовывать очаги полициклических очертаний с мелко-
пластинчатым шелушением. Часто поражаются пушковые и длин-
ные волосы; они обламываются на высоте 6—8 мм над уровнем
кожи.
Г истопатология. При поражениях гладкой кожи от-
мечается акантоз; спонгиоз; на волосистой части головы — лей-
коцитарная инфильтрация в волосяных фолликулах.
Диагноз ставится на основании клинической картины и дан-
ных лабораторного исследования (поражение волоса по типу
«микроспорум эктотрикс», на волосе видна муфта с мозаичным
расположением спор, в чешуйках кожи — мицелий), выделении
возбудителя в культуре и зеленого свечения пораженных волос
в лучах люминесцентной лампы Вуда.
Дифференцируют антропонозную микроспорию от зоонозной
микроспории, трихофитии, фавуса, себорейной экземы, розового
лишая Жибера.
Лечение. Больные с множественными (более 3) очагами на
коже или с поражением волосистой части головы подлежат гос-
питализации. Внутрь назначают гризеофульвин в суточной дозе
22 мг на 1 кг массы тела до получения первого отрицательного
анализа на грибы при ежедневном исследовании, затем в течение
двух недель препарат назначают через день и далее два раза в не-
делю до разрешения клинических проявлений и трех отрицатель-
314
Рис. 65. Антропонозная
микроспория.
ных анализов на грибы с интервалом в 5—7 дней. При единичных
очагах поражения на коже гризеофульвин не назначают. Приме-
няют местную терапию — смазывание очагов поражения 2—5 %
настойкой йода, микосептином, микозолоном, нитрофунгином ут-
ром, 3 % салициловой и 10 % серной мазью вечером. Волосы
сбривают.
Профилактика. Своевременная изоляция и лечение больных,
повышение санитарной культуры, плановые осмотры детских кол-
лективов, карантин в них 6 нед; дезинфекция.
Зоонозная микроспория. Возбудители: Microsporum canis. Син.:
Microsporum felineum, Microsporum lanosum и др.
Эпидемиология. Зоонозные микроспорумы менее конта-
гиозны, чем антропофилы. Основным источником инфицирования
являются больные микроспорией котята (реже взрослые кошки
и собаки). В 80—85 % случаев человек заражается при непосред-
ственном контакте с животными или с вещами, предметами, инфи-
цированными шерстью и чешуйками кожи животных. Заражение
человека друг от друга бывает редко (в 3—5 % случаев) Отме-
чают два пика повышения уровня заболеваемости зоонозной мик-
роспорией — в конце лета и осенью, что совпадает с двумя при-
плодами у кошек, у которых в 2—3 % бывает носительство Mic-
rosporum canis без клинических проявлений. Причины периодиче-
ски возникающих эпизоотий микоза у кошек и собак не изучены.
315
Рис. 66. Зоонозная микроспория.
Заболевание распространено во многих странах; в нашей стране
это основная форма микроспории.
В патогенезе микоза важная роль принадлежит общей реак-
тивности организма, снижение которой способствует развитию
инфильтративно-нагноительной формы микоза.
Клиника. Инкубационный период 3—7 дней. На гладкой
коже появляются множественные шелушащиеся розовые пятна
округлой формы с четкими границами. Очаги поражения обнару-
живаются как на открытых, так и на закрытых одеждой частях
тела. В 85—90 % случаев поражаются пушковые волосы, иногда
волосы бороды, усов, бровей и ресниц. При раздражающей терапии
могут возникнуть микиды — аллергические сыпи в виде эрите-
матозно-сквамозных пятен или лихеноидных узелков.
На волосистой части головы образуются 1—2 крупных округ-
лой формы очага с четкими границами и обильным отрубевидным
шелушением с множеством «отсевов» — мелких очажков по пери-
ферии (рис. 66). Число обломанных на высоте 5—8 мм волос в
очагах больше, чем при антропонозной микроспории, которая
протекает менее остро. У части больных могут увеличиваться
316
шейные, затылочные и заушные лимфатические узлы, наблюда-
ются инфильтративные и нагноительные формы, вплоть до Kerion
Celsi. Ногти поражаются очень редко.
Диагноз ставят на основании клинической картины, учитывая
эпидемиологию и специфическое свечение волос в лучах лампы
Вуда. Диагноз обязательно должен быть подтвержден микроско-
пическим исследованием и выделением культуры возбудителя.
Зоонозную микроспорию дифференцируют от антропонозной мик-
роспории, трихофитии, себорейной экземы, розового лишая Жи-
бера.
Лечение. Аналогично таковому при антропонозной форме мик-
роспории.
Профилактика. Отлов беспризорных кошек и собак, тщатель-
ное обследование с люминесцентной лампой домашних животных
и членов семьи больного. Карантин в детских учреждениях 2 нед.
ФАВУС
Син.: парша, tinea favosa, tinea lupinosa, trichophytia favosa
Хроническое грибковое заболевание кожи, волос, ногтей и
иногда внутренних органов. Характеризуется образованием скутул
(«щитков») и рубцовой атрофии на местах поражения кожи. Забо-
левание известно еще медикам древности. Возбудителя фавуса
открыл Remak в 1837 г., a Schonlein (1839) и Gruby (1941) уста-
новили его грибковую природу.
Возбудителей заболевания в настоящее время относят к роду
трихофитов. Среди них различают антропофилы — Trichophyton
schoenleinii (син.: Achorion schoenleinii) и зоофилы —Trichophyton
quinckeanum Zopf (син.: Achorion quinckeanum Quincke, Microspo-
rum muris Dodge и др.), поражающие иногда кошек, мышей, со-
бак, птиц, овец, лошадей и редко — человека.
Эпидемиология. Источником заражения являются че-
ловек и предметы его обихода (шапки, одежда). Контагиозность
невелика. Однако могут возникнуть длительно существующие се-
мейно-бытовые очаги. Чаще инфекция передается по женской
линии.
Способствуют развитию микоза эндокринопатии, иммунодефи-
цитное состояние, гиповитаминозы, сопутствующие хронические
заболевания, интоксикации, микротравма и др. Возможна гемато-
генная диссеминация гриба в организме (поражение внутренних
органов).
Клиника. Инкубационный период 2 — 3 нед. Различают
фавус волосистой части, гладкой кожи, ногтей и внутренних ор-
ганов.
На коже бывает типичная (скутулярная) и атипичная (сквамоз-
ная, импетигинозная, инфильтративно-нагноительная, алопецие-
видная, гранулематозная) формы.
В типичных случаях на коже на месте внедрения гриба вокруг
волоса появляются эритематозное, слегка шелушащееся пятно,
317
Рис. 67. Фавус.
а — скутулярная форма; б — импетигинозная форма.
затем инфильтрат и желтая пустула в центре. Диаметр очагов
увеличивается по периферии, достигая 1—3 см и более, припод-
нимаются с краев, напоминая блюдце. Так образуется основной
для этого микоза элемент сыпи — скутула. Сливаясь между собой,
они образуют корки грязно-серого, желтого, канареечного цвета,
иногда с зеленоватым или буроватым оттенком (рис. 67, а, б). От
скутул исходит «мышиный» («затхлый», «амбарный») запах за
счет метаболитов сопутствующей микробной флоры. Пораженные
волосы тускнеют, теряют блеск и эластичность, становятся пиг-
ментированными или белесоватыми («седыми»), напоминают пуч-
ки пакли, но не обламываются. В последующем (без лечения) на
месте скутул волосы истончаются, выпадают, в результате чего
возникает рубцовая атрофия кожи с блестящей, розовой, затем
белой поверхностью и атрофией фолликулярного аппарата. Про-
цесс, распространяясь по всей голове, приводит к стойкому облы-
сению, щадя лишь краевую зону.
При сквамозной форме скутул не наблюдают или они точечные
и видны на фоне серовато-белых крупных (псориазиформный
вариант) либо мелких (питириоидный вариант) чешуек. Образуют-
ся слоистые грязно-желтые корки, пронизанные тусклыми воло-
сами.
Импетигинозная форма бывает у детей. Инфильтративно-на-
гноительная форма (фавозный керион) и фавозная гранулема
318
встречаются редко и без микроскопии волоса и выделения куль-
туры гриба трудно дифференцируются от аналогичной формы
трихофитии. Еще реже встречается алопециевидная форма.
Иногда возникают генерализованные формы фавуса и гипер-
кератоз ладоней, как при хронической трихофитии.
У некоторых больных отмечаются регионарные лимфадениты.
Поражения ногтей при фавусе обычно возникают у взрослых.
При этом конфигурация ногтевой пластинки длительное время
не изменяется, прежде чем за счет подногтевого гиперкератоза
она начнет утолщаться, крошиться и отделяться от ногтевого ло-
жа. В толще ногтевой пластинки можно видеть желтое пятно
(скутулу), затем она приобретает грязноватый цвет.
У лиц со сниженной реактивностью (авитаминоз, болезнь
Иценко — Кушинга, туберкулезная интоксикация) возникают по-
ражения легких, желудочно-кишечного тракта, мозгового веще-
ства и оболочек головного мозга, опорно-двигательного аппарата.
Иногда возникают фавиды (аллергические высыпания) в виде
лихеноидных, папулезных, пустулезных и эритематосквамозных
высыпаний, наподобие лишая Жибера.
При заражении от животных и птиц преобладают сквамозные
элементы. Скутулы образуются редко.
Гистопатология. В устьях волосяных фолликулов при
скутуле отмечаются утолщение рогового слоя, гипертрофия маль-
пигиевого слоя, отек и спонгиоз эпидермиса, микроабсцессы.
В дерме — инфильтрация полиморфными лейкоцитами, плазмати-
ческими клетками и фибробластами. Затем фолликулы разруша-
ются, эпидермис истончается, коллагеновая и эластическая ткани
расплавляются и заменяются соединительной тканью (рубцева-
ние) .
Диагноз основывается на обнаружении скутул, рубцовой атро-
фии с облысением и наличии здоровых волос по периферии и ти-
пичной морфологии гриба в пораженном волосе (кучки артроспор,
септированный мицелий, пузырьки воздуха). При атипичном те-
чении фавуса на голове и гладкой коже диагноз основывается
на выделении культуры возбудителя. Дифференцируют фавус во-
лосистой части головы с трихофитией, микроспорией, псевдопела-
дой Брока, эритематозом; на гладкой коже — с псориазом, экзе-
мой, стрептодермией; поражения ногтей — с трихофитией, рубро-
фитией и кандидозом.
Лечение. Назначают г ризеофульвин из расчета 15 мг на 1 кг
массы тела больного в сутки в сочетании с местной противогриб-
ковой йодно-мазевой и общеукрепляющей терапией (особенно у
пожилых и ослабленных больных). Волосы сбривают, корки, ску-
тулы удаляют после наложения 2—3% салициловой мази.
Профилактика. Тщательный контроль за семейными и иными
очагами (осмотр 1 раз в месяц первый квартал, а затем ежегодно
в течение 5 лет). После этого больные снимаются с учета, в слу-
чае если за это время не было выявлено больного, необходимо
проводить дезмероприятия в очагах поражения.
319
КАНДИДОЗ
Син.: кандидамикоз, соормикоз, поверхностный бластомикоз и др.
Грибковое заболевание кожи, слизистых оболочек и внутрен-
них органов, вызываемое грибами рода кандида. Заболевание было
известно врачам еще в древности (stomata aphtoides, aphta infantis).
Впервые описано Б. Лангенбеком в 1839 г., грибы в тканях обна-
ружил в 1843 г. Berg, а в 1923 г. Berkhout выделил среди дрожже-
подобных организмов род Candida. Заболевание встречается во
всех странах мира, но наиболее распространено в тропиках и суб-
тропиках.
Возбудители: Candida albicans, реже другие виды — Candida
tropicalis, Candida pseudotropicalis и др. В роду Candida описано
более 100 видов грибов. В соскобе кожи и слизистых при микро-
скопии обнаруживаются округлые (диаметром 2—8 мкм) почкую-
щиеся и непочкуюгциеся клетки и нити псевдомицелия.
Эпидемиология. Грибы этого рода относят к условно-
патогенным микроорганизмам; в качестве сапрофитов они широко
распространены в природе, обнаруживаются на коже, слизистых
оболочках и в кале почти у пятой части здоровых людей. Канди-
дозом болеют не только люди, но и птицы, скот, домашние и ди-
кие животные. Грибы этого рода ассоциируют с нормальной мик-
рофлорой кожи (до 20 %) и кишечника (до 0,05 %) у человека.
Источником инфицирования может быть больной кандидозом
человек (поцелуй, половой контакт, посуда, инфицирование ново-
рожденных при прохождении в инфицированных родовых путях).
Инфицированию способствуют влажный климат, мацерация эпи-
дермиса, ручная обработка овощей, фруктов, ягод в консервном
и кондитерском производстве, нарушения правил гигиены в яслях.
Эндогенный путь инфицирования связан с активацией кандидоз-
ной флоры, имеющейся в организме в микробных ассоциациях
(развитие вторичного кандидоза при пневмониях, туберкулезе,
неоплазмах и т. д.).
К патогенетическим факторам относят иммунодефицитное со-
стояние, эндокринопатии, гиповитаминозы, обменные нарушения,
хронические болезни, применение антибиотиков широкого спектра
действия, цитостатиков, лучевое воздействие и действие других
средств, снижающих естественную резистентность организма.
Клиника. Выделяют поверхностный кандидоз слизистых
оболочек, кожи, ногтей, хронический генерализованный грануле-
матозный и висцеральный кандидоз.
Дрожжевой стоматит развивается у грудных детей или у лиц
пожилого возраста, ослабленных хроническими заболеваниями..
На слизистой оболочке щек, неба, языке, деснах возникают то-
чечные налеты, пленки белого цвета, напоминающие свернувшееся
молоко («молочница»). При их снятии видна розовая, иногда эро-
зированная, кровоточащая поверхность. При поражении языка
(глоссит) наблюдаются белые пленчатые налеты не только на
320
спинке языка, но и на боковых поверхностях, в складках (бороз-
дах); язык увеличивается за счет отека, нитевидные сосочки сгла-
живаются. Развитию кандидоза у пожилых способствует ношение
зубного протеза. При кандидозной ангине на миндалинах, помимо
налетов, образуются пробки, но глотание безболезненно, темпера-
тура тела не повышается, регионарные узлы не увеличены. При
кандидозном вульвовагините возникают беловатые, крошковидные
выделения; слизистая влагалища гиперемирована, с белым нале-
том, поверхностными эрозиями, больных беспокоит зуд (рис. ,68).
При баланопостите на внутреннем листке крайней плоти и головке
полового члена образуются налеты белого цвета, сочетающиеся с
поверхностными эрозиями; субъективно больных беспокоят жже-
ние, болезненность. При поражениях кожи у этих больных пре-
обладают мацерация, отслоение эпидермиса в виде бордюра во-
круг трещин в углах рта; образуется заеда с инфильтрацией в
основании (рис. 69).
Для кандидозного хейлита характерны покраснение красной
каймы губ, сухость ее, жжение, стягивание, сероватые отслаива-
ющиеся чешуйки.
Наиболее часто поражаются крупные складки кожи (под мо-
лочными железами, паховые, межъягодичная). Границы очага по-
ражения четкие, с бордюром белесоватого мацерированного эпи-
дермиса, с мокнущей, лакированной, малиново-синюшного цвета
поверхностью.
На кистях чаще поражается третья межпальцевая складка,
которая становится красного цвета; роговой слой вокруг нее на-
бухший, белесоватый с перламутровым оттенком. Течение заболе-
вания хроническое с рецидивами, больных беспокоят зуд и жже-
ние. Аналогичные поражения могут быть за ушными раковинами,
вокруг пупка, ануса. На гладкой коже кандидоз может протекать
в виде эритематозных, везикулезных, псориазиформных высы-
паний.
Кандидозная паронихия сопровождается отечностью (подуш-
кообразность) и гиперемией околоногтевого валика, исчезновени-
ем эпонихиума, при надавливании из-под него выделяется капель-
ка гноя. При переходе в хроническую стадию поражается ногте-
вая пластинка, которая становится коричневой, бугристой с поло-
сами и вдавливаниями, затем истончается, иногда отслаивается.
Эта форма кандидоза может быть профессиональной у кондитеров,
работников плодово-ягодных консервных предприятий.
Своеобразной формой является хронический генерализован-
ный гранулематозный кандидоз, обычно развивающийся у лиц с
иммунодефицитным состоянием и эндокринопатиями. Начинается
он в раннем возрасте с кандидоза слизистой оболочки полости
рта, глоссита, макрохейлии. Затем развиваются онихии и парони-
хии, поражается гладкая кожа туловища, конечностей, волосистой
части головы в виде псевдофурункулеза и декальвирующего фол-
ликулита. Очаги на коже гиперемированы, инфильтрированы, с
наличием пластинчатого шелушения, папул и бугорков. Они раз-
12—936
321
Рис. 68.Кандидоз г
талий.
Рис. 69. Кандидозная заеда.
322
Рис. 70. Хронический генерализованный (гранулематозный) кандидоз.
решаются рубцеванием и очаговым облысением на волосистой
части головы (рис. 70). У таких больных часто наблюдаются пнев-
монии, гастриты, гепатиты, эпилептиформные припадки; они от-
стают в развитии.
Кандидоз дыхательных путей нередко бывает самостоятельным
заболеванием, может возникнуть при антибиотикотерапии, но чаще
является вторичным как осложнение бронхита, туберкулеза лег-
ких. То же можно сказать и в отношении поражений желудочно-
кишечного тракта и мочеполовой системы. Описаны кандидоз ЦНС
и кандидасепсис.
За счет нерациональной раздражающей терапии больных кан-
дидозом могут возникнуть аллергические высыпания — левуриды
в виде эритематозно-сквамозных, везикулезных и других сыпей,
сопровождающихся нередко общими явлениями (головная боль,
недомогание и др.).
Гистопатология. При поверхностных поражениях кожи
отмечается межклеточный отек эпидермиса, экзоцитоз с наличием
возбудителя в утолщенном роговом слое. В дерме неспецифиче-
ский воспалительный инфильтрат. При гранулематозных формах
в дерме наблюдаются гранулема с гигантскими клетками инород-
ных тел, микроабсцессы с нейтрофильными гранулоцитами.
Диагноз ставят на основании клинических проявлений, под-
тверждают нахождением элементов гриба в исследуемом материа-
ле и выделением его в культуре. Часто необходимо гистологиче-
ское исследование с окраской по Граму—Вейгерту и Мак-Ма-
12*
323
нусу. При висцеральных формах ставятся серореакции и кожные
аллергические пробы с кандидааллергеном.
Дифференцировать кандидоз следует от туберкулеза, кокци-
диоидоза, бластомикоза легких, других висцеральных микозов.
Лечение должно быть патогенетическим, этиотропным и симп-
томатическим. Внутрь дают нистатин и леворин (6—8 млн ЕД в
сутки в течение 2—3 нед с 7-дневными перерывами между курса-
ми), производят ингаляции с натриевой солью нистатина, назна-
чают также амфоглюкамин, микогептин, низорал. При тяжелых
висцеральных формах назначают внутривенно амфотерицин Б
(250 ЕД на 1 кг массы тела больного, на курс до 2 млн ЕД). На-
ружная терапия заключается в смазывании очагов поражения
1—2 % раствором йода, анилиновых красителей, левориновой
мазью, фукорцином, 3 % салициловой мазью, на слизистых оболоч-
ках— раствором канестена, 5—20 % раствором буры в глицерине.
Профилактика заключается в назначении леворина и нистати-
на, поливитаминов при использовании антибиотиков, в тщательной
дезинфекции белья и посуды в роддомах, механизации и автома-
тизации на консервных и плодово-ягодных предприятиях.
ГЛУБОКИЕ МИКОЗЫ
Глубокие микозы объединяют поражения кожи и внутренних
органов, вызываемые грибами из различных систематических
групп их современной классификации. Некоторые из них, напри-
мер возбудители кокцидиоидоза и гистоплазмоза, весьма конта-
гиозны, могут вызывать крайне тяжелые поражения кожи, слизис-
тых оболочек, внутренних органов. Поэтому вызываемые ими за-
болевания относят к опасным инфекциям. Другие глубокие ми-
козы, например аспергиллез, пенициллиоз, мукороз, споротрихоз,
вызываются факультативно-патогенными грибами и возникают
у людей со сниженной реактивностью организма.
Глубокие микозы наиболее распространены в тропических и
субтропических зонах, в странах с умеренным климатом многие
формы глубоких микозов зарегистрированы лишь в единичных
случаях (хромомикоз, споротрихоз) или не встречаются вовсе
(кокцидиоидоз, гистоплазмоз). Расширение экономических, куль-
турных связей и туризма чревато возможностью завоза возбуди-
телей глубоких микозов и в эти страны. Поэтому знание вопросов
этиологии, эпидемиологии, клиники, диагностики, терапии и про-
филактики глубоких микозов необходимо для медицинских работ-
ников разного профиля.
КОКЦИДИОИДОЗ
Син.: кокцидиоидомикоз, кокцидиоидная гранулема, болезнь Посадаса—Вер-
нике, лихорадка Святого Иохима, долинная лихорадка, ревматизм пустынь
Это системный эндемический глубокий микоз, поражает кожу,
подкожную клетчатку, легкие и другие органы человека и живот-
324
ных (коровы, овцы, грызуны). Относится к группе опасных ми-
козов.
Заболевание впервые описано Posadas, Vernicke в 1892 г. в Ар-
гентине. Ophuls, Maffit в 1900 г. выделили культуру и установили
диморфизм гриба.
Заболевание распространено в эндемичных зонах — пустынных
районах США (Калифорния, Аризона, Техас), в Аргентине, Мек-
сике, Парагвае, странах Африки.
Возбудитель: Coccidioides immitis Rixford (син.: Posadasia es-
teriformis Canton, 1898; Blastomyces immitis, 1928). Относится к по-
рядку Chytridiales, сем. Coccidioidaceae. Гриб диморфный, т. е.
встречается в 2 фазах развития—дрожжевой (тканевой, парази-
тарной) и мицелиальной (вегетативной). В тканях человека и жи-
вотных из мицелиальной образуется тканевая фаза гриба, пред-
ставляющая характерные сферулы — шаровидные образования,
спорангии, до 120 мкм и более в поперечнике, с четкой двухконтур-
ной оболочкой, наполненные эндоспорами округлой формы, 2—
4 мкм в диаметре. При разрыве оболочки спорангия споры выходят
из сферул и в организме цикл повторяется. В культуре на питатель-
ной среде, богатой белком, при температуре 37 °C вырастают ко-
жистые желто-коричневые дрожжевидные колонии; на кислых
средах при 24 °C и в почве образуется нитчатая, весьма контаги-
озная форма гриба. Эндоспоры в культуре прорастают, образуя
септированный мицелий, богатый артроспорами. Колонии гриба
беловатые, пушистые, а позднее — мучнистые. В почве встреча-
ются мицелиальные формы, сферулы не образуются.
Эпидемиология. Почва является естественным резер-
вуаром гриба: здесь он размножается. Инфицирование человека
и животных (грызуны, домашний скот) происходит в основном
ингаляторно, при вдыхании загрязненной элементами гриба пыли,
а также через травмированную кожу. Человек непосредственно
от больного человека или животного не заражается. Описаны слу-
чаи заражения лабораторных работников при посевах и других
манипуляциях с культурами, богатыми артроспорами. Поэтому
работа с патогенными культурами Coccidioides immitis допускается
только в спецбоксах.
Максимальная заболеваемость людей приходится на летние,
жаркие, пыльные месяцы. Чаще заболевают люди, связанные с
земляными работами, строительством, фермеры, сборщики хлопка.
Грызуны являются природным резервуаром этого гриба, они
загрязняют почву в местах обитания.
Клиника. Инкубационный период при кокцидиоидозе длит-
ся 10—20 дней. Различают острую (первичную, доброкачествен-
ную) и хроническую (тяжелую, гранулематозную) формы болезни.
Острая фаза протекает с явлениями катара верхних дыхательных
путей, напоминает грипп, бронхит, бронхопневмонию; в более тя-
желых случаях — активный туберкулез с кровохарканьем, кавер-
нами. Иногда развивается стенокардия; появляются высыпания на
коже типа крапивницы, узловатой и многоформной эритемы. Поч-
325
ти у всех больных поражаются кости (ребра, ключицы). Чер4?з
2—3 нед эти явления проходят.
В 0,2 % случаев острая форма кокцидиоидоза переходит в
системную хроническую, характеризующуюся диссеминацией про-
цесса и развитием гранулематозных очагов поражения в глубоких
слоях кожи (язвенно-некротическая и инфильтративно-абсцеди-
рующая формы), лимфатических узлах, костях; иногда поражает-
ся желудочно-кишечный тракт и даже головной мозг. Периодиче-
ски возникают глубокие абсцессы, соединяющиеся между собой
множественными извитыми свищевыми ходами, и язвы с папилло-
матозными разрастаниями и гнойным отделяемым, в котором об-
наруживаются сферулы.
Характерной локализацией очагов поражения на коже являют-
ся области промежности, крестцово-копчиковая, ягодицы, задняя
поверхность шеи, подкрыльцовые впадины. Нередко заболевание
напоминает актиномикоз (иногда может сочетаться с ним), зло-
качественные новообразования, проявления хронического сеп-
сиса.
Г истопатология. При острой форме кокцидиоидоза от-
мечается пролиферация эндотелия и альтерация стенок сосудов дер-
мы с инфильтрацией ее нейтрофилами, эпителиоидными и гигант-
скими клетками. При хронической форме выявляются гранулемы,
имеющие сходство с милиарным туберкулезом; в них много моно-
нуклеаров, макрофагов, эпителиоидных и гигантских клеток, а
также сферул и эндоспор гриба (иногда фагоцитированных). В ре-
гионарных лимфатических узлах отмечаются гранулемы из эпи-
телиоидных и гигантских клеток с внутри- и внеклеточным рас-
положением спор.
Диагноз базируется на изложенных выше клинических особен-
ностях и обнаружении в гное и биопсированном материале, окра-
шенном гематоксилин-эозином, по Граму — Вейгерту, Боголепо-
ву, Мак-Мануса и Гомори, сферул гриба с четко выраженной
двухконтурной оболочкой и хорошо дифференцированными эндо-
спорами.
Первичный кокцидиоидоз дифференцируют от гриппа, острого
бронхита, пневмоний, а вторичный — от туберкулеза, третичного
сифилиса, других глубоких микозов: криптококкоза, северо- и
южноамериканского бластомикоза, гистоплазмоза, споротрихоза,
актиномикоза. Прогноз для значительной части больных хрони-
ческой диссеминированной формой кокцидиоидоза неблагопри-
ятный.
Лечение. Рекомендуют внутривенное капельное введение ам-
фотерицина Б (1 мг на 1 кг массы тела больного), также назна-
чают низорал (по 400 мг в сутки в течение 3—5 мес), гемотранс-
фузии, сульфаниламиды, витамины и другие средства общего
воздействия, часто в сочетании с хирургическими методами ле-
чения.
Профилактическим мероприятием является борьба с запылен-
ностью воздуха в эндемичных очагах.
326
ГИСТОПЛАЗМОЗ
Син.: болезнь Дарлинга, ретикулоэндотелиальный цитомикоз
Глубокий, системный микоз с избирательным поражением
элементов ретикулоэндотелиальной системы, внутренних органов,
кожи и слизистых оболочек (гистиоцитарный цитомикоз) — одно
из самых тяжелых грибковых заболеваний; относится к группе
опасных глубоких микозов.
Заболевание впервые описал Darling в 1906 г., наблюдая его
в зоне Панамского канала. Da Rocha Lima предположил грибковую
природу заболевания. De Monbreum в 1934 г. выделил культуру
гриба — Histoplasma capsulatum и установил его патогенность для
животных.
В настоящее время больные гистоплазмозом выявлены в стра-
нах различных континентов мира, главным образом в полосе меж-
ду 45° северной и южной широты.
Возбудитель: Histoplasma capsulatum Darling. Синоним:‘Crypto-
coccus capsulatus Castellani. Класс Ascomycetes, семейство Gymno-
ascaceae, род Histoplasma. Сапрофит красных подзолистых почв.
Болеют люди, коровы, собаки, кошки, мыши, летучие мыши.
Гриб диморфный, встречается в тканевой (дрожжевой, пара-
зитической) и культуральной (нитчатой, сапрофитической) фор-
мах (фазах). В тканях человека обнаруживается в селезенке, пе-
чени и лимфатических узлах, внутри макрофагов, гигантских кле-
ток и лейкоцитов в виде округлых или грушевидных почкующихся
образований с ядром и оболочкой размером от 2 до 4 мкм (у аф-
риканского типа гриба 10—13 мкм). Из почвы, птичьего помета
и пыли пещер, где обитают летучие мыши, при посеве на пита-
тельные среды при температуре 25—27 °C могут вырастать пушис-
тые колонии с ветвящимися нитями мицелия и характерными
крупными (7—30 мкм) булавовидными хламидоспорами, покры-
тыми шипами.
Эпидемиология. Почва является источником заражения
человека и животных. Заражение происходит ингаляторно, при
вдыхании пыли, содержащей споры гриба, реже — через желудоч-
но-кишечный тракт. Человек от больного человека или животного
не заражается. Полагают, что летучие мыши и некоторые птицы,
домашние животные и грызуны, болея гистоплазмозом, могут ин-
фицировать навоз и различные отбросы и этим способствовать
заражению человека.
Клиника. Инкубационный период длится от нескольких
недель до 6 мес. Первичная локализация патологического процес-
са возникает в легких; поражения кожи метастатического харак-
тера. В 95 % начальные симптомы гистоплазмоза протекают в
виде легкой респираторной инфекции и значительно реже — в виде
диссеминированной, прогрессирующей, тяжелой, очень опасной
формы.
Выделяют 4 клинические формы гистоплазмоза: а) первичный
острый гистоплазмоз легких (субклиническая, бессимптомная и
327
клинически выраженная форма); б) острый и хронический диссе-
минированный гистоплазмоз легких; в) гистоплазмоз слизистых
оболочек и кожи; г) прогрессирующий диссеминированный гисто-
плазмоз с множественными поражениями внутренних органов.
Часто заболевание начинается с ларингита, бронхита, пневмонии,
энтерита, высокой температуры, сопровождается увеличением пе-
чени, селезенки и лимфатических узлов с явлениями анемии и
лейкопении. Иногда болезнь длительное время протекает бессим-
птомно и выявляется лишь с помощью положительной гистоплаз-
миновой кожной пробы.
Поражение ретикулоэндотелиальной системы может носить
локализованный или диссеминированный характер.
Легочный процесс клинически и рентгенологически может си-
мулировать туберкулез с множественными инфильтратами, кавер-
нами, обызвествлениями, обычно в нижних долях, и экссудатив-
ный плеврит. При поражении желудочно-кишечного тракта наблю-
даются рвота, кровавый понос. Иногда гистоплазмоз по клиниче-
ской картине напоминает лимфогранулематоз, лимфосаркому или
апластическую анемию.
Приблизительно у половины больных в процесс вовлекаются
слизистые оболочки и кожа. При этом на слизистых полости рта,
языка, гортани, глотки и носа возникают папулы, язвы и грануле-
матозные опухоли, на коже высыпания имеют вид пурпуры, пете-
хий, пузырей, узловатой и экссудативной эритемы, папилломатоза,
абсцессов и фурункулоподобных элементов. Они могут быть лока-
лизованными и генерализованными.
Гистопатология. В дерме выявляются неспецифиче-
ский воспалительный инфильтрат с большим количеством макро-
фагов, иногда гигантских клеток и участки некроза. При окраске
по Граму — Вейгерту и Романовскому — Гимзе в гранулеме вы-
является возбудитель, располагающийся внутри макрофагов.
Для установления диагноза важно обнаружение возбудителя
в отделяемом из язв, пунктате костного мозга, печени, селезенки,
лимфоузлов, в лейкоконцентратах и мазках крови. При окраске
по Романовскому — Гимзе возбудитель представляет собой внут-
риклеточно или свободно расположенные почкующиеся клетки
размером 2—5 мкм (у африканского типа 10—13 мкм), окружен-
ные светлым ореолом («капсулой»), Находка гриба у лиц с опи-
санной выше клинической картиной, а также положительная кож-
ная проба с гистоплазмином и положительная серореакция явля-
ются основанием для диагностики гистоплазмоза. Микологическое
исследование по получению культуры и идентификации вида гри-
ба, а также экспериментальное заражение животных, как и при
кокцидиоидозе, проводятся только в спецбоксах соответствующих
лабораторий. Дифференцируют гистоплазмоз от лейкемии, лимфо-
гранулематоза, лимфосаркОмы, кала-азара, легочного туберкулеза,
других глубоких микозов.
Лечение и профилактика аналогичны кокцидиоидозу (но без
использования хирургических методов).
328
БЛАСТОМИКОЗЫ
Криптококкоз
Син.: европейский бластомикоз, торулез, болезнь (бластомикоз) Буссе —
Бушке
Глубокий, системный микоз, протекающий остро, подостро или
хронически, с преимущественным поражением мозга и мозговых
оболочек и сопровождающийся высокой летальностью. Реже выяв-
ляются поражения легких, кожи, слизистых оболочек. Впервые
описан в Европе в 1894 г. Busse, Buschke как генерализованное за-
болевание с поражением кожи, костей и лимфатических узлов.
Встречается почти во всех странах мира, в том числе и в нашей.
Возбудитель: Cryptococcus neoformans [Sanfelise, 1884], имеет
более 50 синонимов и относится к анаскоспоровым дрожжам се-
мейства Cryptococcaceae. Гриб как сапрофит находится в почве и
в помете птиц. Болеют человек, коровы, лошади, кошки, собаки.
Cryptococcus neoformans растет на тех же средах, что и грибы рода
кандида и дерматофиты. Для выявления криптококка исследуют
мокроту, гной, ликвор и аутопсийный материал в щелочи, капель-
ке туши, изотоническом растворе хлорида натрия. Он имеет вид
дрожжевых клеток округлой формы, диаметром от 3 до 15 мкм
с выраженной двухконтурной оболочкой, окруженной желатино-
образной прозрачной капсулой и с одной слегка вытянутой поч-
кой. Колонии гриба слизисто-тягучей консистенции, блестящие,
круглые, без врастания в субстрат напоминают различные виды
дрожжеподобного гриба рода Candida, но не дают характерной
филаментации и не ферментируют сахара (глюкозу, мальтозу,
лактозу, сахарозу). Патогенные виды гриба растут при темпера-
туре 37 °C, образуют уреазу на среде Христиансена и крахмало-
подобное вещество на среде Литтмана и Циммемана.
Отсутствие мицелия и спор, гидролиз мочевины, образование
слизистых капсул, положительная проба с йодом при росте на
специальных средах, ассимиляция мальтозы, сахарозы и глюкозы
(но не лактозы), нитрата калия и патогенность для мышей явля-
ются характерными признаками патогенных криптококков.
Эпидемиология. Криптококки часто обнаруживают в
местах гнездовья голубей, на чердаках, в сараях, сеновалах, ко-
нюшнях и т. п. Голуби могут быть механическими переносчиками
криптококка из почвы, где гриб сапрофитируют. Входными воро-
тами являются дыхательные пути. Описаны случаи первичного
поражения кожи. Возможно носительство гриба на коже и сли-
зистых оболочках здоровых людей. Заболевание часто сочетается
с лимфогранулематозом, диабетом, другой тяжелой патологией
внутренних органов, в лечении которой применяются кортикосте-
роиды.
Клиника. Выделяют субклиническую (доброкачественную),
острую (с температурой до 40 °C, болями в груди), подострую,
напоминающую туберкулез, бронхогенный рак, милиарно-диссеми-
нированную (с кавернами, метастазами в легких) формы крипто-
коккоза.
Рис. 71. Гуммозно-яз-
венный криптококкоз
голени.
Острый криптококкоз на коже проявляется в виде папул, пус-
тул, бляшек, но чаще всего множественными (гуммозного харак-
тера) узлами (рис. 71), изъязвляющимися с образованием боль-
ших язв с подрытыми краями и легко кровоточащим дном, покры-
тым вялыми грануляциями. Рубцы после заживления язвы втяну-
тые, неправильной формы, напоминают туберкулезные. В отделя-
емом из язв и при гистологическом исследовании биопсийно-
го материала находят дрожжевые клетки, окруженные слизью,
иногда почкующиеся, а при посеве — рост слизистых колоний
гриба.
Без лечения процесс затягивается, принимает хроническое
течение. В половине случаев возникает криптококкозное пораже-
ние центральной нервной системы (менингоэнцефалит), и больные
погибают. Часто диагноз ставится лишь на аутопсии.
Г истопатология. Характерно развитие в коже гранулем
с некротическими, казеозными или миксоматозными изменени-
ями, множественными микроабсцессами и крупными абсцессами,
с грибом в центре гранулемы.
Диагноз базируется на обнаружении в соскобах с язв крипто-
кокков и выделении культуры патогенного его вида. Дифференци-
ровать заболевание следует от туберкулезного менингита, опухо-
лей и абсцессов мозга, энцефалита, хронической пиодермии, дру-
330
гих глубоких микозов, туберкулеза легких, саркоидоза, бронхо-
эктазий, кистозных поражений.
Лечение. Назначают амфотерицин В, препараты йода, витами-
ны, сульфаниламиды, средства симптоматической терапии; мест-
но — фунгицидные краски, мази.
Профилактика. Выявление больных в начальной стадии болез-
ни и их лечение. Текущая и заключительная дезинфекция.
Бластомикоз североамериканский
Син.: болезнь (бластомикоз) Джилкрайста (Гилкриста)
Хронический глубокий микоз, протекающий с явлениями на-
гноения, абсцедирования и образованием гранулематозных очагов
в коже, подкожной клетчатке, в легких и других внутренних орга-
нах. Чаще всего встречается в Северной и Центральной Америке.
Впервые описан Gilchrist в 1894 г., в 1898 г. он совместно с Stokes
выявил повторные случаи заболевания и дал наименование воз-
будителю. Микоз описан и в других странах, в том числе и в
нашей.
Возбудитель — Blastomyces dermatitidis Gilchrist (син.: Crypto-
coccus Gilchrist). В тканях (часто внутри гигантских клеток) он
образует дрожжевые клетки 10—30 мкм в поперечнике, с толстой
двухконтурной оболочкой и одиночными почками 8—20 мкм в диа-
метре (представляющие дочерние клетки), сидящими на широком
основании (материнской клетки). В культуре (при температуре
37 °C) имеет дрожжевую и мицелиальную (при температуре
25 °C) формы; толщина мицелия 3—5 мкм, с круглыми, овальны-
ми, грушевидными конидиями, соединенными с мицелием тонкой
ножкой. В старых культурах образуются хламидоспоры.
Эпидемиология. Источники и пути распространения
инфекции не выяснены. Чаще болеют люди, работающие в сель-
ском хозяйстве, а также собаки и лошади. Описаны случаи лабо-
раторного ингаляторного заражения сотрудников.
Клиника. Проявления микоза могут быть ограничены по-
ражениями кожи и подкожной клетчатки или носить системный
характер. В первом случае заболевание начинается чаще всего на
открытых участках кожи (лицо и кисти) и протекает в форме
хронического папилломатозно-язвенного бластомикоза кожи.
Вначале появляются папулезно-пустулезные элементы (рис. 72)
или подкожные узлы, которые с течением времени на фоне хоро-
шего общего состояния абсцедируют и превращаются в язву, по-
крытую коркой. По снятии корки видны папилломатозные разрас-
тания, усеянные мелкими пустулами (микроабсцессы). Это пер-
вичное высыпание в течение 3—5 мес превращается в большую
бляшку (диаметр 4—6 см и более), в центре которой формируется
мягкий тонкий рубец, сочетающийся с папилломатозными разрас-
таниями и серозно-гнойным отделяемым. В таком виде очаг пора-
331
жения может существовать месяцы и годы, подвергаясь медлен-
ному рубцеванию.
Поражение легких клинически и рентгенологически может на-
поминать туберкулез, абсцедирующую пневмонию; иногда наблю-
дается переход процесса на стенку грудной клетки с образованием
свищей. При генерализации микоза поражаются опорно-двигатель-
ный аппарат, внутренние органы, что приводит к гибели больного.
При кожной форме прогноз благоприятный.
При гистологическом исследовании кожи отмечаются псевдо-
эпителиоматозная гиперплазия эпидермиса, множественные микро-
абсцессы интраэпидермальные, дермальные гранулемы с эпители-
оидными и гигантскими клетками. В легких казеоз и гнойный рас-
пад очагов с образованием абсцессов и полостей, некрозами в
бронхиальных лимфоузлах. Грануляционная ткань вокруг некро-
зов с гигантскими клетками типа Пирогова — Лангханса с оби-
лием элементов гриба.
Диагноз ставится на основании описанной выше клинической
картины, обнаружения возбудителя, получения культуры и ретро-
культуры при внутрибрюшинном инфицировании белых мышей.
Дифференцируют североамериканский бластомикоз от гистоплаз-
моза, туберкулеза, рака легких, язвенных и нагноительных заболе-
ваний кожи и подкожной клетчатки, других глубоких микозов.
Лечение. Назначают амфотерицин Б, низорал, нистатин, лево-
рин, натриевые их соли, этилйодид, иногда хирургическое лечение;
местно — фунгицидные средства.
Бластомикоз южноамериканский
Син.: паракокцидиоидоз, паракокцидиоидомикоз, бразильский бластомикоз,
болезнь Лютца — Сплендоре — Альмейды
Глубокий системный микоз с хроническим прогрессирующим
течением, первичным поражением легких и последующим вовле-
чением в процесс кожи, слизистых оболочек носа, щек, лимфати-
ческих узлов, различных внутренних органов (печень, желудок,
селезенка). Распространен в странах Южной Америки.
Возбудитель: Paracoccidioides brasiliensis, син.: Blastomyces Bra-
siliensis (Conant et Howelle, 1941). Класс Fungi imperfecti, семей-
ство- Moniliaceae, род Blastomyces.
В целях выделения гриба исследуют отделяемое язв, свищей,
мокроту, соскобы грануляций в 10 % щелочи или спирте с глице-
рином. При окраске по Граму, Романовскому — Гимзе, Хочки-
су — Мак — Манусу, Гридлеи гриб обнаруживается в виде скоп-
лений или одиночных круглых и овальных почкующихся клеток
с толстыми стенками. При этом одна крупная клетка диаметром
10—60 мкм обычно, как «короной», окружена дочерними (1 —
5 мкм). На среде Сабуро при температуре 37 °C также образует-
ся дрожжевая фаза с церебриформными колониями, а при 20—
25 °C — мицелиальная, для которой характерны белые бархатис-
тые колонии с широким ветвящимся мицелием.
332
Эпидемиология. Считают, что возбудитель заболевания
является сапрофитом растений и почвы, а заражение происходит
при различных повреждениях слизистой оболочки рта во время
чистки зубов веточкой растений. Чаще болеют сельские жители.
От больного здоровому заболевание не передается. Животные
не болеют.
Клиника. Чаще первично поражается слизистая оболочка
рта и носа (реже конъюнктивы и прямой кишки). Язвенный про-
цесс может в последующем привести к разрушению языка, голосо-
вых связок; при переходе на кожу образуются папулы, пустулы,
серпигинирующие язвы с папилломатозным дном, покрытым кор-
ками, напоминающие туберкулез и лейшманиоз. Характерно по-
стоянное вовлечение в процесс лимфатических узлов, селезенки
и легких. Лимфатические узлы могут нагнаиваться, образовывать
свищи, напоминающие скрофулодерму, с грибами в отделяемом.
При гематогенной диссеминации могут поражаться кости, легкие,
напоминая по своей клинической картине туберкулез. Без ле-
чения заболевание тянется до 3 лет и заканчивается гибелью
больного.
Гистопатологическая картина напоминает таковую
при североамериканском бластомикозе.
Диагноз основывается на приведенной выше клинической кар-
тине и обнаружении в патологическом материале возбудителя.
Для его подтверждения патологический материал от больного
внутрибрюшинно вводят мышам. Через 3 нед культурально, микро-
скопически и гистологически идентифицируют гриб из печени,
селезенки, лимфатических узлов и легких зараженных животных.
Заболевание дифференцируют от лимфогранулематоза, кокцидио-
идоза, североамериканского бластомикоза, актиномикоза, других
глубоких микозов.
Лечение заболевания сходно с лечением кокцидиоидоза и гис-
топлазмоза. Профилактика не разработана.
Бластомикоз келоидный
Син.: болезнь Лобо, гленоспороз амазонский
Хронический глубокий локализованный доброкачественный ми-
коз кожи, для которого характерно образование в местах пора-
жения келоидных рубцов. Впервые заболевание описал в Бразилии
J. Lobo (1930), F. Filho в 1931 г. выделил возбудителя.
Возбудитель: Glenosporella loboi (син.: Blastomyces loboi Lan-
geron, Glenosporella loboi Fonseca et Leao; Glenosporella amaso-
nica Fonseca и др.). Класс Fungi imperfecti, семейство Moni-
liaceae, род Blastomyces. Гриб двухфазный, близок к Blastomyces
dermatitidis. В патологическом материале выявляются округлые
или овальные почкующиеся дрожжевые клетки с двухконтурной
оболочкой, диаметром до 16 мкм. С материнской клеткой сопри-
касаются 1—2 дочерние. Колония (при 25 °C) белая, барха-
ззз
Рис. 73. Келоидный бла-
стомикоз голеней.
тистая; мицелий септированный, ветвистый; артроспоры эллипти-
ческие, 2 X 6,5 мкм. При 37 °C вырастает дрожжевая гладкая или
шероховатая желтоватая колония с толстостенными почкующими-
ся клетками, хламидоспорами.
Эпидемиология. Инфицирование экзогенное: при трав-
ме, укусах змей, насекомых. Заболевание встречается в Бразилии
в долине реки Амазонки среди рабочих по добыче каучука. Воз-
будитель во внешней среде не обнаружен. При тестикулярном
заражении прививается морским свинкам, интраназальном — бе-
лым мышам.
Клиника. Высыпания локализуются в основном на коже
лица, ушных раковин, предплечий, голеней. Первичным элементом
являются бугорки красно-фиолетовой окраски, покрытые короч-
ками, бородавчатыми разрастаниями и келоидоподобными болез-
ненными узелками светло-коричневого цвета, склонными к слия-
нию (рис. 73). Лимфатические узлы в процесс не вовлекаются.
Течение длительное (годы), доброкачественное, без нарушения
общего состояния.
Гистопатология. Напоминает акне келоид, хрониче-
скую гранулему с наличием гриба среди эпителиоидных и гигант-
ских клеток.
Диагноз базируется на характерной клинической картине и
обнаружении гриба. Дифференцируют келоидный бластомикоз с
334
Рис. 74. Бугорковая форма хро-
момикоза голени.
акне келоид, бородавчатым
туберкулезом кожи, бугор-
ковым сифилидом.
Лечение хирургическое.
Профилактика не разрабо-
тана.
Хромомикоз
Син.: хромобластомикоз, тро-
пический бластомикоз, болезнь
Педрозо, болезнь Лане—Педрозо,
черный бластомикоз
Хроническое по течению
гранулематозное грибковое
заболевание кожи, характе-
ризующееся бородавчаты-
ми, иногда язвенными по-
ражениями кожи и подкож-
ной клетчатки, в ряде случа-
ев сочетающееся с пораже-
нием внутренних органов
(печени, мозга) и костей.
Впервые описано Pedroso в 1911 г. в Бразилии. Возбудитель вы-
делили Medlar и Lane в 1915 г. и Brumpt в 1922 г. В настоящее
время хромомикоз зарегистрирован почти во всех странах мира,
в том числе и в нашей. Чаще встречается в зонах с тропическим и
субтропическим климатом.
Возбудители: Hormodendrum pedrosoi (Brumpt, 1922). Синони-
мы: Hormodendrum compactum (Carrion, 1935), Phialophora ver-
rucosa (Thaxter, 1915) и др.
Гриб диморфный. В патологическом материале (корки, гной,
биопсированные кусочки), окрашенном по Романовскому — Гимзе
и Граму — Вейгерту, обнаруживают тканевую форму гриба в виде
небольших групп овальных и круглых клеток диаметром 10—
12 мкм светло-коричневого, буроватого или желтоватого цвета,
с отходящими от них нитями септированного мицелия оливкового
цвета. В культуре (рост при 25 °C) — колония пушистая, темного
(«мышиного») цвета, спаяна с субстратом. Мицелий септирован,
конидии овальные, один конец заострен. Хламидоспоры разделе-
ны на 2—4 клетки величиной 3—4 мкм. Фиалоспоры расположе-
ны на фиалидах.
Эпидемиология. Возбудитель хромомикоза находится в
почве и на растениях. Заражение происходит при травме кожи.
Чаще болеют мужчины, занятые в сельском хозяйстве. Заболева-
ние неконтагиозно. Метастазирование лимфогематогенное.
335
Рис. 75. Хромомикоз распространенный.
Клиника. Для заболевания характерно хроническое тече-
ние со склонностью к прогрессированию и образованию грануле-
матозно-веррукозных высыпаний. Первичный элемент возникает
на коже через несколько дней, а иногда месяцев на месте травмы,
напоминая бугорок, папулу синюшно-красного цвета или эритема-
тосквамозную бляшку, наподобие псориатической. Высыпания
возникают чаще на коже нижних или верхних конечностей, ред-
ко — на коже лица, туловища или на слизистых оболочках. Посте-
пенно (спустя несколько месяцев) рядом с основным очагом обра-
зуются другие элементы (1—3 см в диаметре) темно-красной или
темно-бурой окраски с бородавчатой сосочковой поверхностью (по
типу морской капусты). В результате слияния элементов образуют-
ся крупные (до 20 см в диаметре) очаги поражения с фестончатыми
очертаниями и мощным инфильтратом по периферии. Подобные
бляшки напоминают бородавчатый туберкулез (рис. 74).
Различают бугорковую, папилломатозно-язвенную и узловатую
(гуммозную) формы хромомикоза.
Бугорковая форма возникает при лимфогематогенном распро-
странении инфекции. Бугорок напоминает ягоду ежевики. В по-
следующем он размягчается, изъязвляется и покрывается сосоч-
ковыми разрастаниями. Элементы при узловатой форме могут
быть размером до грецкого ореха и даже куриного яйца. После
вскрытия его образуется язва с папилломатозным дном. Встреча-
ются также варианты хромомикоза, напоминающие волчанку и
псориаз. Иногда сочетаются несколько клинических разновидное -
336
тей. Возможно образование келоидных рубцов. Течение болезни
длительное (10—20 лет), медленно прогрессирующее, обычно доб-
рокачественное; могут развиться генерализованные высыпания
(рис. 75).
Г истопатология. При всех клинических разновиднос-
тях хромомикоза гистологическая картина однотипна и характе-
ризуется хронической инфекционной гранулемой с субкорнеальны-
ми и интрадермальными микроабсцессами и характерными сфе-
рическими тельцами возбудителя, окруженными лейкоцитами,
эпителиоидными и гигантскими клетками.
Диагноз ставится на основании клинической картины и под-
тверждается обнаружением элементов гриба и выделением куль-
туры возбудителя. Дифференцируют хромомикоз от ту-
беркулеза кожи, хронической пиодермии, других глубоких мико-
зов (споротрихоз, бластомикозы).
Лечение. Внутривенное капельное или внутриочаговое введе-
ние амфотерицина В (в 2 % растворе новокаина), низорал, обка-
лывание очагов поражения 2 % раствором пипольфена, витамин
Da и препараты йода внутрь курсами в течение 2 мес с перерывами
в 2—3 нед; местно — 20 % пирогалловый пластырь, жидкость
Гордеева и противогрибковые мази. Мелкие очаги удаляют хирур-
гическим путем.
Профилактика заболевания заключается в предупреждении
мелкого травматизма при земляных и сельскохозяйственных ра-
ботах.
Споротрихоз
Син.: болезнь Бермана — Гужеро, болезнь Шенка
Подостро или хронически текущий глубокий микоз, поражаю-
щий кожу, подкожную клетчатку, лимфатическую систему и сли-
зистые оболочки. Описаны также висцеральные формы заболева-
ния с поражением печени, почек, легких. Споротрихоз впервые
описал Schenck в 1898 г. Hektoen, Perkins в 1900 г. выделили куль-
туру возбудителя, которому Berman, Gougerot в 1906 г. дали
название Sporotrichum schenckii.
Микоз встречается во многих странах мира, в том числе и в
нашей, но чаще во Франции, США и Мексике (до 3 % всех дерма-
тозов) .
Возбудитель — Sporotrichum schenckii. Синонимы: Sporotrichum
gougerotii и др. Класс гриба Fungi imperfecti, семейство Monicia-
сеае, род Sporotrichum. Гриб диморфный. В патологическом мате-
риале и биоптатах (окраска по Граму— Вейгерту, Гомори — Гро-
котту и Мак — Манусу) обнаруживаются сигарообразные кони-
дии («челноки») гриба внутри и вне лейкоцитов (размером 2—
5 мкм) или в виде астероидных тел (их скоплений) с округлыми
клетками гриба в центре. В культуре (при температуре 24 СС)
вырастает бархатистая белая, затем чернеющая колония; мицелий
тонкий (2—6 мкм) с овальными конидиями [(2 — 8) X
337
Рис. 76. Споротрихоз, «шанкр» на коже предплечья.
X (2—3) мкм], образует скопления в виде букета — «розетки».
При температуре 37 °C развивается дрожжевая фаза: колонии
мягкой консистенции, гладкие, желтоватые.
Эпидемиология. Гриб в качестве сапрофита распростра-
нен в природе: в почве, на растениях и пр. В организм человека
он попадает при травме и при вдыхании инфицированной грибом
пыли. Заражение от больного человека неизвестно. Чаще болеют
цветоводы, садоводы и сельскохозяйственные рабочие. Болеют
также коровы, лошади, свиньи, собаки.
Клиника. Инкубационный период от 10—15 дней до не-
скольких месяцев. Различают ряд форм споротрихоза: поверх-
ностный (эпидермальный и дермальный), локализованный под-
кожный (лимфатический), диссеминированный кожный (гуммоз-
но-язвенный, язвенно-вегетирующий) и висцеральный (систем-
ный); часто наблюдаются сочетанные формы заболевания.
При поверхностном споротрихозе на коже появляются фолли-
кулиты, акне, папулы, бляшки, веррукозные, папилломатозные
или псориазиформные высыпания, что приводит к частым диагно-
стическим ошибкам. Иногда бывают эритематозные, язвенные,
папилломатозные поражения слизистых полости рта, носа, зева,
гортани. Чаще наблюдается локализованный подкожный споро-
трихоз, характеризующийся развитием в гиподерме безболезнен-
ного, не спаянного с кожей узла, в дальнейшем некротизирующе-
гося с образованием «споротрихозного шанкра» (рис. 76), от ко-
торого по ходу отводящего лимфатического сосуда тянется плот-
ный тяж с множественными узелками. Впоследствии они также
изъязвляются. Развивается гуммозный диссеминированный споро-
трихоз.
338
В ряде случаев при споротрихозе наблюдаются аллергические
сыпи — споротрихиды. При висцеральных формах споротрихоза
могут поражаться кости, суставы, мышцы, сухожилия и различные
внутренние органы. Эти формы бывают у ослабленных больных,
лечению они поддаются трудно и обычно заканчиваются летально.
Гистопатология. В основе поражения — неспецифиче-
ская гранулема в дерме из плазматических, эпителиоидных клеток
и макрофагов, имеющая три зоны: в центре некроз с нейтрофила-
ми, затем фибробласты, лимфоциты и плазматические клетки и,
наконец, эпителиоидные и гигантские клетки.
Диагноз ставится на основании множественных гумм, линей-
ного расположения узлов по ходу лимфатических сосудов, нали-
чия лимфангитов и выделения типичной культуры споротрихума.
Дифференцировать споротрихоз следует от других глубоких мико-
зов (кокцидиоидоза, бластомикозов), туберкулеза, сифилиса, леп-
ры, хронической пиодермии, туляремии.
Лечение. Препараты йода в возрастающих дозировках, амфо-
терицин В, низорал, леворин, нистатин. Хирургическое вмешатель-
ство противопоказано. Иногда вегетации подвергают криодест-
рукции.
Профилактика аналогична таковой при хромомикозе.
Аспергиллез
Грибковое поражение кожи, слизистых оболочек, уха, глаза,
легких и других внутренних органов, обусловленное аспергиллами.
Впервые аспергиллез описал в 1844 г. Bennett. В настоящее
время заболевание зарегистрировано во всех странах мира, в том
числе и в нашей. В последние годы участились случаи в Польше,
Японии, США, Англии.
Возбудители: грибы из рода Aspergillus, класса Ascomycetes,
семейства Aspergillaceae.
Наиболее частыми возбудителями процессов в легких, а также
поверхностных и глубоких поражений кожи являются Aspergillus
fumigatus, Aspergillus flavus и др. Для них характерно строение
органов спороношения: на конце конидиеносца — вертикально
стоящей ветви, отходящей от септированного мицелия, имеется
расширение («везикула»), на котором в 1 или 2 ряда расположены
продолговатые выросты — стеригмы, а на них веерообразно «си-
дят» округлые споры (конидии). Для выявления возбудителя не-
обходимо получение культуры. Цвет колоний зависит от вида
аспергилла (зеленый, черный, коричневый, белый, желтый и др.).
При снижении сопротивляемости организма аспергиллы могут
вызывать интоксикацию (аспергиллотоксикозы), аллергические
высыпания на коже, поверхностные эпидермодермиты и глубокие
поражения — мицетомы типа мадурской стопы или висцеральные
микозы — поражения легких, печени, почек.
Эпидемиология. Аспергиллы широко распространены в
качестве сапрофитов в почве, на растениях, в воздухе и в пыли на
339
Рис. 77. Абсцедирующий аспергиллез кожи ягодиц.
стенах помещений. Путь инфицирования — чаще ингаляторный,
через желудочно-кишечный тракт и реже — через поврежденную
кожу. Болеют также сельскохозяйственные животные и птицы.
Клиника. Кожные формы аспергиллеза протекают под ви-
дом дерматита, в виде интертриго, везикулезной, папулезной сыпи
или генерализованной эритродермии, хронических, язвенных и
абсцедирующих пиодермий (рис. 77); бронхолегочный аспергиллез
напоминает бронхит, пневмонию и туберкулез легких. Описаны
аспергиллезные отиты, тяжелые поражения глаз, придаточных
полостей носа. При поражении легких на томограмме обнаружи-
вают округлое затемнение с серповидной воздушной прослойкой
по периферии (аспергиллома), а в ватообразных комочках мок-
роты выделяются характерные элементы культуры гриба.
Гистопатология. В очагах поражения превалируют
некроз тканей, грануляции с гистиоцитами, фибробластами, ги-
гантскими клетками типа инородных тел и эпителиоидными.
Диагноз должен быть подтвержден выделением возбудителя.
Дифференцировать аспергиллез необходимо от других грибковых
поражений кожи и легких, а также от туберкулеза, саркоидоза,
актиномикоза, паразитарных и непаразитарных кист, пылевых
фиброзов легких и др.
Лечение. Поверхностные процессы на коже, в слуховых про-
ходах поддаются терапии обычными фунгицидными средствами:
фукорцин (жидкость Кастеллани), декаминовая мазь, микосептин,
ундециленаты. При висцеральном аспергиллезе назначают внутрь
нистатин, леворин, низорал, внутривенное капельное введение ам-
фотерицина Б, ингаляции аэрозолей натриевой соли леворина в
340
сочетании с общеукрепляющей терапией. Лечение аспергилломы
легкого обычно хирургическое.
Профилактика заключается в защите работающих от ингаля-
ции спор гриба на производствах, где аспергиллы используются
как продуценты (лимонной кислоты, ферментов, спиртов) или
загрязняют сырье.
Мукороз
Син.: мукормикоз, фикомикоз
Заболевание относится к группе глубоких (плесневых) мико-
зов с хроническим течением. Поражаются кожа, подкожная клет-
чатка, ухо, глаза и внутренние органы (бронхолегочный аппарат,
печень, почки, желудочно-кишечный тракт и центральная нервная
система).
Известны случаи мукороза с явлениями сепсиса. Впервые
мукороз описал Paltauf в 1885 г., а в нашей стране — Р. С. Клисич
в 1899 г.
Возбудители — различные грибы из родов Mucor, класса
Phycomycetes, семейства Mucoraceae. Мицелий этих грибов пере-
городок не имеет. К субстрату он прикрепляется специальными
ответвлениями — ризоидами. Споры заключены в шаровидных или
грушевидных спорангиях (эндогенное спороношение). В патологи-
ческом материале мицелий имеет вид разветвленных широких
(15—20 мкм) нитей. В мокроте обнаруживаются спорангии
(диаметром до 60 мкм) с эндогенными спорами. В культуре —
пушистые, войлокообразные колонии, серовато-беловатого цвета,
с черными или коричневыми головками. Различают их по особен-
ностям строения спорангиеносцев, столонов (пучков гиф).
Эпидемиология. Мукоровые грибы широко распростране-
ны в природе, на продуктах питания; в воздухе имеется обилие
спор этого гриба. Путь заражения чаще аэрогенный. Заболе-
вают в основном больные тяжелым диабетом. Микоз не конта-
гиозен.
Клиника. Кожные формы протекают под видом хрониче-
ских язвенных пиодермий, наружных отитов; легочные возникают
при пневмониях в процессе их неэффективного лечения анти-
биотиками. Описаны мукорозные поражения ЛОР-органов, желу-
дочно-кишечного тракта, тяжелые менингоэнцефалиты вследствие
распространения процесса с придаточных пазух носа у лиц с вы-
раженными формами диабета. Известны также профессиональные
мукорозы у сборщиков апельсинов в виде онихий и паронихий.
Г истопатология. Для гриба характерна способность вы-
зывать некротически-гнойное воспаление и прорастание стенок со-
судов, обусловливающих тромбоз. В дерме лейкоцитарная и лим-
фоцитарная инфильтрация со значительным содержанием эозино-
филов.
Диагноз подтверждается обнаружением возбудителя и выделе-
нием культуры гриба. Мукороз дифференцируют от менинго-
341
энцефалита, пневмонии, новообразований и других глубоких ми-
козов.
Лечение как и при аспергиллезе.
Профилактика. Борьба с запыленностью, профессиональный
отбор.
Пенициллиоз
Пенициллиоз — поражение кожи, ногтей, слизистых оболочек
и внутренних органов плесневыми грибами рода Penicillium.
Впервые у человека этот микоз описал в 1889 г. Siebenmann
при поражении уха.
Возбудители. Наиболее патогенными для человека являются
Penicillium crustaceum Fries.; Penicillium glaucum Link и др. Класс
гриба Ascomycetes, семейство: Aspergillaceae.
Для пенициллов характерны светлые (сизые) тона колоний на
субстрате, образование кисточки на конце конидиеносца с оби-
лием овальных зеленых конидий (2,5X3,3 мкм). По характеру
конечного ветвления конидиеносцев (одно-двухмутовчатые) и
строению кисточки (симметричные, несимметричные) определяют
вид гриба. Мицелий септирован.
Эпидемиология. Пенициллы широко распространены в
природе. В 1 г некоторых почв содержится до 100 000 зародышей
плесневых грибов, главным образом пенициллов. Они обнаружи-
ваются на продуктах питания, в воздухе, на стенах темных сырых
помещений, овощехранилищ. Применяются в производстве сыров
(рокфор) и антибиотиков (пенициллин, гризеофульвин). Сапрофи-
тируют на коже и слизистых оболочках человека. Заражение
аэрогенное или при травме кожи и слизистых оболочек. Заболе-
вание неконтагиозно.
Клиника. При снижении защитных сил организма пени-
циллы могут стать причиной патологических процессов на коже:
дерматита, экземы, хронических язвенных поражений и наружных
отитов. Описаны пенициллиозы слизистых оболочек, бронхолегоч-
ного аппарата, мозга (абсцессы), мицетомы. Во внутренних ор-
ганах пенициллиоз развивается как вторичная инфекция на фоне
нерациональной антибиотикотерапии тяжелого общего заболе-
вания.
Гистопатология. Характерно некротическое воспаление,
образование гранулемы, абсцессов, каверн. Очаги некроза окруже-
ны зоной некробиоза с нитями гриба, слоем грануляционной
ткани с эпителиоидными, иногда гигантскими, клетками.
Диагноз базируется на обнаружении в гное, мокроте, пунктате
закрытых очагов поражений, чешуек кожи, ногтей, соскобов со
слизйстых оболочек, ушной серы септированного мицелия, нередко
с характерным спороношением. Дифференцируют пенициллиоз с
другими глубокими микозами, хронической пиодермией.
Лечение и профилактика аналогичны таковым при аспер-
гиллезе.
342
Цефалоспориоз
Син.: акремониаз, акроасталагмоз
Это глубокий микоз кожи, слизистых оболочек, опорно-дви-
гательного аппарата и внутренних органов. Впервые описан в
1911 г. Pottron и Noisette. Встречается в разных странах мира.
Возбудители: различные виды грибов рода Cephalosporium.
Наиболее часто из них встречается Cephalosporium acremonium
Corda (синоним: Cephalosporium cinnabarinum Corda и др.). Класс
Fungi imperfecti, семейство Moniliaceae, род Cephalosporium.
В патологическом материале при окраске по Граму—Вейгерту
обнаруживают дрожжевидные клетки разной величины. При посе-
ве гриба вырастают плоские, гладкие (позже с радиальными бо-
роздами) колонии с пушистой, затем порошкообразной поверх-
ностью белого, а затем темно-розового цвета. Мицелий септиро-
ванный, образует конидиеносцы, на верхушке которых имеются
головки с эллиптическими конидиями.
Эпидемиология. В качестве сапрофитов цефалоспоры ши-
роко распространены в природе. Заражение обычно происходит
при травме, кожи и слизистых оболочек.
Клиника. Поражения кожи могут быть поверхностными
в виде дерматита, пиодермии, везикулезно-пустулезных элементов
и эрозивно-язвенных очагов (рис. 78) или глубокими (гуммозно-
язвенными, язвенно-вегетирующими, абсцедирующими). Наблюда-
ются поражения типа мицетомы — «мадурской стопы». Висцераль-
ные поражения обычно протекают на фоне септикопиемии.
Рис. 78. Эрозивно-язвенный цефалоспориоз кожи голеней
343
Гистопатологическая картина специфики не имеет и
зависит от локализации, степени и глубины поражений.
Диагноз должен быть подтвержден лабораторными данными.
В патологическом материале встречаются преимущественно септи-
рованный мицелий, характерное спороношение непостоянно. Учи-
тывая, что гриб может быть сапрофитом, для диагноза необходи-
мы повторное получение одной и той же культуры цефалоспориу-
ма при посеве патологического материала, нахождение гриба в
биопсийном материале, выделение ретрокультуры при внутрибрю-
шинном заражении мышей, морских свинок, лягушек. Успех от
лечения заболевания препаратами йода также свидетельствует в
пользу цефалоспориоза. Дифференциальный диагноз проводится с
другими глубокими микозами.
Лечение. Назначают йодистый калий в возрастающих дозиров-
ках внутрь, курсовое лечение нистатином и леворином в больших
дозах (6—8 млн ЕД в сутки), низорал. Иногда хирургическое
иссечение очагов поражения. Местно применяют фунгицидные
мази, красители.
Профилактика заключается в борьбе с микротравматизмом в
сельском хозяйстве, при земляных работах.
Кладоспориоз
Глубокий системный микоз с преимущественным поражением
центральной нервной системы (преимущественно головного моз-
га), реже — кожи. Впервые описан Binford, Thompson, Gorham и
Emmons в 1952 г.
Возбудители: Cladosporium trichoides, Cladosporium mansonii
и др. Класс Fungi imperfecti, семейство Dematiaceae, род Clado-
sporium.
Единичные случаи заболевания описаны в США, Южной Аме-
рике, Африке и некоторых странах Европы.
Эпидемиология. Возбудитель в качестве сапрофита широ-
ко распространен в почве и на растениях. Заболевание некон-
тагиозно. Способы заражения не известны.
Клиника. Поверхностные поражения эпидермиса известны
под названием Tinea nigra, keratomycosis palmaris. Гриб нейротро-
пен. При поражении головного мозга бывают упорные головные
боли, сонливость, апатия, лихорадка, гипертензия. Иногда одно-
временно бывают множественные абсцессы мозга и инкапсули-
рованные абсцессы легких. Болезнь развивается медленно.
Гистопатология. В веществе мозга выявляются инкапсу-
лированные очаги с микроабсцессами, инфильтратами из эпите-
лиоидных клеток, полинуклеаров, гистиоцитов, гигантских клеток
с сегментированными ветвящимися нитями и круглыми дрожже-
подобными почкующимися клетками диаметром 8—10 мкм блед-
но-коричневого цвета.
Диагноз базируется на обнаружении в тканях пигментирован-
ных коричневых нитей шириной 2—3 мкм, распадающихся на
344
споры в виде цепочек и выделении характерной культуры (пуши-
стой, темно-коричневой, с окрашенными нитями и цепочками ко-
нидий на концах). Это же позволяет дифференцировать кладо-
спориоз от вульгарных абсцессов мозга и других его микотиче-
ских поражений — аспергиллеза, мукороза, криптококкоза.
Лечение. Патологические процессы на коже лечат так же, как
и при хромомикозе. При поражении мозга лечение хирургическое
(радикальное иссечение инкапсулированного очага), прогноз при
этом неблагоприятный. Только ранняя диагностика залог успеха
лечения.
Профилактика не разработана.
Риноспоридиоз
Син.: болезнь Зеебера, granuloma rhinosporidioticum
Это хронический глубокий гранулематозный микоз, встречаю-
щийся обычно в странах с тропическим климатом. В СССР опи-
сано лишь несколько случаев заболевания. Эту форму глубокого
микоза и его возбудителя впервые описал Malbran в 1892 г.
Возбудитель: Rhinosporidium seeberi. Синоним: Coccidium see-
beri Wernicke. Класс Phycomycetes, сем. Chytridiales, род Rhino-
sporidium. В патологическом материале выявляют крупные толсто-
стенные сферические спорангии от 50 до 200 и более мкм в по-
перечнике, наполненные крупными овальными 7—9 мкм эндо-
спорами. В культуре возбудитель не получен. Поэтому некоторые
исследователи отрицают принадлежность его к грибам.
Эпидемиология. Обычно заражаются люди, работающие
на рисовых полях, в грязных водоемах. Считают, что водоемы за-
грязняются птицами, которые болеют риноспоридиозом.
Клиника. На слизистой оболочке носа, реже — влагалища
и конъюнктивы или на коже развиваются папилломатозные и
полипозные разрастания в виде малины или цветной капусты, по-
крытые вязкими слизистыми массами. Обильная васкуляризация —
причина легкой травматизации и кровоточивости. Полипы могут
достигать больших размеров (иногда имеют массу до нескольких
десятков граммов) и, развиваясь на слизистой оболочке носа,
препятствуют дыханию. На коже преобладают веррукозные раз-
растания с явлениями кератинизации.
Гистопатология. Гранулема, богатая капиллярами, очаги
некроза, разрастание грануляций и массивный инфильтрат из
лейкоцитов, эозинофилов, гистиоцитов и ретикулярных клеток.
Диагностика не представляет затруднений. Для ее подтвержде-
ния необходимо выявление возбудителя. Риноспоридиоз диффе-
ренцируют от обычных полипозных разрастаний, широких кон-
дилом.
Лечение. Хирургическое удаление или электрокоагуляция по-
липозных разрастаний. Внутривенные вливания 5 % раствора со-
люсурьмина или внутримышечные инъекции 2 % раствора эметина.
Профилактика не разработана.
345
Мицетома
Син.: мадурская стопа, мадуромикоз, фикомицетома
Это хроническое грибковое неконтагиозное заболевание мяг-
ких тканей и костей нижних конечностей и туловища. Впервые
описано в 1712 г. Kampfer. Gill в 1842 г. выделил ее в самостоя-
тельную нозологию. Colebrook в 1846 г. ввел понятие «ма-
дурская стопа», в 1860 г. Van Dyke Carter ввел термин «ми-
цетома».
В качестве возбудителей мицетомы стопы описано около 50 ви-
дов грибов из различных систематических групп, а также аэроб-
ные проактиномицеты — нокардии. Отсюда богатство синонимов
этого заболевания по виду выделенного возбудителя, большая
часть которых широко распространена в природе в качестве
сапрофитов.
Наиболее частыми из них являются грибы: Madurella myce-
tomi, Leptospheria senegaliensis, Cephalosporium falciforme; актино-
мицеты: Nocardia asteroides, Nocardia brasiliensis, Streptomyces ma-
dure и др.
Эпидемиология. Заболевание описано почти во всех стра-
нах мира, но наиболее часто встречается в Африке, Америке, Ин-
дии, Японии. Болеют им преимущественно жители села. Инфици-
рование в основном происходит при травмировании конечности
при хождении босиком, во время работы.
Клиника. При локализации на стопе характерны опухоле-
видное увеличение ее в размерах и деформация, образование
свищей с серозно-геморрагическим отделяемым, в котором имеют-
ся специфические зерна (белой, желтой, красной или черной ок-
раски) с элементами возбудителя внутри и вне их (рис. 79). Это
наиболее часто встречающаяся локализация мицетомы, «мадур-
ской стопы» (по названию провинции в Индии). Поражается, как
правило, одна конечность. Возникает процесс обычно через дли-
тельный срок после травмы появлением плотных постепенно уве-
личивающихся в размерах узелков в гиподерме. Вначале кожа над
ними не изменена, затем появляется красно-коричневое пятно,,
кожа истончается и образуется свищ. Затем фистулы самопроиз-
вольно рубцуются, но вскоре процесс рецидивирует рядом, вовле-
кая мышцы, фасции и кости, приводя к деформации всю стопу.
Стопа синюшной окраски, обезображена конгломератами узлов,
свищами, язвами, рубцами. Пальцы округлены, подняты кверху,
не касаются пола. Несмотря на это, опорная функция стопы со-
храняется долго. Нередко развивается слоновость. На рентгено-
грамме: деструктивные изменения в мягких тканях и мелких кос-
тях стопы разной степени. Отмечают 3 клинико-рентгенологиче-
ские стадии мицетомы: поверхностную (поражение только мягких
тканей, без вовлечения костей), глубокую (с вовлечением кос-
тей— остеопороз, периостит, деструкция их), запущенную — с об-
ширной костной деструкцией.
Мицетома кистей встречается реже и по клинике напоминает
346
Рис. 79. Мицетома стопы.
мицетому стоп. При поражениях на туловище в процесс быстро
вовлекаются мягкие ткани и кости.
При гистологическом исследовании выявляется неспе-
цифическая гранулема с центральным микроабсцессом, с воз-
будителем в центре. В дерме отмечается трехзональный ин-
фильтрат; в центре его нейтрофилы, затем плазмоциты, гистио-
циты, эпителиоидные и гигантские клетки и по периферии ин-
фильтрата грануляционная ткань с фиброзной капсулой.
Диагноз мицетомы стопы в типичных случаях нетруден.
Грибковая этиология подтверждается обнаружением возбудителя в
патологическом материале и идентификацией его в культуре. Сле-
дует отметить, что у нас наиболее часто мицетома вызывается
актиномицетами (преобладают поражения тыла стопы). Диффе-
ренцируют мицетому с бугорково-язвенным третичным сифили-
сом, колликвативным туберкулезом, хронической язвенной пио-
дермией, саркомой Капоши. При локализации ее на груди и
спине — с актиномикозом, неоплазмами, остеомиелитом.
Лечение зависит от вида возбудителя. При выделении нитча-
тых и плесневых грибов показан амфотерицин Б, амфоглюкамин,
низорал. При нахождении актиномицетов — актинолизат, морфо-
циклин, сульфаниламиды. Иногда показано хирургическое вме-
шательство.
Профилактика. Ношение обуви, защищающей стопу от колючек
и заноз в эндемических зонах; повышение санитарной культуры
населения.
347
ПСЕВДОМИКОЗЫ
Сюда отнесены поверхностные (эритразма, подкрыльцовый
трихомикоз — трихонокардиоз) и глубокие (актиномикоз, нокар-
диоз) поражения негрибковой природы, первичной диагностикой
которых и лечением кожных форм традиционно занимаются
дерматологи.
ЭРИТРАЗМА
Син.: grasse parasitaire
Хронически протекающее поверхностное бактериальное пора-
жение кожи в паховой, подкрыльцовых областях, под молочными
железами, иногда в межпальцевых складках. Заболевание впервые
описал в 1859 г. Burchardt. Оно распространено во всех странах
мира, особенно в тропиках.
Возбудитель: Corynebacterium fluorescens erythrasmae. В чешуй-
ках с очагов поражения кожи после обработки их ледяной уксус-
ной кислотой с подогревом и окрашиванием метиленовым синим
под масляной иммерсией обнаруживаются тонкие извилистые ни-
ти мицелия (0,8—11 /-’ мкм) различной длины и кокковидные
зернистые клетки, а также довольно характерные «булавы». На
агаре со средой 199 или кровяном агаре растут кожистые коло-
нии. В мазках выявляются также грамположительные изогнутые
коринебактерии. В лучах Вуда кораллово-красное свечение.
Эпидемиология. Болеют только люди. Контагиозность
эритразмы невелика. В ее патогенезе имеют значение повышенная
потливость, особенности химического состава пота, влажность,
высокая температура воздуха и индивидуальные особенности ор-
ганизма. Полагают, что возбудитель из почвы вначале внедряется
в кожу межпальцевых складок стоп, откуда затем распространяет-
ся на другие участки кожи.
Клиника. Инкубационный период не установлен. Наиболее
частая локализация эритразмы — это пахово-бедренные складки и
примыкающая к ним кожа верхней трети бедер, подмышечные
складки, складки молочных желез, живота, вокруг пупка и задне-
го прохода, между пальцами стоп (рис. 80). Кожа мошонки,
крайней плоти и головки полового члена поражается редко.
Очаги поражения невоспалительного характера состоят из то-
чечных пятен светло-коричневого или кирпично-красного цвета,
гладкие или слегка шелушатся. Сливаясь, они образуют крупные
очаги фестончатых очертаний с четкими границами. Субъектив-
ные ощущения обычно отсутствуют. Заболевание склонно к ре-
цидивам.
При гистологическом исследовании отмечаются раз-
рыхление верхних участков рогового слоя, неравномерный гра-
нулез, разной степени выраженности периваскулярные инфильтра-
ты из лимфоцитов и гистиоцитов.
348
Рис. 80. Эритразма.
Диагноз не представляет затруднений. Очаги поражения в
лучах Вуда имеют характерное кораллово-красное свечение. Эри-
тразму дифференцируют от стертых форм руброфитии, паховой
эпидермофитии, себорейной экземы, псориаза.
Лечение. 5 % эритромициновая мазь (втирать 2 раза в день
в течение 7 дней), 5 % салициловый спирт, 2 % настойка йода.
Профилактика: борьба с потливостью, кислые присыпки,
соблюдение правил гигиены, дезинфекция белья, обуви.
ПОДКРЫЛЬЦОВЫЙ ТРИХОМИКОЗ
Син.: подкрыльцовый трихонокардиоз
Бактериальное заболевание кутикулы волоса подкрыльцовой
области и лобка с образованием на них узелков. Кожа при этом
не поражается.
Впервые описано Martin в 1862 г.
Возбудитель: Nocardia (Corynebacterium) tenuis Castellani, часто
сочетается с пигментообразующими кокками (Micrococcus Castel-
lani, Micrococcus nigrescens) и коринебактериями (Corynebacterium
tenuis).
При микроскопии выявляются тонкие (диаметр 0,7—0,8 мкм)
нити, бациллярные и кокковые формы. Колонии на кровяном ага-
ре или со средой 199 кожистые, серого цвета или желтоватые.
В мазках — грамположительные изогнутые палочки.
349
Эпидемиология. Болеют только люди. Заражение от боль- <
ного человека, через загрязненное им белье, предметы ухода.
Инфицированию благоприятствует повышенная потливость, нару- '
шение правил гигиены.
Клиника. На поверхности волос располагаются узелки жел-
того, иногда красного и черного цвета, мягкой консистенции.
Сливаясь, они окутывают волос чехлом. Узелки слизистые, со-
стоят из кокковых и бациллярных микроорганизмов. Волосы ста-
новятся хрупкими, обламываются, склеиваются между собой. При
этом волосы, пот и белье больного окрашиваются в тот же цвет,
что и узелки.
Гистопатология. Эпидермис и дерма в процесс не вовле-
каются.
Диагноз не сложен. Трихомикоз дифференцируют от измене-
ний волос при пьедре, трихорексисе и монилетриксе.
Лечение. Волосы сбривают, кожу в течение 2 нед протирают
0,1 % раствором сулемы, 2 % раствором формалина в 70° спирте,
2 % салициловым спиртом, 1 % настойкой йода.
Профилактика. Соблюдение правил гигиены, борьба с повы-
шенной потливостью.
АКТИНОМИКОЗ
Син.: стрептотрихоз, лучистогрибковая болезнь
Хронически протекающее гранулематозное гнойное поражение
различных тканей и органов с образованием плотных малоболез-
ненных инфильтратов, абсцессов и длительно не заживающих сви-
щей. В гнойно-кровянистом отделяемом из них часто содержатся
белые или желтоватые зерна, а при микроскопии видны характер-
ные друзы актиномицета — сплетения тонкого мицелия с колбо-
образными утолщениями и желтоватым ободком по периферии.
Актиномикоз впервые описал Langenbek в 1845 г. Культура
возбудителя получена М. И. Афанасьевым в 1888 г., Wolff и Isra-
el — в 1891 г.
Описано большое число возбудителей актиномикоза, однако
основными признаются: 1) Actinomyces Israeli (синоним: Actinomy-
ces hominis Wolf—Israel) —анаэроб, хорошо растущий на мясо-
пептонной среде под слоем вазелинового масла. При микроскопии
видны ветвящиеся нити (0,6 мкм в диаметре), распадающиеся
на палочки и кокки. В тканях образуют друзы 5 мкм в диаметре;
2) Actinomyces bovis (синоним: Proactinomyces bovis) — анаэроб,
видимо, является разновидностью первого. Часто вызывает пора-
жения у животных; 3) Actinomyces albus Rossi—Doria как возбу-
дитель признается не всеми. Аэроб, на среде Сабуро вырастают
кожистые колонии. При микроскопии видны несептированные
нити актиномицета, неветвящиеся, нераспадающиеся на членики;
4) к возбудителям относится также Micromonospora parva. Аэроб,
колонии его оранжевого цвета. На конидиеносце имеется всего
одна овальная спора.
350
Перечисленные возбудители относятся к классу Actinomyces,
семейство Actinomycetaceae и Micromonosporaceae. По биологиче-
ским свойствам стоят ближе к бактериям, чем к грибам.
Эпидемиология. Инфицирование чаще эндогенное в ре-
зультате активации (часто при травме) актиномицетов — обыч-
ных обитателей кожи, слизистых оболочек рта, дыхательных пу-
тей и желудочно-кишечного тракта. Мужчины болеют в 3 раза ча-
ще, чем женщины. Заболевание неконтагиозное. Кроме человека,
болеют домашний скот (коровы, лошади, свиньи), собаки.
Клиника. Инкубационный период длится от 2—3 нед до
многих лет. Течение может быть острым, но чаще хроническое.
Различают первичный актиномикоз и вторичный, связанный с рас-
пространением возбудителя из основного очага. Могут поражать-
ся все органы и ткани. Вначале появляется малоболезненный
плотный инфильтрат вначале синюшно-красного, а затем багро-
вого цвета. С течением времени он размягчается, абсцедирует
и вскрывается; свищи длительно не заживают. В дальнейшем на
их месте образуются плотные втянутые рубцы. В последние годы
в связи с широким применением антибиотиков клиническая кар-
тина актиномикоза изменилась — могут отсутствовать типичная
плотность инфильтрата и свищи.
В зависимости от локализации различают следующие клиниче-
ские формы заболевания. Актиномикоз шеи и головы (наиболее
часто встречается шейно-лицевая форма — до 58 % случаев). При
поражении жевательных мышц развиваются тризм, асимметрия
лица, ограничение подвижности челюсти. Процесс может распро-
страняться на мышечную ткань, кости, придаточные пазухи, в об-
ласть черепа, в грудную полость. При торакальном актиномикозе
(до 20 %) поражаются органы грудной полости с вскрытием сви-
щей на коже грудной клетки и разрушением межреберных мышц
и ребер. Течение вялое, с преимущественной симптоматикой
поражения соответствующего органа (пневмония, абсцесс грудной
клетки, остеомиелит ребер, спондилит, поражение средостения).
Абдоминальный актиномикоз включает поражения брюшной
стенки и органов брюшной полости. Чаще он возникает в илео-
цекальной области или прямой кишке. Выделяют также актиноми-
коз малого таза, мочеполовой системы, параректальной, крестцово-
копчиковой и ягодичной областей с соответствующей симптома-
тикой.
Актиномикоз кожи редко может быть первичным. Обычно он
развивается вторично и проявляется в виде гуммозно-узловатых,
бугорково-пустулезных, атероматозных, инфильтративных, абсце-
дирующих и язвенных форм (рис. 81). Наиболее часто встречает-
ся гуммозно-узловатая форма, начинается с появления в подкож-
ной клетчатке узлов, которые затем сливаются, образуя плотный
безболезненный синюшно-багровый инфильтрат, вскрывающийся
множественными свищами. Лимфатические узлы поражаются ред-
ко. Иногда процесс может напоминать хроническую пиодермию,
флегмоны, кокцидиоидоз (и сочетаться с ним).
351
Рис. 81. Актиномикоз челюстно-лицевой и шейной областей.
Гистопатология зависит от стадии процесса. В месте
проникновения инфекции образуется специфическая гранулема, из
которой развиваются обширные зоны грануляционной ткани из
нейтрофилов, лимфоцитов, плазматических клеток и фиброблас-
тов. В грануляционной ткани образуются абсцессы, а по перифе-
рии — соединительная ткань. Обилие друз бывает обычно в абс-
цессах.
Диагноз базируется на клинической картине и обязательно
подтверждается обнаружением друз и идентификации культуры
актиномицета. Иногда друзы обнаруживаются с трудом лишь при
повторных исследованиях. В этих случаях решающими являются
352
получение культуры актиномицета, положительные кожно-аллер-
гические пробы и реакция связывания комплемента с актино-
лизатом. Дифференцируют актиномикоз с неоплазмами, кокцидио-
идозом, другими глубокими микозами, абсцессами, хронической
пиодермией, сифилитическими гуммами, туберкулезом.
Лечение заключается во внутримышечном введении актиноли-
зата по 3—4 мл или внутрикожно с 0,5 до 2,0 мл 2 раза в неделю
(на курс 20—25 инъекций), морфоциклина, назначение суль-
фаниламидов, гемотрансфузии, витаминов и др., а также симпто-
матических средств; иногда используется хирургическое вмеша-
тельство.
Профилактика. Предупреждение микротравм, санация полости
рта, соблюдение правил личной гигиены.
НОКАРДИОЗ
Син.: стрептотрихоз, кладотрихоз, атипичный актиномикоз
Острое или хроническое, иногда септико-пиемическое заболева-
ние внутренних органов (обычно легких), реже кожи, подкожной
клетчатки, слизистых оболочек, лимфатических узлов.
Заболевание впервые описал Nocard в 1888 г. у быка. В 1890 г.
Eppinger сообщил о нокардиозной плевропневмонии с абсцессом
мозга у человека. Н. М. Берестнев (1897) назвал заболевание
«атипичным актиномикозом» с диффузным развитием возбуди-
теля без друз и зерен в тканях (имеются друзоподобные образо-
вания, но без колб по периферии).
Возбудители: 1) Nocardia asteroides (син.: Streptotrix Eppinger;
Proactinomyces asteroides); 2) Nocardia madurae (син.: Actinomyces
madurae; Streptomyces madurae); 3) Nocardia brasiiiensis Casteliani
(син.: Actinomyces brasiiiensis).
Нокардии представляют собой аэробы, спор и капсул не об-
разуют, обычно грамположительны, кислотостойки, растут при
комнатной температуре, но лучше при температуре 37 °C, на среде
Сабуро и мясопептонном агаре.
Эпидемиология. Заболевание встречается чаще в субтро-
пиках; оно неконтагиозно. Заражение экзогенное, респираторным
путем, через желудочно-кишечный тракт, травмированную кожу и
слизистые оболочки. Чаще болеют люди, получающие стероидные
препараты, страдающие заболеваниями крови.
Клиника. Проявления нокардиоза разнообразны. Выделяют
легочный и генерализованный (септический), первичный и вторич-
ный нокардиоз. Описаны мицетомы, сопровождающиеся пораже-
нием кожи, подкожной клетчатки и костей.
На легочный нокардиоз приходится около 70 % всех локализа-
ций. При этой форме после продромального периода (слабость,
недомогание, головная боль, потливость, кашель при нормальной
температуре) повышается температура тела у больного до 40 °C;
отмечают большие суточные колебания температуры (до нормы),
затем появляются слизисто-гнойная, иногда кровянистая мокрота,
13—936
353
Рис. 82. Узловато-язвенный кокардиоз кожи.
хрипы, шум трения плевры. Рентгенологически определяют много-
численные милиарные очаги разрежения легочной ткани, одиноч-
ные или сливные абсцессы на томограмме.
Возможны гематогенная диссеминация возбудителя и развитие
сепсиса, поражение различных внутренних органов, образование
фистулезных ходов в грудной и брюшной полостях и свищей на
поверхности кожи. Поражения ЦНС протекают по типу абсцессов
или менингитов.
Поражения кожи, подкожной клетчатки и костей в 60 % слу-
чаев наблюдаются на нижних конечностях в виде опухолей с
множеством гнойных синусов, свищей. Возможны язвенные, па-
пилломатозные поражения кожи и узловатые высыпания с после-
дующим изъязвлением, рубцеванием (рис. 82).
Клинически чаще всего нокардиоз напоминает легочный ту-
беркулез, актиномикоз, кокцидиоидоз, гистоплазмоз, от которого
его дифференцируют в первую очередь.
Диагноз должен быть подтвержден лабораторно, в том числе
и с экспериментом на животных.
Гистопатология напоминает соответствующие формы актино-
микоза.
Лечение. Применяются сульфаниламиды, полусинтетические
пенициллины, стрептомицин, морфоциклин, общеукрепляющие
средства, витамины.
Профилактика. Предупреждение травм кожи и слизистых обо-
лочек, дезинфекция зараженного материала.
354
Глава 10
ТУБЕРКУЛЕЗ КОЖИ
Туберкулез кожи — хроническое инфекционное заболевание,
вызванное микобактериями туберкулеза, характеризующееся выра-
женной клинической гетерогенностью и образованием специфиче-
ских гранулем в коже. Клинический полиморфизм в значительной
мере зависит от общего состояния организма, прежде всего им-
мунитета и специфической аллергии, возраста больных, наличия
или отсутствия очагов инфекции в других органах, состояния
микроциркуляции, путей проникновения микобактерий в кожу, их
количества и вирулентности. Туберкулезная природа заболевания
была доказана Р. Кохом в 1882 г. Им же были проведены первые
опыты по изучению патогенеза туберкулеза и открыт туберкулин,
сыгравший большую роль в изучении специфической туберкулез-
ной аллергии и клеточного иммунитета, сохраняющий диагности-
ческое значение до настоящего времени. С тех пор произошли зна-
чительные изменения в заболеваемости, ее структуре, течении и
прогнозе различных форм туберкулеза кожи. Предложены эффек-
тивные методы лечения, создана система борьбы с туберкулезом.
В связи с улучшением эпидемической ситуации по легочному
туберкулезу снизились эпидемиологические показатели внелегоч-
ного туберкулеза, в том числе кожи и подкожной клетчатки. Так,
в Российской Федерации за период с 1970 по 1980 г. заболевае-
мость всеми формами внелегочного туберкулеза снизилась на 50 %
[Петров И. Н., 1984], а в 1984 г. по сравнению с 1979 г. — на
26,8 % [Яковлева Т. К. и др., 1985]. Значительно уменьшилось
число детей, больных туберкулезом кожи [Литовченко О. В., Ша-
повал М. И., 1976]. Если ранее считалось общедоказанным, что
туберкулез кожи является главным образом болезнью дет-
ского возраста, то в настоящее время нередки случаи развития
туберкулеза кожи у взрослых и у пожилых лиц. Так, М. И. Шапо-
вал (1980) наблюдала возникновение колликвативного туберкулеза
в пожилом возрасте. К. Bork (1985) описал редкий вариант рас-
пространенной лихеноидной туберкулезной волчанки у 61-летней
пациентки без других проявлений туберкулеза, Р. Winnen (1981) —
развитие туберкулезной волчанки в 77-летнем возрасте с мно-
жественными высыпаниями на лице, шее, ушных раковинах, спине
и разгибательной поверхности плеч. Изменилось соотношение раз-
личных клинических форм туберкулеза кожи. В частности, в свя-
зи со значительным снижением заболеваемости волчаночным ту-
беркулезом кожи наблюдается некоторое преобладание диссемини-
рованных форм [Зеликман М. А., 1974; Шаповал М. И., 1980,
13* 355
и др.]. Туберкулез кожи стал протекать более благоприятно. СИ
этом может свидетельствовать, в частности, тот факт, что в по
следние годы практически не наблюдаются тяжелопротекающи<
формы туберкулеза, такие как уродующая (мутилирующая^
туберкулезная волчанка и скрофулодерма. Преобладает наибола
доброкачественная поверхностная (плоская) форма волчаночной
туберкулеза кожи [Зеликман М. А., 1978] Шаповал М. И., 1980]
Однако вышеуказанное вовсе не означает, что проблема туберкуле
за кожи успешно решена и утратила актуальность. О необходи
мости усиления мер борьбы с ним указывают в первую очеред
такие данные, как стабилизация удельного веса внелегочного ту
беркулеза среди контингентов, состоящих на учете в противо
туберкулезных диспансерах [Грунд В. Д. и др., 1985], замедлени<
темпов уменьшения контингентов больных туберкулезом лимфати
ческих узлов и кожи [Щерба Б. В. и др., 1985], а на некоторые
территориях и заболеваемости туберкулезом детей и подростке!
[Маслаускене Т. П., Никитина О. И., 1987]. Нередки рецидивь
или обострения туберкулеза кожи, особенно волчанки и диссеми
нированных форм [Зеликман М. А., 1984], что приводит к накоп
лению контингентов больных туберкулезом кожи. Важен вопрос (
раннем выявлении заболевания, так как у 57,1 % больных тубер-
кулезом кожи выявляются запущенные формы [Петров И. Н.
1984]. Данные о нередко запоздалой диагностике и значительно»
количестве диагностических ошибок подтверждает и наш опыт
Следовательно, требуется усиление мер профилактики, повышение
эффективности лечения и совершенствование диагностики тубер1
кулеза кожи. Последняя нередко затруднительна вследствие
патоморфоза болезни и развития ее атипичных форм, а также
вследствие ослабления внимания к этой проблеме в связи с не-
правильным представлением о большой редкости туберкулеза ко-
жи. Необходимость этих мер тем более важна в условиях расши-
ряющегося сотрудничества с развивающимися странами, в кото-
рых туберкулез встречается значительно чаще.
Этиология и патогенез. Возбудителем туберкулеза является ту?
беркулезная палочка, относящаяся к роду Mycobacterium. Тубер?
кулез кожи вызывается в основном туберкулезной палочкой чело?
веческого типа (Mycobacterium tuberculosis humanus). Значительно
реже возбудителем являются микобактерии бычьего вида (Myco-
bacterium tuberculosis bovinus). Обычно они имеют вид тонких,
прямых или слегка изогнутых гомогенных или зернистых пало-
чек длиной 1—4 мкм, шириной 0,2—0,6 мкм, со слегка закруглен-
ными и утолщенными концами. Туберкулезные палочки не обра-
зуют спор, неподвижны, грамположительны, устойчивы к кисло-
там, щелочам и спирту; по Цилю—Нильсену они окрашиваются
в красный цвет, не обесцвечиваются под действием кислот или
спирта. Характерной чертой палочек является значительный поли-
морфизм, что может выражаться в изменении их длины или
ширины, наличии кокковидных, фильтрующихся, а также L-форль
Туберкулезные палочки являются аэробами и отличаются медлен-
356
ным ростом. Они имеют сложный антигенный состав, чем в опре-
деленной мере объясняется многообразие реакций организма в от-
вет на внедрение возбудителя. При этом наряду с протеиновыми
и полисахаридными компонентами микобактерий антигенной ак-
тивностью обладают и фосфолипиды [Краснопольский Ю. М. и
др, 1985].
Туберкулез кожи развивается в связи с общим течением ту-
беркулезной инфекции в организме. Микобактерии попадают в
кожу чаще лимфогематогенно или per contituitatem, реже экзо-
генно.
Эндогенно обусловленный процесс в коже может возникать
не только вследствие диссеминации туберкулезных бацилл из оча-
гов во внутренних органах, преимущественно в легких, но и путем
заноса их в кожу в период первичного инфицирования организма,
как это показано при других формах внелегочного туберкулеза
[Ченских Е. П., 1986]. Наблюдается и экзогенная аутоиннокуля-
ция микобактериями, например при активных формах туберкулеза
легких, мочевыделительных органов. Резкость вовлечения кожи в
туберкулезный процесс может быть объяснена неблагоприятными
условиями в ней для роста и развития микобактерий [Членов М. А,
1900; Подвысоцкая О. Н, 1931, и др.], поэтому экзогенное зара-
жение возможно лишь при массивном инфицировании через пов-
режденную кожу.
Ведущая роль наряду с массивностью инфицирования и виру-
лентностью бактерий принадлежит состоянию иммунной реактив-
ности организма [Хоменко А. Г. и др., 1981; Заболотных Н. В,
Александрова А. Е., 1985; Никитина В. С, 1986, и др.]. Туберку-
лезное воспаление рассматривается как классический пример вос-
паления на иммунной основе, при котором наблюдается волно-
образное течение со сменой клеточных и ^моральных иммунных
механизмов соответственно фазам затухания и обострения про-
цесса [Струков А. И, 1982|. Наиболее изучены при туберкулезе
клеточные механизмы иммунитета, в первую очередь Т-система
иммунитета.
По данным М. П. Ельшанекой, В. В. Ерохина (1984), на са-
мых ранних этапах экспериментального туберкулеза происходит
расширение тимуезависимых зон селезенки и лимфоузлов за счет
инфильтрации лимфоцитами и развития бластреакции, наблюдает-
ся активация тимуса и усиленная миграция из него лимфоцитов.
Истончение тимуса при прогрессировании процесса приводит
к убыли лимфоцитов из тимуезависимых зон и снижению кле-
точного иммунитета. Показано [Александрова А. Е. и др., 1983,
и др.], что его подавление приводит к более тяжелому течению
туберкулезного процесса. С другой стороны, в эксперименте уда-
ется повысить сопротивляемость к инфекции путем переноса лим-
фоцитов от иммунизированных БЦЖ животных [Авербах М. М. и
др, 1974]. Э. Г. Исаева и Н. А. Лаптева (1984) наблюдали в про-
цессе развития туберкулезной инфекции фазовые изменения ак-
тивности различных субпопуляций Т-клеток. При этом кратковре-
357
менная стимуляция функции Т-хелперов во время первичного вос-
палительного процесса сменялась накоплением супрессорных кле-
ток в период генерализации инфекции. С функцией Т-системы
иммунитета тесно связаны и наиболее характерные для туберкуле-
за гиперчувствительность замедленного (туберкулинового) типа и
гранулематозная реакция. Показаны преобладание Т-клеток при
туберкулиновой пробе [Caudy A. L. et al., 1976], где соотношение
Т- и В-клеток составило 5:3, а также антигенпредставляющая
роль клеток Лангерганса, имеющих на поверхности трансплан-
тационные антигены HLA-DR [Braathen L. R., Thorsby Е.,
1980]. Эти клетки имеют существенное значение в афферентной
фазе клеточного иммунного ответа. Гранулематозное воспаление
развивается в условиях длительной персистенции провоцирующего
агента, стойкости раздражителя по отношению к фагоцитам
[Серов В. В., 1982; Струков А. И., 1982; Epstein W. L., 1983;
Hirch В. С., Johnson W. С., 1984]. Туберкулезная гранулема состо-
ит преимущественно из эпителиоидных клеток, а также лимфоцитов
с примесью гигантских клеток Пирогова—Лангханса и фибробла-
стов. В центре бугорка возникает обычно выраженный в разной сте-
пени казеозный некроз. Его появление свидетельстует о развитии
повышенной чувствительности замедленного типа [Adams D. О.,
1976]. Следует отметить, что повышенная чувствительность туберку-
линового типа и гранулематозное воспаление наблюдаются не на
всех этапах развития туберкулезного процесса и не при всех клини-
ческих формах туберкулеза кожи. Различна и степень позитивно-
сти туберкулиновых проб, значительна вариабельность структуры
гранулем. Так, в редких случаях, когда кожа является первичным
местом инфицирования, характер ответной реакции организма от-
личается от таковой при попадании в кожу бактерий из очагов
уже имевшейся в организме инфекции отрицательной туберкули-
новой пробой и незначительно выраженной гранулемой. Туберку-
линовые пробы часто отрицательны у ослабленных больных при
язвенном туберкулезе кожи и слизистых оболочек. Они могут не-
гативироваться при наличии у больных тяжелых сопутствующих
заболеваний (злокачественные лимфомы и др.), под влиянием мас-
сивной кортикостероидной терапии, а также с возрастом больных
при благоприятной эпидемической ситуации как отражение стери-
лизации организма от инфекции. Иногда отрицательные тубер-
кулиновые пробы наблюдаются при диссеминированных формах
туберкулеза кожи [Рудченко Ю. А., 1976], которые, как известно,
протекают на фоне повышенной чувствительности к микобакте-
риям. Особенностью современного течения туберкулеза кожи яв-
ляется снижение чувствительности к туберкулину. Специфический
бугорковый инфильтрат наиболее характерен для туберкулезной
волчанки. При других же формах обычно наблюдаются туберкуло-
идные структуры в ассоциации с различной степенью выраженнос-
ти неспецифической воспалительной реакции. На ранней стадии
развития воспалительной реакции в коже на месте внедрения ми-
кобактерий преобладают неспецифические явления экссудации и
358
альтерации; в инфильтратах доминируют полинуклеары, обна-
руживаются многочисленные микобактерии, а лимфоцитов мало.
Если фагоцитарный ответ недостаточен для разрушения бактерий
(много бацилл, высока их вирулентность, ослаблена реактивность
организма и др.), постепенно характер клеточной реакции меня-
ется и наступает пролиферативная фаза воспаления с развитием
гранулематоза, формированием казеозного некроза. В этот период
микобактерии встречаются редко, становится положительной ту-
беркулиновая проба.
Туберкулезные микобактерии наряду с клеточно-опосредован-
ным иммунитетом индуцируют и антителообразование [Авер-
бах М. М., 1976]. Однако роль гуморального иммунитета в фор-
мировании резистентности к туберкулезу пока неясна.
Недостаточно изучены и факторы, определяющие ту или иную
локализацию внелегочного туберкулеза. Имеются как эксперимен-
тальные [Беллендир Э. Н., 1986], так и клинические [Янев Я. А.,
1981] данные о роли микроциркуляторных нарушений в развитии
и течении туберкулезных поражений кожи. Не исключено, что
каждая из форм заболевания может также контролироваться гене-
тическими факторами, способствующими на фоне предрасполо-
женности к туберкулезу развитию конкретной его локализации,
например в коже. О наличии предрасположенности к туберкулезу
свидетельствуют наряду с характером распределения больных в
семьях результаты типирования HLA-системы [Чуканова В. П. и
др., 1981; Довгалюк И. Ф., Моисеева Л. М., 1985].
Имеется достаточно доказательств неблагоприятной роли ряда
провоцирующих факторов в возникновении туберкулеза, таких
как снижение неспецифической резистентности организма, острые
инфекции, травмы, функциональные нарушения нервной системы,
эндокринные расстройства, в первую очередь сахарный диабет, не-
достаточное питание, гиповитаминозы, беременность, кортикосте-
роидная и цитостатическая терапия [Россиянский Н. Л., Сме-
лов Н. С., 1947; Агапкин И. Н„ Багаева М. И., 1959; Машкил-
лейсон Л. Н., 1960; Нерадов Л. А., 1961; Вейнеров И. Б., 1963, и
др.]. О роли нарушений холестеринового, минерального и водного
обмена в патогенезе кожного туберкулеза свидетельствуют иссле-
дования С. Я. Капланского (1937), Н. Л. Россиянского (1951),
В. В. Захарова (1955) и других авторов.
Имеются данные о большом значении аллергического компо-
нента в возникновении рассеянных форм туберкулеза кожи. Так,
О. В. Литовченко, И. П. Соловьева (1972) показали, что в основе
их морфогенеза лежит изменение сосудов (васкулиты). При па-
раллельном изучении аллергии к стрептококку, стафилококку и
туберкулину in vitro у больных туберкулезом кожи и при нетубер-
кулезных дерматозах М. И. Шаповал (1980) установлено наличие
у них поливалентной аллергии. Достоверных различий в частоте
и степени выраженности аллергии к стафилококку и стрептококку
в этих группах не наблюдалось. В то же время аллергия к тубер-
кулину у больных туберкулезом кожи была в 2,9 раза чаще, чем
359
при нетуберкулезных дерматозах. У больных, обратившихся по
поводу рецидивов туберкулеза, аллергия одновременно к стрепто-
кокку и стафилококку, а также побочные реакции на противо-
туберкулезные препараты встречались в полтора раза чаще, чем
при свежих формах процесса. У подавляющего большинства боль-
ных туберкулезом кожи уровни в крови биогенных аминов — гист-
амина и серотонина — были значительно выше нормы. При
уплотненной эритеме высокое содержание в крови гистамина наб-
людалось у 84 % больных, серотонина — у 79 % и у 89,5 % значи-
тельно снижена способность белков крови связывать гистамин.
При повышенном содержании в крови больных уплотненной эри-
темой гистамина процесс протекал подостро, чаще наблюдались
побочные реакции на противотуберкулезные препараты. Резуль-
таты сопоставлений клинических особенностей уплотненной эрите-
мы с уровнем гистаминопексии свидетельствовали о том, что
аллергические реакции в процессе лечения возникали только у боль-
ных с пониженным или нулевым значением индекса гистаминопек-
сии, равно как и подостро протекающие и изъязвляющиеся фор-
мы. Увеличение в крови серотонина сопутствовало торпидному
течению процесса с выраженным формированием фиброза в оча-
гах поражения. При этом рецидивы заболевания возникали даже
на фоне полноценного противотуберкулезного лечения. Обращает
на себя внимание большая частота изъязвлений у больных уплот-
ненной эритемой с повышенным содержанием в крови серотонина,
чем у больных с высоким уровнем гистамина, что согласуется
с морфологическими проявлениями (продуктивный васкулит).
Вышеизложенное показывает, что патогенез туберкулеза кожи
сложен и во многом еще неясен. Это обстоятельство, а также
многообразие клинических форм туберкулеза кожи, большая ва-
риабельность его гистоморфологических проявлений затрудняют
создание общепринятой классификации туберкулеза как в нашей
стране, так и за рубежом. Основным отличием зарубежных клас-
сификаций является разделение туберкулеза кожи на истинный
туберкулез и туберкулиды, как это было предложено Ж. Дарье
в 1896 г. Так, F. Ehring (1974) к истинному туберкулезу кожи
относит первичный комплекс, туберкулезную волчанку, веррукоз-
ный, острый милиарный, язвенный туберкулез кожи и слизистых
оболочек, а также первичный и вторичный колликвативный ту-
беркулез и нежелательные последствия прививки вакциной БЦЖ.
При большинстве туберкулидов, по мнению автора, туберкулез —
только одна из возможных причин. Это относится к лишаю золо-
тушных, папулонекротическому туберкулиду, узловатой и индура-
тивной эритеме. Сходной является одна из классификаций О. Bra-
un-Falco и соавт. (1977). В группе заболеваний, ранее ошибочно
относимых к туберкулезным, авторы приводят туберкулридную
форму розацеа, кольцевидную гранулему, красную волчанку и
саркоидоз. Lupus miliaris disseminatus рассматривается как аллер-
гическая реакция замедленного типа, вариант розацеа или пери-
оральный дерматит [Lever W. F., Schaumburg-Lever G., 1983].
360
Однако подобная точка зрения разделяется не всеми зарубежными
дерматологами. Так, L. V. do Nacsimento и соавт. (1983) относят
индуративную эритему Bazin к истинному туберкулезу кожи. На
туберкулезную природу рассеянных форм указывал М. Bolgert
(1973). По мнению К. Mihara, М. Isoda (1986), милиарная диссе-
минированная волчанка лица вызвана неизвестным инфекционным
агентом и связана с нарушениями клеточного иммунитета. D. К. Go-
ette и соавт. (1978) считают ее туберкулидом. Отечественные дер-
матологи считают несомненной туберкулезную природу диссеми-
нированных форм, так как причиной возникновения очагов тубер-
кулеза в коже могут быть не только сами микобактерии, но и про-
дукты их распада [Бременер М. М., 1937; Машкиллейсон Л. Н.,
1960; Нерадов Л. А., 1961].
Классификация. Ряд классификаций туберкулеза кожи был
предложен в нашей стране. Так, М. М. Бременер (1937) разработал
классификацию, основанную на связи клинических проявлений за-
болевания с общим течением туберкулезной инфекции организма.
В ней нашли отражение состояние реактивности организма (имму-
нитет, аллергия), стадийность течения туберкулеза (первичная,
вторичная стадия), особенности морфологии.
О. В. Литовченко (1955) при изучении цитологической картины
пунктата лимфатических узлов у 247 больных туберкулезом кожи
обнаружила казеозный некроз при колликвативном, папулонекро-
тическом и индуративном туберкулезе кожи. При туберкулезной
волчанке и бородавчатом туберкулезе кожи в цитологических пре-
паратах наблюдались скопления эпителиоидных клеток. На этом
основании автор высказал предположение о том, что колликватив-
ный туберкулез и рассеянные формы туберкулеза кожи представ-
ляют собой проявления хронически текущего первичного туберкуле-
за, а туберкулезная волчанка возникает на фоне вторичного ту-
беркулеза. С этим не полностью согласны И. Н. Агапкина, М. И. Ба-
гаева (1959). Они указывали: «нельзя категорически утверждать,
что скрофулодерма и диссеминированная форма туберкулеза
кожи не могут развиваться во вторичном, или, вернее, в послепервич-
ном периоде, а волчанка — в периоде хронически текущего первич-
ного туберкулеза». В качестве подтверждения данного положения
авторы привели мнение А. И. Струкова (1948) о трудности разгра-
ничения первичного и вторичного периодов туберкулезной инфек-
ции. Это же в полной мере может быть отнесено и к классификации,
предложенной И. И. Юкелисом (1955).
На трудность точного разделения различных форм туберкулеза
кожи указывала О. Н. Подвысоцкая (1931). По ее мнению, «в жизни
существует много переходных типов, и поэтому всякое ограничение
представляется искусственным».
На основании данных о путях инфицирования и распростране-
ния туберкулезной инфекции, состояния иммунитета и аллергии,
периода болезни мы попытались разделить все формы туберкулеза
кожи на 2 группы, сознавая, однако, условность этого деления.
I. Туберкулез кожи, развившийся у ранее не инфицированных
361
лиц: первичный аффект (первичный комплекс); милиарный тубер-
кулез; колликвативный туберкулез (первичная, гематогенная
скрофулодерма); первичный аффект на месте прививки БЦЖ.
Первичный аффект (комплекс) — результат экзогенного инфи-
цирования. В редких случаях может быть следствием суперинфек-
ции. Вначале туберкулиновые пробы отрицательны. Резистент-
ность вариабельна. Милиарный и колликвативный туберкулез ко-
жи развивается при гематогенном рассеивании микобактерий.
Могут возникать иногда во вторичном периоде туберкулеза при
реактивации заживших очагов и резком снижении иммунитета.
Туберкулиновые пробы чаще отрицательны. Резистентность низ-
кая. Туберкулезные бациллы обнаруживаются.
II. Туберкулез кожи, развившийся у ранее инфицированных
больных. 1. Преимущественно локальные формы: туберкулезная
волчанка; бородавчатый туберкулез; скрофулодерма (вторичная
по отношению к туберкулезу лимфатических узлов и реже других
подлежащих тканей); язвенный (периорифициальный) туберкулез.
2. Преимущественно диссеминированные формы: папулонекроти-
ческий туберкулез; лишай золотушных; эритема уплотненная; вол-
чанка милиарная диссеминированная лица.
Туберкулезная волчанка чаще развивается во вторичном пе-
риоде туберкулеза. При этом туберкулиновые пробы положитель-
ны, резистентность вполне удовлетворительная. Скрофулодерма
может возникнуть как в первичном, так, реже, и во вторичном
периоде. Туберкулиновые пробы при этой форме туберкулеза поло-
жительные, резистентность вариабельна. Бородавчатый туберкулез
кожи является экзогенным, как и язвенный (периорифициаль-
ный), но последний есть следствие аутоинокуляции, что при боро-
давчатом туберкулезе встречается реже. Туберкулиновые пробы
при бородавчатом туберкулезе положительны, общая резистент-
ность хорошая, при язвенном — сопротивляемость плохая, тубер-
кулиновые пробы вначале чаще отрицательны. Туберкулезные ба-
циллы обнаруживаются.
Рассеянные формы туберкулеза возникают чаще в первичном
периоде за счет гематогенной диссеминации небольшого количест-
ва бацилл при общей хорошей сопротивляемости организма, сен-
сибилизированного микобактериями. Кожные пробы положитель-
ны, сопротивляемость хорошая. Туберкулезные бациллы могут
быть обнаружены при индуративной эритеме, в редких случаях —
при папулонекротическом туберкулезе.
ТУБЕРКУЛЕЗ КОЖИ ПЕРВИЧНЫЙ
(TUBERCULOSIS CUTIS PRIMARIA)
Син.: туберкулезный шанкр
Очень редко встречающаяся форма туберкулеза кожи, возни-
кает обычно у ранее не инфицированных. Болеют преимущест-
венно дети, но не исключено развитие заболевания и у взрослых, в
362
том числе как следствие суперинфекции [Аравийский А. А.,
1928]. Непременным условием, помимо вирулентности микобак-
терий и их количества, является наличие травмы, пусть даже
незначительной (бытовая травма, кошачьи царапины, укусы насе-
комых, уколы острыми предметами или плохо стерилизованными
иглами, прокалывание ушных мочек, ритуальная процедура обреза-
ния и др.). Входными воротами инфекции могут служить дефекты
кожи, вызванные кожными заболеваниями, чаще пиококковыми.
Наиболее часто очаг поражения располагается на открытых участ-
ках кожи (конечности, лицо). Возможна локализация в полости
рта, на конъюнктиве, а также на половых органах [Kalkoff К. W.,
1971]. Заражение происходит при прямом контакте с инфициро-
ванным материалом (мокрота, слюна) от больных активным ту-
беркулезом.
Клиника. В типичных случаях в среднем через 3 нед в
месте проникновения микобактерий появляется красновато-корич-
неватая папула плотноватой консистенции, превращающаяся в по-
верхностную безболезненную язву, чаще всего сходную с пиокок-
ковой, но без свойственных пиодермии острых воспалительных
явлений по периферии. Доминирует ливидная окраска. Размеры
язвы обычно не превышают 1 '/<—2 см. Дно ее покрыто гнойным
отделяемым, зернистое, иногда папилломатозно-веррукозное.
Края обычно мягкие, подрытые, но может возникать сплошное
или краевое уплотнение, что придает очагу шанкриформный или
эпителиомоподобный характер. В случаях глубокого проникновения
бактерий возникает узловатый инфильтрат в подкожной клетчатке,
который, расплавляясь, приобретает черты скрофулодермы. Через
2—4 нед от момента появления язвы возникает лимфангит и ре-
гионарный лимфаденит: первичный туберкулезный комплекс. Лим-
фатические узлы безболезненны, вначале плотные, изолированные,
подвижные, затем спаиваются между собой и с кожей, размяг-
чаются и часто вскрываются с образованием язвы, сходной с та-
ковой при скрофулодерме. Вокруг первичного язвенно-некротиче-
ского дефекта иногда появляются люпомы и процесс может транс-
формироваться в волчанку. Через несколько недель или месяцев
наступает заживание язвы с образованием рубца, на котором не
исключено впоследствии развитие бугорков, обызвествление лим-
фатических узлов (в сроки от нескольких месяцев до 1—2 лет и
более) или генерализация инфекции с развитием диссеминиро-
ванных форм — па пуло некротического или милиарного туберкулеза
кожи.
От приведенного течения туберкулеза могут быть различные
отклонения. При попадании в кожу небольшого количества ос-
лабленных микобактерий у больных с хорошей фагоцитарной и
гранулематозной реакцией возбудитель может быть надежно от-
граничен, и процесс может закончиться на стадии первичного
аффекта. Однако быстрое заживление язвенного поражения и от-
сутствие лимфаденита не обязательно свидетельствуют только о
локальном процессе. Прогрессирование заболевания и генерализа-
363
ция инфекции могут наступить и без клинически определяемой
реакции лимфатических узлов. Одним из параспецифических при-
знаков может быть возникновение узловатой эритемы, особенно в
случае расположения входных ворот инфекции в полости рта,
когда первичный аффект может быть столь эфемерным, что не
распознается. Этому в немалой степени способствует и отсутствие
субъективных расстройств. В подобных случаях на развитие спе-
цифического процесса указывает лишь регионарный лимфаденит.
Поэтому появление лимфаденита у маленьких детей всегда подо-
зрительно на туберкулез. Первичный аффект может проявляться в
виде одностороннего увеличения миндалин. На пальцах он может
быть сходным с паронихией. При локализации на конъюнктиве
возникают более выраженные воспалительные изменения, чем на
коже.
Гистопатология. Гистологически на ранней стадии изме-
нения неспецифичны, доминирует островоспалительная инфиль-
трация, деструкция. Многочисленны микобактерии. Постепенно
реакция меняется на типичную гранулематозную. Количество бак-
терий резко уменьшается. Иногда они обнаруживаются только
при прививке материала морским свинкам. Отрицательные вначале
туберкулиновые пробы становятся в дальнейшем положительными.
Прогноз первичного туберкулезного комплекса такой же, как
в случае такового в легких. Развитие его может сопровождаться
субфебрильной температурой. Не исключена реактивация процесса
в обызвествленных лимфатических узлах под влиянием неспеци-
фических воздействий, ослабляющих иммунитет, или суперинфек-
ций. На месте прививки БЦЖ могут возникать сходные измене-
ния, напоминающие туберкулезную волчанку, иногда сопровож-
дающиеся поражением регионарных лимфатических узлов по типу
скрофулодермы.
ТУБЕРКУЛЕЗ КОЖИ ОСТРЫЙ МИЛИАРНЫЙ
(TUBERCULOSIS CUTIS MILIARIS ACUTA DISSEMINATA)
Очень редко встречающаяся форма, возникающая на фоне об-
щего тяжелопротекающего диссеминированного милиарного ту-
беркулеза вследствие гематогенного распространения большого
количества микобактерий.
Клиника. Кожные изменения полиморфны: остро или под-
остро развивающиеся, симметрично располагающиеся, рассеянные
на туловище и конечностях, мелкие пятнисто-папулезные высы-
пания, красновато-буроватого или синюшного цвета, пустулезные,
везикулезные, геморрагические элементы, нодулярные образова-
ния, в том числе подкожные, гуммоподобные. Часть высыпных
элементов, запавшая в центре, эрозирована, покрыта геморрагиче-
скими корочками, что придает высыпаниям некоторое сходство с
папулонекротическим туберкулезом. Могут возникать язвенно-не-
кротические поражения, в том числе симметричная перифериче-
ская гангрена стоп, вероятно, за счет эмболии мелких артериол
364
туберкулезными бациллами [Itin et al., 1986]. Возможно пораже-
ние слизистых. Могут наблюдаться хронические язвенные и ин-
фильтративно-атрофические проявления [Bateman D. Е. et al.,
1980]. Туберкулиновые пробы отрицательны. Эта форма туберку-
леза возникает, как правило, у ослабленных детей раннего воз-
раста. Высыпания могут быть спровоцированы острыми детскими
инфекциями. У взрослых они встречаются редко.
Гистопатология. Гистологически обнаруживается карти-
на неспецифического воспаления с деструкцией. Бугорки отсутст-
вуют или появляются в поздней стадии; они единичны и выявля-
ются в основном по краю очагов. Отмечается большое количество
бацилл.
Прогноз определяется течением общего туберкулеза, но без ле-
чения он плохой, так как у больных постоянно наблюдается быст-
ропрогрессирующий туберкулез легких и других органов [Ка1-
koff К. W., 1980, и др.]. Более благоприятно протекают хрониче-
ские формы. При этом из поверхностных высыпаний может фор-
мироваться рассеянная туберкулезная волчанка, а из глубоких —
скрофулодерма.
ТУБЕРКУЛЕЗ КОЖИ КОЛЛИКВАТИВНЫЙ
(TUBERCULOSIS CUTIS COLLIOUATIYA)
Син.: первичная скрофулодерма
Развивается вследствие гематогенной диссеминации микобак-
терий из первичного очага при сниженной сопротивляемости
организма. В отличие от вторичной скрофулодермы здесь нет свя-
зи с туберкулезом лимфатических узлов. Однако могут наблюдать-
ся смешанные формы.
Клиника. Клинически эта форма туберкулеза характери-
зуется появлением в подкожной клетчатке, преимущественно в
области конечностей, небольших узлов округлой или овальной
формы. Узлы подвижны, плотноваты, безболезненны. Постепенно
они увеличиваются в размерах, выявляются не только при пальпа-
ции, но и на глаз, становятся спаянными с окружающими тканями.
Покрывающая их кожа вначале не изменена, затем приобретает
синюшно-красную окраску. Узлы вскрываются с образованием
торпидных, вялогранулирующих язв, неправильных очертаний, не-
редко с фистулезными ходами и глубокими подрытыми краями.
Отделяемое язв серозно-геморрагическое, иногда крошковатое за
счет некротических масс. Течение хроническое. Заживление мед-
ленное, с образованием неровных бахромчатых, звездчатых руб-
цов.
Развивается преимущественно у ослабленных детей с низкой
сопротивляемостью. Туберкулиновые пробы обычно отрицательны,
особенно в начале заболевания. Сходные изменения иногда на-
блюдаются у взрослых, страдающих диссеминированным тубер-
кулезом, причем наряду с глубокими очагами могут обнаружи-
365
ваться и более поверхностные изменения, напоминающие прояв-
ления туберкулезной волчанки [Hammer G., 1981]. Могут возни-
кать очаги, сходные с хронической вегетирующей пиодермией
(tuberculosis cutis fungosa). М. И. Шаповал (1980) наблюдала воз-
никновение гематогенной скрофулодермы у 2 больных, длительно
получавших кортикостероиды по поводу системной красной вол-
чанки и саркоидоза без одновременного применения противоту-
беркулезных препаратов.
Гистопатология. Гистологически наряду с неспецифи-
ческими воспалительными. изменениями в более глубоких отделах
кожи имеется туберкулоидная гранулематозная реакция. Микобак-
терии обнаруживаются. Имеется склонность к самопроизвольному
рубцеванию, но прогноз зависит от течения общей инфекции.
Может наблюдаться развитие туберкулезной волчанки.
ВОЛЧАНКА ТУБЕРКУЛЕЗНАЯ (LUPUS VULGARIS)
Син.: туберкулез кожи люпоидный
Туберкулезная волчанка является одной из наиболее часто
встречающихся форм туберкулеза кожи [Агапкин И. Н., Багае-
ва М. И., 1959; Рахманов В. А., 1966; Нерадов Л. А., 1961]. Воз-
будитель попадает в кожу преимущественно лимфо- или гемато-
генно из других очагов туберкулезной инфекции в организме
(легкие, лимфатические узлы и др.). По данным F. Ehring и
Н. Liicke (1969), у 38 % больных были обнаружены микобактерии
бычьего типа. О. В. Литовченко (1955) выявила увеличение пери-
ферических лимфатических узлов у 97 % больных. М. И. Шапо-
вал (1980) при рентгенотомографическом обследовании выявила
у 17 % больных туберкулезной волчанкой следы перенесенного
туберкулеза легких (кальцинаты в лимфатических узлах средо-
стения и легких, плевральные сращения и др.). По данным О. Н. Под-
высоцкой (1931), в среднем в 30 % случаев обнаруживались из-
менения костей и суставов. По данным Э. Н. Беллиндера и соавт.
(1979), первоначальные изменения развиваются в субпапиллярных
кровеносных сосудах дермы. Эта локализация связана с особен-
ностями строения микроциркуляторного русла, обусловливающими
проникновение микобактерий в ткани поверхностных слоев кожи.
S. Immamura и соавт. (1982) обнаружили циркулирующие иммун-
ные комплексы, отложение иммуноглобулинов и комплемента в
дермо-эпидермальной зоне, значение которых не определено.
Не исключена роль вегетативных, эндокринных нарушений, учиты-
вая несколько более частое развитие заболевания у женщин.
Клиника. Первичным элементом является бугорок (люпо-
ма). Вначале бугорки малозаметны, имеют вид желтовато-красных
или красновато-коричневых пятен, округлых очертаний, величиной
2—5 мм, резко очерченных, как бы заложенных в дерме. Мед-
ленно увеличиваясь, они становятся более заметными. Характер-
ным признаком является мягкая консистенция, выявляемая при
366
надавливании пуговчатым зондом, который легко разрывает бу-
горок, как бы проваливаясь в него (симптом «зонда» А. И. Поспе-
лова), вызывая болезненность и кровоточивость. При диаскопии
люпом меняется цвет их на желтовато-буроватый (феномен «яб-
лочного желе»). Особенности роста и распространения люпом,
наличие или отсутствие изъязвления, степень инфильтрации кожи,
характер поверхности определяют то многообразие клинических
проявлений, которое считается характерным для люпозного ту-
беркулеза кожи [Дарье Ж., 1930; Подвысоцкая О. Н., 1931; Бре-
менер М. М., 1937; Нерадов Л. А., 1961].
Плоская волчанка является наиболее частой формой
туберкулезной (обычной) волчанки. Так, у 15 из 18 больных,
леченных И. Н. Агапкиным (1975), была плоская волчанка, у 2 —
опухолевидная, у одного — язвенная. Плоская волчанка возникает
за счет слияния бугорков в сплошные очаги различных очертаний
и величины (иногда значительных размеров), что приводит к воз-
никновению диффузных очагов поражения (рис. 83, 84). Вокруг
основного очага, более крупного, могут возникать множественные
мелкие (lupus vulgaris corymbiformis). Поверхность очага пора-
жения обычно гладкая, шелушение отсутствует или небольшое,
лишь в редких случаях оно сильное, отрубевидное или мелкоплас-
тинчатое (рис. 85, 86). Иногда появляются бородавчатые, папил-
ломатозные, вегетирующие разрастания, напоминающие (осо-
бенно при локализации на конечностях) бородавчатый туберкулез
кожи [Brown F. S. et al., 1982]. При резко выраженном гипер-
кератозе ороговение может быть столь значительным, что очаг
становится сходным с кожным рогом. Во всех случаях необходимо
тщательное наблюдение, так как это может быть признаком зло-
качественного перерождения. Довольно часто наблюдается изъяз-
вление, особенно при травматизации, с возникновением поверх-
ностных язвочек с мягкими краями, зернистым легко кровоточа-
щим дном, окруженных ободком инфильтрата, в зоне которого
отчетливо выявляются бугорки. Иногда выражены явления экс-
судации, особенно при вторичном инфицировании. В этих случаях
воспалительные явления становятся более выраженными, очаг
покрывается корками. Может развиться рожистое воспаление,
при рецидивах приводящее ко вторичному элефантиазу, что чаще
наблюдается на ногах и в области верхней губы. По данным
А. А. Штейна (1935), наиболее часто рожистое воспаление на-
блюдалось при плоской и изъязвленной туберкулезной волчанке.
Язвенные формы туберкулезной волчанки обыч-
но встречаются на слизистых оболочках или на участках кожи,
граничащих с ними. При склонности к распространению процесса
очаги поражения могут расти по периферии, сливаться между со-
бой, образуя серпигинирующие участки, в центре которых может
наступить регресс элементов. В особенно неблагоприятных слу-
чаях патологический процесс развивается вглубь, вызывая обшир-
ные и глубокие разрушения подкожной клетчатки, хрящевой час-
ти носа, ушей, отторжение фаланг пальцев. Особой формой яз-
367
Рис, 83. Инфильтра-
тивная туберкулез-
ная волчанка.
Рис. 84. Инфильтра-
тивная туберкулез-
ная волчанка, напо-
минающая красную
волчанку.
368
Рис. 85. Псориази-
формная туберку-
лезная волчанка.
Рис. 86. Инфильтра-
тивно-сквамозная
туберкулезная вол-
чанка.
369
Рис. 87. Тумидная туберкулезная волчанка.
венной волчанки является ранняя инфильтративная волчанка
[Подвысоцкая О. Н., Каплан Я. Б., 1935], которая протекает с
развитием воспалительной инфильтрации в области кончика носа,
а также хрящевой его части. Характеризуется увеличением носа
в размерах, а затем быстрым распадом ткани с формированием
обезображивающих рубцов. Реже поражение встречается на губах,
щеках, на мягком небе и других участках. В редких случаях осо-
бенностью туберкулезной волчанки является вертикальный рост с
развитием инфильтративных, гипертрофических очагов, значитель-
но возвышающихся над кожей (рис. 87). Наряду с небольшими
опухолевидными образованиями, чаще расположенными на кончи-
ке носа, ушной раковине, нередко в сочетании с элементами плос-
кой волчанки на других участках кожи [Агапкин И. Н., Багае-
ва М. И., 1958], могут быть большие очаги, возникшие в резуль-
тате слияния крупных (1—2 см) туберкулезных элементов [Kauf-
mann I., Kurz К., 1985]. К редким вариантам относится эрите-
матозоподобная волчанка, возникающая вследствие сли-
яния мелких поверхностных эритематозных элементов, покрытых
370
плотно прилегающими беловатыми чешуйками, что придает им
сходство с таковыми при красной волчанке, особенно если очаг
располагается в виде «бабочки». В. Hook и соавт. (1982) выде-
ляют саркоидоподобную волчанку, клинически прояв-
ляющуюся инфильтративными эритематозными очагами из слив-
шихся мелких элементов величиной с булавочную головку.
Обычно имеются один или немного очагов, за исключением
диссеминированных вариантов, когда могут наблюдаться атипич-
ные рассеянные папулезные, лихеноидные мелкоузловатые и ин-
фильтративные высыпания [Bork К., 1985]. Иногда диссеминиро-
ванные узелковые высыпания развиваются после острых детских
инфекций (lupus vulgaris postexanthematicus).
В большинстве случаев туберкулезная волчанка возникает
в детском или юношеском возрасте, чаще у лиц женского пола.
Провоцировать развитие заболевания могут острые детские ин-
фекции. Особенностями современного течения волчанки являются
малая выраженность клинических проявлений, что приводит к
позднему ее выявлению (по данным М. И. Шаповал (1980), у
44,8 % больных через 5 лет и более), развитие заболевания у
взрослых и частое поражение слизистой оболочки носа (нередко
с разрушением хрящевой части носовой перегородки с деформа-
цией кончика носа) и полости рта. По данным И. Г. Лукомского
(1945), Б. М. Пашкова и соавт. (1970), очаги туберкулезной вол-
чанки в полости рта локализуются преимущественно на деснах,
твердом и мягком небе, затем на губах, щеках, языке и язычке.
Встречаются изолированные поражения верхних дыхательных
путей и полости рта (Агапкин И. Н., Багаева М. И., 1959]. В про-
цесс может вовлекаться конъюнктива. По данным И. Б. Вейнеро-
ва (1963), при туберкулезной волчанке кожи часто наблюдается
поражение ушей, сопровождающееся гнойными и катаральными
отитами и рубцеванием барабанной перепонки. У 7 из 16 больных
туберкулезной волчанкой наружного уха, наблюдавшихся А. М. Оль-
ховским (1975), первичные высыпания возникли на ушной рако-
вине. К современным особенностям туберкулезной волчанки от-
носится отсутствие избирательной локализации на лице. Не так уж
редко встречаются обширные очаги поражения на закрытых участ-
ках тела, особенно на ягодицах.
Течение волчаночного туберкулеза кожи торпидное, много-
летнее. Ухудшение наблюдается зимой. На месте разрешившихся
очагов остается рубцовая атрофия, по внешнему виду напоминаю-
щая папиросную бумагу, иногда келоидоподобные или склероти-
ческие рубцы [Шаповал М. И., 1980]. В зоне рубцовых изменений,
а также вокруг них характерно появление люпом. Общее состоя-
ние больных, как правило, не страдает, чем, видимо, и объясняет-
ся то обстоятельство, что больные иногда десятилетиями не об-
ращают внимание на изменения кожи, особенно на закрытых
участках тела. У части больных (4,1 %, по данным В. А. Рахма-
нова и др., 1966) туберкулезная волчанка сочетается с другими
формами туберкулеза кожи.
371
Наиболее тяжелым осложнением туберкулезной волчанки, раз-
вивающимся в большинстве случаев в результате нерациональ-
ного лечения (особенно лучевого), является lupus-carcino-
m а, которая протекает более тяжело, чем обычный плоскокле-
точный рак [Агапкин И. Н., Багаева М. И., 1959]. В. А. Рахманов
и соавт. (1966) наблюдали развитие люпус-карциномы у 1,9 %
больных туберкулезной волчанкой. Ни один из них не получал
лучевой терапии, но все больные длительно работали на открытом
воздухе, многократно лечились раздражающими средствами
и УФО. По данным О. В. Санталовой (1960), рак развился у 1 %
больных, лечившихся в Ленинградском люпозории за период с
1947 по 1958 г., чаще на фоне язвенной или изъязвившейся
плоской волчанки. М. А. Зеликман (1978) наблюдал развитие
люпус-карциномы у 12,5 % больных туберкулезной волчанкой, не-
сколько чаще у мужчин, преимущественно в возрасте 50—70 лет
с давностью процесса свыше 10 лет.
Гистологически обнаруживаются бугорки из эпи-
телиоидных клеток с казеозным некрозом в центре, окруженные
лимфоцитами, гигантскими клетками Лангханса. Могут выявлять-
ся туберкулезные палочки.
Туберкулиновые пробы положительны. Прогноз для выздоров-
ления благоприятный. У ряда больных имеется склонность к само-
произвольному разрешению очагов поражения, особенно при ло-
кализации их на туловище, а также регрессированию у детей пост-
экзантематических сыпей.
ТУБЕРКУЛЕЗ КОЖИ БОРОДАВЧАТЫЙ
(TUBERCULOSIS CUTIS VERRUCOSA)
Развивается в результате суперинфекции, при попадании ту-
беркулезных бацилл в кожу ранее инфицированных людей из экзо-
генного источника, реже — как следствие аутоинокуляции. Пре-
имущественно заражаются ветеринарные врачи, прозекторы, ли-
ца, ухаживающие за больными животными, мясники. Болеют
преимущественно мужчины, но могут инфицироваться и дети
[Schmidt Р. W., 1941]. Заболевание чаще вызывается микобакте-
риями бычьего типа.
Клиника. Клиническая картина характеризуется появле-
нием мелких безболезненных веррукозных элементов, серовато-
красного цвета, окруженных узкой воспалительной каймой, сли-
вающихся в очаги округлых или полициклических очертаний, по-
крытых тонкими чешуйками. Нередко высыпания сливаются в
сплошной бородавчатый, иногда папилломатозный, очаг пораже-
ния, резко отграниченный от неизмененной кожи, коричневато-
красноватого цвета,. с трещинами, бороздками, роговыми насло-
ениями в центре, гладким периферическим инфильтрированным
синюшно-красным валом и венчиком синюшной эритемы на грани-
це со здоровой кожей. При надавливании в центральной части
выделяются капельки гноя, в котором могут быть обнаружены
372
микобактерии. Консистенция чаще плотноватая. В дальнейшем
наступает регрессирование процесса в центре и развитие белого
или неравномерно пигментированного атрофического рубца. Счи-
тается, что в отличие от волчанки рецидивы в зоне рубца не на-
ступают. Ж. Дарье (1930) наблюдал на рубце волчаночные бу-
горки. Изредка может наблюдаться регионарный лимфаденит, ча-
ще при выраженных экссудативных проявлениях, обычно обус-
ловленных вторичным инфицированием.
Клинической разновидностью бородавчатого туберкулеза явля-
ется так называемый бугорок анатомов, представляющий
собой обычно профессиональное заболевание, располагающийся на
тыле кистей. Редко встречаются келоидоподобные, склеротические,
деструктивные, вегетирующие (фунгозные) формы, а также очаги,
сходные с веррукозной туберкулезной волчанкой. Бородавчатый
туберкулез кожи наиболее часто располагается на открытых
участках тела, но в восточных странах преимущественной ло-
кализацией является кожа коленных суставов, бедер и ягодиц
[Wong К. О. et al., 1968]. Как следствие аутоинокуляции боро-
давчатый туберкулез может развиться перианально (нередко в ви-
де язвенно-вегетирующих изменений), per contituitatem — из по-
раженных туберкулезом суставов и костей.
Гистопатология. Гистологически обнаруживается гипер-
кератоз, папилломатоз, в дерме сочетание воспалительной и гра-
нулематозной реакции. Типичные бугорки наблюдаются редко.
Микобактерии обнаруживаются с трудом.
Общее состояние больных обычно не нарушается; субъектив-
ные расстройства отсутствуют; туберкулиновые пробы положи-
тельные. Часто у больных бородавчатым туберкулезом обнару-
живается туберкулез других органов, в первую очередь легких
[Агапкин И. Н., Багаева М. И., 1959]. Течение заболевания
хроническое с очень медленным распространением процесса.
Прогноз благоприятный. Это наиболее доброкачественная форма
туберкулеза кожи, хорошо поддающаяся лечению. В редких слу-
чаях возможна злокачественная трансформация [Карповская О. Г.,
1971].
СКРОФУЛОДЕРМА (SCROFULODERMA)
В отличие от гематогенного колликвативного туберкулеза скро-
фулодерма возникает вторично из пораженных туберкулезом лим-
фатических узлов или реже других внелегочных форм туберкулеза.
Если раньше скрофулодерма наблюдалась в основном у детей,
то в настоящее время нередко заболевают взрослые. Это объяс-
няется благоприятной эпидемиологической обстановкой, вслед-
ствие чего с возрастом противотуберкулезный иммунитет сни-
жается из-за отсутствия поддерживающей инфекции и наступле-
ния биологического выздоровления. Поэтому при инфицировании
таких больных развиваются формы туберкулеза, патогенетически
связанные с первичным периодом, что более свойственно детскому
возрасту.
Клиника. В отличие от первичной (гематогенной) скрофуло-
дермы процесс располагается в местах локализации лимфатиче-
ских узлов, наиболее часто шейных [Вайнштейн А. Б., Пав-
лов Д. И., 1948; Агапкин И. Н., Багаева М. И., 1959; Goette D. К.
et al., 1978, и др.], или вокруг свищей костно-суставного туберку-
леза. Узлы располагаются более глубоко, что приводит к возник-
новению более глубоких язв, по заживлении которых могут оста-
ваться втянутые, мостикообразные, обезображивающие рубцы. На
рубцах нередко возникают бугорки [Нерадов Л. А., 1961]. Могут
наблюдаться веррукозные (фунгозные) очаги. В последние годы
скрофулодерма встречается значительно реже, чем раньше, сос-
тавляя около 6 % всех форм туберкулеза кожи [Шаповал М. И.,
1978].
Гистопатология. Гистологически выявляется абсцедиро-
вание за счет неспецифического воспаления, вокруг которого име-
ются бугорки с казеозным некрозом. Микобактерии обнаружи-
ваются.
Заболевание наиболее заразно из всех форм туберкулеза
кожи. В результате интоксикации может ухудшаться общее сос-
тояние. Течение хроническое, с периодами ремиссии и обострения.
Туберкулиновые пробы часто положительны. Нередко выявляется
туберкулезный процесс в других органах, или сочетание скрофуло-
дермы с другими формами туберкулеза кожи [Вайнеров И. Б.,
1963; Simon N., 1959; Andersen S. С., 1970; Iden D. L. et al., 1978,
и др.]. При своевременном лечении прогноз благоприятный. Если
лечение начинается поздно, возможны значительные рубцовые де-
формации. При резко выраженной деструкции паховых лимфати-
ческих узлов может развиться элефантиаз [Gubta М., Chanda-
lia В. S., 1977]. Заболевание может осложниться карциномой
[Кардашенко Б. Я., 1981].
Туберкулез кожи и слизистых оболочек язвенный периорифи-
циальный (tuberculosis cutis et mucosae ulcerosa periorificialis).
Редкая экзогенно возникающая форма туберкулеза слизистых
и прилежащих участков кожи за счет массивной аутоинокуляции
при тяжелопротекающем экссудативном туберкулезе внутренних
органов (легких, желудочно-кишечного тракта, мочевыделитель-
ной системы). Болеют чаще мужчины. Значительная роль в раз-
витии заболевания наряду со снижением иммунной реактивности
отводится травме.
Клиника. Клинически эта форма туберкулеза характеризу-
ется появлением на слизистых оболочках, вокруг естественных от-
верстий, реже, на операционных ранах множественных милиарных
узелков розового или бледно-красного цвета, быстрораспадаю-
щихся с образованием поверхностных небольших язв, округлых
или овальных очертаний, с мягкими подрытыми краями, серозно- .
гнойным отделяемым, неровным зернистым (за счет милиарных
некротических бугорков) дном, отграниченных от окружающих
тканей воспалительным ободком. За счет слияния язвочек могут '
сформироваться обширные язвенные поверхности с фестончатыми
374
краями без тенденции к спонтанному заживлению; наблюдаются
увеличение и болезненность регионарных лимфатических узлов.
В углах рта, вокруг ануса могут возникать болезненные трещины,
иногда с папилломатозными разрастаниями. Изредка процесс на
губе может приобретать шанкриформный характер. Особой фор-
мой туберкулеза слизистых оболочек является язвенный туберку-
лез языка, нередко служащий первым симптомом туберкулеза
внутренних органов [Prabhu S. R. et al., 1978; Rauch D. M„ Fried-
man E., 1978], иногда ошибочно принимаемый за рак [Dimitro-
wa I. et al., 1981].
Гистопатология. Гистологически обнаруживается неспе-
цифическая воспалительная реакция вокруг изъязвления, в глу-
боких отделах — туберкулоидные гранулемы. Микобактерии обна-
руживаются.
Заболевание особенно заразное. Общая резистентность орга-
низма резко снижена. Туберкулиновые пробы часто отрицательны,
но могут развиться и гиперергические реакции. Появление этой
формы туберкулеза — неблагоприятный прогностический признак,
но при своевременно начатом лечении кожный процесс может
разрешиться.
ТУБЕРКУЛЕЗ ПАПУЛОНЕКРОТИЧЕСКИЙ
(TUBERCULOSIS PAPULONECROTICA)
Син.: фолликлис, акнит
В основе заболевания лежит аллергический васкулит, разви-
вающийся вследствие сенсибилизации туберкулезными бактериями
или их продуктами. Возникает преимущественно при хроническом
течении первичного туберкулеза за счет периодической гемато-
генной диссеминации небольшого количества микобактерий. Спо-
собствуют развитию заболевания нарушение кровообращения, эн-
докринные расстройства, острые инфекционные заболевания
(корь, грипп и др.). Встречается папулонекротический туберкулез
в основном у подростков и молодых людей, преимущественно
женщин [Вейнеров И. Б., Рудченко Ю. А., 1973, и др.].
Клиника. Высыпания появляются приступообразно, локали-
зуются симметрично на коже разгибательных поверхностей ко-
нечностей (особенно в области локтей и коленей) и на ягодицах.
Они имеют вид изолированных полу шаровидных папул округлых
очертаний, размером от булавочной головки до горошины, корич-
невато-красноватого или синюшно-красного цвета, плотноватой
консистенции, безболезненных с гладкой или слегка шелушащейся
поверхностью. В центральной части большинства элементов раз-
вивается псевдопустула (некроз). При этом образуется кратеро-
образная язвочка, покрытая плотно прилегающей корочкой, ок-
руженная чуть возвышающимся ободком. После заживления эле-
ментов остаются характерные, как бы штампованные, рубчики,
часто окруженные узким пигментированным венчиком (рис. 88).
375
Рис. .88. Папулонекротический туберкулез кожи.
В связи с приступообразным появлением высыпаний они находят-
ся в различной стадии развития. Продолжительность вспышек
колеблется от 1—2 до нескольких месяцев. Папулонекротический
туберкулез нередко сочетается с индуративной эритемой Базена,
колликвативным и другими формами туберкулеза кожи. Возможно
также развитие на высыпаниях папулонекротического туберкулеза
туберкулезной волчанки [Morrison J. G. L., Fourie Е. D., 1974].
От обычной клинической картины могут быть некоторые от-
клонения. Так, папулезные элементы не подвергаются централь-
ному некрозу, а регрессируют без рубца, оставляя после себя пиг-
ментные пятна, исчезающие в дальнейшем. В то же время на по-
верхности других элементов за счет большей выраженности экс-
судативного компонента может сформироваться псевдопустула,
придающая сходство высыпаниям (особенно при локализации на
лице) с угревой сыпью. Более крупные и глубже расположенные
папулы, регрессируя, оставляют атрофию, или они изъязвляются
с последующим рубцеванием, представляя собой переходную фор-
му к индуративной эритеме. В редких случаях сыпь располагается
на туловище [Коляденко В. Г. и др., 1982], в области половых
органов, в том числе изолированно [Nishigori С., 1986; Ramesh V.,
1986]. У детей доминируют папулезные высыпания, часто распо-
лагающиеся на ягодицах [Агапкин И. Н., Багаева М. И., 1959[,
а некротические изменения встречаются реже, чем у взрослых.
376
Гистопатология. Гистологически обнаруживается цент-
ральный некроз, окруженный неспецифическим, а по периферии
гранулематозным инфильтратом. Выражены сосудистые изменения
| Morrison J. G. L., Foruie Е. D., 1979].
Течение заболевания хроническое, с ухудшением зимой и улуч-
шением в теплое время года. Однако вследствие гиперинсоляции
может возникать обострение летом. Туберкулиновые пробы поло-
жительны. Туберкулезные бациллы обнаруживаются лишь в еди-
ничных случаях. В период вспышки могут быть признаки инто-
ксикации с повышением температуры, недомоганием, болью в сус-
тавах. Прогноз для выздоровления благоприятный. Первичный
очаг (в легких, лимфатических узлах, костях и суставах) чаще
неактивный. Между приступами общее состояние больных обычно
не страдает.
ЛИШАЙ ЗОЛОТУШНЫХ (LICHEN SCROFULOSORUM)
Син.: туберкулез кожи лихеноидный
Очень редкая форма туберкулеза кожи, развивающаяся обычно
в первичном периоде болезни, в основном у ослабленных детей
и подростков, страдающих другими формами туберкулеза (кожи,
лимфатических узлов, костей или реже легких). Возникает за счет
гематогенной диссеминации у лиц с повышенной чувствительно-
стью к микобактериям [Smith N. Р. et al., 1976]. Провоцируют
развитие заболевания острые инфекции, иногда туберкулиновая
проба, а также прививка БЦЖ. Высыпания в виде лихеноидных,
фолликулярных или перифолликулярных элементов, конусовидной
или плоской формы, округлых, реже полигональных очертаний,
часто с роговой чешуйкой на поверхности или пронизанные пуш-
ковым волосом. Располагаются симметрично, преимущественно
в области боковых поверхностей туловища. Цвет их желтовато-
коричневый, красноватый или бледно-розовый. За счет группиров-
ки и тесного расположения могут возникать овальные или коль-
цевидные очаги поражения. Более редко встречаются эритематоз-
ные сыпи, инфильтративные очаги, элементы, как бы переходные
к папулонекротическому туберкулезу [Schmidt Р. W., 1941; Breat-
hanach S. М., Black М. М., 1981], или сочетание этих форм [Ли-
товченко О. В., Гущина А. П., 1972]. При регрессировании эле-
ментов могут оставаться поверхностные рубчики. Описана не-
обычная клиническая картина лихеноидного туберкулеза в виде
множественных остроконечных гиперкератотических высыпаний
коричневатого цвета на ладонях и подошвах у 50-летней больной
скрофулодермой с гистологически обнаруженной туберкулоидной
гранулемой [Premalatha S. et al., 1982], а также сочетание лишая
юлотушных с туберкулезным дактилитом у 22-летней больной,
страдавшей туберкулезом шейных лимфатических узлов [Gra-
ham-Brown R. А. С., Sarcany I., 1980].
377
Гистопатология. Гистологически обнаруживаются пре-
имущественно эпителиоидноклеточные гранулемы, расположенные
перифолликулярно, с небольшой лимфоцитарной реакцией и не-
многочисленными гигантскими клетками.
Течение заболевания хроническое; высыпания развиваются, как
правило, приступообразно. Прогноз благоприятный за счет склон-
ности к самопроизвольному регрессированию через несколько
недель с момента появления или быстрого эффекта от лечения,
однако рецидивы могут наблюдаться, чаще осенью и весной.
Туберкулиновые пробы положительны.
ТУБЕРКУЛЕЗ КОЖИ УПЛОТНЕННЫЙ
(TUBERCULOSIS CUTIS IHDURATIVA)
Син.: эритема уплотненная Базена
В основе заболевания лежит дермо-гиподермальный аллерги-
ческий васкулит, вызванный повышенной чувствительностью к ми-
кобактериям, которые попадают в кожу преимущественно гемато-
генно. Развивается заболевание в основном у девушек и молодых
женщин, страдающих нарушениями периферического кровообра-
щения, гормональными дисфункциями, в первую очередь гипо-
функцией половых желез. Провоцирующим фактором является
длительное пребывание на ногах. Это одна из наиболее распро-
страненных форм туберкулеза кожи. Так, по наблюдениям
М. И. Шаповал (1980), из 437 больных туберкулезом кожи у
239 была индуративная эритема.
Если в нашей стране туберкулезная природа уплотненной
эритемы считается несомненной, за рубежом на этот счет сущест-
вуют различные точки зрения. Так, W. Lever и Schaumburg-
Lever G. (1983) считают, что для туберкулезного генеза индура-
тивной эритемы нет достаточных оснований. F. Ehring (1974) ука-
зывал, что индуративная эритема причисляется к periarteriitis no-
dosa cutanea tarda. В то же время есть работы, в которых принад-
лежность индуративной эритемы к туберкулезу подтверждается
обнаружением в очагах поражения микобактерий (Mascimen-
to L. V. et al., 1983, и др.]. О. Braun-Falko и соавт. (1984) указы-
вали, что, хотя и имеются сомнения многих авторов в туберкулезо-
специфичности процесса при индуративной эритеме, их собствен-
ный опыт подтверждает туберкулезное происхождение этого за-
болевания.
Клиника. Клинически индуративная эритема характеризу-
ется появлением преимущественно на голенях, главным образом
в области икроножных мышц, симметричных глубоко расположен-
ных узлов размером от 1 до 5 см в диаметре тестоватой и плотно-
эластической консистенции. Узлы чаще немногочисленны, мало-
болезненны, округлой или овальной формы, изолированы друг от
друга, с нерезко выраженными границами, особенно при более
378
Рис. 89. Индуративный ту-
беркулез кожи.
диффузных «бляшечных» и плоских элементах. При этих формах
наблюдаются лимфангиты, обнаруживаемые при пальпации в виде
уплотненных тяжей, отходящих от узлов. Кожа над узлами вна-
чале не изменена, но по мере их роста становится гиперемиро-
ванной, синюшной, спаянной с ними. Несмотря на наличие воспа-
лительной реакции, кожа холодная на ощупь. Узлы постепенно
разрешаются, оставляя пигментацию или незначительную, а не-
редко и глубокую атрофию. В ряде случаев часть узлов в центре
размягчается и изъязвляется (рис. 89), что наблюдается, по
данным Л. Н. Машкиллейсона, Л. Л. Нерадова (1937), у 38,9 %
больных, по данным И. Б. Вейнерова и Ю. А. Рудченко (1973) —
в 23,9 % случаев. Образующиеся язвы чаще неглубокие, имеют ок-
руглые или овальные очертания, желтовато-красное дно, покрытое
вялыми грануляциями и серозно-кровянистым отделяемым. Края
язв крутые или редко подрытые, синюшные, плотноватые за счет
венчика нераспавшегося инфильтрата. По заживлении язв остает-
ся гладкий втянутый рубец с гиперпигментацией по периферии.
Следует отметить, что у ряда больных может наблюдаться под-
острое течение уплотненной эритемы. При этом процесс нередко
носит распространенный характер, с довольно быстрым формиро-
ванием болезненных элементов, ранним их изъязвлением, иногда
по всей поверхности, т. е. приобретает черты, свойственные па-
379
пулонекротическому туберкулезу. В начале заболевания может
иметься некоторое сходство с тромбофлебитом. Наблюдаются и
формы, переходные к скрофулодерме [Saraski G. et al., 1975, и
др.) •
Течение заболевания торпидное, волнообразное. В летнее время
может наблюдаться спонтанное исчезновение узлов, а в холодное
время — обострение. У одного и того же больного могут быть
различные стадии процесса: наряду с регрессирующими элемен-
тами появляются новые. Индуративная эритема развивается
преимущественно при хронически текущем первичном туберкулезе.
Нередки другие проявления туберкулезной инфекции, особенно
туберкулезный лимфаденит и папулонекротический туберкулез.
Причем изменения в лимфатических узлах могут проявиться
и после развития кожного процесса [Simon N., 1969]. Иногда
могут наблюдаться папулоэрозивные очаги в полости рта. Тубер-
кулиновые пробы у большинства больных положительны. Общее
состояние больных обычно не страдает, однако при обострениях
могут наблюдаться небольшое повышение температуры, недомога-
ние, боли в суставах.
Гистопатология. Гистологически вначале обнаруживает-
ся гранулематозная, неспецифическая, лимфоцитарно-плазмокле-
точная воспалительная реакция. Значительные сосудистые измене-
ния с набуханием и пролиферацией эндотелия, тромбозом и
облитерацией просветов. В дальнейшем (через 1'/2—2 мес) фор-
мируется специфическая гранулематозная реакция. Казеоз наблю-
дается не всегда. L. Forstrom, М. Hannuksela (1970) отметили
его у 24 из 48 больных. Для диагностики важна глубокая биопсия
[Andersen S. С., 1970], так как основной процесс развивается в
подкожной клетчатке.
Прогноз для выздоровления благоприятный, хотя даже под
влиянием адекватного лечения регрессирование происходит мед-
ленно. Могут наблюдаться поздние рецидивы, иногда через не-
сколько лет после клинического выздоровления.
ВОЛЧАНКА МИЛИАРНАЯ ДИССЕМИНИРОВАННАЯ ЛИЦА
(LUPUS MILIARIS DISSEMINATUS FACIEI)
Син.: туберкулез кожи лица милиарный диссеминированный
Редкая разновидность туберкулеза кожи. Вероятнее всего,
представляет собой папулезный вариант локализованного папуло-
некротического туберкулеза. За рубежом либо вовсе отрицается
связь с туберкулезом [Simon N., 1975, и др.] и заболевание рас-
сматривается как гранулематозный вариант розацеа [Mulla-
nax М. G., Kierland R. R., 1970; Lever W., Schaumburg-Lever G.,
1983], либо отношение к нему считается спорным [Braun-Falko О.
et al., 1984, и др.]. Разновидностью диссеминированной милиар-
ной волчанки лица считают так называемый розацеаподобный
туберкулид Левандовского [Павлов С. Т., 1938; Нерадов Л. А.,
380
1945; Машкиллейсон Л. Н., 1961], хотя другие авторы рассматри-
вают его как люпоидный вариант розацеа или периорального
розацеаподобного дерматита [Braun-Falko О. et al., 1984].
Клиника. Клинически характеризуется появлением почти
исключительно на лице изолированных милиарных безболезнен-
ных папул желтовато-красноватого или красновато-коричневатого
цвета, полушаровиДных, с пустулоподобным центром, мягкой кон-
систенции, дающих при диаскопии феномен яблочного желе. Вы-
сыпания располагаются обычно поверхностно, но могут быть и
более глубокими, напоминающими акнит. Характерно наличие эле-
ментов в различной стадии развития за счет неодновременного
их появления. После регрессирования могут оставаться рубчики.
В редких случаях высыпания, напоминающие папулонекроти-
ческий туберкулез, появляются на конечностях или на туловище.
Может развиться узловатая эритема. Туберкулиновые пробы сла-
боположительные и нередко отрицательные.
Гистопатология. Гистологически в поверхностных слоях
дермы обнаруживается туберкулоидная гранулема с некрозом,
наличием гигантских клеток Пирогова—Лангханса.
Заболевание встречается преимущественно в молодом возрасте.
У больных могут обнаруживаться туберкулезные поражения лег-
ких и других органов, в том числе кожи [Агапкин И. Н., Бага-
ева М. И., 1959; Вейнеров И. Б., Рудченко Ю. А., 1973, и др.].
Течение хроническое, многомесячное, волнообразное.
Диагностика туберкулеза кожи основывается на данных кли-
нических, гистологических, микробиологических исследований,
оценке результатов туберкулиновых проб и тест-терапии. Из этих
методов самым надежным является обнаружение возбудителя, ос-
тальные же информативны только в комплексе. Однако при пора-
жениях кожи микобактерии легко обнаруживаются лишь при пер-
вичном туберкулезном комплексе, остром милиарном, милиарно-
язвенном туберкулезе и скрофулодерме. При остальных же фор-
мах это удается сделать редко, а при диссеминированных — в виде
исключения (не считая индуративную эритему, когда надежда на
успех несколько большая). Для выявления возбудителя использу-
ются бактериоскопия, включая и люминесцентную микроскопию,
культуральный метод, а также биологическая проба — заражение
морских свинок патологическим материалом. Основным методом
окраски мазков является метод Циля—Нильсена. М. А. Карагун-
ский и соавт. (1984) подчеркивают значимость посева на L-формы
бактерий в сочетании с биологической пробой для повышения
частоты выделения микобактерий при туберкулезе лимфатических
узлов.
Гистологическое исследование, являясь очень важным методом
диагностики, имеет ограниченное самостоятельное значение, ес-
ли при этом не обнаружены микобактерии, так как гранулематоз-
ная реакция характерна не только для туберкулеза, но и для ряда
других инфекционных заболеваний, нередко имеющих значитель-
ное клиническое сходство с туберкулезом (сифилис, лепра, глу-
381
бокие микозы). Кроме того, туберкулоидная структура наблюдает-
ся при гранулемах инородного тела, люпоидном варианте розацеа
и других патологических состояниях, в развитии которых сущест-
венна роль иммунного воспаления. В то же время при некоторых
формах туберкулеза, например в ранней стадии туберкулезного
шанкра, при остром милиарном туберкулезе часто обнаруживается
неспецифическая воспалительная реакция. Только на основании
гистологических данных не всегда представляется возможность
дифференцировать такие рассеянные формы туберкулеза, как па-
пулонекротический туберкулез и уплотненная эритема с неспеци-
фическими васкулитами [Литовченко О. В. и др., 1974; Стру-
ков А. И., Соловьева И. П., 1976; Yamauchi Т. et al., 1973; Lee J.
et al., 1975]. Значительная выраженность неспецифических изме-
нений в очагах туберкулеза с деструкцией соединительной ткани,
нарушением структуры сосудов, лимфоцитарными инфильтратами,
на фоне которых позднее могут возникать специфические тубер-
кулоидные морфологические изменения, является особенностью
патоморфоза туберкулеза в последнее время [Литовченко О. В.,
1970—1974; Струков А. И., Соловьева И. П., 1976].
Несмотря на противоречивость данных литературы о диагно-
стической значимости туберкулиновых проб, они входят в обяза-
тельный диагностический минимум, хотя, как и гистологические
исследования, взятые отдельно, они не дают основания для заклю-
чения о туберкулезной природе патологии. Используется кожная
проба Пирке (градуированная — с 1,5, 25, 100 % туберкулином)
и при отсутствии реакции внутрикожная проба Манту с 0,25 мл
отечественного сухого туберкулина PPD-L или 0,1 мл альттуберку-
лина в разведении 1:2000, что соответствует 5 туберкулиновым
единицам (ТЕ). В случае невозможности постановки градуиро-
ванной пробы Пирке (отсутствие туберкулина в разведении и т. д.)
можно использовать пробу Пирке со 100 % туберкулином или сра-
зу применить пробу Манту с 5 ТЕ. Пробу Манту можно проводить
в день прочтения пробы Пирке, так как в случае отсутствия
реакции на кожную пробу результат внутрикожной пробы не за-
висит от чрескожно введенного ранее туберкулина. Подкожное
введение туберкулина (проба Коха) в дерматологической прак-
тике нецелесообразно ввиду его малой информативности и воз-
можности возникновения тяжелых аллергических общих реакций,
так как кожа в данном случае является «шоковым» органом.
Помимо уколочной (местной) реакции при введении туберку-
лина, наблюдаются общая и очаговая реакции. У больных тубер-
кулезом кожи (особенно при папулонекротической форме) эти
реакции возникают на внутрикожное введение туберкулина, а
иногда и на пробу Пирке. Результаты кожной пробы Пирке про-
веряют через 48—72 ч. Измеряют при этом диаметр папулы пер-
пендикулярно царапине. Реакция может быть отрицательной, ког-
да на месте нанесения туберкулина никаких изменений, кроме
малозаметных кожных скарификаций, нет, сомнительной (папула
меньше 3 мм), положительной (папула от 3 мм до 1 см), резко
382
положительной (папула больше 1 см, резко выраженная гипере-
мия кожи вокруг папулы, лимфангит). Результат пробы Манту
оценивается через 48—72 ч. Реакция считается отрицательной
при полном отсутствии инфильтрата (гиперемии) или при нали-
чии уколочной реакции (0—1 мМ), сомнительной при инфильтрате
(папуле) размером 2—4 мм или только гиперемии любого раз-
мера без инфильтрата, положительной при наличии выраженного
инфильтрата (папулы) диаметром 5 мм и более. Гиперергическими
у детей и подростков считаются реакции с диаметром инфильтрата
17 мм и более, у взрослых — 21 мм и более, а также везикуло-
некротические реакции независимо от размера инфильтрата с
лимфангитом или без него.
Следует отметить, что при многих локализациях туберкулеза
отмечается отчетливое снижение туберкулиновой чувствительнос-
ти, обусловленное планово проводимой вакцинацией, уменьшением
инфицированности населения, а следовательно, и числа контак-
тов с бацилловыделителями [Кочнова И. Е., 1972; Авербах М. М.,
1976]. Для повышения надежности раннего выявления туберку-
леза кожи М. И. Шаповал (1980) предложила тест, заключающий-
ся в определении величины гистаминопексии в крови до и через
48 ч после введения туберкулина. О наличии активного туберку-
леза кожи свидетельствует снижение индекса гистаминопексии бо-
лее чем на 5 %. Применение с диагностической целью тест-тера-
пии, рекомендуемое многими авторами [Литовченко О. В., 1970—
1972; Вейнеров И. Б., 1973], ограничивается его длительностью
и возможностью возникновения побочных реакций.
Дифференциальная диагностика. Первичный туберкулезный
аффект необходимо дифференцировать в первую очередь от пио-
дермии, споротрихоза, твердого шанкра и эпителиомы. Решающим
для отличия от первых трех заболеваний является микробиологи-
ческое, а от эпителиомы — гистологическое исследование. Милиар-
ный диссеминированный туберкулез больших затруднений в диаг-
ностике не вызывает, так как основной процесс — тяжелотеку-
щий, острый милиарный туберкулез. При постановке диагноза не-
обходимо учитывать, однако, что известное сходство может наблю-
даться при лекарственных сыпях, гистиоцитозе X, вторичном си-
филисе, остром парапсориазе.
Первичную скрофулодерму необходимо в первую очередь диф-
ференцировать от пиодермии, глубоких микозов, третичного си-
филиса, для чего проводят микробиологическое, серологическое
исследование, постановку туберкулиновых проб.
Туберкулезную волчанку следует отличать от бугоркового си-
филиса, саркоидоза, красной волчанки, туберкулоидной лепры,
туберкулоидной формы лейшманиоза, люпоидного сикоза. От бу-
горкового сифилиса туберкулезная волчанка отличается ранним
началом, поражением хрящевой, а не костной части носа, мед-
ленной динамикой, мягкой консистенцией люпом, положитель-
ными феноменами «яблочного желе» и «зонда», характером рубцов,
отрицательными реакциями на сифилис. Мелкоузелковая форма
383
саркоидоза отличается развитием преимущественно у взрослых,
более яркой окраской и большей плотностью высыпаний, отсут-
ствием, как правило, изъязвления, в большинстве случаев отсут-
ствием реакции на туберкулин. При туберкулезной волчанке от-
сутствуют такие характерные для красной волчанки признаки,
как фолликулярный гиперкератоз, яркая эритема, изменения кол-
лагена. Высыпания при туберкулоидном типе лепры имеют иную
излюбленную локализацию, в их окраске доминируют синюшные
тона, они значительно плотнее, чем люпопы, как правило, не
изъязвляются и сопровождаются расстройством чувствительности.
Для отграничения бугоркового лейшманиоза от волчанки имеют
значение данные анамнеза, лабораторные исследования, а также
более быстрая динамика очагов поражения, большая плотность
бугорков, в связи с чем феномен «зонда» отрицателен. Люпоид-
ный сикоз отличается от волчанки преимущественным развитием
у мужчин, высыпанием пустул, а не люпом, более быстрой дина-
микой элементов и локализацией на участках кожи, покрытых
волосами.
Туберкулез кожи бородавчатый следует дифференцировать от
хромомикоза, вегетирующей пиодермии, бородавчатого плоского
лишая, бромодермы. Основное значение в первых двух случаях
имеют микробиологическое исследование и туберкулинодиагнос-
тика. Веррукозный красный плоский лишай располагается на го-
ленях, а не на тыле кистей, как правило, не изъязвляется, сопро-
вождается зудом, имеет другую гистологическую картину и обычно
сопровождается типичными для красного плоского лишая высыпа-
ниями. Бромо- или йододерма характеризуется более выражен-
ными воспалительными изменениями, большей вегетацией в оча-
гах, развивается при непереносимости брома (йода). ‘
Диагностика скрофулодермы, как правило, не вызывает зна-
чительных затруднений, хотя и требует исключения сифилитиче- '
ской, пиогенной, актиномикотической природы процесса, для чего
производят микробиологическое, серологическое исследование и
постановку туберкулиновых проб. Появление стойких периорифи-
циальных болезненных язв, а также наличие язвенных изменений
на слизистых оболочках всегда должны служить показанием для
микробиологических исследований с целью обнаружения микобак-
терий и проведения дифференциальной диагностики с сифилисом,
эпителиомой, афтозным стоматитом, пузырчаткой. Афта обычно;
существует непродолжительно, первичным элементом при пузыр-;
чатке являются пузыри, в мазках-отпечатках обнаруживаются
клетки Тцанка.
Папулонекротический туберкулез необходимо дифференциро-:
вать с аллергическим некротическим васкулитом, острым пара-;
псориазом, пруриго, акнеформными лекарственными сыпями. Важ-;
ными при этом являются анамнез, наличие туберкулеза других)
органов, положительные туберкулиновые пробы, отсутствие поли-^
морфизма высыпаний, свойственного вариолиформному парапсо-;
риазу, интенсивного зуда, характерного для пруриго, приема:
384 *
х
5
бромистых (йодистых) и кортикостероидных препаратов в анам-
незе.
Лишай золотушных отличается от красного плоского лишая
цветом, отсутствием вдавления в центре высыпаний, предпочти-
тельной их локализацией на боковых поверхностях туловища, от
лихеноидных сифилидов — менее яркой окраской, меньшей плот-
ностью элементов, отрицательными серологическими реакциями на
сифилис. Могут иметь значительное сходство с лишаем золотуш-
ных и лихеноидные аллергические сыпи при глубокой трихофитии,
пиодермии.
Узловатая эритема отличается от индуративной болезненно-
стью, предпочтительной локализацией на передней поверхности
голени, отсутствием изъязвления. Труднее дифференцировать уп-
лотненный туберкулез кожи от аллергических узловатых васку-
литов. При этом учитываются более острое течение последних,
наличие болезненности, отрицательные туберкулиновые пробы, от-
сутствие туберкулеза других органов. Сифилитические гуммы раз-
виваются в более позднем возрасте, обычно асимметричны, более
плотны, чаще единичны, имеют более четкие границы и часто со-
провождаются положительными серологическими реакциями на
сифилис.
Милиарная диссеминированная волчанка лица отличается от
розацеа отсутствием пустулизации, эритемы и телеангиэктазий,
нередко положительной туберкулиновой пробой. От саркоидоза
эта форма туберкулеза кожи отличается меньшей плотностью
высыпаний и отсутствием системных проявлений саркоидоза, от
угревой сыпи — отсутствием комедонов, нагноения, иной гистоло-
гической картиной.
Лечение больных туберкулезом кожи должно быть комплекс-
ным, непрерывным, длительным, проводиться с учетом теорети-
ческих основ химиотерапии при туберкулезе. Этиологическое ле-
чение сочетается с патогенетическим, направленным на повышение
факторов иммунной защиты, снижение воспалительной реакции
и повышенной чувствительности к микобактериям, предупрежде-
ние осложнений туберкулезной инфекции и побочного действия
антибактериальных средств.
Антибактериальная терапия осуществляется с использованием
туберкулостатических препаратов. Применяемые в настоящее
время противотуберкулезные средства разделяются на две группы.
К 1-й группе относятся основные противотуберкулезные пре-
параты: стрептомицин (дигидрострептомицин), препараты группы
гидразида изоникотиновой кислоты (тубазид, фтивазид, салюзид,
метазид, ПАСК (бепаск), рифампицин.
Во 2-ю (резервную) группу входят тибон, этионамид (протио-
намид), пиразинамид, этамбутол, циклосерин, биомицин, кана-
мицин.
Стрептомицин оказывает терапевтическое действие при всех
формах кожного туберкулеза. Суточную дозу препарата для ле-
чения взрослых больных (0,5—1 г) можно вводить в один прием.
14—936
385
Дозы выше 0,5 г в сутки назначаются только в стационаре. Стреп-
томицин вводится также в очаги поражения по 0,1—0,2—0,3 г
в зависимости от их величины один раз в 4—6 дней. При этом
суммарная доза антибиотика (внутримышечно и внутрикожно) не
должна превышать 1 г в сутки. При появлении звона в ушах при
лечении стрептомицином суточными дозами в 1 г препарат сле-
дует временно отменить или необходимо резко сократить его дозу.
Тубазид (изониазид) — чистый гидразид изоникотиновой кис-
лоты, применяется внутрь в суточной дозе 0,6—0,9 г (в 1—2 при-
ема), детям 0,006—0,012 г на 1 кг массы тела в сутки (в 1—2 при-
ема). Этот препарат наиболее эффективен при туберкулезе.
Фтивазид — отечественный препарат гидразида изоникотиновой
кислоты, показан при всех формах туберкулеза кожи. Терапевти-
ческая доза для взрослых стационарных больных варьирует от
1 до 1,5 г в день (2—3 раза по 0,5 г). В амбулаторной практике
суточная доза препарата составляет 0,75—1 г. На курс лечения
при хорошей переносимости назначается 150—200 г фтивазида.
При заболеваниях сердечно-сосудистой и нервной системы, а так-
же при нарушениях функции печени и почек не следует назначать
дозы фтивазида больше чем 0,5 г в день. Детям назначают от
20 до 30 мг на 1 кг массы тела.
Салюзид обладает высокой антибактериальной активностью.
Применяется внутрь по 0,5 г 2—3 раза в сутки (детям 0,03 г на
1 кг массы в сутки) и парентерально в область свищей, натечни-
ков, непосредственно в очаги поражения в 5—10 % водном рас-
творе.
Метазид — малотоксичный препарат, более эффективный, чем
фтивазид, ведет к более глубокому нарушению жизнедеятельности
микобактерий туберкулеза. Приобретенная к фтивазиду устойчи-
вость штаммов микобактерий распространяется и на метазид, но
так как бактериостатическая активность метазида выше, примене-
ние его при устойчивости к фтивазиду целесообразно. Дозировка
такая же, как для фтивазида.
ПАСК (парааминосалициловая кислота). С лечебной целью
применяют натриевую соль парааминосалициловой кислоты и
кальциевую соль парабензоиламиносалициловой кислоты (бепаск).
ПАСК назначают перорально в суточной дозе 9—12 г (для детей
0,15—0,2 г на 1 кг массы), а также местно в виде 25 % мази.
ПАСК усиливает действие стрептомицина. Бепаск применяют при
непереносимости ПАСК, его действие основано на том, что при
попадании в организм от него отщепляется ПАСК. Применяют
бепаск в порошках по 2 г 4 раза в сутки; порошок размешивают
в 0,5 стакана щелочной минеральной воды.
Более токсичные резервные противотуберкулезные препараты
назначают реже, в случаях непереносимости препаратов 1-го ряда
или устойчивости к ним микобактерий туберкулеза.
Тибон оказывает избирательное туберкулостатическое дейст-
вие, применяется перорально при устойчивости к ПАСК по
0,025 г 2 раза в день (2 нед), затем по 0,05 г 2—3 раза в день. Де-
386
тям назначают по 0,5—1 мг на 1 кг массы тела, не более 0,05 г в
сутки. При возникновении побочных реакций на тибон (головной
боли, головокружений, диспепсических расстройств) следует сде-
лать перерыв в лечении на 3—5 дней или отменить препарат.
Этионамид — синтетический препарат, рекомендуемый к при-
менению вместо ПАСК в комбинации со стрептомицином, туба-
зидом, циклосерином в виде таблеток по 0,25 г 3 раза в день.
Для детей препарат назначают 0,01—0,02 г на 1 кг массы в сутки
через час после еды или в свечах по 0,25 г 3 раза в день. Диспеп-
сические расстройства, возникающие при приеме этионамида, мо-
гут быть ослаблены одновременным применением никотинамида
по 0,05 г 3 раза или никотиновой кислоты по 0,05 г 3 раза в сутки,
а также азотнокислого висмута 0,5 г 3 раза в день.
Пиразинамид применяют при устойчивости микобактерий ту-
беркулеза к препаратам группы ГИНК. Он назначается вместо
них или вместе с тубазидом в дозе 0,5 г 3—4 раза в сутки или
по 0,75—1 г 2 раза в день. Для уменьшения токсического действия
на печень больным рекомендуется прием метионина 0,5 г 3 раза
в сутки. Детям препарат назначается по 20—30 мг на 1 кг массы
тела, не более 1,5 г в сутки.
Циклосерин, или серомицин, — антибиотик широкого спектра
действия, заменяет стрептомицин, хотя и менее активен в отноше-
нии микобактерий туберкулеза. Применяется внутрь по 0,25 г
3 раза (детям 0,01—0,02 г на 1 кг массы тела, но не более 0,75 г
в сутки). В случае появления признаков интоксикации препарат
следует отменить.
Биомицин, или флоримицина сульфат, также обладает широ-
ким спектром антимикробного действия, применяется вместо стре-
птомицина внутримышечно в дозе 0,5—1 г 1 раз в сутки 6 раз в
неделю, на 7-й день делают перерыв. Детям из расчета 15—20 мг
на 1 кг массы тела, не более 0,5 г, подросткам — 0,75 г. При пло-
хой переносимости (нарушение слуха, аллергические реакции,
гипокалиемия и т. д.) введение препарата ограничивают до 2 раз
в неделю или его отменяют.
Канамицин — антибиотик широкого спектра действия, равен
стрептомицину по туберкулостатической активности, но более то-
ксичен. Назначается внутримышечно по 0,5—1 г 1 раз в день;
суточная доза для детей и подростков — из расчета 10—20 мг/кг,
но не более 0,5 г для детей и 0,75 г для подростков. Для профи-
лактики невритов назначается пантотеновая кислота.
Рифамицин — антибиотик широкого спектра с высокой тубер-
кулостатической активностью, но быстрым нарастанием устойчиво-
сти к нему микобактерий. Применяется внутрь натощак в суточной
дозе 600 мг (300 мг 2 раза в день), детям 8—10 мг на 1 кг мас-
сы тела в сутки, но не более 0,45 г. Побочные реакции (потеря
аппетита, тошнота, диспепсические расстройства) возникают редко
и обычно не требуют прекращения лечения.
Этамбутол применяют внутрь однократно: взрослым в дозе
25 мг/кг массы тела, детям — 20—25 мг/кг в сутки, но не более
14*
387
1 г. В процессе лечения необходим контроль за органами зрения.
При проведении антибактериальной терапии у больных тубер-
кулезом кожи могут наблюдаться побочные явления аллергическо-
го, токсико-аллергического, токсического характера для устране-
ния которых применяются противовоспалительные, антигистамин-
ные, а в тяжелых случаях и кортикостероидные препараты (при
шоке — в комбинации с сердечными средствами, адреналином).
Туберкулостатики не отменяются только в случае легко протекаю-
щих реакций и эффективности принятых мер.
Для повышения эффективности используется комбинированная
антибактериальная терапия, чем значительно задерживается ско-
рость развития лекарственной устойчивости и тем самым облегча-
ется возможность длительного лечения больных. Кроме того, бла-
годаря различному механизму действия отдельных антибактери-
альных препаратов их совместное применение приводит к синерги-
ческому действию, которое может быть выявлено как in vitro,
так и in vivo.
Основной курс антибактериальной терапии желательно прово-
дить в условиях специализированного стационара (санатория) или
отделения для больных внелегочными формами туберкулеза, где
обеспечивается необходимый лечебно-охранительный режим.
Начинать лечение следует с 3 препаратов основной группы:
стрептомицина или его производных, ПАСК, фтивазида или дру-
гого препарата ГИНК (салюзид, метазид, тубазид). Через 3 мес
стрептомицин можно отменить в связи с тем, что его действие
наиболее выражено при свежих воспалительных изменениях, а
также для предотвращения побочного ототоксического действия
препарата. Фтивазид во избежание устойчивости следует заменить
другим производным гидразида изоникотиновой кислоты, а
ПАСК — бепаском, который лучше переносится больными. При
хорошей переносимости и эффективности такое лечение можно
проводить до окончания основного курса, который продолжается
10—12 мес. При явлениях быстрой инактивации препаратов груп-
пы ГИНК, устойчивости к туберкулостатикам или непереносимо-
сти возможны другие комбинации противотуберкулезных препара-
тов с учетом их взаимозаменяемости, изложенной выше.
Патогенетическая терапия больных туберкулезом кожи вклю-
чает витамины, десенсибилизирующие средства, физиотерапевтиче-
ское воздействие, климатические факторы, лечебное питание, раз-
личные симптоматические средства. В комплексном лечении боль-
ных диссеминированными формами туберкулеза кожи при упорном
течении заболевания, плохой переносимости медикаментозных
средств, гиперергических туберкулиновых пробах, параспецифиче-
ских аллергических реакциях на туберкулез (узловатая эритема,
кольцевидная гранулема, волчаночные реакции и т. д.) могут
быть кратковременно назначены глюкокортикоидные препараты, в
частности преднизолон в дозе 30 мг в сутки в течение 2 нед с
постепенным снижением дозы на 5 мг в неделю. Во избежание
обострения заболевания при отмене препарата в последнюю неде-
388
лю его применения и неделю после его отмены следует назначать
антигистаминные средства. Могут назначаться производные пред-
низолона (дексаметазон и т. д.) в дозах, соответствующих пред-
низолону. В целях иммунокоррекции может быть применен презо-
цил.по 1 таблетке 2—3 раза в сутки в течение 1—2 мес, а также
гистаглобулин, при уплотненной эритеме — тиосульфат натрия.
Из физиотерапевтических методов применяется электрофорез с
10 % раствором тиосульфата натрия (на очаги уплотненной эри-
темы при выраженной плотности элементов и упорном течении
процесса), ультрафиолетовое местное и общее облучение при ту-
беркулезной волчанке по общепринятым методикам в субэритем-
ных дозах. Из климатических факторов используется главным
образом гелиотерапия. При рассеянных формах гиперинсоляция
противопоказана. Имеет значение и лечебное питание. Больным
назначается стол № 11. Величина рациона должна находиться
в соответствии с энергозатратами больного, с возрастом, исход-
ной массой тела и проводимым лечебным режимом. Белки, вита-
мины и соли кальция являются главными пищевыми компонен-
тами в питании больных: количество их должно быть повышено
по сравнению с нормой в среднем на 1/з- К патогенетическим
средствам при рассеянных формах туберкулеза кожи относятся и
препараты, улучшающие периферическое кровообращение (гливе-
нол, эскузан и др.) в течение 1—2 мес. Витамин Й, ранее широко
применявшийся для лечения больных туберкулезной волчанкой, в
настоящее время практически не назначается вследствие возмож-
ных побочных явлений, а также в связи с наличием более эффек-
тивных туберкулостатиков. При рассеянных же формах туберкуле-
за кожи витамин Dj противопоказан.
Местное лечение при туберкулезе кожи не имеет практического
значения. В ряде случаев при торпидном лечении язвенных форм
уплотненной эритемы Ю. Г. Жаров и соавт. (1984) рекомендуют
применять фибринную пленку, 5 % раствор салюзида, усниновую
кислоту (уснинат натрия в 1 % водноспиртовом или 0,5 % масля-
ном растворе с добавлением 2 % анестезина), цинк-желатиновые
повязки. Применение местных прижигающих средств, использо-
вавшихся ранее при туберкулезной волчанке, в настоящее время не
оправдано, так как приводит к образованию грубых обезображи-
вающих рубцов. Хирургическое лечение применяется в основном
при колликвативном туберкулезе. Оно заключается в удалении казе-
озно измененных лимфатических узлов, обезображивающих руб-
цов, вскрытии гнойных карманов и натечников. Весь операционный
материал должен направляться на гистологическое исследование
и посев на питательные среды.
Профилактика и организация диспансерной помощи больным.
Организация борьбы с туберкулезом кожи предусматривает, по-
мимо санитарно-профилактическйх мероприятий и специфической
профилактики общего туберкулеза, возможно более раннее выяв-
ление этого заболевания при периодических медицинских осмот-
рах населения, а также среди контингентов больных активным
туберкулезом легких и его внелегочными формами.
Больных туберкулезом кожи берут на учет противотуберку-
лезные учреждения. Они проводят основное и противорецидивное
лечение (вместе с диспансерным наблюдением). В специализиро-
ванные стационары (люпозории), а также в стационары, имеющие
койки для больных туберкулезом кожи, подлежат приему следую-
щие больные: 1) с любыми активными формами туберкулеза ко-
жи, впервые диагностированными; 2) с обострениями и рецидива-
ми туберкулезного процесса; 3) нуждающиеся в проведении курса
противорецидивной терапии. Срочной госпитализации подлежат
больные, у которых развитие туберкулезного процесса кожи может
вызвать нарушение функции важного органа или тяжелый косме-
тический дефект.
Раннее выявление больных туберкулезом кожи среди активных
туберкулезных контингентов осуществляется путем проведения
профилактических осмотров лиц, страдающих активным легочным
и внелегочным туберкулезом (взрослые и дети), детей с различ-
ными проявлениями туберкулезной инфекции, а также лиц, нахо-
дящихся в контакте с больными, особенно бациллярными форма-
ми туберкулеза.
Подлежат обследованию на туберкулез кожи с применением
рентгенологических, бактериологических и других лабораторных
методов больные хроническими дерматозами, длительное лечение
которых не дало положительного результата. В первую очередь это
относится к больным, страдающим инфекционными и паразитар-
ными заболеваниями, особенно сифилисом, глубокими микозами,
лейшманиозом, а также при атипичных вариантах красной вол-
чанки, саркоидозе, глубоких и некротических васкулитах, включая
и вариолиформный парапсориаз. Должны быть обследованы в
затруднительных случаях больные с новообразованиями кожи,
лица, страдающие инфильтративными и деструктивными заболе-
ваниями слизистых полости рта и носоглотки, одонтогенной гра-
нулемой, а также дети с длительно существующими себорейными,
лихеноидными поражениями кожи, с торпидно протекающими
лимфаденитами неясной этиологии. Обследование больного может
проводиться дерматологами и специалистами общей медицинской
сети, но должно завершаться заключением фтизиодерматолога.
Противотуберкулезные диспансеры должны осуществлять еже-
годные плановые осмотры лиц с повышенным риском заболевания
туберкулезом: детей и подростков в период «виража» туберкули-
новых реакций; контингенты детских учреждений для инфициро-
ванных детей; лиц, находящихся в контакте с бациллярными боль-
ными; взрослых и детей, состоящих под наблюдением противо-
туберкулезных учреждений в различных группах диспансерного
учета; лиц, ранее перенесших туберкулез независимо от локали-
заций, с гиперергическими реакциями на туберкулин, а также
работающих в неблагополучных по туберкулезу хозяйствах круп-
ного рогатого скота; своевременную госпитализацию всех впервые
выявленных больных туберкулезом, а также больных с активными
формами, обострениями и рецидивами заболевания. На врачебных
390
конференциях совместно с врачами общей лечебной сети противо-
туберкулезные диспансеры проводят разбор случаев выявления
больных с запущенными формами туберкулеза кожи.
Учитывая незначительную контагиозность больных туберкуле-
зом кожи и нежелательность их суперинфицирования, пребывание
их в стационарах вместе с бациллярными больными туберкулезом
легких недопустимо. В целях профилактики генерализации тубер-
кулезного процесса больные туберкулезом кожи должны лечиться
во внелегочных стационарах и санаториях.
Одним из основных разделов диспансерной помощи больным
туберкулезом кожи является организация правильного учета боль-
ных. Больные туберкулезом кожи учитываются в пятой группе
диспансерного учета. В группу V-a входят больные с активными
клиническими проявлениями. Они получают основной курс лече-
ния, который продолжается от 10 мес до 1—2 лет. В группу V-6
входят больные, у которых активные клинические проявления
кожно-туберкулезного процесса отсутствуют. Они находятся в ста-
дии видимого клинического излечения (ликвидация активных кли-
нических и морфологических проявлений кожно-туберкулезного
процесса). Таким больным проводится противорецидивное лече-
ние, которое для локализированных форм определяется 5 годами
с двумя курсами в год (всего 10 курсов) по 2 мес весной и
осенью и 3 годами для диссеминированных форм (6 курсов).
В группу V-в входят больные, у которых наступило клиническое
излечение (стойкая ликвидация активных клинических и морфоло-
гических проявлений кожно-туберкулезного процесса), подтвер-
жденное гистологическим исследованием. Активное диспансерное
наблюдение для больных этой группы продолжается в течение
5 лет с двукратным (в течение года) врачебным контролем, после
чего больные могут быть сняты с учета. В VII группу учета по
фтизиодерматологии могут быть отнесены следующие лица: пере-
болевшие той или иной формой туберкулеза кожи, получившие
полноценное противотуберкулезное лечение, снятые с учета с
клиническим излечением, но имеющие серьезные функциональные
и косметические дефекты, устранение которых требует пластиче-
ских и восстановительных операций. К последствиям туберкулез-
ного процесса (главным образом после перенесенной туберкулез-
ной волчанки и скрофулодермы) относятся рубцовые изменения
со стойким выворотом век (эктропион) с последующим развитием
конъюнктивита и дакриоцистита: мутилирующий процесс в тка-
нях носа, ведущий к разрушению кончика носа («птичий клюв»),
кожной и хрящевой перегородки, сужению или исчезновению
отверстий носа; рубцовые изменения тканей рта, дающие выражен-
ное сужение ротового отверстия; мутилирующий процесс, ведущий
к разрушению тканей ушной раковины и рубцовому сужению слу-
хового прохода; мутилирующие процессы на конечностях; слоно-
вость конечностей; процессы разрушения и рубцевания на слизи-
стых оболочках полости рта, десен, носоглотки, ведущие к нару-
шениям функции дыхания, приема пищи, глотания; любые другие
391
рубцовые, атрофические и прочие изменения, нарушающие внешний
облик человека и функцию его органов.
Лица, заболевшие той или иной формой туберкулеза кожи в
доантибактериальный период, у которых процесс потерял актив-
ность (регрессировал) без применения антибактериальных
средств, также подлежат отнесению в эту группу учета. Больные
VII группы учета должны регулярно посещать кабинет туберкулеза
кожи областного противотуберкулезного диспансера не реже 1 ра-
за в год.
Картотека. В кабинете туберкулеза кожи областного
(краевого, республиканского) противотуберкулезного диспансера
должна быть картотека, которая дублирует картотеку, имеющуюся
в туберкулезных кабинетах районных, городских противотуберку-
лезных диспансеров области (края, республики). В соответствии с
делением больных туберкулезом кожи на 4 группы диспансерного
наблюдения контрольные карты на этих больных тоже должны
быть разделены на 4 отдела: V-a, V-б, V-в и VII. В каждом из этих
отделов устанавливаются разделительные указатели по формам
туберкулеза кожи. Картотека, помимо разделения по диагнозам,
делится на группы: взрослых, подростков и детей. В контрольных
картах обязательно должны быть записаны: дата установления
диагноза (впервые диагностирован или ранее состоял на учете: где,
когда, сколько времени), а также проводимые больному лечебные
мероприятия; госпитализация в стационар или на санаторное
лечение; динамика процесса и его активность (группы учета).
Показания для снятия с учета больных туберкулезом кожи:
полное рассасывание туберкулезных очагов кожи или формирова-
ние на месте их окрепшего рубца; подтверждение заживления или
рубцевания этих очагов заключительным гистологическим исследо-
ванием биопсированной ткани; нормализация легочного или внеле-
гочного туберкулезного процесса, устанавливаемая клинике-лабора-
торно-рентгенологическим обследованием; проведение полноценной
антибактериальной и патогенетической терапии туберкулеза кожи
и констатирование клинического излечения; отсутствие в период
пятилетнего активного диспансерного наблюдения в группе
учета рецидивов туберкулезного процесса кожи.
Глава 11
ЛЕПРА (LEPRA)
Син.: болезнь Ганзена, ганзеноз, проказа, elephantiasis graeco-
rum, lepra arabum, болезнь Святого Лазаря и др. Лепра (от греч.
lepros — шероховатый, чешуйчатый, шелушащийся) — хрониче-
ское инфекционное заболевание, вызываемое микобактериями
лепры, характеризующееся гранулематозными поражениями кожи,
слизистых верхних дыхательных путей, периферической нервной
системы и внутренних органов.
По данным ВОЗ (1985), на земном шаре насчитывается около
12 млн больных лепрой. Болезнь регистрируется в большинстве
стран мира, однако к наиболее активным в эпидемиологическом
отношении зонам ее распространения относятся страны Юго-
Восточной Азии, Африки и Латинской Америки.
Лепра характеризуется чрезвычайно длительным (в среднем
5—7 лет и более) инкубационным периодом, неопределенностью
продромальных симптомов, чрезвычайным разнообразием ранних
клинических проявлений заболевания, отсутствием у больного в
течение длительного времени субъективных ощущений, что значи-
тельно затрудняет раннюю диагностику заболевания. Затягивающе-
еся на многие годы, но неизбежно прогрессирующее заболевание
при отсутствии или позднем начале лечения приводит, как прави-
ло, к глубокой инвалидизации больного в результате развития
невритов, параличей, контрактур, мутиляций, поражения слизис-
тых оболочек носоглотки, глаз, внутренних органов.
В распространении лепры решающую роль играют социальные
факторы (экономический уровень жизни, состояние общей и сани-
тарной культуры). Именно поэтому высокая заболеваемость леп-
рой сохраняется и даже растет в развивающихся странах, тогда
как в экономически развитых регионах она сведена до споради-
ческих случаев. Особенно показателен пример Норвегии, где еще
в середине XIX века эта болезнь была довольно распространенной
(2:1000 населения), но уже к концу XIX века благодаря целе-
направленному активному проведению социальных мероприятий
количество больных уменьшилось в десятки раз, а к середине
XX века лепра в Норвегии была полностью ликвидирована.
Лепра — несомненно одно из древнейших из известных заболе-
ваний человека. Описания ее встречаются в наиболее ранних пись-
менных памятниках человечества, таких как древнеиндийские веды
(XV—X века до н. э.) —под названием «kushta», папирус Эберса
и Бругша (XIII—X века до н. э.) — под названием «Uchedu», биб-
393
лейский Ветхий завет (VIII век до н. э.) — под собирательным
названием «Zaraath», древнекитайские книги (IX—V века до
н. э.) — под названием «Li-feng».
К VIII—V векам до н. э. относятся и первые профилактические
наставления против лепры, предусматривающие удаление больных
из общин, их изоляцию, расторжение браков, лишение других
гражданских прав.
Прародиной лепры считаются Юго-Восточная Азия и Централь-
ная Африка, откуда она распространилась по всему миру. В Евро-
пу лепра была первоначально завезена в V—III веке до н. э. из
Египта и Финикии (финикийская болезнь), но особенно ее распро-
странению способствовали походы римских войск под предводи-
тельством Александра Македонского (IV век до н. э.) и Помпея
(I век до н. э.) в страны Средней и Юго-Восточной Азии, а много
позже (X—XIII века н. э.) — крестовые походы. На американский
континент лепра была завезена европейцами, а также в результате
работорговли из Африки в XVI—XVIII веках.
На территорию нашей страны лепра проникла из сопредельных
государств в результате развития торговых отношений и военных
походов.
При этом сформировалось несколько сравнительно ограничен-
ных эндемических очагов в Средней Азии, Казахстане, Сибири,
Нижнем Поволжье, Закавказье, на Северном Кавказе, на Юге
Украины и в Прибалтике.
Поздние проявления лепры довольно полно были описаны еще
Галеном (II век н. э.), который выделял 6 основных признаков
болезни: воспаление кожи, язвы, утолщение нижних конечностей
(элефантиазис), «львиное лицо», выпадение волос и мутиляции.
Становление лепрологии как раздела медицинской науки отно-
сится к первой половине XIX в., когда во многих странах, в том
числе и в России, издаются научные труды, специально посвящен-
ные описанию клинических проявлений и распространения лепры
[Плахов Г., 1841; Danielssen D. С., Boeck С. W. et al., 1847]. Наибо-
лее важными событиями в истории лепрологии являются открытие
возбудителя лепры [Гансен Г. А., 1874], описание лепроминовой
пробы [Митсуда К., 1919], установление противолепрозной актив-
ности препаратов сульфонового ряда [Faget G., 1943], экспери-
ментальное заражение лепрой мышей [Shepard С., 1960] и броне-
носцев [Kirchheimer W., Storrs Е., 1971].
Значительный вклад в развитие лепрологии внесли отечествен-
ные ученые — В. И. Кедровский, А. А. Штейн, Н. А. Торсуев,
И. Н. Переводчиков и др.
Начиная с 1897 г. проводятся международные конгрессы, по-
священные лепре (последний XIII конгресс, Гаага, 1988 г.).
В 1931 г. была создана Международная ассоциация лепрологов, а
в 1953 г. — Комитет экспертов ВОЗ по лепре.
Этиология. Возбудитель лепры был открыт в 1874 г. норвеж-
ским ученым Г. А. Гансеном (1841 —1912). Изучая под микроско-
пом неокрашенный соскоб с поверхности разреза узла у больного
394
«туберозной» лепрой, Гансен отметил, что измененные тканевые
клетки, известные уже и ранее под названием «зернистых бурых
элементов», содержат огромное количество «палочек». Палочко-
видные бактерии Гансен выявил во всех без исключения исследо-
ванных узлах-лепромах, что и позволило ему сделать вывод о
бактериальной природе лепрозного процесса.
Микобактерии (М) лепры обычно имеют вид прямой или изо-
гнутой палочки с закругленными концами. Длина микобактерий
1—7 мкм, диаметр — 0,2—0,5 мкм. В лепрозных поражениях
наряду с гомогенно окрашенными встречаются также зернистые
формы. В теле зернистых палочек содержатся более плотные зер-
нышки (2—5), разделенные слабоокрашенными или неокрашен-
ными промежутками. Размножаются М лепры поперечным деле-
нием на 2—3 дочерние клетки и, оставаясь на месте, постепенно
образуют типичные скопления с характерным расположением
«сигарет в пачке».
В лепрозных поражениях микобактерии встречаются в разном
количестве (от единичных экземпляров до огромных скоплений
в виде шаровидных образований, представляющих собой как бы
чистую культуру возбудителя лепры).
Микобактерии лепры по форме, размерам, окраске, кислото-
стойкое™ и ряду других свойств близки к возбудителю туберку-
леза; они также не образуют типичных спор, лишены жгутиков,
грамположительны, могут окрашиваться различными анилиновыми
и люминесцентными красками.
Характерной особенностью возбудителя лепры является спо-
собность удерживать красный цвет карбол-фуксина после обра-
ботки разведенными кислотами и алкоголем (кислото- и спирто-
стойкость), что и обусловливает их элективную окраску по
Цилю—Нильсену. В определенных условиях микобактерии лепры
могут утрачивать кислотостойкость, оставаясь грамположитель-
ными. Длительное пребывание мазков на солнце или в растворе
формалина, воздействие антилепрозными препаратами приводят к
снижению и исчезновению кислото- и спиртостойкости М лепры.
Возбудитель лепры характеризуется значительным полиморфиз-
мом, что одни авторы предположительно связывают с циклом их
эволюционного развития, а другие — с процессами дегенерации.
Это свойство используют при количественой оценке результатов
бактериоскопических исследований, для чего раздельно подсчитыва-
ют количество гомогенных (равномерно окрашивающихся), фраг-
ментированных и зернистых форм М лепры. Показано, что в актив-
ных, прогрессирующих высыпаниях при клинически выраженной
лепре преобладают гомогенные с наличием делящихся форм мико-
бактерии, а в старых, регрессирующих — зернистые и фрагментиро-
ванные. Переход возбудителя лепры в зернистую форму и последую-
щее разрушение его до фуксинофильной пыли связывают с эффек-
тивным лечением.
Дискуссия о значении зернистых форм микобактерии лепры при-
обрела особую остроту в «сульфоновую эру», поскольку от решения
395
этой проблемы зависят такие важные для практической лепрологии
вопросы, как продолжительность лечения, показания к выписке
больных из лепрозориев, причины рецидивов и т. д. По-видимому,
мнение о том, что зернистость или фрагментация М лепры является
показателем их гибели, нельзя принимать безоговорочно, некоторые
негомогенно окрашивающиеся (зернистые, несплошные, гантеле-
видные, булавовидные и т. д.) формы возбудителя лепры (по анало-
гии с известными данными с возбудителем туберкулеза) остаются
жизнеспособными и могут играть решающую роль в распростране-
нии лепры и ее рецидивах у прекративших лечение или неаккуратно
лечащихся больных.
Ультраструктура М лепры принципиально не отличается от
строения других видов микобактерий. Наружный слой ее представ-
лен электронно-плотной бахромчатой микрокапсулой, толщина ко-
торой 5—15 нм. Установлено, что капсула в основном состоит из
мукополисахаридов; она в значительной степени определяет анти-
генность и формирование лекарственной устойчивости микобакте-
рий. Под микрокапсулой определяется 3-слойная клеточная стенка
(ее толщина 8—20 нм), состоящая из наружного осмиофобного
слоя и двух плотно прилегающих друг к другу осмйофильных слоев.
Клеточная стенка обладает выраженной ригидностью, устойчиво-
стью к деформации и химическим воздействиям; она хорошо сохра-
няется в тканях из лепрозных поражений даже при полном лизисе
цитоплазмы М лепры.
К внутренней поверхности клеточной стенки примыкает 3-слой-
ная цитоплазматическая мембрана, внутренний слой которой плотно
связан с цитоплазмой бактериальной клетки. В ней выявляется не-
большое число (1 — 2) мезосом, представляющих собой инвагинаты
в цитоплазму плазматической мембраны и характеризующихся вы-
раженным полиморфизмом (петлевидные, гроздевидные, трубча-
тые). Собственно цитоплазма представлена мелкогранулярным уме-
ренно электронно-плотным веществом, в котором находятся рибосо-
мы, небольшие электронно-плотные включения волютина, включе-
ния типа вакуолей (возможно, липоидные), крупные гомогенные
включения неизвестной природы, а иногда так называемые «споро-
подобные тельца».
В центре бактериальной клетки вдоль ее длинной оси находится
нуклеоид (ядро), который не имеет строго определенной формы, не
ограничен мембраной, представляет собой свободно «плавающий»
в цитоплазме конгломерат тонких, умеренно плотных нитей ДНК.
М лепры отличаются необычно длинным для бактерий циклом
размножения; время их генерации (скорость одного деления) —
около 12 сут.
Возбудитель лепры является облигатным внутриклеточным пара-
зитом и не культивируется на искусственных питательных средах.
В качестве приближенной экспериментальной модели лепры
человека длительное время использовали лепру крыс (лепра Сте-
фанского), вызываемую микобактериями крысиной лепры (некуль-
тивируемые, кислотостойкие, непатогенные для человека).
396
Первый положительный результат по прививке лепры животным
получен американским исследователем Ч. Шепардом в 1960 г., когда
ему удалось добиться ограниченного размножения микобактерий
лепры при заражении мышей в подушечку лапки. Однако у нормаль-
ных животных размножение было медленным, локальным, генерали-
зации процесса не происходило. Ее удалось достичь подавлением
естественного клеточного иммунитета мыши путем тимэктомии и
сублетальным облучением (около 900 Р). В этом случае у животных
появлялись узлы на лапках, носике, ушах, на хвосте и отмечались
поражения нервов. Инфекция усиливалась введением антилимфоци-
тарной сыворотки. Гистологическая картина поражений у животных
с генерализованной инфекцией была сходна с изменениями при
лепре у больного человека. По методу Шепарда стали успешно зара-
жать и других грызунов — крыс, хомяков.
Следующий крупный шаг в экспериментальной лепрологии был
сделан в 1971 г., когда американские исследователи W. F. Kirchhei-
mer, Е. Storrs сообщили об успешном заражении микобактериями
лепры 9-поясного броненосца (Dasypus novemcinctus Linn). При за-
ражении броненосцев большими дозами (до 10в) М лепры внутри-
венно у 80% броненосцев через 18—35 мес (а еще примерно у
10 % — позже) развивается генерализованный специфический про-
цесс с наличием в пораженных тканях громадного количества
(до 6 • 1012 '*) микобактерий. У этих животных, как и у человека, в
процесс вовлекаются кожа, лимфатические узлы, печень, селезенка,
периферическая нервная система. Но в отличие от человека у броне-
носца рано и интенсивно поражается легочная ткань. Клиническое
течение заболевания и морфологическая картина поражений у 9-по-
ясных броненосцев соответствуют полярному лепроматозному типу
лепры у человека.
Достижения в изучении экспериментальной лепры в последние
25 лет позволили значительно продвинуться в изучении биологиче-
ских свойств микобактерий, а также подойти к изготовлению диаг-
ностических и вакцинных препаратов. Так, использовавшийся ранее
в иммунологических реакциях in vitro и при постановке лепромино-
вой пробы классический лепромин, приготовленный из тканей чело-
веческих лепром, заменен лепромином А (из тканей, зараженных
лепрой броненосцев). Лепромин А является составной частью вак-
цины (лепромин А-(-вакцина БЦЖ), предложенной для профилак-
тики и лечения лепры. Установлено, что М лепры содержат 25—
40 % липидов, представляющих собой фосфатиды, жиры, воски.
Кроме того, бактериальные клетки содержат липопротеиды, нуклеи-
новые кислоты (ДНК, РНК), нуклеопротеиды, ферменты.
В составе М лепры описан безуглеводный липид — фтиоцерал-
димикоцерозат, отличающийся от липидов других микобактерий.
Установлено, что микобактерии обладают способностью продуциро-
вать внеклеточные липиды, а значительная часть обычного для дру-
гих видов микобактерий аланина у них заменена глицином. Подобно
другим микобактериям, М лепры могут утилизировать глицерин и
глюкозу в качестве источников углеводов и имеют специфический
397
фермент О-дифенилоксидазу (ДОФА-оксидаза), описанный
R. Prabhakaran (1967, 1973). У них выделен и идентифицирован
фенольный гликолипид с наличием уникального трисахарида, на
основе которого в ряде лабораторий мира, в том числе и в нашей
стране предпринимаются успешные и многообещающие попытки
создания специфического искусственного антигена, а следователь-
но, и искусственной профилактической вакцины.
Электронно-цитохимическими методами [Ющенко А. А., Мас-
лов А. К., 1978; Маслов А. К., 1982] показано наличие на мем-
бранных структурах возбудителя лепры основных окислительно-
восстановительных ферментов: пероксидазы, цитохромоксидазы;
НАД-Н-диафоразы и сукцинатдегидрогеназы, что свидетельствует
о принадлежности М лепры к аэробам и о наличии у них автоном-
ных систем дыхания. Эти положения получили еще большее под-
тверждение в последнее время, когда у М лепры был описан еще
один фермент — супероксиддисмутаза, входящий в ферментную
систему детоксикации у организмов, утилизирующих кислород
[Kusunose Е. et al., 1980].
Практическое значение всех этих исследований по изучению
биологических свойств М лепры заключается в том, что они не
только подтверждают перспективность дальнейших попыток их
культивирования вне организма-хозяина, но и дают определенные
ориентиры для выбора подходов к решению этой проблемы.
Антигенную структуру микобактерий изучали иммунохимиче-
скими и иммунологическими методами. В 1970 г. М. Абе выделил
2 антигена микобактерии: термостабильный (полисахарид) и
термолабильный (белок, высокоспецифичный для М лепры). Осо-
бенностью антигенных свойств М лепры является более выражен-
ная по сравнению с другими микобактериями способность суспен-
зий микроорганизмов усиливать клеточные иммунные реакции без
добавления адъювантов.
Медленное размножение в подушечке лапки мыши является
отличительной чертой М лепры и используется, как и определение
ДОФА-оксидазы, для их идентификации. Заражение мышей в по-
дошву лапы широко используют для определения жизнеспособ-
ности микобактерии лепры при лечении различными препаратами,
при испытании новых противолепрозных средств, а также для
установления устойчивости М лепры во внешней среде. Например,
с помощью этого теста установлено, что микобактерии лепры оста-
ются жизнеспособными после 10—12 лет хранения лепром при
комнатной температуре в 40 % формалине [Ющенко А. А., 1984].
И это, очевидно, не предел выживаемости М лепры в глицерине,
ибо более длительные исследования не проводились.
Классификация. В настоящее время в различных странах ис-
пользуют 2 основные классификации лепры — «мадридскую» и
Ридли — Джоплинга. По принятой в 1953 г. мадридской класси-
фикации выделяются 2 полярных типа лепры: лепроматозный и
туберкулоидный, и 2 промежуточные группы: недифференцирован-
ная и пограничная (син.: диморфная).
398
X Международный конгресс, посвященный лепре [Берген,
1973], рекомендовал применять для научных и практических целей
классификацию Ридли — Джоплинга, развивающую по сути мад-
ридскую классификацию с учетом новейших достижений в изуче-
нии иммунологии лепры. В основе этой классификации лежит де-
ление больных в зависимости от состояния их иммунологической
реактивности, отражающейся в клинических проявлениях, а также
в данных гистопатологических, бактериоскопических и иммуноби-
ологических исследований. Лепрозный процесс рассматривается
как непрерывный иммунологический спектр между туберкулоид-
ным и лепроматозным типами лепры, называемыми полярными
группами, с выделением первоначально 3 промежуточных (погра-
ничных) групп. В настоящее время по классификации Ридли —
Джоплинга выделяют следующие формы:
ТТП — полярный туберкулоидный тип лепры (син.: полярный
туберкулоид);
ТТС — субполярный туберкулоидный тип (субполярный тубер-
кулоид) ;
ПТ — погранично-туберкулоидный тип (пограничный тубер-
кулоид) ;
ПП — пограничная лепра (пограничная форма);
ПЛ — погранично-лепроматозная форма (пограничный лепро-
матоз);
ЛД. — субполярный лепроматозный тип (субполярный лепро-
матоз);
ЛЛп — полярный лепроматозный тип лепры (полярный лепро-
матоз);
Н — недифференцированная форма.
В специальной литературе часто ТТП и ТТС объединяют под
общим названием «туберкулоидный тип лепры» (ТТ), а ЛД, и
ЛД. — под названием «лепроматозный тип лепры» (ЛЛ).
Кроме того, учитывая то, что по эпидемиологической значи-
мости и по ряду других показателей (реакция на лепромин, кура-
бельность, характер возможных осложнений и др.) формы ЛД,,
ЛД,, ПЛ и ПП, с одной стороны, и ПТ, ТТС и ТТ„ — с другой, во
многом сходны, для них широко используют условные групповые
названия — «лепроматозные формы» и «нелепроматозные формы».
Все формы отличаются характером клинических проявлений,
течением, прогнозом, а также эпидемиологической значимостью.
Для правильной классификации процесса у больного необходи-
мо прежде всего тщательно изучить характер очагов поражений,
их число, расположение, степень нарушения чувствительности и
состояние роста пушковых волос, наличие в высыпаниях и в соско-
бах со слизистой оболочки носа М лепры, а также результаты ре-
акции на лепромин. Наиболее точно при клиническом обследова-
нии больного диагностируют лепроматозный тип лепры. При уста-
новлении остальных групп окончательный диагноз возможен толь-
ко на основе результатов гистолопЛеского исследования. Выявля-
емые гистологически изменения иммунологической реактивности
399
опережают изменения в клинической картине на недели, месяцы,
а иногда и на 1—2 года.
Основными гистологическими критериями для классификации
по Ридли — Джоплингу являются: 1) клеточный состав грануле-
мы: наличие и соотношение гистиоцитов, эпителиоидных и пени-
стых клеток, т. е. клеток, содержащих М лепры; 2) количество
микобактерий (определяется по 6,5-балльной шкале); 3) число и
расположение лимфоцитов; 4) инфильтрация нервов; 5) инфильт-
рация субэпидермальной зоны.
Патогенез. При ТТ лепры гранулема, характеризующаяся чет-
кими фокусами эпителиоидных клеток, окруженных лимфоидным
бордюром, достигает непосредственно эпидермиса. Выявляются
признаки гиперчувствительности (глубокая эрозия эпидермиса,
утолщение и центральный казеоз кожных нервов, фибриноидный
некроз в дерме, наличие гигантских клеток типа клеток Лангхан-
са). Мелкие нервы, как правило, не обнаруживаются, они разру-
шены или резко инфильтрированы. Микобактерии выявить обыч-
ными методами не удается. Такая же картина выявляется и при
ПТ, но с наличием в некоторых местах непораженной субэпидер-
мальной зоны, а также утолщенных нервов и единичных микобак-
терий. Признаки гиперчувствительности менее отчетливы. При ПП
гранулема содержит довольно большое количество возбудителей,
состоит из диффузно расположенных эпителиоидных клеток, поч-
ти без лимфоцитов и без гигантских клеток. Субэпидермальная
зона не инфильтрирована. Нервы выявляются легко, отмечается
пролиферация шванновских клеток. При Л Л гранулема состоит из
макрофагов, в которых намечается вакуолизация. Обычно выявля-
ют скопления лимфоцитов и небольшие количества эпителиоидных
клеток. Субэпидермальная зона не инфильтрирована. Нервы незна-
чительно инфильтрированы, отмечают расслоение периневрия.
В гранулеме большое количество диффузно располагающихся
М лепры (без скоплений типа шаров). При полярном лепроматозе
(ЛЛ„) инфильтрат состоит из макрофагов, находящихся на раз-
ных стадиях жирового перерождения, вплоть до пенистых клеток,
и небольшого количества диффузно расположенных лимфоцитов.
Нервы чаще не изменены, без инфильтрации. Огромное количе-
ство возбудителей, их скопление типа «globi».
ЛД. и ТТС — группы, выделяют в основном для научно-исследо-
вательских целей. ЛД. (субполярный лепроматоз) характеризуется
менее выраженной, чем при ЛД, (полярный лепроматоз), пенис-
тостью цитоплазмы. В гранулеме встречаются лимфоциты и плаз-
матические клетки (клеточная мозаичность). Нервы без ин-
фильтрации, но утолщены, может наблюдаться расслоение пери-
неврия. Большое количество М лепры. При ТТС (субполярный
туберкулоид) в гранулеме число гигантских клеток несколько
меньше, могут встречаться М лепры.
Если при несомненном диагнозе лепры (гипопигментные пятна,
снижение чувствительности, наличие М лепры) выявляется ин-
фильтрат простой воспалительной структуры (без гранулемы) и,
400
следовательно, по гистологическим критериям процесс не соответ-
ствует ни одной из описанных групп, то заболевание относят к
«недифференцированной» лепре. Существует мнение, что недиф-
ференцированная лепра является наиболее ранним проявлением
болезни. В дальнейшем процесс, как правило, трансформируется
в направлении одного из полюсов лепры (туберкулоидного или
лепроматозного).
О непрерывности спектра лепры между «полюсами» свидетель-
ствуют факты «перехода» заболевания из одной подгруппы в
другую. Выявляются следующие тенденции: 1) при отсутствии ле-
чения процесс, как правило, прогрессирует в направлении лепрома-
тозного полюса; 2) успешная химиотерапия сопровождается тен-
денцией «движения» к туберкулоидному полюсу; 3) у больных ПП,
ПЛ и ПТ процесс неустойчив, в то время как у больных полярны-
ми типами ЛЛ и ТТ в большинстве случаев он характеризуется
стабильностью.
В классификацию Ридли — Джоплинга не укладываются такие
разновидности лепроматозного типа лепры, как «лепра Lucio» и
гистоидная лепра, поэтому эти термины продолжают использовать
в научной и практической деятельности.
В естественных условиях лепрой болеет только человек. Из
всех изученных видов животных лишь у представителей семейства
броненосцев (Dasypodidae) при введении очень больших доз
М лепры удалось получить генерализованную инфекцию [Kirchhei-
mer W., Storrs E., 1971]. Активность клеточных реакций иммунно-
го ответа на М лепры (по данным РБТЛ, теста торможения мигра-
ции лейкоцитов, лепроминовой пробы и др.) постепенно снижается
от ТТ к ЛЛ, отражая соответственно наивысшую и наименьшую
степени иммунологической устойчивости к заболеванию.
Одним из первых научных достижений, активизировавших изу-
чение иммунологических основ восприимчивости к лепре, явилась
предложенная в 1919 г. японским исследователем К. Mitsuda
внутрикожная лепроминовая проба.
Оказалось, что у больных ЛЛ поздняя лепроминовая реакция
всегда отрицательная, у больных ТТ, а также у большинства
(80—98 %) здоровых людей она положительная; у больных ПП
лепроминовая проба может быть как положительной, так и отри-
цательной. У больных ТТ во время острой реакции лепромино-
вая проба может временно давать отрицательный результат или
же становиться устойчиво отрицательной, если происходит
трансформация в сторону ЛЛ. Установлено, что реакция может
изменяться в процессе трансформации типов лепры, а также под
влиянием других факторов (лечение, вакцинация и т. д.). Следова-
тельно, диагностического значения лепроминовая проба не имеет.
Она характеризует состояние иммунобиологической реактивности
макроорганизма по отношению к возбудителю лепры и поэтому
имеет определенное дифференциально-диагностическое значение,
помогает в установлении типа лепры, а также имеет прогностиче-
ское значение.
401
У большинства людей, дающих положительную реакцию на
лепромин, относительный естественный иммунитет к лепре харак-
теризуется достаточно высокой напряженностью. Только у незна-
чительной части лиц этого контингента при «умеренном» инфици-
ровании М лепры развиваются в последующем клинические прояв-
ления заболевания, преимущественно ТТ тип. У лиц, не реагирую-
щих на лепромин, чаще развиваются ЛД,, ПЛ или ПП формы
лепры.
У большинства лепроминопозитивных индивидуумов начинаю-
щийся ТТ-процесс заканчивается самоизлечением, у части — раз-
вивается устойчивый ТТ тип болезни, у другой части
больных процесс может трансформироваться в ПТ или ПП формы
лепры. У лиц с отрицательной реакцией Митсуда процесс обычно
с самого начала развивается по типу субполярного или полярного
лепроматоза.
Вирулентность М лепры не оказывает сколько-нибудь значи-
мого воздействия на характер заболевания. Это подтверждается
тем, что в одной и той же семье при наличии одного и того же
источника и одинаковых условий у контактных лиц могут разви-
ваться различные типы лепры с различным исходом.
Иммунитет к лепре является относительным. При часто повто-
ряющемся массивном суперинфицировании заболевание лепрой в
любой форме может быть вызвано и на фоне существующего есте-
ственного и приобретенного иммунитета. С другой стороны, в не-
эндемических зонах встречаются больные, для которых источник
инфекции установить не удается ввиду кратковременности и слу-
чайности контакта и которые, следовательно, должны расценивать-
ся как лица с повышенной восприимчивостью к лепре.
Относительный естественный иммунитет может быть в опреде-
ленной мере усилен путем введения вакцины БЦЖ, т. е. путем
создания приобретенного «инфекционного» антимикобактериаль-
ного иммунитета. На этом основании высказывалось предположе-
ние, что лица, перенесшие первичный туберкулезный комплекс,
становятся менее восприимчивыми к лепрозной инфекции. Степень
реакции на лепромин может быть усилена также повторными вве-
дениями самого лепромина («стерильный» иммунитет). Поэтому
лица с сомнительной или даже отрицательной реакцией при первой
пробе могут дать положительные результаты при последующих
пробах.
Эволюция нелеченых больных ПТ, ПП, ПЛ в направлении суб-
полярного и полярного лепроматоза, по-видимому, свидетельствует
об угнетающем действии больших количеств микобактерий на кле-
точный иммунитет. Этому также способствуют сопутствующие
заболевания, особенно вирусные, психические перенапряжения,
переохлаждение организма, недоедание и др.
«Спектр» всех иммунологических состояний не укладывается
в определенные рамки от ТТ до ЛЛ. Незаболевшие в аналогичных
условиях инфицирования, а также лица, у которых процесс огра-
ничивается субклинической стадией инфекции или самоизлечива-
402
ется на самых ранних стадиях клинических проявлений ТТ, рас-
сматриваются как группа с наиболее выраженным иммунитетом.
Изучаемые иммунологическими методами особенности больных
ЛЛ указывают на недостаточность реакций клеточного иммуните-
та к М лепры. Лимфоциты от больных ЛЛ в присутствии антигенов
М лепры не дают реакции бласттрансформации (при ТТ РБТЛ-
положительна), не активируют макрофаги и не тормозят их мигра-
цию. Таким образом, неактивизированные макрофаги не ограничи-
вают распространение инфекции, а М лепры размножаются имен-
но в макрофагах.
Таким образом, у больных ЛЛ выявляется анергия к М лепры,
не сопровождаемая отчетливым снижением общей реактивности.
Большинство исследователей считают, что анергия к М лепры
у больных ЛЛ и у лепроминонегативных здоровых индивидуумов
может быть обусловлена или наличием генетического дефекта, или
развитием толерантности в результате предшествующего контакта
с перекрестно реагирующими микобактериями или с М лепры.
Предпринималось немало попыток связать восприимчивость к
лепре и развитие ЛЛ с определенными иммуногенетическими
показателями. Наиболее широко проводилось изучение генетиче-
ского полиморфизма больных лепрой по группам крови, а в по-
следнее время — изучение антигенов гистосовместимости и иссле-
дования на близнецах.
Угнетение клеточных реакций иммунитета при ЛЛ сочетается
с высокими титрами гуморальных антител, в том числе и антими-
кобактериальных, которые, по мнению большинства авторов, за-
щитного значения не имеют. При ТТ антитела к М лепры не обна-
руживаются. Увеличение фракции иммуноглобулинов обусловлено
главным образом увеличением количества IgA и IgM.
Наряду с иммуноглобулинами в сыворотке больных ЛЛ выявля-
ются различные аутоантитела, включая ревматоидный фактор,
антитиреоглобулины, антинуклеарные антитела, криоглобулины,
цитотоксические и другие антитела. Сыворотки больных ЛЛ иногда
дают ложноположительную реакцию Вассермана на сифилис.
Как правило, увеличено общее содержание сывороточных бел-
ков (при снижении количества альбуминов), может быть увели-
чена СОЭ, повышен титр С-реактивного белка. Особенно выражены
эти отклонения в реактивной фазе ЛЛ. При этом какой-либо спе-
цифической для лепры серологической реакции не существует.
В последнее время предпринимаются попытки использовать реак-
цию иммунофлюоресценции с М лепры для выявления противо-
лепрозных антител, однако ввиду трудности получения М лепры,
очищенных от тканей организма-хозяина, эти работы не получают
широкого развития.
Клинические проявления лепры. Наиболее отчетливыми разли-
чиями характеризуются проявления полярных типов лепры. ТТ от-
личается более легким по сравнению с ЛЛ течением, лучше под-
дается лечению. Поражаются в основном кожа (четко очерченные
пятна и бляшки) и периферические нервы, реже — некоторые
403
внутренние органы. М лепры выявляются с трудом и только при
гистологическом исследовании, а в соскобе с кожных поражений
и слизистой носа, как правило, их не обнаруживают. Лепромино-
вая проба положительная.
ЛЛ отличается большим разнообразием клинических проявле-
ний на коже (нечеткие пятна, инфильтраты, бляшки, узлы), ран-
ним вовлечением в процесс слизистых оболочек и внутренних ор-
ганов и более поздним — нервной системы, труднее поддается
лечению. Во всех высыпаниях выявляются громадные количества
М лепры. Лепроминовая реакция отрицательная. В клинике дру-
гих разновидностей лепры (ПТ, ПП, ПЛ) в той или иной мере
выражены признаки обоих полярных типов (пограничные состоя-
ния).
Кожные проявления при ТТ в зависимости от стадии
их развития к моменту обследования больного имеют вид одиноч-
ных пятен или папулезных высыпаний, бляшек, бордюрных и сар-
коидных элементов. Пятна при ранней ТТ лепре — гипопигмент-
ные или слегка эритематозные, с четко очерченным краем. В даль-
нейшем по краю пятна появляются мелкие полигональные краснова-
то-синюшные плоские папулы. Как правило, они быстро сливаются в
сплошные, несколько возвышающиеся над уровнем кожи воспали-
тельные бляшки, трансформирующиеся впоследствии в бордюрные
элементы. Поверхность бляшек может быть гладкой или же при
мелкопапулезном строении бляшек неровной («шагреневая ко-
жа»), иногда шелушится. Наиболее типичным, «классическим»,
проявлением развитой ТТ лепры является большая эритематозная
бляшка, с резко очерченным валикообразно приподнятым краем и
склонностью к периферическому росту (рис. 90). По мере увеличе-
ния бляшки в центральной ее части развиваются явления регресса,
выражающиеся в уплощении, атрофии и гипопигментации кожи.
Это приводит к появлению больших кольцевидных, сливающихся
бордюрных элементов (так называемый фигурный туберкулоид) с
эритематозной каймой и слегка запавшим центром (рис. 91).
Ширина «бордюра» может колебаться от нескольких миллиметров
до 2—3 см и более. Наружный край его приподнят, внутренний —
уплощен. Размеры бляшек и бордюрных элементов могут быть
различными — от размеров мелкой монеты до элементов, захваты-
вающих большую часть спины, груди, поясницы. Располагаются
эти элементы асимметрично на любом участке тела.
Характерным признаком высыпаний ТТ лепры является раннее
нарушение в их зоне тактильной, температурной и болевой чувст-
вительности. Иногда вокруг бляшек и бордюрных элементов выяв-
ляется гипопигментация кожи в виде узкого ободка.
Одной из разновидностей проявлений ТТ являются саркоидные
(люпоидные) образования, локализующиеся обычно на лице и ко-
нечностях, реже — на туловище. Саркоидоподобные узлы (бугор-
ки) размером 0,5—1,5 см, с четкими границами и гладкой поверх-
ностью, красно-бурого цвета имеют склонность к группировке.
При регрессе всех элементов ТТ лепры на их месте остаются
404
гипопигментные пятна, а в случае более глубокой инфильтрации —
атрофия кожи.
Кожные высыпания при ПТ по внешнему виду,
расположению и состоянию чувствительности очень напоминают
проявления ТТ. Но при этом пятна и бляшки при ПТ обычно
меньших размеров, множественны, встречаются элементы с четкими
границами. Как правило, имеются утолщения периферических нер-
вных стволов, нарушения чувствительности, потоотделения и роста
пушковых волос, но по сравнению с ТТ все эти проявления менее
выражены. Реакция на лепромин слабоположительная ( + ) или по-
ложительная (++).
Кожные проявления при ПП объединяют в себе
черты как ТТ, так и ЛЛ и в то же время характеризуются типич-
ными, не присущими полярным типам признаками. На ранней
стадии развития процесса — это многочисленные асимметричные
эритематозные пятна, часто неправильной формы, с нечеткими
границами или же бляшки с отчетливым пологим краем и более
выпуклой центральной частью. Характерным для ПП является на-
личие «пробитых» или «штампованных» пятен и бляшек, получив-
ших в литературе название «вид сыра», «дырочек сыра». Такая
картина обусловлена появлением в центральной части высыпания
четко очерченных участков регресса с гипопигментированной или
нормальной по цвету кожей. В случае бляшек кожа в участках
регресса уплощается, элемент сначала принимает вид перевернуто-
го блюдца, а затем вызвышающихся над уровнем кожи округлых
или полосовидных бордюрных элементов с четким обрывистым
внутренним краем (в отличие от бордюрных элементов ТТ, где
внутренний край уплощен); как правило, такие бордюрные прояв-
ления ПП приобретают фиолетовую окраску. Поблизости от пят-
нистых и бордюрных элементов обычно выявляются гроздья мел-
ких высыпаний — сателлитов.
При ПП довольно рано развиваются множественные асиммет-
ричные поражения периферических нервных стволов. В самих вы-
сыпаниях выявляется умеренное нарушение чувствительности. По-
тоотделение на высыпаниях обычно не нарушено, пушковые воло-
сы частично сохранены. Лепроминовая проба, как правило, отрица-
тельная, но может быть и слабоположительной.
Кожные проявления при ПЛ. Как и при полярном
лепроматозе, основными элементами клинических проявлений ПЛ
являются пятна, не имеющие отчетливых границ, папулы, бляшки,
диффузные инфильтраты и узлы. Основной отличительной особен-
ностью ПЛ является наличие «пробитых», «штампованных» высы-
паний и округлых или полосовидных бордюрных элементов с при-
поднятым внутренним краем. Характерно также наличие неболь-
ших вдавлений в центре некоторых папул и бляшек.
Высыпания не столь множественны, как при ЛЛ, нередко рас-
полагаются асимметрично. На некоторых элементах уже в ранней
стадии выявляется снижение чувствительности. Функция потовых
желез не страдает, чаще не нарушен и рост пушковых волос. Как
405
и в случае пограничной лепры (ПП), при ПЛ обычно выявляется
утолщение периферических нервных стволов, что в отличие от ЛЛ
может предшествовать появлению на коже высыпаний.
При ПЛ не развиваются такие типичные для ЛЛ проявления,
как выпадение бровей и ресниц, деформация носа, поражение глаз,
изъязвление слизистой носа, facies leonina. Реакция на лепромин
всегда отрицательная. При бактериоскопии во всех кожных высы-
паниях в большом количестве выявляются М лепры.
Кожные проявления при Л Л. Начальные высыпа-
ния ЛЛ на коже чаще всего имеют вид многочисленных эритема-
тозных, эритематозно-пигментных или эритематозно-гипопигмент-
ных пятен, характерными признаками которых являются симмет-
ричное расположение, небольшие размеры и отсутствие нечетких
контуров (рис. 92).
Наиболее часто пятна локализуются на лице, разгибательных
поверхностях кистей, предплечий и голеней, а также на ягодицах.
Поверхность их гладкая, блестящая. Со временем первоначальный
красный цвет пятен приобретает бурый или желтоватый (медный,
ржавый) оттенок. Чувствительность и потоотделение в пределах
пятен не нарушены.
В течение длительного времени (месяцы, годы) пятна могут
оставаться без заметных изменений, а затем в некоторых случаях
исчезают, но чаще трансформируются в инфильтраты или лепромы
(рис. 93). При развитии инфильтрата пятна приобретают вид
ограниченных бляшек или значительных участков поверхностной
инфильтрации кожи. Границы инфильтратов расплывчатые, посте-
пенно переходящие во внешне неизмененную кожу.
Поверхность инфильтратов обычно имеет бурый или синюшно-
бурый оттенок, что обусловлено развитием пареза сосудов и гемо-
сидерозом.
Инфильтрация кожи сопровождается усилением функции саль-
ных желез, в результате чего кожа в области пятен и инфильтра-
тов становится «жирной», блестящей, лоснящейся. Расширение
фолликулов пушковых волос и выводных протоков потовых желез
придает коже вид апельсиновой корки. Потоотделение в области
инфильтратов сначала снижается, а в поздних стадиях лепры
полностью прекращается. Поверхностные виды чувствительности
(тактильная, болевая, температурная) долгое время остаются не-
нарушенными. На ранних стадиях процесса не нарушается и
рост пушковых волос. При давности процесса в 3—5 лет и более
наблюдается выпадение бровей (начиная с наружной стороны) и
ресниц, а также выпадение пушковых волос на участках инфиль-
трации кожи. В дальнейшем иногда могут выпадать волосы боро-
ды, усов, а в случаях очень запущенного процесса и волосы на
голове.
При диффузной инфильтрации кожи лица естественные морщи-
ны и складки углубляются, надбровные дуги резко выступают, нос
утолщен, щеки, губы и подбородок имеют дольчатый вид (рис. 94).
Инфильтрация кожи лица при ЛЛ, как правило, не переходит
406
на волосистую часть головы. Не развиваются инфильтраты также
на коже локтевых и подколенных сгибательных поверхностей,
внутренней части век и подмышечных впадин — это так называе-
мые иммунные зоны. Установлено, что, хотя видимые проявления
лепры здесь отсутствуют, при распространенном процессе в «им-
мунных» зонах выявляются гистопатологические изменения, ха-
рактерные для ЛЛ.
В области инфильтратов часто уже на ранних стадиях появля-
ются одиночные или множественные бугорки и узлы (лепромы),
размеры которых варьируют от 1—2 мм до 2—3 см (рис. 95).
Лепромы чаще локализуются на лице (надбровные дуги, лоб,
крылья носа, подбородок, щеки), мочках ушей, а также на коже
кистей, предплечий, голеней, реже — бедер, ягодиц, спины. Они
резко отграничены от окружающей кожи, безболезненны.
Лепромы могут быть дермальными или гиподермальными, что
зависит от глубины залегания инфильтрата. Гиподермальные ле-
промы вначале выявляются только пальпаторно, но в дальнейшем
они достигают дермы и становятся видимыми. Дермальные лепро-
мы вначале имеют вид овальных папул, постепенно превращаясь в
бугорки, возвышающиеся в виде полушарий над уровнем кожи.
Поверхность их обычно имеет красновато-ржавый цвет, кожа на-
пряжена, гладкая, лоснится, часто испещрена телеангиэктазиями,
иногда шелушится. Развившиеся лепромы могут длительное время
оставаться без изменений. Консистенция лепром вначале плотно-
эластичная, в дальнейшем становится более мягкой, а в редких
случаях фиброзного перерождения — очень плотной. Иногда они
подвергаются рассасыванию, оставляя после себя пигментирован-
ное, несколько запавшее пятно. Наиболее частым исходом лепро-
мы при отсутствии противолепрозного лечения является изъязвле-
ние. Как правило, процесс изъязвления развивается вяло, торпид-
но, без выраженных воспалительных явлений, он поверхностен и
заканчивается образованием небольшого слабопигментированного
рубца. Реже наблюдается быстрый распад лепром, начинающийся
как с периферии, так и с центра узла, с образованием неглубо-
ких, длительно незаживающих язв, с крутыми, а иногда подрыты-
ми краями. Язвы могут сливаться, образуя обширные язвенные
поверхности. Края язв обычно инфильтрированы, несколько воз-
вышаются над окружающей кожей, могут быть болезненными, но
впоследствии становятся омозолелыми. Дно язв покрыто серова-
то-желтым налетом. После заживления язв остается ровный, слег-
ка запавший, гипохромический, а иногда неровный келоидный
рубец.
Встречаются также стертые и атипичные формы ЛЛ. К первым
относятся одиночные пятна, инфильтраты и лепромы (абортивное
течение), а также очень мелкие лепромы, развившиеся вокруг фол-
ликулов пушковых волос («фолликулярные лепромы»). Из атипич-
ных проявлений ЛЛ описаны ихтиозиформные, склеродермоформ-
ные, пеллагроидные, эризипелоидные, лихеноидные, герпетиформ-
ные высыпания, гистоидная лепра и лепра Лючио.
407
Гистоидной лепрой называют разновидность ЛЛ, ос-
новным морфологическим субстратом которой являются веретено-
образные гистиоциты, содержащие огромное количеством М леп-
ры. Клинически гистоидная лепра характеризуется особой чет-
костью границ и обрывистыми краями элементов (бляшек и уз-
лов), на которых нередко бывают шелушение, точечные вдавления
в центре.
Лепра Лючио (син:. лепра Лючио — Альварадо, диффуз-
ная ЛЛ, диффузная лепра Лючио — Латапи, пятнистая диффузная
лепра) впервые описана в Мексике R. Lucio, I. Alvarado в 1852 г. и
подробно изучена F. Latapi (1938). Это распространяющаяся на
всю поверхность тела диффузная ЛЛ без отдельных пятен, бляшек
и лепром. Кожа становится блестящей и напряженной, как при
склеродермии. Волосяной покров иногда отсутствует. Диффузная
инфильтрация лица («лунообразное лицо»), хриплый голос, отеки
ног напоминают микседему. Диагноз решает выпадение бровей и
ресниц, а главное — наличие М лепры. Лепра Лючио характеризу-
ется слабовыраженной воспалительной реакцией и васкулитом,
сопровождающимся тромбозом кожных кровеносных сосудов, что
приводит к обширным изъязвлениям кожи. Васкулит, встречаю-
щийся при других формах лепры, обычно не сопровождается тром-
бозом. Происхождение тромбоза при лепре Лючио еще не получи-
ло объяснения. Лепра Лючио, сопровождаемая обширными изъяз-
влениями, называется лепрой Св. Лазаря. На поздних стадиях
лепры Лючио развивается «ихтиоз». Встречается также так называе-
мая сливная пятнистая ЛЛ, когда едва заметные гипопигментиро-
ванные или эритематозные пятна, быстро сливаясь, образуют еди-
ное пятно, покрывающее всю кожу, за исключением «иммунных»
зон. Во всех этих случаях решающим в диагностике заболевания
является бактериоскопическое исследование скарификатов пора-
женной кожи: при ЛЛ в них всегда обнаруживается большое коли-
чество М лепры.
Во всех случаях ЛЛ имеются поражения слизистых оболочек
носа, а в запущенных случаях — слизистых полости рта, гортани,
спинки языка, красной каймы губ. Ринит, носовые кровотечения
нередко отмечают еще до появления кожных проявлений лепры.
Слизистая оболочка носа выглядит гиперемированной, сочной, ис-
пещрена небольшими эрозиями. В дальнейшем появляются лепро-
мы, инфильтрация, массивные корки, резко затрудняющие носовое
дыхание. Распад лепром, расположенных на хрящевой перегородке
носа, приводит к перфорации ее и деформации носа. В очень запу-
щенных случаях встречается изъязвление лепром на слизистой не-
ба. Поражение области голосовых связок может привести к резко-
му сужению голосовой щели, афонии.
При ЛЛ, так же как и при других формах лепры, обычно на-
блюдается изменение ногтей. Они становятся тусклыми, сероваты-
ми, утолщенными, изрезанными продольными бороздками, ломки-
ми, легко отслаиваются, крошатся.
Периферическая нервная система (ПНС) по-
408
ражается при всех разновидностях лепры. Особенностью лепроз-
ных невритов является их восходящий характер и «островковый»
тип расстройств чувствительности, что обусловлено разрушением в
первую очередь нервных окончаний в очагах высыпания лепры,
поражением кожных веточек нервов и отдельных стволов ПНС.
Обычно нервные стволы поражаются вначале в определенных уча-
стках, считающихся более уязвимыми для М лепры (участки
предилекции): локтевой нерв — в области срединного мыщелка и
на запястье, срединный нерв — над запястным каналом, луче-
вой нерв — на запястье и немного выше локтя, задний большебер-
цовый нерв — на сгибательной связке, подколенный нерв — в мес-
те сгибаний шейки малоберцовой кости, лицевой нерв — на участ-
ке пересечения скулового отростка верхней челюсти, большой уш-
ной нерв — в месте пересечения им грудиноключично-сосцевидной
мышцы. Чаще всего инвалидность при лепре обусловливается
именно поражением ПНС.
Обострения (реактивные фазы) лепры. При
всех разновидностях лепры могут наблюдаться острые или под-
острые активации процесса (син.: реакции, реактивные фазы, обо-
стрения). Несмотря на неоднократные попытки унифицировать
описания реактивных состояний при лепре, общепринятой класси-
фикации их не существует. Чаще различают два типа реакций:
1) реакции, сопровождающиеся трансформацией болезни в другую
классификационную группу (так называемые пограничные реак-
ции), и 2) реакции, не сопровождающиеся трансформацией про-
цесса. Пограничные реакции могут развиваться у больных ТТ,
ПТ, ПП, ПЛ и ЛЛС (кроме ЛЛ) и делятся на «восходящие» (син.:
обратные, оборонительные, реверсивные — reversal reaction), при
которых происходит трансформация в направлении ТТ, и на «ни-
сходящие», сопровождающиеся сдвигами в направлении ЛЛ. Во
второй группе реакций выделяется обострение типа лепрозной уз-
ловатой эритемы (ЛУЭ) —erythema nodosum leprosum (ENL),
встречаемое только у больных ЛЛ и ПЛ. Нередко реакции носят
характер «рожистого воспаления».
Основными признаками развития пограничной реакции являют-
ся быстрое изменение внешнего вида некоторых или всех кожных
высыпаний (покраснение, напряженность, блеск), местное, а иног-
да и общее повышение температуры, болезненность нервных ство-
лов или зоны иннервации пораженного нерва, отеки конечностей
и лица. Процесс обострения распространяется также на лимфати-
ческие узлы, слизистые оболочки носа и рта, глаза, некоторые
внутренние органы. Позже могут развиваться изъязвление высыпа-
ний, абсцессы (флюктуирующее утолщение) нервных стволов.
Появление новых высыпаний чаще всего свидетельствует о «нисхо-
дящем» характере обострения, однако окончательный вывод мож-
но сделать только на основании гистологического исследования.
При реверсивной реакции выявляются признаки усиления клеточ-
ного иммунитета: увеличение количества лимфоцитов, эпителиоид-
ных и гигантских клеток и уменьшение числа М лепры (при нисхо-
409
дящей реакции — наоборот). При ТТ реверсивная реакция может
привести к выздоровлению. В соответствии с направлением транс-
формации при пограничных реакциях показатели лепроминовой
пробы изменяются в сторону усиления при реверсивных реакциях
и в сторону негативации — при нисходящих.
При обострении ЛЛ могут появляться новые высыпания, отеч-
ность лица и конечностей, возникают или обостряются невриты,
поражения глаз, лимфатических узлов и внутренних органов, изъ-
язвляются старые лепромы. Иногда в реактивной фазе ЛЛ появля-
ются атипичные (уртикарные, лихеноидные, акнеформные, ихтио-
зиформные, розеолезные, пемфигоидные) высыпания. Чаще всего
при ЛЛ встречается обострение типа лепрозной узловатой эрите-
мы, при котором появляются элементы, типичные для erythema
nodosum. Появившиеся ярко-красные узлы и бляшки могут быть
болезненными, бледнеют при надавливании, иногда изъязвляются,
температура в них заметно выше, чем в окружающей их коже.
Как правило, обострения ЛЛ сопровождаются повышением
температуры, болями в нервных стволах, суставах и костях, рас-
стройством сна. Появление на высыпаниях шелушения свидетель-
ствует о наличии регресса (стихания) реакций.
Обострение при лепре Лючио проявляется возникновением на
коже болезненных эритематозных бляшек, в центре которых раз-
вивается некроз (иногда перед этим появляется пузырь). В даль-
нейшем формируется темная корка (струп), отпадающая через не-
сколько дней.
В основе реактивных состояний при лепре лежат изменения
напряженности реакций гуморального и клеточного иммунитета.
Аллергические реакции при ЛЛ и ПЛ развиваются по типу фено-
мена Артюса. Наличие в сыворотке больных ЛЛ большого коли-
чества преципитирующих антител при высокой концентрации в ор-
ганизме антигена приводит к образованию иммунных комплексов
антиген — антитело. Откладываясь в стенках сосудов и в тканях,
они вызывают развитие ответной аллергической реакции. Нередко
при этом выявляется гломерулонефрит иммунного происхождения,
а в сыворотке крови — отклонения в содержании комплемента.
Обострения при ТТ, ПТ и ПП отражают изменения в интен-
сивности гиперчувствительности замедленного типа. Факторами,
способствующими развитию реактивных состояний, являются со-
путствующие заболевания (особенно инфекционные, психические и
др.), иммунизация (особенно против оспы), беременность, роды
и др.
Весьма распространенным и трудно поддающимся лечению
осложнением лепрозного процесса является развитие трофических
язв стоп, которыми страдают приблизительно 30 % больных. Тро-
фические язвы при лепре развиваются в результате специфиче-
ского поражения периферической нервной системы, преимуще-
ственно малоберцовых нервов, с последующим присоединением
поражения сосудов, мягких тканей и костей. Клинически первона-
чально отмечают признаки дистрофии; кожа становится сухой, те-
ряет свою упругость и эластичность, а в дальнейшем развивается
выраженный гиперкератоз. На стопе в местах максимальных на-
грузок на фоне гиперкератоза появляются участки атрофии, окру-
женные зоной отека. В дальнейшем развивается некротический
пузырь, после вскрытия которого образуется первичная поверх-
ностная нейротрофическая язва стопы. При отсутствии лечения,
продолжающейся травматизации и присоединении вторичной ин-
фекции процесс изъязвления распространяется, как правило, на
глубжележащие ткани (фасции, мышцы) и осложняется развити-
ем остеомиелита, т. е. формируется прободная трофическая язва.
При неадекватном лечении последняя, как правило, рецидивирует
и приводит к развитию мутиляций, деформации стопы и как след-
ствие этого инвалидности. Кроме того, наличие хронического оча-
га деструкции тканей может способствовать развитию амилоидоза
почек и других осложнений. Нейротрофические язвы при лепре от-
личаются упорным течением; они требуют настойчивого длительно-
го комплексного лечения.
Диагноз. Представление о клинических проявлениях лепры
нередко ассоциируются у врачей с наличием у больного «львиной
морды», выпадением бровей и ресниц, отсутствием пальцев (мути-
ляции), выраженными контрактурами и анестезиями. Эти синдро-
мы действительно характерны для лепры, но лишь в поздней ста-
дии заболевания: брови у больных лепроматозным типом лепры
нередко начинают выпадать лишь на 6—10-м году после появле-
ния первых клинических проявлений заболевания, «львиная мор-
да» и выраженные мутиляции пальцев, как правило, также наблюда-
ются у болеющих в течение многих лет. Диагностика в этих слу-
чаях не представляет затруднений, но круг проблем, обусловлен-
ных ее несвоевременностью, неизмеримо возрастает (больной
остается инвалидом, задача специфического лечения его значи-
тельно усложняется, возрастает возможность заболевания членов
семьи, усиливается лепрофобия и т. д.).
Диагностика лепры на ранних стадиях заболевания сложна,
но достаточно хорошо разработана.
Для правильного диагностирования лепры необходимы знания
и оценка клинических, главным образом дерматологических и не-
врологических, проявлений заболевания, а также данные функцио-
нальных и лабораторных исследований. Известное значение имеют
анамнез, проживание в эндемичной зоне, контакт с больными леп-
рой. Следует учитывать длительность существования высыпаний и
пятен, жалобы на парестезии в области кожи конечностей, неврал-
гические и артралгические боли в конечностях, нарушение чувстви-
тельности на отдельных участках кожи, незаметно полученные
ожоги, затруднение носового дыхания, частые носовые кровотече-
ния. При обследовании решающее значение имеет осмотр всего
кожного покрова.
Следует обращать внимание на малейшие изменения окраски
кожного покрова, особенно на лице, состояние бровей, наличие
эритемы, акроцианоза, сыпи, полиаденита, отека и пастозности
411
лица, тыла кистей и стоп, трофические расстройства: нарушение
пото-, салоотделения, сухость, «ихтиоз», утолщение и ломкость
ногтей, пузыри на голенях и предплечьях, заканчивающиеся руб-
цами, парезы нервов конечностей, хронические и прободные язвы
стоп, деформации конечностей, атрофии мышц кистей и стоп (ча-
ще всего контрактура V, IV, III пальцев руки), незаживающие
панариции и остеомиелиты, неврит, полиневрит с поражением
верхней ветви лицевого нерва.
Особенно важна диагностика начальных и ранних проявлений
лепры, которые могут быть в виде единичных или немногочислен-
ных эритематозных, гипохромных пятен, мелкопапулезных (лихе-
ноидных) сгруппированных высыпаний, овальных приподнятых
инфильтраций, розеолоподобной сыпи, кольцевидных фигурных
эритем, мелкоочаговых множественных сливных инфильтратов, на-
поминающих мраморную синюшнось при озноблении, состоянии
типа акроцианоза, застойных эритем различной этиологии. Важны-
ми критериями для диагностики лепры являются расстройство
поверхностной чувствительности и трофические изменения, обус-
ловленные поражением кожных нервных окончаний в очагах пора-
жения. Во всех неясных случаях, не регрессирующих при проведе-
нии обычной терапии высыпаний на коже (эритема, гипер- или
гипопигментные пятна, папулы, инфильтраты, бугорки, узлы), сле-
дует подумать о лепре и провести соответствующее дополнитель-
ное обследование: изучить неврологический статус, включая со-
стояние болевой, тактильной и температурной чувствительности в
очагах поражения и дистальных отделах конечностей, поставить
функциональные пробы и провести бактериоскопическое, а если
есть показания, и гистологическое исследования очагов пораже-
ния. Функциональные пробы с никотиновой кислотой, горчични-
ком, на потоотделение и др. помогают выявить характерные для
ТТ и ПТ лепры очень ранние поражения периферической нервной
системы, которые, кроме нарушений поверхностных видов чувстви-
тельности, а иногда и до появления этих нарушений, проявляются
различными вазомоторными, секреторными и трофическими рас-
стройствами.
Для ранних проявлений нелепроматозной лепры характерны
мраморность кожи, не исчезающая при согревании, и стойкая
синюшность ее при охлаждении; «воспламенение» и отек высыпа-
ний (включая и еще невидимые элементы) после внутривенного
введения 5—10 мл 1 % раствора никотиновой кислоты; более блед-
ная окраска этих высыпаний по сравнению с окружающей кожей
после аппликации горчичника или облучения эритемной дозой
ультрафиолетовых лучей: отсутствие фазы рефлекторной эритемы
при постановке на гипохромных пятнах внутрикожных проб с гис-
тамином, морфином или дионином, нарушение потоотделения и
секреции сальных желез; сухость, шелушение и истончение кожи;
выпадение пушковых волос.
Бактериоскопическое исследование (мазки готовят из скарифи-
катов кожи не только очагов поражения, но и надбровных дуг,
412
мочек ушей, подбородка, соскоба со слизистой оболочки носа и
окрашивают по Цилю — Нильсену) необходимо проводить при на-
личии пятен с нечеткими краями, инфильтратов, бугорков, узлов,
т. е. при подозрении на лепроматозный тип лепры. Неврологиче-
ские проявления при этом типе лепры, включая и выявляемые
с помощью функциональных проб, могут долгое время отсутство-
вать, но во всех высыпаниях, как правило, будут в большом коли-
честве выявляться микобактерии лепры.
Обследованию на лепру подлежат лица с жалобами на сниже-
ние или исчезновение чувствительности в отдельных участках тела,
парестезии, частые ожоги, ревматоидные боли в конечностях, не-
резко выраженные контрактуры V, IV и III пальцев верхних конеч-
ностей, снижение мышечного тонуса, начинающуюся атрофию
мышц, пастозность кистей и стоп, стойкие поражения слизистой
оболочки носа, трофические язвы и т. д.
В ранних элементах лепроматозных форм болезни расстрой-
ства поверхностной чувствительности может не быть или же оно
выражено слабо только при ПЛ. Но уже и на этих стадиях могут
отмечаться выпадение пиломоторного рефлекса, снижение или от-
сутствие рефлекторной эритемы в ответ на раздражение. В четких
эритематозных, приподнятых, эритематозно-гипохромных элемен-
тах можно наблюдать поредение пушковой растительности, сниже-
ние потоотделения, сухость, легкое шелушение. В элементах с
заметными трофическими расстройствами отмечается и более вы-
раженное снижение поверхностных видов чувствительности,
вплоть до анестезии, которая начинается с нарушений температур-
ных ощущений. Вначале теряется ощущение холода, затем тепла.
Возникает неадекватная по сравнению с симметричным здоровым
участком кожи реакция на прикосновения тест-пробирок с холод-
ной и горячей водой.
Одинаковые по размерам стеклянные пробирки заполняют на
одном уровне холодной (t + 18 °C) и горячей (t + 45—50 °C) во-
дой. Предварительно пациент должен продемонстрировать способ-
ность различать разницу температур (холодное и теплое) на здо-
ровом участке кожи. Это правило следует помнить при исследова-
нии и других видов поверхностной чувствительности. Если элемент
эритематозно-гипохромического характера, то при лепре наруше-
ние чувствительности отчетливее снижено на гипохромном участ-
ке. Болевая чувствительность в любых условиях легко определяет-
ся попеременным уколом тонкой иглы и прикосновением ее каню-
ли. При этом больной должен отметить разницу «острое» или
«тупое». Тактильную чувствительность легко определить тонкой
кисточкой, заостренным комочком ваты или плоской фильтроваль-
ной бумаги и др. Больному предлагают вести счет прикосновений.
При наличии пушковых волос результат будет неточным. Следует
принимать во внимание возможность случайных ошибок больного.
В ранних поражениях Н и ЛЛ лепры чувствительность, как прави-
ло, сохранена, но иногда при ПЛ, особенно в группах ПП — ПТ —
ТТ лепры, четко выявляются ее нарушения.
413
При подозрении на лепру необходимо исследовать крупные
нервные стволы в местах, доступных пальпации. Наиболее часто
поражаемый n. ulnaris прощупывается с медиальной стороны
нижней трети плеча при полусогнутой руке, п. medianus — на сги-
бательной стороне предплечья, около средней линии при слегка
согнутой в лучезапястном суставе кисти, n. peroneus .communis —
позади головки малоберцовой кисти при положении больного сидя
с выпрямленной ногой, n. tibialis — с медиальной стороны голено-
стопного сустава, около мыщелка, п. auricularis magnus пальпиру-
ется на шее при повороте головы исследуемого в противополож-
ную сторону, по диагонали грудиноключично-сосцевидной мышцы.
В первую очередь утолщаются нервные стволы, в зоне которых
имеются высыпания. При ТТ лепре (реже при ПТ лепре) встреча-
ется утолщение кожного нерва вблизи элемента. Пораженные
нервные стволы могут утолщаться веретенообразно, шаровидно и
прощупываться в виде плотного фиброзного тяжа. При этом нет
параллелизма между утолщением нерва и тяжестью неврологиче-
ских изменений.
Для лепры характерны пестрая, полиморфная (мозаичная, пят-
нистая) картина периферических нервных поражений, сочетание
локальной гипо- и анестезии в элементах и в зоне иннервации
наиболее поражаемых нервных стволов или их отдельных ветвей,
в том числе и кожных. Как и в кожных элементах, в районе пора-
женных нервов раньше наступает расстройство температурной
чувствительности, затем болевой и тактильной. Отмечается также
диссоциация расстройств чувствительности — расстраивается по-
верхностная и длительно сохраняется глубокая чувствительность.
На руках анестезия обычно развивается на внутренней и зад-
ней (локтевой) поверхности предплечий и кистей (в случае пора-
жения локтевого нерва), по передней и внешней поверхности —
при вовлечении в процесс лучевого нерва, на ногах — чаще в об-
ласти большого пальца, по внутренней и внешней стороне голени
до коленного сустава и редко — на бедре. Зона анестезии нередко
имеет вид «чулок или перчаток», но верхняя граница ее всегда рас-
положена косо, наибольшую высоту занимает нарушение термо-
аналгезии, затем идет болевая; менее всего страдает тактильная.
Ладони и подошвы могут сохранять нормальную чувствительность.
При лепре развитие сенсорных расстройств намного опережает
развитие моторных (от нескольких месяцев до нескольких лет).
Моторные расстройства и атрофия мышц появляются одновре-
менно, обычно асимметрично, но бывают парезы и без атрофии.
При поражении п. ulnaris больной замечает ограничение под-
вижности V, IV, III пальцев (контрактура мизинца, IV пальца).
Постепенно при атрофии мышц тенара и гипотенара развивается
деформация кисти по типу лапы грифа. При одновременном
поражении n. ulnaris, п. medianus и развившейся атрофии межко-
стных мышц кисть приобретает вид лодочки, лапы обезьяны. Сви-
сающая кисть бывает при парезе п. radialis, что наблюдается редко.
В далеко зашедших случаях атрофируются соответствующие мыш-
414
цы предплечья. При поражении n. peroneus communis развивается
атрофия наружных мышц голеней — разгибателей стопы. Пораже-
ние п. tibialis anterior, n. peroneus приводит к образованию падаю-
щей стопы («степпаж»): основные фаланги разогнуты, остальные
согнуты. Паралич n. facialis начинается обычно с верхней (орбиль-
ной) ветви. Паралич круговой мышцы век приводит к округлению
глазной щели, лагофтальму, несмыканию век, кератиту, слепоте.
При попытке сомкнуть веки закатывается кверху глазное яблоко.
Нижняя ветвь n. facialis поражается в очень поздних стадиях. При
лепре может быть изолированное поражение верхней ветви n. faci-
alis, но изолированного поражения нижней ветви не бывает.
Определенную диагностическую ценность имеет обследование
слизистых оболочек верхних дыхательных путей и полости рта,
глаз.
Для установления диагноза лепры и определения состояния
активности лепрозного процесса проводят функциональные
пробы, способные выявить поражение микобактериями лепры
нервно-рецепторного аппарата и мелких сосудов.
Для отличия физиологической мраморности кожи от сходной с
ней начальной лепроматозной инфильтрации согревают обследуе-
мого в сухожаровой ванне или в теплом помещении, физиологиче-
ская пятнистая мраморность кожи исчезает, а патологическая,
обусловленная парезом вазомоторов, усиливается. При охлажде-
нии на открытых частях тела у больных лепрой появляется стой-
кая асимметричная синюшность.
На гипо- и анестетических гипохромных участках не развива-
ется (или бывает мозаичной) эритема, вызываемая горчичником,
гальванизацией с большим (матерчатым) электродом, эритемной
дозой ультрафиолетовых лучей, в то время как на соседних уча-
стках покраснение равномерное и выражено резко. На поражен-
ных участках ослабляется рефлекторный дермографизм. Для эле-
ментов лепры на коже характерно выпадение пиломоторной
реакции.
При лепре рано нарушается адаптационная способность вазо-
моторов, что позволяет применять для диагностики ряд функцио-
нальных фармакодинамических проб, в частности для диагностики
лепры широко используют гистаминовую пробу. При интрадер-
мальном (скарификационном) введении 0,1 % раствора гистамина
в случае развития гипо- и анестезии, связанной с разрушением
нервно-рецепторного аппарата клеток, выпадает вторая фаза из
тройной реакции на гистамин — рефлекторная эритема.
При проведении пробы на вызывание рефлекторной эритемы
можно пользоваться вместо гистамина 5 % водным раствором му-
равьиной кислоты, 2 % раствором диамина, 1 % раствором морфи-
на, ацетилхолина [Переводчиков И. Н., 1946, 1954].
В анестетическом участке при поражении лепрозной природы
обычный укол иглой не вызывает эритемы, появляющейся на нор-
мальной коже, а раздражение кожи щипком может вызывать лишь
слабую рефлекторную эритему.
415
Чувствительность гистаминовой, так же как и морфиновой и дру-
гих реакций, определяется степенью выраженности анестезии.
Следует иметь в виду, что этот тест не является абсолютным и
«нормальные» результаты его не исключают наличия лепры.
При лепре вследствие разрушения нервных окончаний и сдав-
ления инфильтратом потовых желез уменьшается и исчезает пото-
отделение на местах высыпаний; иногда расстройства потоотделе-
ния предшествуют анестезии. Поэтому в качестве диагностическо-
го теста используются различные пробы на определение потоотде-
ления. Н. А. Торсуев (1971) рекомендует следующую модифика-
цию пробы Минора. Подозрительный на лепру и соседний здоро-
вый участки кожи смазывают 2—5 % спиртовым раствором йода,
после испарения спирта поверхность припудривают крахмалом.
Больного (исследуемую конечность) помещают в суховоздушную
ванну, дают ему выпить 2—3 стакана горячего чая. Через несколь-
ко минут наступает потоотделение, ясно определяются участки
ангидроза. В начальных стадиях Л Л лепры на клинически здоро-
вой коже возникает неравномерное и неодновременное (мозаич-
ное) потоотделение: в высыпаниях Н и ТТ лепры оно резко сни-
жено или отсутствует.
Для диагностики ранних проявлений лепры удобна и демонст-
ративна никотиновая проба, предложенная Н. Ф. Павловым (1949).
Она основана на определении функционального состояния вазомо-
торов. Через 1—3 мин после внутривенного введения 3—10 мл
1 % раствора никотиновой кислоты постепенно, начиная с лица,
развивается усиливающаяся гиперемия всего кожного покрова.
В активных лепрозных поражениях, в том числе и невидимых,
быстрее, чем на других участках кожи, развиваются покраснение
и отек (феномен воспламенения), сохраняющиеся в течение неко-
торого времени после стихания общей реакции. Этот метод позво-
ляет диагностировать видимые и обнаруживать скрытые пораже-
ния лепрозной этиологии, так как феномен воспламенения харак-
терен только для лепры. При третичной сифилитической розеоле
введение никотиновой кислоты дает покраснение без отека.
Л. М. Чернышева (1956) предложила вместо внутривенного введе-
ния назначать внутрь 50—100 мг никотиновой кислоты. Реакция
наступает через 5—10 мин и продолжается около 30 мин. Никоти-
новая проба представляет большую диагностическую ценность в
активной стадии заболевания и служит контрольным тестом при
наступлении регрессивных изменений.
Дифференциальный диагноз, учитывая разнообразие клиниче-
ских проявлений лепры, следует проводить со многими заболева-
ниями кожи и периферической нервной системы. Лепру называют
«великим имитатором», так как она способна имитировать боль-
шинство дерматозов и заболеваний периферической нервной сис-
темы. Из кожных болезней, клинические проявления которых
сходны с клиническими проявлениями лепры, необходимо прежде
всего иметь в виду бугорковый сифилид, сифилитические гуммы,
токсикодермию, многоформную экссудативную эритему, красный
416
плоский лишай, туберкулезную волчанку, саркоидоз, склеродер-
мию, витилиго, сифилитическую лейкодерму, грибовидный микоз,
ретикулез кожи, трихофитию гладкой кожи, лейшманиоз, узлова-
тую эритему, трофические и прободающие язвы различной этиоло-
гии, рожу, пеллагру, пигментную крапивницу, ихтиоз и др.
В странах тропического пояса лепру необходимо дифференци-
ровать от таких заболеваний, как лейшманиоз, актиномикоз, споро-
трихоз, бластомикоз, онхоцеркоз, пинта, фрамбезия, различные
язвы.
При дифференциальной диагностике лепры следует учитывать
весь комплекс клинических проявлений заболевания, результаты
функциональных проб, а также результаты бактериоскопического
и гистологического исследований. Решающее значение для уста-
новки диагноза имеют обнаружение в дистальных отделах конеч-
ностей и на местах высыпаний снижения поверхностных видов
чувствительности (болевой, температурной, тактильной), а также
утолщения нервных стволов, отсутствие потоотделения на элемен-
тах, а в случаях подозрения на ПП, ПЛ или ЛЛ — результаты
бактериоскопического исследования. Изучение окрашенных по Ци-
лю — Нильсену гистологических срезов биопсированного элемен-
та, как правило, позволяет выставить окончательный диагноз.
При клиническом обследовании больного следует иметь в виду,
что при лепре никогда не наблюдается депигментации кожи (толь-
ко гипопигментация), а также «поседения» пушковых волос (толь-
ко их частичное или полное выпадение).
Определенные трудности могут встречаться при дифференциа-
ции лепры от таких поражений периферической нервной системы,
при которых имеются нарушения чувствительности, контрактуры,
амиотрофии, мутиляции. Это прежде всего сирингомиелия, трав-
матические невриты, миелодисплазии, акроостеолиз, сифилитиче-
ский неврит, прогрессирующая невритическая мышечная атрофия
Шарко — Мари, гипертрофический неврит Дежерина — Сотта.
При дифференциации от этих болезней следует принимать во вни-
мание то, что у больных лепрой преобладают нарушения поверх-
ностных видов чувствительности, тогда как двигательные функции
и глубокая чувствительность сохраняются, поэтому атаксии у них
не наблюдается. Поражения чувствительности при лепре никогда
не развиваются по сегментарному типу. Не развиваются также ат-
рофии мышц плечевого пояса и проксимальных отделов конечно-
стей; ЦНС при лепре не поражается.
Лечение. Эффективность лечения в значительной степени зави-
сит от стадии и особенностей течения лепрозного процесса, воз-
раста больного, наличия сопутствующих заболеваний, правильности
индивидуального подбора химиотерапевтических средств и их до-
зировки.
Основными противолепрозными средствами в настоящее время
являются препараты сульфонового ряда (ДДС, дапсон, авлосуль-
фон, сульфетрон, солюсульфон, диуцифон, диацетил-диамино-диа-
фенил-сульфон), наряду с которыми применяют рифампицин,
лампрен, протионамид и этионамид.
15—936
Лечение больных лепрой должно быть комплексным, включать
применение одновременно 2—3 противолепрозных препаратов в
сочетании со стимулирующими и общеукрепляющими средствами
(у -глобулин, пирогенал, метилурацил, гемотрансфузия, витамины,
липотропные вещества).
Диафенилсульфон (ДДС, дапсон, авлосульфон) применяют
внутрь в суточной дозе от 50 до 200 мг. Масляную суспензию дап-
сона в соответствующей дозе вводят внутримышечно 1—2 раза в
неделю.
Диацетил-диамино-диафенилсульфон (ДАДДС) — сульфон
пролонгированного действия — вводят внутримышечно 1 раз в
72 дня.
Сульфетрон (солюсульфон) вводят внутримышечно в виде
50 % раствора 2 раза в неделю; максимальная доза 3,5 мл (пер-
вая инъекция — 1 мл, вторая — 2 мл, третья — 3 мл, четвертая и
последующие — 3,5 мл).
Бенемицин (рифадин, рифампицин) назначают внутрь еже-
дневно по 300—600 мг.
Протионамид — по одной таблетке (0,25 г) 1—3 раза в день
через 1 ч после еды.
Этионамид (трекатор) — по 0,25 г 2—3 раза в день.
Лампрен (В.663, клофазимин) — внутрь ежедневно по 100 мг
(одна капсула).
Курс лечения противолепрозными препаратами проводят в те-
чение 6 мес. При хорошей переносимости препаратов между кур-
сами лечения не делают перерывов. Как правило, в комплекс про-
тиволепрозных средств включают какой-либо сульфаниламидный
препарат и один или два препарата другой химической структуры.
В целях повышения эффективности лечения и предупреждения
развития лекарственной устойчивости рекомендуют чередовать ле-
карственные препараты и их сочетания через каждые 2 курса лече-
ния. Противопоказанием против проведения комбинированного
лечения могут быть лишь тяжелые заболевания внутренних орга-
нов.
До начала лечения проводят тщательное клинико-лабораторное
обследование больного (общий анализ крови и мочи, изучение
функционального состояния печени и почек, желудочно-кишечного
тракта, легких, эндокринной и сердечно-сосудистой систем) для
выявления и своевременного лечения сопутствующих заболеваний.
В период лечения лабораторные исследования проводят не реже
одного раза в 3 мес.
При лечении больных лепрой предпринимались попытки уси-
лить реакции клеточного иммунитета путем применения наряду с
суль<}юнами различных иммунотерапевтических средств. Наиболее
эффективными оказались многократные инъекции БЦЖ, назначе-
ние левамизола, повторные введения лейкоцитарного «фактора пе-
редачи», а также взвеси аллогенных лейкоцитов.
При лечении лепры современными средствами нередко нараста-
ют клинические проявления лепрозного неврита. Это объясняют
418
быстрым замещением гранулем в нервах рубцовой (фиброзной)
тканью, что не следует рассматривать как противопоказанйе про-
тив продолжения лечения. В целях предупреждения развития или
прогрессирования невритов, амиотрофий и контрактур в число ле-
чебных мероприятий с самого начала необходимо включать раз-
личные физиотерапевтические процедуры, лечебную гимнастику,
механотерапию.
Эффективность противолепрозного лечения оценивают по ско-
рости регресса клинических проявлений заболевания, а также по
результатам бактериоскопического контроля за динамикой количе-
ства возбудителя в очагах поражения, изменением его морфологии
и по результатам гистологического исследования.
Для стандартизации, сравнимости и объективизации результатов
бактериоскопических исследований разработана система их цифро-
вых выражений — бактериоскопический индекс (БИН).
Наибольшее распространение в последние годы получила систе-
ма Ридли (1964), согласно которой БИН подсчитывают по 6-плюсо-
вой системе в цитологических препаратах, приготовленных из скари-
фикатов слизистой оболочки носа, кожи надбровных дуг, мочек
ушей и других наиболее пораженных участков тела. М лепры в
каждом мазке подсчитывают под микроскопом в 100 полях зрения.
Например, БИН равен 1+ при наличии от 1 до 10 микобактерий
в 100 полях зрения микроскопа; 24" —при наличии 1—10 мико-
бактерий в 10 полях зрения, 3-|-при наличии 1 —10 микобакте-
рий в каждом поле зрения; 4-| 10—100 микобактерий; 5-|
100—1000 микобактерий; 6Н---- 1000 и более микобактерий в каж-
дом поле зрения.
БИН больного — это среднее арифметическое БИНов на отдель-
ных участках. Определяется БИН до начала лечения и после каж-
дого курса терапии.
Предложены также морфологический, гранулярный, биопсий-
ный индекс, логарифмический индекс биопсии. При гистологи-
ческом контроле за лечением, помимо динамики клеточного состава
инфильтратов, наличия включений липоидов и изменений морфоло-
гии микобактерий, обращают внимание на площадь инфильтрации.
По мере регресса диффузный лепроматозный инфильтрат разделя-
ется врастанием соединительной ткани на отдельные сегменты,
которые в дальнейшем прогрессивно уменьшаются.
Даже после многих лет терапии сульфонами и полного регрес-
са кожных проявлений лепры жизнеспособные М лепры про-
должают выявляться в периферических нервах и поперечнопо-
лосатых мышцах, хотя дапсон легко проникает в эти ткани. Окон-
чательно объяснить причины такого персистирования М лепры по-
ка не удалось. Именно поэтому большинство исследователей счи-
тают, что современными противолепрозными средствами следует
лечить больных лепрой, особенно формами ЛЛ, ПЛ и ПП, на про-
тяжении всей их жизни. Лечение больных ТТ формой лепры дол-
жно продолжаться не менее 3—5 лет.
Профилактика. Особенности профилактики при лепре обуслов-
15*
419
ливаются неопределенно длительным инкубационным периодом,
т. е. невозможностью применения мер, подобных карантину, а так-
же отсутствием вакцины и быстродействующих лекарственных
средств. Важнейшее значение для профилактики лепры имеют
общеоздоровительные и санитарно-гигиенические мероприятия.
Индивидуальная профилактика сводится в основном к соблюде-
нию мер личной гигиены. Еще А. Гансен писал, что «чистота и
мыло — лучшие меры предупреждения распространения лепры».
Больной лепрой должен иметь отдельную постель, посуду, часто
и тщательно мыться, регулярно производить перевязки изъязвив-
шихся лепром и трофических язв, регулярно лечиться. Для членов
семьи больного, так же как и для обслуживающего медицинского
персонала, никаких специальных правил поведения, помимо со-
блюдения общепринятых норм личной гигиены, не требуется. Так,
например, медицинскими перчатками работникам следует пользо-
ваться только при взятии биоптата и хирургических вмешатель-
ствах, а маску надевать при обследовании верхних дыхательных
путей или взятии соскоба со слизистой оболочки носа.
Наиболее древний способ общественной профилактики лепры
при отсутствии эффективного лечения — полная изоляция боль-
ных в специально предназначенные для этого места. Этой цели
служили лепрозории, отдельные деревни (например, «сегрегацион-
ные деревни для лепрозных» в Африке, махау-кишлаки в Средней
Азии), а также выселение больных за пределы населенных пунк-
тов (например, у якутов в отдельные юрты в тайге).
В настоящее время в большинстве стран, в том числе и в нашей
в специализированные противолепрозные учреждения (лепрозо-
рии, противолепрозные диспансеры или санатории) госпитализиру-
ют только больных-бактериовыделителей. В некоторых странах
(например, Англия, Франция и др.) не имеется специализирован-
ных противолепрозных учреждений; в случае необходимости боль-
ных лепрой госпитализируют в специализированные отделения или
палаты в госпиталях «тропической дерматологии» или инфекцион-
ных больницах. Во многих развивающихся странах, в которых от-
мечают высокий процент заболеваемости лепрой, больных-бакте-
риовыделителей не госпитализируют из-за отсутствия экономиче-
ских возможностей.
В нашей стране ведущим в борьбе с лепрой является диспан-
серный метод, объединяющий комплекс социальных, профилакти-
ческих и лечебных мероприятий.
Не получено достаточных доказательств специфического про-
филактического действия БЦЖ при лепре, однако пока не будет
разработана более эффективная вакцина, вакцинацию БЦЖ в це-
лях профилактики лепры у населения эндемичных по лепре райо-
нов, особенно тех, где преобладает ТТ тип лепры, следует при-
знать целесообразной.
Существует достаточно большое количество данных об эффек-
тивности превентивного лечения лиц, имевших длительный семей-
ный контакт с больными лепрой. Превентивное лечение проводится
420
одним из сульфоновых препаратов, дозировка и схема введения
которого такие же, как и при лечении больных лепрой. Продолжи-
тельность превентивного лечения от 6 мес до 3 лет.
Действующая у нас «Инструкция по превентивному лечению
при лепре» предусматривает проведение химиопрофилактики ли-
цам в возрасте 2—60 лет, проживавшим в одной семье с больны-
ми ЛЛ, ПЛ или ПП формами лепры. Организация и проведение
превентивного лечения осуществляется противолепрозными учреж-
дениями и кожно-венерологическими диспансерами.
Поскольку больной лепрой является единственным источником
заболевания, чрезвычайно важное значение в профилактике лепры
имеет выявление и лечение больных в наиболее ранней стадии
болезни. За выявлением больного обязательно должно следовать
определение круга лиц, которым больной мог передать инфекцию.
Для выявления больных в зонах, эндемических по лепре, следует
регулярно проводить профилактические осмотры.
Членов семей больных лепрой берут под наблюдение в диспан-
серах. Медицинские осмотры и в случае необходимости лаборатор-
ные обследования рекомендуют проводить ежеквартально, во вся-
ком случае не реже одного раза в год. Продолжительность
наблюдения в различных странах от 3 до 10 лет.
Детей, родившихся у больных лепрой, в последние годы при-
знано возможным оставлять с матерью на период до 2—3-летнего
возраста. Если мать аккуратно лечится и соблюдает необходимые
санитарно-гигиенические нормы поведения, возможность заболева-
ния ребенка сводится к нулю. Более того, показано, что с молоком
матери выделяется определенное количество сульфонов и ребенок,
следовательно, получает превентивное лечение. В возрасте 3 лет
ребенка, так же как и детей старшего возраста, на период лечения
матери в противолепрозном учреждении передают в детский дом.
Санитарно-просветительную работу среди больных лепрой, чле-
нов их семей и здорового населения необходимо проводить диф-
ференцированно. Во многих странах существует дискриминация
больных лепрой и членов их семей. Это нередко ведет к укрыва-
тельству больных, самолечению. Давая правильные представления
о природе, распространении, профилактике лепры, а также о важ-
ности лечения больных на ранних стадиях заболевания и возмож-
ности излечения, санитарное просвещение способствует преодоле-
нию лепрофобии, повышению эффективности национальных про-
грамм борьбы с лепрой.
Глава 12
КОЖНЫЙ ЛЕЙШМАНИОЗ (БОЛЕЗНЬ БОРОВСКОГО)
Син.: тропическая язва, восточная язва, эндемическая язва и другие названия,
связанные с местами географического обнаружения болезни (пендинская, ашха-
бадская, ташкентская, каирская, багдадская, делийская, афганская, тунисская,
месопотамская, филлипинская язва, Bouton d’Aleppo, Bouton de Biscra, Bouton de
Gatsa, Dehli-beule и др.) — всего свыше 100 синонимов. В зарубежной литературе
заболевание обычно обозначается термином «кожный лейшманиоз»
Кожный лейшманиоз — эндемичная трансмиссивная болезнь,
свойственная странам с жарким и теплым климатом, проявляю-
щаяся преимущественно поражениями кожи. Болезнь вызывается
простейшими Leishmania tropica, относящимися к семейству три-
паносомид (Trypanosomidae). Переносчики болезни — различные
виды москитов (Phlebotomus).
В нашей стране имеются 2 разновидности кожного лейш-
маниоза: антропонозный (городской тип), вызываемый Leishmania
tropica minor, и зоонозный (сельский тип), вызываемый Leishmania
tropica major.
История лейшманиоза связана с глубокой древностью.
Однако первое достоверное описание кожного лейшманиоза сде-
лал в 1745 г. английский врач Рососк, обнаруживший его среди
жителей Сирии. Несколько позже, в 1756 г. братья Russel подроб-
но описали клинику кожного лейшманиоза. В 1787 г. Volney,
путешествуя по Сирии и Египту, отметил в этих странах эндеми-
ческое заболевание, которое местные жители называют финико-
вым, или аллепским, прыщом.
В середине XIX века в период захватнической колониальной
политики стран Азии, Африки и Ближнего Востока среди военных
европейцев заболеваемость кожным лейшманиозом стала прини-
мать массовый характер, что вызвало повышенный к нему интерес.
В России первой работой, посвященной кожному лейшманиозу,
является диссертация Н. Арендта (1862), в которой автор описы-
вает клинику, эпидемиологию и лечение этого заболевания. Даль-
нейшее знакомство русских врачей с кожным лейшманиозом свя-
зано с присоединением и освоением среднеазиатских территорий
(1865—1885). В 1885 г. среди войсковых контингентов, распо-
ложенных в Маргабском оазисе Туркмении, возникла эпидемия в
виде язвенных поражений кожи. Поскольку наибольшее количе-
ство заболеваний было в районе пендинского приставства (ныне
Тахта-Базар), заболевание получило название пендинской язвы.
В 1886 г. вышла монография Л. Л. Гейденрейха «Пендинская
язва», в которой он описал клинику и различные бактериальные
422
исследования. Автор предложил это заболевание именовать тро-
пической язвой.
Лишь в 1889 г. ординатору Ташкентского военного госпиталя
П. Ф. Боровскому удалось обнаружить и описать возбудителя
болезни, которого автор отнес к простейшим. Последующими ра-
ботами К. Я. Шульгина, Е. И. Марциновского, Л. С. Богрова
(1902—1904) подтверждено открытие П. Ф. Боровского. В 1909 г.
вышла диссертация Е. И. Марциновского «Этиология восточной
язвы и краткие сведения об этой болезни», сыгравшая большую
роль в развитии учения о лейшманиозе в России.
После открытия возбудителя кожного лейшманиоза встал во-
прос о путях проникновения его в организм. В 1902 г. К. Я. Шуль-
гин, П. Ф. Боровский, а позже Е. И. Марциновский и другие вы-
сказали мнение о передаче болезни кровососущими насекомыми,
как это имеет место при малярии. Позднее Sergent (1921), Adler
(1924) доказали, что переносчиками болезни являются москиты.
В 1923 г. Christopherson описал форму, клинически сходную с
туберкулезной волчанкой. В 30-х годах И. И. Гительзон подробно
изучил этот туберкулезный лейшманиоз, назвав его «металейшма-
ниозом», и впервые применил метод профилактических прививок
кожного лейшманиоза культурой возбудителя. В середине 30-х го-
дов в изучение кожного лейшманиоза включились Туркменский
НИИ дерматовенерологии во главе с П. В. Кожевниковым и со-
трудники отдела паразитологии ВИЗМ под руководством академи-
ка Е. Н. Павловского.
В 1940 г. в Ашхабаде было проведено первое межреспубли-
канское совещание по кожному лейшманиозу. Его результаты опу-
бликованы в 1941 г. в сборнике научных трудов «Проблемы кож-
ного лейшманиоза». В 1947 г. вышла монография П. В. Кожевни-
кова, Н. В. Добротворской, Н. И. Латышева «Учение о кожном
лейшманиозе».
В области эпидемиологии основные научно-исследовательские
работы были направлены на изучение резервуара возбудителя бо-
лезни и его переносчика. В 1937 г. Н. И. Латышев, А. П. Крюкова
в Туркмении установили широкое распространение кожного
лейшманиоза среди диких грызунов пустыни и доказали, что нора
грызунов является основным местом выплода и убежища для мос-
китов. Эти исследования показали зоонозную природу сельского
остронекротизирующегося типа кожного лейшманиоза и подтвер-
дили его природную очаговость, учение о котором разработано
академиком Е. Н. Павловским. Источником инфекции в условиях
города является больной лейшманиозом человек. Поэтому этот
тип кожного лейшманиоза отнесен к антропонозам.
В 1940 г. А. П. Крюковой впервые удалось получить заражение
грызуна кожным лейшманиозом через укус москита в искусствен-
ных условиях. Исследования по изучению роли москитов в рас-
пространении лейшманий, проведенные П. А. Петрищевой, легли в
основу профилактики кожного лейшманиоза.
Большое значение в изучении клиники, иммунитета, специфи-
423
ческой профилактики, лечения экспериментального кожного лейш-
маниоза имеют многочисленные работы П. В. Кожевникова и его
учеников (Н. Ф. Родякина, М. Э. Эрешова, Р. С. Добржанской,
Н. М. Ханмамедова, А. Н. Соколовой, А. А. Шаховой, П. А. Ду-
бовского), а также работы В. М. Сафьяновой, О. И. Келлиной,
Э. Е. Шуйкиной, К. М. Гусейн-Заде и др.
Проблеме лейшманиоза и другим трансмиссивным природно-
очаговым заболеваниям в республиках Средней Азии и Закавказья
было посвящено 5 межреспубликанских совещаний: 3 — в Ашха-
баде (1940, 1962, 1969), одно —в Душанбе (1965) и одно—
в Самарканде (1967), 2 международных семинара ВОЗ (1967,
1979).
Географическое распространение кожного
лейшманиоза связано с местами обитания переносчика этого
заболевания — москитами, для жизнедеятельности которых нужен
теплый и жаркий климат, чтобы суточная температура воздуха не
менее 50 дней (время развития одной популяции) не снижалась
ниже 20 °C. Поэтому лейшманиоз преимущественно распространен
в тропических и субтропических странах. Наиболее активные оча-
ги заболеваемости лейшманиозом расположены в Северной и
Центральной Африке (Марокко, Алжир, Тунис, Ливия, Египет,
Эфиопия, Судан и др.) и в Азии (Сирия, Ирак, Израиль, Иорда-
ния, Турция, Иран, Саудовская Аравия, Пакистан, Индия и Афга-
нистан).
В Европе небольшое количество больных регистрируется в
Греции, Италии, Испании, Португалии и на юге Франции. В Аме-
рике особая форма лейшманиоза, близкая по клинике к кожному
лейшманиозу Старого Света, имеет место в Аргентине, Боливии,
Бразилии, Венесуэле, Колумбии, Мексике, Перу и др. Зоонозный
кожный лейшманиоз распространен в Туркмении и Узбекистане.
До 50-х годов отдельные эндемические зоны этого типа лейшма-
ниоза были в Таджикской, Армянской, Грузинской, Казахской
и Киргизской ССР. В последние два десятилетия заболеваемость
в этих республиках не регистрируется. Что касается антропоноз-
ного кожного лейшманиоза, то он за последние 10 лет регистри-
руется очень редко.
В Туркмении и Узбекистане в связи с активным освоением
пустынных и полупустынных территорий выявляются новые,
ранее неизвестные" природные очаги, в которых заболеваемость
кожным лейшманиозом иногда принимает характер эпидемических
вспышек.
Этиология. Возбудитель кожного лейшманиоза открыт П. Ф. Бо-
ровским в 1898 г. На срезах и содержимом лейшманиозных язв
он обнаружил и описал овальные тельца, заполнявшие протоплаз-
му клетки, и отнес их к типу простейших — протозоа. В 1903 г.
J. Wright у приезжего больного из Армении нашел таких же пара-
зитов и дал им название Helcosoma tropicum.
В 1900 г. английский врач W. Leishman в мазках из селезенки
умершего больного от тропической болезни кала-азар обнаружил
424
паразитов в виде овальных телец, описание которых он дал через
три года. В 1903 г. ирландский врач-бактериолог Ch. Donovan в
Мадрасе (Индия) из пунктата селезенки больных кала-азар
обнаружил аналогичных паразитов, идентичных тем, которых ви-
дел Leishman. В том же году паразитолог R. Ross описал этого
паразита и определил его место в систематике простейших. Этому
возбудителю болезни кала-азар дали название Leishmania donovani
в честь врачей Leishman и Donovan, впервые его обнаруживших.
Ввиду того что возбудитель кожного лейшманиоза, открытый
П. Ф. Боровским, морфологически похож на Leishmania donovani,
по предложению J. Wright возбудитель кожного лейшманиоза
получил название Leishmania tropica.
Исходя из сроков и приоритета открытия возбудителя кожного
лейшманиоза, многие отечественные ученые справедливо считают,
что этому возбудителю следовало бы дать название «тельца Боров-
ского», а болезнь называть термином «болезнь Боровского».
Однако исходя из международных правил зоологической номен-
клатуры, большинство отечественных ученых (академик Е. Н. Пав-
ловский и др.) высказались за сохранение термина «лейшмания».
По тем же соображениям сохраняются и термины «кожный лейш-
маниоз» с допустимым добавлением «болезнь Боровского». Возбу-
дитель кожного лейшманиоза по-прежнему называют Leishmania
tropica. В русской транскрипции слово «лейшмания» остается.
Лейшмании относятся к роду семейства трипаносомид (Тгу-
panosomidae), отряду протомонадид (Protomonadida), классу жгу-
тиковых, типу простейших. В организме человека и других позво-
ночных имеют внутриклеточную, неподвижную лейшманиальную
стадию, а в кишечнике переносчика (флеботомусов) и на искус-
ственных средах — жгутиковую, подвижную лептомонадную ста-
дию. Для обозначения различных стадий развития Hoare, Walloce
в 1966 г. предложили лейшманиальную стадию именовать «ама-
стиготы», а лептомонадную стадию — «промастиготы». Эта терми-
нология в последние годы находит широкое употребление (рис. 96).
В стадии амастиготы лейшмании имеют овальную или круглую
форму величиной 2—6Х 2—3 мкм. Протоплазма гомогенна и ок-
рашивается по методу Романовского — Гимзы в голубоватый цвет.
Ядро размером 0,8—1,5 мкм, округлой формы, окрашивается в
красный цвет. В протоплазме имеется кинетопласт округлой или
палочковидной формы. Лейшмании — амастиготы, размножаются
путем продольного деления надвое. Это деление происходит в
протоплазме клеток ретикулоэндотелиальной системы. Паразиты,
размножаясь, разрушают клетку и из межклеточного пространства
попадают в другие клетки.
В 1913—1915 гг. В. Л. Якимов, изучая лейшманиоз в Турке-
стане, по морфологическим особенностям выделил две разновид-
ности лейшманий: 1. Leishmania tropica var. major — большие
паразиты округлой, овальной формы и редко имеющие форму
рисового зерна величиной 5,49X3,92 мкм.
2. Leishmania tropica var. minor малые паразиты преимуще-
425
Рис. 96. Лейшмании.
«А» — амастиготы в макрофагах; «Б» — промастиготы в культуре и в кишечнике москита.
ственно в форме рисового зерна, реже круглые или овальные
величиной 3,92 X 3,24 мкм.
Автор не мог сказать, соответствуют ли этим двум разновид-
ностям лейшманий особые клинические формы заболевания. Это
позже сделали П. В. Кожевников и Н. И. Латышев, выделив
2 типа кожного лейшманиоза на основании клинических и эпи-
демиологических данных. Первый тип антропонозный, городской,
вызывается Leishmania tropica var. minor, второй тип зоонозный,
сельский, вызывается Leishmania tropica var. major.
В стадии промастиготы лейшмании имеют удлиненную верете-
нообразную форму с одним заостренным и другим тупым концом.
Длина лептомонады — 10—25 мкм, ширина — 5—6 мкм. Ядро
располагается в средней части, кинетопласт — в переднем конце
тела паразита. Жгут длиной 15—20 мкм берет начало у кинето-
пласта. Делится продольно: сначала делится кинетопласт, затем
ядро и цитоплазма. При окраске по Романовскому—Гимзе
цитоплазма окрашивается в голубой, а ядро и кинетопласт —
в красно-фиолетовый цвет, жгут — в сиренево-розовый. Лепто-
монады-промастиготы в кишечном канале москитов и на пита-
тельных средах развиваются из лейшманий-амастигот примерно
через 20 ч.
Культивирование лейшманий производится на разных средах.
Чаще всего для их культивирования применяется среда 3N-arap
(Novy—Nial—Nicol), содержащая 14 г агара, 6 г хлористого нат-
рия на 900 мл дистиллированной воды с последующим добавлением
426
Рис. 97. Схематическое изобра-
жение ультратонкого строения
промастиготной стадии лейшма-
нии.
Ж Г — жгут; Ж.Р — жгутиковый резер-
вуар; Б — блефаропласт; ЦМ — цито-
плазматическая мембрана; ПМТ— пел-
ликулярные микротрубочки; М — мито-
хондрии; К — кинетопласт; Р—рибосо-
мы; Я — ядро; ЯО — ядерная оболочка;
АГ — аппарат Гольджи; В — цитоплаз-
матические включения (лизосомы, ли-
посомы, амилоидные тела и др.).
дефибринированной крови
кролика из расчета одна часть
крови на три части агара.
Лейшмании на средах растут
при оптимальной температу-
ре 22 °C и при pH 7,4—7,6.
При температуре 45 °C лейш-
мании быстро погибают, но
при значительном снижении
температуры длительно со-
храняют жизнеспособность.
В последние годы уделя-
ется значительное внимание
ультраструктуре возбудителя
кожного лейшманиоза [Ава-
кян А. А., 1966; Коше-
лев Б. А., 1972; Ману-
кян И. А., Сафьянова В. М.,
1972; Овчинников Н. М. и др.,
1974; Bossie, 1969; Djaczenco,
1969].
На ультратонких срезах
тело промастигот имеет вы-
тянутую и торпедовидную форму, трехслойную мембрану, субпе-
ликулярные микротрубочки, тянущиеся по всей длине лептомона-
ды, цитоплазму с рибосомами, эндоплазматическим ретикулумом,
характерным ядром, кинетопластом с центральной спиралью из
ДНК и жгутика, заключенного в мешок. Зона Гольджи и мито-
хондрии являются составной частью цитоплазмы. Функция жгу-
тика заключается в движении и затягивании пищевых частиц в
мешок. Этот мешок имеет прямое отношение к пищеварению, в
котором принимают участие также липидные гранулы, лизосомы
и пр. (рис. 97).
Основным морфологическим отличием лейшманий-амастигот от
лептомонад-промастигот является круглая и овальная их форма,
короткий жгутик, не выступающий из жгутикового кармана. Эндо-
плазматический ретикулум выражен слабо. В остальном ультра-
структура амастигот соответствует промастиготам.
427
В толковании функционального значения отдельных микро-
структур лейшманий еще много неясного, и эти исследования про-
должаются.
Источник инфекции. Решению этого вопроса во мно-
гом содействовало учение о природной очаговости болезней,
впервые разработанное в СССР академиком Е. Н. Павловским.
Благодаря многолетней работе его учеников проф. Н. И. Латы-
шева и проф. П. А. Петрищевой было выяснено, что сельский тип
кожного лейшманиоза является одной из самых распространенных
болезней диких грызунов, обитающих в пустынных и полупустын-
ных местностях. Классическим природным источником заражения
кожным лейшманиозом людей являются грызуны-песчанки.
Очаги зоонозного кожного лейшманиоза существуют в пустын-
ных и полупустынных местностях вследствие циркуляции возбу-
дителя от больных грызунов к здоровым при посредничестве пе-
реносчика — москитов и не зависят от жизнедеятельности чело-
века. Заражение человека происходит во время его пребывания
в местности с природными лейшманиозными очагами в период
лета москитов.
Основным источником заражения кожным лейшманиозом го-
родского типа является больной человек, поэтому принято город-
ской тип кожного лейшманиоза называть антропонозным.
Переносчиком возбудителя кожного лейшманиоза
являются двукрылые кровососущие насекомые — москиты семей-
ства Psychodidae (бабочниц), подсемейства Phlebotominae.
Москиты заражаются лейшманиями при кровососании пора-
женных участков кожи, заглатывая не только кровь, но и тканевую
жидкость и клетки, в которых содержатся паразиты. В кишечнике
москита лейшмании-амастиготы превращаются в жгутиковые фор-
мы лептомонады-промастиготы к концу первых суток и к четверто-
му дню их обнаруживают в глотке переносчика. Нападая на чело-
века, москиты, пораженные лептомонадами, при укусе переносят
их человеку, вызывая у него кожный патологический процесс.
С установлением возбудителя и его переносчика в природе
кожный лейшманиоз отнесен к природно-очаговым, облигатно-
трансмиссивным инфекциям.
Как уже указывалось, заболеваемость кожным лейшманиозом в
течение года имеет четкий сезонный характер. В Туркмении и Уз-
бекистане заболеваемость зоонозным лейшманиозом начинается в
июне и заканчивается в ноябре, достигая максимума в августе и
сентябре. Небольшие сдвиги в ту или другую сторону обуслов-
лены условиями труда. Строго постоянная сезонная заболевае-
мость главным образом связана с жизнедеятельностью перенос-
чиков болезни — москитов. С прекращением лёта москитов в
ноябре прекращается и заболеваемость лейшманиозом до мая,
когда вновь наступает время их вылета.
Классификация. В 1940 г. П. В. Кожевников и Н. И. Латышев
объединили все имеющиеся кожные формы лейшманиоза в стра-
не в две основные группы, или типы (см. табл. 4): а) поздно изъязв-
428
Таблица 4. Особенности двух типов кожного лейшманиоза
(по П. В. Кожевникову и Н. И. Латышеву)
I тип II тип
Синонимы Инкубация Начальные явления Развитие процесса Время наступления изъязвления Лимфангоиты Бугорки обсеменения Локализация Длительность процесса до эпителизации Сезонность Эпидемические вспышки Хранитель паразитов Места распространения Количество паразитов в лейшмапиомах Вирулентность для белых мышей Возбудитель I [оздноизъязвляющийся лейшманиоз. Ашха- бадская язва. Кокапд- ка. Годовик Длительная: обычно 2— 6 мес, нередко 1 —2 го- да Небольшая папула-буго- рок телесного или бу- роватого цвета Медлен ное Через 3—6 мес и более Редки Относительно редки На лице чаще, чем на нижних конечностях Год и более Первичное заболевание возможно на протяже- нии всего года Наблюдаются редко Человек (?) Преимущественно. в го- родах (typus urbanus) Много Малая Leishmania tropica var. minor Остронекротизирующий- ся лейшманиоз. Пен- динская язва в узком смысле этого понятия. Мургабская язва Короткая: обычно 1- 4 нед Значительный островос- палительный, часто фу- рункулоподобный ин- фильтрат Быстрое Через 1 3 нед Часты Часты На нижних конечностях чаще, чем на лице 3—6 мес Первичное заболевание возможно только в лет- не-осенние месяцы (июль октябрь) Легко развиваются тяже- лые вспышки Дикие грызуны пустыни В сельских поселках, на окраинах городов н пустынных местностях (typus rusticus) Мало Большая Leishmania tropica var. major
ляющийся (Leishmaniosis cutis tardae exulcerans), или первый, тип
и б) остронекротизирующийся (Leishmaniosis cutis cito necrotisans),
или второй, тип.
Такое подразделение основывается:
1. На клинических признаках. В зависимости от скорости на-
ступления некроза кожной лейшманиомы и продолжительности
болезни.
2. На основных резервуарах инфекции. При первом типе ре-
зервуаром инфекции является больной человек (антропоноз), при
втором — дикие грызуны пустыни (зооноз).
3. На приуроченности к ландшафту. Первый тйб распространен
преимущественно в городах — городской тип, второй — в пустын-
ной и сельской местности — сельский тип.
429
4. На морфологических особенностях возбудителя: Leishmania
tropica minor — при антропонозном типе, Leishmania tropica ma-
jor — при зоонозном типе.
В существовании двух типов кожного лейшманиоза оставались
невыясненными вопросы взаимоотношения между ними. Постоян-
ство признаков, свойственных для каждого из них, дало основание
высказать предположение о нозологической самостоятельности
каждого типа. Однако исследования последних лет позволили
накопить ряд факторов, ставящих под сомнение строгое разгра-
ничение кожного лейшманиоза на два самостоятельных заболе-
вания.
Клиническая классификация кожного лей-
шманиоза. Клинические проявления кожного лейшманиоза у
человека разнообразны. Они обусловлены состоянием организма,
типом лейшманиоза, вирулентностью возбудителя, характером за-
ражения, локализацией, возникающими осложнениями и другими
причинами. Все это создает большие трудности в построении
всеобъемлющей клинической классификации.
У человека, заболевшего тем или другим типом кожного лейш-
маниоза, происходят реактивные изменения, которые отражаются
на закономерной смене клинических проявлений. Этот постепен-
ный и строго постоянный переход отдельных периодов болезни
говорит о цикличности кожного лейшманиоза. Если заболевшего
не подвергать терапевтическому вмешательству, то болезнь, пройдя
определенные стадии развития, в большинстве случаев заканчи-
вается выздоровлением. Отдельным стадиям болезни свойственны
постоянные клинические проявления, в которых можно различать
некоторые разновидности, обусловленные типом кожного лейшма-
ниоза, состоянием организма и другими причинами. Тип кожного
лейшманиоза (антропонозный или зоонозный) имеет некоторые
клинические особенности, но они не изменяют основной законо-
мерности течения болезни, связанной с реактивностью организма.
Исходя из этого, все клинические проявления кожного лейшма-
ниоза независимо от его типа следует классифицировать следую-
щим образом:
1. Первичная лейшманиома:
а) стадия бугорка,
б) стадия изъязвления,
в) стадия рубцевания.
2. Последовательная лейшманиома:
а) ранняя,
б) средняя,
в) поздняя.
3. Диффузно-инфильтрирующаяся лейшманиома.
4. Туберкулоидный лейшманиоз.
В эту краткую и простую классификацию входят все клиниче-
ские проявления кожного лейшманиоза без осложнений, которые
классификации не подлежат.
К первичной лейшманиоме относится первичное клиническое
430
проявление болезни на месте внедрения в кожу возбудителя —
лейшманий. Первичной лейшманиоме свойственно строгое циклич-
ное течение с закономерной сменой всех стадий развития болезни.
Как правило, первичная лейшманиома проходит через стадию
бугорка, его распада с образованием язвы и заканчивается стой-
ким рубцом.
К последовательной лейшманиоме относятся те клинические
проявления кожного лейшманиоза, которые возникают и разви-
ваются на месте внедрения лейшманий через некоторое время
после первичной лейшманиомы, когда у больного уже начинают
развиваться иммунологические процессы. Клиническая картина
этих лейшманиом зависит от времени их появления после первич-
ной лейшманиомы.
Диффузно-инфильтрирующая лейшманиома является особой,
редко встречающейся клинической формой заболевания, наблю-
дающейся преимущественно в эндемических очагах антропоноз-
ного типа.
Туберкулоидный лейшманиоз — также особая клиническая
разновидность кожного лейшманиоза, встречающаяся в очагах
антропонозного типа.
ЗООНОЗНЫЙ КОЖНЫЙ ЛЕЙШМАНИОЗ
(ОСТРО НЕКРОТИЗИРУЮЩИЙСЯ КОЖНЫЙ ЛЕЙШМАНИОЗ —
LEISHMANIOSIS CUTIS CITO NECROTISANS)
Инкубационный период. При укусе зараженного
москита в кожу человека внедряются лептомонады-промастиготы,
которые затем трансформируются в лейшмании-амастиготы. Па-
тологический процесс в коже возникает только после этой транс-
формации, на которую требуется некоторое время. В культуре
ткани переход из стадии лептомонад в стадию лейшманий проис-
ходит через 24 ч после заражения культуры. По-видимому, в пре-
делах этого времени происходит трансформация лептомонад в
лейшманийную стадию и при естественном заражении человека.
Длительность инкубационного периода при зоонозном кожном
лейшманиозе продолжается от нескольких дней до 2 мес (в боль-
шинстве случаев 5—15 дней).
Первичная лейшманиома. Стадия бугорка. Это началь-
ная клиническая стадия лейшманиоза возникает на коже после
инкубационного периода на месте укуса зараженного москита.
Появляется ограниченный, островоспалительный, болезненный ин-
фильтрат красного цвета, величиной 2—4 мм. Вначале он плоский,
затем принимает конусообразную форму, похожую на начальную
стадию фурункула, отличаясь от него меньшей плотностью и бо-
лезненностью. Инфильтрат очень быстро растет, увеличивается
по периферии и уже ко второму-третьему дню достигает величины
8—10 и даже 15—20 мм в диаметре. С его ростом увеличивается
и окружающий воспалительный отек кожи, который в некоторых
случаях достигает значительной величины.
431
Стадия изъязвления. Быстрота наступающего некро-
тического распада бугорка с острым течением возникшей язвы
послужила основанием к выделению этого типа кожного лейшма-
ниоза в самостоятельную разновидность, получившую название
Leishmaniosis cutis cito necrotisans.
В центре бугорка формируется некроз, после отторжения ко-
торого образуется небольшая обрывистая, как бы высверленная
язва диаметром 2—4 мм с некротическим дном. Вокруг некротиче-
ской язвы имеется довольно широкая, как при обычном фурунку-
ле, зона инфильтрата с воспалительным отеком окружающей ко-
жи. Вся клиническая картина такой лейшманиомы напоминает
фурункул. Однако в отличие от последнего при лейшманиоме нет
такой острой болезненности и нет типичного некротического
стержня. После начавшегося распада бугорка боль не исчезает
и может даже усилиться. Последующая некротизация инфильтра-
та идет довольно быстро. Иногда образовавшийся некротический
струп не отторгается, а задерживается над поверхностью инфильт-
рата, образуя темно-коричневую, слегка выступающую покрышку.
Эту язвенную клиническую разновидность кожного лейшманиоза
можно назвать фурункулоидно-некротической лейшманиомой.
С этой лейшманиомой больные чаще всего и обращаются за ме-
дицинской помощью.
Наступивший распад центральной части бугорка расширяется
по периферии как за счет распада окружающего инфильтрата,
так и нередко за счет присоединившихся новых очагов некроза,
образующихся на воспаленной коже вокруг инфильтрата. Изъязв-
ление идет довольно быстро и уже в ближайшие 3—5 дней диа-
метр язв может достигать 3—4 см.
Величина язв подвержена большим колебаниям и зависит от
их количества и локализации. Как правило, одиночные язвы, рас-
положенные на коже живота и спины, бывают больших размеров,
достигая иногда величины детской ладони и более. При множест-
венных лейшманиомах, когда число их достигает нескольких де-
сятков, язвы обычно бывают небольшого размера (5—8 мм в
диаметре).
Отделяемое язв серозно-гнойное, обильное. Иногда это отде-
ляемое ссыхается и язва покрывается рыхлой буровато-гнойной
коркой, которая легко отторгается. В дальнейшем дно язвы,
покрытое беловато-серым или гнойным налетом, начинает посте-
пенно очищаться от некротических масс; появляются красные со-
сочковые зернистые разрастания, напоминающие икру. Язва имеет
круглую, овальную или неправильную форму. Края ее то ровные,
подрытые, то фестончатые, как бы изъеденные. В некоторых слу-
чаях они нависают над дном язвы, увеличивая подрытость и обра-
зуя карманы (рис. 98).
Величина инфильтрата вокруг язвы различная. Иногда этот
инфильтрат очень большой, мощный. Некротическая язва на таком
инфильтрате имеет вид узкой щели или незначительного кратеро-
формного образования. В этих случаях инфильтрат шириной до
432
Рис. 98. Язвенная лейшма-
ниома зоонозного типа (дав-
ность 2 мес).
10 мм и более возвыша-
ется над язвой в виде ва-
лика. По мере удаления от
язвы он становится более
пологим и постепенно вы-
равнивается с поверх-
ностью кожи. В других,
более часто встречающих-
ся случаях, инфильтрат
быстро вовлекается ’в яз-
венный процесс, остается
небольшой (шириной 1 —
3 мм), слегка приподня-
тый ободок вокруг язвы.
Во второй половине бо-
лезни дно язвы полностью
очищается от некротиче-
ских наслоений, грануля-
ции начинают быстро раз-
растаться, сосочки стано-
вятся высокими и напоми-
нают папилломы. Такие папилломатозные разрастания могут зна-
чительно выступать над поверхностью кожи. Верхушки сосочков
покрываются белесоватым, как бы роговым слоем, между ними
образуются довольно глубокие бороздки, из которых при надавли-
вании может выделяться серозно-гнойная жидкость. Сами сосочки
вскоре лишаются влажности, высыхают и грубеют. Ножки их ис-
тончаются, и они начинают безболезненно отторгаться, оставляя
шероховатую поверхность (симптом Добротворской). Такая кли-
ническая разновидность может быть названа вегетирующей лейш-
маниомой. Длительность язвенной стадии без лечения продол-
жается от 2 до 4 мес. Однако в лечебной практике часто при-
ходится сталкиваться с отклонениями от типичной клиники,
обусловленными локализацией лейшманиом, их осложнениями и
общей реактивностью организма.
Осложнения язвенной лейшманиом ы. Язвен-
ная стадия очень часто протекает с различными осложнениями.
Их можно разделить на две группы. Одни осложнения связаны с
возбудителем болезни — лейшманиями и поэтому могут быть на-
званы специфическими. Другие возникают от различных причин,
не имеющих прямого отношения к возбудителю.
К специфическим осложнениям относятся так называемые бу-
горки обсеменения и лейшманиозные лимфангиты.
В период изъязвления основной лейшманиомы или несколько
позже на нераспавшемся инфильтрате и за его пределами появ-
«3
ляются то одиночные, то многочисленные бугорки округлой фор-
мы, темно-красного цвета величиной 2—5 мм. Они могут быть
изолированными или сливаться друг с другом и с основной лейш-
маниомой. Некоторые бугорки после своего возникновения на этом
завершают цикл развития, другие распадаются с образованием
небольших язвочек, сливаясь с основной лейшманиозной язвой,
они образуют фестончатость ее краев. При наличии у больного
нескольких лейшманиом бугорки обсеменения могут быть при всех
или только при некоторых. При локализации лейшманиом на сто-
пах, кистях и спине бугорки всегда множественные, количество
их может достигать нескольких десятков. В бугорках обсеменения
обнаруживаются лейшмании, но в значительно меньшем количе-
стве, чем в основной лейшманиоме.
Есть два возможных объяснения появления бугорков обсеме-
нения. Они могут появиться в результате последовательного внед-
рения в кожу возбудителя после укуса одного и того же зара-
женного москита. При первом укусе в кожу внедряется макси-
мальное количество возбудителя, что определяет возникновение
основной лейшманиомы. При повторных укусах того же москита
внедрение в кожу возбудителя постепенно уменьшается, что и
ведет к возникновению менее развитых лейшманиом-бугорков.
Более вероятное возникновение бугорков в результате мигра-
ции лейшманий по межклеточным канальцам из основной лейшма-
ниомы. Это подтверждается появлением бугорков вокруг привив-
ной лейшманиомы, когда естественное заражение от москита
исключается.
Рубцевание распавшихся бугорков обсеменения идет одновре-
менно с рубцеванием основной лейшманиомы, но в некоторых слу-
чаях значительно отстает от нее. Зоонозный кожный лейшманиоз
очень часто протекает с наличием бугорков обсеменения — до
75—80%.
Ко вторым частым специфическим осложнениям язвенной
стадии лейшманиомы относятся лимфангиты и лимфадениты. Они
появляются в первой половине язвенной стадии в результате миг-
рации лейшманий по лимфатическим сосудам, вплоть до лимфа-
тических узлов. В отличие от лимфангитов, вызываемых кокковой
флорой, лейшманиозные лимфангиты имеют своеобразную клини-
ческую картину. От верхнего края распавшейся лейшманиомы в
подкожной клетчатке или более поверхностно появляются плотные
малоболезненные узлы величиной от мелкой горошины до лесного
ореха. Кожа над ними вначале слегка натянута, не спаяна с узлами,
нормального цвета. Затем они начинают несколько увеличиваться,
спаиваться с кожей, которая над ними приобретает сине-красный
цвет. Консистенция узлов становится тестоватой, появляется
болезненность. Воспалительный процесс в некоторых узлах про-
грессирует и приводит к их язвенному распаду. Другие узлы не
доходят до распада и остаются в таком состоянии длительное
время, даже после заживления основной лейшманиомы. Иногда от
язвы отходят тяжи или шнуры, достигающие 1 см в поперечнике
434
Рис. 99. Язвенная
лейшманиома со специ-
фическим лимфадени-
том (давность 3 мес).
и 5—10 см в длину. Располагаясь в подкожной клетчатке, они
плотны на ощупь и вначале не спаяны с кожей. Затем в них уси-
ливаются воспалительные явления с возможным образованием
язвочек с гнойно-серозным отделяемым (рис. 99).
Прямой связи между количеством лейшманиозных язв и часто-
той лимфангитов не существует. Они могут быть при одиночных
лейшманиомах и отсутствовать при множественных. Чаще всего
узловатый лимфангит наблюдается на верхних и нижних конеч-
ностях, на лице. На конечностях четкообразные лимфангиты могут
тянуться через всю голень или предплечье и заканчиваться на
бедре или плече, не доходя до бедренных и подмышечных лим-
фатических узлов. Чаще всего лимфангиты наблюдаются на вто-
ром и третьем месяце язвенной стадии, на верхних и нижних
конечностях у лиц физического труда. Частота их у разных групп
больных колеблется от 12 до 76 %. Специфические лимфадениты
встречаются реже — до 34 %.
Разрешение лимфангитов идет медленнее, чем заживление ос-
новной лейшманиомы. Рассасывание узловатых лимфангитов мо-
жет задерживаться на 1—2 мес после полного рубцевания язвы.
Неспецифические осложнения обычно имеют место при язвен-
ной стадии и связаны с локализацией лейшманиомы и присоеди-
нением пиококковой инфекции. Локализация язв на коленном, го-
леностопном, локтевом и лучезапястном суставах ограничивает их
подвижность и нередко ведет к потере трудоспособности больного.
Постоянная травматизация расположенных здесь лейшманиом
435
мешает эпителизации, а присоединение вторичной инфекции при
отсутствии рационального лечения усиливает воспалительные
явления. В подобных случаях кожа вокруг язвы краснеет, отекает,
увеличивается болезненность и в этих случаях клиническая кар-
тина начинает напоминать рожистое воспаление. Нарушается и
общее состояние больного: появляется слабость, повышается
температура. Иногда появляются пиогенные лимфангиты в виде
красных полос шириной 3—10 мм, сопровождающиеся резкой
болезненностью и отечностью кожи. Процесс протекает остро и
после применения антибактериальной терапии заканчивается в
несколько дней.
Вторичная инфекция может присоединиться к имеющемуся
специфическому лейшманиозному лимфангиту. Тогда в некоторых
узлах увеличивается отечность, появляется ограниченное покрас-
нение, не выходящее за пределы лимфангита. Повышается мест-
ная и общая температура, усиливается болезненность.
В течение язвенной стадии лейшманиоза бактериальная флора,
являясь постоянным ее спутником, оказывает большое влияние
как на клинику, так и на длительность лейшманиозного процесса.
В лейшманиозных язвах обнаруживается разнообразная микро-
флора, но наиболее часто гемолитический стрептококк и золоти-
стый стафилококк.
Стадия рубцевания, завершающая стадия лейшмани-
озного процесса, начинается в период отторжения сосочков и очи-
щения язвы от некротических наслоений. В центре язвы появляют-
ся островки эпителизации, которые быстро увеличиваются, сли-
ваются и покрывают все дно язвы. Центральная эпителизация
очень характерна для зоонозного кожного лейшманиоза, но в
некоторых случаях она может начинаться и с краев. С начала
эпителизации язвы прогрессивные процессы в лейшманиоме еще
могут продолжаться за счет дальнейшего распада и некротизации
инфильтрата. В этом случае дно язвы покрывается свежим моло-
дым эпителием, а по краям его полукольцом или кольцом окру-
жает изъязвившийся инфильтрат. В некоторых случаях распад
инфильтрата происходит не полностью; нераспавшие участки его
остаются до полного заживления язвы и нависают над оформив-
шимся рубцом. В большинстве случаев стадия рубцевания при
зоонозном лейшманиозе длится 15—30 дней.
Все течение первичной лейшманиомы зоонозного типа от вре-
мени появления бугорка до полного рубцевания укладывается в
сроки от 3 до 6 мес, чаще — 3—4 мес.
АНТРОПОНОЗНЫЙ КОЖНЫЙ ЛЕЙШМАНИОЗ
(ПОЗДНО ИЗЪЯЗВЛЯЮЩИЙСЯ КОЖНЫЙ ЛЕЙШМАНИОЗ —
LEISHMANIOSIS CUTIS TARDE EXULCERANS)
Инкубационный период. На основании средних ста-
тистических данных длительность инкубационного периода естест-
венного кожного лейшманиоза антропонозного типа укладывается
436
в сроки от 3 до 6 мес с колебаниями чаще в сторону удлинения.
Первичная лейшманиома. Стадия бугорка. В отличие
от зоонозного типа стадия бугорка кожного лейшманиоза антро-
понозного типа развивается медленно и протекает длительно. На
месте внедрения в кожу возбудителя после длительной инкубации
возникает небольшой, еле заметный бугорок цвета нормальной
кожи или буроватой окраски. Постепенно бугорок выступает над
поверхностью кожи, уплотняется, принимает округлую форму и
более интенсивную буроватую окраску. Величина его вначале не-
большая (2—3 мм), затем постепенно, очень медленно увеличи-
вается и через 3—4 мес может достигнуть от 5—6 до 20 мм в
поперечнике.
По мере роста бугорка кожа над ним становится напряженной,
блестящей. В центре его возникает небольшое кратерообразное
углубление — ямка с роговыми чешуйками на дне. Когда на по-
верхности бугорка возникает шелушение, углубление исчезает.
Блеск бугорка, его плотность, отсутствие активных воспалитель-
ных явлений и наличие в центре углубления — очень характерные
ранние диагностические признаки лейшманиозного бугорка.
Длительность стадии бугорка кожного лейшманиоза антропо-
нозного типа колеблется в широких пределах — от 2 мес до 1 года
и более, но чаще — 4—8 мес.
Стадия изъязвления. Распад бугорка и переход его в
язвенную стадию происходят на 4—8 мес. После отторжения
кровянисто-гнойной корки обнажается эрозивная кровоточащая
поверхность с последующим значительным разрушением эпителия
и дермы. Этому способствует присоединение вторичной инфекции
и усиление воспалительных явлений. Образовавшаяся неглубокая
язва имеет неровные обрывистые края, розовое, слегка зернистое
дно и скудное серозно-гнойное отделяемое. Воспалительные явле-
ния постепенно нарастают, дно язвы покрывается беловатым или
сероватым налетом, возникает некротизация, ведущая к углублению
язвы. В процесс распада вовлекается окружающий инфильтрат,
размер язвы увеличивается, она принимает различную форму.
Изъязвление инфильтрата идет медленно и тогда язва представля-
ется окруженной еще нераспавшимся валикообразным инфильтра-
том, нависающим над ее поверхностью. Глубина язвы относитель-
но невелика (до 2—3 мм), а размеры ее колеблются в значитель-
ных пределах и зависят от локализации, величины окружающего
инфильтрата и возникающих осложнений.
Длительность стадии изъязвления у 55 % больных продолжа-
ется 3 мес, у 40 % — 6 мес и только у 5 % больных эта стадия
затягивается до 1 года и более.
Осложнения язвенной лейшманиом ы. При
антропонозном кожном лейшманиозе у больных могут возникать
те же специфические и неспецифические осложнения, которые
наблюдаются и при зоонозном кожном лейшманиозе.
Бугорки обсеменения встречаются относительно редко. Они
возникают через 6 и более месяцев от начала заболевания в пе-
437
риод перехода бугорковой стадии в стадию изъязвления, сопут-
ствуют этой стадии, а иногда задерживаются до полного рубце-
вания лейшманиомы.
Лейшманиозные лимфангиты и лимфадениты при антропоноз-
ном типе встречаются также значительно реже, чем при зооноз-
ном, и протекают более доброкачественно.
Из неспецифических осложнений встречаются пиогенные
лимфангиты, обусловленные вторичной инфекцией. В отличие от
лейшманиозных они возникают внезапно и клинически протекают
остро в виде красных болезненных полос, с появлением у больного
температуры и слабости. Весь процесс длится короткое время и
при антибактериальной терапии бесследно заканчивается в не-
сколько дней.
Осложнения могут возникать в результате травмы, наслоения
сопутствующих заболеваний. Описаны случаи трансформации
антропонозной лейшманиомы в хроническую язвенную пиодермию
и рак кожи [Эрешов М. Э., Каримов Ш. М., 1957; Гасан-Заде,
1969].
Стадия рубцевания. Обратное развитие лейшманиомы
начинается с очищения язвы от некротических наслоений, появле-
ния зернистости и островков эпителизации. Воспалительные явле-
ния стихают, уменьшается болезненность. Разрастающиеся сосоч-
ки дна язвы поднимаются до уровня ее краев, с которых начи-
нается нарастание эпителия. Эпителизация может также начинать-
ся и с центра. Однако для антропонозного лейшманиоза более
характерна краевая эпителизация. Окружающий язву нераспав-
шийся инфильтрат начинает оседать, уплощаться и рассасываться.
Этот обратный процесс рассасывания инфильтрата по времени
может не совпадать с эпителизацией язвы, задерживаясь на
1—l'/г мес.
Центральная часть сформировавшегося рубца окружена руб-
цовой атрофией, по цвету близкой к нормальной коже. Дно рубца
может быть шероховатым или гладким.
Иногда на поверхности рубца появляются воспалительные
процессы с гиперемией, отечностью, образованием новых узлов
лимфангита или бугорков обсеменения. Такое состояние лейшма-
ниозного рубца может быть длительное времд (до одного года и
более) после заживления лейшманиозной язвы. В рубцах с нали-
чием слабовоспалительных проявлений при их гистологическом
исследовании иногда обнаруживаются лейшмании [Каримов Ш. М.,
Эрешов М. Э., 1961]. Поэтому можно считать, что эпителизация
лейшманиозной язвы не всегда означает окончание болезни.
Стадия рубцевания по времени протекает быстрее, чем две
предыдущих стадии, что, видимо, объясняется степенью возник-
шего иммунитета. У 60 % больных рубцевание лейшманиомы за-
вершается в течение одного месяца от начала появления островков
эпителизации на дне язвы. В более редких случаях оно затяги-
вается до двух месяцев.
Характерной особенностью антропонозного кожного лейшма-
438
ниоза является медленное и относительно спокойное развитие всех
стадий первичной лейшманиомы, особенно стадии бугорка. Позд-
ний его язвенный распад послужил основанием П. В. Кожевникову
дать название этому типу кожного лейшманиоза «Поздноизъязв-
ляющийся лейшманиоз» (Leishmaniosis cutis tarde exulcerans).
По сравнению с зоонозным типом несколько замедленнее проте-
кают и другие стадии — стадия изъязвления и стадия рубцевания.
Длительность течения первичной лейшманиомы антропонозного
типа от появления бугорка до стойкого рубца колеблется в боль-
ших пределах — от 6—8 мес до двух лет, но в большинстве слу-
чаев — от 6 мес до 1 года.
МЕЖТИПОВЫЕ КЛИНИЧЕСКИЕ ФОРМЫ
КОЖНОГО ЛЕЙШМАНИОЗА
В практической деятельности врачей, работающих в эндемич-
ных лейшманиозных зонах, встречаются больные, у которых опре-
делить тип кожного лейшманиоза представляет затруднение. У та-
ких больных возникший на коже патологический процесс по на-
чальным клиническим и эпидемиологическим признакам подходит
к одному из типов кожного лейшманиоза, однако при дальнейшем
развитии патологического процесса возникают изменения, свойст-
венные другому типу лейшманиоза. В таких случаях кожный
лейшманиоз клинически протекает с наличием признаков как
зоонозного, так и антропонозного типа, занимая промежуточное,
переходное положение между ними. Эти клинические формы кож-
ного лейшманиоза мы назвали межтиповыми.
Последовательные лейшманиомы. Если человек, заболевший
кожным лейшманиозом, продолжает оставаться в лейшманиозном
очаге, то на протяжении периода болезни до полного формирова-
ния иммунитета он остается под угрозой суперинфекции, в ре-
зультате которой могут возникать новые лейшманиомы.
Появившимся у больного в результате повторного заражения
новым лейшманиомам по аналогии с последовательными шанкрами
при сифилисе П. В. Кожевников дал название «последовательные
лейшманиомы». Клиническая картина последовательных лейшма-
ниом и длительность их течения связаны с давностью и стадией
первичной лейшманиомы. Однако, как правило, «последовательные
лейшманиомы» заканчиваются одновременно с первичной лейш-
маниомой. Это обстоятельство ставит клиническое течение после-
довательных лейшманиом в прямую зависимость от развития у
больного иммунологических процессов, возникающих в результате
течения первичной лейшманиомы. Можно считать, что последо-
вательные лейшманиомы представляют собой суперинфекцию на
разных этапах специфического иммунитета. Последовательные
лейшманиомы могут возникать при обоих типах кожного лейшма-
ниоза, но они более демонстративны при антропонозном типе,
при котором процессы иммунизации организма развиваются зна-
чительно медленнее, чем при зоонозном типе.
439
Новое внедрение в кожу больного лейшманий при наличии их в
организме больного не всегда вызывает лейшманиомы с полным
циклом развития. По времени появления их можно разделить на
ранние,х средние, поздние.
Ранние последовательные лейшманиомы возникают после пер-
вичной лейшманиомы через 10—15 дней при зоонозном типе и че-
рез 2—3 мес — при антропонозном типе. В своем клиническом
развитии ранние последовательные лейшманиомы проходят все
стадии первичной лейшманиомы.
Средние последовательные лейшманиомы возникают после пер-
вичной лейшманиомы через 20—30 дней при зоонозном типе и
через 3—6 мес — при антропонозном типе. Клинически протекают
в виде бугорка, окруженного инфильтратом, без выраженных
воспалительных явлений.
Поздние последовательные лейшманиомы возникают после
первичной лейшманиомы через 30—50 дней при зоонозном типе
и через 7—8 мес и более — при антропонозном типе. Клинически
протекают абортивно, в виде небольших бугорков, окруженных
воспалительным венчиком.
Наличие последовательных лейшманиом различной давности
создает у больного значительный полиморфизм кожных проявле-
ний. У таких больных можно одновременно наблюдать лейшма-
ниомы, находящиеся в различной стадии развития: от начальной
стадии бугорка до начальной стадии рубцевания.
В ранних последовательных лейшманиомах лейшмании обнару-
живаются в 63,1 % при зоонозном типе и в 70,0 % при антро-
понозном типе; в средних — в 20,0 % при зоонозном типе и в
37,5 % при антропонозном типе; в поздних — в 8,9 % при зооноз-
ном типе и в 17,6 % при антропонозном типе. Следовательно,
чем позже появляется последовательная лейшманиома, тем мень-
ше в ней находится лейшманий.
Диффузно-инфильтрирующая лейшманиома. Эта клиническая
разновидность кожного лейшманиоза встречается в 3—6 % слу-
чаев и чаще наблюдается при антропонозном типе, однако в клас-
сификации она выделена в самостоятельную форму по своему
клиническому течению. Диффузно-инфильтрирующая лейшманио-
ма наблюдается чаще у пожилых людей на лице, кистях, стопах и
характеризуется большой величиной поражения. На 3—4 мес
развития типично лейшманиозного бугорка кожа вокруг него при-
обретает застойно-красный цвет, становится отечной, напряжен-
ной, с гладкой или зернистой поверхностью. Возникший диффуз-
ный инфильтрат постепенно растет, увеличиваясь по периферии.
В таком состоянии процесс остается длительное время. Затем на
поверхности инфильтрата появляются плотно сидящие чешуйки,
инфильтрат начинает постепенно оседать, рассасываться и, на-
конец, полностью разрешается, иногда оставляя незначительную
атрофию кожи, которая постепенно исчезает. Весь процесс от
появления первичного бугорка до полного исчезновения уклады-
вается в срок от 6 мес до 1 года.
440
Туберкулоидный лейшманиоз является особой разновидностью
кожного лейшманиоза антропонозного типа, развивающегося у
человека с измененной реактивностью организма в результате
активации сохранившихся лейшманий или в результате естествен-
ной суперинфекции.
Основным морфологическим проявлением туберкулоидного
лейшманиоза является небольшой бугорок желтовато-бурого цвета
величиной от просяного зерна до чечевицы, плоской, конической
или полушаровидной формы. Эти бугорки могут быть изолиро-
ванными или сливаются друг с другом, образовывая бугорковые
инфильтраты. Поверхность бугорков большей частью гладкая,
блестящая, иногда шелушащаяся. При пальпации бугорков ощуща-
ется некоторая упругость, а при поскаблйвании — небольшая
болезненность. Располагаются бугорки на видимо невоспаленной
коже.
Лейшманиозные туберкулоидные бугорки никогда не появля-
ются первично. Они возникают или в процессе обратного развития
первичной лейшманиомы антропонозного типа, или после образо-
вания лейшманиозного рубца. По внешнему виду бугорки напо-
минают люпомы при туберкулезной волчанке, поэтому туберку-
лоидный лейшманиоз иногда называют люпоидным лейшманиозом.
Это внешнее сходство с туберкулезом кожи привело некоторых
авторов к безрезультатным поискам туберкулезных палочек.
Туберкулоидный лейшманиоз возникает чаще у детей и лиц
молодого возраста. Однако имеются случаи возникновения тубер-
кулоидного лейшманиоза и у лиц пожилого возраста. Наиболее
часто туберкулоидный лейшманиоз бывает на коже лица. Случаи
возникновения бугорков на других участках кожи относительно
редки и если они появляются на закрытых участках, то протекают
относительно доброкачественно.
Туберкулоидный лейшманиоз чаще всего возникает или в про-
цессе заживления, или вскоре после заживления первичной лейш-
маниомы. У части больных он развивается после искусственного
удаления первичной лейшманиомы в ее ранней стадии путем за-
мораживания углекислотой, обкалывания раствором акрихина и
прижиганием различными кислотами и щелочами. В большинстве
случаев бугорки возникают по краю рубца или на рубце после
первичной лейшманиомы, в более редких случаях — на некотором
расстоянии от рубца или даже на участках кожи, совершенно не
связанных с рубцом.
Туберкулоидный лейшманиоз является хроническим процессом.
Возникнув в период заживления первичной лейшманиомы или
через некоторое время после формирования рубца, этот процесс
тянется годами, то затухая, то обостряясь вновь. Просуществовав
неопределенно долгое время, бугорки или рассасываются с обра-
зованием атрофического рубца, или изъязвляются, покрываясь
буровато-гнойной корочкой. Обычно изъязвляются более старые
бугорки давностью 1 — 2 года, в то время как свежие наклонности
к распаду не имеют. Поэтому на пораженном участке можно на-
441
блюдать наряду с изъязвившимися свежие бугорки. На месте
изъязвившихся бугорков через 3—5 мес формируется рубец, на
котором могут вновь появиться лейшманиозные бугорки. Путем
распада и появления новых бугорков зона поражения кожи посте-
пенно увеличивается, захватывая, например, всю кожу щеки, носа,
ушной раковины. При распаде бугорков на ушной раковине в
процесс вовлекается хрящевая ткань с возможной деформацией
раковины.
Г истопатология. Морфологическим проявлением ан-
тропонозного типа кожного лейшманиоза является продуктивное
воспаление в дерме очагового или диффузного характера с обра-
зованием туберкулоидных узелков. Кажущийся клеточный поли-
морфизм даже при одной и той же клинической форме имеет свои
закономерности. Структура инфильтрата и его состав зависят от
давности лейшманиозного процесса, иммунного фона и последова-
тельности высыпания лейшманиом. Например, первичные одиноч-
ные гранулемы в первые 6—8 мес имеют гистиоцитарный узелко-
вый или диффузный инфильтрат, среди которого можно видеть
туберкулоидные узелки, представленные эпителиоидными клетками.
Нередко среди эпителиоидных клеток обнаруживают гигантские
клетки типа Пирогова—Лангханса. Некроза в инфильтрате не
наблюдают. Лейшмании обнаруживаются в макрофагах, эпите-
лиоидных клетках и в гигантских клетках Пирогова—Лангханса,
а в отдельных случаях — в эпителии. Начиная с 7—8-го месяца, в
инфильтрате появляются и постепенно увеличиваются в количестве
лимфоидные и плазматические клетки, что совпадает с началом
фибропластического процесса. С этого времени идет и активная
иммунологическая перестройка в организме. Количество лейшма-
ний в инфильтрате заметно уменьшается. Заживление лейшма-
ниомы происходит по типу специфической фибротизации с посте-
пенным новообразованием аргирофильных, коллагеновых и эласти-
ческих волокон.
Гистологическое исследование различных клинических форм
зоонозного кожного лейшманиоза выявляет ряд общих морфоло-
гических признаков для всех форм, но в то же время имеет неко-
торые отличия.
Первичным морфологическим элементом при зоонозном типе
является бугорок, представленный узелковым инфильтратом из
эпителиоидных клеток, зернистых лейкоцитов, лимфоидных и гис-
тиоцитарных элементов. В центре его, как правило, располага-
ется сосуд с явлениями фибриноидного набухания и фибриноид-
ного некроза стенки. В других сосудах видны тромбы. Периваску-
лярная зона пропитывается белковой жидкостью и лейкоцитами.
В центре бугорка развивается некроз. Вокруг зоны первичного
некроза формируются узелковые инфильтраты. Среди эпителиоид-
ных клеток нередко можно видеть гигантские клетки типа Пиро-
гова—Лангханса, что в целом напоминает туберкулезные бугорки.
Другие узелки образованы скоплением гистиоцитов, зернистых
лейкоцитов и лимфоидных клеток. В подобных гистиоцитарных
442
узелках всегда множество внутриклеточно расположенных лейш-
маний. В центре этих бугорков постепенно развивается некроз.
Зона некроза в одних узелках окаймляется беспорядочно лежа-
щими эпителиоидными клетками, в других — полинуклеарными
лейкоцитами или гистиоцитами. Эти узелковые образования отде-
ляются в виде светлых и темных очагов среди диффузного ин-
фильтрата, а в глубоких слоях и по периферии лейшманиом они
образуют изолированные мелкие узелки. По мере роста и развития
лейшманиомы в верхних слоях инфильтрата зоны некроза сли-
ваются, а в глубине некроз расположен соответственно центру
узелков. Формирующаяся грануляционная ткань в глубине ин-
фильтрата постепенно вытесняет некротические массы.
Начиная со 2—3-го месяца, отмечается нарастание количества
пиронинофильных плазматических клеток и гистиоцитов. Этот пе-
риод совпадает с началом фибропластического процесса и актив-
ной иммунологической перестройки организма.
Таким образом, в диагностике такого или иного типа кожного
лейшманиоза имеет значение клинико-эпидемиологическая и мор-
фологическая картина.
Антропонозному типу присущ чаще узелковый или сливной ин-
фильтрат. Некрозы не наблюдаются. Зоонозный тип кожного
лейшманиоза, имея подобную узелковую структуру, что и антропо-
нозный, всегда сопровождается некрозом. Аллергические измене-
ния сосудов и межуточной ткани нагляднее выражены при зооноз-
ном типе, при котором отмечается также вторичное вовлечение в
процесс сосудов более крупного калибра с развитием тромбовас-
кулитов. Клеточный состав инфильтратов при антропонозном и
зоонозном типах во втором периоде болезни становится более
однородным, а в первом — каждый тип имеет свою морфологиче-
скую специфику (Ш. М. Каримов).
Иммунитет. У человека естественная невосприимчивость к
кожному лейшманиозу отсутствует. Анализ заболеваемости насе-
ления в лейшманиозных очагах показывает, что она не зависит
от пола и возраста: мужчины и женщины, старики и дети в рав-
ной мере подвержены заболеванию. Отсутствует также и индиви-
дуальная невосприимчивость.
Стойкий иммунитет к кожному лейшманиозу у человека возни-
кает только в результате естественного или искусственного
(после прививки) заболевания. Чтобы приобрести невосприимчи-
вость, человек должен переболеть кожным лейшманиозом. Имму-
низация убитыми лептомонадами стойкого иммунитета не вызы-
вает. Приобретенная невосприимчивость после перенесения забо-
левания по наследству не передается. Дети, родившиеся от иммун-
ных родителей, остаются восприимчивыми к заболеванию. Среди
постоянного населения эндемичных лейшманиозных очагов забо-
леваемость наблюдается преимущественно среди детей раннего
возраста и вследствие этого невосприимчивость приобретается в
первые годы жизни. Поэтому среди взрослого постоянного населе-
ния этих очагов заболеваемость встречается относительно редко.
443
Между типами кожного лейшманиоза имеется перекрестный
иммунитет. Лица, переболевшие антропонозным типом, приобре-
тают невосприимчивость как к этому, так и к зоонозному типу и
наоборот. Однако иммунитет, возникающий после зоонозного типа,
отличается быстротой появления, напряженностью и стойкостью.
Полная невосприимчивость к суперинфекции при зоонозном типе
кожного лейшманиоза наступает на втором месяце болезни, при
антропонозном — на седьмом.
Процессы образования специфических антител у человека в
ходе лейшманийной инфекции еще недостаточно изучены. Много-
численные попытки обнаружения гуморальных антител обычно
кончались неудачей [Шуйкина Э. Е., 1963; Lainson R., Bray R.,
1964]. Серологические тесты указывают на присутствие сыворо-
точных антител, выявляемых различными серологическими реак-
циями: агглютинацией, преципитацией в геле, иммунофлюоресцен-
цией и др. С помощью реакции микропреципитации в геле и кон-
центрации сыворотки лимфогелем Р. С. Добржанской, А. И. Гусе-
ву (1975) удалось выявить гуморальные антитела у иммунных к
кожному лейшманиозу людей. В то же время кровь и сыворотка
заведомо иммунных людей мало влияют на рост лейшманий в
культуре и не вызывают их гибели. Переливание иммунной крови
больным не оказывает влияния на течение лейшманиозного про-
цесса.
Иммунологические сдвиги при кожном лейшманиозе прояв-
ляются не только в возникновении стойкого иммунитета, но и в
развитии готовности к аллергической реакции на введение специ-
фического антигена. У лиц, заболевших кожным лейшманиозом,
внутрикожное введение лейшманийного антигена вызывает реак-
цию гиперчувствительности замедленного типа (ГЗТ). Эта кожная
реакция при зоонозном типе появляется на 2—3-й неделе болезни
и сохраняется на долгие годы после выздоровления (реакция
Монтенегро). Ее постоянство при кожном лейшманиозе имеет
большое практическое значение и находит широкое применение
при диагностике болезни.
С проблемой иммунитета тесно связаны вопросы его практи-
ческого применения в диагностике и специфической профилакти-
ке кожного лейшманиоза. В целях диагностики применяют кож-
ные и серологические реакции.
Кожная аллергическая реакция (реакция Монтенегро) дает по-
ложительный результат как у больных, так и переболевших кож-
ным лейшманиозом. Поэтому она широко применяется с диагнос-
тической целью.
Для реакции применяют аллерген — взвесь убитых промасти-
гот в количестве 1—3 млн тел в 1 мл. Эту взвесь вводят строго
внутрикожно в наружную поверхность плеча тонкой иглой в
дозе 0,1—0,2 мл. На месте введения сразу образуется неболь-
шой волдырь в виде лимонной корочки, который бесследно исче-
зает в течение первого часа. При отрицательной реакции на
месте инъекции активных кожных проявлений не возникает, если
444
не считать точки от укола иглой и еле заметной, быстро исче-
зающей гиперемии. При положительной реакции через 6—10 ч
после инъекции появляется гиперемия, которая постепенно увели-
чивается и достигает максимума к концу вторых суток.
При зоонозном типе кожного лейшманиоза внутрикожная
реакция на лейшманийный антиген становится положительной,
начиная с 10—15-го дня болезни, при антропонозном типе кож-
ного лейшманиоза — после 2—3 мес болезни.
Кожная реакция на лейшманийный антиген держится стойко
не только во время болезни, но и неопределенно долго после
выздоровления больного.
В целях диагностики применяют несколько серологических
реакций. В качестве антигена используются свежие лейшманий-
ные культуры антропонозного и зоонозного типа.
Реакция связывания комплемента (РСК) с применением лейш-
манийного антигена может быть применена в диагностике кожного
лейшманиоза, но следует учитывать относительно высокий про-
цент неспецифических реакций (14,7%).
Реакция агглютинации. Техника реакции не отличается от
обычной реакции Видаля. В качестве антигена применяется ампу-
лированная лейшманийная культура 20—30-дневной давности. Ре-
акция читается через 24 ч. Если реакция агглютинации и может
применяться при клиническом исследовании больных, то обяза-
тельно следует учитывать значительный процент неспецифиче-
ских реакций с сыворотками неболевших и отрицательные реакции
с сыворотками больных или болевших кожным лейшманиозом.
Реакция иммобилизации лептомонад (РИЛ) была разработана
Н. Ф. Родякиным и Н. М. Ханмамедовым. Для ее постановки ис-
пользован принцип реакции иммобилизации бледных трепонем
(РИТ). Компонентами реакции являются испытуемая инактиви-
рованная сыворотка, антиген — живая лептомонадная культура и
комплемент морской свинки. Сущность реакции заключается в
том, что лептомонады в сыворотке больных и ранее болевших
кожным лейшманиозом людей в присутствии комплемента теряют
свою подвижность в течение одних суток, тогда как в сыворотке
неболевших они сохраняют свою подвижность до 2—3 сут. Эта
реакция снижает высокий процент неспецифических реакций и
поэтому имеет диагностическое значение.
Реакция микропреципитации в геле (Р. С. Добржанская). Ис-
пользован тест двойной диффузии в геле по Оухтерлони в мик-
ромодификации А. И. Гусева, В. С. Цветкова. Сущность реакции
заключается во взаимодействии антигенов со специфическими ан-
тителами в полутвердой среде и образовании нерастворимых
комплексов. Реагентами в реакции служат лейшманийный анти-
ген, приготовленный из лейшманийной культуры, неинактивиро-
ванная, нативная сыворотка больного.
За последние годы как в отечественной, так и зарубежной
литературе опубликовано несколько серологических реакций,
применяемых главным образом для идентификации возбудителей
445
лейшманиозов. Из них наиболее широкое распространение полу-
чила реакция Адлера [Adler, 1958, 1964] в модификации
В. М. Сафьяновой (1966).
Реинфекции и суперинфекции. Уже в первых ра-
ботах, посвященных кожному лейшманиозу, имеются указания на
то, что лица, перенесшие эту болезнь, как правило, повторно не
заболевают. Однако случаи повторного заболевания все же имеют
место. По нашим наблюдениям, повторные заболевания регистри-
руются у 1,94 % при естественной и у 3 % — при искусственной
реинфекции.
Случаи реинфекции чаще отмечаются у лиц, перенесших антро-
понозный (поздноизъязвляющийся) тип кожного лейшманиоза.
Если суперинфекция происходит до образования у больного
полной невосприимчивости, то появляются последовательные
лейшманиомы.
У лиц, ранее болевших кожным лейшманиозом и проживаю-
щих в эндемичных лейшманиозных очагах, иногда обнаруживают-
ся характерные бугорки, которые являются морфологическим
проявлением суперинфекции. Эти бугорки П. В. Кожевников наз-
вал «аллергическими бугорками», считая, что они соответствуют
кожной аллергической реакции на повторное внедрение живого
возбудителя. Бугорки имеют небольшие размеры 2—4 мм, распо-
лагаются изолированно и напоминают начальные бугорки при
антропонозном кожном лейшманиозе, однако они не изъязвляют-
ся, а самостоятельно исчезают через 2—3 мес после возникнове-
ния. Между аллергическими бугорками и последовательными
лейшманиомами имеется постепенный переход и клиническое
развитие их является результатом иммунологических процессов.
Границей между последовательными лейшманиомами и аллергиче-
скими бугорками условно может служить время заживления
основной лейшманиомы. Новые бугорки, которые возникли в
период, когда основная лейшманиома еще не зажила, следует
отнести к последовательным лейшманиомам. Бугорки, которые
возникли после заживления основной лейшманиомы, а тем более
через длительный промежуток времени после заживления, следу-
ет отнести к аллергическим бугоркам.
Несколько иначе протекает суперинфекция у больных тубер-
кулоидным лейшманиозом. В естественных условиях у этих боль-
ных суперинфекция вызывает образование новых туберкулоид-
ных бугорков с последующим клиническим течением, свойствен-
ным туберкулоидному лейшманиозу. Доказательством естествен-
ной суперинфекции является возникновение бугорков на участках
кожи, не связанных с первичной лейшманиомой, возникновение
их только у лиц, проживающих в лейшманиозных очагах, и обна-
ружение в бугорках лейшманий. Однако имеются случаи, когда
естественная суперинфекция у больных туберкулоидным лейшма-
ниозом проявляется не только в виде бугорков, но и в виде обыч-
ных лейшманиом с соответствующим циклом клинического тече-
ния. Такие случаи крайне редки, но имеют место.
446
Диагноз. Для медицинских работников эндемичных зон диаг-
ноз кожного лейшманиоза не представляет больших затруднений.
Типичная клиника, подтвержденная анамнестическими и эпиде-
миологическими данными, а также данными лабораторного на-
хождения лейшманий из кожных патологических проявлений,
дает возможность быстро и правильно поставить диагноз. Одна-
ко, учитывая миграцию населения и быстроту современных пере-
движений, человек, заразившийся кожным лейшманиозом, может
оказаться далеко за пределами эндемичных лейшманиозных зон.
Для заражения время пребывания в лейшманиозном очаге мо-
жет быть очень коротким — 1—2 дня. Поэтому развитие лейшма-
ниоза у заразившегося может начаться уже за пределами места
заражения и тогда у врачей, редко видевших клинику кожного
лейшманиоза, могут возникнуть трудности в установлении диаг-
ноза. Кроме того, встречаются больные со стертыми клиниче-
скими проявлениями, с так называемыми межтиповыми клиниче-
скими формами, при которых диагноз представляет определен-
ные трудности даже для опытных врачей.
Для правильного диагноза кожного лейшманиоза очень важ-
но выяснение вопроса о возможном, даже кратковременном, пре-
бывании больного в лейшманиозном очаге в активный эпидеми-
ческий период, т. е. с мая по октябрь месяц. Следует также
учитывать и срок инкубации: короткий — при зоонозном и дли-
тельный — при антропонозном типе. Поэтому проявления болез-
ни при зоонозном типе имеют строгую сезонность (с июня по
ноябрь), тогда как проявление болезни при антропонозном типе
может быть на протяжении всего года.
Стадию бугорка можно наблюдать непосредственно в актив-
ных лейшманиозных очагах зоонозного типа в эпидемический пе-
риод при вспышках заболеваемости среди неиммунных организо-
ванных коллективов (отрядах, экспедициях) и при ежедневных
осмотрах лиц, находившихся под угрозой заражения. В этих слу-
чаях возникший на коже бугорок напоминает начальную стадию
фурункула, отличаясь от него меньшей болезненностью, быстрым
ростом инфильтрата и воспалительного отека. Дальнейшее раз-
витие болезни еще больше отличает начальную лейшманиому от
фурункула. Язвенная лейшманиома имеет некоторое сходство с
эктимой, вскрывшимся фурункулом, хронической язвенной пио-
дермией, эпителиомой, с туберкулезными язвами, мягким и твер-
дым шанкром, гуммой, скрофулодермой и другими язвенными
процессами кожи. Наличие у больного множественных последо-
вательных лейшманиом, создающих клинический полиморфизм,
усугубляет диагностическую трудность.
В дифференциальной диагностике с язвенными дерматозами,
помимо знаний их клинических особенностей, следует учитывать
и другие, не всегда выраженные и постоянные клинические при-
знаки: локализацию, консистенцию, отделяемое, длительность те-
чения, субъективные ощущения, количество элементов и др.
Диффузно-инфильтрирующая лейшманиома внешне может
447
напоминать ознобленную волчанку (lupus pernio), дискоидную
красную волчанку, рожистый процесс.
Более значительные трудности для дифференциального диаг-
ноза представляет туберкулоидный лейшманиоз. Внешне эта кли-
ническая разновидность кожного лейшманиоза антропонозного
типа чаще всего напоминает туберкулезную волчанку, реже —
красную волчанку, хроническую поверхностную пиодермию, бу-
горковый сифилис, лепру, рак кожи. Клиническое сходство ту-
беркулоидного лейшманиоза с туберкулезной волчанкой до сих
пор является причиной диагностических ошибок, допускаемых
медицинскими работниками неэндемичных по лейшманиозу мест.
Это сходство проявляется в морфологических элементах (буго-
рок), локализации (чаще лицо), длительности течения (годы),
раннем начале заболевания (в детском возрасте) и в пато-
гистологической картине. Постановка правильного диагноза так-
же затрудняется малым количеством лейшманий, которых удает-
ся обнаружить с трудом. Поэтому данные анамнеза о пребыва-
нии больного в эндемичном лейшманиозном очаге и перенесении
в прошлом антропонозного кожного лейшманиоза в диагностике
туберкулоидного лейшманиоза имеют решающее значение. Окон-
чательный диагноз устанавливается после соответствующих спе-
циальных исследований больного на туберкулез и лейшманиоз.
Бывают случаи, когда поставить диагноз кожного лейшманио-
за только на основании клинических данных трудно. В таких
случаях необходимо произвести всестороннее обследование боль-
ного, начиная с тщательно собранного анамнеза, бактериоско-
пических, бактериологических, гистологических и иммунологиче-
ских исследований.
Во всех случаях, подозрительных на кожный лейшманиоз,
обязательно следует производить исследование на возбудителя
болезни — лейшмании. Их легко обнаружить в бугорковой и яз-
венной стадии лейшманиомы, труднее — в последовательных
лейшманиомах и трудно — в проявлениях туберкулоидного лейш-
маниоза. Бактериологические методы исследования дополняются
бактериологическими, иммунологическими и патогистологически-
ми. Необнаруженные лейшмании при бактериоскопическом иссле-
довании нередко выявляются при бактериологическом исследо-
вании путем посева взятого для исследования материала на
специально приготовленные питательные среды — 3N-arap в ее
оригинальной прописи. Забор материала производится одновре-
менно как для бактериоскопического, так и для бактериологиче-
ского исследования. Для посева на питательную среду материал
из бугорка или краевого инфильтрата удобнее брать стерильной
платиновой петлей.
В тех случаях, когда анамнестические данные и данные кли-
ники допускают возможность предположить лейшманиоз, но в
то же время обнаружить лейшмании ни бактериоскопически,
ни бактериологически не удается, следует произвести пато-
гистологическое исследование. С этой целью делается биопсия
448
бугорка или краевого инфильтрата язвы. В приготовленных гис-
тологических препаратах, помимо соответствующей лейшманиоме
патогистологической структуры, нередко обнаруживаются лейш-
мании. При этом следует учитывать длительность заболевания,
так как с развитием иммунных процессов в больном организме
количество лейшманий уменьшается и в биопсированном мате-
риале, взятом на заключительной стадии болезни, лейшмании
обнаруживаются с трудом. При внимательном просмотре диагно-
стического биопсийного материала и соответствующей осведом-
ленности о патогистологических изменениях диагноз кожного
лейшманиоза возможен даже при отсутствии в препарате лейш-
маний.
При неясной клинической картине и отрицательных лабора-
торных исследованиях ценным подспорьем для установления ди-
агноза может служить внутрикожная аллергическая реакция с
лейшманийным антигеном. При проведении кожно-аллергической
реакции следует учитывать, что она возникает только на 10—
15-й день болезни у больных зоонозным типом и после 2—3 мес
болезни у больных антропонозным типом лейшманиоза.
Прогноз. Кожный лейшманиоз не представляет опасности
для жизни больного. Протекая циклически, болезнь, как правило,
заканчивается выздоровлением. Однако течение болезни и ее
последствия могут быть очень тяжелыми. При расположении
лейшманиомы на суставах, конечностях, а также при наличии
множественных лейшманиом, разбросанных по всей коже, и при
наличии осложнений больные на длительное время становятся
нетрудоспособными. Лейшманиомы на лице, особенно на носу,
губах, щеках, ушных раковинах и веках, помимо болезненности,
создают значительный косметический дефект, отражаясь на пси-
хическом состоянии больного.
Лечение кожного лейшманиоза должно быть комплексным,
специфичным и должно проводиться как с применением местных,
так и общих средств. Выбор средств и методов лечения должен
быть строго индивидуализирован с учетом стадии и распростра-
ненности лейшманиозного процесса, его локализации, возраста
больного и его общего состояния.
При наличии одиночного первичного бугорка небольшой дав-
ности и без воспалительных явлений по периферии его можно
удалить хирургическим путем, методом диатермокоагуляции, за-
мораживанием углекислотой или жидким азотом, пропитыванием
4—5 % раствором акрихина по методу Н. В. Добротворской.
Если бугорки начинают распадаться с образованием язв, следует
подключить общую специфическую терапию. Бугорки поздних
последовательных лейшманиом подвергать местному лечению не
следует, так как они, как правило, рассасываются без изъязвле-
ния и завершают свой цикл развития вместе с первичной лейш-
маниомой.
Больные с множественными и осложненными лейшманиомами,
а также с лейшманиомами, расположенными на лице, подлежат
16—936
449
госпитализации. Особого внимания требуют лейшманиомы у де-
тей, расположенные на лице.
Общие методы лечения. Из антибиотиков эффек-
тивным является мономицин. В условиях стационара мономицин
вводится внутримышечно из расчета 5000 ЕД на 1 кг массы тела
больного на каждую инъекцию, (разведенный в 3—5 мл 0,5 %
раствора новокаина) — три раза в сутки через каждые 8 ч в те-
чение 10—12 дней. Общая курсовая доза препарата должна
равняться 9—12 мл единиц. При лечении мономицином детей
разовая и курсовая дозы аналогичны таковой у взрослых. В про-
цессе лечения мономицином лейшмании не выявляются, начиная
с 5—8-го дня лечения, а специфические инфильтраты рассасы-
ваются на 3-й неделе от начала лечения. Как правило, лейшма-
ниозный процесс ликвидируется после одного курса лечения; в
редких случаях курс мономицина повторяется после перерыва в
12—14 дней (М. Э. Эрешов). Лечение мономицином переносит-
ся хорошо, но проводится под тщательным наблюдением врача,
так как у некоторых больных в конце лечения возникают призна-
ки раздражения почек и слухового нерва. Мономицин не должен
применяться со стрептомицином, мицерином, неомицином, кана-
мицином и другими нефро- и ототоксическими антибиотиками.
Противопоказаниями для применения мономицина являются. бо-
лезни печени, почек и невриты слухового нерва.
Солюсурьмин (Solusurminum) — натриевая соль комплекс-
ного соединения пятивалентной сурьмы (21 — 23 %) и глюконо-
вой кислоты. Для лечения кожного лейшманиоза, особенно его
хронической туберкулоидной формы, солюсурьмин применяется
внутривенно в виде 20 % водного раствора.
Обладая специфическим действием на лейшмании, солюсурь-
мин не оказывает губительного влияния на бактериальную
(пиококковую) флору. Поэтому его применение при язвенной
стадии лейшманиоза, осложненной вторичной инфекцией, следует
сочетать с антимикробными средствами (сульфаниламидами,
антибиотиками).
Солюсурьмин вводится больным ежедневно в стационарных
условиях. Суточная и курсовая доза препарата исчисляется,
исходя из веса больного. Взрослым суточная доза назначается
из расчета 0,35 мл раствора на 1 кг массы, курсовая — 7—8 мл
на 1 кг массы тела больного. Детям до 7 лет суточная доза
составляет 0,5 мл раствора на 1 кг массы тела, курсовая доза —
7,5—9 мл на 1 кг массы тела больного. Взрослым суточная доза
раствора вводится два раза в день (утром и вечером), детям —
один раз в день. Продолжительность курса лечения в среднем
составляет 3—4 нед. При таком лечении количество лейшманий
в очагах поражения начинает уменьшаться в течение первой
недели, и к 10—14-му дню они не выявляются.
При туберкулоидном лейшманиозе иногда приходится курс
лечения повторять из-за наступившего рецидива. В таких слу-
чаях повторный курс лечения солюсурьмином следует проводить
450
не ранее чем через 2 мес после окончания первого курса. Солю-
сурьмин обычно переносится хорошо и не дает осложнений. Абсо-
лютных противопоказаний к применению солюсурьмина нет, од-
нако его применение не рекомендуется лицам пожилого возраста
и ослабленным больным.
Метациклин (син. рондомицин) — антибиотик широкого
спектра действия, гомолог окситетрациклина, из которого полу-
чают этот препарат путем химической дегидратации. Метациклин
активен в отношении грамположительных и грамотрицательных
микроорганизмов. Применяется перорально, что является пре-
имуществом перед другими противолейшманиозными средствами,
так как создает возможность назначать его в амбулаторных
условиях.
Разовая доза метациклина для взрослых и детей старше
12 лет — 0,3 г, суточная — 0,6 г. Если лейшманиоз протекает с
осложнениями, суточную дозу увеличивают до 0,9 г или даже
1,2 г, разделив ее в первом случае на 3, во втором — на 4 прие-
ма. Детям от 5 до 12 лет метациклин назначают из расчета
7,5 мг на 1 кг веса в сутки, а при течении лейшманиозного про-
цесса с осложнениями — до 15 мг на 1 кг массы тела. При лече-
нии метациклином лейшманиомы исчезают на 6—9-й день. Про-
должительность лечения неосложненного кожного лейшманиоза
составляет 10—12 дней, осложненного — до 15 дней. Метациклин
противопоказан при аллергии к тетрациклинам, при беременно-
сти и детям до 5 лет.
Аминохинол (Aminochinolum) — производное хлорстирилхи-
нолина. Применяется перорально в суточной дозе взрослым
0,45—0,6 г, детям до 7 лет — 0,15 г, в возрасте 8—12 лет — 0,3 г,
старше 12 лет — 0,4 г. Курс лечения продолжается 25—30 дней.
Аминохинол не действует на вторичную пиококковую инфек-
цию, поэтому его применение должно сочетаться с антибиотика-
ми или сульфаниламидами. В большинстве случаев под влиянием
аминохинола лейшмании исчезают из очагов поражения через
10—12 дней от начала лечения. Однако в некоторых случаях они
выявляются и спустя 20 и более дней. По сравнению с предыду-
щими препаратами противолейшманиозное действие аминохино-
ла выражено слабее.
Аминохинол не следует применять при повышенной к нему
чувствительности, при лихорадочных состояниях и функциональ-
ных расстройствах внутренних органов.
Фуразолидон (Furazolidonum) — производное нитрофурана.
При пероральном применении по 0,15—0,2 г 4 раза в день (су-
точная доза 0,6—0,8 г) в течение 18 дней фуразолидон обеспе-
чивает излечение взрослых больных в сроки до 20—25 дней.
Лейшмании в кожных поражениях не обнаруживаются на 5—
11-й день лечения. Специфические лимфангиты и другие ослож-
нения, связанные с вторичной пиококковой флорой, ликвиди-
руются в течение 8—10 дней. Препарат больными переносится
хорошо, но при длительном применении могут развиваться
16*
451
невриты. Фуразолидон противопоказан больным при повышен
ной индивидуальной чувствительности к ним и при нарушении
функции почек.
Хингамин (син.: делагил, резохин, хлорохин). Препарат об-
ладает специфическим противолейшманиозным действием. Одна-
ко он индифферентен к вторичной пиококковой флоре, поэтому
его применение следует сочетать с бактерицидными препаратами.
Наиболее удачное сочетание хингамина с сульфаленом. Методи-
ка лечения: взрослые больные получают по 0,25 г делагила 3 ра-
за в день в течение 10 дней или по 0,5 г 2 раза в день в течение
7 дней. На курс лечения 7—8 г. Одновременно назначается
сульфален в первый день 1 г, затем по 0,2 г ежедневно в тече-
ние 10—12 дней. При таком лечении лейшмании исчезают на
10—12-й день, а язвенные лейшманиомы рубцуются на 20—
25-й день от начала лечения. Детям дозировка делагила снижа-
ется в зависимости от возраста. Препарат противопоказан при
болезнях сердца, печени и почек. В процессе применения его
необходимо проводить общие анализы крови, мочщ следить за
функцией печени.
Помимо перечисленных препаратов, при лечении кожного
лейшманиоза широко применяются средства, стимулирующие
общую иммунологическую реактивность организма и влияющие
на вторичную пиококковую флору. К числу первых относятся
витамины, к числу вторых — антибактериальные препараты.
Иммунотерапия пока не нашла широкого применения при ле-
чении кожного лейшманиоза. Однако в связи с научными дости-
жениями в области иммунологии есть основание предполагать^
что иммунотерапия и иммунопрофилактика кожного лейшманио*
за в недалеком будущем займут подобающее им место. '
Местные методы лечения кожного лейшманиоз#
дополняют и значительно улучшают терапевтическую эффектив^
ность общего лечения. В методике применения местного лечения
должна учитываться стадия лейшманиозного процесса. В ранней
стадии бугорка, как указано выше, допустимы хирургические И
разрушающие средства. Учитывая, что язвенная стадия лейшма*
ниомы протекает с наличием пиококковой флоры, уместны дезиЫ
фицирующие и ускоряющие процесс эпителизации средства И
виде мазевых повязок, примочек и присыпок. Наиболее частС!
применяются 5—10 % протарголовая мазь, 1 % акрихиновая, 1 %
риванолевая, 2 % желтая ртутная, 5 % борная, мазь Вишневского
и др. Их целесообразно чередовать с примочками из водных раст-
воров фурацилина, марганцовокислого калия, риванола и др.,
также с растворами анилиновых красок и присыпками 10 % дер4
матола, 3—5 % мономицина, 1 — 2 % фурацилина и др. Целесооб-
разно применение коллагеномономицинового комплекса, состояв
щего из коллагеновой губки с 30 % мономицином (А. Ваисов).
Губка пропитывается физиологическим раствором и накладывай^
ся на язвенную лейшманиому. Смену повязки производить по мер(|
рассасывания губки, обычно через 1 — 2 дня. Всего 8—10 апплйй
452 J
каций. Высвобождающийся мономицин оказывает местное анти-
бактериальное действие.
Одним из местных методов лечения кожного лейшманиоза яв-
ляется применение углекислотного и гелий-неонового лазера.
С помощью первого из них лейшманиомы ликвидируются пол-
ностью («выпариваются»). Облучение гелий-неоновым лазером
способствует более быстрому рубцеванию лейшманиозных язв
и рассасыванию специфических инфильтратов.
Профилактика кожного лейшманиоза исходит из эпидемиче-
ских данных этого природно-очагового, облигатно-трансмиссивно-
го заболевания. Эпидемическая цепь состоит из 3 звеньев: источ-
ника, или резервуара инфекции, переносчика и объекта зараже-
ния. Выпадение любого звена из этой цепи может привести к
прекращению эпидемического процесса и к затуханию лейшмани-
озного очага. Профилактические меры могут быть направлены на
какое-либо одно звено эпидемической цепи либо на все звенья
одновременно.
Борьба с источником инфекции. Поскольку ре-
зервуаром инфекции сельского зоонозного кожного лейшманиоза
являются дикие грызуны, принимаются меры к уничтожению и
оттеснению их природных биотопов от населенных пунктов. В но-
рах грызунов размножаются и обитают переносчики инфекции —
москиты. Поэтому дератизационные работы в полевых условиях
обеспечивают как ликвидацию грызунов, так и ликвидацию мест
выплода москитов.
При антропонозном, городском кожном лейшманиозе резер-
вуаром инфекции является больной человек. Основным профилак-
тическим мероприятием при этом типе является раннее выявление
больных и привлечение их к лечению. Все лейшманиомы у боль-
ных должны быть покрыты повязками и защитными мазями для
разобщения их от укуса москитов. Больным должны быть прове-
дены оздоровительные мероприятия в межэпидемический период.
Борьба с переносчиком инфекции. Противомоскитные меро-
приятия проводятся в двух направлениях: в уничтожении мест
выплода москитов и в борьбе с окрыленными москитами. Эффек-
тивность противомоскитных мероприятий во многом зависит от их
своевременного проведения. Знание фенологических дат активно-
сти москитов имеет большое значение в противомоскитной рабо-
те. Уничтожение мест выплода москитов достигается приведением
населенного пункта в должное санитарное состояние и опрыскива-
нием залежей органического мусора раствором хлорной извести.
Меры против окрыленных москитов сводятся к ограничению их
залета в жилые помещения путем защиты окон металлическими
или матерчатыми сетками достаточной частоты и уничтожением
уже залетевших москитов.
Профилактика заражения. Защита человека от укусов моски- ‘
тов сводится к индивидуальному применению пологов, сеток и
различных репеллентов, особенно в вечернее и ночное время.
К мерам личной профилактики относятся и лейшманийные
453
прививки. Теоретической основой таких прививок является воз-
никновение стойкого иммунитета после перенесения болезни.
Поэтому вакцинация проводится живыми культурами лептомонад.
Появившаяся на месте внутрикожного введения живой культуры
прививная лейшманиома клинически протекает значительно легче
и быстрее, чем естественная лейшманиома. Прививаясь на закры-
тых участках кожи (плечо, бедро), она не оставляет косметиче-
ского дефекта. После прививной лейшманиомы у человека возни-
кает стойкая невосприимчивость к естественному заболеванию.
После того как было установлено, что между антропонозным и
зоонозным типом кожного лейшманиоза имеется перекрестный
иммунитет, прививки стали производиться однократно и только
культурой одного типа. Для массовых профилактических приви-
вок используется ампулированная живая лептомонадная культура
зоонозного типа, обладающая лучшим иммуногенным эффектом.
Прививки проводятся лицам, ранее не болевшим кожным лейшма-
ниозом, проживающим в лейшманиозных очагах, а также лицам
или организованным коллективам, направляющимся для работы в
эндемичные по кожному лейшманиозу районы. Прививки прово-
дятся в межэпидемический период, когда отсутствуют москиты.
Абсолютных противопоказаний для прививок нет.
К мерам индивидуальной защиты от заражения кожным лейш-
маниозом относится и химиопрофилактика хлоридином. Этот ме-
тод показан для защиты небольших организованных коллективов,
временно находящихся в эпидемических лейшманиозных очагах
(различных экспедиций, студенческие строительные отряды и
бригады, геологические и изыскательские партии и т. п.). Хлори-
дин — противопаразитарный препарат, применяемый для лечения
и профилактики малярии и токсоплазмоза. Для химиопрофилак-
тики кожного лейшманиоза препарат назначается перорально в
дозе по 0,02—0,025 1 раз в неделю за 3 дня до въезда и до конца
пребывания в лейшманиозном очаге. Испытание этого метода в
эндемичных по лейшманиозу зонах показало его хорошую профи-
лактическую эффективность (Ф. Я. Хайрулин).
В настоящее время в профилактике кожного лейшманиоза
имеются такие возможности, разумное применение которых может
привести к значительному снижению заболеваемости, а в некото-
рых случаях — и к стойкой ликвидации эндемичных лейшманиоз-
ных очагов.
АМЕРИКАНСКИЙ КОЖНЫЙ ЛЕЙШМАНИОЗ
Заболевание встречается в Центральной и Южной Америке,
преимущественно в странах Латинской Америки. Вызывается раз-
личными видами и подвидами лейшманий. Переносчиками болезни
являются различные виды москитов. Многие вопросы эпидемиоло-
гии американского кожного лейшманиоза еще недостаточно изу-
чены. Известно, что заболевание встречается главным образом
среди сельского населения у рабочих каучуковых, рисовых, кофей-
434
ных плантаций, лесорубов в джунглях, строителей дорог, при
разведке и добыче нефти, у горнорабочих и при военных учениях.
Клинические проявления сходны с кожным лейшманиозом вос-
точного полушария, отличаясь склонностью к более тяжелому и
длительному течению.
Различают несколько клинических разновидностей, каждая из
которых распространена в определенной местности и вызывается
определенным возбудителем. В Мексике, Гватемале, Гондурасе
распространен природно-очаговый кожный лейшманиоз под назва-
нием «язва чиклеров» — заболевание рабочих тропических лесов,
заготавливающих красное дерево. Клиника отличается поражени-
ем кожи уха, медленным хроническим течением, заканчивающим-
ся деструкцией ушной раковины.
Кожный лейшманиоз под названием «Ута» распространен в
Перу и Боливии. Источником заражения служат собаки. Болеют
преимущественно дети. Поражается только кожа. Заболевание
протекает относительно доброкачественно. Единичные лейшма-
ниомы спонтанно заживают через 4—5 мес.
Диффузный кожный лейшманиоз распространен в Венесуэле.
На коже возникают множественные, обычно неизъязвляющиеся,
инфильтрированные бляшки, содержащие лейшмании. Течение
заболевания хроническое, трудно поддается лечению.
Разновидности кожно-слизистого лейшманиоза — эспундии
распространены в Бразилии, Эквадоре, Боливии, Парагвае, Гви-
нее и Панаме. Заболевание имеет природно-очаговый характер и
большое распространение. Поражение локулизуется в области
носа, захватывает кожу и слизистые оболочки с последующим раз-
рушением хрящевой ткани. В дальнейшем патологический процесс
распространяется на небо, гортань и трахею. Больные погибают
от сепсиса.
СУДАНСКИЙ И ЭФИОПСКИЙ КОЖНЫЙ ЛЕЙШМАНИОЗ
Суданский лейшманиоз вызывается особой разновидностью
лейшманий — Leishmania nilotica. Клинически протекает с обра-
зованием на коже келоидных узлов без наклонности к изъязвле-
нию. Встречается в Судане, Египте, Кении, Сомали, Ливии и
Уганде. Течение длительное. Прогноз благоприятный. В Эфиопии
встречается малоизученный кожный лейшманиоз с появлением
на коже плотных инфильтратов, сливающихся в диффузные
бляшки, не проявляющих склонности к изъязвлению. Заболевание
протекает длительно — 2—3 года (лепроматозная форма кожного
лейшманиоза). Возбудитель близок к бразильскому лейшманиозу,
поэтому вопрос о нозологической самостоятельности эфиопского
кожного лейшманиоза некоторыми авторами оспаривается.
При всех формах лейшманиоза диагноз ставится на основа-
нии клиники, нахождения в очагах поражения возбудителя бо-
лезни — лейшманий и положительной кожной пробы с лейшма-
нином (реакция Монтенегро).
455
Глава 13
ПАРАЗИТАРНЫЕ БОЛЕЗНИ КОЖИ
Паразитарные болезни кожи (дерматозоонозы) развиваются
как ответная реакция на воздействие животных паразитов: про-
стейших, кишечнополостных, червей, членистоногих и моллюсков.
Принято выделять поверхностные паразитарные дерматозы
(epizoa), при которых паразиты находятся на коже или в эпи-
дермисе, и глубокие (dermatozoa), при которых паразиты нахо-
дятся в коже или подкожной клетчатке. Материалы излагаются
в порядке системы классификации беспозвоночных жи-
вотных и систематической принадлежности паразитов, которая
приводится ниже.
I. Дерматозы, вызываемые простейшими
А. Жгутиковыми 1. Лейшманиоз 2. Трипаносомозы 3. Трихомониаз Б. Споровиками 1. Малярия 2. Токсоплазмоз В. Саркодовыми I. Амебиаз кожи II. Дерматозы, вызываемые (Flagellata) (Leishmaniosis) (Trypanosomiases) (Trichomoniasis) (Sporozoa) (Malaria) (Toxoplasmosis) (Sarcodina) (Amoebiasis cutis) кишечнополостными
А. Медузами Б. Коралловыми (Meduse) полипам n(Anthozoa)
III. Дерматозы, вызываемые червями
A. Плоскими червями (Plathelmintes) (Trematodes) (Schistosomoses)
I. Сосальщиками
a) Шистосомозы
Б. Ленточными червями 1. Цистицеркоз 2. Эхинококкоз 3. Спарганоз (Cestodea) (Cysticercosis) (Echinococcosis) (Sparganosis)
B. Круглыми червями 1. Аскаридоз 2. Энтеробиоз 3. Анкилостомидозы 4. Стронгилоидоз 5. Трихинеллез 6. Филяриозы 7. Личинка мигрирующая 8. Дракуикулез (Nemathelminthes) (Ascaridosis) (Enterobiosis) (Ancylostomidosis) (Strongyloidosis) (Trichinellosis) (Filarioses) (Larva migrans) (Dracunculosis)
Г. Кольчатыми червями 1. Гирудиноз (Annelides) (Hirudinosis)
IV. Дерматозы, вызываемые членистоногими
А. Ракообразными (Crustacea)
Б. Паукообразными (Arachnida)
456
1. Скорпионами (Scorpiones)
2. Пауками (Aranei)
3. Клещами (Acarina)
В. Н асе ком ым и (Insecta)
1. Полужесткокрылыми (Hemiptera)
2. Вшами (Anoplura)
3. Чешуекрылыми, или бабочками (Lepidoptera)
4. Жесткокрылыми, или жуками (Coleoptera)
5. Блохами (Aphaniptera)
6. Перепончатокрылыми (Hymenoptera)
7. Двукрылыми (Diptera)
Г. М ногоножками (Myriapota)
V. Дерматозы, вызываемые моллюсками
Среди паразитарных дерматозов человека наиболее часто
встречается чесотка. Учитывая важность своевременной диагно-
стики и проведения лечебно-профилактических мероприятий в
целях предотвращения возможности распространения этого зараз-
ного заболевания кожи, данные о чесотке изложены более де-
тально в начале главы, затем следует более краткий обзор других
паразитарных заболеваний кожи в соответствии с систематиза-
цией паразитов.
ЧЕСОТКА
Это заразное паразитарное заболевание кожи. Возбудителем
чесотки у человека является клещ Sarcoptes scabiei.
Чесотка была известна еще в глубокой древности. Самые ран-
ние сведения об этом заболевании кожи содержатся в китайских
источниках задолго до нашей эры. В Древней Греции чесотку от-
носили к группе кожных заболеваний, объединенных термином
«псора», а в Древнем Риме обозначали термином «скабиес», со-
хранившимся до настоящего времени. В средневековых трактатах
уже имеются указания на то, что чесотку вызывает какой-то
очень мелкий паразит. Однако изображение чесоточных клещей,
доказательства их участия в возникновении заболевания появля-
ются только после изобретения микроскопа [Rennuri, 1834].
Очень полное для своего времени описание этиологии, клини-
ки и методов лечения чесотки дал немецкий дерматолог Ферди-
нанд Гебра (Hebra F., 1844] в «Руководстве к изучению болез-
ней кожи», переведенном на русский язык А. Г. Полотебневым в
1876 г. Большой вклад в изучение чесотки и методов ее лечения
внесли отечественные дерматологи Г. И. Мещерский (1927),
И. А. Горчаков (1940), М. П. Демьянович (1947), Б. 3. Гумаров
(1968), Н. С. Смелов и соавт. (1968), В. А. Рахманов и соавт.
(1969), А. А. Левков (1980), Т. В. Соколова и соавт. (1988), а
также зарубежные — К. Mellanby (1944), М. Orkin, Н. Maibach
(1978), Р. Palicka (1979), Т. Rudil (1981), Е. S. Falk (1982) и др.
Эпидемиология. Колебания заболеваемости чесоткой
носят волнообразный характер, причем периоды роста и спада
повторяются через 11—30 лет. Имеется мнение об увеличении
агрессивности чесоточного клеща вследствие его генетических
457
изменений. Некоторые авторы связывают повышение заболевае-
мости чесоткой с резистентностью возбудителя к современным
скабицидам.
Рост заболеваемости чесоткой в периоды войн, экономичес-
кого кризиса и стихийных бедствий объясняется ухудшением са-
нитарно-гигиенических условий, миграцией, нищетой, скучен-
ностью населения. Отмечена связь между половой распущен-
ностью и заболеваемостью чесоткой, что подтверждается данными
о параллелизме роста чесотки и венерических заболеваний. Спо-
собствуют росту заболеваемости чесоткой и недостатки в работе
медицинской службы.
Наиболее часто чесотка наблюдается у лиц молодого возрас-
та [Тимофеева Л. П. и др., 1972; Комов А. О., Смушко Л. Н.,
1982[. Р. Ф. Федоровская и соавт. (1985) при обработке
4000 эпидкарт установили, что 79,8 % заболеваемости чесоткой
приходится на возраст до 29 лет. Частота заболеваемости детей
составляет от 16,6 до 24 %.
Источником заражения при чесотке является больной чело-
век. Различают прямой и непрямой пути заражения чесоткой. При
прямом пути заражения возбудитель переходит непосредственно
от больного человека к здоровому в момент телесного соприкос-
новения. Непрямой путь — передача возбудителя через предметы
личного пользования (мочалка, полотенце, простыня и т. д.). Чаще
заражение происходит при совместном пребывании в постели, в
том числе при половом контакте, реже при уходе за больными,
ребенком, при массаже.
Этиология. Возбудитель чесотки — чесоточный клещ Sarcoptes
scabiei (рис. 100), имеет черепахообразную форму (0,35 X
X 0,25 мм). Ротовые органы клеща несколько выступают кпереди,
по бокам имеется 2 пары передних ножек, снабженных присоска-
ми. Две пары задних ножек располагаются на брюшной поверх-
ности и снабжены у самок длинными щетинками, а у самца на
четвертой паре ножек вместо щетинок имеются присоски. Самец
по размеру значительно меньше самки. Яйца чесоточного клеща
имеют овальную форму. Личинка, вышедшая из яйца, имеет разме-
ры 0,15Х 0,1 мм, отличается наличием только трех пар ножек
(задняя пара отсутствует). Нимфы морфологически похожи на
взрослого клеща, но меньше по размерам. Оболочки яиц, из ко-
торых вылупились личинки, имеют характерный вид. Они прозрач-
ные, спавшиеся, с продольной трещиной по краю. Нередко в пре-
парате обнаруживаются экскременты клеща желтовато-коричне-
вого цвета.
Жизненный цикл чесоточных клещей протекает следующим
образом: из яиц, отложенных самкой в чесоточном ходе, вылупля-
ются личинки. Они линяют и превращаются в восьминогую прото-
нимфу, а затем в телеонимфу. Последняя, линяя, превращается в
самку. Жизненный цикл чесоточного зудня можно разделить на
2 периода, которые были названы репродуктивным и метаморфиче-
ским [Ланге А. Б. и др., 19841 (рис. 101). Репродуктивный период
458
Рис. 100. Чесоточный клещ Sarcoptes scabiei De Geer.
A — самка; Б т—самец; В —личинка [Соколова Т. В. и др., 1988, фото А. Б. Ланге].
Рис. 101. Схема жизненного цикла чесоточного клеща.
А — репродуктивная часть цикла; Б — метаморфическая часть цикла; а — репродуктивный
чесоточный ход; б— начало образования хода; в— везикула, г— фолликулярная папула;
д — метаморфический ход; $— самка; о— самец; х — спаривание; 0 — яйцо; V —
опустевшая яйцевая оболочка, Л — личинка, НП — протонимфа, НТ — телеонимфа [Лан-
ге А. Б. и др., 1984].
осуществляется в чесоточном ходе, где самка откладывает яйца,
из которых вылупляются личинки. Ход как репродуктивная едини-
ца существует длительно, по-видимому, не менее I1/? мес и в те-
чение всего времени служит источником личинок, обсеменяю-
щих больного. Личинки выходят через крышу хода и внедряются
в кожу. Метаморфоз от личинки до самки или самца протекает в
везикулах, папулах, частично в тонких ходах и внешне не изме-
ненной коже. Спаривание, по-видимому, осуществляется на по-
верхности кожи. Несомненно, что самец спаривается с самкой,
а не с телеонимфой (как указано в некоторых источниках), так
как у нимфы еще нет копулятивного канала.
Самка передвигается по поверхности кожи с помощью присо-
сок двух передних пар ног. Внедрение в роговой слой осуще-
ствляется с помощью хелицер (челюстей) при участии концевых
шипов двух передних пар ног. Считают, что погружению способ-
ствует выделение орального секрета. Прокладывая ход в нижней
части рогового слоя эпидермиса, самка питается за счет зерни-
стого слоя. Яйца откладываются последовательно, в ряд, одно
за другим (рис. 102).
Клиника. Инкубационный период при чесотке составляет в
среднем 8—12 дней.
Основными клиническими симптомами чесотки являются зуд,
усиливающийся в вечернее время, наличие чесоточных ходов, по-
460
лиморфизм высыпаний, характерная локализация клинических
проявлений.
Одним из первых и основных симптомов чесотки является
зуд. Усиление последнего в ночное время склонны объяснять су-
точным ритмом активности клещей с увеличением ее в ночные
часы. Механизм развития зуда трактуется по-разному: раздраже-
ние нервных окончаний при движении клеща; выделение клещом
слюны и веществ, находящихся в их экскрементах; развитие сен-
сибилизации организма к клещам и продуктам их жизнедеятель-
ности. Возможно, что в формировании зуда имеют значение
различные факторы на разных стадиях развития заболевания.
Главным диагностическим признаком чесотки, отличающим ее
от других зудящих дерматозов, является наличие чесоточных хо-
дов. Типичный чесоточный ход описан Ф. Гебра (1844). Он имеет
вид прямой или изогнутой, слегка возвышающейся линии белова-
того или грязно-серого цвета, размером от 1 мм до нескольких
сантиметров (рис. 103). Передний слепой конец хода различим
по наличию самки клеща, которая видна сквозь эпидермис в виде
темной точки. Легкая пальпация позволяет обнаружить рельеф
хода — симптом Сезари. Различают несколько разновидностей
чесоточных ходов [Гебра Ф., 1876; Мещерский Г. Н., 1927|.Т. В. Со-
колова (1987) на основании клинико-лабораторных данных
предложила классификацию клинических вариантов чесоточных
ходов (рис. 104). Ею выделены 3 группы ходов, включающие более
15 разновидностей. В первую группу вошли исходный тип хода
и его варианты, во вторую — ходы, образующиеся из клинических
разновидностей первой группы, и в третью — группа ходов с при-
соединением вторичной инфекции. Наиболее часто встречается
исходный тип хода (82,1 %), почти у половины больных ход име-
ет вид цепочки везикул, лентикулярных папул или трещин; не-
редко обнаруживаются ходы в виде «ракетки» и «веретена», ре-
же— серозной корочки и ход в покрышке пузыря (рис. 105).
Почти все больные имеют ходы на кистях, более половины — в
области лучезапястных суставов, более '/•—на стопах, 'Д—на
туловище, 1 Д — в области конечностей (кроме кистей и стоп).
У половины мужчин ходы локализовались на половых органах, у
7io женщин — в области молочных желез.
В последние годы рядом авторов отмечаются так называемые
малосимптомные, стертые и атипичные формы чесотки, чем объяс-
няют нередкость ошибок диагностики. Стертые формы характери-
зуются незначительным количеством чесоточных ходов или слабой
их выраженностью, слабым зудом.
Причиной появления этих форм чесотки считают контакт с
продуктами перегонки нефти, дезинфицирующими растворами, ча-
стое мытье рук, использование кремов и мазей со стероидами,
антигистаминных и" десенсибилизирующих средств [Студни-
цин А. А., Романенко Г. Ф., 1981, и др.]. Чесотку, развившуюся
на фоне приема внутрь или наружно глюкокортикостероидов,
называют «нераспознанной» чесоткой. Это объясняется тем, что
461
Рис. 102, Чесоточный ход.
а — самка с яйцом; б — яйца с эмбрионами; в — образование личиночной кутикулы:
г — личинки, готовые к вылуплению; д — опустевшие яйцевые оболочки; е — активная
личинка перед выходом на поверхность кожи; ж — экскременты; з— граница хода;
и — чешуйки эпидермиса [Ланге А. Б. и др., 1984J.
стероиды, уменьшая воспалительные явления, подавляя зуд, соз-
дают условия для обильного размножения клеща, обусловливая
высокую контагиозность заболевания.
Для чесотки характерен полиморфизм высыпаний (фоллику-
лярные узелковые элементы, везикулы, возникающие на месте
внедрения клещей, а затем появление корочек и эрозий). Однако
в части случаев в папулах и везикулах, расположенных вне чесо-
точных ходов, не выявляются клещи, что свидетельствует об ал-
лергической природе этих высыпаний. Последнее было подтверж-
дено иммунологическими и гистологическими исследованиями.
Вследствие зуда, разрушения первичных морфологических элемен-
тов появляются вторичные — эрозии, кровянистые корочки, ли-
нейные расчесы. В 1940 г. Н. А. Горчаков описал симптом чесот-
ки — наличие точечных кровянистых корочек на локтях и в их
окружности.
Высыпания в виде импетигинозных элементов, пузырьков, ко-
рочек, располагающихся в области межъягодичной складки с пере-
ходом на крестец, получили название симптома треугольника или
ромба Михаелиса. В. Я. Арутюнов (1945) наблюдал его в 60 %,
а Д. Р. Паулавичите (1981) —в 26 % случаев. Как показала
Т. В. Соколова (1987), отсутствие чесоточных ходов в ряде слу-
462
Рис. 102. П родолжение.
Рис. 103. Типичный чесоточный ход в межпальцевой складке [Соколо-
ва Т. В. и др., 1981; фото А. Б. Ланге].
чаев имеет место на ранней стадии заболевания, что является
следствием заражения больных личинками клеща. Последние,
выйдя из ходов, обусловливают появление фолликулярных папул и
везикул, и только после периода метаморфоза личинки превратят-
ся в самку, способную прокладывать ход.
Осложнения при чесотке встречаются почти у половины боль-
ных, обычно в виде дерматита, пиодермии. Симптом Арди — Гор-
чакова, характеризующийся высыпанием пустул из очагов с гной-
ными корками вокруг локтей, встречается у 1/5 больных чесоткой.
Узелковая чесотка. Впервые описана S. Ayres и N. Р. Anderson
(1932) и характеризуется наличием зудящих узелков, появляю-
щихся после полноценного лечения чесотки. Эти проявления за-
болевания имели различные названия — узелковая чесотка, пост-
скабиозная лимфоплазия и др. Предполагается, что папулы воз-
никают в результате внедрения чесоточного клеща и раздраже-
ния кожи при расчесывании вследствие всасывания продуктов
распада и экскрементов клеща, а некоторые авторы придержи-
ваются иммуноаллергического генеза узелковой чесотки. В пато-
генезе возникновения узелковой чесотки лежит особая предрас-
положенность кожи отвечать на раздражитель реактивной гипер-
плазией лимфоидной ткани в местах наибольшего ее скопления
[Потекаев Н. С. и др., 1979]. Т. В. Соколова (1987) находила
464
Ill группа
I группа
II группа
Линейная корочка
Папула
Рис. 104. Классификация клинических вариантов чесоточных ходов
[Соколова Т. В., 1987].
в таких папулах паразитарные элементы, по числу вдвое превы-
шающие их в обычных ходах.
Чесотка у детей. Особенностью клинической картины и тече-
ния чесотки у детей считают нетипичную локализацию сыпи, пре-
обладание экссудативных элементов в полиморфных высыпаниях,
частое осложнение пиодермией и экзематизацией, что способ-
ствует неправильной диагностике заболевания [Скрипкин Ю. К.
и соавт., 1979; Штейнлухт Л. А., Зверькова Ф. А., 1979; Студни-
цин А. А., Романенко Г. Ф., 19811. Процесс обычно распростра-
ненный, при этом высыпания локализуются на любом участке
кожного покрова, включая волосистую часть головы, лицо, шею,
46S
Рис. 105. Чесоточные ходы на ладонях.
ИТ — исходный тип хода; П — ход в покрышке пузыря; Э — эрозия на месте пузыря,
разрушенного при взятии материала; ПС — ходы в покрышке пустулы; К — корочка с
остатками хода [Соколова Т. В., 1987, фото В. С. Российского].
ладони и подошвы. По данным Д. X. Абдиевой (1986), типичные
чесоточные ходы выявляются у 81,1 % детей, больных чесоткой.
В первые 6 мес жизни ребенка основными элементами являются
волдыри, везикулы, пузыри и чесоточные ходы, возникающие на
любом участке кожного покрова. Наличие уртикоподобных высы-
паний определяет некоторое сходство чесотки с клиническими
проявлениями при детской почесухе и крапивнице. Иногда высы-
пания на лице и волосистой части головы клинически напоминают
картину острой мокнущей экземы. Характерной особенностью
клинического течения чесотки у детей раннего детского возраста
является отсутствие высыпаний в области межпальцевых складок
кистей, на боковых поверхностях пальцев рук и на переднем
крае подмышечной складки. Иногда в этой возрастной группе
наблюдается пемфигоидная форма чесотки, характеризующаяся
появлением крупных, до грецкого ореха, пузырей, с прозрачным
содержимым и чесоточным ходом в покрышке, локализующихся
на излюбленных для чесотки участках кожного покрова. Кожный
466
зуд бывает резко выражен, что приводит к нарушению сна. Ред-
кой, но возможной локализацией чесотки у детей грудного и
раннего детского возраста является поражение чесоточным кле-
щом ногтевых пластинок, которые утолщаются, разрыхляются,
на поверхности образуются продольные и поперечные трещины
[Абдиева Д. X. и др., 1986].
Норвежская чесотка. Впервые описана Беком и Даниэльссеном
в 1847 г. в Норвегии у больных лепрой. Термин «норвежская»
чесотка предложил Ф. Гебра. Эта форма заболевания одинаково
часто наблюдается у мужчин и женщин разных возрастов и рас.
Продолжительность ее колеблется от нескольких месяцев до
40 лет. От времени начала заболеваний и появлений корковых на-
слоений проходит срок от 3 мес до 16 лет. Норвежскую чесотку
вызывает обычный чесоточный клещ, но возникает она у лиц при
иммунодефицитных состояниях, сопровождающих лейкозы и
синдром Блума, в связи с длительным приемом гормональных и
цитостатических препаратов, у пациентов со слабоумием, бо-
лезнью Дауна, при тяжелых сопутствующих заболеваниях —
сирингомиелии, лепроматозном типе лепры, спинной сухотке, гене-
рализованном кандидозе и др.
Основными клиническими симптомами этой формы чесотки
являются полиморфные высыпания (папулы, везикулы, пустулы,
чешуйки, корочки), эритродермия, массивные корковые наслоения.
Локализуясь на локтях, коленях, подошвах, затем высыпания
распространяются по кожному покрову, приводя к развитию эрит-
родермии. Толщина корок может достигать 2—3 см; иногда они
имеют вид кожного рога, могут диффузно покрывать кожный
покров в виде рогового панцыря. Поверхность корок покрыта
трещинами и бородавчатыми разрастаниями; верхний слой их
плотный, нижний — рыхлый, между ними выявляется огромное
количество клещей на всех стадиях развития. На нижней поверх-
ности корок видны извилистые углубления, соответствующие че-
соточным ходам. На 1 см2 кожи больного обнаруживается до
200 клещей, ходы в несколько этажей, под корками обширные
мокнущие эрозии. Ногти серо-желтые, бугристые, край изъеден,
легко крошится. Волосы пепельно-серого цвета, сухие, нередко
отмечается алопеция. Вторичные изменения в виде пигментации,
лихенификации. Зуд сильный, иногда отмечается привыкание к
нему. От больного нередко исходит неприятный запах квашеного
теста, повышается температура тела.
Псевдочесотка. При заражении человека чесоткой от живот-
ных ее называют псевдочесоткой, или клещевым дерматитом. Наи-
более частым источником заражения являются собаки, могут быть
свиньи, лошади, овцы, козы, кролики, лисицы и другие живот-
ные. Инкубационный период от нескольких часов до 2 сут. Самки
клещей, внедряясь в эпидермис кожи человека, вызывают зуд,
но не образуют ходов и не откладывают яиц [Ланге А. Б. и
соавт., 1985|. На месте внедрения обычно появляются уртикар-
ные, папулезные, папуловезикулезные элементы. От человека
467
человеку заболевание не передается и при устранении источника
заражения может наступить самоизлечение., Клещей обнаружить
трудно, причем выявляются только самки.
Диагноз чесотки основывается на клинических проявлениях,
эпидемиологических данных и результатах лабораторного иссле-
дования. Подтверждение диагноза чесотки лабораторным методом
представляется особенно важным в тех случаях, когда диагноз
заболевания затруднителен.
1. Традиционный метод извлечения клещей иглой из слепого
конца типичного чесоточного хода с последующим микроскопиро-
ванием клеща, помещенного на предметное стекло в каплю 10 %
едкого натрия, позволяет подтвердить клинический диагноз. Од-
нако этот метод малоэффективен при наличии старых полуразру-
шенных ходов, везикул и папул.
2. Метод тонких срезов участка рогового слоя эпидермиса
в области чесоточного хода или пузырька с последующей обра-
боткой 20 % едким натрием в течение 5 мин и микроскопирова-
нием позволяет обнаруживать не только клеща, но и его яйца.
3. Метод послойного соскоба глазной ложечкой свежих эле-
ментов до появления крови, помещения материала в каплю 20 %
едкой щелочи с глицерином в равных объемах и микроскопирова-
ние через 10—20 мин.
4. Метод щелочного препарирования кожи, заключающийся в
нанесении 10 % щелочи на чесоточные высыпания на коже, со-
скабливании через 2 мин мацерированного эпидермиса скальпе-
лем и микроскопировании препарата в капле воды.
ЦКВИ М3 России совместно с кафедрой энтомологии МГУ
им. М. В. Ломоносова разработана и внедрена в практику новая
методика лабораторной экспресс-диагностики чесотки с примене-
нием молочной кислоты [Ланге А. Б. и др., 1984, 1985|.
Метод основан на способности молочной кислоты быстро про-
светлять эпидермис и клещей в препарате, что позволяет с боль-
шой точностью диагностировать заболевание. Кроме того, молоч-
ная кислота не кристаллизуется, не высыхает, хорошо разрых-
ляет роговой слой эпидермиса перед соскобом, препятствует
развитию пиогенных осложнений и снимает остатки красящих
веществ, применяемых для прокрашивания чесоточных клещей на
предмет их выявления.
Для лабораторной диагностики используется 40 % водный
раствор молочной кислоты. Одну каплю молочной кислоты нано-
сят на чесоточный элемент (чесоточный ход, папулу, везикулу,
корочку и др.). Через 5 мин разрыхленный эпидермис соскабли-
вают острой глазной ложечкой до появления каГц^олярной крови.
Материал переносят на предметное стекло в 1Фплю молочной
кислоты, покрывают покровным стеклом и мик^оскопируют. Ре-
зультат считается положительным, если в препарате содержимого
чесоточного хода выявляются взрослая самка клеща либо даже
только яйца, опустевшие яйцевые оболочки или отдельные личин-
ки и фрагменты.
468
Лечение. Наибольшее распространение при лечении больных
чесоткой получили методы терапии бензилбензоатом и по Демья-
новичу. обладающие высокой эффективностью, хорошей переноси-
мостью и быстротой оказываемого действия. Применяются также
серная мазь, мазь Вилькинсона и полисульфидный линимент. Не-
зависимо от метода терапии обрабатывается противочесоточным
препаратом весь кожный покров.
Лечение бензилбензоатом. Бензилбензоат применяется в виде
20 % водно-мыльной суспензии, детям до 3 лет — 10 % суспен-
зии. Суспензия втирается в весь кожный покров (кроме головы),
а детям до 3 лет, кроме того, и в кожу лица. Втирание бензил-
бензоата в кожу должно проводиться в определенной последо-
вательности: начинают с одновременного втирания в кожу обеих
кистей, затем в левую и правую верхние конечности, потом в
кожу туловища и, наконец, в кожу нижних конечностей, вплоть
до пальцев стоп и подошв.
Изучением жизненного цикла чесоточного клеща и влияния
на него скабицидов было установлено, что все подвижные стадии
развития клеща (самки, самцы, нимфы, личинки) и яйца с эмбрио-
нами гибнут уже после однократного втирания препарата, но не-
большая часть личинок в яйцевых оболочках, готовых к вылупле-
нию, остаются живыми даже после 2-дневного курса лечения.
Их вылупление и внедрение в кожу приводят к появлению новых
высыпаний у некоторых больных и требуют дополнительного ле-
чения. Поскольку сформировавшиеся личинки выходят из яиц через
l'/i’—21 /2 сут и тогда становятся доступными для действия препа-
рата, Р. Ф. Федоровской и соавт. (1986) предложена модифи-
кация методики лечения больных бензилбензоатом: 20 % водно-
мыльная эмульсия бензилбензоата в количестве 100 мл втирается
однократно только в 1-й и на 4-й день курса лечения (всего 200 мл).
Такой интервал между втираниями обусловливает воздействие
препарата на вылупившиеся из яиц в течение 2 сут личинки.
Для механического удаления личинок с поверхности кожи необ-
ходимо купание больного перед каждым втирание^ Во время
2-го и 3-го дня курса специфического лечения не проводится, эти
дни с успехом могут быть использованы для лечения сопутст-
вующих чесотке осложнений. Смена нательного и постельного
белья проводится дважды: после первого и второго втирания
препарата. Больной не моется в течение последующих 3 дней,
но в кисти рук препарат втирается повторно после каждого
мытья. Через 3 дня больной моется горячей водой и вновь меняет
белье. У грудных детей вместо втирания проводят смачивание
кожной поверхности указанными растворами, повторяя курс лече-
ния через 3—4 дня.
Лечение по методу Демьяновича. При применении этого мето-
да проводится последовательное втирание в кожу туловища и ко-
нечностей 60 % раствора гипосульфита натрия (раствор № 1) и
6 % раствора концентрированной соляной кислоты (раствор № 2),
а у детей концентрации растворов соответственно составляют
469
40 % (№ 1) и 4% (№ 2). Раствор гипосульфита перед употреб-
лением слегка подогревают и втирают кожу руками в той же по-
следовательности, что и бензилбензоат. После 10-минутного обсы-
хания на коже появляется масса кристалликов гипосульфита.
Второе втирание проводится тем же раствором и в той же после-
довательности. После повторного 10-минутного перерыва при-
ступают к втиранию в кожу 6 % раствора соляной кислоты, кото-
рое осуществляется в том же порядке 4-кратно с перерывами
по 5 мин для обсыхания. По окончании втирания и после обсы-
хания кожи больной надевает чистое белье и не моется в тече-
ние 3 дней, но в кисти рук растворы повторно втираются после
каждого мытья. Через 3 дня больной моется горячей водой и вновь
меняет белье.
Для лечения чесотки используются также противочесоточные
мази, содержащие серу: 33 % серная мазь, мазь Вилькинсона.
Перед началом лечения больной моется теплой водой с мылом.
Мази втирают ежедневно в течение 5—7 дней, особенно в участки
кожи излюбленной локализации чесоточного клеща. Через
6—8 дней больной моется с мылом и меняет нательное и постель-
ное белье. Для лечения детей применяют 10—15 % серную мазь,
мазь Вилькинсона не рекомендуется. Д. X. Абдиевой (1986) пока-
зана целесообразность проведения лечения детей, больных чесот-
кой, 15 % серной мазью в 1-й и на 4-й день курса терапии, подобно
методике лечения больных бензилбензоатом.
Лечение полисульфидным линиментом. Полисульфидный лини-
мент (10 % концентрации взрослым и 5 % детям) втирают в тече-
ние 10—15 мин во всю поверхность кожи. Повторное втирание
проводят на 2-й день. Больной не моется в течение 3 дней с мо-
мента первого втирания. На 4-й день моется, меняет нательное
и постельное белье.
Для лечения чесотки применяется также мыло «К», которое
втирают в кожу в виде 5 % водной эмульсии ежедневно в течение
5 дней; на 7-й день больной моется и меняет белье.
Ограниченная пиодермия и незначительная экзематизация не
препятствуют применению противочесоточных препаратов в комп-
лексе со средствами, направленными на купирование осложнений.
В тех же случаях, когда чесотка осложняется распространенной
пиодермией с обилием гнойничков, корок, обширной экзематиза-
цией, лечение ее затрудняется. В этих случаях мероприятия
должны быть направлены на купирование экссудации и пустулиза-
ции: по показаниям назначают антибиотики, сульфаниламиды, а
местно — анилиновые красители и дезинфицирующие мази. При
резко выраженном дерматите или экзематизации, сопутствующих
чесотке, назначают внутрь препараты кальция, тиосульфат натрия,
антигистаминные препараты.
Профилактика чесотки проводится с учетом эпидемиологии
заболевания. Большое значение имеет ранняя диагностика, для
чего осуществляется активное выявление путем обследования
контактных с больными чесоткой лиц, при профилактических ос-
470
мотрах, во время подворных обходов в сельских местностях
и т. д.
На каждого выявленного больного заполняются амбулаторная
карта (форма 025/у), извещение в СЭС (форма 089/у), история
болезни для стационарного больного (форма 3), экстренное
извещение на обработку очага (форма 058/у). При выявлении
чесотки в организованном коллективе извещается СЭС для прове-
дения противоэпидемических мероприятий. Дети до полного изле-
чения отстраняются от посещения детского учреждения. Обсле-
дование контактных лиц осуществляется в течение первых 3 сут.
Больные, выявленные в одном очаге, лечатся одновременно
во избежание повторного заражения излечившегося. Госпитали-
зируются на лечение больные с осложненной чесоткой, из много-
детных семей, из закрытых детских учреждений. Лечение осталь-
ных больных проводится в домашних условиях или в скабиозо-
рии, где одновременно осуществляется лечение и дезинфекция
одежды. Медицинский контроль излеченности проводится в тече-
ние 11 /2 мес (первый осмотр через 3 дня после окончания лече-
ния, затем через каждые 10 дней).
Профилактическое лечение необходимо проводить лицам, на-
ходящимся в тесном бытовом и половом контакте, в многодетных
семьях, а также в организованных коллективах путем однократ-
ной обработки кожи контактных лиц одним из противочесоточ-
ных препаратов.
Текущая дезинфекция проводится самим больным или членом
его семьи: обеззараживание постельных принадлежностей, поло-
тенец, нательного белья кипячением в 1—2% растворе соды или
стиральном порошке в течение 5—10 мин с момента закипания.
Верхнюю одежду проглаживают с обеих сторон горячим утюгом.
Часть вещей (плащи, пальто, щубы и др.) может быть обеззара-
жена вывешиванием их на открытый воздух в течение 5 дней.
В помещении проводится ежедневная влажная уборка 1—2 %
мыльно-содовым раствором. Заключительная дезинфекция прово-
дится работником дезотделения СЭС после госпитализации боль-
ного, после окончания амбулаторного лечения, а в детских коллек-
тивах дважды: после выявления больного в группе и по окончании
лечения в изоляторе.
ДЕРМАТОЗЫ, ВЫЗЫВАЕМЫЕ ПРОСТЕЙШИМИ
Трипаносомозы (Trypanosomiasis). Возбудители африканского
(Trypanosoma gambiense, Т. rhodesiense) и американского (Т. cruzi)
трипаносомозов паразитируют в организме человека или живот-
ных.
Переносчиками болезни являются мухи «цеце» и триатомо-
вые клопы [Сергеев В. П., 1983].
Клиника. Поражаются лимфатическая и центральная нерв-
ная системы. После укуса может развиваться трипаносомный
471
шанкр — уплощенный болезненный узел красного цвета, окружен-
ный восковидным ободком, диаметром до 3 см, сопровождающий-
ся лимфангитом и лимфаденитом и разрешающийся в течение
недели. В дальнейшем возникают преходящие болезненные отеки
на веках и конечностях, кратковременные пятнистые сыпи на
груди и спине в виде колец с неясными границами и менее яркой
окраской в центре.
Диагноз подтверждается обнаружением возбудителей в крови,
пунктате и биоптатах лимфоузлов.
Лечение малоэффективное. Используются препараты мышьяка,
сурамин, пентамидина изотионат.
Малярия (Malaria). Возбудители — плазмодии, источник ин-
фекции — больной человек, переносчики болезни — комары рода
Anopheles.
Клиника. Кожные проявления при малярии многообразны
[Бабаянц Р. С., 1984]. Часто регистрируются универсальный зуд и
сухость кожи, при тяжелом течении — отеки лица и конечностей.
Более характерны «малярийные пятна» — геморрагические пятна
на коже и слизистых оболочках. Описаны напоминающие болезнь
Рейно акроасфиксии, герпетиформные, уртикарные, пятнисто-узел-
ковые и типа узловатой эритемы высыпания, дистрофические
изменения волос и ногтей, дисхромии кожи и слизистых оболо-
чек, которые, располагаясь на открытых участках («маска маля-
рика»), напоминают пеллагроидные дерматиты.
Диагноз подтверждается обнаружением возбудителя в крови.
Лечение проводится антималярийными и общеукрепляющими
средствами.
Токсоплазмоз (Toxoplasmosis). Возбудитель Toxoplasma gondi.
Человек инфицируется перорально от животных и через продукты
питания. Высыпания на коже полиморфные: сосудистые и гемор-
рагические пятна, узелки, везикулы, волдыри, скарлатиноподоб-
ное шелушение, сетчатое ливедо, облысения, лимфаденопатии.
Диагноз подтверждается клиническими особенностями, резуль-
татами гистологического и серологического исследований.
Лечение проводится хлоридином, аминохинолом, делагилом в
сочетании с сульфаниламидными препаратами.
Амебиаз кожи (Amoebiasis cutis). Возбудитель — Entamoeba
histolytica. Развивается вторично вследствие распространения из
кишечника, печеночного абсцесса или прямого контакта с инфек-
ционным материалом. Кожные поражения, продолжающиеся до
2 и более лет, представлены глубокими, болезненными язвами или
язвенными гранулемами, ползучими язвами с четкими, утолщен-
ными, выступающими, часто подрытыми краями с гнойно-кровя-
нистым экссудатом и некротическим струпом на дне, типичная
локализация которых перианальные области, ягодицы, реже ноги,
туловище, лицо.
Диагноз подтверждается обнаружением возбудителя в кале,
биоптатах, аспирационной жидкости.
Лечение проводится эметином, ятреном, аминарсоном и т. д.
472
ДЕРМАТОЗЫ. ВЫЗЫВАЕМЫЕ КИШЕЧНОПОЛОСТНЫМИ
При контакте человека с медузами и коралловыми полипами,
выделяющими ядовитую жидкость и травмирующими кожу волос-
ками, возникают сильная боль, зуд, эритема, болезненные отеки,
геморрагии, дерматиты («дерматиты купальщиков»), а в дальней-
шем — длительно не заживающие некрозы и «коралловые язвы».
Одновременно могут быть тошнота, боли в мышцах, суставах и
даже коллаптоидные реакции. Лечение симптоматическое.
ДЕРМАТОЗЫ, ВЫЗЫВАЕМЫЕ ЧЕРВЯМИ
Шистосомозы (Schistosomoses). Син.: бильгарциоз, шистозома-
тоз, шистозомиаз. Возбудитель — трематоды рода Schistosoma.
Человек инфицируется при попадании на кожу и слизистые обо-
лочки церкариев. Различают висцеральный шистозосомоз и чисто
кожный — «церкариальный дерматит». Кожные проявления висце-
рального шистосомоза группируются следующим образом (Яроц-
кий Л. С., 1982; Harman R. R., 1979; Faran F. S., 19791: шисто-
сомный дерматит, уртикарные реакции, парагенитальные грануле-
мы, эктопический кожный шистосомоз. В поздних стадиях (в те-
чение 5—15 лет и более) характерно прогрессирующее развитие
фиброзных процессов в тканях. «Церкариальный дерматит», опи-
санный Л. П. Цыркуновым (1985), — типичный аллергодерматоз.
При повторных вторжениях церкариев в местах контакта с водой
отмечаются зуд и покалывание, а затем появляются мелкие крас-
ные пятна, милиарные и лентикулярные папулы, папуловезикулы,
разрешающиеся в течение 1—2 нед.
Цистицеркоз (Cysticercosis) обусловлен паразитированием ли-
чинок— цистицерков. Заболевание регистрируется в Белоруссии и
западных областях Украины. Различают цистицеркоз мышц, кожи
и подкожной клетчатки, головного мозга. В коже туловища или
реже других участков вокруг паразита формируются единичные
или множественные узлы до 12 см в диаметре, округлой или
овальной формы, подвижные, эластической консистенции, безбо-
лезненные, без признаков острого воспаления, сохраняющиеся в
течение многих лет. В дальнейшем развивается фиброз и кальци-
фикация узлов.
Эхинококкоз (Echinococcosis). Возбудители — личинки Echi-
nococcus granulosus. Распространен в южных республиках и об-
ластях, где развито овцеводство. Чаще поражаются печень и лег-
кие. В коже цисты выявляются в виде узлов различных размеров,
телесного цвета, мягких, подвижных, безболезненных. Они сохра-
няются в течение нескольких лет, а затем дегенерированные кисты
обызвествляются.
Спарганоз (Sparganosis) — гельминтоз, вызываемый личиноч-
ными стадиями дифиллоботрид, паразитирующих в подкожной
клетчатке и мышцах. Заражение происходит при попадании в
организм с питьевой водой процеркоидов, находящихся в цик-
473
лопах, или паразиты находятся в недостаточно обработанном
мясе птиц, свиней и т. д. В местах поражения выявляются отеч-
ные, болезненные узлы, в центре которых двигается лентоподоб-
ная личинка. После ее гибели развивается выраженное воспале-
ние с разрушением ткани и массивной эозинофилией. При зара-
жении лимфатических сосудов развивается ограниченная слоно-
вость.
Аскаридоз (Ascaridosis) вызывается паразитированием в орга-
низме человеческой аскариды, которая широко распространена
во всем мире. Клинические проявления на коже определяются
степенью аллергизации. В ранней стадии они характеризуются
обильными и распространенными волдырями с выраженным зу-
дом, в поздней — симптоматической хронической крапивницей
или элементами центробежной кольцевидной эритемы [Rook А.,
1979].
Энтеробиоз (Enterobiosis, oxyuriasis) —самый распространенный
гельминтоз человека. После инвазии через 1—2 нед у детей и
взрослых формируется ведущий признак поражения кожи —
упорный ночной зуд в анальной области и промежности, а в даль-
нейшем появляются краснота, экскориации, экзематизация, мест-
ная уртикарная реакция.
Анкилостомидозы (Ancylostomidoses) включают два различных
по этиологии, но сходных по клиническим проявлениям гельмин-
тоза — анкилостомоз и некатороз, поражения кожи, известные
под названием «земляная чесотка», «чесотка кули», «водяная че-
сотка», «сыпь рудокопов». В местах внедрения личинок, чаще на
руках и ногах, в межпальцевых складках, на суставах и подошвах,
появляется сопровождающаяся зудом или жжением локализо-
ванная пятнистая, папулезная, папуловезикулезная или буллезная
сыпь, в области лодыжек — отек и уртикарные элементы. Высы-
пания группируются в области фолликулов и на нежных участках
кожи, нередко осложняются пиодермией и разрешаются через
2—3 нед. В поздних стадиях болезни выявляются бледность
кожи и слизистых, единичные полиморфные элементы, гипопиг-
ментные пятна.
Стронгилоидоз (Strongyloidosis), «почвенный зуд», Larva cur-
rens. Возбудитель — угрица кишечная. В ранней стадии заболе-
вания имеют место аллергические реакции, в дальнейшем в местах
внедрения личинок развиваются папулезная, уртикарная, папуло-
везикулезная сыпь с выраженным зудом и эозинофилией, неспе-
цифические дерматиты, отеки кожи, трудно дифференцируемые
с классическим «почвенным зудом» при анкилостомидозах.
В поздних стадиях характерна ползущая сыпь — «Larva currens».
Чаще она начинается в перианальной области и распространяется
на кожу бедер, ягодиц, боковых частей тела до плеч, живота.
Не поражаются голени, стопы, руки, половые органы. Отмечаются
умеренный зуд и по ходу сосудов линейные, ползущие, валико-
образные волдыри, которые могут распространяться со скоростью
до 5—10 см в час.
474
Трихинеллез (Trichinellosis). Син.: трихиноз. Возбудитель
Trichinella spiralis. Заражение происходит при употреблении сы-
рого или недостаточно проваренного мяса больных животных.
Заболевание начинается остро с лихорадки и генерализованной
мышечной боли. Затем отмечается затруднение дыхания, паралич
мышц языка и челюсти, отек век, лица, окологлоточной клетчатки,
диффузное припухание и напряжение кожи, что напоминает
дерматомиозит. На коже конечностей появляются преходящая
пятнисто-папулезная и геморрагическая сыпь. Характерны крово-
излияния под ногтями; в биоптатах кожи часто находят парази-
тов. Через 2—3 нед высыпания разрешаются.
Филяриозы (Filarioses) — группа заболеваний, вызываемых не-
матодами семейства Filaridae [Яровой П. И. и др., 1984], из кото-
рых в дерматологической практике имеют наибольшее значение
вухерериоз, бругиоз, онхоцеркоз, лоаоз. Источник инвазии —
человек, промежуточные хозяева и переносчики — комары, мошки,
слепни.
Вухерериоз (Wuchereriosis) и бругиоз (Brugiosis). Поражается
преимущественно лимфатическая система нижних конечностей и
половых органов. Сначала развивается лихорадка с уртикарными
элементами, регионарными отеками кожи и подкожной клетчатки,
лимфангитами, лимфаденитами, орхитом, эпидидимитом, фунику-
литом, затем — пролиферативные процессы, расширение лимфати-
ческих сосудов кожи и подкожной клетчатки, лимфадениты. Кожа
утолщается, грубеет, трескается, инфицируется пиококками,
изъязвляется. Вокруг паразитов в подкожной клетчатке и мышцах
формируются абсцессы. Для поздних стадий характерна слоно-
вость нижних конечностей, половых органов и других участков кожи
с экзематизацией, папилломатозными разрастаниями, хронической
пиодермией [Бабаянц Р. С., 1984].
Онхоцеркоз (Onchocercosis). Поражаются кожа, подкожная
клетчатка, лимфатическая система и глаза. Ранними признаками
являются кожный зуд и полиморфные высыпания без определенной
локализации. Чаще это мелкие пятнистые и узелковые рассеянные
элементы, сгруппированные волдыри — «филяриозная чесотка»
или картина хронического дерматита, рожистого воспаления со
склероподобным уплотнением. В дальнейшем кожа истончается, ше-
лушится, сморщивается, становится сухой («старческий дерматит»),
появляются дисхромии, лимфаденопатии. Наиболее характерно
формирование в подкожной клетчатке узлов вокруг гельминтов ве-
личиной до куриного яйца, плотных, безболезненных, подвижных,
локализующихся у африканцев преимущественно на туловище,
а у американцев — на голове.
Лоаоз (Loaosis). Поражаются мягкие ткани, конъюнктива, се-
розные оболочки и половые органы. Характерны временные передви-
гающиеся плотные отеки — «Calabar swellings» кожи и подкожной
клетчатки на конечностях и лице, эластичные, цвета кожи, сохра-
няющиеся несколько часов или дней и спонтанно исчезающие. Могут
быть генерализованный болезненный зуд, уртикарные высыпания
475
и дизурические расстройства, колющие и зудящие, ползущие
ощущения.
Личинка мигрирующая (Larva migrans) —это сборный клини-
ческий термин, объединяющий болезни, вызываемые мигрирую-
щими личинками гельминтов животных. Различают кожную и
висцеральную формы болезни. Возбудители кожной формы —
анкилостомиды собак и шистосоматиды водоплавающих птиц.
Подвержены заболеванию дети, работники сельского хозяйства,
пловцы. Под действием ферментов типа коллагеназы личинки
проникают в кожу верхних и нижних конечностей, ягодиц, где
появляется чувство покалывания, жжения, зуда и развивается
быстро проходящий неспецифический дерматит. Личинки могут
сохраняться месяцами или начинают ползать со скоростью движе-
ния от нескольких мм до 3—4 см в день. По извилистому ходу
личинок формируется валикообразная линия розового или телес-
ного цвета различной формы. В результате расчесов могут разви-
ваться дерматиты, экзематизация и вторичная пиодермия. Про-
должительность заболевания 1—2 мес.
Дракункулез (Dracunculosis). Возбудитель—Dracunculus me-
dinensis. Человек заражается через воду, в которой находятся
циклопы с личинками червя. Через 7—10 мес в местах располо-
жения личинок в подкожной клетчатке, чаще на ногах, можно
выявить покраснение, папулы, волдыри, сопровождающиеся нару-
шением общего состояния, лихорадкой, головными болями и зу-
дом. Затем в этом месте появляется выпячивание с интенсивной
воспалительной реакцией, узел, а через несколько дней — пузырь,
в основании которого прощупывается плотноэластический тяж.
В дальнейшем формируется язва с головкой гельминта на дне.
Для этой стадии характерен симптом «молочного фонтанчика» —
выбрасывание из воронкообразной язвы молочного цвета жидко-
сти с большим количеством личинок после наполнения ее теплой
водой. Возможны осложнения с образованием абсцессов и флег-
мон [Литвинов С. К., 1985; Winkler А., 1980].
Диагноз гельминтозов основывается на анамнестических и
эпидемиологических данных, особенностях клинической картины,
результатов гельминтологических и других лабораторных методов
исследования.
Лечение предусматривает специфическую антигельминтную
терапию с учетом вида паразита и симптоматическое лечение с
учетом особенностей патологического процесса.
Профилактика гельминтозов включает санитарно-гигие-
нические мероприятия по благоустройству населенных пунктов,
санитарный надзор за гидротехническими объектами, повышение
невосприимчивости организма к паразитам и санитарно-просве-
тительную работу.
Гирудиноз (Hirudinosis) — заболевание кожи, вызываемое
внедрением пиявок, которые попадают на кожу человека в стоя-
чих водоемах, при ходьбе босиком по мокрой траве и болотам.
Укусы медицинских пиявок малоболезненны, а тропических —
476
вызывают жжение и боль. При первых укусах появляются дли-
тельно кровоточащие ранки, медленно заживающие и осложняю-
щиеся пиодермией. При развитии сенсибилизации возникают
уртикарные, буллезные, некротические высыпания. Возможны
анафилактические реакции. Л. П. Цыркунов (1986) описал аллер-
гический дерматит от пиявок.
ДЕРМАТОЗЫ, ВЫЗЫВАЕМЫЕ ЧЛЕНИСТОНОГИМИ
Ракообразные (Crustacea) вызывают поражения кожи путем
нанесения болезненных укусов. Только Cymothoidea, обнаружи-
ваемые на мелководье морей, могут вызывать дерматиты, при-
крепляясь к рукам или ногам. Укус острый, болезненный, вызы-
вает точечное кровотечение и в дальнейшем появление сыпи «дер-
матита морской вши», который разрешается в течение недели.
Скорпионы (Scorpiones) встречаются в Средней Азии, Закав-
казье, в Крыму; укусы вызывают жгучую боль, выраженный отек и
покраснение кожи, геморрагии, некроз. Введенный яд обусловли-
вает острую токсическую реакцию, которая, особенно у детей
раннего возраста, может привести к летальному исходу.
Пауки (Aranei). Каракурт (Lactodectus tredicimquttatus), рас-
пространенный в Средней Азии, Закавказье, Крыму, Украине,
Молдавии, Нижнем Поволжье, в месте укуса вызывает острую
боль и жжение, покраснение, отечность, а затем развитие папулез-
но-везикулезных элементов, уплотнения кожи. Одновременно с
общей токсической реакцией, судорогами может быть распростра-
ненная пятнисто-папулезная и везикулезно-пустулезная сыпь.
Тарантул (Lycosa Singoriensis) в месте болезненного, но неопас-
ного укуса может вызвать покраснение и отек тканей.
Пузатый клещ (Pediculoides ventricosus) вызывает так называе-
мую зерновую (злаковую) чесотку. Син.: зудень, соломенная че-
сотка, ячменная чесотка, чесотка старых скирд, матрацная чесот-
ка. После укусов напавшего на человека клеща появляются сильно
зудящие, светло-красные милиарные папулы или папуловезикулы,
склонные к превращению в пустулы. Через 1—2 нед наступает
выздоровление. Возможны эпидемии болезни.
Клещи-краснотелки (сем. Trombeae). Вызывают заболевание ли-
чинки клещей (Leptus autumnalis и др.), нападая на человека во вре-
мя прогулок или работы в поле. Через 3—4 ч в месте присасывания
клеща появляется точечное пятно, а затем эритема, у сенсибили-
зированных лиц — милиарная, а затем лентикулярная папула или
пузырьки, иногда геморрагии и лимфаденит. Локализация кожного
процесса: запястья, предплечья, лодыжки, бедра, поясница, у рабо-
чих в поле — лицо и шея. После отпадения клещей через 1—4 нед
наступает выздоровление.
Аргасовые клещи (сем. Argasidae) паразитируют на млекопи-
тающих, птицах. После укуса отмечаются незначительная болез-
ненность и радиально распространяющиеся покраснение и отек.
В центре формируется узелок. Зуд слабо выражен. Возможны
477
геморрагические и папуловезикулезные высыпания. При нара-
стании воспаления наряду с нарушением общего состояния боль-
ного кожные высыпания распространяются, приобретая уртикар-
ный и буллезный характер. Разрешение медленное в течение 4—
5 нед. Клещи могут быть переносчиками возбудителей возвратного
тифа (рекурренса) и риккетсиозов.
Гамазовые клещи (сем. Gamasoidea) паразитируют на птицах и
грызунах. В местах укусов (туловище и конечности, особенно в
местах тесного соприкосновения кожи с одеждой) появляются
боль и геморрагическое пятно, вокруг которого имеется мелко-
пятнистая сосудистая, папулезно-везикулезная и уртикарная сыпь.
При наличии повышенной чувствительности высыпания приобре-
тают распространенный характер.
Иксодовые клещи (сем. Ixodidae) являются кровососущими
паразитами животных и человека. В месте укуса появляется
безболезненная эритема,. которая постепенно увеличивается в
размерах, приобретая вид мигрирующей эритемы и достигая в
диаметре 15—20 см. Сначала она ярко-красная, отечная, с выра-
женным зудом, а в дальнейшем бледная, инфильтрированная с
синюшным оттенком. Через 2—3 нед наступает выздоровление.
Чаще клещи закрепляются в складках кожи, в области гениталий,
суставов, живота. Клещи являются также переносчиками энцефа-
лита и ряда других инфекционных заболеваний.
Клещи-железницы (сем. Demodicidae) паразитируют в волося-
ных фолликулах и сальных железах преимущественно лица,
а также ушных раковин, слухового прохода, ресниц, грудных
желез, гениталий. У человека два специфических вида — Demodex
folliculorum и Demodex brevis, очень мелкие клещи (0,2—0,3 мм)
с веретеновидным телом, короткими ногами и колющими ротовыми
органами. Железницы у животных вызывают заболевание под
общим названием демодекоз, у человека диагностируется как роза-
цеподобный демодекоз, периральный дерматит, чаще наблюдаемый
у женщин. Клинически проявляется в виде симметричных высы-
паний вокруг рта, в области носогубных складок, на прилегающих
участках щек, на подбородке, реже периорбитально. Высыпания
состоят из тесно расположенных папул и папуловезикул розово-
красного цвета и пустулезных элементов на эритематозном фоне.
Субъективные ощущения обычно отсутствуют. У значительной
части людей имеет место бессимптомное носительство демоде-
коза. Применяется комплексное лечение демодекоза 20 % водно-
мыльной суспензией бензилбензоата, мазью «ЯМ», 33 % серной,
1 % трихополовой мазями. Внутрь назначаются трихопол по
0,25 г 3 раза в день циклами по 5 дней, антигистаминные препа-
раты, симптоматическое лечение желудочно-кишечного тракта и
другой патологии.
Полужесткокрылые (Hemiptera). Поражение кожи человека
вызывают постельные клопы. В месте укуса (руки, шея, грудь)
появляется волдырь с выраженным зудом, затем — зудящие урти-
карные папулы, которые разрешаются через несколько дней.
478
«Целующие» клопы (Triatomidae) кусают человека в местах пере-
хода кожи в слизистые на лице, где обнаруживаются папулез-
ные высыпания с точкой в центре, сгруппированные везикулы,
гигантские уртикарии, коричневого цвета отеки больших поверх-
ностей, геморрагические и буллезные элементы.
Вши (Anoplura) — типичные паразиты, питающиеся кровью и
всю жизнь проводящие на теле человека. Они также переносчики
сыпного и возвратного тифа. Обнаружение вшей — свидетельство
неблагополучия санитарно-гигиенического состояния в семье или
коллективе. Источником вшивости является человек.
Головные вши (Pediculus capitis) — чаще паразитируют
на волосах головы девочек и женщин. Наиболее частая локализа-
ция вшей и гнид — височная и затылочная области, реже другие
части головы, а также брови, ресницы, гладкая кожа. Клиниче-
ская картина характеризуется зудом кожи, расчесами, дерматитом
и экзематизацией, вторичной пиодермией. В месте укуса под
влиянием раздражения кожи секретом слюнных желез появляют-
ся зудящие пятна и узелки. Вследствие расчесов усиливается и
распространяется воспаление, образуются эрозии, корочки, шелу-
шение, а в дальнейшем везикулы, мокнутие, т. е. развивается
экзематозный процесс, создающий входные ворота для пиококков.
Появляются гнойнички, экссудат, который склеивает волосы и ссы-
хается с образованием корок. Формируются толстые пучки волос
и так называемые колтуны; от больных исходит неприятный за-
пах. Патологический процесс распространяется на кожу заушных
областей, ушные раковины, шею, воспаляются и увеличиваются
регионарные лимфатические узлы [Демьянович М. П., Добронра-
вов В. Н., 1961; Derbes V. J., 19791. Без лечения кожный процесс
может сохраняться долгое время.
Платяные вши (Pediculus vestimenti) паразитируют в
местах соприкосновения складок и швов белья и одежды с телом
(плечи, верхняя часть спины, подмышечные впадины, живот, по-
ясница, пахово-бедренные складки). Инвазируются чаще неопрят-
ные взрослые лица, реже — дети. В местах укусов видны сосу-
дистые пятна, а затем зудящие папулезно-уртикарные элементы.
При нарастании зуда выявляются расчесы, вторичная пиодермия
(часто эктимы). При длительном течении болезни в указанных
местах развиваются участки утолщения кожи с расчесами, шелу-
шением, светло-коричневой или грязно-серой окраской. После раз-
решения патологического процесса остаются гиперпигментные
пятна.
Лобковые вши, или площицы (Pediculus pubis),
паразитируют в волосах лобковой области, нижней части живота,
бедер и могут переползать на волосы подмышечных впадин, груди
и даже бороды и усов. Поражаются преимущественно взрослые
обычно при половых контактах. При редком поражении детей вши
размещаются в бровях, области ушей и затылка. Площицы при-
крепляются коготками к основанию волос и внедряются в устье
фолликулов. Они обладают также способностью приспосабливать
479
свою окраску к цвету кожи и поэтому трудно различимы. Укусы
лобковых вшей не сопровождаются выраженным зудом и поэтому
реже встречаются расчесы и пиодермия, но появляются характер-
ные голубоватые или серые пятна диаметром до 1 см — «maculae
coeruleae». Большей частью пятна локализуются на внутренней
поверхности бедер, боковых поверхностях тела и подмышечных
впадинах. При поражении ресниц по краю верхнего века появляет-
ся синевато-красная полоска, может развиться конъюнктивит.
Диагноз вшивости основывается на оценке клинической
картины заболевания и результатах паразитологического обследо-
вания.
Лечение. Одновременно уничтожаются вши в волосах, на
теле человека и в белье, одежде и других предметах. При вши-
вости, осложненной пиодермией или экзематозной реакцией,
назначается соответствующая дезинфицирующая и противовоспа-
лительная, а в дальнейшем — антипаразитарная терапия. При
обычном течении педикулеза используют 0,15 % водную суспензию
карбофоса, 5 % шампунь метилацетофоса, 0,25 % водную суспен-
зию дикрезила, 10 % водную мыльно-керосиновую суспензию,
20 % водно-мыльную суспензию бензилбензоата, которые наносят-
ся на 15—30 мин. Затем обработанные места моются горячей
водой с любым моющим средством. Волосы можно прополоскать
теплым водным раствором 5—8 % уксусной кислоты. Эффективно
применение препарата «Ниттифор». Профилактика преду-
сматривает проведение дезинфекции белья, одежды, помещений,
осмотра контактных лиц, санитарно-противоэпидемические меро-
приятия.
Чешуекрылые, или бабочки (Lepidoptera). Гусеницы некоторых
бабочек при попадании на кожу вызывают «гусеничный дерма-
тит» [Цыркунов Л. П., 1986]. Через 10—20 мин после пропол-
зания гусеницы появляются жжение, зуд, линейная отечная полос-
ка красного цвета. В результате расчесов волоски гусениц перено-
сятся на новые участки, где появляются пятнисто-уртикарные
элементы. При повторных контактах развивается пятнисто-булез-
ная сыпь, и заболевание приобретает затяжное течение. Обычно
дерматит разрешается в течение 1—2 нед. Лечение симптомати-
ческое.
Жесткокрылые, или жуки (Coleoptera). Некоторые жуки содер-
жат ядовитые секреты. Поражение возникает в тех случаях,
когда человек раздавливает жука, втирая при этом в кожу содер-
жащуюся в нем токсичную жидкость. Через 2—24 ч развивается
дерматит: покраснение, отек, различной величины пузыри. Зуд
выражен слабо, границы поражения соответствуют месту действия
раздражителя. В течение 1—2 нед высыпания разрешаются. Лече-
ние симптоматическое.
Блохи (Aphaniptera) вызывают заболевание кожи, называемое
дерматофилиаз (dermatophiliasis, pulicosus). В месте укуса ощу-
щается жжение и появляются пятно, папула, волдырь или пузыре!
в зависимости от индивидуальной чувствительности организма, «
480
центре которых геморрагическая точка. Тяжелые местные реакции
бывают редко. Пузыри, сгруппированные на эритематозном фоне
папулы, уртикарии, элементы типа многоформной эритемы с выра-
женным зудом встречаются обычно на бедрах, ягодицах, нижней
части живота, на руках. В Америке, Африке, Азии встречается
Tungiasis (тунгиаз, саркопсилез) — заболевание, вызываемое пес-
чаной (земляной) блохой, которое характеризуется появлением
на половых органах, перианальных областях, бедрах и руках сна-
чала пятна, затем зудящего узелка с пустулой в центре и узлом,
а в дальнейшем язв, абсцессов, лимфангитов, лимфаденитов,
септицемии или даже столбняка [Altmeyer Р., 1980; Winkler А.,
1980].
Перепончатокрылые (Hymenoptera). Укусы пчел, ос, муравьев,
шершней встречаются часто и вызывают жгучую боль, покрасне-
ние и отек кожи. Генерализованная реакция развивается обычно
в течение получаса и характеризуется кожным зудом, ангионевро-
тическим отеком, крапивницей, при нарастании тяжести — различ-
ными системными реакциями. Так как яд обладает кумулятивным
действием, то при повторных укусах реакции могут быть очень
тяжелыми с геморрагической сыпью.
Двукрылые (Diptera). Кровососущие двукрылые питаются
кровью теплокровных и являются переносчиками малярии, москит-
ной лихорадки, лейшманиоза, туляремии, филяриозов. При напа-
дении двукрылых (комаров, москитов, мошек, слепней, мух-кро-
вососок) появляются легкая болезненность, покраснение, волдыри
и в течение суток формируется зудящая папула. У сенсибилизи-
рованных пациентов более выражены уртикарные реакции, могут
быть папулезные и буллезные высыпания.
В Азии, Африке и Латинской Америке распространены флебо-
тодермия и харара [Бабаянц Р. С., 1984]. Флеботодермия
(Phlebotodermia) развивается после укусов москитов рода Phlebo-
tomus dermia и характеризуется длительным течением, интенсив-
ным зудом, распространенными папулезными и узловатыми эле-
ментами, напоминающими узловатую почесуху. Харара (hara-
га) — сезонная многоформная крапивница, развивается после
повторных укусов москитов и по течению близка к флеботодер-
мии; характеризуется выраженным зудом, папуловезикулезными,
а в дальнейшем плотными узловатыми высыпаниями на конеч-
ностях, лице и туловище и длительным течением.
Миазы (myasis) — заболевания, вызываемые червеобразными
личинками двукрылых, некоторых мух и оводов. Различают по-
верхностные и глубокие, облигатные и факультативные миазы.
Поверхностные миазы вызываются видами мух, откладывающих
яйца в ссадины и раны. Вышедшие личинки питаются гноем и
осложняют течение болезни. Глубокие миазы вызываются питаю-
щимися тканями человека личинками вольфрамовой мухи. Поража-
ются кожа, подкожная клетчатка и слизистые оболочки. Личинки
разрушают ткани, образуя язвы и глубокие ходы. При корди-
л о б и а з е (африканском миазе) чаще у детей образуются фу-
481
17—936
рункулоподобные узлы и язвы, абсцессы. Дерматобиаз
(южноамериканский миаз) характеризуется опухолевидным воспа-
лением и подкожными абсцессами с фистулезными отверстиями
на поверхности. Резервуар инвазии — домашние животные. Личин-
ки оводов вызывают «ползучую болезнь», проникая в кожу и про-
делывая в ней извилистые ходы, — «линейный мигрирующий
миаз».
При укусах двукрылых проводится симптоматическое лечение;
при миазах необходимо предварительно обездвижить и удалить
личинки. Профилактика предусматривает выполнение мер общест-
венной и личной гигиены, применение репеллентов.
Многоножки (Myriapoda). Среди многоножек для человека
имеют значение травоядные двупарноногие (Diplopoda) и плото-
ядные губоногие (Chilopoda). Первые выделяют защитную зловон-
ную жидкость, вызывающую серьезное поражение глаз и кожи:
жжение и боль, покраснение, отек, волдыри. Губоногие выделяют
яд, вызывающий боль, отек, появление пурпуры, главным образом
на ногах.
ДЕРМАТОЗЫ, ВЫЗЫВАЕМЫЕ МОЛЛЮСКАМИ
Моллюски, или мягкотелые (Mollusca). Некоторые морские
моллюски имеют ядовитый аппарат и вызывают у купающихся бо-
лезненные ожоги, развитие эрозий, локальных ишемий, цианоза,
онемения, которые быстро могут распространяться на значитель-
ные участки тела. Контакт с некоторыми видами моллюсков
может привести к летальному исходу. Описаны профессиональные
аллергические дерматиты от контактов с кальмарами и мидиями.
Лечение симптоматическое.
Глава 14
ВИРУСНЫЕ ДЕРМАТОЗЫ
В настоящем разделе рассмотрены наиболее распространенные
вирусные дерматозы: простой и опоясывающий герпесы, бородав-
ки, остроконечные кондиломы, контагиозный моллюск, узелки
доильщиц и болезнь кошачьих царапин.
ПРОСТОЙ ГЕРПЕС (HERPES SIMPLEX)
Син.: простой пузырьковый лишай
Это хроническое рецидивирующее заболевание, проявляющееся
пузырьковыми высыпаниями на коже и слизистых оболочках.
Может протекать с вовлечением в патологический процесс различ-
ных органов и систем организма и принимать системный характер.
Этиология и патогенез. Возбудителем заболевания является
вирус простого герпеса (ВПГ). Это дерматонейротропный ДНК-
содержащий вирус со сложной структурой; размер его вирионов
равен 150—300 нм. Размножается ВПГ в ядре и цитоплазме ин-
фицированной клетки, имеет 14-часовой цикл воспроизведения.
При остром инфекционном процессе в восприимчивых клетках
вирус интенсивно репродуцируется, в результате чего погибают
пораженные клетки и высвобождаются дочерние вирионы [Со-
ловьев В. Д., Баландин И. Г., 1973].
Различают ВПГ I и II типов. Вирус простого герпеса одинаково
часто может быть возбудителем как генитальных, так и негени-
тальных форм заболевания. Герпетическая инфекция передается
преимущественно контактным путем (через предметы обихода,
поцелуи, половую связь). Возможен также воздушно-капельный
способ заражения.
Вирус, проникая в организм через кожу или слизистые обо-
лочки, поступает в регионарные лимфатические узлы, кровь и
внутренние органы. В организме он распространяется гемато-
генно и по нервным волокнам. Резервуаром ВПГ у человека явля-
ется регионарный чувствительный ганглий (спинальный или
черепно-мозговой), в котором вирус находится в латентном со-
стоянии [Nesburn А., 1980].
Вскоре после инфицирования в организме образуются анти-
тела к ВПГ. Титры их увеличиваются в течение 3—4 нед и в
дальнейшем сохраняются в течение всей жизни человека на отно-
сительно постоянном уровне независимо от того, имеет ли инфек-
483
17*
ция латентную или манифестную форму. Постоянно существую-
щие в крови специфические антитела, не предупреждая рецидивов
болезни, оказывают определенное смягчающее влияние на тяжесть
рецидивов и его течение.
У большинства людей первичная герпетическая инфекция про-
текает субклинически или асимптомно, принимая характер вирусо-
носительства. И лишь у незначительной части лиц она проявля-
ется клинически.
Состояние биологического равновесия нарушается воздей-
ствием различных провоцирующих факторов, что приводит к
переходу латентной инфекции в хроническую форму заболевания.
Решающая роль во взаимоотношениях вирус — хозяин принадле-
жит состоянию реактивности организма. Этим в значительной сте-
пени определяется многообразие клинических форм герпетиче-
ской инфекции: от локальных до генерализованных, от вирусо-
носительства до хронических рецидивирующих.
У большинства людей иммунные механизмы (преимущест-
венно клеточные) сдерживают реактивацию латентного вируса и
предупреждают развитие рецидивов. Но приблизительно у '/з виру-
соносителей с недостаточной противовирусной резистентностью
возникают манифестные формы герпетической инфекции [Naga-
fuchi S., 1980].
Известны две альтернативные гипотезы, объясняющие возник-
новение рецидивов герпеса: статического и динамического состоя-
ний вируса [Hill Т., Blyth W., 1976]. Согласно первой гипотезе,
вирус находится в клетках паравертебрального сенсорного ганглия
в интегрированном или свободном непродуктивном состоянии.
Реактивируясь под влиянием «пускового фактора», вирус из
ганглия перемещается по аксону периферического нерва и вызы-
вает репликацию ВПГ в эпителиальных клетках. Условием репли-
кации вируса, помимо ослабления иммунологического контроля,
является восприимчивость эпителиальных клеток.
Согласно гипотезе динамического состояния, репликация и вы-
деление из ганглия наибольшего количества вируса происходят
постоянно в течение нескольких дней. Распространяясь по нерву
в кожу, вирус вызывает микрофокусы инфекции, которые сдер- ;
живаются механизмами защиты, что предупреждает рецидивы или .
обусловливает их абортивные проявления. Появление высыпаний
через 1—2 дня после воздействия провоцирующего фактора объяс-
няется поступлением ВПГ в кожу. На развитие рецидивов влияет
состояние местного иммунитета; при угнетении последнего созда- 1
ются условия для репликации находящегося в коже вируса. Им- _
мунная система играет важную роль в ограничении распростра-
нения герпетической инфекции. В иммунной защите участвуют
специфические и неспецифические факторы; ведущая роль при-
надлежит Т-клеточным механизмам иммунитета. На защитные
функции организма и сохранение его гомеостаза большое влияние
оказывает также способность клеток образовывать интерферон
(Соловьев В. Д., Бектемиров Т. А., 1979].
484
Герпетическая инфекция характеризуется разнообразными
клиническими проявлениями, локализацией, тяжестью течения.
Герпес в зависимости от течения подразделяют на первичный и
рецидивирующий. Первичный герпес возникает после первого кон-
такта с вирусом простого герпеса. Обычно он наблюдается в дет-
ском возрасте при отсутствии специфических гуморальных анти-
тел, но может встречаться и у взрослых. Первичный герпес отлича-
ется интенсивностью клинических симптомов. Заболевание возни-
кает после инкубационного периода продолжительностью от
нескольких дней до двух недель. Наиболее тяжело первичный гер-
пес протекает у новорожденных, поскольку вследствие гематоген-
ной диссеминации у них поражаются ЦНС и внутренние органы.
Острый герпетический стоматит — одно из наиболее часто
встречающихся клинических проявлений первичной инфекции.
Заболевание возникает преимущественно у детей раннего возраста.
После инкубационного периода продолжительностью от 1 до
8 дней бурно развиваются клинические симптомы заболевания —
озноб, высокая температура до 39—40 °C, головная боль, сонли-
вость, общее недомогание. Болезненные сгруппированные пузырь-
ки в полости рта чаще локализуются на слизистой оболочке щек,
десен, внутренней поверхности губ, на языке, реже — на мягком и
твердом небе, небных дужках и миндалинах. Пузырьки лопаются,
образуя эрозии с остатками отслоившегося эпителия. На деснах
едва заметные точечные эрозии. При их слиянии образуются
очаги с фестончатыми контурами на отечном фоне. Возникнове-
нию герпетического гингивостоматита способствует прорезание
у детей зубов, а у взрослых их удаление. Регионарные подчелюст-
ные лимфатические узлы часто увеличены и болезненны. Как
правило, при герпетическом стоматите на коже вокруг рта возни-
кают рассеянные пузырьки. У ослабленных детей вследствие
диссеминации вируса в печень, селезенку и другие органы при-
мерно у 25 % наступает летальный исход. В легких случаях про-
цесс регрессирует в течение 2 нед.
Простой герпес часто встречается как рецидивирующая форма
заболевания. По сравнению с первичным герпесом интенсивность
и продолжительность клинических проявлений рецидивов менее
выражены. Наиболее часто процесс локализуется на лице, конъюн-
ктиве и роговице глаз, на половых органах и ягодицах. Заболева-
ние может рецидивировать десятилетия. Частота рецидивов
различная: у одних больных высыпания возникают 1—3 раза в
год, у других — до 5 раз в месяц. В редких случаях процесс
принимает непрерывный хронический характер, когда одни высы-
пания еще не разрешились, а другие появляются. Особенно тягост-
ны частые рецидивы генитального герпеса. У женщин рецидивы
генитального герпеса часто возникают во время менструации.
Локализация герпетических высыпаний обычно фиксированная
и определяется местом внедрения вируса в кожу или слизистую
оболочку. Обычно им предшествуют продромальные явления, вы-
ражающиеся жжением, покалыванием, зудом и другими ощу-
485
щениями. Сгруппированные пузырьки размером I'/a—2 мм воз-
никают на фоне эритемы. Их прозрачное содержимое вскоре
мутнеет вследствие примеси крови и может становиться геморра-
гическим. Сыпь чаще проявляется единичными очагами, состоя-
щими из 3—5 сливающихся пузырьков. Вследствие мацерации и
травматизации они разрываются, образуя слегка болезненные
эрозии с фестончатыми контурами. Дно их мягкое, гладкое, кра-
сноватое, поверхность влажная. При микробном инфицировании
или раздражении эрозия может превратиться в поверхностную
язву с несколько уплотненным дном и небольшим отеком по
периферии. При этом нередко возникает регионарный лимфа-
денит со слегка болезненными лимфоузлами тестоватой консис-
тенции. Содержимое пузырьков ссыхается в буровато-желтоватые
корки. На месте заэпителизировавшихся эрозий могут оставаться
медленно исчезающие красновато-буроватые пятна. В среднем
высыпания разрешаются в течение 10—14 дней. Длительность
рецидивов увеличивается при осложнении вторичной инфекцией.
Выделяют несколько атипичных форм простого герпеса: абор-
тивную, отечную, зостериформную, диссеминированную, мигри-
рующую, геморрагическо-некротическую, элефантиазоподобную,
эрозивно-язвенную, рупиоидную. Абортивная форма
возникает на участках кожи с уплотненным роговым слоем; она
проявляется едва заметными папуллезными элементами. К абор-
тивным проявлениям заболевания относятся также эритематозная
и пруригинозно-некротическая формы, характеризующиеся локаль-
ными субъективными расстройствами без высыпаний. Отечная
форма чаще локализуется на участках кожного покрова с рыхлой
подкожной клетчаткой (веки, губы) и характеризуется выражен-
ным отеком тканей. Зостериформный простой герпес располага-
ется по ходу того или иного нерва на конечности, туловище, лице
и сопровождается невралгиями, а также головной болью, общей
слабостью.
Для диссеминированной формы заболевания характерно одно-
временное появление сыпи на отдаленных друг от друга участках
кожного покрова. При мигрирующем герпесе рецидивирующая
сыпь меняет локализацию. Названия геморрагической и геморра-
гическо-некротической форм определяются кровянистым содер-
жимым пузырьков и развитием некроза. Элефантиазоподобную
форму заболевания можно рассматривать как отечную форму с
развитием стойкой слоновости в области очага поражения.
Выделяют также редко встречающуюся форму — хрониче-
ский кожный простой герпес, наблюдающийся у
больных с иммунодефицитом и характеризующийся перманентны-
ми активными проявлениями заболевания. При этой форме на
месте обычных герпетических высыпаний появляются стойкие
язвенные очаги поражения диаметром до 2 см.
Язвенная ф°Рма простого герпеса при локализации на
половых органах вызывает определенные диагностические труд-"
ности [Потекаев Н. С., Самгин М. А., 1983]. Развитие язвенны»,
486 f
поражений связывают с повышенной вирулентностью штаммов
вируса и ослаблением иммунобиологических механизмов защиты
больного.
Клиническая картина этой формы простого герпеса характери-
зуется образованием язв на местах лопнувших пузырьков и слив-
шихся эрозий. Дно язв мягкое, розово-красного цвета, иногда с
серовато-желтоватым налетом. Уплотнение в основании язвы
отсутствует. Очаги поражения располагаются преимущественно на
внутренней поверхности крайней плоти у мужчин и на больших
половых губах у женщин. Локальная болезненность и жжение
наиболее выражены в первые дни заболевания. Иногда отмечается
незначительное увеличение паховых лимфатических узлов.
Рупиоидная форма простого герпеса чаще возникает
на лице, осложняется вторичной инфекцией с развитием слоистых
корок и трещин. Процесс рецидивирует с частотой от 2—3 раз в
1 год до 1—2 раз в течение месяца. Сыпь обычно сопровождается
болезненными и увеличенными регионарными лимфатическими
узлами.
Герпес рук. Процесс чаще располагается на дистальных
участках кистей. Нередко эта форма заболевания возникает у
медицинских работников, обслуживающих больных герпесом. Вы-
сыпания представлены ограниченными очагами поражения, сос-
тоящими из единичных плотных пузырьков, сопровождаются
болезненностью.
Наиболее распространенная разновидность простого гер-
песа — герпес лица. У большинства больных это спорадические
очаговые пузырьковые высыпания, разрешающиеся чаще в течение
одной недели. При тяжелом течении герпеса лица процесс на коже
захватывает обширные поверхности лица — красную кайму и кожу
губ, носа, лба, щек (рис. 106).
Тяжелой формой простого герпеса является герпетиформ-
ная экзема Капоши, возникающая у детей, больных
экземой и нейродермитом. Впервые эта форма заболевания была
описана Капоши в 1887 г. В нашей стране она всесторонне изу-
чена С. Я. Голосовкером, Ф. А. Зверьковой. Это остро развиваю-
щееся заболевание, сопровождающееся высокой температурой
тела (до 39—40 °C), тяжелым общим состоянием и дессеминиро-
ванным поражением кожи и слизистых оболочек, в части случаев
имеет летальный исход. Источником заболевания являются боль-
ные герпесом. Заболевание чаще встречается в холодное время
года, особенно во время вспышек среди населения острых респира-
торных вирусных инфекций и гриппа (подробное описание приве-
дено в главе XV).
Одной из наиболее часто встречающихся клинических разно-
видностей простого герпеса является генитальный гер-
пес. Этиологическая роль при нем приблизительно одинаково
часто принадлежит ВПГ-1 и ВПГ-2 типам. Инфицирование одним
типом ВПГ не препятствует возникновению инфекции, вызываемой
ВПГ другого типа, что приводит к образованию промежуточных
487
(«двойных») антител. Частое выделение ВПГ-1, который ранее
считали возбудителем негенитальных форм простого герпеса, при
поражении гениталий объясняется распространенностью орогени-
тальных контактов.
Генитальный герпес характеризуется островоспалительными
проявлениями, вариабельностью клинической картины и тенден-
цией к упорному рецидивирующему течению. У мужчин ограничен-
ные герпетические высыпания локализуются на внутреннем листке
крайней плости, в заголовочной бороздке, на головке и стволе по-
лового члена. У женщин поражаются чаще малые половые губы,
клитор, влагалище, шейка матки, промежность и бедра. Высыпа-
ния, представленные везикулами, эрозиями, язвами на фоне эри-
темы и отечности, часто сопровождаются болезненностью, зудом,
ощущением тяжести и давления в области промежности. Паховый
лимфаденит наблюдается приблизительно у ‘/з больных. При во-
влечении в процесс слизистой оболочки уретры появляются бо-
лезненность при мочеиспускании и небольшие серозные выделения
из уретры.
Герпес гениталий у 40—75 % женщин протекает малосимп-
томно [Chang Т., 1975]. Наиболее частым резервуаром ВПГ явля-
ется мочеполовой тракт у мужчин и канал шейки матки у женщин.
С помощью лабораторно-вирусологических исследований ВПГ
обнаруживается в этих органах у 3—15 % обследуемых без мани-
фестации инфекции [Duenas А., 1979].
Источником генитального герпеса могут быть не только боль-
ные в острой стадии заболевания, но и вирусоносители. Первичный
генитальный герпес возникает в среднем после недельного инку-
бационного периода. Он отличается от рецидивирующего более
тяжелым и продолжительным течением. Локализация поражений
на половых органах и прилежащих к ним местах определяется
воротами вирусной инфекции.
Рецидивирующее течение генитального герпеса наблюдается у
50—75 % инфицированных [Belsey Е., Adler М., 1978]. Рецидивы
болезни обычно возникают после отрицательных эмоциональных
воздействий, переохлаждения и других факторов, нарушающих
состояние биологического равновесия организма, способствующих
снижению иммунобиологических защитных сил организма и акти-
вации ВПГ.
Генерализованный герпес новорожденных
возникает остро в первые несколько дней после родов. Может
начинаться с анорексии, диспепсических расстройств, судорог.
Развивается септическое состояние, сопровождающееся повыше-
нием температуры тела до 39—40 °C, возникает диссеминирован-
ная герпетическая сыпь на коже, слизистых оболочках полости
рта, глаз, глотки, пищевода, легких, конъюнктиве; в патологиче-
ский процесс вовлекаются печень, надпочечники и другие органы.
У детей, перенесших генерализованный герпес, нередко наблюда-
ются нервно-психические осложнения.
Гистопатология. В эпидермальных клетках вследствие
488
дистрофических изменений в глубоких слоях эпидермиса образу-
ются однополостные эпидермальные пузырьки. В верхних слоях
эпидермиса обнаруживаются участки баллонирующей дегенерации,
многокамерные пузырьки. В очагах поражения, вызванных ВПГ,
характерно образование в баллонирующих клетках внутриядерных
включений, которые в своей ранней стадии диффузные, базофиль-
ные (они заполняют центр ядра), а позднее становятся эозино-
фильными, более плотными и отделяются от ядерной мембраны
неокрашенным светлым венчиком.
В дерме — воспалительные реакции с вовлечением сосудов,
стенки которых инфильтрированы нейтрофильными гранулоцитами;
периваскулярные инфильтраты состоят из лимфоцитов и нейтро-
фильных гранулоцитов.
Диагноз простого герпеса в большинстве случаев основывается
на клинических данных, анамнезе болезни. В трудных случаях
прибегают к лабораторной диагностике герпеса — обнаружение
морфологических изменений в инфицированных клетках, наличие
вирусного антигена, изоляция вируса, серологические методы
идентификации и определение титра герпес-вирусных антител
[Felman J., Nikitas J., 1979]. Довольно информативны диагности-
ческие тесты, проводимые в первые 5 дней высыпаний: изоляция
вируса, непрямое иммунофлюоресцентное исследование и соскобы
по Тцанку [Veien N., Vestergard В., 1978]. Диагноз рецидивирую-
щего простого герпеса не представляет затруднений.
Дифференциальный диагноз. Герпетиформную экзему Капоши
следует прежде всего отличать от стрептококкового и стрептоста-
филококкового импетиго.
В отличие от герпетиформной экземы при импетиго общее
состояние ухудшается редко, температурная реакция нестойкая,
отсутствуют пупковидные западения в центре элементов, гнойные
серовато-желтые рыхло сидящие, а не массивные геморрагические
корки.
Лечение рецидивирующего герпеса остается трудным и не
всегда эффективным. При рецидивирующем герпесе, в первую оче-
редь при его генитальной разновидности, успеха можно добиться,
если придерживаться определенной тактики [Баринский И. Ф.
и др., 1986]. Она заключается в использовании на разных этапах
болезни комплексного этиологического и патогенетического лече-
ния, которое должно быть направлено как на угнетение возбуди-
теля инфекции, так и на повышение иммунной реактивности
организма. При выборе лечения следует учитывать стадию заболе-
вания: при рецидиве рекомендуются интерферон, противовирус-
ные химиопрепараты, коревой иммуноглобулин, левамизол, аскор-
биновая кислота, дезоксирибонуклеаза, аппликации раствором
сульфата цинка и др., в межрецидивный период — герпетическая
вакцина, полиомиелитная вакцина, пирогенал.
Этиологическую направленность имеют противовирусные хи-
миопрепараты, которые более эффективны при применении в пер-
вые часы и дни появления высыпаний. Среди них отечественный
489
препарат бонафатон применяется внутрь по 150 мг в сутки в
течение 5—7 дней при рецидивах. Одновременно с таблетирован-
ной формой можно назначать бонафатоновую 0,5 % мазь. Она
наносится на очаги поражения открытым способом, начиная с
появления первых признаков рецидива, и легко втирается в кожу
2—3 раза в день в течение 5—7 дней. У отдельных больных
наблюдаются побочные явления — недомогание, жидкий стул,
дерматит.
Эффективен ацикловир, отличающийся низкой токсичностью и
селективностью в отношении ВПГ и вируса ветряной оспы —
опоясывающего лишая. Препарат применяется внутривенно, перо-
рально и местно [Gunby Ph., 1983]. Выражен его терапевтический
эффект при герпетиформной экземе Капоши. Ацикловир вво-
дится внутривенно из расчета 20 мг/кг МТ в сутки [Tarieb A. et
al., 1984]. Но он не предотвращает рецидивы ВПГ, инфекцию
новорожденных или заражение половых партнеров [Stary А.,
Soltz-Szots J., 1983]. Лечение больных с рецидивирующим герпе-
сом ацикловиром по 0,2 5 раз в день в течение 5 дней при рециди-
вах сокращает сроки разрешения высыпаний, уменьшает субъек-
тивные ощущения в местах высыпаний. Профилактическое назна-
чение препарата по 0,2 4 раза в день в течение 6—12 нед делает
рецидивы быстротечными и умеренно выраженными [Maubeuge J.
et al., 1984].
Другие химиопрепараты: алпизарин (2 и 5 % линимент), 1 %
риодоксоловая, 1 % оксолиновая, 1 % хелепиновая, 1 % флори-
налевая мази, рибовирин, виразол. При лечении острого герпети-
ческого стоматита у детей эффективна 0,5 % теброфеновая мазь.
Средние сроки эпителизации эрозий составляют 4—5 дней. Лече-
ние 1 % теброфеновой мазью больных острым и рецидивирующим
герпетическим стоматитом и рецидивирующим герпесом губ, лица,
ягодиц, гениталий ускоряет эпителизацию эрозий, прекращает
субъективные ощущения в очагах поражения. Применение
1 % флориналевой мази при лечении герпетического стоматита и
простого герпеса в течение 5—7 дней укорачивает сроки регресси-
рования, уменьшает болезненные ощущения и может предупреж-
дать повторные высыпания.
Ингибирующее действие на ВПГ оказывают интерферон и его
индукторы (3 % линимент госсипола и мегасина), которые нано-
сят на кожу и легко втирают в течение 4—7 дней. В процессе
лечения противовирусные препараты целесообразно чередовать
при каждом рецидиве. Человеческий и свиной лейкоцитарные
интерфероны эффективны при лечении рецидивирующего герпеса
в продромальный период и при появлении первых признаков ре-
цидивов. Мазь наносится на очаги поражения 2—4 раза в день и
легко втирается. Применение интерфероновой мази в межреци-
дивный период удлиняет ремиссии, прерывает развитие рецидивов.
Мегасин, синтетический аналог госсипола, в качестве 3 % мази
при аналогичном применении способствует увеличению ремиссий,
разрешению рецидивов и их абортивному течению. Отмечают ,
j
490
также тенденцию к уменьшению площади очагов поражения и
размера везикул.
Левамизол благоприятно действует у части больных на течение
рецидивирующих форм простого герпеса, сокращая продолжи-
тельность рецидивов и уменьшая болезненность высыпаний. На-
значается препарат по 50—150 мг в первые 3 дня каждой недели
в течение 6 нед. Аналогичное лечение рецидивирующих афт при-
носит кратковременное улучшение [Luderchmidt Ch., 1979].
С целью профилактики рецидивов при часто рецидивирующих
формах герпеса больным, у которых проводимое ранее лечение
малоэффективно, назначают герпетическую вакцину. Противопока-
занием к лечению вакциной служат поражения паренхиматозных
органов, сахарный диабет, гипертоническая болезнь II и III стадии,
декомпенсированная сердечная деятельность, острые инфекции и
аллергические заболевания, беременность.
Препарат вводят в межрецидивный период внутрикожно по
0,3 мл в область сгибательной поверхности одного из предплечий.
Первые 5 инъекций делают через 3—4 дня, последующие 5 доз —
после 2-недельного перерыва (1 раз в 5—7 дней). Эти 10 инъекций
составляют основной курс лечения. Через 3—6 мес после его окон-
чания проводят 1—2 цикла ревакцинации, каждый из 5 инъекций с
интервалом между инъекциями 7—14 дней и между циклами 6—
8 мес. В течение последующих двух лет дополнительно проводят по
1 циклу ревакцинации из 5 инъекций каждые 8—12 мес. В месте
введения препарата спустя 18—24 ч развивается локальная реак-
ция, выражающаяся развитием эритемы диаметром 2—5 см с папу-
лой в центре, сопровождающаяся жжением. Во время вакцинации
может наблюдаться очаговая реакция по типу абортивных рециди-
вов. При этом в лечении делают перерыв на 2—3 дня, затем его про-
должают.
Специфическая вакцинотерапия приводит к увеличению ремис-
сий, сокращению сроков рецидивов, исчезновению субъективных
ощущений.
В целях вторичной профилактики рецидивов генитального герпе-
са обращается внимание на факторы, провоцирующие заболевание.
Важное значение придается санации организма и оздоровительным
мероприятиям в процессе диспансеризации. Обмывание половых ор-
ганов водой с мылом устраняет раздражающее и провоцирующее
воздействие смегмы и уменьшает частоту вторичной инфекции.
Воздержание от половой жизни до полного разрешения герпетиче-
ских высыпаний значительно уменьшает риск заражения полового
партнера.
ОПОЯСЫВАЮЩИЙ ЛИШАЙ (HERPES ZOSTER]
Это вирусное заболевание, характеризующееся поражением
нервной системы и кожи. Чаще наблюдается в весенний и осенний
период; с увеличением возраста протекает тяжелее. Подвержены
заболеванию преимущественно люди в возрасте 40—70 лет, мужчи-
491
ны болеют несколько чаще женщин. У пожилых больных основным
осложнением является постгерпетическая невралгия.
Этиология и патогенез. Заболевание вызывается вирусом Vari-
cella-zoster, который является одновременно и возбудителем ветря-
ной оспы. Принято считать, что ветряная оспа — заболевание дет-
ского, а опоясывающий лишай — болезнь зрелого и старческого
возраста, что определяется реактивностью макроорганизма. Зрелые
вирусные частицы, обнаруживаемые как в цитоплазме, так и вне
клетки, имеют диаметр 150—200 нм.
При морфологическом исследовании содержимого везикул и со-
скобов со дна эрозий, окрашенных по методу Романовского —
Гимзы, обнаруживают гигантские клетки и эозинофильные внутри-
ядерные включения.
Развитие опоясывающего лишая является результатом реактива-
ции латентного вируса, находящегося в организме после перенесен-
ной в детстве ветряной оспы. Причинами этого могут быть различ-
ные эндогенные и экзогенные факторы, снижающие сопротивление
организма: соматические заболевания, инфекции, переохлаждение,
лучевое воздействие и др.
Клиника. Поражению кожи нередко предшествуют продро-
мальные явления, характерные для общего инфекционного заболе-
вания, — повышение температуры тела, чувство недомогания, общая
слабость, головная боль, нередко с тошнотой и рвотой. Параллельно
с этим развивается чаще односторонняя невралгия определенной
зоны иннервации. Продолжительность инкубационного периода не
установлена. Клиническая картина заболевания отличается выра-
женным полиморфизмом. В течение первых суток после возникно-
вения невралгии на гиперемированной и несколько отечной коже по
ходу чувствительного Яерва и его ветвей появляются единичные
везикулы.
Локализация поражений может быть самая разнообразная. Вы-
сыпания располагаются на любом участке кожного покрова и сли-
зистых оболочек: на туловище в зоне межреберных нервов, на конеч-
ностях, по ходу ветвей тройничного нерва, на голове, лице и т. д.
Они, как правило, носят односторонний характер. Эритематозные
пятнисто-папулезные бляшки имеют полосовидное расположение
(рис. 107). Вскоре содержимое появившихся везикул мутнеет, обра-
зуются пустулы, а после их разрушения — эрозии и корки. Часто
процесс на коже заканчивается в течение 1—3 нед, проявляясь отеч-
ными эритематозными и папулезными высыпаниями (абортивная
форма заболевания).
В тяжелых случаях образуются язвенные и язвенно-некротиче-
ские поражения, покрываются плотными корками. Разрешение вы-
сыпаний наступает в сроки 1 —1'/2 мес [Каламкарян А. А., Кочет-
ков В. Д., 1973].
У небольшой части (2—4 % больных) опоясывающий лишай
вначале протекает как локализованная форма, но в дальнейшем про-
цесс на коже приобретает диссеминированный характер (генерали-
зованная форма). При этом отмечаются увеличение размеров регио-;
492
нарных лимфатических узлов, их болезненность. Распространенные
варицеллоподобные высыпания не сопровождаются сильными боля-
ми, которые часто возникают по ходу пораженного нерва.
Генерализованная форма опоясывающего лишая обычно возни-
кает у лиц с тяжелыми сопутствующими заболеваниями: лимфолей-
козом, лимфомой, злокачественными новообразованиями внутрен-
них органов, а также у больных, получающих иммуносупрессивные
препараты: цитостатики, кортикостероиды, рентенотерапию и др.
Наиболее тяжелая форма зостера — гангренозная, наблюдается
у ослабленных и пожилых больных, страдающих сопутствующими
заболеваниями — сахарным диабетом, язвенной болезнью желудка
и др. Эта форма характеризуется возникновением пузырьков с ге-
моррагическим содержимым и развитием долго незаживающих
глубоких гангренозных язв, оставляющих после себя рубцы.
Болевой синдром, связанный с вовлечением в патологический
процесс симпатической нервной системы, является характерной
клинической особенностью опоясывающего лишая, что в определен-
ной степени обусловлено нейротропностью вируса. Невралгические
парестетические симптомы, патоморфологическую основу которых
составляет поражение того или иного ганглия, нередко возникают в
продромальном периоде, сопутствуют в дальнейшем поражению ко-
жи, слизистых оболочек и нередко остаются длительное время после
разрешения высыпаний.
Боли тупые, стреляющие или жгучие различной продолжитель-
ности могут быть локализованными в области вовлечения в процесс
ганглиев или распространенными. Интенсивность и длительность
болевого синдрома в некоторой степени зависят от возраста боль-
ных, а также от наличия сопутствующих заболеваний. Постгерпес-
зостерная симпаталгия обычно начинается с болей в местах разре-
шения пузырьковых высыпаний. В дальнейшем она может прояв-
ляться тахикардией, склонностью к спазмам гладкой мускулатуры
кишечника, желчных путей, коронарных сосудов. Наблюдающаяся
разнообразная неврологическая симптоматика обусловлена вовлече-
нием в патологический процесс различных структур центральной и
периферической нервной системы, черепных нервов и их ган-
глиев, а также многочисленных образований вегетативной нерв-
ной системы. При ганглионитах грудных и поясничных узлов обычно
поражаются пограничные симпатические узлы и чревные нервы,
солнечное сплетение, что приводит к дисфункции желудочно-кишеч-
ного тракта, задержке мочеиспускания и другим расстройствам.
Резкими стреляющими болями по ходу высыпаний отличается
офтальмологическая разновидность опоясывающего лишая. Она ха-
рактеризуется клиническим многообразием и тяжестью, что опреде-
ляется анатомическими особенностями глазной ветви тройничного
нерва. Кроме кожи, первая ветвь тройничного нерва иннервирует
глазное яблоко, слизистые оболочки верхней части носовой полости,
лобной и решетчатой пазухи.
При опоясывающем глазном герпесе довольно часто патологиче-
ский процесс с кожи переходит на глаз, поражая роговицу, конъ-
493
юнктиву, склеру, радужную оболочку, цилиарное тело. Клиническая
картина характеризуется светобоязнью, блефароспазмом, слезоте-
чением, болями и рядом других симптомов. Возникновение синдрома
Бернара — Хорнера (энофтальм, миоз, сужение глазной щели)
связывают с поражением цилиоспинального центра. Возникающие
первоначально по ходу глазного нерва боли в дальнейшем распро-
страняются по всему лицу, шее и волосистой части головы. Подобная
локализация невралгии объясняется сопутствующими опоясываю-
щему лишаю явлениями верхнешейного ганглионита и шейного
симпатического трункулита.
Вирус — варицеллазостер, проникая из глаза в субарахноидаль-
ные пространства и различные образования головного мозга, может
вызывать картину менингоэнцефалита. При этом наряду с головной
болью, тошнотой, рвотой, симптомом Кернига — Брудзинского
отмечается рассеянная микроорганическая симптоматика.
Поражение клеток коленчатого ганглия характеризуется три-
адой Хунта — парез лицевого нерва, боли в ухе и пузырьковые
высыпания по ходу пораженного нерва. При поражении узлов блуж-
дающего и языкоглоточного нервов наблюдаются односторонние
герпетические высыпания на слизистых оболочках твердого и мягко-
го неба, зева, задней трети языка и глотки. Покрышки пузырьков
быстро разрываются, при этом образуются мелкие болезненные
эрозии с микрофестончатыми краями. Нередко наблюдается
конъюнктивит, реже — менингеальные явления, вероятно, являю-
щиеся следствием распространения воспалительного процесса по
ходу арнольдова нерва, иннервирующего мозговые оболочки.
Герпесзостерное воспаление мозга и мозговых оболочек отлича-
ется тяжелым продолжительным течением. У большинства таких
больных отмечаются также разнообразные вегетативные расстрой-
ства: повышенная потливость, слюнотечение, тошнота и рвота, тахи- :
кардия, лабильность пульса и пр. ;
В ряде случаев у больных опоясывающим лишаем вдали от ос-;
новного очага поражения наблюдаются единичные блуждающие^
(аберрирующие) пузырьки, реже — пузыри величиной с грецкий
орех. При тяжелых сопутствующих заболеваниях могут развиться-
геморрагические пузыри, при подсыхании которых образуются тем-j
но-коричневые кровянистые корки.
Г истопатология. Патоморфологические изменения ко-1
жи при опоясывающем герпесе напоминают таковые при простом
герпесе; внутриклеточный и межклеточный отек в эпидермисе с об-
разованием пузырьков в верхних отделах росткового слоя, балони-^
рующая дегенерация и дистрофия цитоплазмы клеток, наличие ги-
гантских клеток, содержащих по нескольку ядер и ядер с эозино-
фильными включениями. В дерме обнаруживается слабовыраженная.
инфильтрация нейтрофильными гранулоцитами, которые имеют тен-1
денцию к миграции в эпидермис. Аналогичные поражения обнару-^
живаются в клетках различных структур головного, спинного мозга,
а также в печени, селезенке, надпочечниках при генерализованном,
опоясывающем лишае. 1
Обычно выраженных изменений в анализах крови и мочи не
наблюдается, кроме сдвига лейкоцитарной формулы влево (6—
34 % палочкоядерных лейкоцитов).
Диагноз опоясывающего лишая труден в продромальном пери-
оде. В общемедицинской практике ранние проявления герпеса
зостера ошибочно расцениваются как буллезная форма рожистого
воспаления, грипп, гепатохолецистит, пищевая интоксикация и дру-
гие болезни. В отличие от опоясывающего лишая рожа характеризу-
ется более яркой краснотой, большей отграниченностью отека от
здоровой кожи, валикообразными, неровными краями. При этом
очаги поражения сплошные, кожа более плотная и высыпания рас-
полагаются не по ходу нервов.
Начальные и абортивные проявления опоясывающего лишая,
когда отсутствуют пузырьковые высыпания и на первый план высту-
пают болевой синдром, также представляют определенные диагно-
стические трудности. Нередко подобные случаи при локализации в
переднелевой части грудной клетки следует дифференцировать от
стенокардии, в связи с чем больным необходимо проводить ЭКГ.
Единственным критерием различия опоясывающего лишая от зосте-
риформного простого герпеса, клинически мало отличимого, явля-
ются данные вирусологического обследования.
Лечение. Учитывая этиологию, сложные патогенетические меха-
низмы, характер поражения кожи, нервной системы и других орга-
нов и тканей, лечение опоясывающего лишая должно быть комплек-
сным. В качестве этиотропных средств применяются антибиотики
широкого спектра действия (рондомицин, метациклин, тетрациклин
и др.), которые оказывают определенное вирусстатическое действие
и сдерживают сопутствующую очаговую инфекцию. Их назначают в
течение 7—10 дней. Эффективен метисазон из расчета 20 мг на
1 кг массы тела больного в 3 приема после еды в течение 6—7 дней
[Беляев Н. В. и др., 1984].
Патогенетическую основу герпесзостерных невралгий составля-
ют набухание нервных стволов и ущемление их в узких костных про-
странствах. С целью устранения отека нервов назначают салицилаты
(аспирин, натрий салициловый по 0,5 г 1 — 3 раза в день), диакарб,
гипертонический раствор глюкозы (40 %, 20 мл), сернокислую маг-
незию (25 %, 5—12 мл). Своевременное проведение дегидратацион-
ной терапии уже в первые сутки, а иногда и часы снимает острый бо-
левой синдром, способствует более быстрому купированию воспали-
тельного процесса или развитию абортивных форм заболевания без
последующего осложнения постгерпесзостерной невралгией, а так-
же предупреждает ущемление нервных стволов в костных каналах
позвоночника и черепа.
В ранние сроки заболевания применяют курантил (коррекция
микроциркуляторных нарушений и внутрисосудистой коагуляции)
по 0,025—0,05 г 3 раза в день в течение 5—7 дней [ШишовА. С.,
Уманский К. Т., 1981].
В целях купирования симптомов симпатальгии назначают ган-
глиоблокаторы — ганглерон по 1 мл внутримышечно (6—8 инъек-
ций), пахикарпин по 0,05 г 3 раза в день.
Обезболивающий эффект оказывают новокаиновая блокада,
электрофорез с новокаином по ходу распространения болей, аналь-
гетики. Для уменьшения раздражения симпатических узлов погра-
ничного ствола проводятся 6—10 сеансов диатермии (сила тока
1 ‘/э—1 ‘/г А, продолжительность до 20 мин). Для стимуляции за-
щитных сил организма и повышения его сопротивляемости приме-
няются также иммуноглобулин, витамины (В| 6 % — 1,0—2,0
№ 15; В|2 500 мкг № 10—15; аскорбиновая кислота 0,3—0,5),
биогенные стимуляторы (ФИБС, спленин, стекловидное тело),
адаптогены (препараты женьшеня, элеутерококка, аралии манч-
журской).
При генерализованной и гангренозной формах опоясывающего
лишая, развивающихся у соматически отягощенных лиц пожилого
возраста, показано применение иммуноглобулина, противокоревого
у-глобулина (по 3 мл внутримышечно 3 дня, № 6—10).
При поражении глаза (иридоциклит, кератит и др.) и явлениях
менингоэнцефалита назначается 40 % раствор уротропина по 5—
10 мл внутривенно ежедневно (5—8 инъекций), обладающего про-
тивовирусным и противовоспалительным действием.
Наружное лечение включает противовирусные, антимикробные
и кератопластические средства: анилиновые краски, фукорцин,
раствор бриллиантовой зелени, интерфероновую, гелиомициновую
мази, синтомициновую эмульсию; при некротической и гангреноз-
ной формах заболевания — кортикостероидные мази.
В отдельных случаях на заключительном этапе лечения боль-
ным рекомендуются различные виды курортной терапии — грязе-
лечение, сероводородные и радоновые ванны.
В процессе обследования и лечения больных опоясывающим
лишаем, особенно у лиц пожилого возраста при упорном течении
заболевания и при выраженной невралгической симптоматике,
обязательно всестороннее обследование у терапевта, невропатоло-
га, других специалистов на предмет выявления онкологического
заболевания.
БОРОДАВКИ (VERRUCAE)
Различают несколько их клинических разновидностей: обычные
(вульгарные) бородавки, плоские (юношеские), подошвенные, ни-
тевидные, остроконечные кондиломы.
Этиология. Возбудитель бородавки ДНК-содержащий вирус,
представитель группы паповавируса, передается при прямом и не-
прямом контакте.
Типы папилломавируса человека четко различаются по после-
довательности нуклеотидов и антигенности капсидов. Эти различия
коррелируют с наличием различных типов бородавок: ПВЧ, тип 1,
вызывает подошвенные бородавки, ПВЧ, тип 2, — обычные боро-
давки, ПВЧ, тип 3, — плоские, ПВЧ, тип 4, — верруциформную
эпидермодисплазию. Предполагают, что пятый тип ПВЧ индуциру-
ет остроконечные кондиломы. У больных бородавками специфиче-
496
ские противовирусные антитела, по данным разных авторов, выяв~
ляются в 21—66 % случаев [Krogh G., 1982; Pfister Н., Haneke Е
1984].
В формировании резистентности к бородавкам важное значе-
ние имеет клеточный иммунитет. Так, бородавки часто появляются
при иммуносупрессивной терапии и у лиц с дефектами клеточного
иммунитета [Krogh G., 1982].
Обычные (вульгарные) бородавки представляют
собой ограниченные безболезненные гиперкератотические папулы
различного размера (от булавочной головки до крупных конгломе-
ратных образований). Обычно они располагаются на кистях
(рис. 108) и пальцах у детей и юношей, но могут встречаться в
любом возрасте. Обычно бородавки на пальцах, приобретая круп-
ные размеры, легко травмируются, кровоточат, инфицируются, а в
отдельных случаях могут привести к развитию карциномы.
Часто дочерние бородавки возникают вокруг первичного эле-
мента сыпи, могут раполагаться вокруг ногтей, а также под ног-
тями. Подногтевые бородавки деформируют ногти. Последние ста-
новятся плотными и болезненными.
Бородавки плоские (юношеские) чаще распола-
гаются на лице, груди, шее и тыльной поверхности кистей у детей,
юношей и молодых людей. Эти дискретные поражения почти всег-
да множественные, слегка возвышающиеся, с гладкой поверх-
ностью, округлые или полигональной формы папулы различного
размера от булавочной головки до небольшой горошины (рис. 109).
Они часто линейно сгруппированы и большими гроздьями иногда
поражают обширные поверхности. Цвет их телесный или слегка
желтоватый. При рассмотрении бородавок через увеличительное
стекло обнаруживается типичная зернистость.
Состояние, известное как верруциформная эпидер-
модисплазия Левандовского — Лютца, является ге-
нерализованной вирусной инфекцией, обусловлено вирусом папил-
ломы человека, характеризуется высыпанием плоских бородавок,
которые могут сливаться, приобретая характер крупных бляшек на
кистях или стопах. Заболевание часто семейное и рассматривается
как генодерматоз предположительно аутосомно-рецессивного ха-
рактера. Этот редкий вариант имеет тенденцию к злокачественно-
му перерождению. Поэтому больные данным дерматозом должны
быть более тщательно обследованы и находиться под диспансер-
ным наблюдением [Каламкарян А. А., Самсонов В. А., 1977].
Клиническая картина и течение верруциформной эпидермо-
дисплазии варьирует в зависимости от типа папиллома-вируса
человека. Тип 3 ПВЧ находят при долго существующих плоских
бородавках. Для инфекции, вызванной типом 4 ПВЧ, характерны
плоская красноватая веррукоподобная сыпь, бляшки красного цве-
та, красновато-коричневые и депигментные пятна [Jablonska S.
et al., 1979]. Дифференциальную диагностику проводят с красным
плоским лишаем, акрокератозом верруциформным Гопфа, бо-
лезнью Дарье.
Бородавки нитевидные характеризуются удлинен-
ными нежными остроконечными частично ороговевающими отро-
стками, которые обычно располагаются на лице в области подбо-
родка, на веках, вокруг ноздрей и рта. Иногда они появляются на
шее и реже на туловище, конечностях и в подмышечной области.
Нитевидные бородавки могут ороговевать, но они никогда не ста-
новятся такими плотными, как кожный рог.
Подошвенные бородавки — плоские твердые гипер-
кератотические разрастания, единичные или множественные. В не-
которых случаях группа поражений образует «мозаику» подош-
венных бородавок, затрудняющих ходьбу, особенно когда они рас-
полагаются на местах давления, в области пятки, подушечки плюс-
невой кости. Эти бородавки встречаются во всех возрастных груп-
пах, но чаще бывают у юношей.
При тщательном исследовании обнаруживается точечная по-
верхность подошвенных бородавок. Края их четко отграничены
от окружающей нормальной кожи. Подошвенные бородавки имеют
коническую структуру с верхушкой конуса, направленного внутрь,
и широкое основание на поверхности кожи. Эта особенная конфи-
гурация связана с быстрым ростом бородавки в результате посто-
янного давления при ходьбе.
Дифференцированный диагноз подошвенной бородавки следует
проводить с подошвенными мозолями. Последние имеют выражен-
ный кожный рисунок, кожные гребни, которые пересекают центр
мозоли, что не наблюдается при подошвенных бородавках. При
срезывании подошвенных бородавок обнаруживается черно-точеч-
ная поверхность, которая отсутствует при мозолях. Подошвенные
бородавки чувствительны к давлению. Сжатие их между пальцами
вызывает сильную боль, в то время как мозоли обычно безболез-
ненны или малоболезненны.
Гистопатология. Гистопатологическая картина борода-
вок включает четко ограниченную локализированную гиперплазию
эпителия. Слой базальных клеток остается интактным. Клетки
мальпигиева слоя с заметным акантозом. Зернистый слой значи-
тельно утолщен, как и роговой слой. Дермальные сосочки, тонкие
и продолговатые, содержат кровеносные сосуды. Эти сосуды кро-
воточат, когда бородавку срезают, и при тромбировании напомина-
ют темные точки. Шиповидные клетки претерпевают «балонирую-
щую дегенерацию» и напоминают «птичий глаз». Цитоплазма их
становится отечной, ядра удлиняются и наполняются включениями
(они Фельген-положительные, окрашиваются толуидиновым си-
ним). При электронно-микроскопическом исследовании выявляет-
ся, что ядра наполнены вирусными частицами.
Лечение. Бородавки без лечения могут существовать неопреде-
ленно долго, но иногда они регрессируют спонтанно, не оставляя
рубцов. Подошвенные бородавки без лечения склонны увеличи-
ваться в размере и в количестве.
При лечении бородавок используются различные виды терапии.
У части больных эффективна гипнотерапия. Применяют цито-
498
токсические препараты — подофиллин, 5-фторурацил; деструктив-
ное лечение с помощью физических и химических средств: кюре-
таж, криотерапия, электрокоагуляция [Felman Y., Nikitas J., 1979].
Эффективно срезание бородавки острым ножом с последующей
аппликацией каустического (прижигающего) вещества: 50 % насы-
щенные растворы однохлоруксусной или трихлоруксусной кисло-
ты. Особенно трудно лечить околоногтевые бородавки. Не следует
разрушать или уничтожать ногтевое ложе и матрикс, что приводит
к стойкой деформации. Проводится осторожная электрокаутери-
зация.
При подошвенных бородавках важно следить, 'чтобы на подош-
ве не образовалась фиброма, которая часто возникает после диа-
термокоагуляции бородавок, особенно в местах костных выступов.
Кератолитическое действие 40 % салициловой кислоты под лейко-
пластырь еженедельно смягчает бородавки и облегчает процедуру
их срезания с последующим нанесением 50 % растворов одно-
хлоруксусной или трихлоруксусной кислоты. Хотя этот метод
требует повторного лечения, но он предотвращает развитие болез-
ненных остаточных рубцов. Часто полезны резиновые кольца, за-
крепленные лейкопластырем вокруг бородавки: они уменьшают
давление и боль при ходьбе во время лечения.
Наиболее эффективны еженедельные аппликации 25 % раство-
ром подофиллина. Через 4 ч после аппликации больному следует
обмыть обработанный участок, а при перианальных кондиломах
рекомендуется сидячая ванна.
Плоские бородавки обычно трудны для лечения, так как пора-
жения часто многочисленные. Еженедельные аппликации 30 %
раствора трихлоруксусной кислоты, 5 % мази аммонийной ртути,
раствора. Флеминга могут быть полезны при длительном их ис-
пользовании. Лечение должно быть мягким и нетравмирующим из
косметических соображений. Эффективно лечение бородавок на
руках и ногах углекислым лазером (1—3 сеанса).
Бородавки после хирургического удаления или диатермокоагу-
ляции могут рецидивировать на прежнем месте.
ОСТРОКОНЕЧНЫЕ КОНДИЛОМЫ
(CONDILOMA ACAIMINATAE)
Син.: бородавки остроконечные, влажные бородавки, венерические бородавки,
генитальные бородавки
Опухолеподобные образования, обычно возникающие в возрас-
те 20—40 лет, могут наблюдаться и у детей. Часто располагаются
на влажных местах, особенно при переходе слизистой оболочки в
кожу (гениталии, слизистая уретры и прямой кишки, перианаль-
ная область, слизистая полости рта, конъюнктива), а также меж-
пальцевых складках. Остроконечные кондиломы обычно множе-
ственные и, сливаясь, могут образовывать очаги поражения, напо-
минающие цветную капусту. При распространении со слизистой
499
на кожу ОК не отличаются от обычных бородавок, потому что
приобретают роговую поверхность.
Этиология. Возбудитель заболевания вирус папилломы чело-
века.
Генитальные кондиломы вызываются человеческим папиллома-
вирусом VI и XI типа. Вирус папилломы, ДНК-содержащий вирус,
с которым связывают возможность возникновения рака гениталий:
болезнь Бовена, цервикальной дисплазии и карциномы шейки мат-
ки [Beilina J., 1983; Fenenczy А., 1984; Gross G. et al., 1985].
Вирус передается путем прямого, преимущественно полового,
контакта. Однако инфицирование человека после контакта с боль-
ным наступает далеко не всегда, что объясняется повышенной
сопротивляемостью организма к этой инфекции. О довольно выра-
женной противовирусной резистентности к вирусу ОК свидетель-
ствует также длительный инкубационный период — от 1 до 9 мес.
Факторами, предрасполагающими к возникновению остроконеч-
ных кондилом, являются иммунодефицитные состояния организма,
влажность и мацерация кожи, ее повреждение, выделения из урет-
ры и вагины при гонорее, трихомониазе и др. и плохой гигиени-
ческий уход за анально-генитальной областью.
Клиника. Излюбленным местом поражения является об-
ласть наружных половых органов и заднего прохода (рис. ПО).
В редких случаях высыпания располагаются в углах рта, на крас-
ной кайме губ (рис. 111), на веках, конъюнктиве глаз, в межпаль-
цевых складках. У мужчин высыпания располагаются преимуще-
ственно в области заголовочной бороздки, уздечки, наружного
отверстия мочеиспускательного канала, края и внутреннего листка
препуциального мешка, головки полового члена, реже — прилежа-
щей к гениталиям бедренно-мошоночной складки и области ануса.
У женщин поражения локализуются главным образом вокруг вхо-
да во влагалище, на малых половых губах, клиторе и внутренней
поверхности больших половых губ, а также вокруг ануса. Поража-
ются также паховые, межъягодичные складки, крайне редко —
другие участки тела.
Заболевание начинается с единичных мельчайших узелков ро-
зоватой или серовато-красной окраски. Постепенно число элемен-
тов увеличивается. Возникающие множественные сосочковые вы-
сыпания разрастаются, сливаясь между собой. Образующиеся об-
ширные вегетации принимают формы петушиного гребня или цвет-
ной капусты. У остроконечных кондилом суженное в виде ножки
основание и дольчатое строение, что легко обнаруживается с
помощью зонда. Раздвигая дольки, можно определить, что они
отделены друг от друга на различную глубину и имеют мягкую
консистенцию. Окружающая кожа может быть внешне не изме-
ненной или при постоянном механическом раздражении быть вос-
паленной, приобретает ярко-красную окраску и мокнущую поверх-
ность. Иногда, обычно у неопрятных больных, остроконечные кон-
диломы могут достигать больших размеров, превращаясь в розово-
красные дольчатые образования, напоминающие опухоль.
500
При отсутствии надлежащего ухода остроконечные кондиломы
мацерируются, при этом отделяется гной с неприятным запахом;
сосочковые образования могут эрозироваться и даже изъязв-
ляться.
Остроконечные кондиломы аногенитальной области часто реци-
дивируют после хирургического иссечения или лазерного разруше-
ния, что связывают с латентными папиллома-вирусами, располага-
ющимися на границе с нормальной кожей в зоне около 15 мм.
Г истопатология. Патогистологически структура ОК ана-
логична обычной бородавке, но папилломатоз и акантоз выражены
гораздо резче; картина может напоминать псевдоэпителиоматоз-
ную гиперплазию с многочисленными митозами. Роговой слой
истончен или обычной толщины с участками паракератоза. Клетки
эпидермиса вакуолизированы, их ядра пикнотичны. В дерме —
резко выраженный отек, капилляры расширены, очаговая или диф-
фузная инфильтрация преимущественно лимфоидными клетками, с
примесью плазмоцитов. В сосочках — расширение кровеносных и
лимфатических сосудов и хронический воспалительный инфиль-
трат. При присоединении вторичной инфекции в составе инфиль-
трата много полинуклеаров.
Диагноз не вызывает затруднений.
Дифференциальный диагноз. Остроконечные кондиломы внеш-
не могут напоминать широкие кондиломы при вторичном рецидив-
ном сифилисе. В отличие от ОК широкие кондиломы медно-крас-
ного цвета располагаются на широком инфильтрированном основа-
нии, у них отсутствует дольчатость. Кроме этого, в отделяемом
широких кондилом в большом количестве обнаруживаются блед-
ные трепонемы, что не наблюдается при ОК. При наличии аноге-
нитальных ОК всегда нужно исключить злокачественные новооб-
разования.
Лечение ОК хирургическое (иссечение) и консервативное (на-
ружное). Оно проводится у дерматолога, уролога, хирурга, гинеко-
лога. При ОК небольших размеров полезны присыпки из резорци-
на пополам с дерматолом, эффективен 20 % спиртовой раствор
подофиллина, который наносят на каждый элемент.
Лечебные мероприятия при более крупных образованиях за-
ключаются в хирургическом удалении кондилом острой ложкой
или с помощью электрокоагуляции или криотерапии с последующим
прижиганием раневой поверхности палочкой ляписа. В отдельных
случаях требуется более широкое хирургическое лечение, вплоть
до иссечения крайней плоти при расположении на ней множе-
ственных крупных кондилом, не поддающихся консервативной
терапии.
Вместе с этим возможно спонтанное исчезновение сосочковых
разрастаний через несколько месяцев после их появления. Это
встречается у беременных, что, вероятно, обусловлено гормональ-
ной перестройкой организма. Иногда эффективна психотерапия.
Наружно может быть использована 0,5 % омаиновая (колхами-
новая) мазь, подофиллин (0,5, 1, 10 или 25%), 5-флюоурацил и
501
противовирусные химиопрепараты: риодоксоловая, бонафтоновая,
оксолиновая мази.
У части больных эффективно пероральное применение декари-
са (левамизола) по 0,05—0,15 1 раз в день 3-дневным циклом с
4-дневными перерывами (на курс лечения 5—6 циклов).
В тяжелых случаях и при рецидивах заболевания целесообраз-
но комбинировать хирургический и консервативный метод
[Krogh G., 1982; CapJ. et al., 1984]. Эффективен карбондиоксид-
ный лазер, позволяющий получить терапевтический эффект у 97 %
больных при длительности наблюдения до 1 года [Beilina J.,
1983].
Недопустимо бесконтрольное самостоятельное лечение ОК без
наблюдения врача.
Профилактика заключается в гигиеническом уходе за анально-
генитальной областью.
КОНТАГИОЗНЫЙ МОЛЛЮСК
(MOLLUSCUM CONTAGIOSUM)
Син.: эпителиальный моллюск, бородавчатый моллюск, заразная эпителиома
Это доброкачественное вирусное заболевание, характеризую-
щееся высыпанием на коже и слизистых оболочках полушаровид-
ных узелков величиной от булавочной головки до горошины с
центральным пупковидным углублением.
Заболевание впервые описано в 1817 г. (Beterman), а его ин-
фекционная природа доказана в 1841 г. (Paterson).
Этиология. Возбудитель заболевания — ДНК-содержащий ви-
рус группы оспы, размножается в цитоплазме инфицированных
клеток [Juliusberg М., 1905].
Человек, по-видимому, является единственным естественным
хозяином этого вируса. Инфекция передается при непосредствен-
ном контакте с больным, через инфицированные предметы обихо-
да, ванну, при пользовании одним полотенцем, мочалкой. Зарази-
тельный моллюск встречается в любом возрасте, но чаще им боле-
ют дети; в детских коллективах иногда наблюдаются эпидемиче-
ские вспышки. У взрослых при локализации высыпаний на гени-
талиях возможен половой путь передачи.
Клиника. Инкубационный период от 2 нед до 2—6 мес.
Начинается заболевание высыпанием округлых полусферических
или уплощенных узелков величиной с булавочную головку. Папулы
матово-беловатого, восковидного телесного или желтовато-розо-
вого цвета с полупросвечивающимся оттенком на фоне нормальной
кожи, плотной консистенции медленно увеличиваются в размере,
достигая в среднем величины горошины. Поверхность элементов
гладкая; в центре ее имеется пупковидное углубление, из которого
при надавливании с боков легко выделяется крошковатая масса
беловатого цвета, состоящая из эпидермальных ороговевших кле-
ток, жира и моллюсковых телец. Обычно высыпания множествен-
502
ные; узелки располагаются небольшими группами или диссемини-
рованно. Описаны генерализованные формы заболевания. Воз-
можно слияние элементов с образованием гигантских моллюс-
ков размером 2—3 см. Субъективные ощущения обычно отсут-
ствуют.
Атипичные формы контагиозного моллюска: ороговевающие,
гигантские, кистозные и изъязвленные, фурункуло-, милиа-, акне-
и бородавкоподобные.
Излюбленная локализация: лицо (лоб, нос, веки), шея, грудь,
тыл кистей, наружные половые органы, промежность, внутренняя
поверхность бедер. Ладони и подошвы поражаются крайне редко.
Высыпания могут существовать несколько месяцев и даже лет.
Элементы больших размеров легко травмируются и инфицируются
микробами, что может приводить к разрешению поражений без по-
следующей терапии. В нелеченых случаях высыпания могут исче-
зать спонтанно, не оставляя рубцов.
Присутствие вируса в инфицированных клетках обусловливает
наличие циркулирующих в крови антител к этому антигену, что
определяется иммунофлюоресцентным методом.
Большинство взрослых резистентны к заболеванию [Doug-
las R., 1979]. Распространенные поражения встречаются у лиц с
иммунными нарушениями.
Гистопатология. Патогистологически контагиозный мол-
люск представляет собой инфекционную акантому, состоящую из
грушевидных долек, веерообразно выходящих из центра с пупко-
видным вдавлением. Клетки эпидермиса в них увеличены, много
внутриклеточных Фельген-положительных внутриплазматических
включений (моллюсковые тельца), которые содержат вирусные
частицы. Эти включения, вначале в виде овоидных эозинофильных
структур, увеличиваясь в размере, сдавливают ядра эпидермальных
клеток, отодвигают их к цитоплазматической мембране и приобре-
тают базофильный оттенок. В подлежащей дерме отмечаются не-
большие воспалительные инфильтраты. Моллюсковые тельца обна-
руживаются при окраске по Морозову, Романовскому — Гимзе,
Леффлеру, а также при темнопольном микроскопировании.
Диагноз и дифференциальный диагноз. Контагиозный моллюск
следует отличать от обычных бородавок, ОК, базалиомы, сиринго-
мы, гидроцистомы, кератоакантомы, угревой сыпи. Воспалительные
поражения век (ячмень) также могут напоминать КМ.
Лечение. Наиболее эффективным и простым способом является
удаление каждого элемента в отдельности острой кюреткой.
Можно несколько раз проколоть поверхность очага поражения и
выдавить содержимое, обработав затем очаг нитратом серебра,
фенолом или йодом. Заживление происходит без образования
рубцов. После удаления моллюсков участок кожи, где они распола-
гались, в течение нескольких дней следует протирать камфорным
спиртом.
Профилактика включает соблюдение личной гигиены и сани-
тарно-гигиеническое содержание мест общего пользования. Дети,
503
больные контагиозным моллюском, не допускаются в детские уч-
реждения, плавательные бассейны, на спортплощадки. Они долж-
ны находиться под наблюдением врача до полного излечения.
УЗЕЛКИ ДОИЛЬЩИЦ
Син.: бородавки доильщиц, ложная коровья оспа, паравакциния
Это вирусное инфекционное кожное заболевание, передающее-
ся от инфицированного вымени коров, поражающее руки доиль-
щиц и других работников. Вирус узелков доильщиц отличается
от вируса коровьей оспы и лабораторного штамма вируса вакцинии,
использовавшегося для вакцинации против оспы.
Заболевание встречается во всем мире, где выращивают скот,
у доярок, скотоводов и рабочих боен. Поражения у человека обыч-
но появляются на кистях, запястьях и лице приблизительно через
5—7 дней после контакта с инфицированным животным. Эритема-
тозные зудящие папулы увеличиваются, составляя в среднем 1 см
в диаметре, и становятся возвышенными, плотными красно-си-
нюшной окраски. В дальнейшем центральная часть может приоб-
ретать коричневый или синюшный цвет и становится запавшей.
При проколе может выделяться немного жидкости. В более позд-
ние сроки в центральной части наблюдаются красно-коричневые
папилломатозные вегетации. Большинство этих поражений имеет
тенденцию к уплотнению. Отмечают также лимфангит, местный
лимфаденит и слабый фебрилитет. Диагноз несложен. Важное
значение имеет анамнез.
Дифференциальный диагноз с другими высыпаниями на руках
доярок, клинически аналогичных, но вызываемых различными
агентами, например истинная коровья оспа. Шерсть от коровы мо-
жет попасть на кожу и вызвать воспалительную гранулему ино-
родного тела. Такие поражения, как бородавки, контагиозная
эктима, фурункулы, первичная инокуляция туберкулеза, туляре-
мия, экстрагенитальный сифилитический шанкр, сибирская язва
и споротрихоз, могут быть включены в круг дифференциального
диагноза. Основным осложнением узелков доярок является вто-
ричная инфекция.
Лечение заключается в уходе, применении местных симптома-
тических средств. Поражения разрешаются без лечения в сроки от
5 нед до 10 мес. После инфекции на всю жизнь сохраняется им-
мунитет. Профилактика узелков доярок заключается в изоляции
инфицированных животных, соблюдении правил личной гигиены.
БОЛЕЗНЬ КОШАЧЬИХ ЦАРАПИН
Син.: доброкачественный вирусный лимфаденит, фелиноз, доброкачественный
лимфоретикулез
Заболевание, характеризующееся развитием у людей, поцара-
панных кошками, первичного эффекта на коже с последующим
504
поражением регионарных лимфатических узлов. Самостоятель-
ность нозологической формы данного заболевания была доказана
R. Blattner (1951), а затем W. Spaulding и J. Hennessy (1960).
Этиология. Возбудитель — вирус, относящийся к группе псит-
такоза — венерической лимфогранулемы.
Природным резервуаром инфекции служат грызуны (мыши,
крысы) и птицы, при контакте с которыми кошки инфицируются.
Иногда заражение человека происходит в результате повреждения
кожного покрова перьями птиц, иглами ежа и др., но чаще в ре-
зультате царапин или укуса кошки, собаки. У этих животных
признаки болезней отсутствуют.
Клиника. Заболевание возникает спорадически и наблюда-
ется в любом возрасте, чаще у детей и женщин. На месте цара-
пины или укуса через 3 дня — 2 нед (около 50 % на руках) возни-
кают слегка зудящие эритематозные пятна, папулы, папуловезику-
лы и папулопустулы диаметром около 0,5—1 см, на месте которых
образуются гнойные корки. Сыпь распространяется на верхние ко-
нечности, приобретает диссеминированный характер [J. Maubeuge
et al., 19841. В течение 2—6 нед развивается регионарный лимфа-
денит, иногда с нагноением и повышением температуры тела до
38—39 °C, которая держится от нескольких дней до 2 нед. Иногда
отмечаются недомогание, утомляемость, головные и мышечные бо-
ли, артралгии, кишечные расстройства. В редких случаях в процесс
вовлекается центральная нервная система (энцефалит кошачьих
царапин), что проявляется в судорогах, дыхательном параличе и
коматозном состоянии [Т. Thompson et al., 1953]. Одновременно
появляется наиболее характерный и постоянный симптом —
односторонний регионарный лимфаденит в зависимости от локали-
зации очага поражения на коже. Лимфатический узел увеличен,
болезнен, мягкой консистенции с покраснением кожи над ним.
У 1 /з больных регионарный лимфаденит не сопровождается высы-
паниями на коже. Через несколько недель наступает выздоровле-
ние. В острый период болезни отмечают умеренный лейкоцитоз с
нейтрофильным сдвигом влево в лейкограмме и умеренное повы-
шение СОЭ.
Гистопатология. Первичное поражение развивается в
дерме и представлено очагами некроза, окруженными некробиоти-
чески измененной тканью с гистиоцитами, лимфоцитами, много-
ядерными гигантскими клетками и эозинофилами в примыкающей
строме. Эпидермальные изменения неспецифичны; они выражают-
ся в паракератозе, отеке эпидермиса и экзоцитозе воспалительным
инфильтратом.
В пораженном лимфатическом узле выявляются изменения,
соответствующие первичной стадии ретикулоэндотелиальной ги-
перплазии; затем появляется небольшой фокус гранулематоза,
который прогрессирует до микроабсцессов, окруженных эпителио-
идными клетками и часто гигантскими клетками Лангханса. Эти
абсцессы могут увеличиваться, сливаться, а при их заживлении
может развиться фиброз.
505
Диагноз болезни кошачьих царапин основывается на анамнез
стических данных, наличии регионарного лимфаденита и кошачьих
царапин.
Дифференциальный диагноз следует проводить с венерической
лимфогранулемой, болезнью Ходжкина, туляремией, туберкулез-
ным лимфаденитом, инфекционным мононуклеозом, пиогенным
аденитом, бруцеллезом.
Лечение. Часто заболевание спонтанно разрешается в течение
1 — 2 мес. Рецидивы наблюдают крайне редко. Можно назначать
седативные средства и анальгетики. При выраженной клинической
картине болезни применяют антибиотики (тетрациклин, эритро-
мицин, ампициллин и др.) в течение 6—10 дней. Особенно эффек-
тивны антибиотики на ранних стадиях заболевания, до образова-
ния абсцессов. При аспирации иглой одного или группы узлов
часто обнаруживается гной (стерильный), даже тогда, когда его
наличие кажется маловероятным — уплотнение ткани, отсутствие
флюктуации. Комбинация тетрациклина внутрь с аспирацией иглой
гнойного содержимого 1 раз в 3—6 дней обычно позволяет избежать
хирургического вмешательства и предупреждает образование обе-
зображивающих рубцов. Прогноз благоприятный. Выздоровление
обычно наступает через несколько недель.
Глава 15
ОСОБЕННОСТИ ТЕЧЕНИЯ И ЛЕЧЕНИЯ
ДЕРМАТОЗОВ У НОВОРОЖДЕННЫХ
И В РАННЕМ ДЕТСКОМ ВОЗРАСТЕ
ДЕРМАТОЗЫ НОВОРОЖДЕННЫХ
Физиологический катар кожи, или простая эритема, — особое
состояние, связанное с адаптацией кожи новорожденного ребенка
к внеутробной жизни. Характеризуется гиперемией кожи вслед-
ствие расширения кожных капилляров в связи с воздействием
на организм новорожденного более низкой температурой окружа-
ющей среды, чем при внутриутробной жизни. У недоношенных,
а также у детей, родившихся от матерей, страдающих сахарным
диабетом, эритема выражена значительнее. Эритема держится 2—
3 дня, а затем постепенно бледнеет и появляется отрубевидное
шелушение. Иногда к концу недели шелушение становится плас-
тинчатым и обильным. Это состояние называется Desquamatio
lammelesa, оно продолжается, как и отрубевидное шелушение,
около 2 нед.
Vernix caseosa pellicularis — более тяжелая форма пластинчато-
го шелушения. Характеризуется склеиванием скопившихся чешуек
остатками родовой смазки (Vernix caseosa). При этом все тело,
особенно верхняя часть спины новорожденного, покрывается плот-
ной коркой, состоящей из эпителиальных клеток с вкрапленными
в них первичными волосами — lanugo. Ребенок становится беспо-
койным, плохо спит. Лечение ограничивается двумя — тремя теп-
лыми ваннами при температуре 37 °C с последующим смазывани-
ем кожи детским, ланолиновым или спермацетовым кремом. После
этого корковые наслоения отторгаются и кожа становится элас-
тичной и нежной. Необходимо предостерегать родителей от стрем-
ления к насильственному удалению корок, что может привести к
мацерации и инфицированию кожного покрова новорожденного.
Сальный ихтиоз (Ichthyosis sebacea) или ихтиозоподобная су-
хость кожи, которую иногда трудно отличить от врожденного их-
тиоза. Это особое состояние кожи, возникающее вследствие уси-
ленного выделения быстро засыхающего секрета сальных желез.
При этом кожа новорожденного становится грубой, сухой, бурова-
того цвета; на ее поверхности появляются трещины в пределах
верхних слоев эпидермиса, а затем спустя 6—7 дней возникает
обильное пластинчатое шелушение. Указанные явления быстро
проходят и кожа приобретает нормальный вид.
Лечение состоит из нескольких теплых ванн с последую-
щим смазыванием кожного покрова индифферентным кремом (ла-
нолиновый, детский).
507
Телеангиэктазии являются рудиментарными остатками эмбрио- '
нальных сосудов, наблюдаются у 50 % новорожденных. Они имеют
вид пятен или полос с неровными границами бледно-розового цве-
та, локализующихся в области век, переносицы, надбровных дуг,
верхней губы, затылка. При диаскопии они исчезают, а при плаче
ребенка несколько усиливаются. Телеангиэктазии самостоятельно
исчезают к 1 —1,5 годам жизни ребенка.
Сальные кисты (Milia) появляются в связи с застоем секрета
в сальных железах и возникают с момента рождения у половины
родившихся в срок детей. Элементы имеют вид точечных папул
беловато-перламутрового цвета, локализующихся в области лба,
щек, крыльев носа, носогубных складок, затылка, полового члена.
Спустя 1,5—2 нед высыпания исчезают самопроизвольно. Гистоло-
гически эти элементы являются эпидермальными кистами, содер-
жащими роговые пластинки. Иногда вокруг кист появляются вос-
палительные явления в виде ободка гиперемии, что придает им
вид угрей периода полового созревания, и тогда они называются
эстрогенными угрями новорожденных (Acne neonatorum), так как
в появлении их определенное значение имеют гормоны, переходя-
щие от матери. Такие угри могут держаться несколько месяцев, а
затем постепенно исчезают. Лечение не проводится либо кожу
1 — 2 раза в день протирают 0,5 % салициловым спиртом (50—
40°).
Преходящие отеки. У новорожденных первых дней жизни от-
мечается склонность к отечности всей кожи или отдельных ее ;
участков. Этиология и патогенез преходящих отеков сложны и j
разнообразны. Они рассматриваются как особое состояние — про-
явление «реакции беременности», но могут возникнуть у новорож- <
денного при внутриутробном инфицировании вследствие различ- J
ных патологических изменений со стороны сердечно-сосудистой,^
мочевыделительной системы, при охлаждении и т. д. Поэтому сов- j
местно с педиатром нужно установить причину этих отеков. *
Токсическая (аллергическая) эритема наблюдается у половины ;
новорожденных на второй — пятый день жизни. Этиология и пато-;.i
генез окончательно не установлены. Раньше считали, что это по-’
граничное состояние между нормой и патологией. В последние?
годы установлено, что при токсической эритеме новорожденных!
формируется реакция гиперчувствительности замедленного типаД
Так, А. Г. Шамовой, Р.М. Бахтиаровой (1982) при обследовании^
138 новорожденных с токсической эритемой были выявлены еле- {
дующие факторы, влияющие на формирование аллергической реак-j
ции: наследственная отягощенность — у 50 %, профессиональная ?
вредность у матери — у 20 %, токсикозы беременности — у 10 %, •.
лекарственные препараты — у 5,5 %, злоупотребление матерью .
облигатных пищевых аллергенов — у 1,4 %. По данным Г. Ф. Ели-''
невской и В. А. Мазур (1984), у детей, перенесших токсическую '
эритему, чаще выявляется сенсибилизация к яичному белку, у них;’
повышено содержание иммуноглобулинов М и G. Факторами рис-’
ка в плане возникновения токсической эритемы являются поздние?
508 1
и сочетанные токсикозы беременных, эндокринопатии, повторные
беременности. Предлагается новорожденных, перенесших токси-
ческую эритему, относить к группе риска формирования в даль-
нейшем аллергических заболеваний.
Первыми признаками заболевания являются красные или кир-
пично-красные пятна различной величины, плоские или незначи-
тельно возвышающиеся над уровнем кожи. Они множественные,
расположенные близко друг от друга, иногда сливаются, но не ше-
лушатся и не сопровождаются зудом. Определенной локализации
нет, но чаще они появляются на туловище, конечностях, на лице,
волосистой части головы. Ладони и подошвы не поражаются. Не-
редко среди пятен появляются волдыри, папулы, везикулы,
реже — пустулы. Эритемо-папулезная форма имеет склонность к
слиянию элементов и образованию обширных очагов поражения на
щеках, спине, ягодицах. При интенсивном развитии сыпи лицо ка-
жется пятнистым, как при кори. Такое сходство особенно значи-
тельно, если имеется конъюнктивит. Однако против кори свиде-
тельствуют возраст (новорожденный), отсутствие пятен Филато-
ва — Коплика на слизистой оболочке щек и температурной реак-
ции. Сыпь при токсической эритеме исчезает через два — четыре
дня. Иногда из-за появления новых высыпаний токсическая эрите-
ма может сохраняться до конца второй недели жизни. Иногда
могут наблюдаться диспепсический стул, увеличение селезенки,
эозинофилия, микрополиаденопатия.
Лечение. При обильных высыпаниях назначаются глюконат
кальция, антигистаминные препараты. Везикулезные и пустулез-
ные элементы смазываются 2—3 раза в день 1 % спиртовым раст-
вором бриллиантового зеленого с последующей присыпкой талька
с окисью цинка.
Склередема (Scleredema) — своеобразная форма отека, сопро-
вождающаяся заметным уплотнением пораженных тканей. Этиоло-
гия и патогенез не выяснены. Считается, что основной причиной
возникновения заболевания является продолжительное охлажде-
ние ребенка и гипопротеинемия. Известное значение имеют
наклонность новорожденного к отечным состояниям, своеобразный
состав подкожной жировой клетчатки (относительно большее ко-
личество пальмитиновой и стеариновой кислот), повышенная по-
розность стенок капилляров. У недоношенных детей к этому при-
соединяется некоторая незавершенность гистологического строе-
ния кожи и подкожной клетчатки. По-видимому, сказывается и не-
которое несовершенство нервной регуляции водного обмена. Появ-
лению склередемы способствуют инфекционные заболевания, сеп-
тическое состояние, недостаточное питание, ателектазы легких,
зрожденные пороки сердца, а также различные эндокринные рас-
стройства у матерей.
Заболевание наблюдается у недоношенных детей. Но может
лоражать и нормальных крепких детей, особенно при их значи-
тельном охлаждении. Развивается болезнь на второй — четвертый
щи жизни. Появляется некоторая тестоватость кожи и подкожной
509
жировой клетчатки в области икроножных мышц, стоп, лобковой
области, половых органов; позже образуется значительная плот-
ность тканей. Кожа напряжена, холодна на ощупь, в складку не
собирается, но при надавливании остается ямка. Окраска кожи
бледная, иногда с цианотичным оттенком.
Прогноз благоприятный. При хорошем уходе, рациональном
вскармливании, согревании процесс разрешается через несколько
недель.
Лечение. Необходимо согревать ребенка. Целесообразно ис-
пользовать кувез. Назначаются сердечные средства внутрь, но не
подкожно, так как не происходит всасывания. Целесообразны
осторожный поглаживающий массаж, трансфузии крови (по 25 мл
2 раза в неделю), инъекции у-глобулина, аевита (0,1 мл 2 раза
в день внутримышечно). Применяют антибиотики (пенициллин,
карбенициллин, ампиокс) и преднизолон по 1—2 мг на 1 кг в
сутки до значительного уменьшения уплотнения и отека кожи, а
затем дозу постепенно снижают до полной отмены.
Профилактика заключается в предотвращении охлаждения но-
во рожденного.
Склерема (Sclerema) — очень тяжелое заболевание, которое
обнаруживается на 3—4-й день жизни ребенка и характеризуется
значительным диффузным уплотнением кожи, подкожной клетчат-
ки и развитием отека. Наблюдается исключительно у слабых недо-
ношенных детей и при состоянии сильного истощения и обезвожи-
вания.
Этиология и патогенез окончательно не выяснены. Важное зна-
чение имеет резкое и длительное охлаждение, приводящее к паре-
зу капилляров и обезвоживанию организма ребенка. Начинается
склерема в области икроножных мышц и лица, затем уплотнение
распространяется на бедра, ягодицы, туловище, верхние конечно-
сти. Кожа отечная и бледная с синюшным оттенком. Лицо маско-
образно; развивается неподвижность суставов и прежде всего че-
люстных. При надавливании на кожу ямки не появляется. Общее
состояние ребенка тяжелое, крик слабый, аппетит снижен; наблю-
дается сонливость, вялость, температура тела понижена, дыхание
замедленно, брадикардия. В крови выявляются лейкоцитоз, гипо-
протеинемия, гипернатриемия, повышение вязкости крови [Бися-
рина В. П., 1984].
Склерема и склередема могут наблюдаться одновременно у од-
ного и того же ребенка, и поэтому иногда возникают трудности
при их дифференциальной диагностике.
Прогноз серьезен, заболевание нередко заканчивается ле-
тально.
Лечение и профилактика те же, что и при склередеме.
Адипонекроз — очаговый некроз подкожной жировой клетчат-
ки — характеризуется появлением в подкожной клетчатке отгра-
ниченных плотных инфильтратов или узлов, диаметром от 1 до
5 см, иногда величиной с детскую ладонь.
Этиология и патогенез. Известно, что этот дерматоз возникает
510
на местах травмы в связи с акушерскими манипуляциями при тя-
желых родах (оживление новорожденного, накладывание меди-
цинских щипцов). Появлению этого дерматоза способстсвуют фун-
кциональные изменения ретикуло-гистиоцитарной системы под-
кожной клетчатки, а также своеобразный ее химический состав с
более высоким содержанием пальмитиновой и стеариновой жир-
ных кислот и с меньшим количеством олеиновой кислоты у ново-
рожденных детей по сравнению с детьми старшего возраста.
Клиника. Заболевание возникает обычно у детей хорошего
питания в первые дни после рождения или чаще на 1—2-й неделе
жизни. Общее состояние не нарушается. На ягодицах, спине, голо-
ве, реже на конечностях и лице выявляются безболезненные или
малоболезненные инфильтраты с бледной либо фиолетово-красной
кожей над ними. Заболевание имеет доброкачественное течение.
Инфильтраты чаще всего рассасываются самопроизвольно через
3—5 мес, но иногда могут в центре размягчаться и вскрываться с
выделением небольшого количества крошковатой белой массы.
Возможны также присоединение вторичной пиококковой инфекции
или кальцификация.
Гистопатология. Определяются обширные некрозы подкожной
жировой клетчатки с наличием реактивного воспаления, гигант-
ских и эпителиоидных клеток.
Дифференциальная диагностика проводится со склеродемой и
склеремой новорожденных, при которых уплотнение кожи диф-
фузное, особенно при склереме, сопровождается неподвижностью
суставов. При септических абсцессах подкожной жировой клетчат-
ки нарушено общее состояние. Кожа над инфильтратами гипере-
мирована, горяча на ощупь, имеется флюктуация.
Лечение. Назначаются тепловые процедуры: УВЧ, соллюкс, су-
хие повязки с ватой. При более распространенном процессе целе-
сообразно давать ацетат-токоферола внутрь в течение 1—2 мес,
а также преднизолон внутрь по 1 мг/кг в течение 2—3 нед с после-
дующим снижением дозы до полной отмены.
Ограниченные врожденные дефекты кожи и подкожной клет-
чатки (Aplasia cutis et subcutis congenita) встречаются редко, имеют
врожденный характер и проявляются уже во время родов в виде
дефектов кожи, подкожной клетчатки и даже более глубоких тка-
ней.
Этиология и патогенез неясны. В настоящее время считается,
что это заболевание является фетопатией, возникающей при по-
пытке аборта, при бактериальной или вирусной инфекции матери в
начале беременности, интоксикации от лучевых воздействий. Воз-
можно аутосомно-доминантное наследование с различной экспрес-
сивностью и пенетрантностью гена.
Клиника. На волосистой части головы, чаще на темени, а также
на конечностях и на туловище видны круглой, овальной или про-
долговатой формы единичные или множественные дефекты, имею-
щие вид свежих гранулирующих язв или рубцов, размером от
3,2—0,5 до 4—5 см и более. У некоторых новорожденных заболе-
511
вание сочетается с другими аномалиями: гидроцефалия, расщелина
твердого неба и верхней губы, деформация конечностей и др.
Дифференциальную диагностику проводят от термического и
механического повреждений кожи, возможных во время родов, от
буллезного эпидермолиза и врожденного сифилиса.
Лечение назначают в зависимости от состояния больного. При
множественных поражениях применяют в течение нескольких
дней парентеральное введение антибиотиков (пенициллин, линко-
мицин, ампиокс, карбенициллин). Язвы смазывают 1 % водным
раствором метиленового синего или бриллиантового зеленого и
накладывают повязку с глюкокортикоидным кремом, ихтиол-
висмутовой, пастой Лассара. Лечение рубцов не проводится.
Себорейный дерматит (Dermatitis seborrhoides) раннего грудно-
го возраста возникает на первой — второй неделе жизни, иногда в
конце первого месяца жизни и под влиянием рациональной
терапии разрешается не позднее 3 мес жизни.
Этиология и патогенез (см. десквамативная эритродермия).
Клиника. По течению различают легкую, среднетяжелую и тя-
желую формы.
При легкой форме себорейного дерматита общее состояние ре-
бенка не страдает. В области естественных складок отмечается
гиперемия, умеренная инфильтрация с наличием пятнисто-папу-
лезных элементов, покрытых отрубевидными чешуйками по пери-
ферии. Лишь изредка могут отмечаться срыгивания и неустойчи- ,
вый стул.
При среднетяжелой форме, кроме поражения естественных
складок, краснота и шелушение распространяются на туловище и
конечности с отсевами в виде пятнисто-папулезных шелушащихся
элементов на здоровой коже по периферии очагов поражения. На :
волосистой части головы отмечаются гиперемия, инфильтрация,,.1’
скопление чешуек (рис. 112). Отмечаются более частые срыгива--
ния в сочетании с жидким стулом (до 3—4 раз в сутки). Об-::
щее состояние нарушается, ребенок становится беспокойным*
плохо спит. Иногда выявляются умеренная гипохромная анемия,
отит.
При тяжелой форме наблюдается обширное поражение кожно-
го покрова в виде гиперемии, инфильтрации, отрубевидного шелу-
шения. В естественных складках (заушные, шейные, бедренные,
паховые, подмышечные) гиперемия наиболее яркая, отмечаются
мацерация, мокнутие, образование трещин. На волосистой части
головы на фоне гиперемии и инфильтрации наблюдается скопле-
ние «жирных чешуек», покрывающих голову в виде «коры». Общее,
состояние больных нарушено. Ребенок вялый, беспокоен, плохо
сосет грудь. Наблюдаются выраженные диспепсические расстрой-
ства в виде частого жидкого стула, срыгиваний и даже рвот. Масса
тела прибавляется медленно, развивается умеренная, а у некото-
рых больных более заметная гипохромная анемия, умеренная ги-
поальбуминемия, диспротеинемия за счет снижения альбуминов и
повышения а- и у-глобулинов. j
512
Рис, 112. Себорейный дерматит.
Дифференциальный диагноз проводится с десквамативной
эритродермией Лейнера в процессе динамического наблюдения за
течением заболевания, ибо при тяжелой форме себорейного дер-
матита все имеющиеся общие явления менее выражены и быстрее
проходят, чем при десквамативной эритродермии.
Лечение. При легкой форме себорейного дерматита достаточ-
ным оказывается проведение наружного лечения с использовани-
ем дезинфицирующих, кератопластических средств (3 % нафта-
лан, 2 % ихтиол, 3 % висмут, 0,5—1 % резорцин) в виде паст, ма-
зей с предварительным смазыванием пораженных участков кож-
ных складок 1 % водным раствором бриллиантового зеленого или
метиленового синего. Внутрь назначают витамины С, Bi, Вб, В12.
При среднетяжелой и тяжелой формах назначается комплекс-
ное лечение с использованием коротких курсов антибиотиков
(пенициллин, линкомицин, оксациллин, метициллин, карбеницил-
лин), вливания глюкозы с аскорбиновой кислотой, альбумина,
плазмы, введения -у-глобулина. Внутримышечные инъекции вита-
минов Вб, Bi, В]2 до 5—10—15 инъекций каждого. Внутрь приме-
няют витамины С, В2, Bi. используют ферментотерапию (желудоч-
ный сок, пепсин с соляной кислотой, панкреатин).
При всех формах себорейного дерматита после разрешения
кожных поражений и улучшения общего состояния больных про-
водят курс общего У ФО (15—20 сеансов). Дети должны получать
вскармливание грудным материнским молоком либо рациональное
смешанное или искусственное вскармливание.
Десквамативная эритродермия Лейнера—Муссу (Erythrodermia
desquamativa) является тяжелопротекающим заболеванием, пора-
жающим исключительно детей первых 3 мес жизни и не встреча-
18—936
513
Рис. 113. Десквамативная эритродермия Лейнера.
ющимся в других возрастных группах. Впервые дерматоз был вы-
делен в самостоятельное заболевание в 1905 г. французским педи-
атром Moussous и подробно описан в 1907 г. австрийским педиат-
ром Leiner.
Этиология и патогенез окончательно не изучены. Существует
мнение, что десквамативная эритродермия является редко встре-
чающейся генерализованной формой себорейного дерматита.
В развитии заболевания важное значение придается сенсибилизи-
рующему влиянию пиококковой и дрожжевой инфекции при выра-
женных нарушениях у этих больных белкового, углеводного, жи-
рового, минерального обмена веществ, недостаточности некоторых
витаминов (А, Вь В2, В6; С, Е, фолиевой кислоты, биотина) и фа-
гоцитарной активности в связи с дефицитом фракции Cs сыворо-
точного комплемента.
Клиника. Заболевание развивается у большинства детей в пери-
од рождения, реже — в возрасте старше 1 мес жизни. Начинается
дерматоз с покраснения кожи ягодиц и паховых складок, реже —
с верхней части туловища. В течение нескольких дней весь кожный
покров становится ярко гиперемированным, инфильтрированным с
обильным шелушением отрубевидными или пластинчатыми чешуй-
ками. В области промежности, на ягодицах, паховых, бедренных,
подмышечных складок кожа мацерирована, покрыта трещинами,
мокнет. На волосистой части головы образуются жирные чешуйки
серовато-желтого цвета, скапливающиеся в виде коры или панци-
ря, спускающегося на лоб и надбровные дуги (рис. 113).
Общее состояние детей тяжелое. Наблюдаются тяжелые дис-
пепсические расстройства (частые срыгивания, обильная рвота,
частый жидкий стул), слабое увеличение массы тела с последую-
514
щим падением ее; развиваются анорексия, пониженное питание,
вплоть до гипотрофии III степени, появляются стойкие отеки,
особенно заметные на ногах и на пояснице. Дети беспокойны, пло-
хо спят, у них отмечают выраженную гипохромную анемию,
увеличение СОЭ, лейкоцитоз, гипоальбуминемию с диспротеинеми-
ей, гипохолестеринемию, укорочение коагуляционной ленты Вельт-
мана, повышение активности альдолазы, повышение хлоридов в
крови. Характерным является присоединение осложнений и сопут-
ствующих заболеваний: пневмонии, отита, пиелонефрита, лимфа-
денита, гнойного конъюнктивита, блефарита, ксероза роговицы,
множественных абсцессов, флегмоны с некрозом мягких тканей,
остеомиелита, развития тяжелого токсико-септического состояния.
Дифференциальный диагноз проводится с врожденным ихтио-
зом, который в отличие от десквамативной эритродермии выяв-
ляется у ребенка сразу после рождения, сопровождается различ-
ными аномалиями, кератодермией ладоней и подошв. В отличие от
эксфолиативного дерматита Риттера при десквамативной эритро-
дермии отсутствуют эрозии и симптом Никольского.
Лечение проводят комплексное, оно направлено на нормализа-
цию вскармливания, реактивности и иммунобиологических сил ор-
ганизма ребенка. Для борьбы с очагами инфекции необходима ра-
циональная антибактериальная терапия с использованием антиби-
отиков (пенициллин, ампициллин, линкомицин, гентамицин, цепо-
рин) в течение 10—15 дней. Используется стимулирующая терапия
путем введения альбумина, у-глобулина, полиглобулина, трансфу-
зий плазмы и консервированной крови; в течение 1—2 суток про-
водятся внутривенные капельные вливания 5—10 % глюкозы с
раствором Рингера, 5 % раствора альбумина, гемодеза. Ребенку
назначают витамины (С, В>, Вс,, Вг>), ферменты (пепсин с соляной
кислотой, панкреатин), биологические препараты (бифидумбакте-
рин, лактобактерии).
Наружное лечение проводится теми же препаратами, что и при
себорейном дерматите.
Кормящая грудью мать должна получать достаточно калорийное
и витаминизированное питание, дополнительно ей назначаются
внутрь витамины С, Bi, масляный раствор ретинола-ацетата
(100 000 ME в 1 мл) — по 15—20 капель 1 раз в день в течение
всего периода заболевания ребенка (1 — 1'/? мес).
Прогноз при своевременной и рациональной терапии вполне
благоприятный.
Профилактика должна осуществляться еще в антена-
тальном периоде в виде рационального питания беременной жен-
щины, назначения ей дополнительного приема поливитаминных
препаратов в виде курсов по 1 мес с перерывами в 1,5—2 мес.
Строфулюс (strophulus). Син.: хроническая детская крапивница, папулезная
крапивница у детей, пруриго детское, почесуха детская
Это часто встречающийся дерматоз грудного и раннего детско-
го возраста (после 3 мес). Имеет хроническое рецидивирующее
течение, сопровождается характерными высыпаниями и сильным
зудом, развивается на фоне экссудативно-катарального диатеза и
является выражением реакции гиперчувствительности ко многим
раздражителям.
Этиология окончательно не изучена. В патогенезе важная роль
отводится аллергизирующим факторам. Строфулюс может разви-
ваться вследствие воздействия аллергенов окружающей среды
(бытовая пыль, мех, пух, шерстяные и синтетические ткани, до-
машние животные, цветы, растения, косметические средства, иг-
рушки и др.), укусов насекомых (комары, клопы, блохи), некото-
рых медикаментов (йод, бром, хинин, сульфаниламиды, антибио-
тики, амидопирин, анальгин и др.). Существенно влияние трофал-
лергенов пищи, особенно коровьего молока, молочных продуктов
(масло, творог, сметана, сыр), рыбы, мяса, яиц, меда, шоколада,
какао, овощей (горох, морковь, фасоль, шпинат), фруктов (манда-
рины, апельсины, ананасы, персики, абрикосы, дыни, бананы),
ягод (клубника, земляника, черная смородина), орехов (грецкие,
лесные). Определенное значение имеют токсико-аллергические
воздействия различных перенесенных инфекционных, желудочно-
кишечных заболеваний, нарушений функций печени и почек, фо-
кальной инфекции (отиты, тонзиллиты, гаймориты), гельминтозов,
профилактических прививок.
Строфулюс нередко развивается в период прорезания зубов,
когда появление каждого нового зуба сопровождается новым ре-
цидивом высыпаний.
Клиника. Характерным высыпным элементом является вол-
дырь, в центре которого находится твердая на ощупь серопапула
величиной с просяное зерно. Возможны эритемо-уртикарные и
буллезные формы строфулюса [Штейнлухт Л. А., Зверькова Ф. А.,
1979]. Локализация на любом участке кожного покрова, даже на
ладонях и подошвах (рис. 114), реже на лице и волосистой час-
ти головы. Слизистые оболочки не поражаются. Высыпания ди-
намичны— через 6—12 ч волдырь исчезает, остается серопапу-
ла, после рассасывания которой несколько дней сохраняется
пигментация. Нередко в центре папулы вместо везикулы име-
ется серозно-геморрагическая корочка, возникающая из-за рас-
чесов.
Заболевание характеризуется рецидивирующим течением, силь-
ным приступообразным зудом, расчесами, умеренной полиадено-
патией. Больные раздражительны, беспокойны, плаксивы, плохо
спят, страдают анорексией, диспепсическими расстройствами, в
анализах крови — эозинофилия, иногда анемия. Температура тела
нормальная, но в период свежих высыпаний кратковременно по-
вышается до 37,5—38 “С. Вследствие расчесов нередко осложнение
в виде импетиго.
Гистопатология: акантоз, межклеточный и внутриклеточ-
ный отек шиповидного слоя эпидермиса с образованием в нем
мелких полостей с серозным экссудатом; отек сосочкового слоя
дермы, периваскулярная инфильтрация.
516
Рис. 114. Строфулюс.
Диагноз устанавливается на основании типичных морфологи-
ческих элементов сыпи с учетом рецидивирующего течения за-
болевания.
Дифференциальная диагностика проводится с чесоткой, герпе-
тиформным дерматитом Дюринга, токсидермией, укусами насеко-
мых, ветряной оспой, мастоцитозом.
Лечение. Важное значение имеет диетотерапия с исключением
продуктов, вызывающих обострение дерматоза. Назначаются ан-
тигистаминные (димедрол, пипольфен, перитол, супрастин, диа-
золин, тавегил), витаминные (А, С, Вб, рутин) препараты в воз-
растных дозировках, кальция хлорид или глюконат, общее ультра-
фиолетовое облучение субэритемными дозами (20—25 сеансов
через день), ванны (при отсутствии пиококковой инфекции) с от-
варами дубовой коры, череды, ромашки, шалфея.
Наружно применяют индифферентные взбалтываемые взвеси с
добавлением 2—3 % ихтиола, дерматола. При осложнении пио-
кокковой инфекцией элементы смазываются 1—2% спиртовыми
растворами анилиновых красителей (бриллиантовый зеленый, ме-
тиленовый синий) с последующим применением мазей (2—3 %
ихтиолвисмутовой, борнонафталановой).
Прогноз — благоприятный.
Профилактика возникновения и клинической манифестации
строфулюса предусматривает исключение перекармливания ре-
бенка, соблюдение режима, гигиенического ухода.
Беременной женщине и матери в период лактации не следует
517
злоупотреблять яйцами, рыбой, крепкими мясными бульонами,
цитрусовыми, солеными продуктами.
С целью уменьшения развития инфекционной аллергии и ауто-
аллергии необходимо своевременное проведение санации очагов
фокальной инфекции и дегельминтизации не только у детей, но
и у кормящих грудью матерей.
Герпетиформная экзема Капоши (eczema herpetiforme Kaposi). Син.: вакцини-
формный пустулез
Это тяжелое вирусное заболевание, возникающее у детей, чаще
всего раннего возраста, страдающих экземой, нейродермитом,
реже — себорейным дерматитом.
Морфологические изменения на коже и общее состояние
детей детально описал венгерский дерматолог Капоши в 1887 г.
В нашей стране это заболевание было впервые описано на осно-
вании наблюдения и лечения 10 детей С. Я. Голосовкером и
Ф. А. Зверьковой в 1955 г.
Этиология, патогенез. Возбудитель болезни — вирус
простого герпеса, преимущественно (в 98 % случаев) тип А, пора-
жающий кожу вокруг носа, рта, слизистые оболочки верхних ды-
хательных путей, и реже (в 2 % случаев) тип Б, вызывающий по-
ражение слизистых оболочек половых органов, кожи вокруг них,
области ягодиц и бедер. Источником заражения детей является
человек, страдающий простым герпесом. Выявлено, что количество
больных увеличивается зимой и весной и всегда совпадает со
вспышками заболевания населения острыми респираторными ви-
русными инфекциями (ОРВИ) и гриппом [Зверькова Ф. А. и др.,
1985|. Это связано с тем, что у больных ОРВИ и гриппом вслед-
ствие снижения защитных сил организма активизируется герпети-
ческая инфекция. Известно, что переданные внутриутробно ан-
титела против вируса простого герпеса полностью исчезают в
возрасте от 6 мес до 2 лет. На этот возраст и приходится основ-
ное количество (65%) детей, страдающих герпетиформной эк-
земой Капоши.
Клиника. Инкубационный период составляет 5—7 дней, но
может укорачиваться до 2—3 дней или удлиняться до 10 дней и
более. Заболевание начинается остро. У "/больных повышается
температура до 39—40 °C, а у остальных — до 38 °C. Дети стано-
вятся раздражительными, беспокойными, аппетит плохой, затем
у них возникает вялость и даже прострация. Общее состояние
детей тяжелое либо средней тяжести, развивается токсикоз.
После продромального периода (1 — 3 дня) появляются мелкие,
величиной до горошины пузырьки с серозным, некоторые с гной-
ным и геморрагическим содержимым. Пузырьки и пустулы имеют
типичный вид — в центре их пупкообразное западение, а по пери-
ферии валикообразно приподнятые края. Основная локализация
этих элементов — лицо, волосистая часть головы, тыл кистей,
518
Рис. 115. Герпетиформ-
ная экзема Капоши.
реже — туловище и конечности. В процессе эволюции этих элемен-
тов в очагах поражения развивается повышенная кровоточивость,
образуются эрозии, глубокие кровоточащие трещины, наслоения
массивных геморрагических корок, что является патогномонич-
ным признаком герпетиформной экземы. Лицо ребенка становит-
ся «маскообразным» (рис. 115); элементы сыпи видны по перифе-
рии этого диффузного очага поражения. У половины детей раз-
вивается также поражение слизистых оболочек в виде афтозного
стоматита, катаральных явлений в зеве, носоглотке, у части боль-
ных появляется конъюнктивит.
У всех больных возникает регионарный лимфаденит; у боль-
шинства больных выявляют гипохромную анемию, лейкопению,
лейкоцитоз, увеличение СОЭ. Патогномонично — уменьшение или
полное исчезновение в периферической крови эозинофилов в нача-
ле и в разгар заболевания, тогда как для детей, больных экземой
и нейродермитом, всегда типична эозинофилия в периферической
крови. После исчезновения проявлений герпетиформной экземы
количество эозинофилов постепенно нарастает.
Нередко присоединяются вторичная пиококковая инфекция,
пневмония, отит, сепсис.
Высыпание типичных герпетиформных элементов длится от 5
до 14 дней. Характерно, что в разгар высыпаний проявления
519
основного заболевания (экземы и нейродермита) исчезают, зна-
чительно ослабевает зуд. После нормализации температуры, улуч-
шения общего состояния вновь появляется зуд и даже становится
сильнее, а проявления экземы или нейродермита — еще более вы-
раженными, чем они были до присоединения герпетиформной
экземы. Иногда через 3—4 дня после падения температуры мо-
жет появиться вторая волна заболевания, но протекающая легче, с
менее выраженной температурной реакцией, небольшим коли-
чеством элементов сыпи и с более короткой длительностью реци-
дива.
На местах бывших пустулезных элементов после разрешения
их у половины больных остаются поверхностные мелкие округлой
формы рубчики.
Окончательный диагноз герпетиформной экземы Капоши уста-
навливается при исследовании парных сывороток в реакции свя-
зывания комплемента с вирусом простого герпеса. Нарастание
титра антител к вирусу простого герпеса в 4 раза и более под-
тверждает диагноз.
Дифференциальный диагноз проводится со стрептококковым,
вульгарным импетиго, с ветряной оспой, опоясывающим пузырько-
вым лишаем, многоформной экссудативной эритемой на основании
характерного анамнеза (указание на непосредственный контакт
ребенка с больным простым герпесом), тяжелого или среднетяже-
лого общего состояния больных, типичных пузырьковых или пус-
тулезных высыпаний с пупкообразным вдавлением в центре, мас-
сивных геморрагических корок, отсутствия гнойных «медовых» им-
петигинозных корок.
Лечение. Всех больных с герпетиформной экземой Капоши
Необходимо госпитализировать в инфекционные отделения в бок-
сированные палаты.
/ Диета должна соответствовать возрасту ребенка, а при локали-
зации высыпаний на лице пища должна быть протертой. С целью
дезинтоксикации рекомендуется частое питье кипяченой воды, не-
сладкого чая, клюквенного или брусничного морса. При отказе
ребенка от питья, или при невозможности давать жидкость через i
рот проводится трансфузионная терапия: внутривенное вливание
гемодеза, 10 % раствора альбумина, 5 % раствора глюкозы с до-
бавлением солей калия, кальция, 1—2 мл 5 % раствора аскорби-
новой кислоты, 50—100 мг кокарбоксилазы.
В качестве жаропонижающего средства дается метиндол (ин-
дометацин) 2—3 раза в день в возрастных дозировках. Внутри-
мышечно следует вводить 1—2 мл (в зависимости от возраста)
противогриппозного гамма-глобулина 2 раза в неделю.
Внутрь назначаются в возрастных дозировках аскорбиновая
кислота с рутином, витамины В|, В2, В5, Вб, антигистаминные
препараты (димедрол, тавегил, супрастин, пипольфен, диазолин,
перитол) в течение 5—7 дней; назначаются сердечные средства
(адонизид, лантозид, коргликон и др.).
Так как у многих больных имеются гнойные элементы на
520
коже, сопутствующие пневмонии, гнойный отит, то назначаются
антибиотики в виде полусинтетических пенициллинов (оксацил-
лин, метициллин, ампиокс), линкомицин, кефзол в возрастных
дозах.
Наружное лечение проводится путем туширования 3 % раство-
ром перекиси водорода с последующим смазыванием 1 % водным
раствором бриллиантового зеленого или метиленового синего кро-
воточащих эрозий и с накладыванием на них марли, пропитанной
масляным раствором витамина А, маслом шиповника или облепи-
хи, гелем солкосерила. Пузырьки и пустулы смазываются 1 %
спиртовым раствором (70°) бриллиантового зеленого, а затем
0,5 % оксолиновой или теброфеновой мазью. Дерматоловую
(3 %), борнонафталановую (2—3 %), с этакридин-лактатом
(0,5—1 %) мази применяют на массивные геморрагические корки,
после отхождения которых используются кератопластические
пасты (паста Лассара, 2—3 % нафталановая). Противопоказано
применение глюкокортикоидных мазей.
Необходимы консультации невропатолога и окулиста. При вы-
сыпаниях на коже век необходимы профилактическое закапыва-
ние в глазную щель масляного раствора витамина А, капель с АТФ,
раствора интерферона. При поражении конъюнктивы или роговицы
проводится лечение по назначению окулиста.
Прогноз серьезен, зависит от своевременности диагноза и
проведения ранней и адекватной терапии.
Профилактика герпетиформной экземы Капоши предусматри-
вает необходимость предохранения детей, больных экземой, нейро-
дермитом, себорейным дерматитом, экссудативным диатезом, от
контакта с лицами, страдающими герпетиформной экземой Ка-
поши, простым герпесом, ОРВИ, гриппом. Родителям и лицам,
страдающим рецидивирующим герпесом и находящимся в тесном
бытовом контакте с детьми, болеющими экземой, нейродермитом,
себорейным дерматитом, экссудативным диатезом, необходимо с
профилактической целью провести курс лечения противогерпети-
ческой поливакциной. Проведение разъяснительной работы с
родителями и родственниками детей, страдающих экземой и ней-
родермитом, о том, что при появлении у них вирусных заболева-
ний, обнаружении пузырьков на губах и у крыльев носа, им ка-
тегорически противопоказано контактировать с ребенком. В ис-
ключительных случаях при невозможности предотвращения кон-
такта с ребенком следует использовать четырехслойную марле-
вую маску.
ПИОДЕРМИИ У НОВОРОЖДЕННЫХ
Пиодермии — гнойные воспалительные заболевания кожи —
могут возникать под влиянием разнообразных возбудителей (ста-
филококки, стрептококки, пневмококки, кишечная палочка, вуль-
гарный протей, сибиреязвенная палочка и др.). К пиодермитам
в узком смысле слова относятся заболевания, которые возникают
521
в результате внедрения в кожу гноеродных кокков или пиококков
(стафилококков и стрептококков).
Этиология и патогенез. Пиодермии могут быть как в качестве
первичного заболевания, так и возникать вторично вследствие
осложнений других дерматозов у новорожденных и грудных детей.
По статистическим данным, пиодермиты составляют у детей 25—
60 % от всех кожных заболеваний. Они являются обычным ос-
ложнением каждого кожного заболевания, сопровождающегося зу-
дом и нарушением целости эпидермиса у детей [Скрипкин Ю. К.
и др., 19831.
Уже в первые часы после рождения и до 6—8-го дня жизни
ребенка могут отмечаться высокие темпы обсеменения кожи и
слизистых оболочек новорожденного патогенными стафилококка-
ми. Их можно обнаружить особенно в области пупка, несмотря
на тщательное соблюдение санитарно-гигиенического режима в
родильном доме. Эти новорожденные в большинстве случаев не
заболевают, так как наличие возбудителя на коже и слизистых
еще не достаточно для того, чтобы развилась пиодермия [Штейн-
лухт Л. А., Зверькова Ф. А., 1979].
Важными факторами, способствующими возникновению пио-
дермии, являются массивное инфицирование, вирулентность ми-
кробов, состояние иммунитета и наличие входных ворот для ин-
фекции. Новорожденные дети начинают контактировать со ста-
филококками в момент, когда еще не произошло заселение их
тела микробами-антагонистами. Функции защитных механизмов у
новорожденных и грудных детей несовершенны. Пассивный имму-
нитет против стафилококков выражен слабо, титр антитоксинов
в крови низок. Регионарные лимфатические узлы недостаточно
реагируют на внедрение инфекции; ретикулоэндотелиальная сис-
тема поглощает микроорганизмы, но очень медленно переваривает
и разрушает их. В первые месяцы жизни замедлены процессы
синтеза иммунологически активных лимфоидных клеток (Т- и
В-лимфоцитов, макрофагов), что обусловлено недостаточным кор-
ригирующим влиянием вилочковой железы. Установлено, что IgG,
получаемый через плаценту от матери, полностью исчезает из
крови ребенка к 6 мес жизни. Последующее их продуцирование
происходит медленно, особенно IgG и IgA. Так как дети до 42 дня
жизни не способны вырабатывать антитела, то стафилококковый
процесс протекает особенно тяжело у новорожденных.
Входными воротами инфекции у новорожденного являются об-
ласть пупка, а также любые повреждения кожи, легко возникаю-
щие при выполнении гигиенических процедур (обмывание, пеле-
нание, кормление и т. д.). Способствуют заболеванию укутыва-
ние, перегревание — гипергидроз, потница, загрязнение кожи при
недостаточном гигиеническом уходе.
Возможно заражение плода антенатально, когда женщина во
время беременности перекосит какое-либо стафилококковое за-
болевание или имеет очаги хронической инфекции (кариозные
зубы, хронический тонзиллит). Интранатальное инфицирование
522
чаще наблюдается при патологических родах, при наличие у ро-
жениц урогенитальных заболеваний.
Основным этиологическим фактором внутрибольничнцх эпи-
демий септических заболеваний в родильных домах и в стациона-
рах являются стафилококки фаготипов 80 и 80/81, стафило-
кокки II и III фагогрупп.
В качестве предрасполагающих факторов в развитии Циодер-
мий у детей раннего возраста необходимо всегда учитывать воз-
можность общих нарушений в виде расстройств питания из-за
нерационального вскармливания (чрезмерное употребление угле-
водов, при недостаточном поступлении белков и витаминов А, С,
Bi, Be, РР), заболеваний желудочно-кишечного тракта.
Существенное значение имеют анатомо-физиологические осо-
бенности кожи, особенно у новорожденных и грудных детей.
Так, некоторая незаконченность морфологической структуры ко-
жи, нежность и рыхлость рогового слоя, непрочность связи эпи-
дермиса и дермы вследствие слабости базальной мембраны и
некоторой сглаженности сосочков дермы, прямое расположение
протоков эккринных потовых желез и наличие полисахаридного
комплекса в них, щелочная среда поверхности кожи и снижение
защитных свойств ее, несовершенство процессов терморегуляции,
повышенная влажность и абсорбционная способность кожи, ла-
бильность коллоидно-осмотического состояния — все это является
факторами, способствующими возникновению пиодермий у детей
раннего возраста, особенно у новорожденных [Ю. К. Скрип-
кин и др., 1983].
Близкий контакт с больным пиодермитом — непосредственный
или косвенный, также создает условия для перенесения виру-
лентных пиогенных кокков на кожу здоровых детей и приводит
к заболеванию их пиодермией.
Заразительность пиодермии в общем невелика, но именно в
детском возрасте встречаются наиболее контагиозные ее формы —
эпидемический пемфигоид новорожденных и заразительное импе-
тиго (Impetigo contagiosa). Необходимо всегда помнить, что час-
тота пиодермий в раннем детском возрасте прямо пропорцио-
нальна недостаткам личной гигиены лиц, которые окружают де-
тей и непосредственно заботятся о них.
Пиодермии наиболее опасны в период новорожденное™, ибо
у новорожденных детей отмечаются: 1) повышенная чувствитель-
ность к стафилококковой инфекции; 2) имеется наклонность к
генерализации инфекции, 3) стафилококковая инфекция разви-
вается как на коже, так и в ряде других органов, 4) может раз-
виваться сепсис, 5) общая реакция организма остается еще
измененной, в то время как высыпания на коже уже разрешились.
Везикулопустулез (син.: перипорит) встречается сравнительно
часто у новорожденных. Появлению его нередко предшествует
потница, развитию которой способствует перегревание ребенка
(высокая температура окружающей среды, повышение темпера-
туры тела при различных общих или инфекционных заболеваниях
и др.). 523
Клиника. Вначале появляется так называемая потница кра-
сная и кристаллическая в виде множества красных точечных пя-
тен, возникающих из-за расширения сосудов вокруг пор эккрин-
ных потовых желез,и прозрачных, величиной до просяного зерна
пузырьков, располагающихся преимущественно на туловище. За-
тем в складках кожи и на туловище возникает белая потница —
пузырьковые высыпания, наполненные молочно-белым содержи-
мым и расположенные на гиперемированном основании, представ-
ляющие собой фактически стафилококковые пустулы. Этот вариант
потницы является стафилококковой пиодермией, называемой
везикулопустулезом. Данное заболевание появляется с третьего—
пятого дня жизни либо к концу периода новорожденности
(т. е. в конце первого месяца жизни). Кроме туловища, гнойнич-
ки, окруженные воспалительным венчиком, могут располагаться
на волосистой части головы. Количество пустул значительное,
хотя бывают и единичные высыпания. Периодически в течение
нескольких дней появляются свежие элементы, затем они посте-
пенно подсыхают в корочки, под которыми идет эпителизация.
Гистопатологическое исследование указывает на воспалитель-
ные изменения в области устьев эккринных потовых желез, что
и определяет другое название заболевания — перипориты.
Лечение. При своевременно начатом лечении и хорошем уходе
за новорожденным заболевание продолжается от 2—3 до 7—10
дней. Между тем эта поверхностная форма пиодермии очень
опасна, так как инфекция легко распространяется на соседние
участки кожи и в глубину. Кроме того, в редких случаях возни-
кает гематогенное или лимфогенное распространение инфекции
с поражением внутренних органов, костной системы, с развитием
септикопиемии и возникновением осложнений в виде пневмо-
ний, отитов, нормохромной и гипохромной анемии. У некоторых
детей везикулопустулез возникает как проявление пупочного
сепсиса или других форм общей стафилококковой инфекции.
Среди стафилодермий новорожденных везикулопустулез встреча-
ется чаще всего и почти у 70 % больных сочетается с множест-
венными абсцессами, что указывает на общность этих заболеваний,
являющихся фазами единого патологического процесса [Штейн-
лухт Л. А. и др., 1975].
Псевдофурункулез (син.: множественные абсцессы) возникает
при распространении инфекции в глубину протоков эккринных
потовых желез через дефекты поверхностных слоев эпидермиса.
Заболевание появляется чаще на 2—3—4-й неделе жизни ново-
рожденных. На коже появляются в различном количестве ин-
фильтраты в виде узлов величиной с горошину или немного
больше (рис. 116). Множественные абсцессы труднее поддаются
лечению, чем поверхностная гнойничковая сыпь, так как процесс
развивается в толще кожи, захватывая всю эккринную потовую
железу. Начавшись на первом месяце жизни, заболевание при
нерациональном лечении может продолжаться 2—3 мес и дольше.
Процесс часто сопровождается нарушением общего состояния ор-
524
Рис. 116. Псевдофурункулез.
ганизма. Температура вначале субфебрильная, затем повышается
до 38—39 °C. У детей ухудшается аппетит, нарастает бледность,
масса тела начинает снижаться, появляются диспепсия, умерен-
ное увеличение печени и селезенки, интоксикация, гипотрофия.
При посеве крови на сахарный бульон почти всегда высевается
стафилококк, что говорит о постоянной бактериемии. При исследо-
вании периферической крови отмечается анемия; чем дольше про-
должается заболевание, тем анемия более выражена; всегда на-
блюдается лейкоцитоз с нейтрофилезом и сдвигом формулы влево,
СОЭ увеличена до 30—60 мм/ч. Несмотря на благоприятное те-
чение заболевания, у детей картина крови нормализуется мед-
ленно, особенно СОЭ, которая даже после разрешения высыпаний
на коже иногда еще длительное время остается увеличенной.
При тяжелом, рецидивирующем течении псевдофурункулеза
происходит сенсибилизация организма к стафилококку. При этом
нарастает интоксикация, температура держится в пределах 39—
39,5 °C, аппетит отсутствует, масса тела снижается, усиливается
диспепсия, возможно развитие тяжелотекущего стафилококкового
энтероколита, гемоглобин падает до 30—40 %, лейкоцитоз увели-
чивается, отмечается резкий сдвиг лейкоцитарной формулы
влево, вплоть до миелоцитов, появляется токсическая зернис-
тость в нейтрофилах, СОЭ нарастает до 40—65 мм/ч. В моче
определяются белок, лейкоциты, эритроциты, зернистые и гиали-
новые цилиндры. Развивается септицемия с пиемическими оча-
гами в виде гнойного отита, флегмоны и обширных абсцессов
кожи и подкожной клетчатки, абсцедирующей стафилококковой
пневмонии с пиопневмотораксом и плевритом, гнойного менин-
гита, остеомиелита, перитонита, заканчивающихся летально.
Следует всегда учитывать то, что у некоторых детей множест-
венные абсцессы являются входными воротами для развития сеп-
сиса. Поэтому дети, страдающие множественными абсцессами,
525
подлежат госпитализации для проведения тщательного обследо-
вания и лечения.
Эпидемическая пузырчатка новорожденных (син.: пиококко-
вый пемфигоид) — поверхностное гнойное поражение кожи, ха-
рактеризующееся высыпанием «вялых» пузырей (фликтен) вели-
чиной от горошины до лесного ореха, после вскрытия которых
отмечаются эрозии, окруженные остатками покрышки пузыря.
После эпителизации эрозий видны пигментные пятна, исчезаю-
щие через 10—15 и более дней. Период высыпания пузырей длит-
ся от нескольких дней до 2—3 нед. При тяжелых формах забо-
левания число пузырей велико и они более крупные. Локализация
элементов — в области живота, конечностей, спины, кожных скла-
док, очень редко — на ладонях и подошвах. Иногда может раз-
виваться септикопиемия. У 50—70 % больных наблюдается по-
вышение температуры до 37,5—38 С. В анализе крови умеренный
лейкоцитоз, нейтрофилез и сдвиг лейкоцитарной формулы влево.
Заболевание очень контагиозно для новорожденных детей, так
как инфекция легко передается через руки обслуживающего
персонала, через белье и другие предметы ухода. Больных детей
необходимо строго изолировать от здоровых, а также от детей с
другими заболеваниями.
Дифференциальный диагноз следует проводить с сифилитиче-
ской пузырчаткой и врожденным эпидермолизом. При сифилити-
ческой пузырчатке пузыри локализуются чаще всего в области
ладоней и подошв на инфильтрированном основании и окружены
воспалительным венчиком буровато-красного цвета. Выявляются и
другие, характерные для врожденного сифилиса признаки (па-
пулезная сыпь, диффузные инфильтраты, специфический ринит,
гепатоспленомегалия, остеохондриты, положительные серологиче-
ские реакции крови). При буллезном эпидермолизе пузыри появ-
ляются сразу после рождения, чаще на конечностях, на местах,
подвергающихся трению. При дистрофических формах врожден-
ного эпидермолиза пузыри часто бывают на слизистых оболочках,
а на коже после них остается рубцовая атрофия.
Эксфолиативный дерматит Риттера (Dermatitis exfoliativa neo-
natorum, Pemphigus epidemicus neonatorum exfoliativa) — заболе-
вание описано педиатром из Праги — Риттером — в 1870 г. В на-
стоящее время известно, что эксфолиативный дерматит Риттера
вызывается стафилококком II фаговой группы, фаготипом 71 или
55/71, является наиболее тяжелой формой стафилодермии ново-
рожденных и рассматривается как злокачественная разновид-
ность пиококкового пемфигоида. Процесс характеризуется тяже-
лым течением, выраженной интоксикацией и бурными изменения-
ми со стороны кожи и слизистых оболочек в виде гиперемии,
отечности и отслойки эпидермиса. За идентичность обоих заболе-
ваний говорят клинические и эпидемиологические данные, хотя
эксфолиативному дерматиту Риттера и свойственна своеобразная
клиническая картина.
Клиника. Заболевание появляется в конце первой, начале
526
Рис. 117. Эксфолиативный
дерматит.
второй недели жизни но-
ворожденного, при тяже-
лых формах — на 4—5-й
и даже на 2—3-й день
жизни и начинается с по-
явления покраснения, тре-
щин, слущивания верхних
слоев эпидермиса вокруг
рта, а иногда вокруг пуп-
ка. Затем появляется се-
розное пропитывание ко-
жи, и далее возникает
эпидермолиз, т. е. проис-
ходит отслойка эпидерми-
са от дермы крупными
пластами. На туловище и
конечностях, захватывая
ладони и подошвы, возни-
кают обширные эрозии,
имеющие тенденцию к рас-
пространению по всему
кожному покрову. Ново-
рожденный приобретает
вид «ошпаренного кипят-
ком» (рис. 117). Поража-
ются слизистые оболочки
рта и носа, висцеральные
органы.
В других случаях заболевание начинается как при обычном
пиококковом пемфигоиде, т. е. на неизмененной коже появляются
пузыри, которые быстро увеличиваются в размерах, сливаются,
разрываясь, оставляют эрозивную поверхность. Участки кожи
между пузырями внешне кажутся совершенно нормальными, но
они фактически подвергаются таким же изменениям, т. е. под
влиянием серозного пропитывания кожи связь между эпидермисом
и дермой ослабевает и развивается резко положительный симп-
том Никольского. После разрешения процесса на коже рубцов
не остается.
Температура тела обычно субфебрильная, но при тяжелом
течении болезни поднимается до 39—40 °C. Ребенок плохо сосет,
теряет массу тела. В периферической крови выявляется лейко-
цитоз со сдвигом лейкоцитарной формулы влево, быстро разви-
вается гипохромная анемия, увеличивается СОЭ. В биохимических
анализах крови гипопротеинемия, диспротеинемия, гипохолесте-
ринемия. Нередко возникают диспепсические расстройства, пнев-
мония, пиелонефрит, отиты, гнойный конъюнктивит, флегмоны
527
и абсцессы, кандидоз слизистых оболочек. Тяжелое и осложнен-
ное течение болезни может закончиться летальным исходом.
В последние годы наблюдается более доброкачественное и лег-
кое течение эксфолиативного дерматита в виде «абортивной»
формы с незначительной гиперемией кожи, пластинчатым шелуше-
нием без образования эрозий. При этом общее состояние ребенка
не нарушено.
Эксфолиативный дерматит необходимо дифференцировать от
десквамативной эритродермии и врожденного ихтиоза, а также от
токсического эпидермального некролиза Лайелла. В отличие от
эксфолиативного дерматита при врожденном ихтиозе отмечается
уже при рождении ребенка эритродермии, симптом «коллодий-
ной пленки» с последующим образованием крупнопластинчатого
шелушения, трещин в складках кожи, эктропиона век, деформа-
ции ушных раковин и других изменений. При десквамативной
эритродермии отсутствуют деформации, отмечается шелушение в
пределах рогового слоя без обнажения дермы; дерматоз возни-
кает чаще к концу первого месяца жизни. Симптом Никольского
отрицателен и при врожденном ихтиозе, и при десквамативной
эритродермии.
Тяжелая форма эксфолиативного дерматита имеет большое
сходство с токсическим эпидермальным некролизом Лайелла
(ТЭН), возникающим из-за повышенной чувствительности к раз-
личным лекарственным препаратам (антибиотики, сульфанилами-
ды, барбитураты, анальгетики, противотуберкулезные препараты
и др.). Необходимо также помнить о том, что у детей в возрасте
до 5 лет возможно развитие стафилококкового ТЭН. Клиническая
картина поражения кожи при нем соответствует болезни Риттера.
Этот синдром связан с проникновением в организм ребенка ста-
филококка, относящегося к фаговой группе II, но вырабатываю-
щего особый токсин, вызывающий отслойку эпидермиса под зер-
нистым слоем. При медикаментозном ТЭН поражаются более глу-
бокие слои эпидермиса с вовлечением базального слоя.
Лечение. Основные принципы рациональной терапии больных
стафилодермиями сводятся к назначению средств антибактериаль-
ного действия, затем повышающих защитные силы, корригирую-
щих обменные нарушения и функциональные расстройства орга-
низма. Важное значение имеет рациональный уход за больными.
При эксфолиативном дерматите новорожденных помещают
в кувезы или под специальные каркасы с электролампами внутри
для поддержания постоянной температуры 22—24 °C или обкла-
дывают теплыми (негорячими!) грелками. Большую роль играет
правильное питание. При тяжелом течении эксфолиативного дер-
матита больных запрещается прикладывание к груди; необходимо
кормить их сцеженным молоком, иногда приходится кормить
дробно малыми дозами (10—12 раз в сутки) и даже пипеткой
через нос. При гипогалактии у матери следует использовать до-
норское женское молоко.
При всех стафилодермиях с распространенным поражением
528
кожи с выраженными нарушениями общего состояния (токсикоз,
повышение температуры, снижение массы тела, различные ослож-
нения), при псевдофурункулезе, даже если процесс на коже имеет
ограниченный характер, необходимо комплексное лечение. С уче-
том чувствительности выделенных штаммов стафилококков обяза-
тельно назначаются антибиотики в виде полусинтетических пени-
циллинов (оксациллин, метициллин, диклоксациллин), линкоми-
цинов, устойчивых к пенициллиназе. Антибиотики вводят внутри-
мышечно (3—4 приема); индивидуальная продолжительность за-
висит от общего состояния ребенка. Применяют у-глобулин (2—
6 инъекций), вливания антистафилококковой плазмы по 5—8 мл
на 1 кг массы тела (не менее 3 вливаний с 2—3-дневными ин-
тервалами). Для борьбы с токсикозом и коррекции кислотно-
основного и водно-солевого гомеостаза вводят внутривенно 20 %
раствор глюкозы, гемодез, альбумин, плазму, полиглюкин. При
упорных диспепсических явлениях в связи со стафилококковым
поражением кишечника применяют лактобактерии и бифидум-
бактерин. Используется комплекс витаминов А, С, группы В. Де-
тям в возрасте более 3 мес при рецидивирующих множественных
абсцессах назначают инъекции стафилококкового анатоксина.
При хорошем общем состоянии ребенка, нормальной темпера-
туре, удовлетворительном заживлении пупка, при небольшом коли-
честве высыпаний типа везикулопустулеза достаточно применять
лишь наружное лечение. При пемфигоиде новорожденных, даже
при единичных элементах и хорошем общем состоянии, необхо-
димо назначение антибиотиков вследствие высокой контагиозное-
ти этого заболевания.
Важное значение имеет проведение рационального наружного
лечения. Элементы везикулопустулеза и пемфигоида следует
вскрывать стерильной иглой и смазывать 2—3 раза в день 2 %
спиртовыми (50°) или водными растворами анилиновых красите-
лей (бриллиантовый зеленый, метиленовый синий), затем исполь-
зуется присыпка 5—10 % окиси цинка с тальком. Множественные
абсцессы необходимо систематически вскрывать скальпелем, уда-
лять гной, а кожу после этого смазывать 1—2 % растворами
анилиновых красителей. Для рассасывания абсцессов в области
туловища и конечностей используется электрическое поле УВЧ
(5—8 сеансов), а после этого назначается общее УФО (15—
20 сеансов).
При эксфолиативном дерматите свисающие остатки эпидерми-
са осторожно удаляют стерильными ножницами. Участки непора-
женной кожи смазывают 1—2 % водными растворами анилино-
вых красок. В целях адсорбции серозного содержимого и защиты
кожного покрова от раздражения пеленками применяют присыпку
из 5 % окиси цинка с тальком. Белье должно быть стерильным.
В боксе, где находится ребенок, включают бактерицидные лампы.
Такое же лечение назначают и больным, страдающим синдромом
стафилококковой обожженной кожи (SSS-синдром).
В целях профилактики аутоинокуляции необходимо очень ос-
529
торожно купать грудных детей, страдающих стафилодермиями.
Если позволяет общее состояние ребенка, целесообразны ежеднев-
ные ванны со слабым (бледно-розового цвета) раствором калия
перманганата.
Профилактику стафилодермий у новорожденных необходимо
проводить в антенатальном, интранатальном и постнатальном пе-
риодах. Неспецифическую резистентность беременных следует по-
вышать путем использования полноценного, калорийного питания,
установления правильного режима труда, отдыха, сна. Необходимо
своевременно выявлять и рационально лечить очаги острой и хро-
нической инфекции у будущих матерей. Важное значение имеет
соблюдение санитарно-гигиенического режима в родильном доме.
Проведение в антенатальном и постнатальном периодах среди
матерей санитарно-просветительной работы по профилактике ста-
филодермий является также эффективной мерой предупреждения
этих серьезных заболеваний.
СТРЕПТОДЕРМИИ У ДЕТЕЙ РАННЕГО ВОЗРАСТА
Импетиго наблюдается у детей от ясельного до школьного
возраста и является самой частой формой стрептодермии. Ис-
точник инфекции — чаще всего больные стрептококковыми заболе-
ваниями кожи, а также слизистых (хронический ринит, ангина,
скарлатина). Возбудитель передается через предметы быта (белье,
одежда, игрушки), инфицированные руки, насекомых (мухи и
др.). Заболевание может развиться первично на неизмененной
коже, но чаще возникает у детей после расчесывания очагов
экземы, нейродермита, крапивницы, при чесотке, укусах насеко-
мых, после насморка, гнойного отита, блефароконъюнктивита и
др. Кроме того, нарушение иммунологической реактивности ре-
бенка, возникающее при любом инфекционном заболевании, же-
лудочно-кишечных расстройствах, гипотрофии и др., может также
оказаться патогенетическим фактором в развитии импетиго.
Клиника. Заболевание характеризуется появлением на от-
крытых участках кожи (лицо, руки) фликтены размером до лес-
ного ореха с серозным или серозно-гнойным содержимым, воз-
никновению которой предшествует наличие небольшого пятна
розово-красного цвета. Эволюция фликтен — 5—7 дней; после
вскрытия пузырей образуются эрозии, экссудат которых ссыхается
в корочки. После их отторжения остаются нестойкие розовые
пятна без рубцов и атрофии. На волосистой части головы могут
быть временные очаги алопеции.
Наиболее контагиозной формой, часто встречающейся у детей,
является вульгарное (обыкновенное) импетиго, представляющее
собой смешанное стрептостафилококковое поражение кожи, при
котором после засыхания экссудата фликтен появляется толстая
зеленовато-желтого цвета «медовая» корка с идущей под ней
эпителизацией. После заживления через 1—2 нед остается вре-
530
менно пигментация. При этой форме импетиго неоднократно наб-
людались и описывались вспышки заболевания в семьях и детских
коллективах. Следует всегда учитывать, что при распространенных
формах импетиго у ребенка может развиться пиелонефрит.
У детей наряду с импетиго кожи лица могут появляться флик-
тены на слизистой оболочке губ, щек, десен, твердого неба и
языка, слизистой носа. Следует помнить, что существует тесная
связь между стрептодермией и скарлатиной: при подъеме заболе-
ваемости скарлатиной обычно увеличивается количество больных
стрептодермией и наоборот.
Различают следующие клинические разновидности стрепто-
коккового импетиго.
Папуло - эрозивная стрептодермия (син.: си-
филоподобное папулезное импетиго или пеленочный дерматит)
встречается у детей грудного возраста, нередко у новорожденных,
и не наблюдается в более старших возрастных группах.
Заболевание часто наблюдается у детей, кожа которых раз-
дражается и мацерируется под влиянием мочи и кала. Особенно
часто это наблюдается при жидком стуле и механическом раз-
дражении, вызванном непромокаемыми пеленками, мешающими
испарению. Иногда этому способствуют синтетические моющие
средства, содержащие препараты хлора или сильные щелочи, про-
никающие в пеленки. Особое значение придается раздражающему
действию аммиака, образующегося из мочи в смоченных ею пелен-
ках, и щелочной реакции кала, в случаях если ребенок вскармли-
вается коровьим молоком. У детей, находящихся на естественном
вскармливании, «кислые испражнения» также раздражают кожу.
Указанные химические и механические раздражения создают наи-
более благоприятные условия для проникновения и жизнедея-
тельности стрептококка. Имеются сообщения об обнаружении
Candida albicans на коже и в кале больных, страдающих пеленоч-
ным дерматитом [Weston W. L. et al., 1980; Rebora A., Leyden J.,
1981, и др.].
Клиника. Поражаются кожа ягодиц, задней и внутренней
поверхности бедер, иногда промежности, мошонка, на которых по-
являются синюшно-красного цвета, плотноватые на ощупь папулы
размером с горошину, окруженные островоспалительным венчи-
ком. На поверхности папул возникают фликтены, которые, быстро
вскрываясь, оставляют мелкие эрозии и корочки (рис. 118). Эле-
менты сыпи весьма сходны с сифилитическими папулами, но
отличаются от них быстрым эрозированием и наличием по пе-
риферии ободка отслоившегося рогового слоя после вскрывшихся
фликтен. Отсутствуют высыпания на слизистых оболочках и дру-
гие изменения, характерные для сифилиса (исследования на блед-
ную трепонему с очагов поражения и серологические реакции
крови дают отрицательный результат).
Буллезное импетиго. Характеризуется появлением на
разных участках кожи, обычно вблизи складок, на нижних ко-
нечностях, тыльной стороне кистей единичных либо множествен-
531
Рис. 118. Папулезно-эрозивная стрептодермии.
ных вялых, а иногда напряженных пузырей, величиной от горо-
шины до яйца и больше, наполненных серозным мутным содер-
жимым, окруженных гиперемированным венчиком. На местах
вскрывшихся пузырей имеются эрозии, покрытые тонкими короч-
ками, вокруг которых имеются остатки покрышки пузыря. Иногда
появляются лимфангиты и лимфадениты, повышается температура
до 38—38,5 °C, появляются головная боль, общее недомогание.
В клиническом анализе крови — лейкоцитоз, нейтрофилез со сдви-
гом влево, увеличена СОЭ.
Щелевидное импетиго (син.: заеда, угловой стоматит).
Инфекция передается от ребенка к ребенку через соски, игрушки.
Заболевание может иметь семейный характер, распространяясь
через полотенце, посуду, при поцелуях. В углах рта, наружных
углах глазных щелей, у основания крыльев носа появляются
быстро вскрывающиеся фликтены, образуются линейные трещины
и эрозии. Отмечается слюнотечение, болезненность, зуд. Из-за по-
стоянной травматизации кожи углов рта во время еды, слюноте-
чения, привычки облизывать углы рта, наличия ринита, конъюнк-
тивита эта разновидность импетиго протекает часто хронически
(недели, месяцы), особенно при гиповитаминозе Вг, Be и при
нерациональном лечении. В слюне при заедах находят большое
количество стрептококков. Дифференциальный диагноз необходи-
мо проводить с поверхностным кандидозом углов рта, при кото-
ром, кроме более глубоких трещин, имеются молочница, паро-
нихии. В отличие от заеды при эрозивных сифилитических папу-
лах более выражен инфильтрат, который распространяется и на
слизистые оболочки, и выявляются другие признаки сифилиса, в
том числе бледная трепонема в-тканевой жидкости.
• Околоногтевое импетиго (син.: поверхностный пана-
риций) характеризуется появлением вокруг одной или нескольких
532
ногтевых пластинок множества фликтен с серозно-гнойным со-
держимым, расположенных на воспалительном основании. Флик-
тены легко разрываются, образуя поверхностную эрозию, под-
ковообразно окружающую ногтевой валик. Фаланга становится
отечной, болезненной, возможно отторжение ногтевой пластинки.
Иногда нарушается общее состояние, появляется озноб, повыше-
ние температуры до 37,5—38,0 °C. Локтевые лимфатические узлы
увеличены и болезненны. Поверхностный панариций может пре-
вратиться в глубокий с выраженным инфильтратом, обилием гноя
и упорным течением. Дерматозу предшествуют механические по-
вреждения околоногтевого валика, заусеницы.
Интертригинозная стрептодермии чаще наблюдается у детей
с паратрофией, избыточной массой тела, сахарным диабетом,
повышенной потливостью. Характерна локализация на соприка-
сающихся поверхностях крупных складок (паховых, подмышеч-
ных, шейной, ягодичной) и чаще всего за ушными раковинами,
где образуются фликтены величиной с горошину. После их вскры-
тия остаются мокнущие эрозии красного цвета, сливающиеся
между собой и поэтому имеющие фестончатые резкие границы с
бордюром отслаивающегося эпидермиса по периферии и наличием
линейных болезненных, иногда кровоточащих трещин в централь-
ных частях очага поражения. При разрешении процесса обра-
зуются желтовато-бурые корочки, а затем отрубевидное шелуше-
ние, после чего остается временная пигментация.
Сверлящая, прободающая, или пронизывающая,
эктима является наиболее тяжелой формой язвенной стрепто-
дермии, к которой присоединяется синегнойная палочка. Пато-
логический процесс возникает у недостаточно ухоженных, исто-
щенных детей первого года жизни после перенесенных инфек-
ционных и общих заболеваний. Образуются небольшие, величиной
от горошины до лесного ореха, глубоко проникающие в дерму, а
иногда в подкожную жировую клетчатку, резко болезненные
язвы, дно которых покрыто слизисто-гнойным или кровянистым
отделяемым. Заболевание сопровождается нарушением общего со-
стояния, повышением температуры, увеличением регионарных
лимфатических узлов. Прогноз весьма серьезен.
Рожа — острое рецидивирующее стрептококковое заболевание
кожи и подкожной клетчатки. Инкубационный период длится
от нескольких часов до двух дней. Источником инфекции могут
оказаться медицинский персонал и матери, страдающие стрепто-
кокковыми заболеваниями, в том числе ангинами. У новорож-
денных и детей первых трех месяцев жизни болезнь имеет очень
тяжелое течение. Входными воротами для инфекции у новорож-
денных детей чаще всего является пупочная ранка, реже — об-
ласть гениталий и анального отверстия. Возможно проникновение
стрептококка в кожу и гематогенным путем из очага инфекции
на коже или из слизистых оболочек рта и носа.
При развитии рожи у новорожденного поваляется розово-
красного цвета пятно с нерезкими границами, плотное, теплое на
533
ощупь, с выраженным воспалительным отеком и инфильтрацией
подлежащих тканей. Воспалительные явления быстро распро-
страняются на нижнюю часть живота, область гениталий, ниж-
ние конечности, на грудь, спину, реже на лицо. Из-за большой
склонности к миграции у новорожденных детей называют рожу
«бродячей» или «путешествующей».
Общее состояние ребенка тяжелое, температура 39—40 °C,
нарастает интоксикация, вялость, появляются частые срыгивания,
рвота, тахикардия, развиваются септические осложнения в виде
гнойного отита, бронхопневмонии, пиелонефрита, перитонита, ге-
патита, менингита (при роже лица).
Следует учитывать, что у ослабленных детей в самом начале
болезни температура может быть нормальной или субфебрильной
(37,1—37,3 °C), а у недоношенных с гипотрофией наблюдается
даже гипотермия.
Весьма тяжелое течение отмечается при гангренозной роже,
обусловленной вторичным инфицированием (синегнойная палочка,
симбиоз Венсана).
Прогноз при роже у новорожденных и детей раннего возрас-
та может оказаться тяжелым.
Лечение детей, больных стрептодермией. Из общих средств
детям, страдающим распространенным, торпидно текущим импети-
го, буллезной стрептодермией, поверхностным панарицием, эк-
тимой, рожей назначается антибактериальная терапия антибио-
тиками резерва (линкомицин, цепорин, фузидин-натрий, гента-
мицина сульфат и др.) или полусинтетическими пенициллинами.
Одновременно используются стимулирующая терапия с примене-
нием у-глобулина или полиглобулина, витамины А, С, группы В.
Кроме того, при необходимости используются трансфузии крови,
плазмы, альбумина, сердечные средства, УФО.
Наружная терапия. В основе успешных лечебных меро-
приятий лежит частая смена пеленок. Не следует использовать
клеенки, прорезиненный материал. При импетиго вскрывают пу-
зырьки и пустулы и смазывают 2—3 раза в день водными или
спиртовыми растворами анилиновых красителей (метиленовый си-
ний, бриллиантовый зеленый). Для снятия корок в области воло-
систой части головы и на других участках кожи используют мази
с дезинфицирующим, кератолитическим и кератопластическим
действием (1 % салициловый вазелин, 1 % резорцин, 3 % нафта-
лан, 3—5 % дерматол). Не следует применять мази, содержащие
сульфаниламиды и антибиотики, из-за возможности развития ал-
лергического дерматита; вредны и мази, в состав которых входят
гормоны. Не могут быть использованы и препараты ртути, борная
кислота вследствие высокой токсичности для детей грудного воз-
раста. При интертригинозных формах стрептодермии, заедах, па-
пуло-эрозивной стрептодермии, эктимах принципы наружного ле-
чения те же. При роже у детей наружное лечение не применяют.
Профилактика стрептодермий весьма важна как в быту,
так и в детских учреждениях (соблюдение необходимого гигие-
534
нического режима). Дети, страдающие различными формами им-
петиго, должны быть изолированы от здоровых детей до полного
излечения. Помещения, в которых они находятся, необходимо
систематически проветривать, делать в них влажную уборку.
Среди населения следует проводить соответствующую санитарную
пропаганду (лекции, беседы, брошюры, санитарные листки).
ДЕТСКАЯ ЭКЗЕМА
Экзема у детей, так же как и у взрослых, является островос-
палительным хроническим рецидивирующим аллергическим дер-
матозом. По частоте заболевания и распространенности детская
экзема в ее различных проявлениях составляет 30—40 % всех
кожных болезней у детей [Студницин А. А., Скрипкин Ю. К.,
1979].
Этиология и патогенез детской экземы определяются своеобра-
зием морфологических и физиологических особенностей детского
возраста, генетическими факторами. В грудном возрасте, когда
имеет место иммунологическая и ферментативная недостаточ-
ность, провоцирующие механизмы в виде искусственного вскарм-
ливания, погрешностей ухода способствуют раннему формирова-
нию экземы, особенно у детей с наличием патологической наслед-
ственности. У матерей детей, больных экземой, часто констати-
руются патология беременности и наличие сопутствующих забо-
леваний в период беременности, нерациональное питание. У детей
раннего детского возраста, когда наблюдается выраженное состоя-
ние иммунодефицита, этиологическими факторами нередко явля-
ются бактериально-вирусные инфекции или состояние лекарст-
венной аллергии в результате сенсибилизации антибиотиками
(чаще всего пенициллином, его полусинтетическими производ-
ными) и сульфаниламидными препаратами. В этом периоде дет-
ства особенно активно способствует формированию экземы про-
филактическая иммунизация вследствие патологического измене-
ния функциональной активности пула Т-лимфоцитов, сниженной
иммунологической толерантности и увеличенного количества В-
лимфоцитов, продуцирующих не свойственные детскому организму
антитела. Ряд авторов (Выгодчиков Г. В., 1963; Попхристов П.,
1963; Нобл У. К., 1986, и др.] придают решающее этиологическое
значение в развитии экземы у детей пиококкам. Л. А. Штейнлухт
и соавт. (1971) констатировали у больных экземой наиболее
интенсивную обсемененность патогенными стафилококками в виде
сплошного роста колоний. У. К. Нобл и соавт. (1986) объясняют
появление экзематозной мокнущей реакции кожи в ответ на пио-
генные кокки сниженным уровнем иммунного ответа, когда нет
достаточной активности фагоцитоза. Н. В. Шатилова и соавт.
(1980) у больных экземой выявили дисиммуноглобулинемию:
дефицит IgM при избытке IgE с уменьшением числа функциональ-
но активных Т-лимфоцитов и увеличением количества В-лимфо-
535
цитов. Наиболее выраженная иммунопатология установлена у
больных, носителей изоантигенов А, М, N и резуса D4-. Перечис-
ляя патогенетические механизмы формирования экземы, помимо
генетической предрасположенности, метаболических расстройств,
иммунодефицита, сложных нейроэндокринных и гуморальных
сдвигов, следует остановиться на ферментопатиях желудочно-
кишечного тракта, сочетающихся с дисбактериозом кишечника.
Снижение функциональной активности ферментов и гормонов
желудочно-кишечного комплекса сопровождается нарушением ко-
личественного и видового состава, изменением свойств и локали-
зации кишечной микрофлоры. Появление в кишечнике патоген-
ных микроорганизмов, а также возникновение процессов броже-
ния и разложения непереваренного пищевого состава вызывают
дополнительное антигенное раздражение, усиление эндогенной
интоксикации, активизацию алиментарных аллергических реакций.
Помимо пищевых аллергических факторов, известно «экзема-
тогенное» влияние и других аллергенов. К ним относятся домаш-
няя и атмосферная пыль, частицы пуха, пера, волокна шерсти и
синтетических тканей одежды, ковров, строительных материалов.
Развитию экзематозного процесса у детей способствуют очаги
фокальной инфекции, гельминты (аскариды, острицы и др.). Им-
муногенетические исследования позволили установить достовер-
ную ассоциацию антигенов В22 и CW1, являющихся генетическими
маркерами экземы.
Единой классификации многообразных форм экземы пока не
существует. Клиническое своеобразие проявлений экземы поз-
воляет выделить три наиболее часто встречающиеся разновиднос-
ти: истинную (или идиопатическую), себорейную и микробную.
Истинная (идиопатическая) экзема у детей
обычно формируется в грудном возрасте и констатируется наи-
более часто на любом этапе жизни ребенка. Для клинической
картины детской истинной экземы характерно начало заболева-
ния в период от 3 до 6 мес [Штейнлухт Л. А., Зверькова Ф. А.,
1979]. Проявляется острое экзематозное воспаление отечной яр-
кой эритемой с обильным количеством микровезикул, быстро
вскрывающихся и образующих своеобразные влажные эрозии —
«серозные колодцы» с обильным серозным отделяемым. Сливаясь,
эрозии образуют крупные мокнущие участки. Серозный экссудат
подсыхает с последующим образованием корок, шелушения.
Границы очагов нечеткие, участки поражения рассеянные, пере-
межающиеся с нормальной, неизмененной кожей. Локализация
истинной экземы разнообразная, но чаще начинается симмет-
рично на лице в области щек и вокруг рта. Нередко одновре-
менно поражаются волосистая часть головы, ушные раковины,
шея. Истинной экземе свойственно прогрессирующее течение и в
короткий срок процесс распространяется по всему кожному по-
крову. В период диссеминации высыпаний наблюдаются субфеб-
рилитет, диспепсические расстройства, значительный зуд, невро-
тические симптомы с нарушением сна.
536
Себорейная экзема у детей проявляется острыми
воспалительными очагами на местах, где имеется значительное
количество сальных желез: на волосистой части головы, лице, уш-
ных раковинах (и позади них), в паховых, подмышечных и шей-
ных складках. В отличие от истинной экземы при себорейной
явной везикуляции не наблюдаются. Более характерно наличие
желтовато-серых чешуек или чешуйко-корок. Микровезикуляцию
и кратковременное мокнутие можно видеть лишь в период резкого
обострения процесса или при локализации сыпи в складках, как,
например, это часто бывает за ушными раковинами. Поражение
в области волосистой части головы многими педиатрами называет-
ся гнейсом. При этом на эритематозно-отечной коже всей воло-
систой части головы или очагов в области темени выявляются
плотно сидящие корки, чешуйки грязно-серого или буровато-жел-
того цвета. У части детей в поражение вовлекаются и другие
участки — кожа лица, ушных раковин, шеи, груди, крупных скла-
док. Гнейс встречается только у детей грудного возраста, причем
в основном в первые недели жизни.
При себорейной экземе роль вторичной инфекции весьма зна-
чительна, особенно при локализации процесса на волосистой час-
ти головы и в складках кожи. Поэтому наряду с типичными се-
борейными бляшками имеются массивные импетигинозные корки,
присоединяется блефарит. Вследствие этих особенностей нозоло-
гическая самостоятельность себорейной экземы оспаривается.
Себорейная экзема является более ранним заболеванием, чем
истинная, и возникает на второй — третьей неделе жизни, тогда как
истинная экзема чаще формируется на третьем—шестом месяце.
Микробная экзема у детей отличается от истинной
и себорейной экземы выраженной сенсибилизацией к бактериаль-
ной инфекции, грибковой флоре или дрожжевым микроорганиз-
мам. Процесс аллергизации и формирования гиперчувствитель-
ности замедленного типа к различным микробным факторам
совершается на фоне иммунодефицита, нейроэндокринных измене-
ний, висцеральных нарушений и сочетается, как правило, с оча- ,
гами хронической инфекции типа отита, гайморита, тонзиллита,
конъюнктивита, синусита. Состояние сенсибилизации подтвержда-
ется повышенными титрами стрепто- и стафилокиназы, стрепто-
лизина и стафилолизина, положительными кожными тестами со
специфическими антигенами. Способность микробной флоры при-
обретать активные аллергизирующие свойства на фоне поливалент-
ной аутосенсибилизации была доказана путем обнаружения сы-
вороточных аутоантител к бактериальным антигенам.
Иммунодефицитное состояние способствует персистенции ин-
фекционных антигенов с образованием патологических иммунных
комплексов, базирующихся в эпидермисе и в дерме и вызывающих
хроническое воспаление без пустулизации. Поэтому микробная
экзема по своим клиническим проявлениям отличается от пиодер-
мии и импетигинизации, осложняющих различные дерматозы.
Процесс начинается с образования пустулезных эффлоресцен-
537
ций стрепто- или стафилококкового характера или с царапины,
экскориации, быстро превращающихся в отечный гиперемирован-
ный очаг с четкими границами, правильно округлых или овальных
очертаний. На поверхности поражения очаги мокнутия и серозных
«колодцев» чередуются с массивным наслоением серозно-гнойных
корок. Границы участков микробной экземы окаймлены характер-
ным подрытым бордюром отслоившегося эпидермиса, представ-
ляющего собой остатки стрептококковых фликтен. В окружности
на фоне видимо неизмененной кожи можно видеть отдельные
пустулы типа остиофолликулитов, стрептогенного импетиго или
мелкие красные пятна, представляющие собой воспаленные отвер-
стия волосяных фолликулов в стадии начального формирования
стафилококковых остиофолликулитов.
Очаги микробной экземы располагаются несимметрично, не
имеют тенденции к слиянию и локализуются на верхних и ниж-
них конечностях, Тыле кистей и стоп, иногда на коже туловища.
Для микробной экземы характерно усиление аллергической реак-
тивности при раздражении основного очага. Обычно это проис-
ходит под влиянием механического раздражения, а чаще вслед-
ствие нерационального лечения с применением согревающих по-
вязок или мазевой терапии.
Для микробной экземы характерны вторичные аллергические
высыпания, обильные и рассеянные на местах, отдаленных от ос-
новного очага дерматоза. Они манифестируют эритематозно-
отечными пятнами без резких, правильных границ. Часто на их
поверхности образуются папуло-везикулы или везикулы, превра-
щающиеся в мокнущие эрозивные участки. При прогрессирующем
течении болезни аллергические вторичные эффлоресценции, или,
как их часто именуют, «микробиды», склонны к слиянию и обра-
зованию упорно существующих мокнущих участков, что свидетель-
ствует о трансформации микробной экземы в истинную. Такое же
превращение происходит и с себорейной экземой при нерациональ-
ном лечении.
При любой клинической форме экземы у детей наблюдается
изменение слизистых оболочек. Чаще можно констатировать
конъюнктивит или хейлит, а у некоторых больных отмечаются
катаральные явления в зеве, носоглотке, у девочек — вульво-
вагинит.
У половины больных регистрируется увеличение регионарных
лимфатических узлов или полиаденит. В периферической крови у
больных истинной экземой преобладает эозинофилия, а у больных
микробной экземой выявляется увеличенное количество палочко-
ядерных форм.
Диагноз экземы в любой ее разновидности устанавливается
на основании острого воспаления участков поражения, полимор-
физма высыпаний, характерного течения и наличия мокнутия.
Дифференциальный диагноз проводится с герпетиформной
экземой Капоши (вакциниформным пустулезом), диффузным ней-
родермитом, дерматозом Дюринга и детской почесухой.
538
У больных герпетиформной экземой Капоши анамнестически
выявляется контакт с больным, страдающим простым герпесом.
Клинически, помимо резкого ухудшения общего состояния с вы-
соким фебрилитетом, наблюдается появление вариолиформных
пустулезных элементов с значительным наслоением геморраги-
ческих корок. В морфологии крови исчезает эозинофилия. При
нейродермите и детской почесухе выступают четко симпатерги-
ческие синдромы: белый, стойкий дерматографизм, выраженный
пиломоторный рефлекс, отмечается преобладание инфильтрации
и лихенизации, особенно в локтевых сгибах, на боковых поверхно-
стях шеи или в области лучезапястных суставов. Герпетиформный
дерматит Дюринга отличается наличием крупных пузырей, отсут-
ствием спонтанного мокнутия, герпетиформным расположением
высыпаний и значительно увеличенным количеством эозинофилов
не только в периферической крови, но и в содержимом пузырей.
Кожный тест, по Ядассону, с йодидом калия для исключения дер-
матита Дюринга проводить не рекомендуется, так как в детском
возрасте экзематозные высыпания на йодистые препараты реаги-
руют обострением.
Лечение. Желательно у каждого ребенка выявить факторы,
способствовавшие развитию дерматоза и поддерживающие его
хроническое течение. Разнообразие и множественность этиологи-
ческих и патогенетических механизмов и причин обусловливают
необходимость индивидуального подхода с учетом антенатальных
и постнатальных особенностей ребенка. Если раньше основной
акцент в терапии производился на устранении воздействия аллер-
генов, десенсибилизирующем лечении, то в настоящее время в свя-
зи с успехами гастроэнтерологии, иммунологии становится оче-
видным, что на первый план, особенно у детей грудного возраста,
выступают ферментопатия и иммунодефицитное состояние.
Поэтому лекарственное лечение приходится назначать как второ-
степенное, отрегулировав на первом этапе желудочно-кишечное
переваривание. Иначе даже хорошо действующие антигистаминные
и противовоспалительные средства могут дать извращенную или
парадоксальную реакцию из-за патологии усвоения. Следова-
тельно, после тщательного обследования основными моментами
лечения будут следующие: корректировка питания и общего режи-
ма, санация очагов хронической инфекции в комплексе с меди-
каментозным лечением с применением общих и наружных ме-
тодов.
Режим питания и диету назначают с учетом воз-
раста, индивидуальных особенностей и способа вскармливания,
обеспечивая нормальное физиологическое развитие ребенка. В пи-
тании детей уменьшают количество углеводов и сахара, так как
они повышают воспалительный потенциал кожи. До ‘/г суточной
потребности в сахаре можно компенсировать сорбитолом или
ксилитом, которые улучшают функцию печеночных клеток и уси-
ливают желчеотделение. Несмотря на существующее правило —
исключать все аллергизирующие продукты, которые вызывают
539
обострение кожного процесса именно у данного ребенка, необ-
ходимо иметь в виду, что аллергическая реакция может быть не
только на тот или иной продукт, а на вещества, образующиеся
при кулинарной обработке или на конечные шлаковые соеди-
нения, формирующиеся в процессе пищеварения при недостаточ-
ной активности ферментатов. Поэтому лечение детей, больных
любой формой экземы, желательно осуществлять комплексно и
направленно на гипосенсибилизацию организма с применением
препаратов, нормализующих процессы пищеварения, дезинтокси-
кацию с санацией очагов хронической инфекции в сочетании с
противовоспалительными, зудоутоляющими средствами.
В целях коррекции дисбактериоза любой степени выраженно-
сти, наблюдаемого часто у детей с аллергодерматозами, рекомен-
дуется назначение препаратов эубиотиков — бифидумбактерина,
лактобактерина или колибактерина. Бифидумбактерин применяют
у детей до 6 мес по 1 дозе 3 раза в сутки в течение 2 нед. Детям
от 6 мес до 3 лет препарат назначают по 2—3—5 доз 2 раза в
сутки за 30 мин до еды в течение 2—3 нед. Бификол употребляют
с той же целью, что и бифидумбактерин. Дозы варьируют от одной
до трех в 1—2 приема в период от 6 мес до 3 лет с последующим
увеличением до 5 доз детям от 3 до 5 лет; срок лечения 3—6 нед.
Лактобактерии назначают по схеме: до 6 мес — 1—2 дозы, от
6 мес до 1 года — 2—3 дозы, от 1 года до 3 лет — 3—4 дозы, а в
возрасте старше 3 лет — по 4—6 доз; срок применения препарата
2—3 нед. Колибактерин используется от 6 мес до 1 года по 4 дозы
на 2 приема в сутки, после 1 года — по 4—6—8 доз на 2 приема
в сутки в виде раствора за 15—20 мин до еды; курс лечения от
3 недель до 2 месяцев.
Восстановление нормальной микрофлоры обычно замедлено
даже в условиях применения комплексной терапии. Нарушения
функциональной деятельности желудочно-кишечного тракта вызы-
вает дополнительное антигенное раздражение, сопровождается
повышением проницаемости эпителиального барьера для пищевых
антигенов с выраженной неустойчивостью водно-солевого обмена.
Наблюдается повышенное содержание натрия в сыворотке крови
и в коже, что значительно увеличивает воспалительный потенциал
тканей, в то время как содержание кальция и магния, способст-
вующих десенсибилизации и уменьшению сосудистой проницаемо-
сти, резко снижается. Поэтому на первом этапе лечения эубиотики
сочетают с препаратами кальция, антигистаминными и противо-
воспалительными средствами. Кальция глюконат, лактат или гли-
церофосфат назначают детям до 1 года в виде 1 % раствора по
1 чайной ложке 3 раза с едой. От 1 года до 2 лет применяется
5 % раствор в соответствующих дозах (курс лечения 4—6 нед).
Гипосенсибилизирующее и противовоспалительное действия
свойственно салицилату натрия, который хорошо переносится и
обладает стимулирующим влиянием на функцию надпочечных же-
лез. Натрия салицилат назначают грудным детям из расчета 0,1 г
на 1 кг массы тела в сутки, что соответствует 1—2 % раствору
540
по 1 чайной ложке 2—3 раза в день после еды. Детям от 1 года до
2 лет назначается 3 % раствор по 1 чайной ложке 3 раза в сутки,
а детям от 2 до 5 лет — 3 % раствор по 1 десертной или столовой
ложке 2—3 раза в день (курс лечения 3—4 недели). Натрия
тиосульфат характеризуется нежным гипосенсибилизирующим и
противовоспалительным влиянием. Он широко используется в
лечении аллергодерматозов и как средство, обладающее стимули-
рующим рассасывающим действием на очаги воспаления [Гурье-
ва И. Г. и др., 1984). Рекомендуется натрия тиосульфат в виде
5 % раствора по 1 чайной, десертной или столовой ложке 3 раза в
сутки в течение 2—3 нед.
Параллельно с одним из названных препаратов целесообразно
включать противозудные антигистаминные средства, обладающие
и антисеротониновым, антибрадикининовым действием. К ним
относятся димедрол, диазолин, супрастин, пипольфен, тавегил,
перитол, фенкарол и др. Их применяют циклами по 7—10 дней
в дозировках, соответствующих возрасту и массе тела. Весьма це-
лесообразно одновременно назначать аскорбиновую кислоту, что
позволяет несколько уменьшить дозу антигистаминных средств,
так как витамин С является их сенергистом. Среди противозуд-
ных средств выделяется кетотифен (задитен), обладающий ак-
тивным спазмолитическим влиянием при бронхоспазмах, аллерги-
ческих бронхитах, бронхиальной астме. Препарат назначают
детям из расчета 0,025 мг на 1 кг массы тела 2 раза в день. Ципро-
гептадин, или перитол, отличается не только антигистаминной
активностью, но и антисеротониновым и антихолинергическим дей-
ствием. Детям применяется только после 6 мес в дозе 0,4 мг на
1 кг массы тела 2 раза в сутки; в возрасте от 2 до 6 лет — по
2—4—6 мг в сутки (‘/4—*/з и 1 /г таблетки) 3 раза; в возрасте
старше 6 лет доза увеличивается до 12 мг в день (по 1 таблетке
3 раза). При выраженных невротических расстройствах, наруше-
нии сна рекомендуются отвары корня валерианы, пустырника, че-
реды, боярышника по 5—10 г на 200 мл воды по 1 десертной
или столовой ложке 3—4 раза в день в течение 1 — 2 нед.
Больным микробной экземой или при осложнении импетигини-
зацией очагов истинной и себорейной экземы применяют сульфа-
ниламидные препараты или антибиотики. Из сульфаниламидных
средств для детей предпочтительно используются в виде гранул
этазол-натрия (для детей от 1 года и старше) и септрин в виде
педиатрической суспензии (детям от 2 до 6 мес по 10—15 капель
2 раза в день; от 6 мес до 5 лет — по ‘/г или 1 чайной ложке
2 раза в сутки в течение 3—5—7 дней). Из антибиотиков наиболее
употребимы макролиды (эритромицин) или антибиотики резерва
(линкомицин, цефамизин, кефзол, фузидин-натрия и др.). Пени-
циллин или полусинтетические пенициллины детям с аллерго-
дерматозами применять нецелесообразно, так как часто у них вы-
является непереносимость или наступает обострение экземы.
У детей с торпидным течением экзематозного процесса ис-
пользуются стимулирующая терапия с назначением у-глобулина,
541
полиглобулина, иммуностимуляторы типа декариса, метилурацила,
нуклеината натрия, пентоксила. По показаниям и при необходи-
мости назначаются витамины комплекса В, препараты железа,
переливания плазмы, альбумина.
Наружное лечение осуществляют в зависимости от стадии
течения процесса и степени воспалительной реакции. При наличии
острого воспаления с мокнутием используются примочки с содер-
жанием бактерицидных, противовоспалительных средств в малой
концентрации (0,25 % раствор сульфата цинка, 1—2 % раствор
амидопирина, 0,5—1 % раствор танина, 0,2 % раствор нитрата
серебра). После прекращения мокнутия назначают пасты, мази,
комбинируемые с глюкокортикоидными кремами и мазями. Хо-
рошо переносятся и действуют противовоспалительно мази и
кремы, не содержащие кортикостероидных гормонов: бутадиено-
вая мазь, кремы «Dermazin», «Clotrimazol». Для наружной тера-
пии себорейной и микробной экземы в период острого воспаления
или явлениях импетигинизации используются противовоспали-
тельные, часто сменяемые примочки: 0,25—0,5 % Sol. Amidopy-
rini, 1—2 % Sol. ас. Tannici, 1—2 % раствор жидкости Бурова.
Хорошо уменьшают степень отека и гиперемии, ликвидируя ве-
зикуляцию, примочки из отвара крепкого чая или корня алтея.
Последующим этапом наружного лечения является назначение
паст или водных взбалтываемых смесей, действующих противо-
воспалительно. Для усиления противозудного эффекта к пастам
и взбалтываемым смесям добавляют димедрол, нафталанскую
нефть. Характерным свойством микробной экземы является
успешное разрешение высыпаний при назначении дезинфицирую-
щих антипаразитарных мазей — борно-дегтярной, эритромицино-
вой, неомициновой, гентамициновой или других, содержащих анти-
биотики и редуцирующие средства.
НЕЙРОДЕРМИТ
Принято считать, что экземой дети болеют до 3 лет, а при
упорном торпидном течении экзема трансформируется в нейро-
дермит. Действительно, такое явление имеет место и причиной его
чаще всего бывает не только нерациональное лечение, но и свое-
образие гомеостаза организма с наследственной отягощенностью.
В связи с этим считается, что экзема детей, диссеминирован-
ный нейродермит, строфулюс, почесуха вульгарная и почесуха
Бенье являются отдельными стадиями единого аллергического из-
мененного конституционального состояния, обусловленного гене-
тическим предрасположением.
Этиология, патогенез. Так же как и у больных экземой, в
этиологии и патогенезе нейродермита имеют место ферментопатии
с дисбактериозом желудочно-кишечного тракта, интоксикации,
расстройства деятельности внутренних органов, желез внутренней
секреции, обменные нарушения, выраженная аллергическая ре-
активность к домашней пыли и другим бытовым аллергенам.
542
Однако у больных нейродермитом, особенно диффузным (диссе-
минированным), все эти факторы выражены интенсивнее. Кроме
того, аллергическая реактивность с гиперчувствительностью не-
медленно-замедленного типа проявляется чаще более бурно и по-
этому нейродермит нередко сочетается с бронхиальной астмой,
вазомоторным ринитом, конъюнктивитом, крапивницей. Весьма
часто отмечается непереносимость некоторых лекарственных пре-
паратов (особенно антибиотиков, антигистаминных средств, на-
пример димедрола, и др.). У детей, больных нейродермитом, так
же как и у их родителей, выражена функциональная лабильность
нервных процессов — возбуждения и торможения, что позволяет
предположить у них наследственный или врожденный характер
невротических расстройств. У части же больных невротические
проявления возникают вторично как результат длительного, упор-
ного зуда, нарушений сна. Таким образом, неврогенный фактор
может иметь как этиологическое, так и патогенетическое значение.
Помимо перечисленных патогенетических механизмов, у детей с
диффузным нейродермитом выявляются очаги фокальной ин-
фекции на фоне вторичного иммунодефицита, гельминтозы, по-
ниженная функция коры надпочечников (гипокортицизм), повы-
шенная функция вилочковой железы, щитовидной и паращито-
видных желез, изменение активности и соотношения биологически
активных веществ: гистамина, серотонина, брадикинина. Влияние
неблагоприятных факторов внешней среды (погрешности ухода,
питания, психоэмоционального климата, атмосферных сдвигов)
отягощает клиническую картину болезни.
Клиника. В зависимости от распространенности процесса
различают ограниченную (Neurodermitis circumscripta) и диссеми-
нированную диффузную (Neurodermitis diffusa) формы нейродер-
мита. В настоящее время термин «нейродермит», предложенный
Л. Броком в 1891 г., употребляется зарубежными дерматологами
только для ограниченной формы болезни, а диффузный нейродер-
мит описывается под названиями «атопический дерматит», «ато-
пическая экзема», «диатезное пруриго» Бенье. В нашей стране
термин «диффузный нейродермит» утвердился в дерматологиче-
ской литературе как синоним атопического дерматоза. В связи
с более тяжелым течением генетически обусловленного диффуз-
ного нейродермита некоторые авторы считают рациональным
называть эту форму диффузным нейродермитом атопического ге-
неза в отличие от обычной разновидности, развившейся самостоя-
тельно [Матушевская Е. А., 1986, и др.].
Ограниченный и диффузный нейродермит манифестируют пер-
вично возникающим зудом. Считается, что первичный зуд с после-
дующими экскориациями, лихенизацией является характерным
первичным симптомом нейродермита и только этот признак не-
редко позволяет отграничить разные клинические формы нейро-
дермита от экземы.
Ограниченный нейродермит у детей наблюдается чрезвычайно
редко, обычно в возрасте старше 5 лет, ибо на более ранних
543
возрастных этапах особенности сосудистой системы кожи и ее
иннервации по принципу физиологического резонанса обусловли-
вают распространение и диссеминацию воспалительных очагов.
Возникнув на определенном участке (обычно на боковых поверх-
ностях шеи, в области паховых складок, межъягодичной складки),
кожный зуд сопровождается быстрым появлением папулезных вы-
сыпаний плотной консистенции. Под влиянием расчесов поверх-
ность папул экскориируется и покрывается серозно-геморрагиче-
скими корочками. Постепенно папулы сливаются, инфильтрируют-
ся, приобретают буровато-красный цвет и образуют очаги с
овальными или округлыми очертаниями. Поверхность таких очагов
вследствие слившихся, плотно расположенных лихеноидных узел-
ков неровная, шероховатая и, помимо корок, покрыта значитель-
ным количеством серовато-белых чешуек. В период сформировав-
шихся участков поражения в них можно различать 3 зоны. В центре
очага выделяется зона лихенизации с плотным инфильтри-
рованным основанием; поверхность кожи неровная, «шагреневид-
ная». По окружности зоны лихенизации располагаются лихеноид-
ные папулы, застойно-гиперемированные или буровато-красные с
геморрагическими корочками на поверхности из-за интенсивного
зуда. Границы каждой зоны нечеткие, потому постепенно лихено-
идные папулы окаймляются гиперпигментированным участком
округлой формы типа периферического венчика. В тех случаях,
когда отсутствует периферическая зона пигментации (это бывает
при небольшой длительности заболевания), очаг поражения пред-
ставлен лихенизацией, чередующейся с узелковыми элементами
и большим количеством экскориаций. Возникновение зонального
расположения лихенизации и папулезных высыпаний характерно
для хронического рецидивирующего процесса и отмечается у детей
старшего возраста.
Диффузный (диссеминированный) нейродермит манифестиру-
ет инфильтрированными узелковыми элементами, быстро образую-
щими лихенификацию кожи на фоне эритемы неостровоспали-
тельного характера. Из первичных морфологических элементов
преобладают дермо-эпидермальные папулы застойно-розового цве-
та, а иногда и цвета нормальной кожи. Характерна их склон-
ность к слиянию и образованию участков сплошной папулезной
инфильтрации с множеством экскориаций, геморрагических корок
и мелкопластинчатых чешуек. В области естественных складок
на фоне инфильтрации нередко образуются линейные трещины.
Наиболее частой локализацией очагов диффузного нейродермита
являются лицо, боковые поверхности шеи, локтевые и подколен-
ные сгибы, лучезапястные суставы, область внутренней поверх-
ности бедер и боковых участков спины. Наличие интенсивного
зуда, белого стойкого дермографизма, выраженного пиломоторно-
го рефлекса дополняет симптоматику, характерную для нейро-
дермита как очагового, так и диффузного (диссеминированного).
Вегетодистония, невротические проявления сочетаются с кли-
ническими признаками «малого аддисонизма» — гипокортицизма.
544
К ним относятся гипотония, астенизация с адинамией, гипогли-
кемия, повышенная утомляемость с гипоацидным гастритом.
Для очагового и диффузного нейродермита характерна сезон-
ность течения с периодами самопроизвольного разрешения в
весенне-летнее время и обострениями в осенне-зимний сезон.
Диагноз основывается на характерных пароксизмах зуда,
наличии лихенификации, экскориации, белого дермографизма,
своеобразной локализации очагов поражения.
Дифференцируют от экземы, герпетиформного дерматита Дю-
ринга, узловатой почесухи Гайда, строфулюса, крапивницы,
эритематосквамозной стрептодермии.
Лечение. Неясность этиологии и сложность многофакторного
генеза как очагового, локального нейродермита, так и диффуз-
ной его формы обусловливают трудности и недостаточную эф-
фективность лечения. С целью выявления индивидуальных кон-
ституциональных особенностей ребенка проводится клинико-ла-
бораторное обследование с выявлением наиболее актуальных про-
воцирующих факторов и переносимости лекарственных препара-
тов. В процессе индивидуализированного комплексного лечения
необходимо предусмотреть наличие фоновых патологических сос-
тояний, санацию очаговых хронических инфекций. Поскольку в
патогенезе нейродермита значительная роль принадлежит фер-
ментной недостаточности желудочно-кишечного комплекса, особое
внимание уделяется режиму питания, исключению пищевых про-
дуктов, являющихся облигатными аллергенами, так же как гигиене
жилища, кожи, слизистых. При дисбактериозе, кишечной инфек-
ции осуществляется коррекция пищеварительных процессов с при-
менением эубиотиков (бифидумбактерина, бификола, колибакте-
рина). Детям старшего возраста целесообразно и назначение ки-
шечных ферментов типа фестала, панзинорма, оразы, мезимфорте,
трифермента. При нарушении синтеза витамина Be в кишечнике
в сочетании с недостаточностью триптофана применяется пири-
доксин или пиридоксальфосфат в зависимости от возраста боль-
ного по 0,003—0,02 г в сутки, лучше в утренние часы в течение
4—8 нед. У детей с выраженными невротическими расстройствами
и психоневрологической патологией лечение проводят с участием
психоневролога. Применение транквилизаторов и седативных
средств проводят осторожно из-за возможности парадоксальных
извращенных реакций. Нормализации деятельности центральной
нервной системы, уменьшению невротических реакций способству-
ют соблюдение рационального психогигиенического режима в
семье и детском учреждении, использование препаратов валериа-
ны, пустырника, а также ганглиоблокаторы типа амизила, гангле-
рона, антигистаминные противозудные средства (диазолин, фен-
карол, супрастин, дипразин, тавегил, перитол). У больных, у кото-
рых длительное торпидное течение заболевания, диссеминирован-
ный процесс, приходится кратковременно использовать кортико-
стероидные гормоны: преднизолон, дексаметазон, метипред, урба-
зон в дозах, соответствующих возрасту ребенка и массе его тела.
545
19—936
По мере улучшения процесса дозу кортикостероидных гормонов
постепенно уменьшают до полной отмены. С целью предотвраще-
ния катаболического влияния глюкокортикоидов в комплексе с
ними назначают анаболические стероиды (неробол, метиландро-
стендиол, оротат калия) из расчета 0,1 мг на 1 кг массы тела
больного в течение 2—3 нед. Эти лекарственные препараты по-
вышают активность фагоцитоза, способствуют лучшему усвоению
кальция и фосфора, интенсифицируют выработку защитных ан-
тител и таким образом повышают противовоспалительное дейст-
вие кортикостероидов. При значительной эндогенной интоксика-
ции, астенизации используются внутривенные капельные введе-
ния гемодеза, реополиглюкина, 10 % альбумина, гемотерапия,
плазмотерапия и внутримышечные инъекции спленина. Назнача-
ются у-глобулин или гистоглобин, которые вводятся внутрикожно
или внутримышечно, начиная с 0,05—0,1 мл, затем по 0,25 мл
2—3 раза в неделю с учетом местной, общей и очаговой реакций
(на курс лечения 5—7 инъекций). В стадии инфильтрации без
симптомов прогрессирования, при отсутствии уропорфиринов в
моче назначается УФО. Больным ограниченным и диффузным
нейродермитом с дисбалансом гуморальных и клеточных факторов
иммунитета назначают иммуностимулирующие средства: левами-
зол (декарис), пентоксил, метилурацил, нуклеинат натрия. По-
вышению защитных резервов способствуют и такие витамины, как
аскорбиновая кислота, ретинола ацетат (витамин А) и токоферола
ацетат (витамин Е).
Наружное лечение при очаговом и диффузном нейродермите
проводится с учетом стадии процесса и возраста ребенка. При-
нимая во внимание состояние иммунодефицита и присоединение
вторичной инфекции, рекомендуется очистка кожи растительными
маслами, а также гигиеническое мытье. К. Н. Суворова (1983)
считает необходимым ежедневное тщательное обмывание кожи
под душем или в ванне с применением карболового, борно-тимо-
лового или дегтярного мыла. Используются также ванны из отвара
лечебных трав: подорожника, тысячелистника, душицы, зверобоя,
мать-и-мачехи. На очаги поражения накладываются мази и кремы,
содержащие зудоутоляющие, противовоспалительные, редуцирую-
щие вещества. Наиболее эффективны нафталанская нефть, третья
фракция АСД (антисептик-стимулятор А. В. Дорогова), древес-
ный деготь. Целесообразно в сочетании с этими веществами ком-
бинировать настойку валерианы, календулы, хлоралгидрат и ато-
фан для усиления противозудного и противовоспалительного дей-
ствия. У части больных диффузным нейродермитом наблюдается
непереносимость ланолина, в этих случаях целесообразно исполь-
зовать в качестве основы для мазей и кремов свиное сало, автол,
эмульсионный солидол, спермацет, растительные масла, парафин,
масло какао. На ограниченные очаги поражения накладывают
мази и кремы, содержащие кортикостероидные средства: «Флу-
цинар», «Деперзолон», «Лоринден», 0,5 % преднизолоновую, 1 %
гидрокортизоновую. При наличии импетигинизации используют
546
наружные антибактериальные средства в виде анилиновых краси-
телей, жидкости «Фукорцин», пасты и мази с антибиотиками —
эритромициновая, гелиомициновая, неомициновая и др.
Из физиотерапевтических методов лечения применяются серо-
водородные, радоновые ванны, УФО, гелиотерапия, индуктотер-
мия пояснично-крестцовой области. В этапном и противорециди-
вном лечении диффузного нейродермита широко применяются
санаторно-курортное лечение. В ряде курортов имеются специали-
зированные кожные санатории для детей: Сочи, Пятигорск, Ев-
патория, Анапа, Нальчик и др. Больные направляются на курорт
после купирования предварительным лечением острой фазы ре-
цидива и нормализации лабораторных показателей, характеризую-
щих активность болезни. Учитывая, что в последние годы в нашей
стране широко дискутируется терминология нейродермита и ато-
пического дерматита, мы считаем целесообразным более детально
остановиться на механизмах патогенеза, клинических особеннос-
тях и лечении атопического дерматита.
АТОПИЧЕСКИЙ ДЕРМАТИТ*
Атопический дерматит — наследственное заболевание, имею-
щее хронически-рецидивирующее течение с определенной возраст-
ной динамикой, характеризующееся нарушениями клеточной мем-
бранной активации, гиперчувствительностью ко многим иммунным
и неиммунным стимулам и дисфункцией сосудов кожи. Клиниче-
ская картина проявляется зудящими воспалительными изменения-
ми кожи с истинным полиморфизмом сыпи и лихенификацией,
определенной симметричной топографией, зависящей от возраст-
ных особенностей, часто сочетающимися с функциональными рас-
стройствами нервной системы, нарушениями иммунитета и атопи-
ческими поражениями респираторных органов.
История нозологического выделения атопического дерматита
сложна и имеет давние истоки. Зудящие воспалительные пораже-
ния кожи, начинавшиеся с детского возраста, сопровождавшиеся
нагноением, лимфаденитом, нервозностью, называли «доброкачест-
венными скрофулидами», «сложным лихеном», «скрофулезным ли-
хеном с экземой» и т. д. В конце XIX в. было обращено внимание
на три особенности заболевания: 1) диатезический, семейный и
конституциональный характер, 2) полиморфизм клинической кар-
тины, включавшей экзематозные и лихеноидные сыпи, 3) свое-
образие возрастной эволюции проявлений. Е. Besnier (1892) обо-
сновал самостоятельность этой формы, проследив указанные осо-
бенности в ряде семей. Представив демонстрации под названием
«дерматит полиморфный, пруригинозный, хронический, обостряю-
щийся, с зимними пароксизмами, в преимущественно экзематозно-
лихеноидной форме», он подчеркнул, что это заболевание, начав-
шись в грудном возрасте «детской сыпью» в виде «инфантильных
Раздел написан доктором мед. наук К. Н. Суворовой.
547
19*
эритем», экзематизации, псевдолихенов, далее может перейти в
смягченную форму или длительную ремиссию; позже болезнь «ус-
танавливается» и проявляется лихенифицированными очагами,
периодически осложняясь пароксизмами экзематизации и распро-
страненной импетигинизацией. Была отмечена сезонность, семей-
ность, возможность сочетания с астмой, сенным катаром, желудоч-
но-кишечными болезнями. L. Brocq, подчеркивая важность выделе-
ния новой формы болезни с ее «двойной клинической картиной»,
проявлявшейся экземой и лихенификацией, упомянул о сходстве
одного из ее компонентов, а именно лихенификации с изучавшим-
ся им ранее нейродермитом. После этого обсуждения на фран-
цузском дерматологическом обществе выделенная форма стала
называться в литературе «диатезическим пруриго Бенье». Наряду
с этим сохранялась тенденция рассматривать эти поражения в
рамках симптоматических кожных проявлений детских диатезов,
а позже — аллергических состояний. Однако в работах советских
педиатров диатезы всегда рассматривались как аномалии консти-
туции, а не нозологические формы болезней [Маслов М- С., 1939,
1949; Ахмина Н. И. и др., 1983, и др.].
В 20—30-х годах XX века появилась концепция об атопиче-
ском диатезе, «странной» семейной гиперчувствительности, отли-
чавшейся от приобретенной аллергии отсутствием обязательной
зависимости от сенсибилизации, реакцией на множество безвред-
ных для других лиц провоцирующих факторов. Кожная болезнь
такого типа была названа «атопическим дерматитом» [Weis Т.,
Sulzberger М., 1933; Hill L., Sulzberger М., 1935], атопиче-
ским нейродермитом, атопической экземой. Представленные
описания атопического дерматита соответствовали изложению
клинической картины диатезического пруриго Бенье. Однако
если раньше эта болезнь считалась редкой, то с 40—50-х го-
дов нашего столетия атопический дерматит считается во мно-
гих странах одним из самых частых дерматозов. По сводным
данным Б. Т. Глухенького, С. А. Грандо (1985), он составляет
5—30 % от числа всех кожных заболеваний. По мнению В. А. Гре-
бенникова, М. В. Христюка (1980), на атопический дерматит при-
ходится 20 % среди детских кожных болезней. С возрастными
различиями заболеваемости, по-видимому, связаны и разные циф-
ры популяционной частоты атопического дерматита в обследован-
ных контингентах — от 0,5 до 7 %.
За последние 50 лет нозологическое уточнение атопического
дерматита дополнялось многочисленными исследованиями его
патогенеза, обсуждением его диагностических критериев. В про-
цессе клинического изучения атопический дерматит был отграни-
чен от себорейного дерматита, хронического простого лишая
Видаля (ограниченного нейродермита), нуммулярной экземы, стро-
фулюса, пеленочного дерматита и других дерматозов. Несмотря
на неполноту современных знаний о патогенезе, накопленные на-
блюдения о его симптоматике, течении, эпидемиологии считают-
ся достаточным основанием для интерпретации его как вполне
548
очерченной нозологической формы. Не исключается генетическая
гетерогенность атопического дерматита, хотя разнообразие его
клинических форм не противоречит общей закономерности кли-
нического полиморфизма мультифакториальных заболеваний.
Этиология и патогенез. Согласно генеалогическим исследова-
ниям, атопический дерматит относят к мультифакториальной
патологии, которая рассматривается с позиции гипотезы полиген-
ного аддитивного наследования с пороговым эффектом [Vogel F.,
1970; Rajka G., 1975]. Выявление отягощенного семейного анам-
неза достигает 70 % [Leung D., Geha R., 1981]. Б. Т. Глухенький,
С. А. Грандо (1985) отметили атопические заболевания у 38,9 %
пробандов с атопическим дерматитом, Т. А. Гарина (1979) —
у 53,7 %. Чаще всего активный атопический дерматит выявляется
у сибсов больных детей. Среди родителей тоже значительно се-
мейное накопление, но атопический дерматит регистрируется у
них больше по анамнестическим данным. У родтсвенников II сте-
пени родства частота заболевания мало отличается от популя-
ционной. Т. А. Гарина (1979) установила по строгим критериям
активные проявления атопического дерматита у 37,5 % сибсов
пораженных детей (в 7 раз чаще, чем в контрольной группе),
у 5,26 % матерей и лишь у 0,5 % родственников II степени родства.
Генетическая компонента в этиологии атопического дерматита
велика, о чем свидетельствует значительное превышение кон-
кордантности по атопическому дерматиту у монозиготных близ-
нецов по сравнению с дизиготными — соответственно 0,86 и 0,21
[Schultz F. et al., 1985].
В полигонной системе предполагается наличие главного гена,
детерминирующего поражение кожных структур, и дополнитель-
ных генов. Пороговый эффект, приводящий к манифестации бо-
лезни, достигается при их аддитивном действии, а также допол-
нительном влиянии средовых факторов риска. Экзогенные фак-
торы, участвующие в реализации генетической информации в фе-
нотипе больного, провоцируют обострения и способствуют хрони-
ческому течению болезни. Восприимчивость к средовым воздей-
ствиям зависит от возраста больного, его эндогенных конституцио-
нальных особенностей, таких как морфофункциональные харак-
теристики желудочно-кишечного тракта, эндокринной, нервной си-
стемы и т. д. В грудном и раннем детском возрасте преобладают
нарушения в питании, пищеварении и всасывании. Важная роль
принадлежит избытку продуктов, богатых гистаминолибераторами,
пищевой аллергии, незрелости ферментных систем, стафилокок-
ковой инфекции кишечника, заболеваниям печени, нарушениям
обмена витаминов, что детально отражено во многих работах
[Зверькова Ф. А., 1974; Торопова Н. П., 1979, 1981, 1983; Зелен-
цова В. Л., 1982, и др.]. В более старшем возрасте все большее
место занимают психоэмоциональные нагрузки, переутомление, не-
рациональный режим. Их действие усиливается при постинфек-
ционной астенизации, неврозах, у детей на фоне остаточной мик-
росимптоматики врожденного характера, гидроцефального синд-
549
рома, диэнцефальной патологии. Значение нейрогенных факторов
всегда подчеркивалось в работах отечественных исследователей.
Глубокий теоретический базис для этих исследований был создан
учением о рефлексах головного мозга И. М. Сеченова, рефлектор-
ной теорией патологии И. П. Павлова, отражением идей нервизма
в работах выдающихся клиницистов. Во многих работах советских
[Скрипкин Ю. К., 1965, 1967; Беренбейн Б. А., 1971; Чебота-
рев К. С., 1975; Машкиллейсон А. Л. и др., 1976, и др.] и зару-
бежных авторов представлена роль нарушений центральной и ве-
гетативной нервной системы, изменений обмена медиаторов нерв-
ных процессов, нейроциркуляторных расстройств.
Развитию атопического дерматита способствуют и конститу-
циональные особенности иммунитета, иммунодефицитные состоя-
ния, хронические фокальные инфекции, конституциональные об-
менные нарушения.
Несмотря на многостороннее изучениё факторов, способствую-
щих развитию атопического дерматита, начальные звенья его па-
тогенеза не вполне ясны, а первичные продукты генов не опре-
делены. Были попытки рассматривать как первичные поражения
дефект супрессорных Т-лимфоцитов [Jensen J. et al., 1981], повы-
шенную активность цАМФ-зависимой фосфодиэстеразы [Hani-
fin J. М. et al., 1985], аномалию энзима, катализирующего деса-
турацию линолевой кислоты [Whright St., 1985], дефекты, вызы-
вающие генерализованную дисфункцию вазоактивных медиаторов
[Ring J., 1979], нарушения протеинкиназ. Но ни одно из пред-
положений не имеет всеобщего признания и окончательных
доказательств.
Предполагают, что к базисным дефектам близки выявленные
при атопии функциональные нарушения циклических нуклеотидов
и активации мембран. За последние 20 лет опубликовано много
работ о нарушениях мембранной рецепции и внутриклеточной
регуляции. Это было отражено в теории блокады 0-адренорецеп-
торов [Szentivanyi А., 1968], основывавшейся на доказательствах
ослабления активации 0-адренорецепторов с пониженным уров-
нем циклического аденозинмонофосфата (цАМФ),
При изучении мембранной рецепции выяснилось, что у боль-
ных атопическим дерматитом неполноценны клеточные реакции
на стимуляцию гистаминовых рецепторов Нг и рецепторов про-
стагландинов Е1, осуществляющих свои функции через систему
аденилатциклазы и цАМФ. Таким образом, возникло представ-
ление о более общем дефекте мембранной рецепции с супрессией
не только 0-адренорецепторов, но и других рецепторов, активация
которых стабилизирует клетку [Parker С. W. et al., 1977; Bus-
se W., Lands S., 1979; Kragballe K., Herlin T., 1981]. Кроме того,
появились данные, указывающие на гиперчувствительность «-ад-
ренорецепторов и холинергических рецепторов [Ring J. et at,
1981].
На этой основе стало возможным объяснить гиперчувствитель-
ность больных атопическим дерматитом ко многим раздражителям
5S0
как результат повышенной реактивности кожи, инфильтрирующих
ее базофилов и тучных клеток при избыточной чувствительности
к сигнальным веществам, вызывающим дестабилизацию клеток, и
пониженной активности в ответ на сигналы, необходимые для их
стабилизации. При такой ситуации понятно, что различные фак-
торы, меняющие кинетику нейромедиаторов, адреналина и других
гормонов, могут способствовать вспышкам атопического дерма-
тита. В этом же ряду раздражителей находятся аллергены, ток-
сины, реагины, биологически активные вещества, высвобождаю-
щиеся из клеток в ответ на иммунные и неиммунные стимулы,
направленные на клетки-мишени.
Последующие звенья патогенеза атопического дерматита, вы-
текающие из нарушенной мембранной рецепции, многообразны
и включают прежде всего функциональные изменения кожных
сосудов на основе дисфункции вазоактивных медиаторов, функ-
циональные нарушения клеток, участвующих в иммунологических
реакциях, нарушения холинергического и а-адренергического то-
нуса.
Уже давно было замечено, что проявления атопического
дерматита, помимо эритемы и повышенной проницаемости сосудов
кожи, включают ряд других сосудистых изменений, таких как
белый дермографизм, бледность лица или его застойную гипере-
мию, акроцианоз и пролонгированную холодовую эритему, замед-
ленный белый феномен с парадоксальной вазоконстрикцией на
введение ацетилхолина, аномальный сосудосуживающий эффект
при введении эфиров никотиновой кислоты. Подчеркивалась тен-
денция к высвобождению вазоактивных медиаторов как на иммун-
ную, так и неиммунную стимуляцию [Ring J., O’Connor R., 1979].
С повышенным а-адренергическим и холинергическим тону-
сом можно связать и ряд других вегетативных нарушений у
больных атопическим дерматитом; усиленный пиломоторный реф-
лекс, гиперестезию, пароксизмальность зуда, нарушения моторики
гладкомышечных органов, плохой сон, двигательное беспокойство,
навязчивость и т. д. Такие связи, возможно, облегчают условно-
рефлекторное закрепление болезненных реакций на фоне пато-
логической инертности нервных процессов. Поэтому при невроти-
ческих реакциях на травмирующую ситуацию возникают приступы
зуда и эритемы без участия иммунных стимулов. В. Д. Тополян-
ский и М. В. Струковская (1986), подчеркивая псевдоаллергиче-
ские проявления, относят атопический дерматит к психосомати-
ческим расстройствам.
У многих больных атопическим дерматитом выявляется ряд
нарушений клеточного и гуморального иммунитета, в том числе
снижение реакции бласттрансформации лимфоцитов на расти-
тельные митогены, кожной реакции на ДНХБ, некоторые бакте-
риальные антигены, снижение хемотаксиса нейтрофилов и моно-
цитов, цитотоксичности моноцитов, нарушение фагоцитоза, умень-
шение субпопуляции Т-лимфоцитов-супрессоров, тенденция к
транзиторному уменьшению IgA (нейтрализующего пищевые ал-
551
лергены), повышенный уровень IgE у 50—80 % больных, наличие
специфических IgE к пищевым, грибковым, пыльцевым, бытовым
аллергенам, понижение активности естественных киллеров и т. д.
[Скрипкин Ю. К. и др., 1975; Кочергин Н. Г. и др., 1977; Шати-
лова Н. В. и др., 1979; Шуцкий И. В. и др., 1980; Шахтмейс-
тер И. Я. и др., 1983; Горланов И. А., 1985; Потекаев Н. С., Сер-
геев Ю. В., 1985; Turner М. W. et al., 1980; Leung D., Geha R.,
1981; Wuthrich B., 1983, 1984; Kurz K., 1984; Kiene U. et al., 1986].
Повышение уровня IgE связывают не только с сильной и ранней
антигенной стимуляцией, но и с дефектом регулирующей функ-
ции Т-лимфоцитов-супрессоров [Горланов И. А., 1980; Armitste-
ad J. et al., 1983; Chandra R., Baker M., 1983]. Иммунологические
дисфункции способствуют также снижению резистентности к кож-
ной инфекции, усиленной колонизации золотистых стафило-
кокков на коже и дрожжевых форм Pityrosporon orbiculare [Glo-
or M. et al., 1982; Amblard P. et al., 1985; Waersted A., Hjorth N.,
1985; White M. S., Nobel W. C., 1986, и др.], вызывающих воспа-
лительные поражения и усиление зуда. При осложненном тяже-
лой вторичной инфекцией атопическом дерматите особенно вы-
ражено снижение хемотаксиса нейтрофилов и моноцитов, что
связывается со стимуляцией гистамином (при высоком его уров-
не) мембранных Нг-рецепторов. У некоторых больных отмечена
пониженная продукция интерферона и лизоцима.
Многогранность патогенетического спектра атопического дер-
матита, по-видимому, является основой его столь сложного симп-
томокомплекса. Нарушения мембранной рецепции являются не
полными, а частичными блоками и усугубляются под влиянием
интеркуррентных факторов. Этим можно объяснить длительные
ремиссии или ослабление манифестации патологического процесса
с возрастом больных.
Гистопатология атопического дерматита не отличается
патогномоничными чертами. Помимо обычных воспалительных
изменений, отмечается высокая пролиферативная активность эпи-
дермоцитов и круглых клеток в дермальных инфильтратах. В эпи-
дермисе биоптатов из хронических очагов обнаруживаются скоп-
ления клеток Лангерганса, которые, как полагают, участвуют в
иммунологических реакциях и ингибировании пролиферации эпи-
дермальных клеток. Около адвентициальных клеток сосудов много
тучных клеток, а в дерме — дегранулированных базофилов. Выяв-
лены расширение поверхностных венозных сосудов, демиелиниза-
ция нервных волокон, периневральный фиброз, небольшой отек
коллагеновых волокон, пролиферативные и экссудативные измене-
ния в области волосяных фолликулов.
Клиника. Начинается заболевание чаще на 3-м месяце, ни-
когда не бывает врожденным. Нередки случаи и более позднего
начала, но всегда в детском возрасте. Обычно в детстве пора-
жения более распространенные и рецидивы чаще: многие взрослые
имеют локальную форму на кистях или излечиваются. Однако по-
следние работы по изучению катамнеза и долгосрочного наблю-
552
дения показывают, что заболевание продолжается у взрослых в
80 % [Van Hecke Е., Leyes G., 1981] —40% случаев [Rystedt I.,
1985]. При многолетних ремиссиях не исключается возможность
рецидива даже в пожилом возрасте. Рецидивы часто приурочены
к периодам физиологического и эмоционального напряжения: к 7-
летнему возрасту, окончанию школы, наступлению менструаций,
беременности и пр. В детстве обычно летнее улучшение, у многих
взрослых сезонность теряется. Прогностически для ребенка с ато-
пическим дерматитом считаются неблагоприятным раннее начало,
женский пол, сочетание с респираторной атопией, другой наслед-
ственной патологией, ранняя аллергизация, упорные заболевания
желудочно-кишечного тракта, фокальные инфекции.
Различают 3 возрастные фазы заболевания: первая — до двух
лет, вторая — от 2 лет до подросткового возраста, третья — юно-
шеский и зрелый возраст. Основные различия клиники по воз-
растным фазам заключаются в локализации очагов поражения и
соотношении экссудативных и лихеноидных компонентов.
В первой возрастной фазе очаги поражения более экссуда-
тивны, а локализация их приурочена к участкам кожи, в которых
отмечается накопление гистамина. Начальные поражения пред-
ставлены эритемой, нарастающим отеком, нередко везикуляцией,
мокутием с образованием массивных серозных корок. Лихеноид-
ные поражения, трофические изменения кожи с выраженной су-
хостью появляются позже (спустя несколько недель). На этом
фоне у некоторых детей в последующем появляются мелкие пру-
ригинозные папулы. Локализация очагов поражения чаще всего
на щеках, подбородке, на наружных частях голеней, разгибатель-
ных поверхностях верхних конечностей, на ягодицах. В дальней-
шем поражения могут появиться на груди, животе, спине или раз-
вивается эритродермия (атопическая эритродермия Хилла). Гра-
ницы очагов поражения обычно нечеткие. Однако у детей со ста-
филококковой инфекцией кишечника появляются множественные
приподнятые, четко отграниченные, ярко-красные, отечные очаги,
покрытые корками. У некоторых детей с минимальной церебраль-
ной недостаточностью рано развиваются лихенификация, сухость,
морщинистость кожи, мучительный зуд и плохой сон.
Во второй возрастной фазе островоспалительные явления ме-
нее выражены или они кратковременны, но всегда сохраняется
эритема и некоторая отечность в очагах поражения. Высыпные
элементы включают лихеноидные плоские полигональные папулы,
многочисленные фолликулярные папулы, при обострениях — папу-
ловезикулы, пузырьки. Вторичные элементы представлены гемор-
рагическими корками, чешуйками, лихенификацией, трещинами,
эрозиями. Границы очагов поражения нечеткие; они наиболее
часто располагаются в крупных складках (локтевых, подколен-
ных), на шее, на кистях и в области запястий. У многих больных
обнаруживается диффузное поражение кожного покрова с нали-
чием сухости, отрубевидного шелушения, мелких экскориаций,
многочисленных полушаровидных, округлых фолликулярных па-
553
пул. Эти папулы бледные, обычно цвета кожи и лишь при обостре-
нии кратковременно имеют красную окраску. У многих больных,
особенно к концу второй фазы, выражена Периоральная лихени-
фикация и хейлит. А. Л. Машкиллейсон (1983) среди хейлитов
выделяет атопический хейлит и указывает, что некоторое время
он может быть единственным проявлением атопического дерма-
тита. Р. Schudel, В. Wiithrich (1985) в числе микроманифестаций
находили у 17% больных хейлит без других классических прояв-
лений атопического дерматита.
В третьей возрастной фазе снижается активность воспалитель-
ных проявлений, но нарастают явления лихенификации и сосуди-
стых дисфункций. Локализация теряет приуроченность к складкам,
становится заметной избирательность высыпаний в области верх-
ней половины туловища с диффузными поражениями лица, шеи,
верхних конечностей.
Зуд, часто очень сильный и пароксизмальный, является по-
стоянным симптомом во всех возрастных фазах. Он усиливается
ночью, при волнении, приеме пищи, которую больной не пере-
носит и пр. При хроническом течении у многих больных, особенно
во 2-й фазе, выражены дисхромии на туловище, плечах в виде
крупноочаговых пигментаций и гипопигментаций.
При тяжелом и длительном процессе формируются признаки
«атопического лица», включающие псевдо-Хертоге-симптом (раз-
режение латеральной части бровей вследствие постоянного тре-
ния и расчесывания), складки Моргана, линии Дени (углублен-
ные складки на нижних веках), отечность и синюшность нижних
век, шелушение верхних и нижних век, бледность лица или за-
стойную красноватую окраску с пастозностью, периоральную лихе-
нификацию и хейлит.
Белый дермографизм отмечается у многих, но не у всех боль-
ных: иногда дермографическая реакция отсутствует или она блед-
но-розовая. Пиломоторный рефлекс повышен. В подростковом
возрасте часты мраморность кожи, ливедо, акроцианоз, гипер-
гидроз ладоней и подошв. При поражении пальцев рук с трещина-
ми и везикуляцией ногти становятся дистрофичными с глубокими
бороздами. Волосы при обострениях становятся тусклыми.
Периодически возникающая вторичная кожная инфекция на-
столько характерна, что может быть включена в основную картину
атопического дерматита. Встречается эритемато-сквамозная стреп-
тодермия, фолликулиты, гнойные корки, фурункулы, микробная
паронихия, дрожжевые поражения.
Часты инфицированные очаги с трещинами и корками в зауш-
ных складках. Реже возникает импетиго или герпетиформная
экзема. При упорной или нерационально леченной пиогенной ин-
фекции появляется лимфаденит, особенно в подбородочной об-
ласти, на шее, повышается температура.
Среди сочетанных поражений следует отметить возникающие у
некоторых больных уртикарные высыпания и отек Квинке, коре-
подобные эритемы, вазомоторный ринит, бронхит с астматическим
554
компонентом, конъюнктивит, иногда бронхиальную астму или пол-
линоз, еще реже — атопическую катаракту.
В связи с широким фенотипическим размахом целесообразно
выделение ряда клинических форм атопического дерматита: эри-
темато-сквамозную, папуло-везикуло-крустозную, лихеноидную
(«истинное пруриго Бенье»), пруригоподобную и смешанную фор-
мы. Последняя — эритемато-сквамозная с небольшой лихенифика-
цией встречается наиболее часто. Естественно, что это деление
является условным, так как при эволютивных возрастных изме-
нениях клиническая картина меняется постепенно. Различия от-
дельных форм атопического дерматита заключаются в разном со-
отношении первичных высыпных элементов (лихеноидных поли-
гональных папул, фолликулярных папул, папуловезикул). Преоб-
ладание тех или иных элементов сыпи отражает некоторую связь
с экзогенными факторами риска. Так, при лихеноидной форме
больше заметно влияние психогенных факторов, выявляется нев-
роз навязчивости; при пруригоподобных формах часто выявляются
хронический колит, гиперчувствительность к домашней акаро-
фауне, при экзематоидных формах — пищевая или микробная ал-
лергия.
По размеру площади вовлеченного кожного покрова в патоло-
гический процесс различаются локальные (обычно складки, кисти
или периоральная лихенификация), распространенные и эритро-
дермические формы.
Выделяется три типа течения атопического дерматита [Wiit-
rich В., Schudel Р., 1983]. При первом типе выздоровление на-
ступает до двух лет, при втором — выражена манифестация вы-
сыпаний до 2 лет с последующими ремиссиями, иногда длитель-
ными, третий тип характеризуется непрерывным течением.
Целесообразно при прогнозировании и назначении лечения
учитывать четыре степени активности процесса: 1 — минимальную
с локальными поражениями, умеренным зудом, без отклонения ла-
бораторных показателей (гемограммы, протеинограммы), 2 — уме-
ренную степень при более распространенных и выраженных пора-
жениях, сильном зуде, нарастании лихенификации или воспаления,
вторичной инфекции, с небольшими отклонениями в лабораторных
показателях, 3 — высокая степень, характеризующаяся усилением
остроты воспалительных явлений, отека, генерализации высыпа-
ний, значительной лихенификации с пруригинозными высыпа-
ниями, интенсивным пароксизмальным зудом, тяжелыми бакте-
риальными осложнениями, выраженными лабораторными отклоне-
ниями (эозинофилия, анемия, лейкопения или лейкоцитоз, моно-
цитоз или моноцитопения, повышенная СОЭ, диспротеинемия,
патологические печеночные пробы и др.), 4 — максимальная сте-
пень активности патологического процесса характеризуется уни-
версальным поражением кожи, сопровождающимся выраженными
воспалительными явлениями, маскирующими лихенификацию, му-
чительным постоянным зудом, вторичной инфекцией, лимфоадено-
патией, лихорадкой, плохим самочувствием и тяжелым общим
555
состоянием, значительными изменениями лабораторных показа-
телей.
Тяжелые исходы возникают при таких осложнениях, как ана-
филактоидный шок, синдром диссеминированного сосудистого
свертывания, герпетиформная экзема Капоши, длительная и рас-
пространенная пиогенная инфекция с лихорадкой и лимфоадено-
патией.
Диагноз атопического дерматита основывается на: 1) анам-
незе, в котором прежде всего обращается внимание на возраст-
ную эволюцию, сезонность, локализацию предшествующих высы-
паний, множественность провоцирующих факторов, особенно эмо-
циональных, пищевых и др., 2) детальном анализе высыпных
элементов и их локализация в сопоставлении с возрастными фа-
зами и клиническими формами, с учетом интенсивности зуда,
истинного полиморфизма высыпных элементов, сочетания воспа-
лительных и лихенифицированных очагов, характерных осложне-
ний, дисфункции кожных сосудов и вегетативной дистонии.
Дифференциальный диагноз следует проводить с себорейным
дерматитом, простым хроническим лишаем Видаля, симптомати-
ческими лихенификациями при психических и эндокринных за-
болеваниях, с микробной экземой. Кроме истинного полиморфиз-
ма и лихенификации без характерных для лишая Видаля кон-
центрических зон, при этом очень важно проанализировать эво-
лютивные особенности локализации, которых нет ни при одном из
указанных заболеваний. V. Jates и соавт. (1983) считают осо-
бенности локализации наиболее важным диагностическим при-
знаком атопического дерматита при дифференциации его с себо-
рейным дерматитом у детей.
Атопический дерматит часто сочетается с моногенными дер-
матозами, особенно с вульгарным аутосомно-доминантным их-
тиозом. Чтобы не путать сухость и шелушение кожи, возникаю-
щие у больных атопическим дерматитом за счет трофических
нарушений, с вульгарным ихтиозом, следует помнить, что при
последнем обязательно имеется фолликулярный кератоз с рого-
выми пробками и поражение ладоней и подошв в виде грубой
складчатости и утолщения.
Лечение и профилактика. Лечение атопического дерматита
многоплановое и индивидуализированное. В тяжелых случаях
проводится интенсивная терапия с использованием инфузионных и
симптоматических средств (эуфиллин, диуретики), по показаниям
назначаются гепарин, курантил, стугерон, антибиотики. В более
легких случаях используются обычные противовоспалительные
и противотоксические средства (антигистаминные препараты,
кальций, рутин, аскорбиновая кислота, гипосульфит натрия, панто-
тенат кальция, салицилат натрия). Некоторым больным помога-
ют задитен, глицирам, гистаглобулин. По показаниям применяют
в основном у взрослых больных пирилен [Машкиллейсон А. Л.
и др., 1985] или другие ганглиоблокаторы, седативные травы,
пирроксан, электросон или другие успокаивающие физиотерапев-
556
тические процедуры. В части случаев приходится назначать ко-
роткие курсы лечения транквилизаторами, нейролептиками или
антидепрессантами. Для стабилизации мембран или воздействия
на клеточную регуляцию рекомендуют витамин Е или папаверин
[Baer R., 1985]. Для повышения иммунитета и улучшения трофи-
ки назначают витамины А, В|, В2, Be, фитин, препараты железа,
глицерофосфат кальция, алоэ, димоцифон, спленин и др. В груд-
ном и раннем детском возрасте особенно важно назначение фер-
ментов, улучшающих пищеварение, и эубиотиков. У взрослых
больных на первое место выходят седативные воздействия. Осо-
бенно большое значение имеет адекватная наружная терапия.
Она должна включать применение противовоспалительных и рас-
сасывающих средств (пасты и мази с АСД — III фракцией, де-
готь, нафталановая нефть), средства, эпителизирующие и улуч-
шающие трофику кожи (солкосерил, вульнузан), непременно
антибактериальные средства (линкомициновая мазь, левосин, лево-
меколь, риванолевая мазь, дерматологический компресс с ривано-
левой примочкой и т. д.).
Для профилактики атопического дерматита имеется два на-
правления: 1) элиминация средовых факторов риска и лечение ин-
теркуррентных заболеваний, провоцирующих или утяжеляющих
атопический дерматит; 2) медико-генетическое консультирование
семей. Семьи больных с атопическим дерматитом чаще, чем с
другими мультифакториальными дерматозами, обращаются с во-
просами о роли наследственности и о генетическом прогнозе
для потомства. Эмпирический риск наследования для родствен-
ников I степени родства составляет 16 % [Козлова С. И., Прыт-
ков А. Н., 1981]. При генетическом консультировании диагноз
должен быть абсолютно достоверным. Атопический дерматит дол-
жен быть отдифференцирован от таких наследственных заболева-
ний, как синдром Кнаппа — Комровера, синдром гипериммуногло-
булинемии Е, сопровождающийся зудящими поражениями кожи и
рецидивирующей глубокой кожной инфекцией, синдром Вискотта —
Олдрича, фенилкетонурия и пр. Для дифференциации с ними в
медико-генетической консультации может быть оказана лабора-
торная помощь.
ПСОРИАЗ (ЧЕШУЙЧАТЫЙ ЛИШАЙ)
По частоте распространения у детей псориаз занимает второе
место после детской экземы. Больные псориазом составляют бо-
лее 8 % от общего числа регистрируемых ежегодно детей с на-
личием дерматозов.
Этиология и патогенез. Подробно материалы о всех концеп-
циях формирования псориаза и патогенетических механизмах
изложены в специальной главе. У детей наиболее частыми факто-
рами, провоцирующими возникновение болезни, являются готов-
ность к воспалительным процессам кожи, что именуется в прак-
тике педиатров экссудативным диатезом, аллергизирующее влия-
5S7
ние пищевых веществ и даже грудного молока матери при фер-
ментной патологии печени и желудочно-кишечного комплекса,
расстройство эндокринной регуляции при дисфункции тимуса,
сочетающееся с врожденным дисбалансом гуморальных и клеточ-
ных компонентов иммунной системы. Как показал опыт работы
Ю. К. Скрипкина и сотр. (1982), Ф. А. Зверьковой (1983),
И. Н. Ведровой и соавт. (1984), наиболее частыми моментами
риска констатируются острые инфекционные заболевания (ОРВИ,
пневмония, обострение хронического тонзиллита), нарушения ли-
пидного обмена, травматизация кожи. Семейный псориаз у детей
встречается в 15—16 % случаев. Тип наследования псориаза ско-
рее всего является мультифакториальным при недостаточной
пенетрации гена [Мордовцев В. Н. и др., 1981]. Клинические на-
блюдения свидетельствуют, что псориаз у детей дошкольного воз-
раста нередко возникает после психоэмоционального перенапря-
жения, в период выраженных вегетоневротических реакций. Сум-
мируя имеющиеся в настоящее время многочисленные сведения
о многообразной патологии у больных псориазом, следует под-
черкнуть системность поражения и рассматривать данный дерма-
тоз как псориатическую системную болезнь.
Клиника и течение псориаза у детей своеобразны.
Первичные морфологические элементы полиморфны в отличие от
взрослых, где четко выявляется характерная псориатическая па-
пулезная сыпь. Первые признаки болезни у грудных детей обна-
руживаются в виде эритематозных пятен с резкими границами,
с отслойкой рогового слоя по периферии наподобие эпидермаль-
ного венчика у больных микробной экземой или стрептодермией.
В складках кожи появляются мацерированные участки с папуло-
везикулезными эффлоресценциями в окружности, напоминающие
кандидоз или опрелость. На коже туловища наряду с отечно-эри-
тематозными, шелушащимися очагами можно видеть и папулез-
ные элементы. Однако они не имеют выраженной инфильтрации,
границы их нечеткие, шелушение нехарактерное. Вместо серебри-
стых чешуек, напоминающих стеариновое пятно, на поверхности
эффлоресценций наблюдаются чешуйко-корки. Острота воспали-
тельной реакции сказывается и на патогномоничных феноме-
нах — «стеаринового пятна, терминальной пленки и точечного
кровотечения», которые у детей грудного и дошкольного возраста
не отчетливы или вообще не выявляются. Нередко псориаз у де-
тей начинается на волосистой части головы в виде скопления
серовато-белых чешуек или чешуйко-корок на эритематозном фо-
не. В некоторых случаях корки бывают гнойными. Диагноз псо-
риаза у таких больных часто не фиксируется. Заболевание рас-
сматривается как себорейный дерматит или пиодермия. Лишь
последующие наблюдения, катамнестические данные помогают
уточнить истинную природу дерматоза. Характерно, что даже ти-
пичная локализация псориатической сыпи у детей не констати-
руется. Так, Л. А. Штейнпухт, Ф. А. Зверькова (1979) отмечают,
что на локтях, коленях, конечностях сыпь появляется реже, чем
558
в других нетипичных для псориаза местах: лицо, складки, воло-
систая часть головы. Течение псориаза длительное, проявляется
периодами обострений и ремиссиями. Так же, как и у взрослых,
выражена сезонность проявлений. У большинства детей четко про-
является самопроизвольное разрешение сыпи в летнее время и
обострение в осенне-зимний период. Реже встречается летняя
форма болезни, сочетающаяся с увеличением уропорфиринов в
моче и копропорфиринов в фекалиях. Различают и у детей 3 ста-
дии течения: прогрессирующую, стационарную и период регресса.
Распознавание стадий псориаза необходимо для назначения рацио-
нального общего и наружного лечения. Кроме того, в связи с на-
личием в прогрессирующей стадии выраженного состояния аллер-
гической реактивности по немедленно-замедленному типу у боль-
ных псориазом в этот период наблюдается положительный симп-
том Кебнера, когда на местах раздражения, трения, давления,
расчесов возникают новые псориатические элементы. Среди раз-
личных форм псориаза, встречающихся у детей, выделяют psoriasis
inversus — с преимущественной локализацией в складках, в области
промежности; экссудативный псориаз — проявляющийся очагами
мацерации, иногда мокнутия и массивным наслоением рыхлых,
слоистых корко-чешуй. Экссудативные формы псориаза у детей
составляют более 40 %. Значительно реже, чем у взрослых, у детей
наблюдаются тяжелые формы псориаза: псориатическая эритро-
дермия, артропатический псориаз и псориаз ногтей.
Псориатическая эритродермия проявляется диссеминирован-
ными, генерализованными высыпаниями сливного характера по
всему кожному покрову. Как правило, состояние эритродермии
возникает в результате нерационального лечения или как прояв-
ление бурной воспалительной реакции у детей с выраженным им-
мунодефицитом и высокой степенью гиперчувствительности не-
медленно-замедленного типа [Скрипкин Ю. К., 1979]. Одновре-
менно с генерализацией высыпаний отмечается повышение темпе-
ратуры тела, усиливается зуд, появляется чувство жжения, стяги-
вания и напряжения кожи. Общее состояние детей тяжелое. Воз-
можно и одновременное поражение суставов (псориатический
артрит).
Артропатический псориаз у детей наблюдается в виде артрал-
гий или синовитов. Псориатическое поражение ногтей наблюдает-
ся одновременно с любой формой дерматоза. Своеобразие пато-
логии ногтей у детей заключается в преобладании ониходистрофии
с точечными вдавлениями по типу наперстка или с истончением
ногтевых пластинок (атрофическая форма). Часто поражение
ногтей сопровождается псориатическими паронихиями, но воз-
можно и изолированное изменение ногтей.
У детей, больных тяжелыми формами псориаза, а также в пе-
риод прогрессирующей стадии обычной (вульгарной) формы дерма-
тоза изменяется периферическая кровь с увеличением числа лейко-
цитов, палочкоядерных форм, уменьшением лимфоцитов или их
значительным увеличением и высокой СОЭ.
559
Диагноз устанавливается на основании характера элементов
сыпи с учетом хронического рецидивирующего течения.
Дифференциальная диагностика необходима с микробной экзе-
мой, себорейной экземой, кандидозом, пиодермией типа эритемато-
сквамозной стрептодермии.
Лечение детей, больных псориазом, должно быть строго инди-
видуализированным в соответствии с возрастом, степенью актив-
ности процесса, клинической формой болезни, конституциональ-
ными особенностями, наличием сопутствующих заболеваний и фо-
новых патологических состояний. Целесообразно клинико-лабо-
раторное обследование в целях выявления наиболее актуальных
факторов патогенеза. У детей первого года жизни и младшего
возраста наибольшее значение среди всех факторов риска имеют
функциональные нарушения печени, функциональная патология
кишечника с ферментной недостаточностью, дискинезиями, дис-
бактериозом. Коррекция изменения функций печени, поджелудоч-
ной железы, желудочно-кишечного тракта и соблюдение диетиче-
ского режима питания требуют особого внимания зимой и весной,
когда проявляются рецидивы дерматоза. Так же как при экземе,
диффузном нейродермите, у больных псориазом целесообразно
назначение абомина, панкреатина, панкурмена, мезима. При дис-
бактериозе, кишечной инфекции используются эубиотики с приме-
нением бифидумбактерина, бификола, лактобактерина или коли-
бактерина. В период прогрессирования болезни может быть не-
достаточно коррекции фоновых нарушений, поэтому показано на-
значение противовоспалительных, гипосенсибилизирующих лекар-
ственных препаратов. Из них наиболее часто употребляются пре-
параты кальция (лактат кальция, глицерофосфат или глюконат
кальция), салицилат натрия, витамин В|2, Be. Для детоксицирую-
щего воздействия применяются гипосульфит натрия, сернокислая
магнезия, спленин, пантотеновая и аскорбиновая кислоты. В тя-
желых случаях назначается интенсивная терапия с использова-
нием инфузионных средств, восстанавливающих кислотно-щелоч-
ное состояние, электролитный состав и реологические свойства
крови. К ним относят гемодез, реополиглюкин, альбумин, поли-
ионный раствор. При наличии выраженных явлений экссудации,
тенденции к прогрессированию с наклонностью к эритродермии
или псориатическому поражению суставов используются кортико-
стероиды: преднизолон, урбазон, метипред, триамцинолон, дек-
саметазон, кенакорт в соответствии с возрастом и массой тела
и постепенным медленным снижением препаратов после положи-
тельного терапевтического эффекта. С целью уменьшения дози-
ровок кортикостероидов и профилактики атрофии коры надпочеч-
ных желез одновременно назначаются стимуляторы гипофизонад-
почечниковой системы: АКТГ, аскорбиновая кислота (витамин С),
пантотенат кальция, аевит. Детям с нарушениями липидного
обмена рекомендуется диета с ограничением животных жиров.
Назначается пища с содержанием растительных масел в комп-
лексе с липолитическими средствами — цетамифеном, витаминами
560
В|5 (пангамат кальция) и В|3 (оротат калия). В период актив-
ности очагов хронической инфекции (хронический тонзиллит,
ангина, гайморит, хронический холецистит и др.) применяются
антибиотики широкого спектра действия под контролем анти-
биотикограммы и переносимости вместе с антигистаминными
средствами (фенкарол, диазолин, супрастин, тавегил, перитол).
Принимаются меры к возможно быстрой санации очагов хрони-
ческого воспаления. Одновременно после специального тестиро-
вания стрепто- или стафилоантигенами назначается специфиче-
ская гипосенсибилизирующая терапия к микробной флоре —
стрептофиброантиген или стафилоанатоксин. Для коррекции им-
мунных нарушений применяются у-глобулин, гистаглобин, ме-
тилурацил, декарис, пентоксил, нуклеинат натрия, тимозин или
Т-активин.
Для нормализации активности аденилциклазы, фосфодиэсте-
разы, нормализации соотношения цАМФ и цГМФ в последние
годы назначаются производные метилксантинов — теофиллин, эу-
филлин, папаверин и др. [Шумай Н. И., 1983]. В стационарной
и регрессивной стадиях у детей старшего возраста целесообразно
применение аутогемотерапии, пирогенных препаратов (продигио-
зана, пирогенала), УФО, санаторно-курортной терапии.
Наружное лечение псориаза осуществляется обязательно с
учетом стадии болезни, конституциональных особенностей ребен-
ка, наличия сопутствующей патологии. Индифферентные кремы —
ланолиновый, нафталановый, солидоловая мазь, мазь Рыбакова,
1—2% салициловая мазь, мази с кортикостероидами (преднизо-
лоновая, «Флуцинар», «Гиоксизон», «Лоринден А» или «Лорин-
ден С»), теофиллиновая, эуфиллиновая или папавериновая мази
5 % могут широко применяться в период прогрессирования дер-
матоза. В стационарной стадии рекомендуются редуцирующие
средства: деготь, ихтиол, сера, нафталанская нефть в пастах или
мазях. При выраженной инфильтрации очагов в период регресса
высыпаний увеличивается концентрация дегтярных, ихтиоловых
мазей до 5—10 % в сочетании с УФО, грязевыми аппликациями,
применением местно парафина, озокерита, микровзрывов по мето-
ду А. С. Ленского и Г. Я. Шараповой (1985). Рациональное ле-
чение с осуществлением диетрежима, санацией висцеропатий,
эндокринопатий, целесообразное чередование труда и отдыха с
использованием климатолечения, физиотерапии и курортных фак-
торов дают возможность получить стойкую длительную ремиссию
и отдалить сроки очередного рецидива.
АКРОДЕРМАТИТ ЭНТЕРОПАТИЧЕСКИЙ [ACRODERMATITIS
ENTEROPATHICA).
Син.: синдром Danbolt — Closs
Заболевание описано G. W. Wende (1902).
Этиология и патогенез. В основе заболевания лежит дефицит
561
цинка, обусловленный нарушением его всасывания. Наследуется
аутосомно-рецессивно.
Клиника. Основные клинические признаки — везикулезно-пу-
зырные высыпания, располагающиеся преимущественно на дис-
тальных отделах конечностей и периорифициально, шелушение,
придающее нередко очагам поражения псориазиформный харак-
тер, а также выпадение волос и диарея. Часто наблюдаются блефа-
рит, кератоконъюнктивит, фотофобия, стоматит, глоссит, вульвит,
дистрофические изменения ногтей, иногда — замедленное развитие
зубов. Нарушается рост, а нередко и психическое развитие детей.
Заболевание часто осложняется бактериальной и дрожжевой ин-
фекцией. Развивается обычно при переходе на искусственное
вскармливание. Без лечения прогноз неблагоприятный.
Лечение. Окись цинка по 0,03—0,15 г в сутки.
СПИСОК ЛИТЕРАТУРЫ
К главе 1
Гитман С. М. В кн.//Вопросы дерматологии и венерологии/Под ред. Н. М. Тура-
нова. — М., 1953. — С. 63—63.
Григорьев П. С- Учебник венерических и кожных болезней. — 2-е изд. М.-Л.:
Биомедгиз, 1938. — С. 15—19; 341—346.
Дарье Ж. Основы дерматологии: Пер. с франц. — М. —Л.: Гос. изд-во, 1931.
Кожевников П. В.//Многотомное руководство по дерматовенерологии//Под ред.
С. Т. Павлова. — М„ 1961. — Т. 2. — С. 9—15.
Павлов С. Т., Шапошников О. К., Самцов В. И., Ильин И. И. Кожные и венери-
ческие болезни: Учебник. — М.: Медицина, 1975.
Романенко Г. Ф., Беренбейн Б. А., Вербенко Е. В.//Вестн. дерматол. — 1985.—
№ 9. — С. 77—79.
Скрипкин Ю. К., Шарипова Г. Я. Кожные и венерические болезни. Учебник. —
М.; 1972.
Скрипкин Ю. К. В кн.//Кожные и венерические болезни. — М., 1979. — С. 5—17.
Смелов И. С., Торсуев И. А.//БМЭ. — 3-е изд. — М., 1977. — Т. 7. — С. 142—146.
К главе 2
Виноградова Е. В., Михайлов И. /7.//Изв. АН СССР. Сер. биол. — 1974. —
№ 2. — С. 211—219.
Гетлинг 3. М.//Вести. дерматол. — 1976. — № 5. — С. 9—11.
Игошин Ю. М. Вести, дерматол. — 1976. — № 12. — С. 13—17.
Чернух А. М., Александров П. Н., Алексеев О. В. Микроциркуляция. — М.: Меди-
цина, 1984.— С. 108—180.
Шахламов В. А. Капилляры. — М., 1971. — С. 11—91.
Шехтер А. Б. Соединительная ткань/Под ред. В. В. Серова, А. Б. Шехтера.—
М., 1981. —С. 73—83.
Altura В. М. Vaskular endothelium and basement membranes. — Basel, 1980.
Breathnach A. S. An atlas of the ultrastructure of the Human skin. — London, 1971.
Breathanach A. S. J. Invest. Derm.— 1980. — Vol. 75, N 1.— P. 6—11.
Briggaman R. A.//Epidermal keratinicyte. Differ and Fibrillogenesis. — Basel, 1981.—
P. 142—154.
Jen A. K., Braverman J. M. J. Invest. Derm. — 1976. — Vol. 66, N 3. — P. 131—142.
Jessen H., Peters P. D., Hall T. A. J. Sell. Sci. — 1976. — Vol. 22. — P. 161 — 171.
Katz S. J. Arch. Derm. — 1980. — Vol. 116. — P. 1361 — 1362.
Lever W'. F., Schaumburg-Lever G.//Histopathology of the skin. — London, 1983. —
P. 1—42.
Matoltsy A. G., Lavker R. M., Maloltsy J. M. H.//J. Invest. Derm. — 1974. — Vol. 62.—
P. 406—410.
Montagna W., Parakkal P. T.//The structure and function of the skin/Ed. W. Montag-
na, P. F. Parakkal. — Baltimore, 1974. — P. 18—75.
Niebauer G.//Dermatologie in Praxis und Klinik fur die facharztiiche Weiterbildung/
Hrsg. G. W. Korting. — Berlin, 1980. — Bd 1. — S. 1.69—1.87.
Nordlund J., Ackles A. Tissue Antigens.— 1981. — Vol. 17, N 2.— P. 217—225.
Riley P. A. Brit. J. Derm. — 1978. — Vol. 99. — P. 107—109.
Ryan T. J.. J. Invest. Derm. — 1976. — Vol. 67, N 1. — P. 110—118.
563
Shelehy M. G., Junis E. J., Agostini R. M. et al. Lab. Invest. — 1983. — Vol. 48,
N 5. - P. 549—555.
Takahashi S., Hashimoto K. J. Invest. Derm. — 1985. — Vol. 84, N 6. — P. 469—471.
Wilgram G. T., Cauifield J. B., Magdic E. B.//The epidermis/Ed. W. Montagna,
W. C. Lobitz.— New York, 1964.-— P. 275—301.
Winand R. Arch, beiges Derm. — 1972. — Vol. 28. — P. 35—40.
Wolff K.//Current problems in dermatology/Ed. J. W. H. Mali. — New York, 1972. —
Vol. 4. — P. 79—145.
Wolff-Shreiner E. G. Int. J. Derm. — 1977. — Vol. 16, N 2. — P. 77—102.
К главе 3
Владимиров Ю. А., Рощупкин Д. И., Потапенко А. Я., Деев А. И. Биофизика. —
М.; Медицина, 1983—271 с.
Бриттон Г. Биохимия природных пигментов: Пер. с англ. — М.: Мир. — 1986. —
422 с.
Графова В. Н., Данилова Е. И., Игонькина С. //.//Механизмы повреждения,
резистентности, адаптации и компенсации. — Ташкент, 1976. — Т. 2.-—
С. 583—583.
Калантаевская К. А. Морфология и физиология кожи человека. — Киев: Здоров’я,
1972. — 267 с.
Roh Р. М., Рот К. С. Ранняя диагностика болезней обмена веществ: Пер. с англ. —
М.: Медицина, 1986. — 640 с.
Крыжановский Г. Н., Игонькина С. И.//Бюл. экспер. биол.— 1976. — № 6.—
С. 651—653.
Ленинджер А. Основы биохимии: Пер. с англ. — М.: Мир, 1985. — 1056 с.
Мелзак Р. Загадка боли: Пер. с англ. — М.: Медицина, 1981. —232 с.
Страйер Л. Биохимия: Пер. с англ. — М.: Мир, 1985. — Т. I—3.
Физиология человека: Пер. с англ./Под ред. П. Г. Костюка. — М.: Мир, 1986. —
Т. 4. — 312 с.
Morsches B.//Dermatologie in Praxis und Klinik/Hrsg von G. W. Korting. — Berlin,
1980.— Bd 1. — S. 3.1—3.17.
Schaefer H., Zesch A., Stiittgen G. Skin Permeability. — Berlin: Springer Verlag,
1982. — S. 896.
Schalla IV, Bauer E., Schaefer H. Akt. Derm.— 1980. — Bd 6, N 1. — S. 3—11.
Shaw J. E., Chandrasckarn S. A.//Drug absorptions. Intern. Confer/Ed. L. F. Pres-
colt, W. S. Nitntno;—Edinburgh, 1979. — P. 186—186.
Stiittgen G., Shaefer H. Functionelle Dermatologie. — Berlin: Springer Verlag, 1974.
К главе 4
Гржебин 3. H., Цераидис Г. С. Основы гистопатологии кожи. — М.: Медгиз, 1960.
Меркулов Г. А. Курс гистопатологической техники. — М.: Медицина, 1969.
Цветкова Г. М., Калантаевская К. А., Сыч Л. И. Справочник по гистопатологиче-
ской диагностике кожных заболеваний. — Киев: Здоров’я, 1981.
Цветкова Г. М., Мордовцев В. Н. Патоморфологическая диагностика заболеваний
кожи. — М.: Медицина, 1986.
Чернух А. М., Фролов Е. П. Кожа. — М.: Медицина, 1982.
Hirsh В. S„ Johnson W. С. Int. J. Derm. — 1984. — Vol. 23. — Р. 90—100.
Lever W, Schaumburg-Lever G. Histopathology of the skin. — London: J. B. Lippin-
cott Comp, 1983.
Pincus H., Mehregan A. Gide to Dermatohistopathology. 3-rd ed. — New York: Apple-
ton — Centry — Crofts, 1981.
Скрипкин Ю. К., Петрова И. В.//Значение иммунных нарушений в патогенезе
распространенных и тяжело протекающих кожных заболеваний и методы
их терапевтической коррекции. — М, 1982. — С. 3—11.
Белецкая Л. В., Гнездицкая Э. В., Лямперт И. М. и др.//Бюл. экспер. биол.—
1976. — № 2. —212—214.
564
Белецкая Л. В., Беренбейн Б. А., Силагадзе Д. Г., Ежов Н. Я.//Вести, дерматол —
1981. —№ 1, —С. 13—16.
Белецкая Л. В., Беренбейн Б. А.//Вестн. дерматол.— 1986.— № 8. — С. 15___21.
Белокриницкий Д. В., Прозоровская К. Н., Левина С. Г.//Сов. мед. — 1973
№ 6. — С. 33—38.
Беренбейн Б. А. Псевдорак кожи. — М.: Медицина, 1980. — 260 с.
Дмитриев А. А., Белецкая Л. В., Бектемиров Р. А. и др.//Тер. арх. — 1985. —
№ 6. — С. 87—90.
Домагатский С. П., Идельсон Г. Л., Мерзликина О. В. и др.//Иммунология.—
1985. — № 3. — С. 78—79.
Дробышевская Э. И., Силагадзе Д. Г., Абызов В. Н. и др.//Клеточные основы
противоопухолевого иммунитета. Гибридомы. — М., 1985. — С. 33—34.
Ежов Н. Я., Белецкая Л. В., Романенко Г. Ф.//Вести, дерматол.— 1977.—
№ 2.— С. 14—18.
Иммунолюминесценция в медицине/Под ред. Е. Н. Левина. — М.: Медицина.—
1977. — 237 с.
Кормейн Р. X., Асгар С. С.//Иммунопатология и болезни кожи. — М., 1983. —
255 с.
Лямперт И. М., Дробышевская Э. И., Некрасов А. В. и др.//Иммунология.—
1987. — № 1. — С. 664—687.
Насонова В. А. Системная красная волчанка. — М.: Медицина, 1972. — 248 с.
Пашков Б. М., Ребрик М. С., Белецкая Л. В.//Вестн. дерматол., 1973. — № 7.—
С. 26—29.
Силагадзе Д. Г., Белецкая Л. В., Беренбейн Б. А. и др.//Вопр. онкол., 1981.—
№ 6. — С. 27—32.
Трояновский С. М., Крутовских В. А., Банников Г. А.//Бюл. экспер. биол.—
1986. — № 6. — С. 734—736.
Шапошников О. К., Домасева Т. В., Тульчинский А. А., Зубжицкий Ю. //.//Вести,
дерматол. — 1972. — № 12. — С. 34—39.
Beutner Е. Н. Immunopathology of the skin. — Dowden: Hutchinson, USA, 1973.—
461 p.
Celis J. E., Fey S. J., Larsen P. M., Cglis A.//Cancer cells/Eds. Levin A. J. et al. Publ.
Cold spring harbor laboratory. — New York, 1984. — Vol. 1. — P. 125—135.
Chorzelaki T. P-, Beutner E. H.//Xnn. N. Y. Acad. Sci.— 1971. — Vol. 177.—
P. 224—230.
Moll R„ Franke W. W., Schiller D. /..//Cell. — 1982. — Vol. 31. — P. 11—24.
Sun T. T., Eichner R., Nelson И'. G. et al.//J. Invest. Derm.— 1983. — Vol. 81,
N 1, — P. 109—115.
К главе 5
Белецкая Л. В., Беренбейн Б. А., Силагадзе Д. Г.//Ъестн. дерматол.— 1981.—
№ 1. — С. 14—16.
Белецкая Л. В., Беренбейн Б. А.//Вести. дерматол.— 1986. — № 8. — С. 15—21.
Беренбейн Б. А.//Дифференциальная диагностика кожных заболеваний. — М.,
1983. — С. 33—75.
Беренбейн Б. А., Коган М. Г., Белецкая Л. //.//Современные методы морфологи-
ческого исследования в теоретической и практической онкологии, — Тбилиси,
1983. — С. 29—30.
Браиловский А. Я.//О. К. Шапошников и др. Ошибки в дерматологии. — Л.,
1983. — С. 3—23.
Вербенко Е. //.//Дифференциальная диагностика кожных заболеваний/Под
ред. А. А. Студницина. — М., 1983. — С. 169—183.
Машкиллейсон Л. //.//Многоатомное руководство по дерматовенерологии. Л.,
1961.— Т. 2.— С. 60—87.
Павлов С. Т. Кожные и венерические болезни. — Л.: Медицина, 1969.
Скрипкин Ю. К. Кожные и венерические болезни. — М.: Медицина, 1980.
Торсуев Н. А., Шеклаков Н. Д., Романенко В. Н. Буллезные дерматозы. —
М.: Медицина, 1979.
565
Цветкова Г. М.//Дифференциальная диагностика кожных болезней//Под ред,
А. А. Студницина. — М„ 1983. — С. 33—65.
Цветкова Г. М., Мордовцев В. Н. Патоморфологическая диагностика заболеваний
кожи. — М.: Медицина, 1986.
Шапошников О. К., Браиловский А. Я., Разнатовский И. М., Самцов В. И. Ошиб-
ки в дерматологии. — Л.: Медицина, 1987.
К главе 6
Адо А. Д„ Порошина Ю. А.//Прикладная иммунология в профилактике бакте-
риальных инфекций и аллергических заболеваний. — М., 1978. — С. 5—7.
Анохин П. А.//Вопр. кибернетики. — 1976. — Вып. 19. — С. 5—15.
Арчаков А. И., Карузина И. И., Менгазетдинов Д. Э. и др.//Бюл. экспер. биол.—•
1980. — № 3. — С. 323—324.
Бабаянц Р. С., Константинов А. В., Потекаев Н. С., Иванов О. Л.//Вести, дерма-
тол. — 1976. — № 2. — С. 13—14.
Башмаков Г. В.//Дерматология и венерология. — Киев, 1986. — Вып. 21. —
С. 36—39.
Борисенко К. К., Родионова Г. В.//Вестн. дерматол. — 1974. — № 10. — С. 63—66.
Бурыкина Г. Н., Архангельская Е. И., Волокитина Г. /О.//Стафилококковая
инфекция кожи. — М. — Л., 1984. — С. 91—94.
Бухарович А. Т., Голощапов Н. А/.//Вестн. дерматол. — 1984. — Ns 9. — С. 14—19.
Быкова А. А., Закс А. С., Евтеева Т. А. и др.//Новые методы исследования в экс-
периментальной и клинической медицине. — Куйбышев, 1980. — С. 21—23.
Вербенко Е. В., Колчина Н. П., Кикоть В. Н., Булохов М. Т //Вести, дерматол.—
1985. — № 2. — С. 28—30.
Винокуров И. Н., Скрипкин Ю. К., Ухова Л. С.//Сов. мед.— 1966. — № 4.—
' С. 90—94.
Глухенький Б. Т., Делекторский В. В., Федоровская Р. Ф. Гнойничковые болезни
кожи. — Киев: Здоров’я, 1983.
Даниленко М. В., Павловский П. П., Бойко Н. И., Бешлей В. И.//Хирургия. —
1982. — № 11. — С. 812—813.
Дацковский Б. М„ Закс А. С., Митрюковский*Л. С.//Труды Перм. мед. ин-та. —
1975. — Т. 133. — С. 3—82.
Дмитриев А. А., Иванов О. Л., Овчаров А. А. и др.//Вестн. дерматол.— 1981.—
№ 9.— С. 19—21.
Желтаков М. М., Шарапова Г. Я.//Вести, дерматол. — 1963. — № 1. — С. 10—14.
Кондратьев Г. Г., Сергеев В. П.//Труды Ленинград, сан.-гиг. мед. ин-та.— 1971.—
Т. 93. — С. 67—69.
Коротич О. //.//Факторы естественного иммунитета при различных физиологиче-
ских и патологических состояниях. — Челябинск, 1974. — С. 239—241.
Кубанова А. А., Васильева Л. Л., Петрова И. В., Лещенко Г. М.//Вести. дерматол.—
1983. — № 12. — С. 24—27.
Кулага В. В.//Вестн. дерматол. — 1977. — № 4. — С. 70—72.
Лазарев Н. В.//Стимуляторы функций ретикуло-эндотелиальной системы. — Уфа,
1967. — С. 6—10.
Лесников Е. 77.//Всероссийский съезд дермато-венерологов, 3-й: Тезисы докла-
дов. — М., 1971, —С. 129—130.
Лопухин Ю. М., Молоденков М. Н., Шарапова Г. Я., Короткий Н. Г. и др.//Вестн.
дерматол. — 1982. — № 10. — С. 4—7.
Ляпон А. О.//Вестн. дерматол.— 1980. № 11. —С. 8—11.
Марокко И. Н., Кржечковская В. В., Сугоняева И. П.//Всесоюзный биохимиче-
ский съезд, 5-й: Труды. — М., 1986. — С. 349—350.
Мартыненко Ф. П.//Укр. биохим. журн. — 1977. — Т. 49, № 3. — С. 121 —125.
Машкиллейсон А. Л., Машкиллейсон Н. А.//Вести, дерматол.— 1982. — № 9.—
С. 42—44.
Насонова В. А., Алекберова 3. С., Алябьева А. П., Маевская Т. М.//Клин. мед. —
1972. — № 2. — С. 9—15.
Нестеренко Г. Б., Башмаков Г. В., Коган Г. X. и др.//Дерматология и венероло-
гия. — Киев, 1982. — Вып. 17. — С. 65—68.
Нуреев Г. Г.//Вестн. дерматол. — 1982. — № 7. — С. 52—56.
566
Пятикоп А. И., Мадиевская Н. Н., Солошенко Э. Н.//Дерматология и венероло-
гия.— Киев, 1978. — Вып. 13. — С. 10—13.
Розентул М. А. Общая терапия кожных болезней. — М.: Медицина, 1970. — 457 с.
Розентул М. А., Студницин А. А.//Вести, дерматол. — 1961. — № 12. — С. 38—41.
Савицкая Л. Н., Федоровская Р. Ф.//Вести. дерматол. — 1985. — № 9. — С. 9—12.
Скрипкин Ю. К./ /Сов. мед. — 1962. — № 9. — С. 82—87.
Скрипкин Ю. К., Бережной Ю. 3.//Гормональные расстройства и аллергические
процессы. — М, 1969. — С. 165—167.
Скрипкин Ю. К., Хамаганова А. В., Богданова Н. С'.//Вест. дерматол. — 1976. —
№ 9. — С. 11 — 12.
Скрипкин Ю. К., Короткий И. Г., Уджуху В. Ю. и др.//Вестн. дерматол. —
1986. — № 4. — С. 4—7.
Смелов Н. С.//Актуальные вопросы патогенеза и терапии кожных и венерических
болезней. — М., 1969. — С. 69—ПО.
Токарев Ю. Н., Сапожников И. В.//Конференция по вопросам неспецифической
профилактики инфекций и методов повышения сопротивляемости организма:
Материалы. — Челябинск, 1961. — С. 126—129.
Федоровская Р. Ф., Резникова Л. С., Хапилова В. И. и др.//Вестн. дерматол. —
1976. — № 9.— С. 9—10.
Шарапова Г. Я.//Всесоюзным съезд дерматовенерологов, 5-й: Труды. — М., 1961. —
С. 134—137.
Шахнес И. Е., Крепкер Я. Б.//Вести, дерматол. — 1985. — № 3. — С. 55—58.
Шахтмейстер И. Я., Писаренко М. Ф., Владимиров В. В. и др.//Вести, дерматол. —
1982. — № 10.— С. 7—10.
Шеметило И. Г., Воробьев М. Г. Современные методы электро- и светолечения. —
М. — Л., 1980.
Эберт Л. Я., Марачев С. //.//Актуальные вопросы иммунологии. — М., 1981.—
С. 82—83.
Clark W. Н., Miht J. С., Rud R. Y., Ainsworth А. М.//Human Patl . 1974. — Vol. 5,
N 1. — P. 25—43.
Jablonska S., Chowaniec O., Jarzalek-Chorzelska M., Beutner E. H.//Przegl. Derm.—
1980. — Vol. 67, N 6. — P. 709—713.
Jablonska S., Chowaniec O., Beutnes E. H. et al.//Dermatologica.— 1981.—
Vol. 163, N 1, — P. 42—51.
last IP, Barth J., Ryttes M.//Derm. Mschr. — 1983. — Bd 169, N 4. — S. 217—226.
Lauharanta J., Kousa M., Kapfanok et al.//Brit. J. Derm. — 1982. — Vol. 165, N 3. —
P. 267—272.
Middlton M. C.//J. Invest. Derm. — 1980. — Vol. 74, N 4. — P. 219—223.
Parrich J. A.//J. Invest Derm. — 1981. — Vol. 77, N 1. — P. 167—171.
Tosca A., Chrizoboli Z, Hatzis J. et al.//Arch. Derm. Res. — 1981. — Vol. 271, N 3. —
P. 351—356.
Wybran J., Fudenberg H. et aI.//New Engl. J. Med. — 1973. — Vol. 228, N 14.—
P. 710—713.
Акимочкина P. Г.//Вопр. курортол. — 1978. — № 1. — С. 53—56.
Амиров Р. 3.//Вопр. курортол. — 1978. — №2. — С. 1—6.
Богуцкий Б. В., Бокша В. Г.//Вопр. курортол.— 1978. — № 6. — С. 1—7.
Григорьева В. Д., Новикова Н. В.//Вопр. курортол.— 1985. — № 2. — С. 13—17.
Данилов Ю. Е.//Вопр. курортол. — 1978. — № 3. — С. 1—5.
Деменева Л. А., Иванов Е. М., Исаи С. В.//Вопр. курортол. — 1986. — № 2.—
С. 31—34.
Довжанский С. И., Суворов А. 77.//Вопр. курортол.— 1979. — № 1. — С. 63—64.
Дорогина В. М., Першин С. П. Вести, дерматол.— 1985.— Ns 5. — С. 46—49.
Едрева В., Илиева Ё.//Курортол. Физиотер. (Болг.).— 1984. — Т. 21. — № 3.—
С. 113—119.
Костадинов Д., Арнаудова В., СарафоваЛ. и др.//Курортол. Физиотер.— 1984.—
Т. 21. — № 4. — С. 170—175.
Марьясис Е. Д., Чеботарев В. В., Тупикина В. А.//Вопр. курортол.— 1975. —
№ 2.— С. 176—180.
Микунис Р. И., Дубовой А. Ф., Адаменко Д. Л., Бойко И. А.//Вопр. курортол.—
1985. — № 3. — С. 61—63.
Миля вс кий А. И., Аскерова М. И.//Вести, дерматол. — 1975. — № 6. — С. 52—55.
567
Олефиренко В. Т.//Вопр. курортол. — 1977. — №6. — С. 1—3.
Хархаров М. А., Тирулов М. Т., Эльдаров М. Ч.//Вопр. курортол. — 1985. —
№ 4. — С. 58—59.
Шахтмейстер И. Я., Марзеева Г. И., Иванов Л. В., Рязанцев А. К.//Действие фи-
зических факторов на живой организм. — Одесса, 1978. — С. 38-—43.
Arichi S. Asian Med. J. Jap. — 1985. — Vol. 28, N 1. — P. 23—29.
Crielaard J. M„ Lorea V., Reuter A. M. Acta belg. med. phys. — 1985. — Vol. 8,
N 2. — P. 95—99.
Hildebrandt G. Z. Phys. Med. Klim. — 1984. — Bd 13, N 2. — S. 58—69.
Kessler F„ Ecke H. J. Z. Phys. Med. Bain. Med. Klim. — 1984. — Bd 13, N 2.-
S. 51—57.
Puissant A. Presse therm, dim.— 1984. — Bd 121, N 4. — P. 181—182.
Schuitze E.-G.//Helbad u. Kurort.— 1985. — Bd 37, N 5. — S. 122—126.
Usman-Ozer N., Alp H., Devrim A. S. Z. Physiother. — 1985. — Bd 37, N 4. — S. 277—
278.
К главе 7
Александров О. А., Демченкова Г. 3., Случевский И. И. Сов. здравоохр. —
1985. — № 7. — С. 3—7.
Буренков С. П.//БМЭ, 3-е изд. — М. — Т. 7. — С. 350—359.
Демченкова Г. 3.//Проблемы диспансеризации населения/Под ред. А. Ф. Серенко
и А. Ценова. — София, 1982. — С. 20—33.
Жданов А. М.//Сов. здравоохр. — 1983. — №5. — С. 12—17.
Лисицын Ю. П., Царегородцев Г. //.//Полит, самообразование. — 1986. — Na 10. —
С. 29—38.
Майстрах К. В. Диспансерный метод работы лечебно-профилактических учрежде-
ний. — М.: Медгиз, 1955.
Москвичев А. М.//Сов. здравоохр. — 1985. — № 6. — С. 3—10.
Павлова В. И., Гребенкина Е. А., Тихонова А. Я.//Всероссийский съезд дермато-
венерологов 1-й: Тезисы докладов. — М., 1961. — С. 56—56.
Сафонов А. Г.//Сов. здравоохр. — 1985. — № 4. —С. 10—15.
Тесалова О. Т. Вести, дерматол. — 1983. — Na 3. — С. 27—32.-
Щепин О. П., Пчпегородцев Г. И., Ерохин В. Г.//Вестн. АМН СССР. — 1985.—
Na 5. — С. 3—14.
К главе 8
Абрамова Е. И., Ремизов С. М.//Стоматология. — 1970. — Na 4. — С. 95—96.
Глухенький Б. Т., Делекторский В. В., Федоровская Р. Ф. Гнойничковые бо-
лезни кожи. — Киев: Здоров’я, 1983.
Гольдштейн Л. М., Томашевский Д. //.//Вести, дерматол.— 1973. — Na 10.—
С. 73—77.
Каламкарян А. А., Федоровская Р. Ф., Трофимова Л. Я., Перламутров К). Н.//
Клин. мед. — 1986. — Na 8. — С. 130—134.
Патканьян К. Г.//Опыт советской медицины в Великой Отечественной войне
1941 — 1945 гг. — М„ 1951. — Т. 27—28. — С. 25—25.
Попов И. С., Шур С. Г., Кириллова И. //.//Вести, венерол. — 1941. — Na 4. —
С. 50—51.
Bundino S., Zina A.//Dermatologica. — 1984. — Vol. 168, N 5. — P. 230—
232.
Dillaha C., Jansen G., Honeycutt ^.//Clinical dermatology. — Philadelphia, 1983.—
Vol. 3. — P. 1—3.
Fabry H.//Z. Hautkrh. — 1985. — Bd 65, N 23. — S. 1860—1861.
Gianadda B., Gianadda E., Fazio A/.//Dermatologica.— 1982.- Vol. 164, N 3.—
P. 195—200.
Haustein U., Grander H., Bolck /•'.//Derm. Mschr.— 1979. — Bd 169, N 6.—
S. 418—424.
Horton J., Trance J., MacDonald D. Brit. J. Derm.— 1984. — Vol. Ill, N 2.—
P. 227—230.
568
Leyh F„ Wurzel M. Hautarzt. — 1984. — Bd 35, N 4. — S. 188—191.
Massa M., Su W. J. Amer. Acad. Derm.— 1982. — Vol. 6, N 1. — P. 84—91.
Poster J. Clinical Dermatology. — Philadelphia, 1983. — Vol. 1. — P. 1—46.
К главе 9
Ариевич A. M., Шецирули Л. Т. Грибковые заболевания ногтей. — Тбилиси:
Мецниереба, 1972.
Кашкин П. Н., Шеклаков Н. Д. Руководство по медицинской микологии. — М.:
Медицина, 1978.
Кашкин П. Н., Хохряков М. К., Кашкин А. П. Определитель патогенных, токси-
генных и вредных для человека грибов. — Л.: Медицина, 1979.
Кожные н венерические болезни: Атлас/Под ред. Н. М. Тураиова, А. А. Студни-
цииа и Н. С. Смелова. — М.: Медицина, 1977.
Кулага В. В., Романенко И. М., Черномордик А. Б. Кандидозы и их лечение. —
Киев: Здоровья, 1985.
Лещенко В. М. Аспергиллез. — М.: Медицина, 1973.
Лещенко В. М. Лабораторная диагностика грибковых заболеваний. — М.: Медицина,
1982.
Тропические болезни/Под ред. Ю. А. Ильинского и В. И. Лучшева. — М.: Медици-
на, 1984.
Хмельницкий О. К. Гистологическая диагностика поверхностных и глубоких ми-
козов.— Л.: Медицина, 1973.
Шеклаков Н. Д. Болезни ногтей. — М.: Медицина, 1975.
Conant N. F., Smith D. Т„ Backer R. D., Calloway I. L. Manual of Clinical mycology. —
Philadelphia: Saunders, 1971.
Emmons C. W., Binford С. H„ Utz I. P. Medical mycology. — Philadelphia: Saunders,
1971.
К главе 10
Авербах M. М. Иммунология и иммунопатология туберкулеза/Под ред. М. М. Авер-
баха. — М.: Медицина, 1976. — 309 с.
Агапкин И. Н.//Вести, дерматол. — 1975. — № 7. — С. 71—75.
Александрова А. Е„ Ариэль Б. М., Подосинников И. С. и др.//Проб. туб. — 1983. —
№9.— С. 56—61.
Белендер Э. Н., Накосичный Г. Д., Чихарь А. Л/.//Проб. туб.— 1979. — Na 6.—
С. 59—63.
Белендер Э. //.//Всесоюзный съезд фтизиатров, 10-й: Тезисы докладов. — Киев,
1986. — С. 293—294.
Грунд В. Д., Извеков А. Т., Яковлева Т. KJ/Актуальные вопросы туберкулеза.—
М„ 1985.— С. 7—9.
Довгалюк И. Ф., Моисеева Л. Л/.//Проб. туб. — 1985. — Na 11. — С. 28—31.
Елыианская М. П., Ерохин Б. В.//Проб. туб. — 1984. — № 2. — С. 59—64.
Зеликман М. А.//Проб. туб. — 1978. — № 4. — С. 13—17.
Зеликман М. А.//Вести, дерматол. — 1981. — Na 7. — С. 53—55.
Зеликман М. А.//Проб. туб. — 1984. — Na 9. — С. 14—16.
Исаева Э. Г., Лаптева И. А.//Проб. туб.— 1984. — № 6.'—С. 59—64.
Кардашенко Б. Я., Шахтмейтер И. Я., Анименко М. М.//Вести, дерматол. —
1981. — Na 2. — С. 53—54.
Краснопольский К). М., Гольбец И. И., Орлова Г. Л. и др.//Проб. туб. — 1985.—
№ 11. — С. 55—58.
Коляденко В. Г., Голавченко Д. Я., Шмыгало М. П. и др.//Вестн. дерматол.—
1982. — Na 6. — С. 51—54.
Лалаева А. М., Левинтова Г. И., Деменкова Н. В.//Вести, дерматол.— 1981.—
Na 7. — С. 53—55.
Литовченко О. В., Шаповал М. //.//Туберкулез у детей. — М., 1976. — С. 133—
141.
Маслаускене Т. П., Никитина О. И.//Проб. туб. — 1987. — Na 1. — С. 10—11.
Никитина В. С.//Проб. туб. — 1986. — № 1. — С. 20—23.
Ольховский А. Л/.//Вестн. дерматол. — 1975. — Na 12. — С. 60—61.
569
Петров И. Л/.//Эпидемиология, диагностика, клиника и лечение туберкулеза.—
Тбилиси, 1980. — С. 203—207.
Петров И. //.//Организация противотуберкулезной помощи в современных усло-
виях. — М., 1984. — С. 14—20.
Graham-Brown R. А. С., Sarkany /.//Brit. J. Derm.— 1980. — Vol. 103, N 5.—
P. 561—564.
Gupta Mt Chandalia B. S.//1. Hautkrankh. — 1984. — Bd 59, N 3. — S. 436—438.
Hammer G.//Ibid. — 1981. — Bd 56, N 4. — S. 236—238.
Hirsh В. C, Johnson W. C.//Int. J. Derm. — 1984. — Vol. 23, N 2. — P. 90—100.
Horney D. A., Gaither J. M., Lauer R. et al.I/Arch. Derm. — 1985. — Vol. 121, N 5. —
P. 648—650.
Iden D. Lt Rogers R. St Schroeter A. L.//Arch. Derm. — 1978. — Vol. 114, N 4. —
P. 564—566.
Immamura S., Yanase Kt Horiguchi M. et al.//Dermatologica. — 1982. — Vol. 165. —
P. 94—99.
Kaufmann Ц Kun K.//Z. Hautkrankh. — 1985. — Bd 60, N 12. — S. 93—99.
Mihara K„ Isoda M.//Brit. J. Derm. — 1986. — Vol. 115, N 2. — P. 187—192.
Nascimento L. V. do, Azylay R. D., Neves R. G. et al.//An. bras. Derm. Sif. —
1983.— Vol. 58, N 4. —P. 147—152.
Nishigori Ct Taniguchi St Hayakawa M. et al.//Dermatologica.— 1986. — Vol. 172,
N 2. — P. 93—97.
Prabhu St Datary D„ Dholak H.//J. oral Surg. — 1978. — Vol. 36. — P. 384—386.
Premalatha S., Augustine S. M., Yesudian P. et al.//Int. J. Derm. — 1982. — Vol. 21,
N 8. — P. 470—471.
Ramesh K.//Dermatologica. — 1986. — Vol. 173, N 3.— P. 155—156.
Rauch D., Friedman E.//J. oral Surg. — 1978. — Vol. 36. — P. 387—389.
Saraski G„ Takayasu S.//Skin Res. — 1975. — Vol. 17, N 3. — P. 217—222.
Simon A/.//Hautarzt. — 1975. — Bd 26, N 12. — S. 625—630.
Winnen P.f /Z. Hautkrankh. — 1981. — Bd 56, N 9. — S. 607—608.
К главе 11
Абдиров Ч. А., Ющенко А. А., Вдовина Н. А. Руководство по борьбе с лепрой. —
Нукус: Каракалпакстан, 1987. — 172 с.
Бабаянц Р. С. Кожные и венерические болезни жарких стран. — 2-е изд. — М.:
Медицина, 1984. — 384 с.
Библиографический указатель научных работ по лепре (1977—1982 гг.)/Сост.
А. А. Ющенко, Р. Г. Терещенко. — Астрахань, 1983. — 47 с.
Вишневецкий Ф. Е., Ющенко А. А.//Труды Ленингр. науч, о-ва патологоанат. —
Л., 1981. — Вып. 22. — С. 289—294.
Врачебно-трудовая экспертиза при лепре: Метод. рекомендации/Сост. А. А. Ющен-
ко, Н. Д. Каданцев, В. Р. Коган и др. — М., 1987. — 24 с.
Голощапов Н. М., Стекловский В. К., Филипских Т. П., Хромова Е. />.//Вести,
дерматол. — № 4. — С. 67—71.
Дифференциальная диагностика кожных болезней: Рук-во для врачей. 2-е изд./
Под ред. Б. А. Беренбейна и А. А. Студницина. — М.: Медицина, 1989.—
С. 182—184.
Коган В. Р., Шубин В. Фt Давлекамова Ф. А., Семиченко 3. Л.//Вести. дерматол. —
1980.— № 8.— С. 69—71.
Норден С. Н., Сансаррик X. Бюл. ВОЗ.— 1984. — Т. 62. — Na 1. — С. 1—6.
Покровский В. И., Нгуен Танг А. М., Годованный Б. А. Журн. микробиол.—
1987. —№ 10.— С. 103—106.
Полетаев С. Д., Погорелов В. Н. Туберкулез и лепра.— М.: Медицина, 1986.—
128 с.
Роль эпидемиологических показателей в программах борьбы с лепрой: Серия техи.
докл. ВОЗ № 716. — Женева: ВОЗ, 1986. — 60 с.
Руководство по борьбе с лепрой: Пер. с англ. — Жеиева: ВОЗ, 1982. — 116 с.
Химиотерапия в программах борьбы с лепрой: Серия техн. докл. — № 675. —
Жеиева: ВОЗ, 1985. — 34 с.
570
Ющенко А. А., Вишневецкий Ф. Е., Евстратова В. А. Лепра//БМЭ, 3-е изд.—
М., 1980.— Т. 13.— С. 34—50. v "
Gulnto R. S., Abalos R. M., Cellona R. V., Fajardo T. T. An Atlas of Leprosy. —
Tokyo: Sasakawa Memorial Health Foundation, 1983.______57 p.
International Leprosy Congress, 12th: Abstracts. — New Delhi, 1984. — 152 p.
Jopling W. H. Handbook of leprosy. — 3rd ed. — London: W. Heinemann Medical
Books LTD, 1984. — 145 p.
Le prosy/Ы. R. C. Hastings. — Edinburgh: Churchill Livingstone, 1985.— 331.
Parijs L. G. Van. Health Education in Leprosy Work. — London: 1LEP, 1986. —
96 p.
К главе 12
Бабаянц P. С.//Кожные и венерические болезни жарких стран. — М., 1984.—
С. 144—167.
Бароян О. В., Бредли Д. Дж. Современные взгляды на тропическую патологию. —
М., Медицина, 1979.
Боровский П. Ф.//Воен. мед. журн. — 1898. — № 11. — С. 925—925.
Добржанская Р. С. Туберкулоидный кожный лейшманиоз. — Ашхабад, 1964.
Добржанская Р. С. Серо-иммунологические аспекты в клинике кожного лейшмани-
оза. — Ашхабад: Ылым, 1984.
Каримов Ш. М. Патоморфология кожного лейшманиоза. — Ашхабад: Ылым,
1976.
Кассирский И. А., Плотников Н. Н., Токарев Ю. Н., Лысенко А. Я.//Руководство
по тропическим болезням. — М., 1974. — С. 124—154.
Келлина О. И., Шуйкина Э. Е., Сергиева В. 77.//Актуальные вопросы иммунитета
и иммунодиагностики при протозойных инфекциях. — М., 1973. — С. 61—93.
Келлина О. И. Кожный лейшманиоз//БМЭ, 3-е изд. М-, 1980, Т. 12. — С. 497—
501.
Кожевников П. В., Добротворская Н. В. Учение о кожном лейшманиозе. — М.:
Медгиз, 1947.
Кочергин Н. Г.. Садык Мухамед А. X.//Мед. реф. журн. — XI — 1985. — №6. —
С. 7—11.
Латышев Н. И., Кожевников П. В., Повалишина Т. П. Болезнь Боровского, кож-
ный лейшманиоз, пендинская язва. — М.: Медгиз, 1953.
Лейшманиозы: Докл. Ком. экспертов В.ОЗ: Пер. с англ. Серия техн. докл. ВОЗ,
№ 701.
Овчинников Н. М., Делекторский В. В., Космачева С. А.//Вести, дерматол. —
1974. — № 8. — С. 32—32.
Павловский Е. Н. Природно-очаговые болезни человека. — М.: Медгиз, 1960.
Родякин И. Ф., Двуреченская Н. В. Кожный лейшманиоз: Библиографический
указатель литературы (1862—1960). — Ашхабад, 1962.
Родякин Н. Ф. Кожный лейшманиоз (эпидемиология, клиника, лечение и про-
филактика).— Ашхабад: Ылым, 1982.
Сафъянова В. Л/.//Современные взгляды на тропическую патологию. — М.: Меди-
цина, 1979.
Adler S.//Advances in Parasitology. London — New York, 1964.— P. 35—96-
Bray R. S., Ashford R. W., Bray M. A.//Trans. roy Soc. trop. Med. Hyg.— 1973.—
Vol. 67. — P. 345—346.
Bray R. S.//Immunology of parasitic infections. — Oxford, 1976. — Ch. 6. — P. 76—76.
Convit J., Pilardi M. E.//Trypanosomiasis and leishmaniasis with special reference
to Chagas disease. — Amsterdam, 1974. — P. 159—169. , . • .
Grimaldi G. Jr .//Mem. Inst. Oswaldo Cruz.— 1982. — Vol. 77, N 2. — P. 195—215.
Holland E.//S. Afr. Med. J. — 1973. — Vol. 47. — P. 83—83.
Hommel M.//Bull. Inst. Pasteur (Park). — 1978. — Vol. 75. — P. 5—102.
Noveles J.//Int. J. Derm. — 1979. — Vol. 13, N 5. — P. 283—286.
Pareek S. S.//Int. J. Derm. — 1984. — Vol. 23, N 1. — P. 70—71.
Stingl P.//Z. Hautkrankh. — 1982. — Bd 57, N 23. — S. 1709—1721.
Ybsudian P. et al.//Arch. Derm. — 1974. — Vol. 109. — P. 720—722.
571
К главе 13
Абдиева Д. //.//Современные вопросы охраны здоровья человека. — Душанбе,
1984. — С. 3—4.
Абдиева Д. X.//Сборник научных трудов кафедры кожных болезней. — Тадж.
мед. ин-та. — Душанбе, 1986. — С. 59—65.
Арутюнов В. Я. Кожные и венерические болезни. — М.: Медгиз, 1956.
Бабаянц Р. С. Кожные и венерические болезни жарких стран. — М.: Медицина,
1984.
Горчаков Н. Л.//Вести, дерматол. — 1940. — № 12. — С. 26—28.
Гумаров Б. 3.//Вести, дерматол. — 1968. — №9. — С. 82—84.
Демьянович М. П. Чесотка. — М.: Медицина, 1947.
Комов А. О., Смушко Л. Н.//Патогенез и терапия кожных и венерических заболе-
ваний. — Минск, 1982. — С. 175—176.
Ланге А. Б., Клочко Р. Т.//Вести, дерматол. — 1977. — № 1. — С. 19—24.
Ланге А. Б., Федоровская Р. Ф., Соколова Т. В.//Вести, дерматол.— 1984.—
№ 12.— С. 22—29.
Ланге А. Б., Федоровская Р. Ф., Соколова Т. В.//Лаб. дело, 1985. — Na 8. —
С. 492—494.
Левкое Л. Л.//Вести, дерматол. — 1980. — № 12. — С. 28—31.
Литвинов С. К.//Гельминтозы человека. — М., 1985. — С. 250—258.
Паулавичите Д. Р.//Научно-практ. конф, врачей дермато-венерологов: Тезисы
докладов.— Вильнюс, 1981. —С. 91—92.
Потекаев Н. С., Иванов О. И., Сергеев Ю. В.//Вести, дерматол. — 1979. — № 7. —
С. 36—40.
Рахманов В. А., Иняхина А. В., Терентьева Л. /'.//Вести. дерматол. — 1969. —
№ 11. —С. 7—9.
Сергиев В. //.//Руководство по зоонозам. — Л.: Медицина, 1983. — С. 258—266.
Скрипкин Ю. К. Кожные и венерические болезни. — М.: Медицина, 1979.
Смелов Н. С., Никитина Т. А., Большакова Г. М.//Вести. дерматол. — 1968. —
№ 1. — С. 10—14.
Соколова Т. В.//Вести, дерматол. — 1985. — Na 8. — С. 59—63.
Соколова Т. В., Федоровская Р. Ф„ Ланге А. Б. Чесотка. — М.: Медицина,
1988.
Студницин А. А., Романенко Г. Ф.//Вести. дерматол. — 1981. — Na 9. — С. 29—
34.
Федоровская Р. Ф., Чучелин Г. Н., Соколова Т. В. и др.//Вестн. дерматол. —
1985. — Na 7. — С. 31—33.
Федоровская Р. Ф., Соколова Т. В., Ланге А. />.//Вестн. дерматол.— 1986.—
Na 8. — С. 37—43.
Цыркунов Л. П.//Вести, дерматол. — 1985. — Na 8. — С. 51—54.
Цыркунов Л. П. Профессиональные дерматозы от контакта с растениями и жи-
вотными. — М.: Медицина, 1986.
Штейнлухт Л. А., Зверькова Ф. А. Болезни кожи детей грудного возраста. — Л.:
Медицина, 1979. — С. 76—78.
Яровой П. И., Зубчук М. П., Токмалаев А. К. Справочник по медицинской гель-
минтологии. — Кишинев: Картя Молдовеняска, 1984.
Яроцкий Л. С. Шистосомозы. — М.: Медицина, 1982. — 279 с.
AUemeyer P.//Actull. Dermat. — 1980. — Bd 6, N 2. — S. 93—97.
Derbes V. /.//Dermatology in General medicine. — 1979. — New York, Sec. 2. —
P. 1656—1668.
Falk E. S., Matre /{.//Amer. J. Dermatopath.— 1982. — Vol. 4, N 1. — P. 9—15.
Faran F. S.//Dermatology in General medicine. — New York, 1979. — Sec. 2. —
P. 1638—1655.
Orkin M., Mai bach H. /.//Cutis. — 1984. — Vol. 33. N 1. — P. 85—88.
Palicka P.//Czesk. Epidem.— 1979.— Vol. 28, N 2.— P. 108—115.
Palicka P.//Folia Parasitol.— 1982, — Vol. 29, N 1. — P. 51—59.
Rudil T., Mumcnoglu /.//Praxis. — 1981. — Vol. 70, N 10. — P. 414—429.
Winkler A.//Derm. Praxis Klin. — 1980. — Bd 2. — S. 18.209—18.246.
572
К главе 14
Барийский И. Ф., Шубладзе А. К., Каспаров А. А., Гребенюк В. Н. Герпес_____М.:
Медицина, 1986.
Каламкарян А. А., Кочетков В. Д-/ /Вести. дерматол. — 1973. — № 3. — С. 68—73.
Каламкарян А. А., Самсонов В. Л.//Вести, дерматол. — 1977. — № 1. — С. 48—51.
Потекаев Н. С., Самгин М. А.//Сов. мед.— 1983.— Na 6. — С. 79—82.
Соловьев В. Д., Баландин И. Г. Клетка и вирус. — М.: Медицина, 1973.
Соловьев В. Д., Бектемиров Т. Л.//Вести. АМН СССР. — 1979. — №2. — С. 19—26.
Шитов А. С., Уманский К. Г.//Клин. мед.— 1981.— № 3. — С. 66—72.
Beilina J.//Amer. J. Obstet. Gynec. — 1983. — Vol. 147. — P. 375—378.
Belsey E. M., Adler M. IP.//Brit. J. Vener. Dis.— 1978. — Vol. 54. — P. 115—120.
Cap J. P., Schwanitz H. J., Noltings S.//Z. Hautkrankh.— 1984. — Bd 59, N 3.—
P. 193—196.
Chang T. W.//Intern. J. Derm.— 1975. — Vol. 14, N 3. — P. 201—202.
Felman Y., Nikitas J.//New York State J. Med.— 1979.— N 8. — P. 1216—1218.
Fenenczy A.//Amer. J. Obstet. Gynec.— 1984. — Vol. 148, N 1. — P. 9—12.
Gunby Ph.//J. A. M. A. — 1983. — Vol. 250, N 18. — P. 2417—2427.
Hill T. J., Blyth IV. A.//Lancet. — 1976. — Vol. II, N 7956. — P. 397—398.
Juliusberg Af.//Ditsch. med. Wschr.— 1905.— Bd 31. — S. 1598—1599.
Jablonska S., Orth G., Jarzabek-Chorzelska M. et al.//J. Invest. Derm. — 1979.—
Vol. 72, N 3. — P. 114—119.
von Krogh G.//Hautarzt. — 1982. — Bd 33, N 11. — S. 571—573.
Luderschmidt Ch.//Z. Hautkrankh.— 1979. — Bd 54, N 10. — S. 421—423.
De Maubeuge J., Ledoux M., Parent D. et al.//Dermatologjca (Basel).— 1984.—
Bd 108, N 3. — S. 141 — 143.
Nagafuchi S.//Fukuoka acta Med. — 1980. Vol. 71, N 7. — S. 353—354.
Nesburn A. B., Dunkel E. C., Frousdale M. D.//Proc. Soc. exp. Biol. Med. — 1980. —
Vol. 163. — P. 398—401.
Pfister H., Haneke E.//Arch. derm. Res.— 1984. — Vol. 276, N 2. — P. 123—125.
Spaulding W. P., Hennessy J. JV.//Amer. J. Med. — 1960. — Vol. 28. — P. 504—509.
Stary A., Soltz-Szots J.//Wien. Klin. Wschr. — 1983. — Vol. 95, N 23. — P. 823—
827.
Taieb A., Dubrau J. M., Gurllet G. et al.//Ann. Derm. Venerol.— 1984. — Vol. Ill,
N 2. — P. 173—175.
Thompson T. E., Miller K. F.//Krm. intern. Med.— 1953. — Vol. 39.— P. 146—151.
К главе 15
Беренбейн Б. А. Зудящие дерматозы (Нейродерматозы). — М.: Медицина, 1971.
Бисярина В. /7.//БМЭ. — 3-е изд. М., 1984. — Т. 23. — С. 371—372.
Глухенький Б. Т., Грандо С. А. Применение ингибиторов протеиназ больным с
различными клинико-морфологическими формами атопического дерматита//
Вести, дерматол. — 1985. — № 1. — С. 53—56.
Голосовкер С. Я., Зверькова Ф. А.//Сов. мед. — 1955. — Na 5. — С. 43—46.
Елиневская Г. Ф., Мазур В. А.//Вопр. охр. мат.— 1984.— Na 6. — С. 30—32.
Зверькова Ф. А., Качанов В. П., Балясников В. И., Литвинок Н. В. Герпетиформ-
ная экзема Капоши у детей. Клиника, лечение, профилактика: Метод, рекомен-
дации М3 РСФСР.—Л., 1985.
Зверькова Ф. А.//Вопросы детской дерматологии. — Л., 1985. — С. 28—37.
Калашников Б. С.//Вопросы детской дерматологии, — Л., 1985. — С. 24—28.
Потекаев Н. С., Сергеев Ю. В. Атопический дерматит (клиника, диагностика,
лечение и профилактика): Метод, указания. — М., 1986.
Потоцкий И. И., Гребенников В. А., Коляденко В. Т. Нейродермит. — Киев: Здо-
ров’я, 1986. — 136 с.
Скрипкин Ю. К. Нейродермит (вопросы этиологии, патогенеза и терапии). — М.:
Медицина, 1967.
Скрипкин Ю. К., Зверькова Ф. А., Шарапова Г. Я., Студницин А. А. Руководство
по детской дерматовенерологии. — Л.: Медицина, 1983.
573
Таболин В. А.//БМЭ. — 3-е изд. — М„ 1984. — Т. 22. — С. 904—907.
Торопова Н. П., Синявская О. А., Христюк В. М., Бахтилин В. Я. Экзема и нейро-
дермит у детей. — Иркутск: Изд-во Иркут, ун-та, 1986.
Шамова А. Г., Бахтиарова Р. М.//Казан. мед. журн. — 1982. — № 4. — С. 11 —13.
Штейнлухт Л. А., Зверькова Ф. А., Островский А. Д^ Придвижкин И. Г.//Вести,
дерматол. — 1975. — № 3. — С. 3—7.
Штейнлухт Л- А., Зверькова Ф. А. Болезни кожи детей грудного возраста. — Л.:
Медицина, 1979.
Benton Е. С., Barnetson R. С.//Acta derm.-venereol. (Stockh.).— 1985. — Suppl.
114. — P. 129—132.
Braun-Falco O., Ring /.//Hautarzt, 1984. — Bd 35, N 9. — S. 447—454.
Dahl M. lP.//Arch. Derm. — 1986. — Vol. 122, N 3. — P. 265—266.
Erdmann G.//Mschr. Kinderheilk. — 1981. — Bd 129. — P. 4—13.
Hanifin J. M.//J. Amer. Acad. Derm. — 1982. — Vol. 6. — P. 1—13.
Kiene U., Gollnick H., Bauer R., Orfanos C. £.//Hautartz.— 1986. — Bd 37.—
S. 17—22.
Ring J-, Dorsch O'.//Acta derm.-venereol. (Stockh). — 1985. — Suppl. 114.—
P. 9—23.
Rystedt I.//Acta derm.-venereol. (Stockh.). — 1985. — Suppl. 114. — P. 117—120.
Schuiltz F. V., Larsen F., Holm N. P.//Acta derm.-venereol. (Stockh.).— 1985.—
Suppl. 114. — P. 44—47.
Schudel P., Wuthrich B. Z. Hautkrankh. — 1985. — Bd 60. — S. 479—486.
Weston W. L., Lane A. T., Weston J. ^.//Pediatrics.— 1980. — Vol. 66, N 4.—
P. 532—536.
ОГЛАВЛЕНИЕ
Предисловие............................................................ 3
Глава 1. Из истории развития дерматологии и венерологии
(М. И. Бухарович, В. Г. Каляденко).................................... $
Глава 2. Морфология нормальной кожи человека (Г. М. Цветкова) . . 28
Глава 3. Физиология и биохимия нормальной кожи (В. Г. Акимов) . . 50
Глава 4. Общая гистопатология и иммунопатология кожи (И. М. Раз-
натовский, Л. В. Белецкая, И. В. Петрова)............................ 71
Глава 5. Общие принципы диагностики кожных заболеваний (Б. А. Бе-
ренбейн) ........................................................... 123
Глава 6. Основные принципы лечения болезней колеи (Ю. К. Скрипкин.
Г. Я. Шарапова)......................................................157
Глава 7. Роль дерматовенерологических учреждений в организации ле-
чебной помощи и диспансеризации больных (О. Т. Тесалова,
М. В. Яцуха) . ..................................................... 240
Глава 8. Гнойничковые заболевания кожи (А. А. Каламкарян, Е. И. Ар-
хангельская, Б. Т. Глухенький) ........... 256
Глава 9. Грибковые заболевания кожи (В. М. Лещенко)...................295
Глава 10. Туберкулез кожи (В. Н. Мордовцев, М. И. Шаповал) .... 355
Глава 11. Лепра (А. А. Ющенко)........................................393
Глава 12. Кожный лейшманиоз (болезнь Боровского) (Н. Ф. Родякин) . 422
Глава 13. Паразитарные болезни кожи (Р. Ф. Федоровская, Н. И. Рас-
сказов) .............................................................456
Глава 14. Вирусные дерматозы (А. А. Каламкарян, В. Н. Гребенюк) . . 483
Глава 15. Особенности течения и лечения дерматозов у новорожденных
и в раннем детском возрасте (Ф. А. Зверькова, Г. Я. Шара-
пова) ...............................................................507
Список литературы.....................................................563
Руководство
КОЖНЫЕ И ВЕНЕРИЧЕСКИЕ БОЛЕЗНИ
Т. 1
Зав. редакцией Э. М. Попова
Научные редакторы
|Б. А. Беренбейн|, В. Н. Мордовцев
Редактор Н. Д. Карцева
Художественный редактор С. М. Лымина
Художник С. М. Лымина
Технический редактор Г. Н. Жильцова
Корректор Л. В. Петрова
ИБ № 5096
ЛР № 010215 от 11.03.92. Сдано в набор
11.03.94. Подписано к печати 04.08.94. Формат
бумаги 60X90'/i6. Бумага кн.-журн. офс. Гар-
нитура тайме. Печать офсетиая. Усл. печ. л.
37,0. Усл. кр.-отт. 40,0. Уч.-изд. л. 41,65.
Тираж 7000 экз. Заказ № 936. «С» 052.
Ордена Трудового Красного Знамени
издательство «Медицина»
101000, Москва, Петроверигский пер., 6/8
АООТ «Ярославский полиграфкомбинат».
150049, г. Ярославль, ул. Свободы, 97.
Рис. 39. Смешанная стрепто-стафило-микоплазменная инфекция, проте-
кающая по типу фликтенулезного импетиго с резко выраженными гемор-
рагиями и тромбозами сосудов.
К стр. 265
Рис. 40. Фурункул голени.
Рис. 41. Карбункул в области лица (начальная стадия).
Рис. 42. Гидраденит.
К стр. 273
Рис. 43. Стрептококковое импетиго лица у взрослых.
К стр. 273
Рис. 44. Стрептококковое импетиго.
К стр. 273
Рис. 45. Заеда в области правого угла рта и остиофолликулит, трансфор-
мирующиеся в глубокую злокачественную пиодермию. Подчелюстной
лимфаденит.
К стр. 282
Рис. 52. Хроническая язвенно-вегетирующая пиодермия, напоминающая
скрофулодерму.
К стр. 296
Рис. 56. Разноцветный лишай.
К стр. 299
Рис. 58. Дисгидротическая эпидермофития.
а — дисгидротические высыпания на подошвах; б — эритематозно-сквамозные очаги на
боковой поверхности стоп.
К стр. 331
Рис. 72. Папуло-пустулезный североамериканский бластомикоз ягодиц.
К стр. 404
Рис. 90. Туберкулоидный тип лепры. Бляшка на ягодице, сформированная
мелкопапулезными элементами.
К стр. 404
Рис. 91. Туберкулоидный тип лепры (реверсия из субполярного лепро-
матозного типа). Множественные бордюрные элементы с начинающимся
регрессом в центре.
К стр. 406
Рис. 92. Лепроматозный тип лепры. Распространенные пятнистые эрите-
матозные высыпания, инфильтраты.
К стр. 406
Рис. 93. Лепроматозный тип лепры. Множественные сливающиеся узлы
(лепромы) на фоне диффузного инфильтрата.
К стр. 406
Рис. 94. Лепроматозный тип лепры. Инфильтрация кожи лица, множе-
ственные лепромы, некоторые в стадии начинающегося распада.
К стр. 407
Рис. 95. Лепроматозный тип лепры. Множественные лепромы и диффуз-
ная инфильтрация кожи лица, лепромы на красной кайме губ, на ушных
раковинах.
К стр. 487
Рис. 106. Простой герпес лица: поражение красной каймы и кожи губ,
подбородка и щеки.
К стр. 492
Рис. 107. Опоясывающий лишай, в патологический процесс вовлечена
первая ветвь тройничного нерва.
К стр. 497
Рис. 108. Обычная бородавка.
К стр. 497
Рис. 109. Плоские бородавки.
К стр. 500
Рис. 110. Остроконечные кондиломы анальной области.
К стр. 500
Рис. 111. Остроконечные кондиломы красной каймы губ.