Текст
СЕРИЯ: Высокие т
Эндоскопическая
Оглавление
ОБЩАЯ ЧАСТЬ
1. Эндохирургия: состояние и перспективы И.В. Фёдоров 8
2. История эндохирургии В.В. Одинцов, И.В. Фёдоров 16
3. Инструменты и оборудование П.Г. Жуков, В.Я. Попов 32
4. Общие клинические положения и оперативная техника И.В. Фёдоров 49
5. Высокочастотный электрический ток в эндохирургии И. В. Фёдоров 79
6. Особенности обезболивания в эндохирургии В.М. Белопухов 109
7. Общие осложнения в эндохирургии И.В. Фёдоров 129
СПЕЦИАЛЬНАЯ ЧАСТЬ
8. Диагностическая лапароскопия И.В. Фёдоров 140
9. Лапароскопическая холецистэктомия
И.В. Фёдоров, Л.Е. Славин, АЛ. Чугунов 147
10. Осложнения лапароскопической холецистэктомии
Л.Е. Славин, И.В. Фёдоров : 183
11. Лапароскопическая аппендэктомия И.В. Фёдоров 209
12. Торакоскопическая хирургия Е.И. Сигал, Р.Г. Хамидуллин 219
13. Лапароскопическая герниопластика Е.И. Сигал 246
14. Лапароскопические операции на желудке Е.И. Сигал, Л.Е. Славин 253
15. Лапароскопические операции на кишечнике Е.И. Сигал 273
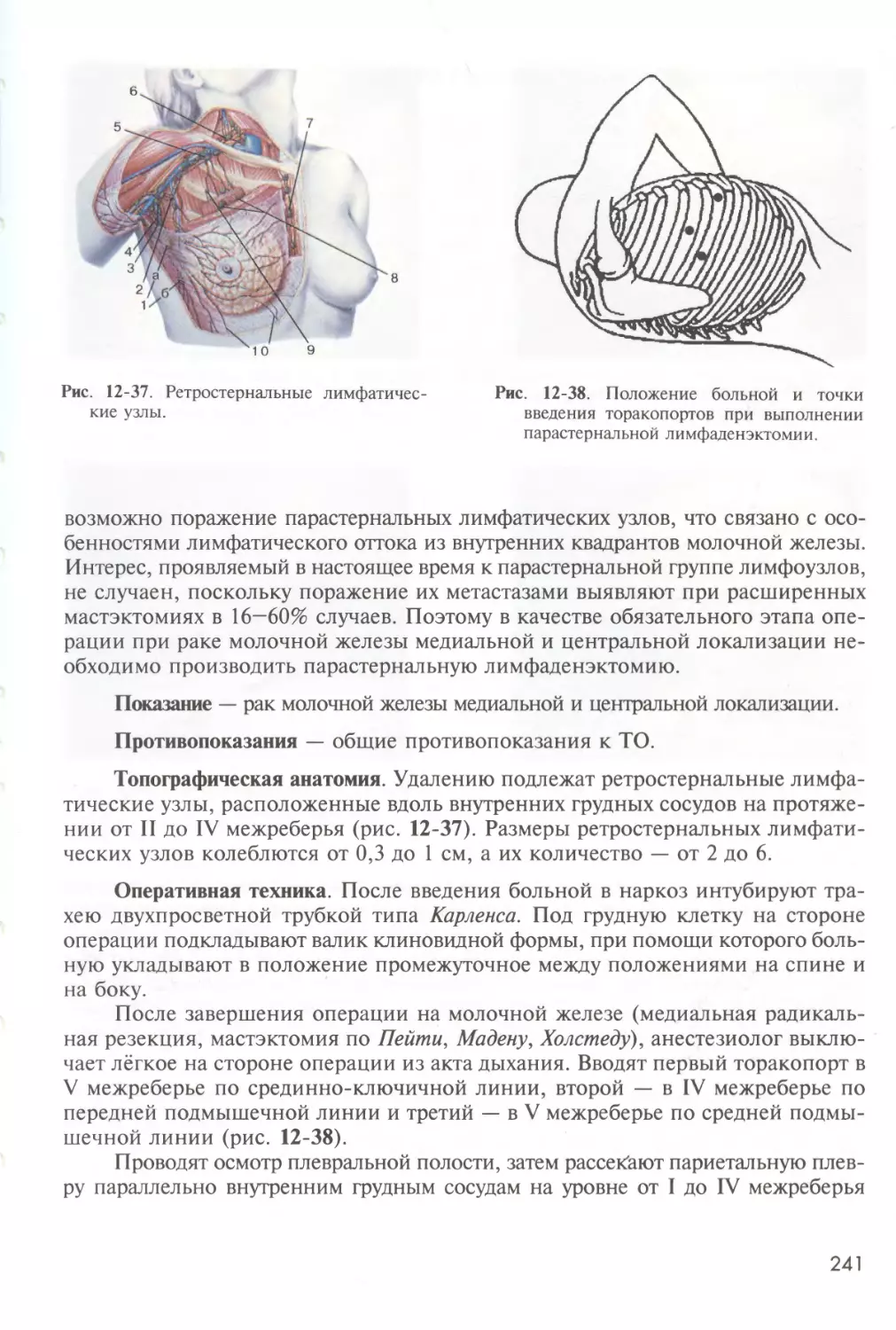
16. Операции на органах забрюшинного пространства 285
Адреналэктомия СИ. Емельянов 285
Поясничная симпатэктомия С.А. Обыдённое 295
17. Лапароскопия в неотложной хирургии И.В. Фёдоров 300
18. Лапароскопическая спленэктомия Е.И. Сигал 309
19. Оперативная лапароскопия в гинекологии Г.Н. Кольцова, И.В. Фёдоров 313
20. Лапароскопия в детской хирургии Н.Н. Молчанов 331
Заключение 350
«... Цель медицинского образования —
дать человеку направление, указать путь
и снабдить картой, весьма неполной
с точки зрения затеваемого путешествия...»
Сэр Уильям Ослер
1
Эндохирургия: состояние
и перспективы
ЭНДОХИРУРГИЯ КАК НОВАЯ
МЕДИЦИНСКАЯ ТЕХНОЛОГИЯ
За минувшее десятилетие в хирургии произошли события, существенно
изменившие принципы оперативного лечения многих заболеваний —
развилась техника эндоскопической хирургии (эндохирургия). Появление эндохи-
рургии, в считанные годы завоевавшей мир весь, было расценено как вторая
французская революция. По значимости эта хирургическая технология сравнима
с распространением асептики и антисептики, внедрением интубационного
наркоза, методики экстракорпорального кровообращения или разработкой
операционных микроскопов.
Эндоскопическая хирургия — метод оперативного лечения заболеваний,
когда радикальные вмешательства выполняют без широкого рассечения покровов, через
точечные проколы тканей или естественные физиологические отверстия. С
конца 80-х годов эти операции выполняют под контролем видеомонитора. В
первую очередь эндохирургия охватывает операции на органах брюшной и
грудной полости — лапароскопические и торакоскопические вмешательства. Именно
эндохирургия позволила самым радикальным образом перейти к выполнению
минимально инвазивных вмешательств.
Минимально инвазивная хирургия — область хирургии, позволяющая
проводить радикальные операции с минимальным повреждением структуры
здоровых тканей и минимальным нарушением их функций. Стремление к малой
травматизации неново в хирургии. Принцип минимального повреждения и
атравматичности сформулировали в своих работах Амбруаз Паре, Теодор Кохер
и Уильям Холстед.
К минимально инвазивной хирургии относят эндоскопические
операции, выполняемые через естественные физиологические отверстия (удаление
полипов желудка и толстой кишки, трансдуоденальную папиллосфинктерото-
мию, трансуретральные вмешательства), операции чрескожного пункционного
дренирования полостей и пространств, выполняемые под контролем
ультразвукового исследования (УЗИ) и компьютерной томографии (КТ), а также
многие другие процедуры.
Особенности эндохирургии (в том числе её преимущества перед
традиционными вмешательствами) подробно рассмотрены в [1—4]. Наиболее
существенные моменты таковы:
Осмотр внутренних органов и манипуляции с ними производят
опосредованно, при помощи видеомонитора (в отличие от прямого визуального
контроля в открытой хирургии).
Обычно операцию выполняют в условиях двухмерного изображения.
Видимое пространство ограничено, отсутствует ощущение «глубины».
Объекты увеличены в несколько раз, что имеет как преимущества, так и
недостатки.
Положение оптической системы и рабочих инструментов относительно
фиксировано.
Существует «эффект качелей» — направление движения рабочей части
инструментов обратно направлению перемещения рукоятки.
Пальпация органов возможна только посредством инструментов, не
дающих тактильных ощущений и имеющих ограниченную свободу движений.
Необходимо применять специальное оборудование и инструменты.
Внедрение эндохирургической технологии устранило один из наиболее
существенных недостатков традиционной полостной хирургии — несоответствие между
продолжительным травматичным созданием доступа к объекту операции и
минимальным по времени вмешательством на самом органе.
Действительно, при оперативном лечении желчнокаменной болезни (ЖКБ),
острого аппендицита и гинекологической патологии чревосечение и
последующее ушивание лапаротомной раны занимают больше времени, чем удаление
жёлчного пузыря или резекция яичника. Кровопотеря и травматизация
тканей в основном также происходят на этом этапе операции. Половина
осложнений в традиционной хирургии непосредственно связана с оперативным
доступом: нагноение ран, эвентрация, образование грыж и лигатурных
свищей. Из-за болей в области раны пациенты вынуждены в течение 2—3 сут
находиться в постели. Это грозит развитием гипостатической пневмонии и
тромботических осложнений. Спаечная болезнь — бич абдоминальных
операций, как и обусловленная этой причиной высокая частота кишечной
непроходимости. Отдельная проблема — косметический результат операции.
Преимущества эндоскопической хирургии перед традиционной могут быть
сформулированы следующим образом.
Снижение травматичное™ операции. Объём рассекаемых тканей,
величина кровопотери и боль после операции существенно меньше.
Многие достоинства этой технологии напрямую связаны с малой травмой.
Снижение частоты и тяжести осложнений. Такие традиционные
осложнения, как эвентрация или образование огромных вентральных грыж,
вообще не встречаются в эндохирургии. Послеоперационный парез ки-
шечника, спаечная болезнь или лёгоч-
ные осложнения возникают
значительно реже, чем при открытых операциях.
Меньше инфицируется операционное
пространство. Не происходит
охлаждения и высушивания серозной
поверхности внутренних органов, что уменьшает
вероятность образования спаек.
Снижение продолжительности
нахождения в стационаре после операции.
За счёт быстрого восстановления
жизненных функций продолжительность
госпитального периода меньше в 2—5
раз. Многие вмешательства при
соответствующей организации
поликлинической службы выполняют амбулаторно.
Сроки утраты трудоспособности и
возвращения к обычному образу жизни короче в 3—4 раза.
Снижение стоимости лечения. Хотя специальное оборудование для эндо-
хирургических вмешательств увеличивает стоимость операции, лечение в
целом дешевле на 20—25% за счёт уменьшения госпитального периода, расхода
медикаментов и быстрой реабилитации пациента.
Косметический эффект чрезвычайно важен, особенно для женщин
(рис. 1-1).
Снижение потребности в лекарственных препаратах имеет не только
экономическое, но и профилактическое значение. Минимально инва-
зивное лечение — это и минимум препаратов с их побочным и
токсическим воздействиями.
Рис. 1-1. Косметический результат холецис-
тэктомии, выполненной
традиционным лапаротомным и
лапароскопическим доступами.
ОТКРЫТАЯ ОПЕРАЦИЯ
ИЛИ ЭНДОХИРУРГИЧЕСКОЕ ВМЕШАТЕЛЬСТВО?
Эндохирургия — не новая специальность, а только способ выполнения
тех или иных хирургических операций; способ, имеющий свои ограничения
и пределы разрешающей способности. Поэтому маловероятно, что
эндохирургия со временем полностью заменит традиционные открытые операции.
Так, чревосечение останется верным помощником хирурга в технически
сложных ситуациях, при вариантах анатомии и развитии осложнений,
возникших по ходу эндохирургических вмешательств.
Преимущества эндохирургической операции определяются
минимальной травматичностью и агрессивностью составляющих её процедур.
Агрессивность хирургических процедур — комплексное понятие,
складывающееся из многих элементов:
— анестезия;
— травма, наносимая при рассечении покровов для создания доступа;
10
— травматичность самой операции (зависит от объёма вмешательства);
— продолжительность операции;
— влияние на сердечно-сосудистую и дыхательную системы;
— влияние на иммунитет;
— нарушение гомеостаза;
— психологический стресс.
Преимущества малоинвазивной технологии наиболее ярко проявляются там,
где травматичностъ при создании доступа соизмерима и превалирует над трав-
матичностъю самой полостной операции.
По мере усложнения операции, при необходимости рассечения
обширных пластов тканей и формирования анастомозов, преимущества эндохирур-
гии теряются (например, при видеоскопической пульмонэктомии или панкре-
атодуоденальной резекции).
Более того, по мнению одного из пионеров лапароскопии Филиппа Муре,
при выполнении обширных вмешательств видеоэндоскопическая процедура
более травматична, чем традиционная открытая операция. В первую очередь за
счёт увеличения продолжительности процедуры и соответственно
длительности наркоза, отрицательного влияния напряжённого пневмоперитонеума (ПП)
и опасности развития общих хирургических осложнений. Например, при таких
операциях, как комбинированная гастрэктомия при раке желудка или
тотальная колэктомия при полипозе толстой кишки, травма, наносимая при
создании доступа, минимальна по сравнению с травматичностью основного этапа
вмешательства. Поэтому при выборе эндохирургического вмешательства облигатно
должны быть рассмотрены следующие критерии:
- летальность и частота осложнений существенно ниже или, по крайней
мере, равны результатам той же операции, выполняемой открытым
методом;
- техника операции доступна большинству хирургов, а не только группе
избранных;
- частота конверсии (перехода к традиционной открытой операции) не
превышает 10% в плановой и 30% в экстренной хирургии.
ЭНДОХИРУРГИЯ: STATUS PRAESENS
В настоящее время эндохирургическая технология широко
распространилась по всему миру. Наибольшие успехи достигнуты в лечении ЖКБ и
гинекологических заболеваний, где преимущества эндохирургии
проявляются наиболее ярко.
При лечении холелитиаза 85-90% операций можно выполнить лапаро-
скопически. Это касается не только холецистэктомии, но и операций на внепе-
чёночных жёлчных протоках (ВЖП) (например, при лечении холедохолитиаза).
В хирургической гинекологии 85-90% полостных операций также
выполнимо посредством лапароскопии. Метод применяют не только при
заболеваниях придатков матки, выполнении миомэктомии, но и для проведения
надвлагалищной ампутации и экстирпации матки.
11
Лапароскопическую фундопликацию при рефлюкс-эзофагите и грыжах
пищеводного отверстия диафрагмы применяют у 50—60% пациентов.
Другими словами, новый метод охватил многие хирургические
специальности. Однако смена технологий в других областях хирургии происходит
не столь стремительно. Причины таковы:
1. Травматичность многих открытых операций невелика
(например, аппендэктомия или грыжесечение при косой паховой грыже), а
изменение способа их выполнения не даёт существенных преимуществ,
оправдывающих материальные затраты.
2. Увеличение объёма операции снижает значимость щадящего
доступа (например, при тотальной колэктомии или экстирпации желудка).
3. При обширных эндохирургических операциях необходимы
дорогостоящие инструменты.
4. Радикальность эндоскопической операции при злокачественных
опухолях весьма сомнительна.
Тем не менее эндохирургические подходы успешно применяются в
следующих областях хирургии:
1. В торакальной хирургии торакоскопические операции применяют
для лечения заболеваний плевры, лёгкого и средостения.
2. В лечении язвенной болезни лапароскопия уместна для
выполнения различных видов ваготомии, а иногда и для резекции желудка.
3. Разработка техники ручного эндохирургического шва
позволяет накладывать анастомозы в хирургии желудочно-кишечного
тракта (ЖКТ).
4. Внедрение сшивающих аппаратов упростило технику резекции
органов. Соустья, наложенные механическим швом, более надёжны,
операция менее продолжительна. Эти устройства незаменимы при выполнении
резекции желудка и кишечника.
5. Разработка устройств для механического поднятия передней
брюшной стенки позволила расширить показания к лапароскопическим
операциям при сопутствующих сердечно-сосудистых и лёгочных заболеваниях.
6. Для онкологических заболеваний была разработана техника лим-
фаденэктомии.
7. В неотложной хирургии разработана эндохирургическая техника
выполнения многих неотложных операций. Так, динамическую
лапароскопию можно применять при разлитом перитоните.
8. Появление электрохирургических генераторов нового поколения с
набором эндохирургических инструментов даёт возможность выполнять
операции быстро, бескровно и безопасно.
ПЕРСПЕКТИВЫ
Дальнейшее развитие эндохирургии определяют следующие положения.
Внедрение новых технологий в практическое здравоохранение. Достижения
последнего десятилетия не должны оставаться привилегией отдельных клиник и
специалистов. Однако расширение объёма эндохирургических вмешательств должно
12
происходить разумно. С учётом потребности региона, оснащённости
оборудованием и уровня подготовки специалистов.
Дальнейшее уменьшение травматичности хирургических операций без ущерба
для их радикальности с учётом не только факторов прямой хирургической
агрессии, но и других составляющих оперативного вмешательства (например,
травматичности анестезиологического пособия или последствий госпитальной
инфекции).
Комбинированный метод — использование эндохирургии в качестве этапа
при расширенных открытых операциях.
Новые технологии
- Сочетание эндохирургии с другими малоинвазивными методами и
высокоэффективными диагностическими исследованиями.
— Робототехника и телекоммуникация.
НЕРЕШЁННЫЕ ПРОБЛЕМЫ
Повсеместное распространение эндохирургических операций принесло
несомненную пользу пациентам, открыло для хирургов возможность
дальнейшего профессионального роста в рамках любимой специальности. Но...
малотравматичная хирургия если и не породила новые, то обострила
существовавшие и ранее в медицине проблемы (например, ятрогенные
повреждения и напрасные хирургические вмешательства), в первую очередь проблемы
этического плана.
Во все времена существовали врачи, производящие ненужные
вмешательства, преследуя финансовый интерес. Горькая шутка «плох тот хирург,
который у купца не распознает острого аппендицита» в настоящее время приобрела
особое звучание. Что не было дозволено путём чревосечения, стало как бы
допустимо методом эндохирургии. Не всякий врач решится на открытую холе-
цистэктомию при бессимптомном холелитиазе. Используя же
лапароскопический доступ, он приведёт массу аргументов для оправдания операции: мелкие
конкременты (опасность миграции в жёлчные протоки) или крупные
конкременты (опасность пролежня), молодой возраст (болезнь всё равно разовьётся
на протяжении жизни) или пожилой возраст (риск сопутствующих
заболеваний). С удивлением в отечественной литературе можно читать о торакоскопи-
ческой стволовой ваготомии в лечении хронической дуоденальной язвы, о
других вмешательствах, давно дискредитировавших себя и ныне реанимируемых
малоинвазивным доступом. Желание быть первым не должно быть
реализовано ценой здоровья пациентов. Напрасные операции распространены и в
гинекологии, например при неясных болях в низу живота больных пытаются лечить
рассечением спаек или резекцией поликистозно-изменённых яичников. Это
положение сохранится до тех пор, пока заработок врача будет пропорционален
числу пациентов, а достаток хирурга — количеству выполненных операций. По
точному выражению мексиканского хирурга Сервантеса, «данный феномен
изменил или скоро изменит путь ведения традиционной хирургии с её устояв-
13
шимися отношениями пациент—врач, заменяя веру на прискорбный
недостаток доверия и на коммерческий интерес» [5].
Другую опасность рождает ситуация, когда врачи пытаются практиковать
в той области хирургии, о которой имеют лишь поверхностные знания
(например, хирургическая онкология или проктология).
Никто не может стать суперспециалистом в узкой области, не имея
практики общего хирурга. Основательное, полное обучение общей хирургии
должно предшествовать любой специализации. Никто не может построить
здание, начиная с верхнего этажа: для поддержания структуры необходим
надёжный фундамент.
Ятрогения в хирургии — распространённый феномен с частотой,
варьирующей в зависимости от страны. В одних регионах данные до сих пор
закрыты. В других статистика угрожающая: согласно исследованиям,
проведённым в США, ежегодно от ошибок медиков умирают 80 000 человек.
Исследовательская Группа Здоровья Нации (американская частная организация)
выявила увеличение частоты врачебных ошибок; число врачей, лишённых
лицензии, составило 1974 в 1992 г. и 2190 в 1993 г. (увеличение на 11% лишь за
один год). Следует заметить, что всё это происходит в стране с множеством
национальных и государственных лицензионных коллегий, совместных
комитетов по аккредитации госпиталей, системой частых проверок. Но до сих
пор врачи допускают непростительные ошибки. В качестве примера
печально известен случай хирурга из Мичигана, выполнившего мастэктомию
здоровой молочной железы вместо поражённой опухолевым процессом. Хирург
же из Флориды ошибочно ампутировал не ту стопу у пациента с диабетом,
поступившего с гангреной пальцев.
По данным той же исследовательской группы, количество
недобросовестных врачей, выполняющих ненужные вмешательства, поразительно
велико. Если при операции, выполняемой по показаниям, возможны ошибки,
представьте ситуацию, когда осложнения возникают при проведении ненуж:-
ной операции [6]. Ещё в начале XX века известный немецкий хирург Ханс
Кер, обращаясь к американским коллегам, писал: «Вы оперируйте кого
хотите, а мы будем оперировать кого нужно» [7].
Зиверт, анализируя громадное увеличение количества лапароскопических
фундопликаций при рефлюкс-эзофагите, говорит об «откровенно
разнузданном расширении показаний», которое необходимо проанализировать. Он же
утверждает, что «вещи, которые до сих пор были фактически неоспоримы,
операции, в которых долго отказывали, сейчас вводятся заново и принимаются
только потому, что их можно выполнить лапароскопически». Зиверт пишет об
«эйфории технически выполнимого» [8].
Все эти факты в эпоху эндохирургии подлежат тщательному анализу и
осмыслению.
14
2
История эндохирургии
Эндохирургия берёт начало от эндоскопии — способа осмотра полостей
человеческого тела. Эндоскопия же родилась от вечного желания человека
постигнуть неведомое, понять непонятное в природе и самом себе. Понять, не
разрушая, а нежно соприкоснувшись и заглянув внутрь. А если необходимо —
поправить и помочь, но сделав это незаметно и мягко.
ДОТЕЛЕВИЗИОННАЯ ЭПОХА
Применение первого эндоскопа для осмотра просвета прямой кишки и
полости матки приписывают Боццини A795 г.). Этот врач назвал новое устройство
проводником света, а в качестве источника света использовал свечу [1}.
Освещение оставалось существенной проблемой до тех пор, пока в 1879 г.
Нитц поместил нагретый добела кусочек платины на конец цистоскопа.
Устройство оказалось непрактичным, поскольку требовало постоянного потока
воды для охлаждения.
Лапароскопия впервые выполнена Дмитрием Оскаровичем Оттом в 1901 г.
[2]. Профессор-гинеколог из Санкт-Петербурга описал процедуру, названную
им вентроскопией. Он осматривал органы малого таза через кольпотомическое
отверстие, используя для освещения лобный рефлектор, электрическую лампу
и зеркало. Ученики Отта — Г.Н. Серёжников и В.П. Якобсон — в 1907 г.
применили вентроскопию для диагностики внематочной беременности и гениталь-
ного туберкулёза.
В том же 1901 г. в эксперименте на собаках лапароскопию выполнил
интернист из Дрездена Георг Келлинг. Автор назвал исследование целиоскопией
[3]. 23 сентября 1901 г. он доложил об этом на 3-м Собрании Общества
немецких врачей. Келлинг наблюдал внутренние органы через цистоскоп Нитца
после предварительной инсуффляции в брюшную полость воздуха,
профильтрованного через стерильный тампон из хлопка.
Цистоскоп для осмотра полостей человеческого тела предложил
использовать в 1910 г. шведский врач Ганс Христиан Якобеус [4]. Тогда же он ввёл
термины «лапароскопия» и «торакоскопия», сообщил о 115 исследованиях
грудной и брюшной полости у 72 пациентов. В этой клинической серии было
сообщено о лапароскопической диагностике сифилиса, туберкулёза, цирроза и
злокачественных опухолей печени. В отличие от Келлинга автор не применял
специальную иглу для наложения ПП, а пользовался грубым троакаром. Несколько
позже A921 г.) Якобеус доложил о 40 торакоскопиях, выполненных по поводу
туберкулёза лёгких. Хирург впервые во время торакоскопии произвёл успешное
16
рассечение спаек методом гальванокаутеризации для создания искусственного
пневмоторакса.
Троакар с автоматическим клапаном для введения лапароскопических
инструментов и предотвращения утечки газа в 1920 г. разработал Ондорфф [5],
врач из Чикаго. Он же описал преимущества пирамидального стилета.
Углекислый газ для создания ПП впервые предложил использовать в 1924 г.
швейцарский хирург Золликофер [6].
Троакар с дополнительным рабочим каналом для инструментов в 1929 г.
разработал гепатолог из Берлина Хайниц Калък. Это был важный шаг от
диагностической лапароскопии к лечебной. Он же разработал методику
лапароскопической пункционной биопсии печени и сконструировал лапароскоп со
специальной осветительной системой и углом зрения 135° вместо 90°. В 1951 г. Калък
опубликовал результаты 2000 лапароскопических исследований без единого
летального исхода. Однако в книге, изданной в 1962 г., на 6129 исследований
уже описано 2 летальных случая [7]. Один — в результате кровотечения после
ранения варикозно-расширенных вен брюшной стенки при циррозе печени,
второй — в момент создания ПП на фоне сердечной декомпенсации.
В середине 30-х годов американский терапевт Раддок [8] разработал
основные принципы диагностической лапароскопии. В своей монографии он писал:
«этот метод заменит диагностическую лапаротомию для дифференциальной
диагностики природы асцита, туберкулёзного перитонита, локализации
первичных опухолей и характера их метастазирования».
Первая лечебная лапароскопия произведена Феверсом A933 г.): он рассёк
спайки в брюшной полости при помощи уретрального цистоскопа. Были
использованы щипцы и инструмент для холодной каутеризации. Впоследствии
он описал редкое осложнение — взрыв газа в брюшной полости в момент
каутеризации спаек [9].
Лапароскопическая стерилизация женщин при помощи высокочастотной
коагуляции предложена в 1937 г. Боучем [10].
Лапароскопическая холецистохолангиография в 1940 г. впервые применена
Ройером. В 1952 г. он опубликовал монографию, в которой обобщил результаты
440 исследований. Тогда же была разработана цветная фотолапароскопия и
лапарокинематография [11].
Биопсию печени под контролем лапароскопа в 1943 г. выполнил Кальк.
Спустя три года Рауль Пальмер [12] произвёл биопсию яичника. Однако эти
процедуры не были популярны, так как отсутствовал надёжный гемостаз.
Пионеры лапароскопии вводили троакары в большинстве случаев без
предварительного создания «воздушной подушки». Поэтому повреждения
кишечника и крупных сосудов были серьёзной проблемой до появления безопасной
иглы и шприца для подачи газа (рис. 2-1).
Автоматическая игла для создания ПП изобретена в 1917 г. Гётцем [13].
Вариант иглы с пружинкой, почти без изменений дошедший до наших дней,
предложил венгерский хирург Янош Вереш в 1938 г. Игла Вереша была
первоначально разработана для создания пневмоторакса [14]. В последующем эта игла
стала служить и для создания ПП. Хотя благодаря игле Вереша и ПП
количество повреждений кишечника и забрюшинных сосудов уменьшилось, принятие
лапароскопии как метода диагностики происходило медленно, поскольку её
считали слепой процедурой.
Обеспокоенный этим, Хассон в 1971 г. разработал троакар с тупым
стилетом, который вводят под контролем зрения непосредственно в брюшную
полость через микролапаротомное отверстие [15]. Он назвал свой метод
открытой лапароскопией, и сегодня его часто называют техникой Хассона.
Одним из важных достижений в разработке лапароскопов было
изобретение в 1966 г. системы стержневых линз, автором которых был британский физик
Хопкинс [16]. Стержневые линзы заметно улучшили разрешение и яркость в
сравнении с традиционными стеклянными линзами. В эти же годы появились
волоконно-оптические кабели источников холодного света. Это значительно
снизило риск термических повреждений кишечника, вызываемых светом от
ламп накаливания. /
Положение Тренделенбурга для гинекологических операций применил
Рауль Пальмер ещё в 1947 г. (рис. 2-2). Он настаивал на контроле внутрибрюшно-
го давления в течение всей операции. Однако прошло два десятилетия, прежде
чем Курт Земм, инженер-хирург из германского города Киля, разработал
автоматический инсуффлятор, непрерывно измеряющий внутрибрюшное давление
и скорость потока газа [17].
Курт Земм был одним из наиболее продуктивных хирургов-исследователей в
области лапароскопии. Многие инструменты и методики, разработанные им,
широко используют в эндохирургии и по сей день. Свой способ он назвал
«оперативная пельвиоскопия» (для того, чтобы отделить его от опыта предшественников).
Рис. 2-1. Наложение ПП при помощи иглы
и шприца (середина 60-х годов).
Рис. 2-2. Диагностическая лапароскопия.
Земм обнаружил, что многие структуры в полости таза лучше видны через
лапароскоп с расположенными под углом линзами (боковая оптика), что
оказалось чрезвычайно важным для развития эндохирургии. Земм разработал
устройство для промывания полости мощным потоком жидкости и для
поддержания в чистоте операционного поля. Для перевязки сосудов и других структур
Земм предложил предварительно завязанную шовную петлю (петлю Рё'дера,
ранее используемую при тонзиллэктомии), а также палочку для опускания
шовного узла в брюшную полость. Вскоре им был разработан клипатор для
наложения титановых клипс на сосуды. Земм усовершенствовал методики
завязывания интра- и экстракорпоральных узлов, разработал комплект
иглодержателей. Многие другие инструменты (например, ножницы с крючком,
микроножницы, конусовидные троакары, атравматические щипцы, вакуумный мо-
билизатор матки и морцеллятор тканей) были также изобретены и
апробированы им и его коллегами.
Новые лапароскопические операции, разработанные Земмом, включали
микрохирургическую пластику фаллопиевых труб в лечении внематочной
беременности, пересечение маточных труб путём электрокоагуляции, сальпингос-
томию, сальпинголизис, фимбриолизис, удаление яичника. Он предложил
лапароскопическое ушивание ранений кишечника, коагуляцию эндометриоид-
ных имплантатов, ушивание перфораций матки. Лапароскопические операции
на органах малого таза стали популярны после выхода в свет в 1975 г.
руководства Земма «Атлас гинекологической лапароскопии и гистероскопии» [16].
Лапароскопическую аппендэктомию (ЛА) впервые в 1983 г. выполнил Курт
Земм [18]. Он же разработал пелъвиотренажёр для обучения хирургов методике
оперативной лапароскопии. «Метод существует, но его мало используют...» —
иронизировали скептики, называя лапароскопию «хирургией замочной
скважины» и «хирургией проколов». К 1988 г. в клинике, возглавляемой Земмом, было
выполнено более 14 000 лапароскопических операций с частотой осложнений 0,28%.
Частота лапаротомий в плановой гинекологии уменьшилась на 90%. Земм чётко
продемонстрировал, что лапароскопическая хирургия безопасна, экономически
выгодна и малотравматична [17].
Хирурги общего профиля, однако, не торопились принимать лапароскопию в
качестве диагностического метода по следующим причинам.
Лапароскопические процедуры многие десятилетия выполнялись одним
хирургом, так как лапароскоп имеет единственный окуляр. Встроенный
второй окуляр давал расщеплённое изображение, но ассистент не мог полноценно
взаимодействовать с оперирующим хирургом из-за неэффективности и
неуклюжести системы. Лапароскопию иронично называли «гарпунной
диагностикой» и «хирургией Микки Мауса».
Ревизия брюшной полости при лапароскопии считалась неполноценной,
так как некоторые её отделы были недоступны осмотру.
Появление таких малоинвазивных и доступных способов диагностики, как
КТ и УЗ И, составило серьёзную конкуренцию диагностической лапароскопии.
Лапароскопическая холецистэктомия (ЛХЭ) на животном впервые была
выполнена в 1985 годов Однако экспозиция была неадекватной. Процедура была
19
выполнена до появления видеолапароскопии, поэтому операционная бригада
не могла эффективно взаимодействовать. Вмешательство было признано
небезопасным.
Торакоскопия до конца 50-х годов применялась с целью создания и
поддержания искусственного пневмоторакса при туберкулёзе лёгких, хотя ещё в
1934 г. Пикхард при торакоскопии впервые обнаружил и описал целомичес-
кую кисту перикарда. С появлением туберкулостатических препаратов и
развитием хирургии лёгких коллапсотерапия в лечении туберкулёза стала
неактуальной, а торакоскопия — редкой процедурой в клинической практике.
Торакоскопию применяли также с лечебной целью при вмешательствах
на вегетативной нервной системе. Р. Заттер A980 г.) и Л.Ц. Иоффе A982 г.)
сообщили об успешных торакоскопических симпатэктомиях. Малая травма-
тичность торакоскопических операций выгодно отличает их от вмешательств,
проводимых торакотомным доступом.
Лазеры. Теорию лазеров детально разработали Таунс и Мейман в конце
50-х — начале 60-х годов. Впервые лазер использовали офтальмологи в
лечении отслойки сетчатки в середине 60-х годов. Вскоре он был апробирован
оториноларингологами при операциях на голосовых связках. Частота
повреждений кишечника при монополярной электрокоагуляции побудила многих
гинекологов принять лазер в качестве источника энергии для рассечения и
коагуляции тканей. Первое клиническое сообщение по этому поводу сделал
Брахет в 1979 г. [19]. Впоследствии лазер стали применять для диссекции и
коагуляции. Однако заявленные преимущества использования лазера (по
сравнению с электрохирургией) — лучший гемостаз, более точная диссекция,
меньший риск повреждения кишечника — не подтвердились на практике.
Более того, при ЛХЭ были описаны случаи полного выпаривания общего
жёлчного протока (ОЖП) лучом лазера. Всё это, а также высокая стоимость
установки привели к тому, что врачи в настоящее время редко применяют
лазер в эндохирургии.
ЭПОХА ВИДЕОСКОПИЧЕСКОЙ ЭНДОХИРУРГИИ
Переворот в хирургии произошёл в 1986 г., когда была разработана
цветная видеокамера с высоким разрешением, работающая на микросхемах (масса
камеры 100—150 г). Это позволило передавать изображение с окуляра
лапароскопа на экран монитора и послужило началом видеоэндоскопической
хирургии. При этом были выявлены следующие преимущества:
1. Сложные операции можно выполнять с активным участием
хирургов-ассистентов. По ходу вмешательства возможно принятие
коллегиального решения.
2. Видеосистема увеличивает изображение в несколько десятков раз
с сохранением чёткости и передачи цвета, что позволяет хирургу
выполнять более точные действия.
3. Видеосистема даёт возможность документировать диагностические
и лечебные процедуры, использовать материал для обучения хирургов.
20
Прогресс в технологии получения изображения стал решающим фактором
в развитии эндохирургии, а понимание несомненных преимуществ оперативной
лапароторакоскопии привело к тому, что хирурги всё чаще стали применять
этот метод в конце 80-х годов.
ОПЕРАТИВНЫЕ ВМЕШАТЕЛЬСТВА
ЛХЭ у человека впервые выполнена Филиппом Муре в июне 1987 г. в
Лионе [20]. Именно это событие впоследствии назвали второй французской
революцией. Им же была предложена безопасная экспозиция зоны ворот печени путём
перемещения дна жёлчного пузыря в краниальном направлении. Первая
операция настолько утомила хирурга, что, выйдя из операционной, Муре сказал
ученикам: «Я думаю, что это была первая и последняя лапароскопическая хо-
лецистэктомия в истории мировой хирургии...». Однако уже на следующее утро
он был вынужден изменить своё мнение, когда в коридоре клиники встретил
своего улыбающегося пациента, который пожал ему руку и попросил выписать
его из стационара, так как все беспокоившие его симптомы исчезли.
Периссе и Дюбуа в 1988 г. быстро приняли технику ЛХЭ и распространили
её во Франции [21]. Год спустя Кушиэри, Бекер, Треде и Троиде внедрили эту
операцию в хирургических клиниках Европы [22]. В США первую ЛХЭ в 1988 г.
выполнили Барри Мак-Кернан и Уильям Сей [23]. Лазерную ЛХЭ в октябре
1988 г. выполнили Реддик и Олсен, они же разработали методику интраопера-
ционной холангиографии [24]. Клиника в Нэшвилле вскоре стала известна во
всём мире. Хирурги приезжали со всего света, чтобы увидеть технику, всего за
несколько месяцев кардинально изменившую принципы лечения ЖКБ. К концу
1992 г. 15 000 хирургов в США обучились технике ЛХЭ.
Первоначально показания к ЛХЭ были строго ограничены. Пациента
оперировали лишь при следующих условиях:
1. Хронический калькулёзный холецистит с приступами печёночной
колики, подтверждённый при помощи УЗИ.
2. Отсутствие признаков патологии ОЖП.
3. Диаметр конкрементов менее 3 см.
4. Отсутствие признаков острого воспаления жёлчного пузыря.
5. Отсутствие перенесённых операций на верхнем этаже брюшной
полости.
В настоящее время ЛХЭ выполнима у 95% больных, страдающих ЖКБ. В
качестве источника энергии для рассечения и коагуляции тканей
первоначально использовали луч лазера. Вскоре выяснилось, что электрокоагуляция так же
эффективна, но значительно дешевле.
Три мощных фактора способствовали стремительному распространению
ЛХЭ по всему миру:
1. Несомненные преимущества новой технологии для больного.
2. Требования пациентов, нарастающие после широкой рекламной
кампании в средствах массовой информации.
21
3. Активность фирм-производителей медицинского оборудования,
быстро оценивших потенциальный рынок в лапароскопической хирургии
и приступивших к изготовлению инструментов. Ими же были спешно
организованы курсы переподготовки хирургов.
Новые методы в хирургии перед внедрением в практику, как правило,
проходят этап тщательной экспериментальной разработки и клинических
испытаний. В случае ЛХЭ эти шаги были опущены. В результате данную
операцию не всегда выполняли хорошо подготовленные и квалифицированные
специалисты. Например, по данным Южного Хирургического Клуба США,
частота повреждения ВЖП на этапе освоения методики составила 2,2% [25].
Вероятно, о многих тяжёлых осложнениях сообщений просто не было.
Потребовались колоссальные усилия ведущих хирургов Европы и США по разработке
безопасной техники ЛХЭ, чтобы снизить частоту этого осложнения до 0,2-0,3%.
Тогда же Кушиери доказал, что частота и тяжесть осложнений в эндохирургии
напрямую связаны с качеством обучения.
Лапароскопическая гистерэктомия. Эту операцию впервые в январе 1988 г.
выполнил Харри Рич [26].
ЛА впервые осуществлена Куртом Земмом в 1983 г. У основания
аппендикса прямой иглой он прошил и перевязал брыжейку. На основание отростка
Земм наложил петлю Рёдера, а перед удалением пересёк его электрохирурги-
чески. Это была профилактическая аппендэктомия, произведённая в
дополнение к гинекологической операции. За 6 лет до этого аппендэктомию с
лапароскопической поддержкой (laparoscopy-assisted) произвёл Де Кок [27].
Первую ЛА при остром аппендиците описал Шребер [28]. В группе из 70
пациентов у 7 был острый аппендицит. У одного из этих больных после
операции произошло истечение кишечного содержимого из культи аппендикса.
Осложнение объяснили электрохирургическим ожогом купола слепой кишки при
неосторожной коагуляции.
ЛА не получила такого широкого распространения, как ЛХЭ или
гинекологические операции, поскольку открытую операцию выполняют через
небольшой разрез, да и сама операция малотравматична.
Язвенная болезнь. Лапароскопические операции при язвенной болезни
двенадцатиперстной кишки в 1989 г. начали выполнять Моуел и Катхода [29].
Первоначально это были различные виды стволовой ваготомии, затем — селективная
проксимальная ваготомия. Через два года эти же авторы сообщили о 8 случаях
ушивания перфоративных дуоденальных язв. В феврале 1992 г. Го и Ком успешно
произвели лапароскопическую резекцию двух третей желудка по Бияьрот—11 [30].
Антирефлюксная операция Ниссена при лечении грыжи пищеводного
отверстия диафрагмы и гастроэзофагеального рефлюкса впервые была
выполнена в 1991 г. (Деллемегё) [31].
Лапароскопическая герниопластика была разработана в 1989 г. группой
исследователей, возглавляемых Ге [32]. Через два года была предложена вне-
брюшинная пластика.
22
Лапароскопическая хирургия кишечника берёт своё начало с 1990 г., когда
Якобе выполнил правостороннюю гемиколэктомию под лапароскопическим
контролем с наложением ьнебрюшинного анастомоза. В этом же году Лехы
произвёл лапароскопическую резекцию сигмовидной кишки, а Флоуэ —
левостороннюю гемиколэктомию под лапароскопическим контролем. В конце 1990 г.
Франклин впервые наложил у животного, а затем у больного ручной и
аппаратный швы толстой кишки. Всего этой группой к 1993 г. было выполнено 119
вмешательств на толстой кишке [33].
Эндохирургические операции на сосудах впервые применили в 1994 г.:
Дюбуа выполнил аортоподвздошное шунтирование.
В эти же годы стали выходить специализированные журналы по эндохи-
рургии: «Surgical Endoscopy» A987), «Journal of Laparoendoscopic Surgery» A990),
«Surgical Laparoscopy & Endoscopy» A991).
Первые видеоторакоскопические операции начали выполнять в начале 90-х
годов. Особое значение метод приобретает в дифференциальной диагностике
заболеваний плевры, лёгких и средостения. Видеоторакоскопию широко
применяют для идентификации внутрилёгочных образований (гамартом, туберку-
лём, гранулём и т.д.). Во время операции выполняют пункционную биопсию
образования и в зависимости от результата исследования производят эндохи-
рургическое вмешательство. В последние годы видеоторакоскопию широко
применяют для лечения спонтанного пневмоторакса, эмпиемы плевры,
доброкачественных опухолей средостения. Особое значение приобретает
видеоторакоскопия при метастатическом поражении лёгких, когда объём
предполагаемой процедуры ограничивают атипической резекцией, а травматичность
традиционной торакотомии несравненно выше травматичности самой операции.
Многие хирурги начали выполнять лобэктомию и пневмонэктомию при раке
лёгкого. Авторы отмечают хорошую переносимость операции, незначительную
кровопотерю и более лёгкое течение послеоперационного периода. Сейчас, по
мнению М. Мак A993), до 70% внутригрудных операций может быть
выполнено с использованием видеоторакоскопии [34].
Эндоскопическая хирургия принципиально изменила подходы к лечению
многих заболеваний. В некоторых клиниках до 50% абдоминальных операций
производят лапароскопически. Хирурги предполагают, что 70% операций в
принципе можно выполнять, используя эндохирургию. Однако очевидно: не всё,
что можно делать, следует делать. Пока не хватает статистически
подтверждённых сравнительных данных о применении эндохирургического подхода и
других методов лечения. Некоторые хирурги с энтузиазмом воспринимают
внедрение лапароскопии в колоректальную хирургию и урологию. Другие
относятся к этому скептически. Каждый новый метод лечения необходимо
критически оценивать.
ЭНДОХИРУРГИЯ В РОССИИ
На протяжении XX века российские учёные внесли значительный вклад в
развитие лапароскопической технологии. Так, в апреле 1901 г. российский аку-
23
шер-гинеколог Дмитрий Отт сообщил о разработанном им новом методе
обследования органов брюшной полости, который назвал вентроскопией.
Предложенный в начале века способ в течение последнего двадцатилетия
получил широкое распространение. Прошло несколько десятилетий первых
успехов, неудач и разочарований, прежде чем лапароскопию настойчиво стали
предлагать для диагностики заболеваний органов брюшной полости. В
середине столетия в Советском Союзе вышло много работ, посвященных
лапароскопии (А.С. Орловский, 1938; A.M. Аминев, 1949; Г.А. Орлов, 1947; Н.М. Дорофеев,
1962; А.С. Логинов, 1964; Р.Х. Васильев, 1968; Г.Г. Исмагилов, 1971; Н.Л. Кущ,
1973; И.Д. Прудков, 1989 и др.) [35—42]. Показания и технику исследования
разрабатывали на кафедрах, руководимых B.C. Маятом, Ю.А. Нестеренко, Ю.М.
Панциревым, B.C. Савельевым, В.М. Буяновым, В.Д. Фёдоровым, И.Д.
Прудковым, О. С. Кочневым и др. Однако до 90-х годов применение метода было
ограничено диагностикой и биопсией внутренних органов в неотложной хирургии,
дренированием и санацией брюшной полости, различными вариантами орга-
ностомий. Можно с уверенностью сказать, что российская хирургическая школа
до середины 80-х годов занимала передовые позиции в мире по разработке
лапароскопических методов диагностики и лечения различных заболеваний
органов брюшной полости.
И всё же, несмотря на наличие в России значительного опыта в
оперативной лапароскопии, в 1987—1990 гг. наша страна оказалась в стороне от
революционных перемен, происходивших в странах Запада. К 1991 г. в развитых
странах эта операция получила широкое распространение, а в мировой практике
был накоплен опыт выполнения нескольких тысяч подобных вмешательств.
Анализ такого опоздания в развитии отечественной хирургии важен как для
понимания современной истории медицины в России, так и для построения её
будущего. Основными причинами задержки развития эндохирургии в России
принято считать экономические трудности периода перестройки и
информационную изоляцию хирургов:
— экономика в конце 80-х годов была на спаде, а финансирование
здравоохранения остаётся скудным и по сей день;
— конференции и семинары, посвященные эндохирургии, не проводили в
России до начала 90-х годов;
— специализированные отечественные журналы, посвященные
эндохирургии, отсутствовали, а доступ к зарубежной периодике в 1988—1990 гг.
был затруднён.
Вместе с тем опыт развития эндохирургии за рубежом показывает, что
состояние новых медицинских технологий в последние годы тесно связано с
маркетинговой политикой финансово-промышленных корпораций,
реализующих исследовательские программы и инвестирующих разработки для
получения новых перспективных продуктов. Именно такие предприятия, как «Karl
Storz», «R.Wolf», «Wisap», «Cabot Medical», «Stryker», «Auto-Suture», «Ethicon»,
«Olympus», сыграли существенную роль в освоении эндохирургических
операций путём постоянной опеки, контроля и финансирования работ хирургов-
новаторов. Наиболее значимые исследователи (Земм, Реддик, Лукас, Кушиери,
Дюбуа, Периссе и др.) были и есть в центре внимания программ по созданию
24
новой техники в этих фирмах. Влияние крупных корпораций, через
собственные исследовательские программы развивающих и формирующих рынок, на
процесс развития практической медицины становится всё более выраженным
в конце XX века. Этот процесс чётко прослеживается в новейшей истории
развития эндохирургии, в том числе и в России. Не умаляя выдающейся роли
передовых российских хирургов, следует признать, что организация первых
семинаров, выпуск информационных изданий, оснащение учебных центров
были инициированы и финансировались вышеназванными фирмами.
Для развития эндохирургии в России в начале 90-х годов решающей
силой была инициатива (точнее, планомерная маркетинговая работа)
иностранных фирм, которым открылся российский рынок, так как для этого появились
необходимые политические и экономические условия. Эндохирургия в России
развивалась в период становления рыночных отношений в государстве, что
определяет особенности и темпы её роста в настоящее время.
ЛХЭ. Так же, как и за рубежом, первой и наиболее массовой видеоэндо-
хирургической операцией в России стала холецистэктомия. Впервые в СССР
это вмешательство в начале 1991 г. в Научном центре хирургии РАМН
выполнил проф. Ю.И. Галлингер [43]. В течение года ЛХЭ была внедрена в практику
на кафедре факультетской хирургии РГМУ, в Институте хирургии им. А.В.
Вишневского, а также в единичных городах России (Казань, Санкт-Петербург).
Общее количество выполненных в 1991 г. ЛХЭ немногим более 200. За
последующие 5 лет эту операцию стали применять во многих регионах России, а к
1996 г. ЛХЭ выполняли в 70 из 80 областей страны. Ежегодное количество ЛХЭ
возросло в России с 2 тыс. операций (в 40 медицинских учреждениях) в 1992 г.
до 50 тыс. (в 800 медицинских учреждениях) в 1996 г. В среднем это составило
около 30% всех операций на жёлчном пузыре, а в ведущих учреждениях был
достигнут европейский стандарт — 85—95% операций при ЖКБ. Объём ЛХЭ в
целом по стране за 5 лет увеличился в 250 раз, при этом он ещё в 2—3 раза ниже
уровня западно-европейских стран.
Другие эндохирургические операции. Следом за ЛХЭ российскими
хирургами были выполнены практически все эндохирургические операции,
имеющиеся в арсенале мировой хирургии: герниопластика {Ю.И. Галлингер, А.Д.
Тимошин, 1992) [44], ушивание перфоративной язвы (О.Э. Луцевич, 1992) [45], холе-
дохолитотомия (А.Л.Андреев, А.Е. Борисов, 1993) [46], поддиафрагмальная
стволовая и передняя селективная ваготомия (А. С. Балалыкин, 1993—1994) [47],
удаление опухолей средостения и лобэктомия (Е.И. Сигал, 1993—1994) [48],
резекция кишечника (В.П. Сажин, 1994 [49]; В.Б. Александров, 1995 [50]; Г.И.
Воробьёв, Ю.А. Шелыгин, 1995 [51]), холедоходуоденостомия {И.С. Малков, 1995)
[52], поясничная симпатэктомия (С.А. Обыдённое, 1995) [53], «безгазовая
лапароскопия» {И.В. Фёдоров, 1995) [54], резекция желудка (В.17. Сажин, 1994 [55],
О.Э. Луцевич, 1994, [56], В.Н. Егиев, 1995 [57]), адреналэктомия (СИ.
Емельянов, 1996 [58], А.Е. Борисов, 1996 [59]), эзофагэктомия (А.А. Гуляев, 1996) [60].
По внедрению лапароскопических операций в гинекологии много сделано в
Институте акушерства, гинекологии и перинаталогии (дир. — акад. В.И.
Кулаков) и на кафедре гинекологии РГМУ (зав. кафедрой — акад. Г.М. Савельева),
где хирурги СВ. Штыров, Л.В. Адамян, Н.И. Волков и др. освоили все виды
лапароскопических операций в гинекологии, включая гистерэктомию [61].
25
Значительное влияние на разработку и внедрение новых операций в
России оказали международные конференции, организованные Научным
центром хирургии РАМН и Институтом хирургии им. А.В. Вишневского. Важным
организационным шагом стало создание в 1995 г. Российской ассоциации
эндоскопической хирургии (президент СИ. Емельянов), организующей выпуск
российского журнала «Эндоскопическая хирургия» и проведение съездов эн-
дохирургов.
Развитие эндохирургии в регионах происходило неравномерно и зависело
от их финансового состояния, наличия крупных промышленных предприятий
и во многом определялось инициативой хирургов на местах. Большой вклад в
развитие новых операций на территории России внесли В.М. Тимербулатов
(Уфа), А.Н. Чугунов (Казань), В.И. Карнаух (Самара), А.Е. Борисов, В.М. Седов,
Л.В. Поташов (Санкт-Петербург), СС Слесаренко (Саратов), П.Я. Сандаков
(Пермь), В.И. Котлобовский (Актюбинск), И.В. Ташкинов (Хабаровск), М.И.
Прудков, В.В. Ходаков (Екатеринбург) и многие другие. По инициативе
хирургов и при поддержке иностранных фирм во многих городах России были
проведены научно-практические конференции и семинары, сыгравшие
решающую роль в популяризации метода на местах. Определённая работа по
внедрению эндохирургии в регионах проведена российской фирмой «Эндомедиум»,
которая совместно с Ассоциацией «Эндохирургия Татарстана» организовала
первичное обучение 500 российских хирургов и провела в регионах серию
семинаров, где было выполнено более 600 показательных операций хирургами-
преподавателями. Этим же предприятием для российских хирургов
организованы выпуск реферативного журнала «Эндохирургия сегодня» и создание
учебных видеофильмов.
Период освоения эндохирургии отличался особой ответственностью
хирургов-новаторов. Неудачи и осложнения порой становились поводом для
жёсткой дискуссии и даже запрета на использование метода. Неравномерная
система финансирования медицинских учреждений создавала дополнительные
сложности. Нередко оборудование поставлялось в ведомственные больницы,
хорошо финансируемые, но не имеющие достаточного опыта и количества
больных. Такая ситуация на местах порождала условия для конфронтации и
нездоровой конкуренции медицинских учреждений. Кризис системы управления
здравоохранением в 1993—1996 гг. затруднят на местах перестройку
хирургической службы, необходимую для системного внедрения новых операций.
Недостатки работы по организации, подготовке кадров и оснащению больниц в
ряде регионов привели к большому количеству осложнений и
неэффективности использования имеющегося оборудования.
В департаментах здравоохранения некоторых регионов (Башкортостан,
Свердловская, Новгородская, Ленинградская и другие области) были
разработаны региональные программы развития эндохирургии, однако они не получили
необходимого финансирования. Наиболее эффективный опыт реализации
региональной программы был осуществлён в Республике Татарстан A993—1996 гг.),
где в результате поэтапного освоения метода в 34 медицинских учреждениях
было произведено более 12 тыс. операций с минимальным количеством
осложнений. Важным следствием этой программы явилось создание учебного центра и
26
развитие отечественных предприятий-производителей. Использование
целевых программ по развитию хирургических технологий на территории России
актуально и сегодня, так как позволяет наиболее эффективно использовать
ресурсы региона.
Обучение хирургов новой технологии требует новых форм и условий, а
существующая система подготовки специалистов в России оказалась
нединамичной и неспособной к быстрой организации широкомасштабной
переподготовки. В 1991—1994 гг. первые курсы обучения были организованы при
содействии иностранных фирм на базе крупных научно-исследовательских
центров, где профессора Ю.И. Галлынгер, К.В. Лапкин, В.П. Стрекаловский, В.А.
Кубышкин, А.С Балалыкин, В.И. Ревякин, A.M. Шулутко, С.Г. Шаповальянц, А.Е.
Борисов и др. развернули деятельность по первичному и продолженному
обучению хирургов. Учебные курсы во многом зависели от иностранных фирм, так
как собственная материально-техническая база институтов была
недостаточной. Мировой опыт показывает, что сегодня необходимы кардинальные
изменения системы образования в целом с использованием разных видов
подготовки: от обязательного введения курсов по эндохирургии в систему обучения
студентов до организации полноценных первичных и продолженных циклов
обучения практикующих врачей. За последние пять лет в России около 2 тыс.
хирургов и гинекологов прошли краткосрочные первичные курсы по
эндохирургии в российских учебных центрах и чуть более 200 — за рубежом. Это явно
недостаточно, учитывая масштаб и динамичность развития эндохирургии.
Необходимо изменить и сам подход к обучению: не длительность пребывания
курсанта на кафедре определяет качество подготовки, а интенсивность
занятий, наличие условий для тренинга и качество преподавания. Отсутствие
единой системы подготовки кадров и низкая оснащённость хирургических кафедр
сдерживают темпы развития технологии. Для решения этих проблем в
Министерстве здравоохранения РФ разработана федеральная программа, однако
крайне низкий уровень финансирования пока не позволяет сделать этот шаг.
Информационное обеспечение хирургов — отдельная нерешённая
проблема. Опыт развития эндохирургии в России свидетельствует о печальных
последствиях информационной изоляции. За период 1991 — 1996 гг. изданы лишь
несколько методических пособий по эндохирургии под редакцией Ю.И. Гал-
лингера, В.П. Сажина, В.Н. Егиева и монография А.С. Балалыкина,
посвященная основным разделам эндохирургии. Необходимо признать явную
недостаточность информационного поля стремительно развивающегося направления
хирургии. Частичное его восполнение реферативным журналом «Эндохирур-
гия сегодня» (под редакцией Е.Г. Дмитриева) и журналом «Эндоскопическая
хирургия» (под редакцией СИ. Емельянова) не решает проблемы в целом.
Оптимальной формой информационного обеспечения для российских хирургов,
разделённых тысячами километров, должна стать электронная почта.
Оперативная информация, поступающая из многочисленных периодических
зарубежных изданий, должна стать доступной для российских хирургов, и сегодня
это возможно с помощью мировых информационных сетей.
Развитие отечественных научно-практических разработок в эндохирургии
важно для распространения метода в России. Совместная работа хирургов с
27
предприятиями, разрабатывающими новое оборудование, имеет несомненную
перспективу, но и ставит ряд вопросов, связанных с авторским правом и
интересами исследователей. История российской хирургии знает множество
фактов, когда оригинальные разработки, принадлежащие российским
изобретателям, воплощали за рубежом, часто без упоминания автора и учёта его
интересов. Один из ярких примеров — предложенный в 1980 г. российским хирургом
СИ. Маркеловым (получено авторское свидетельство) троакар с защитным
колпачком. Через несколько лет идея была воплощена американскими фирмами
без признания авторства СИ. Маркелова.
Важно, что в 1992 г. в России появились новые правовые нормы по
оформлению и защите российских патентов, позволяющие юридически защитить
авторское право. Процесс взаимодействия новаторов с
фирмами-разработчиками необходим, поскольку открывает перспективы в развитии технологии.
Прекрасные условия, созданные крупными промышленными корпорациями
хирургов Западной Европы и Америки, обеспечили стремительный темп в
создании новых методик и оборудования. Однако взаимодействие российских
хирургов с фирмами-разработчиками требует от врачей знания своих прав, а от
государства — их защиты. Важный аспект в создании условий для роста
отечественных хирургов — развитие российских предприятий, разрабатывающих
новое оборудование. История эндохирургии в России свидетельствует о
существенной роли в этом процессе малых предприятий. Среди них «Аксиома»,
«Эндомедиум», «Электрон», Сан ЛТД, «Элепс», «Телемедтехника», «Крыло»,
«Азимут», «Медикап» и др. Эти фирмы — детище новых
социально-экономических условий в России, позволяющих реализовать инициативу и
использовать внутренние ресурсы. Именно эти предприятия, а не крупные
постсоветские промышленные магнаты медицинской техники смогли организовать
выпуск новой продукции, необходимой отечественной медицине. Именно в
таких предприятиях заложена перспектива развития новой техники в России. Уже
сегодня работа российских медиков с отечественными
предприятиями-разработчиками в области эндохирургии даёт свои плоды. Понимание этого процесса
хирургами важно для точного выбора необходимого оборудования, для
эффективного сотрудничества с инженерами-разработчиками по созданию новых
технологий.
Эндохирургия в России — становление новой медицинской технологии в
обществе, в котором развиваются рыночные отношения. В этом процессе есть
свои достоинства и недостатки. В ряде случаев оборудование закупают с целью
организации бизнеса в области платной медицины либо для повышения
имиджа больницы без учёта реальной потребности в дорогостоящей технике. Это
приводит к простою и неэффективному использованию оборудования,
опасным для жизни осложнениям, неоправданному расширению показаний к
хирургическим вмешательствам. Однако развитие коммерческой медицины дало
и положительный результат. Так, внедрение ЛХЭ в платном Центре
эндохирургии и литотрипсии (Москва) позволило получить опыт самого
интенсивного использования методики. В этом учреждении за три года успешно
выполнили более 7000 эндохирургических операций.
28
Серьёзный вопрос — использование эндохирургии как средства
дополнительного заработка. Доступность и развитие хирургии в России сейчас во
многом зависят от системы страховой медицины. Именно этот механизм в
развитых странах обеспечил стремительный прогресс, где страховые компании
сыграли положительную роль в обучении и контроле за качеством эндохирургиче-
ского лечения. В современной России пациент не защищен от неправильного
и неадекватного лечения.
Для изменения такого положения необходимы коренные преобразования
отечественной системы здравоохранения в целом. В настоящее время качество
и адекватность лечения в основном зависят от профессиональной этики и
добросовестности хирурга.
Мировой опыт показывает, что эндовидеохирургия находит всё более
широкое применение и входит в повседневную практику не только при
операциях на органах грудной и брюшной полости, но также в артрологии,
нейрохирургии, сосудистой и сердечной, челюстно-лицевой и пластической хирургии.
Отечественная эндохирургия по этим направлениям идёт вслед за опытом
передовых зарубежных клиник, а её будущее зависит от развития российского
государства в целом.
ЛИТЕРАТУРА
1. Schindler R. (ed): Bozzini PH. Gastroscopy. University of Chicago Press, Chicago,
1937.
2. Ott D.O. Die beleuchtung der Bauchhohle (ventroskopie) als methode bie vaginaler
coeliotomie. Abl Gynekol, 231: 817, 1902.
3. Kelling G. bber Oesophagoskopie, Gastroscopie und Koelioscopie. Munch Med
Wochenschr 49: 21, 1902.
4. Jacobeus H.C. Kurze Ubersicht uber meine Erfahrungen mit der Laparothorakoscopie.
Munch Med Wochenschr, 58: 2017, 1911.
5. OrndoffB.H. The peritoneoscope in diagnosis of diseases of the abdomen. J.Radiol, 1:
307, 1920.
6. Zollicofer R. Zur laparoscopie. Schweiz. Med. Wochenschr, 54: 264, 1924.
7. Kalk H. Erfahrungen mit der Laparoskopie. ZKlin Med 111: 303, 1929.
8. Ruddock J.C. Peritoneoscopy. Surg Gynecol Obstet 65: 623, 1937.
9. Fervers, C: Die Laparoskopie mit dem Cystoskop, Med.Clin. 28: 1042-1045, 1933.
10. Frangenheim, H. Diagnostische und operative Laparoskopie in der Gynakologie,
Mbnchen: Hans Marseille Vergal GmbH, 1980.
11. Royer R. Operative Laparoskopie. Mbnchen: Hans Marseille Vergal GmbH, 1952.
12. Palmer R. Technique et instrumentation de la coelioscopie. Paris: Gynecol Obstet 46:
420, 1947.
13. Goetze O. Die Rontgedianostik bie gasgefullter Bauchhohle: Eine neue Mrthode.
Munch Med Wochenschr 65: 12575, 1918.
14. Veress J. Neues Instrument zur Ausfuhrung von Brust — oder Bauchpunkutionen und
Pneumothoraxbehandlung. Dtsch Med Wochenschr 41: 1480, 1938.
15. Hasson H.M.: Open laparoscopy: a report of 150 cases. J Reprod Med 12: 234, 1974.
16. Semm K. Atlas of Gynecologic Laparoscopy and Hysteroscopy. Rice AL (trans).
Philadelphia: WВ Saunders, 1975.
17. Semm K. History. In Sanfilippo J.S., Levine R.L. (eds); Operative gynecologic
endoscopy. New York; Springer-Vergal, 1989.
29
3
Оборудование
и инструменты
Эндоскопическая хирургия предъявляет высокие требования к
оборудованию и инструментам, используемым при проведении операций. Это
функциональность и надёжность, современный дизайн и эргономичность. Цель этой
глшы~— представить различное оборудование и инструменты, применяемые в
эндохирургии, а также объяснить их основные функции. Полный комплект
инструментов и аппаратов, позволяющий выполнять большинство операций,
получил название «Эндохирургический комплекс» (рис. 3-1). Основной узел
этого комплекса, позволяющий передавать изображение на экран монитора,
представлен эндовидеосистемой. Она состоит из лапароскопа, оптической
системы с миниатюрной видеокамерой, световодного жгута и монитора
видеоизображения. Сигнал, передаваемый видеокамерой на монитор, можно
записать на видеомагнитофон для последующего просмотра и анализа.
ОПТИЧЕСКАЯ СИСТЕМА
Эндоскопическая оптическая система (лапаро- или торакоскоп) —
первое звено в цепи передачи изображения (рис. 3-2). Основной элемент этого
инструмента — оптическая трубка с системой миниатюрных линз. Лапароскоп
передаёт изображение из полости человеческого тела на видеокамеру.
Лапароскопические оптические системы имеют следующие технические параметры.
1. Диаметр инструмента может быть 10, 5 мм и менее. 10-миллиметровая
оптика наиболее распространена в оперативной эндохирургии.
5-миллиметровый лапароскоп применяют в детской хирургии и для
диагностических процедур. В последние годы был сконструирован лапароскоп
диаметром 1,9 мм.
2. Входной угол зрения — угол, в пределах которого лапароскоп передаёт
входное изображение на видеокамеру. В среднем этот параметр лежит в
пределах 80°.
3. Направление оси зрения — 0, 30, 45, 75° (рис. 3-3, 3-4). Если ось зрения
составляет 0°, лапароскоп называют торцовым или прямым. В остальных
случаях лапароскоп называют косым. Косая оптика более функциональна
и удобна при работе в условиях двухмерного изображения (см. рис. 4-24).
Она позволяет осмотреть объект с разных сторон, не меняя точки
введения инструмента. В распоряжении каждого хирурга должна быть как
прямая, так и косая оптика.
32
Рис. 3-1. Эндохирургический комплекс.
В последние годы был предложены видеотроакар и одноразовый
лапароскоп (рис. 3-5).
ВИДЕОКАМЕРА
Несомненно, огромное влияние на развитие оперативной лапароскопии
оказало бурное развитие технологии видеокамер. Высококачественная камера
обладает минимальной массой, высоким разрешением, способностью
передавать мельчайшие нюансы хирургических объектов и высокой
чувствительностью, позволяющей работать с источниками света малой мощности (рис. 3-6).
Основной элемент любой современной эндовидеокамеры —
полупроводниковая фоточувствительная кремниевая пластинка-кристалл,
предназначенная для преобразования оптического изображения, переданного лапароскопом,
в электрический сигнал. Принцип работы основан на формировании и
переносе зарядов по поверхности или внутри полупроводникового кристалла. Этот
кристалл носит название прибора с зарядовой связью (ПЗС). В зависимости от
назначения ПЗС подразделяют на линейные и матричные. В малогабаритных
эндовидеокамерах используют матричные ПЗС, где фоточувствительные
элементы-пикселы организованы в матрицу по строкам и столбцам. Чтобы ПЗС
формировал цветное изображение, всю матрицу покрывают цветным
светофильтром так, чтобы над каждым пикселом находился миниатюрный
светофильтр определённого цвета. Таких цветов три — зелёный, пурпурный и
голубой, причём зелёными светофильтрами покрыта половина пикселов, так как
эта составляющая видеосигнала несёт информацию о яркости.
33
Рис. 3-2. Устройство лапароскопической оптической системы.
0°
50°
N
/
90и
Рис. 3-3. Направление оси зрения лапароскопа.
Рис. 3-4. Разновидности лапароскопов:
диагностический, 10-миллиметровый
прямой, 10-миллиметровый косой
Основные характеристики матричного ПЗС, или ПЗС-матрицы.
1. Минимальный уровень освещения.
2. Размер светочувствительного поля по диагонали.
3. Количество светочувствительных элементов (пикселов).
4. Отношение сигнал-шум.
5. Диапазон работы электронного затвора.
Минимальный уровень освещения — это тот нижний порог внешнего
освещения, при котором видеокамера выдаёт сигнал, позволяющий адекватно
различать объекты во время выполнения операции. У современных видеокамер
этот параметр не ниже 3 лк.1 Современные одноматричные видеокамеры для
обеспечения качества видеосигнала телевизионного стандарта S-VHS имеют не
менее 470 000 пикселов на кристалле размером всего 1/3 дюйма A дюйм =
2,54 см). При этом разрешение достигает 430 ТВЛ (телевизионных линий).
Отношение сигнал-шум современных камер более 46 дБ. Чем больше этот
параметр, тем менее на затемнённых участках изображения будет заметна помеха
в виде «мусора» или «снега». Диапазон работы электронного затвора таких
камер от 1/50 до 1/10 000 с, что позволяет при изменении освещённости более
34
Рис. 3-5. Видеотроакар («Visiport») и
одноразовый лапароскоп.
чем в 200 раз работать с качественным
высококонтрастным изображением без
появления пересвета или «блика».
В последнее время в видеокамерах
высокого класса применяют устройства с
тремя ПЗС-матрицами. Это позволяет
получить изображение высокого качества
с разрешением не менее 550-600 ТВЛ. В
трёхматричной системе цветное
изображение с лапароскопа поступает на цветоде-
лительный блок (призму),
осуществляющий разделение изображения на зелёную,
красную и синюю составляющие. Они
проецируются на три раздельных
кристалла матричных ПЗС, каждый из которых
формирует свой сигнал. Однако эти
камеры более громоздки, требуют
применения оптики с малыми аберрациями
(искажениями по краям изображения) и более
высокой технологии изготовления.
Вследствие этого такие камеры не нашли пока
широкого распространения и достаточно
дороги по сравнению с
однокристальными камерами.
Стереоскопическая эндовидеосистема даёт ощущение трёхмерного
объёмного изображения. Эта система включает стереолапароскоп, совмещённую с
ним стереовидеокамеру, электронное устройство обработки сигнала, монитор
изображения и специальные очки. Стереоизображение может быть получено
только при фокусировании взгляда на мониторе. Отведение взгляда от экрана
(например, при смене инструментов) приводит к неприятному ощущению
мерцания. Стереоизображение не даёт существенных преимуществ по сравнению с
обычной моносистемой, и все известные эндохирургические операции
выполнимы при двухмерном изображении. Кроме того, стоимость стереооборудова-
ния в несколько раз превосходит стоимость традиционного.
Практически все современные видеокамеры и лапароскопы
водонепроницаемы, что позволяет проводить их стерилизацию в растворах «Сайдекс» и «Вер-
кон». Ни в коем случае нельзя применять для стерилизации видеокамер и
лапароскопов сухожаровой шкаф, так как могут произойти их разгерметизация,
выход из строя электроники и оптики. Наиболее простой способ соблюдения
асептики при работе с видеокамерой — помещение её перед операцией в
стерильный матерчатый чехол.
ИСТОЧНИК СВЕТА
Источник света служит для освещения внутренних полостей при
проведении эндохирургических вмешательств (рис. 3-7). Свет в полость подают через
лапароскоп, с которым источник света связан гибким световодным жгутом,
35
представляющим собой сотни
тонких стеклянных волокон,
находящихся в общей
оболочке. На торцовых поверхностях
световодного жгута
расположены разъёмные элементы
стыковки — с одной стороны с
осветителем, с другой — с
лапароскопом. Световод ный
жгут требует бережного
обращения, не допускает резкого
изгиба, так как в этом случае
могут обломиться его тонкие
нежные стеклянные волокна.
Рис. 3-6. Эндовидеокамера. тл
F Источник света в осветителе —
лампа. Наиболее дешёвая и доступная лампа — галогеновая. Однако она имеет
недостатки — малый ресурс работы (не более 100 ч) и жёлто-красный спектр
излучения, который отрицательно сказывается на качестве передачи цвета
изображения. Лампа имеет в спектре излучения мощную инфракрасную составляющую,
способную без применения в осветителе специальных фильтров вызвать ожог
тканей при достаточно близком контакте лапароскопа с внутренними органами.
Более перспективный осветитель — прибор с ксеноновой лампой, которая
по сравнению с галогеновой имеет спектр излучения, приближающийся к
естественному. Её ресурс выше — до 1000 ч. Источник света на ксеноновой лампе
позволяет получать большую освещённость объектов при меньших затратах
электроэнергии, так как коэффициент полезного действия (КПД) у неё выше.
Современные источники света снабжены сменными выходными адаптерами,
позволяющими подключать к осветителю световодные жгуты различных фирм-
производителей. Выходную освещённость источника света регулируют либо
вручную, либо автоматически от видеосигнала видеокамеры. В последнем случае
чем темнее изображение, тем
больше света автоматически
выдаёт источник света.
Следует отметить, что для
источников света в последнее время
начали применять металлога-
лоидные лампы. Они имеют
превосходный спектр света,
оптимизированный к ПЗС-
матрицам видеокамеры,
высокий ресурс работы (до 1000 ч)
и высокий КПД. При
мощности 50 Вт эти лампы
обеспечивают такую же
освещённость, как ксеноновые при
150-200 Вт и галогеновые при
Рис. 3-7. Источник света.
36
Рис. 3-8. Видеокамера, совмещённая
с осветителем.
250-300 Вт. К тому же этот малогабаритный осветитель легко разместить в
корпусе совместно с видеокамерой, что позволяет получить законченный эн-
довидеокомплекс (рис. 3-8).
ИНСУФФЛЯТОР
Инсуффлятор — прибор, обеспечивающий подачу газа в брюшную полость
для создания необходимого пространства и поддерживающий заданное
давление при проведении операции (рис. 3-9). На приборе расположена панель
управления, позволяющая регулировать следующие функции:
1. Поддержание постоянного внутрибрюшного давления (от 0 до 30 мм рт.ст.).
2. Переключение скорости подачи газа (подача малая и большая).
3. Индикация заданного давления.
4. Индикация реального внутрибрюшного давления.
5. Индикация количества израсходованного газа.
6. Включение подачи газа.
Инсуффлятор последнего поколения практически не требует
регулирования и переключений во время операции. Он автоматически поддерживает
установленное давление в брюшной полости пациента, меняет скорость подачи
газа в зависимости от скорости его утечки, подаёт световые и звуковые
сигналы о всех аварийных ситуациях во время проведения вмешательства
(отсутствие газа в баллоне, обрыв шланга, пережатие шланга и т.д.). Для оперативной
лапароскопии необходим мощный инсуффлятор со скоростью подачи газа не
менее 9 л/мин. Это важно для поддержания необходимого пространства при
замене инструментов, введении сшивающих аппаратов, извлечении препарата
или значительной аспирации при кровотечении, т.е. во всех ситуациях,
приводящих к значительной утечке газа и требующих его быстрого восполнения.
37
Рис. 3-9. Инсуффлятор.
Рис. 3-10. Аспиратор-ирригатор.
СИСТЕМА АСПИРАЦИИ
ИРРИГАЦИИ
Практически при всех
лапароскопических
процедурах, как и при традиционных
хирургических операциях,
необходимы аспирация и
ирригация в зоне операционного
поля. Для этой цели
разработаны специальные
инструменты и оборудование.
Инструменты могут иметь общий
канал для подачи промывной
жидкости и отсоса или
раздельные каналы. В последнем
случае можно осуществить
одновременную подачу и отсос,
что резко сокращает время
аспирации-ирригации и
увеличивает эффективность
процедуры. Аспиратор-ирригатор —
прибор с мощными и
регулируемыми подачей и
вакуумным отсасыванием стерильной
жидкости. Нужные параметры
мощности устанавливают
индивидуально в зависимости от
вида операции (рис. 3-10).
Прибор снабжён
накопительной ёмкостью (не менее 2 л) и
устройством, автоматически
выключающим его при
переполнении ёмкости. Это
предотвращает выход из строя
внутренних узлов устройства и
повышает срок его службы.
ЭЛЕКТРОХИРУРГИЧЕСКИЙ
АППАРАТ
Широко применяемая в
операционных всего мира
радиочастотная электрическая
энергия представляет
идеальный источник для рассечения
Рис. 3-11. Электрохирургический генератор.
38
тканей и обеспечения
гемостаза. Прибор для получения
высокочастотных импульсов
называют электрохирургическим
генератором (ЭХГ) или
электроножом (рис. 3-11).
Современный электронож работает
в моно- и биполярном
режимах, имеет достаточно большую
мощность (не менее 200 Вт) и
развитую систему
сигнализации, предотвращающую
поражение пациента и хирурга при
проведении эндохирургичес-
ких вмешательств. На
передней панели электроножа
расположены ручки регулировки
И индикации мощности реза- Рис' 32' Видеомонитор.
ния и коагуляции, выходные разъёмы для подключения моно-, биполярного
инструмента и электрода пациента. Там же расположены кнопка включения
смешанного режима резания с гемостазом и переключатель режима с моно- на
биполярную коагуляцию.
ВИДЕОМОНИТОР
Видеомонитор — устройство для восприятия видеоинформации,
последнее звено в передаче изображения (рис. 3-12). Наиболее дешёвый и доступный
прибор для просмотра видеоинформации — обычный бытовой телевизор.
Однако он обладает малой разрешающей способностью (не более 300 ТВЛ) и не
отвечает стандарту электробезопасности (работа с ним может привести к
поражению электрическим током). Медицинский монитор лишён этих
недостатков. Его разрешающая способность не менее 500—600 ТВЛ, электрозащита
надёжна во всех отношениях. Размер экрана по диагонали у мониторов варьирует
от 14 до 25 дюймов. В эндохирургии предпочтителен монитор с размером
экрана по диагонали 21 дюйм.
ВИДЕОМАГНИТОФОН
Видеомагнитофон — устройство для записи, долговременного хранения и
просмотра видеоизображений. Для хранения и последующего анализа записи
операций вполне подходит обычный бытовой видеомагнитофон формата VHS
с двумя или четырьмя головками. Четырёхголовочный аппарат, в отличие от
двухголовочного, при воспроизведении позволяет получить чёткий стоп-кадр.
Но бытовые магнитофоны имеют разрешающую способность не более 250 ТВЛ
и отношение сигнал-шум не более 46 дБ. Если результаты записи необходимо
39
использовать в качестве учебных пособий, для показа по телевидению и
тиражирования, предпочтение отдают видеомагнитофону формата S-VHS. Он
значительно дороже, но обеспечивает разрешение не менее 400 ТВЛ с высоким
отношением сигнал-шум (например, видеомагнитофоны фирмы «U-Matic»).
Каждый хирург должен записывать свои операции, особенно на этапе освоения
того или иного вмешательства. Это помогает совершенствовать операционную
технику, даёт возможность коллектш " анализировать ошибки и неточности.
ИНСТРУМЕНТ
Эндохирургические инструменты могут быть разделены на инструменты
многократного (металлические) и одноразового (пластиковые) использования.
Большинство хирургов применяют в своей работе оба вида инструментов.
Наиболее доступные и дешёвые в эксплуатации — многократно используемые
разборные металлические инструменты. Они выполнены из нержавеющих
сталей и сплавов. Для оперирования пациентов, страдающих ожирением,
используют длинные (более 300 мм) нестандартные инструменты. Все
лапароскопические инструменты могут быть разделены на две группы:
1. Инструменты доступа.
2. Инструменты для
манипуляций.
Инструменты доступа
К этой группе относят
троакары, торакопорты,
расширители ран и переходники,
гильзы мониторинга (канюли
для динамической
лапароскопии), троакар для кольпото-
мии, инструменты для
наложения ПП (игла Вереша).
Троакары различны по
устройству и размерам. Имеют
общую функцию —
предназначены для обеспечения доступа
к операционному полю и
создания оперативного
пространства. Для этого в троакар-
ной трубке имеются
инструментальный канал с клапаном
и краник канала газоподачи.
Для прокола стенок полостей
внутрь троакарной трубки
вставляют стилет (рис. 3-13).
Стилеты имеют различную рис. 3-13. Троакарная группа инструментов.
40
форму и могут быть снабжены атравма-
тическим защитным колпачком для
безопасного проникновения через ткани
(рис. 3-14). Троакары большего диаметра
снабжены переходными вставками для
введения через них инструментов малого
диаметра. Зарубежные фирмы выпускают
одноразовые троакары с защитным
колпачком (рис. 3-15).
Торакопорты применяют для
выполнения торакоскопических вмешательств.
В зарубежной литературе
существуют синонимы для обозначения различных
частей инструментов доступа. Троакары
называют портами, троакарные трубки —
канюлями, переходные вставки —
редукторами.
Расширители ран и переходники
применяют при необходимости увеличения
размеров доступа для доставки
инструментов с большим диаметром, гемостатичес-
кой губки или удаления массивных
объектов из полостей.
Гильзы для лапаромониторинга
имеют различный диаметр. Гильзы,
фиксированные к коже, могут быть оставлены в
тканях на продолжительное время.
Рис. 3-14. Троакар с атравматическим
стилетом.
Рис. 3-15. Одноразовые пластиковые
троакары с защитным колпачком.
Троакар для колыютомии в комплекте
с 10-миллиметровым «когтистым» захватом входит в кольпотомическии набор.
Его применяют для извлечения препарата через задний свод влагалища без
рассечения передней брюшной стенки.
Игла Вереша служит для наложения первичного ПП с целью создания
«воздушной подушки» и безопасного введения первого троакара в брюшную
полость.
Инструменты для манипуляций
К этой группе относят зажимы, захваты, ножницы, электроды, клипа-
торы, степлеры, инструменты для наложения узлов, швов, вспомогательные
инструменты.
Зажимы — анатомические, хирургические, когтистые, Алеса, Бебкокка и
др. Основное отличие всех зажимов — наличие механизма фиксации губок —
кремольеры, расположенной на ножницеобразных ручках. Предназначены для
41
захвата, удержания органов и тканей при выполнении вмешательств, тракции
и противотракции, извлечении препарата. Зажимы различают по диаметру
E-10 мм) и по форме рабочей части губок. Устройство кремольеры может
быть различным — для указательного пальца, мизинца, отключаемые
кремольеры (рис. 3-16).
Захваты — диссектор, анатомический захват, биполярный пинцет.
Большинство из них не имеет кремольеры и представляет электрод хирурга для
подачи высокочастотного напряжения. Инструменты имеют диэлектрическое
покрытие, на торцовой части каждого из них расположен разъём для
подключения кабеля активного электрода ЭХГ. Предназначены для атравматического
удержания стенок органов и тканей, коагуляции, резания и остановки
кровотечения (рис. 3-17).
Ножницы делят по рабочей части губок на прямые, изогнутые и
клювовидные.
Большинство захватов и ножниц снабжено поворотным механизмом для
указательного пальца, что значительно облегчает работу хирурга во время
операции.
Электроды хирурга не имеют ножницеобразных ручек, на торцовой части
каждого расположен разъём для кабеля активного электрода ЭХГ. Форма
рабочей части может быть различной — крючок, шар, палочка, петля, лопатка,
игла. В зависимости от формы органа и типа электрохирургического
воздействия используют тот или иной диссектор. Крючок применяют для рассечения
тканей. Шарообразный электрод — для коагуляции поверхности
паренхиматозных органов. Электрод в форме лопатки сочетает свойства крючка и шара,
удобен при выделении тканей и коагуляции (рис. 3-18).
Клипаторы (аппликаторы, эндоклиперы) служат для наложения клипс
диаметром от 3 до 10 мм. Различают однобраншевые и двухбраншевые
инструменты. Поворотный механизм обеспечивает удобство в работе. Возможно осевое и
угловое (поперечное) расположение губок, что позволяет накладывать клипсы
в труднодоступных местах. Для удобства зарядки клипатора клипсы помещают
в специальный картридж (рис. 3-19).
Степлер предназначен для наложения скобок с целью фиксации
полипропиленовой сетки и соединения брюшины при герниопластике.
Инструменты для наложения узлов служат для низведения и фиксации
шовного материала. При этом используют многоразовые палочки для опускания
узлов и устройства для доставки эндолигатуры одноразового или
многоразового использования (рис. 3-21).
Инструменты для наложения швов предназначены для ручного или
механического соединения тканей.
Ручной шов накладывают, используя иглодержатель, инструмент для
приёма иглы, иглу Малкова, скорняжную иглу (рис. 3-20).
Механические швы накладывают сшивающими аппаратами.
42
Рис. 3-16. Эндохирургические зажимы: А — анатомические; Б, В, Г — хирургические.
Рис. 3-17. Диэлектрические захваты и ножницы:
А — биопсийные щипцы; Б, В — диссекторы;
Г, Д, Е, Ж — ножницы.
43
Рис. 3-18. Электроды хирурга: А — «крючок», Б — «петля», В — «шар», Г — «лопаточка».
Рис. 3-19. Эндохирургические аппликаторы и
клипсы с картриджем.
44
Рис. 3-20. Эндохирургические иглодержатели.
Рис. 3-21. Эндопетля и устройство для её
доставки.
Рис. 3-23. Эндостич.
Рис. 3-22. Сшивающий аппарат «Endo GIA-30»
со сменными одноразовыми кассетами.
45
Рис. 3-24. Иглы: А — игла скорняжная; Б, В —
игла Вереша; Г — игла пункционная; Д —
игла биопсийная; Е — палочка для
введения шовного материала; Ж — щётка
для чистки инструментов.
Сшивающие аппараты типа «Endo GIA-
30» и «Endo GIA-60» со сменными
одноразовыми кассетами позволяют прошить
ткани шестирядным скрепочным швом и
тут же пересечь их между наложенными
рядами скрепок, оставляя с каждой
стороны по три ряда скрепок. Перед
наложением аппарата определяют толщину
прошиваемых тканей, чтобы выбрать
необходимую кассету — для прошивания
стенки кишки или сосудов. Эти
устройства позволяют выполнять эндоскопическую
интракорпоральную резекцию органов и
наложение анастомозов (рис. 3-22).
Эндостич — инструмент для
наложения механического ниточного шва.
Удобен для ушивания брюшины после гер-
ниопластики, сшивания стенок желудка
при фундопликации, наложения
различных анастомозов. Представляет
альтернативу ручному эндохирургическому шву,
позволяет экономить время и шовный
материал. Инструмент состоит из двух
металлических «пальцев», позволяющих
перемещать иглу с нитью между ними,
прошивая при этом ткани (рис. 3-23).
Вспомогательные инструменты
включают аспиратор-ирригатор (промыватель), ретрактор, штопор для миоматоз-
ных узлов, щипцы и иглы для биопсии, сачок, зонды (маточные, для холанги-
ографии), ранорасширители (рис. 3-24—3-26).
Разработана группа инструментов малого диаметра, позволяющих
минимизировать травму доступа (рис. 3-27).
Обработка и стерилизация
Для многоразовых инструментов после каждой операции необходима
специальная обработка, состоящая из нескольких этапов.
Механическая очистка. Сразу после окончания операции инструменты
разбирают и очищают ершами и щётками в проточной воде.
Дезинфекция. Инструменты помещают на 15 мин в дезинфицирующий
раствор. Рекомендуем «Сайдекс», «Виркон», «Лизетол». Не рекомендуем
средства, приводящие к коррозии металла: перекись водорода, средства,
содержащие хлор, «Пливасепт». Затем инструменты тщательно промывают в
проточной воде до полного исчезновения запаха дезинфицирующего вещества.
Предстерилизационная очистка. Её проводят в моющем растворе,
содержащем 3% раствор перекиси водорода, моющее средство, олеат натрия и воду.
46
Рис. 3-25. Трёхлепестковый ранорасширитель.
Рис. 3-26. Расширители,
аспираторы-ирригаторы и ретрактор.
Рис. 3-27. Инструменты для эндохирургии
диаметром 2 мм.
47
Продолжительность очистки 15 мин при температуре 50 °С. Этот этап
завершают ополаскиванием инструментов в проточной, а затем в дистиллированной
воде. Для подготовки к стерилизации или хранению инструменты тщательно
высушивают либо марлевыми тампонами, либо в сухожаровом шкафу в
разобранном виде без прокладок при температуре не выше 85 °С.
Стерилизация. Инструменты без диэлектрического покрытия стерилизуют
традиционно в сухожаровом шкафу при температуре 170—180 °С в течение 1 ч.
Инструменты, имеющие диэлектрическое покрытие, оптику и прокладки,
стерилизуют в растворе «Сайдекс» A0 ч), затем ополаскивают стерильной
дистиллированной водой, высушивают марлевыми тампонами, укладывают и собирают на
стерильном операционном столе непосредственно перед операцией.
Следует помнить, что долговечность инструментов во многом зависит от
соблюдения правил их обработки.
48
4
Общие клинические положения
и оперативная техника
ПОДБОР БОЛЬНЫХ, ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
Подбор больных для эндохирургических операций чрезвычайно важен,
особенно в период освоения врачом новой технологии. Не меньшее значение
имеет тщательность предоперационного обследования, так как на этом этапе
можно предотвратить многие осложнения.
Каждый хирург должен понимать, что противопоказания к видеоскопиче-
ской операции относительны и зависят от многих факторов. В первую очередь
от уровня подготовки специалиста, его личного опыта в выполнении таких
операций и оснащённости операционной. Например, ожирение III—IV
степени у больного с острым холециститом не послужит противопоказанием, если
хирург выполнил более 100 ЛХЭ. Если тот же хирург для своей первой
лапароскопической гемиколэктомии подготовит больную с ожирением, то
лапароскопический вариант будет абсолютно противопоказан. В настоящее время
противопоказания включают в себя следующие состояния.
Абсолютные противопоказания
1. Острый инфаркт миокарда.
2. Острое нарушение мозгового кровообращения.
3. Некорригируемая коагулопатия.
Относительные противопоказания
1. Непереносимость общего обезболивания.
2. Разлитой перитонит.
3. Перенесённые ранее операции в зоне объекта вмешательства.
4. Склонность к кровоточивости.
5. Поздние сроки беременности.
6. Ожирение III—IV степени.
Эндоскопическая хирургия предъявляет более жёсткие требования к
предоперационному обследованию и точности предоперационного диагноза. Это
связано с такими объективными особенностями эндохирургии, как двухмерное
изображение, ограниченный обзор и невозможность мануальной пальпации
органов. Например, при подготовке к открытой холецистэктомии подозрение
на холедохолитиаз не считают абсолютным показанием к дооперационной
ретроградной холангиопанкреатографии, так как во время операции холангиогра-
фия, мануальное обследование и ревизия ОЖП позволят уточнить диагноз.
При подготовке к ЛХЭ состояние ВЖП до операции должно быть изучено
досконально, так как лапароскопическая холедохолитотомия — сложная и
продолжительная процедура, требующая специальной подготовки. То же самое
49
можно сказать о подготовке к гемиколэктомии (например, при раке
нисходящего отдела толстой кишки). При открытой операции локализацию опухоли
можно уточнить пальпаторно. Во время лапароскопической гемиколэктомии
для точного выбора уровня резекции и объёма лимфаденэктомии хирург
должен точно представлять локализацию опухоли. Поэтому дооперационное
обследование в отличие от подготовки к открытой операции не может
ограничиться колоноскопией, а должно быть дополнено ирригоскопией.
Сопутствующие заболевания сердечно-сосудистой и дыхательной систем
должны быть выявлены и обсуждены совместно с терапевтом и
анестезиологом. Малая травматичность эндохирургии может обернуться большим риском
для пациента, например из-за нежелательных последствий ПП.
Хирург всегда, особенно при освоении новых методик, должен
критически оценивать свои возможности, соотнося их с потенциальной опасностью для
пациента и риском осложнений.
СТРУКТУРА ОПЕРАЦИОННОЙ
Расположение пациента на операционном столе зависит от вида
вмешательства и способа его выполнения (открытого или эндохирургического).
Неверное расположение больного может превратить простую операцию в
сложную процедуру, мучительную для хирурга и опасную для пациента. Поэтому
операционный стол должен быть мобилен и легко управляем (рис. 4-1).
Потребность в изменении положения тела нередко возникает во время
самой операции, поэтому больной должен быть надёжно фиксирован к
операционному столу. Конечности следует закрепить, но так, чтобы это не мешало
работе операционной бригады.
Основная цель изменения положения больного — придание объекту
операции верхнего положения в пространстве, тогда сила тяжести отводит смежные
органы в сторону. Большинство лапароскопических операций выполняют в
положении больного на спине с опущенным (рис. 4-2) или поднятым головным
концом (рис. 4-3). Первую
позицию обычно применяют при
операциях на нижнем этаже
брюшной полости и органах
малого таза, вторую — при
операциях на верхнем этаже
брюшной полости. Нередко
необходимо наклонить больного на
левый или правый бок на
20—30° (рис. 4-4). Например,
при ЛА для того, чтобы
облегчить доступ к слепой кишке,
больному придают положение
Тренделенбурга и поворачивают
стол на левый бок. Большой
Рис. 4-1. Эндохирургическая операционная. Общий вид. сальник И петли кишечника
50
Рис. 4-2. Положение Тренделенбурга.
Рис. 4-3. Положение Фаулера.
смещаются вниз, а слепая
кишка, фиксированная в
подвздошной ямке, занимает верхнее
положение в брюшной полости.
Освещённость в
операционной чрезвычайно важна для
успешного выполнения
операции. Прямой и даже
отражённый солнечный свет
существенно ухудшает качество
изображения на мониторе и
может свести на нет
достоинства любой, даже самой
совершенной видеосистемы.
Поэтому окна следует затемнить,
используя жалюзи или тёмную
плёнку.
Операционная бригада
состоит из хирурга, одного-двух
ассистентов (один из них —
оператор камеры),
операционной сестры и анестезиолога с
помощником. Постоянный
состав бригады позволяет
сократить время операции и
повысить её безопасность.
Оператор камеры.
Координация между хирургом и
оператором камеры
имеет стратегическое
значение для успешного
исхода вмешательства и
профилактики осложнений. Любые манипуляции в полости выполняют под
визуальным контролем: введение всех троакаров, кроме первого, введение
и извлечение инструментов, фиксация и освобождение органов, тракция и
противотракция, рассечение и коагуляция тканей, наложение клипс и
прошивание аппаратом, туалет, санация полости и установка дренажей.
Операционная сестра. Должна разбираться в устройстве оборудования,
начиная с правил включения видеосистемы и заканчивая совпадением
номеров на деталях инструментов.
У операционной сестры должна быть полная готовность к
немедленному переходу к открытой операции, включая набор инструментов, рет-
ракторы и шовный материал. Такая ситуация возникает при
невозможности выполнить операцию закрытым способом из-за выраженного спаечного
процесса или перифокальной инфильтрации тканей либо при
возникновении интраоперационных осложнений (например, кровотечении или
повреждении полого органа).
Рис. 4-4. При выполнении лапароскопической аппендэк-
томии операционный стол наклоняют влево на 20—30°.
51
СОЗДАНИЕ НЕОБХОДИМОГО ПРОСТРАНСТВА
Операции производят в ограниченном замкнутом пространстве —
брюшной или плевральной полости. Это пространство хирург создаёт одним из
следующих способов.
Пневмоперитонеум
Наложение пневмоперитонеума (ПП) — один из наиболее ответственных
этапов выполнения любой лапароскопической операции.
В брюшную полость вводят газ, приподнимающий брюшную стенку и
создающий необходимое для работы пространство. Заданное давление
поддерживают на протяжении всей операции.
Существуют разные способы введения газа в брюшную полость.
а. Прямая пункция иглой Вереша — классическая и наиболее
распространённая техника наложения ПП. Создаваемая «воздушная подушка»
увеличивает расстояние между брюшной стенкой и внутренними органами в
момент введения троакара.
Больного укладывают в горизонтальное положение. Кожу рассекают
на всю толщу в предполагаемой точке введения иглы и первого троакара.
Длина разреза кожи на 2—3 мм превышает диаметр троакара.
Направление разреза выбирают, соблюдая принципы косметической хирургии.
Наименее травматично введение троакара по белой линии живота —
параумбиликально, выше или ниже пупка. Это предотвращает
повреждение сосудов, мышц и нервов. При необходимости разрез бескровно
расширяют. Доступ удобен для ушивания тканей брюшной стенки в конце
операции, наименее опасен в плане формирования послеоперационных грыж.
\
Рис. 4-5. Точки введения иглы Вереша
и первого троакара.
52
Рис. 4-6. Точки Калька для введения троакара
в брюшную полость.
Рис. 4-7. Брюшную стенку в момент пункции приподнимают рукой.
При операциях на верхнем этаже брюшной полости полулунный разрез
выполняют на 1 см ниже пупка, на нижнем этаже — выше пупка (рис. 4-5).
Это необходимо для получения панорамной картины, которая тем
больше, чем дальше лапароскоп от объекта вмешательства.
Для выполнения первого прокола можно использовать пупочное
кольцо. Этот доступ показан при наличии пупочной грыжи, сопутствующей
основному заболеванию. Пластику грыжевых ворот выполняют в конце
операции.
В 60—70-х годах для первичной пункции брюшной стенки чаще
применяли одну из четырёх точек Калька, расположенных на 3 см выше и
ниже пупка и на 0,5 см справа и слева от средней линии (рис. 4-6). В
эпоху диагностической лапароскопии троакарные отверстия в брюшной
стенке не ушивали. Выбор этих точек аргументировали малой
вероятностью образования грыж.
Для введения иглы Вереша и троакара можно выбрать любое место
прокола на передней брюшной стенке. Следует помнить о топографии
надчревной артерии, проходящей параллельно средней линии живота; от
неё отступают латерально на 3—4 см.
Выбор места прокола зависит также от роста и конституции
пациента. У тучных крупных больных лапароскоп вводят ближе к объекту
операции, так как из-за толщины брюшной стенки «полезная часть»
инструмента существенно короче.
53
i Ж
Рис. 4-8. Иглой Вереша мягко пунктируют брюшную полость.
Рис. 4-9. Иглу вводят «под пупок» снизу или
сверху в зависимости от расположения
объекта вмешательства.
После рассечения кожи
кровоточащие сосуды сразу коагулируют,
брюшную стенку приподнимают
рукой, цапкой или лигатурой,
наложенной на апоневроз (рис. 4-7).
Иглу Вереша захватывают тремя
пальцами, как карандаш, и кистевым
движением мягко пунктируют
брюшную полость под углом 60—70° к
брюшной стенке (рис. 4-8).
Иглу вводят «под пупок», где
брюшная стенка тоньше (рис. 4-9).
Тактильно хирург обычно ощущает
прохождение двух препятствий —
апоневроза и брюшины. Реже в полость
проникают одним движением. После
пункции следует избегать маятникооб-
разных движений иглы, способных
привести к повреждению внутренних
органов и сосудов (рис. 4-10).
Чтобы убедиться в правильном
положении иглы, проводят три пробы.
A) Убегание капли. Брюшную стенку
приподнимают, создавая
отрицательное давление в полости. Капля жид-
54
кости с мандрена проскальзывает внутрь. При неверном положении
иглы капля остаётся на месте.
B) Шприцевая проба. Через иглу в брюшную полость вводят 5—10 мл
физиологического раствора (рис. 4-11). Обратное поступление
жидкости при подтягивании поршня свидетельствует о том, что кончик
иглы расположен не в свободной, а в ограниченной полости
(например, в предбрюшинном пространстве). Обратное поступление
жидкости вместе с кровью или кишечным содержимым сигнализирует о
пункции внутреннего органа.
C) Аппаратная проба. Канюлю трубки газоподачи соединяют с манд-
реном иглы Вереша и включают инсуффлятор. Последнее поколение
приборов в этот момент регистрирует отрицательное давление в
брюшной полости, что свидетельствует о правильном расположении иглы.
Эти пробы просты и эффективны. Если результат одной из них
позволяет заподозрить неверное положение иглы, пункцию следует
повторить или избрать другой способ наложения ПП.
Инсуффляцию начинают медленно, со скоростью 1 л/мин. При
правильном положении иглы после введения 500 мл газа перкуторно исчезает
печёночная тупость, брюшная стенка равномерно приподнимается.
Осторожно прижав ладонью брюшную стенку в проекции кончика иглы, хирург
Маятникообразные движения иглы после пункции брюшной полости недопустимы.
Рис. 4-11. Шприцевая проба.
Рис. 4-12. Точки введения иглы Вереша у ранее
оперированных больных.
тактильно ощущает
прохождение пузырьков газа в брюшную
полость. Всего при первичной
пункции вводят 2,5—3 л газа.
Иглу извлекают,
10-миллиметровый троакар вводят
так, как описано в следующем
параграфе. Больным с
ожирением для создания рабочего
пространства может
потребоваться 8-10 л газа.
Перенесённые ранее
операции на органах брюшной
полости требуют большой
осторожности при введении
иглы Вереша. Для первичной
пункции выбирают точку,
максимально удалённую от
рубца (рис. 4-12).
б. Прямая пункция троакаром.
После рассечения кожи
брюшную стенку приподнимают и
сверлящими движениями
мягко вводят троакар в брюшную
полость (рис. 4-13).
56
Следует избегать
сильных прямых толчков
рукой. Тупой троакар
опаснее острого, так как
приводит к большему
изгибу брюшной стенки и
уменьшению «воздушной
подушки» над внутрени-
ми органами.
Направление движения
инструмента — под пупок.
Опасность повреждения
внутренних органов
меньше при
использовании троакара с защитным
колпачком.
Для более
безопасного вхождения в
брюшную полость апоневроз
предварительно
рассекают скальпелем на
протяжении 3—4 мм.
Вероятность
повреждения внутренних
органов в обоих случаях
(пункция иглой или тро-
Рис. 4-13. А — введение первого троакара. Б — троакар с
защитным колпачком.
57
акаром) примерно одинакова, так как брюшную стенку прокалывают
вслепую. Поэтому некоторые хирурги отдают предпочтение прямой пункции
троакаром без предварительного использования иглы. Однако
повреждения иглой и троакаром, имеющими различный диаметр, отличаются по
своей тяжести. Недопустимо применение этих способов около
послеоперационных рубцов из-за опасности повреждения внутренних органов.
в. Открытая лапароскопия. Первый троакар вводят через микролапаротом-
ное отверстие длиной 15—20 мм. Этот способ безопаснее, но занимает
несколько больше времени, чем два предыдущих.
A) Показания
(а) Перенесённые ранее операции в предполагаемой зоне
введения иглы Вереша и первого троакара.
(б) Опасность повреждения внутренних органов из-за
предполагаемого спаечного процесса или других причин (например,
тонкая брюшная стенка).
(в) Неудачные попытки введения иглы Вереша или троакара.
B) Техника
(а) Рассекают кожу и подкожную жировую клетчатку.
(б) Апоневроз захватывают зажимами фон Микулича-Радецкого,
освобождают от клетчатки и приподнимают вверх.
(в) На апоневроз накладывают кисетный шов диаметром 2,5—3 см
так, чтобы обеспечить надёжную герметичность брюшной
полости после его затягивания (рис. 4-14).
(г) Апоневроз рассекают скальпелем в центре шва, затем
рассекают париетальную брюшину.
(д) В случае спаечного процесса органы, фиксированные к
передней брюшной стенке, осторожно отделяют, освобождая
пространство для введения троакара.
(е) В брюшную полость вводят 10-миллиметровый троакар без
стилета, затягивают кисетный шов и начинают инсуффляцию.
Рис. 4-14. Открытая лапароскопия: А — наложение зажимов фон Микулжа-Радецкого на
апоневроз; Б — формирование кисетного шва вокруг будущего отверстия.
58
Для сохранения
герметичности брюшной
полости при открытой
лапароскопии также
применяют троакар Хассона.
Этот инструмент имеет
специальный
цилиндрический конус и «ушки»
для фиксации к брюшной
стенке (рис. 4-15).
Лигатуры накладывают на
апоневроз и завязывают
над «ушками», что
прочно удерживает
инструмент и обеспечивает
герметичность.
Метод открытой
лапароскопии упрощает
извлечение препарата, так
как отверстие в брюшной
стенке после снятия
кисетного шва всегда
больше диаметра троакара.
Техника открытой
лапароскопии — разумная
альтернатива слепому способу проникновения в брюшную полость.
Метод позволяет предотвратить повреждение внутренних органов и крупных
сосудов, избежать предбрюшинной инсуффляции и газовой эмболии на
этапе наложения ПП. Его недостатки — большая вероятность раневой
инфекции и потенциальный риск образования грыж вследствие
рассечения тканей брюшной стенки. Конечно, и при открытой технике
проникновения возможно ранение органов, непосредственно припаянных по
линии рубца. Однако это осложнение распознают сразу. Всё же не следует
производить разрез тканей непосредственно по рубцу, лучше это сделать
выше или ниже линии предшествовавшей кожной инцизии.
г. Другие методы наложения ПП.
A) При опасности спаечного процесса вдоль лапаротомного рубца
можно произвести пункцию брюшной стенки в стороне от белой
линии (например, в левом подреберье). Пункцию производят иглой Ве-
реша или 5-миллиметровым троакаром с последующим введением
5-миллиметрового лапароскопа. Тогда 10-миллиметровый троакар по
средней линии вводят под контролем зрения. Способ не получил
широкого распространения.
B) Использование видеотроакара («Visiport», «Auto Suture»),
теоретически позволяющего в момент прохождения брюшной стенки
визуализировать её слои и брюшную полость с целью профилактики
повреждения внутренних органов.
Рис. 4-15. Троакар Хассона.
59
При малейших сомнениях в безопасности слепого введения инструмента
предпочтение следует отдавать методу открытой лапароскопии.
Величина давления в брюшной полости существенно влияет на объём
рабочего пространства, состояние гемодинамики во время операции, течение
послеоперационного периода, частоту и тяжесть осложнений.
В настоящее время повсеместно используют инсуффляторы с
автоматическим поддержанием давления в брюшной полости. Однако выход аппарата из
строя приводит к неконтролируемому подъёму внутрибрюшного давления с
развитием аритмии, сдавлением диафрагмы и ухудшением кровоснабжения
органов. Попадание воды в трубку инсуффлятора может мешать току газа и
создавать ложный подъём внутрибрюшного давления.
В середине 80-х годов рекомендовали поддерживать давление в пределах
14—15 мм рт.ст. В последующем выяснилось, что для создания необходимого
пространства достаточно 10—12 и даже 8 мм рт.ст. Уменьшение создаваемого
давления уменьшает травматичность операции и вероятность осложнений ПП,
упрощает анестезию и облегчает послеоперационное ведение больного.
Необходимые условия для работы при низком внутрибрюшном давлении —
адекватная релаксация и полная герметичность брюшной полости.
Подъём давления выше 16 мм рт.ст. может привести к опасным
осложнениям со стороны сердечно-сосудистой и дыхательной систем (см. главу 6).
Постоянная утечка газа по ходу операции существенно затрудняет работу
хирурга в силу следующих обстоятельств:
— снижение внутрибрюшного давления уменьшает объём рабочего
пространства, ухудшает обзор, меняет экспозицию и увеличивает риск
осложнений;
— постоянное поступление новых порций холодного газа приводит к
запотеванию оптики;
— звук выходящего газа отвлекает операционную бригаду.
Возможные причины утечки газа:
— неверно собран инструмент;
— повреждена прокладка инструмента;
— отверстие в брюшной стенке не соответствует диаметру троакара;
— при повторном введении троакара сформирован новый раневой канал,
а первый служит источником дегерметизации;
— кисетный шов, наложенный на апоневроз в случае открытой
лапароскопии, сформирован крупными стежками, не обеспечивающими
герметичность.
В случае утечки газа необходимо приостановить операцию и восстановить
герметичность брюшной полости: заменить прокладку, затампонировать рану
влажной марлевой салфеткой, правильно собрать инструмент, наложить
П-образный шов на ткани брюшной стенки вокруг троакара. Нельзя ушивать
только кожу без захвата более глубоких тканей, так как это приведёт к
развитию подкожной эмфиземы.
60
Выбор газа для создания пневмоперитонеума
В брюшную полость вводят углекислый газ, закись азота, воздух
операционной, инертные газы — гелий, аргон. Кислород не используют из-за
опасности взрыва при работе с высокочастотной электроэнергией.
Углекислый газ. Предпочтение отдают углекислому газу, который
недорог, доступен, быстро всасывается брюшиной, не поддерживает горение,
безвреден для персонала, быстро растворяется при попадании в
кровеносное русло. Его недостаток — способность вызывать сердечную
аритмию и ацидоз у пациентов с сердечно-лёгочными заболеваниями.
Закись азота широко использовали в эпоху диагностической
лапароскопии. Она даёт анальгезирующий эффект, меньше всасывается брюшиной,
чем углекислый газ, доступна и недорога. Однако этот газ поддерживает
горение, поэтому неприменим при операциях, требующих
электрохирургического или лазерного воздействия.
Воздух операционной по сравнению с углекислым газом даёт большую за-
дымлённость и хуже растворяется в крови, что увеличивает
потенциальную опасность газовой эмболии. Воздух всегда содержит влагу, которая
конденсируется на клапанах инсуффлятора, снижая надёжность,
электробезопасность и долговечность прибора.
Инертные газы лишены многих из перечисленных выше недостатков,
однако дороги и труднодоступны.
Анестезия
Вопросы обезболивания в эндохирургии подробно обсуждены в главе 6.
Однако определённые моменты начала операции непосредственно связаны с
видом анестезии, от которой во многом зависит безопасность введения иглы
Вереша и первого троакара. В лапароскопической хирургии используют как
местную, так и общую анестезию.
а. Местная инфильтрационная анестезия раствором новокаина с
традиционной премедикацией допустима только для выполнения диагностической
лапароскопии продолжительностью 5—10 мин. В момент наложения ПП
больной находится в сознании. Напрягая по просьбе врача брюшную
стенку, пациент помогает безопасно ввести иглу Вереша и троакар. Обычно
пациенты удовлетворительно переносят раздувание брюшной полости. При
расширении объёма вмешательства необходимо общее обезболивание.
б. Общее внутривенное обезболивание применяют при диагностической и
оперативной лапароскопии, чаще в гинекологии, при небольших по объёму и
продолжительности B0—30 мин) операциях у молодых пациентов
(например, для выполнения лапароскопической стерилизации или адгезиолизиса).
Эти операции следует начинать под местной анестезией при сохранённом
сознании больного. Внутривенный наркоз добавляют после наложения ПП
и введения первого троакара. В противном случае без помощи пациента и
61
при отсутствии релаксации, позволяющей беспрепятственно приподнять
брюшную стенку, слепая пункция может быть сложной и опасной.
в. И нт\ опционный наркоз с искусственной вентиляцией лёгких (ИВЛ)
наиболее удобен для управления глубиной анестезии и контроля за
состоянием жизненно важных функций пациента. Миорелаксация позволяет
свободно пунктировать брюшную стенку и производить операцию при
невысоком внутрибрюшном давлении. Этот вид анестезии наиболее
распространён в эндохирургии.
Механическое поднятие брюшной стенки
Альтернативный ПП способ создания необходимого пространства —
механическое поднятие передней брюшной стенки при помощи различных
устройств (лапаролифтинг). Этот метод получил не совсем точное, но
устоявшееся название безгазовой лапароскопии.
Способ предложен для устранения следующих недостатков ПП:
а. Сдавление венозных сосудов забрюшинного пространства с
нарушением циркуляции крови в нижних конечностях и увеличением вероятности
тромбообразования.
б. Нарушение артериального кровотока в брюшной полости.
в. Нарушение сердечной деятельности: снижение сердечного выброса и
сердечного индекса, аритмии.
г. Сдавление диафрагмы с уменьшением остаточной ёмкости лёгких,
увеличением мёртвого пространства и развитием гиперкапнии.
д. Ротация сердца.
е. Непосредственные осложнения ПП: пневмоторакс, пневмомедиасти-
нум, пневмоперикард, подкожная эмфизема, газовая эмболия.
Недостатки ПП не привлекали внимания хирургов в эпоху
диагностической лапароскопии, когда операция продолжалась не более 15—20 мин.
Радикальные лапароскопические операции требуют большего времени, при этом
становится невозможно игнорировать гемодинамические, дыхательные и
другие последствия напряжённого ПП.
По мере развития эндохирургии показания к малотравматичным
операциям были расширены: их стали применять у пациентов пожилого и старческого
возраста, страдающих заболеваниями сердечно-сосудистой и дыхательной
систем. Именно для этой категории больных чрезвычайно важна ранняя
активизация и быстрая реабилитация в послеоперационном периоде. Однако именно
у них напряжённый ПП опасен развитием тяжёлых осложнений: инфаркта
миокарда, сердечно-сосудистой и дыхательной недостаточности, ишемии
внутренних органов, флеботромбоза и эмболии лёгочной артерии. Риск
осложнений возрастает у пациентов со сниженным кардиопульмональным резервом и
при продолжительности операции более 2 ч. Поэтому именно этой категории
больных показаны лапароскопические операции без наложения ПП.
Первым механическое поднятие брюшной стенки для осмотра
внутренних органов применил Дмитрий Отт в 1901 г. Брюшную стенку приподнима-
62
ли пулевыми щипцами. Органы малого таза осматривали через кольпотомичес-
кое отверстие. За последующие 7 лет Отт и его ученики — Г. П. Серёжников и
В.Л. Якобсон — выполнили около 2000 таких процедур, названных автором вен-
троскопией.
Существует два принципиально различающихся варианта подъёмника:
а) подъёмник, вводимый в толщу передней брюшной стенки;
б) подъёмник, вводимый под брюшину.
В США наиболее популярен «Laparolift/ORIGIN», состоящий из двух
пластин, раздвигаемых в виде угла после введения в брюшную полость. Тракцию
создают «механической рукой», фиксированной к операционому столу (рис. 4-16).
Рис. 4-16. Механический подъёмник брюшной
стенки «Laparolift/ORIGIN».
Рис. 4-17. Механический подъёмник
брюшной стенки «Эндомедиум».
В России первый подъёмник
брюшной стенки разработан и апробирован в
1995 г. НПФ «Эндомедиум» (рис. 4-17).
а. Преимущества безгазовой лапароскопии:
A) Отсутствие гемодинамических,
дыхательных и метаболических
расстройств, связанных с ПП и
адсорбцией углекислого газа.
B) Отсутствие прямых
осложнений ПП (газовая эмболия,
пневмоторакс, пневмомедиастинум,
подкожная эмфизема, боли в
плече).
Рис. 4-18. Форма пространства при
лапароскопии: А — при безгазовой
лапароскопии, Б — после
наложения ПП.
63
C) Отсутствие необходимости в инсуффляторе.
D) Отсутствие неудобств, связанных с поддержанием герметичности
брюшной полости.
E) Возможность использования более простых, надёжных и дешёвых
инструментов для открытой хирургии.
б. Недостатки безгазовой лапароскопии:
A) Форма пространства напоминает усечённую пирамиду, в отличие
от пространства в виде небесного купола, формируемого при
наложении ПП (рис. 4-18).
B) Устройство для безгазовой лапароскопии приподнимает один или
два из четырёх квадрантов брюшной стенки.
C) Экспозиция у тучных больных затруднена.
в. Показания к безгазовой лапароскопии включают сопутствующие
заболевания сердечно-сосудистой и дыхательной систем:
A) Сердечно-сосудистая недостаточность.
B) ИБС и гипертоническая болезнь II—III степени.
C) Инфаркт миокарда в анамнезе.
D) Порок сердца.
E) Перенесённые операции на сердце.
F) Обструктивные заболевания лёгких.
г. Техника безгазовой лапароскопии:
При использовании подъёмника, изображённого на рис. 4-8, тракцию
создают за счёт двух металлических пластин дугообразной формы,
введённых подкожно. Пластины фиксируют к кронштейну, укреплённому на
операционном столе.
Рекомендуемая последовательность действий:
A) Намечают точки введения дуг на расстоянии 12—14 см друг от
друга в предполагаемой зоне операции.
B) В намеченных точках надсекают кожу
на 5—6 мм.
C) Через разрезы подкожно до упора
вводят металлические пластины, фиксируют
их к подъёмнику.
D) Брюшную стенку приподнимают вверх
на 5—6 см так, чтобы она образовала
своеобразный конус, пространство внутри
которого позволит выполнить операцию
(рис. 4-19).
E) Параумбиликально рассекают
брюшную стенку и вводят первый троакар с
открытым краном газоподачи. После
выравнивания внутрибрюшного и
атмосферного давления через троакар вводят
Рис. 4-19. Безгазовая лапароскопия. Под- лапароскоп и оценивают образовавшее-
нятие брюшной стенки. ся пространство. При его недостаточных
64
размерах брюшную стенку приподнимают выше до получения
желаемой панорамы.
F) Последующие троакары вводят в типичных точках.
Операции при минимальном давлении
Лапароскопические операции, выполняемые под минимальным
давлением в брюшной полости, сочетают преимущества и недостатки традиционной и
безгазовой техники. Давление поддерживают на уровне 3—5 мм рт.ст. Оператор
камеры слегка приподнимает брюшную стенку за первый троакар. Такое
низкое давление практически не влияет на дыхание и гемодинамику. Сочетание
механического подъёмника брюшной стенки с минимальным внутрибрюшным
давлением позволяет расправить диафрагму, осмотреть боковые каналы
брюшной полости и улучшить обзор. При выполнении ЛХЭ при минимальном
давлении иногда необходимо через дополнительные доступы ввести два
5-миллиметровых ретрактора для отведения двенадцатиперстной кишки и левой доли
печени. Лапароскопические операции при минимальном давлении в России
разрабатывает А.Н. Чугунов.
Операции под лапароскопическим контролем
К этой группе операций, выполняемых при помощи лапароскопии (laparoscopy-
assisted procedures), относят вмешательства, при которых лишь определённый этап
проходит под контролем монитора, а последующие — открытым традиционным
способом после небольшого разреза грудной
или брюшной стенки (рис. 4-20).
Таким образом была выполнена
первая лапароскопическая резекция
сигмовидной кишки. Этап мобилизации хирург Флоуэ
провёл лапароскопически. Затем в левой
подвздошной области произвёл микролапа-
ротомию длиной 6—7 см. Извлёк
сигмовидную кишку с опухолью наружу, на
поверхность кожи. Выполнил резекцию кишки и
наложил соустье конец в конец обычным
способом при помощи ручного шва.
Эта методика имеет свои преимущества:
— наиболее ответственный момент
вмешательства (например, резекцию
органа и наложение анастомоза)
выполняют при помощи известных,
хорошо отработанных и безопасных
технических приёмов;
— можно использовать недорогие
инструменты для открытой хирургии;
— операция короче и технически
проще.
Рис. 4-20. Правосторонняя гемиколэктомия
под лапароскопическим контролем.
65
К недостаткам следует отнести необходимость выполнения разреза
брюшной или грудной стенки, хотя при злокачественных опухолях в любом случае
необходим разрез достаточной длины, так как фрагментация и
«протаскивание» опухоли через ткани недопустимы.
ВИДЕОПАНОРАМА И ВВЕДЕНИЕ ИНСТРУМЕНТОВ
Через первый троакар в брюшную полость вводят лапароскоп. Перед этим
для удаления следов дезинфицирующих веществ оптику (линзу и окуляр)
следует тщательно протереть влажной и сухой салфетками. Сразу после введения в
брюшную полость лапароскоп запотевает. Вместо чёткого контрастного
изображения хирург видит расплывчатые, неопределённые контуры органов. Не
извлекая инструмент наружу, мягким мажущим движением необходимо
протереть оптику о большой сальник, стенку кишки или печень. Через 30-40 с
оптика согревается до температуры тела. Запотевание можно предотвратить,
предварительно согрев лапароскоп, поместив его на 20—30 с в банку с
физиологическим раствором при температуре 50—60 °С.
Хирург может передвигать оптику в трёх направлениях.
1. По окружности основания воображаемого конуса, вершина которого —
точка прокола. На диагностическом этапе лапароскопии таким образом
осматривают все 6 секторов брюшной полости (см. главу 8).
2. Вперёд и назад в просвете троакара. Это движение приближает и
удаляет объект от лапароскопа, соответственно меняя его размеры на
экране монитора.
3. Вокруг продольной оси лапароскопа, что важно при использовании
боковой оптики.
Комбинируя движения оптики в трёх направлениях, хирург осматривает
необходимые отделы брюшной полости. Полноценной ревизии помогает также
изменение положения тела больного.
До операции выбирают размеры необходимых троакаров с учётом того,
что диаметр 10 мм оставляет хирургу большую свободу в выборе инструментов.
Рис. 4-21. Диафаноскопия.
66
Рис. 4-22. Ткани брюшной стенки прокалывают в косом направлении.
Перед введением второго и последующих троакаров, пальпируя брюшную стенку
снаружи, выбирают место для пункции. Избегают зоны расположения спаек и
внутренних органов. Для профилактики повреждения сосудов подкожной
жировой клетчатки в точках введения последующих троакаров проводят диафа-
носкопию — брюшную стенку изнутри освещают лапароскопом (рис. 4-21).
Все троакары, кроме первого, вводят в брюшную полость под визуальным
контролем. Ткани брюшной стенки прокалывают в косом направлении к
объекту операции (рис. 4-22). Видеоизображение места пункции брюшины,
перемещая лапароскоп, располагают в верхнем углу монитора. Направление
движения троакара, видимое на мониторе, должно совпадать с диагональю экрана
(рис. 4-23). Это создаёт большую перспективу для движения инструмента в
момент прокола брюшной стенки. Так же, под контролем зрения, вводят эн-
дохирургические инструменты, не перекрещивая их в операционном поле по
ходу операции. Описана техника прямого прокола брюшной стенки
инструментом без использования троакара.
Любые перемещения инструментов (трак-
ция, противотракция) и манипуляции с
ними (захват стенки органа или
освобождение его, пересечение или клипирова-
ние структур) производят строго под
контролем зрения. Так же
устанавливают дренажи, извлекают инструменты и
троакары в конце операции.
Безопасность и потенциальные
возможности эндохирургии были
расширены с появлением 30° лапароскопа. Этот
инструмент позволяет хирургу отчасти
преодолеть ограничения двухмерного
пространства, осматривая объект операции с
разных сторон (рис. 4-24).
Рис. 4-23. Введение второго троакара при
лхэ.
67
Взгляд
справа
налево
Взгляд
слева
направо
Взгляд
сверху вниз
Рис. 4-24. Преимущества косой оптики: А — прямой лапароскоп, В — косой лапароскоп.
Большинство хирургов отдают предпочтение «двуручной» технике, когда
в правой руке держат основной (ножницы, диссектор, аппликатор), а в
левой — вспомогательный (зажим, ретрактор) инструмент. В этом случае камеру
и лапароскоп доверяют ассистенту.
ТЕХНИКА РАССЕЧЕНИЯ. СОЕДИНЕНИЯ ТКАНЕЙ И ГЕМОСТАЗ
Успешное выполнение любой, в том числе и эндохирургической,
операции требует определённой последовательности действий. Основные из них —
экспозиция, тракция, рассечение тканей, гемостаз и соединение тканей.
Экспозиция — создание благоприятного доступа к тканям, позволяющего
выполнять на них те или иные хирургические манипуляции: рассечение,
гемостаз и наложение шва. В открытой хирургии для этого применяют ранорасши-
рители, зеркала, крючки, ретракторы или мануально отводят прилежащие органы
от объекта операции. В эндохирургии экспозицию создают наложением ПП,
изменением положения тела больного, подтягиванием тканей зажимами и
выведением их в поле зрения, которое в отличие от открытой хирургии весьма
ограниченно.
Тракция и противотракция. Препаровка, рассечение, ушивание и гемостаз
в хирургии эффективны и безопасны лишь в том случае, если ткани
фиксированы между двумя точками, растянуты и находятся в неподвижном состоянии.
68
Рис. 4-25. Тракция. Первый вариант.
Рис. 4-26. Тракция. Второй вариант.
Этого достигают созданием тракции и противотракции, т.е. тяги и противотя-
ги. Возможны три варианта.
1. Пересекаемые ткани фиксированы в двух противоположных точках и
натянуты естественным образом (например, плоскостные спайки между
печенью и диафрагмой). Печень под действием силы тяжести прилежит к задней
брюшной стенке (тракция), а диафрагма приподнята вверх за счёт
напряжённого ПП (противотракция). Хирургу остаётся ножницами рассечь натянутые
ткани (рис. 4-25).
2. Пересекаемые ткани фиксированы лишь в одной точке. Для их
рассечения необходимо создать натяжение (например, большой сальник, припаянный
к стенке жёлчного пузыря). Зажим, наложенный на прядь сальника, создаёт
тракцию в каудальном направлении. Жёлчный пузырь и неподвижная печень
обеспечивают противотракцию в
краниальном направлении. Прядь сальника
пересекают электрохирургическим крючком
или диссектором (рис. 4-26).
3. Орган свободно перемещается в
полости, не имея жёсткой фиксации. Для
препаровки ткани необходимо растянуть
между двумя зажимами. Пример — вылу-
щивание серозной параовариальной
кисты яичника на тонкой ножке (рис. 4-27).
Любую хирургическую операцию
можно схематично разделить на три этапа:
— разъединение тканей;
— остановка кровотечения;
— соединение тканей.
Каждый из этих этапов требует
времени, специального материала и инстру-
Рис. 4-27. Тракция. Третий вариант.
69
ментов. Поэтому естественно стремление хирурга объединить несколько
движений в одно, несколько инструментов — в один универсальный инструмент,
позволяющий сократить затраты времени и количество этапов операции. Так
были разработаны сшивающие аппараты, которые позволяют рассечение
сочетать с прошиванием и гемостазом. Так появилась лазерная хирургия, где
вместо наложения скобки и лигатуры производят «сваривание» тканей.
Разъединяют ткани остро (ножницы, эндохирургический скальпель), тупо
(диссектор, тупфер), при помощи высокочастотного (ВЧ) электрического тока
или лазера и сшивающими аппаратами, одновременно прошивающими и
пересекающими ткани.
Гемостаз. Большинство тканей содержит сосуды, кровотечение из
которых в открытой хирургии останавливают прижатием, наложением зажима и
лигатуры. В эндохирургии любое кровотечение проще предотвратить, чем
остановить. Поэтому остро рассекают только ткани, содержащие мелкие сосуды
(брюшина, плоскостные спайки), либо предварительно осуществляют гемостаз
(клипирование, перевязку, коагуляцию).
а. Наиболее простой, популярный и вполне надёжный
эндохирургический способ одновременного рассечения и гемостаза — монополярное
электрохирургическое резание и коагуляция. Электрохирургическими
инструментами, находящимися под напряжением, не следует «размахивать» в полости.
Более того, в момент подачи энергии инструмент должен быть
неподвижен. Ткань, подхваченная L-образным электродом или браншей
диссектора, после подачи тока сама «сползает» с инструмента.
б. Более безопасный, но менее эффективный вариант
электрохирургического воздействия — биполярная коагуляция. Метод позволяет бескровно
пересекать сосуды диаметром до 2 мм. При большем диаметре сосуда
необходимы предварительная перевязка, клипирование или наложение
сшивающего аппарата.
Рис. 4-28. Узел, завязанный
экстракорпорально, опускают в брюшную полость,
фиксируя катетер для холангиографии.
Рис. 4-29. ЛА. На основание червеобразного
отростка накидывают эндопетлю.
70
Соединение тканей производят наложением эндохирургической лигатуры,
ручного или механического ниточного шва, скобок, клипс или сшивающего
аппарата.
а. Эндолигатура служит для перевязки каких-либо структур внутри
брюшной полости. Её применяют в виде нити или заранее сформированной
эндопетли. В первом случае один конец лигатуры опускают в брюшную
полость, обводят вокруг какой-либо структуры, извлекают наружу,
завязывают экстракорпоральный узел и низводят его (рис. 4-28). Во втором
случае эндопетлю накидывают на лигируемое образование и затягивают
петлю (рис. 4-29). Для опускания узла используют специальную палочку
или «вилку».
б. Эндохирургический шов применяют для соединения тканей, перевязки
сосудов и других структур внутри полости. В эндохирургии существует
два способа формирования узла — экстракорпоральный и интракорпо-
ральный.
A) Экстракорпоральный узел формируют снаружи, вне полости
одним из следующих способов:
(а) Узел Рёдера первоначально использовали для выполнения тон-
зиллэктомии у детей, а затем адаптировали к эндохирургии
(рис. 4-30а). Необходима лигатура длиной 70—90 см. Один её {сонец
через троакар зажимом опускают в брюшную полость, проводят
вокруг лигируемой ткани (или прошивают её) и вновь извлекают
наружу. В результате в руках хирурга находятся две нити —
ведущая и ведомая. Первая в процессе завязывания узла неподвижна.
Вторую вращают вокруг первой, формируя узел. Преимущества
узла Рёдера, чрезвычайно популярного у хирургов, — прочность,
Рис. 4-30а. Этапы формирования узла Рёдера.
71
Рис. 4-306. Этапы формирования узла Мелзе.
надёжность, узел перемещается только в одном направлении, не
ослабевает при отпускании нити. Другой вариант
формирования экстракорпорального узла — способ Мелзе (рис. 4-306).
(б) Прямой узел наиболее прост для эндохирур-
га. После прошивания ткани снаружи обычным
перехлёстом одной нити вокруг другой
формируют узел и опускают его в брюшную полость
специальной «вилкой». Для надёжного лигиро-
вания тканей необходимо наложить минимум
3 узла. Второй дотягивает первый, а третий
служит для фиксации (рис. 4-31). Как и в
открытой хирургии, при завязывании узлов
направление нити (правое—левое) чередуют [1].
Общие недостатки экстракорпоральных
узлов — расход шовного материала значительной
длины; нить в момент низведения узла
«продёргивают» вокруг перевязываемой структуры,
что может привести к её «спиливанию»;
необходимая тракция вверх, способная привести к
отрыву ткани. Экстракорпоральный метод
используют при наложении простых швов.
Предпочтение отдают синтетическому, легко
скользящему шовному материалу.
B) Интракорпоральный узел формируют внутри
брюшной полости, используют для соединения
деликатных тканей (например, при ушивании
холедохотомического отверстия, наложении би-
лиодигестивного соустья или восстановлении
Рис. 4-31. Прямой
экстракорпоральный узел.
72
серозного покрова желудка после серомиотомии). Эта методика
экономит шовный материал и бережёт ткани. Интракорпоральная
техника сложнее для хирурга и требует длительного тренинга. Нить
захватывают рядом с иглой и через троакар вводят в брюшную полость
(рис. 4-32). Ткань прошивают и завязывают три узла, каждый раз
меняя ведущую и ведомую нити [2, 3].
Простой узел аналогичен инструментальному узлу в открытой
хирургии. Длина нити составляет 8—15 см. Более короткие или длинные
нити не очень удобны для завязывания (рис. 4-33).
в. Наложение клипс — простой и надёжный способ обеспечения гемостаза
и соединения тканей, требующий соблюдения ряда правил.
1. Клипируемая структура (проток, сосуд, маточная труба) должна
быть на достаточном протяжении мобилизована, т.е. освобождена
от посторонних тканей.
2. Размер клипсы должен соответствовать диаметру клипируемой ткани.
3. Клипсу накладывают перпендикулярно продольной оси протока
или сосуда (рис. 4-34).
4. Клипируемая структура должна быть расположена в средней части
просвета клипсы, где компрессия оптимальна (рис. 4-35).
5. В момент наложения клипсы необходимо контролировать
расположение обеих бранш клипатора.
г. Эндохирургический механический ниточный шов накладывают при
помощи инструмента «Эндостич» (см. рис. 3-24). Специальную иглу с нитью
перемещают между двумя браншами инструмента, имеющими фиксатор
Рис. 4-32. Нить захватывают рядом с иглой
и через троакар вводят в брюшную
полость.
Рис. 4-33. Этапы формирования простого
интракорпорального узла.
73
Правильно
Неправильно
Рис. 4-34. Клипсу накладывают перпендикулярно продольной оси сосуда. А — правильно; Б, В -
неправильно.
для иглы. Челночный принцип её движения позволяет накладывать узловой
или непрерывный шов (например, для ушивания брюшины после
грыжесечения или на этапе формирования «муфты» при фундопликации).
д. Сшивающие аппараты открыли возможность выполнения эндохирурги-
ческих операций с пересечением органов и наложением соустий. Нежный
трёхрядный скрепочный шов не вызывает ишемии и раздавливания
тканей, поэтому не требует дополнительной перитонизации. Инструмент
необходим для выполнения резекции желудка и кишечника, прошивания и
пересечения крупных сосудов в торакоскопической хирургии.
ИЗВЛЕЧЕНИЕ ПРЕПАРАТА
Особенности извлечения удаляемых тканей в эндохирургии.
1. Размеры препарата, как правило, не соответствуют диаметру
троакарного отверстия.
2. Удаляемый орган нередко инфицирован, поэтому его контакт с
покровами грозит развитием гнойных осложнений.
3. Соблюдение принципов абластики при удалении злокачественных
новообразований не допускает «протаскивания» опухоли через ткани покровов.
4. Несоответствие диаметра препарата и троакарного отверстия в момент
извлечения органа может привести к его дегерметизации (разрыву кисты, стенки
жёлчного пузыря). Тогда содержимое изливается в полость. Возможная «утеря»
органа удлиняет операцию, иногда требует выполнения чревосечения.
74
Правильно
Рис. 4-35. Клипируемая структура должна быть расположена в средней части просвета клипс.
А — правильно; Б, В — неправильно.
Приёмы, разработанные для извлечения органов.
1. Расширение раны — наиболее простой, но травматичный способ.
Ткани рассекают с осторожностью, учитывая топографию внутренних органов и
сосудов.
2. Раневые расширители (трёхлепестковый расширитель, переходная гильза
10/20 мм).
3. Задняя кольпотомия предложена не только в лапароскопической
гинекологии, но и для удаления других органов (например, жёлчного пузыря).
4. Контейнер (полиэтиленовый мешочек, резиновая перчатка и т.п.) с
помещённым в него органом подтягивают к брюшной стенке, после чего орган
внутри резервуара измельчают или сразу извлекают окончатым зажимом.
5. Морцеллятор — механическое устройство, похожее на мясорубку,
позволяющее измельчать и подавать наружу ткань паренхиматозных органов [4].
ПЕРЕХОД К ТРАДИЦИОННОЙ ОПЕРАЦИИ
В эндоскопической хирургии термин «конверсия» (переход) означает
отказ от продолжения операции эндохирургическим методом и завершение её
традиционным, открытым способом. Больной должен быть психологически
подготовлен к тому, что при возникновении технических сложностей или
осложнений возможен переход к немедленной лапаротомии. Один из
выдающихся эндохирургов Европы, Жак Периссе, считает, что принятие решения о
конверсии включает три основных вопроса: почему переходить, когда переходить,
как переходить?
75
1. Основные мотивы в принятии решения о переходе — необходимость и
благоразумие.
а. Первое абсолютное показание к конверсии — осложнение, не
устранимое эндохирургически. Это может быть кровотечение или повреждение
полого органа (кишечника, мочеточника, желчевыводящих путей).
Необходимость в переходе может возникнуть на любом этапе операции,
иногда совершенно неожиданно. Поэтому эндохирургическое
вмешательство следует выполнять в тех же условиях, что и традиционную
процедуру, при наличии полного набора инструментов для открытой
хирургии. Второе абсолютное показание к переходу — выход из строя
какой-либо части оборудования во время операции. В эндохирургии
используют сложную и хрупкую технику, требующую постоянного ухода.
Если быстрое устранение неисправности или замена невозможна,
процедуру необходимо прервать. Поэтому хирург в большей степени, чем при
открытых операциях, находится в зависимости от состояния
оборудования. Перед каждой операцией он должен персонально убедиться в том,
что весь комплекс исправен и находится в рабочем состоянии.
б. Переход по благоразумию показан при значительных технических
сложностях, они возникают при выраженных воспалительно-инфильтратив-
ных изменениях в зоне расположения жизненно важных структур,
массивных абсцессах, крупных опухолях. Другая причина — неожиданные
анатомические аномалии. Наиболее частая причина перехода по
благоразумию — недостаток опыта. Каждый врач должен объективно
оценивать своё мастерство и не упорствовать в продолжении видеоскопичес-
кой операции, повышая риск для пациента. КоллК писал: «Меня учили
иметь низкий порог перехода к открытой процедуре и с тех пор я
неоднократно был благодарен за это своим учителям...» (рис. 4-36) [5].
2. Время перехода. Ответ на вопрос о времени перехода зависит от его
причины. Понятно, что серьёзное кровотечение требует немедленной
конверсии на любом этапе операции. В других ситуациях у хирурга есть время на
раздумье. Хирург может обратиться к помощи более опытного коллеги,
который справится с осложнением эндохирургически, либо перейти к открытой
операции и устранить осложнение. Но и в этой ситуации хирург должен
реально оценить свои силы, так как основные причины летальности при ятроген-
ных повреждениях — их поздняя диагностика и выполнение сложных
восстановительных операций врачами, не имеющими должного опыта в
реконструктивной хирургии (повреждение мочеточника или ОЖП). В этих
случаях к месту повреждения подводят дренаж, операцию прекращают, а
пациента срочно транспортируют в специализированный центр.
Сложнее определить время перехода, когда причина конверсии —
благоразумие. Многое зависит от опыта хирурга. По мнению Жака Периссе, если эндо-
хирургическая операция не развивается в течение 30 мин, показан переход.
3. В большинстве случаев при переходе от лапароскопической операции к
открытой можно выполнить чревосечение менее травматично, небольшим
разрезом в зоне операции (например, для извлечения препарата после сплен-
эктомии). Минимальный разрез позволяет сохранить преимущества эндохи-
рургического доступа.
76
Рис. 4-36. «Меня учили
иметь низкий порог
перехода...».
Конверсия может иметь различные последствия
для пациента. Если переход произошёл в первые 30
мин, операция мало отличается от «открытой». Если
переход по благоразумию выполняют поздно,
значительно возрастают общая продолжительность
вмешательства и опасность для больного. Последствия будут ещё
серьёзнее, если конверсия обусловлена
необходимостью устранить возникшие осложнения. В нескольких
исследованиях на примере ЛХЭ и фундопликации было
показано, что по количеству осложнений и
летальности результат лапароскопической операции с
последующей конверсией хуже результатов аналогичной
операции, выполняемой с самого начала открытым
способом.
Основной способ снижения частоты переходов к
открытой операции — тщательный отбор больных,
особенно на этапе освоения методики. Конверсия
позволяет хирургу плавно перейти от открытых операций к
эндоскопической хирургии. По мере накопления опыта и повышения
квалификации хирурга частота переходов становится меньше. С другой стороны,
конверсия — неизбежный и естественный компонент эндоскопической
хирургии, поэтому её частота никогда не станет равна нулю [6, 7].
Необходимая критическая оценка любых новых методов диагностики и
лечения возможна лишь при использовании определённых критериев. Наиболее
информативны для оценки результатов чувствительность, специфичность и
общая точность, детально описанные в работе Г.Г. Кармазановского.
Чувствительность — способность выявлять заболевание. Она отражает
отношение правильных заключений к общему числу окончательных диагнозов
в этой группе больных.
Специфичность — способность метода исключать заболевание,
констатировать его отсутствие там, где его действительно нет.
Общая точность — отношение количества достоверно положительных и
достоверно отрицательных заключений к общему числу окончательных
диагнозов [8].
77
5
Высокочастотная электроэнергия
в эндохирургии
Одним из вьщающихся достижений столетия стало использование в
медицине высокочастотной электрохирургии (ВЧЭХ), применяемой для резания и
коагуляции тканей [1, 2]. Эта методика даёт следующие преимущества:
а. Рассечение и гемостаз осуществляют одним движением
инструмента. Последующая коагуляция сосудов не требует его замены.
б. Исчезает потребность в использовании и оставлении в тканях
инородного тела — шовного материала или металлических скобок.
в. Высокая температура отвечает требованием асептики и абластики.
г. Существенно выигрывают время.
д. Уменьшают кровопотерю.
е. Достигают обезболивающего и косметического эффекта.
ж. Посттравматическое воспаление тканей бывает меньше.
з. Используют простые и недорогие инструменты.
Однако мировой опыт, накопленный в последние десятилетия, показал,
что электрохирургия (ЭХ) — надёжный друг и помощник врача — может быть
источником осложнений и даже смертельных исходов при её неправильном
использовании. К нежелательным эффектам относят как ожоги тканей, так и
поражение электрическим током. При этом может пострадать и врач, и больной.
Значимость ВЧЭХ возросла с появлением эндоскопической хирургии, где
она — практически основной способ рассечения тканей и обеспечения
гемостаза. Именно в эндохирургии непонимание специфики ВЧ-энергии чревато
тяжелейшими осложнениями, что и доказало последнее десятилетие.
Всех этих последствий можно избежать при знании законов физики. Не
менее важный вопрос — особенности устройства и работы современных
электрохирургических приборов и инструментов.
Ещё в 1992 г. Рэндл Войлз писал: «В хирургии, вероятно, нет другой такой
области, которую бы так широко использовали и в то же время так мало
понимали, как электрическая энергия» [3].
ФИЗИКА ЭЛЕКТРОХИРУРГИИ
Все тканевые эффекты ЭХ обусловлены преобразованием электрической
энергии в тепловую. Это происходит благодаря прохождению заряженных
частиц через срез ткани. При этом заряды встречают сопротивление, происходит
выделение теплоты (рис. 5-1).
79
г
Силу, посылающую электроны через ткани,
называют напряжением и измеряют в вольтах. Эту
электродвижущую силу создаёт работа прибора, называемого
электрохирургическим генератором (ЭХГ). Основное
назначение ЭХГ — выработка тока определённой формы и
частоты.
Направление электрического тока, применяемого
в бытовых условиях, меняется с частотой 50 колебаний
в секунду. Такой ток называют низкочастотным (НЧ),
его не используют в хирургии, так как он вызывает ней-
ромышечную стимуляцию, судороги, а при большом
напряжении и электрошок. Частоту тока измеряют
герцах (Гц). Если направление тока меняется один раз
в секунду, его частота составляет 1 Гц, 1000 изменений
в секунду — 1 килогерц (КГц), 1000000 циклов в
секунду — 1 мегагерц (МГц). Именно в этом диапазоне
частот работают радиоприёмники и радиопередатчики.
По этой причине ВЧЭХ иногда называют
радиохирургией (рис. 5-2).
Во время операции случайное прикосновение
электрода хирурга к другим металлическим инструментам
приводит к образованию НЧ потоков. Этот эффект
называют демодуляцией. Она вызывает нейромышечные сокращения, способные
привести к повреждению тканей.
Мощность — энергия, выделяемая ЭХГ в единицу времени в зоне
электрод—ткань, как, впрочем, и во всех других точках электрической цепи.
Мощность измеряют в ваттах (Вт). Она зависит от силы тока и напряжения и
определяется как их произведение.
Рис. 5-1. Теплота выде-
* ляется при
прохождении электрических
зарядов через срез
ткани.
50 Гц
100 кГц
Бытовые
электроприборы
Мышечная и
нервная
стимуляция
Электрохирургия
550-1550 кГц 54-880 МГц
Радио
TV
Рис. 5-2. Частота тока и диапазон его применения.
80
Под силой тока понимают
количество заряженных частиц,
прошедших через поперечное сечение
проводника за единицу времени.
Сопротивление — это препятствие
для прохождения электрического
тока, измеряемое в омах (Ом).
Важное понятие — плотность
потока заряженных частиц, прямо
пропорциональная силе тока И об- Рис 5_3 образование ёмкостного индуцирован-
ратно пропорциональная квадрату ного тока в металлическом троакаре,
площади проводника.
Таким образом, наибольшая плотность потока, а следовательно, и
максимальное выделение энергии наблюдают в части электрической цепи,
имеющей наименьший диаметр.
Увеличения плотности можно добиться повышением мощности или
уменьшением площади ткани. Не только площадь поперечного сечения влияет на
выделяемую мощность, но и сопротивление тканей (R) в данном участке цепи.
При минимальном сопротивлении проводника мощность тока, выделяем
мая при его прохождении, также минимальна. При возрастании
сопротивления на конкретном участке цепи резко увеличивается выделяемая мощность.
Типичным примером может служить обушная электрическая лампочка с
нитью накаливания, имеющей малый диаметр и большое сопротивление.
Электрический ток выделяет максимальную энергию в участке
электрической цепи с наибольшим сопротивлением и наименьшим диаметром проводника.
Чрезвычайно важное понятие — ёмкостный эффект, или эффект
конденсатора. При этом электрическая энергия передаётся от одного проводника к
другому без непосредственного контакта за счёт электромагнитной индукции.
Это особенно важно в эндохирургии, где электрический ток в электроде,
покрытом изоляцией, индуцирует образование тока в металлическом трубчатом
троакаре (рис. 5-3). Вместе они представляют ёмкость. Энергия, способная
накопиться на конденсаторе и выделиться на поверхности ткани,
пропорциональна величине ёмкости.
При работе с генератором во время операции хирург, как правило, может
управлять только мощностью, меняя выходное напряжение в диапазоне от 1 до
10 условных единиц шкалы лицевой панели прибора, а также моделировать
своё воздействие — резание, коагуляцию или их сочетание (смешанный режим).
В современных ЭХГ с обратной связью при возрастании сопротивления
тканей {например, при высушивании тканей в процессе коагуляции) не
происходит опасного увеличения мощности. При большом сопротивлении падает
выходное напряжение генератора, поэтому энергия, выделяемая в тканях, не меняется.
ВИДЫ ЭЛЕКТРОХИРУРГИИ
Различают монополярную и биполярную ЭХ. При монополярной ЭХ всё
тело пациента представляет проводник. Электрический ток проходит через него от
электрода хирурга к электроду пациента (рис. 5-4). Ранее их называли активным и
81
Рис. 5-4. Монополярная электрохирургия. Всё тело становится проводником электрического тока.
Рис. 5-5. Биполярная
электрохирургия. Ток проходит через
небольшую порцию ткани, зажатую
между браншами инструмента.
пассивным (возвратным) электродами соответственно. Однако мы имеем дело
с переменным током, где нет постоянного движения заряженных частиц от
одного полюса к другому, а происходят их быстрые колебания. Электроды
хирурга и пациента различают между собой по размеру, площади
соприкосновения с тканями и относительной проводимости. Кроме того, сам термин
«пассивный электрод» провоцирует недостаточное внимание медиков к этой
пластине, способной стать источником серьёзных осложнений.
Монополярная ЭХ — наиболее распространённый способ рассечения
тканей и обеспечения гемостаза как при открытых, так и при лапароскопических
вмешательствах. Достаточно проста и удобна. Семьдесят лет применения
показали её безопасность и эффективность в хирургической практике. Её
используют как для рассечения (резания), так и для коагуляции тканей [3].
При биполярной ЭХ генератор соединён с двумя активными электродами,
смонтированными в одном инструменте. Ток проходит лишь через небольшую
порцию ткани, зажатую между браншами биполярного инструмента (рис. 5-5).
Биполярная ЭХ менее универсальна, требует более сложных электродов, но
безопаснее, так как воздействует на ткани локально [4]. Работают только в
режиме коагуляции. Пластину пациента не применяют. Использование
биполярной ЭХ ограничено отсутствием режима резания, выжигания поверхности
и скоплением нагара на рабочей части инструмента.
82
Электрическая цепь
Необходимое условие ВЧЭХ — создание электрической цепи, по которой
идёт ток, производя резание или коагуляцию. Компоненты цепи различны при
использовании монополярной и биполярной ЭХ.
В первом случае полная цепь состоит из ЭХГ, подающего напряжение
электрода хирурга, электрода пациента и кабелей, соединяющих их с
генератором. Во втором случае оба электрода являются активными и соединяются с
ЭХГ. Когда активный электрод прикасается к тканям, цепь оказывается
замкнутой. При этом его обозначают как электрод под нагрузкой.
Ток всегда идёт по пути наименьшего сопротивления от одного электрода к
другому.
При равнозначном сопротивлении тканей ток всегда выбирает кратчайший путь.
Незамкнутая, но находящаяся под напряжением цепь может быть
причиной осложнений, особенно в эндохирургии.
МЕХАНИЗМ ЭЛЕКТРОХИРУРГИЧЕСКОГО ВОЗДЕЙСТВИЯ НА ТКАНИ
Прохождение ВЧ-тока через ткани приводит к выделению тепловой энергии.
Выделение тепла происходит на участке электрической цепи, имеющей
наименьший диаметр, следовательно, наибольшую плотность тока. При этом
действует тот же закон, что и при включении электрической лампочки. Тонкая
вольфрамовая нить накаливания разогревается и выделяет световую энергию
(рис. 5-6). В ЭХ это происходит на участке цепи, имеющем меньший диаметр
и большее сопротивление, т.е. в месте прикосновения электрода хирурга к
тканям. Тепло не выделяется в зоне пластины пациента, так как большая величина её
площади обусловливает рассеивание и низкую плотность энергии (рис. 5-7).
Рис. 5-6. Тонкая вольфрамовая нить
накаливания разогревается и выделяет световую
энергию.
Рис. 5-7. Энергия рассеивается на большой
площади пластины пациента.
83
Чем меньше диаметр электрода, тем быстрее он нагревает прилегающие к
электроду ткани вследствие меньшего их объёма. Поэтому резание наиболее
эффективно и наименее травматично при использовании игольчатых электродов.
Существует три вида электрохирургического воздействия на ткани:
резание и два вида коагуляции — фульгурация и десиккация.
Для резания и коагуляции используют различные формы электрического
тока. В режиме резания подают непрерывный переменный ток с низким
напряжением (рис. 5-8). Детали механизма резания до конца не поняты. Вероятно,
под воздействием тока происходит непрерывное движение ионов внутри
клетки, что приводит к резкому повышению температуры и выпариванию
внутриклеточной жидкости. Происходит взрыв, объём клетки мгновенно возрастает,
её оболочка лопается, ткани разрушаются. Мы воспринимаем этот процесс как
резание (рис. 5-9). Освобождённые газы расеивают теплоту, что предупреждает
перегревание более глубоких слоев тканей. Поэтому ткани рассекаются с
небольшой боковой температурной передачей и минимальной зоной некроза. Струп
раневой поверхности при этом ничтожен. Из-за поверхостной коагуляции ге-
мостатический эффект в этом режиме выражен незначительно.
Рис. 5-8. Форма волны в режиме «резание»
Рис. 5-9. Выпаривание клеток при резании.
84
Совершенно иную форму электрического тока используют в режиме
коагуляции. Это импульсный переменный ток с высоким напряжением (рис. 5-10).
Наблюдают всплеск электрической активности с последующим постепенным
затуханием синусоидальной волны. ЭХГ подаёт напряжение только в течение
6% времени. В промежутке прибор не производит энергию, ткани остывают.
Нагревание тканей происходит не так быстро, как при резании. Короткий
всплеск высокого напряжения приводит к деваскуляризации ткани, но не к
выпариванию, как в случае резания. Во время паузы происходит высушивание
клеток (рис. 5-11). К моменту следующего электрического пика «сухие клетки»
обладают возросшим сопротивлением, приводящим к большему рассеиванию
теплоты и дальнейшему, более глубокому высушиванию ткани. Это
обеспечивает минимальное рассечение с максимальным проникновением энергии в
глубину тканей, денатурацией белка и образованием тромбов в сосудах. Так ЭХГ
реализует коагуляцию и гемостаз. По мере высушивания ткани её
сопротивление возрастает до тех пор, пока поток практически не прекратится. Этого
эффекта достигают при непосредственном касании электродом тканей. Участок
поражения невелик по площади, но значителен по глубине, что может нести
потенциальную опасность в зоне расположения жизненно важных структур
(например, в треугольнике Кало).
Рис. 5-10. Форма волны в режиме «коагуляция»
Рис. 5-11. Высушивание клеток при коагуляции.
85
Одна из разновидностей электрического сигнала обеспечивает
бесконтактную SPRAY-коагуляцию, или фулъгурацию. При этом электрод не контактирует
с тканями. Энергия рассыпается в виде пучка искр по поверхности ткани,
глубина поражения минимальна (рис. 5-12). Происходит поверхностное местное
воздействие, так как энергия быстро рассеивается. Это удобно для остановки
неглубокого диффузного кровотечения. Глубину воздействия можно изменить,
увеличив мощность ЭХГ, однако при этом возрастают «шальные токи»
ёмкостного эффекта и недостаточной изоляции, что особенно опасно в эндохирургии.
Для достижения одновременного резания и коагуляции используют
смешанный режим (рис. 5-13). Смешанные потоки формируют при напряжении,
большем, чем при режиме резания, но меньшем, чем при режиме коагуляции.
Смешанный режим обеспечивает высушивание прилежащих тканей
(коагуляцию) с одновременным резанием. Современные ЭХГ имеют несколько
смешанных режимов с различным соотношением обоих эффектов.
Единственная изменяемая величина, обусловливающая разделение
функции разных волн (одна волна режет, а другая коагулирует ткань), — количество
производимого тепла. Большая теплота, выделившаяся быстро, даёт резание,
т.е. выпаривание тканей. Небольшая теплота, выделившаяся медленно, даёт
коагуляцию, т.е. высушивание.
В биполярных системах работают только в режиме коагуляции. Ткань,
расположенную между электродами, обезвоживают по мере повышения
температуры. Используют постоянное низкое напряжение. Несмотря на локальное
воздействие, в биполярной ЭХ также происходит боковое распространение тепла,
обусловленное теплопроводностью тканей. Температура, достаточная для
возникновения некроза тканей, может быть зарегистрирована на расстоянии до 2 см
от точки коагуляции.
\Ч
Рис. 5-12. Фульгурация.
Рис. 5-13. Форма волны при «смешанном» режиме.
86
ИНСТРУМЕНТЫ, ОБОРУДОВАНИЕ И ПРАВИЛА ВОЗДЕЙСТВИЯ
Электрохирургический генератор
Генератором называют устройство, вырабатывающее электрические
колебания определённой формы. Форму волны определяет изменение напряжения
электрического тока во времени. ЭХГ — источник потока электронов и
напряжения. Основное его назначение — выработка тока определённой формы и
частоты.
Генератор состоит из современных микросхем с транзисторами и условно
может быть разделён на 4 узла: схема автоматики, плата блока питания,
усилитель мощности, плата управления и индикации.
Спектр аппаратов для ЭХ весьма значителен. Одни предназначены для
универсального применения, другие — для выполнения конкретных операций
в отдельных областях хирургии. Номинальная мощность ЭХГ определяется его
назначением. В целях безопасности она ограничена международным
стандартом величиной 300 Вт. По этой же причине применять мощный генератор для
небольших воздействий нецелесообразно. В настоящее время большинство ЭХГ
для полостной хирургии универсально, т.е. их применяют как для открытых,
так и для эндохирургических вмешательств. Для этого используют
специальные переходные разъёмы.
Включение генератора производят педалью или кнопкой, расположенной
на электродержателе. Выбор способа управления не имеет принципиального
значения и зависит от вкуса хирурга. Режимы резания и коагуляции включают
раздельно сдвоенной педалью или кнопкой.
Интенсивность воздействия, а в действительности — выходную мощность
и напряжение, регулируют при помощи кнопок или ручек, расположенных на
передней панели ЭХГ.
Электроды хирурга для эндоскопической хирургии
Электроды хирурга называют также активными, наконечниками Боуви,
карандашами; их делят по форме на лезвийные, шариковые и игольчатые
электроды. Различают электроды для монополярной и биполярной ЭХ.
Качество работы электрода во многом зависит от вида металла, покрытия
и качества обработки его поверхности. Оптимальны инструменты из
нержавеющей стали. Шероховатости, неровности, зазубрины затрудняют работу
хирурга из-за быстрого появления нагара. При этом резко возрастает сопротивление
в месте контакта тканей с инструментом, что ухудшает резание и коагуляцию.
Очистку электрода нежелательно производить скальпелем или другим
металлическим предметом, так как на инструменте возникают царапины.
Эндоскопическая хирургия имеет свои особенности как в технике
оперирования, так и в инструментальном обеспечении. Используют традиционный
ЭХГ, обычную пластину пациента и совсем иные электроды хирурга. Эти
инструменты имеют следующие особенности:
87
а. Большая длина.
б. Надёжная изоляция от троакара, через который инструмент вводят
в брюшную полость.
в. Повышенные требования к их безопасности.
г. Инструменты с подвижным рабочим концом (ножницы,
диссектор) имеют более сложное устройство, чем пинцет и зажим в открытой
хирургии.
К сожалению, ни один из современных способов изоляции, включая
керамическое покрытие, не гарантирует полной безопасности. Повреждение
изоляции может произойти во время стерилизации, во время прохождения
инструмента через клапан троакара, вследствие электрических пробоев.
Электроды пациента
Электроды пациента называют также пассивными, возвратными или
рассеивающими электродами, а также платами пациента, заземляющими
подушками или подушками Боуви.
Электрод пациента представляет электропроводную пластину для
электрического соединения ЭХГ с участком тела пациента (рис. 5-14). Для
предотвращения нагревания тканей в месте контакта необходимо получить
наименьшую плотность тока в этой зоне. Достигнуть этого можно, увеличив площадь
соприкосновения и максимально снизив переходное сопротивление. Поэтому
пластина в отличие от электрода хирурга имеет значительную площадь
контакта с телом пациента (не менее 100 см2). При этом электрический поток
рассеивается в области пластины, предотвращая перегревание тканей. В процессе
работы допустимо повышение температуры пластины не более чем на 6 °С. Для
Рис. 5-14. Электрод пациента.
88
обеспечения хорошего контакта на границе кожа—пластина ранее применяли
марлевые прокладки, смоченные специальной жидкостью с высокой
электропроводностью (например, физиологическим раствором). Однако эта жидкость
по ходу операции под действием тепла может высохнуть, переходное
сопротивление — возрасти. В результате выделяемая мощность может привести к ожогу.
В последние годы для обеспечения хорошего контакта чаще используют
электропроводящий гель или же липкие REM-электроды, автоматически
контролирующие качество контакта.
Правильная установка пластины пациента обеспечивает оптимальное
резание и коагуляцию при небольшой мощности ЭХГ, позволяет предупредить
ожог тканей. Это особенно важно понимать с учётом того, что кожа и
подкожная жировая клетчатка — плохо кровоснабжаемые ткани, соответственно,
имеющие большое сопротивление в отличие, например, от обильно васкуляризи-
рованных мышц и внутренних органов.
С точки зрения безопасности, важный момент — целостность цепи
пациента, соединённой с заземлённым гнездом ЭХГ. Два условия ухудшают
качество этой цепи:
а. Уменьшение площади контакта между кожей больного и
электродом пациента (например, при изменении положения тела).
б. Отсутствие проводимости между кожей и поверхностью электрода
(например, при подсыхании марлевой салфетки или затекании между ними
жидкости, плохо проводящей электрический ток).
Потеря поверхностного контакта и хорошей проводимости приводит к
опасной концентрации тока, повышению температуры и возможному ожогу
тканей (рис. 5-15).
Качество проводимости и
контакт в области прилегания
пластины к коже пациента должны быть
безупречны.
Ожоги в области пассивного
электрода всегда происходят по вине
медицинского персонала.
В настоящее время используют
автоматический контроль
непрерывности цепи пациента. Кабель
состоит из двух проводов, каждый из
которых соединяют с пластиной
независимо. При нарушении
целостности цепи пациента срабатывает
система блокировки, слышен звуковой
сигнал, работа генератора
прекращается. Следует помнить, что 70%
ожогов от ВЧЭХ исторически
наблюдалось В зоне расположения электро- Рис 5-15. Уменьшение площади контакта пластины
да пациента. с поверхностью кожи приводит к опасной
концентрации тока и возможному ожогу тканей.
89
Существует формула, характеризующая глубину и тяжесть ожога
тканей в ЭХ:
ТЯЖЕСТЬ ОЖОГА =
ТЕПЛО х ВРЕМЯ
ПЛОЩАДЬ
ПРАВИЛА ПОЛЬЗОВАНИЯ
ЭЛЕКТРОХИРУРГИЧЕСКИМ ОБОРУДОВАНИЕМ
На любом этапе работы с электрохирургическим оборудованием
необходимо понимать, что это достаточно сложный технический комплекс, несущий
потенциальные проблемы для хирурга и пациента при его неправильной
эксплуатации.
Как заявила в 1984 г. Американская Ассоциация Операционных сестёр,
«электрохирургическое оборудование более опасно для пациентов, чем любая
другая электрическая медицинская техника в операционной» [5].
Со временем надёжность отдельных узлов генератора и компонентов цепи
может снижаться, что, естественно, влияет на безопасность. Обязателен
ежегодный, ежемесячный и предоперационный контроль, описанный в
прилагаемых инструкциях.
Прибор и инструменты должны быть проверены до появления больного в
операционной. Особое внимание уделяют целостности электродов и кабелей.
Недопустимо использование инструментов с повреждённой изоляцией или
надломленными проводами. Это же касается и целостности стыков, например
между инструментом и кабелем или кабелем и гнездом ЭХГ.
Кабели, идущие от обоих электродов, не должны касаться тела пациента
или операционного стола. Недопустимо их свёртывание в виде петель или
наматывание на цапку в виде спирали (рис. 5-16). Это может индуцировать
«шальные» токи в металлическом инструменте и приводить к ожогу кожи.
Состояние самого генератора должен проконтролировать оперирующий
хирург, как и готовность сигнализирующих и блокирующих систем. Недопустима
проверка аппарата, уже подключённого к пациенту, как и использование
неисправного прибора или инструментов.
Мощность на передней панели
ЭХГ устанавливают
заблаговременно, ориентируясь на
предшествующий опыт. Следует применять
минимальную мощность, достаточную
для получения необходимого
результата. Это безопаснее и уменьшает
износ техники.
Подготовка пациента
В первую очередь необходимо
Рис. 5-16. Недопустимо свёртывание кабелей ВЫЯСНИТЬ, нет ЛИ В теле больного ме-
электродов в виде петель или наматывание на таллических предметов, способных
цапку в виде спирали. стать нежелательной и опасной точ-
90
кой концентрации электрической энергии в ходе вмешательства:
металлических скобок и скрепок, осколков, штифтов, имплантированных
кардиостимуляторов и датчиков, вообще любых электропроводящих предметов. Это важно
для выбора места расположения электрода пациента. В этом случае принимают
решение об использовании только биполярного режима либо отказываются от
применения ЭХ у данного больного.
Особенно опасно применение ЭХ у пациента с кардиостимулятором, так
как это может привести к нарушению сердечного ритма. Этой категории
больных ЭХ не противопоказана, однако работать необходимо на малой мощности
и в дискретном, предпочтительно биполярном, режиме.
Необходимо снять с пациента любые металлические предметы и
украшения (серёжки, цепочки, кулоны, кольца), так как они могут стать источником
концентрации тока на коже и вызвать её ожог.
В месте предполагаемого расположения электрода пациента сбривают
волосы.
Операционный стол
Любой операционный стол согласно требованиям техники безопасности
должен быть заземлён. Контакт тела пациента с металлическим столом
недопустим. Поэтому для изоляции больного используют толстые, обычно
резиновые, прокладки из электроизоляционного материала. Плёнку и перевязочный
материал не применяют, так как при минимальном увлажнении они
становятся электропроводящими. Эти изолирующие прокладки на 15 см минимум
должны перекрывать по периметру изолируемые поверхности. Кожа пациента
должна быть сухой.
Наложение электрода пациента
Основные требования — правильный выбор места наложения электрода и
гарантия его надёжного контакта с телом пациента. И то и другое должен дважды
проконтролировать оперирующий хирург. Небрежность или неудачное
расположение электрода относительно зоны операции чревато возникновением ожогов.
В предполагаемом месте расположения электрода должно быть хорошее
кровоснабжение, дабы обеспечить лучшую электропроводность. Поэтому
электроды не располагают в области суставов, поверхостно расположенных костей
скелета, на участках кожи с грубыми рубцами.
Электрод помещают как можно ближе к зоне электрохирургического
воздействия. При операциях на органах брюшной полости электрод располагают
под ягодицами или на бедре. При торакоскопических вмешательствах его
целесообразнее разместить под лопатками или на плече.
Электрод должен быть надёжно фиксирован и плотно прилегать к коже
всей своей поверхностью. Плотность соприкосновения обеспечивает либо
тяжесть тела, либо фиксирующая повязка. Его смещение при перемене
положения тела больного может быть опасно.
ЭХ и дополнительные устройства
К сожалению, предполагаемая вами электрохирургическая цепь — не
единственный возможный путь для тока. Любая проводящая поверхность,
касающаяся пациента и ведущая к заземлению (включая ЭКГ-электроды,
металлические дуги на операционном столе, анестезиолога, сидящего на металлическом
91
стуле), может замкнуть цепь на «землю», т.е. возможно разделение тока по
цепи к электроду пациента и по альтернативной цепи к другим металлическим
предметам, касающимся тела больного. Всё это увеличивает опасность ожога,
так как ток всегда идёт по цепи с наименьшим сопротивлением и любой
заземлённый объект может замкнуть цепь. Типичным примером может служить
аномальная цепь, замкнутая через ЭКГ-электрод. Он обеспечивает путь к «земле»
с наименьшим сопротивлением, однако из-за малой площади не рассеивает
ток в достаточной степени, не обеспечивая соблюдения принципа
безопасности. Высокая концентрация тока под ЭКГ-электродом ведёт к выделению
теплоты и ожогу в альтернативной точке.
Хотя мы и говорим, что тело больного заземлено через электрод пациента,
в реальной жизни часто возникает необходимость применения
диагностических и других устройств, имеющих самостоятельное заземление (например,
следящей аппаратуры).
Для предупреждения ожогов эти электропроводящие устройства (ЭУ)
следует располагать как можно дальше от операционного поля и электродов с тем,
чтобы электрическая дуга проходила в отдалении от них. Более опасна
близость ЭУ к электроду хирурга, чем к электроду пациента. Наиболее
благоприятна ситуация, когда ЭУ и электрод хирурга расположены по разные стороны
от электрода пациента.
Стратегическое значение имеет площадь соприкосновения ЭУ с телом
пациента. Чем она больше и чем лучше контакт, тем ситуация безопаснее.
Поэтому применение игольчатых электродов, например от
электрокардиографа, нежелательно.
По мнению С.Я. Долецкого и соавт., всегда следует руководствоваться
принципом: «если нельзя изолировать тело пациента от электропроводящих
предметов, лучше обеспечить хороший надёжный контакт между этим предметом и
телом. Самое опасное — наличие плохого электрического контакта и
недостаточной поверхности его прилегания к телу» [1].
ОСЛОЖНЕНИЯ ВЧЭХ
И ИХ ПРОФИЛАКТИКА
Основным недостатком ВЧЭХ признаны возможные осложнения и
опасности, возникающие при её использовании. Во многом это зависит от
грамотности медицинского персонала, а также от совершенства приборов и
инструментов, используемых в операционной.
Именно в ЭХ большая ответственность ложится на разработчиков,
конструкторов и производителей оборудования. Полная безопасность пациента должна
быть предусмотрена и обеспечена даже при неправильных действиях
медицинского персонала.
Американская Ассоциация врачебного страхования (PIAA) утверждает, что
подавляющее большинство повреждений не распознают по ходу лапароскопии.
Это приводит к задержке в лечении. Число осложнений ВЧЭХ увеличивается с
возрастанием сложности вмешательств. По их мнению, образование —
единственный путь снижения частоты осложнений в эндохирургии [5].
92
Истинная частота электрохирургических осложнений в мировой практике
неизвестна, потому что врачи, как и столетия тому назад, не склонны
афишировать свои неудачи.
Поражение током низкой частоты
НЧ-поражения делят на электротравмы и электроудары. К
электротравмам относят ситуации с нарушением целостности тканей в виде ожогов,
«знаков тока» и др. Электрический удар — возбуждение живых тканей проходящим
через них током, приводящее к судорожным сокращениям мышц. Прямым
следствием такого удара может быть нарушение жизненно важных функций —
кровообращения и дыхания. Прохождение слабого НЧ-тока через тело
пациента вызывает стимуляцию мышц. Такое явление также принято считать
электрическим ударом. Прохождение даже слабого НЧ-тока через сердце может
привести к его фибрилляции.
Одна из возможных причин поражения НЧ-током — неисправность ЭХГ и
других приборов и аппаратов, подключённых к пациенту в процессе операции.
Другая причина поражения НЧ-током — демодуляция ВЧ-энергии,
возникающая при контакте электрода хирурга с металлическими предметами
(например, другими инструментами, ранорасширителями, троакарами). Искра,
проскакивающая между двумя металлическими поверхностями, оказывает
выпрямляющее действие на ВЧ-ток. Клинически это проявляется сокращением
мышц тела.
Приводим случай демодуляции, приведшей к ранению левой
подвздошной артерии.
Больная М. была оперирована в отделении гинекологии по поводу
вторичного бесплодия, спаечного процесса в полости малого таза.
Лапароскопический адгезиолизис потребовал препаровки тканей в зоне
расположения левых подвздошных сосудов. Рассечение спаек и освобождение
от сращений маточных труб производили при помощи
электрохирургической техники с использованием L-образного электрода. Для разведения
тканей использовали дополнительный неизолированный металлический
инструмент — зажим «полуволна». После рассечения одной из спаек
электрод, находящийся под напряжением, коснулся металлического зажима.
Произошли демодуляция и выраженное сокращение мышц пациентки.
Смещение тела больной привело к тому, что L-образный электрод, по-
прежнему находящийся под напряжением, рассёк переднюю стенку левой
подвздошной артерии.
Лапаротомия. Временный гемостаз прижатием. Окончательный
гемостаз (сосудистый шов) при участии сосудистого хирурга. Выздоровление.
Ожоги тканей
Ожог тканей — наиболее распространённое осложнение ВЧЭХ.
Существует четыре механизма развития этого осложнения:
а. Ожог при непосредственной активной работе с тканями
электродом, находящимся под напряжением, т.е. когда хирург воздействует на
посторонние ткани, оказавшиеся в операционном поле.
93
б. Ожог тканей электродом, находящимся под напряжением, но в
момент прекращения электрохирургического воздействия, т.е. когда
хирург забыл отпустить педаль. Ситуация парадоксальная, но
встречающаяся, к сожалению, часто.
в. Ожог в области расположения электрода пациента.
г. Ожог как результат остаточного термического воздействия
электрода на ткани после прекращения его активации.
Нагревание тканей до 45 °С не оказываем серьёзного повреждающего
действия. При температуре 45—70 °С степень деструкции зависит от длительности
воздействия. При температуре 70-100 °С происходят денатурация белка и
гибель клеток, при 100 °С испаряется внутриклеточная жидкость. Наконец, при
200 °С и выше клетки распадаются на неорганические вещества.
Электрохирургическое воздействие происходит при температуре 100 °С и выше (табл. 5-1) [6].
Таблица 5-1
Воздействие температуры на ткани
Температура, °С
Эффект Видимый
Поздний
Механизм
34-44
Нет
Отёк
Вазоди-
латация
и
воспаление
44-50
Нет
Некроз
Нарушение
клеточного
метаболизма
50-80
Побеле-
ние
Отторжение нек-
ротическ
их масс
Денатурация
коллагена
80-100
Сжатие
Отторжение нек-
ротическ
их масс
Обезвоживание
100-200
Обвари-
вание
Образование
язвы
Выпари
вание
>200
Обугливание
Большая
язва
Ожог
углеводородов
тканей
Туннелирование тока
Ток идёт по пути наименьшего сопротивления. Предпочтительное
направление включает насыщенные сосудами органы, сами сосуды, различные
протоки и кишечник. Такие структуры могут увеличивать плотность энергии путём
туннелирования тока.
В этих случаях возникают аномальные пути движения тока, в том числе
по трубчатым структурам малого диаметра, где и выделяется энергия.
Аналогичный механизм повреждения описан при развитии поздних
стриктур ОЖП, когда неосторожную препаровку тканей в зоне треугольника Кало
производили электрохирургически.
94
ОСОБЕННОСТИ ЭЛЕКТРОХИРУРГИИ В ЛАПАРОСКОПИИ
Новая эпоха предъявила особые требования к таким традиционным
хирургическим процедурам, как рассечение и соединение тканей, остановка
кровотечения.
Общеизвестная цепочка скальпель—зажим—лигатура малоэффективна в
эндохирургии, где прошивание и перевязка сосудов достаточно сложны,
дороги и отнимают много времени.
Без ЭХ были бы немыслимы все преимущества лапароскопической
технологии: косметический эффект и малая травматичность, сокращение
госпитального периода и сроков утраты трудоспособности, снижение частоты и тяжести
осложнений.
Именно с развитием лапароскопии ЭХ обрела второе дыхание как
незаменимый метод рассечения тканей и обеспечения гемостаза. С другой стороны,
ВЧ-энергия в лапароскопии имеет свои особенности и потенциальные
проблемы, не существующие в открытой хирургии [7]. Большинство хирургов с
трудом понимают и верят в реальность этих проблем до тех пор, пока не
возникнут тяжёлые осложнения.
По данным опроса, проведённого в октябре 1993 г. на заседании
Американской Коллегии Хирургов, 18% врачей заявили, что они на личном опыте
столкнулись с электрохирургическими ожогами в лапароскопии; а ещё 54%
сообщили, что знают хирурга, у которого произошли осложнения вследствие
«шальной» энергии вне поля зрения лапароскопа. У гинекологов было больше
несчастных случаев, чем у врачей других специальностей [8]. Так, в госпитале
Джонса Хопкинса на 3600 лапароскопических стерилизаций наблюдали 11
повреждений органов ЖКТ, 10 из которых были связаны с электрохирургическим
поражением [9].
Общие правила применения ВЧЭХ в эндохирургии
/. Электрод и особенно его изоляцию тщательно осматривают перед каждой
операцией.
2. При малейшем подозрении на нарушение изоляции электрод удаляют из
операционной.
3. Генератор включают до операции, его исправность контролирует
оперирующий хирург.
4. На генераторе устанавливают минимальные цифры мощности,
обеспечивающие необходимое воздействие.
5. Дважды проверяют правильность расположения электрода пациента.
6. Введение электрода через троакар производят осторожно, памятуя о
сохранности диэлектрического покрытия', этот же принцип соблюдают при
очистке, дезинфекции и стерилизации инструмента.
7. При работе строго соблюдают следующую последовательность действий:
а. Электрод, подключённый к кабелю, через троакар под контролем
видеомонитора вводят в брюшную полость.
б. Ткань захватывают инструментом и по возможности
приподнимают (отводят) над окружающими образованиями. Направление тракции должно
95
быть выдержано строго по оси инструмента, внутрь троакара. В другом
случае (гемостаз шарообразным электродом) хирург просто касается
инструментом тканей.
в. Нажатием на педаль подают напряжение в одном из выбранных
режимов. Хирург делает это только после создания замкнутой цепи, т.е.
инструмент должен соприкасаться с тканью.
г. Производят резание или коагуляцию.
д. Сразу же после окончания воздействия подачу тока прекращают
(педаль отпускают).
е. Инструмент извлекают из брюшной полости, помня о том, что
электрод сохраняет опасную температуру ещё на протяжении 2—4 с.
8. Следует избегать использования ВЧЭХ около таких металлических
предметов, как эндохирургические инструменты, клипсы, троакары.
СОЗДАНИЕ ОТКРЫТОЙ ЦЕПИ ПОД НАПРЯЖЕНИЕМ В ЭНДОХИРУР-
ГИИ КРАЙНЕ НЕЖЕЛАТЕЛЬНО.
Открытая цепь резко увеличивает опасность осложнений, в частности
ёмкостного пробоя, и вероятность возникновения аномальных путей
распространения тока. Снижается прочность диэлектрического покрытия. Даже если
электрод хирурга находится в контакте с тканью, т.е. цепь замкнута, напряжение
заметно возрастёт по мере обезвоживания тканей и увеличения их сопротивления.
Биполярная коагуляция в эндохирургии
Это технология, способная снизить частоту осложнений, возникающих
из-за прямого пробоя, ёмкостного пробоя и повреждения изоляции
инструментов. Для биполярной коагуляции используют биполярные щипцы и
биполярные лапароскопические ножницы. Биполярные электроды работают при
низком напряжении, что уменьшает вероятность дугообразования. Если бран-
ши биполярного электрода контактируют с другим металлическим
инструментом (например, зажимом), ток просто течёт от одной бранши к инструменту и
возвращается на генератор через другую. Это уменьшает поток заряженных
частиц через ткани пациента.
Биполярные инструменты по существу устраняют ёмкостный пробой, так
как магнитные поля, создаваемые вокруг каждого проводника биполярной пары,
имеют противоположное направление и поэтому нейтрализуют друг друга.
При работе с биполярными инструментами не возникает проблемы
изоляции. На эти электроды подают энергию по двум проводам, расположенным
внутри изолированной металлической ручки. Поэтому любые царапины на
инструменте или ручке не имеют значения.
Биполярную коагуляцию традиционно чаще применяют гинекологи. И
все же большинство хирургов предпочитают монополярную ЭХ. Многие
используют прижигание при высоком напряжении и большой мощности для
остановки кровотечения — технику, пока неприменимую в биполярном режиме.
Недавно была разработана другая технология, также предотвращающая
ёмкостный пробой и нежелательные последствия повреждения изоляции при
монополярной ЭХ. Эта система состоит из проводящей оболочки, помещае-
96
мой поверх изоляции электрода хирурга. Оболочку присоединяют к системе
активного мониторинга, в свою очередь соединённой с ЭХГ. Оболочка
собирает все «шальные» потоки и возвращает ток на генератор. Если ёмкостные токи
возрастают или обнаружено нарушение изоляции, система мониторинга
отключает ЭХГ. Система работает с любым генератором или любыми
многоразовыми и одноразовыми эндохирургическими инструментами.
Осложнения ВЧЭХ в лапароскопии
Повреждение внутренних органов в эндохирургии может произойти в двух
зонах:
а. В зоне эндоскопического обзора.
б. Вне зоны эндоскопического обзора.
Повреждения в зоне эндоскопического обзора обычно связаны с дефектами
хирургической техники. Они могут быть обусловлены неправильными
движениями электрода, находящегося под напряжением, или использованием ЭХ
непосредственно в зоне расположения жизненно важных структур.
Типичная ошибка начинающего эндохирурга — «размахивание»
электрохирургическим инструментом в полости. Если движение электрода
производят не внутрь троакара, а в сторону, повреждение органов становится
вполне вероятным. Именно таков наиболее частый механизм ранения
диафрагмы и двенадцатиперстной кишки при ЛХЭ, мочевого пузыря и
забрюшинных сосудов в гинекологии, слепой кишки при ЛА.
Другой вариант — повреждение при работе в зоне расположения
жизненно важных структур. При многих заболеваниях нормальная анатомия
органов существенно изменена, что увеличивает риск
электрохирургических повреждений. Например, сморщивание треугольника Кало при скле-
роатрофическом жёлчном пузыре приводит к спаиванию элементов гепа-
тодуоденальной связки с медиальной стенкой органа. Эндометриоз и
выраженный спаечный процесс в полости малого таза могут привести к
подпаиванию придатков матки к задней брюшной стенке. Неосторожная
препаровка L-образным электродом чревата ранением крупных забрюшинных
сосудов и мочеточника.
Повреждения вне зоны эндоскопического обзора могут происходить
вследствие трёх различных механизмов:
а. Дефект изоляции электрода.
б. Ёмкостный пробой электроэнергии.
в. Прямой пробой электроэнергии.
Дефект изоляции электрода
Эндохирургические электроды имеют специальное диэлектрическое
покрытие, предотвращающее схождение тока на троакар или на
прилежащие органы. Благодаря этому мощность высвобождается только на
оперируемые ткани через рабочий конец, лишённый изоляции. Изоляция
любого электрода имеет две характеристики: плотность и диэлектрическое
сопротивление (характеристика изоляционной способности). Даже небольшой,
97
не видимый глазом дефект может привести к высвобождению 100%
энергии на прилежащие органы и ткани в зоне, недоступной обзору. Тем не
менее сегодня наилучший способ проверки износа — осмотр.
Многократное использование инструментов ведёт к повреждению покрытия,
появлению трещин и дефектов.
Факторы, способствующие разрушению изоляции:
а. Обработка, дезинфекция и стерилизация инструментов.
б. Трение о клапан или конец троакара в процессе операции.
в. Создание открытой цепи, когда нагрузка на изоляцию резко
возрастает.
Опыт зарубежных и отечественных хирургов показывает, что
наиболее часто нарушения изоляции возникают на одноразовых инструментах
при их многократном использовании. Изоляция на них менее надёжна, а
хирург, не думая о сохранности инструмента, подает максимальную
мощность генератора. Хотя и не существует доказательств того, что после
стерилизации одноразовые инструменты оказываются непригодными, их
не следует применять повторно. Если это происходит, то гарантии
производителя в случае неисправности утрачивают силу. Во всяком случае, в
Великобритании Акт о Защите Потребителей A987 г.) возлагает
ответственность как на хирурга, так и на медсестру, если инструмент применяют
в противоречии с инструкциями производителя и происходит
повреждение. Агентства по медицинскому страхованию отмечают, что расходы в
этом случае превышают всякую предполагавшуюся экономию средств [5].
Зона 1. Опасность нарушения изоляции зависит от расположения
дефекта (рис. 5-17). Наиболее часто это происходит в дистальной части
электрода (зона 1) в результате повреждения инструмента в момент
проведения через клапан троакара и постоянного термического воздействия.
Хотя ткани в зоне 1 расположены в поле зрения хирурга, нарушение
изоляции может привести к повреждению кишечника или ОЖП. Наконец,
дефект изоляции ведёт к заземлению и сбросу энергии на другие ткани
(например, на поверхность печени при ЛХЭ). В этом случае
эффективность коагуляции на рабочем конце инструмента, естественно, будет
потеряна.
Зона 2 представляет часть электрода, расположенную вне троакара и
недоступную обзору. Повреждения изоляции здесь наиболее опасны.
Рис. 5-17. Зоны возможного расположения дефекта изоляции инструмента.
98
Зона 3. Нарушение изоляции в зоне 3 при работе с пластмассовыми
троакарами не фиксируется. При использовании металлических
троакаров возникает поток заряженных частиц между металлом электрода и
троакара. Происходит демодуляция с выработкой тока низкой частоты, что
вызывает нейромышечную стимуляцию, подёргивание мышц брюшной
стенки и диафрагмы. Возникают помехи на видеомониторе.
Электрохирургическое воздействие на ткани теряет эффективность (ни резания, ни
коагуляции не происходит). В этой ситуации опытный хирург может
заподозрить нарушение изоляции.
Сам «шальной» ток при нарушении изоляции в зоне 3 при
использовании металлических троакаров без вреда рассеивается широкой зоной
контакта в толще передней брюшной стенки. Более продолжительное
сбрасывание энергии через троакар может вызвать высушивание тканей кожи
и брюшной стенки. В результате этого площадь контакта становится
меньше, сопротивление возрастает, появляется возможность ожога.
К сожалению, нарушение изоляции и повреждения кишечника могут
и не сопровождаться указанными выше признаками и привести к
развитию кишечной непроходимости, перитонита или гнойных осложнений.
Зона 4. И наконец, дефекты изоляции в зоне 4 — ручке электрода —
связаны с недостатками технического исполнения инструмента и могут
вызвать ожог кисти хирурга.
Так как при использовании пластмассовых троакаров не бывает
признаков повреждения изоляции, большинство хирургов поддерживают
применение металлических.
В настоящее время отечественные фирмы разрабатывают для
электрохирургических инструментов принципиально новое прочное
металлическое покрытие, имеющее заземление.
Ёмкостный пробой электроэнергии
Ёмкостный пробой — эффект, при котором электрическая энергия
передаётся через неповреждённую изоляцию в расположенные рядом
проводящие материалы благодаря электростатическому полю. Таким
образом, ток в одном проводнике может индуцировать ток в другом,
изолированном от первого (рис. 5-3). Такой ток возникает при тесном
соприкосновении с большой поверхностью (несколько квадратных сантиметров)
двух элементов, один из которых производит электрическое поле. До
некоторой степени ёмкостный пробой происходит при использовании всех
стандартных монополярных электродов. Вызовет ли «шальная» энергия
какие-нибудь клинические проявления, зависит от двух факторов:
а. Общее количество энергии, производимой ёмкостью.
б. Концентрация потока во время его прохождения к электроду
пациента.
Ёмкостный эффект может привести к схождению 70% исходной
мощности тока, хотя он и появляется без прямого электрического контакта и
дефектов изоляции. В эндохирургии такой эффект можно наблюдать между
электрохирургическим инструментом и троакаром или переходной вставкой
99
размером 5—10 см. Аналогичная ситуация возникает при активации
электрода, находящегося внутри рабочего канала операционного лапароскопа.
Прохождение тока по электроду индуцирует ток на металлическом
троакаре или лапароскопе, который может сойти при соприкосновении с
внутренним органом, например петлёй кишки [10].
Таким образом, индуцированный поток к троакару возрастает с
увеличением длины троакара и электрода. Он также возрастает с
увеличением радиуса электрода, но уменьшается с увеличением радиуса троакара.
Следовательно, значительный поток «шального» тока будет индуцирован
при введении 5-миллиметрового инструмента в 5-миллиметровый
троакар, ещё больший — при введении 10-миллиметрового инструмента в 10-
миллиметровый троакар. Наиболее благоприятная в этом отношении
ситуация возникает при работе 5-миллиметровым инструментом в
10-миллиметровом троакаре, так как сила индуцированного тока будет наименьшей.
Ёмкостный эффект возрастает в режиме коагуляции и меньше
выражен при резании тканей (низкое напряжение).
Ёмкостный эффект возрастает при увеличении мощности,
подаваемой на электрод с ЭХГ.
Ёмкостный эффект возрастает при использовании инструментов с
тонким и некачественным диэлектрическим покрытием.
Ёмкостный пробой становится максимальным, когда электрод
активирован, но не соприкасается с тканями (открытая цепь под цагруз-
кой!). Это происходит, когда хирург применяет дугу или неверно
интерпретирует двухмерное лапароскопическое изображение, в
результате чего не происходит желаемого контакта с тканью. Как уже было
сказано, такая ситуация крайне неблагоприятно сказывается на
долговечности изоляционного покрытия.
При использовании цельнометаллических троакаров «шальная»
энергия ёмкостного потока не приводит к развитию электротермических
повреждений внутренних органов даже при подаче большой мощности, так
как энергия безвредно рассеивается через ткани передней брюшной
стенки. В крайнем случае это может привести к незначительному
высушиванию тканей в зоне введения троакара.
Принципиально иная ситуация возникает при использовании
комбинированных (металл-пластмасса) или металлических троакаров, но с
пластмассовыми фиксаторами в передней брюшной стенке. Такие
Одноразовые устройства были в изобилии выпущены
фирмами-производителями эндохирургического оборудования без понимания физики тока и
возможных последствий [11].
При этом брюшная стенка контактирует только с
неэлектропроводным пластмассовым фиксатором и «шальные» токи ёмкостного эффекта
концентрируются на стенке троакара. Далее индуцированный заряд
может разрядиться на внутренние органы (например, кишечник) при
соприкосновении электрода с тканями по ходу лапароскопической операции
(рис. 5-18). Небольшая площадь контакта обеспечит высокую плотность
тока. Возможно, он даже создаст электрическую дугу с последующим
ожогом и перфорацией органа.
100
Другой механизм
повреждения можно встретить при
использовании комбинированных
инструментов, например
изолированного электрода,
проходящего через просвет
металлической трубки
(аспиратор-ирригатор).
Цельнометаллический аспиратор-ирригатор
внутри пластмассового троакара
представляет наибольший риск
повреждений вследствие
ёмкостного пробоя. Весь «шальной»
ток может быть
сконцентрирован в точке прикосновения
инструмента к петле кишки.
Аналогичный механизм
повреждений неоднократно
наблюдали в 70-х годах при
выполнении лапароскопической
стерилизации (пересечении
маточных труб). Щипцы для
коагуляции при этом вводили
через инструментальный канал
операционного лапароскопа.
Ёмкостные токи возникали на
металлической поверхности
лапароскопа и далее разряжались
при соприкосновении со
стенкой кишки.
Рис. 5-18. Поражение стенки кишки ёмкостным
током.
Рис. 5-19. Прямой пробой электрическим током.
Прямой пробой
Под прямым пробоем понимают ситуацию, при которой активный
электрод касается другого металлического инструмента (например,
лапароскопа) в пределах брюшной полости (рис. 5-19). В этом случае может
произойти прямая передача энергии (пробой) с электрода через
лапароскоп на другие ткани (например, на стенку кишки) по длиннику
лапароскопа. Специальные исследования показали, что цельнометаллические
троакары безопасно рассеивают по брюшной стенке потоки прямого
пробоя даже при мощности 100 Вт. Пластмассовые троакары менее
безопасны даже при мощности 15 Вт [11].
Вполне понятно, что хирург должен избегать контакта включённого
электрода с любым металлическим инструментом или лапароскопом во
время любых лапароскопических процедур. Однако работа электродом
происходит на расстоянии 2—4 см от конца лапароскопа и случайный
контакт вполне вероятен.. Если происходит активирование лапароскопа,
металлический троакар, через который введена оптика, рассеивает
«шальную» энергию через брюшную стенку. Пластиковый троакар изолирует
101
энергию от брюшной стенки и концентрирует её передачу на органы
брюшной полости. Таким образом, металлические многоразовые троакары не
только дешевле, но и безопаснее пластмассовых.
Ожоги кожи при использовании цельнометаллических троакаров
встречаются крайне редко. Их наблюдают в случае прямого контакта
активированного электрода с троакаром. Ожог возникает при высоком
напряжении генератора, работающего в режиме коагуляции, и достаточно
длительном воздействии. Ситуация прямого контакта обычно возникает
при соскальзывании троакара внутрь брюшной полости к рабочей части
электрода. Этого можно избежать, используя фиксаторы троакаров
(вертушки) в передней брюшной стенке. Только сделаны они должны быть не
из пластмассы, а из металла.
Аномальные пути движения электрического тока
Начиная электрохирургическое воздействие, хирург предполагает, что
резание или коагуляция произойдёт в желаемой точке, т.е. в зоне контакта
электрод—ткань. Однако в ряде случаев ток выбирает иной, аномальный путь
движения и выделяет энергию в совершенно неожиданном месте. Понятно, что
это может привести к тяжёлым ожогам тканей с малопредсказуемыми
последствиями. Возможны следующие ситуации.
а. Схождение тока с электрода на окружающие органы и ткани. Это
может произойти при повреждении диэлектрического покрытия, но
возможно и в случае прямого контакта рабочей части инструмента с другими
тканями. Типична ситуация при ЛХЭ, когда в процессе выделения
медиальной стенки жёлчного пузыря возникает небольшое кровотечение
(например, из сосудов брюшины). Для гемостаза необходимо захватить сосуд
зажимом и произвести коагуляцию. Обычно инструмент вводят через эпи-
гастральный доступ, параллельно поверхности печени. При этом зажим
захватывает сосуд, но расположен в брюшной полости таким образом, что
своей неизолированной частью (около 2 см) соприкасается с тканью
печени. Поэтому мощность выделяется не столько между кончиками бранш,
удерживающими кровоточащий сосуд, сколько на уровне «серьги» и выше,
т.е. ток идёт по аномальному пути. Опасен не столько поверхностный
ожог ткани печени, сколько неэффективный гемостаз в зоне
кровотечения. Инструмент необходимо ввести через другой доступ,
перпендикулярно поверхности печени, чтобы уменьшить площадь контакта и
сконцентрировать ток в необходимой точке.
б. Сброс заряда через жидкость. Согласно закону физики,
электрический ток всегда идёт к пластине пациента по кратчайшему пути с
наименьшим сопротивлением. Диэлектрическое покрытие электрода,
смоченное жидкостью, становится хорошим проводником и представляет
аномальный путь движения электрического тока. Энергия может выделиться
на любом органе, которого касается инструмент в брюшной полости
(рис. 5-20), особенно в том случае, если мы имеем открытую цепь под
102
Рис. 5-20. Электрохирургическое поражение стенки кишки «через жидкость»
напряжением. Поэтому инструмент, вводимый в брюшную полость,
должен быть сухим, а соприкосновение даже изолированной поверхности с
другими органами нежелательно.
в. Сброс на троакар. Эта ситуация возникает при контакте электрода
с троакаром в момент электрохирургического воздействия (например, когда
часть неизолированного рабочего конца инструмента исчезает за
пределами поля зрения). Следствием этого может быть неэффективность резания
или коагуляции, а также высушивание или ожог тканей брюшной стенки
вокруг троакара. Как и при любом контакте электрода с металлическим
инструментом, возможна демодуляция тока высокой частоты, о
последствиях которой было сказано выше.
г. Разряд на металлические клипсы. Эта опасность возникает при
работе электродом в непосредственной близости с уже наложенными
металлическими клипсами или скобками. Передача энергии может привести
либо к ожогу жизненно важных структур, либо к прорезыванию клипс и
скобок с последующей дегерметизацией.
д. Аномальные пути, возникающие во время операции. Сопротивление
тканей в процессе электрохирургического воздействия может меняться.
При коагуляции происходит их высушивание и сопротивление возрастает.
В результате могут возникать новые, альтернативные пути движения тока,
где сопротивление окажется меньшим. В момент коагуляции спаек
соединительная ткань сморщивается, спайки укорачиваются, вероятность
прямого ожога стенки органа возрастает.
Разберём возможную ситуацию на примере операции лапароскопической
стерилизации, выполняемой при помощи ВЧЭХ. Как видно из рис. 5-21, пред-
103
полагаемый путь тока лежит через матку к электроду пациента. Однако даже
при технике одного прижигания труба может быть скоагулирована
неравномерно. Если ткань с проксимальной стороны (ближе к матке) обрабатывают
первой, её сопротивление, возросшее в результате высушивания, может
электрически изолировать матку, что направит ток через фимбрии на любую ткань,
касающуюся бахромок. То же происходит и при технике двух
последовательных прижиганий. Хирург может изолировать матку, высушивая
проксимальную часть трубы первой. Даже если фаллопиева труба не касается окружающих
тканей непосредственно, высоковольтная фульгурация может создать дугу с
фимбрий на соседние органы, чаще на кишку (см. рис. 5-21). Поэтому в
технике двух прижиганий дистальную часть трубы следует высушивать первой.
Второе прижигание делают проксимально, избегая изолирования матки и
направления тока по аномальному пути.
Один из самых опасных моментов возникновения аномального тока —
любой этап операции, связанный с рассечением спаек. В этом случае
наименьшим диаметром может обладать часть цепи, расположенная вне зоны
электрода хирурга (например, в месте фиксации спайки к стенке кишки).
R.D. Tucker в 1995 г. описал показательный случай электрохирургического
поражения кишечника во время гинекологической операции [12, 13].
Больная была оперирована по поводу бесплодия на почве спаечного
процесса, развившегося в малом тазу. Рассечение спаек выполняли
посредством монополярной ЭХ. На 4-й день у больной появились признаки
перитонита, и ей была выполнена эксплоративная лапаротомия. На
протяжении дистальных 40 см подвздошной кишки обнаружены множествен-
Рис. 5-21. Аномальные пути движения электрического тока.
104
ные некротические участки. 5—10 участков выглядели как ожоги серозной
оболочки, некоторые из них были окутаны сальником, при отделении
которого обнаружены перфорационные отверстия. Левые придатки интакт-
ны. В средней части сигмовидной кишки также имелось несколько
некротических участков, в одном из них — перфорация. Признаки перитонита
наблюдали в правой половине брюшной полости и полости малого таза.
Наложена сигмостома. Изменённый отдел подвздошной кишки
резецирован с формированием межкишечного анастомоза бок в бок. Колостома
закрыта через 2 мес. Пациентка вернулась к нормальной деятельности
через 6 мес после операции.
По мнению независимого эксперта, имело место
электротермическое поражение при пересечении спаек между придатками матки и
петлями кишечника. Увеличение сопротивления при коагуляции спайки
привело к сбросу потока через спайку на петлю кишки. Было указано на
недопустимость электрохирургической работы на малых тканевых
структурах, так как аномальный ток может вызвать повреждение на
расстоянии, что и произошло в данном случае. Даже активация в течение 5 с при
мощности 30 Вт может привести к ожогу кишечника. Пациентке была
присуждена компенсация в виде 500 000 долларов США.
Опытный хирург может распознать признаки аномального движения тока
следующим образом:
а. При уменьшении мощности не следует добавлять её на панели
генератора. Необходимо задуматься о возможных аномальных путях {например,
создаваемых при контакте электрода с троакаром).
б. Подёргивание мускулатуры брюшной стенки говорит о демодуляции
вследствие искрообразования и контакта электрода с другим
металлическим инструментом.
в. Появление «снежной метели» на экране монитора свидетельствует о
том, что произошёл пробой.
Внутрибрюшное возгорание при лапароскопических операциях
В литературе описано несколько серьёзных осложнений, связанных с
видом инсуффлируемого газа. Это редкое, но потенциально смертельное
осложнение. Первый случай внутрибрюшного взрыва без летального исхода был
представлен в 1933 г. Fever при использовании 100% кислорода в качестве газа для
инсуффляции. Когда накалённый каутер был введён в брюшную полость, где
находился кислород, произошёл взрыв, сопровождавшийся вспышкой света.
Хотя это не вызвало у больного серьёзных осложнений, на долю врача, кроме
испуга в первый момент, выпали волнения в ожидании серьёзных последствий
этого события.
В 70-х годах произошло несколько внутрибрюшных взрывов при
использовании закиси азота. Сегодня в хирургической практике используют 100%
углекислый газ, так как он не горюч и не взрывается при появлении искры.
При диагностических процедурах без электрохирургического воздействия
допустимо использование закиси азота.
105
В каждой стране баллоны, содержащие различный газ, имеют
отличительную маркировку, согласно промышленным стандартам.
Последний случай внутрибрюшного возгорания был описан РЕ Greilich в
1995 г. в США [14].
Мужчина 62 лет поступил с признаками разрешающегося
панкреатита и ЖКБ для проведения плановой ЛХЭ. ПП создавали электронным
лапарофлатором, который был присоединён к баллону с двуокисью
углерода, имеющему специальную маркировку. Через 2 ч после начала
операции на мониторе была замечена 2-сантиметровая вспышка, возникшая на
конце электрохирургического инструмента. Несколькими секундами
позже, при извлечении инструмента через троакар, весь экран стал оранжево-
красным, брюшная стенка была явно освещена изнутри. Возгорание
продолжалось примерно 2 с. Осмотр конца электрохирургического
инструмента и троакара показал, что оба они подверглись возгоранию.
Выполнена экстренная лапаротомия доступом в правом подреберье. При ревизии
органов брюшной полости признаков термического ожога органов не
выявлено, за исключением незначительного обугливания серповидной
связки. Жёлчный пузырь удалён. Брюшная полость промыта 3 л
физиологического раствора и послойно ушита. Послеоперационное течение
гладкое. Пациент выписан на 9-й день без каких-либо осложнений.
При тщательном осмотре баллона на его верхней части обнаружена
3-сантиметровая зелёная полоска, указывающая на наличие кислорода.
Оставшаяся часть цилиндра была серой, как это бывает на баллонах с
углекислым газом. Осмотр закрытой метки на баллоне показал, что газ
представлял из себя смесь 14% СО2 и 86% О2 В телефонном разговоре с
компанией-поставщиком газа выяснилось, что любой баллон с
содержанием углекислого газа более 7% снабжают стандартным значком.
Сравнение использованного баллона с 14% СО2с другим, содержащим 100% СО2,
подтвердило, что значки были идентичны. Никто из персонала
операционной не был осведомлён о возможности такой ошибки.
Меры безопасности в эндохирургии
Департамент Здравоохранения Великобритании рекомендует следующие
меры безопасности при использовании ВЧЭХ в лапароскопии [5]:
а. Использовать одноразовые инструменты только один раз.
б. Осматривать инструменты для проверки целостности изоляции.
в. Не применять электрохирургические инструменты с
комбинированными троакарами или пластмассовыми фиксаторами.
г. Использовать металлические фиксаторы для всех металлических
инструментов (например, лапароскопа).
д. Использовать по возможности минимальную мощность ЭХГ.
е. Избегать коагуляции при высоком напряжении.
ж. Не создавать открытой цепи под напряжением. Подавать
напряжение только после прикосновения электрода к тканям.
106
з. После применения охлаждать конец инструмента в поле зрения
лапароскопа.
и. Помнить о возможном нарушении изоляции в цепи и возможности
ёмкостного пробоя.
к. По возможности использовать биполярную коагуляцию.
л. Тщательно осматривать маркировку баллона с газом перед началом
инсуффляции.
м. Не применять ЭХ при работе на малых тканевых структурах (менее
1 мм), так /сак при этом возрастает опасность возникновения аномальных
путей движения тока.
107
6
Особенности анестезии
в эндохирургии
Общее обезболивание и контроль за состоянием жизненно важных функций
в лапароскопической хирургии имеет свои особенности, обусловленные
созданием ПП, изменением положения тела и адсорбцией инсуффлируемого газа.
При торакоскопических вмешательствах операции проводят в условиях
пневмоторакса, когда необходима однолёгочная вентиляция, так как
манипуляции в плевральной полости при раздутом лёгком затруднены.
ВЛИЯНИЕ ПНЕВМОПЕРИТОНЕУМА
И ИЗМЕНЕНИЯ ПОЛОЖЕНИЯ ТЕЛА
В эпоху диагностической лапароскопии врачи не уделяли особого
внимания влиянию ПП на функцию жизненно важных органов и систем, так как
метод применяли у ограниченного круга пациентов, а продолжительность
вмешательства не превышала 10—20 мин. При хирургических заболеваниях
лапароскопия, как правило, носила диагностический характер, небольшие
лечебные процедуры выполняли гинекологи — почти всегда молодым пациенткам с
компенсированным общим состоянием. Поэтому анестезиологические проблемы
в прошлом классифицировали как несущественные.
В настоящее время показания к лапароскопическим операциям
значительно расширены, а продолжительность каждой процедуры удлинилась до
нескольких часов. С расширением спектра хирургических вмешательств
увеличился и возраст оперируемых пациентов. Возникла необходимость полного
пересмотра анестезиологического обеспечения эндохирургии.
Большинство пациентов хорошо переносят напряжённый ПП в пределах
12—15 мм рт.ст. Однако повышение внутрибрюшного давления (ВБД)
небезразлично для функции сердечно-сосудистой и дыхательной систем (рис. 6-1).
Патофизиологические последствия напряжённого ПП включают следующие изменения:
1. Сдавление нижней полой вены с нарушением венозного
кровотока в её бассейне.
2. Нарушение кровотока в артериях органов брюшной полости.
3. Нарушение сердечной деятельности: снижение сердечного
выброса и сердечного индекса.
4. Сдавление лёгких при поднятии диафрагмы с уменьшением
остаточной ёмкости, увеличением мёртвого пространства и исходом в гипер-
капнию.
109
в
р
Рис. 6-1. Побочные эффекты ПП. А — сдавление диафрагмы уменьшает лёгочный объём и
вызывает ротацию сердца, Б — высокое ВБД уменьшает венозный возврат и увеличивает
сосудистое сопротивление, В — артериальное кровоснабжение внутренних органов может быть
снижено, Г — в нижних конечностях наблюдают венозный стаз.
Для реализации данных патофизиологических механизмов важен уровень
ВБД [1]. При ВБД около 16 мм рт.ст. сердечный выброс значительно снижен,
системная сосудистая резистентность повышается в зависимости от
сердечного выброса. При ВБД 8—12 мм рт.ст. отклонения незначительны. Снижение
центрального венозного возврата и как следствие этого сердечного выброса
при ВБД 16 мм рт.ст. возникает всегда. Поддержание ВБД ниже этого уровня
существенно увеличивает венозный возврат благодаря притоку крови из
органов брюшной полости и нижней полой вены.
Лапароскопический доступ позволил снизить на 50% послеоперационную
летальность у пациентов, страдающих хроническими обструктивными
заболеваниями лёгких (ХОЗЛ). У больных, не имеющих в анамнезе ХОЗЛ,
послеоперационные лёгочные осложнения развиваются в 35 раз реже @,6% вместо 21%),
чем в открытой хирургии [2].
ПО
Изменение гемодинамики зависит от давления и скорости инсуффляции
газа. При быстром наложении ПП гемодинамические сдвиги могут быть
существенными. При ВБД 14 мм рт.ст. компрессия нижней полой вены приводит к
повышению давления в венах нижних конечностей на 80% [3]. Давление в
бедренной вене в норме соответствует ВБД, поэтому при создании ПП
происходит депонирование крови в нижних конечностях. Венозный стаз был
доказан при помощи допплерографии. ПП на 37% снижает скорость кровотока в
бедренной вене [4]. Замедление кровотока в глубоких венах бедра и голени
может привести к тромбозу с последующей эмболией лёгочной артерии.
Исследования, проведённые в США, продемонстрировали значительное
расширение вен голени после наложения ПП. Венозный стаз усугубляет изменение
положения тела с приподнятым головным концом. Так, /. Carpini и соавт. A994 г.)
в опытах на добровольцах искусственно создавали положение Фаулера с углом
наклона 45°. Через час было обнаружено статистически значимое увеличение
диаметра икроножных вен, которое было менее выражено у добровольцев,
носящих компрессионные гольфы или эластические бинты. Они же в
клиническом исследовании показали, что интраоперационное расширение вен более
20% по сравнению с предоперационным коррелирует с развитием тромбоза [4].
ПП оказывает влияние и на периферический кровоток. Если операция
продолжается несколько часов, может наступить повреждение паренхимы
почек из-за уменьшения почечного кровотока, клубочковой фильтрации и тубу-
лярной абсорбции [5].
Изменения в артериальной системе состоят в увеличении системной
сосудистой резистентности и среднего АД. Следствие этого, а также уменьшения
венозного возврата в правое предсердие — существенное снижение сердечного
выброса, особенно у пациентов с неадекватным кардиальным резервом [6].
Наблюдают строгую корреляцию между уровнем исходной гиповолемии и
снижением сердечного выброса под влиянием ПП. Феномен увеличения
системного сосудистого сопротивления и среднего АД может сохраняться на
протяжении 1—2 ч после десуффляции [7]. Механизм развития феномена неясен.
Возможно, это следствие механического сдавления артериальных стволов
брюшной полости. Не исключено, что снижение почечного кровотока вызывает
активацию вазоактивных субстанций (катехоламины и система ренин—ангиотен-
зин). Феномен можно объяснить реализацией вазоконстрикторного рефлекса,
запускаемого снижением венозного возврата и сердечного выброса. Другая
причина — прямое раздражающее действие углекислого газа на брюшину, а
также повышение рСО2 в крови с запуском известного механизма: гиперкап-
ния — катехоламины — гипертензия.
У пациентов, страдающих атеросклерозом и ИБС, существует опасность
развития сердечной недостаточности вследствие увеличения ОЦК на фоне
инфузии, с одной стороны, и быстрого повышения ВБД при наложении ПП —
с другой. Пациенты с патологией аортального клапана и гипертрофией левого
желудочка ещё более чувствительны к наркозу на фоне ПП. Увеличение ЧСС
приводит к снижению наполнения левого желудочка, что в свою очередь ведёт
к ишемии головного мозга и миокарда. Поэтому у больных с сердечной
недостаточностью необходимо предупреждать расстройства гемодинамики и
проводить раннюю коррекцию.
111
С целью прогнозирования нежелательных последствий ПП для функций
системы дыхания и кровообращения СИ. Емельяновым и соавт. разработан
способ создания «псевдопневмоперитонеума» специальной манжеткой без
введения газа в брюшную полость. При этом на живот больного накладывают
пневматическую «манжетку», циркулярно охватывающую все отделы передней
брюшной стенки [8].
Изменение положения тела больного также может спровоцировать кар-
диоваскулярные расстройства. Положение Тренделенбурга компенсирует
нарушение венозного возврата, вызванное ПП, однако нарушает экскурсию
диафрагмы и увеличивает внутригрудное давление. Положение Фаулера
усугубляет нарушение венозного возврата, что приводит к снижению сердечного
выброса.
АБСОРБЦИЯ УГЛЕКИСЛОГО ГАЗА
При инсуффляции углекислого газа в брюшную полость часть его быстро
всасывается через брюшину с последующим проникновением в кровоток, где
образуется угольная кислота. Она оказывает прямое влияние на дыхательный
центр и, в меньшей степени, на хеморецепторы синокаротидной зоны.
Увеличение рСО2 до 45—50 мм рт.ст. требует увеличения вентиляции лёгких в 1,5 раза, а
снижение рСО2 до 30 мм рт.ст. — её уменьшения в 1,5 раза.
Абсорбция инсуффлированного СО2 вызывает слабый дыхательный
ацидоз, также наблюдают небольшие сдвиги в сторону метаболического ацидоза
или алкалоза (чаще не имеющие клинической значимости). Больные хорошо
переносят изменения рН, если не происходит абсорбции избыточного
количества углекислого газа.
В условиях выраженной гиперкапнии отрицательное действие высокой
концентрации углекислоты снижает сократительную функцию миокарда,
ухудшает предсердно-желудочковую проводимость, снижает АД, повышает тонус
блуждающего нерва, что уменьшает ЧСС. Углекислота способствует
увеличению диссоциации оксигемоглобина, повышает проницаемость клеточных
мембран для кислорода и увеличивает его сродство к тканям. Однако при
запредельной гиперкапнии наступает быстрое истощение энергетического потенциала
организма, так как под влиянием углекислоты замедляются обменные
процессы, уменьшается потребление О2. Наступает депрессия центральной нервной
системы, подавляется активность дыхательного центра, затрудняется
проводимость по нервным волокнам. Высокая концентрация СО2 в организме
вызывает бронхиолоспазм и вазоконстрикцию в почках, что ведёт к снижению моче-
выделительной функции, нарушению водно-электролитного и
кислотно-основного состояния.
При гиперкапнии, нарастающей на фоне ПП, необходимо немедленное
выведение углекислоты из организма. Параметры ИВЛ меняют в сторону
гипервентиляции. Необходимо помнить, что выраженная гипервентиляция со
снижением рСО2 до 50% нормы уменьшает АД и системное сосудистое
сопротивление. При этом происходят повышение тонуса сосудов головного мозга и
сердца, расширение периферических сосудов, угнетение сократительной функ-
112
ции миокарда. Наступает сосудистый коллапс, сопровождающийся
нарушением мозгового кровотока. В условиях дыхательного алкалоза увеличивается
сродство кислорода к гемоглобину, что затрудняет поступление кислорода в ткани.
Запредельное снижение рСО2 — основная причина длительной депрессии
после наркоза.
ВЫБОР СПОСОБА И ТЕХНИКИ ОБЕЗБОЛИВАНИЯ
Анестезия в эндохирургии требует полного понимания патофизиологии
ПП и однолёгочной вентиляции для профилактики возможных осложнений.
Многих пациентов следует отнести к группе высокого анестезиологического
риска, так как, чем более выражена сопутствующая патология, тем в большей
степени показана операция «без разреза». Безопасная анестезия требует
проведения тщательного предоперационного обследования и интраоперационного
мониторинга.
Задачи анестезиолога — поддержание гемодинамической и респираторной
стабильности, обеспечение адекватной анестезии и анальгезии, мышечной
релаксации для лучшей визуализации брюшной полости.
В эндохирургии наиболее приемлемы следующие методы обезболивания:
а. Внутривенная многокомпонентная общая анестезия со
спонтанным дыханием.
б. Внутривенная многокомпонентная общая анестезия с ИВЛ.
в. Перидуральная анестезия в сочетании с внутривенной амнезией.
г. Перидуральная анестезия в сочетании с внутривенной амнезией
и ИВЛ.
Применение ингаляционных анестетиков, в том числе и N2O, в
лапароскопии ограничено. Этот газ не рекомендуют в силу ряда причин:
а. Закись азота вытесняет кислород на альвеолярном уровне с
последующей десатурацией гемоглобина. Этот феномен сильнее выражен при
создании ПП.
б. Закись азота увеличивает объём кишечника и уменьшает его
перистальтику. Причина этого явления — более быстрое проникновение N2O в
просвет кишечника по сравнению с элиминацией эндогенных газов
(например, метана). Увеличение размеров кишечных петель ухудшает
панораму при лапароскопии и задерживает восстановление перистальтики в
послеоперационном периоде.
в. Закись азота, адсорбируясь в дыхательных путях, проникает в
брюшную полость, создавая смесь N2O с СО2. Эта смесь — одна из причин
возникновения типичного для лапароскопии плечелопаточного болевого
синдрома.
Анестезия в эндохирургии не имеет принципиальных отличий от
обезболивания в открытой хирургии. Эндохирургия малотравматична в
хирургическом аспекте, чего нельзя сказать о последствиях напряжённого ПП, адсорбции
инсуффлируемого газа и обезболивания.
Компоненты анестезии можно изобразить схематично (схема 6-1).
113
Схема 6-1
Компоненты анестезии
Амнезия
(сон, торможение психического восприятия)
Регуляция я
кровообращения
¦ гипорефлексия
а (торможение вегетативных
ш рефлексов)
Регуляция дыхания
(поддержание адекватного
газообмена)
Анальгезия
(блокада болевых
импульсов)
Миорелаксация
(устранение двигательной
активности)
Предоперационная подготовка. Необходимо тщательное предоперационное
обследование пациента для выявления сопутствующей патологии, что важно
как для хирурга, так и для анестезиолога. Уже на этом этапе хирург и
анестезиолог совместно выбирают объём и способ оперативного лечения. Наиболее
важна дооперационная диагностика и коррекция сердечно-сосудистых и лёгочных
заболеваний: сердечных аритмий, поражения коронарных артерий, плохо
корригируемой артериальной гипертензии, миокардиопатии, ХОЗЛ. Последние
составляют около 70% всех хронических заболеваний органов дыхания. На
первый взгляд создаётся впечатление о нежелательности выполнения
лапароскопических операций у этой категории больных. Данную группу больных можно
разделить на две подгруппы.
а. Больные с показаниями к хирургической процедуре, требующей
проведения лапаротомии.
б. Больные с показаниями к хирургической процедуре, не
требующей проведения лапаротомии при выполнении традиционного вмешатель-
114
ства (паховая герниопластика, чрезвлагалищные гинекологические
процедуры и др.).
У пациентов из первой подгруппы, кроме трудностей интраоперационно-
го ведения ИВЛ, выше риск развития послеоперационных сердечно-лёгочных
осложнений. Значительная разница между лапароскопией и лапаротомией
связана с необходимостью в элиминации СО2 с последующим проведением
гипервентиляции в условиях ХОЗЛ.
В исследовании, в котором сравнивают восстановление дыхательной
функции в послеоперационном периоде у пациентов без заболеваний
лёгких, перенёсших либо ЛХЭ, либо традиционную холецистэктомию,
авторы отмечают приоритет лапароскопической операции. Другие
исследования подтверждают, что у пациентов с ХОЗЛ, перенёсших ЛХЭ,
восстановление функции дыхания происходит быстрее, чем у пациентов,
перенёсших холецистэктомию лапаротомным доступом.
Очевидно, что у пациентов с ХОЗЛ из первой подгруппы (холецист-
эктомия, резекция кишки, фундопликация) лапароскопический доступ
обеспечивает лучшее поддержание дыхательной функции в
послеоперационном периоде. Для второй подгруппы пациентов (аппендэктомия, фле-
бэктомия), для которых нет острой необходимости в лапароскопическом
доступе, выбор должен быть сделан в пользу традиционной операции под
местной анестезией.
Проводя предоперационную подготовку, врач должен помнить один из
основных постулатов современной анестезиологии: «Если хирургическое
лечение основного заболевания абсолютно необходимо, противопоказаний для
наркоза нет!». Многое зависит от умения и профессиональных навыков врача.
Премедикация показана всем пациентам, она бывает лечебной и
профилактической. Первую назначают за несколько суток до операции пациентам с
сопутствующей патологией, включающей психоэмоциональные расстройства.
Профилактическую премедикацию проводят в течение суток перед плановыми
операциями и за 40—60 мин перед срочными.
Преиндукция. Проводят транквилизаторами. Этим достигают гипорефлек-
сии — одного из компонентов общей анестезии. Возможно совместное
применение этих препаратов одновременно с премедикацией (за 40 мин до
транспортировки больного в операционную).
Индукция в наркоз и поддержание анестезии. Её проводят следующими
препаратами.
Кетамин (кеталар, кетанест, кетажект, калипсол, С1-581) —
единственный анестетик, не раздражающий тканей при любом способе введения
(в/в, в/м, ректально). В эндохирургии кетамин используют в/в. Доза для
вводного наркоза составляет 2 мг на 1 кг массы тела больного. Через
несколько секунд после введения наступают сон и хирургическая стадия
наркоза. Пик максимальной концентрации в плазме наступает через 1
мин. Продолжительность анестезирующего действия кетамина
характеризуется временем перераспределения его в организме и составляет при в/в
115
введении 7—11 мин. Кетамин метаболизируется в печени, что вместе с
экскрецией препарата занимает 2—3 ч. По окончании анестезии кетами-
ном (т.е. через 7—11 мин при в/в введении) большая часть препарата
сохраняется в организме в неизменённом состоянии. Это способствует
кумулятивному и потенцирующему эффекту кетамина при его сочетанном
применении с другими наркотическими средствами.
Барбитураты ультракороткого действия (тиопентал-натрий и гексе-
нал) желательно использовать при плановых операциях у обследованных
пациентов. Ацидоз и недостаток альбуминов в плазме могут стать
причиной нежелательного углубления анестезии и ухудшения кровотока в
печени, особенно при ЖКБ. Следует помнить, что барбитураты
ультракороткого действия не вызывают гепатотоксического эффекта, как считали
ранее. Желательно ограничить применение барбитуратов лишь вводным
наркозом. Для этой цели их применяют в дозе 300—500 мг в 1—2% растворе.
Оксибутират натрия (ГОМК) — один из лучших препаратов для
вводного, равно как и для основного, наркоза. На этапе индукции препарат
вводят медленно в/в в течение 15 мин и более из расчёта 90—100 мг на 1 кг
массы тела. При этом введение в наркоз происходит медленно, «изящно»,
что оптимально для плановой эндохирургии. ГОМК следует применять
после предварительного введения дроперидола в дозе, необходимой для
обеспечения нейролепсии II степени. Быстрое введение препарата
недопустимо. Продолжительность снотворного эффекта при указанной выше
дозе составляет около 2 ч. Оксибутират натрия разрушается в организме
до естественных метаболитов. Он обладает выраженным антигипоксичес-
ким свойством, и его использование для анестезиологического
обеспечения эндохирургических операций патогенетически обосновано. В дозе,
указанной выше, ГОМК даёт только гипнотический эффект, поэтому для
достижения поликомпонентной анестезии необходимо дополнительно
использовать центральные наркотические анальгетики.
Диприван (пропофол) относят к классу гипнотиков, т.е. препаратов,
способных обеспечивать один из компонентов общей анестезии —
медикаментозный сон. Это состояние наступает благодаря высокой липофиль-
ности дипривана через 30—40 с от начала введения препарата в/в. Через 10
мин его концентрация не превышает 40% исходной. Пробуждение
наступает при достижении в плазме крови концентрации 1мг/мл. Препарат не
обладает способностью к кумуляции. При применении дипривана для
индукции в обычных дозах A,5—2 мг/кг) наблюдают снижение АД.
Существует пропорциональная зависимость между степенью снижения АД и
возрастом пациента. При введении клинически эффективной дозы про-
пофола наблюдают тенденцию к брадикардии из-за ваготонического
действия препарата.
Эти эффекты пропофола можно намеренно использовать при
выраженной тахикардии и артериальной гипертензии. Для уменьшения
побочных эффектов дипривана во время индукции в наркоз обосновано
введение кетамина, вызывающего тахикардию с повышением АД. Такое соче-
116
тание позволяет снизить дозы препаратов. При использовании дипривана
для индукции его необходимо вводить фракционно (примерно 40 мг
каждые 10 с) до появления клинических признаков медикаментозного сна. В
пожилом возрасте и у ослабленных пациентов вводят более низкие дозы
B0 мг каждые 10 с). В тех случаях, когда диприван применяют по
методике постоянной, а не болюсной инфузии, необходимо использовать перфу-
зоры или инфузоматы, чтобы осуществить контроль за скоростью
введения. Через несколько минут после прекращения инфузии пропофола
восстанавливается сознание, быстро активизируется моторная функция, что
характеризует препарат как универсальный по сравнению со всеми
известными гипнотиками. Это особенно важно в эндохирургии. Можно
рекомендовать следующую схему использования дипривана.
Таблица 6-1
Внутривенная общая анестезия с сохранением самостоятельного дыхания
Этап анестезии
Индукция
Поддержание
анестезии
Препарат
диприван
1,4—1,5 мг/кг
5 мг/кг • ч
кетамин
0,4-0,5 мг/кг
1 мг/кг • ч
фентанил
0,001-0,002 мг/кг
0,003-0,004 мг/кг • ч
Таблица 6-2
Внутривенная общая анестезия с ИВЛ
Этап
анестезии
Индукция
Миорелакса-
ция перед
интубацией
Поддержание
анестезии
Тотальная
миоплегия
Препарат
диприван
1,9-2,0 мг/кг
5—6 мг/кг • ч
кетамин
0,5-0,8 мг/кг
1,0-1,2
мг/кг • ч
фентанил
0,002-0,004
мг/кг
0,003-0,004
мг/кг • ч
миорелаксант
Первоначально
деполяризующий —
15-20%
терапевтической дозы,
затем
деполяризующий из расчёта 3
мг/кг
Недеполяризующий
в терапев-
тическойдозе, либо
деполяризующий
(болюсно)
117
Перидуральная анестезия
У пациентов с выраженными сопутствующими заболеваниями
сердечнососудистой и лёгочной систем предпочтение следует отдавать перидуральной
анестезии (ПА). Особенности ПА состоят в следующем:
1. Надёжная анальгезия и гипорефлексия.
2. Торможение гормональной гиперактивности хромаффинной ткани
мозгового вещества надпочечников.
3. Снижение синтеза миокардиального депрессивного фактора.
4. Увеличение пластичности и уменьшение вязкости крови.
5. Увеличение линейной и объёмной скоростей кровотока.
6. Активация спонтанного фибринолиза и устранение
гиперкоагуляции (если она есть).
7. Снижение тонуса артериальных сосудов, пред- и постнагрузки на
сердце.
ПА выполняет подготовленный анестезиолог-реаниматолог.
Техника перидуральной анестезии
1. На фоне премедикации катетеризируют периферическую, а по
показаниям — центральную вену.
2. Пациента укладывают на бок с согнутыми в коленях и максимально
приведёнными к животу нижними конечностями. Голова прижата к груди
(рис. 6-2).
3. Обрабатывают кожу спины антисептическими растворами.
4. Для обезболивания кожи и создания «лимонной корочки» используют
тот же анестетик, что и для последующей ПА.
Рис. 6-2. Положение больного при
выполнении ПА.
Рис. 6-3. Пункция перидурального
пространства.
118
5. Специальной иглой с мандреном пунктируют кожу, подкожную
клетчатку, надостную, межостную и жёлтую связки (рис. 6-3). Левая кисть врача
прилежит тыльной стороной к коже пациента, а большой и указательный пальцы
фиксируют иглу. Правой рукой врач продвигает иглу «шагами» по 2—3 мм,
периодически извлекая мандрен и проверяя шприцем сопротивление тканей.
Важно, чтобы основание иглы упиралось в правую ладонь, а большой и
указательный пальцы помогали движению иглы к перидуральному пространству.
6. При попадании иглы в перидуральное пространство сопротивление
тканей резко уменьшается, пузырь воздуха в шприце не сжимается при
надавливании на поршень. Физиологический раствор свободно поступает в полость.
7. Для дополнительной идентификации перидурального пространства
вводят тестовую дозу анестетика. Она равна количеству, необходимому для
достижения спинномозговой анестезии. Если через 5 мин не наступает субарахнои-
дальная блокада, можно предположить, что игла в перидуральном
пространстве. Инфузируют расчётную дозу анестетика с 0,15—0,25 мг адреналина C-5
капель).
8. Если предполагаемая продолжительность операции более 1 ч,
перидуральное пространство катетеризируют.
9. Атараксии (поверхностного сна) достигают в/в введением либо диазе-
пама (седуксена, реланиума), начиная с общей дозы 2,5 мг, либо натрия окси-
бутирата из расчёта 50—60 мг/кг, либо кетамина 0,7—1,0 мг/кг. При этих дозах
успешно проходят операции на органах нижнего этажа брюшной полости и
малого таза. В случае появления выраженного плечелопаточного синдрома во
время инсуффляции газа необходимо достичь быстрой амнезии увеличением
дозы кетамина до 1 мг/кг. По ходу всей операции больному постоянно подают
кислородно-воздушную смесь, содержащую 60—80% О2. В случае депрессии
или остановки дыхания проводят ИВЛ через маску наркозного аппарата. В тех
случаях, когда не удаётся обеспечить оптимальные условия для работы
хирурга, особенно в случае конверсии, интубируют трахею на фоне введения миоре-
лаксантов при полной амнезии больного.
10. При операциях на верхнем этаже брюшной полости после
наступления ПА достигают полной амнезии и миорелаксации. Операцию начинают в
условиях ИВЛ.
11. Сочетание ПА с диприваном необоснованно, так как может вызвать
гипотензию и брадикардию с последующими осложнениями.
Мониторинг
Принято определять лапароскопическую хирургию как малоинвазивную.
Действительно, хирургическое вмешательство менее агрессивно, чем при
традиционной лапаротомии, но на этом преимущества заканчиваются.
Хирургическое пособие не менее трудно и требует большего опыта, задача же
анестезиолога гораздо сложнее, чем при обычной лапаротомии. Физиопатологические
119
эффекты лапароскопии нельзя назвать несущественными, поэтому
необходимо наличие специфического анестезиологического опыта совместно с более
внимательным и постоянным клиническим наблюдением и мониторингом
сердечно-сосудистой и дыхательной систем. Обычно мониторинг неинвазивен и
включает регистрацию следующих параметров:
1. ВБД.
2. Сердечные шумы (аускультативно).
3. ЭКГ, АД.
4. Частота дыхания, минутный объём, дыхательный объём, давление
дыхательных путей (пиковое и платовое давление), содержание кислорода
во вдыхаемой смеси.
5. Давление N2O в конце выдоха, давление СО2 в конце выдоха; в
отдельных случаях — чрескожное давление СО2, газовый состав крови.
Анестезия при торакоскопических вмешательствах
Анестезия при торакоскопических операциях (ТО) имеет свои особенности.
1. Операции выполняют в условиях открытого пневмоторакса.
2. Необходима однолёгочная вентиляция, так как препаровка тканей
при экскурсии лёгкого сложна и опасна.
3. Часто при выполнении ТО больной лежит на боку.
Методика проведения анестезии при ТО мало отличается от
обезболивания в открытой торакальной хирургии. При интубации используют трубку для
раздельной вентиляции обоих лёгких. Перед введением первого торакопорта
переходят на однолёгочную вентиляцию.
При ТО допустимо, но нежелательно использование ингаляционного
анестетика, так как эти препараты обедняют кислородно-воздушный поток, что
особенно важно при однолёгочной вентиляции. Предпочтение отдают
внутривенной общей анестезии с ИВЛ.
Возможно проведение внутривенной общей анестезии с ВЧ ИВЛ, а также
ПА в сочетании с традиционной ИВЛ. При ВЧ ИВЛ экскурсия лёгких резко
уменьшена или вообще незаметна, что позволяет избежать однолёгочной
вентиляции. Следует помнить, что для ВЧ ИВЛ в конце операции характерны высокая
оксигенация (рО2 более 150 мм рт.ст.) и нарастание рСО2 до 50—60 мм рт.ст.
ОСЛОЖНЕНИЯ И ИХ ПРОФИЛАКТИКА
Газовая эмболия
Газовая эмболия — крайне тяжёлое, но редкое осложнение
лапароскопии, наблюдаемое с частотой 1—2 случая на 10 000 операций. Чаще возникает в
первые минуты операции. Наименее вероятна эмболия при использовании для
инсуффляции СО2, быстро растворяющегося в крови. Возможны два
механизма развития газовой эмболии.
120
1. Прямая пункция иглой Вереша того или иного сосуда с последующим
введением газа непосредственно в кровеносное русло. При ранении
крупного забрюшинного сосуда эмболии сопутствует массивное кровотечение.
2. Если во время операции на фоне напряжённого ПП происходит
ранение вены, газ попадает в сосудистое русло через зияющий дефект
(например, в области ложа жёлчного пузыря).
В настоящее время случаи газовой эмболии чаще связаны с
использованием лазера, наконечник которого охлаждают потоком газа, способного
проникать в просвет пересекаемых сосудов. Большинство случаев газовой
эмболии наблюдают у повторно оперируемых пациентов со спаечным процессом в
брюшной полости. Вероятно, наложение ПП приводит к разрыву некоторых
спаек и появлению зияющих сосудов.
Диагноз. Клинические признаки газовой эмболии.
а. Внезапная гипотензия.
б. Цианоз.
в. Сердечная аритмия.
г. Гипоксия.
д. Наличие при аускультации классического булькающего
водно-воздушного шума «мельничного колеса».
е. Расширение комплекса QRS на ЭКГ.
ж. Возможно развитие отёка лёгких.
В зависимости от количества и скорости распространения СО2 в
кровотоке клинические проявления осложнения различны: от недиагностированного
(небольшие пузырьки, элиминирующиеся дыхательной системой) до резкого
падения сердечного выброса (нарушение венозного возврата к правым отделам
сердца).
Смерть может наступить внезапно от возникновения лёгочного сердца
(введение в кровоток 25—30 мл СО2/кг/мин). Введение до 200 мл углекислого
газа в/в проходит без каких-либо осложнений; большие объёмы газа могут
иметь фатальные последствия. Сердечные сокращения разбивают газ на
мелкие пузырьки, образующие пену, при достижении малого круга
кровообращения создающую лёгочную гипертензию. Эмболы газа блокируют лёгочные
артериолы, увеличивая альвеолярное «мёртвое пространство». Последующая
клиническая картина вызвана прохождением пузырьков газа из малого в
большой круг кровообращения, что проявляется симптомами, наблюдаемыми при
эмболии артерий.
Дифференциальная диагностика. Исключают внутрибрюшное кровотечение,
пневмоторакс, инфаркт миокарда, тромбоэмболию (ТЭ) лёгочной артерии, ва-
зовагальные рефлексы и другие причины сердечно-сосудистого коллапса.
Важно раннее определение изменений рСО2 Возможен как резкий подъём
его даже при эмболии средней тяжести, так и неожиданное падение, связанное
с острой правожелудочковой недостаточностью в результате массивной эмбо-
лизации, при которой кровь не достигает лёгких. Как правило, это состояние
приводит к летальному исходу.
121
Лечение газовой эмболии
1. Немедленная десуффляция.
2. Проведение ИВЛ чистым кислородом.
3. Создание положения Дюранта (Тренделенбурга на левом боку).
4. Немедленная пункция верхней полой вены с проведением
катетера в правое предсердие и желудочек, аспирация газа вместе с кровью.
После дегазации кровь можно инфузировать.
5. В случае асистолии — прямой массаж сердца с одновременной
пункцией его правых отделов с целью удаления газа.
Описано успешное лечение почти фатальной газовой эмболии при
лапароскопии и гистероскопии с применением искусственного кровообращения [9].
Тромботические осложнения
Как было показано в предыдущей главе, повышенное ВБД при
лапароскопии приводит к компрессии нижней полой вены, ограничивает венозный
возврат из нижних конечностей. Не меньшую роль в тромбообразовании
играет и гиперкоагуляция. Повышение свёртываемости крови через сутки после
ЛХЭ было показано на тромбоэластограмме. Послеоперационный ответ был
сходен с таковым после открытой операции [10]. Поэтому ЛХЭ, хотя её и
считают малотравматичной операцией, как и традиционная холецистэктомия,
индуцирует послеоперационную гиперкоагуляцию. Возможно, это отражает
реакцию организма на общее обезболивание, операционную травму в
сочетании с факторами, вызывающими венозный стаз. Пока нет достоверных
статистических данных, позволяющих сравнить частоту ТЭ лёгочной артерии после
открытой операции и ЛХЭ.
К факторам риска ТЭ относят возраст старше 60 лет, ожирение,
злокачественное новообразование, тромбофлебит нижних конечностей в анамнезе,
продолжительность лапароскопической операции более 2 ч [11].
Профилактика ТЭ. В Заявлении Европейской Согласительной
Конференции по предотвращению ТЭ в хирургии A992 г.) были рекомендованы
следующие меры в зависимости от категории риска (табл. 6-3). Рекомендации
относятся как к открытой, так и к лапароскопической хирургии [31].
К низкой категории относят пациентов, имеющих не более 1 балла по
табл. 6-4, к средней — имеющих 2—4 балла, к высокой — имеющих более 4
баллов.
122
Таблица 6-3
Рекомендации по предотвращению тромбоза вен в хирургии
Категория риска Рекомендация
Низкая Можно использовать компрессионные гольфы, эластические
чулки и бинты
Средняя Перемежающаяся пневматическая компрессия, низкие дозы
гепарина или фраксипарина
Высокая Перемежающаяся пневматическая компрессия, гепарин или
фраксипарин
Таблица 6-4
Оценка факторов риска тромбоза вен и ТЭ лёгочной артерии
Возраст 41—60 лет
Возраст 61-70 лет B балла)
Возраст старше 70 лет C балла)
Ожидаемый постельный режим более 72 ч
ТЭ и тромбоз вен в анамнезе C балла)
Варикозное расширение вен нижних конечностей
Ожирение (более 20% нормальной массы тела)
Хирургические операции в анамнезе
Иммобилизация более 72 ч до операции
Инфаркт миокарда
Сердечная недостаточность
Инсульт в анамнезе
Сепсис
Лапароскопическая операция с ПП в положении Фаулера (более 1 ч)
ХОЗЛ
Операции на органах таза
Перелёт на самолёте продолжительностью более 4 часов в первые 6 сут после
операции
Перелом костей таза или крупных трубчатых костей
Отёки нижних конечностей, трофические язвы, лимфостаз
Опухоли
Беременность или послеродовой период (до месяца)
ТЭ или тромбоз вен у родственников
Гормонотерапия
Предполагаемая продолжительность операции более 2 ч
Повышенная свёртываемость крови
Общее количество баллов
Примечание. Необходимо выбрать все подходящие факторы, каждый из которых оценивают
в 1 балл, если нет дополнительного обозначения.
123
Существует несколько методов профилактики тромбозов.
Фармакологические средства: гепарин, фраксипарин, пероральные
антикоагулянты и декстран. В Европе предпочтение отдают
медикаментозной профилактике.
Гепарин, введённый до операции п/к в малых дозах E000 ЕД каждые
8—12 ч), эффективен для профилактики тромботических
осложнений. Хотя и существует небольшой риск кровотечений, метод
достаточно безопасен. Пероральные антикоагулянты и декстран менее
эффективны. Тем не менее хирурги достаточно неохотно
соглашаются на дооперационное введение гепарина при лапароскопических
операциях.
Фраксипарин. В последнее время предпочтение отдают фраксипари-
ну (низкомолекулярному гепарину). Его антитромботическая
активность выше и антикоагулирующее действие слабее, чем
классического гепарина. Первую инъекцию @,3 мл) делают за 2—12 ч до
операции, последующие — по 0,3 мл 2 раза/сут п/к в ткани передней
брюшной стенки.
Физикальные методы, такие как эластические гольфы и
пневматическая компрессия, более популярны в США. Физикальные методы
направлены на устранение венозного стаза, с другой стороны, пневматическая
компрессия стимулирует эндогенный фибринолиз. Метод безопасен и
особенно уместен у пациентов с вероятным кровотечением или
противопоказаниями для введения антикоагулянтов [12, 13].
В каких случаях в эндохирургии нужны специальные методы
профилактики ТЭ? По имеющейся информации, однозначного ответа пока нет. Однако
уже накоплено достаточно фактов, доказывающих, что в эндохирургии
существуют следующие факторы риска, ведущие к ТЭ после операции:
1. Общая анестезия с ИВЛ.
2. Положение пациента с приподнятым головным концом.
3. Напряжённый ПП.
4. Пожилой возраст.
5. Продолжительность операции более 2 ч.
Европейская Конференция заключила, что профилактика должна
соответствовать тяжести заболевания и степени риска. Например, 30-летней
нетучной женщине она, вероятно, не нужна. С другой стороны, 75-летнего больного
с острым холециститом, длительным постельным режимом и тромбофлебитом
в анамнезе безусловно следует отнести к высокой степени риска ТЭ. Хирурги,
применявшие вышеуказанные меры профилактики, отмечают резкое
снижение частоты гемокоагуляционных расстройств после эндохирургических
вмешательств [14—32].
124
Ишемические осложнения
Одно из редких, но зачастую фатальных осложнений лапароскопии —
ишемия внутренних органов, практически не встречающаяся в открытой
хирургии. Первое сообщение о фатальной ишемии кишечника поступило в
начале 1994 г., когда у 68-летнего мужчины на 4-й день после ЛХЭ развился
тромбоз сосудов в бассейне верхней брыжеечной артерии с некрозом всей тонкой и
правой половины толстой кишки. Больной погиб после нескольких операций
от септических осложнений. К этому моменту авторы имели два аналогичных
наблюдения после ЛХЭ и ушивания хиатальной грыжи. Впервые было
высказано предположение о возможной связи напряжённого ПП с ишемией
кишечника [33]. В последующем было описано несколько случаев некроза желудка,
пищевода, печени и кишечника после ЛХЭ и фундопликаций по Ниссену.
Смертность составила 85%.
Патогенез. По мнению многих авторов, ишемические расстройства в
лапароскопии могут непосредственно быть связаны с карбоксиперитонеумом.
При этом возможно сочетание нескольких взаимоотягощающих факторов.
1. Прямая компрессия. Доказано, что получасовой ПП с ВБД 16 мм
рт.ст. на 24% уменьшает кровоток в верхней брыжеечной артерии.
Описано снижение органного кровотока в печени и почках.
2. Сдавление нижней полой вены в сочетании с изменением
положения тела (Фаулера) приводит к депонированию крови, уменьшению
сердечного выброса на 30% и снижению органного кровотока.
3. Гиперкапния, связанная с адсорбцией СО2, сама по себе приводит
к спазму мезентериальных сосудов.
4. Выброс вазопрессина представляет физиологический ответ на ин-
суффляцию СО2.
5. Сопутствующая сосудистая патология в виде атеросклероза или
врождённого сужения устья верхнебрыжеечной артерии увеличивает риск ме-
зентериального тромбоза.
Профилактика. Предотвращение ишемических расстройств состоит в
разработке комплекса профилактических мероприятий и выделении группы
риска, хотя нарушение органного кровотока может развиться и у молодых
пациентов без сопутствующих заболеваний.
Факторы риска
1. Возраст старше 60 лет.
2. Предполагаемая продолжительность операции более 2 ч.
3. Инсульт, инфаркт миокарда, гипертензия и другая сосудистая
патология в анамнезе.
4. Злокачественные опухоли.
5. Повышенная свёртываемость крови.
125
Paul и др. для этой группы пациентов рекомендуют использовать
периодическую декомпрессию брюшной полости по ходу операции. Давление в
брюшной полости следует поддерживать на минимальном уровне, путём
гипервентиляции предотвращать гиперкапнию.
По мере расширения показаний к лапароскопическим процедурам
возрастает количество пациентов пожилого и старческого возраста с
сопутствующими заболеваниями сердечно-сосудистой системы. Расширение спектра
вмешательств в сторону более сложных операций на кишечнике, желудке, сосудах и
органах забрюшинного пространства неизбежно приведёт к увеличению их
продолжительности, а значит, и риску ишемических нарушений, летальность
при которых достигает 70—90%. Один из способов предотвращения
ишемических и других осложнений, связанных с наложением ПП, — дальнейшее
развитие техники безгазовой лапароскопии [34—41].
126
Общие осложнения
лапароскопии
Хотя эндохирургию называют малоинвазивной и малотравматичной
технологией, она остаётся хирургией — специальностью, в которой встречаются
ошибки, неудачи и осложнения.
Осложнения разделяют на две группы.
1. Осложнения, связанные с характером заболевания и видом
выполняемой операции, т.е. присущие аналогичным вмешательствам в
открытой хирургии (например, кровотечение из сегментарной артерии после
торакоскопической лобэктомии или несостоятельность анастомоза после
резекции желудка).
2. Специфические осложнения, присущие только эндохирургической
технологии и не встречающиеся в открытой хирургии (например, троакар-
ные ранения забрюшинных сосудов или венозный стаз вследствие ПП).
В данной главе мы разберём специфические осложнения лапароскопии,
связанные с введением иглы, троакаров и инсуффляцией газа.
1. Экстраперитонеальная инсуффляция.
а. Подкожная эмфизема.
б. Пневмооментум.
в. Пневмомедиастинум.
г. Пневмоторакс.
2. Повреждение сосудов передней брюшной стенки.
3. Повреждение внутренних органов.
4. Повреждение крупных забрюшинных сосудов.
5. Образование грыж.
Тромботические, ишемические осложнения эндохирургии, а также
газовая эмболия подробно описаны в главе 6.
В 50-е годы неоднократно были описаны случаи пункции иглой Берета
патологически изменённого органа (например, увеличенной правой доли
печени). Воздух проникал в вены печени, сердце, лёгочную артерию, вызывал
воздушную эмболию и немедленную смерть.
Калък в книге, изданной в 1962 г., на 6129 исследований описал 2
летальных исхода. Один в результате кровотечения после ранения варикозно-расши-
ренных вен брюшной стенки при циррозе печени, второй в момент создания
ПП на фоне сердечной декомпенсации. Среди других осложнений описано 3
прокола поперечной ободочной и 4 — сигмовидной кишки. Все больные
поправились без операции [1].
129
Хендли в 1956 г. опубликовал данные о 4606 лапароскопических
исследованиях. 10 больных погибли, в 7 случаях после биопсии печени F от кровотечения
и 1 от жёлчного перитонита), в 3 других случаях: 1 от перитонита, 1 после
перфорации кишки и 1 от сердечно-сосудистой недостаточности [цит. по 2].
Виттман в 1966 г. описал 2 случая жёлчного перитонита после
прицельной пункции печени [2]. На его взгляд, осложнения — результат
расширенных показаний и неправильной техники исследования. В то время 25%
публикаций было посвящено проблеме осложнений, а в остальных они также
упоминаются.
Перфорация кишки в середине XX века не была редким осложнением,
особенно у хирургов, не пользовавшихся иглой Вереша для создания
«воздушной подушки». Олим A941 г.) на 150 лапароскопических исследований имел 3
таких осложнения. Все больные поправились после немедленной лапаротомии
[цит. по 2].
Хартлейб A955 г.) сообщил о двух случаях газовой эмболии с летальным
исходом. Это типичный пример дискредитации методики. В обоих случаях
место для наложения ПП было избрано в правом подреберье. После введения 40
мл воздуха наступила внезапная смерть. Вскрытие показало, что в обоих
случаях игла попала в увеличенную правую долю печени. Врач вводил воздух в
печень, откуда газ через внутрипечёночные вены и нижнюю полую вену попал в
сердце и лёгкие [цит. по 2].
ЭКСТРАПЕРИТОНЕАЛЬНАЯ ИНСУФФЛЯЦИЯ
Экстраперитонеальная инсуффляция подразумевает попадание газа в
различные ткани помимо брюшной полости (в подкожную, пред- и забрюшинную
клетчатку, в большой сальник или брыжейку) либо развитие таких
осложнений, как пневмомедиастинум или пневмоторакс.
1. Подкожная эмфизема проявляется в виде припухлости и крепитации в
подкожной жировой клетчатке. Частота её возникновения при лапароскопии
варьирует от 0,43 до 2% [3].
Причины
а. Наиболее частая причина — нагнетание газа через иглу Вереша в
ткани передней брюшной стенки либо неисправность инсуффлятора с
неконтролируемым повышением ВБД.
б. В другом случае газ попадает под кожу из брюшной полости через
троакарные отверстия после случайного извлечения плохо
фиксированных троакаров или в результате неполной десуффляции в конце операции.
Распространённость подкожной эмфиземы зависит от объёма газа,
введённого экстраперитонеально. Эмфизема может достигнуть тканей шеи, лица либо
продвигаться в каудальном направлении (пневмоскротум). Однако чаще она
окружает зону введения троакара. Широкое рассечение париетальной
брюшины (лапароскопическое грыжесечение) или высокое ВБД (неисправность
инсуффлятора) также ведёт к возникновению эмфиземы.
130
Обычно подкожная эмфизема безопасна, существенно не беспокоит
пациентов и самостоятельно рассасывается через 2-3 сут после операции. В
некоторых случаях газ можно эвакуировать подкожным введением иньекцион-
ных игл.
Профилактика. Точное соблюдение правил введения иглы и наложения
ПП, включая все перечисленные пробы, — лучший способ профилактики
этого осложнения.
2. Предбрюшинное введение газа через иглу Вереша отслаивает брюшину
от тканей брюшной стенки и создаёт патологическое пространство
значительных размеров, в которое и попадают троакар с лапароскопом (рис. 7-1).
Свободная брюшная полость на экране монитора отсутствует, видна
неповреждённая брюшина. Последующая пункция париетальной брюшины
затруднительна, поэтому для продолжения операции лучше избрать способ
открытой лапароскопии.
3. Пневмооментум — введение газа в толщу клетчатки большого сальника.
Это осложнение можно заподозрить во время инсуффляции: так как газ
приподнимает брюшную стенку асимметрично, не исчезает печёночная тупость.
После введения лапароскопа видно, что всё пространство в брюшной полости
занимают вздувшиеся пряди сальника.
Эмфизема большого сальника проходит самостоятельно через 10—15 мин,
освобождая необходимое пространство. Описаны случаи разрыва сальника
газом с развитием внутрибрюшного кровотечения.
Предбрюшинное
пространство
Брюшина
Рис. 7-1. Предбрюшинное введение газа создаёт патологическое пространство и затрудняет
продолжение операции.
131
4. Пневмомедиастинум — попадание газа в средостение. Предбрюшинное
введение СО2 может привести к его распространению загрудинно в переднее
средостение и выше, по направлению к шее, где газ образует плотный
«воротник». Первым об этом сигнализирует анестезиолог. Частота этого осложнения
0,03-0,08% [3].
Пневмомедиастинум может возникнуть после рассечения брюшины в зоне
пищеводного отверстия диафрагмы во время лапароскопической фундоплика-
ции, кардиомиотомии или селективной проксимальной ваготомии (СПВ). Эти
операции следует выполнять под небольшим давлением ПП A0—12 мм рт.ст.).
Серьёзные нарушения сердечной деятельности и дыхания наблюдают
редко, хотя в литературе описаны случаи сдавления трахеи, крупных бронхов и
тампонады сердца (рис. 7-2). В этой ситуации газ из брюшной полости
немедленно удаляют до выяснения причины пневмомедиастинума. В тяжёлых
случаях показаны мероприятия, направленные на ликвидацию напряжённого пневмо-
Рис. 7-2. Возможные пути распространения газа в средостении, перикардиальном пространстве и
плевральной полости во время лапароскопии. А1 — диафрагмальная грыжа, А2 — плевропери-
кардиалъная мембрана, A3 — перикардиоперитонеалъный канал, Б1 — параэзофагеальная грыжа,
Б2 — попадание газа из средостения в плевральную полость через лёгочные ворота, БЗ —
попадание газа из средостения в полость перикарда вдоль сосудов, В1 — проникновение газа
между волокнами диафрагмы или вдоль крупных сосудов в заднее средостение, В2 —
подкожная эмфизема и попадание газа в переднее средостение, Г — баротравма, разрыв ткани
лёгкого или бронха с попаданием газа в плевральную полость или средостение.
132
медиастинума (подкожное введение инъекционных игл или кожные разрезы в
области яремной вырезки).
5. Пневмоторакс — попадание газа в плевральную полость. Напряжённый
пневмоторакс — весьма опасное осложнение. В лапароскопической хирургии
возможны четыре основные причины его развития.
1. Лапароскопия при торакоабдоминальных ранениях со сквозным
повреждением диафрагмы и возникновением прямого сообщения между
брюшной и плевральной полостью.
2. Ятрогенное сквозное ранение диафрагмы (например, при
неосторожном выделении дна жёлчного пузыря электрохирургическим крючком
при ЛХЭ).
3. Разрыв медиастинальной плевры при операциях по поводу грыжи
пищеводного отверстия диафрагмы на фоне напряжённого ПП.
4. Спонтанный пневмоторакс по ходу интубационного наркоза с ИВЛ.
Чаще наблюдают у больных с ХОЗЛ.
Как считают B.C. Савельев и соавт., лишь в редких случаях можно
предположить распространение воздуха в плевральную полость или средостение по
физиологически «слабым местам» диафрагмы (область аорты, нижней полой
вены, пищевода) [4].
Клинические проявления пневмоторакса.
1. Дыхательная и сердечно-сосудистая недостаточность.
2. Цианоз.
3. Тахикардия.
4. Гипотензия.
5. Ослабление дыхания на стороне поражения, тимпанит при перкуссии.
6. Снижение рО2.
7. Повышение давления в дыхательных путях.
8. Снижение оксигенации артериальной крови.
Для подтверждения диагноза и разрешения напряжённого пневмоторакса
немедленно пунктируют плевральную полость, из которой под давлением
выходит газ. ПП временно ликвидируют до выяснения причины пневмоторакса.
6. Пневмоперикард опасен развитием тампонады сердца с типичным симп-
томокомплексом.
ПОВРЕЖДЕНИЕ СОСУДОВ ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ
Это осложнение может привести к массивному наружному или
внутреннему кровотечению. Частота поражения сосудов передней брюшной стенки по
данным литературы варьирует в пределах 0,05—2,5% [5]. В принципе,
кровотечение, которое может возникнуть при лапароскопии, менее выражено, чем в
открытой хирургии из-за тампонирующего эффекта ПП. Чаще повреждают
нижнюю эпигастральную артерию или её ветви. Основные причины —
неправильный выбор точки и направления введения троакара, аномалии расположения
сосудов брюшной стенки или их варикозное расширение.
133
Наиболее безопасна для пункции белая линия живота. При введении
троакаров в другие точки брюшной стенки следует помнить о топографии верхних
и нижних эпигастральных сосудов (рис. 7-3), проходящих в предбрюшинной
клетчатке на 3—4 см латеральнее белой линии живота и почти параллельно ей.
Стилет троакара повреждает эти сосуды в момент прохождения брюшины в тех
случаях, когда раневой канал косо пересекает брюшную стенку и кожный
прокол не совпадает с точкой рассечения брюшины (рис. 7-4).
Риск повреждения сосудов возрастает при варикозном расширении вен
брюшной стенки на фоне цирроза печени. Диафаноскопия (просвечивание
лапароскопом) позволяет осмотреть сосуды, расположенные подкожно.
Симптомы. Краевое ранение сосуда обычно приводит к развитию
гематомы передней брюшной стенки либо проявляет себя наружным или
внутренним кровотечением.
Диагностика кровотечения из инструментальных доступов B, 3-й и
т.д.) не представляет сложности. Кровотечение из первого прокола можно
заподозрить по «замутнению» оптики или образованию «лужицы» крови
на сальнике под точкой прокола.
Лечение. Кровотечение из подкожной клетчатки или мышц
останавливают наружным прошиванием мягких тканей вокруг троакара. Зону
введения первого троакара изнутри осматривают через другой доступ. При
повреждении предбрюшинных сосудов используют специальную технику
прошивания скорняжной иглой (рис. 7-5).
Рис. 7-3. Проекция эпигастральных
сосудов на переднюю брюшную стенку.
Рис. 7-4. Кровотечение при повреждении
нижней эпигастральной артерии
троакаром.
134
Иглой с заряженной нитью
вдоль троакара прокалывают
брюшную стенку. Эндохирургическим
инструментом освобождают нить из
ушка иглы, последнюю извлекают
наружу и вводят в брюшную полость
с противоположной стороны
троакара. Заряжают нить в ушко иглы,
извлекают её наружу. Эта техника
позволяет прошить ткани брюшной
стенки на всю толщину. Нить
завязывают. Данный приём при
необходимости повторяют несколько раз,
что обеспечивает полный гемостаз.
Такой же шов можно наложить,
используя прямую атравматическую
эндохирургическую иглу (рис. 7-6).
Наиболее простой, но травматичный
способ гемостаза — выполнение ми-
кролапаротомии над повреждённым
сосудом.
Троакар в конце операции следует
извлекать под контролем зрения, так как
после прекращения компрессии
кровотечение из раневого канала может
возобновиться.
Рис. 7-5. Скорняжная игла.
Рис. 7-6. Прошивание брюшной стенки ат-
равматической иглой.
ПОСЛЕОПЕРАЦИОННЫЕ ГРЫЖИ
Это осложнение чаще наблюдают при использовании троакаров
диаметром 10 мм и более. Частота его варьирует от 0,23 до 3,1% [3]. Как правило,
формирование грыжи — результат неадекватного ушивания тканей брюшной
стенки на фоне ожирения. Обычное грыжевое содержимое — прядь сальника
или кишка. Заболевание проявляет себя локальным болевым синдромом или
признаками кишечной непроходимости.
Профилактика формирования грыж.
1. В конце операции воздух из брюшной полости удаляют до
извлечения троакаров.
2. В момент извлечения троакаров релаксация должна быть безупречна.
3. Все 10-миллиметровые отверстия следует полноценно ушивать, с
особым вниманием — у тучных пациентов.
135
ПОВРЕЖДЕНИЯ ВНУТРЕННИХ ОРГАНОВ
Данные о частоте повреждения внутренних органов иглой Вереша и
троакарами при лапароскопических операциях весьма противоречивы. По
данным зарубежной сводной статистики (более 200 000 ЛХЭ и гинекологических
вмешательств), частота этих осложнений составляет 3 на 1000 операций. Из
них 82%, примерно поровну, приходится на слепой этап вмешательства —
введение иглы Вереша и первого троакара. Частота повреждений кишки
составляет 0,27% [б].
Заслуживают внимания данные канадских гинекологов, которые на 135 997
лапароскопических вмешательств наблюдали 274 таких повреждения.
Большинство ранений C9,8%) было нанесено иглой Вереша, 37,9% — первым троакаром
и 22,2% — последующими троакарами [7]. Удивляет последняя цифра, так как
эти инструменты следует вводить в брюшную полость под визуальным
контролем. Особо отмечено, что осложнения чаще наблюдали у хирургов, не
прошедших специального лапароскопического тренинга.
Из органов брюшной полости чаще страдают печень, кишечник, желудок,
мочевой пузырь. Обычно повреждают увеличенный в размерах орган (печень
при гепатомегалии, переполненный мочевой пузырь, вздутая петля кишки).
Нередко повреждения остаются нераспознанными по ходу лапароскопии и
проявляют себя позднее разлитым перитонитом, сепсисом или
формированием внутрибрюшных абсцессов. Смертность при ранении органов ЖКТ
составляет 5%. Основная причина повреждений — грубое нарушение правил
введения инструментов.
Нередко ранение происходит при наличии в брюшной полости спаечного
процесса, развившегося после:
— инфекционного заболевания (туберкулёзный перитонит, хламидиоз);
— лучевой терапии при онкологических заболеваниях органов брюшной
полости или забрюшинного пространства;
— перенесённых операций на органах брюшной полости.
Контакт иглы Вереша или стилета троакара с органом, свободно
перемещающимся в брюшной полости, как правило, не приводит к его повреждению.
Иная ситуация возникает при спаечном процессе, когда петля кишки или
желудок фиксирован к другим органам или к париетальной брюшине. Поэтому
при подозрении на спаечный процесс, наличии рубцов на коже в
непосредственной близости к точке введения иглы или троакара необходимо использовать
метод открытой лапароскопии, т.е. входить в брюшную полость строго под
контролем зрения. На наш взгляд, в этой ситуации безопасное расстояние
должно составлять не менее 10 см.
Это осложнение не удалось предотвратить внедрением одноразовых
троакаров с защитным колпачком. Ранение внутренних органов происходит
раньше, чем срабатывает защитное устройство.
Профилактика повреждений внутренних органов состоит в строгом
соблюдении классических правил наложения ПП, введения иглы Вереша и
троакаров. До начала инсуффляции необходимо установить назогастральный зонд,
а при операции на нижнем этаже брюшной полости — мочевой катетер. Ква-
136
лифицированное УЗИ до операции позволяет диагностировать спаечный
процесс вдоль париетальной брюшины.
Первичная пункция — иглой и троакаром — не представляет трудностей у
пациентов пожилого возраста, рожавших женщин, когда апоневроз в зоне
прокола истончён. У молодых больных спортивного телосложения преодолеть
сопротивление апоневротической ткани значительно сложнее. Наращивая
давление инструмента на ткани, хирург в определённый момент перестаёт
контролировать своё усилие. В этот момент кисть вместе с инструментом может
«провалиться» в брюшную полость и повредить внутренние органы или забрюшин-
ные сосуды. Поэтому при значительном сопротивлении апоневроза его следует
рассечь скальпелем на 3—4 мм, а затем иглой или троакаром свободно
проколоть брюшину. Не менее важна адекватная релаксация передней брюшной стенки
в момент слепого введения иглы и троакара. При малейшем сомнении в
правильности расположения иглы или кончика троакара следует перейти к методу
открытой лапароскопии.
ПОВРЕЖДЕНИЯ КРУПНЫХ ЗАБРЮШИННЫХ СОСУДОВ
Частота повреждений аорты, подвздошных артерий и нижней полой вены
в лапароскопии составляет 3—7 случаев на 10 000 операций. Погибают, по
данным различных источников, 10—56% больных. К 1995 г. в американской
литературе на 700 000 ЛХЭ было описано 25 случаев повреждений крупных забрю-
шинных сосудов @,03%). Из них погибли 5 пациентов [8]. Вероятно, частота
повреждений всё же выше. Так, некоторые авторы приводят 0,4% этих
осложнений [9]. В раде случаев повреждение сосудов сочетается с газовой эмболией.
Чаще повреждают аорту, нередки смешанные аортовенозные повреждения.
Первым проявлением осложнения нередко служит струя крови,
фонтанирующая через иглу Вереша или троакар. В других случаях массивное кровотечение
распознают по резкому падению АД. Особенно коварны ранения крупных
сосудов иглой Вереша, так как эти повреждения приводят к развитию огромных
забрюшинных гематом с минимальным количеством крови в брюшной полости.
Проявления повреждения крупных сосудов варьируют от
пульсирующего фонтана крови, поступающего наружу через троакар, до массивного
внутрибрюшного кровотечения. Чаще ранение сосуда распознают по
нарастающей гематоме корня брыжейки тонкой кишки.
Лечение. При подозрении на повреждение крупных сосудов, не
вынимая лапароскопических инструментов их брюшной полости,
выполняют немедленную лапаротомию и временный гемостаз прижатием.
Оставленный инструмент помогает быстро сориентироваться в топографии
повреждения.
Профилактика. Все описанные в литературе случаи повреждения
крупных забрюшинных сосудов произошли при слепом проникновении в
брюшную полость, в том числе при использовании видеотроакара Visiport (Auto
Suture) [10]. И ни одного ранения — при технике Хассона. Поэтому
лучший способ профилактики данного осложнения — метод открытой
лапароскопии.
137
СПАЙКООБРАЗОВАНИЕ
Спаечный процесс — неизбежное следствие любой хирургической
операции. Спайки могут существовать бессимптомно или вызывать заболевание:
хроническую абдоминальную боль, нарушения моторики внутренних органов,
нарушение репродуктивной функции, острую кишечную непроходимость.
После чревосечения основные очаги спайкообразования — зона операции и лапа-
ротомный рубец, хотя спайки возникают и в других отделах брюшной полости.
Лапароскопический доступ позволил на 75% снизить частоту образования
спаек по следующим причинам.
1. Оперирование в замкнутом пространстве предотвращает
высушивание тканей.
2. Тампонирующий эффект ПП сопровождается гемостатическим
действием.
3. Исключены такие факторы, как «перчаточный сок», марлевая пыль,
мануальная травма.
Образование новых спаек после лапаротомного адгезиолизиса наблюдают
в 50% случаев, а после лапароскопического — только в 12%. Однако для
предотвращения спайкообразования в эндохирургии необходимо помнить о
нескольких базовых микрохирургических принципах.
1. Осторожное обращение с тканями.
2. Точный, своевременный и аккуратный гемостаз.
3. Многократное увеличение изображения объекта вмешательства для
обеспечения прицельного гемостаза.
4. Использование тонких инструментов и ареактивного шовного
материала.
Исследования на животных показали, что реперитонизация (ушивание
дефекта брюшины) провоцирует образование спаек, поэтому предпочтительно
оставление дефекта брюшины для самостоятельного заживления.
Восстановление целостности брюшины посредством ручного или механического шва
может вызвать ишемию тканей или воспалительную реакцию на инородний
материал, т.е. создать условия, предрасполагающие к спайкообразованию [11].
Способ рассечения тканей — лазер, ВЧЭХ, традиционный скальпель — не
влияет на частоту образования спаек. При ирригации с целью профилактики
спайкообразования путём разделения повреждённых поверхностей наилучшие
результаты получены после введения 500—1000 мл лактата Рингера.
138
8
Диагностическая
лапароскопия
Лапароскопия была разработана в начале века как метод диагностики
заболеваний органов брюшной полости и практически без особого развития
сохранилась до 60-х годов, когда Курт Земм. разработал технику оперативной
пельвиоскопии. Тем не менее и в настоящее время лапароскопия остаётся
ценным методом диагностики, позволяя выявить заболевание, избрать
правильную тактику, а иногда — перейти к радикальному вмешательству, не выполняя
чревосечения. Ещё в 1921 г. Корбш точно определил показания для этого
исследования: «Лапароскопию надо применять, если другие методы исследования не
помогают в диагностике, а с помощью лапароскопии мы будем видеть
изменения в органах» [1].
ПОКАЗАНИЯ
Плановая лапароскопия
1. Подозрение на злокачественные и доброкачественные опухоли
брюшной полости и забрюшинного пространства, которые невозможно
исключить другими, менее инвазивными методами исследований.
2. Стадирование злокачественных опухолей для определения
распространённости процесса.
3. Дифференциальная диагностика заболеваний печени.
4. Асцит неясной этиологии.
Экстренная лапароскопия
1. Острая или тупая травма живота для диагностики характера и
распространённости повреждений.
2. Подозрение на острую хирургическую патологию при неясной
клинической картине.
ПРОТИВОПОКАЗАНИЯ
Общие
1. Шок любой этиологии.
2. Острый инфаркт миокарда.
3. Острое нарушение мозгового кровообращения.
4. Нарушение свёртываемости крови.
5. Сердечно-сосудистая и лёгочная недостаточность в стадии
декомпенсации.
140
Местные
1. Разлитой перитонит.
2. Резкое вздутие кишечника.
3. Множественные свищи передней брюшной стенки.
Возраст пациента не считают противопоказанием к лапароскопии.
Исследование проводят как новорождённым, так и пациентам пожилого возраста.
Предоперационное обследование включает общеклинические анализы, ЭКГ
и определение показателей свёртывающей системы крови. В неотложной
ситуации спектр этих исследований может быть сокращён. Учитывают
противопоказания и выбирают способ обезболивания.
ОПЕРАТИВНАЯ ТЕХНИКА
Анестезия. Исследование проводят под местной анестезией,
внутривенным или интубационным наркозом. Выбор способа анестезии зависит от
соматического и психологического состояния больного с учётом предполагаемой
операционной программы. Местная анестезия менее травматична, однако в
условиях экстренной ситуации общее обезболивание даёт большие
возможности для управления функцией сердечно-сосудистой и дыхательной систем.
Релаксация мышц передней брюшной стенки улучшает обзор и повышает
диагностическую ценность процедуры. Варианты анестезии подробно описаны в
главе 6.
Пневмоперитонеум накладывают одним из известных способов. В
зависимости от диаметра лапароскопа вводят 5- или 10-миллиметровый троакар.
Диагностическую лапароскопию предпочтительно проводить с использованием
видеосистемы.
Осмотр органов брюшной полости начинают в горизонтальном
положении больного. Впоследствии для прицельного осмотра того или иного органа,
управляя операционным столом, создают положение Тренделенбурга, Фаулера,
на правом или левом боку.
Видеосистема — лапароскоп + камера + монитор — обеспечивает настолько
естественную передачу изображения, что цвет, контуры, взаиморасположение
органов мало отличаются от визуальной картины, воспринимаемой хирургом
при чревосечении. Поэтому для специалиста, имеющего опыт вмешательств в
открытой хирургии, интерпретация операционных находок, полученных с
видеомонитора, не представляет особых сложностей.
Как и в открытой хирургии, при лапароскопии необходимо соблюдать
определенную последовательность действий. Следует помнить, что в
конкретный момент в поле зрения попадает лишь незначительная часть брюшной
полости. Гарантия успеха диагностической лапароскопии — методичность.
Различают панорамный и прицельный осмотр отдельных органов и областей.
Панорамный осмотр позволяет получить общее представление о
состоянии органов брюшной полости, подтвердить наличие жидкости (кровь,
141
гной, серозный выпот), фибрина, спаечного
процесса, диссеменации злокачественной опухоли.
Оценивают прямые и косвенные признаки
заболевания. Иногда уже на этом этапе хирург
устанавливает предварительный диагноз (разлитой
перитонит, массивное внутрибрюшное
кровотечение) и определяет дальнейшую тактику
(продолжение операции лапароскопически, переход к ла-
паротомии).
Прицельный осмотр позволяет уточнить
диагноз, произвести биопсию. В некоторых случаях
для прицельного осмотра необходимо через
второй, 5-миллиметровый троакар, ввести
дополнительный инструмент (зажим, диссектор, ретрак-
тор), чтобы приподнять или отвести ткани. Инст-
Рис. 8-1. Последовательность ос- румент ВВ0Дят в точке, удобной для последующих
мотра брюшной полости при *J „ ^ J -
диагностической лапароскопии, манипуляции. Этот же доступ при необходимости
используют для аспирации жидкости и взятия
материала для биопсии. Очаг поражения следует осматривать в последнюю
очередь.
Осмотр брюшной полости проводят по часовой стрелке, начиная с
правого верхнего квадранта живота (рис. 8-1). Для удобства ревизии И. Вит-
тман предложил разделить брюшную полость на 6 условных секторов [1].
I сектор — правый верхний квадрант живота: правая доля печени,
правая половина диафрагмы, жёлчный пузырь, двенадцатиперстная
кишка, часть большого сальника, расположенные в этой зоне петли
кишечника. Слева эта область ограничена серповидной и круглой
связками печени.
II сектор — левый верхний квадрант живота: левая доля печени,
передняя стенка желудка, левая половина диафрагмы, часть большого
сальника и кишечника, селезёнка.
III сектор — брюшина левой половины живота.
IV сектор — малый таз с расположенными в нём органами (в
положении Тренделенбурга).
V сектор — брюшина правой половины живота.
VI сектор — основание брюшной полости: тонкая и толстая кишка,
большой сальник, слепая кишка, червеобразный отросток.
В лапароскопии существуют слепые зоны: место введения
лапароскопа, задняя стенка брюшной полости, некоторые органы,
расположенные мезо- и ретроперитонеально.
Осмотр проводят от здоровых органов к больным.
142
После окончания осмотра выбирают дальнейшую лечебную тактику:
завершение процедуры, биопсия или дренирование, лапароскопическое
выполнение радикальной операции, переход к лапаротомии.
Биопсия различных органов для последующего гистологического
исследования входит в комплекс диагностических мероприятий. Это биопсия печени,
ткани яичника, поражённого участка брюшины или других патологических
образований. Ещё 20—30 лет назад безопасность этой процедуры была
сомнительна. Например, после биопсии печени неоднократно наблюдали
смертельные кровотечения или желчеистечения с развитием перитонита.
Совершенствование инструментов и техники электрохирургического воздействия
позволило решить эту проблему.
В настоящее время биопсию выполняют диэлектрическими щипцами или
ножницами. После взятия кусочка ткани в случае геморрагии кровоточащий
участок сразу коагулируют, что предотвращает осложнение.
Аспирация жидкости из брюшной полости имеет как диагностическое, так
и лечебное значение. Её количество может варьировать от нескольких
миллилитров до нескольких литров. По характеру это могут быть асцитическая или
геморрагическая жидкость, воспалительный экссудат или кровь. Не во всех
случаях удаётся визуально определить её источник. Дифференциальной
диагностике помогают цитологическое исследование и бактериологический посев.
Послеоперационное ведение. Пациенты, как правило, легко переносят
диагностическую лапароскопию. Через 2 ч разрешают приём жидкой пищи.
Через сутки отменяют постельный режим. Дальнейшие ограничения диеты и
режима могут быть связаны лишь с основным заболеванием.
143
144
Рис. 8-2. Диагностическая лапароскопия при различных заболеваниях. А — острый гангренозный
холецистит, Б — смешанный цирроз печени, В — крупноузловой цирроз печени, Г —
неизменённый червеобразный отросток, Д — острый флегмонозный аппендицит, Е — острый
гнойный сальпингит, Ж — внематочная беременность, 3 — апоплексия яичника.
НЕУДАЧИ И ОШИБКИ
Лапароскопия, как и любой метод диагностики, имеет свои ограничения
и пределы разрешающей способности. Поэтому врач, производящий
исследование, должен чувствовать себя не «эндоскопистом» или «лапароскопистом», а
хирургом и клиницистом, не потерявшим умение анализировать все
симптомы, существующие у данного больного [2].
Неудачи, по мнению B.C. Савельева и соавт., — это такие
лапароскопические исследования, которые хирург либо не смог выполнить, либо полученные
данные оказались неинформативны [3], т.е. не была разрешена
диагностическая задача. Например, не удалось наложить ПП и создать необходимое
пространство у тучного больного или пациента с обширным спаечным процессом.
Либо возникли осложнения, потребовавшие приостановить процедуру. К
неудачам относят и те ситуации, когда диагноз в силу специфики заболевания не
был установлен при лапароскопии (например, при ретроцекальном
расположении червервеобразного отростка или забрюшинной опухоли). В этих случаях
диагностическая программа должна быть расширена выполнением лапарото-
мии или обратимой мобилизацией органа под контролем видеомонитора.
Ошибки диагностической лапароскопии связаны с ограничениями
метода, недостаточным опытом хирурга и неверной интерпретацией полученных
данных. Возможны ложноположительные и ложноотритцательные результаты.
В первом случае мы имеем гипердиагностику заболеваний, что приводит к
напрасной лапаротомии или бесполезному назначению лекарственных
препаратов [4]. Во втором, что ещё более опасно, — гиподиагностику, когда патология
остаётся нераспознанной и болезнь продолжает прогрессировать. В этом
случае любые диагностические сомнения должны быть решены в пользу экспло-
ративной лапаротомии. Осложнения диагностической лапароскопии подробно
описаны в главе 7.
145
9
Лапароскопическая
холецистэктомия
ВЫБОР СПОСОБА ЛЕЧЕНИЯ ЖЕЛЧНОКАМЕННОЙ БОЛЕЗНИ
Современная история лечения ЖКБ начитывает немногим более 100 лет с
момента, когда в 1882 г. Лангенбух выполнил первую холецистэктомию.
Прогресс в лечении этого заболевания до начала 70-х годов нашего столетия в
основном был связан с общим развитием медицины — открытием
антибиотиков, разработкой принципов общей анестезии, развитием лучевых методов
диагностики. Однако в последние десятилетия начался новый этап в лечении
холелитиаза. Особый интерес к этой проблеме связан с чрезвычайно высоким
ростом заболеваемости ЖКБ в развитых странах (каждое послевоенное
десятилетие этот показатель удваивается). 20 млн американцев имеют конкременты в
жёлчном пузыре, хирурги в этой стране ежегодно выполняют 500 000 холецис-
тэктомий. Ежегодные медицинские затраты составляют 1 млрд долларов, и это
без потери зарплаты, производительности труда и стоимости лечения
послеоперационных осложнений [1]. С другой стороны, технический прогресс и
успехи фундаментальных наук нашли своё приложение в клинической
медицине, что привело к пересмотру стратегии и тактики лечения ЖКБ.
Основные изменения коснулись не только лечебной, но и
диагностической программы. Если до 70-х годов в распоряжении врача были только
рентгенография как метод диагностики и открытая операция как метод лечения, то за
последние 20—25 лет были разработаны УЗИ, КТ и прямые способы
контрастирования жёлчных путей. В лечении, кроме открытой операции, стали
использовать лапароскопические вмешательства. Появились такие методы
консервативного лечения, как медикаментозное растворение и
экстракорпоральная литотрипсия (ЭКЛТ). Возник вопрос — какой метод диагностики и
лечения следует избрать для конкретного больного?
Идея обойтись без операции, безусловно, весьма заманчива. Еще в 1937 г.
была предпринята попытка выполнить медикаментозное растворение жёлчных
камней путём назначения микстуры, содержащей смесь жёлчных кислот.
Однако, широкого применения этот метод не находил до 1972 г., когда впервые
было описано полное растворение жёлчных камней в результате применения
чистой хенодезоксихолиевой кислоты (ХДХК). Впоследствии были
разработаны вопросы отбора пациентов и дозировка препарата [2].
Основное показание для назначения медикаментозного лечения — высокий
операционный риск. К сожалению, для назначения ХДХК достаточно много
противопоказаний, связанных с общими заболеваниями: сахарным диабетом,
147
заболеваниями печени, патологией ЖКТ, сопровождающейся диареей,
язвенной болезнью, хроническими заболеваниями почек. Выяснилось, что
основную массу пациентов, которым назначают медикаментозное лечение,
составляет контингент, в силу тех или иных причин уклоняющийся от операции.
Главный критерий, оказывающий влияние на результаты лечения, —
правильный отбор больных. Основные условия, позволяющие назначить
медикаментозное лечение, включают холестериновые рентгенонегативные конкременты
диаметром до 2 см и функционирующий жёлчный пузырь. Растворение камней
размером более 1,5 см может потребовать более 2 лет [2].
Основные недостатки медикаментозного лечения.
1. Необходимость отбора больных. Лучшие результаты получены у
пациентов, имеющих плавающие холестериновые камни размером до 5 мм.
Количество таких больных не более 15%.
2. Недостаточная эффективность метода. При самом тщательном отборе
растворить конкременты удаётся не более чем у 50-60% больных.
3. Высокий процент рецидивов. В течение первых 5 лет после курса
медикаментозного растворения ежегодно у 10% пациентов конкременты
образуются вновь.
Многолетний опыт применения медикаментов для растворения жёлчных
камней показал, что лечение наиболее эффективно у больных с единичными
конкрементами, молодого возраста и не страдающих ожирением, т.е. никак не
подходящих к группе высокого риска оперативного вмешательства.
С середины 80-х годов в клинической практике стала популярна ЭКЛТ —
метод нехирургического лечения ЖКБ. Аппараты для ЭКЛТ генерируют и
фокусируют ударную волну большой мощности. Показания те же, что и для
медикаментозного лечения. Назначение ЭКЛТ в меньшей степени зависит от
сопутствующих заболеваний. Поэтому круг противопоказаний ограничен:
— беременность,
— наличие кардиостимулятора,
— нарушения свёртывающей системы крови,
— острый холецистит,
— кистозные образования по ходу ударной волны.
Однако процент рецидивов в отдалённые сроки достаточно велик. Метод
недостаточно эффективен — фрагментация конкреметов происходит не более
чем у 50—70% больных. Число пациентов, подходящих для этой процедуры, не
превышает 30% из всех страдающих ЖКБ. Реально метод эффективен у
субъектов с мягкими одиночными холестериновыми камнями диаметром 0,5—1,5 см.
Раздробить конкремент до состояния пыли не удаётся, диаметр фрагментов
достигает 0,3-0,5 см. ЭКЛТ даёт некоторое количество осложнений.
Большинство из них связано с миграцией фрагментов по жёлчным путям: развитие
острого холецистита и панкреатита. Возможно образование гематом в зоне
ударной волны.
В середине 80-х годов было предложено контактное растворение жёлчных
камней. Растворитель — метилтетрабутиловый эфир — вводят в жёлчный
пузырь после его чрескожной чреспечёночной пункции. Способ не получил
широкого распространения.
148
Таблица 9-1
Результаты лечения ЖКБ [2]
Возможность применения, %
Эффективность, %
Результаты, %:
летальность
осложнения
повреждения ВЖП
рецидивы
Сроки лечения в стационаре,
дни
Общая нетрудоспособность,
дни
Дискомфорт
охэ
98
100
<1
4-8
0,1-0,2
0
3-7
20-40
Выраженный
лхэ
90-95
100
<1
2-5
0,2-0,6
0
1-2
7-14
Слабый
эклт
7-16
60-95
0
5
—
50
<1
1-2
Слабый
МР
15-30
40-90
0
0
—
50
—
<1
Нет
Примечание. МР — медикаментозное растворение.
Всем нехирургическим методам лечения ЖКБ присущ общий
недостаток — непатогенетичность терапии. Тот факт, что причина заболевания не
устранена, приводит к высокому проценту рецидивов. Еще в 1882 г. Лангенбух
сказал: «Жёлчный пузырь должен быть удалён не потому, что он содержит
камни, а потому, что их продуцирует». Следовательно, консервативные методы
лечения следует рассматривать как вспомогательные и использовать лишь в
исключительных случаях. Вопрос о назначении неоперативного лечения
должен решать только хирург.
Разочарование в консервативных методах лечения ЖКБ совпало по
времени с внедрением в широкую практику ЛХЭ.
До недавнего времени «золотым стандартом» в лечении ЖКБ была
открытая холецистэктомия (ОХЭ), с результатами которой и сравнивали другие
методы лечения. Летальность при плановых ОХЭ не превышала 0,5%.
Количество осложнений в зависимости от характера заболевания и общего состояния
пациента составляло 5—15%. Большинство из них не было опасно для жизни.
Внедрение в практику оперативной лапароскопии произвело переворот во
взглядах на хирургическое лечение ЖКБ. Показательны данные Американского
Института Здоровья, где проведено сравнение различных способов лечения
ЖКБ (табл. 9-1).
149
ПОКАЗАНИЯ К ЛАПАРОСКОПИЧЕСКОЙ ХОЛЕЦИСТЭКТОМИИ
1. Хронический калькулёзный холецистит.
2. Холестероз жёлчного пузыря.
3. Полипоз жёлчного пузыря.
4. Острый холецистит.
В период внедрения показания к этой операции были весьма
ограниченны. В последующем, по мере накопления опыта, показания к ЛХЭ стали шире
и в настоящее время практически приближаются к таковым в открытой
хирургии. Лапароскопическим доступом выполняют не только изолированную ЛХЭ,
но и интраоперационную холангиографию, холедохотомию с эксплорацией
ОЖП, наложение билиодигестивных анастомозов.
ПРОТИВОПОКАЗАНИЯ К ЛАПАРОСКОПИЧЕСКОЙ
ХОЛЕЦИСТЭКТОМИИ
Абсолютные противопоказания
1. Общие противопоказания к проведению лапароскопической операции
(см. главу 4).
2. Рак жёлчного пузыря.
3. Плотный инфильтрат в зоне шейки жёлчного пузыря.
4. Поздние сроки беременности.
Рак жёлчного пузыря, как правило, протекает под маской острого
холецистита, нередко в сочетании с ЖКБ. По данным разных авторов, рак жёлчного
пузыря составляет 0,5—2% органических заболеваний этого органа. У
пациентов, страдающих раком жёлчного пузыря, в 95% случаев обнаруживают
конкременты в его просвете. В 8 из 10 случаев диагноз устанавливают лишь после
получения окончательного гистологического заключения. Подозрение на рак —
показание к срочной биопсии и немедленному гистологическому
исследованию препарата. Подтверждение диагноза требует выполнения лапаротомии и
продолжения операции по онкологическим принципам [3, 4].
Плотный инфильтрат в зоне шейки жёлчного пузыря — одна из основных
причин повреждения элементов гепатодуоденальной связки при ЛХЭ. Требует
перехода к открытой операции.
На поздних сроках беременности ЛХЭ не показана, так как увеличенная
матка затрудняет вхождение в брюшную полость и ограничивает рабочее
пространство. Главная опасность состоит в непредсказуемом воздействии
напряженного ПП на плод.
Относительные противопоказания
1. Холедохолитиаз, механическая желтуха, холангит.
2. Острый панкреатит.
3. Синдром Мириззи.
4. Склероатрофический жёлчный пузырь.
5. Цирроз печени.
6. Острый холецистит на сроках более 72 ч от начала заболевания.
7. Перенесённые операции на органах верхнего этажа брюшной полости.
150
8. Псевдотуморозный панкреатит.
9. Язвенная болезнь.
10. Ожирение III—IV степени.
Вопрос об относительных противопоказаниях в каждом случае следует
рассматривать индивидуально, в зависимости от уровня подготовки хирурга и
оснащённости его операционной.
ДООПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ
Проводят для уточнения характера основного заболевания, выявления его
осложнений и сопутствующей патологии со стороны других органов. При
анализе полученных результатов могут быть выявлены противопоказания к ЛХЭ
как со стороны гепатобилиарной системы, так и общего характера, связанные
с непереносимостью интубационного наркоза или ПП.
1. УЗИ — основной метод диагностики ЖКБ [5, 6], позволяющий
определить:
— наличие конкрементов в жёлчном пузыре и их размеры;
— наличие конкрементов в ОЖП или косвенные признаки холедохолитиаза;
— степень воспалительно-инфильтративных изменений и толщину
стенки жёлчного пузыря;
— диаметр ОЖП, общего печёночного и пузырного протоков;
— расположение и размеры жёлчного пузыря;
— наличие спаечного процесса в подпечёночном пространстве.
2. Биохимические анализы важны для диагностики сопутствующего
гепатита. Определяют содержание билирубина (прямую и непрямую фракции), АЛТ,
ACT и ЩФ.
3. Внутривенная и пероральная холеграфия малоинформативны из-за
большого количества ложных результатов. Предпочтение отдают прямым методам
контрастирования жёлчевыводящих путей.
4. Ретроградная холангио-
панкреатикография (РХПГ) —
прямое трансдуоденальное
эндоскопическое
контрастирование жёлчевыводящих путей
(рис. 9-2).
РХПГ выполняют при
подозрении на холедохолити-
аз, для выяснения характера
механической желтухи и
изучения анатомии протоков
перед операцией.
Рис. 9-1. Конкременты в жёлчном
пузыре.
Конкременты
151
Конкремент
ОЖП
Рис. 9-2. РХПГ. Холедохолитиаз.
Показания к РХПГ
должны быть строго
аргументированы, так как это инвазивная
процедура, частота осложнений при
которой достигает 3%, а
летальность — 0,1—0,2%. Основные
осложнения: панкреонекроз,
перфорация
двенадцатиперстной кишки, кровотечение в
просвет ЖКТ.
5. Обследование
сердечнососудистой, дыхательной и
выделительной систем для
исключения противопоказаний к
операции. При необходимости
проводят предоперационную
подготовку и коррекцию
выявленных нарушений.
ТОПОГРАФИЧЕСКАЯ АНАТОМИЯ И ВАРИАНТЫ СТРОЕНИЯ
Анатомические варианты строения внепечёночных
жёлчных протоков
Частота нетипичного строения ВЖП достигает 35—47%. Практическая
значимость различных вариантов строения ВЖП неодинакова и в большинстве
случаев не оказывает существенного влияния на частоту осложнений.
В норме общий печёночный проток образуется путём слияния правого и
левого долевых протоков вне печени в виде бифуркации, обычно
расположенной на расстоянии 0,75—1,5 см от поверхности паренхимы печени. Пузырный
проток впадает в правую стенку общего печёночного протока под острым
углом (рис. 9-3).
Рис. 9-3. Нормальное строение ВЖП.
152
Рис. 9-4. Низкое слияние долевых протоков.
Опасно низкое слияние долевых протоков, когда общий печёночный
проток практически отсутствует. В этой ситуации при выполнении ЛХЭ возможно
ранение правого долевого протока, который может быть принят за пузырный
проток (рис. 9-4).
Практическое значение имеет вариант, когда из ворот печени выходит
более двух протоков. Их количество, по данным СМ. Курбангалеева, может
достигать 9. Для холецистэктомии важно место впадения или слияния
протоков. Например, при впадении дополнительных протоков непосредственно в
жёлчный пузырь по ходу ЛХЭ они могут быть незаметно пересечены, что
повышает риск жёлчеистечения (рис. 9-5).
Впадение дополнительного протока в зону шейки жёлчного пузыря или
пузырный проток требует обязательного выполнения интраоперационной хо-
лангиографии. Цель исследования — определить значимость протока и его связь
с магистральной протоковой системой, поскольку простое пересечение или
клипирование дополнительного протока может привести к значительному жёл-
чеистечению или развитию синдрома недренируемой доли. Большое значение
имеют различные варианты впадения пузырного протока в общий
печёночный. Наиболее опасно сочетание короткого пузырного протока с тонким
D—5 мм) общим печёночным протоком (рис. 9-6).
Наибольший риск пересечения ОЖП возникает при почти полном
отсутствии пузырного протока. На практике эта ситуация — следствие
сморщивания протока в результате склероатрофического процесса после неоднократных
приступов острого воспаления (рис. 9-7).
Многочисленные варианты строения пузырного протока, связанные с
увеличением длины, не играют существенной роли, так как при ЛХЭ его
пересекают непосредствено у стенки жёлчного пузыря. Доказано, что оставление
длинной культи не приводит к развитию постхолецистэктомического синдрома
(рис. 9-8).
Ретроспективный анализ случаев повреждения ВЖП при ЛХЭ показал,
что необычные анатомические варианты послужили причиной осложнений
приблизительно у 10% больных с ранениями жёлчных протоков.
Рис. 9-5. Впадение дополнительных
протоков в жёлчный пузырь.
Рис. 9-6. Короткий пузырный проток.
153
Рис. 9-7. Отсутствие пузырного протока.
Рис. 9-8. Низкое впадение длинного
пузырного протока в общий
печёночный.
Анатомические варианты кровоснабжения жёлчного пузыря
Определённое значение в отношении повреждений ВЖП имеет
атипичное строение сосудистой системы в области жёлчного пузыря и ворот
печени, поскольку интраоперационное кровотечение повышает риск
ранения протоков.
Кровотечение при ЛХЭ имеет свои особенности.
1. Невозможность мануальной пальпации и пережатия гепатодуоденаль-
ной связки при кровотечении для точного гемостаза на «сухом» поле.
2. Аспирация крови может привести к резкому снижению внутрибрюшно-
го давления и ухудшить экспозицию.
3. Кровотечение затрудняет визуализацию анатомических структур в зоне
ворот печени.
4. Кровотечение нарушает обзор в результате загрязнения линзы телескопа.
5. Сложно адекватно оценить кровопотерю из-за существенного
увеличения изображения на экране.
Для снижения риска внезапного интраоперационного кровотечения
следует рассмотреть варианты кровоснабжения жёлчного пузыря.
Нормальное расположение пузырной артерии встречается у 70—80%
пациентов (рис. 9-9). При этом отходящая от правой печёночной артерии
пузырная артерия непосредственно у стенки жёлчного пузыря разделяется
на переднюю и заднюю ветви, которые соответственно кровоснабжают
переднюю и заднюю его поверхности. В некоторых случаях эти ветви
пузырной артерии приходится обрабатывать раздельно, поскольку главный
ориентир при препаровке — стенка жёлчного пузыря.
Из необычных вариантов кровоснабжения жёлчного пузыря
наиболее часто (до 20%) встречается удвоение пузырной артерии (рис. 9-10).
154
Дополнительная артерия чаще
всего отходит от правой печёночной
артерии или от её внутрипечёночной
части, соответственно V или VI сегменту
печени. Дополнительная ветвь
пузырной артерии чаще заменяет глубокую
или заднюю ветвь нормального
сосуда. Поэтому отсутствие «развилки» и
глубокой ветви пузырной артерии
должно насторожить хирурга.
Следовательно, и при нормальном строении
пузырной артерии, и при её удвоении
возможно выявление
дополнительного сосуда при препаровке в области
шейки жёлчного пузыря.
Так называемая извитая правая
печёночная артерия встречается у 4—15%
пациентов. Чаще это приобретённое
изменение сосуда вследствие его
поражения атеросклерозом у пожилых
больных (рис. 9-11).
Такой вариант строения сосудов
при ЛХЭ опасен тем, что вместо
пузырной артерии может быть
перевязана правая печёночная, а при ранении
может возникнуть сильное
кровотечение. Опыт открытой холецистэктомии
свидетельствует, что в большинстве
случаев перевязка правой печёночной
артерии не ведёт к развитию грубых
морфологических изменений в печени.
Анализ 1000 аутопсий пациентов,
перенёсших ранее холецистэктомию,
показал, что печёночная артерия была
перевязана в 7% случаев. Причём
морфологических изменений в печени при
этом обнаружено не было [7].
Расположение пузырной артерии
впереди общего печёночного протока
(ОПП) наблюдают у 4—12% пациентов.
В этом случае пузырная артерия в
треугольнике Кало отсутствует (рис. 9-12).
Обычно она проходит ниже и
кпереди пузырного протока, вентральнее
ОЖП. Пузырная артерия оказывается
первым образованием, пересекаемым
при выделении шейки жёлчного пузы-
Рис. 9-9. Нормальное расположение
пузырной артерии.
Рис. 9-10. Удвоение пузырной артерии.
Рис. 9-11. Извитая правая печёночная
артерия, проходящая вдоль
медиальной стенки жёлчного пузыря.
155
Рис. 9-12. Пузырная артерия проходит впереди ОПП, вентральнее и ниже пузырного протока.
ря. Для адекватной визуализации пузырного протока её необходимо
отпрепарировать. Правильно оценить характер трубчатого образования можно
по наличию пульсации и диаметру (пузырная артерия, как правило, уже
пузырного протока). Существует множество вариантов отхождения
пузырной артерии, устье которой может быть расположено не только в
различных отделах правой печёночной артерии, но и вообще вне её. Это не
имеет существенного значения при выполнени ЛХЭ. Следует помнить, что
варианты анатомического строения ВЖП и кровоснабжения жёлчного
пузыря чаще наблюдают у мужчин, для которых вообще нетипична ЖКБ.
ОПЕРАТИВНАЯ ТЕХНИКА
Положение больного
Различают два способа укладки больного и расположения операционной
бригады — французский и американский.
В первом случае пациент лежит на спине, его ноги разведены, хирург
стоит между нижними конечностями пациента. Во втором случае пациент
находится на спине, ноги сведены, хирург находится слева от больного
(рис. 9-13).
В первой позиции хирургу удобно манипулировать обеими руками, но
монитор и инструментальный (эпигастральный) троакар несколько отдалены
от него. Во втором варианте экран расположен напротив глаз хирурга, справа
от головы пациента. При операции с одним монитором эта позиция менее
удобна для ассистента. В целом нет существенной разницы в расположении
пациента и бригады. Каждый хирург выбирает наиболее удобный для себя
вариант.
156
Рис. 9-13. Положение пациента и операционной бригады при ЛХЭ, А — французский вариант;
Б — американский вариант.
Доступ
Типичную ЛХЭ выполняют из 4 доступов (рис. 9-14). Технические
особенности (например, гепатомегалия или внутрипеченочное расположение
жёлчного пузыря) могут потребовать введения дополнительного, пятого троакара
для отведения печени. Разработана косметическая модификация ЛХЭ из трёх
доступов для технически простых случаев [8].
По одной из вышеописанных методик накладывают ПП. Первый троакар
для лапароскопа вводят параумбиликально по белой линии живота ниже
пупка. У крупных и высоких пациентов удобнее ввести лапароскоп выше пупка.
Рис. 9-14. Точки введения троакаров при
ЛХЭ.
Рис. 9-15. ЛХЭ. Введены троакары и инструменты.
157
Последовательно осматривают брюшную полость. Все последующие
инструменты вводят в брюшную полость строго под контролем видеомонитора.
Второй, инструментальный троакар вводят в эпигастральной области как
можно ближе к мечевидному отростку, чтобы угол между лапароскопом и
троакаром приближался к 90°. Брюшную стенку пунктируют в косом направлении
под углом 45° так, чтобы стилет троакара появился в поле зрения правее
круглой связки печени (см. рис. 4-23).
Третий и четвёртый вспомогательные троакары вводят соответственно по
срединно-ключичной линии на 4—5 см ниже рёберной дуги и по передней
подмышечной линии на уровне пупка. Важно> чтобы эти инструменты не
находились на одной вертикальной линии (рис. 9-15).
Пятый троакар вводят при необходимости дополнительного отведения
печени ретрактором. Брюшную стенку прокалывают в левом подреберье.
Осматривают печень и жёлчный пузырь (рис. 9-16—9-18). Уточняют
диагноз и тактику.
Рис. 9-16. Хронический калькулёзный
холецистит.
Рис. 9-17. Острый флегмонозный
холецистит.
Рис. 9-18. Острый гангренозный
холецистит.
Рис. 9-19. Припаявшийся сальник
отделяют от дна жёлчного пузыря.
158
Этапы операции
Тракция. Цель этого этапа — приподнять жёлчный пузырь, обнажить
ворота печени и зону треугольника Кало для последующей препаровки.
На дно жёлчного пузыря накладывают мягкий анатомический зажим,
введённый через доступ 4. Если из-за рубцового процесса или припаявшегося
сальника дно жёлчного пузыря не визуализируется, выполняют препаровку
тканей L-образным электродом или диссектором, введённым через доступ 2
(рис. 9-19). Спайки между печенью и диафрагмой должны быть пересечены,
так как затрудняют создание экспозиции.
Зажимом дно жёлчного пузыря приподнимают, выполняя тракцию в це-
фалическом направлении и несколько латерально.
Освобождают от спаек область тела жёлчного пузыря. На карман Харт-
манна накладывают второй зажим, введённый через доступ 3. В процессе
операции этот инструмент находится в левой руке хирурга. Последующая тракция
возможна в двух вариантах — французском (а) и американском (б).
а. Французский вариант. Выполняют тракцию латерально, вниз и по
направлению к передней брюшной стенке. Этот вариант расправляет
треугольник Кало и открывает его обзору (рис. 9-20).
б. Американский вариант. Производят тракцию вверх и латерально. При
этом треугольник Кало сморщивается, пузырный проток приближается к
ОПП и становится непосредственным продолжением ОЖП. Именно
такой вариант тракции — одна из причин высокого уровня повреждений
ВЖП (до 1%) в США в период освоения ЛХЭ (рис. 9-21).
Рис. 9-20. Французский вариант тракции.
Рис. 9-21. Американский вариант тракции.
159
Рис. 9-22. Рассечение брюшины по меди- Рис. 9-23. Рассечение брюшины по лате-
альной стенке жёлчного пузыря. ральной стенке жёлчного пузыря.
Прицельному осмотру зоны шейки жёлчного пузыря может
препятствовать нависающая увеличенная квадратная доля печени. Изменение положения
тела и тракция, как правило, позволяют исправить ситуацию. При
неэффективности этого приёма через дополнительный 5-миллиметровый прокол в
левом подреберье вводят ретрактор и приподнимают квадратную долю вверх. У
полных пациентов осмотр и препаровка шейки жёлчного пузыря могут быть
затруднены из-за выраженной околопузырной клетчатки и увеличенных
размеров большого сальника. Облегчить визуализацию ворот печени помогают
ретрактор и лапароскоп со скошенной оптикой.
Рассечение брюшины. Мобилизацию начинают с рассечения брюшины
L-образным электродом по переходной складке на уровне средней трети
медиальной поверхности жёлчного пузыря (рис. 9-22). Далее U-образный разрез
продолжают над карманом Хартманна с переходом на латеральную стенку
органа (рис. 9-23). Для сохранения принципа безопасности очень важно рассечь
брюшину скорее дистально — в зоне кармана Хартманна, чем проксимально —
над пузырным протоком или элементами гепатодуоденальной связки.
Рассекают только брюшину без подлежащей клетчатки, захватывая и приподнимая её
электрохирургическим крючком. Ошибочный уровень рассечения брюшины
нередко бывает первым звеном в цепи ошибок, приводящих в конечном счёте
к повреждению ВЖП (рис. 9-24) [9].
Препаровка треугольника Кало. Тупо, при помощи диссектора, тупфера
или «пяточки» электрохирургического крючка рассечённую брюшину вместе с
подлежащей жировой клетчаткой смещают проксимально, по направлению к
гепатодуоденальной связке (рис. 9-25). Обнажают пузырный проток и
артерию. Разделение тканей производят крючком или диссектором строго вдоль
стенки жёлчного пузыря, не углубляясь в сторону ОПП. Пузырный проток и
артерию очищают от спаек и жировой клетчатки, подготавливая к клипирова-
нию и пересечению (рис. 9-26).
160
Техника «хобот слона». Выделение
элементов шейки жёлчного пузыря —
один из наиболее ответственных
моментов операции. В настоящее время
наиболее безопасной признана техника
«хобот слона», восстанавливающая
естественные топографические
взаимоотношения между пузырным протоком и ОЖП
в условиях тракции.
Основной её принцип состоит в том,
что медиальную стенку жёлчного пузыря
выделяют на протяжении 1/3 по всей
окружности, не пересекая пузырный
проток (рис. 9-27). Это чрезвычайно важно,
так как именно здесь может проходить
интимно спаянный с медиальной
стенкой пузыря ОПП или правая ветвь
печёночной артерии. Такую ситуацию часто
наблюдают при склероатрофическом
жёлчном пузыре или при его остром воспалении. Два правила, выработанные
ещё в начале XX века, следует строго соблюдать при выделении органа.
/. Ни одно трубчатое образование, идущее к жёлчному пузырю, не должно
быть пересечено до полного прояснения анатомии этой зоны.
2. Необходимо убедиться, что после выполнения обратимой
мобилизации лишь два трубчатых образования — артерия и проток — подходят к
жёлчному пузырю.
Пересечение артерии. Сосуд предварительно клипируют или коагулируют
диссектором в 3—4 местах на протяжении, затем пересекают его около стенки
жёлчного пузыря. В половине случаев ствол пузырной артерии не визуализиру-
Рис. 9-24. Уровень рассечения брюшины в
зоне шейки жёлчного пузыря, А —
правильный; Б, В — неправильный.
Рис. 9-25. Препаровка треугольника Кало.
Рис. 9-26. Выделение пузырного протока и
артерии.
161
Рис. 9-27. Техника «хобот слона». Мобилизация проксимальной трети жёлчного пузыря до
пересечения протока.
ется, а терминальные ветви сосуда коагулируют при выделении медиальной
стенки органа (рис. 9-28).
После пересечения артерии проксимальная часть жёлчного пузыря вместе
с пузырным протоком внешне напоминает хобот слона.
Пересечение пузырного протока. Выделяют пузырный проток по всему
периметру. Размер клипсы E или 8 мм) выбирают в зависимости от диаметра
протока. Первой накладывают дистальную клипсу, как можно ближе к шейке
пузыря (рис. 9-29). Затем накладывают две проксимальных клипсы. В момент
клипирования в поле зрения должны находиться пузырный проток и обе бран-
ши аппликатора. Пузырный проток пересекают ножницами без коагуляции,
оставляя 2 клипсы на проксимальной культе (рис. 9-30). Обращают внимание
на то, что пересечённая структура имеет один просвет.
Холангиография — основной метод интраоперационной диагностики хо-
ледохолитиаза при ЛХЭ. Различные хирургические школы придерживаются
селективного (выборочного) и рутинного (обязательного) использования
интраоперационной холангиографии (ИХГ).
Рутинное применение ИХГ поддерживают не
более 50% хирургов. Отказ от
обязательного применения ИХГ обьясняют
следующими факторами:
1. Облучение пациента и персонала
операционной.
2. Значительное A0-20%) количество лож-
ноположительных результатов.
3. Возможно повреждение магистральных
протоков при выполнении ИХГ «любой
ценой».
4. Высокая стоимость исследования.
Рис. 9-28. Клипирование пузырной артерии.
162
Рис. 9-29. Клипирование пузырного протока.
Показания для селективного использования холангиографии.
1. Широкий пузырный проток (более 5 мм).
2. Наличие мелких конкрементов в жёлчном пузыре и особенно в
пузырном протоке.
3. Интраоперационная визуализация расширенного жёлчного протока,
т.е. когда имеется расхождение между данными дооперационного УЗИ и
интраоперационной находкой. Для интраоперационного измерения
диаметра пузырного протока и ОЖП разработаны специальные
инструменты (рис. 9-31).
4. Неясная анатомия в зоне треугольника Кало.
5. Невозможность, при наличии соответствующих показаний,
дооперационного выполнения РХПГ или чрескожной чреспечёночной
холангиографии (ЧЧХГ).
Селективные показания для выполнения ИХГ имеют место у 13—20%
пациентов. При рутинном использовании ИХГ частота резидуального холедохо-
литиаза достигает 1% (рис. 9-32) [10].
Техника холангиографии
1. На пузырный проток
накладывают дистальную клипсу.
2. Катетер для холангиографии
вводят в брюшную полость через
троакар 3 или через специальный прокол.
Точку введения катетера выбирают
таким образом, чтобы он проходил в
пузырный проток под острым углом.
3. Пузырный проток вскрывают
ножницами на 1/2 окружности. Катетер
вводят в просвет пузырного протока
на 2—3 см и фиксируют его
наложением КЛИПСЫ, не СЖИМая бранши ДО Рис. 9-30. Пересечение пузырного протока.
163
упора (рис. 9-33). Для фиксации катетера
можно использовать специальный зажим
(рис. 9-34).
4. До введения контрастного вещества
возвращают операционный стол в исходное
положение, извлекают инструменты,
расположенные в зоне снимка.
5. После извлечения катетера
окончательно клипируют пузырный проток.
6. Альтернанивный способ
контрастирования ВЖП — холецистохолангиография.
а. В этом случае под контролем
видеосистемы пунктируют жёлчный пузырь, аспи-
рируют жёлчь и вводят контрастное
вещество.
б. Метод более прост, однако его
применение невозможно у пациентов с
отключённым жёлчным пузырем, при его
остром воспалении. При мелких конкрементах (одно из показаний к
холангиографии) реальна миграция камней в жёлчные протоки.
Мобилизация жёлчного пузыря. После пересечения пузырной артерии и
протока при помощи крючка или ножниц вьщеляют жёлчный пузырь из ложа
(рис. 9-35). Иногда для этого удобно использовать марлевый тупфер.
Рис. 9-31. Инструмент для определения
диаметра трубчатых структур.
Рис. 9-32. ИХГ. Холедохолитиаз. Конкремент расположен в терминальном отделе ОЖП.
164
Рис. 9-33. ИХГ.
Техника с использованием
электрохирургического крючка — классическая
для ЛХЭ. Она позволяет точно выделить
и детально осмотреть перед рассечением
любую тканевую структуру.
Иссечение жёлчного пузыря
ножницами более травматично, хотя и занимает
меньше времени.
Манипулируя обоими зажимами,
хирург меняет экспозицию и получает для
обзора всё новые ткани, подлежащие
пересечению. Как и в открытой хирургии, в
неосложнённых случаях после рассечения
брюшины удаётся тупо и бескровно
отделить жёлчный пузырь от ложа. В
процессе мобилизации в 25% случаев хирург повреждает стенку пузыря, что не
считается осложнением, но создаёт определённые неудобства. В этих случаях жёлчь
аспирируют через перфорационное отверстие, на которое накладывают эндо-
петлю, клипсу или анатомический зажим. Выпавшие конкременты помещают
в контейнер и извлекают.
Перед отсечением от печени дна жёлчного пузыря последний
«закидывают» вверх под диафрагму, промывают ложе и подпечёночное пространство,
шарообразным электродом коагулируют кровоточащие участки (рис. 9-36).
Необходимо обеспечить полный гемостаз, а затем отсечь орган и повторно
проконтролировать гемостаз. Жёлчный пузырь временно «укладывают» за печень
под диафрагму.
Возвращают больного в исходное положение, аспирируют сгустки крови,
промывают и осушают брюшную полость. Через четвёртый троакар
устанавливают подпечёночный дренаж. Полная аспирация промывной жидкости, жёлчи
и крови — залог гладкого течения
послеоперационного периода. Оставленная
жидкость приводит к болям в плече,
локальному напряжению мышц и симптомам
раздражения брюшины в первые дни
после операции.
Дренирование брюшной полости.
Показания к дренированию зависят от
принципов, существующих в вашем лечебном
учреждении.
Абсолютные показания
1. Острое воспаление жёлчного
пузыря.
2. Сомнения в гемостазе.
3. Перфорация стенки жёлчного пу- Рис 9-34. Зажим для интраоперационной
ЗЫрЯ В процессе мобилизации. холангиографии.
165
Рис. 9-35. Выделение жёлчного пузыря из
ложа.
Рис. 9-36. Гемостаз ложа жёлчного пузыря.
Извлечение препарата — ответственный момент операции, так как
возможен разрыв стенки органа с выпадением камней, истечением жёлчи,
инфицированием брюшной полости и «потерей» препарата.
Традиционно жёлчный пузырь извлекают через доступ 1, перемещая
лапароскоп во второй троакар. При крупных конкрементах целесообразно
расширить отверстие в брюшной стенке или поступить следующим образом.
Шейку жёлчного пузыря извлекают наружу, вскрывают и аспирируют жёлчь.
В просвет органа вводят окончатый зажим, разрушают конкременты и
извлекают их по частям (рис. 9-37).
При остром воспалении жёлчного пузыря или нарушении его
герметичности в момент извлечения целесообразно использование контейнера или
переходной гильзы 10/20 мм (рис. 9-38).
Рис. 9-37. Извлечение конкрементов из
жёлчного пузыря.
Рис. 9-38. Извлечение жёлчного пузыря
через переходную гильзу.
166
Весьма эффективен для удаления не только жёлчного пузыря, но и других
органов трёхлепестковый расширитель. Инструмент вводят вдоль троакара, как
по проводнику, последний извлекают. Бранши расширителя позволяют
увеличить диаметр отверстия в 1,5—2 раза и беспрепятственно извлечь препарат (см.
рис. 3-25).
Окончание операции. После извлечения препарата проводят контрольный
осмотр брюшной полости и зоны операции. Аспирируют остатки жидкости.
Под контролем зрения извлекают инструменты, из брюшной полости удаляют
газ. Ушивают отверстия в брюшной стенке. Швы на апоневроз накладывают
только в местах введения 10-миллиметровых троакаров — доступы 1 и 2.
ПЕРЕХОД К ЛАПАРОТОМИИ
Необходимость в конверсии по ходу ЛХЭ возникает в 3—7% случаев
(табл. 9-2).
Показания
1. Неясная анатомия в зоне треугольника Кало.
2. Невозможность идентифицировать элементы ворот печени из-за
выраженных инфильтративных или рубцово-склеротических изменений.
3. Интраоперационные осложнения: ранение ВЖП и кровотечение,
которое невозможно остановить без риска повреждения элементов гепатодуоде-
нальной связки.
Таблица 9-2
Результаты ЛХЭ в ведущих странах Европы и США в 1992 г.
СТРАНА
Англия и
Уэльс
Бельгия
Франция
Шотландия
Швейцария
США
Выполнено
ЛХЭ
3 319
3 244
2 955
1 655
910
77 604
Переход
к открытой
операции, %
5,2
6,5
4,8
14,0
8,1
3-8
Повреждения
ВЖП, %
0,33
0,50
0,60
0,70
0,50
0,59
Летальность,
%
0,17
0,09
0,03
0,50
0
0,04
4. Выявление по ходу лапароскопии заболеваний, не диагностированных
до операции. Чаще это опухолевый процесс с локализацией в ободочной
кишке. По ходу ЛХЭ рак ободочной кишки обнаруживают в 0,5% случаев [11].
Переход к лапаротомии не является поражением хирурга, признаком его
слабости и некомпетентности. Лапаротомия — почётное отступление,
позволяющее предотвратить тяжелые, иногда фатальные осложнения.
167
По мнению J.Hunter, необходимо установить предел времени для пробной
мобилизации жёлчного пузыря. За 30 мин от начала его выделения пузырный
проток должен быть чётко определён и подготовлен к клипированию.
Лапароскопическая операция не может быть в несколько раз продолжительнее
открытой. Чревосечение должно быть выполнено до того, как хирург затратит
слишком много сил и времени на лапароскопическую мобилизацию, когда переход
к лапаротомии становится эмоционально невозможен [12].
Снижение порога перехода к лапаротомии — один из основных факторов
профилактики осложнений в эндохирургии. Группа французских хирургов
выполнила более 2000 ЛХЭ без единого повреждения ВЖП. Они добились этого,
расширив показания к чревосечению на этапе освоения метода: на первые 100
ЛХЭ лапаротомия выполнена в 22 случаях, на вторую сотню — у 12, на третью —
у 6 пациентов. Далее частота конверсии установилась на уровне 1—2% [13].
ПОСЛЕОПЕРАЦИОННОЕ ВЕДЕНИЕ
Эндоскопическая хирургия изменила принципы ведения больных после
операции. Отсутствие болей в животе и мышцах брюшной стенки позволяет не
ограничивать физическую активность пациента уже в первые сутки после
операции. Наркотические анальгетики не назначают. Полноценная экскурсия
диафрагмы предотвращает гипостатическую пневмонию. Перистальтика
восстанавливается через несколько часов, самое позднее — через сутки после
операции. Тошнота и рвота — редкие явления. В отличие от традиционной
абдоминальной хирургии напряжения мышц передней брюшной стенки нет,
незначительная локальная болезненность имеет место лишь в местах введения
троакаров. Дефанс и вздутие живота настолько нетипичны для лапароскопических
операций, что их появление всегда свидетельствует о послеоперационном
осложнении (кровотечение, жёлчеистечение, повреждение кишечника и др.).
Антибиотики назначают только при остром воспалении жёлчного пузыря или
при дегерметизации органа в процессе ЛХЭ. Инфузионную терапию назначают
только по показаниям. Принимать пищу больному позволяют со вторых суток.
Длительность нахождения в стационаре составляет 1—7 дней, что зависит от
особенностей заболевания и характера операции. Как правило, через 1-2 нед
после вмешательства пациент может вернуться к привычному образу жизни,
включая лёгкий физический труд и занятия спортом.
ПРОБЛЕМА ХОЛЕДОХОЛИТИАЗА
Частота холедохолитиаза при ЖКБ составляет около 10%.
Нераспознанный и неизлеченный холедохолитиаз — одна из основных причин неудач в
хирургии ЖКБ. Диагностику холедохолитиаза осуществляют до, во время и
после ЛХЭ. Оптимальна дооперационная диагностика, позволяющая заранее
выбрать адекватную и наименее опасную тактику лечения. Четыре фактора
позволяют заподозрить холедохолитиаз: холангит, расширение ВЖП по
данным УЗИ более 8 мм, увеличение содержания трансаминаз и прямого
билирубина. При сочетании всех четырёх факторов вероятность холедохолитиаза
достигает 99%. При их отсутствии частота холедохолитиаза равна 7% [14].
168
Диагностика холедохолитиаза
Дооперационная диагностика: стандартные обязательные исследования.
1. Клиническое обследование — наличие при поступлении или в анамнезе
желтухи и холангита, приступа желчнокаменного панкреатита. Если
проявления первых двух осложнений ЖКБ достаточно ясны,
дифференциальная диагностика различных форм панкреатита сложна. К главным
факторам, свидетельствующим о билиарном характере панкреатита, помимо
наличия конкрементов в жёлчном пузыре, относят:
а) повышение содержания ЩФ свыше 300 ЕД/л;
б) возраст старше 50 лет;
в) женский пол;
г) содержание АЛТ больше 100 ЕД/л.
Простой подсчёт показывает, что при полном отсутствии или наличии
только одного из перечисленных факторов в 90% случаев приступ
панкреатита не связан с миграцией конкрементов и, наоборот, при наличии
признаков 3 и более в 87% случаев речь идёт о желчнокаменном
панкреатите [15].
2. Биохимическое исследование крови. Для диагностики значимо
повышение концентрации билирубина (главным образом за счёт прямой
фракции) более чем в 2 раза.
3. УЗИ. Холедохолитиаз при обычном исследовании обнаруживают не более
чем у 30% больных, имеющих конкременты в жёлчных протоках.
Косвенный фактор, свидетельствующий в пользу наличия конкрементов в ОЖП, —
расширение общего печёночного протока свыше 8 мм (рис. 9-39, 9-40).
УЗИ следует проводить не ранее чем за 7 дней до операции, поскольку со
временем картина может измениться. Для получения более точной
информации УЗИ желательно провести 2—3 раза до операции. Необходим
постоянный контакт между хирургом и оператором УЗИ с целью
сравнения данных УЗИ и интраоперационных находок.
Трансдуоденальное УЗИ. Возможно более детальное исследование прото-
ковой системы при использовании трансдуоденального эндоскопического
датчика УЗИ.
Техника этого исследования. Положение пациента на левом боку. После
стандартной для ФГДС подготовки в двенадцатиперстную кишку до
уровня большого дуоденального соска вводят эндоскоп,
сопряжённый с секторным ультразвуковым датчиком, работающим на частоте
7,5 или 12 МГц. Для обеспечения акустического соединения
используют баллончик с жидкостью. Во время исследования датчик
постепенно вытягивают в луковицу двенадцатиперстной кишки.
Небольшие изменения положения датчика позволяют изучить
проксимальную часть ОЖП и ОПП. Принципиальное значение имеет появление
акустической тени в зоне действия датчика.
Показания для трансдуоденального УЗИ аналогичны показаниям для
РХПГ. Особое значение исследование приобретает в случаях, когда
169
Рис. 9-39. УЗИ. Расширение ОЖП при холе-
дохолитиазе.
Рис. 9-40. Та же сонограмма при большем
увеличении.
не удаётся канюлировать фатеров сосок, пациент не переносит
контрастный препарат или в анамнезе у него — недавно перенесённый
приступ острого панкреатита (РХПГ может вызвать обострение процесса).
Противопоказания. Исследование непоказано, если дистальная часть
ОЖП хорошо визуализируется при обычном трансабдоминальном
УЗИ. В некоторых случаях проведение трансдуоденального УЗИ
невозможно — при наличии стенозирующей язвы двенадцатиперстной
кишки или при сдавлении кишки извне. Необходимо учитывать тот
факт, что глубина проникновения при использовании датчика,
работающего на частоте 7,5 МГц, не превышает 6 см.
Точность. По точности диагностики холедохолитиаза
трансдуоденальное УЗИ сравнимо с прямыми методами контрастирования ВЖП:
РХПГ и ЧЧХГ (рис. 9-41) [16]. По данным Ю.Г. Старкова и соавт.,
метод позволил выявить холедохолитиаз, не диагностированный до
операции, у 5% больных. Точность диагностики холедохолитиаза по
данным интраоперационного УЗИ в этой ситуации составила 100%,
тогда как информативность ИХГ — лишь 57% [17].
4. Внутривенная холангиография малоинформативна в диагностике
холедохолитиаза. Тем не менее, её можно использовать при наличии ге-
пацитотропного контрастного вещества (билископин) и
рентгеновского аппарата, позволяющего получать томограммы на уровне ОПП
(рис. 9-42) [18].
5. РХПГ относят к прямым методам контрастирования жёлчных путей.
Контрастный препарат вводят ретроградно после эндоскопической
катетеризации фатерова соска. Точность этого исследования в отношении
выявления холедохолитиаза близка к 100%. Однако вмешательства на
фатеровом соске сопровождаются осложнениями, частота которых
достигает 2—3%, и летальностью в доли процента. К ним относят острый
панкреатит, кровотечение и перфорацию двенадцатиперстной кишки,
Поэтому в большинстве клиник РХПГ перед ЛХЭ применяют
селективно (рис. 9-43).
170
Показания для РХПГ
а. Желтуха или холангит при
поступлении или в анамнезе.
б. Повышение показателей печёночных
проб в 2 раза и более.
в. Желчнокаменный панкреатит.
г. Расширение общего печёночного
протока более 8 мм.
Выполнение РХПГ возможно у 80—90%
пациентов. Трудности при выполнении
этой процедуры связаны с
анатомическими аномалиями расположения фате-
рова соска и наличием парафатериаль-
ных дивертикулов [19].
6. Чрескожная чреспечёночная холангиография
ЧЧХГ также относят к прямым методам
контрастирования жёлчных путей и выполняют
по тем же показаниям, что и РХПГ. С целью
диагностики холедохолитиаза ЧЧХГ обычно
применяют в случаях, когда РХПГ невыполнима. Эта процедура
эффективна при расширении ВЖП и жёлчной гипертензии. С 1969 г. для
выполнения этого исследования применяют иглу Хиба. Под контролем рентге-
нотелевизионной установки иглу вводят в девятое межреберье по среднепод-
мышечной линии по направлению к воротам печени на глубину 12—15 см.
При лёгком подтягивании иглы и одновременном введении контрастного
вещества следят на экране за появлением изображения печёночных
жёлчных ходов. Частота осложнений составляет 0,9—4,9% [20].
Рис. 9-41. Схема транс
дуоденального УЗ И ОЖП.
Рис. 9-42. Томограмма ОЖП. Холедохолитиаз.
Рис. 9-43. РХПГ при холедохоли-
тиазе. Расширение жёлчевы-
водящих путей.
171
Осложнения
1. Жёлчеистечение в брюшную полость.
2. Холангит.
3. Подкапсульная гематома.
4. Поддиафрагмальный абсцесс.
ЧЧХГ уступает РХПГ по эффективности, поскольку извлечение
конкрементов из протоков чреспечёночным доступом сложнее [21].
Интраоперационная диагностика холедохолитиаза
Как и при открытой холецистэктомии, основной способ
интраоперационной диагностики холедохолитиаза при ЛХЭ — рентгенологическое исследование
жёлчных путей. В эндохирургии значимость интраоперационной холангиогра-
фии возрастает из-за невозможности мануальной пальпации ВЖП. Холангио-
графия во время ЛХЭ может быть успешно выполнена у 70-95% пациентов
(рис. 9-44).
Альтернативным методом диагостики холедохолитиаза по ходу
вмешательства может быть интраоперационная РХПГ (рис. 9-45). Однако это исследование
в положении больного на спине неудобно для эндоскописта, поэтому лучше
выполнить его в ближайшем послеоперационном периоде (например, на
следующий день после операции).
Начиная с 1991 г. для интраоперационной диагностики холедохолитиаза
стали применять интраоперационное УЗИ. Это исследование требует
специального датчика, который вводят через
10-миллиметровый троакар.
Преимущество интраоперационного
УЗИ — отсутствие вредного действия
радиации на пациента и персонал.
Главные недостатки —
необходимость специального дорогостоящего
оборудования и невозможность
диагностировать конкременты в терминальном
отделе ОЖП [22].
Эффективный метод не только
диагностики, но и лечения холедохолитиаза —
лапароскопическая холедохоскопия.
Послеоперационная диагностика
холедохолитиаза
Частота резидуального
холедохолитиаза составляет 1—2%. Клинические
признаки холедохолитиаза могут
проявиться на различных сроках после ЛХЭ.
В раннем послеоперационном периоде,
при нарушении жёлчеоттока возможно
жёлчеистечение из ложа пузыря в брюш-
Рис. 9-44. ИХГ. Холедохолитиаз. ную ПОЛОСТЬ.
172
" .¦¦'¦•:'•.
На более поздних сроках
превалируют симптомы жёлчной гипертен-
зии: распирающие боли в правом
подреберье, желтуха, сопровождающая
приступы, холангит. Для диагностики
холедохолитиаза используют РХПГ и
ччхг.
Лечебная тактика
при холедохолитиазе
1. Эндоскопическая папиллосфин-
ктеротомия (ЭПСТ). Оптимальным
способом коррекции холедохолитиаза
считают дооперационную ЭПСТ с
извлечением конкрементов из протоков [23].
Лучше выполнять процедуру не ранее
чем за 24 ч до операции. Это снижает до минимума вероятность миграции
новых конкрементов из жёлчного пузыря (рис. 9-46).
Однако выполнение РХПГ возможно не у всех пациентов.
Противопоказаниями служат наличие парафатериальных дивертикулов и анатомические
аномалии расположения фатерова соска. Относительное противопоказание —
хронический панкреатит. Нередко после выполнения РХПГ выясняется, что
произвести ЭПСТ и извлечь конкременты не представляется возможным. Основными
препятствиями служат тубулярный стеноз терминальной части ОЖП и крупные
(более 1 см в диаметре) конкременты. В этой ситуации при наличии
соответствующего оборудования и опыта показана лапароскопическая холедохолитотомия или
освобождение протоков чрескожно-чреспеченочным доступом.
К сожалению, ЭПСТ имеет свои недостатки. Анализ отдалённых
результатов показал, что через 4—5 лет возрастает число больных с атрофией
слизистой оболочки желудка, уменьшается диаметр папиллотомного отверстия.
Явления холангита отмечены не только у больных с рестенозом большого дуоде-
Рис. 9-45. РХПГ. Резидуальный холедохолити-
аз и жёлчеистечение.
Рис. 9-46. ЭПСТ.
173
нального сосочка, но и при полном рассечении сфинктера Одди вследствие
развития дуоденобилиарного рефлюкса [24].
2. Лапароскопическая холедохотолитотомия
Для выполнения этого приёма необходимы:
— операционный холедохоскоп с набором инструментов для извлечения
камней;
— дренажи для лапароскопического дренирования жёлчных путей;
— специалист, владеющий техникой эндохирургического шва.
Оперативная техника
Существует два варианта эксплорации и ревизии ОЖП — через пузырный
проток и путём холедохотомии. Преимущество доступа через пузырный
проток — в сохранении целостности ОЖП. Однако этот способ требует
применения баллонной дилатации пузырного протока для введения инструментов.
Второе преимущество — отсутствие необходимости в ушивании холедохото-
мического отверстия (рис. 9-47). После эксплорации ОЖП конкременты
извлекают с помощью корзинки Дормиа или катетера Фолея (рис. 9-48).
Процесс контролируют либо рентгенологически, либо визуально через
гибкий холедохоскоп. В некоторых случаях возможно «проталкивание»
конкрементов в двенадцатиперстную кишку. Завершают операцию
дренированием ОЖП через пузырный проток или холедохотомическое
отверстие по Керу. Герметичность проверяют введением физиологического
раствора и контрольной холангиографией. Подпечёночное пространство
дренируют отдельной трубкой.
Основное преимущество лапароскопической холедохолитотомии перед
РХПГ и ЭПСТ — сохранение сфинктерного аппарата фатерова соска.
Для снижения травматичности процедуры предложено интраоперацион-
ное применение ЭКЛТ с целью измельчения конкрементов перед экстракцией
[25,26].
Рис. 9-47. Лапароскопическая холедохолитотомия через пузырный проток. А — Баллонная дила-
тация пузырного протока, Б — Извлечение конкрементов через пузырный проток с помощью
корзинки Дормиа.
174
Рис. 9-48. Лапароскопическая холедохолитотомия путём холедохотомии. А — холедохотомия, Б —
Еведение холедохоскопа, В — извлечение конкремента корзинкой Дормиа, Г — контрольная
холедохоскопия, Д — установка Т-образного дренажа, Е — ушивание холедохотомического
отверстия.
При отсутствии контроля за полнотой лапароскопической холедохолито-
томии возможно эндохирургическое наложение холедоходуоденоанастомоза.
3. Переход к открытой операции и ревизия ВЖП
Основное показание для открытой эксплорации ОЖП — невозможность
по тем или иным причинам выполнения эндоскопической или
лапароскопической холедохолитотомии при доказанном холедохолитиазе.
В целом тактика хирурга при подозрении на холедохолитиаз может быть
представлена в виде схемы.
Представленная схема подразумевает выполнение ЛХЭ на любом этапе,
если холедохолитиаз не подтвердился или был ликвидирован эндоскопическим
либо чрескожным доступом.
Схема 9-1
Диагностика и лечение холедохолитиаза
Клинические признаки:
желтуха, х лангит,
желчнокаменный панкреатит
ччхг
<—
РХПГ
Чрескожное
извлечение
Взаимозаменяемые
диагностические приёмы
— — — "^ Неэффективность метода
Интраоперационное УЗИ
176
«ТРУДНАЯ» ЛХЭ
Десятилетний опыт
выполнения ЛХЭ позволил
расширить показания для
выполнения этого вмешательства и
способствовал разработке
технических приёмов в
анатомически сложных ситуациях.
Обстоятельства,
приводящие к «трудной» ЛХЭ
1. Острый холецистит.
2. Склероатрофический
жёлчный пузырь.
3. Водянка жёлчного
пузыря.
4. Синдром Мириззи.
Рис. 9-49. УЗИ. Острый обтурационный холецистит.
Конкремент в шейке жёлчного пузыря. Утолщение и двух-
контурность стенок жёлчного пузыря.
5. Холецистоинтестинальный свищ.
6. Анатомические варианты строения ВЖП.
Острый холецистит
ЛХЭ при остром холецистите имеет ряд особенностей, присущих
каждому этапу операции. Первые затруднения могут возникнуть на этапе создания
экспозиции. При этой патологии жёлчный пузырь нередко окутан
сальником. Однако рыхлый инфильтрат возможно разделить тупым путём.
Основная трудность при создании экспозиции — напряжение жёлчного пузыря,
утолщение и уплотнение его стенок, что мешает наложить зажимы на орган
(рис. 9-49). Поэтому ЛХЭ при остром холецистите следует начинать с
пункции жёлчного пузыря, что облегчает наложение инструментов и создание
экспозиции (рис. 9-50) [27-29].
При утолщённой инфильтрированной стенке пузыря целесообразно
использовать хирургические зажимы (рис. 9-51). При выраженной деструкции
тканей показано наложение на стенку жёлчного пузыря П-образного шва.
Если жёлчный пузырь содержит множественные конкременты, «замазку»,
густую жёлчь, которую сложно аспирировать через иглу, следует вскрыть его
просвет на протяжении 5—7 мм в области дна, ввести в отверстие отсос и
эвакуировать содержимое, используя заранее приготовленный контейнер.
Отверстие герметизируют наложением зажима, клипсы или эндопетли.
Наиболее опасны с точки зрения повреждения ВЖП инфильтративные
изменения в зоне шейки жёлчного пузыря. Инфильтрированная брюшина
кровоточит после рассечения, что затрудняет идентификацию пузырного протока
и стыка пузырный проток — жёлчный пузырь. В этой ситуации можно
применить способ выделения жёлчного пузыря «от дна» [30].
Выделение жёлчного пузыря из ложа в большинстве случаев не
представляет трудностей. При наличии плотных сращений в этой зоне их следует пере-
177
Рис. 9-50. Пункция жёлчного пузыря при
остром холецистите.
Рис. 9-51. Утолщение стенок жёлчного
пузыря при остром холецистите.
секать ножницами. Использование крючка при невозможности визуализации
«слоя» ведёт к множественным перфорациям органа и повреждению
паренхимы печени.
Повышенная кровоточивость тканей при остром воспалении требует
применения местных гемостатиков — гемостатической губки или фибринового клея.
В исключительных случаях возможно подведение к ложу марлевого тампона
через отдельный небольшой разрез.
При извлечении воспалённого жёлчного пузыря желательно использовать
контейнер для предотвращения инфицирования тканей передней брюшной
стенки.
Водянка жёлчного пузыря
При этой патологии технические трудности обусловлены двумя
факторами — увеличением размеров органа и наличием «вколоченного» конкремента в
области кармана Хартманна или в пузырном протоке (рис. 9-52).
Для облегчения выделения органа операцию, так же как и при остром
холецистите, начинают с пункции. Опорожнение жёлчного пузыря
обеспечивает доступ к зоне треугольника Кало. Тракцию за хартманновский карман при
вколоченном конкременте осуществляют ретрактором или за лигатуру,
наложенную на стенку жёлчного пузыря.
При водянке следует внимательно осмотреть пузырный проток.
Обнаружение камня требует вскрытия протока, извлечения камня и выполнения через
образовавшееся отверстие ИХГ (рис. 9-53).
Синдром Мириззи
Первоначально автор синдрома понимал под этим осложнением ЖКБ
механическую желтуху вследствие сдавления ОПП конкрементом,
расположенном в кармане Хартманна [31]. Впоследствии стали различать 4 степени
выраженности синдрома — от компрессии ОПП до развития холецистохоледохеаль-
178
Рис. 9-52. «Вколоченный» камень в пузыр- Рис. 9-53. Извлечение конкремента из пу-
ном протоке. зырного протока.
ного свища и полного перемещения камня в просвет ОПП (рис. 9-54) [32].
Частота этого осложнения ЖКБ достигает 1%, что в эпоху ЛХЭ имеет особое
значение вследствие трудности интраоперационной диагностики и опасности
повреждения ВЖП. Большинство авторов рекомендуют при синдроме Мириззи
выполнение радикальной операции лапаротомным доступом [33].
Склероатрофический жёлчный пузырь
Технические трудности в этой ситуации обусловлены следующими причинами:
1. Утолщение и ригидность стенки жёлчного пузыря.
2. Выраженный спаечный процесс.
3. Сморщивание треугольника Кало.
Ригидность стенок затрудняет взятие жёлчного пузыря на зажимы,
особенно при полном заполнении органа конкрементами. Для осуществления трак-
ции можно прошить жёлчный пузырь в области дна и шейки и осуществлять
тягу за лигатуры.
Препаровку в области треугольника Кало лучше начинать с выделения и
пересечения артерии. Такая последовательность способствует «расправлению»
промежутка между пузырным и общим печёночным протоком. Выделение
элементов шейки жёлчного пузыря должно быть осторожным, с минимальным
использованием электроножа.
При этом патологическом состоянии нередко наблюдают укорочение и
сморщивание пузырного протока, что особенно опасно в сочетании с тонким
ОЖП (рис. 9-55).
Выделение жёлчного пузыря из его ложа также сопряжено с
трудностями — плотное сращение с тканью печени препятствует идентификации слоя.
При выраженных сращениях целесообразно оставить часть стенки жёлчного
пузыря на печени, скоагулировав слизистую оболочку.
179
Рис. 9-54. Синдром Мириззи. Четыре степени выраженности синдрома и варианты хирургической
коррекции (открытым методом).
Холецистоинтестинальный свищ
Это патологическое состояние возникает в результате пенетрации
жёлчного пузыря в поперечную ободочную или двенадцатиперстную кишку. При
наличии плотных сращений между органами их разделяют остро, используя
ножницы. Применение коагуляции опасно вследствие непредсказуемости зоны
ожога тканей и последующей несостоятельности линии швов. Выполняют хо-
лецистэктомию, а дефект стенки кишки ушивают.
Рис. 9-55. Укорочение пузырного протока.
180
10
Осложнения лапароскопической
холецистэктомии
ПОВРЕЖДЕНИЯ ВНЕПЕЧЁНОЧНЫХ ЖЁЛЧНЫХ ПРОТОКОВ
Из всех осложнений ЛХЭ наиболее значимы повреждения ВЖП. Их
частота достигает 6 случаев на 1000 операций, тогда как при открытой
холецистэктомии она в 2—5 раз меньше. Кроме того, сравнение ЛХЭ и открытой
холецистэктомии не совсем корректно, поскольку группы существенно отличаются
по характеристикам пациентов. Традиционным способом оперируют
практически всех больных с осложнениями ЖКБ (острый холецистит, механическая
желтуха), а ЛХЭ применяют в более простых и благоприятных в
прогностическом плане случаях. Хотя общая летальность после ЛХЭ ниже, чем после
открытой холецистэктомии @,06—0,1 и 0,2—0,4% соответственно), более
половины смертей после лапароскопических операций при ЖКБ обусловлено самим
методом. Тогда как при открытой операции 90% летальных исходов связано с
сопутствующими заболеваниями сердечно-сосудистой и лёгочной систем.
Поэтому проблема ятрогенных повреждений ВЖП при ЛХЭ имеет
первостепенное значение.
Классификация повреждений ВЖП
Ранения жёлчных протоков весьма различны как по характеру, так и по
последствиям, способным варьировать от небольшого желчеистечения до
неизлечимых стриктур внутрипечёночных протоков [1, 2]. Различают большие и
малые повреждения, частота которых примерно одинакова в отличие от
открытой хирургии, где преобладают небольшие повреждения.
«Большие повреждения» — это полное пересечение ОЖП, общего
печёночного, долевого печёночного протоков или пересечение протока на более
чем 50% его окружности. Описано 5 вариантов «больших» повреждений ВЖП
при ЛХЭ.
1-й вариант «классического» повреждения. Хирург ошибочно
принимает ОЖП за пузырный проток. Он клипирует и пересекает сначала ОЖП,
затем ОПП. Одновременно происходит ранение правой печёночной
артерии, расположенной в этой зоне. Такой механизм наблюдают в 20%
«больших» повреждений ВЖП. Осложнение, как правило, распознают после
выполнения лапаротомии, предпринятой по поводу массивного
кровотечения из этого сосуда (рис. 10-1).
183
Правая печёночная артерия
Пузырная артерия
Пересечённый ОПП
Пересечённый ОЖП
ОПП
Рис. 10-1. «Классическое» повреждение
ВЖП. А — 1-й вариант, Б — 2-й
вариант.
Пересечённый
пузырный
проток
ОЖП
2-й вариант «классического» повреждения. ОЖП принимают за
проксимальную часть пузырного протока, мобилизуют и клипируют. Дисталь-
ную часть пузырного протока идентифицируют правильно, клипируют и
пересекают. Исход такого осложнения, наблюдаемого у 10% пациентов с
«большими» повреждениями ВЖП, — обильное желчеистечение в
послеоперационном периоде (рис. 10-2) [3, 4].
3-й вариант «большого» повреждения ВЖП состоит в одновременном
клипировании ОПП и ОЖП, сложенных в дупликатуру при чрезмерной
184
Рис. 10-2. «Классическое» повреждение ВЖП A-й вариант). А
Б — пересечение ОЖП.
ошибочная мобилизация ОЖП,
латеральной тракции (рис. 10-3). Это наиболее вероятный механизм
полного пересечения ВЖП, наблюдаемый в 50% случаев.
4-й вариант. Пересечение правого печёночного протока, ошибочно
принятого за пузырный проток. Это тяжёлое повреждение высоко в
воротах печени наблюдают в 10% случаев (рис. 10-4).
5-й вариант, наблюдаемый также у 10% пациентов с «большими»
повреждениями, — электрокоагуляционное поражение, опасное развитием
поздних стриктур ВЖП (рис. 10-5).
Малые повреждения — краевые ранения ВЖП (не более 50% окружности),
несостоятельность культи пузырного протока, повреждения мелких жёлчных
протоков (например, ходов Лютка) (рис. 10-6).
Рис. 10-3. Общий печёночный и жёлчный протоки
сложены в виде дупликатуры и «втянуты» в
клипсу при чрезмерной тракции за карман Хартманна.
Рис. 10-4. Пересечение правого
печёночного протока.
185
Повреждения ВЖП
проявляются в виде желчеистече-
ния, жёлчной гипертензии и
их комбинации.
1. Желчеистечение:
а) из ложа жёлчного
пузыря (ходов Люш-
ка, дополнительных
печёночных
протоков);
б) из культи
пузырного протока;
в) из ОПП при его
краевом ранении;
г) при полном
пересечении
магистральных жёлчных
протоков.
Рис. 10-5. Электрокоагуляционное повреждение ВЖП.
2. Жёлчная гипертензия:
а) полная окклюзия части билиарного тракта;
б) частичная окклюзия магистральных протоков;
в) полная окклюзия билиарного тракта.
3. Сочетание желчеистечения и жёлчной гипертензии.
Рис. 10-6. Малые повреждения ВЖП. А —
повреждения малых жёлчных ходов и пузырного
протока, Б — повреждения добавочного жёлчного
протока, В — краевое ранение ОПП, Г —
продольное рассечение ОЖП.
186
Рис. 10-7. Классификация повреждений ВЖП по Bismuth.
Для выработки адекватной лечебной тактики при «больших»
повреждениях, принята классификация Bismuth [5] (рис. 10-7). В своё время она была
предложена для выработки тактики лечения стриктур ОПП и ОЖП. Её
использование для классификации повреждений ВЖП после ЛХЭ обусловлено особым
характером травмы протоков во время лапароскопических вмешательств.
Своеобразие состоит в значительной потере ткани ОПП при лапароскопических
операциях.
В фундаментальном исследовании, проведённом D.Deziel и соавт. [6] на
опыте 4292 госпиталей США, выполнивших 77 604 ЛХЭ, авторы приводят
следующее распределение осложнений по локализации (табл. 10-1).
Таблица 10-1
Повреждения ВЖП при выполнении 77 604 ЛХЭ
Участок повреждения
Число пациентов
ОЖП
ОПП
Аберрантный проток
Правый печёночный проток
Пузырный проток
271
38
48
8
94
Всего
459 @,59%)
Факторы риска повреждения ВЖП
Частоту и тяжесть ятрогенных повреждений ВЖП определяют не только
технические ошибки хирурга, но и неправильные показания к операции [7].
Согласно классификации R.Martin и R.Rossi [8], существуют три группы
факторов риска: опасная анатомия, опасные патологические данные и опасная
хирургия.
187
Опасная анатомия
Этот фактор включает анатомические варианты строения ВЖП
(описанные в предыдущей главе) и наличие жировой клетчатки в воротах печени.
Жировая клетчатка в воротах печени
По данным R.Rossi [9], тучность и выраженная жировая клетчатка в
зоне ворот печени — факторы риска повреждений ВЖП. Однако
значимость этого не следует преувеличивать, тем более что большинство
пациентов с ЖКБ имеет избыточную массу тела и соответствующие жировые
отложения в области ворот печени.
Опасные патологические данные
Острый холецистит следует отнести к несомненным факторам риска
повреждения ВЖП. Поэтому ЛХЭ при остром воспалении на сроке более 48—72 ч
с момента начала заболевания противопоказана. На долю этой формы
заболевания падает 20% повреждений ВЖП, чему способствуют три основных фактора.
1. Трудность в создании необходимой тракции из-за утолщения и
ригидности стенок жёлчного пузыря.
2. Инфильтративные изменения в области шейки, что усложняет
идентификацию пузырного протока и артерии.
3. Повышенная кровоточивость тканей.
Стихающий приступ острого холецистита
На сроках более 72 ч от начала заболевания рыхлый инфильтрат
уплотняется, треугольник Кало сморщивается и его препаровка становится опасной.
Нередко в рубцово-спаечный процесс вдоль медиальной стенки органа
вовлекаются ОПП и правая печёночная артерия. При стихающем приступе острого
холецистита ЛХЭ противопоказана. Плановую операцию следует провести
через 1,5—2 мес после перенесённого приступа.
Склероатрофический жёлчный пузырь
Прогнозировать до операции склероатрофические изменения в жёлчном
пузыре достаточно сложно. Факторы, имеющие относительное значение для
диагностики.
1. Данные УЗИ (см. раздел «Прогностическое значение УЗИ»).
2. Сроки заболевания (более 5 лет).
3. Клинические признаки (приступы острого холецистита или печёночной
колики после каждой погрешности в диете).
ЛХЭ при склероатрофических изменениях жёлчного пузыря протекает
атипично. Причины технических трудностей.
1. Уплотнение и ригидность стенок.
2. Заполнение всего просвета конкрементами.
3. Укорочение и сморщивание пузырного протока.
4. Прочное сращение жёлчного пузыря с его печёночным ложем.
5. Спаяние медиальной стенки органа с ОПП и правой печёночной артерией.
188
Синдром Мириззи
Степень серьёзности этого синдрома меняется от незначительной
внешней компрессии до явного холецистобилиарного свища. Часто установить
истинное расположение стыка пузырь-пузырный проток невозможно. Пенетри-
рующий в ОПП конкремент принимают за карман Хартманна, мобилизуют и
пересекают проток. При обнаружении синдрома Мириззи в большинстве
случаев показан переход к открытой операции.
Другие опасные патологические данные
Среди других заболеваний наиболее часто предрасполагает к
повреждению ВЖП сопутствующая язвенная болезнь двенадцатиперстной кишки (Я БД ПК)
с выраженным перифокальным воспалением, нередко распространяющимся
на гепатодуоденальную связку. Поэтому ФГДС — обязательный метод доопе-
рационного обследования пациента. При сопутствующей язвенной болезни
плановую операцию выполняют через 2-3 мес после полного заживления
язвенного дефекта.
Цирроз печени опасен с точки зрения повреждения ВЖП из-за
повышенной кровоточивости тканей.
Опасная хирургия
Неправильная тракция
Создание экспозиции — основа безопасного выполнения любой, в том
числе и эндохирургической, операции. Экспозиции достигают тракцией и про-
тивотракцией. При этом жёлчные протоки могут выстроиться в положение,
уменьшающее либо увеличивающее опасность их повреждения. Цель тракции —
выведение жёлчного пузыря и «открытие» треугольника Кало обзору. Это
обеспечивает безопасную мобилизацию пузырного протока и артерии вдали от
трубчатых структур гепатодуоденальной связки.
Варианты неправильной тракции
1. Тракция за карман Хартманна в краниальном направлении и
несколько латерально приводит к тому, что пузырный проток становится
непосредственным продолжением ОЖП. Они выстраиваются в одну
прямую линию, скрывая место слияния общего печёночного и пузырного
протоков. Риск клипирования и иссечения части ОЖП особенно возрастает
при сочетании короткого пузырного протока и тонкого ( 4—5 мм)
подвижного ОЖП.
2. Излишняя тракция за карман Хартманна опасна тем, что ОПП и
ОЖП складываются в виде дупликатуры, «втягивающейся» в клипсу.
Поэтому в момент клипирования тракция за карман Хартманна в
латеральном направлении должна быть ослаблена.
3. Низкое наложение зажима. Эта ситуация возникает при наложении
инструмента не на стенку кармана Хартманна, а на зону шейки жёлчного
пузыря (рис. 10-8). При этом препаровку производят не в области
перехода жёлчного пузыря в пузырный проток, а заведомо проксимальнее —
ближе к ОЖП.
189
Местное кровотечение и желчеистечение
Наиболее распространённая ошибка при кровотечении, возникающем при
препаровке в области шейки жёлчного пузыря, — слепое клипирование,
захватывание тканей зажимом и коагуляция. Гемостаз можно проводить только при
хорошей визуализации и после аккуратного отведения источника
кровотечения от окружающих структур. Для остановки кровотечения удобно
одновременно использовать кровоостанавливающий инструмент (диссектор) и отсос,
введённый в брюшную полость через один из 5-миллиметровых троакаров.
Иногда для этого необходимо установить
дополнительный, пятый троакар. При
невозможности осуществить безопасный
гемостаз показана лапаротомия.
При появлении в зоне препаровки
жёлчи необходимо точно установить
причину желчеистечения. Для этого следует
осушить операционное поле. Если есть
сомнение относительно источника
желчеистечения, проводят ИХГ через место
повреждения или холецистохолангиографию
с предварительной установкой меток
(клипс) в зоне повреждения.
Рис. 10-8. Низкое наложение зажима
привело к ошибочному выделению, а затем
и пересечению ОЖП.
Неверная последовательность
мобилизации жёлчного пузыря
Для безопасного выделения органа
необходимо строго придерживаться
последовательности, рекомендованной в разделе «Техника ЛХЭ» предыдущей главы.
Тепловые и лазерные повреждения
Электрокоагуляционные повреждения ВЖП.
1. Прямое ранение при рассечении тканей.
2. Опосредованное повреждение через клипсы или инструменты.
3. Ишемические повреждения ВЖП вследствие деваскуляризации
при использовании ВЧЭХ.
Электрокоагуляционные повреждения могут проявиться
стриктурами ВЖП на сроках от месяца до года. Подробно эти осложнения
обсуждены в главе 5.
Лазер в эндохирургии применяют реже, чем ВЧЭХ. Использование
лазера сопровождается большей частотой повреждений ВЖП, вплоть до
выпаривания тканей протока (рис. 10-9) [10].
Этап обучения и освоения технологии
Этап освоения ЛХЭ — мощный фактор риска повреждения ВЖП.
Наиболее опасны первые 10—20 операций. Для уменьшения опасности первых
вмешательств необходима систематизированная программа обучения и
прохождение этапа освоения ЛХЭ совместно с опытным эндохирургом-наставником.
190
Для первых операций должны быть подобраны наиболее простые в
техническом отношении случаи.
Холангиография и холедохотомия
При выполнении ИХГ нередко возникает небольшое, но мешающее
хирургу кровотечение из сосудов, кровоснабжающих пузырный проток. Для
остановки этого кровотечения используют коагуляцию, при чрезмерности которой
возможно развитие стриктуры ОПП. Грубая канюляция пузырного протока
может привести к перфорации противоположной стенки ОЖП (рис. 10—10).
Рис. 10-9. Термическое поражение ОЖП при
мобилизации кармана Хартманна.
Рис. 10-10. Перфорация стенки жёлчного
протока при канюлировании
пузырного протока.
Техника выполнения ИХГ должна быть точной и осторожной. Вскрытие
ОЖП вместо пузырного протока можно рассматривать как его повреждение. В
этом отношении более безопасна интраоперационная холецистохолангиогра-
фия [11].
Неверная идентификация анатомических структур
Все перечисленные выше факторы, несомненно, важны для понимания
механизма ятогенного повреждения ВЖП. Однако основным моментом,
приводящим к повреждению ВЖП, признана неверная идентификация
анатомических структур треугольника Кало, гепатодуоденалъной связки и ворот печени, т.е.
ситуация, когда происходит потеря точки слияния пузырного и общего
печёночного протоков. В половине случаев повреждение возникает в анатомически
благоприятных ситуациях, при отсутствии грубых патологических изменений и
других факторов риска.
191
Профилактика повреждений ВЖП
Дооперационная профилактика состоит в отборе пациентов с учётом
показаний и противопоказаний к ЛХЭ. Как следует из материалов 3-го Ежегодного
Конгресса Европейской Ассоциации Эндоскопических Хирургов, прошедшего
в июне 1995 г. в Люксембурге, единственное абсолютное противопоказание к
ЛХЭ — рак жёлчного пузыря. Всё остальное технически осуществимо, включая
лечение холедохолитиаза, синдрома Мириззи и других осложнений ЖКБ.
Однако речь идёт о хирургах, имеющих опыт выполнения нескольких сотен и тысяч
ЛХЭ. На этапе освоения методики показания должны учитывать факторы
риска, перечисленные выше.
Можно предположить, что холецистэктомия будет трудной в следующих
случаях:
— при остром холецистите или после перенесённого приступа острого
воспаления за 1,5—2 мес до операции;
— при длительности заболевания более 5 лет;
— при частых и выраженных приступах.
Усложняют операцию и перенесённые ранее вмешательства на верхнем
этаже брюшной полости. Особое значение в прогнозировании технически
сложной ЛХЭ отводят УЗИ.
Прогностическое значение УЗИ
При отборе пациентов наиболее важны два вопроса:
1. Есть ли у больного холедохолитиаз или его косвенные признаки?
2. Какова вероятность технических трудностей при операции?
Значение УЗИ для диагностики холедохолитиаза описано в главе 9.
Вероятность технических трудностей при выполнении ЛХЭ определяют следующие
критерии.
1. Толщина стенок жёлчного пузыря. Исследование проводят после
12-часового голодания, чтобы исключить артефакт, связанный с
возможным сокращением органа. Толщину стенки оценивают в области
прилегания жёлчного пузыря к печени. При хроническом калькулёзном
холецистите она достигает 3 мм (рис. 10-11). Толщина стенок более 4 мм
свидетельствует либо о сморщивании жёлчного пузыря, либо о его воспалении.
При остром холецистите выполнение ЛХЭ возможно в стадии отёка,
когда по данным УЗИ толщина стенки органа не превышает 10 мм. Большее
увеличение свидетельствует о давности процесса и возможных
трудностях, обусловленных ригидностью жёлчного пузыря и невозможностью
создать адекватную экспозицию [12].
2. Расположение жёлчного пузыря. Практическое значение имеет
соотношение топографии дна органа и края печени. Если дно пузыря
находится на уровне края печени или выступает за него, при ЛХЭ затруднений
не возникает. Если дно пузыря расположено глубже края печени,
возможны технические трудности, ибо высока вероятность спаечного процесса.
192
3. Сморщенный или полностью заполненный конкрементами жёлчный
пузырь. Если при УЗИ жёлчный пузырь не определяется или полностью
заполнен конкрементами, а стенку визуализировать не удаётся, ЛХЭ будет
трудной.
4. Размеры жёлчного пузыря. Технические трудности при ЛХЭ могут
возникнуть при растянутом жёлчном пузыре. Максимально «безопасный»
размер — 13 х 4 см.
5. Спаечный процесс в области жёлчного пузыря. Это состояние не
идентифицируется на УЗИ до тех пор, пока не наступит сморщивание или
утолщение стенок жёлчного пузыря.
Идентифицировать брюшину, а следовательно, и спайки можно только
при использовании высокочастотного ( 5 МГц и более) датчика.
В настоящее время УЗИ — основной способ диагностики ЖКБ. Просчёты
оператора УЗИ могут оказать серьёзное влияние на исход ЛХЭ. Наиболее
частая ошибка — неточность в определении холецистолитиаза — ложноположи-
тельный результат УЗИ, выявляемый только после извлечения препарата из
брюшной полости. Удаление жёлчного пузыря, не содержащего конкрементов,
даёт в 70% случаев неудовлетворительный отдалённый результат лечения.
Прогностическая ценность метода в отношении возможных технических
трудностей при ЛХЭ составляет 60—80%.
Интраопероционная профилактика повреждений ВЖП
Основа интраоперационной профилактики повреждений ВЖП — строгое
соблюдение принципов безопасной техники выполнения ЛХЭ, понимание
механизма развития осложнений. На этапе освоения методики следует
поддерживать низкий порог перехода к открытой операции. Частота конверсии
¦ s ¦¦¦*.•:¦ J
Рис. 10-11. УЗИ. Хронический
калькулёзный холецистит.
Толщина стенки жёлчного
пузыря 0,22 см.
193
при отсутствии строгого отбора пациентов составляет не менее 5—7%, в
некоторых странах (Шотландия) достигает 10-13% [13].
Определённое значение отводится и ИХГ как мере интраоперационной
профилактики повреждений ВЖП.
Диагностика и лечение повреждений ВЖП
Ближайшие и отдалённые результаты лечения повреждений ВЖП
неудовлетворительны. Непосредственная летальность после реконструктивных
вмешательств составляет 8—10%, а на поздних сроках — 13—17% [14]. Основные
причины неудач:
1. Несвоевременность диагностики.
2. Выполнение сложных реконструктивных операций врачами, не
имеющими должного опыта в этой области хирургии.
Определяющее значение с точки зрения исходов лечения имеют сроки
выявления повреждений ВЖП. Поэтому особое внимание следует уделять
интраоперационной диагностике ранений ВЖП.
Интраоперационная диагностика повреждений ВЖП:
Это осложнение диагностируют во время ЛХЭ только у 10—45% пациентов.
Интраоперационные признаки повреждения ВЖП:
1. Появление жёлчи в области операционного поля при неясном
источнике её истечения (рис. 10-12).
2. Появление дополнительных трубчатых структур в области шейки
жёлчного пузыря (рис. 10-13).
3. Расширение предполагаемой культи пузырного протока к концу
операции.
4. Нарушение целостности протоков по данным ИХГ.
Рис. 10-12. Появление жёлчи в области
операционного поля при сохранении
герметичности жёлчного пузыря
свидетельствует о повреждении ВЖП.
Рис. 10-13. Дополнительные трубчатые
структуры в области шейки жёлчного пузыря.
194
Рис. 10-14. Часть ОПП, иссечённая вместе с
жёлчным пузырем.
Особое внимание следует
уделять расшифровке данных ИХГ.
Незаполнение контрастным веществом
протоков выше места введения
катетера может указывать на
пересечение ОПП. В сомнительных
случаях при получении такой холанги-
ограммы исследование следует
повторить, введя предварительно
морфин, чтобы вызвать спазм фатерова
соска.
Переход к открытой операции
также следует рассматривать как
меру диагностики и профилактики
повреждений ВЖП. Конверсия
показана при неясной анатомии, рубцово-инфильтративном процессе и внезапно
возникшем кровотечении, которое не удаётся безопасно остановить лапаро-
скопически. После выполнения лапаротомии необходимо точно определить и
проследить ОЖП и печёночный проток, .а при невозможности визуализации —
выполнить пункционную ИХГ.
Послеоперационная диагностика повреждений ВЖП
Диагностику начинают с осмотра препарата (рис. 10-14).
Сложность диагностики повреждений ВЖП после ЛХЭ связана со
стёртостью клинической картины и непродолжительным наблюдением за
пациентами вследствие их ранней выписки из стационара.
Клиническая картина повреждений ВЖП зависит от характера травмы, но в
любом случае будет проявляться в виде трёх возможных вариантов:
1. Синдром желчеистечения.
2. Синдром жёлчной гипертензии.
3. Сочетание синдромов желчеистечения и гипертензии.
Повреждения ВЖП проявляют себя в виде боли и чувства распирания в
правом подреберье, повышения температуры до фебрильных цифр, желтухи,
потери аппетита, тошноты, рвоты, перитонеальных знаков, желчеистечения по
дренажу или через точки введения троакаров. Жалобы на выраженные боли в
животе на следующий день после ЛХЭ нехарактерны для гладкого течения
послеоперационного периода и должны насторожить хирурга. Если боли носят
разлитой характер или, по крайней мере, имеют тенденцию к
распространению, а также сопровождаются появлением защитного напряжения мышц
передней брюшной стенки не только в местах проколов, следует думать о желче-
истечении или повреждении полого органа. При тупом характере болей,
распирающих болях в области печени чаще имеет место нарушение желчеоттока.
Появление желтухи и холангита окончательно подтверждает диагноз.
195
Повышение температуры также нехарактерно для нормального
послеоперационного периода. Фебрилитет при гладком течении наблюдают не более
чем у 4% пациентов.
Особое внимание после операции следует уделять малым симптомам. При
появлении чувства разбитости, вялости, плохого аппетита нельзя торопиться с
выпиской больного из стационара.
Лабораторная и инструментальная диагностика повреждений ВЖП
строится по принципу «от простого к сложному» с учётом риска проведения самих
диагностических процедур и степени оснащённости конкретного лечебного
учреждения.
ЖЕЛЧЕИСТЕЧЕНИЕ
Истинную частоту желчеистечения установить трудно, поскольку оно
часто протекает бессимптомно. Жидкость в подпечёночном пространстве после
ЛХЭ можно обнаружить у 20—25% пациентов. Радионуклидные методы
исследования показывают, что в 30—45% случаев эта жидкость содержит жёлчь.
Однако клинически значимое подтекание жёлчи наблюдают не более чем у 1%
пациентов [15].
Клиническая картина желчеистечения после ЛХЭ зависит от следующих
факторов:
1. Темп желчеистечения.
2. Степень отграниченности источника желчеистечения.
3. Степень инфицированности жёлчи.
4. Наличие или отсутствие дренажа.
Клинические проявления желчеистечения зависят от того, куда
происходит сброс. Если жёлчь поступает наружу, через дренаж или точки введения
троакаров, то может сформироваться жёлчный свищ; если внутрь, то вероятно
развитие биломы, жёлчного асцита, жёлчного перитонита.
Жёлчный свищ. Различают три степени тяжести желчеистечения:
1. Количество подтекающей жёлчи не превышает 100 мл/сут. Обычно
источник такого желчеистечения — ложе жёлчного пузыря или
небольшой дефект магистральных протоков (неполное клипирование
пузырного протока, точечное краевое ранение ОПП).
2. Количество жёлчи составляет от 100—500 мл/сут. Чаще такой темп
желчеистечения наблюдают при несостоятельности культи
пузырного протока или ранении долевого протока.
3. Количество жёлчи более 500 мл/сут. Такое желчеистечение
свидетельствует о пересечении магистрального жёлчного протока.
Конечно такое разграничение условно, тем более, что, помимо
количественных характеристик, необходимо учитывать временной фактор —
на какие сутки после ЛХЭ выделяется данное количество жёлчи.
Приведённые цифры относятся к первым-вторым суткам после операции.
196
i
Билома — скопление
жёлчи, окружённое псевдокапсулой
(петли кишечника, сальник).
Обычно билома возникает в
результате небольшого
порционного поступления жёлчи в
брюшную полость, когда вокруг
успевает сформироваться
псевдокапсула. Билома была
описана в эру открытой холецис-
тэктомии, но после ЛХЭ её
частота возросла. Клинически это
осложнение проявляется в виде
абсцедирующего инфильтрата в
подпечёночном пространстве
(рис. 10-15).
Жёлчный асцит возникает
При попадании В брюшную ПО- Рис Ю-15. Сцинтиграфия после ЛХЭ. Билома.
лость небольшого количества
стерильной жёлчи. Развитие этого осложнения после ЛХЭ обусловлено
закрытостью лапароскопической операции, т.е. отсутствием интраопера-
ционного инфицирования брюшной полости. В ответ на раздражение
стерильной жёлчью брюшина начинает продуцировать жидкость. Эта форма
желчеистечения протекает почти бессимптомно и может привести к
скоплению в брюшной полости нескольких литров жидкости. Клинические
проявления — свободная жидкость в брюшной полости, определяемая при
осмотре или по данным УЗИ.
Жёлчный перитонит развивается после ЛХЭ по тем же причинам, что
и после открытой холецистэктомии. Особенность этого осложнения после
ЛХЭ — стёртость клинической картины.
Диагностика желчеистечения начинается с оценки жалоб, о которых было
сказано выше. Если «сработал» дренаж, уточнить источник желчеистечения
можно с помощью чресфистульной холангиографии. Контрастное вещество
вводят в дренаж под небольшим давлением под прикрытием антибиотиков
широкого спектра действия.
В анализе белой крови появляются изменения воспалительного характера,
выраженность которых зависит от степени инфицированности жёлчи. При
попадании в брюшную полость небольшого количества стерильной жёлчи
изменений со стороны общего анализа крови может не быть.
Изменения со стороны биохимических показателей крови (АЛТ, ACT, ЩФ)
отмечают при гладком послеоперационном течении у 53—82% пациентов.
Однако повышение содержания билирубина при неосложнённом
послеоперационном течении возникает не более чем у 14% пациентов [16].
Таким образом, данные лабораторных исследований необходимо
сопоставлять с клинической картиной.
197
Рис. 10-16. КТ. Скопление жидкости в подпечёночном
пространстве.
Неинвазивные методы
диагностики
УЗИ. Наиболее доступный
и простой метод — УЗИ. Это
исследование позволяет
определить наличие жидкости в
свободной брюшной полости и
подпечёночном пространстве.
Однако данные УЗИ также
должны быть сопоставлены с
клинической картиной, поскольку
само по себе обнаружение
жидкости не свидетельствует о
развитии осложнения.
КТ. Помимо УЗИ для
обнаружения жидкости может
быть использована КТ (рис. 10-16). Хотя КТ носит более объективный
характер, чем УЗИ, и её результаты меньше зависят от субъективной оценки
врача, оба этих метода имеют общие недостатки.
1. Неспецифичны по
отношению к качественному составу
обнаруженной жидкости.
2. Не позволяют определить
источник истечения жидкости.
3. Не дают ответа на вопрос,
продолжается истечение или
нет.
Основное преимущество этих
методов — неинвазивность, однако
для окончательной постановки
диагноза требуется применение
дополнительной процедуры — чрескожной
пункции места скопления жидкости
под контролем УЗИ или КТ.
Диагностическая пункция позволяет
определить качественный состав
жидкости, а в некоторых случаях —
провести лечебное дренирование полости.
Холесцинтиграфия. Особое
место среди неинвазивных методов
диагностики отводят холесцинтиграфии.
Главное её достоинство —
возможность определения количественных и
качественных характеристик желче-
истечения. Радиоизотопную метку Рис 1(М7 СцинтигРафия. Диффузное
ВВОДЯТ внутривенно ("Тс HIDA, желчеистечение.
198
DISIDA) в дозе 3—5 мКи. По
характеру экскреции изотопа выясняют
следующие вопросы:
1. Содержит ли жидкость жёлчь
2. Продолжается ли желчеисте-
чение (рис. 10-17)
Значение неинвазивных методов
сводится к уточнению диагноза, а при
небольшом по объёму желчеистечении
становится возможным наружное дренирование.
Инвазивные методы диагностики
РХПГ. Наиболее
распространённым методом контрастирования
ВЖП признана РХПГ. Исследование
позволяет определить место и
характер повреждения ВЖП. При
желчеистечении с помощью РХПГ можно
диагностировать несостоятельность
культи пузырного протока, краевое
ранение магистральных протоков, их
полное пересечение. Метод может
оказаться неинформативным при
желчеистечении из дополнительного
печёночного протока или ложа
жёлчного пузыря. Очень ценно и то, что
РХПГ в ряде случаев становится не
только диагностической, но и
лечебной процедурой. Так, при
желчеистечении из пузырного протока или
краевом ранении ОПП с целью
декомпрессии выполняют назобилиар-
ное дренирование жёлчных путей
(рис. 10-18).
ЧЧХГ. Для диагностики
желчеистечения также применяют ЧЧХГ.
Этот метод позволяет выявить жел-
чеистечение из дополнительных протоков, впадающих в жёлчный пузырь.
Чрескожное чреспечёночное дренирование жёлчного дерева можно
применять для устранения жёлчной гипертензии как этап предоперационной
подготовки при желчеистечении и стриктурах ВЖП.
Если выполнение РХПГ и ЧЧХГ невозможно, для диагностики
желчеистечения используют релапароскопию. Наконец, в ряде случаев окончательный
диагноз и источник желчеистечения могут быть установлены во время лапаро-
томии.
Рис. 10-18. РХПГ. А — несостоятельность
пузырного протока, Б — назобилиарное
дренирование для декомпрессии
жёлчного дерева и ликвидации
желчеистечения.
199
Лечение желчеистечения
Существуют следующие способы лечения этого осложнения:
1. Эндоскопическое трансдуоденальное назобилиарное дренирование.
2. Транспечёночное дренирование.
3. Лапаротомия.
4. Релапароскопия.
Выбор способа определяется местом и темпом желчеистечения. Объём
излившейся жёлчи определяют на основании неинвазивных методов
исследования или визуально, по дренажу. При отделении жёлчи по дренажу в
количестве менее 100 мл и стабильном состоянии пациента возможна выжидательная
тактика. Источником такой желчепотери, как правило, служит ложе жёлчного
пузыря (ходы Люшка). При отсутствии жёлчной гипертензии наступает
самоизлечение. При дебите жёлчи более 100 мл/сут показано проведение РХПГ.
Основной причиной такого желчеистечения бывает либо несостоятельность
пузырного протока, либо краевое ранение магистрального протока.
Лечение начинают с назобилиарного дренирования жёлчного дерева. Если
при этом желчеотделение по дренажу прекращается, назобилиарное
дренирование оказывается окончательным
лечебным методом. Сроки назобилиарного
дренирования составляют от 10 дней до 6 нед.
Жёлчь из брюшной полости эвакуируют
путём чрескожной пункции под
контролем УЗ И или КТ. Перед извлечением
дренажа выполняют контрольную чреззондо-
вую холангиографию.
Если РХПГ выполнить не удаётся,
при желчеистечении 1—2-й степени
выполняют ЧЧХГ и наружное дренирование.
Дальнейшие действия аналогичны
таковым при эндоскопическом способе
лечения (рис. 10-19) [17-19].
Недостатки чрескожного чреспечё-
ночного доступа:
1. Дренирование жёлчного дерева при
нерасширенных протоках затруднено.
2. Дренаж может служить входными
воротами для инфекции.
3. Чреспечёночное дренирование
сопровождается большими потерями жидкости
и электролитов, что особенно значимо для
пожилых и ослабленных пациентов.
4. Катетер вызывает дискомфорт у
пациента.
Рис. 10-19. ЧЧХГ при несостоятельности
культи пузырного протока. Желчеисте-
чение в подпечёночное пространство.
Лапаротомия. При желчеистечении
3-й степени показана лапаротомия. Такую
200
же тактику применяют при желчеистечении 2-й степени, когда нет условий
для выполнения РХПГ и ЧЧХГ. Операционная тактика зависит от характера
осложнения.
1. При желчеистечении из ложа жёлчного пузыря во время лапарото-
мии точно определить источник желчепотери обычно не удаётся. В этом
случае выполняют ИХГ и при отсутствии препятствия в терминальном
отделе ОПП операцию заканчивают ушиванием ложа и обязательным
наружным дренированием жёлчных путей. При выявлении жёлчной гипер-
тензии тактика зависит от её природы.
2. При несостоятельности культи пузырного протока её лигируют,
подпечёночное пространство дренируют. При краевом ранении ОЖП или
ОПП дефект ушивают на Т-образном дренаже по Керу (рис. 10-20). Сроки
дренирования прямо пропорциональны размерам дефекта и обратно
пропорциональны ширине ОЖП, т.е. чем больше дефект и уже проток, тем
дольше должен стоять дренаж. Возможно ушивание дефекта протока
наглухо, однако этот способ коррекции применяют только при свежих (не
более суток) повреждениях и с использованием прецизионной техники.
3. При полном пересечении ОПП конкретные детали операции
определяет количество «унесённой» ткани протока. В качестве операции
выбора общепризнана гепатикоеюностомия по Ру. Анастомоз накладывают
на транспечёночном управляемом дренаже. Сроки дренирования зависят
от диаметра протока и составляют от 6 до 12 мес (рис. 10-21).
Рис. 10-20. Ушивание дефекта протока на
Т-образном дренаже.
Рис. 10-21. Гепатикоеюноанастомоз на
транспечёночном управляемом дренаже.
201
В последнее десятилетие
предпочтение отдают анастомозам без
использования каркасного дренажа. Гепатикоеюнос-
томию в этом случае осуществляют микро-
хирургически с обязательным
прецизионным швом слизистой (рис. 10-22) [20—24].
При небольшом диастазе между
проксимальной и дистальной частью протока
в принципе возможно простое ушивание
дефекта на дренаже. Однако сравнение
отдалённых результатов свидетельствует,
что после ушивания на дренаже по типу
конец в конец у 50% пациентов
развивается стриктура ОЖП. После гепатикоею-
ностомии по Ру это осложнение
наблюдают не более чем у 20% больных [25].
Релапароскопия. Релапароскопию в
лечении повреждений ВЖП следует
применять ограниченно — до развития
грубых воспалительных изменений в
области ворот печени при желчеистечении 1-2-й степени. При этом можно
повторно клипировать культю пузырного протока, скоагулировать ходы Лютка на
поверхности ложа жёлчного пузыря (рис. 10-23). Возможно лапароскопическое
дренирование ВЖП при их краевом ранении. В любом случае по ходу
операции следует исключить жёлчную гипертензию органической природы как
первопричину желчеистечения.
Схема 10-1
Рис. 10-22. Гепатикоеюностомия по Ру.
Клинические проявления
желчеистечения
I Сцинтиграфия | | Наблюдение
Наружное дренирование
желчных путей
¦->
I
Релапароскопия
-->
Лапаротомия
Чрескожное дренирование
под контролем УЗИ или КТ
Сочетание этапов
При неэффективности метода
При отрицательном результате
исследования
202
Рис. 10-23. Повторное наложение клипсы на
культю пузырного протока.
ЖЁЛЧНАЯ ГИПЕРТЕНЗИЯ
Синдром жёлчной гипертензии обусловлен обструкцией части или всего
жёлчного дерева. После ЛХЭ этот синдром развивается в результате
клипирования добавочных, долевых, печёночного протоков, ОЖП, а также вследствие
резидуального холедохолитиаза.
Диагностика строится на клинических проявлениях и изменении
биохимических показателей. Неинвазивные способы диагностики (УЗИ, КТ)
выявляют косвенные признаки жёлчной гипертензии — расширение печёночных
ходов. При нарастании желтухи в послеоперационном периоде показано
прямое контрастирование жёлчных путей — РХПГ и ЧЧХГ (рис. 10-24, 10-25).
Чрескожные эндобилиарные вмешательства в ряде случаев позволяют не
только уточнить диагноз, но и выполнить лечебную дилатацию протоков [26].
В случае полного клипирования ОЖП или печёночного протока с
иссечением части ткани может потребоваться совместное использование этих
диагностических приёмов для точного определения анатомических
взаимоотношений между сохранившимися частями
протока. В большинстве случаев
пациентам с этим типом повреждений ВЖП
показана лапаротомия. Хирургическое
вмешательство направлено на устранение
жёлчной гипертензии. У ослабленных
пациентов в качестве предоперационной
подготовки выполняют чрескожно-чрес-
печёночное дренирование.
Сроки выполнения лапаротомии
зависят от состояния пациента. При
стабильном состоянии, отсутствии холангита и
перитонита лучше выждать 4—5 дней с
целью расширения протоков для более
благоприятных условий наложения
анастомоза.
г
Рис. 10-24. РХПГ. Стриктура ОЖП в
результате клипирования.
203
Рис. 10-25. ЧЧХГ. А - обструкция ОЖП в
результате пересечения и клипирования. Б
— стриктура общего печёночного протока
через месяц после ЛХЭ в результате
электрохирургического поражения.
Тактика. При частичном нарушении желчеоттока (перевязка долевого или
добавочного протока) тактика зависит от наличия или отсутствия сообщения
между перевязанным протоком и остальным жёлчным деревом. При отсутствии
связи желчеотток восстанавливают наложением гепатикоеюностомы по Ру.
Схема 10-2
Клинические проявления:
желтуха, холангит, повышение уровня билирубина,
ЩФ, АЛТ, ACT
Дилатация
стриктуры
Направление в специализированный
центр
При неэффективности метода
Лечебный этап
204
Рис. 10-26. Дренирование ОЖП
Г-образным дренажем.
СОЧЕТАНИЕ ЖЕЛЧЕИСТЕЧЕНИЯ
И ЖЁЛЧНОЙ ГИПЕРТЕНЗИИ
Сочетание синдромов — результат
комбинированной патологии. В основе диагностической
программы лежат прямые методы
контрастирования ВЖП — РХПГ и ЧЧХГ. При отсутствии
условий для проведения этих исследований и
обоснованных подозрениях (по лабораторным данным,
УЗ И, КТ) в отношении комбинированных
осложнений показана релапароскопия или лапаротомия
с обязательной ИХГ.
Наиболее часто встречают желчеистечение из
ложа жёлчного пузыря на фоне резидуального
холедохолитиаза. Лечебная тактика описана в
соответствующем разделе, посвященном желчеисте-
чению.
Более сложная ситуация — сочетание
синдромов, наблюдаемое при клипировании ОЖП и
несостоятельности культи пузырного протока (второй вариант «классического»
повреждения). В этом случае показаны лапаротомия и восстановление
проходимости ОЖП на дренаже-каркасе во избежание развития поздней стриктуры
ОЖП. Оптимальная хирургическая тактика — установка Т-образного дренажа.
При широком пузырном протоке с этой целью используют Г-образный дренаж
(рис. 10-26).
При размозжении ткани ОЖП показано иссечение повреждённого
участка в пределах здоровых тканей с восстановлением желчеоттока путём гепатико-
еюностомии по Ру или гепатико-гепатикостомии конец в конец (в зависимости
от конкретной анатомической ситуации).
Исход лечения повреждений ВЖП во многом определяют ранняя
диагностика и хирургическая тактика. В 1995 г. GJack сказал: «Несколько лет назад я
решил для себя, что если когда-нибудь пересеку общий жёлчный проток,
особенно при ЛХЭ, то направлю своего пациента к хирургу, имеющему больший
опыт и должную репутацию в лечении этих осложнений ...».
Реконструктивные операции следует выполнять только в условиях
специализированного стационара с участием квалифицированного специалиста.
Если возможности немедленного перевода пациента в
специализированный центр нет, в проксимальную и дистальную культи жёлчного протока
вставляют трубки, формируя наружный жёлчный свищ.
КРОВОТЕЧЕНИЕ
Это осложнение очень затрудняет операцию и является одной из
основных причин конверсии. Частота серьёзного кровотечения при ЛХЭ,
требующего лапаротомии, достигает 0,25%.
205
Рис. 10-27. Кровотечение из пузырной
артерии.
Рис. 10-28. Кровотечение из общей
печёночной артерии.
Возможные источники кровотечения
1. Пузырная артерия (рис. 10-27).
2. Правая печёночная артерия.
3. Общая печёночная артерия (рис. 10-28).
4. Воротная вена.
5. Сосуды ложа жёлчного пузыря.
Диагностика интраоперационного кровотечения очевидна, однако для
выработки адекватной тактики гемостаза необходимо знание топографической
анатомии. Если источник кровотечения точно не идентифицирован, нельзя
использовать коагуляцию или клипирование, поскольку это ведёт к ещё
большим осложнениям. Как правило, в случаях профузного кровотечения и
неясной анатомии показан переход к открытой операции.
Лечебная тактика при ранениях сосудов гепатодуоденальной связки
зависит от локализации и размеров повреждения.
Кровотечение при точечных ранениях крупных сосудов
останавливают прижатием и местным использованием гемостатиков.
Повреждения воротной вены и общей печёночной артерии требуют
наложения сосудистого шва.
Повреждение правой печёночной артерии допускает её лигирование.
Кровоснабжение печени существенно не пострадает.
Кровотечение из ложа жёлчного пузыря опасно тем, что может быть
неправильно оценено во время операции. Именно этот вид геморрагии
часто требует выполнения лапаротомии в раннем послеоперационном
периоде.
При подозрении на кровотечение показана релапароскопия. Умеренная
кровопотеря (до 200 мл) допускает проведение лапароскопического гемостаза.
При большем кровотечении показана лапаротомия. Для профилактики этого
осложнения рекомендуют во всех сомнительных случаях использовать местные
гемостатические средства (гемостатическую губку, фибриновую пленку и др.).
206
11
Лапароскопическая
аппендэктомия
Аппендэктомия — одна из наиболее распространённых операций в
хирургической практике, так как острый аппендицит на протяжении жизни
возникает у 7% населения. К нерешённым проблемам лечения этого заболевания
относят не только позднюю диагностику с развитием тяжёлых осложнений, но
и необоснованное проведение аппендэктомии, частота которого достигает 20—
40%. При обнаружении неизменённого червеобразного отростка полноценная
ревизия брюшной полости через разрез в правой подвздошной области
невозможна. Кроме того, необоснованная аппендэктомия может привести к
нежелательным последствиям как в раннем, так и в позднем послеоперационном
периоде. К последним относят вторичное бесплодие у женщин, спаечную
непроходимость кишечника, образование грыж и др. Лапароскопия позволяет
установить точный диагноз острого аппендицита в 95—97% случаев, а при
соответствующих показаниях — выполнить ЛА [1—8].
Тем не менее преимущества эндохирургии в лечении острого аппендицита
проявляются не столь ярко, как при лечении ЖКБ или в оперативной
гинекологии, по следующим причинам:
1. Традиционная аппендэктомия в типичных случаях —
малотравматичная операция, выполняемая через небольшой разрез без пересечения
мышц передней брюшной стенки.
2. Выполнение ЛА в отличие от традиционной аппендэктомии
требует общего обезболивания.
3. Для выполнения ЛА необходимо дорогостоящее оборудование, а
также и наличие квалифицированных специалистов и подготовленного
персонала.
4. Специфика неотложной хирургии предусматривает выполнение
операций в вечернее и ночное время, поэтому в большинстве случаев нет
возможности привлечь квалифицированных специалистов.
Показания к ЛА те же, что и к открытой операции, однако за последние
годы были выделены группы пациентов с острым аппендицитом, у которых ЛА
имеет несомненные преимущества:
1. Пациенты, у которых невозможно исключить острый аппендицит
даже при динамическом наблюдении. Диагностическая лапароскопия
позволяет уточнить диагноз и перейти к ЛА, технически выполнимой у 70%
пациентов.
209
2. Женщины репродуктивного возраста, у которых клинически
сложно провести дифференциальную диагностику между острым
аппендицитом и острой гинекологической патологией. В этой группе частота
необоснованных аппендэктомий достигает 22-47% (для сравнения: у
мужчин — 7—15%), что приводит к нежелательным последствиям в виде
спаечного процесса и вторичного бесплодия. Также крайне важен
косметический эффект операции.
3. Пациенты с сопутствующим сахарным диабетом, увеличивающим
риск развития гнойных осложнений.
4. Пациенты с выраженным подкожным жировым слоем передней
брюшной стенки. В этом случае традиционная аппендэктомия требует
значительного кожного разреза и часто осложняется нагноением раны.
5. Пациенты, желающие проведения Л А.
Противопоказания:
1. Время, прошедшее с появления первых симптомов острого
аппендицита, более 24 ч.
2. Аппендикулярный инфильтрат, периаппендикулярный абсцесс.
3. Тифлит с выраженной инфильтрацией основания червеобразного
отростка.
4. Разлитой перитонит.
5. Общие противопоказания к лапароскопии (коагулопатия, поздние
сроки беременности, ХОЗЛ, инфаркт миокарда, выраженная
сердечнососудистая недостаточность).
ОПЕРАТИВНАЯ ТЕХНИКА
Положение больного. Лапароскопию начинают в обычном положении, а
затем в случае принятия решения о ЛА больного переводят в положение Трен-
деленбурга на левом боку (с наклоном
головного конца операционного стола на
30°), что позволяет отвести большой
сальник и петли кишечника от правой
подвздошной ямки. Монитор располагают
справа около ножного конца
операционного стола. Хирург находится слева от
пациента, ассистент — напротив него
(рис. 11-1).
Анестезиологическое пособие.
Операцию проводят под общим внутривенным
или эндотрахеальным обезболиванием.
Эндотрахеальное обезболивание
предпочтительнее, так как обеспечивает более
полную мышечную релаксацию и более безо-
Рис. П-1. Расположение операционной пасно^ на этапах электрохирургического
бригады и монитора при ЛА. воздействия (см. главу 5).
Операционная
сестра
210
Доступы. Иглу Вереша и первый троакар вводят параумбиликально,
выполняя полулунный разрез выше пупка. Детальный осмотр слепой кишки,
червеобразного отростка и органов малого таза, как правило, требует
дополнительного 5-миллиметрового манипулятора, вводимого через прокол в левой
подвздошной области. При наличии в брюшной полости выпота его тщательно
аспирируют. В случае выполнения ЛА третий 10-миллиметровый троакар
вводят в правой мезогастральной области на уровне пупка (рис. 11-2). Некоторые
хирурги используют четвёртый 5-миллиметровый троакар, который вводят в
надлобковой области. При деструктивных формах острого аппендицита
показано внутривенное до- и интраоперационное введение антибиотиков.
ВАРИАНТЫ ЛАПАРОСКОПИЧЕСКОЙ АППЕНДЭКТОМИИ
После завершения диагностического этапа лапароскопии принимают
окончательное решение об объёме вмешательства. В норме червеобразный отросток
легко смещается инструментом, что говорит об отсутствии напряжения его
мышечного слоя, брюшина его имеет голубоватую окраску, сосудистый
рисунок не нарушен. Как и при открытой аппендэктомии, принципиальное
значение имеет способ обработки брыжейки и культи червеобразного отростка.
Существует три способа выполнения ЛА — экстракорпоральный, интракорпо-
ральный и комбинированный.
1. Экстракорпоральный способ — лапароскопически уточняют диагноз,
находят и захватывают зажимом дистальный конец червеобразного
отростка, а затем вместе с брыжейкой извлекают его через доступ 3 (рис. 11-2).
Далее выполняют обычную аппендэктомию с наложением кисетного и
"¦%
У
\
Рис. 11-2. Точки введения троакаров
при ЛА.
Рис. 11-3. Экстракорпоральная ЛА.
211
Z-образного швов. Брюшную полость промывают, осушают и дренируют.
Необходимые условия: подвижная слепая кишка, небольшой диаметр
червеобразного отростка и отсутствие инфильтративных изменений в его
брыжейке. Экстракорпоральный способ предпочтителен на этапе освоения
специалистом техники ЛА (рис. 11-3).
2. Интракорпоральный способ — общепринятый способ выполнения
ЛА, подразумевающий осуществление всех этапов вмешательства внутри
брюшной полости.
3. Комбинированный способ применяют при короткой
инфильтрированной брыжейке, которую коагулируют внутри брюшной полости
(рис. 11-4). Мобилизованный червеобразный отросток извлекают наружу
и дальнейшие этапы операции проводят традиционным способом.
Этапы операции
Тракция. Дистальный конец червеобразного отростка захватывают
зажимом, введённым через доступ 3 и приподнимают по направлению к передней
брюшной стенке. Червеобразный отросток освобождают от спаек и сращений,
а затем располагают таким образом, чтобы брыжейка находилась во
фронтальной плоскости.
Пересечение брыжейки проводят одним из четырёх способов.
1. Через доступ 2 вводят электрохирургический монополярный
зажим или диссектор. Постепенно по 2—3 мм захватывают ткань брыжейки
и коагулируют её, продвигаясь по направлению к основанию
червеобразного отростка (рис. 11-5). Особая осторожность необходима вблизи
купола слепой .кишки. Следует соблюдать строгую последовательность
действий: небольшой участок ткани захватывают диссектором, отводят его от
купола слепой кишки и только затем коагулируют. Необходимо обращать
внимание на близость к инструменту петель кишечника. Этот способ
наиболее прост, обеспечивает надёжный гемостаз и занимает немного времени.
Рис. 11-4. Комбинированная Л А. Коагуляция брыжейки в монополярном режиме.
212
Рис. 11-5. Коагуляция брыжейки
червеобразного отростка.
Необходимо полностью выделить
основание червеобразного отростка по
всей окружности, подготовив его к
наложению лигатуры.
2. Для обработки брыжейки
можно использовать биполярную
коагуляцию, что более безопасно, но
требует специального инструмента и
занимает больше времени. При
инфильтрированной утолщённой
брыжейке биполярная коагуляция может
не обеспечить достаточный гемостаз,
поэтому она требует фрагментации
брыжейки.
3. Перевязка брыжейки
лигатурой. У основания червеобразного
отростка в брыжейке формируют окно, проводят через него лигатуру, оба
конца которой извлекают наружу через троакар. Узел, сформированный
экстракорпорально, опускают в брюшную полость (рис. 11-6). Брыжейку
пересекают ножницами. Наложение отдельных титановых клипс ненадёжно,
особенно в инфильтрированных тканях, и довольно дорого.
4. Брыжейку пересекают с одновременным прошиванием при
помощи сшивающего аппарата.
Формирование культи червеобразного отростка производят одним из трёх
способов.
1. Лигатурный способ наиболее распространён. Он признан наиболее
безопасным отечественными и зарубежными хирургами. После
пересечения брыжейки через доступ 3 вводят эндопетлю, накидывают её на
червеобразный отросток и опускают до основания, используя зажим (рис. 11-7).
Петлю затягивают, лигатуру срезают. Обычно на культе червеобразного
отростка оставляют одну или две лигатуры, наложенные друг на друга
Рис. 11-6. Наложение лигатуры на брыжейку червеобразного отростка.
213
Рис. 11-7. Наложение проксимальной
лигатуры на основание червеобразного
отростка.
Рис. 11-8. Наложение дистальной лигатуры.
(одну из них можно заменить 8-миллиметровой клипсой). На дистальный
отдел червеобразного отростка также накладывают лигатуру, клипсу или
хирургический зажим, за который препарат после отсечения немедленно
извлекают (рис. 11-8—11-11). Размер культи над лигатурой обычно равен
2—3 мм. После отсечения червеобразного отростка слизистую культи
поверхностно коагулируют шарообразным электродом, введённым через
доступ 2 (рис. 11-12). Напоминаем, что коагуляция вблизи металлических
клипс недопустима. При достаточном опыте продолжительность ЛА не
превышает по времени открытой операции и составляет 20—30 мин.
2. Аппаратный способ. Через 12-миллиметровый троакар из доступа 3
вводят эндохирургический сшивающий аппарат, накладываемый
раздельно на червеобразный отросток и его брыжейку, пересекая их поочерёдно.
При небольшой толщине тканей обе структуры прошивают
одномоментно (рис. 11-13). Аппаратная аппендэктомия сокращает время операции и
Рис. 11-9. Наложение клипсы.
Рис. 11-10. Пересечение червеобразного
отростка.
214
позволяет при необходимости
выполнить резекцию купола слепой
кишки с соблюдением асептических
условий. Единственный недостаток
метода — высокая стоимость
сшивающего аппарата.
3. Погружение культи в купол
слепой кишки наложением интра-
корпорального кисетного и Z-образ-
ного швов. Методика была
разработана основоположником ЛА Куртом
Земмом [9] и требует совершенного
владения техникой эндохирургичес-
кого шва.
Извлечение препарата —
ответственный момент операции. Во избежание
распространения внутрибрюшной инфекции
препарат извлекают наружу немедленно
после отсечения червеобразного
отростка. Необходимо предотвратить контакт
воспалённого червеобразного отростка с
тканями передней брюшной стенки; в
противном случае инфицирование тканей с
большой вероятностью приведёт к
развитию гнойных осложнений. Для этого
используют один из следующих приёмов:
1. При диаметре
червеобразного отростка и его брыжейки менее 10
мм препарат можно
беспрепятственно извлечь через троакар 3.
2. При большем диаметре
препарата применяют переходную
гильзу 10/20 мм (рис. 11-14).
3. Червеобразный отросток
перед извлечением помещают в
контейнер.
Окончание операции. Зону
вмешательства тщательно промывают раствором
антисептика в количестве 500—700 мл.
Пациента возвращают из позиции Тренделен-
бурга в обычное положение, аспирируют
из брюшной полости жидкость,
устанавливают дренаж. Раны ушивают.
Рис. 11-11. Червеобразный отросток
извлекают сразу после отсечения.
215
Рис. 11-12. Слизистую культи осторожно коагулируют шарообразным электродом.
Рис. 11-13. Аппаратная аппендэктомия.
Рис. 11-14. Извлечение препарата через
переходную гильзу 10/20 мм.
216
ПОСЛЕОПЕРАЦИОННОЕ ВЕДЕНИЕ
Послеоперационный период при ЛА протекает значительно легче, чем после
традиционной аппендэктомии. Больного активизируют к концу 1-х суток
после удаления дренажа, разрешают приём жидкой пищи. Однако антибиотики
назначают всем пациентам. Выписывают больного через 3—7 дней. В не-
осложнённых случаях срок утраты трудоспособности не превышает 14 дней.
ОСЛОЖНЕНИЯ И ИХ ПРОФИЛАКТИКА
Раневая инфекция — одно из наиболее вероятных осложнений ЛА,
напрямую связанное со способом извлечения червеобразного отростка из брюшной
полости.
Внутрибрюшная инфекция в виде абсцессов или перитонита может быть
следствием неадекватной санации и дренирования или неполной аспирации
жидкости из брюшной полости. В целом гнойные осложнения после ЛА
наблюдают в 4 раза реже, чем после открытой аппендэктомии [2].
Рецидив острого аппендицита — необычное осложнение, возникающее
после ЛА. Клинически проявляется симптомами острого аппендицита на сроках
3-6 мес после проведения лапароскопической операции. На повторной
операции находят воспалённую культю червеобразного отростка длиной 2-3 см.
Причины осложнения — неполная мобилизация основания червеобразного
отростка при ЛА и чрезмерная длина его культи.
Несостоятельность культи червеобразного отростка — редкое осложнение,
впервые описанное Шребер. Связана либо с неоправданным расширением
показаний к лигатурному методу формирования культи при ЛА (тифлит,
инфильтрация основания червеобразного отростка), либо с термическим поражением
купола слепой кишки при неосторожной коагуляции.
Синдром «пятого дня» — острый тифлит, возникающий на 5-е сутки после
операции. Его возникновение связывают с электрохирургическим ожогом
купола слепой кишки при неосторожном применении монополярной
коагуляции. Для осложнения характерны сильные боли в правой подвздошной
области, защитное мышечное напряжение, перитонеальные симптомы, фебрильная
температура тела. В этом случае необходимо хирургическое лечение; на
операции обнаруживают фибринозный тифлит, как правило, без перфорации.
Грыжа в точке введения одного из троакаров появляется, как правило,
через 1-4 нед после операции, когда пациент возвращается к обычному образу
жизни. Причины осложнения — нагноение, гематома передней брюшной
стенки в области одной из ран или дефект хирургической техники при ушивании
тканей.
217
12
Торакоскопическая
хирургия
ОБЩИЕ ПОЛОЖЕНИЯ
Внедрение в клиническую практику эндоскопической хирургии
распространилось и на торакальные операции [1]. Известная ранее диагностическая
торакоскопия переросла в новое направление — оперативную торакоскопию.
Показания к диагностической и оперативной торакоскопии:
Диагностическая торакоскопия
1. Экссудативный плеврит неясной этиологии.
2. Диссеминированные заболевания лёгких.
3. Определение стадии рака лёгкого.
4. Медиастинальные лимфаденопатии.
5. Злокачественные опухоли средостения.
6. Уточнение природы перикардита.
Оперативная торакоскопия
1. Спонтанный пневмоторакс как осложнение буллёзной болезни.
2. Эмпиема плевры.
3. Бронхоэктатическая болезнь.
4. Периферические доброкачественные опухоли лёгких.
5. Солитарные лёгочные метастазы.
6. Периферический рак лёгкого Tj_2N0.
7. Доброкачественные опухоли средостения.
8. Операции на вегетативной нервной системе.
9. Травмы и ранения грудной клетки.
10. Доброкачественные заболевания пищевода.
11. Эхинококкоз лёгкого.
12. Рак молочной железы (в этом случае возможно проведение пара-
стернальной лимфаденэктомии).
В настоящее время расширяются показания к применению торакоскопи-
ческих вмешательств.
а. Кардиохирургия (лигирование открытого артериального протока,
имплантация электродов водителей ритма, аортокоронарное
шунтирование) [2].
б. Эзофагэктомия [3].
в. Спондилиты различной этиологии [4].
г. Эмфизема лёгких [5].
219
Противопоказания принято делить на общие и местные.
Общие противопоказания включают:
1. Острый инфаркт миокарда.
2. Острое нарушение мозгового кровообращения.
3. Некорригируемая коагулопатия.
4. Непереносимость однолёгочной вентиляции.
Местные — облитерация плевральной полости.
Предоперационное обследование
1. Общее клиническое обследование (общий анализ крови с лейкофор-
мулой, общий анализ мочи, биохимические анализы крови, ЭКГ).
2. Рентгенологическое исследование органов грудной клетки.
3. Томография органов грудной клетки.
4. КТ органов грудной клетки.
5. Бронхоскопическое исследование.
6. Спирометрия.
Положение больного на операционном столе. Основные требования —
возможность нормального функционирования лёгкого на стороне,
противоположной операции, и удобство для хирургических манипуляций. Наиболее часто
операции производят при положении больного на здоровом боку (рис. 12-1).
Такое положение, хотя и удобно для хирурга, имеет свои недостатки.
Компрессия здорового лёгкого при выключении из вентиляции лёгкого на стороне
операции неблагоприятно отражается на дыхательной функции. Кроме того, в этом
положении увеличивается риск аспирации бронхиального секрета в
дыхательные пути здорового лёгкого с последующим развитием осложнений. Более
щадящее положение больного — полубоковое на клинообразном валике (рис.
12-2). В этом случае здоровое лёгкое подвергается меньшему сдавлению, в то
же время операционное поле по размерам достаточно для проведения
торакоскопии. Иногда возникает необходимость в наклоне операционного стола в ту
или иную сторону, поэтому больного необходимо надёжно зафиксировать. В
редких случаях (при эзофагэктомии) больного укладывают на живот.
Анестезиологическое пособие.
Наиболее часто при ТО применяют
общее обезболивание с
искусственной вентиляцией лёгких, хотя
проведение диагностических операций
возможно и под местным
обезболиванием (рис. 12-3). Раздельная
интубация бронхов с выключением из
дыхания лёгкого на стороне
поражения обеспечивает пространство,
достаточное для проведения
вмешательства. Спавшееся, неподвижное
лёгкое создаёт оптимальные условия
для выполнения манипуляций как
на самом лёгком, так и на других
Рис. 12-1. Положение больного на операционном
столе на боку.
220
органах грудной полости [6].
Рис. 12-2. Промежуточное полубоковое положение
больного на клинообразном валике.
Наложение пневмоторакса
В отличие от брюшной
полости грудная клетка имеет костный
каркас, поэтому торакоскопия не
требует создания искусственного
пространства путём нагнетения газа
под давлением. Для проведения
вмешательства первоначально
достаточен небольшой объём полости —
около 200 см3. Герметичность
плевральной полости при проведении
торакоскопии не обязательна, но
некоторые хирурги предпочитают
проведение диагностической
торакоскопии на герметичной плевральной
полости с предварительной инсуф-
фляцией СО2 под давлением не
более 8 мм рт.ст., что, однако, может
привести к смещению средостения,
снижению венозного возврата и
нарушению сердечной деятельности.
Существует несколько способов
создания пневмоторакса и введения то-
ракопортов:
1. Плевральную полость
пунктируют иглой Вереша в V—VII
межреберье по средней подмышечной
линии. Убедившись в правильном
положении иглы (засасывание
воздуха в плевральную полость через
канюлю), инсуффлируют 200-300
см3 газа. Затем в плевральную
полость в месте пункции вводят тора-
копорт для торакоскопа.
2. Пункцию и инсуффляцию
газа не производят, а сразу после
небольшого разреза кожи длиной
около 1 см торакопортом проникают в
плевральную полость.
3. При подозрении на наличие спаечного процесса или облитерацию
плевральной полости производят разрез кожи, тупым способом разводят
межрёберные мышцы и проникают пальцем в плевральную полость, затем
вводят торакопорт.
4. Выполняют миниторакотомию протяжённостью 3—4 см в IV или V
межреберье в проекции передней подмышечной линии. Через созданное
отверстие вводят инструменты (в том числе и общехирургические), а в
конце операции через него же удаляют препарат.
Рис. 12-3. Раздельная интубация трубкой Кар-
ленса.
221
Чаще всего первый торакопорт вводят в V межреберье по срединноклю-
чичной линии (рис. 12-4). При вмешательстве на нижних отделах средостения
используют III—IV межреберье, при операциях на передневерхних отделах
средостения — VI—VIII межреберье. После осмотра плевральной полости вводят
дополнительные манипуляционные торакопорты под контролем зрения. Их
количество и места введения определяет характер предполагаемой операции.
При диагностической торакоскопии, как правило, достаточно одного рабочего
торакопорта. При оперативной торакоскопии их вводят два или три.
Оперативная техника
Торакоскопию проводят ригидным торакоскопом с углом зрения 0° или
30°. Последний вариант более удобен, так как позволяет осмотреть всю
плевральную полость. Последовательно осматривают лёгкое, висцеральную и
париетальную плевру, диафрагму, органы средостения. Обращают внимание на
наличие выпота, высыпаний или наложений на плевре, патологических
образований в средостении.
После окончания операции лёгкое под контролем зрения раздувают.
Плевральную полость дренируют одной или двумя трубками, устанавливаемыми в
точках расположения верхнего и нижнего торакопортов (рис. 12-5).
Послеоперационный период
Больных активизируют сразу после окончания медикаментозного сна. На
1-е сутки после операции проводят контрольную рентгенографию органов
грудной клетки. По показаниям вводят ненаркотические анальгетики. Дренажи
обычно извлекают на 2—3-й сутки после операции. Показанием к их удалению
служит восстановление пневмостаза и прекращение экссудации (менее 100 мл в
сутки).
Осложнения и их профилактика
Осложнения разделяют на две группы: неспецифические осложнения,
возникающие при любой торакальной операции независимо от метода её
проведения, и специфические осложнения при ТО [7—8].
1. К осложнениям первой группы относят дыхательную и
сердечнососудистую недостаточность, послеоперационное кровотечение, раневую
инфекцию, неполный пневмостаз. Лёгочно-сердечная недостаточность и
инфекционные осложнения возникают при ТО реже. Это можно
объяснить меньшей травматичностью операции, незначительным
повреждением мягких тканей грудной стенки. В то же время такое осложнение, как
неполный пневмостаз, при торакоскопических процедурах наблюдают чаще,
чем при открытых операциях, что связано с более сложной техникой ин-
тракорпорального шва. Кровотечение при ТО иногда требует перехода на
торакотомию.
222
Рис. 12-4. Установка первого торакопорта.
Рис. 12-5. Дренирование плевральной
полости.
2. К осложнениям второй группы относят ранение диафрагмы,
перикарда, лёгкого и межрёберных сосудов при введении торакопортов;
смещение средостения, связанное с напряжённым пневмотораксом;
межрёберную невралгию; имплантацию опухолевых клеток в точках введения
торакопортов.
Причины возникновения осложнений и их профилактика.
Кровотечение из крупных сосудов корня лёгкого при выполнении лобэк-
томии в настоящее время стало редким осложнением благодаря
совершенствованию оперативной техники и улучшению качества медицинских
инструментов. При биопсии выбор бессосудистого участка и предварительная пункция
опухоли средостения снижают риск развития кровотечения. Использование
торакопортов с тупым концом и введение их под контролем зрения позволяют
предотвратить повреждение диафрагмы, перикарда, лёгкого и межрёберных
сосудов.
Смещение средостения предотвращают проведением операции на
разгерметизированной плевральной полости без инсуффляции СО2. Раздельная
интубация бронхов с выключением из акта дыхания лёгкого на стороне
вмешательства создаёт оптимальные условия для операции.
Межрёберная невралгия — достаточно редкое осложнение ТО. Её
возникновения можно избежать правильным введением торакопорта или
использованием гибких троакаров малого диаметра.
Имплантационное метастазирование предупреждают, используя эндохирур-
гические сачки и контейнеры для удаления препарата. Эти способы исключают
контакт опухоли с раневой поверхностью.
223
Причины перехода от эндоскопической к открытой операции
Причины, не связанные с оперативной техникой:
1. Непереносимость однолёгочной вентиляции.
2. Облитерация плевральной полости.
3. Анатомические особенности (большие размеры патологического
образования, заращение междолевых борозд).
4. Невозможность визуализации патологического образования.
Эти ситуации не относят к осложнениям торакоскопии. В ряде случаев
даже тщательное предоперационное обследование, включающее КТ, не
позволяет получить информацию о возможном спаечном процессе и точно
установить локализацию образования в лёгком.
Причины, связанные с оперативной техникой:
1. Неконтролируемое кровотечение.
2. Повреждение пищевода, стволовых бронхов.
3. Чрезмерная продолжительность ТО при её безуспешности.
Длительные попытки выполнить операцию непременно эндоскопическим
доступом ведут к интраоперационным осложнениям. Необоснованное
затягивание продолжительности операции утяжеляет течение
послеоперационного периода и полностью перечёркивает преимущества малоинвазив-
ных методик [9].
ДИАГНОСТИЧЕСКАЯ ТОРАКОСКОПИЯ
Торакоскопия — один из наиболее информативных инвазивных методов
диагностики заболеваний органов грудной полости. Малая травматичность
процедуры в сочетании с широкими диагностическими возможностями позволяет
использовать торакоскопию для прицельной биопсии плевры, лимфатических
узлов, опухолей средостения, ткани лёгкого. Диагностическая торакоскопия
благодаря возможности получения гистологического или цитологического
материала позволяет сделать окончательное заключение о характере
патологического процесса.
Показания
1. Экссудативный плеврит неясной этиологии. Наиболее часто плеврит
обусловливают туберкулёз, злокачественная мезотелиома или диссеминация рака
по плевре. Диагностическую торакоскопию выполняют с целью получения
полноценного биопсийного материала под контролем зрения. Другие методы
(цитологическое исследование плеврального выпота, слепая биопсия) гораздо
менее информативны [10—16].
2. Определение стадии рака лёгкого. При подозрении на метастатическое
поражение лимфатических узлов средостения диагностическая торакоскопия с
прицельной биопсией позволяет установить распространённость процесса и
избежать диагностической торакотомии [17].
224
3. Медиастиналыгая лимфаденопатия. Диагностическая торакоскопия
показана всем больным с увеличенными лимфатическими узлами средостения
для установления этиологии поражения (лимфогранулематоз, злокачественная
лимфома, саркоидоз, туберкулёз), так как только гистологическое и
гистохимическое исследования поражённого лимфатического узла позволяют
установить диагноз [18—20].
4. Злокачественные опухоли средостения. Эти опухоли в 90—95% случаев на
момент диагностирования неоперабельны. Диагностическая торакоскопия у этой
категории больных позволяет не только установить морфологический диагноз
опухоли, но и выявить её распространённость, прорастание в органы
средостения и/или лёгкое [21—22] для назначения в последующем адекватной химио-
или лучевой терапии.
5. Диссеминированные заболевания лёгких. В диагностике интерстициаль-
ных и диссеминированных заболеваний лёгких диагностическая торакоскопия
с краевой резекцией — наиболее точный метод, позволяющий получить
материал для гистологической верификации процесса. Бронхологическое
обследование, чрескожная пункция лёгочной ткани при этих заболеваниях
малоинформативны [23].
6. Перикардит. Диагностическая торакоскопия позволяет уточнить
этиологию перикардита, провести декомпрессию и дренирование полости перикарда [24].
Оперативная техника
Диагностическую торакоскопию выполняют под местным или общим
обезболиванием. В плевральную полость вводят торакоскоп и с его помощью
проводят ревизию плевральной полости. При наличии выпота его аспирируют.
Заболевания плевры. При заболеваниях плевры (злокачественная мезоте-
лиома, диссеминация рака, туберкулёзный плеврит и т.д.) биопсийными
щипцами получают до 20 биоптатов наиболее изменённых участков с целью
проведения срочного гистологического исследования. При наличии
злокачественного процесса показан плевродез тальком или блеомицином с целью
облитерации плевральной полости и прекращения экссудации. При выявлении
туберкулёза или воспалительного плеврита назначают соответствующее лечение.
Определение стадии рака лёгкого. Производят биопсию лимфатических
узлов средостения, при наличии метастазов определяют их прорастание в
окружающие ткани. Биопсию выполняют специальными щипцами или путём экс-
цизии. Незначительное кровотечение из лимфатического узла останавливают
электрокоагуляцией. Биопсию злокачественных опухолей средостения
производят по такой же методике (рис. 12-6).
Медиастинальная лимфаденопатия. Выполняют биопсию лимфатического
узла путём вылущивания его из окружающих тканей. При выделении
лимфатического узла следует соблюдать осторожность и избегать его повреждения
(рис. 12-7). Предварительно целесообразно клипировать сосудистую ножку;
также возможна её электрокоагуляция.
225
Рис. 12-6. Биопсия злокачественной опухо- Рис. 12-7. Вылущивание лимфатического уз-
ли средостения. ла средостения.
Интерстициальные заболевания лёгких.
Краевую резекцию выполняют с
предварительным наложением эндопетли или
использованием сшивающего аппарата
(рис. 12-8).
Перикардиты. Резекцию перикарда
осуществляют при помощи сшивающего
аппарата или ножниц. Участок
резецированной ткани (перикардиалъное окно)
должен быть размером 2x4 см. При
выполнении операции необходимо
идентифицировать диафрагмальный нерв и
проходящие рядом сосуды во избежание их
повреждения. Перикардиальный выпот ас-
пирируют.
Операцию заканчивают раздуванием лёгкого, санацией и дренированием
плевральной полости.
ОПЕРАТИВНАЯ ТОРАКОСКОПИЯ
Пневмоторакс
Спонтанный пневмоторакс — одно из наиболее частых показаний к
видеоторакоскопии. Наиболее распространёнными причинами пневмоторакса
считают буллёзную болезнь лёгких, эмфизему лёгких, врождённый поликис-
тоз, повреждение ткани лёгкого при переломе рёбер. Цель операции —
устранение пневмоторакса и, при спонтанном пневмотораксе, облитерация
плевральной полости [25, 26].
Оперативная техника. В плевральную полость вводят троакар через V или
VI межреберье по средней подмышечной линии. Проводят ревизию
плевральной полости, устанавливают наличие спаек. Под контролем зрения в плевральную
Рис. 12-8. Краевая резекция лёгкого
аппаратом EndoGIA-30.
226
Рис. 12-9. Буллёзная болезнь лёгкого. Рис 1210 Плеврэктомия.
полость вводят рабочие траокары: в III межреберье по передней подмышечной
линии и в V межреберье по срединно-ключичной линии. Такое расположение
торакопортов удобно для манипуляций в области верхней доли, где наиболее
часто локализуются буллы.
Во время ревизии плевральной полости следует обратить особое внимание
на наличие и размер булл, особенно важно выявление нарушений целостности
паренхимы лёгкого и висцеральной плевры вследствие разрыва тонкостенных
булл. Для выявления скрытых повреждений паренхимы лёгкого в плевральную
полость вводят жидкость (чаще всего изотонический раствор хлорида натрия)
и лёгкое раздувают; появление пузырьков воздуха позволяет определить
локализацию дефекта.
1. Крупные буллы (более 2 см в диаметре) и ранения лёгкого требуют
наложения эндопетли, ручного или аппаратного шва. Дозированным
раздуванием лёгкого подтверждают надёжность пневмостаза (рис. 12-9).
2. При буллах менее 2 см в диаметре производят их электрокоагуляцию.
С целью облитерации плевральной полости производят плевродез или пле-
врэктомию.
1. Плеврэктомию выполняют на протяжении от II до VII межреберья.
Рассекают плевру вдоль ребра электрокоагуляционным крючком или
ножницами, отслаивают от подлежащих тканей и удаляют. Гемостаз
обеспечивают электрокоагуляцией кровоточащих сосудов шарообразным
электродом (рис. 12-10).
2. Механический плевродез. Марлевым тупфером производят
натирание париетальной плевры в области верхней доли лёгкого до
возникновения капиллярного кровотечения.
3. Химический плевродез тальком. В плевральную полость инсуфф-
лируют 3—6 г порошка талька.
4. Облитерации плевральной полости можно достигнуть
электроскарификацией париетальной плевры. Для этого электрокоагуляционным
крючком или шарообразным электродом производят электрокоагуляцию
париетальной плевры вдоль рёбер.
227
Операцию заканчивают дренированием плевральной полости одной или
двумя дренажными трубками и раздуванием лёгкого под контролем зрения.
Дренажные трубки подключают к вакуум-аспиратору с постоянным
отрицательным давлением около 20 мм вод. ст.
Послеоперационный период. Ежедневно проводят рентгенографию органов
грудной клетки для контроля за состоянием лёгких и плевральных полостей.
Дренажные трубки удаляют после установления пневмостаза (чаще на 2—3-й сутки).
Осложнения и профилактика. Для профилактики повторного пневмоторакса
в послеоперационном периоде необходимы тщательный уход за дренажными
трубками и поддержание постоянного отрицательного давления в плевральной
полости.
Эмпиема плевры
При безуспешности консервативной терапии пункциями, закрытым
дренированием и санацией полости эмпиемы плевры прибегают к торакоскопии
[27-30].
Оперативная техника. Процедуру выполняют под общим обезболиванием
с искусственной вентиляцией лёгких. Троакар для торакоскопа вводят в
полость эмпиемы плевры в точке, определённой с помощью рентгенологического
исследования. Эвакуируют экссудат и отправляют его на бактериологическое
исследование. Затем проводят осмотр полости эмпиемы плевры и в наиболее
удобном для манипуляций месте вводят торакопорт для инструментов. Элект-
рокоагуляционным крючком разъединяют спайки, создавая таким образом
единую полость. Некротические ткани, фибрин удаляют с помощью инструментов
либо аспирацией. Полость эмпиемы плевры санируют антисептиками,
облучают СО2-лазером или УФО, затем дренируют.
Послеоперационный период. Производят активное дренирование полости
эмпиемы плевры, обработку растворами антисептиков. Назначают дезинток-
сикационную и мощную антибактериальную терапию по принятым схемам.
Периферические опухоли лёгких
Дифференциальная диагностика периферических доброкачественных и
злокачественных новообразований лёгких сложна. Периферические опухоли
лёгких и солитарные метастазы — показания для оперативного лечения.
Несмотря на косвенные рентгенологические и томографические признаки
доброкачественности процесса, окончательный диагноз устанавливают только при
гистологическом исследовании препарата. Бронхоскопическое исследование
малоинформативно, особенно при периферических опухолях небольших
размеров. Чрескожная пункционная биопсия при злокачественных
новообразованиях позволяет поставить диагноз в 43—76% случаев, при доброкачественных
новообразованиях чувствительность этого метода значительно ниже [31—32].
Больным преклонного возраста с периферическим раком лёгкого Tj_2N0 с
низкими функциональными данными в связи с тяжёлой сопутствующей пато-
228
логией показана атипическая резекция лёгкого [33—38]. Объём вмешательства
при доброкачественных периферических опухолях и солитарных метастазах —
атипическая резекция лёгкого или вылущивание опухоли.
Показания к торакоскопической операции
1. Периферические доброкачественные опухоли лёгких.
2. Солитарные лёгочные метастазы.
3. Периферический рак лёгкого Tj_2N0 (у больных с ЛСН).
Оперативная техника. Торакоскопию выполняют с применением общего
эндотрахеального обезболивания с раздельной интубацией бронхов.
Выключают вентиляцию лёгкого на стороне операции. В V межреберье по срединно-
ключичной линии вводят торакопорт для торакоскопа. Осматривают
плевральную полость и лёгкое. Торакопорты для инструментов вводят под визуальным
контролем в точках, наиболее удобных для манипуляций (выбор точек
введения инструментальных торакопортов зависит от локализации опухоли в
лёгком). При выполнении операции обычно достаточно 2—3 торакопортов.
Опухоли, расположенные субплеврально, доступны осмотру (рис. 12-11).
Опухоли, расположенные в глубине паренхимы лёгкого, выявляют одним
из перечисленных ниже способов.
1. До операции под контролем КТ проводят чрескожную пункцию
опухоли специальной иглой с крючком на конце и вводят раствор метиле-
нового синего. Во время торакоскопии по окрашиванию лёгкого и
локализации иглы определяют расположение опухоли [39].
2. Интраоперационное УЗИ проводят с помощью специального эндо-
хирургического датчика. Эхолокация лёгкого не всегда позволяет
определить локализацию опухоли из-за воздушности лёгочной паренхимы [40].
3. Инструментальная пальпация лёгкого. При помощи диссектора
пальпируют паренхиму лёгкого, определяя локализацию патологического
образования.
4. Мануальная пальпация лёгкого. Расширяют один из проколов
грудной стенки, вводят в плевральную полость палец и производят пальпацию
лёгкого в месте предполагаемой локализации опухоли. Этот способ
обнаружения периферических опухолей наиболее прост и эффективен.
После выявления производят пункцию опухоли. Пунктат подвергают
срочному цитологическому исследованию (рис. 12-12). В зависимости от
результатов цитологического исследования выполняют ту или иную операцию.
Атипическая резекция лёгкого. На ткань лёгкого по линии предполагаемой
резекции накладывают сшивающий аппарат. Резецируют необходимый
участок лёгкого с опухолью (рис. 12-13). В зависимости от объёма удаляемого
участка лёгкого аппарат накладывают до 5—6 раз [41, 42].
Вылущивание опухоли лёгкого. Ткань лёгкого рассекают над опухолью,
используя электрохирургические инструменты (ножницы или крючок).
Производят вылущивание опухоли. Целостность лёгкого восстанавливают, накладывая
эндохирургические швы, причём узлы завязывают интра- или экстракорпорально
(рис. 12-14).
229
Рис. 12-11. Субплевральная периферическая
опухоль лёгкого.
Рис. 12-12. Пункция периферической
опухоли лёгкого.
Рис. 12-13. Атипическая резекция лёгкого.
Рис. 12-14. Ушивание лёгкого.
Удалённую опухоль подвергают срочному гистологическому исследованию.
При подтверждении доброкачественности процесса операцию заканчивают.
Наличие злокачественной опухоли служит показанием к анатомической лобэк-
томии (см. ниже), выполняемой торакоскопическим либо обычным способом.
Плевральную полость заполняют жидкостью и постепенно раздувают
лёгкое для контроля пневмостаза: появление пузырьков воздуха говорит о
недостаточной герметичности и требует наложения дополнительных швов на
лёгкое. Лёгкое раздувают после дренирования плевральной полости, удаляют то-
ракопорты, на операционные раны накладывают швы.
Анатомическая лобэктомия. Злокачественные периферические опухоли
лёгких требуют выполнения анатомической лобэктомии. Причём при раке
лёгкого важна полноценная лимфаденэктомия. Методика ТО аналогична
традиционной лобэктомии [43-44]. Анатомическую лобэктомию применяют также при
бронхоэктатической болезни и хроническом абсцессе лёгкого.
230
Показания:
1. Периферический рак лёгкого T^N^
2. Бронхоэктатическая болезнь в стадии ремиссии.
3. Хронический абсцесс лёгкого.
Противопоказания:
1. Центральный рак лёгкого.
2. Наличие метастазов в корне лёгкого.
3. Заращение междолевых борозд.
Оперативная техника. Операцию выполняют с использованием четырёх
торакопортов или дополняют миниторакотомией (в IV или V межреберье).
Первый торакопорт для торакоскопа вводят в V межреберье по средней
подмышечной линии. Второй и третий — в то же межреберье по парастернальной и
задней подмышечной линиям. Четвёртый торакопорт вводят в III межреберье
по срединно-ключичной линии (рис. 12-15).
1. Нижняя лобэктомия. Разделяют междолевую щель при помощи
электрокоагуляционного крючка. Им же рассекают лёгочную связку.
Верхнюю долю лёгочным зажимом отводят кверху, достигая тем самым
обнажения корня нижней доли (рис. 12-16). Диссектором выделяют
нижнедолевую артерию. С особой тщательностью следует выделять заднюю стенку
артерии, где она спаяна с нижнедолевым бронхом. Бронхопульмональные
лимфатические узлы смещают в дистальном направлении. На
нижнедолевую артерию накладывают сшивающий аппарат (EndoGIA-ЗО), введённый
через торакопорт 2. Артерию прошивают и пересекают (рис. 12-17).
Выделяют нижнедолевую вену и обрабатывают этим же сшивающим аппаратом
(рис. 12-18). Возможна обработка сосудов лигатурным способом, обычно
применяемым в традиционной хирургии. Далее на нижнедолевой бронх
накладывают сшивающий аппарат, бронх прошивают и пересекают
(рис. 12-19). Резецированную долю помещают в контейнер и удаляют
через миниторакотомную рану. Проверяют герметичность культи
нижнедолевого бронха, контролируют гемостаз. Плевральную полость дренируют
двумя аспирационными дренажами, лёгкое раздувают, раны ушивают.
Рис. 12-15. Точки расположения торакопортов
при выполнении лобэктомии.
231
Рис. 12-16. Вид корня лёгкого после разделе
ния междолевой щели.
Рис. 12-17. Обработка нижнедолевой
артерии аппаратом EndoGIA-30. 1 —
нижнедолевая артерия.
Рис. 12-18. Обработка нижнедолевой вены
аппаратом EndoGIA-30. 1 —
нижнедолевая вена.
Рис. 12-19. Обработка нижнедолевого
бронха аппаратом EndoGIA-30. 1 —
нижнедолевой бронх.
Рис. 12-20. Обработка верхнедолевой вены
сшивающим аппаратом. 1 —
верхнедолевая вена.
Рис. 12-21. Выделение сегментарных артерий верхней доли. 1 — сегментарные артерии, 2
лёгочная артерия, 3 — безымянная вена.
Рис. 12-22. Выделение артерии II сегмента. 1 — лёгочная артерия, 2 — артерия II сегмента.
2. Верхняя лобэктомия. Разделяют междолевую щель. Верхнюю долю
отводят кверху. Диссектором осторожно выделяют верхнедолевую вену.
При препаровке вены удобно использовать также ретрактор и тупфер. Вену
обрабатывают сшивающим аппаратом (рис. 12-20). Выделяют
сегментарные сосуды верхней доли и затем клипируют их (рис. 12-21, 12-22) или
обрабатывают сшивающим аппаратом. За верхнедолевой бронх заводят
ретрактор, накладыват сшивающий аппарат, бронх прошивают и пересекают.
Остальные этапы операции не отличаются от предыдущей.
Послеоперационный период. Слабая интенсивность послеоперационных
болей способствует ранней активизации больных. В связи с этим значительно
снижается по сравнению с открытыми операциями количество таких
послеоперационных осложнений, как ателектаз и гипостатическая пневмония. Для
купирования болевого синдрома достаточно назначение ненаркотических
анальгетиков. Больным разрешают садиться в постели на 2-е сутки после операции.
233
Дренажные трубки удаляют после восстановления пневмостаза и прекращения
экссудации. Проводят контрольную рентгенографию органов грудной полости.
Операции на симпатической нервной системе
Грудная симпатэктомия — одна из наиболее часто выполняемых ТО.
Небольшой объём вмешательства, простота выполнения несравнимы с обширной
травматизациеи грудной клетки при традиционной торакотомии [45-48].
Показания:
1. Синдром Рейно.
2. Гипергидроз.
3. Выраженный болевой синдром
при запущенном раке органов
верхнего этажа брюшной полости
(поджелудочной железы или желудка).
Оперативная техника. Операцию
производят под общим
обезболиванием с раздельной интубацией
бронхов. Возможно выполнение операции
при участии в дыхании обоих лёгких,
но в этом случае необходим
дополнительный торакопорт для введения рет-
рактора для отведения лёгкого.
Обычно операцию выполняют
из 2—3 доступов: в V межреберье по
средней подмышечной линии вводят
торакопорт для торакоскопа, во II
межреберье и IV межреберье по сре-
динно-ключичной линии —
инструментальные торакопорты (рис. 12-23).
В области рёберно-позвоночно-
го угла визуализируют
симпатический ствол, просвечивающий сквозь
париетальную плевру в виде
белесоватого тяжа (рис. 12-24).
Электрокоагуляционным
крючком рассекают париетальную плевру
над симпатическим стволом. При
синдроме Рейно и гипергидрозе
симпатический ствол выделяют от II до
IV ганглиев и иссекают на
протяжении 5 см от II до IV межреберья. При
раке поджелудочной железы,
желудка для купирования болевого
синдрома симпатический ствол удаляют
на протяжении от VII до XI межре-
Рис. 12-23. Точки расположения торакопортов
при выполнении симпатэктомии.
Звёздчатый
узел
1-ое ребро
2-ое ребро
3-е ребро
4-е ребро
Рис. 12-24. Вид внутригрудного
симпатического ствола.
234
берья. Препарат направляют на гистологическое исследование.
Электрокоагуляцией разрушают дополнительные нервные волокна (при неполном
пересечении симпатического ствола эффект от операции минимален), осуществляют
гемостаз. Лёгкое раздувают, плевральную полость дренируют, дренажные
трубки удаляют на 1-е сутки. Некоторые хирурги предпочитают не дренировать
плевральную полость при этой операции. Учитывая небольшую травматичность,
по показаниям допустимо выполнение одновременной двусторонней симпа-
тэктомии. В этих случаях торакоскопию производят последовательно с одной,
а затем с другой стороны.
Осложнения и их профилактика. Специфическое осложнение внутригруд-
ной симпатэктомии — развитие синдрома Хорнера при чрезмерно высокой
резекции симпатического ствола (удалении звёздчатого узла).
Торакоскопия при травмах и повреждениях грудной клетки
Большинству больных с закрытыми и проникающими ранениями органов
грудной полости выполняют диагностическую торакотомию или проводят
консервативное лечение. Поэтому, с одной стороны, возможно проведение
неоправданных травматичных торакотомий, а с другой — консервативная тактика
может задержать необходимое пациенту оперативное вмешательство [49—55].
Видеоторакоскопия, сочетая в себе малую травматичность и большие
диагностические возможности, позволяет выбрать оптимальную тактику.
Диагностическая процедура во многих случаях может перейти в лечебную. Различают
неотложную (проведённую при сроке менее суток с момента повреждения) и
отсроченную торакоскопию.
Показания
1. Проникающие ранения грудной клетки ниже уровня VJI ребра
(возможность торакоабдоминального ранения).
2. Проникающие ранения грудной клетки в проекции сердца и
крупных сосудов.
3. Закрытые травмы грудной клетки с кровопотерей более 1 л в сутки,
диагностированной при торакоцентезе или дренировании
плевральной полости.
4. Свернувшийся гемоторакс.
5. Пневмоторакс.
Противопоказания
1. Геморрагический шок.
2. Тампонада сердца.
3. Облитерация плевральной полости.
Предоперационное обследование больных включает физикальное
обследование (определение наличия и локализации ран, клинических признаков шокау
переломов рёбер и т.д.), рентгенологическое исследование органов грудной
клетки (признаки пневмоторакса, гемоторакса, гемоперикарда и т.д.).
Оперативная техника. Первый торакопорт для введения торакоскопа вводят в
V—VI межреберье по передней подмышечной линии. После осмотра плевральной
полости и определения объёма предполагаемого вмешательства устанавливают
235
дополнительно 1—3 торакопорта для введения в плевральную полость
инструментов. Точки введения и диаметр используемых торакопортов определяют в
зависимости от локализации повреждения и характера оперативного
вмешательства. После введения в плевральную полость торакоскопа и
манипуляторов проводят осмотр плевральной полости. При наличии крови плевральную
полость осушают.
Ранение диафрагмы. Выявленное при осмотре сквозное ранение
диафрагмы ушивают интра- или экстракорпорально. Отверстие в диафрагме
можно ликвидировать через лапаротомный доступ. В любом случае при
торакоабдоминальном ранении следует исключить повреждения органов
брюшной полости, выполнив диагностическую лапароскопию или лапа-
ротомию.
Ранение лёгкого. При ранении лёгкого гемостаз и пневмостаз
осуществляют одним из следующих способов:
1. Наложение петли Рёдера на повреждённый участок лёгкого (рис.
12-25).
2. Наложение ручного шва (рис. 12-26).
3. Прошивание сшивающим аппаратом (рис. 12-27).
Ранение межрёберной и внутренней грудной артерий. Кровотечение из
этих сосудов останавливают электрокоагуляцией, наложением
экстракорпорального шва или клипированием.
Ранение перикарда, крупных сосудов, бронхов и пищевода — показание
для выполнения экстренной торакотомии.
Свернувшийся гемоторакс. Производят торакоскопию, эвакуируют
жидкую кровь и сгустки. Устанавливают источник кровотечения —
межрёберные и внутренние грудные сосуды, ткань лёгкого, отломки рёбер.
Кровотечение останавливают электрокоагуляцией, клипированием или
прошиванием. Плевральную полость промывают изотоническим
раствором хлорида натрия и дренируют.
Рис. 12-25. Наложение петли Рёдера на
повреждённый участок лёгкого.
Рис. 12-26. Наложение ручного Z-
образного шва.
236
Рис. 12-27. Прошивание ткани лёгкого
сшивающим аппаратом.
Доброкачественные новообразования средостения
Видеоторакоскопию в лечении доброкачественных опухолей и кист
средостения можно считать методом выбора, так как травматичность
общепринятой торакотомии в ряде случаев значительно выше травматичности этапа
собственно удаления опухоли. Даже небольшие медиастинальные
новообразования вынуждают хирурга производить несоразмерно большие разрезы грудной
стенки [56—59].
Показания
1. Целомические кисты перикарда.
2. Медиастинальные липомы.
3. Доброкачественные тимомы.
4. Кисты вилочковой железы.
5. Неврогенные опухоли средостения.
6. Тератомы средостения.
7. Фибромы средостения.
Противопоказания
1. Общие противопоказания к ТО.
2. Значительные размеры новообразования — относительное
противопоказание, так как нередко возможно удаление опухолей более
10 см в диаметре.
Топографическая анатомия средостения. Предложено несколько схем
деления средостения на этажи и отделы. Для видеоторакоскопических операций
наиболее приемлемо выделение 5 зон — передневерхней, передненижней, зад-
неверхней, задненижней и центральной (рис. 12-28).
Тимомы локализуются в передневерхней зоне, целомические кисты
перикарда и медиастинальные липомы — в передненижней, неврогенные опухоли — в
заднем средостении. Согласно вышеописанным зонам и относительно
постоянной локализации новообразований существуют чётко определённые точки
введения торакопортов при операциях на средостении.
237
Рис. 12-28. Схема деления средостения.
Оперативная техника. Операцию выполняют под общим эндотрахеальным
обезболиванием с раздельной вентиляцией обоих бронхов. Первый торакопорт
для торакоскопа вводят в V межреберье по передней подмышечной линии.
После ревизии органов грудной полости и определения операбельности вводят
инструментальные торакопорты. Их количество определяет характер
новообразования и объём предполагаемой операции. Чаще всего достаточно двух то-
ракопортов. Точки для введения инструментов зависят от локализации
опухоли. При её расположении в передневерхней зоне средостения инструменты
вводят в V межреберье по парастернальной линии и в III межреберье по задней
подмышечной линии (рис. 12-29).
Рис. 12-29. Точки введения троакаров при
операциях на передневерхней зоне
средостения.
Рис. 12-30. Точки введения троакаров при
операциях на передненижней зоне
средостения.
238
Рис. 12-31. Точки введения троакаров при
операциях на задневерхней зоне средостения.
Рис. 12-32. Точки введения троакаров при
операциях на задней ижней зоне
средостения.
При новообразованиях передне-
нижней зоны троакары вводят в III
межреберье по передней
подмышечной линии и в V межреберье по
задней подмышечной линии (рис. 12-30).
При патологии задневерхней
зоны точки для введения
инструментов располагают в III межреберье по
передней подмышечной линии и в V
межреберье по парастернальной
линии (рис. 12-31).
При новообразованиях задне-
нижней зоны троакары вводят в III
межреберье по парастернальной
линии и в V межреберье по задней
подмышечной линии (рис. 12-32).
Для работы на центральной зоне инструменты располагают в III
межреберье по передней подмышечной линии и в V межреберье по задней
подмышечной линии (рис. 12-33).
Техника операции не отличается от общепринятой в открытой хирургии.
После рассечения медиастинальной плевры выделяют новообразование,
питающие опухоль сосуды препарируют, затем клипируют или коагулируют
(рис. 12-34, 12-35).
При наличии сращений с паренхимой лёгкого возможно применение эн-
дохирургических сшивающих аппаратов (рис. 12-36).
Кисты больших размеров пунктируют и вылущивают для облегчения
манипуляций. Затем оболочки кисты иссекают.
Рис. 12-33. Точки введения троакаров при
операциях на центральной зоне средостения.
239
Рис. 12-34. Выделение питающей ножки
тимомы. 1 — питающая ножка.
Рис. 12-35. Наложение клипсы на сосуд при
удалении тимомы.
Рис. 12-36. Прошивание паренхимы лёгкого
аппаратом «EndoGIA-ЗО» при удалении
фибромы перикарда.
После окончательного вылущивания
опухоли препарат помещают в контейнер
и удаляют через наибольший по диаметру
торакопорт. При значительных размерах
новообразования выполняют минитора-
котомию длиной 4—6 см для извлечения
опухоли.
В конце операции проводят
тщательный гемостаз и ревизию ложа опухоли.
Под контролем зрения после
дренирования плевральной полости инструменты
удаляют, раны ушивают.
Осложнения и их профилактика.
Учитывая анатомические особенности
средостения, сложность взаимоотношений
жизненно важных органов, близость
крупных кровеносных сосудов и сердца, при грубых манипуляциях и
неопытности хирурга возможно их повреждение с возникновением профузного
кровотечения, требующего выполнения срочной торакотомии. Детальная
визуализация всех анатомических структур, отточенная оперативная техника —
основные меры профилактики серьёзных интра- и постоперационных осложнений.
Парастернальная лимфаденэктомия
Как известно, лимфоотток из молочной железы происходит в
подмышечный, подлопаточный, подключичный коллекторы и в ретростернальные
лимфатические узлы. Изучение лимфатической системы и клинические
наблюдения показали, что при медиальном и центральном расположении опухоли
240
Рис. 12-37. Ретростернальные
лимфатические узлы.
Рис. 12-38. Положение больной и точки
введения торакопортов при выполнении
парастернальной лимфаденэктомии.
возможно поражение парастернальных лимфатических узлов, что связано с
особенностями лимфатического оттока из внутренних квадрантов молочной железы.
Интерес, проявляемый в настоящее время к парастернальной группе лимфоузлов,
не случаен, поскольку поражение их метастазами выявляют при расширенных
мастэктомиях в 16—60% случаев. Поэтому в качестве обязательного этапа
операции при раке молочной железы медиальной и центральной локализации
необходимо производить парастернальную лимфаденэктомию.
Показание — рак молочной железы медиальной и центральной локализации.
Противопоказания — общие противопоказания к ТО.
Топографическая анатомия. Удалению подлежат ретростернальные
лимфатические узлы, расположенные вдоль внутренних грудных сосудов на
протяжении от II до IV межреберья (рис. 12-37). Размеры ретростернальных
лимфатических узлов колеблются от 0,3 до 1 см, а их количество — от 2 до 6.
Оперативная техника. После введения больной в наркоз интубируют
трахею двухпросветной трубкой типа Карленса. Под грудную клетку на стороне
операции подкладывают валик клиновидной формы, при помощи которого
больную укладывают в положение промежуточное между положениями на спине и
на боку.
После завершения операции на молочной железе (медиальная
радикальная резекция, мастэктомия по Пейты, Мадену, Холстеду), анестезиолог
выключает лёгкое на стороне операции из акта дыхания. Вводят первый торакопорт в
V межреберье по срединно-ключичной линии, второй — в IV межреберье по
передней подмышечной линии и третий — в V межреберье по средней
подмышечной линии (рис. 12-38).
Проводят осмотр плевральной полости, затем рассекают париетальную
плевру параллельно внутренним грудным сосудам на уровне от I до IV межреберья
241
Рис. 12-39. Рассечение париетальной плевры
вдоль внутренних грудных сосудов.
Рис. 12-40. Клипирование внутренних
грудных сосудов в первом межреберье.
Рис. 12-41. Пересечение внутренних
грудных сосудов в пятом межреберье.
Рис. 12-42. Вид операционного поля после
удаления препарата.
(рис. 12-39). В I межреберье клипируют и пересекают внутренние грудные
артерию и вену (рис. 12-40). Выделяют жировую клетчатку с лимфатическими
узлами, расположенную вдоль сосудов до уровня IV межреберья, где повторно
клипируют и пересекают внутренние грудные сосуды (рис. 12-41). Препарат
удаляют. Зону манипуляций промывают изотоническим раствором хлорида натрия,
мелкие кровоточащие сосуды коагулируют (рис. 12-42). Санируют
плевральную полость и под контролем зрения вводят дренаж. Лёгкое раздувают,
операционную рану ушивают.
Послеоперационное ведение не отличается от обычного ведения после
радикальной мастэктомии. Дренаж из плевральной полости удаляют на 2—3-й
сутки после операции по окончании экссудации.
242
13
Герниопластика
Грыжесечение — одна из самых распространённых операций во всём мире.
В США ежегодно выполняют около 500 000 таких вмешательств. В 1884 г. Эдуарде*
Бассини впервые предложил методику хирургического лечения паховых грыж.
До настоящего времени множество различных операций по поводу этой
патологии — лишь варианты этой методики. По данным литературы, рецидив
паховой грыжи возникает в 10—20% случаев, что объясняют натяжением и
неоднородностью сопоставляемых тканей. Больные, перенёсшие операцию по поводу
паховой грыжи, находятся на стационарном лечении 5-8 дней, возвращение
же к обычному образу жизни происходит через 6—8 нед.
В конце 80-х годов нашего века Лихтенштейн предложил производить
пластику задней стенки пахового канала синтетическим материалом. При
использовании этой методики не возникает натяжения тканей пахового канала,
вследствие чего резко снижается частота рецидивов заболевания (до 1%) [1].
Внедрение в хирургическую практику эндохирургических методик
коснулось и операций при паховых, бедренных и вентральных грыжах. Появились
сообщения о различных методиках эндохирургической герниопластики [2-12].
Мнения о показаниях к лапароскопическому лечению паховых и
бедренных грыж противоречивы. Многие хирурги не поддерживают мнения о том,
что лапароскопия обладает существенными преимуществами по сравнению с
открытыми операциями при первичных паховых грыжах. При пластике
грыжевых ворот синтетической сеткой рецидивы возникают в 3% случаев. В
некоторых случаях лапароскопическую герниопластику проводят амбулаторно. При
первичных грыжах лапароскопия имеет преимущества, состоящие в
уменьшении травматичности операции, раннем возвращении к активной деятельности.
С другой стороны, при лапароскопических вмешательствах необходимо общее
обезболивание (в сравнении с традиционным выполнением открытых
операций под местной анестезией), что нужно учитывать при выборе метода лечения.
Показания
1. Двусторонние грыжи.
2. Рецидивные грыжи.
3. Желание больного.
Противопоказания
1. Непереносимость напряжённого ПП.
2. Перенесённые ранее операции на нижнем этаже брюшной полости.
3. Невправимые пахово-мошоночные грыжи значительных размеров.
4. Ущемлённые грыжи (относительное противопоказание).
246
Предоперационное обследование не имеет особенностей. Больным
показано общее клиническое обследование, включающее общий анализ крови с лей-
коформулой, мочи, коагулограмму, ЭКГ. Накануне операции показана
очистительная клизма.
Топографическая анатомия. Независимо от способа выполнения операции
необходимо знание анатомии пахово-подвздошной области в
лапароскопическом изображении «изнутри-кнаружи» (рис. 13-1).
Первым ориентиром при выполнении герниопластики служит пупочная
связка, идущая вниз от пупка и лежащая строго по средней линии передней
брюшной стенки. Латеральнее расположены последовательно прямая мышца
живота, нижние надчревные сосуды, отходящие от наружных подвздошных
артерии и вены. Перпендикулярно им лежит паховая (пупартова) связка,
идущая от лобковой к подвздошной кости. Паховые грыжи образуются выше
пупартовой связки. Прямая паховая грыжа расположена медиальнее нижних
надчревных сосудов, косая — латеральнее. Ниже паховой связки локализуются
бедренные грыжи.
Применительно к лапароскопической герниопластике важны две зоны,
названные роковым треугольником и треугольником боли. Своё название они
получили в связи с возможными при проведении вмешательства
осложнениями. Роковой треугольник с медиальной стороны ограничен линией, идущей вдоль
наружной подвздошной вены, латеральная граница проходит вдоль яичковых
сосудов. Верхушка треугольника находится в области внутреннего пахового
кольца. Треугольник боли имеет следующие границы: медиально граничит с
роковым треугольником, а латеральная граница проходит вдоль паховой связки.
Верхушка этого треугольника также лежит в области внутреннего пахового кольца.
Оперативная техника при лапароскопической герниопластике
универсальна при проведении операций по поводу прямой, косой паховых и бедренной
грыж. Лапароскопическую герниопластику выполняют из интраперитонеаль-
ного или экстраперитонеального доступа.
Интраперитонеальная герниопластика
Больного укладывают на операционный стол в положение на спине,
вводят уретральный катетер. Вмешательство выполняют под общим
обезболиванием с ИВЛ. Одним из известных способов накладывают ПП (см.
главу 4), параумбиликально вводят троакар и лапаркоскоп с углом зрения
30°. Осматривают органы брюшной полости и переднюю брюшную
стенку. Больного переводят в положение Тренделенбурга. Дополнительно
вводят 2 троакара для инструментов E- и 12-миллиметровые) (рис. 13-2).
Ножницами или электрохирургическим крючком рассекают
париетальную брюшину на 1—2 см выше пупартовой связки параллельно ей,
начиная от передней верхней подвздошной ости до лонной кости.
Брюшину отслаивают кверху, обнажая поперечную мышцу и пупартову
связку (рис. 13-3). При этом особую осторожность следует соблюдать в
области прохождения нижних надчревных сосудов/ Затем выделяют
грыжевой мешок путём инвагинации его в брюшную полость. Следует
учитывать, что на верхушке грыжевого мешка нередко расположена предбрюшин-
247
ная липома, которую
необходимо удалить. Элементы
семенного канатика отделяют от
брюшины грыжевого мешка.
Расширяют образовавшийся
дефект брюшины по
направлению книзу, обнажая все три
возможные зоны
возникновения грыж: бедренной, прямой
и косой паховых.
В брюшную полость
вводят синтетический сетчатый
протез соответствующих
размеров (примерно 8x12 см). Углы
сетки срезают. Протез
помещают в сформированное окно
брюшины, фиксируют при
помощи грыжевого степлера
(рис. 13-4). Сверху и латерально скобки накладывают вдоль пупартовой
связки, медиально — вдоль лонной кости и куперовой связки (рис. 13-5).
Во избежание повреждения сосудов в области рокового треугольника и
травмы подвздошно-пахового и бедренного нервов в области треугольника боли
не следует фиксировать сетку между 5 и 8 часами воображаемого
циферблата в операционном поле. Затем восстанавливают целостность
париетальной брюшины при помощи степлера или интракорпорального
непрерывного шва (рис. 13-6). Производят ревизию операционного поля,
контролируют гемостаз, троакары извлекают, накладывают швы.
Рис. 13-1. Лапароскопичесая анатомия левой
подвздошной области.
/ч.
Рис. 13-2. Расположение операционной бригады и точки введения троакаров при выполнении
герниопл астики.
248
Рис. 13-3. Рассечение париетальной брюшины.
Рис. 13-4. Герниостеплер.
Рис. 13-5. Фиксация полипропиленовой сетки.
Рис. 13-6. Ушивание париетальной
брюшины.
Экстраперитонеальная герниопластика
Операцию выполняют без
проникновения в брюшную полость. Такая
тактика исключает повреждение органов
брюшной полости, сосудов, осложнения
ПП. Эта операция может быть
выполнена под спинномозговой или ПА, что
позволяет избежать последствий
наркоза. Учитывая перечисленные
преимущества, многие хирурги рекомендуют экс-
траперитонеальный доступ.
Разрез выполняют по срединной
линии на 1 см ниже пупка. Со стороны
грыжи рассекают переднюю стенку
влагалища прямой мышцы живота, мышцу
отводят и проникают в предбрюшинное пространство. Троакар,
снабжённый баллоном-диссектором, вводят под апоневроз, а затем осторожно
продвигают по направлению к лонной кости предбрюшинно.
Растяжением баллона отслаивают брюшину, создавая тем самым необходимое
пространство. Баллон извлекают, образовавшуюся полость поддерживают,
инсуффлируя в неё углекислый газ под давлением 8 мм рт.ст. В
предбрюшинное пространство вводят лапароскоп с углом зрения 30° и 2 рабочих
троакара E- и 12-миллиметровые). Вправляют грыжевой мешок.
Обнажают лобковую кость, паховую связку, элементы семенного канатика, купе-
рову связку и нижние надчревные сосуды. В предбрюшинное
пространство вводят синтетическую сетку. Грыжевым степлером фиксируют её к
лобковой кости, куперовой и пупартовой связкам.
Послеоперационный период
По окончании операции извлекают уретральный катетер. Больному
назначают ненаркотические анальгетики и антибиотики широкого спектра
действия. После пробуждения больного активизируют.
Осложнения и профилактика
1. Ранение подвздошных и нижних надчревных сосудов может
возникнуть при грубых манипуляциях в предбрюшинном пространстве.
Существует риск непосредственного ранения сосуда степлером при
накладывании скобок в области рокового треугольника. Избежать данного
осложнения позволяют знание анатомии, прецизионная техника
препарирования тканей.
2. Травму элементов семенного канатика предупреждают
визуализацией и осторожным выделением структур в области грыжевого мешка.
3. Повреждения подвздошно-пахового и бедренного нервов
возникают при наложении скобок в области треугольника боли. Для
профилактики этого осложнения не следует накладывать скобки,, фиксирующие
протез, между 5 и 8 часами воображаемого циферблата.
4. Ненадёжная фиксация протеза может привести к смещению сетки
и возникновению рецидива грыжи. Предупредить данное осложнение
250
позволяет тщательное отслоение жировой клетчатки от подлежащих
тканей и правильное наложение скобок.
5. Тщательный гемостаз во время операции предупреждает
возникновение гематом и сером в области грыжевого мешка.
6. Эмфизема мошонки возникает при высоком внутрибрюшном
давлении во время операции. Это осложнение не ведёт к каким-либо серьёзным
последствиям и не требует специальных мер по его устранению. Появления
эмфиземы можно избежать при внутрибрюшном давлении 7—8 мм рт. ст.
7. После интраперитонеальной герниопластики при неполной пери-
тонизации протеза могут возникнуть спайки и связанная с ними
кишечная непроходимость. Для предупреждения этого осложнения следует
тщательно ушивать брюшину над сеткой.
8. При выполнении операции экстраперитонеальным способом
хирург должен соблюдать максимальную осторожность в момент введения
троакара с баллоном-диссектором в предбрюшинную клетчатку. Троакар
может перфорировать брюшину и тем самым вынудить хирурга к переходу
на внутрибрюшинный способ операции.
251
14
Лапароскопические
операции на желудке
ОПЕРАЦИИ ПРИ ЖЕЛУДОЧНО ПИЩЕВОДНОМ РЕФЛЮКСЕ
Единственный способ, позволяющий восстановить функцию кардиально-
го сфинктера при его недостаточности и/или грыже пищеводного отверстия
диафрагмы, — антирефлюксная операция (фундопликация). Наиболее
распространённой и эффективной операцией, как и в открытой хирургии, признана
фундопликация по Ниссену. Другие варианты — операции Тупе и Дора. Цель
этих вмешательств — устранение рефлюкса желудочного содержимого в
пищевод и связанного с этим рефлюкс-эзофагита [1—6].
Показания
1. Неэффективность антацидной терапии рефлюкс-эзофагита,
проводимой в течение 1 года.
2. Пептический эзофагит.
3. Пищевод Берретгпа.
4. Хронические воспалительные заболевания дыхательных путей,
связанные с рефлюкс-эзофагитом.
Противопоказания
1. Общие противопоказания к лапароскопическим операциям.
2. Обширный спаечный процесс в верхнем этаже брюшной полости
после перенесённых ранее оперативных вмешательств.
3. Укороченный пищевод, требующий трансторакальной антирефлюкс-
ной операции.
4. Необходимость в симультантной операции, невыполнимой лапа-
роскопически.
Дооперационное обследование
1. Контрастное рентгенологическое исследование пищевода и
желудка последовательно в положении стоя и в положении Тренделенбурга, во
время которого определяют наличие грыжи пищеводного отверстия
диафрагмы и желудочно-пищеводного рефлюкса.
2. ФЭГДС с биопсией слизистой оболочки пищевода для
определения степени воспалительных изменений и исключения рака.
3. Пищеводная манометрия предназначена для оценки моторной
функции пищевода и кардиального сфинктера.
4. Определение рН содержимого пищевода позволяет уточнить
степень закисления.
253
Оперативная техника. Положение больного на операционном столе на спине
с отведёнными на 90° руками. Создают положение Фаулера. Устанавливают
тонкий назогастральный зонд. Хирург располагается справа от операционного
стола, ассистент — слева (рис. 14-1).
Одним из перечисленных выше способов (см. главу 4) накладывают ПП.
Лапароскопические антирефлюксные операции выполняют из пяти проколов,
расположенных в верхних квадрантах брюшной стенки (рис. 14-2). Через пара-
умбиликальный прокол вводят лапароскоп с углом зрения 30°, проводят
ревизию брюшной полости. Под контролем зрения вводят троакары для
инструментов: один — по срединно-ключичной линии в правой подреберной
области, второй — по средней линии ниже мечевидного отростка грудины, третий —
по срединно-ключичной линии в левой подрёберной области, четвёртый — на
середине линии, соединяющей точки 1 и 4.
Фундопликация по Ниссену. Ретрактором, введённым через доступ 2
или 3, отводят левую долю печени кверху, осматривают пищеводно-желу-
дочной переход, пищеводное отверстие диафрагмы. Рассекают пищевод-
но-желудочную связку, париетальную брюшину над пищеводом.
Выделяют передний блуждающий нерв. В желудок вводят толстый
назогастральный зонд. Мобилизацию пищевода начинают с рассечения париетальной
брюшины вдоль левой ножки диафрагмы. Тракцией за кардиальный отдел
желудка каудально и по направлению к передней брюшной стенке
приподнимают абдоминальный отдел пищевода. Электрокоагуляционным
крючком или диссектором выделяют заднюю стенку пищевода по
направлению к левой ножке диафрагмы, сохраняя задний блуждающий нерв и
париетальную плевру левого кард иод иафрагмального синуса. Для
облегчения визуализации пищевода целесообразно в его просвет ввести фибро-
эзофагоскоп и провести трансиллюминацию. После выделения задней
стенки пищевода создают отверстие в пищеводно-диафрагмальной связке,
расширяемое тупым и острым способами (рис. 14-3). Рассекают желудочно-
диафрагмальную связку, мобилизуют дно желудка для последующего
создания манжетки. При необходимости клипируют и пересекают 1—2
коротких сосуда желудка. Дно желудка заводят в сформированное окно
позади пищевода и формируют фундопликационную манжетку, сшивая
переднюю и заднюю стенки органа, в шов также захватывают переднюю
стенку пищевода. Накладывают, как правило, 3-4 узловых шва нерасса-
сывающимся шовным материалом. Длина манжетки должна быть не
менее 3—4 см (рис. 14-4). Заднюю крурорафию производят при широком
пищеводном отверстии диафрагмы, накладывая 1—2 шва на её ножки (рис. 14-5).
Брюшную полость промывают и осушают.
Фундопликация по Тут. Показания, точки введения троакаров, этапы
мобилизации пищевода и дна желудка не отличаются от описанных выше.
В отличие от циркулярной фундопликации по Ниссену при данной
операции пищевод окутывают дном желудка только по задней полуокружности
(рис. 14-6). Для этого мобилизованное дно желудка заводят в
сформированное позади пищевода окно и фиксируют его последовательно к левой
и правой ножкам диафрагмы. Узловыми швами дно желудка подшивают к
правой стенке пищевода [7].
254
Рис. 14-1. Расположение больного,
операционной бригады и аппаратуры.
"V
k. <ъ
I !
Рис. 14-2. Точки введения
троакаров.
Рис. 14-3. Формирование ретроэзофагеаль-
ного окна. 1 — пищевод, 2 — левая
ножка диафрагмы, 3 — правая ножка
диафрагмы.
255
Фундоплйкация по Дору. Показания и точки введения троакаров
совпадают с описанными выше. При данной методике дно желудка
укладывают впереди абдоминального отдела пищевода и фиксируют к его правой
стенке (рис. 14-7) [8].
Послеоперационный период. Наркотические обезболивающие, как
правило, не назначают. Приём пищи разрешают после восстановления
перистальтики кишечника A—2-е сутки после операции). При отсутствии осложнений
больных выписывают из стационара на 4—5-й день после операции.
Осложнения и их профилактика
1. Рассечение париетальной брюшины в области пищеводного
отверстия диафрагмы при давлении газа в брюшной полости более 14 мм рт.ст.
может привести к пневмомедиастинуму и возникновению подкожной
эмфиземы шеи.
2. При манипуляциях в области левой ножки диафрагмы возможно
повреждение медиастинальнои плевры слева и возникновение
напряжённого пневмоторакса, что может сделать лапароскопическую операцию
невозможной. При выделении ножек диафрагмы необходимо помнить о
близости кардиодиафрагмального синуса плевральной полости.
3. Травму блуждающих нервов можно предупредить, визуализируя их
и отведя из зоны действий хирурга.
4. При мобилизации задней стенки пищевода для профилактики её
повреждения целесообразно ввести фиброэзофагоскоп и выполнить
трансиллюминацию.
5. При выделении большой кривизны желудка следует быть особенно
осторожным в связи с опасностью повреждения селезёнки и коротких
желудочных сосудов.
6. Для предупреждения возникновения в послеоперационном
периоде дисфагии необходимо формировать манжетку после введения в
желудок толстого зонда.
ОПЕРАЦИИ ПРИ АХАЛАЗИИ ПИЩЕВОДА И КАРДИОСПАЗМЕ
Дисфагия, вызванная ахалазией пищевода, — показание к оперативному
лечению. Как и в открытой хирургии, кардиомиотомия по Геллеру признана
операцией выбора для восстановления естественного пассажа пищевых масс [9—12].
Показание — ахалазия 1—3-й степени.
Противопоказания
1. Общие противопоказания к лапароскопическим вмешательствам.
2. Обширный спаечный процесс в верхнем этаже брюшной полости
после перенесённых ранее операций.
3. Ахалазия 4-й степени.
Дооперационное обследование
1. Контрастное рентгенологическое исследование пищевода
позволяет обнаружить характерное для ахалазии циркулярное сужение просвета
органа и установить степень ахалазии.
256
Рис. 14-4. Вид операционного поля после фундопликации по Ниссену.
Рис. 14-5. Задняя крурорафия.
Рис. 14-6. Фундопликация по Тупе.
Рис. 14-7. Фундопликация по Дору.
2. ФЭГДС с биопсией позволяет исключить кардиоэзофагеальный рак.
3. Пищеводная манометрия позволяет оценить моторную функцию
пищевода и кардиального жома.
Оперативная техника. Положение больного на операционном столе,
расположение операционной бригады и аппаратуры, установка троакаров
аналогичны описанным для операции Ниссена (см. рис. 14-1, 14-2).
Ретрактором отводят кверху левую долю печени. Осматривают зону пище-
водно-желудочного перехода, электрохирургическим крючком рассекают
париетальную брюшину над абдоминальным отделом пищевода. Выделяют
пищевод до уровня пищеводного отверстия диафрагмы, идентифицируют и
отводят в сторону передний блуждающий нерв. Мобилизацию пищевода в
средостении заканчивают на 6—7 см выше кардиального жома. В желудок вводят
толстый зонд. Электрохирургическим крючком рассекают продольные
мышечные волокна передней поверхности кардиоэзофагеального перехода. Разрез
начинают на 2—3 см ниже кардиального жома и продлевают вверх на 6—7 см.
Залегающие глубже циркулярные волокна рассекают ножницами или
электрохирургическим крючком. Мышечный слой пищевода осторожно отделяют от
слизистой оболочки (рис. 14-8).
В просвет пищевода вводят фиброэзофагоскоп и проводят
гидравлическую пробу. Целостность слизистой оболочки пищевода определяют
следующим образом: в поддиафрагмальное пространство заливают физиологический
раствор, через фиброэзофагоскоп инсуффлируют в просвет пищевода воздух.
Отсутствие пузырьков газа подтверждает сохранность слизистой оболочки.
Выполняют фундопликацию по Дору. Трансназально в желудок вводят
тонкий зонд. Брюшную полость промывают и осушают.
Послеоперационный период. Ведение послеоперационного периода не
отличается от описанного для операции Ниссена.
Осложнения и их профилактика
1. Рассечение париетальной брюшины в области пищеводного
отверстия диафрагмы при давлении газа в брюшной полости более 14 мм рт.ст.
Рис. 14-8. Кардиомиотомия по Геллеру.
258
может привести к пневмомедиастинуму и возникновению подкожной
эмфиземы шеи.
2. Травму блуждающих нервов можно предупредить, визуализируя их
и отведя из зоны действий хирурга.
3. Повреждение слизистой оболочки пищевода, специфичное для
миотомии осложнение, предотвращают осторожной препаровкой тканей.
РЕЗЕКЦИЯ ЖЕЛУДКА
Внедрение в практику эндоскопических сшивающих аппаратов,
совершенствование оперативной техники позволили расширить диапазон хирургических
вмешательств, производимых с использованием малоинвазивных методик. В
последние годы появились публикации о лапароскопических операциях на
желудке и двенадцатиперстной кишке [13—18]. Опыт выполнения таких
операций невелик, их преимущества окончательно не доказаны. Наиболее часто
выполняют резекцию желудка по Билърот—II.
Показания
1. Язвенная болезнь желудка, резистентная к консервативной терапии.
2. Осложнённая ЯБДПК.
3. Рак дистального отдела желудка Tj_2.
Противопоказания
1. Общие противопоказания к лапароскопическим операциям.
2. Обширный спаечный процесс в верхнем этаже брюшной полости.
3. Пенетрация язвы в окружающие органы.
Дооперационное обследование
1. Общее клиническое обследование.
2. Контрастное рентгенологическое исследование желудка и
двенадцатиперстной кишки.
3. Определение кислотности желудочного сока.
4. ФЭГДС с обязательной биопсией.
Оперативная техника. Создают положение Фаулера с отведёнными руками.
Операцию проводят под интубационным наркозом с ИВЛ. Трансназально
вводят желудочный зонд. Накладывают ПП. В брюшную полость вводят 5
троакаров (рис. 14-9).
Параумбиликально вводят троакар для лапароскопа. Проводят ревизию
органов брюшной полости, при необходимости рассекают спайки. Левую долю
печени отводят ретрактором, введённым через троакар, расположенный под
мечевидным отростком. Диссекцию начинают с препаровки большого
сальника, рассекаемого вдоль большой кривизны желудка от двенадцатиперстной
кишки до нижнего полюса селезёнки. Для рассечения сальника используют
электрокоагуляционные ножницы. Правые желудочно-сальниковые сосуды и
крупные ветви сальниковых сосудов предварительно клипируют, а затем
пересекают. Желудок оттягивают влево и к передней брюшной стенке. Вскрывают
малый сальник и выделяют верхний край двенадцатиперстной кишки,
клипируют правую желудочную артерию. Перед пересечением двенадцатиперстной
259
Рис. 14-9. Расположение операционной бригады, аппаратуры и троакаров при резекции желудка.
кишки следует обратить особое внимание на сохранность элементов желудоч-
но-двенадцатиперстной связки. На мобилизованную двенадцатиперстную кишку
несколько ниже привратника накладывают сшивающий аппарат («EndoGIA-30»),
кишку прошивают и пересекают (рис. 14-10).
Малый сальник рассекают в проксимальном направлении до угла
желудка. При помощи сшивающего аппарата прошивают и пересекают нисходящую
ветвь левой желудочной артерии. Тракцией вправо и каудально натягивают
большую кривизну желудка. Подтягивают желудочный зонд. Намечают линию
резекции путём осторожной коагуляции. Сшивающим аппаратом прошивают и
резецируют желудок. Обычно аппарат накладывают 3—4 раза (рис. 14-11).
Отсечённый препарат временно помещают в правое поддиафрагмальное
пространство.
Узловыми швами, наложенными в области малой и большой кривизны,
подшивают культю желудка к передней брюшной стенке (рис. 14-12). После
этого становится видимой задняя стенка культи.
Двумя мягкими зажимами поднимают поперечную ободочную кишку.
Находят связку Трейтца и начальный отдел тощей кишки, который подтягивают
к культе желудка через сформированное отверстие в бессосудистой зоне
брыжейки поперечной ободочной кишки позади последней. Двумя швами петлю
тощей кишки фиксируют к задней стенке культи желудка. ,
При помощи ВЧЭХ крючком или ножницами вскрывают заднюю стенку
культи желудка и тощую кишку (рис. 14-13). В просвет желудка и тощей
кишки вводят бранши аппарата «EndoGIA-ЗО», двумя прошиваниями формируют
анастомоз (рис. 14-14).
Переднюю незамкнутую стенку анастомоза ушивают непрерывным швом
рассасывающейся нитью (рис. 14-15).
260
Рис. 14-10. Пересечение
двенадцатиперстной кишки.
Рис. 14-11. Пересечение желудка.
Рис. 14-12. Культя желудка «подвешена» к
передней брюшной стенке.
Рис. 14-13. Петля тощей кишки подшита к
культе желудка, формирование отверстий
для наложения аппарата EndoGIA-30.
Рис. 14-14. Формирование желудочно-
тонкокишечного анастомоза аппаратом
EndoGIA-30.
Рис. 14-15. Ушивание передней стенки
анастомоза.
В желудок вводят фиброгастроскоп, культю желудка раздувают с целью
контроля герметичности наложенного соустья. Вводят тонкий назогастраль-
ный зонд для декомпрессии. Расширяют одно из отверстий в передней
брюшной стенке и удаляют препарат. Брюшную полость санируют, устанавливают
дренажную трубку, удаляют троакары. Раны ушивают.
Особенности резекции желудка по поводу рака. Учитывая небольшой
опыт лапароскопических резекций желудка по поводу рака и отсутствие
отдалённых результатов, в настоящее время нельзя считать доказанной
целесообразность выполнения этого вмешательства. Хирурги, успешно
выполняющие лапароскопические резекции желудка, отмечают, что
операцию можно проводить по тем же онкологическим принципам, что и в
открытой хирургии [19, 20]. Принципы хирургического лечения рака
желудка, сформулированные несколько десятилетий назад в работах
ведущих отечественных и зарубежных специалистов, необходимо безупречно
соблюдать и в эпоху эндохирургии. Резекцию желудка по поводу рака с
удалением большого и малого сальников необходимо дополнять лимфаден-
эктомией, включающей в себя удаление следующих групп лимфатических
узлов (рис. 14-16):
Рис. 14-16. Лимфатическая система желудка и лимфатические узлы, подлежащие удалению.
262
Рис. 14-17. Клипирование правой
желудочной артерии после выделения
желудочно-двенадцатиперстной связки.
Рис. 14-18. Вид операционного поля после
завершения лимфаденэктомии. 1 —
общая печёночная артерия, 2 — левая
желудочная артерия, 3 — селезёночная
артерия.
1. Правые паракардиальные лимфатические узлы.
2. Левые паракардиальные лимфатические узлы.
3. Лимфатические узлы по ходу левой желудочной артерии.
4. Лимфатические узлы большой кривизны и большого сальника.
5. Верхнедуоденальные и пилорические лимфатические узлы.
6. Ретродуоденальные лимфатические узлы.
7. 8, 9. Чревные лимфатические узлы.
10. Лимфатические узлы по ходу селезёночной артерии и верхнего
края поджелудочной железы.
11. Лимфатические узлы по ходу печёночной артерии до ворот печени.
Учитывая изложенное выше, мобилизацию начинают с отсечения
большого сальника от поперечной ободочной кишки в непосредственной
близости от последней. При лигировании правых желудочно-сальниковых
сосудов необходимо в блок удаляемых тканей включить препилорические
лимфатические узлы (рис. 14-17).
Большой сальник отсекают до уровня нижнего полюса селезёнки.
Желудок отводят кверху, обнажают верхний край поджелудочной железы.
Выделяют селезёночную и общую печёночную артерии. Жировую
клетчатку с лимфатическими узлами смещают к желудку. Выделяют левую
желудочную артерию, которую клипируют или обрабатывают сшивающим
аппаратом сразу у места её отхождения от чревного ствола. Таким образом
выполняют лифмаденэктомию (рис. 14-18). Последующие этапы
операции не отличаются от изложенной выше методики. Препарат следует удалять
в контейнере для предупреждения контакта опухоли с поверхностью раны.
Послеоперационный период. Назогастральный зонд удаляют на 1—2-е сутки,
после чего разрешают приём жидкой пищи. Питание твёрдой пищей начинают с
4-го дня после операции. Выписывают больных на 4—7-е сутки после
вмешательства, предварительно проведя контрольную ФЭГДС или контрастное
рентгенологическое исследование.
263
Осложнения и их профилактика
1. Во избежание повреждения следует с осторожностью отводить
левую долю печени.
2. При манипуляциях вблизи нижнего полюса селезёнки возможен
надрыв капсулы с последующим кровотечением, поэтому необходимо
соблюдать осторожность.
3. Диаметр соустья и его герметичность контролируют интраопераци-
онной ФЭГДС.
4. Следует визуализовать основные сосуды, подлежащие пересечению,
и надёжно их обработать во избежание кровотечения в
послеоперационном периоде.
ЛАПАРОСКОПИЧЕСКАЯ ВАГОТОМИЯ
Ваготомию для лечения ЯБДПК предложил в 1922 г. Латерже [21]. В
клиническую практику это вмешательство внедрено Драгстедом и Оуенсом,
выполнившими в 1943 г. стволовую ваготомию (СВ) [22].
При парасимпатической денервации желудка происходит снижение ба-
зальной секреции соляной кислоты на 80%, а стимулированной — на 85%.
Однако СВ имеет ряд существенных недостатков. Во-первых, это
вмешательство требует выполнения пилоропластики или наложения гастроэнтероанасто-
моза. Во-вторых, СВ у 5—10% больных приводит к развитию гастростаза,
диареи и демпинг-синдрома. Развитие этих осложнений связано с денервацией
органов брюшной полости (печени, кишечника) и утратой функций
привратника, хотя цель операции состоит только в угнетении кислотообразующей
функции желудка. Поэтому в 1957 г. была предложена СПВ, впервые выполненная
в клинике в 1970 г. [23]
В дальнейшем были предложены модификации ваготомии:
1. Задняя СВ в сочетании с передней серомиотомией (операция
Тейлора).
2. Задняя СВ в сочетании с передней селективной ваготомией
(операция Хилла).
Результаты этих операций сходны с таковыми после СПВ: хорошие и
отличные A—2 по шкале Визика) — 86% больных. Рецидив заболевания
наблюдают у 9% пациентов, а постваготомические расстройства — у 5% пациентов [24].
Однако к середине 80-х годов количество плановых операций по поводу
дуоденальной язвы снизилось в несколько раз. Это связано в первую очередь с
широким внедрением в практику Н2-блокаторов. Фармакотерапия сегодня
эффективна не менее чем у 90% больных. Но даже при курсовом использовании
препаратов язва рецидивирует у 80% больных в течение гоДа. Для стойкой
ремиссии необходим многолетний приём препаратов, хотя и при
поддерживающей терапии частоту рецидивов не удаётся снизить до уровня менее 30% [25].
Наконец, у 30% больных развиваются осложнения — кровотечение,
перфорация и стеноз. Количество экстренных операций по поводу осложнений
язвенной болезни после внедрения Н2-блокаторов снизилось в гораздо меньшей
степени, чем плановых. Не совсем ясна роль Helicobacter pylori. Микроорганизмы
264
достоверно оказывают влияние на течение язвенной болезни, однако
убедительных доказательств их этиологической роли в развитии заболевания нет [26].
Следовательно, и на сегодняшний день проблема хирургического лечения
ЯБДПК остаётся нерешённой, более того, она приобретает новое звучание в
связи с внедрением лапароскопических технологий. Это обусловлено
следующими причинами:
1. Сокращение сроков реабилитации. После лапароскопической ва-
готомии, результаты которой сравнимы с исходами открытой операции,
пациентов выписывают из стационара на 3—4-й день с возвращением к
обычному образу жизни на 8-10-е сутки.
2. Затраты на лапароскопическую операцию сравнимы со
стоимостью консервативного лечения в течение 8 лет. Поэтому, с учётом быстрой
реабилитации пациентов, экономическая целесообразность становится
очевидной.
Применяют следующие виды операций:
1. Классические операции
а. СВ в сочетании с одной из дренирующих операций (пилоропла-
стикой, пилоромиотомией, гастроэнтеростомией, антрумэктомией).
б. СПВ.
2. Модифицированные операции
а. Задняя СВ в сочетании с передней СПВ.
б. Задняя СВ в сочетании с передней серомиотомией.
в. СВ в сочетании с эндоскопической пилородилатацией.
г. Трансторакальная СВ в сочетании с эндоскопической
пилородилатацией.
Выбор способа операции зависит от опыта хирурга, характера патологии
(клиническое течение, экстренность, наличие операций на желудке в прошлом)
и общего состояния пациента.
Показания
1. Резистентная к консервативному лечению ЯБДПК.
2. Часто рецидивирующая ЯБДПК.
3. Осложнённая ЯБДПК (кровотечение, перфорация, стеноз).
Противопоказания
1. Общие противопоказания к лапароскопическим операциям.
2. Противопоказания к открытой ваготомии.
Дооперационное обследование
1. Общеклиническое обследование.
2. Рентгенологическое исследование желудка.
3. ФЭГДС.
4. Определение секреторной функции желудка (желудочное
зондирование).
5. Определение гастрина при подозрении на синдром Золлингера—
Элиссона.
265
Оперативная техника. Операцию производят под интубационным
наркозом с ИВЛ. Пациента укладывают на спину с разведёнными нижними
конечностями. Создают положение Фаулера. Вводят назогастральный зонд. Хирург
располагается между ногами пациента, ассистенты — по бокам (рис. 14-19).
Точки введения троакаров определяются планом предполагаемой
операции. Все троакары имеют диаметр 10 мм (рис. 14-20).
Первый троакар для лапароскопа вводят параумбиликально. Производят
ревизию брюшной полости. Под контролем зрения вводят остальные
троакары. Если планируется вмешательство на привратнике, троакары вводят, как
показано на рис. 14-21.
Стволовая ваготомия. Этапы операции:
1. Доступ к пищеводному отверстию диафрагмы обеспечивают путём
мобилизации и отведения левой доли печени. Затем вскрывают малый
сальник и визуализируют правую ножку диафрагмы (рис. 14-22). При этом
нужно помнить о возможном наличии добавочной печёночной артерии (у
12% пациентов), которую пересекают после клипирования.
2. При выполнении задней СВ параэзофагеальную брюшину
вскрывают вдоль левого края правой ножки диафрагмы. Выделяют заднюю
поверхность абдоминального отдела пищевода, где визуализируют задний
блуждающий нерв. Нерв осторожно захватывают зажимом и отделяют от
сосудистого сплетения с помощью электрокоагуляционного крючка,
резецируют после клипирования. Препарат отправляют на гистологическую
идентификацию.
3. Передняя СВ технически проще.
Находят передний блуждающий нерв, лежащий
на передней поверхности абдоминального
отдела пищевода, и пересекают. Затруднения
могут возникнуть при выделении
«криминальных» ветвей Грасси, проходящих по левому
краю передней поверхности пищевода. Для
их пересечения необходимо повернуть
пищевод вокруг своей оси.
4. В качестве дренирующей операции
при лапароскопической СВ чаще
используют эндоскопическую пилородилатацию. Для
этой цели используют гидравлический
(давление 15 мм рт.ст., экспозиция 10 мин) или
проволочный дилататор B0—30 мм в
диаметре, давление 20—30 мм рт.ст.).
Расположение дилататора определяют лапаро- и гаст-
роскопически.
Селективная проксимальная ваготомия
Для выполнения СП В вводят пять 10-
миллиметровых троакаров (рис. 14-23).
Рис. 14-19. Расположение
операционной бригады.
266
Рис. 14-20. Точки введения троакаров.
Рис. 14-21. Точки введения троакаров при
ваготомии и вмешательстве на
привратнике.
После введения троакаров ретрактором отводят печень. При
необходимости левую долю мобилизуют. Желудок оттягивают влево и каудально
(рис. 14-24).
СПВ начинают с пересечения ветвей переднего блуждающего
нерва, сохраняя две ветви «гусиной лапки», отступив приблизительно на 6
см проксимальнее привратника. Рассекают висцеральную брюшину вдоль
малой кривизны. Сосуды пересекают после клипирования.
Мобилизацию малой кривизны производят в проксимальном направлении до пи-
щеводно-желудочного соединения, идентифицировать которое помогает
интраоперационная
трансиллюминация с помощью фиброэндоско-
па (рис. 14-25). Затем рассекают
брюшину над абдоминальным
отделом пищевода, обнажая его на
протяжении 5—7 см с целью
пересечения «криминальных» ветвей
Грасси (рис. 14-26). Таким же
образом пересекают ветви заднего
блуждающего нерва. Денудирован-
ную малую кривизну ушивают
узловыми или непрерывным швом.
По показаниям выполняют фун-
допликацию. Полноценность
ваготомии контролируют интраопера- Рис ып д°ступ к правой ножке диаФ"
TtT „ рагмы и абдоминальному отделу пище-
ционнои рН-метриеи. вода
267
Возможен и другой порядок выполнения СП В: операцию начинают с
идентификации заднего, а затем переднего стволов блуждающего нерва на
уровне абдоминального отдела пищевода. После этого пересекают ветви
блуждающего нерва, идущие к желудку, по вышеописанной методике [27].
Задняя СВ в сочетании с передней селективной ваготомией
Производят пересечение веток переднего блуждающего нерва по
вышеописанной методике (см. «Селективная проксимальная ваготомия»).
Затем выполняют заднюю СВ (см. «Стволовая ваготомия»).
Задняя СВ в сочетании с передней серомиотомией
Серомиотомию от дна желудка до «гусиной лапки» производят
электрохирургическим способом или хирургическим лазером. Глубина
рассечения — до слизистой оболочки желудка. Рассечённые ткани ушивают
непрерывным обвивным швом (рис. 14-27). Заканчивают операцию
введением в желудок раствора метиленового синего для контроля целостности
слизистой оболочки.
Как вариант этого вмешательства можно рассматривать линейную
резекцию передней стенки желудка вдоль малой кривизны,
производимую с помощью эндоскопических сшивающих аппаратов («EndoGIA-30»)
(рис. 14-28). Эта методика позволяет сократить время операции, снижает
риск перфорации стенки органа. Однако это вмешательство требует
дополнительных затрат и после него возможно возникновение осложнений,
связанных с наложением полнослойного шва на стенку полого органа.
Осложнения и их профилактика
1. Группа осложнений, связанных с манипуляциями в области
абдоминального отдела пищевода (см. пункты 1—4 в разделе «Операции при
желудочно-пищеводном рефлюксе»).
2. Для профилактики кровотечения все пересекаемые сосуды
необходимо клипировать или коагулировать.
3. Специфические осложнения при ваготомии подробно описаны в
соответствующей литературе. В основе их профилактики лежит чёткое
определение показаний к ваготомии и тщательное техническое
исполнение операции.
Заключение. Лапароскопическую ваготомию в настоящее время
выполняют в немногих лечебных учреждениях, поэтому оценить её результаты на
настоящий момент невозможно. Вероятнее всего, наилучшие результаты, так же
как и в открытой хирургии, должна давать СПВ. Использование лапароскопии
позволит обеспечить более точное выполнение всех этапов операции.
268
Рис. 14-23. СПВ. Места введения троакаров.
1 — лапароскоп, 2 — ретрактор, 3, 4 —
электрохирургические инструменты:
крючок, ножницы, диссектор, 5 — зажим
Бебкока.
Рис. 14-24. Начальный этап выполнения
СПВ. Идентификация «гусиной лапки».
Рис. 14-25. СПВ. Мобилизация малой кривизны желудка.
Рис. 14-26. СПВ. Мобилизация абдоминального
отдела пищевода.
Рис. 14-27. Задняя СВ, передняя серомиотомия.
Рис. 14-28. Резекция малой кривизны желудка.
270
15
Лапароскопические операции
на толстой кишке
Бурное развитие лапароскопической хирургии в начале 90-х годов,
связанное с совершенствованием оперативной техники, изобретением
сшивающих аппаратов, послужило толчком к внедрению в клиническую практику
операций на толстой кишке. Сейчас стало возможным выполнять эти
вмешательства, используя все принципы открытой хирургии. Более того, лапароскопия
обеспечивает лучший обзор операционного поля и позволяет использовать
прецизионную технику при выполнении оперативных вмешательств. Хирурги, в
совершенстве владеющие техникой лапароскопических операций на толстой
кишке, к преимуществам методики относят уменьшение количества
осложнений (нагноения послеоперационных ран и возникновения грыж), раннее
восстановление перистальтики, снижение интенсивности болевого синдрома,
укорочение срока госпитализации, раннюю реабилитацию больных [1—8]. К
недостаткам относят сложность выполнения операции (особенно в период
освоения методики, а также у тучных больных), большую продолжительность
оперативного вмешательства и его высокую стоимость.
Показания к операциям на толстой кишке не отличаются от принятых в
открытой хирургии.
1. Дивертикулит толстой кишки.
2. Воспалительные псевдоопухоли толстой кишки.
3. Ишемический колит.
4. Полипы и полипоз толстой кишки.
5. Травматические повреждения толстой кишки.
6. Выпадение прямой кишки.
7. Рак толстой кишки.
Противопоказания
Общие противопоказания при операциях на толстой кишке те же, что
и при других лапароскопических вмешательствах. Следует отметить более
строгие критерии отбора больных для этих операций в связи с их большой
продолжительностью. Это касается в первую очередь пациентов с
дыхательной недостаточностью или лёгочными заболеваниями, так как
длительный ПП у этой группы больных приводит к опасным для жизни
нарушениям газообмена.
273
Специфические противопоказания
1. Значительное расширение толстой кишки вследствие
непроходимости.
2. Обширный спаечный процесс, связанный с различными
заболеваниями или предшествующими операциями.
3. Перитонит.
4. Ожирение и большая толщина брыжейки толстой кишки —
относительные противопоказания, так как они могут значительно
усложнить процедуру или сделать её невыполнимой.
Дооперационное обследование
1. Общее клиническое обследование, включающее анализ крови с
лейкоформулой, анализ мочи, биохимические анализы крови, ЭКГ.
2. Рентгенологическое исследование лёгких (для исключения
метастазов).
3. Спирометрия (для оценки дыхательных функций с учётом
длительной операции в условиях напряжённого ПП).
4. КТ органов брюшной полости.
5. Ирригография (для уточнения индивидуальной топографии
толстой кишки и локализации патологического очага).
6. Колоноскопия с биопсией.
Предоперационная подготовка. Подготовку кишечника начинают за 5-7
дней до операции: назначают бесшлаковую диету, сульфат магния внутрь. За 2
дня до операции утром и вечером показаны солевые очистительные клизмы.
Накануне операции перорально назначают эритромицин или неомицин, мет-
рагил внутривенно в терапевтических дозировках.
Особенности операций при раке толстой и прямой кишки. Как и в открытой
хирургии, при выполнении лапароскопических вмешательств на толстой
кишке по поводу рака необходимо соблюдать правила выполнения онкологических
операций.
1. Проведение полноценной ревизии органов брюшной полости для
определения распространённости процесса (печени, париетальной и
висцеральной брюшины, забрюшинных лимфатических узлов, органов
малого таза).
2. Выполнение полноценной лимфаденэктомии. Этого достигают
тщательной препаровкой сосудов брыжейки толстой кишки и
включением её в блок удаляемых тканей.
3. Минимальный контакт хирурга с опухолью при мобилизации
толстой кишки.
4. Достаточный объём резекции (не менее 6—7 см от опухоли в обе
стороны).
5. Удаление препарата в контейнере во избежание возникновения
имплантационных метастазов.
Оперативная техника. Операции выполняют под интубационным
наркозом с ИВЛ. Устанавливают назогастральный зонд и уретральный катетер. По-
274
ложение больного на операционном столе зависит от характера
предполагаемой операции.
Для выполнения радикального вмешательства на толстой кишке
необходимо 5 троакаров.
Интраоперационную ревизию толстой кишки дополняют колоноскопией
при невозможности визуализировать патологический очаг.
Этап мобилизации толстой кишки во всех случаях выполняют лапароско-
пически. Этапы резекции и наложения соустья можно осуществить либо ин-
тра-, либо экстракорпорально. В последнем случае резекцию органа и
наложение анастомоза выполняют после минилапаротомии.
Правосторонняя гемиколэктомия. Больного укладывают в положение
на спине, обрабатывают операционное поле. Одним из известных
способов накладывают ПП (см. главу 4), параумбиликально устанавливают
троакар для лапароскопа (угол зрения 30°) и проводят ревизию органов
брюшной полости. Затем под контролем зрения вводят дополнительные
троакары для инструментов (рис. 15-1). Операционный стол наклоняют влево,
чем добиваются смещения петель тонкой кишки.
Мобилизацию начинают с рассечения париетальной брюшины вдоль
слепой и восходящей ободочной кишки до печёночного угла по правому
боковому каналу. Слепую кишку захватывают кишечным жомом и
отводят влево и краниально, брюшину рассекают электрохирургическим
крючком или ножницами (рис. 15-2).
Ретроперитонеальные сращения разрушают электрокоагуляционно или
препаровкой тупым способом. На этом этапе операции необходимо визуа-
лизовать правый мочеточник и отвести его латерально во избежание
повреждения. Затем кишечным жомом захватывают кишку в области печёночного
Рис. 15-1. Расположение операционной бригады и точки введения троакаров при правосторонней
гемиколэктомии.
275
Рис. 15-2. Рассечение париетальной брюшины вдоль правого бокового канала.
угла и производят тракцию влево и каудально, натягивая париетальную
брюшину и большой сальник в этой области. Электрокоагуляционным
крючком или ножницами рассекают брюшину и сальник вдоль
печёночного угла по направлению к поперечной ободочной кишке. Иногда
возникает необходимость в клипировании сальниковых сосудов.
При мобилизации печёночного угла необходимо визуализировать
двенадцатиперстную кишку и правый мочеточник. Большой сальник
отделяют от поперечной ободочной кишки до уровня предполагаемой резекции.
Мобилизованную правую половину толстой кишки приподнимают,
растягивая брыжейку. Идентифицируют и выделяют верхние брыжеечные
артерию и вену, подвздошно-ободочно-кишечную артерию, правую и
среднюю ободочные артерии, в бессосудистых участках брыжейку ободочной
кишки рассекают. Этот этап удобно выполнять, используя
трансиллюминацию: через троакар, расположенный в правой подрёберной области,
вводят источник света и просвечивают брыжейку ободочной кишки. При этом
Рис. 15-3. Пересечение магистральных сосудов.
276
становятся видимыми бессосудистые
участки. На магистральные сосуды,
подлежащие пересечению,
накладывают клипсы, эндолигатуры или
сшивающий аппарат. Сосуды
пересекают (рис. 15-3). Если необходимо
формирование интракорпорального
анастомоза, в намеченном для резекции
месте сшивающим аппаратом
пересекают подвздошную и поперечную
ободочную кишку (рис. 15-4).
Препарат помещают в контейнер. При
формировании экстракорпорального
анастомоза резекцию кишки
производят после выведения её из
брюшной полости.
Рис. 15-4. Пересечение подвздошной
кишки аппаратом EndoGIA-30.
Наложение экстраабдоминального анастомоза. В правой мезогастраль-
ной области выполняют минилапаротомию протяжённостью 4-6 см.
Мобилизованную толстую кишку извлекают из брюшной полости.
Препарат резецируют и удаляют. Если лапароскопически были
обработаны не все магистральные сосуды, это можно сделать на данном
этапе операции. Накладывают илеотрансверсоанастомоз при помощи
сшивающих аппаратов или путём наложения швов (рис. 15-5, 15-6).
После наложения анастомоза кишку погружают в брюшную полость,
минилапаротомную рану ушивают. Восстанавливают ПП. Отверстие
в брыжейке ободочной кишки при необходимости ушивают.
Производят ревизию, санацию брюшной полости, контролируют гемостаз.
Брюшную полость дренируют, под контролем зрения извлекают
троакары. Раны ушивают.
Рис. 15-5. Наложение илеотрансверсоанастомоза.
277
Рис. 15-6. Завершение илеотрансверсоанасто-
моза.
Рис. 15-7. Наложены швы между петлями ана-
стомозируемых кишок, вскрыты их
просветы, введён аппарат «EndoGIA-30».
Наложение интраабдоминалыюго анастомоза. Сближают петли
подвздошной и поперечной ободочной кишки, предназначенные для
анастомозирования, двумя узловыми швами, наложенными по про-
тивобрыжеечному краю, фиксируют их друг к другу. В этой зоне
вскрывают кишечные просветы и вводят бранши сшивающего аппарата
(рис. 15-7).
Аппаратом прошивают и рассекают анастомозируемые отделы
кишечника. Аппарат извлекают. Оставшийся дефект замыкают
повторным наложением степлера (рис. 15-8).
Контролируют герметичность анастомоза, гемостаз. Ушивают окно
брыжейки. Через небольшой разрез брюшной стенки удаляют
препарат. Брюшную полость дренируют, извлекают троакары.
Левосторонняя гемиколэктомия и
резекция сигмовидной кишки. Больного
укладывают в литотомическую позицию,
обрабатывают операционное поле.
Накладывают ПП и параумбиликально
вводят троакар для лапароскопа, а затем
троакары дня инструментов (рис. 15-9).
Операционный стол наклоняют
вправо и опускают головной конец.
Проводят ревизию органов
брюшной полости. Локализацию
выявленного поражения толстой кишки отмечают
электрокоагуляционно или
наложением узлового шва. Кишечными жомами
производят тракцию кишки вправо и
вверх к передней брюшной стенке,
растягивая её брыжейку. Электрокоагуля-
ционным крючком или ножницами
вскрывают париетальную брюшину вдоль
левого бокового канала (рис. 15-10).
Рис. 15-8. Ушивание дефекта анастомоза
аппаратом «EndoGIA-30».
278
Рис. 15-9. Расположение операционной бригады и точки введения троакаров при операциях на
левой половине толстой кишки.
Нисходящую ободочную и сигмовидную кишку смещают вправо,
разрушая ретроперитонеальные сращения тупым и острым способами.
Идентифицируют и отводят в сторону левый мочеточник и яичковые сосуды
(рис. 15-11). С помощью трансиллюминации выделяют магистральные
сосуды, подлежащие пересечению. Сосуды клипируют или обрабатывают
сшивающим аппаратом (рис. 15-12). Рассекают брыжейку при помощи
электрокоагуляционного крючка или ножниц. Сшивающим аппаратом
прошивают и пересекают проксимальный и дистальный конец кишки
(рис. 15-13). Резецированную кишку помещают в контейнер.
Рис. 15-10. Рассечение брюшины вдоль
левого бокового канала.
Рис. 15-11. Выделение левого мочеточника.
279
Рис. 15-12. Пересечение клипированной
сигмовидной артерии.
Рис. 15-13. Обработка сигмовидной кишк
сшивающим аппаратом.
Далее ход операции зависит от способов наложения коло-колоанас
томоза (интра- или экстракорпорального), описанных выше. При экстре
корпоральном наложении анастомоза минилапаротомию выполняют
левой половине брюшной стенки.
При этих видах резекции толстой кишки интракорпоральный анас
томоз можно накладывать с помощью циркулярного сшивающего аппарс
та (например, ЕЕА). После мобилизации и клипирования сосудов кишк
пересекают дистальнее опухоли линейным сшивающим аппаратом (т
пример, «EndoGIA-ЗО»). Кишку выводят через минилапаротомную ран
на переднюю брюшную стенку. Подлежащий участок кишки резецирую'
На проксимальную культю кишки накладывают кисетный шов и погружа
ют в неё головку циркулярного сшивающего аппарата (рис. 15-14). Кисеп
ный шов завязывают на стилете головки аппарата. Кишку погружают
брюшную полость, рану послойно ушивают. Восстанавливают ПП.
Рис. 15-14. Погружение головки сшивающего аппарата ЕЕА в проксимальную культю толсто
кишки.
280
Трансанально вводят основную
часть циркулярного аппарата,
выдвигают его троакар, прокалывают им
дистальную культю кишки в центре
наложенного ранее линейного шва
(рис. 15-15), троакар извлекают.
Соединяют стилет головки, введённый
в проксимальный отдел кишки, с
основной частью циркулярного
аппарата (рис. 15-16). Сближают
проксимальную и дистальную культи кишок
и сшивают их. Аппарат извлекают.
Проверяют герметичность
наложенного анастомоза: в брюшную полость
вводят физиологический раствор
хлорида натрия в количестве,
достаточном для полного покрытия созданного анастомоза, а затем в прямую
кишку инсуффлируют воздух. Отсутствие пузырьков воздуха свидетельствует о
герметичности соустья.
Окно в брыжейке сигмовидной кишки ушивают узловыми швами,
брюшную полость санируют, контролируют гемостаз. Устанавливают в
полость малого таза дренажную трубку, извлекают троакары, раны ушивают.
При наличии противопоказаний к наложению анастомоза
выполняют операцию Хартманна. Выведенную толстую кишку послойно
фиксируют к минилапаротомной ране, препарат резецируют и формируют
колостому.
Брюшно-анальная резекция прямой кишки. Больного укладывают в
литотомическую позицию, обрабатывают операционное поле.
Операционный стол поворачивают в положение Тренделенбурга. Накладывают ПП,
параумбиликально вводят троакар для лапароскопа. Проводят ревизию
Рис. 15-15. Прокалывание троакаром
аппарата ЕЕА, введённым трансанально,
дистальной культи кишки.
Рис. 15-16. Наложение циркулярного анастомоза аппаратом ЕЕА.
281
органов брюшной полости, затем под контролем зрения вводят троакары
для инструментов. Расположение их аналогично таковому при
левосторонней гемиколэктомии.
Сигмовидную кишку кишечными жомами отводят вправо и вверх к
передней брюшной стенке. Рассекают париетальную брюшину вдоль
левого бокового канала до селезёночного угла толстой кишки.
Визуализируют левый мочеточник и яичковые сосуды, смещаемые латерально.
Выделяют нижние брыжеечные артерию и вену. Артерию обрабатывают
сшивающим аппаратом или клипируют у места её отхождения от аорты.
Аналогичным способом обрабатывают нижнюю брыжеечную вену. Брыжейку
сигмовидной кишки рассекают электрокоагуляционным способом,
мелкие сосуды клипируют. Левую половину толстой кишки мобилизуют до
селезёночного угла. Длина мобилизованной нисходящей ободочной
кишки должна позволять без натяжения сформировать десцендоректоанастомоз.
Рассекают париетальную брюшину тазового дна вокруг кишки.
Кишечным жомом подтягивают сигмовидную кишку краниально и вверх к
передней брюшной стенке. Выделение прямой кишки начинают с задней
её стенки при помощи электрохирургических инструментов. Затем
обнажают боковые связки прямой кишки. Верхние и средние прямокишечные
сосуды клипируют или коагулируют. Далее выделяют переднюю стенку
прямой кишки. Мобилизацию заканчивают на уровне тазового дна. На
этом уровне на кишку накладывают сшивающий аппарат, кишку
прошивают и пересекают.
Мобилизованную толстую кишку низводят в анальный канал, после
чего формируют колоректальный анастомоз после отсечения препарата.
Брюшно-промежностная экстирпация прямой кишки. Положение
больного на операционном столе, расположение операционной бригады,
точки введения троакаров аналогичны описанным для брюшно-анальной
резекции.
Этапы мобилизации прямой и сигмовидной кишки не отличаются от
описанных выше, однако необходимости в мобилизации нисходящей
ободочной кишки и селезёночного угла не возникает. По завершении
мобилизации прямой кишки сшивающим аппаратом обрабатывают
сигмовидную кишку. В левой подвздошной области формируют колостому.
Промежностный этап операции не отличается от такового при
открытой операции. После удаления препарата промежностную рану
послойно ушивают. Восстанавливают ПП, после чего ушивают и
париетальную брюшину.
Санируют брюшную полость, контролируют гемостаз. Брюшную
полость дренируют, под контролем зрения удаляют троакары. Раны ушивают.
Ректопексия. Больного укладывают в положение на спине.
Операционный стол поворачивают в положение Тренделенбурга. Обрабатывают
операционное поле и вводят троакары.
Проводят ревизию органов брюшной полости. Кишечный жом
накладывают на сигмовидную кишку в области тазового дна и подтягивают
её краниально. При помощи электрокоагуляционного крючка или нож-
282
ниц формируют окно в брыжейке толстой кишки. В брюшную полость
вводят полоску полипропиленовой сетки размером 1,5x10 см, которой
оборачивают толстую кишку. При помощи грыжевого степлера
фиксируют сетку к сигмовидной кишке и крестцу. Контролируют гемостаз, под
контролем зрения удаляют троакары. Раны ушивают.
Послеоперационный период. Назогастральный зонд удаляют в конце
операции или на следующий день. Приём жидкости разрешают на 2-й день или
после восстановления перистальтики. На 3—4-й день расширяют диету. В эти
же сроки отменяют внутривенные инфузии.
Уретральный катетер извлекают на 2—3-й день после операции. Дренаж
удаляют на 2—3-й послеоперационный день, когда экссудация сокращается до
50 мл/сут. Больных выписывают на 4—7-е сутки после операции.
Осложнения и их профилактика
1. Во избежание повреждения мочеточник следует визуализировать в
начале операции и с осторожностью использовать вблизи него
электрокоагуляцию.
2. Мобилизацию прямой кишки проводят на удалении от её стенки
во избежание вскрытия просвета органа.
3. Анатомическая препаровка магистральных сосудов предотвращает
возникновение кровотечения.
4. При мобилизации толстой кишки в области нижнего полюса
селезёнки следует опасаться надрыва её капсулы.
5. Профилактика несостоятельности анастомоза заключается в
тщательном наложении швов или аппаратов и проверке соустья на
герметичность.
6. Излишняя деваскуляризация анастомозируемых петель
кишечника может привести к ишемическим расстройствам.
7. Возникновение имплантационных метастазов предотвращают
помещением препарата перед извлечением в контейнер.
283
16
Операции на органах
забрюшинного пространства
ЛАПАРОСКОПИЧЕСКАЯ АДРЕНАЛЭКТОМИЯ
Адреналэктомия — относительно недавнее дополнение к списку
хирургических процедур, успешно выполненных с использованием
лапароскопических или минимально инвазивных хирургических методов. Анатомическое
расположение надпочечников позволяет максимально использовать
преимущества лапароскопической хирургии для их удаления, так как большинство
опухолей этой локализации имеют небольшие размеры и хорошо
дифференцируются от окружающих тканей. Однако их расположение в забрюшинном
пространстве в непосредственной близости и даже в интимном соприкосновении с
жизненно важными органами долгое время ограничивало возможности
эндоскопической хирургии. В настоящее время распространение получили несколько
эндоскопических методик выполнения адреналэктомии, технические аспекты
которых будут рассмотрены ниже.
Кроме собственно техники эндоскопических вмешательств при опухолях
надпочечников, в этой главе будут представлены краткие анатомические
сведения, показания к оперативному лечению, а также исторический экскурс.
Морфологические особенности надпочечников. Хирурги, предпринимающие
попытку выполнения эндоскопической адреналэктомии, должны хорошо
представлять топографическую анатомию надпочечников и твёрдо придерживаться
принципов, установленных для открытой хирургии. Надлежащий отбор и
подготовка пациентов для операции также существенно влияют на результат.
Как известно, надпочечники отличаются весьма сложным
гистологическим строением. Это связано с различным эмбриональным происхождением
коркового и мозгового слоев и различиями в гормонпродуцирующих функциях.
Надпочечники представляют собой парный внебрюшинный орган,
расположенный у верхних полюсов почек (рис. 16-1). Каждый надпочечник имеет
массу в среднем 4 г, что не зависит от пола и массы тела. Правый надпочечник
имеет пирамидальную форму, левый более сглажен и, как правило, имеет вид
полумесяца. Надпочечники покрыты капсулой и хорошо различимы в
околопочечной клетчатке — выделяются характерным оранжевым цветом и точечно-
зернистой структурой кортикальной поверхности. Железа имеет рыхлую
консистенцию и легко разрушается при грубых манипуляциях [2].
Топографическая анатомия. Задней поверхностью оба надпочечника
соприкасаются с диафрагмой. Правый вплотную прилежит к забрюшинной части
285
ПРАВЫЙ
НАДПОЧЕЧНИК
НАДПОЧЕЧНИКОВЫЕ
АРТЕРИИ
1АФРАГМАЛЬНАЯ ВЕНА
ЛЕВЫЙ НАДПОЧЕЧНИК
НИЖНЯЯ ПОЛАЯ ВЕНА
БРЮШНАЯ АОРТА
Рис. 16-1. Нормальная анатомия надпочечников [1].
правой доли печени, нижней полой вене и правой почке. Левый прилежит к
хвосту поджелудочной железы, селезёночным сосудам и левой почечной вене,
что необходимо учитывать при хирургической препаровке.
Надпочечниковые артерии и вены пространственно разделены. Каждая
железа получает кровоснабжение из трёх артерий: верхней, средней и нижней
надпочечниковых. Надпочечниковые вены (по одной с каждой стороны)
впадают в нижнюю полую (справа) и в почечную вену (слева). Центральная вена
правого надпочечника имеет протяжённость в среднем 5 мм, вена левого
несколько длиннее. Описаны единичные случаи наличия второй вены правого
надпочечника, впадающей в правую почечную вену. Хирургические
манипуляции в области надпочечной вены потенциально опасны, особенно на правой
стороне, где недостаточно прецизионная техника может привести к
повреждению нижней полой вены и развитию неконтролируемого кровотечения.
Нервные пучки надпочечников образуют сплетение вдоль медиальной
поверхности железы и проходят сквозь корковый слой к мозговому.
На долю коркового слоя у взрослого человека приходится около 90%
ткани надпочечника. Этот слой состоит из трёх зон: наружной (клубочковой),
средней (пучковой) и внутренней (сетчатой). Располагаясь непосредственно
под фиброзной капсулой, клубочковая зона занимает примерно 15% объёма
коркового слоя; её клетки содержат сравнительно небольшое количество
цитоплазмы и липидов, вырабатывают гормон альдостерон. На долю пучковой зоны
286
приходится 75% всего коркового вещества; её клетки богаты холестерином и
эфирами холестерина, вырабатывают в основном кортизол. Клетки сетчатой
зоны также продуцируют это вещество; они относительно бедны липидами и
содержат много гранул. Помимо кортизола, клетки этой зоны (как и пучковой)
вырабатывают половые гормоны — андрогены и эстрогены.
В корковом слое надпочечников вырабатывается более 50 различных
стероидных соединений. Он служит единственным источником глюко- и минера-
локортикоидов в организме, важнейшим источником андрогенов у женщин и
играет незначительную роль в продукции эстрогенов и прогестинов. Основной
глюкокортикоид человека — кортизол; избыток или недостаток этого стероида
сопровождается угрожающими жизни сдвигами гомеостаза. Из минералокор-
тикоидов наиболее важен альдостерон. Избыток минералокортикоидов
обусловливает артериальную гипертензию и гипокалиемию, а недостаток — гипер-
калиемию, которые могут оказаться несовместимы с жизнью.
Мозговой слой надпочечников продуцирует катехоламины. К ним
относят адреналин, норадреналин и дофамин. Воздействие катехоламинов на
обмен веществ складывается из прямых и опосредованных эффектов при
взаимосвязи со специфическими рецепторами органов и клеток-мишеней.
Опухоли надпочечников. Опухоли надпочечников могут не только
изменять их гормонпродуцирующую функцию, но и самостоятельно вырабатывать
биологически активные вещества.
Наиболее целесообразна на сегодняшний день классификация опухолей
надпочечников, предложенная в 1980 г. Всемирной организацией
здравоохранения и основанная на гистогенетическом принципе [3].
1. Эпителиальные опухоли коры надпочечников: аденома, карцинома.
2. Мезенхимальные опухоли: миелолипома, липома, фиброма, ангиома.
3. Опухоли мозгового слоя вещества надпочечников: феохромоцито-
ма, нейробластома, ганглиома-симпатогониома.
Опухоли надпочечников могут быть гормонально-активными или
гормонально-неактивными, доброкачественными или злокачественными. С этих
позиций удобна морфологическая классификация (Micali и соавт., 1985),
учитывающая морфофункциональные особенности опухолей, а также указывающая
на доброкачественный или злокачественный характер образования.
1. Опухоли, исходящие из коркового слоя.
1.1. Гормонально-активные опухоли: гиперплазия ткани, аденома,
карцинома.
1.2. Гормонально-неактивные опухоли: аденома, карцинома,
2. Опухоли, исходящие из мозгового слоя.
2.1. Гормонально-активные опухоли: феохромоцитома.
2.2. Гормонально-неактивные опухоли: симпатогониома, симпатоб-
ластобластома, ганглионейробластома, ганглионейрома, кисты-
амилоидоз, миелолипома.
Клиническая картина опухолей надпочечников разнообразна и зависит от
локализации и функциональных особенностей опухолей.
287
Показания к адреналэктомии
1. Опухоли коркового слоя надпочечников
Синдром Кушинга. Избыточная продукция глюкокортикоидов
корой надпочечника клинически проявляется совокупностью
признаков, широко известных как синдром Кушинга. Наиболее
частая причина синдрома Кушинга F0-70% случаев) —
гиперсекреция гипофизарного адренокортикотропного гормона (АКТГ) при
аденоме гипофиза. Первичные опухоли надпочечников (аденомы
и карциномы) составляют от 15 до 20% случаев, в 15% случаев
имеют место эктопически расположенные АКТГ-секретирующие
опухоли [4, 5].
Для пациентов с синдромом Кушинга, обусловленным надпочеч-
никовой кортикальной аденомой, предпочтительна односторонняя
адреналэктомия. Двусторонняя адреналэктомия возможна у
больных с двусторонней надпочечниковой гиперплазией. Синдром
Кушинга гипофизарного происхождения — показание к
адреналэктомии лишь при неэффективности лечения первичного поражения
гипофиза.
Альдостерома. Увеличенная продукция клубочковой зоной
надпочечника альдостерона приводит к развитию синдрома первичного
альдостеронизма. Особенность этого состояния — артериальная ги-
пертензия в сочетании с гипокалиемией. Основные причины
первичного гиперальдостеронизма — альдостеронпродуцирующие
аденомы F5% случаев) и двусторонняя гиперплазия C5% случаев).
Для первичного альдостеронизма характерен повышенный уровень
альдостерона в крови и моче. При постановке диагноза
первичного альдостеронизма важно отличить альдостеронпродуцирующую
аденому от идиопатического гиперальдостеронизма, так как
последний не отвечает на хирургическое лечение и поддаётся
лекарственной терапии.
Альдостеронпродуцирующие аденомы — опухоли мягкой
консистенции небольших размеров (от 1 до 3 см), поэтому их
лапароскопическое удаление не встречает затруднений [6].
Альдостеронпродуцирующую карциному надпочечника встречают чрезвычайно
редко. Как правило, она секретирует одновременно несколько
стероидных гормонов.
Кортикальный рак. Надпочечниковый кортикальный рак — редкая
опухоль, частота составляет приблизительно один случай
заболевания на 2 000 000 населения в год. Эти опухоли
гормонально-активны и часто продуцируют кортизол, андрогены и другие гормоны. У
пациентов возможно развитие синдрома Кушинга. Диагноз надпо-
чечникового кортикального рака трудно поставить даже при
гистологическом исследовании, однако для него характерны сравнительно
большие размеры и масса опухоли (около 100 г), прорастание в
окружающие ткани, отдалённые метастазы в лёгкие, печень или кости.
288
2. Опухоли мозгового слоя надпочечников
Феохромоцитома. Феохромоцитомы — опухоли, секретирующие ка-
техоламины, возникающие в пределах хромаффинной ткани. Фео-
хромоцитому находят у одного из 1000 пациентов с диастоличес-
кой гипертензией. Подавляющее большинство феохромоцитом
возникает в пределах мозгового слоя надпочечников, но от 10 до 15%
этих опухолей имеет вненадпочечниковую локализацию.
Феохромоцитомы могут быть двусторонними в 10% случаев и с такой же
частотой — злокачественными. Классическая клиническая
картина у больного с феохромоцитомой — рецидивирующие пароксиз-
мальные приступы артериальной гипертензии в сочетании с
головными болями, беспокойством и потоотделением. Диагностика
основана на определении уровня катехоламинов в крови и моче. С
успехом применяют радиоизотопные методы исследования. Доопе-
рационную адренергическую блокаду используют для
профилактики гипертонического криза в момент мобилизации и удаления
опухоли.
3. Другие опухоли надпочечников. Помимо вышеперечисленных,
часто возникают гормонально-неактивные кортикальные аденомы. Для
определения показаний к оперативному лечению бессимптомных опухолей
руководствуются размерами образований. Если поражение небольшое
(менее 3 см), больному может быть рекомендовано периодическое
наблюдение для оценки тенденции роста опухоли. Большие образования (более
6 см) необходимо удалить независимо от функционального статуса по
причине риска развития кортикального рака. Показания к хирургическому
лечению пациентов с промежуточными размерами бессимптомных
опухолей (от 3 до 6 см) спорны. Большинство авторов рекомендует удаление
этих образований даже при незначительном риске малигнизации.
Лапароскопическая адреналэктомия предпочтительна именно при лечения
опухолей промежуточных размеров.
Надпочечник может быть местом локализации метастазов других
злокачественных новообразований. Наиболее частые источники метастазов в
надпочечник: рак лёгкого, желудка и меланомы различной локализации [7].
Оперативная техника. Эндоскопическая адреналэктомия — относительно
недавно разработанная процедура, для выполнения которой предлагалось
большое количество методик, ни одну из которых на данный момент нельзя
назвать предпочтительной. До настоящего времени сообщения об успешной
лапароскопической адреналэктомии были ограничены небольшим количеством
операций, не позволяющим делать окончательные выводы о преимуществах и
недостатках этого метода. Основная цель лапароскопических подходов,
используемых в настоящее время, — заменить открытые хирургические
вмешательства на малоинвазивные методы лечения.
Все эндохирургические доступы при адреналэктомии принципиально
можно разделить на два вида: трансабдоминальный (лапароскопический) и забрю-
шинный [8—12].
289
Независимо от вида доступа необходимо неукоснительно соблюдать
принципы, разработанные для традиционной хирургии надпочечников.
1. Внекапсульная препаровка железы с сохранением её целостности
для предотвращения имплантации клеток опухоли в забрюшинное
пространство.
2. Прецизионная техника выполнения всех манипуляций для
предотвращения повреждения жизненно важных органов.
Наиболее удобен с точки зрения оперативной технологии
лапароскопический доступ.
Расположение операционной бригады и аппаратуры для выполнения
лапароскопической адреналэктомии показано на рис. 16-2. В дополнение к стан-
МОНИТОР
ИНСУФФЛЯТОР
МОНИТОР
ВИДЕОКАМЕРА
/ОПЕРАЦИОННАЯ
СЕСТРА
Рис. 16-2. Расположение операционной бригады при левосторонней адреналэктомии [1].
290
дартному комплекту эндоскопического оборудования необходимы угловой
лапароскоп (угол зрения 30—45°), электрохирургические ножницы, атравматичес-
кие щипцы A0- или 11-миллиметровые) и контейнер для эвакуации органа из
брюшной полости. Ретрактор с широкой изгибающейся рабочей частью может
быть полезен для отведения печени в ходе правосторонней адреналэктомии. Все
порты и троакары должны быть диаметром от 10 до И мм для обеспечения
широкого выбора инструментов и оперативной техники. Большинство опухолей
надпочечников достаточно малы и легко удалимы из брюшной полости в
стандартном контейнере с незначительным рассечением апоневроза в области
одного из проколов.
Лапароскопическая адреналэктомия боковым доступом. Наиболее
удобным расположением троакаров для лапароскопической адреналэктомии
признан так называемый боковой доступ или доступ с фланга. О таком
подходе впервые сообщил Gagnern соавт. в сентябре 1992 г.
Пациент находится на операционном столе в положении лежа на
соответствующем боку, при этом операционный стол имеет перегиб на
уровне поясницы под углом приблизительно 30° (рис. 16-3). Такой излом
позволяет обеспечить максимальное расхождение подвздошной кости и
рёберной дуги на стороне операции, обеспечивая удобный лапароскопический
подход. На рисунке изображено положение больного при левосторонней
адреналэктомии. Таким же образом больного располагают на левом боку
при операции справа. Пациента необходимо надёжно зафиксировать на
операционном столе для предотвращения сползания его во время
поворотов стола в ходе операции. Вмешательство начинают с наложения ПП в
подрёберной области по срединно-ключичной линии латеральнее прямой
мышцы. Давление газа в брюшной полости устанавливают на уровне
15 мм рт.ст.
После удаления иглы Берета на её место устанавливают первый
троакар и вводят лапароскоп.
Два дополнительных 10-миллиметровых троакара вводят под
визуальным контролем соответственно по передней и средней подмышечным
Рис. 16-3. Положение больного на операционном столе при левосторонней адреналэктомии [1].
291
линиям ниже XII ребра и выше
подвздошного гребня. Прежде чем установить
четвёртый троакар, который может быть
помещён на уровне задней подмышечной
линии, целесообразно произвести
мобилизацию селезёночного угла толстой кишки
при левосторонней адреналэктомии и
печёночного изгиба толстой кишки — при
правосторонней (рис. 16-4).
При левосторонней
лапароскопической адреналэктомии селезёночный изгиб
ободочной кишки мобилизуют путём
рассечения листка брюшины между толстой
кишкой и нижним полюсом селезёнки.
Натяжение тканей и хорошая
визуализация зоны операции достигаются путём
отведения селезёночного угла при помощи
атравматичного зажима в
нижнемедиальном направлении. В забрюшинное
пространство между селезёнкой и почкой
проникают после рассечения селезёночно-по-
чечной связки. По мере прецизионного
рассечения связки необходимо отвести
селезёнку ретрактором в медиальном
направлении для предотвращения
повреждения её сосудов. Больного переводят в
положение с приподнятым головным концом. Благодаря этому кишечник
перемещается в нижние отделы брюшной полости, создавая
благоприятную экспозицию для мобилизации печёночного и селезёночного угла
ободочной кишки. При правосторонней адреналэктомии печёночно-ободоч-
ную связку рассекают после отведения правой доли печени в
краниальном направлении с использованием широкого ретрактора с ротикулято-
ром (рис. 16-5).
Надпочечник, располагаясь непосредственно у верхнего полюса
почки, легко отличим от окружающей клетчатки благодаря характерному ярко-
оранжевому окрашиванию, что значительно облегчает его внекапсульную
препаровку. Необходимо повторно указать на необходимость бережного
отделения надпочечника от окружающих тканей, поскольку разрушение
железы ведёт к неконтролируемому выбросу в кровь катехоламинов и
развитию трудноуправляемой гипертензии. В свою очередь повреждение
центральной вены надпочечника, почечной или нижней полой вены ведёт к
массивному кровотечению и требует лапаротомии. При левосторонней
адреналэктомии недостаточно осторожные действия могут привести к
повреждению хвоста поджелудочной железы или селезёнки.
Таким образом, диссекцию надпочечника производят точно по
границе его капсулы и окружающей клетчатки (рис. 16-6). Для мобилизации
Рис. 16-4. Расположение троакаров при
левосторонней лапароскопической
адреналэктомии боковым доступом [ 1 ].
292
железы лучше использовать электрохирургические ножницы диаметром
10 мм с двумя длинными активными браншами. Достаточно большая
площадь рабочей части такого инструмента позволяет эффективно
использовать его для остановки незначительного кровотечения, неизбежно
возникающего в ходе выделения органа. Кроме того, пересечение артериальных
сосудов надпочечника необходимо производить под контролем
электрокоагуляции вследствие рассыпного типа кровоснабжения и
невозможности лигирования каждого сосуда в отдельности.
После получения адекватного доступа к железе дальнейшее её
выделение из окружающих тканей прекращают вплоть до клипирования и
пересечения основного венозного ствола надпочечника, по которому
собственно и происходит сброс гормонов в кровь пациента. Таким образом,
чем раньше в ходе операции выполнен этот этап, тем меньше риск
развития осложнений, связанных с гормональным дисбалансом. Вена правого
надпочечника впадает непосредственно в нижнюю полую вену и имеет
протяжённость всего около 0,5 см, поэтому для точной идентификации
лучше всего верифицировать её, двигаясь в ходе диссекции вдоль стенки
нижней полой вены сверху вниз. Центральную вену левого надпочечника
(рис. 16-7) верифицировать значительно проще, она имеет протяжённость
около 1,5 см и впадает в левую почечную вену.
После двойного клипирования (рис. 16-8) центральную вену
пересекают, и операция вступает в завершающую стадию, которая, однако,
может сопровождаться большими трудностями. Выделение надпочечников
достаточно сложно при больших размерах опухоли и рыхлой её
консистенции. В такой ситуации даже самый атравматичный зажим,
используемый для фиксации железы, повреждает её ткани. В случае разрушения
опухоли её фрагменты немедленно помещают в стандартный пластиковый
контейнер и удаляют опухоль из брюшной полости.
Лапароскопическая адреналэктомия прямым абдоминальным доступом.
Первая успешная лапароскопическая адреналэктомия была выполнена в
Рис. 16-5. Создание экспозиции при
правосторонней адреналэктомии. 1 — пе-
чёночно-ободочная связка.
Рис. 16-6. Выделение надпочечника из
окружающих тканей с использованием
электрохирургическпх ножниц. 1 —
опухоль надпочечника.
293
1992 г. Petelin с использованием подхода, называемого в настоящее время
прямым абдоминальным доступом. Преимущества этого подхода состоят
в том, что он обеспечивает хирургу большее оперативное пространство и
позволяет вводить манипуляционные инструменты под более тупым
углом к зоне удаляемого объекта. Серьёзный недостаток этого доступа —
дополнительные усилия по отведению внутренних органов.
Отличие прямого доступа от бокового состоит в расположении
троакаров: порт для лапароскопа устанавливают в области пупка,
дополнительные манипуляционные порты располагают по срединно-ключичной
линии ниже рёберной дуги и на уровне пупка. Основной операционный
троакар устанавливают на середине расстояния от пупка до мечевидного
отростка по средней линии.
Лапароскопическая адреналэктомия из забрюшинного доступа. Наиболее
короткий хирургический доступ к надпочечнику — люмботомический
разрез. При такой операции используют исключительно забрюшинную дис-
секцию, что даёт неоспоримые преимущества. За всё время существования
эндоскопической хирургии было предложено два различных метода,
основная цель которых — воспользоваться преимуществами внебрюшинной дис-
секции при использовании эндоскопической техники оперирования.
Окада и соавт. A992 г.) предлагали выполнять заднюю забрюшинную
эндоскопическую адреналэктомию, используя широкий эндоскоп,
имевший отверстие для лапароскопа и четыре инструментальных канала.
Диаметр этого прибора составлял 40 мм, вводили его в забрюшинное
пространство через минилюмботомический разрез длиной 5 см по краю XII
ребра. Забрюшинное пространство открывали обычным хирургическим
путём, затем в рану вводили эндоскоп. Надпочечник удавалось
мобилизовать и произвести перевязку его сосудов, несмотря на неудобное
параллельное расположение инструментов в каналах.
Рис. 16-7. Выделение центральной вены
левого надпочечника. 1 — центральная
вена левого надпочечника.
Рис. 16-8. Клипирование центральной
вены правого надпочечника. 1 —
нижняя полая вена; 2 — центральная
вена правого надпочечника.
294
В настоящее время существует целый ряд специальных приборов с
раздувными баллонами для пневматической препаровки. Введение такого
устройства позволяет создать в забрюшинном пространстве полость,
которая после извлечения баллона может быть заполнена углекислым газом
(ретрокарбоксиперитонеум). В настоящее время опыт таких операций
невелик. Технические аспекты подобных вмешательств разработаны
преимущественно на животных, однако технология безусловно перспективна и
неизбежно будет активно внедряться в эндоскопическую хирургию в силу
своей малой инвазивности и высокой эффективности.
Обсуждение. Роль эндоскопической технологии в лечении опухолей
надпочечников в настоящее время возрастает. Как и в других областях хирургии,
новая методика оперирования постепенно завоёвывает одну позицию за другой
вследствие малой травматичности и значительного сокращения сроков
реабилитации пациентов. Практически все серьёзные недостатки эндоскопической
хирургии забрюшинного пространства касаются технических аспектов
операции. Они постепенно будут преодолены по мере появления новых
технологических идей и решений [13—25].
До настоящего времени возможности удаления крупных опухолей
ограниченны, что необходимо учитывать при подборе пациентов. Не до конца
решена проблема забрюшинного эндоскопического доступа к
надпочечникам, необходимость трансабдоминальной операции во многом определяет
скептическое отношение хирургов к внебрюшинному доступу. Нет
достаточно чётко разработанной единой концепции эндоскопического вмешательства
на надпочечниках. Наконец, сравнительно небольшой опыт таких вмешательств
не позволяет судить с достаточной долей уверенности об отдалённых
результатах [26-33].
На сегодняшний день эндоскопическая хирургия забрюшинного
пространства должна развиваться в клиниках, имеющих соответствующее
оснащение. Для успешной работы необходимо оборудование только самого высокого
качества. Это связано с необходимостью прецизионной оперативной техники в
условиях затруднённой визуализации объекта.
И последнее, о чём следует помнить в повседневной работе практического
хирурга: открытая адреналэктомия — безопасная, эффективная и детально
разработанная процедура. Однако не следует подвергать пациентов
лапароскопической операции, если известные принципы открытой адреналэктомии не
могут быть соблюдены.
ВИДЕОСКОПИЧЕСКАЯ ЗАБРЮШИННАЯ ПОЯСНИЧНАЯ
СИМПАТЭКТОМИЯ
Показания
1. Облитерирующий эндартериит и неспецифический артериит I—III
степени.
2. Диабетическая ангиопатия.
3. Облитерирующий атеросклероз сосудов нижних конечностей (как
дополнение к реконструктивной операции на аорте и её ветвях) при
хронической артериальной недостаточности IIA—III степени (поА.В. Покровскому).
295
4. Постфлебитический синдром глубоких вен нижних конечностей в
III стадии заболевания (по B.C. Савельеву) — относительное показание.
Преимущества видиоскопической симпатэктомии по сравнению с
традиционной:
1. Малая травматичность снижает интенсивность
послеоперационных болей, часто встречающихся при открытой операции. Редко
наблюдают послеоперационный парез кишечника.
2. Короткий послеоперационный госпитальный период — больные
через сутки способны самостоятельно вставать, начинают приём пищи.
Через 2—3 дня пациента можно переводить на амбулаторное лечение.
3. Косметический эффект.
4. Снижение частоты развития послеоперационных гнойных
осложнений.
Относительные противопоказания связаны с необходимостью создания
напряжённого ретропневмоперитонеума
1. Тяжёлые сопутствующие заболевания сердечно-сосудистой и
лёгочной систем.
а. Обструктивные заболевания лёгких.
б. Инфаркт миокарда.
в. Врождённые и приобретённые пороки сердца.
г. Сердечно-сосудистая недостаточность III степени.
д. Перенесённые операции на органах забрюшинного пространства.
2. Ожирение III—IV степени. Из-за сильно развитой жировой
клетчатки выделение симпатического ствола проблематично.
Предоперационная подготовка к эндоскопической поясничной
симпатэктомии такая же, как и к открытой забрюшинной симпатэктомии.
Обезболивание. Применяют интубационный наркоз или высокую
спинномозговую анестезию.
Положение больного. Для выполнения поясничной симпатэктомии как
справа, так и слева пациента укладывают на бок с подложенным под него валиком.
Оперативная техника
Ретропневмоперитонеум. Забрюшинная поясничная симпатэктомия
требует создания пространства между поясничными мышцами и
забрюшинной клетчаткой для выделения поясничного симпатического ствола.
Операция проходит на фоне напряжённого ретропневмоперитонеума, для
создания которого используют углекислый газ или воздух.
В области схождения косых и прямой мышц живота на уровне пупка
производят разрез кожи длиной 10 мм для введения видеотроакара
(например, «Visiport») (рис. 16-9). Затем под контролем лапараскопа
постепенно и осторожно расслаивают мягкие ткани до брюшины (рис. 16-10).
После обнажения брюшины её тупо отслаивают для создания полости в
забрюшинном пространстве.
296
Этот этап выполняют одним из двух вариантов.
1. Для создания необходимого пространства используют
специальный раздувной баллон. Затем его удаляют и под контролем
лапароскопа вводят второй 10-миллиметровый троакар для эндоретрактора.
2. После частичной отслойки брюшины вводят 10-миллиметровый
троакар, лапароскоп и нагнетают газ для создания полости. Под
контролем лапароскопа на 2—3 см ниже первого троакара вводят
второй 10-миллиметровый троакар для эндоретрактора. Этим
инструментом продолжают отслаивать брюшину и забрюшинную
клетчатку до поясничных мышц.
На следующем этапе вводят еще два 5-миллиметровых троакара для
инструментов: один — отступя 2—3 см от гребня подвздошной кости,
другой — отступя 2—3 см от рёберной дуги по подмышечной линии.
После того как ретрактором от поясничных мышц отслоены брюшина и
забрюшинная клетчатка им же выделяют симпатический ствол с ганглиями
(рис. 16-11). Слева он будет находиться между аортой и поясничными
мышцами, справа — между нижней полой веной и поясничными мышцами.
Ассистент удерживает ретрактором забрюшинную клетчатку, а
оперирующий хирург вводит L-образный электрод и гибкий
5-миллиметровый диссектор. Подведя диссектор под симпатический ствол и поднимая
его, хирург отсекает L-образным электродом коллатеральные ветви ствола
и выделяет симпатические ганглии (рис. 16-12). Как правило достаточно
удалить 3—4 ганглия. После их выделения ретрактор меняют на зажим, а
диссектор — на ножницы. Симпатический ствол вместе с ганглиями
иссекают ножницами без коагуляции для предупреждения болей в
послеоперационном периоде. После контроля гемостаза газ удаляют.
Возможно одномоментное выполнение двусторонней симпатэктомии.
Осложнения
1. Повреждение брюшины во время создания ретропневмоперитонеу-
ма требует прекращения видеоскопической операции, так как введение
т
Рис. 16-9. Точки введения троакаров при
симпатэктомии.
Рис. 16-10. Препаровка мягких тканей для
создания необходимого пространства.
297
газа создаст ПП, сдавливающий забрюшинное пространство. Операцию
заканчивают открытым методом.
Частота этого осложнения вариирует от 2% до 8%.
2. Повреждение кровеносных сосудов. При левосторонней симпатэк-
томии возможно ранение поясничных артерий, отходящих от аорты, при
правосторонней — поясничных вен, отходящих от нижней полой вены.
Поясничные артерии обычно удаётся клипировать, повреждение вен
может потребовать перехода к открытой операции.
3. Нагноение операционных ран происходит крайне редко.
Продолжительность операции — от 30 до 60 минут. Видеоскопичес-
кая поясничная симпатэктомия — безопасная и достаточно эффективная
операция в сравнении с открытым вмешательством.
Рис. 16-11. Выделение симпатического
ганглия.
Рис. 16-12. Мобилизация гибким ретрак-
тором симпатического ствола.
ЛИТЕРАТУРА
1. Brunt L.M., Soper N.J. Laparoscopic adrenalectomy // Principles of laparoscopic
surgery, New York, 1995, 230 p.
2. Silen W. Adrenal glands. In Nora PF, ed. Operative Surgery: Principles and Techniques.
3rd edition. Philadelphia: WB Saunders, 1990, p. 842-854.
3. Thompson NW, Cheung PSY. Diagnosis and treatment of functioning and
nonfunctioning adrenocortical neoplasms including incidentalomas. Surg Clin N Am. 1987
67, p. 423-437.
4. Young WF Jr, et al. Primary aldosteronism: diagnosis and treatment. Mayo Clin Proc,
1990, 65, p. 96-110.
5. Brennan MF. The adrenal gland. In: DeVita VT Jr, Hellman S, Rosenberg SA.
Cancer: Principles and Practice of Oncology. 2nd edition. Philadelphia: JB Lippincott, 1985 p
1192-1206.
298
17
Оперативная лапароскопия
в неотложной хирургии
Острый живот — одна из наиболее важных областей хирургии, её
колыбель, место её рождения; именно в этой области специальность приобрела свою
основу и получила признание. В этой области абдоминальная хирургия сделала
свои первые шаги, определила собственные цели, добилась первых успехов.
Именно в неотложной хирургии был получен опыт, были сформулированы
правила и принципы, которые позднее были перенесены в плановую
хирургию. Острый живот — ситуация, представляющая реальную угрозу для жизни
больного, а операция — последняя попытка спасти его, «попробовать
совершить невозможное». И тем более удивителен факт, что острый живот долгое
время считали противопоказанием к лапароскопии. В 70-е годы произошёл
переворот в сознании хирургов, в первую очередь благодаря диагностической
лапароскопии [1—5]. Произошла трансформация диагностической лапарото-
мии в диагностическую лапароскопию.
НАЛОЖЕНИЕ ХОЛЕЦИСТОСТОМЫ
Показания
1. Деструктивный холецистит или механическая желтуха на фоне
общего тяжёлого состояния больного (интоксикация, местный перитонит).
2. Деструктивный холецистит на фоне тяжёлых сопутствующих
заболеваний сердечно-сосудистой и дыхательной систем.
3. Острый панкреатит с выраженной жёлчной гипертензией.
Оперативная техника. Одним из первых лапароскопическую холецистото-
му предложил в 1974 г. И.Д. Прудков [1]. По его методике дно жёлчного пузыря
выводят наружу и фиксируют к передней брюшной стенке. Метод прост,
эффективен, но имеет три основных недостатка:
1. Вывести дно жёлчного пузыря невозможно при его резкой
инфильтрации, отёке, напряжении и сращении с краем печени.
2. Через 1—2 дня после опорожнения увеличенного жёлчного пузыря
ткани органа сокращаются, жёлчный пузырь отходит от брюшной стенки
и его содержимое в ряде случаев начинает поступать в брюшную полость.
3. В результате операции формируется губовидный свищ, требующий
оперативного закрытия.
300
С целью устранения этих недостатков им же сконструирована игла в виде
штопора, которую наворачивают на стенку жёлчного пузыря.
Чрескожную чреспечёночную холецистостомию разрабатывали Р.Х.
Васильев и В. Н. Сотников. Однако этот вариант не исключает повреждения
паренхимы печени и возникновения кровотечения, а диаметр вводимого через иглу
катетера не обеспечивает адекватной декомпрессии.
Оптимальный, на наш взгляд, метод наложения холецистостомы был
разработан в клинике О. С. Кочнева [4]. Лапароскопическую микрохолецистостому
на дно жёлчного пузыря накладывают с помощью иглы-троакара длиной 250
мм с диаметром от 2 до 5 мм. Техника операции: под контролем лапароскопа
иглой-троакаром производят пункцию жёлчного пузыря в области дна (рис. 17-1).
При этом необходимо соблюдать следующие правила:
1. Диаметр иглы-троакара (а значит, и будущего отверстия в стенке
жёлчного пузыря) должен соответствовать диаметру дренажной трубки. В
противном случае возможно подтекание жёлчи в брюшную полость.
2. После пункции жёлчного пузыря дренажную трубку немедленно,
не дожидаясь спадения стенок, вводят в жёлчный пузырь на 8—10 см
таким образом, чтобы трубка свернулась в его просвете в виде кольца, что
необходимо для профилактики её выпадения.
3. Дренажная трубка должна свободно лежать в брюшной полости,
без натяжения и перегибов.
4. В конце операции трубку прочно фиксируют к коже.
5. Подпечёночное пространство по показаниям дренируют через
отдельный прокол брюшной стенки.
Послеоперационное ведение. Первые 2 сут пациент должен соблюдать
постельный режим. Холецистохолангиографию выполняют не ранее 5 сут после
операции. После стихания острого воспаления и ликвидации признаков
механической желтухи больным выполняют радикальное вмешательство (ЭПСТ,
ЛХЭ, открытая холецистэктомия с ревизией ВЖП). Лапароскопическая холе-
цистостомия, выполненная по данной методике, не осложняется подтеканием
жёлчи в брюшную полость или выпадением дренажа [5].
Рис. 17-1. Лапароскопическая холецистостомия через дно жёлчного пузыря.
301
ЛЕЧЕНИЕ ОСТРОЙ КИШЕЧНОЙ НЕПРОХОДИМОСТИ
Кишечная непроходимость остаётся одним из наиболее серьёзных
заболеваний в неотложной хирургии. Летальность составляет 10-30%, а частота
развития серьёзных послеоперационных осложнений достигает 20—30%. Одна из
основных причин высоких показателей летальности и частоты развития
осложнений — задержка с выполнением операции. Во многих случаях следование
постулату — «Никогда не позволяйте солнцу взойти дважды при
непроходимости кишечника» — самая разумная тактика. Непроходимость кишечника,
требующая неотложной операции, как правило, обусловлена тремя причинами —
спаечной болезнью кишечника, грыжами и опухолями, обусловливающими 80%
всех случаев непроходимости кишечника, причём более половины вызваны
спаечным процессом после предшествующих вмешательств [6]. Многие
специалисты, освоившие ЛХЭ, герниопластику и ЛА, признали лапароскопическую
хирургию как альтернативный способ лечения непроходимости тонкой кишки,
тем более что рассечение спаек в лапароскопической гинекологии известно с
1933 г. [7].
Показания. Подбор пациентов для лапароскопической операции при
непроходимости кишечника зависит от владения хирургом техникой
лапароскопических операций и от клинической ситуации. Очевидно, что такое
вмешательство должен выполнять опытный специалист, особенно у больного,
перенёсшего ранее несколько полостных операций.
Противопоказания
1. Сопутствующий перитонит.
2. Интраоперационные признаки некроза кишечника.
3. Массивный спаечный процесс, при котором возникают сомнения
в безопасности разделения спаек или который требует
значительного удлинения времени операции.
Предоперационная подготовка. Как только пациенту был поставлен
диагноз непроходимости кишечника, вводят назогастральный зонд. Для
восполнения дефицита жидкости и электролитов проводят инфузионную терапию. Если
консервативные мероприятия не дают эффекта на протяжении 24 ч, показано
оперативное лечение, причём целесообразнее его начать с лапароскопии.
Оперативная техника. Необходима особая осторожность при наложении
ПП и введении первого троакара. При наличии рубцов на передней брюшной
стенке после перенесённых операций вмешательство начинают методом
открытой лапароскопии. При осмотре органов брюшной полости обращают
внимание на выраженность дилатации кишечника, признаки его
жизнеспособности на разных участках, наличие и характер выпота в брюшной полости. В
левой и правой мезогастральной области вводят два 5-миллиметровых
троакара (рис. 17-2).
Создают положение Тренделенбурга и наклоняют операционный стол в
левую сторону на 30°. Это позволяет вывести в поле зрения слепую кишку.
Осмотр тонкой кишки начинают с её терминального отдела, продвигаясь в
проксимальном направлении и одновременно «сдаивая» кишечное содержимое.
302
При этом используют технику из руки в руку
(рис. 17-3). Из инструментов наиболее безопасны
атравматические щипцы с длинными браншами.
Замена их диссектором или зажимом может
привести к перфорации дилатированнои истончённой
кишки. При обнаружении места сдавления
спайки остро рассекают ножницами. К
электрокоагуляции прибегают с большой осторожностью,
помня о близости кишечной стенки, аномальных
путях движения электрического тока в тканях и
недопустимости коагуляции малых тканевых
структур.
Переход к лапаротомии при непроходимости
кишечника следует осуществлять при гнойном
перитоните, некрозе петли кишки и выраженном
спаечном процессе. Невозможность
ликвидировать непроходимость лапароскопическим способом в течение разумного про
межутка времени также требует лапаротомии [8, 9].
Рис. 17-2. Лапароскопическая
ревизия тонкой кишки.
I
II
В А
Рис. 17-3. Техника осмотра кишечника из руки в руку. «Сдаивание» содержимого тонкой кишки в
проксимальном направлении.
303
ПЕРФОРАТИВНАЯ ЯЗВА ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ
Лапароскопический метод лечения этого осложнения ЯБДПК полностью
отвечает требованиям малоинвазивной хирургии, так как требует выполнения
непродолжительного и относительно простого вмешательства.
Противопоказания
1. Сроки перфорации более 12 ч.
2. Расположение перфорационного отверстия в зоне,
труднодоступной для ушивания при лапароскопической операции.
3. Сочетание перфорации с кровотечением или стенозом.
Оперативная техника. Операцию выполняют из четырёх доступов. Левую
долю печени приподнимают ретрактором, после чего уточняют диагноз. Вся
передняя поверхность двенадцатиперстной кишки до края перфорационного
отверстия должна быть доступна осмотру. При небольших размерах
перфорационного отверстия B—3 мм) достаточно простого ушивания дефекта (рис. 17-4). При
большем диаметре показана дополнительная тампонада прядью большого
сальника. Возможно применение оригинальной методики погружения сальника в
просвет пилородуоденального канала при помощи гастродуоденоскопа [10].
Инструмент вводят в двенадцатиперстную кишку, биопсийными щипцами через
перфорационное отверстие проникают в брюшную полость и под контролем
лапароскопа захватывают прядь большого сальника. Затем эндоскопист
подтягивает щипцы в просвет желудка вместе с большим сальником (рис. 17-5).
Ушивают перфорационное отверстие, завязывая узел интракорпорально.
Экстракорпоральный способ формирования узла требует натяжения нити и, как
правило, приводит к прорезанию инфильтрированных тканей стенки
двенадцатиперстной кишки [11].
Рис. 17-4. Простое ушивание
перфорационного отверстия.
Фиброгастроскоп
Рис. 17-5. Комбинированное лапарогастро-
скопическое ушивание перфоративной
язвы.
304
Применение спиралевидной иглы для
лапароскопического ушивания перфора-
тивной язвы предложил И.С. Малков
(рис. 17-6). Игла прошивает ткани,
протаскивая за собой лигатуру по
спиралевидному каналу (рис. 17-7). После
извлечения иглы узел завязывают интракорпо-
рально, при необходимости подшивая
прядь большого сальника или
мобилизованную круглую связку печени.
Рис. 17-1. Лапароскопическая холецистос-
томия через дно жёлчного пузыря.
ЛЕЧЕНИЕ ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЙ ЖИВОТА
Диагностическую и лечебную лапароскопию в настоящее время широко
применяют при закрытых, ножевых и огнестрельных ранениях живота.
Первоначально метод использовали исключительно с диагностической целью, что
позволило существенно снизить число необоснованных чревосечений [12].
Альтернативные методы диагностики — КТ, УЗИ и диагностический перито-
неальный лаваж — уступают лапароскопии по специфичности и точности
диагностики. Метод позволяет непосредственно визуализировать повреждение и
определить наличие продолжающегося кровотечения.
Лапароскопия при тупой травме живота. Неотложная лапаротомия
безусловно показана при явных признаках повреждения внутренних органов:
наличии перитонита, массивного внутрибрюшного кровотечения,
рентгенологических признаков разрыва диафрагмы [13, 14]. Кроме того, диагностическая
лапароскопия показана также в следующих ситуациях:
1. При неясной клинической картине и подозрении на повреждение
внутренних органов.
2. Пациентам с сочетанной абдоминальной и черепно-мозговой
травмой, а также пострадавшим, находящимся в состоянии
алкогольного или наркотического опьянения.
3. При артериальной гипотензии неясного генеза.
Полноценному осмотру органов брюшной полости способствуют
введение дополнительного манипулятора, использование лапароскопа с углом
зрения 30° и активное изменение положения тела больного для лучшей
визуализации органов, прикрытых петлями кишечника и большим сальником.
Диагностическая лапароскопия — достаточно дорогой и травматичный метод
диагностики по сравнению с УЗИ. Поэтому его следует использовать в качестве
второго этапа диагностики у пациентов с нечёткими показаниями к лапаротомии.
Возможности лечебной лапароскопии при тупой травме живота могут быть
расширены по мере накопления опыта. Из методов гемостаза у пациентов со
стабильной гемодинамикой целесообразно применение гемостатической
губки, электрокоагуляции и хирургического лазера.
305
Рис. 17-7. Ушивание перфоративного отверстия. А — прошивание тканей спиралевидной иглой,
Б — укрепление линии швов прядью большого сальника.
Лапароскопия при колотых ранениях живота служит для определения
целостности париетальной брюшины и соответственно диагностики проникающего
характера ранения. В клинической практике наиболее целесообразна
следующая тактика.
Пациентам с подозрением на проникающий характер ранения и
стабильной гемодинамикой выполняют ревизию раны. Отсутствие повреждения
передней фасции брюшной стенки свидетельствует о непроникающем характере
ранения, что наблюдают у 1/3 пациентов. Объём вмешательства ограничивают
первичной хирургической обработкой. Повреждение передней фасции служит
показанием к выполнению диагностической лапароскопии, так как в этом
случае исключить повреждение париетальной брюшины при наружной ревизии
раны практически невозможно. При отсутствии повреждения париетальной
брюшины, осматриваемой с особой тщательностью, травму считают
непроникающей. Повреждение брюшины свидетельствует о проникающем характере ранения.
306
Такой подход позволяет снизить частоту неоправданных лапаротомий с 16-50
до 4—5% [15]. Дальнейшая тактика зависит от опыта хирурга, оснащённости
операционной и тяжести повреждений внутренних органов. Выполняют лапа-
ротомию или ликвидируют повреждение лапароскопическим методом
(остановка кровотечения, ушивание раны кишечника и др.). У больных с
нестабильной гемодинамикой или явными симптомами разлитого перитонита
диагностические манипуляции не проводят, а выполняют экстренную лапарото-
мию. Лапароскопия у больных с повреждениями поверхностной фасции
передней брюшной стенки позволяет избежать чревосечения у 51% больных
вследствие отсутствия повреждения париетальной брюшины. Из оставшихся больных
с повреждениями париетальной брюшины лишь 31% пациентов производят
лечебную лапаротомию, у остальных больных повреждений внутренних
органов при лапароскопии не обнаруживают [15]. Лапароскопическая диагностика
колотых повреждений кишечника достаточно сложна и ненадёжна, поэтому
необходимо пристальное внимание при осмотре висцеральной брюшины, так
как при лапароскопии бывает трудно диагностировать повреждения кишечной
стенки [16]. Для исключения таких ошибок предложено дополнять
лапароскопию разрезом длиной 4 см, через который последовательно извлекают и
экстракорпорально осматривают тонкую кишку. Однако эта методика не имеет
существенных преимуществ перед лапаротомией [17].
Особое значение диагностическая лапароскопия приобретает при
подозрении на повреждения диафрагмы, трудно диагностируемые другими
методами. Частота повреждений диафрагмы при проникающей травме в торакоабдо-
минальной зоне (от соска до края рёберной дуги) достигает 47%. При
отсутствии своевременной диагностики торакоабдоминальных ранений существенно
возрастают летальность и частота послеоперационных осложнений [18]. К тому
же наложение ПП при сквозном ранении диафрагмы может привести к
развитию напряжённого пневмоторакса. Поэтому лапароскопию следует проводить
при невысоком внутрибрюшном давлении, а осмотр органов брюшной полости
начинать с диафрагмы.
Лапароскопия при огнестрельных ранениях живота. В настоящее время
частота огнестрельных ранений среди гражданского населения неуклонно растёт.
Как и при других видах повреждений живота, лапароскопия позволяет снизить
частоту необоснованных лапаротомий, уменьшить вероятность тактических
ошибок, сократить число послеоперационных осложнений и
продолжительность госпитализации. Частота необоснованных лапаротомий при
огнестрельных ранениях живота составляет 20—25% [19]. Применение лапароскопии
позволяет сократить частоту ненужных операций до 5—10% [20]. Лапароскопия
при огнестрельных ранениях рентабельна и эффективна только в случае
правильно сформулированных показаний и при отборе пациентов. Исследование
не выполняют больным с явными проникающими или очевидными
поверхностными ранениями живота. При огнестрельных ранениях брюшной полости у
пациентов со стабильной гемодинамикой и отсутствием явных признаков
проникающих повреждений лапароскопия позволяет избежать неоправданной
лапаротомий у 65% пациентов [21, 22].
307
18
Спленэктомия
Спленэктомия — операция, которую в настоящее время часто производят
с использованием лапароскопической техники. Анатомическое расположение
органа позволяет использовать преимущества малоинвазивной хирургии.
Поэтому в настоящее время всё большее количество хирургов переходит на
выполнение этой операции лапароскопическим доступом [1—6]. Показания к
спленэктомии достаточно обширны.
Показания
1. Заболевания крови (тромбоцитопеническая пурпура, первичная
селезёночная панцитопения).
2. Лимфомы.
3. Травматический разрыв селезёнки без признаков профузного
кровотечения.
4. Кисты и опухоли селезёнки.
Противопоказания
1. Спленомегалия.
2. Некорригируемая коагулопатия.
3. Геморрагический шок.
4. Общие противопоказания к лапароскопическим операциям.
Топографическая анатомия. Селезёнка расположена в левом поддиафраг-
мальном пространстве. Её размеры варьируют в значительных пределах.
Нормальная селезёнка имеет форму боба размерами 10-12 х 5—6 см. Располагаясь
интраперитонеально, селезёнка имеет следующие связки:
— желудочно-селезёночную, в которой проходят 4—6 коротких
желудочных сосудов;
— селезёночно-почёчную, в которой находятся селезёночные артерия
и вена;
— селезёночно-толстокишечную;
— селезёночно-диафрагмальную.
Во избежание осложнений при выполнении спленэктомии необходимо
учитывать следующие анатомические особенности: тип ветвления
селезёночной артерии, взаиморасположение селезёночных артерии и вены, хвоста
поджелудочной железы и ворот селезёнки.
Наиболее часто G0%) встречают рассыпной тип ветвления селезёночной
артерии, когда она делится на несколько ветвей на удалении от ворот
селезёнки (рис. 18-1). Магистральный тип ветвления селезёночной артерии встречают
реже C0%); он характеризуется делением сосуда на свои конечные ветви
непосредственно в воротах органа (рис. 18-2).
309
Рис. 18-1. Рассыпной тип ветвления
селезёночной артерии.
Рис. 18-2. Магистральный тип ветвления
селезёночной артерии.
Обычно селезёночная артерия расположена выше и кпереди от вены E4%).
У 44% людей вена обвивает артерию, а в воротах селезёнки лежит позади
артерии. Очень редко вена находится впереди артерии B%).
Хвост поджелудочной железы, как правило, прилежит непосредственно к
воротам селезёнки или находится от них на расстоянии 1—2 см. Значительно
реже он расположен в области нижнего полюса селезёнки (рис. 18-3).
Знание анатомии селезёнки позволяет провести лапароскопическую сплен-
эктомию быстро, бескровно и элегантно.
Операционная техника. Операцию выполняют под интубационным
наркозом с искусственной вентиляцией лёгких. Устанавливают назогастральный зонд.
Больного укладывают в левое полубоковое положение на валик, подложенный
в области поясницы. Создают положение Фаулера. Расположение
операционной бригады показано на рис. 18-4.
Накладывают ПП и параумбиликально вводят троакар для лапароскопа
(угол зрения 30°). После ревизии органов брюшной полости под визуальным
контролем устанавливают троакары для инструментов (рис. 18-5).
Мобилизацию начинают с рассечения селезёночно-ободочной связки
электрохирургическими ножницами. Далее на дно желудка накладывают мягкий жом.
Натягивают желудочно-селезёночную связку путём тракции дна желудка вправо. По-
Рис. 18-3. Ворота селезёнки. 1 — селезёночная артерия, 2 — селезёночная вена.
310
Рис. 18-4. Расположение операционной
бригады при выполнении спленэктомии.
Рис. 18-5. Точки введения троакаров.
следовательно клипируют и пересекают короткие желудочные сосуды (рис. 18-6).
С особой осторожностью следует рассекать желудочно-селезёночную связку в
области верхнего полюса селезёнки, где к нему близко прилежит дно желудка.
После рассечения желудочно-селезёночной связки становятся видимыми хвост
поджелудочной железы и ворота селезёнки. Выделяют при помощи ретрактора
селезёночные вену и артерию (рис. 18-7). В созданное окно вводят сшивающий
аппарат, артерию и вену прошивают и пересекают (рис. 18-8). При обработке
селезёночных сосудов необходимо накладывать аппарат ближе к её воротам во
избежание травмы хвоста поджелудочной железы. После пересечения сосудов
селезёнку отводят медиально, электрохирургическими ножницами рассекают се-
лезёночно-почечную связку по направлению снизу вверх. Разрушают рыхлые
сращения органа с забрюшинной клетчаткой, окончательно мобилизуя
селезёнку. Таким образом, селезёнка остаётся подвешенной на селезёночно-диафрагмаль-
ной связке. В брюшную полость вводят контейнер, помещают в него селезёнку и
Рис. 18-6. Клипирование коротких
желудочных сосудов.
Рис. 18-7. Выделение селезёночной артерии
и вены.
311
только затем пересекают селезеночно-диа-
фрагмальную связку.
Расширяют до 4-5 см одно из
отверстий передней брюшной стенки и к нему
подводят контейнер. Пальцем, введённым
в контейнер, разрушают пульпу селезёнки
и извлекают препарат. Этот приём, с одной
стороны, позволяет уменьшить объём
органа, а с другой — сохранить ткань для
последующего гистологического исследования.
Рану брюшной стенки ушивают,
восстанавливают ПП. Производят ревизию
ложа селезёнки, контролируют гемостаз.
Рис. 18-8. Обработка селезёночной артерии Левое поддиафрагмальное пространство
и вены аппаратом EndoGIA-ЗО. дренируют.
Послеоперационный период. По окончании операции извлекают назогас-
тральный зонд, на 1—2-е сутки назначают ненаркотические анальгетики и
антибиотики широкого спектра действия. Дренаж, как правило, удаляют на 1—2-е сутки
после операции. Больного активизируют на следующий после операции день.
Осложнения и профилактика
1. Повреждение капсулы селезёнки и связанное с этим кровотечение
можно предупредить осторожной препаровкой тканей, не входя в
соприкосновение с органом.
2. Панкреатит после спленэктомии обычно связан с травмой хвоста
поджелудочной железы, поэтому при обработке селезёночных артерии и
вены следует накладывать сшивающий аппарат в непосредственной
близости к воротам селезёнки.
3. При неполном гемостазе и плохом дренировании поддиафрагмаль-
ного пространства в послеоперационном периоде может возникнуть поддиа-
фрагмальный абсцесс. Тщательный гемостаз, санация операционного поля
и адекватное дренирование позволяют избежать данного осложнения.
ЛИТЕРАТУРА
1. Akle С.A., Wickham J.E., Dick R. Laparoscopic splenectomy. Br J Surg., 1993,
80, p. 126.
2. Cadiere G.B., Delaitre В., Tulman S. Laparoscopic splenectomy: fifteen cases. First
European Congress of the European Association for Endoscopic Surgery. Cologne, June 3,
1993, p. 48.
3. Thibault C, Mamazza J., Letourneau R., Poulin E. Laparoscopic splenectomy. Surg
Laparosc. Endosc, 1992, vol. 2, p. 257-261.
4. Дронов А.Ф., Поддубный И.В., Дедов К.А., Залихин Д.В. Лапароскопические
операции при патологии селезёнки у детей. Тез. 2-го московского межд. конгресса по
эндоскопической хирургии, 1997, с. 161 — 163.
5. Пучков К.В., Гаусман Б.Я., Мартынов М.М Лапароскопическая спленэктомия:
приемущества и технические аспеты. Эндоскопическая хирургия, 1997, N 1, с.90.
6. Андреев А.Л., Перекатова Т.Н., Прядко А.С. Лапароскопическая спленэктомия
из латерального доступа. Эндоскопическая хирургия, 1997, N 1, с. 42.
312
19
Оперативная лапароскопия
в гинекологии
ОБЩИЕ ПОЛОЖЕНИЯ
Оперативная лапароскопия в гинекологии — раздел эндоскопической
хирургии, в котором преимущества новой технологии проявляются наиболее ярко.
В настоящее время более 75% гинекологических операций в развитых странах
выполняют под контролем видеомонитора [13, 15, 24]. Лапароскопическая
хирургия изначально была создана гинекологами и для гинекологов. Ещё до
появления видеомониторов были выполнены многие лапароскопические
операции. Неудивительно, что Первые видеоэндоскопические операции в общей
хирургии были также выполнены гинекологами, а Курт Земм до сегодняшнего
дня остаётся наиболее ярким и продуктивным хирургом в истории эндохирургии.
Анатомия органов малого таза и характер многих гинекологических
заболеваний наиболее удобны для лапароскопического доступа. Спектр
лапароскопических операций в гинекологии по мере возрастания сложности вмешательств
можно представить следующим образом: диагностическая лапароскопия с
биопсией и дренированием, стерилизация, адгезиолизис, цистэктомия, тубэкто-
мия, овариоэктомия, аднексэктомия, консервативная миомэктомия,
ампутация и экстирпация матки, экстирпация матки с лимфаденэктомией.
Показания. В лапароскопической гинекологии, как и в других областях
хирургии, различают операции, выполняемые по плановым и экстренным
показаниям.
Плановые показания
1. Стерилизация.
2. Трубное и перитонеальное бесплодие.
3. Синдром поликистоза яичников.
4. Опухоли и кисты яичников.
5. Пороки развития внутренних половых органов.
6. Наружный эндометриоз с выраженным болевым синдромом.
7. Боли внизу живота неясной этиологии.
8. Миомы матки
Экстренные показания
1. Трубная беременность.
2. Апоплексия яичника.
3. Разрыв кисты яичника.
4. Перекрут придатков матки.
5. Перекрут субсерозного миомного узла.
313
6. Дифференциальная диагностика между острой хирургической и
гинекологической патологией.
7. Острые воспалительные заболевания придатков матки (гнойный
сальпингит, пиосальпинкс, пиовар, гнойные тубоовариальные
образования).
Противопоказания
Абсолютные противопоказания
1. Геморрагический шок.
2. Общие противопоказания к лапароскопии (см. главу 6).
Относительные противопоказания
1. Ожирение III—IV степени.
2. Выраженный спаечный процесс после перенесённых операций
на органах малого таза.
3. Непроходимость маточных труб в интрамуральном и истмичес-
ком отделе.
4. Значительное количество крови в брюшной полости A—2 л).
5. Большие размеры патологического образования внутренних
половых органов (более 10 см в диаметре).
6. Злокачественная опухоль яичника.
Дооперационное обследование включает в себя общий анализ крови с лей-
коформулой, анализ мочи, определение состояния свертывающей системы крови,
биохимические анализы крови, ЭКГ, рентгенографию лёгких, УЗИ и КТ
органов малого таза, влагалищное исследование.
Предоперационная подготовка не отличается от аналогичных при
подготовке к лапаротомным операциям.
Топографическая анатомия органов малого таза показана на рис. 19-1 и 19-2.
Мочеточник
подвздошная
Рис. 19-1. Топографическая анатомия
органов малого таза.
314
Рис. 19-2. Топографическая анатомия органов
малого таза. Профиль.
Рис. 19-3. Точки введения троакаров в
оперативной гинекологии.
Анестезиологическое пособие.
Операции выполняют под
внутривенным или интубационным
наркозом. В некоторых случаях показана
ПА. Положение Тренделенбурга
улучшает венозный возврат, но
усугубляет нагрузку на диафрагму и сдав-
ление лёгких.
Оперативная техника. Положение
больной. Лапароскопические
операции в гинекологии производят в
положении Тренделенбурга (с
опущенным головным концом
операционного стола на 20—30°). При этом за счёт
действия силы тяжести большой
сальник и петли кишечника
перемещаются краниально, открывая обзору
матку с придатками. При
необходимости пациентку поворачивают на левый
или правый бок.
Доступы и наложение ПП. Иглу
Вереша и первый троакар вводят выше
пупка. Накладывают ПП. Следующие
два троакара вводят по краям
предполагаемого разреза по Пфанненшгпи-
лю как можно дальше от средней
линии живота (рис. 19-3). Чем дальше
друг от друга введены инструменты,
тем легче ими манипулировать. В
случае необходимости четвёртый троакар
вводят по белой линии на середине
расстояния между пупком и
лобковым симфизом.
Оперативная техника в
лапароскопической гинекологии мало
отличается от техники, принятой в
оперативной лапароскопии. Желательно
введение маточной канюли, которая
помогает вывести орган из полости
малого таза, обеспечить противотрак-
цию и при необходимости
произвести хромосальпингографию.
Механический шов редко применяют в
лапароскопической гинекологии.
Рассечение тканей и гемостаз при этих
операциях, как правило, производят с ис-
315
пользованием ВЧЭХ. Электрохирургическая техника в эндоскопической
гинекологии проявляет себя во всей своей красоте и изяществе, начиная от
осторожного рассечения плоскостных спаек и заканчивая надёжной коагуляцией
маточной артерии.
Переход к лапаротомии показан при выявлении злокачественной
опухоли, нетипичной анатомии и выраженных рубцово-инфильтративных
изменениях органов малого таза (спаечный процесс, эндометриоз IV степени), а
также при возникновении осложнений по ходу операции (кровотечение,
повреждение стенки кишки). Частота перехода к лапаротомии в лапароскопической
гинекологии меньше, чем в общей хирургии, и составляет 0,5—1% [13, 24].
Послеоперационный период протекает значительно легче, чем после
открытых вмешательств. Больных активизируют к концу 1-х суток, тогда же
разрешают приём жидкой пищи. Больных выписывают через 1-7 дней в
зависимости от характера заболевания и объёма операции. Реабилитация наступает
через 2—3 нед.
Осложнения и их профилактика. Общие осложнения, возможные при
любой лапароскопической операции, подробно описаны в главе 7. Осложнения,
специфичные для лапароскопической гинекологии, включают в себя ранение
мочеточника, подвздошных сосудов, мочевого пузыря и кишечника при
наличии спаечного процесса в брюшной полости. Избежать перечисленных
осложнений позволяют знание анатомии органов малого таза и забрюшинного
пространства, прецизионная техника, точное соблюдение правил использования
ВЧЭХ. Больным, оперируемым повторно, а также в случае предполагаемой
продолжительности вмешательства более 1 ч показана катетеризация мочевого
пузыря.
ХИРУРГИЧЕСКАЯ СТЕРИЛИЗАЦИЯ
Исторически стерилизация — одна из первых процедур в
гинекологической лапароскопии. Медицинская стерилизация — облитерация маточных труб,
выполняется с целью лишения женщины способности выделять половые
клетки, препятствует тем самым нежелательному оплодотворению яйцеклетки и
воспроизводству потомства. В соответствии с Основами законодательства
Российской Федерации об охране здоровья граждан (статья 37), медицинская
стерилизация может быть произведена только по письменному заявлению
гражданина не моложе 35 лет или имеющего не менее двух детей. При наличии
медицинских показаний и согласия гражданина стерилизацию допустимо
производить независимо от возраста и наличия детей. Показания перечислены в
соответствующем приказе Минздрава РФ и включают 55 нозологических форм.
Медицинские показания устанавливает комиссия в составе не менее 3
специалистов: акушера-гинеколога, врача той специальности, к области которого
относится заболевание пациентки, и руководителя лечебного учреждения.
Медицинскую стерилизацию женщин, признанных недееспособными и
страдающих психическими заболеваниями, осуществляют только на основании
судебного решения. Пациентке необходимо разъяснить, что восстановление
проходимости маточных труб после любого способа стерилизации не гарантировано.
316
Противопоказания к лапароскопической хирургической стерилизации те
же, что и к любому эндохирургическому вмешательству.
Оперативная техника. Операцию чаще выполняют через 2 доступа.
Первый, 10-миллиметровый, троакар для лапароскопа вводят параумбиликально,
второй, 5-миллиметровый, — в левой или правой подвздошной области,
отступив от верхней передней подвздошной ости по направлению к лобковому
симфизу на 3—4 см. Другой вариант — введение второго троакара по средней
линии над лонным сочленением. При наличии спаечного процесса в брюшной
полости вводят третий троакар.
Существует 2 способа лапароскопической стерилизации:
электрокоагуляция и механическая окклюзия маточных труб.
1. Электрохирургическая стерилизация может быть выполнена в
монополярном или биполярном режиме.
а. В первом случае маточную трубу захватывают диссектором на
расстоянии не менее 2 см от угла матки и производят
электрокоагуляцию (рис. 19-4). Для достижения необходимого эффекта
следует использовать инструмент с узкими браншами, что уменьшает
площадь соприкосновения и увеличивает плотность тока.
Маточную трубу пересекают, не повреждая ей брыжейку. В момент
подачи напряжения следует внимательно контролировать положение
инструмента, троакара и окружающих органов для профилактики
ожога тканей. Наиболее опасно случайное образование
альтернативной цепи и включение в неё петли кишечника. Последующая
перфорация представляет реальную угрозу для жизни больной (рис. 5-21).
б. Биполярная коагуляция — самая безопасная, но
продолжительная методика лапароскопической стерилизации. Поток тока
ограничен тканями, захваченными инструментом, но при этом
одномоментно можно коагулировать только небольшие участки.
Обычно хирург коагулирует маточную трубу в 2 или 3 местах,
неоднократно захватывая её биполярным зажимом.
Рис. 19-4. Стерилизация. Монополярная коагуляция маточной трубы.
317
2. Механическая стерилизация может быть выполнена одним из
следующих методов:
а. Стерилизация при помощи специальных колец. Вводят
инструмент — аппликатор с браншами для захвата маточной трубы с
надетым на него эластичным кольцом. В среднем отделе маточную
трубу захватывают браншами и затягивают в просвет инструмента.
Кольцо, надетое на аппликатор, соскакивает на фаллопиеву трубу и
пережимает её. Эту методику не следует применять при отёчных
тканях, так как возможен их разрыв.
б. Стерилизация при помощи клипс. На маточную трубу, отступив
2-3 см от угла матки, накладывают две 8-миллиметровые клипсы.
Маточную трубу между ними пересекают. Клипирование без
пересечения менее надёжно, так как возможны прорезывание клипсы
и реканализация фаллопиевой трубы. Даже при полном
пересечении маточной трубы описаны случаи реканализации, встречаемой
в среднем с частотой 2 на 1000 оперируемых.
Послеоперационный период. Пациентку активизируют к концу 1-х суток,
тогда же разрешают приём жидкой пищи. Медикаментозную терапию при
гладком течении не назначают. Госпитальный период после операции длится
1—3 сут.
Осложнения и их профилактика
1. Ожоги окружающих тканей при коагуляции предотвращают
соблюдением следующих правил:
а. Строгий контроль за исправностью электроинструментов.
б. Визуализация всех этапов операции.
в. Адекватный ПП.
2. Кровотечение из сосудов брыжейки маточной трубы
предотвращают аккуратным наложением на неё бранш зажима, а также осторожными
манипуляциями ножницами при рассечении маточной трубы.
ОПЕРАЦИИ ПРИ БЕСПЛОДИИ
Операции для лечения бесплодия выполняют при обязательном
соблюдении следующих условий:
1. Возраст не старше 35 лет при удовлетворительном состоянии
здоровья пациентки.
2. Полноценное обследование как самой пациентки, так и её
партнёра (тесты функциональной диагностики, определение содержания
гормонов, УЗИ, гистеросальпингография, посткоитальный тест, спермограмма)
для исключения других возможных причин бесплодия.
3. Операции возможны и при наличии сопутствующих факторов
бесплодия (ановуляция, наличие у женщины шеечного фактора), но при
условии, что они будут устранены в процессе комплексного лечения.
4. До лапароскопической коррекции бесплодия необходимо
провести обязательную противовоспалительную терапию.
318
Показания
1. Спаечный процесс в полости малого таза.
2. Сактосальпинкс.
3. Фимоз фимбриальных отделов маточных труб.
4. Эндометриоз.
Противопоказания
1. Возраст старше 35 лет.
2. Длительность заболевания более 10 лет.
3. Туберкулёз органов малого таза.
4. Частое обострение воспаления придатков матки B раза в год и
более) или недавно перенесённый (до 1 года) острый
воспалительный процесс области придатков.
5. Гидросальпинкс диаметром более 30 мм.
6. Спаечный процесс в полости малого таза III—IV степени
выраженности (плотные инкапсулированные сращения вокруг маточных труб
и яичников, вовлечение в процесс петель кишечника).
7. Общие противопоказания к лапароскопии (см. главу 6).
Оперативная техника. При выполнении любой операции по поводу труб-
но-перитонеального бесплодия показана интраоперационная восходящая хро-
могидротубация. Она необходима для определения уровня обструкции
маточной трубы и выбора способа восстановления её проходимости. До операции
тщательно обрабатывают наружные половые органы и влагалище. Шейку
матки захватывают пулевыми щипцами. Через наружный маточный зев вводят
маточную канюлю. Пулевые щипцы и канюлю фиксируют друг к другу.
Исследование проводят дважды:
а. На диагностическом этапе при определении уровня обструкции.
б. После выполнения вмешательства на маточных трубах для
подтверждения эффективности операции.
Для проведения хромогидротубации используют изотонический раствор
хлорида натрия, окрашенный метиленовым синим (рис. 19-5). Важно создать
герметичное соприкосновение между канюлей и цервикальным каналом для
профилактики подтекания раствора наружу. Уровень обструкции маточной трубы
можно определить по заполнению её жидкостью. Отсутствие заполнения
маточной трубы вводимой жидкостью говорит о её непроходимости в истмичес-
ком отделе. Выбор способа операции зависит от уровня обструкции и
характера патологического процесса.
1. Сальпингоовариолизис. Создание полноценной экспозиции требует
введения четырёх троакаров. Цель операции — восстановление
нормальных топографических взаимоотношений путём рассечения спаек вокруг
маточной трубы и яичника, изолирующих их друг от друга.
Сальпингоовариолизис выполняют либо в виде самостоятельной операции, либо в
качестве подготовительного этапа для операции на маточной трубе. Спайки
пересекают ножницами или другим электрохирургическим инструментом
(рис. 19-6). Грубые спайки после рассечения иссекают и удаляют из
брюшной полости.
319
Рис. 19-5. Хромосальпингография.
Поступление метиленового синего в
брюшную полость.
Рис. 19-6. Сальпингоовариолизис.
2. Фимбриолизис. Выполняют при фимозе (сужении) фимбриального
отдела маточной трубы. Для этого в освобождённый от спаек фимбриаль-
ный отдел вводят диссектор в сомкнутом состоянии. Раскрывают бранши в
просвете маточной трубы на ширину 2,5—3 см и в этом положении
извлекают их из трубного просвета (рис. 19-7). Процедуру повторяют 2—3 раза.
3. Сальпингостомия. Операцию
выполняют при тугом заполнении маточной
трубы раствором метиленового синего.
Ампулярный отдел фиксируют между двумя
зажимами. Петлевым, игольчатым или L-об-
разным электродом крестообразно
рассекают запаянный ампулярный отдел маточной
трубы (рис. 19-8). Края разреза по
периметру коагулируют точечными касаниями при
минимальной мощности ЭХГ. При этом края
стомы выворачиваются наружу.
4. Салышнгонеостомия. Эта операция
подразумевает создание нового
искусственного отверстия в ампулярном отделе
маточной трубы (рис. 19-9). Операцию
производят при невозможности вскрыть трубный
Рис. 19-7. Фимбриолизис при фи- пРосвет в Фимбриальном отделе,
мозе дистального отдела
маточной труб.
320
Рис. 19-8. Салышнгостомия — крестообразное
вскрытие ампулярного отдела маточной
трубы.
Рис. 19-9. Сальпингонеостомия. Создание
нового отверстия в ампулярном отделе
маточной трубы.
ОПУХОЛИ И КИСТЫ ЯИЧНИКА
Показания
1. Доброкачественные опухоли: серозная цистаденома, зрелая
тератома, эндометриома и др.
2. Опухолевидные образования: параовариальная киста,
фолликулярная киста, киста жёлтого тела. Последние два образования не требуют
оперативного лечения, однако без лапароскопии провести
дифференциальную диагностику трудно. Если по данным дооперационного
обследования предполагают наличие ретенционной кисты, то в этом случае
показаны консервативная терапия и динамическое наблюдение в течение 3 мес.
При отсутствии положительной динамики проводят оперативное лечение.
Противопоказания. Подозрение на злокачественный характер опухоли
яичника (по данным УЗИ, КТ и объективного обследования) служит показанием к
выполнению открытой операции. Чревосечение также показано при
возникновении подозрения на злокачественное образование на диагностическом этапе
лапароскопии.
Объём вмешательства при доброкачественных опухолях и опухолевидных
образованиях яичников зависит от характера процесса и возраста пациентки.
Функциональные кисты (фолликулярные, жёлтого тела) не требуют удаления.
Их пунктируют, содержимое аспирируют, производят биопсию стенки кисты.
Параовариальные кисты вылущивают. Так же поступают при
доброкачественных опухолях яичников у молодых пациенток с небольшими размерами
опухоли и сохранившейся тканью яичника. При крупных опухолях и отсутствии
здоровой ткани яичника у молодых пациенток допустима овариоэктомия с
сохранением маточной трубы. Женщинам старше 35 лет с истинными
доброкачественными опухолями показана аднексэктомия [2, 17].
321
Окончательный диагноз устанавливают на основании лапароскопических
признаков. Стенка ретенционной кисты тонкая, сквозь неё просвечивает
прозрачное содержимое. Внутренняя стенка цистаденомы гладкая,
функциональных кист — бахромчатая. При вылущивании стенка функциональной кисты в
отличие от цистаденомы, эндометриомы, зрелой тератомы с трудом отделяется
от ткани яичника, рвётся.
Оперативная техника
Цистэктомия. Яичник захватывают мягким зажимом за собственную
связку и фиксируют. Электрохирургическим петлевым или L-образным
электродом в зоне наиболее поверхностного залегания кисты вдоль оси
яичника производят коагуляцию в виде дорожки (место предполагаемого
разреза) (рис. 19-10). Ножницами рассекают коагулированные ранее
ткани. Края раны захватывают зажимами и разводят для последующей
энуклеации объёмного образования. Вылущивание эффективно при
сохранённой целостности кисты. При этом препаровку тканей производят
диссектором, тупфером или методом акводиссекции. После вылущивания
осматривают ложе удалённого образования, контролируют гемостаз. Рану
яичника, как правило, не ушивают. Ткани кисты удаляют через один из
проколов передней брюшной стенки (рис. 19-11).
Овариоэктомия. Операцию выполняют при помощи зажима и
диссектора. Тракцию создают зажимом, введённым со стороны поражения,
добиваясь натяжения собственной связки яичника, перпендикулярно к
ней подводят диссектор. Собственную связку пересекают в
непосредственной близости к яичнику. После удаления препарата контролируют
гемостаз.
Аднексэктомия. Зажимом, введённым на стороне поражения,
захватывают маточную трубу, создают тракцию, обеспечивая натяжение
тканей. Диссектором в области маточного угла в режиме коагуляции
пересекают маточную трубу. Далее вдоль неё пересекают брыжейку маточной
трубы на 2/3 её протяжённости. Пересекают собственную связку яичника
и 2/3 брыжейки яичника (рис. 19-12). Для удобства создания экспозиции
инструменты меняют местами, зажимом захватывают ампулярный отдел
маточной трубы с яичником. Натягивают и после предварительной
коагуляции пересекают воронкотазовую связку. Пересекают оставшуюся часть
брыжеек фаллопиевой трубы и яичника. Контролируют гемостаз.
МИОМА МАТКИ
Лапароскопический доступ позволяет выполнять как консервативные (ми-
омэктомия), так и радикальные (надвлагалищная ампутация, экстирпация)
операции на матке.
Консервативная мимэктомия показана женщинам в возрасте до 35 лет
при наличии одного или нескольких субсерозно расположенных миомных
узлов. Удаление субсерозно-интрамуральных узлов значительно сложнее в связи
с необходимостью ушивания дефекта стенки матки [1, 4, 7, 22].
322
Рис. 19-10. Этапы вылущивания кисты яичника.
Рис. 19-11. Ткани кисты удаляют через
один из проколов.
Рис. 19-12. Аднексэктомия. Пересечение
брыжейки маточной трубы
Противопоказания
1. Диаметр миомного узла более 10 см.
2. Расположение миоматозного узла в перешеечной или шеечной
области.
3. Общие противопоказания к лапароскопии (см. главу 6).
Оперативная техника. При миомных узлах на ножке последнюю
коагулируют и пересекают. При субсерозном расположении миомы на широком
основании и субсерозно-интрамуральных миомах над узлом рассекают брюшину,
мышечный слой и капсулу опухоли. Хирургическим зажимом или
специальным штопором захватывают узел и диссектором вылущивают образование
(рис. 19-13). Кровоточащие сосуды тщательно коагулируют. При
возникновении значительного дефекта мышечного слоя ушивают стенку матки.
Контролируют гемостаз. Препарат помещают в контейнер, расширяют один из
проколов передней брюшной стенки и удаляют миому.
Рис. 19-13. Вылущивание субсерозного
миомного узла.
324
НАДВЛАГАЛИЩНАЯ АМПУТАЦИЯ И ЭКСТИРПАЦИЯ МАТКИ
Показания к эндоскопическому удалению матки не отличаются от
таковых в открытой хирургии.
1. Субмукозная, интрамуральная миома матки в сочетании с
опухолями яичников.
2. Миома матки в сочетании с аденомиозом и заболеваниями шейки
матки.
3. Аденомиоз матки.
4. Гиперпластические заболевания эндометрия при
неэффективности гормональной терапии.
Противопоказания
1. Размеры матки, соответствующие сроку более 12—14 нед беременности.
2. Размеры сопутствующих придатковых образований более 15 см в
диаметре.
3. Эндометриоз IV степени.
Оперативная техника
Надвлагалищная ампутация матки
Операцию выполняют под общим интубационным наркозом из
четырёх доступов. Троакар для лапароскопа вводят в параумбиликальной
области, троакары для инструментов — в обеих подвздошных областях и
по средней линии на 3 см выше лонного сочленения. Устанавливают вну-
триматочную канюлю для смещений матки. Гемостаз обеспечивают моно-
или биполярной электрокоагуляцией. Диссектором в режиме
монополярной электрокоагуляции пересекают круглые связки матки, между ними
ножницами рассекают брюшину по пузырно-маточной складке.
Отслаивают тупым способом мочевой пузырь. Коагулируют и пересекают
собственные связки яичников и связки маточной трубы. Отсечение придатков
от матки можно произвести сшивающим аппаратом. При необходимости
удаления придатков матки на этом этапе операции пересекают воронко-
тазовые связки. Тело матки отсекают от шейки, используя монополярную
электрокоагуляцию одним из электрохирургических инструментов
(лопаточка, игла, петля). Перитонизацию культи шейки матки производят
одним или двумя швами за счёт брюшины пузырно-маточной складки [5, 6].
Препарат удаляют через кольпотомное отверстие заднего свода влагалища.
Кольпотомию осуществляют при помощи влагалищного экстрактора —
10-миллиметрового троакара с диэлектрическим шаром на конце. Шар
снаружи вставляют в задний свод влагалища и со стороны брюшной
полости над ним производят кольпотомию. Разрез выполняют монополярным
электродом между крестцово-маточными связками, не выходя за их
пределы. Через троакар, введённый в кольпотомное отверстие, в брюшную
полость вводят щипцы, которыми захватывают и удаляют матку (рис. 19-14).
Кольпотомное отверстие ушивают либо со стороны влагалища, либо со
стороны брюшной полости. Альтернативный способ извлечения
препарата — размельчение матки зубчатым макроморцеллятором с последующей
эвакуацией её ткани (рис. 19-15) [24].
325
Рис. 19-14. Матку удаляют через кольпо-
томное отверстие.
Рис. 19-15. Энуклеация миомного узла
морцеллятором Земма.
Лапароскопическая гистерэктомия. Различают операцию, полностью
выполняемую лапароскопическим методом, и комбинированное
вмешательство, когда лапароскопически только лигируют или коагулируют
маточные сосуды, а последующие манипуляции осуществляют влагалищным
доступом.
Начальные этапы операции аналогичны таковым при надвлагалищ-
ной ампутации матки. После мобилизации тела матки до её шейки
коагулируют в монополярном режиме или прошивают маточные сосуды.
Коагулируют и пересекают кардинальные связки. Отделяют матку от сводов
влагалища, последовательно вскрывая передний, задний и боковые своды
и отсекая тем самым матку. Тщательно коагулируют сосуды. Препарат
извлекают из брюшной полости через влагалище, последнее ушивают [20, 21, 23].
Осложнения. Кроме осложнений, встречаемых при выполнении операций
открытым способом и специфических для лапароскопических операций,
наибольшую опасность при выполнении ампутации и экстирпации матки представляют
ранения мочеточника, мочевого пузыря и толстой кишки. Повреждения этих
органов чаще встречают при неправильном наложении сшивающих аппаратов. Реже
это происходит при использовании моно- и биполярной коагуляции.
Предупредить перечисленные выше осложнения позволяет знание анатомии, а также
визуализация прилежащих органов до наложения сшивающего аппарата.
ОПЕРАЦИИ ПРИ ТРУБНОЙ БЕРЕМЕННОСТИ
Показания — трубная беременность. Прервавшуюся трубную беременность
считают неотложным состоянием.
Противопоказания
1. Геморрагический шок.
2. Локализация плодного яйца в интрамуральном отделе маточной
трубы.
3. Общие противопоказания к лапароскопическим операциям (см.
главу 6).
326
Рис. 19-16. Инструмент для
одновременного промывания-отсасывания.
Тубэктомия — наиболее частая
операция при этом заболевании.
Вмешательство выполняют из трёх
доступов, используя один
5-миллиметровый и два 10-миллиметровых
троакара. Аспирируют кровь и сгустки, вводят
10-миллиметровый аспиратор или
инструмент для одновременного
промывания-отсасывания, производят
промывание брюшной полости (рис. 19-16).
Проводят ревизию брюшной полости,
уточняют диагноз и тактику. После
установления показаний к тубэктомии
подтягивают маточную трубу, создавая
экспозицию. Электрохирургическим
диссектором в режиме монополярной коагуляции пересекают маточную трубу и её
брыжейку в непосредственной близости от последней для профилактики
повреждения сосудов и возникновения интралигаментарной гематомы (рис. 19-17).
Таким же образом маточную трубу отделяют от воронкотазовой связки.
Маточную трубу и плодное яйцо удаляют из брюшной полости через 10-миллиметровый
троакар. При большем диаметре маточной трубы используют переходную гильзу
10/20 мм, контейнер или кольпотомное отверстие. Производят санацию брюшной
полости, при сомнении в надёжности гемостаза её дренируют.
Туботомия с сохранением маточной трубы при внематочной беременности
возможна при диаметре плодного яйца не более 4 см.
Начальные этапы операции не отличаются от описанных выше при
выполнении тубэктомии. Маточную трубу вскрывают продольно игольчатым или
L-образным электродом над проксимальным участком расширения, где
обычно расположено плодное яйцо (дистальная часть расширения маточной трубы
Линия пересечения
мезосальпинкса
Яичник
Рис. 19-17. Уровень пересечения маточной трубы и её брыжейки.
327
Электрохирургичес- ,,
кий крючок
Матка
Зажим
Фаллопиева
труба
Фимбрии
Яичник
Рис. 19-18. Туботомия при внематочной беременности. А — вид маточной трубы до вскрытия
просвета, Б — вид маточной трубы после удаления плодного яйца, В — линия рассечения
маточной трубы.
заполнена сгустками крови) (рис. 19-18). Плодное яйцо отслаивают
гидравлической препаровкой. Просвет маточной трубы тщательно промывают. Контролируют
гемостаз, плодное яйцо удаляют.
Отверстие в маточной трубе после туботомии, как правило, не ушивают.
Полное заживление раны с восстановлением целостности и проходимости
наступает через 3—6 мес [18, 19].
ОПЕРАЦИИ ПРИ ГНОЙНЫХ ЗАБОЛЕВАНИЯХ ПРИДАТКОВ МАТКИ
К гнойным заболеваниям придатков матки относят острый гнойный
сальпингит, пиосальпинкс, пиовар и тубоовариальный абсцесс. Объём вмешательства
при гнойно-воспалительных заболеваниях внутренних половых органов зависит
от характера процесса и возраста пациентки. При остром гнойном сальпингите
328
Рис. 19-19. Гильза для динамической лапа- Рис. 19-20. Перекрут придатков матки,
роскопии.
без деструктивных изменений показаны санация и дренирование брюшной
полости. При тубоовариальных гнойных образованиях у женщин
репродуктивного возраста желательно выполнение органосберегающих операций. В возрасте
старше 40 лет предпочтительны радикальные вмешательства с удалением очага
инфекции (тубэктомия или аднексэктомия).
Вскрытие очага инфекции включает следующие этапы:
1. Аспирация выпота промывание и санация брюшной полости.
2. Рассечение спаек и сращений в полости малого таза. Этот этап
целесообразно выполнять острым (ножницами) или тупым (диссектором
или анатомическим зажимом) способами. ВЧЭХ следует использовать с
особой осторожностью.
3. Вскрытие абсцесса и промывание его полости раствором антисептика.
4. Дренирование брюшной полости.
Динамическая лапароскопия — эффективный метод лечения
гнойно-воспалительных заболеваний внутренних половых органов. Он позволяет без
повторного введения троакаров с интервалом 1—2 сут проводить промывание и
санацию брюшной полости вплоть до стихания воспалительного процесса.
Показания — деструктивные гнойно-воспалительные заболевания
внутренних половых органов у больных молодого возраста.
Методика выполнения
1. В конце операции параумбиликальный 10-миллиметровый
троакар заменяют гильзой для динамического наблюдения (рис. 19-19).
2. При повторной лапароскопии в гильзу вводят лапароскоп.
Накладывают ПП. Брюшную полость промывают, разрушают
сращения, производят промывание и санацию.
3. Количество повторных лапароскопии определяет динамика
воспалительного процесса.
Эта методика не требует установки дренажных трубок в брюшной
полости, проходимость которых обычно нарушается через несколько
часов после операции [11, 13, 16].
329
ПЕРЕКРУТ ПРИДАТКОВ МАТКИ
Эта операция, как правило, выполняемая по экстренным показаниям, в
случае некроза тканей требует выполнения аднексэктомии (рис. 19-20). При
сохранённой жизнеспособности тканей у молодых пациенток возможна орга-
носохраняющая операция — устранение перекрута.
ЛИТЕРАТУРА
1. Адамян Л.В., Зарубиани З.Р., Киселёв СИ. Акушерство и гинекология. 1997, 3,
с. 40-43.
2. Андреев Е.Н., Яроцкая Е.Л., Ткаченко Э.Р., Хачатрян А.К. Акушерство и
гинекология. 1995, 5, с. 15-17.
3. Бреусенко В.Г. Эндоскопия в гинекологии. Под ред. Савельевой Г.М. М.:
Медицина, 1983, 150 с.
4. Вихляева Е.М., Уварова Е.В., Ищенко И.Г. Акушерство и гинекология. 1965, 1,
с. 41-45.
5. Ищенко А.И., Кудрина Е.А., Бабурина И.П., Зуев В.М. Лапароскопическая
надвлагалищная ампутация матки с помощью «петлевой» лигатуры. Методические
рекомендации. М., 1996, 30 с.
6. Карнаух В.И., Дурасов В.В., Тугушев М.Т. Эндохирургия для России (Самара).
1993, 1, с. 15-18.
7. Кудрина Е.А., Ищенко А.И., Бабурина И.П. Акушерство и гинекология. 1997, 1,
с. 19-22.
8. Кулаков В.И., Овсянникова Т.В., Волков Н.И. Акушерство и гинекология. 1997,
3, с. 25-27.
9. Овсянникова Т.В., Степанов В.В., Камилова Д.П. Диагностика и лечение
бесплодного брака. Практическое руководство. М.: Медицина, 1996, 120 с.
10. Пшеничникова Т.В., Земм К., Кузнецова Т.В., Волков Н.И. Практическое
руководство по оперативной эндоскопии в клинике женского беслодия. — М.:
Медицина, 1991, 130 с.
11. Савельева Г.М., Штыров СВ., Брусенко В.Г. Вестник Российской Ассоциации
акушерства-гинекологии. 1995, 3, с. 17—19.
12. Стрижаков А.Н., Давыдов А.И. Оперативная лапароскопия в гинекологии —
М.: Медицина, 1995, 280 с.
13. Штыров СВ. Акушерство и гинекология. 1996, 5, с. 29—33.
14. Савельева Г.М., Штыров СВ., Хатиашвили В.В. Надвлагалищная
экстирпация матки эндоскопическим методом. Акушерство и гинекология, 1996, 8: 17-21.
15. Hasson H. M. Operative. Endoscopy. New York, 1989, p. 86-107.
16. Henry-Suchet J. Aggiorn Sci Ginec. Obstet. 1992, 1, p. 56-63.
17. Hezhat F., Hezhat С International Congress of Gynaecological Endoscopy. Chicago,
1992, p. 63-65.
18. Parker W.H. Operativ. Endoscopy. New York, 1989, p. 78-86.
19. Parker W.H. J.Amer.Ass.Gynec.laparosc. 1993, vol. 1, N 1, p. 51-54.
20. Reach H., De Caprio J., Me. Glynn F. J.Gynec. Surg. 1989, vol. 5, p. 213-216.
21. Reach H. Surg. Laparosc.Tndosc. 1992, vol. 2, p. 74-78.
22. Semm K. Pelvioscopy. Operativ. Guidelines. Kiel, 1988, p. 23-25.
23. Semm K. Endoscopic Intraabdominal Surgery. Kiel, 1993, 270 p.
24. Semm K. Morcellation at Endoscopy // /. Europ. Priv. Hosp. 1996, 5, p. 69-76.
330
20
Лапароскопия
в детской хирургии
ОБЩИЕ СВЕДЕНИЯ
Интерес к детской хирургии велик, так как дети составляют около 30%
населения.
Специфика диагностики и обследования ребёнка, особенно раннего
возраста, состоит в том, что он самостоятельно не предъявляет жалоб, собрать
анамнез и осмотреть пациента достаточно сложно.
Объективное обследование дополняют различными диагностическими
методами, в том числе и лапароскопией. В педиатрии большинство
диагностических манипуляций проводят под общим обезболиванием.
Особенности хирургических заболеваний у детей:
1. Преобладают острые хирургические заболевания и пороки
развития.
2. Хирургические заболевания протекают на фоне выраженной
общей симптоматики (интоксикация, повышение температуры тела
до фебрильных цифр, диспепсия) при слабо выраженных
локальных признаках заболевания.
К достоинствам лапароскопии в педиатрии относят сокращение времени
пребывания ребёнка в стационаре, уменьшение выраженности болевого
синдрома в послеоперационном периоде, быстрое наступление полного
выздоровления и значительно менее интенсивный спаечный процесс в брюшной
полости. Есть сообщения, указывающие на низкую частоту инфицирования
операционной раны и брюшной полости.
Лапароскопические операции в детском возрасте принципиально сходны
с вмешательствами во взрослом возрасте, однако они имеют отличия,
связанные с анатомо-физиологическими особенностями ребёнка. На Европейском
симпозиуме по детской лапароскопии в Утрехте (Нидерланды) в 1995 г было
отмечено значительное число осложнений, наблюдаемых у детей при
наложении ПП с помощью иглы Вереша. Возникновению осложнений способствует
небольшая толщина передней брюшной стенки ребёнка. Поэтому было
рекомендовано использовать метод открытой лапароскопии.
Малый объём брюшной полости, эластичность и толщина передней
брюшной стенки, незрелость тканей и органов ребёнка, податливость стенок
крупных сосудов и диафрагмы — всё это меняется с возрастом и определяет
технические особенности лапароскопических вмешательств у детей. В связи со
спецификой структуры заболеваний в детском возрасте некоторые операции, проводимые
331
у взрослых, в педиатрической практике пока не нашли широкого применения
(колэктомия, грыжесечение), а наиболее частая операция у взрослых — ЛХЭ —
занимает далеко не первое место в детской хирургии.
Определённые трудности наблюдают у детей раннего возраста и
новорождённых, у которых глубина введения троакаров ограниченна. Объём брюшной
полости очень мал, поэтому манипуляции затруднены. Дети плохо переносят
напряжённый ПП, поэтому внутрибрюшное давление во время операции не
должно превышать 8—10 мм рт.ст., а первичную инсуффляцию следует
проводить медленно, со скоростью 0,5 л/мин. Чрезмерное повышение внутрибрюш-
ного давления с целью увеличения объёма брюшной полости может привести к
гемодинамическим расстройствам вследствие подъёма диафрагмы, сдавления
тонкостенных сосудов (прежде всего нижней полой вены). Поэтому при
лапароскопических операциях у детей раннего возраста рекомендуют максимально
отдалить инструменты друг от друга. Также одним из путей преодоления этих
затруднений считают применение лапаролифтинга, для чего можно
использовать крючки Фарабефа. Количество используемых троакаров и их диаметр
зависят от объёма вмешательства. На практике используют 10-миллиметровый
лапароскоп (наиболее удобный у маленьких детей), хотя возможно
применение и меньших по диаметру оптических трубок.
НЕОТЛОЖНАЯ ХИРУРГИЯ
Диагностическая лапароскопия в неотложной хирургии
Диагностика острых заболеваний у детей, сопровождающихся болями в
животе, представляет значительные трудности. Объяснение этому находят в
своеобразии течения большинства заболеваний и в особенностях обследования
детей. Кроме того, в зависимости от возраста меняется и спектр заболеваний.
Очевидно, что для уточнения диагноза и решения лечебно-тактических
вопросов необходим малотравматичный, но высокоинформативный метод
диагностики. Таковым можно считать лапароскопию, позволяющую провести
полноценную ревизию брюшной полости, выполнить биопсию, при
необходимости произвести радикальное хирургическое вмешательство.
Если у ребёнка с болями в животе при осмотре брюшной полости
отсутствуют болезненность, напряжение мышц передней брюшной стенки и
симптомы раздражения брюшины, то в данном случае лапароскопия не показана.
Необходимость в эндохирургическом диагностическом исследовании
возникает после динамического наблюдения в следующих ситуациях:
1. Подозрение на наличие острой хирургической патологии.
Подобная ситуация может встретиться при отграниченном процессе в брюшной
полости, атипичном расположении органа, его внебрюшинной
локализации, начальных стадиях развития патологического процесса.
2. Наличие нескольких симптомов острой хирургической патологии
в брюшной полости у ребёнка. В этой ситуации лапароскопия
необходима для подтверждения диагноза. Примеры: перитонизм при
урологической патологии, сахарном диабете, ревматизме, капилляротоксикозе;
трудности в дифференциальном диагностике кишечной инфекции и непро-
332
ходимости кишечника, пельвиоперитонита и острого аппендицита,
острого аппендицита и перфоративной язвы желудка.
3. Необычная локализация симптомов острого живота.
4. Сомнения в наличии и выраженности осложнений (перитонит,
непроходимость кишечника и т.п.).
5. Кровотечения в просвет ЖКТ неясной этиологии; в этом случае
лапароскопия позволяет установить локализацию источника
кровотечения (дивертикул Меккеля, гемангиома кишечника и т.п.).
6. Травмы брюшной полости — изолированные, сочетанные и
комбинированные.
7. Накопление жидкости в брюшной полости — лапароскопия
позволяет уточнить её характер (асцитическая, экссудат при перитоните, кровь,
содержимое кисты брюшной полости при ей разрыве).
Во многих случаях для решения диагностических задач бывает достаточно
введения одного лапароскопа. Если необходимо проведение каких-либо
манипуляций (инструментальная пальпация, биопсия, осмотр боковых каналов),
устанавливают дополнительный троакар.
Необходимо учитывать, что вследствие небольшой толщины тканей
передней брюшной стенки, напряжённый ПП приводит к просачиванию газа
вдоль троакара. Герметичность обеспечивают наложением вокруг инструмента
кисетного шва.
Лапароскопическая аппендэктомия у детей
В практике детской хирургии аппендэктомия — самое частое
абдоминальное вмешательство, названное «холецистэктомией» детских хирургов. Дети с
болями в животе должны быть госпитализированы в стационар для врачебного
наблюдения, а при наличии выраженных клинических проявлений острого
аппендицита — оперированы. Вместе с тем отрицательная сторона сложившегося
традиционного подхода — гипердиагностика и неоправданные аппендэктомии.
Сложность разрешения этой проблемы заключается в том, что существует
большое число заболеваний, протекающих с абдоминальным синдромом, при
котором неинвазивные методы исследования (УЗИ, электротермография,
электромиография и др.) не позволяют точно установить диагноз. Хирург в подобных
ситуациях руководствуется старым принципом: «сомневаешься — оперируй». В
результате частота удаления неизменённых червеобразных отростков у детей
достигает 60%. В дальнейшем проводимая антибактериальная терапия
маскирует или даже излечивает истинное заболевание, послужившее причиной
возникновения абдоминальных болей. По некоторым данным, у каждого пятого
ребёнка, перенёсшего неоправданную аппендэктомию, боли в животе
сохраняются [1]. Операция может привести к развитию тяжёлых осложнений:
перитонита, кишечной непроходимости, кровотечений, спаечной болезни,
образованию грыж, протекающих значительно тяжелее начального заболевания.
Разрешить проблему можно с помощью диагностической лапароскопии,
позволяющей провести визуальный осмотр червеобразного отростка, его
пальпацию, осмотреть брюшную полость и выбрать оптимальную лечебную тактику.
333
Проведённые некоторыми авторами сравнения традиционной аппендэк-
томии и эндохирургического вмешательства обнаруживают преимущества и
недостатки обоих методов. Среднее время операции при осложнённом
аппендиците при открытом вмешательстве составляет 45—90 мин, при
лапароскопической операции — 80 мин. Потребность в дренировании возникает одинаково
часто, совпадает и частота ранних осложнений послеоперационного периода.
Лапароскопически возможна более полноценная ревизия брюшной
полости и санация гнойных очагов, однако выполнение ЛА технически сложнее и
иногда требует конверсии. ЛА сокращает на 1/3 время пребывания больного в
стационаре, уменьшает вероятность развития спаечной болезни, благоприятна
в косметическом отношении.
На конференции Европейской Ассоциации Эндоскопической Хирургии
(Мадрид, 1994 г.) было заявлено: «Лапароскопическая аппендэктомия — новая
технология. Её выполнимость и безопасность отражена в публикациях
специальных центров эндоскопической хирургии. Серьёзные осложнения
немногочисленны, но хирург должен осознавать потенциальные опасности метода».
Противопоказания
1. Общие противопоказания к лапароскопическим операциям.
2. Периаппендикулярный инфильтрат, периаппендикулярный абсцесс.
3. Разлитой перитонит.
4. Перфорация червеобразного отростка.
Оперативная техника. ЛА — достаточно сложная операция. На начальном
этапе освоения техники вмешательства оптимален экстракорпоральный или
комбинированный вариант аппендэктомии [2]. По мере накопления опыта
следует переходить на интракорпоральный метод операции с использованием
лигатурного способа обработки культи червеобразного отростка (см. главу 11).
Доказано, что культя червеобразного отростка при лигатурном методе
постепенно погружается в слепую кишку с самопроизвольной перитонизацией [3]. В
последующем лигатурный метод аппендэктомии нашёл широкое применение в
клинической практике [4].
Некоторые хирурги для создания ПП используют иглу Вереша, но более
безопасным считают открытое введение первого троакара по Хассону.
Величина внутрибрюшного давления и объём вводимого газа зависят от возраста и
массы тела ребёнка. В умбиликальной области несколько ниже пупка вводят
троакар для лапароскопа. Троакары для инструментов вводят под прямым
визуальным контролем согласно классическим схемам, описанным выше.
Проводят ревизию брюшной полости и устанавливают локализацию
патологического очага. Обращают внимание на наличие, количество и характер выпота в
брюшной полости, состояние брюшины, так как именно она в первую очередь
локально реагирует гиперемией на воспалительный процесс. Неизменённый
червеобразный отросток имеет бледно-розовый либо бледно-голубой цвет,
легко смещаем при манипуляциях, изменения брюшины отсутствуют. Признаки
аппендицита — гиперемия и тусклость серозной оболочки, инъекции сосудов.
Стенка червеобразного отростка и его брыжейка инфильтрированы, возможен
налёт фибрина. Червеобразный отросток напряжён и ригиден при
инструментальной пальпации. В ряде наблюдений видны рыхлые спайки между
червеобразным отростком и окружающими органами.
334
Наибольшие трудности в дифференциальной диагностике возникают при
начальных стадиях воспаления червеобразного отростка. В этих ситуациях из
всех признаков имеет место легкая гиперемия его брюшинного покрова
(данный признак встречают в 98,9% случаев) и только ригидность отростка при
пальпации свидетельствует о деструктивном процессе. Этот признак позволяет
выявить следующий приём: червеобразный отросток приподнимают
манипулятором в средней трети [5]. Если при этом он перегибается, данный симптом
считают отрицательным (нет внутренней гипертензии). Когда отросток при этой
манипуляции сохраняет форму стержня (весь или в какой-либо части) —
симптом положительный.
Существуют значительные трудности при дифференциальной
диагностике выраженных вторичных изменений в червеобразном отростке от
деструктивных изменений. Наложения фибрина иногда образуются вследствие
распространения воспалительной реакции из первичного очага другой
локализации, а не являются признаком собственно воспаления червеобразного
отростка. Симптом ригидности червеобразного отростка в этой ситуации становится
недостоверным из-за отёка стенки органа. Если при наличии изменений
висцеральной брюшины имеется ригидность червеобразного отростка, вопрос об
аппендэктомии решают положительно. При ретроперитонеальном
расположении червеобразного отростка иногда симптом ригидности выявить
невозможно; в этом случае острый аппендицит диагностируют на основании изменений
париетальной брюшины вокруг отростка.
Лапароскопическое вмешательство затруднено у маленького ребёнка с
локализованным гнилостным процессом при отсутствии воспалительных
изменений в других отделах брюшной полости. В то же время
лапароскопический доступ в этой ситуации имеет преимущества, позволяя выполнить
полноценное промывание с одномоментной ликвидацией рыхлых плоскостных
спаек, избежать необходимого при традиционной операции расширения раны.
Промывание брюшной полости выполняют на завершающем этапе операции.
Задачи лаважа, проводимого тёплыми растворами (фурацилин, изотонический
раствор хлорида натрия), — аспирация крови и экссудата. При промывании
брюшной полости внутренние органы отодвигают с помощью инструментов,
также меняют положение операционного стола. По ходу операции
осматривают подвздошную кишку для исключения воспаления дивертикула Меккеля.
В 3,6% случаев ЛА возникают интраоперационные ситуации, требующие
перехода к лапаротомии. К ним можно отнести большие размеры
деструктивно-изменённого отростка, перфорацию и самоампутацию органа. Наличие
плотного аппендикулярного инфильтрата также вынуждает хирурга изменить
тактику и выполнить лапаротомию.
Осложнения и их профилактика: ранняя спаечная кишечная
непроходимость, внутрибрюшные абсцессы и синдром «пятого дня» (см. главу 11).
Лапароскопия при травмах органов брюшной полости
Значительные трудности диагностики повреждений органов брюшной
полости определяют в настоящее время активную диагностическую тактику при
335
проникающих повреждениях живота. При таком подходе к диагностике
данного вида травмы частота необоснованных лапаротомий достигает 30%.
При закрытой травме живота, более характерной для детского возраста,
наиболее эффективны в диагностике ангиография и лапароскопия. Закрытая
травма, даже при ясной клинической картине острого заболевания органов
брюшной полости, требует проведения диагностической лапароскопии.
Абдоминальную травму чаще наблюдают в возрасте от 5 до 13 лет, причём
чаще у мальчиков. Повреждения внутренних органов брюшной полости могут
произойти при непосредственном внезапном ударе движущимся предметом по
животу или спине, ударе животом или спиной по неподвижному твёрдому
предмету, сдавлении живота, резком инерционном смещении органов при падении
с высоты. Степень повреждения органов зависит от механизма травмы.
Большинство детей поступают в клинику с явлениями шока, симптомами
острой кровопотери или признаками перитонита. Тяжёлое состояние ребёнка
ограничивает время на диагностические мероприятия и служит показанием к
экстренной лапаротомий. В подобных ситуациях лапароскопия не показана.
При осмотре ребёнка с закрытой травмой живота практически всегда
приходится решать вопрос: имеет место ушиб брюшной стенки или повреждение
внутренних органов. Среди закрытых повреждений передней брюшной стенки —
отслойка подкожной клетчатки, разрывы апоневроза, мышц, брюшины,
крупных сосудов с одновременным повреждением нервных сплетений, что и
определяет клиническую картину. При этих повреждениях пальпация живота
болезненна, иногда появляется защитное напряжение мышц передней брюшной
стенки. Боль в брюшной стенке усиливается при кашле, движениях, активном
напряжении мышц. Если почасовое динамическое наблюдение не позволяет
исключить повреждение органов брюшной полости, показано выполнение
лапароскопии.
Повреждения селезёнки составляют у детей 50% всех ранений органов
брюшной полости. Морфофункциональные особенности селезёнки
способствуют лёгкой травматизации её даже при незначительном воздействии.
Повреждения селезёнки могут сочетаться с разрывами печени, почки, кишечника.
Закрытые изолированные повреждения селезёнки протекают с типичной
картиной разрыва паренхиматозного органа и внутрибрюшного кровотечения,
возможен вариант стёртого течения (подкапсульные и внутриорганные разрывы).
Поведение ребёнка в момент осмотра не всегда адекватно тяжести травмы.
Первый и наиболее важный признак травматического повреждения
паренхиматозных органов — свободная кровь в брюшной полости. При
значительном количестве крови, когда она скапливается в полости малого таза и
обоих боковых каналах, можно быть уверенным в серьёзном повреждении, что
даёт основания для лапаротомий.
Оперативная техника. После введения лапароскопа производят аспирацию
крови чаще всего в полости малого таза и области печёночного изгиба толстой
кишки. Производят осмотр печени и селезёнки. Травматические повреждения
паренхиматозных органов варьируют от небольших линейных надрывов, под-
капсульных гематом до обширных размозжений.
336
Осмотр печени. В положении больного на спине хорошо видна передняя
часть диафрагмальной поверхности правой и левой долей печени.
Манипулятором приподнимают орган и осматривают его нижнюю поверхность.
Осмотр селезёнки. Для полноценного осмотра селезёнки необходимо
повернуть ребёнка на правый бок, при этом видны диафрагмальная
поверхность органа и его верхний полюс. При эндоскопии в области
разрыва органа чаще всего обнаруживают сгустки крови, покрывающие
повреждение. В случае разрыва селезёнки показана лапаротомия.
Если в брюшной полости имеется небольшое количество крови, которое
после аспирации не увеличивается, а при ревизии выявлены небольшие
линейные поверхностные надрывы органа без признаков кровотечения, возможна
консервативная тактика. Оставляют контрольный дренаж, подводимый
непосредственно к зоне повреждения.
Нередко при осмотре печени и селезёнки видны подкапсульные
гематомы. Множественные мелкие подкапсульные кровоизлияния не требуют
оперативного лечения. При крупных одиночных подкапсульных гематомах обычно
сильно выражен болевой синдром и существует опасность спонтанного
разрыва. Их пунктируют под визуальным контролем. Кровотечения из места
пункции обычно не наблюдают.
Динамическая лапароскопия
Для динамического наблюдения за развитием патологического процесса
или за течением послеоперационного периода существует метод, названный
динамической лапароскопией. Динамическая лапароскопия позволяет на
протяжении нескольких суток непосредственно наблюдать за изменениями,
происходящими в брюшной полости. Сущность методики заключается в
следующем: после первичной лапароскопической операции или в конце
традиционного вмешательства в тканях передней брюшной стенки устанавливают
специальную лапароскопическую гильзу, которая применима для наложения ПП и
для введения лапароскопа в брюшную полость.
Показания
1. Необходимость динамической визуальной оценки состояния
органов брюшной полости.
2. Необходимость визуального определения эффективности
проводимого лечения.
3. Подозрение на возможное возникновение послеоперационных
осложнений (непроходимость кишечника, абсцессы, кровотечение или некроз).
4. Необходимость контроля за течением патологических процессов,
если во время операции или после ранее выполненной лапароскопии неясна
динамика заболевания [6].
Методика проведения. Операцию производят под интубационным
наркозом. В послеоперационном периоде через канюлю с помощью лапароскопа
производят пролонгированную санацию брюшной полости. Осматривают все
337
ее отделы и межпетлевые промежутки кишечника с одновременной
эвакуацией экссудата. Полость промывают раствором фурацилина, вводят антибиотики.
Сеансы санации проводятся через 6, 12, 24, 36 ч. Первые два сеанса
осуществляют с интервалом 6 ч, так как это период максимальной экссудации. Через 36
ч начинает восстанавливаться моторно-эвакуаторная функция кишечника,
поэтому именно на этих сроках обычно удаляют канюлю. Лечебную эффективность
динамической лапароскопии оценивают по числу устранённых осложнений.
При острой кишечной непроходимости длительность канюляции
составляет от 2 до 7 сут, при первичном перитоните — от 1 до 10 сут. В случае
воспалительных процессов в брюшной полости (оментит, деструктивный мезо-
аденит, ректосигмоидит, болезнь Крона) канюлю оставляют на срок до 3 сут.
Лапароскопия при спаечной непроходимости
кишечника у детей
При спаечной болезни брюшной полости лапароскопия показана для
устранения предрасполагающих к кишечной непроходимости факторов и
собственно для лечения спаечной кишечной непроходимости (адгезиолизис).
К первому можно отнести синдром припаянного сальника, спаечную
болезнь брюшной полости. Во втором варианте операцию выполняют при острой
обтурационной и странгуляционной кишечной непроходимости.
1. Синдром припаянного сальника (синдром Хноха). В 75% повторных
лапаротомий обнаруживают мощные спайки большого сальника с
передней брюшной стенкой и органами брюшной полости, причём в 27%
случаев спайки между сальником и передней брюшной стенкой и
внутренними органами — единственная причина состояния, обусловившего
возникновение необходимости релапаротомии. Чаще всего сальник оказывается
фиксированным к рубцу после нижней срединной лапаротомий или
разреза в правой подвздошной области. Заподозрить данную патологию
можно при наличии типичной клинической картины: боль в области
послеоперационного рубца при напряжении брюшного пресса, а также при
смещении брюшной стенки во время пальпации и при разгибании
позвоночника в поясничном отделе [7].
Дети предъявляют жалобы на тупые постоянные боли,
усиливающиеся при движении, иногда связанные с приёмом пищи. Боли
уменьшаются или полностью исчезают в горизонтальном положении с подтянутыми
к животу ногами. Отсечение подпаянной пряди большого сальника
избавляет ребёнка от болей.
2. Спаечная болезнь брюшной полости. Один из факторов,
ограничивающих возможности лапароскопической хирургии, — распространённость
спаечного процесса, под которым понимают степень вовлечённости
органов и пространства брюшной полости в данный процесс [8].
Классификация, характеризующая спаечный процесс:
1-я степень — локальный спаечный процесс, ограниченный областью
послеоперационного рубца или частью брюшной полости, занимающей
не более 1/3 одного этажа, при отсутствии спаек в других областях.
338
2-я степень — локальный спаечный процесс в сочетании с
одиночными, редкими спайками в других областях.
3-я степень — спаечный процесс, занимающий 1/3 брюшной полости.
4-я степень — диффузный спаечный процесс, занимающий 2/3
брюшной полости и более.
Кроме распространённости спаечного процесса, достаточно важна
плотность спаек и их выраженность между петлями кишечника. Именно
последнее обстоятельство определяет сложность и трудность выполнения
адгезиолизиса. Высокую вероятность распространённого спаечного
процесса отмечают у детей после перитонита аппендикулярной этиологии,
после операций по поводу травмы органов брюшной полости и любых
абдоминальных операций в периоде новорождённое™. Наибольшую
частоту спаечной болезни отмечают у детей с периаппендикулярными
инфильтратами в анамнезе.
Спаечный процесс в брюшной полости выявляют чаще всего спустя
несколько месяцев после операции. Для него характерны
рецидивирующие боли в животе, а также несоответствие между степенью
распространённости спаечного процесса и клиническими проявлениями. Например,
при наличии одиночных спаек чаще возникает картина острой кишечной
непроходимости, однако при обширном спаечном процессе чаще
развивается хронический болевой синдром, метеоризм, нерегулярный стул.
Повторные курсы консервативной терапии (ЛФК, массаж брюшной
полости, физиотерапия) не всегда эффективны. Лапароскопический адгези-
олизис позволяет избежать лапаротомии при развитии в последующем
кишечной непроходимости, т.е. в лечении спаечных процессов в
брюшной полости лапароскопическое вмешательство следует считать
операцией выбора, позволяющей разорвать порочный круг.
Адгезиолизис — одна из наиболее трудных лапароскопических операций.
Она требует мастерства и терпения. Лапароскопию можно применять при
выполнении открытых вмешательств у детей, имеющих в анамнезе операции на
органах брюшной полости. В таких случаях лапароскопия — этап,
предваряющий лапаротомию. Наиболее целесообразно использование такой комбинации
при закрытии илеостом, наложенных при гнойно-фибринозных перитонитах и
некрозах кишечника. Лапароскопический этап позволяет разрушить внутри-
брюшные спайки вдали от кишечного свища и ограничить лапаротомный
доступ зоной выведенной на кожу стомы.
Лапароскопическое лечение спаечной кишечной непроходимости возможно
при выполнении следующих условий:
1. Достаточно большая область брюшной стенки свободна от рубцов.
2. Отсутствует выраженное вздутие петель кишечника и связанное с
ним растяжение передней брюшной стенки.
3. Отсутствуют признаки некроза кишечника и перитонита.
Оперативная техника при лечении кишечной непроходимости
ПП накладывают методом открытой лапароскопии. Диагностический этап
позволяет уточнить диагноз острой кишечной непроходимости, определить её тип
339
и степень видимых морфологических изменений, определить дальнейшую
лечебную тактику. Наиболее трудна диагностика спаечной непроходимости на
ранних сроках (на фоне пареза кишечника, перитонита). При осмотре
брюшной полости обращают внимание на степень вздутия петель тонкой кишки,
наличие или отсутствие спавшихся участков, их локализацию, выраженность
изменений кишечной стенки, наличие и характер выпота.
В раннем послеоперационном периоде спаечный процесс локализован,
как правило, в местах наиболее выраженных воспалительных изменений и
операционной травмы, что служит ориентиром при определении локализации уровня
непроходимости. Однако при ранней спаечной кишечной непроходимости его
удаётся обнаружить не всегда. В таких случаях помогают инструментальная
пальпация органов и изменение положения больного на операционном столе.
Пересекают сращения прядей большого сальника с передней брюшной
стенкой и кишечными петлями, ликвидируют межпетлевые спайки. Выполняют это в
бессосудистых участках острым путём, реже используют электрокоагуляцию.
При ранней спаечной кишечной непроходимости спайки рыхлые,
отёчные. Межпетлевые сращения и спайки с париетальной брюшиной
относительно легко разделяют тупым и острым путём. В ходе адгезиолизиса обычно
используют 2 манипулятора. При электрохирургическом воздействии возникает
сморщивание и укорочение спайки, при этом зона коагуляционного некроза
приближается к стенке кишки и возникает опасность её повреждения.
После разделения спаек и контроля гемостаза выполняют ревизию тонкой
кишки в месте произведённого адгезиолизиса с целью проверки полной!
устранения деформации кишечной трубки. Для этого её тщательно осматривают
от расширенных отделов до спавшихся участков, используя атравматические
инструменты.
Чаще всего лапароскопическая санация бывает успешной при локальном
спаечном процессе 1—2-й степени, при обструкции с образованием
«двустволки» и ущемлением кишки одиночными тяжами или прядью сальника.
Наиболее опасно неполное разделение спаек. При малейших сомнениях в
успешности лапароскопического адгезиолизиса или при наличии осложнений
выполняют лапаротомию.
Технические трудности возникают при разделении спаек близко
расположенных органов, определении границ между Рубцовыми тканями и стенкой
кишки, протяжённых спайках кишки и брюшной стенки. В последнем случае
возможно вскрытие просвета кишки (как и при лапаротомии). Некоторые
авторы предлагают устранять только непосредственную причину обструкции и
пересекать лишь спайки, потенциально опасные в плане развития кишечной
непроходимости.
Причины перехода к лапаротомии. Отказываться от лапароскопической
санации приходится при тотальном поражении брюшной полости спаечным
процессом, технических трудностях осмотра места непроходимости, сочетании
непроходимости и перитонита, выраженном парезе кишечника, локализации
спаечной непроходимости в области свищей (гастростома, илеостома, колосто-
ма). Лапароскопию прекращают после этапа ревизии при невозможности
надёжного адгезиолизиса.
340
У 53—80% больных лапароскопическое лечение при острой кишечной
непроходимости оказывается эффективным [4]. Средняя продолжительность
операции при спаечной непроходимости составляет 130 мин.
Осложнения. После лапароскопического адгезиолизиса частота рецидивов
спаечной болезни меньше, чем при открытом доступе. При ранней спаечной
непроходимости результаты адгезиолизиса хуже, чем при поздней.
Лапароскопия при инвагинации кишечника
Применение лапароскопии позволяет избежать лапаротомии у 60% детей
с инвагинацией кишечника. Лапароскопия даёт возможность хирургу провести
вмешательство, сочетая процедуру нагнетания воздуха в толстую кишку с
визуальным контролем эффективности дезинвагинации и определением
жизнеспособности дезинвагинированной кишки. Лапароскопическая дезинвагинация
успешна в 86,5% наблюдений, т.е. практически любую инвагинацию
кишечника, не сопровождающуюся некрозом кишечной стенки, можно расправить
консервативным методом в сочетании с лапароскопией. Использование
лапароскопии позволяет увеличить лимит времени для консервативного
расправления кишечной инвагинации при отсутствии абдоминальных осложнений или
даже произвести резекцию некротизированной кишки.
У детей старшего возраста причиной инвагинации кишечника могут быть
дивертикул Меккеля, опухоли и другие заболевания. Лапароскопия в подобной
ситуации позволяет при консервативном расправлении или после него избрать
наиболее рациональную тактику лечения.
Показания
1. Сомнения в расправлении инвагината консервативным путём
(опасность некроза кишки).
2. Оценка состояния дезинвагинированной кишки на сроках
расправления более 12 ч.
3. Ревизия кишечника при консервативном лечении инвагинации у
детей старше 1,5 лет.
4. Рецидивирующая инвагинация (для выявления причины рецидива).
5. Сомнения в диагнозе после традиционной хирургической
дезинвагинации.
Противопоказания. Выполнение лапароскопии при инвагинации
кишечника возможно при отсутствии явлений перитонита, шока, резкого вздутия
петель кишечника.
Оперативная техника
1. Лапароскоп устанавливают либо параумбиликально, либо в левой
подвздошной области.
2. Количество троакаров для инструментов определяют
индивидуально в зависимости от выраженности патологических изменений и объёма
оперативного пособия.
341
3. При необходимости резекции кишки её можно провести с
помощью аппаратного механического эндохирургического шва внутрибрюшинно
или с применением экстракорпоральной методики.
ПЛАНОВАЯ ХИРУРГИЯ
Биопсия печени
Существует три различных варианта техники получения печёночной
ткани для анализа: слепая чрескожная биопсия с УЗИ-контролем или без него,
открытая биопсия при лапаротомии и лапароскопическая биопсия.
Диагностическая лапароскопия позволяет осмотреть печень и
окружающие ткани, осуществлять контроль за гемостазом и производить биопсию
нескольких участков органа. Однако по сравнению с чрескожной техникой
лапароскопическая биопсия имеет большую продолжительность, высокую стоимость
и требует общего обезболивания. Лапароскопическая биопсия печени показана
в случаях, когда необходимо получить несколько образцов тканей, имеется
опасность кровотечения и при необходимости осмотра других органов
брюшной полости.
При пункционно-аспирационной биопсии обычно удаётся получить пунк-
тат, пригодный только для цитологического исследования. Оптимальным
считают получение материала из нескольких участков органа. Как правило,
кровотечение при биопсии незначительно и останавливается самостоятельно в
течение 1—3 мин, хотя иногда бывает необходима электрокоагуляция раневого
канала. Наиболее опасные и вероятные осложнения — жёлчный перитонит и
кровотечение. Частота геморрагии при биопсии достигает 0,02—0,2%.
Наиболее серьёзные кровотечения наблюдают при циррозе печени и сосудистых
опухолях. Для предотвращения кровотечения лучше применять так называемую
угловую биопсию — под углом 30° к поверхности печени. Гемостаз
осуществляют прижатием и электрокоагуляцией.
Лапароскопия в детской онкологии
Применение лапароскопии в этой области позволяет верифицировать
диагноз онкологического заболевания у ребёнка, установить его
распространённость, предоставляет возможность взятия биопсийного материала с помощью
резекции или пункции органа, помогает выработать наиболее рациональную
тактику лечения.
Полученные в ходе исследования данные позволяют быстро определить
гистологический диагноз опухоли и начать направленную химиотерапию на
фоне продолжающегося обследования.
Несмотря на кажущуюся простоту лапароскопической процедуры в
онкологии, она потенциально опасна: в ходе опухолевого роста меняются
взаимоотношения органов и тканей, происходит смещение сосудов, меняется
устойчивость тканей к травматизации, что грозит кровотечением и перфорацией.
Уже при наложении ПП возможно повреждение опухоли при её врастании в
брюшную стенку с кровотечением, остановка которого затруднена, особенно
342
при злокачественных распадающихся опухолях. Однако риск лапароскопии при
опухолевом росте оправдан объёмом получаемой информации.
Оптимально введение лапароскопа на стороне, противоположной
расположению опухоли. При доказанной злокачественной природе опухоли задача
процедуры — исключение отдалённых метастазов и асцита. Если необходимо
уточнение топического и морфологического диагнозов, осмотр следует
начинать с зоны уже известной или предполагаемой локализации патологических
изменений.
Лапароскопия в детской гинекологии
Удобство доступа к органам малого таза, сравнительная безопасность,
высокая информативность — основные преимущества лапароскопии у девочек
с патологией внутренних половых органов. В детской гинекологии
лапароскопия бывает плановой и экстренной. Детский хирург чаще выполняет
экстренную лапароскопию у детей с подозрением на острую патологию органов
брюшной полости. Наиболее часто встречают следующие разновидности
гинекологической патологии.
1. Апоплексия яичника. Для апоплексии яичника характерно
кровоизлияние с нарушением целостности органа и кровотечением в брюшную
полость. Оперативное лечение апоплексии показано лишь при
значительном кровотечении. Оно сводится к коагуляции кровоточащей ткани,
аспирации крови из брюшной полости. К сожалению, из-за сложностей
диагностики в большинстве случаев этих больных подвергают
чревосечению. Во время лапароскопии, предпринятой по поводу болей в животе
неясной этиологии, эндохирург обнаруживает кровь в малом тазу, мелко-
кистозные изменения, иногда кисты яичников, хроническое воспаление
придатков матки.
2. Пельвиоперитонит. Диагноз ставят при наличии гнойного
пенистого выпота, гиперемии и отёка брюшины. Воспаление выражено прежде
всего в ампулярной части маточной трубы и в случае прогрессирования
процесса распространяется на брюшину малого таза. Во время операции
тщательно аспирируют гной из всех отделов, промывают брюшную полость
раствором фурацилина и метраджила, устанавливают дренажные трубки.
3. Гидатиды Морганъи. Рудиментарные остатки половых протоков
зародыша, в эмбриональном периоде не участвовавшие в формировании
функциональных структур, получили название гидатид Морганъи. Они
прикрепляются к фимбриям маточных труб. В препубертатном периоде
гидатида фаллопиевой трубы обычно трансформируется в кисту и
представляет собой более или менее крупный пузырёк на длинной тонкой ножке
длиной до 10—12 см (чаще не превышает 3—4 см). У девочек перекрут и
некроз гидатиды приводят к появлению болей в животе незначительной
интенсивности, постоянного характера, усиливающихся при ходьбе.
Гидатида Морганьи может осложниться, помимо некроза, воспалением
асептического характера, странгуляционной кишечной непроходимостью. При
правосторонней локализации процесса заболевание симулирует острый
аппендицит.
343
4. Перекрут неизменённых придатков матки. Клиническая картина
зависит от возраста. У новорождённых кисты часто достигают громадных
размеров и приводят к развитию кишечной непроходимости. У девочек
2—5 лет единственный признак кистозного образования — пальпируемое
опухолевидное образование в брюшной полости. В старшем возрасте
кисты выявляют при возникновении осложнений: перекруте ножки кисты
или разрыве кистозно-изменённого яичника.
5. Опухоли яичников у девочек уступают по частоте лишь опухолям
печени, составляя 40% от числа солидных новообразований органов
брюшной полости в детском возрасте. Наибольшее число опухолей яичников
выявляют в препубертатном и пубертатном периоде, когда наиболее
выражены гормональные сдвиги в организме. К доброкачественным опухолям
яичников у детей относят дермоидные кисты, зрелые тератомы. Среди
злокачественных — тератобластомы, дисгерминомы, гормонпродуцирующие
опухоли, рак. В детскую хирургическую клинику девочки с опухолями
попадают с синдромом болей в животе неясной этиологии, причём нет
зависимости между сроками существования опухоли и её злокачественностью.
Характерные особенности малого таза и внутренних половых
органов у девочек приводят к более частому, чем у взрослых, выходу опухолей
яичников за пределы малого таза. Вследствие их большой подвижности
возникает перекручивание ножки опухоли яичников. При меняющих
положение неполных перекрутах ножки опухоли боли могут исчезать, но
через некоторое время приступ повторяется.
Оперативная техника. Лапароскопию при подозрении на патологию
половых органов проводят в положении Тренделенбурга. При обнаружении у
девочек гинекологических заболеваний во время лапароскопии показана
следующая тактика:
1. При кистах яичников показана резекция кисты с гистологическим
исследованием.
2. При параовариальных кистах необходимо их вылущивание.
3. При перекрутах кист показано удаление кисты.
4. При пельвиоперитонитах необходимы аспирация экссудата,
промывание раствором антисептика, дренирование.
5. При апоплексии яичника показан гемостаз.
6. При гидатидах яичников необходимо их удаление.
Лапароскопическая холецистэктомия у детей
Холелитиаз и холецистит относительно редко возникают у детей, однако
имеется тенденция к ежегодному увеличению заболеваемости ЖКБ у детей.
Диагностику холелитиаза основывают, как правило, на результатах
клинического и специального обследования. Наиболее информативны УЗИ,
эндоскопическая ретроградная папиллосфинктерография, радиоизотопное сканирование.
По этиологическим факторам дети с холелитиазом могут быть разделены на 2
группы: в первой патогенез заболевания сходен с таковым у взрослых пациен-
344
тов. Это дети старшего возраста, причём преобладают девочки; для этой
группы характерны повышенное питание и нарушения функций печени, у
некоторых детей выявляют наследственную предрасположенность. Во второй группе
дети с холелитиазом имеют в анамнезе гемолитическую болезнь (серповидно-
клеточная анемия, талассемия, врождённый сфероцитоз). Сюда же относят
детей, получавших длительное время (около месяца) парентеральное питание,
перенёсших обширные резекции кишечника, тяжёлые инфекции, имеющих ки-
стофиброз и анатомические пороки развития жёлчных путей. В литературе
описаны рождения детей с камнями в жёлчном пузыре. Причём холелитиаз в
возрасте до 2 лет в 50% случаев осложняется перфорацией жёлчного пузыря и
тяжёлыми кровотечениями с высокой летальностью.
Лечение детей с ЖКБ — сложная проблема. Обычно пациенты получают
длительную консервативную терапию, диетотерапию, санаторно-курортное
лечение. Эффективность этой терапии оставляет желать лучшего. Как литолити-
ческая терапия, так и экстракопоральная литотрипсия имеет существенный
недостаток — даже полная ликвидация камней в жёлчном пузыре не избавляет
больного от ЖКБ, так как остаются патологически изменённый жёлчный
пузырь и факторы, приводящие к рецидиву камнеобразования, сохраняется лито-
генность жёлчи.
Наиболее частый симптом ЖКБ — боль в правом верхнем квадранте
живота; остальные признаки (диспепсия, желтуха, лихорадка) наблюдают
значительно реже. Отмечено наличие гемолитической анемии у многих больных каль-
кулёзным холециститом. Наиболее частая причина возникновения
гемолитической анемии — врождённый сфероцитоз, серповидно-клеточная анемия и
талассемия. Учитывая большую частоту гемолитической анемии при кальку-
лёзном холецистите, рекомендуют при выполнении спленэктомии по поводу
анемии подвергать жёлчные пути тщательной ревизии и при наличии холели-
тиаза удалять жёлчный пузырь.
Показания. Очевидно, что лапароскопическая холецистэктомия показана
детям со стойким и рецидивирующим болевым синдромом, обусловленным
наличием камней в жёлчном пузыре, не поддающимся повторным курсам
консервативной терапии. Абсолютные показания существуют при пороках
жёлчного пузыря, связанных с нарушением опорожнения органа, холестерозом,
грубой деформацией, при отключённом жёлчном пузыре.
Оперативная техника. Как и у взрослых, операция выбора при ЖКБ в
детском возрасте — ЛХЭ, имеющая свои особенности.
Первый троакар для лапароскопа диаметром 10 мм вводят параумби-
ликально ниже пупка. Ещё более низкое введение лапароскопа
приемлемо для маленьких детей. Внутрибрюшное давление не должно превышать
15 мм рт.ст., до 8-летнего возраста — 10—12 мм рт.ст.
Второй, эпигастральный порт располагают несколько ниже и лате-
ральнее, чем у взрослых. Печень маленького ребёнка относительно
больших размеров и опускается ниже, чем у старших детей. До введения
первых двух троакаров под наркозом нужно уточнить расположение печени.
Высокое введение троакаров создаёт неудобную экспозицию.
345
Четвёртый троакар у маленьких детей устанавливают вблизи гребня
подвздошной кости. Цель подобного размещения — максимально развести
инструменты, избежать касания их между собой в небольшой по объёму
брюшной полости.
Максимально раннее выделение пузырного протока предотвращает
проскальзывание камней в ОЖП. При миграции камней в пузырный
проток их возвращают обратно и накладывают дополнительную клипсу.
ИХГ применяют избирательно по тем же показаниям, что и у взрослых.
Использование электрокоагуляции у детей требует повышенной
осторожности из-за малого диаметра анатомических структур и близкого
расположения крупных сосудов.
Выраженность жировой клетчатки в шейке жёлчного пузыря
относительно меньше, чем у взрослых. То же можно сказать о расстоянии между
пузырным протоком и пузырной артерией. Это диктует необходимость
более осторожных манипуляций в зоне треугольника Кало.
Небольшая толщина стенки жёлчного пузыря A-3 мм) увеличивает
опасность перфорации органа при его мобилизации.
Операции при дивертикуле Меккеля
Частота заболеваний меккелева дивертикула составляет 1-3% среди
заболеваний ЖКТ.
Дивертикул Меккеля часто проявляет себя развитием осложнений
(изъязвление, воспаление с перфорацией или без неё, кровотечение, кишечная
непроходимость).
Первое место среди осложнений у детей по частоте и тяжести занимает
кровотечение. Для него характерны внезапность и массивность. У взрослых
кровотечение из меккелева дивертикула имеет более постепенное начало и
относительно меньшую выраженность.
Кишечная непроходимость на фоне меккелева дивертикула занимает
второе место. Чаще это инвагинация кишечника, реже — ущемление кишечных
петель остатком желточного протока. Кишечная непроходимость на почве
дивертикула может носить характер рецидивирующей.
Воспаление или перфорация дивертикула Меккеля возникает достаточно
часто. Они обусловлены пептическим изъязвлением стенки или внедрением
инородного тела. Дивертикулит часто протекает под маской острого
аппендицита. Достоверных клинических признаков и методов обследования,
позволяющих установить диагноз дивертикула Меккеля, пока на существует.
Хирургическое лечение осложнений дивертикула Меккеля зависит от
особенностей каждого из них. При простой непроходимости кишечника,
вызванной сдавлением кишечной стенки остатком (тяжом) желточного протока или
собственно дивертикулом, вполне достаточно удалить дивертикул, что не
представляет особых затруднений. При перфорации или дивертикулите резекция
поражённой или воспалённой части должна быть достаточной для удаления
патологически изменённых тканей, при этом может потребоваться
клиновидная резекция прилежащих отделов подвздошной кишки. При кровоточащем
346
дивертикуле Меккеля наиболее частая причина кровотечения — язва,
открывшаяся вследствие присутствия кислотопродуцирующего желудочного эпителия
в дивертикуле. Однако следует иметь в виду, что изъязвлённым может быть и
участок рядом расположенной части подвздошной кишки.
Большинство осложнений легко диагностировать. Достоинства
лапароскопии при этом — высокая точность диагностики, не сравнимая с другими
методиками. Лапароскопически мы имеем возможность идентифицировать уровень
источника кровотечения, в том числе и меккелева дивертикула как его
причины. При необходимости гемостаза поражённый участок кишки выводят
наружу через небольшой разрез брюшной стенки.
Лапароскопическую ревизию рекомендуют проводить от связки Трейтца
до илеоцекального угла. Кровоточащий дивертикул с участком кишки выводят
из брюшной полости либо резецируют интракорпорально.
Лапароскопия при синдроме хронических болей в животе
неясной этиологии
В повседневной практике врач часто встречается с детьми, имеющими
жалобы на рецидивирующие боли в животе. Жалобы, как правило,
недостаточно чётко сформулированы — неизвестны время появления этих симптомов,
точная локализация болей, продолжительность отдельных болевых приступов.
Клиническое исследование при этом не выявляет органических изменений.
Рецидивирующие боли в животе чаще носят функциональный характер и
возникают у 5—12% детей школьного возраста, хотя их встречают и в других
возрастных группах. Более чем в 90% случаев никаких органических
изменений для объяснения подобных болей в животе не выявляют.
Органические заболевания выявляют у 5—10% детей с рецидивирующими
болями в животе неясной этиологии. Наиболее частые причины
рецидивирующих болей в животе — обструктивные урологические заболевания с
гидронефрозом и пиелонефритом, незавершённый поворот кишечника и
рецидивирующая кишечная непроходимость, болезнь Крона и неспецифический язвенный
колит с болевым синдром (у детей часто протекает без наличия крови и слизи
в испражнениях). У 4—30% детей с рецидивирующими болями в животе
отмечают спастические запоры. Причинами болей в животе у ребёнка могут быть
пищевая аллергия и непереносимость определённых продуктов. Вопреки
распространённому мнению, глистная инвазия редко вызывает абдоминальные боли.
Детям с рецидивирующими болями в животе нередко ставят диагноз
хронического аппендицита, который после операции подтверждается
гистологически лишь у небольшой части больных. Неоправданные аппендэктомии
связаны с риском ранних и поздних осложнений, особенно у девочек.
Часто боли в животе и диспепсические явления бывают психогенными,
связанными с неуверенностью и страхом, возникающими при посещении школы.
После травмы живота, которой не было придано значения, возможно развитие
болевого синдрома, связанного с интрамуральными гематомами и сращениями
в брюшной полости. У девочек в пубертатном периоде боли могут возникать в
связи с функциональной перестройкой половой системы.
347
При осмотре ребёнка с рецидивирующими болями в животе прежде всего
следует исключить острую хирургическую абдоминальную патологию. При
отсутствии симптоматики острого живота дальнейшее ведение определяют
совместно с педиатром.
Необходимость в лапароскопическом обследовании возникает при
подозрении на острую хирургическую патологию.
УЗИ, КТ и другие неинвазивные методы эффективны при исследовании
паренхиматозных органов. Информация о состоянии подвижных и меняющих
свою конфигурацию и размеры органов, получаемая с помощью указанных
методов исследования, явно недостаточна. ФЭГДС и колоноскопия позволяют
исследовать лишь часть ЖКТ, дают представления о внутрипросветных
изменениях органов. Поэтому из малоинвазивных методов исследования только
лапароскопия позволяет судить о состоянии кишечника со стороны его
брюшинного покрова, взаимоотношениях органов, нарушениях ротации и
фиксации кишечной трубки, наличии и локализации врождённых и приобретённых
соединительнотканных образований, кист, патологии придатков матки у
девочек. С помощью лапароскопии можно изучить состояние лимфатического
аппарата брыжейки, выявить патологию большого сальника, диагностировать
некоторые виды диафрагмальных грыж, установить начальные стадии
онкологических заболеваний органов брюшной полости и осуществить биопсию. Кроме
того, лапароскопия позволяет сразу после постановки диагноза перейти к
хирургическому лечению. Безусловно, использовать эндохирургию следует после
проведения неинвазивных методов диагностики. Выполнять процедуру нужно
обоснованно и получив согласие родителей ребёнка на её проведение.
Лапароскопия при болезни Хиршспрунга
При болезни Хиршспрунга показания к операции абсолютны. Суть
оперативного лечения состоит в удалении аганглионарной части кишечника.
Существуют радикальные операции, выполняемые лапароскопическим доступом по
методикам Дюамеля—Мартина и Свенсона [9].
Лапароскопия при врождённом гипертрофическом
пилоростенозе
Лапароскопия позволяет расширить возможности постановки диагноза и
лечения заболевания у новорождённых детей.
Лапароскопическая пилоромиотомия — альтернатива открытому
вмешательству. Однако открытое вмешательство выполняют быстрее, технически оно
несложно, суммарная длина кожных разрезов для троакаров сравнима с
длиной традиционного доступа.
ЗАКЛЮЧЕНИЕ
Анализ структуры детской хирургической патологии показывает, что при
многих заболеваниях органов брюшной полости эндоскопическая хирургия имеет
преимущества перед традиционной хирургией. Лапароскопия помогает хирургу
348
в постановке диагноза, позволяет выбрать оперативную тактику, а во многих
ситуациях — выполнить радикальное вмешательство.
Развитие эндоскопической хирургии позволяет пересмотреть
традиционные принципы диагностики и лечения больных, ранее подвергавшихся
диагностической лапаротомии. Описанные выше заболевания и лапароскопические
вмешательства далеко не исчерпывают возможности эндоскопической
хирургии, остаётся неизученным применение эндоскопических методов во многих
разделах хирургии: лапароскопия новорождённых, особенности
анестезиологического обеспечения, послеоперационного ведения и т.п.
Вероятно, в следующем десятилетии лапароскопический доступ заменит у
большинства больных детей традиционную лапаротомию.
Однако выполнение лапароскопических операций требует от врача
хорошей подготовки в общей хирургии, навыков принятия и реализации решений в
ходе операции, а также при возникновении осложнений. Вопрос о том, кто
должен заниматься лапароскопией, следует решать однозначно: только
квалифицированный детский хирург, прошедший подготовку по эндоскопической
хирургии. Лапароскопия — прекрасный метод в опытных руках, но
осложнения могут быть очень серьёзными и опасными. Их профилактика во многом
зависит от опыта персонала, качества оборудования, правильности тактики
лечения.
В освоении лапароскопических вмешательств необходимо соблюдать
определённую стадийность. Первый этап — овладение техникой диагностических
процедур, затем следует приобретение навыков ручного и механического шва,
и наконец, период работы на высокопрофессиональном уровне, расширение и
внедрение сложных операций.
ЛИТЕРАТУРА
1. Рокицкий М.Р. Ошибки и опасности в хирургии детского возраста. М., 1986, 280 с.
2. Прудков М.И., Нишневич Е.В., Багманян Ш.Б. Первый опыт применения ла-
пароскопически дополненных операций при остром аппендиците. Эндохирургия
сегодня, N 4, 1995, с. 122-123.
3. Ленюшкин А.И. Методика обработки культи червеобразного отростка при ап-
пендэктомии у детей. Дисс. канд. М., 1961.
4. Исаков Ю.Ф., Дронов А.Ф., Котлобовский В.И., Поддубный И.В.
Лапароскопическая хирургия у детей — настоящее и будущее. Матер, симп. «Лапароскопические
операции у детей», Ярославль, 1996, с. 3—4.
5. Дронов А.Ф., Котлобовский В.И., Поддубный И.В. Лапароскопическая аппен-
дэктомия у детей. Новые медицинские технологии. Выпуск 1, М., 1996, с. 58—60.
6. Рошаль Л.М., Граников О.Д., Петлах В.И., Воздвиженский И.С. Лечебная
лапароскопия в неотложной хирургии детского возраста. Хирургия, 1985, 10, с. 63—66.
7. Фомченко А.И., Шмаков А.Т., Заблодский А.Н. Опыт эндоскопического
лечения синдрома припаянного сальника. Материалы симпозиума «Актуальные вопросы
лапароскопии в педиатрии», М., 1994, с. 37.
8. Блинников О.И., Дронов А.Ф., Смирнов А.Н. Лапароскопические операции
при острой спаечной кишечной непроходимости у детей. В кн.: Лапароскопическая
хирургия. Международн.конгресс. М., 1993, с. 82-87.
9. Вах N.M. Laparoscopic Treatment of Hirschsprung Disease. Laparoscopic Procedures
in Children. Utrecht. 1995, с 26-27.
349
СОКРАЩЕНИЯ
ВЖП — внепечёночные жёлчные протоки
ВБД — внутрибрюшное давление
в/в — внутривенно
в/м — внутримышечно
ВЧ — высокочастотный
ВЧЭХ — высокочастотная электрохирургия
ЖКБ — желчнокаменная болезнь
ЖКТ — желудочно-кишечный тракт
ИВЛ — искусственная вентиляция лёгких
ИХГ — интраоперационная холангиография
КПД — коэффициент полезного действия
КТ — компьютерная томография
ЛА — лапароскопическая аппендэктомия
ЛХЭ — лапароскопическая холецистэктомия
НЧ — низкочастотный
ОЖП — общий жёлчный проток
ОПП — общий печёночный проток
ОХЭ — открытая холецистэктомия
ПА — перидуральная анестезия
ПЗС — прибор с зарядовой связью
п/к — подкожно
ПП — пневмоперитонеум
РХПГ — ретроградная холангиопанкреатикография
СПВ — селективная проксимальная ваготомия
СВ — стволовая ваготомия
ТВЛ — телевизионная линия
ТО — торакоскопические операции
ТЭ — тромбоэмболия
УЗ И — ультразвуковое исследование
УФО — ультрафиолетовое облучение
ФЭГДС — фиброэзофагогастродуоденоскопия
ХДХК — хенодезоксихолиевая кислота
ХОЗЛ — хронические обструктивные заболевания лёгких
ЧЧХГ — чрескожная чреспечёночная халангиография
ЭКГ — электрокардиография
ЭКЛТ — экстракорпоральная литотрипсия
ЭПСТ — эндоскопическая папиллосфинктеротомия
ЭУ — электропроводящее устройство
ЭХ — электрохирургия
ЭХГ — электрохирургический генератор
ЯБДПК — язвенная болезнь двенадцатиперстной кишки
351