Автор: Никитин Г.А.
Теги: материальные основы жизни биохимия молекулярная биология биофизика общетехнические дисциплины химия биология микробиология
ISBN: 5-11-002513-4
Год: 1992
Текст
*
БНО
Г.А.НИКИТИН
ХИМИЧЕСКИЕ.
ОСНОВЫ
МИКРО
БИОЛОГИЧЕСКИХ
^производств
»■ д. -•■"■■ . -.■
ББК 30.16
Н62
УДК 577.1(07)
Рецензент канд. Снол. наук //. А. Василевская (Киевский
государственный университет)
Редакционная группа литературы по химии и горному делу
Редактор Н. А. Микитюк
Никитин Г. А.
Н62 Биохимические основы микробиологических производств:
Учеб. пособие.— 2-е изд., перераб. и доп.— К.: Виша шч.,
1992.—319 с: ил.
ISBN 5-11-002513-4
Приведены обобщенные сведении по технологии производств, связанных
с применением микроорганизмов. Даны представления о форме, размерах,
внутреннем строении н качественном состсее клеток микроорганизмов,
приведены основные данные о культивировании микроорганизмов,
генетические принципы, лежащие в основе получения полезных форм промышленных
микроорганизмов.
Во 2-м издании (1-е изд.— 1981 г.) освещены вопросы Снохимин
метанового броження, энергосберегающей технологии, биохимической очистки
сточных вод.
Для студентов вузов, обучающихся по специальностям ^Технология
бродильных производств», «Л1нкробиология» и «Биотехнология».
. 4002000000—024
Н М2И(04)-92 '69~91 ББК. 30-в
© Издательское объединение
«Вища школа», 198!
ISBN 5-П-0025П-4 © Г. А Никитин. 1992,
с изменениями
ПРЕДИСЛОВИЕ
Микробиологическая промышленность объединяет большое
количество производств, выпускающих пищевые, кормовые и
технические продукты: ферменты, витамины, антибиотики, аминокислоты,
органические кислоты, растворители, микробный белок и другие
вещества микробного происхождения. Микробиологические процессы
используют и в других отраслях промышленности, например
хлебопекарной, молочной, которые в целом не относятся к
микробиологическим.
В настоящее время все большее значение приобретает развитие
производства продуктов микробного происхождения для животных.
Развитие животноводства — важнейшая задача мировой проблемы
обеспечения людей мясной пищей. Огромное внимание этой
проблеме уделяется и в нашей стране.
Микробная биомасса — пенное сырье для производства
пищевого белка, поскольку микробный белок является полноценным по
аминокислотному составу и в этом отношении близок к белку
человека и животных.
Практическое значение микроорганизмов постоянно возрастает.
В соответствии с этим интенсивно развивается н
микробиологическая наука. Промышленная микробиология лежит в основе нового
направления науки — биотехнологии. В связи с возрастающим
значением этого направления возникли научно-исследовательские
учреждения, разрабатывающие различные вопросы биотехнологии.
В учебных заведениях есть кафедры и факультеты биотехнологии.
Многие учрежлеипя, не имеющие прямого отношения к
биотехнологии, в гон или иной степени занимаются вопросами, связанными с
применением микроорганизмов. Работники указанных учреждений
и студенты, изучающие биотехнологию, нуждаются н пособиях по
биохимическим основам производств, использующих
микроорганизмы.
В предлагаемом пособии обобщены материалы, содержащиеся
и специальных руководствах и касающиеся биохимических
процессов, которые происходят при культивировании микроорганизмов.
Лапы основные понятия о генетике и селекции микроорганизмов.
Селекция актчвных штаммов промышленных микроорганизмов
является очппм из важнейших вопросов микробиологических
производств. Она основана па использовании законов1 ■.< редачн
наследственных свойств и и\ изменчивости. Передача наследственных
снопов снизана с процессом размножении микроорганизмов, а нзме-
9
пение этнх свойств — с изменением структуры ДНК. Поэтому в
пособии изложены принципы, лежащие в основе процесса размноже.
пня микроорганизмов, н методы воздействия па структуру ДНК с
целью изменения свойств оггапизма. Охарактеризованы основные
вещества, способные вызывать мугашпо микроорганизмов. Кратко
описаны биохимические изменения, вызывающие появление новых
свойств. Показаны практические достижения в области
искусственного получения новых штаммов промышленных микроорганизмов с
нужными- свойствами.
Рассматриваются основные микробиологические производства,
приведены краткие сведения о химическом составе сырья, о
содержании в этом сырье веществ, необходимых для жизнедеятельности
микроорганизмов. Подробно описаны биохимические превращения,
происходящие при переработке сырья под влиянием
микроорганизмов.
Существенное внимание уделено влиянию химического состава
сред па биосинтез ферментов. В производстве ферментов это имеет
особое значение, поскольку процесс образования ферментов зависит
от наличия в среде определенного субстрата (индуктора).
Прямое отношение ко всем областям науки п производства,
затрагиваемым в данном пособии, имеет вопрос очистки сточных вод.
Технология нх очистки основана на применении биохимических
процессов, происходящих под влиянием микроорганизмов. Процесс
очистки сточных вод— неотъемлемая часть основного производства,
поскольку целью очистки является возвращение производственных
потерь в виде различных продуктов, в том числе и волы. В то же
время этот процесс рассматривается как вторичное производство,
выпускающее продукты микробного происхождения на основе
переработки производственных отходов.
Особенностью данного пособия является то, что сведения о
биохимических процессах н свойствах веществ приведены избирательно,
т. е. в связи с нх значением для технологии. Так, описание
аминокислот дается в связи с их ролью в формировании свойств белка, а
при характеристике белков акцептируется внимание на свойствах,
лежащих в основе их выделения. Жиры рассматриваются с точки
зрения их промышленного получения и способности к храпению.
Описание ферментов дается с учетом их практического значения.
В книге использованы нетрадиционные прпеМы изложения
материала, облегчающие понимание принципов биохимии. Так.
окислительное фосфорплпронаиие сравнивается с фошфосфорнлнрова-
ипем, что позволяет нскрыть аналогию этих процессов и общность
принципов биоэнергетики, в основе которых лежит перенос
водорода и электронов. Оригинально предспилеп материал о химизме
процессов брожении углеводов и окисления жирных кислот. Для
каждого процесса приведен баланс Л ГФ и восстановленных дегнд-рпге-
наз — основных факторов жпзнслеягслыюстн микробной клетки.
Дано предеlaii.TCHHe о вторичных и побочных процессах, которые
необхотнмо учитывать при п.*-работе мстдив управления
производством.
4
Для лучшего восприятия процессов, лежащих в основе
производств, их химизм представлен в виде схем.
Второе издание пособия дополнено материалом по различным
вопросам общей и специальной биохимии, в частности но биохимии
метанового брожения, практического использования биохимических
процессов в биотехнологии (энергосберегающая технология,
биохимическая очистка сточных вод, некоторые вопросы биосинтеза белка
и ферментов). Шире освещена проблемность вопросов
биотехнологии, поскольку ь настоящее время этому придается большое
значение в процессе подготовки специалистов. Это относится к
использованию процесса метанового брожения, производству препаратов
биологически активных веществ, биогаза.
С целью развития творческого мышления студентов автор счел
целесообразным во втором издании пособия привести материалы о
различных взглядах иа некоторые вопросы биохимии и
микробиологии, например на механизм окислительно-восстановительных
процессов, в результате которых образуется АТФ в анаэробных
условиях, физиологию питания метанобразующих бактерий. Глубже
освещены дискуссионные вопросы, касающиеся функции второй
спирали ДНК, представления об аминокислотном коде, возможной роли
АТФ в механизме терморегуляции иа молекулярном уровне.
2 - 2-1702
ВВЕДЕНИЕ
Микроорганизмы играют огромную роль в копрой обеспечения
человечества продуктами питания и другими товарами широкого
потребления. С давних пор микроорганизмы использовались в
технологии произволе та продуктов для человека и животных, однако
что лишь незначительная часть того, что должна дагь человеку
техническая микробиология. Для микроорганизмов в основном харак-
юрпы те же общие закономерности обмена, что н для других живых
организмов, однако они имеют специфические особенности. Одной
и» таких особенностей является многообразие осуществляемых ими
процессов п резкие индивидуальные различия в метаболизме от-
чельныч видов. Среди других живых организмов микроорганизмы
выделяются способностью широко изменять направление
метаболизма под влиянием условий культивирования или в результате
искусственном перестройки наследственных структур самой клетки. Такие
«направленные» биохимические процессы лежат в основе
большинства микробиологических производств.
В настоящее время известно более ста тысяч живых существ,
которые можно о шести к микроорганизмам. Сравнительно
небольшое количество их используется в промышленности. Большинство
микроорганизмов, хорошо изучено в морфологическом п
физиологическом отношении, однако их место в системе живых существ
определено недостаточно четко. Для эффективного использования
микроорганизмов большое значение имеет знание их естественной
классификации и филогенетических (родственных)
взаимоотношении между отдельными представителями. От этого в значительной
степени зависят совершенствование технологии и максимальное
использование возможности управления свойствами
производственных штаммов. Однако разработка естественной классификации и
определение места отдельных видов микроорганизмов в системе
является трудной задачей.
Естественная классификация микроорганизмов может бь'ть
построена на основе их генетических признаков. У животных и
растений sin признаки четко проявляются в фенотипе, создавая тем
самым морфологическую дифференциацию видов, позволяющую
определить их системашческое положение. Микроорганизмы обладают
слабыми морфологическими различиями, поэтому попытка
перенести этот принцип б мпкробнолСн ню не привела к созданию
естественной систематики чнкро^ргг.ин.-п'о^. Значительный \cnex в этом от-
Ь
ВВЕДЕНИЕ
Микроорганизмы играют огромную роль в иопршч обеспечения
человечества продуктами питания и другими товарами широкого
потребления. С давних пор микроорганизмы использовались в
технологии н[)оизводс1ва продуктов для человека и животных, однако
-iro лишь незначительная часть того, что должна дать человеку
техническая микробиология. Для микроорганизмов в основном
характерны те же общие закономерности обмена, что и для других живых
организмов, однако они имеют специфические особенности. Одной
из таких особенностей является многообразие осуществляемых ими
процессов, и резкие индивидуальные различия в метаболизме
отдельных видов. Среди других живых организмов микроорганизмы
выделяются способностью широко изменять направление
метаболизма под влиянием условий культивирования или в результате
искусственной перестройки наследственных структур самой клетки. Такие
«направленные» биохимические процессы лежат в основе
большинства микробиологических производств.
В настоящее время известно более ста тысяч живых существ,
которые можно отнести к микроорганизмам. Сравнительно
небольшое количество их используется в промышленности. Большинство
микроорганизмов хорошо изучено в морфологическом и
физиологическом отношении, однако их место в системе живых существ
определено недостаточно четко. Для эффективного использования
микроорганизмов большое значение имеет знание их естественной
классификации и филогенетических (родственных)
взаимоотношений между отдельными представителями. От этого в значительной
степени зависят совершенствование технологии и максимальное
использование возможности управления свойствами производстве!'.
пых штаммов. Однако разработка естественной классификации и
определение места отдельных видов микроорганизмов в системе
является трудной задачей.
Естественная классификация микроорганизмов может бь'ть
построена на основе их генетических признаков. У животных и расте
ннн эти признаки четко проявляются в фенотипе, создавая тем
самым морфологическую дифференциацию видов,
позволяющую'определить их систематическое положение. Микроорганизмы обладают
слабыми морфологическими различиями, поэтому попытка
перенести этот принцип в микробиологию не привела к созданию
естественной систематики мпьрооргппн.п'ов. Значительный успех в этом от-
l
ношении обеспечило использование биохимического принципа клас
сификации микроорганизмов, т. е. их различий по ферметатнвным
способностям, продуктам обмена, антигенным свойствам. Однако
и этот принцип имеет недостаток, поскольку филогенетически pai-
личные микроорганизмы часто проявляют одинаковые
биохимические признаки, а родственные микроорганизмы, имеющие общим
генотип, могут проявлять различные свойства в зависимости от
условий обитания. Поэтому классификация микроорганизмов
должна строиться на основе изучения самого генотипа, а не на основе
его частичных проявлений. Наиболее полно это отражено в генном
аппарате ДНК.
Ввиду трудности установления родственных связей мнкроорга
низмов до сих пор еще нет ясности в вопросе о том, какое
положение они занимают в мире живых существ. Для систематики живых
организмов применяются следующие таксономические категории:
мир — царство — подцарство — тип — класс — порядок —
семейство — род — вид. Весь мир живых организмов делится на три
царства: животные, растения и протисты (простейшие растительные
организмы). Микроорганизмы отнесены к последнему царству и
тем самым признана их принадлежность к растительным организ
мам. На четвертой ступени системы происходит деление
микроорганизмов на три типа, два из которых — шизофиты и грибы — вклю
чают все формы, используемые в микробиологической
промышленности. В дальнейшем на уровне классов и порядков промышленные
микроорганизмы включены в систематические единицы, носящие
распространенные (собирательные) названия: бактерии, плесневые
грибы, дрожжи, дрожжеподобные грибы. Промышленные
микроорганизмы принято делить иа физиологические группы. Названия
отдельных групп происходят от названий продуктов, которые они об
разуют (уксуснокислые, пропионовокислые, масляпокпелыс, аието-
но-бутиловые, метанобразующие), или от названий субстратов, на
которые они действуют (целлюлозоразлагающие, пектпнразлагаю
щие). Многие бактерии не имеют таких физиологических особенно
стей, поэтому промышленные названия даются им по случайным
признакам (картофельная палочка, сенная палочка) пли по
названию рода (азотобактер, лейконосток). Для плесневых грибов в
промышленности распространены родовые названии (аспергпллы,
пеницнллы, мукор, ризоп). То же самое наблюдается и в отношении
дрожжеподобиых грибов (каидида, торула, родоторула, трнхоспо-
рон). Более конкретные — видовые и раебные— различия отражены
в промышленных названиях дрожжей (винные дрожжи, спиртовые
и хлебопекарные расы «В», «Я», «М», «Краснодарские» и т. д.).
Из промышленных микроорганизмов наиболее изучены дрожжи,
плесневые грибы и некоторые бактерии, менее изучены
микроорганизмы, называемые дрожжевыми грибами. По многим признакам
они близки к дрожжам, но ие могут быть отнесены к ним из-за
отсутствия данных о'наличии у них полового процесса. По этой
причине они отнесены к классу несовершенных грибов. Эго большой
и малоизученный класс микроорганизмов, представители которого
7
находят все большее практическое применение. Наряду с
плесневыми грибами многие представители класса несовершенных грибов
являются наиболее перспективными в промышленном отношении
ввиду их неприхотливости, широкой ферментативной способности
и высокой продуктивности.
Микроорганизмы имеют ряд особенностей, определяющих их
отличие от других представителей мира живых существ. Одной из них
является строение тела микроорганизмов. Они состоят из одной или
нескольких клеток и не имеют сосудистой системы. Это
обусловливает своеобразие их тина питания, при котором питательные
вещества усваиваются через внешнюю оболочку. Такой тип питания
называется голофитпым. Это накладывает особенности на методы
промышленного выращивания микроорганизмов, заключающиеся в
необходимости помещать микроорганизмы в питательную среду и
обеспечивать максимальный контакт их с усвояемыми
компонентами. Микроорганизмы Fie имеют органов дифференцирования
питательного субстрата, однако по отношению к последнему обладают
специализацией, обусловленной определенным набором ферментов
у каждого вида. Микроорганизмы питаются через оболочку, через
нее также выделяются пз клеток различные продукты обмена.
Своеобразие типа питания микроорганизмов, вероятно, обусловило еще
одну особенность их физиологии — неполное окисление питательных
веществ. Поэтому продуктами обмена микроорганизмов являются
вещества, которые могут быть использованы человеком с самыми
различными целями. Они накапливаются во внешней среде в
значительном количестве, что позволяет создать технологию их
производства. Совокупность питательной среды и растущих в ней
микроорганизмов называют культуральной жидкостью, а совокупность
выросших микроорганизмов — культурой. Культура может быть
однородной (чистой) —состоящей из клеток одного и того же вида,
и неоднородной (смешанной) — представляющей собой сочетание
(ассоциацию) клеток различных видов микроорганизмов.
Особенность типа питания микроорганизмов позволяет создать условия,
при которых культура может находиться длительное время в
молодом, активном состоянии. Для этого достаточно обеспечить
интенсивный отток продуктов обмена от микробной клетки и
непрерывное поступление питательных веществ в клетку. В идеальных
условиях микробная клетка может бесконечно долго находиться в
молодом возрасте, т. е. в стадии размножения и активного роста, не
достигая стадии отмирания. Накопленные по этому вопросу
экспериментальные данные позволяют расширить представление о
продолжительности возрастных периодов высших живых существ.
Несовершенство путей вывода из клеток продуктов обмена и
обеспечения их свежими питательными веществами ведет к сокращению
периода активной жизнедеятельности высших живых существ.и
относительно быстрому наступлению периода старения и смерти.
Важнейшим фактором, обусловливающим практическое
применение микроорганизмов, является высокая скорость их размножения.
Для удвоения клетки в благоприятных условиях требуется около
8
получаса. За сутки из одной клетки теоретически можно получитi
около 10 млн. клеток, т. е. из 1 г около 10 т микробной массы
(биомассы). На практике эта цифра гораздо меньше. Тем не менее
реальные возможности синтеза биомассы у микроорганизмов намного
больше, чем у животных и растений. Так, в сосуде вместимостью
1000 м3, т. е. имеющем размеры (ЮХЮХЮ)м, за сутки можно
получить 10 т микробной биомассы, содержащей 5 т белка. Чтобы
получить такой привес за одни сутки от животных, необходимо иметь
стадо крупного рогатого скота не менее чем 15 тыс. голов.
Питательной средой для выращивания микроорганизмов могут
служить отходы различных производств и всевозможные виды
непищевого сырья. Это создает широкие перспективы производства
продуктов микробного происхождения для удовлетворения
потребностей животных и человека.
Микробиологические производства существуют с давних пор, но
они основывались лишь на способности микроорганизмов к
образованию некоторых продуктов обмена — этанола, уксусной, проппоно-
вой и молочной кислот. С развитием учения о микроорганизмах
резко увеличилось количество продуктов, производимых с помощью
микроорганизмов (янтарная, яблочная, лимонная, нтакоповая и
другие кислоты, ацетон, бутанол). В дальнейшем стало известно, что
микроорганизмы могут накапливать в среде или в клетке
значительные количества вторичных метаболитов, не имеющих основного
значения для физиологии продуцента, но являющихся ценными для
человека. Имеются в виду антибиотики, гербициды, каротнноиды и
другие органические соединения. Наиболее развито в настоящее
время производство антибиотиков, используемых не только для
лечебных целен, но и в качестве эффективных добавок в корм скоту.
Достижения физиологии и биохимии микроорганизмов в
последние десятилетия позволили создать условия, прн которых
микроорганизмы осуществляют усиленное образование (сверхспнтез)
основных метаболитов — аминокислот, витаминов, ферментов. Это
обеспечило создание производства указанных вещеегв, имеющих боль,
шое народнохозяйственное значение. Следует отметить, что условия,
создаваемые для интенсивного синтеза метаболитов, являются
неестественными для нормальной физиологии микроорганизма. В ряде
случаев вмешательством в структуру генного аппарата создаются
необычные формы микроорганизмов, способность которых к
сверхсинтезу какого-либо метаболита является наследственно
закрепленной, неотъемлемой частью его физиологии. Прн этом у
микроорганизмов, как правило, имеет место нарушение каких-либо других
физиологических функции, однако это не является препятствием для
практического использования таких «ненормальных» форм.
С помощью микроорганизмов производят аминокислоты —лизни,
глутамнновую, аспарагиновую кислоты, алакнп. Ведутся работы по
созданию производства метноннна и триптофана — наиболее
важных незаменимых аминокислот. Во многих странах функционирует
микробиологическое производство рибофлавина, витамина В|2,
каротина — источника витамина А. Витамин D получают из стеролов
9
микробного происхождения. Широко распространено
производство самых различных ферментов с помощью микроорганизмов. К
ним относятся прежде всего амилазы, протеазы, целлюлазы, пекто-
литические ферменты, необходимые для различных отраслей
промышленности и сельского хозяйства.
Наконец, сама микробная биомасса является иенным источником
белка для человека и животных. По своему аминокислотному
составу бе.юк микробного происхождения приближается к полноценному
животному белку. Существуют предприятия по получению
микробного белка для животных (кормового белка), и результаты его
применения свидетельствуют о том, что микробиологической
промышленности принадлежит большое будущее в решении проблемы
производства корма для животных и пнищ для человека.
В настоящее время микробиологическая промышленность бурно
развивается. Микроорганизмы — это пока единственный
экономически целесообразный путь синтеза многих веществ, необходимых
для человека, животных и для использования в промышленности.
В связи с этим происходит интенсивное развитие науки о
микроорганизмах. Открываются все новые и новые возможности
микробиологического синтеза. Однако эти возможности реализуются
недостаточно полно, но для этого есть ряд объективных причин. Существует,
например, проблема сырья для производства микробного белка и
других продуктов. Не найдены эффективные продуценты метионина
и триптофана. Нет продуцентов целлюлазы, способных
перерабатывать натуральное целлюлозосодержащее сырье. Для производства
рибофлавина, каротинов, ряда ферментов еще применяются
сравнительно дорогие питательные среды. Эти причины создают
препятствия к полной реализации возможностей практического
использования микроорганизмов, но указанные вопросы должны быть решены
в ближайшее время. Первостепенное значение при этом имеет
всестороннее изучение промышленных микроорганизмов, выявление их
естественных свойств, накопленных в процессе эволюции и
заложенных в генотипе, максимальное использование возможности
перестройки генном структуры ДНК в нужном направлении.
ГЛАВА I
СТРОЕНИЕ И ХИМИЧЕСКИЙ СОСТАВ МИКРООРГАНИЗМОВ
Микроорганизмы резко отличаются от представителен других
живых существ строением тела. Физиологической единицей всех
живых организмов является клетка. Человек, животные и
растения — многоклеточные организмы. Существует дифференциация
клеток по их назначению в живом организме. Каждый вид клеток
выполняет определенную физиологическую функцию.
Жизнедеятельность высших живых существ немыслима без взаимосвязи н
строгой координации физиологических функций отдельных видов
клеток. Микроорганизмы в этом отношении весьма своеобразны.
Большинство из них — одноклеточны, т. е. весь организм
представлен одной клеткой. Есть микроорганизмы, которые можно назвать
многоклеточными, однако количество клеток в таких организмах
невелико по сравнению с их количеством в организме животных и
растений, и все они физиологически идентичны. Многоклеточность
микроорганизмов возникает в результате незавершенного деления
клеток и не является следствием специализации их функций. Только
половые клетки, встречающиеся у большинства микроорганизмов и
называемые половыми спорами, являются специализированными в
отличие от вегетативных клеток, т. е. клеток самого тела. Имеются
еще и так называемые вегетативные споры, возникающие из
вегетативных клеток. Они отличаются от вегетативных клеток формой и
внутренним строением, но физиологической специализации не имеют.
Половые н вегетативные споры служат для размножения и
сохранения вида микроорганизмов, а функцию продуцента в технологии
любого микробиологического производства выполняют вегетативные
клетки. Таким образом, производство имеет дело с множеством
клеток микроорганизмов, идентичных по физиологии и строению тела.
По внутренней структуре и химическому составу клеток
микроорганизмы очень сходны с высшими живыми существами.
МОРФОЛОГИЯ МИКРООРГАНИЗМОВ
Основная особенность микроорганизмов — их малые размеры,
колеблющиеся в пределах от десятых долей до нескольких
микрометров и лишь в некоторых случаях (у грибов и нитчатых
бактерий) — до нескольких десятков микрометров. Микроорганизмы
видны лишь под микроскопом при увеличении в десятки и сотни раз.
Ввиду малых размеров микроорганизмов возникают трудности при
их использовании в производстве. В первую очередь это сказыпа-
и
ется на методах контроля, требующих применения сложной
микроскопической аппаратуры и препаративной техники. Кроме того,
малые размеры микроорганизмов затрудняли их выделение из куль-
туральной жидкости после выращивания, поэтому пришлось
разрабатывать специальные системы аппаратов, основанные на примене-
Рис. 1. Формы клеток бактерий, имеющих промышленное значение (Х90):
а — вегетативные клетки картофельной палочки в молодом возрасте; б — спорообразую-
щие клетки клострндиум карбоиея: в — спорообразующие клетки клострндпум клюйвери;
г — спорообразующие клеи<и бациллус мегатэриум; д — вегетативные и
спорообразующие клетки ыетамобактериуы омелянскня; е — клетки псевдоыоиас флюоресценс
ним методов фильтрации или центрифугирования при большом числе
оборотов. Другая особенность микроорганизмов — слабая
дифференциация их формы. У бактерии, например, все разнообразие
морфологии сиодптся к различным вариантам палочковидных и
шарообразных форм (рис. I—4). Есть бактерии и других форм,
например нзБИтые, нитчатые, но они в промышленности не применяются.
Палочкомпцпые бактерии, принадлежащие к разным видам, могут
различаться по размерам. Так, некоторые виды молочнокислых бак-
12
терий, анаэробные иеллюлозоразрушаюшие и другие значительно
меньше в диаметре, чем бактерии сенной и картофельной палочек.
Однако размеры каждого вида микроорганизмов могут значительно
варьировать в зависимости от условии культивирования.
Картофельная палочка или маслинокиелме бактерии при развитии на агаре
Рис. 2. Формы клеток маслянокислых бактерий, выращенных в различных
условиях (Х90):
с — спорообрззующие клетки на агаре; б — клостридии на картофельном авторе: в. г —
цепочечные и нитчатые формы на агаре
могут приобретать форму коротких тонких палочек, цепочек или
нитей (см. рис. 2, а, в, г), а на картофельном загоре появляются сильно
утолщенные формы (см. рис. 2, б). Аналогичные изменения
свойственны возбудителям брожения целлюлозы (см. рис. 3) и многим
другим бактериям.
Даже при развитии на среде одного и того же состава размеры
клеток микроорганизмов могут значительно различаться в зависи-
могти от физико-химических условий их культивирования.
13
Форма и размеры мит.роорганпшов изменяются на различных
стадиях развит» (онтогенеза). ^ бактерий, например, это касается
ьндов, способных к образованию спор, т. е. специальных
образований, ь которые превращается клетка в неблагоприятны* условиях.
Образование спор у бактерии— эш способ сохранения вида. При
этом содержимое клетки уплотняйся, клеточные органеллы
концентрируются в меньшем объеме, часть клетки, не участвующая в
процессе спорообразовании, елмирает п разрушается. В результате
имспо •■'ic'v:' появляется плотное образование— спора, которая
в блг.гомрн'П'пнч условиях снова превращается в микробную
клетку. Процесс формирования споры начинается внутри клетки, н
последняя чриобретасг вин палочки, утолщенной в центре
(веретенообразная форма) или на отном из концов клетки (барабанная
палочка). У пмогих бактерии спора имеет овальную форму и ее
сравнительно тегко отличии, от вегетативной клетки. У некоторых
бактерии споры круглые, что создает впечатление присутствия
посторонних MiiKpoopiaHiUMOB. Некоторые микроорганизмы, например
14
пропионовокислые бактерии, в зависимости от условий
приобретают палочковидную или шарообразную форму, ,не образуя спор,
однако это наблюдается редко. Изменение формы клеток в
онтогенезе свойственно многим микроорганизмам, что затрудняет их
идентификацию на производстве.
Что касается бактерий, имеющих шарообразную (кокковую)
форму, то им не свойственны такие изменения и они, как правило,
не образуют спор. Различные виды шарообразных микроорганизмов
щ
•1Ш
Рис. 4. Шарообразные формы бактерий:
/ — одиночные клеткн (коккн); S — клетки, соединенные попарно (диплококки); 8 —
цепочки на клеток (стрептококки): 4 — скопления клеток ■ виде пакетов (сарцины): в —
скопления клеток ■ виде виноградных гроздей (стафилококки)
могут различаться по размерам. Одним из существенных
морфологических отличий таких микроорганизмов является способноость
соединяться попарно, по четыре клетки, в виде цепочек или скоплений
разнообразной формы (см. рис 4). Такие формы называются
соответственно диплококками, тетракокками, стрептококками, сарцииа-
мн и стафилококками. Некоторые микроорганизмы имеют четко
выраженную способность к образованию таких форм, и этот признак
является основой их классификации. К таким микроорганизмам
относится молочнокислый стрептококк — один из возбудителей
процесса молочнокислого брожения, имеющего большое промышленное
значение.
Каждый микроорганизм имеет своеобразную форму колоний
(рис. 5), однако у различных видов микроорганизмов может быть
и большое сходство между колониями. Более характерные
индивидуальные отличия имеют формы колоний в самом начале
образования, когда они видны лишь под микроскопом (рис. 6).
Иначе обстоит дело с морфологией дрожжей (рис. 7) и дрожже-
подобных грибов. Эти микроорганизмы имеют большие размеры,
чем бактерии. Если толщина клеток бактерий находится в пределах
одного микрометра, то толщина клеток дрожжей составляет 2—
4 мкм. Длина палочковидных бактерий варьирует в пределах 1—5,
клеток дрожжей — 6—8 мкм. Дрожжи, принадлежащие к различным
семействам, легко различить по форме делящихся клеток, однако
16
д ^*^ х. —-г е
Рис. 5. Колонии бактерий в возрасте 3 сут (Х2,5):
а — картофельная палочка; б — клострнднум карбонсП; в — клистридиум клюйаери: *-
бациллус ыегат9рнум; д — метанобактсрнум омслянскиА; fl — пеевдомонас флюоресценс
Рис. (3. Л\||кроколон||ц бактерий в возрасте 18—20 ч (Х90) (.«означения re же,
что и на рис. 5)
различия между отдельными расами и даже видами визуально
обнаружить невозможно. Для этого необходимо исследовать другие
признаки.
Рис. 7. Почкующиеся, спорообразующие клетки и
скопления неразделившихся дрожжевых клеток
Клетки дрожжеподобных грибов очень близки по форме к
клеткам дрожжей, однако их морфология имеет некоторые особенности^
и их можно использовать для визуального контроля. Дрожжеподоб-
ные грибы более склонны к полиморфизму, т. е. к непостоянству
размеров и формы клеток, а также к образованию псевдомицелия —
Rci ита тинная гифа
а б
Рис. 8. Формы плесневых грибов:
а — аспергнлл; С — пенионлл
длинных, часто разветвленных нитей. Следует учитывать, что
истинные дрожжи в определенных условиях также образуют такие
формы.
Наибольшими морфологическими различиями характеризуются
плесневые грибы, резко отличающиеся по форме от других микро-
18
организмов (рис. 8). Внутри группы плесневых грибов имеется чет
кая морфологическая дифференциация, по которой легко установи п.
родовую принадлежность. В ряде случаев нетрудно найти и вндоиыи
ОТЛИЧИЯ.
По некоторым морфологическим признакам плесневые грибы
напоминают высшие растения. В отличие от бактерий и дрожжей —
это многоклеточные организмы. Их тело, называемое мицелием.
представляет собой сплетение нитей (гиф), многие из которых несут
на себе органы плодоношения. Часть мицелия, подобно корням
растений, проникает в питательный субстрат и обеспечивает питание
всего организма. Воздушная часть
мицелия служит главным
образом для размножения. Способы
размножения самые
разнообразные (о них будет сказано ниже).
В данном случае речь идет об
органах спороношения, морфология
которых позволяет определить их
родовую принадлежность. Так,
представители рода пеиициллов
легко определяются по наличию
органов спороношения, имеющих
форму кисти руки (за что им
дано название «кистевик»).
Органы спороношения аслергиллов
имеют форму булавы, от которой
веерообразно отходят стеригмы
и цепочки спор. Они напоминают
струи воды, льющейся из лейки,
за что названы «леечными»
грибами. Эти споры (конидии) легко
осыпаются и в этом случае аспер-
гиллы легко спутать с
представителями другого класса грибов, например мукором или ризопом.
Органы спороношения у мукора и р изо па также имеют вид булавы,
но на головках этих грибов нет никаких образований. Споры у инх
образуются внутри головок и внимательное наблюдение позволяет
легко отличить их по этому признаку от аспергиллов.
Актииомицеты морфологически сходны с плесневыми грибами
(рис. 9), однако характерной особенностью их является то, что все
представители этого класса — одноклеточные организмы, т. е. весь
мицелий их состоит из одной клетки. По этому и по другим
признакам актииомицеты близки к бактериям.
Рис. 9. Формы клеток актиноми-
цетов:
а— ыицелнй; б — образование спор; в —
отдельные встияшиеся палочкн
ВНУТРЕННЕЕ СТРОЕНИЕ МИКРОБНОЙ КЛЕТКИ
Многие биохимические процессы, протекающие в живом
организме, строго локализованы, т. е. совершаются в определенных
частицах клетки, называемых органеллами, или клеточными структурами.
з*
19
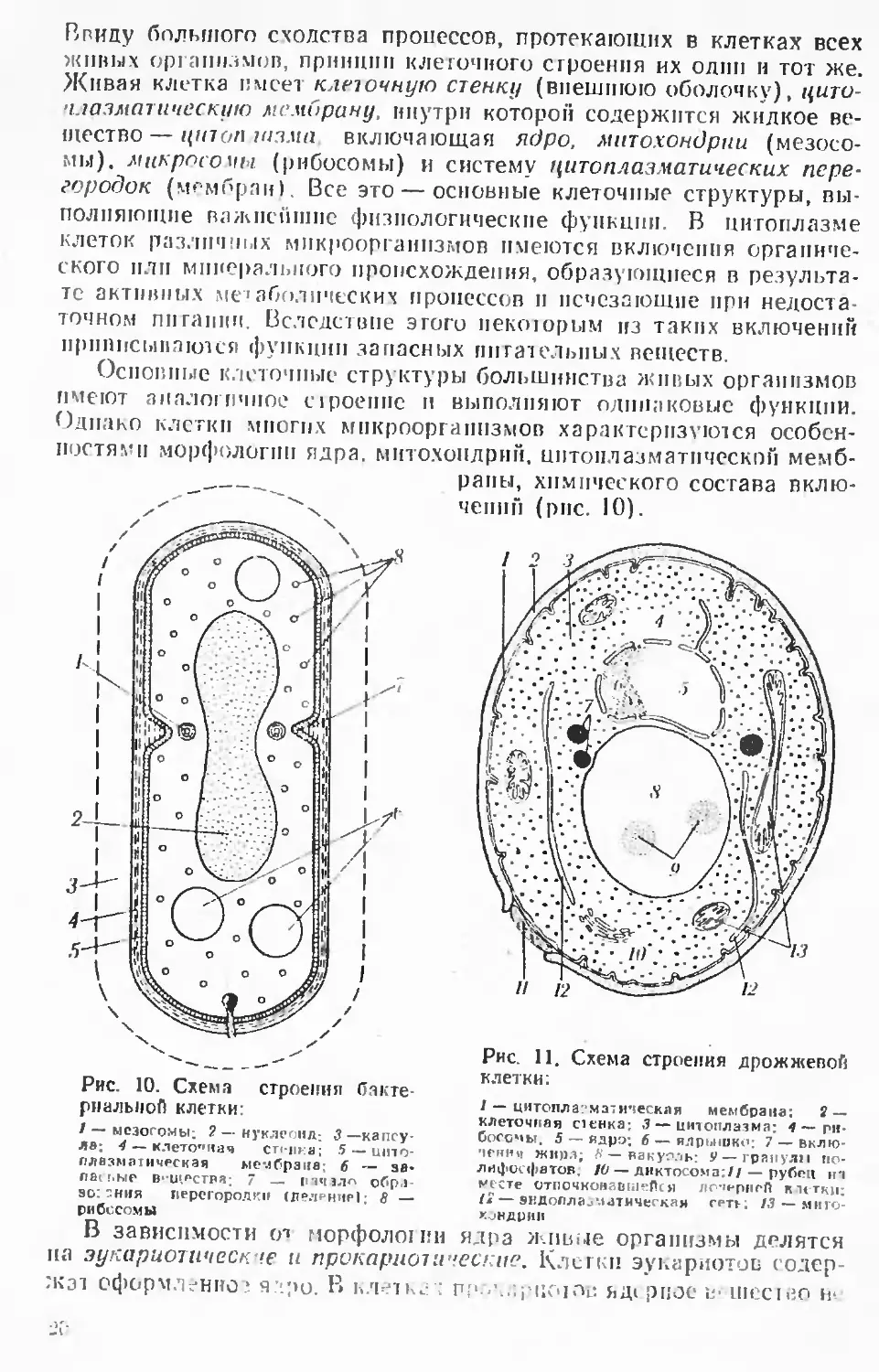
В гиду большого сходства процессов, протекающих в клетках всех
живых организмов, принцип клеточного строения их одни и тот же.
Живая клитка имеет клеточную стенку (внешнюю оболочку), цити-
•иазматическию мембрану, инутрн которой содержится жидкое
вещество— union UI3MU включающая ядро, митохондрии (мезосо-
мы). микросомы (рибосомы) и систему цитоплазматических
перегородок (мгмГ'рпн). Все это — основные клеточные структуры,
выполняющие важнейшие физиологические функции. В цитоплазме
клеток различных микроорганизмов имеются включения
органического пли минерального происхождения, образующиеся в
результате активных метаболических процессов и исчезающие при
недостаточном ппгапнн. Вследствие этого иекоюрым из таких включении
нрипцсыпаклея функции запасных питательных веществ.
Основные клеточные структуры большинства живых организмов
имеют аналогичное сiроение и выполняют одинаковые функции.
Однако клетки многих микроорганизмов характеризуются
особенностями морфологии ядра, митохондрий, цптонлазматпчеекпп мемб-
_, рапы, химического состава
включений (рис. 10).
О'ш
Рис. 10. Схема строения
бактериальной клетки:
/ — мезогомы; ? — нукдеоид; 3 —капсу-
Рис. 11.
клетки:
Схема строения дрожжевой
/ — цитопла^мэ^ическая мембрана: S —
клеточная стенка; 3 — цитоплазма; 4 —
рибосомы. 5 — ядро; б—ядрышко; 7 —
включении жира; & — вакуоль: 9— грянули ио-
л^ фосфатов, 10 — диктосома;// — рубец in
месте отпочкомасш^Пся лпчнрнгП к it тки:
{*—якдоплао'.итнческая сет»-: 13 — миго-
кондрнн
В зависимости ся морфожннн ядра жтнле организмы делятся
на эукариотииескче и прокариот ические. Клетки эукнриотоп
Содержа! СфОрМЛ^ННО^ Я.ЧрО. В ЬЛгЧК^: : ПГЧ-^..'.i-(10Ir»L: 5,Д1 piJOC U- UICCIiJO h'.
Л8; 4 — клетог,мач стенка; 5 — шпо-
плвзматичрская мембрана; 6 — ЗВ-
nair.ЫР В'-Ш.^СТРЯ; 7 — |П«ПЛП обр,1-
so: "ния перегородки (лел.рнир|; 8 —
рибосомы
имеет упорядоченной структуры и приобретает форму лишь в
определенном физиологическом состоянии организма. Среди
микроорганизмов имеются как кариоты. так и прокариоты. К карногам
относятся плесневые грибы н дрожжи, к прокариотам — бактерии
и актнномицеты.
Клетки дрожжей имеют такие же органоиды, как и клетки
высших организмов, а именно: ядро, митохондрии, рибосомы, иитоплаз-
матическую мембрану, клеточную стенку, вакуоли (рис. 11). В
клетках дрожжей имеются комплекс Гольджи, лнзосомы, а в дрожжевом
ядре обнаружены веретенообразные структуры, что указывает иа
сходство механизмов деления ядер у клеток дрожжей и высших
организмов. Плесневые грибы близки в этом отношении к дрожжам.
У бактерий и актиномицетов строение клеток иное. Главное отличие
их состоит в несовершенстве строения ядра, за что они отнесены к
прокариотам.
Клеточная стенка — это внешняя оболочка клетки, выполняющая
механическую функцию (придает форму и прочность клетке). Она
выдерживает внутриклеточное осмотическое давление до 2,5 МПа.
Клеточная стенка обладает ригидностью (прочностью) и в то же
время эластична. Толщина клеточной стенки у различных
микроорганизмов неодинакова и колеблется в пределах 10—25 им.
Клеточная стенка может быть окружена слизистым слоем — капсулой, за
щищающей клетку от внешних воздействий. Капсула служит
резервом питательных веществ нли является ненужным продуктом
жизнедеятельности. Клеточная стенка составляет 20—30 % всей массп
микроорганизма. Она состоит из двух слоев, разделенных
промежуточным слоем, не задерживающим электронные лучи. Химический
состав клеточной стенки весьма разнообразен. Основную часть ее
(до 70 % сухих веществ) составляют полисахариды, состоящие из
остатков глюкозы и маннозы. Встречаются другие гексозы и пепго-
зы, аминокислоты, амппосахара (глкжозамин, галактозамии), мура-
мовая кислота — эфир глюкозамина с молочной кислотой. До 7%
массы оболочки составляют белки, и среди них глюконротенды
(мукопротеиды). Имеются также производные липндов. В клеточ
ной стенке обнаружены специфические кислоты, получившие
название тейхоевых, или тейхонповых кислот (от слова тепхос — клетка).
Это полимеры фосфорных эфиров глицерина и рпбпта.
Различные микроорганизмы имеют специфические особенности
строения клеточной стенки. У большинства водорослей основу
структуры клеточной стенки составляют целлюлозные нити. У некоторых
водорослей клеточные стенки пропитываются кремнеземом и
карбонатом кальция. Клеточные стенкн большинства мниелнальных
грибов содержат нити (мпкрофнбрнллы) из хитина. Бывают также
целлюлозные нити. У дрожжей клеточные стенкн имеют другой
состав: они содержат главным образом глгокг.н со связями 1—3 и 1—6,
маинан со связями 1—2, 1—3, 1 —6, небольшое i-олпчество белков,
липндов и глюкозамина. Для клеточных стеной бллктерпй
характерно наличие тейхоевых кислот и глюкопепть.дов, называемых
мукопептидами, -тли чургинами.
4 - 2-1702
21
Молекулы веществ, расположенные на внешней поверхности
клеточной стсики. содержат ионизированные атомные группировки,
в результате чего клетки имеют заряд, называемый
дзета-потенциалом. Поверхность клеток большинства микроорганизмов заряжена
отрицательно. Изоэлектрическая точка их находится в кислой зоне,
что необходимо учитывать при разработке методов осаждения и
выделения микроорганизмов. С увеличением возраста клетки
величина заряда может изменяться, возрастая в стареющих культурах.
Клеточную стенку можно разрушить, не разрушая других
структур. Для этого чаще всего применяют специальный фермент — лизо-
цим, разрушающий основные химические вещества клеточной
стенки — N-аиетнлглюкозамин и N-ацетилмурамовую кислоту. В
результате получается микробная клетка, лишенная оболочки и
называемая протопластом. Прн этом клетка теряет начальную форму,
по сохраняет способность к размножению. Такие формы клеток
микроорганизмов используют для работ, связанных с получением новых
генетических вариантов, необходимых для научных целей и для
промышленности. С клетками, лишенными стенок, легко осуществлять
различные операции генетических исследований — извлечение ядер
и перенесение их из одной клетки в другую, копуляцию (слияние)
клеток и т. д.
. Цитоплазмагическая мембрана. Под наружной клеточной
стенкой находится оболочка, называемая цитоплазматнческой
мембраной. Ее функция состоит в контролировании транспорта веществ
в клетку и из клетки. Она пропускает в клетку необходимые
питательные вещества, препятствуя проникновению ненужных веществ,
и выпускает продукты обмена. Разумеется, такая способность имеет
определенные пределы н реализуется при определенных
концентрациях веществ в растворе. Толщина цитоплазматнческой мембраны
около 8 им. Масса мембраны достигает 10 % массы сухих веществ
клетки, состоит из бимолекулярного липидного слоя, покрытого с
обеих сторон белковыми слоями, содержит до 25 % углеводов
(главным образом маннозу). Липиды связаны с каротиноидамн.
Способность к кумуляции различных метаболитов создает большое
внутриклеточное давление, которое клетки выдерживают, не
разрушаясь, благодаря прочной клеточной стенке.
В цитоплазматнческой мембране содержатся цитохромная
система н дегидрогеназы. Цитоплазматнческая мембрана v бактерий
и грибов имеет ответвления, переходящие во внутриклеточные
(цитоплазматические) образования, называемые мезосомами. Эти
образования, связанные с цитоплазматическон мембраной, могут
разрастаться в сложную систему перегородок—эндоплазм
этическую сеть (эндоплазматический ретикулум). Они имеют систему
канальцев, по которым питательные вещества перемешаются внутрь
клетки. Вероятно, это облегчает доступ веществ к различным ор-
ганеллам клетки. Возможно, чго в процессе транспорта этих
веществ происходит их трансформация (превращение) под влияньем
ферментов, локализованных на стенках канальцев, т. е. эндоплаэ-
матическая сеть одновременно выполняет функции н передачи, и
Ж
превращения питательных веществ. Об эгом свидетельствует
существование специальных образовании, происходящих от эпдоплазма-
тической сети и называемых пластинчатым комплексом Гольджи.
Они представляют собой скопление большого количества полостей,
ограниченных мембранами. Внутри каждой полости синтезируются
сложные углеводы и глюкопротеиды. Это своеобразная фабрика
углеводов, подобно тому, как рибосомы можно назвать фабрикой
белков.
У плесневых грибов н дрожжей, как н у высших организмов,
содержатся обособленные мембранные структуры — митохондрии.
Они имеют вид слабо изогнутых эллипсовидных палочек длиной
около 1,5 и диаметром около 0,5 мкм. Их количество в клетке
колеблется от десятка у дрожжей до нескольких сотен у высших организ,-
мов. В митохондриях имеется трехслойная система перегородок,
состоящая из относительно гладкого наружного слоя,
межмембранного пространства и высокоструктуриропаипой внутренней
мембраны, образующей многочисленные складки (кристы), с тысячами
мелких частиц (выступов), прикрепленных одним концом к мембране.
На другом, свободном, конце сосредоточиваются ферменты,
осуществляющие окислительно-восстановительные процессы с переносом
электронов.
Во всех мембранных структурах совершаются важнейшие
биохимические процессы. Локализация (прикрепление) ферментов в
определенных местах мембран обусловливает разобщенность и,
следовательно, упорядоченность многочисленных ферментативных
процессов, происходящих одновременно в небольшом объеме клетки
Многослойность и искривленность мембранных образований
обеспечивает большую поверхность, необходимую для осуществления
интенсивных биохимических процессов.
Основная физиологическая функция митохондрий и мезосом—
осуществление окислительно-восстановительных процессов, в
результате которых энергия окисления органических пешеегн
превращается в биологическую энергию. Аккумулятором этой энергии
является адепозннтрифосфорпая кислота (АТФ). Поэтому
митохондрии называются энергетическими станциями клеток. У фотосин-
тезирующих микроорганизмов роль энергетических ст.чшшй
выполняют хлоропласты — окрашенные органеллы, сопержашпе интохро-
мы, каротинонды и другие пигменты, осуществляющие
энергетические процессы в клетке. В зависимости от преобладающего цвета
пигмента их называют хлоропластамн '(зеленый), родопластамн
(красный) и т. д.
Цитоплазма. Внутреннее содержимое клеток обычно называют
цитоплазмой. Это коллоидное вещество, являющееся вместилищем
всех клеточных структур и необходимых для жизнедеятельности
клетки растворенных веществ—аминокислот, жиров, углеводов и
других органических и минеральных соединений. В цитоплазме
бактериальных клеток'содержится большое количество РНК,
создающей базофильность, т. е. способность окрашиваться исиовными
красителями.
23
Микросомы. В цитоплазме клеток микроорганизмов и других
кнвых существ содержится большое количество мелкогранулярных
образовании диаметром 10—20 им. Их называют микросомами. Они
обладают способностью прн наличии нинов магния образовывать
би- и полимерные структуры. Многие из них содержат большое
количество РНК и вследствие этого называются рибосомами. В них
совершаются важнейшие биохимические процессы — синтез белка и
ферментов. В клетке бактерий насчитывается до 10 тысяч
рибосом .
Ядро — наиболее крупное морфологическое образование,
заключенное в цитоплазме клеткн. Оно выполняет важнейшую функцию
в живом организме. В ядре заложен механизм управления
процессом синтеза белка и ферментов, т. е. зашифрованы все свойства
живого организма. С делением ядра связана передача свойств по
наследству.
В клетке обычно содержится одно ядро. Оно состоит из базо-
фпльного вещества (содержит 20—40 % ДНК) и имеет сфернческую
форму. У большинства организмов ядро окружено оболочкой,
состоящей из двух слоев, разделенных внутримембранным
пространством. По морфологической структуре ядро является сложным
образованием. У высших организмов оно всегда оформлено. В период
телепня клетки ядерное вещество сосредоточивается в специальных
частицах (субьедпннцах), которые называются хромосомами.
Количество хромосом строго определенно для клеток каждого организма.
В определенной фазе развития клетки хромосомы приобретают
форму, хорошо видимую под микроскопом. Строение их различно, чаще
всего они имеют вид прямых илн искривленных палочек, v многих
организмов расположенных попарно. Каждая пара — это
родственные хромосомы. Их парность связана с половым способом
размножения, т. е. с происхождением организма от двух родителей.
а б «г
Рис. 12. Структуры ядеупого вещества в инволюционных клетках бактерий:
а — возбудители брожения келлюлоэы; 6. в — маслянокмелые бактерии; г — ецетонобути-
ловые бактгрии
Ядра микроорганизмов имеют более простое строение. У многих
микроорганизмов также обнаружены хромосомы, причем
количество их у разных видов микроорганизмов неодинаково. У кишечной
палочки, например, содержится одна хромосома, имеющая вид
замкнутого кольца. У наиболее просто организованных
микроорганизмов— вирусов — хромисомой является одиночная молекула ДНК.
Многие специалисты прс/mn.iaiают, что и у бактерий каждая нить
ДНК cooiBciciinci одн-ы хромосоме, однако параллельно evmeer-
"ч*
24
вует и другое мнение, что хромосома бактерий состоит нз многих
молекул ДНК.
Ядро в клетках бактерий находится в оформленном состоянии
лишь на определенной стадии развития — перед размножением или
в период образования инволюционных форм (рис. 12). Все остальное
время оно рассредоточено в цитоплазме в виде дискретных
(прерывистых) частиц — нуклеоидов. Нуклеоиды бактерий не отделены от
цитоплазмы мембранами. У микроскопических грибов ядерное
вещество находится также в виде нуклеонда, не имеющего оболочки,
однако оно всегда оформлено. Только клетки дрожжей и некоторых
других микроорганизмов содержат оформленное ядро, окруженное
оболочкой.
Цитоплазматические включения. Микроорганизмы содержат
несколько категорий цнтоплазматических включении различной
природы. Они расположены в цитоплазме клеток в виде гранул,
наблюдаемых под микроскопом. Основные включения — это волютнн,
жир, крахмалоподобные вещества (гликоген, гранулеза).
Встречаются включения минеральных солей.
Зерна волютина имеют сферическую форму н размеры от
нескольких десятков до 500 нм. Он представляет собой комплекс РНК
с метафосфатами, обладающими способностью к метахромазии,
г. е. окрашиванию в пурпурный цвет метнлеиовым синим. За эту
способность включение названо метахроматнном. Название «волютип>
оно получило от названия микроорганизма — спнриллум волютанс,
и котором это включение было обнаружено впервые. Зерна
волютина, по-видимому, служат резервными веществами, например
источниками азота, фосфора.
Жир находится в клетке в виде мелких капель. В клетках
дрожжевых организмов в определенных условиях может накапливаться
жира до 60 % массы сухих веществ. Его образование в значительной
степени связано с потреблением кислорода. Капли жира видны под
микроскопом без окраски или после окрашивания Суданом. У
многих микроорганизмов это триглицериды, но в ряде случаев лнпоид-
ные гранулы содержат относительно большое количество поли-Р-ок-
симасляиой кислоты. Это запасное энергетическое вещество, которое
используется прн необходимости.
В клетках микроорганизмов встречаются углеводные включения
различных типов. Чаще всего это гликоген, окрашивающийся иодом
в красно-бурый цвет (так же окрашиваются эритродекстрины).
Встречаются включения крахмалоподобного вещества,
окрашивающиеся в снний цвет и называемые гранулезой. В клетках масляно-
кислых бактерий гликоген и гранулеза образуются одповре-
. менно.
У некоторых автотрофных бактерий в результате окисления
сероводорода образуются включения серы в виде зерен или блестящих
капель. Онн могут служить запасным источником энергии.
В клетках микроорганизмов могут образовываться включения
СаС03, H2Si03 и другие нерастворимые минеральные вещества.
25
ХИМИЧЕСКИЙ СОСТАВ МИКРООРГАНИЗМОВ
Микробные клетки содержат 20—25 % сухих веществ и 75—й0 %
воды. Вода в живой клетке в основном находится в свободном
состоянии, но часть ее связана, т. е. заключена между мицеллами
коллоидных веществ. Сиободная вода легче удаляется, чем
связанная. Вода играет большую роль в жизнедеятельности клеткн. Она
является растворителем всех веществ, участвующих в обмене.
Биохимические реакции возможны лишь в том случае, если вещества
находятся в растворе. При удалении из клеток воды процесс
жизнедеятельности замедляется, однако клеткн не теряют
жизнеспособности до определенных пределов обезвоживания. По устойчивости к
обезвоживанию клеткн микроорганизмов резко отличаются от
клеток животных. Они сохраняют жизнеспособность при почти полном
удалении влаги, если при этом не происходит денатурация белка.
Большое значение имеет способ удаления влаги. Если это
происходит при низкой температуре под вакуумом или при
кратковременном контакте с теплоносителем, высушенные микроорганизмы
могут длительное время сохранять жизнеспособность. Это свойство
используется на практике для получения живых бактериальных
препаратов, для приготовления сухого посевного материала, который в
гаком виде можно хранить и транспортировать на любые
расстояния. Процесс высушивания микроорганизмов при низкой
температуре под вакуумом называется лиофильной сушкой. Для
высушивания микроорганизмов способом кратковременного контакта с
теплоносителем используются так называемые распылительные сушилки.
Культуральнан жидкость в таких сушилках распыляется до
мельчайшей взвеси в токе горячего воздуха. В этих условиях для
удаления влаги достаточно кратковременного контакта клеток с
теплоносителем.
По относительному содержанию органогенов в клетках
микроорганизмы различаются незначительно. Содержание углерода в них
составляет в среднем 50 % массы сухих веществ, азота — немного
больше 12 % у бактерий и 5 % у плесневых грибов. Водорода в
клетках всех организмов содержится около 6,7%, кислорода — 30—
40 %. Обшее количество минеральных веществ (золы) в клетках
бактерий можег значительно колебаться в зависимости от их вида
и условий выращивания. Верхний предел — около 13 % массы
микроорганизма. В состав минеральных веществ в большом количестве
входят соединения Р205 (10—50%), Na20 (11—34%), К20(8—
26 %). Содержа 1ся также MgO, CaO, соединения кремния, хлора,
железа, алюминия и очень малые количества солей меди, марганца,
бора и других элементов. Минеральные соли в клетках
микроорганизмов необходимы для регулирования осмотического давления,
активации ферментов, регулирования окнелнтельно-восстановительных
условий н рН. Минеральные соли играют также пластическую роль,
входя в состав конструктивного материала клеток. Важным
проявлением свойств минеральных веществ является антагонизм нонов.
Он заключается в том, что ионы одних металлов могут устранять
26
(нейтрализовать) токсическое действие нонов других металлов.
Такой антагонизм существует между ионами кальция и калия,
магния и натрия, магния и кальция.
Одним нз наиболее необходимых элементов для клетки
является фосфор. С тех пор как было доказано, что многие
органические вещества участвуют в обмене в виде фосфорных эфиров, стала
ясной огромная роль фосфорной кислоты и, следовательно,
фосфора в процессе жизнедеятельности живых существ. Многие реакции —
превращение гексоз в триозы, взаимопревращение гексоз,
расщепление и синтез полисахаридов и т. д. — происходят только при
условии, что реагирующие вещества находятся в виде соединений с
фосфорной кислотой. Последняя является неотъемлемой частью макро-
эргических соединений.
Важную роль в физиологии микроорганизмов играет калий. Его
присутствие обусловливает перенос фосфорных остатков. Гидролиз
АТФ и освобождение фосфатов также требуют наличия калня. Во
многих случаях его могут заменять ионы аммония NH4+. Для пре-
врящення яблочной кислоты в молочную или пировиноградную
требуется наличие ионов калия.
Кальцин выполняет в клетке роль катализатора. Некоторые
ферменты образуются при наличии солей кальция.
Многие ферменты активирует магний. Он играет большую
роль в проиесах клеточного деления.
Относительно роли натрия в живом организме данных еще
недостаточно.
Большую роль в клетке играет сера. Наличие в молекуле
белка серусодержащей аминокислоты — цистеипа — обусловливает
образование дисульфндных связен — S — S—, имеющих большое
значение в формировании структур белковых молекул. Огромное
значение в жизнедеятельности организмов имеет сульф гидр ильная
трупа — SH. Она обусловливает активность многих ферментов,
является активным началом ацилтрансфераз и, вероятно, других
ферментов.
Железо участвует в окислительно-восстановительных
процессах. Оно входит в состав цитохромов, каталазы, перокендазы.
Медь входит в состав полифенолоксидазы, оксидазы
аскорбиновой кислоты.
Кобальт является составной частью витамина Bi2.
Некоторые элементы, например серебро, способны вызывать
олнгодинамическое действие, т. е. в бесконечно малых количествах
вызывать гибель клеток микроорганизмов. Это свойство серебра
применяется для обработки (обеззараживания) питьевой воды.
По составу органических веществ клетки
микроорганизмов сходны с клетками растений и животных. Однако в клетках
микроорганизмов содержатся соединения, Fie встречающиеся в
клетках других организмов. Характерной особенностью поведения
органических веществ в клетках микроорганизмов является их
способность к образованию, различных комплексов. Это, вероятно,
приводит к взаимному усилению физиологических функций органических
27
иеществ и обусловливает высокую метаболическую активность
микроорганизмов по сравнению с организмами животных и растений.
Клетки микроорганизмов отличаются от клеток растений н
даже животных высоким содержанием белков. У большинства
микроорганизмов белки составляют до 80 % массы сухого вещества
клеток, хотя у некоторых видов относительное содержание белков
невелико (13—14 %), например у бактерий, образующих слизистые
капсулы. Белок микроорганизмов по аминокислотному составу
приближается к белку животных и является более ценным, чем белок
растений, содержащий недостаточное количество некоторых
наиболее важных дли человека и животных аминокислот.
В цитоплазме клетки микроорганизма содержатся в свободном
виде все аминокислоты.
Значительное место среди белков принадлежит нуклеопро-
тендам (до 50 % всех белков). Этим объясняется и высокое
содержание нуклеиновых кнелот (10—30% массы сухих веществ).
Большое количество пуклеонротеидов и нуклеиновых кнелот
обусловливает исключительно высокую активность клеток
микроорганизмов, их высокую скорость размножения и быструю
приспособляемость к изменяющимся условиям культивирования.
Л и п н д ы находятся в клетке в свободном и в связанном
состояниях в виде гигантских молекул с молекулярной массой до
1 000 000. В клетках молодых культур содержание липидов выше.
Общее количество их колеблется в зависимости от условий и
возраста в пределах 5—40 % массы сухих веществ. По составу лппиды
микроорганизмов сложнее и разнообразнее, чем липиды животных
и растений Кроме жиров клетки микроорганизмов иногда содержат
воск и. Предполагают, что наличие микробного'воска связано с
иммунологическими свойствами. Среди липидов микроорганизмов
большое место занимают фосфатиды, содержащие коламин и нно-
знт. Наличие значительного количества ненасыщенных жирных
кислот в лнппдах клеток бактерий обеспечивает способность липидов
к переносу электронов, что имеет большое значение в энергетике
микроорганизмов.
Высокое содержание белков и липидов в клетках
микроорганизмов имеет важное практическое значение. Большая скорость
размножения позволяет использовать их для производства белка и
жира в первую очередь как корма для животных, а затем и для
потребления человеком. Основные поставщики белка для
животных—растения. Однако в растениях, особенно злаковых,
содержится всего 10—15 % белка, в котором отсутствуют некоторые
наиболее важные аминокислоты. В силу этого для удовлетворения
потребное той животных в белке необходимо большое количество
растительного корма. Рели в растительный корм добавлять микробный
белок, потребность животных в ьорме сократится. Вот почему в
настоящее время вопрос производства кормового белка стал одним из
важных вопросов народного хозяйства.
Клетки микроорганизмов содержат многоатомные спирты (10
30 % массы сухих веществ), прежде всего глнщ-рпн, :■. также р'г.ит.
ич
инозит. Спирты в клетках микроорганизмов образуют сложные
комплексы с различными органическими веществами.
В клетках микроорганизмов распространен!.! олнгосахарнды,
содержащие до 10 остатков моиосахаров. Часто встречается диса-
харнд трегалоза, который при участии гплроксильпых i pyrin
образует с жирными кислотами соединения тина липндов. Наибольшее
количество углеводов содержится в капсулах, клеточных стенках
и цитоплазмагнческоп мембране. Имеются как гомо-, так п гстеро-
нолпозы, однако в большинстве сл\ чаев это соединения типа
гликогена и крахмала. Встречаются полимеры иеллобпуроповой
кислоты с молекулярной массой до 110 000. Среди гетерополноз o6nauv-
жены глюкозамнн, анетплталакгозамин, необычные сахара—диде-
зокенсахарнды.
Некоторые ампиосахара, например мурампиовая кислота,
содержатся только в оболочке бактерий. Среди гегерополнеахарндов
встречается гиалуроповая кислота.
Таким образом, основа химической конструкции
микроорганизмов такая же, как н других живых организмов. Однако
общераспространенные структурные элементы жпиых организмов в микробной
клетке часто находятся в сложной .химической взаимосвязи,
которая у других существ не встречается. Эго обусловливает
способность микроорганизмов к осуществлению мпоншбразпых моаболи-
ческнх процессов н их высокую ферментативную активность.
БЕЛКОВЫЕ ВЕЩЕСТВА МИКРООРГАНИЗМОВ
Белковые вещества, т. е. белки п продукты их распада, принято
называть азотистыми веществами. Массовая доля а.ют а и пил редко
превышает 20 %• Азотистыми веществами их называют, чтобы
отличить от жиров и углеводов, которые вовсе не сотержат азота.
В состав белков мпкробпою происхождения плодяi такие же
аминокислоты, как и в состав белков животыч и растений. По
аминокислотному составу белок микроорганизмов близок к белку
животных, от растительного белка отличается тем, что содержит
больше важнейших для человека и животных аминокислот.
По химической сфуктуре аминокислоты — это органические
кислоты, содержащие аминогруппу:
R—СII—СООН.
I
N11,
Можно представить себе огромное количество аминокислот,
однако существует принцип строения природных аминокислот,
который резко ограничивает их количеств') и систлпе белка. Так, п
живом организме синтезируются только а-амнпокнелогы, имеющие
аминогруппу в u-ноложенин. Пели же аминокислота имеет две
аминогруппы, то одна из них расположена в конце молекулы. В составе
белка встречается только две такие аминокислоты—лизин и
аргинин Природные аминокислоты происходят не от любых
органических кислот, а лишь от пяти жирных — уксусной, пропноновой,
масляной, валерьяновой, капроновой п двух днкарбопоных кислот —
•Д
янтарной и глутаровой. Некоторые аминокислоты содержат
радикалы циклического ряда. Содержание аминогруппы в а-положении
придает второму атому углерода асимметричность, вследствие чего
аминокислоты имеют оптические изомеры. Природные
аминокислоты имеют ограничения и в этом отношении: около 8 аминокислот,
входящих в состав белка, являются правовращающими, остальные
(около 12) —левовращающими. Для каждой аминокислоты
существует еще два изомера по конфигурации молекул, отличающиеся
расположением атомных группировок относительно
асимметрического атома углерода и составляющие D- и L-ряды. Аминокислоты,
входящие в состав белка, принадлежат только к L-ряду. В составе
пептидов некоторых микроорганизмов обнаружены D-аминокнсло-
ты, например D-алаиин содержится в клетках некоторых плесневых
грибов, D-глутаминовая кислота найдена в капсулах некоторых
бактерий. Указанные ограничения приводят к тому, что из
огромного количества возможных аминокислот в составе природных
белков их находится всего около двадцати.
Следует отметить некоторые свойства аминокислот, имеющие
большое промышленное и общебнологическое значение.
Одной из особенностей аминокислот является то, что они —
амфогерные электролиты, т. е. содержат одновременно кислотную
и щелочную группы. Это обусловливает их буферность н имеет
большое значение в метаболизме. В водном растворе аминокислоты
находятся в виде амфионов (биполярных ионов) вследствие
диссоциации кислотной и щелочной групп. При этом у большинства
аминокислот появляется два разноименных заряда, компенсирующих
друг друга. Молекулы этих аминокислот в целом
электронейтральны Только молекулы аминокислот, имеющих две аминогруппы и
две карбоксильные группы, в растворе заряжены положительно или
отрицательно в зависимости от того, какой заряд преобладает.
Механизм диссоциации аминокислот и образования биполярных ионов
можно представить так. Карбоксильная группа диссоциирует в воде
с образованием ионов карбоксила и водорода. Аминогруппа не
диссоциирует, она вначале присоединяет молекулу воды с
образованием соединения типа гидроксича аммония, который и диссоциирует
на соответствующие ионы:
#_сн-шон !!£. к- сн-сосг +- н^я—сн-cocr -j- н».
I I I ,.
NH, NUjOM NH3f -i-ОЦ-
По химической структуре аминокислоты, входящие в состав
белка, сходны между собой, в то же время каждая из и их обладает
индивидуальными особенностями, имеющими определенное
биологическое значение. Роль некоторых структурных элементов
аминокислот еще недостаточно изучена. Мы не знаем всех конкретных
функций таких структурных элементов аминокислот, как остатки
бензола, фенола, гуаинднпа, пиррола, однако несомненно, что они
имеют большое значение в формировании свойств белка и
биологических особенностей ферментов, например, специфичное!!! их
действия. Хорошо изучена роль таких функциональных групп в моле-
30
кулах аминокислот, как —СООН, —NH2, —ОН, —SH. Химические
связи, образованные указанными функциональными группами,
"обусловливают разнообразие структур и свойств белка.
Все предложенные классификации аминокислот условны.
Совершенная классификация их невозможна ввиду большой
индивидуальности каждой аминокислоты. В зависимости от количества и
вида функциональных групп аминокислоты можно разделить на
следующие группы.
1. Простые аминокислоты, содержащие только
карбоксильную группу и аминогруппу, т. е. функциональные группы,
определяющие первичную структуру белковых молекул. К ним
относятся: глицин, аланин, валим, лейцин, изолейцин, норлейцнн.
2. Днкарбоновые аминокислоты — аснарагиновая,
глутаминовая и их амиды. В молекуле белка у дикарбоновых
аминокислот остается по одной свободной карбоксильной группе,
которые определяют образование эфирных связей, гидрофильные
свойства и наличие отрицательного заряда белковых молекул. Они же
выполняют функцию связывания аммиака, превращаясь в амиды —
аспарагин и глутамии, которые по мере необходимости могут снова
превращаться в аспарагнновую и глутаминовую аминокислоты.
Однако главная роль аспарагина и глутамина заключается не
и этом. Они имеют собственные коды и являются полноправными
структурными элементами белка, как аспарагиноиая, глутаминовая
и другие аминокислоты.
3. Диаминокислоты — лизин и аргинин,— содержащие по
две аминогруппы. В молекуле белка у таких аминокислот остается
по одной свободной аминогруппе, которые обусловливают
гидрофильные свойства и наличие положительного заряда белковой
молекулы.
4. О к с и а м и но к и с л о т ы — серии, треонин, тирозин,—
содержащие гидроксильные группы, которые определяют образование
эфирных связей, и, следовательно, различных структур белковых
молекул. Наличием этих групп обусловлены также гидрофильные
свойства белка.
5. Серусодержащие аминокислоты — цистеин и ме-
тионин. Цистеин содержит сульфгидрильную группу, наличием
которой определяется образование различных структур белка,
поскольку она легко образует дисульфидную связь—S—S. Наличие
сульфгндрильной группы придает белку гидрофильные свойства.
Она, как уже было сказано, является активным началом многих
ферментов и принимает участие в переносе различных атомных
группировок, влияет на регуляцию окислительно-восстановительных
условий. Метионни благодаря наличию серы является резервом
цнетеина, одновременно выполняет другие биологические функции
в составе белковых молекул.
6. Сложные аминокислоты, состоящие из остатка
простой аминокислоты аланина и какого-либо циклического
радикала— остатка бензола (фепилаланин), фенола (тирозин), имидазо-
ла (гистидин) или индола (триптофан).
31
7. И м и и о к и с л о г а — пролин, содержит иминогруппу, хотя
и называется аминокислотой. В отношении классификации ее нельзя
включить в какую-либо группу ни по химической структуре, пи по
биохимическим функциям. Особенность структуры этой
аминокислоты, а именно, наличие имнногругшы, обусловливает образование
видоизмененной пептидной связи —СО—N<. Это приводит к де-
спирализацнн белковых молекул и, следовательно, к изменению
биологических свойств белка.
В приведенной классификации не упоминаются цистни и окси-
пролип. Они часто указываются в списках аминокислот, входящих
и состав белка. О шако в процессе биосинтеза белка они не
используются в качестве строительного материала, так как в генетическом
аппарате для них пет кодов. ДНК живого организма содержит коды
только двадцати упомянутых выше аминокислот (включая аспара-
гин и глутамип). Оксипролпн образуется уже в синтезированной
молекуле белка путем окисления пролнпа, а при гидролизе белка
он содержится в гпдролпзате. То же самое относится к цпстнпу,
который образуется из двух остатков цнетенпа уже в молекуле
белка. В гпдролпзате всегда содержится цистни.
В промышленности и народном хозяйстве большое значение
имеют так называемые незаменимые аминокислоты. Это
аминокислоты, которые в живом организме не синтезируются. Они должны
поступать в организм в готовом виде'с пищей. Для человека и
животных известно 8 незаменимых аминокислот: лизин, метиопин,
фенплалапнн, треонин, триптофан, валик, лейцин и изолейцнп.
Некоторые из них содержатся в недостаточном количестве в
растительных продуктах. Микроорганизмы в этом отношении весьма
разнообразны. Многие ил них способны строить все аминокислоты из
углеводов,мнпералы1ых веществ (дрожжи, дрожжеподобные грибы,
плесневые грибы, многие бактерии). Для некоторых
микроорганизмов, наоборот, почти все аминокислоты являются незаменимыми.
Существенное практическое значение имеет способность
аминокислот давать цветные реакции с некоторыми веществами.
Большинство цветных реакций является специфическими для
определенных функциональных групп, однако они не применяются на
практике, поскольку в естественных субстратах всегда содержатся
посторонние вещества с такими же функциональными группами,
которые мешают выявлению аминокислот. Широко распространена
на производстве и в лабораториях неспецифическая цветная
реакция, позволяющая обнаружить все аминокислоты. Это реакция
с нингидрином. Под влиянием нннгидрнпа аминокислоты
разлагаются с выделением аммиака. Последний связывается с двумя
молекулами нннгндрпна, в результате чего образуется соединение,
имеющее сине-фиолетовую окраску:
' о о о
а
Эту реакцию дают все а-аминокислоты и белки. Оиз не может
быть применена при наличии аммиака, поскольку при этом
образуется такое же соединение. Нингидриновая реакция на
аминокислоты является неотъемлемой частью хроматографического метода
определения аминокислот, наиболее распространенного в
лабораторной практике.
Практическое значение имеют некоторые пецветные реакции на
аминокислоты. Наиболее распространена и проста в выполнении
реакция с формальдегидом. Ее называют «формальным
титрованием». Формальдегид связывает аминогруппу, образуя метилеиовое
производное аминокислоты. Последняя является кислотой, и ее
можно оттитровать щелочью:
/?—сн—соон + неон -► я-сн-соон + н,о.
NH, N=CHa
Другая нецветная реакция связана с окислением аминокислот
азотистой кислотой, сопровождающемся выделением азота, по
количеству которого можно судить о количестие аминокислоты (метод
Ван-Слайка). Эта реакция сложна в выполнении и применяется
редко.
Большое значение в микробиологической промышленности
имеют некоторые физико-химические свойства белков. Так, в основе
пыделения белков лежат такие их характеристики, как
молекулярная масса, размеры молекул, наличие заряда, водной оболочки.
Молекулы белков имеют очень большие размеры, поэтому их
называют макромолекулами. Из-за больших размеров молекул белки
по свойствам напоминают клей, т. е. обладают коллоиапыми
свойствами. Этими свойствами белки значительно отличаются от
кристаллических веществ. В отлнчиеот последних белки образуют
мутные растворы, поскольку размеры их молекул больше члнпы
световой волны. Проходящие через раствор лучи отражаются от
молекул белков и рассеиваются. Из-за больших размеров белковые
молекулы не проходят через полупроницаемую перегородку, т. е.
белки не способны к диализу Это свойство используется и
промышленности для отделения белков от других веществ, способных
проходить через полупроницаемые перегородки.
Молекулярная масса белков достигает десятков шсяч, т. е. в
сотни и тысячи раз больше молекулярной массы простых веществ.
Это позволяет выделять белки центрифугированием.
Все способы выделения белков эффективны при условии их
предварительного осаждения, вернее, ликвидации факюров,
удерживающих белок в растворе. Вещества с большой молекулярной
массой нерастворимы, поскольку их молекулы не удерживаются в
растворе и выпадают в осадок. Белок же растворим в воде, несмотря
на большую молекулярную массу. Устойчивость ею в растворе
обусловлена наличием заряда молекул Заряды возникают вслед-
5 - 2-1702
33
i-iBiie наличия свободных карбоксильных групп и аминогрупп.
Преобладание тех или иных групп определяет суммарный заряд
молекулы. Большинство белков имеют отрицательный заряд, однако есть
и положительно заряженные белки, отличающиеся высоким
содержанием щелочных аминокислот—аргинина и лизина (протамнны
и гнстоиы). Молекулы белка, имеющие одинаковые заряды, в
растворе отталкиваются друг от друга, что препятствует их слипанию
и Hunaiennio в осадок. Другим фактором, препятствующим вына-
меппю молекул белков в осадок, является водная оболочка,
возникающая вокр\т молекулы белка, благодаря наличию гидрофильных
групп — COOil, —NH3, —ОН, —СО, —NH и др. Наибольшую гид-
рофпльность проявляет карбоксильная группа.
Дчя осаждения белка необходимо ликвидировать заряд и
водную оболочку молекул. Для снятия заряда молекулы не
обязательно полностью ликвидировать положительные и отрицательные
заряды, их достаточно лишь скомпенсировать, т. е. уменьшить
количество преобладающих зарядов. Количество положительных или
отрицательных зарядов нельзя уменьшить нейтрализацией
кислотных или щелочных групп, поскольку при этом образуются соли,
которые диссоциируют так же, как и кислоты, н количество зарядов
не изменится. Уменьшить количество зарядов можно только
уменьшением степени диссоциации кислотных и щелочных групп.
Степень диссоциации кислоты можно уменьшить добавлением в
раствор более сильной кислоты. Поскольку белки обладают очень
слабыми кислотными свойствами, степень диссоциации их можно
уменьшить добавлением в раствор любой кислоты. То же самое
можно сказать относительно щелочной группы белка. Таким
образом, можно уравнять количество зарядов, при этом молекулы
белка в целом не будут иметь заряда, т. е. будут находиться в изоэлек-
трическом состоянии. Для каждого белка такое состояние
соответствует определенному значению рН, которое называют изоэлектри-
ческой точкой. Белковые молекулы при этом не отталкиваются и
выпадают в осадок, поэтому достижение изоэлектрическон точки
можно определить визуально по помутнению раствора.
Ликвидация заряда не всегда является достаточным условием
для полного перевода белка в осадок, поскольку этому может
препятствовать водная оболочка молекул. Для ее снятия необходимо
добавить в раствор вещества с более сильными гидрофильными
свойствами (водоотпимающие вешества)—растворители (ацетон,
этанол), минеральные соли (сульфат аммония, хлорид натрия)
и т. д. Чаше всего для этого используют соли. Процесс осаждения
белков веществами с более, сильными гидрофильными свойствами
называется высаливанием.
Снятие водной оболочки возможно лишь при использовании
соли в большой концентрации. При наличии небольшого количества
солей растворимость белков, наоборот, может повышаться. Обьяс
ниетси это тем, что нсы солен в растворе взаимодействуют с
противоположно заг-ч/кеииымн нонгмн Ссмкошх молекул, в результате
:н
чего увеличивается количество гидрофильных ионов, окружающие
молекулу белка. Это ослабляет белок-белковое взаимодействие и
приводит к еще большему уплотнению водной оболочки. Вследствие
этого увеличивается стойкость белковых молекул в paciBope, т. е.
растворимость белка. Иными словами, увеличение количества ионов
вокруг молекулы белка обусловливает увеличение его гидрофиль-
иости и, следовательно, растворимости. Однако если концентрация
гидрофильных ионов в растворе высока, то избыток попов
отвлекает на себя поляризованные молекулы воды и полиостью снимает
водную оболочку независимо от степени ионизации белковых
молекул.
Осажденный белок можно снова перевести в раствор, однако
способность белка к растворению при этом полностью не
восстанавливается, следовательно, не восстанавливаются и его
первоначальные свойства. Потеря первоначальных свойств и растворимости
белка при осаждении называется денатурацией. Слепень
денатурации зависит от условий осаждения. Применение органических
растворителей приводит к большей степени депа1урацни, чем
применение солен, однако при низкой температуре (—3...—5°С)
денатурация не происходит.
Для полного выделения белка из раствора и освобождения его
от примесей необходимо многократное осаждение и растворение
Применение совершенных способов выделения позволило получить
белковые препараты высокой степени очистки. При этом
выяснилось, что чистые препараты белка имеют кристаллическое
строение.
При взаимодействии с водой белки с большой силон связывают
ее, образуя студнеобразную массу. Этот процесс называется
набуханием белка. Связанная вода не замерзает до температуры
—100 "С и ниже. При этом, очевидно, возможны биохимические
процессы. Этим объясняется то, что микроорганизмы не погибают
при очень низкой температуре.
Белки имеют сложное строение и очень разнообразны, что
зависит от количества аминокислот, входящих в состав их молекул,
порядка их расположения в молекуле и формы самих молекул.
Структуры белковых молекул делят на категории по возрастающей
сложности: первичную, вторичную, третичную и
четвертичную. Первичная структура — это состав и
последовательность соединения аминокислот в молекуле белка. Остатки
аминокислот связаны между собой пептидной связью —СО—NH—.
Открытие этой связи принадлежит А. Я. Данилевскому и Э. Фишеру,
создавшим пептидную теорию строения белка.
Соединение нескольких остатков аминокислот пептидной связью
называется пептидом. Белки являются полипептидами, содержащими сот-
пи остатков аминокислот. Большую роль в живом организме играют
и пептиды с небольшим количеством остатков аминокислот. Так,
трипелтид глутатиои, состоящий из остатков глутамнновой кислоты,
пистеина и глицина, является активатором протеолитических фер-
35
ментов и участвует в процессе переноса водорода. Пептидами
являются некоторые антибиотики, микробные токсины. Совершенные
методы, применяемые в настоящее время в биохимии, позволяют
раскрыть и синтезировать первичную структуру любого белка,
однако это лишь частично решает проблему искусственного
получения натурального белка. Первичная структура является только
основой для образования сложных конфигураций (структур)
белковых молекул. Остатки аминокислот в молекуле белка
соединяются между собой не только пептидной связью, образующейся в
результате взаимодействия —СООН- и —NH2-rpynn. Благодаря
наличию остатков аминокислот с двумя карбоксильными и двумя
аминогруппами в молекуле белка содержатся свободные —СООН- и
—NH2-rpynnbi, которые реагируют между собой, образуя солевые
(ионные) связи. Свободные —СООН-группы взаимодействуют с
—ОН-группами оксиамнпокпслот, при этом возникают эфирные
связи. Сульфгидрильные группы остатков цистеина соединяются
дисульфид н он с в я э ыо —S—S—. В молекуле белка
возникают н пехнмнческие связи. Важнейшей из них является водород-
пая связь, образующаяся между атомами водорода, имеющими
некоторый положительный заряд, и отрицательно заряженными
атомами кислорода и азота. Эта связь примерно в 20 раз слабее
химической, легко разрывается, по и легко восстанавливается.
Именно поэтому она имеет огромное значение в живом организме.
Возникают также еще более слабые нехимические связи, например
гидрофобные, вследствие того, что гидрофобные атомные
группировки (остатки валина, лейцина, изолепцина и др.), отталкивая
воду, оказываются в результате этого сближенными между собой.
Все перечисленные связи заставляют полипептидную цепочку
принимать различные формы. Наиболее простые из них —
вторичные структуры. Они имеют вид закрученных в виде спирали
иитей или упаковки нескольких продольно расположенных
полипептидов. В порядке очередности открытия их обозначили буквами
греческого алфавита аир. Первые называют а-спиралями, вторые —
р-складчатыми слоями или просто а- и р-структурами. В том и
другом случаях в основе образования вторичной структуры лежит
водородная связь. В а-спирали водородная связь образуется между
—СО- и —NH-группами, отстоящими друг от друга на 3—4
остатка аминокислот. В результате молекула белка закручивается так,
что —СО- и —NH-группы, расположенные через указанное
количество остатков аминокислот, оказываются рядом, и каждый виток
содержит 3—4 остатка аминокислот. Причем а-спираль может быть
правая и левая. Все открытые до сих пор а-спирали правые.
Спиральная форма обычно не распространяется на весь
полипептид, а охватывает лишь часть молекулы белка. У некоторых
белков две или больше спирали закручиваются одна вокруг
другой, образуя суперспираль (кератины, миозин мышц, фибриноген
крови).
26
В р-складчатом слое полинептидпые нити связаны между собой
тоже водородными связями, образованными —СО- и —NH-rpyn-
пами отдельных нитей. Внутри каждой нити такие связи
отсутствуют.
В процессе образования вторичных структур принимают участи^
и другие связи.
Полипептидная цепочка, имеющая спиральную или другую
форму, располагается в пространстве несвободно, а упаковывается в
определенном объеме, образуя клубки (глобулы), имеющие раз
личные размеры и форму и называемые третичной
структурой (рис. 13). В образовании третичной структуры участвуют
водородные и днсульфидные связи, вандерваальсовские (т. е. диполь-
ные, индукционные и дисперсионные) силы. Несколько полипептн-
дов, имеющих третичную
структуру, могут располагаться в
пространстве в виде комплекса,
называемого четвертичной
структурой. Такие
структуры имеют гемоглобин,
миозин, лактоглобулии, пепсин п
другие белки.
Расшифровать и
синтезировать все сложные структуры
белка пока нево1можно
Белки делятся па две
большие группы — протеины
(простые) и протеиды (сложные).
Простые белки состоят только
из аминокислот, сложные — из
простого белка и небелковой
части, называемой простетиче-
ской группой (prosteo—
присоединять). Простетнческими
группами могут быть углеводы, жиры, нуклеиновые кислоты и
другие вещества.
Простые белки делятся на группы, многие из них встречаются
в клетках микроорганизмов. Это альбумины и глобулины.
Они различаются растворимостью и дистиллированной иоде и
растворах солей. Это свойстно положено в. основу метода разделения
альбуминов и глобулинов.
В клетках микроорганизмов встречаются нротамьны и г и-
стоны. Это наипростейшие белки. Поскольку в их составе
преобладают аминокислоты с двумя аминогруппами (лизин и аргинин),
эти белки имеют щелочные свойств и положи 1ельный заряд
молекул. Гнстопы содержат не все аминокислоты. В них нет цистеина,
цистнна, триптофана, мало метиопина, фепилаланипа. Многие из
этих аминокислот незаменимые, поэгому гисюны обладают низкой
питательной ценностью дтя человека и животных. Протамнны —
простейшие белки с малой молекулярной массой (2000- 3000) и
Рис. 13. Схема третичной структуры
белка мииглобипа
6 - 2-1702
37
м;1Лы.\|И размерами молекул, вследствие чего они не свертываются
и не выпадают в осадок. Они также не содержат некоторых
аминокислот. До 80 % их массы составляет аргинин.
.Наличие других групп простых белков в клетках
микроорганизмов не характерно.
Из сложных белков, вхоаящнх в состав микроорганизмов,
содержатся глюкопрогеиды, хромопротеиды, нуклеопро-
тепды. Значение других представителен сложных белков для
микроорганизмов не достаточно ясно.
Простетическоп группой у глюкопротеидов являются углеводы
и их производные. В клетках микроорганизмов встречаются муко-
прогеп ш (муцины). Простетическоп группой их являются мукопо-
лнсахариды. например мукоитнн-серная кислота — полимер глюку-
роновон кислоты и глюкозамниа, соединенного с серной кислотой.
\\i чругнх мукополисахаридов, встречающихся в составе муцинов
микроорганизмов, можно назвать гиалуроновую кислоту. Муцины
характерны для микроорганизмов, образующих капсулы.
Простегнческой группой хромопротеидов являются какие-либо
окрашенные соединения, чаще всего производные порфипа (лорфи-
рпны). Наибольшее значение имеют порфнрпны, содержащие
железо. У микроорганизмов встречаются почти все те железонорфи-
рнновые белки, что и у других живых организмов. Это в основном
фермеи гы — ц и то хромы, каталаза, пероксидаза. В от
лнчне от животных у микроорганизмов нет таких железопор
фирпповых белков, как гемоглобин, миоглобнн. В состав мнкро
организмов, как и растении, входят магнийпорфирииы — х л о р о
ф и л л ы.
Нуклеопрогепды, небелковой частью которых являются
нуклеиновые кислоты, встречаются в клетках всех живых существ: Их
молекулярная масса достигает нескольких миллионов. Белковой
частью нуклеопротендов чаще всего являются протамины и гистоны.
У микроорганизмов, кроме этого, встречаются иуклеопротемды
иного строения.
НУКЛЕИНОВЫЕ КИСЛОТЫ
Нуклеиновые кислоты играют большую роль в живом
организме не только как составные части нуклеопротендов, по и как
самостоятельные вещества. Изучение этих веществ позволило раскрыть
механизм важнейших процессов живого организма. Общебнологн-
ческая роль нуклеиновых кислот заключается в том, что они
управляют всеми процессами и, следовательно, всеми свойствами живого
организма и передачей этих свойств по наследству. В структуре
нуклеиновых кислот заложен механизм управления биосинтезом
белков и ферментов. Микроорганизмы явились наилучшим
объектом для изучения нуклеиновых кислот. Возможности управления
процессами живого организма, открытые в результате познания
'ib
структуры и функций нуклеиновых кислот, реализованы трсжае
всего на микроорганизмах, причем получечы цепкие штаммы тля
микробиологической промышленности.
Существуют два типа нуклеиновых кис-от; р п б о ч у к лени о-
в а я (РНК) и дезоксирибоиук леи новая (ДНК). По хн
мическому строению они представляют собой пстин^клеотиль.. /'ь
клеотид — это соединение, состоящее из остатков азотистого
основания, сахара и фосфорной кислоты. Вещество, состоящее нз
остатков азотистого основания и сахара, называется нуклеозидом. 1\-
азотистых основании в состав нуклеиновых кислот вход>т двп про
изводных пурина — а д е н и и и гуанин и три производных
пиримидина— урацил, тимин и аитозин, причем в состав
РНК ие входит тимин, а в состав ДНК не входит урацил.
Следовательно, каждой тип нуклеиновой кислоты содержит всего чегыре
основании. В качестве сахара в состав РНК входит рнбоза, в
состав ДНК—дезокснрнбоза.
Все азотистые основания имеют таутомер и ы е формы. Ввит,
наличия гидрокснлыюй группы все они, кроме адеплма, могут быть
как в энольной, так и в кетоннон форме. Адепин также имеет гауто-
мерные формы. В составе нуклеиновых кислот все азотистые оспе
вания, кроме адепииа, находятся в кетонной форме.
В состав нуклеиновых кислот иногда входят дру> не производные
пурина и пиримидина, их называют минорными основаниями. /Моле
кулярная масса нуклеиновых кислот очень велика. Например, моле
кулярная масса РНК, содержащей сравнительно небольшое
количество остатков нуклеотндов, составляет 25 000 — 30 000.
Молекулярная масса РНК вируса табачной мозаики' равна 2 0U0U00, а
молекулярная масса ДНК —5 000 000 —8 000 000. Это гигантские
молекулы, длина которых в растянутом виде может достигай
0,5 см.
Нуклеиновые кислоты имеют первичную, вторичную
итретичную структуры.
Первичная структура — это порядок сое шиення оста1
ков нуклестидов фосфорно-эфнрной связью.
Схематически часть молекулы лолннуклеотнда. состоянию iu
остатков нуклеотндов (рнбонуклеотидов или дезоксирибонуклести
дов), можно представить так:
Адепин — рибоза/
>®
I уакин — рибоза^
>®
Урацил — рибоза/
>©
Цнтоэни— рибоза^
Адепин — дезокси|)нбоза<
I уаннн — дезиксирнбоза^
Тнмии — дезоксирибозач
Цигозии— дезокс|1| iiw)ja<T
6*
Молекула ДНК состоит из двух комплементарных
(взаимодополняющих) полинуклеотидов, соединенных водородными связями,
образующимися между азотистыми основаниями, причем между
адеиииом и тимипом образуются две водородные связи, а между
гуанином и цитознном — три:
HNXXf'H
о-р=о
и-
S.CHj
<£*"**•
н о
о-
О-Г^-О
н А
ЧГ I
Схематически часть молекулы ДНК можно изобразить так:
дезоксирнбоэа — аденин ::: тимнн — дезоксирнбоэа^
Хдезокснрибоза — гуанин ::: цитознн — дезоксирнбоэа^
Ф< >®
Хдезокснрнбоэа — тнмни ::: аденин —дезоксирнбоэа(
хдезокснрнбоза — цнтознн ::■ гуанин — дезоксирнбоза<
Вследствие такой структуры молекулы ДНК сумма основании
Г+ U
А + т
A-fT в ней всегда равна сумме оснований Т + Ц. Отношение
является непостоянным для ДНК различного происхождения, по
вполне определенное для каждого организма. Это отношение
определяет отличие свойств ДНК каждого организма и называется
коэффициентом специфичности. Особенно четкие видовые
особенности у ДНК микроорганизмов, где указанный коэффициент
варьирует в пределах 0.45—2.57. У животных и растений этот
коэффициент варьирует в значительно меньших пределах: 0,5—1,0.
*0
Имеются также данные и о коэффициенте специфичности РНК
различного происхождения.
Каждый вид организмов характеризуется неповторимым
строением ДНК. У микроорганизмов, где трудно определить видовую
принадлежность, эта особенность может служить таксономическим
признаком и уже применяется в классификации.
Характерной особенностью вторичной структуры нуклеиновых
кислот является их способность образовывать спирали. Этим
свойством обладают ДНК и РНК, хотя у РНК оио проявляется в
меньшей степени. Спирализация нуклеиновых кислот обусловлена
образованием водородных связей между комплементарными парами
оснований, находящихся в разных участках молекулы. В молекуле
РНК аденину комплементарен урацил, водородные связи между
ними аналогичны связям между аденином и тимином в молекуле
ДНК. Таким образом, водородные связи образуются не только
между двумя нитями ДНК, но и между
азотистыми основаниями одной и той же
нити. В молекуле РНК это приводит к
образованию различных конфигураций,
ДНК же всегда имеет внд спирали.
Вторичная структура ДНК (рис. 14)
была открыта английскими учеными
Д. Уотсоном и Ф. Криком в 1953 г.
Кроме водородных связей для
образования структуры нуклеиновых кислот
имеют значение и другие явления,
например гидрофобность азотистых
оснований.
РНК может иметь различные типы
третичной структуры; беспорядочно
расположенную в пространстве цепь,
клубок или компактные палочки,
содержащие биспиральные участки.
Предполагается, что и ДНК имеет третичную
структуру, поскольку в вытянутом состоянии
ее длина значительно больше, чем в
естественном. Возможно, что третичная
структура ДНК имеет вид спирали
второго порядка.
Нуклеотиды, входящие в состав
нуклеиновых КИСЛОТ, играют большую роль рис. И. Двойная спираль
в свободном состоянии. Важнейшим из ДНК
свободных нуклеотидов является адено-
зинтрифосфорная кислота (АТФ). Она выполняет роль
аккумулятора энергии н образуется в результате экзэргонических
окислительно-восстановительных процессов. По химической структуре
АТФ является соединением остатков аденина, рибозы и трех
остатков фосфорной кислоты:
3,4ны
То.34им
41
NH:
chj-o-®-o~©-o4B>
■ K>
Химическая связь, обозначенная к}*л.>.-.1 линией, сазынается мак-
роэргтеской связью. В молекуле АТФ имеются две такие связи.
Они содержат значительно больше энергии, чем обычные
химические связи. Соединения, имеющие такие связи, называются макро-
эргинескими. Известны макроэргические соединения, играющие
большую роль в энергетическом обмене живых организмов.
Фосфатные связи этих соединений содержат от 29,4 до 67,2 кДж/моль
отщепленного фосфата. Обычная связь фосфорных эфиров, в том
числе первая связь в молекуле АТФ, содержит 8,4—12,6 кДж
энергии.
Согласно имеющимся данным, процесс гидролиза фосфатных
связен АТФ является экзэргоннческим, т. е. идет с
уменьшением свободной энергии вещества. На основании этого принято
считать, что при гидролизе макроэргических соединений выделяется
энергия, которая используется на построение веществ.
Большую роль в организме играют не только трифосфаты аде-
позина, но и трифосфаты других пуклеозидов — гуапознптрифосфат
(ГТФ), уридинтрнфосфат (УТФ), тимндннтрнфосфат (ТТФ) и цнти-
динтрифосфат (ЦТФ). Они участвуют в отдельных звеньях
важнейших ферментативных процессов обмена веществ.
Нуклеотиды имеют огромное значение в организме как
составные части ферментом Так, адепнловая кислота (АМФ) входит в
состав активных групп (кофермептов) всех дегидрогеназ
Производное алениловой кислоты является составной частью кофермента
ацилнрооанпя (кофермента А, нлн КсА).
В coci-id ферментов дегидрогеназ входят необычные нуклеотиды.
Так, я coci;!B кофермента пиридиновых дегидрогеназ входит нуклео-
тнд, азотистым основанием которого служит амид никотиновой
кислота (рчтамн" В6). Этот кэфермент пиридиновых дегидрогеназ
является соединением остатков двух нуклеотидов—адепиннуклео-
гпда » никотинзмиднуклеотида н называется н и кот и н а м и д-
а д е и и и д и и у к л е о т и д о м (НАД).
Кофермептами других дегидрогеназ — флавиновых— являются
ф л а в и н м о и о I' у к л ео т и д (ФМН) и ф л а в и п а де и и и д и-
н > к л еи i п д (ФАД). В состав ФМН входит азотистое основание —
флавпп, а вместо рибозы— ее восстановленная форма — рибнт.
ФАД аналогично НАД состоит из остатков двух нуклеотидов — аде-
нилового и флавннового. Строение этих нуклеотидов рассмотрено
в гл. П.
42
УГЛЕВОДЫ И ЛИПИДЫ МИКРООРГАНИЗМОВ
Для микроорганизмов, как и для организмов' животных,
углеводы не являются основным строительным материалом. Это
характерно лишь для растении, являющихся источником углеводов для
всех других живых существ. Однако н у рас гений не все
производимые ими углеводы служат строительным материалом. Эту
функцию выполняют главным образом клетчатка, гемицеллюлозы,
пентозапы, пектиновые вещества. Крахмал, сахароза и некоторые
моносахариды не являются у растений строительным материалом,
а служат запасными питательными веществами.
Для промышленных микроорганизмов также характерно
накопление некоторых углеводов в качестве запасных питательных
веществ, которые и следует считать компонентами их химического
состава. К ним относится гликоген, называемый еще животным
крахмалом, поскольку он обрадуется в организме животных и
человека, где служит запасным энергетическим материалом. По
структуре гликоген близок к амплопектнну, но отличается от последнего
гсм, что ответвления в его молекуле встречаются чаще — через
каждые 12 глкжозиых остатков.
Способностью к образованию гликогена в наибольшей степени
обладают плесневые грибы н дрожжи. Гликоген окрашивается
подом в красно-бурый цвет. Эта способность используется в
микробиологической промышленности для определения физиологического
состояния микроорганизмов, поскольку накопление гликогена
происходит па определенной стадии развития культур.
В клетках некоторых микроорганизмов, например маслянокис-
лых, ацетопобутнловых, пектниразлагающнх бактерий, встречается
крахмалоподобпое вещество, называемое гранулезой.
Многие микроорганизмы образуют так называемые
бактериальные полисахариды, которые не встречаются у иных живых существ.
Из микроорганизмов, используемых в промышленности, такие
полисахариды образуют картофельная палочка и лейкопосток. Это
вредители производств. Картофельная палочка образует
полисахарид левап, представляющий собой полифруктозид, структурной
единицей которого являются метокенлпрованмые остатки фруктозы,
соединенные связью 2—6. Картофельная палочка является
вредителем хлебопекарного производства. Развиваясь в хлебных
изделиях, она превращает в левап крахмал п другие углеводы.
Лейкопосток образует полисахарид декстрап. Это полиглюкознд, в
котором остатки а-глюкозы соединены связью 1—6. Этот микроорганизм
вредитель сахарного и спиртового производства, он превращает
сахарозу в декстрап, нанося этим ущерб производству. Лейкопосток
применяется и как промышленный микроорганизм для
производства декстрапа, используемого в качестве заменителя крови. Кроме
того, из декстрана получают сефадексы — вещества с сетчастон
структурой, которые применяются в качестве молекулярных сит.
Липиды — это эфиры спиртов и высших жирных кислот. К ним
относятся жиры и жироподобные вещества, которые, в свою оче-
43
редь, делятся на воскн, фосфатиды и стериды. Важнейшие физико-
химические свойства жиров — это гндрофобность и нерастворимость
в воде. Они растворяются только в органических растворителях —
эфире, хлороформе, бензине, бечзоле п др. Роль липидов в живом
организме различна. В водном растворе создается строгая
ориентация их молекул: гидрофобная (углеводородная) часть
выталкивается из раствора, а гидрофильная группа (—СООН), наоборот,
погружается в водный раствор. В результате липнды всплывают на
поверхность и растекаются по ней гидрофобными концами вверх
мономолекулярным слоем. Кроме того, жиры являются в организме
запасными энергетическими Беществчмн. Важную роль в организме
играют также комплексы липидсв с углеводами, белками и другими
соединениями
Из липидов в клетках микроорганизмов содержатся главным
образом жиры. Некоторые дрожжеподобпые грибы образуют
значительные количества жира, что спужит основой для его
производства. Микробный жир производится пока в небольших
количествах и используется для технических н кормовых целей.
Жиры (глниернды)—это эфнры трехатомпого спирта
глицерина и жирных кислот. Ич общая формула
СН,—О—СО—Pt
Сн—о—го—/?,
СН8—О-СО—Яа,
где Ri, R2, R3 — остатки жирных кислот.
Глицерины бывают пгюстыми и сложными. В .состав простых
глицеридов входит остатки одном жирной кислоты, з состав
сложных— остатки различных жирных кислот.
В состав жиров входят главным образом остатки кислот с
четным количеством атомов углерода. Это обусловлю тем, чго
источником образования молекулы жирной кислоты в живом организме
является в основном вещество с друмя атомами углерода — ацетил-
КоА. В состяв жиров кроме насыщенных могут входить жирные
кислоты с одной, двумя, тремя и о^же четырьмя двойными связями.
Из них ча-це всего встречаются олеиновая C|sH3402, лииолевая
С-вН^О;., лннотеновая Ci8H3.X\ и ар^хнтоновая С2оНз202 кислоты
Жиры, содержащие насыщенные жирные кнсюты, имеют твердую
консистенцию, а ненасыщенные —жидкую.
Химический состав жиров животного и растительного
происхождения более постоянный, чем микробных жиров.
Большое влияние па качество жира при производстве и
хранении оказывает его способность расщепляться на глицерин и жирные
кислоты. Жиры, содержащие остатки ненасыщенных жирных
кислот, подвержены окислению в присутствии воздуха ввиду
способности кислорода присоединяться по месту двойных связей. При этом
продукты распада окисляюгеч с обрачовтннем разнообразных
веществ горького вкуса, снижающих качество жира. Окисление жира
насыплется щюгорьпчигм. Способность жиров к окислению имеет
И
отрицательное значение при хранении не только жиров, но и
других веществ — муки, крупы и многих других продуктов
растительного и животного происхождения. Химизм окисления
ненасыщенных жирных кислот можно представить так:
R—СН=СН-СООН 2.' у. Я-СН-СН-СООН.
Лнпооксндаза | |
О—О
Кислород активируется ферментом липооксидазой, который
содержится в свежих растительных и животных продуктах.
Пероксиды жиров распадаются на оксиды, причем образуется
активный кислород, который частично превращается в озон 03,
частично используется в процессе переокисления воды с
образованием пероксида Н202:
R—СН—СН—СООН .Н,°у R—СН—СН-СООН + 0,+ Н.О..
I I \/
О—О О
Озон окисляет ненасыщенные жирные кислоты с образованием
озонидов:
R— СН=СН—СООН -°' > R—СН СН—СООН.
I /
О—О—О
Озониды нестойки и распадаются с образованием альдегидов
и альде! идокиглот, которые, в свою очередь, окисляются до
соответствующих кислот:
R—СН СН—СООН-» R—СОН + НОС—СООН
I /
О—О—О
R—СООН «■ НООС—СООН.
Из пероксидов жирных кислот образуются оксикислоты:
R—СН—СН—СООН ..Н,° R—СН—СН— СООН.
II II
О—О ОН ОН
Пероксиды жирных кислот, реагируя между собой или с
ненасыщенными жирными кислотами, образуют продукты полимеризации:
Я—СН—СН—СООН R—СН—СН—СООН
О
I I I
—о о о
+ I
О—О О О
II II
R—СН— СН—СООН R—СН—СН—СООН;
Я—СН—СН—СООН Я—СН—СН-СООН
II I I
+ О О О О
I I
Я— СН=СН-СООН Я—СН— СН— СООН.
«б
При участии ненасыщенных жирных кислот с несколькими
двойными связями образуются более сложные продукты полимеризации.
Лауреат Нобелевской премии академик Н. Н. Семенов
обнаружил, что под влиянием света при наличии кислорода в жирах
происходят свободнораднкальные процессы, в результате чего также
образуются указанные выше продукты. Под влиянием кванта света
hx от молекулы ненасыщенной кислоты отщепляется радикал
водорода Н". При этом образуется свободный радикал жирной кислоты,
который присоединяет атом кислорода с образованием перекисного
радикала. Последний отнимает водород от следующей молекулы
жирной кислоты и превращается в гидроперекись, а из молекулы
жирной кислоты образуется новый свободный радикал. Последний,
присоединяя атом кислорода, дает новый перекисный радикал,
который отнимает водород у следующей молекулы жирной кислоты
с образованием тех же продуктов—гидроперекиси и следующего
свободного радикала жирной кислоты. Возникает цепная реакция,
которая длится до изменения внешних условий. Процесс не
ограничивается образованием указанных продуктов. Из гидроперекисей
жирных кислот образуются вторичные продукты — альдегиды, ке-
тоны, кислоты и другие вещества. Радикал водорода, возникший
на начальной стадии процесса, также способен присоединять атом
кислорода с образованием перекисного радикала водорода,
который превращается в конечном итоге в перекись водорода и
свободный кислород. Все промежуточные и конечные продукты свободно-
радикальных процессов вредны для организма.
Установлено, что окисление молекулы жирной кислоты в свобод-
норадикалыюм процессе происходит не по месту расположения
двойной связи, а главным образом по месту соседнего с двойной
связью атома углерода, у которого ослаблена связь с атомом
водорода. Свободнораднкальпый процесс можно представить
упрощенной схемой.
Я—СНа—СН=СН—СНа
/IV V |
R—СН—СН=СН—СНа
R-CII—СН=СН—СМа
о—о-
R—С>1а-СП=СН-СН, СООН
- ——^
К—СН—СН=С11—СНа
I
о-он
.}. я—СП—СН=СН—СНа СООН
1 ' °'> I
R—СН—СН=СН—СНа СООН и т. д.
I
о-о-
СООН
—соон + н
-сеюн „Г"0'
наоа+оа
-СООН+
46
Для контроля качества жира существуют показатели, иазыва
емые константами жиров. Наиболее важное значение в
производстве имеют следующие константы. Кислотное число—количество
миллиграммов КОН, необходимое для нейтрализации свободных
жирных кислот, содержащихся в одном грамме жира. Кислотное
число определяется титрованием и указывает на количество
свободных жирных кислот, образующихся при разложении жира.
Полученное значение необходимо сравнивать с общим количеством
кислот, входящих в состав жира. Показателем общего количества
жирных кислот является другая константа — число омыления —
количество миллиграммов КОН, необходимое для нейтрализации
всех жирных кислот, содержащихся в одном грамме жира.
Разность между значениями числа омыления и кислотного числа
называется эфирным числом. Степень ненасыщенное™ жирных кислот,
входящих в состав жира, характеризуется йодным числом, которое
показывает количество граммов иода, связывающегося 100
граммами жира.
Для оценки степени окислепности жира кислородом определяют
переписное число — количество граммов иода, выделившегося из
подпда калия иод влиянием содержащихся в жире перекисей.
Для предотвращения разложения жнра необходимо содержать
его при низкой температуре при отсутствии воды. Для
предохранения жира от окисления кислородом применяют антиокислители —
соединения, имеющие много ненасыщенных связей (токоферолы и
др.), роль которых заключается в поглощении содержащегося в
жире кислорода. При этом необходимо ограничить доступ свежего
кислорода из окружающей среды. Для предохранения жира от
окисления применяют также фермент глюкозооксидазу. Суть аитн-
окислительного действия этого фермента заключается в том, что он
окисляет глюкозу кислородом, содержащимся в жире. При этом
должна присутствовать глюкоза.
В о с к и — это сложные эфиры высокомолекулярных одпоатом-
ных спиртов и жирных кислот. Синтезируются в организмах
животных, растений и микробов.
Фосфатиды — это эфиры глицерина, высших жирных кислот
и фосфорной кислоты, один атом водорода которой замещен
остатком азотистого основания — холина или коламииа (этаноламина).
О роли этих веществ для микроорганизмов пока еще мало
сведений.
Стериды — это эфиры высокомолекулярных ароматических
спиртов — стеролов и высших жирных кислот. Они встречаются во
всех живых организмах. Большую роль в метаболизме играют
свободные стеролы. В зависимости от происхождения бывают з о о с т е-
ролы (животные), ф и то с те рол ы (растительные) имикосте-
рол ы (микробные). Типичным представителем животных стеролов
является холестерол, представителем растительных стеролов—стиг-
мастерол. Среди микроорганизмов наиболее богаты стеролами
дрожжи. Они содержат эргостерол. Все стеролы являются
провитаминами, т. с. предшественниками витаминов группы D. При облу-
47
чении ультрафиолетовыми лучами они превращаются в эти
витамины. Например, эргостерол превращается в витамин D2, 7-дегидро-
холестерол — в витамин D3 и т. д.
По химической структуре стеролы являются производными цик-
лопентанопергндрофенантрена.
Структуры различных стеролов отличаются небольшими
изменениями в боковой цепи.
ГЛАВА II
ОБЩИЕ ЗАКОНОМЕРНОСТИ ОБМЕНА ВЕЩЕСТВ
У МИКРООРГАНИЗМОВ
Важнейшей особенностью жизни является непрерывный обмен
веществ. В живом организме постоянно происходят процессы
ассимиляции (усвоение) веществ окружающей среды. Одновременно
с этим происходит непрерывная диссимиляция (разложение)
веществ самого организма. Живой организм в одно и то же время
строится и разрушается. Следовательно, жизнь — это динамический
процесс, а живой организм — непрерывно обновляющаяся система.
ОСОБЕННОСТИ ПИТАНИЯ МИКРООРГАНИЗМОВ
Для питания любого организма необходимы главным образом
углерод, азот и фосфор в отношении примерно 100 : 10 : I. В
небольшом количестве требуются и другие элементы. Источниками
углерода могут быть все органические вещества и оксид углерода (IV),
источниками азота и фосфора — различные органические и
минеральные соединения.
Организмы, синтезирующие органические вещества из
углекислого газа, называются автотрофными. К иим относятся растения
и некоторые микроорганизмы. Источником азота н фосфора для них
являются минеральные вещества. Организмы, использующие только
органические источники углерода, называются гетеротрофными.
К ним относятся человек, животные и большинство
микроорганизмов. В отношении источников азота микроорганизмы обладают
характерной особенностью по сравнению с другими организмами.
Для человека и животных необходимы органические источники
азота—белки, аминокислоты, азотистые основания. Большинство
MiiKpoopiaiiH3MOH хорошо развивается в присутствии смеси
органических и минеральных форм азота, а некоторые, например дрожжи,
предпочитают минеральные соединения азота.
Авютрофные организмы используют солнечную энергию.
Процесс образования органических веществ из углекислого газа за счет
солнечной энергии называется фотосинтезом. Некоторые автотроф-
пые микроорганизмы используют энергию окисления минеральных
веществ—аммиака, соединений серы, железа. Процесс
образования веществ из оксида углерода (IV) за счет энергии окисления
минеральных btmecrB называется хемосинтезом.
4S
Гетеротрофные организмы используют энергию окисления орга
нических веществ. Потребляя органические вещества, они
одновременно используют их в качестве источника энергии и строительного
(конструктивного) материала.
У микроорганизмов отсутствуют органы пищеварения.
Питательные вещества поступают в клетку через оболочку так называемым
голофитиым способом. Поэтому клеточная оболочка играет особую
роль в регулировании процесса поступления веществ в клетку и
вывода из нее продуктов обмена. Эту роль выполняет цнтоплазмаги
ческая мембрана, поэтому ее называют избирательной мембраной
Цитоплазматическая мембрана, как отмечалось выше,
представляет собой двойной слой липидов, покрытый с обеих сторон слоями
белков. Это делает мембрану непроницаемой для большинства
веществ: гидрофильные вещества не проходят через слои липидов,
гидрофобные— через слои белков. Тем не менее перенос веществ через
мембрану происходит. Он осуществляется с помощью специальных
систем, действие которых основано на биологических и
физико-химических законах. Система переноса обладает способностью к
саморегуляции, в основе которой лежат те же законы. Механизм
переноса веществ в клетку и продуктов обмена из клетки сложен и мало
изучен. Он основан на двух принципах: диффузии и переносе с
участием посредников (переносчиков, пермеаз). Принцип процесса
диффузии прост. Движущей силой этого процесса является
разность концентраций веществ (осмотическое давление), а также
разность потенциалов, если вещества находятся в виде ионов.
Иными словами, диффузия — это стремление к выравниванию
концентраций веществ, т. е. проявление всеобщего принципа pjBiioBeciiH
в природе. В клеточных мембранах этот принцип проявляется в
разнообразных формах. Наиболее простая из них — так называемая
пассивная диффузия, т. е. поток веществ в сторону их меньшей
концентрации. Непрерывная ассимиляция веществ внутри клетки
создает постоянную разность концентраций. Возможность такой
формы диффузии ограничена, поскольку мембрана является для
этого препятствием. Получены данные, согласно которым в
клеточной мембране есть поры, через которые вещества могут свободно
диффундировать в клетку. Через них же в клетку проникает вода,
для которой мембрана является также барьером. Проход вешеств
через поры встречает ограничения, обусловленные наличием
зарядов в порах. Проникновение вещества через поры зависит от того,
какой оно имеет заряд и какой заряд имеет пора. Иными словами,
наличие заряда в порах является одним из факторов регуляции
переноса электролитов — веществ, находящихся в ионной форме.
Ввиду малых размеров пор регулируется и проникновение молекул
неэлектролитов — веществ, не имеющих заряда.
Процесс переноса веществ с большой молекулярной массой
очень сложен, что.связано с преодолением барьера. Известные
механизмы переноса основаны прежде всего на том ж л принципе
диффузии. Одним из таких механизмов является так называемая
активная диффузия: проникающее вещество превращается в мембране
7 - 2-1702
49
в другую форму, способную растворяться и проходить через липнд-
ный и белковый слои. Пройдя через мембрану, вещество переходит
и прежнее состояние. Движущей силой при этом также является
разность копнем граций: превращение вещества в другую форму
создает разность концентраций исходной формы на границе между
средой и мембраной, а обратное превращение вещества в исходную
форму в клетке и его дальнейшее потребление создает разность
концентрации на границе между мембраной и внутриклеточной
средой. В результате этого вещество непрерывно поступает в кле(ку
и может накапливаться в ней в количествах, превышающих его
содержание в окружающей среде. В целом создается иллюзия
движения вещества против градиента концентрации. Па самом деле здесь
действует тот же всеобщий закон выравнивания концентраций и на
каждом этапе перенос вещества происходит только в сторону его
меньшей концентрации.
Следует отметить, что описанные превращения веществ из
одной формы в другую не могут быть глубокими. Вероятнее всего
такие обратимые превращения происходят не ферментативным
путем. Указанными свойствами обладают далеко не все вещества,
необходимые для питания микроорганизмов. В случае простых
веществ, например попов металлов, вообще нельзя представить себе
какой-либо переход в другую форму. В этом случае процесс
переноса осуществляется с участием специальных переносчиков — пер
м е а з, представляющих собой комплекс веществ белковой природы
Пермеазы не обладают ферментативными свойствами, они способ
ны лишь связываться с субстратом, образуя белково-субстратный
комплекс, отличающийся по свойствам от исходных белка и
субстрата. Возможно, что пермеазы — это видоизмененные ферменты,
утратившие ферментативные свойства, но сохранившие способность
связываться с субстратом. Собственно, отсутствие ферментативных
свойств обусловливает существование комплекса фермент —
субстрат в течение некоторого времени, необходимого для диффузии
через мембрану. Белки-пермеазы обладают высокой (стереохнмиче-
ской) специфичностью, т. е. «различают» даже стереоизомеры
одного и того же вещества, в связи с чем такой перенос называют
специфичным стереохимическим переносом.
Перенос белково-субстрагного комплекса через мембрану
происходит по тем же законам диффузии. Основным условием переноса,
очевидно, является то, что образующееся соединение пермеаз с
веществом растворимо н белковом и липидном слоях мембраны.
Другое условие переноса — разность концентраций. В результате
связывания вещества с пермеазами его концентрация непрерывно
уменьшается и возникает движущая сила диффузии, направленная
внутрь мембраны, где вещество и пермеазы переходят в
первоначальные состояния. Вещество не способно растворяться в мембране
и перемешаться в обратном направлении, поэтому может
накапливаться в количестве, большем, чем в окружающей среде.
Освобождающиеся пермеазы но мере накопления диффундируют в обрат:
ном направлении к внешней стороне мембраны, где конце!!грация
Ьи
свободных пермеаз непрерывно уменьшается вследствие их связи
ваиия с веществом. Таким образом, в мембране устанавливается
непрерывный поток связанных и свободных пермеаз во взанмопро
тивоположных направлениях.
Для обеспечения условий выращивания микроорганизмов в
питательной среде должны присутствовать источники углерода,
азота, фосфора и других элементов. В целом микроорганизмы
способны потреблять самые различные вещества, однако каждын вш
микроорганизмов обладает определенной, а в ряде случаев строгой
специфичностью по отношению к потребляемым веществам.
Универсальными источниками углерода являются простые-сахара — г.чю
коза, фруктоза. Дисахариды усваиваются не всеми
микроорганизмами. Способность к усвоению полисахаридов весьма различна.
Многие микроорганизмы, в том числе и ряд промышленных, не
усваивают крахмал. Способностью к потреблению клетчатки,
пектиновых веществ и многих других полисахаридов обладают лишь
некоторые виды микроорганизмов. Однако в общем можно сказать, чго
в природе нет органических веществ, которые не подвергались бы
действию микроорганизмов.
Неспособность некоторых промышленных микроорганизмов
потреблять полисахариды затрудняет использование
распространенного растительного сырья для производства различных продуктов.
Так, например, в тех производствах, где используются дрожжи и
молочнокислые бактерии, крахмалсодержащее сырье необходимо
предварительно подвергать специальной обработке с целью
превращения крахмала в сахар, поскольку указанные микроорганизмы не
усваивают крахмал. Для этого применяют какой-либо четочник
фермента амилазы — солод или другие микроорганизмы, способные
осахаривать крахмал. Самый распространенный полисахарид —
клетчатку — можно использовать в микробиологической
промышленности лишь после сложной обработки.
В отношении источников азота микроорганизмы также
проявляют специфичность. Большинство микроорганизмов усвапвае!
аминокислоты, однако неспособны к усвоению белков.
При наличии в среде многих питательных веществ миьроорга
пизмы могут потреблять их в определенной последовательности
Эта последовательность соблюдается прежде всего по отношению
к веществам одного и того же класса, в первую очередь к
углеводам. Наиболее доступной из них является глюкоза и в ее
присутствии другие углеводы не потребляются. По мере исчезновения
глюкозы из среды начинается потребление других углеводов, вначале
моносахаридов, затем более сложных углеводов. Моносахариды,
в свою очередь, тоже потребляются в определенной
последовательности. Эта последовательность в значительной степени зависит от
природы микроорганизма. Только потребление глюкозы ire зависит
от присутствия других веществ.
Очередность потребления веществ называется Яиауксией. В ее
основе лежат репляториые механизмы биосинтеза ферментов, о
которых будет сказано ниже.
51
Способность микроорганизмов к усвоению питательных веществ
обусловлена многими факторами. Прежде всего это зависит от
набора ферментов. Большое значение имеет способность веществ
к растворению. Вследствие плохой растворимости затруднено
использование в микробиологической промышленности таких
неисчерпаемых источников углерода, как газообразные углеводороды,
парафины нефти. Нерастворимость вешеств в воде затрудняет их
контакт с клетками микроорганизмов и проникновение в клетку.
Однако слабая способность микроорганизмов к усвоению этих
веществ объясняется не только их плохой растворимостью, но и
инертностью. Тем не менее парафины усваиваются. Их молекулы, адсор-
бируясь на поверхности клетки, впитываются в ее оболочку и,
соприкасаясь с цнтоилазматическон мембраной, растворяются в
содержащихся в пей липидах. В растворенном состоянии они
подвергаются действию ферментов. Вопрос усвоения таких
нерастворимых веществ, как клетчатка, пектиновые вещества, белки,
решается иначе: клетки микроорганизмов выделяют в среду ферменты,
которые гидролизуют эти вещества и превращают их в растворимые
соединения, легко проникающие в клетку. В процессе метаболизма
любых живых существ участвует значительно большее количество
соединений, чем их содержится в потребляемом продукте,
поскольку многие из этих соединений синтезируются самим организмом.
Однако не все вещества, необходимые для обмена, могут
синтезироваться организмом. Многие из них обязательно должны
присутствовать в потребляемом продукте и поступать в организм в
готовом виде. Такие вещества называют обязательными, или
незаменимыми. Если они необходимы для построения более сложных
соединений организма, то усваиваются целиком, без предварительного
разложения. Для человека и животных, например, незаменимыми
являются восемь аминокислот. Потребность в аминокислотах
микроорганизмов весьма разнообразна. Даже близкие формы могут
значительно различаться в этом отношении. Существуют бактерии,
для которых обязательными являются 23 аминокислоты. Некоторые
виды молочнокислых бактерий требуют присутствия в среде 17
аминокислот. Другие микроорганизмы могут развиваться при полном
отсутствии аминокислот в среде (дрожжи, грибы, актипомнцеты),
однако добавление аминокислот в среду стимулирует их рост.
Микроорганизмы, не способные расти при отсутствии готовых
аминокислот, называются аминогетеротрофами. Список обязательных
аминокислот для какого-либо микроорганизма называют его аминограм-
мой. Микроорганизмы, способные синтезировать все аминокислоты
и развиваться при их отсутствии, называются аминоавтотрофами.
Однако при наличии амитюкислог они переключаются на усвоение
их в готовом виде, т е. на аминогетерптрофный путь. В качестве
источника азота, необходимого для синтеза аминокислот,
микроорганизмы используют аммиак. Поскольку в молекуле аммиака
азот находится в восстановленной форме, он участвует в
образовании аминокислот без предварительного изменения. На зтом оо:о
52
вании следовало бы считать аммиачные солн лучшими тпочппкаш
азота для микроорганизмов. Однако они обладают физиологической
кислотностью: потребление ионов NH* приводит к увеличению н
среде количества ионов кислоты, например SOj , и повышенна
кислотности. Источниками азота могут бить нитраты. Наряду с
использованием азота нитратов некоторые микроорганизмы
используют и кислород этих соединений. При этом расход нитратов сильно
нозрастает, азот не успевает потребляться и в восстановленном виде
выделяется наружу. Если нитраты используются только в качестве
источников азота, они превращаются в нитраты, которые могу г
быть источником азота, если они находятся в небольшом количестве
(не более 0,003 моль). При более высоких концентрациях они
реагируют с аминогруппами некоторых ферментов, чем проявляют
токсическое действие. Некоторые микроорганизмы используют в
качестве источника азота мочевину.
Для развития микроорганизмов нужны не только
аминокислоты, но и другие вещества, например витамины. Еще в начале прош
лого века было установлено, что микроорганизмам нужны какие-то
вещества, содержащиеся в свежих растительных продуктах.
Вначале им дали названия «б и о о, «ростовые вещества»,
«факторы роста». Теперь известно, что это в основном
витамины. Для некоторых микроорганизмов они являются
обязательными компонентами среды, другие, например плесневые грибы,
дрожжи, могут расти и при их отсутствии, хотя наличие витаминов
значительно ускоряет их рост. В последнее время в понятие
«ростовые вещества» стали включать и обязательные аминокислоты.
Для некоторых микроорганизмов роль ростовых веществ играю1
амиды аминокислот—аспарагин и глутамнн Стимуляторами
роста микроорганизмов, как и всех существ, являются органические
кислоты, прежде всего янтарная кислота— промежуточный прочую
циклического окисления пнровиноградной кислоты. Стимулирующее
действие па микроорганизмы проянляют некоторые ненасыщенные
кислоты, например олеиновая, однако эти же кислоты могут оказы
вать и ингнбирующее действие.
Потребление витаминов и витамииоподобных веществ принято
называть ауксотрофией. Перечень витаминов, необходимых для дач
* ного микроорганизма, называют ауксограммой, микроорганизмы
способные синтезировать все витамины,— ауксоавтотрофами, мик
роорганизмы, нуждающиеся в витаминах,— ауксогетерспрофаии.
Для упрощения терминологии все микроорганизмы, нуждающиеся
в аминокислотах и витаминах, называют ауксотрофами. В
настоящее время ауксотрофные микроорганизмы широко
применяют в экспериментальной микробиологии в качестве индикаторных
культур.
Одной из важных особенностей этих микроорганизмов является
ю, что в результате нарушения обмена веществ у них иногда
появляется чрезмерно сильная способность к образованию какого-
либо метаболита, что п используется в микробиологической
промышленности.
- - - - ы
8 — 2-1702
ФЕРМЕНТЫ ОСНОВНЫХ БИОХИМИЧЕСКИХ ПРОЦЕССОВ
Ферменты — биологически активные вещества белковой
природы. Они осуществляют все реакции в живом организме. Ферменты
широко применяются в промышленности, где они используются для
той же цели — ускорения различных реакций, а также в
животноводстве для .ускорения процесса переваривания трудпогидролизуе-
мы.ч веществ.
Ферменты хорошо и всесторонне изучены, однако неясным
остается вопрос о механизме их действия, механизме ускорения
реакций.
Согласно современным представлениям, роль ферментов
заключается в снижении энергетического барьера молекул реагирующих
веществ. Энергетический барьер—это внутримолекулярные силы
сцепления, препятствующие взаимодействию молекул. Для
осуществления реакции необходимо уменьшить энергетический барьер,
т. е. ослабить силы сцепления, активировать молекулы, затратив
определенное количество энергии (энергия активации).
Универсальный метод активирования реагирующих молекул—
нагревание, причем во многих случаях достаточно первоначально
нагреть определенное количество молекул, затем между ними
происходит экзотермическая реакция, и выделяющейся теплоты с
избытком хватает для активации последующих молекул. Так
осуществляется горение всех веществ — газа, бензина, нефти, угля, древесины
и т. д. Если же реакция между веществами эндотермическая,
необходимо подогревать реакционную смесь в течение всего процесса.
Установлено, что количество теплоты, выделяющейся или
поглощаемой во время реакции, не зависит от величины энергетического
барьера. Это одно из важнейших положении теории катализа. В
настоящее время общепризнанной теорией ферментативного катализа
является теория фермент-субстратного комплекса, предложенная
Л. Михаэлисом и Meine» (IQ13 г.). Согласно этой теории, ферменты,
вступая во взаимодействие с веществом (субстратом) и образуя
промежуточное соединение (фермент-субстратный комплекс),
уменьшают силы внутримолекулярного сцепления, т. е. снижают
энергетический барьер и активируют реакцию.
Изучая кинетику ферментативных реакций, авторы обнаружили
их отличие от обычных химических реакции. Лри малых
концентрациях реагирующих веществ, т. е. субстрата, на который действует
фермент, наблюдается закономерность, характерная для обычных
химических реакции: скорость реакции пропорциональна
концентрации субстрата. При увеличении концентрации субстрата скорость
реакции, как и в химических процессах, находи гея в сложной
зависимости от ряда причин. Однако при дальнейшем увеличении
концентрации субстрата скорость ферментативной реакции
стабилизируется и нереааст зависеть от концентрации субстрата. Это
означает, что в процессе ферментативной реакции происходит
насыщение фермента с\-бсфа:ом. Исследование jToro явления привело
к сооа'иню yiiovniiyroii пыме г сорил де.'игвин ферментов. Согласно
5-1
этой теории, ферментативную реакцию можно предстаинть в випе
уравнения
к, к.
где е — фермент; S— субстрат; eS—промежуточное соединение,
Р— продукт реакции.
Соблюдая принцип химической кинетики, можно сделать апгшь
ферментативной реакции. Однако анализ реакции, в которой
участвуют несколько продуктов, очень сложен. Проще проанализирован,
начальную стадию реакции, когда взаимодействуют два вещее i
ва — е и S, и образуется лишь промежуточное соединение eS.
Конечный продукт Р еще не образовался. Для анализа
ферментативной реакции на такой стадии необходимо также допустить, чю
между прямой и обратной реакциями существует равновесие. Тогда,
согласно закону действующих масс, скорости прямой и обратной
реакций соответственно будут равны
V1 = K1[k\[S]—реакция второго порядка (скорость реакции
зависит от концентрации двух веществ);
l/a = /<2[eSj—реакция первого порядка (скорость реакции
зависит or концентрации одного вещества). Бывают также реакции
нулевого порядка, когда их скорость не зависит от концентрации
субстрата. Именно такая реакция происходит при насыщении фермента
субстратом.
Если между рассматриваемыми реакциями устанавливается
равновесие, то их скорости сравниваются между собой:
К, = Vit т. е. К, И [SI = /yeS].
откуда [E]fSl = ^[eSl.
Отношение Ki/Kl = Ks называется константой диссоциации
(субстратной константой).
Тогда [e][S] = /C5[eS].
В любой момент реакции концентрация фермента равна pai
иостн между его начальной концентрацией и концентрацией свя
занпого фермента:
[el = [*■>! - [*$]■'
Подставляя значение е в предыдущее уравнение, получим:
(М - I"SJ) (SI = Ks [eS],
, ci r i (SI f£Sl f5)
откуда [eSl = [e0]7f-TT^, нлн-^ = 7?7+Щ-
Принимая, что приданной скорости реакции V концентрация
фермент-субстратного комплекса будет равняться [eS], а при мпкеималь-
8*
55
ной скорости Vmox она будет соответствовать всему количеству
фермента [е0], можно записать:
'i£!=_L_ т е v - tgi
откуда
v-v lS]
nnKs+lSy
Это уравнение Михаэлиса — Ментен для скорости
ферментативной реакции. Оно имеет недостаток, так как учитывает условия
лить начальной стадии реакции и не может учесть влияние
продукта реакции. В дальнейшем Дж. Б. Холдейн и Д. Бриггс
усовершенствовали зависимость Михаэлиса — Меитеи. Они решили, что
скорость разложения промежуточного соединения eS будет
больше, если учесть, что в момент достижения равновесия оио
расщепляется не только на исходные вещества e+S, no и в какой-то
степени иа конечные продукты Р + е. Тогда общая скорость разложения
eS является суммой скоростей двух реакций, направленных в
противоположные стороны^ eS -~), т. е.
V, = K,leS] + K,leS], или V, = (К, + К3) [eS].
Тогда равенство скоростей V\ и V2 будет выражено иначе, чем
согласно уравнению Михаэлиса — Ментен, а именно:
tfil«l[S)-(K, + K.)[isSJ.
откуда
Отношение -■ * Т—- = Km называется константой Михаэлиса. По-
этому условия равенства скоростей можно записать выражением
[e][S] = /fm[eS].
После аналогичных расчетов уравнение Михаэлиса — Меитеи
приобретает вид
V-V [S]
m" Km + ISJ .
Это уравнение отличается от предыдущего лишь константой Кт,
имеющей большее значение, чем константа Ks, поскольку она позволяет
в определенной степени учитывать влияние конечного продукта
реакции.
Преобразуя уравнение Мн.\гэлнся — Меитеи, можно получить
важные сведения. Перенося знаменатель в левую часть уравнения.
56
получим
vKm+visi = vmM{S],
или
VK„
(^.x-'Ofsi.
Согласно последнему уравнению, при V ■.
Кт = IS].
l/2V„
Это значит, что константа Михаэлиса
соответствует концентрации субстрата, при которой
скорость ферментативной реакции равняется
половине ее максимальной скорости.
При стабильной концентрации фермента с = const зависимость
скорости реакции от концентрации субстрата можно выразить так,
как показано на рис. 15.
Графически константу Михаэлиса можно представить проекцией
участка кривой, соответствующего половине максимальной скорости
реакции, иа ось концентрации субстрата.
►шах
Рис. 15. Зависимость скорости
реакции от концентрации субстрата
При обработке уравнения Михаэлиса — Ментен по методу
двойных обратных величин можно получить уравнение прямой линии
типа у = ах+Ь, а именно:
К,
" IS] ^ \'
Это уравнение является линеаризацией зависимости Miisaa.inca —
Ментен и называется уравнением Лайнуивера—Eepi:a (рис. 16).
Такая графическая зависимость имеет определенные
преимущества перед графической зависимостью Михаэлиса — A'ieiiTcii. Она
позволяет, например, более точно определить Утьх, которая па кри-
57
ной Михаэлиса — Ментеи является асимптотической величиной и не
может быть определена точно. График Ланнуивера— Берна дает
возможность получить и другую лополнительную информацию
о ферментативной реакции.
Все ферменты являются белками. Каталитическими свойствами
обладают также многие обычные белки, не относящиеся к
ферментам. Как и белки, ферменты бывают простыми (однокомпонентны-
ми) и сложными (двухкомпонетнымн). Небелковая часть сложных
ферментов (кофермент) определяет силу ферментативного действия
и может быть одинаковой у многих ферментов. Белковая часть
фермента играет направляющую роль и, следовательно, определяет
его специфичность. Однокомпопептные ферменты имеют активный
Рис. 16. Графическая интерпретация
уравнения Ланнуивера — Берка
центр, играющий роль кофермента. Это определенное сочетание
остатков аминокислот или атомных группировок, способное
соединяться с субстратом и проявлять каталитическое действие. Во
многие случаях образованию таких группировок (активных центров)
способствуют металлы—цинк, магний и др. Активных центров у
простых ферментов может быть несколько.
Важное практическое значение имеет понятие об активности
ферментов. Принято использовать следующие единицы активности.
Молярная активность («число оборотов») — число молей вещества,
превращенного одним молем фермента за одну минуту (достигает
нескольких тысяч). Стандартная единица активности — количество
фермента, способное превратить один микромоль вещества за одну
минуту (следовательно, в одном микромоле фермента содержится
несколько тысяч единиц активности). Удельная активность — число
единиц активности, содержащееся в одном миллиграмме фермента.
Ферменты делятся на шесть классов.
1. бкеидоредуктазы (окислительно-восстановительные
ферменты) осуществляют важнейшие энергетические процессы —
перенос водорода и электронов, а также другие
окислительно-восстановительные реакции.
2. Трансферазы (ферменты переноса) катализируют пере
нос атомных группировок в процессе синтеза и распада
органических инцест.
уч
3. Гидролазы (гидролитические ферменты) ос>ществляют
гидролиз, т. е. разложение органических веществ, а также синтез
с участием воды.
4. Л н а з ы ускоряют негидролнтнческий распад веществ по
связям С—С, С—N, С—О декарбоксилирование или карбоксилиропаиие
и гидратацию, реакции отщепления или присоединения по месту
двоимых связен.
5. И з о м е р а з ы осуществляют реакции изомеризации.
6. Л и г а з ы (синтетазы) осуществляют синтез веществ.
Каждый класс ферментов делится на подклассы, а
последние на под подклассы. Подподклассы включают ряд
ферментов. Каждый фермент имеет шифр, состоящий из четырех цифр,
первая из которых обозначает помер класса, вторая — подкласса,
третья — поднодкласса и четвертая — порядковый номер фермента
п том подподклассе, к которому он принадлежит. Ферменты имеют
тривиальные н систематические названия. Ниже приведены
некоторые данные о ферментах, имеющих важнейшее физиологическое и
промышленное значение.
Оксидоредуктазы. По химической структуре все ферменты этого
класса являются д в \ х к о м п о н е и т п ы м и, известно и строение
их небелковой части. Важнейшими ферментами этого класса
являются д е г и д р о г е н а з ы, катализирующие перенос водорода, н
ни то хромы, катализирующие перенос электронов. Небелковой
частью дегндрогеназ в большинстве случаев являются
дннуклеогиды, один из которых исегда аденнловып, а азотистым основанием
другого нуклеотпда является производное пиридина (ннкотинампд)
или производное флавниа (рибофлавин). Небелковая часть
некоторых дегндрогеназ состоит из одного флавпиового нуклеотпда. В за-
ннспмости от этого дегндрогепазы делятся па пиридиновые
и ф л а в и и о в ы е. Небелковая часть пиридиновых дегндрогеназ
называется никотинамидадениндануклеотидом (НАД) или никоти-
намидидениндинуклеотидфогфагом (ПАДФ), если в молекуле ри-
бозы во втором положении имеется один остаток фосфорной
кислоты. Небелковая часть флавпновых дегндрогеназ — флавинмоно-
нуклеотид (ФЛШ) или флавинадениндинуклеотид (ФАД).
Пиридиновые дегиарогепазы переносят водород не к кислороду,
а па какие-либо другие акцепторы, поэтому их называют
анаэробными. Флавнновые дегидрогеназы также в основном
анаэробные, но в некоторых случаях они могут передавать водород
непосредственно к кислороду, тогда их называют аэробными.
В процессе переноса водородз окисленная " восстановленная
формы дегндрогеназ взанмопревращаются.
Отщепляемый от субстрата водород превращается в два
восстановительных эквивалента — гидрид-нон Н~, несущий
дополнительный электрон, и протон Н+, утративший электрон. Гидрид-ион
присоединяется к пиридиновому кольцу кофермета, а протон
переходит и cpC'iy. Поэтому восстановленной пиридиновый нук.теотнд
обозначается НАД • П+Ы1". Тем самым подчеркивается, что протон
всегда находится «поблизости*. Однако трудно объяснить, каким
59
с бразом происходит синхронный перенос двух столь разобщенных
восстановительных эквивалентов от окисляемого субстрата на фла-
ннповую дегидрогеиазу или другой акцептор водорода.
Предполагают, что один нли оба фосфатных остатка коферментов
пиридиновых дегидрогеназ (НАД и НАДФ) находятся в виде ионов.
Возможно, они и удерживают перешедшие в среду протоны. Во всяком
случае пиридиновые дегидрогеназы' отщепляют и передают оба
атома водорода окнсляемого вещества. Учитывая это, активную
группу пиридиновых дегидрогеназ в восстановленном состоянии
можно условно обозначать НАД»Н2 пли НАДФ Н2. В отношении
флавиновых дешдрогепаз гакон вопрос не возникает, поскольку в
этом случае протоны водорода присоединяются по месту
расположения двойной связи диметилизоаллоксазннового кольца:
Механизм передачи водорода активной группой
пиридиновых (о) и флавиновых (ё) дегндрпп-маз
<г
N'
о о Ц*>
!1 II ^
a i,-o-t'-o-p -10-CH.j
Ю 4" *" >гЧ^
НАД
NH2
CONH, ^f\
о о kNAV
CHz-O-P-O-P-O-CHj п
НЛЛ-Нэ
И
СИ.
СИ.
Со
£нс
ФАД-
2H+ Chf-
NH,
ФАД-Н,
сн2-о-©*-о-®-о-сн2
Ichoh)3 IcS
•'■ NH О
. ^ NH
NH Y
В большинстве биохимических процессов, связанных с переносом
1юдорода, участвуют пиридиновые дегидрогеназы, активной группой
которых является НАД. К ним относятся алкоготьдегидрогенезв,
участвующая в процессе спиртового брожения, лактатдегидроге-
иаза, участвующая в процессе молочнокислого брожения, глице-
ральдгтнлдегидрогепаза, принимающая участие в процессе
аэробного расщепления глюкозы до пировнпоградиой кислоты, пируват-
легн фогепаза, дегидрогеназы а-кетоглутаровой и яблочной кислот,
участвующие в процессе аэробного окисления пировнпоградиой
кислоты. Пиридиновые дегидрогеназы, активной группой которых
60
является НАДФ, участвуют в процессе фотосинтеза, окисления
жирных кислот, аэробного окисления пировиноградной кислоты.
Биохимические процессы с участием ФАД для микроор!анизмои
менее характерны.
К этому классу относятся также ферменты, участв) ющне в
переносе водорода: аскорбатоксидаза, гликолакток-
сидаза, глюкозооксидаза, полифенолоксидаза.
каталаза, пероксидаза. Некоторые из них присущи
плесневым грибам и другим аэробным промышленным микроорганизмам.
В анаэробных процессах они не участвуют. Ферментные препараты
глюкозооксидазы и каталазы применяются в промышленности и
производятся микробиологическим способом — с помощью
плесневых грибов. Глюкозооксидаза применяется в качестве антиокси-
данта (для связывания кислорода, содержащегося в продуктвх,
и предохранения этих продуктов от окисления). Каталаза
используется для разложения перокенда водорода, образующегося в
результате действия глюкозооксидазы.
Небелковая часть глюкозооксидазы содержит две молекулы
флавинаденнндипуклеотнда. Небелковой частью каталазы
является железонорфнрнн.
Цнтохромы осуществляют перенос электронов водорода от
восстановленных дегндрогепаз к кислороду. Известно около 20
цитохромов, однако участие в процессе жизнедеятельности
организмов (дыхания) принимают четыре цнтохрома — цитохромы о,
Ь, с и цитохромоксндаза (цитохром аз). Роль остальных цитохромов
не выяснена.
Небелковой частью цитохромов являются железопорфнрины.
Передачу электронов осуществляет атом железа, который
переходит то в восстановленную, то в окисленную форму.
Трансферазы. Важнейшими представителями этого класса
ферментов являются фосфотрансферазы (киназы), глюкозилтрансфера-
зы (фосфорилазы) и ацилтрансферазы. Фосфотрансферазы
осуществляют перенос фосфатного остатка от АТФ на углеводы и,
наоборот, от фосфорилированного вещества на АДФ с
образованием АТФ. Эти процессы имеют большое значение в
энергетическом обмене. Фосфорилировапие глюкозы за счет АТФ является
первым и обязательным этапом всех процессов превращения этого
углевода.
Глюкозилтрансферазы катализируют перепое остатков
моносахаров с участием фосфорной кислоты (переглюкозндирова-
ние). В результате происходит взаимопревращение углеводов. При
переносе остатков моносахаров на фосфорную кислоту от
полисахарида происходит разложение последнего с образованием
фосфорных эфиров моносахаров.
Такой процесс разложения полисахаридов называется фосфоро-
лизом. Он аналогичен гидролизу, только роль воды выполняет
фосфорная кислота. В отличие от гидролаз фосфорилазы
осуществляют и обратный процесс — синтез сложных углеводов,
перенося остатки моносахаров от их фосфорных эфиров на углеводы.
61
Ацилтрансферазы участвуют в переносе остатков
органических кислот, главным образом остатка уксусной кислоты —
ацетила (СН3СО~). Этот процесс является важнейшим этапом
аэробного окисления углеводов, а также окисления и синтеза
жирных кислот. Небелковая часть адилтрансфераз, называемая
коферментом ацилировсния (КоА), состоит из производного АДФ,
остатка пантотеновой кислоты и тиоэтаноламина. Активное начало
кофермента — сульфгидрильпая группа тиоэтаноламина — SH,
поэтому кофермент ацилирования обозначают также символом
SH — КоА. Кислотные остатки присоединяются к сульфгидриль-
пой группе посредством макрозргической связи, например:
CH3CO~S-KoA (ацетил-КоА).
Гидролазь:. Представители этого класса ферментов широко
применяются в народном хозяйстве и производятся
микробиологической промышленностью в виде ферментных препаратов.
Гидролазы делятся на подклассы. Наибольшее промышленное значение
имеют представители подклассов эстераз, карбогидраз
и п р о т е а з.
Эстеразы осуществляют гидролиз и синтез сложных эфиров.
Наиболее важными из них являются липаза и пектаза.
Липаза гидролизует и синтезирует жиры. Пектаза (пектинэстераза)
гндролнзует эфирную связь в пектиновых веществах:
Пектинэстераза
/ СН3 \ СН,
Пек1инзс1ераза в комплексе с другими пектинразлагаюшимп
ферментами применяется для разложения пектиновых вешесть.
Промышленными продуцентами их являются плесневые грибы.
Карбогидразы расщепляют глюкозидные связи,
осуществляя гидролиз углеводов и других ыгскозидов, они широко
применяются в промышленности. Делятся па олигазы, гидролизующие
олигосахарпды, н п о л и а з ы, гидролизующие полисахариды
второго порядка. Наибольшее промышленное значение имеют олн-
газы, охарактеризованные ниже.
Фермент а-г л ю коз и д а з а (мальтаза) расщепляет
и-глю^ознд^ую связь в дисахаридах мальтозе и сахарозе:
Мальтоза Сахароза
' СН2ОН
ПЛ PIJOL
on \^~ он он S енлж
^ а-ГлюкиЗИЛаза
6J
Фермент мальтаза имеет большое значение в хлебопечении.
В этом производстве одной из биохимических стадий,
обусловливающих качество хлеба, является процесс сбраживания мальтозы
дрожжами. Последние должны обладать высокой мальтаз-
пой активностью. Этим требованиям удовлетворяют
специальные хлебопекарные дрожжи. Для хлебопечения целесообразно
применять дешевые осадочные дрожжи спиртовых заводов,
однако они имеют низкую мальтазную активность. Поэтому перед
производством стоит задача повышения мальтазной активности
спиртовых рас дрожжей. Для гидролиза мальтозы можно
применять ферментный препарат мальтазы, однако получение его еще
не налажено.
Фермент р-гл юкоз и д а з а (целлобиаза) расщепляет
р-глюкозндные связи в днеахаридах, например целлобиозе:
Р-Глюкозидаз'а
о<сГ
он
Фермент а-г а л а ктоз и д а з а (мелибиаза) расщепляет
«-галактозндную связь в мелнбнозе и рафннозе:
\он сн,он
а-Галактоэидаэа
Фермент а-галактозидаза имеет промышленное значение.
Спиртовое производство, использующее свекловичную мелассу,
несет существенные потери из-за того, что содержащаяся в этом
сырье рафипоза не сбраживается полностью дрожжами. Дрожжи
содержат фермент р-фруктозидазу и не вырабатывают о-галакто-
зидазу. Вследствие этого они отщепляют от рафинозы только
фруктозу. Оставшаяся часть молекулы — мелибиоза — не гидро-
лнзуется и поэтому не подвергается дальнейшему превращению
в спирт. Эта проблема может быть решена двумя путями:
получением специальных рас дрожжей, обладающих р-галактозндазной
активностью, или применением ферментного препарата а-галакто-
зидазы.
Фермент - р-галактозндаза (лактаза) расщепляет
Р-галактозидную связь в лактозе:
p-ra.iaKTOjn.Tj.ia
I N Ч__/он
63
Этог фермент кроме выполнения важной роли в живом
организме применяется в промышленности. При приготовлении
продуктов из молока (мороженое и др.) для улучшения их вкусовых и
других качеств целесообразно расщеплять лактозу молока иа
моносахара. Этот процесс осуществляется добавлением
ферментного препарата рталактозидазы.
Фермент р-ф р у к то з и д а з а (сахараза, иивертаза)
расщепляет р-фруктозидную связь и сахарозе и рафннозе:
Сахароза ' Рафниоэа
снаон он /1 снаон
ОН ^ ^CHsOH ОН J2^ CHsOH
{S-Фруктозидвза ,—''""'^
Этот фермент играет большую роль в организме человека и
животных, поскольку многие потребляемые продукты содержат
сахарозу. Он необходим и многим промышленным
микроорганизмам, поскольку сахарозосодержащне материалы — свекловичная
мелласса, тростниковая меласса—являются наиболее
распространенным сырьем в микробиологической промышленности. В
некоторых производствах, например в кондитерском, применяется
препарат инвертэзы, называемый инвертином. Для его
производства используются дрожжи, обладающие наибольшей активностью
в эгом отношении.
Из пол и аз наибольшее промышленное значение имеют
ферменты, охарактеризованные ниже.
Амилазы — группа ферментов, гидролнзующих крахмал.
Фермент о-а м и л а з а (животная амилаза, декстрипогенамнлаза),
в организме животного ее содержится больше, чем в растениях.
Большое количество а-амилазы образуют плесневые грибы. Она
гидролизует крахмал не полностью, образуя продукты с
небольшим числом остатков глюкозы — ннзкомолекулярные декстрины,
а также небольшое количество мальтозы и глюкозы.
Фермент р амилаза (растительная амилаза, сахарогенами-
лаза) содержится главным образом в растениях. Гидролизует
крахмал до мальтозы и высокомолекулярных декстринов.
Ферменты и- и р-амнлазы гидролнзуют только связи 1—4.
Разнообразие i, .>дуктов гидролиза объясняется различным
характером действия этих ферментов на крахмал (рис. 17). Фермент
u-амилаза действует на крахмал беспорядочно, расщепляя связи
независимо от места их расположения в молекуле, р-амнлаза—
с определенной закономерностью; она расщепляет каждую вторую
связь со стороны свободных концов молекул, образуя мальтозу,
однако в амилопектипе действие ее распространяется только до
разветвления молекулы. В результате образуются мальтоза и
крупные декстрины (р-лекстрнны). Если в среде присутствует и а-ами-
лаза, то она расщепляет крупные декстрины, обеспечивая возмож-
(М
ность дальнейшего действия В-амилазы. Присутствие а-амилази
усиливает активность В-амилазы. Следовательно, активность двух
амилаз при совместном присутствии выше суммы активностей
каждой из них в отдельности, т. е. в данном случае имеет место с и-
нергическое действие двух амилаз. Отличаются а- и
В-амилазы чувствительностью к температуре и реакции среди.
а-Амилаза более устойчива к температуре, но чувствительна к
кислотности среды. Это используется в хлебопекарной
промышленности, где продукты действия а-амнлазы— низкомолекуляриые
декстрины — снижают качество хлеба.
Амилоза
I люкоамнла и
*"-р Амилаза
*-СС Амнлада
•с Редуцирующий мшец
^ *» Амило-1,6-1 люкчиндааа
Рис. 17. Схема действия амилаз на амилозу и амилопектии
При совместном действии а- и В-амилаз крахмал гидролизу-
стся на 85 %. Негндролпзовапный крахмал представляет собой
остатки со связями I—6 и так называемые аномальные структуры,
на которые не действуют эти ферменты. Расщепление связей 1—6
осуществляют фермент олиго-[,6-глюкозидаза (предельная декстри-
иаза) и амнлопектнн-1,6-глюкозидаза (/?-ферменг). Аномальные
структуры гидролизует специальный Z фермент.
Ряд организмов, особенно плесневые грибы, образует так
называемую глюкоамплазу (а-1—4-глюканглюкоамнлаза, у
амилаза), которая гидролизует кажчую 1—4-связь с нередуцирующнх
коннов молекулы крахмала, отщепляя остатки глюкозы, а также
расщепляя I—6-связи.
Амилазы имеют большое значение в народном хозяйстве. Они
применяются в самых различных отраслях промышл лностн.
9 - 2-1702
65
В качестве источника этих ферментов используется проросшее
зерно — солод. Наиболее богат амилазами ячмень. В натуральном
зерне (5-амилаза находится в свободном состоянии, а а-амилаза
связана с белками и поэтому неактивна. Освобождается она при
прорастании зерна.
В настоящее время для производства амилаз используются
микроорганизмы — плесневые грибы и бактерии. Это значительно
) аешевляет производство и дает возможность получать высокоак-
ишные препараты амилаз.
Подкласс протеаз включает ферменты, гидролизующне
белки (п р о те и и а з ы) и пептиды (пептидазы). Наибольшее
промышленное значение из протенназ имеют ферменты,
охарактеризованные ниже.
Пенс и п — содержится в слизистой оболочке желудка.
Кристаллический препарат обладает очень высокой активностью: 1 г
ею за 2 ч разлагает 500 кг сваренного яичного белка и
створаживает 100 000 л молока. Действие пепсина специфично: он гидроли-
зуег преимущественно пептидные связи, образованные
аминогруппой тирозина и фсиилалапнна. В организме находится в виде пеп-
' "hoiепа, освобождается под влиянием соляной кислоты.
Г р и н с и н — содержится в соке поджелудочной железы.
В организме находится в виде трипсиногена. Освобождается
вначале под действием энтерокнназы, а затем автокаталитн-
ческн.
Р е н н 11 и (хнмознн, лабфермент) — содержится в
четвертом отделе желудка теленка (сычуге), называется
сычужным фермрнтом. Применяется для створаживания молока при
производстве сыра. Створаживающее действие заключается в
превращении растворенного белка казеиногена в нерастворимый
осадок (сгусток) казенпата кальция. Одного грамма сычужного
фермента достаточно для створаживания 4550 л молока.
X и м о т р и п с и н — содержится в поджелудочной железе.
Действует на пептидные связи, образованные карбоксильной
группой тирозина и фенилаланина.
Папани—растительный протеолитическнй фермент.
Содержится также в дрожжах. Активируется сульфгидрильнымн
соединениями. Особую роль при этом играет восстановленный глутатион.
Он передает подород к окисленной форме фермента и,
восстанавливая его, переводит в активное состояние, что отрицательно
сказывается на храпении дрожжей. Восстановленный глутатион
повышает нротеолигическую активность дрожжей, ускоряя
процесс их аптолнза и тем самым уменьшая срок хранения. Для
предотвращения этого япления необходим перевод глутатиона в
окисленную форму путем повышения кислотности среды и
добавления окислителен.
Протеолнтическне ферменты широко применяются в народном
хозяйстве н производятся микробиологической промышленностью.
Наиболее богаты протеолнтическими ферментами плесневые
грибы.
66
Протеолитнческне ферменты микроорганизмов еще
недостаточно хорошо изучены. Они обладают способностью гпдролизовагь
самые различные белки. Ферменты плесневых грибов расщепляют
желатин, казеин, гемоглобин, альбумины, кератин, эластин и
другие белкн, т. е. имеют широкий диапазон действия и, следовательно,
меньшую специфичность, чем протеолитнческне ферменты
животного происхождения. Это затрудняет получение ферментов
специального назначения с помощью мпкроор1анизмов. Так, например, для
молочной промышленности необходимо пронзвочить замени
тели сычужного фермента, который используют для створа
живания молока и получают дорогостоящим способом из
животного сырья. Известны различные продуценты и разработана
технология получения протеолитнческнх ферментов для
створаживания молока, однако получаемые препараты не обладают
такой специфичностью, как сычужный фермент.
Из ферментов класса л и а з наибольшее значение имеют э но
лаза, альдолаза, пируватдекарбоксилаза. Он»
осуществляют важнейшие этапы разложения глюкозы в процессе
брожения и дыхания. Некоторые из них применяются в медицине
(пируватдекарбоксилаза). Альдолаза не только y4acTBveT в
процессе разложения глюкозы, но н осуществляет синтез гексоз из
триоз в организме.
Изомеразы играют большую роль в процессе
взаимопревращений углеводов.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ ОБ ЭНЕРГЕТИЧЕСКОМ ОБМЕНЕ
Все живые организмы состоят из одних и тех же веществ,
однако источники энергии и строительного материала у них различ
ны. Автотрофы строят свое тело из оксида углерода (IV) и
минеральных солей с помощью энергии солнечного света пли энергии,
выделяющейся в процессе окисления неорганических веществ.
Гетеротрофы же извлекают все необходимое из органических
веществ. Однако энергию солнечного света можно использовать
только днем, а жизнедеятельность необходимо поддерживать
непрерывно. Поэтому у автотрофов также имеются все механизмы
гетеротрофного существования: ночью они осуществляют
жизнедеятельность за счет органических веществ, запасенных при
фотосинтезе.
Энергетические процессы в организме. Принято считать, что
для синтеза веществ, из которых организм строит свое тело,
необходимо затратить энергию, для извлечения же энергии, т. е. для
ее выделения, необходимо осуществить разложение (окисление)
веществ. В химии и физике существуют понятия «энергия»,
«работа», «теплота». Физический смысл этих понятий не всегда
можно представить. Выделение и поглощение теплоты легко ощутить
по изменению температуры, однако энергия и рп^ота — понятия
относительные, величину энергии и работы можно подсчитать
только косвенно. Наиболее общее и наименее осязаемое понятие —
67
«энергия». Оно объединяет все — механическое, химическое,
электрическое, тепловое — состояния и саму материю. Законы
превращения энергии шучаст наука термодинамика.
Рассчитывают величину энергии па основе законов термодинамики, однако
пизестпые законы термодинамики не позволяют определить
абсолютное количество энергии вещества пли системы. Можно
определить только прирост пли убыль энергии, т. е. изменение
энергетического состояния вещества. Для количественного выражения
этих изменений введена величина ДС — изменение свободной
энергии, зависящая от механического, химического,
электрохимического и теплового состоянии системы. Найдены
зависимости между изменением свободной энергии и величинами,
характеризующими состояние системы. По аналогии с тепловым эффектом
свободная энергия реакции может быть положительной величиной,
если энергия поглощается, или отрицательной, если она
выделяется. Если реакция эндэргонпческая, т. е. происходит с
поглощением энергии, то энергия продуктов реакции увеличивается
(+ДС) за счет энергии внешней среды. При экзэргонической
реакции энергия реагирующей системы уменьшается (—ДС), т. е.
выделяется во внешнюю среду. В живой системе обмен энергией
между реагирующей системой и окружающей средой происходит
не прямо, а через «посредника», которым является ЛТФ.
Существуют различные способы расчета изменения свободной
энергии с применением величин, характеризующих состояние
веществ. Например, при взаимодействии двух вешеств расчет
ведется по величине константы равновесия:
до = RT In К.
Кроме константы равновесия АС в данном случае используются
абсолютная температура Т и универсальная газовая постоянная/?.
При другом способе расчета изменения свободной энергии,
например в случае переноса электронов, используются
электрохимические величины:
до = — nFEB,
где п—количество перепесенных электронов; F—константа Фа-
радея, учитывающая электрическое состояние; Е0 —
электродвижущая сила (ЭДС), определяющая
окислительно-восстановительный потенциал системы.
Используются и другие способы расчета изменения свободной
энергии.
В настоящее время для многих веществ тем или иным
способом установлена энергия их образования из химических
элементов. Зная это, простым суммированием можно определить
изменение свободной энергии реакции. Так, использование этих приемов
позволило рассчитать энергию гидролиза АТФ:
А1Ф+ ПоО — ЛДФ-Ь ll.1V).,, Л^.= — 243 Ю Дж/имь.
Этот расчет осуществлен л.тп стандартных условий, т. е. для
молярных кочш и транш"' peai. '-ующих веществ. При фпзиологн-
t,s
ческнх концентрациях, т. е. при концентрациях, имеющих место в
живом организме, эта величина должна быть иной.
Расчетное значение изменения свободной энергии гидролиза
АТФ имеет отрицательный знак, что свидетельствует об экзэрго-
пическом характере реакции. Поскольку гидролиз АТФ, т. е.
превращение АТФ в АДФ, сопровождает многие процессы синтеза,
например процесс образования белка в живом организме,
принято считать, что выделяющаяся энергия расходуется на синтез
веществ. Отождествляя гидролиз АТФ с разрывом макроэргических
связен, а синтез веществ, например белка, с образованием связей
(в данном случае пептидных), часто говорят, что энергия разрыва
макроэргических связей используется для образования пептидных
и других связей. Однако такое выражение противоречит
классическому закону термохимии, согласно которому разрыв какой-либо
химической связи не может сопровождаться выделением теплоты.
Наоборот, при этом энергия поглощается. При образовании же
химической связи энергия выделяется. В связи с этим предложено
вместо понятия «макроэргпческие связи* использовать понятие
«макроэргнческие соединения», а термин «разрыв связи»
заменить термином «внутримолекулярное перераспределение энергии».
Пользуясь такой терминологией, можно сказать, что при гидролизе
макроэргических соединений происходит внутримолекулярное
перераспределение энергии и избыток ее расходуется па синтез
веществ. Однако совершенно неясно, каким образом совершается
переход этой энергии в систему реагирующих веществ.
В литературе можно найти подробные сведения о том, сколько
молекул АТФ требуется на включение мономеров в процессе
биосинтеза белков, углеводов, нуклеиновых кислот. Например,
включение остатка аминокислоты в молекулу белка требует затраты
энергии, соответствующей трем макроэргическим соединениям, т. е.
расходуются три молекулы АТФ. При синтезе нуклеиновых кислот
на включение каждого мономера требуется пять молекул АТФ,
на включение в полисахарид каждого мономера — две молекулы
АТФ. Ученые решили многие вопросы механизма распача и
синтеза АТФ. Однако вопрос о том, каков же механизм
использования энергии макроэргических связен (макроэргических
соединении), не ясен. В то же время общеизвестно, что макроэргпческие
связи содержат значительно больше энергии, чем обычные
химические связи, и это их преимущество используется в процессе
жизнедеятельности организмов.
Исходя из законов термохимии и учитывая неустойчивость АТФ (и других
фосфатов) к повышению температуры, можно предположить, что это соединение
выполняет и дру1ую функцию в организме. Поскольку процесс биосинтеза
веществ; т. е образование химических связей, экзотермический, а фермент образует
множество связей в единицу времени, на активном центре фермента возможно
повышение температуры, что может вызва1ь инактивацию фермента. В связи
с этим должны существовать механизмы терморегуляции на молекулярном уровне.
Один из возможных механизмов состоит п том, что теплота, выделяющаяся при
образовании связи, вызывает распад неустойчивых махроэр .кеекпх соединений.
Этот распад, согласно законам термохимии, сопровождается поглощением
теплоты, что и препятствует повышению температуры. Расчеты показывают, что
опито - 2-1702
69
санная ситуация на активном центре фермента вполне вероятна. Ориентировочно
можно вычислить прирост температуры на активном центре фермента. Используя
справочные данные о молярном тепловом эффекте образования димера (связи)
и о количестве молекул образовавшегося вещества (димера) в одном моле (число
Аиогадро), можно определить тепловой эффект образования одной связи:
ссв = 6 • 10!S -
Пространство, в котором влияние теплового эффекта существенно для
активного центра фермента, можно представить с запасом в виде шара диаметром 1 нм.
Объем этого пространства, который условно можно назвать объемом связи,
вычисляется но формуле
л£>э л • I3 л
1/св=~б_= 6 "м = 6 • 10"л-
Отсюча изменение температуры в результате реакции образования одной связи
в данном объеме составит
л,= VCB = 6- 10"я = я и-
Судя по справочным данным, при образовании пептидной связи выделяется
около 115 кДж теплоты, Вследствие этого в пространстве, где совершается
данная ферментативная реакция, может произойти повышение температуры на
28 • 0,2388
10 • 3,14 =90°С-
Аналогично можно вычислить, что прн включении остатка уксусной кислоты
в процессе образования жирных кислот температура на активном центре
фермента может повыситься на СО, а прн образовании водородной связи — на 33 "С.
Совершенно очевидно, что после каждого акта повышения температуры
происходит ее выравнивание (релаксащ|я) по закону теплопередачи. Однако в
клеточных структурах, |де локализованы ферменты, происходит множество энзима-
тических реакций одновременно. Если к тому же учесть высокую молярную
активность ферментов, синтезирующих вещества, трудно представить, чтобы
естественная релаксация могла компенсировать «напряженность» теплового эффекта,
возникающую в клеточных структурах. Для предотвращения повышения
температуры в этих условиях требуется активное поглощение теплоты, т. е.
осуществление реакций с обратным тепловым эффектом.
Высказанное предположение, вероятно, не исчерпывает возможных
механизмов терморегуляции на молекулярном уровне. Все биохимические превращения в
организме происходят в соответствии с классическими законами термохимии, и в
процессе эволюции живой организм выработал механизмы, удовлетворяющие
этим законам. Почему, например, в процессе биосинтеза полнпептндов,
полисахаридов, высших жирш>1х кислот соответствующие мономеры — аминокислоты,
моносахариды и т. д.— участвуют в реакциях ие в виде чистых веществ, а в виде их
производных (аденилатов, фосфатов, активного ацетила и т. д.)? В биохимии
это обычно рассматривается как активирование мономеров, ослабление
внутримолекулярных связей. Но ведь ослабление этих связей (устранение энергетического
барьера) осуществляют фермеиты1 Можно предположить, что участие мономеров
в ферментативных реакциях в виде различных производных имеет смысл н сточки
зрения терморегуляции. Сравнивая реакции взаимодействия чистых веществ и
тех же веществ в виде производных, нетрудно заметить существенные различия
результатов этих реакций. Если взаимодействуют между собой две аминокислоты
или два моносахарида, образуются соответствующие димеры и вода. Если
взаимодействуют между собой производные этих аминокислот или моносахаридов,
получаются те же днмеры, но вместо воды образуются другие вещества. В первом
случае, т. е. при образовании воды, возникает связь ОН—Н, а в случае
взаимодействия производных — связи —СО—Н, —S—Н и другие с меньшим тепловым
эффектом. Известно, что реакция образования воды — это одна из наиболее
мощных экзотермических реакций, происходящая с большим тепловым эффектом.
70
Именно эту реакцию использует живой организм для извлечения энергии, т. е.
в процессах, ведущих к образованию АТФ, например при икнелителыюм фисфи
рнлировании В данном же случае, наоборот, используя приизводпие вместо
чистых веществ, организм осуществляет процессы синтеза в об.чид високоэргн
ческой реакции образования воды, т. е. использует сше одни механизм, нре
пягствующий тепловой инактивации ферментов.
Пути образования АТФ. В настоящее время в основных чертах
известны все пути, ведущие к образованию АТФ, хотя детали
самого процесса аккумулирования энергии в молекуле АТФ не йены.
В любом случае, независимо от того, каким путем это происходит,
процесс образования АТФ называется фосфорилированием.
Основным условием фосфорилирования, т. е. образования АТФ,
является наличие окислительно-восстановительных процессов.
Механизмы этих процессов существенно различаются в зависимости о г
использования энергии солнечного света (у автотрофов) или
энергии окисления органических веществ (у гетеротрофов). Однако
общим для обоих случаев является то, что в основе окиелнтельно-
восстановнтельных процессов лежит перенос электронов и
водорода.
При отсутствии света автотрофные организмы существуют за
счет тех же энергетических и конструктивных процессов, что и
гетеротрофные.
Автотрофный обмен — источник жизни на Земле. Используя
энергию солнечного света, автотрофы синтезируют органические
вещества из оксида углерода (IV). Процесс образования
органических веществ из оксида углерода (IV) под влиянием солнечного
света называется фотосинтезом. Гетеротрофы существуют за счет
веществ, накопленных в процессе фотосинтеза. В результате
фотосинтеза образуется и кислород, необходимый для
жизнедеятельности гетеротрофов. Таким образом, процесс образования веществ
при фотосинтезе — это своеобразный способ запасания (консер
вирования) солнечной энергии, которая используется затем и ге
теротрофами, и автотрофами. Солнечная энергия, запасенная n op
гаиических веществах, используется во всех видах человеческой дея
тельности. Сжигание топлива — угля, нефти, газа, торфа, древеси
ны — является основным источником получения всех видов энергии
Химизм процесса фотосинтеза сложен и не до конца изучен
Достаточно хорошо известен химизм превращения углекислого
газа в органические вещества. Менее изучена биохимия процесса
преобразования солнечной энергии в энергию макроэргических
связей АТФ. По существующему представлению, процесс
фотосинтеза у растений и фотосинтезирующнх микроорганизмов протекает
в две фазы: световую и темиовую. В световой фазе под
влиянием света образуются АТФ и восстановленные дегидрогена-
зы. В темновой фазе (при отсутствии света) нз углекислого газа
с помощью АТФ и восстановленных дегидроиенаэ синтезируются
органические вещества.
Принципиальный механизм образования АТФ у растений и фо-
тосиитезирующих микроорганизмов один и тот же. Движ щей си-
71
loii фогофосфорплнровапня в обоих случаях является изменение
окислительно-восстановительного потенциала, вызванное
-поглощением свсга фоточувствительпымп системами (фотосепсн'били-
заторамн) и сопровождающееся перемещением электронов и
водорода. Этт принцип лежит и в основе окислигелыюго фосфори-
лпровапия, т. е. энергетического обмена у гетеротрофов, только в
эгом случае разность потенциалов и перемещение электронов и
водорода созтают дегпдрогепазы, взаимодействуя с окисляемым
субстратом. Принцип фогофосфорилпрованнн заключается в
следующем. Система фотосепснбнлпзаторов поглощает световые лучи и
изменяет свой окпслнтелыю-воссгаповнтельпып потенциал.
Различные по химической природе фотосепспбнлнзаюры поглощают
лучи с различной длиной волны. Вследствие этого между
системами появляются разность потенциалов и поток электронов. Это
сопровождается выделением энергии, за счет которой АДФ пре
вращается в АТФ, т. е. идет процесс фогофосфорилиро-
в а и и я. Фоточхвствнтельные системы сложны. Все они содержа!
пигменты. Главные из них — хлорофилл у растений и бактерио-
хлорофплл у микроорганизмов. Кроме хлорофилла в процессе
фотосинтеза участвуют каротппоиды, хниопы (пластохннон у
растений и убихпнои у микроорганизмов), ферредоксип, цнтохромы
1г, Ь, с, /. Способностью поглощать солнечные лучи обладают лишь
хлорофилл и некоторые другие пигменты, остальные вещества
являются просто передатчиками электронов на восстановленные
дегпдрогепазы. Первым в цепи передачи электронов всегда стоит
хлорофилл. Конечный акцептор электронов — дегпдрогепаза. Та
кнм образом, процесс передачи электронов приводит к
образованию не только ЛТФ, но и восстановленной дегпдрогепазы. Каждый
посредник, отдавая электроны, восполняет их потерю за счет
электронов предыдущего передатчика, т. е. переходит в первоначальное
(восстановленное) состояние. В противном случае, т. е. при
безвозвратной отдаче электронов, расходовались бы пигменты.
Хлорофилл же, стоящий первым в цепи передачи, восстанавливает
утраченные электроны за счет электронов водорода (у растении
для этого используется водород воды, у
микроорганизмов—водород сероводорода или других соединений). Сам же водород при
этом передается дегидрогеназе.
Процесс мобилизации водорода и электронов у растений
осуществляется в результате разложения воды под влиянием
солнечного света (фотолиза), происходящего с участием хлорофилла:
Солнечный свет
4Н20 * 4Н + 40Н
Хлорофилл |
"1 Н 2Н.О + 0,.
К хлоро- К дегндро-
фщлу renaie (НЛДФ)
В результате фотолиза поты образуется свободный кнслорот,
используемый гетгротрофамн и самими растениями для
окисления органических вещесгз и и влечении из них энергии. Таким
т:
образом, растения, запасая солнечную энергию в виде
органических веществ, запасают при этом и кислород, необходимый для
извлечения этой энергии.
Процесс мобилизации водорода и электронов у фотосннтези-
рующпх серобактерий можно представить схемой
Солнечный свет
2H2S - 2Н -f 2SH
Бактерно хлорофилл , ' , м i
Ч И I
К бактерио- К дегндро- HgS-f-S
хлорофиллу гемазе (НАД)
Вместо свободного 02 у микроорганизмов в данном случае
образуется молекулярная S, которая откладывается в их клетках.
Растения восполняют утраченные хлорофиллом электроны н
другим способом, при котором, пройдя цепь переносчиков,
электроны вновь возпрашаются к хлорофиллу. Этот способ тоже
приводит к образованию АТФ н называется циклическим
фосфор и л и р о в а и н е м. Однако восстановленные дегпдрогепа-
зы при этом не образуются. Таким образом, в основе всех
способов превращения световой эпергип в биологическую лежит один
и тот же принцип, различие состоит лишь в источниках н путях
передачи электронов и водорода.
Ниже показаны основные системы, участвующие в процессе
переноса электронов и водороаа при фотофосфорилировапнн у
растении (а) и фотосинтезируюпшх микроорганизмов (пурпурных
серобактерии) (б), нспользуюшнх энергию спета:
Солнечный спет
, » I ♦ Г~1
2е Система \АС~
пигментов У
II HIITOXpOMOR Л.
» ~У ^НАДФ-гЬ
А_1^ Т2Н*
В атмосферу-, О.
211-
Солнечпый спет
гт~г-г
Система
2с пигментов
и цнтохромов
211
\Т*Ф?
НАД
НАД-Н,
«2Н*
П настоящее время еще многое не ясно о химизме
фотосинтеза. Роль ряда веществ, участвующих в эгом процессе, не
установлена. Не ясен вопрос интенсивности фосфорнлнровання и
количества образующихся молекул АТФ. И.шестио, что у растении АТФ
образуется в момент передачи электронов о г водорода поды к
хлорофиллу, затем — ог пптохро.ма b к цптохрому /. У мнкрооргапнз-
73
мов эти стадии пока ие определены, хотя иет сомнения в том, что
передача электронов приводит к образованию АТФ.
Установлено, что передача водорода от восстановленной дегид-
рогеназы к фосфоглицериновой кислоте также сопровождается
образованием АТФ, однако это уже не относится к световой фазе.
Извлечение энергии из органических веществ при
гетеротрофном обмене основано также на принципе переноса электронов и
водорода. Источником электронов и водорода при этом является
органическое вещество (окисляемый субстрат), роль переиосчикоя
выполняют дегидрогеназы и цигохромы. Акцептор водорода и
электронов — кислород воздуха, а при отсутствии воздуха
акцептором может служить кислород каких-либо минеральных веществ.
На основании многочисленных работ сформулирована теория
окисления веществ в живом организме, называемая теорией
биологического окисления (теорией дыхания). Согласно этой теории,
окисление вещества начинается с отнятия водорода пиридиновыми
дегидрогеназами и передачи его флавиновым дегидрогеназам.
После этого система цитохромов передает электроны этого
водорода кислороду. В результате присоединения электронов кислород
переходит в ионную форму. Водород, отдавший электроны, также
ионизируется и переходит в раствор. Заряженные частицы
водорода и кислорода соединяются между собой, образуя воду.
Ниже представлена упрощенная схема переноса Н2 и
электронов при окислительном фосфорилировании (дыхательная цень):
ФАД-Н,. x-Fe'x /"-"«"\ /"^'Ч /"Fe'
2Н* 'It ц. j | */е~ц. с 12е"«° |'2е"ц.<1э
F.3
НАД-Н, \ " ФАД
ЛТФ
АТФ АТФ
2Н-
На схеме показаны только четыре цитохрома: Ь, с, а и аз,
участие которых наиболее изучено (ХН2—окисляемый субстрат).
В дыхательной цепи участвуют и другие вещества. Большинство
из них играют вспомогательную роль и не являются
непосредственными переносчиками протонов и электронов. Есть также и
вещества небелковой природы, например, убихинон, стоящий в цепп
между флавниовой дегидрогеназой и системой цитохромов.
Биологический смысл переноса водорода и электронов
заключается в использовании энергии образования воды. Реакция
соединения водорода и кислорода—наиболее эффективная
экзотермическая реакция между химическими элементами. Природа
использовала эту реакцию в качестве источника энергии для
биохимических процессов. Вне организма эта реакция происходит
мгновенно, со взрывом, а в живом организме — постепенно. Водород
передается кислороду через цепь передатчиков, и энергия
выделяется не сразу, а по частям, что дает возможность использовать
ее для биохимических процессов. Каждый этап перемещения водо-
74
рода и электронов от фермента к ферменту сопровождается
выделением энергии, и на определенных этапах выделяющейся энергии
достаточно для осуществления процесса фофорилировання и
образования молекулы АТФ. Во всей цепи установлено три таких
этапа. Процесс образования АТФ при биологическом окислении
называется окислительным фосфорилированием. Этот путь
образования АТФ является универсальным н используется всеми
организмами в процессе нх жизнедеятельности в присутствии кислорода.
Многие микроорганизмы, в том числе и промышленные,
способны существовать при отсутствии кислорода. В этом случае они
используют иные пути образования АТФ. Один из них близок к
универсальному пути биологического окисления. Отличие состоит
в том, что при этом микроорганизмы используют в качестве
конечного акцептора водорода кислород окисленных минеральных
веществ, например сульфатов, нитратов. В результате, как и в
общем случае, образуется вода, т. е. организм использует энергию
образования воды. Такие процессы называют редукцией. Процесс
использования кислорода может быть частичным или полным. При
этом кислород одной молекулы вещества неоднократно
акцептирует водород окисляемого субстрата. Схема процесса переноса
водорода и электронов на кислород нитратов (а) и сульфатов (б)
приведена ниже:
НМСЫнитрат)
7 Y Система If Нитрат- >L н 0
А переноса А редуктаза Л
НМСЫннтрит)
н2о
HNOljHjNjOf-i'aoT-
Ху^ 1 I новатистая кнс-
" А Л
лота)
„.. NH2OH (гндрокснл-
NH3(aMMFiaK)
а
ХИ2 >» *■ HjSOj (сульфат)
^у Система уСульфатЛ! н п
,Лт;-саАре: -
ЗХИ - " ^Н2*0.,(сульфнт)
СульфатЛ!
, редуктаэаХ
IX ■• X * ^":°
3 Xм
11; S(cepnKO.\opOA)
75
Детали процесса переноса водорода и электронов к кислороду
указанных акцепторов пока еще не ясны и не известно количество
образующихся при этом молекул АТФ. Предполагают, что нптрат-
редуцирующне бактерии используют те же ферменты переноса
водорода, которые осуществляют этот процесс в присутствии
кислорода воздуха, только вместо цитохромоксндазы конечным
переносчиком является нитратредуктаза. Цитохромы же у
микроорганизмов, существующих в анаэробных условиях, не обнаружены.
Более подробно изучен процесс восстановления сульфатов.
Известно, что в нем участвует фермент АТФ — сульфатадепнлил-
трансфераза (АТФ-сульфурилаза). Под действием этого фермента
образуется аденозин-б'-фосфосульфаг, который под влиянием
специальной редуктазы превращается в сульфат и АМФ. Далее идет
восстановление до сульфида, но детали этого процесса не
ясны.
Учитывая, что микробиологические процессы, для которых
характерна редукция нитратов и сульфатов, всегда сопровождаются
образованием мегана, можно предположить, что параллельно с
этими процессами идет редукция карбонатов, кислород которых
также является акцептором водорода окисляемых веществ в
анаэробных условиях. Карбонаты восстанавливаются аналогично
нитратам и сульфатам. Конечным продуктом восстановления
является метан. Схема процесса переноса водорода н электронов па
кислород карбонатов приведена ниже:
у/ Си
A "eF
X-
НСООП(форииат)
Д-н,о
нстемау' Формиат^
переноса I дегидро- -■•Н/Э
/V НГе- У Ч геназа^
XII
лА
хм
X
X] I
X
В литературе этот
процесс рассматривается как
восстановление С02
специальными метанобразую-
щими бактериями. Причем
для восстановления эти
бактерии используют водород,
отщепляемый от
органических веществ другими
микроорганизмами. Однако более
вероятно, что мобилизация
водорода окисляемых
веществ и передача его к
кислороду карбонатов — это,
как п в случае редукции
нитратов н сульфатов,
единый окислптелыю-восстапо-
о «тельный процесс, происходящий в одном п том же организме.
Первый продукт восстановления — форммат — образуется, как
известно, с участием формнатдегндрогеназы. Аналогичную роль
выполняют нитрат- и сульфатдсгпдрогепазы. Вполне вероятно, что
кислород нитратов, сульфатоп и карбонатов и анаэробных условиях
может использовать один п тот же микроорганизм.
Второй путь образоиаипя АТФ — субстратное фосфорилирпва-
ние. Оно также используется организмами при отсутствии кнело-
НСОН (фирмяль-
XJ дегнд)
CHjOHIokchmitim)
—НаО
СН<(метаН|
7tj
рода воздуха. Осуществляется не вследствие окислительно
восстановительного процесса переноса воморода и электронов, а прямым
переносом остатка фосфорной кислоты от какого-либо фосфирп-
лнроваппою вешестна (cy6crpaia) па ЛДФ с помощью ферментов
кппаз. Эгот путь нснольз\ют в качестве единственного источника
АТФ различные вилы промышленных микроорганизмов —
дрожжей и бактерии в процессе брожения (в присутствии кислорода
они переходят па аэробное окисление органических пешестн).
В аэробных условиях субстратное фосфорнлнровапие является
дополнительным источником АТФ у всех организмов, потребляющих
углеводы. При разложен ни других веществ субстратное
фосфорнлнровапие не происходит. Источниками фосфата в эюм случае
являются фосфоглпиерпновая н фосфоэнолпнрошпимрадная
кислоты.
ПРЕВРАЩЕНИЯ ОКИСЛЯЕМЫХ ВЕЩЕСТВ
Не все вешестна могут быть окисляемым субстратом.
Окислению, т. е. дегидрированию, могут подпереться только соединения
с определенными аюмпымн группировками. Универсальными
окисляемыми субстратами являются глицериновый альдегид, кетокпс-
Л01Ы — ппропппоградпая, a-Kemr.-i\ laponan, дпкарбонопые
кислоты—янтарная, яблочная, трпкарбоиовая пзолпмонная кислота,
молочная окспкнслота. Дегидрированию могут подвергаться более
сложные соединения—глюкоза, высшие жирные кислоты,
азотистые основания, причем отшепленпе водорода от некоторых веществ
происходит многократно.
Многие окисляемые вещества находятся в природе в
свободном состоянии и окисляются сразу при поступлении и организм.
В других случаях они образуются в организме в результате
разложения более сложных всшеств, которые не могут быть
непосредственно окисляемым субстратом, например белки, полисахариды,
полипуклеотнды. Некоторые вещества, например глюкоза, в
зависимости от условий и прнрочы организма могут либо
непосредственно окисляться, либо предварительно разлагаться с
образованием промежуточных продуктов, способных к окислению.
Существуют многочисленные пути распада веществ в зависимости от их
структуры, а также условии, важнейшим из которых является
природа акцептора водорота. Б присутствии кислорода потребляемые
вещества в качестве источников энергии и строительного
материала используются максимально. При отсутствии кислорода (и
анаэробных условиях), когда акцептором водорода является
кислород неорганических веществ или промежуточные продукты
распада, потребляемые вещества используются неполно и
малоэффективно. Такой обмен характерен для многих микроорганизмов, в
результате жизнедеятельности которых накапливаются
разнообразные "•;• ~"кги неполного распада органических вещее гэ. Это
77
лежит в основе производства многих продуктов микробного
происхождения.
Центральными звеньями в процессах распада органических
веществ являются пировниоградная кислота и ацетил-КоА, в
процессе дальнейших превращений которых образуются окисляемые
вещества и строительный материал. Разнообразие химизма
превращения органических веществ в присутствии кислорода состоит
главным образом в разнообразии путей образования пировииоград-
ной кислоты и аиетил-КоА. В конечном итоге все сводится к
окислению ацетил-КоА, поскольку п него превращается
пировниоградная кислота Кроме того, ацетнл-КоА может образовываться
другими путями, т. е. не из пировнпоградпом кислоты.
Ацетнл-КоА, образовавшийся тем или иным способом,
подвергается превращениям, начинаемым циклом Кребса, или
циклом ди- н трикарбо новых кислот (рис. 18).
ClljCO~KoA
СН2СООН
сосоон
НАД./j Щавелевоуксусная
кислота
СН2СООН
ЗАТФ Т
СНОНСООМ
Яблочная кислота
СНСООМ
СНСООИ
Фуыаровая кнслотй
*A^HS
си2соом
2 АТФ '■
CHjCOOH
Яшарная кислота
ГТФ
CHjCOOH
Лимонная*4 ioHCOOH
l/игплта Г
С112СООН
кислота
CHjCOOH
ЧЛС-Акони- С-СООН
товая кислота Д „ _
СНСООН
HjO
:оон
Изолиыониая Ди/-«Л1,
кислота VHCO°H
СНОНСООН
£j -С02
СНгСООП
CHi
СО-КоА
а-Кетоглутан <J4aCC
ровая кислота гц
fСОСООН 3 АТФ
•КоА
Сукцннил-КоА
Рис. 18. Аэробное окисление ацетнл-КоА (цикл Кребса)
Циклическим этот механизм называется потому, что процесс
начинается со вступления в реакцию с ацетнл-КоА щавелево-
уксусной кислоты и заканчивается образованием этой же кислоты,
а остаток ацетил-КоА полностью разлагается (окисляется). Затем
цикл снова повторяется с новой молекулой ацетил-КоА. В резуль-
7й
тате взаимодействия ацетил-КоА со щавелево-уксуснон кислотой
образуется лимонная кислота, которая через цис-акошповую
кислоту превращается в изолимонную. Этот этап превращений пе
имеет энергетического (и, вероятно, конструктивного) значения
для организма. Изолимонная кислота окисляется под влиянием
фермента изоцитратдегидрогеназы, который передает
отщепленный водород и электроны через систему ферментов к кислороду.
Поскольку пзоцитратдегидрогеназа является пиридиновой
(активная группа ее НАДФ), передача водорода и электронов
сопровождается образованием трех молекул АТФ. В результате
дегидрирования и декарбоксилнрования нзолимоппой кислоты образуется
а-кетоглутаровая кислота. Последняя подвергается
окислительному декарбоксилироваиию, причем дегндрогеназа а-кетоглутаровоп
кислоты (активная группа НАД) передает водород и электроны
к кислороду также с образованием трех молекул АТФ.
Превращение а-глутаровой кислоты (как и пировипоградпой)
происходит с участием КоА. В результате образуется сукциннл
КоА. Его превращение в янтарную кислоту сопряжено с образо
ваннем макроэргического соединения ГТФ. Последний может
передавать свои фосфатный остаток на АДФ, т. е. служить
дополнительным источником АТФ. Образующаяся янтарная кислота
окисляется сукииндегидротеназой (активная группа ФАД),
которая передает водород п электроны к кислороду с образованием
двух молекул АТФ. Возникающая фумаровая кислота под
влиянием фумаратгидратазы превращается в яблочную кислоту,
которая окисляется малатдегидрогеназой (активная группа НАД). При
этом передача водорода и электронов к кислороду, как и в
большинстве случаев, сопровождается трехкратным фосфорнлнрова-
нием. Образующая щавелево-уксусная кислота взаимодействует
с новой молекулой ацетил-КоА, и цикл взаимопревращений
повторяется.
Таким образом, в процессе превращений ацетил-КоА полностью
разлагается. При этом происходит четырехкратное отщепление
пар водородных ионов. Ацетил-КоА содержит всего три атома
водорода. Остальные атомы водорода извлекаются из воды.
Следовательно, в цикле указанных превращений возможностей
отщепления водорода значительно больше, чем их заложено в
молекуле окисляемого вещества. Это свидетельствует о том, что в
процесс эволюции энергетического обмена веществ в живом
организме произошел отбор такого пути их взаимопревращений,
который охватывает возможно большее количестве промежуточных
продуктов, способных к дегидрированию и максимальному
выделен иго энергии, причем структура промежуточных продуктов
иногда намного сложнее етуктуры исходного вещества.
Интересно, что в процессе этих превращений вода становится источником
водорода, недостающего в исходном субстрате, т. е. вода участвует
в процессе окисления.
Некоторые микроорганизмы при потреблении уксусной
кислоты используют более короткий путь окисления ацетил-КоА, иазы-
79
ваемый циклом глиоксилевой кислоты. Суть его
заключается в том, что изолнмонная кислота разлагается на
янтарную и глпокснлевую кислоты. Последняя, взаимодействуя с
уксусной кисло юн, образует яблочную, которая подвергается
дальнейшему окислению, как и в цикле Кребса.
Окисляемые вещества образуются из органических веществ,
потребляемых живым организмом. Для этого органические вещества
должны разлагаться. Существуют разнообразные пути разложения
органических веществ в зависимости от нх химической структуры,
условий и природы живого организма. Наиболее распространенным
источником питания для всех организмов являются углеводы —
основной продукт фотосинтеза. Углеводы ивляюгся хорошим
источником как энергии, так и строительного материала. Это обьясия-
ется тем, что в процессе нх разложения легко образуются все
основные энергетические и строительные элементы — пировиног-
радная кислота, ацетнл-КоА, глицериновый альдегид и др. В
настоящее время хорошо изучены основные пути разложения
углеводов. В общем виде они представлены на с. 81.
Одни нз этих путей, называемый гликолитическим
(гексозоднфоефатпым), характеризуется образованием дифосфата
фруктозы, что приводит к ее разложению на две триозы,
подвергающиеся дальнейшим превращениям с образованием глицеринового
альдегида, нпровиноградноп кислоты и ацетнл-КоА.
Взаимопревращения всех моно- н полисахаридов сводятся к образованию
фрукгозо-1,6-фосфата. При другом пути пентозофосфат-
п о м (или гексозомопофосфатпом) — гексоза, превращаясь в моно-
фосфаг, сразу окисляется, что через ряд промежуточных стадий
приводит к образованию фруктозомонофосфата и фосфоглнцери-
пового альдегида, т. е. основных продуктов гликолнтического
разложения. В дальнейшем эти продукты подвергаются тем же
превращенном, что и при глнколитическом разложении. Это позволяет
дополнительно извлечь определенное количество энергии в виде
АТФ. Однако этот путь, вероятно, более сложен для
осуществления. Некоторые микроорганизмы, например, дрожжи, могут
разлагать- этим путем до 30 % углеводов, у отдельных плесневых
грибов этот путь преобладает.
Некоторые микроорганизмы используют другой вариант гексо-
зомоиофосфатного пути, называемого кетодезоксифосфо-
г л ю к о и а т н ы м (КДФГ-путь). Для этого варианта характерна
дегидратация образующейся фосфоглюконовой кислоты с
образованием 2-кето-З дезокснглюконата. Последний превращается в пи-
ропппоградную кислоту и фосфоглнцериповый альдегид —
обычные нролукты энергетического и конструктивного обмена.
Кроме углеводов большую энергетическую ценность
представляют жнры. Они обладают большими энергетической ценностью
и способностью к окислению, чем углеводы, но труднее
разлагаются в живом организме. Среди микроорганизмов лишь немногие
способны разлагать жнры, хотя нх составные части — жирные
*у
Гликолитический (гексозодифосфатный) путь
разложения углеводов
Полназы
f
I
Глюкоза
Кинаэы
+АТФ
-i
Полисахариды
Фруктоза
=г
=}
Манноза
Галактоза
ч
^
Глюкозо-6-®-«-Фруктозо-6-®—Маннозо-6-® Галактозо-6-
I
Книаза
+АТФ
~\S~
Глюкозо-1-®
Фруктозо-1,6-©
Альдолаза
®-Диоксиацетон ^-Z. 3-ф*глнцериновый
альдегид
НАД
НАД-Н2
2Н,е"к кислороду
НзРО,
1|3-©-глицериновая
кислота
I—АТФ
3- ©-глицериновая
кислота
2-®-глицериновая
кислота
J—-Н20
2-®- энолпировиноградная
кислота
I— АТФ
Эноллировпнограднаи
кислота
I
Пировиноградная
кислота
ЗАТФ
НАД
НАД-Hj
^7
Ацетил-КоА.
КоА
Этанол
Молочная
кислота
Масляная
кислота
кислоты и глицерин— хорошо усваиваются микроорганизмами.
Превращение глицерина и жирных кислот сопровождается
образованием основных продуктов энергетического и конструктивного
обмена. Глицерин окисляется с образованием глицеринового
альдегида, а затем пировиноградной кислоты — центрально! *> звена
И - 2-1702
Ы
Пентозофосфатный (гексозомонофосфатный) путь
разложения глюкозы
3 Глюкоза
3 ЛТФ-
ЗГ.1ЮКОЗО-6-®
ЗНЛД-
4
-«-3 НАД-Н2-
НГе-
-»- к кислороду
3 ®-глюкоиовая кислота
ЗС02—
3 НАД —
ЗНАД-Hj-
3-3 АТФ
НГе-
т "~к кислороду
3-3 АТФ
Рибозо-5-®—— 3 Рибулозо-5-®——2 Ксилулозо-5- ®
' гх= ■
3-® "Глицериновый
альдегид
DC
Седогептулозо-7-®
I
Фруктозо-6-®
ЭритрЧ)30-4-®
Фр) ктозо-6-® 3-®-глииеринопи(1
• альдегид
метаболизма. Жирные кислоты разлагаются различными путями.
Наиболее распространенным, дающим максимальный выход
энергии и конструктивного материала, является путь, называемый
Р-окисленнем:
р-Окнслеиие жирных кислот
сн2
сн,
CH,
coon
К>А
H.V
|—2 АТФ
* г
1 ФАД-Ня
сн, .
сч, |
сн,
1
СО^КоЛ
R
CHs
сн+н'°
-II
сн
СОгэКоА
»У
|— зАТФ
й <
( НАД-Н2
СН2 |
снон|
сн2
1
СОгоКоА
ЗАТФ>^^СЧ
[ Цикл
\ Кребса
■;А1Ф '
R
1
СНг
со tH'°
_| . .
СН2
1
СО ~ Ко А
ЗАТФ-,
У4-ЗАТФ
5АГФ 2АТФ
й
С112
СООМ Й
СН3 СП»
СО" Ко А СОмКоА.
] )
' Цикл |
i Кребса 1
X—-f'A ■vт',,
*ЗАТФ
62
Окисление начинается с отщепления водорода пи месгу распо
ложеиия р-связи. По месту образовавшейся двойной связи присо
единяется вода и возникает оксикислота, которая снова отдает но
дород, превращаясь в кетокнслоту. Последняя в присутствии води
распадается на ацетил-КоА и жирную кислоту, содержащую иа
два атома углерода меньше, чем исходная. Образовавшийся аце-
тил-КоА окисляется по циклу Кребса. При расчетах выхода
энергии следует учитывать расход АТФ на активирование кислоты и
дополнительную возможность ее образования на стадии
превращения сукцннил-КоА в цикле Кребса.
Все сказанное относится к разложению жиров и жирных
кислот в аэробных условиях. При отсутствии кислорода жиры
разлагаются менее интенсивно. Вопросу анаэробного разложения
высших жирных кислот до сих пор не уделялось достаточно внимания,
хотя для практики это немаловажно. Химизм их разложения,
вероятно, такой же, как и в аэробных условиях, и отличается тем, что
образующийся ацетил-КоА не вступает в циклическое окисление,
а превращается в уксусную кислоту, метан или другие продукты
Энергетическое значение азотистых веществ различно ввиду
разнообразия их структуры и химизма окисления. Однако все они
имеют общие этапы—образование пировиноградной кислоты и
ацетил-КоА, где сходятся пути энергетического и конструктивного
обмена всех веществ. Особенно характерна множественность
стадий разложения для метаболизма аминокислот, позволяющая
максимально использовать промежуточные продукты разложения и
обеспечивающая широкие возможности образования
конструктивного материала и, в первую очередь, самих аминокислот.
Ниже показаны пути входа аминокислот в цикл ди- и трнкар
боновых кислот в процессе их разложения:
Глиции, аланин, серии, цистеип, треонин
Фенилаланнн, тирозин, лейцин, Пировиноградная кислота
лизин, триптофан : I
'*' I
Ацетоацетнл-КоА » Ацетил-КоА
Аспарагиновая
кислота
Валнн, изолейцин, метионки
Сукцннил-КоА
Аргинин, гистнянн.
иролин
И-Кетоглутароваи
кислота/
Глутамнноман
кнели и
Наиболее простые по химической структуре аминокислоты—
глиции, аланин, серии, цистеин, треонин —включаются в цикл
последовательно через пировиноградную кислоту и ацетил-КjA. Бо-
83
и-
лее сложные аминокислоты включаются иначе. Так, фенилаланин,
гпрозии, лейцин, лизин, триптофан трансформируются в ацетил-
КоА через ацетоаиетил-КоА. Ряд аминокислот в процессе
разложения не проходит полный цикл аэробного окисления, а включается
в него па стадии какого-то промежуточного продукта. Так, аспара-
гиповая кислота включается в цикл через щавелево-уксусную, валин,
пзолеГшнн, метиомип — через янтарную, а глутаминовая кислота,
аргинин, гистидин, пролин включаются в циклическое окисление
через а-'кетоглутаровую кислоту. Некоторые аминокислоты могут
включаться в цикл тем или иным путем в зависимости от условий
и физиологического состояния организма.
В анаэробных условиях организм лишен таких возможностей
извлечения энергии и ограничивается использованием
незаконченных (рудиментарных) путей энергетического обмена. Подробнее
об этом сказано в разделах о промышленном использовании
анаэробных процессов.
ОСНОВЫ КОНСТРУКТИВНОГО ОБМЕНА
В процессе жизнедеятельности живых организмов одни и те же
вещества используются и в качестве источников энергии, и в
качестве строительного материала. Так, глицериновый альдегид,
являясь окисляемым веществом, может использоваться для
построения углеводов:
Глицериновый альдегид -f- Диоксиацетон ->- Гексозы -* Полисахариды
Из органических кислот, играющих главную роль в
энергетике, образуются аминокислоты — составные части белка:
Пнровиноградная кислота-»- Алании.
а-Кетоглутаровая кислота -*■ Глутаминовая кислота.
Янтарная, яблочная и фумаровая кислоты -»■ Аспарагиновая кислота.
Аминокислоты легко превращаются друг в друга, поэтому для
образования белка достаточно наличия указанных аминокислот,,
образующихся в процессе энергетического обмена (в цикле Креб-
са). Ацетил-КоА, играющий важнейшую роль в энергетическом
обмене, используется для построения жирных кислот и жиров.
Перечисленные метаболиты являются исходными веществами
для конструктивного обмена у всех организмов — автотрофов и ге-
теротрофов. Различие заключается лишь в происхождении
первоисточников: автотрофы их синтезируют из углекислого, газа, а ге-
теротрофы заимствуют у автотрофов.
В целом жизнедеятельность автотрофных и гетеротрофных
организмов можно рассматривать как непрерывный круговорот воды
и углекислого газа в природе, как динамическое равновесие
между окисленной и восстановленной формами углерода и других
химических элементов. Автотрофные организмы (растения и
некоторые микроорганизмы) превращают углекислый газ и воду в
органические вещества и кислород, а гетеротрофные (человек,
животные, микроорганизмы) снова разрушают эти вещества с
помощью кислорода и превращают их в углекислый газ и водуз
84
п2а
^втотрофы.
етеротрофьГ
Механизм синтеза белков, жиров и других веществ для авто
трофных и гетеротрофных организмов один и тот же. В химизме
биосинтеза углеводов имеются различия в начальных стадиях
процесса (до стадии образования триоз). У автотрофных
организмов образованию глицериновой кислоты предшествуют сложные
взаимодействия между рибулозофосфатом и углекислым газом.
Для них это единственный путь образования углеводов, а из пос
ледних—и всех других веществ. У гетеротрофных организмов об
разованию глицериновой кислоты предшествует возникновение
пировиноградной, которая образуется из любого потребляемого
вещества.
Образование углеводов при фотосинтезе без учета реакций,
дающих необходимые для этого АТФ и восстановленные дегидро-
геиазы, можно представить упрощенной схемой:
fiC02 + 6Н20 + 18АТФ + 12НАДФ-На
■ .' '\ /
, I 6АТФ' 12АТФ /
ЧЧ ^12 3-(Р)-ПС\Ч>/
ИРнбулозо-1,5-®/
V У
61'|:Лу:юзо-5-(Р)
-" зз-®-га 3®-;ia
3 Фруктоэо-|,6-(Р)
/
Глюкоэо-б-®
12 - 2-1702
Механизм образования углеводов из углекислого газа
называется циклическим, поскольку в этом процессе наряду с
образованием конечного продукта — гексоэы — образуется одно из исход
пых веществ — рнбулозофосфат. На начальном этапе превращении
синтезир)ется фосфат глицериновой кислоты. Дальнейшие этапы
превращении — восстановление глицериновой кислоты и
взаимодействие образующихся триоз — общие в химизме образования
углеводов для всех живых организмов.
Химизм превращения триоз сложнее, чем показано па схеме.
Более подробнее он представлен во многих пособиях в виде схемы,
называемой циклом Кальвина.
В конечном итоге для образования молекулы гексозы требуется
6 молекул С02 п 6 молекул Н20. Разложение гексозы гетеротроф
пыми организмами приводит к образованию такого же количества
С02 и Н20.
Круговорот Н20 и С02 в природе под влиянием автотрофов и
гетеротрофов упрощенно можно записать в виде уравнения
6COJ + 6llaO*=tCeH)aOe.
Интересно отметить, что для образования одной молекулы
гексозы требуется 18 молекул АТФ. Это, на первый взгляд,
противоречит тому, что процесс образования углеводов является способом
«консервирования» энергии. Тем не менее это действительно так.
поскольку в процессе полного окисления гексозы образуется вдвое
больше АТФ, чем ее затрачивается на синтез.
Гетеротрофные пути образования углеводов из органических
веществ сходятся па стадии пировипоградной кислоты. Многие
аминокислоты превращаются в углеводы через пировпиоградную
кислоту (глпкогепные аминокислоты). Углеводы образуются ил
жиров. Жиры расщепляются на глицерин и жирные кислоты.
Последние окисляются в аиетил-КоА. Глицерин и ацетнл-КоА
превращаются в пировнноградную кислоту. Дальнейший синтез
углеводов идет обычным путем.
Образование углеводов из других веществ для гетеротрофов
можно представить схемой:
Органические веществе
I
ПировинО! радиан кислота
п ' '
2-(£^-энолпироп||ноград||аи кислота
3-(Р)-глицериновая кислота
(£)-Дипк.:и«.|1с1011 * 3-(Р> ГлнцермиовыП альдегид
ФруКТ'м/j-I.fi- фосфит
Ь6
Таким образом, процессы синтеза и разложения углеводов име
ют много общего.
Образовавшийся фосфат фруктозы превращается в другие гек-
созы. Взаимопревращение гексоз происходит через образование
их фосфорных эфнроЕ.
Из полисахаридов наиболее характерным для микроорганизмов
является гликоген (животный крахмал). Он образуется
аналогично образованию крахмала в клетках растений. Механизм синтеза
разветвленных цепей изучен мало.
Исходным веществом в процессе синтеза жирных кислот
является ацетил-КоА, который образуется из пировиноградпой или
уксусной кислоты. Последняя используется в производстве микроб
ного жира. '
Синтез жирных кислот с четным числом атомов углерода, пре
обладающим в составе всех жиров, начинается с конденсации двух
молекул ацетил-КоА с последующим восстановлением
образующегося продукта и дальнейшим присоединением двууглеродиых
радикалов до достижения необходимой длины цепочки. При этом
двууглеродными радикалами могут быть ацетил КоА и малонил-
КоА. Последний в процессе взаимодействия декарбоксилируется,
и цепочка удлиняется только на два атома углерода.
Синтез жирной кислоты из ацетил-КоА н малонил-КоА можно
представить так:
Ацетил-КоА Ацетил-КоА
АТФ-
СО,
АТФ
СО„
Малонил-КоА НАД ■ На НАД ■ И. Малоннл-КоА
I \ I i
Ацетил-КоА-+- Ацвтоацетил-КоА-»-Окснбутирил-КоА ->-рутирил-КоА-»- и т. д.
СОа СОя
Если исходным веществом является только малонпл-КоА, для
синтеза жирной кислоты не требуется АТФ.
Липиды микроорганизмов содержат жирные кислоты с одной
и двумя двойными связями. Двойные связи образуются
дегидрированием активных остатков насыщенной жирной кислоты в
присутствии кислорода:
Os; НАДФ
СНа(СН,)мСО ~ КоА ► СН„ (СН,)5СН = СН (СН,),СО ~ КоА.
НАДФ ■ На
При отсутствии кислорода двойные связи могут
образовываться путем дегидратации оксикислот с последующим включением их
в состав жирных кислот.
Химизм образования жира из глицерина и жирных кислот
одинаков для всех организмов.
87
В живом организме легко синтезируются аминокислоты. В
связи с важной ролью аминокислот живой организм выработал
многообразные пути их синтеза. Одни из них легко образуются
прямым аминнриванием, переамннированием или посредством
других способов включения аммиака в соответствующие
органические соединения. Аминокислоты могут сравнительно легко
взанмопренращаться. Так, глутаминовая кислота образуется из
а-кетоглутаровоп кислоты и аммиака. Эта аминокислота может
образовываться в результате реакции переаминировання между
а-кетоглутаровой кислотой и какой-либо аминокислотой.
Глутаминовая кислота может подвергаться циклизации с образованием
аминокислоты — иролина. Из глутамииовой кислоты через
промежуточные стадии образуется аминокислота — гистидин.
Подобными путями образуется аспарагиновая кислота: пере-
амнпнрованнем из щавелево-уксусной кислоты, прямым аминиро-
ваннем фумаровой кислоты. Аспарагиновая кислота через стадию
образования нолуальдегида превращается в треоннн. Треонин
может образовываться из глнцина и уксусного альдегида.
Метнонпн образуется из цнетеина и гомосерина. Источником
образования лизина является а-кетоглутаровая кислота.
Серии и глиипп образуются нз глицериновой кислоты,
являющейся продуктом разложения глюкозы.
Алании образуется лекарбскенлированнемаспарагииовой кислоты
Синтез многих аминокислот взаимосвязан. Так, образование
валнна, лепнина и нзоленципа проходит через стадию образования
их промежуточных продуктов — изовалерьяновых кислот. Общим
промежуточным продуктом образования тирозина, фенплаланипп
и триптофана является шнкимовая кислота.
ХИМИЗМ БИОСИНТЕЗА БЕЛКА И ФЕРМЕНТОВ
Белковые вещества имеют первостепенное значение,
поскольку опн выполняют роль структурных элементов живого организма,
а многие з них являются ферментами, осуществляющими все
физиологические функции, т. е. процесс обмена всех веществ в живом
организме, в том числе и самих структурных белков. Поэтому
раскрытие химизма биосинтеза белка является одной из важнейших
задач биологии. В настоящее время известны основные этапы
химизма биосинтеза белков и ферментов, разработана
обоснованная теория регуляции этого процесса.
Процесс биосинтеза белка изучали главным образом на
микроорганизмах. Поскольку структуры белка и ферментов обусловлены
количеством аминокислот и порядком их расположения в молекуле,
в основе биосинтеза прежде всего лежит механизм построения
аминокислот в определенном порядке, т. е. механизм ориентации
их в линейном строю (рис. F9). Управление этим процессом
осуществляет ДНК, а сам процесс построения происходит с помощью
РНК. В процессе биосинтеза белка участвуют три вида РНК —
информационная (иРНК). транспортная (тРНК) и рпбосоммая
(рРНК). Информационная РНК — это копия отдельных участков
8Р
молекулы ДНК. Она отпечатывается на молекуле ДНК и тем
самым снимает информацию о порядке построения аминокислот в
молекуле белка. Затем в рибосомах она сама является матрицей,
на которой отпечатываются молекулы белка. Транспортная РНК
выполняет функцию переноса и построения (ориентации)
аминокислот на молекуле нРНК. Рнбосомная РНК является
структурным элементом рибосом. Ее функция в процессе биосинтеза белка
не ясна. Поскольку известно, что рРНК в какой-то степени (0,2 %)
происходит от ДНК, можно полагать, что и она принимает
активное участие в построении аминокислот.
Местом синтеза белка являются рибосомы. В процессе
биосинтеза участвуют рибосомы с константой седиментации 70 единиц
Сведберга (70 S). Они состоят из двух частиц (субъединиц) —
30 S и 50 S. Белок может синтезироваться в одной или сразу в
нескольких рибосомах, связанных информационной РНК и
называемых п о л и с о м а м и. Построение аминокислот начинается с их
активации в результате взаимодействия с АТФ:
R—СНСООН + АТФ + Фермент-у R—СНСО ~ АМФ-фермент.
I I
NH, NHa
В результате образуется комплекс из остатков аминокислот
и АМФ (аминоацил-АМФ), или адеиилат аминокислоты, который
затем взаимодействует с тРНК. Каждой аминокислоте
соответствуют определенные тРНК.
Взаимодействию тРН К с аминокислотой предшествует ее
активация, заключающаяся в присоединении остатков трех нуклеотидов
к концевой части молекулы тРНК, причем два нуклеотида являются
цитнднловой кислотой и один (концевой) — адениловой кислотой:
тРНК + 2ЦТФ + АIФ ->- тРНК—Ц—Ц—А + ЗН,Р207.
Активированные тРНК взаимодействуют с аденилатами
аминокислот:
/?—СНСО *> АМФ-фермент + тРНК—Ц— Ц—А —
I
NHa
— R—СНСО ~ А—Ц—Ц—тРНК + АМФ-фермент.
NHa
Образуются макроэргические соединения — аминоацилтранс-
портпые РНК. Запас их энергии расходуется на образование
пептидных связей. Амнноацилтранспортные РНК поступают в
рибосомы и располагаются в определенном порядке, соответствующем
строю нуклеотидов в иРНК, находящейся в рибосоме, причем
орнетацию, т. е. отыскание места расположения, осуществляют
тРНК, за которыми следуют аминокислоты.
Система управления. Кодирование аминокислот и транскрипция
(переписывание) кода. Наиболее ответственным и сложным
механизмом процесса биосинтеза белка является система, управляющая
построением аминокислот. Программа построения записана в
молекуле ДНК. В процессе размножения организма эта программа в
£Ю
результате удвоения ДНК в неизменном виде переходит от поко
лення к поколению, что и обусловливает сохранение свойств,
выработанных в процессе эволюции, и, следовательно, сохранение
вида. В процессе роста клетки, т. е. в процессе биосинтеза белка,
программа нострсеппя аминокислот через посредник иРНК
передается из ядра в рибосомы. Роль ДНК заключается не только в
сохранении и передаче программы построения аминокислот. ДИК
управляет и процессом реализации этой программы, т. е. процессом
мобилизации аминокислот и их транспорта из цитоплазмы в
рибосомы через тРПК, которые тоже синтезируются на молекуле ДНК.
Программа посфоепии аминокислот записана в молекуле
ДНК в виде сочетаний нуклсотидов. Каждая аминокислота имеет
свой код (шифр) в молекуле ДНК. Поскольку в молекуле ДНК
имеется всего четыре вида иуклеотидов, каждой аминокислоте не
может соответствовать один нуклеотид, т. е. один нуклеотид не
может быть кодом аминокислоты. Простой арифметический подсчет
показывает, что кодом аминокислоты может быть сочетание не
менее трех иуклеотидов. Из четырех иуклеотидов таких сочетании
может быть 64. Следовательно, для одной аминокислоты
существует несколько кодов, что доказано экспериментально. Кодирование
всех аминокислот какого-либо полипептида происходит на
относительно небольшем участке ДНК, а вся молекула ДНК
кодирует множество полипептндов. Реализуя свои код, молекула ДНК
непрерывно отпечатывает па различных участках множество
молекул иРНК, каждый из которых содержит информацию о построении
комплекса ферментов. Отпечатанные иРНК направляются в
рибосомы. Процесс отнечатываиия иРНК на молекуле ДНК, т. е.
процесс переписывания кода, называется транскрипцией. В рибосоме
на молекуле иРНК строятся аминокислоты в том порядке, в
каком расположены их коды, т. е. сочетания (триплеты) иуклеотидов.
Однако нуклеотиды не могут непосредственно определить
(укачать) место расположения аминокислоты иа молекуле иРНК,
поскольку между нуклеотидами и аминокислотами не могут
возникнуть какие-либо силы взаимодействия. Построение аминокислот
на нуклестида.х или другими словами отыскание их кода
происходит с помощью второго посредника — тРНК.
Механизм ориентации тРНК на молекуле иРНК и трансляция
(считывание) кода. Ориентация тРНК на иРНК происходит
благодаря взаимодействию комплементарных иуклеотидов (вернее,
ломплемеитарных сочетаний нуклеотндов-трнплетов), являющихся
чодом аминокислот. В молекуле тРНК в опеределепном месте
(антикодоне) имеется сочетание трех иуклеотидов,
комплементарных сочетанию трех иуклеотидов в определенном месте
иРНК (ко до не). На этом месте и располагается тРНК со своей
аминокислотой, благодаря взаимодействию этих триплетов, т. е.
образованию между ними водородных связен. Антикодои — это
как бы антишифр, а вернее, другая половина шифра аминокислот.
Первой половиной его является комплементарный триплет в
молекуле иРНК-
91
На молекуле иРНК выстраивается ряд аитикодоиов, т. е. ряд
тРНК со своими аминокислотами, между которыми образуется
пептидная связь и получается белок, соответствующий данному
сочетанию ко донов.
Другими словами, происходит считывание кода, переданного
от ДНК через молекулы иРНК-
Аминокислотный код полностью расшнфрсваи и приводится в
виде следующих сочетаний иуклеотидов в молекуле иРНК:
Серии УЦУ, УЦЦ, УЦА, УЦГ, АГУ, АГЦ
Лейцин УУГ, УУА\ ЦУЦ, ЦУУ, ЦУГ, ЦУА
Аргинин ЦГУ, ЦГЦ, ЦГА, ЦГГ, АГА, АГР
Алании ГЦУ, ГЦЦ, ГЦА, ГЦГ
Глицин ГГУ, ГГЦ, ГГА ГГГ
Валии ГУУ, ГУЦ, ГУА. ГУГ
Треоиии АЦУ, АЦЦ, АЦА, АЦГ
Пролии ЦЦУ, ЦЦЦ. ЦЦА, ЦЦР
Изолейцнн АУУ, АУЦ, АУА
Аспарагаиовая ГАУ, ГАЦ
кислота
Аспарапш ААУ, ААЦ
Глутаминовая ГАА, ГАГ
кислота
Глутамни ЦАА, ЦАГ
Цистеии УГУ, УГЦ
Гистидин ЦАУ, ЦАЦ
Фенилаланип УУУ, УУЦ
Тирозин УАУ. УАЦ
Лизин AAA, ААГ
Триптофан УГГ
Метнонии АУГ
То, что код является трнплетным, было ясно до его
расшифровки, так как в меньшем сочетании четыре иуклеотида не
обеспечивают количества кодов для 20 аминокислот. В сочетании но три
получается 64 кода, и большинству аминокислот состветствует
более одного кода. Поэтому код аминокислот является
множественным. Его еще называют вырожденным, поскольку
в нем допустима определенная, а в ряде случаев — любая
взаимозамена третьего основания без изменения смысла кода. Код
является универсальным, т. е. одним и тем же для всех
живых организмов.
Из 64 возможных триплетов в кодировании аминокислот
участвует только 61. Три триплета (УГА, УАА, УАГ) имеют другое
значение в процессе синтеза белка. Два из них (УАА, УАГ) являют-
ся т е р м и н и р у ю щ и м и, т. е., располагаясь в молекуле иРНК,
они определяют окончание синтеза молекулы белка. Эти триплеты
не имеют антикодона в молекуле тРНК, и последние не метут
располагаться со своими аминокислотами в данном месте молекулы
иРНК. Вследствие этого происходит пропуск в процессе
считывания информации с молекулы иРНК, т. е. в данном месте
заканчивается синтез одной и начинается синтез другой молекулы
полипептида. Роль триплета УГА еще не ясна.
Принято считать, что коды аминскислот отпечатываются на
одной из нитей ДНК. О роли второй нити ДНК говорится мало.
92
Между тем вполне очевидно, что кодирование какой-либо
аминокислоты осуществляют триплеты обеих нитей ДНК, т. е. кодом
аминокислоты следует считать два комплементарных триплета.
ДНК посылает этот кед в рибосомы по частям: половину кода,
т. е. копию триплета одной из спиралей молекула ДНК посылает
в рибосомы в составе иРНК в виде кодона, вторая половина этого
кода отпечатывается с комплементарного триплета другой спирали
и направляется в рибосомы в составе тРНК в виде антнкодона.
В рибосоме код восстанавливается, т. е. части кода находят («узна
ют») друг друга и тем самым расшифровывают структуру
молекулы соответствующего полипептида (определяют порядок
построения аминокислот).
Исходя из этого, можно сделать вывод, что код аминокислот,
представленный в виде сочетаний нуклеотидов в молекуле иРНК,
является неполным. Полный кед хранится в молекуле ДНК и пред
ставляет собой двойной триплет, т. е. два противоположных (ком
плементарных) триплета ДНК. Оба триплета и, следовательно,
обе спирали выполняют общую функцию— передачу кода в
рибосомы по частям. Такой способ передачи кода возник в связи с той
ролью, которую выполнят ДНК как хранитель наследственной
информации. Хранение информации в виде двух частей — это,
вероятно, единственный способ сохранения вида, поскольку
наличие двух комплементарных цепей позволяет путем редупликации
ДНК в процессе размножения воспроизвести их копии и тем са
мым передать потомству в неизменном виде информацию о
свойствах родительских особей. В связи с этим организм выработал и
соответствующий механизм передачи обеих частей кода в
рибосомы в процессе роста: одна часть передается с помощью иРНК,
другая — с помощью тРНК. Остальные биохимические процессы
биосинтеза белка и ферментов подчинены этому механизму.
В табл. I приведены комплементарные триплеты в молекуле
ДНК, являющиеся полными кодами аминокислот. Таблица дает
наглядное представление о том, как четыре нуклеотида
обеспечивают кодирование 20 аминокислот. При рассмотрении любой из
двух «комплементарных» половин таблицы видно, что каждый из
четырех нуклеотидов, стоящих в первом ряду от центра,
участвует в кодировании группы аминокислот. Таких групп,
естественно, всего четыре. При сочетании нуклеотидов по два число кодов
(пар) возрастает до 16 и повышается их специализация, т. е. часть
нуклеотидных пар (их восемь) обеспечивает кодирование по одной
аминокислоте. Другие же пары участвуют в кодировании
одновременно двух аминокислот, другими словами 16 нуклеотидных пар
недостаточно для кодирования 20 аминокислот. Необходима
дальнейшая специализация, при которой одно и то же сочетание
нуклеотидов не могло бы колировать разные аминокислоты. Это
возможно лить при наличии третьего члена кода. Для этого
in пользовались те же четыре нуклеотида, т. е. каждая из 16 пар
нол\чнла по четыре нуклеотида в качестве третьих членов кола
(они расположены в крайних графах табл. J). Это привело к боль-
93
шому избытку кодов, т. е. недостаток специализации дуплетного
кода перерос во множественность триплетного кода. При этом
многие коды выполняют одинаковые функции — кодируют одну и ту же
аминокислоту. В результате ряд аминокислот имеет по четыре
и даже по шесть кодов, у которых третьим членом может быть
любой нуклеотид. Коды остальных аминокислот делят между
собой четыре нуклеотнда в качестве третьего члена. Вполне
естественно, что у аминокислот третьим членом кода которых
являются все четыре иуклеотида, любая их взаимозамена не
изменяет смысл кода, т. е. любой полученный триплет будет
кодировать одну и ту же аминокислоту. Такие коды характерны для
Таблица 1
Сочетания нуклеотидов, кодирующих аминокислоты, в комплементарных нитях ДНК
■I' ! -
в с 1- и з
F. 5 6 к
S < с
_ о.
о <
М]
гатц
Г
гатц
А
га
тц
т
гатц
U
Г
гатц
Г
га
тц
А
га
тц
Т
га
т
Ц
Ц
А
гатц
Г
гат1ц
А
га
тц
т
га
тц
Ц
т
гатц
Г
гатц
А
га
тц
Т
гатц
Ц
Ц
Ц
Ц
цтаг
Т
цтаг
А
ЦТ
аг
Г
цтаг
т
Ц
цтаг
Т
ЦТ
аг
А
ЦТ
аг
Г
иг
а
г
А
и
цтаг
т
цта
г
А
ЦТ
аг
Г
иг
аг
Г
Ц
цтаг
Т
цтаг
ЦТ
аг
цтаг
восьми аминокислот. В большинстве остальных кодов третьим
членом может быть не любой из четырех нуклеотндов, а лишь
один нз каких-либо двух. Значит, в этих случаях замена третьего
члена кода без изменения его смысла возможна только в
пределах этих двух нуклеотидов. Для двух аминокислот — триптофана
и метиопнна — вообще не возможно заменять какой-либо
нуклеотид, так как у них всего по одному коду. Это ограничивает
включение указанных аминокислот в белок и, вероятно, поэтому во
многих белках ощущается их недостаток.
Можно предположить, что трнп.петный код появился не сразу.
Возможно, на какой-то стадии эволюции в состав белка входило
всего 16 аминокислот н было достаточно дуплетного кода.
Совершенствование организма вызвало потребность в дополнительных
аминокислотах для создания более сложных белков. Появилась
необходимость в увеличении числа кодов, что возможно лишь при
создании триплетного кода из тех же четырех нуклеотидов. Это
привело к избытку кодов. В настоящий период не псе они
«задействованы», но в будущем — это «запас» возможностей для даль-
94
нейшего увеличения количества аминокислот, т. е. усложнения
структуры белка и совершенствования организма.
Регуляториые механизмы синтеза ферментов. Синтез веществ
не может идти бесконечно, после накопления достаточного их
количества действие ферментов должно прекращаться. По истечении
определенного времени действие ферментов должно
возобновляться. В живой клетке имеются механизмы, управляющие
деятельностью ферментов, а
Структурные
Ген-регулятор Ген-оператор гены
также включением и
выключением самого
процесса их биосинтеза.
Программа построения
ферментов заложена в
молекуле ДНК, там же
находится и механизм
включения и выключения нх
синтеза. Механизм
регуляции активности
каждого из ферментов находится
в их молекулах.
Производство ферментов
уменьшается торможением
действия соответствующего
гена, а ферментативная
активность —
торможением действия самого
фермента.
Торможение
действия гена
(репрессия). Ген какого-либо
фермента — это участок
ДНК, содержащий
комплекс кодов (шифров) всех
аминокислот, входящих в
состав фермента. Этот
участок называется
структурным геном (цистро-
ном). Структурные гены
располагаются в виде
блоков— геномов. Каждый
OS, s2
s<
ш
Лнк
Шг
zzjmm///mmz^
ji
О Sj S2
54
-zm ушмш/шл 'дни
Лпорепргссор
AAA/V
и РНК
Л
Продукт обмена
(корепрессор)
Рис. 20. Схема регуляции процесса биосинтеза
ферментов (торможение действия гена):
а — участок ДНК. содержащий гены, ответственные
ва синтез группы ферментов; б ■— ген-оперятор
блокирован и геном не передиет информацию; в — ген-
оператор свободен (активен), информационная РНК
синтезируется н происходит синтез ферментов
геном содержит несколько генов и управляет синтезом нескольких
ферментов, необходимых для осуществления нескольких
взаимосвязанных процессов. Каждый геном имеет на одном конце небольшой
участок — дополнительный ген (ген-оператор). Вся группа генов
вместе с геном-оператором называется опероном. Ген-оператор
включает и выключает действие структурных генов. Однако
регулируется это включение и выключение не самим геном-
оператором, а извне. На некотором расстоянии от
гена-оператора расположен ген-регулятор (рис. 20). Он выделяет в среду
95
Определенное вещество, которое само по себе не активно.
Соединяясь в цитоплазме с другим веществом, оно приобретает
активность, реагирует с геном-оператором и блокирует (выключает) его.
Такой способ включения гена-оператора, ведущий к прекращению
транскрипции нРНК. (передачи информации) и прекращению
синтеза ферментов, называется репрессией. Вещество, действующее
на ген-оператор, называется репрессором. Следовательно, репрес-
сор состоит из двух частей: вещества, выделяемого
геном-регулятором (апорепрессора), и другого вещества, вступающего во
взаимодействие с первым (корепрессора). Корепрессором является
конечный продукт реакции. По мере исчезновения этого продукта
наступает дерепрессия и оперон снова синтезирует фермент. Например,
если какая-либо аминокислота накапливается в избытке, она всту
пает во взаимодействие с апорепрессором, и образующийся
продукт выключает ген-оператор, управляющий синтезом ферментов,
участвующих в процессе образования дайной аминокислоты.
Другими словами, избыток данной аминокислоты посредством
гена-оператора выключает действие ферментов, участвующих в ее
биосинтезе. По мере исчезновения данной аминокислоты
(вследствие включения ее в молекулу белка) блок снимается и ферменты
продолжают ее синтезировать. Если данная аминокислота
образовалась в результате разложения какого-либо полипептида, то она,
вероятно, тоже репрессирует образование ферментов, участвующих
в ее биосинтезе. Ферменты же, разлагающие полипептид, про
должают действовать, и накопление данной аминокислоты может
продолжаться. Процесс разложения веществ, вероятно, не всегда
можег регулироваться конечным продуктом, поскольку конечным
продуктом разложения многих соединений может быть одно
и то же вещество. Одним из механизмов регуляции синтеза
разлагающих ферментов является конкурентная репрессия.
При этом корепрессором является не конечный и не начальный
продукт распада, а другое, конкурентное вещество. Такой
механизм репрессии характерен для процесса распада углеводов.
Причем универсальным конкурентным корепрессором является
глюкоза. Она не имеет конкурентов, поэтому процесс синтеза
ферментов расщепления глюкозы происходит беспрепятственно
и не зависит от наличия в среде каких-либо веществ и самой
глюкозы. Такие ферменты, синтез которых не зависит от наличия
субстрата, называют конститутивными.
Конкурентный корепрессор, например глюкоза, вступает в
реакцию с апорепрессором и блокирует ген-оператор, ответственный
за синтез ферментов, разлагающих другие углеводы. По
исчезновению из среды глюкозы блок снимается, и начинается синтез фер
ментов, разлагающих другой углевод, если он присутствует
в среде. В этом случае другой углевод является
индуктором, т. е. веществом, индуцирующим синтез разлагающих его
ферментов. Такие ферменты называются индуктивными.
Индукция может быть последовательной. При этом
микроорганизм в присутствии индуктора вырабатывает вначале одни фер-
96
мент, осуществляющий начало разложения. Образующийся
промежуточный продукт индуцирует образование другого фермента,
необходимого для следующей стадии процесса, н т. д.
Микробиологи называют индуктивные ферменты
адаптивными, т. е. появляющимися в результате адаптации
микроорганизма к данному субстрату. Однако это нельзя понимать так, что
до адаптации микроорганизма к данному веществу в молекуле его
ДНК не было генов, ответственных за синтез эгнх ферментов,
поскольку структура ДНК не изменяется в процессе
жизнедеятельности организма.
Примером индуктивного фермента является р-галактозидаза
(лактаза) кишечной палочки. Если ее выращивать в среде с
глюкозой, в клетках не обнаруживается лактаза, в среде с лактозой
клетки начинают вырабатывать лактазу. При перенесении клеток
из среды с глюкозой в среду с лактозой биосинтез лактазы
начинается после некоторого периода адаптации, длящегося около трех
минут. Если же поместить клетки в среду, содержащую смесь
глюкозы и лактозы, они начинают потреблять вначале глюкозу.
По исчезновении глюкозы на некоторое время рост клеток
прекращается, затем они начинают потреблять лактозу.
Таким образом, индукция — это дерепрессия генов, имеющихся
в молекуле ДНК, т. е. снятие блока, вызванного присутствием
конкурентного репрессора.
Конкурентная репрессия и индукция лежат в основе явления,
называемого диауксией. Суть его заключается в том, что
микроорганизмы в присутствии смеси источников углерода потребляют
их не одновременно, а поочередно, начинам с наиболее легко
усвояемого. В присутствии смеси различных источников углерода
функционируют только гены, ответственные за разложение
наиболее доступного вещества (наиболее сильного копкурента-корепрес-
сора), все другие гены, ответственные за синтез ферментов,
разлагающих присутствующие вещества, находится в состоянии
репрессии. Причем корепрессором для всех генов является наиболее
доступное вещество.
Торможение действия фермента (а л л остер и-
ческое торможение). Репрессия служит для грубого
регулирования процесса синтеза ферментов. Существует более быстрое
(тонкое) регулирование—это инактивация самого фермента,
называемая аллостерическим торможением. В молекуле фермента
имеется два пространственно-разобщенных активных центра.
Одним из них фермент связывается с субстратом, другим — с
конечным продуктом. Соединяясь с субстратом, фермент превращает
его в конечный продукт. Если конечный продукт накапливается в
избытке, он присоединяется к аллостерическому центру, в
результате чего фермент теряет способность соединяться с субстратом
и превращать его.
Регуляция биохимических процессов более эффективна, когда
действуют оба механизма — репрессия и аллостернческое
торможение.
13 - 2-1702
97
ГЛАВА ill
КУЛЬТИВИРОВАНИЕ ПРОМЫШЛЕННЫХ
МИКРООРГАНИЗМОВ
Большое значение в технологии микробиологических
производств имеет выбор сырья и физико-химических условий
культивирования. Некоторые виды сырья являются общими для многих
микробиологических производств, однако в каждом конкретном
случае его химический состав подвергается определенным
изменениям в результате специальной обработки или введения
дополнительных компонентов. Важными физико химическими факторами
являются температура культивирования, концентрация
водородных ионов (рН). окислительно-восстановительный потенциал среды
(ОВП). Многие микробиологические производства основаны на
применении аэробных процессов. Для них первостепенное
значение имеет вопрос аэрации, т. е. насыщение среды кислородом.
Большое значение п технологическом процессе имеет взаимосвязь
между такими факторами, как рост культур, потребление
питательных веществ, длительность контакта клеток микроорганизмов
с питательными веществами, концентрация продуктов обмена в
культуральнон жидкости. Все перечисленные факторы имеют
прямое отношение к биохимическим процессам, происходящим в
клетке микроорганизмов при их культивировании.
ИСТОЧНИКИ ПИТАНИЯ
Ферментативные способности промышленных микроорганизмов
позволяют применять разнообразные вещества в качестве
источников питания при их культивировании. Применение тех или иных
веществ в отдельных производствах определяется рядом условий.
Универсальным источником питания для всех живых организмов
является растительное сырье. Это же относится и к
промышленным микроорганизмам. Основными питательными веществами в
растениях являются углеводы. Выбор сырья для
микробиологических производств зависит, в первую очередь, от ферментативных
способностей микроорганизмов. Немаловажное значение имеет
распространенность данного вида сырья и, следовательно,
экономическая целесообразность его применения. Выбор сырья иногда
зависит не только от указанных выше причин. В отдельных
случаях, например при производстве некоторых аминокислот,
витаминов, антибиотиков, приходится применять дорогостоящие
углеводы, поскольку в присутствии других источников питания
микроорганизмы не образуют нужных продуктов, хотя и проявляют
способность к развитию. При производстве ферментов существуют
свои ограничения з выборе сырья, обусловленные необходимостью
применения индукторов. Продуцент»! ферментов способны
развиваться в присутствии различны; >глеводов, однако обязательное
6В
условие синтеза ферментов — наличие соответствующего субстра
та. При производстве некоторых продуктов обмена в среде должны
присутствовать вещества, не являющиеся ни индукторами, ни
основными источниками питания, но влияющие на направление
биохимических процессов. Так, в процессе ацеюно-бутнлового
производства для иптесивного накопления растворителей кроме
основного источника питания — крахмала необходимо присутствие
определенного количества белковых веществ. Однако в
подавляющем большинстве случаев основным источником питания в сырье,
используемом на производстве, являются углеводы. В растительном
сырье они находятся главным образом в виде полисахаридов,
причем моносахариды входят в состав природных полисахаридов
в определенных формах. '
Из пентоз в растительных полисахаридах встречаются арабино-
за и ксилоза. Наиболее важными составными частями большинства
природных полисахаридов являются гексозы: глюкоза, галактоза
и фруктоза. В свободном состоянии они встречаются реже. Так,
глюкоза (виноградный сахар) и фруктоза (плодовый сахар)
содержатся в соке плодов и ягод. При наличии фруктозы сильно
повышается сладость продукта, поскольку фруктоза в пжь раз слаще
глюкозы и в 1,7 раза слэше сахарозы. В природных соединениях
глюкоза и галактоза находятся в а- и р-ниранозной форме,
фруктоза— только в Рфуранозной форме. Природные моносахариды
относятся к D-ряду.
Природные дисахариды встречаются в виде различных
сочетаний остатков глюкозы, галактозы и реже фруктозы. Остатки
моносахаридов обычно связаны между собой связями 1—4. т. е.
глюкозидный гндроксил одного моносахарида соединяется с неглю-
козндным гидроксилом другого моносахарида, у которого
глюкозидный гидроксил остается свободным и определяет наличие
редуцирующих свойств дисахарида. Только в одном случае (в молекуле
сахарозы) имеется связь 1—2, т. е. глюкозидные гидрокснлы обоих
моносахаридов связаны между собой, что обусловливает
отсутствие редуцирующих свойств у сахарозы. Наибольшее значение
имеют дисахариды: сахароза, лактоза, мальтоза и целлобноза:
ен2он он
0 он
СХХ^ .ONQ,,
он ^ сн2он- он
Сахароза Лактоза
■ риа рис*
Мальтоза Целлобиоза
Сахароза (тростниковый или свекловичный сахар) состоит из
остатков а-глюкозы и р-фруктозы (связь 1—2), содержится в
99
большом количестве в соке сахарного тростинка и свеклы,
которые выращиваются для производства этого углевода. Отход
производства— меласса — является самым распространенным
сырьем микробиологической промышленности.
Лактоза (молочный сахар) состоит из остатков р-галактозы
и а-глюкозы (связь 1—4), содержится в молоке всех животных
и является одной пз составных частей, определяющих его
питательную ценность. Используется при производстве ферментов.
МалЬтоза (солодовый сахар) состоит из остатков а-глюкозы
(связь 1—4), в свободном состоянии пе встречается, является
структурной единицей крахмала. Имеет большое значение в
пищевой и микробиологической промышленности как промежуточный
продукт разложения крахмала.
Целлобиоза состоит из двух остатков глюкозы (связь I—4),
причем первый из остатков глюкозы, глюкозндная связь которого
участвует в реакции, находится в р-форме, а второй может быть
и в а- и в р-форме. В свободном состоянии целлобиоза не
встречается, является структурной единицей клетчатки.
Из трпсахарндов в природе обнаружена в основном рафипоза.
Она состоит из остатков а-галактозы и сахарозы, связанных между
собой связью 1—6:
он л п сн2он
cntxtt
он сн2он
Рафииоза
В небольшом количестве содержится в сахарном тростнике и
сахарной свекле. Имеет промышленное значение как
дополнительный источник питания при использовании отходов сахарного
производства.
Из полисахаридов большое распространение в природе и
наиболее важное промышленное значение имеет крахмал. Он состоит
из двух полисахаридов — амнлозы и амилопектииа.
Амилоза — это неразветвленная цепочка, содержащая около
300 остатков а-глюкозы, соединенных связью 1—4:
JC^fC-AJK^L
-о- _
Амилоза
Молекулярная масса амилозы около 1 000 000, она хорошо
растворяется в воде.
Амнлопектин — это разветвленная цепочка из остатков
а-глюкозы, имеющая в местах разветвления связь I—6. Разветвления
встречаются через каждые 28—30 остатков глюкозы:
100
-о
n
-о-
-JO
-"28-30
28-30
Амилопектии
Молекулярная масса амилопектппа достигает нескольких
сотен миллионов. Амилонекгип растворяется в воде при высокой
температуре под давлением.
Под влиянием кислот или ферментов крахмал гидролизуется
с образованием промежуточных продуктов с постепенно уменьшаю
щимся количеством остатков глюкозы—декстринов:
Крахмал -> Ами.-|адскС1[)ини -> Эритродекстрины -»- Ахроодекстриии -»-
(сшшП) (сшн'-фнолеюиые) (красные) (не окрашены)
-* Мальтодекстрнны -*- Мальтоза -»- Глюкоза.
С уменьшением количества остатков глюкозы в декстринах
снижается интенсивность их окрашивания иодом и, начиная с ах-
роодекстринов, они полностью теряют способность окрашиваться.
Это используется в микробиологической промышленности д.:я ви
зуалыюго контроля степени гидролиза крахмала.
В качестве сырья в спиртовой промышленности иногда
применяется полнфрукгознд—инулин. Он состоит из остатков {5-фрук-
тозы, соединенных связью 1—2. Количество остатков не превышает
34. В растениях обнаружены инулниоподобпые вещества, еодер
жащие от 2 до 34 остатков фруктозы. Ииулнпсодержащее сырье —
топинамбур, георгин, кок-сагыз, цикорий распространено лишь в
определенных географических районах, чю ограничивает его
промышленное применение.
Большие потенциальные возможности для применении в мпк
робнологнческой промышленности имеет клетчатка — наиболее
распространенный полисахарид в природе, составляющий более
50 % массы древесины. Структурной единицей ее является целло-
биоза, т. е. клетчатка состоит из остатков р-глюкозы, соединенных
связью 1—4. В растениях находится в связанном виде с лигнином
и другими веществами, от которых может быть отделена
сульфитом. На этом основан способ обработки, древесины в целлюлозно-
бумажной промышленности. Клетчатка нерастворима в поде и
растворяется в медно-аммиачном растворе или при кипячении е
серной кислотой. Это ограничивает ее применение в
микробиологической промышленности, однако совершенствование способа
гидролиза может обеспечить широкое использование ее в качестве
углеводного сырья.
То же самое можно сказать о гемицеллюлозах,
высокомолекулярных полисахаридах, широко распространенны- в растениях и
состоящих из остатков различных гексозанов и пентозанов.
14 - 2-1702
101
Большое значение в промышленности имеют пектиновые веще-
стпа Это б такие к полисахаридам соединения, содержащиеся в
плоаах и ягодах. В смеси с сахаром образуют гели, что
используется в кондитерской промышленности. Пектиновые вещества
применяются в ферментной промышленности как составные части
1'итателы.ь'х сред. Они представляют интерес п в другом
отношении. Так, п вниоаелпн пектиновые вещества выпадают в осадок
при созревании вин, что снижает качество последних. В
производстве соков они препятствуют полному разрушению клеточных стенок
плодов и ягот и высвобождению сока. В этих произвояствах пеоб-
хошмо применение пектинразлагающих ферментов микробного
пропсхожаепия. Процесс микробиологического разложения
пектиновых веществ является также одной из стадии обработки
растительного волокна, например льна (мочка льна). В связи с этим
большие значение имеет подбор микроорганизмов, способных гид-
ролизовать пектиновые вещества.
В растениях пектиновые вещества находятся в виде
нерастворимого и растворимого пектина. Нерастворимый пектин,
называемый протопектином, представляет собой соединение растворимого
пектина с каким-либо полисахаридом. При действии кислот или
ферментов нерастворимый пектин переходит в растворимый.
Растворимый пектин — это метиловый эфир полнгалактуроновоп
кислоты, называемой пектиновой кислотой:
О О О
и и II
С-О-СНз С-О-СНл С-О-СНз
ФИЗИКО-ХИМИЧЕСКИЕ УСЛОВИЯ КУЛЬТИВИРОВАНИЯ
Важным технологическим показателем микробиологических
производств является температура культивирования. Значение
температуры состоит прежде всего в ее влиянии па активность
ферментов, а также на состояние конструктивного материала клетки.
Микроорганизмы, как н все живые существа, имеют оптимальную
температуру развития. В мире микроорганизмов значение этого
фактора не настолько строго определенно, как у животных, но
общие закономерности влияния температуры одни и те же.
Повышение температуры может привести к инактивации ферментов и
нег.*",рптнмому прекращению жизнедеятельности микроорганизмов.
Снижение температуры приводит к замедлению гействпя фермеп
тон, причем микроорганизмы могут сохранять жизнеспособность
и пребывать длительное время в таком состоянии, называемом
анабиозом.
102
Микроорганизмы не могут проявлять ферментативную актк„
ность при температуре выше 70 °С. Существуы зависимость между
изменением температуры и скоростью ферментагивной реакции:
при повышении температуры на 10°С скорость реакции возрастает
в 2—4 раза (правило Вант-Гоффа). Эта з ичоиомерассть проя-i
ляется до температуры 45—50 "С. Что касается оптимальной тем
пературы, то. у ферментов в этом отношении наблюдается
определенная специфика: некоторые ферменты активны при довольно
низкой температуре (около 10°С), другие—при средней температуре
(около 37СС), третьи— при высокой (около 50СС). На основании
этого микроорганизмы делят на п с и х р о ф и л ь и ы е, мезс-
ф и л ь и ы е и термофильные, развивающиеся соответственно
при низкой, средней и высокой температурах. В основе такого
различия своисть лежит не только приспособление ферментных систем
к определенной температуре, но и приспособление самой
структурной организации клетки. Об этом свидетельствует то, что среди
одного и того же вида микроорганизмов, обладающих одинаковым
набором ферментов, могут быть мезофильные и термофильные.
Более того, мезофильный микроорганизм можно адаптировать
к высокой температуре.
Большое значение в микробиологической промышленности
имеет применение термофильных микроорганизмов, позволяющих
повысить эффективность производства, хотя и требующих
определенных дополнительных затрат па поддержание температуры. Однако
среди промышленных микроорганизмов пока еще мало
термофильных.
Активность ферментов в значительной степени зависит от
концентрации водородных ионов. Изменение концентрации
водородных ионов влияет на количество свободны* аминогрупп и
карбоксильных групп, от концентрации которых зависят свойства белка
и активность ферментов. Ферменты столь же чувствительны к
изменению реакции среды, как и к изменению температуры
Возможные концентрации водородных ионов находятся и
пределах 1,0...0,00000000000001 г/л. Верхний предел концентрации
водородных ионов наблюдается в среде, кислотность которой
соответствует 1 и. раствору кислоты, нижний предел соответствует I и.
раствору щелочи. Ввиду малых числовых значений концентрации
водородных ионов ее величину выражают отрицательным
десятичным логарифмом. Например, в 0,01 н. растворе кислоты содержится
0,01 или Ю-2 г/л водородных ионов. Отрицательный логарифм этого
числа равен 2 Концентрация водородных ионов обознэч 1ется
символом рН. В данном примере рН раствора pjsen 2. Наименьшая
концентрация водородных ионов в кислой среде равна Ю-7 г/л, что
соответствует рН= 7,0 (нейтральная реакция). Дальнейшее
уменьшение концентрации водородных ионов происходит в щелочной
среде. С уменьшением концентрации водородных ионов увелнчи-
иается щелочность среды, и при наименьшей их концентрации
рН=14, что соответствует 1 п. раствору щелочи.
103
14-
Многие вещества, содержащиеся в среде, противодействуют
увеличению и кислотности, и щелочности. Они называются буферными
веществами. Буферными свойствами обладают аминокислоты и
белкн. Их буферность объясняется амфотерностыо, способностью
реагировать с кислотами и щелочами. Буферными свойствами
обладают минеральные вещества, а также разнообразные смеси
минеральных н органических веществ. Общей особенностью всех
буферных веществ является их незначительная степень
диссоциаци н, т. е. слабое проявление кислотных и щелочным
свойств, с одной стороны, и способность реагировать с кислотными
(Н-1") н щелочными (ОН-) ионами — с другой. В качестве
буферного раствора чаще всего применяют смесь дигнлро- и
гидрофосфата калмя — КИ2Р04 и K2IIPO4. В присутствии щелочи они отдают
водород, нейтрализуя гидроксильную группу ОН-:
КП,РО« H-|Na+OH--* KNaHPO« + HtO;
в присутствии кислоты они отдают ионы металла, присоединяя
кислотный нон Н+:
KjHPO, + Н+СГ — KH,POj + KC1.
В качестве буферов используют карбонаты и гидрокарбонаты
в зависимости от предполагаемого изменения реакции среды. Если
в результате жизнедеятельности предполагается нежелательное
увеличение кислотности, в среду добавляют карбонаты. В растворе
карбонаты имеют нейтральную реакцию. Являясь солями очень
слабой кислоты, они реагируют со всеми кислотами, образуя
нейтральные соли и угольную кислоту, которая разлагается с
выделением СОг:
СО,
Т
Na,COs + 2HC1 -*- 2NaCI + H2COs-*H20.
Гндрокарбопаты, являясь нейтральными веществами,
препятствуют повышению щелочности среды. Они отдают ионы водорода,
нейтрализуя щелочные ионы ОН-:
NaHCOj Ч- NaOH -»■ Na.CO, + Н,0.
Концентрацию водородных ионов можно определять различными
методами. Один из них, называемый колориметрическим, основан
на изменении цвета определенных веществ, называемых
индикаторами, при определенной концентрации водородных ионов.
С помощью набора индикаторов определяют значение рН.
Другой метод определения концентрации водородных ионов —
электрометрический — основан на измерении электрического
потенциала, возникающего между окисленной (водородными ионами) и
восстановленной (молекулярным е дородом) формами водорода.
Электрический потенциал, как известно, возникает между
восстановленной и окисленной формами химических элементов. Если
в раствор, содержащий ионы металла (катионы), погрузить
электрод, изготовленный из этого же металла, то электрод будет
104
отдавать в раствор положительно заряженные ионы, приобретая
при этом отрицательный заряд. Если концентрация ионов в растворе
будет больше, чем их может отдать электрод, то поток ионов
пойдет в обратном направлении, и электрод начнет заряжаться
положительно. Водород по свойствам близок к металлам. Если в
жидкость, содержащую ионы водорода Н+, погрузить электрод,
изготовленный каким-либо способом из водорода, то возникает
поток ионов и электрический потенциал на электроде. Такими
электродами могут быть платина или золото, насыщенные водородом
(последний хорошо растворяется в этих металлах). Однако
возникший электродный потенциал нельзя измерить. Необходимо иметь
еще один потенциал, отличающийся по значению от данного. При
соединении электродов, имеющих различные потенциалы, провод-
инком появляется ток (ЭДС), величина которого зависит от
разности потенциалов, а следовательно, от концентрации ионов водорода
в исследуемых растворах. Если концентрация ионов водорода
одного раствора известна, то можно определить концентрацию их
в другом растворе по уравнению Нернста:
RT [Н„]
E = ZF |п[НЧ' (1)
где Е—разность потенциалов (показания гальванометра, мВ);
R — универсальная газовая постоянная Дж/(моль-К);
Т—абсолютная температура, К; и — валентность ионов;
F—электрохимический эквивалент.
Отношение RT/nF называется константой Нернста. При
температуре 291 и переводе натурального логарифма в десятичный она
равна 0,0577. Таким образом, если известна концентрация попов
водорода в одном растворе, можно определить их концентрацию
в другом. Если взять для сравнения раствор, дающий очень малый
(практически нулевой) потенциал на электроде, то измеряемый
потенциал будет абсолютной величиной. Таким является раствор
1 моль ионов водорода в 1 л воды. Водородный электрод,
помещенный в такой раствор, имеет незначительный электрический
потенциал (—0,276 В) и называется нормальным водородным
электродом, который и принимается за нулевой. В таком случае можно
принять, что разность потенциалов, измеряемая между каким-либо
электродом и нормальным (нулевым), равняется:
Е = 0,0577 Ir -{щ = 0.0577 (- lg [H+|). (2>
поскольку —lg [FT] это рН, то £==0,0577 рН, откуда
Е
РН = 0ДО77 • (3)
В существующих электрических приборах для определения
разности потенциалов при градуировании шкалы гальванометра
учитывается коэффициент 0,0577, и прибор непосредственно показыва-
и '5
ет значение рН. Другие приборы позволяют определять значения
н ЭДС и рН.
Практически трудно получить 1 и. раствор ионов водорода,
поэтому при измерении рН нормальный водородный электрод обычно
ие применяют. Вместо него применяют так называемый
каломелевый электрод. Металлом в нем является ртуть, а жидкостью —
раствор каломели HgjCI2. Каломель малорастворима. Для
увеличения степени ее диссоциации применяется КО. Для того чтобы
степень диссоциации каломели была стабильной, создают
стабильную (насыщенную) концентрацию КО. При этом электрическим
потенциал, возникающий на ртути, постоянный и на +250 мВ
больше значения нормального водородного. Это учитывают при
измерениях. Электрический потенциал е ртутного электрода снимают
платиновой проволокой (электродом). Таким образом,
ртутный (каломелевый) электрод применяется вместо нулевого
(нормального).
Для измерения разности потенциалов не обязательно применять
насыщенный водородный электрод, т. е. платину, насыщенную
водородом. Насыщение платины связано с определенными
трудностями. Платину можно помещать не в насыщенный раствор водорода,
а в раствор, имеющий любую, но стабильную концентрацию
водорода, например в раствор хипгидрона. Хингидрон растворяется в
воде в строго определенном количестве, превращаясь при этом в
хиной и гидрохинон. Последний тут же разлагается на хнпоп н
водород. По мере уменьшения концентрации хингидрона в растворе
(в результате разложения) нерастворенпый хингидрон непрерывно
переходит в раствор. Таким образом, если в жидкость добавлять
избыток хипгидрона, то будет создаваться динамическое равновесие
между процессами его растворения и разложения, в результате
чего установится стабильная (динамическая) концентрация
выделяющегося водорода в жидкости. Если поместить в такую жидкость
платиновую пластину, то она будет насыщена постоянным
количеством водорода. Таким образом, систему хингидрон—платина
можно использовать вместо нормального водородного электрода.
Эту систему в паре с каломелевым электродом, принимаемым за
нулевой, можно использовать для определения рН. Для этого
нужно добавить избыток хипгидрона и опустить платиновый электрод
в исследуемый раствор. Содержащиеся в нем ноны водорода
создадут электрический потенциал на платиновом электроде, который
можно измерить, соединив платиновый и каломелевый электроды.
Наряду с концентрацией водородных ионов в
микробиологической промышленности широко применяется понятие
«окислите л ь п о-в о t с г а н о в и т е л ьн ы е условия», выражающее
степень окпелелностн и восстаповлениости компонентов
питательной среды. Эти условия определяются соотношением количеств
окисленных и восстановленных веществ. Для определения этого
соотношения можно титровать среду восстановителями (например,
Na^SjCb) или окислителями (например, КМпСМ- В результате
можно получил, общее представление о количестве окисленных нлнвос-
1<т
станевленных веществ в среде аналогично тому, как определяется
общая кислотность. Однако этого недостаточно для характеристики
окислительно-восстановительных условий. Как и в случае
кислотности, более существенным для жизнедеятельности
микроорганизмов является не общее количество окисленных и восстановленных
веществ, а активная окислительно-восстановительная способность,
т. с. соотношение между системой окисленных и восстановленных
веществ. Это соотношение, т. е. разница между противоположными
состояниями системы, называется окислительн о-в о с с т а и о-
вительным потенциалом. Это
окислительно-восстановительная мощность (напряженность) системы, способная
активизировать окислительно-восстановительные процессы. Для определения
мощности окислительно-восстановительной системы используют ее
способность создавать электрический потенциал (/Г/г). Если в
раствор, содержащий смесь окисленных и восстановленных веществ,
поместить электрод, то па нем создастся потенциал подобно юму, как
он создается при измерении концентрации водородных ионов (рН).
Различие состоит в том, что для создания электрического
потенциала водородными ионами мы искусственно вводим в раствор
восстановленную форму водорода. Другими словами, в создании
электрического потенциала при определении концентрации водородных
ионов участвует лишь один компонент исследуемого раствора —
ноны водорода Н+. Окислительно-восстановительный потенциал —
это электрический потенциал, создаваемый уже имеющейся в
растворе системой окисленных и восстановленных форм веществ.
Окислители и восстановители находятся в растворе в виде пар
ионов, например Fe2+**Fe3+, янтарная кнелота^фумаровая
кислота, Н2ч*2Н+ и т. д.
Большое значение в создании окислительно-восстановительного
потенциала имеет система окисленной и восстановленной форм
водорода. Окислительно-восстановительный потенциал системы и
концентрация водородных ионов находятся в тесной взаимосвязи,
и величина окислительно-восстаиовнтельного потенциала зависит
от иеличины рН.
Электрический потенциал, создаваемый
окислительно-восстановительной системой на электроде, можно измерить, если второй
электрод поместить в другой раствор, содержащий смесь окисленных
н восстановленных веществ, ио в другом соотношении, т. е. с
другим значением окислительно-восстановительного потенциала.
Между электродами возникает ток, ЭДС которого будет зависеть от
разницы окиелнтельно-воестзновительных потенциалов двух систем.
Если взять систему с минимальным и строго постоянным
окислительно-восстановительным потенциалом и принять этот потенциал
за нуль, то относительно него можно измерять
окислительно-восстановительные потенциалы любых систем. В качестве такого эталона
сравнения берут, как и в случае определения рН, нормальный
водородный электрод или, для удобства,— каломелевын электрод,
учитывая, что значение его потенциала на +250 мВ больше, чем
нормального водородного. Разность потенциалов, или ЭДС, возннкаю-
107
щая между нулевым и исследуемым электродами и создаваемая
окислительно-восстановительной системой исследуемого раствора,
обозначается Eh, а потенциал нулевого электрода Е0. Значение
* Eh может быть положительным или отрицательным в зависимости
от направления возникающего электрического тока. Последнее
зависит от направления потока электронов между электродами и
раствором, в который они погружены, а в конечном итоге от
соотношения между количеством окисленных и восстановленных веществ в
растворе. При преобладающем количестве окисленных веществ в
растворе возникает положительная ЭДС (стрелка гальванометра
отклоняется вправо) и, наоборот, прн избытке посстанопленных
реществ в системе возникает ток обратного направления.
Величина Eh в окислительно-восстановительной системе
колеблется в пределах —252 ... +910 мВ.
Поскольку концентрация водородных ионов является фактором
возникновения потенциала как при определепи рН, так и при
определении Eh, между этими величинами существует зависимость,
которая выражается уравнением Нернста:
£Л = £0 + 0.029 Ig^, (4)
где Е0— потенциал электрода сравнения.
Учитывая, что для нормального водородного электрода Ео — 0,
£» = 0,029 lgJp^j = 0.029 (21g [Н*|-lglH.1). (5)
Величину 21g|H+) можно представить как —2рН. Величину
—lg[H2], т. е. отрицательный логарифм концентрации
молекулярного водорода по аналогии с отрицательным логарифмом
концентрации водородных ионов, принято обозначать символом гНг- Тогда
Zf/i = 0,029(rlI2—2рН). Это выражение отражает взаимосвязь
между электрическим потенциалом, возникающим в окислительно-
восстановительной системе, и концентрацией водородных ионов.
В микробиологии часто принимают величину гН? для
характеристики окислительно-восстановительного потенциала среды или
культуралыюп жидкости. Исходя из приведенной формулы,
rU*=om+2pU- (6)
Значение г\\2 окисленных и восстановленных сред находятся в
пределах 0,0... 42,6.
Различные микроорганизмы по-разному реагируют на
изменение окпслнтельпо-посстапонитслыюго потенциала. Большинство из
них может приспосабливаться к различным окиелнтелыю-восстано-
внгельпым условиям,— это физиологически
полиморфные микроорганизмы. Некоторые микроорганизмы не могут
изменять свою жизнедеятельность н погибают при изменении
окислительно-восстановительною потенциала.
Ш
Окислительио-восстановнтельный потенциал можно изменить
добавлением окислителей или восстановителей. Восстановители
снижают гН2. К ним относятся сульфиды FeS, Na2S, гидросульфиты
Na2S203, Na2S205> углеводы — глюкоза и другие редуцирующие
сахара. В качестве окислителей, повышающих гН2, можно
применять КМп04, 12 и др.
Для ускорения начала развития микроорганизмов можно
добавлять окислители или восстановители. Однако следует учитывать,
что каждый микроорганизм в процессе жизнедеятельности
устанавливает определенный окислительно-восстановительный потенциал
среды, в которой он развивается. Уровень
окислительно-восстановительного потенциала в растущей культуре устанавливается самим
процессом обмена веществ. Если, например, приготовить несколько
вариантов среды с различными значениями rH2, создаваемыми с
помощью окислителей или восстановителен, и произвести посев
смешанной культуры метанобразующих бактерий, то через
некоторое время, когда микроорганизмы начнут интенсивно развиваться,
значение гН2 во всех случаях установится примерно на одном
уровне (в данном случае 6,7—7,5, рис. 21). Если в процессе метанового
г
16
12
8
4
Н2
-
w 4
^
1
5
i i
=^Ь*г4е==;
1
1 ^ 1
8 10 Время, сут
Рис. 21. Изменение окислительно-восстановительного потенциала в
процессе метанового брожения на различных средах:
/ — дрожжевой автолиэат; 7 — мягопептонный бульон; 3 — среда, содержа
щая крахмал; 4 — среда, содержащая нелетучие органические кислоты; 5 —
среда, содержащая низшие жирные кислоты
брожения каким-либо образом резко изменить
окислительно-восстановительный потенциал (например, интенсифицировать процесс
образования кислот добавлением свежей среды), то через некоторое
время значение гН2 снова уменьшится в результате развития
микроорганизмов, хотя последние будут осуществлять не метановое,
а другое брожение (рис. 22).
Принято считать, что анаэробные микроорганизмы развиваются
п пределах значении г\\-2= 0,0 ... 20.0, а оптимальный окнелнтелыю-
иосстаноинтельпып потенциал ,пля их развития лежит в пределах
109
/H2=8,0... 12,0. Аэробные микроорганизмы развиваются при более
высоких значениях гН2. Установление оптимального значения гН2
для аэробных микроорганизмов является трудной задачей. Для их
нормального развития необходимо насыщение среды кислородом.
В присутствии кислорода резко повышается гН2, что мешает
определению потенциала, возникающего в результате развития
микроорганизмов.
£ -
юо
80
60
40
20 2 -
Добавление среды
Продолжительность
брожения;
сут
Рис. 22. Изменение окислительно-восстанивнтелыюго потенциала и образование
метана в результате залповой подачи среды
ОБЕСПЕЧЕНИЕ СРЕДЫ КИСЛОРОДОМ
Одной из важнейших проблем промышленной микробиологии
является обеспечение микроорганизмов кислородом в процессе их
культивирования. Микроорганизмы обладают различной
потребностью в кислороде. Большинство аэробных промышленных
микроорганизмов требует обеспечения максимального контакта их
клеток с кислородом. Режим аэрации определяется в некоторых
случаях не только потребностью микроорганизма, но и тем, какой
продукт желают получить. Производство микробной биомассы всегда
связано с максимальным обеспечением контакта клеток с
кислородом. Получение многих биологически активных веществ —
ферментов, витаминов, аминокислот— находится в прямой зависимости
от интенсивности роста клеток и, следовательно, также требует
максимальной аэрации. Некоторые вещества, например каротины,
образуются на стадии «дозревания», т. е. не в период
максимальной интенсивности роста клеток, однако количество образующихся
НО
продуктов обусловлено количеством биомассы и косвенно связано
с интенсивностью аэрации. В спиртовом и пивоваренном
производствах основной продукт образуется в анаэробных условиях, однако
и в данном случае для осуществления основного процесса
необходимо предварительное накопление биомассы в присутствии кислорода.
Проблема обеспечения контакта клеток с кислородом воздуха
породила различные способы культивирования промышленных
микроорганизмов и многочисленные приемы аэрации. Существуют
глубинный н поверхностный способы культивирования.
При поверхностном способе микроорганизмы выращивают на по-
«ерхности питательной среды, где имеется свободный доступ
кислорода к клеткам. Многие микроорганизмы, например плесневые
грибы, развиваются на поверхности жидкости, образуя подводную
часть тела (мицелий), извлекающую, подобно корням растений,
питательные вещества из среды, и надводную часть тела, служащую
в основном для размножения. Аналогичным образом такие
микроорганизмы развиваются и на твердых материалах, проникая
нижней частью своего тола в поверхностный слой питательного
субстрата. Это имеет технологические преимущества, поскольку позволяет
резко увеличить поверхность выращивания микроорганизмов по
сравнению с поверхностью жидкой среды и получить высокий
урожай микробной биомассы. Для осуществления этого способа
используют различные сыпучие материалы, которые могут одновременно
служить и поверхностью, и питательной средой (например, отруби)
или быть наполнителем, который необходимо пропитывать
питательной средой.
Глубинный способ основан на выращивании микроорганизмов
в глубине среды за счет кислорода, растворенного в жидкости. Для
растворения кислорода в жидкости через нее необходимо
пропускать воздух. Этот способ использовался вначале для
культивирования микроорганизмов, не образующих развитого
мицелия и способных .хорошо развиваться в глубине среды,
например дрожжеподобных грибов, бактерий. Плесневые
грибы вначале не удавалось с таким же успехом культивировать
в глубине среды из-за очень высокой потребности их в
кислороде. Однако выявленные преимущества глубинного
культивирования стимулировали развитие техники аэрации, позволившей
резко увеличить скорость растворения кислорода в жидкости.
Оказалось, что при достаточно интенсивном обеспечении культуральной
жидкости кислородом плесневые грибы и другие строго аэробные
микроорганизмы могут с такой же скоростью развиваться в
глубине среды, как и на ее поверхности. Большие преимущества
глубинного способа обусловили широкое внедрение его для
культивирования всех промышленных микроорганизмов. Эти преимущества
заключаются в том, что этот способ не требует больших площадей
и громоздкого оборудования, поскольку выращивание происходит
в сосудах простой конструкции, объем которых можно создавать
за счет высоты. Простота обслуживания, возможность автоматнза-
чии позволяют создать большую производительность заводов на
111
сравнительно малой площади. Весьма важным преимуществом
глубинного способа выращивания микроорганизмов является
удобство выделения продуктов метаболизма и самой биомассы из куль-
туральной жидкости по сравнению с обработкой полуфабрикатов,
полученных поверхностным способом. Широкое применение
глубинного способа выращивания промышленных микроорганизмов
заострило проблему аэрации, поскольку реализация всех преимуществ
этого способа возможна лишь при достаточном обеспечении клеток
микроорганизмов кислородом. Главная задача при этом
заключается в создании условий максимального растворения кислорода в
жидкости, что зависит от величины поверхности контакта воздуха
с жидкостью. Величина этой поверхности зависит от степени
измельчения пузырьков воздуха, пропускаемого через жидкость.
Растворенный кислород, с одной стороны, снова стремится
выделиться из культуралыюй жидкости, особенно при
сравнительно высокой температуре, при которой происходит культивирование.
С другой стороны, кислород непрерывно потребляется
микроорганизмами. В связи с этим необходимо не только создавать, но и
поддерживать процесс непрерывного растворения кислорода в
жидкости. Все это обеспечивается пропусканием воздуха через
специальные трубы с отверстиями, называемые барботерами.
Скорость потребления кислорода микроорганизмами зависит от
разности концентраций его внутри и вне клетки. Процесс
потребления кислорода сопровождается непрерывным уменьшением его
концентрации у внешней оболочки. Это ведет к уменьшению
активности роста клетки. Для сохранения постоянной разности
концентрации, т. е. для сохранения максимального давления кислорода у
внешней оболочки клетки, необходимо создание условий
непрерывного перемещения клетки по всему объему жидкости. То же самое
происходит н с концентрацией питательных веществ вне клетки и
внутри ее: скорость их проникновения в клетку непрерывно
уменьшается вследствие уменьшения разности их концентраций по обе
стороны клеточной стенки. Не менее важным при этом является
поддержание максимальной скорости выхода продуктов обмена из
клетки. Для обеспечения всех этих условий необходимо
интенсивное перемешивание культуралыюй жидкости. Простые аэрирующие
приспособления не могут создать условий интенсивного
перемешивания, поэтому наряду с барботерами применяются
механические перемешивающие устройств'а. Многочисленные
аэрирующие устройства, созданные в настоящее время, имеют свои
преимущества и недостатки, поэтому в каждом конкретном случае
они должны подбираться индивидуально.
Следует отметить, что механическое диспергирование воздуха
чает эффект лишь на определенной высоте столба жидкости,
примерно до 1 м. С увеличением высоты столба жидкости
всплывающие пузырьки воздуха соединяются между собой (коалесцируют),
и поверхность контакта их с жидкостью уменьшается. Для
поддержания эффективности насыщения жидкости кислородом на высоте
более 1 м необходимо вводить дополнительные диспергирующие
112
устройства. Однако большая высота столба дает и положительный
эффект: с увеличением высоты столба увеличивается длительность
пребывания воздуха в жидкости и уменьшается расход воздуха на
аэрацию. Например, при высоте столба жидкости 3,5, 9,5 н 23,7 м
расход воздуха для насыщения кислородом одного и того же
объема жидкости составляет соответственно 4,95, 1,94 и 0,78 м3/с.
Длительность пребывания воздуха в жидкости равна
отношению высоты столба жидкости h к скорости движения пузырькоь
воздуха /:
t = hlf. с. (7)
Средняя скорость прохождения воздуха через жидкость
обычно равна 0,1—0,5 м/с. При этом лишь часть кислорода растворяет
ся в жидкости, остальное его количество не используется.
Отношение количества растворенного кислорода к общему его количеству,
поступающему с воздухом, па 1 м высоты столба жидкости пазы
вается коэффициентом использования кислорода Ко- Для простых
способов аэрации Ко= 0,02... 0,026 кг/(кг.м). Для аэрации с
мешалкой Л'о=0,026 ... 0,03 кг/(кг-м) при высоте столба жидкости
не менее 2—3 м. При таких незначительных коэффициентах
использования кислорода для максимального перехода его нз воздуха
в раствор теоретически необходима высота столба жидкости до
50 м, что практически невыполнимо. Поэтому необходимое
насыщение достигается увеличением объема пропускаемого воздуха. Так,
для выращивания дрожжеподобных грибов в зависимости от аэра-
ционной системы расход воздуха составляет 30—100 м3 на 1 м3
среды. Из этого количества всего 10 % кислорода используется на
синтез биомассы. Такое повышение расхода воздуха связано сто
с тем, что увеличение скорости растворения кислорода
значительно отстает от увеличения интенсивности аэрации. Например, при
увеличении расхода воздуха в 6 раз содержание газовой фазы в
жидкости возрастает всего в 2,5 раза.
Насыщение среды кислородом должно иметь определенные
пределы. Чрезмерное насыщение неэкономично, а недостаточное на
сыщенне приводит к уменьшению скорости развития мнкроорганиз
мов. Существует критическое парциальное давление кислорода
(2,02 кПа), ниже которого нарушается жизнедеятельность
микроорганизма. Существует и критическая концентрация кислорода
У ряда промышленных микроорганизмов она находится в
пределах 0,1...0,5 мг/л. у дрожжей и дрожжеподобных грибов составляет
0,05 мг/л. Нормальные условия жизнедеятельности
микроорганизмов создаются при концентрации и парциальном давлении
кислорода несколько превышающих критические. Па практике очень
трудно создать нормальные условия аэрации, т. е. нормальные
давление и концентрацию кислорода. Этому препятствует много
факторов. Так, в молодом возрасте, на стадии активного роста
микроорганизмы более интенсивно потребляют кислород, чем при
старении. Изменение физического состояния клетки, например
агглютинация, приводит к уменьшению скорости потребления кгморода.
15 - 2-1702
ИЗ
изменение состава среды в процессе развития микроорганизмов
также влияет ня скорость потребления кислорода.
Интенсивность насыщения среды кислородом зависит от
нескольких физических факторов. Повышение давления приводит к
увеличению интенсивности растворения кислорода. С повышением
давления до 50.5—101 кПа растворение кислорода увеличивается
ча 10—15 % (до 8.0—9,0 мг/л при 30°С). Однако этот эффект т
используется на практике, поскольку требует применения спеии
алыюй аппаратуры, значительно повышающей стоимость
производства.
Повышение температуры, наоборот, уменьшает степень раство
рения кислорода п жидкости. Ниже приведены величины предел!
ного насыщения дистиллированной воды кислородом при пачли"
нон температуре:
/, "С
0
2
4
fi
8
10
12
14
[02J, мг/л
14,6
13,8
13,1
12.5
11.9
11,3
10,8
10,4
/, °С
16
18
20
22
24
26
28
30
[О,), мг/л
10,0
9,5
9,2
8,8
8,5
8,2
7.9
7,6
Как пплно из приведенных данных, при температуре,
оптимальной для выращивания большинства микроорганизмов, т. е. нрм
28—30 СС, кислорода в воле растворяется почти вдвое меньше, чем
при температуре, близкой к 0-С. Максимальное насыщение среды
кислородом в процессе культивирования микроорганизмов
невозможно, поскольку при низкой температуре прекращается их
развитие.
Растворимость кислорода в воде понижается при наличии солей
и взвешенных частиц. В присутствии иерастворенных частиц
происходит десорбция газа, слияние (коалесценцня) пузырьков и их
выделение. Добавление в среду 2 % бумажной пульпы или мертвых
клеток микроорганизмов уменьшает растворимость кислорода на
85—90 %. При концентрации сухих (растворенных) веществ в
среде до 13 % растворимость кислорода уменьшается почти на 85 %.
В морской воде при концентрации солей 3,4 % растворимость
кислорода уменьшается на 20 % по сравнению с растворимостью в
обычной воде. Ослабление этого эффекта может быть достигнуто
непрерывной загрузкой питательных веществ, т. е. при
непрерывном способе культивирования.
Некоторые вещества, наоборот, способствуют диспергированию
пузырьков воздуха в поде, увеличивают скорость диффузии
кислорода в жидкость. К таким веществам относятся эфпры, спирты,
органические кислоты и другие гидрофильные соедииенич.
Добавление небольшого количества гидрофильных соединений п культу-
рэльную жидкость уречн'ппрс-т степень диспергирования пузырь-
".14
ков воздуха. Например, добавление 0,1 % уксусной кислоты умень
шает диаметр пузырьков от 2,0 (в чистой воде) до 0,1 мм.
Интересно, что при этом почти не изменяются вязкость жидкости и ее
поверхностное натяжение.
Потребность микроорганизмов в кислороде зависит не только от
физиологических свойств микроорганизма, но н от состава
производственной среды, в частности от природы и концентрации
веществ, используемых в качестве окисляемого субстрата. Другими
словами, потребность в кислороде определяется его количеством,
необходимым для окисления веществ, содержащихся в данной среде,
точнее, веществ, потребляемых микроорганизмами в данных
условиях культивирования. Зная состав и количество окисляемых
веществ, можно определить количество кислорода, необходимое для
их окисления. Например, процесс окисления глюкозы протекает по
уравнению
СвН,2Ов + 602 -> 6СО, + 6НаО.
На окисление каждого моля глюкозы расходуется 6 моль
кислорода, т. е. на 180 г глюкозы требуется 192 г кислорода, а на 1 г
его необходимо 1,07 г или ■'■ '—- = 0,75 л кислорода. Поскольку
в воздухе содержится 20,9 % кислорода, на окисление 1 г глюкозы
, 0,75 -100 _ „
требуется————= 3,о л воздуха при условии полного
использования содержащегося в нем кислорода, т. е. в идеальных условиях.
Практический коэффициент использования кислорода для многих
аэрирующих систем равен 3%. Значит, для окисления 1 г пюкозы не-
, 3,6 - 100 1Г)Г1 0
обходимо пропустить через жидкость —т,— = 120 л вшдуха. с>тс
количество воздуха является минимальным, поскольку необходимо
еще учесть расход воздуха на создание определенного избыточного
давления кислорода и другие факторы.
Такой метод расчета количества кислорода можно применять
в случае использования искусственной среды, состан которой
известен. Однако химизм окисления органических веществ естествен
ных сред практически описать невозможно. В этом случае
потребность в кислороде устанавливается эмпирически. Для этого могу г
быть использованы различные принципы. Один из них вытекает из
самой технологии производства и состоит в том, что аэрацией куль-
туралыюй жидкости в оптимальных условиях в иеболылом объеме
устанавливается количество воздуха, необходимое для полного
окисления органических веществ, а в случае избытка веществ — для
максимального накопления биомассы или нужных продуктов
метаболизма.
Второй принцип заключается в определении количества
кислорода, израсходованного на окисление органических веществ в
стационарных условиях (без аэрации). Для этого среча, насыщенная
кислородом и засеянная микроорганизмами, н-иержннаегся до
полного окисления органических веществ, после чего онре-еляется
15*
115
количество кислорода, израсходованного на их окисление. Конец
жнеления устанавливается по появлению нитритов,
свидетельствующих о том, что окисление органических веществ окончено и кне-
чпрод начинает окислять неорганические источники азота. Для
гьчюлнення этой методики требуются определение концентрации
кислорода в жидкости и качественные анализы на нитриты. В пер-
поч же случае необходимы определение концентрации кислорода
п пыходяшем воздухе, измерение его объема, анализ продуктов
обмена (или биомассы) и количественный анализ окисляемых
рещесгв.
Величина, определяемая по второму методу, называется
биохимическим потреблением кислорода (БПК). Этот метод применяется
н случае определения количества кислорода, необходимого для
полного окисления органических веществ среды, т. е. при очистке
сточных вод. В других отраслях микробиологических производств по-
iровность в кислороде устанавливается в расчете на единицу массы
микроорганизмов или на единицу объема культуральной
жидкости.
Методика определения БПК весьма трудна для выполнения.
Проведение ее требует много времени (до 20 сут) и тщательной
подготовки, обусловленной тем, что количества кислорода,
способного раствориться в жидкости (около 8 мг/л), должно с избытком
хватить для окисления всех содержащихся в жидкости органических
веществ. Следовательно, этих веществ должно быть очень мало,
что требует больших разбавлений исследуемой среды, снижающих
ючность анализа.
В производстве, связанном с культивированием дрожжей и
дрожжеподобных грибов, потребность в кислороде определяется
в расчете на единицу синтезируемой биомассы или на единицу
окисляемого субстрата, причем проводится дифференциация на
расход кислорода, связанный с синтезом биомассы, и fасход,
связанный с синтезом бсзазотнстых веществ. При этом используются
коэффициенты, которые необходимо получать эмпирически.
Рассчитывать потребность в кислороде этим методом необходимо для
каждого источника углерода в отдельности. При использовании среды
сложного состава необходимо иметь данные о выходе биомассы
на каждом компоненте. Для этого необходимо прежде всего
исследовать состав компонентов. Зная расход кислорода на 1 г
биомассы, можно определить скорость его потребления:
Kr = iixg, г/(л.ч). №
где и. — удельная скорость роста микроорганизма, 1/ч; х—
концентрация биомассы, г/л; g — расход кислорода на единицу массы
микроорганизмов, г/г.
При непрерывном способе производства вместо удельной
скорости роста микроорганизмов можно использовать скорость
разбавления D.
Скорость потребления кислорода микроорганизмами должна
соответствовать скорости растворения кислорода, поступающего
ПС
в жидкость с воздухом. Скорость растворения кислорода, или
скорость адсорбции, определяется уравнением массообмена:
KD = $F (C0 - С), кг/(м* • ч). (9j
где С0—предельно возможная концентрация кислорода в данной
жидкости при данной температуре и парциальном давлении
кислорода в продуваемом воздухе, кг/м3; С — фактическая концентрация
кислорода в культуральной жидкости, кг/м3; р — константа диф
фузии кислорода для данных условий (температуры и состава среды),
м/ч; F — удельная поверхность контакта жидкости с воздухом, м2/м3.
Произведение р/-1 характеризует эффективность аэрирующего
устройства и обозначается Klq- Поэтому скорость растворения
кислорода можно выразить уравнением
Kd = Klb (co - О. кг/(м» ■ ч). (10)
Нормальные условия жизнедеятельности клетки могут быть
достигнуты при равенстве скоростей растворения и потребления
кислорода:
KD = Кг.
Следовательно, скорость растворения кислорода Ко можно
выразить уравнением
Ko = M'g. r/(.i -ч). (И)
откуда видна зависимость процесса образования биомассы от
скорости растворения кислорода. Однако эта зависимость имеет место
лишь до предельной концентрации кислорода в среде (критической
концентрации).
Исходя из равенства Kt =/Си, т. е. KL„ (С0—С) -- u.vg, можно
определить параметры простым вычислением, не прибегая к
эмпирическому установлению всех величин, характеризующих процесс
культивирования аэробных микроорганизмов. При этом некоторые
величины, например С0, и, и другие, могут быть известными н cia-
бильными для данных условий.
НЕКОТОРЫЕ ЗАКОНОМЕРНОСТИ РОСТА МИКРОБНЫХ КУЛЬТУР
Одной из важнейших задач каждого микробиологи'».*:)-....?! прл
изводства является получение максимального колнчесша нрод^к
тов жизнедеятельности микроорганизмов. Во всех случаях,
особенно при производстве микробной биомассы, основным показателем
является интенсивность роста и размножения клеток. Увеличение
этого показателя — важнейшее условие совершенствования
технологии микробиологических производств. Рост и размножение
микроорганизмов — не постоянные величины, а зависят от питательной
ценности среды, фнзнко-.хнмнческнх условий культивировании,
физиологического состояния (возраста) культур. Понятие о
возрасте микроорганизмов вполне определенно в смысле
онтогенетического цикла, но весьма относительно во времени. Пребывание в
молодом возрасте и процесс старения в значительной степени зааисят
16 _ 2-1702
Ш
от условий культивирования. Основная причина старения —
накопление продуктов обмена и недостаточно быстрое удаление их в
окружающую среду. Перемешиванием и другими способами можно нн-
тенсифчт'.крпвать процесс отвода продуктов обмена и контакт клеток
с питатель»"'.ми веществами среды. При интенсивных отводе
продуктов обмена н притоке питательных веществ клетки
микроорганизмов могут длительное время пребывать в молодом возрасте.
Технологическими приемами, например непрерывным культивированием,
можно создать условия, при которых ассоциация микроорганизмов
в целом будет находиться в молодом возрасте (активной
жизнедеятельности) вследствие преобладания количества молодых
клеток в культуральион жнткостн. В таком случае говорят о молодом
возрасте культуры, а не отдельных клеток микроорганизмов.
Каждая клетка при этом проходит все стадии онтогенеза — молодость,
зрелость и стярение, только старение происходит за пределами
наблюдаемого этапа технологии, т. е. за пределами аппарата-куль-
тнватсра.
В идеальных условиях, при интенсивном отводе продуктов
обмена от кяждо i клетки и максимальном притоке к ней питательных
веществ, можно наблюдать бесконечный рост и размножение
клеток и отсутствие фазы отмирания. Зная длительность генерации
данного микроорганизма g, т. е. период времени, в течение которого
происходит телепне (удвоение) клетки, и начальное количество
ктегок Х0, можно определять их количество за любой период
культивирования г, исходя из уравнения
Л = *„.2». (12)
где п — число генерации, которое легко определить, разделив
длительность культивирования на длительность генерации n = t/g.
Тогда
Х=*Х0.2~ё. (|3)
Рост культуры в идеальных условиях зависит только от числа
делений (генерации), которое стоит в экспоненте (в показателе
степени). Поэтому данная зависимость (функция) является
экспоненциальной (показательной).
Иная картина наблюдается в действительности, особенно при
периодическом способе культивирования. Клетки микроорганизмов,
помещенные в свежую питательную среду, вначале проходят
период адаптации, называемый лаг-фазой, или фазой задержки роста.
В результате резких изменений условий ферментные системы
микроорганизмов в течение некоторого времени находятся в подавлечном
состоянии. Затем клетки начинают интенсивно размножаться —
наступает экспоненциальная фаза, или лог-фаза (рис. 23). Эту фазу
называют еще логарифмической, что не совсем правильно,
поскольку логарифмическа-? функция обратна экспоненциальной
(показательной). Количество мнкроорганнзмгн з этот период увеличивается
в геометрической прогрессии по экспоненциальному закону.-Однако
в реальных условиях такой чрочесс длится относительно нетолго.
116
до ощутимых изменений химического состава с^еды. Через некого
рый период времени, зависящий от количества читатель.::...ч пещгств
в среде, начальной концентрации клеток и других условий, клетки
микроорганизмов, достигнув зрелого возраста, стареют иод алия
нием продуктов обмена и из-за недостатка пнгьте.^лгл.х веществ.
Наступает равновесие, т. е. количество клеток (биомассы) не
увеличивается н не уменьшается, поскольку количество отмерших
клеток равно количеству появившихся в результате размножения.
Этот период называется стационарной фазой. Затем количество
отмерших клеток начинает преобладать и кривая опускается вниз
Наступает фаза отмирания.
Для производства, естественно, представляет интерес
экспоненциальная фаза.
Развитие культур
микроорганизмов принято
характеризовать некоторыми
взаимосвязанными
количественными
показателями, используемыми на
практике. Одним из иих
является скорость роста
культур, т. е. увеличение
количества биомассы за
единицу времени:
ч
J»
8
п
•е-
п
£
IE
п
X
Л
■;
п
Х^
!о
п
X
и
X
X
о
о
X
го
2
«
Т 1
*- it
s X
s/l
Х/ ,
/ |
/ |
i
i
i
i
i.
3
&
(К
п
X
о.
X
О
X
=1
Ста
^""■"^-^^^
(К
X
X
п
о.
X
X
1-
о
а
(С
в
'i-'o
мг/ч.
(14)
Время
Рис. 23. Кривая роста бактериальной культуры
Однако эта величина абсолютная и указывает лишь на
изменение общего количества биомассы в данных конкретных условиях.
Она не может быть применена для сравнительной характеристики
производств различного масштаба и для оценки эффективности
данного микроорганизма. Более правильное представление об этом
дает скорость роста, отнесенная к первоначальном) количеству
биомассы, называемая удельной скоростью роста:
V
(1 =
1/4.
(iS)
Если скорость роста выразить в дифференциальной форме
v = dx/dt,T. е. прирост биомассы отнести к изменению времени, то
удельная скорость роста
и. = dx/dtx.
Поскольку 1/х можно выразить как ." , то
dxd (\nx) d (In x) In xt — In xa
1*= dtdx = dt = /, —10
или
(16)
2.3 (lex, — ]gxB)
i*= —T~zn •
(17)
119
Таким образом, математические выражения абсолютной и
удельной скорости роста культур аналогичны, только в последнем случае
вместо абсолютных значений биомассы берутся их логарифмы.
■ Уравнение (17) можно преобразовать:
|i (<i — 'о) = 1п дг, — In дг0.
Из полученного выражения видно, что \i{tt—t0)—это
показатель степени натурального логарифма, поскольку указанное
выражение получается при логарифмировании уравнения
где е — основание натурального логарифма.
Отсюда можно определить количество биомассы в любой период
роста:
*, = г„е""--'°». (18)
Удельная скорость роста для данных условий обычно известна.
Валовый рост микробных культур, описанный выше в виде
уравнений, слагается из процесса деления клеток и увеличения их
массы между делениями. В некоторых случаях, например в гепетнче
ских исследованиях, необходимо охарактеризовать только процесс
размножения культуры. Для этого нужно иметь представление
о скорости размножения и связанных с ней величинах. Исходными
данными для характеристики процесса размножения являются
начальное и конечное количества клеток А'0 и Хп, а также
длительность генерации микроорганизма в данных условиях g. Имея эти
значения, можно использовать зависимость между ними.
Число генерации (делений)
«=^°. 09)
где t,—10 — промежуток времени.
Скорость размножения (коэффициент размножрнил) — это
число делений в единицу времени:
п
I, ~t„
1/4.
Длительность каждой генерации
е = -^—= 7'ч: (2|)
количество клеток в любой период роста:
А' = Л„ ■ 2". - (22)
Из последней зависимости вытекает еще один способ
определения числа делении (генерации):
„ = 'gYl,~";'Yo = 3,32 (,R X, - lB ,Y0), (23)
тогда
3.32 fie-V, - IpA'o)
v —
»i-'n
(24)
1?0
Если учесть, что масса микроорганизмов равна массе каждой
клетки, умноженной на их количество, т. е. х = аХ, то количество
клеток равно отношению массы микроорганизмов к массе каждой
клетки:
А" = х/а. (25)
Подставив это выражение в (24) и преобразовав его, получим:
3.-Ц«1е*, - 1дг„)
Из приведенных арифметических уравнений видно, что
результаты расчета скоростей роста и размножения микроорганизмов не
зависят от того, какой показатель при этом
используется—количество клеток или количество биомассы.
Из уравнений (17) и (26) находим, что в одном случае
а в другом
<1
•g*l
t,
-'о
— Ig'o
-'о
~ 2,3 ■
V
~3,32
Иными словами, 2Т = зЖ' откУДа следуют зависимости:
v= 1,44ц; (27)
И = 0,G93v; (28)
0.693
g = —; (29)
°-693
Приведенных количественных показателей, связанных только
с ростом культур, недостаточно для полной характеристики
микробиологического процесса. Необходимо учитывать и изменения,
происходящие в среде в результате жизнедеятельности клеток,—
уменьшение концентрации питательных веществ, накопление продуктов
обмена. Именно эти изменения обусловливают скорость
размножения и другие величины, определяющие активность культур,
производительность и другие показатели производства.
Между удельной скоростью роста культуры и скоростью
потребления субстрата существует зависимость
Ks+S'
(31)
где um»x — максимальная скорость роста культуры (константа
роста), предел, к которому стремится скорость роста по мере
повышения концентрации потребляемого субстрата; 5—концентрация
потребляемого субстрата; Ks — константа насыщения, равная
концентрации питательного субстрата, при которой скорость роста
достигает половины предельной, т. е.
И = ('„.ах/2-
121
Приведенное уравнение аналогично уравнению Михаэлиса —
1ентен для определения скорости ферментативных реакций.
Основным фактором, определяющим скорость роста культур,
является накопление продуктов метаболизма. Существует
зависимость между образованием продуктов и удельной скоростью роста
культур:
H-jgf*. (32)
где цо — удельная скорость роста микроорганизмов в данной среде
при полном отсутствии в ней продуктов обмена; Р—фактическая
концентрация продуктов обмена; КР — константа, равная
концентрации продуктов обмена, при которой скорость роста снижается
вдвое, т. е. при р.=ц0/2.
Следующий показатель развития промышленных культур
микроорганизмов — физиологическая активность. Этот показатель
аналогичен удельной скорости роста, только вместо прироста клеток
(биомассы) имеется в виду убыль потребляемого субстрата или
прирост продуктов обмена:
5„ — 5, Р1 — Рв
'-«,-/.)*• ИЛИ9 = <7Г=7^' <33>
где S0—5| — количество потребленных веществ;
Л—10—наблюдаемый период времени; х — количество накопившейся биомассы;
Pi—Л) — количество накопившихся продуктов обмена.
Приведенные формулы не охватывают всех процессов обмена
веществ, от которых зависит эффективность производства
микробной биомассы. В связи с этим введен еще один показатель
микробиологического производства — экономический коэффициент,
представляющий собой отношение прироста биомассы к количеству
потребленного субстрата (выход биомассы с единицы субстрата):
у=^Ц2-, „ли У-£. (34)
Описанные выше количественные показатели жизнедеятельности
микроорганизмов имеют максимальные значения в идеальных
условиях обеспечения клетки питательными веществами и
освобождения от продуктов обмена. В реалы:ых производственных условиях
эти показатели имеют наибольшее значение лишь в определенный
период времени — в период активного роста культур. Для
увеличения эффективности использования микробиологического процесса
необходимо сократить фазы неактивного роста культур, т. е.
создать условия постоянного отвода продуктов обмена и восполнения
запаса потребляемых питательных веществ. Это возможно при
культивировании микроорганизмов з замкнутом сосуде, через который
постоянно протекает питательная среда, г клетки удерживаются
в сосуде специальными фильтрами. При этом создаются идеальные
условия, при которых клетки микроорганизмов неограниченный
период времени пребывают в молодом возрасте, размножаясь в
геометрической прогрессии. Однако такой способ, называемый не-
122
прерывно-циклическим, невыполним в реальных условиях
из-за технических трудностей. Способ непрерывного фильтрования
не может осуществляться длительное время вследствие
закупоривания фильтров микроорганизмами. Кроме того, появляется
необходимость постоянного вывода биомассы из замкнутой системы.
Практическое применение нашел непрерывный способ
культивирования микроорганизмов в открытой системе, когда в аппарат
постоянно поступает питательная среда, а из него выводятся
продукты жизнедеятельности вместе с избытком клеток. Это позволяет
ликвидировать некоторые недостатки периодического развития
культуры, а именно: ликвидировать фазу задержки роста, сократить
период старения и использовать другие преимущества идеальной
культуры. Однако прч этом остаются некоторые недостатки
периодического развития культуры. Они связаны с необходимостью
соблюдения условий, при которых количество клеток, выведенных
из аппарата, не должно превышать количество вновь образующихся
клеток, в противном случае клетки будут полностью удалены
(«вымыты») из аппарата. Следовательно, не может быть и речи о полном
удалении прол\ ктон обмена. Кроме того, питательные вещества
должны поступать в аппарат в таком количестве, чтобы остаточная
концентрация их была минимальной во избежание
производственных потерь с выходящей нз аппарата культурной жидкостью. Трм
не менее этот способ имеет большие преимущества с точки зрения
физиологии микроорганизма и особенно в технологическом
отношении. Очень важным из этих преимуществ является стабильность
условий, создающихся при непрерывном культивировании
(вследствие чего такой способ и называется
гомогенно-непрерывным). Концентрация биомассы прч этом постоянна. Процесс
развития каждой клетки в данных условиях характеризуется
отсутствием лаг-фазы ввиду стабильных условий жизнедеятельности.
Фаза отмирания при этом имеет место за пределами аппарата,
в котором происходит непрерывное культивирование.
Способ непрерывного культивирования с успехом используется
в тех случаях, когда продуктом микробиологического производства
является микробная биомасса или продукт, содержащийся в
клетках микроорганизмов. При производстве внеклеточных продуктов
обмена непрерывный способ может оказаться экономически
нецелесообразным, поскольку концентрация клеток, которую необходимо
поддерживать в аппарате для обеспечения непрерывного процесса,
может быть недостаточной для накопления максимального
количества продуктов обмена. Поаышенне концентрации клеток за счет
увеличения длительности культивирования (уменьшения скорости
притока среды) или увеличения концентрации питательных веществ
приводит к образованию ненужных продуктов автолиза и другим
Отрицательным результатам. Выходом из этого положения является
пространственное разделение процессов накопления клеток и
образования продукта обмена. Прн этом вначале осуществляют
накопление клеток, затем смешивают их с питательным субстратом в
соотношении, обеспечивающем максимальное накопление продукта.
123
Такой способ применяется в спиртовом производстве (способ
«больших дрожжей»).
Для интенсификации микробиологического процесса важное
значение имеет создание стабильных физико-химических условий на
каждой стадии жизнедеятельности. Для этого применяются
технологические приемы, позволяющие пространственно разделить
отдельные стадии развития микроорганизмов. Аппарат, в котором
осуществляется культивирование, делится на секции, через которые
постепенно проходит культурная жидкость. Длительность
пребывания микроорганизмов в каждой секции регулируется
соотношением объемов этих секций. Таким образом, в отдельных секциях
можно создать оптимальные условия для каждой физиологической
стадии развития микроорганизма. В спиртовом производстве
вместо секций применяется серия («батарея») аппаратов, через которые
непрерывно подается культуральная жидкость. Этот
микробиологический процесс не является непрерывным, поскольку соотношение
количества микроорганизмов и среды при этом регулируется
искусственно. Этот процесс является непрерывным с технологической
точки зрения и позволяет исключить некоторые недостатки
периодического способа. В промышленности его называют «граднент-
н о-н е п р ер ы в н ы м» способом.
Непрерывный способ культивирования характеризуется
некоторыми показателями, главным из которых является скорость
притока среды, от которой зависит равновесие между приростом
клеток в аппарате и выносом их из аппарата. Скорость притока F —
это количество среды W, поступающей в аппарат за единицу
времени:
F=W/t, мз/ч. (35)
Основное условие непрерывного культивирования — это
соответствие между скоростями притока среды и развития
микроорганизмов. Поскольку эти величины несопоставимы, скорость притока
выражается по отношению к объему аппарата V. Эту величину
называют скоростью разбавления D:
D=FiV. 1/ч. (36)
При непрерывном процессе относительная (удельная) скорость
размножения клеток должна быть равной относительной скорости
притока, т. е. скорости разбавления среды:
м-О.
В каждый момент dt количество микроорганизмов в аппарате
возрастает на
где А' — общее количество клеток в аппарате.
Количество клеток, уносимых из аппарата в этот же момент,
XD = XD. (37)
Тогда изменение количества клеток в аппарате за данный
момент составит
dx/dt = Хм - XD = *м - XD = X Oi - D). {38)
/
124
При \i>D изменение (прирост) клеток будет положительным,
т. е. количество биомассы в аппарате будет непрерывно
увеличиваться. При ц<;£, наоборот, прирост клеток будет отрицательным,
что приведет к вымыванию нх из аппарата.
Исследование непрерывных и проточных культур значительно
изменило представление о жизненном цикле и продолжительности
жизни микроорганизмов и живых существ вообще. Оказалось, что
фазы развития живого организма — молодость, зрелость, старость —
являются относительными понятиями. Быстрое старение клеток
обусловлено недостаточным контактом их с питательными
веществами и вредным влиянием продуктов обмена. Справедливость такого
положения продемонстрирована многочисленными опытами с
микроорганизмами и культурами тканей животных.
В последние годы в микробиологической промышленности все
больший интерес проявляют к ассоциациям, в связи с чем знание
биохимических основ взаимоотношений микроорганизмов прп соп-
месгг!ом нх развитии приобретает огромное значение. Все
промышленные микроорганизмы выделены из естественной среды, где они
обитают совместно. В естественных условиях они вступают в спм-
биотическне или антагонистические взаимоотношения. Существ)ют
различные формы симбиотических взаимоотношений, известных под
названиями метабиоз, сателлнзм, синергизм. Под
метабиозом понимают такое сожительство, при котором один
микроорганизм потребляет продукты обмена другого. Сателлизм
означает стимуляцию жизнедеятельности одного микроорганизма
другим. Синергизм — это усиление ферментативных функций или
появление новых свойств, не присущих каждой отдельной из
совместных культур.
Понятие симбиоз применяется в широком смысле, когда
микроорганизмы приносят друг другу пользу при совместном
существовании, и в более узком смысле, когда сожительство является
обязательным условием их существования. В последнем случае можно
говорить об облигатном симбиозе, когда микроорганизмы не могуг
существовать раздельно.
При совместном существовании в природе у микроорганизмов
выработалась специализация свойств и появились виды, в
значительной степени утратившие способность к самостоятельному
существованию. Поэтому чистые культуры микроорганизмов,
выделенные из естественной среды, предъявляют повышенные требования
к среде. Однако в процессе специализации биохимических свойств
наряду с ухудшением определенных функций у микроорганизмов
вырабатывается повышенная активность в каком-либо другом
отношении. Использование чистых культур в микробиологической
промышленности как раз и основано на том, что они обладают
повышенной способностью к образованию нужного продукта. Таким
образом, специализация микроорганизмов, возникшая в
естественных условиях, оказывается полезной для человека. Однако в
некоторых случаях, когда требуется получать не какой-то продукт
метаболизма, а микробную биомассу, необходимо применять микро-
125
организмы с хорошими ферментативными свойствами, способными
ь интенсивному росту и использованию разнообразных источников
питания. Иногда образование продуктов или биомассы вообще не
является целью производства, например при очистке сточных вод,
когда требуется лишь максимальное разложение органических
веществ. В таких случаях применение чистых культур не может
привести к полному решению вопроса. В связи с этим в
микробиологической промышленности все большее значение приобретают
смешанные культуры, т е. ассоциации микроорганизмов,
обладающих совокупностью необходимых ферментативных свойств.
Положительное взаимное влияние микроорганизмов при
совместном культивировании можно продемонстрировать кривыми
(рис. 24). При использовании одинакового количества посевного
Рис 24. Накопление
биомассы при совместном и
раздельном росте
бактерии:
о — бацнллус путрнфнкус:
6 — метенобактернум оме-
лиисккА.
40 50
Время, ч
материала совместный рост нескольких штаммов и накопление
биомассы идут боле интенсивно, чем при выращиваний каждого из них
в отдельности. Такое явление наблюдается и в том случае, когда
между микроорганизмами нет облигатного симбиоза. Это означает,
что усиление физиологических функции при совместном развитии
свойственно многим микроорганизмам, среди которых можно искать
производствен но-полезные ассоциации.
ГЛАВА IV
ГЕНЕТИКА И ПРИНЦИПЫ СЕЛЕКЦИИ ПРОМЫШЛЕННЫХ
МИКРООРГАНИЗМОВ
Генетика — это наука, изучающая законы передачи
наследственных свойств живых организмов и их изменчивости. Изучение
и использование этих законов открывают большие возможности для
развития и совершенствования микробиологической
промышленности. Искусственное изменение свойств живых организмов
позволило создать новые цепные породы животных и растений.
Направленным изменением свойств создано много полезных форм
промышленных микроорганизмов.
/
12ь
ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ (ДЕЛЕНИЕ) КАК СПОСОБ
ПЕРЕДАЧИ И СОХРАНЕНИЯ НАСЛЕДСТВЕННЫХ СВОЙСТВ
Наследственным материалом у всех живых организмов являете-
ДИК, за исключением некоторых вирусов, у которых эту роль
выполняет РНК. единицей наследственных свойств являются гены
(цистроны), т. е. сочетания иуклеотпдов, ответственные за
синтез фермента или группы ферментов. Управляя процессом синтеза
ферментов, гены управляют всеми свойствами организма. В связи
с этим организм в процессе^ споего филогенетического развития
должен выработать такой способ передачи генов (и, следовательно,
свойств) от поколения к поколению, который гарантировал бы
сохранение приобретенных свойств и в то же время обеспечивал
бы определенную их изменчивость, необходимую для
приспособления к изменяющимся условиям существования. Эти два
противоречивых биологических фактора лежат в основе борьбы живого
организма за сохранение вида.
В конкретных условиях существования не все гены, заложенные
в ДНК, имеют внешнее проявление. Потенциальный запас генов
в живом организме называется его генотипом. Внешнее проявление
генов, т. е. сумма признаков, присущих организму в данных
условиях, называется фенотипом.
У микроорганизмов внешним проявлением генов являются в
основном их биохимические признаки, у высших организмов
фенотип— это сочетание внешней формы и биохимических признаков.
Некоторые свойства, заложенные в генотипе, могут не проявляться
в данных условиях существования. Важным условием успешного
применения микроорганизмов в промышленности является знание
их генотипа, т. е. всего потенциального запаса генов, умение
индуцировать действие нужных генов и проявление полезных свойств.
Кроме того, необходимо уметь изменять генотип в нужном
направлении. Генетика микроорганизмов предоставляет в этом отношении
большие возможности. Для использования этой возможности нужно
знать структуру наследственного материала и его поведение в
процессе роста и размножения микроорганизмов.
Наследственный материал — ДНК—находится в ядре клеток.
Структура ядра у различных микроорганизмов неодинакова. Эука-
риотические организмы имеют оформленное ядро в виде
изолированного тельца, расположенного в центре клетки, а чаше
эксцентрично. Ядерное вещество заключено в оболочку. ДНК в ядре находится
в виде пуклеопротеидпых нитевидных структур, которые
называются хромосомами. Они четко видны лишь в период деления клег-
ки. В период между делениями ядерное вещество находится в виде
зернистой или сетчатой структуры. Из микроорганизмов к эукарио-
там относятся грибы. В клетках прокариотов, к которым
принадлежат бактерии и актиномицеты, нег оформленного ядра. Ядерное
вещество у них находится в отдельных местах или рассредоточено
по всей клетке. Перед делением, а иногда и в других условиях
ядерное вещество приобретает вид отдельных оформленных час-
J27
тиц—нуклеоидов. Нуклеоиды многих бактерий представляют
собой замкнутую цепь ДНК. У кишечной палочки вся ДНК
образует одну нить (длиной около 1 мм), замкнутую в кольцо. Такие
нити называют бактериальными хромосомами, поскольку они
являются аналогами хромосом высших организмов. У вирусов и
фагов вся клетка состоит в основном из генетического материала —
ДНК (или РНК у вирусов растений)- Клетки некоторых
бактериофагов представляют собой одну нить ДНК. Молекула ДНК
некоторых фагов включает всего десять генов (цнетрон). Однако в
большинстве случаев молекулы ДНК микроорганизмов и высших
организмов содержат до 100 цистроп. В ядерном веществе бактерий
содержится до 1000 молекул ДНК. следовательно, в ядре клеток
бактерий заключена информация о структуре сотен тысяч белков
и ферментов. У высших организмов количество молекул ДНК в ядре
в десятки и сотнн раз больше, чем у бактерий.
Структура ДНК в период роста клеток не изменяется, остается
постоянным ее количество. Только в период размножения клеток
количество ДНК удваивается. Процесс размножения является
необходимым условием сохранения вида, поскольку только смена
поколений способствует возникновению н отбору наиболее
приспособленных особен. В такой же степени важным, но
противоположным условием сохранения вида является «удерживание»
приобретенных свойств, сохранение способности к существованию в
данных условиях. Простое деление как способ размножения дает
возможность воспроизводить лишь себе подобные поколения с
неизменными свойствами. При таком способе не выполняется первое
условие сохранения вида. Поэтому природа в течение длительной
эво1юцни живых существ выработчла различные способы
усложнения процесса размножения, позволяющие живому организму в
определенных пределах изменять свои свойства. Однако в основе всех
способов размножении живого организма лежит деление.
Деление как наиболее простой способ размножения появился
на первых этапах эволюции живого организма. У многих видов
одноклеточных организмов, в частности у бактерий, он сохранился до
настоящего времени. Этот способ размножения, хотя и
примитивный, неправильно называть делением. Его нельзя рассматривать
как разделение целого на две одинаковые половины. Такое
впечатление складывается лишь внешне, при визуальном наблюдении за
делящимся организмом пли клеткой. Однако в живой клетке, как
и в живом организме вообще, нет таких структур, которые могли
бы разделиться на две одинаковые (идентичные) части. Под
делением следует понимать процесс удвоения, т. е. получения двух
идентичных структур па основе одной. Процесс удвоения обычно
называют репликацией, или редупгикацией. Достижения биохимии
позволили выяснить механизм репликации основных клеточных
структур и в первую очередь £ШК. Основными частями клетки
являются ядро, митохондрии, рибосомы и клеточная стенка.
Размножение клетки связано с воспроизведением этих структур.
Важнейшей составной частью клетки является ядро. Синтез ядра — необ-
m
ходимое условие синтеза других клеточных структур. В основе
деления ядра лежит деление (удвоение ) ДНК. Механизм удвоения ДНК
заключается в образовании двух комплементарных нитей на
молекуле материнской (исходной) ДНК (рис. 25). Обе новые двойные
цепи ДНК идентичны. В данном разделе речь идет о способах
удвоения ядра не на молекулярном уровне, а на уровне клеточных
структур (органелл). Форма удвоения ядра, т. е. поведение ядерного
вещества во время размножения, зависит от его структуры. У клеток
■ -MO.iCKY.ia фосфорной кислоты;Щ-молекула дезокснрибозы;
$ Щ -нуклеотиды
Рис. 25. Cxi.\ia образования комплементарных цепей ДНК
грибов форма ядра приближается к форме ядер высших
организмов, у которых наследственный материал находится в виде
хромосом. Процесс удвоения ДНК сопровождается удвоением хромосом,
после чего они расходятся к полюсам клетки. В результате
образуется два набора хромосом, которые составляют основу двух
ядер будущих дочерних клеток. Однако у тех форм
микроорганизмов, у которых ядерное вещество приближается по форме к
хромосомам, процесс удвоения хромосом лежит в основе деления
(размножения) соматических клеток, т. е. процесса роста
многоклеточного организма. Способ размножения самих организмов более
сложен. У низших" форм микроорганизмов — бактерии — удвоение
ядерного вещества определяет деление (размножение) всех
клеточных структур и самой клетки. Ядерное вещество у них имеот форму
17 - 2-1702
129
иуклеонда. Структура нуклеондов различна. У многих бактерий —
нуклеоич.— это замкнутое кольцо из нити ДНК. Репликация
таких нуклеондов происходит последовательно по всему кольцу,
начиная с какой-либо его точки. Перед репликацией двойная
спираль раскручивается. Обе нити в период удвоения прикреплены к
иитоплазматической мембране, которая играет большую роль в
разъединении наследственного материала на две комплементарные
части и в последующем соединении дочерних и материнских
комплементарных цепей.
Репликация митохондрий у микроорганизмов (в частности, у
дрожжей) находится не в полной зависимости от репликации
ядерной ДИК. Объясняется это тем, что митохондрии имеют свою ДНК
II, следовательно, определенную независимость в процессе
биогенеза. Рост митохондрий после деления связан с образованием ци-
тохромов.
Каждая новая клетка, образующаяся в результате
размножения, синтезирует полный набор рибосом. Предшественниками
рибосом являются частицы, называемые аосомами и неосомами. Они
постепенно развиваются в 30 S и 50 S рибосомы. Изучены
количественные показатели биогенеза рибосом. В клетке кишечной
палочки, например, содержится около 10 000 рибосом. Они синтезируются
за период генерации, равный 30 мин. За каждую секунду
синтезируется 5—6 рибосом.
Механизм воспроизведения и биогенеза других оргапелл изучен
мало.
Почти все микроорганизмы, в том числе и бактерии, способны
воспроизводить потомство более сложными путями,
обеспечивающими возможность изменчивости свойств, однако в
производственных условиях в процессе культивирования микроорганизмы
размножаются главным образом простым делением или усложненными
вариантами деления — почкованием (дрожжи), вегетативным
спорообразованием (плесневые грибы), при которых свойства
организма изменяются только в результате случайных изменений
структуры ДНК.
Раскрытие механизма репликации наследственного материала
дает возможность ответить иа вопрос об отношениях между
сменяющимися поколениями. Исходную клетку принято называть
материнской, а образующуюся — дочерней. Однако если учесть, что
способ репликации ДНК является полуконсервативным (рис. 26),
т. с. каждая из двух образующихся молекул ДНК состоит нз одной
нити исходной молекулы и одной повой, то по составу ядерного
вещества образующиеся клетки является одновременно и
материнскими, и дочерними. Материнской можно считать лишь исходную,
уже не существующую, клетку Появившиеся клетки а большей
степени можно считать дочерними, поскольку построение их
организма происходит злн'Ч'о. D'l.ibiuiiiiCTHLi клеточных структур
исходной клетки рлстчоряч-тсч не; ед '.елейном и образующиеся
органика
ческне вещества используются в качестве питательного
субстрата.
Способ размножения, при котором из одной клетки образуются
две, является малоэффективным для сохранения вида. Для
интенсификации процесса воспроизведения потомства природз
использовала возможность образования многих зародышевых клеток из
одной исходной, а также обеспечила высокую скорость их
генерации. У некоторых бактерий скорость генерации, т. е. период полной
смены поколения, составляет всего около 30 мин. У многих
микроорганизмов образующиеся зародышевые клетки имеют
специальную структуру, устойчивую к внешним воздействиям и способную
длительное время сохранять генетический
материал при отсутствии питательных веществ, что
значительно увеличивает вероятность выживания
п сохранения вида.
Первым усложнением способа деления явилось
образование о и д и н (или г о и н д и й) у
некоторых пилон микроорганизмов. При атом способе от
растущей клетки непрерывно отшнуровываютея
дочерние клс1кп, которым передается часть
генетического материала. Из них затем вырастает
организм, от клеток которого снова
отшнуровываются оидип (гонндпп).
Аналогично образуются дочерние клетки у
одноклеточных микроорганизмов — актиномицетов.
Па одном из концов клетки появляется ряд
сегментов (фрагментов), из которых затем
образуются дочерние клетки, называемые спорами.
Они отрываются, рассеиваются и дают начало
новым организмам.
15олси сложным вариантом деления является
образование вегетативных спор у
плесневых грибов. При этом одна из клеток
многоклеточного организма делится на большое
количество клеток, которые превращаклея в плотные
образования, называемые спорами или конидиями
и зависимости от места их расположения. Они
содержат генетический материал и небольшое коли- р,к 2,) ( 4t?4J
чество («затрапку») питательных вещееiв, нсоб II0If; ;1L. lt„IIH
холимых для начала роста организма. Образую- (удичеппя). ЛИК
шаяся спора обладает высокой устойчивостью к
имевшим воздействиях. Способность к образованию устойчивых
форм клеток широко распространена среди микроорганизмов.
Мнете бактерии обладают способностью в неблагоприятных условиях
превращаться в подобные формы, которые по аналогии с
размножающимися клетками называются спорами, хотя н не являются
способом размножения. Процесс образования устой'Г'внч форм
клеток— спор — являек-и важнейшей стадией н более сложного —
полового процесса размножения микроорганизмов.
17-
•j'li
ФАКТОРЫ ИЗМЕНЧИВОСТИ СВОЙСТВ — ПОЛОВОЕ РАЗМНОЖЕНИЕ
И МУТАЦИЯ
Одним из постоянно действующих факторов изменчивости в
мире живых существ является половое размножение. Простейший
вариант полового размножения — это соединение двух клеток в
одну с последующим разделением на дочерние клетки. В процессе
слияния н разделения ядерного вещества между элементами
генного аппарата возможен обмен, который и приводит к изменению
спонств дочерних клеток. Этот простой принцип лежит в основе
всех многообразных и сложных способов полового размножения.
Этот принцип дает возможность изменять свойства живого
организма. Однако возможность его ограничена тем, что изменение
происходит в пределах свойств организмов, участвующих в процессе
размножения. Более того, половое размножение, т. е. слияние
клеток, возможно лишь в пределах одного и того же вида. Это
необходимо для сохранения вида, поскольку неограниченная
возможность изменчивости ведет к деградации вида и сводит к нулю
принцип копирования генного материала — главный фактор
сохранения свойств организма и вида в целом.
В наиболее упрощенном варианте, когда сливающиеся клетки
имеют всего по одной единице ядерного вещества, возможность
изменения свойств можно представить так. Две клетки с ядерным
веществом сливаются, образуя зиготу. В зиготе ядерное вещество
перемешивается, после чего вновь разделяется на две единицы, что
сопровождается делением клетки на две дочерние, каждая из
которых затем делится путем удвоения ядерного вещества, т. е.
размножается вегетативным способом до следующего полового
слияния. В процессе перемешивания ядерного вещества в зиготе
происходит переплетение нитей хромосом, называемое в генетике
перекрестом, или кроссинговером (рис. 27). При последующем
расхождении хромосом их участки, отрываясь, оказываются в составе
другой хромосомы, и новые хромосомы состоят из отрезков исходных
хромосом. Таким образом, дочерние клетки получают генный
аппарат и комбинированные свойства исходные организмов, т. е.
происходит процесс мутации. Если в исходных клетках было по
несколько хромосом, то возможность получения мутантов
увеличивается. В этом случае кроме обмена участками хромосом может
происходить обмен и целыми хромосомами.
Описанное поведение ядерного вещества лежит в основе всех
способов полового размножения организмов. Оно присуще и
микроорганизмам, у которых имеются хромосомы или подобные им
образования. У наиболее простых форм микроорганизмов — бактерий и
актпномицетов — содержится всего одна хромосома или другая
форма нечетко выраженного ядра. У бактерий наблюдается
копуляция. При этом мужская клетка (F+) отдает молекулу ДНК или
ее часть женской клетке (F~), в результате чего образуется зигота
(или неполная зигота — мерозигою — при неполной передаче
ядерного вещества). У актиномицегов соединяются две нити мице-
13->
лпя, образуя мостик — анастомоз, который обеспечивает
смешивание протоплазмы и ядерного вещества. При этом образуется двои
пое ядро — дикарион, которое в процессе прораиания подвергает
ся редукционному делению.
Дальнейшим развитием полового процесса, давшим большие
возможности к изменчивости и явившимся одновременно мощной
защитой от вырождения, было появление диплоидии. Суть се за
ключается в том, что клетки высших оргаиизмон имеют двойной
набор хромосом. Клетки с двойным набором хромосом
насыпаются диплоидными, а клетки с одним набором хромосом — гаплош)
ними. В диплоидной клетке каждое слоисто организма паходннх
под контролем двух генов,
ГЛ
причем один из них
пребывает в активном
состоянии и называется
доминантным
(преобладающим), другой ген,
контролирующий этот же
признак, пребывает в неак-
тнпном (подавленном)
состоянии и называется
рецессивным. Это
отражается и на внешнем
проявлении генов, т. е. на
фенотипе. Оба гена могут бьпь
одинаковыми, т. е.
доминантными пли
рецессивными. Организмы,
имеющие одинаковые гены по
какому-либо признаку,
называются гомозиготными,
организмы с разными
генами — гетерозиготными
по данному признаку.
Наличие двух генов по одному и тому же признаку, т е. дьы'пи ii koih
роль биосинтеза данного белка или фермета, у.чищнмы иозмож
поен, деградации признака и способствует его закреплению В то /Ki
время дннлоидпя увеличивает число возможных комбинации генов
и признаков в поколениях и, следовательно, возможное п. изыенчи
востп и отбора особей с лучшими свонешамн.
Каково же поведение ядерного вещества при ра шпижении и
развитии диплоидных организмов?
Процесс размножения этих организмов очень c.io.i-.eii и
разнообразен. Причиной этого является то, что при слиянии к iciok ко
лнчество ядерного вещества удваивается. Пеобхотнмо уменьшение
количества хромосом до исходного во избежание бесконечного
увеличения их количества в последующих поколениях Г.и-зовагель-
по, после каждого слияния клеток необходима ci ui>i сокращения
(редукции) количества хромосом. В принципе лот иопр' : реша-
Рис 27. Схема ьроссш.ничра и |
которою происходит с.Г.чси j-ia. i,
>...! laii:
jMii хро-
IS - 2-1702
133
ется дифференциацией клеток на половые, способные к
слиянию, и соматические, т. е. клетки самого тела организма.
Соматические клетки являются диплоидными, а половые —
гаплоидными. Слияние половых (гаплоидных) клеток приводит к
образованию диплоидных клеток (знготы), из которых развивается
организм. На определенной стадии его развития образуются
гаплоидные половые клетки из диплоидных соматических. Стадия
сокращения (редукции) количества хромосом и образования клеток
с одним набором хромосом называется мейозом (рис. 28, а). Про-
Рис. 28. Поведение
хромосом при различных
способах деления ядра:
а — мейоз; б — митоз
чегг деления диплоидной клетки па две гаплоидные называется
редукционным делением. Процесс деления (удвоения) клеток без
•пменепия количества хромосом называется митозом (см. рис. 28,6).
Пребнппнне организма в диплоидном или гаплоидном состоянии
называется соответственно дипло- или гаплофазой (рис. 29).
Порядок чередования, длительность этих фаз, а также формы
организмов в этих фазах и обусловливают огромное разнообразие форм
полового размножения.
Диплоидные организмы имеют специальные половые клетки
(половые споры) и половые органы, в которых зарождаются и
сохраняются половые клетки.
После упомянутых выше бактерий и актиномицетов по
сложности полового процесса размножения стоят дрожжи. Половой
процесс у них может происходить двояко: слиянием самих клеток или
слиянием половых спор. При слиянии (конъюгации) клеток
ядерное вещество перемешивается. Оплодотворенное ядро делится
два или три раза соответственно на 4 или иа 8 частей. Это приводит
к образованию четырех или восьми половых спор. Клетка при этом
превращается в сумку (а с к), поэтому дрожжи и называются
а с к о м и ц е т а м и. Половые споры по устойчивости к внешним
воздействиям близки к устойчивости вегетативных спор
микроорганизмов. Аскоспоры могут образовываться и без полового
процесса. Ядро клетки также делится два-три раза и полученные
части превращаются в аскоспоры.
Более сложен половой процесс у плесневых грибов. Этим
микроорганизмам свойственны самые разнообразные способы
вегетативного я полового размножения V кекоторых грибов, например муко-
134
ровых, при половом процессе происходит слияние двух одинаковых
клеток (изогамия). Образуется половая спора — зигота,
которая прорастает и образует спорангий с большим количеством
вегетативных спор (эндоспор'). В зиготе ядро диплоидное, при
прорастании происходят редукционное деление и нормализация
количества хромосом; почти весь период существования гриб
находится в гаплоидной стадии и только зигота является диплоидной.
У некоторых плесневых грибов копулируют клетки разного пола
(оогамия). В некоторых случаях слияние ядер происходит не
сразу. Вначале (после копуляции) они размножаются попарно и
сливаются лишь после образования специальных хранилищ спор —
сумок. Сумки содержат до
8 СПОр. У некоторых ПЛеС- Гаплобиоиты Диплобионты
невых грибов сумки
заключены в специальные ^V\ /' Ч*Ч ) ^N:'\ '"-VS/' .
плодовые тела (а поте- V"-- - -V
ЦИИ, перитеции). У J! Слияние шмет
некоторых грибов сумки
X
не образуются, а споры ~^v~*"" Меиоа
располагаются на поверх- N. ' / \ .N»^ - "^L
Ч N X
ности специальных орга
нов — б а з и д и й (к иим
относятся и съедобные
грибы).
Несмотря па то что по- -у. ■ Ч.
ловой процесс дает воз- ^ .. ,
г : Me
Возможность изменчивости
только в пределах свойств
ДаННОГО ВИДа, МИКрООрга- Сшинис latici <
низмы являются хорошим :;"^& *
объектом для поиска по- '^ШШ1'
лезных рекомбинантов. *
Этому способствует
высокая скорость размноже- Р,,с- 29- Поведение генных структур,У «ашюшмых
г г и диплоидных организмов
иия, возможность
скрещивания (гибридизации) штаммов, значительно различаваишхса по
свойствам и принадлежащих даже к различным видам, а
возможность механически переносить генетический материал из одной клет
ки микроорганизма в другую позволяет комбинировать свойства
штаммов более отдаленных в систематическом положении. У высших
организмов в этом отношении имеются значительные ограничения.
Возможное и. получения новых форм путем половых
рекомбинаций запнеит or того, а какой форме находится генетический
материал'. Если в клетке содержится одна молекула ДНК,
рекомбинации генетического материала невозможны, поскольку при
копуляции двух таких особей не могут возникнуть различные сочетания
ДНК. В этом случае смешивание и дальнейшее расхождение
молекулы ДИК можег привести лишь к кроссинговеру, т. е. обмену
участками ДНК. Поэтому эволюция живой природы привела к тому,
18-
125
что у большинства организмов генетический материал находится
в виде многих молекул ДНК или в виде комплексов ДНК,
называемых хромосомами. Это дает возможность получения
разнообразных комбинации ядерного вещества при половом процессе.
У бактерий наблюдается несовершенный половой процесс
(аналог полового процесса), при котором не происходит полного
слияния ядер н, следовательно, полной рекомбинации генов. Несмотря
па эю, половым размножением можно получить смешанное
потомство бактерий, позволяющее вести отбор штаммов с нужными
свойствами. У бактерий известны три процесса, при которых может ре-
кокбинироваться генетический материал двух родительских
организмов: конъюгация, трансформация и транедукция. Во всех
случаях лишь часть генетического материала передается от одного
организма (донора) к другому (р е цеп и енту). Последний,
приняв часть генетического материала, становится диплоидным (по
тем генам, которые он принял). В результате получается неполная
зигота (м ер оз и гот а).
Конъюгации—это процесс соединения двух родительских
клеток с помощью «мостика», через который происходит обмен
генетическим материалом. Этот процесс хорошо изучен для кишечной
палочки. После копуляции мужская клетка постепенно вводит свою
(единственную) хромосому в женскую. Процесс ввода хромосомы
можно остановить встряхиванием. В этом случае женской клетке
передастся лишь часть генетического материала. Однако и при
благоприятных условиях хромосома вводится не до конца. Возможность
остановки этого процесса на любой стадии широко используется
для изучения локализации генов в хромосоме и построения
генетических карт.
Трансформация — это введение чистой ДНК, полученной от
какого-либо микроорганизма, в клетку другого штамма. Для этого
извлекают ДНК из клеток, очищают, затем смешивают с клетками
бактерий другого штамма. В процессе роста последнего ДНК
проникает из среды в клетку. Количество переданных генов при этом
зависит от степени родства исследуемых культур микроорганизмов:
чем больше различаются по свойствам исходные штаммы, тем
меньше свойств приобретает реципиент. Поэтому таким способом редко
удается передать больше, чем одно свойство.
Транедукция — это передача свойств с помощью бактериофагов.
При заражении бактерий фагом последний развивается за счет
содержимого клеток, причем отдельные участки ДНК целиком
переходят в молекулу ДИК фага. При заражении таким фагом другой
культуры бактерий такие участки ДНК могут переходить в
молекулу ДНК этой культуры и последняя приобретает новые свойства
(если не погибает в результате развития фага). Путем транедук-
цин также редко удается передать более чем одно свойство
другому микроорганизму.
Механизм генетической рекомбинации у актиномицетов сходен
с таковым у бактерий. При получении генетических рекомбинатов
актиномицетов псиользуютс! такие же методы, как и в бактериаль-
136
ной генетике. В основе их лежит совместное культивирование
штаммов, отличающихся друг от друга по каким-либо признакам. После
совместного культивирования микроорганизмы высевают на среду,
на которой способны расти лишь формы с нужными
комбинациями свойств и не растут родительские формы высеваемых
микроорганизмов.
Характерной особенностью процесса рекомбинации у актиноми-
цетов, как и у бактерий, является образование неполной зиготы
(мерозиготы). У актиномнцетов, как и у бактерий, наблюдается
половая полярность, т. е. дифференциация особей по
половому признаку (мужские и женские). Рекомбинации у
актиномнцетов возникают только при скрещивании штаммов близкого
происхождения, относящихся к одному и тому же виду.
Почти у всех грибов обнаружена способность к половому
размножению, поэтому теоретически у них возможна и рекомбинация
признаков смешиванием генетического материала с последующим
расхождением генов в различных сочетаниях. Однако в
действительности дело обстоит сложнее. Грибы существуют в двух
морфологических вариантах, соответствующих двум физиологическим
стадиям развития — половой и вегетативной. На половой стадии
они приобретают особую форму, называемую плодовым
телом, в котором заключен генетический материал в виде спор. Эти
споры в период пребывания в плодовых телах могут копулировать
между собой, превращаясь в диплоидную зиготу с последующим
редукционным делением и всеми дальнейшими закономерностями
развития организма, возникшего в результате полового
скрещивания. Однако происходящее при этом перераспределение
генетического материала не приводит к образованию организмов с новыми
свойствами, поскольку копулирующие половые клетки
принадлежат одной и той же особи. Качественное изменение генетического
материала возможно лишь в результате копуляции половых клеток,
освободившихся из плодовых тел и принадлежащих особям с
неодинаковыми свойствами. На стадии вегетативного существования
грибы имеют разнообразные формы, представляющие собой
многоклеточные организмы, в каждой из клеток которых заключен
один или несколько наборов генетического материала в виде ядер.
Некоторые грибы, например дрожжи (сахаромицеты), на этой
стадии существуют в виде одной клетки, содержащей ядро. Между
клетками вегетативной формы дрожжей возможны копуляции,
соединение ядерного вещества с образованием зиготы, последующей
рекомбинацией генетического материала и развитием особи с
измененным сочетанием признаков. Этот процесс, называемый
гибридизацией, в естественных условиях маловероятен, но вполне
осуществим искусственно и применяется для получения новых рас
дрожжей промышленного назначения. При этом в качестве
исходного материала с успехом можно использовать клетки,
освобожденные от внешней оболочки, тормозящей процесс копуляции. Еще
лучший результат дает механический перенос ядерного вещества
из одной клетки в другую с помощью микробиологической техни-
137
кн. Что касается вегетативной формы грибов, то процесс копуляции
между ними и образование гибридных форм представляются
иначе. Вполне очевидно, что одновременное слияние всех клеток
двух многоклеточных особей невозможно. Тем не менее у
плесневых грибов наблюдается процесс, приводящий к рекомбинации
признаков. В отличие от истинного полового процесса это явление
называется п а р а с е к с у а л ь и ы м циклом. Суть его
заключается в том, что между отдельными частями тела гриба, точнее
между участками гиф, соприкасающимися друг с другом, образуются
мостики (анастомозы), по которым перемещается ядро из одной
гифы в другую. Образуется г ет е р о к а р и о и, т. е. клетка с
диплоидным ядром, содержащая двойной набор генетического
материала. В дальнейшем тем или иным способом ядерное вещество
расщепляется, что приводит к появлению рекомбинаптпых форм
с гаплоидными ядрами. Весьма интересным с промышленной
точки зрения является тот факт, что при дальнейшем развитии гете-
рокариона, т. е. диплоидной клетки, ядерное вещество может не
расщепляться с образованием гаплоидных форм организма и
последний продолжает развиваться в диплоидном состоянии. Более
того, в результате полового процесса между такими организмами
может происходить дальнейшее удвоение набора генетического
материала. В результате получаются полиплоиды — организмы,
имеющие по нескольку наборов генетического материала,
происходящего от различных особей. Такие организмы имеют большие
практические преимущества: крупные размеры клеток, большую
скорость роста и другие полезные качества. В свя.ш с этим
полиплоидия привлекает внимание ученых и специалистов
микробиологической промышленности. Таким образом, рассмотренный выше поло-
вон способ размножения предоставляет большие возможности для
получения микроорганизмов с практически полезными
свойствами.
Второй путь направленного получения организмов с новыми
свойствами—мутация, т. е. изменение структуры ДНК. Организм
с измененной структурой ДНК называется мутантом. Мутация
происходит под влиянием различных физических и химических
факторов— мутагенов. Мутации могут происходить в естественных
условиях (спонтанные мутации). Они могут возникать, например, оттого,
что в некоторых азотистых основаниях происходят случайные тау-
томерные превращения. Например, тимпи связан с аденнпом в ке-
тоформе. Если тимин во время репликации ДНК но какой-либо
причине перешел в энольную форму, то он уже будет спариваться
с гуанином. В результате появляется «незаконная» пара
оснований, которая вызывает определенные изменения свойств
организма—мутацию. Естественные мутации происходят редко, однако
среди огромного числа микроорганизмов, обитающих в природе,
вероятно существует значительное число мутантов с нужными
свойствами. Поэтому выделение и отбор полезных форм из природных
субстратов имеет важное значение для производства. Эффективным
1?ь
методом получения полезных форм микроорганизмов является
направленная мутация — искусственное воздействие на
структуру ДНК.
Изменение свойств организма, или мутация, возникает лишь при
слабом воздействии мутагенных факторов, когда в структуре ДНК
возникают небольшие изменения, после которых ДНК продолжает
функционировать. Более сильные воздействия приводят к гибели
организма. Следует отметить, что не всякие мутации проявляются
в генотипе, т. е. не всякие изменения в структуре генов приводят
к изменению свойств организма. Для многих триплетов — кодов
аминокислот — изменение третьего азотистого основания не влияет
на свойства синтезируемого белка.
Вырожденность кода создает определенную защиту от
случайных мутаций. Благодаря наличию нескольких кодов у одной
аминокислоты происходит более быстрое восстановление (реверсия)
утраченного признака, причем код аминокислот построен так, что
первые два азотистые основания менее подвержены мутации, чем
третье, не основное.
Кроме того, в кодах глутаминовой и аспарагиновой
аминокислот, например, первые два нуклеотнда одинаковы, поэтому при
утрате шифра одной из этих аминокислот сстается шифр другой
аминокислоты, близкой по своему значению в молекуле белка, т. е.
также обеспечивающей те свойства белка, которые зависят от
наличия свободной карбоксильной группы. Существуют данные,
что вырожденность кода дает возможность взаимозамены и
других аминокислот: щелочных щелочными, алифатических
алифатическими, однако с помощью кодовой таблицы это объяснить
трудно.
Способность кода к реверсии играет большую роль в борьбе за
существование вида, снижает эффективность воздействия
мутагенных факторов. В промышленности это, наоборот, имеет
отрицательное значение.
Физические мутагены. Мутагенное действие могут проявлять
физические факторы, способные проникать в организм и
воздействовать на ДНК, не затрагивая других жизненно важных
структур и процессов. Такими факторами являются излучения
различного происхождения, широко используемые на практике. Наиболее
распространены ионизирующие и ультрафиолетовые
излучения. Из ионизирующих чаще применяются рентгеновское,
■у-излучение, быстрые нейтроны. Ионизирующее излучение,
проникая в клетку, вызывает ионизацию атомов и молекул веществ,
т. е. образование нар ионов. Радиоактивное излучение вызывает
отрыв электронов от молекул одного вещества, которые
превращаются в положительно заряженные частицы, а оторвавшиеся
электроны присоединяются к молекулам другого вещества,
превращая их в отрицательно заряженные частицы. При этом одно и то же
вещество, например вода, может образовывать пару ионов. Под
влиянием излучения от молекулы ьоды отрывается электрон, и она
139
приобретает положительный заряц. Другая молекула воды,
захватывая электрон, получает отрицательный заряд:
1е-
Энергни —»- Н2С —>- И„0".
IF
п2о*
ijuiuy неустойчивости ионизированных мочекул воды
происходит их разложение п рекомбинация радикалов с образованием
устойчивых форм молекул, т. е. Н20, И к и Н202. Пероксид водорода
под действием кагалазы разлагается на кислород и воду. Под
влиянием перокснда водорода и образующегося активного кислорода
появляются liepekiicnue органические соединения. Свободные
радикалы и перокеиды, возникающие в результате действия
ионизирующего излечения, Bcrynaioi во взаимодействие с нуклеиновыми
кислотами и изменяю! пч структуру. К мутационным изменениям
приводит и непосредственное попадание лучей в молекулу
нуклеиновой кпслиты и ионизирование какой-либо ее части (теор и я «м и-
■п е и и»). Однако р а д и а ц и tj и и ы е м у т а ц и н — это прежде
шею химические изменения геиешческого материала, происходя-
пше поа влиянием возникших активных радикалов. К таким
изменениям ОТПОСЯ1СЯ дсгидроксплпроваппе и дезамнпироиаппе ДНК,
oKiii'ieiiiie деюксп||Пбозы, разрыв глюкозпдпой связи между пенто-
:ich"i и ajoiiicibiM осионанпем, распаривание азотистых оснований,
разрыв пеночки иолппуклеогпда и освобождение фосфата п т. д.
У i ь i р а ф и о л е г о в о е и з л у ч е н и е обладает
значительно меньшей анергией, чем ионизирующее. Оно не вызывает
ионизации молекул и значительно труднее проникает
в'клетку./Ультрафиолетовые лучи, попадая и молекулу, вызывают переход
электронов па более высокий уровень, тем самым повышая энергетический
iioieiiiuia.il вещества, что увеличивает его реакционную способность.
В опрсчеченныч условиях такое вещество подвергается химическим
превращениям, ведущим к различным мутационным изменениям.
Прямое воздействие ультрафнолетвых лучей па ДНК может
принести к превращению ппрнмп типовых оснований в ура кил —
необычное азошегое основание для молекулы ДНК. Это вызывает
нарушение механизма биосинтеза белка и ферментов п появление
мутантов.
Процессы, происходящие в клетке под влиянием
ультрафиолетового ШЛ} ченпи, сходны с фотохимическими процессами.
Большое чиаченпе при iron имеет в н д и м ы й с в е т. При воздействии
видимою cut id на микроорганизмы, подвергшиеся
ультрафиолетовому обручении, происходи! восстановление клеток с нарушенным
обменом пешее т. Видимый свет снижает легальное
(губите чьиск-) действие у льтрафпилетвих .тучен на микроорганизмы.
:чот эффект получил название фоюриикишации. Использование
"лого -фф1К1.> пошо.чн.ю прнмешпь более жесткий режим ультра-
.|мю ii'iiiiioro облучения п 1ем самым увелнчшь возможное 1Ь полу-
чс:ч|> ч> i:iiiioi>. Hiijeiiiiu п лругие мети мл |)еактпвацпп, например
1 ,.j
культивирование при пониженной температуре, обработка
химическими реактивами (иодацетатом, пируватом). Механизм
реактивации еще не выяснен.
Химические мутагены. Химическими мутагенами являются все
вещества, способные производить химические превращения,
приводящие к измененю структуры ДНК. Естественно, что таких веществ
очень много. Предпринимаются попытки классифицировать
химические мутагены в зависимости от их химического состава и
характера действия на генетический материал. Известно пять групп
химических мутагенов: ингибиторы синтеза предшественников ДНК;
аналоги азотистых оснований; алкилирующие соединения;
акридиновые красители; вещества, изменяющие структуру азотистых
оснований.
Ингибиторы синтеза предшественников нуклеиновых кислот —
это вещества, препяствующие образованию азотистых оснований.
К ним относятся азасерин, бензимидазол, теобромин, тетраметил-
мочевая кислота, этилуретан н др. Механизм их действия не
выяснен, но есть предположения, что, являясь структурными аналогами
метаболитов, они блокируют активный центр соответствующих
ферментов и тормозят синтез азотистых оснований.
Аналоги азотистых оснований — это вещества, способные
заменять азотистые основания в молекуле ДНК. Наиболее сильным
мутагенным действием такого характера обладают 5-бромурацпл
(БУ), 5-бромурацилдезокснрпбоза (ДБУ) и др. Первый из них в
процессе синтеза ДНК занимает место тимина. Кроме того, БУ
легко переходит в энольную форму и приобретает способность
спариваться с гуанином, т. е. образовывать «незаконную» пару
оснований.
Алкилирующие соединения — это вещества, при наличии
которых к какой-либо составной части молекулы ДНК присоединяются
остатки углеводородов (алкилов), например метнльныи, этильный
и др. По химической структуре эти вещества являются
соединениями углеводородных остатков с какой-либо группой,
отщепляющейся в процессе реакции. Наиболее эффективными алкилирующими
соединениями являются этилэтансульфонат, метилметансульфонат,
этнлметансульфонатдиметилсульфат, этиленимин, азотный и
серный аналоги иприта. Сюда же относятся окись пропилена,
формалин и другие соединения, содержащие активный кислород.
Алкилирующие соединения активно взаимодействуют с фосфатной
группой, образуя нестойкое соединение алкила с фосфатом. Последнее
гидролизуется с образованием свободной алкилыюн группы,
которая присоединяется к пуриновому или пнримидиновому
основанию. Большую способность к алкилироваиию проявляет гуаниднн.
Может происходить и непосредственное алкилнроваиие азотистых
оснований. Например, этилметилсульфонат этнлнрует гуанин.
Образующееся соединение отщепляется от цепи Полинуклеотнла, в
результате чего обрт\ятся «пропуск». В процессе репликации ДНК
на это место включается «незаконное» основание, в частности ал-
крлгуанин вместо пары гуанин — цитозин образует пару с тнмнпом.
141
Акридиновые красители действуют иначе. Молекула акридина
внедряется между соседствующими основаниями цепи ДНК,
увеличивая тем самым расстояние между ними. При репликации это
вызывает потерю или включение дополнительного нуклеотнда, что
ведет к нарушению порядка считывания информации и процесса
синтеза белка.
К веществам, изменяющим структуру азотистых оснований,
относится прежде всего азотистая кислота, вызывающая реакцию
окислительного дезамимнровання. При этом адеиип превращается
в гнпоксашнн, который спаривается не с тимпном, как аденнн,
а с цнтозпном. При окислительном дезамнннровапии цнтозина
образуется урацпл, который спаривается не с гуанином, а с адени-
ном. Гуанин при окислительном дсзампнпрованпи превращается
в ксаптпп, который по-прежнему спаривается с цитозииом, но
только двумя водородными связями. В этом случае мутация не
происходит. Урацил и гнмнн не подвергаются действию азотистой
кислоты, поскольку не содержат аминогрупп.
Другое вещество этой группы — гпдрокснламин. Его действие
распространяется только па цитознн, который при этом
приобретает способность спариваться с алепппом.
Открытие разнообразных физических н химических мутагенов
привело к мысли о совместном их применении. Большие успехи
достигнуты в результат комбинированного действия этнлг ппмнпа
и ультрафиолетовых лучей.
ОСОБЕННОСТИ ПОЛУЧЕНИЯ НОВЫХ ФОРМ ПРОМЫШЛЕННЫХ
МИКРООРГАНИЗМОВ
Достижения в области генетики совпали с развитие^
производства продуктов микробного происхождения. Впервые методы
генетики били использованы для селекции высокоактивных
продуцентов апгпбиошков. С развитием микробиологической
промышленности был получен ряд производственных штаммов —
продуцентов аминокислот, витаминов, ферментов и других биологически
активпi>iх веществ. Наибольшие успехи достигнуты в области
культивировании мутантов плесневых грибов, актипоминетов.
Получено несколько промышленных мутантов бактерий. По вопросу
селекции MyiaiiroB дрожжей п дрожжевых грибов сделано еше
сравнительно мало.
Первый штамм плесневых грибов — пепнипллов, применяемый
для пчл\че1М1Я пенициллина, обладал активностью 10—20 ед/мл.
Затем простым глбором из естественной среды был выделен штамм
акшипмстыо 2Г)0 сд/мл. Обработкой этого штамма
рентгеновскими д\чамп пол\чеп муташ амивпоетыи до Г>00 ед/мл. Затем с
помощью ультрафиолетовых лучей удалось получить штамм
активностью !)00 c.t'm.i Применение метода комбинированного действия
\.1!.|рафнолетовы\ .т\чеп н ппрща па споры гриба позволило
повысим, активность некоторых штаммов до 2о0() ед/мл. С. целью
::o»liiiu-uh-: актпшмет и нродл Цсшпв пенициллина применялся также
п.»
способ гибридизации между различными штаммами путем
получения анастомозов. В конечном итоге в результате применения
различных методов селекции получен штамм активностью 5000 ед/мл.
Аналогичные превращения происходили со штаммами актиномн-
цетов продуцентов стрептомицина. Первая культура имела
активность около 30 ед/мл. Затем был селекционирован из естественной
среды штамм активностью 250 ед/мл. К этому штамму било
применено несколько последовательных воздействии различными
мутагенными факторами. После обработки ультрафиолетовыми
лучами из пего получен штамм активностью 400 ед/мл. Па следующем
этапе селекции активность увеличилась до 600 ед/мл. В
дальнейшем проведено еще несколько этапов селекции с чередующейся
обработкой рентгеновскими и ультрафиолетовыми лучами, что
позволило получить штамм активностью 2000 ед/мл.
Большие успехи достигнуты в получении активных штаммов
актнномнцетов—продуцентов тетрациклииов. Наиболее важным
из этих антибиотиков является хлортетрацнклии (биомицин, аурео-
мпцпп). Последовательным применением мутагенных факторов —
рентгеновских и ультрафиолетовых лучен, этиленнмина, а также
использованием этих факторов в различных сочетаниях удалось
получить штаммы активностью до 3000 ед/мл.
Большую роль сыграло применение мутагенных факторов и в
получении активных продуцентов других антибиотиков.
Вопрос искусственного получения активных продуцентов
аминокислот сложнее. Аминокислоты являются первичными
метаболитами, т. е. непосредственно участвуют в пажнейших процессах
обмена веществ организма, тогда как антибиотик» и многие другие
вещества имеют вторичное происхождение. Поэтому воздействие
каких-либо факторов на генный аппарат, управляющий синтезом
аминокислот, отражяггся па всей физиологии обмена веществ. Это
накладывает свой oiпечаток на методы селекции продуцентов
аминокислот.
Пути биосинтеза основных метаболитов в организме
неразрывно связаны между собой, поэтому воздействие на одну
биохимическую реакцию приводит к изменению скоростей других реакции,
сопряженных с первой. Необходимо учитывать также
существование двух способов регулирования процесса биосинтеза первичных
метаболитов — репрессии н а л л остер пч ее кого
торможения (регрчипгнбировання). Рели микроорганизм начинает
синтезировать избыток какой-либо аминокислоты, последняя,
включая тот и другой механизмы, нмактивирует фермент, который
осуществляет ее синтез.
Это свидетельствует о том, что процесс получения мутантов,
синтезирующих повышенное количество аминокислот, должен быть
связан с воздействием на механизм регуляции и образованием дере-
прессивпы.х форм, ферментная система которых пе реагирует пч
избыток в среде данного метаболита. Выключение регуляторпого
механизма синтеза какой-либо аминокислоты может происходить
в результате адаптации микроорганизма к присутствию аналога
141
этой аминокислоты, т. е. антиметаболита. В связи с этим при
получении нужных мутантов аминокислот наряду с мутагенными
факторами широко применяется добавление в среду антиметаболитов.
Мутанты с повышенной способностью к синтезу какой-либо
аминокислоты — это патологические формы, утратившие
способность к образованию различных метаболитов — витаминов,
аминокислот и других биологически активных веществ. Поэтому их
называют ауксотрофными (или дефицитными), т. е. требующими
присутствия в среде биологически активных веществ. Это весьма
нежелательно в микробиологической промышленности, поскольку
добавление биологически активных веществ в среду повышает
себестоимость продукта. Тем не менее использование ауксотрофных
мутантов является ценным способом получения аминокислот и
других продуктов. Задача несколько упрощается тем, что в качестве
источника необходимых ростовых веществ можно .добавлять в
питательную среду естественные материалы — экстракты
растительного сырья и отходы различных микробиологических производств.
Разработаны и другие способы решения этого вопроса, например
совместное культивирование мутантов с различными свойствами.
Следует отметить, что сверхсинтез аминокислот обусловлен не
только нарушением регуляторных механизмов. Большую роль в
этом может играть изменение проницаемости клеточной мембраны.
Повышение проницаемости клеточной мембраны по отношению к
данной аминокислоте способствует ускоренному выводу ее из
клетки в среду. Вследствие этого, а также из-за расхода ее на синтез
белков концентрация данной аминокислоты в клетке уменьшается,
что вызывает усиленный биосинтез ее ферментными системами.
Первым для микробиологического получения аминокислот был
использован продуцент глутамнповои кислоты, принадлежащий к
микрококкам (Micr. glutamicus). Впоследствии был выявлен
другой продуцент, обладающий такой же способностью, но
принадлежащий к ко р и и е б а к т е р и я м. Оба продуцента получены
в результате обработки указанных микроорганизмов
ультрафиолетовыми лучами и являются ауксотрофными, в частности они
нуждаются в биотине и требуют интенсивной аэрации. Эти штаммы
накапливают до 30 мг/мл глутамнповои кислоты.
Установлено, что многие микроорганизмы, обитающие в
естественных условиях, обладают повышенной способностью к
биосинтезу аминокислот. Однако среди природных штаммов не оказалось
микроорганизмов, пригодных для производства наиболее
дефицитных незаменимых аминокислот. С помощью различных мутагенных
факторов (ультрафиолетовых лучей, быстрых нейтронов, сарколи-
зппа) были получены мутанты микрококков — продуцентов глута-
мнноиий кислоты, образующие большое количество лизина (до
20 мг/мл). Такие мутанты нуждаются в гомосернне. Они обладают
определенными недостатками, образуя кроме лизина другие
аминокислоты— аланин, валин (особенно при ухудшении аэрации).
Эти штаммы чувствительны к треонину п изолейцину, присутствие
которых тормозит биосинтез лизина. Проводилась работа в иаирав-
144
лении ликвидации этих недостатков. Применялись методы
дополнительных мутаций, адаптации к треонину. Однако двойные и
тройные мутации не привели к заметному изменению свойств в нужном
направлении по сравнению с первой мутацией.
В распоряжении генетиков в настоящее время имеется
большое количество высокопродуктивных штаммов — продуцентов раз
личных аминокислот. Многие из них получены из культур
кишечной палочки. Они синтезируют валин, треонин, феиилаланин и
другие незаменимые аминокислоты. Однако среди полученных
мутантов еще нет активных продуцентов наиболее важных аминокислот —
триптофана и метионина. Некоторые мутанты могут синтезировать
значительные количества триптофана из предшественника — антра-
ниловой кислоты (до 6 мг/мл). Имеются ауксотрофные мутанты
микроорганизмов, синтезирующих до 6 мг/мл метионина, однако
промышленное получение этой аминокислоты пока еще не
налажено.
В области производства ферментов селекция продуцентов с
применением мутагенных факторов не имеет столь широкого
распространения и успеха, как в области антибиотиков, хотя продуцентами
и в том и в другом случаях могут быть одни и те же
микроорганизмы. Объясняется это тем, что способность к образованию
ферментов — это основа жизнедеятельности микроорганизмов, и
все штаммы, обитающие в естественных условиях, обладают
достаточно высокой активностью в этом отношении. Процесс биосинтеза
ферментов индуцируется наличием соответствующего субстрата и
повышать продуктивность возможно подбором соответствующих
технологических условий. Тем не менее мутацией удается получать
активные в этом отношении штаммы.
Наилучшими продуцентами ферментов являются плесневые
грибы, из которых первое место занимают аспергиллы. Есть данные
о получении мутантов различных видов аспергиллов, обладающих
высокой протеолитической активностью. Для этого использовалось
комбинированное воздействие ультрафиолетовых лучей и этиленн-
мина. Большой протеолитической активностью обладают актино-
мицеты, применяющиеся для производства этих ферментов. С по*
мощью актиномнцетов в США получен препарат кератипаза
непосредственно гидролизующнй шерсть (без предварительной
обработки). Этот фермент применяется для обезволошивання кожи.
Имеются данные о применении ультрафиолетовых лучей и паров
диэтилсульфата для получения мутантов актиномнцетов, но
практически эти мутанты пока не применяются.
Проводится селекция продуцентов амилолитнческих ферментов.
Наиболее активными микроорганизмами в этом отношении явля
ются также представители плесневых грибов — аспергиллов. Для
получения мутантов используется комбинированное воздействие
ультрафиолетовых, рентгеновских лучей и этиленимина. Известно
большое количество мутантов — продуцентов амилолитнческих
ферментов. Они обладают в несколько раз большей активностью,
чем исходные штаммы. Такой же уровень повышения активности
19 - 2-1702
145
известен и для плесневых грибов — продуцентов протеолитнческих
ферментов.
В области получения мутантов — продуцентов витаминов —
пока еще достигнуто мало. Большое промышленное значение имеют
рибофлавин и витамин Bi2. Естественные штаммы многих
микроорганизмов способны к образованию большого количества
рибофлавина и могут быть использованы для его производства. Что
касается продуцентов витамина Bi2, то работы проводились с ак-
гнномицетами. Получены штаммы в несколько раз более активные,
чем исходный.
Предпринимались попытки получить мутацией активные штаммы
микроорганизмов — продуцентов органических кислот.
Плесневые грибы, применяемые для этой цели в промышленности,
являются удобным объектом для воздействия мутагенными
факторами. Однако органические кислоты, как и аминокислоты, являются
метаболитами основных процессов жизнедеятельности, что
снижает позможность получения высокоэффективных мутантов.
А\ксотрофные мутанты широко используются для изучения ме-
чзшмма различных процессов, происходящих в живом организме.
Они являются удобным объектом для исследования механизма
регуляции синтеза белка и ферментов. Большие перспективы имеют
мутанты в области использования их в качестве тест-организмов
для определения концентрации биологически активных веществ.
Потребность в каком-либо веществе вызывает реакцию
микроорганизма на наличие этого вещества в среде. Интенсивность роста
такого микроорганизма находится в прямой зависимости от
концентрации вещества. Установив заранее взаимосвязь между
концентрацией вещества и интенсивностью роста микроорганизма в
виле кривой, можно определить неизвестные концентрации этого
вещества в растворе
Экспериментальная генетика открывает широкие возможности
для получения тест-организмов. Имеются приемы, позволяющие
получить ауксотрофные мутанты с широким диапазоном
потребности в органических веществах. Известна так называемая пени-
циллиновая методика, основанная на том, что в определенной
среде клетки ауксотрофных мутантов сохраняются в покоящемся
состоянии, в то время как проросшие клетки с ненарушенной
физиологией погибают под действием пенициллина.
Метод гибридизации наиболее применим к бактериям и
дрожжам, у которых возможна истинная копуляция между клетками
или спорами. Описанные выше парасексуальные процессы
позволяют получить гибриды среди грибов и актиномицетов, однако,
как показывает опыт, полученные таким методом гибриды этих
микроорганизмов в процессе дальнейшего развития теряют
приобретенные новые свойства и возвращаются в прежнее состояние.
Существенные практические достижения в области получения
гибридов с нужными свойствами получены в бродильном
производстве, глс примеряется дрожжи. Объясняется это тем. что
дрожжи гт-.тчотся белее удг£ ъ'\\ f'ibCKTPV для проведения работ по
J.G
гибридизации. У этих микроорганизмов сравнительно легко
осуществлять копуляцию между клетками или спорами, испочьзуя
технику микроскопии и микроманипуляцин . Кроме того, в брочпль-
ном производстве имеется возможность получения гибридов
внутри одного и того же вида, что облегчает достижение
положительного результата. Применяемые в этой отрасли промышленности
расы дрожжей принадлежат в основном к одному и тому же виду
и в редких случаях к разным видам одного рода. Каждая из
используемых рас имеет какие-либо недостатки, хота в целом
дрожжи данного вида обладают большинством свойств, необходимых
для технологии. Задача селекции при этом сводится к передаче
какой-либо расе дрожжей дополнительного свойства ог другого
микроорганизма, без изменений уже имеющегося у нее комплекса
свойств. Так, спиртовые дрожжи, обладая высокой гицролнтнче-
ской активностью по отношению к основному углеводу мелассы —
сахарозе, не способны полностью расщеплять рафниозу. Для
полного расщепления рафипозы необходимы два фермента — ишзертаза
(р-фруктозндаза) и мелнбиаза (а-галактозидаза). Спиртовые
дрожжи, содержащие активную инвертазу, не вырабатывают фермента
мелнбиазы. В то же время среди других дрожжей имеются расы,
обладающие высокой мелибиазной активностью, но не
удовлетворяющие другим требованиям спиртового производства. Так возникла
проблема передачи мелибиазной активности спиртовым дру.жмам,
которая успешно решается советскими учеными метолом
гибридизации. Метод гибридизации дает возможность ме голым -rif»
дать новое биохимическое свойство дрожжам, но и, усилить
проявление уже имеющегося. Значительные достнжеи.адл получены в
отношении мальтазной активности, бродильной сноилйшети и
других свойств дрожжей, о чем подробнее будет сказано, нлже.
ГЛАВА V
ПРОИЗВОДСТВО ПРОДУКТОВ БРОЖЕНИЯ
Процессы анаэробного разложения вещееiв широко ihiio.ii.>
ются в промышленности. Все они называются бримешшии. Боть-
шое практическое значение имеют молочнокислое п спиртное бро
жения. Они применяются с давних пор для консервирования пролук
тов и приготовления различных напитков. В настоящее время
широко применяются также пропнононое, маслянокпелое и метановое
брожения. Технологии производства продуктов брожения имеют
много общего. Большинство этих производств используют одно и го
же сырье—мелассу, зерно, картофель. Зернпкартофелыюе сырь,
требует специальной подготовки при производстве пива п спирта.
Это необходимо, а первую очередь, для превращения крахмала и
сбраживаемые сахара. В производстве масляной гт'лигы, ацетона,
бутанола в этом пет необходимости, так как применяемые при этом
микроорганизмы способны усваивать крахмал. При hciio.i юваппп
- П7
19-
мелассы такая подготовка ие требуется, поскольку содержащийся
в ней источник углерода — сахароза — хорошо усваивается всеми
промышленными микроорганизмами.
Микроорганизмы, применяемые в бродильных производствах,
хороню разнипяются в анаэробных условиях. Однако было бы
неправильным считать все эти микроорганизмы анаэробными, для
которых отсутствие кислорода является нормальным условием
жизнедеятельности. Наоборот, для большинства возбудителей
брожений нормальными являются аэробные условия. Они способны
существовать и при отсутствии кислорода, однако в присутствии
кислорода они развиваются лучше. При вынужденном их развитии
в анаэробных условиях можно получить продукты неполного
расщепления веществ.
МОЛОЧНОКИСЛОЕ БРОЖЕНИЕ
Молочнокислое брожение— наиболее распространенный процесс
в природе и практике. Его используют и высшие организмы, где
этот процесс служит дополнительным источником энергии. При
недостатке АТФ, производимой в организме окислительным фосфо-
рилнрованием, начинается процесс молочнокислого брожения
запасных углеводов (гликолиз или гликогенолиз).
Среди микроорганизмов имеются разнообразные виды
молочнокислых бактерий, специализирующихся на использовании
процесса сбраживания различных углеводов. Эти микроорганизмы широко
используются в различных отраслях промышленности и сельского
хозяйства.
Имеются производства, в которых молочнокислое брожение
является основным процессом (производство молочной кислоты,
молочная промышленность и производства, связанные с
консервированием пищевых и кормовых продуктов), другие же используют
его как вспомогательный процесс (спиртовое, хлебопекарное
производства, мясная и рыбная промышленность). В спиртовом
производстве молочнокислое брожение используется для подкисления
среды с целью предотвращения развития посторонних
микроорганизмов. В хлебопекарном производстве продукты молочнокислого
брожения, кроме этого, имеют значение как компоненты качества
хлебных изделий. Аналогичную роль молочнокислое брожение
выполняет в мясной и рыбной промышленности. Наряду с этим во
многих микробиологических и других производствах
молочнокислое брожение имеет большое отрицательное значение как
побочный процесс, ведущий к снижению выхода и ухудшению качества
вырабатываемого продукта.
Производства, основанные на применении молочнокислого
брожения, используют разнообразное сырье. Однако ферментативные
способности молочнокислых бактерий ограничены: сбраживаемым
субстратом во всех видах сырья являются простые углеводы.
Получение молочной кислоты. Молочная кислота широко приме-
нясчея в народном хозяйстве: для подкисления различных пищевых
U8
продуктов с целью улучшения их вкуса и уснанваемостп, в
технологии многих производств, например для декальцинироваини
шкур в кожевенной н обработки тканей в текстильной
промышленности и др. Широко используется способность молочной кислены
образовынать разнообразные эфиры благодаря наличию спиртовой
и карбоксильной групп.
Производство молочной кислоты в виде лактата кальция
существует с давних пор. Вначале для этого применяли молоко, которое
подвергалось молочнокислому брожению (откуда и появилось па-
звание кислоты). Для производств молочной кислоты в принципе
можно применять любое сырье, содержащее простые углеводы,
однако многие виды растительного сырья нельзя использовать для
этой цели ввиду трудности его подготовки и выделения готового
продукта. Основным сырьем для получения молочной кислоты
являются отходы сахарного производства — кормовая, рафинадная,
тростниковая меласса. Источником углерода в этих видах сырья
является сахароза. В качестве сырья можег быть использована
молочная сыворотка, содержащая лактозу. Для молочнокислого
брожения можно использовать отходы, получаемые при переработке
древесины и содержащие продукты гидролиза клетчатки и пепто-
занов, а также гндролпзаты отходов сельского хозяйства.
Большинство из перечисленных видов сырья не является естественными
материалами, а получаются к результате переработки последних.
В процессе переработки разрешается значительная часть вигами
нов и других ростовых веществ. Потребность молочнокислых
бактерий в ростовых веществах вызывает необходимость добавлении
их в производстнеппую среду. В качестве источника ростовых
веществ используют солодовый, кукурузный экстракты, солодовые
ростки, дрожжевой аптолнзат.
В производстве молочной кислоты применяются различные виды
молочнокислых бактерий в зависимости от вида сырья. Чаще всего
для этого используют термофильные бактерии, развивающиеся при
относительно высокой температуре (45—50 СС). В пашен стране дли
производства молочной кислоты используют свекловичную или ра
финадную мелассу. В среду добавляют фосфа! аммония в качестве
источника азота п фосфора и солодовые ростки — источник
ростовых веществ. Концентрация сахара в среде составтиет около
12 %. Более высокую концентрацию сахара поддерживать
нецелесообразно из-за того, что па последних стадиях брожения при эюм
образуется кристаллический молочнокислый кальций,
осложняющий процесс брожения.
Молочнокислое брожение ведется в присутствии технического
карбоната кальция (мела), который нейтрализует молочную к и
слоту н переводит ее в кальциевую соль — диктат кальпня. При
отсутствии пейфалпзатора образующаяся молочная кислота сильно
повышает кислотность среды, что губительно влияет на
молочнокислые бактерии, и процесс прекращается преждевременно.
Культуральпая жидкость, полученная в результате брожения,
обрабатывается гашеной известью для полного ослжтспня тактата
20 - 2-1702
14У
кальция. Затем молочную кислоту переводят в свободное состояние
добавлением серной кислоты. После отфнльтровывания
образующегося сульфата кальция получается техническая молочная кислота.
Существуют разчичные способы получения пищевой молочной
кислоты из технической. Разнообразие способов обусловлено
трудностью отделения молочной кислоты от примесей. Чистую
молочную кислоту можно получить в виде кристаллов
молочнокислого кальция, который затем отделяют от примесей промыванием
и центрифугированием. Для выделения высокоочищеннон
молочной кислоты применяют метод перегонки ее с водяным паром под
глубоким вакуумом. Можно использовать способ экстрагирования
ее различными растворителями.
Получение кисломолочных продуктов. При производстве
продуктов с использованием молочнокислого брожения из
натурального сырья растительного илн животного происхождения не
требуется дополнительное введение ростовых веществ, поскольку в
натуральном сырье они содержатся в достаточном количестве. Одной
из наиболее благоприятных сред для развития молочнокислых
бактерий является молоко. Быстрое скисание молока является след»
ствнем интенсивного развития молочнокислых бактерий,
попадающих в молоко из внешней среды. Основным углеводом молока
является лактоза. Молоко содержит достаточный набор
аминокислот, необходимых для развития молочнокислых бактерий.
Существуют разнообразные кисломолочные продукты,
получаемые с применением молочнокислого брожения. Наиболее
распространено производство творога и сметаны, являющихся
продуктами массового потребления. Имеется большое количество
специальных диетических кисломолочных продуктов, многие из них
имеют лечебное назначение (кефир, кумыс, лактобациллин).
Кисломолочные продукты производят под влиянием естественной
микрофлоры («самоквасом»), или с применением специальных
культур молочнокислых бактерий (заквасок).
В процессе приготовления продуктов наряду с молочнокислым
брожением имеют место различные процессы, осуществляемые
другими микроорганизмами. Сопутствующие процессы могут быть
полезными для формирования качества продукта илн, наоборот,
нежелательными. Разнообразие кисломолочных продуктов
определяется составом микрофлоры, которая создается поддержанием
определенных условий нли внесением с закваской. Одним из
наиболее характерных факторов качества кисломолочных продуктов
является консистенция сгустка, образующегося в результате
осаждения казенната кальция под влиянием молочной кислоты. Имеется
целый ряд переходов консистенции сгустка — от рыхлого осадка,
в котором отдельные хлопья казеината кальция почти ие связаны
между собой, до однородного, почти твердого состояния. Северные
типы кисломолочных продуктов характеризуются слизистой
тягучей консистенцией (скандинавское тягучее молоко — тэтта,
голландское тягучее молоьо). Для производства южных типов
кисломолочных продуктов характерно использование одновременно
150
молочнокислого и спиртового брожении, причем качество продукта
зависит от соотношения интенснвностен этих процессов.
Преобладание молочнокислого брожения ведет к образованию более плотного
сгустка, а интенсивное спиртовое брожение, наоборот, к получению
жидкого продукта. Южные кисломолочные продукты готовятся с
применением заквасок, состоящих из молочнокислых бактерий
п дрожжей.
В производстве сливок и масла молочнокислое брожение
используется лишь для создания вкуса и аромата отдельных сортов
этих продуктов. При этом молочная кислота играет и
консервирующую роль, препятствуя развитию протеолнтическнх и лнполитиче-
скнх бактерий, ухудшающих качество продуктов.
Наиболее сложно в биохимическом отношении пронзподство
сыра. Оно включает две стадии: получение сырной массы и
созревание сыра. Получение сырной массы может быть основано на
применении микробиологического процесса — молочнокислого
брожения (безсычужные сыры) и на применении чисто ферментативного
процесса, т. е. обработки молока комплексом иротеолитических
(сычужных) ферментов (сычужные сыры). Технология
производства сычужных сыров не исключает молочнокислого брожения,
поскольку оно и в этом случае имеет место на второй стадии
производства сыра. Основной процесс во второй стадии — пронноиово-
кнелое брожение. Параллельно с ним идет молочнокислое брожение
Образующаяся молочная кислота является субстратом для про
пиоповокнелого брожения и одновременно фактором формирования
качества сыра. В технологии приготовления некоторых сортов сыра
микробиологические процессы более разнообразны. Так, и нроиз
водстве сыра «челдар» кроме молочнокислых и нропноновокислых
бактерий принимают участие плесневые грибы.
Вопрос о роли молочнокислого брожения во второй стадии
производства сыра долгое время не был до конца ясен. Давно
известно, что одним из основных процессов этой стадии является
гидролиз белков. Большинство молочнокислых бактерий обладает
слабой протеолитической активностью. Однако в дальнейшем было
установлено, что ряд молочнокислых бактерий, участвующих в
процессе созревания сыра, обладает достаточной протеолитической
активностью. В процессе производства сычужных сыров протеолиз
белков на стадии созревания происходит под влиянием ферментов
сычуга. Доказано, что молочнокислое брожение активирует
действие протеолнтическнх ферментов сычуга, если даже
молочнокислые бактерии не обладают протеолитической активностью. Другими
словами, в процессе производства сыра имеет место своего рода
«синергизм» биохимических процессов.
Консервирование растительных продуктов. Консервирующее
действие молочнокислого брожения широко применяется для
приготовления различных пищевых и кормовых продуктов из
растительного сырья. Значение молочнокислого брожения при этом
заключается не только и консервирующих свойствах молочной
кислоты, но н в том, что оно обусловливает качество продуктов. Процесс
20'
151
консервирования растительных пищевых продуктов называется
квашением или солением. Первое название более правильно,
поскольку соление — это лишь вспомогательная стадия, осуществляемая
с целью ускорения процесса. Для консервирования растительных
продуктов с помощью молочнокислого брожения характерен период
задержки процесса, связанный с тем, что необходимо определенное
премя для экстракции углеводов и других питательных веществ из
растительного сырья в раствор. Для ускорения процесса диффузии
нешеств в раствор в консервируемый материал добавляется
поваренная соль, являющаяся также составной частью вкуса квашеных
продуктов. При высокой концентрации соль может оказывать и кон-
серн npvioiuce действие.
Из угленотов в растительном сырье содержатся глюкоза, фрук-
1чза и сахароза. Технология производства квашеных продуктов
• аключаетси в выдерживании растительного сырья в солевом
растворе, где под влиянием спонтанной микрофлоры возникает
молочнокислое брожение. Вначале сырье выдерживают при температуре,
при которой интенсивно развиваются молочнокислые бактерии, что
прению гвует развитию других микроорганизмов. Одцако
длительное выдержннапне при высокой температуре ухудшает качество
продукта, поэтому дальнейшее выдерживание производят в
охлажденном помещении.
(Молочнокислые бактерии. Характерной физиологической
особенностью молочнокислых бактерий является их высокая
требовательность к среде. Ферментативные способности этих микроорганизмов
сформировались в процессе эволюции таким образом, что они
используют готовые вещества организма хозяина — растений и
животных. Это объясняет разнообразие форм симбнотическнх
взаимоотношений молочнокислых бактерий с другими организмами.
Большинство молочнокислых бактерий утратили способность
к деструкции сложных органических веществ — белков, жиров,
полисахаридов, и они используют в качестве источников питания
готовые продукты гидролиза — аминокислоты и простые сахара.
Наиболее доступными источниками углерода для молочнокислых
бактерий являются моно- н дисахариды — глюкоза, лактоза,
мальтоза и сахароза. Используются и промежуточные продукты
окисления органических веществ — дп- и трикарбоновые кислоты. Лишь
некоторые представители молочнокислых бактерий способны гид-
ролнзовать крахмал и ннулин. Относительно большей активностью
обладают они по отношению к белкам. Прежде всего это
относится к белкам молока, в частности к казеину. Это свойство имеет
большое значение в молочной промышленности, особенно в
процессе производства сыра. Вкус, аромат и другие качества сыра
в значительной степени зависят от содержания аминокислот —
продуктов гидролиза белка. У некоторых молочнокислых бактсрпГ:
обнаружена лпр/хлнтпческая способность, что также имеет
положительное значение в процессе созревания сыра. По отношению
к продуктам гидро.пгз.з сложных веществ молочнокислые бактерии
ia-кже нроязлмю, сп-.'цН^птчо.чь. Ра этичные виды этих мньроир-
15.'
ганизмов характеризуются неодинаковым набором незаменимых
аминокислот, а отдельные вилы не способны синтезировать
большинство аминокислот, и отсутствие хотя бы одной нз них
вызывает прекращение роста бактерий и процесса молочнокислого
брожения. Для многих молочнокислых бактерий незаменимыми
являются аргинин, цистеин,.глутамниовая кислота, лейцин, фенил-
аланин, триптофан, тирозин, валин, причем половина нз них не
являются обязательными для человека и животных.
Для молочнокислых бактерий свойственны определенные
взаимоотношения между аминокислотами в процессе их обмена.
В одних случаях наблюдается взаимозаменяемость аминокислот.
Например, некоторые виды молочнокислых бактерий не
развиваются при отсутствии глицина и серина, однако наличия одной из
этих аминокислог достаточно для их нормального роста. Между
некоторыми аминокислотами наблюдается антагонизм: треонин
препятствует усвоению серина, изолейцин не усваивается в
присутствии лейцина и валика.
Из ростовых веществ для многих видов молочнокислых
бактерий требуются фолневая и фолиновая кислоты. Многие нз них
проявляют потребность в пнрндокспне. Для роста большинства
молочнокислых бактерии необходимы никотиновая н паитотеповая
кисло]ы. Большое значение в обмене этих микроорганизмов
имеют и другие витамины группы В. Их потребность в витаминах
зависит от условии культивирования. Как и в случае с
аминокислотами, у молочнокислых бактерий наблюдается
взаимозаменяемость витаминов. Так, аскорбиновая кислота и глутатнои могут
в определенных условиях заменять витамин В|2. Такую же роль
могут выполнять дезокенрибознды. Пурииовые основания могуг
влиять на потребность в я-амннобензойпон кислоте. В присутствии
пуриновых и пиримидиновых оснований снижается потребность
в фолиевой кислоте, которая, как известно, участвует в синтезе
этих веществ в организме. Аснарагиповая и олеиновая кислоты
удовлетворяют потребность молочнокислых бактерий в бнотине.
Ростовыми факторами для молочнокислых бактерий являются
все азотистые основания, входящие н состав нуклеиновых кислот,
ряд их производных, а также некоторые органические кислоты,
главным образом ненасыщенные — олеиновая, лниолевая, лпполе-
новая. Ростовое действие оказывают уксусная и Муравьиная
кислоты. Потребность молочнокислых бактерий распространяется и
на продукты неполного гидролиза белков — пептиды. Присутствие
последних стимулирует развитие бактерий — возбудителей
молочнокислого брожения.
Хороню известны взаимоотношения молочнокислых бактерий
с другими микроорганизмами Продукты молочнокислого
брожения издавна применяются для профилактики и лечения ожогов,
ран и для других нелеп в иаротной медицине. В процессе
жизнедеятельности возбутптелеи молочнокислого брожения образуются
продукты обмена, обусловливающие их антагонизм по отношению
к различным микроорганизмам. II И. Мечников впервые нсследо-
154
вал и обосновал возможность использования молочнокислых
бактерий для борьбы с гннлоспгыми микроорганизмами пищевого
канала. Антагонистические свойства молочнокислых бактерий
обусловлены прежде всего нх способностью к накоплению
относительно большого количества молочной кислоты. Кроме того, они
продуцируют вещества, обладающие антибиотической активностью.
Некоторые из них выделены и изучены («лнзнн», «лактоцид», «лак-
толин», «бревин», «диплококцин» н др.).
Антибиотики молочнокислых бактерий используются в
производстве для борьбы с развитием посторонних микроорганизмов.
Так, в спиртовом производстве проведены широкие исследования
по применению антибиотика лактоцида и получены
положительные результаты.
Не менее известны симбиотнческие взаимоотношения
молочнокислых бактерий между собой и с другими микроорганизмами.
В основе этих отношений лежит взаимное обеспечение
различными факторами роста. Если молочнокислые бактерии нуждаются
в какой-либо аминокислоте, они могут хорошо развираться
совместно с микроорганизмом, синтезирующим данную
аминокислоту. Основными факторами взаимоотношений молочнокислых
бактерий с другими микроорганизмами являются аминокислоты и
витамины. На основе способности молочнокислых бактерий к
симбиозу разрабатываются методы исследования процесса биосинтеза
различных метаболитов.
Взаимное обогащение ростовыми веществами лежит в основе
тесных взаимоотношений молочнокислых бактерий с дрожжами.
Последние способны к синтезу самых разнообразных веществ —
аминокислот, витаминов, необходимых для молочнокислых
бактерий. Положительно влияют на дрожжи и продукты
жизнедеятельности молочнокислых бактерий, хотя этот вопрос менее изучен.
Положительное влияние молочнокислых бактерий на дрожжи
заключается в их способности к образованию молочной кислоты,
тормозящей развитие посторонней микрофлоры, в проявлении про-
теолитической активности некоторых их видов, что улучшает
азотистое питание дрожжей, а также в способности к образованию
некоторых органических кислот, хорошо усваивающихся дрожжами.
Брожение. В производствах, основанных на применении
молочнокислого брожения, наряду с основным процессом могут
происходить другие. Процесс молочнокислого брожения может быть
чистым и смешанным. В первом случае образуется
преимущественно молочная кислота, во втором кроме молочной кислоты
образуются уксусная кислота, углекислый газ, этиловый спирт.
Эгн брожения осуществляют различные виды молочнокислых
бактерий, которые называются соответственно гомофермента-
тивными игетероферментатнвными. На производстве
желательно поддерживать развитие гомоферментативных и не
допускать развития гетероферментативных молочнокислых бактерий.
Эго осуществимо лишь с применением чистых культур при
соблюдении определенных условий, препятствующих попаданию посто-
154
АТФ
АТФ
Гдокозо -6- (
I
Фруктозо-6-i
-4
Фруктозо-1,6-®
ронних микроорганизмов в производственную среду. В связи с тем
что это требует дополнительных затрат, на практике наблюдается
развитие гетероферментативных бактерий и образование других
продуктов. Кроме того, в начале технологического процесса, когда
развитие гомоферментатнвных (истинных) молочнокислых
бактерий еще не достигло высокого уровня и молочная кислота не
подавляет посторонние микроорганизмы, происходят побочные
процессы с образованием различных продуктов. Таким образом, в
производствах, основанных на применении молочнокислого брожения,
протекают разнообразные биохимические процессы.
Следует отметить, что молочная кислота может
образовываться и в процессе жизнедеятельности других микроорганизмов.
В то же время для
молочнокислых бактерий МОЛОЧ- Гомоферментатнвное молочнокислое брожение
НОКИСЛОе брожение ЯВЛЯ- Глюкоза
ется не единственным и
даже не главным
процессом жизнедеятельности.
Они используют его лишь
при отсутствии кислорода.
Между тем все
молочнокислые бактерии
развиваются в присутствии
воздуха и используют более
мощный источник
энергии и конструктивного
материала — аэробное
окисление.
Гомоферментатнвное
молочнокислое брожение.
Молочнокислые
бактерии совершают процесс
образования молочной
кислоты с целью
извлечения энергии. Однако им
столь же необходимы
конструктивный материал и
восстановленные дегидро-
геназы. В отношении
восстановленных дегидроге-
наз процесс
молочнокислого брожения как бы
«работает на себя», т. е.
образующиеся
восстановленные дсгидрогеназы
используются в этом же
процессе на восстановление
пнровнноградкоп кислоты;
2 3-®-глицерииовый альдегид
2 НАД —-■ -4 2 НАД-Нг—■,
21,3-
^3-
-глицериновая кислота
■2 АТФ
-глицериновая кислота
IHO
I
"'2 2-ф-глицернноввя кислота
2 2-{£>- эиолпировиноградиая кислота
|—*-2!АТФ
2Энолпировиноградиая кислота
2 Пировииоградиая кислота
I-
U- 2 НАД
- 2 НАД-Н4-
2 Молочная кислота
Баланс АТФ
Баланс НАД • Н,
Синтез
Расход
+ 4 АТФ
-2 АТФ
Выход 2 АТФ
Синтез + 2 НАД •
Расход — 2 НАД
Н,
Н.
Выход О
156
Для того чтобы восстановленные дегидрогеназы могли
использоваться па конструктивные нужды, процесс молочнокислого
брожения должен идти не до конца, и часть углеводов, следовательно,
тратится на синтез биомассы. Вопрос о соотношении углеводов на
конструктивные и энергетические нужды у молочнокислых
бактерии, как и у дрожжей, до конца не изучен. Однако на основе
химизма общеизвестных биохимических превращений можно
предполагать, как и в случае спиртового брожения, что для
удовлетворения конструктивных нужд процесс разложения глюкозы в
анаэробных условиях по схеме молочнокислого брожения должен
идти лишь до стадии образования пировнноградной кислоты,
которая затем превращается в нужные метаболиты. При этом
организм получает преимущество в отношении баланса
восстановленных дегндрогеназ: они расходуются уже не на 'восстановление
пировнноградной кислоты, а на конструктивные нужды.
При гомофермептативиом молочнокислом брожении на
практике около 90 % продуктов составляет молочная кислота, причем
она находится в виде рацемической смеси D ( + )- u L (—)-
молочной кислоты. Изомеры молочной кислоты не устойчивы.
Каждый из них может существовать лишь в абсолютно чистом виде.
Следы примесей превращают молочную кислоту в рацемат. В
концентрированном растворе молочная кислота конденсируется и
дегидрируется с образованием ангидрида.
Ангидрид молочной кислоты при температуре 130—140°С
превращается в лактоыолочную кислоту. Последняя при дальнейшем
нагревании превращается в лаптоп:
СИ,—СН—С=0
I I
ОН О
I
СИв—СП—СООН
Ге1ерофсрмеитативное . молочнокислое брожение.
Микроорганизмы, не содержащие фермептон альдолазы и трпозофосфатизо-
меразы, используют этот тип брожении.
Процесс растепления глюкозы при этом начинается так же,
как и по пептозофосфатному механизму, т. е. с фосфирплпровапия
глюкозы и последующего образовании иептоз. С участием КоА из
иептоз образуются фосфоглнцерпногшп альдегид п ацетнл-КоА.
Хл'.'Кл'пд обычным фрукюзоднфосфатиым путем превращается в
молочную кислоту, а из ацетил-КоА образуются побочные
продукты— этанол и уксусная кислота. Полное превращение
глюкозы в молочную, уксусную кислоты п этанол дает клетке всего две
молекулы АТФ. Образующиеся восстановленные лепирогеназы
полное 1ыо расходуются на восстановление конечных продуктов.
Следовательно, конструктивный и энергетический потенциалы гете-
рсформещативиого молочнокислого брожения такие же, как и
СН3—С—СН=0
/\
О О + Н20.
I I
о=с—сн-сн.
j>.i
Гетероферментативное молочнокислое брожение
Глюкоза
АТФ J
Глюкозо-6-(]
-НАД-
-НАД-1!2-
6-(£)-глюконовая кислота
-НАД-
—НАД-Н2-»
-^со2
Рибулозо-5-©
I
Ксилулозо-5-ф
Ко А «-I —I JjjO
3-<5)-глицерниовыП
альдегид
Л
НАД
НАД-М2—1
-АТФ
-АТФ
Пировииоградиая
кислота
Ацетил-КоА
Уксусная
кислота
Молочная кислота
-НЛД-
-НАА-
Уксусный
альдегид
-4-
Г ^— КоЛ
.Этанол
у гомоферментатпвного молочнокислого и других типов брожения.
Соотношение продуктов, образующихся при гетероферментативном
молочнокислом брожении, зависит от вида микроорганизма.
Некоторые бактерии образуют в основном молочную кислоту,
этиловый спирт и углекислый газ.
Гетероферментативном}' молочнокислому брожению могут
подвергаться пенгозы, причем этот процесс могут осуществлять
бактерии, сбраживающие глюкозу только гомофермеитативпым путем.
Следовательно, направленность процесса молочнокислого
брожения на производстве завис»г как от вида молочнокислых бактерий,
так и от углеводного состава среды.
157
СПИРТОВОЕ БРОЖЕНИЕ
Процесс спиртового брожения лежит в основе производства
спирта, пнва и вина. В биохимическом отношении эти
производства имеют много общего. Это касается основной стадии
технологического процесса — стадии брожения, физиологических
особенностей используемых микроорганизмов, а спиртовое и
пивоваренное производства весьма близки в отношении используемого сырья
н его подготовки.
Характеристика сырья и его подготовка к сбраживанию. Сырье
спиртового и пивоваренного производства — зерно и картофель —
содержит все вещества, необходимые для жизнедеятельности
дрожжей. Основную часть органических веществ картофеля составляет
крахмал (в среднем 18,5 %)• Имеются небольшие количества
простых Сахаров (до 0,8%), клетчатки (1,0%), пектиновых веществ
(1.5%), органических азотистых веществ (2,0%) и жира (0,2 %).
Азотистые вещества представлены всеми формами азота:
основная форма — белковый азот (около 60 %), аминный (26 %), амид-
иый (6%), аммиачный азот (8%). В картофеле содержится
около 1 % минеральных солей по отношению к сухой массе.
Количество фосфорных соединений невелико (около 0,04 % массы
клубней) . Картофель содержит большинство витаминов группы В и
небольшое количество органических кислот.
В зерне содержится около 84 % органических веществ,
представленных крахмалом (до 52%), простыми сахарами (до 3%),
клетчаткой (6%), пентозанамп п пектиновыми веществами (9%),
азотнс!ЫМн веществами (II %) н жиром (3%). Органические
азотистые вещества представлены главным образом белками.
Свободных аминокислот мало. Кроме витаминов группы В зерно
богато витамином П (особенно зародыши). Содержатся стериды.
Щиток и алейроновый слой богаты тиамином. Минеральных
веществ в зерне 1,5—3,0 %. Основная часть их — фосфат калия.
Имеются органические кислоты.
Свекловичная меласса содержит в среднем 80 % с.ухнх веществ,
ил которых до 50 % составляет сахароза и до 30 % другие угле-
и(>,и,1, органические безазошетые и азотистые соединения. Из
yr.ienuToti кроме сахарозы содержатся глюкоза, фруктоза («ипверт-
пып гахар»), грпеахарпд рафпноза, небольшое количество трнса-
харнта кссло.ш (микробного ироисхожтеиин). Имеются некоторые
пентрзы. В мелассе содержится значительное количество
органических кисло г (ди- и трпкарбоповых), оксикнелот (молочной),
лек чих кислот (уксусной, пропионовой, масляной) Содержатся
некоторые гумнповые кислоты. Меласса богата азотистыми
веществами. В пей обнаружено ао 2 % различных форм азота:
амннный (^6%), ампапып (0,03%), азот бетаинов (1,0%),
аммиачный п нщрашый (0,07%), белковый (0,04%). Среди азотистых
нс1чсстн много аминокислот, из которых особое место занимает
i.r г.-1мнп1>ия» кислота. Высокое содержание глутамннопой
кислоты (5 5 1!) массы мелассы) позпотяет организовать промышленное
158
получение ее из мелассы. В мелассе она содержится в основном
в виде пнрролидопкарбоновон кислоты. То же самое можно
сказать о бетаинах (особенно глнкоколбетаине), которые химическим
способом выделяют из мелассы.
Из органических соединений в мелассе содержится
значительное количество окрашенных веществ и коллоидов. Важное место
среди них занимают карамели — продукты термического
превращения сахарозы и других углеводов. Это смесь ангидридов
Сахаров, карбоновых кислот и темноокрашенных (глуминовых)
кислот. Содержится значительное количество меланоиди-
н о в — продуктов химического взаимодействия Сахаров и
аминокислот. Имеются и меланины — продукты ферментативного
окисления тирозина.
Коллоидные вещества мелассы имеют различную химическую
структуру. Они являются нежелательными примесями в мелассе.
Обладая большой поверхностной активностью, коллоиды
адсорбируются на дрожжевой клетке, препятствуя обмену.
Минеральные вещества (до 8,5 % массы золы) содержат
соединения калня, натрия, кальция и других элементов, необходимых
для развития микроорганизмов. Соли фосфора входят в состав
в небольшом количестве (около 0,6 % Р2О5 массы мелассы).
Меласса богата микроэлементами. Витамины группы В в
значительной степени теряются в процессе производства сахара.
Меласса, полученная в результате производства сахара из
сахарного тростинка, по составу ростовых веществ (витаминов)
близка к свекловичной мелассе, но бедна азотистыми веществами
и содержит меньше солей.
Данные о химическом составе сырья, применяемого в
спиртовом производстве, свидетельствуют о том, что на
жизнедеятельность дрожжей и образование продукта расходуются далеко не
все содержащиеся в нем вещества. Значительное количество их
остается в сырье после использования его в бродильном
производстве. Особенно это относится к спиртовому производству, цель
которого получение только спирта. Вещества, оставшиеся после
отделения спирта, среди которых кроме несброженных веществ
сырья имеются продукты метаболизма дрожжей, являются
основным сырьем для производства многих других продуктов. Иначе
обстоят дела в производстве вина и пива: все вещества сырья,
перешедшие в раствор и оставшиеся после брожения, наряду с
продуктами метаболизма являются компонентами получаемых
напитков. Отходы этих производств — лишь нерастворимые вещества,
оставшиеся на стадии приготовления сусла.
Процессы подготонкн сырья в бродильном производстве
различны. Подготовка мелассы, например, заключается в смешивании
ее с кодой и внесении компонентов, необходимых для
жизнедеятельности дрожжей и подавления посторонних микроорганизмов.
Подготовка сахаросодержащего сырья также не представляет
сложности. Сахарная снекпа измельчается, смешивается с горячей водой
л.гч lio.inoio распиреинч iiivipoit, 11 полученная смесь сбраживается.
159
Несколько сложнее подготовка сахаросодержащего сырья в вино-
делнн. Она заключается в дроблении винограда или других
растительных материалов, настаивании (в случае приготовления
специальных вин), извлечении сока и отстанванни. В этот период
наряду с диффузией происходят и ферментативные процессы, прежде
всего окислительно-восстановительные реакции. Полнфенолы
превращаются в хиноны под влиянием полифенолоксидазы. В
дальнейшем может происходить процесс восстановления хинонов за
счет водорода других соединений, например аскорбиновой или
диоксифумаровой кислот, аминокислот. В зависимости от
соотношении количеств полифенолов и хинонов устанавливается окраска
вина. Под влиянием инвертазы в период подготовки виноградного
сусла сахароза быстро гидролизуется. Пектинразлагающие
ферменты гидролизуют пектиновые вещества. Процесс разложения
пектиновых веществ способствует разрушению клетчатки и
высвобождению сока. Поскольку пектинразлагающие ферменты
растений (винограда) малоактивны, процесс приготовления сока
осуществляется с добавлением ферментов микробного
происхождения (ферментных препаратов). В результате действия пектинраз-
лагающнх ферментов кроме ускорения и увеличения сокоотдачи
уменьшается вязкость сока, что ускоряет процесс его фильтрации
и осветления. Выход сока увеличивается иа 3—5 %.
Качество вина во многом зависит от интенсивности
окислительных процессов на стадий приготовления сока. Интенсивность
окислительных процессов, например при приготовлении столовых вин,
шампанских виноматериалов, уменьшают добавлением серной
кислоты или обработкой бентонитом с целью инактивации и удаления
ферментов. В других случаях, например при приготовлении
кахетинских вин, наоборот, желательно интенсифицировать процессы
окисления, для чего добавляют ферментные препараты.
Значительно сложнее процесс подготовки крахмалсодержащего
сырья. Крахмал необходимо подвергнуть ферментативному
гидролизу и превратить его в простые сахара. Одним из условий
полного и быстрого гидролиза (осахарнвания) крахмала является
измельчение и водно-тепловая обработка растительного сырья
с целью извлечения крахмала из клеток и перевода его в
растворимое и клейстерообразное состояния, доступные для действия
гидролитических ферментов. В процессе подготовки сырья
содержащиеся в нем крахмал и органические вещества изменяются.
В присутствии воды происходит гидратация гидроксильных групп
остатков глюкозы; крахмал зерна, поглощая воду, набухает и
сильно (в 25—30 раз) увеличивается в объеме. При этом растворимая
в воде амилоза диффундирует в окружающую водную среду.
Водородные и другие связи между молекулами крахмала
разрываются, нарушается кристаллическая структура крахмала и
расположение молекул становится беспорядочным. В результате
образуется вязкая масса, называемая клейстером, а процесс его
образования клейстеризацией. Процесс гидратации крахмала, т .е.
взаимодействие между молекулами воды и гидрофильными груп-
160
памп молекул крахмала (набухание), сопровождается
выделением теплоты, а следующий за ним процесс разрыва
межмолекулярных связей, т. е. процесс клейстернзацпп,— поглощением теплоты.
При шдрагацин выделяется около 105,0, а при клейстернзацни
поглощается около о,3 Дж теплоты на I г крахмала.
При нагревании набухание и клейстернзаннн идут
значительно быстрее. При температуре 12и°С начинается растворение амн
лопектпиа, в результате образуется золь, которын при охлаждении
превращается в гель. Раствор крахмала (золь) при охлаждении
ретроград нрует, т. е. между молекулами вновь образуются
связи, и крахмал переходит в нерастворимое сосгоянне. Знание
закономерностей физико-химических изменений крахмала имеет
большое значение для разработки методов его ферментативного
гидролиза в производственных условиях.
В процессе разваривания сырья происходит частичный
химический и ферментативный гидролиз углеводов, являющийся
нежелательным на данном этапе производства, поскольку приводит
к дальнейшему разрушению образующихся простых Сахаров.
Химический гидролиз обусловлен действием водородных ионов, а фер
мептатнвпый — влиянием ферментов, содержащихся в сырье и
активирующихся при нагревании. В наибольшей степени гидролизу
подвергается крахмал, частично пектиновые вещества и гемпцел
люлозы. Образующиеся простые сахара, а также сахара,
содержащиеся в сырье, при тепловой обработке могут подвергнуться
различным препращенням. При температуре 120"С пентозы и гек-
созы разлагаются с образованием фурфурола и оконмегплфурфуро-
ла, которые затем взаимодействуют с аминокислотами и другими
продуктами расщепления белков, образуя меланонднны. При
температуре Rbiuie 180°С происходит реакция карамелизацин
углеводов, заключающаяся н обрашпапни ангидридов с последующей их
полимеризацией. Все это учитывается при разработке режимов
подготовки сырья.
В процессе подготовки сырья претерпевают некоторые
изменения и азотистые вещества. Белки частично гндролнзуются, увели
чивается количество растворимых азотистых соединений, хотя
полный гидролиз белков не происходит.
Источником ферментов, необходимых для осахаринання
крахмала, могут быть растительные продукты или микроорганизмы
Весьма удобно использовать ферменты того же растительного
сырья, из которого производятся продукты брожения. Ферментный
комплекс зернового сырья вполне обеспечивает гидролиз
большинства содержащихся в нем углеводов, чего нельзя сказать о
сахарной свекле и некоторых других видах растительной продукции,
являющейся сырьем для бродильного производства. Однако
ферменты сырья, предназначенного для производства, не могут быть
полностью использованы для осахарнвапнн крахмала, поскольку
они в значительной степени разрушаются при тепловой обработке.
Особенно это относится к спиртовому производству, где
применяются жесткие режимы подготовки сырья. Кроме того, гн; ролнти-
21 - 2-1702
161
ческне ферменты находятся в сырье в связанном состоянии и их
активирование требует специальной подготовки — проращивания.
Все это приводит к тому, чю в спиртовом производстве, перераба-
1ЫНЯЮЩСМ крахмалсодержащее сырье, необходима отдельная ста-
чня 1ЮД1 отопки сырья для накопления активных амнлолитических
ферментов, i. е. еолодоращение. В спиртовом производстве для
этого можно использовав лпи1ь определенную часть зерна от
всего количества, взятого для получения спирта. В пивоваренном
производиве проращиванию подвергается всё"исходное сырье.
Принцип проращивания зерна с целью активирования амнло-
ппнчеекпх ферментов давно применяется для приготовления оса-
хчрпвающнх материалов. В дальнейшем выяснилось, что с этой
не чью можно применять ферменты микробного происхождения.
Особое внимание в этом отношении привлекли плесневые грибы,
1 о гор we можно выращивать па педорогостоящпх растительных
материалах. Это дает возможность сэкономить большое количество
зерна и получить активные ферментные препараты. Последние
имеют еще одно преимущество: они содержат кроме амнлолитических
ферментов еще н другие ферменты, разрушающие различные поли-
tuxapii'iu. Так возникла целесообразность замены солода
ферментами микробного происхождения. В пивоваренном производстве
полная замена солода сталкивается с затруднениями, поскольку
солод в этом случае является источником не только ферментов, но
и других веществ, необходимых для получения продукта нужного
качества. Тем не менее частичная замена солода дает значительные
преимущества. В спиртовом производстве необходима полная
замена солода ферментными препаратами микробного происхождения.
Для пригоювлення солода применяется отборное зерно
высокого качества, главным образом ячмень, дающий солод с высокой
Р-амилазноп (осахарпваюшей) и а-амилазнон (декстрннирующей)
активностями. Первым этапом в процессе приготовления солода
является замачивание зерна, вызывающее его усиленное дыхание.
Для этого необходим максимальный доступ кислорода, в
противном случае в зерне начинаются анаэробные процессы (брожение),
и образующиеся продукты угнетают жизнедеятельность
зародыша. Увлажненное зерно подвергается проращиванию в
определенных условиях. Механизм накопления амнлолитических ферментов
в процессе проращивания заключается в том, что протеолнтиче-
скне ферменты растений (главным образом папаин) разрушают
белковый комплекс, связывающий амилолитические ферменты, и
переводят последние в активное состояние. Связывание
ферментов происходит во время созревания зерна. Молодое зерно,
особенно р период молочной спелости, обладает активным амилолитиче-
скнм комплексом. В период восковой спелости его активность
уменьшается п в созревшем зерие амилаза переходит в
неактивный нерастворимый белковый комплекс, называемый зчмогеноч
В спелом зерне пабтюаается незначительное проявление
активности р-ачнла.чы, гогла i.jr в согревающем зерие активны ампло.тн-
uinrci;».» [I ij.\i г.- ii.pM.nTf. Г с. "за ни ого состояния ферменты
1- '
можно вывести обработкой сырья протеолитическими ферментами
При действии на зерно папанна, трипсина и других протеаз в
течение непродолжительного времени (около суток) амилолнгнче-
ские ферменты активируются почти в такой же степени, как в про
цессе -приготовления солода. Таким образом, прогеолитнческни
ферменты играют первостепенную роль в высвобождении
ферментов из связанного состояния.
Многие гидролитические ферменты, в том числе а-амнла^н,
синтезируются при прорастании зерна под влиянием гормопоно-
добных веществ, содержащихся в щитке зерна. При увлажнении
зерна эти вещества, среди которых большую роль играет гнббе-
релловая кислота, проникают в алейроновый слой эндосперма, ые
синтезируются ферменты. Образующиеся протеолнтическне
ферменты гндролнзуют белковый слой, которым покрыты
крахмальные зерна. Во время прорастания зародыш выделяет вещееiво,
способствующее активированию u-амилазы и протеаз. Это
вещество называется зародышевым фактором. В готовом солоде около
7 % а-амилазы находится в зародыше, остальные 93 % — в эндо
сперме.
Из протеолитических ферментов зерна и других растительных
продуктов наибольшее значение имеет папаин. Он активируется
синильной кислотой и сульфгидрильнымн соединениями, среди ко
горых особое место занимает глутатнон. С накоплением глутатиопа
в прорастающем зерне возрастает активность протеолитических
ферментов. Активирующее действие на протеолнтическне фермен
ты, в частности на кислые протенназы, оказывает цистеин. В
результате действия протеолитических ферментов на белковые вс
щества зерна образуются аминокислоты, которые подвергаются
дезамннированию с образованием кетокислот и аммиака. Кетокнс-
лоты затем превращаются в углеводы, жиры и лр>гпе беза.югн-
стые соединения. Образующийся аммиак связывается
органическими кислотами и аминокислотами — аспарагнновоп и глутамнновоп
с образованием амидов. Таким образом в зерне накапливаются
растворимые азотистые соединения, необходимые для питания
дрожжей. В результате декарбоксилнрования аминокислот
образуются амины, дезаминирование которых приводит к образонанню
альдегидов. Некоторые из них расходуются на образование
алкалоидов, которые могут образовываться в результате
метилирования •аминов. Метилирование самих аминокислот приводит к
образованию бетаинов.
В процессе замачивания и проращивания зерна большую ропт
играют цитолитическне ферменты (цитазы), включающие целлю-
лазы. гемицеллюлазы, пектнназы, ксиланазы В результате
действия гемицеллюлаз наряду с действием протеолитических
ферментов стенки клеток эндосперма разрушаются и не препятствуют
'шоникновению ферментов. Последние, получая доступ к углево-
'ам, гндролнзуют их, и продукты гидролиза нспольт.ются для
жизнедеятельности зародыша. Главной составной частью гемннеллю-
лоз является р-глюкан, имеющий 0-1,3 и р-1,4-связн. Его ра.щен.те-
ii) j
ш'.е осуществляем энло-р-глюконаза (эндополиглюкозндаза),
действующая в основном на fi-1.4 сплзн. Образуются глюкановые
декстрины н олнгосахарнды, в том числе целлобпоза, которая
может гндролнзоваться с образованием глюкозы. В зерне
содержатся также пентоэаиы (арабаноксиланы). Их гндролнзуег арабано-
чндаза, отщенл'иошаи боковые пени арабаноксилана с
образованием o.nirocaxapiLioR. Другой фермеиг — эндокенланаза — гидро-
чнзуег длинные цепи арабаноксилана с образованием продуктов
шпа декстринов, которые также имеют боковые цепи, но их
отщепляет уже фермепг экзокспланаза. Образующиеся
олнгосахарнды расщепляются ферментом кенлобиазой.
К концу проращивания в ^ерне накапливается липаза. Процесс
солодоращення сопровождается также активацией фосфатаз и
некоторых дыхательных ферментов.
В процессе приготовления солода иротерпеваюг значительные
изменения различные вещества зерна. В наибольшей степени гид-
рол!иуется белок, поскольку условия приготовления солода
благоприятны для действия протеолнтнческнх ферментов. Более 50 %
всех исходных белкон гндролнзуются, однако значительная часть
продуктов гидролиза расходуется на образование новых белковых
веществ прорастающего зерна. Основным же энергетическим
источником н строительным материалом прорастающего зерна
является крахмал. Часть продуктов превращения крахмала, не
израсходованная на дыхание и построение стебелька, остается в зерне
и представляет собой смесь глюкозы, фруктозы, мальтозы и
сахарозы.
В результате гидролиза пентозанов в солоде накапливаются
нентозы. Количество клетчатки в процессе солодоращення
изменяется незначительно, количество жира уменьшается па 10—30%,
органические фосфорные соединения переходят* в минеральную
форму, накапливается небольшое количество продуктов обмена —
лимонной, молочной, муравьиной и других органических кислот.
Готовность солода определяется но нескольким параметрам,
главными из которых являются амилолнтнческая (АС) и декстри-
ннрующая (ДС) активности. В зависимости от происхождения
солода оптимальные значения этих величии различны. Значение
АС обычно колеблется в пределах 3—6. причем меньшее значение
относится к просяному солоду, большее — к ячменному. Овсяный
и ржаной солод характеризуется промежуточными значениями АС.
Значение ДС наибольшее у просяного солода (около 100).
Ячменный, ржаной и пшеничный солод имеют оптимальное значение
ДС — 35, овсяный — около 45.
Процесс приготовления солона на этом заканчивается. Готовый
солод измельчают для лучшего растворения ферменюв,
смешивают с водой и получают раствор (солодовое молоко), используемый
для осахарппаиня сырья.
Аналогично готовится солод для пивоварения, оанако значение
различных стадий процесса сололормшеипя л.in пшкппрегного и
спиртового принлиодств пс одллгког.о. В спиртном про;и.-.>дсп е
114
солод готовится с целью максимального накопления амнлолитиче-
ских ферментов, для пивоварения же не меньшее значение имеют
многие другие вещества, образующиеся в процессе приготовления
солода и содержащиеся в натуральном зерне. Роль амилолитнче-
ских ферментов в том и другом случаях примерно одна и та же.
Протеолшическне ферменты в спиртовом производстве
необходимы лишь для перевода белков в растворимые азотистые
соединения, необходимые для питания дрожжей. В пивоварении помимо
этого белки и другие азотистые вещества, образующиеся в
процессе солодоращиння, необходимы для создания характерных свойств
пива. В связи с этим в процессе приготовления солода для
пивоварения большое внимание уделяется контролю процесса
разложения белков. Различают три фазы разложения белков при солодо-
ращепни. Первая фаза, продолжающаяся 100 ч (включая
замачивание), почти не сопровождается разложением белков, вторая
фаза такой же продолжительности сопровождается сильным
разложением горденна и глутелипа, третья фаза — это равновесие
между процессами гидролиза и синтеза белков.
Большое значение в процессе приготовления солода для пива
имеет поведение веществ вторичного происхождения.
Определенным изменениям подвергаются дубильные вещества: в солоде они
становятся более растворимыми, чем в исходном зерне. Особый
интерес представляют антоцианы. В процессе приготовления
солода они изменяются незначительно. Их окнсленню препятствует
способность оболочки зерна регулировать поступление кислорода
из внешней среды. Количество поступающего кислорода
достаточно только для дыхания зерна. Окисление антоцнанов наблюдается
лишь при повреждении оболочки.
Одной из наиболее важных операций процесса приготовления
солода является его сушка. В биохимическом отношении это
сложный процесс. Основной задачей процесса сушки является
удаление ростков, придающих горький вкус пиву, и накопление веществ
(меланоидинов), обусловливающих цвет, вкус и аромат пива. Во
время сушкн в солоде продолжаются с большей интенсивностью
процессы, происходящие при проращивании, в результате чего
увеличивается количество продуктов обмена. Процесс сушки
по-разному влияет на активность ферментов. Цнтолитические ферменты
в значительной степени инактивируются. Снижается активность
Р-амилазы, а-амилаза более устойчива к температуре.
Сравнительно хорошо сохраняется активность протеолитических ферментов.
Изменяются органические вещества, уменьшается количество
растворимых азотистых соединений за счет взаимодействия
аминокислот с сахарами. Реакция аминокислот с сахарами имеет большое
значение в процессе образования темноокрашенных веществ —
меланоидинов. Различают три стадии меланоидннообразоваиня:
начальная — без изменения цвета; промежуточная —
слабое пожелтение; конечная — интенсивное образован е окра-
22 - 2-1702
165
шейных продуктов. На первой стадии протекает сахароамииная
реакция с образованием N-глюкозида:
С°Н НС .
(£нон)п + *-сн-соон (CHOH)n i
CI 1,011 NH, H(J I
CH.OH
Образующийся N-глюкозид изомеризуется в 1-амино-1-дезоксн-
Ч кстолу. Па второй стадии это соединение дегидратируется и при
aaibiienincM нагрев мни превращается в фурфурол (если
исходным сахаром была нентоза) или в оксиметнлфурфурол (если
исходным сахаром была гексоза). Кроме этих соединений образуются
другие вещества, обладающие сильными восстановительными
свойствами (редуктоны). Среди них имеются альдегиды, метилглиок-
саль, анегонн, днацетпл. Эти вещества образуют различные
продукты при взаимодействии с аминокислотами. На последней стадии
фурфурол, оксиметнлфурфурол и другие промежуточные продукты
взаимодействуют с аминокислотами с образованием меланоидинов.
Образуются также вещества типа азотистых оснований —
пиррола, нмндазола, пиридина, пиразола. Эти соединения также
имеют окраску. Интенсивность меланоидинообразовання возрастает
с уменьшением молекулярной массы реагирующих веществ. Пенто-
зы легче образуют меланонднны, чем гексозЫ. Этот же принцип
относится к аминокислотам, хотя н в меньшей степени.
Химическая структура меланоидинов мало изучена, однако известны
некоторые их свойства. Более чем па 50 % они состоят из углерода,
содержат около 30 % кислорода, около 5 % водорода, до 5 % азотв,
содержат спиртовые, карбонильные и карбоксильные группы, имеют
кислую реакцию, обладают восстановительными свойствами. Им
присуши коллоидные свойства и антиокнслительная способность, что
имеет большое значение в пивоварении. Их способность к
образованию поверхностной пленки обусловливает пеностойкость.
Большое значение в пивоварении имеют другие окрашенные
вещества — карамели, образующиеся в результате термической
обработки углеводов. Карамели — это продукты дегидратации
углеводов. От степени дегидратации зависят цвет и аромат
образующихся продуктов. Они не сбраживаются дрожжами, хотя хорошо
растворяются в воле.
В спиртовом производстве подготовленное крахмалсодержащее
сырье, т. е. разваренная и охлажденная до температуры действия
ферментов растительная масса, смешивается с солодовым молоком
или культурой плесневых грибов, в результате чего происходит
осахарнвачне крахмала. Основная задача этого
процесса—максимальное превращение крахмала в сахар. В настоящее время
большое внимание припекает также возможность пиролиза со-
ll-'i
держащейся в сырье клетчатки. Для ее разложения можно
использовать специальные культуры микроорганизмов, обладающих
высокой целлюлазной активностью. Существенное значение имеют
также поиски возможности гидролиза и других полисахаридов
сырья с целью повышения эффективности его использования н
повышении выхода спирта. Однако применяемые в настоящее время
ферментные препараты содержат главным образом комплекс амн
лолитических ферментов.
В результате действия а- и р-амилазы на крахмал зернового
или картофельного сырья в осахариваемой массе (заторе)
образуется смесь углеводов, состоящая из мальтозы, небольшого
количества глюкозы и конечных декстринов, негидролизованных
остатков крахмала, содержащих 1,6-глюкозидные связи. В состав
солода входит и третий фермент — олиго-1,6-глюкозидаза (декст-
риназа), которая гпдролнзует 1,6-связи в насыщенных декстринах.
Амилолитический комплекс ферментов солода содержит также
а-глюкозидазу (мальтазу), глюкозилтрансферазу (фосфорилазу) и
р-фруктозидазу (инвертазу), под влиянием которых
соответствующие сахара превращаются в моносахариды. Весьма важно
присутствие фосфорилазы. При наличии фосфорной кислоты этот
фермент отщепляет от концов молекулы крахмала остатки глюкозы
в виде глюкозо-1-фосфата. При достаточном количестве фосфор-
нон кислоты амилоза расщепляется полностью этим ферментом,
а при недостатке фосфорной кислоты процесс может идти в
обратном направлении.
Осахаривающне препараты микробного происхождения
отличаются от солода по составу амилолитического комплекса. Они
содержат а-амилазу, глюкоамилазу, а-глюкозидазу, олнго-1,6 глюко-
зидазу и нзомальтазу. О содержании р-амилазы в ферментном
комплексе грибного происхождения имеются различные данные.
Функцию р-амнлазы в препаратах микробного происхождения
выполняет глюкоамилаза. Кроме того, глюкоамилаза гидролизует
1,6-связи в конечных декстринах. Следующим ферментом,
расщепляющим 1,6-связи, является изомальтаза, действующая
предпочтительно на изомальтозу. Таким образом, плесневой
амилолитический комплекс характеризуется высокой гидролитической
активностью по отношению к а-1,6-связям, что обеспечивает
интенсивное сбраживание осахаренного растительного сырья дрожжами.
Ферментный состав и активность амилолитического комплекса
осахаривающих материалов не одинаковы, поэтому целесообразно
применение смешанных осахаривающих материалов,
обеспечивающих полный гидролиз углеводов.
Другие органические вещества растительного сырья — гемнцел-
люлоза, целлюлоза, пектиновые вещества — почти не изменяются
в процессе осахарнваиия сырья солодом. Однако при
использовании ферментов микробного происхождения эти вещества
претерпевают значительные изменения. Плесневые препараты содержат
пектинразлагающне ферменты и цитазу, которые образуют гексозы
и несбражнваемые дрожжами пентозы.
167
Протеолишчсскне ферменты осахаривающих материалов пре-
г-.р-чппюг белки н аминокислоты, которые используются
дрожжами при брожении.
Фермент фосфагала высвобождает фосфорную кислоту из фос-
форорпшнческнх соединении, что создает буферность и благопрн-
■иные условия для жизнедеятельности дрожжей.
Целью осахарпвания крахмала в пивоваренном производстве
'■пишется полное превращение его в сбраживаемые сахара и
обратившие ряда продуктов, обусловливающих вкус и аромат пнва.
Технология приготовления среды для пивоварения кроме нзмель-
чрцня солода и осахарпвания крахмала (затирания) включает ста-
тмю варки пивного сусла, состоящую в кипячении осахаренного
зчора в присутствии хмеля. Процесс осахарпвания крахмала, как
и п случае спиртового производства, сопровождается гидролизом
ipynix полисахаридов, белков и многих веществ солода. Если в
спиртовом производстве положительная роль образующихся
побочных продуктов заключается лишь в том, что они способствуют
накоплению источников азотистого питания и некоторых других
неществ, необходимых для роста дрожжей, то в пивоварении дело
обстоит иначе. D эюм случае вещества, образующиеся в процессе
пиролиза сложных соединений, не только служат источником
питания дрожжей, по и являются важными компонентами, опреде-
чиющнми качество самого продукта — пива.
Процесс гидролиза веществ с биохимической точки зрения во
всех броцнльпых производствах идет одинаково. Имеются лишь
количественные различия, связанные с особенностями подготовки
сырья и приготовления питательной среды. В процессе
приготовления пивного сусла создаются условия, благоприятные для
действия р-амилазы, под влиянием которой осахаривается 85 %
крахмала. Вследствие этого пивное сусло из продуктов гидролиза
крахмала содержит главным образом мальтозу и
высокомолекулярные декстрины. Следовательно, действие р-амилазы
уменьшает количество несбраживаемых декстринов и увеличивает
количество мальтозы, доступной для действия дрожжей.
Под действием р-амнлазы около 50 % амилопектнна
превращается в мальтозу. Количественное соотношение между
образующимися р-декстрнпамн и мальтозой зависит от числа концов цепи
амилопектнна. а-Лмплаза действует на внутреннюю часть
молекулы амилопектнна, увеличивая количество нередуцнрующих
концов цепи. При отсутствии п-амилазы действие р-амилазы неэф
фектнвпо, поскольку в молекуле крахмала содержится лишь около
3 % глюкозных единиц, т. е. нередуцнрующих концов цепи,
расположенных на периферии молекулы. В присутствии п амилазы
быстро гндролнзустся около 15% чальтозных связей н резко
возрастает количество нередуцнрующих концов цепи, т. е. субстрата
для действия р-амилазы.
Совместное icueiпие п- и р-амчдаз регулируется
технологическими приемами Оноечая цель чш\ приемов — создать условия
тлч рг< имущеетеннгчп действе" р-лчнлазы и не ннпктнвнровать
полностью а-амнлазу. В случае усиления активности а-амнлазы
возрастает концентрация продуктов ее действии, которые не
подвергаются дальнейшему гидролизу ферментами и не
сбраживаются дрожжами. К ним относятся мальтотрноза, декстрины,
состоящие из 3, 4, 5 и более остатков мальтозы, разветвленные
декстрины, содержащие 5 и более остатков" глюкозы, и другие
углеводы.
Оптимальное значение температуры действия р-амилазы,
которая создается в процессе приготовления пивного сусла, находится
в пределах 60—65 °С. Естественная концентрация водородных попов,
создаваемая при затирании, соответствует значению рП 5,6...5,9
и не является оптимальной для действия амплолнтнческнх
ферментов. Оптимальное значение рН для действия а-амплазы
приближается к 6,0, а для р-амилазы — лежит в пределах 4,5—4,8.
Вопрос регулирования концентрации водородных ионов сложнее,
чем регулирования температуры, поскольку он связан с внесением
дополнительных веществ, изменяющих качество пива.
Процесс сушки солода при пивоварении почти полностью пнак
гнвнрует цитолнтические ферменты. Для восполнения этих потерь
в процессе затирания принято вводить добавки препаратов из
солода, высушенного при низкой температуре (днафорина)
Для пивоварения большое значение имеет процесс
разложения белков. Недостаточный гидролиз белков ухудшает качество
пнва, понижает его стойкость. Продукты разложения белков
необходимы для питания дрожжей.
В процессе приготовления затора различные соли нз солода
переходят в раствор. Вследствие этого в растворе увеличивается
содержание электролитов, способствующих растворению
глобулинов (эдестина) и альбуминов (лейкозина). Эти белки, а также
продукты их гидролиза, называемые «стойко растворим ы-
ми белками», не выпадают в осадок при дальнейшем
кипячении сусла. Однако большая часть общего количества белков,
перешедших в раствор («растворимых белков»), при
кипячении коагулирует и выпадает в осадок.
Протеазы ферментов разрушаются при сравнительно низкой
температуре. Температурный режим затирания превышает
оптимальную температуру действия протеолптнческих ферментов, тем
не менее они проявляют высокую активность благодаря
защитному действию коллоидов, нахочяшихся в заторе.
Несколько иные биохимические процессы происходят в случае
применения ферментных препаратов микробного происхождения.
Использование несоложеных материалов, содержащих
дополнительное количество углеводов и имеющих низкую ферментативную
активность, требует дополнительного внесения источников
ферментов. Среди ферментов микробного происхождения имеются
амилазы, более устойчивые к повышенной температуре, чем амила.ш
солода. Эго относится н к другим ферментам. Ферменты
микробного происхождения имеют больший диапазон оптимальных
значений рП, а также лр\тнс преимущества, позволяющие шпенгн-
Ь'Ч
фицировать процесс приготовления пива без ухудшения его
качества.
Стадия варки пивного сусла осуществляется с целью
инактивации ферментов, стерилизации, коагуляции белков и обогащения
сусла вкусовыми веществами хмеля. Инактивация ферментов
необходима для сохранения определенного состава сусла и пива.
Коагуляция белков необходима для предотвращения их
осаждения в готовом пиве. В процессе кипячения происходит
дегидратация белковых молекул, т. е. ликвидация гидрофильной оболочки,
что сопровождается переходом белка в гидрофобное состояние и
его денатурацией. Однако белки при этом коагулируют не
полностью, поскольку изоэлектрическая точка белков солода находится
при различных значениях рН.
При кипячении сусла образуются сложные комплексы
белковых веществ с различными органическими и неорганическими
соединениями. Положительно заряженные белки соединяются с
отрицательно заряженными дубильными веществами (таннинами).
Аналогичные комплексы образуются с разноименно заряженными
белками и ионами неорганических соединений. Другие коллоидные
вещества также образуют комплексы с белками. Образование
комплексов интенсифицирует процессы коагуляции и осаждения.
Большое значение при этом имеют дубильные вещества, хотя их роль
еще полностью не выяснена.
Дубильные вещества — это смесь близких по составу соединений. Они
делятся нагидролизуемые и негидролизуемые (конденсированные).
Гидролизуемые дубильные вещества — это эфнры глюкозы (или другого
углевода) и ароматических оксикислот. Чаще всего в состав дубильных веществ
входят галловая и пнрокатеховая кислоты. Остатки этих кислот в дубильных
веществах соединены между собой по несколько штук в виде депсидов (днлепсиды,
тридепсиды и т. д.). Часто встречаются кофейная и хинная кислоты, а также
соединение остатков этих кислот, называемое хлорогеновой кислотой.
Общая формула дубильных веществ, происходящих от глюкозы, следующая:
сн-о-/е
I
. СН—О—R
I
СН—O-R О,
СН—0-R
I
СН
I
сна-о-д
гче R — остатки одной или разных ароматических оксикислот или их депсидов.
В основе строения негидролизуемых дубильных веществ лежат производные
фчавонолон и антоинаиов, называемых катехинами. Последние связаны между
сибон не -фирмой связью, как в молекуле гндролпзц'мых дубильных веществ,
а непосредственно через >глеродные атомы (конденсирование).
Дубильные вещества попадают в сусло из хмеля и солода.
Значительная часть их при кипячении конденсируется во флоба-
феиы, образующие нерастворимые комплексы с белком. Часть ду-
)70
бильных веществ непосредственно образует с белками комплексы,
выпадающие в осадок при охлаждении. Из минеральных веществ
наибольшей коагулирующей способностью обладают железо, цинк,
алюминий, медь и другие металлы, попадающие в сусло из хмеля
(хмелевых шишек).
Вкусовые качества пиву придают разнообразные органические
соединения хмеля, имеющие горький вкус. К ним относятся
главным образом смолы. Они делятся на несколько фракций в
зависимости от растворимости н других физико-химических свойств.
Основное значение имеет «смола, состоящая из гумулона и его
гомологов — когумулопа и адгумулона. Некоторое значение
имеет р-смола нли лупулон.
Аромат пиву придают эфирные масла. В процессе кипячения
многие из них улетучиваются. Для удержания возможно большего
количества эфирных масел в пиве применяется способ дробного
внесения хмеля, что обеспечивает полноту их экстракции.
Эфирные масла — это терпены (или изопреноиди). Их общая формула —
С|пН|в. Имеется большое разнообразие эфирных масел, что обусловлено
различным расположением двойных связей, циклизацией молекулы, наличием или
отсутствием спиртовой группы. Наибольшее практическое значение имеют такие
эфирные масла:
НС Н С. ^
3 ^С-СН-СНг-СНг-С-СИ=СНг ;ОСН-.СНа-СНг-С-СН=СН8
"зС Ы, Нз° сн3
Мирцен Лииалорл
KiCL
,с=сн-
СНз СНг
чс'
ОЬг-СНг-С-
Гераииол
-CH-CHjOH
15
СНз/СН3
СН
СНз
Ментол
Основное эфирное масло хмеля — мнрцен.
Характеристика дрожжей. Спиртовое и пивоваренное
производства используют дрожжи, относящиеся к одному и тому же виду,
но различающиеся некоторыми особенностями, на основе которых
их подразделяют на расы. В виноделии применяют дрожжи,
имеющие существенные отличия, позволяющие отнести их к другому
виду. Все дрожжи, используемые в бродильном производстве,
имеют общие биохимические особенности, отличающие их от других
микроорганизмов. Главная iij mix — это способность к
существованию при отсутствии кислорода. Дрожжи могут удовлетворять
171
свои энергетические и конструктивные потребности только за счет
спиртового брожения, хотя процесс аэробного окисления
углеводов для них является более выгодным, как и для большинства
живых существ. Ферментативные способности дрожжей
разнообразны, но для всех представителен этой группы микроорганизмов
характерно отсутствие ферментов полназ. Они не способны гидро-
лизовать крахмал, клетчатку, пектиновые вещества и все другие
полисахариды. Их способность гидролнзовать олигосахарнды
также ограничена и распространяется главным образом на дисахарн-
ды. Это объясняется тем, что местом обитания этих
микроорганизмов в природе являются плоды, ягоды н другие растительные
продукты, содержащие легкорастворимые моно- и дисахариды.
Поэтому они обладают специфичностью даже и по отношению к ди-
сахаридам, например ие сбраживают лактозу, не содержащуюся
в растительных продуктах. Влиянием условий обитания
объясняется н ограниченная протеолитическая способность дрожжей. Они
обладают протеолитической активностью по отношению к белкам
собственного организма, вследствие чего в неблагоприятных
условиях легко подвергаются автолизу (протеолизу), а также
определенной активностью н по отношению к чужеродным белкам,
которые используют в качестве источников азота, однако
существование их только за счет белковых веществ невозможно. В
присутствии минеральных источников азота дрожжи снижают активность
по отношению к органическим азотистым веществам и используют
преимущественно минеральные соли азота.
Дрожжи по некоторым особенностям напоминают автотрофные
организмы. Они способны синтезировать все аминокислоты из
минеральных форм азота, используя в качестве источника углерода
продукты разложения углеводов. Пути метаболизма углеводов
у дрожжей весьма разнообразны: глпколнтичеекпн, пентозный
(гексозомопофосфатнып), цикл ди- и трикарбоповы.х кислот, т. е.
за счег углеводов они могут существовать в любых условиях. Для
дрожжей характерны те же основные пути обмена аминокислот и
белков, что и лля всех организмов. Наиболее распространенной
реакцией образования аминокислот у дрожжей является аминнро-
ванне соответствующих кетокнелот. Дрожжи легко осуществляют
реакцию прямого амнннроваппя фумаровон кислоты, а также
реакции взаимопревращения различных аминокислот. У дрожжей
значительно развита способность ассимилировать аминокислоты
в неизменном виде, тогда как усвоение аминокислот у других
организмов начинается с процесса их разложения. Прямая
ассимиляция аминокислот приводит к снижению расхода углеводов на
синтез клеточного материала. При этом увеличиваются относительные
затраты углеводов па энергетические нужды. Промежуточные
продукты разложения углеводов, которые должны были
попользоваться иа конструктивные цели, расходуются на образование спирта.
Это приводит к увеличению выхода спирта по отношению к
сбраживаемым углеводам. Присутствие полного набора аминокислот
в срече сказывается и па потребности дрожжей в биологически
172
активных веществах, участвующих в обмене аминокислот,
например сводится к минимуму потребность в пирндоксине как состав-
поп части ферментов амипотрансфераз. Наличие готовых
аминокислот ускоряет процесс биосинтеза белка дрожжей, что, в свою
очередь, интенсифицирует процесс их размножения.
В отличие от других микроорганизмов дрожжевые клетки
содержат относительно большое количество свободных аминокислот.
Это свидетельствует о том, что регуляторпые механизмы
биосинтеза аминокислот у дрожжен менее чувствительны.
В дрожжевых клетках всегда содержатся полипептиды. Это
запасные вещества, служащие источником аминокислот в случае
необходимоеш, например во время размножения, когда
интенсифицируется процесс биосинтеза белка.
Дрожжи, как и лруше организмы, удовлетворяют потребность
в фосфоре за счет минеральных соединений. В их клетках
обнаружены различные формы минеральных соединений фосфора, в том
числе нолпфосфаты. Среди них имеются кислотоустойчивые
фосфаты с невысокой молекулярной массой, состоящие нз 3—16
остатков фосфорной кислоты. Содержатся и высокомолекулярные не-
растнорнмые в кислотах фосфаты, в состав которых входит
большое количество остатков фосфорной кислоты.
Полифосфаты могут использоваться в качестве источников
фосфатных трупп для фосфорнлнровання углеводов и АДФ, а
также пуклеозндоп. Имеются данные о том, что полифосфаты
содержат макрозргичеекпе связи и, вероятно, являются не только
аккумуляторами фосфора, но п энергии.
Дрожжи, применяемые в производстве спирта, пива и вина,
существенно различаются между собой но биохимическим
признакам. Выявлены различия и между штаммами, применяемыми в
одном и том *е производстве. Штаммы дрожжей,
зарекомендовавшие себя и применяемые как наилучшие в определенных
конкретных условиях в бродильном производстве, принято называть
росами. Каждое производство предъявляет свои требования к
дрожжам. Дрожжи, применяемые в спиртовом производстве, должны
облачать способностью к интенсивному сбраживанию углеводов,
быть устойчивыми к наличию продуктов обмена и посторонних
микроорганизмов.
В производстве спирта нз крахмалсодержащего сырья
применяются дрожжи рас II, IV, X, XII. Наиболее распространена
раса XII. Она хорошо сбраживает гексозы, из днеахарндов —
мальтозу н сахарозу, трнсахарпд рафннозу сбраживает лишь на 1/3,
поскольку не образует фермент u-галактозидазу (как и все
спиртовые дрожжи), а также не сбраживает лактозу, пентозы и
декстрины. При производстве спирта нз мелассы рекомендуются
■||«'жжн, облачающие осмофильностью, т. е. способностью к
развитию в присутствии большого количества солей, содержащихся
в мелпеспых растворах. К пнм относится раса Я (Якубовского).
R vc'iophhv производства дрожжи адаптируются и свойства
гримеч;емы\ рас несколько улучшаются. Так появилась раса Ял
173
(Лохвицкая), которая применяется теперь вместо расы Я.
Хорошими качествами в условиях спиртовых заводов,
перерабатывающих мелассу, обладает раса В (Венгерская). Характерной
особенностью ее является повышенная мальтазная активность по
сравнению с другими расами, применяемыми для сбраживания
мелассы. Способность сбраживать мальтозу не является необходимой
для дрожжей, применяемых при переработке мелассы, поскольку
последняя не содержит этого дисахарнда. Однако в связи с
использованием дрожжей, накопившихся в процессе спиртового
производства, для целей хлебопечения мальтазная активность нх имеет
большое значение. Это требование в настоящее время является
существенным при подборе рас дрожжей для производства спирта.
Культивируются и другие производственные расы дрожжей,
каждая из которых обладает определенными преимуществами.
В Чехословакии есть расы ГБИЛЗ, отличающиеся более высокой
степенью сбраживания рафинозы. В Румынии применяется раса
PC, обладающая высокой устойчивостью к антисептикам.
Различие свойств производственных рас дрожжей и
возрастающие требования к ним стимулируют работы по искусственному
получению гибридов, совмещающих качества отдельных рас.
Такие работы интенсивно проводятся в Институте общей генетики.
Ученые К. В. Косиков и О. Г. Раевская впервые путем
гибридизации успешно решили вопрос u-галактозндазной (мелибиазпой)
активности спиртовых дрожжей. Скрещивая спиртовую расу Я
с пивными дрожжами, принадлежащими к другому виду н
обладающими мелибиазной активностью, они получили гибрид,
который, сохранив свойства спиртовой расы, приобрел способность
полностью сбраживать рафинозу (гибрнд-67). Однако у этого гибрида
уменьшилась бродильная способность. Дальнейшим скрещиванием
гнбрида-67 с гибрндом-26, полученным в результате скрещивания
рас Я и XII, получен гибрид-73, сбраживающий рафинозу и
обладающий высокой бродильной способностью. В дальнейшем
получены гибриды (75, 105, 112, 202 и др.), представляющие
практический интерес. Гнбрнд-112, например, обладает высокой мальтаз-
ноп активностью. Среди гибридов есть устойчивые к повышенной
кислотности, инфекции и т. д. В то же время у полученных гнб-
ричон наблюдается ухудшение некоторых качеств, имеющихся
у ис.хо mux рас. В связи с этим на производстве брожение под
влиянием гибридов осуществляют как дополнительную стадию,
т е. вначале среда сбраживается обычными штаммами, после чего
тображнианне Bi-дется с помощью гибридов. Таким образом исполь-
jyifncH преимущества обоих микроорганизмов.
R спичи с целесообразностью применения нескольких
микроорганизмов л ля осуществления процесса спиртового брожения
возрастает актуальность вопроса применения ассоциаций и поиска
штаммов дрожжей, способных к длительному сосуществованию
н условиях спиртового производства.
Пивоваренное производство предъявляет своп требования
к чрижжам. Основная цель пивоварения — накопления разпооб-
\:-\
разных продуктов, определяющих питательные и вкусовые
качества пива, в том числе небольшого количества спирта. Для
обеспечения этих качеств необходимо применять сложные
технологические приемы, в том числе большую длительность брожения.
Последнее, в свою очередь, возможно в условиях пониженной
температуры. Всем этим требованиям должны удовлетворять дрожжи,
применяемые в пивоварении. В биохимическом н технологическом
отношении процесс брожения в пивоваренном производстве
делится на две стадии: главное брожение и дображивай и е.
Эти стадии осуществляются в различных температурных
условиях— соответственно 6...9 и 1...2°С. Перечисленным особенностям
производства соответствуют дрожжи вида Saccharomyces carlsber-
gensis, применяемые в настоящее время п пивоварении. Фермент
ный комплекс этих дрожжей включает u-галакгозпдазу. Они
полностью сбраживают рафинозу и используются в качестве исходных
рас в процессе получения гибридов для спиртовой промышленности.
В связи с тем что зш дрожжи образуют хлопья, быстро
выпадают в осадок и осуществляют процесс главного брожения в
нижнем слое жидкости, их называют «хлопьевидными», или «нпзовы
ми». В пивоварении иногда применяются представители того же
вила, что и в спиртовом производстве — Saccharomyces cerevisiae.
Они не образуют хлопьев, находятся в среде в виде мелких
взвешенных частиц, поднимающихся в верхний слон под денстпем
выделяющегося углекислого 1аза. Эти дрожжи получили название
«пылевидных», или «верхневых».
При переработке сырья низкого качества и песоложеных
материалов используется раса 77G, способная в этих условиях давать
пиво хорошего качества. Раса II, применяемая па пивоваренных
заводах, отличается более интенсивным сбраживанием сусла, что
позволяет сократить период главного брожеинч. Применяются
также расы 41, 44, обладающие положительными свойствами.
Некоторые расы предложены производством (Львовская, Рижская).
Широко используются расы Р и F, предложенные Чехословакией
и имеющие пенные производственные качества.
Иные требования предъявляет к дрожжам винодельческое
производство. Винные дрожжи должны обеспечить полноту
сбраживания углеводов, быть устойчивыми к инфекции, высокой
кислотности, а также выдерживать большие концентрации спирта (до
18%). Дрожжевые организмы по своей природе обладают
качествами, позволяющими выдерживать влияние указанных
неблагоприятных условий. Это дает возможность осуществлять процесс
виноделия на естественной микрофлоре. Во время приготовления
внноматсриалоп в них попадает большое количество различных
видов микроорганизмов, содержащихся на поверхности плодов и
ягод. Однако условия, создающиеся в процессе брожения, угнетают
развитие всей микрофлоры, за исключением определенных типов
дрожжей. Для более быстрого подавления посторонней
мнкрофторы на производстве ппиочатериалы обрабатывают сернистым
ангидридом, присутствие которого винные дрожжи вытержнвают и
175
большем степени, чем другие микроорганизмы. Несмотря на
особые физиологические свойства, лрожжп подвергаются влиянию
внешних факторов, в том числе и основного продукта — спирта.
В связи с этим в винодельческим, как н в других производствах,
большое значение имеет применение чистых культур специально
выведенных устойчивых рас дрожжей. Известные промышленные
расы винных дрожжей принадлежат в основном к виду Saccharo-
myces villi и реже Succliaromyccs oviforincs, применяемым для
производства хереса. По ферментативным способностям они мало
ОГЛИЧЛЮ1СИ от спиртовых и пивных рас: хорошо сбраживают гек-
созы, днсахариды растительного происхождения, не обладают
«-галактозидазной активностью, не сбраживают пептоз,
декстринов и полисахаридов. Имеемся большое количество вниных рас
дрожжей. Для каждой категории вин рекомендуются
определенные расы. Виноградные вина, например, готовятся с применением
рас Темпельгор 14 и 29, Серсиаль 14. Для крепких випоматерпа-
лов рекомендуются расы Массандра 3, Туркестанский 36/5 и др.
Плодово-ягодные вина получают с применением рас Яблочная 7,
Спдровая 100, Вишневая 33. Имеются специальные расы для
производства клюквенных, брусничных вин, хереса, шампанских и т. д.
Химизм образования спирта и других продуктов. В
технологическом отношении спиртовое брожение — это не только процесс
образования спирта. Превращение углеводов в спирт
сопровождается многими другими процессами, приводящими к образованию
различных продуктов. Кроме того, брожению поавергаются не
/олько углеводы. В сбраживаемом сырье содержатся и другие
вещества, нз которых образуются побочные продукты.
Химизм образования спирта можно представить схемой:
Схема образования АТФ и восстановленных дегндрогеназ
в процессе превращения глюкозы в этиловый спирт
Глюкоза
2 АТФ -J
2 3-®-глицериновый альдегид
2 НАД -| -2 НАД-Hj
2 1,3-®-глицериновая кислота
>=С4АТФ
2 Пировиноградшя кислота
| -2 СО;
2 Уксусный альдегид
L j- *
2 Этиловый спирт
Баланс АТФ Ба.танс НАД И
Синтез + 4АТФ Стпел + 2(1 АЛ ■ Н,
Расход — 2АТФ Расход — 2НАД \]„
Выход 2.\ТФ
Вычод О
Процесс разложения углеводов проходит те же стадии, что и
при других тинах брожений. Различия начинаются со стадии
превращения пировиноградной кислоты. При спиртовом брожении
пнровиноградная кислота под влиянием фермента пируватдекар-
боксилазы превращается в уксусный альдегид, который
восстанавливается алкогольдегндрогеназой в этиловый спирт. Перенос
водорода при этом не приводит к образованию АТФ. Последняя
образуется лишь субстратным фосфорнлнрованнем. Это дает в
сумме всего две молекулы АТФ на одну молекулу глюкозы (с учетом
расхода на фосфорилирование глюкозы).
Химизм образования спирта из глюкозы имеет нулевой баланс
восстановленных дегидрогеназ. Значит, этот процесс используется
только как источник энергии. Восстановленная дегидрогеназа,
образующаяся при окислении глицеринового альдегида, использует
активный водород на восстановление уксусного альдегида в
этиловый спирт. Для дрожжевой клетки это не имеет значения,
поскольку этиловый спирт не потребляется дрожжами. Он
накапливается как конечный продукт обмена. Биологический смысл этого
окислительно-восстановительного процесса состоит в том, что
вследствие его протекания высвобождается дегидрогеназа для
последующего окисления глицеринового альдегида. Именно это имеет
первостепенное значение, так как на стадиях, следующих за
окислением глицеринового альдегида, происходит субстратное
фосфорилирование и образуется АТФ. Если по каким-либо причинам
дегидрогеназа не может отдавать водород уксусному альдегиду
(о чем будет сказано ниже), то передача происходит па другие
вещества. В любом случае совершается процесс высвобождения
дегидрогеназы для выполнения главной функции — окисления
глицеринового альдегида с целью извлечения энергии на последующих
стадиях путем субстратного фосфорилнровапия. Для
осуществления конструктивного обмена клетке необходимы восстановленные
дегидрогеназы для других целей. В таком случае восстановление
уксусного альдегида не происходит, и он не образуется вовсе,
поскольку для строительных целей нужна пнровиноградная кислота.
Из нее образуются все необходимые вещества* Таким образом,
в конструктивном обмене процесс идет до стадии превращения
пировиноградной кислоты. Это дает организму возможность
использовать АТФ и восстановленные дегидрогеназы. Этиловый спирт при
этом не образуется, а происходит рост дрожжевых клеток.
Поэтому между количествами образующейся биомассы дрожжей и
этилового спирта при сбраживании какой-либо среды существует
обратная зависимость, что следует учитывать в этом
произвол ст I) е.
Приведенная схема образования спирта является идеальной.
В реальных условиях, даже в том случае, если в среде
присутствует только глюкоза, химизм ее превращения в спирт
сопровождается побочными процессами, число которых зависит от физико-
химических условий. При этом наряду со спиртом образуй..ся дру-
23 _ 2-1702
177
rue продукты брожения. В среде, содержащей смесь различных
органических веществ, спиртовое брожение по химизму является
значительно более сложным биохимическим процессом,
совокупностью спиртового и многочисленных сопутствующих брожений,
ведущих к образованию примесей. Продукты брожения,
образующиеся наряду со спиртом, принято делить на вторичные и побочные.
Промежуточные и конечный продукты разложения глюкозы могут
подвергаться различным превращениям, вследствие чего
возникают вторичные процессы, и одновременно с этиловым спиртом в
среде накапливаются вторичные продукты — глицерин, уксусный
альдегид, уксусная кислота, 2,3-бутиленгликоль, ацетонн, пировино-
градпая кислота. В спиртовой бражке всегда присутствуют ди- и
трнкарбоповые кислоты, образующиеся во время культивирования
дрожжей в аэробных условиях, т. е. в период размножения
дрожжей. Однако образование последних возможно и в анаэробных
условиях.
В средах сложного состава многие вещества, присутствующие
наряду с углеводами, подвергаются различным превращениям,
хотя и не являются источниками образования спирта. Процессы
превращения этих веществ, не имеющие отношения к
спиртовому брожению, обычно называют побочными процессами,
а образующиеся при этом продукты — побочными продуктами
брожения.
При сбраживании чистых растворов Сахаров образование
примесей обусловлено прежде всего способностью альдегидов к
окисли гелыю-восстаповнтельному взаимодействию. Кстати, основной
продукт — этиловый спирт — также образуется в результате
ферментативного взаимодействия уксусного и глицеринового
альдегидов. В начале процесса спиртового брожения, называемого в
технологии индукционным периодом, когда в среде еще не накопилось
достаточного количества уксусного альдегида, восстановленная
дегндрогеназа переносит водород от одной молекулы 3-фосфогли-
иернпопого альдегида к другой, т. е.
окислительно-восстановительная реакция происходит между двумя молекулами 3-фосфоглнце-
риионого альдегида. При этом одна молекула его превращается
в 3-фосфоглицерин, который, в свою очередь, под влиянием
фермента фосфатазы превращается в глицерин. Другая молекула
альдегида окисляется в 3-фосфоглицериновую, а затем и в пнро-
вппоградную кислоту. Эта форма превращений называется глице-
рппировинпградным брожением. Такое отклонение от основного
процесса некоторые авторы объясняют угнетающим действием
высокой концентрации Сахаров па активность алкогольдегидрогена-
зы. Эго можно объяснить и недостаточным количеством уксусного
алыегща, необходимого для индукции процесса биосинтеза
фермента алкогольдегнлрогепазы.
После накопления определенного количества уксусного альде
i н:п начинается пормалыюе'спнртовое брожение
(стационарный период). В ннтукцноннмп период накапливается опргде-
1Г-г
ленное количество глицерина. Химизм этого процесса можно прел
ставить следующей упрощенной схемой:
Глниеропнровииоградное брожение
Глюкоза
3-®-глицериновый 3-®-глицерннивый
альдегид альдегид
—НАД'Н2 -
НАД —
1,3-®-глнцери новая
кислота
'Пнровнноградная
кислота'
-НАД
Глицерин
Если в процессе спиртового брожения воспрепятствовать
восстановлению уксусного альдегида, например связывая его
гидросульфитом натрия, то окислительно-восстановительная реакция
будет происходить только между двумя молекулами 3-фосфоглпис
ринового альдегида с образованием глицерина и продукта
взаимодействия уксусного альдегида с гидросульфитом натрия — альде-
гидсульфнтного соединения CH3CHOH-S03Na. Этот процесс лежт
в основе микробиологического получения глицерина. Процесс
брожения, направленный в сторону образования глицерина в
присутствии гидросульфита натрия, называется глицериновым брожение.и
Его химизм может быть представлен схемой:
Глицериновое брожение
Глюкоза
3-®" глицериновый 3-®"Глнцер1шовий
альдегид- альдегид
НАД-
-НАЛ-Hj-
1,3-®-глицериновая
кислота
*
Пнровнноградная
кислота
| -СО,
Уксусный
альдегид
Гидросульфит
Альдегид-
сульфнт1юе
соединение
н
-►НАД
Глицерин
23 •
179
Для связывания уксусного альдегида вместо гидросульфита
натрии, образующего нерастворимые соли, можно применять
сульфит аммония, что облегчает очистку глицерина от примесей. Этот
способ широко применялся для производства глицерина во время
и юрой мировой воины в сняли с ограниченным количеством
жирового сырья для этой цели. Впоследствии были предложены
варианты технологии производства глицерина с помошыо мнкроор-
laiiiiflMoB, причем доказано, что возбудителями брожения могут
быть не только спиртовые дрожжи, по и некоторые бактерии.
Процесс разложения глюкозы, сопровождающийся окислитель-
ио-воссгаповителыюй реакцией между двумя молекулами
глицеринового альдегида, называется второй формой брожения Ней-
бсрга.
Некоторые ученые считают, что
окислительно-восстановительное взаимодействие между двумя молекулами глицеринового
альдегида может происходить с тем же результатом и без участия
дегндрогеназы (реакция днемутации, или реакция Канниццаро).
Процесс брожения обычно протекает в кислой среде. При
изменении реакции среды на щелочную интенсивность окислительно-
восстановительной реакции между молекулами З-фосфоглииерино-
ного и уксусного альдегидов снижается. При высоких значениях
рП, т. е. в щелочной среде, уксусный альдегид дегидрогеназой
вообще не восстанавливается. При этом акцептором водорода
восстановленной дегндрогеназы снова становится 3-фосфоглицерино-
вый альдегид, т. е. наблюдается почти то же, что и при глицеро-
ппровнноградном брожении, с тем лишь различием, что в данном
случае молекулы уксусного альдегида взаимно связываются
(реакция днемутации), а восстановленная дегидрогеиаза направляет
водород на восстановление глицеринового альдегида. Образуются
уксусная кислота, этиловый спирт и глицерин. Химизм брожения
в щелочной среде, называемый третьей формой брожения Нейбер-
га, можно представить схемой:
Спиртовое брожение в щелочной среде
Глюкоза
3-©-глнисриновый Зт,©-глицериновый
альдегид альдегид
НАД ^ -НА Д- Н, -f *-НА Д
1,3-(£)-глицсриновзя Глицерин
кислота'
Пировмиогралиая
кислота
Уксусный Уксусный
■ альдегнц альтегит
Уксусная ЭтилппиП
КИСЛИ! Л C'MlpT
]:.0
Не существует единого мнения о том, как происходит
окислительно-восстановительная реакция между двумя молекулами
уксусного альдегида: с участием дегидрогеназы или химическим
путем. Однако, судя по тому, что щелочная среда препятствуй
восстановлению уксусного альдегида алкогольдегидрогеназой, фер
ментативное взаимодействие между молекулами уксусного аль
дегнда менее вероятно.
Как видно из приведенных схем, в химизме всех форм
брожения нет принципиальных различий: во всех случаях причиной от
клонения от основного процесса образования спирта является
отсутствие возможности передачи водорода дегидрогеназы
уксусному альдегиду. Различие состоит лишь в форме блокирования
уксусного альдегида: в первом случае (в индукционный период
брожения) уксусный альдегид вообще отсутствует, во втором
(стационарный период) — связывается гидросульфитом натрия, в
третьем — молекулы уксусного альдегида взаимосвязываются. Во всех
случаях вместо этилового спирта образуется эквивалентное коли
чество глицерина, и, несмотря на различные причины, источник
образования глицерина при этом остается одним и тем же.
В производстве спирта количество образующегося глицерина
колеблется в зависимости от вида используемого сырья и
технологического режима. При сбраживании мелассы, например, его
количество может достигать 6,0 г/л. На образование глицерина
расходуется более 2,5 % сахарозы. В процессе приготовления
вина глицерина накапливается до 4,0 г/л. Его присутствие
способствует умягчению вкуса вина. Менее интенсивно глицерин
накапливается в пиве— 1,5—2,0 г/л.
Среди многочисленных продуктов, образующихся в процессе
спиртового брожения, выявлены различные органические кислоты,
альдегиды, кетоны, сложные эфнры, спирты. Из эгих продуктов
образуются другие, например 2,3-бутнленгликоль, ацетопп, диаце-
тил, бутандиол и т. д.
Органические кислоты, содержащиеся в продуктах
брожения, могут быть самого различного происхождения. Они
образуются в результате вторичных н побочных процессов, а в вино
попадают в большом количестве из сырья. Во всех процессах
брожения органические кислоты играют положительную рол!
как антисептики. В виноделии они, кроме того, необходимы для
повышения стойкости вина вследствие их способности
связывать ионы железа и .других коагулянтов. Однако повышенное
содержание органических кислот в вине создает резкость его
вкуса.
Кроме уксусной кислоты в процессе брожения образуются
другие летучие кислоты — муравьиная, пропноповая, масляная.
В спиртовом производстве наличие кислот в готовом продукте
нежелательно. Некоторые нз них, например маслячля,
отрицательно влияют на жизнедеятельность дрожжей. В готовом продукте
органических кислот должно быть не более 1 г/л.
2« - 2.1702
181
В процессе производства пива накапливается до 150 мг/л
летучих кислот в пересчете на уксусную и до 300 мг/л нелетучих кислот.
Наибольшее количество органических кислот содержится
в вине: летучих— 1,20—1,75, нелетучих (ди- и трнкарбоновых) —
до 1,5, молочной — до 5,0 г/л.
Следует отметить, что в бродильных производствах имеет место
не только анаэробный процесс, т. е. спиртовое брожение.
Значительный период жизнедеятельности дрожжей протекает в
присутствии кислорода. Кроме гого, во всех производствах
одновременно с дрожжами в производственной среде развиваются
посторонние микроорганизмы. Следовательно, продукты обмена образуются
всеми известными способами, независимо от специфики
спиртового брожения. В качестве примера можно привести молочную
кислоту. Во всех бродильных производствах развитие дрожжей
сопровождается ростом молочнокислых бактерий. Это основная
причина накопления большого количества молочной кислоты во
всех продуктах брожения. Главная стадия химизма образования
молочной кислоты — восстановление пировиноградной кислоты.
Можно предположить, что такой путь образования молочной
кислоты возможен и в процессе жизнедеятельности дрожжей. Есть
также предположения, что молочная кислота может
образовываться из фосфоглицерннового альлегнла:
СОН
i
СНОН *н20
I
CHj-O-®
Пути образования ди- и трнкарбоновых кислот связаны с их
способностью к взаимопревращениям. Наиболее вероятно их
образование во время размножения дрожжей в присутствии
кислорода, т. е. при аэробном окислении углеводов. Отдельные звенья
цикла аэробного окисления могут иметь место и в анаэробных
условиях. Источником дн- и трнкарбоновых кислот являются также
аминокислоты, содержащиеся в сырье. В процессе спиртового
брожения возникают и дополнительные пути образования
органических кислот, связанные с наличием уксусного альдегида. Так,
янтарная кислота может образовываться в результате конденсации
уксусного альдегида с уксусной кислотой, а также двух молекул
уксусной кислоты:
2СН.СООН СН.СООН
+ - | +СН8СН,ОН;
сн„сон сн2соон
-2Н» СН.СООН
СН.СООН + СН.СООН—»- |
СН.СООН.
В связи с этим между количествами уксусной и янтарной
кнелпт существует определенное соотношение. Оно изменяется
н ходе брожения, смещаясь п конце процесса в сторону увели
чення концентрации яитариоГ: кислоты. Соотношение между ко
СООН
I
— скон
I
СН3
чг
личествами этих кислот зависит также от штамма дрожжей.
В виноделии различают ацетогенные, янтарогенные и
нейтральные штаммы.
Источником янтарной кислоты является глутаминовая
кислота. Вначале происходит переаминирование с пнровиноградной
кислотой и образование а-кегоглутаровой кислоты, которая затем
декарбоксилнруется в янтарный альдегид:
НООССНаСНаСНСООН + CHjCOCOOH -* HOOCCHJCHaCOCOO Н -f
NH,
-f CH,CHCOOH;
I
NHa
—CO»
HOOCCH2CH2COCOOH —* HOOCCHjCHjCOH.
Янтарный альдегид может вступать в реакцию дисмутации
с уксусным альдегидом с образованием янтарной кислоты и
этилового спирта:
НООССН,СН,СОН
-»-2Н* ■
ноосснаснасоон сн„сн,он.
Янтарная кислота служит источником образования фумаровой,
яблочной и винной кислот.
В химизме спиртового брожения имеется специфический путь
образования лимонной кислоты, связанный с наличием уксусного
альдегида и его способностью к реакциям дисмутации:
СНаСООН
9CHsCOH-*COHCOOH-f 5CHsCHaOH.
снасоон
В процессе спиртового брожения различными путями образу
ются альдегиды — уксусный, пропионовый, изовалерьяновый, фу
рановый и кетоны — ацетон, ацетоин, диацетил. Встречаются
непредельные альдегиды — кротоновый альдегид, акролеин.
Уксусный альдегид является продуктом основного
метаболизма углеводов и накапливается в наибольшем количестве. В
спиртовом производстве концентрация уксусного альдегида в бражке
составляет 100—400, в пиве — до 20, в вине — до 200 мг/л. Кетоны
накапливаются в процессе виноделия в количестве от 1 до 30 мг/л,
в том числе ацетоина до 3, диацетила — до 5 мг/л. Все эти
вещества участвуют в создании букета вина. Высшие альдегиды
определяют тон токайских вин, фурфурол придает «меланжевый» тон.
Присутствие уксусного альдегида в некоторых винах
нежелательно, поскольку придает им резкий вкус н аромат. В некоторых
винах, наоборот, его присутствие необходимо, например в
формировании букета хереса, мадеры.
183
Небольшое количество кетонов содержится в пиве: 0,4—1,6 мг/л
диацетпла, 0,56—2,24 мг/л ацетоина. Повышенное содержание
чиацетила придает продукту медовый привкус и запах.
Альдегиды и к е т о н ы могут иметь самое различное
происхождение. Они образуются в результате декарбоксилирова-
ипя кетокпслот. Так, уксусный альдегид возникает в результате
чсчарбокснлировапня пнровиноградной кислоты. Аналогично обра-
з\ется альдегид янтарной кислоты из а-кетоглутаровой:
-со. ,0
1IOOC—CI 1а-СН,-С-СООН —► HOOC-CH.-CH,—Of .
II ХН
о
В результате переаминирования аминокислот образуются
кетокпслот ы, при декарбоксплироваини которых также возникают
альте i иды:
О
II
/?-СН—СООН -f R—С—СООН -> К—С—СООН -f R—СН-СООН.
I II I
NH, О NH,
о"
.1
Я-С-Н
II
о
Анетон образуется нз фосфодноксиацетона. Известны и другие
нут образования альдегидов п кетонов.
Хорошо изучен химизм образования 2,3 бутандиола (бутилен-
1Лнколя), ацетоина, диацегила. Пути биосинтеза этих продуктов
взаимосвязаны. Пнровиноградпая кислота конденсируется с аце-
тнл-КоА, образуя ацетомолочную кислоту, которая декарбоксили-
руется в аиетоии. Последний может восстанавливаться в 2,3-бутан-
диол или окисляться в диацетил:
О
II О СН, О
СНяс-СООН || | _COt ||
+ ■ -* СН.С—С—СООН —ril_^CHsC—CH-CHj-*
CHjC ~ Koa | |
|| ОН ОН
Q Ацетомолочная кислота Ацетоин
О О
-2Н* И II
► СНд—С—С—СН„
Днацетил
+2Н»
»- СН3-СН—СН—СН,.
I I
он он
2.3-Бутанднол
Источником образования 2,3-бутандиола может быть также
янтарная кислота.
IP»
Сложные эфиры имеют большое значение в формировании
аромата продуктов. Ввиду низкой концентрации органических
кислот и спиртов в продуктах брожения реакция этерпфикации
осуществляется трудно. Эфиры образуются в конце брожения,
когда в среде накапливается значительное количество кислот и
спиртов. Однако доказано, что эфиры образуются и в началь
ной стации брожения непосредственно из альдегидов. Так, из
уксусного альдегида образуется уксусно-этнловый эфир (эти-
л ацетат):
О О О
II II II
СНз-С-Н + CHj-C-H -* СНя-С-0-СН,-СН,.
Этот эфир имеет наибольшее значение в формировании
аромата и вкуса продуктов бродильных производств, ио большое его
количеств нежелательно. В пиве содержится около 70 мг/л эфи-
ров, в том числе более 30 мг/л этилацетата. В вине содержится
около 400 мг/л эфнроп, большая часть их представлена этилацета
том. В вине накапливаются также эфиры этилового спирта с
высшими жирными кислотами (нх называют «энантовым эфиром»),
эфиры яблочной, янтарной и винной кислот (до 200 мг/л).
Наиболее характерными продуктами, образующимися в
результате протекания побочных процессов, являются высшие спирты
(сивушные масла). Источником образования высших спиртов
шляются аминокислоты Химизм этого процесса заключается
ч том, что вначале происходит перенос аммиака на кетокнслоту
(чаще всего на пировпногралпую), причем аминокислота
подвергается окислительному дезамиинрованпю с образованием
соответствующей кстокислоты. Последняя декарбоксилируется с
образованием альдегида. Затем альдегид восстанавливается в
соответствующий спирт. Пблыпую часть высших спиртов составляют
нзоамиловыс спирты, источником образования которых являются
аминокислоты группы лейцина, например:
(СН,)2СНСН2СНСООН + СН3СОСООН -+ (CHJ.CHCHjCOCOOH +
NII2
+ CH3CHC001I;
I
NUj
-CO, +4H»
(СИ:1).2СНСП,СОСоОН (CH3)2CIICH,COII ► (П1г)аСНСНаСН,ОН.
Аналогично о"раз\ются и другие высшие спирты: из валнна —
изобутпловый спирт, из тирозина —тирозол.
Высшие спирты могут образовываться не только из
аминокислот, по и ц результате протекания вторичных процессов, т. е.
в |>1чульта[е дальнейших превращений продуктов сбраживания
у.к'но.шв. Так, ппровип'л рзчная кислота может конденсироваться
с аш-тнл-КоЛ с образованием ацетомолочной кислоты. Последняя,
186
претерпевая ряд превращений, образует изобутнловый спирт. При
конденсации а-кетоизовалерьяновой кислоты с ацетил-КоА
образуется а-кетоизокапроновая кислота, которая декарбоксилнрова-
ннем и восстановлением превращается в изоамиловый спирт.
Конденсация ацетил-КоА с а-кетомасляной кислотой приводит к
образованию н-бутилового спирта. При этом, как и в случае
превращения аминокислот, предшественниками высших спиртов
являются соответствующие а-кетокислоты. Таким образом, поб.очные и
вторичные процессы также связаны между собой и в отношении
образования высших спиртов. Доказано, что добавление в среду
аминокислот приводит к образованию высших спиртов. Это
объясняется тем, что высшие спирты являются промежуточными
продуктами биосинтеза аминокислот. Избыток аминокислот в среде
подавляет их синтез, и процесс прекращается на стадии
образования высших спиртов.
Процесс образования высших спиртов, с одной стороны, связан
с процессами биосинтеза, с другой — с процессами разложения
углеводов.
Несмотря на многообразие путей образования высших
спиртов, этот процесс зависит от интенсивности накопления биомассы,
что дает возможность предвидеть и регулировать накопление
сивушных масел.
Из сказанного легко понять, что центральными
промежуточными продуктами образования высших спиртов являются кето-
кислоты. Они образуются разнообразными путями: вследствие
гликолиза н других превращений углеводов, конденсации продуктов
метаболизма с участием ацетил-КоА, переаминироваиия
аминокислот и т. д. Дальнейшие превращения кетокнслот происходят по
единому механизму: декарбоксилирование и последующее восста
новление образующихся альдегидов. В общем виде это можно
представить схемой:
Органические вещества
I
я_со—соон
\. -.—2Н+
R—СНа—ОН
Аналогично идет образование этилового спирта от стадии
превращения пировипоградпой кислоты, которая также является кето-
кислотой, т. е. химизм образования всех спиртов от стадии
превращения кетокнслот один и тот же. Следовательно, спиртовым
брожением можно с одинаковым правом называть процесс
образования любого спирта. Образование этилового спирта так же неверно
называть спиртовым брожением, как молочнокислое или масляно-
кислое — кислотным.
В ряде продуктов бродильных производств важное значение
имеет образующийся углекислый газ. Он находится в напитках в
J 86
растворенном и связанном состояниях. Более важную роль играет
связанный углекислый газ, способный удерживаться в готовом
продукте. Углекислый газ может реагировать со свободными
аминогруппами аминокислот и белков:
R—СН—СООН + СО, -► R—СН—СООН
I I
NH, HN-COOH.
При взаимодействии углекислого газа с водой образуется
угольная кислота, которая находится в растворе в виде биполярных
ионов:
Они способны взаимодействовать с заряженными частицами
белковых молекул. При малых значениях рН вследствие уменьшения
степени диссоциации карбоксильных групп молекулы белка
приобретают положительный заряд и адсорбируют отрицательно
заряженные карбоксильные группы угольной кислоты. Чем больше п
растворе углекислого газа, тем сильнее уменьшается рН и тем больше
насыщается напиток углекислым газом. Кроме того, углекислый
газ образует эфиры со спиртовыми группами различных веществ.
Поскольку угольная кислота является двухосновной, образуются
эфнры двух видов — полные и неполные:
/0R
о=С/°Н + /?ОН Г°~Счон
ХОН+2/?ОП 1_0==с/0/?
Х0/?
В реакцию этерификации с угольной кислотой могут пстунать
этиловый и метиловый спирты, глюкоза, сахароза и другие
вещества. При снятии давления в сосуде, в котором содержится
напиток, очень быстро выделяется растворенный углекислый газ.
Химически связанный углекислый газ выделяется медленно, и напиток
длительное время пребывает в гостояини насыщения. Это является
одним из основных качеств пива, шампанского и других
газированных напитков.
Соотношение количеств различных продуктов, образующихся в
процессе спиртового брожения в условиях производства, зависит от
многих факторов. Во время приготовления засевных дрожжей
производится интенсивная их аэрация, что сильно влияет па состав
продуктов. В результате аэрации может уменьшаться количество
образующегося глицерина и увеличиваться накопление альдегидов,
кислот, высших спиртов. Вследствие этого увеличивается
содержание эфиров. С повышением кислотности уменьшается
содержание этилового спирта и снижается интенсивность образования
эфиров и глицерина, а количество альдегидов, органических кислот
и высших спиртов, наоборот, увеличивается. Прн повышении
температуры зозрастает скорость образования эфиров н уменьшается
количество органических кислот. Таким образом, эффективное регу-
157
лирование технологического процесса возможно лишь при глубоком
знании химизма происходящих процессов и их зависимости от
физико-химических условий.
ПРОПИОНОВОКИСЛОЕ БРОЖЕНИ1
Пропионовокислое брожение также является анаэробным, хотя
пропиоповые бактерии могут развиваться и в аэробных условиях.
Пропионовокислое брожение используется в производстве сыра,
где оно происходит после молочнокислого брожения. Пропионово-
кнслые бактерии применяются для производства витамина Bij.
однако главной целью этого производства является накопление
биомассы этих микроорганизмов, в которой содержится указанный
витамин, поэтому не совсем правильно говорить о том, что такое
производство основано на применении процесса пропионовокислого
брожения.
Относительно химизма образования пропионовой кислоты среди
ученых нет единого мнения. Учитывая данные о том, что
промежуточными продуктами превращения углеводов пропионовыми
бактериями являются дикарбоиовые кислоты цикла Кребса, а также
сведения о возможности карбоксилирования пировиноградной
кислоты этими бактериями, химизм этого процесса можно представить
схемой:
Пропионовокислое брожение глюкозы
Глюкоза
АТФ Н
АТФ -\
'1 'А-®- глицериновый альдегид
2 НАД -| 2 ПЛД-Н2
2 1,3-®-1'Л11цер11иовая кислота
I 2 АТФ
| — 2 А IФ
2 Пировиноградная кислота
2 С02 -|
2 Щавелевоуксусиая кислота
1 I '
2 Яблочная кислота
|—2Н2()
2 Фумаровая кислота
2ФАД — —J-» -.'ФЛЛ-М^
2 Янтарная кислота
1—2 СО,
'J П|>о||||(1ш>«.1И к пени а
1-3
Бала но АТФ
Синтез + 4АТФ
Расход — 2 АТФ
Выход 2 АТФ
Баланс НАД • Н,
Синтез + 2 НАД. Н„
Расход —2 НАД-П2,2ФАД-Н,
Дефицит 2 ФЛД-Н,
Процесс образования npoinioiiOBoii кислоты по такой схеме даст
обычный выход энергии, характерный для всех типов брожения: две
молекулы АТФ. Однако восстановленных дегидрогепаз от этого
процесса клетка не получает. Наоборот, молекул восстановленных
дегидрогепаз, образующихся при разложении глюкозы, хватает
лишь на однократное восстановление промежуточных продуктов
превращения ппровшюградион кислоты в пропиоповую. Для
полного осуществления схемы образования проиноновой кислоты
требуется еше две молекулы восстановленных дегидрогепаз, которые
клетка должна получить иными путями.
Пропионовокнслые бактерии могут существовать за счет
потребления молочной кислоты, при этом молочная кислота превращается
в пировнпоградпую. Дальнейшие превращения те же, что п при
сбраживании глюкозы. При этом наблюдается дефицит
восстановленных дегидрогепаз, т. е. молекулы дегпдрогепазы, получаемые
клеткой другими путями, расходуются на образование проппоповий
кислоты. Таким образом, процессы превращения глюкозы н
молочной кислоты в нронноповую мало выгодны и происходят, вероятно,
сопряженно с другими процессами. Имеющиеся сведения о
смешанном характере нропноповокислого брожения позволяют
предполагать, что процесс образования пропшпювой кислоты идет
параллельно с преврашеписм глюкозы или молочной кислоты п другие
продукты, например в уксусную кислоту. Если брожению
подвергается молочная кислота, то превращение ее при смешанном
брожении можно представить схемой:
Смешанное пропионовокислое брожение молочной кислоты
Молочная кислота
НДД-
Молочная кчелота
-Н.\Д.Н2-
Пнровннограднаи кислота
КоЛ-
11АД-
- НАД
Н.,0
Пропноиовая кислота
■НЛД.И2
Ацетнл-КиД
ИаО
Укосная кислота
•КоА
1W
Баланс НАД- Н,
Синтез + 2 НАД-Н,
Расход— I НАД-На
Выход 1 НАД-Н,
Процесс начинается с окислительно-восстановительной реакции
между двумя молекулами молочной кислоты, что приводит к
одновременному образованию молекул пропионовой и уксусной кислот
и позволяет получить дополнительно молекулу восстановленной
дегпдрогепазы, необходимой для конструктивных потребностей,
а также получить конструктивный материал в виде пировиноград-
иоii кислоты и ацетил-КоА. Однако в этой схеме нет источников
ЛТФ, поэтому микроорганизмы могут использовать ее лишь для
конструктивных целен. Если же процесс пропионовокислого
брожения начинается с молекулы глюкозы, то такой химизм
удовлетворяет потребное in клегкп и и ЛТФ, и в восстановленных дегидроге-
пазах:
Смешанное нроппоновокислое брожение глюкозы
Глюкоза
►♦
-МАА
Т
ЛТФ
Л1Ф -\
2 3-®-1Л11це||||М1>вь1Н
альдегид
-2 НАД -| 2НАД-1^-
2 1.1-(£)-1лицер|111оиан
кислота
* 2 АТФ
| ~2АТФ
1 jbio.iHiipmtniioi радиан
Kiic.ioia
Ннропшюградпан Пирошннл ралым
кислота кислота
НАД—-\ -ПЛ'1-М,- -г—-НАД
КоА
IMIL.IUIH
Ацетил-КоА
-ll-f).
Молочная
кислота
-Ко Л
Уксуснан
кислота
1~
-НАД
i
Прошюноиаи
кислота
r\J
—-нлл-и,—
НАД-Н»
Баланс НАД-II,,
Сшпсз -+- > НАД-II,
Расход— НАД -Н4
Йылод 1 ПЛДП,
\90
МАСЛЯНОКИСЛОЕ И АЦЕТОНОБУТИЛОВОЕ БРОЖЕНИЕ
Маслянокнслое брожение используется в небольших масштабах
для получения масляной кислоты, имеет место в процессе мочки
льна, встречается на некоторых производствах как побочное
нежелательное явление. Ацетонобутнловое брожение широко
применяется на практике для производства органических растворителей—
ацетона, бутанола. По химизму оно является вариантом
маслянокислого брожения, при котором из предшественников масляной
кислоты образуются ацетон и бутапол. Поэтому возбудители
маслянокислого и ацетопобутилового брожений — близкие но многим
свойствам микроорганизмы.
Наилучшим для этих производств является зерновое крахмал-
содержащее сырье — мука. В настоящее время значительная часть
муки заменяется более дешевым сырьем — мелассой.
Процесс приготовления среды включает разваривание крахмал-
содержащего сырья. Сырье не осахаривают, поскольку возбудители
этих брожений обладают высокой амилолитическоп активностью.
Приготовленный затор, состоящий нз смеси мелассы с мукой,
стерилизуют.
Этот этап, как указывалось выше, отсутствует в других
бродильных производствах. Объясняется это тем, что ацетонобутиловые и
маслянокнслые бактерии не способны конкурировать с другими
микроорганизмами, как молочнокислые бактерии н дрожжи, вернее
они не могут нормально развиваться в снльнокнслой среде, которая
создается в других производствах (естественно или искусственно)
и предотвращает развитие посторонних микроорганизмов.
Под влиянием термической обработки в процессе разваривания
и дальнейшей стерилизации происходят изменения органических
веществ, аналогичные описанным в предыдущих разделах.
Представители групп аиетонобутиловых и масляпокнслых
бактерий обладают хорошими ферментативными способностями но
отношению к углеводам. Они сбраживают простые углеводы,
большинство олигосахаридов и крахмалоподобные вещества. К этим
микроорганизмам по физиологическим свойствам близки
возбудители маслянокислого брожения пектиновых веществ, используемые
в процессе мочки льна. Наконец, некоторые бактерии вызывают
анаэробное разложение клетчатки, которое по химизму также
является маслянокнслым брожением. Па основании общности химизма
процессов, вызываемых перечисленными микроорганизмами,
последние могут быть объединены в физиологическую группу
масляпокнслых бактерий. По современной классификации они относятся
к одному и тому же роду микроорганизмов. Видовая же
принадлежность их определена природой субстрата, на который они действуют
(пектннразлагающие, анаэробные целлюлозные), или
преобладающими продуктами брожения (маслянокнслые, ацетонпбутиловые).
Общпос1ь этих микроорганизмов и процессов, которые они
осуществляют, подтверждается еще и тем, что соотношение продуктов
брожения зависит пе только от вптовоп прниаа-тежпостн микроор-
1'Л
ганизмов, но и от условий, в которых происходит брожение. Так,
например, под влиянием ацетонобутиловых бактерий может
происходить и маслянокислое, н ацетопобутиловое брожение. Если
процесс ведется в нейтральной среде (в присутствии мела), то основным
продуктом брожения будет масляная кислота, а бутанол
накапливается в небольшом количестве. Характер брожения резко
изменяется, если брожение ведется в кислой среде. В этих условиях
происходит торможение процесса образования масляной кислоты,
в результате чего в качестве основного продукта накапливается
бутанол. Более того, если в среду добавлять масляную кислоту,
интенсивность образования бутанола возрастает.
В процессе сбраживания углеводов маслянокислыми бактериями
образуется смесь разнообразных продуктов: кислот (масляной,
уксусной, молочной), спиртов (бутанола, этанола, изопропанола),
газов (водорода, углекислого газа). Это свидетельствуете
многообразии путей метаболизма этих бактерий. В то же время масляно-
кислые бактерии способны потреблять ие только углеводы, но и
кислоты, особенно молочную, различные спирты. Для
ацетонобутиловых бактерий характерно потребление белковых веществ, которые
служат источниками азота. Состав продуктов ацетопобутнлового
брожения зависит еще и от соотношения растворимых и
нерастворимых форм азотистых веществ. Наличие нерастворимых форм
азота ведет к преимущественному образованию растворителей —
ацетона и бутанола, хотя для начала развития ацетонобутиловых
бактерий требуется наличие растворимых азотистых веществ—
аминокислот. Поэтому сырье, применяемое для ацетопобутнлового
производства, должно содержать белковые вещества или другие не-'
растворимые формы азота. Наилучшим сырьем в этом отношении
является кукуруза, содержащая мало растворимых форм азота и
одновременно являющаяся хорошим источником крахмала.
Маслянокнслые и особенно ацетонобутиловые бактерии
предъявляют высокие требования к наличию в среде ростовых веществ.
Они хорошо синтезируют лишь некоторые витамины. Так, в
продуктах ацетопобутнлового брожения накапливается значительное
количество рибофлавина, что может использоваться даже для
промышленного получения этого витамина. Ацетонобутиловые
бактерии не развиваются при отсутствии в среде биотипа и п-амннобен-
зойпой кислоты. Этн витамины необходимо добавлять в среду. Для
бактерий-возбудителей ацетопобутнлового брожения необходимо
также присутствие аспарагнна и других биологически активных
веществ.
Аммиачные соли, являющиеся универсальным источником азота
для многих микроорганизмов, не могут полностью удовлетворить
потребности ацетонобутиловых бактерии в азоте.
Химизм брожения. Рассматриваемый процесс, как и процесс
спиртового брожения, является разносторонним, поскольку наряду
с основным — масляпокнелым брожением — протекают вторичные
процессы, ведущие к образованию ацетона, бутанола,
изопропанола, уксусной кислоты (см. схемы). Если же основным процессом
192
является ацетонобутнловое брожение, при этом также образуются
перечисленные продукты. Пути их образования, очевидно, одни
и те же в обоих случаях. Различие же в химизме масляпокислого
и ацетопобутилового брожения начинается с момента образования
бутирнл-КоА:
Образование масляной кислоты
Глюкоза
2АТФ-
2НАД-
■2НАДП2-
• 4АТФ
2Пнровн1Юградная кислота
2КоА-
21 [АД
-2ИАДИ2-
2Ацетнл-КоА
-КоА
Ацетоацетил-КоА
-НАД-
•11АД.11»
. fi-Оксибутирил-КоА
I HjO
Кротоннл-КоА
НАД-
■НАДИа-
Бутирнл-КоА
н,о
КоА
Масляная кислота
Баланс АТФ
Синтез + 4 АТФ
Расход — 2 АТФ
Выход 2 АТФ
Баланс НАД-Н,
Синтез + 4 НАД • Н,
Расход— 2 НАД-Н,
Выход 2НАД-Н,
Последующие этапы образования бутанола в процессе анетоно-
бутилового брожения называются второй фазой, или фазой
восстановления масляной кислоты в бутанол. Однако, судя по химизму,
масляная кислота не является прямым предшественником бутанола.
Его образование начинается с восстановления бутирил-КоА,
который в других условиях превращается в масляную кислоту. Таким
25 _ 2-1102
103
Образование ацетона и язопропаюла
Глюкоза
2АТФ-
— 2НАД—
.2НАД.На-
-4АТФ
2Пировиноградная кислота
2КоА
■2НАД-
2Ацетил-КоА
-^КоА
Амтоацетнл-КоА
НаО
КоА
Ацетоуксусная кислота
COs
НАД
Ацетон
I
—2НАД.На^-
, ,НАДНа _j
Изопроланол
Балано НАД-Н, (для ацетона)
Снитеэ+4НАДНа
Расход О
Ьыход 4 НАД.Н,
образом, образование бутаиола можно рассматривать ие как фазу
восстановления масляной кислоты, а как изменение направления
процесса иа стадии превращения бутирнл-КоА.
Химизм образования вторичных продуктов тесно связан с основ-
иым процессом Как в случае маслянокислого, так и в случае ацето-
нобутилового брожения. Объединяющим звеном всех процессов
является ацетил-КоА.
Химизм образования любого из продуктов брожений в
отдельности дает один и тот же энергетический эффект — две молекулы
АТФ. В конструктивном отношении наиболее выгодно образование
ацетона. Он образуется декарбоксилированнем ацетоуксусной
кислоты, на что ие требуется затраты восстановленных дегидрогеназ.
Общее количество образующихся восстановленных дегидрогеназ
при этом составляет четыре молекулы. Такой же эффект получается
194
Образование бутанола
Глюкоза
2АТФ
211АД -
2КоА-
-2НАД-
-НАД-
-НАД-
-НАД-
НАД
•■2НАДН2-
- 4АТФ
2Пнровиноград|1ая кислота
-2ЦЛД.Н*
2Ацетил-КоА
-КоА
Ацетоацетил-КоА
НАД. l^-
ft -Оксибутирил-Ко А
П.О
Крогонил-КоА
-ПА'1 II
Бутирнл-КоА
-ИЛД И2-
-КоА
Масляный альдегид
— МАЛ II,
и-Бутанол
Баланс НАД • На
Синтез +4 НАД-На
Расход — 4 НАДНа
Выход О
при образовании вторичного продукта — уксусной кислоты.
Наименее целесообразным в отношении восстановленных дегидрогеназ
является образование бутанола и этанола. В процессе образования
масляной кислоты появляется возможность обеспечения клетки
энергией и восстановленными дегидрогеназамн.
198
Образование уксусной кислоты и втанола
Глюкоза
2АТФ-
■ 2НАЛ-
2КоА-
-2НАЛ-
-2НАЛ-
-2НАД-
■ 2НАД.Н,
-4АТФ
2Пнровнногр дпая кислота
-2НАД.На-»
2Ацетил-КоА_
2НАД.На—
Ц2КоА
2УксусныП альдегид
-2НАЛ.Н,
2HJO
( \__L__». 2Уксусная
J кислота
2КоА
2 Этанол
Бала но НАД ■ На
Синтез -f 4 НАД- Н,
Расход — 4 НАДН,
Выход О
Анализ химизма аиетонобутилового и маслянокислого брожения
в энергетическом и конструктивном отношении позволяет понять
значение этих процессов для жизнедеятельности микроорганизмов.
Процессы образования основных продуктов аиетонобутилового
брожения— ацетона и бутанола — являются взаимодополняющими в
отношении обеспечения клетки энергетическим и конструктивным
материалом. Процесс образования бутанола не обеспечивает клетку
восстановленными дегидрогеназамн и, следовательно, ие играет
существенной роли в конструктивном обмене. Этот процесс
используется с энергетической целью. Источником восстановленных де-
гндрогеназ, необходимых для синтеза различных вешеств, является
процесс образования ацетона. Последний одновременно является
н источником АТФ, однако соотношение количеств АТФ и
восстановленных дегидрогеназ при этом, очевидно, недостаточно для
полного удовлетворения потребностей микроорганизмов и они исполь-
эуют процесс образования бутанола как дополнительный источник
энергии.
Процессы образования вторичных продуктов — уксусной
кислоты, этанола и других — используются как вспомогательные
источники АТФ и НАДН2, однако роль их в этом отношении невелика,
поскольку при ацетонобутиловом и маслянокислом брожении эти
продукты накапливаются в небольших количествах.
КС
МЕТАНОВОЕ БРОЖЕНИЕ
До сих пор мы рассматривали узкоспециализированные онохн
мическне процессы, используемые для получения какою-либо одно
го основного продукта метаболизма. В микробиологической
промышленности нередко встречаются случаи, когда один и тот же
процесс используется для различных целей. К таким процессам
относится метановое брожение. С давних нор оно применяется для
получения горючего газа — метана. Это часто сочеталось с
получением органических удобрений. Метановое брожение применяется
для очистки сточных вод, где оно одновременно может быть
использовано для получения метана. В последнее время процесс метано
вого брожения применяется для производства кормового
концентрата витамина В|2.
Процесс метанового брожения — это один из немногих микро
биологических процессов, для которого не требуется специфическая
среда. Метановому брожению подвергаются практически все веще
ства, хотя и с различной интенсивностью. Только нерастворимы*
органические соединения, например жиры, натуральная клетчатка
(древесина), медленно сбраживаются метанобразующнмп
бактериями. Метановое брожение осуществляется всюду, где есть остат
кн веществ растительного или животного происхождения. Непри
хотлнвость метапобразующнх бактерий позволяет применять для
осуществления метанового брожения дешевые отходы различных
производств. Так, при очистке сточных вод средой для метанового
брожения служит осадок или избыточный активный ил,
образующийся в аэротенках. Сбраживаемым субстратом при этом являют
ся белки, аминокислоты и другие органические вешеова. Разрабо
таны рекомендации для использования пронесем ме^нового броже
ния с целью предварительного снижения концентрации органиче
ских веществ в сточных водах. С большим эффектом эю можно
осуществить при обработке отходов мясной промышленности, i,i.e
источником питания возбудителей метанового брожения ян.шотся
белкн н аминокислоты. Метановому брожению с целью очисти
лучше всего подвергать сточные воды, содержащие белковые
вещества, аминокислоты, минимальное количество жира и других
трудносбраживаемых веществ. Чем меньше общее количество орга
нических веществ, тем легче достигается высокая степень очистки
Если же отходы мясной промышленности используются для пронз
водства какого-либо продукта — витамина В|2, метана или микроб
ной биомассы, то наиболее целесообразно применять копцептрпро
ванные сточные воды, образующиеся в результате варки мяса (мяс
ной бульон), или кровь.
Метановое брожение может быть использовано как прелварп
тельная стадия очистки сточных вод предприятий еппрювого, дрож
жевого, ацетопобугнлового, пивоваренного, молочного и 'ipyi их
пищевых производств. Однако сточные воды некоторых категорий
нельзя обрабатывать этим способом. К ним относятся сточные воды,
содержащие нефтепродукты, клетчатку, жир, углеводороды, лнг-
26 .- 2-1702
197
нин, фенолы и многие вещества, входящие в состав отходов
химической, нефтеперерабатывающей и других отраслей
промышленности.
Производство препаратов витамина В|2 ведется на отходах аце-
тонобутилового, мелассио-спиртового производств и отходах
производства кормовых дрожжей (вторичная барда). По химическому
составу эти среды, т. е. отходы перечисленных производств,
подобные. Это объясняется тем, что онн имеют общее происхождение,
поскольку основой сред, используемых для ацетонобутилового и
спиртового производств, служит меласса. В мелассно-спнртовом
производстве среда полностью готовится из мелассы, а в ацетонобутнло-
вом применяется смесь мелассы с мукой, причем меласса составляет
до 30 % всего количества сырья. Концентрация сухих веществ в
отходах ацетонобутилового производства (ацетонобутиловая барда)
составляет около 2,5%. В ней содержатся белки, аминокислоты,-
некоторое количество углеводов, а также органические кислоты,
спирты и другие продукты брожения. Концентрация сухих веществ
в мелассно-спиртовон барде выше, а именно 8—9 %. Объясняется
это большим различием начальных концентраций сред,
используемых для спиртового и ацетонобутилового производств. Из всего
количества сухих веществ мелассно-спнртовой барды до 2,5 %
составляют минеральные соли, около половины количества
органических веществ — органические кислоты, остальное —
редуцирующие вещества, бетаины, пнрролидонкарбоновая кислота,
аминокислоты, а также трудносбражнваемые карамели и меланон-
дины.
Концентрация сухих веществ во вторичной барде в среднем
составляет 4,5 %, среди них содержится до 1,5 % органических
веществ, представленных упомянутыми выше продуктами, но в ином
соотношении. Таким образом, основными питательными веществами
во всех средах, используемых для осуществления метанового
брожения, являются продукты белкового происхождения, органические
кислоты и некоторые другие вещества, которые в основном хорошо
усваиваются различными микроорганизмами в анаэробных
условиях.
Возбудителями процесса метанового брожения являются
смешанные культуры микроорганизмов, имеющие обобщенное
название— метанобризующие бактерии. Физиология их изучена не
полностью. Это связано с тем, что отдельные представители
микроорганизмов, выделенные нз смешанных культур, не вызывают
брожения. Вследствие этого трудно доказать, является ли выделенная
культура микроорганизма возбудителем процесса метанового
брожения нли она относится к сопутствующей микрофлоре. Тем не
менее известно несколько пи до в микроорганизмов, описанных в
литературе как метапобразуюшне бактерии, хотя в виде чистой
культуры большинство нз них не вызывает нормального процесса мега-
новою брожения
В отношении физиологии питания четанобразующих бактерии
имеются противоречивые лзннне. Некоторые учение считают, что
198
большинство видов этих микроорганизмов ведет полуавтогрофпт
существование, т. е. источниками их питания служат углекислый
газ, низшие жирные кислоты и минеральные азотистые соединения
Из низших жирных кислот имеется в виду прежде всего уксусная
кислота. Однако осуществить процесс метанового брожения на
средах такого состава под влиянием чистых культур не удается. Не
сбраживаются такие среды и смешанными культурами. Такое пред
ставление о пищевых потребностях метанобразующнх бактерий
сложилось на основании того, что углекислый газ и уксусная кислота
теоретически являются блнжаншнми предшественниками метана
Однако тенденция исследователей укладывать представление о фн
зиологии питания этих микроорганизмов в рамкн механизма обра
зовання метана, очевидно, неправильна. Эго приводит к отрннаншо
способности метанобразующнх бактерии потреблять углеводы, бел
новые и другие вещества и затрудняет объяснение их эпергешчь
ского обмена. Уксусная кислота и тем более углекислый raj в ana
эробных условиях не могут окисляться с образованием АТФ. Счи
тать, что процесс восстановления этих веществ в метан hbjIHcic»
источником энергии, как это делают некоторые исследователи,
неверно, поскольку эгот процесс, наоборот, возможен лишь при
сопряженном окислении органических соединении с высоким энергет
ческим потенциалом. Процесс образования метана можно рассмат
ривать лишь как результат акцептирования водорода, нередава
емого от окисляемых веществ, т. е. от источников
питания,'полноценных в энергетическом отношении. При отсутствии последних ни
уксусная кислота, ни тем более углекислый газ не могу г подвей
гаться метановому брожению. Некоторые виды известных метаноб
разующих бактерий используют в качестве источника питания спир
ты, что вполне удовлетворяет потребностям и в энергетическом итно
шенин. В литературе описано несколько видов гнилостных оаые
рий, являющихся возбудителями метанового брожения белковых
веществ. Эти вещества в наибольшей степени удовлетворяют
пищевым потребностям возбудителей такого процесса, как метановое
брожение. Белковые вещества обладают высоким энертичесьим
потенциалом, являются источником водорода, необходимого для
восстановительных реакций, а процесс пх разложения создает фи
зико-химическне условия, требующиеся для осуществления процес
са метанового брожения, т. е. высокое значение рН и низкий уро
вень окислительно-восстановительного потенциала. Все это иод
тверждается тем, что процессы гниения и метанового брожения
неразрывно связаны между собой в природе.
Химизм и особенности процесса метанового брожения. Одной 1ь
характерных особенностей процесса метанового брожения является
его ассоциативная микробиологическая природа. Оно происходи!
под влиянием смешанных культур микроорганизмов, состав которых
определяется составом среды и условиями культивирования.
Метановое брожение в некоторых отношениях напоминает анеюпобути
ловое» Оно также происходит в щелочной среде. Если эю ус-ювт.
не обеспечивается, процесс брожения смещается в сторону образо-
26-
lyj
пания кислот (происходит так называемое «кислотное» брожение).
При метановом брожении значение рН повышается естественным
путем в результате образования продуктов обмена, способствующих
повышению щелочности среды и снижению уровня окислительно-
восстановительного потенциала. Для создания таких условий, как
и в случае ацетонобутилового брожения, необходимо присутствие
белков и других органических азотсодержащих соединений. В
отличие ог ацетонобутилового брожения нейтрализация среды добав-
leiniCM мела существенно не влияет на смещение процесса
брожения в сторону образования метана. Как и в случае
ацетонобутилового брожения, при сбраживании естественных сред метанобразую-
[цнмн бактериями начальный период характеризуется образованием
кисло г, затем брожение постепенно переходит в метановое. Однако
двухфазиость процесса метанового брожения нельзя понимать как
обязательное образование кислот в течение всего периода
брожения с последующим восстановлением их в метан. Процесс брожения
идет по более экономичному пути, и направление процесса
изменяется на стадии образования какого-либо промежуточного продукта.
Подтверждением этого является тот факт, что уксусная кислота
(или ее соли) — основной продукт «кислотного» брожения — не
может подвергаться метановому брожению с такой интенсивностью,
как белки, аминокислоты и другие органические азотсодержащие
вещества. Именно поэтому процесс метанового брожения не может
быть использован па практике для очистки сточных вод от низших
жирных кисло г. В этом отношении также можно провести
аналогию с двухфазностыо ацетонобутилового брожения: масляная и дру-
[ие кислоты при этом брожении образуются только в начале
процесса. После юго как создадутся условия для образования
растворителей, масляная кислота уже не накапливается. Направление
процесса изменяется в сторону биосинтеза бутанола на стадии
образования промежуточного продукта — бутнрил-КоА, хотя при этом
не исключается возможность восстановления некоторого количества
масляной кислоты в бутанол.
Следующей особенностью процесса метанового брожения,
имеющей важное технологическое значение, является его строгая
зависимость от времени. Лимитирующим фактором процесса
образования метана, очевидно, является недостаточно высокая скорость
восстановления промежуточных продуктов (предшественников)
в метан по сравнению со скоростью других биохимических
процессов, предшествующих процессу образования метана. Требуется
определенное время для достижения состояния равновесия между
процессами окисления и восстановления. На производстве это время
устанавливается эмпирически по внешним признакам, по
соотношению количеств продуктов кислотного и щелочного брожения,
точнее, по значению рН, которое должно соответствовать стадии
образования метана. В условиях непрерывного технолошческого
процесса понятие времени заменяе1ся понятием скорости брожения
(скорое [.и протока среды) или количеством
сбраживаемого суРсгрит? (нагрузкой), приходящегося на единицу вме-
Ксо
стимости аппарата или единицу массы микроорганизмов.
Увеличение скорости протока среды или нагрузки приводит к
смещению процесса брожения в сторону образования кислот, т. е.
в сторону незавершенного разложения органических веществ
среды.
Скорость процесса метанового брожения значительно возрастает
с повышением температуры. Оптимальная температура брожения
находится в пределах 50—55"С. Ускорение процесса метанового
брожения путем повышения температуры используется в
промышленности, однако это требует определенных затрат на подогревание
среды.
В оптимальных условиях в процессе метанового брожения
органические вещества почти полностью превращаются п метан и
углекислый газ. Это одни из известных анаэробных процессов, который
по полноте разложения субстрата приближается к аэробному
процессу окисления. Однако даже в оптимальных условиях метановое
брожение сопровождается образованием определенного количества
низших жирных кислот—конечных продуктов брожения. Эго не
позволяет использовать процесс метанового брожения для полной
очистки сточных вод. Его рекомендуют применять лишь для ирод
варнтельного снижения загрязнений в высококопцентрпроваппых
отходах. Однако рассматривать процесс метанового брожения как
способ предварительного (неполного) снижения концентрации
органических веществ было бы значительным преуменьшением его
возможностей. Степень очистки сточных вод в результате метано
во го брожения весьма различна и зависит от химической природы
сбраживаемого субстрата. В большинстве случаев степень снижения
основного показателя очистки БПК (биохимической потребности
кислорода) составляет более 60 % но отношению к начальному, а в
некоторых случаях, например при сбраживании отходов
мясокомбината, достигает 95—98 % и более. В таких случаях процесс
метанового брожения следует рассматривать как основной процесс
очистки сточных вод, после которого требуется лишь доочпетка
аэробным способом.
Малая скорость процесса метанового брожения явилась
тормозом к широкому внедрению его в практику очистки
сточных вод.
Среди ученых нет единого мнения о путях образования мпа"■'.
Тенденция свести все возможные механизмы образования метана
к одному — неправильна. Разнообразие данных по этому вопросу
соответствует именно тому, что пути образования метана различны,
подобно образованию сероводорода или аммиака. Известно, что
отщепление--S1I- и — Nil2-rpynn так же, как и восстановление NOJj
и SOI?"-групп приводит к образованию одних п тех же продуктов —
аммиака и сероводорода. Метан также может образовываться как
из мет ильных i руин, так п п результате восстановления окисленных
соединений yi-терот.а.
Известные дачные о химизме образования метана отражены и
схеме:
ч<Л
Вероятные пути образования метана из углекислого газа
и других веществ
, т Формнатдегидрогеназа
СОг »- gfnj, — НСООН (связанная)
АТФ, ТГФК
НСО-ТГФК
2[Н]
ТГФК
Серии ; - СИЯ-ТГФКН-Глишти
2[Н]
АТФ
CHjOU 1 СоВ,2-фермент
СН3-Со^|2 ^
~Т
£1Га'-СООН-
-COs
;f CHs~CoBlz'-фермент
2[Н]
АТФ
С\14+ СоЬи-фермеит
Приведенная схема является общепризнанной в отношении
последовательности процессов редукции С02 и промежуточных мета-
болнюв. Однако пути получения активного водорода, необходимого
для репукции, не иены. Нет сомнения, что источником его являются
сбраживаемые вещества. Некоторые ученые считают, что окисление
веществ, i. е. мобилизацию водорода, осуществляют одни
микроорганизмы, а восстановление С02 в метан — другие, так называемые
истинные метанобразующие бактерии, которые не способны к
сбраживанию веществ. При этом водород, отщепляемый
гетеротрофными бактериями, переходит в свободную молекулярную форму, а
затем используется меганобразующнмп бактериями для
восстановления С02 в метай. Однако доказательств получить не удается,
вероятно, потому, что расщепление прочно связанного молекулярного
водороча в анаэробных условиях маловероятно.
Проанализировав результаты специальных исследовании и
данные опыта использования метанового брожения, можно
предположить, что метанобразующие бактерии извлекают активный водород,
непосредственно окисляя сбраживаемые вещества. В этом
отношении от\ являются литогетерспрофпымн микроорганизмами,
осуществляющими перенос водорода от окисляемых органических вешеств
к кислороду минеральных соединении. Поскольку С02 может
находиться в растворе в вн.те карбонат-попов СОз—, образование
метане по аналогии с редукцией сульфатов п нитратов можно
рассматривать как редукцию карбонатов.
£-02
В соответствии с высказанными предположениями процесс
восстановления карбонатов можно представить схемой:
Органические pL
вещества
ЗНаО
Процесс образования метана требует постоянного наличия ССу
Известно, что метан может образовываться практически нз всех
органических веществ. Значит, в процессе разложения любого
вещества должна быть стадия декарбоксилирования. Такая
возможность действительно предусмотрена в метаболизме многих веществ,
однако не всегда. Так, например при р-окнелении жирных кислот
это не происходит, если учесть, что цикл трикарбоновых кислот п
анаэробнь(х условиях отсутствует. Есть и другие примеры
анаэробного разложения веществ при отсутствии стадии
декарбоксилирования. Тем не менее этн вещества превращаются в метай.
Следовательно, в процессе разложения веществ при метановом брожении
происходит образование какого-то общего промежуточного
метаболита, дающего во всех случаях С02. В аэробных условиях, как
известно, все разнообразие путей разложения веществ сходится па
стадии промежуточных продуктов, ведущих в цикл трикарбоновых
кнелот. Главным из них является ацетил-КоА. В анаэробных
условиях, вероятно, используются те же механизмы разложения
веществ, которые сходятся на стадии ацетил-КоА. Последний, не имея
возможности вступить в цикл трикарбоновых кислот, превращается
в СН4 и С02:
CHjCO ~ S-KoA ——» СН4 + СО, + SH-KoA.
Из С02 образуются карбонаты, кислород которых служит
акцептором водорода окисляемых веществ. Перенос водорода на кислород
карбонатов обеспечивает определенные энергетические оозможпости,
утраченные в связи с отсутствием цикла трикарбоновых кислот.
Некоторые ученые считают, что такому превращению
подвергается уксусная кислота:
CHjCOOH -*■ СН4 + СО,.
Метан в этом случае образуется не сразу, а путем трансформации
гипотетического продукта Х\\ъ, что, впрочем, не исключается и в
предложенной автором схеме. В связи с таким превращением
уксусной кислоты высказывается возможность метаболизма всех веществ
через уксусную кислоту. По мнению автора, уксусную кислоту
нельзя рассматривать как промежуточный метаболит, а если она
и образуется при метановом брожении, то это результат частичного
203
отклонения процесса, которое можно представить следующим
образом:
СН.СО ~ S-KoA !*£-* СН3СООН + SH-KoA.
Такое отклонение встречается и в других процессах, где участвует
ацетил-КоА (гетеротрофное молочнокислое, пропионовокислое, аце-
топобутиловое брожение). Это своего рода вторичный процесс,
характерный для любого брожения. На практике, где используется
метановое брожение, нарушение технологического режима
приводит к тому, что процесс брожения идет преимущественно по этому
пути и вместо метана образуется уксусная кислота, а
неиспользованный водород выделяется в атмосферу («кислотное» брожение).
Аналогичным примером химизма анаэробного разложения
веществ является ацетонобутиловое брожение. Вначале
предполагалось, что образование бутанола происходит в две фазы: в первой
фазе образуется масляная кислота, во второй она
восстанавливается в бутанол. Однако такое впечатление производят лишь
внешние признаки брожения. В действительности переход к процессу
образования бутанола происходит на стадии бутирил-КоА. Только
в начальный период брожения из него образуется определенное
количество масляной кислоты, загем его превращение идет по пути
восстановления в бутанол.
Участие ацетил-КоА в качестве универсального промежуточного
продукта в процессе метанового брожения соответствует его
известной реакционной способности, выработанной в процессе эволюции
н дающей организму широкие возможности для конструктивного и
энергетического метаболизма. Как отмечалось выше, это соединение
является универсальным промежуточным продуктом разложения
псех органических соединений в аэробных условиях и участвует в
большинстве анаэробных процессов, завершающихся неполным
разложением вешеств, причем в других анаэробных процессах
образуются более сложные конечные продукты, чем при метановом
брожении, т. е. разложение и чет менее глубоко. Возможно, что
различные типы анаэробных брожений являются незаконченными
вариантами одного, наиболее глубокого анаэробного разложения
веществ — метаповою брожения.
Поскольку центральным метаболитом в процессе метанового
брожения является апетил-КоА, полное его превращение в метан
должно происходить по схеме:
Окисляемое
вещество
/?Н2 4НАЛН2 \
| 4,0 Н20 \
СП.,СО КоА V -СО_, » ► H2COj \—►ЗН ,0
сн4 сн4
Для полнот превращения ацешл-КоА в метан потребляемое
ьешесгво в процессе окисления должно обеспечить не менее 4 моль
204
восстановленных дегидрогеназ. Если этого не происходит, то наряду
с метаном образуется С02 в количестве, зависящем от количества
недостающих НАДН2. Необходимо учесть, чго окисляемое вещество
может дать большее количество восстановленных дегидрогеназ, чем
требуется для восстановления I моль С02, образующегося из
молекулы ацетил-КоА. Тогда восстановлению подвергается С02,
образующаяся другими путями. Возможна и обратная ситуация, когда
количества восстановленных дегидрогеназ недостаточно для
поляной редукции С02. В таком случае возрастает доля С02 в составе
образующихся газообразных продуктов метанового брожения.
Таким образом, соотношение СН4 и С02 при метановом брожении
зависит от природы потребляемых веществ, и в первую очередь, от нх
энергетического потенциала, т. е. от количества активного водорода,
отщепляющегося в процессе окисления и передаваемого на
восстановление карбонатов.
Поскольку восстановлению подвергаются карбонаты, а не
просто С02, следует рассмотреть это несколько подробнее. Вопрос о
количестве связанного С02 сложен. Этот газообразный продукт хорошо
растворяется, но в малой степени связывается водой. Поэтому в
чистой воде лишь часть С02 переходит в связанную форму — в форму
карбонат-ионов СО.i", образующихся в результате диссоциации
угольной кислоты. В сложной среде, в которой происходит
метановое брожение, появляются различные пути взаимодействия С02
с растворенными веществами, и возможность связывания его
возрастает. Между ионами карбонатов и щелочей образуются солевые
связи. Возникает электростатическое взаимодействие между
отрицательно заряженными ионами карбонатов и положительно
заряженными аминогруппами аминокислот и белков. Происходит эте-
рификация угольной кислоты с ОИ-1рунпами спиртов, углеводов
н других веществ. Интенсивность этих взаимодействий зависит не
только от концентрации соответствующих веществ, но и от
конкретных физико-химических условий. Например, при повышении
кислотности среды в результате накопления низших жирных кислот
уменьшается степень диссоциации угольной кислоты и,
следовательно, образование карбон а г-ионов. Это приводит к вытеснению СО* из
культуральиой жидкости и уменьшает возможность образования
карбонат-ионов. Чрезмерно высокое значение рН среды, наоборот,
угнетает диссоциацию аминогрупп аминокислот и белков, т. е.
уменьшает количество положительно заряженных ионов, способных свя
зывать отрицательно заряженные ионн угольной кислоты. Все это
оказывает влияние на биохимию процесса метанового брожения
и должно учитываться в технологии.
Поскольку химизм разложения всех веществ до стадии ацстил-
КоА известен, предлагаемая схема позволяет рассчитать
соотношение количеств метана и углекислого газа при метановом
брожении любого вещества. Для расчета необходимо определить
количества восстановленных дегидрогеназ н С02, образующихся в
процессе разложения вещества. В качестве примера рассмотрим
процесс разложения аминокислоты аланина:
20о
сн3снсоон
НАД ►
Н20 ►
СН3СОСООН
НАД ►
КоА ►
СН3СО~КоА
н2о
СН< СОа
В результате разложения молекулы аланина получается 1
молекула CIU, 2 молекулы НАД- Н2, 2 молекулы С02. 2 моль НАДНа
способны восстановить 0,5 моль С02. Следовательно, в конечном
итоге при метановом брожении аланина может образоваться
1,5 моль СН4 н 1,5 моль С02, т. е. соотношение образующихся
газообразных продуктов будет СН<: СО2=50 : 50.
Результаты исследований показывают, что соотношение
количеств метана и углекислого газа на практике близко к расчетному.
Наименьшее относительное количество метана дают углеводы,
наибольшее— высшие жирные кислоты. Ряд аминокислот в этом
отношении приближается к углеводам, а многие —к высшим жирным
кислотам. В целом расчетное относительное количество метана,
образующегося при разложении различных веществ, колеблется в
пределах 50—70%. На практике при метановом брожении метана
выделяется больше —в пределах 60—80%. Это объясняется тем,
что часть С02 остается в среде в связанном виде и в атмосферу его
соответственно выделяется меньше, поэтому в составе
выделяющихся газообразных продуктов содержание метана больше расчетного.
Обобщая известные экспериментальные данные н основанные
на них предположения, можно сделать заключение о взаимосвязи
процессов аэробного и анаэробного разложения вешеств. Все пути
разложения веществ в аэробных условиях сводятся к образованию
аиегнл-КоА. До стадии ацетнл-КоА они разнообразны, после чего
происходит единый для всех веществ процесс полного окисления
аиепп-КоА в С02 и Н20. В анаэробных условиях организм
использует те же пути разложения веществ, и в большинстве случаев они
приводят к центральному промежуточному метаболиту — ацетил-
КоЛ Наиболее выгодное дальнейшее превращение ацетил-КоА в
анаэробных условиях в С02 и СН4, т. е. в предельно окисленный
и восошювлеиный продукты. Это дает максимальный выход энер-
►НАД-Hj
-NH3
*НАД-На
~СОа
200
гии, которая извлекается в том и другом случаях путем переноса
водорода: в аэробных условиях — иа свободный кислород
атмосферы, в анаэробных — на кислород карбонатов. В первом случае это
приводит к образованию воды, во втором — воды и метана, т. е. во
втором случае восстановлению подвергаются два химических
элемента — кислород и углерод.
Принципиальное различие аэробных и анаэробных процессов
разложения веществ состоит в том, что анаэробное
разложение— это сокращенное (редуцированное) аэробное разложение
веществ, ведущее также к образованию максимально окисленных и
восстановленных конечных продуктов, но с меньшим числом
промежуточных метаболитов, способных подвергаться окислению и
выделять энергию, причем как в аэробных, так и в анаэробных
условиях процессы разложения в зависимости от условий и
происхождения организма могут заканчиваться неполным разложением
веществ. В аэробных условиях в этом случае накапливаются
промежуточные продукты цикла трикарбоновых кислот, в анаэробных —
спирты, органические кислоты, растворители. Можно предполагать,
что все анаэробные брожения — молочнокислое, спиртовое, масля-
иокислое и другие являются вариантами незавершенного процесса
метанового брожения.
Учитывая сказанное, можно представить общую схему
превращения веществ при метановом брожении:
Схема образовании метана из органических веществ
Аминокислоты
Жирные кислоты
СН3СОСООН
СН3СО~КоА
Щавелевоуксусная
кислота
Яблочная
кислота
Фу паровая
кислота
Янтарная
кислота
И-Кетоглутаровая кислота
207
Приведенные в схеме превращения до стадии ацетил-КоА
известны в биохимии как пути входа органических веществ в цикл ди-
п трикарбоновых кислот. Превращения С02 в СН4 также известны
как гипотетическая схема Г. Баркера, признанная большинством
исследователей и в значительной степени подтвержденная
экспериментально. Отличне предлагаемой автором схемы состоит лишь
в том, что промежуточным продуктом превращения веществ в метан
является не ацетат, а его активный остаток ацетил-КоА, и процесс
восстановления С02 в ChU рассматривается как редукция
карбонатов. Это, казалось бы, несущественное отличие меняет существующее
убеждение о том, что метанобразующие бактерии осуществляют
лишь процесс восстановления С02 в СН4, а предшествующие
превращения органических веществ совершаются другими,
сопутствующими микроорганизмами. Согласно предлагаемой схеме, все
превращения любого вещества в метан происходят в клетке одного и
того же микроорганизма. При этом исключается необходимость
искать доказательства существования у метанобразуюших
бактерий термодинамически невыгодного процесса анаэробного
расщепления молекулярного водорода экзогенного происхождения с
помощью гпдрогеиазы, так как возбудители метанового брожения,
окисляя различные вещества с помощью дегндрогеназ, легко
получают активный водород, необходимый для восстановления С02
(карбонатов) в СН4. Чю касается мегилыюй группы, отщепляемой от
молекулы ацетнл-КоА, то ее превращение в метан происходит тем
же путем, который сше в 1951 г. предложил Г. Баркер, предполагая
участие в эгом процессе гипотетнческого переносчика, природа
которого в настоящее время изучается.
Относительно участия в этом процессе фермента гпдрогеиазы
можно сказать следующее. Чрезвычайно высокая энергия
молекулярного распада водорода, известная в химии как энергия
диссоциации водорода, является косвенным свидетельством того, что
1 мкон механизм образования активного водорода в анаэробных
условиях маловероятен. Другое дело — извлечение атомарного
водорода из каких-либо веществ, где он находится в менее прочной
химической связи. В химии таким примером может быть выделение
водорода под возденет пнем металлов па кислоту. В момент выделения
во юрод находится в активной форме и его можно использовать на
восстановительные реакции. В биохимии аналогичную активацию
поторода opi эпических вешеств осуществляют дегндрогеназы. Ак-
тнвнпя биологическая форма водорода — НАД • Н2 — это своего
рода «hisbitu nascenrii». Продолжая эту аналогию, можно сказать,
чю в живом организме, как и в химии, такой путь извлечения
активною водорода юра^'ю легче, чем днесоцпання его молекулярной
формы. К этому можно добавшь, что превращение молекулярного
во юрода меганобразующимн бамерннмн с помощью гпдрогеиазы
jбеTiiie.ibiio подтверди!ь не удается.
2№
ГЛАВА VI
ПРОИЗВОДСТВО ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Широкое применение ферментов обусловило развитие их npun.i
водства с помощью микроорганизмов. Наибольшее значение имеют
амилолнтические и протеолитические ферменты
Амнлолитические ферменты необходимы в производстве для
осуществления процесса гидролиза крахмала. Микроорганизмы
являются более дешевым и эффективным источником амилолитическнх
ферментов, чем солод, применяемый для этой цели. Широко
используются и протеолитические ферменты. С большим эффектом они
применяются в кожевенной промышленности вместо трудоемкого
и вредного для человека химического способа обезволошиваиия
кожи. В мясной промышленности применение ферментов открыло
новые пути совершенствования технологии и улучшения качества
мясных продуктов.
В виноделии используют пектолитические ферменты для
разрушения пектиновых веществ, выпадающих п осадок в процессе
выдерживания пин. Эти же ферменты применяются для
разрушения клеточных стенок при извлечении сокоп из плодов и ягод.
Ферменты используются для предотвращения кристаллизации
Сахаров в некоторых продуктах, например сахарозы в кондитерских
изделиях (инвертаза), лактозы в молочных продуктах (лактаза)
Широкие перспективы имеет применение ферментов, гидролизую-
щих клетчатку и гемицеллюлозы, например в бродильном произвол
стве для повышения концентрации сбраживаемых Сахаров в среде,
в животноводстве для повышения питательной ценноеш
растительного корма (гидролиз неусвояемых полисахаридов).
Следует отметить, что в большинстве перечисленных отраслей
народного хозяйства не обязательно применение ферментов в чн
стом виде. Они могут быть использованы в неочищенном или полу-
очнщениом виде. Очистка их требуется главным образом п тех
случаях, когда нежелательно присутствие сопутствующих ферментов,
обладающих другим действием. Наличие же органических или
неорганических примесей не имеет существенного значения. В связи
с этим ферментная промышленность выпускает неочищенные
продукты, называемые ферментными препаратами.
СЫРЬЕ И ОСОБЕННОСТИ СОСТАВА ПИТАТЕЛЬНЫХ СРЕД
Характеристика сырья. Для продуцентов ферментов
используются, главным образом, комплексные среды, представляющие собой
смесь синтетических сред с естественными материалами
растительного, животного или микробного происхождения. Синтетическая,
т. е. искусственно составленная, часть сред включает необходимые
минеральные солн" и отдельные органические соединения,
являющиеся источниками углерода — углеводы, ennpnj, органические
кислоты.
27 - 2-1702 209
Одним из условий, определяющих рентабельность производства
ферментов, ягияегся применение отходов различных производств
в качестве естественных материалов. К ним относятся отруби,
меласса, гидрол. кукурузный экстракт, отходы переработки плодов
и овощей, жмыхи, отходы спиртового, крахмало-паточного и других
пншевых производств. Однако для повышения производительности
заводом необходимо использовать и более дорогостоящие
материалы — муку, крахмал и др.
Пшеничные офубн используются как источник питания и в то же
гремя для создания поверхности при поверхностном способе куль-
швпроппмня ферментов.
Замочные воды, образующиеся в результате водно-тепловой
обработки кукуруз!>1 на крахмало-паточпых заводах, содержат до 8 %
сухих веществ, состоящих нз перешедших в раствор углеводов,
азотсодержащих н минеральных веществ. Их можно непосредст-
геипо использовать в качестве составной части среды для
производства ферментов. Упаренные до содержания 50 % сухих веществ
замочные воды называются кукурузным экстрактом. Он содержит
значительное количество меланоидннов, образующихся в результа-
ie термического воздействия па углеводы и аминокислоты.
Кукурузный экстракт—ценный источник азотсодержащих веществ,
которые составляют 40—50 % всего количества веществ и более
половины нз них представлено аминокислотами.
Гидрол — отход производства глюкозы из крахмала, содержит
около 70 % рецуцпрующих Сахаров, большую часть которых
составляет глюкоза.
Солодовые ростки — отход производства солода, содержат
большое количество свободных аминокислот и других органических
азотсодержащих соединений. Более 50 % сухих веществ ростков
составляют растворимые безазотистые соединения и клетчатка.
Ростки богаты витаминами и другими веществами, необходимыми
для жизнедеятельности микроорганизмов.
Ценными питательными свойствами обладают пивная дробииа
и пивные дрожжи.
Для производства ферментных препаратов могут быть
использованы отходы производства спирта — мелассно-спиртовая и зерио-
картофельпая барда, барда ацетонобутиловых заводов.
Хорошим источником питательных веществ являются остатки
измельченной сахарной свеклы после экстракции сахарозы —
свекловичный жом.
Более дорогостоящим сырьем для производства ферментов
является картофель. Основным источником углерода в нем является
крахмал, составляющий около 20 % массы картофеля.
Основными компонентами сред, используемых в качестве
источники углерода, являются мука и крахмал. Используются различные
сорта картофельного и кукурузного крахмала.
Богатым источником азотсодержащих веществ является соевая
мука, широко нсиолпзуемая и качестве основного компонента сред
в производстве ферментов.
2IJ
Влияние состава среды на образование ферментов. По мниги
случаях процесс образования того или иного фермента зависит m
столько от природы микроорганизма, сколько от состава питатель
ной среды, применяемой для его культивирования. Один и тот же
микроорганизм образует различные ферменты в средах различного
состава. Большое значение при этом имеет соотношение между
количествами различных компонентов, причем некоторые вещества
могут сильно влиять на биосинтез ферментов, не являясь субсгра
том его действия. В этом отношении процесс образования фермеи
тов очень своеобразен. Многое зависит и от того, является ли дан
ный фермент адаптивным или конститутивным. Так, ами
лазы являются адаптивными (индуктивными) ферментами, поэтому
для производства этих ферментов необходимо присутствие в среде
соответствующих источников углерода— крахмала, декстринов,
мальтозы. Некоторые углеводы, являющиеся доступными для
продуцентов амилолитических ферментов, и даже такие, как глюкоза,
могут тормозить синтез амилаз.
Активным стимулятором образования а-амилазы являются
некоторые высшие жирные кислоты. Так, олеиновая и стеариновая
кислоты в три раза повышают интенсивность синтеза глюкоами-
лазы, тогда как миристиновая кислота, наоборот, тормозит этот
процесс.
Для нормального синтеза амилолитических фер.м,ентов в среде
кроме углеродсодержащих соединений должны присутствовать ис-
сточпики азота. Они должны составлять примерно. 5. % количества
углеводов. Благоприятное соотношение количеств азотсодержащих
веществ и углеводов, например в кукурузной муке, позволяет
получить высокую активность амилаз, причем содержание крахмала
может быть значительно меньшим, чем в синтетической cpeie, где
очень трудно сбалансировать соотношение источников углерода и
азота.
Биосинтез амилолитических ферментов тесно c&aaaiA с наличием
солей магния, фосфора, кальция. Большую роль играет сера. Акта
ность амилолитических ферментов обусловлена наличием сульф-
гидрильной группы.
При производстве протеолитнческих ферментов, состав среды
имеет еще большее значение, чем при производстве
амилолитических ферментов. В обоих случаях наличие индуктора необходимо,
однако при производстве протеолитнческих ферментов углеводы,
не являющиеся индуктором их биосинтеза, имеют не меньшее
значение, чем азотсодержащие вещества. В отличие от синтеза амишд.-
литических ферментов ннтенсивпосхь синтеза протениаз повышается
при наличии глюкозы. Положительно влияют фруктоза, сахароз.»,
мальтоза.
Наряду с важной ролью углеводов в процессе синтеза протеи^а-ь
необходимо присутствие в среде органических источников азота in
качестве индукторов. Этим объясняется высокая интенсивность
накопления протеолитнческих ферментов в средах с естественными
материалами, содержащими органические азотистые вещества Такими
~- 211
■ 27-
источниками являются кукурузная, соевая, пшеничная, ржаная
мука, пшеничные отруби, дрожжевой автолнзат, пептон, казеин и
лр. В присутствии казеина большинство аспергиллов повышает
интенсивность синтеза протеипаз. Наиболее благоприятные условия
для биосинтеза протеолитнческнх ферментов создаются при
совместном нрисутстнин в среде казеина, пептона и глюкозы. Имеются
данные о значительном положительном действии смеси
органических и неорганических источников азота.
Биосинтез иротеолитических ферментов стимулируют
аминокислоты. В этом отношении продуценты ферментов имеют некоторые
особенности. Различные продуценты ио-разиому реагируют иа
присутствие одних и тех же аминокислот. Так, например, некоторые
штаммы Asp. oryzae увеличивают накопление протеипаз при
наличии глишша, аланииа. метнонииа н лейцина. На активность гриба
Asp. fumaricus стимулирующе влияют другие аминокислоты —
лизин, цпстии, норлепцин, фенилаланнп. Многие аминокислоты
ингибируют синтез иротеолитических ферментов. Валнн, глутамиио-
вая кислота н некоторые другие аминокислоты тормозят синтез
протеипаз у Asp. oryzae, в то же время стимулируя рост самих
продуцентов. Такие аминокислоты, как лизин, тирозин, ингибируют
синтез протеолитнческнх ферментов и жизнедеятельность клеток
некоторых штаммов плесневых грибов, а цистеин, аргинин, гистидии,
наоборот, по своему положительному действию почти равноценны
казеину и пептону.
Наилучшим неорганическим источником азота для бактерий-
продуцентов протеолитнческнх ферментов является гидрофосфат
аммония. Другие минеральные соли азота снижают интенсивность
синтеза ферментов. Концентрация органических источников азота
имеет определенные пределы оптимальных значении. При
концентрациях, превышающих эти пределы, действие органических
источников азота становится обратным, т. е. активность протеаз
уменьшается.
Неполитические ферменты, как и многие другие гидролазы,
являются индуктивными, поэтому среды, используемые для их
культивирования, должны содержать пектиновые вещества. Пектин
индуцирует образование комплекса пектолитических ферментов —
пектазы и пектииазы. Некоторые аспергиллы продуцируют пектоли-
тнческие ферменты на отрубях без пектина. На основании этого
принято считать, что некоторые компоненты комплекса
пектолитических ферментов, например эндопектииаза, могут быть у некоторых
продуцентов конститутивными.
Еще более строгое соответствие между субстратом и ферментом
наблюдается у продуцентов целлюлаз. Микроорганизмы могут
синтезировать эти ферменты только в среде, содержащей целлюлозу.
Некоторые продуценты развиваются на естественных материалах,
содержащих клетчатку, однако для производства целлюлолитиче-
ских ферментов такие материалы, как, например древесина,
неприменимы, поскольку процесс роста микроорганизмов и разложения
клетчатки в таких условиях происходит медленно. Целлюлоза не
212
является для каких-либо микроорганизмов единственным и даже
главным источником питания. Клетчатка разлагается некоторыми
микроорганизмами лишь при отсутствии более доступных
источников питания. Наилучшим источником углерода для продуцентов
целлюлолитических ферментов, как и для многих других
микроорганизмов, является глюкоза, однако она является в то же время
репрессором синтеза целлюлаз и в ее присутствии разложение
клетчатки прекращается. Для интенсивного развития продуцентов и
накопления ферментов в среде, содержащей клетчатку, последняя
должна подвергаться обработке с целью обеспечения большей
доступности ее для микроорганизмов. Для этого часто применяется
фильтровальная бумага. Хорошим компонентом производственных
сред является свекловичный жом.
Из всех источников азота наилучшим для синтеза целлюлолн
тических ферментов являются нитраты. Аммонийный азот
усваивается хуже, а в некоторых случаях ингибнрует синтез ферментов
Это можно объяснить тем, что потребление азота аммонийных
солей ведет к подкнслению среды, потребление же нитратов н нигрн
тов, наоборот, вызывает подщелачиванне среды, что благоприятно
влияет на развитие продуцентов. Подкисленне среды вызывает
прекращение процесса разложения клетчатки. В связи с этим
присутствие глюкозы и других легко разлагающихся углеводов тормозит
процесс образования целлюлаз не только потому, что они
репрессируют регуляторные механизмы, но и вследствие подкнсления
среды. Процесс разложения клетчатки не приводит к такому
эффекту, хотя продуктом ее разложения является -Также глюкоза. Дело
в том, что клетчатка гидролизуется медленнее, чем разлагается
глюкоза, вследствие чего в процессе развитии микроорганизмов в
среде, содержащей клетчатку, глюкоза не может накапливаться
в значительных количествах, поскольку полностью утилизируется
по мере разложения клетчатки.
Строгая зависимость между наличием субстрата и
ферментативной способностью наблюдается в отношении линолитических
ферментов. Присутствие жиров для биосинтеза липолн тических
ферментов является необходимым. Продуценты липаз — это в основном
такие же виды плесневых грибов, которые являются продуцентами
других ферментов. У бактерий эта способность встречается реже.
Для культивирования продуцентов липолитических ферментов
используются отходы жировой промышленности, главным образом
подсолнечный шрот. Большое значение имеет концентрация жира
в среде. При содержании более 3 % жира процесс синтеза
ферментов тормозится. Продукты разложения жира — жирные кислоты —
являются репрессорами синтеза липаз. Наибольшее влияние в этом
отношении оказывает олеиновая и пальмитиновая кислоты. В
зависимости от содержания этих кислот применение того или иного
естественного материала дает различный вффект.
По этой причипе наличие подсолнечного масла в среде
приводит к более интенсивному синтезу липолитических ферментов, чем
наличие оливкового масла. Для синтеза этих ферментов могут быть
28 _ 2-1702
213
использованы и твердые жнры. Хорошие результаты, например,
могут быть получены в среде, содержащей кашалотовый жир. Однако
с увеличением плотности жира уменьшается его значение как
субстрата вследствие уменьшения растворимости (эмульгирования).
Применение ноиерхиостпо-активных веществ, способствующих
эмульгированию жира, усиливает процесс накопления лнполитиче-
ских ферментов.
ПРОДУЦЕНТЫ ФЕРМЕНТОВ И ИХ ХАРАКТЕРИСТИКА
Если рассмотренные выше микроорганизмы — возбудители
различных типов брожений — характеризуются наличием комплекса
ферментов, обусловливающих образование какого-либо конечного
продукта обмена, то к продуцентам ферментов предъявляют иные
требования: они должны обладать способностью к образованию
большого количества какого-либо одного фермента. Вполне
естественно, что исключить полностью способность к образованию
других сопутствующих ферментов практически невозможно. Во
многих случаях пет необходимости исключать наличие.сопутствующих
ферментов в готовом продукте, поскольку их присутствие является
желательным.
Следует отметить, что получение мутантов, способных к сверх-
еннтезу биологически активных веществ, в данном случае не дает
того эффекта, который можег быть достигнут в области получения
продуцентов вторичных метаболитов, например антибиотиков. Это
объясняется, вероятно, тем, что резкие изменения в соотношении
ферментов, ответственных за основной метаболизм клеток,
приводят к потере их жизнеспособности.
В естественных условиях существует большое количество
микроорганизмов, обладающих высокой ферментативной активностью,
среди которых могут быть отобраны производственные штаммы.
Большое значение в вопросе подбора высокоактивных
производственных штаммов имеет то обстоятельство, что многие ферменты
являются индуктивными (адаптивными). Это дает возможность
достичь большой продуктивности варьированием качественного и
количественного составов среды. Задача облегчается еще и тем, что
один и тот же микроорганизм при изменении условий легко
переключает свой биохимический механизм иа синтез того или иного
фермента. В отношении синтеза различных компонентов одного и
того же комплекса ферментов микроорганизмы обладают
значительной специфичностью. Производственные штаммы могут
образовывать, например преимущественно а-амилазу, обладая слабой
способностью к синтезу других ферментов амилолнтиче.кого
комплекса.
В качестве продуцентов ферментоп используются разнообразные
микроорганизмы, особенно плесневые грибы. Часто применяются
актнномнцеты. Некоторые ферменты производятся с помощью
дрожжей п дрожжеподобпых грибов. Наиболее высокой активностью
н широким ферментативным спектром обладают представители
■:и
плесневых грибов — аспергиллы. Представители этого рода — Asp
oryzae, Asp. avamori, Asp. niger — в соответствующих условиях
могут быть активными продуцентами амилолитнческих, протеолити-
ческих, пектолитическнх и других ферментов. Аналогичной
способностью обладают бактерии видов Вас. mesentericus и Вас. subtilis.
Они также являются активными продуцентами амилаз, протеаз и
некоторых других ферментов. Наиболее известны препараты,
полученные с применением Asp. oryzae и Вас. subtilis («Амилоризин»,
«Проторнзин», «Амилосубтилин», «Протосубгилин»). Для
микроорганизмов характерно образование а-амилазы, глюкоамилазы и
других амилаз, однако образовывать р-амнлазу они почти не способны.
Особый интерес для промышленности представляют
микроорганизмы, способные к преимущественному образованию глюкоамилазы.
Наличие этого фермента в амилолитическом комплексе
способствует полному превращению крахмала в глюкозу, что очень важно
для производства. Весьма активные штаммы, образующие глюко-
амилазу, обнаружены среди плесневых грибов Asp. oryzae, Asp.
awamori, Rliiz. delemar и др. Воздействием мутагенными факторами
удалось получигь штаммы аспергиллов, обладающих высокой ами-
лолитнческой активностью.
Из бактерий наиболее широко применяются в производстве
амилолитнческих ферментов представители вида Вас. subtilis. Для
производства этих ферментов рекомендованы термофильные
бактерии— Вас. diastaticum и другие, способные развиваться при
температуре 50—70°С. Они в несколько раз интенсивнее синтезируют
ферменты, чем обычные мезофильные штаммы. Применение таких
микроорганизмов имеет преимущество и в том отношении, что
высокая температура препятствует развитию посторонней микрофлоры
Активным продуцентом амилолитнческих ферментов является
дрожжеподобпый гриб Endomycop-sis sp. 209, синтезирующий
наряду с а-амилазоп и глюкоамилазой такие ферменты, как пнвер-
таза и глюкозилтрансфераза.
Для производства протеолптических ферментов наиболее часто
используются бактерии вида Вас. subtilis, а также различные виды
плесневых грибов, главным образом аспергиллов. Разнообразие
плесневых грибов,"рекомендуемых для производства иротеолнтиче-
скнх ферментов, объясняется их спецификой в отношении качества
синтезируемых ферментов. Различные виды плесневых грибов
синтезируют протспназы с различными оптимальными значениями рН.
Имеются представители, способные синтезировать протеолитиче-
ские ферменты типа ренпнна (сычужного фермента), вызывающего
интенсивное скисание молока. Такие штаммы известны среди
представителей рода Rhizopus. Они широко используются в Японии для
произвочетва заменителей реннина в сыроделии. Способностью
к образованию такого типа протенназ обладают и другие
представители плесневых, грибов, а также бактерии. Многие плесневые
грибы способны синтезировать одновременно нсскочько протенназ,
отличающихся специфичностью в отношении оптимальных
значений рН и других свойств.
21В
'38--
Для получения протеолнтнческих ферментов могут быть
использованы представители группы гнилостных микроорганизмов.
В качестве продуцентов неполитических ферментов
используются плесневые грибы, бактерии и дрожжи. Из плесневых грибов
наибольшей активностью обладают аспергиллы. Из них Asp. awa-
mori является продуцентом одновременно нескольких ферментов
пектолитического комплекса, Asp. niger продуцирует
преимущественно пектинэстеразу. Способностью к образованию различных
пектолнтическнх ферментов обладают пеиициллы и многие
представители других классов грибов. Дрожжи вида Saccharomyces
fragilis продуцируют ферменты, способные гидролизовать
пектиновую (полигалактуроновую) кислоту с образованием продукта,
состоящего из двух остатков галактуроновой кислоты. Многие из
промышленных штаммов микроорганизмов продуцируют смесь
пектииэстеразы (пектазы) и полигалактуроиазы (пектиназы).
Именно такое сочетание необходимо для применения в виноделии
с целью разрушения растворимого пектина, переходящего из
раствора в осадок в процессе выдерживания вии.
Способность к разложению пектиновых веществ давно известна
у бактерий, участвующих в процессе мочки льна,— CI. felsineuin
и Cr. pectinovorum. Они и были первыми из бактерий,
рекомендованных для использования в качестве продуцентов
пектолнтическнх ферментов. В настоящее время известны и многие другие
бактерии — продуценты этих ферментов. Для промышленного
использования рекомендовано несколько мутантов — представителей
аспергиллов.
Значительно меньший выбор микроорганизмов — продуцентов
целлюлаз и гемнцеллюлаз. Способностью к разложению клетчатки
обладают представители несовершенных грибов родов Alternaria,
Trichoderma, Cladosporium, некоторые фуразии — Fus. culmorum,
Fus. oxysporum, а также отдельные виды аспергиллов и пеиицил-
лов. Способностью к разложению целлюлозы обладают некоторые
бактерии, среди которых имеются анаэробы. Однако бактерии,
особенно анаэробы, не могут быть рекомендованы в качестве
продуцентов целлюлолитических ферментов, поскольку они не
способны разрушать натуральную клетчатку и растут лишь в среде,
содержащей специально обработанную целлюлозу в виде
фильтровальной бумаги или делингнифицироваиных растительных материалов.
Еще меньше микроорганизмов можно рекомендовать для
производства ферментов гемнцеллюлаз. Они встречаются лишь
среди плесневых грибов родов Trichoderma, Trichothecium, Fusa-
rium, а также аспергиллов и пеннциллов.
Способностью к образованию таких ферментов, как иивертаза,
обладают многочисленные бактерии и грибы. Для промышленного
производства этого фермента используются дрожжи
(сахаромицеты), обладающие наиболее высокой ипвертазной активностью.
Для производства лактазы ((3-галактозндазы) рекомендованы
отдельные виды дрожжей и могу г быть использованы бактерии
Е. соП.
216
Основными промышленными микроорганизмами для произвол
ства ферментов являются плесневые грибы. По физиологическим
особенностям они значительно отличаются от других
микроорганизмов. В отличие от бактерий и дрожжей они не обладают строгой
специфичностью в отношении потребляемых источников углерода
(1 могут усваивать различные моно-, олнго- и полисахариды, спирты,
органические кислоты, углеводороды и даже токсические вещества.
Однако имеются различия в интенсивности потребления ими того
или иного источника углерода. Наиболее доступным источником
углерода для них, как и для большииста организмов, является
глюкоза. Имеется лишь небольшое число грибов, которые
потребляют предпочтительно другие углеводы.
Несмотря на широкий диапазон ферментативных способностей,
у грибов наблюдается существенная специфичность по отношению
к конкретным веществам. Гексозы усваиваются лучше, чем пен-
тозы. Из олигосахарндов хорошо усваиваются сахароза, мальтоза.
Что касается полисахаридов, то на грибы распространяется
общеизвестная закономерность, согласно которой доступность
потребляемого вещества в большей степени определяется его структурой,
чем природой микроорганизма. Хорошо усваиваются крахмал
и крахмалоподобные вещества, сравнительно легко — пектиновые
вещества.
При изучении физиологии питания плесневых грибов
обнаружено, что некоторые углеводы при совместном присутствии
оказывают более сильное ростовое действие, чем каждый из них в
отдельности. В некоторых случаях наблюдается явление,
напоминающее синергическое действие: совместное присутствие двух
углеводов оказывает больший эффект, чем сумма эффектов каждого из
них в отдельности.
У промышленных штаммов бактерий наблюдается более строгая
специфичность по отношению к углеводам, чем у плесневых грибов.
Основные продуценты амилолнтических, протеолнтических н
неполитических ферментов, перечисленные выше, близки к
физиологической группе масляпокислых бактерии, для которых
характерно потребление крахмала и глюкозы. По отношению к другим
углеводам у этих бактерий могут быть определенные различия, но
в целом диапазон потребляемых углеводов, особенно
полисахаридов, значительно меньший, чем у плесневых грибов.
Продуценты инвертазы и л-чктазы, т. е. дрожжи и бактерии типа
кишечной палочки, обладают оолее узким спектром
ферментативных способностей, которые ограничиваются моно- и олигосахари-
дами, не распространяясь на полисахариды.
Следует отметить, что многие плесневые грибы, бактерии
и дрожжи потребляют различные спирты. Плесневые грибы хорошо
усваивают многие органические кислоты. Бактерии и дрожжи
способны к потреблению лишь определенных органических кислот,
гланннм образом кислот цикла Кребса, и в меньшей степени
жирных кислот.
217
Большое значение в жизнедеятельности продуцентов ферментов
имеют источники азота. Для большинства грибов доступными
источниками азота являются минеральные соли — нитраты и соли
аммония. При потреблении нитратов усваивается аннон NOr, а в
среде остаются катионы К+ или Na+, создающие щелочную
реакцию среды. Из солен аммония, наоборот, в качестве источника
азота усваивается каиюн NH+, а остающийся анион, т. е. остаток
каком-либо кислоты, создает кислую реакцию среды. Некоторые
плесневые грибы хорошо усваивают газообразный аммиак.
Следует иметь в виду, что intipaibi являются не только
источником азота для микроорганизмов. Использование нитратов может
быть связано с тем, что входящий в их состав кислород служит
акцептором водорода, особенно в случае недостатка кислорода
воздуха. При этом образуется аммиак, который может быть
использован в качестве источника азота. В этом случае нитраты
выполняют двойную функцию.
Еще в большей степени способность к потреблению нитратов
и солен аммония свойственна бактериям — продуцентам
ферментов. Они менее требовательны к наличию кислорода воздуха,
хорошо усваивают кислород нитратов, а продукты редукции нитратов
утилизируют в качестве источника азота, т. е. одновременно
используют анноны и катионы нитратов.
Дли дрожжей способность к усвоению нитратов менее
характерна. Наилучшим источником азота для них являются соли
аммония. Кислород нитратов дрожжи не используют, поскольку
в условиях недостатка кислорода воздуха эти микроорганизмы
существуют за счет процесса спиртового брожения. ■
Грибы, бактерии и дрожжи могут использовать в качестве
источника азота аминокислоты. Для грибов наилучшими из них
являются аспарагнновая н глутамииовая кислоты, аспарагин, глу-
тамнн. Циклические и серосодержащие аминокислоты используются
в меньшей степени. Многие продуценты ферментов проявляют
специфичность по отношению к аминокислотам. Некоторые
аминокислоты ипгибнруют рост плесневых грибов. Смесь аминокислот
создает наилучшие условия для роста микроорганизмов. Амиио-
кпсчогы имеют большое значение в метаболизме мутантов,
поскольку у них может полностью отсутствовать способность к
синтезу отдельных аминокислот.
Рост некоторых видов грибов стимулируется добавлением
в среду белковых веществ. В качестве источника азота может быть
использована мочевина.
Продуценты ферментов нуждаются и в других химических
элементах.
Большинство из них использует серу сульфатов. Источниками
серы могут служить также метионнн, цнстеин, цистии. Некоторые
виды грибов утилизируют элементарную серу, сульфиды.
Легочником фосфора являются главным образом фосфаты,
а также фосфорные эфиры органических веществ.
21S
Железо необходимо всем плесневым грибам, некоторые из них
используют его для образования хелатов, играющих важную роль
в процессе детоксикацин метаболитов.
Для роста грибов н дрожжей необходимы микроэлементы —
цинк, магний, молибден и др.
Важную роль в физиологии продуцентов ферментов играют
витамины. Многие из них, как известно, входят в состав ферментов.
Среди продуцентов ферментов обнаружены автотрофные и
гетеротрофные микроорганизмы по отношению к витаминам. Однако
большинство из них — сапрофнты и поэтому являются ауксоавтотрофа-
ми, т. с. способны синтезировать большинство витаминов, хотя в
некоторых витаминах проявляют потребность. Большинство
грибов не нуждается в рибофлавине.
Никотиновая кислота, пирилокенн, гс-аминобензойная и фолневая
кислоты необходимы некоторым видам плесневых грибов и многим
видам дрожжей.
ФЕРМЕНТАЦИЯ
Важнейшим требованием производства на стадии
культивирования является максимальное накопление нужного продукта и
полное использование питательных веществ среды. Для этого
необходимо обеспечить оптимальные условия роста микроорганизмов.
Кроме состава срецы под условиями роста подразумевают
температуру культивирования, значение рН, максимальный контакт
микроорганизмов с питательными веществами, удале^е продуктов
обмена, обеспечение клеток кислородом воздуха. Сложность
одновременного выполнения всех этих требовании вызывает
необходимость применения различных вариантов технологии
культивирования, каждый из которых имеет те или иные преимущества.
Применяются два принципиальных способа выращивания продуцентов
ферментов: поверхностный и глубинный. Оба способа
имеют различные видоизменения, касающиеся приемов и средств
обеспечения оптимальных условий культивирования. Как было
отмечено выше, основным преимуществом поверхностного способа
является возможность максимального контакта клеток
микроорганизмов с кислородом воздуха, чего нельзя сказать о глубинном
способе. По степени аэрофнльности продуценты ферментов могут
быть разделены на две группы. Одна из них— плесневые грибы —
Tpc6veT максимального обеспечения среды кислородом. Кроме того,
плесневые грибы подобно растениям хорошо развиваются в
условиях, когда часть нх тела, обеспечивающая организм питательными
веществами, погружена в питательную среду, а другая часть,
включающая репродуктивные органы, находится в воздушной
среде. Такие условия позволяют обеспечить поверхностный способ,
т. е. выращивание микроорганизмов на поверхности твердых, полу-
Ж1ИКИХ или сыпучих материалов.
Вторая группа лротуцептов ферментов— это бактерии и другие
микроорганизмы, способные интенсивно развиваться в условиях
глубинного способа культивирования, не обладающего преимуществами
219
в отношении контакта клеток с кислородом, но имеющего многие
другие технологические преимущества. Последние настолько
значительны, что глубинный способ применяют и для культивирования
строго аэробных микроорганизмов, какими являются плесневые
грнби н некоторые бактерии, хотя для этого пришлось
разрабатывав специальные методы аэрации, позволяющие максимально
насыщать среду кислородом. Однако эти методы требуют
дальнейшего совершенствования, и существующий способ глубинного
культивирования пока еще не может обеспечить всех преимуществ
поверхностного способа.
Поверхностный способ. Для роста продуцентов ферментов на
поверхности субстрата необходимо создать определенную
влажность воздушной части среды. Для нормального развития
плесневых грибов и накопления ферментов необходимо поддерживать
влажность в пределах 6U—70 %. Для интенсивного
спорообразования требуется меньшая влажность (порядка 40%). В процессе
культивирования влажность воздушной части среды может
значительно изменяться: уменьшаться в результате уноса паров с
циркулирующим воздухом или, наоборот, увеличиваться при
выращивании продуцентов в закрытой системе, например в колбе. Все это
может сильно влиять на метаболизм продуцентов и должно
учитываться в процессе производства. В условиях циркуляции воздуха
его относительная влажность должна составлять 96—100 %■
Окислительные процессы, происходящие в клетке
микроорганизма в аэробных условиях, сопровождаются выделением энергии,
часть которой аккумулируется в биологической форме в молекулах
макроэргическнх соединений, а неиспользованная часть ее
выделяется в виде теплоты. Выделение теплоты приводит к
значительному повышению температуры окружающей среды, что
отрицательно влияет на процесс культивирования. Оптимальная температура
культивирования плесневых грибов 28—30, бактерий—32—38°С.
Избыток теплоты можно удалять путем увеличения скорости
циркуляции воздуха в растильных камерах, однако это приводит к
интенсивному уносу паров воды и снижению влажности культуры,
что отрицательно сказывается на интенсивности роста
микроорганизмов, накопления ферментов и, кроме того, приводит к
нерациональному расходу воздуха. Все это вызывает необходимость
разработки специальных технологических приемов и конструкций
аппаратуры, позволяющих применять для циркуляции
паровоздушную смесь, отводить теплоту с помощью закрытых теплообменных
устройств и т. д.
Теплота выделяется на стадии интенсивного роста
продуцентов. Начальный период развития культуры — прорастание спор
ими конидии, наоборот, сопровождается поглощением теплоты и
снижением температуры окружающей среды. Это же наблюдается
но окончании роста минелия. Продолжительность этих стадий
роста может быть различной в зависимости от многих факторов,
полому для поддержания оптимальных условий необходим
строгий технологический контроль.
Процесс аэрации также требует тщательного регулирования в
зависимости от физиологической стадии развития культуры. В
период прорастания спор достаточно небольшой аэрации, поскольку
клетки не требуют большого количества кислорода и, кроме того,
на этой стадии нет необходимости отводить теплоту. На стадии
активного роста мицелия продуцент нуждается в интенсивной
аэрации, необходимой для обеспечения клеток кислородом, а также
для отвода теплоты и образующихся продуктов обмена. Если в
период прорастания спор для аэрации достаточно 4—5-кратного
обмена воздуха в час, то в период интенсивного роста
микроорганизмов необходима циркуляция 30—60 объемов воздуха на один
объем растительной камеры в час. Потребность кислорода в период
активного роста составляет около 8 м3 на одну тонну культуры
в час, что в перерасчете на воздух составит около 40 м3 при условии
полного потребления кислорода воздуха микроорганизмами.
Однако в действительности клетки микроорганизмов поглощают лишь
6—7 % содержащегося в воздухе кислорода. Следовательно,
потребность продуцента в воздухе составит около 600 м 3 на одну
тонну культуры в час. В реальных условиях производства с учетом
необходимого отвода теплоты с воздухом и других
непроизводительных затрат расход воздуха значительно превышает
потребность и достигает 22 000 м3/ч. При использовании других
способов отвода теплоты эта величина может быть снижена до
3000 м3/ч.
Максимальная интенсивность накопления ферментов начинается
по окончании стадии максимальной интенсивности роста культуры.
С физиологической точки зрения это означает, что расход
ферментов на процесс разложения органических веществ среды снижается
в культуральноп жидкости. В связи со снижением интенсивности
роста культуры уменьшается и потребность клеток в кислороде, что
позволяет в 3—5 раз снизить расход воздуха на аэрацию.
Продолжительность культивирования зависит от многих
факторов и слагается из продолжительностей отдельных стадии роста
микроорганизмов. Начальная стадия—прорастание спор—для
плесневых грибов составляет 10—20 ч. Приблизительно такая же
продолжительность стадии активного роста продуцентов. Ферменты
накапливаются в течение различного времени в зависимости ог
штамма микроорганизма и вида фермента. Периоды накопления
различных ферментов ие совпадают, поэтому общая
продолжительность этой стадии зависит от того, какой ферментный препарат
выпускает данное производство. Если микроорганизм образует в
данных условиях комплекс ферментов, то для достижения нужного
соотношения между активностью ферментов этого комплекса
необходимо более длительное время, поскольку в процессе синтеза
различных ферментов существует определенная
последовательность. Например, производственные штаммы вида Asp. oryzae —
продуценты различных ферментов — накапливают максимальное
количество амилаз за 21—30 ч. Образование протеолитических
ферментов начинается несколько позже, и период их максималь-
221
ного накопления смещается по сравнению с периодом
максимального накопления амилаз. Образование пектолитических ферментов
начинается еще позже, и для максимального их накопления
необходимо увеличивать длительность культивирования в 1,5 раза
по сравнению со временем, необходимым для максимального
накопления амилолитическнх ферментов (до 48 ч). Одновременно с
пектолитнческими ферментами начинается образование гемицеллю-
лазного комплекса, однако эти ферменты накапливаются
медленно, и процесс может затягиваться до 3 сут. Еще больше времени
(до 10 сут) требуется для накопления целлюлолитических
ферментов.
При поверхностном способе культивирования не требуется
регулирования рН культуральной жидкости, поскольку в строго
аэробных условиях при максимальном контакте клеток микроорганизмов
с кислородом органические вещества полностью окисляются до
углекислого газа и воды. Углекислый газ удаляется с
циркулирующим воздухом. Растворимые продукты метаболизма, которые
могли бы повлиять на значение рН, почти не образуются.
Первоначальное значение рН среды для плесневых грибов устанавливается
в пределах 4,5—5,0 с целью предотвращения развития посторонней
микрофлоры. При таком значении рН плесневые грибы хорошо раэ-
внваючся и синтезируют амилолитические ферменты. Протеолити-
ческне ферменты синтезируются грибами при более высоком
значении рП, близком к нейтральному. Бактерии же при низких значениях
рН развиваются плохо и не синтезируют ферментов.
Глубинный способ. Одной из задач, выполнение которой
представляет значительные технические трудности при глубинном
культивировании, является обеспечение максимального контакта
клеток с кислородом, распределение клеток микроорганизмов по
всему объему и постоянное их перемещение в жидкости. Это
необходимо для достижения наилучшего контакта клеток с
питательными веществами и отвода от клеток продуктов обмена. Контакт
клеток с кислородом обеспечивается пропусканием воздуха через
культуральнуго жидкость. Другие требования выполняются
перемешиванием. Аэрация и перемешивание отчасти являются
взаимозаменяемыми процессами: с одной стороны, в результате аэрации
происходит и перемешивание среды, с другой — в процессе
перемешивания культуральная жидкость смешивается с воздухом и
насыщается кислородом. В тех случаях, когда микроорганизмы
не требуют большого количества кислорода, например в процессе
микробиологической очистки сточных вод, одного из этих приемов
(аэрации пли перемешивания) может быть достаточно для
выполнения всех перечисленных выше требований, т. е. обеспечения
клеток кислородом, контакта их с питательными веществами и
отвода продуктов обмена. Однако в случае культивирования
продуцентов ферментов для создания оптимальных условий роста
клеток и потребления ими питательных веществ аэрацию и переме
шпвапне необходимо совмещать. Это связано с физиологическими
особенностями продуцентов и в значительной степени с высокой
К Л
концентрацией питательных веществ и необходимостью их полной
утилизации.
Главным фактором, определяющим пригодность аэрирующих
устройств, является количество растворенного кислорода,
обеспечиваемое этим устройством, вернее, избыточное количество
растворенного кислорода, если аэрации подвергается среда, в которой
культивируется микроорганизм. Избыточным оно называется
потому, что представляет собой разность между общим количеством
кислорода, растворяющегося в среде при данных условиях, и
количеством кислорода, потребляемого растущими
микроорганизмами. Эта разность может колебаться в пределах 1,0—3,0 мг/л. Очень
малое значение избыточной концентрации кислорода
свидетельствует о недостаточно интенсивной аэрации, а слишком большое —
о нецелесообразном перерасходе воздуха или слабой
интенсивности роста микроорганизмов.
Несмотря на многие преимущества глубинного способа
культивирования, его применение в производстве иногда встречает
затруднения. Например, если продуцент образует экзофермгнты,
т. е. ферменты, выделяющиеся из клеток в среду, осложняется нх
выделение нз культуральной жидкости. Если ферменты
накапливаются внутри клеток, выделение их облегчается, поскольку
отделение биомассы не представляет особых затруднении.
Как при поверхностном, так и при глубинном способе
культивирования накопление ферментов зависит от состава питательных
веществ среды, происхождения микроорганизмов и других
условий. При производстве а-амилаэы с помощью плесневых грибов
вида Asp. oryzae необходимо соблюдение следующих условий:
темпер«атуру культивирования поддерживать в пределах 30—
32 СС, количество воздуха — 30 м3 на I м3 аэрируемой жидкости
в час в период подготовки посевного материала и 40 м3 в час — во
время ферментации. Выращивание посевного материала длится
48 ч, процесс ферментации — 48—52 ч. Максимальная активность
амилолитических ферментов наблюдается на третьи сутки.
Оптимальное значение рН питательной среды — 6,0—7,0. Для
производства амилолитических ферментов глубинным способом может
быть использована зернокартофельная барда—отход спиртовых
заводов. При этом срок культивирования — 68—72 ч, расход
воздуха— 10—12 м3 на 1 м3 среды в час. Количество посевного
материала составляет 10 % объема питательной среды. В процессе
культивирования значение рН изменяется в пределах 5,5—6,0. В
данных условиях накапливаются амилолптические и декстрииолиги-
ческие ферменты, активность которых составляет соответственно
30—40 и 1300-1400 единиц на 100 мл.
Непрерывное культивирование осуществляется в батарее
ферментаторов, соединенных между собой так, что культуральная
жидкость перетекает из одного аппарата в другой, подвергаясь
сбраживанию.
Несколько иные условия глубинного культивирования
плесневых грибов Лзр. avvamori необходимы при производстве препарата
223
глюкоамилаэы. Производственный штамм продуцента во время
приготовления посевного материала растет при температуре
28—30 °С, рН = 7,0...7,2 в течение 48 ч. Затем осуществляется
производственное культнвнриьанне для накопления биомассы и
ферментов при температуре 30—32 °С в течение 52 ч и
более. При этом значение рН культуральной жидкости повышается до
7,6—8,0.
Для производства протеолнтичеекпх ферментов глубинным
способом применяются плесневые грибы видов Asp. oryzae и Asp. ter-
ricola. Последние обладают более высокой активностью.
Производственное культивирование рекомендуется осуществлять при
температуре 30 °С, pi 1 = 6,4 в течение 48 ч. При этом требуется до 60 м3
воздуха на I м3 культуральной жидкости в час.
Препараты неполитических ферментов получают с применением
плесневых грибов Агр. niger. В качестве посевного материала
может быть использована 24—48 часовая культура. Накопление
биомассы II ферментов продолжается 65—72 ч. Температура
выращивании посевного материала, как и в других случаях, несколько
ниже температуры производственного культивирования.
Из приведенных примеров видно, что режимы глубинного
способа выращивания продуцентов различных ферментов имеют
определенное сходство, н основными факторами, обусловливающими
образование того или иного фермента, являются описанные выше
различия в составе используемых сред, видовых особенностях
штаммов продуцентов. Для достижения максимальной активности
ферментов немаловажную роль играет режим выращивания:
температура выращивания посевного материала и производственного
культивирования, продолжительность культивирования, реакция
среды, количество воздуха, подаваемого па аэрацию, и др.
ВЫДЕЛЕНИЕ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Принципы выделения ферментов. Выделение ферментов
является одной из наиболее ответственных стадий технологии их
произведена. Это объясняется тем, что все принципы выделения
ферментов в той пли иной степени связаны с воздействием на культураль-
ную жидкость и, следовательно, на содержащиеся в ней ферменты
какими-либо внешними факторами. Если в процессе
культивирования создаются наилучшие условия для проявления активности
ферментов, то в процессе их выделения мы сталкиваемся с
трудноразрешимым противоречием между необходимостью воздействия
па ферменты неблагоприятными физико-химическими факторами
и максимального сохранения их активности. Сложная структура
белка, как известно, сильно подвержена воздействию различных
химических, физических и электрических факторов, вызывающих
его денатурацию н изменение натпвпых свойств. К ферментам это
отпоен 1ся в большей степени, поскольку все изменения в структуре
ич молекул отражаются прежде всего на функции активных
центров, что веает к потере ферментативных свойств.
W-i
Технология выделения ферментов, точнее получения
ферментных препаратов, зависит от назначения препарата. Например, для
использования ферментов в кормовых целях, т. е. в качестве
добавки в корм скоту, не требуются их выделение н специальная очистка
от примесей. Необходимо лишь сконцентрировать кулыуральную
жидкость для удобства использования и транспортировки. Наличие
примесей в ферментных препаратах не оказывает отрицательного
влияния на животных, а упрощение технологии выделения позволя
ет максимально снизить их стоимость, что является главным
условием успешного применения ферментов. В неочищенном виде
ферментные препараты могут использоваться и в некоторых
отраслях промышленности.
В производстве очищенных препаратов первой стадией
технологии очистки ферментов является отделение клеток микроорганизмов
от культуральной жидкости. Если ферменты содержатся в
клетках— эндофермснты— дальнейшей обработке подвергается
полученная биомасса, если ферменты накапливаются вне клеток —
экзоферменты — их выделяют из культуралыюй жидкости, если
ферменты распределяются между клетками и культуралыюй
жидкостью— обрабатываются оба компонента после их разделения.
Ферменты можно извлекать из клеток и непосредственно в куль-
туральной жидкости, после чего необходимо отделение шламма
(клеточных стенок) с последующей обработкой культуралыюй
жидкости.
Клетки микроорганизмов (или шламм) отделяют фильтрацией
или центрифугированием. Выбор способа зависит or особенностей
культуралыюй жидкости, которая подвергается обработке. При
выделении бактерий, например, применение фильтров
нецелесообразно, поскольку бактерии, имеющие малые размеры клеюк,
забивают поры фильтрующего материала. Клетки дрожжей имеют
более крупные размеры, однако они быстро автолизуклен, что
также осложняет процесс фильтрации вследствие забивания пор авто-
лнзатом и остатками разрушенных клеток. Культуральнаи
жидкость, содержащая плесневые грнбы, хорошо фильтруется, и этот
способ наиболее распространен в производстве ферментов.
Для выделения биомассы микроорганизмов из культуралыюй
жидкости широко применяется центрифугирование. Большое
значение при этом также имеют размеры клеток микроорганизмов.
Принцип разделения на центрифуге заключается в том, что под
влиянием центробежной силы увеличивается масса находящихся
в жидкости частиц, т. е. микробных клеток, и они перемещаются
в направлении действия центробежной силы. Чем больше размеры
клеток, тем значительнее увеличивается их масса под влиянием
иептробежн-iii силы и тем больше коэффициент разделения. Для
отделения мелких клеток необходимо создавать большую
центробежную силу. Современные достижения техники позволяют создать
центрифуги с очень большим числом оборотов (ультчацентрифуги),
способные отделять не только клетки микроорганизмов, но и
молекулы белковых веществ, в том числе и ферментов. Поэтому центри-
29 _ 2-1702
225
фуги применяются не только для отделения клеток и других
примесей or культуралыюй жидкости, но и на стадии дальнейшей
очистки Ферментов после их осаждения.
Независимо ог того, какой способ используется для выделения
ферментов, на первой стадии выделения получают раствор
ферментов, который за1ем подвергается концентрированию (сгущению).
Разработаны различные способы сгущения, по в основе
большинства их лежит принцип удаления влаги нагреванием
(упариванием). В результат воздействия на ферменты температуры
происходит их денатурация н снижается активность. Степень снижения
активности прямо пропорциональна температуре и времени ее
воздействия на ферменты. Так, при пятичасовом упаривании культу-
ралыюи жидкости при температуре 55 °С ферменты полностью
ннактнвируются, а при температуре 45 СС их активность снижается
на 50—75 %. Двухчасовое упаривание при температуре 45 °С
приводит к потере активности всего на 20%- Основными условиями,
обеспечивающими максимальное сохранение активности ферментов
в процессе упаривания, являются минимальная длительность
контакта ферментов с теплоносителями и минимальная температура
упаривания. Однако между этими величинами существует обратно
пропорциональная зависимость: при снижении температуры д„ти-
тельпость контакта с теплоносителем увеличивается, а уменьшение
длительности контакта влечет за собой повышение температуры.
Задачей технологии упаривания является создание условий, при
которых снижение значения одной из этих величин не приводило бы
к резкому увеличению значения другой. Одним из решений этого
вопроса является упаривание под вакуумом. Применение вакуума
позволяет снизить температуру кипения (упаривания), причем
резко снижается степень инактивации ферментов. Современная
аппаратура, работающая по такому принципу (вакуум—выпарные
аппараты), позволяет создать разрежение, при котором жидкость
кипит при температуре 30 °С (значительно ниже температура
инактивации ферментов). Это позволяет повысить температуру
упаривания и, следовательно, уменьшить длительность контакта
ферментов с теплоносителем. Резкое уменьшение длительности контакта,
в свою очередь, позволяет повышать температуру до значении,
которые в обычных условиях выше критических. В условиях
производства используются и другие методы интенсификации процесса
упаривания, например резкое увеличение площади испарения и
уменьшения толщины кипящего слоя (аппараты пленочного типа).
Растворы, содержащие ферменты, сгущают до различной
концентрации сухнх веществ (в пределах 10—40%) в зависимости от
конечной цели технологического процесса. Во многих случаях
полученный упаренный концентрат высушивают.
Процесс дальнейшего удаления влаги сопровождается
интенсивной инактивацией ферментов, поэтому требует применения более
совершенных методов. Oihhm из них является сушка распылением.
Высушиваемый материал с помощью специального приспособления
подвергается сильному диспергированмо, т. е. превращению в мель-
:"2j
чайшие частицы, и высушивается во взвешенном состоянии
нагретым воздухом, тазом или перегретым паром. Диспергирование
(распыление) происходит в верхней части аппарата, называемого
распылительной сушилкой. Диспергированные частицы опускаются
вниз навстречу теплоносителю, подаваемому в нижнюю часть
аппарата. Такой метод обеспечивает удаление влаги при мгновенном
контакте ферментов с теплоносителем, т. е. длительность
воздействия температуры на ферменты уменьшается до очень малых
величин (доли секунды). Этим способом можно высушивать
концентрированные растворы и натуральную культуральную жидкость,
хотя в последнем случае требуются значительные затраты
энергии.
Существуют методы получения высококонцентрнрованных
растворов или сухих препаратов ферментов без применения
повышенной температуры — ультрафнльтрацня, диализ, вымораживание,
сублимация, сорбция. Применяется комбинирование различных
методов. Прн получении высокоочищеиных препаратов обязательным
этапом является осаждение.
Метод ультрафильтрации основан на применении
полупроницаемой мембраны, способной пропускать воду и вещества
с небольшой молекулярной массой (примеси) и задерживать
молекулы ферментов. Процесс ультрафильтрацни осуществляется под
давлением. В принципе метод не отличается от обычной
фильтрации, но предъявляет высокие требования к качеству фильтрующего
материала, а также исходного раствора, предназначенного для
обработки. Последний должен быть тщательно освобожден от
взвешенных частиц во избежание забивания пор мембраны.
Близким к ультрафильтрации по принципу является метод
диализа, в котором также применяется полупроницаемая
мембрана. Различие состоит в том, что движущей силой процесса
фильтрации является не физическое давление, как в первом случае,
а разность концентраций веществ в растворах, находящихся по обе
стороны мембраны. Наибольшая разность концентраций создастся
при условии, когда по одну сторону мембраны находится
высококонцентрированный раствор, по другую — чистая вода. При этом
низкомолекулярные вещества диффундируют через поры в воду,
а ферменты остаются в исходном растворе. Во избежание
выравнивания концентраций веществ, ведущего к уменьшению движущей
силы фильтрации, по обе стороны мембраны создаются
противоположные потоки воды и раствора, омывающие поверхности
мембраны. Метод диализа применяется не для концентрирования
раствора, а лишь для освобождения его от примесей, поскольку при
этом вода не удаляется.
Процессы, основанные на применении полупроницаемых
мембран, эффективно используются для обработки растворов,
содержащих однокомпонентные ферменты. Двухкомпонентные ферменты
могут подвергаться значительной инактивации вследствие отрыва
и прохождения через мембраны нростетической группы или
металла, содержащегося в активном центре фермента.
227
Эффективным методом концентрирования ферментных
препаратов, позволяющим сохранить их активность, является вы мор а-
ж н в а и и е. Под действием низких температур денатурация белков
и инактивация ферментов не происходят. Технология этого
процесса сое гон г в замораживании раствора с последующим отделением
кристаллов льда центрифугированием. Вымораживанию
целесообразно нолнергагь растворы, предварительно сконцентрированные
другими методами. Потери ферментов в процессе вымораживания
происходят в основном от механических причин, например в
результате захвата ферментов льдом и механического увеличения их
частицами льда во время центрифугирования. В биохимическом
отношении активность ферментов не снижается. Наоборот, часто
суммарная активность ферментов возрастает, что можно объяснить
высвобождением некоторой части ферментов, находящихся в
"связанном состоянии с остатками клеточных структур или с другими
взвешенными частицами.
Для обработки ферментных растворов широко применяется
осажленне. Основная сложность — ликвидация гндратной
оболочки, поскольку для этого необходимо вводить в раствор химическое
вещество, которое, обладая высокими гидрофильными свойствами,
не должно действовать на ферменты. Снятие заряда
осуществляется значительно проще и во всех случаях является
дополнительным факюром осаждения. Для разрушения гндратной оболочки
в промышленности применяются органические растворители и соли.
В качестве оелдителен наиболее часто применяются спирты:
метиловый, этиловый, изопронпловым, а также ацетон. Хороший эффект
дают смешанные растворители.
Для осущестлепня процесса высаливания применяются
сульфаты аммония, натрия, цинка и хлорид натрия. С повышением
температуры интенсивность высаливания увеличивается. Большим
преимуществом метода высаливания является возможность
фракционирования ферментов, поскольку растворимость различных
ферментов соответствует различной концентрации солей
(различной степени насыщения раствора солями).
Для высушивания сконцентрированных и предварительно
очищенных препаратов применяется метод сублимации
(возгонки) замороженного раствора в вакууме без подогревания.
Поскольку вакуум не влияет на ферменты, то отсутствуют факторы,
отрицательно влияющие на их активность. Этот метод почти на
100 % сохраняет активность ферментов. Сущность его состоит
в том, что в аппарате, куда помещается раствор, создастся
глубокий вакуум. В условиях глубокого вакуума температура резко
снижается и жидкость замерзает. Образовавшийся лед под действием
иакуума сублимируется, т. е. переходит в пар, минуя жидкое
состояние. Этот метод можно применять и до! высушивания культу-
ралыюп жидкости, а также любых растворен, сп-держащих
ферменты. Однако обработка этим методом би.тыпнх объемов жнткогтн
встречает конструктив'!'."..- и экономические (атрудпешп. Поэтому
масштабы при icc.-hh ■■}"'"• '■'>vj;-ii<4ii\0H счип.н отрасх-пт.акле.-;
растворами ферментов, уже сконцентрированных другими
методами.
Выделение ферментов из концентрированных растворов может
осуществляться методом сорбции. Преимущество этого
метода заключается в том, что он является селективным
(избирательным) и позволяет ие только концентрировать, но и разделять
ферменты. Для этого достаточно подобрать соответствующий
сорбент. Наилучшие условия сорбции создаются при наличии сродства
сорбирующего материала к ферменту. Существует большое
количество сорбентов общего и селективного характера. Широко
распространены ионообменные смолы. Механизм сорбции ферментов
этими смолами основан на ионообменном процессе между белковыми
веществами и сорбентом. Сорбция за счет ионообменных процессов
может происходить на различных ионосодержащих материалах
(ионитах) органического и неорганического происхождения
(крахмал, целлюлоза, декстраи, карбоксиметилцеллюлоза, сефадексы,
алюмосиликаты — бентонит, селикагель, глауконит, кизельгур,
каолин, искусственные силикаты). В зависимости от характера
преобладающих ионов иониты могут быть кислыми (катиониты) или
щелочными (аниониты). Для выделения амилазы, например,
наилучшим сорбентом является специально обработанный
(модифицированный) крахмал. Он сорбирует только амилазу, для которой
является субстратом. Применяется для разделения амилаз и про-
теииаз.
После сорбции ферменты на ионите производится его
десорбция. Ферменты могут применяться в сорбированном виде. Метод
применения ферментов в сорбированном (прикрепленном на
поверхности сорбента) виде имеет большие перспективы
практического применения (иммобилизованные ферменты). Большим
преимуществом его является многократность использования
фермента. Применение ферментов в различных отраслях народного хозяй
ства в большинстве случаев связано с безвозвратной их утратой,
т. е. использование ферментов является однократным. Это
противоречит самой природе ферментов, которые, обеспечивая взанмодей
ствие веществ, не расходуются в процессе реакции. Многократное
использование ферментов на практике имеет большое
народнохозяйственное значение. Метод прикрепления ферментов на какой-
либо поверхности дает возможность повторного их использования.
Существует большое количество природных и искусственных
материалов, которые могут быть использованы в качестве поверхности
(матрицы) для прикрепления ферментов.
Механизм прикрепления к матрице сводится в основном к
взаимодействию функциональных групп белковых молекул и
материала, используемого в качестве сорбента (матрицы). Основным
качеством этих материалов является наличие максимального
количества функциональных групп, способных образовывать связи со
свободными карбоксильными, аминнымн, гидроксчльными и
другими группами белка, за счет которых происходит «пришивание»
ферментов к поверхности.
30 _ 2-1702
229
Амнлолнтическне препараты. На практике применяются амило-
лшнческне препараты различной степени очистки. Для их
получения могут быть использованы поверхностный и глубинный способы
культивирования. Из поверхностных культур, выращиваемых на
пшеничных огрубях, получают препараты со степенью очистки Пх,
ПЮх н П15х. В качестве продуцентов при поверхностном способе
производства амнлолитнческих ферментов используют плесневые
грибы н бактерии. Препарат Пх готовят непосредственным
высушиванием выросших культур. Для получения очищенных
препаратов культуры экстрагируют водой. Активность полученных
экстрактов — 35—40 ед. АС / мл. Экстракты очищают от примесей частиц
н микроорганизмов к упаривают до содержания 50 % сухнх
веществ, получая таким образом препараты со степенью очистки П2х.
Активность таких препаратов составляет 70—90 ед/г сухнх
ьеществ. Из этих препаратов получают более очищенные
ферментные препараты, применяя метод осаждения различными
растворителями. В зависимости от растворителя и условий осаждения
получают препараты различной степени очистки. Методом осаждения
этанолом получают препараты, содержащие смесь амнлаз к про-
тенназ с активностью по амилазе до 500 ед/г сухих веществ и
степенью очистки ПЮх. Препараты с такой же степенью очистки, но
более высокой активностью (до 600 ед/г сухнх веществ) получают
методом высаливания. Применяя метод фракционированного
осаждения, получают препараты, освобожденные от протеиназ степенью
очистки П15х и амилолитической активностью до 1200 ед/г сухих
веществ. Применяя для осаждения повышенные концентрации
спирта, получают осадок амнлолитнческих ферментов почти без
примеси протеиназ. Из этого продукта получают кристаллические
препараты а-амнлазы. Для этого его полностью освобождают от
протеиназ на бентоните, затем от пигментов (осветляют)
добавлением химических веществ в раствор препарата, осаждают
сульфатом аммония, вновь растворяют в воде, очищают от механических
примесей и подвергают диализу для полного удаления солей и
других ннзкомолекулярных веществ. Из полученного раствора,
освобожденного от солей, амилазу осаждают риванолом, отделяют
полученный осадок и освобождают его от риванола на бентоните.
Раствор охлаждают, осаждают амилазу ацетоном и кристаллизуют
из раствора ацетона. В результате получают кристаллический
препарат активностью около 180 тыс. ед. АС/г белка.
Поскольку сс-амилаза является металлопротендом, в процессе
очистки ее стабилизируют нонами кальция.
Аналогично получают высокоочпщенные препараты глюкоами-
лазы. Особенность технологии очистки чаще всего связана с
происхождением культур. Так, гриб Акр. awamori — продуцент глю-
коамнлазы — образует наряду с основным ферментом много фосфо-
рплазы и других ферментов, поэтому получение вмеокоочищенных
амнлаз из этой культуры значительно осложняется ввиду
необходимости освобождения продукта от посторонних ферментов. В
остальном режимы получения преларлуоа глюкоамнлазы не имеют прнн-
2L-0
цнпиальных отличий от режимов получения а-амилазы. Высокоочи-
щенные препараты глюкоамилазы имеют активность около 40 тыс..
ед/г белка.
При производстве ферментных препаратов глубинным способом
для практических целен можно использовать непосредственно
фильтрат культуралыюй жидкости, если условия применения не
требуют специальной очистки. Упариванием культуралыюй
жидкости получают препарат со степенью очистки Г2х, а при
дальнейшем высушивании па распылительной сушилке с наполнителем
можно получить более активные препараты со степенью очистки
ГЗх. Для получения высококонцентрнроваппых препаратов культу-
ральную жидкость концентрируют до 6—10 % сухих веществ, и из
полученного концентра га осаждением органическими
растворителями, солями и другими описанными методами получают
препараты со степенью очистки Г10х н Г15х.
Из культуральной жидкости, полученной с применением
продуцента В. subtilis, производят высокоочнщенпые кристаллические
препараты, которые используются в медицине. Существует
большое разнообразие методов очистки и кристаллизации амилолнти-
ческих ферментов, основная цель которых максимальное
освобождение от посторонних ферментов и сохранение активности
основного фермента.
Протеолнтические препараты. В промышленности нротеолитн-
ческие препараты получают как поверхностным, так и глубинным
способом. Для поверхностного выращивания продуцентов чаще
всего используют пшеничные огруби, для глубинного — среды
различного состава в зависимости от вида применяемых
микроорганизмов и других условий.
При использовании плесневых грибов максимальное
накопление протеолптпческнх ферментов совпадает со стадией
спорообразования, но во избежание резких нарушении правил охраны
труда нз-за массового появления спор в помещении культивирование
закапчивают в начальной стадии спорообразования.
Из полученной культуралыюй жидкости методом экстракции
и упаривания до содержания 50 % сухих веществ получают
протеолнтические препараты со степенью очистки П2х. Из экстрактов
методами осаждения растворителями и высаливания получают
очищенные препараты. Как и в случае получения амнлолитнческих
препаратов, протенназы наиболее полно осаждаются при
добавлении нзопропнлового спирта, однако нзопропнловый спирт
осаждает так же многие балластные вещества, которые препятствуют
дальнейшей очистке ферментов. Поэтому на производстве
используют в основном этиловый спирт.
В результате экстракции ферментов из поверхностных культур
получают раствор активностью 5—15 ед. ПС/мл (препарат Пх).
После концентрирования препарат со степенью очистки П2х имеет
прогеолнтическую активность до 100 ед/г. В резупьтате
осаждения этиловым спиртом получают препараты активностью 400 —
800 ец. ПС/г.
231
Варианты глубинного способа культивирования продуцентов
протестгическнх ферментов более разнообразны. Для получения
нейтральных и щелочных протеиназ применяют культуры
бактерий и актпномнцетов, для получения кислых протеиназ —
плесневые грибы. В качестве источника белковых веществ и
стимуляторов роста при глубинном- выращивании продуцентов протеиназ
используют биомассу дрожжей, метанобразующих бактерий (в виде
ВВК).
Концентрированные и очищенные препараты протеиназ
получают такими же методами, которые применяются в производстве
амнлолнгпчеекпх ферментов: упаривание до содержания 50%
сухих веществ дает препараты со степенью очистки Г2х,
высушиванием упаренного концентрата получают препараты со степенью
очнеткп ГЗх. Такие препараты содержат смесь различных
ферментов, п их используют там, где чистота препарата не имеет
особого значения, например в кожевенной промышленности.
Из концентрированных растворов ферментов получают
очищенные препараты методом осаждения этиловым спиртом или солями,
причем высаливание дает лучшие результаты. Высокоочнщенные
ферменты можно получшь методом сорбции на ионнообменнон
смоле. Затем из раствора, полученного в результате элюции
фермента буферной смесью (NH4OH-f-NaCl), фермент осаждают
сульфатом аммония и после дополнительной обработки и
освобождения or примесей получают высокоочнщенный протеолитическнй
препарат.
При получении очищенных протеиназ большое значение имеет
реакция среды, поскольку эти ферменты сохраняют активность
в определенных пределах значений рН, близких к нейтральной
реакции.
Протеолнтнческне ферменты не являются металлопротендами,
однако при наличии ионов алюминия, натрия, железа, кобальта
их активность попытается. Ионы тяжелых металлов — свинца,
ртути — ннактнвнруют нротеолитические ферменты.
В настоящее время в микробиологической промышленности
развивается производство узкоспецнфических протеолитнческнх
ферментов — заменителей ренннна (сычужного фермента).
Известно, что ферменты животного происхождения отличаются большой
специфичностью. Репнин вызывает разрыв только одной пептидной
связи в казеине, что приводит к скисанию молока, т. е. выпадению
в осадок сгустка казенна. Протеолнтнческне ферменты
микробного происхождения обладают более общим действием, вызывая
частичный прогеолнз казеина и ухудшая качество продукта. Тем
не менее среди микроорганизмов обнаружены продуценты,
образующие протеолнтнческне ферменты, близкие к ренпину.
Продуценты рсппиноПразующпх ферментов выращивают поверхностным
н глубинным способами. Мо.юкосвертыпающая активность
зависит от прироты продуцента, состава среты и многих других
условий. Для очистки фермента применяют методы экстракции, выса-
.".Ш'знн:!, сорбичл и др.
?:<■
В Японии получают фермент, близки» по свойствам к ренни
иу, с применением гриба Mucor pussulus. В СССР работали в этом
направлении с культурами плесневых грибов рода Aspergillus и
некоторых бактерий (В. mesentericus). В США такие препараты
получают с помощью плесневых грибов — паразитов пекоюрых
растений.
Пектолитнческне препараты. Микробиологическая
промышленность выпускает пектолитнческне препараты со степенью очистки
ПЮх, ПОх и полуочищенные препараты ГЗх. При выращивании
продуцентов поверхностным способом пектолитнческне ферменты
экстрагируют водой и осаждают из полученного раствора
этиловым спиртом. Длительный контакт с этиловым спиртом может
снизить активность ферментов. Отрицательно влияет также
высокая температура, поэтому осаждение проводят при температуре
2—5 "С. Активность препаратов, осажденных спиртом из
концентрата поверхностных культур (ПЮх), составляет 22 тыс. ед. ПкА/г
сухнх веществ и выше.
Культуральная жидкость, полученная при глубинном способе
выращивания, после фильтрации может подвергаться
высушиванию на распылительной сушилке, причем получается препарат со
степенью очистки ГЗх. Исходная культуральная жидкость может
обладать активностью 20—30 ед. ПкА/мл, а полученный из нее
препарат ГЗх содержит около 2 тыс. ед. ПкА/г сухнх веществ.
Из фильтрата культуралыюн жидкости метолом осаждения
изопропаполом, ацетоном пли высаливанием получают высокоочн-
щепные препараты Г 10х активностью от 3 тыс. до 9 тыс. ед. ПкА/г
сухнх веществ. Если после высаливания производят очистку
препарата от солен и других примесей методами диализа и гельфнльт-
рацни через сефадекс G-25, получают препарат активностью
30 тыс. ед. ПкА/г сухнх веществ.
Аналогично получают препараты пектолнтпческих ферментов
с применением культур анаэробных бактерий — CI. felsineum н др.
Из фильтрата культуралыюн жидкости на распылительной
сушилке получают препарат «Пектоклострндпн» ГЗх, а методом
осаждения— «Пектоклострпдин» ГЮх. Они имеют активность
соответственно 6 и 12,8 тыс. ед. ПкА/г сухнх веществ. Особенностью
препаратов из культур анаэробных бактерий является то, что в
анаэробных условиях образуются слабоактпвпые целлюлолнтнче-
ские ферменты. Это позволяет применять пектолитнческне
препараты в неочищенном виде для манерацпи льна.
Целлюлолнтическне препараты. Процесс ферментативного
гидролиза целлюлозы, а также весь комплекс целлюлолитнческнч
ферментов до конца не изучен. Хорошо известен фермент цел .л к) -
лаза, гндролизуюшпи 1,4-глюкппдпые связи в молекуле
целлюлозы, и фермент целлобпаза (р-глюкозитпза), расщепляющий дн-
еахарпд нел.тобпозу. Однако плтнппая клетчатка имеет сложное
строение кристаллическом решетки, п процессе образопап:ы которой
участвуют иочортные- сияй;, обнаружены и другие взаимодействия
атомных группгроя^к. Фермсн": нел.'молгз.ч не способен рлстцеп-
233
лять натнвную целлюлозу. Выдвинуто предположение, что в
процессе разложения природной целлюлозы участвует комплекс
ферментов. Вначале под действием особого фактора или нескольких
факторов нерастворимая патпвнаи целлюлоза превращается в
растворимую. Затем растворимая целлюлоза под действием целлю-
лазы гндролизустся до целлодекстрипов и целлобпозы. Последняя
разлагается целлобиазон, а низкомолекулярные декстрины
расщепляет экзоглюкопаза.
Большинство микроорганизмов, как известно, не способно
разлагать клетчатку. Имеются микроорганизмы, сравнительно хорошо
разлагающие модифицированную клетчатку, например
фильтровальную бумагу или специально обработанную целлюлозу. Однако
микроорганизмов, разлагающих натнвную клетчатку,
известно мало. Это сдерживает развитие производства всего комплекса
целлюлолитических ферментов. Наилучшими продуцентами их
являются плесневые грибы родов Triclioderma и Aspergillus. В
нашей стране работы в этом направлении находятся па стадии
лабораторных исследований и экспериментальной проверки. Большие
успехи достигнуты в Японии, где получают кристаллические
препараты целлюлазы.
Процесс культивирования плесневых грибов поверхностным
способом осуществляют так же, как и в случае получения других
ферментных препаратов. Основным компонентом среды являются
пшеничные отруби. Хорошие результаты дает добавление
свекловичного жома. Для выделения и очистки целлюлолитических
ферментов применяются те же методы, что и для других ферментов.
Глубинный способ культивирования продуцентов
целлюлолитических ферментов осложняется тем, что субстрат их действия
нерастворим в воде. Однако обнаружены микроорганизмы, у
которых индукторами образования целлюлолитических ферментов
являются крахмал, лактоза и другие источники углерода. Кроме
того, для приготовления сред можно применять специально
обработанные материалы, содержащие клетчатку. Таким образом, для
глубинного способа культивирования существуют сравнительно
хороню разработанные режимы и среды.
Из куль-гуральпой жидкости, полученной при глубинном
способе культивирования, может быть выделен весь комплекс
целлюлолитических ферментов методом Еысалнвания сульфатом
аммония. Для разделения комплекса ферментов применяются
различные метоаы: фракционирование с помощью солей, применение
иоипообмеппых смол, сефадексов и т. д.
Многие из микроорганизмов, способных к образованию
комплекса целлюлолитических ферментов, обладают способностью раз-
pvi-чать п гемннеллюлозы Гемнцеллюлазный комплекс включает
большое число компонентов, поэтому направленное получение
препаратов с преимущественным содержанием определенного
фермента чтого комплекса затруднено.
Глюкозооксилаза и каталаза. Ферментные препараты глюкозо-
окс!п;|."ш получают поверхностным и глубинным способами с по-
ТМ
мощью плесневых грибов видов Pen. vitale и Asp. niger. В СССР
разработан метод получения кристаллической глюкозооксндазы
(М. Ф. Гулый) из культуральной жидкости плесневого гриба Реп.
vitale Pidopl, et Bilai, образующейся в среде с глюкозой и
нитратом калия. При выращивании продуцента одновременно с глюко-
зооксидазой образуется другой фермент — каталаза. Соотношение
между этими ферментами можно регулировать составом среды.
Прн концентрации глюкозы в среде 10 % и нитрата калия 0,5—
1,0 % в культуральной жидкости образуется только глюкозоок-
сндаза. В среде с сахарозой продуцент глюкозоксидазы гидролн-
зует ее и потребляет только образующуюся глюкозу. При этом
отходы производства глюкозооксндазы могут служить источником
получения фруктозы.
При поверхностном способе культивирования преимущественно
образуется глюкозооксидаза, каталаза образуется в сравнительно
небольших количествах. В условиях глубинного способа
культивирования накопление каталазы значительное. Выход
фермента глюкозооксндазы при поверхностном способе составляет 40—
80, при глубинном — около 20 мг/л. Фермент глюкозооксидаза
выделяется из фильтрата культуральной жидкости методом сорбции
на оксиде алюминия. Фермент каталаза при этом не сорбируется,
что позволяет получить чистый препарат фермента
глюкозооксндазы. Из элюированного раствора фермент осаждается этиловым
спиртом прн пониженной температуре. Из осажденного продукта
фермент снова переводится в раствор ледяной водой, в которой не
растворяются соли, отделяемые затем центрифугированием. После
этого фермент осаждают ацетоном. Операции осаждения
ацетоном и растворения ледяной водой повторяют до полного
удаления солен, н полученный осадок высушивают методом сублимации.
Процесс производства каталазы основан на применении того же
продуцента, который используется для получения глюкозооксндазы.
Среда имеет такой же состав компонентов, но в другом
соотношении. Осуществление способа возможно благодаря
физиологической особенности продуцента Pen. vitale, заключающейся в том,
что изменение количественного соотношения источников углерода
и азота ведет к изменению количественного соотношения
образующихся каталазы и глюкозооксндазы. Преимущественное
образование каталазы происходит при содержании в среде 1,0%
глюкозы и 0,1—0,5 % нитрата калия.
В некоторых случаях целесообразно применять комплексный
препарат глюкозооксндазы и каталазы. Для получения такого
препарата рекомендуется использовать продуцент Asp. niger.
Характерной особенностью продуцента является внутриклеточное
накопление этих ферментов. Культивирование ведут в среде с мелассой
и минеральными солями. Источником азота при этом также
является нитрат калия.
После культивирования биомассу отчеляют. разрушают
мицелий, после чего фермент экстрагируют водой и осаждают нзопро-
пиловым спиртом. Полученный препарат содержит глюкозоокси-
235
дазу и каталазу в соотношении примерно равном 10:8. В
препарате содержится также инвертаза.
Препараты инвертазы. Источником инвертазы являются
дрожжи. Для нронзводства препаратов инвертазы используют отходы
пивоваренного производства — пивные осадочные дрожжи. В
зависимости от назначения производят различные препараты
инвертазы: очищенный фермент в виде порошка или
водно-глицеринового концентрата, в виде дрожжевого автолизата или сухих
дрожжей. Основными стадиями получения препаратов инвертазы
являются активация дрожжей, разрушение клеток, выделение
фермента и приготовление препарата. Дрожжи вначале очищают,
отмывают от примесей и сепарируют. Полученную биомассу
смешивают с сахарозой в отношении 1 :2 и активируют дрожжи при
температуре 45 °С в течение 2—3 ч. В результате получают сладкий
снроп активностью 100—300 ед. ИА/г, который используется под
названием универсального препарата.
Метод получения другого препарата в виде пасты заключается
в том, что суспензию, содержащую 5 % дрожжей, обрабатывают
ультразвуком для инактивации клеток, центрифугируют,
полученную дрожжевую пасту подвергают автолизу и смешивают с
поваренной солью. Полученный препарат—паста — имеет активность
около 500 ед. ИА/г.
Сухой препарат инвертазы получают высушиванием отмытых
клеток дрожжей на распылительной сушилке. Его активность
составляет 500—1500 ец. ИА/г. Для получения очищенного
препарата клетки дрожжей разрушают различными способами:
механическим (растнранне), термическим (автолиз), чередованием
процессов замораживания и оттаивания, ультразвуком или под влиянием
ядов (бензола, толуола, хлороформа). Разрушенные клетки
отделяют центрифугированием, н фермент осаждают этиловым
спиртом. Осадок отделяют центрифугированием и высушивают. Сухой
препарат имеет активность 15—20 тыс. ед. ИА/г. Однако при
хранении активность препарата снижается. Более стойкий препарат
получается, если осадок после обработки спиртом смешать с
глицерином (25% глицерина). Полученный водно-глицериновый
концентрат имеет активность 3—4 тыс. ед. ИА/г и может храниться
в течение нескольких лет.
ГЛАВА VII
ПРОИЗВОДСТВО КОРМОВЫХ ПРЕПАРАТОВ
БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
Многие продукты микробного происхождения производятся для
кормовых целей, т. е. для использования в животноводстве. К ним
относятся важнейшие биологически активные вещества:
витамины, аминокислоты, некоторые антибиотики. С этой же целью
производится так называемый микробный белок, т. е. биомасса мик-
230
роорганнзмов, состоящая примерно на 50 % из белка,
полноценного по аминокислотному составу для организма животного.
Производство кормовых биологически активных веществ с
помощью микроорганизмов имеет большое значение для решения
важнейшей народнохозяйственной задачи — развития животноводства,
главной задачи всемирной проблемы обеспечения человечества
продовольствием. По данным Всемирной организации
здравоохранения, менее одной трети населения земною шара обеспечено
достаточным количеством пищи. Следовательно, уже в настоящее
время необходимо утроить производство пищевых продуктов. Л
если учесть, что население земного шара удваивается за несколько
десятилетий, производство пищевых продуктов необходимо
развивать очень высокими темпами. Наиболее важными пищевыми
продуктами являются продукты, содержащие белок. Это объясняется
тем, что другие вещества — жиры, углеводы — в живом организме
могут взанмопревращаться н образовываться нз различных
соединении, а недостаток белка не может быть ничем восполнен,
поскольку незаменимые аминокислоты, входящие в состав белка, не
могут образовываться из других веществ. Человек в сретпем дол
жен потреблять 70 г белка в сутки. По данным ООП, в наиболее
развитых странах суточное потребление белка составляет 45—
50 г на человека, в развивающихся странах — всего 5—7 г.
Необходимо использовать все возможности для быстрейшего
увеличения производства полноценного белка для человека, т. е.
животного белка. Эго можно решить развитием животноводства. Основным
тормозом в развшип животноводства является недостаток
животных кормов. Существующие посевные площади не обеспечивают
достаточного количества кормов. Это связано с тем, что
растительный корм неполноценный по аминокислотному cociany. Для
роста животных, как н человека, необходим полноценный белок.
Однако белок растений содержит недостаточное количество
незаменимых аминокислот, поэтому не удовлетворяет потребностям
животных. В растениях ощущается большой недостаток лизина,
метионина и триптофана. Если в растительные корма добавлять
этн аминокислоты, животным потребуется значительно меньше
корма. Так возникла проблема производства незаменимых
аминокислот. В каждой стране эта проблема решается по-своему, но
общим для всех является то, что производство аминокислот основано
па применении микроорганизмов. Только с помощью
микроорганизмов можно получить нх быстро и в большом количестве. Однако
этим проблема обогащения растительного корма решается не
полностью. Оказалось, что растительные корма недостаточно хорошо
усваиваются еще и потому, что они бепны некоторыми
витаминами. Обнаружено, что добавление витамина А (или каротина) в
растительный корм резко ускоряет рост и размножение животных.
Аналогично действуют рибофлавин, витамин Bt2 и др. Особое
значение имеет витамин В.?. Он не содержится в растениях, но
является необходимым Для роста животных. Витамин В,? образуют
только микроорганизмы. У жвачных животных имеется особый
2?7
отдел желудка — рубец, в котором развиваются микроорганизмы,
образующие витамин В|2. Однако этого недостаточно для
удовлетворения потребностей организма. У нежвачных животных
микроорганизмы пищевого канала образуют очень мало витамина В[2,
поэтому такие животные остро нуждаются в этом витамине.
Витамин В,2 участвует в разнообразных биохимических
процессах, в том числе в процессе биосинтеза белка. Обогащение
растительных кормов витамином В,2 приводит к увеличению
продуктивности животных на 10 % и более. Такого действия не оказывает
никакой другой витамин, поэтому витамин В|2 называют
«фактором животного белка*.
На рост животных положительно влияет одновременное
добавление витамина В|2 и некоторых антибиотиков, например
биомицина.
Большое значение в животноводстве имеет применение
витаминов группы D. Животные ощущают недостаток этого витамина,
особенно в период, когда они пребывают в помещении и не имеют
достаточного контакта с солнечным светом. Это относится к
молодняку, который в результате этого страдает рахитом и гибнет
в большом количестве.
Большое влияние на усвояемость животных кормов имеют и
другие витамины, применение которых в животноводстве также
необходимо.
Кроме витаминов положительно влияют на рост животных
антибиотики. Большое распространение в этом отношении получил
биомицин. Во многих странах мира его производят специально
для применения в животноводстве. Используются и другие
антибиотики. При этом пет необходимости применять их в очищенном
виде. Наоборот, смесь веществ, образуемых продуцентами
антибиотиков, действует на животных лучше, чем чистые препараты.
Положительная роль антибиотиков заключается не только в
подавлении роста вредных микроорганизмов. Профилактическое
действие их, несомненно, имеет место, но антибиотики положительно
влияют па макрооргапизмы, стимулируя некоторые
физиологические функции животных.
Возможность улучшения питательной ценности животного
корма не ограничивается перечисленными биологически активными
веществами. Для обогащения кормов применяются также
ферменты. Особое значение имеет иеллюлаза. Растительные корма
содержат большое количество клетчатки, которая не усваивается
организмом животных. Решение проблемы превращения клетчатки в
доступные для организма углеводы имеет огромное
народнохозяйственное значение.
Все перечисленные вещества могут производиться только
микроорганизмами.
Кроме биологически активных веществ для обогащения
растительных кормов целесообразно применять и микробный белок, т. е.
cn\iv микробную биомассу, которая по аминокислотному составу
приближается к животному белку — содержит все незаменимые
238
аминокислоты. Микробный белок в дальнейшем будет источником
пищевого белка, т. е. белка для человека. В настоящее время уже
накоплен опыт получения пищевых белковых продуктов из
биомассы микроорганизмов. Однако массовое производство таких
продуктов— дело будущего. Сейчас необходимо обеспечить микроб
ним белком животных. Для удовлетворения потребности
животноводства в этом белке его потребуется большое количество, в
связи с чем возникает проблема сырья для производства микробного
белка. Микроорганизмы способны развиваться в самых различных
средах, не пригодных для развития других видов живых
организмов. Казалось бы, это дает большой выбор сырья для производства
микробного белка. Однако имеются и ограничения. Главное из
них — стоимость: сырье, как и микробный белок, получаемый на
этом сырье, должно иметь минимальную стоимость. Это относится
ко всем веществам, применяемым в животноводстве. Одни из путей
решения этого вопроса — использование для производства
микробного белка отходов промышленности и сельского хозяйства.
В настоящее время производство витаминов и аминокислот в
микробиологической промышленности занимает сравнительно
небольшое место. Промышленность выпускает препараты наиболее
важных из этих веществ, главным образом витамина Ви, каротина,
лизина и некоторых других. Масштабы эгих производств еще
недостаточно велики.
ВИТАМИНЫ
Витамины — биологически активные вещества, необходимые
для жизнедеятельности живого организма. Очень малые
количества витаминов сильно стимулируют биохимические процессы,
поэтому их, как и ферменты, называют биокатализаторами.
Основными источниками витаминов являются растения и микроорганизмы.
В организме животных они накапливаются из растительного
корма и благодаря жизнедеятельности микроорганизмов. В организм
человека витамины попадают с мясной и растительной пищей и
частично образуются микроорганизмами, обитающими в пищевом
канале.
Принципы химического строения витаминов настолько
разнообразны, что классификация их на основе структуры невозможна.
Витамины делятся но принципу растворимости на
жирорастворимые и водорастворимые.
Из жирорастворимых витаминов наибольшее значение в
народном хозяйстве и в микробиологической промышленности имеют
витамины групп Л и D. Группа А включает витамины At и А2. Они
СХОТ.НЫ по химическому строению и проявляют одинаковую
активность по отношению к человеку и животным, поэтому о них часто
говорят как об одном витамине.
К группе D относятся витамины D|, D2, D3, D4, D5, D6 и D7,
причем D| и D2 — один и тот же витамин. Витамины группы D, как и
предыдущие витамины, и организме животных образуются из пред-
шест печников. 3 данном случае предшественниками являются сте-
239
ролы. Наибольшее промышленное значение имеет эргостерол
дрожжей, из которых получают препараты витамина D2.
Водорастворимые витамины, или витамины группы В, имеют
разностороннее значение. Большинство их входит в состав
ферментов. Так, тиамин (витамин В|) в виде фосфорного эфира
является коферментом пируватдекарбоксилазы, рибофлавин
(витамин В2) входит в состав флавиновых дегндрогеназ, пантотеновая
кислота (витамин В3) является составной частью кофермента ацил-
трансфераз (КоА), никотинамнд (витамин В5) входит в состав
пиридиновых дегндрогеназ, пнридоксин (витамин Be) является
составной частью ферментов, участвующих в обмене аминокислот,
бнотин (витамин В7) входит в состав декарбоксилазы щавелево-
уксусной кислоты, фолневая кислота и цианкобаламин (витамин
В|2) участвуют в переносе одиоуглеродных радикалов.
Водорастворимые витамины широко применяются в медицине
для лечения авитаминозов. Некоторые из них имеют большое
значение как факторы роста в животноводстве и применяются в
качестве добавок в корм скоту. Наибольшее значение в этом
отношении имеют витамины В2 и В)2.
Микробиологический синтез различных витаминов имеет мало
общего в отношении состава сред, биохимической характеристики
продуцентов и химизма процессов их биосинтеза. Более того, для
производства одного и того же витамина применяют различные
питательные среды и продуценты. В процессе получения очищенных
или кристаллических препаратов витаминов есть общие стадии,
например отделение биомассы от культуралыюй жидкости,
экстракция, сорбция, элюнрование, кристаллизация. Эти стадии общие
для производства не только витаминов, но и всех биологически
активных веществ.
Витамин D2. Предшественники витаминов группы D — стеро-
лы — содержатся во всех живых организмах. Под влиянием
ультрафиолетового света они постоянно превращаются в витамины
группы D. При недостаточном пребывании животных на солнце
растительный корм необходимо обогащать препаратами,
содержащими витамины группы D. Одним из них является препарат
витамина Г)2.
Технология получения кормового препарата очень проста. Его
легко получить облучением дрожжей, причем эргостерол дрожжей
превращается в витамин D2. Механизм этого процесса известен. Он
заключается в разрыве одного кольца молекулы цнклопентанопер-
гпдрофенантрена:
Для облучения дрожжей применяются специальные
ультрафиолетовые лампы. Облученные дрожжи высушивают и в таком виде
240
применяют в качестве добавок в корм скоту. Такое производство
может быть организовано на спиртовых заводах. На некоторых
спиртовых заводах построены цехи по производству облученных
дрожжей для животных.
Каротин — источник витамина А. Витамин А — один из
наиболее необходимых для животных витаминов. Виивлены несколько
аналогов, из которых наиболее распространены витамины Ai и А2.
В растениях содержатся каротины, являющиеся прецшественннка-
ми (провитаминами) витамина А, причем количество их в
растительных продуктах невелико. Однако и этот каротин не может
быть использован молодняком, не способным еще к потреблению
растительной пищи. Небольшое количество витамина А содержится
в материнском молоке, которым питается молодняк, но этого не
хватает им для нормального развития. В витамине А испытывают
потребность и взрослые животные.
Витамин А в чистом виде не синтезируется ни растениями, пи
микроорганизмами. Он образуется только из карогнна под
действием фермента каротиназы В большом количестве он накаплива
ется в жире некоторых животных, особенно рыб. В печени
кашалота его содержится до 60 мг на один грамм жира. Однако добывать
витамин А из рыбьего жира можно лишь для медицинских целей,
где он расходуется в сравнительно небольших количествах.
Годовое производство витамина А из рыбьего жира в развитых странах
может составлять всего несколько тонн, а для удовлетворения
потребностей животноводства нужно несколько сотен тонн этого
витамина в год. Удовлетворение такой потребности возможно лишь
путем производства каротина, причем растения не могут быть
использованы для этой цели, поскольку их выращивание потребует
очень больших посевных площадей. В растительных продуктах
каротинов содержится всего 20—100 мкг/г. Производство большого
количества каротина возможно только микробиологическим методом.
По химической структуре витамины группы А могут
рассматриваться как изопреноиды (состоящие из четырех остатков
изопрена) или дитерпены. Различие в строении молекул витаминов At
и А2 состоит в количестве двойных связей:
Витамин А| Витамин А2
Циклическая часть молекул называется р-ионоиовым
к о л.ь цо м.
При соединении двух остатков витамина At с отщеплением двух
молекул воды образуется р-каротин (тетратерпен). Существуют
еще а- и у-каротицы, а также большое количество их производных,
объединяемых общим названием — к а рот и ной . ы. Однако при
гидролизе большинства каротнноидов в организме человека и
животных образуется лишь одна молекула витамина А, Только р-
31 - 2-1702
241
каротин превращается в две молекулы витамина А. В связи с этим
возникает вопрос подбора микроорганизмов, образующих
преимущественно р-каротнн. Это че единственное требование к этим
промышленным микроорганизмам. Необходимо, чтобы они, как и
другие микроорганизмы, применяемые для получения кормовых
препаратов, обладали способностью к росту в доступной дешевой
среде. Способ производства каротинов с помощью
микроорганизмов осложняется тем, что процесс накопления каротина в клетках
микроорганизмов требует определенных условий, несколько
отличающихся от тех, которые требуются для роста его продуцентов.
Если данная среда пригодна для роста продуцента, то это еще не
означает, что в иен будет хорошо накапливаться и каротин.
Каротин начинает накапливаться в клетках по окончании роста
микроорганизма. Производство каротина является как бы двухстаднйпым:
вначале накапливается биомасса микроорганизмов, затем
образуется каротин (стадия созревания). На каждой стадии должно
соблюдаться определенное количественное соотношение источников
углерода и азота. Количество азота в период роста должно
максимально удовлетворять потребностям клеток, однако в период
накопления каротина азотсодержащие вещества могут тормозить
процесс образования каротина. Углерода же в период роста клеток
и в период накопления каротина должно быть в избытке.
Существует способ производства каротина с использованием среды,
содержащей кукурузный экстракт, казеиновый гидролизат, глюкозу,
глицерин и другие вещества. Однако такой способ связан с
большими затратами. Для производства кормового каротина
рекомендуются другие, более дешевые среды, содержащие мелассу, отход
спиртового производства — мелассную барду, отходы гидролизных
заводов. В качестве сырья можно использовать отходы переработки
растительного сырья — овощей, фруктов. Растительное сырье
богато веществами, которые могут быть предшественниками
каротинов.
В связи с разнообразием сырья, которое можно использовать
для получения каротина, необходим и соответствующий подбор
микроорганизмов, способных развиваться в таких средах и
синтезировать каротин. В качестве продуцентов каротина в
искусственных средах, содержащих глюкозу и другие дорогостоящие
материалы, применяются микроорганизмы Blakeslea frispora, Neurospora
Krassa. Для получения каротина в среде из отходов производства
наилучшими продуцентами являются дрожжеподобные грибы рола
Rhodotorula. Они не являются наиболее активными по сравнению
с другими микроорганизмами, однако выгодно отличаются
неприхотливостью, способностью развиваться в среде из различных
отходов, что позволяет получать недорогостоящнй каротин для
животных. Результаты исследований, проведенных учеными разных
стран, показали, что эти микроорганизмы способны к росту и
биосинтезу каротина из углеволороаах нефти Показано, что наиболее
активными штаммами я этом отношении явлпются представители
вида Rhod. glutinis. Они накапливают в среде с нормальными па-
242
рафинами более 300 мкг каротинов на 1 г сухих веществ, причем
до 50 % образующихся каротинов составляет 0-каротин.
Накопление каротинов на углеводородах увеличивается при добавлении
этанола и мелассы. Ферментация обычно длится несколько суток.
Поскольку каротины — это терпены, то и синтез их идет по пути
биосинтеза терпенов. Вещества, являющиеся промежуточными
продуктами образования терпенов в живом организме или близкие
по свойствам к терпенам, могут быть использованы для ускорения
процесса образования каротинов. Поскольку терпены являются
ненасыщенными соединениями, некоторые вещества с
ненасыщенными связями также могут использоваться для увеличения выхода
каротинов. Так, положительно влияют на образование каротинов
жидкие жиры — хлопковое, оливковое масло, а также
ненасыщенные жирные кислоты, входящие в состав этих жиров,— олеиновая,
линолевая. Большой выбор предшественников и стимуляторов
образования каротинов имеется среди эфирных масел, которые по
структуре являются терпенами. Наличием эфирных масел
объясняется хорошее каротинообразование у дрожжеподобных грибов при
развитии их на отходах переработки растительного сырья.
Основные стадии химизма образования каротинов хорошо
изучены. Исходным продуктом биосинтеза каротинов является мевало-
новая кислота, которая легко синтезируется в организме из аце-
тил-КоА или другим путем. В результате фосфорилнрованпя и
дека рбокснлнрования мевалоновой кислоты образуется изопрен, две
молекулы которого конденсируются, в терпен — фосфорный эфир
гераниола. Последовательное присоединение к гераниолу двух
остатков мевалоновой кислоты дает дитерпен — фосфорный эфир ге-
ранилгераниола, из двух молекул которого образуется тетратерпен
фитони. Это основной предшественник каротинов. Из него в
результате превращений, заканчивающихся циклизацией и
образованием р-иоповых колец, синтезируются р-каротин и другие каротины:
Биосинтез каротикоидов
3 СНяСО-КоА
Ацетнл-КоА
(сНз
COOH-CHi-C-CHj-CH2OH
он
Мевалоновая _^
кислота Ц"'
®-®S==*rCHj-C=CH-CH2-©-(E)
СН2.
II 1
СН5-С-СН2-СН2
Иэопентшширофосфат Днметилаллилпнрофосфат
(изопрен) |
снь- с=сн—„сн2хсн2-с=сн-снг-®-ф
Геранилпнрофосфат (терпен)
31-
243
I" Изопентилпирофосфат
Гераинлгераиилоирофосфат
1дитерпен)
1* Димеризация
Фнтоии
(тетратерпен)
I
Каротнионды
Рибофлавин (витамин В2). Продуцентами рибофлавина
являются многие бактерии и грибы. Наиболее интенсивно образует
рибофлавин гриб Ereinolhecium ashbii. Некоторые представители рода
канлнда, ацетопобутнловые бактерии образуют значительные
количества этого витамина.
Производство рибофлавина с применением Ег. ashbii дороже,
чем с применением дрожжеподобных грибов. Для этого необходима
среда, содержащая в качестве источника азота молочную
сыворотку, бобы, рыбную муку, кукурузную муку или экстракт, соевую
муку, казеин. В качестве источника углерода применяются глюкоза,
сахароза, крахмал, пшеничная мука.
Культивирование микроорганизмов длится 30—40 ч. После
полного потребления углеводов начинается интенсивный синтез
рибофлавина. Этот процесс идет параллельно с автолизом клеток.
Для культивирования продуцентов рибофлавина необходима
аэрация.
Биосинтез рибофлавина стимулируется добавлением
ненасыщенных жирных кислот, насыщенные, наоборот, тормозят его
образование.
Развитие Ег. ashbii стимулируется добавлением биотина,
тиамина, инозита, ростовых веществ, содержащихся в зародыше зерен
пшеницы, картофельном соке и дрожжевом автолизате. Пиримнди-
новые и пуриновые основания являются предшественниками
образования рибофлавина и также могут быть использованы для
интенсификации его биосинтеза. Это аденин, гуанин, гипоксантин,
мочевая кислота. Наилучшим стимулятором является ксантин.
Для производства рибофлавина с применением Ег. ashbii
используются поверхностный и глубинный способы
культивирования. В оптимальных условиях этот продуцент
образует более 2 мг рибофлавина в 1 мл культуральной жидкости.
Рекомендовано также для производства рибофлавина применять
среду, содержащую 5 % сахара-сырца, 3 пептона, I пшеничных за
родышей, 0,3 мясного экстракта, 0,3 КН2Р04 и 0,25 % NaCI,
рН = 6,0, длительность культивирования 7 сут. В этих условиях
накапливается до 1,8 мг рибофлавина в 1 мл культуралыюй
жидкости.
2-11
Выделяют рибофлавин экстракцией из микробной биомассы
смесью пиридин — метанол — вода в соотношении 1:3:1. В связи
с автолизом и трудностью выделения биомассы витамин
можно экстрагировать непосредственно из культуральной
жидкости.
Существует способ производства рибофлавина с применением
других микроорганизмов, способных развиваться в простых средах.
Так, рибофлавин получают как отход при производстве ацетона,
где применяется микроорганизм CI. acetobutylicum. Этот отход
используют в животноводстве в качестве источника рибофлавина.
Если в процессе производства ацетона создать благоприятные
условия для образования рибофлавина без ущерба для выхода
ацетона (снизить до минимума содержание в среде железа, увеличить
концентрацию кальция и некоторых других минеральных солей),
то рибофлавин может накапливаться в значительном количестве.
Источником углерода может служить меласса или смесь мелассы с
мукой. Выход витамина при этом способе производства составляет
20—30, а при добавлении ксилозы — до 90 мкг/мл.
При производстве рибофлавина с применением дрожжеподоб-
ных грибов рода Candida в искусственной среде, содержащей
глюкозу или сахарозу, выход витамина может достигать 500 мкг/мл.
При использовании мелассы выход рибофлавина несколько
меньше, однако этот способ экономичнее.
Биосинтез рибофлавина идет через стадию образования азот
содержащих оснований — ксантина и диамнноурацила. При
взаимодействии последних с ацетоином образуется рибофлавин:
I ICOOl I
Wooh nm|JH л
со, о о
Ксантин Производное
дидминоурацила
ш
Препараты цианкобаламина (витамина В,2). О роли цианкоба-
ламнна в жизнедеятельности человека и животных говорилось
выше. Вопрос его микробиологического производства занимает особое
место, поскольку этот витамин не образуется ни растениями, ни
животными организмами.
По химической структуре это группа аналогов, обладающих
примерно одинаковой активностью по отношению к человеку и
животным. Главным -из них является цнанкобаламнн, пли истинный
витамин В)2.
Цнанкобаламнн состоит из порфирипового производного, свя>
запного с пуклеотидом и кобальтом:
"""■р чк' Аиетоин
«- РиЛпфлзвии.
- 32 _ 2-1702
245
NHS CO-NH2 NHj CO-NH2
CO CH2 rH CO CH,
1 I CH3 1 1
СНз СНз I Cffc CH2
Азотистым основанием в иуклеотидиой части является диме-
тилбензимндазол. Известно много производных витамина В|2, среди
которых имеются активные и неактивные формы по отношению
к человеку и животным. Производное витамина Bi2, содержащее
вместо цианистой группы гндроксил, называется оксикобаламнном
(витамин В|2о). Если одна из метильных групп молекулы диметил-
бензимидазола замещена гидроксидом, образуется производное,
называемое фактором III. Оба производных обладают такой же
активностью, как и цнанкобаламин. Порфириновая часть витамина
В(2 (без нуклеотида) называется фактором В. Если диметилбензн-
мидазол заменен другим азотистым основанием — аденином,
гуанином и т. д., получаются производные, называемые
псевдовитаминами. Как фактор В, так и псевдовитамины не активны по отношению
к человеку и животным, а по отношению к микроорганизмам
проявляют витаминную активность.
Производство препаратов витамина Bt2 — это один из немногих
примеров использования различных микробиологических процсс-
246
сов для одной и той же цели. В основе технологии производи ва
препаратов витамина Вылежат анаэробные процессы — пропноио-
вокислое и метановое брожение, а также аэробный процесс
жизнедеятельности микроорганизмов, в частности актиномицстов. В то же
время процесс образования витамина В)2 в большинстве случаен
связан с процессом роста и накопления биомассы клеток
микроорганизмов н в меньшей степени зависит от процесса образования
пропиоиовой кислоты, метана и других продуктов брожения пли
аэробного окисления. Поскольку указанные типы брожений не
только лежат в основе производства препаратов витамина В|2, но
используются и для других целен, их химизм и общие особенности
технологии рассмотрены отдельно (см. гл. V). В данном разделе
рассмотрены вопросы, связанные непосредственно с биосинтезом
витамина В|2 и условиями его накопления в культуральной
жидкости и клетках микроорганизмов.
В зависимости от назначения существуют различные способы
получения препаратов витамина В)2. По назначению бывают
медицинские (очищенный, кристаллический) и кормовые (неочищенный,
в виде биомассы клеток микроорганизмов) препараты. Различие в
способах получения кормового и медицинского препарата
витамина В|2 заключается в составе сред и природы продуцентов. Для
выделения кристаллического препарата необходимо, чтобы в
культуральной жидкости содержалось много витамина В)2 и минимальное
количество побочных продуктов, в том числе его неактивных
аналогов, усложняющих процесс выделения продукта. Необходим
подбор продуцентов, соответствующих этим требованиям, а также
специальные среды, содержащие дорогостоящие компоненты — угле
воды и предшественники нужных форм витамина Bt2. Существова
ние различных способов производства препаратов витамина Ъ12
обусловлено также исторически сложившимися причинами.
Впервые этот витамин получили из продукта животного происхождения—
печени, где он образуется в результате жизнедеятельное!и
микроорганизмов. Затем было установлено, что этот витамин образуется
микроорганизмами, и его продуценты выявлены среди промыныен
ных штаммов, применяемых для производства других продуктов,
например антибиотиков. Это дало возможность разработать способ
получения препаратов витамина В)2 из отходов производства
антибиотиков. Как выяснилось позже, некоторые антибиотики могу!
с таким же успехом применяться в животноводстве, как и витамин
В|2, после чего был разработан способ производства комплексного
препарата, содержащего антибиотик биомицин и витамин В|2,
который называется «Биомицин кормовой витаминизированный» (Г>КВ)
С открытием новых, более активных продуцентов витамина В,г
оказалось целесообразнее вести направленное производство
кристаллических препаратов витамина, чем использовать отхолы
производства антибиотиков. Среди многих продуцентов предпочтение
отдано пропионовокислым бактериям как наиболее активным
микроорганизмам в отношении количества и качества синтезируемого
витамина. Развитие производства препаратов витамина Вц с по-
32-
'Ш
иощыо пропноновокпслых бактерий показало, что выделение
кристаллического препарата из культуральнои жидкости целесообразно
лишь в том случае, когда концентрация его после культивирования
является сравнительно высокой (5—Ю мкг/мл и выше). Культу-
ральиую жидкость с низкой концентрацией витамина рационально
использовать для получения неочищенного кормового препарата.
Так на одном и том же производстве появилось два варианта
технологии—получение кристаллического и кормового препаратов
витамина Bt2 с помощью пропиоиовокислых бактерий.
В связи с успешным применением кормового препарата
витамина В|2 потребность животноводства в нем возросла и появилась
необходимое гь поиска новых, более дешевых источников и сред
для увеличения его производства. Было обнаружено, что витамин
13,2 в значительном количестве накапливается в активном иле,
образующемся в процессе очистки сточных вод, особенно в
анаэробных услоппнх, т. е. в процессе метанового брожения. Это облегчило
задачу поиска дешевых способов, поскольку метановое брожение
может осуществляться на отходах самых различных производств.
После испытаний различных отходов разработаны способы
получения кормового препарата витамина Bi2 на основе метанового
брожения отходов спиртового и ацетонобутилового производства.
Так решена проблема микробиологического производства
кормового it медицинского препаратов этого важнейшего витамина.
Получение препаратов витамина Bt2 с
применением а к т и н о м и цето в. На многих предприятиях
спиртовой промышленности изготовляют комплексный кормовой
препарат, содержащий антибиотик биомицин и витамин Bt2 (БКВ). В
качестве продуцента используют отселекционированный
высокоактивный штамм Actinomyces aureofaciens. Этот микроорганизм почти
одновременно накапливает биомицин и витамин В|2. Наибольшая
интенсивность процессов наблюдается по окончании роста
культуры. Одновременное образование биомицина и витамина Bt2
позволяет получить максимальный выход этих продуктов.
Актиномицеты способны потреблять углерод различных
источников. Наилучшим компонентом среды для образования
антибиотика является крахмал. Объясняется это тем, что в присутствии
более легко потребляемых углеводов, например глюкозы, очень
быстро заканчивается процесс роста культуры и резко сокращется
период образования антибиотика. Для создания условий
максимального накопления антибиотика и, следовательно, витамина Bt2,
необходимо готовить среду па основе источников углерода,
медленно потребляемых микроорганизмом. В качестве последнего кроме
крахмала может быть использована сахароза. Наилучшим
источником азота и ростовых веществ является кукурузный экстракт. Для
упелнчення интенсивности образования витамина Bt2 необходимо
добавлять в среду соли кпбальтя (лучше rtcero нитрат кобальта)
Концентрация нитрата кобальта должна находиться в пределах
0.12—0.0Г) мг%, повышенное его содержание пнгнбнрует процесс
обрат.тзипя пиичпна В|2 к биомицина.
2-J»
Полученная культуральная жидкость фильтруется, биомасса вы
сушнвается и в таком внле используется как добавка в корм скоту.
Существует способ направленного биосинтеза витамина В)2 с
помощью специальных штаммов актииомпцетов, образующих
преимущественно витамин В|2 без антибиотика. Для направленного
получения витамина В)2 применяется штамм актнномнцета,
принадлежащий к виду Act. olevaceus. Основными компонентами
среды для культивирования этого штамма являются кукурузный
экстракт, крахмал, гидрол. Можно использовать глюкозу. Источником
азота являются соли аммония. В среду добавляются соли
кобальта, а в качестве нейтрализатора — мел.
В процессе культивирования вначале накапливается биомасса,
а затем витамин В)2. Интенсивно образуется витамин в период,
когда процесс роста клеток в основном закончен. В период
интенсивного роста клеток субстрат потребляется быстро, что
сопровождается образованием кислот и снижением рН до 6,5—6,8. По
окончании роста клеток в период интенсивного.образования витамина
рН повышается до 8,2—8,7 в результате потребления кислот и
аммонификации органических и минеральных соединений азота.
Повышение интенсивности аэрации обусловливает увеличение
концентрации витамина Bt2. Интенсивность накопления витамина В|2
при этом выше, чем интенсивность накопления биомассы. Процесс
накопления витамина Bt2 актиномицетами в таких условиях
находится не в прямой зависимости от роста биомассы.
Для повышения интенсивности образования витамина Bi2 в
среду добавляют соли кобальта. Добавление предшественника —
5,6-диметилбеизимидазола в данном случае на выход витамина Bt2
влияет не существенно.
Актиномицеты культивируют в течение 72—96 ч при
температуре 28—30 °С. Полученная культуральная жидкость используется
для производства препаратов витамина Bt2.
Получение препаратов витамина В,2 с
применением пропионовокислых бактерий. Для
выращивания пропионовокислых бактерий источником углерода служит
глюкоза, источником ростовых веществ — кукурузный экстракт или
дрожжевой автолизат (два последних являются и источниками
азота). В качестве минеральной соли азота добавляется сульфат
аммония. Присутствие солей кобальта обязательно. На выход
витамина Bi2 в данном случае сильно влияет наличие в среде 5,6-лнме-
тнлбензимидазола. Процесс культивирования длится ло 120 ч.
Витамин образуется в основном впутрпклеючно. Характерно, что
витамин В|2 в клетках пропионовокислых бактерий накапливается
главным образом в молодом возрасте, в интенсивно
размножающейся культуре и находится в прямой зависимости от интенсивности
образования биомассы клеток. Для производства препаратов
витамина В|? целесообразно применять непрерывный процесс брожения,
который позволяет длительное время поддерживать культуру на
стадии Bi.K.-iKofi физиологической активности. Однако процесс иро-
пиоповокислого брожения подвержен влиянию инфекции, которая
249
резко снижает выход витамина. Чтобы приблизиться к оптимальным
условиям, осуществляют порционный ввод глюкозы в среду в
процессе ферментации, в результате чего наблюдается интенсивный
рост биомассы в течение исего процесса ферментации.
Высокая требовательность пропноновокиелых бактерий к
условиям культивирования вынуждает применять дорогостоящую
аппаратуру из нержавеющей сгалп, тщательно стерилизовать среду и
предпринимать другие меры, усложняющие производство.
Проппоновокнслые бактерии развиваются в нейтральной среде.
Наиболее интенсивно витамин В)2 образуется при рН = 6,8... 7,2,
поэтому в процессе культивирования среду нейтрализуют мелом.
Проппоновокнслые бактерии лучше образуют витамин В|2 в
анаэробных условиях, тогда как клетки могут расти как в
аэробных, так и в анаэробных условиях.
Па синтез витамина В12 отрицательно влияют ионы цинка.
Существенно снижают выход витамина Bi2 соли марганца. Ингнби-
рующее действие марганца объясняют его восстановительными
свойствами, т. е. способностью окисляться.
Получение препаратов витамина В12 с
применением метанового брожения. С тех пор, как стало
известно, что болотный нл и' ил, образующийся в результате
гниения нечистот, богаты витамином В|2, появились предложения
использовать ею в качестве источника этого витамина. Наиболее
реальным сырьем является активный ил, образующийся в
результате метанового брожения осадка сточных вод и используемый во
многих странах как удобрение. В некоторых странах, например в
США, где имеется достаточное количество такого сырья, оно стало
источником получения препаратов витамина В,2. Можно также
направленно получать препараты этого витамина, используя процесс
метанового брожения, а в качестве сырья — отходы различных
производств. Впервые направленное получение препаратов
витамина В,2 с использованием процесса метанового брожения
осуществлено в Японии, однако стоимость нх в условиях Японии оказалась
выше стоимости препаратов витамина Bi2, производимых в США
нз осадка сточных вод. У нас применяются два способа получения
нренараюв вшамнна В12: пропноновокислое брожение для
производства кристаллического препарата и направленное метановое
брожение, позволяющее получать дешевый препарат для кормовых целей.
Для осуществления процесса метанового брожения
используется три вида сред: отходы аиетопобутнловых заводов (аистоно-
бутнловая оарла), отходы мелассно-спнртового производства (ме-
лассно-спнртовая барда) и отходы производства кормовых
дрожжей на мелассно-спнртовой барде (вторичная мелассная барда).
О химическом составе этих сред было сказано выше (см. гл. V).
Все эти отходы используются непосредственно без предварительной
подготовки.
Вопрос о том, какие микроорганизмы являются продуцентами
пи га мина Bi2 при этом способе производства последнего, еще
недостаточно хорошо изучен. Несомненно, что продуцентами витами-
SSO
на Bi2 являются возбудители процесса метанового брожения,
однако нельзя утверждать, что любой возбудитель процесса метанового
брожения — продуцент витамина В12. В процессе метанового
брожения принимают участие ассоциации микроорганизмов,
видовой состав которых может быть различным в зависимости от
химического состава сбраживаемых сред и даже в одной и той же
среде при различных физико-химических условиях
культивирования. Не все микроорганизмы, участвующие в процессе
метанового брожения, в одинаковой степени являются продуцентами
витамина В|2. Исследования бактерий, изолированных из
смешанных культур, под влиянием которых осуществляется процесс
метанового брожения при производстве кормового концентрата
витамина B(2 на мелассно спиртовой барде, показали, что все
основные их виды, проявляющие наибольшую активность в этом
процессе, способны к образованию витамина В)2. Однако эта
способность у различных бактерий неодинакова. Так, некоторые
бактерии, относящиеся к группе гнилостных микроорганизмов
(Ps. fluorescens, В. putrificus), образуют соответственно 45—25 мкг
витамина В|2 на 1 г сухой биомассы, а бактерии М. omelianskii,
которые принято считать истинными возбудителями процесса
метанового брожения, синтезируют его до 10 мкг/г. Один из
микроорганизмов, известный как возбудитель метанового
брожения — CI. Kluyveri, обнаруживает наибольшую способность к
образованию витамина В|2 — до 120 мкг/г. Этот микроорганизм имеет
многие признаки, характерные для представителей группы
гнилостных бактерий. Все сказанное свидетельствует о том, что
физиологической группе гнилостных микроорганизмов
принадлежит важная роль в процессе образования метана н витамина В(2.
Об этом свидетельствует и то, что добавление в среду веществ,
являющихся наилучшими источниками питания для гнилостных
бактерий (белков, аминокислот, спиртов, молочной н других
кислот), приводит к повышению интенсивности процессов метанового
брожения и образования витамина Bi2. Кроме того, исследования
показали, что гнилостные бактерии способны осуществлять процесс
метанового брожения.
В основе способов получения различных вариантов кормового
препарата витамина В|2 нет существенных различий. Метановое
брожение во всех случаях осуществляется непрерывным способом.
Особенность процесса — большая длительность. При
периодическом способе этот процесс начинается очень медленно. Особое
значение имеет количество посевного материала. При обычном
(1 : 10) соотношении объемов посевного материала и среды,
принятом в микробиологической практике, очень сильно затягивается
начальный период, и термофильное брожение длится около 20 сут,
а мезофнльпое еще дольше. Поэтому осуществление этого
процесса непрерывным способом имеет большое практическое
значение. Непрерывное брожение позволяет сократить начальный
период до mhhhmvm.i и осчшествлять процесс г относительно высокой
скоростью. Скорость непрерывного брожения для различных сред
2-31
несколько различна. Сбраживание ацетонобутиловой барды идет
со скоростью протока среды, соответствующей 15—20 %
вместимости метантенка в сутки, что при периодическом процессе
составило бы 5—7 сут. Мелассно-спиртовая барда сбраживается более
медленно, и скорость протока соответствует 10 % вместимости
метантенка в сутки (10 суточное периодическое брожение).
Объясняется это тем, что мелассно-спиртовая барда имеет более
высокую концентрацию органических веществ, что требует более
длительного времени для их полного разложения. Имеет значение
и степень усвояемости веществ среды. Ацетонобутнловая барда
в этом отношении имеет некоторые преимущества. Скорость
сбраживания вторичной мелассной барды почти вдвое превышает
скорость сбраживания мелассно-сппртовой барды, поскольку
концентрация сбраживаемых веществ во вторичной барде почти
вдвое ниже.
Метановое брожение, как и некоторые другие процессы,
принято делить па термофильное и мезофильное. Для резкого
разграничения этих процессов нет оснований, поскольку они
осуществляются одними и теми же микроорганизмами. Различие состоит в том,
что в условиях мезофильного брожения (37°С и ниже) способно
развиваться большее количество микроорганизмов, чем в
условиях термофильного. В некотором отношении это может давать
определенные преимущества. Среди возбудителей процесса
метанового брожения встречаются микроорганизмы, интенсивно
образующие витамин Bi2, но слабо развивающиеся при высокой
температуре. Однако при оценке факторов, способствующих
интенсификации процесса производства препаратов витамина Вц,
необходимо учитывать, что при переходе на мезофильныи режим скорость
сбраживания уменьшается в два-три раза.
Процесс метанового брожения во всех средах, используемых
для производства препаратов витамина В|2, идет при рН > 7,0.
При малой скорости сбраживания и высокой концентрации
азотсодержащих веществ значение рН может повышаться до 9,0 и более.
Значение рН является важным показателем метанового брожения.
При рН < 7,0 метановое брожение нарушается, т. е. происходит
неполное окисление органических веществ с образованием
продуктов полураспада. Кислая реакция среды неблагоприятна для
восстановительных процессов, в том числе для процесса образования
метана. Однако дело, вероятно, не только в этом, поскольку
искусственная нейтрализация среды не возобновляет нарушенного
процесса метанового брожения. Это возможно лишь при снижении
скорости протока среды. Очевидно, для осуществления процесса
метанового брожения необходимо соблюдать равновесие между
скоростью окисления (дегидрирования) и скоростью
восстановительных процессов. Равновесие достигается изменением скорости
протока. Естественное значение рН при этом устанавливается
больше 7,0. Искусственное уменьшение значения рН тормозит
процесс образования метана, однако это не означает, что
искусственного его повышения достаточно для осуществления процесса.
25;.'
Высокое значение рН является скорее показателем (следствием
нормального процесса метанового брожения, чем его причиной
Это дает возможность использовать этот показатель для контроля
и регулирования процесса метанового брожения, высокое значение
рН позволяет увеличить скорость протока среды, низкое
свидетельствует о необходимости ее снижения.
Процесс метанового брожения при производстве препаратов
витамина В)2 характеризуется активным потреблением аминокис-
СН4, мл/л
в сутки аминокислоты,
Nopr. мг% белки, г/л
Летучие
кислоты
8 10 12 14 16 18 20 24 Время, сут-
Рис. 30. Динамика потребления веществ в процессе метанового брожения
лот и других органических азотсодержащих соединений.
Органические кислоты потребляются несколько медленнее. Потребление
питательных веществ сопровождается накоплением определенного
количества низших жирных кислот — обычных продуктов
анаэробных процессов. Рассматривая динамику потребления веществ в
периодическом процессе (рис. 30), можно наблюдать резкое снижение
концентрации аминокислот и других азотсодержащих веществ. Если
в среде содержатся углеводы, они потребляются в первую очередь,
однако содержание их допустимо лишь до определенных пределов,
выше которых возможно нарушение процесса метанового брожения
вследствие интенсивного превращения их в кислоты. В
непрерывном процессе нельзя наблюдать потребление веществ и образование
продуктов в динамике, поскольку при этом создается равновесие
между поступлением веществ в бродильный аппарат и их
потреблением, чем и определяется скорость протока среды при непрерывном
брожении. При этом необходимо соблюдать основное условие
непрерывного процесса—равенство удельной скорости роста клеток
и скорости разбавления.
Процесс метанового брожения на производстве
контролируется не только по значению рН. Решающую роль этот параметр,
253
как уже отмечалось, играет тогда, когда процесс смещается в
сторону образования кислот. Высокое значение рН ие
препятствуют процессу брожения. Однако н в этой зоне рН имеет
оптимальное значение, определяемое степенью потребления субстрата,
которая должна быть максимально возможной. Если потребление
субстрата закончилось, а период выдерживания культуры
продолжается, наступает автолиз клеток, и рН культуральной жидкости
повышается. Следовательно, период выдерживания культуры
должен быть ограничен максимальным потреблением субстрата.
Значение рН, соответствующее максимальному потреблению
субстрата, и является оптимальным. Дальнейшее повышение рН
культуральной жидкости нецелесообразно. Оптимальное значение
рН в каждом конкретном случае устанавливается
экспериментально. Для сбраживания указанных сред рН = 7,5 ... 8,0.
Совершенно очевидно, что для рассматриваемого
производства более правильно было бы связывать оптимальное значение рН
с максимальным накоплением витамина В|2, однако между этими
величинами нет четкой взаимосвязи, а максимальное потребление
субстрата примерно соответствует максимальному накоплению
витамина В|2.
Следует отметить, что точное определение максимального
снижения концентрации потребляемого субстрата на производстве
весьма затруднительно, поскольку необходимо определять
концентрацию каждого из веществ, присутствующих в среде. Вместо этого
на практике определяют суммарную концентрацию веществ по
сахарометру или методом высушивания. Разумеется, описанные
методы никогда не дадут нулевых значений концентрации даже
при полном потреблении органических веществ, поскольку в среде
остаются минеральные соединения. Значения концентраций,
получаемые этими методами, которые соответствуют полному
сбраживанию веществ среды, устанавливаются в каждом конкретном
случае экспериментально. Так, первнчая спиртовая барда до
сбраживания содержит в среднем 8—9 % сухих веществ по
сахарометру. Максимальное потребление органических веществ в
процессе метанового брожения соответствует концентрации оставшихся
сухих веществ 4,5—5,0 % по сахарометру. Показания обусловлены
наличием в среде минеральных веществ и небольшого количества
продуктов обмена, главным образом уксусной и некоторого
количества других низших жирных кислот (до1,0%). При
сбраживании вторичной меласспой барды, начальная концентрация которой
соответствует примерно 5 % по сахарометру, этот показатель
уменьшается до 2,5—3,0 %. Низших жирных кислот содержится
до 6 г/л (0,6%), остальное—минеральные соли и некоторое ко
личество трудносбражипаемых органических веществ. Конечная
концентрация сухих веществ при сбраживании ацетонобутиловон
барды значительно ниже (до 1 %) ввиду небольшого количества
минеральных солен.
В процессе метанового брожения накапливается биомасса
клеток, содержащих витамин Вц. и другие витамины группы В. Между
2М
.процессом образования витамина Bi2 и потреблением субстрата
четкой закономерности не установлено. Витамин В(а образуется
главным образом впутриклеючно, поэтому его количество
зависит от количества образующемся биомассы. Однако и эта
зависимость не постоянна и на практике не используется.
Вопрос о количественном содержании витамина В|2 в каком-
либо продукте весьма сложен. Обьясняется это, во-первых, тем,
что этот витамин представлен многочисленными формами, среди
которых нмеклея активные и неактивные но отношению к человеку
н животным. Следовательно, необходимо учитывать лишь
активные формы витамина В|2. Во вторых, в процессе брожения
происходит непрерывное взаимопревращение активных и неактивных
форм, в определенной степени поддающееся регулированию.
Наконец, разработка метода определения, учитывающего все
формы витамина В,2, является сложной задачей, а существующие
методы пе даю1 правильного представления о концентрации всех
активных форм.
В процессе метанового брожения образуются главным образом
истинный витамин В!г (циаикобаламип), фактор В, фактор 111 н
некоторые мсендовнгампны. Большую часть всех продуктов
составляют фактор В и цнанкобаламин. Соотношение между ними не
стабильно. Во многих случаях количество фактора В
преобладает, но поскольку он не активен но отношению к человеку и
животным, важной задачей производства является перевод этого
производного в активную форму. Фактор В — это циаикобаламип без
нуклеогидной части. Петь основания предполагать, что некоторые
микроорганизмы, присутствующие в смешанных культурах метан-
образующих бактерий, расщепляют витамин В|2, используя его
нуклеотндпую часть. В результате этого в среде накапливается
фактор В. Такие данные получены в опытах с чистыми
культурами микроорганизмов, выделенными из смешанных культур
метанобразующпх бактерий. Это подтверждается также тем, что
фактор В обнаруживается в культуральной жидкости, а в клетках
содержится в основном истинный витамин Bi2. Освободиться от
микроорганизмов, разлагающих истинный витамин В|2, или не
допустить его выхода в среду из клеток практически невозможно.
Предпринимались попытки интенсифицировать биосинтез пуклео-
тидиой части добавлением 5,6-днметнлбензнмдазола, однако это не
привело к ощутимым результатам. Общее количество всех форм
витамина несколько увеличивается при добавлении солей
кобальта. Общее количество витамина В|2 в культуральной жидкости,
полученной в результат!' метанового брожения спиртовой и аце-
тонобутиловой барды без обогащения, составляет 1,0—1,5 мкг/мл.
При сбраживании вторичной спиртовой барды его образуется
около 0,8 мкг/мл. Учитывая, что количество витамина Bi2 повышается
с увеличением концентрации биомассы, можно
интенсифицировать процесс добавлением различных источников питания.
Наилучшими из них являются боковые вещества, спирты, молочная
кислота. Добавление дрожжевого автолн-ыта, спиртовой барды
2оЪ
или других материалов, содержащих эти вещества, приводит к
увеличению концентрации витамина В|2 в культуральной
жидкости в два-три раза.
Химизм образования витамина Ви связан с биосинтезом
порфиринов (сукцинатглнциновым циклом). Биосинтез порфиринов
начинается с одного из промежуточных продуктов цикла ди- и
трикарбоновых кислот—янтарной кислоты (точнее — сукцинил-
КоА). Источниками сукциннл-КоА могут быть также глутаминовая
и а-кетоглутаровая кислоты. Поскольку для метанового брожения
как для анаэробного процесса не характерен цикл ди- и
трикарбоновых кислот, все указанные исходные продукты синтеза
порфиринов образуются иными путями. Следует отметить, что
потребность микроорганизмов в порфирипах невелика, поскольку в
анаэробных условиях в процессе метаболизма не участвуют цитохромы.
Конденсация сукцнпил-КоА с глицигjm приводит к
образованию а амино-р-кетоадипиновой кислоты, которая декарбоксили-
руется в 6-аминолевулиповую кислоту. Последняя димеризуется
в иорфобилиноген, из которого образуются порфирины:
Образование порфиринов
Глутаминовая кислота
Янтарная кислота СС-Кетоглутаровая кислота
- SH-KoA -
1 * Сукцинил-КоА- '
Глицин -I
а-Ампно- Й-кетоадипиновая kmciotj
J
д-Аминолевулииовая кислота
Димеризация
. Порфобилииогеи
Порфирины
В присутствии кобальта, циаиогруппы, 5,6-днметилбензнми
дазола н обычных компонентов нуклеотидов из порфиринов
образуются различные производные витамины В)2.
Известно, -что 6-аминолевулиновая кислота обусловливает
начало синтеза пуриновых оснований, что указывает на важность
этого соединения как промежуточного метаболита.
Культуральная жидкость, полученная в результате метанового
брожения, подвергается дальнейшей обработке с целью получения
кормового препарата витамина В,2. Пути получения этого
препарата могут быть различными. Учитывая, что витамин В|2 образуется
главным образом в клетках, можно выделять биомассу,
высушивать н в таком виде использовать в качестве добавки в корм скоту.
Этот метод вначале был принят, но в дальнейшем от него приш-
260
лось отказаться ввиду трудности выделения биомассы. Клетки
метанобразующих бактерий имеют относшельно малые размеры,
что создает препятствия при фильтрации и центрифугировании.
Коэффициент разделения существующих центрифуг недостаточен
для полного отделения таких клеток микроорганизмов. При
фильтрации клетки бактерий _забивают_поры_фильтров_и_выиодят
последние из строя." Кроме того, часть витамина выходнг из
клеток в среду и остается в фильтрате илн фугате, снижая выход
продукта. В настоящее время получение препаратов витамина В)2
основано иа упаривании и высушивании. Культуральная
жидкость подвергается упариванию в вакуум-выпарных аппаратах.
Максимальная температура упаривания 130°С. Несмотря на
высокую температуру, кратковременный контакт культуралыюн
жидкости с теплоносителем не приводит к значительному разрушению
витамина В|2. Известно, что этот витамин неустойчив в щелочной
среде н хороню сохраняется в кислой среде. Поэтому для
повышения устойчивости витамина В,г к высокой температуре в процессе
упаривания культуральную жидкость подкисляют соляной
кислотой.
Упаренный концентрат, содержащий до 50 % сухих веществ,
высушивают. Применяются те же способы высушивания, что и в
других микробиологических производствах. В настоящее время
широко распространена распылительная сушилка, преимущества
"которой были описаны выше. При этом получается препарат без
наполнителя, что дает возможность повысить концентрацию
витамина В,2 в готовом продукте. Другие способы высушивания
требуют применения наполнителя — отрубей или других материалов
Готовые препараты содержат от 70 (на вторичной меласспон бар
де) до 300 мкг (на ацетонобутиловой барде) витамина В)2 на
1 г сухих веществ. Одновременно с этим в препаратах содержатся
и другие витамины группы В, что повышает их кормовую ценность.
АМИНОКИСЛОТЫ
Одна из главных задач микробиологического производства —
получение незаменимых аминокислот. Наиболее важными из них
являются лизин, триптофан и метнонин. Многие аминокислоты
применяются как лечебные препараты, хотя и не являются
незаменимыми. К ним относится, например, глутамиповая кислота. Она
широко применяется как лечебный препарат для восстановления
нормального функционирования нервной системы при
переутомлении. Ее добавляют так же, как вкусовое вещество, в пищевые про
дукты. Практически применяются и другие аминокислоты, не
относящиеся к незаменимым. Например, алаиип используется как
противолучевое средство (очевидно, потому, что он легко
превращается в другие аминокислоты и аннулирует нарушение обмена
веществ, возникающее при облучении).
Кратко рассмотрим способы получения некоторых аминокислот
Алании. В основе микробиологического способа получения ала-
и ми а лежат три реакции.
33 - 2-1702
»57
1. Переамин и рование в присутствии пировино-
градной кислоты. Это наиболее распространенная реакция
образования алапнна в живом организме. Донатором
аминогруппы при этом служит какая-либо другая аминокислота:
R— СН— СООН -{ (;Н3—СО—СООП-* Я—СО—СООН + СН3—СН—СООН.
I I
NHa Nil,
2. Декарбоксил и рование а с и а р а г и и о в о и кислоты:
—со,
ноос-сн.-сн-соон ► сн,—сн—соон.
I I
NHa NHa
3. Восстановительное аминироваиие п и ров и но-
град и ой кислоты:
+NH,
СН.-СО-СООИ »- СН,—СН—СООН + НАД + И.О.
+НЛД.Н, |
NHa
Для производства аланина применяются актиномнцеты (Str.
tyoideus, Str. ovicolustus), представители рода Brevibacteriuin
(Br. aniylolyliciiiii), корпнебактернн (Corin. gelatinosum).
Источниками углерода в производственных средах являются
крахмал, глюкоза и другие углеводы. Источниками азота служат
обычно аммиак, мочевина. Необходимо добавлять ростовые
вещества — кукурузный экстракт, дрожжевой автолнзат. У некоторых
микроорганизмов выход аланина резко увеличивается при
добавлении лактата аммония. Концентрация аланина в культуралыюн
жидкости при этом достигает 30—40 г/л. Ведутся разработки
способов использования пентоз в качестве источников углерода при
произиоцстве аланина.
В Японии для производства аланина используется смесь трех
видов микроорганизмов. Один из них обладает активной аланнп-
дегидрогеназон, другой — траисамнназон, третий — аспартатде-
карбоксилазон. Это приводит к значительному повышению
эффективности производства аланина.
Технологическая схема производства аланина несложна. Она
состоит из трех стадии: подготовки среды, культивирования и
выделения аланина. Для выделения аланина, как и во многих
случаях, применяют ионообменные смолы.
Аспарагннопая кислота. В некоторых странах, например в
Японии, аспарагнповую кислоту производят с применением
микроорганизмов. Это производство основано на превращении фумаровоп
кислоты в аспарагнповую под влиянием бактерии Е. Coli. В
основе химизма процесса лежит реакция ампнпроваипя фумаровоп
кислоты. Вначале накапливают биомассу микроорганизмов в
среде, содержащей пептон. Затем в накопленную биомассу задают
20—30 %-й расшор фумарат?. Период накопления acnapaiиловой
кислоты 24—48 ".
ГЯЧ
Весьма высокой способностью к образованию аснарапшовоп
кислоты обладают мпкроор1апизми рода PseuJoriioiias. Некоторые
из них, например Ps. liguelaciens, в лабораторных условиях
образуют до 100—200 г/л аснарапшовоп кислоты в среде, содержащей
фумарат.
Известны некоторые виды рода Pseudoiiionas, способные
превращать яблочную кислоту в фумаровую. Это представляет
практический интерес, поскольку яблочная кислота дешевле.
Глутаминовая кислота. Для производства глутатиповой
кислоты используются два способа: микробиологический и
химический (выделение из отходов спиртовых заводов,
перерабатывающих мелассу).
Продуцентами глутамиповой кислоты могут быть различные
микроорганизмы. Некоторые виды, например В. subtilis, Ps. flno-
lescens, способны накапливать глутамнновую кислоту в
присутствии а-кетоглутаровой кислоты н хлорида аммония. В основе
химизма этого процесса лежит обычная реакция восстановительного
амннирования кетокислот. Предшественником глутамиповой
кислоты может быть амииомасляиан кислота, однако дешевле
получать глутамнновую кислоту в среде, содержащей углеводы.
Наиболее распространенным продуцентом при промышленном
производстве глутампновоп кислоты являются бактерии вида Micr.
gluiamicus. Такой же способностью обладают бревпбактерин п
коринебактерии. Из бревпбактерин используются культуры Вг.
flavum.
В Институте микробиологии (Латвия) учеными
разработана технология получения глутамиповой кислоты с применением
мутанта М. glntamicus 5-И Р. В среде, содержащей 5 % сахарозы,
1 мочевины, 1,5 мелассы и по 0,1 минеральных солей (сульфат
магния, дегндро- н гидрофпсфат калия), выращивают посевном
материал, затем осуществляют промышленное культннпропанне
в среде, содержащей до 10% сахарозы н уменьшенное количество
мочевины (до 0,5 %)■ При этом образуется до 60 г/л глутамиповой
кислоты.
Особенностью производства глутамиповой кислоты является
усиленная аэрация среды. При снижении интенсивности аэрации
активируется процесс образования побочных продуктов — алани-
на, молочной кислоты и других, на что тратятся источники
углерода.
На среде, содержащей глюкозу, выход глутамиповой кислоты
достигает 50 г/л. Все продуценты глутамиповой кислоты
нуждаются в биотипе.
Известно, что биотип регулирует синтез ненасыщенных
жирных кислот в мембранах. Недостаток биотипа приводит к
нарушению проницаемости клеточной мембраны н затруднению
выхода глутамиповой. кислоты. Добавлением олеиновой кислоты
устраняют необходимость добавления биотина.
Химический способ получения глутамиповой кислоты основан
па извлечении ее из продуктов переработки сахарной свеклы.
259
В процессе роста сахарной свеклы накапливается много глутами-
новой кислоты. При производстве сахара из сахарной свеклы глу-
таминовая кислота превращается в ангидрид, называемый пирро-
лидонкарбоновой кислотой:
соон
NH
В процессе производства спирта из мелассы пирролидонкар-
боновая кислота не усваивается дрожжами и переходит в отход —
мелассно-спнртовую барду, откуда ее можно извлечь в виде глу-
гаминовой кислоты. Применяемая технология получения глута-
миновой кислоты из мелассно-спиртовон барды позволяет
одновременно получать и другие ценные вещества — глицерин и бетаин
(в виде ацидина, т. е. в солянокислой растворимой форме).
Технологический процесс выделения этих продуктов
начинается с упаривания мелассной барды до содержания 50 % сухих
веществ.
Полученный остаток обрабатывают раствором серной кислоты,
причем получаются соли натрия и калия, которые отделяются
центрифугированием (в густой барде они нерастворимы). Затем
раствор снова упаривается и из него с помощью пара выдувается
глицерин. После этого пирролндоикарбоновую кислоту гидролн-
зугот соляной кислотой. В результате получается смесь глутамн-
новой кислоты с бетаином и минеральными солями.
Центрифугированием отделяют раствор глутаминовой кислоты, при
упаривании которого и получают чистую глутаминовую кислоту.
Фугат содержит бетаин и минеральные соли. Добавлением
соляной кислоты бетаин переводят в ацидин. Затем ацидин
отделяют от минеральных солей центрифугированием. Полученный
раствор упаривают и получают ацидин.
Лизин содержится в растениях в незначительном количестве.
Недостаток лизина в пищевых и кормовых продуктах усиливается
еще и тем, что это нестабильное соединение. При термической
обработке е-аминогруппа связывается с карбоксильной группой
и лизин теряет активность.
Наиболее распространенным продуцентом лизина является
ауксотрофный мутант Micr. glulamicus. У нас лизин производят
с применением Brevibacterium sp. 22. Этот штамм может быть
использован и для получения глутаминовой кислоты. При
содержании в среде 1—4 мкг/л биотипа сн образует глутаминовую
кислоту, а в присутствии 15—20 мкг/л биотипа —лизин.
Все ауксотрофные мутанты требуют добавления в среду для
биосинтеза каких-либо ростозых веществ. Так, Brevibacteninn
требует добавления биотина, мсгионина и треонина, Micr. gluta-
micus — биотипа и гомосернна. Добавление этих вешесгв
удорожает производство. Для снижения расходов в качестве,
источника ростовых рсщсств доблвляюг кукурузным экстракт, мелассу
200
и др. Среда для биосинтеза лизина содержит до 25 % мелассы,
1—2 кукурузного экстракта, 1—2 аммонийных солей и 0,1 % смеси
гидро- и дигидрофосфатов калия.
Разработана также технологическая схема,
предусматривающая одновременное получение кормового и кристаллического
препаратов лизина. Принцип этой схемы заключается в том, что
вначале готовят питательную среду, стерилизуют ее и засевают
микроорганизмами. Брожение идет в течение трех суток. Концентра-
дня лизина достигает 25 г/л. После выращивания микроорганизмы
отделяют центрифугированием. Полученный раствор
нейтрализуют и пропускают через колонку с катнонитом. Затем
адсорбированный лизин десорбируют раствором аммиака, который удаляется
в вакуум-выпарном аппарате. Полученый лизни переводят в
солянокислую соль, последнюю обработкой этанолом осаждают и
кристаллизуют. Так получают кристаллический препарат.
Для получения кормового препарата лизина часть культураль-
ной жидкости, полученной после ферментации, упаривают и
концентрат высушивают.
По технологии, предложенной к внедрению Институтом
микробиологии, для получения кормового лизина культуральпую
жидкость подкисляют до рН = 5,0...6,0, добавляют стабилизатор
(0,15 %-й раствор гндросульфата натрия) и упаривают до
содержания 40—50 % сухих веществ. Полученный жидкий концентрат
лизина (ЖКЛ) используют для обогащения кормов. Выпускают
также сухой кормовой концентрат лизина (ККЛ). Для его
получения жидкий концентрат высушивают иа распылительной
сушилке до содержания влаги 5—6 %■ Сухой концентрат более удобен
для транспортирования и хранения. Он содержит 10—20 %
лизина, 13—14 % других аминокислот, до 130 мкг/г рибофлавина, до
50 мкг/r пантотеновон кислоты, около 20 мг/г фолневон кислоты,
до 65 мкг/г никотинамида. Кроме того, в концентрате содержится
10—13% бетаина — очень ценного источника азота и донатора
метильных групп.
Для уменьшения гигроскопичности сухого препарата лизина
рекомендуется применять наполнители, наилучшими из которых
являются отруби.
Существует иной путь получения лизина, при котором
химическим способом получают предшественник — диамипопнмелнно-
вую кислоту, и с применением микроорганизмов превращают ее
в лизин.
Известны два основных пути биосинтеза лизина: через а-диами-
нопнмелиновую и через а-аминоадипиновую кислоту. Для
бактерий, используемых в промышленности, характерен первый путь
Исходными продуктами при этом являются аспарагиповая кислота,
сукипннл-КоА и пировнноградная кислота. Все эти вещества
легко образуются -в процессе обмена из углеводов. Синтез
начинается с конденсации этих веществ и образования сукцнннлпро-
изводного кетоамннопимелиновон кислоты. Затем углерод кето-
группы аминируется аминогруппой глутаминовой кислоты с об-
261
mj _ 1.1701
разованнем сукцинилпроизводного диаминопимелиновой кислоты.
Последующее отщепление остатка янтарной кислоты и декарбо-
ксилированне приводят к образованию диамииокапроновон
кислоты, т. е. лизина:
CH.CO—СООН
+
NH,
СООН-СН-СН.-СОН
СООН-СН,-СН,-СО~ КоА
соон соон
С-0 СН,
I I
<СН,), СН
-НС
соон
+ NH.
Г /
сн-нсо
соон соон
CH-NH.CH,
«■ (СН,), СН, J^,
I I I
CH-NH-C=0 Сукцнн!
СООН
СООН
CH-NH,
I
(СН,),
CH.-NH,.
Метионин. Как и лизин, метионнн является одной из наиболее
важных незаменимых аминокислот. В растениях его содержится
очень мало. Многие микроорганизмы способны его синтезировать,
однако такого микроорганизма, который продуцировал бы его
в больших количествах, до снх пор не найдено в природе и не
получено мутацией. В связи с этим метнонин получают пока
синтетически из акролеина и метилмеркаптана. Этот путь дороже, чем
микробиологический, поэтому проблема поиска штамма,
образующего рентабельные концентрации метионина, остается актуальной.
В живом организме предшественником метионина является
гомоцнстеип. При взаимодействии гомосернна и цистеина
образуются серии и гомоцистеин (промежуточное соединение — циста-
тионин). Затем метилированием гомоцистеина получают метнонин
(гомосернн может образовываться при восстановлении аспараги-
новой кислоты):
СООН
СН,
CH-NH,
СООН
+2НАД ■ Н,
—н,о
CHa-sx
I
СН,
СН,
I
СН—NH,
СИ—NH,|
I СООН
СООН
СН,ОН
I
СН—NH.
I
С ООН
сн,он
I
сн,
- I
СН—NH,
соон
CHaSH
СИ,
I
СП—N11,
I
соон
СН,—SH
!
-f CH-NH,
I
соон
+СН.ОН
CH,-S-CH,
сна
сн-мп,
соон
Валин. Много микроорганизмов является продуцентами этой
аминокислоты. К ним можно отнести виды Micr. glutamicus, Ps.
denitrificans, N. crassa и др. Очень важно то, что естественные
штаммы микроорганизмов образуют значительные количества
валяна, и нет необходимости в организации дорогостоящего
производства с применением ауксотрофных мутантов, требующих
обогащения среды биологически активными веществами.
Предшественником валина является кетоизовалерьяновая
кислота, образующаяся в результате конденсации пировиноградной
кислоты и этанола. Промежуточными продуктами выступают аце-
толактат и дигидроксиизовалерьяновая кислота:
СН„ СН„ СН„ СН„ CHS
II I II
СН, + СО -ч- СО ч- CHS—СОН -+СН,—СН
II I I I + "*
ОН СООН СНа-СОН СНОН СО
СООН СООН СООН
СН,
СН,—СН
CH-NH,.
„ООН
и
Триптофан. Относится к незаменимым аминокислотам,
необходим для нужд животноводства. Однако пока не найдены
микроорганизмы, синтезирующие его в значительных количествах из
углеводов.. Процесс образования триптофана различными
микроорганизмами происходит лишь в присутствии предшественников.
Некоторые бактерии способны превращать индолилпировиноградпую
кислоту в триптофан. При этом происходит восстановительное
дезаминирование предшественника с участием пиридиновой дегнд-
рогеназы (НАД). Однако применение индолнлннровиноградпой
кислоты для производства триптофана практически
нецелесообразно, поскольку по химической структуре этот предшественник мало
отличается от триптофана и на его получение химическим
способом требуются почти такие же затраты. Более выгодно получать
триптофан из другого предшественника — антраниловой кислоты.
В Японии впервые получен мутант микроорганизма, способный
превращать антраниловую кислоту в триптофан, и разработана
технология микробиологического производства этой аминокислоты
Продуцентами могут служить дрожжеподобные грибы родов
Candida,. Torulopsis и др. Биосинтез триптофана из антраниловой
кислоты протекает в присутствии глюкозы. Разработана технология
производства триптофана с применением дрожжеподобных грибов
вида Candida utilis. При этом вместо глюкозы используется
меласса. Производственная среда содержит около 6 % мепассы, 0,5
мочевины, 0,01 дигидрофосфата калия, 0,01 хлорида кальция и 0,005 %
сульфата магния. Ферментация идет в две стадии. Внача г
вырази 263
питается биомасса микроорганизмов в обогащенной среде,
содержащей 10 % мелассы, затем с помощью биомассы периодическим
способом осуществляется превращение аптраииловон кислоты в
триптофан.
Механизм процесса сводится к превращению антраниловой
кнслогы в индол н конденсации последнего с серипом:
Антрвишювая Индол Триптофан
кислота
ПРЕПАРАТЫ МИКРОБНОГО БЕЛКА
Наилучшим продуктом для обогащения и повышения
питательной ценности растительного корма является микробная биомасса,
или так называемый микробный белок, близкий по
аминокислотному составу к животному белку. Применение отдельных
аминокислот для обогащения корма дает возможность лучше
балансировать аминокислотный состав последнего, однако во многих
других отношениях применение полноценного микробного белка для
этой цели имеет преимущества. Главным из них является низкая
стоимость микробного белка. Это объясняется тем, что для
выращивания микробной биомассы не требуется сложной аппаратуры,
применения специальных методов очистки, а сырьем являются
дешевые отходы. В настоящее время решены многие вопросы
производства кормовой микробной биомассы. Определены
микроорганизмы, способные развиваться на отходах различных производств
и удовлетворяющие требованиям, предъявляемым к кормовым
веществам, разработаны технология культивирования этих
микроорганизмов и способы выделения биомассы. Однако вопрос об
используемом сырье полностью еще не решен. Отходы многих
производств содержат органические вещества и могут
использоваться для выращивания микроорганизмов. Однако эти вещества
не всегда содержатся в количестве, достаточном для
рентабельного производства микробной биомассы. Наилучшими в этом
отношении являются отходы производства спирта — мелассно-спир-
товая барда, сульфитно-спиртовая барда (или непосредственно
сульфитные щелока), барда гидролнзпо-еппртовых заводов. На
существующем производстве кормового белка используются
именно эти отходы. Однако их количество не может обеспечить
крупномасштабного производства кормового белка, необходимого для
удовлетворения потребностей животноводства. Перспективными
являются отходы нефтеперерабатывающей промышленности,
растительные отходы сельского хозяйства и газы. Кормовой белок па
углеводородах нефти уже производят, отпако вопрос о наиболее
перспективном сырье еще не решен.
2Г.4
Среды и микроорганизмы. Производство кормовых белковых
препаратов впервые было организовано на гидролизных и
сульфитно-спиртовых заводах. Гндролнзно-спиртовая барда образуется
в результате переработки древесины в спирт. Древесину гидролн-
зуют с целью превращения клетчатки и других, полисахаридов в
простые сахара. Основным продуктом гидролиза является
глюкоза, которая подвергается спиртовому брожению под влиянием
сахаромицетов. В результате гидролиза наряду с глюкозой
образуются другие простые углеводы, среди которых содержится
большое количество пентоз, не сбраживающихся спиртовыми
дрожжами. Эти углеводы и являются основой для производства
кормового микробного белка с применением дрожжеподобных грибов
(кормовых дрожжей), которые хорошо усваивают пентозы и
другие оставшиеся иесброженпымн сахара.
Гидролнзно-спнртовая барда содержит 0,6—0,7 %
редуцирующих Сахаров, основное количество которых составляют ксилоза
(0,3—0,4%) и арабппоза (0,08—0,13%), а также галактоза и
рампоза (по 0,01—0,03 %).
Для производства кормовых дрожжей могут быть
использованы н непосредственно гндролизаты, особенно в тех случаях, когда
они по какой-либо причине не используются для производства
спирта, например при недостаточно высокой концентрации
сбраживаемых Сахаров. Гндролизаты содержат около 3,3 %
редуцирующих веществ, в том числе до 2,4 % гексоз, около 0,8 % пентоз и
различные вещества, не принадлежащие к сахарам, а также
органические кислоты (з среднем 0,38 %).
Сульфитно-спиртовая барда по химическому составу и
происхождению близка к гпдролнзно-спнртовой. Эго отход производства
спирта из так называемых сульфитных щелоков. Последние, в свою
очередь, являются отходами целлюлозно-бумажной
промышленности и образуются п результате химической обработки целлю-
лозосодержащпх материалов. При этом в раствор переходят
простые сахара — продукты разложения клетчатки и гемпцеллюлоз,
которые и являются источником получения спирта. После
отделения спирта остается сульфитно-спиртовая барда, содержащая не-
сброжепные пентозы и другие сахара, которые используются для
выращивания дрожжеподобных грибов.
Для производства кормовых дрожжей применяются и
сульфитные щелока. Целлюлозная промышленность использует в качестве
сырья различные виды древесины, камыш, отходы сельского
хозяйства. В связи с этим состав органических веществ в отходах
целлюлозной промышленности, а также в барде, получаемой после
переработки этих отходов в спирт, неодинаков. Однако различия
эти несущественны, поскольку основными углеводами всех
указанных видов сырья являются клетчатка и гемннеллюлоза,
которые в результате химической обработки превращаются в моноса-
хара — источники питания дрожжей и дрожжеподобных грибов.
Общее количество растворимых Сахаров в сульфитных щелоках
составляет 2,5—4,0 % в зависимости ог способа гпдротнза целлю-
■2ь5
лозосодержащих материалов, 65—70 % от этого количества — это
сбраживаемые сахара. Сульфитный щелок, получаемый мягким
гидролизом сырья, содержит мало моносахаридов и значительное
количество олигосахарндов. Такие щелока подвергаются
дальнейшей обработке с целью увеличения количества моносахаридов и
повышения выхода дрожжей.
Сульфитные щелока, как и любые гидролизаты растительного
сырья, содержат примеси, ингибирующие дрожжи и дрожжеподоб-
ные грибы. Среди них содержатся летучие вещества (SO2,
фурфурол и др.), которые удаляются при продувании паром.
В сульфитных щелоках содержится 0,05—0,10% метилового
спирта, 0,2—0,5 % низших жирных кислот (главным образом
муравьиной и уксусной) и другие вещества, которые могут быть
источниками питания микроорганизмов.
Сульфитно-спиртовая барда, получаемая при производстве
спирта из сульфидных щелоков, содержит 0,6—1,0%
редуцирующих Сахаров, представленных в основном ксилозой, 0,3—0,4 %
низших жирных кислот — муравьиной и уксусной, и небольшое
количество продуктов спиртового брожения, оставшихся после
выделения спирта.
О химическом составе мелассно-спиртовой барды частично
упоминалось в предыдущем разделе. Источником углерода для
производства биомассы дрожжеподобных грибов (кормовых
дрожжей) в этой среде является небольшое количество (0,1—0,2 %)
редуцирующих Сахаров, органические кислоты (среди которых 1,0—
2,0% нелетучих, главным образом молочной), 0,2—0,3% низших
жирных кислот (в основном уксусной) и глицерин — около 0,5%.
Основное количество органических источников азота в барде
составляют бетанн, аминокислоты. Содержатся азотистые
основания н различные минеральные азотсодержащие соединения —
аммиачные солн, амиды. В барде обнаружено небольшое количество
продуктов неполного разложения дрожжей — пептидов — с
различной молекулярной массой. Несмотря на значительное количество
азотсодержащих веществ в барде (до 0,6%), она должна
обогащаться дополнительными источниками азота. Для этой цели при-_
нято использовать мочевину (карбамид). Барда содержит
недостаточное количество фосфора, поэтому в нее добавляют
суперфосфат, диаммопийфосфат или фосфорную кислоту. Последняя
одновременно уменьшает значение рН. Спиртовая мелассная
барда является благоприятной средой для развития многих
микроорганизмов, в том числе посторонних, т. е. вредных по отношению
к данному производству. Кислая реакция среды тормозит развитие
посторонних микроорганизмов, не препятствуя росту
дрожжеподобных грибов. Для предотвращения развития вредных
микроорганизмов необходимо искусственное подкислепие среды.
При производстве микробного белка в среде, содержащей
углеводороды нефти, готовят раствор необходимых минеральных солей,
в который добавляют парафины. Последние, как известно,
являются инертными веществами и трудно окисляются, это усугубля-
Sflo
ется тем, что парафины нерастворимы в воде. Сравнительно
хорошо доступны для действия ферментов нормальные парафины,
содержащие в цепи 10—24 атомов углерода (Сю—С24). Более
высокомолекулярные парафины, изопарафины, а также циклические
парафины очень плохо усваиваются микроорганизмами. В связи
с этим для производства кормовых дрожжей используются
главным образом низкокипящне фракции парафинов. Концентрация их
в среде обусловлена различными факторами. В первую очередь
необходимо применять концентрации, обеспечивающие
существенное накопление биомассы, т. е. рентабельность производства.
Однако повышение концентрации парафинов в среде ограничивается
невысокой степенью их потребления микроорганизмами. Опыт
производства показывает, что применять концентрацию парафинов
в среде более 2 % нецелесообразно, поскольку при наиболее
благоприятных условиях они полностью не потребляются. Кроме того,
повышение концентрации парафинов в среде увеличивает
вероятность накопления их в клетках микроорганизмов (остаточные
парафины), что является одной из причин, препятствующих
успешному применению микробной биомассы в животноводстве. Ввиду
невозможности применения высоких концентрации парафинов
в среде производство микробного белка этим способом является
рентабельным лишь при создании заводов большой
производительности — 20, 30 и более тыс. т продукта в год.
Процесс приготовления среды, содержащей парафины,
своеобразен. Для приготовления среды вместо воды используют
жидкость (фугат), полученную при центрифугировании дрожжей
из культуральной жидкости (80% фугата и 20% воды). Из
минеральных веществ используют фосфорную кислоту, хлорид калня,
сульфат магния, аммиак и сульфат аммония. Поскольку среда
готовится искусственно, необходимо добавлять микроэлементы
в виде солен железа, марганца, цинка, медн и др. Для улучшения
процесса смешивания нерастворимых (в основном твердых)
парафинов со средой их добавляют при температуре 50—60 °С.
Дальнейшее эмульгирование их осуществляют интенсивной аэрацией и
перемешиванием.
Для производства микробной биомассы во всех указанных
средах применяются дрожжеподобные грибы. Они обладают
пенными технологическими качествами и имеют преимущества перед
плесневыми-грибами и бактериями. Бактерии неприменимы для
втой цели вследствие малых размеров клеток, что препятствует их
выделению из культуральной жидкости. Кроме того, бактерии не
способны накапливать большие количества биомассы, как это
характерно для плесневых и дрожжеподобных грибов.
Наилучшими в эт1 ч отношении являются плесневые грибы, их также
удобно выделять из культуральной жидкости. Однако плесневые грн
бы не применяются в качестве продуцентов микробного белка
вследствие их способности к токеннообразовапию.
Дрожжеподобные грибы имеют сравнительно крупные размеры
клеток и хорошо выделяются из культуральной жидкости. В отли-
Ы7
чие от плесневых грибов он-и обладают некоторыми бродильными
свойствами и могут развиваться в условиях слабой аэрации.
Однако важнейшим технологическим качеством дрожжеподобных
грибов является их широкая ферментативная способность. Они не
обладают узкой специфичностью к сахарам и потребляют
различные моносахариды — пентозы, гексозы; способны гидролизовать
олигосахариды — сахарозу, мальтозу, но имеют ограниченную
способность к потреблению полисахаридов. Дрожжеподобные грибы
хорошо потребляют продукты гидролиза белков и многие другие
органические азотсодержащие вещества. Наконец,
дрожжеподобные грибы усваивают такие инертные вещества, как парафины. Все
это позволяет использовать для производства микробной
биомассы различные отходы промышленности.
К недостаткам дрожжеподобных грибов как промышленных
микроорганизмов можно отнести их условную патогенность. Как
и многие другие микроорганизмы, они являются постоянными
обитателями организма человека и животных, однако в нормальных
условиях не вызывают заболеваний. Только в определенных
условиях, например, когда в организме не развивается сопутствующая
микрофлора, дрожжеподобные грибы начинают усиленно
развиваться, вызывая серьезные, трудноизлечимые заболевания. Однако
sro не является препятствием к использованию их в
животноводстве. Кормовые белковые препараты не опасны уже потому, что
микробная биомасса в процессе высушивания подвергается
термической обработке и не содержит живых клеток
дрожжеподобных грибов. Если же, вопреки соблюдению правил безопасности,
возникает случай заболевания животного, оно уничтожается и
опасность заражения человека ликвидируется. Кроме того,
заболевания животных и человека возникают лишь при определенном
состоянии организма. Тем не менее на производстве, где в
качестве продуцентов применяются дрожжеподобные грибы, должны
соблюдаться все правила техники безопасности.
Наиболее распространены в качестве продуцентов микробного
белка дрожжеподобные грибы рода Candida. В зависимости от
состава среды и прочих условий используются виды С. tropicalis,
С. utilis, С. arborea, С. humicola. Получены штаммы
дрожжеподобных грибов, приспособленных к местным условиям. Широко
распространены штаммы С. tropicalis СК-4. Практический интерес
представляют дрожжеподобные грнбы рода Trichosporon. Они
обладают широкими ферментативными способностями и потребляют
вещества, малодоступные для дрожжеподобных грибов других
родов. Однако эти микроорганизмы не могут быть использованы
в качестве основных продуцентов, поскольку уступают
представителям рода Candida в других отношениях (повышенная
требовательность к аэрации, невысокая скорость роста и др.). Эгн
микроорганизмы рекомендуется иснользовагь для более полной
утилизации органических веществ среды после кулынвнровання
основного производственного штамма.
'ЛЬ
Производственные штаммы дрожжеподобных грибов хорошо
усваивают различные вещества используемых сред — глюкозу,
ксилозу, арабинозу, этиловый и другие спирты, глицерин.
Указанные выше отходы содержат значительное количество уксусной
кислоты, которая хорошо усваивается дрожжеподобнымн
грибами. Из нелетучих органических кислот наиболее активно
потребляются янтарная, фумаровая, яблочная, лимонная. Щавелевая
кислота усваивается немного хуже. Интересно, что между сахара-
ми и органическими кислотами наблюдается своего рода синергизм:
в присутствии Сахаров активность дрожжеподобных грибов по
отношению к органическим кислотам усиливается.
Дрожжеподобные грибы используют различные соединения
в качестве источников азота, однако применение того или иного
источника зависит от условии. Например, в среде, содержащей
углеводы (гидролизная, сульфитно-спиртовая барда),
нежелательно использовать сульфат аммония, хотя он и является
легкодоступным источником азота. При потреблении ионов аммония
(NH4+) в среде накапливаются анионы серной кислоты (S(V~),
что ведет к сильному снижению рН и торможению роста
дрожжеподобных грибов. В других средах, например в среде, содержащей
мелассную барду, где источником питания являются органические
кислоты и аминокислоты, потребление которых ведет к подщела-
чнванню среды, наоборот, необходимо подкнслепие. Поэтому в
данном случае применение сульфата аммония желательно.
Нейтральным источником азота является мочспина, которая хорошо
усваивается дрожжеподобнымн грибами. Наилучшим источником азота
является смесь аминокислот, которые могут непосредственно (без
предварительного разложения) усваиваться дрожжеподобнымн
грибами. Аминокислоты легко превращаются друг в друга и при
необходимости могут взаимозаменяться. В присутствии смеси
аминокислот уменьшается необходимость синтезировать их заново.
При этом снижается и потребность в других веществах, например
в мнтамннах, принимающих участие в процессе синтеза
аминокислот.
Дрожжеподобные грибы обладают сравнительно высокой
чувствительностью к присутствию минеральных солен. Оптимальная
концентрация фосфатов калия составляет 1—2 г/л. Концентрация
солей различных микроэлементов должна быть в пределах 0.01 —
0,10 г/л. Увеличение или уменьшение концентрации солей
тормозит развитие дрожжеподобных грибов. Это наблюдается в среде,
содержащем*! мелассную барду, количество минеральных солен в
которой составляет 25 % всего количества растворимых веществ.
Потребность дрожжеподобных грибов в ростовых веществах
зависит от природы штамма и в значительной степени от условии
культивирования. Многие штаммы дрожжеподобных грибов рода
Candida нуждаются р биотипе, тиамине, пантотеновои кислоте.
Для других штаммов наличие этих витаминов не обязательно.
Такие витамины, как пнртпкеин. никотиновая кислота,
синтезируются большинством дрожжеподобных грибов. При наличии
/
•SO
некоторых веществ снижается потребность в витаминах. Так,
добавление аспарагиновой кислоты ведет к снижению потребности
в биотипе. Если аснарагнновая кислота (или анарагин)
добавляется в смеси с ненасыщенными жирными кислотами, потребность
дрожжеподобных грибов в биотипе уменьшается еще больше.
Культивирование. Дрожженодобные грибы выращивают
непрерывным способом. Длительность культивирования зависит от
условий н состава среды. При периодическом процессе длительность
культивирования в среднем составляет 10 ч. В переводе на
параметры непрерывного процесса это соответствует скорости
разбавления (протоку) Д —0,1 ч-1. Это значение установлено
эмпирически и является оптимальным для различных условии. Во всех
случаях это значение протока значительно меньше максимальной
удельной скорости роста дрожжеподобных грибов в указанных
средах, что обеспечивает запас времени для накопления биомассы
в культуральнон жидкости и относительно полное потребление
органических веществ среды. Непрерывное культивирование с
максимально возможной скоростью протока среды практически
невыгодно, поскольку это ведет к неполной утилизации веществ среды
и снижению выхода продукта.
Скорость роста дрожжеподобных грибов зависит от многих
факторов. В среде, содержащей глюкозу, она выше, чем в среде,
содержащей мелассу или мелассную барду. Сильно влияют па
скорость роста грибов продукты обмена. При периодическом
процессе по мере накопления продуктов обмена и истощения запасов
питательных веществ в среде скорость роста дрожжеподобных
грибов снижается в несколько раз. При непрерывном процессе
условия в этом отношении значительно лучше, чем при
периодическом, вследствие постоянного притока питательных веществ и
удаления продуктов обмена. При культивировании на мелассной
барде удельная скорость роста может превышать 0,2 ч-1. В средах,
содержащих углеводы, в том числе гидролизаты, она может быть
выше, что позволяет увеличить проток (скорость разбавления) и
сократить длительность культивирования.
В среде, содержащей парафины, скорость роста
дрожжеподобных грибов значительно меньше — 0,13—0,16 ч_|, и источник
углерода в основном процессе полностью не используется. Однако
в процессе выращивания дрожжеподобных грибов в среде,
содержащей парафины, большое значение имеет не столько
максимальное использование веществ среды, сколько удаление парафинов,
накопившихся в клетках микроорганизмов. Для этого процесс
ферментации осуществляют в две стадии: первая стадия —
основной процесс выращивания дрожжеподобных грибов при
интенсивной аэрации в свежен среде, вторая стадия —
дозревание, т. е. выдерживание биомассы при пониженной аэрации
п обедненной ере не с нелыо утилизации парафинов,
накопившихся в клетках.
В процессе культивировании дрожжеподобных грибов п средах
ел 1ЖПОГ1) состава органические тмцесгна ycnauuaioicu не одно-
»'7м
временно, что отражается на интенсивности накопления биомассы,
длительности культивирования и других показателях производства.
Последовательность поребления компонентов среды, называемая
диауксией, особенно заметна в средах, содержащих пеигозы и гек-
созы. Глюкоза является корепрессором в механизме регуляции
процесса биосинтеза ферментов, разлагающих пептозы. Ксилоза,
например, потребляется после полного потребления глюкозы, что
вызывает необходимость уменьшения протока при непрерывном
процессе. В определенной последовательности потребляются дрож-
жеподобнымн грибами органические кислоты. Так, для С. ulilis
характерно потребление органических кислот в такой
последовательности: янтарная, яблочная, лимонная, винная, молочная, глн-
колевая. Если в среде содержатся питательные вещества,
принадлежащие к различным классам органических соединений, С. utilis
потребляет их в такой последовательности: наиболее интенсивно —
уксусную кислоту, фруктозу, глицерин; затем — молочную,
яблочную, янтарную кислоты н в меньшей степени — гликолевую
кислоту и аминокислоты.
Процесс усвоения органических кислот зависит от значения рП.
Снижение рП ведет к уменьшению степени диссоциации кислот,
что, в свою очередь, отрчцателыю отражается на процессе нх
усвоения. Некоторые органические кислоты, например уксусная,
в недиссоцннрованном состоянии угнетают рост дрожженидобишх
грибов.
Большое значение имеет концентрация питательных веществ
в среде. Важным показателем производства является выход
биомассы на единицу субстрата, содержащегося в среде. Чем полнее
потребляется питательное вещество, тем больше выход продукта
на единицу его массы. Полное потребление веществ возможно при
невысокой концентрации нх в среде. Остаточные вещества
отрицательно влияют на выход продукта, поэтому но возможности
стараются разбавлять среды. В производствах, использующих
барду гидролизных и сульфитно-спиртовых заводов, среды
разбавляют до содержания 1,0—1,5 % редуцирующих веществ. Это дает
возможность сократить длительность культивирования до 3,5—
4,5 ч. Мелассно-сппртовая барда используется в неразбавленном
виде. Это увеличивает период аэрации до 10—12 ч. Разбавление
сред ведет к увеличению расхода воды и количества стоков, что
весьма нежелательно. Увеличение выхода биомассы
возможно при интенсивной аэрации и уменьшении протока. Степень
аэрации сильно возрастает при одновременном применении бар-
ботеров и механического перемешивания. Если скорость сорбции
кислорода в дрожжерастигельных аппаратах с эрлнфтнон
системой аэраипп не превышает 1,8 г 02/(л-ч), то при применении
мешалки с числом оборотов, равным 1000 об/мнн, она может
превысить 16,0 г 02/(л-ч).
Интенсивность аэрации при культивировании дрожженодобных
грнбгв обычно составляет 50—60 м3 воздуха и более па 1 м3
аэрируемой культуралыюн жидкости в час.
171
Химизм окисления органических веществ в процессе
выращивания дрожжеподобных грибов в основном ясен из сведений,
приведенных в предыдущих разделах. Тут остановимся лишь на
химизме окисления углеводородов. Первая стадия процесса
разложения углеводородов—окисление конечного атома углерода
молекулярным кислородом. Образующееся соединение,
содержащее спиртовую группу, последовательно окисляется в альдегид,
а затем в кислоту. При этом возможно двухкратное отщепление
водорода с помощью дегидрогеиаз и передача его кислороду, т. е.
окислительное фосфорилирование с образованием АТФ.
Двухкратная передача водорода может дать клетке 6 молекул АТФ.
Окисление конечного атома углерода приводит к образованию жирной
кислоты, которая подвергается затем р-окислению. Тогда
максимальное количество АТФ с учетом шести молекул, образующихся
при окислении конечного атома углерода, составит:
АТФ = 2 (4л — 3) + 6.
Механизм начального этапа окисления нормальных парафинов
можно представить схемой
+ -U
^ 2 ■ —2Н* +Н.0
А>_СНа—СН„ =♦ R—СЛа—СН.ОН * Я—СН,—СОН -^jjj»
—R—СНа—СООН.
Механизм дальнейшего окисления (р-окислеиия) приведен
в гл. II.
Существуют и другие механизмы окисления алканов.
Например, окисление может происходить по второму атому углерода
с образованием метилкетонов:
+ Т° -ан*
R—СНа-СНа R—СНОМ—СНЭ * А>—СО—СН,.
Возможно одновременное окисление по двум механизмам.
Существует механизм окисления углеводородов с обоих концов
молекул.
Окисление ненасыщенных углеводородов (алкенов) изучено
меньше. Есть данные, что дрожжеподобные грибы окисляют
ненасыщенные связи с образованием диолов:
ОН ОН
Я-СН=СНа —"- А>-СН-СНа.
Начальный этап окисления во всех механизмах требует
участия ферментов окснгеиаз, иод влиянием которых присоединяется
молекулярный кислород. Предполагается, что эта реакция
происходит в цнтоплазматнческой мембране, откуда окисленное
вещество фанспортируется в клетку.
Механизм окисления циклических углеводородов недостаточно
изучен. Как источники углерода для микробиологической
промышленности они представляют меньший интерес, поскольку плохо
уевпнрпются дрожжепотобнымп грибами.
5Г2
Выделение препаратов. Выделение биомассы и получение
готового продукта основано на изложенных выше принципах. Первая
стадия выделения—это центрифугирование (сепарирование),
в процессе которого концентрация клеток в культуралыюй
жидкости возрастает. Сепарирование производится многократно, в две
и более стадий, в зависимости от того, до какой концентрации
биомассы необходимо сгущать культуральную жидкость.
Необходимость применения стадийного способа сгущен1;я объясняется
тем, что при однократном сепарировании нельзя получить
суспензию клеток нужной концентрации. При производстве белкового
препарата на мелассной барде целесообразно сгущать до
концентрации дрожжевой суспензии 400—500, а на среде, содержащей
углеводороды нефти,— до 600—700 г/л.
Поскольку дрожжеподобные грибы содержат значительное ко
лнчество эргостерола (до 0,48 %), весьма целесообразно преира
щать его в витамин D2. Поэтому дрожжевую суспензию облучают
ультрафиолетовым светом. Облучать можно н высушенные
дрожжи. С одной стороны, это упрощает процесс ввиду неболыного
количества сухих дрожжей по сравнению с количеством жидкости.
Однако в качественном отношении целесообразнее облучать
жидкие дрожжи, поскольку при этом можно создать усЛ(Л1ПЯ
равномерного облучения (тщательным перемешиванием, образованием
тоЕ1кого слоя в виде пленки и т. д.). Неравномерное
перемешивание приводит к образованию токсических соединений в местах
чрезмерного воздействия ультрафиолетового света, в
поверхностных слоях биомассы. Облученная биомасса содержит 4000—6000
интернациональных единиц витамина D2.
Перед высушиванием дрожжевую суспензию в течение 45 мни
нагревают до температуры 70 °С или кипятя г для инактивации
дрожжей и посторонних микроорганизмов. Этот процесс
называют термолизом. Он необходим для предохранения биомассы от
порчи на дальнейших стадиях производства, а также потому, что
цельные клетки дрожжей хуже усваиваются животными. В
процессе термообработки клетки разрушаются, кроме того,
улучшаются технологические качества дрожжевой суспензии, например
вязкость, что облегчает транспортирование по трубопроводам и
распыление на распылительной сушилке.
Большое значение имеет температурный режим сушки
полученной дрожжевой суспензии. Под влиянием температуры могут
разрушаться ценные биологически активные вещества. Более
чувствительны к температуре витамины. Разрушаться могут
аминокислоты и белки. В биомассе дрожжей содержится определенное
количество углеводов, которые могут взанмоденавовать с
аминокислотами с образованием мелапоидинов, не обладающих
питательными свойствами. В процессе сушки возможны и
ферментативные превращения веществ. Сохранение питательной ценности
продукта зависит от длительности контакта дрожжей с
теплоносителем. Фактор времени имеет большое значение и для
химических взаимодействий. Следует учитывать, что в процессе сушки
35 2-1702
273
по мере удаления влаги увеличивается концентрация
реагирующих веществ, то повышает интенсивность химических и
ферментативных взаимодействий.
.Наименее устойчивы к воздействию температуры водо- и соле-
paciBopiiv.ne белки, преимущественно альбумины и глобулины. Из
аминокислот наибольшие изменения претерпевают лизин, глута-
мнновая и аспарагпновая кислоты, серии, треонин, аланнн,
тирозин. Потеря незаменимых аминокислот резко снижает
питательную ценность микробного белка, поэтому подбор режима сушки —
ответственный этан производства.
При производстве микробного белка применяются в основном
вальцевые ч распылительные сушилки. Последние обладают
преимуществами. Опыт применения этих сушилок на гидролизных и
сульфныо-спнртоных заводах показал, что потери белка
снижаются на 7,5—17,5 % по сравнению с потерями на других тинах
сушилок.
Перед высушиванием дрожжевую суспензию можно
предварительно упаривать или смешивать с наполнителями. Применение
распылительных сушилок позволяет миновать эш процессы.
Готовый продукт имеет различный состав в зависимости от
способа получения. Сухие дрожжи, полученные в среде,
содержащей парафины, состоят из 50 % белка (сырого протеина,
определяемого по содержанию общего азота), 12—20 углеводов, 6—12
нуклеиновых кислот, С—10% минеральных веществ. По составу
незаменимых аминокислот сухие дрожжи удовлетворяют
потребностям большинства животных, однако метноинна они содержат
недостаточно — 0,9—1,9%. Триптофана в сухом препарате
содержится 1,5—3,6%, лизина — 5—8%. По витаминному составу и
другим качествам эти дрожжи приближаются к дрожжам,
получаемым в среде, содержащей углеводы. Один из их недостатков —
наличие остаточных парафинов (0,2—0,7 %).
Дрожжеподобпые грибы, выращенные на отходах гидролизных
и сульфитно-спиртовых заводов, содержат соответственно 48—
56 и 45—52 % сырого протеина. Наиболее высокое содержание
протеина в дрожжах, получаемых на меласснон барде,— 47—55 %.
Содержание углеводов по всех препаратах примерно одинаково —
12—20 %• Все препараты содержат до 5 % -'• и11ar 2,5—3.5 %
лизина, триптофана н метноинна образуется сравн мстьио мало.
Препараты содержат большой пабор витаминов: все нптампны
группы В, эргостерол, витамин D2 и др. Одни из важнейших
витаминов— рибофлавин — содержится в кормовых белковых
препаратах в большем количестве, чем в большинстве кормовых
продуктов животного и растительного происхождения (14—
130 мкг/г). То же можно сказать о холи не, нтчугнпамичс.
Витамин В12 содержится в небольшом количестве. В целом кормовые
препараты дрожжеподобннх грибов по витаминному,
аминокислотному составу н другим качествам значительно превосходит >п-
вестные кормовые тобг'гкн — рмбную, мясокостную муку н
растительные корма — once, горох п: j.-iinny и кукурузу.
ГЛАВА VIII
БИОЛОГИЧЕСКАЯ ОЧИСТКА ПРОМЫШЛЕННЫХ
СТОЧНЫХ ВОД
Большинство производств, в юм числе микробиологических,
использует огромное количество воды на технологические нужды.
В микробиологических производствах вода расходуыся кчаиним
образом для прнгогоилення тппательных сред. После ииделишя
микроорганизмов н образующихся продуктов она ви<">расииае1ся
из производства. Количество питательных веществ в средах, не
пользуемых для выращивания микроорганизмов, в большинстве
случаев менее 20%, следовательно, большую часть среди
составляет вода, котрая после выращивания и извлечения
микроорганизмов становится отходом производства, т. е. сточной водой. Г;е
без предварительной очистки нельзя повторно ненользива!ь для
приготовления питательной среды, поскольку она содержит ос таг
ки продуктов обмена, вредно влияющих на рост промышленных
микроорганизмов. Количество воды, используемой в микробполо
гнческнх производствах, весьма велико н составляет coihii н тыся
чи кубометров в сутки для одною предприятия. В таком же
примерно количестве и а предприятиях образуются сточные воды,
которые должны бьпь очищены и возвращены в производство.
ПРОБЛЕМА ВОДЫ И ОХРАНА ВОДОЕМОВ
Интенсивное развитие производства создало проблему
нехватки пресной воды, проблему «водного кризиса». В илечиящее
время это одна из важнейших проблем человечеива. Концептp.iuiu
промышленности и населения привела к шпепеншюму нофебле-
иию воды. В крупных промышленных центрах пофебление води
составляет около 1 м3 в сутки на каждого человека (с yqeiOM
промышленных расходов). Такое потребление создает серьешие
затруднения в снабжении городов водой. Проблема воды пасчилько
важна, что от ее решения зависит развнте народного хозяйства
всех стран и развитие цивилизации в целом, несмотря на то, чт
водные пространства — моря и океаны — занимают в несколько
раз большую поверхность, чем суша.
Запас волы на земном таре составляет около 1,5-1018 м3, на
одного человека приходится по 500 млн. м3. Однако 97 % згой
воды непригодно для питья и промышленного использования из-за
высокой концентрации солен, 2% воды находится в виде льда
и лишь 1 % всей иолы на Земле — это пресная вода, пригодная
для жизпелсителыюсги человека. Этого количеств может хватить
па 20 млрд. человек, i. е. на то количество населения, которое
будет на Земле и 2100 г.
Выдвинуто много предложении но предо!вращению угрозы
нехватки пресной виды: щей буксирования ансиеркж н
использования их и качестве игючникои пресной воды, нроекнл l.rmoi,-
275
. 35"
ных пластиковых танкеров объемом свыше 10 млн. м3 для
транспортирования пресной воды на большие расстояния. Однако эти
мероприятия не могут решить проблему водного кризиса на
Земле. Наиболее перспективным является опреснение морской воды.
Однако современный уровень развития техники и технологии
опреснения еще не позволяет получать дешевую пресную воду.
В настоящее время многие страны предпринимают попытки
увеличить запасы пресной воды задерживанием ее в
искусственных водоемах. Поскольку вода из большинства рек стекает в моря
и океаны, человек стремится удержать ее, создавая плотины и
искусственные озера на пути движения рек. Однако искусственные
водоемы создают новые проблемы: пода в них быстро зарастает
водорослями, продукты гниения которых загрязняют водоемы и
делают их непригодными для существования рыбы, животных и
птицы. Продукты гниения, среди которых есть и токсические
вещества, попадают в реки, что создает необходимость их очистки.
Имеющихся запасов воды могло бы вполне хватить для всех
нужд населения: ведь она используется не безвозвратно. Почти
вся вода, которая используется человеком для различных целей,
снова возвращается в источник. Однако возвращает ее человек
в загрязненном, непригодном для повторного применения виде.
Воду, которая возвращается после использования человеком в
водоемы, необходимо очищать. В какой-то степени это делает н сама
пр-чрода. Если п одном месте река загрязняется сточной водой,
ю через 80—100 км по течению реки вода вновь становится
сравнительно чистой. Поэтому раньше населенные пункты и
промышленные объекты располагались на берегах рек на расстояниях,
достаточных для самоочищения воды. Однако это можно было
делать только на реках. Если же источником воды служит озеро,
то в нем самоочищение идет медленнее п одно предприятие
может загрязнить всю воду. В настоящее время концентрация
промышленности н населенных пунктов настолько велика, что
большие расстояния между ними невозможны. Поэтому каждое
предприятие должно очищать использованную воду, прежде чем ее
сбрасывать в реку. В противном случае другое предприятие не
сможет ее использовать. Однако дело не только в этом.
Загрязненная вода, попадая в водоем, уничтожает все живое, прежде
всего приводит к гибели рыбы, которая является одним из
основных источников питания человека. Вредное влияние сточной воды
заключается в том, что содержащиеся в ней органические
вещества окисляются, на что расходуется растворенный в воде
кислород. Уменьшение концентрации кислорода в воде и приводит к
гибели рыбы и других животных, обитающих в воде. Кроме того, на
обитателей водоемов губительно действуют яды, многие
минеральные вещества и другие продукты, содержащиеся в сточных водах.
В настоящее время вода многих рек и других водоемов в
результате загрязнения сточными водами уже непригодна не только для
потребления человеком, по и для жизнедеятельности обитателей
,. водоемов. В некоторых реках Европы, Америки п других cipan
27S
полиостью отсутствует животный и растительный мнр, они
превращены в сточные канавы. Под угрозой находятся и некоторые
реки нашей страны.
В настоящее время во всех странах мира большое внимание
уделяется проблеме очистки сточных вод. Об этом свидетельствуют
Международные конвенции по предотвращению загрязнений
океанов, морей и рек, решения съездов, конференций и совещаний по
вопросу борьбы с загрязнением водоемов. По существующему
положению, каждое строящееся промышленное предприятие должно
иметь сооружения по очистке сточных вод. Такие сооружения
создаются и на существующих предприятиях. Очистка сточных вод
является неотъемлемой частью технологии современного
производства, поэтому знание основ процесса очистки обязательно для
работников большинства промышленных и сельскохозяйственных
предприятий.
В стране установлены и действуют условия спуска сточных
вод в водоемы. Существуют нормативы качества воды для
водоемов питьевого и культурно-бытового водоснабжения, а также для
рыбохозянственных водоемов. Установлены предельно допустимые
концентрации различных веществ, попадающих в водоем со
сточными водами. Спуск сточных вод в водоем разрешается лишь при
условии, что это не приведет к существенным изменениям ряда
показателей качества воды водоема. Так, содержание взвешенных
частиц не должно увеличиваться более чем на 0,25—0,75 мг/л,
вода не должна приобретать запаха и цвета; колебания значения
рН, концентрации растворенного кислорода, органических веществ
и многие другие показатели в результате сбрасывания сточных
вод допустимы лишь в определенных пределах. Вода не должна
содержать возбудителен заболеваний. В связи с этим особое
значение придается дезинфекции сточных вод, предназначенных для
сбрасывания в водоем. Более жесткие требования предъявляются
к воде водоемов, используемых в рыбохозяйственных целях,
особенно если водоем предназначен для сохранения и
воспроизводства ценных пород рыбы. В этом случае вода должна содержать
более 4—6 мг/л растворенного кислорода. Биохимическое
потребление кислорода, т. е. его расход на окисление органических
веществ, не должно превышать 2 мг/л. В воде допускается строго
определенное содержание токсичных веществ и солей некоторых
металлов — свинца, медн, цинка, никеля и др. Особое значение
придается нефтепродуктам, содержание которых в водоемах
бытового пользования допускается 0,1—0,3, а в рибохозянсгвешшх
водоемах — не более' 0,05 мг/л.
Существующие требования к сточным волам вызывают
необходимость совершено!воваиня производства н создания такой
технологии, при которой количества потребляемой и, следовательно,
сточной воды минимальны. Для этого необходимо шире внедрять
безводные процессы. Такие процессы уже применяются, например,
в производстве синтетического каучука, бумаги. Большое
значение в решении проблемы водоснабжения н борьбы с загря пением
36 - 2-1702
277
водоемов имеет повторное использование воды, при котором
латраты свежей воды необходимы лишь для пополнения
безвозвратных потерь, а сброс в водоем должен быть практически
прекращен. Для этого сгочные воды необходимо очищать от
примесей и доводить их качество до норм, удовлетворяющих
требованиям технологии того или иного производства.
Сточные воды можно использовать для орошения полей, что
уменьшит ее количество, забираемое для этой цели из водоемов.
Это Те)кже в немалой степени может способствовать решению
проблемы воды.
Несмотря на большое внимание, которое уделяется очистке
сточных вод, к многочисленные мероприятия, стимулирующие
работы в этом направлении, проблема предохранения водоемов от
загрязнения еще далека от решения. Прежде всего это
объясняется отсутствием единого метода, которым можно было бы решить
эту проблему. Большое разнообразие сточных вод по химическому
составу требует разработки собственной технологии очистки для
каждого производства или для нескольких родственных
производств. Кроме того, строительство очистных сооружений требует
много времени и средств. Немаловажное значение при этом
имеет недостаточная подютовка работников промышленности по
вопросам очистки сточных вод и охраны водоемов. Эти вопросы
должны быть предметом изучения не только специальных наук,
касающихся охраны природы, значительное внимание им должны
уделять все технологические дисциплины, преподаваемые в вузах,
особенно такие науки, как биохимия и микробиология. Вопросы
очистки сточных вот должны решаться и в программах
экономических паук. Прямой ущерб экономике народного хозчйства от
ухудшения качества воды и условий существования гндробионтов
весьма велик. Методики подсчета этого ущерба, к сожалению,
пока ire существует. Не менее важно получение экономии от
утилизации пенных продуктов, содержащихся в сточных водах. Учет
этого эффекта должен быть обязательной статьей экономики
каждого производства, что способствовало бы и решению вопроса
охраны природы. Необходимо учитывать н социальный ущерб,
связанный с ухудшением условий жизни и отдыха трудящихся в
результате сброса сточных вод в водоемы.
ХАРАКТЕРИСТИКА СТОЧНЫХ ВОД ПИЩЕВЫХ
И МИКРОБИОЛОГИЧЕСКИХ ПРОИЗВОДСТВ
Для правильного конструирования и эксплуатации очистных
сооружений необходимо знать состав загрязнений и количество
сточных вод, образующихся на данном производстве. Загрязнения
обычно делятся по физическому состоянию на нерастворимые
(взвешенные) вещества, коллоиды — с размерами частиц 0,001 —
0,1 мкм п растворимые вещества — с размерами частиц менее
0,001 мкм. Загрязнения, бывают минеральными и орган и-
ч ее к им н. Органические вещества Солее опасны для загрязне-
278
ния водоемов, поскольку нх окисление приводит к связыванию
растворенного в воде кислорода. Многие вещества, содержащиеся
в сточной воде различных предприятий, являются ядами для гнд-
робноитов. Сбрасывание минеральных веществ в во ноем и также
нежелательно, поскольку это может привести к нарушению
условий минерального питания водной растительности, являющейся
кормом для различных обитателей водоемов, в том числе рыб.
Биохимический метод очистки применим главным образом к
сточным водам, содержащим органические примеси. Количество
минеральных веществ при этом, наоборот, увеличивается вследствие
минерализации органических примесей. Однако минеральные
вещества, образующиеся в результате биохимической очистки, не
вредны для гидробнонтов. Это в основном соли азота и фосфора,
необходимые для питания всех живых организмов.
Вышесказанным объясняется то, что в разделе о биохимической очистке
сточных вод затрагиваются вопросы очистки, содержащих только
органические примеси. Существует много категорий сточных вод,
содержащих минеральные примеси и являющихся не менее
вредными для водоемов, однако рассматриваемый биохимический
метод неприменим для их очистки. В настоящее время предложен
биологический метод очистки сточных вод от минеральных
примесей, основанный на применении высшей водной
растительности. Среди высших водных растений встречаются виды,
способные поглощать большие количества минеральных веществ iu
воды, что и используется для ее очистки, причем минеральные
вещества могут быть извлечены затем из растении и
использованы в народном хозяйстве, а растения — на корм скоту. Однако
процесс биохимического окисления при этом не является
основным и метод не может считаться биохимическим.
Второй причиной, обусловливающей рассмотрение вопросив
очистки сточных вод только с органическими загрязнениями,
является то, что именно такие сточные воды характерны для
производств, рассматриваемых в данном пособии.
В сточных водах пищевых и микробиологических производств
присутствуют вещества животного, растительною н микробного
происхождения. Все сточные воды, содержащие органические
вещества, являются благоприятными средами для разни тя
микроорганизмов, поэтому вещества микробного происхождения всегда
присутствуют в сточных водах независимо от того, являются
производства микробиологическими или нет. В сточных волах могут
содержаться и болезнетворные микроорганизмы, поэтому в
характеристике сточных вод существует понятие «бактериальные
загрязнения», борьбе с которыми придается большое значение.
Нерастворимые (взвешенные) вещества, присутствующие в
сточных водах, делятся кг оседающие и неосепаюшие.
К оседающим относятся вещества, выпадающие в осадок при
отстаивании воды в течение двух часов, к неоседан.щим—не
выпадающие в оса цок за это время. Указанный период времени
выбран условно. Это связано с тем, что в промышленных t .истных
(79
сооружениях принят такой нериот. для отстаивания взвешенных
частиц из сточных вол перед тем, как последние подвергают
биохимической очистке. Практически установлено, что этого времеип
достаточно для удаления из сточных вод всех пешеегв,
неспособных к биохимическому окислению в аэрогепках. Взвешенные
вещества, отделяемые из сточных вод, подвергаются гниению н
анаэробных услоипях. Количество оседающих взвешенных веществ
определяется отстаиванием сточной воды в течение двух часов в
цилиндрах вместимостью 2 л. Соотношение между количествами
оседающих » псоседаюшпх взвешенных веществ может быть
различным. Концентрации оседающих веществ состав мнет 50- г,,%
количества всех взвешенных веществ. Все взвешенные вещества
(оседающие и псоселающпе) отделяют фильтрованием сточной
воды и взвешиванием сухого остатка на фильтре, причем
используется беззольпып фильтр для последующего определения золы
сжиганием сухого остатка.
Содержащиеся в сточной воде коллоидные вещества весьма
разнообразны. Среди них бывают гидрофильные и
гидрофобные. К гидрофильным относятся белковые вещества,
клетчатка, крахмал, мыла, многие красители и полисахариды
микробного происхождения. Гидрофобные коллопчы, это главным
образом минеральные вещества. К ним относятся глина, гндрокенды
железа п алюминия, кремниевая кислота и др.
Коллоидные вещества проходят через фильтр при
фильтровании сточной воды п определяются обычно вместе с рассоренными
веществами. Для установления количества коллоидных веществ
используются ульгрлфильтры, не пропускающие частиц размером
более 0,1 мкм. Отпако использование ультрафильтров также не
позволяет отделить все коллоидные вещества, поскольку размеры
их части мшут быть меньшими размеров- пор фильтрующего
материала.
Количество растворенных веществ в сточной воде зависит от
многих факторов, в том числе от солевого состава воды,
используемой в производстве. Содержание растворенных веществ
(плотного п л и сухого остатка) определяется выпариванием н
высушиванием фильтрата сточной воды. Сжигая сухой остаток,
можно oiipeic.THib количество органических и минеральных
веществ, растворенных в сточной воде.
Сточные воды содержат большое количество микроорганизмов,
которые находят гам благопрня-тные условия для развития. Они
попа тают п сточные волы из производства, с протуктамп обмена
человека и жппптпых. из воды, почвы. Срс тн микроорганизмов
сточных вод могут быть патогенные. Чаще вгего это возбушгелн
заболевании пищевого капала и туберкулеза. Общее колнчеспю
микроорганизмов п поте не рв.тяекя определяющим фактором
в санптарпч-эшпемнодогпческом отношении, т. е. в отношении
опасности сточных вот пя человек) как нсгочннка инфекнни.
Последнее зависит oi п;< шчпя и.пшенных мт рооргапнзмов. Опре-
ле.тепие н.шиешшх мпкро.>рт.п ii.sm'H» в сгочпоП во те npeiiiaiuser
I'M'
значительные трудности, особенно в условиях производства. Об
их наличии судят косвенно по присутствию кишечной палочки. Эти
микроорганизмы являются условно-патогенными. В обычных
условиях они не вызывают заболевании, но развиваются в такой же
среде, как и патгенные микроорганизмы. Благоприятной средой
для развития тех и других является фекальная масса, т. е.
содержимое пищевого канала человека и животных, где всегда
содержится значительное количество кишечной палочки. Таким
образом, наличие кишечной палочки свидетельствует о том, что
в сточных водах есть фекальная масса.
Для характеристики сточных вод в
санитарно-эпидемиологическом отношении применяются величины колн-титр и коли-индекс.
Коли-титр — это наименьший объем воды, в котором содержится
одна кишечная палочка. Коли-индекс, наоборот, это количество
кишечных палочек, содержащихся в определенном объеме (1 л)
воды. Если в 100 мл сточной воды содержится одна кишечная
палочка, то колн-титр ее равен 100 мл, а коли-индекс 1000: 100=
= 10, т. е. в 1 л воды содержится 10 кишечных палочек. Колн-
нпдекс сточных вод, содержащих продукты обмена человека и
животных, может достигать миллионов. Колп-пидекс более
удобен для характеристики сточных вод, и его в основном используют
на практике.
Для определения общего количества микроорганизмов в
сточных водах используют плотную среду, называемую мясопепгонпым
агаром. Это раствор продуктов гидролиза белковых веществ (мясо-
иептнпып бульон), в который добавляют I—2% агар-агара,
обладающего способностью выбывать затвердевание жидкости,
нагретой до кипении и охлажденной до комнатной температуры.
Смесь мясопептонного бульона с агар-агаром нагревают до
расплавления и разливают тонким слоем в специальные стеклянные
чашки (чашки Петри). После охлаждения образуется плотная
поверхность питательной среды, па которую наносится малое
количество (капля) сточной воды и равномерно размазывается по
поверхности. Объем наносимой капли должен быть известен
(измеряется мнкроппнеткой) и составлять десятые или сотые доли
миллилитра. После культивирования в термостате на поверхности
агарпзопаппой среды появляются колонии выросших
микроорганизмов, по количеству которых судят о количестве микробных клеток
в данном объеме жплкопн (допуская, что одна колония
вырастает из одной клетки). При наличии большого количества
микроорганизмов в сточной поле подсчет колонии возможен лишь после
разбавления исходной пробы водой в. десятки тысяч и
миллионы pa.i.
Для обнаружения кишечной палочки каплю сточной вочы
нанося! па поверхность специальной среды (среда Энто), на которой
колонии кишечной нтточкп окрашиваются в красным цвет и по-
этчу сганопяи-н отличимыми от колоний других
микроорганизмов Поскольку колонии некоторых ipyrnx микроорганизмов в дап-
ч!.'\ услииичх vuiyi шчрчн нвзН.1-Я ик я<1\ ьти тальпейшей и icii-
281
тификацин кишечной палочки дополнительно используют другие
ее особые свойства — способность к характерной окраске (окраска
но Грамму) и способность к образованию газов в жидкой среде.
Химический состав п концентрация органических веществ в
сточных водах зависит от того, насколько правильно ведется
технология производства. Работники промышленности должны
совершенствовать нуги использования воды на технологические
нужды, добиваясь максимального снижения ее расхода и
уменьшения общего количества сточных вод. Совершенствование техно-
логин ведет также к уменьшению потерь сырья и полупродуктов
на разных стадиях производства, т. е. количества отходов,
которое определяет объем сточных вод и содержание в них
органических веществ.
На предприятиях, производящих спирт, вода расходуется
главным образом на получение раствора мелассы, а при производстве
спирта из зернокартофельного сырья — на мойку картофеля,
замачивание зерна, охлаждение разваренной массы, приготовления
заторов. Кроме того, вода на этом производстве расходуется на
охлаждение брагоректифаканиоиных аппаратов, дрожжанок,
бродильных чанов и мойку аппаратуры. Вода, расходуемая па
охлаждение, используется повторно на различные нужды, где
необходимо применение горячей воды. Избыток такой воцы, не имеющей
существенного загрязнения, сбрасывается в
производственно-дождевую канализацию, из которой сточные воды направляются в
водоем без очистки. Для сброса загрязненных сточных вод
предусматривается специальная бытовая канализация, из которой вода
должна поступать па очистку перед сбрасыванием ее в водоем.
Основную часть загрязнений сточных вод па спиртовых заводах
составляют ос1атки органических веществ после отгонки спирта —
спиртовая барда. Ьарца спиртовых заводов,
перерабатывающих мелассу (м е л а с с н а я барда), по химическому составу
значительно отличается от зернокартофельной. Последняя
содержит мало вредных примесей и может непосредственно
направляться на корм скоту. Это облегчает решение вопроса
очистки сточных вод на таких заводах. Значительно сложнее обстоит
дело с очисткой барды спиртовых заводов, перерабатывающих
мелассу. Мелассиая барда не может скармливаться скоту ввиду
высокого содержания минеральных солей, а также окрашенных
веществ — карамелей и меланоидинов, вредно влияющих па
организм животных. Мелассиая барда может быть использована лишь
для получения удобрений илн в качестве среды для производства
кормового микробного белка пли других продуктов. В связи с тем
что такие (вторичные) производства не организованы еще в
широком масштабе, в настоящее время весьма остро стоит вопрос
очистки сточных вод мелассно-еппртовых заводов. На этих
заводах прелусмофепы специальные сооружения (так называемые
поля ф и л ь т р а ц н и). Сточные воды, проходя через почву, осво-
божтаюгея от примесей и поступают в водоем в очищенном виде.
Отпако со временем почва вокруг этих сооружений теряет фнльт-
■Л2
рующую и пропускную способность и бардяные ямы
превращаются в простые резервуары—хранилища производственных отходов.
При хранении в них происходят биохимические процессы, главным
образом метановое брожение, которые приводят к снижению
концентрации органических примесей, однако эти процессы в
естественных условиях идут медленно и очистке подвергается лишь
незначительная часть сточных вод. Вследствие этого на спиртовых
заводах имеется большое количество бардяных ям, занимающих
согни гектаров дорогих посевных площадей и содержащих
миллионы кубометров барды.
О химическом составе отходов спиртовых заводов говорилось
выше (см. гл. VIII) как о сырье для производства кормовых
белковых препаратов. С точки зрения биохимической очистки эти
сточные воды характеризуются следующими основными
показателями. Биохимическое потребление кислорода, определяемое за
5 сут (БПК-,), мелассно-спнртовой барды достигает 50 тыс.
Концентрация взвешенных веществ в среднем 7000 мг/л, общего
азота— 4300, аммонийного азота — 2500, фосфора —95 мг/л, рП = 5,0.
Приведенный состав свидетельствует о том, что мелассно-спирго-
вая барда — это высококонцеигрпрованнаи сточная вода. Однако
содержащиеся в ней органические вещества сравнительно легко
окисляются биохимически. Недостатком барды в этом отношении
является наличие окрашенных веществ, которые трудно
окисляются микроорганизмами.
В пивоваренном производстве вода расходуется на подготовку
сырья (замачивание зерна), приготовление среды, т. е. пивного
сусла, на охлаждение сусла, транспортирование материалов,
мойку оборудования, бутылок и на нужды холодильио-компрессор-
пого оборудования. В отличие от спиртовых заводов вода,
расходуемая на приготовление производственных сред, не поступает
в сточные воды, поскольку является составной частью готового
продукта — пива. Наиболее зафязнсииые сточные воды в
пивоваренном производстве образуются в результате мойки
оборудования, где происходят бродильные процессы, и фильтров. Количество
этой воды относительно небольшое, поэтому общие сточные воды
содержат меньше загрязнений, чем сточные воды спиртовых
заводов (БПКб около 200 мг/л, общего азота — до 30 мг/л).
При производстве кормовых дрожжей на барде гидролизных,
сульфитно-спиртовых и мелассно-еппртовых заводов вода
требуется на нужды охлаждения, приготовление раствора минеральных
солеи, на промывку дрожжей в процессе их выделения. Сточных
иод тут образуется значительно больше, чем требуется воды на
производство, поскольку основное количество воды содержится
м исходной бзрде, из которой готовится среда для культивирова
чип. В результате производства кормовых дрожжей образуются
сточные воды, основную часть которых составляет вторичная бар-
ля. Она содержит значительно меньше органических веществ, чем
исходная среда, тем не менее остатки дрожжей в воте,
поступающей из цеха сепарации, создают сравнительно высокое значение
£83
БПК. При производстве кормовых дрожжей на барде
гидролизных заводов БПК5 общих сточных вод составляет 2000—3000 мг/л.
Концентрация органических веществ не высока (до 0,5 г/л).
Сточная вода содержит небольшие количества азота (до 30 мг/л) и
фосфора (около 20 мг/л). В сточных водах содержится до 6 мг/л
фурфурола. Значительно богаче органическими веществами
сточные воды производства кормовых дрожжей на мелассно-спирто-
вой барде. БПК5 их превышает 10 000 мг/л, азота содержится
200—300 мг/л, концетрацня фосфора зависит от количества
фосфорных солей, добавляемых в барду в качестве источника
минерального питания.
В производстве пекарских дрожжей на специализированных
заводах вода расходуется на приготовление мелассиых растворов.
Большое количество воды потребляется на охлаждение дрожжей,
питательной среды, холодилыю-комирессориой аппаратуры, где
вода почти не загрязняется. Эта вода используется повторно на
мойку аппаратуры дрожжерастильиых чанов, промывку дрожжей и
фильтрующих материалов, где и происходит ее основное
загрязнение. БПКго сточных вод дрожжевых заводов составляет 1500—
5000 мг/л, что значительно ниже значений, приведенных для
сточных вод производства кормовых дрожжей и спирта. Источником
загрязнений сточных вод дрожжевых заводов являются остатки
дрожжей, несброженные углеводы и азотистые вещества. Такие
сточные воды являются хорошей питательной средой для
микроорганизмов, участвующих в процессе биохимической очистки.
На предприятиях, производящих ферментные препараты, сточ
ные воды могут иметь различный состав в зависимости от
применяемого сырья и способов ведения технологического процесса.
Вода в этом производстве расходуется в основном на
приготовление питательной среды при глубинном культивировании и на
экстракцию ферментов при поверхностном способе выращивания.
Другие виды расхода воды аналогичны описанным для прочих
микробиологических производств. В зависимости от вида
производимых ферментов, т. е. от вида питательных сред, в сточных
водах ферментного производства могут присутствовать углеводы —
остатки крахмала и простых Сахаров, пектиновые вещества, белки
и продукты их гидролиза. Сточные воды производства
большинства ферментов не могут быть непосредственно использованы для
кормовых целей из-за наличия токсичных веществ — продуктов
метаболизма плесневых грибов. Они малопригодны и в качестве
сред для производства продуктов микробного происхождения,
поскольку содержат токсичные вещества, препятствующие росту
микроорганизмов. Смешанные культуры микроорганизмов,
содержащиеся в активном иле очистных сооружений, разлагают и
токсичные вещества. Исключение составляют сточные воды,
образующиеся в цехах по получению очищенных препаратов, где
применяются различные растворители, способные в значительных
концентрациях тормозить жизнедеятельность микроорганизмов активного
ила. При большом разбавлении эти вещества не проявляют анти-
2Ы
микробного действия. Для подробной характеристики сточных вод
всех ферментных производств с точки зрения их биохимической
очистки пока не накоплено достаточно данных, поскольку эти
производства находятся в стадии развития.
На многих предприятиях микробиологической промышленности
сточные воды близки по происхождению ввиду использования
одного и того же или близкого по химическому составу сырья. Так,
сточные воды ацетоиобугнловых заводов близки по составу к
сточным водам спиртовых заводов, работающих на зерновом сырье.
Основными компонентами таких сточных вод являются несбро-
женпые вещества муки. Различие состоит в примесях, являющихся
продуктами обмена дрожжей и ацетонобутпловых бактерий. То же
самое можно сказать о сточных водах производства различных
органических кислот, где в качестве сырья используется меласса.
Большое количество сточных вод имеет производство
молочных продуктов. На молочных заводах вода расходуется в
основном на мойку аппаратуры и резервуаров, включая
железнодорожные цистерны. Во всех случаях в воду попадают молоко н молочные
продукты. Они содержат легкоразлагающиеся органические
вещества. Вода, применяемая для охлаждения молочных продуктом,
повторно используется для мойки аппаратуры, что значительно
сокращает общий расход воды и количество сточных вод.
Концентрация органических веществ в сточных водах производства сыра
обычно выше, чем в сточных водах других молочных производств.
Об этом свидетельствует значение ПБКго. которое для сточных
вод производства сыра составляет 2400, а для сточных вод
молочных заводов—1200 мг/л. Поскольку большинство молочных
заводов находится в городах, очиака их сточных вод
осуществляется совместно с городскими (бытовыми) сточными водами на
городских очистных сооружениях. Однако такое решение вопроса
не вполне правильно, поскольку сточные воды этих предприятий
могут быть использованы в качеаве сырья для культивирования
хозяйственно-полезных микроорганизмов.
Большую проблему представляет очистка сточных вод
предприятий мясной промышленности, сахарных заводов. Трудность
решения вопроса очистки сточных вод этих предприятий
заключается в том, что сахарные заводы и многие мясокомбинаты
расположены в сельской местности. Для очистки сточных вод
необходимо строить индивидуальные очистные сооружения, что
обходится значительно дороже, чем использование общегородских
очистных сооружений.
Сточные воды различных цехов мясокомбинатов неодинаковы
по составу. Наиболее концентрированными являются отходы
колбасных цехов, значение БПК2о которых может превышать
10 000 мг/л. Состав сточных вод убойного цеха зависит от
тщательности выполнения технологии. Недостаточно полный сбор
крови приводит к попаданию ее в сточные воды и резкому
повышению их БПК. В процессе очистки желудков их содержимое —
остатки полуиереварепного растительного корма (каныга)—по-
2S5
падаю i в сточные волы и осложняют процесс их очистки. Сточные
води различных цехов мясокомбинатов направляются в общую
коммуникацию. bllKs общих сючных вод составляет 1200—
1500 мг/л. Грудную проблему в отношении очистки создает
наличие жира в сточных водах мясного производства. По
существующем! технологии жир должен отделиться иа специальных
приспособлениях— жироловках, однако па практике жир отделяется не
полностью. Его присутствие затрудняет биохимическую очистку
сточных вод. Это связано с тем, что микроорганизмы, используемые
для окисления органических веществ, обладают слабой лпполпти-
ческой активностью, т. е. способностью вырабатывать фермент
липазу, гндролизующий жиры.
Сточные воды сахарного производства также делятся на
различные категории. Органические загрязнения попадают в сточные
воды в процессе мойки и транспортирования сахарной свеклы,
промывки центрифуг, фильтров и другой аппаратуры. Большое
количество органических примесей содержится в жомовой воде,
т. е. в воде, стекающей с частиц измельченной сахарной свеклы
(стружки) после извлечения из них сахарозы. БПК сточных вод
сахарного производства зависит от многих факторов и может
достигать нескольких тысяч миллиграммов на литр.
В микробиологической промышленности существует категория
сточных вод, представляющих собой конденсаты, образующиеся
в результате упаривания культуралыюй жидкости пли
промежуточного продукт производства. Такие сточные вочы образуются
в производствах витамина В|2, кормовых дрожжей, аминокислот,
ферментов. Они содержат летучие органические примеси, главным
обрл.юм низшие жирные кислоты, некоторые растворители. Кон-
цеп грация этих веществ невелика, и они могут подвергаться
биохимической очистке вместе с другими счочпымп водами данного
нрои шолств.т. Однако существуют методы, с помощью которых
сравнительно легко освободиться от летучих примесей без
применения биохимической очистки, например пропусканием паров через
соответствующие поглотители перед их конденсированием. При
этом гюлучае1ся очищенная вода, не содержащая
микроорганизмов и продуктов их обмена, что имеет место при биохимической
очистке. Это позволяет возвратить конденсаты в производство для
повторного использования и значительно сократить расход воды
на технологически!? нужды. В некоторых случаях, например при
производстве кормовых дрожжей па меллеспой бар ie, конденсаты
могу г использоваться для прпгоювтеиия среч без прсаварптель-
ной очистки.
К особой катсюрии в oiношении врешостп для живых
организмов и трудности биохимической очистки oiносятся сточные
йоды, сочержашне иефк-продукты. В микробиологической
промышленности такие сточные волы ибрл.гскнея при производстве
короткого бс.тка на угтево юро.тпч пефш. В других отраслях па-
рочпотч \озяйс|ва имеется большое разнообразие таких сточных
под п.л иронехожчеппю и концентрации нефтепродукта. В болыппн-
ЦУа
стве случаев после несложной обработки такие сточные воды
содержат небольшое количество нефтепродуктов (50—100 мг/л). Они
характеризуются невысокими значениями ЬПКго (300—500 мг/л).
Тем не менее сточные воды эшх категорий представляют особую
опасность для обитателей водоемов, куда их сбрасывают.
Особенность их заключается в том, что нефтепродукты не растворяются
в воде и могут мигрировать по всему водоему, скапливаясь в
больших количествах в определенных местах и нанося вред гидро-
биоптам. Нефтепродукты скапливаются вначале па поверхности,
затем, адсорбнруясь па частицах взвешенных веществ, оседают на
дно, занимая большие пространства. Нефтепродукты трудно
окисляются, и самоочищение водоемов от них происходит очень
медленно. 1'акнм образом, пред, наносимый нефтепродуктами
обитателям водоема, обусловлен не столько поглощением кислорода
в результате их окисления, сколько действием самих
нефтепродуктов, хотя н процессе нх окисления поглощается сущееiвенное ко-
личсово растворенного в noie кислорода. Кроме того,
нефтепродукты, образуя на поверхности воды пленку, ухудшают контакт
воды с воздухом и затрудняют процесс растворения кпелорчда.
Вредное действие самих нефтепродуктов объясняется тем, что они
ие усваиваются животными, а, проникая в организм,
накапливаются в нем и препятствуют протеканию нормального метаболизма.
Наличие нефтепродуктов в мембранах клеток нарушает их
избирательность и проницаемость для питательных веществ и
продуктов обмена.
Происхождение сточных под, содержащих нефтепродукты,
может быть самым разнообразным. Кроме отходов производства
кормового белка большое количество их образуйся па
нефтеперерабатывающих заводах. Состав сточных вод
нефтеперерабатывающих заводов сложен. Кроме \ i леводородов нефти они содержат
продукты ее переработки — органические кислоты, растворители и
другие органические вещество.
Значительное количество нефтепродуктов попадает в водоемы
из гидротехнических сооружений и транспортных судов из-за пе-
герметичпости смазочных устройств н в результате неполного
сгорания топлива. Загрязнение водоемов нефтепродуктами такого
происхождения можно свести к минимуму при правильной
эксплуатации соответствующего оборудования, опнако полностью устра-
нить утечку горюче-смазочных материалов п процессе- работы
механизмов практически невозможно. В связи с этим сточные воды,
содержащие нефтепродукты, собирают (где это возможно) в
специальные емкости с целью их очистки перед сбросом в водоем.
Этот способ применяется на речных и морских судах, где пефте-
солержащис сточные полы образуются в результате монкн
помещений и механизмов. В процессе мойки пода стекает под настилы
(счанп) пли в льяла судов (поэтому н называется подслапсвой пли
чьяльпой водой). Сочержаипе нефтепродуктов и пей может дости-
1ать 10 °/о, однако основное количество нх легко отделяется простым
счешем. Существуют специальные станции отг.онного типа, где
2S7
нефтепродукты отделяются до концентрации 20—50 мг/л. Для
дальнейшей очистки необходимо применение других методов, в том
числе биохимического, позволяющего получить очищенную воду,
удовлетворяющую большинству современных требовании.
Большое количество иефтесодержащих сточных вод образуется
на танкерах. После перекачки нефтепродуктов из трюмов
последние заполняются водой для сохранения равновесия судов. Вода
смешивается с остатками нефтепродуктов, в результате чего
образуются так называемые балластные воды, которые по окончании
рейса должны очищаться перед сбрасыванием их в водоем.
Существуют станции очистки балластных вод, работающие по принципу
отстоя. Доочнстка их также требует применения биохимического
метода.
ОЧИСТКА СТОЧНЫХ ВОД В ЕСТЕСТВЕННЫХ УСЛОВИЯХ
Самоочищение воды в естественных водоемах. Процесс очистки
воды от загрязнении постоянно происходит в естественных условиях.
Интенсивность процесса естественной очистки должна преобладать
над интенсивностью ее загрязнения. В водоемах, расположенных
вблизи населенных пунктов и промышленных предприятий,
наблюдается обратная зависимость. Поэтому возникает необходимость
ликвидировать загрязнения воды, поступающей из населенных
пунктов и промышленных предприятии в водоем.
Любой водоем — это сложная биологическая система с
разнообразными обитателями. Изменение степени загрязнения водоема
ведет к изменению условий существования водных организмов и
изменению их видового состава. В каждом водоеме возникают зоны
с различной степенью загрязнения. В процессе самоочищения
концентрация загрязнений и степень минерализации изменяются. Зоны
водоема с различной степенью минерализации органических веществ
определяют развитие соответствующих водных организмов (сапро-
бпинтой) и называются зонами саиробности. Различают
поли-, мезо- и олигосапробные зоны. Полисапробная зона — зона
сильнейшего загрязнения. В ней резко выражены гнилостные
анаэробные процессы, т. е. процессы разложения белков, аминокислот
и других органических азотистых веществ, а также брожения
углеводов, пектиновых веществ. В этой зоне развиваются организмы,
стойкие к повышенным концентрациям органических веществ и
продуктов обмена — кислот, сероводорода, метана, углекислого
газа. В полисапробной зоне почти полностью отсутствует кислород,
поэтому преобладают анаэробные процессы.
И мезосапробной зоне продолжаются процессы минерализации
веществ и начинают преобладать процессы аэробного окисления.
Уменьшение общего количества органических веществ в этой зоне
обусловливает усиленное окисление аммиака с образованием
нитритов и нитратов, а также образование сульфатов из сероводорода.
Вода ноли- п мо.юсапробпоп зон водоема сочержпт большое
количество микроорганизмов. О.иыосапроЛчич зона — это зона чнеюй
Уса
воды, лишенной органических веществ. Она содержит мало
микроорганизмов. Нитриты, нитраты и сульфаты в пен таьже почти не
образуются. Наиболее значительны здесь процессы окисления солей
железа (II) под влиянием железобактерий, которые являются
показателем олигосапробнон зоны.
Самоочищение волы в искусственных сооружениях.
Происходящие в природе естественные биохимические процессы
разложения органических веществ, а также процессы фильтрации,
адсорбции с давних пор использовались для обработки сточных вод. Для
этого сооружали специальные сборники (ямы), в которые собирали
сточные воды одного или нескольких производств, выдерживали
их там длительное время, подвергая органические вещества
естественному разложению под влиянием микроорганизмов. Наряду
с этим использовалась фильтрующая способность почвы.
Органические вещества, задержанные верхним слоем почвы, могут
служить удобрением. Так появились варианты очистных сооружений.
Они существуют и в настоящее время и называются полями
орошения, полями фильтрации, биологическими прудами.
Поля орошения — это специально подготовленные участки
земли, на которые сливаются сточные воды с целью полива этих
участков и одновременного удобрения почвы органическими веществами,
содержащимися в сточных водах. При правильном использовании
этого метода, т. е. при условии, что сточные воды не содержат
примесей, вредных для почвы и сельскохозяйственных культур, при
соблюдении прочих агротехнических требований — это один из
лучших методов очистки и утилизации сточных вод. Существуют
коммунальные и земледельческие поля орошения.
Коммунальные поля предназначены главным образом для очистки
сточных вод, а использование последних для орошения имеет
вспомогательное значение. На такие поля дается максимальная нагрузка
и подбираются специальные виды сельскохозяйственных культур,
требующих больших количеств влаги и удобрений. Основная цель
земледельческих полей — орошение, т. е. внесение в почву влаги
и удобрений в количестве, оптимальном для произрастания
сельскохозяйственных культур. Одновременно с этим достигается
очистка сточных вод. Земледельческие поля принимают сравнительно
небольшую нагрузку на единицу площади и для их строительства
требуется меньше затрат, чем для сооружения коммуннкальных
полей.
Сточные воды ряда категорий представляют большую ценность,
чем некоторые традиционные удобрения, например навоз.
Наиболее ценные элементы питания растений — азот, фосфор и калий.
Соотношение их в навозе равно 2:1:2. В коммунальных сточных
водах их соотношение равно 5:1:2, т. е. важнейшего элемента
питания растений—азота — в несколько раз больше. То же самое
можно сказать о некоторых других сточных водах.
ОдниМ из условий правильного использования полей орошения
является освобождение сточных вод от взвешенных часгиц,
особенно жироподобных веществ. Попадание их в почву приводи" к эаку-
37 _ 2-1702
2В9
лориванию пор, чго затрудняет доступ воздуха в почву и нарушает
чроцесс окисления органических веществ. Процесс
предварительной ОЧНС1КП воа ст взвешенных частиц способствует освобождению
их or iiciroreiniux микроорганизмов и гельминтов. В процессе от-
стйнпрння сточных под в течение 1—2 ч можно освободить их иа
7Г>—95 % or гельминтов и в значительной степени от патогенной
мнгрофторм. Наиболее устойчивыми и нежелательными в санитар-
по-эп.члсмиплогнческом отношении являются яйца гельминтов.
ПоэтомуЧанптарпымн нормами запрещено орошение сточными
волами сельскохозяйственных нолей, где выращиваются культуры,
употребляемые и ннщу в сыром виде.
I IcofiAfiiiinuM условием применения сточных вод для орошения
являемся гмсутепше в них токсичных веществ.
Поля фи шрации. Эти сооружения предназначены только для
o'mictkii сточных вод. Они представляют собой отдельные участки
(к:tpiLi), ограниченные земляными валиками. На производствах,
пс недостаточно тощади, эти карты имеют значительные
углубления. Наиболее пригодны для полей фильтрации песчаные, еу-
исччпиыс, суглинистые и черноземные почвы. Вблизи полей
фильтрации, как и нолей орошения, не должно быть грунтовых вод.
служащих источником водоснабжения. Поля фильтрации имеют
дренажную систему, по которой вода после фильтрации отводится в
рекп или другие водоемы. Сточные воды, очищенные на полях
фильтрации и нолях орошения, характеризуются следующими
показателями: БПК2о= Ю...15 мг/л, содержание нитритов — до
25 мг/л, количество микроорганизмов — 0,1 —1,0 % по отношению
к первоначальному, г. е. очищенная вода не нуждается в
дезинфекции.
Недостатком всех указанных сооружений по очистке сточных
вод является сезонность их использования. Из-за промерзания
почвы значительно или полностью теряют фильтрующую
способность. При этом поступающая сточная вода намерзает, процесс
биохимического окисления загрязнений почти прекращается и с
наступлением весны сточные воды в неочищенном виде поступают
в водоемы. Кроме того, с течением времени фильтрующая
способность почвы уменьшается вследствие накопления
минерализованных веществ и появляется необходимость сооружения новых
карт, что недопустимо при известном дефиците посевных
площадей.
Биологические пруды представляют собой земляные
резервуары, в которых биохимическая очистка сточных вод происходит
естественным путем. В прудах происходят такие же процессы, как
и при самоочищении водоемов. Биохимические процессы в биоло-
гичесчих прудах происходят при температуре не ниже +6fC.
В зимний период биохимические процессы практически
прекращаются. Биологические пр>ды используют главным образом для до-
оч.четкн сточных вод, прошедших биохимическую очнс1ку.
Биологические пруды 1ф|.годны для разведения рыбы. Ввиду невысокого
содержания cpr^m*...- .i.x прлл.^соа и воде, иастули.ышей в биоло-
JSC
гнческие пруды, и невысокой интенсивности окислительных
процессов в воде содержится растворенный кислород в количестве,
необходимом для жизни рыбы В большинстве случаев такие грудь
бывают проточными с полным водообменом за 8—10 сут. Проточ-
ность и специальные перегородки, устраиваемые в биологически:'
прудах, создают условия для хорошей диффузии кислорода. В
биологических прудах наблюдается хороший эффект деочнстки
сточных вод. При этом количество взвешенных частиц уменьшается на
98 %, окисляемость снижается на 97 %, аммиак почти полностью
окисляется в нитраты, что имеет большое положительное значение
для водоемов, в которые затем из биологических прудов
сбрасываются сточные воды. В биологических прудах количество
микроорганизмов уменьшается на 99 %. Весной в биологические пруды
запускают мальков карпа, прирост массы которых за сезон может
составить 0,3—1,0 т на 1 га прудов. Вблизи биологических прудов
обычно устраивают малые зимовальные пруды для сохранения
рыбы в зимний период. Они имеют большую глубину — до 2,5 м
и более, интенсивный проток воды в расчете па полный обмен за
5—7 сут. Для предупреждения полного зарастанич прудов ряской
в них разводят уток, для которых ряска являетсч хорошим кормом.
В других случаях наоборот, целесообразно осуществлять
регулируемое развеаение ряски или других высших водных растений,
которые облапают высокой способностью к очистке воды от
различных примесей, например металлов и токсичных минеральных солей
Использование водных растений, как и резпедемие полезных ж и
вотных, повышает рентабельность биологических прудов.
ОЧИСТКА СТОЧНЫХ ВОД С НАПРАВЛЕННЫМ ИСПОЛЬЗОВАНИЕМ
БИОХИМИЧЕСКИХ ПРОЦЕССОВ
Вспомогательные методы. Методы очистки сточных под в ис
кусственно созданных условиях принято делить на механические,
химические и биохимические. Последние называются еще
биологическими и микробиологическими. Главная задача применения
химических реактивов заключается в том, чтобы изменить физическое
состояние органических веществ, в частности ьызпагь коагуляцию
растворенных веществ, которые затем выделяются механически.
Коагуляцию веществ можно вызвать и другими, не химическими
методами, например методом пропускания электрического тока; этот
метод в настоящее время распространяется все шире. Для
ускорения процесса осаждения частиц можно использовать метод
адсорбции. Во всех случаях удаление веществ осуществляется
механическим методом, другие же принципы применяются лишь для интен
енфнкйцнн этого процесса.
Механические Методы в целом также являются вспомогагель
ными н предназначены для удаления нераствсунмих примесей,
способных отделяться от жидкостей вследствие отличия "х плот-
29»
кости от плотности воды. В основе механических методов лежит
естественное отстаивание или принудительное отделение примесей
центрифугированием, фильтрованием или различными вариантами
Э1н.\ метол mi. И зависимости от природы нерастворимых
(взвешенных) чаепш они при разделении могут осаждаться
(седиментация) пли всплывать (флотация). Последнее относится к
веществам с меньшей плотностью, чем у воды, находящимся во
взвешенном или эмульгированном состоянии (жироподобные
вещества, нефтепродукты). Процессы седиментации и флотации
можно интенсифицировать различными методами, способствующими
укрупнению частиц и увеличению скорости их осаждения или всплы-
ванни. Коагуляция может происходить под влиянием
различных факторов, способствующих образованию комплексов или
агрегации молекул на основе взаимодействий, обусловленных
гидрофильными, гидрофобными, электрическими и другими свойствами
молекул органических веществ. Изменение физического состояния
вешеств достигается добавлением химических реактивов, изменением
рН среды, применением электрического тока, изменением
температуры и т. д. Эмульгированные частицы липидов, нефтепродуктов
могут укрупняться в результате простого продувания воздуха через
сточную воду или пропускания ее через мелкопорнстыЙ фильтр.
В этом случае процесс укрупнения называется коалесцен-
u и е и. Существуют так называемые коалесцирующие фильтры,
которые используют для отделения нефтепродуктов.
Все вариант механических методов очистки не могут быть
в принципе использованы для отделения растворенных примесей
и применяются главным образом как предварительные, после
которых пода должна направляться на биохимическую очистку.
Во многих случаях вещества, отделяемые механическим
методом, подвергаются биохимическому окислению в метантенках или
других сооружениях.
Наиболее распространенным методом отделения взвешенных
частиц или переведенных в такое состояние коагуляцией является
естественный отстой, поскольку принудительное отделение
центрифугированием или фильтрацией значительно дороже. Для
осуществления процесса осаждения применяются отстойники различных
конструкции. Полнота осаждения в отстойниках достигается тем,
что объем их рабочей части, в котором оседают частицы, должен
обеспечить достаточно для этого время отстаивания жидкости. Это
время, как уже говорилось выше, принято считать равным двум
часам. Следовательно, объем рабочей части отстойника должен
быть равным количеству сточных вод, накапливающихся на данном
предприятии в течение двух часов. Поскольку на производстве
имеют место определенные колебания количества образующихся
сточных вод в течение суток, принято использовать для расчетов
среднесуточный обьем Q-.ут. м3. Тогда объем рабочей части отстойника
W = JSTE • 2 = ут
р..-v .м- ]2 •
Форма рабочей части отстойников может быть различной, При
выборе формы необходимо учитывать условия, способствующие
процессу осаждения частиц. Поскольку в процессе очистки сточная
жидкость непрерывным потоком проходит через очистные
сооружения, во всех емкостях имеет место перемешивание,
препятствующее осаждению частиц. Прн этом возникают восходящие потоки
жидкости, направленные против движения осаждаемых частиц
Необходимо, чтобы скорость восходящих потоков была меньше
скорости осаждения частиц. Установлено, что для обеспечения
максимального осаждения взвешенных частиц скорость восходящего
потока VB не должна превышать 0,0007 м/с (0,7 мм/с). Скорость
восходящего потока при стабильном общем объеме сточных вод
зависит от площади сечения отстойника, т. е. от его диаметра.
Поскольку скорость оседания частиц для данной категории сточных
вод постоянна, нужное соотношение между указанными скоростями
достигается расчетом и подбором соответствующего ана метра
отстойника. Более сложно решение вопроса об объеме и форме
нерабочей части отстойника, которая служит для сбора и удаления
осадка. Форма нерабочей части отстойника зависит от метода
удаления осадка. Если это осуществляется под естественным давлением
или отсасыванием из нижней части, нерабочая часть отстойника
выполняется в виде усеченного конуса. Такая форма обеспечивает
сужение сосуда в нижней части. При этом необходимо соблюдать
условие свободного скольжения осадка по внутренней поверхности
конуса. Для этого угол откоса по отношению к горизонтальной
плоскости должен быть не менее 45°. Соблюдение этого условия
возможно при выборе соответствующей высоты рабочей части
отстойника. Обычно эта высота бывает значительной, что вызывает
необходимость углубления или поднятия отстойника. Для
устранения этого недостатка предложено использовать отстойники с
плоским днищем, а осадок собирать скребковыми механизмами, пра
щающнмнея со скоростью, не вызывающей взмучивания осадка
Объем нерабочей части отстойника зависит и от концентрации
взвешенных частиц в сточной воде, от длительности пребывания осадка
в отстойнике. Если оседающие частицы удаляются непрерывно,
объем нерабочей части отстойника может быть значительно
уменьшен. Во многих случаях с.стойникн совмещают с емкостями,
предназначенными для биохимического разложения осадка. Такие
аппараты называются отстойниками-перегнивателями. В процессе
биохимического окисления органических веществ отстойники
применяются для отделения активного ила и возврата его в очистные
сооружения .
Применение биофильтров. Биофильтры — это сооружения, в
которых биохимическое окисление органических веществ осушестилг-
ется в процессе фильтрации их через слои крупнозернистого
материала, называемого загрузкой. В результате биохимических
процессов поверхность частиц загрузки покрывает!, биологической
пленкой, заселенной аэробными микроорганизмами. Сточные воды
направляются на биофильтр после их осветления в nepBiiiiiux от-
3S -. 2-1702
293
гтойпнкач. Растворенные и отчасти нераствореннке вещества, про-
хчия через биофильтр, контактируют с микроорганизмами бноплен-
ьа и окисляю геи. ГЗо внутреннюю часть биофильтра непрерывно
по петел г.(мду.\ (естественным путем или принудительно), киелс-
Р'.-д которого расходуется на окисление веществ. Кочичество кис-
лоппци. подаваемого на биофильтр в расчете на 1 м2 площади
■\ гыырующего материала в сутки, называется окислите/юной
мощностью. Хорошие услопия контакта микроорганизмов с оргаьиче-
. ч.пмг! neineciii-'.Mii с точных вод, большая поверхность контакта и
неограниченное количество поступающего кислород? создают
условия л.чя более интенсивного окисления по сравнению с
естественными условиями.
Биофильтры выполняются в виде сооружение н.ч 4 стен В
нижней -мои располагается дренажное устройство — дырчатое дне, ни
которое загружается фильтрующий материал. Под ним имеется
сплошное дно, по которому стекает жндность, проходящая чере'
■лом з.мрузкн биофильтра. В зависимости от пропускной
Способности бывают малопроизводительные (капельные) и высокопро
и шодительпые (в ы с о к о н а г р у :к а е м ы е) биофильтры (а э р о-
фильтры). П капельные биофильтры сточные воды поступают
очень малыми долами, что позволяет полностью очищать их от
органических примесей. Однако малая производительность сильно
увеличивает обьем биофильтра и при обьемах сточных иод более
1000 мя/сут их строшельство нецелесообразно. Высокопагружаемые
биофильтры пропускают в десятки раз больше сточных вод, чем
капельные. Оли загружаются более крупными частицами, между
которыми создается больший объем пор. Это позволяет усилить
обмен воздуха, что приводит к большему насыщению жидкости
кислородом и увеличению окислительной мощности биофильтра,
однако ислелстнне большой скорости фильтрации в высоконзгру-
жаемых биофильтрах органические пешестпа сточных вод окнеля
юте я не полностью. Трулноокнслясмыс вещества вымываются h.i
биофильтра вместе с избытком бпопленкн, которая интенсивно
образуется в этих условиях. Для повышения степени очистки сточных
вод необходимо разбавлять нх чистой водой или повторно
пропускать через биофильтр (р е ц и р к у л я и и я). Это сильно
уменьшает производиle/iMiocTb биофильтра. При среднегодовой температу
ре воздуха до +3"С биофильтры размещаются в отапливаемом
помещении, при более высокой среднегодовой температуре они мо
гут работать без искусственного подогревания. При размещении
биофильтров пне отапливаемого помещения рекомендуется
подогревать воздух, предназначенный для аэрации
Недостатком биофильтров яв.-.яется их большей объем и
трудность регулирования происходящих в них биохимических
процессов. Надежность нх работы также невысока. При несоответствии
размеров частиц рекомендуемым нормам и по другим причинам
биофильтры М'-тут р.'б'.пать неэффективно пли почти полносты'.
Ве:.\ОДЧТЬ HJ •• р.»- чС.|.. ".ГТВН.' ТОГО, ЧТО ПОТОКИ ЗО.'ЛЛ'Ха И ■СТОЧИ'".".
ггд- ;т:: :>.:. . ;i'/p "-л. не »ь.- всему объему . !'■"■.. г■• r.i\
: ■ i
Ичиг/ч* aoai с аэротенках. Аэр^те-о: - *ю pc3.:|v,..\';.u. ^ r.;.if'
ром производится искусственное насыш.гьш. стачных чг.,,1 ..тлоро
дом воздуха в присутствии микроорганизмов. Наряду с
микроорганизмами в аэротенках могут развиваться макроскопические
(низшие) растения и животные. Смесь микроскопических л ив их
организмов и остатков нерастворимых веществ образует хлопьевидные
осадок, называемые активным нлом. Эффектичность очистки
сточных вод в аэротенках зависит от физиологических свойств и
технологических качеств активного ила, от интенсивности аэрации.
Большое значение имеет соотношение источников углерод.], азота
и фосфора в сточных водах. Количество азотистого и фосфорного
питания останавливается, исходя из соотношения: БПКь: N : Р =
= 100:5: 1.
Процесс очистки сточных вод в аэротенке происходит в три
стадии. На первой стадии в момент поступления свежих
сточных вод в аэротенк ил адсорбирует загрязнения и разлагает Jier-
<:оокисляющнеся вещества. Это приводит к резкому снижению БПК
(на 70—80 %) н потреблению основного количества кислорода.
Первая стадия длится 1—2 ч. На второй стадии
разлагаются медленноокнсляемые вещества и активный ил регенерируетсч.
т. е. разлагаются вещества, адсорбированные на иле, и
восстанавливаются его первоначальное состояние и активность. Скорость
потребления кислорода при этом меньше, чем на первой стадии. На
••ретьей стадии происходит процесс нчтрифнкацни
аммонийных соединений. Этот процесс идет интенсивно, что проявляется
в увеличении скорости потребления кислорода на этой стадии.
Протесе нитрификации происходит иод влиянием нитрифицирующих
бактерий. В биохимическом и микробиологическом отношении jrof
процесс делится на две фазы. В первой фазе аммиак окисляется
s нитриты:
2NH8 + ЗО, = 2HN03 -J- 2Н,0„
Эту фазу осуществляют бактерии, относящиеся к роду Nitro
somonas
Во второй фазе нитриты окисляются в нитраты:
2HN03 + О, = 2HNOs.
Эту фазу осуществляют бактерии рода Nitrrbac'er. Первая фаза
нитрификации проходит значительно быстрее.
Процесс нитрификации является показателем того, что
разложение органических веществ уже закончено. С точки зрения
качества очищенной воды этот процесс важен тем, что он
способствует накоплению связанного кислорода. При недостатке г.нллорода в
ооде водоема, куда сбрасывают сточные волы, микроорганизмы
используют кислород нитратов для окисления органических
веществ. Таким образом, наличие нитратов являйся положительным
показателем очищенной сточной поды.
Для обеспечения полноты очистки сгочпих под допускают
затраты определенного времени на шпрнфикацпю и про глжа:ст
acs
очистку до тех пор, пока в жидкости не образуется 5—6 мг/л
нитратов. На это требуется 6—8 ч, причем БПКг снижается до 15—25 мг/л.
Затраты кислорода на нитрификацию примерно равны конечному
значению 1И1К очищенных сточных вод. По окончании очистки
концентрация растворенного кислорода увеличивается. Описанные
изменения характерны для процесса очистки сточных вод в
стационарных условиях, т. е. для периодического процесса. На практике
выгоднее использовать непрерывный процесс, при котором условия
окисления постоянны н колебаний указанных параметров не
наблюдается. Значения этих параметров регулируются скоростью
протока сточной жидкости через аэротенк.
Лэротенки могут быть использованы для полной очистки сточных
под с широким диапазоном концентрации органических веществ,
п том числе для очистки сточных вод пищевых и
микробиологических производств. Однако высококонцентрнрованные сточные воды
этих производств требуют дальнейшего совершенствования этого
метода. В первую очередь необходимо совершенствование методов
аэрации. Основная задача — добиться максимального измельчения
нушрькон воздуха. Обычные барботеры, т. е. трубы с отверстиями,
не обеспечивают высокой степени диспергирования воздуха. Более
эффективны в этом отношении фнльтросные пластины,
изготовленные из мелкопорнстого материала. Однако наряду с эффективным
■шенергировапнем воздуха они имеют недостатки, к которым
относят трудоемкость их монтирования, возможность забивания пор и
трудность регенерации. Вместо фильтросных пластин применяют
тканевые аэраторы, не имеющие указанных недостатков. Однако
для них характерны свои недостатки, например быстрый износ
ткани. Дальнейшим совершенствованием такого типа аэраторов
явились трубы из пористого материала. Они удобны для монтажа
и позволяют осуществить секционную подачу воздуха. Это
облегчает равномерное распределение воздуха, улучшает аэрацию и
упрощает эксплуатацию сооружений.
Все перечисленные системы аэраторов требуют высокого
давления воздуха и больших затрат электроэнергии. Более проста в этом
отношении ннзконапорная аэрация, для осуществления которой
применяют специальные вентиляторы, не требующие большого
расхода электроэнергии. В качестве аэрирующего устройства при этом
используют дырчатые трубы.
В процессе аэробной очистки сточных под воздух не только
является источником кислорода, но и способствует перемешиванию
жидкости. Это должно учитываться при выборе аэрирующего
устройства. Существенные преимущества имеют механические
аэраторы, выполняемые в различной фирме. При механическом
перемешивании воздух захватывается мешалкой н кислород
растворяется и жидкости Это обеспечпчает контакт клеток микроорганизмов
с кислородом и пнгатсльчмми пешестпачн. Недостатком
механических метопов я'-р,гшш чпчяогн сложность использования их в
а->[1(чс1и-.л\ бо.')).|!1"п cvkjcti! При -том необходимо устанавливать
iieiKfvi.i г- a-'i'ii \;»>г"1 ч,-' ji < ь..- -\ чип; певмгод.чо.
Существенными преимуществами обладает метод аэрации
водяным вакуум-насосом, в котором происходит сильное
перемешивание сточной воды с воздухом с последующей подачей воздушно-
водяной смеси в аэротеик.
Другой особенностью очистки в аэротенках является
необходимость отделения активного ила после окончания процесса
окисления сточных вод. В стационарных условиях это возможно отстаива-
ннем содержимого аэротенка с последующим де .антнромапнем
очищенной воды. Однако такой способ малоэффективен н не может
применяться на практике. В действительности сточные йоды
непрерывным потоком проходят через аэротенк и при отсутствии каких-
либо задерживающих устройств выходят из аэротенка вместе с
активным илом. Поскольку задерживающие устройства
практически не могут быть применимы, смесь ила и воды направляется из
аэротенка в специальные резервуары — вторичные отстойники, нз
которых очищенная вода сливается в водоем, а осажденный
активный ил возвращается в аэротенк для повторного использования.
Вторичные отстойники — это аппараты такого же типа, как и
отстойники, предназначенные для предварительного (первичного)
отделения взвешенных частиц.
Конструкция аэротенков несложна. Это четырехугольные или
круглые сосуды, внутри которых располагается система аэрации.
Объем аэротенка зависит от колнчестпа очищаемых сточных под,
а также времени, необходимого для полной очнеткн. Для
большинства категорий сточных вод время аэрации принимается равным
J2 или 8 ч. При 12 ч аэрации объем аэротенка равен половине
суточного количества сточных вод данного производства, при 8 ч —
одной трети суточного количества сточных вод. Объем аэротенка
для любого времени аэрации можно рассчитать по формуле
^«Р= ~24" ■ м •
где QcyT— суточное количество сточной воды, м"; t — время
аэрации, ч.
Габариты аэротенка, т. е. соотношение длины, ширины и
высоты, определяются строительными и другими нормами. При этом
учитываются и биохимические факторы, связанные с растворением
кислорода в сточной воде, циркуляцией активного ила и т. д.
В большинстве очистных сооружений аэротенкн выполняются
в блоке со вторичными отстопникал'и, т. е. последние как бы
являются продолжением аэротенков. При расчете вторичных
отстойников исходят нз того, что активный ил из них непрерывно
возвращается в аэротенк. При этом необходимо учитывать, что вместе
с илом в аэротенк возвращается определенное количество воды, чго
сказывается па скорости потока смеси ила и воды из аэрогенка в
отстойник и, следовательно, на размерах отстойника.
Интенсивность очистки в аэротенках зависит от количества
микроорганизмов, т. е. от концентрации активного ила в очищаемой
сточной воде. Копгк'ство активного ила и аэротенко зависит от
игл
режима рабпы рторм«нсг^ отегмчпра. Прчкптое времч отст-»
1,5-- 2.0 ч i -'с-спечнааег кони> лграикю акпинсго ила в аэрэтенке
на уровне о r/л. Концентрация ила может быть увеличена
интенсификацией процесса возврата его из отстойники в аэротенк
(увеличением количества циркулирующего нла). Однако при
концентрации ила до 6 г/л кратность циркулирующей воды превышает
100 %, что ухудшает условия отегол, качество очистки и требует
значительного увеличения объема отстойника. Тем не менее
высокая лонцектрация ила значительно ускоряет процесс окисления
органических всидеств и такой принцип используется на практике.
Для его осуществления предложены аппараты, в которых аэротенк
и отстойник еовА'ещены пким образом, что сточная вода
непрерывно поступает ь отстойник и снова возвращается в аэротенк почти
с такой же скоростью. Различье в режимах работы аэротенка и
отстойника состоит лишь ь том, vio в отстойнихе не происходит
Ёэрацни. а это дает возможность активному илу перемешаться в
нижнюю часть отстойника, откуда ок сразу же поступает в
аэротенк. Такие типы сооружений целесообразно применять для
неполной очистки высококонаентрированных сточных вед.
Активный ьл, осажденный во вторичном отстойнике, содержит
кеокьеленные органические вещества и значительное количество
запасных питательных веществ, накопленных вследствие избытка
источников питания. Это яедег к быстрому стсреаию клеток
микроорганизмов и снижению их акгпзности. Для поддержания клеток
микроорганизмов в молодом активном состоянии необходима
регенерация, т. е. освобождение клеток от згнасных питательных
веществ н продуктов обмена и возвращение их в первоначальное
активное состояние. Для этого в отдельном резервуаре активный ил
подвергают аэрации в течение определенного времени при
незначительном содержании или полном отсутствия питательных веществ.
Одним из биохимических показателей, характеризующих
работу лэротеика, является его окислительная мощность, т. е. значение
ISIlKs сточных вод, снимаемое однчм кубическим метром емкости
чэротенки в сутки. Окислительная мощность зависит от нагрузки
ia 1 г активного ила по БПК, а также от всего количества актнв-
чого ила. Нагрузка на ! г сухого беззолыюго вещества активного
чла при полной очистке бытовых сточных вод колеблется в
пределах Ю0—500 мг/г в сутки, а при неполной очистке увеличивается
ю 2000 мг/г. Для очистки сточных вод с высоким содержанием
-рнмесей используется двухс-упенчатая аэрация. В аэротенке на
юрвон ступени осуществляется интенсивное, но неполное
окисление веществ, а доочистка их происходит на второй ступени. Для
:аж10го аэротенка при этом характерен свой режим работы.
С целыо интенсификации процесса очистки сточных вод их
предварительно аэрируют в отдельной емкости (пр е а э р а то р е).
'Три этом тонкоднепррпфонанные взвешенные примеси укрупяяют-
.•«I, их процесс осаждения ускоряется. Продолжительность процесса
■ рс-дйчрптельной аэрации соептля-.т 10—20 мня. При эюм БПК
iMt'i;i,ni.ieTC>i на 5—8 %, Для улучшения процесса осветления сточ-
■_".):<
ной воды в преаэраторах в нее вводят активный «л. Такие
сооружения называются б и о к о а г у л я т о р а м и.
В процессе аэробного окисления органических гсщрстз в аэро-
тенке происходят прирост клеток микроорганизме» и ургчтение
количества активного ила. За определенное время его становится
больше, ием может быть возвращено из отстойника в зэротенк, и
появляется необходимость удаления так н.'пызаемого
избыточного активного ила. Решение вопроса ликвидации
избыточного активного inn ivc-жет быть самым различным Наиболее
целесообразно нспользоеэть его кзк ценный оргэмическш"
материал, о чем подс'Онее будет счазано ниже. Постельку в ча^тояше.
время вопрос утилизации окончательно не решен, избыточный ai.
тивный ил вместе с осадком из первичных отстойников
подвергнется анзэообному биохимическому разложению в мет?нтечках
Одним из методов .ликвидации избыточного активного ила
является аэробная минерализация его в специальных аппяр?тах.
Процесс аэробного окисления органических вещестч мож:-'о риулнро-
вагь так, что избыточный активны"! ил вообще но будет
образовываться. Для этого необходимо продолжить аэрацию сточной жид
косгн в аэротенках в расчете па то, что избыток биомассы
микроорганизмов будет разлагаться. Другими словами, необходимо
создать равновесие между процессами биосинтеза и разложения
клеточного материала. Этот метод называется про длен мой
аэрацией. Недостатком его является появление мелкого, шн -
хо оседающего активного ила (в результате голодания), что
ведет к уменьшению скорости его осаждения и выносу из аэ-
ротепка.
Окислительные каналы. Для доочисткн сточных вод, а иногда
вместо аэротенков могут Сыть использованы менее дорогостоящие
сооружения — окислительные каналы. Они представляют собой
длинные траншей, вырытые в земле и укрепленные бетоном или
другим материалом Сточная вода, протекая от одного конца
капала к другому, аэрируется. Для лучшей аэрашш па пути движения
води ставятся перегородки, создающие турбулентность потока, или
применяются механические аэраторы в виде горизонтального вала
с лопастями. Окислительные каналы применяются для очистки
сравнительно небольших количеств сточных вод. Они имеются на
предприятиях молочного, пивоваренного и других производств. Сточные
воды молочных заводов, очищенные в окислительных каналах,
имеют БПКб около 10 мг/л, однако более загрязненные поды, например
бытовые, так удается очистить лишь до значения БИКгс 2С мг/л
Недостатком окислительных каналов является отсутствие
возможности регулировать температуру. Кроме того, ввиду большой
протяженности каналов необходимо делать изгибы и повороты, в
которых активный ил задерживается и загнивает По этой причине
каналам следует придавать кольцевую форму.
Существуют каналы периодического и непр"ры
и о г г» действия Канялы периодического действии не имеют вто
рнчпы) отчтойнчкоз н применяются в тех случаях, кс^у с >->чиы*.
2Ш
воды поступают с перерывом. Этот перерыв используется для
отстаивания активного нла. При каналах непрерывного действия
имеются вторичные отстойники. Активный ил из вторичных
отстойников возвращается в каналы, а избыток его направляется на
иловые площадки.
Основные показатели активного ила. Активный ил азротенков
имеет вид желтовато-бурых хлопьев, содержащих различные виды
организмов, в основном микроскопических. В составе активного
нла встречаются простейшие, гельминты, грибы, бактерии,
дрожжи и другие организмы. Основную роль в процессе очистки сточных
вод играют микроорганизмы, которым доступны растворенные
питательные вещества. Простейшие ведут паразитический образ
жизни, пожирая бактерии. Питательными веществами для червей
и, вероятно, простейших являются взвешенные частицы
коллоидных веществ. Отмершие простейшие и черви разлагаются
бактериями. Соотношение между количеством обитателей активного ила
может значительно изменяться в зависимости от условий. При
очистке сточных вод, содержащих нефтепродукты, кроме бактерий и
дрожжеподобных грибов не встречается никаких других живых
организмов. Сточные воды мясокомбинатов содержат большое
количество простейших. Соотношение между отдельными видами
организмов изменяется даже в одной и той же сточной воде в
зависимости от нагрузки на активный ил по БПК.
Важнейшим показателем скорости биохимического окисления
органических веществ является концентрация активного ила,
выраженная в граммах на 1 л воды. Концентрация нла определяется
фильтрованием определенного обьема сточной воды и
высушиванием полученного осадка до постоянной массы при температуре
105 "С. Концентрация ила по сухому веществу определяется по
формуле
(х — I/) 1000
а = р , г/л,
где х — масса осадка на фильтре, г; у — масса фильтра, г; V —
объем взятой для анализа пробы, мл.
Оптимальная концентрация активного нла колеблется в
пределах нескольких граммов. Для большинства сточных вод она
составляет 3 г/л.
Существенное значение имеет зольность активного нла, которая
определяется сжиганием осадка. Масса золы, полученной после
сжигания, выражается в процентах по отношению к массе сухого
остатка.
Процесс биохимической очистки зависит от физических и
биологических свойств активного ила, а именно: физического состояния
(хлопьевидный, пылевидный), способности к осаждению, дегидро-
геплзной активности, видового состава микроорганизмов. Для
характеристики физического состояния активного нла принята
величина, называемая н л о в ы м индексом. Он равен объему,
который занимает 1 г активного нла после получасового огстаипа-
.100
иия (в пересчете на сухое вещество). Для определения илового
индекса пробу иловой смеси наливают в литровый мерный цилиндр,
выдерживают в течение получаса и отмечают объем, занимаемый
осевшим активным илом (предварительно определяют его
концентрацию, т. е. число граммов в литре). Значение илового индекса
зависит от размеров его частиц. Плотный ил с мелкими частицами
быстро оседает, что важно для его отделения в отстойнике. Однако
он имеет меньший объем и поверхность контакта с питательными
веществами, т. е. обладает меньшей биохимической активностью.
Хлопьевидный ил имеет преимущества в этом отношении, ио для
его осаждения требуется больше времени. От значения илового
индекса и его концентрации зависит эффективность работы
вторичного отсюнника. При повышении значения илового индекса
(до 100—150 мл/г) нельзя увеличить концентрацию ила в аэротен-
ке более 4—5 г/л, поскольку ил будет неполностью оседать в
отстойнике и выноситься с очищенной водой. Оптимальное значение
илового индекса для разных категорий сточных вод различно. Для
коммунальных под оно должно быть на уровне ВО мл/г. При низких
значениях илового индекса необходимо повышать дозу активного
ила в аэротсике, поскольку от этого зависит окислительная
мощность очистных сооружений. При этом нужно учитывать
возможность обеспечения иловой смеси достаточным количеством
кислорода.
Значение илового индекса зависит не только от физического
состояния пла, но н от его концентрации и смеси. Эта зависимость
обусловлена методикой определения илового индекса. Если для
определения илового индекса каким-либо образом брать только 1 г
активного ила и устанавливать его обьем после получасового
отстоя, то значение индекса было бы истинным и не зависело бы от
концентрации ила в аэротсике. Однако при изменении общего
количества ила в смеси динамика осаждения его изменяется.
Увеличение объема, занимаемого илом после получасового отстоя, не
будет строго пропорционально увеличению количества его в
жидкости, так как объем каждого грамма ила в смеси не будет равен
объему одного грамма, измеренному в отдельности.
Практически эта закономерность такова. Повышение
концентрации активного ила в аэротенке вначале почти не вызывает
увеличения илового индекса. Затем, начиная с некоторой предельной
концентрации ила, его индекс резко возрастает до определенной
критической концентра мни, при которой значение илового индекса
максимально. При дальнейшем нонышепни концентрации ила
индекс уменьшается. Это объясняется тем, что после критической
концентрации нарушается естественное соотношение между
увеличивающимся объемом активного ила и имеющимся объемом
жидкости, который остается постоянным, т. е. нарушается условие есте-
.1 псиного осаждения. В этим случае уже нельзя говорить об
клоком индексе. При копнен грации ила выше критической пловая смесь
i ообще не будет разделяться, поскольку пет условии для его
осаждения (его ос и до к уже занимает весь объем жидкости).
301
Важным биохимическим параметром очистки сточных вод
является нагрузка на активный ил по органическим
веществам или по БПК. Нагрузка может определяться по подаваемым
и по сьягым загрязнениям. Нагрузка по снятым загрязнениям
называется удельной скоростью окисления, или
окислительной способностью активного ила. Нагрузка
на активный нл измеряется в миллиграммах вещества или БПК на
1 г ила в час илн в сутки. Представление о значениях эт?лэ
показателя дают приведенные выше сведения об основных параметрах
биохимической очистки, i е. о концентрации активного ила (3—
5 г/л), значении БПКго оточлых вод (от нссколькн-; сотен до
нескольких тысяч миллиграммов на литр), времени аэрации (6—
12 ч). Поскольку биохимической очисткой преследуется цель
практически полного снятия БПК, целесообразно по значенью
последнего судить и о нагрузке на активный нл. При этом нагрузку /?„
на ил можно определить по формуле
г, БПК
где а — количестве активного ила, г/л; .' — время аэрации, ч.
Д е г и д р or e н а з и а я активность. Этот показатель
имеет прямое отношение к мехьни^му биохимического окисления.
Он зависит не только от физиологического состояния активного
ила, по и от химического состава сточных вод, от химической
природы окисляемых веществ. Значение дегндрогеназной активности
используется для контроля интенсивности процесса очистки. Для
характеристики активного ила рекомендуется определять
одновременно исходную дегидрогеназную активность (v„), т. е.
активность смеси нла со сточ.чоР водой в данный момент очистки,
а к т и в н о с г ь л я а в в о д о п р о в о ч и о й воде (vHgO) и
активность ила в свежей с тс ч ной воде (vCTB). Соотношения
■лежду указанными показателями характеризуют основные этапы
процесса очистки. Так, для неочищенной сточной воды v„ > vCT.B> vHjo.
После очистки сточной воду ог органических примесей vCT.„;>vH;>
">vh,o- После регенерации активного и па vct.b>vhjo>vh. Эти
отношения позволяют устапсвчть полноту очистки сточных ьод и степень
lereiiepdiuiu активного ила. В последнем случае значение дегнлроге-
чазной активности нла приближается к нулю.
Для определения дегидрогечазнэй активности ила используются
метиды, основанные на восстановлении бесцветной окисленной
||юрмы трифечшпетразолнйхлорида (ТТХ) и превращение его в
формазап, нмею'ций красный цвет:
г n_n_qh5 1 2ц. J4-NH-C.H,
QH6-Cf ! СГ—*k'CeHt-cf
[ xN=N+-Q,Ht J \\=N-C„HS.
Интенсивность окрашивания, г. е. количество восстановленного
фопма.1.1:и, пропорционально дегндрогеназной активности нла. Де-
;>о^
гидрогеназная активность выражается в миллиграммах
восстановленного формазана на 1 г сухого вещества ила (удельная
активность).
Биохимическое потребление кислорода (или
биохимическая потребность в кнслор'оде)—это количество
миллиграммов кислорода, необходимое для окисления органических
веществ, содержащихся в I л сточной воды. Это общин показатель
загрязнения воды органическими веществами. Он используется для
оценки степени загрязнения сточных вод, загрязнения рек и других
водоемов, при строительстве очистных сооружений, при
определении норм сброса сточных вод или водоемов совершенно не
обязательно знать состав оргаьическнх веществ, поскольку БПК
указывает на количество кислорода, поглощаемое
микроорганизмами для окисления этих веществ. Для оценки же работы очгсгных
сооружений желательно иметь представление и о химическом
составе органических веществ, поскольку скорость их окисления дллеко
не одинакова.
Теоретически необходимое количество кислорода для полного
окисления какого-либо вещества вытекает из уравнения его
разложения до углекислого газа и воды. Одчако практически
органические вещества подвергаются неполному окислению, поскольку
определенная часть промежуточных продут он расходуется на
конструктивные цели (на построение клеточного материала). На
построение клеток может расходоваться до 60 % питательных веществ,
однако было бы чегравельно учитывать это значение для
определения расхода кислорода, поскольку в культурах микроорганизмов
процессы роста и отмирания клеток происходят одновременно.
Отмершие клетки разлагаются и продукты разложении вновь
участвуют в метаболизме, окисляются и потребляют кислород.
Практическое значение ВПК всегда меньше теоретического. Так, дли
окисления I г этанола необходимо следующее количество кислорода:
СЛОН + 30, = 2СОа + ЗН.О.
4G.05 г 86 г
Для окне пения -16,05 г зтанола требуется 96 г кислорода, для
I • 96
окисления I г этанола — "ZrW ~ ^№ г кислорода. На практике
установлено, что для жидкости, содержащей 1 г эганола, БПК равно
1,82 г/л.
Биохимическое потребление кислорода сточных вод
определяется выращиванием в них микроорганизмов. Этот принцип очень
прост, опт ко выполнение методики встречает затруднения. По
принятому методу сточная вода наливается в специальные сосуды,
в нее вносится определенное количество микроорганизмов, н
сосуды выдерживаются длительное время для окисления
органических веществ кислородом, растворенным в этой воде. Известно, что
количество кислорода, растворенного в обычных условиях в воде,
составляет около 8 мг/л. Следовательно, исследуеман вода должна
■W.
содержать такое количество органических веществ, на
окисление которых с избытком было бы достаточно растворенного
кислорода. Для точности анализов рекомендуется, чтобы после полного
окисления органических веществ в исследуемой воде оставалось
около 3 мг/л кислорода. Если исследуемая сточная вода
предположительно имеет БПК порядка нескольких тысяч (что
ориентировочно устанавливается химически), то для постановки опыта ее
необходимо разбавить в тысячу и более раз. Вполне понятно, что
большое разбавление приводит к существенной ошибке при расчете,
результатов анализа. .:,
Опыты по определению БПК требуют много времени. Для
полного окисления органических веществ в стационарных условиях при
комнатной температуре необходимо около 20 суток. Об окончании
процесса окнелення органических веществ судят по появлению
нитритов, поскольку после окисления органических, веществ начиг.
нается окисление аммиака. Полученные результаты определения
БПК обозначают как БПКп (полное) или БПКго (за 20 суток).
Ввиду длительности анализа вместо БПК2о часто определяют
БПКб- За это время окисляется основная часть органических
веществ. Для коммунальных сточных вод установлено, что за 5 суток
потребляется 87,5 % всего требующегося кислорода. Это дает
представление о БПКп, если разделить значение, полученное за 5 суток,
на 0,875. Такие переводные коэффициенты можно установить для
других категорий сточных вод.
Количество кислорода, необходимое для окисления
органических веществ, можно установить и другими методами, например
химическим. Широко распространены методы окисления иодатом
калия н дихроматом калня, которые называются соответственно
иодатная окнеляемость н дихроматная окисляемость. По аналогии
с БПК эту величину предложено называть химическим
потреблением кислорода (ХПК). Значение ХПК обычно пыше значения
БПК, поскольку химическому окислению подвергается большее
количество веществ, чем действию микроорганизмов. Установлено,
что БПК бытовых сточных вод составляет 86 % их ХПК. Для
промышленных сточных вод это соотношение может быть иным. Так,
БПК сточных нод некоторых химических предприятий равно всего
20 % их ХПК. БПК сточных вод молочного производства составляе'""
80—84 % их ХПК. Это соотношение может быть установлено длр
сточных вод любой категории.
Применение метантенков. В процессе очистки сточных вод
метановое брожение используется для разложения осадка из
первичных отстойников и избыточного активного ила. Брожение
осуществляется в анаэробных условиях в закрытых сосудах, называемых
мстантенкамн. Поскольку осадок н активный ил являются
составными частями сточных вод, т. е. частью органических веществ,
подлежащих разложению, можно считать, что метановое брожение и в
данном случае выполняет часть процесса биохимического
окисления органических веществ сточных вод. Однако этот процесс
во многих случаях можно использовать для сбраживания раство-
304
ренных органических веществ, для чего до настоящего времени
применяются лишь аэротенки.
Биохимия процесса метанового брожения и некоторые его
особенности описаны в гл. VI и VIII. В данном разделе рассмотрены
некоторые особенности, связанные с очисткой сточных вод.
Разложение осадка осуществляется в метантенках, имеющих систему
механизмов для перемешивания сбраживаемой массы.
Циркуляционными насосами содержимое метантенка перекачивается из
одной части в другую с большой скоростью, позволяющей создать
активное перемешивание массы. Для сбраживания относительно
•устой массы, какой является осадок из первичных отстойников
или избыточный активный ил, перемешивание необходимо. Для
улучшения условий перемешивания метантенки должны иметь
небольшую высоту, хотя процесс метанового брожения в силу своей
анаэробной природы предъявляет совершенно иные требования к
форме бродильного сосуда: чем больше высота сосуда, тем
интенсивнее происходит анаэробный процесс. Известно также, что в
стационарных условиях (без перемешивания) создаются более
благоприятные условия для развития анаэробных микроорганизмов
Таким образом, конструкция метаптенков, предназначенных для
сбраживания осадка, определяется не требованиями процесса
метанового брожения, а технологией. Существующие типы метаптенков
сложные и дорогие. Процесс сбраживания осадка в метантенках
идет медленно — 20 суток н более, что требует их большой емкости.
Малая скорость брожения характерна для таких материалов, как
осадок из отстойников, активный ил, навоз и другие отходы,
содержащие большое количество органических веществ, в том числе
таких трудносбраживаемых веществ, как клетчатка, гемииеллюло-
зы, пектиновые вещества и др. Для биохимической очистки сточных
вод с низким содержанием органических веществ целесообразно
применять аэробную очистку, при которой окисление органических
веществ идет с более высокой скоростью. Однако увеличение
концентрации органических примесей выше определенного предела,
резко повышает расход воздуха, требует разбавления и
рециркуляции сточной жидкости, т. е. возврата ее в аэротенк для очистки.
Лля очистки высококонцентрнрованиых сточных вод целесообразно
1фименять метановое брожение для предварительного снижения
концентрации органических веществ с дальнейшей доочисткой в
аэротенках. Указанные выше недостатки метанового брожения, т. е.
малая скорость сбраживания, низкая степень очпегкн и высокая
стоимость изготовления метаптенков, явились тормозом к
широкому использованию этого процесса для очнегкн сточных вод.
Исследования, проведенные в последнее десятилетне, показали, что
метановое брожение на сточных водах имеет совершенно иную
характеристику, чем при обработке осадка. Прежде всио ью относится
к скорости процесса. Скорость сбраживания осалка очистных
сооружений составляет всего 3—5 % объема бродильного аппарата
в сугкн, что в переводе на размерность, принятую а теория непре-
3« - 2 17U2
305
рыпнмх процессов, составляет 0,0012—0,0021 ч~* (в периодическом
процессе это соответствует примерно 20—30 суткам). Метановое
брожение других отходов, например мелассно-спиртовой барды,
составят !0 '% объема аппарата в сутки (0,0042 ч-1 при
непрерывном или 10 суток при периодическом процессе). Однако есть
категории сточных вод, которые сбраживаются со скоростью,
превосходящей скорость протекания других анаэробных процессов и
приближающейся к скорости аэробного окисления. Так, скорость
метанового брожения отходов мясокомбинатов составляет 50—100 %
объема аппарата в сутки (0,02—0,04 ч-' при непрерывном или 1 —
2 суток при периодическом процессе). Эта скорость примерно равна
скорости спиртового и молочнокислого брожения и значительно
превышает скорость маслянокислого, ацетонобутилового и других
брожений.
Сложившееся представление о низкой степени окисления
органических веществ также необходимо пересмотреть в связи с
многочисленными данными, полученными в последнее время. Степень
снижения БПК в результате метанового брожения некоторых
сточных под превышает 80 %. а в некоторых случаях, например при
сбраживании сточных вод мясного производства, может достигать
98 %. Наконец, установлен еще один факт, свидетельствующий
о том, что в процессе метанового брожения сточных вод, не
содержащих большого количества взвешенных частиц, не обязательно
применять перемешивание. Процесс метанового брожения можно
пеан неограниченное время при непрерывном протоке сточных вод,
поступающих в нижнюю часть бродильного аппарата и выходящих
из верхней его части в очищенном виде. Образующаяся биомасса
клеток микроорганизмов находится в осевшем и отчасти во
взвешенном состоянии в нижней части аппарата, что вполне
обеспечивает контакт клеток со средой в нижней части и достаточно полное
разделение биомассы и чистой воды в верхней части аппарата, чего
не может быть при перемешивании. Таким образом, отсутствие
перемешивания создает условия, при которых в одном и том же
аппарате происходит и сбраживание, и отделение сброженных
сточных вод от активного ила. При увеличении количества активного
ила в результате его прироста через определенное время начинается
вынос его избытка из аппарата. Во избежание этого из нижней
части аппарата необходимо периодически отбирать определенное
количество активного ила и направлять его па утилизацию. Так
можно регулировать процесс метанового брожения с
одновременным отстаиванием п одном н том же аппарате. Однако полностью
освободить очищенную воду от клеток микроорганизмов при этом
нельзя, поскольку жидкость в аппарате частично перемешивается
выделяющимися газами, в результате чего часть клеток всплывает
в верхние слон жткосгп. Для улучшения процесса отстаивания
бноч.и'сы н условий метанового брожения в целом предложено
ос\щостплять очистку посчедизатеч''Ю в двух метантемк-чх. В
первом и.i пч\ происходи инь iicHinioe Срожсннс с разложением
основною liiwin-jccr11, .jj4?!iii'ic^i.!ii налепи, во втором—доиражив'чше.
причем интенсивного перемешивания жидкости не наблюдаекя
ввиду небольшого количества выделяющихся газон. Это создае!
лучшие условия для отстаивания. Перечисленные выше особенности
процесса метанового брожения сточных вод, выявленные в
результате многочисленных наблюдений в лаборатории и на
производстве, позволяют существенно изменить конструкцию и стоимость
метантенков и не применять для этого дорогостоящую аппаратуру,
предназначенную для сбраживания осадка. По имеющимся данным
практического применения метантенков упрощенной конструкции,
их строительство обходится намного дешевле, чем строительство
типовых метантенков для сбражинання осадка.
Все сказанное меняет представление о том, какое место должен
занимать процесс метанового брожения в технологии очипкн
сточных вод. Для некоторых категорий сточных вод, содержащих лег-
коокисляемые вещества, метановое брожение можно рассматривай,
как основной процесс очистки с использованием аэротепков для
доочистки. Проведенные опыты показали, что в результате
метанового брожения сточных вод мясокомбинатов нх ВПК снижается
с 20 000—30 000 до 150—200 мл/г. Дальнейшую доочнетку легко
осуществить аэробным окислением.
Использование процесса метанового брожения в качестве
основного метода очистки дает преимущества в отношении количества
осадка, который необходимо разложить. Дело в том, что сточные
воды, содержащие взвешенные коллоидные вещее та белкового пли
углеводного происхождения, легко подвергаются метановому
брожению, поэтому пет необходимости нх предварите.п.пи осаждать
и разлагать отдельно от сточных вод, как это дслаекн при
аэробном окислении. Это дает существенную экономию затрат па
очистку.
Определенные помехи для биологического метода о-.негкн пред
сгавляст наличие в некоторых сточных водач жира. Ьолыиппаво
микроорганизмов, участвующих в процессах аэробнг-й и анаэробной
очисток, не обладает линолптнческой активностью и не способно
гндролнзовать жиры. На предприятиях, сточные воды которых
содержат жир, имеются сооружения для его отделения, работающие
но принципу механического отстоя н ф.'ннанни. Однако они
работают неэффективно и полное решение этого вопроса я ил не гея
одной из задач промышленности. Более перспективным и этом
отношении, вероятно, является фнзпко-химичееь.нп метод, поскольку
способность к гидролизу жиров не свойственна болыиппаиу мнкро
организмов. Для этой цели с успехом могут применяйся метан
юики. При определенном изменении конструкции они могут
выполни ib одновременно функции метанового брожения п процесса
отделения жира. В процессе метанового брожения ннтс-пснипо
разделяется жирован эмульсия, поскольку выделяющими i a.iu создают
благоприятные условия для флотации. Разработка таких
конструкций метантенков позволяет сэкономить сре.четна, чатрачшыемые на
сооружение жнро.тоиок, и улучшить условия а-рооной доочнеткп
жпросодержащих сточных вод.
J'J7
УТИЛИЗАЦИЯ ПРОДУКТОВ, ОБРАЗУЮЩИХСЯ В ПРОЦЕССЕ
ОЧИСТКИ СТОЧНЫХ ВОД
Биохимические процессы аэробного и анаэробного разложения
органических веществ до сих пор рассматривались как средство
решения одной из важнейших проблем — очистки сточных вод.
Однако нельзя не видеть, что биохимическая очистка сточных вод
с большим содержанием органических примесей есть не что иное,
как микробиологическое производство. В процессе биохимической
очистки сточных вод накапливается биомасса микроорганизмов.
То же самое происходит и в любом микробиологическом
производстве. Различие состоит в том, что специализированные
микробиологические производства используют для технологии определенные
штаммы микроорганизмов, способные к максимальному
образованию какого-либо продукта метаболизма или самой биомассы. К
микроорганизмам, участвующим в процессе очистки сточных вод,
предъявляются иные требования: они должны обладать максимальной
способностью к разложению веществ. Однако и при этом
накапливается биомасса (избыточный активный ил), а также другие
продукты, например горючий газ.
Биомасса микроорганизмов, участвующих в процессе очистки
сточных вод, независимо от их видовой принадлежности
характеризуется высоким содержанием белка (около 50 %), полноценная
по аминокислотному составу, богата другими биологически
активными веществами и может быть использована в качестве корма
для скота. Существенную кормовую ценность представляет также
осадок, выделяемый из сточных вод некоторых категорий, например
из сточных вод мясного производства. В настоящее время он
сбраживается в метантепках с целью его ликвидации, что совершенно
неправильно с хозяйственной точки зрения.
Процесс биохимической очистки в определенной степени можно
регулировать в отношении количества образующейся биомассы,
культивируя вначале на сточных водах некоторые виды
микроорганизмов, обладающих высокой способностью к биосинтезу
белка. Проведенные опыты показали, что при культивировании
дрожженодобных грибов на сточных водах мясокомбината
образуется в среднем 5 г/л биомассы, тогда как обычное
окисление их в аэротенках сопровождается накоплением 1—2 г/л
биомассы.
Огромное значение имеет разработка методов полной
утилизации сточных вод, учитывая и возврат воды в производство.
Недостаток воды для производственных нужд требует быстрейшего
решения вопроса повторного использования воды. Однако в этом
направлении сделано пока мало.
Говоря об утилизации веществ сточных вод, следует отмстить,
что при метановом брожении образуется меньше биомассы, чем
при аэробном окислении. Однако этот недостаток перекрывается
преимуществами, которые дзет использование выделяющихся га-
эол. В присутстгии кислорода сбраживаемые органические веще-
:;os
ства превращаются в углекислый газ и воду. В анаэробных ж>
условиях такая возможность отсутствует и вещества окисляются
не полностью. Только часть органических веществ в анаэробных
условиях окисляется за счет кислорода нитратов, сульфатов,
карбонатов. Большая часть веществ.подвергается неполному
анаэробному окислению с образованием восстановленных продуктов,
преимущественно метана и небольшого количества водорода. Так, при
метановом брожении мелассно-спиртовой барды образуется до 20
объемов газов на один объем сбраживаемой среды. В составе газов
более 80 % метана. Концентрация веществ в результате метанового
брожения снижается с 8—9 до 5,0—5,5 % по сухим веществам.
Следовательно, на каждые 30—35 кг сброженных веществ образуется
около 16 м3 чистого метана. Поскольку 16 г метана (т. е. 1 г-моль)
занимает объем 22,4 л, в 16 м3 его будет около 11 кг. Следовательно,
одна треть органических веществ, удаленных из сточных под
в процессе метанового брожения, может быть утилизирована в
качестве горючего газа. Образующийся метан можно сжигать в
котельной данного производства, что значительно снизит расходы на
энергетические нужды. Использование горючих газов,
образующихся в процессе метанового брожения, практикуется с дапиих пор.
Существуют специальные установки, предназначенные для этой
цели, сырьем служат навоз и различные отходы сельского
хозяйства. Образующийся метан используется в качестве топлива для
тракторов и других машин, а также на нужды животноводческих
ферм. Однако в промышленности, где метановое брожение
применяется для очистки сточных вод, утилизация газов не получила
еще должного распространения.
На многих предприятиях страны имеется опыт приготовления
кормовых продуктов из активного ила аэротенков. Имеются
сведения об использовании активного ила для этой цели за рубежом.
Для получения белково-витампнных концентратов используется
активный ил очистных сооружений скотобоен, коксохимических и
нефтеперерабатывающих заводов, сыроварен и других производств.
Большая работа по использовании активного ила для корма скогу
проводится в ФРГ. Полученные кбрмовые концентраты по
эффективности вскармливания не уступают дрожжам, а по содержанию
витаминов даже превосходят их. В активном иле присутствуют
основные витамины группы В, необходимые животным: тиамин,
рибофлавин, никотиновая кислота, пнрпдокспп, бнотпн, и витамин
В|2. Концентраты, получаемые из активного ила, содержат
значительные количества наиболее дефицитных аминокислот — лнзнна,
метиоппна, триптофана.
Существенное преимущество имеет совместное использование
биомассы микроорганизмов, образующейся при анаэробной и аэроб-
нон очистке сточных вод. Активный ил, образующийся в процессе
метанового брожения, характеризуется высоким содержанием
витамина В|2. В активном иле мсгаптенкоп концентрация этого
витамина составляет 45—50 мкг/г сухого вещества, т<,да как в
активном иле из аэротенков его 25—30 мкг/г. Для лучшей усвс'емости
40 - 2-1702
309
.пробного активного ила его целесообразно частично сбраживать
н метаптеиках.
Выделение эмникого ила нз сточных вод очистных сооружений
на.некоторых производствах не представляет затруднений. Так,
в условиях мясокомбинатов нмею|ся цехи по приготовлению
мясокостной муки. Аппаратура этих цехов может быть использована
для сушки и."а. Битее тою, мясокостную муку можно высушивать
и добавлять в корм CKoty совместно с активным илом. Мясокостная,
мука добавляется в корм скоту как источник азотистых веществ,
витаминов она почти не содержит. Активный ил может
компенсировать недостаток витаминов в этом продуме.
Таким образом, утилизация продуктов, образующихся в
процессе очистки еючных вод, покрывает расходы на строительство
очистных сооружении и является обязательным для всех производств,
особенно для предприятий пищевой и микробиологической
промышленности, отходы которых содержат ценные источники питания.
В связи с важностью вопроса утилизации отходов технологию
очисти сточных вод следует рассматривать как часть основного
производства, как завершающую стадию основной технологии,
направленную на предотвращение производственных потерь, т. е. на
во трат воды и значительной части продуктов, теряющихся на
отдельных стяднпх производства. Одновременно с этим безотходное
и бессточное производства решают задачу ликвидации ущерба,
наносимого сточными водами народному хозяйству и человечеству
в целом. К сожалению, п экономических расчетах это
обстоятельство не всегда учитывается. Принято считать, что затраты на
очистку сточных вод не окупаются, а технология очистки имеет
отрицательный экономический эффект для производства. Причиной
этого является то, что до настоящего времени перед технологией
очистки сточных вод ставилась заведомо убыточная цель для дан-
нон промышленности — ликвидация и удаление из производства
всех цепных компонентов сточных вод, в том числе и самой воды.
В настоящее время в корне изменилось представление о назначении
процесса очистки сточных вод. В ближайшем будущем этот вопрос
должен быть полностью решен и большая роль в этом принадлежит
биохимии.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Аиба Ш.ш Хемфри А., Миллис И. Биохимическая технология и аппаратура.—
М.: Пищ. пром-сть, 1975.
2 Бекер Л1. Е. Впеденне в биотехнологию.— М.: Пищ. пром-сть, 1978.
3. Безбородое А. Л1. Биохимические основы микробиологического синтеза.— М.:
Лег. и пищ пром-сть, 1984.
4. Билай В. И. Основы обшей микологии.— К.: Вища шк. Головное иэд-во, 1974.
5. Булгаков Н. И. Биохимия солода и пива.— М.: Пиш. нром сть, 1976.
6. Гельман Н. С. Лукоянова М. А., Островский Д. Н. Мембраны бактерий и
дыхательная цепь.— М.: Наука, 1972.
7. Грачева И. М. Технология ферментных препаратов,— М.: Пищ. пром-сть, 1975.
8. Жвирблянская А. Ю.. Бакушинская О. А. Микробиология в пищевой
промышленности.— М.: Пищ. пром-сть, 1975.
9. Забродский А. Г. Получение кормовых дрожжей на мелаесно-спиртовых за-
волах.— М.: Пиш. пром-сть, 1972.
10. Забродский А. Г. Получение кормовых дрожжей нз мелассной барди.— К.:
Техника, 1977.
11. Заварзин Г. А. Литотрофные микроорганизмы.— М.: Наука, 1972.
12. Квасников Е. И., Нестеренко О. А. Молочнокислые бактерии и пути их
использования.— М.: Наука, 1975.
13. Кишковский 3. Н., Скурихин И. М. Химия вина.— М.: Пнщ. пром-сть, 1976
14. Коновалов С. А. Биосинтез ферментов микроорганизмами.— М.: Пищ.
пром-сть, 1972.
15. Королев С А. Основы технической микробиологии молочного дела.—М.: Пищ.
пром-сть, 1974.
16. Кретович В. Л. Техническая биохимия.— М.: Высш. шк., 1973.
17. Маринченко В. А.. Метюшев Б. Д., Швец В. II. Технология спирта из
мелассы.— К.: Вища шк., Головное изд-во, 1975.
18. СтрайерЛ. Биохимия.— М.: Мир, 1984.
19. Основы биохимии/А. Уайт, Ф. Хендлер, Э. Смит и др.— М.: Мир, 1981.
20. Ферментные препараты в пищевой промышленности / Под ред. В. Л. Крею-
вича и В. Л. Яровенко.— М.: Пищ. пром-сть, 1976.
21. Фертман Г. //., Шойхер М. И. Технология продуктов брожения.— М.: Высш.
шк., 1976.
22. Шлегель Г. Обшая микробиология,—М.: Мир, 1972.
предметный указатель
АкП|В!ГПСТЬ
ями.почпгнчгскяя (ЛС) 164
дегнд1|10гг'цпз|1ия 3(12, 303
докстрпннруюшчя (ДС) 164
мальтазняя 58
молярная 58
удмшая 58
фи.ниишгнческяя 122
Akiiiiiomiii'.cim 1Я. 21, 248
Алании 205, 200. 257, 258
Л'|ЬбуМН!!Ы 37
Лчьйнгды 181
А.п.дол11.!;| 67
Аммязл (u) G1—вв
Амилоза fifi. 100
Амилош-киш ''5, 100
Аминоапютрофы 52
Апнсоготеротрифы 52
Амц|!1)|'рэмиа -52
Аминокислота (и) 31, 257
дскарпоновие 31
кодирование 90
незаменимые 32
простые 31
ссрусодержащие 31
сложные 31
Амфнопы 30
Амфотерность 104
Анабиоз 102
Анастомоз 133, 138
Анпонпты 229
Антнкодон 91
Апорспрсссор 96
Апотешш 135
Аргинин 29
Аскомндсгы 134
Аскоспоры 134
Аспергн.члы 19, 216
Ауксоавтотрофи 53
Ауксограмма 53
Ауксотрофня 53
Ауксотрофы 53, 144
Ацегонн 184
Ацетон 184, 194
Ацл.-'трансферязы 61, 62
Аэраторы 296
Аэрация 113
продленная 299
Аэротснк 295—297
Аэрофильтры £94
Базилик 135
Бактерии 14, 15
ацетонобутиловые 191, 192
маслянокнелые 191, 192
метанобразующне 198
молочнокислые 152—154
пропионопокислые 249
Варботсры 112
Барда
гндролизно-спнртовая 265
зернокартофельная 282
мелассная 260, 282
меласенп-спиртовая 260, 266, 283
спиртовая 282
сульфитно-спиртовая 265, 266
Барьер энергетический 54
Безофильность 23
Белок (ки) 10, 28
жслезопорфнрииовые 38
микробный 10. 238, 239
«растворнмысэ 169
«стойко растворимые» 169
строение 35
структура 35—37
схема биосинтеза 89
химизм —»— 88
Биокаталнзаторы 239
Биокоагуляторы 299
Биомасса 9
Биофильтры 293
выеоконагружаемые 294
капельные 294
Биохимическое потребление
кислорода
(ВПК) 116,283, 284, 303
Брожение (я) 147
ацетоиобутиловое 191—196
глазное 175
глицериновое 179
глнцеропировиноградпое 178, 179
«кислотное» 200, 204
маслянокислое 191, 194—196
мезофилыюе 252
метановое 197—208, 250—256, 305
молочнокислое 148—157
— гетероферментатнвное 155—157
— гомофермситативиое 155—157
— смешанное 154
— чистое 154
Не.чберга 1*0
S12
— вторая форма 180
— третья—>— 180
пропиоиовокислое 188, 189
спиртовое 158—188
— в щелочной среде 180
термофильное 252
Бутанол 195
Буфериость 104
Буферы 104
Валии 263
Вещества
азотистые 29
белковые-29
гидрофильные 280
гидрофобные 280
дубильные 170
— гидролизуемые 170
— иегидролизуемые 170
коллоидные 280
неоседающие 279
оседающие 279
ростовые 53
Вирусы 24
Витамин (ы) 53, 239
А 237, 239, 241
водорастворимые 239, 240
группы В 210
В, 240
В, 240, 244
В3 240
В5 240
В, 240
В, 240
В12 237, 238, 240. 246, 247, 249
группы D 238—240
D, 420
жирорастворимые 239
Включения цнтоплазмэтические 25
Вода (ы)
замочные 210
пресная 276
сточные 275—293
Водородный показатель рН
методы определения 104
— калориметрический 104
— электрометрический 104
Волютни 25
Воски 47
Вымораживание 227, 228
Высаливание 34, 228
Гаплофаэа 134
Геи (ы)
доминантные 133
рецессивные 133
структурный 95
торможение действия 95
Генерация (и)
длительность 120
число 120
Генетика 126
микрооргаииэуов 127
Геномы 95
Геи-онератор 95
Генотип 127
Геп-ре|улятор 95
Гераниол 171, 243
Гетерокариои 138
Гибридизация 137, 146, 147
Гндрол 210
Гндрмлазы 59, 62
Гистоиы 37
Гифы 19
Гликоген 43
Глгшериды
простые 44
сложные 44
Глобулины 37
Глобулы 37
Глюкоамнлаза 65
Глюкоза ■
разложг'лие 80
Глкжозилтрансферазн 61
Глюкозооксндаза 234, 235
Гоннлпн 131
Грибы 7
дрожжевые 7
дрожжемодобные 7, 15, 18, 267—
2С9, 274
«леечные* 19
несовершенные 7, 8
плесневые 7, 8, 18, 19, 217
Дегпдрогеназы 59
пнрилиноные 59, 60
флавнновые 69, 60
Деление 128
редукционное 134
ядра 134
Денатурация 35
Диализ 227, 228
Днамииокислоты 31
Диаукеня 51, 97, 271
Днкэрпон 133
Днплоидня 133
Диплококки 15
Днплофаза 134
Диффузия
активная 49
пассивная 49
ДНК 127
структура 40, 41, 128
удвоение 129
Дображнпаиие 175
Донор 136
Дрожжи 15
шшные 173, 175, 176
пивные 173. 175. 176, 210
«пылевндныеэ 175
расы 173—177
спиртовые 173, 174, 176
сухие 274
характеристика 171
«хлопьевидные» 175
Единица
активности стандартная 56
Сведберга 90
Жидкость культуральиая 8, 224, 225,
233. 231
Жир (ы) 44
микробный 44
окисление 45, 46
лрогорканне 45
строение 44
Загрузка 293
Загрязнения
бактериальные 279
минеральные 278, 279
органические 278, 279
Зародышевый фактор 163
Зигота 132
Знмоген 162
Зона (ы)
ыезосапробная 288
олигосапробная 288, 28!)
полнсапробная 288
сапробности 288
Зоостеролы 47
Излучение (я)
ионизирующие 139, 140
радиоактивное 139
ультрафиолетовые 139, 140
Изогамия 135
Нзомсразы 59, 67
Пзопропанол 194
Ил активный 295—297, 299, 301, 309
избыточный 299
зольность 300
концентрация 300—302
нагрузка 302
— по органическим веществам 302
— по снятым загрязнениям 302
окислительная способность 302
основные показатели 300
Иловый индекс 300, 301
Имннокнслота 31
Иивертаза 64
Индикатор 104
Индол 264
Индуыор 96
Индукция последовательная 96
Инулин 101
Каналы окислительные 299
непрерывного действия 299
периодического —»— 299
Капсула 21
Карамоли 159, 166
Карбогидраза 62
Кариоты 21
Каротин 241—243
кормопой 242
Каротинонды 241
314
биосинтез 243
Каталаза 234, 235
Катехииы 170
К^тионнты 229
Кетоны 184
Кислота (ы)
антраннловая 264
аспарагиновая 258
глутамиповая 257, 259
дезоксирнбоиуклеииовая 39
жирные
— окисление 82
— синтез 87
масляная 193
молочная 148, 149, 182
нуклеиновые 38—42
органические 181 —184
пектиновая 102
нировиноградная 184, 258
лирролидоикарбоновая 260
пропионовая 188, 189
рибонуклеиновая 39
уксусная 196
янтарная 182—184
Клейстер 160
Клейстернзаиия 160, 161
Клетка (и)
бактерий 12, 20
вегетативные 11, 12
гаплоидные 133, 134
диплоидные 133, 134
дрожжевая 20
инволюционные 24
половые II, 134
соматические 134
спорообразукмдие 12, 13
Клеточная стенка 20—22
Коагуляция 292
Коалесценция 292
Код 90-94
аминокислотный 92
вырожденный 92
множественный 92
универсальный 92
Кодом 89—92
Коли-индекс 281
Колн-титр 281
Комплекс Гольджи 23
Конидии 18. 19, 131
Константа (ы)
жиров 47
Михаэлиса 56, 57
Нернста 105
равновесия 68
роста 121
К.опьюпт.ш 134, 136
Корепрессор 96
конкурентный 96
Корит бактерии 144
Кофермеш ацилировапня (КоА) 62
Коэффициент
использования кислорода 113, 115
размножения 120
специфичности 40
экономический: 122 .
Красители акридиновые 141, 142
Кцисты 23
Кроссинговер 132, 133
Крахмал животный 43
Кгантии 145
Культура 8
неоднородная (смешанная) 8
однородная (чистая) 8
Мальтоза 62, 99, 100
Масла
сивушные 185
эфирные 171
Мезосомы 20. 22
Мейоэ 134, 135
Меланины 159
Меланондипы 159, 164
Мслибиаза 63
Мембрана цитоплазматическая 20. 22
Ментол 171
Метабиоз 125
Метантенки 304
Метахромазня 25
Метахроматин 25
Мстионпн 262
Миод (ы)
биологический 279, 291, 307
биохимический 279, 291
Ван-Сланка 33
механические 291
микробиологические 291
очистки сточных вод 278—310
химические 291
Микрококки 144
Микроорганизмы 6, 7
аэробные 110
классификация 6, 7
мезофнльине 103
морфологии 11
патогенные 280
питание 8
промышленные 7
систематика 7
скорость роста 119, 120
способы культивирования 111
— «больших дрожжей» 124
— глубинный 111, 112
— гомогенно-непрерывный 123
— гралнгнтно-непрерыпный 123
— непрерывно циклический 123
— непрерьшный 114, 123, 124
— периодический 118, 123
— поверхностный 111
строение 11
термофильные 103
условно-патогенные ?81
физиологически полиморфные 108
химический состав 11, 26—29
Микросомы 20, 24
Мнкостеролы 47
Мирней 1Г|
Митоз 134
Митохондрии 20, 23
Мниелпй 19
Мощность окислительная 294, 298
Мукор 19
Мукопептнцы 21
MvKonpoieinbi 38
Муреины 21
Мутагены 138
физические 139
химические 141
Мутант 138—144
Мутация естественная 138
Муцины 38
Нлбухаинс 35
Неосомы 130
Нефтепродукты 287
Микотннамидадсннндинуклеотнл
(НАД) 42
Никотинамидадениндинуклеотидфосфат
(НЛДФ) 59
Нуклеонды 25, 128
Нуклеозид 39
Муклеопротеиды 28, 38
Нуклеотид 39
Озониды 45
Окснаминокиелоты 31
Оксплоиедуктазы 58, 5'1
Оксик-бяламин ?46
Олигазы 62
Олнгодинамнческое действие 27
Оогамня 135
Опгрон 95
Органсллы 19
Организм (ы)
гетерозиготные 133
гомозиготные 133
многоклеточные 11, 19
одноклеточный 11
Осаждение 228
Осмофильиость 173
Отстойники 298
вторичные 297
Палочка
картофельная 43
кишечная 97, 281
П.шаин 66
Парафины 266, 267
Пектин 102
нерастворимый 102
растворимый 102
Пекткиэстераза 62
Пепнцнллнновая методика 146
Пепиниллн 19
Пепсин 66
Пептид 36
Псптидазы 66
816
Перекрест 132
Перенос стереохнмнческнП
специфичный 50
Псритеинн 135
Пермеазы 50
Полиплоиды 138
Полипептиды 35, 36
Полисом и. 90
Поля
орошения 289
фильтрации 282, 290
Полярность половая 137
Порфнрины 256
Потенциал
окиелнтельио-восстаноиительный 10'
электрический 107
Правило ВаитТоффа 103
Преааратор 298
Препараты
амилолнтические 230, 231
выделение 273
ннвертазы 236
концентрированные 232
микробного белка 264
очншенные 232
неполитические 233
полуочншенные 233
протолнтическне 231, 232
универсальные 236
ферментные 209
целюлолитическне 233
цнанкобаламина 245, 246
Рафиноза 64, 100
Реакция
дисмутаиии 180
карамелнзацпн 161
сахароамннная 166
с нингндрнном 32, 33
—> — формальдегидом 33
Ренпнн 66, 215
Репликация 128, 130
митохондрий 130
ядерной ДИК 130
Репрессия 95—97. 143
конкурс ища» 96
Репрессор 96, 97
Ретикулин эндоплазмагический 22
Ретро! радання 161
Ретроишнбпровапне см. Торможение
аллостернческое
Ренениент 136
Рециркуляция 294
Рибосомы 24
Рибофлавин 244, 245
Риаоп 19
РНК
информационная 88-~-90
рнбосомпая 88
транегюршая 88, 89
Родопласты 23
J'ocihii со.юдоиие 210
Сапробиоиты 288
Сариипы 15
Сателлизм 125
Сахароза 64, 99
Связь (и)
водородная 36
гидрофобные 36
дисульфидная 36
макроэргическая 42, 69
пептидная 32, 36
солевая 36
эфирные 36
Седиментация 292
Сефадекс 43
Симбиоз 125
облигатный 125
Синергизм 125
Соединение (я)
алкилнрующие 141
макроэргнческие 42, 69, 90
Солод 164
Сорбенты 229
Сорбция 229
Спора (ы) 14. 131, 221
вегетативные 11, 131
половые 11
Стафилококки 15
Стериды 47
Стеролы 47, 48
Стрептококки 15
Сублимация 228
Сумка лиофильная 26
Схема Г. Баркера 208
Тело плодовое 137
Теория
.биологического окисления 74
«мишениэ НО
строения белка пептидная 35
Термолиз 273
Терпен 243
Тетракокки 15
Торможение аллостернческое 97, 143
Точка изоэлекгрическая 34
Трансдукиия 136
Транскрипция 90, 91
Трансферазы 59
Трансформация 136
Триплет (ы) 91—94
двойной 93
комплементарный 91, 93, 94
терминирующие 92
Трипсин 66
Триптофан 263, 264
Ультрафильтрация 227
Уравнение
Лайнуивера — Берка 57, 58
массообмена 117
Михаэлнеа —Ментеи 56, 57
Нернста 105, 108
Утилизация 308
Фаза
задержки роста 118
отмирания 119
стационарная 119
экспоненциальная 118, 119
Фактор В 246, 255
Фактор III 246, 255
Фенотип 127
Фермент (ы) 54
адаптивные 97, 211
амнлолитическне 209, 211
выделение 224. 225
индуктивные 96, 97, 211, 214
конститутивные 96, 211
липолитнческие 213, 214
пектолитические 212, 216
применение 229
протолитические 209, 211, 212, 215
способы культивирования 220
— глубинный 222—224
— непрерывный 223
— поверхностный 220, 221
Ферментация 219
Фермент-субстратиый комллекс 54
Фитостеролы 47
Флавннадеииндииуклеотнд (ФАД) 42
Флавинмононуклеотид (ФМН) 42
Флотация 292
Формазаи 302
«Формольиое титрование» 33
Фосфамиды 47
Фосфорилирование 71—77
окислительное 74, 75
субстратное 77
циклическое 73
Фосфоролиз 61
Фосфотраисферазы 61
Фотореактивация 140
Фотосинтез 71—73
Фотофосфорнлироваиие 72, 73
Й-Фруктозндаэа 63
Химозин 66
Химотрипенн 66
Хлоропласты 23
Хлорофилл (ы) 38
Хромопротеиды 38
Хромосомы 24, 127—129, 132
бактериальные 128
Целлобиоза 63, 99, 100
Цикл
глиоксилевой кислоты 79
Кальвина 86
Крсбса (дн- и трикарбоновых
кислот) 78, 81, 83, 256
парасексуальный 138
сукцииатглицииовый 256
Цнстеии 27
Цистрои (ы) 95, 127, 128
Цитоплазма 20, 23
Цитохромы 59, 61
Экзоферменты 223, 225
Экзэргонический процесс 42
Экстракт кукурузный 210
Электрод
водородный нормальный 105—I
каломельный 106, 107
нлатинопый 106
ртутный 106
Эндоспоры 135
Эпдоферменты 225
Энергия
актнвашш 54
гидролиза АТФ 68, 69
свободная 68
Энолаза 67
Эосомы 130
Эргостерол 240
Эукариоты 20
Эфиры сложные 185
ОГЛАВЛЕНИЕ
Предисловие . . . • 3
Введение • . > • 6
Глава I Строение и химический состав микроорганизме! 11
Морфология микроорганизмов ••■ И
Внутреннее строение микробной клетки 19
Химический состав микроорганизмов 26
Белковые вещестпа мнкрооргвнизмов 29
Нуклеиновые кислоты . • • 38
Углеводы и линиды микроорганизмов 43
Главе 11. Общие закономерности обмена веществ у микроорганизмов . . 48
Особенности питания микроорганизмов 48
Ферменты основных биохимических процессов ... 54
Современные представления об энергетическом обмене 67
Превращения окисляемых веществ , .77
Основы конструктивного обмена • • 84
Химизм биосинтеза белка и ферментов ' . . 88
Глаьа III. Культивирование промышленных микроорганизмов ..... .98
Источники питания ........... 98
Физико-химические условия культивирования 102
Обеспечение среды кислородом 110
Некоторые закономерности роста микробных культур 117
Глава IV. Генетика и принципы селекции промышленных мнкроорганизмоа 126
Негетатнвпое размножение (деление) как способ передачи и сохранения
наследственных свойств 127
Факторы изменчивости свойств — половое размножение и мутация .... 132
Особенности получения новых форм промышленных микроорганизмов . . . 142
Глава V. Производство продуктов брожения . . i 147
Молочнокислое бр.океине 148
Спиртовое брожение 158
Проппонопокислие брожение , 188
'Магляпокнслое н ацетонобугиловое брожение 191
AUranohoe брожение 197
Глава VI. Производство ферментных препаратов 209
Сырье и особенности состава питательных сред 209
Продуценты ферментов и их характеристика 214
Ферментация • .......... . 219
Выделение ферментных препаратов 224
Глава VII. Производство кормовых препаратов биологически активных
вещеегь . , , , , , . , ... 236
bin амины 239
Аминокислоты 257
Прснпрати .микробного белка 264
318
Глава VIII. Биохимическая очистка промышленных сточных вод ..... 27
Проблема воды и охрана водоемов 275
Характеристика сточных вод пищевых Н микробиологических производств 278
Очистка сточных вод в естественных условиях 288
Очистка сточных вод с направленным использованием биохимических процессов 291
Утилизация продуктов, образующихся в процессе очистки хточных вод . . 308
Список рекомендуемой литературы 311
Предметные ужааатель 312
Учебное иэда ние
Никитин Геннадий Ачсксеевич
БИОХИМИЧЕСКИЕ ОСНОВЫ
МИКРОБИОЛОГИЧЕСКИХ ПРОИЗВОДСТВ
2-е издание,
переработанное и дополненное
Переплет художника С.И.Белая
Художественный редактор А.Д.Бондаренко
Технический редактор Т.Г.Шепновская
Корректор Е.В.Ткачук
Отпечатано с матриц
РПО "Пшшграфкнига"
НБ № 14294
Сдано в набор 20.03.90. Подписано в печать 27.01.92. Формат
60Х90Д6. Бум. тип. № 2. Гарнитура литературная Высокая
печать. Усл. псч. л 20.U. Усл. кр.-отт. 20.0. Уч.-н.»д. Л. 22,69.
Тираж 10(10 эк). № 8328. Звк. 2-1702.
ИЗДВТСДШ?0 "Вища школа". 2520S4., Кн*в-54., ул. Гоголевская, 7
фирма "ИИПОЛ" 252151, Киев, ул.Волыиская, 60
*
*
♦
Ч '
*»
*
1
\м*л
<1
*
%
ч
^ «
&*
\
VI
■ч j*«