Автор: Акбаев М.Ш. Василевич Ф.И. Балагула Т.В. Коновалов Н.К.
Теги: медицинские науки ветеринария биология микробиология
ISBN: 5-10-003592-7
Год: 2001
Текст
УЧЕБНИК
М.Ш.АКБАЕВ, ф.И.ВАСИЛЕВИЧ
Т.В.БАЛАГУЛА, Н.К.КОНОЗАЛОВ
ПАРАЗИТОЛОГИЯ
И ИНВАЗИОННЫЕ
БОЛЕЗНИ
ЖИВОТНЫХ
УДК 619.616.99-07 (075.32)
ББК 48.73я723
А38
Редактор В. Н. Сайтаниди
Рецензенты: директор Кузнецовского зооветгехникума Пензенской об-
ласти заслуженный учитель Российской Федерации Л. Н.Долбилова и преподава-
тель паразитологии Кузнецовского зооветгехникума Пензенской области заслу-
женный учитель Российской Федерации Н. Е. Данилина
Акбаев М. Ш., Василевич Ф. И., Балагула Т. В., Коновалов Н. К.
А38 Паразитология и инвазионные болезни животных/Под ред.
М. Ш. Акбаева. — М.: Колос, 2001. — 528 с.: ил. — (Учебники
и учеб, пособия для студентов средних специальных учебных
заведений).
ISBN 5-10-003592-7.
Учебник состоит из четырех разделов. В первом разделе рассмотрены ос-
новы общей паразитологии, во втором — представлены болезни, вызывае-
мые гельминтами. Третий раздел посвящен арахноэнтомологии, четвер-
тый — протозоологии.
Для студентов средних специальных учебных заведений, обучающихся
по специальности «Ветеринария».
УДК 619.616.99-07(075.32)
ББК 48.73я723
ISBN 5-10-003592-7
© Издательство «Колос», 2001
ВВЕДЕНИЕ
За время, прошедшее после выпуска учебника в 1992 г., в стра-
не произошли значительные социально-экономические измене-
ния. В общественном пользовании резко сократилось поголовье
животных всех видов. Распалось большинство колхозов и совхо-
зов, образовались акционерные общества открытого, закрытого
типов, мелкие фермерские и индивидуальные хозяйства, а также
частные подворья. В результате у ветеринарных работников воз-
никли определенные трудности в обслуживании животных, в
организации ветеринарно-санитарной службы и реализации про-
дукции. К сожалению, не в лучшую сторону изменилось снабже-
ние ветеринарной службы и животноводства биопрепаратами и
противопаразитарными средствами.
Безусловно, все это требует определенных изменений при под-
готовке ветеринарных специалистов среднего звена — ветеринар-
ных фельдшеров и санитаров.
В настоящий учебник включены материалы, касающиеся эко-
логии, дезинвазии объектов внешней среды, эпизоотологии, а
также заболевания, имеющие важное значение в народном хозяй-
стве. Учтены новые средства защиты животных в области гель-
минтологии, протозоологии и арахноэнтомологии.
Изложение каждой темы строго унифицировано, что способ-
ствует усвоению материала студентами.
Материал учебника изложен традиционно: приведены сведе-
ния о систематическом положении паразитических организмов;
биология возбудителей; эпизоотологические закономерности раз-
вития инвазии и течения заболеваний; симптомы, патогенез, ди-
агностика, лечение и профилактика болезней. Обобщены данные
литературы и практики как отечественных, так и зарубежных ис-
следователей, касающиеся мер борьбы и профилактики.
Номенклатура заболеваний дана в соответствии с традицией
К. И. Скрябина. Например, болезнь, вызываемая Ascaris suum, на-
зывается аскариоз (а не аскаридоз), Parascaris equorum вызывает
параскариоз (а не параскаридоз) и т. д.
В учебнике дано новое систематическое положение паразити-
3
ческих простейших, которое обобщено в монографии М. В. Кры-
лова (1996), с учетом мирового опыта.
Задачи ветеринарных специалистов по сохранению здоровья жи-
вотных. Ветеринарные специалисты далеко не ограничиваются со-
хранением здоровья животных, они решают целый комплекс за-
дач, касающихся прежде всего благополучия людей. В настоящее
время возросли миграционные процессы среди населения. Созда-
ются многочисленные мелкотоварные непрофессиональные пред-
приятия по производству продукции животного происхождения.
Возникло множество фирм и предприятий, выпускающих био- и
химиопрепараты в примитивных условиях при отсутствии конт-
роля на должном уровне. Все это создает повышенный риск рас-
пространения заболеваний как среди людей, так и животных.
Это в первую очередь касается Российской Федерации с ее ог-
ромной территорией и продолжительными границами со многи-
ми странами.
Расширились ввоз и вывоз пищевых продуктов, био- и химио-
препаратов ветеринарного назначения, которые часто используют
без предварительного исследования, по чужим рецептам и инст-
рукциям, без учета того, что они не всегда могут проявить надле-
жащую эффективность в условиях, отличных от тех, при которых
они были изначально апробированы.
В связи с указанными негативными явлениями возросла значи-
мость проблем профилактики многочисленных зоонозов инфек-
ционного и инвазионного происхождения. Человек может зара-
зиться через продукты питания 16 видами бактерий, тремя груп-
пами вирусов, 27 видами паразитов, в том числе простейшими. По
данным литературы, наиболее актуальными из них являются кам-
пилобактериоз, иерсиниоз, листериоз, губкообразная энцефало-
патия крупного рогатого скота и инфекции, вызываемые энтеро-
патогенными эшерихиями (Е. coli 0157 Н 7), сальмонеллезы (свы-
ше 2000 сероваров), цистицеркозы крупного рогатого скота и сви-
ней, трихинеллез, токсоплазмоз и др.
Анализ эпизоотической ситуации Российской Федерации по-
казывает, что в структуре инфекционной и инвазионной патоло-
гии крупного рогатого скота первое место занимают туберкулез,
лейкоз, фасциолез, парамфистоматозы, диктиокаулез, гиподерма-
тозы; у овец — бруцеллез, оспа, дикроцелиоз, эхинококкоз, дик-
тиокаулез; у птиц — болезнь Марека, синдром снижения яйценос-
кости, болезнь Гамборо, цестодозы, нематодозы и эймериозы. В
свиноводческих хозяйствах главной проблемой остаются острые
пневмоэнтериты, инфекционный вирусный гастроэнтерит, гемо-
филезная дизентерия, колибактериоз, отечная болезнь, пастерел-
лез, сальмонеллез, желудочно-кишечные нематодозы. Весьма
проблематичная обстановка создалась в отраслях рыбоводства,
пчеловодства и звероводства.
В этой связи необходимо резко улучшить качество диагностики
4
инфекционных и инвазионных болезней, а также на законода-
тельном уровне разрешить реализацию продукции животного
происхождения только после ее сертификации.
Параллельно требуется заменить устаревшее лабораторное обо-
рудование, для чего необходимо приобрести современную лабора-
торную технику и диагностические тесты.
Ветеринарные работники многих уровней по роду своей дея-
тельности подвержены риску заражения зоонозными инфекцион-
ными и инвазионными заболеваниями. Тем не менее разработан-
ное Министерством финансов положение по обязательному госу-
дарственному страхованию людей, работающих в неблагополуч-
ных условиях, не предусматривает законодательный акт о
специалистах по практической ветеринарной службе. В этой связи
первый шаг, который сделан Департаментом ветеринарии и Росаг-
робиопрома МСХ РФ по созданию национальной страховой ком-
пании, необходимо всячески поддерживать и расширять.
Не менее важная задача ветеринарных работников разных
уровней и направлений — усиление научных разработок в области
ветеринарно-санитарных и технологических проблем кормления
и содержания маточного поголовья и молодняка животных. Не-
полноценное кормление и содержание маток и молодняка приво-
дят к снижению устойчивости к инфекционным и инвазионным
заболеваниям, к дефициту иммунного статуса организма.
Известно, что такими болезнями, как стронгилятозы желудоч-
но-кишечного тракта, диктиокаулез, ценуроз, весенний моние-
зиоз, эймериоз, заражаются и тяжело болеют только ягнята, те-
лята и другой молодняк в раннем возрасте. Поэтому для их со-
хранения необходимо не только улучшать кормление и содержа-
ние, но и широко использовать коррекцию иммунной системы с
применением иммуностимуляторов и иммуномодуляторов орга-
нического и неорганического происхождения, в том числе Т- и
В-активаторов.
Определение и содержание паразитологии и ее место среди смежных дисциплин.
Паразитология (от гр. parasitos — нахлебник, тунеядец, logos — наука) была сфор-
мирована в самостоятельную дисциплину сравнительно недавно —в 1917—
1920 гг. К. И. Скрябиным. Это комплексная наука, изучающая систематику, мор-
фологию, биологию, экологию различных паразитических организмов; взаимоот-
ношения между паразитом и хозяином; болезни, вызываемые паразитами у чело-
века, животных и растений; методы борьбы с паразитическими организмами.
Паразиты (от гр. para — около, sitos — питание) — организмы, живущие внутри
или на поверхности тела других животных — хозяев, питающиеся за счет их, мак-
симально приспособленные к таким условиям существования и приносящие
организму хозяина вред. Из известных науке 1,5 млн видов живых организмов
около 5—6 % ведут паразитический образ жизни.
Во времена правления герцога Перикла (V в. до н. э.) в Древней Греции суще-
ствовал закон, по которому видные государственные деятели пользовались услуга-
ми и жили за счет государства. Для людей этой категории строили жилища, кото-
рые назывались паразитариями, а сами жильцы — паразитами. Позже это слово у
древних римлян приняло другое значение, т. е. существующий за чужой счет. В
этом понимании его употребляют и в биологии.
5
В человеческом обществе меняются общественные формации, различные по-
нятия и традиции нередко теряют свое первоначальное значение, но законы жиз-
ни вечны.
Общепризнанными этапами в эволюции жизни были:
переход безъядерных одноклеточных организмов (прокариоты) к одноклеточ-
ным с ядром (эукариоты);
переход от одноклеточных организмов к многоклеточным;
начало формирования у организмов скелета.
Жизнь есть форма существования белковых тел, характеризующаяся постоян-
ством обмена веществ с окружающей средой (Ф. Энгельс, 1877).
Движущая сила жизни на земле — непрерывный круговорот веществ в приро-
де: растения-продуценты из элементов неорганического происхождения окружа-
ющей среды создают свои ткани с содержанием органических веществ; животные-
консументы употребляют растения, создавая органы и ткани органической приро-
ды — белки, углеводы и жиры; микроорганизмы-редуценты расщепляют органи-
ческие вещества на неорганические составляющие. При этом в живых организмах
происходят различной интенсивности сбалансированные процессы ассимиляции
(анаболизм) и диссимиляции (катаболизм).
Таким образом, в природе растения и некоторые бактерии синтезируют орга-
нические вещества из неорганических соединений с использованием энергии
солнца — автотрофы, другие же организмы (животные, человек, грибы, часть бак-
терий) эти вещества употребляют — гетеротрофы. В свою очередь, гетеротрофы
делятся на сапрофитов, хищников и паразитов. Сапрофиты питаются продуктами
распада тканей мертвых организмов (некоторые бактерии, грибы и актиномице-
ты). Огромное количество нематод растений трофически привязано к ризосфере
(прикорневой зоне) и Питается за счет корней растений и их отходов.
Хищничество — вид взаимоотношений между организмами, близко стоящий к
паразитизму, но отличающийся от него агрессивностью.
На наш взгляд, между хищничеством и паразитизмом пролегает глубокий ров
и без учета основополагающего фактора — иммунобиологического барьера между
этими двумя проявлениями жизни толковать эти понятия невозможно. Ведь когда
волк голоден, единственная преграда между ним и жертвой (овцой, зайцем, соба-
кой, лосем, крысой, лягушкой и т. д.) — физическая, а не биологическая возмож-
ность волка, т. е. биологической несовместимости и неспецифичности не суще-
ствует. Хищник убивает жертву потому, что, например, лось не отдаст доброволь-
но волку хотя бы одну конечность для того, чтобы он был сыт.
Немалый интерес в этом отношении представляет то, что многие виды рыб,
муравьев, птиц, грызунов питаются червями, моллюсками, насекомыми и т. д.,
однако их не называют хищниками. В то же время треска, питающаяся сель-
дью, — хищник, акулы в основном все хищники.
Хищничество развито среди крупных и мелких видов животных организмов,
растений и др. Например, низшие и несовершенные хищные грибы Arthrobotrys
oligospora на гифах образуют орудия ловли и убийства простейших и личинок не-
матод.
По характеру способов нападения хищные грибы делят на три группы:
1) грибы, выделяющие небольшие нити с клеевым веществом, которое прочно
приклеивает жертву к мицелию;
2) грибы, выделяющие клеевое вещество и образующие на боковых стенках
мицелия «ловчие сети»;
3) грибы, не вырабатывающие клеевого вещества, а ловящие добычу в ло-
вушки.
При всех этих случаях пищеварительные гифы грибов врастают внутрь личи-
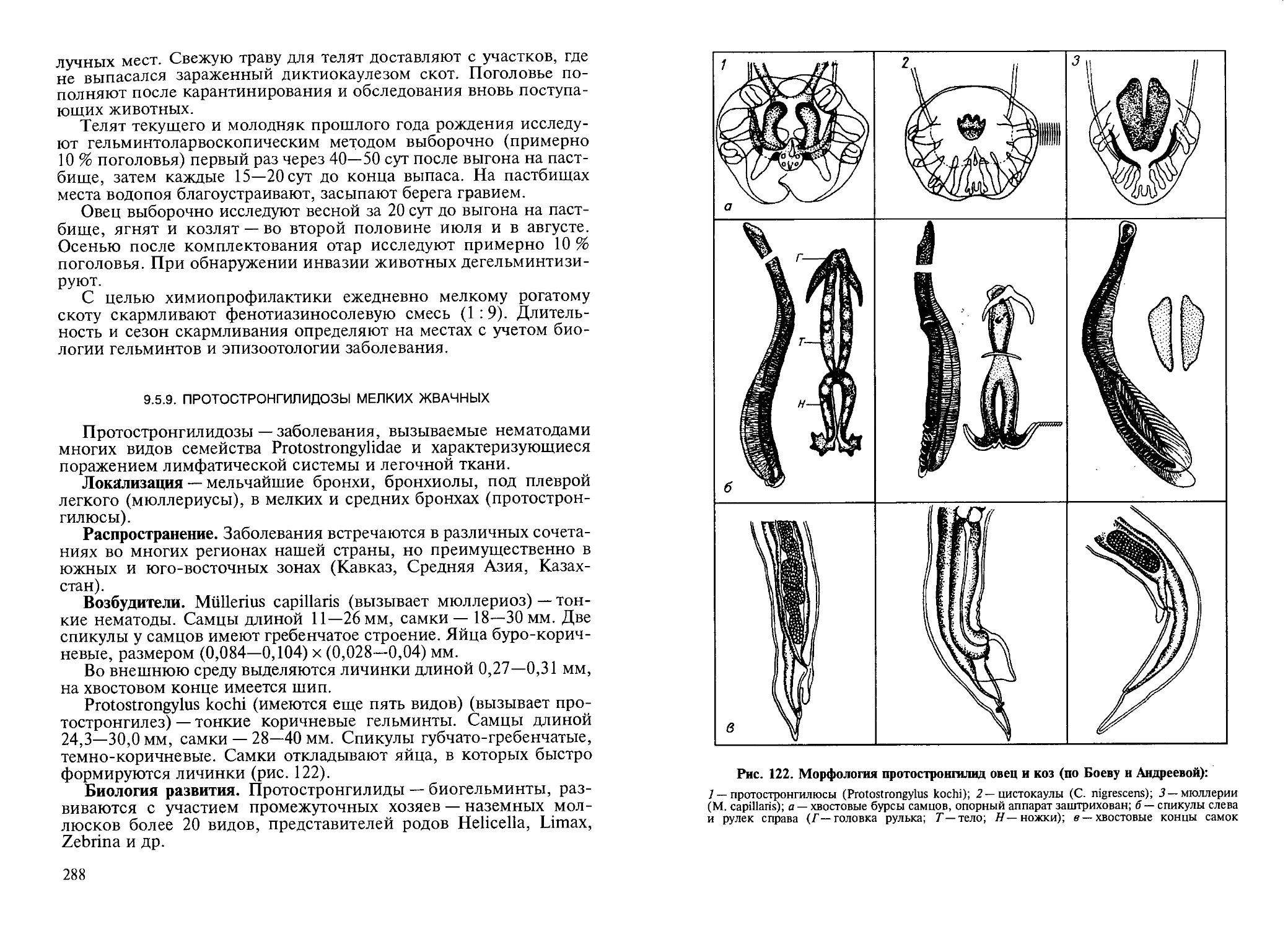
нок и самих нематод и переваривают их, употребляя в пищу (рис. 1).
Нередкое явление среди простейших — виды, ведущие хищнический образ
жизни: инфузории Dileptus, Lacrimaria olor, Didinium nasutum и т. д. Инфузории
дидинии длиной в среднем около 0,1—0,15 мм. На вытянутом в виде хоботка пере-
днем конце расположено ротовое отверстие (рис. 2). Они, нападая на крупную ин-
фузорию туфельку, длина которой около 0,2 мм, проглатывают ее, что, казалось
бы, невозможно в природе.
6
Рис. 1. Хищные грибы, нападающие иа нематод (по Сопрунову, 1958)
Среди нематод тоже встречаются
хищники (рис. 3), поедающие других
круглых червей из семейств
Monochidae и Enoplidae.
Паразитология — одна из отраслей
биологии. Различают паразитологию
общую, медицинскую, ветеринарную и
агрономическую. Каждая из них пред-
ставляет самостоятельное направление.
Общая паразитология рас-
сматривает теоретические основы всех
разделов паразитологии.
Медицинская паразитоло-
гия рассматривает в основном те орга-
низмы, которые вызывают заболевания
у людей.
Ветеринарная паразитоло-
гия изучает низшие паразитические
организмы и вызываемые ими заболе-
вания у домашних и промысловых жи-
вотных, в том числе у птиц, рыб, пчел;
разрабатывает методы борьбы и профи-
Рис. 2. Инфузории дидинии (Didinium
nasutum), пожирающие инфузорию ту-
фельку
7
Рис. 3. Нематоды-хищники:
1, 2— мононх, поедающий другую нематоду; 3, 4— мононхида и эноплида — нематоды
семейства Monochidae (слева) и Enoplidae (справа) (из книги Р. С. Шульца)
лактики. Она относится к зоопаразитологии и включает протозоологию — науку о
простейших и вызываемых ими болезнях; гельминтологию — науку, изучающую
паразитических гельминтов и вызываемые ими болезни; арахнологию и энтомоло-
гию, которые изучают паукообразных и насекомых как возбудителей, так и пере-
носчиков возбудителей инфекционных и инвазионных болезней.
Агрономическая паразитология изучает гельминтов (в основном
это нематоды), простейших и членистоногих, паразитирующих на культурных ра-
стениях, и разрабатывает меры борьбы с ними.
Паразитов растительного происхождения изучают микробиологи, эпизоотоло-
ги, вирусологи, микологи, фитопатологи. Заболевания, вызываемые ими, называ-
ют инфекционными. Паразитов животного происхождения (гельминты, клещи, на-
секомые и т. д.) называют зоопаразитами, а заболевания — инвазионными.
Паразитология — биологическая наука, органически связанная со многими
прикладными дисциплинами.
Почти 90 тыс. паразитических организмов разных типов и классов встречают-
ся практически у всех живых организмов, в том числе и у человека. Изучение мор-
фологии и биологии развития возбудителей паразитарных болезней роднит пара-
зитологию с общей биологией и зоологией. Кроме того, паразитологи изучают
причины возникновения заболеваний, проводят сравнительные исследования
больных, что подразумевает знание экологии, эпизоотологии, клинической диаг-
ностики, патологической физиологии и патологической анатомии.
Краткая история развития паразитологии
Некоторые сведения о медицине и ветеринарии, в частности о
паразитологии, упоминались в письменностях Китая и Египта
(4000—3000 лет до н. э.), Индии (2500—2000 лет до н. э.), Древней
Греции (700 лет до н. э.) и т. д. Однако начальному периоду разви-
тия паразитологии было присуще лишь простое созерцание и на-
блюдение. Позже Гиппократ (370—460 гг. до н.э.) установил влия-
ние некоторых паразитических червей на здоровье людей. Аристо-
тель (384—342 гг. до н. э.) знал уже три вида червей (аскариды, те-
нии, острицы) и описал финноз свиней, ввел термины entomon
(насекомое), akari (клещи), ascaris (аскариды) и т. д. Его перу при-
надлежат таксономические понятия вида (species) и рода (genus).
Он же впервые охарактеризовал и описал полный и неполный ме-
таморфоз насекомых, привел сведения о животных 250 видов.
Огромное влияние на развитие медицины и паразитологии
оказал выдающийся ученый Востока Абу-Али Ибн-Сина (980—
1037), чьи труды в XV в. переиздавались 16 раз, в XVI в. — более 20
раз. В своем знаменитом труде «Канон врачебной науки» он опи-
сал ряд паразитических организмов, развил учение о патологии
гельминтозов, терапии и диетическом питании.
Существенна роль Альберта Великого (1193—1280), написав-
шего 26-томный труд «О животных», где были описаны паразиты
человека и животных, известные к тому времени.
Однако даже при наличии многовековых наблюдений за пара-
зитическими организмами бытовало мнение о том, что черви и
другие паразиты зарождаются в организме хозяина самопроиз-
вольно. Даже Альберт Великий доказывал, что цвет вшей зависит
9
от того, из влаги какого цвета они произошли, а гельминты родят-
ся из содержимого кишок, пиявки — из ила, блохи — из мусора и
т. д. Фома Аквинский (1225—1274) — один из столпов правосла-
вия — в своей книге «Основы теологии» утверждал, что души гни-
ющих в аду грешников рождают червей.
Лишь в первой половине XVIII в. работами Ф. Редии, К. Лин-
нея, П. Симона, П. С. Палласа идея о самозарождении паразитов
была поставлена под сомнение. Стало преобладать мнение о том,
что паразитические черви, да и животные всех других видов про-
исходят от подобных им родителей. Точку же над теорией самоза-
рождения поставил замечательный французский ученый-экспери-
ментатор Луи Пастер (1864). Это совпало по времени с фундамен-
тальными работами Мелиса, К. Т. Зибольда, Ф. Кюхенмейстра,
Ван Бенедени и других, также показавших несостоятельность тео-
рии эмпиризма.
Профессор анатомии и физиологии в Берлине Карл Асмунд
Рудольфи (1771 —1832) по справедливости считается отцом гель-
минтологии (термин helmins введен Гиппократом). К. Рудольфи
дал сводку о паразитических червях, которых к тому времени уже
насчитывалось 981 вид и 30 родов, выделенных от 756 различных
хозяев.
Восхищает трудолюбие и трепетное отношение к науке знаме-
нитого голландского естествоиспытателя А.Левенгука (1632—
1723). Изготовленные им микроскопы давали увеличение в 300
раз, благодаря чему он первый обнаружил эритроциты человека,
лягушек и рыб, поперечную полосатость мышц, фасетчатые глаза
насекомых, сперматозоиды человека и животных. Он впервые со-
общил об обитателях воды: бактериях, простейших, одноклеточ-
ных водорослях, ракообразных и т. д. Описал инфузории
Vorticella, их реснитчатый аппарат. Открыл эймерии в печени кро-
лика, лямблии в кишечнике у человека. Раскрыл тайну развития
блох, установил, что кипячение воды убивает мелких живых су-
ществ.
Однако в XVIII в. протозоология носила лишь описательный
характер, без дифференциации значения простейших для челове-
ка и животных. И лишь в конце XIX в. такие ученые, как Фабр,
Э. К. Брандт, И. А. Порчинский, Н. А. Холодковский и др., зало-
жили научные основы этиологии паразитарных болезней.
Русский ученый Д. Л. Романовский (1861 — 1921), открывший
методы окраски мазков крови и возбудителей малярийной плаз-
модии, положил начало изучению кровепаразитарных болезней и
других простейших. В XIX в. русскими учеными были открыты
возбудители кожного лейшманиоза, тропической и трехдневной
малярии, малярии птиц и лямблиоза.
Вторая половина XIX в. характеризовалась развитием всех раз-
делов паразитологии, в том числе и гельминтологии. Такие круп-
ные клиницисты, как С. П. Боткин, В. П. Манассеин, В. Т. Чуд-
10
ковский, И. И. Мечников, открывший чередование поколений у
нематод и суть инфекции и инвазии, Н. П. Гундобин и др., прида-
вали серьезное значение гельминтам и другим паразитическим
организмам в патологии животных и человека.
Среди ученых этого времени видное место принадлежит рус-
скому зоологу и паразитологу Н.А. Холодковскому (1858—1921),
написавшему 180 научных работ по различным разделам зоологии
и паразитологии. Н. А. Холодковский впервые создал «Атлас чело-
веческих глист», в котором даны оригинальные рисунки и выска-
зана точка зрения о патогенности гельминтов и необходимости
лечения и профилактики. Особенно большое внимание он уделял
систематике гельминтов, изучению вшей, блох, клешей, клопов,
тараканов и др
Тем не менее к началу XX в. все еше отсутствовал целенаправ-
ленный теоретический и практический подход к проблемам пара-
зитологии. Можно утверждать, что целенаправленное и научное
развитие паразитологии началось в 1917—1920 гг.
Роль отечественных ученых в развитии паразитологических школ.
В нашей стране официально признаны четыре научные школы
паразитологов —академиков К. И. Скрябина, Е. Н. Павловского,
профессоров В. Л. Якимова и В. А. Догеля.
Герой Социалистического Труда К. И. Скрябин (1878—1972) —
основоположник советской гельминтологической школы. За все-
стороннюю и плодотворную научно-организаторскую деятель-
ность в области общей биологии, ветеринарии и медицины ему
были присвоены степени доктора ветеринарных, биологических и
медицинских наук. Выдающийся ученый и педагог, талантливый
организатор, он за короткий срок создал большую школу гель-
К. И. Скрябин (1878—1972)
Е. Н. Павловский (1884—1965)
11
В. Л. Якимов (1870-1940)
В. А. Догель (1882—1955)
минтологов, работающих ныне в ветеринарных, медицинских и
биологических учебных и научных учреждениях страны К И Скря-
бин написал более 800 научных работ, среди которых 25 томов
монографии «Трематоды животных и человека». Под редакцией
К И. Скрябина опубликованы такие работы, как «Определитель
паразитических нематод» (4 тома), «Основы нематодологии»
(23 тома), «Основы цестодологии» (7 томов), «Акантоцефалы»
(2 тома) и «Строительство советской гельминтологии» (5 томов).
К. И. Скрябин открыл и описал около 200 гельминтов и дал обо-
снование более 100 новым родам, создал кафедры паразитологии
и инвазионных болезней сельскохозяйственных животных в сель-
скохозяйственных, общебиологических и медицинских вузах.
Вместе с сотрудниками разработал и написал учебные программы,
учебники и пособия.
В развитии ветеринарной паразитологии велики заслуги со-
ратников и учеников К. И. Скрябина, таких, как Б. Г. Массино,
Н П Попов, А. М. Петров, Р С. Шульц, В. П. Баскаков, Д Н Ан-
типин, В. Г. Гагарин, И В. Орлов. В. С. Ершов, Е. Е. Шумакович
и др. Результатом их деятельности стала стройная система мероп-
риятий, проводимых в настоящее время против гельмингозов жи-
вотных.
Герой Социалистического Труда Е. Н. Павловский (1884—
1965) внес значительный вклад в развитие обшей паразитологии,
создал учение о трансмиссивных болезнях и природной очаговос-
ти. Он первым отметил роль паразитоценозов в развитии патоло-
гического процесса при инвазионных болезнях. Перу ученого
12
принадлежит более 1500 научных работ, в том числе несколько
учебников. Е Н. Павловский является пионером полевых эпиде-
миолого-паразитологических исследований. Его известные во
всем мире ученики — профессора П. А. Петрищев, А. С. Мончадс-
кий, Г. С. Первомайский, Г. Г. Смирнов, И. Г Галузо и др. — раз-
вили его школу.
В. Л. Якимов (1870—1940) создал школу ветеринарной протозо-
ологии. Он впервые на территории России описал токсоплазмоз,
лейшманиоз собак, открыл возбудителей трипаносомоза верблю-
дов. лошадей и собак, тейлериоза на Дальнем Востоке, франнай-
еллеза на Кавказе и в Белоруссии.
Совместно с учениками он описал более 200 видов возбудите-
лей протозойных болезней (трипаносомозов, кокцидиозов и пи-
роплазмидозов животных). Опубликовал свыше 600 научных ра-
бот, в том числе монографии «Химиотерапия», «Болезни домаш-
них животных, вызываемые простейшими (Protozoa)» и др. Среди
учеников немало известных ветеринарных протозоологов: про-
фессора Н. А. Колабский, В. Ф. Гусев, С. Н. Никольский, Н. А. Зо-
лотарев, Л. С. Иванова, Е. Н. Петрашевская и др.
В. А. Догель (1882—1955) — основоположник эколого-парази-
тологической школы, изучающей гельминтофауну животных в за-
висимости от состояния их организма и условий окружающей сре-
ды. Существенна его роль в развитии обшей паразитологии и изу-
чении болезней рыб. Он описал большое количество новых видов
паразитических простейших, разработал и рекомендовал оснбв-
ные мероприятия по борьбе с заболеваниями прудовых рыб. На-
писал около 300 работ, среди которых несколько учебников и мо-
нографий. Ученики В. А. Догеля; профессора А. П. Маркевич,
Ю И. Полянский, Г О. Марков. Б Е Быховский. В. Н. Беклеми-
шев и др.
Задачи ветеринарной паразитологии. Задачи ветеринарной пара-
зитологии — наиболее полное изучение паразито-хозяинных взаи-
моотношений, совершенствование методов профилактики и лече-
ния животных при инвазионных болезнях, искоренение наиболее
опасных, общих для животных и человека, а также экономически
значимых заболеваний домашних и промысловых животных, в
том числе рыб и пчел.
Известно, что многие гельминтозы могут быть причиной забо-
левания людей, например эхинококкоз, альвеококкоз, трихинел-
лез, описторхоз и др. Источником распространения или зараже-
ния служат при этом животные. Такие гельминтозы называют
гельминтозоонозами.
В настоящее время известно 44 вида гидробионтов (моллюс-
ки, ракообразные, рыбы, лягушки, змеи, черепахи и др ), кото-
рые являются потенциальными носителями возбудителей 47 ви-
дов гельминтозов людей. Человек заражается личинками не-
скольких видов нематод семейства Anisakidae, поражается ли-
13
чинками или служит дефинитивным хозяином лентецов, скреб-
ней и трематод.
В другой группе заболеваний участие человека обязательно для
развития возбудителя, например при бычьем и свином селитере.
Такие гельминтозы называют антропогельминтозо-
о н о з а м и. Несколько заболеваний, таких, как токсоплазмоз,
криптоспоридиоз, висцеральный лейшманиоз и, вероятно, пнев-
моцистоз, имеют для людей исключительно большое значение.
Есть сообщения о заражении человека возбудителями Babesia
divergens и В. microti от крупного рогатого скота и грызунов. Доста-
точно сказать, что по официальной статистике в Российской Феде-
рации ежегодно регистрируют более 70 тыс. инвазионных заболе-
ваний людей, а с учетом поправочного коэффициента — свыше
670 тыс.
Таким образом, на ветеринарную службу, в частности на пара-
зитологов, возлагается ответственность за контроль качества про-
дуктов животноводства, решение ветеринарно-медицинских про-
блем здравоохранения, а также состояние дел в животноводстве.
Ветеринарные паразитологи в тесном контакте с медицинской
службой обязаны строго контролировать эпизоотическую и эпи-
демиологическую ситуацию животноводческих районов, областей
и краев с учетом технологии ведения животноводства.
Особо важное значение в профилактике инвазионных заболева-
ний приобретает контроль за состоянием территории вокруг живот-
новодческих помещений, своевременной дезинвазией внешней
среды, качественной уборкой навоза и его утилизацией.
Практические ветеринарные работники в борьбе с паразитар-
ными и инфекционными заболеваниями используют огромное
количество химиопрепаратов, инсектицидов, акарицидов, репел-
лентов (отпугивающих веществ), аттрактантов (привлекающих ве-
ществ), дезинфектантов, а также биологически активных препара-
тов. Поэтому жизненно важно квалифицированно и целесообраз-
но применять тот или иной препарат, чтобы получить максимум
эффекта при минимальном загрязнении организма животного и
внешней среды.
Контрольные вопросы. 1. В чем суть паразитологии? 2. Какова история разви-
тия паразитологии? 3. Какие научные школы действуют в нашей стране? 4. Како-
ва связь паразитологии с другими дисциплинами ветеринарии? 5. Каковы задачи
ветеринарных паразитологов?
1
РАЗДЕЛ
ОСНОВЫ ОБЩЕЙ ПАРАЗИТОЛОГИИ
Паразитология (от гр. parasites — нахлебник, паразит, logos —
учение) — наука, изучающая паразитов, вызываемые ими болезни
и методы борьбы с ними.
1. БИОЛОГИЧЕСКИЕ ОСНОВЫ ПАРАЗИТОЛОГИИ
1.1. ТИПЫ ВЗАИМООТНОШЕНИЙ ОРГАНИЗМОВ В ПРИРОДЕ
Каждый организм сам по себе уникален с присущим ему обме-
ном веществ, энергией и генетическим кодом. В то же время каж-
дый из них связан с себе подобными (видами), популяцией, а так-
же со всей окружающей (абиотической и биотической) средой. В
природе все находится в тесном контакте, все взаимосвязано и
взаимообусловлено. Связь (биотическая) между живыми организ-
мами характеризуется большой лабильностью, сложностью и раз-
нообразием, основанными на пространственном и пищевом взаи-
моотношениях. Все многообразие организмов образовано просты-
ми и сложными сообществами. Отмечают самые разные отноше-
ния между организмами: паразитизм, хищничество, симбиоз с его
сложными взаимосвязями.
Паразитизм — исторически сложившаяся ассоциация генети-
чески разнородных организмов, основанная на иммунобиологи-
ческих взаимоотношениях, пищевых связях и взаимообмене, при
котором один организм — паразит (от гр. para — около, sites — пи-
тание) использует другой — хозяина в качестве среды обитания и
источника питания.
Происхождение паразитизма — сложное явление, как и само
возникновение жизни на Земле. Паразитизм — создание природы
и продукт ее эволюции. Это подтверждается многими факторами:
1) адаптацией к различным типам и способом питания представи-
телей классов эндо- и эктопаразитов; 2) морфофункциональными
изменениями в процессе эволюции как наружных, так и внутрен-
них органов паразитических организмов; 3) сложным циклом раз-
15
вития со сменой хозяев и среды при постоянстве генома, хорошо
прослеживаемого (особенно у эндопаразитов); 4) строгой приспо-
собленностью (специфичностью) паразитов к паразитированию
на животных определенных видов. Каждый из этих факторов
представляет собой сложнейшую проблему в становлении парази-
та и взаимоотношений паразит — хозяин.
Паразитизм впервые возник среди более сложных организмов. Существует
мнение о том, что в венде (700—650 млн лет назад) симбиоз был представлен го-
раздо шире, чем в настоящее время. Усложнение строения организмов привело к
тому, что около 520 млн лет назад кишечнополостные животные приобрели скелет
(кремниевый, силикатный, карбонатный) самых разных форм (конической, ци-
линдрической и др.) со свободной полостью внутри, где могло помещаться тело
другого животного. Это послужило причиной возникновения еще более сложных
взаимоотношений между разными видами организмов, т. е. установлению ком-
менсализма с его разновидностями.
Природа планеты развивалась по принципу роста разнообразия представите-
лей животного и растительного мира, совершенствования их взаимоотношений, и
со временем хищничество и паразитизм могли найти в ней обширное место.
В нижней кембрии (580—570 млн лет назад) были широко представлены губ-
ки, моллюски (примитивные двустворчатые, древнейшие головоногие), брахио-
поды, полихеты, членистоногие и особенно трилобиты и мшанки. Согласно со-
временным представлениям турбеллярии произошли от древних кишечнополост-
ных. А так как происхождение трематод и цестод от турбеллярий общепризнанно,
значит, древние кишечнополостные — далекие предки плоских гельминтов
(рис. 4).
С эволюционной точки зрения эктопаразитизм членистоногих возник относи-
тельно недавно — после появления основных групп современных позвоночных
животных. Наиболее древними эктопаразитами, появившимися в триасе (около
250 млн лет назад), считаются комары, клопы и некоторые другие.
Переход к паразитическому образу жизни — сложный и неодно-
родный процесс. Так, при возникновении эндопаразитизма эво-
люция организмов должна проходить по этапам: регулирование
кислородного обмена в анаэробных условиях; снижение затрат
на подвижность и обмен; обеспечение незаменимым строитель-
ным материалом интенсивного биосинтеза, связанного с быст-
рым ростом и крайне высокой активностью репродуктивной сис-
темы; преодоление защитных барьеров и систем организма хозя-
ина и т. д.
У Scolecida (надтип плоских гельминтов) паразитизм распрост-
ранен неравномерно (табл. 1). Некоторые классы представлены
одними паразитическими организмами, при этом экто- и эндопа-
разиты распределены неравномерно. Мезозой — эндопаразиты
беспозвоночных. Они прошли путь глубокой морфофункциональ-
ной регрессии и представлены небольшим числом видов. Моноге-
неи — в основном эктопаразиты рыб и амфибий. Гирокотилиды —
эндопаразиты древних рыб (акуловых и химер) — представлены
небольшим числом видов.
16
Рис. 4. Филогенез беспозвоночных (по Абрикосову н Шульцу)
1. Число вадов паразитических платод и скребней (по Ф. Ф. Сопрунову, 1987)
Класс Всего Экто- паразиты Эндо- паразиты Развитие Окончательный хозяин
Turbellaria 1600 80 — Прямое Беспозвоночные
Temnocephala 50 20 — » »
Trematoda Более 3000 — Более 3000 Сложное Позвоночные
Mesozoa 60 — 60 Прямое Беспозвоночные
Monogenea 1500 1500 — » Позвоночные
Girocotilida 20 —. 20 »
Cestoda Более 3000 — Более 3000 Сложное »
Acanthocephala 300 — 300 » »
Среди многочисленных гельминтов из класса Nematoda (круг-
лые гельминты) встречаются хищники, свободноживущие эндопа-
разиты животных и человека, паразиты растений.
С точки зрения науки и практики значительный интерес пред-
ставляет закономерность распределения паразитических простей-
ших в водной среде (табл. 2).
2. Ориешнровочное распространение простейших в разных водных средах
(по Ф. Ф. Сопрунову)
Класс Всего Морские Пресноводные Паразиты
число %
Kinetoplastidea 3500 1300 1300 900 25,7
Entamoebidea 8000 7300 600 100 1,25
Rimostomatea 6000 1500 3500 1000 16,6
Coccidea 1100 — — 1100 100,00
Microsporea 900 — — 900 100,00
Представители класса Kinetoplastidea (жгутиконосцы) по обра-
зу жизни и морфологии весьма разнообразны. Характерным явля-
ется наличие жгутиков — органов движения. По характеру пита-
ния и обмена веществ жгутиконосцев делят на два класса: расти-
тельные и животные. Представители последнего класса являются
объектом изучения ветеринарно-медицинской паразитологии
(трипаносомы у животных).
Класс Entamoebidea (саркодовые, амебы), по М. В. Крылову, —
обитатели морей, но есть и пресноводные, а также обитающие в
почве. Широко представлены виды представителей корненожек,
лучевиков и солнечников, много паразитов в отряде Entamoebida.
Так, хорошо известна амеба Entamoeba Hystolitica (дизентерий-
ная), паразитирующая в кишечнике человека и вызывающая кро-
вавый понос.
Класс Rimostomatea (реснитчатые) — паразитирующие и сво-
бодноживущие инфузории. По сравнению со многими простей-
шими они имеют наиболее сложное строение. Широко встречает-
18
ся в пресноводных водоемах инфузория туфелька (Paramecium
caudatum). Среди инфузорий встречаются хищники (Didinium
nasutus) и много паразитирующих видов (триходины, баланти-
дии).
Все представители класса Coccidea (споровики) — паразитичес-
кие организмы. Так, отряд Coccidia (кокцидии) представляет со-
бой обширную группу простейших, паразитирующих у животных
различных видов. Споровики — внутриклеточные паразиты (эй-
мерии, малярийные плазмодии и др.).
Класс Microsporea состоит из паразитических организмов.
Включает в себя в основном слизистые споровики — паразиты
морских и пресноводных рыб.
Все многообразие организмов на планете образует простые и
сложные сообщества.
Симбиоз (от гр. simbiosis — сожительство разнородных организ-
мов с различными видами взаимоотношений). Впервые это поня-
тие было использовано ботаником де Бари в 1879 г. Различают
следующие виды взаимоотношений организмов:
1) индифферентное сожительство;
2) антагонизм (взаимовраждебность);
3) мутуализм (обоюдосторонняя выгода);
4) односторонний симбиоз (синойкия).
В природе симбиоз проявляется чрезвычайно многолико, и не-
которые категории отношений не всегда укладываются в назван-
ные пункты. Так, например, хищничество хотя и не входит в ранг
паразитизма и мутуализма, но может считаться близко стоящим к
ним по ряду признаков.
Индифферентнее сожительство — такое взаи-
моотношение, когда каждый организм, сохраняя свою независи-
мость, тесно связан с окружающей средой единой жизнью, напри-
мер, организмы морского дна (коралловые полипы, морские ежи,
лилии, черви, ракообразные и др.) и растительные сообщества
(девственный лес — хвойный, широколиственный, тропический;
пустыня, степь, тундра). При всем этом действует незыблемый
закон минимума, выдвинутый Ю. Либихом: веществом, темпера-
турой, светом или каким-то другим фактором среды, находящим-
ся в минимуме, управляется урожай, жизнедеятельность каждого
из сочлена в стации, определяются величина и устойчивость (жиз-
ненность) каждого в конкретном случае. Таким образом, суще-
ствуют лимитирующие факторы среды, которые могуч' находиться
в недостатке, ниже критического уровня, или, наоборот, в избыт-
ке, превышающем переносимый организмами предел. Например,
для проявления и сохранения активного образа жизни орибатид-
ных клещей — промежуточных хозяев мониезий в средней полосе
России весной существует только один лимитирующий фактор —
температура в пределах 10—12 °C. Также хорошо известно, что при
недостатке в почве кальция, фосфора, меди и других элементов
19
существенно снижаются продуктивность и репродуктивные воз-
можности животных.
Мутуализм (от лат. mutuus — взаимный, франц, mutualite —
взаимопомощь) — обоюдостороннее дружественное взаимоотно-
шение, характеризующееся тем, что оба сожительствующих парт-
нера извлекают взаимную пользу. Например, на клешнях краба
находятся актинии, с помощью которых он защищается и добыва-
ет корм, а актинии Приобретают подвижность, что создает им луч-
шие условия для питания (рис. 5). В ряде случаев подобное сожи-
тельство настолько необходимо, что отсутствие одного партнера
губительно для другого.
В рубце жвачных обитают реснитчатые инфузории более 100
видов семейств Ophrioscolecidae, Isotrichidae и Biitschelidae (рис. 6).
В 1 л содержимого рубца коровы 18 г составляет биомасса инфузо-
рий, способных расщеплять клетчатку. В течение суток в рубце
коровы синтезируется 142 г микробиальных липидов, 29 г из них
синтезируют бактерии и 113 г — инфузории.
Односторонний симбиоз, или синойкия, —
взаимоотношения двух организмов, один из которых извлекает
для себя пользу, а другой нет. Например, морской желудь (род
Belanus) прирастает к раковинам различных моллюсков, что при-
дает ему большую подвижность и создает лучшие условия для пи-
тания.
Разновидности синойкии — квартирничество и комменсализм.
Квартирничество — форма симбиоза, при которой одно животное
использует другое в качестве убежища. Например, червь нереида
обитает в раковине морского моллюска, занятой раком-отшельни-
ком. Нереида временами выползает из раковины, чтобы использо-
вать остатки пищи рака. Любопытные отношения создались меж-
ду десятиногими рачками (спонгикола) и стеклянной губкой, из-
Рис. 5. Крабик, несущий в клещах актиний буноде-
опсис (Bunodeopsis)
20
3
Рис. 6. Инфузория семейства Ophryoscolecidae из рубца жвачных:
а — Entodinium simplex; б и в — Polyplastron multivesiculatum; вид с левой и правой стороны со-
ответственно; г — Anoplodinium denticulatum; д — Eudiplodinium neglectum; е — Ophryoscolex
caudatus; 1 — малое ядро (микронуклеус); 2— большое ядро (макронуклеус); 3 — околоротовая
ресничная зона; 4 — сократительная вакуоль; 5 — спинная ресничная зона; 6 — скелетные пла-
стинки
Рис. 7. Квартириичество:
а —стеклянная губка (кор-
зинка Венеры); б — пара де-
сятиногих рачков
вестной под названием корзинки Венеры
(рис. 7). Еще в личиночной стадии пара
рачков забирается в полость губки и во
взрослом состоянии уже не может оттуда
выйти. Вероятно, там рачки питаются
фильтрующимися через стенки губки мел-
кими организмами.
Комменсализм, или нахлебничество, —
использование одним животным пищевых
остатков другого. Данное явление в приро-
де представлено широко. В саваннах Афри-
ки шакалы поедают остатки пищи у гиен,
гиены — у львов и тигров. Рыба-прилипала
прикрепляется спинным плавником к коже
акулы в области головы и получает возмож-
ность передвигаться и кормиться остатками
пищи хищника (рис. 8).
Следует сказать, что многие указанные
выше взаимоотношения организмов весьма
хрупки. Например, на берегу Баренцева
моря обитает большое количество дву-
створчатых моллюсков, на поверхности ко-
торых прикрепляются ракообразные — морские желуди (Belanus
belanus). Это односторонний симбиоз. Однако нередко желуди
прикрепляются и к устью моллюска, из-за чего створки не могут
раскрыться, и моллюск погибает. Такое взаимоотношение нельзя
считать даже нахлебничеством. Еще один пример. Мелкая рыба
Fierasfer находит убежище в водяном легком и кишечнике голо-
турии. Время от времени рыбки выходят из них и плавают вбли-
зи. Как только появляются хищники, рыбки быстро проникают
обратно в голотурии через анальное отверстие. Однако этот без-
вредный обитатель иногда использует в пищу часть тела своего
«хранителя». Можно допустить, что использование Fierasfer ор-
ганов и тканей голотурии в пищу в процессе эволюции может
усиливаться и закрепляться, и тогда открывается прямой путь к
хищничеству или паразитизму.
Рис. 8. Рыба-прилипала (Echeneis remora)
22
1.2. ХОЗЯЕВА ПАРАЗИТОВ
Хозяева паразитов — живые организмы многих видов, в теле
которых проходит часть жизненного цикла паразитов. В зависи-
мости от стадии развития паразитов в организме хозяина и ряда
других биологических особенностей хозяев подразделяют на не-
сколько категорий.
Дефинитивным, окончательным, хозяином, но
не основном называется организм, в теле которого паразит дости-
гает стадии половой зрелости. Хозяева, в организме которых про-
исходит развитие промежуточных стадий паразита (у гельминтов и
многих насекомых — личинок, у простейших — фаз), называются
промежуточными. В теле промежуточных хозяев личинки
трематод и цестод развиваются до инвазионной стадии.
У отдельных гельминтов бывает два промежуточных хозяина, и
в таком случае второго хозяина называют дополнитель-
ны м. В его теле личинка паразита достигает инвазионной стадии.
В теле промежуточного хозяина паразиты размножаются беспо-
лым путем.
Среди окончательных хозяев есть такие, в организме которых
предоставляются оптимальные условия для питания и развития
паразита. В нем за короткий срок паразит достигает стадии поло-
вой зрелости, вырастает до максимальных размеров, живет про-
должительнее, выделяет больше яиц и личинок. Поэтому такие
окончательные хозяева являются облигатными (обязатель-
ными) для тех или иных паразитов. В противоположность обли-
гатным имеются и факультативные хозяева, в теле кото-
рых паразиты хотя и развиваются, но оптимальных условий для
жизненного цикла не находят. Например, для эхинококкуса соба-
ка — облигатный хозяин, а лиса — факультативный.
В природе широко встречается явление, называемое резер-
вуарным хозяином. В теле резервуарного хозяина накаплива-
ются инвазионные яйца или личинки гельминтов, но рост и раз-
витие не происходят. Однако создаются благоприятные условия
для массового заражения животных. Например, дождевые черви,
поедая землю, захватывают яйца аскарисов свиней и кур и в ре-
зультате становятся резервуаром — источником массового зараже-
ния свиней и птиц.
По срокам паразитирования паразиты бывают временными,
постоянными и периодическими.
Временные паразиты — организмы, которые используют
своих хозяев в определенный период жизни. Например, комары,
слепни, мошки и др. используют животных лишь как источник
питания, но растут и развиваются во внешней среде.
Постоянные паразиты — организмы, в основном парази-
тирующие во внутренних органах и тканях хозяина. Так, фасциола
обыкновенная обитает в желчных ходах печени; мониезии — в
23
тонком кишечнике; бабезии (кровепаразиты) — в эритроцитах.
Однако и на поверхности тела животного постоянно паразитирует
много видов паукообразных и насекомых, например вши, власо-
еды, чесоточные клещи.
Периодические (фазовые) паразиты отличаются от
временных тем, что паразитируют только на личиночной стадии
развития. Примером такого рода паразитирования служат личин-
ки подкожных, желудочных и полостных оводов.
По месту локализации паразитов подразделяют на две катего-
рии: эндопаразиты (внутренние) — диктиокаулюсы,
гемонхусы, парамфистомумы, пироплазмы, эймерии и т. д. и э к -
топаразиты (наружные) — вши, пухоеды, власоеды и др.
По стадии паразитирования выделяют имагинальных
(от лат. imago — взрослое животное) половозрелых (у дефинитив-
ных хозяев вызывают заболевания половозрелые гельминты) и
ларвальных (от лат. larva — личинка) паразитов (у промежу-
точных хозяев заболевания вызывают личинки, например, эхино-
коккоз овец, свиней).
1.3. ПАРАЗИТО-ХОЗЯИННЫЕ ВЗАИМООТНОШЕНИЯ
Паразит в организме хозяина — не индифферентное физичес-
кое тело, а биологически активный агент, который в процессе
жизни входит в тесные физико-химические и биологические от-
ношения с хозяином. Особо тесные взаимоотношения в системе
паразит — хозяин проявляются у эндопаразитов.
Сложность взаимоотношений обусловливается рядом показате-
лей, в том числе строением внешних покровов трематод, цестод и
нематод. У трематод и цестод внешние покровы представляют со-
бой цитоплазматический тегумент (термин введен А. Н. Rothman в
1959 г.), состоящий из наружной и внутренней частей. В отличие
от кутикулы нематод тегумент цестод и в некоторой степени тре-
матод — активный орган, выполняющий функции секреции, пи-
щеварения и всасывания. У цестод и личинок трематод (у споро-
цист и частично у редий) на плазматической мембране (наружная
поверхность тегумента) расположены микроворсинки приблизи-
тельно от 600 до 1500 мкм длиной и 100—400 мкм шириной с про-
светом между микроворсинками около 50 мкм. Такая структура
поверхности тела паразитов во много раз увеличивает площадь со-
прикосновения гельминтов с пищевыми субстратами и слизистой
оболочкой того или иного органа хозяина, что создает условия для
максимального усвоения пищи и пристеночного пищеварения
(рис. 9).
Большую роль во взаимоотношениях паразит — хозяин играют
ферментно-гормональные факторы. У эндопаразитов (трематод и
цестод) на поверхности тела обнаружены все жизненно важные
окислительно-восстановительные и пищеварительные ферменты.
24
Рис. 9. Схема строения покровов (тегумент) трематод (Л), цестод (Б) по электронной
микроскопии (но Шульцу и Гвоздеву, 1970):
I— наружная часть: ЦМ — цитоплазматическая мембрана; III— шипик; БС— безъядерный
синцитий; В —вакуоли; М— митохондрии; ЭС— эндоплазматическая сеть; БМ— базальная
мембрана; 11— внутренняя часть: КМ— кольцевые мышцы; ПМ— продольные мышцы; МК—
межклеточное вещество; ЦТ— цитоплазматические тяжи; Я—ядра; ПТ— погруженная часть
тегумента; Мтр — микротрихии
Кроме того, эти паразиты способны использовать ферменты орга-
низма хозяина с той же целью, что и сам хозяин. Так, с поверхно-
сти тегумента трематод и особенно цестод выделена неспецифи-
ческая щелочная фосфатаза, что подтверждает факт активного пе-
реноса некоторых питательных веществ через покровы тела. У
дикроцелиумов и фасциол в стенках половых органов, а также у
фасциол в мышечных волокнах, проходящих во внутренней части
тегумента, обнаружена холинэстераза. Установлено, что у дикро-
целий хлорофос в организм проникает через внешние покровы,
разрушая холинэстеразу и действуя на трематод губительно.
У цестод, у которых отсутствует пищеварительная система, эту
функцию выполняет тегумент, поэтому на его поверхности (в ос-
новном на микроворсинках) адсорбируются эстеразы, протеина-
зы, пептидазы, холинэстеразы, щелочная фосфатаза и другие фер-
менты хозяина. Они способны расщеплять пищевые субстраты с
последующим переносом продуктов распада в организм паразита.
Это доказывает, что тегумент у плоских гельминтов — активно
функционирующий орган, и, следовательно, знание функции это-
го органа поможет в изучении механизма действия антигельмин-
тиков и рациональному их подбору. В настоящее время установле-
но, что наружный покров у колючеголовых — акантоцефала при-
мерно такого же типа строения.
25
В стенках кишечника трематод и нематод выявлены специфи-
ческие ферменты, способные переваривать соответствующую
пищу. Паразиты питаются самыми разными по происхождению и
составу продуктами: кровью, тканями, химусом и т. д. В целом
питание паразитических организмов, в том числе и гельминтов,
изучено пока недостаточно. Например, аскарисы свиней обычно
паразитируют в тонком кишечнике и питаются субстратами ок-
ружающей среды и поверхностью слизистой оболочки. Однако
их нередко обнаруживают и в печени животных, и в желчных
протоках.
Установлено также, что половые гормоны самцов заметно со-
кращают репродукцию яиц и личинок кишечных нематод, тогда
как влияние гормонов лактации самок противоположно.
Среди многих проблем взаимоотношений паразит — хозяин
есть такие, которые вызывают живой интерес учащихся и специа-
листов любого ранга. Почему, например, в желудке собаки, где
перевариваются даже массивные кости, не перевариваются не-
жные личинки эхинококкуса, ценуруса и др.? Данный вопрос тре-
бует изучения. Однако можно предположить, что паразиты выра-
батывают биологически активные вещества (ингибиторы), пре-
дохраняющие их от гибели в организме хозяина. Так, мертвые мо-
ниезии, помещенные в химус из тощей кишки ягнят, при
температуре 37—38 °C под действием трипсина и хемотрипсина
вскоре распадаются на мелкие фрагменты, тогда как для живых
цестод в естественных условиях такая среда служит местом обита-
ния и развития.
Некоторая защитная роль приписывается веществам типа му-
цина, который равномерно покрывает поверхность трематод и це-
стод. И наконец, определенной защитой служат известковые тель-
ца (они нейтрализуют кислоты), находящиеся в глубине тегумента
в области сколекса (головы) и шейки. Значительна роль нативных
белков, которые у живых гельминтов находятся в биологически
активном состоянии. Известно, что нативные альбумины, глобу-
лины и другие белки весьма незначительно подвергаются воздей-
ствию трипсина, хотя после денатурации различными агентами
легко гидролизуются.
Интересные отношения возникают между паразитами и хозяе-
вами на уровне органов и тканей хозяев при проникновении пара-
зитов в организм. Например, реакция хозяина (овцы) на внедрив-
шихся в ее внутренние органы личинок эхинококкуса проявляется
образованием соединительнотканной капсулы вокруг них. Счита-
ют, что паразиты окружают себя в капсуле особыми веществами —
тилациями. Например, у растений это галлы. Казалось бы, в ре-
зультате активной реакции клеток (элементы иммунитета) пара-
зит, разрушающий органы хозяина, изолируется. Но, с другой сто-
роны, с момента инкапсуляции личинки могут жить в
безопасности несколько месяцев и даже лет, до того времени, ког-
26
да они смогут осуществить свою главную функцию — заражение
дефинитивных хозяев.
В системе паразит — хозяин целесообразно рассмотреть еще та-
кие понятия, как «специфичность» и «неспецифичность» парази-
тических организмов по отношению к хозяевам. Взаимоотноше-
ния между партнерами в системе паразит — хозяин исторически
обусловили у каждого из них определенные анатомо-морфологи-
ческие изменения и приспособительные реакции. Известно, что у
животных разных видов паразитические организмы встречаются
достаточно строго избирательно. Так, у собак паразитируют одни
виды гельминтов — унцинария, анкилостома, дипилидиум; у пар-
нокопытных — другие — гемонхус, нематодирус, бунастомум; у
непарнокопытных — третьи — делафондия, альфортия, параска-
рис. Чем генеалогически животные дальше друг от друга, тем ярче
выражена эта разница. Все это говорит о специфичности парази-
тов определенным видам животных.
Принято считать, что высокая специфичность — свидетельство
давности отношений паразит — хозяин и отражение филогении
как паразита, так и хозяина. Однако есть примеры, когда этот
принцип не выдерживается. Так, Fasciola hepatica (трематода), за-
везенная в Австралию совсем недавно, из-за отсутствия на данном
материке ее европейского промежуточного хозяина Lymnaea
truncatula приспособилась к паразитированию у местного моллюс-
ка L. tomentosa и стала высокоспецифичным паразитом. Следова-
тельно, специфичность непостоянна. Безусловно, данный случай
не единственный, но он наталкивает на мысль о том, что суще-
ствуют и потенциальные хозяева паразитов.
Для установления системы паразит — хозяин, становления па-
разитических отношений, выбора хозяина и его закрепления не-
обходимы определенные условия: хозяин и паразит должны всту-
пить в контакт друг с другом, это зависит от условий внешней сре-
ды, поведения членов цепи и т. д.; хозяин должен обеспечить все
условия для жизнедеятельности паразита (место обитания, пита-
ние и многое другое); паразит должен быть устойчив к любым
противодействующим ему реакциям организма хозяина.
Чем лучше выполняются эти условия, тем хозяин и паразит
специфичнее друг для друга. Важны и иммунобиологические вза-
имоотношения двух разнородных организмов. Иммунологические
реакции хозяина должны быть менее острыми, а паразита — тер-
пимыми, но в то же время настойчивыми.
Влияние среды обитания (хозяина) на морфологию и биологию па-
разита. Изменения строения тела, вызванные паразитизмом, мож-
но отнести к категории либо регрессивных, либо прогрессивных.
Потеря крыльев у блох, вшей, клопов, безусловно, — явление рег-
ресса. Клещи отряда Acariformes утратили дыхательные трахеи и
перешли к кожному дыханию, у блох глаза стали простыми, поте-
ряв фасетчатость. Все это — регрессивные изменения. Этого
27
нельзя сказать о трематодах и цестодах, у которых в процессе па-
разитирования гипертрофировались органы фиксации (присоски
и крючки на хоботке или теле). У некоторых паразитических ин-
фузорий из рода Opalina, обитающих в заднем отделе кишечника
лягушек, полностью исчезло ротовое отверстие, тогда как у сво-
бодноживущих форм оно есть. Встречаются круглые черви-нема-
тоды, у которых либо облитерировано анальное отверстие, либо
оно полностью отсутствует (Dracunculus medinensis). Нельзя сво-
дить изменения паразитов только к случаям появления или исчез-
новения каких-то органов на их теле. Так, например, у трипано-
сом верблюдов в процессе паразитирования постоянно меняется
структура внешней оболочки под влиянием хозяина (неразличи-
мая под световым микроскопом), что свидетельствует о возникно-
вении у паразитов оптимальных приспособительных реакций.
Прогрессивным признаком, возникшим в процессе эндопарази-
тизма, можно считать и гермафродитизм, встречающийся у пред-
ставителей многих классов трематод и цестод.
Не менее яркий признак прогресса у паразита — хорошо выра-
женная репродуктивная способность и многохозяинность (проме-
жуточные, дополнительные, резервуарные). Так, фасциола еже-
дневно продуцирует 2400 яиц. Далее в процессе бесполого раз-
множения в теле промежуточного хозяина — моллюска из каждого
яйца образуется около 100 церкариев. Следовательно, каждая фас-
циола ежесуточно дает свыше 240 тыс. личинок. У бычьего цепня
в зрелом членике находится более 170 тыс. яиц. Свиные аскарисы
способны продуцировать ежесуточно до 200 тыс. яиц. Партеноге-
нетическое размножение присуще и паразитическим простейшим
из рода Eimeria u Theileria.
Воздействие паразита на организм хозяина. Болезнетворное вли-
яние паразита на организм хозяина зависит от вида паразитов, их
количества, места обитания и способа размножения (в тканях или
полостях хозяина), физиологического состояния хозяина и мно-
гих других факторов.
Необходимо выделить следующие болезнетворные факторы:
механические, аллергические, токсические, трофические, иноку-
ляторные.
Механическое влияние на организм хозяина обуслов-
лено миграцией личинок, паразитированием взрослых гельмин-
тов, членистоногих (клещей) и личинок насекомых (подкожные
и полостные оводы) в органах и тканях хозяина. В результате по-
вреждаются кровеносные сосуды (личинки аскарид, стронгилид
лошадей, диктиокаулюсов и др.); разрушаются и атрофируются
клетки органов (ценурусы головного и спинного мозга, эхино-
коккусы печени и легких, фасциолы печени и др.); закупорива-
ется и разрывается кишечник (мониезии, аскарисы); разрушают-
ся эпителий кишечника (эймерии), клетки крови (пироплазми-
ды). Так, вухарерии вызывают застой лимфы в лимфатических
28
Рис. 10. Вухарериоз (слоновость):
1 — грудных желез (случай д-ра Vehrs
из Западной Африки); 2— ног (случай
д-ра Coombes из Индии)
сосудах. В результате происходят застойные явления и разроет со-
единительной ткани конечности, мошонки, что приводит к сло-
новости органа.
Однако следует помнить, что механические изменения органов
и тканей, как правило, приводят и к нарушениям их многочислен-
ных функций. Поэтому этот процесс следует понимать шире —
как морфофункциональное воздействие паразитов (рис. 10).
Аллергическое воздействие паразитов заключается в
том, что в процессе жизнедеятельности они выделяют продукты
метаболизма, секреции и экскреции, обладающие свойствами ал-
лергенов. Под их влиянием в организме развивается аллергичес-
кая реакция, создается иммунитет различной степени напряжен-
ности. Значительное место в этом процессе занимают и аллергены
соматического происхождения (полипептиды, протеины, полиса-
хариды и гликолипиды), которые образуются при гибели личинок
и взрослых паразитов в организме хозяина, при выделении члени-
ков цестодами. Таким образом, гельминты и другие паразитичес-
кие организмы способны вызвать аллергическую реакцию, в том
числе эозинофилию, обычно проявляющуюся особенно ярко при
гельминтозах.
29
Токсическое влияние паразитических организмов изуче-
но плохо. До сих пор никому не удалось выделить токсины у гель-
минтов. Тем не менее при некоторых гельминтозах это проявляет-
ся у больных животных ухудшением общего состояния, потерей
аппетита, расстройством функций желудочно-кишечного канала,
снижением содержания эритроцитов, гемоглобина и т. д. Токси-
коз при гельминтозах, в частности при кишечных цестодозах, дей-
ствительно существует, но его генезис мы рассматриваем в не-
сколько другом аспекте (см. Мониезиозы жвачных).
В настоящее время признаками токсикозов считают умень-
шение содержания в сыворотке крови холинэстеразы, увеличе-
ние количества патологически светящихся лейкоцитов и цито-
патическое влияние различных субстратов паразитов на искус-
ственно выращиваемые клетки (перевиваемые клетки амниона
человека, раковые клетки Нер-2, первично трипсинизирован-
ные клетки фибробластов эмбриона человека и куриные фиб-
робласты). Следует отметить, что до недавнего времени из-за
незнания вопроса симптомы аллергии приписывали токсикозу.
При массовом нападении мошек у животных (крупный рогатый
скот, лошади) под действием гемолитического яда развивается
симулидотоксикоз. У саркоцист (простейшие) выделен токсин
саркоцистин, который вызывает некроз тканей у многих лабо-
раторных животных.
Трофическое влияние паразитов заключается в том, что
в организме животных они питаются либо кровью, соками, ткане-
выми элементами, либо мономерами пищевых субстратов химуса.
Такие крупные гельминты, как кишечные цестоды, аскарисы,
имеющие большую биомассу, используют из организма хозяина
значительную часть пищи, микро- и макроэлементов, витаминов
и др.
Инокуляторное действие паразитов заключается в том,
что личинки многих гельминтов (диктиокаулюсы, стронгилоиде-
сы, аскарисы, стронгилиды), насекомых (подкожные оводы), а
также молодые фасциолы, парамфистомы и др.'в период мигра-
ции переносят во многие органы и ткани хозяина микроорганиз-
мы различных видов. Многие двукрылые насекомые при кровосо-
сании инокулируют в организм здоровых животных возбудителей
сибирской язвы, бруцеллеза и других инфекционных болезней.
Эймерии в период шизогонального развития, разрушая эпители-
альные клетки кишечника, открывают микроорганизмам доступ в
глубоколежащие ткани хозяина. В результате может произойти
обсеменение организма различными микроорганизмами, что не-
редко осложняет течение инвазионного или инфекционного забо-
левания.
30
1.4. ПАРАЗИТОЦЕНОЗЫ И ИХ РОЛЬ В РАЗВИТИИ ПАТОЛОГИИ
Совокупность паразитов разных видов, населяющих организм
хозяина или его отдельные органы, получила название паразито-
ценоза (Е. Н. Павловский, 1937). В естественных условиях в орга-
нах и тканях одного животного обитают паразиты различных ро-
дов, видов и даже типов. Так, у овец в Нечерноземье нередко па-
разитируют нематоды 12 видов, цестоды 3 видов, эймерии 3—5
видов, волосовики, кровососки и вши. Количество видов в отдель-
ных зонах может существенно изменяться.
В пищеварительном канале и в легких кроме указанных пара-
зитических организмов обитает огромное количество микроорга-
низмов, в том числе актиномицеты, грибы, инфузории — обычные
сожители высокоразвитых организмов. При этом сочлены биоце-
ноза действуют либо синергически (усиливающе), либо антагони-
стически (угнетающе). Например, лямблия (жгутиковое простей-
шее) чаще и интенсивнее паразитирует в кишечнике человека
вместе с широким лентецом или карликовым цепнем, нежели с
аскарисами. При мониезиозе у ягнят значительно увеличивается
количество кишечных нематод и при этом нередко меняются мес-
та их обычной локализации.
Поэтому профилактика и лечение тех или иных заболеваний
должны основываться на глубоких профессиональных знаниях и
учете доминирующей роли возбудителей отдельных видов и обще-
го состояния хозяина (среды обитания).
Контрольные вопросы. 1. Какова суть происхождения паразитизма? 2. Каков
характер распространения паразитических организмов в различных средах? 3. Ка-
кие виды взаимоотношений существуют между животными различных видов?
4. Каково отличие облигатных хозяев от факультативных? 5. Каково значение ре-
зервуарных хозяев? 6. Как подразделяют паразитов в зависимости от образа жизни
и места обитания? 7. В чем сложность взаимоотношений паразита и хозяина?
8. Почему в желудке собаки не перевариваются живые личинки эхинококкуса?
9. Как влияют хозяева на морфологию и биологию паразитов? 10. Какое болезнет-
ворное действие оказывают паразиты на организм хозяев? 11. Что означает поня-
тие «паразитоценоз»?
2. ИНВАЗИОННЫЕ (ПАРАЗИТАРНЫЕ) БОЛЕЗНИ
Заразные болезни животных, в том числе птиц, рыб и пчел,
подразделяются на инфекционные и инвазионные. Хотя в целом
они и имеют общие закономерности развития, но отличаются по
многим признакам проявления и характеру течения. Инвазион-
ные болезни (от лат. invasio — вторжение, нападение) вызывают
возбудители животного происхождения (простейшие, гельминты,
паукообразные и насекомые). Инфекционные болезни (от
лат. infectio — заражение) обусловлены организмами растительно-
го и другого происхождения (вирусами, микробами, грибами и
риккетсиями).
31
Инвазионная болезнь — результат патогенного действия возбу-
дителя-паразита на организм животного. Патогенное влияние па-
разита обусловлено комплексом факторов (механических, аллер-
гических, токсических), количеством паразитов, путями проник-
новения, местом обитания, биологией развития (миграция личи-
нок, способность размножаться в организме).
Патогенность паразитических организмов — строго ин-
дивидуальный генетический признак, способный вызывать болез-
нетворный процесс. Установлено, что среди особей одного и того
же паразита встречаются изоляты и штаммы с присущими только
им свойствами. Например, в Казахстане существует один штамм
эхинококкуса, который наиболее оптимально приспособлен к
обитанию у овец и собак (овца — собака — овца), в Белоруссии —
другой штамм, но уже в системе собака — свинья — собака.
Для определения степени патогенности того или иного штамма
или изолята паразита употребляют термин вирулентность.
Он характеризует индивидуальные качества паразита, его способ-
ность наиболее ярко проявлять патогенность в конкретных усло-
виях заражения хозяев. Например, вирулентность возбудителей
протозойных заболеваний может быть повышена путем удаления
селезенки у подопытного животного или понижения при культи-
вировании шизонтов in vitro (у тейлерии).
В зависимости от комплекса взаимосвязанных процессов инва-
зионные болезни могут протекать остро — с выраженными симп-
томами болезни, хронически — с менее выраженными признака-
ми и субклинически, когда визуально трудно установить какие-
либо признаки болезни.
2.1. КЛАССИФИКАЦИЯ ПАРАЗИТОВ И НОМЕНКЛАТУРА
ИНВАЗИОННЫХ БОЛЕЗНЕЙ
Единицей классификации паразитических организмов как рас-
тений, так и животных служит вид. Вид — это популяция особей,
обладающих сходными морфофункциональными признаками,
имеющих общее происхождение и скрещивающихся только между
собой. Близкие виды возводятся в более высокую единицу — род.
Научное название паразита состоит из двух латинских слов, обо-
значающих род и вид. Например, возбудитель аскариоза свиней
называется Ascaris suum, где Ascaris — род, suum — вид. Название
рода стоит на первом месте и пишется с прописной буквы. Подоб-
ная биноминальная (двухименная) система была впервые приме-
нена шведским натуралистом Карлом Линнеем (1735).
Близкие роды объединяются в семейства, семейства — в отря-
ды, отряды — в классы, классы — в типы. Чтобы в указанные так-
соны вместить все паразитические организмы для максимального
уточнения нюансов принадлежности отдельных организмов к той
32
или иной единице систематики, вводят дополнительные субъеди-
ницы — подвид, подрод, подсемейство, надсемейство, подотряд и
т. д.
В 1928 г. К. И. Скрябин и Р. С. Шульц упорядочили номенкла-
туру гельминтозов, которая используется и в других разделах пара-
зитологии. Заболевания называют по зоологическому наименова-
нию рода возбудителя с прибавлением к корню слова суффикса
«оз» или «ез». Например, род Ascaris, а заболевание аскариоз, род
Fasciola — заболевание фасциолез. Русское название гельминта в
единственном и множественном числе также образуется по родо-
вому названию. Например, Dicrocoelium lanceatum — дикроцели-
ум и дикроцелиумы. Однако нередко употребляют названия забо-
леваний более высоких таксонов. Например, аскаридатозы живот-
ных (плотоядных), саркоптоидозы, пироплазмидозы животных и
т. д. В данном случае слово «аскаридатозы» обозначает сумму бо-
лезней всех животных или плотоядных, так как все виды аскари-
сов животных относятся к одному подотряду Ascaridata; саркопто-
идозы — надсемейству Sarcoptoidea и т. д.; пироплазмидозы — от-
ряду Piroplasmida.
2.2. ПРЕДПОСЫЛКИ ВОЗНИКНОВЕНИЯ И РАСПРОСТРАНЕНИЯ
ПАРАЗИТАРНЫХ БОЛЕЗНЕЙ
Паразитарные заболевания чрезвычайно широко распростра-
нены в самых различных природно-климатических условиях и у
животных всех видов. В частности, большинство паразитических
организмов, в том числе и гельминтов, весьма древние, а поэтому
эволюционно они максимально приспособлены к условиям суще-
ствования как во внешней среде, так и в организме хозяина.
Так, аскарисы свиней живут в кишечнике животного до 10 мес
и более и за это время ежесуточно продуцируют по 200 тыс. яиц,
которые в суровых условиях средней полосы России сохраняют
жизнеспособность до 6 лет. При этом животные заражаются круг-
лый год. Происходит это как при непосредственном заглатывании
яиц с кормом и водой, так и через дождевых червей-резервуаров, в
организме которых накапливается огромное количество инвази-
онных яиц, что способствует интенсивному заражению животных.
С другой стороны, множество гельминтов и паразитических
простейших имеют промежуточных (где паразиты размножаются
партеногенетически или путем шизогонии, увеличивая числен-
ность в сотни раз) и дополнительных хозяев, где личинки парази-
та становятся инвазионными и доступными дефинитивным хозяе-
вам (например, дикроцелиум, простогонимусы, кровепаразиты
семейства Babesiidae, малярийный плазмодиум и т. д.).
Кроме того, среди гельминтов широко встречаются резервуар-
ные хозяева, которые максимально способствуют заражению де-
33
финитивного хозяина и распространению паразита среди живот-
ных. Например, заражение собак Spirocerca lupi (гельминт плото-
ядных животных) на юге достигает 50—60 %. Удивительно! Ибо
промежуточный хозяин нематоды — жук-капрофаг, которого со-
баки практически не едят. Причиной столь широкого распростра-
нения болезни оказалось наличие резервуаров: рыб, лягушек, ле-
тучих мышей, куниц, которые поедают жуков и становятся источ-
ником заражения собак и других плотоядных (рис. 11).
Приспособленность к распространению паразитов через своих
хозяев весьма велика. Например, пироплазмы лошадей в организ-
ме хозяина сохраняются до 3 лет, в клещах же — переносчиках ро-
дов Dermacentor и Hyalomma — в 13 поколениях; В. equi (син. Nut.
equi) — в одном поколении клещей, а в организме лошадей — до
18 лет; эхинококкусные пузыри в организме животных сохраня-
ются свыше 10—15 лет и, кроме того, размножаются партеногене-
тически, отпочковывая из герминативной оболочки сотни тысяч
протосколексов — будущих цестод у собак.
Не менее удивительной стороной приспособленности к разви-
тию паразитов является их чрезвычайная многоплановость в из-
брании мест локализации: в крови (простейшие кровепаразиты,
гельминты — дирофилярий, шистосомы), в головном и спинном
мозге (ценурус, элефостронгилус), в сердце (дипеталонема, диро-
филярии), в сухожилиях (онхоцеркусы), в почках (диоктофимы), в
глазах (Loa 1оа), в лимфососудах (вухарерии), в легких и печени
(эхинококкусы, альвеококкусы, диктиокаулюсы), на брыжейке
(тонкошейная финна), в брюшной и других полостях (сетарии), в
желудке (гастрофилюсы, амидостомумы, гемонхусы), в мышцах
(трихинеллы, цистицеркусы), в кишечнике (сотни нематод, цес-
тод, трематод) и т. д. Кроме того, многие паразитические организ-
мы, до того как попадут в организм своих хозяев, сутками, месяца-
ми и даже годами живут и накапливаются во внешней среде, не
теряя жизнеспособности.
Таким образом, паразитические организмы являются компо-
нентом всего комплекса биосферы, и, следовательно, предпосыл-
ки их возникновения или исчезновения следует рассматривать не
изолированно, а в связи со всеобщим развитием всего живого и
неживого в иерархической лестнице биосфера — биогеоценозы —
биоценозы — популяции — виды (отдельные организмы).
Основоположник популяционной концепции в паразитологии
В. Н. Беклемишев популяции паразита и хозяина рассматривал в
единой паразитарной системе.
Мы остановимся на наиболее понятном и удобном определе-
нии популяции, данном В. А. Ромашовым (1988). Он считает, что
популяция — это совокупность особей одного вида, длительно на-
селяющая определенное пространство в биоценозе и представля-
ющая форму существования вида. Популяции гельминтов, как и
многих других паразитов, имеют много форм, единиц: имагопопу-
34
Хозяева
Рис. 11. Биология развития Spirocerca lupi:
7 —общий вид нематоды; 2—опухолевидные образования на слизистой пищевода со спиро-
церками; 3—головной конец нематоды; 4— хвостовой конец самца; 5—яйцо; 6—жуки; 7—
инвазионная личинка, инкапсулированная в теле резервуарного хозяина
ляция, экзопопуляция, имагомикропопуляция, лярвоэндопопуля-
ция и т. д. Например, популяцию дикроцелиумов можно рассмат-
ривать в двух единицах: имагопопуляции — совокупности всех дик-
роцелиумов во всех дефинитивных хозяевах (домашних и диких)
на определенной территории; лярвоэндопопуляции — совокупности
личиночных особей дикроцелиумов (в моллюсках и муравьях),
объединенных общностью территории. В этот комплекс необхо-
димо вводить и экзопопуляцию, т. е. совокупность всех яиц дикро-
целиумов, находящихся на той же территории (в абиотической
среде). Отсюда возникновение заболевания на определенной тер-
ритории связано с разнообразием видов популяции. В свою оче-
редь, жизнеспособность этих популяций зависит от факторов
внешней среды, условий жизни и развития промежуточных и до-
полнительных хозяев.
Предпосылки возникновения паразитарных заболеваний, веро-
ятно, следует рассматривать с двух позиций: естественное зараже-
ние — дикая природа и фауна и искусственное — хозяйства с раз-
витым животноводством и объекты внешней среды под деятель-
ностью человека.
Рассмотрим ход развития паразитарных заболеваний с этих по-
зиций. Например, как происходит развитие паразитозов в дикой
фауне в условиях природных ландшафтов? Ведь в природе суще-
ствовали и продолжают существовать сотни видов диких живот-
ных со своими паразитами. Притом плотность животных отдель-
ных видов в ареале достигает внушительных размеров (например,
сайгаки на территории Калмыкии, зебры, антилопы-гну в саван-
нах Африки, бесчисленное количество чаек и грачей в условиях
Нечерноземья и т. д.). По мнению К. Кеннеди (1978), процесс зара-
жения паразитами приводит к так называемому перерассеянному
распределению их в популяции животных, т. е. большая часть пара-
зитов сосредоточена на относительно небольшом числе особей хо-
зяина. Таким образом, данный вид животных сохраняется в приро-
де, если вмешательство человека не будет иметь отрицательного
воздействия. Кроме того, в дикой природе большие популяции жи-
вотных, как правило, совершают суточные и сезонные миграции,
что профилактирует массовое заражение их паразитами.
По другой позиции возникновение и распространение парази-
тозов происходит по вине антропогенных факторов. В некоторых
хозяйствах значительное количество животных определенных ви-
дов содержат на небольших территориях, ежедневно выпасают их
на одних и тех же участках, несвоевременно отбивают молодняк
от взрослых животных, кормят скудно и нарушают плановые вете-
ринарно-санитарные мероприятия. В этих условиях при наличии
благоприятных абиотических факторов чрезмерно концентриру-
ется инвазионное начало и возникают заболевания (фасциолез,
диктиокаулез, кишечные нематодозы, эймериозы и т. д.).
36
2.3. ЗНАЧЕНИЕ.СИСТЕМАТИКИ В ПАРАЗИТОЛОГИИ
Систематику в научном мире используют для изучения законов
эволюции природы, так как это дает возможность установить
близкие родственные связи между таксонами.
Таксономия (от гр. taxis — ряд, порядок, monas — за-
кон) — учение о принципах классификации, ее законах и методах.
Систематику справедливо считают математической биологией,
так как, чтобы классифицировать и систематизировать такое мно-
гообразие животного мира, исследователям необходимо изучать и
учитывать множество признаков и свойств организмов.
Основоположником научной систематики считают шведского
натуралиста Карла Линнея, издавшего «Systema nature» в 1735 г.
Его заслугой явились определение понятия вида и создание
иерархической системы соподчиненных категорий: вид, род, от-
ряд, класс. Он узаконил животное каждого вида именовать двумя
словами: вид и род. Например, заяц-беляк (род Lepus — заяц, вид
timidus — трусливый).
Позже Ж. Кювье (1769—1832) ввел понятия «семейство» и
«тип» и стало шесть основных категорий систематики: тип, класс,
отряд, семейство, род и вид. Однако дальнейшее изучение живот-
ного и растительного мира выявило потребность в добавлении
еще ряда категорий. Таким образом, появились надцарства, под-
царства, надклассы, подклассы, надсемейства, подотряды и т. д.
Ныне введены еще царства, раздел триба и т. д.
В настоящее время систематика основывается на самых совре-
менных достижениях биологии и смежных с ней наук — зоологии,
генетики, палеонтологии и др.
В паразитологии систематика изучаемых объектов нужна для
глубокого познания сообществ организмов, обладающих общими
признаками и свойствами, а следовательно, для определения их
патогенности, закономерностей развития патологического про-
цесса, установления дифференциальной диагностики и последую-
щего принятия мер борьбы.
Существует международный кодекс зоологической номенкла-
туры, в котором строго соблюдаются правила описания вида, его
систематизация, сохранение приоритета и т. д.
Необходимо отметить, что в 1928 г. К. И. Скрябин и Р. С. Шульц
существенно упорядочили номенклатуру инвазионных болезней,
которую сейчас успешно используют во многих разделах парази-
тологии.
2.4. ЭПИЗООТОЛОГИЯ ПАРАЗИТАРНЫХ БОЛЕЗНЕЙ
Эпизоотология паразитарных болезней животных изучает зако-
номерности возникновения и угасания заболеваний, особенности
их течения в разных условиях и методы управления этими процес-
37
сами для скорейшего искоренения болезней с наименьшими зат-
ратами труда и материальных средств.
В эпизоотологии важно знать такую категорию, как эпизоо-
тический процесс, означающий непрерывную цепь после-
довательного перехода возбудителей от больных животных или пара-
зитоносителей к здоровым через присущий им механизм передачи.
Многие паразитические организмы имеют сложный цикл раз-
вития, происходящий только при участии промежуточного, иног-
да дополнительного хозяина или без их участия. Их называют со-
ответственно био- и геогельминтами, а заболевания, вызываемые
ими, — био- или геогельминтозами.
Если в развитии эпизоотического процесса при геогельминто-
зах решающую роль играют факторы внешней среды (почва, вла-
га, температура и т. д.), то при биогельминтозах необходимо учи-
тывать и наличие промежуточных хозяев или биологических пере-
носчиков. Некоторые промежуточные хозяева гельминтов (мош-
ки, мокрецы и др.) за весенне-летний сезон могут преодолевать
большие расстояния, следовательно, ареал инвазии расширяется.
Другие же ведут оседлый образ жизни (моллюски, муравьи и мно-
гие беспозвоночные, обитающие в изолированных водоемах). При
геогельминтозах эпизоотический процесс усложняется еще и по-
тому, что у промежуточных хозяев или переносчиков болезней
возбудители могут сохраняться не один год. Так, возбудитель
В. equi лошадей в теле иксодовых клещей может сохраняться на
протяжении 13 поколений.
В эпизоотическом процессе важное значение имеют учет вре-
мени завершения биологии и развития каждого возбудителя (от
яйца или личинки до половозрелой особи) и количество завер-
шенных биологических циклов за текущий год — интенсивность
биологического цикла (В. В. Филиппов, 1984). Знание этих факто-
ров в эпизоотологии дает возможность обоснованно контролиро-
вать и профилактировать инвазионные заболевания.
Источники распространения и заражения животных. В эпизоото-
логии инвазионных болезней следует четко разграничивать два
понятия: «источник распространения» и «источник заражения».
Эти понятия тесно связаны с такими факторами, как зональность,
сезонность, возраст животного и др.
Источник распространения инвазий — больные
животные и паразитоносители. Основную роль при этом играют
хронически больные, так как только половозрелые гельминты вы-
деляют во внешнюю среду инвазионное начало —яйца или ли-
чинки.
В зависимости от географической зоны источником распрост-
ранения одного и того же возбудителя могут быть животные раз-
ного возраста. Например, в Средней Азии и Закавказье в распрос-
транении мониезиоза большую роль играют взрослые овцы, а в
Нечерноземье — в основном молодняк текущего года рождения.
38
Источником заражения в зависимости от вида воз-
будителя служат внешняя среда (почва, трава, водоемы и т. п. при
геогельминтозах, эймериозах и др.), промежуточные хозяева (на-
секомые, паукообразные, моллюски и др. при биогельминтозах).
Большое значение имеет и наличие резервуарного хозяина.
Пути заражения животных. При многих гельминтозах и прото-
зоозах (эймериозы, токсоплазмозы, балантидиоз и др.) наиболее
распространен алиментарный путь заражения. При па-
стбищном или стойловом содержании во время кормления и по-
ения животные заглатывают инвазионное начало. В некоторых
случаях они заражаются и при поедании промежуточных хозяев
гельминтов. Так, например, заражаются собаки огуречным цеп-
нем (при поедании инвазированных блох), а овцы и козы — про-
тостронгилидами (при поедании моллюсков) или мониезиями
(при поедании клещей).
При контактном пути заражения возбудители парази-
тарных болезней могут переходить от одного животного к другому
при соприкосновении, что часто происходит в стойловый период,
при массовых обработках и перегонах. Так передаются возбудите-
ли саркоптоидозов, кровососы, вши, волосовики и пухоеды. Та-
кой путь передачи инвазии может быть при пироплазмидозах,
когда зараженные иксодовые клещи для сосания крови переходят
с одного животного на другое, или при естественной случке коров
и кобыл с больным быком или жеребцом (возбудители трихомо-
ноза, или случной болезни).
Перкутанный путь заражения и через есте-
ственные полости. Возбудители некоторых инвазионных
болезней проникают в организм животных через кожный покров.
Так происходит заражение жвачных животных возбудителями
ориентобильхарциоза, бунастомоза, стронгилоидоза, эдемагеноза
(северных оленей) и анкилостоматидозов (плотоядных). Через но-
совую полость лошадей, овец, оленей проникают личинки полос-
тных оводов.
Трансмиссивный путь заражения характерен глав-
ным образом для возбудителей кровепаразитарных болезней. Воз-
будитель проникает в организм хозяина при укусах кровососущих
насекомых (трипаносомы верблюдов) и иксодовых клещей (бабе-
зии, анаплазмы, тейлерии и др.). Таким путем распространяются
возбудители онхоцеркозов животных и человека (через укус мо-
шек и мокрецов).
Внутриутробный путь заражения не имеет широко-
го распространения в природе. Тем не менее возбудители неоаска-
риоза телят, токсокароза щенков заражают плод через плаценту.
Таким путем животные и человек заражаются возбудителем ток-
соплазмоза, при этом часто регистрируют уродства плода.
Краевая паразитология. Основы краевой паразитологии перво-
начально были заложены К. И. Скрябиным по результатам его
39
многочисленных экспедиций, посвященных изучению гельминто-
фауны животных на обширной территории б. СССР.
По мнению К. И. Скрябина, результаты экспедиции, в процес-
се которой были собраны разнообразные виды гельминтофауны
от самых разных животных, обитающих на экологически отлича-
ющихся друг от друга территориях страны, дали материал для раз-
вития гельминтогеографии — новой науки, необходимой для пла-
нирования противогельминтозных мероприятий.
Краевая паразитология достаточно широко представлена и в
работах В. А. Догеля. При изучении данной проблемы на гельмин-
тах рыб исследователем была установлена зависимость различий
паразитофауны от зоогеографических факторов, размеров площа-
ди распространения хозяина и степени ее изолированности и т. д.
Роль зоогеографических зон в распространении паразитофау-
ны животных четко выступает и в отношении протозойных болез-
ней и аранхо-энтомозов. В частности, ареал кровепаразитов круп-
ного рогатого скота полностью совпадает с таковым паразитофор-
мных клещей — переносчиков инвазии. Это можно сказать в от-
ношении эстроза овец, возбудитель которого Oestrus ovis
распространен только в южных районах страны.
Но есть возбудители инвазионных болезней, которые менее
связаны с условиями внешней среды. Так, саркоптоидозы живот-
ных, возбудители которых постоянно связаны с телом хозяина,
широко распространены в различных зонах страны.
Поэтому закономерность распространения паразитарных бо-
лезней в зависимости от агроклиматических условий географичес-
ких зон областей, краев и регионов должна быть учтена при пла-
нировании и организации мер борьбы с различными видами воз-
будителей инвазионных болезней.
Течение инвазионных болезней, экстенсивность и интенсивность
инвазии. Течение инвазионных болезней зависит от многих факто-
ров: вида; биологии паразита; интенсивности инвазии; физиоло-
гического состояния животного и т. д. Поэтому в зависимости от
указанных причин паразитарные болезни могут протекать остро
с явным проявлением клинических признаков и субклини-
чески без видимых признаков, когда трудно уловить симптомы
болезни.
Установлено илатентное (от лат. latentis — скрытый) те-
чение инвазии при кишечных нематодозах и диктиокаулезе жвач-
ных. Так, осеннее заражение молодняка овец хорошей упитаннос-
ти личинками диктиокаулюсов нередко заканчивается задержкой
паразитов в брыжеечных лимфоузлах. Однако ранней весной при
отсутствии качественных кормов, сквозняках и других отрица-
тельных факторах личинки свободно преодолевают естественные
барьеры хозяина и мигрируют в легкие, вызывая диктиокаулез.
Псороптоз (накожниковая чесотка) в осенне-зимний период у
тонкорунных овец протекает остро с поражением обширных учас-
40
тков тела, но летом при наличии хороших пастбищ и обилии сол-
нечных дней эта инвазия протекает латентно.
Большинство паразитарных болезней животных протекает без
явных клинических симптомов и имеет характер хроничес-
ких исубклинических заболеваний.
Заражаемость животных паразитами связана также с фактором
специфичности; наличием врожденного или приобретенного им-
мунитета, естественной резистентности; видом, породой, возрас-
том животного, условиями содержания и кормления. Животные
могут заражаться на одних и тех же пастбищах в разные сроки,
неодинаковым количеством паразитических организмов и разны-
ми их видами.
Известно, что количество паразитов непосредственно влияет
на течение инвазии у зараженных животных. Поэтому для харак-
теристики инвазионных болезней в паразитологии используют
понятие экстенсивность инвазии, означающее коли-
чество зараженных особей из всего обследованного поголовья, вы-
раженное в процентах. Например, при гельминтокопрологии 100
свиноматок в 10 пробах обнаружены яйца аскарисов, значит, эк-
стенсивность инвазии составляет 10%. Интенсивность
инвазии устанавливается путем вскрытия животного с учетом
количества выявленных паразитов определенного вида и оценива-
ется в экземплярах. Так, при вскрытии печени коровы обнаруже-
но 10 фасциол, значит, интенсивность инвазии составляет Юэкз.
Приблизительную интенсивность инвазии устанавливают метода-
ми копроскопических исследований.
На основании предварительного изучения экстенсивности и
интенсивности инвазии можно оценить результаты эффективнос-
ти противопаразитарных мероприятий. При этом дополнительно
используют такие понятия, как экстенс- и интенсэф-
фективность, выражаемые в процентах.
2.5. УЧЕНИЕ Е. Н. ПАВЛОВСКОГО О ПРИРОДНОЙ ОЧАГОВОСТИ
И ТРАНСМИССИВНЫХ БОЛЕЗНЯХ
Популяция животных определенного вида, занимающая естественный участок
ландшафта, тесно контактирует с флорой и фауной (биоценоз), непосредственно
связана со средой обитания. В комплексе все это составляет биогеоценоз.
Е. Н. Павловский в 1939 г. разработал учение о природной очаговости болез-
ней (существование эпидемических и эпизоотических очагов, возникающих в оп-
ределенном биогеоценозе в процессе его эволюции). Возбудители болезней, рас-
тения и животные — сочлены сложившегося комплекса, где в процессе развития
постоянно циркулирует инвазия. Например, в отдельных районах Севера между
рыбой и дикими плотоядными циркулирует возбудитель описторхоза, связующим
звеном которого служит промежуточный хозяин — пресноводный моллюск.
Такая же картина наблюдается при альвеококкозе в отношении между песца-
ми и мышевидными грызунами в природном комплексе Сибири, лейшманиозе —
в пустынных районах Туркестана, где возбудитель инвазии циркулирует между
песчанками и москитами и т. д. Таким образом, различные возбудители инвазион-
41
ных болезней существуют в природе без вмешательства человека. Если же в при-
родную цепь циркуляции возбудителя включается человек или сельскохозяй-
ственные животные, то возникает заболевание.
Природная очаговость характерна и для многих инфекционных болезней
(бруцеллез, бешенство, туляремия и др.).
Е. Н. Павловский разработал теорию о трансмиссивных заболеваниях (от
лат. trans — сквозь, через). Это такие инфекционные и инвазионные болезни, воз-
будители которых передаются от больных животных (доноров) к здоровым (реци-
пиентам) через укусы кровососущих насекомых и паукообразных. Примерами
служат возбудители трипаносомоза верблюдов, пироплазмидозов крупного и мел-
кого рогатого скота. В природе имеются трансмиссивные природно-очаговые бо-
лезни. Например, возбудитель таежного энцефаломиелита (вирус) встречается во
многих районах страны и в природе циркулирует между некоторыми дикими мле-
копитающими и иксодовым клещом (Ixodes persulcatus). Вторжение человека на
территорию природного очага болезни, безусловно, приводит к нападению на
него клещей — переносчиков возбудителя, в результате чего возникает тяжелое
заболевание — энцефаломиелит.
Контрольные вопросы. 1. Чем отличается инвазия от инфекции? 2. Каковы
принципы классификации гельминтов и образования названия болезней? 3. Что
включает в себя понятие «эпизоотология инвазионных болезней»? 4. Чем отлича-
ется источник заражения от источника распространения? 5. Каковы пути переда-
чи инвазии? 6. Как может протекать инвазия? 7. Каковы критерии экстенсивности
и интенсивности инвазии? 8. Какова суть природной очаговости болезней? 9. По-
чему некоторые заболевания называются трансмиссивными?
2.6. ПРОТИВОПАРАЗИТАРНЫЕ МЕРОПРИЯТИЯ
Экономический ущерб от паразитарных болезней. Возбудители
инвазионных болезней, обитая в различных органах и тканях хо-
зяев, оказывают на них вредное воздействие. В зависимости от
степени инвазии оно может быть выражено как в виде еле замет-
ных, так и более глубоких морфофункциональных изменений ор-
ганов и тканей.
Под экономическим ущербом, причиняемым животноводству,
понимают потери от болезней животных, выраженные в денежной
форме. Они складываются из падежа животных, в том числе птиц,
рыб и пчел, выбраковки органов, туш или тушек, пораженных ин-
вазией, и потери других видов продуктивности. Установлено, что
потери от хронически и субклинически протекающих гельминто-
зов в 10—20 раз больше, чем при остром течении некоторых бо-
лезней (Р. С. Шульц, 1964).
Значительные изменения в организме, а также потерю продук-
тивности регистрируют уже в начале болезни. При многих гельмин-
тозах переболевший молодняк отстает в росте и развитии и его
выбраковывают как некондиционный. Наиболее заметные убытки
скотоводству наносят фасциолезы, диктиокаулез, телязиозы, па-
рамфистоматозы; овцеводству — эхинококкоз, фасциолезы, дикро-
целиоз, мониезиозы, диктиокаулез и кишечные нематодозы; сви-
новодству — аскариоз, эзофагостомоз, ларвальные цестодозы, три-
хинеллез; птицеводству — аскаридиоз, гименолепидозы и др.
Паразитарные болезни снижают репродуктивные качества жи-
42
вотных — возрастают случаи абортов и яловости. Приплод рожда-
ется с низкой массой и пониженной резистентностью. Нарушает-
ся функция иммунокомпетентных органов и клеток, в результате у
вакцинированных против инфекционных болезней животных со-
здается неполноценный и менее напряженный иммунитет.
Слабо изучено качество продукции больных животных при ин-
вазионных болезнях. Тем не менее доказано, что при некоторых
инвазиях, в том числе гельминтозах, резко нарушаются количе-
ственные показатели и соотношение заменимых и незаменимых
аминокислот, содержание витаминов, микро- и макроэлементов и
т. д. У овец резко уменьшается количество волосяных луковиц,
увеличиваются тонина и извитость шерсти при уменьшении элас-
тичности волос.
Планирование противопаразитарных мероприятий. Планирова-
ние мероприятий — одно из важнейших условий успешной рабо-
ты ветеринарной службы. Оно способствует правильной организа-
ции всей деятельности специалистов, своевременному и успешно-
му выполнению мероприятий, рациональному использованию ма-
териальных и финансовых средств, рабочей силы и обеспечению
высокого экономического эффекта при меньших затратах труда и
средств. Планирование мероприятий обязательно для всех звеньев
государственной и ведомственной ветеринарной службы.
Для всей ветеринарной службы выработаны следующие прин-
ципы планирования: единство, комплексность, демократичность
и ведущее звено.
Единство планов предусматривает обязательность
планов противопаразитарных мероприятий на определенной тер-
ритории независимо от ведомственной принадлежности хозяйств.
Комплексность предполагает сочетание в плане орга-
низационно-хозяйственных мероприятий и специальных мер
профилактики и ликвидации инвазии.
Демократичность предусматривает планирование ме-
роприятий снизу вверх — от колхозов, совхозов и других предпри-
ятий до высших ветеринарных органов. План, составленный вете-
ринарными специалистами первичной организации, утверждается
администрацией хозяйства, после чего представляется главному
ветеринарному врачу района. Утвержденный план приобретает
силу закона и обязателен для выполнения.
Ведущее звено — это первоочередное мероприятие, без
проведения которого нельзя выполнить другие пункты плана. На-
пример, при ликвидации диктиокаулеза крупного рогатого скота
необходимо ежемесячно проводить гельминтокопрологические
исследования, предопределяющие текущую дегельминтизацию,
профилактирующую дальнейшее распространение инвазии.
Требования, предъявляемые к планам профилактических и лечеб-
ных мероприятий. В зависимости от цели и задач планы должны
составляться на перспективу (5—10 лет) и на текущий срок (1 год).
43
При составлении перспективного плана необходи-
мо учитывать развитие и достижения ветеринарной науки, вне-
дрение новых эффективных препаратов, методов и передового
опыта. В них необходимо предусматривать строительство ветуч-
реждений на соответствующей территории, переподготовку вете-
ринарных кадров и материально-техническое оснащение ветуч-
реждений. Такие заболевания, как описторхоз, эхинококкоз, цис-
тицеркозы крупного рогатого скота и свиней, трихинеллез, ток-
соплазмоз, — общие для человека и животных (антропозоонозы).
Мероприятия по борьбе с ними в перспективный план следует
включать в первую очередь.
Текущие планы на год разрабатывают с учетом выпол-
нения перспективного плана. В плане предусматривают профилак-
тику и лечение животных при распространенных инвазионных бо-
лезнях, встречающихся в хозяйствах района, таких, как фасциолез,
диктиокаулез, гиподерматоз, кровепаразитарные болезни и др. От-
ражают организационные, общие и специальные мероприятия, на-
правленные на резкое снижение возможности возникновения ин-
вазионных болезней в хозяйствах. Предусматривают проведение ве-
теринарно-санитарных мероприятий и их финансирование.
Приступая к составлению плана, нужно учесть статистические
показатели по той или иной инвазии за ряд лет, изучить паразито-
логическую ситуацию на фермах, пастбищах, в хозяйствах. Виды
работ должны быть конкретными, иметь количественное выраже-
ние и календарные сроки выполнения, все мероприятия — эконо-
мически целесообразными.
При борьбе с фасциолезами, диктиокаулезами, мониезиозами
и др. большое значение имеет прогнозирование. Оно дает возмож-
ность ветеринарному персоналу хозяйств строго следить за тече-
нием и распространением инвазионных болезней в конкретных
условиях, учитывать экономический ущерб, заблаговременно за-
купать эффективные химиопрепараты и своевременно проводить
лечебно-профилактические мероприятия.
Организационные мероприятия включают обязатель-
ное проведение среди животноводов разъяснительной работы.
Особое внимание следует обратить на профилактические и
специальные мероприятия. К профилактическим отно-
сятся мероприятия, способствующие улучшению ветеринарно-са-
нитарных условий хозяйств, повышению естественной резистент-
ности животных: полноценное кормление и хорошее содержание
животных, окультуривание сенокосов и пастбищ, соблюдение ги-
гиены поения животных, биотермическое обеззараживание навоза
и помета, постройка скотомогильников, смена пастбищ, стойло-
во-выгульное содержание телят, клеточное содержание кур и кро-
ликов, выращивание утят и гусят без водоемов ит. д. К специ-
альным мероприятиям относятся: уточнение паразитологичес-
кой ситуации на фермах, пастбищах и водоемах, проведение тера-
44
певтических мероприятий, организация профилактических обра-
боток объектов внешней среды (химиопрофилактика, дезинвазия,
дезинсекция, дератизация). Профилактические обработки живот-
ных проводят только при слабой зараженности.
Широко применяется химиопрофилактика: купка
или опрыскивание животных против иксодовых клещей, двукры-
лых насекомых, чесоточных заболеваний; длительное скармлива-
ние солефенотиазиновой и солефенотиазиномедно-купоросовой
смесей и т. д. Необходимый эффект достигается только в том слу-
чае, если строго выдерживать научно обоснованные сроки, крат-
ность и продолжительность применения препаратов с учетом осо-
бенностей развития инвазионных болезней.
Лечебно-профилактические мероприятия проводят при клини-
чески выраженных заболеваниях.
Различают текущую дезинвазию (после отправки очеред-
ной партии скота и птицы на убой и после противопаразитарной
обработки поголовья), профилактическую (после пере-
вода животных в лагеря и выгона на пастбища) и заключи-
тельную (после оздоровления животных от конкретного забо-
левания — балантидиоза, псороптоза, стронгилоидоза и др.).
Проводя дезинсекцию, дератизацию и дезинвазию, следует по-
мнить об охране окружающей среды. Необходимо подобрать эф-
фективные, но малостабильные во внешней среде соединения.
Так, наиболее долго сохраняются в почве хлорорганические со-
единения (линдан — до 6 лет, хлордан — 5 лет, ГХЦГ — 3 года,
гептахлор — 2 года). Малостабильны пиретроиды (перметрин, ци-
перметрин, дельтаметрин и др.). Полностью они разрушаются за
5—15 сут.
Учение академика К. И. Скрябина о девастации. К. И. Скрябин в 1945 г. ввел в
гельминтологию термин «девастация» (от лат. devastatio — истребление), означаю-
щий комплекс активных лечебно-профилактических мероприятий, направленных
на тотальную (полную) или парциальную (значительную, но неполную) ликвида-
цию гельминтозов в определенных зонах, районах и т. д. Пути и способы деваста-
ции гельминтов и других возбудителей паразитарных болезней различны: механи-
ческие, химические, физические и биологические.
Мировая практика показывает, что достоверное снижение (не говоря уже о
полной ликвидации) паразитарных болезней возможно при тщательно планируе-
мом и комплексном применении средств дегельминтизации, а также терапии и
профилактики.
В б. СССР пример тотальной девастации — ликвидация дракункулеза в Сред-
ней Азии, парциальной девастации — снижение в отдельных районах диктиокау-
лезов крупного и мелкого рогатого скота, гемонхоза, цистицеркозов (финнозов),
ценуроза и других заболеваний.
Контрольные вопросы. 1. Из чего складывается экономический ущерб при раз-
личных гельминтозах животных? 2. Что дает планирование противогельминтоз-
ных мероприятий? 3. В чем заключаются принципы планирования лечебно-про-
филактических мероприятий? 4. Что относится к организационным и специаль-
ным мероприятиям при гельминтозах?
/
2
РАЗДЕЛ
ВЕТЕРИНАРНАЯ ГЕЛЬМИНТОЛОГИЯ
3. ОБЩИЕ СВЕДЕНИЯ О ГЕЛЬМИНТАХ
И ВЫЗЫВАЕМЫХ ИМИ БОЛЕЗНЯХ
Гельминт (от гр. helmins — червь) — экологическое понятие,
указывающее на образ жизни и вред, который паразит наносит
различным живым организмам. Гельминтология — комплексная
наука, изучающая морфологию различных гельминтов с целью их
дифференциации и вызываемые ими болезни для организации
мер борьбы с ними. Гельминтология как прикладная наука имеет
три самостоятельных направления — медицинское, ветеринарное
и агрономическое. Эти направления тесно связаны друг с другом.
Так, ветеринарная гельминтология изучает гельминтозы живот-
ных, медицинская — гельминтозы человека. Однако многие за-
болевания, вызываемые гельминтами, — гельминтозоонозы, т. е.
они общие для человека и животных, например описторхоз, фас-
циолез, дипилидиоз, эхинококкоз, трихинеллез и др. В случае,
когда гельминтозы развиваются с обязательным участием челове-
ка, они могут быть названы облигатными атропогельминтозоо-
нозами. Сюда относятся цистицеркозы крупного рогатого скота
и свиней.
У животных, в том числе птиц и рыб, в органах и тканях пара-
зитирует огромное количество гельминтов различных видов. У де-
финитивных хозяев они растут и развиваются до половой зрелос-
ти, у промежуточных — до инвазионной стадии. Отмечают случаи,
когда гельминты в организме попадают в несвойственные им мес-
та локализации (извращенная локализация), не находят там нор-
мальных условий для развития и, следовательно, не имеют эпизо-
отического значения. Известны примеры, когда у крупного рога-
того скота в мышцах были обнаружены фасциолы, в желчных хо-
дах печени человека и свиней — аскарисы, в яйцеводах и даже в
курином яйце — аскаридии. Однако независимо от места локали-
зации гельминты оказывают на ткани и органы хозяина болезне-
творное влияние, обусловливая различного рода патологии как
местного характера, так и всего организма.
Систематика, краткая характеристика морфологии и биологии
гельминтов. Все паразитические гельминты относятся к надтипу
Scolecida, который объединяет ряд самостоятельных типов. Из
них наибольшее эпидемиологическое и эпизоотологическое зна-
46
чение имеют представители типа Plathelminthes (плоские черви) с
двумя классами: Trematoda (сосальщики) и Cestoda (ленточные);
типа Nemathelminthes (нематоды, или круглые черви) с классом
Nematoda; типа Acanthocephales (скребни, или колючеголовые) с
классом Acanthocephala; типа Nemertini (немертины) с классом
Nemertina.
Изучение морфологических признаков гельминтов дает воз-
можность выявлять еще более низкие таксоны — подотряд, надсе-
мейство, подсемейство, подрод и подвид. Только тип нематод на-
считывает девять подотрядов, объединяющих огромное количе-
ство субъединиц и видов круглых гельминтов.
Гельминты — многоклеточные организмы, достигающие в дли-
ну от нескольких миллиметров (например, самцы трихинелл —
1,4—1,5 мм) до 30 м (Polygonoporus giganticus в кишечнике ка-
шалота). Трематоды и цестоды
снаружи покрыты тегументом
(см. рис. 9). Некоторые исследо-
ватели рассматривают его как
самостоятельную неклеточную
ткань. Тегумент плоских червей,
особенно цестод, играет исклю-
чительную роль в физиологии
питания и имеет большое значе-
ние для изучения биофизичес-
ких и биохимических взаимоот-
ношений паразит — хозяин. С
точки зрения практики знание
морфофункциональных призна-
ков внешних покровов гельмин-
тов необходимо для рациональ-
ного подбора новых противопа-
разитарных химиопрепаратов. У
нематод наружный покров со-
стоит из плотной кутикулы с
прилегающими к ней слоями
(рис. 12).
Рис. 12. Схема строения нематод
(по Th. Hiepe, 1985):
/—поперечный разрез: 1 — кутикула; 2—
подкутикулярный слой; 3 — экскреторный
канал; 4, 5—мышечные клетки; 6, 11 —
вентральный и дорсальный нервные ство-
лы; 7—яйцевод; 8— матка; 9— кишечник;
10— яичник; //—самка: 7 —ротовая капсу-
ла; 2— кутикула; 3 — экскреционная железа;
4— яичник; 5—матка; 6— вагина; 7—
анальное отверстие; ///—самец: / — пище-
вод; 2— нервный узел; 3 — экскреторный ка-
нал; 4— семенники; 5—кишечник; 6— спи-
кула; 7—клоака
47
У гельминтов хорошо развиты половые органы и выдели-
тельная система. Нервная и пищеварительная системы развиты
меньше. У цестод и акантоцефал пищеварительная система от-
сутствует.
Эпизоотологическая классификация гельминтозов. По эпизоото-
логии и эпидемиологии, а также биологии развития гельминтов
подразделяют на геогельминтов, развивающихся без участия про-
межуточных хозяев, и биогельминтов, развитие которых происхо-
дит с участием промежуточных хозяев. Такая классификация важ-
на для дифференцированного подхода к проблемам организации
лечебно-профилактических мероприятий при гельминтозах.
При геогельминтозах источником заражения яйцами и
личинками служат факторы внешней среды. Следовательно, жи-
вотные заражаются при приеме корма, воды или же личинки сами
проникают через кожу (буностомумы, стронгилоидесы). Поэтому
против геогельминтозов необходимо проводить общие ветеринар-
но-санитарные мероприятия, дезинвазию внешней среды, дегель-
минтизацию зараженных животных. Благоприятными факторами
сохранения яиц и личинок во внешней среде являются оптималь-
ные температура и влажность, наличие развитой растительности и
захламленность территории, помещений для скота и пастбищ.
Огромную роль в развитии и распространении инвазионного
начала играют зональные особенности местности. Так, за 6—
7 мес холодной зимы в Нечерноземье РФ яйца и личинки многих
гельминтов не доживают до весны, как это наблюдают в Закавка-
зье или Средней Азии. Что же касается субтропических и тропи-
ческих стран, то в различные сезоны года элементы инвазии со-
храняются во внешней среде в значительном количестве и долгое
время.
При биогельминтозах кроме компонентов внешней
среды и больных животных в общем процессе участвуют и проме-
жуточные хозяева. Противогельминтозные мероприятия усложня-
ются, так как нужно проводить мероприятия по охране промежу-
точных хозяев от заражения и по обезвреживанию личинок в про-
межуточном хозяине (например, цистицеркусов в мясе свиней и
крупного рогатого скота), а иногда и локально уничтожать после-
дних (моллюсков при фасциолезе). Важно учитывать и то, что су-
ществуют еще дополнительные, а также резервуарные хозяева, в
теле которых инвазионные элементы могут накапливаться и со-
хранять жизнеспособность продолжительное время (яйца аскари-
сов свиней в теле дождевых червей).
В зависимости от вида паразита, биологии его развития, усло-
вий внешней среды и других факторов гельминты имеют локаль-
ное (фасциола гигантская, авителлина) или широкое распростра-
нение (кишечные стронгилятозы лошадей, мониезиозы жвачных).
Поэтому для установления особенностей распространения тех или
иных гельминтозов и организации конкретных мер борьбы с ними
48
целесообразно изучать краевую эпизоотологию. Гельминтозы мо-
гут также проявляться энзоотически, когда гельминты, ограни-
ченные определенными условиями, вызывают заболевания живот-
ных лишь в отдельных районах. Например, в Казахстане хасстиле-
зиоз овец встречается лишь в горных районах юго-востока, там,
где есть условия для развития моллюсков — промежуточных хозя-
ев трематод. В то же время в условиях Нечерноземья РФ в отдель-
ные дождливые годы фасциолез проявляется эпизоотически, охва-
тывая одновременно многие районы. Такая же картина отмечается
при диктиокаулезе овец и крупного рогатого скота.
3.1. ВИДЫ И НАПРАВЛЕННОСТЬ ДЕГЕЛЬМИНТИЗАЦИИ,
ДЕЗИНВАЗИЯ
Впервые термин «дегельминтизация» был применен К. И. Скря-
биным в 1925 г. Под этим термином он понимал разнообразные
методы умерщвления паразитических червей на всех стадиях раз-
вития, локализующихся не только в организме хозяина (дефини-
тивного, промежуточного и дополнительного), но и загрязняю-
щих внешнюю среду.
Дегельминтизация должна быть эффективной и безопасной
для пациента, а также полностью предохранять внешнюю среду
от загрязнения яйцами и личинками гельминтов. Чтобы дегель-
минтизация достигла цели, она должна быть специфической, пе-
риодической, массовой, планомерной, рациональной и обяза-
тельной.
Различают несколько видов дегельминтизации. Например, в
зависимости от среды, в которой пребывают гельминты, назнача-
ют дегельминтизацию хозяина, дезинвазию
внешней среды. С учетом основной цели проводят вы-
нужденную, лечебную, профилактическую или
диагностическую дегельминтизацию. И наконец, в зави-
симости от стадии развития гельминтов выполняют и м а г и -
нальную, преимагинальную и постимаги-
н а л ь н у ю дегельминтизацию. Вынужденную дегельминтиза-
цию осуществляют при клинических проявлениях гельминтозов в
любое время года. Диагностическая дегельминтизация проводится
с целью подтверждения предполагаемого диагноза.
В связи с тем что в настоящее время ветеринарная служба дос-
таточно обеспечена антительминтиками, успешно действующими
на фасциол в ранние стадии развития и других гельминтов (аце-
мидофен, фазинекс, рафоксанид и др.) и на монезии (феналидон,
панакур и др.), то более рационально проведение ранней
преимагинальной дегельминтизации. Это дает
возможность предотвратить развитие патологического процесса у
зараженных животных и полностью профилактировать распрост-
ранение инвазии.
49
Терапия (лечение) и дегельминтизация — понятия неравноз-
начные. Терапия гельминтозов — комплекс лечебных вмеша-
тельств, направленных на устранение причины болезни и вызван-
ных ею патологических процессов, иногда вторичных явлений
или осложнений. Так, при гемонхозе кроме дегельминтизации не-
обходимо устранить анемию, вызванную потреблением нематода-
ми большого количества крови, и нарушения пищеварения. По-
этому кроме специфических препаратов назначают еще и железо-
содержащие, а также общетонизирующие препараты.
На наш взгляд, термин «дегельминтизация» приемлем только
по отношению к организму больного животного. По отношению к
внешней среде целесообразно употреблять другие термины: на-
пример, «дезинвазия», или «обезвреживание». Отсюда следует
признать неприемлемость и понятия «заражение внешней среды
яйцами и личинками гельминтов». Так как заражение включает в
себя специфичность отношений паразит — хозяин, то целесооб-
разно говорить о загрязнении или обсеменении почвы яйцами и
личинками гельминтов, а не о заражении.
3.2. ПАТОГЕНЕЗ И ИММУНИТЕТ
Патогенез при гельминтозах следует рассматривать как сложный
комплекс взаимосвязанных и взаимообусловленных процессов,
возникающих при патогенном действии гельминтов, как ответную
реакцию организма на их внедрение. Возникновение патологичес-
ких процессов зависит не только от возбудителя, но и от реакции
организма животного.
При гельминтозах различают первичное (специфическое) и
вторичное (неспецифическое) воздействия возбудителей на орга-
низм хозяина.
Если явления первичного характера (травмы, атрофия) возни-
кают при непосредственном воздействии гельминтов, то вторич-
ные — результат реагирования центральной нервной системы с
последующими нервно-рефлекторными, нервно-гуморальными и
иммунологическими реакциями.
Патогенное влияние гельминтов на организм животных много-
образно. Это механические, аллергические, токсические и трофи-
ческие воздействия. Кроме того, гельминты, мигрируя в личиноч-
ной стадии в теле хозяина и травмируя слизистую оболочку ки-
шечника, бронхов, открывают доступ в различные органы и ткани
животного микроорганизмам.
Механическое воздействие гельминтов заключа-
ется в том, что в местах локализации крючьями, присосками, бот-
риями, ротовой капсулой, шипами они повреждают ткани и вызы-
вают воспаление. Скопление крупных гельминтов в кишечнике
(мониезии, аскарисы) вызывает атрофию слизистой оболочки и
50
нередко приводит к разрыву стенки; в кровеносных сосудах обра-
зуются тромбы и аневризмы (личинки диктиокаулюсов, деляфон-
дий). В головном мозге у овец ценурусы вызывают атрофию мозга,
черепа, а эхинококкусы, достигая в печени и легких больших раз-
меров, нередко занимают всю ткань органа. Личинки лигулы, дос-
тигающие в длину 35 см, часто разрывают брюшную стенку у рыб.
Миграция личинок фасциол, тениат, аскарисов, диктиокаулюсов
и многих кишечных нематод приводит к травмам слизистой обо-
лочки кишечника, мелких и крупных кровеносных сосудов, ткани
лимфоузлов, печени и легких, что сопровождается функциональ-
ными расстройствами.
Аллергическое воздействие гельминтов на орга-
низм рассматривается как основной процесс в патогенезе. В теле
гельминтов и их метаболитах содержатся полипептиды, аллерго-
генные или анафилактогенные протеины, а также гликолипиды и
полисахариды. Эти вещества, первично попав в организм, вызы-
вают сенсибилизацию, которая может быть выявлена внутрикож-
ной аллергической пробой. Период сенсибилизации зависит от
дозы аллергена, его биологической активности, вида и возраста
животного. Так, при аскариозе, трихинеллезе, метастронгилезе
свиней, диктиокаулезе жвачных он равен 7—18 сут, при мониези-
озах — 12—14 сут. При повторном введении разрешающих доз ал-
лергена у животных возникают аллергические реакции немедлен-
ного или замедленного типа.
Аллергическая реакция усиливается при супер- и реинвазиях.
Особенно повышенная реакция проявляется при гельминтозах,
возбудители которых в личиночной стадии совершают тканевую
миграцию в организме хозяина (аскарисы, диктиокаулюсы, цис-
тицеркусы и т. д.). К показателю аллергического состояния орга-
низма следует отнести дегрануляцию тучных клеток. При этом ос-
вобождаются биологически активные вещества — гистамин, серо-
тонин, брадикинин, играющие большую роль в поражении сосу-
дистой системы и возникновении аллергического воспаления
местного характера.
Аллергическое состояние, сопровождающее гельминтозы, не-
благоприятно сказывается на формировании иммунитета против
инфекционных болезней.
Патологические процессы при гельминтозах до недавнего вре-
мени рассматривали как следствие токсического влияния гель-
минтов. Тем не менее до сих пор не удалось выделить у них токси-
ны, подобные тем, что встречаются у микробов (гемолизин, лей-
коцидин, нейротоксины, энтеротоксины и др.). Однако полнос-
тью отрицать токсическое влияние гельминтов на организм
нельзя. Установлено, что после первичного парентерального вве-
дения полостной жидкости аскарисов, а также экстрактов и сус-
пензии из гельминтов у несенсибилизированных животных на-
блюдаются признаки интоксикации (снижение аппетита, вялость,
51
слюнотечение, нервные явления и др.). К числу признаков токси-
коза относят и ингибирование активности сывороточной холинэс-
теразы, а также увеличение в периферической крови количества
лейкоцитов с патологическим свечением ядер (желтое, оранжевое,
красное вместо зеленого в норме). При токсикозах через 12 ч от-
мечается максимальное снижение активности холинэстеразы (при
аллергии — лишь незначительное снижение), количество лейко-
цитов с патологическим свечением ядра достигает максимума —
69—89 % (при аллергии 19—23 %), что наблюдается в период с 12 ч
до 3 сут.
Известно, что экстракты и продукты жизнедеятельности гель-
минтов оказывают цитопатическое действие на клеточные культу-
ры, что также указывает на наличие у них токсинов. При имаги-
нальных цестодозах, в частности при мониезиозах, установлено,
что токсикоз клинически проявляется в поздние сроки инвазии и
возникает в результате нарушения структуры слизистой оболочки
кишечника и его секреторно-моторной функции. В связи с этим
изменяется pH содержимого, появляется дисбактериоз — резко
увеличивается количество гнилостных спорообразующих аэробов,
клостридий и токсинобразующих патогенных вариантов эшери-
хий при сокращении содержания банальных форм, числа молоч-
нокислых бактерий и актиномицетов (поставщиков витаминов
группы В). Все это сопровождается нарушением обмена веществ,
дефицитом витаминов, микро- и макроэлементов в организме.
Нарушается полостное и пристеночное пищеварение, образуются
продукты неполного и гнилостного расщепления белков и других
веществ (фенола, крезола, скатола, индола, меркаптена и т. д.),
которые, всасываясь в кишечнике, токсически действуют на орга-
низм, вызывая вторичный токсикоз.
Гельминты, усиленно развиваясь в органах и тканях хозяина,
поглощают значительное количество белков, углеводов, липидов,
витаминов и других веществ, что усугубляет течение и развитие
патологического процесса.
Иммунитет при гельминтозах незначительно отличается от им-
мунитета при бактериальных и вирусных болезнях. Иммунитет
при гельминтозах бывает приобретенным (после переболевания
или иммунизации), возрастным и естественным (абсолютным или
относительным). Относительный иммунитет характеризуется до-
вольно коротким сроком, более напряженный отмечен в период
пребывания в организме хозяина личинок гельминтов (во время
их линьки) — активных продуцентов антигенов. Взрослые гель-
минты, паразитирующие в полостях, не играют значительной
роли в иммунизации животных. По мере поступления экскретор-
но-секреторных и соматических антигенов гельминтов в организм
хозяина в последнем вырабатываются как циркулирующие (гумо-
ральные) антитела — иммуноглобулины (IgM, IgG и IgA, IgD), так
и реагины и реагиноподобные антитела (IgE).
52
При различных гельминтозах и на разных стадиях развития бо-
лезней соотношение IgM, IgG и IgA может меняться. В начале ин-
вазии регистрируют макроглобулин IgM, в хронических случаях
течения — IgG. Эти антитела могут непосредственно влиять на
возбудителя, усиливать фагоцитоз, адсорбируясь на поверхности
макрофагов и повышая их сродство с антигеном. Кроме того, они
связывают и нейтрализуют ферменты и другие вещества, обладаю-
щие антигенным свойством. Антитела, относящиеся к классу IgE,
секретируют местный лимфоидный аппарат слизистой оболочки
кишечника и кожи. Их в значительном количестве обнаруживают
в слизистой оболочке кишечника и содержимом последнего. Они
усиливают кожно-слизистые барьеры организма и препятствуют
внедрению личинок гельминтов. Антитела, связанные с тучными
клетками и базофилами, в присутствии антигена могут вызывать
их деструкцию с выделением гистамина, серотонина, брадикини-
на и других биологически активных соединений, что ведет к раз-
витию гиперчувствительности немедленного типа, формирующей
острую фазу того или иного гельминтоза.
Большую роль в формировании иммунитета при гельминтозах
отводят и реакциям замедленного типа. В их основе лежат проли-
феративные процессы в ретикулоэндотелиальной ткани. В резуль-
тате резко повышается выработка лимфоцитов, эозинофилов,
плазматических клеток. Образуются паразитарные гранулемы,
представляющие собой скопление клеточных элементов (гигантс-
кие, эпителиоидные, эозинофильные и лимфоидные клетки) вок-
руг живых и погибших личинок гельминтов. Отмечают аллерги-
ческое воспаление слизистой оболочки кишечника, бронхов, жел-
чных протоков. Все это препятствует развитию и миграции личи-
нок, способствует удалению их из организма хозяина.
При гельминтозах отмечают повышенную реакцию эозинофи-
лов, но для всех случаев проявления инвазии она непостоянна.
Так, высокое число эозинофилов может смениться резким умень-
шением их количества по мере ухудшения состояния больного
животного. В целом роль этих клеток в аллергическом состоянии
животных велика. Они участвуют в ограничении местных воспа-
лительных реакций, выделяя ферменты, разрушающие медиато-
ры, которые высвобождаются тучными клетками.
С развитием клеточной реакции связывают процесс самоочи-
щения при гельминтозах. Дело в том, что при заражении живот-
ных большим числом нематод происходит самоудаление гельмин-
тов, что регулируется иммунными малыми лимфоцитами.
Хорошие условия содержания и полноценное кормление жи-
вотных при сбалансированности количества витаминов, микро- и
макроэлементов усиливают защитные реакции организма.
53
4. ДИАГНОСТИКА ГЕЛЬМИНТОЗОВ
Диагностика гельминтозов может проводиться с исследова-
тельской и профилактической целями, для установления экстен-
сивности и интенсивности инвазии, а также дифференциации
гельминтов. Различают прижизненные и посмертные методы ди-
агностики.
4.1. ПРИЖИЗНЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ
Диагноз на гельминтозы следует ставить с учетом эпизоотоло-
гических данных (зональности, сезонности, видовых, породных и
возрастных особенностей животных и т. д.); симптомов болезни
(например, при телязиозах отмечают кератоконъюнктивиты, при
оксиурозе лошадей — зачесы на корне хвоста, при дрепанидотени-
озе гусят -г нервные явления, при цростогонимозе кур — «литье»
яиц и т. Д.),атакже результатов лабораторных исследований.
Определяющим моментом в планировании и проведении ле-
чебно-профилактических мероприятий при гельминтозах служат
лабораторные методы диагностики, так как их достоверность бес-
спорна по сравнению со многими другими методами.
Основное значение придают гельминтокопроскопическим и
специальным исследованиям крови, мочи, кожи, мышц, сухожи-
лий, истечений из глаз, содержимого желудка и пр. Ставится
цель — исследовать различные субстраты на наличие яиц, личи-
нок, гельминтов или их фрагментов, определить в крови эозино-
филию и т. д. Следует всегда помнить, что яйца, личинки и члени-
ки обнаруживают в пробах фекалий только в том случае, если
гельминты в организме хозяина достигли половозрелой стадии.
Гельминтокопроскопические исследования подразделяют на
гельминтоовоскопические (лат. ovum — яйцо), гельминтоларво-
скопические (лат. larva — личинка) и гельминтоскопические.
Гельминтокопроскопические исследования проводят планово или
по мере необходимости.
Гельминтоовоскопические методы. Для исследования использу-
ют биологические микроскопы Биолам Р-2 У42, МБИ; биноку-
лярные лупы (БМ-51-2, МБС-1); центрифуги (ЦУМ-1 и др.); мо-
дифицированный аппарат Бермана (рис. 13 и 14); кюветы; ступки
фарфоровые; чашки Петри; баночки на 200 мл; стеклянные или
синтетические мензурки на 50 мл; ситечки; воронки; стеклянные
палочки; резиновые груши; предметные и покровные стекла; пи-
петки; металлические петли; резиновые трубки; марлю; вату; гли-
церин; метиленовый синий; натрия хлорид; аммония нитрат плот-
ностью 1,3; цинка хлорид плотностью 1,82 и др.
Фекалии животных в количестве 4—10 г берут пальцами, надев
тонкие резиновые перчатки или напальчники. В зависимости от
вида гельминта и цели исследования пробы следует брать из пря-
мой кишки (на легочные и кишечные стронгилятозы). При иссле-
54
2
1
Рис. 13. Предметы для гельминтокопрологических исследо-
ваний:
1 — воронки с пробирками для метода Бермана — Орлова; 2 — спринцовки для отсасывания
жидкости из стаканчика; 3 — ситечки в стаканы и воронки; 4 — стаканы для метода последова-
тельного промывания (175 мл); 5 — полуконические стаканчики для упрощенного метода гель-
минтоларвоскопических исследований (50 мл); 6— цилиндр для промывания стеклянных па-
лочек и спринцовок; 7— стаканчики для метода Фюллеборна (75 мл); 8 — штатив для проби-
рок и спринцовок
довании на фасциолезы, мониезиозы, аскаридатозы можно допус-
тить отбор проб с пола. Определяя зараженность каждого живот-
ного (в случае вывоза или ввоза в хозяйство, при коммерческих
операциях), указывают инвентарный номер, а устанавливая общее
благополучие отары или стада, вести индивидуальный учет необя-
зательно.
Пробы фекалий берут от 10 % поголовья. Помещают их в куль-
ки из пергаментной бумаги, в целлофановые пакеты, пеницилли-
новые флаконы или небольшие баночки. В сопроводительном до-
кументе указывают хозяйство, фамилию чабана или скотника, вид
животного, его возраст, цель исследований, должна быть подпись
ветеринарного специалиста. На легочные стронгилятозы пробы
нужно исследовать в день их отбора. Если это невозможно, фека-
лии оставляют в холодильной камере при температуре 0—3 °C до
следующего дня.
Гельминтоовоскопические исследования фекалий проводят с
помощью методов последовательных смывов (осаждения) или
флотации (метод Фюллеборна).
Последовательные смывы фекалий с успехом
применяют для исследования трематодозов, реже — нематодозов и
цестодозов. Пробу фекалий (3—Юг) смешивают в фарфоровой
55
Рис. 14. Оборудование для гельминтокопрологических исследований:
а—методом флотации: 7—фарфоровая чашка с пестиком; 2—емкость с насыщенным ра-
створом поваренной соли; 3 — стаканчик для промывания стеклянных палочек; 4 — металли-
ческое ситечко; 5—химические стаканы; 6— проволочные петли; б— методом последователь-
ных смывов: 1 — фарфоровая чашка с пестиком; 2— емкость для промывания стеклянных па-
лочек; 3— пипетка; 4 — металлическое ситечко; 5 —химические стаканы; в —методами гель-
минтоларвоскопии: 1 — модифицированный аппарат Бермана (по Щербовичу); 2, 2'— марля;
3, 3'— марлевый сверток с фекалиями; 4, 4'— марлевый сверток, свободно лежащий в воде (2,
3, 4— по Шильникову); г — сетка для подсчета яиц и личинок гельминтов, ооцист простейших (по
Акбаеву): 1 — предметное стекло; 2— пленка с сеткой
ступке с 10-кратным количеством воды. Смесь фильтруют через
металлическое ситечко (можно через марлю) в баночку и в зависи-
мости от загрязнения и цвета отстаивают 10—15 мин. Верхний
слой содержимого баночки до темной полосы осадка сливают. До-
бавляют к осадку чуть меньшее, чем первый раз, количество воды и
отстаивают 8—10 мин и снова сливают верхний слой. Промывают
до тех пор (2—3 раза), пока верхний слой воды не станет прозрач-
ным, затем осадок исследуют. Для этого со дна стакана, удерживае-
мого в руке под углом 45°, пипеткой берут две-три капли.
56
Разновидность указанного метода — изучение натив-
ного мазка. Для этого берут небольшое количество фекалий
(с горошину), помещают на предметное стекло и добавляют две-
три капли смеси равных частей глицерина и воды. После тщатель-
ного смешивания твердые частицы удаляют, а остаток накрывают
покровным стеклом и исследуют. Недостаток метода — низкая
эффективность, коррелирующая с интенсивностью инвазии.
Метод Фюллеборна — гельминтоовоскопическое ис-
следование с применением метода флотации (всплывания) заклю-
чается в том, что в солевых растворах более высокой плотности
яйца многих видов гельминтов всплывают на поверхность. В ре-
зультате число яиц на небольшой площади и в незначительном
объеме жидкости многократно увеличивается.
Для флотации яиц используют растворы многих солей: насы-
щенный раствор натрия хлорида (поваренной соли) плотностью
1,18—1,2 (380—400 г на 1л кипящей воды), растворы гранулиро-
ванного нитрата аммония (аммиачной селитры) плотностью 1,3
(1500 г на 1 л горячей воды), нитрата свинца (азотнокислого свин-
ца) плотностью 1,5 (650 г на 1 л воды), сульфата цинка (сернокис-
лого цинка) плотностью 1,24 (450 г на 1 л воды) и др. Плотность
раствора контролируют денсиметром.
На практике наиболее часто применяют растворы двух первых
указанных солей. Растворы других солей применяют реже, хотя,
по данным отдельных авторов, в растворе сульфата свинца на по-
верхность жидкости всплывают и яйца фасциол (Вишняускас,
1965), в насыщенном растворе нитрата натрия (1 кг на 1л воды) —
яйца описторхисов (по методу Калантарян) и в растворе нитрата
свинца — яйца фасциолы, парамфистомумов, дикроцелиумов
(Котельников, Хренов, 1984).
Для исследования методом Фюллеборна 3—Юг фекалий поме-
щают в ступку, заливают небольшим количеством насыщенного ра-
створа натрия хлорида или другой соли и тщательно растирают пес-
тиком. Смесь фильтруют через сито и в зависимости от исследуемо-
го материала отстаивают 10—45 мин. Затем металлической петлей
снимают пленку с поверхности и переносят на предметное стекло
для микроскопирования. Этим методом пользуются, как правило,
для диагностики нематодозов и имагинальных цестодозов.
Для обнаружения яиц гельминтов с более высокой плотностью
(метастронгилюсов, трихоцефалюсов и др.) можно пользоваться
методом Щербовича (920 г сернокислой магнезии на 1 л
горячей воды) иДарлинга (глицерин и вода в равных количе-
ствах), которые сочетают осаждение и флотацию.
Исследователи полагают — чем больше гельминтов в организме
животного, тем больше яиц и личинок в их фекалиях. Однако на
практике нет строгой зависимости между этими показателями, так
как яйца и личинки гельминтов в выделениях животных распреде-
ляются неравномерно.
57
Для того чтобы получить приближенные данные об интенсив-
ности инвазии, существует ряд методов учета количества яиц и
личинок паразитов в фекалиях (Столла, Трача, стандартизирован-
ные методы Фюллеборна, Щербовича, Акбаева и т. д.).
Методом Акбаева ведут учет количества яиц и личи-
нок гельминтов на сетке, изготовленной на тонком органическом
стекле, или отмытой рентгеновской пленке. Для изготовления
сетки необходимы офицерская линейка, циркуль или иглы и бе-
зопасная бритва. Четырехугольную линейку размером 40 х 17 мм
размещают на органическом стекле или рентгеновской пленке и
наносят слегка заметные точки на расстоянии 1,6 мм друг от дру-
га. Затем лезвием по линейке проводят 10 горизонтальных и
26 вертикальных линий. Горизонтальные линии пронумеровыва-
ют. Вырезают участок материала по размеру предметного стекла
и приклеивают канадским бальзамом сеткой вверх. Наносят на
него 0,1 мл исследуемого осадка, покрывают предметным стек-
лом толщиной 1 мм, укороченным на 2 см. Под микроскопом
подсчитывают яйца. Число яиц, подсчитанных в 0,1 мл жидко-
сти, умножают на общее количество осадка, полученного из 1—
3 г фекалий.
Гельминтоларвоскопические методы. Применяют для диагности-
ки гельминтозов, при которых в организме животных паразитиру-
ют личинки (аскарисы в легких при остром аскариозе свиней,
микроонхоцерки в коже), выделяющиеся с фекалиями (при дик-
тиокаулезе и мюллериозе), слезой (при телязиозе) и молоком (при
стронгилоидозе, неоаскариозе). Метод заключается в том, что ли-
чинки нематод, обладая свойством термотаксиса, в теплой воде
(37—38 °C) быстрее освобождаются (особенно до и после линьки)
из толщи фекалий или ткани (при кишечных стронгилятозах) и
опускаются на дно посуды. Удалив верхний слой воды с фекалия-
ми и тканью, можно исследовать осадок на наличие личинок.
Метод Бермана и Орлова применяют для диагно-
стики легочных и кишечных (после выхода личинок из яиц) нема-
тодозов. Впервые метод был предложен Берманом для выявления
личинок свободноживущих нематод, позже его использовал
И. В. Орлов (1934) для диагностики диктиокаулезов животных.
Для этого пробы фекалий (10—20 г) помещают на сетку или мар-
лю, натянутую (нетуго) на верхний край воронки, прикрепленной
к штативу. На конец воронки надевают резиновую трубку с про-
биркой. Затем в воронку наливают теплую (37—38 °C) воду так,
чтобы все фекалии находились в воде, и оставляют при комнатной
температуре на 3—6 ч. По истечении этого времени осторожно от-
соединяют от воронки резиновую трубу, сливают воду из пробир-
ки до осадка, а осадок исследуют под микроскопом.
В настоящее время в нашей стране используют упрощенные мо-
дификации метода Бермана, например по Щербовичу или Шиль-
никову. С этой целью 5—10 г фекалий завертывают в марлю и кла-
58
дут или подвешивают в конусовидный стаканчик с 50 мл теплой
(37—38 °C) воды на 6 ч. Затем марлю с содержимым удаляют, воду
сливают, осадок отсасывают и пипеткой наносят по каплям на
предметное стекло для исследования под микроскопом.
Иногда для выявления личинок пользуются методом
В а й д а. С этой целью на часовое или большое предметное стекло
или чашку Петри кладут несколько шариков фекалий овец и коз,
заливают их теплой (38—40 °C) водой. Через 30—40 мин шарики
удаляют, а осадок исследуют под микроскопом. Эффективность
метода повышается при периодическом помешивании фекалий.
Все эти методы используют для выявления личинок кишечных
нематод животных и при их культивировании. Культивиро-
вание личинок применяют для дифференциальной диаг-
ностики нематодозов, так как яйца кишечных нематод подотряда
Strongylata, за исключением отдельных видов (нематодирусов),
идентичны, и, следовательно, овоскопически можно поставить
только диагноз — стронгилятозы.
Существует много способов культивирования личинок, но наи-
более приемлем, достаточно прост и эффективен следующий. Фе-
калии (50—100 г) помещают в баночку или стакан объемом 200 мл,
увлажняют теплой водой, накрывают марлей или стеклом и ставят
в теплое место или термостат при 24—28 °C на 7—8 или 10—12 сут
в зависимости от предполагаемого гельминтоза. При необходимо-
сти фекалии увлажняют и проветривают до достижения личинка-
ми инвазионной стадии. После этого выявляют личинок, опреде-
ляют количество кишечных клеток, изучают отдельные морфоло-
гические признаки, позволяющие установить видовую принад-
лежность гельминтов.
Гельминтоскопические методы. Выявление гельминтов в фека-
лиях животных необходимо для постановки диагноза, уточнения
вида, определения эффективности применяемых химиопрепара-
тов. С этой целью 50—60 г фекалий (желательно их брать в разное
время суток) последовательно промывают в кюветах. Осадок ис-
следуют макроскопически и под микроскопом.
Макроскопическое исследование. Для более
эффективного выявления гельминтов можно проводить диагнос-
тическую дегельминтизацию обследуемых животных. С целью об-
наружения кишечных нематод промытый осадок фекалий слегка
разбавляют водой и рассматривают в кюветах с белым и черным
дном. Обнаруженных гельминтов выбирают иглой или кисточкой.
Членики цестод и многие нематоды хорошо видны в кюветах с
черным дном; половозрелые фасциолы, дикроцелии из печени —
в кюветах с белым дном. Мелкие нематоды и молодые парафисто-
мумы можно рассмотреть, используя лупу МБС-1 или микроскоп.
Для обнаружения члеников тениид фекалии плотоядных живот-
ных необходимо исследовать вскоре после акта дефекации.
59
4.2. СПЕЦИАЛЬНЫЕ МЕТОДЫ ДИАГНОСТИЧЕСКИХ
ИССЛЕДОВАНИЙ
К таким исследованиям относятся методы, которые в условиях
хозяйств широко не используются. Однако при освоении некото-
рых навыков многие из них могут быть выполнены не только в
районных и областных лабораториях, но и в хозяйствах.
Исследование мочи. Заболеваний, при которых яйца гельминтов
выделяются через мочеполовые пути животных, немного: диокто-
фимы, например, паразитируют в почках собаки, свиньи, норки,
куницы, гепардов, пумы; капиллярии — в мочевом пузыре собаки,
енотовидной собаки, песца, соболя, норки, лисицы, куницы; яйца
ориентобильхарций выделяются с мочой при поражении крове-
носных сосудов мочевого пузыря жвачных.
Мочу для исследования берут катетером или общепринятыми
способами. Ее вначале осматривают макроскопически И под лу-
пой, так как в ней могут быть гельминты. Для обнаружения яиц
мочу разводят водой в соотношении 1:1 и центрифугируют 2—
3 мин при 1000—1500 мин-1. Затем верхний слой сливают, а оса-
док исследуют под микроскопом.
Исследование крови. Гельминты Setaria equina (у непарноко-
пытных), S. labiatopapillosa (у крупного рогатого скота) обитают в
брюшной полости; Parafilaria multipapillosa (у непарнокопытных),
Р. bovicola (у крупного рогатого скота) — в подкожной клетчатке;
Dipetalonema evansi (у верблюдов) — в кровеносных сосудах;
Dirofilaria immitis (у собак и других плотоядных) — в желудочках
сердца; D. repens (у них же) — в подкожной клетчатке. Яйца или
личинки эти гельминты выделяют в кровь, при этом развиваются
разные патологические процессы. Поэтому исследование крови
целесообразно не только для обнаружения яиц, личинок, а иногда
и самих гельминтов, но и для изучения морфологических или био-
химических показателей (в зависимости от влияния гельминтов) с
целью выявления патологии.
При исследовании на сетариоз кровь желательно брать рано ут-
ром или ночью, так как в это время суток в крови больше микро-
сетариев (личинок). Для диагностики сетариоза и дирофиляриоза
используют венозную и периферическую кровь с кончика уха, ди-
петалонемоза и парафиляриоза — периферическую кровь.
Существует много методов исследования крови, но наиболее
просты и достаточно эффективны следующие:
венозную кровь (2—3 мл) с добавлением гепарина или других
антикоагулянтов центрифугируют 8—10 мин при 1500—2000 мин-1.
Верхний слой сливают, а осадок разводят физиологическим ра-
створом 1:1 и исследуют под микроскопом;
кровь разводят в соотношении 1:5 или 1:10 дистиллированной
водой (для гемолиза), центрифугируют, осадок исследуют под
микроскопом;
60
венозную кровь (3—4 мл) смешивают с 3-5- или 10-кратным
количеством 3%-ного раствора уксусной кислоты. Смесь центри-
фугируют, осадок исследуют под микроскопом.
При парафиляриозе («сечении») яйца и личинки паразита не-
редко обнаруживают путем исследования под микроскопом выде-
лившейся на коже крови. Можно развести ее физиологическим
раствором 1:1.
Подсчет абсолютного количества эози-
нофилов. При гельминтозах наиболее показателен учет числа
эозинофилов в 1 мкл крови. Метод прост и удобен для выполне-
ния в условиях лабораторий и даже хозяйств. Заранее готовят 2%-
ный водный раствор эозина — маточный раствор. Из него при ис-
следовании крови готовят рабочий раствор, состоящий из 5 мл ма-
точного раствора, 5 мл ацетона ч.д.а. (чистого для анализа) и
100 мл дистиллированной воды. Кровь с антикоагулянтом набира-
ют в меланжер для подсчета лейкоцитов до метки I и разбавляют
рабочим раствором до метки II. Меланжер слегка встряхивают в
течение 1 мин, заряжают счетную камеру Горяева и подсчитывают
эозинофилы (розового цвета, слегка овальной формы, с хорошо
выраженной зернистостью) в 25 больших квадратах (в 100 малых).
Результат умножают на 50.
Исследование кожи и сухожилий (посмертно). Для обнаружения
личинок онхоцерков у лошадей (Onchocerca reticulata, О. cervicalis)
и крупного рогатого скота (О. gutturosa, О. lineatus) проводят био-
псию кожи (рис. 15) и исследуют ее разными методами.
Диагностическая дегельминтизация. С целью ранней диагности-
ки гельминтозов, когда возбудители не достигли половой зрелос-
ти, небольшой группе животных (15—20 гол.) назначают антигель-
минтик. Животных изолируют на 12—24 ч, затем исследуют их фе-
калии методом гельминтоскопии. Как правило, у плотоядных и
птиц гельминты начинают отходить через 5—6 ч, у овец и крупно-
го рогатого скота —через 12—18 ч. Данный метод применяют
чаще при диагностике кишечных цестодозов и аскаридатозов жи-
вотных, так как эти гельминты крупные и легко обнаруживаются.
Иммунобиологическая диагностика. Несмотря на безусловную
прогрессивность, она не нашла широкого применения в условиях
производства из-за большой трудоемкости, отсутствия необходи-
мых чистых антигенов, с помощью которых можно было бы полу-
чить специфическую реакцию, низкой ______
чувствительности диагностикумов и __________
отсутствия совершенных биотехноло- ДгуТ-ч
гий приготовления антигенов. г V сАА.
Разработан аллергический
метод диагностики эхинококкоза
(реакция Кацони) и ценуроза мелкого
и крупного рогатого скота. В качестве Рис 15 ЮЯТ1|Я
антигена используют стерильно полу- проб кожи (по Кивако)
61
ченную жидкость из эхиноккусного или ценурусного пузыря.
Принцип реакции состоит в том, что у больных сенсибилизиро-
ванных животных на месте внутрикожного введения антигена в
течение нескольких часов развивается аллергическая реакция,
оцениваемая как положительная, сомнительная или отрицатель-
ная.
Серьезное внимание уделяют разработке серологичес-
ких реакций, при которых в качестве антигена используют
живых личинок нематод, трематод и цестод, внося их в сыворот-
ку крови больных животных. По этому принципу ставят реакции
микропреципитации и сколексопреципитации, при которых
преципитины в течение 24 ч концентрируются вокруг ротового
(на хоботке или сколексе) и полового отверстий личинок гель-
минтов.
Есть более сложные и достаточно эффективные методы имму-
нодиагностики при трихинеллезе свиней, токсокарозе собак и че-
ловека. Эти методы, заключающиеся в создании диагностических
тест-систем на основе реакции энзиммеченых антител (РЭМА),
довольно сложны, но высокоэффективны и специфичны.
4.3. ПОСМЕРТНЫЕ МЕТОДЫ ДИАГНОСТИКИ
Посмертная диагностика гельминтозов, осуществляемая путем
вскрытия павших или вынужденно убитых животных, более дос-
товерна. Нередко с диагностической целью убивают отдельных
животных. Следует помнить, что обычные методы патологичес-
ких вскрытий павших животных заметно отличаются от гельмин-
тологических вскрытий, разработанных К. И. Скрябиным в
1918 г. Цель таких вскрытий — выявление в органах и тканях
гельминтов и определение их роли в развитии патологии и гибе-
ли животного.
В зависимости от целевого назначения различают полное гель-
минтологическое вскрытие животного (применяется чаще при на-
учных исследованиях), вскрытие отдельного органа и неполное
(частичное) гельминтологическое вскрытие органов.
Полное гельминтологическое вскрытие. Оно заключается в том,
что для обнаружения паразитов вначале тщательно обследуют
кожный покров павшего животного. Снимают кожу и осматрива-
ют подкожную клетчатку. Далее вскрывают органы пищевари-
тельного канала, грудную и брюшную полости, собирают кровь,
вскрывают все другие органы, желчные ходы, кровеносные сосуды
и т. д. Содержимое отделов пищеварительного канала помещают в
разную посуду с целью дальнейшего исследования.
Осмотр проводят, используя лупу и микроскоп. При этом при-
меняют методы последовательных смывов, нативного мазка, сдав-
ливают между предметными стеклами кусочки слизистой оболоч-
62
ки пищеварительного канала и органов. В процессе работы необ-
ходимо регистрировать в журнале обнаруженные паразитические
организмы с указанием (по возможности) их вида, количества и
места локализации.
Метод полного гельминтологического вскрытия органов (пече-
ни, легких, желудка, сердца и т. д.) наиболее приемлем в условиях
хозяйств для установления причины падежа животных, интенсив-
ности инвазии и эффективности лечения. Орган помещают в про-
сторную посуду с водой, собирают поверхностно лежащих гель-
минтов. Вскрывают полости, ходы и сосуды до определенной глу-
бины. Затем орган разрезают на мелкие кусочки, сдавливают их
пальцами в воде, изгоняя содержимое из их глубины. Остатки тка-
ни и верхний слой воды удаляют, а осадок исследуют на наличие
гельминтов или их личинок.
Неполное гельминтологическое вскрытие. Его проводят более
упрощенным методом — делают разрезы органов, мышц, частично
вскрывают полости и извлекают гельминтов. Это позволяет уточ-
нить или поставить диагноз на гельминтоз.
Сбор, фиксация и этикетирование гельминтов. Гельминтов и дру-
гих паразитических организмов, собранных во время вскрытия
трупов, при необходимости консервируют. Используют для этого
3%-ный раствор формалина на физиологическом растворе (жид-
кости Барбагалло) или 70%-ный раствор спирта (7,3 мл 96%-ного
спирта и 2,7 мл воды). Перед фиксацией гельминтов тщательно
отмывают в воде и только после гибели помещают в жидкость для
консервации.
Трематод, цестод и акантоцефал обычно консервируют в ра-
створе спирта; нематод, ларвацист, цестод-цистицеркусов, эхино-
коккусов, альвеококкусов, ценурусов — в жидкости Барбагалло.
Тарой для фиксации служит стеклянная посуда с притертой проб-
кой или плотно закрывающейся пластмассовой крышкой. Со-
бранный материал снабжают этикеткой с указанием названия хо-
зяйства, вида, возраста животного, места обнаружения гельмин-
тов, фамилии исследователя и даты сбора. Записи делают простым
мягким карандашом на белой плотной бумаге, которую приклеи-
вают к посуде или помещают внутрь ее. Если берут небольшие
органы с гельминтами, то их в течение 48—72 ч фиксируют 5—
10%-ным раствором формалина, а затем перекладывают в свежий
фиксатор на длительное хранение. Фекалии животных фиксируют
в 25%-ном растворе формалина.
Лабораторная работа
Задания. Освоить методику взятия проб фекалий от животных
разных видов. Ознакомиться с оборудованием и реактивами,
употребляемыми при исследовании проб фекалий животных на
гельминтозы. Исследовать пробы фекалий животных гельминто-
63
овоскопическими методами. Исследовать печень овцы или круп-
ного рогатого скота по методу полного гельминтологического
вскрытия.
Оборудование, материалы и объекты исследований: микроскопы; предметные и
покровные стекла; пинцеты; стеклянные палочки; стаканчики; металлические
петли; ситечки; насыщенные растворы натрия хлорида, технической аммиачной
селитры; вода; оберточная бумага; кюветы, стеклянные банки; прямые ножницы;
компрессориумы; бактериологические чашки; жидкость Барбагалло; спирт 70%-
ный, пробы фекалий овец, свиней, лошадей; печень и легкие жвачных; кишечник
птиц.
Место занятия: лаборатория паразитологии и инвазионных бо-
лезней животных.
Методика проведения занятия. Преподаватель кратко объясняет
методику взятия фекалий животных разных видов. Двое учащихся
под руководством преподавателя берут эти пробы от животных в
клинике или учебном хозяйстве техникума. В отдельных случаях
накануне занятий преподаватель может поручить лаборанту взять
пробы фекалий на ферме колхоза или совхоза и других форм хо-
зяйств, неблагополучных по гельминтозам.
Преподаватель знакомит учащихся с оборудованием и материа-
лами, а также с объектами исследований, приготовленными для
проведения лабораторного занятия по изучению фекалий, кратко
излагает методику работы. Объяснения сопровождаются показом
наиболее сложных манипуляций, демонстрацией таблиц яиц и ли-
чинок гельминтов. Затем учащиеся исследуют фекалии наиболее
распространенными в гельминтологической практике методами,
знакомятся со строением обнаруженных яиц, личинок и фрагмен-
тов гельминтов. Ведут краткие записи в тетрадях для лабораторно-
практических занятий и делают зарисовки наиболее характерных
яиц гельминтов. Схематические рисунки яиц должны быть масш-
табными.
Перед гельминтологическими вскрытиями оборудуют рабочие
места и заранее доставляют материал (трупы птиц или поражен-
ные гельминтами паренхиматозные органы жвачных). Учащиеся
под руководством преподавателя проводят вскрытие. Обнаружен-
ных гельминтов собирают, фиксируют и этикетируют.
Практическое занятие
Задания. Освоить методику взятия фекалий из прямой кишки
овец и крупного рогатого скота. Провести частичное и полное
вскрытие печени и кишечника овцы. Составить акты проведен-
ных исследований.
Оборудование, материалы и объекты исследований: акушерские перчатки; на-
пальчники; стаканы вместимостью 200 мл; кульки из пергаментной бумаги; цел-
лофановые пакеты; кюветы; тазики; ведра; полотенца; халаты; скальпели; ножни-
цы; препаровальные иглы; кисточки; стеклянные емкости; формалин; спирт;
жвачные животные; печень и органы желудочно-кишечного канала крупного ро-
гатого скота или овцы.
64
Место занятия: учебно-производственная клиника техникума
или животноводческая ферма хозяйства.
Методика проведения занятия. Фекалии могут быть собраны в
животноводческих помещениях в любое время рабочего дня. Фе-
калии обычно берут от накормленных животных (особенно от
овец). Вначале преподаватель объясняет общие приемы подхода к
животным и способы взятия фекалий из прямой кишки (жела-
тельно демонстрируя). Далее разбивают учащихся на звенья по
пять-шесть человек, назначают в каждом из них старшего, кото-
рый получает материалы и оборудование.
У крупного рогатого скота фекалии берут рукой в акушерской
перчатке. При легком массаже области ануса коровы нередко са-
мопроизвольно выделяют фекалии. Если этого не происходит, то
руку легким буравящим движением вводят в прямую кишку и из-
влекают нужное количество содержимого. Один из студентов про-
стым карандашом записывает на кулечке инвентарный номер жи-
вотного, его пол и возраст. По ходу занятия студенты меняются
между собой рабочими операциями.
Для сбора фекалий у овец надевают напальчник на указатель-
ный палец, затем, смочив его водой и слегка согнув, вводят в пря-
мую кишку и извлекают из нее содержимое. При отсутствии фека-
лий в конечном участке кишки делают легкий массаж слизистой
оболочки. Это способствует выделению содержимого. Следует по-
мнить, что работа с необрезанными ногтями и без перчаток или
напальчника приводит к травмированию слизистой оболочки пря-
мой кишки животного.
Печень и кишечник павших животных вскрывают в светлом и
просторном помещении. В теплую погоду можно во дворе. При
частичном вскрытии органов острым скальпелем делают несколь-
ко глубоких разрезов вдоль и поперек желчных ходов печени и
вдоль изучаемого отрезка кишечника.
При полном гельминтологическом вскрытии печени необходи-
мо более тщательное исследование содержимого желчного пузы-
ря, желчных ходов, кровеносных сосудов и стромы органа. Вскры-
вая кишечник, каждый отдел нужно изолировать в отдельную по-
суду, после чего осматривают содержимое и слизистую оболочку
по общепринятым методикам.
Обнаруженных в органах гельминтов собирают в отдельную
посуду с водой для предварительного промывания, затем парази-
тов подсчитывают, фиксируют и этикетируют. Как правило, пол-
ная обработка собранного материала осуществляется в условиях
соответствующих лабораторий и кафедр. В конце работы состав-
ляют акт с указанием даты, времени, хозяйства, вида и числа жи-
вотных, а также количества их органов, подвергнутых исследова-
нию.
Контрольные вопросы. 1. В чем суть прижизненных и посмертных методов ди-
агностики? 2. Каковы условия проведения гельминтокопроскопических исследо-
65
ваний? 3. В каких условиях необходимо проводить исследование на количество
яиц и личинок в фекалиях? 4. В чем состоит принцип флотационных методов ис-
следований фекалий? 5. В каких случаях проводят гельминтоскопические иссле-
дования? 6. При каких гельминтозах целесообразно проводить специальные диаг-
ностические исследования? 7. В чем различие между полным и неполным гель-
минтологическим вскрытием органов?
5. МОНОГЕНЕОЗЫ РЫБ
Моногенеозы — болезни рыб, вызываемые сосальщиками из
класса Monogenea. Это довольно распространенные (более 1500
видов) паразитические черви длиной от 0,3 до 30 мм. Тело удли-
ненное, розоватое или красновато-коричневое, на переднем кон-
це расположены органы фиксации (присоски, крючья, шипы и
т. д.). Имеют все четыре системы — нервную, пищеварительную,
выделительную, половую, близкие по строению к таковым у тре-
матод. Паразиты — гермафродиты и развиваются прямым путем
(без участия промежуточных хозяев). Моногенеи преимуществен-
но эктопаразиты. Из этого класса у рыб часто паразитируют пред-
ставители семейств Gyrodactylidae, Dactylogyridae и некоторые
другие.
5.1. ГИРОДАКТИЛЕЗЫ РЫБ
Гиродактилезы — паразитарные заболевания рыб многих ви-
дов, характеризующиеся поражением кожи и плавников, их разру-
шением и образованием язв, а также некрозом жаберного аппара-
та. Возбудители — моногенетические сосальщики из семейства
Gyrodactylidae.
Локализация — кожный покров, плавники и жаберный аппарат.
Распространение. Заболевания широко распространены среди
пресноводных и даже морских рыб. Только у пресноводных рыб
паразитируют гельминты более 20 видов. Из-за гибели мальков
болезнь причиняет рыбоводческим хозяйствам немалый ущерб.
Возбудители — Gyrodactylus medius, G. elegans и др. (рис. 16) —
продолговатые сосальщики длиной от 0,2 до 1 мм. На переднем
конце тела расположены два сократительных сосочка с отверстия-
ми головных желез, глаз нет. На заднем конце имеется фиксатор-
ный прикрепительный диск, вооруженный двумя крупными цент-
ральными и 16 краевыми крючками. Ротовое отверстие находится
в передней трети тела на вентральной стороне. Кишечник состоит
из двух слепо заканчивающихся стволов. Паразит имеет по одному
семеннику и яичнику.
Биология развития. Гиродактилюсы — живородящие паразиты,
развиваются без смены хозяев. В материнском организме из яйца
формируется зародыш I генерации — дочерняя особь, при дальней-
шем развитии внутри образуется зародыш II генерации, в нем — за-
66
родыш III генерации, внутри последнего —
зародыш IV генерации. Зародыш I генера-
ции выходит из организма сосальщика,
прикрепляется к коже рыбы и постепенно
достигает половой зрелости, а развитие
каждого эмбриона последующих поколе-
ний за это время продвигается на одну ге-
нерацию. На формирование дочерней осо-
би и ее выход из взрослого гельминта тре-
буется 4—5 сут. Продолжительность жизни
гиродактилюсов 12—15 сут.
Эпизоотологические данные. Гиродак-
тилез встречается в рыбоводческих хозяй-
ствах Украины, Белоруссии, Краснодарс-
кого края и в некоторых других районах.
Инвазируются пресноводные (карп, са-
зан, карась, белый амур) и морские (ло-
сось, треска и корюшка) рыбы. В основ-
ном болеют и погибают мальки и сеголет-
ки карпа, сазана и его гибридов, карасей и
молодь белых амуров. Рыба старших воз-
растов клинически не болеет, но может
быть гельминтоносителем. Пик инвазии
приходится на весну — 85—100 % случаев
заболеваний при интенсивности зараже-
ния 75—100 гельминтов. В зимовальных
прудах нередко погибает значительная
часть сеголеток. Рыба заражается при
контакте и через воду. Весной массовому
размножению возбудителей способствуют
повышение температуры воды и плохие
санитарные условия в прудах.
Патогенез и симптомы болезни. Гиро-
дактилюсы на кожном покрове рыбы пи-
таются слизью и клетками ткани. Поэтому
нарушается образование слизи и травми-
руется кожа, что облегчает проникнове-
Рис. 16. Возбудитель
гиродактилеза:
1 — прикрепительный диск;
2— глотка; 3 — железы; 4 —
зародыш I генерации; 5 — за-
родыш II генерации; <5—ро-
товое отверстие; 7 — яичник
ние в нее патогенных грибов и микробов.
У больных рыб на поверхности тела и плавниках появляется голу-
бовато-матовый налет, разрушаются межлучевые перепонки. На
коже нередко наблюдают кровоизлияния и повреждения, через
которые в организм рыб проникает патогенная микрофлора. Рыба
худеет, глаза глубоко западают, заостряются брюшко и спинка. На
жабрах отмечаются неравномерная окраска лепестков, кровоизли-
яния и очаговый некроз.
В результате нарушения дыхания рыбы собираются у притока
свежей воды, всплывают на поверхность, заглатывают воздух.
67
Диагностика. Диагноз ставят на основании клинических при-
знаков и микроскопического исследования соскобов с поверхнос-
ти тела и плавников. Слизь, собранную скальпелем, наносят на
предметное стекло, добавляют 2—3 капли воды, накрывают по-
кровным стеклом и исследуют под микроскопом при малом уве-
личении (х 56). Отдельные жаберные лепестки тщательно осмат-
ривают под лупой (х 24).
Лечение. Проводят обработку рыб в ваннах 5%-ным раствором
натрия хлорида с экспозицией 5 мин. Хорошими антигельминт-
ными свойствами обладают растворы формалина (1:4000, 1:5000) с
экспозицией 25 мин. После обработки рыбу помещают в проточ-
ную воду. Зимовальные пруды обрабатывают метиленовой синью
в концентрации 1 г/м3, малахитовым зеленым, фиолетовым К,
бриллиантовым зеленым в концентрации 0,1—0,12 г/м3 с экспози-
цией 3—4 ч. Сохранность рыбы повышается до 80—86 %.
Профилактика и меры борьбы. Для предотвращения инвазии в
неблагополучных хозяйствах проводят комплекс мероприятий: го-
довалых карпов перед посадкой в нагульные пруды, производите-
лей и ремонтных рыб перед нерестом обрабатывают одним из ука-
занных выше препаратов; выростные пруды после отлова рыб
просушивают и дезинфицируют негашеной известью из расчета
2500 кг на 1 га, на зиму воду из прудов спускают; рыбу внутри хо-
зяйства перемещают только после обработки растворами натрия
хлорида или формалина.
Санитарная оценка. Рыбу, пораженную гиродактилюсами, если
она отвечает требованиям товарной продукции, допускают в пищу
людям и плотоядным без ограничений. Если же она не отвечает
этим требованиям, подвергают технической утилизации или скар-
мливают пушным зверям и другим животным.
5.2. ДАКТИЛОГИРОЗЫ РЫБ
Дактилогирозы вызывают моногенетические сосальщики из се-
мейства Dactylogyridae, паразитирующие у пресноводных рыб
(карпов, сазанов и их гибридов). Болезнь характеризуется пораже-
нием жаберных лепестков и нарушением функции дыхания.
Локализация — жаберный аппарат.
Распространение. Дактилогирозы рыб регистрируют в различ-
ных районах нашей страны. У пресноводных рыб паразитируют
около 160 видов дактилогирусов. Тяжело болеют и погибают маль-
ки карпов и сазанов, а из растительноядных — белый амур. Ущерб
главным образом определяется гибелью молоди, иногда до 60—
70%.
Возбудители — Dactylogyrus vastator, D. extensus у карпов и саза-
нов, имеют плоское тело длиной соответственно 0,57—1,1 и 0,3—
0,35 мм, шириной 0,15—0,4 и 0,3—0,35 мм. У белого амура парази-
68
Рис. 17. Возбудитель дактилогироза D. vastator
(из Быховского, 1933):
7 — глазки; 2 —ротовое отверстие; 3 — копулятивный орган;
4 — кишечный ствол; 5 — яичник; 6 — семенник; 7 — фиксатор-
ный диск, краевые крючья; 8 — центральные крючья; 9—яйцо;
10— личинка; 11 — яйца на жабрах
тируют два вида — D. lamellatus и D. ctenopharyngodonis. Длина их
тела соответственно 0,48 и 0,5 мм, ширина 0,11 и 0,08 мм. В пере-
дней части тела у дактилогирусов имеется четыре лопасти, две
пары глаз, в задней — фиксаторный диск с двумя большими цент-
ральными крючками и 14 мелкими краевыми. В матке находятся
яйца овальной формы с отростком на одном полюсе и с крышеч-
кой на другом (рис. 17).
Биология развития. Развитие происходит прямым путем. Дакти-
логирусы откладывают яйца на жабры, подводную растительность
или непосредственно в воду. При температуре 22—26 °C один
гельминт способен отложить в сутки 14—29 яиц. В этих условиях
развитие яиц завершается в течение 2—3 сут, при 30 °C и выше оно
угнетается, а при температуре ниже 4 °C созревание яиц прекра-
щается. Вышедшая из яйца личинка удлиненной формы с пятью
группами ресничек и двумя парами пигментных глаз. Зачаточный
фиксаторный диск вооружен 14 краевыми крючочками. Личинка
активно плавает и попадает на жабры хозяина, с помощью крю-
чочков прикрепляется к ним, сбрасывает реснички и при 20—
23 °C за 7—8 сут формируется в половозрелого гельминта.
Эпизоотологические данные. Дактилогирусы распространены
повсеместно, но заболевания в основном встречаются в рыбовод-
ных прудовых хозяйствах. D. vastator поражает главным образом
молодь карпа, сазана и гибридов амурского сазана с карпом, а
D. extensus — рыб всех возрастов — от мальков до производителей
(этих же видов). Энзоотии при заражении паразитами последнего
69
вида в основном возникают на севере и северо-западе страны в
июле—августе. В южных районах молодь чаще заражается
D. vastator в конце мая или в июне. Пик инвазии у мальков отме-
чается в 1—1,5-месячном возрасте в конце июля, когда экстенсив-
ность инвазии достигает 100 % при высокой степени гибели —
60-70 %.
Патогенез и симптомы болезни. Под влиянием механического
воздействия гельминтов эпителий жаберных лепестков разрушает-
ся. Отделение слизи усиливается, в ней интенсивно размножаются
микроорганизмы, вызывающие образование некротических участ-
ков. Капилляры отграничиваются от внешней среды слоями эпи-
телиальных клеток, следовательно, нарушаются газообмен и кро-
вообращение. Характерны разрастание эпителия жаберных лепес-
тков, образование анастомозов и отторжение омертвевших участ-
ков.
Течение и клинические признаки инвазии тесно связаны с ин-
тенсивностью заражения рыб. Больная рыба малоподвижна, скап-
ливается в местах притока свежей, богатой кислородом воды или
держится у поверхности, заглатывая воздух. Она истощена, глаза
западают, жабры покрыты слизью, местами некротизированы, с
мутноватым налетом (гифы гриба сапролегния). Рыба погибает от
гипоксии.
Диагностика. Учитывают эпизоотические данные, симптомы
болезни и результаты микроскопии соскобов слизи с жаберного
аппарата (см. Гиродактилезы рыб).
Профилактика и меры борьбы. При дактилогирозах профилак-
тика и меры борьбы в основном те же, что и при гиродактилезах.
Выростные пруды заполняют водой не раньше чем за 10—12 сут до
посадки в них личинок. Производителей карпа перед нерестом с
профилактической целью обрабатывают в ваннах с 0,1%-ным ра-
створом аммиака или 5%-ным раствором натрия хлорида, а после
нереста их сразу же удаляют. Нежелательно попадание в пруды
карасей и других сорных рыб, так как в природе они служат резер-
вуарами дактилогирусов.
Лабораторная работа
Задания. Ознакомиться с морфологическими признаками гиро-
дактилюсов и дактилогирусов рыб. Исследовать жабры и кожу рыб
на наличие возбудителей моногенеозов.
Оборудование, материалы и объекты исследования: микроскопы; лупы; эмали-
рованные кюветы; стеклянные банки; бактериологические чашки, ножницы пря-
мые; пинцеты глазные; предметные и покровные стекла; мальки рыб, инвазиро-
ванные гиродактилюсами и дактилогирусами.
Место занятия: лаборатория паразитологии и инвазионных бо-
лезней сельскохозяйственных животных.
70
Методика проведения занятия. До начала лабораторной работы
оборудуют рабочие места для учащихся. Живых мальков рыб же-
лательно взять в рыбном хозяйстве, неблагополучном по моноге-
ноидозам.
После краткого объяснения преподавателя учащиеся приступа-
ют к микроскопии жаберных лучей под лупой. На предметных
стеклах под микроскопом исследуют соскобы слизи, снятой
скальпелем с кожи, плавников и жабр мальков. Определяют вид
паразита и интенсивность инвазии путем подсчета всех найден-
ных гельминтов.
При дифференциации возбудителей разных видов следует об-
ратить внимание учащихся на фиксаторный диск в задней части
паразита: у дактилогирусов он с двумя серединными и 14 мелкими
краевыми крючками, у гиродактилюсов с двумя крупными и 16
мелкими крючками.
Контрольные вопросы. 1. Какими признаками характеризуются моногенёи?
2. В каком возрасте рыба чаще всего заражается возбудителями гиродактилезов?
3. Какие симптомы наиболее характерны для дактилогирозов рыб? 4. Как заража-
ется рыба возбудителями гиродактилезов и дактилогирозов? 5. Какие препараты
применяют для лечения рыб и профилактики моногенеозов?
6. ТРЕМАТОДОЗЫ
Трематодозы — заболевания, вызываемые плоскими гельмин-
тами, паразитирующими у животных в печени, поджелудочной
железе, пищеварительном канале и кровеносной системе. Трема-
тоды — эндопаразиты сельскохозяйственных и промысловых жи-
вотных, а также человека. По данным В. И. Петреченко (1967), у
млекопитающих паразитирует около 390 видов всех известных
трематод, у птиц — 780 и у человека — свыше 30 видов.
6.1. СИСТЕМАТИКА, КРАТКАЯ МОРФОЛОГИЯ
И БИОЛОГИЯ ТРЕМАТОД
Представители класса Thrematoda (сосальщики), подкласса
Digenea (дигенетические гельминты) — паразиты теплокровных
животных, имеют наибольшее ветеринарно-медицинское значе-
ние среди многих классов и плоских червей типа Plathelminthes.
В учебнике приведены сведения о представителях четырех по-
дотрядов: Fasciolata, Paramphistomata, Echinostomatata, Hetero-
phyata.
Размеры трематод варьируют от долей миллиметра до 10—
15 см. У многих представителей этого класса тело сплющено в
дорсовентральном направлении. Форма трематод разнообразна —
листовидная (фасциолы), грушевидная (парамфистомата), ните-
видная (ориентобильхарции) и др. На внешнем покрове (тегумен-
71
те) многих гельминтов имеются развитые шипы. Трематоды при-
крепляются при помощи ротовой и брюшной присосок. Имеют
нервную, выделительную, пищеварительную и половую системы.
Нервная система состоит из двух лежащих по бокам
глотки ганглиев и отходящих от них нервных стволов, соединяю-
щихся поперечными комиссурами.
Выделительная система представлена мелкими ка-
нальцами, которые начинаются с боков тела и вливаются в общий
экскреторный канал, расположенный по оси тела и заканчиваю-
щийся отверстием на задней его части.
Пищеварительная система включает ротовое от-
верстие, находящееся на дне ротовой присоски, глотку, пищевод
и кишечные стволы, которые заканчиваются слепо на заднем
конце тела паразита. Многие трематоды имеют кишечные ство-
лы с боковыми ветвящимися отростками (фасциолы). Неперева-
ренные остатки пищи из кишечника удаляются через ротовое от-
верстие.
В обменных процессах трематод определенное участие прини-
мает тегумент (внешний покров). Об активной функции его сви-
детельствует тот факт, что на поверхности цитоплазматической
мембраны обнаруживают мукополисахарид, щелочную фосфатазу
и другие ферменты. Кроме того, в паренхиматозном слое тегумен-
та находятся связанные с кишечными стволами гельминта и на-
ружной частью тегумента звездчатые клетки с запасами гликогена.
Таким образом, паренхима принимает большое участие в обмене
веществ. Все это позволяет понять механизм влияния многих ан-
тигельминтиков, действующих не только через пищеварительный
канал, но и через внешний покров гельминта.
Половая система сложная и хорошо развита. Все со-
сальщики, за исключением представителей семейства Schistoso-
matidae, гермафродиты (двуполые). Мужской половой аппарат
включает в себя семенники (компактные или разветвленные), от
которых отходят семяпроводы, вливающиеся в общий семявыно-
сящий проток, заключенный в мышечный мешок — половую бур-
су. Конец семявыносящего протока — циррус (половой орган) от-
крывается рядом с женским половым органом — влагалищем впе-
реди брюшной присоски.
К женскому половому аппарату относится оотип, где оплодо-
творяются и формируются яйца. С оотипом посредством яйцевода
соединяются яичник, продуцирующий яйцевые клетки, и семя-
приемник, содержащий спермии. С этим аппаратом сообщаются и
желточники, которые расположены по бокам тела и вырабатыва-
ют желточные клетки, богатые питательными субстратами и гра-
нулами, необходимыми для образования скорлупы яиц. Секрет
тельца Мелиса активизирует спермии и способствует скольжению
яиц в оотипе и матке. Матка в виде извитой трубки одним концом
соединена с оотипом. Другой ее конец выполняет функцию влага-
72
Рис. 18. Схема строения трематод:
а — строение: 1 — ротовая присоска; 2 — глотка; 3 — пищевод; 4 — кишечные стволы; 5 — жен-
ское половое отверстие; 6— мужское половое отверстие; 7— матка; 8— желточник; 9 — оотип;
10 — желточный проток; 11 — яичник; 12— семяпроводы; 13— семенники;/-/— слепые концы
кишечных стволов; 15— экскреторный пузырь; 76 — экскреторное отверстие; 17— лауреров
канал; 18— тельце Мелиса; 19— семяприемник; 20— общий семявыносящий проток; 21 —
семенной пузырек; 22 — брюшная присоска; 23 — половая бурса; б — половой аппарат:
М. б. — мужская бурса; П. ж. — простатические железы; С. из. — семенной пузырек; Св.п. — се-
мявыносящий проток; Сей —семяпроводы; С—семенники; М— матка; Т. М. — тельце Мели-
са; Оо — оотип; Л. к. — лауреров канал; Ж — желточники; Я — яичник; Спр — семяприемник
лища. У трематод происходит как перекрестное, так и самоопло-
дотворение (рис. 18).
Трематоды —биогельминты, развиваются с чередованием по-
колений и сменой хозяев. Половозрелые особи (мариты) парази-
тируют у позвоночных животных и человека. Личиночная фаза
развивается с участием промежуточных хозяев — моллюсков (вод-
ных или сухопутных) и дополнительных хозяев — кольчатых чер-
вей, моллюсков, ракообразных, членистоногих и рыб. Размножа-
ются трематоды посредством яиц, которые при выходе наружу со-
держат зародыш, окруженный желточными клетками, или мира-
цидий, что свидетельствует об инвазионности яиц.
6.2. ДИСКОКОТИЛЕЗ РЫБ
Дискокотилез — болезнь лососевых и хариусовых рыб, вызыва-
емая плоскими гельминтами семейства Discocotylidae Price.
Локализация. Взрослые гельминты паразитируют на жабрах
рыб семейств сиговых и хариусовых.
73
Распространение. Дискокотилез распространен в естественных
водоемах северных районов европейской части России и Сибири,
реже в прудовых хозяйствах страны.
Возбудители. У лососевых и хариусовых рыб паразитируют два
вида моногенетических гельминтов рода Discocotyle: D. sagittata и
D. salmonis.
Тело D. sagittata серо-бурого цвета, ланцетовидной формы,
сплющенное, длиной 6—9 мм, шириной 0,3—0,5 мм. На переднем
конце имеется две небольшие присоски, а на заднем — прикрепи-
тельный диск с восьмью хитиновыми ущемляющими застежко-
видными аппаратами в два ряда (по четыре аппарата в каждом).
Кишечник имеет два ствола, заканчивающихся слепо в заднем
конце тела. Половое отверстие находится позади ротового. Мно-
жество семенников расположено по оси в задней половине тела.
Впереди семенников имеется один яичник. Матка занимает пере-
Рис. 19. Возбудитель диско-
котилеза лососевых рыб —
D. sagittata:.
1 — присоски; 2—глотка; 3 —
кишечник; 4 — яичник; 5 — се-
менники; 6 — прикрепительный
диск; 7 — желточники
дний край яичника и содержит внутри
одно или несколько яиц. По бокам тела
расположены развитые желточники
(рис. 19).
Биология развития. Развитие проис-
ходит без участия промежуточных хозя-
ев. Гельминты в местах локализации
выделяют яйца, в которых либо на жаб-
рах, либо в воде развиваются личинки
при температуре 18—20 °C за 8—10 сут,
при 10—12 °C за 15—17, при 5—7 °C за
20—25 сут. При более низкой темпера-
туре личинки не развиваются. При вы-
ходе из яйца они прикрепляются к жа-
берным лепесткам рыбы и вскоре пре-
вращаются во взрослого гельминта.
Эпизоотологические данные. Заража-
ются рыбы всех возрастов, но тяжело
болезнь протекает у молоди. Взрослая
рыба — носитель инвазии и источник
ее распространения. Интенсивность
инвазии нередко достигает 100 экз.
Патогенез и симптомы болезни. Пара-
зиты, глубоко прикрепляясь фиксатор-
ным органом к жабрам, поглощают зна-
чительное количество крови. В резуль-
тате возникают морфофункциональные
изменения их: жабры бледнеют, появля-
ются язвы и кровоизлияния; в ранках
накапливается сапрофитная микрофло-
ра, что усиливает патологический про-
цесс, развивается сильная анемия.
74
Рыба худеет, отстает в росте и развитии, часто поднимается в
верхние слои воды, глотает воздух, тело становится пятнисто-ма-
товой окраски. Тяжелобольная молодь погибает.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, клинических, патологоанатомических признаков и лабо-
раторных исследований. Для обнаружения гельминтов скальпелем
берут соскобы с жабр рыб и компрессорным методом просматри-
вают под микроскопом.
Трупы малокровные с потускневшей кожей. Иногда при
вскрытии выявляют жировое перерождение мышц, сердца и раз-
рушение плавников.
Лечение. Зараженную рыбу обрабатывают в противопаразитар-
ных ваннах с 2,5—5%-ным раствором натрия хлорида в течение
5 мин.
Профилактика и меры борьбы. В неблагополучных рыбоводных
хозяйствах проводят ветеринарно-санитарные мероприятия, на-
правленные на предотвращение проникновения возбудителей в
водоемы и создание в прудах и бассейнах оптимальных зоогигие-
нических условий.
Чтобы ликвидировать заболевание в хозяйстве, всю рыбу с кли-
ническими признаками болезни вылавливают, обрабатывают в ра-
створе натрия хлорида, а пруды дезинвазируют хлорной и негаше-
ной известью.
Санитарная оценка. Пораженная рыба не опасна для человека,
и, если она отвечает требованиям товарной кондиции, ее допуска-
ют в реализацию без ограничений.
6.3. ТЕТРАОНХОЗ РЫБ
Тетраонхоз — заболевание сиговых рыб, вызываемое плоскими
гельминтами из класса Monogenea.
Локализация. Тетраонхусы — эктопаразиты, паразитируют на
жабрах.
Распространение. Заболевание распространено в основном в ес-
тественных водоемах Сибири, Башкирии и Южного Урала.
Возбудители. У сиговых рыб паразитирует Tetraonchus alascensis
семейства Tetraonchidae, у щук нередко обнаруживают другой
вид — Т. monenteron.
Тело гельминта плоское, длиной 2,0—2,5 мм, шириной 0,5 мм.
Фиксаторный аппарат расположен на заднем конце тела, воору-
жен 16 краевыми крючками, двумя парами средних крючков и од-
ной соединительной пластинкой. Кишечник одинарный, без бо-
ковых выростов, заканчивается слепо. Округлый семенник распо-
ложен по оси тела в середине паразита. Яичник находится впереди
семенника (рис. 20).
Биология развития. Гельминты, как и другие моногенеи, разви-
ваются прямым путем. На жаберном аппарате тетраонхусы откла-
75
Рис. 20. Возбудитель
тетраоихоза сиговых рыб
Т. atascensis:
/ — железистые органы; 2—гла-
за; 3 — глотка; 4—кишечник;
5 — желточники; 6 — яичник;
7—семенник; 8— прикрепи-
тельный диск
дывают яйца, из которых вылупляются
личинки. Они прикрепляются к жаб-
рам и растут, достигая вскоре половой
зрелости.
Эпизоотоло! и чес кие данные В ос-
новном заражаются сиговые рыбы
(пыжьян, чир, пелядь, нельма и др.).
Заболевание распространено среди
взрослых рыб —4 года и старше. Пик
инвазии в виде энзоотии регистрируют
с конца июля по октябрь. Нередко эк-
стенсивность инвазии достигает 75—
90 % при высокой интенсивности.
Патогенез и симптомы болезни. Лока-
лизуясь при помощи мощного фикса-
торного органа и питаясь кровью, тет-
раонхусы разрушают лепестки жабр.
При поражении этих участков грибами
рода Saprolegnia патологический про-
цесс осложняется. Образуются некро-
тические участки, возникают кровоиз-
лияния. В результате нарушается обмен
кислорода, возникают признаки ас-
фиксии и больная рыба погибает.
Диагностика. Для постановки диаг-
ноза проводят комплексные исследо-
вания. Особое внимание обращают на
возраст пораженных рыб и сезон года.
Исследуют соскобы с жабр и слизь под
микроскопом при увеличении х 40 или
х 56 на наличие гельминтов.
Лечение. Не разработано.
Профилактика и меры борьбы. В не-
благополучных хозяйствах проводят ветеринарно-санитарные и
мелиоративные мероприятия, направленные на формирование
стад рыб, не восприимчивых к инвазии. Завоз рыбы разрешается
только из благополучных по тетраонхозу хозяйств.
Санитарная оценка. Возбудитель не представляет опасности для
других животных и человека. Если товарные качества рыбы отве-
чают требованиям ветеринарного законодательства, ее реализуют
на общих основаниях.
6.4. ФАСЦИОЛЕЗЫ
Фасциолезы — остро или хронически протекающие заболева-
ния мелкого и крупного рогатого скота, возбудители которых —
крупные трематоды из семейства Fasciolidae. У косуль и особенно
76
у лосей паразитирует специфический вид трематод — Рага-
fasciolopsis fasciolaemorpha. Встречаются и иные виды.
Локализация — желчные ходы печени.
Распространение. Fasciola hepatica распространена повсеместно,
a F. gigantica встречается в регионах с теплым климатом (в Астра-
ханской и Гурьевской областях, Закавказье, республиках Средней
Азии и Казахстане).
Болезнь сопровождается падежом (особенно в острый период
инвазии), потерей прироста живой массы (до 10%), молока (до
20 %), шерсти (до 30 %), утилизацией печени, яловостью коров и
овцематок (до 20—40 %).
Возбудители. F. hepatica (обыкновенная) — трематода листовид-
ной формы, длиной 2—3 см, шириной 0,8—1,2 см. Марита темно-
серого цвета, неполовозрелые особи серого. Хорошо выражены
плечики. Характерный признак фасциолы — все ее внутренние
органы разветвлены. Среднюю и заднюю части тела занимают вет-
вистые семенники. Розетковидная матка и яичник (в форме оле-
ньих рогов) находятся несколько сбоку и позади брюшной при-
соски. Боковые поля заняты желточниками, а половая бурса и
женское половое отверстие открываются между разветвленной
вилкой кишечника и брюшной присоской.
F. gigantica (гигантская) отличается от F. hepatica большим раз-
мером тела (длина 4,0—7,5 см, ширина 0,5—1,2 см). Плечики не
выражены. Вся поверхность фасциолы покрыта шипами лопатко-
видной формы, расположенными рядами поперек тела (рис. 21).
Шип состоит из основания и лезвия. Длина шипа 0,0386 мм, в том
числе лезвия 0.0194 мм. ширина лезвия 0,0252 мм. Края шипа за-
зубрены. Яйца фасциол золотисто-желтого
цвета, овальной формы. Длина 0,12—
0,14 мм, ширина 0,07—0,09 мм. На узком по-
люсе есть крышечка, вся полость скорлупки
заполнена желточными клетками, в толще
которых находится зародыш.
Биология развития. Фасциолы — биогель-
минты, их развитие происходит с участием
промежуточных хозяев (рис. 22). Для фасци-
олы обыкновенной это Lymnaea truncatula
(малый прудовик), для гигантской —
L. auricularia. В желчных ходах дефинитив-
ных хозяев трематоды продуцируют яйца,
которые с желчью попадают в кишечник и
из него — во внешнюю среду. В пресной
воде при благоприятной температуре воздуха
(20—30 °C) яйцо через 12—18сут становится
инвазионным. В нем формируется мираци-
дий, который только при свете вылупляется
в воду. Мирацидии в воде активно плавают и
Рис. 21. Шипы на тегу-
меите фасциолы обык-
новенной (no Th. Hiepe
1985)
77
ю
Рис. 22. Фасциолы и стадии их развития:
ю
9
а — F. hepatica; б — F. gigantica; 1 — ротовая присоска; 2 — глотка;
3 — пищевод; 4— разветвленный кишечник; 5—половая бурса;
6 — брюшная присоска; 7— матка; 8— яичник в виде оленьего рога;
9— желточник; 10— желточные протоки; 11 — семенники с семя-
проводами; в —яйцо; г— мирацидий; д — спороциста; е — церкарий;
ж — адолескарий; з — адолескарий на листе растения; и — промежу-
точный хозяин: моллюск Lymneae truncatula; к—печень; л —желч-
ные протоки овцы, пораженные фасциолами
при встрече с моллюсками внедряются в их ножки, затем в печень,
где последовательно проходят стадии спороцисты, редии, церка-
рия (бесполое, или партеногенетическое, размножение). В благо-
приятных условиях развитие паразита от мирацидия до церкария
продолжается 2—3 мес. Из одного мирацидия может образоваться
до 1 тыс. церкариев, которые постепенно выходят в воду через
мантийную полость моллюска и в течение нескольких минут пре-
вращаются в инвазионные личинки — адолескарий. Последние
пассивно прикрепляются к растительности или свободно держат-
ся на воде.
Животные заражаются алиментарным путем во время пастьбы
78
Рис. 23. Биология развития F. hepatica:
1 — общий вид трематоды; 2 — яйцо; 3— мирацидий; 4 — спороциста; 5— редия;
6— церкарий; 7—моллюск; 8— адолескарий
на низинных болотистых пастбищах. В кишечнике дефинитивных
хозяев адолескарий освобождаются от толстой защитной оболоч-
ки. Молодые фасциолы проникают в печень гематогенным путем
и через брюшную полость, становятся половозрелыми в среднем
за 3—4 мес и живут 8—10 лет (рис.23).
Эпизоотологические данные. Источник распространения инва-
зии в условиях Нечерноземья — зараженные животные, выпущен-
ные на пастбище без предварительной дегельминтизации. Опре-
деленную роль в этом процессе играют олени, косули, лоси, арха-
ры, верблюды, зайцы, кабаны, нутрии. Известно более 40 видов
животных, являющихся дефинитивными хозяевами фасциол.
79
Источник заражения — растительность и водоемы, где рассея-
ны адолескарии. Различные факторы внешней среды способству-
ют распространению промежуточных хозяев, развитию в них ли-
чиночных стадий фасциол, длительности сохранения в моллюске
и во внешней среде. Например, в Нечерноземной зоне России за
6 осенне-зимних месяцев яйца фасциол, адолескарии и заражен-
ные моллюски практически все погибают, следовательно, живот-
ные начинают заражаться главным образом с середины лета, тогда
как в теплых районах страны (в Средней Азии, Закавказье, Крас-
нодарском и Ставропольском краях и др.) инвазионное начало в
значительном количестве может сохраниться зимой ивесной стать
источником заражения.
Дождливые весна и лето при теплой погоде способствуют рез-
кому увеличению численности моллюсков, заражению их яйцами
фасциол и появлению в большом количестве адолескариев на паст-
бищах. Освоение новых земель с применением открытой системы
орошения также способствует распространению инвазии, так как
моллюски быстро осваивают новые биотопы.
Патогенез и симптомы болезни. Патогенез фасциолеза свя-
зан с биологией развития возбудителя у дефинитивных хозяев.
Молодые фасциолы, травмируя слизистую оболочку тощей киш-
ки, внедряются в мелкие капилляры, а затем через воротную вену
попадают в печень, переходят в ее строму, а затем в желчные ходы.
Некоторые из них проходят сквозь стенки кишечника и, попав в
брюшную полость через глиссонову капсулу, внедряются в строму
печени и желчные ходы. В кровеносных сосудах, стенке кишечни-
ка, лимфоузлах, брюшине, печени и желчных ходах в результате
травм возникает воспалительный процесс. Фасциолы переносят в
органы и ткани большое количество микрофлоры. Во время миг-
рации отдельные фасциолы погибают, освобождая значительное
количество антигена, который вместе с продуктами метаболизма
живых трематод оказывает аллергическое воздействие. Взрослые
фасциолы, передвигаясь в желчных ходах, травмируют их шипами
и способствуют отложению минеральных солей. Скапливаясь в
больших количествах, паразиты закупоривают желчные протоки и
вызывают застой желчи. Вследствие этого отдельные участки хо-
дов расширяются и заметно выступают на поверхности печени,
развивается цирроз.
Клиническое проявление фасциолеза (острое или
хроническое) зависит от интенсивности заражения, вида и возрас-
та животного. Наиболее тяжело с признаками острого течения бо-
леет молодняк овец и реже крупный рогатый скот. У взрослых
животных инвазия в основном протекает хронически или субкли-
нически.
Острое течение фасциолеза проявляется через 60—80 сут с на-
чала заражения и обусловливается миграцией молодых трематод и
их скоплением в печени. У инвазированных животных резко сни-
80
жается аппетит, общее состояние становится угнетенным, темпе-
ратура тела повышается до 41,2—41,6 °C. Видимые слизистые обо-
лочки бледные, иногда отмечают желтушность. Нарушается пи-
щеварение, наблюдают поносы и тимпанию. Дыхание учащенное
и поверхностное, отмечают нервные явления. Область печени
притуплена. При пальпации печень болезненна. Из-за асцита
объем живота может быть увеличенным.
Хроническое течение инвазии длится месяцами. Оно обусловле-
но паразитированием взрослых гельминтов. У больных овец отме-
чают вялость, исхудание, бледность и постоянную желтушность
слизистых оболочек. Поносы сменяются запорами, появляются
отеки в межчелюстном пространстве и нижней части тела. Шерсть
местами выпадает, становится ломкой. У коров симптомы болезни
выражены слабее. Отмечают гипотонию и атонию преджелудков,
снижение прироста массы, удоев, аборты. В крови уменьшается
количество эритроцитов, снижается уровень гемоглобина, отмеча-
ются эозинофилия и лейкоцитоз. Существенно нарушается вита-
минный обмен, особенно витаминов группы В, А и С. При фасци-
олезе, вызванном гигантской фасциолой, патологический процесс
проявляется глубже, а симптомы болезни выражены ярче.
Диагностика. При жизни диагноз ставят с учетом результатов
лабораторных исследований, а также эпизоотологических данных
и симптомов болезни. Очень важно своевременно выявить острый
фасциолез, для чего проводят диагностический убой больного жи-
вотного и исследуют печень методом полного гельминтологичес-
кого вскрытия. При убое такого животного выделяется очень мало
крови из-за развития асцита. Печень увеличена, края округлены,
на поверхности точечные кровоизлияния. Фасциолы светло-серо-
го цвета, величиной от нескольких миллиметров до 1 см.
При хроническом фасциолезе исследуют 4—5 г фекалий мето-
дом последовательных смывов. Для обнаружения яиц фасциол бе-
рут три капли со дна осадка, помещают их на предметное стекло и
накрывают другим тонким (толщиной 1 мм) предметным стеклом,
укороченным на 2 см.
При патологоанатомическом вскрытии обращают внимание на
желчные ходы печени. Желчный пузырь увеличен в объеме. На
разрезе печени находят отложения солей в желчных ходах, что не
бывает при ее токсическом поражении.
Яйца фасциол необходимо дифференцировать от яиц
парамфистомид, отличающихся рыхлым расположением желточ-
ных клеток и серым цветом.
Лечение. Лечение животных следует проводить строго диффе-
ренцированно с учетом возраста фасциол. Это связано с тем, что
антигельминтики действуют на трематод по-разному в зависимос-
ти от стадии их развития. Против молодых фасциол при остром
течении инвазии применяют ацемидофен, ацетвикол, дертил, ур-
совермит, фасковерм и фазинекс.
81
Ацемидофен назначают в виде 10%-ной водной суспен-
зии индивидуально перорально без ограничений в режиме корм-
ления. Доза для овец по действующему веществу (д. в.) 0,15 г/кг
массы тела. Крупному рогатому скоту с профилактической целью
дают 0,15 г/кг, с лечебной — 0,2 г/кг. Суспензию готовят непос-
редственно перед дегельминтизацией.
Препарат губительно действует на паразитов всех возрастов, но
особенно эффективен против юных и неполовозрелых фасциол.
Убой животных в течение 15 сут после дегельминтизации не раз-
решается.
Ацетвикол — стабильная суспензия ацемидофена. Перед
применением необходимо взболтать. Задают индивидуально, че-
рез рот. Доза для овец 1 мл/кг массы тела.
Д е р т и л выпускают в форме таблеток желтого цвета (дертил
О) для овец и зеленого (дертил Б) для крупного рогатого скота.
Дертил О овцам дают внутрь при хроническом фасциолезе в дозе
0,04 г, или одна таблетка на 50 кг массы тела, при остром 0,08 г/кг
(две таблетки на 50 кг массы). Каждая таблетка содержит 0,1 г д. в.
Дертил Б крупному рогатому скоту дают в дозе 0,04 г/кг (одна
таблетка на 100 кг массы тела). Каждая таблетка содержит 0,3 г
д. в. Лактирующим коровам препарат применять нельзя. Не следу-
ет заменять дертил Б дертилом О и наоборот. Эти таблетки после
раздробления или растворения можно применять с кормом или
водой.
Урсовермит (рафоксанид) — суспензия белого цвета. В
100 мл ее содержится 2,5 г д. в. рафоксанида. Срок хранения
2 года. Назначают индивидуально перорально однократно (перед
утренним кормлением). Суспензию взбалтывают и дозируют
шприцем. Применяют с лечебной и профилактической целями
овцам и крупному рогатому скоту в дозе 20 мл на 50 кг массы тела,
при остром фасциолезе — в дозе 30 мл на 50 кг массы тела. Лакти-
рующим животным давать препарат не рекомендуется. Убой раз-
решается не ранее чем через 28 сут после обработки.
Фасковерм. Выпускают во флаконах по 100 мл. В 1 мл пре-
парата содержится 50 мг клозантела гидроксида. Срок хранения
2тода. Применяют однократно подкожно или внутримышечно ов-
цам и крупному рогатому скоту в дозе 2—5 мг по д. в. на 1 кг массы
или 1 мл на 20 кг массы тела. Мясо и молоко животных не исполь-
зуют в пищу в течение 14 сут после обработки.
Фазинекс выпускают в виде суспензии. Применяют одно-
кратно через рот. Доза для овец 1 мл 5%-ной суспензии на 5 кг
массы тела, для крупного рогатого скота 6 мл 10%-ной суспензии
на 50 кг массы тела. Этот препарат не противопоказан беремен-
ным, сильно инвазированным и ослабленным животным. Лакти-
рующим животным применять не рекомендуется.
Гексихол назначают крупному рогатому скоту в дозе 0,3 г,
овцам и козам — 0,2 г на 1 кг массы тела. Дают однократно в смеси
82
с концентратами. Во избежание осложнений за 1 сут до обработки
и 2 сут после нее из рациона исключают легкосбраживающиеся
недоброкачественные корма. Установлено, что дача препарата в
смеси с мелкой поваренной солью (натрия хлоридом) в соотноше-
нии 2 :1 профилактирует нежелательные последствия. Молодняку
крупного рогатого скота и овцам гексихол скармливают группо-
вым методом (20—30 животным).
Политрем — лекарственная форма, полученная на основе
гексихола С. Применяют с концентрированными кормами без ог-
раничения режима кормления. Доза для крупного рогатого скота
0,3 г на 1 кг, для овец и коз —0,14 г на 1 кг массы тела. Овцам и
молодняку крупного рогатого скота назначают групповым спосо-
бом. Срок годности препарата 1 год со дня изготовления.
Четыреххлористый углерод вводят крупному ро-
гатому скоту внутримышечно в виде смеси с медицинским вазели-
новым маслом (1:1) в дозе 10 мл на 100 кг массы тела.
Препарат оказывает заметное отрицательное влияние на работу
сердца, легких и в особенности печени, поэтому следует избегать
его частого применения.
Д и с а л а н назначают индивидуально перорально в форме
водной суспензии или в смеси с комбикормом. Доза 15 мг на 1 кг
массы тела нелактирующим коровам и 10 мг на 1 кг массы 2 дня
подряд овцам. Убой разрешается через 28 сут после дачи препа-
рата.
Ивомек плюс с содержанием 1 % ивермектина и 10 %
клорсулона вводят нелактирующим коровам подкожно в дозе 1 мл
на 50 кг массы тела. Убой разрешается через 28 сут после дегель-
минтизации.
Д и с а л а р (действующее вещество — дисалан) в форме 10%-
ного раствора эффективен против эстроза и фасциолеза овец.
Вводят внутримышечно однократно в дозе 1 мл на 20 кг массы
тела.
Р о л е н о л (действующее вещество — клозантел) выпускают
во флаконах по 100 и 250 мл. В 1 мл раствора — 25 мг д. в. Вводят
однократно внутримышечно или подкожно из расчета 0,5 мл на
10 кг массы тела. Применяют нелактирующим коровам. Убой раз-
решается через 28 сут после дегельминтизации.
При фасциолезе применяют также вермитан, ацетокс, альбен-
дазол, валбазен, левацид, корибан и др.
Профилактика и меры борьбы. Проводят комплекс ветеринар-
но-санитарных мероприятий с учетом биологии возбудителей и
эпизоотологии фасциолеза. Главные звенья этих мероприятий —
изучение гельминтологической ситуации пастбищ, плановые де-
гельминтизации животных и обеззараживание навоза.
Профилактические дегельминтизации следует проводить в со-
ответствии с климатогеографическими условиями. Так, в Нечер-
ноземье молодняк животных целесообразно дегельминтизировать
83
трижды: первый раз — в конце сентября или начале октября, вто-
рой — в начале января и третий раз (при необходимости) — за ме-
сяц перед выгоном животных на пастбище. Взрослых животных
дегельминтизируют первый раз в ноябре или январе и второй раз
(при необходимости) — в начале весны.
В Средней Азии животные заражаются почти круглый год, но
преимущественно во второй половине лета и осенью. Поэтому ре-
комендуется трехкратная дегельминтизация: первая — в апреле—
мае, вторая — в августе—сентябре и третья — в декабре—январе. В
пустынно-пастбищной зоне достаточна однократная обработка в
декабре (Ш. А. Азимов, 1971). В Закавказье овцы заражаются в ос-
новном после пригона с летних пастбищ, следовательно, острый
фасциолез наблюдается в конце декабря или начале января. По-
этому преимагинальную дегельминтизацию целесообразно прово-
дить через 6 нед после прибытия на зимние пастбища (Я. Гаджиев
и др., 1988). При необходимости обработку повторяют в конце ян-
варя — начале февраля.
На Украине животные начинают заражаться в июне—июле,
следовательно, дегельминтизацию нужно проводить не менее
3 раз в год: в августе—сентябре, октябре—ноябре и весной перед
выгоном скота на пастбище.
Сроки дегельминтизации должны быть уточнены на местах.
Мероприятие должно охватить и животных индивидуального сек-
тора. Лучше проводить преимагинальную дегельминтизацию. Об-
работать надо весь гурт или отару, если даже в лаборатории уста-
новлена не 100%-ная зараженность животных.
Надежно предотвращает животных от заражения и заболевания
фасциолезом стойлово-выгульное содержание в летне-осенний
период с обязательной подкормкой свежей зеленью и сеном с бла-
гополучных сенокосов. В неблагополучных хозяйствах через каж-
дые 2 мес животных переводят на новые участки выпаса. При от-
сутствии такой возможности пастбища меняют 1 раз. Время смены
пастбищ в зависимости от климатогеографических условий — для
Нечерноземья — в конце июля — начале августа. Надежно предот-
вращают рассеивание яиц фасциол биотермическое обеззаражива-
ние навоза, постройка навозохранилищ на территории ферм круп-
ного и мелкого рогатого скота.
На ограниченных территориях проводят борьбу с моллюсками
путем осушения небольших биотопов или путем засыпки их зем-
лей и гравием. Применяют также в июне и августе химические
средства, такие, как меди сульфат в концентрации 1: 5000, дихлор-
салициланилид 1:10 000 и свежегашеная известь из расчета 1300—
1500 кг на 1 га, аммиачная селитра — 200—300 кг на 1 га и другие
моллюскоциды. Эффективность дегельминтизаций определяют
через 28—30 сут. Благополучие хозяйств устанавливают комплекс-
ными исследованиями — гельминтоовоскопией и гельминтологи-
ческим вскрытием печени.
84
6.5. ПАРАМФИСТОМАТОЗЫ
Парамфистоматозы — остро или хронически протекающие за-
болевания крупного и мелкого рогатого скота, а также диких
жвачных. У домашних и диких жвачных описано более 60 видов
парамфистомат.
Локализация — преджелудки (половозрелые гельминты) и под-
слизистая оболочка 12-перстной кишки (молодые паразиты).
Распространение. Парамфистоматы распространены повсюду —
в Азии, Африке, Австралии, Америке и Европе, но наибольшее
разнообразие видового состава наблюдается в странах с тропичес-
ким и субтропическим климатом.
Тот или иной вид, нередко в сочетании, встречается в Средней
Азии, Казахстане, Закавказье, на Украине, в центральных райо-
нах Нечерноземья, Белоруссии. Гибель молодняка от этого забо-
левания достигает 30—40%. У больных животных в 10—20 раз
снижается прирост живой массы, среднесуточные надои от коров
в среднем уменьшаются на 700 г, настриг шерсти от одной овцы —
на 300 г. Усвояемость питательных веществ корма у зараженных
животных ниже, чем у здоровых, так как парамфистоматы уничто-
жают большое число инфузорий — мутуалистов.
Возбудители. Заболевание вызывают трематоды Paramphisto-
mum ichikawai, Р. cervi, Liorchis scotiae, Calicophoron calicophorum
из семейства Paramphistomatidae и Gastrothylax crumenifer из се-
мейства Gastrothylacidae подотряда Paramphistomata.
По внешнему виду парамфистомат трудно дифференцировать.
Все они конической (грушевидной) формы, слабо-розового цвета.
Ротовая присоска отсутствует, а брюшная — мощная, расположена
на заднем конце тела. Длина трематод от 5 до 20 мм. Две кишеч-
ные трубки не разветвлены. В отличие от фасциол два семенника
компактные, поперечно-овальной формы, находятся один позади
другого в средней части тела. Яйца размером (0,11—0,16) х (0,07 —
0,08) мм, овальной формы, серого цвета, не полностью заполнены
желточными клетками (рис. 24).
Биология развития. Парамфистоматы — биогельминты, развива-
ются с участием промежуточных хозяев — пресноводных моллюс-
ков родов Planorbis, Anisus и других из семейства Planorbidae. Яйца
и личинки в основном развиваются так же, как фасциолы. Развитие
церкариев в теле моллюска завершается за 2,5—3 мес. После этого
они выходят в воду и формируются в адолескариев.
Жвачные животные заражаются на низинных болотистых паст-
бищах во время пастьбы и водопоя. В желудке и 12-перстной киш-
ке циста адолескария разрушается, и молодые трематоды активно
внедряются в подслизистую оболочку 12-перстной кишки. Здесь
они паразитируют около 2 мес и более, затем мигрируют в пред-
желудки (главным образом в рубец). Половой зрелости трематоды
85
1
ж
Рис. 24. Парамфистомум и стадии его развития:
а —строение Paramphistomum spp.: 7 —ротовое отверстие; 2—пищевод; 3 — кишечник; 4—
желточник; 5—половая бурса; о —семенники; 7—брюшная присоска; б—яйцо; в — церка-
рий; г —адолескарий; д— моллюски Р. planorbis; е — пилорическая часть 12-перстной кишки,
пораженной юными парамфистомами; ж — участок рубца, пораженный взрослыми трематода-
ми (по Капустину)
достигают в разные сроки: лиорхисы у крупного рогатого скота —
за 97—130 сут, у овец —за 96—107 сут; парамфистомиды — соот-
ветственно за 40—100 и 103—115 сут. Продолжительность жизни
взрослых паразитов 4—5 лет (рис. 25).
Эпизоотологические данные. Источник заражения животных —
болотистые переувлажненные пастбища, водоемы, неблагополуч-
ные по инвазии. Источники распространения инвазии — больные
животные (крупный и мелкий рогатый скот, буйволы, зебу, лоси,
зубры, олени, косули и другие дефинитивные хозяева). Огромное
значение в распространении парамфистоматозов имеют зональ-
86
Рис. 25. Биология развития парамфистомид:
1 — общий вид трематоды; 2 — яйцо; 3 — мирацидий; 4 — спороциста; 5 — редия;
6— церкарий; 7—моллюски; 8— адолескарий
ные особенности региона, связанные с теплым климатом и высо-
кой влажностью. Так, инвазия часто встречается у животных всех
видов в тропических и субтропических районах.
С возрастом интенсивность инвазии повышается и у многих
коров может достигать 100 тыс. экз. и более. Степень инвазии
снижается к весне, а с мая снова нарастает, максимум приходится
на осень И начало зимы.
Биотопы (естественные места обитания) моллюсков семейства
Planorbidae расположены по берегам мелководных каналов, пру-
дов, ручьев, заводей рек и на заливных пастбищах.
87
Патогенез и симптомы болезни. Молодые трематоды в период
миграции могут внедряться не только в подслизистую оболочку
12-перстной кишки и желудка (типичные места миграции), но и в
желчный проток, поджелудочную железу, а также в лимфатичес-
кую систему кишечника. Паразиты травмируют ткани, в результа-
те в кровь и ткани проникают различные микроорганизмы из ки-
шечника; возникают изменения экссудативно-альтернативного
характера. Частичная гибель молодых трематод в тканях и орга-
нах, а также продукты их метаболизма вызывают аллергию. Взрос-
лые парамфистоматы, прикрепляясь мощной брюшной присос-
кой к слизистой преджелудков, вызывают ее атрофию и нарушают
секрецию и всасывание. Значительное количество инфузорий-му-
туалистов уничтожается трематодами, что сказывается на интен-
сивности расщепления клетчатки в преджелудках.
При остром течении инвазии у молодняка наблюдают-
ся общее угнетение, слабость, потеря аппетита и анемия. Харак-
терный признак— диарея (постоянное выделение зловонных,
преимущественно водянистых фекалий). Отмечают колики, отеки
в области подчелюстного пространства, прогрессирующее исхуда-
ние, приводящее через 7—14 сут к гибели животных. Уже через
15 сут с начала заражения содержимое преджелудков становится
кислее, в результате количество инфузорий в них снижается.
Хроническое течение болезни отмечается у более
взрослых животных и сопровождается нарушением функции пи-
щеварительного канала, снижением аппетита, исхуданием, отека-
ми в нижних частях тела и т. д.
Диагностика. Прижизненный диагноз ставится комплексно с
учетом эпизоотологических данных, симптомов болезни и резуль-
татов лабораторных исследований. При остром течении инвазии
применяют метод гельминтоскопии фекалий. От больных живот-
ных берут 150—200 г фекалий и исследуют в черной кювете мето-
дом последовательных смывов. Обнаруживают молодых трематод
длиной 0,5—3 мм. Эффективность метода — до 80 %.
Хроническое течение болезни диагностируют путем обнаруже-
ния яиц при исследовании фекалий методом последовательных
смывов.
Патологоанатомические изменения. При остром течении инвазии
находят воспаление и многочисленные кровоизлияния в слизистой
оболочке желудка и 12-перстной кишки, обилие слизи. Брыжеечные
лимфатические узлы увеличены, сочны на разрезе. В подслизистом
слое 12-перстной кишки обнаруживают молодых трематод. В брюш-
ной полости — значительное количество жидкости.
Гельминтологическое вскрытие кишечника и преджелудков
(при хроническом течении болезни) дает возможность обнару-
жить соответственно молодых и половозрелых парамфистомат.
Лечение. Битионол назначают овцам в дозе 0,15г на 1 кг
массы тела индивидуально или в дозе 0,2 г на 1 кг массы тела груп-
88
повым методом с комбикормом. Крупному рогатому скоту этот
препарат дают индивидуально с комбикормом в дозе 0,07 г на 1 кг
массы тела после 12-часовой голодной диеты.
Платенол (20%-ный гранулят битионола) задают крупно-
му рогатому скоту в смеси с комбикормом индивидуально в дозе
50 мг на 1 кг массы тела, овцам — в той же дозе индивидуально
или групповым методом в смеси с 300 г комбикорма на животное.
Политрем назначают однократно в дозе 0,5 г на 1 кг массы
тела в утреннее кормление (после 12-часового голодания) в смеси
с комбикормом. Препарат животные поедают неохотно, поэтому
необходим индивидуальный подход. Убой животных разрешен че-
рез 12, 7 и 15 сут после дегельминтизации соответственно битио-
нолом, платенолом и политремом.
Для дегельминтизации отдельных животных можно применять
петролейное масло внутрь в дозе 150—200 мл. За рубе-
жом рекомендуют применять ряд антигельминтиков, таких, как
никлозамид, резорантел, оксиклозанид, р и -
тинол, никлофолан, которые эффективны против моло-
дых и взрослых трематод.
Профилактика. Необходимы стойлово-выгульное содержание
телят до года и выпас молодняка старших возрастов на культурных
и суходольных пастбищах. Летом (июнь —июль) проводят пре-
имагинальную дегельминтизацию, а зимой (январь) и весной (на-
чало марта) — против взрослых форм паразита. Борьба с моллюс-
ками и другие мероприятия те же, что и при фасциолезе.
6.6. ДИКРОЦЕЛИОЗ
Дикроцелиоз — хронически протекающее заболевание мелкого
и крупного рогатого скота, многих диких животных, а иногда и
человека, возбудитель которого мелкие трематоды.
Локализация — желчные ходы печени.
Распространение. Дикроцелиоз в нашей стране распространен
повсюду, особо пагубно влияет на овец. Особенно неблагополуч-
ны по дикроцелиозу предгорные и горные районы Центрального
Кавказа, Читинская область, отдельные южные районы Казахста-
на, Средней Азии, Украины, Молдовы и Закавказья. В Ульяновс-
кой, Курской и Калужской областях зараженность овец достигает
80%.
Болезнь сопровождается потерей шерстной продуктивности,
падежом, недополучением приплода, ухудшением качества про-
дукции, а главное — выбраковкой печени.
Возбудитель. Заболевание вызывают трематоды Dicrocoelium
lanceatum семейства Dicrocoeliidae. Тело паразита продолговатое,
зауженное с обоих концов, темно-серого цвета, длиной 8—10 мм,
шириной 1,5—2 мм. Характерный признак возбудителя — темно-
89
коричневые петли матки, занимают заднюю половину, а два ок-
руглых семенника (иногда лопастные), расположенные наискось,
находятся в передней части тела. Непарный округлой формы яич-
ник расположен позади семенников.
Яйца асимметричные, темно-бурого цвета, размером (0,02—
0,03) х (0,038—0,045) мм (рис. 26). В яйце находится мирацидий, в
задней части тела которого видны два темных пятнышка (глазки
Лейкарта).
Биология развития. Развитие паразита происходит с участием
промежуточных хозяев — сухопутных моллюсков из родов
Helicella, Chondrula, Zonitoides, Fruticicola и др. (более 40 видов).
Дополнительные хозяева — муравьи из родов Formica и
Proformica (более 20 видов). Яйца дикроцелиумов с желчью попа-
Рис. 26. Дикроцелиум и стадии его развития:
а — D. lanceatum: 7 —ротовая присоска; 2— глотка; 3— пищевод; 4— половая бурса; 5—ки-
шечник; 6 — брюшная присоска; 7—семенники; 8 — яичник; 9 —желточник; 10 — петли мат-
ки; б— яйцо;
промежуточные хозяева — сухопутные моллюски: в — Chondrula tridens; г — Zonitoides nitidus;
д — Helicella crenimargo; e — H. derbentina;
дополнительные хозяева — муравей и личиночные стадии дикроцелиума: ж — муравей F. rufibarbis
с метацеркариями; з — метацеркарий инцистированный; и — личинка, освобожденная из цис-
ты; к — церкарий; л — печень, пораженная дикроцелиумами
90
Рис. 27. Биология развития D. lanceatum:
1 — общий вид трематоды; 2 — яйцо; 3 — мирацидий; 4 — спороциста; 5 — церкарий;
6— моллюски; 7—муравей; 8— оцепеневший муравей
дают в кишечник, затем выделяются наружу и вместе с травой заг-
латываются моллюсками (рис. 27). В кишечнике моллюска из
яйца выходит мирацидий, который внедряется в печень. В печени
мирацидий превращается в материнскую спороцисту. Внутри ее
развиваются дочерние спороцисты. В дальнейшем материнская
спороциста разрушается, а в дочерних развиваются церкарии,
мигрирующие в полость легких. Здесь они инцистируются и фор-
мируются в слизистые комочки (100—ЗООэкз.). После дождя или
обильной росы моллюски, ползая по траве, выделяют эти комоч-
ки, которые затем поедают рабочие муравьи.
91
Развитие яйца до церкария в среднем продолжается от 3—4 до
5—6 мес. Церкарии из кишечника муравья проникают в брюшную
полость, где инцистируются и за 26—60 сут достигают инвазион-
ной стадии — метацеркария.
Как правило, один церкарий из числа проглоченных муравьем
внедряется в подглоточный ганглий, иннервирующий челюстной
аппарат насекомого. В результате у муравья нарушается функция
нервной системы. Утром и вечером (в прохладное время суток), а
в пасмурную погоду в течение дня такие муравьи впадают в состо-
яние оцепенения. Животные заражаются, поедая вместе с листья-
ми таких муравьев. В кишечнике животных метацеркарии теряют
цисту, и молодые дикроцелиумы внедряются в печень через об-
щий желчный проток. Здесь они достигают половой зрелости за
40—76 сут в зависимости от вида животного. В организме овцы
дикроцелиумы живут более 6 лет.
Эпизоотологические данные. Кроме мелкого и крупного рогато-
го скота источниками распространения инвазии могут быть и ди-
кие животные — косули, олени, архары, сайгаки, зайцы и даже
медведи. Дикроцелиумами заражаются многие виды грызунов.
Инвазия возможна и у человека. Столь широкое распространение
дикроцелиоза связано со множеством видов промежуточных и до-
полнительных хозяев возбудителя, в теле которых личинки могут
сохраняться соответственно 24 и 7—8 мес. Яйца дикроцелиумов во
многих районах страны могут сохранять жизнеспособность более
года. Особенно неблагополучны пастбища ранней весной и в
июле—сентябре, когда встречается большое количество «оцепе-
невших» муравьев. У муравейников экстенсивность инвазии дос-
тигает 30 %, а у моллюсков — 50 % и более.
Патогенез и симптомы болезни. Патогенное влияние дикроцели-
умов связано с большим скоплением их в желчных ходах печени.
Болезнь проявляется обычно в возрасте 1,5 года, когда интенсив-
ность инвазии достигает 250—300 экз. У взрослых овцематок инва-
зированность непрерывно возрастает, и к 4—5 годам численность
дикроцелиумов у них в среднем составляет 10—15 тыс. экз. Под
воздействием продуктов метаболизма происходит аллергическая
перестройка всего организма. В результате морфофункциональ-
ных изменений в печени нарушаются нормальное выделение жел-
чи и ее поступление в кишечник. Это, в свою очередь, сказывается
на моторике кишечника и пищеварении, возникают токсикозы и
гиповитаминозы.
Взрослые овцематки при высокой интенсивности инвазии уг-
нетены (особенно весной), быстро худеют. В области подгрудка и
в межчелюстном пространстве появляется отечность, шерсть ста-
новится ломкой, выпадает. Часто нарушается пищеварение. У су-
ягных маток перед гибелью нередко отмечают коматозное состоя-
ние. У молодняка при низкой степени инвазии болезнь протекает
субклинически. Острое течение инвазии не наблюдается.
92
Диагностика. При жизни диагноз ставят с учетом эпизоотологи-
ческих данных, симптомов болезни и результатов лабораторных
исследований. Для обнаружения яиц дикроцелиумов исследуют
фекалии методом последовательных смывов. При вскрытии пав-
ших животных отмечают увеличение желчного пузыря и расшире-
ние желчных протоков печени. Окраска печени желтовато-корич-
невая, на ее поверхности выступают соединительнотканные обра-
зования. Отмечают биллиарный цирроз, интерстициальный гепа-
тит, атрофию печени. При дикроцелиозе в отличие от фасциолеза
в желчных ходах печени не отмечают обызвествления.
Лечение. Крупному и мелкому рогатому скоту назначают по-
ли т р е м в дозе 0,3 г на 1 кг массы тела. Овцам и козам его дают
групповым методом, для чего препарат смешивают с комбикор-
мом (из расчета 150—200 г на животное) и скармливают утром.
Крупный рогатый скот препарат получает индивидуально с ком-
бикормом.
Фенбендазол (панакур) овцам и козам дают 2 дня
подряд в дозе 22,2 мг по д. в. на 1 кг массы тела с комбикормом
путем группового (по 100—150 гол.) скармливания. Крупному ро-
гатому скоту препарат назначают в дозе 33 мг по д. в. на 1 кг
массы тела. Скармливают его однократно индивидуально в смеси
с 0,5—1,0 кг комбикорма.
Тиабендазол в виде суспензии эффективен в дозе 200—
300 мг на 1 кг массы тела при назначении внутрь однократно.
Можно давать при помощи пистолета-дозатора.
Фасковерм (клозантел) назначают в дозе 1 мл на
10 кг массы тела внутримышечно однократно.
Фазинекс применяют внутрь из расчета 6—12 мг на 1 кг
массы тела. Препарат выпускают в виде 5—10%-ной суспензии.
Камбендазол дают внутрь крупному рогатому скоту в
дозе 25 мг на 1 кг, овцам — 30—40 мг на 1 кг массы тела.
Профилактика и меры борьбы. Учитывая сложный путь разви-
тия дикроцелиумов, основным эффективным методом борьбы с
инвазией следует считать дегельминтизацию животных. Проводят
ее в ноябре и декабре, обрабатывают все поголовье. Вынужденная
дегельминтизация животных возможна в любое время года. Эф-
фективность дегельминтизации определяют через 20—28 сут после
обработки.
С профилактической целью овец дегельминтизируют в следую-
щие сроки: первый раз — в 1,5 года, второй — в 3 года, третий — в
5 лет и четвертый, последний раз — в 7 лет.
Необходимо систематически улучшать пастбища и сенокосы.
Для этого уничтожают кочки, кротовины и кустарники, так как в
них чаще всего обитают моллюски. В .августе и сентябре животных
следует пасти по стерне. Необходимо строить навозохранилища
при кошарах и фермах, а навоз на поля вывозить только после
биотермического обезвреживания.
93
6.7. ХАССТИЛЕЗИОЗ МЕЛКОГО РОГАТОГО СКОТА
Хасстилезиоз — заболевание овец, коз, архаров, вызываемое
трематодой подотряда Fasciolata.
Локализация — в глубоких и верхних слоях слизистой тонкой
кишки.
Распространение. Заболевание распространено в горных райо-
нах Казахстана, Средней Азии и Тывы. Больной молодняк из-за
нарушения обмена веществ отстает в росте и развитии. Разница в
живой массе контрольных и подопытных животных через 4мес
после заражения достигает в среднем 5,6—7,6 кг.
Возбудитель — трематода Hasstilesia ovis семейства Brachy-
laemidae бурого цвета, яйцевидной формы, длиной 0,92—1,12 мм,
шириной 0,49—0,7 мм. Поверхность тела покрыта шипиками, ро-
товая и брюшная присоски примерно одинаковой величины. Два
семенника округлой формы занимают заднюю часть гельминта.
Яичник непарный, округлый, находится впереди семенников.
Утолщенные трубки матки с яйцами расположены в передней час-
ти тела, желточники идут по бокам тела. Яйца асимметричные, с
выпуклой крышечкой, темно-бурые, длиной 0,019—0,035 мм, ши-
риной 0,016—0,032 мм, содержат инвазионные мирацидии
(рис. 28).
Биология развития. Трематоды развиваются с участием проме-
жуточных хозяев — сухопутных моллюсков Pupilla muscorum и
Vallonia costata и дефинитивных хозяев — овец, коз, архаров, козе-
рогов. Экспериментально заражаются кролики.
Рис. 28. Хасстилезия и ее стадии развития:
а — Hasstilesia ovis (по Касьянову): 1 — ротовая присоска; 2 — глотка; 3 — брюшная присоска;
4 — желточники; 5 — петли матки; <5—яичник; 7—половая бурса; 8— кишечник; 9— тегумент
с шипами; 10— семенники; 11 — выделительный канал; б—яйцо; в — спороциста; г —церка-
рий; д — метацеркарий; промежуточные хозяева — сухопутные моллюски: е — Pupilla muscorum;
ж — Vallonis costata
94
Выделенные наружу яйца гельминтов поедают моллюски, в ки-
шечнике которых вылупляются мирацидии. Из них в печени мол-
люска формируются спороцисты, в которых развиваются церка-
рии, затем метацеркарии. Цикл развития длится 2,0—2,5 мес.
Мелкий рогатый скот заражается при поедании инвазирован-
ных моллюсков. Метацеркарии, освободившись из тела моллюска
и окружающей их оболочки в 12-перстной кишке овцы и других
животных, прикрепляются к слизистой оболочке кишечника и за
25—30 сут вырастают до половой зрелости. Продолжительность
жизни паразита более года (рис. 29).
Эпизоотологические данные. Максимум зараженности молодня-
ка овец, например в Алма-Атинской области, приходится на ок-
тябрь (93,4%), в январе экстенсивность инвазии составляет
63,3 %, в марте — апреле — 30 %. Среди взрослых животных дина-
мика инвазии соответствует таковой у молодняка, но степень за-
раженности гораздо ниже (33,3 %). Молодняк текущего года рож-
дения заражается наиболее интенсивно (до 120 тыс. экз.), но с воз-
растом степень зараженности заметно снижается и к 2 годам со-
ставляет около 40 тыс. экз. Интенсивность инвазии у взрослых
овец составляет 107—2574 экз. Метацеркарии перезимовывают в
моллюсках и весной становятся источником заражения животных.
Промежуточные (они же дополнительные) хозяева хасстилезий
распространены на горных влажных, засоренных камнями, кус-
тарниками пастбищах. Располагаются очагово колониями по
80 экз. на 1 м2.
Патогенез и симптомы болезни. Трематоды присасываются сво-
ими присосками к слизистой оболочке тонкой кишки, часто ме-
няют место локализации. Кроме того, острыми шипами, которы-
ми покрыта их поверхность, они раздражают ткани в местах их
локализации. В результате возникают морфофункциональные из-
менения и атрофия слизистой и глубжележащих слоев тонкого ки-
шечника, что в целом приводит к нарушению секреции и экскре-
ции кишечных ферментов, пищеварения.
Первые клинические признаки заболевания у ягнят отмечают
через 14—15 сут после выгона их на неблагополучные пастбища. У
отдельных животных отмечают залеживание, вялость, напряжен-
ность брюшной стенки. На 30—35-е сутки развивается диарея.
Животные отказываются от корма, фекалии темно-коричневого
цвета, зловонного запаха, слизистые оболочки бледные. Темпера-
тура тела повышается до 40,2—40,7 °C. В крови уменьшается коли-
чество эритроцитов, гемоглобина, увеличивается число лейкоци-
тов и эозинофилов.
У взрослых животных указанные признаки менее выражены,
но хронически больные животные худеют и отстают в росте и раз-
витии.
Диагностика. Проводят комплексные исследования, придавая
особое значение эпизоотологии и обнаружению яиц методом пос-
95
Рис. 29. Биология развития Н. ovis:
7 — общий вид трематоды; 2 —яйцо; 3 — спороцисты; 4— церкарий; 5—моллюски; 6 —
метацеркарий; 7— метацеркарий в моллюске
ледовательных смывов. При гельминтологическом вскрытии важ-
ную роль играет тщательное изучение слизистой тонкого кишеч-
ника.
Изменения, наблюдаемые при вскрытии, достаточно характер-
ны. Стенки 12-перстной и тощей кишок утолщены и имеют труб-
кообразный вид. Выражены катаральное воспаление и отек слизи-
стой оболочки кишечника, просвет его сужен.
96
Лечение и профилактика. Достаточно эффективно индивидуаль-
ное применение урсовермита (2,5%-ная суспензия рафок-
сонида) в дозах 0,75—0,8 мл на 1 кг массы тела.
Ацетвикол дают индивидуально перорально в дозе 150 мг
по д. в. на 1 кг массы тела.
Ивомек (1%-ный раствор ивермектина) применяют под-
кожно однократно в дозе 1,125 мл на 1 кг массы тела.
П а н а к у р (22,2%-ный гранулят) скармливают групповым
методом с комбикормом в дозе 0,015 г по д. в. на 1 кг массы тела
или 68 мг панакур-гранулята на 1 кг массы тела. Есть и такие ан-
тигельминтики, как ивомек плюс, вермитан, полит-
рем, фазинек с, роленол и др.
С целью профилактики молодняк текущего года рождения сле-
дует выпасать на открытых, менее засоренных и заросших пастби-
щах. Молодняк старше года и взрослых животных дегельминтизи-
руют за месяц перед выгоном на пастбище, а затем дважды через
50 и 90 сут. Ягнят текущего года рекомендуют дегельминтизиро-
вать трижды. Первый раз — через месяц с начала пастьбы.
6.8. 0ПИСТ0РХ03 И ДРУГИЕ ТРЕМАТ0Д03Ы ПЛОТОЯДНЫХ
Описторхоз — хронически протекающее заболевание в основ-
ном собак, кошек, пушных зверей. Тяжело болеет и человек.
Локализация — желчные ходы печени и реже поджелудочная
железа.
Распространение. Очаги описторхоза распространены в бассей-
нах рек Оби и Иртыша, реже Печоры, Днепра, Дона, Волги, Се-
верной Двины и Немана. Инвазия имеет тенденцию к более ши-
рокому распространению.
Возбудитель — трематода Opisthorchis felineus семейства
Opisthorchidae. Тело ее продолговатое, заметно суживающееся к
переднему концу, длиной 8—13 мм, шириной 1,2—2,6 мм. Специ-
фический признак — два лопастных семенника, расположенных
наискось в задней части тела. Между ними проходит экскретор-
ный канал S-образной формы. Петли матки находятся впереди се-
менников.
Яйца мелкие — (0,01—0,02) х (0,662—0,003) мм, бледно-желто-
го цвета, с нежной двухконтурной оболочкой, крышечкой на од-
ном полюсе и бугорком на противоположном. Яйца при выходе
наружу уже инвазионны, так как содержат мирацидий (рис. 30).
Биология развития. Описторхисы развиваются с участием про-
межуточных хозяев — пресноводных моллюсков рода Codiella и
дополнительных хозяев — рыб семейства карповых (карп, линь,
вобла, красноперка, сазан, лещ, жерех, плотва и др.) (рис. 31).
Яйца трематоды попадают в воду, заглатываются моллюсками. В
их кишечнике из яиц вылупляются мирацидии, мигрирующие в
97
Рис. 30. Описторхис и его стадии развития:
а — Opisthorchis felineus: 7 —ротовая присоска; 2 — глотка; 3— пищевод; -/—кишечник; 5—
брюшная присоска; 6— петли матки; 7— семявыносящий канал; 8 — желточник; 9— яичник;
10— семяприемник; 11 — семенники; 12 — выделительный канал; б — яйцо; в— мирацидий;
г — церкарий; д — метацеркарий; е — промежуточный хозяин моллюск Bithynia leachi; ж — пе-
чень кошки, пораженная описторхисами
печень и превращающиеся в спороцисту. В печени развиваются
редии, затем церкарии, которые, выйдя в воду, активно внедряют-
ся через кожу в мышцы рыб, превращаясь в дальнейшем в мета-
церкариев — инвазионную стадию. Срок развития от яйца до ме-
тацеркария 2,5 мес.
Плотоядные животные и человек заражаются при потреблении
сырой, слабомороженой или вяленой рыбы, инвазированной
метацеркариями. Из кишечника дефинитивного хозяина юные
паразиты проникают через желчный и поджелудочный протоки в
98
Рис. 31. Биология развития О. felineus:
7 —общий вид трематоды; 2 — яйцо; 3 — мирацидий; -/—спороциста; 5—церкарий;
6— моллюск; 7—рыбы
печень и поджелудочную железу. В печени дефинитивного хозяи-
на описторхисы за 21—28 сут достигают половой зрелости. Про-
должительность жизни трематод в организме у плотоядных живот-
ных более 3 лет, в организме человека — 10—20 лет.
Эпизоотологические данные. Описторхоз — природное очаговое
заболевание, которое поддерживается во многих районах благода-
ря наличию диких плотоядных животных. Описторхозом тяжело
болеют пушные звери, собаки, кошки, может заразиться свинья.
Болеет также человек. Основной источник распространения инва-
99
зии — человек и плотоядные животные. Большая плотность мол-
люсков (5 тыс. экз. и выше на 1 м2) в поймах рек и значительное
разнообразие пресноводных рыб (источника заражения) — причи-
ны широкого распространения заболевания. Значительная роль в
распространении принадлежит и традициям народов Севера, ко-
торые часто употребляют рыбу в сыром виде. В отдельных очагах
экстенсивность инвазии у кошек достигает 87,8 %, у человека —
80%, при большой степени интенсивности — соответственно 5 и
25 тыс. экз.
Патогенез и симптомы болезни. На организм зараженных живот-
ных гельминты, особенно молодые, имеющие на поверхности тела
шипы, оказывают аллерготоксическое, нервно-рефлекторное, ме-
ханическое воздействие и способствуют возникновению вторич-
ной инфекции в результате инокуляции микрофлоры. У живот-
ных через 15—20 сут после заражения понижается аппетит, выра-
жены угнетенное состояние, расстройство пищеварения, желтуш-
ность видимых слизистых оболочек и болезненность в области
печени. При длительном течении инвазии у кошек прощупыва-
ются бугристость печени, расширенные участки желчных прото-
ков. Принято считать, что описторхисы обусловливают вторич-
ный рак печени.
На вскрытии при интенсивной инвазии печень уплотнена, че-
рез Глиссонову капсулу просматриваются кистеобразно расши-
ренные с утолщенной стенкой желчные протоки. В них заметны
разрастания эпителия, имеющие характер папиллом или аденом, а
чаще — тех и других. В поджелудочной железе — пролиферации
эпителия протоков.
Диагностика. Кроме учета эпизоотологических данных и кли-
нических признаков гельминтоза для постановки диагноза ис-
пользуют метод последовательных смывов фекалий, метод флота-
ции с применением насыщенного раствора гипосульфита натрия
(1750 г на 1л кипящей воды) по Щербовичу и нитрата натрия (1 кг
на 1 л кипящей воды) по Калантаряну.
Описторхисы следует дифференцировать от клонорхисов, у ко-
торых яичник и семенники сильно ветвятся.
Лечение. При описторхозе высокоэффективны гексихол и
политрем, назначаемые однократно индивидуально собакам,
кошкам, песцам, лисам и соболям в дозе 0,2 г и 0,15 г на 1 кг мас-
сы тела соответственно в смеси с мясным фаршем.
Празиквантел применяют однократно собакам в дозе
100 мг на 1 кг массы тела в смеси с небольшим количеством мяс-
ного или рыбного фарша после 12-часового голодания, кошкам —
через зонд с небольшим количеством воды.
Гексахлорэтан назначают собакам в дозе 0,1—0,2 г на
1 кг массы тела с небольшим количеством корма (мясной фарш,
каша) после 14-часового голодания; пушным зверям его дают од-
нократно в дозе 0,1—0,2 г на 1 кг массы тела по той же методике,
100
что и собакам. В настоящее время применяют еще ряд препаратов:
атазол, вермитан и др.
Профилактика и меры борьбы. Большое значение в борьбе с ин-
вазией имеют ветеринарно-санитарное просвещение населения,
охрана водных ресурсов от загрязнения испражнениями заражен-
ных животных.
Свежую рыбу, используемую для кормления пушных зверей и
собак, исследуют на зараженность метацеркариями. Для этого
тонкий срез (2—3 мм) подкожных спинных мышц с двумя-тремя
каплями воды сдавливают между предметными стеклами и про-
сматривают под лупой (х 14—28) или микроскопом (х 56). Мета-
церкарий округлой формы, длиной около 0,3 мм, шириной
0,24 мм.
В неблагополучных районах запрещается употреблять в пищу
сырую рыбу. Трупы плотоядных животных утилизируют. Плано-
вую дегельминтизацию лисиц и песцов проводят за месяц до гона
и через 10 дней после отъема щенков. Щенков дегельминтизируют
с 3-месячного возраста. Периодически повторяют диагностичес-
кие исследования пушных зверей, собак и кошек. При необходи-
мости их дегельминтизируют.
Трематоды других видов. В пищеварительной сис-
теме плотоядных паразитируют трематоды еще нескольких видов.
Например, собаки и другие плотоядные болеют меторхозом, псев-
дамфистомозом, эхинохазмозом, метагонимозом, парагонимозом,
клонорхозом и другими трематодозами. Меторхисы, псевдамфис-
томумы, клонорхисы паразитируют в желчных ходах печени и
даже в поджелудочной железе (клонорхисы), эхинохазмусы и ме-
тагонимусы — в тонком кишечнике, а парагонимусы — в бронхах,
на плевре, диафрагме, в поджелудочной железе, кишечнике, ме-
зентериальных лимфоузлах, предстательной железе, печени, го-
ловном мозге и т. д.
Это плоские гельминты-сосальщики длиной от 2,5 до 13 мм
(парагонимусы), шириной от 1,6 до 4—8 мм.
Биология развития. У названных выше трематод она примерно
идентична, т. е. дефинитивными хозяевами являются собаки, дру-
гие плотоядные, а также человек, промежуточными — пресновод-
ные моллюски, дополнительные хозяева — пресноводные рыбы
семейства карповых (язь, плотва, красноперка, уклея, лещ, че-
хонь, шустера и др.), для некоторых гельминтов — еще щука,
линь, судак, окунь и т. д. Только парагонимус составляет исклю-
чение. Для него дополнительные хозяева — ракообразные (раки,
крабы и креветки).
Мирацидиц, вышедшие из яиц трематод, внедряются в тело
моллюсков, проходят обычный путь развития личиночных стадий.
Затем церкарии, вышедшие из моллюсков, внедряются через кожу
рыб в мышечную ткань, где примерно через 30 сут формируются
метацеркарии.
101
Дефинитивные хозяева заражаются при поедании сырой, плохо
провяленной или недостаточно промороженной рыбы, заражен-
ной метацеркариями. Гельминты в организме хозяина достигают
половой зрелости за 28—35 сут и живут по нескольку лет.
Эти трематоды распространены в самых разных районах Рос-
сийской Федерации, но некоторые имеют локальное значение,
например клонорхоз встречается лишь в бассейнах Уссури, ниж-
него, среднего и частично верхнего Амура.
Трематоды весьма патогенны и, оказывая на организм заражен-
ных животных аллерготоксическое влияние, вызывают морфо-
функциональные изменения в местах локализации. Поверхность
таких трематод, как эхинохазмус и метагонимус, покрыта острыми
шипами, что значительно усугубляет патологическое влияние па-
разитов.
Диагностика. Диагноз ставят, исходя из эпизоотологических
данных, симптомов болезни и результатов лабораторных исследо-
ваний (методами флотации, последовательных смывов) и гель-
минтологических вскрытий павших животных.
Лечение. При меторхозе и псевдамфистомозе оно аналогично
лечению при описторхозе. Для лечения кишечных трематодозов
можно применять битионол, ареколин, гексихол,
политрем и другие современные противотрематодозные ан-
тигельминтики. При эхинохазмозе собак эффективен п а н а к у р
в дозе 33 мг по д. в. на 1 кг массы тела, применяемый с кормом
двукратно 1 раз в день.
Профилактика трематодозов основана на своевременной диаг-
ностике и лечении больных животных. Нельзя скармливать пло-
тоядным сырую рыбу, раков, крабов. Фекалии животных необхо-
димо обеззараживать.
6.9. ЭХИНОСТОМАТИДОЗЫ ПТИЦ
Эхиностоматидозы — болезни, вызываемые трематодами более
20 видов семейства Echinostomatidae, паразитирующими в кишеч-
нике уток, гусей и других птиц.
Локализация — тонкая кишка.
Распространение. Эхиностоматиды распространены повсемест-
но, причиняют значительный ущерб птицеводству мелких и инди-
видуальных хозяйств западных областей Украины и Белоруссии,
республик Закавказья и многих регионов Российской Федерации.
Возбудители. В Российской Федерации наиболее распростране-
ны и патогенны трематоды трех видов: Echinostoma revolutum,
Hypodereum conoideum и Echinoparyphium recurvatum. Живые
трематоды красного цвета, длиной 3—13 мм, шириной 0,69—
1,12 мм. На переднем конце тела находится адоральный диск, воо-
руженный шипами, число которых имеет диагностическое значе-
102
ние. Так, у эхиностомы на воротнике 37 шипов, у гиподереума и
эхинопарифиума — 45. Передняя часть тела некоторых эхиносто-
матид покрыта острыми шипами. Ротовая и брюшная присоски
хорошо развиты. Яйца овальной формы, золотисто-желтого цвета,
величиной (0,09—0,13) х (0,05 — 0,07) мм. В момент выделения на-
ружу инвазионны.
Биология развития. В развитии трематод участвуют промежуточ-
ные хозяева — пресноводные моллюски многих родов (Radix,
Lymnaea, Physa, Planorbis, Anisus и др.) и дополнительные хозяева —
моллюски тех же родов, насекомые семейства гребляков, рыбы
(горчак) и лягушки. Яйца становятся инвазионными в воде за 6—
12 сут. Затем мирацидии внедряются в тело моллюска и за 1,5—
2 мес проходят несколько стадий развития: спороцисты, редии, до-
черние редии и церкарии. Личинки в стадии церкариев покидают
организм первого промежуточного хозяина и проникают в тело до-
полнительного хозяина, где через 12—21 сут превращаются в инва-
зионную личинку — метацеркария. Дефинитивные хозяева (утки и
гуси) заражаются в теплый период года на водоемах при поедании
моллюсков, головастиков, лягушек, инвазированных метацеркари-
ями. Половой зрелости эхиностоматиды достигают за 6—16 сут.
Продолжительность жизни E.revolutum около 2 мес (рис. 32).
Эпизоотологические данные. Кроме домашних и диких водопла-
вающих птиц (источники распространения инвазии) возбудителя-
ми эхиностоматидозов заражаются куры и индейки. Источники
заражения — водоемы, где обитают инвазированные дополнитель-
ные хозяева трематод. Максимум заражения приходится на летне-
осенний период, но в южных районах гуси и утки подвержены
инвазии круглый год. Значительный отход среди больных регист-
рируют у молодняка в 2 мес.
Патогенез и симптомы болезни. Постоянно передвигаясь по сли-
зистой оболочке кишечника и присасываясь мощными присоска-
ми, трематоды сильно травмируют ее. Продукты обмена веществ
оказывают на организм птицы сенсибилизирующее влияние.
Вследствие этого нарушаются секреция кишечных ферментов и
полостное пищеварение.
При интенсивном заражении у молодняка отмечают угнетен-
ное состояние, пониженный аппетит, слабость и понос. Гибель
возможна при явлениях кахексии. У взрослой птицы болезнь чаще
протекает субклинически, снижается яйценоскость.
Диагностика. Прижизненно диагноз ставят путем исследования
фекалий методом последовательных смывов, посмертно при
вскрытии кишечника обнаруживают трематод. Слизистая кишеч-
ника набухшая, в просвете — густая слизь, иногда с примесью
крови.
Лечение. Для дегельминтизации уток и гусей применяют фе-
на с а л групповым методом в дозе 0,3 г на 1 кг массы тела, би-
тионол— 0,6 и филиксан — 0,35—0,4 г на 1 кг массы тела. Ч е -
103
Рис. 32. Биология развития эхиностоматид:
У —головной конец гельминта (адоральный диск); 2 —яйцо; 3 — мирацидий;
/ — спороциста; 5—редия; 6— церкарий; 7—моллюски; 8 — головастик; 9—
моллюск с метацеркариями
тыреххлористый углерод назначают индивидуально
через рот в дозе 2 мл на 1 кг массы тела.
Профилактика и меры борьбы. Для поения молодняка следует
использовать благополучные водоемы. С этой целью проводят
гельминтологическую оценку водоемов. В случае низкой числен-
ности моллюсков (1 экз. на 1 м2) и слабой их зараженности водо-
емы можно считать благополучными (условно). После лечения
птицу в загонах выдерживают до Зсут, а помет биотермически
обезвреживают.
104
6.10. ДИПЛОСТОМОЗ РЫБ
Диплостомоз — остро или хронически протекающее заболева-
ние рыб многих видов, при котором поражаются различные ткани
глаза и нервная система.
Локализация метацеркариев — хрусталик глаза, реже стекло-
видное тело между склерой и ретиной.
Распространение. Заболевание распространено повсеместно.
Заражению подвержена рыба более 100 видов в естественных во-
доемах и прудовых хозяйствах. При высокой интенсивности инва-
зии взрослые рыбы отстают в росте и развитии. Гибель личинок
карпов достигает 70—85 %, особенно опасно заболевание для мо-
лоди форели, сига, пеляди, белого и пестрого толстолобиков.
Возбудитель. Возбудитель заболевания — личинки (метацерка-
рии) дигенетической трематоды семейства Diplostomatidae. Мета-
церкарии Diplostomum spathaceum овальной формы, на передней
части их имеются два ушковидных выроста и ротовая присоска.
Брюшная присоска находится в середине вентральной стороны
тела, а за ней каудально расположен железистый фиксаторный ап-
парат.
Взрослый паразит плоский, длина тела 0,4—0,5 см, ширина
0,2—0,3 мм. В середине тела есть перетяжка, которая делит его на
переднюю листовидно-расширенную часть и заднюю — более уз-
кую, цилиндрическую. Ротовая присоска и два железистых обра-
зования расположены в передней части тела, брюшная присоска
находится в середине тела. Округлые яичники, матка и семенники
расположены в задней части тела. Яйца овальной формы, с кры-
шечкой, при выходе наружу неинвазионны.
Биология развития. Дефинитивные хозяева — рыбоядные пти-
цы, преимущественно чайковые, промежуточные хозяева — пре-
сноводные моллюски Lymnaea stagnalis, Radix ovata и др., допол-
нительные — рыбы (карп, лещ, окунь,
щука, форель, толстолобик и др.). В ки-
шечнике птицы гельминты откладыва-
ют яйца, которые при выходе наружу
содержат мирацидий. Мирацидии, пла-
вая в воде, отыскивают моллюсков и
внедряются в их печень, где происхо-
дит бесполое размножение. Образуются
спороцисты, редии и вилохвостые цер-
карии. Церкарии покидают организм
моллюска и, попав в воду, внедряются
через кожный покров в мышцы рыб и
затем по кровеносным сосудам попада-
ют в глаза, далее — в хрусталик, где
вскоре превращаются в метацеркариев
(рис. 33). Считают, что в рыбе метацер-
Рис. 33. Хрусталик глаза фо-
рели с метацеркариями дипло-
105
карии могут быть жизне-
способными 3—4 года. В
кишечнике птицы после
поедания рыбы трематоды
достигают половой зрело-
сти за 4—5 сут (рис. 34).
Эпизоотологические
данные. Ареал диплосто-
моза чрезвычайно широк.
Заболевание встречается
среди рыб многих видов
(карп, лещ, елец, окунь,
судак, налим, щука, фо-
рель, омуль, белый амур и
др.) в естественных водо-
емах и прудовых хозяй-
ствах.
Источник распростра-
нения трематоды — инва-
зированные птицы, источ-
ник заражения — инвази-
рованные рыбы. Большое
значение в распростране-
нии возбудителя имеют
рыбоядные птицы. Совер-
шая суточную и сезонную
миграцию, они переносят
возбудителя болезни на
большие расстояния.
Диплостомоз чаще все-
го проявляется в весенне-
летний период. Личинки
рыб заражаются вскоре после выклева из икры. Наиболее часто
заболевание регистрируют в выростных прудах после пересадки
молоди из нерестовых прудов. Болезнь встречается и в нагульных
водоемах, хотя более взрослые популяции рыб заражаются не так
интенсивно.
Патогенез и симптомы болезни. Метацеркарии, поселяясь в хру-
сталике рыбы, вызывают его воспаление, а затем помутнение. В
передней камере глаза скапливается экссудат, из-за которого
внутриглазное давление повышается, что приводит к пучеглазию.
Заболевание протекает остро или хронически.
Острое течение наблюдается у молоди рыб, особенно
личинок форели, пеляди, карпа, и обусловлено миграцией цер-
кариев в организме рыб. Из-за поражения нервной системы у
мальков нарушается координация движений. Они опускаются на
дно и часто выпрыгивают из воды. На кожном покрове отмечают
106
Рис. 34. Биология развития Diplostomum
spathaceum:
Г —чайка (дефинитивный хозяин); 2— яйцо; 3 —
мирацидий; 4— моллюск (промежуточный хозяин);
5—церкарий; <5—рыба (дополнительный хозяин);
7 — метацеркарий в рыбе
точечные кровоизлияния, наблюдается искривление позвоноч-
ника. Внедрение в организм 10—12 церкариев вызывает гибель
75—85 % мальков 7—10-суточного возраста. Смертельное коли-
чество церкариев для молоди форели в 2 раза больше, чем для
карпа.
Хроническое течение инвазии наблюдается у рыб старшего
возраста и у молоди при слабой интенсивности заражения. Мета-
церкарии, локализующиеся в хрусталике, вызывают слепоту, рыба
худеет, отстает в росте и развитии. Такие рыбы плавают у поверх-
ности водоемов и становятся жертвами чаек.
Диагноз. Симптом поражения глаз дает основание подозревать
диплостомоз. Однако окончательный диагноз ставят путем вскры-
тия глаза и изучения хрусталика под микроскопом. Глазное ябло-
ко извлекают пинцетом, отделяют хрусталик, кладут его на пред-
метное стекло, наносят одну-две капли физиологического раство-
ра или воды и накрывают другим стеклом, которым хрусталик раз-
давливают, чтобы образовался белый круг. Метацеркарии, как
правило, располагаются по периферии хрусталика, имеют оваль-
ную форму, различаются по наличию известковых телец.
Лечение. Не разработано.
Профилактика и меры борьбы. Главная цель ликвидации дипло-
стомоза рыб — разрыв цепи развития возбудителя путем уничто-
жения моллюсков физическими, химическими или биологически-
ми методами. Физические методы — осушение и промораживание
ложа прудов. С определенной осторожностью для обработки ложа
можно применять и некоторые химические вещества: сульфат
меди в концентрации 25—20 мг/л; хлорную известь — 35 ц/га;
5,4-дихлорсалициланилид — 1: 500 000 с экспозицией 12—15 сут.
Затем пруд промывают и заполняют свежей водой. Посадку рыб
после промывания ложа осуществляют не ранее чем через 12—
15 сут. Моллюсками питаются утки и черный амур. Поэтому осе-
нью после вылова рыбы в пруды пускают водоплавающих птиц. В
южных районах в пруды подсаживают черного амура.
6.11. ПОСТОДИПЛОСТОМОЗ РЫБ
Постодиплостомоз — заболевание рыб, характеризующееся по-
явлением на теле черных пятен (чернопятнистая болезнь) из-за
отложения пигмента в местах обитания личинок трематоды.
Локализация — под кожей и в мышцах на глубине 1,2—2 мм.
Личинка покрыта соединительнотканной капсулой.
Распространение. Заболевание широко распространено среди
рыб разных видов, преимущественно карповых, в естественных
водоемах, прудах и нерестово-выростных хозяйствах. В отдельных
хозяйствах зараженность рыб достигает 85—100 %. При высокой
интенсивности инвазии отмечают гибель молоди.
107
Пигментные пятна портят товарный вид рыбы, поэтому интен-
сивно зараженных рыб выбраковывают.
Возбудитель. Возбудители болезни — метацеркарий дигенети-
ческого сосальщика Posthodiplostomum cuticola семейства Diplo-
stomatidae класса Trematoda.
Половозрелая трематода плоская, длина тела 1,5 мм, ширина
0,5—0,7 мм. Тело четко разделено перетяжкой и состоит из расши-
ренного переднего и суженного заднего отделов. Хорошо выраже-
ны ротовая и брюшная присоски; две ветви кишечника заканчива-
ются слепо в задней части тела. Яйца овальной формы, с крышеч-
кой размером 0,07—0,09 мм. Позади брюшной присоски располо-
жен фиксаторный железистый аппарат — орган Брандеса. Размер,
форма и строение тела метацеркария идентичны таковым взрос-
лых гельминтов, но недоразвиты половые органы.
Биология развития. Дефинитивные хозяева — цапли квакши и
другие рыбоядные птицы, в тонком кишечнике которых парази-
тируют взрослые гельминты. В местах локализации паразиты
продуцируют яйца. В воде из них за 10—17 сут формируются и
выходят личинки — мирацидии. Они проникают в тело промежу-
точного хозяина — моллюсков Planorbis planorbis, Р. carinatus и
др. В моллюсках происходит бесполое размножение личинки:
образуется материнская спороциста, в ней — дочерние редии и
затем — хвостатые церкарии. Весь цикл развития длится 75—
95 сут.
Церкарии покидают организм моллюска и внедряются под
кожу и в мышцы рыб, где за 25—65 сут достигают инвазионной
стадии — метацеркария. Птицы заражаются при поедании рыб,
инвазированных метацеркариями. В кишечнике птицы гельминты
через 3—7 сут достигают половой зрелости (рис. 35). Полный цикл
завершается за 2,5—3 мес в летнее время или за 9 мес, включая
осень и зиму. Метацеркарий в организме рыбы сохраняются до
1,5 года.
Эпизоотологические данные. Заболевание встречается повсемес-
тно, но наиболее широко распространено в южных и юго-запад-
ных районах страны. Заражаются пресноводные рыбы более чем
35 видов (карп, сазан, лещ, плотва, амур, толстолобик, вобла,
окунь и др.). При этом особенно восприимчивы мальки и сеголет-
ки, которые заражаются с 10—12-суточного возраста, и рыбы с
мягкой чешуей. Инвазию распространяют цапли и другие птицы.
Источник заражения — больные рыбы. В весенне-летний период
экстенсивность инвазии во многих хозяйствах достигает 100 %
при высокой интенсивности — 350—400 метацеркариев.
Патогенез и симптомы болезни. Церкарии проникают через
кожу, травмируют ее поверхностные слои и сосуды, вызывая кро-
воизлияния. Вокруг личинки образуется соединительнотканная
капсула, где откладывается пигмент гемомеланин — продукт рас-
пада гемоглобина и меланоцитов. Многочисленные поражения
108
Рис. 35. Биология развития Р. cuticola:
/ — метацеркарий; 2 —общий вид гельминта; 5 —цапля (дефинитивный хозяин); 4 — выход
мирацвдия из яйца; 5— моллюск (промежуточный хозяин); 6, 7— спороцисты; 8— внедрение
церкария в тело рыбы (дополнительного хозяина); 9— метацеркарий в рыбе
приводят к снижению эластичности тканей и очаговому некрозу.
У мальков и сеголеток под кожей появляются небольшие бугорки
черного цвета, внутри которых находятся метацеркарии. С возрас-
том количество черных пятен увеличивается, они наблюдаются по
всей поверхности тела рыбы и достигают 1—1,5 см в диаметре,
принимают разлитой характер. Такие рыбы плавают у поверхнос-
ти воды, слабеют и нередко погибают или становятся добычей ры-
боядных птиц.
Диагностика. Болезнь диагностируют по наличию на теле рыб
характерных черных бугорков и пятен. Для подтверждения диаг-
ноза можно вскрыть соединительнотканные бугорки, под микро-
скопом будут видны метацеркарии.
Профилактика и меры борьбы. Для профилактики постодиплос-
томоза проводят те же мероприятия, что и при диплостомозе.
Кроме того, чтобы предотвратить заболевание рыб в выростных
прудах, их заливают водой незадолго до посадки мальков. Интен-
сивный отлов больных рыб способствует уменьшению заражаемо-
сти птиц. Целесообразно отпугивание рыбоядных птиц от небла-
гополучных водоемов.
6.12. САНГВИНИКОЛЕЗЫ
Сангвиниколезы — заболевания карповых рыб, вызываемые
плоскими гельминтами из класса Trematoda.
Локализация — кровеносные сосуды жабр, почек, сердца и дру-
гих органов. Наибольшее количество трематод обнаруживают в
артериальной луковице, брюшной аорте и приносящих жаберных
артериях.
Распространение. Сангвиниколезы встречаются в рыбоводных
хозяйствах Западной Европы, в странах СНГ и центральных обла-
стях Российской Федерации. В основном болеет молодь прудовых
карповых рыб, что вызывает истощение и нередко массовую их
гибель.
Возбудители. Болезнь вызывают четыре вида сосальщика се-
мейства Sanguinicolidae рода Sanguinicola. Вид S. inermis паразити-
рует у карпа и сазана, S. armata — у линя, S. intermedia — у карася,
S. volgensis — у плотвы и чехони.
Основное эпизоотологическое значение имеет в прудовом ры-
боводстве S. inermis. Трематода достигает в длину 1 мм. Тело плос-
кое, лентовидной формы, передний и задний концы слегка заост-
рены. Характерные для трематод присоски отсутствуют. Передний
конец с ротовым отверстием заметно вытянут, имеет вид хоботка,
от которого начинается пищевод, переходящий в передней поло-
вине тела (по оси тела) в кишку с четырьмя мешковидными раз-
ветвлениями. Желточники расположены в передней части по бо-
кам тела. Позади двух лопастей кишечника по средней линии тела
ПО
находятся мужские половые железы (семенники) в виде палочек с
заметными утолщениями на концах, расположенных один позади
другого (15 пар) по одноосной лестнице. Сзади к семенникам при-
мыкает непарный яичник’ с двумя лопастями, напоминающий
крылья бабочки.
Вся поверхность трематоды покрыта мелкими шипиками, ко-
торые заметны при специальных исследованиях. Матка в виде ко-
роткой трубки содержит одно яйцо треугольной формы, располо-
жена позади яичника. Заднюю часть гельминта занимают петли
экскреторного канала. Яйца коричневого цвета, треугольной фор-
мы с закругленными углами, размером (0,06 — 0,07) х (0,03 —
0,04) мм. При выходе из матки они содержат эмбриональную ли-
чинку — мирацидий, т. е. инвазионны.
Биология развития. Сангвиниколы — типичные биогельминты,
т. е. в биологии развития участвуют: карповые рыбы (карп, сазан и
др.) — дефинитивные хозяева, пресноводные моллюски (прудови-
ки Limnaea auricularia, Radix ovata, L. stagnalis) — промежуточные
хозяева.
В местах локализации трематоды продуцируют яйца, которые
при выходе из матки попадают в кровеносное русло. С током кро-
ви они разносятся по всему телу и задерживаются в капиллярах
различных органов, в том числе жаберного аппарата и почек. Из
яиц выходят мирацидии и при помощи стилета, расположенного в
передней части тела, разрывают капилляры и попадают в воду. В
воде они активно плавают и, встретившись с промежуточными хо-
зяевами, внедряются в ножку моллюска, далее в печень, где про-
исходит партеногенетическое размножение паразита (спороциста,
редия и затем церкарии). Церкарии формируются в редиях и в ко-
нечной стадии развития имеют удлиненное тело с вилообразно
раздвоенным хвостом и высоким прозрачным гребнем (для плава-
ния) на дорсальной стороне передней части тела. Церкарии поки-
дают тело моллюска и активно отыскивают рыб — дефинитивных
хозяев, внедряются в жабры и кожный покров, попадая в крове-
носные сосуды, где достигают половой зрелости (рис. 36). Весь
цикл развития, по некоторым данным, завершается за 75—90
дней. В организме рыб они паратизируют от 1,5 до 8 мес (в зависи-
мости от температуры воды).
Эпизоотологические данные. Известно, что среди многих ви-
дов рыб семейства карповых встречаются все четыре вида санг-
виниколы. Однако существенный ущерб рыбоводным хозяй-
ствам по разведению карпа и сазана наносит один вид —
S. inermis. Болеют и гибнут мальки, сеголетки и иногда двухлет-
ки. Взрослая рыба чаще является носителем инвазии.
Постоянный источник распространения возбудителя — взрос-
лая рыба, а в летний период и молодь. Источник же заражения
рыб — различные водоемы.
Заболевание и падеж рыб имеют явно выраженный сезонный
111
Рис. 36. Биология развития S. inermis:
А — взрослый гельминт из кровеносного сосуда рыб; Б — развитие сангвиниколы; 1 — ротовое
отверстие; 2 — кишечник; 3 — семенники; / — яичник; 5 — желточники; 6 —яйца; 7—мира-
цидий; 8— промежуточный хозяин (моллюск); 9, 10— спороциста и редии в моллюске; 11 —
церкарий
характер. Так, энзоотии заболевания регистрируют весной и ле-
том в выростных прудах и реже у карпа 2-летнего возраста — в
нагульных. Иногда сангвиниколез среди карпов и сазанов регис-
трируют в нерестовых прудах в первые дни жизни мальков. Воз-
можно и вторичное заражение карпов в выростных прудах осе-
нью и, как следствие, повышение экстенсивности и интенсивно-
сти инвазии годовиков карпов весной. В целом известно, что
наиболее интенсивное выделение яиц гельминтами отмечают в
теплое время года при 25 °C и выше. Выход же церкариев из за-
раженных прудовиков наблюдается при температуре не ниже
12 °C. Продолжительность жизни церкариев в воде зависит от
температуры: при 20 °C они живут 22—29 ч, при 16 °C — 36—40, а
при 12 °C — 40—48 ч.
Патогенез и симптомы болезни. Течение болезни зависит от воз-
раста рыб и интенсивности заражения их гельминтами. Как пра-
вило, возникновение патологических процессов соответствует
тому моменту, когда церкарии массово внедряются в кровеносные
сосуды жабр рыб. Развивается местное воспаление пораженных
сосудов, открываются ворота для внедрения разного рода микро-
организмов, в том числе гнилостной микрофлоры.
После достижения половой зрелости трематоды интенсивно
начинают продуцировать яйца, которые с током крови заносятся
в капилляры различных органов и тканей. В частности, у маль-
ков и сеголеток в силу узости капилляров яйца в большом коли-
честве застревают в жаберном аппарате, в результате чего разви-
ваются местные дистрофические и некротические процессы. У
более взрослых рыб (двухлеток) яйца более-менее свободно цир-
кулируют и с током крови попадают в спинную аорту, а затем во
внутренние паренхиматозные органы. Далее они скапливаются
главным образом в почках и печени, что обусловливает воспале-
ние этих органов. В дальнейшем нарушается нормальный ток
крови, происходит выпотевание ее жидкой части, образуется
асцит, или общая водянка тела, которая сопровождается ероше-
нием чешуи (отек кожи) и пучеглазием. У зеркального карпа на
поверхности тела могут возникать пузыри, наполненные экссу-
датом.
Мальки и сеголетки болеют остро (жаберная форма), а двухлет-
ки и рыбы более старшего возраста — хронически (почечная фор-
ма). Участки жабр анемичны или темно-синей окраски, могут
быть в стадии некротического распада. Больные рыбы скаплива-
ются на притоке, всплывают на поверхность и заглатывают воздух
широко раскрытым ртом. Они прекращают питаться, вследствие
чего происходит их полное истощение. Такое течение инвазии со-
провождается значительной гибелью рыб.
Патологоанатомические изменения. При осмотре и вскрытии
мальков и сеголеток основные изменения обнаруживают в жабер-
ном аппарате, где преобладает некротический процесс, а у двухле-
113
ток и старше — воспаление почек и печени. В мышце сердца, в
печени, почках, межмышечной соединительной ткани находят не-
кротические очаги серо-белого цвета, содержащие яйца парази-
тов, и атрофию паренхиматозных клеток. Вокруг некротических
участков видна сильно разросшаяся соединительная ткань, вслед-
ствие чего органы имеют бледно-серый цвет.
Диагностика. Сангвиниколез диагностируют комплексными
исследованиями с учетом эпизоотологических данных, симптомов
болезни и лабораторных исследований. Точный диагноз может
быть поставлен на основании обнаружения в крови трематод или
их яиц. Кровь для исследования следует брать из аортальной луко-
вицы, брюшной аорты и артериальных сосудов, приносящих
кровь в жабры и паренхиматозные органы. Исследуют ее методом
раздавленной капли.
При исследовании зараженных мальков и сеголеток жабер-
ные лепестки компрессируют между предметным и покровным
стеклами и изучают под микроскопом при большом увеличе-
нии. Обнаруживают яйца и прозрачных мирацидий с пигмент-
ным глазком.
Сангвиниколез с поражением жабр клинически протекает
сходно с бранхиомикозом, миксоспоридиозом, вирусным и неза-
разной этиологии бранхионекрозами, а также дактилогирозами.
Лечение. Не разработано. По данным Г. И. Сапожникова и
А. М. Наумовой, определенным эффектом обладают ацемидофен
и осарсол.
Профилактика и меры борьбы. Проводят планомерные хозяй-
ственные мероприятия, направленные на борьбу с возбудителями
сангвиниколезов в прудовых и рыбоводных хозяйствах. Для унич-
тожения моллюсков — промежуточных хозяев используют различ-
ные методы: физические, химические и биологические. Физичес-
кие методы уничтожения прудовиков заключаются в том, что пе-
риодически весной проводят осушение прудов или содержат их
зимой без воды для промораживания. У всех прудов устанавлива-
ют ящики-сороуловители для задержки дикой рыбы и моллюсков,
приносимых током воды. Запрещен завоз рыбы из неблагополуч-
ных по сангвиниколезу прудов или хозяйств. Не следует зарыб-
лять головной пруд питомников восприимчивой к трематодозу
рыбой, что предотвратит размножение и распространение возбу-
дителей инвазии в источнике водоснабжения нерестовых и вырос-
тных прудов.
Химические методы борьбы с моллюсками предусматривают:
уничтожение промежуточных хозяев путем обработки заболочен-
ных участков ложа спущенных прудов хлорной (500 кг/га) или
негашеной (25 ц/га) известью. Кроме того, для этой цели ре-
комендуется применять медный купорос (0,005г/л), а
также карбатин (1: 10 000) и 5,4-д и х л о р с а л и ц и ла-
н и л и д (1:100 000) с экспозицией 48 ч.
114
Достаточно эффективным методом для прудовых хозяйств яв-
ляется биологический метод борьбы с моллюсками: посадка в не-
благополучные пруды черного амура, который питается моллюс-
ками. Установлено, что интенсивность инвазии при этом снижа-
ется в несколько раз, а экстенсивность инвазии — на 25—30 %.
Возбудитель сангвиниколеза не опасен для человека и живот-
ных, поэтому зараженную трематодами рыбу с поражением от-
дельных органов, но отвечающую требованиям товарной конди-
ции допускают людям в пищу без ограничений. Однако заметно
истощенную рыбу, потерявшую товарный вид, с наличием общей
водянки тела, пучеглазием и ерошением чешуи по усмотрению
специалиста-ихтиопатолога подвергают технической утилизации
или направляют на корм пушным зверям.
6.13. ТЕТРАКОТИЛЕЗЫ
Тетракотилезы — заболевания рыб многих видов различных се-
мейств, вызываемых личиночной стадией (метацеркариями) плос-
ких гельминтов из класса Trematoda.
Локализация — мышцы, серозные покровы полости тела, ки-
шечник, стенки плавательного пузыря, печень, сердце, яичники,
почки и др. У некоторых видов рыб (гольян, вьюн и др.) метацер-
карии Т. petromyzentis fluviatilis обнаружены в головном мозге.
Распространение. Тетракотилезы широко распространены сре-
ди различных пород и видов рыб как в диких водоемах, так и в
рыбоводных хозяйствах Российской Федерации, ближнего и даль-
него зарубежья.
Возбудители. Болезнь вызывают метацеркарий многих видов
трематод, относящихся к трем родам семейства Strigeidae:
Tetracotyle, Apharyngostrigea, Cotylurus. Трематоды в стадии има-
го — массивные гельминты с расширенным передним концом. На
дне ротовой присоски открывается ротовое отверстие, которое со-
единяется с короткой глоткой и пищеводом, открывающимся в
кишечник с двумя стволами, которые расположены по бокам тела.
По обе стороны ротовой присоски находятся две присоскообраз-
ные овальные ямки. Брюшная присоска значительно крупнее ро-
товой и у трематод разных видов лежит на разном расстоянии от
ротовой присоски. Позади брюшной присоски расположен хоро-
шо выраженный орган Брандеса, позади которого находится двух-
лопастный яичник (рис. 37).
Метацеркарий окружены в местах локализации плотной соеди-
нительнотканной оболочкой, поэтому они заметны даже невоору-
женным глазом. Тело личинок размером до 1—2 мм, короткое,
массивное, овальное или грушевидное с расширенным передним
концом, вогнутое на брюшной стороне. Присоски хорошо разви-
ты. По бокам ротовой присоски видны две боковые присоски,
115
Рис. 37. Биология развития Tetrakotyle и других стригеид:
А — Apharyngostrigea cornu: 1 — взрослая трематода; 2 — метацеркарий; Б — дефинитивные хо-
зяева: 3, 4, 5, 6, 7—баклан, чайка, гагара, крачка, цапля; В — развитие гельминта в воде и
первом промежуточном хозяине: 8— яйцо; 9 — мираций; 10— моллюск (77 —спироциста,
12— редии, 73—церкарий); Г—вторые промежуточные хозяева (а, 6, в, г, д — сиг, щука, су-
дак, окунь, ерш); Д— инцистированные метацеркарии в стенке плавательного пузыря ерша
овально вытянутые и окруженные многочисленными железами.
Позади брюшной присоски находится хорошо развитый прикре-
пительный орган Брандеса, за которым обнаруживают скопление
клеток — зачаток половых желез.
Биология развития. Дефинитивные хозяева — рыбоядные птицы
многих видов, в тонком кишечнике которых паразитируют взрос-
лые трематоды. Например, для трематоды A. cornu дефинитивные
хозяева — серая цапля, для Т. intermedia — гагары, а для Т. dimi-
nuta, Т. percaefluviatilis и Т. communis — чайки. Дефинитивными
хозяевами могут быть бакланы и другие рыбоядные птицы. Пер-
вые промежуточные хозяева — пресноводные брюхоногие мол-
люски Bathyomphalus concortus и др., в теле которых трематоды
развиваются партеногенетически. Вторым промежуточным, или
дополнительным, хозяином, в теле которого развиваются мета-
церкарии (инвазионные личинки), являются рыбы различных
видов. Например, метацеркарий С. pilatus чаще обнаруживают
на серозных покровах полости тела и в плавательном пузыре у
ерша, судака, щуки, корюшки и др., Т. percaefluviatilis — на
брюшине, стенках плавательного пузыря, сердце, печени, бры-
жейке у этих же рыб, а Т. intermedia — на сердце у сиговых и
лососевых рыб.
Половозрелые трематоды в тонком кишечнике рыбоядных
птиц откладывают яйца, которые с пометом выделяются в водоем.
В теплое время года в яйцах развиваются мирацидии, которые вы-
ходят в воду и проникают в тело моллюска — промежуточного хо-
зяина. В печени последнего происходит бесполое размножение
личинок. В начале формируется спороциста с зародышевыми
клетками, из которых образуются редии, а в них — церкарии. Цер-
карии покидают тело моллюска, при встрече с дополнительным
хозяином (рыбой) внедряются в его тело, инцистируются во мно-
гих внутренних органах, образуя метацеркариев — инвазионных
личинок. Поедая больных рыб, рыбоядные птицы заражаются тре-
матодами. В кишечнике птицы личинки, прикрепившись к слизи-
стой оболочке, растут и развиваются, достигая половозрелой ста-
дии за 4—5 сут.
Эпизоотологические данные. Тетракотилезы рыб широко рас-
пространены как в естественных водоемах (озерах, лиманах, водо-
хранилищах), так и в прудовых (нерестово-выростных) хозяй-
ствах. Возбудители заболевания встречаются на Цимлянском во-
дохранилище, Волге, Днепре, Енисее, Южном Буге, в озерах Ле-
нинградской области, Карелии. Чаще заражаются ерш, судак,
окунь, щука, корюшка, белый амур. Возбудитель широко распро-
странен у лососевых и сиговых рыб, обитающих в реках Сибири.
Вид Т. variegeta обнаружен у 36 разновидностей рыб, а
Т. intermedia — у 26 видов лососевых рыб.
Источник инвазии — дикая рыба естественных водоемов и ры-
боядные птицы. Наиболее опасна болезнь для молоди рыб: маль-
117
ков и сеголеток, а также годовиков ершей, окуней и белого амура.
Экстенсивность и интенсивность инвазии рыб достаточно высо-
кие. Например, имеются сведения о том, что при вспышке болез-
ни в Чудском озере среди ершей на протяжении одного метра бе-
рега находили по 10—15 погибших рыб. Интенсивность инвазии у
сеголеток и двухлеток может составить 200—500 и более метацер-
кариев у одной особи.
Зимой рыбы не заражаются, но возбудители сохраняются и в
рыбах, и в моллюсках — промежуточных хозяевах. Пик инвазии
приходится на весенне-летний период.
Патогенез и симптомы болезни. Патогенез тетракотилезов свя-
зан с биологией развития возбудителей и местом их локализации в
организме зараженных рыб. Проникая через кожу и толщу мышц,
церкарии разрушают микроструктуру тканей и кровеносных сосу-
дов и заносят с собой различные микробы. В зонах внедрения и
прикрепления личинок — на стенке плавательного пузыря, на се-
розных покровах полостей тела, паренхиматозных органах, бры-
жейке находят очаги воспаления или соединительнотканные кап-
сулы толщиной до 2 мм, внутри которых находятся метацеркарии.
При поражениях гонад происходит паразитарная кастрация (сте-
рилизация органа). Больные рыбы по мере развития патологичес-
кого процесса концентрируются у берегов и на мелководье. Они
слабо реагируют на приближение человека, их можно легко пой-
мать. Молодь рыбы отстает в росте и развитии, заметно худеет.
При высокой интенсивности инвазии брюшко зараженной рыбы
уплотненное, увеличенное, отвислое, иногда отмечают ерошение
чешуи, покраснение оснований плавников. Чешуя и кожа туск-
лые, глаза мутные.
Больные рыбы истощены, их мышцы атрофированы, выраже-
но ерошение чешуи. На вскрытии находят водянку брюшной и
перикардиальной полостей. На серозной оболочке паренхима-
тозных органов и плавательного пузыря расположено большое
количество белых цист размером 1—2 мм. Между петлями ки-
шечника и в брыжейке находится красно-коричневая масса с
включенными в нее метацеркариями. В яичниках больных рыб
часто обнаруживают желтоватые зерна, которые образуются в ре-
зультате инкапсуляции паразита. В почках и печени находят не-
кротические очаги.
Диагностика. Учитывают эпизоотологические данные, симпто-
мы болезни и результаты гельминтологического вскрытия рыб.
Цисты метацеркариев исследуют компрессорным методом под
микроскопом.
Лечение. Не разработано.
Профилактика и меры борьбы. Меры борьбы с тетракотилезами
такие же, как при многих трематодозах, где промежуточными хо-
зяевами являются пресноводные моллюски. С целью уничтожения
моллюсков в прудовых рыбоводных, нерестово-выростных хозяй-
118
ствах тщательно осушают ложе прудов. В зимнее время пруды со-
держат без воды, проводят поочередное летование прудов, дезин-
вазию ложа хлорной и негашеной известью (см. Сангвиниколезы),
применяют и моллюскоциды. Прибрежную растительность выка-
шивают.
Поскольку возбудители тетракотилезов рыб не опасны для жи-
вотных других видов и человека, то при отсутствии признаков, не-
соответствующих товарной кондиции, рыбу допускают в пищу
людям на общих основаниях. Но если у рыбы сильно поражены
кожа и серозные покровы, то ее подвергают технической утилиза-
ции или направляют на корм пушным зверям и другим животным.
6.14. ОПИСТОРХОЗ КАРПОВЫХ РЫБ
Описторхоз — антропозоонозное заболевание рыб семейства
карповых, вызываемое личиночной стадией гельминтов (метацер-
кариями) класса Trematoda.
Локализация — мышцы тела рыб, главным образом поверхност-
ного слоя спины.
Распространение. Описторхоз — весьма широко распространен-
ное заболевание во многих странах мира. В нашей стране оно
встречается в бассейнах крупных рек Сибири, средней полосы и
юго-западных районов.
Возбудитель. Болезнь вызывает метацеркарий — личиночная
стадия трематоды Opisthorchis felineus семейства Opisthorchidae.
Он серого цвета, округло-овальной, реже округлой формы с тол-
стой оболочкой, длиной 0,23—0,37 мм, шириной 0,18—0,28 мм.
Имеет достаточно крупную брюшную присоску. Экскреторный
пузырь округлой формы расположен на одном конце тела личин-
ки. Марита трематоды продолговатой, заметно суживающейся к
переднему концу формы, длиной 8—13 мм, шириной 1,5—2,5 мм.
Присоски (ротовая и брюшная) почти одинаковой величины.
Специфический признак гельминта — наличие в задней части тела
двух лопастных семенников, между которыми проходит 5-образно
извивающийся экскреторный канал. Кишечные стволы оканчива-
ются слепо позади заднего семенника. Впереди семенников лежат
яичник (округлый) и семяприемники. Средняя часть паразита за-
нята петлями матки, извивающимися между кишечными ствола-
ми, и гроздьями желточников, лежащих сбоку от кишечника. По-
ловые отверстия находятся впереди брюшной присоски. Мужская
половая бурса отсутствует, имеется сильноизвитый семяновыно-
сящий проток (рис. 38).
Яйца мелкие — (0,01—0,02) х (0,002 — 0,003) мм, бледно-желто-
го цвета, с нежной двухконтурной оболочкой, крышечкой на од-
ном и бугорком на другом полюсе. Яйца при выходе наружу уже
инвазионны, так как содержат мирацидий.
119
Рис. 38. Морфология О. felineus:
А — О. felineus; Б — яйцо с мирацидием; В — спороциста; Г~ редия; Д — промежуточный хозяин
(Bithynia tentaculata); Е— метацеркарий в мышцах рыбы; Ж— церкарии; 3 — чебак — допол-
нительный хозяин
Биология развития. Описторхисы развиваются с участием про-
межуточных хозяев — пресноводных моллюсков рода Codiella (ра-
нее считали Bithynia leachi) и дополнительных хозяев — рыб се-
мейства карповых (язь, елец, голавль, карп, линь, вобла, красно-
перка, уклея, чехонь, линь, пескарь, сазан, лещ, жерех, плотва и
др.). Дефинитивные хозяева — плотоядные животные (домашние
и дикие) и человек.
Взрослые трематоды в местах локализации продуцируют яйца,
которые с фекалиями выделяются наружу, рассеиваются в окружа-
ющей среде и попадают в воду, где их заглатывают моллюски. В
кишечнике последних из яиц вылупляются мирацидии, мигриру-
ющие в печень, где они превращаются в спороцисты. В спороцис-
тах образуются редии, затем церкарии, которые, выйдя в воду из
моллюска, активно внедряются через кожу в мышцы рыб и пре-
вращаются в метацеркарий — инвазионную стадию. Срок разви-
тия от яйца до метацеркария 2,5 мес.
Животные и человек заражаются при употреблении сырой, сла-
бомороженой или вяленой рыбы, инвазированной метацеркария-
ми. Из 12-перстной кишки дефинитивных хозяев юные паразиты
проникают через желчный и поджелудочный протоки в печень и
поджелудочную железу. Описторхисы в организме дефинитивного
хозяина достигают половой зрелости за 21—28 сут (рис. 39). Про-
должительность жизни гельминта у плотоядных животных более
3 лет, а в организме человека — 10—20 лет.
Эпизоотологические данные. Описторхоз рыб, вызываемый па-
разитированием метацеркариев, — природно-очаговое заболева-
ние, которое поддерживается во многих районах благодаря нали-
чию диких плотоядных, водоемов с рыбами и моллюсками. Опис-
торхоз распространен на территории бассейнов рек Оби и Ирты-
ша, Печоры, Днепра, Дона, Волги, Северной Двины и Немана и
имеет тенденцию к более широкому распространению. Этому
способствуют большая плотность моллюсков (5 тыс. экз. и больше
на 1 м2) в поймах многих рек и значительное разнообразие пре-
сноводных рыб.
Источник заражения рыб — неблагополучные водоемы. В от-
дельных очагах экстенсивность инвазии у кошек достигает 87,7 %,
у человека —до 80 %, при большой интенсивности — соответ-
ственно 5 и 25 тыс. экз. Экстенсивность инвазии у рыб в Оби и
Иртыше достигает 90 %. В спинных мышцах рыб нередко можно
обнаружить 3—5 экз. метацеркариев на 1 см2.
Патогенез и симптомы болезни. Изучены недостаточно. При
вскрытии павших и убитых рыб, интенсивно зараженных мета-
церкариями О. felineus, в межмышечной соединительной ткани
находят светло-серые, размером с просяное или конопляное зерно
цисты с живыми или мертвыми метацеркариями. Возле полюсов
цисты откладываются жировые шарики, мышечная ткань вокруг
цист перерождена.
121
Рис. 39. Биология развития О. felineus:
1— общий вид; 2—яйца; 3 — спороциста; 4— редий; 5—церкарий; 6— рыба, пораженная
метацеркариями
Диагностика. Описторхоз у дефинитивных хозяев диагностиру-
ют по результатам гельминтологических и гельминтокопрологи-
ческих исследований. Наиболее эффективными считаются методы
флотации с применением насыщенного раствора гипосульфита
натрия (1750 г на 1 л кипящей воды) по Шербовичу и нитрата на-
трия (1кг на 1л кипящей воды) по Калантаряну. В последние
годы рекомендуют применять раствор хлорида цинка плотностью
1,82 (2 кг на 1л горячей воды). Для обнаружения метацеркариев
готовят тонкие (0,5—1,0 мм) срезы мышц и исследуют под бино-
кулярной лупой МБС-10 при увеличении х 16 компрессорным ме-
тодом.
Лечение. Не разработано.
Профилактика и меры борьбы. Мероприятия, проводимые при
многих трематодозах рыб, не совсем приемлемы в отношении
рыб, зараженных метацеркариями описторхиса из-за сложности
их развития. Существенное значение в борьбе с описторхозом
122
имеют мероприятия по просвещению населения и охране водных
ресурсов от загрязнения нечистотами. Прежде чем скармливать
рыбу плотоядным, нужно уточнить благополучие по описторхозу
районов, из которых она поступила.
Для профилактики описторхоза очень важно правильно опре-
делить жизнеспособность метацеркариев в замороженной, копче-
ной и другими способами заготовленной рыбе. В теплом (37—
38 °C) 0,5%-ном растворе трипсина на физиологическом растворе
или растворе Локкера живые личинки через несколько секунд ак-
тивизируются и сохраняют активность длительное время. При от-
сутствии же движения личинок в течение 15—20 мин можно гово-
рить об их нежизнеспособности.
Санитарная оценка. Если будет установлена зараженность рыбы
какого-либо вида, рыбы других видов этого водоема считаются ус-
ловно годными. Реализация необеззараженной рыбы из неблаго-
получного водоема запрещена. Рыбу с высокой интенсивностью
инвазии направляют на техническую утилизацию. Слабо заражен-
ную рыбу товарной кондиции используют в пищевых целях после
обработки, гарантирующей обеззараживание продукта. Это может
быть крепкий и средний посол, обеспечивающий содержание
соли в мясе рыбы 14 % (плотность тузлука 1,2 при температуре 1—
2 °C). Продолжительность посола мелкой рыбы (пескарь, уклея,
гольян, верховка и др.) 10 сут, средней (плотва, елец, красноперка,
жерех, чехонь и др.) — 21, крупной (язь, лещ, линь) — 40 сут. Если
предварительно рыбу замораживают, то возможен более слабый
или менее длительный посол.
Более надежный метод обеззараживания рыбы — заморажива-
ние: пораженную рыбу выдерживают при минус 40 °C 7 сут, при
минус 35 °C — 14 и при минус 32 °C — 32 сут.
В быту чаще применяют термическую обработку рыбы. С этой
целью изделия из частиковых рыб и рыбные котлеты следует жа-
рить 15 мин, куски массой 100 г —20 мин. Мелкую рыбу жарят
15—20 мин. При варке рыбу выдерживают в кипятке не менее
20 мин.
Пушным зверям и другим плотоядным рыбу скармливают пос-
ле определения жизнеспособности метацеркариев и соответствую-
щего обеззараживания.
Лабораторная работа
Задания. Изучить строение основных возбудителей трематодо-
зо в жвачных, плотоядных, птиц и рыб. Исследовать фекалии
жвачных методом последовательного промывания. Ознакомиться
с промежуточными и дополнительными хозяевами трематод ско-
та, птицы и методами их вскрытия. Исследовать печень крупного
и мелкого рогатого скота, пораженную трематодами, методом
полного гельминтологического вскрытия.
123
Оборудование, материалы и объекты исследования: микроскопы; эмалирован-
ные тазики; стаканы; чашки Петри; стеклянные банки и палочки; фарфоровые
ступки; пестики; металлические петли и сита; ножницы прямые; пинцеты; пред-
метные и покровные стекла; живые пресноводные и сухопутные моллюски, их
раковины; муравьи рода Formica; рыбы; пробы фекалий овец и печень жвачных
животных, пораженных фасциолами и дикроцелиумами; кишечник птиц при эхи-
ностоматидозах.
Место занятия: лаборатория паразитологии и инвазионных бо-
лезней животных.
Методика проведения занятия. До начала занятий тщательно го-
товят рабочие места (одно место на трех студентов) для проведе-
ния последовательного промывания фекалий, вскрытия печени и
изучения моллюсков и муравьев. Вывешивают плакаты с рисунка-
ми трематод и яиц, на стол преподавателя ставят все необходимые
для показа исследования объекты.
Преподаватель знакомит учащихся с особенностями строения
трематод, их яиц, промежуточными и дополнительными хозяева-
ми; отмечает характерные (дифференциальные) признаки; пока-
зывает методы вскрытия печени, кишечника и других органов; оп-
рашивает студентов. Затем студенты приступают к изучению тре-
матод и их яиц. Осмотр визуальный — под лупой и микроскопом.
Схематические рисунки делают масштабно. Фекалии исследуют
по ранее описанной методике. Можно разделить учащихся на
группы и исследовать фекалии различных животных одновремен-
но, обмениваясь результатами.
При вскрытии печени следует обратить внимание на признаки,
характерные для острой и хронической инвазии, и на соответству-
ющие изменения органа. Чтобы обнаружить юные формы фасци-
ол, при остром фасциолезе печень разрезают поперек желчных хо-
дов на небольшие кусочки и разминают пальцами в теплой воде.
Фасциол дифференцируют от дикроцелий по светло-серому цве-
ту (дикроцелии темно-серые) и отсутствию половых органов или
яиц. При хроническом поражении печени фасциолезом обнару-
живают взрослых трематод и отложение солей внутри желчных
ходов.
Для выявления парамфистомат и хасстилезий исследуют пред-
желудки или 12-перстную и тощую кишки (острое течение болез-
ни). Эхиностомиды в тонком кишечнике гусей и уток обнаружи-
вают путем изучения содержимого методом последовательных
смывов. Для обнаружения личинок описторхиса под компрессо-
риумом исследуют спинные мышцы рыб.
Моллюски различаются в основном по величине и форме рако-
вины, строению органов. Малый прудовик длиной 0,1—1см, с
тонкостенной раковиной с пятью закрученными вправо завитка-
ми. Раковина ушковидного прудовика длиной 2,5—3 см, с че-
тырьмя завитками. Для планорбид характерна плоская раковина
диаметром 0,5—1,5 см, с пятью завитками.
124
У наземных моллюсков раковина прочная, у большинства по-
луконическая, диаметром до 2,5 см, с темными и светлыми поло-
сами. Раковина моллюсков рода Chondrula яйцевидной формы, с
четырьмя зубчиками у входа в устье и шестью завитками.
Для вскрытия следует брать более молодых моллюсков. Мол-
люска сдавливают между предметными стеклами, удаляют кусоч-
ки раковины и мясистую ножку. Затем наносят две-три капли
физиологического раствора, накрывают покровным или пред-
метным стеклом. Исследуют под малым (х 56) увеличением мик-
роскопа.
Следует обратить внимание на состояние печени зараженных и
незараженных моллюсков. У первых печень под влиянием личи-
нок дикроцелиумов разрушается и имеет темно-коричневый,
иногда черный цвет. Церкарии светло-серого цвета, удлиненной
формы, с длинным хвостом и хорошо видимыми присосками.
Церкарии фасциол овальной формы, светло-серые, с развитым
хвостом, хорошо выраженными присосками и кишечными ствола-
ми. Редии в отличие от спороцист мешковидной формы, имеют
удлиненное тело, подвижны, внутри находятся оформленные или
более юные церкарии. Церкарии L. scotiae, как и другие парамфи-
стоматы, темно-коричневого цвета, тело грушевидное, с коротким
хвостом.
Муравьи отличаются друг от друга величиной, цветом, наличи-
ем и расположением на теле волосков, а также строением отдель-
ных органов. Например, F. rufibarbis — довольно крупные, с ко-
ричневым оттенком тела. На передней спинке густо расположены
волоски. Купол гнезда надземный. F. foreli — темно-коричневого
цвета, затылочный край головы с глубокой выемкой. Острокони-
ческие гнезда их построены из мелкой сухой травы. F. fusca (лес-
ной рыжий муравей) — крупный, коричневато-рыжеватого цвета,
обитает в лесах и на лесных полянах средней полосы России. Ку-
пол гнезда достигает огромных размеров и построен из веточек и
растений.
Для выявления зараженных метацеркариями муравьев их соби-
рают на пастбищах в теплый период года. Однако более эффек-
тивно брать оцепеневших муравьев, которые в значительном ко-
личестве встречаются на растительности утром и вечером, а в пас-
мурную погоду — круглосуточно вблизи муравейников (до 4 м).
Насекомых обездвиживают эфиром и собирают во флаконы и
пробирки с 3%-ным раствором формалина. У мертвых насекомых
удаляют скальпелем грудь и голову, а брюшко вскрывают в двух-
трех каплях физиологического раствора бактериологическими иг-
лами.
Метацеркарии дикроцелиумов овальной формы, с толстой обо-
лочкой, светло-серого цвета, длиной 0,6727—0,8029 мм. Под мик-
роскопом хорошо видны ротовая и брюшная присоски.
125
Практическое занятие
Задания. Освоить технику дегельминтизации крупного рогатого
скота и овец при фасциолезе политремом или другими препарата-
ми. Составить акт на дегельминтизацию.
Оборудование, материалы и объекты исследования: весы роговые; разновес; ре-
зиновые бутылки; пластмассовые совочки; ведра; политрем; комбикорм; жвачные
животные, подготовленные к дегельминтизации.
Место занятия: ветеринарная учебно-производственная клини-
ка техникума или животноводческая ферма колхоза (совхоза).
Методика проведения занятия. Дегельминтизацию животных
желательно проводить после предварительного гельминтокопро-
скопического обследования. За несколько дней до занятия или
учебной практики преподаватель отбирает в хозяйстве животных
и дает задание обслуживающему персоналу подготовить их к де-
гельминтизации. Накануне выезда в хозяйство лаборант готовит
оборудование и антигельминтики.
Учащихся разделяют на звенья по пять человек. В каждом из
них назначают старшего. Желательно, чтобы преподавателю по-
могал ветработник хозяйства. Прежде чем приступить к дегель-
минтизации, преподаватель напоминает ее технику, обращая осо-
бое внимание на дозировки антигельминтиков. Объяснение пре-
подавателя сопровождается демонстрацией разных методов дачи
антигельминтиков овцам и крупному рогатому скоту. Затем каж-
дое звено приступает к работе под руководством преподавателя.
Политрем крупному рогатому скоту назначают индивидуально
с кормом, овцам — методом группового скармливания. Препода-
ватель проверяет и оценивает практическую работу каждого уча-
щегося.
После дегельминтизации составляют акт с указанием времени,
места, вида и числа обработанных животных; серии , дозы, метода
назначения и количества израсходованного антигельминтика.
При отсутствии в хозяйстве политрема крупный рогатый скот
или овец можно дегельминтизировать другим, применяемым при
фасциолезе антигельминтиком.
Контрольные вопросы. 1. Какие морфологические признаки наиболее харак-
терны для трематод? 2. Каков принцип дифференциации трематодозов жвачных
при жизни животных и посмертно? 3. Какие антигельминтики применяют для де-
гельминтизации животных при фасциолезе? 4. В чем заключается биологический
метод борьбы с моллюсками? 5. Какие мероприятия имеют первоочередное значе-
ние в борьбе с парамфистомидозами телят? 6. Как происходит заражение плотояд-
ных животных и человека возбудителем описторхоза и другими трематодозами?
7. Почему происходит оцепенение муравьев? 8. Кто дополнительные хозяева хас-
стилезий? 9. Какова роль дополнительных хозяев в распространении трематодозов
животных?
126
7. ЦЕСТОДОЗЫ
Систематика, краткая морфология и биология цестод. Возбудите-
ли цестодозов сельскохозяйственных и других животных, а также
человека — ленточные гельминты из класса Cestoda, относящиеся
к типу Plathelminthes (плоские черви). В ветеринарии и медицине
основное значение имеют представители двух отрядов — лентецов
(Pseudophyllidea) и цепней (Cyclophyllidea). Только в первом отря-
де насчитывается 10 семейств. Семейство Diphyllobothriidae вклю-
чает в себя восемь родов и около 30 видов. В отряде цепней шесть
подотрядов и огромное число семейств, родов и видов.
Представители отрядов лентецов и цепней отличаются друг от
друга как биологией развития, так и морфологическими призна-
ками.
Половозрелые цестоды паразитируют в пищеварительном ка-
нале теплокровных животных, достигая различных размеров. Тело
цестод (стробила) лентовидное, состоит из головки (сколекса),
шейки (зоны роста) и члеников (проглоттид). Члеников может
быть от одного-двух до нескольких тысяч. В первых от шейки чле-
никах половые органы отсутствуют (молодые членики), но в пос-
ледующих появляются мужские, а затем и женские половые орга-
ны. Членики, содержащие полный комплект половых органов, на-
зываются гермафродитными. В дальнейшем в оплодотворенных
члениках начинают дегенерировать мужские, затем женские орга-
ны. Таким образом, у половозрелых гельминтов в последних чле-
никах находится лишь одна матка, заполненная яйцами (зрелые
членики), которые у цестод, как правило, отделяются от стробилы
и выходят с фекалиями наружу. Мужская половая система вклю-
чает в себя множество семенников, семявыводящих канальцев, се-
мяпроводов, циррус и половую бурсу. Женская половая система
состоит из яичников, яйцевода, желточников, тельца Мелиса,
оотипа, вагины и матки (рис. 40).
Тело цестод покрыто тонким покровом (тегументом), состоя-
щим из наружного и внутреннего слоев (см. рис. 9).
Сколекс служит для прикрепления цестод к местам локализа-
ции. Он снабжен присосками (у цепней их четыре), иногда с вы-
раженным хоботком, на котором у паразитов отдельных видов
есть крючки (вооруженный сколекс) или ботрии (присасыватель-
ные щели — у лентецов).
У цепней матка закрытого типа в виде продольного или попе-
речного ствола с боковыми ответвлениями, иногда мешковидная
или распадающаяся на капсулы. Половое отверстие (влагалище)
открывается сбоку членика. Яйца внутри содержат онкосферу ок-
руглой формы, с тремя парами крючков.
У лентецов матка открытого типа в виде петлистого канала. От-
крывается на вентральной поверхности каждого членика. Яйца
овальной формы (сходны с яйцами трематод), на одном из полю-
сов имеется крышечка, на другом — бугорочек. Внутри при соот-
127
Рис. 40. Строение полового аппарата цестод:
а — у цепней; б — у лентецов; 1 — отверстие вагины; 2 — выводное отверстие мужского полово-
го аппарата; 3 — половая бурса; 4 — внутренний семенной пузырек; 5—наружный семенной
пузырек; 6 — семявыносящий проток; 7—вагина; 8— семяприемник; 9—тельца мелиса;
10— семяпроводы; 11 — семенники; 12 — желточники; 13 — оотип; 14—яичник; 15— матка;
16— отверстие матки
ветствующих условиях внешней среды формируется корацидий
округлой формы, с ресничками и шестью эмбриональными крюч-
ками.
Нервная система состоит из центрального нервного узла, рас-
положенного в сколексе, и отходящих от него вдоль стробилы
продольных стволов. В пределах членика главные стволы соединя-
ются между собой поперечными ветвями.
Экскреторная система (осморегулирующая) цестод в принципе
такая же, как у трематод. Имеются вентральные и дорсальные ка-
налы, которые в конце стробилы соединяются в общий сосуд, от-
крывающийся в середине заднего края членика.
Цестоды — биогельминты. Их развитие происходит с участием
промежуточных хозяев. У цепней промежуточный хозяин один —
крупные позвоночные животные, у лентецов — два: первый — бес-
позвоночные, второй — рыбы.
128
Рис. 41. Строение личинок цестод:
д
а — цистицеркус: 1 — сколекс ввернутый; 2—сколекс вывернутый;
б— ценурус: 1 — сколексы в пузыре; 2—сколексы в стенке пузыря в
виде островков; в — эхинококкус: 1 — строение пузыря; 2—сколекс
из выводковой капсулы; г — цистицеркоид; д — плероцеркоид; е —
альвеококкус; 1 — строение пузыря; 2 — конгломерат пузырей
Среди цестод есть и такие виды, биология развития которых
необычна. Например, развитие Hymenolepis папа упрощено — ис-
чезает феномен смены хозяев. Человек для этого гельминта и про-
межуточный (в ворсинках тонких кишок из онкосферы развивает-
ся цистицеркоид), и дефинитивный (в просвете кишечника лока-
лизуется сама цестода) хозяин. Таким образом, в пищеваритель-
ном канале хозяина паразитируют половозрелые цестоды
(имаго), а в организме промежуточных хозяев — личинки (лар-
129
ва). Поэтому заболевания, вызываемые ими, называются соот-
ветственно имагинальными и ларвальными цестодозами. Для оп-
ределения видовой принадлежности взрослых иестод и их личи-
нок изучают форму тела, размеры, строение отдельных органов,
крючьев и т. д. Строение личинок некоторых иестод, паразити-
рующих в организме теплокровных и беспозвоночных животных,
дано на рисунке 41.
7.1. ЛАРВАЛЬНЫЕ ЦЕСТОДОЗЫ
7.1.1. ЦИСТИЦЕРКОЗ КРУПНОГО РОГАТОГО СКОТА (ФИННОЗ)
Цистицеркоз (бовисный) вызывается личинками бычьего цеп-’
ня ленточного гельминта класса Cestoda, подотряда Taeniata, се-
мейства Taeniidae. Заболевание характеризуется острым или хро-
ническим течением в результате поражения личинками (цисти-
церкусами) поперечнополосатых мыши крупного рогатого скота и
других животных из подсемейства Bovinae.
Локализация — скелетные мышцы, мышцы языка, сердца, на-
ружные и внутренние жевательные мышцы, реже печень и мозг.
Распространение. Болезнь встречается повсеместно, но чаше в
республиках Средней Азии, Закавказья, в Дагестане, южных и во-
сточных районах Сибири.
Возбудитель. Cysticercus bovis — пузырь серовато-белого цвета,
овальной формы, длиной 5—9 мм, шириной 3—6 мм. Внутри пу-
зыря ввернута головка с четырьмя присосками и жидкость. На-
ружная соединительнотканная оболочка личинки образована тка-
нями хозяина в результате иммунной реакции его организма
(рис. 42).
Цестода Taeniarhynchus saginatus (бычий солитер) достигает в
длину 10 м и более, ширина последних члеников 12—14 мм. В зре-
лых члениках от основного ствола, расположенного вдоль оси, в
обе стороны отходят 18—32 боковых ответвления. В члениках дли-
ной около 2 см находится более 150 тыс. яиц слабо-коричневого
цвета. Матка закрытого типа. Сбоку членика открывается половое
отверстие.
Яйца округлой формы, с толстой двухконтурной оболочкой и
выраженной исчерченностью. Внутри расположена онкосфера
(эмбриональная личинка с тремя парами крючьев). В гермафро-
дитных члениках яичник имеет две лопасти почти одинаковых
размеров (рис. 43).
Биология развития. Бычий солитер — биогельминт. Локализует-
ся в тонком кишечнике единственного дефинитивного хозяина —
человека. По мере созревания гельминта зрелые членики отрыва-
ются и с фекалиями выделяются наружу, где могут передвигаться
на значительные расстояния, червеобразно сокращаясь. На своем
пути они оставляют большое количество яиц, которые выходят из
130
Рис. 42. Сердце, пораженное лнчннкамн Т. saginatus
разорванной матки. Яйца тениидного типа снабжены двухконтур-
ной оболочкой с радиальной исчерченностью, желтовато-корич-
невого цвета, длиной 0.03—0,04 мм, шириной 0,02—0,03 мм.
Промежуточные хозяева (крупный рогатый скот, буйволы,
зебу, яки и северные олени) заражаются, поедая яйца и членики
гельминта во время пастьбы, кормления и поения (рис. 44). В ки-
шечнике животных из яйца выходит онкосфера, через слизистую
оболочку внедряется в мелкие кровеносные сосуды и заносится в
различные органы и ткани. Однако онкосферы преимущественно
оседают в тех органах, где интенсивно циркулирует кровь. Через
3—4,5 мес цистицеркусы достигают максимальной величины и
становятся инвазионными. Есть сведения о том, что у однократно
зараженных животных цистицеркусы живут около 3 лет, но, по
некоторым данным, дегенерация личинок начинается через 4 нед
после заражения.
Возбудителем тениаринхоза человек заражается при употребле-
нии недостаточно проваренного, прожаренного или проморожен-
ного мяса, пораженного цистицеркусами. В кишечнике человека
под воздействием желчи и соков цистицеркусы выворачивают
сколекс и при помощи мощных присосок прикрепляются к слизи-
131
Рис. 43. Общий вид Т. saginatus
Рис. 44. Биология развития Т. saginatus:
/ — сколекс цепня: 2—гермафродитный членик; 3 — зрелый членик; 4 — яйцо; 5—мышцы,
пораженные цистицеркусами; 6 — цистицеркусы в сердечной мышце
стой оболочке. В дальнейшем личинки быстро растут и развива-
ются, достигая половой зрелости за 2,5—3 мес. Зрелые цестоды
ежесуточно выделяют в среднем шесть—восемь проглоттид, а за
год — 2.5 тыс., или около 440 млн яиц. Продолжительность жизни
тениаринхуса более 10 лет.
133
Эпизоотологические данные. Цистицеркоз крупного рогатого
скота — гельминтоантропозоонозное заболевание. Встречается в
Австралии, странах Африки, Америки и Европы. В странах СНГ
инвазия распространена почти повсеместно. В некоторых респуб-
ликах и районах болезнь регистрируется очень широко, например
в Азербайджане, Дагестане, Алтайском крае, Якутии, республиках
Средней Азии. Значительно заражены дикие копытные (газели
Томпсона и Гранта, буйволы и антилопы-гну) национального
парка Серенгети (Танзания).
Большое значение в распространении заболевания имеют обы-
чаи и традиции населения, в соответствии с которыми в пищу
употребляют недостаточно проваренное и прожаренное мясо. В
пригородных хозяйствах один из важных источников распростра-
нения яиц возбудителя — сточные воды, используемые для полива
пастбищ и кормовых культур. Огромное значение имеют некаче-
ственная экспертиза туш и мяса, подворный убой скота и несвое-
временное выявление больных тениаринхозом людей. Что же ка-
сается распространения цистицеркоза в возрастной динамике, то
в Азербайджане экстенсивность инвазии у животных 1,5—2 лет со-
ставила 28,5 %, в возрасте 2—4лет—14,4, 5—6лет —8 и в 9—
12 лет-2,08 %.
Исследователи признают существование штаммности С. bovis
для различных географических зон. Штаммы различаются по при-
живаемости и продолжительности жизни в организме хозяина,
месту локализации. Например, в Судане и Эфиопии цистицерку-
сы крупного рогатого скота в основном локализуются в печени
животных, а на территории России это редкое явление. Данное
заболевание представляет значительную проблему для оленевод-
ческих хозяйств Севера.
Возбудителем цистицеркоза крупного рогатого скота в сильной
степени заражаются олени. Личинки достигают инвазионной ста-
дии лишь под оболочками головного мозга. Жители Севера зара-
жаются при употреблении в пищу сырого мозга оленя.
На эпизоотологию заболевания влияют сезонность и связанные
с ней факторы. Крупный рогатый скот заражается яйцами возбу-
дителя главным образом на пастбищах и прифермских участках.
При этом более реальные условия для заражения животных созда-
ются весной и осенью, что связано с оптимальными температурой
и влажностью воздуха. Отсутствие благоустроенных туалетов на
фермах и нарушения ветеринарно-санитарных правил также спо-
собствуют распространению яиц гельминта во внешней среде и в
помещениях для скота. Летом под лучами солнца яйца и членики
гельминта погибают быстрее и животные заражаются реже. Уста-
новлено, что даже в промышленных комплексах для разведения
крупного рогатого скота нередко наблюдают заражение животных
цистицеркозом. Это связано с тем, что больные тениаринхозом
134
люди пренебрегают санитарными нормами на фермах, загрязняют
яйцами цестод помещения и корма.
Патогенез и симптомы болезни. Болезнетворное влияние цисти-
церкусов в основном проявляется в период их миграции. Множе-
ство онкосфер, проникая в слизистую кишечника и мелкие ка-
пилляры, нарушает их целостность и одновременно инокулирует
микрофлору. Продукты метаболизма личинок аллергически и ток-
сически влияют на весь организм. Подрастая в мышцах, цисти-
церкусы сдавливают окружающую ткань, развивается миозит. В
местах локализации личинок начинается воспаление (скаплива-
ются фибробласты, гистиоциты, лимфоциты и эозинофилы), что
способствует образованию соединительнотканной капсулы, бога-
той капиллярами. В волокнах мышц исчезает поперечная исчер-
ченность. В дальнейшем личинки адсорбируют соли кальция и
другие элементы, постепенно гибнут и в пузыре происходит заме-
щение жидкости минеральными солями.
Симптомы болезни проявляются в соответствии с патогенезом:
нарушается пищеварение; ухудшается работа сердца; в нижних час-
тях тела появляются отеки и асцит. При инвазии сильной степени
животные угнетены, отмечаются слабость, дрожь, парезы конечно-
стей и высокая температура (39,8—41,8 °C). Телята чаще лежат, раз-
вивается атония преджелудков. Иногда наблюдают зуд кожи, болез-
ненность брюшной и грудной мышц. Инвазия слабой степени в
обычных условиях содержания животных протекает незаметно. По
истечении 1,5—2нед с начала заражения симптомы болезни сгла-
живаются и животные выглядят клинически здоровыми.
При остром течении инвазии в пораженных мышцах, брюши-
не, селезенке, других органах и тканях обнаруживают значитель-
ное количество точечных кровоизлияний и мелких цистицерку-
сов. При хроническом цистицеркозе скелетные мышцы серого
цвета, видны студенистые личинки светло-серого цвета.
Диагностика. При жизни поставить точный диагноз на основа-
нии симптомов болезни трудно. Поэтому более эффективны им-
мунологические методы диагностики. В настоящее время разрабо-
таны внутрикожная аллергическая проба, реакция латекс-агглю-
тинации (РЛА) и реакция непрямой гемагглютинации (РИГА).
Для выявления неблагополучных хозяйств наиболее результатив-
но исследование сыворотки крови по РИГА, процент положитель-
ных случаев составляет 92,8.
Наиболее эффективен и приемлем послеубойный осмотр туш.
Как правило, интенсивнее поражается передняя часть туловища
животного, особенно наружные и внутренние жевательные мыш-
цы, мышцы языка и сердца. Для осмотра делают продольные раз-
резы, а при необходимости — дополнительно разрезы шейных и
поясничных мышц.
Послеубойный осмотр туш и мяса при помощи люминесцент-
ной лампы ОЛД-41 существенно повышает эффективность иссле-
135
дования. Осмотр проводят в темном помещении. Через 5—7 мин
после включения лампа готова к работе. Площадь освещения лам-
пы равна 100 см2 с расстояния 50—60 см. Через 1.5—2 ч работы ее
надо отключить. Обычно личинки светятся темно-вишневым или
красным светом. При замораживании мяса личинки хотя и поги-
бают, но не перестают светиться, поэтому определять жизнеспо-
собность личинок при помощи лампы нельзя. При варке мяса све-
чение личинок исчезает через 80—90 мин.
Цистицеркусов (финн) необходимо дифференцировать от мо-
лодых тонкошейных пузырей, у которых головка вооружена. Ло-
кализуются они главным образом на серозных покровах.
Профилактика и меры борьбы. Для профилактики цистицеркоза
животных и, следовательно, тениаринхоза человека необходимо
разорвать биологию развития возбудителя. С этой целью проводят
комплекс ветеринарно-санитарных мероприятий:
1) запрещают подворный убой животных и реализацию мясных
продуктов без ветеринарного осмотра на мясокомбинатах, убой-
ных пунктах и т. д.;
2) информируют о гельминтоантропозоонозах животноводов и
население неблагополучных хозяйств;
3) осуществляют ветеринарно-санитарный контроль за состоя-
нием ферм, убойных пунктов и площадок;
4) биркуют убойных животных;
5) утилизируют туши и субпродукты при обнаружении на раз-
резах мышц более трех цистицеркусов.
Кроме того, осуществляют медико-санитарные мероприятия,
которые заключаются: 1) в периодической диспансеризации жи-
вотноводов и населения неблагополучных хозяйств. (При обнару-
жении гельминтоза у людей их необходимо дегельминтизировать в
условиях медицинских учреждений и провести профилактику рас-
сеивания яиц и члеников гельминта.); 2) создают на животновод-
ческих фермах санитарно-гигиенические условия с целью профи-
лактики инвазии.
Лечение. При цистицеркозе крупного рогатого скота лечение
почти не разработано, хотя в последние годы получены доволь-
но эффективные результаты применения празиквантелла
(дронцита).
7.1.2. ЦИСТИЦЕРКОЗ СВИНЕЙ (ФИННОЗ)
Цистицеркоз, или финноз, свиней (целлюлозный) и некоторых
других животных — остро или хронически протекающее гельмин-
тоантропозоонозное заболевание, вызываемое личинками свиного
цепня Taenia solium семейства Taeniidae.
Локализация — межмышечная ткань скелетных мышц.
Распространение. Заболевание распространено во многих ре-
гионах страны, особенно в районах Полесья, Белоруссии, цент-
136
ральных областях Нечерноземной зоны Российской Федерации
и др.
Ущерб от этой инвазии складывается из многих показателей:
технической утилизации туш или их обезвреживания, потери при-
роста живой массы, абортов, снижения плодовитости и молочной
продуктивности свиноматок.
Возбудитель. Cysticercus cellulosae — пузырь эллипсоидной фор-
мы светло-серого цвета, длиной 6—20 мм, шириной 5—10 мм
(рис. 45). Цистицеркус целлюлозный в озличие от бовисного на
сколексе имеет два ряда крючьев (22—32 шт.).
Рис. 45. Цистицеркусы целлюлозные (натуральная величи-
на, по Капустину):
а — извлеченные из мышц свиней; б—с вывернутыми наружу
сколексами
137
В половозрелой стадии длина свиного цепня Taenia solium око-
ло 3 м (реже до 6 м).
Характерная особенность незрелых члеников цестоды — нали-
чие в них трехлопастного яичника, а в зрелом членике от основно-
го ствола матки отходит 7—12 боковых ответвлений. Яйца тениид-
ного типа.
Биология развития. Человек — единственный дефинитивный
хозяин свиного цепня — заражается при употреблении недоста-
точно проваренного или прожаренного мяса, пораженного цисти-
церкусами. В желудке мясо переваривается, а личинки выворачи-
ваются из пузыря и, прикрепившись присосками и крючками к
слизистой оболочке, в течение 2,5 мес достигают стадии имаго
(рис. 46).
Промежуточный хозяин — свинья — заражается при поедании
яиц и члеников цестоды, которые выделяются больными людьми.
Дальнейшее развитие цистицеркуса целлюлозного происходит так
же, как и цистицеркуса бовисного. Он локализуется в основном в
тех же мышцах и органах. Инвазионной стадии личинки достига-
ют за 3—4 мес. Следует помнить, что биология развития свиного
цепня имеет ряд особенностей. Промежуточные хозяева очень
разнообразны — это свинья, кабан, верблюд, собака, кошка, заяц,
обезьяна и человек. Человек в качестве промежуточного хозяина
заражается личинками гельминта двумя путями: яйца цестоды по-
падают внутрь с пищей и с загрязненных рук; яйца попадают пос-
ле разрушения члеников в желудке (аутоинвазия) в кишечник в
случаях забрасывания стробил при антиперистальтических движе-
ниях (рвота). Онкосферы, освободившись от яйцевой оболочки,
через слизистую оболочку кишечника проникают в кровь и разно-
сятся по всему организму. При этом у человека они локализуются
чаще всего в мозгу, глазах, подкожной клетчатке и вызывают тя-
желые и нередко неизлечимые патологические изменения.
Эпизоотологические данные. Эпизоотология данной инвазии
идентична таковой при цистицеркозе крупного рогатого скота.
Однако имеются некоторые особенности развития инвазии. Изве-
стно, что свиньи возбудителем цистицеркоза заражаются более
интенсивно, чем другие животные, так как они часто поедают вы-
деления человека. Кроме того, необходимо учитывать разнообра-
зие промежуточных хозяев, способствующих распространению
инвазии. С другой стороны, это заболевание носит локальный ха-
рактер, так как во многих республиках и регионах России свинину
не употребляют в пищу из-за национальных и религиозных тради-
ций.
В организме свиней личинки могут сохранять жизнеспособ-
ность до 6 лет, после чего они интенсивно погибают.
Патогенез и симптомы болезни. Патогенное воздействие онко-
сфер и цистицеркусов, а также симптомы болезни такие же, как и
при цистицеркозе бовисном. Но поскольку свиньи заражаются
138
Дефинитивный
хозяин
более высокими дозами яиц, чем крупный рогатый скот, то пато-
логический процесс при цистицеркозе свиней бывает более глубо-
ким, а симптомы болезни выражены ярче. Так, у месячных поро-
сят, получивших по 1000 яиц Т. solium, уже к концу 2-х суток от-
мечают общее угнетение, плохой аппетит, повышение чувстви-
тельности кожи и понос. На 8-е сутки появляются рвота, понос с
кровью, жажда и болезненность скелетных мышц. Пульс учащает-
139
ся до 110, дыхание — до 52 в I мин, температура тела повышается
до 40.6 °C. Хотя симптомы болезни к 15—17-м суткам с начала ин-
вазии постепенно нормализуются, в крови отмечают существен-
ные изменения: уменьшаются количество эритроцитов и общий
уровень белка в сыворотке крови, увеличивается число лейкоци-
тов (до 29 тыс. в 1 мкл) и эозинофилов.
Повышенные дозы яиц (Зтыс., 6 тыс., 12 тыс. и 24тыс.) обус-
ловливают те же симптомы, но они более выражены. При даче 50
и 150 тыс. яиц у поросят (в возрасте 2 мес) появляются дополни-
тельные признаки: потеря голоса, опухание век, губ, пучеглазие,
цианоз видимых слизистых оболочек и нервные расстройства.
Смерть наступает соответственно через 12—13 и 8—10 сут.
Если учесть, что в одном членике гельминта насчитывается
около 140 тыс. яиц, то указанные выше дозы заражения в есте-
ственных условиях содержания животных вполне реальны.
Диагностика. При жизни поставить точный диагноз не всегда
возможно. Существующие иммунобиологические методы хотя и
дают обнадеживающие результаты, но пока не получили широкого
практического применения. При патологоанатомическом вскрытии
трупа в местах расположения цистицеркусов находят атрофию
мышц, они водянистые и пронизаны соединительной тканью.
Наиболее эффективна и практически выполнима ветсанэкс-
пертиза туш, а также применение люминесцентной лампы ОЛД-
41, как при цистицеркозе крупного рогатого скота.
Профилактика и меры борьбы. Меры борьбы и профилактики
почти такие же, как при цистицеркозе крупного рогатого скота.
Однако, учитывая, что источником заражения человека личинка-
ми свиного цепня может быть мясо кабанов, верблюдов, зайцев,
кроликов, а в некоторых географических зонах — мясо собаки,
обезьяны, в неблагополучных регионах туши и головной мозг этих
животных подвергают ветсанэкспертизе. Замораживание свинины
до минус 10 °C и посол в крепком рассоле приводят к гибели цис-
тицеркусов через 2—3 нед.
7.1.3. ЦИСТИЦЕРКОЗ ТЕНУИКОЛЬНЫЙ
Широко распространенное остро или хронически протекаю-
щее заболевание овец, коз, свиней, реже крупного рогатого скота
и верблюдов, а также лосей, оленей и других диких животных, вы-
зываемое личиночной стадией цестоды Cysticercus taenuicollis се-
мейства Taeniidae.
Локализация — серозные покровы сальника, брыжейки, пече-
ни, плевры.
Распространение. Заболевание распространено повсеместно,
особенно в районах интенсивного овцеводства.
Возбудитель. Заболевание вызывает Cysticercus taenuicollis —
тонкошейный цистицеркус. Как правило, он овальной формы,
140
Рис. 47. Цистицеркусы тенуикольные:
а — на печени; б — на сальнике
светло-серого цвета, старые особи серые или серовато-желтова-
тые, размером до куриного яйца. Пузырь полузаполнен прозрач-
ной жидкостью, внутри него свободно перемешается белого цвета
сколекс с четырьмя присосками, вооруженный крючками.
Половозрелая цестода Т. hydatigena крупная, длиной до 5 м.
Сколекс вооружен 26—44 крючками. В зрелых члениках длиной
10—15 мм и шириной 4—5 мм находится матка, от основного ство-
ла которой отходит 5—10 боковых ответвлений. Яйца круглые, с
исчерченной толстой оболочкой тениидного типа, диаметром
0,03—0,04 мм, внутри содержат онкосферу (рис. 47).
141
Биология развития. Дефинитивные хозяева (собака, волк, ша-
кал, лиса, соболь, ласка) с фекалиями выделяют яйца и членики
цестод. Овцы, свиньи и другие промежуточные хозяева заражают-
ся яйцами и члениками, поедая корм и при поении. Онкосферы
из тонкой кишки заносятся кровью в печень, где формируются
сигарообразной формы личинки. Через 10—18 сут они интенсив-
но выходят из паренхимы печени в брюшную полость. Там за 35—
65 сут личинки достигают инвазионной стадии.
Дефинитивные хозяева заражаются при поедании органов жи-
вотных, пораженных инвазионными цистицеркусами. Паразиты
достигают половой зрелости в кишечнике собаки за 1,5—2,5 мес.
Установлены случаи заражения человека как промежуточного хо-
зяина.
Эпизоотологические данные. Молодые животные заражаются
чаще и интенсивнее весной и осенью на пастбищах и прикошар-
ных участках. Однако животноводы с целью охраны часто привя-
зывают собак вблизи сена и комбикормов, это способствует рас-
пространению яиц и члеников с кормами. Кроме того, скармлива-
ние собакам внутренних органов, пораженных цистицеркусами,
отсутствие скотомогильников — причины широкого распростра-
нения инвазии среди дефинитивных и промежуточных хозяев. Ос-
новной источник инвазии — приотарные собаки, но в отдельных
зонах страны (при отсутствии строгих мер профилактики) нема-
лая роль принадлежит волкам и шакалам.
Патогенез и симптомы болезни. Наибольшее патогенное воздей-
ствие на организм промежуточных хозяев оказывают зародыши
паразита в период миграции онкосфер из кишечника в печень, а
затем, сформировавшись в довольно крупные сигарообразные пу-
зыри, из паренхимы печени в брюшную полость. В этот период
выявляются последствия травм от миграции личинок. Развивают-
ся травматический гепатит, перигепатит, серозно-фибринозный
перитонит, очаговая пневмония и серозно-фибринозный плеврит.
Аллергические реакции начинают проявляться на 10-е сутки с мо-
мента заражения и максимально выражены на 25—35-е сутки. В
зависимости от интенсивности инвазии заболевание протекает ос-
тро или хронически.
Острое течение характеризуется повышением темпе-
ратуры тела, беспокойством и отказом от корма. Дыхание и
пульс учащены, появляется болезненность в области печени. У
поросят, получивших 50—70 тыс. яиц, начинаются нервные рас-
стройства и нарушается координация движений. Большие изме-
нения аллергического характера происходят в форменных эле-
ментах крови. Животные резко худеют, а в острый период инва-
зии даже погибают.
Хроническое течение инвазии обусловлено при-
креплением личинок к поверхности серозных покровов. Живот-
ные при этом худеют.
142
Диагностика. Точный диагноз ставят при вскрытии животных и
обнаружении цистицеркусов в местах локализации. При остром
течении инвазии видны ходы миграции личинок в печени в виде
кровоизлияний. Выражены острый гепатит, серозно-фибриноз-
ный перитонит и перигепатит. Брыжеечные лимфатические узлы
увеличены, на разрезе сочные. Иногда тонкошейные цистицерку-
сы приходится дифференцировать от эхинококкусных пузырей,
так как они часто локализуются на поверхности или частично в
печени зараженных животных. Характерный признак для
С. taenuicollis — в цистицеркусе содержится одна подвижная бело-
го цвета головка личинки, которая хорошо видна через стенки пу-
зыря.
7.1.4. ЦИСТИЦЕРКОЗ ОВЕЦ
Цистицеркоз овец, коз и некоторых диких жвачных (промежу-
точных хозяев) вызывается паразитированием личинок Cysticercus
ovis ленточного гельминта Taenia ovis семейства Taeniidae.
Локализация — скелетные мышцы, сердце и реже паренхима-
тозные органы.
Биология развития. Овцы, козы, верблюды, джейраны, черно-
хвостый олень заражаются при поедании вместе с кормом яиц це-
стоды. Далее онкосфера мигрирует в места локализации, где за
2 мес формируется Cysticercus ovis до инвазионной стадии. Дефи-
нитивные хозяева (собаки, кошки, шакалы, лисы и волк) заража-
ются при поедании мяса, пораженного цистицеркусами. У собак
гельминты достигают стадии имаго за 61—156 сут, у кошек —за
52 сут. Цестоды живут в кишечнике собак свыше года.
Эпизоотологические данные. Цистицеркоз овец и коз — доста-
точно широко распространенное заболевание в нашей стране и
странах СНГ. Этому способствуют нарушения ветеринарно-сани-
тарных условий в хозяйствах, а также широкий круг дефинитив-
ных и промежуточных хозяев. У молодых животных экстенсив-
ность и интенсивность инвазии выше, чем у взрослых, кроме того,
у них продолжительнее выживаемость личинок.
Патогенез и симптомы болезни. Клинические признаки цисти-
церкоза изучены только при экспериментах. У больных нарушает-
ся функция органов пищеварения, дыхание через 4—8 сут после
заражения учащенное, поверхностное, аппетит понижен, види-
мые слизистые оболочки анемичны, температура тела повышена,
животные залеживаются. Однако к 13—14-м суткам с начала инва-
зии состояние животных улучшается.
Диагностика. Диагноз ставят при ветсанэкспертизе зараженных
животных, обнаруживая в их органах и тканях личинок. Наиболее
часто бывают заражены мышцы задних конечностей — от 20 до
29 %. Цистицеркусы встречаются в легких, сердце, диафрагме и
143
т. д. Чаше личинки в ранние сроки петрифицируются, хотя у от-
дельных животных они бывают жизнеспособными и через 215 сут
после заражения.
Лечение. Не разработано.
Профилактика и меры борьбы. Хороший результат дает приме-
нение ультрафиолетовой лампы ОЛД-41 (см. Цистицеркоз круп-
ного рогатого скота).
Профилактические меры борьбы идентичны применяемым при
цистицеркозах других животных. При слабой степени инвазии
мясо тщательно проваривают, а при сильной — утилизируют.
7.1.5. ЦИСТИЦЕРКОЗЫ СЕВЕРНЫХ ОЛЕНЕЙ И КОСУЛЬ
Цистицеркозы оленей и косуль (промежуточные хозяева) вы-
зываются личинками Cysticercus tarandi, С. parenchimatosa и
С. cervi ленточных гельминтов соответственно Taenia crabbei,
Т. parenchimatosa, Т. cervi.
Локализация — С. tarandi у оленей паразитирует в скелетных
мышцах и сердце, иногда в печени, головном мозге и в глазах;
С. parenchimatosa — преимущественно в печени, а при сильной за-
раженности — в сердце, в скелетных мышцах и брюшине. Цисти-
церкусы у косуль выявляются в скелетных мышцах, легких, пече-
ни и мозгу.
Возбудитети. С. tarandi — пузырь продолговатой формы, дли-
ной 7,0—10,5 мм, шириной 2,5—4,5 мм. Сколекс и присоски пузы-
ря округлые, хоботок вооружен 26—34 крючками, расположенны-
ми в два ряда. Поверхность личинки исчерчена, края фестонча-
тые. Шейка состоит из 9—48 псевдосегментов.
С. parenchimatosa — округлой формы, диаметр цист 5,0—
14,0 мм при максимальной ширине 4.0—10,5 мм. Хоботок воору-
жен 30—34 крючьями, расположенными в два ряда. Шейка состо-
ит из 11—17 псевдосегментов. Хвостовой пузырь овальный, дли-
ной 7,4—28,5 мм.
С. cervi — чаше овальный, хоботок вооружен 24—32 крючьями,
расположенными в два ряда. В мышцах окружен капсулой, легко
отделяется от окружающей ткани.
Взрослые цестоды достаточно крупные — от 35 до 225 см. Пара-
зитируют у собак, волков, песцов. Т. crabbei может быть еще у
койотов, кошек, рысей, а для Т. cervi лисиц является факультатив-
ным хозяином.
Олени и косули заражаются в любом возрасте и достаточно ча-
сто и интенсивно. Основной источник их заражения — собаки и
волки.
Диагностика. Болезнь диагностируют с учетом комплексных
исследований, но уточняют при вскрытии.
Профилактика и меры борьбы. В целом они такие же, как и при
других ларвальных цестодозах животных.
144
7.1.6. ЦИСТИЦЕРКОЗ ПИЗИФОРМНЫЙ КРОЛИКОВ И ЗАЙЦЕВ
Цистицеркоз пизиформный — достаточно широко распростра-
ненный гельминтоз среди кроликов и зайцев.
Локализация — серозные покровы брюшной и реже грудной
полости, сальник.
Возбудитель. Cysticercus pisiformis — пузырь величиной от 5,0 до
15 мм, округлой или продолговатой формы. Нередко эти пузыри
охватывают прямую кишку и оказываются в глубине тазовой по-
лости (рис. 48).
Взрослая цестода паразитирует в тонком кишечнике собак,
Рис. 48. Cysticercus pisiformis на серозных покровах кролика (уменьшено,
по В. Ф. Капустину)
145
волков, шакалов, лис. реже кошки и других плотоядных. Больные
животные малоподвижны, у них резко снижается аппетит, живот-
ные худеют. Печень увеличена, плотная, болезненна при пальпа-
ции. Среди 1—2-месячных крольчат отмечают значительный па-
деж.
Диагностика. Практически диагноз ставят при вскрытии пав-
ших и убитых животных.
Профилактика и меры борьбы. В целом они такие же, как при
цистицеркозах других животных. Следует тщательно осматривать
внутренние органы и даже тушки кроликов и зайцев перед скарм-
ливанием плотоядным.
Запрещается допускать на территории крольчатников и в места
убоя кроликов собак и кошек. Охотники и обслуживающий персо-
нал охотничьих хозяйств должны быть информированы о прави-
лах ветсанэкспертизы.
7.1.7. ЦЕНУРОЗ ЦЕРЕБРАЛЬНЫЙ (ВЕРТЯЧКА)
Ценуроз — заболевание главным образом молодняка овец, реже
коз и крупного рогатого скота, вызываемое личинками Coenurus
cerebralis цестоды Multiceps multiceps семейства Taeniidae.
Локализация — головной и реже спинной мозг.
Распространение. Ценуроз чаше всего встречается в Казахстане,
Средней Азии, Закавказье, на Северном Кавказе и в некоторых
других районах с развитым овцеводством. Экономический ущерб
складывается из падежа молодняка и вынужденного убоя больных
животных. Больные животные сильно истощены, поэтому туши,
как правило, утилизируют.
Возбудитель. Пузырь (ценурус) — Coenurus cerebralis светло-се-
рого цвета, заполнен прозрачной жидкостью, на его внутренней
оболочке (герминативной) островками расположены 500 и более
сколексов. Величина пузыря зависит от степени его развития и
нередко достигает размеров куриного яйца (рис. 49). Длина цесто-
ды М. multiceps колеблется от 40 до 100 см. Сколекс снабжен 22—
32 крючьями, расположенными в два ряда. Длина члеников в 2—
3 раза превышает ширину. В зрелых члениках от матки отходит
19—26 боковых ответвлений. Яйца, как и у многих тениат, округ-
лые, диаметром 0,03—0,04 мм, коричневато-серого цвета.
Биология развития. У собак и волков (дефинитивные хозяева) в
тонком кишечнике половозрелые мультицепсы ежесуточно выде-
ляют наружу значительное количество члеников. Свежие членики
способны сокращаться и ползать, оставляя на своем пути боль-
шое число яиц. Промежуточные хозяева (овцы и другие живот-
ные) заражаются возбудителем ценуроза алиментарным путем,
поедая яйца и членики цестоды на пастбище, вблизи овчарни, с
загрязненным кормом и т. д. (рис. 50). Онкосферы гельминта из
146
Рис. 49. Coenurus cerebralis:
a — два пузыря в головном мозге овиы; б — вскрытый иенурусный пузырь с зародышевыми
головками (из учебника Th. Hiepe)
кишечника овцы с кровью проникают в различные органы, в том
числе головной мозг, где за 2—3 мес формируется ценурус — инва-
зионная стадия пузыря. В свою очередь, дефинитивные хозяева
заражаются при поедании головного или спинного мозга живот-
ных, зараженных ценурусами. В кишечнике плотоядных мульти-
цепсы достигают половой зрелости через 1,5—2 мес.
Эпизоотологические данные. Яйца и членики мультицепсов на
пастбище и территории помещений для скота распространяют со-
баки, не подвергающиеся плановым дегельминтизациям, волки и
другие хищники при наличии доступа к пораженным ценурусами
органам — источникам заражения. В основном возбудителем це-
нуроза заражаются в пастбищный сезон ягнята и молодняк овец
до года, реже — до 2 лет. Для более взрослых овец характерен воз-
растной иммунитет. У других животных, в том числе и диких, это
заболевание встречается реже.
Поражение спинного мозга ценурусами нередко бывает у овец
в хозяйствах Южного Казахстана, тогда как в предгорьях Ставро-
полья оно фактически не отмечается. Следовательно, можно до-
пустить наличие штаммности паразита. Кроме того, в Казахстане
зарегистрирован ценуроз овец и коз с поражением мышечной тка-
147
Рис. 50. Биология развития М. multiceps:
1 — сколекс цестоды; 2— гермафродитный членик; 3 — зрелый членик; 4— яйцо; 5, 6—
строение ценуруса; 7— ценурус в головном мозге овцы
ни и подкожной клетчатки, вызываемый личинками Coenurus
skijabini цестоды Multiceps skrjabini, паразитирующей в кишечнике
собак.
Патогенез и симптомы болезни. На 2-е сутки после заражения
следы личинок («ходы бурения») находят в печени, сердце и дру-
гих органах. Через 48 ч с начала инвазии в головном мозге обнару-
148
живают гиперемию, инфильтраты, в желудочках увеличивается
объем жидкости. На 15—20-е сутки отмечают не только «ходы бу-
рения», но находят и самих ценурусов. На 40—100-е сутки пузырь
увеличивается, давит на окружающую ткань и кости черепа. Про-
исходят атрофия мозга и истончение черепа. В последней стадии
развития ценурус занимает 2/3 полости черепа.
Симптомы болезни зависят от количества пузырей, их располо-
жения в мозгу и давности инвазии. В течение ценуроза различают
четыре стадии:
первая стадия длится примерно до 16 сут с начала заражения.
В это время видимых признаков болезни нет. Зараженность жи-
вотных можно установить только с помощью аллергической ре-
акции;
вторая стадия — 16—23 сут после заражения. Появляются при-
знаки пугливости, тонические и клинические судороги, вынуж-
денные позы, конъюнктива гиперемирована. Эти признаки обус-
ловлены проникновением в мозг онкосфер и ростом пузыря;
третья стадия продолжается длительно. На 25-е сутки после за-
ражения как бы улучшается состояние больного, но идет усилен-
ный рост ценуруса, который давит на окружающую ткань;
четвертая стадия продолжается около 1—2 мес. Появляются яв-
ные симптомы болезни, и завершается она гибелью.
В случае локализации пузыря в лобной доле мозга больные жи-
вотные безудержно движутся вперед с опущенной головой или по-
долгу стоят, упершись головой во что-нибудь. При локализации
ценуруса в правой или левой височной доле животные вращаются
вправо или влево. Поражение затылочной доли обусловливает
запрокидывание головы на спину, животное стоит или пятится
назад. Поражение мозжечка характеризуется пугливостью, нару-
шением равновесия и координации движений. При расположении
пузыря в спинном мозге наступает парез и паралич задних конеч-
ностей.
Диагностика. При жизни диагноз ставят на основании эпизоо-
тологических данных и симптомов болезни, а также с помощью
аллергической реакции и осмотра дна глаз. У больных с пораже-
нием мозга обнаруживают застойные явления в соске зрительного
нерва. Посмертно ценуроз диагностируют путем вскрытия головы
и обнаружения пузыря.
При вскрытии павшей или убитой овцы находят один или реже
два пузыря. Мозг атрофирован, череп местами утончен и легко
прогибается.
Ценуроз необходимо дифференцировать от эстроза (признаки
ложной «вертячки»), вызываемого личинками насекомого Oestrus
ovis, и от весеннего мониезиоза, иногда сопровождаемого нервны-
ми явлениями. Нередко признаки ценуроза у молодняка овец по-
являются при инфекционных заболеваниях — листериозе, брадзо-
те, бешенстве и при медленно протекающих инфекциях. Пораже-
149
ние внутреннего уха тоже может сопровождаться признаками
«вертячки».
Лечение. При ценурозе овец, особенно в ранней стадии течения
инвазии, эффективен антигельминтик панакур в дозе 0,025 г д. в.
на 1 кг массы тела. Применяют его в течение 3 дней перорально с
кормом или водой в соотношении 1:5, 1:10. В особых случаях
при позднем течении инвазии возможно хирургическое лечение,
но оно экономически не оправдано.
Профилактика и меры борьбы. Большое значение имеют свое-
временное выявление заболевших животных и их сдача на мясо-
комбинат. Н Е Косминковым и др. (1986) разработана вакцина,
которая представляет собой инактивированную культуру 2—3-су-
точных проценурусов цестоды М. multiceps и среду культивирова-
ния (199), консервированную мертиолятом. В качестве адъюванта
(стимулирующего иммуногенез) введен гель гидроксида алюми-
ния. Вакцину применяют для активной иммунизации ятнят в воз-
расте 1,5—3 мес внутримышечно в дозе 1 мл. Ягнят иммунизируют
дважды с интервалом 10 сут за 1 мес до выгона на пастбище Им-
мунитет развивается в течение 1 мес и сохраняется минимально
1 год. Вакцину хранят при 2—10 °C в сухом месте около 4 мес. За-
мораживанию не подлежит. По данным авторов вакцины, за 3—
4 года хозяйства полностью освобождаются от ценуроза без при-
нятия каких-либо дополнительных профилактических мер. В це-
лом же при ценурозе проводят те же мероприятия, что и при эхи-
нококкозе животных.
7.1.8 ЭХИНОКОККОЗ
Эхинококкоз — заболевание млекопитающих животных и че-
ловека, вызываемое личинками Echinococcus granulosus L цестоды
Echinococcus granulosus семейства Taeniidae.
Локализация — печень, легкие, селезенка, почки, реже—дру-
гие органы (даже костная ткань).
Распространение. Болезнь регистрируется во многих странах
мира. В нашей стране и странах СНГ — в районах интенсивного
животноводства (Казахстан. Средняя Азия, Закавказье, Ставро-
польский край, Саратовская, Омская и многие другие области).
Экономический ущерб складывается из потери прироста, ухуд-
шения качества продукции, выбраковки органов, падежа живот-
ных, значительных затрат материальных средств. Эхинококкоз на-
носит невосполнимый урон здоровью людей.
Возбудитель. Эхинококкус в личиночной стадии Echinococcus
granulosus L. — наполненный жидкостью пузырь, на герминатив-
ной (внутренней) оболочке которого расположены протосколек-
сы. Снаружи пузырь покрыт соединительнотканной оболочкой,
образованной тканью хозяина. Внутри пузыря содержится слегка
опалесцирующая жидкость нередко с зародышевыми головками, а
150
также с дочерними, а в них с внучатыми пузырями. Эти пузыри
называются соответственно Е. vetennorum и Е. hominis. Кроме
того, встречаются пузыри, в которых отсутствуют сколексы, их на-
зывают стерильными, или ацефалоцистами. Развитие такого пу-
зыря — результат иммунной реакции хозяина. Следует помнить,
что пузыри этих типов — лишь анатомические изменения, возни-
кающие в зависимости от вида, возраста и иммунного состояния
хозяина, а не зоологический признак (рис. 51, 52).
Ленточный эхинококкус Е. granulosus — цестода длиной 2—6 мм,
Рис. 51. Печень овцы, пораженная личиночной стадией
Е. granulosus (по Th Hiepe)
Рис. 52. Поражение кишечника собаки эхинококкусами
(по Капустину)
151
Рис. 53. Общий вид Е. granulosus
состоит из трех-четырех члеников, сколекса, вооруженного 28—
40 крючьями. В зрелом, последнем членике имеется мешковидная
матка, наполненная яйцами. Яйца округлой формы, желтовато-
серого цвета, диаметром 0,03—0,036 мм. Характерны для многих
цестод семейства Taeniidae (рис. 53).
Биология развития. Дефинитивные хозяева эхинококкуса —
собака, волк, шакал, койот, динго и лиса (факультативный хозя-
ин). Промежуточные хозяева — овца, коза, крупный рогатый
скот, свинья, верблюд, олень, человек и реже лошадь.
С фекалиями зараженной собаки наружу выделяются яйца и
зрелые членики цестоды, попадающие затем в воду и другие объек-
ты окружающей среды. Промежуточные хозяева заражаются ли-
чинками во время приема корма и воды. Онкосферы из кишечни-
ка промежуточного хозяина с током крови разносятся по всему
организму. Эхинококкусные пузыри растут медленно и в зависи-
мости от вида хозяина и его состоя-
ния через 6—15 мес достигают инва-
зионной стадии (рис. 54).
Дефинитивные хозяева заража-
ются при поедании внутренних ор-
ганов промежуточных хозяев, пора-
женных инвазионными эхинокок-
кусными пузырями. В кишечнике
животных из протосколексов вырас-
тают ленточные гельминты, которые
в течение 2—3 мес достигают поло-
вой зрелости. Продолжительность
жизни цестод около 5—7 мес.
Эпизоотологические данные. Ос-
новной источник распространения
инвазии — приотарные собаки, зара-
женность которых в отдельных овце-
водческих зонах достигает 70 %. Ис-
точник заражения — органы овец,
крупного рогатого скота, свиней и
других промежуточных хозяев, пора-
женные эхинококкусными пузыря-
ми. Основной сезон заражения дефи-
нитивных и промежуточных хозя-
ев — весна и осень, что связано с
наиболее благоприятными для выжи-
вания яиц и личинок гельминта ус-
ловиями внешней среды, падежом,
массовым убоем животных, когда со-
баки и хищники имеют доступ к по-
раженным органам.
Массовому распространению ин-
152
Рис. 54. Биология развития Е. granulosus:
/ — сколекс; 2 — общий вид цестоды; 3 — яйца в фекалиях; 4 — морфология яйца; 5 — пузыри
в легком; 6— печень, пораженная эхинококкусами
вазии способствуют неудовлетворительные ветеринарно-санитар-
ные условия содержания животных и отсутствие построек для
централизованного убоя их, а также скотомогильников. Молодняк
заражается чаще и интенсивнее, но поскольку эхинококкусные
пузыри сохраняются в организме зараженных животных годами,
153
то с возрастом повышаются экстенсивность и интенсивность ин-
вазии. Так, в Казахстане при обследовании 471 045 овец установ-
лено, что среди ягнят до 1 года были инвазированы в среднем
7,8 %, от 1 года до 2 лет — 11, от 2 до 3 лет — 16,6, от 3 до 4 лет —
25,4, от 4 лет и старше — 28,4 %.
У ягнят до 1 года, а у крупного рогатого скота до 2 лет фертиль-
ные (инвазионные) пузыри не обнаружены. У крупного рогатого
скота от 4 лет и старше экстенсивность инвазии достигает 13,5 %,
у свиней (вскрыто 54 626) — в среднем 3,6 %. У верблюдов инвази-
рованность колебалась от 12 до 75 %, у лошадей (вскрыто 4772)
она составила 4 % с колебаниями в различных районах страны от
2,1 до 15 %. У 82,3 % животных из числа инвазированных цисты
петрифицированы и только у 17,7 % паразиты были живыми, но
неинвазионными.
В последние годы в разных регионах страны установлены
штаммовые отличия в биологии развития эхинококку сов. Так, для
овцеводческих регионов Средней Азии, Казахстана и Ставрополья
наиболее характерно развитие паразита по схеме собака — овца —
собака, а для Белоруссии — собака — свинья — собака. В Англии
встречается штамм собака — лошадь — собака.
Патогенез и симптомы болезни. В патогенезе эхинококкоза сель-
скохозяйственных животных важную роль играют аллергический
фактор (вплоть до анафилактического шока) и механические по-
вреждения жизненно важных органов, а также инокуляторное,
токсическое, тиотрофическое воздействие личинок возбудителя на
организм хозяина. Степень болезнетворного влияния эхинококку-
са на организм животных различна. Зависит она от локализации,
количества и размеров пузырей, степени аллергии у хозяина и ме-
ханического повреждения органов и тканей.
Пораженные личинками паразита животные постепенно худе-
ют, нередко доходят до истощения. При локализации пузырей в
печени преобладают желтушность и расстройство пищеварения,
при поражении легких — затрудненное дыхание, одышка, кашель.
В крови уменьшается количество эритроцитов и гемоглобина,
альбуминов, но повышается содержание гамма-глобулинов, отме-
чаются лейкоцитоз и эозинофилия. У овец, зараженных яйцами
эхинококкуса, через 10—30 сут с начала инвазии в крови снижает-
ся концентрация витаминов А, С, В] и В2.
Неполноценное кормление и плохие условия содержания спо-
собствуют более тяжелому течению болезни. У больных собак —
носителей половозрелых эхинококкусов и других тениид — рас-
страивается пищеварение (запор чередуется с поносом), наблюда-
ются истощение, зуд в области ануса.
Диагностика. Эхинококкоз у животных может быть диагности-
рован как при жизни, так и посмертно. Кроме учета эпизоотоло-
гических данных и симптомов болезни большое значение придают
иммунологическим методам диагностики. К ним относятся внут-
154
рикожная реакция (Кацони), реакция непрямой гемагглютинации
(РИГА), реакция латекс-агглютинации (РЛА), реакция кольце-
преципитации (РКП) и сколексопреципитации (РСКП) и др.
В условиях производства чаще применяют реакцию Кацони
(экстенсэффективность ее достигает 90—100 %). Для ее проведе-
ния из эхинококкусного пузыря стерильно берут жидкость и вво-
дят внутрикожно 0,2 мл овцам в подхвостовую складку, 0,5 мл
крупному рогатого скоту в область шеи. Через 20—45 мин появля-
ется припухлость, через 2—3,5 ч она достигает максимальных раз-
меров (у овец — 2,5 см и более, у крупного рогатого скота — 4,6 см
и более). Припухлость темно-багрового цвета, с выраженной отеч-
ностью.
У плотоядных животных эхинококкоз диагностируют методами
гельминтоовоскопии и гельминтоскопии.
После убоя животных диагноз ставят на основании обнаруже-
ния во внутренних органах эхинококкусных пузырей, а в кишеч-
нике собак — половозрелых цестод. При интенсивной инвазии у
промежуточных хозяев резко увеличиваются в объеме органы
(масса печени у свиней достигает 32 кг, у крупного рогатого ско-
та — 45 кг). В них находят пузыри разной величины. Поверхность
пораженных органов бугристая, неровная. В тонком кишечнике
плотоядных при интенсивной инвазии — катаральный энтерит.
Эхинококкусный пузырь следует дифференцировать от альвео-
коккусного пузыря (отсутствует жидкость) и тонкошейного цис-
тицеркуса (видна головка в виде белого пятнышка).
Лечение, профилактика и меры борьбы. Следует помнить, что
яйца многих цестод семейства Taeniidae весьма устойчивы к воз-
действию факторов внешней среды. В борьбе с тениидозами и
ларвальными цестодозами соблюдают комплекс ветеринарно-са-
нитарных и хозяйственных мероприятий. Необходима постоян-
ная ветеринарно-медицинская информация о ларвальных цесто-
дозах.
В целях предотвращения заражения возбудителями тениидозов
собак строго запрещаются подворный и прифермский убой жи-
вотных и скармливание пораженных органов собакам. В каждом
хозяйстве необходимо иметь оборудованный убойный пункт
(вскрывочный пункт) и скотомогильник, отвечающие ветеринар-
но-санитарным требованиям утилизации субпродуктов. В период
перегона животных на отгонные пастбища трупы и органы, пора-
женные личинками тениид, сжигают. На отгонных пастбищах вы-
полняют те же мероприятия, что и в условиях стационара.
В неблагополучных хозяйствах в конце лета проводят диагнос-
тические исследования поголовья. Положительно реагирующих
животных сдают на мясокомбинат. Кроме того, необходимо осу-
ществлять мероприятия, направленные на предотвращение зара-
жения животных и человека как промежуточных хозяев. В каждой
отаре разрешается иметь не более двух собак, в гурте и на токах
155
для охраны кормов — одну. Бродячие собаки подлежат отлову и
уничтожению. Всех собак на животноводческих фермах ставят на
баланс хозяйства, заводят на каждую паспорт и в нем записывают
все проведенные ветеринарные мероприятия.
Собак, принадлежащих частным липам, а также службам по ох-
ране различных объектов и охотничьим хозяйствам, берут на учет
местные органы ветеринарной и медицинской службы. В отноше-
нии их проводят мероприятия в соответствии с инструкциями.
В неблагополучных по эхинококкозу районах и хозяйствах всех
собак 4 раза в год подвергают плановым (по определению зональ-
ных НИВИ и НИВС) диагностическим исследованиям.
Для обнаружения члеников и стробил цестод фекалии и слизь
исследуют под микроскопом. При положительных результатах на
эхинококкоз и альвеококкоз больную собаку ставят на особый учет
и уничтожают согласно ветеринарному законодательству. При те-
ниидозах, вызванных М. multiceps, Т. ovis, Т. hydatigena и др., кроме
указанных выше общих мер проводят плановые дегельминтизации
собак с декабря по апрель через каждые 45 сут. с мая по ноябрь —
через каждые 30 сут. Для этого применяют ареколин б р о -
м и сто - водород н ы й. фе н асал, дрон ци т и др.
Фенасал в форме порошка назначают с кормом без выдер-
жки животных на голодной диете в дозе 0,25 г на 1 кг массы тела
индивидуально однократно.
Дроннит в форме порошка дают собакам и кошкам в дозе
0,005 г на 1 кг массы тела однократно с кормом или в таблетках —
одна таблетка на 10 кг массы животного без выдержки на голод-
ной диете.
Феналидон назначают собакам по 100мг на 1 кг массы
тела однократно с кормом.
Бунамидин оксинафтоат можно применять с кор-
мом в дозе 50 мг на 1 кг массы тела.
В ветеринарной практике применяют также л о п а т о л,
сульфен, дронталь плюс, цестекс, трихлоро-
фен и др.
7.1.9. АЛЬВЕОКОККОЗ
Альвеококкоз животных и человека — природно-очаговое забо-
левание, вызываемое личиночной стадией цестоды семейства
Taeniidae.
Локализация — печень и другие паренхиматозные органы.
Распространение. Заболевание встречается в различных частях
мира. В нашей стране распространено локально в северных, вос-
точных и южных районах. Экономический ущерб складывается из
ухудшения качества пушнины зараженных лисиц, песцов, ондатр,
выбраковки паренхиматозных органов крупного рогатого скота,
овец и свиней.
156
Возбудитель. В личиночной стадии гельминт Alveococcus
multilocularis — многокамерный альвеококкусный пузырь, пред-
ставляющий собой конгломерат мелких пузырьков, в которых на-
ходятся протосколексы, но отсутствует жидкость (в отличие от
эхинококкуса). На разрезе пузырей видна ячеистость (рис. 55, см.
также рис. 41, е).
Половозрелая цестода A. multilocularis длиной до 3 мм, имеет
три-четыре членика. В отличие от Е. granulosus матка в зрелом
членике альвеококкуса шаровидной формы (рис. 56). Яйца иден-
тичны яйцам эхинококкуса.
Биология развития. Дефинитивные хозяева альвеококкуса — пес-
цы, лисицы, собаки, волки, корсаки и реже кошки, в тошей кишке
которых локализуется паразит. Промежуточные (облигатные) хозя-
ева —ондатра, мышь (домовая, белая), крыса, суслик, белка, хлоп-
ковая крыса и заяц. К факультативным промежуточным хозяевам
можно отнести крупный и мелкий рогатый скот, свиней, в организ-
ме которых личинки не достигают инвазионной стадии.
Промежуточные хозяева заражаются при заглатывании яиц и
члеников цестод, выделяемых дефинитивными хозяевами. Чело-
Рис. 55. Множественные метастазы альвео-
коккуса в легком. Секционный препарат (по
Ишенко)
Рис. 56. Общий вид
Alveococcus multilocularis:
П— присоски. П. б — половая
бурса; С — семенники; Э. к. —
экскреторный канал; М — матка
157
век в очагах альвеококкоза заражается при употреблении немытых
ягод или обработке шкурок лисиц, песцов и волков. В кишечнике
промежуточных хозяев онкосферы внедряются в кровеносные со-
суды и с кровью заносятся в различные органы и ткани хозяина.
Однако до инвазионной стадии личинки развиваются главным об-
разом в печени (за 1,5—4 мес). В кишечнике плотоядных альвео-
коккусы через 50—56 сут становятся половозрелыми. Продолжи-
тельность жизни взрослых цестод около 3.5 мес.
Эпизоотологические данные. Болезнь чаше всего встречается в
Восточной и Западной Сибири, Казахстане. Средней Азии, Мол-
дове и в отдельных районах Поволжья.
Огромное значение в заражении животных и человека имеют
природно-климатические условия и уклад жизни населения. На-
пример, в северных районах песцы и грызуны поддерживают при-
родный очаг инвазии, но человек, все шире осваивая эти районы,
также становится жертвой болезни.
В Казахстане и Средней Азии, где имеются водоемы и поли-
вные хлопковые плантации, как правило, растет обильная расти-
тельность, поэтому здесь обитают грызуны различных видов, ко-
торые служат пишей лисицам и другим плотоядным, что создает
условия для распространения альвеококкоза.
Патогенез и симптомы болезни. Инфильтрирующий рост альвео-
коккусных пузырей в печени промежуточного хозяина приводит к
атрофии органа. Кроме того, у человека установлены случаи не
только поражения печени, но и образования метастазов в легкие и
другие органы. В результате развиваются морфофункциональные
нарушения и наступает тяжелое аллергическое состояние.
У дефинитивных хозяев (лисиц, песцов, собак), зараженных
цестодами, нарушается пищеварение, животные худеют, качество
пушнины ухудшается.
Диагностика. Диагноз у промежуточных хозяев, в том числе и
грызунов, ставят посмертно при вскрытии. У дефинитивных хозя-
ев исследуют фекалии на яйца и членики цестод. Альвеококкоз
дифференцируют от эхинококкоза.
Профилактика и меры борьбы. При выявлении у собак альвео-
коккоза их уничтожают. Шкурки песцов и лисиц снимают, обра-
батывают в специальных помещениях (в спецодежде) с соблюде-
нием мер предосторожности В эндемических очагах альвеококко-
за для питья употребляют кипяченую воду. Фрукты, ягоды и ово-
щи тщательно моют.
Общие мероприятия при альвекоккозе такие же, как и при эхи-
нококкозе и других ларвальных цестодозах (см. Эхинококкоз).
7.2. ИМАГИНАЛЬНЫЕ ЦЕСТОДОЗЫ
Имагинальные цестодозы — гельминтозные заболевания чело-
века. животных, в том числе птиц, вызываемые паразитированием
в пищеварительном канале цестод, относящихся к типу Plathel-
158
Рис. 57. Язва, образованная на месте
локализации A. perfoliata (по Андрее-
вой)
minthes (плоские черви). Так, у
плотоядных животных и челове-
ка в кишечнике паразитируют
ленточные гельминты подотря-
да Taeniata, вызывающие эхино-
коккоз, мультицептоз, тениа-
ринхоз и т. д. У парнокопытных
и непарнокопытных в кишеч-
нике паразитируют ленточные
гельминты подотряда Anoploce-
phalata, вызывающие мониези-
оз, тизаниезиоз, авителлиноз у
жвачных и аноплоцефалидоз у
лошадей. В Средней Азии, Ка-
захстане, Республике Саха
(Якутия) и других местах у не-
парнокопытных животных в
тонком и толстом кишечнике обитают цестоды семейства
Anoplocephalidae, достигающие в длину от 10 до 520 мм (рис. 57). У
птиц в кишечнике паразитирует большое количество цестод, от-
носящихся к подотрядам Hymenolepidata, Davaineata.
Все эти ленточные гельминты обитают в разных отделах ки-
шечника (преимущественно в тощей кишке), вызывая в организ-
ме хозяина патологические процессы той или иной степени. Они
связаны с аллергическим, механическим, трофическим влиянием
гельминтов, нарушением обмена веществ и статуса микроорга-
низмов в пищеварительном канале, токсикозами и гиповитами-
нозами.
7.2.1. МОНИЕЗИОЗЫ ЖВАЧНЫХ
Мониезиозы — заболевания, вызываемые паразитированием в
тонком кишечнике домашних и диких жвачных ленточных гель-
минтов нескольких видов семейства Anoplocehalidae подотряда
Anoplocephalata.
Локализация — тощая, ободочная, реже 12-перстная кишка.
Распространение. Мониезиозы жвачных чрезвычайно широко
распространены в нашей стране и за ее пределами Особенно не-
благополучны районы с развитым овцеводством. В постоянно не-
благополучных хозяйствах гибель ягнят и отход молодняка дости-
гают 43 %. От переболевших ягнят недополучают в среднем около
Зкг мяса и 0,84 ±0,09 кг шерсти. Ухудшается качество шерсти и
мяса, у ягнят снижается естественная резистентность.
Возбудители. Установлено 10 видов мониезий, однако практи-
чески ветеринарные специалисты имеют дело с двумя — Moniezia
expansa и М. benedeni. Сколекс мониезий не вооружен, имеет че-
тыре присоски. Для цестод характерен двойной половой аппарат,
159
Рис. 58. Гермафродитные членики мониезий:
А — М expansa; Б — М benedem. М ж. — межпроглотгилные железы; Св. к. — семявыносящий
канал, П. 6. — половая бурса; В — вагина; Я— яичник, Э. к. — экскреторный канал, Ж— жел-
точники, Т. М — тельце Мелиса; С — семенники; М — матка
следовательно, половые отверстия открываются с двух сторон
каждого членика. Яйцо мониезии содержит онкосферу с тремя па-
рами крючьев, окруженную грушевидным аппаратом.
М. expansa длиной 6—8 м, молочно-серого цвета. Межпроглот-
тидные железы розетковидной формы. Яйца треугольные с закруг-
ленными краями, темно-серого цвета. М. benedeni длиной 2—4 м
Членики широкие, соломенно-желтого цвета (рис. 58). Межпрог-
лоттидные железы имеют вид сплошной полосы. Яйца четырех-
угольные с тупыми углами, темно-серого цвета (рис. 59).
Биология развития. Мониезии — биогельминты. Развитие цестод
происходит с участием дефинитивных (мелкий и крупный рогатый
скот, олени, сайгаки, косули, архары и др.) и промежуточных (пан-
цирные, почвенные клещи семейства Oribatidae — более 72 видов)
хозяев. Больные животные выделяют яйца и членики вместе с фе-
калиями. В каждом членике находится около 20 тыс. яиц.
160
На пастбище орибатидные клеши родов Scheloribates,
Zigoribatula, Golumna и др. (в зависимости от зоны) вместе с рас-
тениями захватывают яйца цестод (рис. 60). В кишечник клеща
онкосфера выходит из скорлупы и проникает в брюшную полость.
Проходя различные стадии развития, онкосфера через 2,5—5 мес в
зависимости от условий внешней среды и вида клеща становится
инвазионной — цистицеркоид. Животные заражаются во время
пастьбы, заглатывая вместе с травой зараженных иистинеркоида-
ми клещей.
Половой зрелости мониезия достигает в среднем за 38—45 сут.
Продолжительность жизни цестод в кишечнике овец 2,5—3 мес,
редко — около 7 мес (рис. 61).
Эпизоотологические данные. Говоря о мониезиозах, необходимо
выделить весенний мониезиоз ягнят и телят, вызываемый
М. expansa, и осенний мониезиоз молодняка 5—8 мес и старше,
вызываемый М. benedeni и М. autumnalia (особенно у крупного
рогатого скота).
В силу особенностей природно-климатических условий и тех-
нологии ведения животноводства первичные сроки заражения жи-
вотных и интенсивность эпизоотического процесса при мониези-
озах в различных зонах страны проявляются неодинаково. Так, в
а
Рис. 59. Яйца мониезии:
а — М. expansa; б— М. benedeni
6
161
Рис. 60. ОрибатидныЙ клеш с цистицер-
коидами
условиях Нечерноземья и се-
верных районов ягнята и телята
текущего года рождения начи-
нают заражаться с конца тре-
тьей декады апреля или в нача-
ле мая. тогда как в Средней
Азии и на Кавказе заражение
возможно уже в начале марта.
Кроме того, в первом случае ос-
новной источник распростра-
нения инвазии — ягнята и мо-
лодняк, которые возбудителями
весеннего мониезиоза заража-
ются в последний месяц весны
и при отсутствии плановой пре-
имагинальной дегельминтиза-
ции из года в год перезаражают
промежуточных хозяев. А в юж-
ных районах, где стойловый пе-
риод короткий, мониезии в
организме взрослых животных
могут переживать зиму, весной
такие животные становятся до-
полнительным источником рас-
пространения инвазии.
Источниками заражения жи-
вотных всюду являются инва-
зированные цистицеркоидами
орибатидные клеши, которые в
естественных условиях живут
от 15 до 24 мес.
В Нечерноземье возбудите-
лем весеннего мониезиоза жи-
вотные заражаются в мае «молниеносно», так как согласно зако-
ну биоритмов клешей животные на пастбищах чаше контактиру-
ют с зараженными клешами. Интенсивность инвазии у ягнят в
среднем достигает 3,01 ± 0,4 экз. с колебаниями от 1 до 57 мони-
езий и более.
Пик осеннего мониезиоза приходится на август—октябрь (эк-
стенсивность инвазии 42—62 %, интенсивность 2,31 ± 1,6 экз.). В
других регионах страны указанные сроки заражения, экстенсив-
ность и интенсивность инвазии могут быть другими, что следует
учитывать при организации мероприятий по борьбе.
Мониезиозы наносят существенный ущерб оленеводческим хо-
зяйствам Севера и сайгачатам в Казахстане и Калмыкии. Необхо-
димо помнить, что домашние животные играют большую роль в
распространении инвазии среди диких животных. У северных оле-
162
Рис. 61. Биология развития М. expanse:
1 — сколекс; 2 — гермафродитный членик; 3 — фекалии животных с члениками иестоды;
4— яйца; 5— цистицеркоид; 6 — орибатидные клеши с нистииеркоидами в тете
ней установлены и свои специфические виды, такие, как
М. rangiferina и М. taimyrica.
Патогенез и симптомы болезни. В тощей кишке дефинитивного
хозяина личинки мониезий прикрепляются мощными присоска-
ми к слизистой оболочке кишечника и оказывают на его стенки и
163
нервные окончания механическое воздействие, которое затем вос-
принимается головным мозгом. Молодые мониезии интенсивно
растут (до 19 см в 1 сут), обменные процессы между хозяином и
паразитом постоянно усиливаются, а продукты метаболизма гель-
минтов оказывают все возрастающее аллергическое воздействие.
Таким образом, у ягнят, зараженных мониезиями, уже на 12-е сут-
ки инвазии проявляется аллергия, обнаруживают значительные
изменения моторики кишечника, активности кишечных гидролаз
и морфологии крови. Однако устойчивые отклонения в организме
больных отмечают на 20—30-е сутки, когда гельминты достигают
больших размеров. Характер патологических изменений соответ-
ствует интенсивности и продолжительности инвазии.
На 15—20-е сутки с начала инвазии резко нарушаются ритм и
сила сокращений кишечника, в 17 раз и более увеличиваются ин-
тервалы между эвакуаторными волнами, в кишечнике превалиру-
ет кислая реакция, резко нарушается секреция кишечных фермен-
тов и их функция.
На 25—38-е сутки инвазии существенно уменьшается количе-
ство эритроцитов, гемоглобина, увеличивается число лейкоцитов
и эозинофилов (вместо 100—150 клеток насчитывается 350—500 в
1 мкл крови), значительно повышается уровень гамма-глобули-
нов. Расстройства моторики и статуса pH содержимого кишечни-
ка обусловливают дисбактериоз: резко уменьшается количество
эшерихий, молочнокислых бактерий, но увеличивается числен-
ность клостридий, гнилостных спорообразующих аэробов и про-
тея. В разных отделах пищеварительного канала уменьшается ко-
личество актиномицетов, изменяются их антибиотические и вита-
минообразующие свойства. Все это усиливает гнилостный распад
белков и ведет к образованию индола, скатола, меркаптена, серо-
водорода и других веществ, обусловливающих интоксикацию
организма (вторичный токсикоз).
Симптомы болезни проявляются одновременно с развитием
патологии. Они, как правило, соответствуют интенсивности и
длительности инвазии. На 28—38-е сутки у больных животных на-
блюдают исхудание, вялость, малоподвижность, разжижение фе-
калий (временами понос), часто в фекалиях присутствует слизь,
выделяются членики, а иногда целые фрагменты гельминта. Про-
грессирующая диарея приводит животных к полному истощению
и гибели. Весной и в первой половине лета у ягнят 2—4-месячного
возраста иногда устанавливают обтурационную форму болезни
(полная непроходимость кишечника из-за паразитирования боль-
шого количества мониезий). Больные ягнята прижимают голову к
животу, кружатся, бьют ногами. При полной закупорке и инваги-
нации кишечника наступает гибель.
При резком снижении содержания ацетилхолинэстеразы в кро-
ви и развитии Bb В2, Вб, В^-гиповитаминозов у ягнят могут на-
ступить нервные симптомы в виде клонических судорог мышц,
164
кружения и т. п., что также приводит к гибели через несколько ча-
сов или суток.
Диагностика. Мониезиозы диагностируют на основании комп-
лексных исследований: учета эпизоотологических данных, симп-
томов болезни и лабораторных исследований. При жизни диагноз
ставят с помощью гельминтоскопии (последовательные смывы),
гельминтоовоскопии (метод Фюллеборна), а посмертно проводят
частичное гельминтологическое вскрытие кишечника. Для диаг-
ностики инвазии в ранние сроки, когда мониезии не достигли по-
ловой зрелости, проводят диагностическую дегельминтизацию.
Используют и иммунологические методы диагностики, для этого
в ранние сроки инвазии применяют белковый, полисахаридный и
другие антигены, которые, однако, на практике не нашли широ-
кого применения.
Нервная форма мониезиоза в некотором отношении идентична
с признаками ценуроза, эстроза, листериоза и медленно протека-
ющей инфекции, поэтому при этих заболеваниях следует выявить
специфического возбудителя.
Как самих мониезий, так и осенний мониезиоз труднее диффе-
ренцировать от тизаниезий и тизаниезиоза, которые встречаются
в осенне-зимнее время у более взрослых овец.
Поскольку тизаниезии от мониезий трудноотличимы и симп-
томы болезни идентичны, а сезоны проявления тизаниезиоза при-
мерно совпадают с осенним мониезиозом, то при обоих гельмин-
тозах проводят одни и те же оздоровительные мероприятия.
Лечение. Для дегельминтизации применяют фенасал, фенали-
дон, панакур, 2%-ный раствор меди сульфата и др.
Фенасал назначают овцам и козам индивидуально в дозе
0,1 г на 1 кг массы тела, групповым способом — 0,2 г на I кг. Ин-
дивидуально животным препарат задают в виде 1%-ной крахмаль-
ной или 5%-ной мучной суспензии. Если препарат употребляют
групповым способом (с комбикормом), то в группе должно быть
не более 200 овец. Телята получают препарат в дозах 0,15 г на 1 кг
массы тела индивидуально и 0,2 г на 1 кг — групповым способом
(15—20 животных).
Феналидон применяют для индивидуальной преимаги-
нальной дегельминтизации. Препарат в форме водной суспензии
задают однократно перорально перед утренним кормлением. Сус-
пензию готовят перед дегельминтизацией из расчета 30 мг препа-
рата на 1 мл воды. При первичной дегельминтизации весной сус-
пензию феналидона дают по 2 мл на 1 кг, при последующих — по
1 мл на 1 кг массы тела животного.
Фенбендазол (панакур) применяют через рот одно-
кратно в дозе 10 мг по д. в. на 1 кг массы тела. Препарат выпуска-
ют в форме суспензии (содержит 2,5 и 10 % д. в.), гранулята
(22,2 % д. в.), порошка и пилюль (2 % д. в.). При применении
165
групповым методом лучше использовать препарат с комбикор-
мом, который дают из расчета 100—150 г на животное.
Меди сульфат выпускают в целлофановых пакетах или
полиэтиленовых мешках по 50 кг. Срок годности 3 года. Препарат
применяют в виде 1—2%-ного раствора. 1%-ный раствор малоэф-
фективен, влияет только на половозрелых гельминтов. Поэтому в
последнее время разработана методика применения 2%-ного ра-
створа препарата в тех же объемах, что и 1%-ного. Назначают его ин-
дивидуально или групповым способом в виде мешанки (М. Ш. Акба-
ев, 1987).
Меди сульфат растворяют в дистиллированной или дождевой
воде с добавлением 1—4 мл соляной кислоты на 1л воды. Для
скармливания групповым методом готовят полусухую мешанку в
деревянном ящике. С этой целью в нужное количество комбикор-
ма наливают порциями раствор меди сульфата из расчета 44 мл на
100 г комбикорма, тщательно перемешивают деревянной лопатой,
доводя смесь до полусухой консистенции. Мешанку дают живот-
ным в рештаках (150—200 гол.) в утреннее кормление. После де-
гельминтизации ягнят подпускают к маткам через 3 ч. Взрослых
животных выгоняют на пастбище и дают воду только через 4—5 ч.
Дозы 1—2%-ных растворов меди сульфата овцам: в возрасте 1 —
1,5 мес — 15—20 мл; в 1,5—2 мес — 21—25; в 2—3 мес — 26—30; в
3—4 мес — 31—35; в 4—5 мес — 36—40; в 5—6 мес — 41—45; в 6—
7 мес — 46—50; в 7—8 мес — 51—60; в 8—9 мес — 61—70; в 9—
10 мес — 71— 80 и в возрасте старше 10 мес — 81 —100 мл на одно
животное.
Профилактика и меры борьбы. При возможности в хозяйстве
организуют стойловое или стойлово-выгульное содержание ягнят
и молодняка. Эффективны и мероприятия по использованию
культурных пастбищ с подсевом однолетних и многолетних трав.
Если нет возможности выполнить указанные мероприятия, то
следует проводить профилактическую дегельминтизацию и хи-
миопрофилактику.
Раннюю преимагинальную профилактическую дегельминтиза-
цию проводят первый раз через 14—16 сут после выгона ягнят и
козлят на пастбище, второй — через 15—20 сут после первой, тре-
тий раз — через 25—30 сут после второй дегельминтизации. Овце-
маток первый раз обрабатывают в конце июня—начале июля, а в
сентябре или октябре дегельминтизируют все поголовье.
Телят текущего года рождения подвергают двукратным профи-
лактическим дегельминтизациям: первый раз — через 35—40 сут
после перевода на пастбище, второй — через 35—40 сут после пер-
вой. Телят старше 1 года обрабатывают однократно спустя 35—
40 дней после выгона на пастбище.
С целью химиопрофилактики применяют солефенотиа-
зиномедно-купоросовую смесь: 1 часть мелко ис-
толченного сульфата меди, 10 — фенотиазина ветеринарного и
166
100 частей кормовой соли. Смесь тщательно перемешивают и хра-
нят в деревянном ящике. Положительные результаты можно дос-
тичь лишь в случае, если препарат дают с учетом течения инвазии
и сроков заражения животных. Например, в Нечерноземной зоне
Российской Федерации смесь целесообразно давать с мая по ко-
нец июня, а затем с начала августа до середины сентября.
С целью профилактики рекомендуется применять имели
карбонат (ягнятам — только в зоне Сибири). В настоящее
время рекомендуют давать иалбендазол, камбендазол,
в е р п а н и л-б олюсы, эксфендазол и др.
7.2.2. АВИТЕЛЛИНОЗ ЖВАЧНЫХ
Авителлиноз — цестодозное заболевание овец, коз, реже —
крупного рогатого скота и диких жвачных, вызываемое ленточным
гельминтом семейства Avitellinidae подотряда Anoplocephalata.
Локализация — тонкая кишка.
Распространение. Болезнь встречается во многих районах Аф-
рики, Азии и Европы. В нашей стране инвазия распространена
преимущественно в южных и восточных районах с теплым клима-
том.
Ущерб складывается из снижения прироста живой массы, шер-
стной продуктивности и падежа больных животных. Нередко по-
гибают взрослые упитанные овцы и бараны. Значителен падеж от
авителлиноза молодняка сайгаков.
Возбудитель. Avitellina centripunctata — тонкая цестода молоч-
но-белого цвета, со средней непрозрачной и двумя прозрачными
латеральными линиями на теле (экскреторные линии). Длина ее в
среднем около 2 м, максимальная ширина в средней части тела
2,0—2,3 мм (рис. 62). Сколекс почти круглый, с четырьмя присос-
ками. Желточники отсутствуют, матка имеет вид однокамерного
поперечного мешка. Половой аппарат одинарный, половые отвер-
стия чередуются неравномерно и открываются с одной или другой
стороны члеников. Матка окружена околоматочным органом с
10—15 яйценосными капсулами, содержит 70—90 яиц округлой
формы. Яйца без грушевидного аппарата, 0,021—0,038 мм в диа-
метре.
Биология развития. Авителлина — биогельминт. Дефинитивные
хозяева — овца, коза, крупный рогатый скот, сайгак, архар, верб-
люд и другие жвачные.
В условиях лаборатории инвазионная личинка авителлины
(цистицеркоид) размером 0,3—0,39 мм формируется при темпера-
туре 26—27 °C за 30 сут. Она округлой формы, с тонкой прозрач-
ной наружной оболочкой, по периферии расположены известко-
вые тельца диаметром 0,01 мм. Хорошо заметны четыре присоски
размером 0,13 мм.
167
Рис. 62. A. ccntripunctata (по Тищенко):
а — общий вид; б — нистицеркоид авителлины, в — коллембола — промежуточный хозяин
авитсл1И1и।
Промежуточные хозяева A. arctica (паразит северных оленей) —
коллемболы (ногохвостки) (Д. П. Козлов, 1986). В Якутии 40 %
оленей заражены A. arctica.
Биология A. centnpunctata расшифрована П. Т. Твердохлебо-
вым и Л. Г. Тищенко в 1988 г.
168
Установлено около 4 тыс. видов коллембол. Эти насекомые
распространены повсеместно, требовательны к наличию влаги. Их
много в верхних слоях почвы и в растительной подстилке, реже
встречаются в травостое. Ротовой аппарат грызугце-сосушего
типа, питаются разложившимися органическими остатками.
При скармливании коллемболам нескольких родов яиц авител-
лины положительный результат получен только у представителей
рода Entomobrya.
Больные овцы выделяют наружу членики авителлин, поедае-
мые затем коллемболами В брюшной полости насекомых за 30 сут
и более формируются цистицеркоиды (от 1 до 20). Животные за-
ражаются цестодой на пастбище при поедании инвазированных
коллембол.
Авителлины в организме овцы достигают половой зрелости за
50 сут. Продолжительность жизни до 1 года (рис. 63).
Эпизоотологические данные Авителлиноз широко распростра-
нен в Средней Азии, Казахстане, Закавказье, Молдове, Читинской
области, Бурятии, Ставропольском крае, на юге Украины и др. В
среднем экстенсивность инвазии у овец достигает от 3,5 до 60—
800.
Заражаются животные в возрасте 6 мес и старше, максималь-
но — к 2 годам. Пик инвазии приходится на зиму или начало вес-
ны. В зимний период нередко происходит дестробиляция цестод,
выражающаяся в отторжении члеников и сокращении стробилы.
Этот феномен расценивают как морфофизиологическую адапта-
цию.
Патогенез и симптомы болезни. Несмотря на незначительную по
сравнению с мониезиями величину, авителлины оказывают на
организм хозяина выраженное патогенное (аллергическое, меха-
ническое, токсическое и трофическое) действие. У животных, ве-
роятно. возникает дисбактериоз с резким увеличением количества
клостридий. Установлено, что у овец, зараженных этой цестодой,
часто наблюдают симптомы болезни, идентичные наблюдаемым
при брадзоте.
У больных овец появляются беспокойство, судороги и парали-
чи, нарушается координация движений, снижается аппетит. У
взрослых животных симптомы болезни проявляются внезапно:
животные угнетены; температура иногда повышается до 41 °C и
выше; появляются нервные явления. Смерть наступает через 1 —
2 ч, реже через 5—6 ч.
Диагностика. Диагноз ставят так же, как при мониезиозах. но
следует обратить особое внимание на эпизоотологию и особенно-
сти течения болезни.
Профилактика и меры борьбы. Меры борьбы против авителли-
ноза должны быть строго координированы в соответствии с кли-
мато-географическими условиями. В неблагополучных хозяйствах
молодняк овец старше 6 мес дегельминтизируют первый раз в
169
Рис. 63. Биология развития A. centripunctata:
1 — сколекс; 2 — зрелый членик; 3 — фекалии животных с яйценосными капсулами;
4— коллембола; 5 — цистицеркоид в теле коллемболы
июле, второй — в сентябре и третий раз — в ноябре—декабре.
Взрослых овец старше 1 года обрабатывают первый раз в мае, вто-
рой — в августе и последний — в ноябре—декабре. Для этого при-
меняют такие же химиопрепараты, как и при мониезиозах овец, за
исключением 1%-ного раствора сульфата меди.
170
7.2.3. ДРЕПАНИДОТЕНИОЗ И НЕКОТОРЫЕ ДРУГИЕ
ГИМЕНОЛЕПИДОЗЫ ГУСЕЙ
Дрепанидотениоз вызывают цестоды семейства Hymenolepi-
didae, паразитирующие в тонких кишках домашних и диких гусей.
Данный гельминтоз регистрируют в разных зонах страны. Дрепа-
нидотениоз причиняет гусеводству значительный экономический
ущерб, который складывается из падежа и резкого отставания в
росте и развитии больных гусят.
Возбудитель. Drepanidotaenia lanceolata — цестода длиной 11 —
23 см, шириной 0,8—1,2 см (рис. 64). На сколексе кроме четырех
присосок расположено восемь крючьев. Ширина члеников в
20 раз превышает их длину. В гермафродитном членике три се-
менника, расположенные поперек. Половые отверстия открыва-
ются с одной стороны, циррус снабжен крупными шипами. Зре-
Рис. 64. Морфологические признаки Drepanidotaenia lanceolata:
7 —сколекс; 2 —яйцо; 3 — гермафродитный членик; 4— зрелый членик;
П— присоска; Хб — хоботок; Он — онкосфера; Я— яичник; Ж— желточ-
ник; С—семенники; Э.к — экскреторный канал; 77.6—половая бурса;
М— матка, наполненная яйцами
171
лый членик полностью занят маткой. Яйца слегка овальной фор-
мы, светло-серые, при выходе наружу инвазионны, размером
(0,05-0,1) х (0,04-0,09) мм.
Биология развития. Дрепанидотения — биогельминт. Развивает-
ся с участием дефинитивных (гусей) и промежуточных (низших
ракообразных — циклопов и диаптомусов) хозяев.
Вместе с экскрементами инвазированные гуси выделяют зре-
лые членики и яйца дрепанидотений. Во внешней среде членики
разрушаются, освобождая яйца цестоды. Для дальнейшего разви-
тия яйца должны попасть в воду, где их заглатывают промежуточ-
ные хозяева. В органах пищеварения циклопов из яйца освобож-
дается онкосфера, которая проникает в полость тела и через 11—
21 сут превращается в инвазионную личинку — цистицеркоид
(рис. 65). Гуси заражаются при заглатывании циклопов и диапто-
мусов, инвазированных цистицеркоидами дрепанидотений. В ки-
шечнике гусей дрепанидотения достигает половой зрелости через
14—21 сут (рис. 66).
Эпизоотологические данные. Источник распространения дре-
панидотениоза — домашние и дикие гуси-дрёпанидотенионоси-
тели, источник инвазии — зараженные циклопы и диаптомусы.
Наиболее восприимчивы гуси в возрасте от 1 до 4 мес. Очень
редко заражаются утята. У взрослых гусей при низкой интенсив-
ности инвазии заболевание протекает субклинически. Гусята за-
ражаются ранней весной на мелких, хорошо прогреваемых и за-
росших травой пресноводных водоемах, мелких участках озер,
прудов и заводей рек и ручьев, где
обитает большое количество цикло-
пов.
Патогенез и симптомы болезни. Дре-
панидотении воздействуют на орга-
низм гусей аллергически, механичес-
ки, токсически и инокуляторно. Про-
является это в нарушении целостности
слизистой оболочки кишечника, обме-
на веществ, нервных явлениях и исху-
дании. Фекалии больных гусят жидкие
с примесью члеников цестод. Заметны
общее угнетение, прогрессирующее
исхудание, отставание в росте и разви-
тии, шаткая походка, приседание на
хвост во время движения, искривление
шеи и запрокидывание головы, плава-
тельные движения лапками при лежа-
нии на спине или боку, иногда пара-
лич ног. Нервные расстройства прояв-
ляются периодически. Отмечается зна-
чительный падеж молодняка.
0.02 мм
Рис. 65. Цистицеркоид
172
Рис. 66. Биология развития D. lanceolata (по Шевцову и Заскинд)
Диагностика. При жизни диагноз ставят на основании осмотра
и исследования фекалий по методу последовательного промыва-
ния или диагностической дегельминтизации, посмертно — при
обнаружении в кишечнике дрепанидотений. При вскрытии слизи-
стая оболочка кишечника местами катарально воспалена, гипере-
мирована. В местах скопления дрепанидотений нередко бывают
закупорка, инвагинация. Отмечают также увеличение печени,
желчного пузыря и селезенки.
Лечение. В неблагополучных по инвазии совхозах, колхозах,
индивидуальных хозяйствах применяют один из следующих анти-
гельминтиков: фенасал, битионол, филиксан и др.
Ф е н а с а л назначают гусям однократно в дозе 0,3 г на 1 кг
массы тела по методу группового скармливания (с кормом) и ин-
дивидуально (в болюсах).
Битионол дают птице однократно в дозе 0,6 г на 1 кг мас-
сы тела групповым методом и индивидуально.
Филиксан назначают гусям однократно в дозе 0,45г на
1 кг массы тела с кормом (норму корма уменьшают на 1/3) и ин-
дивидуально — в болюсах из муки.
173
Албендазол назначают однократно в дозе 10 мг д. в. на
1 кг массы тела с кормом или внутрь в виде суспензий. Эффектив-
ность обработки равна 100 %.
Ф е н а п э г, примененный внутрь с кормом в дозе 45 мг д. в.
на 1 кг массы тела при гименолепидозах, показал 100%-ную эф-
фективность.
Ликвофен (36%-ные гранулы фенасала), задаваемый с
кормом однократно в дозе 0,75 г на 1 кг массы тела, обеспечил
85,7%-ную эффективность.
Перед дегельминтизацией птицу 12—16 ч выдерживают на го-
лодной диете, поение не ограничивают, а после обработки сутки
не выпускают на водоемы и пастбища. Птицу содержат на откры-
тых, очищенных от подстилки и помета загонах, где хорошо за-
метны выделяющиеся ленточные черви. Их тщательно собирают и
уничтожают.
У домашних и диких гусей Нечерноземья в тонком кишечнике
выявлено еще четыре вида цестоды семейства Hymenolepididae:
Retinometra longicirrosa, Tschertkovileps krabbei, Tsch. setigera,
Fimbriaria fasciolaris. R. longicirrosa длиной до 50—160 мм при мак-
симальной ширине 2,3 мм. Сколекс вооружен, на сколексе имеет-
ся восемь крючьев. Три округлых семенника лежат на одной ли-
нии поперек членика. Яйца сферические.
Tsch. krabbei длиной около 40—150 мм при максимальной ши-
рине 0,8 мм. Сколекс вооружен десятью крючьями. Три округлых
семенника расположены в один ряд в средней части членика.
Яйца овальные.
Tsch. setigera длиной 150—200 мм, шириной Змм. На хорошо
развитом сколексе имеется десять крючьев, циррус густо покрыт
шипиками. Яйца слегка овальные.
F. fasciolaris длиной 200—400 мм. Хорошо выражен хоботок с де-
сятью крючьями. Имеет псевдосколекс. Яичник и матка сетчатые.
Биология развития всех гименолепидид примерно одинакова.
Дефинитивные хозяева — гуси и утки, промежуточные — рачки-
циклопы и диаптомусы, резервуарные хозяева — пресноводные
моллюски. В теле рачков инвазионная личинка — цистицеркоид
развивается за 6—7 сут. Птица заражается при поедании инвази-
рованных моллюсков. В тонком кишечнике гусей гельминты ста-
новятся половозрелыми за 8—14 сут. Продолжительность жизни
их около 4 мес.
Цестоды чрезвычайно широко распространены в Нечернозе-
мье, нами установлено, что гусята в естественных лужах или со-
зданных специально для содержания гусят до месячного возраста
заражаются цестодами пяти видов. Зараженность 4—6-месячных
гусят в Ярославской области составила 76,0 %, в Курской — 58,2. В
Брянской области гусята, которые до месячного возраста содержа-
лись в лужах во дворе, через 12—16 сут с начала пастьбы были за-
ражены на 100 %.
174
К зиме экстенсивность инвазии снижается, а весной встреча-
ются лишь единичные случаи паразитирования цестод. Ранней
весной источником заражения гусей являются перезимовавшие
инвазированные циклопы.
Профилактика и меры борьбы. В птицеводческих неблагополуч-
ных по дрепанидотениозу хозяйствах предусматривают охрану во-
доплавающей птицы от заражения ленточными гельминтами, не
допускают загрязнения внешней среды, в первую очередь водо-
емов, члениками и яйцами данного гельминта и других цестод.
Гусей после дегельминтизации содержат в специально отведен-
ном месте. Молодняк выращивают на изолированном благополуч-
ном водоеме, который периодически меняют и в течение 1—2 лет
не используют. Необходимо следить за нагрузкой водоемов. В от-
дельных случаях птицу выращивают без водоемов.
Маточное поголовье с целью профилактики дегельминтизиру-
ют 2 раза в год: осенью — после окончания выгула и весной — за
месяц до использования водоемов. При выпасе молодняка на не-
благополучном водоеме проводят преимагинальную дегельминти-
зацию через 12—14 сут после начала выпаса. Через 2 нед дегель-
минтизацию повторяют.
Лечение и профилактика при других гименолепидозах пример-
но такие же, что и при дрепанидотениозе гусей. Однако, учитывая
особенностей заражения гусят в раннем возрасте, следует прово-
дить целенаправленные мероприятия по уничтожению цикло-
пов — промежуточных хозяев. С этой целью осушают и промора-
живают мелкие водоемы, создаваемые гражданами для выращива-
ния гусят в раннем возрасте. Дополнительно ложа водоемов обра-
батывают негашеной известью из расчета 240—250 г на 1м2
площади.
7.2.4. ДИПИЛИДИОЗ СОБАК И КОШЕК
Дипилидиоз плотоядных вызывается цестодой подотряда
Hymenolepidata семейства Dipylidiidae.
Локализация — тонкая кишка.
Возбудитель. Dipylidium caninum (огуречный цепень) — серо-
белого, иногда розоватого цвета, длиной 40—70 см при макси-
мальной ширине 3 мм. Сколекс вооружен, крючки расположены в
четыре ряда. Характерно для гельминта наличие двойной половой
системы, половые отверстия открываются по бокам каждого чле-
ника.
Зрелые (последние) членики удлиненной формы и напомина-
ют огуречные семена. В этих члениках содержатся коконы, окру-
женные капсулой матки. Внутри них находится 8—21 яйцо диа-
метром 0,025—0,03 мм. Онкосфера в яйце снабжена тремя парами
крючьев (рис. 67).
175
Биология развития. Дипилидиум — биогельминт. Развитие его
происходит с участием дефинитивных (собака, кошка, лисица, пе-
сец и другие плотоядные) и промежуточных (кошачья, собачья и
человеческая блохи, собачий власоед) хозяев. Иногда гельминт
паразитирует у человека (рис. 68).
Членики с яйцами (коконами), выделенные во внешнюю сре-
ду, поедают личинки блох, которые обитают в подстилке собак,
мусоре и т. д. Однако личинки гельминта не развиваются в личин-
ках блох. Развитие начинается только в теле куколок блохи, кото-
рые через 2 нед превращаются во взрослых особей. Инвазионной
стадии — цистицеркоида личинки дипилидиума достигают в теле
а
в
Рис. 67. Dipylidium caninuni
а — общий вид; б — передний конец; в —
176
взрослой блохи. У одной блохи могут сформироваться до 50 цис-
тицеркоидов. Собаки и другие плотоядные заражаются, когда гры-
зут пораженные участки тела, при этом они заглатывают блох. Це-
стоды растут и развиваются в тонком кишечнике и за 1,5—2 мес
достигают половой зрелости. Продолжительность жизни гельмин-
та несколько месяцев.
Эпизоотологические данные. Заболевание распространено ши-
роко. Причина этого — несвоевременная и некачественная де-
гельминтизация больных животных: наличие большого числа
бродячих собак и кошек; антисанитарные условия содержания
животных, а также подвалов, где часто обитают бродячие собаки и
кошки, и несвоевременная диагностика инвазии. Заражение жи-
вотных при высокой экстенсивности и интенсивности инвазии
происходит почти во все сезоны года.
Патогенез и симптомы болезни. Дипилидиумы механически воз-
действуют на слизистую оболочку кишечника, что вызывает деск-
вамацию и атрофию ворсинок кишки, нарушаются секреторно-
моторная функция кишечника и переваривание пищи. Возникает
дисбактериоз на фоне изменения pH в кислую сторону. Актив-
ность кишечных гидролаз снижается, происходит гнилостный
распад пищи, в результате чего образуются индол, скотол, крезол,
фенол, сероводород. Все это приводит к вторичному токсикозу.
г
(огуречный цепень):
гермафродитный членик; г— кокон с яйцами
177
Рис. 68. Биология развития D. caninum:
7 —сколекс; 2 — гермафродитный членик; 3 — общий вид цестоды; 4— зрелый членик;
5—коконы с яйцами; б—личинки блох; 7—блоха; 8— цистицеркоид; 9 — власоед
Животные истощаются, нарушается функция пищеварения, т. е.
появляются поносы и запоры. У молодых собак нередко отмечают
нервные явления.
Диагностика. При жизни диагноз ставят путем обнаружения
члеников или коконов по методу Фюллеборна. В случае падежа
производят гельминтологическое вскрытие кишечника.
Лечение. Для лечения цестодоза применяют фенасал, фенапэг,
феналидон, девермин, бромисто-водородный ареколин, лопатол,
бунамидин, никлозамид, празиквантел, дронталь плюс и др.
Фенасал и его формы (феналидон, фенапэг) назна-
чают однократно в дозах 150—250 мг на 1 кг массы тела с кормом.
178
Бунамидин собакам дают с мясным фаршем в дозе 50 мг
на 1 кг массы тела двукратно с интервалом 4 дня.
Л о п а т о л назначают внутрь в дозе 100 мг на 1 кг массы тела
с кормом.
Фебантел применяют внутрь из расчета одна таблетка на
10 кг массы тела или 10 мг д. в. на 1 кг массы тела 3 дня подряд с
кормом.
Дронталь плюс дают собакам через рот из расчета одна
таблетка на 10 кг массы тела. Кошкам его дают внутрь однократно
с мясом или в измельченном виде из расчета одна таблетка на 4 кг
массы тела.
Празиквантел всем плотоядным дают однократно перо-
рально в дозе 5 мг на 1 кг массы тела.
Профилактика и меры борьбы. С целью профилактики дипили-
диоза строго следят за ветеринарно-санитарными условиями со-
держания животных. Следует чаще менять подстилку, коврики
ошпаривать кипятком, проводить дезинсекцию в домиках и клет-
ках 0,5%-ной эмульсией карбофоса, 1%-ным водным раствором
хлорофоса. Эффективны аэрозоли «Акродекс», «Перол», «Актол».
Эти же препараты применяют для уничтожения блох и власоедов
на животных. Хороший результат дает применение 0,05%-ной
эмульсии перметрина, эктомина 1 : 1000, неостомазана 1 : 200. Не-
обходимо вести работу по регуляции и учету безнадзорных собак и
кошек. Подвалы и чердаки должны быть надежно закрыты.
7.2.5. ДИФИЛЛОБОТРИОЗЫ ПЛОТОЯДНЫХ
Дифиллоботриозы — цестодозы собак и других плотоядных
животных, в том числе птиц, а также человека, вызываемые ленте-
цами (ременцами) из отряда Pseudophyllidea.
Локализация — все виды лентецов локализуются в тонком ки-
шечнике. Личинки — плероцеркоиды — в разных органах и тканях
дополнительных хозяев.
Распространение. Заболевания широко распространены в на-
шей стране, но в целом носят очаговый характер.
Больные животные худеют, отстают в росте и развитии. У зве-
рей пушнина теряет качество.
На обезвреживание зараженной рыбы затрачиваются большие
средства.
Возбудители. Diphyllobothrium latum — широкий лентец, у со-
бак достигает в длину 10 м при ширине 1,5 см. У пушных зверей
он меньше — длиной до 1,5 м. Сколекс сдавлен с боков, имеет две
глубокие щели — ботрии. Членики короткие, но широкие, боко-
вые поля заполнены мелкими (в виде точек) семенниками числом
700—800. Яичник по форме напоминает крылья бабочки и нахо-
дится позади матки. Матка открытого типа, на вентральной по-
179
верхности каждого членика открываются три половых отверстия
(мужское, вагина, матка). Яйца трематодного типа, овальные, се-
рого цвета, с крышечкой на одном полюсе, размером (0,063—
0,073) х (0,042-0,052) мм.
D. minus — лентец малый, коричневого цвета, длиной до 26 см,
шириной 11 мм. Шели от сколекса переходят в область шейки.
Широкие задние края чтеников напоминают зубчатую пилу.
D. stnetum — лентец узкий, длиной до 47 см, шириной 4 мм.
Зрелые членики удлиненные.
D. tungussicum — лентец тунгусский длиной до 63 см, шириной
3,6 мм. Членики короткие. Яйца напоминают грецкий орех, с не-
ровной поверхностью.
В медицинской литературе выделяют D dedriticum, D kleba-
novskii, D luxi (рис. 69).
Биология развития. Все лентецы — биогельминты. Дефинитив-
ные хозяева — собака, кошка, лисица, песец, куница и человек.
Дефинитивный хозяин вида D. dendriticum — чайки. Промежуточ-
ные хозяева — рачки-циклопы (Cyclops strenuus и др.). Дополни-
тельные хозяева — пресноводные рыбы (окунь, ерш, форель, на-
лим, шука, хариус, сиг, судак, бычок и др ).
Во внешней среде в яйце за 20—25 сут развивается эмбриональ-
ная личинка — корапидий округлой формы, покрыт ресничками.
В водоемах их заглатывают рачки. В теле рачков за 14—20 сут фор-
мируются процеркоиды. Далее рачков заглатывают рыбы. Из ки-
шечника процеркоиды проникают в мышцы, икру, печень, под-
кожную клетчатку, где превращаются в инвазионную личинку —
плероцеркоид длиной 6—10 мм и более. Дефинитивные хозяева
заражаются при поедании инвазированной рыбы. В кишечнике
собак лентец достигает половой зрелости за 13—23 сут, лисиц —
16—36, песцов — 21—26, человека — за 60 сут. Продолжительность
жизни гельминта у человека составляет около 29 лет, у собаки —
394сут, у песцов —389, у лисиц—112, у кошек — 21—27сут
(рис. 70).
Эпизоотологические данные. На территории Российской Феде-
рации и стран СНГ эти цестоды распространены преимуществен-
но на севере по крупным водным артериям и водоемам Неблаго-
получны районы Карелии. Балтики, тундры, в азиатской части —
бассейны рек Тазы, Енисея, Лены, Оби, Амура. Нередко регист-
рируют на Сахалине, Таймырском полуострове, в Тюмени,
Астрахани.
У хищных рыб (резервуары) экстенсивность инвазии плероцер-
коидами достигает нередко 100% при интенсивности 650личи-
нок. Плероцеркоидами нередко поражены лягушки, ящерицы и
змеи, а через них (трофическая связь) заражаются дикие кабаны.
Основной источник распространения инвазии — плотоядные, в
том числе и дикие, но иногда существенную роль в этом играет
человек.
180
Рис. 69. Diphyllobothrium (по Капустину):
а — общий вид (уменьшено); б— яйцо
181
Рис. 70. Биология развития D. latum:
7 — общий вид члеников лентеца; 2— сколекс с ботриями; 3 — зрелые членики; 4— яйцо
трематодноготипа; 5—короцидий; б—циклопы; 7 — процеркоид; 8— плероцеркоид
Патогенез и симптомы болезни. Патогенез при дифилдоботриозе
развивается так же, как и при цестодозах (см. Дипилидиоз), но
описано немало случаев, когда у больных животных и человека
отмечали пернициозную (злокачественную) анемию. Как прави-
ло, отмечают гиповитаминоз Bi2, извращение аппетита, наруше-
ние функции пищеварения — поносы или запоры. Уменьшаются
количество эритроцитов и уровень гемоглобина, увеличивается
число эозинофилов и юных форм нейтрофилов. Отмечаются лей-
коцитоз или лейкопения. Возникает дисбактериоз. Одни живот-
ные угнетены, другие — возбуждены.
Диагностика. При жизни животного диагноз ставят путем обна-
182
ружения в фекалиях члеников или яиц по методу Фюллеборна,
для чего используют 64%-ные растворы гипосульфита или амми-
ачной селитры плотностью 1,3 (1,5 кг соли на 1 л воды). Исследу-
ют речных рыб, осматривая брюшную полость, икру, поверхность
кишечника, желудок, печень и др.
Посмертно вскрывают тонкую кишку животного.
Паразитирование плероцеркоидов у некоторых других живот-
ных, например кабанов, вызывает заболевание спарганоз.
Лечение. Собакам и другим плотоядным применяют те же хи-
миопрепараты и в тех же дозах, что и при дипилидиозе собак.
Профилактика и меры борьбы. В распространении дифиллобот-
риоза существенную роль играют человек и пушные звери, поэто-
му нельзя строить зверофермы и туалеты вблизи рек и водоемов.
Фекалии пушных зверей нужно своевременно удалять в навозо-
хранилище. Всем плотоядным животным запрещено скармливать
пораженную плероцеркоидами рыбу без предварительного обез-
вреживания.
С этой целью применяют посол: крепкий (14 сут в тузлуке
плотностью 1,20 при температуре 2—4 °C); средний (14—16 сут в
тузлуке плотностью 1,18 при 2 °C); слабый (16 сут в тузлуке плот-
ностью 1,16 при 2—4 °C). Варить рыбу следует порциями не менее
20 мин с момента закипания, рыбные пельмени — не менее 5 мин.
При естественном замораживании рыбы личинки лентеца ши-
рокого и гаечного гибнут при температуре в теле рыбы минус 20 °C
за 8 ч, при минус 30 °C — за 6, при минус 35 °C — за 3, при минус
40 °C — за 2 ч. Сильно зараженная рыба подлежит технической
утилизации. В икре личинки гибнут при посоле в 3%-ном раство-
ре натрия хлорида (3 г соли на 100 г икры) только через 2 сут, в
5%-ном растворе — через 30 мин.
7.2.6. МЕЗОЦЕСТОИДОЗ ПЛОТОЯДНЫХ ЖИВОТНЫХ
Мезоцестоидоз — заболевание плотоядных животных, вызыва-
емое цестодой семейства Mesocestoididae подотряда Mesocestoi-
data.
Локализация — имаго паразитируют в тонком кишечнике дефи-
нитивных хозяев, личинки локализуются в грудной и брюшной
полостях, диафрагме, в стенках кровеносных сосудов и кишечни-
ка, сердечной сорочке, зобной железе, печени, лимфатических уз-
лах дополнительных хозяев.
Возбудитель. Есть несколько видов цестод, но чаще паразити-
рует Mesocestoides lineatus. Длина цестоды около 2,5 м. Сколекс с
четырьмя присосками, не содержит крючков. Матка мешковид-
ной формы, расположена по средней линии членика. Гермафро-
дитные членики (незрелые) — квадратные, а зрелые напоминают
семена арбуза. Зрелые яйца собираются в шаровидный орган, ок-
183
ружаюший начальную часть матки. Яйца овальные с тонкой обо-
лочкой, длиной 0,03 мм, шириной 0,029 мм, содержат онкосферу
(рис. 71).
Инвазионная личинка — тетратиридий удлиненной формы, пе-
редний конец расширен и включает в себя втянутый внутрь ско-
лекс с присосками. Длина от 5—7 до 10—19 см.
Биология развития. Мезоцестоидесы — биогельминты. Дефини-
тивные хозяева — собака, кошка, волк, барсук, енот, песец, лиси-
ца, куница, соболь и др., промежуточные — орибатидные клеши
(Oribatidae), дополнительные — амфибии, рептилии, птицы, гры-
зуны, хорьки, куницы (рис. 72). Некоторые из них являются также
резервуарными хозяевами.
Яйца, выделенные плотоядными, поедают орибатиды, в теле
которых за 4 мес формируются цистинеркоиды. Затем эти клещи с
кормом попадают в организм дополнительных хозяев, где образу-
ются тетратиридии. У дополнительных хозяев (их около 200 ви-
дов) тетратиридии локализуются в разных органах и местах, при
поедании которых заражаются дефинитивные хозяева. В кишеч-
нике собак цестода за 22—30 сут достигает половой зрелости.
Эпизоотологические данные. У многих плотоядных паразитиру-
ют цестоды нескольких видов: Mesocestoides lineatus, М. corti,
М. petrovi, М litteratus. Последний вид чаще встречается у собак и
Рис. 71. Mesocestoides lineatus:
а - - членики на различных стадиях
развития; б— сколекс с развитыми
присосками
184
Рис. 72. Биология развития М. lineatus:
А — строение цестоды: 1 — сколекс цестоды; 2— гермафродитный членик; 3— зрелый членик;
4— кишечнике прикрепленными цестодами; Б— промежуточные хозяева: 1, 2—орибатидные
квеши; В — дополнительные хозяева; Г— резервуарные хозяева; Д — дефинитивные хозяева
лисиц в европейских странах. В грудной, брюшной полостях де-
финитивных хозяев, случайно заглатывающих орибатидных кле-
шей с цистицеркоидами, вырастают тетратиридии. В этом случае
собаки и другие плотоядные выступают уже в роли дополнитель-
ных хозяев.
При заражении лисиц и песцов от куниц и соболей гельминт
половой зрелости достигает за 14—15 сут. У лисиц цестоды в зим-
ний период сбрасывают стробилу, которая восстанавливается вес-
ной. У пушных зверей мезоцестоидоз чаще отмечают с 3-месячно-
185
го возраста, но иногда болеют и взрослые животные — 7—8 лет.
Собаки и кошки чаще заражаются в сельских районах.
Патогенез и симптомы болезни. Патогенез развития болезни ха-
рактерен для всех цестодозов. Нередко отмечают закупорку ки-
шечника, поносы, запоры, рвоту, нервные приступы, напоминаю-
щие бешенство.
Тетратиридиоз у соболей, куниц протекает тяжело с выражен-
ной анемией, отказом от корма, истощением, приводящим к гибе-
ли животных.
Диагностика. Прижизненный диагноз ставят путем обнаруже-
ния члеников в фекалиях и яиц по методу Фюллеборна. Посмерт-
но диагностируют болезнь при вскрытии животного.
Лечение. То же, что и при других цестодозах собак.
Профилактика и меры борьбы. В неблагополучных по цестодозу
хозяйствах пушных зверей содержат в шедах и клетках на припод-
нятом сетчатом полу. Собакам, кошкам и зверям нельзя скармли-
вать трупы мелких и крупных животных, в том числе пушных зве-
рей, без предварительной термической обработки. На территории
зверинца уничтожают грызунов.
7.2.7. ГИДАТИГЕРОЗ КОШЕК
Заболевание плотоядных из семейства кошачьих, вызываемое
цестодой семейства Taeniidae подотряда Taeniata.
Локализация — цестоды паразитируют в тонкой кишке, личи-
ночная стадия — В: печени, реже в грудной и брюшной полостях
грызунов — промежуточных хозяев.
Возбудитель. Болезнь вызывает цестода Hydatigera fasciolaris,
именуемая в последние годы Н. taeniaformis. Длина ее 15—60 см,
ширина 5—6 мм. Имеет развитый хоботок с 26—52 крючочками,
расположенными в два ряда. Сколекс с четырьмя присосками не-
заметно переходит в тело паразита (шейка отсутствует). В зрелых
члениках матка содержит 16—18 боковых ответвлений.
Личинка Strobilocercus fasciolaris паразитирует в основном в пе-
чени грызунов. Имеет форму цисты диаметром около 10 мм, жел-
товатого цвета. Освобожденная от цисты личинка удлиненной
формы, сколекс вооружен, тело ложночленистое и снабжено пу-
зыревидным хвостовым концом. Длина личинки 5—20 см, ширина
до 5 мм. Яйца округлые, в диаметре 0,031—0,037 мм.
Биология развития. Дефинитивные хозяева — домашняя и ди-
кая кошки, тигр и другие кошачьи, реже и собака, промежуточ-
ные — крыса, мышь, нутрия, ондатра, белка, крот, летучая мышь
(рис. 73).
Промежуточные хозяева заражаются при заглатывании яиц и
члеников цестоды, выделяемых дефинитивными хозяевами. Из
кишечника грызунов онкосферы мигрируют в печень, грудную и
186
Рис. 73. Биология развития Н. fasciolaris:
1 — цестода; 2—большие и малые крючки; 3 — зрелый членик; 4 — S. fasciolaris; 5— печень,
пораженная стробилоперкусами
брюшную полости, где образуются стробилоцеркусы округлой
формы. Дефинитивные хозяева заражаются при поедании зара-
женных промежуточных хозяев.
Половой зрелости цестоды у кошек достигают за 34—80 сут.
Продолжительность их жизни около 7—24 мес.
Эпизоотологические данные. Главный источник распростране-
ния заболевания — кошка, у которой экстенсивность инвазии мо-
жет достигать 20 %. Один членик гельминта содержит 1606 ±
±402 яйца.
Причины широкого распространения гельминтоза — большое
количество промежуточных хозяев, интенсивный рост числа без-
надзорных кошек.
187
Патогенез и симптомы болезни. Гидатигероз развивается, как и
другие цестодозы плотоядных. Степень проявления симптомов
болезни зависит от возраста кошек (молодые переболевают тяже-
лее), интенсивности инвазии и других факторов.
Лабораторные мыши и нутрии часто тяжело болеют стробило-
церкозом. Нами зарегистрированы случаи, когда из 480 нутрий
пали 250 животных с признаками ухудшения аппетита, исхудания,
расстройства функции пищеварения и нервных явлений. При
вскрытии обнаруживали в печени 14—15 личинок, диаметр кото-
рых достигал 10—12 мм, а длина стробилоцеркусов — 8—10 см при
ширине 4,6—5 мм.
Из 85 мышей, отобранных в питомнике Подмосковья с призна-
ками малая подвижность, снижение аппетита, увеличение объема
живота, 80 оказались зараженными стробилоцеркусами при ин-
тенсивности инвазии 2—5 экз.
Диагностика. Проводят комплексные исследования и с учетом
эпизоотологии, обнаружением члеников, яиц (у кошек), строби-
лоцеркусов (у грызунов) ставят точный диагноз.
Лечение. Для дегельминтизации кошек применяют ф е н а п э г
и другие антительминтики в тех же дозах, что и при других цесто-
дозах плотоядных.
Камалу назначают кошке внутрь с молоком однократно в
дозе 0,5—2 г.
Д р о н т а л кошкам дают из расчета одна таблетка на 4 кг мас-
сы тела в мясе плотной консистенции или в размельченном виде с
кормом.
Верпанил плюс — таблетки для применения внутрь.
Таблетка массой 300 мг содержит 100 мг мебендазола (действую-
щего вещества). Доза препарата 10 мг д. в. на 1 кг массы тела утром
и вечером с кормом.
Биовермин — паста, 1 г которой содержит 0,044 г флубен-
дазола (действующего вещества). Дают ее в дозе 22 мг д. в. на 1 кг
массы тела, т. е. 1г пасты на 2 кг массы тела 1 раз в сутки 2 дня
подряд.
Профилактика и меры борьбы. Необходимо систематически
уничтожать грызунов в подвалах, свинарниках, кошарах, птични-
ках, складских помещениях и т. д. Кошки не должны иметь доступ
к питомникам грызунов.
7.2.8. ЛИГУЛИДОЗЫ РЫБ
Лигулидозы (лигулез и диграммоз) — заболевания карповых
рыб, сопровождаемые нарушением функции внутренних органов
вследствие паразитирования в брюшной полости ленточных чер-
вей в личиночной стадии (плероцеркоида), относящихся к семей-
ству Lygulidae отряда Pseudophyllidea.
188
Локализация — брюшная полость.
Распространение. Лигулидозы широко распространены в водо-
хранилищах, озерах и прудовых хозяйствах страны. У больных
рыб ухудшается качество мяса, на 20—35 % снижается прирост их
массы, часть рыб гибнет.
Возбудители. Болезнь вызывают плероцеркоиды ремнецов —
Lygula intestinalis, Digramma interrupta, Schistocephalus solidus и др.
Личинки белого, желтоватого или сероватого цвета, длиной 5—
120 см, шириной 0,5—1,7 см. Наружная расчлененность тела ли-
чинок и взрослых паразитов отсутствует. На переднем закруглен-
ном конце есть две ямки — щелевидные ботрии (органы фикса-
ции). Шейка не выражена. У половозрелых гельминтов и личинок
на вентральной стороне каждого ложного членика открываются
три отверстия — мужское, вагины и матки. В соответствии с ними
вдоль всей стробилы видны борозды — одна у лигулы и шистоце-
фалюса и две у диграммы.
Яйца овальной формы, трематодного типа, с крышечкой и бу-
горком, желтоватого цвета, длиной 0,04—0,6 мм, шириной
0,03 мм.
Биология развития. Ремнецы развиваются с участием дефини-
тивных (чайки, поганки, крачки и реже—утки), промежуточных
(циклопы, диаптомусы) и дополнительных (рыбы) хозяев. В ки-
шечнике птиц половозрелые гельминты откладывают яйца, кото-
рые выделяются с фекалиями наружу. В зависимости от темпера-
туры воды (10—25 °C) в яйце за 5—15 сут формируется эмбрио-
нальная личинка — корацидий. При выходе из яйца корацидии
при помощи ресничек плавают в воде. Их заглатывают рачки, в
теле которых за 10—15 сут вырастают процеркоиды.
Рыбы заражаются личинками гельминтов при поедании зара-
женных промежуточных хозяев (рачков). Из кишечника рыбы
процеркоиды проникают в брюшную полость и через 8—12 мес
превращаются в плероцеркоидов, напоминающих взрослых рем-
нецов. В рыбе плероцеркоиды жизнеспособны более 3 лет. Зара-
женные плероцеркоидами рыбы становятся добычей чаек и других
птиц, в кишечнике которых за 3—5 сут ремнецы становятся поло-
возрелыми (рис. 74). Выделение яиц продолжается 5—7 дней, пос-
ле чего гельминты погибают.
Эпизоотологические данные. Экстенсивность инвазии промыс-
ловых рыб на Волге, в Цимлянском водохранилище, озерах Эсто-
нии, Якутии, Урала нередко достигает 40—60 % при интенсивнос-
ти инвазии 3—7 гельминтов. Массовое заражение и гибель рыбы
отмечают весной и летом. В южных районах страны заболевание
встречается чаще и с большей интенсивностью инвазии, чем в
других регионах.
Лигулидозы — природно-очаговые болезни. Встречаются у пре-
сноводных рыб, в основном у карповых (лещ, плотва, язь, карась,
елец, пескарь, усач и др., более 47 видов). В последнее время пле-
189
Рис. 74. Биология развития лигулцд:
1 — чайки — дефинитивные хозяева; 2 — общий вид гельминтов; 3 — яйцо; 4—
корацидий; 5 — веслоногие рачки — промежуточные хозяева; 6 — процеркоид в
теле рачка; 7, 8— рыбы с плероцеркоидами — дополнительные хозяева
роцеркоидов стали находить у карпов и сазанов. Лигулезом также
поражаются белый амур, белые и пестрые толстолобики. В есте-
ственных водоемах, где в зарослях камыша и другой растительнос-
ти гнездятся многочисленные водоплавающие птицы — дефини-
тивные хозяева, заболевание встречается чаще. В этих местах для
питания в большом количестве собирается инвазированная рыба,
что способствует постоянному перезаражению.
Патогенез и симптомы болезни. Поселяясь в брюшной полости
рыбы, плероцеркоиды своей большой массой механически воз-
190
действуют на внутренние органы. Это приводит к атрофии и
уменьшению размеров органов в 2—3 раза, нарушается их функ-
ция. Брюшко увеличивается, становится плотным, упругим,
брюшная стенка нередко разрывается, и гельминты частично сви-
сают наружу. В результате рыба становится бесплодной, рыбопро-
дуктивность водоемов снижается. Больные рыбы истощены, часто
скапливаются в мелководье, держатся на поверхности воды и пла-
вают на боку или брюшком вверх. Таких рыб легко вылавливать,
или они становятся добычей птиц.
Диагностика. Диагноз ставят на основании обнаружения плеро-
церкоидов в брюшной полости при вскрытии рыб. У чаек и уток
половозрелые ремнецы локализуются в тонком кишечнике.
Профилактика и меры борьбы. В прудовых хозяйствах лигулидо-
зы профилактируют путем отпугивания рыбоядных птиц, не до-
пускают их гнездования. При установлении неблагополучия хо-
зяйства осенью всю рыбу вылавливают, воду сливают, а ямы — бо-
чаги обрабатывают негашеной известью из расчета 25 ц на 1 га. На
больших водоемах, озерах, лиманах также отпугивают птиц, а
больную рыбу вылавливают. По возможности водоемы заселяют
сиговыми рыбами, которые не болеют лигулидозами. Ремнецами
заражаются и домашние утки, поэтому при показаниях ихдегель-
минтизируют фенасалом, битионолом, а выделения уничтожают.
Больную рыбу товарной кондиции можно использовать в пищу
без ограничений.
7.2.9. БОТРИОЦЕФАЛЕЗ РЫБ
Заболевание вызывают цестоды рода Bothryocephalus семейства
Bothryocephalidae отряда Pseudophyllidea, паразитирующие у пре-
сноводных и морских рыб.
Локализация — кишечник.
Распространение. Ботриоцефалез пресноводных рыб распрост-
ранен повсеместно в прудовых хозяйствах и естественных водо-
емах страны. Встречается и у морских рыб. Продуктивность боль-
ных рыб снижается, иногда рыбы гибнут.
Возбудитель. Болезнь вызывает цестода В. acheilognathi
(В. gowkongensis). Длина ее 15—25 см, ширина Змм. Состоит из
сколекса, снабженного двумя ботриями, шейки и члеников. Боко-
вые края стробилы зазубрены. Яйца овальные, небольшие (0,03—
0,05 мм), серого цвета, с крышечкой на одном полюсе. При выхо-
де из матки в яйце содержится почти сформировавшаяся личинка.
Биология развития. Ботриоцефалюсы развиваются при участии
дефинитивных (карп, белый амур, толстолобик, сазан, лещ, сом,
плотва, карась, усач и др.) и промежуточных (веслоногие рачки,
чаще — циклопы) хозяев. У морских рыб ботриоцефалюсы разви-
ваются при участии двух промежуточных хозяев — ракообразных и
191
мелких рыб (корюшка, бычки) и дефинитивных хозяев — угрей,
камбалы, сельди, трески и др. Яйца паразита с фекалиями рыб по-
падают в воду, где при температуре 16—18 °C за 4—5 сут формиру-
ются корацидии. Корацидиев поедают циклопы. За 3—8 сут в теле
циклопов они превращаются в процеркоидов.
Рыбы заражаются при заглатывании инвазированных цикло-
пов. В кишечнике рыб через 12—31 сут гельминт достигает поло-
вой зрелости. Продолжительность жизни паразита около года. Зи-
мой у ботриоцефалюсов наступает дестробиляция (рис. 75).
Эпизоотологические данные. Ботриоцефалез чаще всего встреча-
ется в южных зонах страны. Заболевание особенно опасно для се-
голеток карпа и белого амура, у которых зараженность к середине
лета может достигать 98—100 % при интенсивности инвазии 25
паразитов у карпа и 180—200 — у белого амура (сеголеток и годо-
виков). Рыбы старших возрастов — паразитоносители. Мальки за-
ражаются в 6—7-суточном возрасте, когда начинают питаться зоо-
планктоном. В центральных районах страны зараженность карпов
в 10-дневном возрасте составила в июне 12 %, в 30-дневном — 38,
в 45-дневном — 70,7, в 60-дневном — 93—100 % при интенсивнос-
ти инвазии от 7 до 98 экз. Зараженность 2-летних карпов достигает
35—60 %, но 3-летние рыбы и рыбы более старшего возраста зара-
жены редко.
Инвазия может передаваться при перевозке рыб из неблагопо-
лучных хозяйств или зараженными циклопами с током воды.
Патогенез и симптомы болезни. Стробилы ботриоцефалюсов, по
данным К. В. Секретарюка (1986), входят в тесные морфофунк-
циональные контакты со слизистой оболочкой кишечника рыбы.
В результате происходит атрофия слизистой кишечника и даже
мышечного слоя. В ряде случаев кишечник зараженной рыбы
утончается до такой степени, что через него просматриваются
гельминты.
Больная рыба, особенно сеголетки и годовики, становится вя-
лой, худеет, плавает в поверхностных слоях воды. Спина заостре-
на, глаза запавшие, брюшко увеличено, упругое, жабры анемич-
ны. Больные сеголетки карпа и белого амура плохо переносят зи-
мовку и часто погибают в зимовальных прудах.
Диагностика. У маточного поголовья на гельминтоносительство
исследуют фекалии по методу Фюллеборна. Решающее значение
имеют вскрытие кишечника и обнаружение ботриоцефалюсов.
Лечение. Для дегельминтизации применяют циприноце-
стин — гранулированный корм, содержащий 1 % фенасала. Су-
точная доза его составляет от 6 до 14 % массы рыбы (в зависимос-
ти от ее возраста и температуры воды). Сеголеток дегельминтизи-
руют дважды: первый раз — в июле или августе, второй — через
7—8 сут после первой обработки. На юге в октябре, перед зимов-
кой, проводят третью однократную обработку.
Производителей и ремонтных рыб можно дегельминтизировать
192
1
Рис. 75. Биология развития В. acheilognathi:
А — взрослый гельминт: 1 — головка и шейка; 2— членик; Б — дефинитивные хозяева: 1 — са-
зан; 2— карп; 3 — карась; 4 — толстолобик; 5— белый амур; 6— сом; В — развитие в воде: 1 —
яйцо; 2 — выход корацидия из яйца; 3 — корацидий; 4 — процеркоид в теле циклопа — проме-
жуточного хозяина
индивидуально. Для этого водную суспензию фенасала вво-
дят перорально в кишечник рыбы с помощью шприца и резиново-
го шланга. Рыбе массой 0,5—1,5 кг вводят 0,5 г фенасала, произво-
дителям — не более 1 г. Хорошие результаты получены при ис-
пользовании других форм фенасала — микрофена, микросала и
лечебного корма «Цестокарп».
193
Профилактика и меры борьбы. На неблагополучные хозяйства
накладывают ограничения, согласно которым запрещен вывоз
больных и ввоз здоровых рыб. Проводят рыбоводно-мелиоратив-
ные мероприятия, дезинвазию ложа прудов хлорной (5 ц на 1 га)
или негашеной (25 г на 1 га) известью. Создают благоприятные
зоогигиенические условия в водоемах.
7.2.10. КАВИОЗ И КАРИОФИЛЛЕЗ РЫБ
Это заболевания пресноводных рыб, вызываемые цестодами се-
мейства гвоздичниковых (Caryophyllaeidae) отряда Caryophyllidea.
Локализация — кишечник.
Распространение. Кавиоз и кариофиллез широко распростране-
ны в некоторых странах Европы и Азии, в которых развито прудо-
вое рыбоводство. В нашей стране кавиоз встречается во всех зонах
карповодства. Кариофиллез чаще регистрируют в прудовых хозяй-
ствах западных областей и в нижних течениях рек европейской
части Российской Федерации.
Ущерб складывается из замедления прироста массы у рыб, ги-
бели сеголеток во время зимовки.
Возбудители. Существует несколько возбудителей, но наиболее
патогенны Khawia sinensis и Caryophyllaeus fimbriceps, С. laticeps,
вызывающие кавиоз и кариофиллез соответственно.
Kh. sinensis — цестода белого цвета, длиной 80—175 мм, шири-
ной 3,5—4,5 мм. Тело нерасчлененное. Головной конец веерооб-
разно расширен, с фестончатым передним краем. Яичник Н-об-
разной формы, расположен в заднем конце тела. На некотором
расстоянии от головного конца внутри находится большое коли-
чество семенников и желточников. Матка с большим числом пе-
тель занимает середину тела. Яйца сероватые, с крышечкой, раз-
мером (0,038—0,076) х (0,021—0,028) мм.
Возбудители кариофиллеза по строению фактически идентич-
ны Kh. sinensis, но в отличие от него С. fimbriceps несколько мень-
шего размера: длина 13—18 мм, ширина 0,9—1,4 мм (рис. 76).
Желточники начинаются позади шейки. Матка с небольшим ко-
личеством петель находится в заднем конце тела. Яйца светло-се-
рые, с крышечкой, размером (0,061—0,071) х (0,03—0,04) мм.
Биология развития. Оба заболевания развиваются однотипно с
участием одного промежуточного хозяина — малощетинковых
червей (трубочников), живущих на дне водоемов. Дефинитивные
хозяева — сазан, карп и их гибриды, а для С. fimbriceps — лещ, си-
нец, белоглазка, густера, красноперка, плотва, усач, елец. Яйца
гельминтов выделяются с фекалиями и заглатываются малоще-
тинковыми червями. В их теле за 2,5—3 мес формируется процер-
коид. Длина личинки 10—15 мм. Рыба заражается при поедании
червей, зараженных процеркоидами. В кишечнике рыбы гельмин-
ты растут и через 1,5—2,5 мес становятся половозрелыми.
194
Рис. 76. Морфология цестод:
а — С. fimbriceps; б—С. laticeps; в — возбудитель кавиоза; 1 —
передний конец тела; 2— задний конец тела
Эпизоотологические данные. Возбудителей регистрируют почти
во всех зонах карповодства. В основном болеют сеголетки, заража-
ясь при переходе на питание бентосом. Пик инвазии приходится
на июль—август. Экстенсивность инвазии в отдельных хозяйствах
достигает 70—100% при высокой интенсивности (15—30 экз.). К
сентябрю экстенсивность заражения снижается, но осенью отме-
чают новую волну инвазии.
195
Двухлетки инвазируются весной, но максимум зараженности
приходится на середину лета. Гельминтоносителями чаще бывают
взрослые рыбы.
На распространенность инвазии во многом влияет состояние
водоемов. Так, в водоемах с илистым дном создаются оптималь-
ные условия для развития червей, следовательно, рыбы, интенсив-
но питаясь ими, скорее могут быть зараженными.
Зимой гельминты сохраняются в организме рыб в пассивном
состоянии, но с наступлением весны активизируются и начинают
выделять яйца. Личинки цестод также перезимовывают в теле чер-
вей и весной могут стать источником инвазии.
Симптомы болезни. У больных рыб понижен аппетит, они от-
стают в росте и развитии. Жаберный аппарат анемичен, брюшко
увеличено. Иногда отмечают пучеглазие. Рыба скапливается на
мелководье у берегов пруда.
Диагностика. При вскрытии кишечника обращают внимание на
интенсивность инвазии и определяют видовую принадлежность
гельминтов. Можно исследовать экскременты больных рыб по ме-
тоду Фюллеборна с целью обнаружения яиц.
Лечение. Применяют гранулированный лечебный корм —
циприноцестин с учетом возраста рыб и температуры
воды так же, как и при ботриоцефалезе. Сеголеток дегельминти-
зируют в период подъема инвазии (июль—август) двукратно с ин-
тервалом 7—8 сут, двухлеток карпа — однократно в июне или
июле.
Сеголеток карпа можно лечить гранулированным комбикор-
мом с галосфеном, подмешивая его к корму из расчета 0,5 г
на 1 кг массы тела. Применяют двукратно с интервалом 24 ч.
Производителей можно обрабатывать индивидуально ф е на-
садом или камалой в дозе 0,5 г на 1 кг массы тела. Раствор
препаратов вводят в кишечник с помощью резинового катетера.
Профилактика и меры борьбы. В прудах уничтожают малоще-
тинковых червей путем просушивания водоемов и обработки ложа
негашеной (25—30 ц на 1 га) или хлорной (5 ц на 1 га) известью.
Если нет возможности осушить водоемы, то в них можно разво-
дить невосприимчивых к указанным цестодам рыб.
7.2.11. ТРИЕНОФОРОЗЫ ХИЩНЫХ И ДРУГИХ РЫБ
Триенофорозы — цестодозы многих видов рыб, вызываемые
лентецами из класса Cestoda отряда Pseudophyllidea.
Локализация — взрослые цестоды — в кишечнике хищных рыб,
а личинки (плероцеркоиды) — в мышцах лососевых, бычковых,
ротана и форели. Личинки же цестод некоторых видов паразити-
руют в печени и полости тела карповых, лососевых, окуневых.
Плероцеркоиды Triaenophorus crassus локализуются под кожей,
погружаясь в мышцы.
196
1
Рис. 77. Биология развития Triaenophorus (из Schaperclaus’a, 1979 г.
с дополнениями):
7 — дефинитивные хозяева (хищные рыбы); 2—яйцо; 5—выход корацидия
из яйца; 4 — корацидий; 5 — промежуточный хозяин (циклоп) с процеркои-
дом в теле; 6—дополнительные хозяева (мирные рыбы); а — Т. nodulosus; б—
Т. crassus
Распространение. Заболевания распространены повсеместно. В
нашей стране встречаются в крупных реках Севера, средней поло-
сы России и в озерах Карелии.
Возбудители. У различных рыб в нашей стране паразитируют
личинки возбудителей семейства Triaenophoridae рода Triaeno-
phorus. Известны виды Т. nodulosus, Т. crassus, Т. amurensis и др.
Однако наибольшее эпизоотологическое значение имеют два пер-
вых вида. Лентецы во взрослой стадии светло-серого цвета, дли-
ной от 90 до 480 мм, шириной 2—6 мм. Сколексы вооружены дву-
мя парами трехзубцовых крючков, расположенных попарно с вен-
тральной и дорсальной сторон. Половая система представлена
множеством семенников, яичником, желточниками и сильно из-
витой маткой. Половые отверстия открываются сбоку членика
(рис. 77). Яйца овальные, размером (0,052—0,071) х (0,033—
0,045) мм, с крышечкой на одном полюсе (трематодного типа).
Плероцеркоид удлиненной формы, длиной 6—10 мм, а по отдель-
ным данным 13—15 мм. Строение сколекса у личинок идентично
с таковым у взрослых цестод.
197
Биология развития. Развитие лентецов происходит с участием
трех хозяев: дефинитивных — хищные рыбы, дополнительных —
мирные рыбы и промежуточных — циклопы и диаптомусы. Хищ-
ные рыбы (щуки, окунь, омуль, хариус) с фекалиями выделяют
яйца цестоды, которые заглатываются циклопами, развиваются
при температуре 18—24 °C и за 5—7 сут формируются корацидии.
При температуре 5—7 °C корацидии образуются за 29—35 сут. Ко-
рацидии выходят из яиц и заглатываются промежуточными хозяе-
вами. В теле циклопов корацидии превращаются в процеркоиды и
через 10—15 сут становятся инвазионными.
Дополнительные хозяева заражаются при поедании заражен-
ных циклопов. Процеркоиды проникают в полость тела, печень,
реже в другие органы. У сигов процеркоиды внедряются в мышцы.
В местах локализации они инкапсулируются и становятся инвази-
онными — плероцеркоидами. На этой стадии они могут оставать-
ся в организме рыб несколько лет.
Хищные рыбы заражаются при поедании рыб с плероцеркоида-
ми. В кишечнике хищных рыб лентецы достигают половой зрело-
сти за 3—4 нед.
Эпизоотологические данные. Триенофорозы — в основном бо-
лезнь рыб естественных водоемов. В прудовых хозяйствах заболе-
вание встречается у щук и форели. Источники распространения
инвазии — хищные рыбы, а источники заражения — мирные
рыбы. В период миграции рыбы инвазия может распространяться
на значительные расстояния. Щуки зимой освобождаются от цес-
тод, но экстенсивность инвазии резко повышается к лету (июнь-
август). Одновременно они могут быть заражены как взрослыми
особями, так и личинками гельминта. Особенно опасна болезнь
для мальков, сеголеток и двухлеток радужной и ручьевой форели в
прудовых хозяйствах. В бассейнах Амура зараженность щук со-
ставляет 50—100 гельминтов при высокой экстенсивности инва-
зии. В зимний период рыбы (морские) почти не заражаются.
Патогенез и симптомы болезни. Взрослые гельминты травмиру-
ют слизистую оболочку кишечника, возникают кровоизлияния и
отеки. Нередко гельминты закупоривают просвет кишечника.
Плероцеркоиды на печени способствуют образованию цист с кап-
сулой из соединительной ткани светло-серого цвета. Цисты, срос-
шиеся с окружающей тканью, давят на печень, нарушая ее функ-
ции. У сиговых рыб личинки с заметной капсулой локализуются в
мышцах, вызывая деструкцию окружающей ткани.
Брюшко больных рыб вздуто, тело искривлено, жабры анемич-
ны. Рыбы чаще плавают с открытым ртом на поверхности воды,
прибиваясь к берегу. Кожа и чешуя матового цвета, глаза запав-
шие.
Диагностика. Диагноз ставят по результатам комплексных ис-
следований. При вскрытии ищут цестод и признаки поражения
печени.
198
Лечение. Не разработано.
Профилактика и меры борьбы. В целях профилактики зараже-
ния форели в прудовых хозяйствах необходимо оградить пруды от
попадания в них щук, для чего устанавливают оградительные ре-
шетки. Для задержания рачков устраивают песчано-гравийные
фильтры. Выращивая щук-сеголеток, их содержат изолированно
от взрослых. При перевозках рыб с целью акклиматизации и ры-
боразведения необходимо проводить диагностические исследова-
ния.
Поскольку возбудители триенофорозов для человека и плото-
ядных животных не представляют опасности, то пораженную
рыбу, отвечающую требованиям товарной кондиции, допускают к
реализации. Некондиционную рыбу утилизируют или скармлива-
ют животным.
7.2.12. ПРОТЕОЦЕФАЛЕЗЫ ПРЕСНОВОДНЫХ РЫБ
Протеоцефалезы — заболевания, вызываемые ленточными
гельминтами класса Cestoda подотряда Proteocephalata семейства
Proteocephalidae.
Локализация — тонкий кишечник.
Распространение. У пресноводных рыб в европейской части
России, Сибири и на Дальнем Востоке распространены цестоды
15 видов. Больная рыба теряет упитанность и нередко товарную
кондицию.
Возбудители. Семейство Proteocephalidae включает 16 родов.
Особенно распространены возбудители рода Proteocephalus, пред-
ставители которого (более 60 видов) паразитируют у пресновод-
ных рыб (лососевых, окуневых, хариусовых, сиговых, карповых,
сома, щук).
Характерный признак цестод — наличие на сколексе с четырь-
мя присосками хоботка с крючками или терминальной присоски,
или железистого апикального органа.
Proteocephalus exyguus — паразит лососей и сигов — светло-се-
рого цвета, длиной от 9 до 33 мм, шириной 0,4—1,2 мм. Сколекс
округлый, с четырьмя боковыми и одной теменной присосками.
Один двухлопастный желточник занимает задний край членика.
Ствол матки расположен посредине тела и имеет четыре-пять бо-
ковых ответвлений, открывается на вентральной стороне членика
(рис. 78). Яйца диаметром 0,04—0,05 мм.
Биология развития. Протеоцефалюсы развиваются с участием
промежуточных хозяев — циклопов (родов Cyclops, Eucyclops,
Mesocyclops и др.) и дефинитивных хозяев — пресноводных рыб
(пелядь, окунь, щука, омуль, муксун, ряпушка, чир, сом, сиг, ха-
риус, корюшка).
В тонком кишечнике рыб гельминты выделяют членики и
199
Рис. 78. Биология развития Proteocephalus spp.:
I — дефинитивные хозяева (а —щука; б— омуль; в —хариус; г —ряпушка; д — сом; е —
окунь); 2 — зрелый членик цестоды; 3 — промежуточный хозяин (циклоп); 4— рыбы с плеро-
церкоидами; 5—головной конец; б—зрелый членик; 7—плероцеркоид
яйца, которые попадают в воду. Их заглатывают циклопы, в теле
которых формируются процеркоиды. Зараженных циклопов заг-
латывают рыбы, в кишечнике которых из процеркоида развивает-
ся плероцеркоид, а затем ленточный гельминт.
Эпизоотологические данные. Протеоцефалезы в основном рас-
пространены в естественных водоемах крупных сибирских рек и
озер Дальнего Востока, европейской части Российской Федера-
ции. Болезнь проявляется преимущественно в летне-осенний пе-
риод года. Болеют рыбы всех возрастных групп, но больше мо-
лодь. Экстенсивность инвазии к августу достигает 80—100 %.
В озерах Сибири нередко заражено до 100 % пеляди при высо-
кой интенсивности инвазии — до 5—7 тыс. экз.
Инвазия распространяется с больной рыбой, передвигающей-
ся в текучей воде, иногда из-за хозяйственной деятельности че-
ловека.
Патогенез и симптомы болезни. Цестоды, скапливаясь в кишеч-
нике, вызывают атрофию, нередко изъязвления, некрозы слизис-
той оболочки, закупорку кишечника, иногда полную непроходи-
мость. Больная рыба держится на поверхности воды и мелководье.
Снижается аппетит, подвижность рыбы ограничена, что приводит
к истощению. Жабры анемичны, чешуя матовая, выражено увели-
чение брюшка.
Диагностика. Диагноз ставят по данным эпизоотологии, лабо-
раторных исследований и результатов вскрытия.
Лечение. Не разработано.
Профилактика и меры борьбы. В случае обнаружения протеоце-
фалезов в прудовых хозяйствах запрещается перевозка рыб в дру-
гие хозяйства.
Протеоцефалюсы не опасны для человека и животных. Если
рыба отвечает требованиям ветеринарно-санитарной экспертизы,
она направляется в пищу людям без ограничения. При обнаруже-
нии в кишечнике рыб цестод внутренности удаляют, а тушку ис-
пользуют в пищу.
Лабораторная работа
Задания. Изучить морфологические признаки имагинальных и
ларвальных стадий ленточных червей плотоядных, жвачных, гусей
и рыб. Провести исследование проб фекалий овец, гусей, рыб по
методам гельминтоскопии и Фюллеборна. Ознакомиться с проме-
жуточными хозяевами мониезий и дрепанидотений — орибатид-
ными клещами и низшими ракообразными. Исследовать головной
мозг овец и мышцы крупного рогатого скота на наличие личинок
цестод.
Оборудование, материалы и объекты исследования: микроскопы; эмалирован-
ные тазики; стаканчики; стеклянные банки; пипетки; предметные и покровные
стекла; препаровальные иглы; пинцеты; ножницы прямые; пробы фекалий ягнят
201
и гусят; тотальные препараты мониезий, дрепанидотений; орибатидные клещи и
низшие ракообразные; головной мозг овцы и мышечная ткань крупного рогатого
скота; рыбы, зараженные кавиями, ботриоцефалюсами, лигулами.
Место занятий: лаборатория кафедры паразитологии и инвази-
онных болезней сельскохозяйственных животных.
Методика проведения занятия. До начала занятия в лабораторию
доставляют пробы фекалий овец и гусей, головной мозг овцы и
мышцы жвачных, пораженные личинками цестод. В начале заня-
тия преподаватель кратко знакомит учащихся с наиболее харак-
терными признаками строения паразита имагинальной и ларваль-
ной стадий, промежуточных хозяев мониезий и дрепанидотений.
Студенты рассматривают под микроскопом и визуально имаги-
нальные и ларвальные стадии ленточных червей плотоядных,
жвачных, птиц и рыб (сколексы, гермафродитные и зрелые Члени-
ки, яйца), а также промежуточных хозяев (беспозвоночных). Раз-
ные виды цестод собак и пушных зверей дифференцируют: 1) по
длине стробилы: большая (2—5 м) — у тении гидатигенной, сред-
няя (40—80 см) — у мультицепса и маленькая (3—4 мм) — у эхи-
нококкуса и альвеококкуса; 2) по строению матки в зрелых чле-
никах: около 10 ветвей — у тении, свыше 20 ветвей — у мульти-
цепса, мешковидная — у эхинококкуса и шаровидная — у альвео-
коккуса.
Длина ботриоцефалюса 15—25 мм, сколекс снабжен двумя бот-
риями. У кариофиллид головной конец веерообразно расширен,
на заднем конце тела расположен яичник Н-образной формы.
Плероцеркоиды ремнецов сероватого или желтоватого цвета, дли-
ной от 5 до 120 см, шириной 0,5—1,7 мм. Сколекс имеет две
ямки — щелевидные ботрии.
Указанных выше цестод в ларвальных стадиях различают: 1) по
локализации: ценурусы паразитируют в спинном мозге; тонко-
шейные цистицеркусы — на сальнике и брыжейке; эхинококкусы
и альвеококкусы — преимущественно в глубине паренхиматозных
органов травоядных и всеядных и грызунов; 2) по величине пузы-
рей: крупные — эхинококкусы, средние — цистицеркусы (тенуи-
кольный) и ценурусы, мелкие — альвеококкусы; 3) По толщине
оболочек: плотные (непрозрачные) — у эхинококкусов и альвео-
коккусов, тонкие — у цистицеркусов, очень тонкие — у ценурусов;
4) по количеству сколексов внутри пузырей: очень много — у эхи-
нококкусов, много — у ценурусов и альвеококкусов, только по од-
ному — у цистицеркусов.
Мониезии жвачных имеют длинную стробилу (6—8 м), нево-
оруженный сколекс и двойной половой аппарат в гермафродит-
ных члениках. Дрепанидотения снабжена вооруженным сколек-
сом (восемь крючков), широкой стробилой (до 1,2 см), три се-
менника расположены поперек в каждом ряду гермафродитных
члеников.
В исследуемой по методу Фюллеборна взвеси фекалий живот-
202
ных можно обнаружить трех- или четырехугольные яйца моние-
зий (с грушевидным аппаратом внутри) и крупные яйца почти ок-
руглой формы дрепанидотений (светло-серые).
Промежуточные хозяева мониезий — мелкие почвенные бес-
позвоночные (орибатидные клещи); дрепанидотений, ботриоце-
фалюсов — низшие ракообразные (циклопы и диаптомусы), живу-
щие в мелких стоячих водоемах; кариофиллид — малощетинковые
черви, обитающие на дне водоемов.
В конце занятий учащиеся схематично зарисовывают яйца мо-
ниезий, дрепанидотений и других гельминтов.
Практическое занятие
Задания. Освоить технику индивидуальной дегельминтизации
собак ареколином бромисто-водородным при тениидозах и рыб
при ботриоцефалезе или кариофиллезе. Осуществить групповую
дегельминтизацию гусей фенасалом при дрепанидотениозе. Со-
ставить акты на проведение дегельминтизации собак и гусей.
Оборудование, материалы и объекты исследования: весы роговые и разновесы;
шприц, резиновая трубочка; почковидный тазик; ареколин бромисто-водород-
ный; фенасал; узкие корыта; вода; комбикорм; 2—3 собаки; 10—15 гусят; 5—10
рыб, подготовленных для дегельминтизации.
Место занятия: ветеринарная учебно-производственная клини-
ка техникума или птицеферма хозяйства.
Методика проведения занятия. На основании результатов анам-
неза и гельминтокопрологических исследований отбирают не-
сколько собак и небольшую группу гусят, подлежащих дегельмин-
тизации против цестодозов. Собакам индивидуально назначают
ареколин в дозе 0,004 г на 1 кг массы тела в кусочке мясного фар-
ша или хлебного болюса после 12-часовой голодной диеты. Мож-
но растворить ареколин в 300 мл молока и дать собаке. Собак пос-
ле назначения антигельминтика содержат на привязи и следят за
тремя актами дефекации при обязательном термическом обезвре-
живании выделившихся ленточных червей и фекалий.
Для групповой дегельминтизации гусят при дрепанидотениозе
применяют фенасал в дозе 0,3 г на 1 кг массы тела в смеси с ком-
бикормом. Гусят после дегельминтизации не выпускают на водо-
ем в течение 24 ч.
Для дегельминтизации рыб при ботриоцефалезе, кариофиллезе
применяют фенасал.
Проведенные обработки оформляют актами.
Преподаватель оценивает практическую работу каждого учаще-
гося.
Контрольные вопросы. 1. По каким признакам отличают цепней от лентецов?
2. Какими цестодозами могут заразиться сельскохозяйственные животные и чело-
век от плотоядных? 3. Какие клинические признаки наиболее характерны для це-
нуроза овец? 4. У каких животных и где встречаются цистицеркусы? 5. Какие ан-
203
тигельминтики назначают собакам при цестодозах? 6. В какой период года может
происходить массовое заражение ягнят М. expansa? 7. На каком принципе основа-
на преимагинальная дегельминтизация? 8. Как проводят химиопрофилактику мо-
ниезиоза овец? 9. Какие антигельминтики используют для группового примене-
ния при цестодозах гусей, уток и рыб? 10. Какую роль в распространении лигули-
дозов рыб играют дикие птицы? 11. Какие средства используют при ботриоцефа-
лезе и кавиозе рыб? 12. Какие виды рыб и в каком возрасте болеют кавиозом и
кариофиллезом? 13. В каком виде паразитируют личинки триенофорусов на пече-
ни рыб? 14. Какие особенности строения сколекса у лентецов, в том числе у про-
теоцефалюса?
8. АКАНТОЦЕФАЛЕЗЫ
Акантоцефалезы — заболевания, возбудителями которых явля-
ются скребни (акантоцефалы), или колючеголовые. Скребни —
паразиты многих видов домашних и промысловых млекопитаю-
щих, некоторых птиц, рыб и человека. Распространены в основ-
ном среди морских и частично пресноводных рыб.
Систематика и краткая характеристика скребней. Тип
Acanthocephales с одним классом Acanthocephala включает более
500 видов гельминтов. В классе шесть отрядов, из которых в пара-
зитологии наибольшее значение имеют три: Oligacanthorhynchida,
Giganthorhynchida и Polymorphida.
Тегумент акантоцефалов является пограничной тканью, орга-
низованной в виде симпластов. Он состоит из гликокаликса, по-
кровного комплекса и пяти слоев: поперечнополосатого, везику-
лярного, войлочно-волокнистого, радиально-волокнистого и тру-
бочкового.
Форма тела скребней веретенообразная, овальная, цилиндри-
ческая. Длина колеблется от нескольких миллиметров до десятков
сантиметров. Паразиты обычно белого, серо-белого, желтоватого
или оранжевого цвета, что зависит от субстрата, всасываемого из
кишечника хозяина. Тело имеет два отдела, разделенных перего-
родкой. Передний отдел — просома включает втягиваемый в тело
хоботок цилиндрической, яйцевидной, шаровидной или конусо-
видной формы. Хоботок вооружен хитиновыми крючками, При
помощи которых гельминт прикрепляется к стенке кишечника
(рис. 79).
Нервная система состоит из нервного узла, расположенного у
хоботка, и продольно отходящих от него стволов. Выделительная
система протонефридиального типа, у некоторых особей она от-
сутствует. Скребни — раздельнополые гельминты. Самцы имеют
два семенника с выводными протоками, цементные железы, поло-
вую бурсу и совокупительный орган (пенис). Цементные железы
удлиненные, их число бывает разным (3, 4, 6 и 8). Они выделяют
клейкий секрет, закупоривающий половое отверстие самки после
оплодотворения.
Половая система молодых самок состоит из двух яичников, ма-
204
Рис. 79. Общий вид скребней:
1 — Carynosoma strumosum; 2 — Apororhynchus hemignati; 3 — Moniliformis moniliformis, самец;
4— Corynosoma semerme, самец; 5— Arhythomrhynchus frassoni, самка; 6— Prostorhynchus
spiralis; 7—Acanthocephalus lutzi, самка; 8 — Empodius taeniatus, самец; 9 — Polymorphic pupa;
10— Pseudoechinorhynchus cintulus, самец (из книги P. С. Шульца и Е. В. Гвоздева)
точного колокола, матки, вагины с наружным половым отверсти-
ем. По мере созревания самок яичники распадаются на яйцевид-
ные клетки, свободно плавающие в полости тела. После их опло-
дотворения происходит формирование и созревание яиц. Наружу
яйца выходят через особый мышечный орган — маточный коло-
кол. Он соединен с маткой, переходящей в вагину. Вагина откры-
вается женским половым отверстием в задней части тела.
Яйца при выходе наружу инвазионны, содержат эмбриональ-
ную личинку — акантор.
8.1. МАКРАКАНТОРИНХОЗ СВИНЕЙ
Макраканторинхоз — заболевание свиней, вызываемое скреб-
нями семейства Oligacanthorhynchida.
Локализация — тонкая кишка.
Распространение. Болезнь регистрируют в виде очагов в райо-
нах Белоруссии, Украины, Приморского края, Грузии, Средней
Азии и Казахстана. Экстенсивность инвазии поголовья в возрасте
6—8 мес и старше иногда достигает 86—100 %.
У больных снижается прирост массы, они отстают в росте и
развитии. Часть интенсивно зараженных животных погибает — до
30%.
Возбудитель. Скребень-великан Macracanthorhynchus hirudina-
ceus молочно-белого или розового цвета, тело его несколько
сплющено в дорсовентральном направлении, спереди утолщено,
сзади сужено. Длина самцов 7—15 см, самок 65—68 см. Булавовид-
ный хоботок снабжен 36 крючками, расположенными в 12 про-
дольных рядах.
Яйца овальные, покрыты толстой темно-коричневой оболоч-
кой с вдавлениями, размером (0,08—0,1) х (0,05—0,056) мм. При
выходе наружу содержат сформированный зародыш — акантор.
Биология развития. Скребень-великан — биогельминт. Дефини-
тивные хозяева — свинья, кабан, гривистая свинья. Самка парази-
та в кишечнике хозяина ежесуточно выделяет рекордное число
яиц — 500 000, которые выходят наружу с фекалиями. Яйца поеда-
ют промежуточные хозяева — личинки майских жуков, бронзовок,
жужелиц, жуков-носорогов, навозников. В кишечнике личинок
жуков из яйца скребня выходит эмбриональная личинка — акан-
тор, которая развивается до инвазионной стадии — акантеллы.
Акантеллы белого цвета, длиной 3,6—4,4 мм, шириной 1,5—
1,8 мм. Если личинки жуков заражаются до конца июня, то акан-
теллы развиваются за 3,5—4 мес; если же заражение произошло в
июле и позже, — 12—13 мес. Акантеллы в теле промежуточного
хозяина могут жить до 3 лет, находясь во всех фазах развития: ли-
чинка, куколка и взрослая особь.
Свиньи и другие животные заражаются при поедании жуков и
206
Рис. 80. Биология развития М. hirudinace us (скребия-
великаиа):
1 — хоботок скребня; 2—яйцо; 3— акантор; 4 — преакантелла; 5—
акантелла; 6— жук-носорог; 7— личинка жука; 8 — майский жук;
9— акантелла в теле жука-носорога
их личинок, инвазированных акантеллами. В кишечнике свиньи
последние освобождаются от цисты, внедряются хоботком в тол-
щу слизистой оболочки и через 2,5—4 мес вырастают в половозре-
лых самцов и самок. Продолжительность жизни скребней около
23 мес (рис. 80).
Эпизоотологические данные. Возбудителем макроканторинхоза
заражаются не только свиньи, но и бурундуки, белки, американс-
кий водяной крот. Случайно могут заразиться собаки, гиены, он-
207
датры, коровы и реже — обезьяны и человек. Болеют чаще всего
взрослые животные. Свинья и кабаны инвазируются в теплое время
года близ свинарников и лесных массивов, где чаще обитают жуки
и их личинки. Этому способствуют антисанитарные условия содер-
жания и кормления животных (отсутствие уборки навоза и его
обезвреживания, бессистемное использование пастбищ и т. д.).
Экстенсивность инвазии в отдельных хозяйствах Белоруссии,
Приморского края и др. может достигать 80—100 %. В отдельные
сезоны года в Узбекистане заражено 38—61,6 % кабанов при ин-
тенсивности инвазии от 1 до 17 экз. Экстенсивность заражения
промежуточных хозяев, особенно майских жуков и жуков-носоро-
гов, достигает 60—100% при высокой интенсивности (1—
200 экз.).
Яйца скребня-великана устойчивы и могут сохраняться во
внешней среде более 3 лет.
Патогенез и симптомы болезни. Паразиты, внедряясь своим
мощным хоботком в толщу стенки кишечника, вызывают энтери-
ты, нередко и перитониты. При нарушении целостности сосудов
возникают кровотечения в полость кишечника. В поврежденные
ткани проникают микроорганизмы и возникают гнойные воспа-
ления и абсцессы. При высокой интенсивности заражения (50 экз.
и более) симптомы болезни проявляются через 3—5 сут после на-
чала инвазии, но явные клинические признаки (исхудание, отста-
вание в росте и развитии, бледность слизистых оболочек и кожи,
ухудшение аппетита, расстройство пищеварения, подергивание
мышц, ползание на животе и др.) проявляются через 1,5—2 мес.
При прободении стенки кишечника температура тела повышается
до 41 °C. При низкой интенсивности заражения (1—15 экз.) бо-
лезнь протекает субклинически.
Диагноз. Исследуют фекалии методом последовательных смы-
вов или по Щербовичу, используя растворы натрия гипосульфита
(1750 г на 1л воды). Посмертно диагноз ставят путем вскрытия
кишечника. Павшие животные истощены, слизистая оболочка ки-
шечника катарально воспалена, местами изъязвлена, некротизи-
рована.
Лечение. Антискребнин назначают в форме гранул в
дозе 0,8 г на 1 кг массы тела. Свиньям массой до 30 кг антискреб-
нин дают в виде суспензии по 7,5 мл, при массе от 30 до 45 кг — по
15 и более 45 кг — по 27,5 мл. Перед дачей препарата свиней вы-
держивают на голодной диете 8—12 ч. Препарат лучше давать в ут-
реннее кормление 4 дня подряд.
Фенбендазол дают в дозе 20 мг на 1 кг массы тела в ут-
реннее кормление 4 дня подряд.
Профилактика и меры борьбы. С целью профилактики свиней
дегельминтизируют не менее 3 раз в год: первый раз перед выго-
ном на неблагополучные пастбища, второй —через 10—15 сут
после первой обработки и третий раз — в январе.
208
В целях профилактики инвазии свиней переводят на стойловое
содержание, обязательно оборудуют навозохранилища для био-
термической обработки навоза в течение не менее 6 мес. Молод-
няк выпасают на благополучных выпасах. Свиней дегельминтизи-
руют фенбендазолом первый раз перед выгоном на пастбище и
выгул, второй —через 10 сут после первой обработки, третий
раз — при постановке на стойловое содержание.
8.2. ПОЛИМОРФОЗ УТОК
Полиморфоз уток вызывают скребни семейства Polymorphidae.
Локализация — тонкая и толстая кишки.
Распространение. Инвазия встречается в Северном Казахстане,
Западной Сибири, средней полосе европейской части РФ и в не-
которых других регионах
страны. Ущерб складыва-
ется из потери прироста
массы и падежа утят.
Возбудители. Polymor-
phus magnus в 75 % случаев
паразитирует в тонкой
кишке и Р. minutus в 80 %
случаев — в толстой киш-
ке. Тело паразитов верете-
нообразной формы, дли-
ной 9,2—14,7 мм, при жиз-
ни желтое или оранжевое.
Хоботок вооружен крюч-
ками, расположенными в
16 продольных рядах, в
каждом ряду по семь-во-
семь крючьев. У самцов
четыре цементные железы
кишкообразной формы
(рис. 81).
Яйца веретенообразные,
размером (0,12—0,13) х
х (0,01—0,02) мм, покрыты
толстой оболочкой, содер-
жат зародыш с тремя тол-
стыми оболочками, в сред-
ней из которых на полюсах
есть выпячивания.
Биология развития. Де-
финитивные хозяева поли-
морфусов — утки. В их ки-
шечнике самки гельмин-
Рис. 81. Морфология Polymorphus magnus:
1 — самец; 2 — самка; 3 — яйцо (по Петраченко)
0.2мп
Г~.... 1
209
тов откладывают яйца, которые с фекалиями выбрасываются на-
ружу. Яйца в водоемах заглатываются рачками-бокоплавами (гам-
марус). В теле беспозвоночных за 54—60 сут личинки развиваются
в преакантеллы, а затем в акантеллы. Утки заражаются при поеда-
нии инвазированных гаммарусов и резервуарных хозяев полимор-
фусов — рыб восьми видов. Рыбы заражаются, заглатывая гамма-
русов с акантеллами.
В кишечнике уток за 27—30 сут из акантелл вырастает половоз-
релый скребень.
Эпизоотологические данные. Источник распространения инва-
зии — больные домашние и дикие утки. Экстенсивность инвазии в
отдельных хозяйствах достигает 70 % при высокой интенсивности
заражения (640 экз.). Источник заражения — рачки, живущие око-
ло 2 лет, и следовательно, инвазия сохраняется довольно долго.
Для сезонной динамики болезни характерна закономерность: на-
чало заражения — весна, пик —лето, снижение — осень, макси-
мальное освобождение от инвазии — зима.
Патогенез и симптомы болезни. На слизистой оболочке кишеч-
ника, куда прикрепляются полиморфусы, наблюдаются кровоиз-
лияния и значительные изъязвления. При глубоком проникнове-
нии хоботка хорошо заметны узелки со стороны серозной оболоч-
ки. Травмы способствуют проникновению микроорганизмов в
глубоколежащие органы и ткани.
У больных уток нарушаются пищеварение и функции органов
других систем. Это сопровождается поносами, исхуданием, отста-
ванием в росте и развитии.
Диагностика. При жизни диагноз ставят путем исследования
фекалий методом Фюллеборна. Посмертно болезнь диагностиру-
ют на вскрытии.
В неблагополучных хозяйствах следует заранее изучить гель-
минтологическое состояние водоемов путем компрессорного ис-
следования гаммарусов. Акантеллы в теле рачков-бокоплавов ло-
кализуются в спинной части и хорошо заметны по оранжевой ок-
раске и значительной величине.
Лечение, профилактика и меры борьбы при полиморфозе в ос-
новном такие же, как и при филиколлезе (см. Филиколлез). Кро-
ме того, при полиморфозе применяют филиксан в дозе 0,5 г
на 1 кг массы тела с кормом 3 дня подряд в утреннее кормление.
Битионол дают в дозе 0,5 г на 1 кг массы тела с кормом в со-
отношении 1 : 50 после 12-часовой голодной диеты.
8.3. ФИЛИКОЛЛЕЗ УТОК
Заболевание вызывают скребни семейства Filicollidae.
Локализация — тонкая кишка.
Распространение. Филиколлез распространен во многих зонах
страны. Ущерб складывается из потери прироста, отставания в ро-
210
сте и развитии, особенно молодняка. Нередко отмечают падеж
утят.
Возбудитель. Скребни Filicollis anatis желтовато-белого цвета,
спереди и сзади несколько суживающиеся. Самка длиной 10—
25 см, шириной 4 мм, самцы 6—8 и 1,4 мм соответственно. У сам-
ки тонкая шейка переходит в довольно большой шарообразный
хоботок, у самца она значительно меньше, а хоботок овальный
или грушевидный. Расположение крючков у самца и самки одина-
ковое. Передняя часть хоботка усажена крючками, расположен-
ными звездообразно в 18 продольных рядов, по 10—11 (у самцов
16) крючков в ряду. У самца в передней части тела находятся ши-
пики, в средней —два семенника, за ними — шесть цементных
желез. Яйца овальные, размером (0,06—0,07) х (0,02—0,03) мм, с
толстой оболочкой, внутри содержат личинку — акантор.
Биология развития. Дефинитивные хозяева скребня — утки,
гуси, лебеди и другие водоплавающие птицы, промежуточный хо-
зяин — водяной ослик (Asellus aquaticus). Яйца, выделенные дефи-
нитивными хозяевами, заглатывают водяные ослики, в теле кото-
рых за 1—1,5 мес вырастают инвазионные личинки. Птицы инва-
зируются при поедании промежуточных хозяев гельминта, зара-
женных акантеллами скребня. В кишечнике уток филиколлисы
достигают половой зрелости через 30 сут (рис. 82).
Эпизоотологические данные. Филиколлезом тяжело болеет 2-3-
месячный молодняк уток. Источник заражения — водяные осли-
ки, которые живут более 1 года, что соответствует и продолжи-
тельности жизни личинок паразита. Эпизоотии инвазии регистри-
руют преимущественно во второй половине лета и осенью, но к
зиме птица в основном освобождается от гельминтов.
Патогенез и симптомы болезни. Похожи на таковые при поли-
морфозе уток.
Диагностика. Для обнаружения яиц гельминта исследуют фека-
лии методом последовательных смывов или флотации с использо-
ванием насыщенного раствора аммиачной селитры. При гельмин-
тологическом вскрытии тонкого кишечника птиц обнаруживают
самих гельминтов. Целесообразно исследовать и водяных осликов
компрессорным методом. Акантеллы филиколлиса белого цвета,
овальной формы, длиной до 0,9 мм.
Лечение. Для дегельминтизации при филиколлезе и полимор-
фозе назначают четыреххлористый углерод инди-
видуально в дозе 2 мл на 1 кг массы тела путем инъекции в зоб или
введением через пищеводный зонд.
Профилактика и меры борьбы. Для профилактики полиморфоза
и филиколлеза для уток выделяют благополучные водоемы. Благо-
получие водоемов определяют систематически путем исследова-
ния промежуточных хозяев полиморфусов и филиколлисов. При
этом маточное поголовье уток и гусей на водоемах содержат от-
дельно от молодняка. Неблагополучные водоемы обезвреживают,
211
Рис. 82. Биология развития F. anatis:
7 — передний конец тела самца; 2 — бульбовидный хоботок самки; 3 —
яйцо; 4— акантор; 5—преакантелла; 6— акантелла; 7—рачок (водя-
ной ослик); 8— акантелла в теле рачка
прекращая выгул птиц в течение 2 лет. В случае выявления той
или иной инвазии проводят вынужденную дегельминтизацию.
После дегельминтизации уток не выпускают на водоем в течение
суток.
8.4. НЕОЭХИНОРИНХОЗ РЫБ
Неоэхиноринхоз — заболевание многих ценных рыб, вызывае-
мое скребнем семейства Neoechinorhynchidae.
Локализация — тонкий кишечник рыб.
Возбудитель. Скребень Neoechinorhynchus rutili веретенообраз-
ной формы, слегка изогнут на брюшную сторону. Хоботок ма-
ленький, округлой формы, с тремя рядами крючков по шесть в
212
Рис. 83. Морфология N. rutili:
о —самец; б—самка; в —хоботок
каждом ряду. Длина тела самца около 6 мм, самки 10 мм. Яйца
овальные, с тремя оболочками (рис. 83).
Биология развития. Гельминты в кишечнике рыб (ручьевая и
радужная форель, усач, маринка, осман, налим, окунь, хариус,
сиг, карп и др.) откладывают яйца, которые выделяются с фекали-
ями в воду. Яйца заглатывают промежуточные хозяева — ракушко-
вые рачки рода Ostracoda, вислокрылки Sialis niger, аннелиды
Nephelis octaculata. В теле промежуточных хозяев формируются
инвазионные личинки — акантеллы. Заражение рыб происходит
при поедании ими промежуточных хозяев, инвазированных акан-
теллами. В кишечнике рыбы беспозвоночные перевариваются, а
акантеллы прикрепляются к стенке кишечника и примерно за
25—30 сут вырастают до половозрелой стадии.
Эпизоотологические данные. Как правило, заболевание в виде
эпизоотии встречается редко, но экстенсивность инвазии в от-
дельных хозяевах нередко достигает 60—70 % при высокой интен-
сивности зараженности — до 320 колючеголовых червей.
Источник распространения болез-
ни — больные рыбы, а источник зара-
жения — инвазированные промежу-
точные хозяева.
Яйца скребней в воде могут сохра-
няться и быть источником заражения
промежуточных хозяев до 5—6 мес.
Интенсивное заражение рыб начина-
ется к концу весны, пик инвазии реги-
стрируют в июне и июле. К осени как
экстенсивность, так и интенсивность
инвазии снижаются.
Патогенез и симптомы болезни.
Скребни достаточно мощным хоботком
внедряются в глубь слизистой оболочки
кишечника, повреждая окружающую
ткань. В места повреждений внедряют-
ся микроорганизмы, обусловливая
воспаление. На этой почве нарушается
процесс экскреции, секреции фермен-
тов и, следовательно, пищеварения.
Больная рыба худеет, отстает в росте и
развитии и нередко гибнет. При
вскрытии на слизистой кишечника об-
наруживают кровоизлияния и гемор-
рагическое воспаление, в местах при-
крепления гельминтов — бугорки. В
целом слизистая оболочка кишечника
гипертрофирована, и кишечник при-
обретает узловатую форму.
213
Диагностика. Диагноз ставят путем комплексных исследований,
но окончательное заключение делают при вскрытии и обнаруже-
нии гельминтов.
Лечение. Не разработано.
Профилактика и меры борьбы. Рекомендуют строго следить за
ветеринарно-санитарным состоянием неблагополучных по забо-
леванию хозяйств. Завоз больной рыбы в благополучные хозяй-
ства запрещен. При перевозке рыбу обязательно предварительно
исследуют.
8.5. ПОМФОРИНХОЗ ХИЩНЫХ РЫБ
Помфоринхоз — заболевание многих хищных рыб, вызываемое
скребнем семейства Pomphorhynchidae.
Локализация — тонкий кишечник рыб.
Возбудитель. Тело Pomphorhynchus laevis почти цилиндричес-
кой формы, с длинной шейкой и цилиндрическим хоботком, на
котором продольно расположены 18 рядов крючков по 12 в каж-
дом. Самец длиной 13—16 мм, самка — 22—28 мм, шириной 1,3—
1,5 и 3 мм соответственно. Цементные железы округлые, располо-
жены тремя парами. Яйца веретенообразной формы, длиной
0,119—0,121 мм (рис. 84).
Биология развития. Яйца скребней с фекалиями рыб выбрасы-
ваются в воду, где их поедают промежуточные хозяева — рачки-
бокоплавы Gammarus pulex. В теле последних из яйца выходит ли-
чинка первой стадии — акантор, а через 2—3 нед формируется
промежуточная личинка — преакантелла. В течение 1 мес в ли-
чинке этой стадии закладываются почти все внутренние органы
будущего скребня, и примерно через 30 сут она превращается в
личинку третьей стадии — акантеллу.
Рыбы заражаются при поедании бокоплавов с акантеллой. Че-
рез 10—12 сут в организме рыб гельминт вырастает до половозре-
лой стадии. Нередко зараженных бокоплавов заглатывают мирные
рыбы — карповые. Личинки в их организме поселяются в полости
тела, в печени и инкапсулируются. Таким образом эти рыбы ста-
новятся как бы дополнительными хозяевами (что необязательно).
При поедании таких рыб заражаются (дополнительно) дефини-
тивные хозяева — хищные рыбы: усач, налим, щука, судак, окунь,
форель, язь, угорь и многие представители сиговых и хариусовых
рыб.
Эпизоотологические данные. Источники распространения инва-
зии — больные рыбы, а источники заражения — зараженные бо-
коплавы и молодые рыбы семейства карповых (в качестве допол-
нительных хозяев).
Усиленное заражение рыб происходит в весенне-летний пери-
од, пик инвазии регистрируют летом, а также в начале осени. Ин-
тенсивность заражения нередко доходит до 500—600 экз.
214
Патогенез и симптомы болезни. Патогенез идентичен с таковым
при неоэхиноринхозе. Скребни закупоривают просвет кишечника
и затрудняют прохождение пищи, иногда пронизывают стенку ки-
шечника и повреждают печень. Все это вызывает истощение рыб,
отставание в росте и развитии.
Диагностика. Диагноз ставят комплексными исследованиями,
но окончательно при обнаружении скребней во время вскрытия
рыб.
Лечение. Не разработано.
Профилактика и меры борьбы. Главное в профилактике помфо-
ринхоза рыб — недопущение завоза зараженной рыбы в благопо-
лучные водоемы. С этой целью при перевозках рыб обязательно
исследуют их на зараженность.
8.6. ЭХИНОРИНХОЗ РЫБ
Эхиноринхоз — заболевание многих видов ценных рыб, вызы-
ваемое паразитированием скребня семейства Echinorhynchidae,
класса Acanthocephala.
215
Рис. 85. Морфология Р. clavula:
а — общий вид; б — хоботок
(по Люэ)
Локализация — задний отдел то-
щей кишки.
Распространение. Инвазия доста-
точно широко распространена в реках
и озерах европейского и азиатского
регионов нашей страны.
Экономический ущерб складыва-
ется из потери упитанности и массы
тела.
Возбудитель. Тело и хоботок
скребня Pseudoechinorhynchus clavula
цилиндрической формы. Длина сам-
ца 3,5—6,5 мм, самки 25—30 мм, ши-
рина их около 0,8—1,2 мм. На хоботке
имеется 18—20 рядов крючков по 11 —
13 в ряду. Хоботковые влагалища
мешковидной формы, с шестью це-
ментными железами, расположенны-
ми парами. Яйца удлиненно-оваль-
ной формы, размером (0,1—0,11) х
х 0,023 мм (рис. 85).
Биология развития. Развитие про-
исходит так же, как и у других скреб-
ней с участием промежуточных хозя-
ев — бокоплавов родов Gammarus,
Pontoporeia, Amphithae и дефинитив-
ных хозяев — карповых, некоторых
видов хариусовых, щук, угрей и ко-
рюшковых рыб.
Эпизоотологические данные. Заболевание встречается в есте-
ственных водных ресурсах. Летом создаются наиболее благоприят-
ные условия для развития гельминта, поэтому как экстенсивность,
так и интенсивность инвазии достигают максимума в это время.
Источник распространения инвазии — зараженные рыбы, а ис-
точник заражения — бокоплавы, инвазированные личинкой гель-
минта. В водоемах Башкирии зараженность налима достигает 91 %
при интенсивности инвазии до 600 экз.
Патогенез и симптомы болезни. Идентичны таковым при других
акантоцефалезах рыб. У рыб отмечена существенная интоксика-
ция, что, вероятно, связано с нарушением функции пищеварения.
Диагностика. Диагноз ставят на основании учета эпизоотологи-
ческих данных и результатов вскрытия больных рыб.
Лечение. Не разработано.
Профилактика и меры борьбы. Проводят те же мероприятия, что
и при помфоринхозе рыб.
216
Лабораторная работа
Задания. Изучить морфологические признаки скребней птиц и
рыб. Исследовать пробы фекалий уток по методу флотации с на-
сыщенным раствором аммиачной селитры. Ознакомиться с про-
межуточными хозяевами птичьих и рыбных скребней — бокопла-
вами и водяными осликами. Схематично зарисовать яйца поли-
морфуса, филиколлиса и эхиноринхуса или других скребней рыб.
Оборудование, материалы и объекты исследований: микроскопы; предметные и
покровные стекла; 50%-ный раствор глицерина; насыщенный раствор аммиачной
селитры; пробы фекалий уток; рисунки скребней, яиц, высших ракообразных.
Место занятия: лаборатория паразитологии и инвазионных бо-
лезней сельскохозяйственных животных.
Методика проведения занятий. После предварительного объяс-
нения преподавателя учащиеся приступают к изучению строения
полиморфуса, филиколлиса, эхиноринхуса на тотальных (посто-
янных) и временных (влажных) препаратах, обращая внимание на
величину и форму хоботка, число и форму цементных желез у
самцов. Морфологические особенности яиц паразитов учащиеся
изучают на временных (влажных) препаратах, приготовленных из
половозрелых самок акантоцефалов.
При использовании в качестве флотационной жидкости насы-
щенного раствора аммиачной селитры в фекалиях уток можно об-
наружить крупные веретенообразные яйца полиморфусов и сред-
ние овальные яйца филиколлисов.
При ознакомлении с промежуточными хозяевами скребней уча-
щиеся обращают внимание на значительный размер ракообразных
(длина 1—2 см) и наличие конечностей на брюшке. У бокоплавов
изогнутое тело сплющено с боков, а у водяного ослика — в дорсо-
вентральном направлении; у ослика есть длинные антенны.
В конце занятия учащиеся зарисовывают яйца скребней двух-
трех видов.
Контрольные вопросы. 1. По каким морфологическим признакам отличают
акантоцефалов от гельминтов других классов? 2. Какие промежуточные хозяева
участвуют в развитии скребня-великана? 3. Как дифференцировать полиморфоз
от филиколлеза уток при жизни и посмертно? 4. Какие антигельминтики приме-
няют при полиморфозе и филиколлезе уток? 5. Как предупредить заболевание
утят акантоцефалезами, если в хозяйстве нет благополучных водоемов? 6. Особен-
ности строения тела скребней у рыб. 7. Как ставят диагноз на акантоцефалезы
рыб? 8. Какие рыбы болеют акантоцефалезами?
9. НЕМАТОДОЗЫ
Нематодозы — заболевания животных и человека, вызываемые
многочисленными (свыше 500 тыс. видов) круглыми (в сечении)
гельминтами класса Nematoda типа Nemathelminthes. Значитель-
217
ная часть нематод ведет сапрофитный образ жизни в почве, морях,
пресных водоемах, питаясь органическими субстратами. Немато-
ды паразитируют у различных животных — беспозвоночных и по-
звоночных.
Систематика и краткая характеристика нематод. Из многочис-
ленных видов нематод в учебнике даны сведения о представителях
восьми подотрядов, имеющих большое ветеринарное значение:
Oxyurata, Ascaridata, Trichocephalata, Strongylata, Spirurata, Filariata,
Rhabditata, Dioctophymata. Нематоды каждого подотряда имеют
свои морфологические и биологические особенности, описанные
в соответствующих разделах.
Размеры нематод колеблются от 1 мм до 1 м и более. Так, не-
матода Placentonema giganticus (паразит кашалота) достигает 6—
8 м. Тело нематод удлиненно-веретенообразное, встречается и
шаровидно-овальное, в частности у самок тетрамересов. Тело не-
матод покрыто кутикулой, под ней эпителиальный и мышечный
слои образуют кожно-мышечный мешок. В его полости (схизо-
цели) расположены внутренние органы и содержится некоторое
количество жидкости. Кутикула в зависимости от вида может
иметь выросты или шипы, гребни, сосочки и другие образова-
ния, которые имеют большое значение для дифференциации ви-
дов нематод.
Нервная система состоит из нервного кольца, расположенного
в передней части пищевода, и стволов, отходящих от него вдоль
тела. Экскреторная система включает в себя два канала, общее от-
верстие которых открывается в передней части паразита на вент-
ральной стороне.
В отличие от трематод и цестод нематоды — разнополые гель-
минты. Половые органы у нематод трубчатые. У самок имеются
два извитых яичника, два яйцевода и одна матка или более. Мат-
ки, соединяясь, образуют одну вагину, открывающуюся на вент-
ральной поверхности тела.
Строение половых органов у самцов более сложное. Трубчатый
семенник переходит в семяпровод, открывающийся в прямую
кишку. Есть также мужские вспомогательные органы, играющие
фиксаторную и осязательную роли, одна или две спикулы, различ-
ные по величине и строению, хвостовая бурса (веретенообразная с
пальцевидными выростами), рулек, преанальная присоска, сосоч-
ки и т. д. Строение половых органов самцов имеет большое значе-
ние для дифференциальной диагностики нематод.
Пищеварительная система начинается ротовым отверстием,
имеющим различную величину, форму, количество губ и лепест-
ков, продолжается пищеводом (различного строения), переходя-
щим в кишечную трубку, которая у многих нематод заканчивается
анальным отверстием. Нематоды питаются различными субстра-
тами — содержимым кишечника, его слизистой оболочкой, кро-
вью. При этом они могут поглощать часть микроорганизмов. Роль
218
Рис. 86. Биология развития иематод-геогельминтов:
7—3 — развитие личинок и яиц во внешней среде до инвазионной (Ш) стадии
кутикулы в питании круглых гельминтов незначительна, хотя ас-
кариды способны к активному всасыванию через поверхность тела
аминокислот (аргинина, триптофана и др.).
Биология развития. В зависимости от развития нематод подраз-
деляют на гео- и биогельминтов. Большинство нематод отклады-
вает яйца. Для геогельминтов характерны три вида развития
(рис. 86):
гельминты (диктиокаулюсы и другие легочные) с фекалиями
выделяют во внешнюю среду личинки. В бронхах животных от-
кладывают яйца, затем личинка претерпевает вторую и третью
стадии развития и становится инвазионной;
гельминты (в основном кишечные стронгиляты) с фекалиями
выделяют во внешнюю среду яйца с шарами дробления. Из яиц
вылупляются личинки первой стадии, которые через несколько
дней достигают инвазионной (третьей) стадии;
гельминты (в основном аскарисы и некоторые другие) с фека-
лиями выделяют яйца с шарами дробления. В зависимости от ус-
ловий в них в разные сроки образуются личинки, которые, не по-
кидая яйца, становятся инвазионными, способными при попада-
219
нии внутрь (перорально) заразить животных. В организме хозяина
личинки завершают четвертую и пятую стадии развития и стано-
вятся половозрелыми.
В развитии многих нематод-биогельминтов участвуют проме-
жуточные хозяева, например дождевые черви у метастронгилюсов
свиньи. В теле промежуточного хозяина личинки достигают инва-
зионной стадии и могут паразитировать несколько месяцев. Жи-
вотные заражаются при поедании промежуточного хозяина, в теле
которого находится инвазионная личинка. Личинки аскарисов
свиней способны мигрировать в организме неспецифичных хозяев
(например, у человека) и могут вызвать различного рода патоло-
гии (Larva migrans — мигрирующая личинка).
9.1. ОКСИУРАТОЗЫ
У разных животных, а также у человека паразитируют немато-
ды из подотряда Oxyurata. Ротовое отверстие этих гельминтов
имеет три или шесть губ. Задний конец пищевода с шаровидным
расширением (бульбус). Половое отверстие открывается в пере-
дней части тела. Яйца асимметричные.
Гельминты локализуются в толстой кишке, и по мере созрева-
ния самки передвигаются к анусу животного, где откладывают
яйца и погибают.
У человека (особенно у детей) широко распространен энтеро-
биоз, вызываемый Enterobius vermicularis.
9.1.1. ОКСИУРОЗ ЛОШАДЕЙ
Оксиуроз вызывают нематоды семейства Oxyuridae. Болеют ло-
шади и многие другие непарнокопытные животные.
Локализация — большая ободочная и слепая кишки.
Распространение. Заболевание распространено повсеместно.
Ущерб складывается из потери продуктивности, а также затрат на
лечение и профилактику инвазии.
Болезнь. Болезнь вызывает Oxyuris equi (шилохвост). Длина
самки 15—18 см, самца 6—15 мм. Характерные признаки — шести-
гранное ротовое отверстие, пищевод с выраженным бульбусом,
хвостовой конец самки тонкий и удлиненный, головной — утол-
щенный, у самца — одна тонкая спикула. Яйца размером (0,08—
0,09) х (0,04—0,05) мм, асимметричные, серые. На одном из полю-
сов имеют подобие пробочки (рис. 87).
Биология развития. Оксиурис — геогельминт. После оплодо-
творения самцы погибают, а самки по мере созревания посте-
пенно передвигаются к прямой кишке и частично длинным хво-
стовым концом прикрепляются в преанальных складках. При досту-
пе кислорода они начинают выделять в преанальную область
220
Рис. 87. Oxyuris equi:
a — передний коней тела самки; б— яйцо; в — оксиуроз лошади: «зачес» хвоста
яйца, которые маточным сектором прикрепляются под корнем
хвоста лошади. Самки, выпадающие наружу, могут откладывать
яйца, если попадут на поверхностные слои фекалий (при доступе
кислорода). Через 2—3 сут в яйце развивается инвазионная ли-
чинка.
Животные заражаются перорально во время приема корма,
воды, облизывания стен денника и кормушек, куда часто попада-
ют яйца. В кишечнике лошади из яйца выходит личинка и через
30—45 сут становится половозрелой. Продолжительность жизни
гельминтов ограничивается длительностью их роста и развития в
организме хозяина.
Эпизоотологические данные. Оксиуроз — заболевание лошадей,
проявляющееся в основном при содержании в конюшнях. Макси-
мум инвазии приходится на вторую половину зимы и раннюю вес-
ну. Чаще всего болеют молодняк до 1 года и старые ослабленные
лошади.
221
Кроме лошадей оксиуроз отмечен у ослов, мулов, лошаков и
зебр.
Патогенез и симптомы болезни. Оксиурисы, попадая в область
ануса, механически воздействуют на слизистую оболочку прямой
кишки, вследствие чего нередко развиваются проктиты. Характер-
ный признак заболевания — зуд у корня хвоста. Лошади часто
трутся о стены и другие предметы, поэтому у корня хвоста волосы
взъерошены («зачёсы» хвоста) и в дальнейшем выпадают, появля-
ются экземы. Больные худеют, фекалии часто не сформированы и
покрыты слизью.
Диагностика. При жизни оксиуроз диагностируют с учетом ха-
рактерных симптомов болезни и исследований фекалий по методу
Фюллеборна. Нередко ограничиваются исследованием содержи-
мого поверхности перианальных складок, пленок вокруг ануса и
промежности. Для этого берут деревянную палочку или спичку,
один конец смачивают 50%-ным раствором глицерина в воде и
снимают слизь или пленку. Материал наносят на предметное
стекло с двумя-тремя каплями раствора глицерина и исследуют
под микроскопом.
Лечение. Применяют четыреххлористый углерод
в капсулах перорально или через носопищеводный зонд после 8—
10-часовой голодной диеты. Взрослым животным дают 25—40 мл
препарата, от 2 до Злет —20—25, до 2 лет — 12—20, до 12 мес —
10—12 и от 7 до 10 мес — 8—10 мл.
Пиперазин в виде солей (адипинат, фосфат и сульфат)
назначают в смеси с концентратами индивидуально и групповым
методом (на 20—25 лошадей). Рекомендуют 7—10-часовую голод-
ную диету. Доза препарата 0,1 г на 1 кг массы тела двукратно с ин-
тервалом 1 сут.
Фенотиазин дают с увлажненными концентратами одно-
кратно в дозе не более 0,1 г на 1 кг массы тела.
Фенбендазол (панакур) назначают с концентратами.
Лошадям до 4 лет гранулят дают в дозе 68 мг на 1 кг массы тела,
с 4 лет — 45 мг на 1 кг массы тела.
Из импортных антигельминтиков эффективны тетрами-
з о л —20%-ный гранулят, тиабендазол, парбендазол,
морантел тартрат. Рекомендуют верпанил плюс, в одной
части пасты которого содержится 0,1 г мебендазола и 0,459 г мет-
рифоната. Паста расфасована в пластмассовые шприцы с градуи-
ровкой по 40 г. Доза 1/9 шприца на 50 кг массы тела лошади одно-
кратно, что составляет 8 мг д. в. на 1 кг массы тела мебендазола и
40 мг на 1 кг метрифоната. Паста эффективна и против других не-
матод желудочно-кишечного канала и гастрофилюсов.
Профилактика и меры борьбы. Проводят общие ветеринарно-
санитарные мероприятия, заключающиеся в изоляции больных и
их лечении, механической очистке помещений и обработке ки-
пятком полов, инвентаря и предметов ухода за лошадьми. По ис-
222
течении 2 сут назначают диагностические исследования всего по-
головья. В случае установления неблагополучия лошадей дегель-
минтизируют 3—4 раза через каждые 1—1,5 мес.
9.1.2. ПАССАПУРОЗ КРОЛИКОВ
Заболевание вызывает нематода семейства Oxyuridae.
Локализация — ободочная и слепая кишки, а во время откладки
яиц — у выхода из прямой кишки.
Распространение. Гельминтоз распространен повсеместно с вы-
сокой экстенсивностью и интенсивностью инвазии. Ущерб скла-
дывается из потери прироста и ухудшения качества шкурок.
Возбудитель. Passalurus ambiquus — нематода с веретенообраз-
ным телом. Конец пищевода с бульбусом. На хвостовом конце
самца имеется тонкий шиловидный отросток, спикула — одна.
Хвостовой конец самки длинный и острый с заметным кольцевид-
ным утолщением кутикулы. Длина самки 8,0—12,0 мм, самца 3,0—
5,0 мм. Яйца серые, длиной 0,095—0,115 мм, шириной 0,044—
0,056 мм, асимметричные, на одном полюсе — пробковидное об-
разование (рис. 88).
Биология развития. Пассалурусы развиваются по оксиуридному
типу. Оплодотворенная самка со временем передвигается к пря-
мой кишке, где у выхода откладывает яйца, которые могут при-
крепляться к шерсти задних конечностей, вокруг ануса и частично
выходят с фекалиями наружу. Инвазионной стадии яйца достига-
ют за 24—48 ч (по М. В. Харичковой, за 7—8 сут). Кролики заража-
ются перорально, поедая инва-
зионные яйца с кормом. Личин-
ки частично внедряются в крип-
ты слепой кишки и двукратно
линяют, затем возвращаются в
полость кишечника и достигают
половой зрелости за 17—24 сут.
Продолжительность жизни не-
матод 60— 106 сут.
Эпизоотологические данные. К
инвазии восприимчивы кролики
и зайцы в любом возрасте. Одна-
ко молодые животные заражают-
ся чаще и интенсивнее, чем
взрослые. Экстенсивность инва-
зии достигает 40—90 % при высо-
кой интенсивности. Тесное со-
держание кроликов на земляном
полу и антисанитарные условия
способствуют распространению
пассалуроза. Оптимальная тем-
Рис. 88. Морфология Р. ambiquus:
1 — головной конец паразита; 2 — хвостовой
конец самца; 3 — хвостовой конец самки;
4— яйцо
223
пература для развития яиц 35—38 °C. При понижении температу-
ры до 15—16 °C и повышении ее до 40 °C и более яйца гибнут.
Патогенез и симптомы болезни. При интенсивной инвазии от-
мечают катаральные и катарально-некротические воспаления сли-
зистой оболочки кишечника. Катаральное воспаление наблюдают
в прямой кишке и анусе, нередки случаи поноса. Характерны рас-
чесы в области ануса, зуд и беспокойство. Зараженные кролики
часто трутся анусом о землю, клетку или кормушку, садятся в по-
илки.
Диагностика. Диагноз ставят по той же методике, что и при ок-
сиурозе лошадей.
Лечение. Соли пиперазина дают с кормом в дозе (на
1 кг массы тела) взрослым кроликам 1,0 г однократно или по 0,5 г
2 дня подряд, молодняку после отъема — по 0,75 г 2 дня подряд.
Фенотиазин взрослым кроликам назначают в разовой
дозе 1,0 г, молодняку — 1,5 г на 1 кг массы тела 2 дня подряд. Пре-
парат кролики получают с кормом в виде влажной мешанки или с
измельченными корнеплодами (индивидуально или групповым
методом) после 18—24-часовой голодной диеты.
Ивомек микрогран ул ированный дают с кормом в
дозе 1,5 мг д. в. на 1 кг массы тела однократно (ЭЭ = 100 %).
Левамизол назначают с кормом в дозе 1,5 г на 1 кг массы
тела однократно.
Фебантел дают внутрь в дозе 10 мг на 1 кг массы тела 1 раз
в течение 5 сут.
Фенбендазол с кормом в дозе 12,5 мг на 1 кг массы тела
1 раз в день скармливают в течение 5 сут.
Профилактика и меры борьбы. Рекомендуются ежедневная тща-
тельная уборка и обработка кипятком помещений, клеток, по-
илок. Крольчатам после отъема ежедневно в течение 50 сут дают с
кормом (групповым методом) пиперазина адипинат в дозах 0,1—
0,15 г на 1 кг массы тела.
9.1.3. ГЕТЕРАКИОЗ ПТИЦ
Гетеракиоз кур, гусей и других птиц вызывают нематоды се-
мейства Heterakidae подотряда Oxyurata.
Локализация — слепая кишка.
Возбудитель. Heterakis gallinae — возбудитель гетеракиоза кур.
На пищеводе гельминт имеет выраженный бульбус. Самец длиной
6—11 мм снабжен двумя спикулами неодинаковой величины, име-
ет преанальную присоску и половые сосочки. Самки длиной 8—
12 мм, хвостовой конец удлиненный и острый. Яйца величиной
(0,05—0,07) х (0,03—0,04) мм, с двухконтурной оболочкой, наруку
выделяются с шарами дробления.
У гусей и уток паразитирует Ganguleterakis dispar — возбудитель
гангулетеракиоза. Строение тела и яиц идентично с гетеракисами,
224
Рис. 89. Морфология Н. gallinae:
1 — головной конец; 2— хвостовой конец самца; 3 — хвостовой
конец самки; -/—самка и самец в натуральную величину; 5 —
яйцо
но отличается большими размерами (самец 10—15 мм, самка 15—
17 мм) и у самца есть две короткие спикулы одинаковой величины
(рис. 89).
Биология развития. Эти нематоды — типичные геогельминты.
Яйца, отложенные паразитами в местах локализации, с фекалия-
ми выбрасываются наружу. При благоприятных условиях через 7—
21 сут они становятся инвазионными. Птица заражается на выгу-
лах и в птичниках при склевывании таких яиц с кормом. В тощей
кишке из яиц выходят личинки и, дойдя до слепой кишки, вне-
дряются в толщу слизистой оболочки и кишечных желез. После
линьки через 5 сут личинки возвращаются в просвет кишечника,
где за 24—48 сут достигают половой зрелости. Продолжительность
жизни гельминтов около 1 года.
Гангулетеракисы развиваются до половой зрелости за 18—
25 сут.
Эпизоотологические данные. Возбудителем гетеракиоза кур мо-
гут заразиться индейки, цесарки, фазаны, реже — утки и гуси. Но-
сители инвазии — взрослые птицы. Болеет птица всех возрастов,
но наиболее тяжело инвазия протекает у молодняка в возрасте от
8 мес до 2 лет. Заболевание встречается повсеместно с высокой
интенсивностью инвазии (до 1,5 тыс. экз.).
225
Яйца весьма устойчивы к условиям внешней среды, следова-
тельно, частично могут перезимовывать. Пик инвазии отмечается
летом, а затем осенью и зимой.
Патогенез и симптомы болезни. Личинки нематод существенно
деформируют структуру кишечных желез, что приводит к наруше-
нию секреции и всасывания Целостность слизистой оболочки на-
рушается, развивается тифлит — воспаление слепых кишок, в их
сечении образуются узелки. При гетеракиозе кур в глубжележа-
щие ткани и органы проникают микроорганизмы, в том числе и
простейшие — гистомонасы. Больная птица часто выделяет нару-
жу яйца гетеракисов одновременно с гистомоносами и тем самым
служит источником двух болезней — гетеракиоза и гистомоноза.
Птица угнетена, отстает в росте и развитии, у нее ухудшается
аппетит, нарушается пищеварение, снижается яйценоскость.
Диагностика. Ставят диагноз комплексно, но чаще проводят
исследование фекалий по методу Фюллеборна. У кур и гусей не-
редко отмечают смешанную инвазию — гетеракиоз и гангулетера-
киоз + амидостомоз.
Лечение и профилактика. При гетеракиозе кур и гангулетераки-
озе гусей они примерно такие же, как и при аскаридиозе кур.
9.2. АСКАРИДАТОЗЫ
Из подотряда Ascaridata у различных животных, в том числе
птиц, паразитируют специфи-
ческие виды аскарисов. Следу-
ет отметить, что все аскарисы
имеют много общего как в
морфологии, так и в биологии
(все они геогельминты). Кроме
того, для них характерна миг-
рация личинок даже в организ-
ме неспецифических хозяев
(Larva migrans), которая вызы-
вает различного рода патоло-
гии, в том числе аллергию. Тем
не менее животные не всех ви-
дов одинаково подвержены за-
ражению аскарисами. Напри-
мер, неоаскариоз крупного ро-
гатого скота, вызываемый
Neoascaris vitilorum, встречает-
ся в нашей стране в основном
Рис. 90. Строение губ A. lunihricoides
(no Th. Hiepe, 1985):
1 — форма; 2— зубчики по краям
226
в южных районах. Болеют телята в возрасте 1 —2 мес, поэтому в
неблагополучных хозяйствах дегельминтизацию проводят с месяч-
ного возраста. С целью профилактики инвазии коров содержат от-
дельно от телят. У стельных животных отмечено внутриутробное
заражение плода.
У аскарисов всех видов ротовое отверстие с тремя губами, на
краях которых у многих из них имеются зубчики (рис. 90). Поло-
вое отверстие самки открывается в передней части тела. У самца —
две одинаковые спикулы Яйца бугристые, покрыты ячеистой или
гладкой оболочкой. Достигнув инвазионной стадии, личинка не
выходит из яйца.
Многие виды аскарисов развиваются по аскаридному, а неко-
торые — не по аскаридному типу.
9.2.1. АСКАРИОЗ СВИНЕЙ
Аскариоз — острое или хронически протекающее заболевание
свиней, вызываемое личинками или половозрелыми нематодами
семейства Ascaridae подотряда Ascaridata.
Локализация — тонкий кишечник.
Распространение. Аскариоз распространен во многих странах
мира. В основном болеет молодняк. Чем южнее расположен реги-
он, тем выше экстенсивность и интенсивность инвазии. Ущерб
складывается из потери прироста живой массы (до 30 %), ухудше-
ния качества мяса, падежа молодняка и перерасхода кормов.
Возбудитель. Ascaris suum — крупная веретенообразная немато-
да. Длина самцов 10—25 см, самок — 20—40 см. Ротовое отверстие
окружено тремя выраженными губами с острыми зубчиками по
краям. У самцов есть две короткие равной величины спикулы.
Яйца овальные, размером (0,06—0,08) х (0,04—0,05) мм, с толстой
бугристой оболочкой, коричневые Наружу яйца выделяются с
шарами дробления (рис. 91).
Биология развития. Аскарисы — геогельминт, развивается в
организме хозяина со сложной миграцией по аскаридному типу.
Половозрелые самки продуцируют ежесуточно до 200 тыс. яиц,
которые с фекалиями выбрасываются наружу. При температуре
24—26 °C и наличии влаги за 21—28 сут в яйце развивается личин-
ка до инвазионной стадии.
Свиньи заражаются при заглатывании инвазионных яиц с кор-
мом или водой. В кишечнике из яиц выходят личинки и внедря-
ются в кровеносные сосуды. По воротной вене они попадают в
печень, а через полую вену — в правое предсердие. Оттуда личин-
ки переносятся в легкие, мельчайшие капилляры, альвеолы, а за-
тем в бронхиолы, бронхи, со слизью попадают в ротовую полость
и снова заглатываются. Попав в кишечник, вырастают до половоз-
релых гельминтов за 1,5—2,5 мес. Продолжительность жизни не-
матоды в среднем равна 4—10 мес.
227
Рис. 91. Ascaris suuni (по Скрябину):
а — нематода: 1 — самец; 2 — самка; б—
яйцо
Эпизоотологические данные.
Взрослые свиньи болеют суб-
клинически и служат носите-
лями и источниками распрост-
ранения инвазии. Наиболее тя-
жело болеет молодняк в возра-
сте 2—6 мес (рис. 92). Поросята
в основном заражаются в под-
сосный период от загрязненно-
го яйцами аскарисов вымени
матки.
Дождевые черви — резервуа-
ры, так как в их организме скап-
ливается большое количество
личинок аскарисов, вышедших
из проглоченных яиц. Яйца ас-
карисов устойчивы к воздей-
ствию внешней среды и могут
сохранять жизнеспособность бо-
лее 2 лет (яйца аскариса челове-
ка— до 6лет). Антисанитарные
условия в свинарниках и загонах
способствуют широкому рас-
пространению инвазии. Боль-
шое значение имеют зональные
особенности. Так, на юге таеж-
ной зоны летом экстенсивность инвазии составляет 10 %, в зоне
смешанных лесов — 14, в зоне степей — 26, в субтропиках Закав-
казья — 36 %.
Патогенез и симптомы бозезни. Развитие болезни при аскариозе
свиней тесно связано с биологией паразита. Личинки во время
миграции по схеме кишечник — печень — сердце — легкие — ки-
шечник сильно травмируют органы и ткани, обусловливая воспа-
лительные процессы. Кроме того, они линяют и частично погиба-
ют, выделяя продукты метаболизма. Все это служит источником
мощного антигенного фактора, и у животных развивается аллер-
гия. При хроническом аскариозе нарушается функция пищевари-
тельного канала, возникает дисбактериоз.
В зависимости от стадии развития паразита различают острый
(миграционный) и хронический (кишечный) аскариоз. При ост-
ром аскариозе наблюдают признаки аллергии и бронхопневмо-
нии, нервные расстройства (судороги), слюнотечение, дрожь от-
дельных мышц, нарушение координации, сначала сухой, затем
влажный кашель, учащенное поверхностное дыхание. Иногда по-
вышается температура тела. Часто больные поросята гибнут. При
хронической инвазии снижается аппетит, нарушается пищеваре-
ние, животное худеет.
228
Диагностика. Диагноз ставят комплексно с учетом течения бо-
лезни. Для окончательной диагностики острого аскариоза разре-
зают в теплой воде легкие убитого или павшего животного на мел-
кие кусочки и исследуют по методу Бермана. Обнаруживают ли-
чинок аскариса. Характерный признак болезни в этот период —
наличие белых пятен на печени (белопятнистая печень), которые
образуются в результате аллергической реакции организма.
Хронический аскариоз диагностируют путем исследования фе-
калий по методу Фюллеборна. При вскрытии обнаруживают гель-
минтов и катаральное воспаление слизистой оболочки тонкого
кишечника. С целью обнаружения гельминтов можно пользовать-
ся и методом диагностической дегельминтизации.
Лечение. Применяют препараты пиперазина, нилверм, фенбен-
дазол (панакур), фебантел (ринтал) и др.
Препараты пиперазина поросятам до 4-месячного возра-
ста дают в разовой дозе 0,3 г на 1 кг массы тела в смеси с кормом,
без голодной диеты. Свиньям живой массой 50 кг и более препа-
рат дают 2 раза — утром и вечером по 15 г на животное. В день де-
гельминтизации количество корма уменьшают в 2 раза, поение не
ограничивают. Слабых поросят отделяют и дегельминтизируют
группами по 20—30 животных.
Рис. 92. Печень поросенка, пораженная аскарисами
229
Н и л в е р м применяют в дозе 7 мг на I кг массы тела 2 раза в
течение 2 сут подряд. Дают его в смеси с кормом утром.
Фенбендазол назначают с кормом в дозе 15 мг д. в. на
1 кг массы тела двукратно — утром и вечером.
Фебантел (ринтал) в форме 10%-ного гранулята вводят
через рот в дозе 5 мг д. в. на 1 кг массы тела 2 дня подряд.
И в о м е к в форме 1 %-ного раствора вводят подкожно одно-
кратно из расчета 1 мл раствора на 33 кг массы тела.
Для преимагинальной дегельминтизации молодняку свиней с
12- до 60-суточного возраста применяют тетра м изо л, н и л -
вер м, фенбендазол и фебантел в дозе 2 мг на 1 кг
массы тела с кормом еженедельно (1 раз в 7 сут).
У н и в е р м (0,2%-ная лекарственная форма аверсектина С)
дают с кормом в дозе 50 мг на 1 кг массы тела 2 раза с интервалом
24 ч.
Для нормализации микрофлоры пищеварительного канала сле-
дует применять пробиотики. Хороший результат получен при на-
значении поросятам пробиотика ветом 1.1 двукратно на 2-е и
4-е сутки после дегельминтизации в дозах по 2 млрд микробных
тел на 1 кг массы тела. Препарат скармливают с увлажненным
кормом.
Профилактика и меры борьбы. Против аскариоза проводят ме-
роприятия с учетом технологии содержания свиней, особенностей
течения болезни, климатогеографических условий. В репродук-
торных, племенных и репродукторно-откормочных хозяйствах за
месяц до опороса дегельминтизируют всех свиноматок. В неблаго-
получных хозяйствах поросят подвергают преимагинальной де-
гельминтизации с мая по декабрь: первый раз в возрасте 35—
40 сут, второй —50—55 и третий раз —90 сут; с декабря по май:
первый раз — в возрасте 50—55 сут, второй — 90 сут.
В откормочных группах проводят гельминтокопрологические
исследования. При необходимости животных дегельминтизируют.
Свинарники-маточники дезинвазируют перед каждым туром опо-
росов, свинарники для доращивания поросят и откормочники —
перед очередной загрузкой помещений. Карантинные помещения
обрабатывают после перевода животных на откорм, а откормоч-
ные сьинарники — после окончания очередного цикла откорма.
Свинарники и выгулы обрабатывают 10%-ной горячей (70—80 °C)
водной эмульсией ксилонафта (экспозиция 3 ч) и 5%-ным горя-
чим (70—80 °C) раствором гидроксида натрия или калия (экспози-
ция 6 ч).
9.2.2. ПАРАСКАРИОЗ ЛОШАДЕЙ
Параскариоз лошадей вызывает нематода семейства Ascaridae.
Локализация — тонкий кишечник (преимущественно тощая
кишка).
230
Распространение. Параска-
риоз — широко распространен-
ное во всех странах мира забо-
левание. Больные животные
отстают в росте и развитии.
Взрослые лошади теряют рабо-
тоспособность и резвость.
Возбудитель. Нематода Рага-
scaris equorum белого или со
слабым серо-коричневым от-
тенком цвета. Длина самок
18—40 см. самцов 15—28 см. У
самца хвост несколько изогнут,
с двумя равными спикулами
(рис. 93). Яйца округлые, раз-
мером 0,09x0,1 мм. С фекали-
Рис. 93. Общий гид Parascaria equorum
(уменьшено)
ями выделяются светло-серые
и темно-коричневые яйца, в которых содержатся зародышевые
клетки (рис. 94).
Биология развития. Параскарисы развиваются по аскаридному
типу. Яйца нематоды во внешней среде при 20—25 °C через 7—
12 сут достигают инвазионной стадии. Лошади заражаются при
заглатывании инвазионных яиц с кормом или водой. Личинки
после гемато-пульмональной миграции за 1,5—2,5 мес вырастают
в тонкой кишке до половозрелой стадии (рис. 95).
Рис. 94. Parascaris equorum
(по Капустину):
а — разрыв кишечника жеребенка
(уменьшено); б—яйцо (увеличено в
600 раз)
231
Рис. 95. Биология развития Р. equorum:
7 —хвостовой конец самки; 2—хвостовой конец самца; 3— 5— развитие личинки
в яйце; 6 — яйцо с инвазионной личинкой
Эпизоотологические данные. Преимущественно болеет молод-
няк текущего года рождения, иногда со смертельным исходом.
Взрослые животные, как правило, служат носителями инвазии.
Зараженность достигает 40—50 %. Животные заражаются факти-
чески круглый год как при стойловом содержании, так и в теплый
период года на пастбищах. Пик инвазии приходится на осенне-
зимние месяцы. Нерегулярная уборка денников, кормушек, корм-
ление животных сеном с пола способствуют широкому распрост-
ранению инвазии.
На яйца гельминтов губительно действует температура выше
232
40 °C, особенно при низкой относительной влажности (ниже
70 %). Нижний температурный предел развития яиц 10 °C.
Патогенез и симптомы болезни. Патогенное влияние на орга-
низм зараженных животных оказывают личинки в период мигра-
ции и параскарисы, находящиеся в кишечнике. Продукты метабо-
лизма и тех и других — антигены, вызывающие аллергическую ре-
акцию у хозяина. Кроме того, в период миграции личинки трав-
мируют слизистую оболочку кишечника, мелкие сосуды отдельных
органов. Нередко, скапливаясь в большом количестве, параскарисы
вызывают закупорку и разрыв кишечника (см. рис. 94, а).
На 9—16-е сутки с начала инвазии у животных нарушается пи-
щеварение, наблюдаются бронхопневмония, истечения из носа,
кратковременное повышение температуры тела, нервные явления,
кашель.
Хроническое течение инвазии характеризуется исхуданием
больных животных, периодическими поносами или запорами. В
крови отмечают значительные изменения, соответствующие ал-
лергическим и токсическим проявлениям заболевания.
Диагностика. Параскариоз, вызванный миграцией личинок,
можно установить лишь путем исследования кусочков легкого по
методу Бермана. В период, когда неполовозрелые параскарисы
обитают в кишечнике, рекомендуют проводить диагностическую
дегельминтизацию. Хронический параскариоз выявляют с помо-
щью гельминтокопроскопических исследований по методу Фюл-
леборна.
Лечение. Применяют соли пиперазина, фенбендазол (панакур),
фебантел (ринтал), четыреххлористый углерод, тетрамизол грану-
лят, мебендазол гранулят.
Соли пиперазина (адипинат, сульфат и фосфат) и
пиперазина гексагидрат назначают лошадям в дозе
0,05 г на 1 кг массы тела (от 8 до 25 г на животное) групповым
(10—15 лошадей) методом и индивидуально 2 дня подряд в смеси
с 1 кг концентратов (на одну лошадь) после 7—10-часовой голод-
ной диеты.
Четыреххлористый углерод лошадям вводят пос-
ле 12-часовой голодной диеты в зависимости от возраста в дозах от
8 до 40 мл на животное в капсулах или через носопищеводный
зонд. После дегельминтизации лошадей на 3 сут освобождают от
работы.
Фенбендазол (панакур) применяют 1 раз с концент-
ратами. Лошадям от 6 мес до 4 лет гранулят дают в дозе 68 мг
(15 мг д. в.) на 1 кг массы тела, старше 4 лет — 45 мг (10 мг д. в.) на
1 кг массы тела.
Фебантел (ринтал) выпускают в виде суспензии, грану-
лята, пасты и таблеток, содержащих от 0,6 до 10 % д. в. Применя-
ют через рот однократно в дозе 60 мг гранулята (6 мг д. в.) на 1 кг
массы тела.
233
Мебендазол применяют из расчета 6—8 мг чистого ве-
щества на 1 кг массы тела или 6—8 г на 100 кг массы тела в форме
мебенвета.
Тетрамизол дают в дозе 20 мг на 1 кг массы тела с кор-
мом.
Верпанил плюс применяют однократно в дозе 8 мг д. в.
мебендазола и 40 мг д. в. метрифоната на 1 кг массы тела. Препа-
рат задают на корень языка из шприца с градуированным порш-
нем из расчета одно деление поршня (1/9 шприца) на 50 кг массы
тела.
Профилактика и меры борьбы. Жеребят текущего года рождения
с целью профилактики первый раз дегельминтизируют в августе,
второй — после отъема, молодняк 1—2 лет и взрослых лошадей —
в марте—апреле и в октябре—ноябре соответственно.
При табунном содержании жеребятам 3-месячного возраста
ежемесячно скармливают по 10 г пиперазина 2 дня подряд, а с ав-
густа до конца года — по 15 г на животное (групповым методом).
Лошадей на ипподромах при необходимости дегельминтизируют
во время карантина. С целью профилактики их обрабатывают ме-
бендазолом, тетрамизолом через каждые 2—3 мес. Лошадей для
биологических предприятий дегельминтизируют в хозяйствах-по-
ставщиках перед вывозом, а затем в карантине при поступлении
на предприятие.
При стойловом содержании лошадей конюшни подвергают де-
зинвазии; табунных лошадей после обработки в течение 3—4 сут
содержат на обособленном участке, подлежащем распашке.
9.2.3. ТОКСОКАРОЗ ПЛОТОЯДНЫХ
Токсокароз плотоядных животных вызывают нематоды семей-
ства Anisakidae.
Локализация — тонкая кишка, иногда желчные ходы печени и
поджелудочная железа.
Возбудитель. Нематода Toxocara canis слабого серо-желтого
цвета. Длина самцов 5—10 см, хвостовой конец изогнут, на нем
находятся две одинаковые спикулы. Длина самок 10—18 см. На
головном конце есть кутикулярные крылья. Между пищеводом и
кишечником имеется желудочек — характерный признак этого
вида. Яйца размером 0,068—0,075 мм, округлые, темновато-серые,
с хорошо выраженной ячеистостью (рис. 96, 97).
У львов и кошек паразитируют гельминты идентичного вида —
Toxocara cati. Самцы длиной 3—6 см, имеют две неодинакового
размера спикулы. Самки длиной 4—10 см.
Биология развития. Дефинитивные хозяева токсокар — собаки,
песцы, лисицы и некоторые другие плотоядные, выделяющие на-
ружу яйца гельминтов. Нематоды развиваются по аскаридному
234
Рис. 96. Аскариды собак:
а — Т. canis; б— Т. leonina; 1 — передние
концы; 2— хвостовые концы самцов
типу (см. Аскариоз свиней). Жи-
вотные заражаются, поедая яйца.
При благоприятных условиях они
за 8—15 сут достигают инвазион-
ное™. В биологии данного пара-
зита прослеживаются некоторые
особенности, имеющие большое
эпизоотическое значение. Дело в
том, что на 8-й день после зараже-
ния собак часть личинок токсокар
мигрирует в печень, легкие, поч-
ки, мышцы и другие органы, хотя
они в этих местах и не развивают-
ся. При этом личинки долго со-
храняют жизнеспособность в
организме взрослых собак. Затем
при беременности сук часть личи-
нок активизируется и мигрирует
через плаценту в кровь, вызывая
внутриутробное заражение щен-
ков. Оставшиеся личинки могут
служить источником внутриутроб-
ной инвазии плодов при повтор-
ной беременности. Считают, что
этот процесс регулируют гормоны
желез внутренней секреции. У
щенков личинки токсокар обнару-
живают в легких и печени. После миграции через трахею в кишеч-
ник они за 20—21 сут достигают половой зрелости.
Эпизоотологические данные. Личинки токсокар сохраняют жиз-
неспособность в органах и тканях сук до 385 сут после заражения
и способны заразить щенков внутриутробно. Плоды заражаются
только к 42-м суткам беременности. Большое эпизоотологическое
значение в заражении плотоядных токсокарами имеет канниба-
лизм, когда инкапсулированные личинки в мышцах одних живот-
ных служат источником заражения других. Кроме того, опреде-
ленное место отводится грызунам, в мышцах которых сохраняют-
ся личинки и которых поедают многие плотоядные. Следует по-
мнить, что повсеместному распространению этой инвазии в
значительной степени способствуют высокая устойчивость яиц к
воздействию внешней среды и высокая численность собак в боль-
ших городах.
Токсокары опасны и для людей, в особенности для детей до 7—
8 лет.
Патогенез и симптомы болезни. Массовая миграция личинок в
организме взрослых собак (особенно беременных самок) и щен-
ков приводит к поражению сосудов слизистой оболочки кишеч-
235
Рис. 97. Яйца гельминтов плотоядных:
7 — Т. leonina; 2 — Т. canis; 3 — Uncinaria stenocephala; 4 — Ancylostoma caninum; 5 — Spirocerca
lupi; 6 — Thominx aerophilus; 7— Soboliphimebaturine; 8— Dioctophyme renale; 9— Physoloptera
sibirica; 10— Rictularia affinis; 11 — Capillaria mucronata; 12 — Capillaria plica; 13— Hepaticola
hepatica; 14— Trichocephala vulpis; 15— Macracanthorhynchus catulinus
ника и многих органов, в том числе и плаценты. Взрослые парази-
ты травмируют слизистую кишечника, желудка и вызывают заку-
порку кишечника, желчных ходов и поджелудочной железы. Миг-
рирующие личинки заносят в различные органы хозяина микро-
организмы, а продукты метаболизма гельминтов воздействуют ал-
лергически и токсически.
Больные щенки угнетены, у них извращается аппетит, расстра-
ивается пищеварение. Отмечается бледность слизистых оболочек,
животные худеют, нередко выражены нервные явления.
236
Личинки токсокар способны мигрировать и в организме чело-
века. Они вызывают тяжелую аллергическую реакцию, пневмо-
нию, мышечные боли, астму, поражение печени, а иногда пораже-
ние нервной системы.
Диагностика. При жизни диагноз ставят на основании эпизоо-
тологии, симптомов болезни и гельминтоовоскопии по Фюлле-
борну. Посмертно для обнаружения токсокар проводят полное
или частичное вскрытие кишечника и желчных ходов печени.
Лечение и профилактика. Применяют те же средства и меры, что
и при токсаскариозе собак и других животных.
9.2.4. ТОКСАСКАРИОЗ ПЛОТОЯДНЫХ
Токсаскариоз у многих плотоядных животных вызывает нема-
тода семейства Ascaridae.
Локализация — тонкая кишка.
Распространение. Заболевание наблюдается во многих зонах
страны. Чаще болеют взрослые плотоядные животные. Из пушных
зверей наиболее сильно заражаются песцы. Это отрицательно ска-
зывается на качестве пушнины.
Возбудитель. Нематода Toxascaris leonina серо-желтого цвета,
на головном конце имеет узкие боковые крылья (см. рис. 96,6).
Самцы длиной 4—7 см, имеют постепенно утончающийся хвост с
двумя одинаковой величины спикулами. Самки длиной 6—10 см,
вульва открывается в передней части тела. Яйца светло-серые, ок-
руглые, с толстой гладкой оболочкой, диаметром 0,075—0,085 мм
(см. рис. 97, 7).
Биология развития. Токсаскарисы развиваются прямым путем,
не по аскаридному типу. При оптимальной температуре (30 °C) и
достаточной влажности за 3—6 сут в яйце развивается инвазион-
ная личинка. Плотоядные заражаются при проглатывании инвази-
онных яиц. В кишечнике хозяина личинки выходят из яиц и вне-
дряются под слизистый слой, где происходит двукратная (вторая и
третья) линька. Спустя 21—35 сут личинки линяют четвертый раз,
но еще находятся в слизистой кишечника. Через 42 сут в просвете
кишечника появляются молодые формы нематод, а с 74-х суток
токсаскарисы начинают продуцировать яйца. Резервуарный хозя-
ин этого гельминта — мыши.
Эпизоотологические данные. Заражаются животные от 6 мес и
старше. Широкому распространению заболевания способствуют
антисанитарные условия содержания собак и песцов.
Патогенез и симптомы болезни. Патогенное влияние токсаска-
рисов и клиническое проявление болезни выражены слабее, чем
при токсокарозе. Тем не менее миграция личинок в глубокие слои
стенки кишечника вызывает значительные изменения структуры
пищеварительных желез, а взрослые гельминты травмируют сли-
зистую оболочку. Все это нарушает секрецию, переваривание
237
пищи и всасывание. В результате наступают анемия, исхудание,
иногда извращение аппетита.
Диагностика. При жизни для выявления яиц исследуют фека-
лии по Фюллеборну, посмертно проводят гельминтологическое
вскрытие кишечника для обнаружения токсаскарисов.
Лечение. Применяют соли пиперазина (адипинат, сульфат или
фосфат), нилверм, фебантел (ринтал) и др.
Н и л в е р м взрослым собакам дают в дозе 0,02 г на 1 кг массы
тела однократно с кормом, щенкам —0,01 г на 1 кг массы тела
двукратно с интервалом 24 ч в виде 1%-ного водного раствора
(1 мл на 1 кг).
Фебантел (ринтал) назначают собакам внутрь в дозе
0,01 г д. в. на 1 кг массы тела 1 раз в день 3 дня подряд с кормом
или в форме суспензии.
Препараты пиперазина скармливают в разовой дозе 0,2 г на
1 кг массы тела 3 дня подряд, индивидуально с фаршем, кашей и др.
Нафтамон песцы получают в дозе 0,2 г на 1 кг массы тела
однократно, индивидуально в смеси с 1/3 разовой нормы фарша
после 12—16-часовой голодной диеты.
Биовермин (действующее вещество — флюбендазол) —
таблетки белого цвета, растворяются в воде, широкого спектра
действия — против нематод и цестод. Его применяют внутрь с
кормом в дозе 20 мг д. в. на 1 кг массы тела (одна таблетка на 5 кг
массы тела) 1 раз в день 2 дня подряд.
Паста биовермин однородная, белого цвета с кремо-
вым оттенком. В 1 г пасты содержится 0,044 г д. в. флюбендазола.
Применяют индивидуально в дозе 22 мг д. в. на 1 кг массы тела (1г
препарата на 2 кг массы тела) 1 раз в сутки 2 дня подряд. Собакам
и кошкам пасту наносят на корень языка или дают с кормом.
Дронтал плюс для собак применяют внутрь однократно в
дозе одна таблетка на 10 кг массы тела. Дронтал для кошек дают
внутрь однократно из расчета одна таблетка на 4 кг массы тела в
плотном кубике мяса или в размягченном виде с кормом.
Профилактика и меры борьбы. В целях профилактики лисиц и
песцов содержат в клетках с сетчатым полом. Клетки и домики
ежедневно чистят. Перед посадкой беременных маток клетку об-
жигают паяльной лампой. Профилактически песцов и лисиц де-
гельминтизируют 2 раза в год: первый раз — после отсадки щенков
(июнь—июль), второй — перед гоном (в декабре). С лечебной це-
лью обработку проводят в любое время года. Щенков собак и пес-
цов дегельминтизируют соответственно в 22-25- и 70—80-днев-
ном возрасте. Беременных самок обрабатывают за месяц до щене-
ния и через месяц после него. Помещения дезинфицируют 5%-
ными горячими (70—80 °C) растворами гидроксида натрия или
калия либо карболовой кислотой из расчета 1 л на 1 м2 поверхнос-
ти с экспозицией 3 ч. С целью профилактики токсокароза собакам
не рекомендуется скармливать мясо диких плотоядных.
238
9.2.5. АСКАРИДИОЗ КУР
Аскаридиоз кур вызывает нематода семейства Ascaridae.
Локализация — тонкая кишка.
Распространение. Заболевание распространено во всех зонах
нашей страны. Ущерб складывается из того, что больные цыплята
отстают в росте и развитии, происходит падеж. У зараженных ас-
каридиями кур на 15—30 % снижается яйценоскость.
Возбудитель. Нематода Ascaridia galli желтовато-белого цвета.
Самки длиной 7—12 см, самцы — 3—7 см. У самцов развита пре-
анальная присоска с хитиновым кольцом, есть две равные тонкие
спикулы. Яйца овальные, светло-серые, с гладкой оболочкой, раз-
мером (0,07—0,09) х (0,04—0,06) мм. Наружу они выделяются в
предсегментационной стадии (рис. 98).
Биология развития. Развитие аскаридий прямое, не по аскарид-
ному типу. Яйца выделяются с пометом зараженной птицы. До
инвазионной стадии они развиваются за 7—14 сут. Куры заража-
ются, проглатывая инвазионные яйца с кормом или водой, а так-
же дождевых червей (резервуарных хозяев). Личинки в 12-перст-
ной кишке освобождаются от яйцевых оболочек и локализуются
между кишечными ворсинками. По истечении 8 сут они внедря-
ются в толщу слизистой оболочки, где в течение 7—10 сут линяют
Рис. 98. Морфология Ascaridia galli:
1 — самец и самка в натуральную величину; 2 — головной конец; 3 — хвостовой конец самки;
4 — хвостовой конец самца; 5— яйцо в разных стадиях развития
239
и развиваются, затем возвращаются в полость кишечника. Аскари-
дии достигают половой зрелости через 35—58 сут с начала зараже-
ния. Продолжительность жизни гельминта около года.
Эпизоотологические данные. В основном возбудителем аскари-
диоза заражаются и болеют цыплята и молодые (до 5—6 мес) куры.
Взрослые птицы играют роль носителей инвазии. Инвазионные
яйца в почве могут сохранять жизнеспособность в теплое время
года 6 мес и более. В сухих местах, прогреваемых солнцем, они
быстро погибают. На степень распространения инвазии суще-
ственно влияют кормление и содержание кур. Недостаток в раци-
оне витаминов А, С и D, а также кальция резко снижает устойчи-
вость цыплят к аскаридиозу. Широкому распространению инва-
зии способствуют напольное содержание молодняка в антисани-
тарных условиях и контакт со взрослой птицей.
Патогенез и симптомы болезни. Мигрирующие личинки аскари-
дий разрушают структуру ворсинок слизистой и либеркюновых
желез. Это ведет к нарушению пищеварения. В результате снижа-
ется аппетит, отмечаются длительные поносы. Цыплята отстают в
росте и развитии. Они вяло передвигаются, наблюдается блед-
ность слизистых оболочек и гребешков.
Диагностика. При жизни (в ранние сроки инвазии) можно про-
водить диагностическую дегельминтизацию 10—20 подозритель-
ных по заболеванию птиц. Когда гельминты достигли половой
зрелости, исследуют фекалии по методу Фюллеборна. Посмертно
диагноз ставят путем вскрытия птицы и обнаружения аскаридий в
тонких кишках. Миграционный аскаридиоз можно диагностиро-
вать методом компрессорных исследований соскобов со слизистой
оболочки пораженных участков кишечника.
Яйца аскаридий следует дифференцировать от идентичных яиц
гетеракисов.
Лечение. Лечебную дегельминтизацию при аскаридиозе и гете-
ракидозе кур, гангулетеракиозе гусей назначают при установле-
нии инвазии.
Препараты пиперазина (пиперазин гексагидрат
или пиперазин адипинат) курам дают в разовой дозе 0,5 г на птицу
в смеси с кормом 2 дня подряд.
Нилверм (тетрамизол) при аскаридиозе и гетераки-
дозе кур применяют утром с кормом в дозе 0,04 г д. в. на птицу
2 дня подряд. Гусям его назначают в той же дозе однократно.
Фенбендазол (панакур) дают натощак с кормом в
дозе 5 мг д. в. на птицу 2 дня подряд. При смешанной инвазии (ас-
каридиоз + гетеракиоз) дозу увеличивают вдвое. При гангулетера-
киозе гусей доза составляет 0,04 г д. в. на 1 кг массы тела. Приме-
няют групповым методом в смеси с концентрированными корма-
ми однократно в утреннее кормление.
Фебантел (ринтал) курам дают утром в дозе 5 мг д. в. на
птицу 2 дня подряд. При смешанной инвазии (аскаридиоз + гете-
ракиоз) дозу увеличивают в 2 раза.
240
Смесь пиперазина с фенотиазином дают
2 дня подряд цыплятам до 4 мес в дозах 0,5 и 0,3 г соответственно,
птице старше 4 мес — 0,5 и 0,7 г соответственно на птицу.
Смесь нилверма (тетрамизола)с фенотиазином
назначают 2 дня подряд молодняку до 4 мес в дозах 0,04 и 0,3 г д. в.
соответственно, курам старше 4 мес — 0,04 и 0,5 г д. в. соответ-
ственно. Клеточное содержание кур фактически предотвращает
заражение возбудителями аскаридиоза и гетеракиоза.
Порошок биовермин содержит 5 % флюбендазола — дей-
ствующего вещества. Применяют групповым способом в течение
7 дней курам и гусям из расчета 60 г на 100 кг корма. Кормосмесь
предварительно испытывают на небольшой группе (5—7 гол.)
птиц и при отсутствии осложнений через 2—3 дня проводят мас-
совую дегельминтизацию.
Профилактика и меры борьбы. Профилактические дегельминти-
зации проводят в зависимости от условий содержания птицы: при
напольном и напольно-выгульном содержании — через каждые
45—60 сут, при напольно-клеточном содержании — первый раз
перед посадкой в клетки, второй — через месяц после посадки.
9.3. ТРИХОЦЕФАЛЯТОЗЫ
У животных разных видов встречаются специфические виды
возбудителей подотряда Trichocephalata. Так, у мелкого и крупно-
го рогатого скота, верблюдов паразитируют виды Т. ovis,
Т. skijabini рода Trichocephalus, у собак, волков, лисиц, нутрий —
Рис. 99. Морфология Trichocephalus ovis:
1 — хвостовой конец самца со спикулой и спикулярным влагалищем у Т. ovis;
2 — то же у Т. skrjabini; 3 — яйцо
241
T. vulpis и Т. nutria, у свиней —
Т. suis, у человека — Т. trichiuris
этого же рода.
Представители подотряда
характеризуются идентичным
строением тела. У них тонкий
передний и толстый хвостовой
конец. Яйца бочкообразные,
коричневые, с пробочками на
полюсах (рис. 99). Гельминты
весьма патогенны, особенно
для молодняка овец в возрасте
8—10 мес. Пик инвазии отмеча-
ется поздно осенью и в начале
зимы. При экстенсивности ин-
вазии 60—80 % ее интенсив-
ность достигает от нескольких
паразитов до 100 и более
(рис. 100).
Молодняк овец следует де-
гельминтизировать в сентяб-
ре — октябре, а взрослых — пе-
ред постановкой на стойловое
содержание. Для обработки
применяют проминтик в дозе
0,23 г на 1 кг массы тела под-
кожно и минтик в дозе 1,25 г на
1 кг массы тела. Можно исполь-
зовать и бубулин в дозе 0,25 мл
на 1 кг массы тела путем инъек-
ции в рубец. Нилверм дают в
дозе 20 мг на 1 кг массы тела од-
нократно. Фенбендазол назна-
чают внутрь с кормом в дозе
7,5—10 мг на 1 кг массы тела од-
нократно.
9.3.1. ТРИХОЦЕФАПЕЗ СВИНЕЙ
Рис. 100. Толстая кишка овцы, пора- Трихоцефалез свинеи вызы-
женная трихоцефалюсами (по Скрябину) вают нематоды из семейства
Trichocephalidae.
Локализация — слепая киш-
ка, частично — ободочная кишка.
Распространение. Заболевание распространено повсеместно,
особенно в южных районах страны. У откормочных животных при
этом недополучают более 60 % прироста массы. Наблюдается зна-
чительный отход больных животных, нарушается иммунитет.
242
Возбудитель. Trichocephalus suis — власоглав светло-серый, дли-
ной 33—53 мм. Передний конец тонкий, хвостовой— толстый.
Половое отверстие у самок открывается на границе передней и
задней частей тела. У самца хвостовой конец закручен и имеет
одну спикулу, заключенную во влагалище, покрытое шипами
(рис. 101).
Яйца желто-коричневые, бочкообразные, с толстой оболочкой,
размером (0,05—0,06) х (0,04—0,05) мм, с пробочками на полюсах.
Выделяются наружу с зародышем в предсегментационной стадии.
Биология развития. Власоглав — геогельминт. Яйца трихоцефа-
люсов вместе с фекалиями выделяются наружу. При благоприят-
ных условиях яйца развиваются и через 21—31 сут становятся ин-
вазионными. Свиньи заражаются, заглатывая инвазионные яйца
власоглавов вместе с кормом или водой. В пищеварительном ка-
нале животного личинки освобождаются от яйцевых оболочек и
через 40—45 сут достигают половой зрелости. В организме свиней
они живут 3—4 мес.
Эпизоотологические данные. Экстенсивность инвазии животных
в некоторых неблагополучных хозяйствах достигает 80—100%
при высокой интенсивности заражения (до 3—5 тыс. экз.). В ос-
новном заражаются поросята-отъемыши и откормочники в воз-
расте 2—8 мес в свинарниках, на выгульных двориках и пастби-
щах. Это происходит, как правило, в теплое время года. Взрос-
лые свиньи заражаются реже. Яйца власоглавов в помещениях
могут быть распространены механически насекомыми, таракана-
ми, дождевыми червями или предметами ухода. Они устойчивы к
холоду, но довольно быстро погибают под лучами солнца и при
высушивании.
Патогенез и симптомы болезни. Патогенное действие власогла-
вов обусловлено внедрением личинок во время развития в под-
слизистую оболочку, проникновением в толщу стенки кишечни-
ка взрослых особей и питанием их кровью. Гельминты в местах
локализации нарушают целостность
кровеносных сосудов и секреторно-
всасывательную способность. Отме-
чают глубокий дегенеративный про-
цесс в слизистой оболочке, особенно
в эпителиальном слое. Нередко реги-
стрируют утолщение стенки кишеч-
ника при резком снижении его элас-
тичности.
У больных животных аппетит по-
нижен и извращен. Развивается об-
щая слабость, наблюдается понос,
иногда с прожилками крови. Перио-
дически возникают фибриллярные
сокращения мышц отдельных групп.
Рис. 101. Общий вид Trichocepha-
lus suis: самка и самец в иатураль-
ную величину
243
Уменьшается содержание гемоглобина и эритроцитов, увеличи-
вается количество лейкоцитов, эозинофилов и гамма-глобули-
нов, ускоряется СОЭ. В отдельных случаях на 3-и сутки после
появления признаков болезни поросята погибают.
Диагностика. При жизни диагноз ставят на основании исследо-
ваний фекалий по методу Фюллеборна в насыщенном растворе
аммиачной селитры. Можно пользоваться и методом последова-
тельных смывов. Для обнаружения трихоцефалюсов посмертно
вскрывают кишечник. При этом видно, что слизистая оболочка
отечна, утолщена, покрыта точечными кровоизлияниями. Мезен-
териальные лимфатические узлы сочные (лимфаденит).
Лечение. Для дегельминтизации применяют фенбендазол (па-
накур), фебантел (ринтал), нилверм и нафтамон.
Фенбендазол (панакур) назначают в дозе 0,033 г д. в.
на 1 кг массы тела 2 раза в день с кормом.
Фебантел (ринтал) гранулят 10%-ный применяют так
же, как и при аскариозе. Вводят через рот в дозе 5 мг д. в. на 1 кг
массы тела 2 дня подряд.
Нилверм и нафтамон рекомендуют давать одновре-
менно в смеси с кормом групповым методом 3 дня подряд в дозах
5 мг и 0,2 г соответственно на 1 кг массы тела. Таким же способом
можно применять тиабендазол (0,05 г) с нафтамоном
(0,2 г) на 1 кг массы тела.
Профилактика и меры борьбы. Общие ветеринарно-санитарные
мероприятия такие же, как и при аскариозе свиней. Помещения
дезинвазируют после перевода животных на откорм, а откормоч-
ные свинарники — после окончания очередного откорма. Полы
всех свинарников должны иметь твердое покрытие. Профилакти-
ческую дегельминтизацию проводят перед переводом свиней в ла-
геря и перед постановкой на стойловое содержание.
9.3.2. ТРИХИНЕЛЛЕЗЫ
Трихинеллезы — антропозоонозы животных, которые вызыва-
ют нематоды из подотряда Trichocephalata семейства Trichinellidae.
Локализация — личинки — в поперечнополосатых мышцах (под
сарколеммой мышечных волокон), взрослые особи — в тонкой
кишке (в полости и подслизистой оболочке — в просвете либер-
кюновых желез).
Распространение. Чрезвычайно распространенная инвазия во
всех странах мира. Восприимчивы животные более 100 видов, а
также человек. В Российской Федерации и странах СНГ особенно
неблагополучны отдельные районы Белоруссии, Украины, Крас-
нодарского края, Дальнего Востока и др.
Ущерб складывается из выбраковки и технической утилизации
пораженных свиных туш и затрат на содержание большого коли-
чества ветеринарного персонала для диагностики инвазии.
244
Возбудитель. В настоящее время бесспорно признаются возбу-
дителями трихинеллеза два вида: Trichinella spiralis и
Т. pseudospiralis. Длина самцов Т. spiralis в среднем 1,4—1,6 мм, са-
мок 3—4 мм. У самцов спикул нет. У самок половое отверстие от-
крывается в передней части тела. Самки живородящие. Личинки в
мышцах достигают длины от 639 до 874 мкм.
Биология развития. Трихинеллы в процессе эволюции приобре-
ли феноменальную особенность — для них одно и то же животное
служит промежуточным и дефинитивным хозяином. Например, в
тонкой кишке свиньи самки оплодотворяются, после этого самцы
погибают, а самки внедряются в подслизистую и через 6—7 сут про-
дуцируют в большом количестве личинок (от 1,5 до 10 тыс. экз.).
Личинки внедряются в кровеносные сосуды и током крови разно-
сятся по всему организму (кроме мышц сердца). В местах локали-
зации они растут, развиваются, спиралеобразно сворачиваются и
через 17 сут достигают инвазионной стадии. Вокруг личинки через
21—28 сут формируется лимоновидная капсула (рис. 102). По ис-
течении 5—6 мес на полюсах начинают откладываться соли Са, Р
и других элементов. В организме животных мышечные трихинел-
лы сохраняют жизнеспособность годами, у человека — до 25 лет.
Животные и человек заражаются при употреблении мяса, пора-
женного инвазионными личинками гельминта. Мясо в желудке
переваривается, а личинки в кишечнике приблизительно через
2 сут достигают половой зрелости (кишечные трихинеллы).
Эпизоотологические данные. К трихинеллезу восприимчивы
животные многих видов — свиньи, кабаны, собаки, волки, шака-
лы, лисицы, кошки, белые и бурые медведи, крысы, барсуки,
горностаи, ежи. Инвазию обнаруживают и у морских млекопита-
ющих — китов, моржей, тюленей. В качестве резервуаров выяв-
лены морские звезды, моллюски и ракообразные. Эксперимен-
тально Т. pseudospiralis были заражены куры, утки, сороки и во-
роны. В последнее время трихинеллы обнаружены в мышцах ло-
шадей.
В европейской части Российской Федерации в большой степе-
ни заражены енотовидные собаки, волки, лисицы, в Сибири —
волки, медведи, рыси, на Северном Кавказе и в Узбекистане —
корсаки, шакалы и лисицы, на Дальнем Востоке — енотовидные
собаки и песцы. В отдельных районах страны зараженность вол-
ков достигает 90 %. В Гренландии заражены 27,7 % белых медве-
дей, на Аляске — 50 % бурых медведей, 0,8 — моржей, 40 — вол-
ков, 35,3 — полярных лисиц, 0,6 — дельфинов, 2 — речных бобров,
от 0,9 до 4,3 % — мышевидных грызунов.
Основной источник заражения свиней — трупы инвазирован-
ных крыс и отходы от обработки шкур зараженных кабанов и
хищников, а также отходы убоя свиней. В природе у диких живот-
ных существует естественная пищевая связь как при употреблении
одного вида другим, так и в виде каннибализма. Поэтому в отдель-
245
Рис. 102. Биология развития Т. spiralis:
/ — хвостовой конец самки; 2 —хвостовой конец самца; 3, 5—инкапсулированные
личинки в мышцах; 4— личинка вне капсулы
ных районах существуют природные очаги трихинеллеза. При не-
соблюдении правил ветеринарно-санитарной экспертизы в небла-
гополучных районах нередко заболевают люди.
Патогенез и симптомы болезни. Степень патогенного влияния
трихинелл зависит от степени зараженности животных и стадии
развития паразита. Так, самки, внедряясь в слизистую оболочку
кишечника, разрушают эпителиальный слой и либеркюновые
железы. При миграции из подслизистой кишечника в скелет-
ные мышцы личинки повреждают мелкие кровеносные сосуды,
а в последующем сарколеммы мышечных волокон, вплоть до
246
разрушения (лизиса) миофибрилл и гомогенизации сарко-
плазмы.
При инвазии сильной степени симптомы болезни проявляются
на 3—5-е сутки после заражения. Повышается температура тела,
отмечается понос, резко снижается аппетит, животное худеет. Ре-
гистрируют болезненность мышц, животные подолгу лежат. Дыха-
ние у больных учащенное и поверхностное, конечности отечные.
Иногда наблюдают дрожь мышц, нарушение координации движе-
ний, слезотечение. Симптомы болезни проявляются в течение 1 —
1,5 мес, а затем указанные признаки сглаживаются до бессимп-
томного течения.
Различают кишечный трихинеллез, вызываемый трихинеллами
в предимагинальной и имагинальной стадиях, и мышечный три-
хинеллез, возникающий в результате паразитирования личинок в
скелетных мышцах.
Диагностика. Согласно инструкции исследованию подлежат
туши, полутуши, четвертина свиней (кроме поросят до 3-недель-
ного возраста), кабанов, барсуков, медведей, всеядных и плотояд-
ных животных, а также нутрий.
Методика прижизненной диагностики разработана недостаточ-
но. Некоторое практическое значение имеют биопсия ушных
мышц и иммуноферментный анализ (ИФА).
Послеубойные исследования проводят двумя методами: комп-
рессорным (под микроскопом, трихинеллоскопом) и методом пе-
реваривания мяса в искусственном желудочном соке.
Шпик с мышечной прослойкой исследуют только компрессор-
ным методом, копчености и импортную свинину в блоках (выбо-
рочный контроль) — методом переваривания. Берут пробы из но-
жек диафрагмы, а при их отсутствии — из межреберных, шейных,
жевательных, поясничных, икроножных мышц, сгибателей и раз-
гибателей пясти, а также мышц языка, пищевода и гортани. От
туш морских животных (млекопитающих) берут мышцы кончика
языка и глаза. Проба от каждой группы мышц должна быть массой
не менее 5 г, а общая масса пробы от животного — 25 г. От каждо-
го куска соленого, копченого шпика на исследование берут по
25 г. Из субпродуктов (свиные языки, головы, ножки, хвосты) бе-
рут пробы от 3 % упаковочных единиц по 10—15 выемок (из каж-
дой) и делают объединенную пробу массой не менее 25 г. Исследу-
ют не менее 1 % от партии импортной свинины в блоках. Берут по
25 выемок (по 1 г) от каждого блока. Общая масса пробы не менее
25 г.
Для исследования мяса используют микроскопы при малых
увеличениях (х 40; х 56; х 80) или трихинеллоскопы нескольких
марок: трихинеллоскоп ТМП, трихинеллоскоп проекционный пор-
тативный (ТПП), насадку проекционного микроскопа (НПМ-2),
трихинеллоскоп проекционный (ТП-1) (рис. 103).
Для исследования компрессорным методом необходимы: ком-
247
; Рис. 103. Устройства для грихинеллоскопии:
а — трихинеллоскоп ТМЯ; б—трихинеллоскоп проекционный
портативный (ТПП); в —насадка проекционная микроскопа
(НПМ-2); г — трихинеллоскоп проекционный (ТП-1)
б в г
прессориум с двумя металлическими зажимами, острые ножницы
Купера, скальпель, флакон с водой и пипетка.
Скальпелем вырезают кусочек мяса массой около 0,5 г. Держат
его двумя пальцами или хирургическим пинцетом, ножницами
вдоль волокон отрезают 24 кусочка размером чуть меньше овсяно-
го зерна и помешают на квадратики в компрессориуме (их 36). На
кусочки мяса можно нанести капельки воды или (в особых случа-
ях) молочной кислоты, 5%-ного раствора гидроксида натрия —
просветляющих жидкостей. Стекла компрессориума при помощи
металлических зажимов, помогая пальцами, прижимают так, что-
бы кусочки равномерно расплющились. Затем компрессориум ус-
танавливают на столик трихинеллоскопа и в проходящем свете
рассматривают все срезы. Можно компрессориум изучить и под
малым увеличением микроскопа. В отдельных случаях кусочки
мяса можно зажать между двумя предметными стеклами и иссле-
довать под микроскопом. Число срезов (от 24 до 96) определяют в
зависимости от эпизоотического и эпидемиологического состоя-
ния территории и хозяйства в соответствии с методическими ука-
заниями «Профилактика гельминтозов, передающихся через мясо
и мясные продукты».
Для исследования шпика из мышечных прослоек готовят 24
среза, помешают на 5—8 мин в чашку Петри с 0,5 см3 раствора
248
(1%-ный раствор фуксина в 5%-ном растворе гидроксида натрия)
и изучают под трихинеллоскопом.
Для метода переваривания мышц в ис-
кусственном желудочном соке (ИЖС) последний
готовят по прописи: вода водопроводная 41—42 °C—1000 см3;
концентрированная соляная кислота—10 см3; пепсин пишевой
свиной (ТУ 10.02.01.III—89) — 2 г при исследовании свежего мяса
и мясопродуктов, 10 г при исследовании соленого, копченого мяса
и мясопродуктов, шпика. При использовании пепсина медицин-
ского дозу увеличивают до 20 г. Срок годности ИЖС 8 ч.
Пробы мышц массой 10 г измельчают в мясорубке с диаметром
решетки 3—4 мм, переносят в коническую колбу, заливают ИЖС в
соотношении 1 : 15 и ставят в термостат при температуре 41 —
42 °C на 5—7 ч, периодически помешивая. За 10 мин до конца пе-
ремешивание прекращают. Из колбы 2/3 надосадочной жидко-
сти выливают, а осадок помешают на капроновое сито с диамет-
ром ячеек 400 мкм, установленное в стеклянной воронке диамет-
ром 90—120 мм, соединенной резиновой трубкой с пробиркой
вместимостью 5 см3. Осадок отстаивают 15—20 мин, затем трубку
перекрывают зажимом и пробирку отсоединяют. Содержимое
пробирки переносят на часовое стекло порционно и изучают под
микроскопом.
Применяют по ситуации еще и метод группового
переваривания в аппаратах АВТ-Л2, ABT-J13 и др.
При обнаружении хотя бы одной личинки результаты считают
положительными.
Дифференциальная диагностика. У животных многих видов в
мышцах капсула трихинеллы имеет лимоновидную и нередко ок-
руглую форму. Внутри ее находятся спирально свернутая личин-
ка или личинки. Но в мышцах встречаются также и саркоцисты
продолговатой формы (мишеровы мешочки), и микрофинны. С
целью дифференциации учитывают морфологию возбудителя:
при разрушении оболочки саркоцисты внутри обнаруживают
огромное число мерозоитов в форме дольки апельсина; микро-
финны в отличие от трихинелл локализуются между мышечны-
ми волокнами, имеют овальную форму и окружены слоистой
оболочкой.
Лечение. В ветеринарной практике лечение трихинеллеза не
разработано, хотя известны довольно эффективные химиопрепа-
раты — тиабендазол, парбендазол, мебендазол, тетрамизол.
Профилактика и меры борьбы. В основном они сводятся к вете-
ринарно-санитарному осмотру всех свиных туш и мяса кабанов,
медведей, барсуков и др. с обязательной их трихинеллоскопией.
Запрещается подворный убой животных. Принимают специаль-
ные меры по уничтожению крыс и других грызунов на животно-
водческих фермах и хранилищах продуктов. Тушки различных
животных скармливают свиньям, собакам и другим плотоядным
249
только после обезвреживания путем проваривания или перераба-
тывают на мясокостную муку. В неблагополучных районах охот-
никам запрещают использовать для приманки непроверенные и
необезвреженные трупы и тушки животных, в том числе птиц.
9.4. СТРОНГИЛОИДОЗЫ МОЛОДНЯКА
Стронгилоидозы животных вызывают нематоды подотряда
Rhabditata семейства Strongyloididae. Инвазии подвержены мелкий
и крупный рогатый скот, свиньи, лошади, пушные звери, у кото-
рых паразитируют специфические для них виды нематод. Пред-
ставители подотряда характеризуются тем, что пищевод у них
имеет два бульбуса: передний и задний. Такие личинки называют-
ся рабдитовидными. Это мелкие паразиты, среди которых есть и
свободноживущие популяции. С фекалиями животных выделяют-
ся мелкие яйца, содержащие личинок.
Распространение. Встречаются повсеместно, особенно в райо-
нах с теплым и влажным климатом.
Локализация — тонкий кишечник.
Возбудители. Особи в паразитической стадии — гермафродитные
самки: Strongyloides papillosus (у жвачных) длиной 3,5—6,3 мм, ши-
риной 0,05—0,06 мм; S. ransomi (у свиней) длиной 3,5—6,0 мм,
шириной 0,05—0,08; S. westeri (у лошадей) длиной 8,0—9,0 мм и
шириной 0,08—0,095 мм. Тело нитевидное, спереди утончается.
Рот имеет три малые губы, переходящие в удлиненный цилиндри-
ческий пищевод. У свободноживущих самок и самцов пищевод с
двумя бульбусами.
Яйца стронгилоидесов всех видов светло-серые, овальные, раз-
мером (0,04—0,06) х (0,03—0,04) мм. Внутри находятся подвижные
свернутые 8-образной формы личинки.
Биология развития. Развитие стронгилоидесов происходит с че-
редованием паразитического и свободноживущего поколений. В
зависимости от условий внешней среды у них наблюдаются пря-
мой и непрямой пути развития. При прямом пути развития (пре-
имущественно в теплый период года) вышедшие из яиц рабдито-
видные личинки (с двумя расширениями на коротком пищеводе)
двукратно линяют и через 2—3 сут при температуре 20—30 °C ста-
новятся филяриевидными — инвазионными. У них длинный ци-
линдрический пищевод, занимающий около половины длины
тела.
При непрямом пути развития (ноябрь—март) после первой
линьки рабдитовидных личинок первой стадии формируются ли-
чинки второй стадии, которые превращаются в свободноживущих
раздельнополых стронгилоидесов. Из вышедших личинок способ-
ны формироваться (после линьки) свободноживущие самцы и
самки, или филяриевидные формы. Во внешней среде (в фекали-
ях, навозе) самки этих нематод откладывают яйца.
250
Рис. 104. Биология развития стронгилоидесов:
1 — передний конец паразитирующей самки; 2 — передний конец сво-
бодноживущей самки; 3 — яйцо с личинкой; 4 — рабдитовидные ли-
чинки; 5, б—самец и самка свободноживущей генерации; 7—филя-
риевидные личинки
Животные заражаются при заглатывании с кормом или водой
инвазионных личинок нематод и перкутанно при активном про-
никновении филяриевидных личинок нематод через кожу конеч-
ностей и других частей тела. После миграции личинок в крови и
органах дыхательного аппарата через 5—10 сут у жвачных, 8—
10 сут у лошадей и 5—9 сут у свиней в переднем отделе тонких ки-
шок формируются взрослые кишечные стронгилоидесы. Продол-
жительность жизни данных гельминтов у животных разных видов
5—9 мес (рис. 104).
Эпизоотологические данные. Стронгилоидозы — широко рас-
пространенные заболевания ягнят, телят, поросят и жеребят во
многих районах нашей страны и за рубежом. Молодняк заражает-
251
ся с первых дней жизни. В последнее время доказано, что поросята
могут заразиться через молоко матери. Одна из особенностей возбу-
дителей стронгилоидозов — они хорошо развиваются в условиях
животноводческих помещений, и ягнята, поросята и телята заража-
ются ранней весной во время стойлового содержания. У ягнят в за-
висимости от сроков окота признаки болезни отмечают на 12—14-й
день жизни. У телят максимум экстенсивности и интенсивности
инвазии регистрируют летом. Интенсивность инвазии у животных
достигает от сотен до тысяч экземпляров. Инвазионные личинки во
внешней среде остаются жизнеспособными 2—3 мес.
Патогенез и симптомы болезни. Личинки стронгилоидесов вне-
дряются под эпителий слизистой оболочки тонкого кишечника,
где и обнаруживаются яйца гельминтов (Р. А. Бузмакова, 1987).
Ведущий фактор патогенеза стронгилоидоза ягнят раннего возрас-
та — сенсибилизирующее действие гельминтов на организм, пере-
ходящее в аллергию с обширными эозинофильными инфильтра-
тами и тучноклеточной реакцией. При перкутанном заражении
ягнят уже через 7 сут в сосочковом и сетчатом слоях дермы вокруг
личинок образуется большое количество паразитарных гранулем.
Вокруг личинки скапливаются эпителиоидные и лимфоидные
клетки, эозинофилы. По периферии гранулем нередко встречают-
ся гигантские клетки (макрофаги), которые способны фагоцити-
ровать личинок.
На разрезе слизистая оболочка тонкой кишки набухшая, утол-
щена, пятнисто гиперемирована, отмечаются кровоизлияния и
обилие слизи. Брыжеечные и легочные лимфоузлы на разрезе соч-
ные, увеличены.
У молодняка животных всех видов при стронгилоидозе отмеча-
ют идентичные симптомы болезни. Так, при высокой интенсив-
ности инвазии наблюдаются расстройства пищеварения, иногда
высокая температура, кашель, кожный зуд, местами отечность
подкожной клетчатки, потеря эластичности кожи.
Возбудителем стронгилоидоза свиней может заразиться и чело-
век.
Диагностика. При жизни учитывают комплекс факторов: жи-
вотные болеют в первый месяц жизни; выражены кожный зуд и
экзематозные поражения.
Фекалии исследуют по методу Фюллеборна, в них обнаружива-
ют характерные яйца с личинками. Фекалии, пролежавшие более
6 ч, с целью обнаружения рабдитовидных личинок исследуют по
методу Бермана. Для выявления самок вскрывают тонкий кишеч-
ник, берут соскобы слизистой оболочки и изучают под микроско-
пом.
Лечение. Фенбендазол в форме панакура применяют яг-
нятам, козлятам, телятам и поросятам в дозе 0,01 г д. в. на 1 кг
массы тела в смеси с кормом однократно индивидуально или
групповым способом.
252
Н и л в е р м задают телятам внутрь в дозе 0,01 г на 1 кг мас-
сы тела двукратно с интервалом 24 ч в виде 1%-ного водного ра-
створа.
Тетрамизол гранулят 20%-ный назначают группо-
вым методом двукратно с интервалом 1—5 сут в дозах: телятам
массой до 100 кг —0,75 г на 10 кг, более 100 кг —0,5 г на 10 кг
массы тела. Овцам и козам нилверм дают так же, как при дикти-
окаулезе. Поросятам препарат задают в утреннее кормление с
кормом в разовой дозе 7 мг на 1 кг массы тела 2 раза в течение
2 сут подряд.
Фебантел (ринтал) применяют через рот однократно в
дозах (д. в. на 1 кг массы тела): телятам — 7,5 мг, ягнятам — 10 и
поросятам — 5 мг. Жеребятам фебантел (ринтал) и фенбендазол
(панакур) назначают так же, как и при параскариозе.
Профилактика и меры борьбы. Одна из основных мер профи-
лактики стронгилоидоза в период стойлового содержания живот-
ных — своевременная уборка навоза из животноводческих поме-
щений и дезинвазия объектов внешней среды. Полы в помещени-
ях для свиноматок и поросят-сосунов должны быть гладкими или
щелевыми. У маточного поголовья (свиньи, козы, овцы) во второй
половине беременности исследуют фекалии по методу Фюллебор-
на и при необходимости животных дегельминтизируют. Молод-
няк животных всех видов обследуют и при наличии зараженных
животных осуществляют дегельминтизацию.
9.5. СТРОНГИЛЯТОЗЫ
Стронгилятозы многих непарно- и парнокопытных животных
вызывают круглые гельминты подотряда Strongylata, обитающие в
пищеварительном канале и дыхательной системе хозяев. Основ-
ной характерный признак стронгилят — наличие у самцов разви-
той половой кутикулярной бурсы с ребрами. Яйца с тонкой обо-
лочкой содержат шары дробления. Во внешней среде личинки вы-
ходят из яйца и после двух-трех линек становятся инвазионными.
Среди стронгилят встречаются био- и геогельминты.
9.5.1. СТРОНГИЛИДОЗЫ ЛОШАДЕЙ
Стронгилидозы лошадей вызываются паразитированием как
личинок, так и взрослых особей различных нематод семейства
Strongylidae. В кишечнике лошадей и других непарнокопытных
паразитируют также нематоды (около 40 видов), относящиеся к
семейству Trichonematidae. Представители первого семейства,
имеющего огромное ветеринарное значение, характеризуются на-
личием шарообразной ротовой капсулы, тогда как у представите-
лей второго семейства ротовая капсула цилиндрическая. Личинки
253
третьей стадии (у трихонематид) мигрируют в толщу слизистых
оболочек указанных кишок и через месяц после линьки, достиг-
нув длины 5—10 мм, возвращаются в полость пищеварительного
канала и вскоре становятся половозрелыми.
Взрослые стронгилиды локализуются в полости слепой и обо-
дочной кишок, тогда как личинки четвертой и пятой стадий раз-
виваются в кровеносных сосудах органов пищеварения
(D. vulgaris), под париетальным листом брюшины (A. edentatus) и в
поджелудочной железе (S. equinus).
Распространение. Стронгилидозы лошадей — самые распрост-
раненные гельминтозы как в нашей стране, так и в различных
странах мира. Особенно велик ущерб от аневризм и тромбоэмбо-
лических колик, возникающих в результате паразитирования ли-
чинок делафондий в кровеносных сосудах кишечника. Заболева-
ния часто приводят к гибели весьма ценных и породистых лоша-
дей, резко снижается работоспособность больных животных.
Возбудители. Delafondia vulgaris (вызывает делафондиоз) — сам-
цы длиной 14—16 мм, самки — 20—24 мм. В большой шаровидной
ротовой капсуле у основания дорсального желоба расположено
два ушковидных зуба. У инвазионной личинки имеется 32 кишеч-
ные клетки.
Alfortia edentatus (вызывает альфортиоз) — самцы длиной 23—
26 мм, самки — 32—40 мм. В большой округлой ротовой капсуле
зубы отсутствуют. У инвазионной личинки насчитывается 20 ки-
шечных клеток.
Strongylus equinus (вызывает стронгилез) — самцы длиной 25—
35 мм, самки — 35—45 мм. В мощной шаровидной ротовой капсу-
ле у основания дорсального желоба находятся четыре зуба тре-
угольной формы. Инвазионная личинка имеет 16 кишечных кле-
ток.
Яйца указанных стронгилид идентичны, серые, овальные, раз-
мером в среднем (0,07—0,1) х (0,04—0,045) мм. При выходе наружу
содержат незначительное число шаров дробления. Яйца трихоне-
матид идентичны яйцам стронгилид.
Биология развития. Во внешней среде при температуре 12—
38 °C в яйце за 2—3 сут образуется личинка, которая выходит на-
ружу, дважды линяет и через 6—8 сут достигает инвазионной (тре-
тьей) стадии.
Лошади заражаются стронгилидами алиментарным путем. Пос-
ле попадания в слизистую оболочку кишечника личинки стронги-
лид разных видов в дальнейшем претерпевают неодинаковое раз-
витие.
Личинки третьей стадии делафондии в организме лошади раз-
виваются только после попадания в артериальные сосуды, по ин-
тиме которых они продвигаются против тока крови (ретроградно)
в брыжеечные артерии. Здесь они чаще всего останавливаются и
образуют тромбы. Основа тромбообразования — реакция преци-
254
питации. В тромбе личинки паразитируют 5—6 мес, достигая дли-
ны до 2 см. Выйдя из тромба, личинки пятой стадии пассивно за-
носятся в стенку кишечника, где задерживаются на 3—4 нед. Затем
они попадают в просвет кишок и через короткий промежуток вре-
мени достигают половой зрелости.
Личинки третьей стадии альфортии проникают через кишеч-
ную стенку в серозную оболочку, мигрируют до корня брыжейки,
затем под париетальным листком брюшины — в области пупка,
ложных ребер, малого таза и там оседают в жировой клетчатке,
линяют и растут. Через 5—6 мес личинки пятой стадии тем же пу-
тем возвращаются в толстый кишечник, задерживаются около
1 мес в узелках, выходят в просвет кишечника и превращаются в
половозрелых паразитов.
Личинки третьей стадии стронгилюса попадают в поджелудоч-
ную железу, где паразитируют в течение 6—7 мес. За это время они
дважды линяют и растут. Личинки пятой стадии мигрируют в про-
свет толстого кишечника, где быстро достигают половой зрелости
(рис. 105, 106).
Эпизоотологические данные. Источник распространения возбу-
дителей заболевания — взрослые лошади-гельминтоносители, а
источник заражения — внешняя среда (почва, трава, вода). Жи-
вотные заражаются во время стойлового содержания, в левадах и
на пастбищах. С возрастом экстенсивность и интенсивность инва-
зии у лошадей возрастают. Массовое заражение на пастбищах
происходит в мае—июне и осенью. Инвазионные личинки строн-
гилид весьма устойчивы к высокой и низкой температурам, поэто-
му могут сохранять жизнеспособность 5—12 мес и более.
Патогенез и симптомы болезни. Паразитирование большого ко-
личества стронгилид, питающихся кровью в толстой кишке, отри-
цательно влияет на структуру ее слизистой оболочки, на крове-
творные органы и центральную нервную систему больных живот-
ных.
Личинки всех стронгилид мигрируют в глубжележащие ткани в
течение 6—7 мес, повреждают сосуды и инокулируют микрофло-
ру. При этом дважды линяют, вырастая до 2 см. Продукты обмена
веществ личинок оказывают аллергическое воздействие на орга-
низм. Личинки альфортий вызывают морфологические изменения
брюшины, а личинки стронгилюсов — поджелудочной железы.
Нарушается работа печени, легких и кишечника в результате об-
разования в них узелков стронгилидной этиологии.
В зависимости от стадии паразитирования стронгилид различа-
ют кишечный и миграционный стронгилидоз. При кишечном
стронгилидозе, который протекает хронически, отмечают рас-
стройство функции органов пищеварения и кроветворения. При
высокой интенсивности инвазии животные худеют, в крови
уменьшается содержание эритроцитов, гемоглобина, увеличивает-
ся количество элементов белой крови.
255
Рис. 105. Биология развития стронгилнд лошадей:
1 — D vulgar», 2— A. edentatus; 3 — S equinus, 4— яйцо (неинвазионное);
5— выход личинки из яйца, 6 — инвазионная личинка
Особое место в патологии лошадей отводится личинкам
D. vulgaris (рис. 107). В период миграции они поражают интиму
аорты и брыжеечных артерий, питающих органы брюшной полос-
ти (рис. 108). В этих сосудах образуются тромбы и эмболы. Нару-
шение кровообращения приводит к геморрагическому инфаркту и
последующему некрозу слизистой оболочки кишечника, в резуль-
тате возникают приступы колик Максимум деляфондиозных ко-
лик отмечают у животных от 5 до 10 лет. В крупных сосудах обра-
зуются аневризмы больших размеров, где скапливается кровь
(рис. 109). В период интенсивной эксплуатации лошадей аневриз-
мы могут разорваться и наступает мгновенная смерть. Во время
256
Рис. 106. Морфология кишечных клеток инвазионных личинок стронгилнд
лошадей:
а — D. vulgaris; б — A. edentatus; в — S. equinus
колик лошади сильно беспокоят-
ся, учащаются пульс и дыхание,
появляется дрожь отдельных
мышц. Животные падают, катают-
ся по земле, иногда принимают
позу сидящей собаки.
Диагностика. При жизни диаг-
ноз ставят с помощью гельминто-
копрологических исследований по
методу Фюллеборна. По обнару-
жению яиц ставят общий диагноз
Рис. 107. Головной конец D. vulgaris (видны
два ушковидных зуба; увеличено в 30 раз)
257
Рис 108. Пораженные личинками D. vulgaris участки брыжеечной
артерии лошади (по Капустину)
на стронгилятоз, так как яйца всех стронгилят лошадей идентич-
ны. Для дифференциальной диагностики в условиях лаборатории
вырашиваюз инвазионных личинок в течение 8—9 сут и с учетом
количества кишечных клеток у них ставят диагноз. Личинки пред-
ставителей семейства Trichonematidae имеют восемь кишечных
клеток.
Посмертно виды стронгилид дифференцируют по строению
ротовой капсулы.
258
Лечение, профилактика и меры борьбы. При кишечных стронги-
лидозах лошадей применяют химиопрепараты.
Фенбендазол (панакур) и четыреххлорис-
тый углерод назначают в тех же дозах, что и при параскари-
озе.
Фебантел (ринтал) применяют через рот однократно с
кормом в дозе 60 мг гранулята (6 мг д. в.) на 1 кг массы тела.
Фенотиазин ветеринарный с целью профилактики при-
меняют первый раз весной (через 2 нед с начала пастьбы), второй
раз — через 2 мес после первой обработки. При стойловом содер-
жании лошадей фенотиазин скармливают однократно индивиду-
ально с 1 кг предварительно увлажненных концентратов. Доза фе-
нотиазина не должна превышать 0,1 кг на 1 кг массы тела. Живот-
ные в возрасте от 3 до 12 мес получают 5—10 г, от 1 года до 2 лет —
11—20, от 2 до Злет —21—30, старше Злет—31—40 г препарата.
Рнс. 109. Образование узелков иа стенке слепой
кишки прн паразитировании лнчнииг: III н IV стадии
S. equinus (нз книги fh. Hiepe)
259
При табунном содержании фенотиазин назначают групповым
(20—25 лошадей) методом 2 дня подряд в разовых дозах на живот-
ное в возрасте от 3 до 12 мес — 5—10 г, от 1 года до 2 лет — 15, от 2
до 3 лет — 20, старше 3 лет — 25 г.
Профилактика. Для химиопрофилактики лошадям ежедневно
скармливают фенотиазиносолевую смесь (1 : 10) в тече-
ние всего пастбищного периода. Кобыл во второй половине бере-
менности не дегельминтизируют. Слабым животным препарат на-
значают дробными порциями.
9.5.2. СТРОНГИЛЯТОЗЫ ПИЩЕВАРИТЕЛЬНОГО КАНАЛА
ЖВАЧНЫХ
Фауна стронгилят чрезвычайно многообразна. В подотряде
стронгилят четыре семейства: Strongylidae (род Chabertia);
Trichostrongylidae (роды Trichostrongylus, Ostertagia, Nematodirus и
др.); Trichonematidae (род Oesophagostomum); Ancylostomatidae
(род Bunostomun). Многие из указанных родов насчитывают не-
сколько видов. В пищеварительном канале жвачных паразитирует
более 400 видов нематод семейства Trichostrongylidae (подотряд
Strongylata). Чаще всего кишечные нематоды паразитируют в ассо-
циации и оказывают общее патогенное влияние на организм. Их
объединение базируется на общности локализации, биологии,
эпизоотологии.
Локализация — различные отделы пищеварительного канала:
желудок (гемонхусы, иногда — остертагии, трихостронгилюсы),
тонкий (нематодирусы, буностомумы и др.) и толстый (эзофагос-
томумы, хабертии и др.) кишечник.
Распространение. Нематоды пищеварительного канала овец и
других жвачных широко распространены в различных странах
мира.
Возбудители. Стронгиляты пищеварительного канала овец и
других жвачных животных — мелкие волосовидные светло-серые
нематоды, однако цвет некоторых видов красновато-розовый, что
связано с типом питания (кровь). У одних паразитов ротовое от-
верстие маленькое (гемонхусы, трихостронгилюсы, остертагии,
маршаллагии и др.), у других — большое шарообразное или ворон-
кообразное (хабертии, буностомумы и др.). Хвостовой конец у
Рис. ПО. Кишечные нематоды жвачных:
a — Hemonchus contortus: 1 — головной конец; 2 — бурса самца со спикулами; 3 — область
вульвы у самки; б— Bunostomum trigonocephalum: 1, 2 — передний конец нематоды с вентраль-
ной и латеральной сторон; в — Nematodirus spathiger: 1 — головной конец паразита; 2 — хвосто-
вой конец самки; 3 — бурса самца; 4— яйцо
260
2
Рис. 111. Яйца нематод:
1 — Skijabinema ovis; 2— Neoascaris vitilorum; 3— Gongylonema pul-
chrum; 4 — Trichocephalus ovis; 5—Capillaria bovis; 6 — Mecistocirrus
digitatus; 7—Nematodirus spathiger; 8— Haemonchus contortus; 9 — Bu-
nostomum trigonocephalum; 10— Strongyloides papillosus
самцов снабжен мощной многолопастной бурсой. Лопасти соеди-
нены между собой пальцевидными выростами — ребрами. Длина
тела трихостронгилюсов составляет несколько миллиметров, тогда
как гемонхусы, хабертии, буностомумы, нематодирусы, мецисто-
циррусы достигают 3—4 см и более (рис. ПО).
Биология развития. Стронгиляты пищеварительного канала —
геогельминты. Развитие их сходно. В яйцах, выделенных во вне-
шнюю среду, при 20—25 °C за 12—17 ч формируются личинки
первой стадии. Они выходят из полости яйца, через 30—40 ч линя-
262
Рис. 112. Инвазионные личинки (по Полякову):
1 — Haemonchus contortus; 2— Cooperia spp.; 3 — Trichostrongylus spp.;
4— Ostertagia spp.; 5—Chabertia ovina; 6, 7— Oesophagostomum spp.;
8— Bunostomum spp.; 9— Nematodirus spp.
ют, превращаясь в личинок второй стадии. При благоприятных
условиях через 4—6 сут личинки повторно линяют и переходят в
третью стадию.
У нематодирусов, нематодирелл личинки развиваются до инва-
зионной стадии в яйце от 8—14 до 24—28 сут, после чего выходят
из него (рис. 111, 112).
Инвазионные личинки способны мигрировать во всех направ-
лениях, что обеспечивает встречу с хозяином и его заражение. Де-
финитивные хозяева (овцы, козы, крупный рогатый скот и многие
263
дикие жвачные) заражаются главным образом на пастбищах (не-
матодирусами заражаются и в помещениях). В организме хозяина
личинки сначала проникают в толщу слизистой желудка или ки-
шечника, где дважды линяют, затем выходят в полость сычуга или
кишечника и становятся половозрелыми гельминтами. Стадии
имаго трихостронгилиды достигают за 20—30 сут, хабертии — за
32—60, эзофагостомумы — за 24—43 сут. Но есть и исключения.
Так, буностомумами животные заражаются двумя путями — перо-
рально и через неповрежденную кожу.
Хабертии в организме дефинитивных хозяев в среднем живут
9 мес, эзофагостомумы, буностомумы — 1 год и более, нематоди-
русы — около 5 мес, гемонхусы — 6—8 мес.
Эпизоотологические данные. Особое значение для заражения
мелкого и крупного рогатого скота в нашей стране имеют предста-
вители семейства Trichostrongylidae. В различных районах кишеч-
ные стронгиляты распространены неравномерно, но, как правило,
они встречаются в ассоциации. Например, в Нечерноземье у овец
паразитируют в среднем 11—17 видов, в Молдове — 17, а в специа-
лизированных овцеводческих хозяйствах Украины — 11 видов. В
Узбекистане у коз из 34 видов нематод наиболее распространены
15 стронгилят пищеварительного канала, а в Забайкалье — 23
вида. В лесостепной зоне Западной Сибири у овец паразитируют
стронгиляты 8 видов, но наиболее часто встречаются 3. В Ростов-
ской области у мелкого рогатого скота обнаружено 17 видов
стронгилят и столько же было обнаружено у овец и коз в Волго-
градской области. Что касается Казахстана и некоторых других рес-
публик Средней Азии, то фауна стронгилят здесь более многооб-
разна. Например, на юго-востоке Казахстана только нематодиру-
сов насчитывается более 11 видов.
Основной источник распространения стронгилятозов — взрос-
лые животные-гельминтоносители, а источник заражения — вне-
шняя среда (почва, трава, водоемы). Инвазионные личинки
стронгилят весьма устойчивы к условиям внешней среды. Напри-
мер, личинки хабертий сохраняют жизнеспособность в почве до
13 мес, буностомумов — 4—7, гемонхусов — 6, нематодирусов —
15 мес.
Возрастная устойчивость овец к первичному заражению не ус-
тановлена. Но ягнята чаще инвазированы трихостронгилидами 8—
10 видов (экстенсивность инвазии 41,4%), молодняк — 5—7
(56,3 %), взрослые животные — 2—4 видов (47 %). Максимальная
зараженность ягнят и молодняка текущего года рождения в боль-
шинстве географических зон установлена осенью, когда экстен-
сивность инвазии составляет 90—100 % при высокой интенсивно-
сти заражения (до 10 тыс. и более). Нематодирусами наиболее ин-
тенсивно заражаются ягнята, остертагиями, буностомумами, ха-
бертиями, маршаллагиями — животные старших возрастов.
Яйца нематодирусов в основном перезимовывают и легко пере-
264
носят относительную влажность 20 %. Ранней весной ягнята зара-
жаются нематодирусами в кошарах и на пастбищах. В условиях ко-
шар и катонов овцы могут заразиться и буностомумами. Молодняк
летом и осенью инвазирован максимально, а зимой и весной — до
60—90 %. У взрослых овец с мая по август наблюдается максимум
заражения — до 100 %, осенью — 80—90, зимой — 30—40 %.
Установлено, что при заражении упитанных, с высокой резис-
тентностью животных личинки многих стронгилят в подслизис-
той сычуга и кишечника впадают в анабиоз и их развитие тормо-
зится (латентное течение инвазии). Затем к весне с наступлением
ненастья и при резком снижении упитанности животных личинки
активизируются и завершают цикл развития, обусловливая забо-
левание. Экспериментально доказано, что количество откладыва-
емых самками яиц находится в прямой зависимости от гормонов
лактации.
Патогенез и симптомы болезни. Характер и степень патогенного
воздействия стронгилят на организм хозяина зависят от вида и
интенсивности инвазии, стадии развития нематод и индивидуаль-
ных особенностей организма. Личинки четвертой и пятой стадий
развития внедряются в подслизистую оболочку сычуга или кишеч-
ника, нарушают целостность слизистого и подслизистого слоев,
деятельность пищеварительных желез. При эзофагостомозе часть
узелков, образованных личинками, может вскрыться со стороны
серозной оболочки кишечника. Личинки буностомума вызывают
обширные дерматиты, многочисленные кровоизлияния в легоч-
ной ткани и печени. Скопление пенистой жидкости в мелких
бронхах приводит к ателектазу и бронхопневмонии.
Трихостронгилиды — в основном гематофаги. Буностомумы и
хабертии фиксируются на слизистой оболочке с помощью рото-
вых капсул и вызывают застойные явления в стенке и железистом
аппарате кишечника. Гемонхусы внедряются передним концом в
выводные протоки желез сычуга, обусловливая воспаление. Нару-
шается секреторно-моторная функция пищеварительного канала,
возникает дисбактериоз, создается дефицит содержания в органах
и тканях цинка, магния, натрия, меди, железа.
Клинические признаки при стронгилятозах идентичны, за не-
которыми исключениями, связанными с видом и биологией от-
дельных паразитов. Например, при буностомозе наблюдают дер-
матиты, при остертагиозе — узелки в слизистой сычуга, при коо-
периозе — воспаление поджелудочной железы. При нематодирозе
весь процесс протекает быстрее и животное погибает через 4—
5 сут. У взрослых животных заболевание протекает в основном
субклинически, у ягнят и молодняка симптомы болезни выраже-
ны. Осенью, как правило, у молодняка отмечают гастроэнтерит,
пневмонию, понос, запор, жажду, интоксикацию вследствие нару-
шения секреции и пищеварения, анемичность слизистых оболо-
чек, гидремию тканей. Шерсть теряет блеск, легко выдергивается,
265
животные малоподвижны, аппетит у них ухудшается. Гибель на-
ступает при явлениях кахексии.
Диагностика. При жизни в условиях лаборатории исследуют
фекалии животных по методу Фюллеборна. Это дает возможность
выяснить общую ситуацию по данным гельминтозам. Для опреде-
ления видовой принадлежности нематод культивируют личинки и
по морфологии инвазионных личинок ставят дифференциальный
диагноз. Лишь крупные, эллипсоидной формы яйца нематодиру-
сов размером (0,231 —0,238) х (0,119—0,136) мм с большими шара-
ми дробления и маршаллагии размером (0,16—0,20) х (0,075—
0,10) мм в отличие от яиц трихостронгилид, размер которых
0,073 х 0,27 мм, легко поддаются определению.
Большое практическое значение имеет определение степени ин-
тенсивности инвазии при овоскопических и ларвоскопических ис-
следованиях: слабая (+), когда в 1 г фекалий содержится до 20 яиц
или личинок, средняя (++) — до 50, сильная (+++) — 200 и более.
Посмертно диагноз на стронгилятозы ставят по методу частич-
ного или полного гельминтологического вскрытия сычуга и ки-
шечника. Личинок четвертой и пятой стадий развития можно об-
наружить в глубоком соскобе со слизистой оболочки пищевари-
тельного канала. Соскоб можно изучить в компрессориуме и с по-
мощью метода переваривания соскоба в искусственном
желудочном соке. Есть довольно эффективный метод выявления
личинок стронгилят четвертой и пятой стадий развития. Для этого
сычуг и кишечник освобождают от содержимого и выворачивают
слизистой оболочкой наружу. Кишечник можно разрезать на не-
большие куски, которые помещают в теплую (40—42 °C) воду и ос-
тавляют при комнатной температуре на 10—12 ч. Затем ткани про-
поласкивают и удаляют, а в жидкости изучают осадок на наличие
личинок. Если куски тканей залить физиологическим раствором и
поместить в термостат (37—38 °C), эффективность выхода личи-
нок будет выше.
Лечение. Фенотиазин ветеринарный довольно
эффективен при гемонхозе, маршаллагиозе, нематодирозе, хабер-
тиозе и многих других инвазиях. Назначают в дозе 0,5 г на 1 кг
массы тела в смеси с концентратами, зерном, жмыхом, в болюсах
из муки или в виде водной взвеси с эмульгаторами (мучной отвар,
крахмал, бентонит) перед утренним кормлением.
Меди сульфат (1—2%-ные растворы) применяют про-
тив гемонхусов, остертагий и трихостронгилюсов индивидуально
в тех же дозах, что при мониезиозах овец.
Н и л в е р м назначают в виде 5—10%-ных стерильных водных
растворов или порошка в смеси с кормом. Раствор готовят на дис-
тиллированной воде, стерилизуют и применяют в свежем теплом
(35—37 °C) виде. Доза —0,015 г на 1кг массы тела однократно
подкожно в область шеи или внутрь. Применяют индивидуально.
Истощенным животным и ягнятам дают в дозе 0,01 г на 1 кг массы
266
тела двукратно 2 дня подряд. В форме кормолекарственной смеси
препарат назначают овцам в дозе 0,01 г на 1 кг массы тела двукрат-
но с интервалом 24 ч. Смесь готовят в соотношении 1 : 700 и скар-
мливают 100—150 животным одного возраста.
Фенбендазол (панакур) задают овцам в дозе 15 мг
д. в. на 1 кг массы тела однократно в смеси с сыпучим кормом.
Фебантел (ринтал) применяют в дозе 10 мг д. в., в фор-
ме гранулята — 100 мгд. в. на 1 кг массы тела. Дают через рот ин-
дивидуально или групповым методом в смеси с концентратами.
Нафтамон назначают в дозе 0,5 г на 1 кг массы тела через
рот, без соблюдения диеты, однократно в виде 10%-ной эмульсии.
Ее готовят на воде в день использования в эмалированной, стек-
лянной или деревянной посуде. Во время работы эмульсию посто-
янно размешивают. Нафтамон микрокапсулированный использу-
ют в дозе 0,3 г (0,24 г д. в.) на 1 кг массы тела в смеси с комбикор-
мом групповым методом.
Тетрамизол гранулят 20%-ный применяют в дозе
0,01 г на 1 кг массы тела двукратно 2 дня подряд в смеси с комби-
кормом групповым методом. Телята массой до 100 кг получают по
0,075 г, более 100 кг — 0,05 г на 1 кг массы тела.
Тивидин (пиранте л-т а р т р а т) назначают однократ-
но через рот до кормления в виде 2,5%-ного водного раствора в
дозе 25 мг д. в. или 1 мл на 1 кг массы тела.
М о р а н т е л-т а р т р а т задают в смеси с кормом двукратно с
интервалом 7—10 сут в дозе 0,08 г на 1 кг массы тела.
Мебендазол применяют групповым методом в дозе 0,02 г
на 1 кг массы тела в смеси с комбикормом.
Профилактика и меры борьбы. Плановые диагностические об-
следования молодняка и взрослых овец целесообразно проводить
в марте, ягнят текущего года рождения — в июне—июле и в нояб-
ре. Эти сроки можно изменять в зависимости от региона.
В неблагополучных по стронгилятозам хозяйствах проводят
профилактические дегельминтизации, химио- и пастбищную про-
филактику. Сроки профилактических дегельминтизаций опреде-
ляют на основании изучения эпизоотологических данных той или
иной зоны.
В Нечерноземье в хозяйствах по нагулу молодняка крупного
рогатого скота рекомендуется первую профилактическую дегель-
минтизацию проводить в апреле—мае, вторую — в июле и тре-
тью — в августе.
Ягнят текущего года рождения обрабатывают в конце июля —
начале августа, второй раз — после перевода на стойловое содер-
жание. Молодняк и овец старших возрастных групп дегельминти-
зируют весной, до выгона на пастбище, и осенью, при постановке
на стойловое содержание. Указанные сроки дегельминтизации яг-
нят текущего года рождения действительны для Молдавии, Север-
ного Кавказа и Нижнего Поволжья.
267
Для химиопрофилактики рекомендуют использовать солефе-
нотиазиновую смесь (1 : 10) или медно-купоросо-фенотиазино-
солевую смесь (0,5 : 1 : 9). Смеси препаратов дают животным не-
продолжительное время в различные периоды выпасного сезона с
учетом местных агроклиматических условий и сроков интенсив-
ного заражения животных.
Следует укреплять кормовую базу, создавать культурные паст-
бища, своевременно очищать от навоза кошары и территорию, за-
гоны, места тырловок, оборудовать водопой, осушать переувлаж-
ненные пастбища и организовывать смену пастбищ через 5—7 сут.
9.5.3. ЭЗОФАГОСТОМОЗ СВИНЕЙ
Эзофагостомоз свиней вызывают нематоды из подотряда
Strongylata семейства Trichomematidae.
Локализация — толстый кишечник.
Распространение. Заболевание распространено повсеместно,
особенно в свиноводческих хозяйствах. Экономический ущерб
складывается из снижения продуктивности, отставания в росте и
развитии, гибели значительного количества больных животных.
Возбудители. Oesophagostomum dentatum, О. longicaudatum,
О. georgianum и др.— толстые серо-белые нематоды длиной 12—
20 мм. Ротовое отверстие небольшое, расположено терминально. На
переднем конце есть кутикулярная везикула, отделенная от тела
вентральной бороздкой. У самцов развита хвостовая бурса с двумя
спикулами (рис. 113). Яйца эллипсоидные, с гладкой оболочкой,
внутри находится 8—16 бластомер. Размеры яиц в среднем (0,06—
0,08) х (0,035—0,05) мм.
Биология развития. Яйца эзофагостомумов выделяются с фека-
лиями животных. При 14—31 °C внутри их развиваются личинки
первой стадии, которые выходят из яиц, дважды линяют и через
7—10 сут становятся инвазионными. Свиньи заражаются в сви-
нарниках и на выгулах при заглатывании с кормом или водой ин-
вазионных личинок эзофагостомумов. В толстом кишечнике ли-
чинки проникают в глубь слизистого слоя, где инкапсулируются,
образуя узелки, и дважды линяют. В узелках они находятся 21—
25 сут, после чего выходят в просвет кишечника. Половой зрелос-
ти гельминты достигают за 45—60 сут. Продолжительность жизни
взрослых нематод около 1 года.
Эпизоотологические данные. Основной источник заражения
свиней — выгульные дворики, пастбища и места водопоя на тер-
ритории свинарников. Эзофагостомумами заражено 60—70 % по-
головья молодняка 7—8 мес и разовых маток при интенсивности
инвазии свыше 1000 экз. Молодые животные инвазированы мень-
ше, чем взрослые. Например, в Узбекистане заражено 3,5 % поро-
сят до 2 мес, 12,5 % — 3—4, 24,5 % — 5—6, 29,6 % — 7—8 мес,
268
Рис. 113. Морфология О. longicaudatum:
1 — головной конец; 2 — хвостовой конец самки; 3 — хвостовой конец самца;
4— концы спикул; 5 — рулек; 6— половой конус самца
55,8 % — взрослых свиней. Интенсивность инвазии соответствен-
но составила 9, 46, 101, 221 и 131 экз. (Ж. Шаполатов, 1987).
Патогенез и симптомы болезни. Личинки, проникнув в слизис-
тую оболочку кишечника, повреждают мелкие сосуды и нервы.
Образование плотных узелков усугубляет этот процесс. В период
выхода личинок узелки вскрываются в полость кишечника, иног-
да — в противоположную сторону. В поврежденные ткани прони-
кают микроорганизмы, в результате узелки начинают гноиться.
Симптомы болезни, как правило, проявляются во второй поло-
269
вине лета и осенью. У больных свиней отмечают понос, снижение
аппетита, исхудание и боли в области живота. При осложнениях, с
развитием гнойного перитонита, регистрируют гибель животных.
В крови наблюдают уменьшение количества эритроцитов, ане-
мию, лейкоцитоз, эозинофилию и ускорение СОЭ.
Диагностика. При жизни диагноз ставят путем исследования
фекалий по методу Фюллеборна. Посмертно устанавливают вид
эзофагостомумов и наличие узелков, в которых обнаруживают
гнойно-казеозное содержимое.
Лечение. Применяют те же препараты и по той же методике,
что и при аскариозе свиней.
Профилактика и меры борьбы. В репродукторных и племенных
хозяйствах обследуют свиноматок и поросят старше 3 мес. При
наличии инвазии маток дегельминтизируют за 30 сут до опороса
однократно. Животных старше 3 мес обрабатывают перед перево-
дом в лагеря и постановкой на стойловое содержание. Ремонтный
молодняк дегельминтизируют дважды: в 5- и 6-месячном возрасте.
Общие профилактические мероприятия идентичны таковым при
аскариозе свиней.
9.5.4. ОЛЛУЛАНОЗ СВИНЕЙ
Оллуланоз — заболевание свиней, вызываемое нематодами из
семейства Ollulanidae подотряда Strongylata.
Локализация — просвет желудка и толща слизистой оболочки
его, выводные протоки желез желудка, а также 12-перстная киш-
ка.
Распространение. Заболевание достаточно широко наблюдается
на территории Российской Федерации. Патогенное влияние нема-
тод выражается в том, что нарушается секреторная функция же-
лудка и 12-перстной кишки. Резко понижается уровень перевари-
вания пищи и всасывания конечных мономеров. Животные худе-
ют, отстают в росте и развитии.
Возбудители. Ollulanus tricuspis и О. suis — мелкие нематоды
длиной 0,7—1,3 мм, шириной 0,03—0,04 мм. Тело свернуто спира-
леобразно или в кольцо. Кутикула продольно и поперечно исчер-
чена. Самец имеет две короткие спикулы равной величины, раз-
двоенные на конце на острую и притупленную ветви. У самки
матка и яичник одинарные. Вульва расположена на задней части
тела. Яйца размером 0,03—0,061 мм.
Биология развития. Оллуланусы развиваются без смены хозяев
(по эндоциклу), т. е. все стадии развития происходят в одном и
том же хозяине. У половозрелой самки в матке содержится два-
пять яиц, в которых через сутки образуются личинки. Они вылуп-
ляются и в матке гельминта дважды линяют, после чего выделяют-
ся из нее. В желудке хозяина личинки подвергаются дальнейшей
метаморфозе и за 10 сут достигают половой зрелости, а на 11-е
270
сутки у самок уже формируются в матке яйца и личинки
(рис. 114).
Вид О. tricuspis — общий для кошек, свиней, львов, красной
лисицы, тигра, гепарда.
Эпизоотологические данные. Источник распространения инва-
зии — больные свиньи, кошки. Способствуют заражению скучен-
ное содержание свиней, формирование разновозрастных групп и
круглогодичное стойловое содержание. В Новосибирской области
экстенсивность инвазии взрослых свиней 60,2 %, откормочни-
ков — 2,8, поросят 5—6 мес — 2,2, поросят 2—4 мес — 0,4 %. У по-
росят до 2-месячного возраста оллуланусы не были обнаружены.
Интенсивность инвазии колебалась от единиц до 100 тыс. экз. и
более. У свиноматок после четвертого опороса инвазия идет на
убыль. Заслуживает внимания то, что поголовье частного сектора
оказалось благополучным по гельминтозу. От сезона года заражае-
мость животных особо не зависит, хотя к концу лета заболевание
прогрессирует.
Как низкие, так и высокие (30 °C и выше) температуры отрица-
тельно влияют на жизнеспособность гельминтов во внешней сре-
де. На каменной, деревянной и бетонной поверхностях при 5—
10 °C гельминты погибают за 4—5 сут. Выживаемость их повыша-
ется при антисанитарных условиях и высокой влажности.
В разных странах мира у плотоядных животных паразитируют
специфические виды гельминтов.
Патогенез и симптомы болезни. Оллуланусы, паразитируя в сли-
зистой оболочке желудка, особенно в его фундальной части, ока-
зывают механическое и аллергическое влияние. На этих местах
возникают эрозии, воспалительные процессы. Нарушается секре-
торная функция желудка.
При экспериментальном заражении 30—40-дневных поросят
дозой личинок 16 тыс. экз. у животных отмечали беспокойство,
вялость и вздрагивания. Появлялась болезненность мышц в облас-
ти живота, нарушалось пищеварение, кал приобретал гнилостный
запах. На 2-е сутки поросята отказывались от корма, на поверхно-
сти языка появлялся белый налет. В этот период возможен падеж.
В дальнейшем у поросят бледнеют слизистые оболочки, взъеро-
шивается щетина, заметно снижается аппетит, больные отстают в
росте и развитии.
При хроническом течении инвазии у животных отмечают час-
тые позевывания, слюнотечение, рвоту. С рвотной массой выделя-
ется значительное число гельминтов.
От больных свиноматок поросята рождаются небольшой массы
и слабой жизнеспособности.
Диагностика. При жизни поставить диагноз трудно. Поэтому
точный диагноз ставят после убоя, исследуя содержимое желудка,
12-перстной кишки и слизистые оболочки этих органов. Пробы
слизистой оболочки дна желудка берут при помощи ножниц Ку-
271
Рис. 114. Биология развития О. suis:
1 — самка; 2 — хвостовой конец личинки самца; 3 — половая бурса самца; 4 — возбудители в
слизистой оболочке желудка свиньи; 5 — возбудители в 12-перстной кишке
пера или ножом. Фиксируют в баночке с жидкостью Барбагалло.
Используют компрессорный метод, для чего выпрямляют иголка-
ми исследуемый материал и зажимают пластинки до отказа. Ис-
следование проводят под микроскопом МБС при отраженном све-
те и увеличении х16 или в трихинеллоскопе.
Можно использовать метод переваривания, для чего готовят
желудочный сок с содержанием 1 % соляной кислоты и 3 % пепси-
на. В колбу с 15—30 г материала из желудка заливают желудочный
сок температурой 35—39 °C в соотношении 1:15 — 1:20. Содер-
жимое колбы постоянно помешивают в течение 25 мин и более
(до переваривания). Затем материал переносят в 1—2-литровые
стаканы с теплой (35—39 °C) водой на 15—20 мин. Верхний слой
сливают, а осадок изучают под микроскопом.
Лечение. Н и л в е р м дают свиноматкам, животным на дора-
щивании и откорме в дозе 7 мг на 1 кг массы тела 3 дня подряд,
поросятам до 2 мес — 5 мг на 1 кг массы тела 5 дней без перерыва.
Тетрамизол гранулят назначают с кормом группо-
вым методом в дозе 10 мг д. в. на 1 кг массы тела однократно.
Левамизол эффективен в дозе 7 мг на 1 кг массы тела при
однократной даче.
Фенбендазол (панакур) применяют взрослым в дозе
10 мг двукратно, поросятам до 2 мес — 2,5, а молодняку старше
2 мес — 5 мг на 1 кг массы тела 3 дня подряд.
Вермитан (албендазол, 2,5%-ная эмульсия) приме-
няют в смеси с кормом в дозе 5 мг д. в. на 1 кг массы тела 2 дня
подряд.
И в о м е к (ивермектин) взрослым свиньям дают в дозе 0,5 мг,
животным отъемного возраста, а также на доращивании и откор-
ме — 0,3 мл на 1 кг живой массы тела подкожно однократно.
Профилактика и меры борьбы. С целью профилактики новые
свинофермы следует укомплектовывать животными из благопо-
лучных групп. Свиноматок дегельминтизируют в первой половине
супоросности. Рвотные массы убирают. Станки обезвреживают
3%-ными растворами гидроксида натрия или калия, раствором
ксилонафта. Свиноматок дегельминтизируют 2 раза в год: перед
случкой и за месяц до опороса. Поросят обрабатывают в возрасте
30 сут или 2—3 мес.
Строго запрещен доступ к свиноферме и местам приготовления
корма собак и кошек, ибо О. tricuspis одинаково опасен для собак,
кошек и свиней.
9.5.5. АМИДОСТОМОЗ ГУСЕЙ
Амидостомоз вызывает нематода подотряда Strongylata семей-
ства Amidostomatidae.
Локализация — под кутикулой мышечного желудка домашних и
диких гусей.
273
Распространение. Регистрируют заболевание повсеместно.
Возбудитель. Amidostomum anseris — тонкая средней величины
нематода длиной 10—20 мм, розового цвета. В ротовой полости
находятся три острых зуба. У самцов имеются трехлопастная хвос-
товая бурса, две одинаковой величины спикулы и рулек желтого
цвета. Вульва самок покрыта большим кутикулярным клапаном.
Яйца крупные — (0,1—0,12) х (0,05—0,06) мм, овальные, серые.
Биология развития. Выделившиеся во внешнюю среду яйца па-
разита развиваются. Внутри их формируются личинки первой ста-
дии, которые дважды линяют и в период вылупления (через 7—
10 сут) становятся инвазионными (рис. 115). Гуси заражаются при
заглатывании с травой, кормом или водой инвазионных личинок
амидостомумов, проникающих под кутикулу мышечного желудка.
Через 21—28 сут инвазионные личинки в желудке гуся становятся
взрослыми паразитами.
Эпизоотологические данные. Гуси заражаются в любом возрас-
те, но высокая интенсивность инвазии чаще наблюдается у 1—4-
месячных гусят. Птица инвазируется в теплый период года на
низинных пастбищах, неблагоустроенных выгульных двориках и
в птичниках, загрязненных инвазионными личинками амидосто-
мумов.
Патогенез и симптомы болезни. Амидостомумы оказывают вы-
раженное механическое и антигенное действие на организм, в ре-
зультате чего нарушается пищеварение. Больные гусята малопод-
вижны, слабо покрыты перьями, отстают в росте и развитии. При
смешанной инвазии (амидостомоз + гангулетеракиоз) обостряется
и осложняется течение каждого из заболеваний. Часты случаи па-
дежа гусят.
Диагностика. Диагноз ставят на основании исследования фека-
лий по методу Фюллеборна и вскрытия трупов гусей. При вскры-
тии павших от амидостомоза гусей в мышечном желудке обнару-
живают множественные кровоизлияния, под кутикулой отложе-
ние кровяного пигмента, изъязвление слизистой оболочки. На по-
раженных участках желудка находят многочисленных
амидостомумов. Однако нами установлено, если гусей к зиме пе-
реводят на концентратный тип кормления, то амидостомумы пе-
реселяются в железистый желудок.
Лечение. Нилверм задают гусям с кормом в соотношении
1 :30 или в форме тетрамизола гранулята 20%-ного в дозе 0,04 г
д. в. на 1 кг массы тела групповым способом однократно в утрен-
нее кормление.
П иперазин (адипинат, фосфат, сульфат, гексагидрат) на-
значают в разовой дозе 1 г на 1 кг массы тела групповым способом
в смеси с кормом в соотношении 1 : 10 в утреннее кормление 3 дня
подряд. Для улучшения поедаемости препарата смесь сдабривают
сывороткой молока или обезжиренным молоком.
Высокую эффективность получают от применения ф е н -
274
Рис. 115. Биология развития A. anseris:
1 — головной конец нематоды; 2 — хвостовой конец самца; 3 —
неинвазионное яйцо; -/ — инвазионное яйцо; 5—инвазионная
личинка
бендазола с кормом внутрь однократно в дозе 15 мг на 1 кг
массы тела.
Ивомек мелкогранулированный дают с кормом внутрь од-
нократно в дозе 0,2—0,3 мг на 1 кг массы тела.
Пиаветрин назначают внутрь с кормом в дозе 1 г на 1 кг
массы тела 2 дня подряд.
Профилактика и меры борьбы. В неблагополучных гусефермах
молодняк необходимо содержать изолированно на свободных от
инвазии выгулах. Не рекомендуется выпасать птиц на низинных
увлажненных пастбищах. Откормочное поголовье содержат строго
275
изолированно от птиц других направлений продуктивности. Вы-
гульные площадки желательно иметь с твердым покрытием. При
выращивании птиц на глубокой несменяемой подстилке помеще-
ния убирают после каждой партии.
Профилактические дегельминтизации осуществляют через ме-
сяц после перевода гусей на зимнее содержание и весной за месяц
до выгона на пастбище или водоемы. Вынужденное лечение про-
водят в любое время года.
. 9.5.6. АНКИЛОСТОМАТИДОЗЫ ПЛОТОЯДНЫХ
Унцинариоз и анкилостомоз плотоядных вызывают нематоды
подотряда Strongylata семейства Ancylostomatidae. Заболевание ха-
рактеризуется нарушением пищеварения и нередко поражением
кожи.
Локализация — тонкая кишка.
Распространение. Унцинариоз распространен почти повсемест-
но, анкилостомоз чаще всего встречается в районах с теплым и
влажным климатом (на юге и Дальнем Востоке).
Возбудители. Uncinaria stenocephala — светло-желтого цвета,
длиной до 16 мм. Довольно большая ротовая капсула снабжена
двумя хитиновыми пластинами (зубами). На хвосте самца распо-
ложены трехлопастная бурса и две одинаковые спикулы. У самки
на кончике хвоста есть острый шипик (рис. 116).
Ancylostoma caninum — длиной до 21 мм. Большая ротовая кап-
сула снабжена двумя хитиновыми пластинками, на краях которой
выступают три крючковидных зуба (рис. 117). Яйца у обеих нема-
тод серые, овальные, размером (0,06—0,08) х (0,04—0,05) мм,
внутри — бластомеры.
Биология развития. Дефинитивные хозяева нематод — собаки,
кошки, лисицы, песцы, еноты и морские котики (для унцинарий).
Личинки в яйцах анкилостоматид во внешней среде линяют дваж-
ды и при 15—30 °C становятся инвазионными за 7—14 сут. Зараже-
ние животных происходит двумя путями: перорально при заглаты-
вании инвазионных личинок с кормом и облизывании кормушек,
предметов ухода, стен и т. д.; активным внедрением личинок через
кожу животных. Далее они проникают в кровеносные сосуды, за-
носятся в правый желудочек сердца и по малому кругу кровообра-
щения попадают в легкие, бронхиолы, трахею и заглатываются со
слюной. В тонком кишечнике унцинарии достигают половой зре-
лости за 12—23 сут, анкилостомы — за 14—16 сут. Анкилостомати-
ды при заражении зверей через кожу развиваются на 4—6 сут доль-
ше, чем при заражении через рот. Паразиты в организме плотояд-
ных живут 1—2 года.
Эпизоотологические данные. Унцинариоз распространен во всех
зонах, анкилостомоз — в районах с теплым и влажным климатом.
Лисята заражаются в 1,5—2-месячном возрасте. Нередко отмечают
276
Рис.116. Морфология U. stenocephala:
1 — в натуральную величину; 2 — головной конец паразита; 3 —
хвостовой конец самца; 4— яйцо
гибель молодняка котиков на Южном Сахалине (остров Медный),
где лежбищем служит песчаный берег. На лежбище с крупным
гравием животные не заражаются. Носители инвазии — в основ-
ном взрослые животные. В северной и средних зонах страны яйца
и личинки анкилостоматид не перезимовывают.
Патогенез и симптомы болезни. При миграции личинок через
кожу травмируется большое количество мелких кровеносных со-
судов, тканей и органов. Одновременно происходит инокуляция
различного рода микроорганизмов. Взрослые гельминты мощной
ротовой капсулой прикрепляются к слизистой оболочке и зубами
сильно ее травмируют.
277
Рис. 117. Морфология A. caninum:
1 — в натуральную величину; 2,3 — головной конец с вент-
ральной и латеральной сторон; -/—бурса самца; 5 —хвос-
товой конец самки; 6 — яйцо
Данные гельминты — гематофаги. Железы, находящиеся в ро-
товой полости, вырабатывают секрет, гемолизирующий кровь.
У больных животных аппетит понижен, извращен, отмечают
понос, иногда запор, в фекалиях кровь. Слизистые оболочки ане-
мичны, шерсть тускнеет и становится ломкой, молодняк задержи-
вается в росте и развитии и нередко погибает.
Диагностика. При жизни диагноз ставят по методу Фюллебор-
на, после смерти — по обнаружению анкилостоматид.
Лечение, профилактика и меры борьбы. Такие же, как при аска-
ридатозах собак и пушных зверей.
278
9.5.7. ДИРОФИЛЯРИОЗ ПЛОТОЯДНЫХ
Дирофиляриоз собак и пушных зверей вызывают круглые гель-
минты подотряда Strongylata семейства Filariidae.
Локализация — нематоды — в правом желудочке сердца и пред-
сердии, реже — в левом желудочке легочной артерии; личинки — в
кровеносных сосудах, а в вечернее время чаще в периферической
крови.
Распространение. Инвазия распространена на Дальнем Востоке
и в южных районах.
Возбудитель. Dirofilaria immitis — гельминт светло-желтого
цвета, сужающийся к обоим концам. Поверхность тела снабжена
продольными гребнями. Ротовое отверстие маленькое, пищевод
цилиндрический. Длина самца 120—180 мм, самки 250—300 мм,
ширина 1,124—1,286 и 0,75—1,514мм соответственно. Самец
имеет две неравные спикулы. Хвостовой конец самки закруглен,
анус открывается субтерминально (рис. 118). Личинки (микроди-
рофилярии) длиной 0,22—0,28 мм, шириной 0,005—0,007 мм
(рис. 119).
Существует и другой вид — D. repens. Длина самца 18—70 мм,
самки 100—170 мм. Паразитируют под кожей собаки и даже чело-
века.
Биология развития. Дефинитивные хозяева дирофилярий — со-
бака, волк, лисица и другие плотоядные, промежуточные — кома-
ры родов Anopheles, Culex, Aedes. Самки, постоянно циркулируя в
крови, продуцируют личинок, которые в большом количестве
скапливаются в периферической крови, в основном вечером и но-
чью. Именно в это время максимально активизируются комары,
которые, всасывая кровь, заглатывают личинок. Личинки в орга-
низме комаров достигают инвазионности за 10—12 сут. При по-
вторном кровососании личинки из комаров попадают в организм
животного. Из глубины кожи они мигрируют лимфогенным и ге-
матогенным путями к месту локализации гельминтов. Этот про-
цесс миграции у собак продолжается 85—120 сут. Гельминты дос-
тигают половой зрелости за 8—9 мес, а продолжительность жизни
составляет 2—3 года.
Эпизоотологические данные. D. repens кроме плотоядных пара-
зитирует под кожей у человека в центральных районах Нечернозе-
мья, Красноярского края и на Украине.
Начало заражения собак совпадает с лётом комаров и заканчи-
вается поздно осенью. В силу того что личинки гельминта в крови
животных мигрируют до 120 сут и более (до 2 лет, если не прошли
через организм комара), создаются оптимальные условия кон-
такта их с комарами. По некоторым сообщениям, у молодых собак
(до 1 года) личинок в крови не обнаруживают. При массовом зара-
жении комары погибают от инвазии.
Патогенез и симптомы болезни. Дирофилярии, скапливаясь в
279
Рис.118. Биология развития D. immitis:
1 — лирофилярии в сердце собаки; 2— головной конец гельминта; 3— хвостовой конец
самки; 4 — хвостовой конец самца; 5— яйца и личинки комара; 6 — комары и блоха
большом количестве в правом желудочке сердца, предсердии и ле-
гочной артерии, резко нарушают кровоток в организме, в резуль-
тате чего наступает асфиксия. Продукты метаболизма, выделяясь в
кровь, обусловливают аллергию. D. repens в области головы и на
лапах вызывает участки поражения в виде папулезного дерматоза.
Отмечают частый сухой кашель, учащенное дыхание, исхудание и
апатичность. При интенсивном заражении у больных отмечают
отеки и водянки полостей. Поражается нервная система, наблю-
даются парезы и искривления шеи. Больные животные часто по-
гибают при физической нагрузке.
280
Диагностика. Диагноз ставят комплексно с учетом эпизоотоло-
гии и симптомов болезни. Решающим при этом является обнару-
жение личинок в периферической крови. Для исследования берут
кровь, лучше в вечернее время, и разводят ее физиологическим
раствором 1 :2. Изучают под микроскопом. Готовят также и тол-
стые мазки крови, красят их по Романовскому—Гимзе и исследу-
ют под микроскопом. Посмертно вскрывают сердце и легочную
артерию.
Лечение и профилактические меры борьбы. Применяют химио-
профилактику, направленную против мигрирующих личинок, т. е.
через 20—25 сут с начала нападения комаров подкожно вводят
ивомек в дозе 1 мл на 50 кг массы тела 3 раза с промежутками
30 сут.
Зарубежные авторы рекомендуют применять дихтилкар-
бамазинцитрат в дозе 5 мг на 1 кг массы тела ежедневно
после кормления со дня поступления собаки в неблагополучную
зону. Дачу препарата прекращают через 60 сут после выхода из
этой зоны. В неблагополучной же зоне дачу препарата прекраща-
ют через 60 сут после снижения активности лёта комаров.
Рис.119. Личинка дирофилярии из крови собаки (увеличено,
но Капустину)
281
Рекомендуют применять тиабендазол, мебендазол,
арсенамид, филарсен и др.
Для защиты собак от комаров применяют отпугивающие пре-
параты (растворы перметринов). Личинок комаров уничто-
жают 0,005—0,02%-ной водной эмульсией дифоса из расчета 20—
50 г д. в. на 1 га площади, сульфидофоса — 40—100 г на 1 га, бакто-
кулицида — 0,5—2 кг на 1 га.
9.5.8. ДИКТИОКАУЛЕЗЫ ЖВАЧНЫХ
Диктиокаулезы жвачных вызываются паразитированием в
бронхах и трахее специфических нематод подотряда Strongylata се-
мейства Dictyocaulidae.
Локализация — средние и крупные бронхи, реже — трахея.
Распространение. Диктиокаулезы встречаются во всех зонах
страны и приурочены к теплым сезонам года. Особо неблагопо-
лучны по инвазии предгорно-горные районы и лесная зона евро-
пейской части Российской Федерации.
Возбудитель. Dictyocaulus filaria паразитирует у овец, коз, верб-
людов, некоторых диких жвачных, D. viviparus — у крупного рога-
того скота, D. eckerti — у северных оленей, лосей, маралов и ко-
суль.
Диктиокаулюсы — довольно крупные, светло-серого, молочно-
го или слабого соломенно-желтоватого цвета гельминты. Хвосто-
вой конец самцов снабжен развитой половой бурсой, поддержива-
емой ребрами.
D. filaria молочно-серого цвета. Самцы длиной 30—80 мм, сам-
ки—50—150мм. Две равные по величине спикулы у самцов по
форме похожи на чулок, интенсивно-коричневые, сетчатой струк-
туры.
D. viviparus слабо-желтого цвета. Самцы длиной 17—44, сам-
ки — 23—73 мм. Спикулы самцов буровато-желтые, более прямые,
имеется рулек— дополнительный орган между спикулами. Яйца
диктиокалюсов примерно равны по размеру (0,112—0,138) х
х (0,069—0,09) мм, светло-серого цвета, овальной формы, содер-
жат сформированную личинку (рис. 120).
Биология развития. Диктиокаулюсы в бронхах жвачных откла-
дывают яйца с личинками, которые затем во время кашля вместе с
мокротой попадают в рот и заглатываются. В тощей кишке из яиц
вылупляются личинки первой стадии, которые вместе с фекалия-
ми выделяются наружу. При благоприятной температуре (16—
28 °C), достаточной влажности и наличии кислорода личинки пос-
ле двукратной линьки становятся инвазионными: D. filaria через
5—8 сут, D. viviparus через 3—5 сут. При температуре ниже 10 °C
личинки диктиокаулюсов развиваются более продолжительное
время.
282
Рис.120. Морфология D.vivipanis:
7 — передний конец тела; 2— хвостовой конец самки; 5 — спикулы;
/—яйцо; 5—бурса самца
Животные заражаются при проглатывании инвазионных личи-
нок диктиокаулюсов вместе с кормом или водой. В дальнейшем
по лимфатической и кровеносной системам из кишечника личин-
ки попадают в легкие, затем в альвеолы и бронхи. Половозрелой
стадии диктиокаулюсы у крупного рогатого скота достигают через
21—28 сут, у овец — через 28—30 сут. Эти нематоды паразитируют
в органах дыхания жвачных от 2 до 6 мес, у истощенных живот-
ных — более 1 года.
Эпизоотологические данные. С наступлением осенне-зимних
холодов диктиокаулюсы временно перестают выделять яйца, на-
ступает половая депрессия. При хорошей упитанности и нали-
чии иммунитета осеннее заражение у животных протекает латен-
тно (скрыто). Однако весной при снижении естественной резис-
тентности у животных (плохие условия кормления и содержа-
ния) личинки, находящиеся в лимфоузлах в «дремлющем»
состоянии, пробуждаются и мигрируют в легкие, вызывая брон-
хопневмонию.
Источник инвазии — взрослые овцы и крупный рогатый скот, у
которых инвазия протекает суб клинически. Источники зараже-
ния — трава на пастбищах, прикошарной территории и выгулах,
неблагополучные водоемы и др.
Животные в средней полосе России могут заражаться с мая по
15—20 октября, но максимум инвазии приходится на август—сен-
тябрь. На юге и в Средней Азии летом животные заражаются в ос-
новном на летних горных и высокогорных пастбищах, осенью —
на низинных. В Нечерноземье личинки фактически достигают
инвазионное™ в апреле за 10—15 сут, в мае —за 8—10, в июне,
июле и августе — за 6—8, в сентябре —за 12—15, в октябре —за
20—25 сут.
Патогенез и симптомы болезни. Диктиокаулез — заболевание
всего организма. В период массового проникновения личинок в
слизистую оболочку кишечника развиваются острые катаральные
и катарально-геморрагические энтериты. В связи с этим наруша-
ется секреторно-моторная функция пищеварительного канала.
Мигрирующие личинки, достигнув легких, временно застревают в
капиллярах альвеол, в них возникают тромбозы, тромбоэмболии и
кровоизлияния. В последующем в местах локализации личинок
стенка капилляра атрофируется, и они проваливаются в альвеолы.
Личинки постепенно продвигаются в бронхиолы и бронхи. На
продукты обмена гельминтов и их механическое воздействие сли-
зистая оболочка бронхов реагирует остро. Это сопровождается
обильным выделением слизи. В мелких бронхах диктиокаулюсы
вместе со слизью образуют пробки, приводящие к образованию
ателектазов.
В соответствии с развитием патогенеза, болезни вначале отме-
чают сухой болезненный кашель, переходящий во влажный. Из
носовой полости выделяется серозно-слизистое истечение, дыха-
284
ние поверхностное и учащенное. Под влиянием гельминтов эпи-
телиальные клетки бронхов разрушаются, скапливается слизь, и в
этой среде развивается гноеродная микрофлора, что обусловлива-
ет гнойную бронхопневмонию. У молодняка крупного рогатого
скота затрудняется дыхание, животные дышат с открытым ртом,
язык заметно высовывается, с него стекает густая слизь.
Диагностика. Диагноз ставят на основании комплексных иссле-
дований с учетом эпизоотологии, симптомов болезни и лабора-
торных данных. При исследовании необходимо принимать во
внимание особенности биологии (половая депрессия) и эпизоото-
логии (латентное течение и др.). Для исследования из прямой
кишки животных берут 3—5 г фекалий. Изучают пробы в тот же
день, а при отсутствии такой возможности хранят их в холодиль-
нике (4—5 °C) до следующего дня.
Посмертно диктиокаулез диагностируют путем вскрытия лег-
ких. Устанавливаются патологические изменения — бронхиты,
бронхопневмонии, эмфиземы и ателектазы по краям диафраг-
мальных долей.
Диктиокаулез у 4—5-месячных телят следует дифференциро-
вать от крупозной пневмонии, которая сопровождается высокой
температурой и характеризуется стадийностью течения (притуп-
ление, тимпанический звук и норма). Кроме того, при диктиока-
улезе в основном поражены каудальные доли, при бронхопнев-
мониях незаразной этиологии — передние доли легких. .При
пневмониях незаразного характера наблюдается лейкоцитоз, ви-
русного происхождения — лимфоцитоз, при гельминтозах —
эозинофилия.
Личинки диктиокаулюсов первой стадии (у овец) на переднем
конце имеют бугорчатое утолщение, их длина 0,5—0,54 мм, длина
личинок других легочных гельминтов (протостронгилид) 0,27—
0,345 мм. У личинок мюллерий хвост снабжен дорсальным ши-
пом, у протостронгилюсов — волнообразно изогнут, у цистокау-
люсов кишечник пигментирован и хвост с шипом (рис. 121). Ли-
чинки диктиокаулюсов крупного рогатого скота длиной 0,31—
0,36 мм, передний конец закруглен, хвостовой заострен. Средняя
часть заполнена сероватыми зернами — глыбками, передний и
хвостовой концы остаются свободными, поэтому они светлые.
Для изучения морфологии личинок диктиокаулюсов и других
нематод их обездвиживают.
Личинок диктиокаулюсов можно дифференцировать от других
нематод, если внести в исследуемый осадок одну-две капли 0,1 %-
ного водного раствора метиленовой сини. Через 20—30 с они ок-
рашиваются в ярко-сиреневый цвет.
Лечение. Для дегельминтизации мелкого и крупного рогатого
скота применяют одни и те же химиопрепараты.
Н и л в е р м дают овцам и козам в виде 5—10%-ных стериль-
ных водных растворов или порошка в смеси с кормом. Раствор
285
1 — D. filaria первой стадии; 2— D. viviparus; 3 — Protostrongylus hobmaieri; 4— Mullerius
capillaris; 5— Cystocaulus nigrescens
препарата стерилизуют на водяной бане и употребляют в свежем
теплом (35—37 °C) виде. Доза — 15 мг на 1 кг массы тела однократ-
но подкожно в область шеи, подлопаточную область или внутрь.
Слабым животным назначают в дозе 0,01 г на 1 кг массы тела дву-
кратно 2 дня подряд внутрь или подкожно. В виде кормолекар-
ственной смеси нилверм или тетрамизол гранулят
20%-ный назначают в дозе 0,01 г д. в. на 1 кг массы тела двукрат-
но с интервалом 24 ч. Смесь готовят в соотношении 1 : 700 (пре-
парат: комбикорм) и скармливают 100—150 животным одного
возраста.
Крупному рогатому скоту нилверм дают внутрь в дозе 0,01 г на
1 кг массы тела двукратно с интервалом 24 ч в виде 1%-ного вод-
ного раствора. Смесь с кормом готовят и скармливают так же, как
286
и овцам, но количество животных с одинаковой живой массой
должно быть равно 10.
Тетрамизол гранулят 20%-ный применяют индиви-
дуально или групповым методом двукратно с интервалом 1—5 сут
в дозах: телятам до 100 кг — 0,75 г на 10 кг, более 100 кг — 0,5 г на
10 кг массы тела. Максимальная разовая доза препарата не должна
превышать 15 г (3 г по д. в.).
Фенбендазол (панакур) назначают овцам и козам
при субклиническом течении через рот однократно в дозе 5 мг
д. в. или 23 мг панакура гранулята на 1 кг массы тела, при клини-
чески выраженном течении — 15 и 68 мг соответственно.
Крупному рогатому скоту препарат дают однократно через рот
в дозе 10 мг д. в. или 45 мг панакура гранулята 20%-ного на 1 кг
массы тела. Антигельминтик животные получают индивидуально
или в смеси с комбикормом.
Фебантел (ринтал) назначают овцам и козам в дозах
10 мг д. в. или 100 мг в форме гранулята на 1 кг массы тела. Круп-
ный рогатый скот получает препарат индивидуально или группо-
вым методом с концентрированными кормами в дозе 7,5 мг д. в. и
75 мг 10%-ного гранулята на 1 кг массы тела.
Дитразина цитрат овцам и козам вводят в виде 25%-
ного стерильного водного раствора в дозе 4 мл на 10 кг массы тела
(сухого вещества 0,1 г на 1 кг) подкожно двукратно с интервалом
24 ч. Этот же раствор назначают крупному рогатому скоту в дозе
2 мл на 10 кг (сухого вещества 0,05 г на 1 кг) подкожно или внут-
римышечно трехкратно (на 1, 2 и 4-й день).
Локсуран овцам и козам дают в дозе 2,5 мл на 10 кг массы
тела подкожно двукратно с интервалом 24 ч. Доза для крупного
рогатого скота составляет 1,25 мл на 10 кг массы тела подкожно
или внутримышечно на 1, 2 и 4-й день.
И в о м е к (1%-ный раствор) для инъекций под кожу содер-
жит ивермектин — активно действующее вещество. Крупному ро-
гатому скоту, овцам и козам его дают из расчета 0,2 мг на 1 кг мас-
сы тела.
Можно также пользоваться раствором йода в соответствии с
инструкцией. Применяются еще ряд препаратов: левамизол,
урсолевамизол, албендазол, мебендазол, ок-
сифендазол, цидектин, дектомакс и др.
Профилактика и меры борьбы. Для ликвидации диктиокаулеза
жвачных в неблагополучных хозяйствах проводят ряд мероприя-
тий:
сменяют пастбища в зависимости от сезона года с учетом био-
логии развития личинок;
отдельно содержат телят на благополучных пастбищах;
применяют изолированное стойлово-выгульное выращивание
телят (из расчета 25 м2 на теленка).
Животных поят водой из колодцев или привозят ее из благопо-
287
лучных мест. Свежую траву для телят доставляют с участков, где
не выпасался зараженный диктиокаулезом скот. Поголовье по-
полняют после карантинирования и обследования вновь поступа-
ющих животных.
Телят текущего и молодняк прошлого года рождения исследу-
ют гельминтоларвоскопическим методом выборочно (примерно
10 % поголовья) первый раз через 40—50 сут после выгона на паст-
бище, затем каждые 15—20 сут до конца выпаса. На пастбищах
места водопоя благоустраивают, засыпают берега гравием.
Овец выборочно исследуют весной за 20 сут до выгона на паст-
бище, ягнят и козлят — во второй половине июля и в августе.
Осенью после комплектования отар исследуют примерно 10 %
поголовья. При обнаружении инвазии животных дегельминтизи-
руют.
С целью химиопрофилактики ежедневно мелкому рогатому
скоту скармливают фенотиазиносолевую смесь (1 :9). Длитель-
ность и сезон скармливания определяют на местах с учетом био-
логии гельминтов и эпизоотологии заболевания.
9.5.9. ПРОТОСТРОНГИЛИДОЗЫ МЕЛКИХ ЖВАЧНЫХ
Протостронгилидозы— заболевания, вызываемые нематодами
многих видов семейства Protostrongylidae и характеризующиеся
поражением лимфатической системы и легочной ткани.
Локализация — мельчайшие бронхи, бронхиолы, под плеврой
легкого (мюллериусы), в мелких и средних бронхах (протострон-
гилюсы).
Распространение. Заболевания встречаются в различных сочета-
ниях во многих регионах нашей страны, но преимущественно в
южных и юго-восточных зонах (Кавказ, Средняя Азия, Казах-
стан).
Возбудители. Miillerius capillaris (вызывает мюллериоз) — тон-
кие нематоды. Самцы длиной 11—26 мм, самки — 18—30 мм. Две
спикулы у самцов имеют гребенчатое строение. Яйца буро-корич-
невые, размером (0,084—0,104) х (0,028—0,04) мм.
Во внешнюю среду выделяются личинки длиной 0,27—0,31 мм,
на хвостовом конце имеется шип.
Protostrongylus kochi (имеются еще пять видов) (вызывает про-
тостронгилез) — тонкие коричневые гельминты. Самцы длиной
24,3—30,0 мм, самки — 28—40 мм. Спикулы губчато-гребенчатые,
темно-коричневые. Самки откладывают яйца, в которых быстро
формируются личинки (рис. 122).
Биология развития. Протостронгилиды — биогельминты, раз-
виваются с участием промежуточных хозяев — наземных мол-
люсков более 20 видов, представителей родов Helicella, Limax,
Zebrina и др.
288
Рис. 122. Морфология протостронгилид овец и коз (по Боеву и Андреевой):
1 — протостронгилюсы (Protostrongylus kochi); 2— цистокаулы (С. nigrescens); 3— мюллерии
(М. capillaris); а — хвостовые бурсы самцов, опорный аппарат заштрихован; 6 — спикулы слева
и рулек справа (Г—головка рулька; Г—тело; Я—ножки); в —хвостовые концы самок
Во внешнюю среду с фекалиями дефинитивных хозяев (овцы,
козы, серны, муфлоны и др.) выделяются личинки. При контакте
с наземными моллюсками личинки первой стадии развития ак-
тивно внедряются в их ножку, затем в тело, где через 14—42 сут
после двукратной линьки становятся инвазионными. Защищен-
ные двумя чехликами, они могут покидать тело моллюсков и вы-
ползать на траву. Мелкие жвачные заражаются при проглатыва-
нии инвазионных моллюсков либо при поедании травы с инвази-
онными личинками этих нематод. Личинки третьей стадии, попав
в кишечник овец и коз, лимфогематогенным путем заносятся в
легкие, где через 2—2,5 мес становятся половозрелыми.
Эпизоотологические данные. У взрослых коз и овец нередко на-
блюдается высокая интенсивность и экстенсивность инвазии. У
молодняка мелкого рогатого скота до 3-месячного возраста прото-
стронгилидозы не регистрируют. Максимальная зараженность ли-
чинками протостронгилид наземных моллюсков отмечена летом и
осенью. Часть личинок гельминтов в осенний период покидает
моллюсков и заползает на траву. На культурных пастбищах назем-
ных моллюсков фактически нет.
У коз экстенсивность инвазии достигает 100 %, у овец —59,3 %.
В Казахстане пик инвазии приходится на октябрь. На Кавказе и в
Азербайджане максимум протостронгилидозов регистрируют в
феврале—марте.
Патогенез и симптомы болезни. Болезнетворное действие возбу-
дителей протостронгилидозов в основном складывается из меха-
нического, антигенного и инокуляторного влияния и зависит от
интенсивности инвазии, локализации паразитов и общего состоя-
ния организма овец и коз. Мюллериусы вызывают плевриты и
пневмонии, протостронгилюсы — бронхиты. У больных животных
наблюдаются кашель, исхудание и снижение продуктивности. От-
мечается дефицит витамина А в печени.
Диагностика. Прижизненно протостронгилидозы диагностиру-
ют на основании результатов исследования проб фекалий по Бер-
ману-Орлову или по Вайду. Посмертно исследуют мелкие бронхи
и проводят компрессорное изучение пораженных участков легких
под микроскопом. При мюллериозе, как правило, в задних долях
легких обнаруживают плотные на ощупь желто-серые очаги, при
протостронгилезе — катаральное воспаление бронхов. Иногда на
наличие личинок протостронгилид под микроскопом исследуют
наземных моллюсков.
Лечение. При мюллериозе и протостронгилезе овец и коз при-
меняют в период зимнего стойлового содержания нилверм в
дозе 0,01 г на 1 кг массы тела в виде 5—10%-ных стерильных вод-
ных растворов подкожно или в виде порошка в смеси с кормом
при мюллериозе двукратно, при протостронгилезе трехкратно с
интервалами 24 ч.
Тетрамизол дают в дозе 10 мг на 1 кг массы тела с кормом
290
при мюллериозе двукратно, при протостронгилезе трехкратно с
интервалом 24 ч.
Ивомек вводят подкожно в дозе 0,2 мг на 1 кг массы тела,
фенбендазол с кормом — в дозе 20мг на 1 кг однократно,
фебантел — в дозе 20мг на 1 кг массы тела с кормом одно-
кратно.
Профилактика и меры борьбы. На пастбищах и вблизи кошар
уничтожают мелкие кустарники, сеют культурные многолетние
травы. Для уничтожения моллюсков после дождя на ограничен-
ных участках применяют 5%-ные гранулы метальдегида-аттрак-
танта. Препарат рассеивают на участке из расчета 40—60 кг на 1 га.
В лесной и лесостепной зонах до третьей декады июля животных
выпасают на одних участках, вторую половину сезона — на других.
Животных дегельминтизируют в период стойлового содержания.
9.5.10. МЕТАСТРОНГИЛЕЗЫ СВИНЕЙ
Метастронгилезы — заболевания свиней, вызываемые парази-
тированием нематод различных видов рода Metastrongylus семей-
ства Metastrongylidae и характеризующиеся поражением сосудис-
той системы, бронхов и легочной ткани.
Локализация — бронхи и трахея.
Распространение. Метастронгилезы свиней и кабанов распрост-
ранены почти повсеместно. Зараженность в отдельных районах
колеблется от 33 до 92 %.
Возбудители. В нашей стране наиболее распространены три
вида нематод: М. elongatus, М. salmi и М. pudendodectus. Мета-
стронгилюсы — белые или желтовато-белые тонкие нематоды.
Самцы достигают в длину 1,5—2,5 см, самки —2,5 см. Характер-
ные морфологические признаки — длинные нитевидные спикулы
у самцов, особенно у М. elengatus, и кутикулярный надвульварный
клапан, более крупный у М. pudendodectus. Яйца мелкие — (0,04—
0,06) х (0,03—0,04) мм, овальной формы, покрыты толстой скорлу-
пой, наружная оболочка которой мелкобугристая (рис. 123).
Биология развития. Метастронгилюсы — биогельминты. Дефи-
нитивные хозяева — свиньи, кабаны, промежуточные — дождевые
черви родов Eisenia, Bimastus и др., которые обитают в почве и на-
возе. Самки нематод откладывают яйца в просвет бронхов. С мок-
ротой яйца попадают в глотку, заглатываются, проходят желудоч-
но-кишечный канал и вместе с фекалиями выделяются во вне-
шнюю среду. В сырой почве из яиц редко выходят личинки. Дож-
девые черви вместе с почвой или навозом заглатывают яйца
(личинки) этих нематод. Личинки в черве часто внедряются в тол-
щу пищевода или его кровеносные сосуды, дважды линяют и че-
рез 11—21 сут становятся инвазионными. Свиньи заражаются при
заглатывании дождевых червей с инвазионными личинками мета-
291
1
2
3
Рис.123. Морфология метастронгилюсов:
а — хвостовые концы самок: 1 — М. elongatus; 2 — М. salmi; 3 — М. pudendotectus; б — бурсы
самцов: 1 — М. salmi; 2 — М. pudendotectus; в — нижние концы спикул: 1 — М. salmi; 2— М.
pudendotectus; г — яйцо; д — личинки метастронгилид
стронгилюсов. В пищеварительном канале животного дождевые
черви перевариваются, а освободившиеся личинки возбудителей
внедряются в слизистую оболочку кишечника, затем лимфогема-
тогенным путем заносятся в легкие и в бронхах достигают половой
зрелости через 25—35 сут.
Эпизоотологические данные. В дождливые годы метастронгиле-
зы распространены более широко. Черви родов Eisenia и Bimastus
обитают вблизи свинарников, живут 5—7 сут. Экстенсивность ин-
вазии у червей достигает 80 % при высокой интенсивности — до
900 личинок. Плотность олигохет на 1 м2 территории свинарников
может достичь 1,5 тыс. экз. Чаще и интенсивнее болеют поросята.
Инвазия нарастает постепенно, достигая максимума летом и осе-
нью. Личинки в теле червей остаются жизнеспособными до трех
лет и более.
Патогенез и симптомы болезни. Мигрирующие личинки мета-
стронгилюсов травмируют слизистую оболочку кишечника, сосу-
ды и легочную ткань. В процессе развития они выделяют продук-
ты метаболизма, которые вызывают у рольных животных аллер-
гические реакции — эозинофилию, образование в печени и лег-
ких паразитарных узелков. Взрослые паразиты оказывают
механическое, аллергическое и токсическое действие на орга-
низм свиней. У больных поросят, подсвинков и реже у взрослых
животных снижается аппетит, наблюдается бледность слизистых
оболочек, учащенное жесткое затрудненное дыхание, хрипы и
кашель. Снижается прирост массы, молодняк часто погибает (в
среднем 30 %).
Диагностика. При жизни метастронгилезы диагностируют гель-
минтоовоскопически по методу Щербовича. Эффективен метод
флотации с применением раствора аммиачной селитры. Учитывают
эпизоотологические данные и симптомы болезни. При посмертном
исследовании обращают внимание на наличие нематод в бронхах и
патологические изменения в легких. Обычно обнаруживают диф-
фузную пневмонию, альвеолярную эмфизему, бронхит и парази-
тарные узелки в слизистой оболочке толстой кишки.
Лечение. При метастронгилезах эффективен антигельминтик
нилверм в дозах: поросятам массой до 20кг —0,1г, более
50 кг — 0,25 г на животное; подсвинкам от 20 до 50 кг — 0,005 г на
1 кг массы тела с кормом 1 раз в день. Для преимагинальной де-
гельминтизации указанные дозы назначают 2 дня подряд, для ле-
чебной — 3 дня.
Фенбендазол (панаку р) дают в дозе 5 мг д. в. на 1 кг
массы тела двукратно в течение 2 сут в смеси с кормом.
Фебантел применяют в дозе 5 мг на 1 кг массы тела 1 раз в
день 2 дня подряд.
И в о м е к назначают в форме 1%-ного раствора в дозе 0,3 мг
на 1 кг массы тела подкожно однократно из расчета 1 мл на 33 кг
массы тела.
293
Профилактика и меры борьбы. Для профилактики метастронги-
лезов свиней в неблагополучных хозяйствах проводят ветеринар-
но-санитарные мероприятия. Навоз из помещений ежедневно
удаляют для биотермической обработки. Деревянные полы в сви-
нарниках должны быть без щелей. Выгульные дворики изолируют
от прилегающей территории глубокой канавой, стенки которой
строго вертикальны. Летние лагеря желательно строить на возвы-
шенных местах. Не рекомендуется выпасать свиней сразу после
дождя.
Свиней дегельминтизируют дважды: перед постановкой в стой-
ла и весной — до выгона на выгульные дворики и пастбища. Ле-
чебные обработки проводят в любое время года.
9.5.11. ТЕЛЯЗИОЗЫ КРУПНОГО РОГАТОГО СКОТА
X
Телязиозы крупного рогатого скота вызывают нематоды под-
отряда Spirurata семейства Thelaziidae. Заболевание характеризует-
ся кератоконъюнктивитами.
Локализация — конъюнктивальный мешок и третье веко
(Th. rhodesi), слезно-носовой канал и протоки слезных желез
(Th. skijabini, Th. gulosa).
Распространение. Телязиозы распространены почти повсемест-
но.
Возбудители. Телязии — гельминты желтовато-серого цвета,
длиной 1—2 см. Их различают по строению кутикулы (у
Th. rhodesi грубая поперечная исчерченность), величине ротовой
капсулы (у Th. gulosa большая ротовая капсула) и строению спи-
кул у самцов (у Th. skijabini короткие спикулы равной величины, у
паразитов других видов — неравные).
Биология развития. Телязии — биогельминты. Развиваются с
участием дефинитивных (крупный рогатый скот) и промежуточ-
ных хозяев (мухи-коровницы — Musca autumnalis, М. arnica др.).
Перезимовавшие в глазах животных самки телязий отрождают
живых личинок первой стадии, которые вместе со слезой поступа-
ют в область внутреннего угла глаза и заглатываются мухами, в
теле которых личинки 2 раза линяют и через 14—28 сут становятся
инвазионными. В момент, когда инвазированные мухи садятся на
увлажненную кожу внутреннего угла глаза или век крупного рога-
того скота, инвазионные личинки телязий через хоботок попада-
ют сначала на кожу, а затем в глаза, где растут и через 21 —42 сут
становятся половозрелыми (рис. 124). Продолжительность жизни
телязий в глазах крупного рогатого скота около 1 года.
Эпизоотологические данные. Источник распространения забо-
левания — зараженный крупный рогатый скот, который выгоняют
на пастбища без предварительной дегельминтизации. Лёт насеко-
мых в зависимости от географической зоны начинается в разное
294
Рис. 124. Биология развития телязий:
передний конец тела: 1 — Т. rhodesi; 2— Т. gulosa; 3 —Т. skrjabini; 4 — промежу-
точный хозяин с личинкой гельминта; 5 — инвазионная личинка; 6 — промежу-
точный хозяин с инвазионной личинкой
время — весной и летом. В Нечерноземье, например, насеко-
мые — промежуточные хозяева — появляются на пастбищах в пер-
вой декаде июня, в Средней Азии и Южном Казахстане — в апре-
ле, в Закавказье — в конце апреля — начале мая. Животные зара-
жаются через 14—28 сут после появления мух. Постепенно инва-
зия нарастает, достигая максимума в августе — сентябре.
Th. rhodesi во многих зонах распространена более широко, чем
телязии других видов. В последние годы установлено, что Th.
gulosa и Th. skijabini распространены в Нечерноземной зоне Рос-
295
сии шире, чем предполагали раньше. Кроме того, телязии парази-
тируют у лошадей (Th. lacrimalis), свиней (Th. erschowi) и собак
(Th. callipaeda).
Патогенез и симптомы болезни. Наиболее патогенны гельминты
вида Th. rhodesi, так как у них из-за глубокой поперечной исчер-
ченности передней части тела по краям выступают зазубрины,
сильно травмирующие слизистую оболочку глаза. Передвигаясь
по слизистой оболочке, паразиты повреждают роговицу и конъ-
юнктиву. Возникают сильное слезотечение и светобоязнь. Конъ-
юнктива воспаляется, что приводит к закрыванию век. Роговица
мутнеет, из-под'век выделяется серозно-гнойное истечение, засы-
хающее на ресницах. Глубокие дегенеративные явления в рогови-
це заканчиваются эрозией и язвами. Часты случаи прободения ро-
говицы и повреждения хрусталика. Развивается фиброзно-гемор-
рагический иридоциклит. Сильно помутневшая роговица приоб-
ретает красноватый оттенок, глазное яблоко выпячивается, сосуды
глаза сильно гиперемированы. Наиболее остро телязиоз протекает
у телят от 4 мес и старше.
Вероятно, влияние нематод двух других видов на развитие те-
лязиоза связано с механическим раздражением протоков слезных
желез и нарушением их функций.
Диагностика. Диагноз ставят по характерным симптомам болез-
ни с учетом эпизоотологических данных и обнаружения возбуди-
телей. Телязиозы следует дифференцировать от инфекционного
кератоконъюнктивита, инфекционного ринотрахеита и травм раз-
личной этиологии.
Для обнаружения Th. rhodesi исследуют жидкость, полученную
при промывании конъюнктивальной полости животного физио-
логическим раствором. Обнаружить Th. gulosa и Th. skrjabini удает-
ся путем послеубойного исследования слезно-носового канала и
выводных протоков слезных желез.
Лечение. При телязиозе, вызванном Th. rhodesi, удаляют нема-
тод из глаза путем промывания одним из дезинфицирую-
щих растворов: 0,5%-ным лизола, 2—3%-ным борной кис-
лоты, 1 : 2000 йода, 1%-ным хлорофоса. В конъюнктивальную по-
лость глаза под умеренным давлением вводят по 50—60 мл раство-
ра. Эффективна также 3%-н а я эмульсия ихтиола или
лизола на рыбьем жире в дозе 2—3 мл. После введения эмуль-
сии веки осторожно массируют. При осложненных случаях прово-
дят и симптоматическое лечение пенициллином, сульфанилами-
дами, глазными лекарственными пленками и др.
Для дегельминтизации скота, зараженного другими видами те-
лязий, применяют дитразина цитрат: вводят его двукрат-
но с интервалом 24ч подкожно в область шеи в виде 25%-ного
водного раствора в дозе 0,016 г на 1 кг массы тела.
Локсуран (40%-ный водный раствор) применяют в той же
дозе и по той же методике, что и при диктиокаулезе.
296
Ивомек назначают подкожно в область шеи в дозе 1 мл на
50 кг массы тела.
Хороший эффект получен при промывании конъюнктивальной
полости 2%-ным раствором хлорофоса.
Профилактика и меры борьбы. В неблагополучных хозяйствах
рекомендуют проводить дегельминтизацию всего поголовья, за
исключением телят текущего года рождения, перед выгоном на
пастбище и после постановки на стойловое содержание. Обраба-
тывают весь индивидуальный и арендуемый скот. Молодняк
крупного рогатого скота в жаркое время дня желательно содер-
жать в закрытых помещениях, куда не залетают мухи — промежу-
точные хозяева. Можно проводить пастбищную профилактику пу-
тем применения ушных серег, содержащих пиретроиды.
Промежуточных хозяев (мух) истребляют путем мелкодисперс-
ного опрыскивания кожно-волосяного покрова животных 2%-
ным раствором хлорофоса, 1—2%-ными эмульсиями диброма,
ДДВФ или циодрина, 1—2%-ным щелочным раствором хлорофо-
са 1 : 5 (30 мл для молодняка и 50 мл для взрослого животного) или
0,5—1%-ным раствором хлорофоса, 0,5%-ными эмульсиями диб-
рома, ДДВФ, 0,5%-ным щелочным раствором хлорофоса из расче-
та 500—700 мл на одно животное. Инсектицидами коров обраба-
тывают после утренней дойки. Для опрыскивания используют де-
зинфекционные машины (ЛСД, ВДМ и др.).
9.5.12. ТЕТРАМЕРОЗ УТОК
Тетрамероз вызывают нематоды семейства Tetrameridae.
Локализация — в железистом желудке домашних уток, диких
водоплавающих птиц, редко — гусей и кур.
Распространение. Тетрамероз — самый распространенный гель-
минтоз уток, регистрируют повсеместно, за исключением Крайне-
го Севера.
Возбудитель. Tetrameres fissispina — очень мелкие нематоды
(длина 3—4 мм) с резко выраженным половым деморфизмом.
Самки мешковидные, с нитевидными концами тела, красные,
самцы — очень тонкие, нитевидные, на теле имеют четыре про-
дольных ряда острых кутикулярных шипов. Яйца величиной
(0,04—0,05) х (0,02—0,03) мм, овальные, покрыты толстой скорлу-
пой серого цвета, с маленькими крышечками на полюсах, инвази-
онны при выходе наружу.
Биология развития. Основные промежуточные хозяева тетраме-
реса — бокоплавы, или гаммарусы (горбунцы), реже водяные ос-
лики, дафнии, личинки поденок и реснитчатые черви. Самки тет-
рамереса откладывают большое количество инвазионных яиц, вы-
деляемых вместе с пометом во внешнюю среду. В водоемах их за-
глатывают промежуточные хозяева, в организме которых из яиц
297
Рис. 125. Биология развития Т. fissispina:
1 — самец; 2 — самка; 3 — яйцо; 4 — инвазионная личинка; 5 — рачок-
бокоплав; 6 — инвазионная личинка в теле бокоплава
вылупляются личинки. Они дважды линяют и через 7—14 сут ста-
новятся инвазионными (рис. 125).
Домашние утки и дикие птицы заражаются на водоемах с пре-
сной или соленой водой при заглатывании промежуточных и ре-
зервуарных хозяев (рыб), инвазированных личинками гельминта.
Половой зрелости в желудке птиц тетрамересы достигают через
14—21 сут. Полный цикл развития тетрамереса в весенне-летний
период продолжается 21—35 сут.
Эпизоотологические данные. Источник распространения тетра-
мероза — больные домашние и дикие утки-тетрамересоносители.
298
Наиболее благоприятные условия для их интенсивного взаимного
перезаражения создаются на мелководных участках морей и озер,
при содержании уток на огороженных сеткой водных выгулах.
При безводном содержании утки не заражаются. На водоемах пти-
ца инвазируется в разные сезоны года.
В водоемах, богатых кислородом, бокоплавы живут 2—3 года.
Одни виды гаммарусов — обитатели пресноводных озер (G. 1а-
custris), другие — мелководных участков морей и лиманов с соле-
ной водой (G. maetticus и др.).
Патогенез и симптомы болезни. Самки возбудителя тетрамероза
оказывают механическое, инокуляторное и антигенное действие,
в результате чего развивается гастрит с дегенерацией и атрофией
железистой ткани, нарушением пищеварительной функции же-
лудка. При интенсивном заражении (сотни паразитов) у больных
утят отмечают отсутствие аппетита, понос, иногда рвоту, угнетен-
ное общее состояние, малокровие, истощение, отставание в росте
и развитии. При смешанной инвазии (тетрамероз + полиморфоз)
чаще погибает больной молодняк птицы.
Диагностика. При жизни диагностировать болезнь трудно
вследствие того, что строение яиц нематоды почти такое же, как и
стрептокары и эхинурии. Точно диагноз ставят посмертно — при
вскрытии трупов. При этом обнаруживают тетрамересов в желези-
стом желудке птиц. Целесообразно также исследовать промежу-
точных хозяев на наличие личинок тетрамересов.
При вскрытии обнаруживают резкое увеличение железистого
желудка (одинаковый объем с мышечным). Слизистая оболочка
желудка воспалена, отечна и обильно покрыта слизью. В просвете
желез находятся самки паразита (до 380 экз.). Они имеют вид тем-
но-красных точек, хорошо заметных при осмотре стенки желудка
против источника света.
Лечение. При тетрамерозе уток для группового применения ре-
комендован нилверм в дозе 0,125 г на 1 кг массы тела с кор-
мом в течение 5 дней подряд или битионол в дозе 0,3 г на 1 кг
массы тела 2 дня подряд в смеси с кормом; для индивидуально-
го—четыреххлористый углерод в дозе 2мл на 1 кг
массы тела однократно внутрь в форме капсул или при помощи
резиновой трубки (зонда) и шприца. После дегельминтизации во-
доплавающую птицу в течение Зсут содержат в помещении. По-
мет тщательно убирают и обезвреживают.
Профилактика и меры борьбы. Выращивание уток и гусей без
использования водоемов полностью профилактирует тетрамероз.
Положительные результаты получают при выпасе птиц на глубо-
ких или проточных водоемах с плотностью не более 250 голов на
1 га. Рекомендуют периодически определять зараженность проме-
жуточных хозяев. Для снижения численности рачков и других бес-
позвоночных водоемы зарыбляют. При возможности организуют
смену водоемов через каждые 2 года. Молодняк выращивают изо-
299
лированно от взрослой птицы. Плановую дегельминтизацию уток
и гусей проводят дважды: весной — перед выпуском на водоемы и
осенью — после прекращения выгула на водоемах.
9.5.13. СТРЕПТОКАРОЗ УТОК
Стрептокароз — гельминтоз домашних уток, гусей и диких во-
доплавающих птиц, вызываемый нематодами семейства
Acuariidae.
Локализация — под кутикулой мышечного желудка.
Распространение. Очаги этого гельминтоза регистрируют в За-
падной Сибири, Казахстане и некоторых других регионах страны.
Возбудитель. Streptocara crassicauda — тонкая нематода длиной
4—И мм. У самцов имеются две неравные спикулы и хвостовые
кутикулярные крылья, поддерживаемые длинными сосочками.
Самки выделяют инвазионные овальные серые яйца размером
(0,03-0,04) х (0,01-0,02) мм (рис. 126).
Биология развития. Стрептокара развивается с участием дефи-
нитивных и промежуточных (пресно- и соленоводных бокопла-
вов) хозяев. В водоемах яйца стрептокары заглатывают бокоплавы,
в полости тела которых личинки дважды линяют и через 21 —
300
25 сут становятся инвазионными. В этот период они вырастают до
3,5—4 мм. При поедании бокоплавов рыбами (резервуарные хозя-
ева) в их теле личинки стрептокары длительное время могут оста-
ваться жизнеспособными. Водоплавающая птица заражается при
поедании бокоплавов и рыбы, инвазированных личинками гель-
минта. Иногда возбудителем стрептокароза заражаются и цыпля-
та. В мышечном желудке уток стрептокары достигают половой
зрелости через 10—11 сут.
Эпизоотологические данные. Стрептокароз — природно-очаго-
вая болезнь, в распространении которой значительная роль при-
надлежит диким водным и болотным птицам. В теле бокоплавов
инвазионные личинки стрептокар сохраняются до 2 лет. В желуд-
ке птицы паразит живет несколько месяцев, и к весне утки полно-
стью освобождаются от стрептокар. (Этого не наблюдается при
тетрамерозе.)
Патогенез и симптомы болезни. В результате механического, ан-
тигенного и токсического действия стрептокар и их метаболитов
на ткани мышечного желудка нарушается его физиологическая
функция с последующим расстройством пищеварения, отставани-
ем в росте и развитии молодняка птицы. Больные утята малопод-
вижны, аппетит у них понижен или полностью отсутствует, на-
блюдается истощение. При смешанной инвазии (стрептокароз +
+ тетрамероз + полиморфоз) и несвоевременной ветеринарной
помощи может наблюдаться большой отход утят.
Диагностика. Наиболее достоверно посмертное исследование
трупов уток на выявление в мышечном желудке стрептокар и ха-
рактерных изменений. При вскрытии отмечают истощение, нару-
шение целостности и изменение цвета кутикулы мышечного же-
лудка. Она утолщена, имеет полости, заполненные кровью, бурым
пигментом, стрептокарами и их яйцами. Слизистая оболочка мы-
шечного желудка покрыта кровоизлияниями и язвами.
Компрессорное исследование бокоплавов под микроскопом
позволяет контролировать благополучие водоемов по стрептока-
розу. Стрептокар надо дифференцировать от амидостом.
Лечение. Птице задают четыреххлористый угле-
роде дозе 2 мл на 1 кг массы тела в капсулах или через тонкую
резиновую трубочку и шприц.
Групповым методом можно назначать нилверм и би-
тионол так же, как при тетрамерозе птиц.
Профилактика и меры борьбы. При стрептокарозе они те же, что
и при тетрамерозе.
9.5.14. ЭХИНУРИОЗ УТОК И ГУСЕЙ
Эхинуриоз вызывают нематоды семейства Acuariidae подотряда
Spirurata. Заболевание характеризуется поражением слизистой
оболочки желудка и расстройством пищеварения.
301
Локализация — слизистая оболочка и мышечные слои железис-
того желудка.
Распространение. Гельминтоз встречается в северо-восточных
районах Закавказья, в Средней Азии, Нечерноземье, на Северном
Кавказе, Украине и др.
Возбудитель. Echinuria uncinata — тонкая нематода длиной 6—
17 мм. Передний конец снабжен двумя сильно выступающими гу-
бами и шейными канатиками. Поверхность кутикулы вооружена
четырьмя рядами шипов. Яйца овальные, покрыты толстой обо-
лочкой, серые, размером (0,02—0,03) х (0,01—0,02) мм, инвазион-
ны (рис. 127).
Биология развития. Дефинитивные хозяева — главным образом
домашние и дикие утки, гуси, а также лебеди, поганки, нырки,
казарки и др. Промежуточные хозяева — дафнии (Daphnia pulex,
D. magna), которые обитают в полустоячих и медленно текущих
водоемах или в прибрежных зонах больших водоемов. В целом
развитие эхинурий происходит так же, как у тетрамересов и стреп-
токар. В теле дафнии личинки эхинурий становятся инвазионны-
ми через 21—28 сут (личинка спиралевидная, длиной 1,5 мм). Де-
финитивные хозяева заражаются, поедая инвазионных дафний.
Эхинурии достигают половой зрелости через 42—49 сут. Продол-
жительность жизни нематод около 2 мес.
Эпизоотологические данные. Эхинуриоз — очаговое сезонное за-
болевание, связанное с технологией содержания птиц. Основной
источник распространения инвазии — взрослые утки-носители.
Источник заражения — дафнии, зараженные личинками гельмин-
та. Наиболее восприимчивы к заболеванию утята и гусята в возра-
сте от 1 до 2,5 мес. Пик инвазии приходится на летние месяцы.
Дафнии летом размножаются интенсивно партеногенетически,
302
давая все новые поколения в течение 3—4 сут, каждая особь дает
около 80 потомков. Все это способствует широкому распростране-
нию эхинуриоза в природе.
Патогенез и симптомы болезни. Эхинурии на разных стадиях
развития оказывают на организм больных уток и гусей резко вы-
раженное патогенное действие. В результате аллергических реак-
ций в стенке железистого желудка птиц образуется эхинуриозный
узел — реактивное разрастание соединительной ткани с сильно
выраженной клеточной реакцией. При высокой интенсивности
инвазии (сотни паразитов), погрешностях в кормлении и содер-
жании водоплавающей птицы наблюдается тяжелое клиническое
проявление болезни — общая слабость, жажда, затрудненное гло-
тание, частое открывание клюва, шаткая походка, прогрессирую-
щее исхудание, нередко заканчивающееся летально. Субклини-
ческое течение болезни отмечают у взрослых уток при низкой ин-
тенсивности инвазии.
Лечение и профилактика. При эхинуриозе они такие же, как при
тетрамерозе уток и другой птицы. С целью профилактики можно
давать утятам ежедневно до 2—2,5-месячного возраста соли пи-
перазина в дозе 0,2 г на 1 кг массы тела или фенотиази-
н а. 0,3—0,4 г на 1 кг массы тела групповым методом. Препараты
назначают с влажной мешанкой.
Тетрамизол назначают в дозе 125мг на 1 кг массы тела
5 дней подряд с кормом.
Вероятно, эффективны фенбендазол, пиаветрин,
ивомек мелкогранулированный. Рекомендуется давать би-
тионол в дозе 300 мг на 1 кг массы тела 2 дня подряд с кормом.
9.5.15. ОНХОЦЕРКОЗЫ ЖИВОТНЫХ
Онхоцеркозы — заболевания лошадей и крупного рогатого ско-
та, вызываемые нематодами нескольких видов подотряда Filariata
семейства Filariidae. У лошадей и крупного рогатого скота из этого
подотряда кроме онхоцерков паразитируют еще и другие виды —
Paraphilaria miltipapillosa (в подкожной клетчатке), Setaria equina
(в брюшной и грудной полостях) и Setaria labiatopapillosa (в брюш-
ной, реже — в грудной полости). У лошадей заболевание называ-
ется парафиляриоз (сечение), у крупного рогатого скота — сетари-
оз. Парафиляриоз непарнокопытных животных в жарких районах
страны (Казахстан, Средняя Азия и др.) наносит значительный
ущерб. Летом в жаркие дни на коже животных в местах локализа-
ции парафилярий открываются в большом количестве кровоточа-
щие ранки, это явление прекращается с заходом солнца.
Локализация — у лошадей — выйная связка шеи и холки, под-
кожная клетчатка, сухожилия сгибателей конечностей; у крупного
рогатого скота — пластинчатая часть шейной связки и гастролие-
303
нальная связка. Личинки онхоцерков (микроонхоиерки) обитают
в толше кожи.
Распространение. Онхоцеркозы распространены почти повсе-
местно.
Возбудители. Onchocerca reticulata (в сухожилиях конечностей)
и O.cervicalis у лошадей (в выйной связке) —светло-серые нема-
тоды длиной до 80 см, тонкие и эластичные. Кутикула плотная,
исчерчена в продольном направлении и снаружи укреплена осо-
быми кольцевидно-спиралевидными утолщениями. Самки живо-
родящие.
O.gutturosa (в шейной связке) и O.lienalis у крупного рогатого
скота (в гастролиенальной связке) — светло-серые нематоды, сам-
ки длиной до 100 см, самцы 3—4 см. Строение кутикулы у них та-
кое же, как у онхоцерков лошадей. Самки живородящие, длина
личинок 0,2—0,25 мм (рис. 128).
Биология развития. Дефинитивные хозяева онхоцерков — не-
парнокопытные (лошади) и парнокопытные (крупный рогатый
скот) животные. Могут заразиться и другие близкородственные
животные указанных видов. Промежуточные хозяева — мокрецы
рода Culicoides (для онхоцерков лошадей) и мошки семейства
Simulidae (для крупного
рогатого скота).
Самки онхоцерков от-
рождают сформировав-
шихся личинок, которые
с током крови заносятся
в кожу. В период нападе-
ния самок мокрецов и
мошек на животных и
сосания крови насеко-
мые заглатывают личи-
нок онхоцерков. В теле
насекомых личинки па-
разитов крупного рогато-
го скота через 7—21 сут,
онхоцерков лошадей че-
рез 20—25 сут становятся
инвазионными. Мошки
и мокрецы многократно
питаются кровью живот-
ных. Поэтому при по-
вторном сосании крови
насекомые инокулируют
инвазионных личинок в
Рис. 128. Общий вид O.gutturosa:
7 — самка, 2 — самец в натуральную величину
(по Гнединой)
организм дефинитивных
хозяев. Личинки, мигри-
руя в организме, попада-
304
Рис. 129. Биология развития онхоцерков:
1 — участок тела самки нематоды; 2,3 — хвостовые концы самцов; 4 — мошка и
мокрец; 5.6— промежуточные хозяева с инвазионной личинкой; 7— инвазион-
ная личинка
ют в излюбленные места, где и достигают половозрелой стадии у
крупного рогатого скота через 7—8 мес, у лошадей через 4—5 мес
(рис. 129).
Эпизоотологические данные. Онхоцеркозы — сезонные заболе-
вания лошадей и крупного рогатого скота, связанные с активным
лётом и сосанием крови мошками и мокрецами. В заражаемости
животных большое значение имеют зональные особенности и ре-
льеф местности, так как мошки размножаются в быстро текущих,
богатых кислородом реках, а мокрецы — в стоячих и болотистых
водоемах.
Самки мокрецов и мошек нападают на животных в безветрен-
ные вечера и перед дождем. Установлено, что в основном болеют
более взрослые лошади. Что касается крупного рогатого скота, то
305
экстенсивность инвазии достигает во многих зонах страны 90—
100%.
Патогенез и симптомы болезни. У многих животных заболевание
протекает в виде носительства или субклинически. Таким обра-
зом, следы инвазии (гиалинизированные и обызвествленные оча-
ги) обнаруживают только при вскрытии трупов лошадей. Нередко
онхоцеркоз протекает в асептической форме, в таких случаях жи-
вотные выздоравливают. Процесс может осложниться, особенно у
рабочих лошадей, гноеродной инфекцией. В результате образуют-
ся гнойно-некротические очаги, свищи и ходы, из которых посто-
янно выделяются серозно-гнойная жидкость и фрагменты гель-
минтов.
В случаях, когда онхоцерки локализуются в коже и подкожной
клетчатке (чаще — в передней части туловища), обнаруживают уп-
лотненные депигментированные участки диаметром 2—9 см, ко-
торые в дальнейшем частично исчезают или размягчаются, обра-
зуя свищи. При поражении конечностей отмечают гипертрофию и
некротические явления сухожилий, что обусловливает хромоту
различной степени.
Онхоцеркоз крупного рогатого скота протекает без заметных
клинических признаков. Тем не менее микроонхоцерки вызывают
гиалиноз дермы, утолщение эпидермиса, гиперкератоз, разруше-
ние коллагеновых волокон и потерю механической прочности
кожи. На коже сосков вымени зараженных коров летом обнару-
живают мелкие трещины и воспаление основы кожи. В надвымян-
ных и паховых лимфоузлах наблюдают хронический негнойный
лимфаденит.
Диагностика. Диагноз ставят на основании комплексных иссле-
дований. Для выявления личинок у лошадей берут кожу в области
холки, плеча или передней конечности по Р. С. Чеботареву. Учас-
ток для биопсии дезинфицируют, кожу собирают в складку и вы-
резают кусочек толщиной 3—4 мм и площадью 15—30 мм2. Пробу
помещают в пробирку с 2—3 мл физиологического раствора (кожу
можно разорвать иголками) и оставляют на несколько часов при
комнатной температуре или ставят в термостат при 35—37 °C. В
последующем кожу удаляют, а осадок исследуют под микроско-
пом.
У крупного рогатого скота кожу исследуют примерно так же,
как у лошадей. Пробы берут у животных (с 1,5—2 лет) на брюш-
ной стенке впереди пупка при помощи ножниц Купера или щип-
цов Кивако. Выдерживают 16—20 ч в физиологическом растворе,
кожу удаляют, а осадок исследуют под микроскопом (можно пред-
варительно отцентрифугировать).
Для выявления взрослых нематод сухожилия переваривают в
искусственном желудочном соке (7 мл концентрированной соля-
ной кислоты, 7 г пепсина медицинского и 1 л воды) в течение 24—
36 ч при 37 °C.
306
Лечение и профилактика. Крупному рогатому скоту и лошадям
вводят и в о м е к в виде 1%-ного раствора подкожно в дозе 0,2 мг
на 1 кг (1 мл на 50 кг) массы тела.
Фасковерм крупному рогатому скоту вводят внутримы-
шечно в дозе 5 мг на 1 кг массы тела в виде 5%-ного раствора из
расчета 1 мл на 10 кг массы тела. Летом, когда мошки высокоак-
тивны, препарат применяют повторно с интервалом 1,5 мес.
Летние лагеря для животных размещают на возвышенных сухих
местах, а молодняк пасут на расстоянии 5—10 км от коров. При
высокой активности мошек животных пасут в ночное время. Ли-
чинок мошек уничтожают общепринятыми способами. Для отпу-
гивания применяют репелленты (2%-ные эмульсии оксамата
терпеноидного) из расчета 1,5—2 л на взрослое животное и
0,75—1,0 л на теленка. Подача воды на территорию хозяйства за-
крытым способом исключает создание биотопов мошек и мокре-
цов — промежуточных хозяев онхоцерков.
9.5.16. ПАРАФИЛЯРИОЗ (СЕЧЕНИЕ) ЛОШАДЕЙ
Парафиляриоз — заболевание лошадей, ослов и других непар-
нокопытных, вызываемое нематодой семейства Filariidae подотря-
да Filariata.
Локализация — гельминты — в подкожной клетчатке, яйца и
личинки — в местах ранения гельминтами кожи, где каплями со-
чится кровь.
Распространение. Заболевание встречается в Южном Поволжье,
Крыму, Средней Азии, Казахстане, на Дальнем Востоке, Украине.
Больных животных отстраняют от работы, нередко в области хол-
ки и на боках у лошадей образуются нагнеты и флегмоны. Ветери-
нарная служба производит значительные затраты на лечение и
профилактику болезни.
Возбудитель. Paraphilaria multipapillosa — белые нитевидные
гельминты. Самки длиной 40—70 мм, самцы 28 мм. Вульва у самки
открывается рядом с ротовым отверстием. У самца две спикулы
неравной величины. Яйцо при выходе из матки содержит личин-
ку. Она светло-серого цвета, передний конец закруглен, хвостовой
тупо заострен, хвост короткий, длина 0,18—0,225 мм, ширина
0,09—0,011 мм.
На переднем конце нематоды имеют кутикулярные образова-
ния, благодаря чему они пробуравливают кожу и образуют в ней
отверстие (рис. 130).
Биология развития. Парафилярии, находясь под кожей в облас-
ти холки, шеи, по бокам и на крупе у дефинитивных хозяев — ло-
шадей, ослов, в ранки, которые они делают сами, откладывают
яйца. Из них через некоторое время вылупляются личинки. Про-
межуточные хозяева Haematobia atripalpis заглатывают личинок и
307
Рис.130. Морфология Р. multipapillosa (по Василь-
кову):
1 — в натуральную величину; 2 — головной конец; 3, 4 —
хвостовые концы самца и самки; 5 — яйцо из капли крови,
выделившейся на коже; 6 — личинка
яйца с кровью, в теле которых за 10—15 сут развиваются инвази-
онные личинки. При повторном нападении насекомые инокули-
руют последних в организм животных. Через год парафилярии до-
стигают половой зрелости.
Эпизоотологические данные. Заболевание регистрируют в теп-
лый период года, начиная с конца апреля. Максимально болезнь
проявляется в июле—августе, но к октябрю прекращается. В основ-
ном болеют животные от 3 лет и старше, при этом как экстенсив-
ность, так и интенсивность инвазии бывают весьма высокие. На-
пример, в Арысском районе Казахстана зараженность чабанских
ослов летом достигала 100%. Яйца и личинки в жаркую погоду
под лучами солнца быстро погибают, но в кровеносных сосудах
сохраняются до 12 ч.
Патогенез и симптомы болезни. Гельминты, находясь под ко-
жей, передвигаются на разные участки, в этих местах на коже по-
являются бугорки, которые увеличиваются до размера горошины
и фасоли. Затем в этих местах в жаркую погоду к полудню образу-
ются отверстия, откуда из разорванных мелких сосудов сочится
кровь. Поэтому симптомы болезни весьма характерны. Чем выше
температура днем, тем больше образуется кровоточащих ранок. К
308
вечеру кровотечение утихает, а ночью полностью прекращается.
Число ранок, откуда сочится кровь, достигает 120—170, поэтому
лошади теряют много крови. При соприкосновении с ранками хо-
мута, седла на коже образуются нагнеты и флегмоны.
Диагностика. Диагноз ставят с учетом эпизоотологических дан-
ных и симптомов болезни. Для уточнения микроскопируют капли
крови из мест поражения кожи. Каплю крови разводят тремя-че-
тырьмя каплями воды или физиологического раствора и изучают
под микроскопом при малом увеличении.
В циркулирующей крови микрофилярий (личинок) не бывает.
Лечение. Ивомек вводят подкожно в дозе 1 мл на 50 кг мас-
сы тела однократно.
Профилактика и меры борьбы. С целью профилактики перед
выгоном животных на пастбище (в неблагополучных хозяйствах)
их необходимо обработать пастой эквалан.
9.5.17. ФИЛОМЕТРОИДОЗ КАРПОВ
Филометроидоз — заболевание прудовых рыб, вызываемое не-
матодами семейства Filometridae, характеризующееся острым вос-
палением печени, плавательного пузыря и почек, поражением
кожи, нарушением координации движений.
Локализация — мышечная ткань, чешуйные кармашки, реже —
полости тела (половозрелые самки), печень, почки, плавательный
пузырь и гонады (личинки). Половозрелые самцы паразитируют в
стенке плавательного пузыря, реже — в области почек.
Распространение. Филометроидоз встречается почти во всех зо-
нах страны, где разводят карпов, нередко — в естественных водо-
емах.
Ущерб складывается из массовой гибели мальков, значитель-
ных потерь прироста и выбраковки сильно инвазированной рыбы.
Содержание белка в мясе снижается на 25—30 %, ухудшаются вку-
совые качества рыбы.
Возбудитель. Philometroides lusiana — розовая или вишнево-
красная нематода. Самки длиной 80—125 мм, шириной 0,8—1 мм,
самцы — 2,9—4,5 и 0,035—0,046 мм соответственно. На переднем
конце гельминта имеются четыре бугорка, между которыми рас-
положено трехгранное ротовое отверстие. Затем — короткий пи-
щевод и кишечник, идущий до заднего конца тела, у самок он за-
канчивается слепо. У самцов есть две равной величины спикулы.
Вся полость тела самки нематоды заполнена мешковидной маткой
со множеством яиц.
Яйца округлые, диаметром 0,032—0,042 мм. Гельминт живоро-
дящий. Личинки удлиненно-шиловидные, достигают длины 0,4—
0,5 мм (рис. 131).
309
Биология развития. Фи-
лометроидесы — биогельмин-
ты. Дефинитивные хозяе-
ва — карпы и его гибриды с
сазаном, промежуточные
хозяева — циклопы многих
видов (Cyclops strenuus и
др.).
Весной при температуре
воды 17—18 °C самка гель-
минта рождает 200—250 ли-
чинок, которые выходят
при разрыве заднего конца
тела самки; в воде они жиз-
неспособны в течение 7—
10 сут. За это время их за-
глатывают циклопы. У них в
теле личинки в зависимости
от температуры воды (от 8—
10 до 21 °C) через 7—8 или
20—25 сут после двукратной
линьки становятся инвази-
онными. Рыбы заражаются при поедании инвазированных цикло-
пов.
Личинки из кишечника рыбы переселяются в печень и почки, где
третий раз линяют, переходят в плавательный пузырь и линяют в
четвертый раз, достигая через 35—40 сут половой зрелости. После
оплодотворения самки из плавательного пузыря мигрируют в обыч-
ные места локализации, а самцы погибают и рассасываются. Про-
должительность жизни самок 14—16, самцов 13—14 мес (рис. 132).
Эпизоотологические данные. Источник распространения гель-
минтоза — зараженные рыбы, в теле которых взрослые самки не-
матод могут перезимовывать, источник заражения — циклопы.
Болеет рыба всех возрастов — от 7—8-суточных мальков до произ-
водителей. При высокой интенсивности инвазии, равной 10—15
личинок, мальки погибают на 14—21-е сутки. Наибольшую эк-
стенсивность инвазии (90—100%) при высокой интенсивности
(40—50 нематод) отмечают у 2—3-летних карпов. У 6—8-летних
производителей экстенсивность инвазии бывает высокой, а ин-
тенсивность низкой. Вероятно, существует возрастной иммуни-
тет, хотя приобретенная резистентность при этой инвазии выра-
жена слабо. Наиболее восприимчивы чешуйчатые карпы, зара-
женность зеркальных карпов ниже, и нематод обнаруживают
только во внутренних органах.
Экстенсивность и интенсивность инвазии нарастают с мая по
июль. Инвазированные циклопы током воды переносятся на зна-
чительное расстояние и тем самым становятся источником инва-
310
зии. Завоз рыб из неблагополучных хозяйств способствует распро-
странению заболевания.
Патогенез и симптомы болезни. Мигрирующие личинки травми-
руют внутренние органы и кровеносные сосуды зараженных рыб.
Особенно большой вред личинки наносят организму мальков,
когда мигрируют в ткани плавательного пузыря и разрывают его.
Поэтому рыба не может нормально плавать и, следовательно, пи-
таться. Все это обусловливает отставание в росте и развитии, а
также гибель. Печень и почки воспалены, увеличены в размерах.
Стенка плавательного пузыря отечная, матовая, кровеносные со-
суды инъецированы. В брюшной полости обнаруживают кровяни-
стый экссудат.
Заболевание протекает остро или хронически. Острое течение
наблюдают у мальков, которые беспорядочно плавают в поверхно-
стном слое воды. Гибель наступает через 2—3 сут. Хроническое те-
чение характерно для более взрослых рыб (от 2 лет). У них на теле
обнаруживают бугорки, кровянистые пятна (в местах локализации
гельминта). Разрушаются пигмент чешуек и сами чешуйки. На по-
раженных участках кожи поселяется сапролегниевый гриб, что ос-
ложняет течение болезни. Больная рыба теряет товарные качества,
и ее часто выбраковывают.
Диагностика. Филометроидоз диагностируют комплексно, но
окончательно диагноз ставят
после обнаружения личинок не-
матоды в паренхиматозных
органах и плавательном пузыре,
а взрослых гельминтов — в под-
чешуйных кармашках, мышцах,
плавательном пузыре.
Лечение. Ремонтным рыбам
и производителям применяют
внутрь дитразина цит-
рат с помощью пищеводного
зонда в дозе 0,4 г на 1 кг массы
тела в виде 20%-ного или 40%-
ного раствора на дистиллиро-
ванной воде. Дегельминтиза-
цию проводят за 14—21 сут до
нереста двукратно с интервалом
7—8 сут.
Локсуран назначают в
тех же дозах и по той же мето-
дике, что и дитразина цитрат.
Для групповой дегельминти-
зации применяют лечебный
корм с нилвермом.
Рис.132. Биология развития Ph. lusiana:
7—взрослые нематоды на теле карпа; 2 —
личинки; 3 — циклопы (промежуточные хо-
зяева)
311
Профилактика и меры борьбы. Осенью рыб дегельминтизируют
перед посадкой в зимовальные пруды при температуре воды не
ниже 10 °C. Для освобождения маточного поголовья от нематод и
профилактики реинвазии весной следует применять 2—3-кратную
смену водоемов. В неблагополучных хозяйствах накладывают ка-
рантинные ограничения и проводят меры борьбы в соответствии с
инструкцией.
Филометроидоз широко распространен среди карасей и вызы-
вается Philometroides sanguinea. У лещей и густеры обнаруживают
филометроидесов других видов.
Морфология, биология, места локализации этих паразитов и
течение заболевания идентичны таковым у карпов.
Лабораторная работа
Задания. 1. Изучить морфологические признаки основных не-
матод: трихоцефалид, стронгилид, трихостронгилид, аскарид и
спирурид. 2. Исследовать пробы фекалий свиней, лошадей, овец и
собак по методу Фюллеборна на нематодозы. 3. Ознакомиться с
промежуточными хозяевами метастронгилюсов (дождевые черви),
телязий (мухи-коровницы), тетрамересов и стрептокар (бокопла-
вы). 4. Схематично зарисовать яйца трихостронгилид (жвачных),
власоглавов (свиней, овец), аскариса (свиней), параскариса (ло-
шадей), токсокар и токсаскариса (плотоядных), нематод (птиц).
5. Провести ветеринарно-санитарную экспертизу свиного мяса на
трихинеллез методами раздавливания кусочков проб в компрессо-
риуме и переваривания в желудочном соке. 6. Исследовать легкие
и кишечник овцы, крупного рогатого скота, пораженных дикти-
окаулюсами и нематодами пищеварительного канала методами
последовательного промывания содержимого, а также с помощью
компрессориума (слизистой оболочки кишечника).
Оборудование, материалы и объекты исследования: микроскопы; эмалирован-
ные тазики; стаканчики; стеклянные палочки; металлические петли; предметные
и покровные стекла; компрессориум; изогнутые ножницы; насыщенный раствор
натрия хлорида; макропрепараты; постоянные (тотальные) препараты мелких не-
матод и их яиц; плакаты и рисунки яиц нематод разных видов; пробы фекалий
свиней, лошадей, овец, собак и птиц; мышцы (кусочки диафрагмы) свиньи; ку-
сочки легких и кишечника овцы и крупного рогатого скота.
Место работы: лаборатория паразитологии и инвазионных бо-
лезней животных.
Методика проведения занятия. Накануне дня занятий лаборант
доставляет из хозяйства пробы фекалий свиней, лошадей, овец,
собак или других плотоядных, птиц, легкие и кишечник овцы и
крупного рогатого скота, мышцы свиней. После краткого объяс-
нения преподавателя учащиеся заражают пробы фекалий по мето-
ду Фюллеборна и оставляют на 30 мин. В это время студенты про-
сматривают под микроскопом постоянные препараты. Если по-
312
стоянных препаратов нематод нет, то до начала занятий можно
приготовить временные препараты этих гельминтов с использова-
нием 50%-ного глицерина или молочной кислоты. При исследо-
вании под микроскопом трех капель верхней пленки из каждого
стаканчика яйца нематод обнаружить нетрудно.
При дифференциации яиц нематод разных видов учитывают
форму (круглая — у параскариса, бочковидная — у власоглавов,
овальная — у трихостронгилид), цвет (коричневый — у яиц пара-
скариса и аскарисов, желто-коричневый — у власоглавов), строе-
ние скорлупы яиц (бугристая — у аскариса и метастронгилид сви-
ней, ячеистая — у собак, с пробочками на полюсах — у тетрамере-
са). Основные различия некоторых видов промежуточных хозяев
нематод-биогельминтов заключаются в следующем: дождевые
черви красного цвета обитают в свином навозе; мухи-навозни-
цы — чаще всего в летних лагерях; комары трех родов, мошки и
мокрецы, которые встречаются в теплое время года, рачки-боко-
плавы — в озерах с чистой водой.
В конце занятия учащиеся в тетрадях схематически зарисовы-
вают яйца власоглава, параскариса, аскариса и других гельминтов.
Практическое занятие 1
Задания. 1. Освоить технику групповой дегельминтизации сви-
ней пиперазином при аскариозе, ягнят — тетрамизолом грануля-
том 20%-ным при диктиокаулезе. 2. Подвергнуть групповой де-
гельминтизации 20 подсвинков препаратами пиперазина при ас-
кариозе. 3. Составить акт о проведенной дегельминтизации сви-
ней.
Оборудование и материалы: весы; разновесы; ведра; корыта; пиперазин адипи-
нат, сульфат и др.
Место работы: свиноферма хозяйства, неблагополучная по ас-
кар и озу.
Методика проведения занятия. Преподаватель кратко знакомит
учащихся с принципом дозирования пиперазина адипината (на
единицу концентрированного или комбинированного корма) для
свиней двух групп в зависимости от живой массы и с техникой
скармливания животным лекарственно-кормовой смеси.
Каждую партию антигельминтика предварительно проверяют
на небольшом поголовье малоценных животных. Затем учащихся
разбивают на звенья в зависимости от количества групп свиней,
подлежащих дегельминтизации. Правильность дозировки и тща-
тельность размешивания препарата с кормом, а также консистен-
цию смеси контролируют преподаватель и ветеринарный специа-
лист хозяйства. Пиперазин можно заменить кремнефтористым
натрием или другими химиопрепаратами.
После дегельминтизации свиней составляют акт по общепри-
нятой форме.
313
Практическое занятие 2
Задания. 1. Освоить технику индивидуальной дегельминтиза-
ции крупного рогатого скота фенотиазином и дитразина цитра-
том, овец при диктиокаулезе, гусей фенотиазином при амидосто-
мозе, уток при тетрамерозе и стрептокарозе. 2. Провести индиви-
дуальную дегельминтизацию крупного рогатого скота 2%-ным ра-
створом хлорофоса при телязиозе. 3. Составить акт о проведенной
дегельминтизации крупного рогатого скота.
Оборудование и материалы: спринцовки с мягким наконечником; почковид-
ные тазики; ручные лупы; банки стеклянные; пробирки; пинцеты глазные; вод-
ный раствор йода (1 : 200); жидкость Барбагалло.
Место работы: ферма колхоза или совхоза.
Методика проведения занятия. Вначале преподаватель кратко
объясняет методику приготовления водного раствора йода и тех-
нику вымывания телязий из конъюнктивального мешка глаз. Уча-
щиеся рассчитывают, какое количество йода, калия йодида и воды
нужно для приготовления раствора на определенное число живот-
ных. Группы делят на звенья по четыре человека в каждом. В зве-
не двое учащихся фиксируют голову животного, третий вводит ра-
створ йода под третье веко, а четвертый собирает в почковидный
тазик вытекающую из-под третьего века жидкость и просматрива-
ет ее. Периодически учащиеся меняются местами.
Обнаруженных гельминтов помещают в пробирки с жидкостью
Барбагалло и на очередном занятии изучают их строение под мик-
роскопом. Из изучаемых паразитов можно приготовить постоян-
ные препараты телязий.
Работу заканчивают составлением акта по общепринятой
форме.
Контрольные вопросы. 1. Какой морфологический признак яиц власоглавов
служит отличительным при дифференциации нематод? 2. Какие животные играют
основную роль в распространении трихинеллеза у людей и в природе? 3. Какова
особенность развития стронгилоидесов животных? 4. Где обитают личинки дела-
фондий в организме лошадей и как следует дифференцировать личинок стронги-
лид лошадей? 5. В чем различие между дегельминтизацией и химиопрофилакти-
кой животных? 6. Как дифференцируют возбудителя диктиокаулеза от возбудите-
лей протостронгилидозов у мелкого рогатого скота? 7. Какие нематоды скота и
птиц относятся к биогельминтам? 8. Какую роль играют дождевые черви при ас-
кариозе свиней и аскаридиозе кур? 9. Какие антигельминтики обладают широким
спектром действия? 10. Почему в свиноводческих и птицеводческих хозяйствах
промышленного типа не регистрируют биогельминтозы? 11. В чем различие био-
логии развития нематодирусов от развития других трихостронгилид жвачных?
12. Особенности биологии развития оллуланусов. 13. Как установить прижизнен-
ный диагноз на дирофиляриоз? 14. Как исследуют крупный рогатый скот и лоша-
дей на онхоцеркоз? 15. В каком возрасте чаще и интенсивнее заражаются карпы
возбудителем филометроидоза? 16. Личинки каких гельминтов обитают в крови
лошадей и крупного рогатого скота? 17. Какие нематоды паразитируют у гусей и
уток в железистом желудке?
3
РАЗДЕЛ
ВЕТЕРИНАРНАЯ ПРОТОЗООЛОГИЯ
10. ОБЩИЕ СВЕДЕНИЯ О ВЕТЕРИНАРНОЙ
ПРОТОЗООЛОГИИ
Определение и содержание ветеринарной протозоологии. Про-
тозоология— наука о простейших одноклеточных организ-
мах, относящихся к царству Protista (Haeckel, 1866). Видовой со-
став простейших чрезвычайно обширен: описано около 70 тыс.
видов, из которых свыше 10 тыс. являются опасными паразитами
животных, а также человека. Болезни, вызываемые ими, называ-
ются протозоозами.
Простейшие — первые живые организмы, возникшие на нашей
планете, из которых в последующем произошли многоклеточные
животные.
Паразитические простейшие обладают свойством приспосаб-
ливаться к обитанию в различных органах и тканях животного
организма. Они локализуются в крови, сердце, печени, почках,
центральной нервной системе, половых путях, в органах пищева-
рительной системы и т. д. При этом они могут быть строго специ-
фичными в отношении своего хозяина (Toxoplasma gondii у кош-
ки) и могут использовать для своего развития животных различ-
ных видов (Trypanosoma evansi у верблюда, лошади, осла, крупно-
го рогатого скота, собаки).
В зависимости от морфологических и биологических особен-
ностей возбудителей протозоозы условно можно разделить на вы-
зываемые споровиками, жгутиковыми, ресничными и другими
простейшими.
Систематика простейших и краткая их характеристика. В настоя-
щее время согласно Международному комитету по таксономии
все организмы делятся на две большие группы: прокариоты —
организмы без ядра, нуклеопротеидных хромосом, митоза и мейо-
за и эукариоты — организмы с ядром и оболочкой, нуклеопроте-
идными хромосомами, митозом и мейозом. В этом учебнике нас
интересует последняя группа — империя Eukaryota, куда входят
четыре царства:
1. Animalia L, 1753 (лат. animal — животное) — многоклеточные
гетеротрофные организмы. Известно более 1,5 млн видов;
2. Plantae L, 1753 — многоклеточные, обнаруживающие авто-
315
трофный (фототрофный с хлорофиллом А и В) способ питания.
Известно около 0,5 млн. видов;
3. Fungi L, 1753 (лат. «фунгус» — гриб) — организмы с хитино-
выми стенками клеток. Известно около 100 тыс. видов;
4. Protista Haeckel, 1866 (гр. protistos — самый первый) — биоло-
гические одноклеточные организмы (простейшие). Известно око-
ло 12 тыс. видов.
В царство Protista входят семь типов:
1. Rhizopoda (ризопода) с четырьмя классами, одним подклас-
сом, шестью отрядами;
2. Chytridiomycota (хитридиомикота) с одним классом и одним
отрядом;
3. Kinetoplastida (кинетопластида) с одним классом, представи-
тели которого имеют большое значение в ветеринарии, и одним
отрядом (Trypanosomatida);
4. Chrysophyta (хризофита) с двумя классами и двумя отрядами.
5. Polymastigota (полимастигота) с тремя классами и четырьмя
отрядами, из которых большое значение имеют представители от-
ряда Trichomonadida;
6. Sporozoa (споровики) (синоним Apicomplexa) с тремя класса-
ми, четырьмя подклассами, отдельные представители которых
имеют огромное значение, и шестью отрядами, из которых боль-
шое значение имеют Coccidiida и Haemosporida;
7. Ciliophora (цилиофора) с четырьмя классами и шестью отря-
дами, из которых существенное значение имеют представители
отрядов Balantidiida и Entodiniida.
Морфология и биология простейших. Тело простейших состоит
из одной эукариотной клетки сложной структуры, способной вы-
полнять все жизненные функции. Клетка простейших состоит из
оболочки, цитоплазмы с различными включениями и ядра.
Оболочка клетки — плазматическая мембрана (плаз-
малемма). Состоит из наружного и внутреннего слоев белковой
природы и среднего — липидного.
Ядро покрыто оболочкой, состоящей из двух мембран. Деле-
ние ядра митотическое, но при этом оболочка его сохраняется, что
является отличительным признаком простейших от клеток много-
клеточных организмов. В состав ядра входят пластин, хроматин,
ядерный сок, различно относящиеся к красящим веществам. Пла-
стин окрашивается кислыми красками и входит в состав ядерных
включений, называемых ядрышками или нуклеолами. Хроматин
окрашивается основными красками. Это главная составная часть
ядра. Ядерный сок, или основное вещество ядра, представляет со-
бой бесцветную неокрашивающуюся массу, в которой расположе-
ны хроматин и пластин.
Ядро выполняет две функции — регулирование обмена веществ
и размножение — содержит генетический код (ДНК).
Цитоплазма — составная часть клетки, жидкой или полу-
316
жидкой консистенции, снаружи покрыта цитоплазматической
мембраной. Более плотный наружный слой цитоплазмы у некото-
рых простейших называют пелликулой. В цитоплазме имеются
органоиды — митохондрии, рибосомы, лизосомы, аппарат Гольд-
жи и другие включения, свойственные только простейшим (жгу-
тики, реснички). В цитоплазме, рибосомах и эндоплазматической
сети содержится РНК.
Питание у простейших осуществляется через специальный
органоид — цитостом путем фагоцитоза или пиноцитоза (пино —
пить), или через жгутиковый карман (у трипаносом). При культи-
вировании на питательных средах или культуре тканей простей-
шие нуждаются в белках, углеводах, жирах, микроэлементах, вита-
минах. Продукты жизнедеятельности клетки выделяются через
специальное отверстие. При культивировании на питательных
средах одни простейшие нуждаются в кислороде (например, тей-
лерии), другие нет (трихомонады).
Дыхание простейших осуществляется через систему дыхатель-
ных ферментов. Оно может быть аэробным или анаэробным.
Простейшим свойственна раздражимость. Раздражителями мо-
гут быть изменения условий внешней среды в виде химических,
механических, термических и других факторов.
Многие простейшие обладают способностью образовывать
вокруг своего тела особую защитную оболочку (цисту). Этот про-
цесс называют инцистированием. Эксцистирование — сбрасыва-
ние оболочки и превращение в активную форму у паразитических
простейших — происходит при воздействии пищеварительных эн-
зимов хозяина.
Движутся простейшие с помощью ресничек, жгутиков или за
счет псевдоподий.
Размножение происходит бесполым или половым путем.
Бесполое размножение осуществляется:
1) простым делением клетки на две равные дочерние особи;
2) почкованием — неравное деление тела, при котором от круп-
ной материнской особи отпочковывается одна или несколько до-
черних особей;
3) мерогонией (шизогонией) — множественное бесполое деле-
ние. При множественном размножении происходит повторное де-
ление ядра и простейшие становятся временно многоядерными.
После этого вокруг новых ядер в клетках образуется цитоплазма,
формируются органоиды, затем начинается множественное разде-
ление на большее число новых организмов. Если в процессе деле-
ния образуются бесполые особи, их называют шизонтами, а сам
процесс деления — шизогонией. Новые простейшие, возникшие в
результате шизогонии, называются мерозоитами. Если в процессе
деления образуются мужские и женские особи, то многоядерная
клетка называется гамонтом, а сам процесс — гаметогонией. Особи,
образовавшиеся в результате гаметогонии, называются гаметами:
317
микрогаметы (мужская половая клетка — сперматозоид) и макрога-
меты (женская яйцеклетка). Если множественное деление наступа-
ет после полового процесса, то многоядерная клетка называется
споронтом, а сам процесс деления — спорогонией. Вновь возник-
шие в результате спорогонии особи называются спорозоитами.
При половом размножении простейших оплодотворение осу-
ществляется путем копуляции или конъюгации. При копуляции
происходит слияние двух клеток в одну. Клетки, которые долж-
ны слиться, называются гаметами, а результат их слияния — зи-
готами. При конъюгации особи, вступая в половой процесс, не
сливаются, а только временно соединяются, обмениваясь части-
цами ядерного аппарата и цитоплазмой, а затем расходятся, воз-
вращаясь к самостоятельной жизни. Биологическое значение
конъюгации заключается в изменении наследственных свойств
обоих конъюгатов вследствие полового процесса. Как копуля-
ция, так и конъюгация — половые процессы, но не процессы
размножения. Число особей при этом не увеличивается. После-
днее отмечают при бесполом размножении, которое чередуется с
половым.
Некоторые простейшие в период их становления в качестве па-
разитов адаптировались к обитанию в двух или трех хозяинах.
Один хозяин обычно принадлежит к позвоночным, а другой — к
беспозвоночным животным. Переход от одного хозяина к другому
совершается при попадании паразита вместе с кормом и водой в
кишечник хозяина или при питании на животных кровососущих
насекомых и клещей.
Патогенез протозойных болезней. Важные условия, определяю-
щие возникновение протозойных болезней животных — патоген-
ность и вирулентность возбудителей, с одной стороны, и реактив-
ность организма животного (естественная и приобретенная резис-
тентность, нервная регуляция иммунобиологических механизмов
защиты и физиологического состояния) — с другой, а также усло-
вия окружающей внешней среды.
Простейшие одного вида патогенны для животного только оп-
ределенного вида, но есть простейшие, которые могут инвазиро-
вать животных нескольких видов. Например, токсоплазма пато-
генна для млекопитающих многих видов.
Каждому патогенному простейшему свойственна более или
менее выраженная вирулентность, которая подвержена изменчи-
вости. Вирулентность простейших может понижаться или повы-
шаться под влиянием физических и биологических факторов.
Так, N.equi — возбудитель нутталиоза лошадей, переданный
клещом Dermacentor, вызывает легкое переболевание, а при пе-
редаче клещом Hyalomma у лошадей отмечается тяжелое течение
болезни. Почти все бабезиидозы у молодых животных протекают
легко, а взрослые особи болеют тяжело, часто со смертельным
исходом.
318
У патогенных простейших вирулентность многогранна и про-
является в различных формах воздействия на инвазированный
организм — механическое, антигенное и токсическое.
Антигенное действие простейших выражается появлением в
крови инвазированных животных соответствующих иммунных
глобулинов. До сих пор еще нет определенных данных о наличии
токсинов у патогенных простейших, за исключением саркоцист,
которые выделяют саркоцистин. Тем не менее патогенные возбу-
дители обладают свойственным только им воздействием на инва-
зированный организм, что находит отражение в проявлении спе-
цифических симптомов болезни.
Иммунитет при протозойных болезнях. Невосприимчивость жи-
вотных к возбудителям протозойных болезней — следствие ес-
тественного (врожденного) или приобретенного иммунитета.
Естественный иммунитет обусловлен биологическими свойствами
животного и является признаком хозяина. Он может быть абсо-
лютным и относительным. Приобретенный иммунитет к возбуди-
телям протозойных болезней в зависимости от их вида может быть
стерильным и нестерильным. Нестерильный иммунитет называют
премуницией. С исчезновением возбудителя из организма конча-
ется и премуниция. Приобретенный иммунитет к протозойным
болезням животных обусловлен клеточными и гуморальными
факторами, тесно связанными между собой. Фагоцитарные клет-
ки имеют значение в механизме усвоения антигенов и образова-
ния антител, в то время как образующиеся специфические антите-
ла повышают фагоцитоз.
Плод, находящийся в утробе матери, защищен от большин-
ства патогенных простейших, поскольку паразиты не могут
пройти через неповрежденный плацентарный барьер, даже если
животное больное или паразитоноситель. Не проникают через
плаценту и антитела (они попадают в плод только у собак и
овец). У новорожденных неспецифические защитные гумораль-
ные факторы, как правило, отсутствуют, так как глобулины либо
не вырабатываются, либо поступают в кровь в незначительном
количестве.
В этот период в защите молодого организма от возбудителей
протозойных болезней участвуют фагоциты и антитела, поступаю-
щие с молоком матери. Степень этой защиты у животных различ-
ных видов выражена по-разному.
В организме иммуноглобулины начинают вырабатываться с 4-
недельного возраста. В защите животных от возбудителей прото-
зойных заболеваний большое значение имеет клеточная система
организма. В защитных механизмах инвазированного организма
участвуют и гормоны, которые стимулируют или угнетают образо-
вание лимфоцитов. Все процессы выработки антител регулируют-
ся гипоталамо-гипофизарной системой организма.
В возникновении гуморальных реакций иммунитета на антиген
319
у животных при протозойных болезнях имеется полная аналогия с
образованием антител при инфекционных болезнях.
Стерильный иммунитет выявлен у животных против трипано-
сом и у птиц — против боррелий. Против большинства возбудите-
лей протозойных болезней у животных возникает нестерильный
лабильный иммунитет. При понижении резистентности организ-
ма происходит активирование жизнедеятельности паразита, мо-
жет возникнуть рецидив.
Нестерильный иммунитет, предохраняя животных от последу-
ющего заражения, в ряде случаев служит источником рассеивания
возбудителей в окружающей среде через испражнения при кишеч-
ных паразитах или через переносчиков при трансмиссивных бо-
лезнях. Иммунитет животных при протозойных болезнях строго
специфичен, иммунные тела вырабатываются только против того
вида или штамма возбудителя, который вызвал заболевание. Не-
стерильный иммунитет при большинстве протозойных болезней
адекватен степени перенесенного заболевания и сохраняется до
тех пор, пока в организме присутствует возбудитель. Его продол-
жительность пребывания в организме колеблется от нескольких
месяцев до 2 лет и более. Знания закономерностей развития имму-
ногенеза у животных при различных протозоозах дали возмож-
ность создать отечественным ученым вакцины против тейлериоза
крупного рогатого скота и эймериозов кур.
11. ДИАГНОСТИКА ПРОТОЗОЙНЫХ БОЛЕЗНЕЙ
Правильная и своевременная диагностика — первое звено в
цепи мероприятий по профилактике и борьбе с протозойными бо-
лезнями. Диагноз ставят комплексно с учетом эпизоотологичес-
ких данных, симптомов болезни, результатов патологоанатоми-
ческого вскрытия и лабораторных исследований для установления
возбудителя болезни.
При анализе эпизоотологических данных
учитывают благополучие местности по заболеванию, сезонность,
зоны географического распространения инвазии, источники зара-
жения, пути распространения, морфологию и биологию перенос-
чиков, эпизоотологические карты. Все это позволяет не только
поставить диагноз, но и облегчить дифференциацию простейших
друг от друга, а также от возбудителей инфекционных заболева-
ний.
При клинической диагностике протозойных бо-
лезней следует учитывать симптомы болезни, ее течение. Необхо-
димо помнить, что течение болезни и степень проявления ее сим-
птомов во многом зависят от состояния центральной нервной сис-
темы.
Большую помощь в постановке диагноза оказывает патоло-
гоанатомическое вскрытие, при котором выявляют-
320
ся изменения в органах и тканях, а также обнаруживаются возбу-
дители, многие из которых сохраняются в них только непродол-
жительное время.
Из лабораторных методов применяют микроско-
пическую диагностику, культуральный метод, серологическую и
биологическую диагностику.
Микроскопическая диагностика имеет большое значение для по-
становки диагноза. При остром и подостром течении болезни
найти возбудителя в исследуемом материале довольно легко. Па-
разитарная и температурная реакции чаще всего совпадают (бабе-
зиидозы). При хроническом течении (случная болезнь, трихомо-
ноз) возбудитель в исследуемом материале обнаруживают с тру-
дом. Материал для микроскопии берут из различных органов: со-
скобы со слизистых оболочек мочеполовых органов, истечение из
половых путей (случная болезнь, трихомоноз), периферическую
кровь (су-ауру, бабезиидозы), фекалии, помет (эймериозы птиц,
балантидиоз свиней). Готовят тонкие мазки и раздавленную кап-
лю. В мазках рассматривают возбудителей в фиксированном и ок-
рашенном виде, в раздавленной капле — живых паразитов.
Культуральный метод применяют при диагностике некоторых
протозойных болезней. Производят посев исследуемого материала
на искусственные питательные среды. Лучше всего удается куль-
тивировать трихомонад и эймерий (образование в ооцистах спо-
робластов и спорозоитов).
Серологическую диагностику проводят довольно часто. Впер-
вые реакция связывания комплемента (РСК) была испытана при
трипаносомозах. Формалиновую реакцию (ФР) применяют ис-
ключительно при обследовании верблюдов на трипаносомоз, ре-
акцию длительного связывания комплемента (РДСК) и реакцию
флуоресцирующих антител (РФА) — для диагностики токсоплаз-
моза, реакцию непрямой иммунофлуоресценции (РНИФ) — для
диагностики су-ауру у верблюдов, реакцию агглютинации (РА),
реакцию непрямой гемагглютинации (РИГА) и реакцию иммуно-
флуоресценции (РИФ) — для диагностики анаплазмозов.
Серологические исследования проводят в соответствии с мето-
дическими указаниями. Для этого используют сыворотку крови от
больных животных.
При биологической диагностике ставят биопробу — самый точ-
ный и надежный метод диагностики, особенно при подозрении на
трипаносомоз верблюдов. Тем не менее этот метод применяется в
исключительных случаях, так как он неэкономичен.
В комплексе диагностических приемов определенное место за-
нимает терапевтическая диагностика, которая ос-
нована на специфическом лечебном действии химиопрепаратов
при протозойных болезнях. Применение беренила, азидина и дру-
гих препаратов дает положительный результат при бабезиидозах, а
при отсутствии лечебного эффекта служит основанием подозре-
321
вать сибирскую язву, гематурию, лептоспироз. Применение нага-
нина дает возможность дифференцировать случную болезнь от
доброкачественной половой сыпи лошадей.
12. ЛЕЧЕНИЕ ЖИВОТНЫХ ПРИ ПРОТОЗОЙНЫХ
БОЛЕЗНЯХ
Лечение протозойных болезней заключается в применении
специфических, патогенетических и других препаратов неспеци-
фического действия, которые подавляют жизнедеятельность воз-
будителей, активизируют иммуногенные механизмы и нормализу-
ют нарушенные функции органов и систем больного животного.
К специфическим препаратам относят химиотерапевтические
препараты и др., которые обладают избирательным действием на
патогенных простейших одного или нескольких видов. Специ-
фические препараты должны быть максимально паразитотроп-
ными и минимально органотропными для животных. Чем боль-
ше соотношение между его органотропной и паразитотропной
дозой (лечебная доза), тем он безопаснее для лечения больного
животного.
В результате воздействия специфического препарата наступает
выздоровление. Оно может сопровождаться полным уничтожени-
ем всех паразитов и неполным — паразиты сохраняются в неболь-
шом количестве и их размножение контролируется иммуногенны-
ми механизмами организма — наступает состояние премуниции.
Премуниция возникает, как правило, если специфические препа-
раты вводить в конце инкубационного периода болезни — проис-
ходит предупреждение развития болезни. Такой метод получил
название митигирующей профилактики (один из способов про-
филактики пироплазмидозов).
Среди специфических препаратов есть такие, которые, не уби-
вая возбудителей в организме, задерживают их размножение. Эти
препараты нашли широкое применение при кокцидиозах.
Пребывание специфического препарата в организме можно
продлить, если одновременно вводить вещества, задерживающие
его всасывание (пролонгаторы). Для пролонгированной химио-
профилактики пироплазмидозов крупного рогатого скота и овец
применяют азидин (беренил) в сочетании с наганином. Эффек-
тивность лечения зависит от стадии инвазионного процесса. Если
специфические препараты применяют в начале болезни, то их эф-
фективность будет гораздо выше, чем во второй период болезни.
Неспецифическая терапия, не влияя на возбудителя непосред-
ственно, способствует восстановлению нарушенных функций ор-
ганов и систем у больных и переболевших животных.
322
13. ПРОФИЛАКТИКА ПРОТОЗОЙНЫХ БОЛЕЗНЕЙ
Устойчивость животных к болезням во многом определяется
условиями кормления и содержания. Для предохранения от
трансмиссивных болезней (пироплазмидозы и др.) уничтожают
переносчиков возбудителей (клещей, слепней) на животных, в ме-
стах обитания и помещениях. Эффективна и смена пастбищ, где
это возможно. Для предохранения от пироплазмидозов, эймерио-
зов проводят специфическую химиопрофилактику. Запрещается
допускать кошек и собак (кроме сторожевых) в помещения для
животных.
При смене в животноводческих помещениях поголовья свиней,
кроликов, птиц и других животных проводят тщательную дезинва-
зию рекомендуемыми препаратами против возбудителей той или
иной инвазии. Так, при эймериозах наиболее эффективна дезин-
вазия паром или горячей (80 °C и выше) водой, при балантидио-
зе — раствором гидроксида натрия.
При поступлении животных в хозяйства устанавливают профи-
лактический карантин и организуют в этот период проведение не-
обходимых ветеринарных мероприятий в соответствии с действу-
ющими инструкциями.
Применение химиопрофилактических препаратов во многих
случаях хотя и дает достаточно высокие результаты, но не лишено
и отрицательных моментов. Например, интенсивное и длительное
применение химиопрепаратов приводит к возникновению устой-
чивых штаммов паразитов к определенным препаратам. Кроме
того, происходит загрязнение окружающей среды и продуктов жи-
вотного сырья и т. д. Поэтому в борьбе с протозоозами следует ак-
тивнее разрабатывать биологические методы борьбы путем вакци-
нации восприимчивого поголовья.
Благодаря усилиям отечественных ученых и практиков в насто-
ящее время разработаны и изготовлены достаточно эффективные
вакцины против тейлериоза крупного рогатого скота и эймерио-
зов кур. Своевременное применение этих вакцин надежно предох-
раняет от заболеваний животных, в том числе птиц, и создает ус-
тойчивый иммунитет.
Для профилактики антропозоонозов, таких, как балантидиоз,
саркоцистоз, всех работников ферм обследуют в медицинских уч-
реждениях. При установлении протозойных болезней хозяйства
объявляют неблагополучными и проводят мероприятия в соот-
ветствии с инструкциями, наставлениями, методическими указа-
ниями.
Контрольные вопросы. 1. Какие типы и классы простейших — возбудителей
протозойных болезней вам известны? 2. Как устроено тело простейших? 3. Какую
функцию выполняют ядро и цитоплазма простейших? 4. Как осуществляется бес-
полое размножение простейших? 5. Как протекает половое размножение у про-
стейших?
323
14. ПИРОПЛАЗМИДОЗЫ животных
Пироплазмидозы — большая группа протозойных болезней,
возбудители которых паразитируют в эритроцитах или других
клетках ретикулоэндотелиальной системы. Эти болезни относятся
к трансмиссивным, сезонным, природно-очаговым инвазиям.
В настоящее время описано 170 видов пироплазмид, наиболь-
шее количество паразитов встречается у парнокопытных (41) и
грызунов (37). Из домашних животных наиболее восприимчивы
крупный рогатый скот, овцы, козы, лошади, ослы, северные оле-
ни, свиньи, собаки, кошки.
Пироплазмидозы характеризуются резко выраженной анемией,
желтухой, гемоглобинурией, повышением температуры тела, на-
рушением деятельности сердечно-сосудистой системы, желудоч-
но-кишечного канала и высокой смертностью.
Пироплазмидозы причиняют большой экономический ущерб
животноводству. Потери от пироплазмидозов обусловливаются
значительной смертностью, особенно среди животных, завезен-
ных из благополучной зоны в неблагополучные, несвоевременной
диагностикой и лечением. При этом падеж и вынужденный убой
среди крупного рогатого скота могут составить от 20 до 60 %, а в
отдельных хозяйствах до 80 %. У заболевших коров удой снижает-
ся на 40—60 %, отдельные животные полностью прекращают дачу
молока, а после переболевания надои восстанавливаются только
на 70-75 %.
Большие затраты денежных средств и напряженная работа ве-
теринарных специалистов направлены на предупреждение и лече-
ние пироплазмозов и защиту животных от нападения клещей.
Систематика, морфология и биология. У крупного рогатого скота
описано 12 видов пироплазмид, у мелких животных — 8, у лоша-
дей — 2, у собак — 4, у свиней — 2, у кошек — 2 вида. Все они от-
носятся к отряду Piroplasmida, который включает семейства
Babesiidae (Piroplasmidae), Theileriidae и Nicolliidae (Nuttalliia) с со-
ответствующими родами Babesia, Theileria, Nicollia.
Бабезииды обычно локализуются в эритроцитах, иногда их на-
ходят в лейкоцитах, плазме крови.
При изучении морфологических признаков бабезиид обращают
внимание на форму и размер паразитов, их положение в эритро-
цитах, угол соединения парных грушевидных форм. В зависимос-
ти от вида паразита может быть поражено от 3 до 80 % эритроци-
тов. В каждом из них обнаруживают одного-двух, иногда четырех
и более паразитов. Величина их 0,5 — 7 мкм.
Хозяева — клещи семейства Ixodidae и позвоночные животные.
В клещах возбудитель циркулирует трансфазно и трансовариаль-
но. Размножение бабезиид в эритроцитах происходит бинарным
делением и почкованием. После деления ядра дочерние клетки
длительное время не расходятся, образуя парные грушевидные
324
формы. Попав в организм клеща-переносчика вместе с эритроци-
тами, бабезииды вначале размножаются в просвете кишечника,
образуя из одноядерных стадий 2, 4 и 6-ядерные стадии. Затем они
мигрируют в гемолимфу, яйцевые клетки и другие органы, где
также происходит множественное и бинарное деление. Множе-
ственное деление при этом повторяется многократно.
В кишечнике клещей описаны формы полового развития — га-
меты. Зигота (оокинета) подвижная. На определенном этапе раз-
вития подвижные формы проникают в слюнные железы клеща,,
где в результате деления формируются мелкие одноядерные ста-
дии (мерозоиты), способные вызвать заражение позвоночного хо-
зяина. Процесс этот длится 9 сут. Паразитирование в теплокров-
ном хозяине продолжается от нескольких недель до 1—2,5, реже
3 лет.
Семейство Theileriidae рода Theileria на территории России
представлено четырьмя видами телерий, паразитирующими у
крупного рогатого скота, двумя видами у мелкого рогатого скота и
одним видом у северных оленей. Вызывают одну из самых злока-
чественных кровепаразитарных болезней, приводящих к гибели
животных. Паразиты имеют сложную биологию развития, разно-
образные морфологические признаки в зависимости от стадии
развития. Вначале тейлерии локализуются в лимфатических клет-
ках и других органах кровообращения, затем мигрируют в эрит-
роциты. Размножаются путем множественного деления (мерого-
ния или шизогония). Переносчиками у крупного рогатого скота
являются иксодовые клещи, у оленей кроме клещей и кровососу-
щие насекомые (рис. 133).
Семейство Nicollidae рода Nicollia (Nuttallia) представлено од-
ним видом — N. equi, паразитирующим у непарнокопытных. Пе-
реносчиками являются иксодовые клещи рода Dermacentor. При
размножении в эритроцитах образуют характерные формы в виде
мальтийского креста (см. рис. 138).
Эпизоотология пироплазмидозов. Пироплазмидозы возникают
при взаимодействии трех звеньев эпизоотической цепи (воспри-
имчивых животных, переносчиков возбудителя болезни и больно-
го животного или паразитоносителя). Наибольшее распростране-
ние имеют в южных регионах СНГ, несколько меньшее — в цент-
ральных районах России, Белоруссии, Прибалтике, Западной Ук-
раине. Возникают болезни в теплое время года, что обусловлено
активной фазой развития клещей-переносчиков.
Эпизоотология пироплазмидозов определена также особеннос-
тями экологии и биологии иксодовых клещей, которые обитают в
различных по природно-климатическим условиям территориях.
На основе многолетних исследований разработана специальная
классификация территорий.
В зависимости от наличия звеньев эпизоотической цепи выде-
ляют четыре зоны.
325
Рис.133. Стадии развития Th. annulata в эритроцитах
Благополучная зона — территория, на которой нет
ни клещей-переносчиков, ни больных животных, ни носителей
возбудителя.
Угрожаемая зона — территория, на которой нет жи-
вотных-паразитоносителей, но имеются переносчики. При попа-
дании в эту зону животных-паразитоносителей она превращается
в энзоотическую.
Энзоотическая зона — территория имеет все три зве-
на эпизоотической цепи. На этой территории ежегодно колеблет-
ся количество иксодовых клещей и переболевает значительная
часть скота. Но некоторые животные не заражаются, утрачивают
премуницию, поэтому сохраняют восприимчивость к заболева-
нию (если животные выпасаются на культурных пастбищах). Зона
326
может переходить в латентную, угрожаемую или оставаться посто-
янно действующей, что также определяется вмешательством чело-
века.
Латентная зона — территория, на которой много зара-
женных пироплазмидами клещей, ежегодно контактирующих с
животными. В данной зоне болезни не проявляются клиничес-
ки, так как все животные имеют премуницию. Вновь завезен-
ные из благополучной зоны животные очень тяжело заболева-
ют, с высокой смертностью. Молодняк переболевает легко,
приобретает продолжительный и ежегодно подкрепляемый им-
мунитет.
Патогенез. Имеются существенные различия в развитии пато-
логических процессов при бабезиидозах и тейлериозах.
При бабезиидозах восприимчивые животные инвазируются
специфическими бабезиидами независимо от возраста. Но в сте-
пени развития инвазионного процесса имеются существенные
различия. Молодняк, рожденный от матерей, имеющих премуни-
цию, переболевает более легко (если его организм не ослаблен),
чем взрослые животные. Исключение составляют щенки, которые
очень тяжело переболевают бабезиозом. Телята, жеребята и ягнята
в первые дни после рождения, получающие молозиво и молоко от
матерей-паразитоносителей, переболевают бабезиидозами срав-
нительно легко и часто бессимптомно. Это связано с тем, что вме-
сте с молозивом от матери-паразитоносителя передаются антитела
против бабезиид. Очевидно, двумя факторами (естественная рези-
стентность молодого возраста и получение антител с молозивом)
можно объяснить отсутствие заболевания молодняка в местности,
где у взрослых животных имеется премуниция к возбудителям ба-
безиидозов.
Для продолжения полученной первичной премуниции молод-
няк и взрослые животные должны подвергаться суперинвазии ба-
безиидами в результате повторных нападений клещей-переносчи-
ков. Это наблюдается в тех местах, где аборигенный (местный)
скот в пастбищный период постоянно выпасается на заклещеван-
ных участках.
Взрослые животные из благополучной местности переболевают
бабезиидозами с тяжелым течением и большой смертностью. Осо-
бенно тяжело переносят бабезиидозы породистые животные и вы-
сокомолочные коровы. У зебувидного скота отмечают меньший
процент смертности, чем у других пород. Степень развития болез-
ненного процесса у животных определяется не только их воспри-
имчивостью, но и вирулентностью возбудителя, которая проявля-
ется в основном токсическим воздействием паразитов да цент-
ральную нервную систему и жизненные функции организма. У
всех животных при заражении бабезиидами снижаются показате-
ли крови: количество эритроцитов — в 2—2,5 раза, гемоглобина — в
2 и более раза. Кроме того, снижаются показатели общего белка,
327
резервной щелочности, хлора и только количество сахара в начале
болезни увеличивается.
Действие метаболитов паразитов, продукты распада эритроци-
тов и других жизненно важных клеток тканей приводят к наруше-
нию обменных процессов, изменению гемопоэза и функциональ-
ной активности лейкоцитов.
Снижение количества эритроцитов влечет за собой кислород-
ную недостаточность в организме. Для ее компенсации усиливает-
ся работа сердца, легких. Учащение дыхания сопровождается
одышкой, застойными явлениями в малом круге кровообращения,
возможен отек легких. В тканях накапливаются недоокисленные
продукты обмена, развиваются явления ацидоза.
Как следствие этого увеличивается порозность сосудов и ка-
пилляров, появляются отеки и кровоизлияния в органах и тканях.
Нарушение кровообращения и интоксикация организма приводят
к ослаблению функции почек (альбуминурия и олигурия). Кроме
того, при изменении биохимических процессов происходит ги-
перплазия клеток РЭС, что ведет к увеличению объема селезенки,
печени, лимфатических узлов.
Освободившийся при распаде эритроцитов гемоглобин остает-
ся растворенным в плазме. Отсюда он частично всасывается эрит-
роцитами, которые вследствие этого становятся гиперхромными,
а частично выводится почками, что проявляется гемоглобинури-
ей — одним из характерных признаков болезни. И наконец, часть
гемоглобина перерабатывается в желчные пигменты (билирубин),
что и обусловливает желтушную окраску мышц, слизистых и се-
розных оболочек.
Одновременно в организме развивается и желудочно-кишеч-
ный синдром. В начале болезни продукты нарушенного обмена
воздействуют на рецепторы кишечника, в результате чего усили-
вается перистальтика. Отмечают снижение аппетита, ухудшение
процессов переваривания и всасывания. Постепенно развивается
катаральное состояние, ослабевает перистальтика, возникает ме-
теоризм, замедляется резорбция газов. Животные в период болез-
ни заметно худеют. Следовательно, в зависимости от вирулентно-
сти возбудителя и степени восприимчивости и резистентности
животного (естественной или приобретенной) возникшая инвазия
может развиться в тяжело протекающий процесс, и нередко бо-
лезнь заканчивается летально. При благоприятном течении, сво-
евременном лечении организм животного активизируется, у него
вырабатывается иммунитет и наступает постепенное восстановле-
ние работы всех нарушенных систем и органов.
Процесс выздоровления при бабезиидозах длительный и при
тяжелом течении нередко осложняется миокардитами, нефритами
и гепатитами. Молочная продуктивность у коров после тяжелого
переболевания полностью восстанавливается только в последую-
щую лактацию.
328
Иммунитет. К бабезиозу восприимчив крупный рогатый скот
всех пород. Наиболее тяжело переболевают взрослые животные,
но особенно коровы старше 8 лет. Телята переболевают почти бес-
симптомно. Молодняк от года до 2 лет может болеть тяжело, осо-
бенно в энзоотической зоне.
У переболевших животных создается нестерильный иммунитет
или премуниция, напряженность и длительность которого зависят
от вирулентности возбудителя, вызвавшего заболевание, тяжести
переболевания и состояния организма животного. При легком пе-
реболевании создается менее продолжительный и менее напря-
женный иммунитет (от 6 мес до года).
Симптомы болезни. Инкубационный период при заражении че-
рез клещей 8—14 дней. Заболевание начинается с подъема темпе-
ратуры до 40—42 °C с общим угнетением. Пульс нитевидный, до
90—110 ударов в 1 мин, в дальнейшем становится аритмичным,
сердечный толчок усилен. Дыхание учащается до 70—80 движений
в 1 мин. С повышением температуры тела снижается удой в пер-
вые дни на 40—60 %, а в последующие на 80 %. Молоко нередко
желтоватого цвета с примесью крови, горькое на вкус.
На 2—3-й день температурного подъема появляется гемоглоби-
нурия, при этом моча становится розовой, а затем красной и тем-
но-красной. При тяжелом течении бабезиоза моча выделяется не-
большими струйками темно-вишневого цвета. Процесс диуреза у
больного животного затруднен, при этом оно изгибает спину. При
длительной задержке мочи температура падает ниже нормы, на-
блюдается мышечная дрожь.
Видимые слизистые оболочки вначале анемичные, затем желтуш-
ные, иногда покрыты точечными или разлитыми кровоизлияниями.
Аппетит у больного животного пропадает, прекращается жвач-
ка, появляется понос, последний сменяется запором, развиваются
стойкая атония рубца и завал книжки.
Кровь водянистая, количество эритроцитов снижается до 2 млн
в 1 мкл3, а гемоглобина — до 30 %, иногда ниже. В лейкоцитарной
формуле отмечается сдвиг влево, до появления миелоцитов, но
особенно часто до юных и палочкоядерных нейтрофилов. Разви-
ваются лейкопения, нейтрофилия и моноцитоз. Процент лимфо-
цитов увеличивается, а общее число нейтрофилов и эозинофилов
уменьшается. Наблюдаются анизоцитоз, пойкилоцитоз и поли-
хроматофилия. При тяжелом течении болезни в крови обнаружи-
вают нормобласты.
При отсутствии или несвоевременном лечении больные живот-
ные с каждым днем слабеют, лежат, безучастны к окружающему,
уши и спина становятся холодными, температура тела падает до
36—35 °C, появляются судороги, развивается сердечная слабость и
животное на 4—8-й день погибает. Иногда смерть наступает вне-
запно на 3—4-й день болезни в результате разрыва селезенки при
сильной гиперплазии.
329
Смертность при бабезиозе может достигать 40 и реже 60 %.
Иммунитет при пироплазмидозах нестерильный, он поддер-
живается, пока в организме переболевшего животного находятся
в небольшом количестве паразиты. Пироплазмиды строго специ-
фичны к своим хозяевам, поэтому иммунитет вырабатывается
только против определенных видов. В естественных условиях
иммунитет поддерживается за счет постоянной реинвазии. При
ее отсутствии он постепенно ослабевает. Изучение иммунных ре-
акций при пироплазмидозах позволило разработать ряд сероло-
гических методов для диагностики и создать препараты для пас-
сивной и активной иммунизации животных. Наиболее успешно
используют вакцинацию крупного рогатого скота против тейле-
риоза.
Патологоанатомические изменения. Павшие животные истоще-
ны. Слизистые анемичны и желтушны. Подкожная клетчатка
слегка отечна, с желтушным оттенком, в отдельных случаях в ней
обнаруживают точечные кровоизлияния. Скелетные мышцы блед-
ные, иногда имеют вид вареного мяса. Лимфатические узлы слег-
ка увеличены, на разрезе сочные, красноватого цвета. Селезенка
увеличена в 1,5—2 раза, края ее закруглены, под капсулой бывают
кровоизлияния. На разрезе пульпа размягчена, темно-вишневого
цвета, легко снимается тупой частью ножа.
При тейлериозах паразиты вначале размножаются в лимфати-
ческих узлах и других органах кроветворения, вызывая нарушение
деятельности ретикулоэндотелиальной системы и внутренних ор-
ганов, повышается проницаемость стенок кровеносных сосудов
для эритроцитов, что ведет к множественным кровоизлияниям и
анемии. Анемия и наступающее в связи с этим резкое кислород-
ное голодание сильно ухудшают общее состояние больных живот-
ных, в тяжелых случаях через 8—12 дней после начала болезни они
погибают. Развитие тейлерий в лимфоидных клетках и клетках ре-
тикулоэндотелиальной системы слизистых оболочек сычуга и ки-
шечника приводит к появлению гранулемоподобных образова-
ний, а затем язв. Желтуха выражена слабо, гемоглобинурия отсут-
ствует.
Диагностика. Чем раньше и точнее поставлен диагноз, тем эф-
фективнее лечение.
Диагноз ставят с учетом эпизоотологических данных (очаг, се-
зон, наличие определенного клеща на теле животных), клиничес-
ких признаков (высокая температура, анемичность и желтушность
слизистых оболочек, гемоглобинурия и увеличение поверхностно-
го лимфатического узла), патологоанатомических изменений
(желтушность тканей трупа, увеличение селезенки и лимфоузлов,
кровоизлияния на слизистых и паренхиматозных органах), а так-
же микроскопии мазков крови. Обнаруженных в мазке паразитов
дифференцируют по величине, форме, расположению внутри
эритроцитов.
330
о
X
О
*
О
е;
е.
С
о
X
о
S
А
331
Микроскопия мазков крови играет решающую роль для уста-
новления диагноза на пироплазмидозы. Мазки крови готовят до
применения лечебных препаратов. Кровь берут из кончика уха.
Место взятия крови выстригают, тщательно протирают спиртом
или эфиром. Прокол делают иглой в области поверхностных вен,
берут первую каплю (можно и последующие) — она содержит
большое число пораженных эритроцитов. У животных, подозрева-
емых в заболевании тейлериозом, мазки готовят из пунктатов
лимфоузлов и периферической крови. Мазки высушивают на воз-
духе, защищая от солнца, мух и пыли. На мазке иглой отмечают
вид животного, номер или кличку, затем мазок заворачивают в бу-
магу и отправляют в лабораторию. Цель микроскопии мазков —
определение паразита до вида, для этого устанавливают преобла-
дающие и характерные формы пироплазмид, угол расхождения
парных грушевидных организмов, центральное или периферичес-
кое их положение, величину паразита.
Химиотерапевтический метод диагностики основан на специ-
фическом пироплазмицидном действии препаратов. Он применя-
ется для дифференциации сходных по клинической картине бо-
лезней.
В случае гибели или вынужденного убоя животных учитывают
патологоанатомические изменения: желтушность слизистых по-
кровов, подкожной клетчатки, увеличение селезенки, водянистую
кровь, кровоизлияния во внутренних органах, наличие в мочевом
пузыре мочи красного цвета.
Для микроскопического исследования от павших животных го-
товят мазки крови из сосудов сердца, головного мозга, селезенки,
печени, почек, легких и пораженных лимфоузлов.
14.1. БАБЕЗИОЗ КРУПНОГО РОГАТОГО СКОТА,
ВЫЗЫВАЕМЫЙ BABESIA BIGEMINA
Бабезиоз — остро протекающее заболевание, сопровождаемое
высокой температурой, анемией и желтушностью слизистых обо-
лочек, гемоглобинурией, расстройством сердечно-сосудистой, пи-
щеварительной и нервной систем.
Экономический ущерб складывается из гибели животных, по-
тери молочной и мясной продуктивности, расходов на лечение и
профилактику. Отдельные коровы абортируют.
Возбудитель. Babesia bigemina (Piroplasma bigeminum) относится
к семейству Babesiidae. В крови больных животных бабезии обна-
руживаются в виде овальных, кольцевидных или парных груше-
видных форм. В эритроците паразиты занимают центральное по-
ложение. Грушевидные формы больше радиуса эритроцита, между
собой соединены узкими концами и расположены под острым уг-
лом. Величина бабезий 2,2—4,5 мкм, грушевидных — 6 мкм. Пора-
332
Рис.134. Стадии развития В. bigemina в эритроцитах
женность эритроцитов достигает 40 %, особенно высока она в
эритроцитах кровеносных сосудов головного мозга и почек (80—
100 %) (рис. 134).
Биология развития. Бабезии развиваются в организме позвоноч-
ных хозяев и в переносчиках — клещах Boophilus calcaratus, иногда
Rhipicephalus bursa и Haemophysalis punctata. Восприимчивые жи-
вотные — крупный рогатый скот, зебу, буйволы. В организме жи-
вотных паразиты размножаются прямым делением или почкова-
нием. При питании клещей на животных бабезии попадают к ним
с кровью, в теле клещей наблюдается шизотональное деление па-
разитов. В клещах паразит циркулирует трансовариально. В орга-
низме крупного рогатого скота бабезии существуют 6—12нед,
иногда 12—16нед. Вне организма животного паразит быстро по-
333
гибает, а в трупах в зависимости от окружающей среды сохраняет-
ся до 1 сут, размеры паразита при этом уменьшаются, форма ста-
новится округлой.
Эпизоотологические данные. Болезнь распространена в южных
районах, на Северном Кавказе, в Средней Азии и Казахстане.
Протекает в виде одной или двух вспышек за пастбищный сезон,
спорадические случаи возможны в течение всего года. Молодняк,
аборигенный скот, зебу и буйволы переболевают легче. Истощен-
ные, старые и высокопродуктивные животные переболевают тя-
желее, выздоравливают медленно. Чаще болезнь регистрируют ле-
том — в июне и осенью — в сентябре, так как к этому времени в
природе появляется наибольшее количество личинок клещей —
переносчиков возбудителя.
Бабезиоз часто протекает в виде смешанной инвазии с так на-
зываемым южным бабезиозом (франсаиеллезом).
Симптомы болезни. Инкубационный период длится 8—12 сут с
момента нападения личинок клеща. У животных снижается аппе-
тит, общее состояние угнетенное. Больные животные отстают от
стада, больше лежат. Молочная продуктивность резко снижается.
Пульс и дыхание учащаются. Температура тела повышается до
41—42 °C. На 2-й день температурного подъема появляется гемог-
лобинурия, на 3-й и 4-й дни болезнь прогрессирует. Животные
отказываются от корма и воды. Слизистые оболочки желтушные, с
точечными кровоизлияниями. При отсутствии лечения смерть мо-
жет наступить на 3—5-е сутки. Смертность достигает 6—60 %. При
благоприятном исходе клинические признаки начинают стихать,
но гемограмма восстанавливается через 2 мес и позднее.
Иммунитет нестерильный, его длительность от 4—6 мес до
1 года. В крови больных и переболевших животных появляются
антитела, выявляемые РСК и РИФ.
Патологоанатомические изменения. Павшие животные ниже
средней или средней упитанности. Подкожная клетчатка, сухожи-
лия желтушные. Мышцы бледные, лимфоузлы увеличены, соч-
ные, с кровоизлияниями. Кровь водянистая, плохо свертывается.
Селезенка резко увеличена, ее края утолщены, при разрезе пульпа
размягчена, рисунок строения выражен. Печень увеличена, раз-
мягчена, глинистого цвета. Желчный пузырь сильно растянут,
желчь густая, темно-зеленая. Почки увеличены, размягчены, гра-
ница слоев сглажена. Мочевой пузырь часто растянут большим
количеством мочи от розового до темно-красного цвета. Книжка
заполнена сильно спрессованными сухими кормовыми массами.
Слизистая оболочка кишечника гиперемирована. Легкие отечны,
сердце увеличено, цвета вареного мяса. На всех слизистых и се-
розных покровах точечные кровоизлияния.
Диагностика. Диагноз ставят с учетом эпизоотологических дан-
ных, симптомов болезни, патологоанатомических изменений, ре-
зультатов микроскопии мазков крови.
334
Бабезиоз следует дифференцировать от сибирской язвы, леп-
тоспироза, пастереллеза, гематурии, анаплазмоза и бабезиоза, вы-
зываемого другим видом паразита.
Лечение. Рекомендуется применять азидин (беренил)в
виде 7%-ного раствора на дистиллированной или кипяченой воде
в дозе 3,5 мг на 1 кг массы тела внутримышечно или подкожно;
диамидин — 1—2 мг на 1 кг массы тела подкожно или внутри-
мышечно в виде 1—7%-ного водного раствора; солянокис-
лый флавакридин — внутривенно 0,003—0,04г на 1 кг
массы тела в 1%-ном водном стерилизованном кипячением в те-
чение 30 мин и охлажденном до 37 °C растворе (тяжелобольным
животным препарат вводят в половинной дозе с повторением че-
рез 12 ч); пироплазмин (а к а п р и н) — подкожно или
внутримышечно в дозе 0,001 г на 1 кг массы тела в 1—2%-ном вод-
ном растворе после стерилизации текучим паром или на водяной
бане в течение 15 мин; гемоспоридин — подкожно 0,0005 г
на 1кг массы тела с 10—15 мл стерильной дистиллированной
воды; трипансинь (трипанблау) — внутривенно в дозе
0,005 г на 1 кг массы тела в виде 1%-ного раствора на дистиллиро-
ванной воде или физиологическом растворе после 30-минутной
стерилизации на водяной бане.
Одновременно со специфическими препаратами рекомендуют
назначать сердечные и слабительные средства. Больных животных
следует часто поить малыми порциями, в рацион вводить свежее
сено, траву.
Профилактика и меры борьбы. Животных выпасают на незакле-
щеванных, преимущественно культурных пастбищах. В благопо-
лучные по бабезиозу местности можно завозить животных не
старше 2 лет, взрослый скот доставляют в осенне-зимний период.
Надежная мера профилактики — стойловое содержание животных
и регулярное купание или опрыскивание растворами акарицидов
(бензофосфат, перметрин, К-отрин, бутокс и др.).
В энзоотических очагах в начале вспышки болезни животным
вводят беренил, азидин, обладающие способностью предохранять
организм от заболевания в течение 2—3 нед.
В хозяйствах следует вести борьбу с клещами главным образом
путем уничтожения клещей B.calcaratus агротехническими и ме-
лиоративными мероприятиями.
14.2. БАБЕЗИОЗ КРУПНОГО РОГАТОГО СКОТА,
ВЫЗЫВАЕМЫЙ BABESIA BOVIS
Остро протекающая болезнь, вызываемая кровепаразитами из
семейства Babesiidae.
Локализация — в эритроцитах, реже в лейкоцитах и плазме
крови.
335
Рис.135. Стадии развития В. bovis в эритроцитах
Возбудитель. Babesia bovis встречается в крови в различных
формах, наиболее типичны парные грушевидные формы, соеди-
ненные тонкими концами под тупым углом, они как бы «сидят
верхом» на эритроците. Размер парных грушевидных форм мень-
ше радиуса эритроцита. В одном эритроците может быть один-
два, иногда три-четыре возбудителя. Пораженность эритроцитов
57 % и более (рис. 135).
Биология развития. В организме крупного рогатого скота бабе-
зии размножаются в эритроцитах путем прямого деления или поч-
кования. Переносчики болезни — клещи рода Ixodes (I. ricinus и I.
persulcatus). В их организм, где происходит дальнейшее развитие,
бабезии попадают вместе с кровью в период кровососания. Инва-
зионные стадии паразита образуются в слюнных железах клещей
336
уже через 48 ч после кровососания. Передача возбудителя из поко-
ления в поколение возможна на всех стадиях развития клещей
(трансовариально и трансфазно).
Эпизоотологические данные. Бабезиоз распространен во многих
странах Европы, в том числе в средней полосе России. Широкому
распространению заболевания способствуют наличие мелких кус-
тарников, заболоченных лугов и лесов, где широко распростране-
ны клещи-переносчики. Болеют животные всех возрастов, но осо-
бенно коровы старше 8 лет и молодняк 1—2-летнего возраста. Те-
лята переболевают сравнительно легко. Бабезиоз регистрируется в
пастбищный период; при стойловом содержании — очень редко —
при заносе клещей с сеном или травой, а иногда при обострении
паразитоносительства.
Первые случаи заболевания отмечаются весной, примерно
через 2 нед после выгона животных на пастбища. Наибольшее
число заболевших животных в июне—июле. В южных районах
заболевание встречается и в августе—сентябре, что связано с
появлением максимального количества клещей-переносчиков.
Быстрому развитию и размножению клещей и распростране-
нию бабезиоза способствуют дождливая погода, обилие на паст-
бищах мелких млекопитающих — прокормителей переносчиков
болезни.
Симптомы болезни. Они весьма сходны с наблюдаемыми при
пироплазмозе крупного рогатого скота. У коров преобладают ос-
ложнения, связанные с нарушением работы желудочно-кишечно-
го канала, нередко наступает гибель от закупорки книжки и раз-
рыва селезенки. Смертность составляет около 30 %. В Московской
области нами установлено атипичное течение бабезиоза — низкая
температура, невыраженная желтушность.
Патологоанатомические изменения. Существенных отличий от
пироплазмоза крупного рогатого скота не имеют.
Диагностика. Диагноз ставят комплексно. Дифференциация ве-
дется с учетом эпизоотической обстановки. Весьма существенны
результаты микроскопии мазков крови, в которых находят про-
стейших, соответствующих описанию рода Babesia.
Иммунитет нестерильный, продолжительность до 2 лет, иногда
меньше.
Лечение. Существенно не отличается от лечения пироплазмоза
крупного рогатого скота. Особое внимание уделяют предупрежде-
нию атонии желудочно-кишечного канала и закупорки книжки
спрессованными сухими кормовыми массами.
Профилактика. Такая же, как при пироплазмидозах. Она слага-
ется из химиопрофилактики и борьбы с клещами рода Ixodes.
337
14.3. ТЕЙЛЕРИОЗ КРУПНОГО РОГАТОГО СКОТА
Тейлериоз — остро или подостро протекающее заболевание
крупного рогатого скота, вызываемое простейшими семейства
Theileriidae.
Экономический ущерб от болезни складывается из снижения
продуктивности и высокой смертности (до 60—80 %). Коровы рез-
ко снижают удой молока, после выздоровления надой восстанав-
ливается не полностью (на 60—70 %).
Локализация — эритроциты, макрофаги, лимфоциты, ретику-
лоэндотелиальные клетки лимфоузлов, селезенки, печени и дру-
гих органов.
Возбудитель. Болезнь вызывают Theileria annulata, Th.sergenti и
др. В мазках из пунктата лимфатических узлов, печени или селе-
зенки в первые дни болезни паразит имеет форму гранатных тел
(микро- и макромеронты). Гранатные тела —клетки, состоящие
из цитоплазмы и большого числа (40—50 и более) ядер самой раз-
нообразной формы, величина которых колеблется от 8 до 20 мкм.
При распаде микрошизонтов образуются микромерозоиты, про-
никающие в эритроциты и обнаруживающиеся на 2—3-й день бо-
лезни (иногда позднее). Форма их круглая, овальная, запятовид-
ная, палочковидная, крестообразная или анаплазмоидная. Вели-
чина зависит от формы и составляет 0,5—2,9 мкм. В одном эрит-
роците может быть одна—семь тейлерий. Пораженность
эритроцитов достигает 80—95 %.
Биология развития. Тейлерии имеют двух хозяев — клещей-пе-
реносчиков рода Hyalomma для Th. annulata и рода Haemaphysalis
для Th. sergenti, а также теплокровных животных (крупный рога-
тый скот и др.) из подсемейства Bovinae, в организме которых
происходит несколько стадий развития. Тейлерии, проникнув со
слюной клеща в организм животного, устремляются в ближайший
лимфатический узел и там размножаются путем бесполого множе-
ственного деления (рис. 136). В результате образуются макроме-
ронты, которые вновь распадаются на мерозоиты. Молодой меро-
зоит снова делится, образуя макромеронты, и так повторяется
многократно. Последняя стадия мерозоитов образует микроме-
ронты, распадающиеся на микромерозоиты, которые проникают в
эритроциты. В эритроцитах они размножаются бинарным делени-
ем и попадают в организм клещей во время сосания ими крови,
где опять размножаются путем множественного деления. Затем
проникают в слюнные железы для следующей стадии развития
клеща. При нападении на животное клещи со слюной вводят тей-
лерий в организм крупного рогатого скота.
В организме животных возбудитель сохраняется до 6 лет и бо-
лее. Во внешней среде тейлерии быстро погибают.
Эпизоотологические данные. Болезнь распространена в южных
зонах страны, где имеются клещи рода Hyalomma, а также на
338
Рис. 136. Биология развития 1Ъ. annulata:
7 — спорозоиты; 2 —лимфоузел; 3, 4— лимфоциты с макромеронтами; 5—микромерозоиты;
6 — эритроциты
Дальнем Востоке, в Хабаровском крае — в зоне распространения
клещей рода Haemaphysalis. Заболевание наиболее тяжело проте-
кает у привозного скота и молодняка. Болезнь регистрируют
обычно с мая по сентябрь, но особенно численность больных ве-
лика в июне—июле. В отдельных случаях возможны заболевания в
стойловый период, так как клещи рода Hyalomma иногда обитают
в помещениях.
Симптомы болезни. Тейлериозы протекают остро или подостро.
Инкубационный период 6—12 дней, иногда больше. Самый ран-
ний симптом — одностороннее резкое увеличение и болезнен-
339
ность наружных региональных лимфоузлов, расположенных по
ходу лимфатических сосудов от места прикрепления клещей к
телу животного. Через 1—3 сут после этого температура тела повы-
шается до 41—42 °C, а еще через 3—4 сут в мазках крови из пери-
ферических сосудов обнаруживают возбудителя заболевания. Вы-
сокая температура удерживается 5—10 сут, иногда за это время она
может снизиться до нормы, а затем снова поднимается и удержи-
вается несколько дней.
Общее состояние животных в первые дни болезни остается
удовлетворительным, но уже через 3—4 сут больные животные
становятся угнетенными, аппетит снижается или полностью исче-
зает. Жвачка отсутствует, появляется запор, резко снижается отде-
ление молока. Слизистые оболочки гиперемированы, иногда ане-
мичны и слабо желтушны. Веки отечны, отмечают слезотечение. В
слезах со следами крови находят шизонтов тейлерий. Пульс уча-
щен, сердечный толчок усилен. Больные животные чаще лежат,
завернув голову набок. Стельные коровы могут абортировать. Ис-
худание и слабость быстро нарастают, и при явлениях кахексии
животные погибают. Процент гибели среди больных весьма вы-
сок— от 35 до 95.
Иммунитет. Переболевшие животные приобретают напряжен-
ный нестерильный иммунитет, сохраняющийся в течение не-
скольких лет. В крови больных и переболевших животных выявле-
ны антитела. Напряженность иммунитета не зависит от тяжести
переболевания — легкопереболевшие животные также не заболе-
вают повторно.
Тейлерии из различных регионов России обладают сходными
иммуногенными свойствами. Против тейлериоза крупного рога-
того скота создана вакцина (Н. И. Степанова, В. Т. Заблоцкий,
3. П. Мутузкина), которая прошла широкие производственные
испытания в Узбекистане, Таджикистане и Казахстане и надежно
защищает животных. Вакцину готовят из шизонтов (гранатных
тел) тейлерий, выращенных в культуре лимфоидных клеток орга-
нов и тканей крупного рогатого скота.
Патологоанатомические изменения. Павшие животные истоще-
ны. Непигментированные участки кожи и видимые слизистые
оболочки с множественными кровоизлияниями. Подкожные лим-
фоузлы резко увеличены, гиперемированы, с кровоизлияниями.
Печень, селезенка и прилежащие к ним лимфатические узлы уве-
личены, с кровоизлияниями. Сердце дряблое, под эпикардом то-
чечные, пятнистые и полосчатые кровоизлияния. Слизистые обо-
лочки кишечника и особенно сычуга покрыты кровоизлияниями
и изъязвлены. Полость книжки заполнена сухими, сильно спрес-
сованными кормовыми массами.
Диагностика. Диагноз ставят на основании данных эпизоотоло-
гии, симптомов болезни, подтверждаемых обнаружением гранат-
ных тел в пунктатах из поверхностных лимфатических узлов (а
340
также печени и селезенки) и эритроцитарных форм тейлерий в
мазках крови животных. Для ранней диагностики и установления
тейлерионосительства используют серологические методы —
РСК, РДСК, РИФ с антигеном, приготовленным из гранатных
тел или эритроцитарных форм тейлерий.
Лечение. Больных животных переводят на стойловое содержа-
ние и улучшают кормление. В рацион включают свежескошенную
траву или хорошее сено, легкопереваримые концентрированные
корма (отруби, комбикорм). Поят животных вволю.
При тейлериозе рекомендуют несколько схем лечения больных
животных. X и н о ц и д назначают при увеличении поверхност-
ных лимфоузлов в первые 3 дня лечения в дозе 1 мг на 1 кг массы
тела, бигумаль — в последующие 4—5 дней в дозе 12,5 мг на
1 кг. Препараты вводят внутрь однократно в виде 1%-ного водного
раствора, который готовят на кипяченой воде в день применения.
При повышении температуры тела в период лечения животным
назначают оба препарата одновременно в тех же дозах, что и до
повышения температуры. Вводят препараты до снижения темпе-
ратуры тела и еще в течение 2 последующих дней после. Общий
курс лечения не должен превышать 6 дней.
Симптоматические и патогенетические средства рекомендуют с
первого дня лечения: кофеи н-б ензоат натрия — 1,0—
2,0г внутрь 1—2 раза в день, фталазол — 10,0г; хлорис-
тый кобальт — 50 мг; сернокислая медь — 500 мг
внутрь 1 раз с водой или кормом; витамин В12 — 300—500 мкг
внутримышечно 1 раз в 2—3 дня с момента появления признаков
анемии вплоть до выздоровления. Молодняку до 2 лет назначают
половину дозы, в возрасте 1 года — 1/4, телятам 4—8 мес — 1/16
дозы взрослого животного.
Противомалярийный комплексный препарат АБП (ак-
рихин, бигумаль, плазмацид) дают в сочетании с антибиотиками и
симптоматическими средствами внутрь в дозе 1,1г (0,5 г акрихи-
на, 0,5 г бигумаля и 0,1 г плазмацида) на 100 кг массы тела в тече-
ние 5—8 сут до снижения температуры тела и паразитемии.
Лечение состоит из трех комплексов. В комплекс № 1 входят
7%-ный раствор беренила или азидина в дозе 0,01 г
на 1 кг массы тела внутримышечно и окситетрациклин
(террамицин)в дозе 2000—5000 ЕД на 1 кг массы тела внутри-
мышечно. Через 2—6 ч животному вводят комплекс № 2, состоя-
щий из 10%-ного раствора хлорида натрия в дозе 0,5 мг
на 1 кг массы тела внутривенно иаскорбиновой кисло-
ты — 1 мл на 3—5 кг массы тела внутривенно. Сразу после введе-
ния этих двух растворов животному дают воду, обезжиренное мо-
локо или молочную сыворотку. Можно смешать по два препарата
(беренил и окситетрациклин, кофеин и витамин В12, хлориды и
аскорбиновую кислоту) и вводить их за три инъекции.
Со 2-го дня терапевтические средства назначают с учетом со-
341
стояния больного животного. Обычно препараты комплексов № 1
и 2 вводят не более 3 раз. В остальные дни по мере необходимости
вводят отдельные компоненты этих комплексов, но чаще комп-
лекс № 2 или комплекс № 2 + кофеин и витамин В12 и т. д. При
очень тяжелом состоянии больного животного и при понижении
температуры тела (норма и ниже) вместо комплекса № 2 назнача-
ют комплекс № 3: 40%-ный раствор глюкозы в дозе 0,5 мг на 1 кг
массы тела и 10%-ный раствор аскорбиновой кислоты в дозе 1 мл
на 3 кг массы тела внутривенно.
Профилактика. Восприимчивый молодняк иммунизируют в
осенне-зимний период за 2—3 мес до появления на пастбищах
клещей — переносчиков тейлерий. Вакцину вводят однократно
подкожно в дозе 1 мл на животное независимо от его живой массы
и возраста. Иммунитет у привитых телят наступает на 30—35-е
сутки и, если происходит повторное инвазирование, сохраняется
пожизненно. В условиях, исключающих повторное инвазирование
животных, вакцина создает иммунитет продолжительностью до
2 лет (срок наблюдения).
Наиболее надежным считается предотвращение нападения
клещей-переносчиков путем выпаса животных на культурных
пастбищах или, где это экономически оправдано, перевод их на
стойловое содержание, а также вакцинация молодняка в соответ-
ствии с наставлением.
14.4. БАБЕЗИОЗЫ ОВЕЦ И КОЗ
Бабезиозы овец и коз — трансмиссивные сезонные болезни,
протекающие остро или подостро. Вызываются двумя видами про-
стейших из семейства Babesiidae. Экономический ущерб обуслов-
лен потерей всех видов продуктивности больных животных и не-
редко гибелью.
Локализация — идентична таковой у крупного рогатого скота.
Возбудители. Babesia ovis — круглой, овальной, грушевидной
или парногрушевидной формы паразит размером 1—2,5 мкм. Угол
схождения парногрушевидных форм тупой. В одном эритроците
обнаруживают одного-двух, иногда трех паразитов. Пораженность
эритроцитов достигает 45 %.
Babesia motasi (Piroplasma ovis) — более крупный (2,5—4 мкм),
круглой, овальной, амебовидной и грушевидной формы паразит.
Встречаются парногрушевидные формы, которые соединяются
между собой узкими концами под острым углом. Пораженность
эритроцитов до 20 %.
Биология развития. В организме овец и коз бабезии размножа-
ются простым делением или почкованием. С кровью они попада-
ют в организм клеща Rhipicephalus bursa, где размножаются мно-
жественным делением. Затем паразит попадает в половые органы
342
самки и трансовариально передается ее потомству. Вышедшие из
яиц личинки содержат возбудителей, которые проникают в слюн-
ные железы клеща. При питании на овцах или козах клещи ино-
кулируют возбудителей в их организм.
Эпизоотологические данные. Заболевание регистрируют в хозяй-
ствах Северного Кавказа, Закавказья, Крыма, Средней Азии и Ка-
захстана. Появляется весной — с половины мая до конца июня.
Это связано с нападением на животных имаго клещей Rh.bursa. С
июля по октябрь регистрируют единичные случаи заболеваний,
связанные с нападением личинок и нимф клеща.
Бабезиозы можно отнести к природно-очаговым заболеваниям,
так как к данным возбудителям восприимчивы и дикие парноко-
пытные. Кроме того, установлено, что клещи данного вида могут в
течение 56 генераций (срок наблюдения) передавать бабезии по-
томству.
Иммунитет нестерильный, сохраняется 1—2 года.
Симптомы болезни. Инкубационный период болезни длится 5—
12 сут, затем у больных животных повышается температура тела до
42 °C, наступает общее угнетение. Овцы больше лежат, выбирая
тень и прохладные места. Учащаются пульс и дыхание. Слизистые
оболочки вначале гиперемированы, а через 2—3 сут становятся
бледными и желтушными. Сокращения рубца замедляются, на 4—
5-е сутки развивается атония. Фекалии сухие, покрыты слизью,
иногда с примесью крови. Моча мутная, желтая, потом становится
красной или темно-красной. У коз, как правило, гемоглобинурии
не бывает. Корм и воду животные принимают только 2—3 сут. Ги-
бель наступает на 4—7-е сутки. Если температура тела не повыша-
ется выше 41 °C, животные часто выздоравливают без лечения.
Смертность достигает 60—80 %.
Патологоанатомические изменения. Они аналогичны таковым
при пироплазмидозах крупного рогатого скота.
Диагностика. Диагноз ставят так же, как при пироплазмидозах
крупного рогатого скота.
Бабезиоз необходимо дифференцировать от анаплазмоза, леп-
тоспироза и сибирской язвы. При анаплазмозе не бывает кровавой
мочи. Слизистые оболочки фарфорово-белые. Диагноз подтверж-
дается только микроскопией мазков крови. При лептоспирозе
желтушны не только слизистые оболочки, но и кожа, на которой
могут быть и некротизированные участки. При сибирской язве на
трупе часто отмечают красноватые пенистые истечения из есте-
ственных отверстий. Селезенка увеличена, пульпа размягчена,
кровь не свертывается.
Лечение. Больных животных выделяют из отары, помещают в
тень, назначают свежую траву, молоко или питьевую воду. Лечат
специфическими средствами. Азидин (беренил) применя-
ют в виде 7%-ного раствора из расчета 0,0035 г на 1 кг массы тела
внутримышечно; диамидин — в виде 1—7%-ного раствора по
343
0,001—0,002 г на 1кг массы тела. Хороший эффект оказывает
трипансинь (трипанблау)в дозе 5 мг на 1 кг массы в
виде 1%-ного раствора. Обязательно проводят симптоматическое
и патогенетическое лечение.
Профилактика и меры борьбы. При отгонной системе содержа-
ния овец и коз из неблагополучных районов перегоняют на высо-
когорные пастбища до появления клещей. В случае обнаружения
на отдельных животных клещей-переносчиков или появления
единичных заболеваний всю отару подвергают химиопрофилакти-
ке азидином в рекомендуемых дозах через каждые 15 сут до пре-
кращения угрозы возникновения заболевания.
Для уничтожения клещей мелкий рогатый скот купают в про-
плывных ваннах или опрыскивают 0,2%-ной эмульсией бензофос-
фата 1 раз в 10 дней, 0,1%-ной эмульсией дурсбана, 0,02%-ной
эмульсией перметрина, 0,05%-ной эмульсией неоцидола через 9—
10 дней.
Купание овец начинают за 2—3 сут до нападения клещей и
проводят в период всего сезона паразитирования их на животных.
14.5. БАБЕЗИОЗ (ПИРОПЛАЗМОЗ) ЛОШАДЕЙ
Бабезиоз лошадей — остро и хронически протекающая болезнь
непарнокопытных, вызываемая простейшими семейства Babe-
siidae.
Экономический ущерб обусловливается потерей приростов
массы, работоспособности, а иногда гибелью животных.
Локализация — эритроциты крови позвоночного хозяина.
Возбудитель. Babesia caballi (Piroplasma caballi) относится к се-
мейству Babesiidae. В мазках крови от больных лошадей паразиты
имеют овальную, кольцевидную, амебовидную и грушевидную
формы. Размер их больше радиуса эритроцита. Парногрушевид-
ные формы располагаются в центре эритроцита, соединены между
собой под острым углом и достигают длины 2,5—4 мкм. В эритро-
ците обычно бывает один-два паразита. Пораженность эритроци-
тов до 10 % (рис.137).
Биология развития. Развитие бабезий происходит со сменой хо-
зяев. В эритроцитах лошадей и других непарнокопытных бабезии
размножаются простым делением и почкованием. У клещей-пере-
носчиков родов Dermacentor и Hyalomma паразит размножается
путем множественного деления — шизогонией. В организме ло-
шадей возбудитель сохраняется 1—2 года, в клещах циркулирует
трансовариально в нескольких поколениях.
Эпизоотологические данные. Заболевание распространено почти
во всех странах мира, в центральных и западных областях России,
на Урале, Дальнем Востоке, в Сибири, Белоруссии, Казахстане,
Средней Азии, Закавказье и на Украине. В течение последних де-
344
Рис.137. Стадии развития В. caballi в эритроцитах
сятилетий регистрируют лишь отдельные случаи заболевания. В
средней полосе России бабезиоз появляется чаще весной (пик
приходится на май), отчего его называют «майской болезнью». Не
исключен бабезиоз и зимой при заносе клещей рода Hyalomma в
теплые конюшни с сеном.
Симптомы болезни. Инкубационный период 8—12 сут. При ост-
ром течении болезни температура тела повышается до 41—42 °C.
Пульс и дыхание учащены, сердечный толчок усилен. На 2—3-и сут-
ки признаки болезни нарастают, лошади стоят с опущенной голо-
вой, широко расставив передние конечности, тяжело дышат, ап-
петит отсутствует, сердечный толчок заметен на расстоянии, уси-
ливается перистальтика кишечника. Видимые слизистые оболоч-
ки желтые, с полосчатыми и пятнистыми кровоизлияниями.
Иногда наблюдают гемоглобинурию, хотя она выражена слабо из-
за мутности мочи лошадей. Жеребые кобылы нередко абортируют.
Количество эритроцитов и гемоглобина резко уменьшается, СОЭ
существенно повышается. Гибель лошадей наступает на 5—8-е
345
сутки болезни, смертность достигает 30—40 %. Молодняк в возра-
сте 1—2 лет, ослы и мулы переболевают легко. Использование не
полностью выздоровевших лошадей даже на легкой работе обо-
стряет течение болезни и нередко приводит к гибели животных.
Иммунитет нестерильный, сохраняется 1—2 года.
Патологоанатомические изменения. Они аналогичны изменени-
ям при бабезиозе крупного рогатого скота.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, симптомов болезни и микроскопии мазков крови — обна-
ружения в центре эритроцитов парных грушевидных образований,
соединенных под острым углом. Бабезиоз дифференцируют от
нутталлиоза и инфекционной анемии, учитывают и возможность
одновременного заболевания. Для диагностики болезни использу-
ют также РСК, РДСК, РИФ, реакцию микроагглютинации, РИД.
Лечение. На время лечения животным предоставляют полный
покой и освобождают их от всех видов эксплуатации в течение 2—
3 нед после выздоровления. Так как данная инвазия трудно диф-
ференцируется от нутталлиоза и к тому же эти заболевания неред-
ко встречаются в смешанной форме, то рекомендуют применять
препараты, эффективные против обоих заболеваний. С этой це-
лью вводят внутримышечно азидин (б ере н и л) в виде 7%-
ного водного раствора в дозе 0,0035 г на 1 кг массы тела, д и а м и -
дин в виде 10%-ного раствора в дозе 0,002 г на 1 кг массы тела.
Для полного освобождения организма лошадей от возбудителя ба-
безиоза диамидин вводят в дозе 0,004 г на 1 кг массы тела 2 раза в
сутки, а против нутталлий — в дозе 0,005 г на 1 кг массы тела 4
раза через 72 ч, чередуя места введения препарата. Одновременно
следует назначать симптоматическое лечение: сердечные (кофеин,
камфорное масло), слабительные средства.
Профилактика и меры борьбы. С целью профилактики в актив-
ный период нападения клещей лошадей рекомендуют опрыски-
вать 0,02%-ной эмульсией перметрина, 0,15%-ной эмульсией дур-
сбана, 0,5%-ной водной эмульсией циодрина. Обработку повторя-
ют через 7 сут. Расходуют 2—2,5 л препарата на животное. В паст-
бищный период при обнаружении клещей на теле животных или
первого случая заболевания проводят химиопрофилактику, при-
меняя азидин в лечебной дозе через 6—8 сут. Дачу препарата по-
вторяют через 10—12 сут после первой инъекции.
14.6. НУТТАЛЛИОЗ ЛОШАДЕЙ
Нутталлиоз — остро или подостро протекающее заболевание
непарнокопытных животных (лошадей, ослов, мулов), вызывае-
мое простейшими отряда Piroplasmida.
Экономический ущерб складывается из потери прироста мас-
сы, молочности кобыл, а также работоспособности на длительное
время.
346
Рис. 138. Стадии развития N. equi
Локализация — эритроциты.
Возбудитель. Nuttallia equi (Nicollia equi) характеризуется разно-
образием форм и неодинаковой величиной в эритроцитах. В маз-
ках крови встречаются круглые, кольцевидные и грушевидные
формы. Для нутталлий характерно своеобразное расположение
паразитов, напоминающее мальтийский крест, образующееся в
результате почкования. По величине паразиты в эритроцитах
подразделяются на крупные (равны радиусу эритроцита), средние
(1/2 радиуса) и мелкие (1/4 радиуса эритроцита). Мелких нуттал-
лий обычно обнаруживают в эритроцитах у лошадей-нутталлио-
носителей и при хроническом течении инвазии (рис. 138).
Биология развития. Нутталлии развиваются у двух хозяев — не-
парнокопытных и клещей-переносчиков родов Hyalomma и
Dermacentor. В начале инвазии они развиваются в лимфатической
системе, образуя шизонты, а затем в эритроцитах размножаются
делением на четыре особи с образованием крестообразной формы.
347
Эпизоотологические данные. Болезнь встречается в Закавказье,
Средней Азии, Забайкалье, Сибири, ряде центральных областей
России, Поволжья, на Украине и Дальнем Востоке. Источник воз-
будителя инвазии — больные нутталлиозом лошади и нутталлио-
носители, в крови которых после однократного заражения паразит
сохраняется пожизненно — более 18 лет, а также зараженные кле-
щи. Заболевание протекает более тяжело, если заражение насту-
пило в результате укусов клещей Hyalomma и Rhipicephalus. При
передаче нутталлий клещами Dermacentor у лошадей размножают-
ся паразиты средней величины и заболевание протекает подостро.
Изменение размеров нутталлий в различные периоды течения
болезни указывает на зависимость вирулентности паразитов от их
величины. Установлено также, что примуниция при нутталлиозе
приводит к изменению размеров в сторону уменьшения.
Патогенез и симптомы болезни. Установлено, что нутталлий, как
и тейлерии, в организме животного проходят две стадии разви-
тия — тканевую (шизогония в лимфоидных клетках) и эритроци-
тарную (в эритроцитах лошадей). Осуществлено культивирование
in vitro лимфобластов с шизонтами N.equi в течение 25 пассажей.
Нутталлиоз протекает остро, подостро или хронически. Неред-
ко отмечают смешанное течение двух болезней: нутталлиоз + ба-
безиоз; нутталлиоз + инфекционная анемия. В южных районах
болезнь протекает остро.
Инкубационный период длится 1— 2 нед. Начинается заболе-
вание с подъема температуры тела до 41,5 °C. Лихорадка переме-
жающегося типа. Состояние животных угнетенное. На 3—4-е
сутки от начала болезни появляются желтушность и анемичность
слизистых оболочек, их цвет становится лимонным, наблюдают
кровоизлияния. У лошадей часто появляются атония кишечника,
запор, который может смениться поносом. Регистрируют гемог-
лобинурию, но не всегда. Летальный исход обычно наблюдается
в первые дни болезни, при нарастании общей слабости, анемии,
желтушности, ослаблении деятельности сердечно-сосудистой си-
стемы.
При подостром течении обнаруживают те же симп-
томы, что и при остром, но они менее выражены. Инкубацион-
ный период продолжается до 3 нед, а болезнь — до месяца. Выздо-
ровевшие животные длительное время остаются нутталлионосите-
лями.
При хроническом течении болезнь длится 3,5 мес и
более. Летальный исход редок.
Иммунитет нестерильный. Паразитоносительство фактически
пожизненное. У больных и переболевших животных в крови воз-
никают антитела, которые выявляют РСК, РДСК.
Патологоанатомические изменения. Довольно четко выражены
при остром течении и менее четко — при подостром. Основные
изменения подобны изменениям при бабезиозе лошадей.
348
Диагностика. Диагноз ставят комплексно, как при пироплазмо-
зе. Для дифференциальной диагностики нутталлиоза и бабезиоза
обязательно исследование мазка крови. Иногда исследуют сыво-
ротку крови в РДСК с нутталлийным антигеном. Инфекционная
анемия отличается от нутталлиоза тем, что она возникает у лоша-
дей чаще всего во второй половине лета и осенью. Слизистые обо-
лочки бледно-серые, но не желтушные. Аппетит у лошадей хоро-
ший, несмотря на повышенную температуру. Азидин и гемоспо-
ридин при инфекционной анемии лечебного действия не оказы-
вают.
Лечение и профилактика. Такие же, как при бабезиозе лошадей.
Высоким лечебным действием обладает диамидин в дозе 5 мг
на 1 кг массы тела. Четырехкратное его введение с интервалом 72 ч
обеспечивает полное освобождение организма лошади от нуттал-
лий. После выздоровления животных освобождают от работы на
1 мес.
14.7. БАБЕЗИОЗ (ПИРОПЛАЗМОЗ) СОБАК
Бабезиоз собак — остро, подостро или хронически протекаю-
щее заболевание, вызванное простейшими отряда Piroplasmida се-
мейства Babesiidae.
Локализация — эритроциты крови позвоночного хозяина.
Возбудитель. Babesia canis (Piroplasma canis) семейства
Babesiidae в эритроцитах может быть в виде овальных, кольцевид-
ных, амебовидных и грушевидных форм. В одном эритроците
чаще всего встречается один-два паразита, но в некоторых может
находиться до 16 особей. Бабезии крупные — до 7 мкм и заполня-
ют почти весь эритроцит. Величина круглых форм 2,0 — 4,2 мкм,
грушевидных (3,1—5,3) х (1,9—3,1) мкм.
Бабезии в организме собак развиваются простым делением или
почкованием. С кровью животных паразиты попадают в организм
клещей-переносчиков рода Dermacentor, где размножаются путем
шизогонии. Установлена трансовариальная передача возбудителя
среди клещей (рис. 139).
Эпизоотологические данные. Бабезиоз распространен в средней
полосе России, Белоруссии, на Северном Кавказе, Украине, Ура-
ле и в районах Западной Сибири. Заболевание наблюдается летом,
весной и осенью. Особенность болезни — тяжелое переболевание
щенков.
Симптомы болезни. Инкубационный период длится 6—20 сут.
Начинается заболевание повышением температуры тела до 41 °C.
Собаки больше лежат, аппетит отсутствует. Слизистые оболочки
бледнеют, затем становятся желтушными. Пульс и дыхание уча-
щаются. Нередко наблюдают понос, иногда рвоту. На 2—3-и сутки
температурного подъема моча приобретает красный цвет, а на сле-
дующий день — темно-красный. Болезнь продолжается 3—9 сут.
349
;”зч
При подостром течении температура 40 °C, аппетит плохой. Подъем
температуры чередуется с ее снижением до нормы. При этом присту-
пы обострения повторяются через 3—4 сут. Болезнь длится 2—3 нед.
При хроническом течении заболевание протекает вяло.
Иммунитет нестерильный, продолжительностью от 4 мес до 1
года. Беспородные животные переболевают легко.
Патологоанатомические изменения. Они такие, как при бабези-
идозах других животных.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, симптомов болезни и исследования мазков крови, а также
применения бабезиоцидных препаратов.
Бабезиоз собак необходимо дифференцировать от чумы плото-
ядных, при которой препараты не оказывают лечебного действия.
Лечение. Назначают а з и д и н или беренил в форме 1 —
7%-ного раствора внутримышечно в дозе О,ОО35г на 1 кг массы
тела. Через сутки рекомендуют инъекции повторить.
350
Диамидин вводят в дозе 0,001—0,002 г на 1 кг массы тела в
виде 10%-ного водного раствора внутримышечно.
Лабораторная работа
Задания. 1. Подготовить предметные стекла для изготовления
мазков крови. 2. Освоить технику изготовления и фиксации маз-
ков крови, их окраски по методу Романовского — Гимзы. 3. Осво-
ить технику исследования окрашенных мазков под иммерсионной
системой микроскопа. 4. Научиться различать разные виды пиро-
плазмид по морфологии характерных форм в эритроцитах. 5. Оз-
накомиться с морфологией гранатных тел в окрашенных мазках
пунктата из лимфоузлов. 6. Зарисовать контуры характерных
форм пироплазмид.
Оборудование, материалы и объекты исследования: кривые ножницы; инъекци-
онные иглы; шприцы; обезжиренные предметные и шлифованные покровные
стекла; пипетки; полотенце; малые и большие кюветы; бактериологические чаш-
ки; бутылки с тубусами; микроскопы, снабженные окулярами с указателями; ней-
тральная дистиллированная вода; фильтровальная бумага; спиртовой раствор
йода; метиловый или этиловый спирт; краска Романовского — Гимзы; набор раз-
ных по качеству приготовления и окраске мазков; кедровое масло; окрашенные
мазки крови с тейлериями, бабезиями и нутталлиями; мазки пунктата из лимфо-
узлов с гранатными телами; плакаты с рисунками характерных форм пироплаз-
мид; подопытные животные.
Место занятий: лаборатория паразитологии, ветеринарная кли-
ника.
Методика проведения занятия. Преподаватель кратко объясняет
студентам технику приготовления мазков крови и пунктата из
лимфоузлов, демонстрируя набор удачных и неудачных мазков.
Затем студенты разделяются на звенья, за каждым звеном закреп-
ляют животное, и студенты приступают к изготовлению мазков.
Преподаватель проверяет их качество, демонстрируя наиболее
удачные. На высушенных мазках в толстой их части процарапыва-
ют вид, номер или кличку животного.
Качественные мазки фиксируют в спирту. После краткой инст-
рукции преподавателя о технике окраски мазков студенты готовят
рабочий раствор краски. Для этого на 1 мл дистиллированной усред-
ненной воды добавляют две-три капли краски. Фиксированные маз-
ки помещают в бактериологическую чашку на спички и наливают
приготовленную краску. Окрашивание длится 30—45 мин. Мазки
промывают усредненной дистиллированной водой. Промытые и вы-
сушенные мазки проверяет и оценивает преподаватель. Правильно
окрашенные мазки розоватого цвета с фиолетовым оттенком.
Пока мазки окрашиваются, преподаватель объясняет правила
исследования мазков под иммерсионной системой микроскопа и
перечисляет особенности морфологии характерных форм пиро-
плазмид. Обнаруженные под микроскопом характерные формы
пироплазмид схематично зарисовывают. В конце занятия препо-
даватель выставляет студентам оценки.
351
Практическое занятие
Задания. 1. Рассчитать дозу и приготовить 7%-ный раствор ус-
ловного азидина, 1%-ный раствор диамидина и гемоспоридина.
2. Подготовить место введения и ввести раствор препарата живот-
ному. 3. Определить затраты в денежном выражении на химио-
профилактику бабезиоза 1000 гол. крупного рогатого скота диами-
дином, беренилом (азидином), гемоспоридином.
Оборудование, материалы и объекты исследования: весы и разновесы; шприцы
на 5 и 10 мл с иглами; стерилизатор; нагревательный прибор; пинцеты; вощеная
бумага; колбочки небольшие для приготовления раствора; мерный цилиндр и
мерные пипетки; ножницы Купера; вата, колба с дистиллированной стерильной
водой; химиопрепараты азидин, диамидин и гемоспоридин в банках из темного
стекла; спиртовой раствор йода; животные (коровы, овцы, собаки).
Место работы: учебно-производственная клиника.
Методика проведения занятия. Занятие целесообразно начать с
краткого опроса теоретического материала. Затем группу делят на
звенья. Каждое звено получает задание — рассчитать дозу препа-
рата на одно животное определенной массы. Например, сколько
надо азидина для коровы массой 400 кг? 0,0035 • 400 = 1,4 г. При-
готовить 7%-ный раствор этого препарата: (1,4 • 100): 7=20 мл.
Преподаватель каждому звену может дать свое задание.
Студентам надо указать, какой нужен препарат и как его вво-
дить — внутримышечно или подкожно. Препараты вводят в об-
ласть крупа или бедра, соблюдая правила асептики и антисептики.
Следует напомнить, что гемоспоридин кипятить нельзя — при
температуре выше 60 °C он разлагается.
Сначала студенты рассчитывают дозу, затем один из членов
звена подготавливает место введения препарата, другой стерили-
зует шприцы и иглы, третий готовит раствор необходимой кон-
центрации и вводит препарат.
Контрольные вопросы. 1. Что означают пироплазмидозы? 2. При наличии ка-
ких факторов возможно возникновение пироплазмидозных заболеваний? 3. Ка-
ковы основные отличия благополучной зоны от угрожаемой, энзоотической и
латентной? 4. Почему пироплазмидозы относят к природно-очаговым, транс-
миссивным, сезонным болезням? 5. Каков механизм развития анемии, желтухи
и гемоглобинурии при бабезиидозах? 6. Каковы отличительные диагностические
признаки бабезий, тейлерий, нутталлий и специфических клещей-переносчи-
ков? 7. Как приготовить мазок крови для диагностики пироплазмидозов? 8. Ка-
ковы основные пироплазмициды и порядок применения их с лечебной и профи-
лактической целями? 9. Как дифференцировать пироплазмидозы от сибирской
язвы, лептоспироза, гематурии, инфекционной анемии и других сходных забо-
леваний?
352
15. КОКЦИДИОЗЫ животных
Кокцидиозы — остро, подостро и хронически протекающие бо-
лезни животных и человека, вызываемые простейшими различных
видов. Кокцидиозы проявляются общим угнетением, расстрой-
ством пищеварения, сопровождаемым сильным поносом (нередко
кровавым) и истощением. Эти заболевания могут причинить ог-
ромный экономический ущерб. Падеж от эймериоза кроликов мо-
жет достигать 85 %, ягнят (особенно в дождливое лето) — 90, цып-
лят — 100 %. Больные животные отстают в росте и теряют от 12 до
30 % живой массы. Кроме того, для лечения и профилактики забо-
леваний в неблагополучных хозяйствах затрачивают большие ма-
териальные средства.
Систематика кокцидий. По современной систематике кокци-
дий относят к типу Sporozoa, классу Coccidea, подклассу
Coccidia, отряду Coccidiida, который включает три семейства:
Eimeriidae (род Eimeria и род Isospora); Cryptosporidiidae (род
Cryptosporidium); Sarcocystidae, имеющего несколько родов. Се-
мейство Sarcocystidae делится на два подсемейства: Sarcocystinae
(род Sarcocystis) и Toxoplasmatinae (роды Toxoplasma, Neospora,
Besnoitia и Hammondia.).
Эймерии паразитируют в эпителиальных клетках кишечника,
желчных протоков печени (у кроликов) и почек (у гусей). Весь
жизненный цикл проходит в одном хозяине и завершается во
внешней среде. Кокцидии родов Isospora, Sarcocystis, Toxoplasma
развиваются со сменой хозяев. Дефинитивным хозяином обычно
служат хищники (кошки, волки, песцы, собаки и др.), а промежу-
точным — домашние и дикие животные и человек. Человек может
быть и дефинитивным, и промежуточным хозяином, например
для саркоцист.
Морфология и биология кокцидий. Представители разных се-
мейств имеют сложную биологию развития. Стадии возбудителей,
развивающиеся в организме животных, называются эндогенными.
Эндогенные стадии семейств Eimeriidae (род Eimeria) и
Cryptosporidiidae строго специфичны и развиваются в организме
одного вида животного, поэтому их называют моноксенными.
Возбудители подсемейств Sarcocystinae (род Sarcocystis) и
Toxoplasmatinae (род Toxoplasma) эндогенное развитие проходят в
организме двух хозяев — дефинитивного и промежуточного. Их
называют гетероксенными.
Во внешней среде при определенных условиях в ооцисте фор-
мируется у представителей рода Eimeria четыре спороцисты, в
каждой из которых по два спорозоита, у представителей родов
Isospora, Sarcocystis и Toxoplasma — по две спороцисты с четырьмя
спорозоитами в каждой.
Болезни, вызываемые представителями отряда Coccidiida се-
мейства Eimeriidae, называют кокцидиозами или эймериозами
353
(по названию отряда или семейства); болезни, вызываемые возбу-
дителями других семейств, у которых эндогенные стадии развития
происходят в промежуточном хозяине, называют по родовому на-
званию: токсоплазмоз, саркоцистоз, безноитиоз и др.
Биология развития. Эймерии характеризуются тремя стадиями
развития — эймериоидный тип: спорогонией, шизогонией и гаме-
тогонией. Первая проходит во внешней среде при определенной
температуре (оптимальная 18—25 °C), необходимой влажности и
доступе кислорода. Эта стадия называется экзогенной. В ооцисте
формируются четыре спороцисты и в каждой из них по два споро-
зоита. Такие ооцисты называют спорулированными или инвази-
онными. Они способны заражать восприимчивых животных, в
организме которых происходит развитие эндогенной стадии.
Попав вместе с кормом или водой в желудочно-кишечный ка-
нал, оболочки ооцист и спороцист разрушаются, а высвободив^
шиеся спорозоиты внедряются в эпителиальные клетки кишеч-
ника. Внутри клетки ядро спорозоитд-увелинивается. окрушяет-
ся и многоКратноделится (шизогония), формируется многоядер-
ное образование'—мёронт первой- генерации. Далее' в нем
образуется столькотрозоитттв,'^ было'ядер. Меро-
зоиты, разрушив клетку,'выходят в'пр’освет-кишечиик-а-и внгдря-
ются в новые эпителиальные клетки. В них формируются мерон-
ты второй генерации. Этот процесс бесполого множественного
размножения может повторяться до 5 раз. Каждый вид эймерий
эту стадию развития проходит в строго определенном участке ки-
шечника.
Мерозоиты последней генерации, проникая в здоровые клетки,
дают начало образованию макро- и микрогаметоцитов. Из макро-
гаметоцитов формируются женские клетки — макрогаметы, а из
микрогаметоцитов формируется множество микрогамет — мужс-
ких половых клеток, имеюцщхдва жгутика. Этот процесс-называ-
ется гаметогонией. МиКрбгаметЪгподвижны, онй’копулируют с
крупныкпГнеподвижтьши макрогаметами. Образуется зигота, ко-
торая покрывается оболочкой и в виде ооцисты выделяется во
внешнюю среду, где проходит стадия спорогонии.
Патогенез. Патологический процесс начинается с проникнове-
ния спорозоитов в эпителиальные клетки кишечника у большин-
ства животных, желчных ходов у кроликов при поражении их Е.
stiedai и мочевых канальцев у гусей при поражении их Е. truncata.
На стадии мерогонии наступает массовая гибель эпителиальных
клеток. Так, в меронте первой генерации у Е. tenella образуется
свыше 900 мерозоитов, которые, поражая такое же число клеток,
разрушают их, формируя меронты второй генерации. Установле-
но, что в организме больного животного ежедневно гибнет более
500 млн эпителиальных клеток кишечника.
Одновременно с гибелью эпителиальных клеток разрушаются
кровеносные сосуды и нервные клетки. Нарушается целостность
354
стенки кишечника. Массовый распад клеточных элементов при-
водит к тому, что на мертвом белковом субстрате размножается
гнилостная микрофлора. Она усиливает воспалительные процессы
в кишечнике, вызывая расстройство всасывательной и двигатель-
ной функций и способствуя развитию поносов. Это приводит к
хроническому голоданию, застойным явлениям и отекам в раз-
личных органах и тканях.
С развитием болезни происходит нарушение водного баланса,
увеличивается вязкость крови, что осложняет работу сердца,
уменьшается число эритроцитов в крови, падает уровень гемогло-
бина.
Продукты метаболизма эймерий и измененной микрофлоры
при возникшем дисбактериозе и вторичном токсикозе, нарушение
процессов ассимиляции и диссимиляции вызывают патологичес-
кие изменения в центральной нервной системе, проявляющиеся
параличами конечностей и другими клиническими признаками.
Переболевшие эймериозом животные приобретают резистент-
ность к повторному заражению эймериями тех видов, которыми
была вызвана инвазия. Степень невосприимчивости зависит от
многих факторов, и прежде всего от количества эймерий, посту-
пивших в организм, кратности поступления, вирулентности, ви-
дового состава, физиологического состояния организма, условий
кормления и содержания животных и многих других факторов.
Чем тяжелее переболевает животное, чем длительнее протекает
инвазия, тем выше у него невосприимчивость к повторному зара-
жению.
Иммунитет при эймериозах нестерилен и обусловлен наличием
паразита в организме, что обеспечивается на практике частыми
реинвазиями. Эти особенности используются в производственных
условиях для активной иммунизации восприимчивого поголовья.
Животным дают внутрь с кормом или водой определенное коли-
чество возбудителей нужного вида, которое не вызвало бы прояв-
ление клинического заболевания. Если точную дозировку обеспе-
чить трудно, то одновременно с эймериями дают эймериостатики.
В результате происходит бессимптомное переболевание животных
и они приобретают иммунитет к повторному заражению.
Эпизоотология и методы диагностики кокцидиозов. Кокцидиозы
распространены повсеместно. Источники распространения —
больные, переболевшие животные. Источники заражения — за-
грязненные ооцистами корма, кормушки, инвентарь. Болезнь но-
сит сезонный характер. Но при нарушении кормления, скучен-
ном, антисанитарном содержании вспышки эймериоза могут ре-
гистрироваться в любое время года. Чаще болеет молодняк с
высоким процентом падежа.
Кокцидиозы при жизни животных диагностируют на основа-
нии эпизоотологических данных, клинических признаков и ис-
следования фекалий по методу Фюллеборна или Дарлинга. По-
355
смертно диагноз ставят при вскрытии трупов и исследовании со-
скобов с пораженных органов. С целью установления вида возбу-
дителя проводят культивирование ооцист кокцидий. Для этого
фекалии смешивают со слабыми растворами дезинфицирующих
веществ (обычно с 2,5—5%-ным раствором двухромового калия)
или мелкоистолченным древесным углем, чтобы предохранить от
плесени. Тонкий слой смеси в чашках Петри помещают в термо-
стат на 2—3 сут при 29—30 °C.
При дифференциальной диагностике возбудителей кокцидио-
зов учитывают следующие признаки: у ооцист — величину, форму,
цвет, остаточное тело, микропиле; у спороцист — величину, оста-
точное тело, продолжительность спорогонии; у меронтов (шизон-
тов) — величину, форму; у мерозоитов — величину, форму, число.
Учитывают также локализацию в организме.
Правила профилактики кокцидиозов. 1. Изолированное содер-
жание и выпас молодняка отдельно от взрослых животных. 2. Ги-
гиена содержания и кормления животных (регулярная уборка по-
мещений с последующим биотермическим обеззараживанием на-
воза, соблюдение оптимального режима микроклимата в помеще-
ниях, предохранение кормов и воды от загрязнения фекалиями).
Для кур и кроликов обязательно клеточное содержание на сетча-
том полу с выносом кормушек и поилок за пределы клеток.
3. Обеспечение полноценным сбалансированным рационом.
4. Химиопрофилактика. 5. Вакцинация при некоторых кокцидио-
зах и при эймериозах кур.
15.1. ЭЙМЕРИОЗЫ КРОЛИКОВ
Эймериозы кроликов — остро, подостро или хронически про-
текающие болезни крольчат до 4—5-месячного возраста, вызывае-
мые простейшими из отряда Coccidiida.
Локализация — эпителиальные клетки тонкого кишечника и в
желчных протоках печени.
Возбудители. У кроликов паразитируют эймерии девяти видов:
восемь — в кишечнике и один — в желчных протоках печени.
Наибольшее значение имеют четыре из них (рис. 140).
Е. perforans — ооцисты эллипсоидной или овальной формы,
размерами (20—25) х (12—15) мкм, бесцветные, микропиле видно
не у всех особей. Спорогония длится 1—2 сут. Эндогенное разви-
тие происходит в нижнем отделе тонкого кишечника.
Е. media — ооцисты овальные, размерами (18—33) х (13—
21) мкм, желто-коричневые, микропиле хорошо выражено. Спо-
рогония длится 2—3 сут. Эндогенное развитие происходит в 12-
перстной кишке, верхнем отделе тощей кишки.
Е. magna — ооцисты овальные, размерами (32—37) х (21—
25) мкм, желтовато-коричневые, микропиле выражено хорошо,
356
оболочка вокруг него утолщена в виде ва-
лика. Спорогония длится 3—5 сут. Эндо-
генное развитие происходит в средней и
нижней частях тонкого кишечника.
Е. stiedai — ооцисты овальные или эл-
липсоидные, размерами 37—21 мкм, жел-
товато-коричневые, оболочка гладкая, на
суженном конце имеется микропиле. Спо-
рогония длится 3—4 сут. Эндогенное раз-
витие происходит в желчных протоках.
Биология развития. Общая для всех эй-
мерий рода Eimeria (рис. 141).
Эпизоотологические данные. Болезнь
распространена повсеместно. Для ее раз-
вития особенно благоприятны теплые и
влажные сезоны года. Наиболее подверже-
ны заражению животные в возрасте 1 —
4 мес. Крольчата инвазируются с первых
дней жизни, заглатывая ооцисты с загряз-
ненных сосков матери, затем с кормом и
водой. У молодняка обнаруживают ооцис-
ты с 8—10-дневного возраста.
Источник инвазии — взрослые кроли-
ки — носители эймерий, больные и пере-
болевшие крольчата. Ооцисты паразита
могут быть занесены с предметами ухода,
грызунами, птицами, насекомыми. Ооци-
сты весьма устойчивы к воздействиям
внешней среды, но их быстро (через 5—
10 мин) убивает высокая температура
(80—100 °C). Переболевание эймериозом
протекает тяжелее при неполноценном
кормлении и резком изменении рациона,
особенно в период отъема крольчат от ма-
ток. Смертность может быть очень высо-
кой.
Рис. 140. Возбудители
эймериоза кроликов:
/, 2— Е. perforans; 3, 4— Е.
media; 5, 6— Е. magna; 7, 8—
Е. irresidua; 9, 10— E.stiedai
Симптомы болезни. Инкубационный период длится 4—12 сут.
Течение болезни острое, подострое или хроническое. В зависимо-
сти от локализации возбудителя различают кишечную, печеноч-
ную или смешанные формы эймериоза. Первый признак заболе-
вания — кролики становятся вялыми, малоподвижными, больше
лежат, резко снижается масса тела. Брюшко вздуто, болезненно.
Отмечают почти полный отказ от корма, понос, фекалии со сли-
зью, нередко с кровью, частое мочеиспускание. В результате ток-
сикоза резко увеличивается слюновыделение, обильно увлажняю-
щее мордочку крольчонка. Шерстный покров взъерошен, туск-
лый. Перед смертью могут быть судороги, параличи конечностей
357
Рис. 141. Биология развития эймерий у кроликов:
/—7 —спорозоит; 2—4 — развитие шизонтов; 7/, ///— 5 — мерозонты
трех генераций; IV— развитие микро- (7) и макрогамет (2); 3 — зигота
(ооциста); V— 1— ооциста свежевыделенная; 2—4— спорогонии
и шейных мышц. При печеночной форме — желтушность слизис-
тых оболочек и болезненность печени при пальпации.
Патологоанатомические изменения. Павшие крольчата истоще-
ны. При печеночной форме печень увеличена в 4—5 раз. Желчные
ходы расширены. На поверхности и внутри печени видны желто-
вато-белые узелки разных размеров и формы (от просяного зерна
до фасолевого). Внутри узелка содержится творожистая масса, а в
358
ней множество ооцист. Отмечают интерстициальный гепатит.
При кишечной форме серозная оболочка над пораженной частью
кишечника синюшно-красная. Наблюдают катаральное и ката-
рально-геморрагическое воспаление кишечника. В местах скопле-
ния паразитов видны беловатые мелкие точки. Из-за значитель-
ных поражений кишечника его общая масса увеличена.
При хроническом течении болезни слизистая оболочка тонкого
кишечника и слепого отростка незначительно утолщена, серого
цвета и усеяна беловатыми плотными узелками, заполненными
возбудителями на разных стадиях развития.
Диагностика. Диагноз ставят с учетом эпизоотологических дан-
ных, симптомов болезни, патологоанатомических изменений и
исследования фекалий по методу Фюллеборна или Дарлинга с це-
лью обнаружения ооцист эймерий.
Лечение. Кроликам назначают норсульфазол в дозе
0,3—0,4 г на 1 кг массы тела в виде 0,5—1%-ного раствора с моно-
мицином (25 000 ЕД) за два курса по 4—5 дней с интервалом 3 дня;
сульфадиметоксин или сульфапиридозин в
дозе 0,1 г на 1 кг массы тела сочетают с мономицином за два курса
по 5 дней с интервалом 3 дня; в о д н о-м олочный ра-
створ йода (50мл 2%-ного раствора йода смешивают с
250 мл молока и подогревают на легком огне, затем к смеси добав-
ляют 1800 мл воды и выпаивают кроликам в течение 7—14 дней по
250 мл на животное). С лечебной и профилактической целями
применяют премиксы, содержащие кокцидиостатики.
Профилактика и меры борьбы. Кроликов содержат в клетках с
сетчатым полом. Фекалии из поддона убирают не реже 2 раз в сут-
ки в плотные ящики и отвозят в навозохранилище. Клетки и ин-
вентарь содержат в чистоте. Кормушки и поилки должны быть
постоянно чистыми. Чтобы в них не попадали фекалии, их распо-
лагают вне клеток. Корма и подстилку хранят в специально отве-
денных помещениях.
Крольчат после отъема переводят на обычный рацион. С про-
филактической целью применяют сульфадиметоксин с мономи-
цином или сульфапиридозин с мономицином так же, как и с ле-
чебной целью.
«15.2. ЭЙМЕРИОЗЫ КУР
Эймериозы кур — остро, подостро или хронически протекаю-
щие болезни цыплят в возрасте от 10 до 80 дней, вызываемые про-
стейшими, относящимися к отряду Coccidiida.
Локализация — эпителиальные клетки тонких кишок.
Возбудители. Эймериозы кур вызывают девять видов эймерий
семейства Eimeriidae рода Eimeria. Из них наиболее распростра-
ненными считаются четыре.
359
E. tenella — самый распространенный и вирулентный вид.
Ооцисты зеленоватого цвета, овальной формы, размерами (22,96—
24,5) х (18,2—19,16) мкм, имеют двухконтурную оболочку. На од-
ном из полюсов полярная гранула, микропиле нет. Спорогония
продолжается при оптимальных условиях от 18 до 48 ч. Паразити-
рует в слепых кишках.
Е. necatrix — очень вирулентный вид эймерий. Ооцисты бес-
цветные, овальной или яйцевидной формы, размерами (13—
20) х (И —18,3) мкм, имеют полярную гранулу. Спорогония про-
должается 14—21 ч. Паразитирует чаще в среднем отделе тонкого
кишечника.
Е. acervulina — слабовирулентный вид. Ооцисты бесцветные,
яйцевидной формы, размерами (16—20,2) х (12,7—16,3) мкм. На
заостренном конце имеются слабозаметное микропиле, одна или
несколько полярных гранул. Спорогония продолжается до 48 ч.
Паразитирует чаще в 12-перстной кишке.
Е. maxima — ооцисты желто-коричневого цвета, яйцевидной
или овальной формы, размерами (21,4—42,5) х (16,5—29,8) мкм.
На заостренном конце имеются микропиле и полярная гранула.
Спорогония продолжается 30—48 ч. Паразитирует в тонком отделе
кишечника (рис. 142).
Биология развития. Аналогична биологии развития эймерий
других животных.
Эпизоотологические данные. Эймериозы кур распространены
повсеместно. Это обусловлено прежде всего высокой устойчиво-
стью эймерий во внешней среде, их высокой репродуктивной спо-
собностью. На птицефабриках сезонность заболевания не выраже-
на. В фермерских, индивидуальных хозяйствах вспышки эймерио-
Рис.142. Возбудители эймериоза кур:
1, 2— Е. maxima; 3, 4— Е. tenella; 5, 6— Е. acervulina; 7, 8~ Е. necatrix
360
зов могут наблюдаться весной, в начале лета, когда климатические
условия становятся оптимальными для развития эймерий во
внешней среде, а младшие возрастные группы цыплят наиболее
восприимчивы к заражению.
Большое значение в распространении эймериозов имеют
скученность птицы в помещениях, повышенная влажность воз-
духа и подстилки, сырость на выгульных двориках, неполно-
ценное кормление, т. е. нарушение технологии выращивания
молодняка.
Источниками инвазии являются, как правило, больные или пе-
реболевшие цыплята, а также взрослые куры, которые могут быть
носителями эймерий. Инвазионное начало распространяется че-
рез загрязненные ооцистами эймерии корма, воду, кормушки,
подстилку, хозяйственный инвентарь. Механическими перенос-
чиками могут быть обслуживающий персонал, грызуны, дикие
птицы, насекомые и т. д.
Ооцисты обладают высокой устойчивостью к действию всех
химических средств и низких температур. Они погибают при вы-
сушивании и чувствительны к действию высокой температуры.
Надежное средство дезинвазии клеток, кормушек, поилок и дру-
гого оборудования — фламбирование огнем паяльной лампы или
газовой горелки.
Симптомы болезни. Инкубационный период длится 4—7 сут. У
цыплят отмечают угнетение, они прижимаются друг к другу и к
источнику тепла, сидят нахохлившись. Перья взъерошены, кры-
лья опущены, мокрые. Отмечают слабость, шаткость при движе-
нии, аппетит снижен или вообще отсутствует, жажда повышена.
Испражнения жидкие, с большим количеством слизи и крови. В
дальнейшем понос усиливается, перья вокруг клоаки загрязнены
жидкими испражнениями. При остром течении гибель наступает
на 2—3-и сутки. При подостром течении наблюдаются те же кли-
нические признаки, однако заболевание развивается медленно, не
так бурно. У больных могут быть парезы крыльев, паралич ног.
Цыплята погибают на 7—10-е сутки болезни.
Патологоанатомические изменения. Павшие птицы истощены.
Гребешки, сережки и конъюнктива анемичны. Основные измене-
ния обнаруживают в кишечнике. Слизистая оболочка слепых от-
ростков геморрагически воспалена, темно-красная, местами
изъязвлена. При более остром течении болезни такое же воспале-
ние наблюдается на серозной оболочке.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, клинических признаков, патологоанатомических измене-
ний, микроскопии соскобов со слизистой оболочки кишечника,
результатов исследований помета и подстилки по методу Фюлле-
борна или Дарлинга на наличие ооцист эймерий.
Особое внимание обращают на дифференциальную диагности-
ку эймериоза от пастереллеза, псевдочумы, спирохетоза. При этих
361
инфекциях птицы болеют круглый год и, кроме того, выявляют
специфические виды возбудителей.
Лечение. Для лечения применяют кокцидиостатики.
Их условно делят на две группы. Одна группа не препятствует со-
зданию иммунитета в организме цыплят, и ее можно использовать
в хозяйствах яичного и племенного направлений, другая — пре-
пятствует, и ее можно использовать для бройлеров, в хозяйствах
мясного направления.
К первой группе относятся кокцидин, ирамин, ампролиум, фу-
разолидон, сульфаквиноксалин, ко второй — химкокцид (робики-
дин), фармкокцид (клопидол, регикокцин).
Кокцидин (зоален) с лечебной целью скармливают
цыплятам в течение 3—5 сут в дозе 250 мг на 1 кг корма, затем
7 сут — по 125 мг на 1 кг корма ежедневно. В необходимых случаях
после 2-дневного перерыва можно применять еще 10 сут в дозе
125 мг на 1 кг корма.
Ирамин с лечебной целью первые 3 дня применяют в дозе
800 мг на 1 кг корма, затем 7 дней подряд — по 400 мг на 1 кг кор-
ма. При необходимости после 3-дневного перерыва дают в дозе
400 мг на 1 кг корма в течение 10 дней.
Ампролиум с лечебной целью назначают в течение 5—7
дней в дозе 1 г на 1 л воды, после улучшения состояния — 1 г на
1 кг корма в течение 7—10 нед.
Фуразолидон дают с кормом из расчета 3 г на 100 гол. 3
раза в день в течение 6—7 дней, птице старших возрастов — из
расчета 4 г на 100 гол.
Сульфаквиноксалин дают 10 дней в дозе 500 мг на
1 кг корма.
Профилактика и меры борьбы. Цыплят следует размещать в
клетках и дезинвазированных помещениях. Дезинвазию проводят
горячим паром или горячей (не ниже 80 °C) водой, огнем (где это
возможно по противопожарным условиям). Молодняк нельзя со-
держать вместе с птицей старшего возраста. Необходимо своевре-
менно проводить химиопрофилактику.
С профилактической целью назначают кокцидин — 125 мг на
1 кг корма ежедневно (два-три 10-дневных курса с 3-дневным пе-
рерывом между ними), ирамин — 400 мг на 1 кг корма ежедневно
(два-три 10-дневных курса). Начинают профилактическую обра-
ботку с 10-дневного возраста.
Бройлерам начиная с 10-дневного возраста ежедневно в тече-
ние всего периода выращивания дают химкокцид — 125 мг на 1 кг
корма, фармкокцид — 250—500 мг на 1 кг корма. Применение
препаратов прекращают за 3 сут до убоя птицы.
С профилактической целью применяют премикс химкокцид-7
из расчета 500 мг на 1 кг корма (500 г на 1 кг комбикорма) в тече-
ние всего периода выращивания, с лечебной — 1000 г на 1 кг кор-
ма в течение 5 сут; клирамин-20 в дозе 560 г на 1 кг корма начиная
362
с 15-дневного возраста для профилактики и 1120 г на 1 кг корма 5
дней подряд с лечебной целью.
Иммунохимиопрофилактика эймериозов кур заключается в од-
новременном введении в организм птицы иммуногенных (не вы-
зывающих клинического проявления болезни) доз трех видов эй-
мерий и химиотерапевтического препарата, не препятствующего
образованию иммунитета к эймериозам. К мерам профилактики
следует отнести раздельное содержание цыплят от кур, дезинва-
зию кормушек, поилок и предметов ухода, введение в рационы
птицы витаминных кормов и микроэлементов.
15.3. ЭЙМЕРИОЗЫ КРУПНОГО РОГАТОГО СКОТА
Эймериозы крупного рогатого скота — остро, подостро и хро-
нически протекающие болезни молодняка в возрасте от 3—6 мес
до года, вызываемые простейшими отряда Coccidiida.
Локализация — эпителиальные клетки тонких и толстых ки-
шок.
Возбудители. Описано свыше 15 видов эймерий, вызывающих
эймериозы крупного рогатого скота. Все они относятся к семей-
ству Eimeriidae, роду Eimeria. Наиболее часто у животных встреча-
ются виды Е. bovis, Е. zuernii, Е. ellipsoidalis, Е. bukidnonensis
Лрис. 143)____ ____ __
ETbovis — ооцисты яйцевидной или овальной формы, размера-
ми (23—34) х (17—23) мкм, оболочка гладкая, состоит из двух сло-
ев: наружного — бесцветного и внутреннего — желто-коричнево-
го. На суженном конце имеется микропиле. Спорогония длится
2—3 сут)Докал44зуется в толстом кишечнике и нижнем отделе тон-
-когОкишечника.
Е. zuernii — ооцисты круглой, овальной, яйцевидной формы,
размерами (12—29) х (10—21) мкм. Оболочка однослойная, глад-
кая. В ооцисте одна или несколько светопреломляющих гранул.
Спорогония длится 1—6 сут. Паразитирует в тонком и толстом ки-
шечнике.
Е. ellipsoidalis — ооцисты с гладкой оболочкой, бесцветные, эл-
липсоидной формы, размерами (20—26) х (13—17) мкм. Спорого-
ния длится 3 сут. Локализуется в тонком кишечнике.
Е. bukidnonensis — ооцисты грушевидной формы, оболочка
двухслойная, наружный слой с радиальной исчерченностью. На
одном конце имеется микропиле. Спороцисты продолговатые,
размером 20 х 10 мкм. Спорогония длится до 17 сут. Паразитирует
в тонком кишечнике.
Эпизоотологические данные. Болезнь распространена повсемес-
тно. К эймериозу восприимчивы крупный рогатый скот, буйволы
и зебу. Наиболее тяжело переболевают телята до 6-месячного воз-
раста. Однако возможно проявление резких клинических призна-
ков болезни и у животных старше года.
363
2
Рис. 143. Возбудители эймериоза крупного
рогатого скота:
1— Е. bovis; 2— Е. zuernii; 3— Е. ellipsoidalis
Источники распространения — больные, переболевшие телята
и эймерионосители (животные старших возрастных групп). Ис-
точниками заражения становятся загрязненные ооцистами корма,
кормушки, подстилки, места водопоя, заболоченные, переувлаж-
ненные пастбища. Болезнь проявляется чаще осенью при поста-
новке на стойловое содержание. Однако при нарушении кормле-
ния, скученном содержании, антисанитарии вспышки эймериоза
могут регистрироваться в любое время года. Наиболее чувстви-
тельны животные с месячного возраста до 2 лет.
Иммунитет. У переболевшего поголовья формируется невосп-
риимчивость к повторному заражению практически сразу после
выздоровления. Устойчивость сохраняется длительное время, что
обусловлено последующими реинвазиями. Отмечено, что чем тя-
желее протекала болезнь, тем более высокой степени иммунитет у
животного. Если животное не переболело эймериозом в молодом
возрасте, то оно может заразиться в последующие годы, возможно
тяжелое течение болезни, заканчивающееся часто гибелью живот-
ного.
Симптомы болезни. Инкубационный период при эймериозе
длится 14—24 сут.
При остром течении отмечают общее угнетение, на 2—
3-и сутки болезни появляется понос, в фекалиях содержится мно-
го слизи с примесью крови. Спустя неделю ухудшается общее со-
стояние животного, усиливается перистальтика, сильно гипереми-
рована слизистая оболочка прямой кишки. Шерстный покров в
задней части тела загрязнен жидкими испражнениями. В дальней-
364
шем фекалии становятся зеленовато-коричневыми, водянистыми,
с примесью пленок фибрина. К концу 2-й недели понос усилива-
ется и акт дефекации становится непроизвольным. Температура
тела больных повышается до 41 °C. Телята сильно худеют, почти
не реагируют на внешние раздражители. Слизистые оболочки ане-
мичны, анус открыт, его слизистая покрыта точечными или по-
лосчатыми кровоизлияниями. Температура снижается до 35—
36 °C, и животное погибает.
При подостром течении описанные клинические
признаки менее выражены. Заболевание протекает вяло, более
длительно и наблюдается чаще у телят старшего возраста.
Хроническое течение отмечается чаще у животных
старших возрастных групп. В неблагополучных хозяйствах оно бы-
вает часто. Клинические признаки характеризуются исхуданием,
периодически появляющимися поносами. У больных животных на
3—7-е сутки понос может прекращаться, а акт дефекации — затруд-
няться. Заметны общее угнетение, анемия слизистых оболочек.
Больные животные отстают в развитии. Падеж бывает редко.
Патологоанатомические изменения. Трупы истощены, слизис-
тые оболочки анемичны. В брюшной полости находится экссудат
желтоватого цвета. Мезентериальные лимфатические узлы увели-
чены, на разрезе сочные, серого цвета. Слизистая оболочка тонко-
го кишечника отечна и геперемирована, утолщена, с точечными
или полосчатыми кровоизлияниями. В просвете много слизи с
примесью крови. В толстом кишечнике изменения более глубо-
кие. На слизистой видны массовые точечные, полосчатые, а иног-
да обширные кровоизлияния. Иногда в слепой и прямой кишках
обнаруживают язвы, покрытые творожистой массой.
Диагностика. Диагноз ставят комплексно. У больных животных
берут фекалии и исследуют методами нативного мазка, Дарлинга
или Фюллеборна. Однако при постановке диагноза на эймериоз
необходимо отличать субклинические проявления болезни, когда
в поле зрения микроскопа видны единичные ооцисты, против
множества ооцист при остром течении.
При дифференциальной диагностике исключают отравления,
сальмонеллез, колибактериоз и энтериты неинфекционной этио-
логии.
Лечение. Больных животных изолируют и улучшают им усло-
вия содержания, назначают диетическое кормление. В рацион те-
лят включают кисломолочные продукты, мучные болтушки, сено
хорошего качества или высокопитательные травяные смеси, со-
ставленные из свежескошенных трав.
Для лечения назначают внутрь к л о п и д о л-25 в дозе 20 мг
д. в. на 1 кг массы тела в течение 4 сут подряд, а затем через 4 сут
курс лечения повторяют. Норсульфазол дают в дозе 60 мг
на 1 кг массы тела в виде раствора двумя 4-дневными курсами с
перерывом 4 сут.
365
При остром эймериозе хороший лечебный эффект получен от
сочетания норсульфазола с фуразолидоном в
дозе 2—3 мг на 1 кг массы тела в течение 4—5 сут.
Сульфадимезин назначают в дозе 80—100 мг на 1 кг
массы тела 2 раза в день 5 сут подряд.
Сульфапиридазин дают в дозе 50—60 мг на 1 кг массы
тела в течение 4—5 дней. Фармкокцид — в дозе 40 мг на 1 кг
массы тела 4—5 дней. Через 4 дня курс лечения повторяют.
Химкокцид-7 в дозе 20 мг д. в. на 1 кг массы тела скарм-
ливают 10-дневными курсами с промежутками между ними 10
дней до достижения телятами 3—4-месячного возраста.
Новарсенол применяют в дозах: внутривенно 0,01 г и
внутрь 0,02 г на 1 кг массы тела.
При подостром течении телятам назначают внутрь с у л ь -
г и н — 0,2 г на 1 кг массы тела 1—2 раза в день.
Профилактика и меры борьбы. Вновь поступающих в хозяйство
животных выдерживают на карантине 1 мес. Для них создают нор-
мальные условия содержания и кормления. Регулярно очищают
помещения и выгульные площадки с последующей дезинвазией,
навоз обезвреживают. Необходимо помнить, что губительно на
эймерий действует высушивание, а лучший способ дезинвазии —
обжигание паяльной лампой или огнем газовой горелки. Органи-
зуют раздельную пастьбу телят и взрослого поголовья. Проводят
мелиоративные работы с целью осушения переувлажненных паст-
бищ.
Для химиопрофилактики применяют кокцидиовит (0,03 г на
1 кг массы тела) с левомицетином (0,02 г на 1 кг), кокцидин (0,08 г
на 1 кг) с хлортетрациклина гидрохлоридом (0,02 г на 1 кг) 2-днев-
ными курсами, кокцидиовит (0,09 г на 1 кг) и фталазол (0,06 г на
1 кг) 1 раз в неделю, норсульфазол (0,02 г на 1 кг), сульфадимезин
(0,1 г на 1 кг) и фталазол (0,1 г на 1 кг) 4-дневными курсами с 10-
дневными перерывами.
Животным, которым назначали химиопрепараты, дают после
их применения АБК в дозе 50—70 мл, ПАБК в дозе 100—120 мкг
для восстановления полезной кишечной микрофлоры. В эти же
сроки вводят витамины (на одно животное) группы А — 60—
100 тыс. ME, D — 40—50 тыс. ME.
15.4. ЭЙМЕРИОЗЫ МЕЛКОГО РОГАТОГО СКОТА
Эймериозы мелкого рогатого скота — остро, подостро и хрони-
чески протекающие болезни молодняка, вызываемые простейши-
ми отряда Coccidiida.
Локализация — толстый и тонкий кишечник.
Возбудители. Описано свыше 20 видов возбудителей эймериоза.
На территории России зарегистрировано более 10 видов семейства
Eimeriidae, но наиболее патогенны три из них.
366
Рис. 144. Возбудители эймериоза овец:
1 — Е. arloingi; 2— Е. ninaekohl jakimovae; 3 — Е. parva; 4— Е. faurei; 5— Е. intricate; 6— Е.
ahsata
Е. ninaekohl jakimovae — ооцисты овальные или эллипсоидные,
размерами (16,5—27,5) х (14,3—23,1) мкм. Наружный слой ооцис-
ты гладкий, бесцветный, внутренний — желто-коричневый. Спо-
рогония завершается за 2—3 сут. Локализуются в тонком и тол-
стом кишечнике.
Е. arloingi — ооцисты овальной или круглой формы, размера-
ми (20,9—31,9) х (16,5—23,1) мкм. Оболочка двухслойная, наруж-
ный слой гладкий, бесцветный, внутренний — желто-коричне-
вый. В ооцисте имеются полярная гранула, микропиле с шапоч-
кой. Спорогония длится 2—3 сут. Локализуются в тонком кишеч-
нике.
Е. faurei — ооцисты яйцевидной или овальной формы, размера-
ми (20,9—36,3) х (16,5—27,5) мкм. Имеются микропиле и свето-
преломляющая гранула. Спорогония длится 2—3 сут. Локализуют-
ся в тонком кишечнике (рис. 144).
Биология развития. Аналогична для всего рода Eimeria.
Эпизоотологические данные. Болезнь распространена повсемес-
367
тно. Наиболее часто встречается в южных зонах с повышенным
увлажнением почвы, в дождливые годы. Особенно восприимчивы
ягнята поздневесеннего окота (1—3-месячного возраста). Зараже-
ние происходит в кошарах, тырлах, на базах и прикошарных паст-
бищах при заглатывании инвазионных ооцист эймерий с кормом
и водой, а также с загрязненных сосков матери.
В условиях Нечерноземья, в частности в Тверской области,
максимум зараженности 6—7-месячного молодняка овец регист-
рируют в конце июня и в июле.
Источник инвазий — больные ягнята и взрослые животные-эй-
мерионосители.
Патогенез и симптомы болезни. Патогенез сходен с патогенезом
при эймериозах других животных. При высокой интенсивности
инвазии инкубационный период продолжается 10—20 сут, по ис-
течении которых у ягнят развивается изнурительный понос с на-
личием в фекалиях обрывков слущенного эпителия, слизистой
оболочки кишечника и крови. Отмечают жажду. Иногда темпера-
тура тела повышается до 42 °C, развиваются слабость, апатия, ис-
тощение. Заболевание длится от нескольких дней до 2 мес. Смерть
наступает при явлениях коматозного состояния. У взрослых жи-
вотных болезнь протекает бессимптомно.
Иммунитет. Переболевшие ягнята становятся эймерионосите-
лями и слабо восприимчивы к повторному инвазированию. Забо-
левание, вызванное одним видом эймерий, не предохраняет овец
от заражения другими видами.
Патологоанатомические изменения. Павшие ягнята истощены,
анемичны. Слизистая оболочка тонкого кишечника, а также сле-
пой кишки катарально воспалена, утолщена, отечна, местами по-
крыта кровоизлияниями и узелками беловато-серого цвета, хоро-
шо заметными со стороны серозной оболочки кишечника. В них
находятся эймерии в эндогенной стадии развития. Мезентериаль-
ные лимфатические узлы увеличены.
Диагностика. Диагноз ставят комплексно с учетом исследова-
ний фекалий и обнаружения ооцист эймерий. При оценке резуль-
татов исследований условно определяют: до 1 тыс. ооцист в 1 г фе-
калий — слабая инвазия, до 5 тыс. — средняя, более 5 тыс. — силь-
ная инвазия.
Эймериоз необходимо дифференцировать от сальмонеллеза
(бактериологическое исследование), стронгилоидоза и стронгиля-
тозов желудочно-кишечного канала (гельминтокопроскопические
исследования) и энтеритов алиментарного происхождения.
Лечение. Больных изолируют. Назначают химкокцид в
дозе 0,03 г на 1 кг массы тела с кормом 1 раз в день в течение двух
5-дневных курсов с интервалом 3 дня.
Положительные результаты получены от ежедневной дачи с
кормом групповым способом в течение 5—7 дней к л о п и д о -
ла—0,25 г на 1кг, ф а р м к о к ц и д а — 0,25, химкокци-
368
д a — 1 г на 1 кг массы тела. Применяют сульфаниламиды и другие
препараты в растворах так же, как и при эймериозе телят.
Профилактика и меры борьбы. В неблагополучных хозяйствах
проводят химиопрофилактику. Животным дают кокцидиовит
(200 мг на 1 кг корма) в течение 7—10 нед, водные растворы суль-
фадимезина (0,2%-ные), норсульфазола (0,3—0,5%-ные) вместо
питья 7—9 сут подряд. Эффективно скармливать фенотиазиносо-
левую смесь (мелкого помола) в отношении 1:9с кормом. Корм-
ление должно быть полноценным, без перебоев. Водопойные ко-
рыта следует держать в чистоте и размещать на сухих возвышен-
ных местах. Где это возможно, поить животных из проточных во-
доемов.
15.5. ТОКСОПЛАЗМОЗ КОШЕК
Токсоплазмоз кошек — остро, подостро и хронически протека-
ющая болезнь, вызываемая простейшими отряда Coccidiida.
Локализация — эпителиальные клетки кишечника.
Возбудитель. Болезнь вызывает Toxoplasma gondii семейства
Sarcocystidae рода Toxoplasma.
Биология развития. См. Токсоплазмоз животных (рис. 145).
Эпизоотологические данные. Токсоплазмоз распространен по-
всеместно. В его распространении огромную роль играют кошки и
мышевидные грызуны — дефинитивные и промежуточные хозяе-
ва. Поэтому токсоплазмоз относят к группе болезней с природной
очаговостью.
Определенное эпизоотологическое значение имеет транспла-
центарная передача токсоплазм. Однако главную опасность в за-
ражении токсоплазмозом представляют ооцисты Т. gondii, выде-
ляемые кошкой и другими животными семейства кошачьих. Под-
считано, что в 20 г фекалий кошки содержится до 20 млн ооцист.
Причем их выделение продолжается в течение 2 нед. Они устой-
чивы во внешней среде и могут сохраняться в почве до полутора
лет. Обнаружение ооцист в фекалиях взрослых кошек в неболь-
шом количестве объясняется лишь 2-недельным латентным пери-
одом. К моменту исследования выделение ооцист может быть
полностью завершено.
Патогенез и иммунитет. Развитие патологии зависит от многих
факторов: количества инвазионного материала, одновременно по-
павшего в восприимчивый организм; вирулентности штамма; воз-
раста и состояния животного; условий содержания и кормления. В
целом патогенез токсоплазмоза у кошек изучен недостаточно.
Имеются данные, что большинство кошек выделяют ооцисты
1 раз в жизни после поедания зараженного промежуточного хозя-
ина или его тканей и органов. До 90 % кошек после первичного
заражения становятся иммунными.
369
Рис.145. Биология развития Т. gondii:
1 — спорозоит; 2 — меронт (с мерозоитами); 3— микрогамета проника-
ет в макрогамету; 4 — зигота; 5—7— ооцисты на разных стадиях разви-
тия; 8— трофозоиты; 9— циста; 10 — трофозоиты в органах крысы;
11 — циста в мозгу мыши
Симптомы болезни. При остром течении отмечают общее угне-
тение, лихорадку, расстройство функций желудочно-кишечного
канала: понос, рвоту. Могут отмечаться нервные явления, конъ-
юнктивит, ринит. При хроническом течении наблюдаются анало-
гичные симптомы, но менее выраженные. Через 2—3 нед они ис-
чезают. Кишечная форма болезни проявляется поносами, потерей
аппетита, исхуданием, повышением температуры тела до 40—
41 °C.
Патологоанатомические изменения. В период развития в слизис-
той оболочке тонкого кишечника меронтов и половых стадий ток-
370
соплазм отмечают ее набухание, покраснение и признаки воспа-
ления. В отдельных местах можно наблюдать очаги некроза эпите-
лия ворсинок и крипт — места развития эндогенных стадий. В со-
скобах, взятых из этих участков, обнаруживают токсоплазм раз-
ных стадий развития.
Диагностика. Диагноз ставят комплексно и подтверждают лабо-
раторными исследованиями. Исследуют свежие фекалии методом
Дарлинга или Фюллеборна и обнаруживают неспорулированные
ооцисты токсоплазм. Для идентификации ооцист выделяют из фе-
калий, помещают в 2—3%-ный раствор бихромата калия, прово-
дят их споруляцию в термостате при температуре 25—30 °C и зара-
жают ими мышей с кормом или водой. В положительных случаях
во внутренних органах и перитонеальной жидкости развиваются
трофозоиты токсоплазм, и мыши погибают на 7—10-е сутки после
заражения.
Лечение. Кошкам назначают химкокцид при остром тече-
нии 24 мг на 1 кг массы тела в течение 3 сут с кормом или водой.
Затем переходят на половинную дозу — 12 мг на 1 кг и применяют
непрерывно в течение 25 сут.
Эффективны сульфаниламидные препараты в
общепринятых дозах.
Профилактика и меры борьбы. Нельзя скармливать кошкам сы-
рое мясо животных, не прошедшее ветеринарного осмотра, мясо
диких животных и грызунов. Не следует допускать заражения про-
межуточных хозяев (их около 200 видов) ооцистами, выделяемы-
ми кошками.
Борьба с экзогенными стадиями должна предусматривать со-
блюдение всех требований ветеринарно-санитарных правил.
Проводят дезинвазию окружающей среды, дератизационные ме-
роприятия с целью разрыва цикла передачи возбудителя токсо-
плазмоза между грызунами, кошками и сельскохозяйственными
животными.
15.6. ТОКСОПЛАЗМОЗ СЕЛЬСКОХОЗЯЙСТВЕННЫХ
И ДРУГИХ животных
Токсоплазмоз —остро, подостро, хронически, а чаще бессимп-
томно протекающая зооантропонозная болезнь животных, вызы-
ваемая патогенными простейшими отряда Coccidiida семейства
Sarcocystidae подсемейства Toxoplasmatinae.
Локализация — у промежуточных хозяев — в различных клетках
органов и тканей, включая головной мозг, половые органы, эндо-
телиальные клетки, лейкоциты, клетки печени, селезенки, легких,
мышцы сердца, скелетные мышцы, в перитонеальной жидкости и
плазме крови.
Возбудитель. Toxoplasma gondii в организме промежуточных
хозяев (около 350 видов и человек) паразитирует в форме тро-
371
фозоитов — эндозоитов (пролиферативные формы) или цист.
Трофозоиты (зоиты) имеют полулунную форму, похожую на
дольку апельсина, размером (4—8) х (2—4) мкм. Размер цист (ци-
стозоиты) от 30 до 100 мкм. Внутри их находятся мерозоиты. В
эпителиальных клетках кишечника дефинитивных хозяев фор-
мируются округло-овальной формы ооцисты размерами (9—
11) х (10—14) мкм. Спорулированные ооцисты содержат две спо-
роцисты с четырьмя спорозоитами в каждой; микропиле и оста-
точное тело отсутствуют.
Биология развития. Возбудитель проходит две фазы развития:
бесполое размножение в организме промежуточных хозяев
(крупный и мелкий рогатый скот, лошадь, свинья, птица, мышь
и животные многих других видов, а также человек) и половое
(кишечное) в организме окончательного хозяина (кошка и дру-
гие семейства кошачьих). Во внешнюю среду кошки выделяют
неспорулированные ооцисты, которые спорулируют во внешней
среде.
Промежуточные хозяева заражаются при заглатывании спору-
лированных ооцист с кормом или водой. Из ооцист освобожда-
ются спорозоиты и расселяются в клетках различных органов и
тканей, в которых размножаются путем эндодиогении (внутрен-
него почкования) и образуют псевдоцисты. При хроническом те-
чении инвазии образуются (в основном в головном мозге) истин-
ные цисты округлой формы с собственной двухконтурной обо-
лочкой. Цисты содержат большое количество цистозоитов (ме-
розоитов).
В свою очередь, дефинитивные хозяева (кошки и др.) заража-
ются при поедании мяса промежуточных хозяев, пораженных
трофозоитами или цистами. Трофозоиты и мерозоиты (из цист)
в кишечнике кошки внедряются в эпителиальные клетки кишеч-
ника, где размножаются сначала путем шизогонии, а затем гаме-
тогонии, завершающейся образованием ооцист (зигоцист). Далее
ооцисты с фекалиями кошки выбрасываются во внешнюю среду,
где могут быть проглочены животными — промежуточными хо-
зяевами.
Эпизоотологические данные. Токсоплазмоз крупного и мелкого
рогатого скота широко распространен, что обусловлено легкостью
контактов между промежуточными и дефинитивными хозяевами.
Установлено около 350 видов животных — потенциальных проме-
жуточных хозяев. Наиболее чувствителен к заражению молодняк
животных. Особую роль в поддержании очага токсоплазмоза, по-
видимому, играет связь кошка — мышь. Мыши, являясь наиболее
чувствительными к заражению токсоплазмозом, заражаются им от
кошек, контактируя с ними в сфере обитания человека. В свою
очередь, кошки, поедая мышей, пораженных токсоплазмами, вы-
деляют во внешнюю среду огромное количество ооцист.
Кошки могут быть и дефинитивными, и промежуточными хо-
372
зяевами. Если трофозоиты или цисты токсоплазмы попадают
кошкам внутрь с мясом, у них наблюдается лишь кишечная стадия
токсоплазмоза, но при заглатывании кошками инвазионных
ооцист вначале в их органах и тканях развивается бесполая, про-
лиферативная стадия, а затем кишечная или половая.
Источником инвазии являются больные животные — промежу-
точные хозяева, которые выделяют токсоплазм при остром тече-
нии болезни с молоком, мочой, фекалиями и другими экскремен-
тами. Наибольшее количество токсоплазм выделяется с абортиро-
ванными плодами, плацентой и околоплодными водами.
Патогенез. Попадая в организм животных, токсоплазмы разно-
сятся с кровью и лимфой в органы ретикулоэндотелиальной, не-
рвной и половой систем, где, бурно размножаясь, вызывают мас-
совое разрушение клеток. Новые поколения паразитов проникают
в здоровые клетки, процесс повторяется. В этот период наблюда-
ется острое проявление болезни, при котором во внешнюю среду
в огромном количестве выделяются токсоплазмы.
Иммунитет при токсоплазмозе нестерильный. После острой
стадии инвазии, проходящей без заметного проявления или с вы-
раженными симптомами, наступает период формирования имму-
нитета. После заражения животных вирулентными штаммами
токсоплазм наступает иммунная перестройка организма и живот-
ные становятся резистентными к высоковирулентным штаммам.
Животные старших возрастных групп приобретают устойчи-
вость за счет периодического инвазирования малыми дозами воз-
будителя.
Симптомы болезни. При остром течении болезнь ха-
рактеризуется сильной лихорадкой, выраженной общей интокси-
кацией и тяжелым поражением центральной нервной системы.
Характер патологии зависит от многих факторов, и прежде всего
от иммунного состояния организма и вирулентности штамма воз-
будителя.
Животные отказываются от корма, у них появляются поносы.
Из носовых отверстий и глаз выделяются слизисто-гнойные истече-
ния. Могут наблюдаться парезы и параличи конечностей. Стельные
и суягные самки абортируют. В дальнейшем температура тела мо-
жет резко снизиться, после чего животное погибает.
При подостром течении описанные признаки менее
выражены.
Хронический токсоплазмоз протекает без харак-
терных клинических признаков и может быть первичным или
продолжением острой формы инвазии. У животных отмечают
подъем температуры, расстройство функций органов пищеваре-
ния, могут наблюдаться нервные явления, аборты, рождение урод-
ливого плода, длительное бесплодие.
Патологоанатомические изменения. В трупах коров и овец, пав-
ших от острого токсоплазмоза, отмечают увеличение лимфатичес-
373
ких узлов, селезенки, печени, отек и воспаление легких, наличие в
них кровоизлияний и очагов некроза. При подостром течении
токсоплазмоза к описанным явлениям добавляются геморрагичес-
кий энтерит, плохая свертываемость крови и наличие очагов раз-
мягчения в головном мозге.
Диагностика. Диагноз ставят комплексно, анализируя эпизоо-
тологические данные, подтвержденные лабораторными исследо-
ваниями. Обращают внимание на наличие абортов у животных в
ранний период беременности, рождение мертвых и уродливых
плодов. Родившиеся телята и ягнята отстают в росте и развитии, у
них могут наблюдаться парезы и параличи конечностей, повы-
шенная восприимчивость к заболеваниям.
Для лабораторных исследований берут кусочки головного моз-
га, сердца, легкого, печени, селезенки, лимфатических узлов и
глазного яблока. При абортах на анализ посылают целиком плод и
плаценту. Материал необходимо исследовать свежим. Из кусочков
паренхиматозных органов делают мазки-отпечатки, околоплод-
ную жидкость центрифугируют и из осадка делают мазки, фикси-
руют и красят по Романовскому. В окрашенных препаратах обна-
руживают трофозоиты. При необходимости ставят биопробу на
лабораторных животных — белых мышах, заражая их внутрибрю-
шинно суспензией из патологического материала. Если есть анти-
ген из токсоплазм, можно ставить серологические реакции РСК,
РДСК, РИФ.
Токсоплазмоз необходимо дифференцировать от бруцеллеза,
кампилобактериоза, колибактериоза, лептоспироза, листериоза,
трихомоноза крупного рогатого скота.
Лечение. Не разработано.
Профилактика и меры борьбы. Прежде всего необходимо прове-
сти мероприятия, направленные на разрыв биологии развития
токсоплазм, который завершается в организме кошачьих. Только
кошки выделяют во внешнюю среду возбудителя (ооцисты) и спо-
собны заражать животных других видов. Поэтому все мероприя-
тия должны быть направлены на то, чтобы не допустить зараже-
ния кошек возбудителем токсоплазмоза.
Для повышения устойчивости животных к токсоплазмозу непре-
менное условие — организация полноценного кормления и строгое
соблюдение санитарно-гигиенических требований. Проводят де-
зинвазию внешней среды, уничтожая мышевидных грызунов и без-
домных кошек на фермах. Мертворожденные и абортированные
плоды необходимо уничтожать, а станки, где находились больные
животные, дезинвазировать 2—3%-ным раствором карболовой кис-
лоты или гидроксида натрия, или 5%-ным раствором креолина.
Больных животных выбраковывают и отправляют на убой. Мясо
используют только после термической обработки. Разделывать
туши, оказывать акушерскую помощь больным животным, а также
вскрывать трупы следует только в резиновых перчатках.
374
15.7. САРКОЦИСТОЗЫ СЕЛЬСКОХОЗЯЙСТВЕННЫХ
И ДРУГИХ ЖИВОТНЫХ
Саркоцистозы — подостро или хронически, а чаще бессимп-
томно протекающие заболевания животных, а также человека, вы-
зываемые простейшими отряда Coccidiida.
Локализация — в поперечнополосатых мышцах, стенке пище-
вода (стадия цист), эндотелии сосудов, головном мозге, почках и
других органах (стадия шизогонии). Паразитируя в мышечной
ткани, возбудители формируют цисты (саркоцисты) размером от
0,001 до 20 мм.
Возбудители. У крупного рогатого скота паразитируют сарко-
цисты трех видов: Sarcocystis bovicanis, S. bovifelis. S. bovihominis; у
свиней — двух видов: S. suicanis, S. suihominis; у овец — двух видов:
S. ovicanis, S. ovifelis.
В цистах развиваются паразиты двух форм:
1) эндозоит (зоит, трофозоит, цистозоит) — полностью сфор-
мировавшаяся форма возбудителя, способная к дальнейшему рас-
селению в организме промежуточного хозяина, а в случае поеда-
ния зараженного мяса собакой, кошкой или человеком — к разви-
тию в их кишечнике до формирования ооцист;
2) метроцит (тахизоит) — форма активного деления саркоцист,
в результате в цисте увеличивается число эндозоитов. Эндозоиты
(цистозоиты) имеют банановидную, овальную, бобовидную или
серповидную форму, размерами (8—11) х (2—4) мкм. Деление
внутри цист заканчивается через 2,5—3 мес.
Ооциста изоспороидного типа. Она имеет тонкую наружную
оболочку с вдавлением между спороцистами, которая часто раз-
рывается, и инвазионные спороцисты выходят наружу. Размеры
ооцист (14,0—20,0) х (10,0—16,5) мкм.
Биология развития. Саркоцисты развиваются со сменой хозяев.
Дефинитивные хозяева S. bovicanis, S. suicanis, S. ovicanis — соба-
ка, волк, койот, лиса; S. bovifelis, S. suifelis, S. ovifelis — кошки и
S. bovihominis, S. suihominis — человек. Дефинитивные хозяева с
фекалиями выделяют ооцисты и спороцисты саркоцист.
В кишечнике промежуточного хозяина из ооцист и спороцист
освобождаются спорозоиты, которые проникают в эндотелий
кровеносных сосудов органов и тканей, где развиваются путем
множественного деления (шизогония), завершающегося форми-
рованием мерозоитов. Мерозоиты проникают в поперечнополо-
сатые мышцы и инцистируются в течение 2 мес и более. В цисте
образуются камеры. Внутри их формируются метроциты и эндо-
зоиты. При поедании мяса с цистами эндозоиты освобождаются,
внедряются в клетки слизистой оболочки кишечника дефини-
тивных хозяев, где и проходит половая стадия развития, завер-
шающаяся образованием ооцист с двумя спороцистами, содер-
жащими по четыре спорозоита. Ооцисты в кишечнике собак раз-
375
Рис. 146. Биология развития Sarcocystis ovicams:
Л — развитие в кишечнике собак; Б — развитие в организме овец; 1—4— развитие микрогаме-
ты; 4а — развитие макрогаметы; 5 — макрогамета; 6— микрогаметы; 7—9 — спорогонии; 10—
спорулированная ооциста; 11— спороцисты, освободившиеся из ооцисты; 12 — меронты в
кровеносных сосудах; 13 — циста в мышцах промежуточного хозяина
виваются 7—14 сут, а инвазионные ооцисты выделяются 30 сут и
более (рис. 146).
Эпизоотологические данные. Саркоцистозы распространены
широко. Молодняк заболевает с 3—6-месячного возраста. Сезон-
ности не отмечают. Пораженность скота может достигать 40—
100 % (крупный рогатый скот).
Источник инвазии — собаки, волки, еноты, кошки, человек,
выделяющие ооцисты и спороцисты саркоцист во внешнюю среду
с фекалиями. Саркоцисты, выделенные от собак, для животных
376
более патогенны. Факторы передачи возбудителя — трупы и мясо
животных, пораженные саркоцистами.
Патогенез. У дефинитивных хозяев патогенное воздействие на
организм обусловлено развитием эндогенной стадии паразита, что
приводит к нарушению целостности слизистой оболочки кишеч-
ника, расстройству функций желудочно-кишечного канала, раз-
витию воспалительных процессов. Последнее является ответом
организма на внедрение возбудителя. Поражение эндотелия кро-
веносных сосудов ведет к накоплению токсических веществ, дист-
рофическим изменениям паренхиматозных органов. Считается,
что саркоцисты наиболее вирулентны в период мерогонии. Про-
явление вирулентности связано с выделением паразитом токсина
саркоцистина, который нарушает нормальное течение биохими-
ческих процессов в клетках. Из-за повышенной порозности сосу-
дов и обширных массовых кровоизлияний развивается анемия,
усиливается работа легких и сердца, что вызывает острую сердеч-
ную недостаточность. Развитие меронтов в эндотелии почек, пе-
чени, кишечника приводит к нарушению их функциональной дея-
тельности. Развивающиеся цисты способствуют атрофии окружа-
ющей мышечной ткани. В местах разрыва цист могут образовы-
ваться очаги некроза.
Пораженный саркоцистами организм борется с инвазией путем
мобилизации защитных механизмов, в том числе и образованием
антител. Саркоцисты сенсибилизируют организм больного живот-
ного, стимулируя аллергические реакции.
Считается, что дефинитивные хозяева могут многократно зара-
жаться саркоцистами одних и тех же видов. Крупный и мелкий
рогатый скот с возрастом накапливает инвазию вследствие много-
кратных перезаражений.
Симптомы болезни. Они зависят от многих факторов, и прежде
всего от интенсивности заражения животных. Чаще всего болезнь
протекает хронически. У животных ухудшается общее состояние,
повышается температура тела до 40,5 °C и выше, снижаются аппе-
тит и продуктивность. Могут быть эрозии на языке и слизистой
оболочке щек. Стельные и суягные животные абортируют. Интен-
сивное поражение саркоцистами сердечной мышцы может выз-
вать аритмию. Развитие цист в поперечнополосатых мышцах ста-
новится причиной возникновения миозитов, что проявляется бо-
лезненностью при пальпации и шаткостью походки.
Длительное (до 2 мес) течение болезни приводит к анемии,
отеку тканей в области подчелюстного пространства, сильному
истощению и гибели. У экспериментально зараженных телят и яг-
нят наблюдают двукратный подъем температуры, который совпа-
дает с развитием меронтов первой и второй генераций ооцист. За-
тем наступают угнетение, слабость, исхудание, лихорадка, тахи-
кардия, учащенное дыхание, одышка, скрежет зубами, подергива-
ние мышц, шаткость походки, понос, повышенная жажда.
377
У дефинитивных хозяев (собак, кошек, песцов) клинических
признаков при скармливании им сырого мяса, зараженного сарко-
цистами, как правило, не регистрируют.
Патологоанатомические изменения. У крупного и мелкого рога-
того скота они характеризуются истощением, анемией слизистых
оболочек, матовостью волосяного покрова.
На серозных оболочках и в паренхиме всех внутренних орга-
нов — массовые кровоизлияния. Все лимфатические узлы увели-
чены. В грудной и брюшной полостях обнаруживают большое ко-
личество прозрачного желтого цвета экссудата. Возможны ин-
фильтрация и отеки сердца, мозга, почек, мышц с очагами воспа-
ления, некроза и обызвествления. На губах, деснах, языке, мягком
нёбе, пищеводе, сычуге и на всем протяжении кишечника можно
видеть эрозии и изъязвления, в средних артериях легких и селе-
зенки — тромбы.
Диагностика. Диагноз на саркоцистозы ставят комплексно, ана-
лизируя эпизоотологические данные, симптомы болезни, картину
патологоанатомического вскрытия, что подтверждают данными
лабораторных исследований.
У дефинитивных хозяев — собак, кошек — диагноз ставят ис-
следованием фекалий методами Дарлинга и Фюллеборна. При по-
ложительных результатах обнаруживают спорулированные ооцис-
ты или спороцисты возбудителей.
Как у крупного, так и мелкого рогатого скота нет каких-либо
характерных только для саркоцистоза признаков. По клиничес-
ким признакам поставить диагноз очень трудно.
При вскрытии трупов и ветеринарно-санитарной экспертизе
туш овец и крупного рогатого скота в стенке шейной части пище-
вода находят макроцисты величиной с рисовое зерно или гороши-
ну белого или желтоватого цвета. Цисты можно обнаружить в ске-
летных мышцах, мышцах языка, сердца и диафрагмы. Для обнару-
жения микроцист берут пробы мышц сердца, пищевода, диафраг-
мы, скелетных мышц величиной с овсяное зерно, четыре среза
помещают между стеклами компрессориума, сдавливают и иссле-
дуют под малым увеличением микроскопа. Микроцисты имеют
веретенообразную или овальную форму и располагаются между
мышечными волокнами. Для обнаружения мерозоитов в капле
воды разрывают макро- или микроцисты из мышечной ткани и
исследуют под микроскопом при увеличении х 200.
Для прижизненной диагностики используют аллергические и
серологические методы исследований.
Саркоцистоз крупного и мелкого рогатого скота следует диф-
ференцировать от ряда инвазионных и инфекционных болезней,
таких, как токсоплазмоз, цистицеркозы, пастереллез, бруцеллез.
При дифференциации ооцист сар}«щист от ооцист других воз-
будителей (эймерий и токсоплазм) учитывают их морфологию и
биологические особенности.
378
Лечение. При терапии саркоцистозов крупного рогатого скота
применяют ампролиум в дозе 100 мг на 1 кг массы тела.
Мелкому рогатому скоту вводят галофугинон (стене-
р о л) в дозе 0,66 мг на 1 кг массы тела. Препарат токсичен и тре-
бует точной дозировки.
Для лечения собак применяют химкокцид в дозе 50 мг на
I кг, а также л е р б е к в дозе 200 мг на 1 кг массы тела.
Профилактика и меры борьбы. Все действия должны быть на-
правлены на разрыв биологии развития, т. е. передачу возбудителя
от дефинитивного хозяина промежуточному и наоборот. При этом
нужно помнить, что человек также является дефинитивным хозя-
ином.
Категорически запрещается скармливать собакам и кошкам
мясо, пораженное саркоцистами. Все трупы животных необходи-
мо подвергать технической утилизации или захоронению на дос-
таточную глубину.
Необходимо организовать отлов бездомных животных, систе-
матически проводить дератизацию против крыс. На всех фермах
должны быть оборудованы санузлы.
Важным звеном в профилактике саркоцистоза является сани-
тарно-просветительная работа среди обслуживающего персонала
и всего населения о путях заражения возбудителем саркоцистоза
животных и человека.
15.8. ИЗОСПОРОЗЫ ПЛОТОЯДНЫХ
Изоспорозы — протозойные болезни плотоядных (собак, ко-
шек и др.) семейств Canidae и Felidae, вызываемые простейшими
отряда Coccidiida.
Локализация — у дефинитивных хозяев — в эпителиальных
клетках кишечника, у промежуточных — в различных органах и
тканях организма.
Возбудители. Описаны более 10 видов возбудителей, которые
относятся к типу Sporozoa семейству Eimeriidae роду Isospora, но
наибольшее значение имеют четыре.
Isospora canis паразитирует у собак. Спорулированные ооцисты
овальной формы, размерами (34—42) х (27—33) мкм, бледно-жел-
того или светло-зеленого цвета. Спороцисты эллипсоидные, раз-
мерами (18—24) х (15—18) мкм, бесцветные, содержат остаточное
тело. Спорозоиты цилиндрической формы, обычно занимают всю
длину спороцисты. Продолжительность споруляции 16—48 ч, пре-
патентного периода — 9—11 сут, патентного — 28 сут.
Isospora ohioensis паразитирует у собак. Ооцисты овальной или
яйцевидной формы, размерами (20—27) х (15—24) мкм, бледно-
желтого цвета, могут быть бесцветными. Спороцисты эллипсоид-
ной формы, размерами (12—19) х (9—13) мкм, содержат остаточ-
379
ное тело. Спорозоиты банановидной формы, размерами (9—
13) х (2,5—5) мкм, содержат одну или более светлых гранул. Пре-
патентный период длится 4—5 сут, патентный — до 35 сут.
Isospora felis паразитирует у кошек. Ооцисты яйцевидной фор-
мы, размерами (32—53) х (26—43) мкм, светло-желтого или свет-
ло-коричневого цвета. Светопреломляющая гранула содержится
не во всех ооцистах. Спороцисты эллипсоидные, размерами (20—
17) х (17—22) мкм, включают остаточное тело. Спорозоиты ци-
линдрической формы, длиной 10—15 мкм. Продолжительность
споруляции 12—48 ч, препатентного периода — 7—10 сут, патент-
ного — 10—12 сут.
Isospora rivolta паразитирует у кошек. Ооцисты овальной или
яйцевидной формы, размерами (28—29) х (20—26) мкм, светло-ко-
ричневого цвета, могут быть бесцветными. Спороцисты широко-
эллипсоидные, размерами (14—16) х (10—13) мкм, содержат оста-
точное тело. Спорозоиты банановидной формы располагаются
вдоль всей ооцисты. Продолжительность споруляции 1—2 сут,
препатентного периода — 4—7, патентного — 6 сут (рис. 147).
Биология развития. Собаки и кошки — дефинитивные хозяе-
ва — заражаются при проглатывании спорулированных ооцист и
при поедании инвазированных мышевидных грызунов (мышей,
крыс, хомяков и др.) — промежуточных хозяев. Последние могут
быть факультативными промежуточными или резервуарными хо-
зяевами изоспор.
Рис. 147. Возбудители плотоядных:
1 — Isospora canis; 2—1. rivolta; 3—1. burrowsi; 4—1. ohioensis
380
При инвазировании дефинитивных хозяев ооцистами у собак и
кошек в кишечнике происходит вначале процесс бесполого раз-
множения паразита — мерогония. В эпителиальных клетках фор-
мируется последовательно три генерации меронтов, затем макро-
и микрогаметы, которые копулируют с образованием зиготы. Из
зиготы формируется ооциста, которая выводится во внешнюю
среду, где спорулирует.
Инвазионными ооцистами изоспор могут заражаться мыши,
крысы, хомяки. В течение недели после их заражения паразит раз-
множается в организме животного — в мезентериальных лимфати-
ческих узлах, особенно в лимфоидных фолликулах, а также в лег-
ких, печени, селезенке, скелетных мышцах тела, где сохраняется
длительное время (до 23 мес).
Изоспоры I. felis, I. rivolta обладают биологической особенностью,
заключающейся в том, что в организме кошек можно обнаружить
внекишечные стадии их эндогенного развития в различных внутрен-
них органах, а также мезентериальных лимфатических узлах.
Эпизоотологические данные. Изоспорозы плотоядных распрост-
ранены повсеместно. Экстенсивность инвазии может достигнуть
20 % и выше. Источники инвазии — больные и переболевшие жи-
вотные, выделяющие с фекалиями ооцисты изоспор.
Заражение происходит через загрязненные корма, вымя мате-
ри, воду, подстилку, а также при поедании промежуточных или
резервуарных хозяев или их инвазированных органов и тканей.
Последние не только увеличивают возможность распространения
инвазии, но и являются резервуаром возбудителя, защищенным
на длительное время от воздействия неблагоприятных факторов
внешней среды.
Наиболее восприимчив к заражению молодняк до 6-месячного
возраста. Могут быть инвазированы и взрослые животные. Изо-
споры устойчивы к воздействию дезинфицирующих веществ, не-
благоприятных факторов внешней среды, где могут сохранять
жизнеспособность месяцами. Высокая репродуктивная актив-
ность возбудителей способствует обсеменению изоспорами мест
обитания животных, что приводит к перезаражению как основ-
ных, так и промежуточных (или резервуарных) хозяев.
Патогенез и иммунитет. Эндогенные стадии развития изоспор
вызывают нарушение целостности слизистой оболочки тонкого и
частично толстого кишечника. Патогенез при изоспорозах иден-
тичен таковому при кокцидиозах.
К цистоизоспорозу наиболее восприимчивы щенки и котята с
30-дневного до 4—6-месячного возраста. При неблагоприятных
условиях содержания и кормления могут болеть и животные более
старшего возраста. Переболевшие животные остаются длительное
время носителями изоспор и становятся невосприимчивыми к по-
вторному заражению теми видами возбудителей, которые вызвали
первичное заболевание.
381
Симптомы болезни. Зависят от дозы изоспор, иммунного состо-
яния организма, условий содержания и кормления животных. Ин-
кубационный период продолжается от 3 до 11 сут. Чаще болезнь у
собак и кошек протекает подостро или хронически. У больных от-
мечают вялость, апатичность, ухудшение, а затем отсутствие аппе-
тита. Фекалии часто разжижены, с большим количеством слизи, а
иногда с прожилками крови. Отмечают полиурию. При несвоев-
ременном принятии мер состояние животных ухудшается, они
больше лежат, слабо реагируют на раздражения, сильно худеют и
погибают.
Патологоанатомические изменения. Трупы животных истощены,
шерстный покров матовый, видимые слизистые оболочки анемич-
ны. Слизистая оболочка тонкого кишечника катарально или ге-
моррагически воспалена. Можно наблюдать десквамацию эпите-
лия, атрофию и некроз ворсинок. Селезенка и мезентериальные
лимфатические узлы увеличены, наполнены кровью.
Диагностика. Диагноз на изоспорозы ставят комплексно с уче-
том эпизоотологических, клинических и патологоанатомических
данных и подтверждают результатами лабораторных исследова-
ний. В лаборатории исследуют фекалии методом Дарлинга или
Фюллеборна. У больных обнаруживают огромное количество не-
спорулированных ооцист изоспор. Ооцисты изоспор собак и ко-
шек можно обнаружить в фекалиях в любое время года, но значи-
тельно чаще они встречаются летом.
При вскрытии с пораженных участков кишечника делают глу-
бокие соскобы слизистой оболочки. Их помещают на предметное
стекло, накрывают покровным, сдавливают и исследуют как не-
окрашенные препараты, так и окрашенные по Романовскому.
При микроскопии обнаруживают эндогенные стадии развития
изоспор — меронты, мерозоиты, микрогаметы.
Лечение. Для лечения применяют сульфаниламидные и нитро-
фурановые препараты, обладающие эймериостатическими и анти-
бактериальными действиями.
Сульфадиметоксин назначают в течение 2 нед в дозе
50 мг на 1 кг массы тела в первые сутки лечения и в половинной
дозе во все последующие.
Сульфадимезин собакам дают в дозе 0,5—1 г на живот-
ное 1 раз в течение 3 сут, затем 3—4 сут левомицетин и еще
3 сут сульфадимезин.
Нитрофуразолидон назначают из расчета 0,025 % к
корму по схеме: 3 сут препарат, 2 сут перерыв, 3 сут препарат.
Кошкам дают сульфамонометоксин в дозе 50 мг на
1 кг массы тела в течение недели, химкокцид — 24 мг на 1 кг массы
тела в течение 3—5 сут. Одновременно проводят симптоматичес-
кое лечение.
Профилактика и меры борьбы. В питомниках проводят плано-
вые диагностические исследования на изоспорозы. Всех вновь
382
поступающих собак также исследуют в карантине на изоспорозы.
Животных, выделяющих ооцист, подвергают лечению. Вольеры,
клетки систематически чистят, моют и дезинфицируют 2%-ным
раствором натрия гидроксида. Фекалии собак собирают и обез-
вреживают. Предметы ухода, щетки, ошейники, поводки дезин-
фицируют 2 раза в неделю. В местах содержания животных дол-
жно быть сухо и чисто. Ведут борьбу с грызунами, мухами, во-
робьями, голубями, которые могут переносить ооцист механи-
чески. Особое внимание уделяют полноценному кормлению
животных.
С профилактической целью, особенно перед транспортиров-
кой, щенкам 1,5 — 2-месячного возраста ежедневно в течение не-
дели добавляют в корм 1,25 г 20%-ного порошка ампролиума на
четверых щенков. Если при этом возникают нервные явления,
вводят внутримышечно глюконат кальция и бромид тиамина.
15.9. САРКОЦИСТОЗЫ СОБАК И КОШЕК
Саркоцистозы собак и кошек — инвазионные болезни, вызван-
ные простейшими отряда Coccidiida, протекающие остро, подостро
и хронически.
Локализация — эпителиальные клетки тонкого кишечника.
Возбудители. У собак паразитируют Sarcocystis bovicanis,
S. ovicanis, S. suicanis, у кошек — S. bovifelis, S. ovifelis, S. suifelis.
Они относятся к семейству Sarcocystidae роду Sarcocystis.
Биология развития. Саркоцисты развиваются с участием дефи-
нитивных и промежуточных хозяев, где дефинитивные хозяева —
собаки и кошки, а промежуточные — крупный и мелкий рогатый
скот и свиньи (см. Саркоцистозы сельскохозяйственных и других
животных).
Эпизоотологические данные. Источники заражения собак —
мясо овец, крупного рогатого скота, свиней, инвазированное сар-
коцистами. Зараженность собак саркоцистозом в некоторых зонах
достигает 90 %. Только одна собака способна выделить в сутки
30 млн ооцист, что и обусловливает высокую степень заражения
саркоцистозом промежуточных хозяев.
Собаки и кошки могут заражаться в любое время года. А так
как ооцисты и спороцисты выделяются дефинитивными хозяева-
ми уже спорулированными, то и перезаражение промежуточных
хозяев также мало зависит от климатических условий и времени
года. Ооцисты саркоцист устойчивы во внешней среде. Они могут
сохранять жизнеспособность годами (свыше Злет) при отрица-
тельной температуре, перезимовать в почве, переносить замора-
живание и оттаивание, а в пастбищный период заражать воспри-
имчивых промежуточных хозяев. Наиболее восприимчивы моло-
дые животные.
383
Патогенез. Развитие макро- и микрогамет, зигот и ооцист в
тонком кишечнике собак и кошек сопровождается теми же изме-
нениями, что и при других кокцидиозах плотоядных.
Иммунитет. После переболевания собак и кошек саркоцисто-
зом возникает нестерильный и ненапряженный иммунитет. Дефи-
нитивные хозяева могут заражаться саркоцистами одного и того
же вида многократно. С возрастом вследствие неоднократных ре-
инвазий у животных развивается резистентность, при этом прояв-
ления клинических признаков у них практически не отмечается.
Котята и щенки при массированном однократном заражении мо-
гут переболевать в легкой форме.
Симптомы болезни. У собак и кошек саркоцистоз протекает, как
правило, субклинически и лишь у молодых животных при силь-
ной инвазии могут наблюдаться расстройство деятельности желу-
дочно-кишечного канала, ухудшение аппетита, вялость, отстава-
ние в росте.
Патологоанатомические изменения. Наблюдается выраженная
гиперемия слизистой оболочки тонкого кишечника, особенно
ворсинок. Соединительнотканная основа их разрыхлена, а эпите-
лий десквамирован.
Диагностика. Диагноз ставят комплексно с учетом эпизоотоло-
гических, клинических и патологоанатомических данных, под-
тверждая лабораторными исследованиями фекалий собак и кошек
методами- Дарлинга или Фюллеборна. Рекомендуется исследовать
свежевыделенные фекалии. Это дает возможность отличить ооци-
сты саркоцист от ооцист токсоплазм, изоспор, эймерий. Ооцисты
саркоцист выделяются во внешнюю среду спорулированными в
отличие от ооцист других возбудителей. Копрологические иссле-
дования необходимо проводить многократно с интервалом 2—
3 сут, так как ооцисты выделяются неежедневно.
Лечение. Назначают химкокцид в дозе 50 мг на 1 кг массы
тела и лербек в дозе 200 мг на 1 кг массы тела с кормом в тече-
ние 3 сут. В дальнейшем препараты применяют в половинной дозе
в течение 25 сут.
Профилактика и меры борьбы. Направлены на разрыв биологии
развития паразита. Запрещается скармливать собакам и кошкам
сырое мясо, не прошедшее ветеринарно-санитарной экспертизы.
Исключаются контакты сельскохозяйственных животных с без-
надзорными кошками и собаками. Недопустимо их пребыва-
ние на территории скотных дворов и ферм. Служебных собак сис-
тематически обследуют трехкратно одним из флотационных мето-
дов на наличие возбудителей. При обнаружении в фекалиях собак
и кошек ооцист или спороцист животных подвергают лечению.
Бродячих собак уничтожают.
384
15.10. ЭЙМЕРИОЗ КАРПА И ТОЛСТОЛОБИКА
Эймериоз карпа и толстолобика вызывается эймериями отряда
Coccidiida.
Локализация — эпителий кишечника.
Возбудитель. Эймериоз карпа вызывает споровик Eimeria
carpelli, а у толстолобика — Е. sinensis семейства Eimeriidae рода
Eimeria.
Ооцисты эймерий карпа и толстолобика сферические, тонко-
стенные, диаметром 8,5—14 и 9,2—10,7 мкм соответственно. Внут-
ри ооцист расположены четыре спороцисты с двумя спорозоитами
в каждой из них (рис. 148).
Биология развития. При заглатывании ооцист рыбой спорозои-
ты покидают спороцисту, внедряются в эпителиальные клетки ки-
шечника и растут, превращаясь в округлую или овальную клетку
(шизонт), в которой происходит многократное деление ядер и об-
разование новых клеток — мерозоитов (шизогония). Последние
проникают в другие клетки эпителия, снова растут, превращаясь в
шизонта и повторяя вышеописанный процесс шизогонии. В ре-
зультате происходит многократное перезаражение клеток кишеч-
ника и их повреждение.
Рис. 148. Биология развития Eimeria сагреШ (О. Н. Бауер, 1981):
7 —шизогония; 2 — образование макрогамет; 3 — образование микрога-
мет; 4— оплодотворение; 5 — образование ооцисты и спор; б—ооциста;
О — остаточное тело; С—споры; СП— спорозоиты
385
После образования нескольких бесполых поколений следуют
половой процесс и спорообразование, при котором мерозоиты
проходят половую дифференцировку и образуют гамонты. После-
дние превращаются в микро- и макрогаметы, которые, сливаясь
друг с другом, образуют зиготу. Зигота обрастает плотной оболоч-
кой, превращается в ооцисту, в которой после деления ядер обра-
зуются спороцисты и спорозоиты. Отличительной особенностью
эймерий рыб является, во-первых, то, что спорогония у них про-
исходит еще в теле хозяина, а не во внешней среде, и, во-вторых,
оболочка ооцист очень тонкая. При эймериозе рыб в эпителии
кишечника находят не ооцисты, а так называемые желтые шары,
которые образуются из остатков распавшихся клеток и ооцист эй-
мерий. Желтые шары отпадают, с экскрементами рыб выходят во
внешнюю среду и заражают следующих рыб.
Эпизоотологические данные. Болезнь широко распространена в
прудовых хозяйствах в основном среди молоди карпа, белого и пе-
строго толстолобиков. Рыбы старшего возраста являются парази-
тоносителями. Источником возбудителей инвазии служат боль-
ные рыбы и паразитоносители, а резервуарами -—дикие рыбы. За-
ражению подвержены все возрастные группы рыб, но больше
мальки и сеголетки. Наибольшая интенсивность инвазии отмеча-
ется летом. К осени интенсивность снижается, а зимой паразиты
обнаруживаются редко. К концу зимовки интенсивность инвазии
снова нарастает.
Патогенез и симптомы болезни. Рыбы худеют, становятся вялы-
ми, плохо поедают корм, не реагируют на внешние раздражители.
Брюшко увеличено, из анального отверстия выделяются желтова-
тые тяжи, содержащие слизь, в которой находятся инвазионные
ооцисты.
Патологоанатомические изменения. При вскрытии больных рыб
обнаруживают воспаление слизистой оболочки кишечника с то-
чечными кровоизлияниями. В просвете кишечника тягучий мут-
ный экссудат.
Диагностика. Диагноз на эймериоз ставится на основании кли-
нических признаков и микроскопического исследования содер-
жимого кишечника и соскобов слизи кишечника.
Лечение. Применяют фуразолидон в дозе 30 мг на 1 кг
массы рыб с кормом в течение 3 дней, курс повторяют 2—3 раза
или используют стандартный лечебный корм «фурокарп».
Меры борьбы и профилактика. В неблагополучных хозяйствах
проводят комплекс оздоровительных мероприятий. После облова
рыб ложе обрабатывают хлоркой (5 ц/га) или негашеной известью
(25 ц/га).
Профилактика заключается в проведении общих мероприятий,
особенно нежелательны смешанно-возрастные посадки рыб.
386
15.11. ИХТИОБОДОЗ (КОСТИОЗ) КАРПОВ
Ихтиободоз (костиоз) — инвазионное заболевание молоди рыб,
вызываемое жгутиконосцем из типа Mastigophora.
Локализация — кожа и жабры рыб.
Возбудитель болезни — жгутиконосец Ichthyobodo (Costia)
necatrix семейства Bodonidae — мелкий паразит длиной 8—15 мкм,
грушевидной формы. На переднем конце находится два жгутика, с
помощью которых костия может держаться и плавать в воде.
Внутри находятся ядро и одна (иногда две) крупные пищевари-
тельные вакуоли (рис. 149). При неблагоприятных условиях кос-
тия образует цисту, весьма устойчивую к внешним факторам.
Размножается костия путем деления при температуре воды 15—
20 °C. Поселяется на жабрах и коже разных видов пресноводных
рыб.
Эпизоотологические данные. Ихтиободоз широко распростра-
нен в южных зонах карповодства — на Украине, Северном Кавка-
зе, в центральных районах России и во многих других странах.
Болеет молодь карпа, форели, карася и многих аквариумных
рыб. Это типичное заболевание для молоди карпа при искусствен-
ном выращивании, развивающееся чаще всего при недостатке
корма в нерестовых прудах. После пересадки в выростные пруды,
где популяция мальков становится меньшей и обеспеченность
кормами лучше, зараженность снижается и болезнь постепенно
затухает. Часто ихтиободоз проявляется у годовиков карпа в зимо-
вальных прудах и бассейнах при тем-
пературе воды 2—7 °C. Болезнь на-
блюдается также при подращивании
личинок форели и других лососевых
в тепловодных хозяйствах и лотках
для подращивания молоди. Из зара-
женных прудов инвазия переносится
с водой, а также рыбоядными птица-
ми.
При понижении температуры или
других неблагоприятных условиях
костия образует цисты для покоя.
Цисты могут оставаться на эпидер-
мисе рыб или опадают на дно пруда,
где могут сохраняться продолжитель-
ное время и даже перезимовывать.
Ихтиободоз — частое заболевание
и причина гибели аквариумных рыб.
Возникает при плотной посадке мо-
лоди рыб в аквариуме, недостатке
кормов и понижении резистентности
организма рыб. Взрослые рыбы по-
Рис. 149. Возбудитель ихтиобо-
доза Ichthyobodo necatrix (О. Н.
Бауер, 1981):
а — свободноплавающий жгутиконо-
сец; б — жгутиконосец на коже
рыбы; 1 — цитостом; 2— жгутиковый
карман; 3 — сократительная вакуоль;
/—жгутики
387
гибают редко, но являются паразитоносителями. В аквариумы
паразит заносится с живым кормом, водной растительностью,
рыбами-паразитоносителями, сохраняется в грунте и воде аква-
риумов.
Патогенез и симптомы болезни. Паразит, локализуясь на поверх-
ности кожи и жабр, раздражающе и в последующем некробиоти-
чески действует на клетки покровного эпителия, вызывает обиль-
ное выделение слизи и в конечном итоге приводит к гибели рыб
от асфиксии.
При тяжелой форме ихтиободоза на поверхности тела рыб об-
наруживают пятна, которые в дальнейшем сливаются в сплошной
сероватый налет, иногда с голубоватым оттенком. Часто наблюда-
ется разрушение плавников и обнажение их лучей. Пораженные
жабры вследствие анемии приобретают бледноватую окраску,
обильно покрываются слизью, а иногда содержат очаги некроза.
Больные мальки при нарушении газообмена поднимаются к по-
верхности воды, скапливаются на притоке, заглатывают воздух.
Патологоанатомические изменения. У погибших рыб основные
изменения находятся на жабрах и коже, внутренние органы без
повреждений.
Диагностика. Диагноз на ихтиободоз ставится на основании ви-
зуального наблюдения за клиническими проявлениями болезни —
наличия на теле сероватого или голубоватого налета и обязатель-
ного проведения микроскопических исследований, соскобов с
кожи жабр. В них обнаруживают костий.
Лечение. При установлении заболеваний рыбу обрабатывают в
3,5%-ных солевых ваннах. Хорошие результаты дает лечение в ра-
створе формалина (1:5000) и других препаратов, применяемых
при эктопаразитарных болезнях.
Меры борьбы и профилактика. Неблагополучные пруды дезин-
фицируют негашеной (25 ц/га) или хлорной (5 ц/га) известью;
производителей перед нерестом купают в 5%-ных солевых ваннах
в течение 5 мин; мальков пересаживают в выростные пруды на 5—
6-й день; в нерестовых и мальковых прудах создают хорошую кор-
мовую базу.
Санитарная оценка рыбы. При поражении костиозом товарная
рыба используется в пищу без ограничений.
15.12. ООДИНИУМОЗ АКВАРИУМНЫХ РЫБ
Оодиниумоз (болезнь колиза, пиллуларис, золотая пыль, вель-
ветовая болезнь) — протозойное заболевание аквариумных рыб,
вызываемое простейшими класса Dinoflagellata. Они представляют
собой промежуточные организмы между водорослями и жгутико-
выми, так как содержат в диноспорах остатки хлорофилла.
Локализация — подэпителиальные слои кожи, плавников, жа-
берных дуг и лепестков и ротовой полости.
388
Возбудители. Возбудителями оодиниумоза считают три вида
жгутиконосцев. У пресноводных рыб паразитируют два вида:
Oodinium pillularis и О. limneticum, а у морских коралловых рыб —
О. ocellatum.
Биология развития. Эти виды отличаются рядом биологических
особенностей, хотя близки по морфологическим признакам. Био-
логия развития О. pillularis и О. ocellatum одинаковая, О. lim-
neticum отличается от них местом локализации и развитием.
О. pillularis — жгутиконосец каплевидной формы, размером
25—140 мкм, золотисто-коричневого цвета. Тело его покрыто рес-
ничками и снабжено двумя жгутиками, один из которых значи-
тельно длиннее второго. Внутри тела находится ядро диаметром
около 12 мкм.
О. ocellatum в нативных препаратах имеет интенсивно темную
окраску (до черной), из-за чего его овальное ядро слабо заметно,
малоподвижен. При помощи ресничек и жгутиков паразиты, по-
падая на рыбу, фиксируются на поверхности ее тела заострен-
ным концом. После этого они проникают под эпителиальные
слои кожного покрова. Под эпителием паразиты растут, увели-
чиваясь в размере, и через не-
которое время выходят во вне-
шнюю среду.
Покинув рыбу, паразиты
опускаются на дно аквариума
или на водную растительность,
где округляются, покрываясь
цистой. В этой стадии развития
они называются пальмеллами.
Внутри пальмеллы клетки мно-
гократно делятся, в результате
образуется от 32 до 64 молодых
жгутиконосцев, которые разры-
вают цисту, выходят в воду и
некоторое время представляют
собой свободноживущие фор-
мы —диноспоры. Диноспора
снабжена двумя жгутиками,
один из которых скрыт склад-
кой тела и имеет глазок красно-
ватого цвета. При помощи жгу-
тиков и ресничек она плавает в
воде и, найдя рыбу, внедряется
под эпителиальные слои кож-
ных покровов. Биология разви-
тия паразита повторяется
(рис. 150).
Температура и pH воды, а
Рис. 150. Биология развития Oodiniutn
pillularis:
а —общий вид жгутиконосца; б, в —деле-
ние жгутиконосца в цисте; г — выход моло-
дых паразитов в воду; д — жгутиконосец в
момент внедрения под эпителий кожи
389
также освещенность аквариума значительно влияют на сроки раз-
вития жгутиконосцев. Оптимальны температура 23—25 °C, pH
около 7 и яркое освещение. При таком режиме биология развития
жгутиконосцев длится в среднем 6—8 сут. Активность диноспоры
увеличивают яркое освещение и температура воды выше 26 °C. В
то же время срок ее самостоятельной жизни до перехода к парази-
тизму при этих условиях значительно сокращается и составляет
немногим более суток.
Жгутиконосец О. limneticum овальной формы, его тело разде-
лено бороздкой пополам. Органами движения служат два жгутика,
а для фиксации на поверхности хозяина дополнительно имеются
псевдоподии. Паразит желтоватой окраски за счет зерен хлоро-
филла, разбросанных по всему телу.
В отличие от предыдущих возбудителей О. limneticum локали-
зуется не под эпидермисом кожи и плавников, а на поверхности.
Размножается на теле хозяина, где он инцистируется, многократ-
но делится, образуя до 200 дочерних клеток. После разрыва цисты
диноспоры выходят в воду и активно разыскивают нового хозяи-
на. В течение 3 сут они живут за счет запасов хлорофилла и, если
не поселятся на рыбах, погибают. При оптимальной температуре
22—26 °C развитие паразита длится 8—10 сут.
Эпизоотологические данные. Оодиниумоз — одна из наиболее
распространенных болезней аквариумных рыб. Болезнь широко
распространена среди многих пресноводных и морских (коралло-
вых) рыб, разводимых в аквариумах, и наносит ощутимый ущерб
аквариумному рыбоводству за счет гибели рыб и потерь на их ле-
чение и профилактику болезни.
О. pillularis и О. limneticum паразитируют на пресноводных эк-
зотических рыбах всех видов и возрастов. Наиболее восприимчи-
вы к болезни рыбы из видов танихтис (кардиналы), нотобранхиус,
хифессобрикон, нанностомус, пунтиус, брахиданио, данио, а так-
же из отряда карпозубых и семейства анабатид (лялиусы, петушки
и макроподы). Наименее чувствительны рыбы семейства цихлид,
хотя они могут быть носителями инвазии.
О. ocellatum паразитирует на оранжевых коралловых рыбах —
Prochilus percula, Dascillus aruanus, Pterios radiata, Scatophagus
argus, Platax vesperitilio и др.
Мальки и рыбы, не достигшие половой зрелости, более подвер-
жены заболеванию, чем взрослые особи. Случаи массовой гибели
наблюдаются редко, только среди молоди рыб. Инвазия развива-
ется медленно, с незначительным отходом больной рыбы.
В нашей стране оодиниумоз в естественных водоемах, в прудо-
вых хозяйствах не зарегистрирован. В связи с этим основными ис-
точниками распространения возбудителей болезни являются экзо-
тические рыбы, растительность, моллюски, грунт и вода из неблаго-
получных по оодиниумозу аквариумов, а также общие для всех ком-
натных водоемов орудия лова и другой рыбоводный инвентарь.
390
Патогенез и симптомы болезни. Паразиты, проникая под кожу и
разрушая эпителиальный слой, вызывают интенсивное слизевы-
деление, что приводит к нарушению кожного дыхания. Это осо-
бенно опасно для молоди рыб, у которой недоразвит жаберный
аппарат, а основной газообмен происходит за счет кожного дыха-
ния. Из перечисленных возбудителей наиболее опасным является
О. pillularis.
Клинические признаки оодиниумоза, вызываемого всеми вида-
ми жгутиконосцев, сходны. На поверхности кожного покрова и
плавниках рыб появляются мельчайшие узелки, внешне напоми-
нающие мучнистую пыль золотистого или серого цвета.
Одни рыбы ведут себя неспокойно, часто почесываясь о грунт
и растения, другие, наоборот, забиваются в углы аквариума или
заросли водной растительности, подплывая к переднему стеклу
только во время кормления. Ранее веерообразно расправленные
плавники, особенно спинной и хвостовой, безжизненно повисают
и становятся как бы склеенными. Межлучевая ткань плавников
разрушается, и они становятся расщепленными. С повышением
интенсивности инвазии разрушение эпителиального слоя кожи
увеличивается, что проявляется хлопьевидным отслоением. От-
дельные пораженные участки кожи тела и плавников приобретают
серовато-бурый оттенок, что объясняется массовым скоплением в
них паразитов. За счет интенсивного размножения оодиниумов
размер таких участков постепенно увеличивается.
Отличительной особенностью оодиниумоза является сохране-
ние аппетита у больных рыб до гибели.
У взрослых рыб болезнь протекает доброкачественно, со слабо-
выраженными симптомами заболевания. Поражение жабр также
незначительно.
Патологоанатомические изменения. Они ограничиваются выше-
перечисленными признаками на внешних покровах рыб.
Диагностика. Диагноз ставят на основании клинических при-
знаков и паразитологических исследований соскобов с поверхнос-
ти тела рыб и учета эпизоотологических данных. Оодиниумоз в
первую очередь следует дифференцировать от ихтиофтириоза на
основании микроскопического исследования соскобов.
Лечение. Оно должно быть комплексным, направленным на
уничтожение возбудителей разных стадий развития: взрослых па-
разитов на рыбах и дочерних клеток в воде и на различных объек-
тах аквариумов. При этом применяют паразитоцидные препараты
для обработки рыб. Одновременно стимулируют размножение и
выход дочерних клеток из цист в воду путем повышения темпера-
туры и яркого освещения аквариумов.
Лечение проводят как в отдельном сосуде, так и в общем аква-
риуме. В первом случае применяют лечебные растворы т р и -
пафлавина (1г на 100л воды), малахитового зеленого, ос-
новного фиолетового К, сульфата меди или бициллина-5. В об-
391
щем аквариуме применяют раствор бициллина-5 или комбиниро-
ванный раствор малахитового зеленого с сульфатом меди. Парал-
лельно с этим повышают температуру воды до 24—26 °C и ярко
освещают аквариум для стимуляции выплода молодых форм воз-
будителя. Курс лечения — две-три обработки с последующим мик-
роскопическим контролем их эффективности.
Если лечение проводят в отдельном сосуде, то воду, грунт и ра-
стительность оставляют в аквариуме без рыбы в течение 7—8 дней,
поддерживая в нем температуру 24—26 °C и ярко освещая. Рыбо-
водный инвентарь дезинфицируют. Только после этого рыб, про-
шедших курс лечения в отдельном сосуде, сажают в аквариум.
Меры борьбы и профилактика. При установлении оодиниумоза
исключают любые контакты с неблагополучными аквариумами,
не допуская пересадок рыб, использования общего оборудования
для всех аквариумов и т. п., проводят интенсивное лечение рыб.
Профилактика болезни заключается в обязательном каранти-
нировании рыб, в случае необходимости — проведении лечебно-
профилактических обработок их перед посадкой в аквариумы, а
также соблюдении оптимальной плотности посадки рыб, созда-
нии благоприятных условий содержания и кормления.
Лабораторная работа
Задания. 1. Изучить под микроскопом строение ооцист кокци-
дий и зарисовать их. 2. Освоить методику лабораторной диагнос-
тики кокцидиозов. 3. Исследовать фекалии кроликов и кур по ме-
тоду Фюллеборна и Дарлинга.
Оборудование и материалы: микроскопы; центрифуга; стаканчики; сита; кю-
ветки; предметные и покровные стекла; стеклянные палочки; проволочные петли;
пинцеты; плакаты с рисунками ооцист кокцидий; насыщенный раствор хлорида
натрия; глицерин; пробы фекалий кур, кроликов, собак и кошек.
Место занятия: лаборатория паразитологии и инвазионных бо-
лезней сельскохозяйственных животных.
Методика проведения занятий. Лаборант заранее доставляет
пробы фекалий из хозяйства и готовит необходимое оборудова-
ние. После краткого объяснения преподавателя и методических
указаний по теме занятия студенты готовят для исследования про-
бы фекалий кроликов, кур, собак и кошек по методу Фюллеборна
или Дарлинга.
Во время отстаивания проб они знакомятся со строением
ооцист эймерий разных видов и обращают внимание на их размер,
цвет, форму, а также на наличие остаточных тел в ооцисте и спо-
роцисте. Строение ооцист рассматривают под микроскопом на
влажных препаратах, покрытых стеклом, и зарисовывают обнару-
женные ооцисты эймерий и ооцисты изоспор. Результаты записы-
вают в журнал учета лабораторных исследований на паразитарные
болезни животных (Сельхозучет, форма № 18-вет).
392
Практическое занятие
Задания. 1. Рассчитать необходимое количество препарата,
имеющегося в хозяйстве, на группу цыплят и кроликов. 2. Провес-
ти тщательное смешивание препарата с комбикормом. 3. Рассчи-
тать затраты на профилактику 1000 цыплят в натуральном и де-
нежном выражении при использовании различных противокок-
цидиозных препаратов.
Оборудование и материалы: весы, разновесы; совочки; ведра; деревянные ме-
шалки; микрокалькуляторы; комбикорм; противококцидиозные препараты (ира-
мин, кокцидиовит, химкокцид, сульфадиметоксин и другие, имеющиеся в нали-
чии).
Место занятия. Ветеринарная учебно-производственная клини-
ка или птицефабрика, а также лаборатория паразитологии и инва-
зионных болезней животных.
Методика проведения занятия. На предыдущем занятии студен-
ты получают задание на дом рассчитать необходимое количество
того или иного препарата для цыплят. Например, надо определить
количество ирамина для профилактики эймериоза цыплят. Извес-
тно, что для 100 цыплят 20-дневного возраста требуется 30 кг ком-
бикорма в день, 30-дневного возраста — 35, 40-дневного — 40 кг.
Всего 105 кг. Ирамин с профилактической целью применяют в
дозе 0,04 % к корму в течение 10 дней тремя курсами с 3-дневны-
ми перерывами между ними. Проведя расчеты, получаем, что для
лечения цыплят необходимо 4,2 кг ирамина.
В классе студенты рассчитывают необходимое количество кок-
цидиовита, химкокцида-7, фармкокцида в натуральном и денеж-
ном выражении для сравнения себестоимости обработки 1000
птиц.
После проверки расчета дозы каждое звено (три—пять человек)
взвешивает препарат, комбикорм и тщательно их перемешивает.
Преподаватель напоминает, что от равномерности смешивания
лечебного комбикорма зависит эффективность обработки. При
неравномерном размешивании не исключены отравления, так как
одно животное может получить препарат в большей дозе, а другое
не получит. Для равномерного смешивания вначале лечебное
средство смешивают с небольшим количеством корма, затем с ос-
тавшимся объемом. Приготовленный таким образом комбикорм
раздают в кормушки цыплятам. Составляют акт на выполненную
работу.
В журнал учета лечебной обработки птицы (Сельхозучет, фор-
ма № 8-вет) заносят соответствующую запись о проведенной об-
работке.
Студенты кратко описывают свойства препаратов, метод при-
готовления и введения каждого препарата.
В конце занятия преподаватель опрашивает студентов по прой-
денному материалу, просматривает зарисовки и ставит оценки.
393
Контрольные вопросы. 1. Что такое кокцидиозы и какие заболевания входят в
эту группу? 2. Какое строение имеют ооцисты рода эймерий и рода изоспор?
3. Каковы основные стадии развития ооцист кокцидий? 4. Каковы основные раз-
личия биологии моноксенных и гетероксенных кокцидий? 5. Почему при эймери-
озах развивается понос и наступает сильная интоксикация организма? 6. Каковы
общие принципы лечения эймериозов? 7. Каковы источники инвазирования жи-
вотных и человека токсоплазмами и саркоцистами? 8. Как поставить диагноз на
эймериозы животных и установить вид возбудителя? 9. Какие противококцидиоз-
ные средства применяют в птицеводческих хозяйствах? 10. Какие меры борьбы и
профилактики применяют при эймериозе карпа и толстолобика? 11. Какие возбу-
дители вызывают болезни аквариумных рыб? 12. Какие препараты применяют
при болезнях аквариумных рыб?
16. ПРОТОЗОЙНЫЕ БОЛЕЗНИ ЖИВОТНЫХ,
ВЫЗЫВАЕМЫЕ ЖГУТИКОВЫМИ
Систематика, морфология и биология жгутиковых. Жгутиковых
относят к двум типам: Polymastigota и Kinetoplastida. От других
простейших их отличает наличие органоидов движения в виде
жгутиков или псевдоподий (ложных ножек).
Из типа Kinetoplastida важное ветеринарное и медицинское
значение имеет класс Kynetoplastidea. Он включает отряд
Trypanosomatida, семейство Trypanosomatidae, роды Trypanosoma и
Leishmania, которые вызывают трипаносомозы верблюдов и лоша-
дей, лейшманиоз собак.
Трипаносомы имеют веретенообразную форму с заостренным
передним и закругленным задним концами тела. В окрашенных
по Романовскому—Гимзе препаратах у них выявляются оболочка,
жгутик, ядро и кинетопласт, расположенный на заднем конце
тела. От кинетопласта начинается жгутик, который идет вдоль
тела к переднему концу и заканчивается свободно.
Трипаносомы локализуются в плазме крови, лимфатических
узлах, нервной системе, лейшмании — в клетках печени, селезен-
ки, костного мозга и крови.
Тип Polymastigota представлен классом Parabasalea, отрядом
Trichomonadida. Этот отряд включает два семейства: Trichomo-
nadidae (род Trichomonas) и Monocercomonadidae (род Histo-
monas). Семейство Trichomonadidae характеризует наличие от че-
тырех до шести жгутиков, из которых один направлен назад и
прикреплен к ундулирующей мембране. Представители семейства
Monocercomonadidae ундулирующей мембраны не имеют. Особен-
ности морфологии и биологии родов этих семейств изложены
ниже при описании трихомоноза крупного рогатого скота и гисто-
моноза птиц.
394
16.1. ТРИТРИХОМОНОЗ (ТРИХОМОНОЗ) КРУПНОГО
РОГАТОГО СКОТА
Тритрихомоноз — протозойная болезнь, вызываемая жгутико-
выми из отряда Trichomonadida типа Polymastigota. Проявляется
у коров абортами на ранних стадиях стельности (в первые 3—
4 мес).
Локализация — слизистые оболочки половых органов у коров
(влагалище, матка, плод и околоплодная жидкость), препуций,
уретра, придаточные железы и сперма у быков.
Возбудитель. Tritrichomonas foetus (Trichomonas foetus) относит-
ся к семейству Trichomonadidae роду Tritrichomonas. Паразиты
размерами (6—30) х (3—10) мкм, чаще овальной, грушевидной и
веретенообразной формы. На переднем конце тела имеются три
направленных вперед равных длине паразита жгутика. Четвертый
жгутик — краевой — направлен назад, расположен по краю унду-
лирующей мембраны, заканчивается свободно на заднем конце. У
трихомонасом (тритрихомонасов) есть аксостиль. При неблаго-
приятных условиях паразиты образуют цисты (рис. 151).
Биология развития. Размножаются прямым делением на две и
большее количество особей. Обладают способностью к активному
движению и могут передвигаться против
тока жидкости, что обеспечивает их про-
движение через канал шейки матки. Хоро-
шо культивируются на питательных средах
(среда Петровского). В организме живот-
ных паразиты выживают несколько лет. В
патологическом материале при температу-
ре 20—23 °C остаются жизнеспособными
3—4 нед, при 45 °C и выше быстро погиба-
ют. При низких температурах (от минус 79
до минус 196 °C) в средах специального со-
става сохраняются долго. К антибиотикам
весьма устойчивы.
Эпизоотологические данные. Тритрихо-
моноз распространен в ряде областей Рос-
сии, Украины, Белоруссии, на Кавказе, в
Средней Азии, Казахстане, на Дальнем Во-
стоке. Источник инвазии — больные быки
и коровы. Особенно опасны быки-тритри-
хомонадоносители. Тритрихомонады у бы-
ков выделяются с препуциальной слизью и
спермой, у коров и нетелей — с экссудатом
и абортированными плодами. Фактор пе-
редачи — контакт больного животного со
здоровыми при естественной случке, а так-
же искусственное осеменение спермой
Рис. 151. Схема строе-
ния тритрихомонаса:
Ж— передние жгутики; 3 —
задний жгутик; М— унду-
лируюшая мембрана; Н —
краевая нить; Я— ядро;
Л —вакуоль в цитоплазме;
О — осевой стержень—ак-
состиль; П— включение в
цитоплазму
395
больных быков. Возбудитель тритрихомоноза может быть передан
механически через предметы ухода за животными, инструменты
(влагалищное зеркало, искусственная вагина и др.). Иногда источ-
ником распространения инвазии служат молодые бычки (до года)
и телочки 9—10 мес.
Тритрихомоноз наносит большой экономический ущерб из-за
большой яловости (до 50—70 %), длительных перегудов, абортов,
снижения продуктивности, качества спермы, выбраковки высоко-
ценных племенных быков-производителей.
Патогенез. Попав при случке во влагалище или матку коров, на
слизистую оболочку полового члена быков, возбудитель быстро
размножается и уже через 1—3 сут вызывает развитие воспали-
тельного процесса. Позднее воспаление распространяется все
дальше от первичного очага инвазии, захватывает матку и разви-
вающийся в ней плод (при беременности), в результате плод поги-
бает. В дальнейшем погибший плод в матке мацерируется и расса-
сывается или выделяется истечениями из матки (аборт чаще всего
на 1—3-м месяце беременности). Патологические процессы в по-
ловых органах приводят к нарушению полового цикла и яловости
у коров.
Симптомы болезни. Уже через несколько часов после заражения
у коров наблюдают беспокойство. Животные оглядываются назад,
часто меняют положение хвоста, переступают задними конечнос-
тями. Через 1—2 сут отмечают покраснение и припухание слизис-
той оболочки влагалища. При пальпации она болезненная. Поло-
вые губы вульвы отечны. В последующем на слизистой оболочке
влагалища, вблизи шейки матки появляются мелкие узелки разме-
ром от просяного до конопляного зерна, так называемая тритри-
хомонадная «терка». Данный симптом наблюдается в течение 3—
6 нед.
После аборта в матке скапливается довольно значительное ко-
личество слизисто-гнойного экссудата, выделяемого наружу. При
вовлечении в патологический процесс яйцеводов и яичников рез-
ко нарушается половой цикл.
У быков симптомы выражены менее отчетливо и наблюдаются
обычно в начале болезни. Через 3—5 сут после заражения слизис-
тая препуция отекает, на ощупь болезненная. Быки испытывают
боль при мочеиспускании, половом акте. Через 2—3 нед эти симп-
томы исчезают, внешне животные кажутся здоровыми, но они
длительное время остаются паразитоносителями, так как парази-
ты проникают в придатки семенников.
Иммунитет. Изучен слабо, однако известны случаи самовыздо-
ровления животных, которые в последующем повторно не заража-
ются.
Диагностика. Диагноз ставят на основании результатов микро-
скопического, культурального исследования с учетом эпизоотоло-
гических и клинических данных.
396
Для исследования в лабораторию направляют абортированный
плод целиком с плодными оболочками или часть плаценты и па-
тологические выделения из половых органов, вагинально-церви-
кальную слизь от подозрительных по заболеванию животных,
смывы со слизистой оболочки препуция, секрет придаточных по-
ловых желез, сперму быков и выделения из половых органов, взя-
тые с соблюдением стерильности.
Материал для исследования берут не раньше чем через 6 сут
после профилактических орошений и через 10 сут после лечения
трихомонадоцидными препаратами.
Абортированный плод, плаценту доставляют в лабораторию не
позднее 12 ч после аборта. Пробы секрета придаточных половых
желез, препуциальной и вагинальной слизи, патологические вы-
деления в пробирках, неразбавленную сперму в полиэтиленовых
пакетах доставляют в лабораторию в термосе со льдом не позднее
6 ч после взятия. Нативный материал (соскобы, секрет, сперму)
исследуют методом раздавленной капли.
При микроскопии надо учитывать, что живые возбудители
имеют ундулирующую мембрану и аксостиль, движения их скач-
кообразно поступательные и поступательно-вращательные.
Для получения культуры возбудителя болезни используют сре-
ды Петровского или пептонно-агаровую.
При установлении болезни стадо, ферму или хозяйство в целом
объявляют неблагополучными.
Лечение. Коровам назначают препараты, сокращающие матку с
целью удаления из нее содержимого, а именно: 0,5%-ный раствор
прозерина, 0,1 %-ный раствор карбахолина или 0,1 %-ный
раствор фурамона в дозе 2мл подкожно 3 раза через день.
Через 6 сут курс лечения повторяют.
Одновременно с введением названных растворов йолость мат-
ки орошают 8—10%-ным раствором ихтиола (лучше на глице-
рине), раствором йода на физиологическом растворе в концент-
рации 1 : 1000, раствором флавакридина в такой же кон-
центрации или раствором нитрофурановой смеси
(фуразолидон 0,1г, фурацилин 0,2 г, физиологический раствор
1000 мл). Растворы вводят подогретыми до 37—40 °C и не более
500 мл.
При гнойном воспалении матки назначают 1 %-ный раствор
синэстрола в дозе 2мл 3 раза через день. После удаления
гноя матку орошают вышеупомянутыми растворами. Спустя 8—
10 сут после проведенного курса лечения коров обследуют на на-
личие тритрихомонасов. При обнаружении паразитов курс лече-
ния повторяют.
Лечение быков наиболее эффективно при 6-дневном курсе по
схеме: 1-й день — подкожно 2 мл 1 %-ного раствора фурамона
или 0,5%-ного раствора прозерина и местная обработка пре-
пуциального мешка раствором нитрофурановой смеси
397
в сочетании с 0,5%-ной суспензией фуразолидона; 2-й день —
внутримышечно 10%-ная суспензия фуразолидона и мест-
ная обработка, как в 1-й; 3-й день — как в 1-й; 4-й день — как во
2-й; 5-й день — как в 1 -й и 6-й день — как во 2-й.
При трихомонозе быков с успехом применяют три—пять инъ-
екций метронидазола (трихопола)в дозе 50 мг на 1 кг
массы тела подкожно и 10 мг на 1 кг массы тела внутримышечно.
Для подкожного введения трихопол растворяют в физиологичес-
ком растворе, для внутримышечного — в смеси глицерина с водой
в соотношении 1 : 3. Раствором трихопола (2—5%-ным) на физио-
логическом растворе орошают также препуциальный мешок.
Быков считают здоровыми при отсутствии у них возбудителя
при культуральном исследовании смыва из препуция.
Профилактика и меры борьбы. Быков допускают к случке и для
взятия спермы только после получения трехкратного отрицатель-
ного результата исследования на трихомоноз с интервалом 10 сут.
Взрослый крупный рогатый скот, поступающий из других хо-
зяйств, независимо от свидетельства о благополучии по данному
заболеванию следует обязательно проверять на тритрихомоноз. В
хозяйствах с искусственным осеменением строго следят за обра-
боткой инструментов. Станки, где находились больные, а также
место лечения тщательно дезинфицируют 5%-ным раствором кре-
олина, горячим 3%-ным раствором кальцинированной соды или
2%-ным раствором гидроксида натрия. После дезинфекции полы
и станки обрабатывают 20%-ной взвесью свежегашеной извести.
16.2. ТРИПАНОСОМОЗЫ
Трипаносомозы — болезни, вызываемые простейшими, кото-
рые относятся к типу Kinetoplastida. Трипаносомы паразитируют в
плазме крови животных и человека. В СНГ из трипаносомозов за-
регистрированы су-ауру и случная болезнь.
16.2.1. СУ-АУРУ (СУРРА) ВЕРБЛЮДОВ И ДРУГИХ ЖИВОТНЫХ
Су-ауру — трансмиссивная болезнь верблюдов, реже лошадей,
ослов и собак, вызываемая жгутиковыми простейшими отряда
Т rypanosomatida.
Локализация — плазма крови.
Возбудитель. Trypanosoma evansi (Tr. ninaekohl jakimovi семей-
ства Trypanosomatidae) по морфологическим признакам похожа на
других трипаносом. Ее размеры (20,9—32,0) х (1,4—2,9) мкм
(рис. 152). Трипаносомы (trypanon — бурав, soma —тело) имеют
веретенообразную форму тела, передний конец заострен, задний
округлен, напоминают бурав. Все трипаносомы морфологически
398
сходны, тело их состоит их ци-
топлазмы, ядра, кинетопласта
(базальное тело), ундулирующей
мембраны и жгутика, который
заканчивается в передней части
тела. Движутся паразиты при
помощи жгутика и сокращения
тела.
Биология развития. Трипано-
сомы размножаются путем про-
стого деления на две клетки.
Первоначально делится жгутик,
затем ядро и в последнюю оче-
редь цитоплазма. Питаются при
помощи жгутикового кармана.
Трипаносомы в трупе сохраня-
ются 6—12 ч, иногда 48 ч, при
глубоком замораживании (от
минус 79 до минус 196 °C) —
длительное время.
Эпизоотологические данные.
Болезнь распространена в Средней Азии и Южном Казахстане.
Восприимчивы верблюды, лошади, ослы, мулы, волки, кошки и
лабораторные животные (белые мыши и крысы, морские свинки и
кролики). Болеют животные всех возрастов. Источник инвазии —
больные и переболевшие, недолеченные животные. Переносчики
возбудителя — слепни и другие кровососущие насекомые.
Су-ауру протекает энзоотически, реже — как эпизоотия.
Заражение собак, волков, кошек происходит при поедании све-
жих трупов больных или при скармливании мяса вынужденно
убитых животных. Возбудитель может передаваться при использо-
вании нестерильных инструментов — шприцев, игл, скальпелей, а
также во время случки и через плаценту. Болезнь сезонная и свя-
зана с лётом кровососущих насекомых (слепней, комаров и др.),
которые выплаживаются в водоемах.
Патогенез. Возбудитель начинает размножаться в крови или
лимфе на месте инокуляции, затем попадает в лимфатические
узлы, различные органы и ткани животного. Трипаносомы обра-
зуют трипанотоксин, который выделяется при их лизисе под воз-
действием трипанолизина, вырабатывающегося в организме жи-
вотного. Трипанотоксин обусловливает нарушение обмена ве-
ществ, вызывает морфологические изменения различных органов
и тканей, особенно нервной системы. После лизиса основной
массы трипаносом оставшиеся паразиты вновь размножаются до
наступления следующего лизиса и так несколько раз. Такая смена
размножения и лизиса возбудителя изнуряет организм хозяина и
приводит его к гибели.
399
Симптомы болезни. Болезнь протекает обычно хронически,
реже подостро или остро. Инкубационный период длится 1—
3 нед. Для больных характерны интермиттирующий тип лихорад-
ки, быстрая утомляемость, отеки губ и щек, подчелюстного про-
странства, век, подгрудка, половых органов, желтуха, исхудание,
конъюнктивит, кератит (даже с полной потерей зрения), ирит.
Иногда поражается кожа (экзема, крапивница), увеличиваются
подчелюстные лимфатические узлы. На фоне общего угнетения
отмечают снижение количества эритроцитов и гемоглобина. Мо-
гут наступать парезы и параличи. Так продолжается в течение не-
скольких (10—18) месяцев, в результате животные теряют рабо-
тоспособность. Самовыздоровление бывает редко.
При остром течении болезни клинические признаки развива-
ются быстро, нарастают 2—3 нед, и животные погибают.
Патологоанатомические изменения. Отмечают истощение, ане-
мию, иногда желтушность слизистых оболочек, отеки подкожной
клетчатки. Сердечная мышца перерождена, лимфатические узлы
увеличены. При остром течении инвазии увеличена селезенка. В
грудной и брюшной полостях серозная жидкость. Кровь водянис-
тая, плохо свертывается.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, клинических признаков болезни, результатов микроско-
пии мазков крови и серологических реакций. Из серологических
реакций применяют РСК и РДСК (у лошадей и собак) с трипано-
сомным антигеном. У верблюдов ставят формалиновую пробу или
НРФА (непрямая реакция иммунофлуоресценции).
Для дифференциальной диагностики су-ауру от случной болез-
ни применяют биопробу на лабораторных животных, которые лег-
ко заражаются возбудителем су-ауру. Необходимо дифференциро-
вать су-ауру от инфекционной анемии, пироплазмидов и петехи-
альной горячки. Петехиальная горячка протекает без повышения
температуры, но с выраженной отечностью в области головы —
«голова гиппопотама». РСК дает отрицательный результат.
Лечение. Применяют наганин, соварсен и новарсенол. При по-
явлении устойчивости трипаносом к наганину используют азидин
(беренил). Азидин вводят внутримышечно в виде 7%-ного ра-
створа двукратно с интервалом 24 ч в дозе 3,5 мг на 1кг массы
тела. В случае рецидива болезни лечение азидином повторяют.
Кроме трипаноцидных препаратов животному назначают сер-
дечные средства, а также препараты, стимулирующие кроветворе-
ние и работу органов пищеварения.
Профилактика и меры борьбы. В неблагополучных по су-ауру
хозяйствах животных после лечения рекомендуется содержать
изолированно в течение 6 мес. Затем их подвергают клиническому
осмотру, микроскопическим и серологическим исследованиям.
Животных, у которых обнаружены трипаносомы или высокий
титр антител, лечат повторно.
400
В период лёта кровососущих насекомых (слепней) следует вы-
пасать животных вдали от водоемов — на пастбищах, свободных
от переносчиков. Мясо вынужденно убитых животных можно ис-
пользовать на корм животным только после проваривания. Шку-
ры обезвреживают с помощью просушивания и засолки. Трупы
утилизируют.
16.2.2. СЛУЧНАЯ БОЛЕЗНЬ ЛОШАДЕЙ
Случная болезнь (дурина, подседал) — болезнь непарнокопыт-
ных животных, вызываемая жгутиковыми простейшими отряда
Trypanosomatida. Характеризуется хроническим течением, пора-
жением половых органов.
Локализация — мельчайшие капилляры слизистой оболочки
мочеполовых путей.
Возбудитель. Trypanosoma (Trypanozoon) equiperdum относится
к семейству Trypanosomatidae. Трипаносомы веретенообразной
формы, размерами (22—28) х (1,4—2,6) мкм. Морфологически
возбудитель сходен с таковым су-ауру.
Биология развития. Трипаносомы размножаются продольным
делением (двойное и множественное). Паразиты погибают при
температуре выше 50 °C, но хорошо сохраняются при низких тем-
пературах (от минус 70 до минус 196 °C). Способны самостоятель-
но передвигаться в плазме крови.
Эпизоотологические данные. Случная болезнь спорадически
встречается в Средней Азии и Казахстане. В нашей стране регист-
рируется в юго-восточных районах. Восприимчивы лошади, ослы
и мулы. Источник инвазии — жеребцы и кобылы, больные случ-
ной болезнью. В естественных условиях заражение происходит во
время случки и при искусственном осеменении спермой и загряз-
ненными инструментами. Беспородные лошади переболевают ча-
сто бессимптомно. Жеребята заражаются при сосании матерей
или при слизывании истечений из их половых органов.
Патогенез. Трипаносомы, локализуясь на капиллярах слизис-
тых оболочек половых органов, вызывают воспаление, проникают
в лимфатическую и кровеносную системы, а следовательно, в
лимфатические узлы и органы. Иногда трипаносом обнаруживают
в сперме жеребцов и молоке кобыл. В общем кровотоке их выяв-
ляют редко. Паразиты вырабатывают трипанотоксин, который
вызывает поражение сосудистой и нервной систем, в связи с чем
наблюдаются парезы и параличи, нарушение течения беременнос-
ти у кобыл и воспроизводительной способности у заболевших жи-
вотных.
Симптомы болезни. Для болезни характерна периодичность.
Инкубационный период продолжается от 2—3 нед до 2—3 мес.
Симптомы болезни развиваются в определенной последова-
401
тельности. Различают три периода заболевания: первый — изме-
нения появляются на слизистой оболочке половых органов, вто-
рой — изменения на коже и третий — развиваются парезы и па-
раличи.
В первый период болезни у жеребцов появляется отек препу-
ция, мошонки и полового члена, у кобыл — отек половых органов,
вымени, живота (наличие «бруса»). Места отека на ощупь холод-
ные и безболезненные. При проводке отеки не исчезают, но могут
уменьшаться. Далее на коже и слизистых оболочках половых орга-
нов появляются узелки и язвочки. На месте заживления язвочек —
беспигментные, или «жабьи», пятна (депигментация), особенно
заметные на вульве.
Во второй период болезни появляются симптомы, указываю-
щие на поражение сосудистой и нервной систем — появляются
сыпь и «талерные бляшки» 4—20 см в диаметре. Это отеки, обычно
кольцевидные или овальные. Шерсть на краях припухлостей взъе-
рошена, и поэтому они хорошо заметны. Количество «бляшек»
различно — от единиц до десятка. Появляются на боках, крупе как
бы внезапно, быстро (от нескольких часов до суток), исчезают и
могут появиться вновь на тех же и других местах. Аборты чаще
наблюдаются во второй период болезни.
Заболевание постепенно переходит в третий период.
У лошадей появляются парезы и параличи лицевого или трой-
ничного нерва, а также пояснично-крестцовых нервов. При паре-
зах поясничного отдела развивается слабость зада, лошадь хромает
на одну или обе задние конечности. Животное как бы приседает
(отсюда название подседал) и часто спотыкается. Слабость задней
части туловища прогрессирует, несмотря на хороший аппетит ис-
худание нарастает. Лошади больше лежат, с трудом встают и через
некоторое время погибают. Перечисленные симптомы болезни
ярче проявляются у высокопородных животных. Болезнь протека-
ет хронически 1—2 года, у породистых лошадей — остро.
Иммунитет. Изучен недостаточно полно. У переболевших жи-
вотных снижается восприимчивость к повторному заражению.
Патологоанатомические изменения. Павшие животные истоще-
ны. Часто выражены несимметричность парализованных губ и
ушей, отеки, язвы на слизистых оболочках и депигментация на
половых органах. Мышцы крупа и задних конечностей перерож-
дены. Селезенка увеличена.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, клинических признаков, результатов микроскопических
и серологических исследований. Для микроскопии берут соскобы
из половых путей и пунктат с краев «талерных бляшек». Кровь для
РСК берут так же, как для исследования на бруцеллез. Лошадей,
подозреваемых в заражении, обследуют с помощью РСК, РДСК,
НРИФ, РСКК.
Лечение. Не проводят. Больных животных убивают.
402
Профилактика и меры борьбы. Жеребцов, не имеющих племен-
ной ценности, следует своевременно кастрировать. На пунктах
искусственного осеменения «кобыл-спермособирательниц» еже-
месячно обрабатывают наганином. Перед каждым осеменением (и
тем более перед случкой) кобыл и жеребцов клинически осматри-
вают и исследуют. В районах, где есть хозяйства, неблагополучные
по случной болезни, клинически здоровым жеребцам перед нача-
лом случного сезона и через 1,5 мес после него вводят наганин.
Жеребцов серологически исследуют не менее 3 раз в год: первый
раз — через 1 мес после окончания случного сезона и не ранее чем
через 2 мес после последнего введения наганина; второй и третий
раз — через 1 мес после первого и второго исследований.
16.2.3. гистомоноз птиц
Гистомоноз (энтерогепатит, черная голова, гниение печени) —
протозойное заболевание индюшат, цыплят, цесарят, фазанят и
молодняка некоторых диких птиц, вызываемое простейшими из
отряда Trichomonadida.
Локализация — слизистая оболочка слепых кишок, печень, же-
лезистый желудок и другие органы.
Возбудитель. Histomonas meleagridis относится к семейству
Monocercomonadidae роду Histomonas.
Биология развития. Развитие гистомонаса складывается из двух
фаз — жгутиковой и безжгутиковой (амебовидной). В жгутиковой
фазе паразит имеет округлую форму, диаметр 12—21 мкм, один-
четыре жгутика. Аксостиль, ундулирующая мембрана и цистостом
отсутствуют.
Безжгутиковые гистомонасы овальной или круглой формы.
При движении выпячивают псевдоподии. Размер паразитов от
2x3 до 8x10 мкм, у индюшат они крупнее —от 12x16 до
14 х 18 мкм (рис. 153). Амебовидных паразитов находят в повреж-
денных тканях больных птиц. В инвазионной стадии они активно
поселяются в тканях при помощи псевдоподий, проникают в меж-
клеточное пространство, где активно размножаются двойным де-
лением.
Рис. 153. Histomonas meleagridis:
1 — жгутиковые; 2 — безжгутиковые
403
Гистомонасы растут на искусственных средах. Они факульта-
тивные анаэробы, быстро погибают во внешней среде, при высу-
шивании и под действием дезинфицирующих средств. Гистомона-
сы попадают в яйца гетеракисов, где могут сохраняться длитель-
ное время.
Эпизоотологические данные. Гистомоноз распространен повсе-
местно. Погибает около 70 % больного молодняка птицы, снижа-
ются яйценоскость и качество мяса.
Болеет молодняк в возрасте от 2 дней до 2—3 мес. Обычно забо-
левание возникает в середине или конце лета. Осенью и зимой
может болеть взрослая птица, особенно при плохих условиях со-
держания.
Важным эпизоотологическим фактором является длительное
сохранение яиц гетеракисов во внешней среде, где содержатся ги-
стомонасы. Выгульные площадки загрязняются яйцами гельмин-
тов, которые попадают со сточными водами, пометом и т. д. Пере-
носчиками возбудителя могут быть дождевые черви, а также куз-
нечики.
Патогенез и иммунитет. Гистомонасы повреждают в первую
очередь слизистую оболочку слепых кишок, затем мигрируют в
железистый желудок и другие органы. Слизистая оболочка кишеч-
ника воспаляется, а в дальнейшем некротизируется в результате
разрушения ткани под воздействием ферментов паразита. Гисто-
монасы могут быстро проникать в толщу кишечной стенки, по-
вреждая мышечный слой и серозную оболочку. В результате нару-
шается барьерная функция кишечника. В связи с поражением се-
розной оболочки тонкого кишечника и развитием слипчивого
воспаления функция пищеварительного канала нарушается еще
больше.
Из кишечника через воротную вену гистомонасы проникают в
печень, вызывая развитие некротических очагов размером от мик-
роскопических до горошины и лесного ореха. У больной птицы
нарушается обмен веществ, снижается содержание общего белка и
альбуминов в сыворотке крови. Исчезает гликоген из печени, сер-
дечной и грудной мышц.
Иммунитет нестерильный, переболевшая птица остается пара-
зитоносителем длительное время.
Симптомы болезни. Инкубационный период длится от 7 до
30 сут. Болезнь может протекать сверхостро (молниеносно), остро
и хронически.
Сверхострое течение бывает редко.
При остром течении у молодняка ухудшается аппетит.
Больные птицы малоподвижны, угнетены, собираются в группы.
Через 2—4 сут наблюдается общая слабость, оперение теряет
блеск, крылья повисают. Появляется понос, фекалии имеют не-
приятный запах, светло-желтый, а затем зеленоватый и бурый
цвет. С развитием заболевания птица слабеет, худеет. Развиваются
404
застойные явления, кожа головы становится темно-синей (у мо-
лодняка — черной). Температура тела до конца болезни понижает-
ся на 1—2 °C. Могут быть продолжительные конвульсии. Смерть
наступает через 1—3 нед.
У взрослых птиц заболевание протекает хронически. Это
проявляется в общей слабости и исхудании.
Патологоанатомические изменения. При исследовании погиб-
шей птицы обнаруживают утолщение слепых кишок. Просвет ки-
шечника заполнен творожистой массой. После ее удаления на
слизистой оболочке обнаруживают язвы. Нередко может быть
фибринозный перитонит в результате воспаления серозной обо-
лочки кишок. Печень увеличена, на ее поверхности или в парен-
химе видны узелки серо-бурого цвета.
Диагностика. Диагноз ставят с учетом клинических признаков
болезни, эпизоотологических данных и результатов исследования
на наличие гистомонасов. Чтобы найти возбудителя заболевания,
берут содержимое поврежденных слепых отростков или соскобы
со слизистой оболочки кишечника и просматривают в темном
поле микроскопа или исследуют путем фазово-контрастной мик-
роскопии в препарате висячая капля. Готовят мазки и окрашива-
ют по Романовскому—Гимзе, а также делают посевы на искусст-
венную питательную среду.
Гистомоноз дифференцируют от эймериоза, трихомоноза, ту-
беркулеза, лейкоза, колибактериоза.
Лечение. При появлении заболевания больным птицам назнача-
ют метронидазол (трихопол) в дозе 0,05 % от массы корма на протя-
жении 5—7 сут (не больше 9), а затем с профилактической целью в
половинной дозе; нитазол (энгиптин А, ацинитра-
з о л) — в дозе 1 % от массы корма не более 5 сут, затем продолжа-
ют давать по 0,3 %; г и с т о м о н (н и ф у р с о л) —0,2 % от мас-
сы корма в период возможного заражения. Можно также приме-
нять фуразолидон в дозе 0,02—0,04 % от массы корма. Мо-
лодняку 9—Ю-недельного возраста применяют фенотиазин
в дозе 0,5 г на птицу в течение 2 сут, затем кокцидиовит в
дозе 0,12 г на 1л воды. Продолжительность лечения 10 сут. Метро-
нидазол в дозе 0,5 % от массы корма дают на протяжении 10 сут.
Профилактика и меры борьбы. Для профилактики гистомоноза
молодняк выращивают отдельно от взрослой птицы. Лучше при-
менять для содержания сетчатый пол. Необходимо, чтобы индю-
шата, цыплята, утята и гусята получали полноценный корм и не-
обходимое количество витаминов. Для химиопрофилактики гис-
томоноза многие исследователи применяли энтеросептол (0,02 г
на 1 кг массы тела) с кормом, фуразолидон (0,006 г на птицу с кор-
мом). Необходимо своевременно делать дегельминтизацию про-
тив гетеракиоза и других инвазионных болезней.
405
16.2.4. ЛЕЙШМАНИОЗ СОБАК
Лейшманиоз собак — протозойная трансмиссивная природно-
очаговая болезнь, вызываемая простейшими отряда Trypanosoma-
tida типа Kinetoplastida. Кроме собак к болезни восприимчивы
грызуны и человек.
Локализация — кожа и внутренние органы. Впервые возбудите-
ля установил русский врач И.П. Боровский в 1837 г., однако опи-
сал лейшманиоз собак Николь (1908) в Тунисе.
Возбудители. В настоящее время установлены следующие виды
лейшманий — простейших, относящиеся к семейству Trypanoso-
matidae.
Leishmania tropica — возбудитель кожного лейшманиоза собак и
человека. Паразитирует в клетках кожи.
L.danovani — возбудитель висцерального (внутренних органов)
лейшманиоза собак и человека. Паразитирует в клетках печени,
селезенки, костного мозга и крови.
Морфологически оба вида идентичны. В организме теплокров-
ных животных обнаруживают безжгутиковые шаровидные или
овальные формы размерами (3—5) х (1—3) мкм. В организме мос-
китов и на искусственных питательных средах лейшмании приобре-
тают веретенообразную форму и имеют жгутик. Размеры паразитов
(10—20) х (2—4) мкм. Жгутик длиной до 18—20 мкм (рис. 154).
Биология развития. Переносчики лейшманий — москиты
Phlebotomus papatasi, Ph. sergenti, Ph. caucasica и другие, широко
распространенные в субтропических и тропических странах. При
нападении на людей и собак, больных лейшманиозом, в организм
москитов из язв, крови попадают нежгутиковые формы паразита.
Они быстро размножаются и преобразуются в жгутиковые. Через
8—10 сут при повторном нападении на собак москиты инокулиру-
ют паразитов в кровь или ткани кожи. При раздавливании моски-
тов лейшмании могут быть втерты в кожные покровы. Во внутрен-
них органах лейшмании утрачивают жгутики и быстро размножа-
ются, разрушая большое количество клеток.
Рис. 154. Лейшмании:
а — в организме позвоночного хозяина; б — в переносчике
406
Эпизоотологические данные. Су-
ществуют природные очаги лейшма-
ниоза, где возбудитель сохраняется
за счет перезаражения москитов от
грызунов (песчанок, сусликов раз-
личных видов), в норах которых не-
редко обитают. К лейшманиозу со-
бак восприимчивы люди, и наобо-
рот, от человека могут заражаться
собаки. Заражение может происхо-
дить не только при нападении мос-
Рис. 155. Кожный лейшманиоз
у собаки
китов, но и при непосредственном
контакте больных животных со здо-
ровыми. Короткошерстные собаки
чаще заражаются инвазией. Экстен-
сивность заражения москитов местами доходит до 35 %.
Патогенез. Продукты жизнедеятельности лейшманий поврежда-
ют клетки ретикулоэндотелиальной системы, вызывают гиперпла-
зию лимфатических узлов, селезенки. На коже образуются язвы.
Иммунитет. Изучен недостаточно.
Симптомы болезни. У молодых собак болезнь чаще протекает
остро, у взрослых — хронически и нередко оканчивается выздо-
ровлением. Кожный лейшманиоз вначале характеризуется по-
явлением узелков, затем на спинке носа, губах, бровях, ушах,
пальцах формируются длительно не заживающие язвы (рис.
155). Лимфатические узлы увеличены, плотные и бугристые на
ощупь.
Висцеральный лейшманиоз в большинстве случаев протекает
остро. Повышается температура тела, резко снижается аппетит,
общее состояние угнетенное. Животные худеют, развиваются диа-
рея и анемия. Больные животные лежат, не реагируют на внешние
раздражители. Болезнь длится от 3—4 сут до 2—3 нед.
При хроническом течении у больных животных на-
блюдают истощение, временами повышение температуры. Кожа
шелушится, наблюдаются сечение волос, облысение отдельных
участков, появляются изъязвления на морде, вокруг глаз, на носу,
коже спины. Иногда развиваются диарея, слабость конечностей и
даже параличи.
Патологоанатомические изменения. При вскрытии павших от
лейшманиоза собак отмечают истощение, анемию, увеличение пе-
чени, селезенки, лимфатических узлов в 2—3 раза. В некоторых
случаях устанавливают катаральный гастроэнтероколит, язвы на
коже и слизистых оболочках, отек легких, нефриты.
Диагностика. Диагноз на лейшманиоз ставят комплексно с уче-
том эпизоотологических данных и клинических признаков болез-
ни, а также микроскопией мазков из язв на коже, окрашенных по
Романовскому.
407
При висцеральном лейшманиозе исследуют мазки из пункта-
тов костного мозга и лимфоузлов.
Лечение. При кожном лейшманиозе рекомендуется в кожу вок-
руг язв, а также в толщу узелков вводить 4—5%-ный раствор ак-
рихина в 1%-ном растворе новокаина. В медицинской практи-
ке получены положительные результаты при использовании с о -
люсурмина внутривенно в виде 20%-ного водного раствора
из расчета 0,12—0,2 г на 1кг массы тела ежедневно в течение
12 сут.
Профилактика и меры борьбы. С целью профилактики болезни
в очагах лейшманиоза принимают меры по уничтожению грызу-
нов, москитов, отлову бродячих собак. Применяют также инсек-
тициды и репелленты.
Лабораторная работа
Задание. Изучить строение тритрихомонаса под микроскопом и
зарисовать его.
Оборудование, материалы и объекты исследования: микроскопы; предметные и
покровные стекла; пипетки; ножницы; часовое стекло; препаровальные иглы,
препаровальная ванночка; стакан с теплой водой; физиологический раствор; про-
бирки с культурой трихомонасов или мыши, пораженные трихомонозом.
Место занятия. Лаборатория паразитологии и инвазионных бо-
лезней животных.
Методика проведения занятия. В начале занятия учащиеся по-
вторяют строение тритрихомонасов, методы лабораторной диаг-
ностики. Затем преподаватель делит группу на звенья и каждому
звену дает задание приготовить раздавленную каплю культуры из
пробирки или часового стекла, в которое предварительно налита
суспензия из содержимого слепой кишки мыши. Препарат с раз-
давленной каплей просматривают под средним увеличением мик-
роскопа в затемненном поле. Найденного паразита зарисовывают.
Затем преподаватель демонстрирует препараты, используемые
для лечения трихомоноза крупного рогатого скота: фуразолидон,
фурацилин, наганин, соварсен, метронидазол, флавакридин, ра-
створ йода 1 : 1000, 3%-ный раствор пероксида водорода, ампулы с
синэстролом, карбахолином, прозерином, фумагиллин.
Контрольные вопросы. 1. Что такое мастигофорозы и какие заболевания жи-
вотных входят в эту группу? 2. Где, когда и как лошади и верблюды заражаются
возбудителем су-ауру? 3. Какие симптомы болезни заставляют предположить
случную болезнь лошадей, су-ауру верблюдов, тритрихомоноз крупного рога-
того скота? 4. Какие лабораторные методы диагностики тритрихомоноза, су-
ауру и случной болезни вы знаете? 5. Как взять материал для исследования на
трихомоноз, су-ауру, случную болезнь? 6. Какие препараты используют для ле-
чения мастигофорозов? 7. Каковы меры профилактики тритрихомоноза круп-
ного рогатого скота? 8. Как поступают с лошадьми при обнаружении возбуди-
теля случной болезни?
408
16.3. ЦИЛИАТОЗЫ
Систематика, морфология и биология инфузорий. Возбудители
цилиатозов — наиболее сложно устроенные простейшие — инфу-
зории. В настоящее время описано свыше 70 видов их. Характе-
ризуются наличием органоидов движения в виде ресничек и двух
качественно разных ядер (крупное вегетативное ядро — макронук-
леус и мелкое — микронуклеус). Наибольшее количество инфузо-
рий относится к типу Ciliophora, классам Rimostomatea (равнорес-
ничные инфузории), Apicostomatea, Synciliostomatea, Hymenosto-
mata с соответствующими отрядами. Представители отряда Balan-
tidiida имеют разнообразную форму тела, покрытое ресничками.
Большинство инфузорий имеют ротовое отверстие. Непереварен-
ные частицы выталкиваются во внешнюю среду через специаль-
ное отверстие.
Инфузориям свойственно бесполое путем прямого деления
размножение. Периодически в биологии развития инфузорий
происходит половой процесс в виде конъюгации. У некоторых ви-
дов размножение осуществляется путем внутреннего или наруж-
ного почкования. Среди инфузорий встречаются свободноживу-
щие, которых много в морских и пресных водоемах, почве. Мно-
гие виды инфузорий паразитируют в организме различных живот-
ных, поселяясь в желудочно-кишечном канале.
16.3.1. БАЛАНТИДИОЗ СВИНЕЙ
Балантидиоз — широко распространенная болезнь, вызываемая
простейшими отряда Balantidiida.
Локализация — толстый кишечник, нередко подслизистый
слой.
Возбудитель. Инфузория Balantidium coli (В. suis) может суще-
ствовать в виде трофозоитов и цист. Трофозоиты овальной фор-
мы, покрыты косопродольными рядами ресничек. Размер (30—
150) х (25—120) мкм. Макронуклеус бобовидной формы, микро-
нуклеус одиночный, расположен в центре трофозоита. В цито-
плазме много пищеварительных вакуолей. Цитостом треугольный,
расположен на переднем конце тела (рис. 156).
Биология развития. Размножаются балантидиумы прямым деле-
нием, иногда этому предшествует конъюгация. При неблагопри-
ятных условиях они инцистируются, теряют реснички, покрыва-
ются двухконтурной толстой оболочкой и в таком состоянии со-
храняют жизнеспособность около года. В просвете кишечника па-
разиты питаются частицами содержимого, бактериями, а в толще
слизистой оболочки — продуктами воспалительного процесса,
захватывают лейкоциты и эритроциты. Культивируются баланти-
диумы на питательных средах.
409
Рис. 156. Balantidium coli:
7 — макронуклеус; 2— микронуклеус; 3,
4 — сократительные вакуоли; 5—пищева-
рительная вакуоль; 6 — ротовое отверстие
Эпизоотологические данные.
Болезнь распространена повсе-
местно. Заболевают преимуще-
ственно поросята-отъемыши до
4-месячного возраста, иногда и
взрослые животные (при нару-
шении технологии содержания).
Источник возбудителя — боль-
ные свиньи и паразитоносители.
Факторы передачи — корма и
вода, загрязненные балантидиу-
мами. Животные заражаются
при заглатывании цист возбуди-
телей с кормом и водой. Благо-
приятствует распространению
инвазии неправильное кормле-
ние поросят в период отъема.
Патогенез. Балантидиумы па-
разитируют в кишечнике свиней
и человека, часто ведут коммен-
сальный образ жизни. Однако
комменсализм может быть нару-
шен под влиянием изменения
пищевого режима или воспали-
тельного процесса (недостаток в
рационе минеральных веществ и
витаминов, плохо переваримый
или недоброкачественный корм,
ранний и быстрый отъем от ма-
ток и другие стрессовые факторы).
С момента изменения нормальной деятельности кишечника
под влиянием нарушений пищевого режима или воспалительного
процесса инфузории проникают в толщу слизистой оболочки, пи-
таются воспалительным экссудатом. Продукты жизнедеятельнос-
ти паразитов раздражают ткани кишечника, вызывают дегенера-
цию и некроз эпителия и даже подслизистого и слизистого слоев.
Размножаясь в тканях кишечной стенки, паразиты затем проника-
ют в просвет кишечника, вызывая изъязвления и очаги некроза.
Моторная и секреторная функции кишечника при этом наруша-
ются. У животных развивается энтероколит. Поступающие в кровь
продукты распада поврежденных тканей и метаболизма баланти-
дий вызывают общую интоксикацию.
Иммунитет. Переболевшие животные приобретают иммунитет
и становятся невосприимчивыми к повторному заражению, хотя и
остаются длительное время паразитоносителями. Механизм им-
мунитета изучен слабо.
Симптомы болезни. Инкубационный период длится 8—10 сут.
410
При высокой интенсивности инвазии наиболее тяжело переболева-
ет молодняк в период отъема. Болезнь протекает остро, подостро и
хронически.
При остром течении в первые 2 сут у больных поросят
температура тела повышается на I —1,5 °C, затем снижается до
нормы. У поросят появляется понос, они угнетены, больше лежат,
отказываются от корма, иногда извращается аппетит; больные
пьют навозную жижу даже при наличии воды. Перистальтика ки-
шечника усиливается. Акт дефекации частый, фекалии водянис-
тые, серо-грязные, с гнилостным запахом. В дальнейшем понос
усиливается. Фекалии становятся серо-бурого или шоколадного
цвета, с большим количеством слизи и прожилками крови, иногда
с кровью. Животные истощены, зарываются в подстилку. Болезнь
продолжается 2—3 нед.
При подостром и хроническом течении ин-
вазии животные являются паразитоносителями, с фекалиями вы-
деляются балантидиумы в стадии трофозоитов или цист. Понос
менее выражен, чем при остром течении, в жидких фекалиях об-
наруживают только следы крови. Поросята худеют, отстают в рос-
те, развиваются анемия, слабость и полное истощение.
Патологоанатомические изменения. Павшие животные истоще-
ны. Слизистые оболочки анемичны. Слизистая оболочка кишеч-
ника на всем протяжении утолщена, отечна, геморрагически вос-
палена, собрана в поперечные складки, покрыта слизью, иногда
пленками омертвевшего эпителия, наблюдаются кровоизлияния.
При снятии этих наложений обнаруживают эрозии и язвы в под-
слизистом слое кишечника. В желудке — острое и катаральное
воспаление с выраженной гиперемией и кровоизлияниями на
слизистой оболочке. В тонком кишечнике изменения носят ха-
рактер катарального воспаления.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, клинической картины, результатов патологоанатомичес-
кого вскрытия и микроскопического исследования фекалий.
Балантидиумы у свиней встречаются в двух формах: вегетатив-
ной (пролиферативной) и инцистированной.
Для микроскопических исследований берут пробу фекалий
массой 3—5 г, а при поносах — от одной-двух капель до несколь-
ких миллилитров. Фекалии заливают теплым физиологическим
раствором 1 : 2, 1 : 4. С осадка широкой пипеткой берут две—четы-
ре капли, наносят на предметное стекло и накрывают покровным
стеклом. Просматривают под малым увеличением микроскопа
(7x8, 10x10). Жидкие фекалии можно исследовать под микро-
скопом без разведения. При положительных результатах в препа-
рате видны трофозоиты и цисты. Трофозоиты подвижны.
Обнаружение единичных балантидиумов у клинически здоро-
вых свиней в благополучном хозяйстве не может служить основа-
нием для установления диагноза на балантидиоз. Более объектив-
411
ные данные получают при определении количества простейших в
1 г фекалий. Балантидиоз следует дифференцировать от гельмин-
тозов и эймериоза.
Лечение. Для лечения животных, больных балантидиозом, при-
меняют один из следующих препаратов.
Ветдипасфен поросятам до 30 дней дают в дозе 125 мг,
от 31 до 60 — 250, от 61 до 120 — 375, старше 120 дней — 725 мг на
одно животное 1 раз в день.
Й о д и н о л назначают поросятам до 4-месячного возраста в
дозе 3—15 мл, старше 4 мес — 20—25 мл 2 раза в день; нифу-
л и н — из расчета 5 кг препарата на 1 т корма 2 раза в день;
осарсол — в дозе 30 мг на 1 кг массы тела 2 раза в день; т р и -
хопол (метранидазол) свиньям массой до 40 кг — 0,25 г,
свыше 40 кг — 0,5 г 2 раза в день; фуразолидон поросятам-
сосунам — 0,1 г, отъемышам — 0,3 и взрослым — 0,5 г на одно жи-
вотное 2 раза в день; я т р е н — 0,05 г на 1 кг массы тела 2 раза в
день.
Указанные препараты применяют 3—5-дневными курсами.
При наличии показаний через 5 — 7 сут курс лечения повторяют.
Профилактика и меры борьбы. Химиопрофилактику балантиди-
оза свиней проводят в стационарно неблагополучных хозяйствах
за 2—3 сут до отъема или сразу после отъема поросят от свинома-
ток. Препараты применяют курсами по 3 — 5 сут с интервалами
между ними 10—12 сут до 4-месячного возраста животных. В дру-
гих хозяйствах химиопрофилактике подвергают лишь животных, у
которых интенсивность инвазии в первую неделю после отъема
достигает 30 тыс. простейших в 1 г фекалий. Для химиопрофилак-
тики используют препараты, применяемые для лечения.
Для дезинвазии помещений, предметов ухода за животными и
станков применяют 2—3%-ный раствор каустической соды или
4%-ный раствор формалина. Хорошее средство для дезинфекции
полов негашеная известь, которую наносят на 10—15 мин, а затем
смывают. Навоз подвергают обеззараживанию биотермическим
способом.
16.3.2. ХИЛОДОНЕЛЛЕЗ РЫБ
Хилодонеллез — заболевание прудовых рыб, характеризующее-
ся поражением кожного покрова и жаберного аппарата. Вызыва-
ется простейшими отряда Holotricha типа Ciliophora.
Локализация — кожа и жаберный аппарат.
Возбудитель. Chilodonella cyprini семейства Chlamidodontidae —
равноресничная инфузория листовидной формы с выемкой на
заднем конце тела. Длина ее 33—77 мкм, ширина 21—57, толщина
около 18 мкм. При рассмотрении живого паразита под микроско-
пом внутри тела можно различить яйцевидное ядро и две сократи-
тельные вакуоли. На вентральной поверхности, ближе к передне-
412
хилодонеллеза:
Рис. 157. Возбудитель
а — вегетативная форма; б— циста; / — ро-
товое отверстие; 2 — глотка; 3 — сократи-
тельная вакуоль; -/—ядро; 5 —реснички;
6— оболочка
му концу, находится округлый
цитостом — ротовое отверстие,
переходящее в глотку, снабжен-
ную палковидным аппаратом
(рис. 157).
Биология развития. Хилодо-
неллы размножаются путем де-
ления надвое в поперечном на-
правлении. Интенсивно пара-
зит делится при температуре 5—
10 °C. При температуре 20 °C и
выше инфузории погибают. В
неблагоприятных условиях об-
разуются цисты покоя, сохраня-
ющиеся в воде и иле водоемов
длительное время. Рыба заражается при попадании на нее цист.
Установлено, что на свету размножение хилодонеллы замедляется.
Эпизоотологические данные. Хилодонеллезом болеют рыбы всех
видов, разводимых в прудах, включая лососевых и осетровых. Бо-
лезнь проявляется только у годовиков во время зимовки. Взрослая
рыба не болеет, но может быть носителем возбудителя и тем са-
мым поддерживать инвазию в данном водоеме. Заражение проис-
ходит путем прямого контакта.
Возбудитель болезни из водоема в водоем заносится при пере-
возке больных рыб, с водой из неблагополучных по хилодонеллезу
прудов или вместе с сорной рыбой.
Симптомы болезни. Признаками болезни служат подъем из
глубины и массовое движение рыб в зимовальном пруду. Они со-
бираются у притока свежей воды, заглатывают воздух и плавают
кругами или выпрыгивают из воды. На теле рыб образуется сли-
зистый голубовато-серый (молочный) налет, на жабрах — слизь
и наблюдается некроз отдельных участков жаберных лепестков.
В результате поражения кожи и жабр нарушается дыхание. В
тяжелых случаях течения болезни отмечают массовую гибель
рыб.
Диагностика. Диагноз ставят на основании симптомов болезни
и результатов микроскопического исследования соскобов с кожи,
плавников и жабр.
Лечение. Применяют солевые ванны из 5%-ного ра-
створа хлорида натрия в течение 5 мин или 0,1—0,2%-ный раствор
непосредственно в пруду в течение 24—48 ч. Рекомендуется также
малахитовый зеленый в дозе 0,5—1,0 г на 1 м3 воды с
экспозицией 4—5 ч. В условиях зимовальных бассейнов для лече-
ния используют свободный х л о р в дозе 1,0—1,5 мг на 1 л воды с
экспозицией 40—50мин, перманганат калия — 10мл на
1 л с экспозицией 10 мин, формальдегид в концентрации
1:10 000 с экспозицией 1 ч.
413
Профилактика и меры борьбы. На водоподающих каналах ис-
пользуют фильтры для предотвращения попадания в водоемы сор-
ной рыбы. Рыбу перед посадкой на зимовку подвергают профи-
лактической обработке в антипаразитарных ваннах (5%-ные соле-
вые растворы в течение 1—5 мин), а также своевременно проводят
мероприятия, обеспечивающие в прудах оптимальные условия для
рыб.
Пораженную рыбу, если она отвечает требованиям товарной
кондиции, допускают в пищу людям без ограничений, не отвеча-
ющую этим требованиям направляют для кормления скота и пти-
цы с предварительной проваркой.
16.3.3. ТРИХОДИНОЗЫ РЫБ
Триходинозы — заболевания пресноводных и морских рыб, вы-
зываемые простейшими типа Ciliophora. Характеризуются пора-
жением кожного покрова и жаберного аппарата.
Локализация — кожа и жабры.
Возбудитель. Кругоресничные инфузории Trichodina domerquei
и другие семейства Urceolariidae блюдцеобразной или грушевид-
ной формы, 26—75 мкм в диаметре (рис. 158). Прикрепительный
диск полосчатый, снабжен кольцеобразным венчиком из хитино-
вых зубцов. Зубцы имеют внутренние и наружные отростки раз-
личной величины и формы. На верхнем и нижнем концевых дис-
ках тела инфузорий расположены реснички, с помощью которых
они передвигаются по поверхности тела рыбы и свободно плавают
в воде.
Биология развития. Триходины размножаются путем чередова-
ния простого деления и полового процесса — конъюгации.
Эпизоотологические данные. Источники возбудителя инвазии —
больные рыбы, естественный резервуар инвазии в природе — сор-
Рис. 158. Trichodina domerquei:
1 — сократительная вакуоль; 2 — прикрепительное кольцо; 3 — венчик ресничек; 4— ядро;
5 — выделительная вакуоль
414
ные рыбы. К триходинозу восприимчивы мальки, сеголетки и го-
довики всех культивируемых прудовых рыб. Другие возрастные
категории могут быть источником возбудителей триходиноза. Эн-
зоотии возможны во все сезоны года при благоприятных условиях
массового развития паразитов.
Триходинозы, протекающие у годовиков, зимующих в прудах
при высокой плотности посадки рыб, сопровождаются их гибе-
лью.
Симптомы болезни. На поверхности тела больных рыб регист-
рируют голубовато-серый налет, образующийся из обильно выде-
ляющейся слизи и отмерших эпителиальных клеток кожи. Тело
рыб постепенно становится матовым. При развитии патологичес-
кого процесса коагулирующая слизь сползает с поверхности тела
в виде небольших хлопьев. Это хорошо заметно при перемещении
рыб в емкости с разной температурой воды. Жабры бледные, по-
крыты слизью.
В разгар эпизоотии сильно пораженная инфузориями рыба
(более 100 паразитов в поле зрения микроскопа при малом увели-
чении) стремится к прорубям или притоку свежей воды, заглаты-
вает воздух, не реагирует на раздражители, плавает на боку и по-
гибает.
Диагностика. Диагноз ставят на основании клинических при-
знаков и результатов исследований соскобов с кожи и жабр, в ко-
торых находят возбудителя в большом количестве.
Лечение. Такое же, как при хилодонеллезе рыб.
Профилактика и меры борьбы. Проводят ветеринарно-санитар-
ные, рыбоводно-мелиоративные и биотехнологические мероприя-
тия, направленные на создание в прудах и бассейнах оптимальных
зоогигиенических условий, способствующих повышению есте-
ственной устойчивости рыб к триходинозу. Одновременно с этим
принимают меры к оздоровлению головного источника водоснаб-
жения путем его дезинвазии в соответствии с установленными
нормами.
Больную рыбу, если она отвечает требованиям товарной кон-
диции, допускают в пищу людям на общих основаниях. Не отве-
чающую этим требованиям подвергают технической утилизации
или направляют на корм скоту и птице в проваренном виде.
16.3.4. ИХТИОФТИРИОЗ РЫБ
Ихтиофтириоз — заболевание пресноводных, прудовых и аква-
риумных рыб, вызываемое простейшими типа Ciliophora. Характе-
ризуется поражением кожи, плавников и жабр. У морских рыб за-
болевание вызывает вид из рода Cryptocarion.
Локализация — подэпителиальный слой кожи, плавники и жабры.
Возбудитель. Ichthyophthirius multifilus — равноресничная ин-
фузория семейства Ophryoglenidae. Тело округлое или яйцевидное,
415
Рис. 159. Биология развития ихтиофтириуса:
1 — рыба (дефинитивный хозяин); 2— трофозоит; 3 — деление паразита; 4— циста;
5 — выход «бродяжек»
длиной 0,5—1,0 мм. Вокруг маленького круглого рта — реснички.
На поверхности тела — продольные ряды ресничек, сходящиеся
на переднем конце тела. Крупное массивное ядро подковообразно
изогнуто, к нему прилегает микронуклеус. Имеются многочислен-
ные сократительные вакуоли (рис. 159).
416
Биология развития. Инфузории размножаются вне рыбы путем
многократно повторяющегося деления надвое. Зрелые паразиты
разрывают эпителий кожи и попадают в воду. Биология развития
инфузории включает стадию цисты, образующейся во внешней
среде. Внутри цисты формируются многочисленные дочерние
молодые инфузории — «бродяжки», которые выходят во вне-
шнюю среду, достигают инвазионной стадии и активно внедря-
ются в подэпителиальный слой кожи, жабр и плавников.
Эпизоотологические данные. К заболеванию восприимчивы
рыбы всех возрастных групп, но болезнь более остро, с летальным
исходом протекает у молодых рыб и производителей. Чаще прояв-
ляется в весенне-летний период, у годовиков — зимой, когда
рыбы в зимовальных прудах находятся в скученном состоянии.
Источники и резервуары инвазии в природе — больные рыбы,
ложе неблагополучного пруда и вода.
Симптомы болезни. На теле рыб видны белые мелкие бугорки.
Они появляются и на роговице глаза, что приводит к потере зре-
ния. Больные рыбы беспокойные, трутся о дно или берег водоема
и скапливаются у притока свежей воды. При сильном поражении
кожа с боков может сходить кусками. Жабры обескровлены и мес-
тами некротизированы. Рыба отказывается от корма и погибает.
Диагностика. Диагноз ставят на основании симптомов болезни
и результатов микроскопического исследования соскобов кожи,
плавников, жабр. В соскобах обнаруживают возбудителя (при ма-
лом увеличении микроскопа).
Лечение. Применяют 0,6—0,7%-ные солевые ванны из
смеси поваренной и горькой английской соли (3,5: 1,5) длитель-
ного действия — от 3 до 11 сут в зависимости от температуры
воды; малахитовый зеленый в дозе 0,1—0,9мг на 1л
воды с экспозицией от 4 до 24 ч; я р к о-з еленый оксалат
ифиолетовый К при концентрации 0,1—0,2 мг на 1 л с экс-
позицией от нескольких часов до одних суток; метиленовый
синий в дозе 0,5—1,0 мг на 1 л в канавных садках и бассейнах с
экспозицией от 2 до 24 ч и более.
Профилактика и меры борьбы. Проводят ветеринарно-санитар-
ные, рыбоводно-мелиоративные и зоотехнические мероприятия.
Не допускают переуплотненную посадку молоди, ее содержат от-
дельно от взрослых рыб. Пруды периодически осушают и дезин-
фицируют негашеной известью, удаляют сорную рыбу. После не-
реста производителей не позднее чем через 1 сут отсаживают в
летние маточные пруды.
Рыбу, если она отвечает требованиям товарной кондиции, до-
пускают в пищу людям на общих основаниях. Не отвечающую
этим требованиям подвергают технической утилизации или на-
правляют на корм скоту и птице в проваренном виде.
417
16.3.5. НОЗЕМАТОЗ ПЧЕЛ
Нозематоз — протозойное заболевание пчел, вызываемое про-
стейшими типа Microspora отряда Nosematida.
Локализация — средняя кишка пчел.
Возбудитель. Nosema apis семейства Nosematidae. Споры в ок-
ружающей среде имеют размеры (4,5—7,5) х (2,2—3,3) мкм, оваль-
ную форму. Снаружи они покрыты плотной хитиновой оболоч-
кой. Цитоплазма плотная, удерживает мало воды, содержит два
ядра, вакуоль с полюсной нитью длиной около 160 мкм, свернутой
в виде спирали (рис. 160).
Биология развития. Попадая с кормом в среднюю кишку пчелы,
спора ноземы прорастает. Эта стадия ноземы называется планон-
том или амебулой. Планонт мигрирует в эпителий средней киш-
ки, где начинает делиться с образованием меронта. В результате
размножения эпителиальные клетки средней кишки быстро за-
полняются паразитами, теряют свои функции и отрываются от
стенки кишечника. В средней кишке образуются споры, которые с
содержимым кишечника выделяются во внешнюю среду. Нозема
развивается в кишечнике пчелы при температуре в улье от 22 до
34 °C.
Споры нозем сохраняются в меде и сотах около года. Гибнут
при подогревании меда до 60 °C за 60 мин. Водный 4%-ный ра-
створ формалина убивает споры нозем при 25 °C за 1 ч, пары фор-
малина в концентрации 50 г на 1 м3 объема при температуре 35 °C
убивают их за 15 мин.
Эпизоотологические данные. К здоровым пчелам споры попада-
ют через мед, воду, соты, пергу, пчеловодный инвентарь. В 1 г
меда от больной семьи содержится более 10 млн спор.
Заболевание чаще наблюдают весной, редко — осенью. Вспыш-
кам болезни способствуют долгие зимовки пчел, плохое качество
зимнего корма, высокая влажность, беспокойство пчел.
Патогенез. Размножаясь в кишечнике пчелы, ноземы вызывают
гибель эпителиальных клеток стенки кишок. Ферментативная дея-
тельность эпителия понижается, а перистальтика средней кишки
усиливается. При этом задняя кишка быстрее заполняется экскре-
ментами, в результате чего появляется изнуряющий организм
пчел понос.
Иммунитет. Не изучен.
Симптомы болезни. Характерны для нозематоза понос у пчел и
большая гибель их на протяжении зимовки и первого месяца вы-
носа ульев из зимних помещений. Пчелы слабеют, ползают перед
ульем, у некоторых из них наблюдается увеличение брюшка. Рабо-
чие пчелы не способны кормить личинок. Матка становится вя-
лой, не откладывает яиц и погибает. Развитие пчелиных семей на
пасеке происходит неравномерно. Больные семьи дают меньше
меда, чем здоровые. У погибших пчел брюшко мягкое, увеличен-
ное, средняя кишка также увеличена, белого цвета.
418
Рис. 160. Споробласты рода Nosema:
1, 2 — по Исси, 1986; 3 — по Matsumoto, Joshida, 1984; ПГЦ и ШТ, — пластинчатый и пузырча-
тый поляропласты; ЗВ — задняя вакуоль
Диагностика. Диагноз ставят на основе клинических признаков
и результатов микроскопии содержимого кишечника пчел и сус-
пензии, которую получают, растирая брюшко погибшей пчелы
изотоническим раствором натрия хлорида.
Нозематоз пчел дифференцируют от падевого токсикоза и
сальмонеллеза.
Лечение. Больных пчел лечат фумагилином. Для этого в
1 л сахарного сиропа растворяют 50—100 г фумагилина. Лечебный
сироп, подогретый до 30 °C, дают весной по 200 мл на каждую
пчелиную семью 2—4 раза с 1—2-недельным перерывом.
Можно применять энтеросептол. Дают его также в кон-
це зимы или ранней весной сразу после выноса ульев.
Рамки, ульи и все деревянные их части дезинфицируют горя-
чим 2%-ным зольным щелоком или 2%-ным раствором кальци-
нированной соды. Ульи и рамки тщательно моют водой и де-
зинфицируют 4%-ным раствором формалина или 2%-ным раство-
ром хинозола. Проводят также водно-формалиновую или паро-
формалиновую дезинвазию. Можно с этой целью применять
неразведенную молочную кислоту примерно 200мл на один 12-
рамочный улей.
Профилактика и меры борьбы. При появлении зимой в пчели-
ных семьях поноса пчел выносят с зимовки и осматривают. Во
время весеннего осмотра семьи пересаживают в чистые ульи, за-
грязненные соты заменяют чистыми.
Мед, который ставят на зиму, исследуют на наличие пади. Па-
девый мед забирают и заменяют цветковым или сахарным сиро-
пом. Каждой семье на зиму скармливают 3—5 кг сахара. На зиму
оставляют только сильные пчелиные семьи с большим количе-
ством молодых пчел. Зимой пчел содержат в сухих зимовниках.
Лабораторная работа
Задания. 1. Освоить методику взятия проб фекалий у свиней на
балантидиоз. 2. Освоить технику исследования фекалий на нали-
чие балантидий. 3. Ознакомиться со строением трофозоитов и
цист паразита и зарисовать их. 4. Освоить методику взятия соско-
бов у рыб. Ознакомиться со строением инфузорий и зарисовать
их. 5. Освоить методику приготовления препарата из кишечника
пчел, изучить нозем под микроскопом и зарисовать.
Оборудование, материалы и объект исследования: микроскоп; кюветы; стакан-
чики; пинцеты; прибор для взятия фекалий у свиней; пробирки с теплым физра-
створом; полоскательница с теплой водой; предметные и покровные стекла; пас-
теровские пипетки; скальпели; плакат с рисунками балантидий, ихтиофтирий,
триходин, хилодонелл; рыба.
Место занятия: лаборатория паразитологии и инвазионных бо-
лезней сельскохозяйственных животных и учебная клиника.
420
Методика проведения занятия. Лаборант готовит необходимое
оборудование. Преподаватель проводит краткий опрос студентов
и делит группу на звенья. Каждое звено получает оборудование
для взятия проб фекалий. Стакан или пробирку с фекалиями по-
мещают в теплую воду для сохранения подвижных форм баланти-
дий. Если фекалии жидкие, пипеткой берут каплю, помещают ее
на предметное стекло и накрывают покровным. Если фекалии
сформированные, их разводят теплой (37—23 °C) водой, размеши-
вают и пастеровской пипеткой берут пробы со дна на предметное
стекло. Под микроскопом находят трофозоиты и цисты, зарисо-
вывают их.
Затем студенты делают соскобы с кожи рыбы, помещают на
предметное стекло, накрывают покровным и также исследуют под
микроскопом на наличие инфузорий. Обнаруженных паразитов
определяют и зарисовывают.
Для исследования на нозематоз пчел умерщвляют, отпрепаро-
вывают среднюю кишку и помещают на предметное стекло в кап-
лю воды. Изучают без окраски под средним увеличением микро-
скопа в затемненном поле. Нозем и их споры зарисовывают, ис-
пользуя плакаты.
Практическое занятие
Задания. 1. Рассчитать необходимое количество препарата для
группы поросят при балантидиозе свиней. 2. Смешать препарат с
комбикормом. 3. Рассчитать затраты в натуральном и денежном
выражении на обработку поголовья различными препаратами.
Оборудование и материалы: весы; разновесы, деревянные мешалки; лекар-
ственные препараты (осарсол, метранидазол, энтеросептол, фуразолидон, тилан,
ветдипасфен, поваренная соль, хлорная известь, формальдегид); комбикорм, вед-
ра с водой.
Место занятия: ветеринарная учебно-производственная клини-
ка, лаборатория паразитологии и инвазионных болезней.
Методика проведения занятия. Учащиеся на предыдущем заня-
тии получают задание на дом рассчитать необходимое количество
ветдипасфена для 1000 поросят до 40—60-дневного возраста, при-
меняемого из расчета 250 мг на одно животное 1 раз в день двумя
5-дневными курсами через 7 сут.
Аналогичные расчеты можно сделать для осарсола, трихопола,
фуразолидона.
Затем студенты определяют затраты в денежном выражении и
сравнивают себестоимость обработки различными препаратами.
После проверки расчета препарат взвешивают и готовят для при-
менения в соответствии с наставлением.
По окончании работы составляют акт о выполнении и делают
соответствующую запись в журнал (Сельхозучет, формы № 2-вет и
11-вет).
421
Контрольные вопросы. 1. Какие морфологические признаки характерны для
возбудителя балантидиоза свиней, ихтиофтириоза, хилодонеллеза и триходиноза
рыб? 2. Какие симптомы указывают на балантидиоз свиней, хилодонеллез и их-
тиофтириоз рыб? 3. Что объединяет балантидиоз свиней, хилодонеллез, триходи-
ноз, ихтиофтириоз рыб в одну группу — цилиатозы? 4. Что исследуют для обнару-
жения возбудителей болезней рыб? 5. Какие приемы используют для обнаружения
вегетативной формы балантидий в фекалиях? 6. Какие препараты применяют при
балантидиозе свиней? 7. Какие мероприятия проводят по профилактике баланти-
диоза свиней? 8. Как лечить рыбу при цилиатозах?
17. ПРОКАРИОТЫ И ВЫЗЫВАЕМЫЕ ИМИ БОЛЕЗНИ
Выполненные в последние годы исследования позволили выяс-
нить, что анаплазмы, эперитрозооны, гемобартонеллы и некото-
рые другие организмы по структуре принципиально отличаются
от простейших, к которым их относили длительное время. Ана-
плазмы не имеют истинного ядра и органелл, свойственных про-
стейшим, т. е. они являются доядерными организмами. Особенно-
сти строения этих организмов свидетельствуют о их близости к
риккетсиям (отряд Rickettsiales). Сюда же входит род Aegyptianella
(паразиты птиц). Эперитрозооны и гемобартонеллы относятся к
отряду Mycoplasmatales. В отряд Spirochaetales входят боррелии
(трепонемы, спирохеты)
Все эти группы микроорганизмов объединяет тип Protophyta,
однако по сложившейся традиции их изучают в курсе паразитоло-
гии.
17.1. АНАПЛАЗМОЗ КРУПНОГО РОГАТОГО СКОТА
Анаплазмоз крупного рогатого скота — трансмиссивная бо-
лезнь, характеризующаяся лихорадкой, анемией, атонией желу-
дочно-кишечного канала и прогрессирующим исхуданием, обус-
ловливаемая прокариотами семейства Anaplasmatacea.
Риккетсии — самостоятельная группа бактерий. По морфоло-
гии, окраске, некоторым структурным компонентам и антиген-
ным свойствам бактерии этой группы сходны.
Риккетсии — облигатные паразиты, живут и размножаются в
животных клетках, что сближает их с вирусами. Полиморфны,
имеют кокковидную, палочковидную или нитевидную форму.
Спор и капсул не образуют, неподвижны.
Локализация — эритроциты, иногда лейкоциты и тромбоциты.
Возбудитель. Anaplasma marginale относится к семейству
Anaplasmatacea роду Anaplasma (Rickettsia).
При исследовании мазков крови, окрашенных по Романовско-
му, обнаруживают круглые включения величиной 0,2—1,2 мкм
темно-синего цвета. Микроорганизмы располагаются в эритроци-
тах преимущественно на периферии, иногда ближе к центру. В
одном эритроците может быть от одного до четырех возбудителей.
422
Рис. 161. Возбудители анаплазмозов:
верхний ряд — Anaplasma marginale; нижний ряд — A. ovis
Пораженность эритроцитов составляет 3—4 %, в отдельных случа-
ях она может достигать 80 % (рис. 161).
Биология развития. Анаплазмы размножаются простым делени-
ем и почкованием, формируя колонии из одной—восьми особей.
При электронномикроскопическом исследовании в анаплазмах
обнаружены так называемые инициальные, окруженные двух-
слойной плазменной оболочкой тельца, состоящие из микроколо-
ний. Эти тельца могут переходить из эритроцитов через мембрану
и в здоровые эритроциты. В кишечник иксодовых клещей и дру-
гих кровососущих двукрылых насекомых анаплазмы проникают
вместе с высасываемой кровью. Передача анаплазм переходит
трансфазно и трансовариально.
Кровососущие насекомые могут переносить анаплазм от одних
животных к другим в процессе питания кровью, однако в их орга-
низме они не размножаются, поэтому насекомых считают механи-
ческими переносчиками (в отличие от иксодовых клещей).
Эпизоотологические данные. К A. marginale восприимчивы так-
же лоси, северные олени, овцы, козы и буйволы. Болеют как
взрослые животные, так и молодняк. Наличие восприимчивых
животных в дикой природе, клещей-переносчиков и широкое па-
разитоносительство среди животных позволяют отнести анаплаз-
моз к природно-очаговым болезням. Возбудителей анаплазмоза
переносят иксодовые клещи 11 видов и аргасовые одного вида, а
также слепни, комары, мошки, мокрецы, мухи-жигалки и др. Пе-
ренос анаплазм от одних животных к другим возможен механи-
ческим путем при работе нестерильными хирургическими инстру-
ментами.
Анаплазмоз регистрируют весной, летом и осенью. В редких
случаях болезнь проявляется в зимнее время, особенно при пло-
хом кормлении, в условиях минеральной и витаминной недоста-
точности.
423
Часто анаплазмоз протекает одновременно с бабезиидозами и
тейлериозом, а также с инфекционными болезнями.
Патогенез. Попадая в организм восприимчивых животных,
анаплазмы нарушают окислительно-восстановительные обменные
процессы. Для своего развития они используют фосфолипиды
эритроцитов, что приводит к осмотической хрупкости последних.
Сокращается продолжительность жизни эритроцитов, усиливает-
ся эритрофагоцитоз. В активности последнего важную роль игра-
ют аутоантитела, образующиеся против антигенно-измененных
эритроцитов. Нарушается гемопоэз. Уменьшается количество
эритроцитов и гемоглобина в крови, что приводит к нарушению
окислительно-восстановительного процесса в клетках и тканях.
Развивается анемия. Гемоглобинурия бывает редко. В крови сни-
жается содержание общего белка и альбуминов.
Иммунитет. В формировании иммунитета при анаплазмозе уча-
ствуют клеточные и гуморальные факторы. Однако он нестериль-
ный и обусловливается длительным носительством анаплазм в
организме переболевших животных. Наличие анаплазм вызывает
выработку специфических антител, а также аутоантител, которые
способствуют их утилизации в клетках системы мононуклеарных
фагоцитов. Молодняк клинически не болеет или переболевает
легко, что связано с тем, что новорожденные животные получают
с молоком матери антитела против анаплазм.
Симптомы болезни. Инкубационный период продолжается
40 сут и более. Болезнь протекает остро и хронически.
При остром течении болезнь начинается с повышения
температуры тела до 41 °C. У животных ухудшается общее состоя-
ние, снижается аппетит. Основной признак анаплазмоза — выра-
женная анемия, слизистые оболочки могут быть желтушными на
вид. Увеличиваются лимфатические узлы. Ухудшается деятель-
ность сердечно-сосудистой системы и органов дыхания. Развива-
ется атония преджелудков, сменяющаяся иногда диареей. Живот-
ные быстро худеют, что тоже является одним из ведущих призна-
ков болезни. Могут развиваться отеки в области подгрудка. Кровь
водянистая, с низким содержанием форменных элементов и ге-
моглобина. При микроскопии мазков крови устанавливают анизо-
цитоз, пойкилоцитоз и полихромазию.
Хроническое течение анаплазмоза характеризуется
тем, что животные плохо едят корм, быстро устают при перегонах
и теряют прирост массы. Наблюдается гипотония желудочно-ки-
шечного канала. Наряду со значительными изменениями крови
видимые слизистые оболочки становятся бледными. Отмечается
базофильная зернистость, что считается благоприятным прогнос-
тическим признаком.
Тяжело болеет привозной скот, часто с летальным исходом.
Патологоанатомические изменения. Трупы животных сильно ис-
тощены, слизистые оболочки анемичны, в некоторых случаях с
424
желтушным оттенком. Кровь светлая, водянистая, сгустки рых-
лые. Сердце увеличено, мышца дряблая, под эпикардом кровоиз-
лияния. Легкие эмфизематозные. Селезенка увеличена, размяг-
ченной или плотной консистенции, иногда с кровоизлияниями.
Печень увеличена, желтушная, на вид пятнистая. Желчный пу-
зырь увеличен, наполнен густой желчью. Почки на разрезе темно-
желтого цвета, иногда с кровоизлияниями в корковом слое и по-
чечной лоханке. Мочевой пузырь растянут, заполнен мутной,
желтоватого цвета мочой.
Диагностика. При постановке диагноза учитывают эпизоотоло-
гические данные, клинические признаки, а также исследуют на
наличие анаплазм мазки крови, окрашенные по Романовскому.
Разработаны серологические методы диагностики (РА, РСК,
РИФ). Больные и недавно переболевшие животные дают положи-
тельную реакцию в титрах от 1 : 80 до 1 : 280 и выше, у паразитоно-
сителей — от 1 : 10 до 1 : 40.
Лечение. Больных животных следует содержать в стойле, назна-
чать диетические корма. Применяют симптоматическое лечение в
зависимости от показаний.
В качестве специфических средств применяют антибио-
тики тетрациклинового ряда (террамицин,
тетрациклин) в дозе 5—10 тыс. ЕД на 1 кг массы тела на 1—
2%-ном растворе новокаина внутримышечно 4—6 сут подряд.
Можно вводитьтеррамицин внутривенно в виде 1 — 1,5%-ного
раствора на 40%-ном растворе глюкозы из расчета 10—15 мг на
1 кг массы тела 3—4 раза с интервалом 12—24 ч.
Сульфапиридази н-н атрий назначают в дозе 0,05 г
на 1 кг массы тела в разведении 1 : 10 на дистиллированной воде
внутримышечно 3 сут подряд.
Сульфантрол применяют внутримышечно в дозе 0,003 г
на 1 кг массы тела в виде 20%-ного раствора или альбаргин
внутривенно по 150—200 мл в виде 1%-ного водного раствора.
Хорошие результаты дает применение спиртового раствора
этакридина лактата, который готовят по прописи: этак-
ридина лактата 0,2 мл, спирта этилового 60, воды дистиллирован-
ной 120 мл. Все компоненты смешивают, раствор фильтруют, ох-
лаждают и вводят внутривенно. В рацион добавляют микроэле-
менты и витамины.
Профилактика и меры борьбы. В неблагополучных хозяйствах
строго выполняют правила карантинирования. Проводят проти-
воклещевые мероприятия. При массовых обработках животных
строго соблюдают правила асептики и антисептики. Племенных
животных, подлежащих вывозу из неблагополучного хозяйства,
обрабатывают препаратами тетрациклинового ряда, которые вво-
дят из расчета 10 тыс. ЕД на 1 кг массы тела ежедневно в течение
10 сут. Важное значение имеют организация культурных паст-
425
бищ, проведение мелиоративных мероприятий. Разработаны ме-
тоды специфической профилактики путем иммунизации живот-
ных.
17.2. БОРРЕЛИОЗ (СПИРОХЕТОЗ) ПТИЦ
Боррелиоз (спирохетоз, трепонемоз) — трансмиссивная бо-
лезнь домашних и диких птиц, вызываемая возбудителем отряда
Spirochaetales, типа Protophyta.
Локализация — печень, селезенка, костный мозг, плазма крови.
Возбудитель. Borrelia gallinarum (Spirochaeta anserinum) имеет
нитевидную форму, закручена в виде спирали. Число завитков 9—
12 (рис. 162). Длина 3—30 мкм, толщина 0,2—0,4 мкм. Боррелии
могут поступательно двигаться, быстро ввинчиваясь в виде што-
пора. Хорошо растут на куриных эмбрионах.
Болеют куры, гуси, реже утки и индейки, а также дикие птицы.
Биология развития. Боррелии переносят от больной птицы к
здоровой аргасовые (Argas persicus и др.) и гамазовые (Dermanyssus
gallinae) клещи и клопы (Cimex lectularius). Кроме того, боррелии
могут передаваться через клещей рода Omithodorus. Механически-
ми переносчиками могут быть пухоеды рода Мепороп. Клещами
возбудители передаются трансфазно и трансовариально. В орга-
низме восприимчивой птицы и клещей размножение происходит
путем поперечного деления. В клещах боррелий обнаруживают в
просвете кишечника, центральном нервном стволе, слюнных же-
лезах и органах размножения.
Эпизоотологические данные. Боррелиоз имеет широкое распро-
странение во многих странах мира, имеющих теплый климат, и
наносит огромный экономический ущерб в результате гибели
птиц.
Основной переносчик боррелиоза — аргасовые клещи, созда-
ющие природный очаг болезни. Заражение происходит при на-
падении клещей-переносчиков или
Рис. 162. Borrelia anserinum
в крови птицы
клопов на домашнюю или дикую пти-
цу. Возможен перенос возбудителя че-
рез клещей-переносчиков от одного
вида птицы к другому. Боррелиоз — се-
зонная болезнь, так как аргасовые кле-
щи наиболее активны в теплое время
года. Распространители болезни — ди-
кие птицы, так как на них могут дли-
тельное время паразитировать личинки
клещей. В организме клещей боррелии
сохраняются до 8 лет.
Патогенез. Боррелии быстро размно-
жаются во внутренних органах и крови
птиц. Массовое размножение сопровож-
426
дается выделением токсических веществ, которые воздействуют
на центральную нервную систему, вызывают нарушение обмена
веществ, лизис эритроцитов, угнетают кроветворение. Размножа-
ющиеся в крови боррелии могут образовывать клубки, закупори-
вая кровеносные сосуды, что усугубляет течение болезни. Гибель
птицы может доходить до 30—90 %.
Иммунитет. После выздоровления птица приобретает стойкий
иммунитет. Он довольно продолжительный — до 3 лет. Однако
имеются данные о том, что различные штаммы боррелей не вызы-
вают возникновения иммунитета к гетерологичному штамму.
Симптомы болезни. Инкубационный период длится 2—7 сут.
Болезнь может протекать остро, подостро и хронически.
При остром течении температура тела повышается до
42—43 °C. Резко ухудшается аппетит, появляется жажда. Быстро
развиваются малокровие, истощение, гребень и сережки становят-
ся бледными. Затем наступают сонливое состояние, нервные явле-
ния, особенно у гусят. Может наблюдаться понос. Птица слабеет,
передвигается с трудом. Течение болезни затягивается на 2—3 нед.
Птица постепенно слабеет, наблюдаются параличи и парезы ко-
нечностей.
Хроническое течение боррелиоза чаще наблюдает-
ся среди взрослых птиц. Осложняют течение болезни гельминто-
зы, эймериоз, колибактериоз, авитаминозы и др.
Патологоанатомические изменения. У павших птиц отмечают
истощение, анемичность слизистых и серозных оболочек, массо-
вые кровоизлияния на поверхности внутренних органов, увеличе-
ние селезенки в 6—8 раз, дистрофию паренхиматозных органов.
Слизистые оболочки тонкого и толстого кишечника гиперемиро-
ваны, с отечностью и кровоизлияниями. Содержимое кишечника
с запахом. Сердечная мышца с кровоизлияниями, имеет вид варе-
ного мяса.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, клинических признаков и микроскопических исследова-
ний мазков, приготовленных из крови, костного мозга и печени.
Мазки окрашивают по Романовскому, Бурри (черной тушью) или
Морозову.
Боррелиоз дифференцируют от эгиптианеллеза, чумы, клеще-
вого токсикоза и других болезней. Может быть смешанное тече-
ние боррелиоза с эймериозом (А. И. Ятусевич).
Лечение. Высокий эффект дает применение 1%-ного ра-
створа новарсенола внутримышечно в дозе 0,02—0,05 г
на 1 кг массы тела.
Менее эффективно применение пенициллина в дозе
20—25 тыс. ME, бициллин а-6 в дозе 50 тыс. ME на 1 кг массы
тела внутримышечно однократно.
Имеются сообщения о хорошем эффекте от применения внутрь
осарсола в дозе 0,03 г на 1 кг массы тела в сутки на 1%-ном
427
растворе бикарбоната натрия, хлортетрациклина гид-
рохлорида —10—20 мг внутрь один раз в сутки, морфо-
ц и к л и н а — 60 мг на 1 кг массы тела внутрь.
Профилактика и меры борьбы. В птичниках периодически про-
водят дезакаризационные мероприятия.
В неблагополучных по боррелиозу птицеводческих хозяйствах
вакцинируют всю птицу 2 раза с интервалом 8—12 сут. Одновре-
менно проводят мероприятия по уничтожению клещей-перенос-
чиков.
Контрольные вопросы. 1. Какие особенности строения анаплазм позволяют от-
нести их к прокариотам, а не бабезиидозам? 2. Где, когда и как животные заража-
ются возбудителями анаплазмоза? 3. Какие клещи и насекомые — переносчики
анаплазм? 4. Какие симптомы болезни указывают на боррелиоз? 5. Как провести
исследование на анаплазмоз и боррелиоз? 6. Что обнаруживают в мазках крови
при анаплазмозе и боррелиозе? 7. Какие препараты применяют при анаплазмозе?
8. Какие препараты используют при боррелиозе? 9. Как предупредить заражение
крупного рогатого скота возбудителем анаплазмоза?
4
РАЗДЕЛ
ВЕТЕРИНАРНАЯ АРАХНОЭНТОМОЛОГИЯ
Содержание ветеринарной арахноэнтомологии. Ветеринарная
арахноэнтомология — наука, изучающая паукообразных и насеко-
мых — паразитов животных.
Тип членистоногих (Arthropoda) включает пять классов, однако
ветеринарное значение имеют три: паукообразные, или арахниды
(Arachnida), ракообразные (Crustacea) и насекомые (Insecta).
Членистоногие — двусторонние симметричные сегментирован-
ные животные. Тело у них покрыто кутикулой, выполняющей
роль опорного скелета для внутренних органов и конечностей.
Тело насекомых делится на голову, грудь и брюшко. У паукооб-
разных голова слита с грудным отделом и образует головогрудь. У
клещей тело слито воедино. Конечности состоят из члеников (от-
сюда название — членистоногие). Число ног у взрослых особей
различно. Так, например, у насекомых три пары ног, у паукооб-
разных — четыре.
Членистоногие, как правило, раздельнополые организмы, раз-
множаются оплодотворением. Большинство видов откладывают
яйца и только некоторые рождают личинок.
В цикле развития клещей различают стадии: яйцо — личинка —
нимфа (одна или несколько) — имаго.
Насекомые развиваются с полным или неполным метаморфо-
зом. У насекомых с полным метаморфозом присутствуют стадии:
яйца — личинки — куколки — имаго; с неполным — стадия кукол-
ки выпадает.
Ветеринарная арахноэнтомология изучает членистоногих в
трех аспектах:
1) членистоногих — возбудителей болезней животных. Заболе-
вания, вызываемые насекомыми, называются энтомозами (гипо-
дерматоз, эстроз, гастрофилез и др.), а паукообразными — арахно-
зами (саркоптоз, демодекоз, варрооз и др.);
2) членистоногих — переносчиков возбудителей инфекцион-
ных и инвазионных (трансмиссивных) болезней, представляющих
опасность для животных и человека (иксодовые, гамазовые и арга-
совые клещи, зоофильные мухи, гнус и др.);
3) членистоногих, вызывающих порчу продуктов животного
429
происхождения (амбарные, мучные, сырные клещи, моли, коже-
еды и др.).
Отдельные представители класса ракообразных служат проме-
жуточными хозяевами возбудителей некоторых гельминтозов, а
также возбудителями болезней рыб.
Среди животного мира тип Arthropoda — самый многочислен-
ный и насчитывает около 1,5 млн видов. Особенно многочислен-
ны насекомые, которые составляют более 90 % числа видов типа
членистоногих.
Сбор, консервирование членистоногих, приготовление музейных
препаратов. В связи с разнообразием жизненных связей насекомых
с их хозяевами, целей исследования и характера биотопов техника
сбора и учета паразитов, а также методы их лова различны.
Сбор паразитических насекомых на теле
животного. Обычно это делают в дни и часы интенсивного
нападения насекомых. Крупных насекомых (слепней, мух, ово-
дов) учитывают на всем теле животного, мелких (комаров, мошек,
мокрецов) — по отдельным анатомо-топографическим областям
тела. Блох, вшей, власоедов и пухопероедов собирают мелким
пинцетом или кисточкой, смоченной 70%-ным спиртом, с учетом
локализации их на теле хозяина. При сборе пухопероедов тело
птицы слегка увлажняют 3%-ной эмульсией оксамата или пирет-
роидами (перметрин, бутокс). Волосяной покров плотоядных, по-
раженных блохами и власоедами, перед их сбором целесообразно
обработать инсектицидами в аэрозольных упаковках (перол, псо-
роптол, эстрозоль). Затем их извлекают пинцетом или вычесыва-
ют плотным гребешком.
При сборе личинок оводов учитывают их локализацию в тканях,
органах и полостях тела хозяина. После выхода личинок во вне-
шнюю среду на окукливание их собирают на земле или полу. Для
изучения или хранения личинок моют водой, а затем живыми на
15 с опускают в кипяток и переносят в жидкость Барбагалло.
Сбор насекомых вне тела хозяина. Для отло-
ва оводов, мух и слепней используют энтомологический сачок из
тюля или марли (диаметр обруча 25—30 см, длина ручки 70—
80 см). Ловят насекомых стоя на одном месте и делая 100 взмахов
сачком со скоростью один раз в 1 с (один учет). Насекомых отлав-
ливают на растительности, по берегам речек, озер, в местах встреч
разнополых оводов — на возвышенных участках. Помещают в ши-
рокогорлую стеклянную банку (морилку), куда кладут вату, смо-
ченную эфиром.
Для сбора слепней юловидную ловушку конструкции С. Д. Пав-
лова с привлекающим устройством в виде черного дерматиново-
го шара, устанавливаемого на одной трубчатой стойке с тремя
растяжками, размещают на освещенной солнцем поляне, про-
секе, в 50— 100 м от опушки леса или на открытых пастбищах
вблизи мест выплода слепней. За световой день в такую ловуш-
430
ку попадает 7—10 тыс. самок слепней. Эффективность ее увеличи-
вается при использовании в качестве аттрактанта углекислого
газа, подаваемого в ловушку из баллона со скоростью 0,5—2 мл в
1 мин.
Окрыленных мошек и комаров собирают энтомологическим
сачком в прибрежной травянистой растительности, мокрецов
обычно отлавливают на свет, применяя световые ловушки различ-
ных вариантов. Окрыленных мух в животноводческих помещени-
ях собирают разными мухоловками или с помощью липкой бума-
ги. Последнюю приготавливают следующим образом: к одной час-
ти канифоли добавляют две части касторового масла, подогревают
до 60—70 °C и размешивают до полного растворения канифоли.
Полученную массу наносят тонким слоем на целлофановую плен-
ку размером 20 х 50 см, которую развешивают в местах скопления
мух. Более эффективны энтомологические клеи «Пестификс»,
КЗР, «Мускалур», ГИПК-222, а также феромонные приманки с
трикозеном. Прилипших мух снимают с липучки, моют в спирте и
накалывают на булавки или переносят в 70%-ный спирт для хра-
нения.
Для изучения ротового аппарата готовят постоянные препара-
ты. Для этого от тела мухи отсекают голову, проводят ее через
спирты восходящей крепости и на предметном стекле заделывают
в канадский бальзам.
Хранение насекомых на ватном матраце.
Отловленных и умерщвленных крупных насекомых через 30—
40 мин извлекают из банки-морилки и раскладывают рядами на
тонкие слои ваты (ватные матрацы), вкалывают этикетку с назва-
нием местности, датой и временем отлова. На один матрац обыч-
но помещается 40—55 насекомых. Чтобы матрацы не помялись, их
помещают в деревянную коробку со стеклянной верхней крышеч-
кой, через которую хорошо видны насекомые. Для защиты со-
бранного материала от вредителей (жуков, моли, муравьев и др.) в
коробку кладут кусочки нафталина или ватку, смоченную лаван-
довым маслом.
Мелких насекомых накалывают на тонкие короткие энтомоло-
гические булавки — минуции, укрепленные на пластинках или
брусочках из сердцевины бузины иди подсолнечника (размер
11x6x2 мм), или на мелкие картонные треугольники. Последние
же монтируют на более толстые булавки № 2.
Приготовление постоянных микропрепа-
ратов. Такие препараты удобны для изучения анатомо-морфо-
логического строения насекомых под лупой или микроскопом.
Кроме того, они сохраняются длительное время. Если насекомые
сухие и хрупкие, их предварительно 2—3 дня размягчают на влаж-
ном песке под стеклянным колпаком. Затем консервируют спир-
том, помещают в 5%-ный водный раствор оксида калия, кипятят в
нем несколько минут или вымачивают несколько часов. (Насеко-
431
мых с плотным хитиновым покровом перед вымачиванием прока-
лывают тонкой иглой.) После этого насекомых промывают водой,
проводят через спирты восходящей крепости, просветляют 15—
20 мин в карбоксилоле или гвоздичном масле и заключают в ка-
надский бальзам. Мелких насекомых с тонким хитиновым покро-
вом из спирта переносят на предметное стекло и заделывают в
жидкость, приготовленную по прописи: гуммиарабика или виш-
невого клея 24,0, хлоральгидрата 160,0, воды 40,0.
Принципы подбора и применения инсектоакарицидов. Для борьбы
с членистоногими паразитами применяют специальные химичес-
кие препараты, которые называют пестицидами (лат. pestis — вред
и caedo — убиваю). В зависимости от направленности их действия
различают акарициды — препараты, применяемые против
клещей, и инсектициды — препараты против насекомых.
Обычно в ветеринарной практике используют инсектоака-
р и ц и д ы — препараты широкого спектра действия (ивермекти-
ны, пиретроиды, фосфорорганические и др.).
В зависимости от путей, которыми инсектоакарициды прони-
кают в организм членистоногих, различают четыре группы: кон-
тактные (токсичность проявляется при попадании на покровы
паразитов), кишечные (при попадании в органы пищеварения),
системные (проникновение яда в организм вредителя при пита-
нии кровью животного, которому предварительно было введено
данное вещество) и фумиганты (при попадании в органы дыха-
ния).
Инсектоакарициды должны иметь низкую токсичность для жи-
вотных и человека, избирательно (селективно) действовать на вред-
ные организмы, в минимальных дозах обладать персистирующей
способностью (остаточным действием), они не должны накапли-
ваться во внешней среде, должны быть безопасными для обслужи-
вающего персонала и не обладать отдаленными последствиями.
Все мероприятия, связанные с применением инсектоакарици-
дов, проводят в соответствии с санитарными правилами по хране-
нию, транспортировке и использованию их в животноводстве.
При систематическом использовании инсектицида или акари-
цида у насекомых и клещей развивается резистентность к этому
препарату. Резистентность — выработанная в процессе отбора не-
чувствительность к заведомо смертельным концентрациям яда.
Для защиты людей и животных от кровососущих насекомых
(гнуса) и клещей используют отпугивающие вещества — репел-
ленты (лат. repello — отпугивать, отгонять) в виде опрыскива-
ний, аэрозолей, мазей.
В настоящее время при промышленном ведении животновод-
ства, сопровождающемся концентрацией животных, своевремен-
ное проведение профилактических мероприятий против болез-
ней, вызываемых паразитическими насекомыми и клещами, при-
обретает особое значение. В современных условиях каждый вете-
432
ринарный специалист должен хорошо владеть средствами и ме-
тодами массовых обработок животных против паразитарных бо-
лезней.
В животноводстве и ветеринарии пестициды применяют путем
опрыскивания, опыливания, нанесения на поверхность тела с по-
мощью пуронов, купания животных и аэрозольной обработки.
Опрыскивание — наиболее широко применяемый спо-
соб обработки, особенно крупных животных. Достоинства мето-
да — равномерное распределение действующего вещества по по-
верхности тела, возможность применения комбинированных со-
ставов пестицидов.
Опыливание — нанесение пестицида в пылевидном со-
стоянии на поверхность тела животных. Достоинства метода —
простота исполнения, возможность локального нанесения на жи-
вотных и использование готовых стандартизированных дустов,
недостаток — большой расход препарата, запыление рабочей
зоны.
Обработка пуронами — поливание животных вдоль
позвоночника композициями из органических растворителей и
пестицидов.
Купка животных — обработка животных путем погру-
жения в водные растворы пестицидов. Положительные свойства
метода — высокая эффективность обработки, недостаток — трудо-
емкость процедуры.
В ветеринарной практике инсектоакарициды используются в
виде растворов, эмульсий, суспензий, порошков (дустов), аэрозо-
лей, пуронов, зоошампуней, ушных бирок и др.
Растворы — жидкая лекарственная форма, состоящая из
растворимого инсектоакарицида и растворителя.
Эмульсия — однородная по внешнему виду лекарственная
форма, состоящая из нерастворимых тонкодисперсных жидко-
стей, предназначенная для наружного, внутреннего или паренте-
рального применения. При разбавлении водой эти формы дают
устойчивые эмульсии, удобные для опрыскивания поверхностей и
животных.
Концентраты эмульсий (к. э.) представляют собой
композицию из двух несмешивающихся жидкостей, стабилизиро-
ванных добавлением эмульгаторов. При смешивании с водой к. э.
дают устойчивую водную эмульсию. Отрицательное свойство
к. э. — расслоение при стоянии.
Лосьоны — эмульсии, содержащие дополнительно в своем
составе спиртовые добавки.
Суспензии — дисперсная система, в которой твердое ве-
щество взвешено в жидкости.
Порошки (дусты) — лекарственная форма в виде сухого
сыпучего вещества для наружного и внутреннего применения. По-
рошки получают путем механического измельчения твердых ле-
433
карственных форм с последующим просеиванием через сита с от-
верстиями определенного размера. В качестве наполнителей ис-
пользуют цеолиты, тальк, каолин, силикагель и др. Содержание
д. в. в дусте обычно составляет 1 — 10 %. В гранулированные препа-
раты, кроме того, вводят добавки связующих веществ — желатин
или синтетические смолы, а в смачивающие порошки —до 5%
поверхностно-активных веществ типа ОП-7 или ОП-Ю. Негатив-
ные свойства порошков — их слабая прилипаемость к поверхнос-
тям, комкование и слеживаемость при длительном хранении.
Аэрозоли — твердые или жидкие частицы пестицидов, на-
ходящихся в воздухе во взвешенном состоянии. Диаметр аэро-
зольных частиц может быть от 1 нм до несколько сотен микромет-
ров.
П у р о н ы — препараты, название которым дано по способу
применения. Исследования пуронов показали, что достаточная
эффективность этих форм достигается при нанесении необходи-
мого количества препарата на ограниченную область тела, обычно
вдоль позвоночника. Поэтому форма пурон имеет несомненное
преимущество перед опрыскиванием или купкой, так как полное
покрытие животного препаратом не требуется и отпадает необхо-
димость хранения его в купонной ванне. Недостаток этой фор-
мы — возможность раздражения после нанесения.
Инсектицидные мази — смесь пестицидов с вазели-
новым маслом или вазелином.
Инсектицидные карандаши — смесь воска, аэро-
сила, парафина, мела, инертных наполнителей и пестицида. Их
применяют в борьбе с тараканами, клопами, мухами и т. д. С этой
целью в местах скопления насекомых карандашом наносят поло-
сы шириной 2—4 см.
Инсектицидные мыла — механические смешивания
на водяной бане пестицида в жидкой форме с мылом.
Зоошампуни — композиция пестицидов с косметически-
ми шампунями. Их используют в основном для домашних живот-
ных в борьбе с эктопаразитами.
Пленки — пестицид введен в основу лака или пленку, кото-
рую наносят на поверхность предметов, стен и т. д. В этом случае
пестицид постепенно выкристаллизовывается, а насекомые, пол-
зая по поверхности, контаминируют с д. в.
Бирки, ушные номера — пестицид введен в полимер-
ную основу, из которой изготавливается номер или бирка, кото-
рые прикрепляются к ушной раковине животных. Недостаток би-
рок — их плохая сохраняемость на животных и относительно не-
высокая эффективность.
В качестве инсектоакарицидов применяют вещества из следую-
щих классов химических соединений: хлорорганические (ушные
капли Аурикан), фосфорорганические (ДДВФ, диазинон, дурс-
бан, блотик, гиподермин-хлорофос, диоксафос, гипхлофос и др.),
434
карбаматы (байгон, больфо-пудра, шампунь, ошейник), пиретро-
иды (перметрин, стомозан, креопир, креохин, бутокс, К-отрин),
органические серосодержащие соединения (плизон, лепран),
ивермектины (ивомек, цидектин, баймек, аверсект и др.), форма-
мидины (амитраз, амитразин) и др.
В ветеринарной практике для обработок больших групп живот-
ных против клещей и других эктопаразитов широко применяют
специальные проплывные — купонные ванны и механизирован-
ные, сооружаемые по типовым проектам.
Кроме ванн используют также специальные установки и гене-
раторы для опрыскивания животных и помещений. Животных оп-
рыскивают на площадках с твердым покрытием или в душевых ка-
мерах.
Наиболее широкое применение имеют дезинфекционная ус-
тановка Комарова (ДУК), установка дезинфекционная самоход-
ная (УДС), ветеринарная дезинфекционная машина (ВДМ),
штанги горизонтальные распылительные (ШГР), опрыскиватель
«Олень», аэрозольный генератор (АГ-УД-2), форсунки (ТАН,
ПВАН и др.).
Контрольные вопросы. 1. На какие классы делят тип членистоногих? 2. Чем от-
личаются клещи от насекомых? 3. Как собирать и фиксировать насекомых и кле-
щей? 4. Какие инсектоакарициды и репелленты применяют для борьбы с парази-
тическими членистоногими? 5. Какие основные способы применения инсекто-
акарицидов? 6. Какие технические средства используют для применения инсекто-
акарицидов?
18. ЭНТОМОЗЫ
18.1. МОРФОЛОГИЯ, СИСТЕМАТИКА И БИОЛОГИЯ
ПАРАЗИТИЧЕСКИХ НАСЕКОМЫХ
Энтомология — наука о насекомых. Ветеринарная энтомология
изучает насекомых как возбудителей энтомозов животных, пере-
носчиков возбудителей инфекционных и инвазионных (трансмис-
сивных) болезней и вредителей продуктов животного происхожде-
ния.
Тело насекомых состоит из трех отделов: головы, груди и
брюшка. Снаружи оно покрыто защитной хитинизированной ку-
тикулой. Голова подвижно соединена с грудью, на ней имеются
органы зрения, обоняния и осязания. Ротовой аппарат в зависи-
мости от способа питания может быть грызущего, сосущего или
колюще-сосущего типа.
Грудь имеет три сегмента: переднегрудь, среднегрудь, задне-
грудь. Снизу к груди прикреплены три пары ног, а сверху — две
пары крыльев. Органы дыхания — трахеи находятся по бокам гру-
ди и брюшка. Трахеи — мельчайшие трубочки, пронизывают все
тело насекомых.
435
Кровеносная система незамкнутая, представлена одним крове-
носным сосудом (сердце), расположенным на спинной стороне
брюшка. Кровь (гемолимфа) прозрачная, желтоватого или зелено-
ватого цвета. Клетки (гемоциты) внешне похожи на лейкоциты.
Пищеварительный аппарат в виде трубки, разделенной на пере-
днюю, среднюю и заднюю кишки. В последнюю впадают мальпи-
гиевы сосуды, выполняющие роль выделительных органов.
Нервная система в виде нервных узлов, расположенных цепоч-
кой по длине тела. Под кутикулой имеются клетки — сенсиллы,
выполняющие роль чувствительных рецепторов. У насекомых раз-
личают механическое, химическое и гипотермическое чувства,
слух и зрение.
Насекомые раздельнополы, размножаются половым путем, бы-
вают яйцекладущие и живородящие. Развиваются путем метамор-
фоза (превращений). Полное превращение (Holometabola) — это
когда развитие насекомого проходит фазы яйца, личинки, кукол-
ки и имаго. При неполном превращении (Hemimetabola) выпадает
фаза куколки.
Все насекомые принадлежат к типу Arthropoda — членистоно-
гие, классу Insecta, разделу крылатые — Pterygota.
Этот раздел включает насекомых с полным и неполным пре-
вращением. К насекомым с полным превращением относится от-
ряд двукрылых — Diptera (оводы, мухи, комары, мошки, мокрецы,
москиты, слепни и блохи). Остальные эктопаразиты животных
(вши, клопы, власоеды, пухоеды) — с неполным превращением.
Так же развиваются и тараканы.
18.2. ГИПОДЕРМАТОЗ КРУПНОГО РОГАТОГО СКОТА
Гиподерматоз — хроническое заболевание, вызываемое личин-
ками подкожных оводов Hypoderma bovis (обыкновенный под-
кожник, строка) и Н. lineatum (пищеводник) семейства Hypoder-
matidae, паразитирующими в организме крупного рогатого скота.
Заболевание характеризуется воспалительными явлениями в мес-
тах их локализации, общей интоксикацией организма и снижени-
ем продуктивности животных. Личинки оводов могут развиваться
у зебу, буйволов, яков, лошадей, овец и коз. На территории Рос-
сии обитают оба вида подкожных оводов.
Биология развития. Взрослые оводы по внешнему виду похожи
на шмелей, но меньше по размеру. Нападают на животных только
самки оводов в жаркое время (июнь — август). Самки весьма пло-
довиты, откладывают до 800 яиц, что позволяет им при сравни-
тельно небольшой численности поддерживать существование
вида. Н. bovis откладывает яйца на шерстный покров верхней час-
ти задних конечностей, живот, вымя, а Н. lineatum — на подгрудок
и передние конечности, приклеивая их к шерсти группами. После
откладки яиц самки погибают.
436
Яйца желтовато-белого цвета, с глянцевой поверхностью. В те-
чение 5—7 сут в них созревают личинки, которые выходят из обо-
лочек и проникают в кожу. Личинка длиной 0,6 мм, бледно-жел-
того цвета, имеет множество мелких шипиков. Попадая под кожу,
личинки мигрируют (строка — в спинномозговой канал, пищевод-
ник—под слизистую оболочку пищевода). Здесь они находятся
5—6 мес. Затем мигрируют к области спины и поясницы, где фор-
мируют соединительнотканные капсулы. Для дальнейшего разви-
тия они нуждаются в кислороде воздуха, поэтому образуют в коже
свищевые отверстия. Затем личинки линяют во вторую стадию.
Через 3—4 нед совершают вторую линьку и переходят в третью
стадию. Созревшая личинка выползает из капсулы и падает на
землю, где окукливается. Продолжительность развития куколки
4—6 нед (рис. 163).
Взрослые оводы не питаются, у них не развиты ротовые органы,
живут за счет жирового тела, образующегося в стадии личинки.
Эпизоотологические данные. Основной источник инвазии —
животные, зараженные личинками оводов. Молодняк инвазирует-
ся интенсивнее, чем взрослые животные, и свищевые капсулы у
них появляются весной на месяц раньше. Плотность расселения
скота — один из основных факторов, влияющих на численность
оводов и пораженность животных личинками.
Патогенез и симптомы болезни. Личинки первой стадии, прони-
кая через кожу, вызывают болезненность, беспокойство животно-
го. Мигрируя в организме, они повреждают ткани. Скопление
большого количества личинок в пищеводе может нарушать его
проходимость, а при скоплении в спинномозговом канале быть
причиной полупаралича задних конечностей животных.
Личинки второй и третьей стадий вызывают хронические вос-
палительные процессы с разрастанием соединительной ткани вок-
руг свищевых капсул. Продукты обмена вызывают истощение жи-
вотного и снижение молочной продуктивности у коров.
К весне под кожей спины появляются небольшие уплотнения,
образуемые личинками. На этих местах в коже появляются отвер-
стия, из которых выделяется серозная жидкость. Кожа вокруг сви-
щевой капсулы (желвака) менее эластична, болезненна, шерсть в
этих местах склеена.
Диагностика. Диагноз ставят весной на основании осмотра и
пальпации (прощупывания) кожи животного в области спины и
обнаружения желваков. Раннюю диагностику гиподерматоза про-
водят в октябре — ноябре реакцией непрямой гемагглютинации
(РИГА).
Лечение. Основное место в системе мер борьбы с гиподермато-
зом занимает ранняя химиотерапия, направленная на уничтоже-
ние личинок первой стадии, мигрирующих в организме, и по-
здняя обработка с целью уничтожения личинок, находящихся в
свищевых капсулах (желваках).
437
Рис. 163. Биология развития подкожного овода:
7 — окрыленный овод (самка); 2— яйца на волосах; 3 — выход из яйца личинки;
4— личинки / стадии (в спинномозговом канале); 5—личинка ///стадии (под
кожей); 6—куколка (в почве); 7—взрослый овод (самец)
Раннюю химиотерапию проводят осенью после окончания лёта
оводов: в большинстве зон Российской Федерации — в сентябре —
ноябре. Обработке подлежит все поголовье крупного рогатого
скота, выпасавшееся на пастбище, в том числе и скот индивиду-
ального сектора. Для этого применяют инсектициды системного
действия: гиподерми н-х лорофос, диоксафо с-К,
амидофо с, сульфидофо с-2 0 , и в о м е к и ф а с к о -
в е р м. Обрабатывают животных методом поливания препарата
438
тонкой струйкой по обе стороны позвоночника от холки до крест-
ца с помощью дозатора гиподермин-хлорофоса, шприца, полуав-
томата Шилова, шприца Жанэ, автомата-дозатора АД-1 и др.
Гиподерми н-х л о р о ф о с дают животным массой до
200 кг в дозе 16 мл, более 200 кг — 24; д и о к с а ф о с-К — соот-
ветственно 12и 16;сульфидофо с-20 — животным массой до
200 кг — 5, 200—400 кг — 10, более 400 кг — 12 мл.
Г ипхлофос применяют в дозе 16—18 мл. Чтобы достичь
100%-ной эффективности лечения, животных обрабатывают осе-
нью двукратно с интервалом 30 дней.
Ивомек, цидектин, аверсек т-2, б а й м е к вводят
однократно подкожно в дозе 200 мкг на 1 кг массы тела, фаско-
в е р м — подкожно из расчета 1 мл на 20 кг массы, но не более
10 мл на животное.
Профилактика и меры борьбы. Весной с целью выявления боль-
ных животных проводят однократное обследование поголовья.
Животных, пораженных личинками второй и третьей стадий, об-
рабатывают вышеуказанными препаратами в тех же дозах, реко-
мендуют также 0,02%-ную эмульсию циперметрина, 0,05%-ную
эмульсию К-отрина, 0,0025%-ную эмульсию бутокса, 2%-ную
водную эмульсию гипхлофоса в объеме 200 мл на животное. Летом
один раз в 20 сут животных обрабатывают пиретроидами согласно
действующим наставлениям.
18.3. ЭДЕМАГЕНОЗ СЕВЕРНЫХ ОЛЕНЕЙ
Эдемагеноз — хронически протекающая болезнь северных оле-
ней, вызываемая личинками подкожного овода Oedamagena
tarandi (пилю) семейства Hypodermatidae, характеризующаяся об-
щей интоксикацией организма, снижением продуктивности и по-
ражением кожи.
Возбудитель. Имаго длиной 14—16 мм, тело покрыто длинными
волосками, черными на спине, ярко-оранжевыми на брюшке. У
самки длинный яйцеклад. Ротовой аппарат не развит. Яйца свет-
ло-желтого цвета, длиной вместе с придатком до 1 мм. Личинка
первой стадии при выходе из яйца длиной 0,73 мм, прозрачная.
Личинка второй стадии длиной 7—14 мм, молочно-белого цвета.
Ротовые крючки отсутствуют. Личинка третьей стадии до 30 мм,
яйцевидная, характерно окаймление сверху и с боков очень мел-
кими шипами в виде узкой полоски задних дыхалец на восьмом
брюшном членике.
Биология развития. После спаривания самки летят на поиски
оленьих стад, а самцы после нескольких спариваний погибают.
Самка на протяжении жизни (2—3 нед) находится вблизи стада и
откладывает 600—700 яиц на волосы оленей. Вышедшая из яйца
личинка проникает под кожу и мигрирует по рыхлому слою по-
439
верхностной подкожной фасции в область спины, крупа и верхней
части бедер. Через 3—4 мес личинка увеличивается в длину до
9 мм, подходит вплотную к коже, поворачивается к ней задним
концом тела (на нем расположены дыхальца), проделывает свище-
вое отверстие в коже и превращается в личинку второй стадии.
Вокруг нее образуется плотная соединительнотканная капсула.
Через 3—4 мес личинка снова линяет и переходит в третью стадию
развития, которая продолжается еще около 3 мес. Личинки пита-
ются кровью, лимфой и клетками внутренней поверхности капсу-
лы. Их выход на окукливание начинается в конце мая. Фаза ку-
колки продолжается 18—60 сут. Лёт овода отмечается в июле —
сентябре.
Патогенез. Личинки на путях миграции травмируют ткани,
развивается воспаление. Интенсивность инвазии, как правило,
высокая, в связи с чем свищевые капсулы зачастую расположены
очень близко друг к другу и отдельные участки воспаления сли-
ваются, образуя обширные очаги. Продукты распада кожи и жиз-
недеятельности личинок вызывают интоксикацию организма,
изменяются морфологический состав крови и биохимический
гомеостаз.
Симптомы болезни. В период заражения олени сильно беспоко-
ятся, стремятся укрыться от нападения. С переходом личинок во
вторую и третью стадии становятся заметными желваки, горячие и
болезненные при надавливании. Волосяной покров взъерошен,
загрязнен засохшими выделениями из свищевых капсул. Больные
олени худеют, хуже переносят зимовку, нередко отстают от стада.
У одного животного обнаруживают 200 личинок и более.
Диагностика. Весной проводят визуальный осмотр и пальпацию
кожно-волосяного покрова спины и крупа, обнаруживают свище-
вые капсулы.
Лечение. Осенью после окончания лёта оводов (в конце авгус-
та — октябре) оленей обрабатывают препаратами системного дей-
ствия. Внутримышечно вводят э т а ц и д в дозе 10 мг на 1 кг мас-
сы тела, варбекс в дозе 20 мг на 1 кг, ф а с к о в е р м в дозе
1 мл на 20 кг массы тела, но не более 5 мл на животное. Эффектив-
ны подкожные инъекции ивомека, цидектина и а в е р -
секта (фармации а) в дозе 0,2 мг на 1 кг массы тела. Обра-
ботку оленей проводят в коралли или при отлове на аркан.
Профилактика и меры борьбы. Основные элементы организа-
ционных мероприятий сводятся к снижению численности ово-
дов в природе. Со второй половины апреля и в мае, когда начи-
нается массовое отхождение личинок на окукливание, не следует
держать оленей на сухих и хорошо прогреваемых участках паст-
бищ, являющихся для развития овода благоприятными в данной
фазе. В такие периоды оленей обычно выпасают в низинах, пре-
имущественно на сырых участках осоково-разнотравных лугов,
ивняков и др.
440
Летом стада оленей опрыскивают против имаго оводов и гнуса
эмульсиями инсектицидов с помощью опрыскивателей «Север»,
«Олень», а также аэрозольных установок «Микронизер», К-145 и
РАА. Для опрыскивания применяют в расчете на животное:
0,25%-ную эмульсию ДДВФ в дозе 100 мл; смесь ДДВФ и оксама-
та —50 мл; 0,25%-ную эмульсию диброма — 150 мл; 3%-ную
эмульсию оксамата — 100мл; 10%>-ную эмульсию ТСН—80мл;
0,1%-ную эмульсию стомозана или 0,05%-ную эмульсию цимбу-
ша — 100 мл (в форме аэрозолей — 20 мл); 0,0125%-ную эмульсию
К-отрина или бутокса — 80 мл; 0,2%-ную эмульсию сумициди-
на — 50—100 мл. При высокой численности и активности насеко-
мых проводят два-три опрыскивания с интервалом 3—4 ч в сутки.
Всего за сезон выполняют 20—30 обработок.
18.4. ЭСТРОЗ ОВЕЦ
Эстроз вызывается личинками овечьего овода Oestrus ovis се-
мейства Oestridae, развивающимися в носовой полости, лобных
пазухах и пространствах роговых отростков. Сопровождается вос-
палением слизистых оболочек верхних дыхательных путей, рас-
стройством функциональной деятельности органов дыхания, пи-
щеварения и центральной нервной системы.
Возбудитель. Имаго овечьего овода обычно желто-коричневого
цвета, длиной 10—12 мм. Тело покрыто редкими волосками, сидя-
щими на небольших темных бугорках. Голова крупная, шире гру-
ди. Ротовое отверстие отсутствует. На среднеспинке имеется че-
тыре темные полосы. Грудь темно-серого цвета, крылья прозрач-
ные, с тремя темными пятнышками. У основания ноги короткие,
коричневые, слегка волосистые. Брюшко из пяти сегментов, на
его коричневом фоне имеются беловатые пятна (рис. 164).
Яйца белого цвета, длиной до 1 мм, дугообразно искривленные.
Личинки первой стадии веретенообразной формы, белого цвета,
длиной до 4,5 мм, с двумя темными хитиновыми крючками на пе-
реднем конце и с многочисленными шипиками, рассеянными по
всему телу. На каудальном конце личинок имеется 22—25 хвосто-
вых крючков. Личинки второй стадии белого цвета, длиной 5—
12 мм; первый грудной и восьмой брюшной членики личинки во-
оружены мелкими коническими шипами. Личинки третьей ста-
дии длиной 10—30 мм; у зрелых личинок на спинной стороне вид-
ны характерные темные поперечные полосы.
Биология развития. Имаго не питаются, живут за счет питатель-
ных веществ, накопленных в фазе личинки. Самки овода живоро-
дящие. После оплодотворения в маткообразном приемнике фор-
мируются личинки. В этот период они не летают, в течение 10—
15 сут сидят в углублениях, щелях построек и др. Самки с созрев-
шими личинками становятся активными, подвижными, начинают
441
Рис. 164. Oestrus ovis:
a — самка; б — личинка: 7 — с дорсальной стороны; 2 — с вентральной стороны
летать. Их подлет вызывает сильное беспокойство у овец, они со-
бираются в кучи, часами стоят, низко опустив голову, фыркают.
Самки оводов долго летают среди овец, часто садятся на них,
впрыскивают личинок в их носовую полость как на лету с рассто-
яния до 40 см, так и с земли. В один прием самка выбрасывает 8—
12, иногда до 40 личинок. Живут имаго 2—3 нед. Плодовитость са-
мок около 600 личинок. Нападение самок на овец длится 2—4 сут,
после чего они погибают.
Личинки первой стадии локализуются главным образом на
внутренней и наружной поверхностях нижних носовых раковин,
носовой перегородке и стенке носовой полости, личинки второй и
третьей стадий — в лобных пазухах и полостях у основания рогов.
В южных районах в течение одного сезона может развиваться
две генерации оводов. Длительность развития личинок у овец в
зоне с одной генерацией в год составляет 8—11 мес, а в зонах с
двумя генерациями личинок осенней генерации — 8—10 мес, ве-
сенней — от 20—30 сут до 3—6 мес.
Зрелые личинки третьей стадии мигрируют из лобных пазух в
носовую полость, и во время чихания овцы выбрасывают их на
землю. Окукливание происходит в почве на глубине 1—5 см. Про-
должительность фазы куколки 14—46 сут.
Эпизоотологические данные. Эстроз широко распространен в
степных и полустепных районах. Экстенсивность инвазии обычно
442
составляет 70—100% при интенсивности несколько десятков эк-
земпляров у одной овцы. Наиболее высокую интенсивность зара-
жения овец личинками отмечают к концу лёта оводов. Зимой
часть личинок погибает и интенсивность инвазии снижается, с
апреля по июнь она минимальная в связи с выпадением личинок
на окукливание. Старые и слабые животные интенсивнее поража-
ются личинками, чем молодые и здоровые.
Патогенез. Личинки оводов оказывают механическое, общее
токсическое действие и вызывают сенсибилизацию организма
овец. Шипами личинки ранят слизистую оболочку носовой поло-
сти, она воспаляется, набухает, изъязвляется. Воспаление часто
носит гнойно-некротический характер и распространяется на обо-
лочки головного мозга. У больных овец отмечают эритропению,
лейкоцитоз, эозинофилию, снижение содержания общего белка,
альбуминов, увеличение активности ферментов переаминирова-
ния, щелочной фосфатазы и др. (В. И. Толоконников).
Симптомы болезни. Зависят от степени инвазии, возраста, лока-
лизации личинок и общего состояния организма. Различают три
периода болезни. В первые часы после заражения овцы чихают,
фыркают, трясут головой, трутся о ноги и твердые предметы. На
2—3-е сутки из ноздрей появляется серозно-слизистое истечение,
иногда с прожилками крови, затрудняется дыхание. После окон-
чания лёта оводов симптомы болезни исчезают, наступает скры-
тый период. Третий период развивается ближе к весне. Появляет-
ся обильное серозное или серозно-гнойное истечение из носовых
раковин, животное судорожно кашляет, часто отфыркивается. Не-
редко воспалительные процессы распространяются на глотку,
слизистые оболочки решетчатой кости, лобные пазухи и оболочки
головного мозга. Нарушается координация движения, появляются
судороги и манежные движения — «ложная вертячка». Через 3—
5 сут такие животные погибают. Особенно тяжело болеют эстро-
зом ягнята текущего года рождения. Из-за сильного ринита они
дышат через рот, что мешает им сосать маток, быстро худеют и
часто погибают.
Патологоанатомические изменения. В начальной стадии болезни
отмечают гиперемию, катаральное воспаление, отечность и изъяз-
вление слизистых оболочек носовой полости, трахеи и бронхов.
Слизистая оболочка решетчатой кости воспалена, лабиринты за-
полнены слизистым или гнойным содержимым с ихорозным запа-
хом.
При гистологическом исследовании тканей носовой полости
и лобных пазух отмечают их утолщение за счет разрастания эпи-
телия, местами серозно-клеточную инфильтрацию. Воспали-
тельные процессы характеризуются признаками реакции гипер-
чувствительности замедленного типа. В участках локализации
мертвых личинок имеются очаги некроза. Сосуды оболочек го-
ловного мозга инъецированы, передние части больших полуша-
443
рий отечны и пигментированы, в желудочках и аммониевых рогах
инфильтрат.
Диагностика. Диагноз ставят на основании клинических при-
знаков и результатов вскрытия убитых и павших животных. При
этом учитывают общую ситуацию (эпизоотологическую), сезон-
ность заболевания и зональные особенности экологии овечьего
овода.
Для ранней диагностики эстроза овец и контроля эффектив-
ности лечения применяют антигенвыявляющий вариант имму-
ноферментного анализа (Д. М. Аязбаев). Высокоспецифичны
также реакции кольцепреципитации, непрямой гемагглютина-
ции, латекс-агглютинации, двойной диффузии в агаровом геле
(Г. С. Сивков).
Лечение, профилактика и меры борьбы. Для борьбы с эстрозом
проводят комплекс организационно-санитарных и лечебно-про-
филактических мероприятий с учетом зональных особенностей
экологии оводов. Ежегодно осматривают всех животных с целью
выявления и лечения больных: в средней полосе в апреле — мае,
на юге в марте — апреле.
Общие меры профилактики предусматривают регулярный ос-
мотр поголовья, выявление и лечение больных животных; весной
не реже 1 раза в 2 нед чистят кошары и тырла от навоза и склады-
вают его для биотермического обеззараживания; уничтожают при
вскрытии павших овец личинок третьей стадии и др.
При отсиживании самок овода в укрытии в период эмбриоге-
неза личинок в июне — июле осматривают наружные стены кошар
и приотарных построек и обрабатывают их инсектицидами. Для
этого используют водные эмульсии дифоса (5%-ные), циодрина
(0,5%-ные), перметрина или стомозана (0,025%-ные), ципермет-
рина, цимбуша, фендона (0,03%-ные), К-отрина (0,0125%-ные),
бутокса (0,005%-ные) и др.
Для защиты овец от нападения имаго в июне и июле проводят
профилактические опрыскивания их 1 раз в 2 нед 0,5%-ной вод-
ной эмульсией трихлорметафоса-3 из расчета 0,5—1,0 л на живот-
ное. Применяют также мелкокапельное опрыскивание водными
эмульсиями: 2%-ной циодрина, 0,025%-ной бутокса, 0,2%-ной
стомозана и др., расходуя по 100 мл на животное. Овец опрыски-
вают с помощью установок «Автомакс», ДУК, ЛСД, ВДМ, ШГРУ
в загонах или при прохождении через раскол.
Осенью (сентябрь — ноябрь) после окончания лёта оводов про-
водят раннюю химиотерапию животных. Овец обрабатывают ме-
ханическими или термическими аэрозолями хлорофоса или
ДДВФ. Механические аэрозоли генерируют с помощью ВДМ, АУ-1,
ТАН, САГ из расчета 10, 20 и 24%-ного водного раствора хлоро-
фоса 4 г на 1 м3; 1%-ной водной эмульсии ДДВФ и 12,5%-ного
ДДВФ в аэрозольных баллонах «Эстрозоль» — 150 мг на 1 м3. Тер-
мические аэрозоли получают из шашек ШИФ-1 и ПХСШ-14 при
444
экспозиции 1 ч, после чего открывают окна и двери для проветри-
вания. Методом вольного выпаивания применяют 0,03%-ный ра-
створ хлорофоса в течение 4 сут подряд или 0,1%-ный раствор од-
нократно.
Из индивидуальных методов орошают носовую полость 4%-
ным водным раствором хлорофоса, 0,5%-ной водной эмульсией
циперметрина, 0,1%-ной водной эмульсией дельтаметрина, расхо-
дуя по 4 мл на животное. Эффективны подкожные инъекции иво-
мека, цидектина и аверсекта по 0,2 мл на 10 кг массы тела или
подкожное введение фасковерма по 1 мл на 10 кг массы тела.
18.5. ГАСТРОФИЛЕЗ НЕПАРНОКОПЫТНЫХ
Гастрофилез — хронически протекающие болезни непарноко-
пытных (лошадей, ослов и мулов), вызываемые личинками желу-
дочно-кишечных оводов семейства Gastrophilidae рода
Gastrophilus.
Возбудители. Наиболее распространены следующие виды:
G. intestinalis — большой желудочный овод, крючок; G. veterinus —
двенадцатиперстник; G. haemorrhoidalis — усоклей; G. ресошш —
травняк; G. inermis — малый желудочный овод — якорек; G.nigri-
comis — черноус.
Большой желудочный овод —имаго (рис. 165) желтовато-бу-
рого цвета, длиной 10—15 мм. Голова большая, с расположенны-
ми по бокам фасеточными глазами и тремя простыми — на теме-
ни. Среднеспинка темная, покрыта светло-желтыми или бурова-
тыми волосками. Крылья с темными пятнами. Брюшко овальное,
яйцеклад резко подогнут под брюшко. Яйца желтоватые, клино-
видные, поперечно исчерчены, длиной до 1,25 мм. Личинка пер-
вой стадии веретенообразной формы, длиной около 1 мм, белого
цвета, состоит из 13 сегментов. На голове два подвижных изогну-
тых крючка, между ними ротовое отверстие.
Личинка третьей стадии овально-цилиндрическая, длиной до
20 мм. Приротовые крючья мощные, изогнутые. Сегменты со вто-
рого по десятый несут по два ряда шипов: в первом ряду крупные,
во втором мелкие.
Двенадцатиперстник — имаго черно-коричневого цвета, дли-
ной 12—13 мм. Голова уже среднеспинки. Грудь и ноги черные.
Крылья прозрачные, без пятен. Брюшко темное, покрыто густыми
волосками. Личинка третьей стадии длиной до 20 мм, шипы на
сегментах расположены в один ряд.
Усоклей — имаго темно-бурого цвета, длиной 9—11 мм. Голова
крупная. Крылья прозрачные, ноги коричневато-желтые, покры-
ты волосками. Брюшко удлиненное, темно-коричневое. Личинка
третьей стадии длиной до 18,5 мм, мелкие шипы на сегментах рас-
положены в два ряда, последние три сегмента без вооружения.
445
б
в
Травняк — самки темно-бурого цвета, длиной 16 мм, самцы не-
много светлее, длиной до 13 мм. Голова уже груди. Лоб узкий.
Грудь коричневая, среднеспинка черная с двумя продольными
светлыми полосами. Крылья дымчатые. Личинки третьей стадии
длиной до 20 мм, от остальных отличаются наличием срединной
группы шипов на псевдоцефале. Шипы первого ряда на члениках
в 2 раза крупнее шипов второго ряда.
Якорек — имаго похож на большого желудочного овода, но
меньше его по размерам, длина тела 9—11 мм, серого цвета, кры-
лья пятнистые. Личинка третьей стадии длиной до 16 мм, с сильно
загнутыми назад ротовыми крючками.
Черноус — имаго серовато-желтого цвета, длиной 10—11мм.
446
Грудь и брюшко черные, покрыты волосками серо-желтого цвета.
Задний край брюшка округленный. Личинка третьей стадии дли-
ной до 22 мм, первый грудной членик цилиндрической формы,
что отличает ее от других видов рода.
Биология развития. Желудочные оводы развиваются с полным
метаморфозом. Плодовитость самок в зависимости от вида 300—
2500 яиц. Самки крючка откладывают яйца на лету, приклеивая их
к волосу, чаще на конечности, плечи, бока; усоклея — на тонкие
волоски губ; двенадцати перстни ка — на волосы межчелюстного
пространства; малого желудочного овода — в области массетеров;
черноуса — на волосы вокруг рта; травняка — на растения. Личин-
ки в яйцах развиваются 7—16 сут, однако их вылупление сразу не
происходит. Они могут сохранять жизнеспособность в яйце 1,5—
3 мес. Чтобы личинки вышли из яйца, необходимы определенные
условия (влажная среда, температура 37—42 °C, прикосновение
постороннего предмета), которые создаются при расчесывании зу-
бами мест прикрепления их или при водопое. Вышедшие из яиц
личинки попадают в ротовую полость, прикрепляются к слизис-
той оболочке различных ее разделов и паразитируют в течение
21—28 сут, поле чего линяют и переходят во вторую стадию. Раз-
витие личинок второй и третьей стадий большинства видов про-
исходит в кардиальной части желудка, a G. veterinus — в 12-перст-
ной кишке. Весной следующего года личинки третьей стадии по-
кидают желудок и вместе с фекалиями выходят наружу. Окуклива-
ние происходит в поверхностном слое почвы. Фаза куколки
длится 16—54 сут, после чего из нее вылупляется имаго. В южных
районах оводы могут давать два поколения в год.
Эпизоотологические данные. В умеренном климате лёт оводов
отмечен в июле — августе, на юге сроки лёта более растянуты. Ис-
точник инвазии — больные гастрофилезом животные, которые
рассеивают личинки по территории хозяйств, на пастбищах и т. п.
Наиболее благоприятные условия для развития имаго и заражения
лошадей в жаркую сухую погоду. На лошадь может быть отложено
до 3—5 тыс. яиц.
Патогенез. Болезнь сопровождается значительным воспалени-
ем слизистой оболочки ротовой полости, желудка, нативной части
и 12-перстной кишки. В желудке и кишечнике образуются язвы,
возникает желудочное и кишечное кровотечение. В прямой кишке
личинки усоклея и травняка вызывают катаральное воспаление,
значительное скопление личинок может привести к ее выпаде-
нию.
Симптомы болезни. Животные, больные гастрофилезом, часто
истощены, шерсть их взъерошена, без блеска, слизистые оболочки
анемичны, аппетит понижен. Отмечают понос, колики. При лока-
лизации личинок в глотке и области мягкого нёба появляется ка-
шель, во время водопоя из носа таких животных вытекает вода,
затрудняются пережевывание и глотание корма. Личинки черно-
447
уса и якорька, мигрирующие в коже щек, вызывают дерматит,
складки и язвы на губах.
Диагностика. При обследовании кожно-волосяного покрова об-
наруживают яйца оводов, в ротовой полости — личинок первой
стадии. Во время осмотра корня языка и глотки рот лошади рас-
крывают с помощью зевника, а ротовую полость освещают реф-
лектором, язык предельно вытягивают или прижимают шпате-
лем. Наиболее удобно использовать гибкий эндоскоп Мачида
ФГС-БЛ.
Зимой и ранней весной диагноз можно поставить по обнаруже-
нию в кале личинок после дачи внутрь 40—60 мг на 1 кг массы
тела кристаллического хлорофоса в водном растворе, пасты эква-
лана и других препаратов, вызывающих гибель личинок и их мас-
совое выделение. Предложены аллергический и серологический
(РИГА) методы диагностики гастрофилеза.
Лечение. Основополагающим мероприятием в системе мер
борьбы с гастрофилезом является ранняя химиотерапия, проводи-
мая в конце сентября — ноябре. Для ранней химиотерапии приме-
няют хлорофос, амидофос, эстрозоль, эквалан и др.
Хлорофос используют только кристаллический из расчета
40 мг на 1 кг массы тела и применяют следующими методами: оро-
шают 5%-ным раствором хлорофоса зернофураж или сено и скар-
мливают по 1 кг на животное; используют кормовые гранулы с
хлорофосом. Молодняку скармливают 0,5 кг, взрослым живот-
ным — 1—1,2 кг гранул на голову. Эффективно групповое вольное
выпаивание 0,1%-ного раствора хлорофоса, а также скармливание
его со снегом в течение 10—12 ч.
Амидофос применяют таким же способом, что и хлоро-
фос.
Фасковерм используют внутримышечно в дозе 1 мл на
20 кг массы тела.
Эквалан применяют внутрь в дозе 0,2 мг на 1 кг массы тела.
Препаратом эстрозоль лошадей обрабатывают в закрытых
помещениях при норме расхода 60 мг на 1 м3 при экспозиции 1 ч.
В зонах с двумя генерациями овода химиотерапию проводят в
конце июля — августе и октябре — ноябре.
Профилактика. Для предупреждения нападения имаго желудоч-
ных оводов в период их массового лёта лошадей опрыскивают
0,05%-ной водной эмульсией перметрина с нормой расхода 500 мл
на взрослое животное и 250 мл на жеребенка или 0,0025%-ной
эмульсией бутокса с нормой расхода соответственно 100 и 50 мл.
Эффективна также 10%-ная водная эмульсия ТСН из расчета 0,5—
1,0 л на лошадь, 3%-ная водная эмульсия оксамата — 1,5—2,0 л на
лошадь.
Весной личинок, выпадающих на окукливание, собирают и
уничтожают путем биотермического обеззараживания фекалий.
448
18.6. ВОЛЬФАРТИОЗ
Вольфартиоз (зачервление ран) вызывается личинками мухи
Вольфарта (Wohlfartia magnifica). Болеют в основном овцы,
реже — другие домашние и дикие животные.
Возбудитель. Вольфартова муха — крупное, длиной 9—13 мм,
серого цвета, с тремя продольными темными полосками на груди
и шашечным рисунком брюшка живородящее насекомое. Ли-
чинки всех стадий размером от 1,5 до 20 мм. На головном конце
имеют три крупных изогнутых крючка, на каждом сегменте ши-
пики.
Биология развития. Имаго питаются соками растений. Через
10—12 дней после спаривания у самки созревает 120—200 личи-
нок, которые она откладывает по 10—35 шт. в раны, царапины, на
слизистые оболочки и мацерированные участки кожи животного.
В ранах личинки развиваются в течение 4—6 дней. Питаются ли-
чинки в ранах клетками тканей, экссудатом и кровью. Личинки
третьей стадии выползают из раны, падают на землю, зарываются
на глубину 1—18 см и окукливаются. Фаза куколки длится 9—
24 сут. За лето в центральной полосе развивается две-три генера-
ции, на юге — пять-шесть генераций мух. Личинки, выпавшие
осенью, зимуют в фазе куколки.
Эпизоотологические данные. Вольфартиоз регистрируют в цент-
ральной полосе с мая по сентябрь, в южных районах с апреля по
ноябрь. Факторами, предрасполагающими к заболеванию овец,
являются: поздняя стрижка овец, кастрация и обрезка хвостов у
ягнят; поение овец из водоисточников с топкими подходами, где
происходит мацерация кожи; порезы кожи при стрижке; изъязв-
ление кожи препуция у баранов и валухов; мацерация преаналь-
ной области вымени у овцематок.
Патогенез и симптомы болезни. Попавшие в раны личинки раз-
рушают ткани, вызывают зуд, боль. Овцы пытаются от них осво-
бодиться, беспокоятся, грызут раны зубами. Больные овцы плохо
пасутся, часто ложатся, отстают от отары. При сильном пораже-
нии отмечают повышение температуры тела, угнетенное состоя-
ние, животные быстро худеют, теряя в сутки до 1 кг массы тела.
Диагностика. Диагноз ставят на основании клинических при-
знаков, по наличию личинок вольфартовой мухи в ране.
Лечение. Для выявления больных животных рекомендуется пе-
риодически проводить клинический осмотр овец в сезон парази-
тирования личинок (каждые 2—3 дня). Больных животных обра-
батывают вольфартолом, вольфазолем-Д, эстрозолем, гиподер-
мин-хлорофосом, хлорофосом, стомозаном, ДДВФ.
Препараты в аэрозольных баллонах для обработки ран приме-
няют однократно или двукратно с интервалом 5—8 дней. Струю
препарата направляют на рану и удерживают 1—5 с с расстояния
15—20 см. Гиподермин-хлорофос или диоксафос-К наносят на
449
рану из шприца или тампоном с нормой расхода 0,2 мл на 1 см2
однократно или 2 раза с интервалом 6 сут. Хлорофос применяют в
виде 4%-ного водного раствора, ДДВФ — в виде 1%-ной водной
эмульсии. Обработку повторяют через каждые 2—3 сут до зажив-
ления ран.
Профилактика. Чтобы снизить численность вольфартовых мух
при выходе их из зимовки и предупредить заражение овец личин-
ками, весной с наступлением теплых дней проводят профилакти-
ческие опрыскивания отар овец 1%-ным водным раствором хло-
рофоса 1 раз в 7 дней с нормой расхода 0,5—1 л на животное. Эф-
фективны также 0,2%-ные эмульсии анометрина (перметрин, сто-
мозана) и 0,01%-ная эмульсия К-отрина. Опрыскивание проводят
из дезинфекционных машин ДУК, ВДМ, ЛСД и других механиз-
мов на специальных площадках или в расколах.
В период стрижки раны обрабатывают пленкообразующими
препаратами — коллодием, креолом, клеем БФ-6 или .кубатолом.
Рану обрабатывают через 15—20 мин после остановки кровотече-
ния. Норма расхода препарата 0,2 мл на 1 см2 поверхности раны.
18.7. МЕЛОФАГОЗ ОВЕЦ
Мелофагоз — заболевание овец, вызываемое паразитированием
на их теле стационарного эктопаразита Melophagus ovinus (овечий
рунец) семейства Hyppoboscidae.
Возбудитель. Бескрылое насекомое желто-бурого цвета, длиной
4—7 мм. Тело сплющено в дорсовентральном направлении, по-
Рис. 166. Овечий рунец
крыто волосками и щетинками
(рис. 166). Голова небольшая,
плотно прилегает к груди. Глаза
фасеточные, коричневые. Усики
короткие, двучленистые. Рото-
вой аппарат колюще-сосущего
типа. Ноги развиты, лапки окан-
чиваются двумя серповидными
коготками. Брюшко широкое и
сплюснутое, со слабовыражен-
ной сегментацией. По бокам
шесть дыхалец. У самок задний
край брюшка с выемкой, у сам-
цов округлый.
Биология развития. У опло-
дотворенных самок через 7—
9 сут из яиц в яйцеводах вылуп-
ляются личинки, питающиеся
выделениями половых желез.
Зрелые личинки самка прикреп-
450
ляет секретом к прикорневой части волос. Хитиновый покров у
них быстро твердеет, и через 4—6 ч они превращаются в куколок.
Фаза куколки длится 3—4 нед. Вышедшие из куколок кровососки
через 5—10 сут становятся половозрелыми. За 7—8 мес жизни сам-
ка отрождает 15—20 личинок. Вне тела хозяина при температуре
16—20 °C рунцы живут до 7 сут, при отрицательной температуре
быстро погибают. Питаются кровососки кровью.
Эпизоотологические данные. Заболевание распространено по-
всеместно. Источник инвазии — зараженные рунцами животные.
Численность насекомых выше зимой при содержании овец в по-
мещениях. После стрижки заражаемость овец кровососками сни-
жается. В этот период интенсивность инвазии увеличивается у мо-
лодняка.
Патогенез. Уколы при кровососании вызывают зуд, беспокой-
ство животных, расчесывание и дерматиты. Светлая шерсть от фе-
калий кровососок приобретает серо-зеленоватый цвет. Массовое
поражение овец кровососками (более 100 экз.) уменьшает средне-
суточный привес на 13,4%, настриг шерсти на 20, выход чистого
волокна на 2—3 %. Овечий рунец — переносчик трипаносом, рик-
кетсий, бруцелл и др.
Симптомы болезни. При невысокой интенсивности инвазии со-
стояние овец существенно не изменяется. При высокой численно-
сти насекомых овцы сильно беспокоятся, трутся о различные
предметы, чешут зубами зудящие участки кожи, появляются об-
лысения, дерматиты, кровоизлияния. В прикорневой части волос
легко обнаружить подвижных рунцов.
Лечение, профилактика и меры борьбы. При комплектовании
отар необходимо тщательно осматривать поголовье и зараженных
рунцом животных обрабатывать инсектицидами. Отары, в кото-
рых выделены больные мелофагозом животные, купают в инсек-
тицидных растворах: 0,05%-ном неоцидоле (диазино-
н е), 0,25%-ном циодрине, 0,1%-ном себацеле (фок-
симе), 0,05%-ном к р е о п и р е-2 или 0,01%-ном креохине.
Применяют также протеид в разведении с водой 1 : 1000, б л о -
тик (пропетамфос)в разведении с водой 1: 2000, неосто-
м о з а н — 1 : 1000 и др.
Овец опрыскивают 0,75%-ным раствором хлорофоса,
0,5%-ной водной эмульсией карбофоса, 0,1%-ной водной эмуль-
сией перметрина (анометрина, стомозана) и
0,0025%-ной водной эмульсией бутокса из расчета 0,5 л на голову.
В зимнее время применяют системно действующие инсектициды:
ивомек, цидектин, аверсект (фармации), фас-
ковер м, пэкт, ципек и др. в тех же дозах, что и при псо-
роптозе овец.
451
18.8. ЛИПОПТЕНОЗ ОЛЕНЕЙ
Липоптеноз — заболевание оленей, лосей и косуль, вызываемое
кровосоской Lipoptena cervi (оленья кровососка).
Возбудитель. Крылатое насекомое серо-коричневого цвета,
длиной 5—7 мм. Хоботок колюще-сосущего типа. Глаза фасеточ-
ные, длина их в 2 раза больше ширины. Крылья с тремя продоль-
ными жилками. Куколки темного цвета, блестящие.
Биология развития. L. cervi — кровосос подстерегающего типа.
Нападает на животных с деревьев в радиусе до 50 м. На животных
сбрасывает крылья. На 5—7-е сутки паразитирования и питания
кровью происходит копуляция. Самка отрождает предкуколки,
которые вскоре превращаются в куколки. При оптимальных усло-
виях одна самка за 120—180 сут может отложить 25—32 предкукол-
ки. Они паразитируют на лосях 5—9-месячного возраста, после
чего куколки попадают в почву, где развиваются в течение 86—
166 сут. Из куколок выходят молодые крылатые кровососки. На-
падение на животных начинается в конце июля и заканчивается с
наступлением устойчивых заморозков.
Эпизоотологические данные. Высокую численность кровососок
на лосях отмечают с октября по февраль. В лесу L. cervi нападает
на домашних животных (лошадей, коров, собак), а также на лю-
дей, вызывая сильное беспокойство своими укусами.
Патогенез и симптомы болезни. Паразитируя в большом количе-
стве и питаясь кровью, оленьи кровососки причиняют повседнев-
ное беспокойство животным, истощают их. При высокой интен-
сивности инвазии (3—5 тыс. кровососок на животное) лоси ежед-
невно теряют по 20—30 г крови.
Испытывая сильный зуд, лоси чешутся о деревья, забираются в
воду, где подолгу стоят, что нарушает их нормальное питание.
Развиваются обширные дерматиты, осложняющиеся микрофло-
рой.
Лечение. Не разработано.
Профилактика и меры борьбы. Борьба с L. cervi чрезвычайно
затруднена, поскольку основными прокормителями этого вида
кровососок являются дикие животные, а куколки рассеяны на
большой территории. Обработка домашних животных инсектици-
дами вызывает гибель паразитирующих кровососок, но не предох-
раняет от их повторных нападений даже на следующий день. Сле-
дует избегать выпаса животных в августе — октябре в местах мас-
сового нападения кровососок. Репелленты против них неэффек-
тивны.
18.9. СИФУНКУЛЯТОЗЫ
Сифункулятозы — заболевания, вызываемые паразитировани-
ем на теле вшей из отряда Siphunculata, характеризующиеся бес-
покойством животных, зудом, дерматитами и снижением продук-
452
тивности. Из семейства Haematopinidae на крупном рогатом скоте
паразитирует Н. euristemus, на свиньях — Н. suis, на однокопыт-
ных — Н. asini. Из семейства Linognathidae на телятах паразитиру-
ет L. vituli (рис. 167).
Возбудители. Вши —мелкие (1,5—5 мм), продолговато-оваль-
ные, сплющенные в дорсовентральном направлении, бескрылые
насекомые желтовато-серого цвета. Голова уже груди, с парой ан-
тенн и ротовым аппаратом колюще-сосущего типа. Глаз нет. Три
пары ног оканчиваются хорошо развитыми коготками. Брюшко
овальной формы, из девяти сегментов, у самок с треугольной вы-
емкой на последнем членике. Яйца (гниды) овальные, беловато-
желтые, блестящие, с крышечкой. Личинка похожа на взрослое
насекомое.
Биология развития. Вши относятся к постоянным паразитам.
Зимой они более многочисленны, чем летом. Плодовитость вшей
50—100 яиц. Самка приклеивает за сутки по 1—7 яиц на прикор-
невую часть волос, из которых через 10—18 дней выводятся ли-
чинки, способные сразу же сосать кровь. В течение 2 нед личинки
трижды линяют и становятся половозрелыми. Кровью питаются
самцы и самки. Кровососание длится 5—30 мин.
Эпизоотологические данные. Болезнь распространена повсемес-
тно. Источник инвазии — больные сифункулятозом животные.
Возбудитель может передаваться при непосредственном контакте
животных, через предметы ухода, подстилку, упряжь. Летом чис-
ленность вшей на животных снижается.
Патогенез и симптомы болезни. Во время кровососания вши ра-
нят кожу и вводят в ранку токсичную слюну. Появляется зуд, жи-
вотные расчесывают зудящие места о кормушки, столбы и другие
предметы. В ранки проникают микробы и образуются нагноения.
На коже появляются ссадины, она теряет эластичность, шелушит-
Рис. 167. Вши:
1— Haematopinus euristemus; 2— Linognathus vituli (черная
телячья вошь); 3 — Haematopinus suis
453
ся, волос выпадает. Животные худеют, снижают продуктивность,
молодняк отстает в росте.
У крупного рогатого скота вши чаще обитают у основания ро-
гов, в верхней части шеи, на подгрудке, в области холки, у лоша-
дей — у корня хвоста, в области лопаток и шеи, у свиней — на
шее, спине и пояснице.
Вши переносят такие заболевания, как сибирская язва, рожа
свиней, туляремия, паратиф и др.
Диагностика. При осмотре животного в местах расчесов, на
прикорневой части волос хорошо заметны гниды, на теле — вши.
Лечение. Вшей на животных уничтожают инсектицидами в
форме растворов, эмульсий, аэрозолей и дустов. Наиболее чув-
ствительны к инсектицидам личинки вшей. На гниды инсектици-
ды практически не действуют. Животных против вшей обрабаты-
вают дважды с интервалом 10—14 сут. Эффективны опрыскивания
0,75%-ным водным раствором хлорофоса; 0,75%-ной водной
эмульсией карбофоса; 3%-ной водной эмульсией о к с а м а -
т а; 0,15%-ными водными эмульсиями циодрина или фок-
сима; 0,05%-ной водной эмульсией перметрина (сто -
мозана, неостомозана 1:400); 0,0125%-ной водной
эмульсией К-о трина и 0,003%-ной эмульсией бутокса до
полного смачивания волосяного покрова. В аэрозольных и бес-
пропеллентных баллонах используют акродекс, дермато-
золь, гематопинозоль, перол, инсектол и другие
препараты из расчета 40—60 г на животное. Делают подкожные
инъекции ивомек а, цидектина, аверсекта (фар-
мац и н а) в дозах 0,2 мг на 1 кг массы тела, а также и в о м е ка-
пу р о н а — 1 мл на 10 кг массы тела.
Профилактика и меры борьбы. Животных следует содержать в
чистых и сухих помещениях, предоставлять им моцион, кожный
покров регулярно чистить или обмывать водой. Не следует пере-
мещать зараженных животных в другие хозяйства и на благопо-
лучные по сифункулятозам фермы.
18.10. АФАНИПТЕРОЗ СОБАК, КОШЕК И ПУШНЫХ ЗВЕРЕЙ
Афаниптероз — заболевание, вызываемое паразитированием на
их теле блох отряда Siphonaptera.
Возбудители. Ctenocephalides canis (собачья блоха), С. felis (ко-
шачья блоха) и Pulex irritans (человечья блоха). Это мелкие (1,8—
2,0 мм) кровососущие насекомые. Тело сплюснуто с боков, по-
крыто направленными назад щетинками, волосками, гребнями
(ктенидиями), хорошо приспособлено к движению в шерсти. На
голове расположены ротовой аппарат колюще-сосущего типа, два
простых глаза и пара коротких усиков. Последние находятся в
усиковых ямках и разделяют голову на переднюю (лобную) и зад-
454
нюю (теменную) части. Грудь состоит из трех сегментов, каждому
из которых соответствует пара членистых конечностей. Третья
пара ног длиннее других и служит насекомому опорой при прыж-
ках. Брюшко насчитывает 10 сегментов, состоящих из спинного
(тергит) и грудного (стернит) полуколец, соединенных растяжи-
мой мембраной. Цвет насекомых от светло-желтого до темно-ко-
ричневого.
Биология развития. Блохи — насекомые с полным метаморфо-
зом (рис. 168). Кровью животных питаются самцы и самки. В те-
чение жизни самки многократно откладывают на шерсть живот-
ных овальные, белого цвета яйца. Яйца неклейкие и не удержива-
ются на шерсти, а распределяются в среде обитания собак, кошек
и др. Через 7—12 сут из яиц выходят личинки, имеющие непиг-
ментированную головку, трехчлениковую грудь и 10-члениковое
брюшко. Тело личинок покрыто волосками и щетинками. Они
питаются органическим субстратом. По мере роста личинки за
10—12 сут трижды линяют и превращаются в куколки. Через 2 нед
из куколок появляются взрослые особи. Живут имаго 3—7 мес.
Эпизоотологические данные. Блохи распространены повсемест-
но. Особенно они многочисленны в теплое время года. Заражают-
ся собаки чаще во время прогулок. Личинки блох обитают в ще-
лях, плинтусах, на ковриках, в фекалиях собак и др. Блохи опасны
как переносчики возбудителя дипилидиоза и некоторых инфекци-
онных болезней. Имаго способны к длительному голоданию (до
18 мес).
Патогенез и симптомы болезни. Уколы блох болезненны, вызы-
вают зуд, образование папул, дерматиты, истощение. Животные
расчесывают зудящие участки, в результате чего появляются сса-
дины, царапины, волосы выпадают и сваливаются, появляется об-
лысение. Изменения на коже зависят от интенсивности и продол-
Рис. 168. Биология развития блох:
а — яйцо; б — личинка; в — куколка; г — взрослая самка
455
жительности патологического процесса. Пораженные блохами со-
баки становятся непослушными, невнимательными. Паразиты
легко перепрыгивают со взрослых собак на щенков, которые по-
ражаются интенсивнее и тяжелее переносят инвазию. У них на-
блюдается резко выраженная анемия, прогрессирующее истоще-
ние, нередко гибель.
Диагностика. Диагноз ставят при обнаружении блох при обсле-
довании животных и помещений. Можно также посадить собаку и
кошку на белую подстилку и тщательно вычесывать, при этом на
ткани обнаруживаются маленькие черно-коричневые крошки (за-
сохшая кровь, не переваренная блохами). Если их бросить в воду,
она станет красной.
Лечение, профилактика и меры борьбы. Для уничтожения блох
на животных применяют 0,05%-ную водную эмульсию пер-
метрина (стомозана), 0,5%-ную водную эмульсию кар-
бофоса, 0,003%-ную водную эмульсию бутокса, 0,005%-
ную водную эмульсию цимбуша, а также неостомозан в
разведении 1 : 200, э к т о м и н 1 : 1000, б л о т и к 1 : 2000 и др.
Препараты наносят на кожно-волосяной покров методом опрыс-
кивания. Обработки проводят дважды: летом через 7—10 сут, зи-
мой через 14—18 сут. Эффективны аэрозоли: акродес, дер-
матозоль, перол, акрозоль, актол и др. Собак и ко-
шек можно мыть различными зоошампунями, что ведет к гибели
эктопаразитов, очищению кожи и исчезновению запаха. Эти же
препараты применяют для дезинсекции заселенных блохами по-
мещений, возможных мест их выплода.
Основные профилактические мероприятия против блох — под-
держание высокой санитарной культуры в помещениях и перио-
дическое проведение дезинсекции, дератизации. Для профилак-
тики афаниптероза эффективны ошейники, импрегнированные
инсектицидами. Защитное действие ошейников до 5 мес.
18.11. ЭНТОМОЗЫ ПЧЕЛ
18.11. 1. БРАУЛЕЗ
Браулез — заболевание маток, рабочих пчел и трутней, вызыва-
емое пчелиной вошью Braula соеса.
Возбудитель. Бескрылое насекомое красновато-бурого цвета,
размером 1 —1,5 мм. Голова большая, плоская, треугольная, с гла-
зами. Грудь короткая, конечности 5-члениковые. Брюшко оваль-
ное, у самцов вытянуто, у самок заканчивается церками, у сам-
цов — гипопигием (рис. 169).
Биология развития. Самка откладывает яйца на восковые кры-
шечки сотов, щели улья. Вышедшие из яиц личинки питаются
воском, медом, затем они пробуравливают ходы в крышечках ме-
456
довых сотов и там окукливаются. Весь
цикл длится 21 сут.
Браулы из пораженной семьи в здо-
ровую переносятся пчелами при воров-
стве, блуждании, через роение и др.
Взрослые браулы способны прикреп-
ляться к движущимся объектам (форе-
зия). Интенсивному их развитию спо-
собствуют мягкая зима, старые соты и
др. Диагноз ставят на основании обна-
ружения браул на теле пчел и маток, а
Рис. 169. Braula соеса
также ходов личинок.
На неблагополучную по браулезу пасеку накладывают каран-
тин, при котором запрещают вывоз, кочевку и продажу пчел. Про-
водят комплекс мероприятий: уничтожают яйца, личинки, кукол-
ки паразита, систематически заменяя гнездовые соты. Весной че-
рез каждые 10—14 сут чистят дно ульев, с запечатанного меда сни-
мают восковые крышечки ножом или вилкой и перетапливают их.
Для лечения применяют фенотиазин, фольбекс. Курс лечения по-
вторяют через 10 сут. Отпавших браул собирают и сжигают.
18.11. 2. МЕЛЕОЗ
Мелеоз — болезнь пчел, вызываемая паразитированием личи-
нок (триангулин) жуков-маек семейства Meloidae (нарывники).
Возбудители — триангулины пестрой (Meloe variegatus) и
обыкновенной (М. proscarabeus) майки. Триангулины длиной
1,2—5 мм, с плоским телом, оранжевого, коричневого или черно-
го цвета.
Биология развития. Жуки-нарывники растительноядные. Самки
откладывают яйца в почву. Через 23—25 сут из яиц выходят ли-
чинки первой стадии (триангулины), которые взбираются на рас-
тения, цветки и др. При посещении пчелами таких цветков ли-
чинки быстро перемещаются на их тело, прикрепляются между
кольцами брюшка, груди и других частей и разрушают межсегмент-
ные перегородки тела пчел. На теле пчел личинки сохраняются до
30 сут, могут переходить с тела в ячейку, где уничтожают яйца
пчел, дважды линяют и превращаются в псевдонифму, а затем и в
куколку.
Эпизоотологические данные. Болезнь чаще регистрируют на
юге. Наибольшую пораженность медоносных пчел отмечают в ме-
стах обитания одиноких пчел. Личинки при попадании в улей мо-
гут переходить на других пчел и матку.
Патогенез и симптомы болезни. Паразитирование личинок пест-
рой майки ослабляет организм пчел, вызывает их гибель. У летка и
на дне улья находят погибших пчел. Живые пчелы беспокоятся,
падают на землю, подпрыгивают, пытаются очистить свое тело.
457
Диагностика. Диагноз ставят на основании признаков пораже-
ния и выявления на теле пчел личинок нарывников.
Лечение, профилактика и меры борьбы. Пораженные семьи об-
рабатывают табачным дымом (50 г махорки высыпают на
раскаленные угли дымаря). Обработку повторяют через 3—5 сут.
Упавших на дно улья личинок собирают и сжигают.
С целью профилактики не следует располагать семьи пчел в
местах массового размножения маек (вблизи гнезд одиноких
пчел). Взрослых жуков уничтожают путем обработки поверхности
почвы водными растворами 0,2%-ного перфектона или 0,4%-ного
раствора рогора соответственно 500 и 600 л на 1 га.
18.11.3. СЕНОТАИНИОЗ
Сенотаиниоз — поражение одиночных медоносных пчел и
шмелей личинками мух Senotainia tricuspis семейства Sarco-
phagidae.
Возбудитель. Самки мухи сенотаинии длиной 5—8 мм, пепель-
ного цвета, с широкими белыми полосами на голове. Имаго — не-
ктарофаги (рис. 170).
Биология развития. Мухи откладывают личинки на тело пчел на
лету в область сочленения головы с грудью. Личинки первой ста-
дии развития (0,5—0,9 мм) ак-
тивно внедряются через хитин в
грудь пчел и расползаются под
слюнными железами. Питаются
мышцами и переходят во вторую
стадию, достигают 1,1—1,3 мм.
После гибели пчелы (обычно че-
рез 3—4 сут) находятся в трупе
5—7 сут, выедая все содержимое.
Затем мигрируют в почву, где и
окукливаются. Фаза куколки
длится 12—18 сут.
Эпизоотологические данные.
Поражение медоносных пчел от-
мечают с июля по сентябрь.
Пчелы теряют способность к по-
Рис. 170. Муха
сенотанния:
1 — самка; 2 — голова
самки
лету, делают неестественные
прыгающие движения, ползают,
затем погибают.
Диагностика. Диагноз ставят
по обнаружении личинок мух в
груди пчел и шмелей, для чего
исследуют 29—30 насекомых с
признаками поражения.
458
Лечение, профилактика и меры борьбы. Для уничтожения насе-
комых на крышки ульев кладут листы светлой жести или стекла
белого цвета, покрытые 0,05%-ной вазелиновой эмульсией циод-
рина. Осенью в перепаханную почву вносят тиазон (100г на 1 м2).
Мусор и погибших насекомых систематически собирают и сжига-
ют, уплотняют слой земли на пасеках или кладут листы шифера
перед ульями.
18.12. МАЛЛОФАГОЗЫ ПТИЦ
Маллофагозы — болезни, вызываемые пухоедами и пероедами,
характеризуются сильным зудом, беспокойством птицы, гиперке-
ратозом, частичной потерей перьев, снижением упитанности и
яйценоскости.
Возбудитель. На домашней птице паразитируют пухоеды се-
мейства Menoponidae, видов Menopon gallinae, Menocantus
stramineus и др. и пероеды семейства Philopteridae (рис. 171).
Бескрылые насекомые бело-желтого цвета, длиной 1,5—2,5 мм,
голова шире груди, ротовой аппарат грызущего типа. Глаза про-
долговатые, светло-бурого цвета. Конечности снабжены коготка-
ми. Брюшко удлиненное, слабосуженное в задней половине, с
четкими светлыми межсегментными швами.
Биология развития. Маллофаги — постоянные эктопаразиты
птиц. Они развиваются с неполным метаморфозом. Самка откла-
дывает яйца пучками у основания пера. Через 4—20 сут из яиц вы-
лупляются личинки, внешне похожие на взрослых насекомых, ко-
торые через 2—3 нед превращаются в имаго. Последние питаются
выделениями кожи, перьями, эпидермисом, кровью и лимфой,
появляющимися после расчесов.
Рис. 171. Пухопероеды:
а — Menopon gallinae; б — Menocanthus stramineus; в — Lipeurus caponis; г — Goniodes
hologaster; d — G. gigans
459
Эпизоотологические данные. Перезаражение происходит при
контакте здоровых птиц с инвазированными, а также через пред-
меты ухода, подстилку, насесты, гнезда и др. Распространению
паразитов способствуют несоблюдение санитарных правил, на-
польное содержание птиц и др. Петухи чаще поражаются, парази-
тов на них больше. На одной птице может быть несколько видов
насекомых.
Патогенез и симптомы болезни. Пухоеды, питаясь омертвевшим
эпидермисом, кровью, лимфой и жировыми выделениями кожи,
повреждают кожные покровы птиц, часто поедают пуховую часть
пера, а иногда все опахало. Передвигаясь по телу, они повреждают
оперение и ткани, вызывая у птиц непрерывное раздражение и
зуд. Птицы часто и подолгу перебирают клювом оперение в облас-
ти груди, брюха, вокруг клоаки. Молодняк плохо растет, худеет, у
кур снижается яйценоскость. При локализации на голове пухоеды
иногда переходят на конъюнктиву, вызывая кератоконъюнктивит.
Диагностика. Диагноз ставят при обнаружении на птице пухо-
пероедов. При этом обследуют птиц старше 3 мес, выборочно по
10 или 25 особей из каждой тысячи соответственно при наполь-
ном и клеточном содержании в 5—10 точках помещения. Осмат-
ривают кожу в области спины, живота, головы, вокруг клоаки и
под крыльями.
Лечение, профилактика и меры борьбы. Птицу опрыскивают
2%-ной водной эмульсией оксамата или 5%-ной водной сус-
пензией турингина из ДУК, ВДМ и других технических
средств из расчета 25—50 мл на голову. Эти препараты высокоэф-
фективны против пухопероедов, нетоксичны для птиц, не выделя-
ются с яйцом у обработанных кур.
Другие инсектициды, такие, как 0,5%-ный водный раствор
хлорофоса, 0,2%-ная водная эмульсия карбофоса, диб-
рома и неоцидола, 0,05%-ная водная эмульсия пер-
метрина, также эффективны против пухопероедов, но их
нельзя применять на яйценоской птице, обработку необходимо
проводить не позднее чем за 30 сут до убоя. Эффективны также
термомеханические аэрозоли с помощью шашек ШИФ-П на ос-
нове перметрина.
Перед заселением птицы помещение обязательно обрабаты-
вают инсектицидами согласно действующей инструкции. Кро-
ме того, периодически осматривают птиц на наличие эктопара-
зитов.
Лабораторная работа
Задания. 1. Изучить морфологические особенности личинок
третьей стадии гиподерм, эструсов и гастрофилюсов, а затем их
зарисовать. 2. Научиться дифференцировать личинок третьей ста-
дии подкожных носоглоточных и желудочно-кишечных оводов.
460
Материалы и оборудование: лупы; пинцеты; препаровальные иглы; бактерио-
логические чашки; плакаты; рисунки и таблицы личинок; консервированные ли-
чинки оводов.
Место занятия: лаборатория паразитологии.
Методика проведения занятия. Преподаватель объясняет, ис-
пользуя плакаты и рисунки, морфологические особенности ли-
чинок оводов. Учащиеся с помощью луп самостоятельно опреде-
ляют личинок третьей стадии оводов и схематически их зарисо-
вывают.
Контрольные вопросы. 1. Какие методы применения инсектицидов существуют
при обработках животных против энтомозов? 2. Что такое ранняя и поздняя хи-
миотерапия при оводовых болезнях животных? 3. Какие инсектициды системного
действия применяются для борьбы с гиподерматозом крупного рогатого скота, га-
строфилезом лошадей и эстрозом овец? 4. Какой жизненный цикл у возбудителей
оводовых болезней животных? 5. Какие стационарные эктопаразиты встречаются
у сельскохозяйственных животных, в том числе у птиц?
19. НАСЕКОМЫЕ — ПЕРЕНОСЧИКИ ВОЗБУДИТЕЛЕЙ
ТРАНСМИССИВНЫХ БОЛЕЗНЕЙ
19.1. ЗООФИЛЬНЫЕ МУХИ
Зоофильные мухи относятся к отряду двукрылых (Diptera),
подотряду короткоусых (Brachicera) насекомых. Всего известно 67
семейств, но ветеринарное значение имеют: настоящие мухи се-
мейства Muscidae, мясные, или падальные, мухи семейства
Calliphoridae и серые мясные мухи семейства Sarcophagidae.
Настоящие мухи. Эти мухи обычно серовато-бурого цвета, раз-
мером 4—15 мм. Тело разделено на голову, грудь и брюшко, по-
крыто волосками и щетинками. Голова полушаровидная с круп-
ными фасеточными глазами. Хоботок у некровососущих мух ли-
жущего типа, у кровососущих — колюще-сосущего типа. Грудь не-
сет на себе три пары ног, пару крыльев и жужальца.
Биология и экология. Мухи развиваются с полным превращени-
ем и проходят четыре фазы: яйца, личинки, куколки и имаго
(рис. 172). Через 5—7 дней после выхода из куколки происходит
оплодотворение и самка откладывает яйца. Всего в течение жизни
самка комнатной мухи откладывает свыше 600 яиц. Места отклад-
ки — навоз, мусор, различные органические вещества. Через 8—
10 ч из яиц вылупляются личинки, которые продолжают развитие
на глубине 10 — 20 см от поверхности субстрата в местах с влажно-
стью 45 — 80 %. Фаза личинки длится до 3 дней, за это время они 3
раза линяют и переходят в предкуколку, которая переползает в
почву и окукливается. Куколка развивается около 5 дней, она не
питается. Вышедшая из куколки муха через 3 ч способна летать,
через 5 — 6 дней при температуре воздуха не ниже 17 °C приступа-
ет к откладке яиц. Весь цикл развития длится 2—3 нед. Зимуют
461
Рис. 172. Фазы развития мух:
/ — комнатная муха; 2 — яйца; 3 — личинка ///стадии; 4— осенняя жигалка; 5—куколка
мухи в фазе личинки, куколки или имаго. В помещениях, где тем-
пература не опускается ниже 17 — 18°С, выплод мух идет в течение
всего года.
Ветеринарное значение. В животноводческих помещениях и на
пастбищах мухи беспокоят животных, снижают их продуктив-
ность. Установлено, что при большой численности мух удои сни-
жаются на 10 — 20 %, жирность молока — на 0,1 %, прирост мас-
сы — на 100 — 150 г в сутки.
Лижущие мухи. Эти мухи — полифаги, принимают пищу каж-
дый час. Частый контакт мух с зараженными субстратами создает
условия для переноса ими на корма и животных возбудителей ин-
фекционных и инвазионных болезней. Например, полевая муха
(Musca autumnalia) служит промежуточным хозяином возбудите-
лей телязиоза крупного рогатого скота. Осенняя жигалка
(Stomoxys calcitrans) живет в помещениях и в открытой природе.
Выплаживается главным образом в гниющих растительных остат-
ках. Кровью питаются самцы и самки. Уколы этих мух очень бо-
лезненны, кроме того, они механически могут переносить возбу-
дителей инфекций и инвазий.
В отличие от осенней другие виды жигалок (Lyperosia irritans —
малая коровья жигалка, Haematobia stimulans — лошадиная жигал-
ка) нападают на животных на пастбищах, выплаживаются в фека-
лиях. Они подолгу сосут кровь, вызывая истощение животных и
снижение продуктивности.
Мясные (падальные) мухи. Ветеринарное значение имеют пред-
ставители рода Calliphora — синие мясные мухи (падальные, мяс-
462
ная и весенняя) и рода Lucilia — зеленые мухи, которые служат
возбудителями миазов у животных. Места выплода — трупы жи-
вотных, мясные и рыбные продукты, помойные ямы, гниющие
овощи и фрукты.
Меры борьбы с мухами. Борьбу с мухами проводят в помещени-
ях и на пастбищах. Профилактические меры направлены на лик-
видацию мест выплода мух на территории животноводческих
ферм и предотвращение залета их на фермы. Проводят постоянно
независимо от наличия и численности мух. Необходимо своевре-
менно убирать навоз, удалять остатки корма, чистить кормушки.
Следует регулярно очищать сточные канавы от навоза: при меха-
нической системе навозоудаления — ежедневно, при гидросплав-
ной — не реже 1 раза в 2 нед. Выгульные площадки асфальтируют
и очищают от остатков корма и навоза каждые 3—5 дней.
Места выплода мух (жижесточные канавы, туалеты, навозные
кучи, мусорные ящики и др.) обрабатывают эмульсиями инсектици-
дов: 0,1%-ной ДДВФ, 0,2%-ным карбофоса, циодрина,
раствором аммиачной воды, 10%-ными креолина,
ксилонафта или нафтолизола, а также 0,5%-ными
микробными препаратами (битоксибацил-
линоми турингином). Норма расхода ларвицидов 1—5 л
на 1 м2 в зависимости от консистенции субстрата. Высокоэффек-
тивным действием обладает сухая хлорная известь (1кг
на 1 м2 поверхности). В мае, сентябре и октябре обработки прово-
дят 1 раз в 2 нед, в июле—августе — каждые 5—7 дней.
Истребление окрыленных мух. Для влажной дезинсекции поме-
щений применяют 1%-ный раствор хлорофоса, смесь 1%-ного ра-
створа хлорофоса с 0,5%-ной кальцинированной содой, 0,5%-ные
эмульсии карбофоса, неоцидола, 0,05%-ную эмульсию перметри-
на, 0,005%-ную эмульсию циперметрина с нормами расхода 50—
200 мл на 1 м2.
Для дезинсекции помещений в присутствии свиней, птицы и
кроликов применяют аэрозоли ДДВФ, получаемые безап-
паратным способом путем химической реакции хлорофоса с ще-
лочью и водой в соотношении 1:1:1. Норма расхода хлорофоса,
КОН и воды по 1 кг на 1000 м3 помещения, экспозиция 30 мин.
Убой животных на мясо разрешен через 5 дней.
Обработки повторяют по мере восстановления численности
мух на ферме. В молокоприемных, кормоцехах, где распыление
инсектицидов нежелательно, применяют отравленные
приманки, состоящие из 0,5 % хлорофоса, 0,5 % углекислого
аммония, воды и привлекающих веществ — мелассы, патоки, мяс-
ных и рыбных отходов. Расставляют их в помещениях из расчета
0,2—0,4 м2 поверхности на 100 м2 площади пола. Обновляют при-
манки через 10—15 дней.
В настоящее время используют феромонные при-
манки-ловушки размером 15x30 см с содержанием 5 мг
463
трикозена на полиэтиленовой пленке, обработанной энтомологи-
ческим клеем «Пестификс» или ГИПК-222.
Борьба с мухами на пастбищах осуществляется путем периоди-
ческих обработок крупного рогатого скота и лошадей инсектици-
дами: 1—2%-ными эмульсиями ДДВФ, диброма,
циодрина, перметрина, циперметрина с норма-
ми расхода 30—50 мл на животное. Препарат наносят поверхност-
но только на волосяной покров спины или головы и шеи. За лето
проводят три-четыре таких опрыскивания с интервалом 5—7 дней.
За рубежом используют ушные бирки для коров с пирет-
роидами. Они постепенно выделяются из бирок и в течение
всего летнего времени защищают животных от укусов насекомых.
19.2. КРОВОСОСУЩИЕ ДВУКРЫЛЫЕ НАСЕКОМЫЕ
19.2.1. ГНУС
Гнус — кровососущие двукрылые насекомые. К ним относятся
слепни, комары, мошки, мокрецы, москиты.
Гнусу присущ двойственный характер питания. Для поддержа-
ния жизни взрослым насекомым достаточно растительных соков.
Для созревания яиц в яичниках самкам в качестве белковой пищи
необходима кровь. Поэтому нападают на животных и людей толь-
ко самки, которые сосут кровь сразу после оплодотворения, а за-
тем после каждой яйцекладки.
Слепни. Наиболее крупные кровососущие насекомые семей-
ства Tabanidae. Многочисленны в таежной, лесной и лесостепной
зонах. На территории Российской Федерации обитает около 190
видов слепней. Наиболее богаты видами роды Tabanus, Atylotus,
Hybomitra, или собственно слепни, Haematopota — дождевки,
Chrysops — пестрянки, или златоглазки.
Биология. Слепни влаголюбивы, часто пьют воду, захватывая ее
на лету или садясь на поверхность водоема. Оптимальная темпера-
тура для лёта 19—30 °C, минимальная на юге и в средних широтах
15—16 °C, на севере 11—12 °C. Спаривание самцов и самок проис-
ходит в воздухе.
Питаются слепни соками растений, оплодотворенные самки
еще и кровью теплокровных. За 2—3 мин одна самка поглощает от
50 до 250 мг крови. Через 3—4 дня яйца созревают и самка начина-
ет их откладывать в виде обтекаемой капли до 1000 шт. на расте-
ния вблизи воды и над водой. Через 4 — 8 дней из яиц вылупляют-
ся личинки, которые падают в воду или на влажную почву и ведут
хищнический образ жизни, несколько раз линяют и растут, дости-
гая к концу лета 2—5 см. Зимуют личинки в почве на глубине 5—
10 см. Весной они переползают на более сухое место, окукливают-
ся в почве и через 1—3 нед из куколки выходит взрослое насеко-
мое. А весь цикл развития слепня занимает 1—3 года (рис. 173).
464
Рис. 173. Фазы развития слепня (по Олсуфьеву):
1 — кладка яиц на водном растении; 2 — личинка;
3 — куколка; 4 — бычий слепень
Благодаря острому зрению и обонянию слепни быстро отыски-
вают животных, мешают им пастись. Уколы их весьма болезнен-
ны. Животные теряют упитанность, у коров на 15—20 % снижают-
ся удои. При кровососании на больных животных, свежих трупах,
при питье воды из открытых источников слепни могут стать опас-
ными переносчиками возбудителей сибирской язвы, инфекцион-
ной анемии лошадей, трипаносомоза, анаплазмоза, туляремии,
некробактериоза и др.
Мошки. В семейство мошек (Simulidae) входит более 900 ви-
дов. Мошки — важнейшие представители гнуса в лесных и таеж-
ных районах, особенно вблизи крупных рек. Это серые или сине-
ватого цвета мелкие (2—6 мм) мушки с округлой, подогнутой под
грудь головой. Хоботок короткий, колюще-сосущего типа.
Биология и экология. Места выплода мошек — быстротекущие
реки, ручьи, дренажные каналы. Яйца они откладывают на смачи-
ваемые водой камни, листья растений или сбрасывают в воду во
время полета. Через 4—5 дней из яйца выходит личинка, а через
15—20 дней она превращается в куколку. Выход из куколки взрос-
лого насекомого происходит в воде. Окруженная пузырьком возду-
ха мошка поднимается на поверхность водотока и взлетает
(рис. 174). Вскоре после вылета во время роения самки спариваются
с самцами. Питаются мошки в основном нектаром цветов, соками
465
Рис. 174. Биология развития мошек:
7 —самка; 2—яйца; 3 — личинка; •/—куколка
растений, но самкам многих видов для развития яиц необходима
кровь. Нападают на животных в основном утром и вечером. За год
дают одно—три поколения. Зимуют в фазе яйца и личинки.
Мошки — массовые злостные кровососы, опасны как перенос-
чики ряда возбудителей болезней животных и человека. Механи-
ческим путем они передают возбудителей туляремии, сибирской
язвы, энцефалита; биологическим — возбудителей онхоцеркоза
крупного рогатого скота и трипаносомоза птиц.
Мошки весьма назойливы, забираются в глаза, уши, проника-
ют в верхние дыхательные пути. Укусы мошек очень болезненны,
слюна содержит гемолитический яд, вызывающий интоксикацию
организма — симулиотоксикоз. Он проявляется вначале сильным
беспокойством, затем угнетением, саливацией, отеками языка,
466
подгрудка и подчелюстного пространства, увеличением лимфати-
ческих узлов, учащением пульса и дыхания. Смерть наступает в
течение 1 — 2 дней. Лечение симулиотоксикоза симптоматичес-
кое: сердечные и дыхательные аналептики, внутривенное введе-
ние глюкозы и физиологического раствора.
Комары. В нашей стране 80 видов комаров семейства
Culicidae, большинство из них относятся к трем родам: Culex,
Aedes, Anopheles. Кровососущие комары — мелкие и средних раз-
меров (4—11 мм) насекомые, имеют удлиненный хоботок, ротовой
аппарат колюще-сосущего типа, ноги удлиненные. Окраска тела
серая, черная, коричневая или желтая (рис. 175).
Биология. После копуляции у самки появляется потребность в
кровососании. Насосавшись крови животных или человека, они
через некоторое время откладывают яйца (120— 400 шт. за 1 раз)
на воду в стоячие водоемы или во влажный грунт. Через 2 — 8
дней в яйце формируется личинка, которая 4 раза линяет и пре-
вращается в куколку, из нее затем выходит имаго. Питаются ли-
чинки органическими остатками. Зимуют комары в фазе яйца и
имаго. Наиболее активно нападают на животных и человека в ве-
чернее, ночное время и утром. От мест выплода самки способны
летать в поисках пищи на 3 км, а с помощью ветра и на более зна-
чительные расстояния.
Питаясь на животных, комары приводят их в состояние воз-
буждения, переходящее затем в депрессию (признак токсикоза).
Высасывая кровь, вызывают развитие анемии у животных, их ис-
тощение. Кожа на месте массовых укусов отекает, развивается
дерматит. Комары переносят возбудителей арбовирусных инфек-
ций животных.
Мокрецы. Распространены почти во всех зонах страны.
Наиболее многочисленны мокрецы семейства Ceratopogonidae в
Сибири и на Дальнем Востоке.
Мокрецы — самые мелкие (1,5—2 мм) из компонентов гнуса.
Они сероватого цвета, по строению напоминают комаров, имеют
почковидные фасеточные глаза, крылья обычно пятнистые, ноги
удлиненные, покрыты щетинками.
Биология. Места выплода мокрецов — мелководные участки
рек, озер, болот, дупла деревьев, влажная лесная подстилка. Через
3 — 6 дней из яиц выходят личинки, а через 2—3 нед они превра-
щаются в куколки. Фаза куколки длится 3—7 дней. В течение года
может развиться до пяти генераций мокрецов. Мокрецы зимуют в
фазах яйца и личинки.
Укусы мокрецов вызывают беспокойство животных, зуд, воспа-
ление кожи, отек подкожной клетчатки. Слюна — причина обще-
го токсикоза. Кроме того, мокрецы служат промежуточными хозя-
евами возбудителя онхоцеркоза лошадей. Они могут быть механи-
ческими переносчиками возбудителей ряда инфекционных и ин-
вазионных болезней животных.
467
Culicinc
Anoph elini
Anopheles
Aedes Си I esc
Яйца
Рис. 175. Отличительные признаки малярийных (а) и немалярийных (б) комаров:
7 —поплавки; 2, 7—хвостовые волоски; 3 — брюшко; 4— антенны; 5—щетки; б—глаза;
8— плечевые лопасти; 9— нижнечелюстные щупики; 10 — пальмовидные волоски; 77 —хобо-
ток; 12 — 19— брюшко из восьми сегментов; 20— сифон; 21 — дыхальце; 22— грудь; 23— ды-
хательные трубки; 24— поверхность воды
Меры борьбы с гнусом. При организации борьбы с кровососу-
щими насекомыми в животноводстве предусматривают общехо-
зяйственные мероприятия, меры по ограничению и ликвидации
мест выплода, истребление личинок и окрыленных насекомых, а
также специальные мероприятия, направленные на групповую и
индивидуальную защиту от гнуса животных разных видов.
Общехозяйственные мероприятия. Животноводческие фермы,
летние лагеря и загоны размещают вдали от болот, заболоченных
468
лесов и кустарников, на возвышенных, сухих, хорошо продувае-
мых ветром участках. Для выпаса животных необходимо исполь-
зовать время наименьшей активности насекомых. При высокой
численности слепней животных пасут в ночные, утренние и ве-
черние часы. Если доминируют комары, мокрецы и мошки, жи-
вотных выпасают днем и ночью.
Ограничение мест выплода. Сюда входят такие
экологические мероприятия, как мелиорация заболоченных тер-
риторий, культурное освоение пастбищ, строительство гидротех-
нических сооружений, изменяющих и регулирующих режим про-
точных водоемов, и др.
В условиях орошаемого земледелия, а также при мелиорации
земель систему каналов и другие ирригационные сооружения не-
обходимо содержать в исправности и не допускать сброса воды на
неиспользуемые под посевы территории.
Истребление личинок. Для истребления личинок
комаров применяют наземные и авиационные обработки инсек-
тицидами водоемов. При наземной обработке используют 0,005—
0,02%-ные эмульсии дифоса из расчета 20—50 г д. в. на 1 га пло-
щади, сульфидофоса — 40—100 г на 1 га. Эффективен биопрепа-
рат бактокулицид в дозах 0,5—2 кг на 1 га, а также аналоги юве-
нильных гормонов (альтозид, димилин и др.). Необходимо
помнить, что затраты окупаются лишь при наличии биотопов на
площади не более 15—20 % общей территории пастбищ.
Для борьбы с личинками мошек большое значение имеет шлю-
зование рек, дренажных каналов и других водоемов с быстротеку-
щей водой. При этом повышается уровень воды, увеличивается ее
мутность и снижается насыщение кислородом, что ведет к массо-
вой гибели личинок мошек. Освобождению от личинок и куколок
способствует также последующий сброс накопившейся воды.
Борьба с преимагинальными стадиями других компонентов
гнуса не проводится в силу их биологических особенностей.
Уничтожение окрыленных насекомых. С
этой целью применяют наземную или авиационную обработку
территории инсектицидами. При наземном методе места дневок и
скоплений гнуса обрабатывают из ЛСД, ДУК, ВДМ, гидропульта
1%-ной водной эмульсией дифоса с нормой расхода 20 мл на 1 м2.
Эффективен также гексахлорановый дым, получаемый при
сжигании шашек Г-17. На открытой территории шашки Г-17 рас-
ставляют по фронту с наветренной стороны на расстоянии 35 м (в
лесу 100 м) одна от другой.
Защита животных от гнуса на пастбищах.
Для опрыскивания крупного рогатого скота применяют оксамат и
терпеноидный репеллент, а также инсектициды ДДВФ, дибром,
перметрин.
Оксамат применяют при:
крупнокапельном опрыскивании из дезмашин ДУК, ЛСД,
469
ВДМ, штанг горизонтальных распылительных и других установок,
используя 3%-ную водную эмульсию с нормой расхода 0,5—1 л на
теленка и 1,5—2 л на взрослое животное;
малообъемном мелкокапельном опрыскивании из форсунок
ТАН, ПВАН, опрыскивателя «Олень» и других установок, исполь-
зуя 20%-ную водную эмульсию оксамата из расчета 50 мл на те-
ленка и 100 мл на взрослое животное.
Инсектициды ДДВФ и дибром применяют для опрыскивания
в виде 0,5%-ных, перметрин — 0,025—0,05%-ных водных эмуль-
сий с нормой расхода 500 — 700 мл на животное. Обработку про-
водят так же, как и репеллентами.
При интенсивном лёте комаров животных обрабатывают вече-
ром после дойки, против слепней — утром.
Эффективны ушные бирки фирмы «Флектрон», содержащие
перметрин, которые длительное время защищают животных от
гнуса.
Рабочих лошадей опрыскивают 20%-ной водной эмульсией
оксамата из расчета 50—100 мл на животное. Применяют также
специальные ленточные покрывала, смоченные в 10%-ной
эмульсии оксамата, которые надевают на запряженную лошадь.
Эффективны перетроиды (перметрин, стомозан, анометрин, бу-
токс и др.).
Северных оленей с начала лёта комаров опрыскивают 3%-ной
эмульсией оксамата из расчета 150—200 мл на одно животное. С
появлением слепней и оводов оленей обрабатывают инсектицида-
ми: 0,25%-ными эмульсиями ДДВФ или диброма на тандере с по-
мощью опрыскивателей «Север» или «Олень». Транспортных оле-
ней опрыскивают 20%-ными эмульсиями оксамата из расчета 50—
100 мл на оленя или обрабатывают из аэрозольных баллонов окса-
матом.
19.2.2. БЛОХИ
Блохи — бескрылые кровососущие насекомые, паразитирую-
щие на теплокровных. В нашей стране известно более 500 видов
их.
На животных и человеке наиболее часто паразитируют блохи
видов: Ctenocephalides canis — собачья блоха; Pulex irritas — чело-
вечья блоха; Vermipsylla alacurt — паразитирует на копытных жи-
вотных, встречается в республиках Средней Азии; Echdnophaga
gallinacea — паразитирует на птицах и других домашних живот-
ных.
Морфология. У блох сжатое с боков тело длиной до 0,5—15 мм,
цвет от темно-бурого до светло-желтого. Глаза простые, черные.
Ротовой аппарат колюще-сосущего типа, хорошо развит.
Биология. Развиваются блохи с полным превращением. Кровь
сосут самцы и самки. После оплодотворения самки откладывают
470
от 400 до 2500 яиц в несколько приемов во внешней среде — гни-
ющих остатках органических веществ, в пыли, скоплениях мусо-
ра, на почву, в щели полов и т. д. Яйца белые, длиной около
0,5 мм. Через 5—60 дней, в зависимости от условий, из яиц вылуп-
ляются червеобразные личинки, которые после трех линек пре-
вращаются в куколки, а куколка через некоторое время в имаго.
Продолжительность жизни блох в фазе имаго до 1 года и более.
Блохи способны к длительному голоданию (до 18 мес).
Уколы блох болезненны, вызывают зуд, образование папул,
дерматиты, истощение. Они опасны как переносчики возбудите-
лей многих опасных болезней: чумы, бруцеллеза, сибирской
язвы, пастереллеза, листериоза, миксоматоза и др. Блохи кошек
и собак являются промежуточными хозяевами возбудителей ди-
пилидиоза. —
Диагностика. Диагноз ставят на основании обнаружения блох
при обследовании животных и помещений.
Лечение и профилактика. Для уничтожения блох на животных
применяют 0,05%-ную эмульсию перметрина (стомозана), 0,5%-
ную водную эмульсию карбофоса, 0,003%-ную водную эмульсию
бутокса, 0,005%-ную водную эмульсию цимбуша, а также неосто-
мозан в разведении 1 : 200, эктомин 1 : 1000, блотик 1 : 2000 и др.
Препараты наносят на кожно-волосяной покров методом опрыс-
кивания. Обработки проводят дважды: летом через 7—10 сут, зи-
мой через 14—18 сут. Эффективны аэрозоли (акродекс, дермато-
золь, перол, акрозоль, актол и др.)
19.2.3. КЛОПЫ
Клопы семейства Cimicidae отряда Hemiptera (полужесткокры-
лые) паразитируют чаще всего на курах, индейках и цесарках —
Cimex lectularius (постельный клоп) и С. columbarius (голубиный
клоп).
Морфология. Тело овальное, сильно уплощено, длиной 4,2—
6,5 мм. Окраска от желтоватой до буровато-красной. Голова сла-
боподвижная, усики четырехчленико-
вые. Глаза сложные, выпуклые. Хобо-
ток трехчлениковый, колюще-сосуще-
го типа. Надкрылья укорочены, кожи-
стые, не прикрывают брюшко. Ниж-
ние крылья отсутствуют. Ноги
ходильные, лапки трехчлениковые
(рис. 176).
Биология развития. Клопы развива-
ются с неполным метаморфозом. Ко-
пуляция травматическая: самец прока-
лывает парамером покровы самки В Рис. 176. Постельный клоп
471
области вторичных генитальных структур на брюшке. Спермато-
зоиды поступают в особый внутренний орган и из него мигрируют
в основание яичников. Самка откладывает от 1 до 12 яиц в день, а
в течение жизни — до 500 яиц. Выплод личинок из яиц при 20—
22 °C происходит через 2—2,5 нед, при 24—26 °C — через 8—9 сут,
а при 30— 35 °C — через 5—6 сут. Вышедшие из яйца личинки 4
раза линяют, причем после каждой линьки они питаются кровью.
Развитие от яйца до имаго длится 1—4 мес. Живут клопы 1 —
1,5 года, питаются кровью каждые 24—48 ч, но могут 1,5 года го-
лодать. Они поселяются в глубоких щелях стен и оборудования,
но ночью выползают из убежищ, нападают на птицу и животных,
после чего снова прячутся.
Эпизоотологические данные. Постельные клопы держатся обыч-
но в жилищах человека и питаются его кровью, но также парази-
тируют на курах, кошках, собаках, голубях, мелких грызунах и др.
Клопы могут быть переносчиками ряда инфекционных заболева-
ний: туляремии, спирохетоза птиц, возвратного и крысиного
тифа, оспы, чумы кур.
В местах укусов клопов появляются припухлость, покрасне-
ние и сильный зуд. В расчесанные ранки может быть внесена
вторичная инфекция. Животные беспокоятся, расчесывают по-
раженные участки тела, худеют. У кур снижается яйценоскость,
они истощаются, отмечается общее угнетение организма. У кро-
ликов, морских свинок в результате расчесов развиваются об-
ширные дерматиты.
Профилактика и меры борьбы. В птицеводческих хозяйствах при
обнаружении клопов проводят профилактические и истребитель-
ные мероприятия. Птицеводческие помещения и птицу не реже
1 раза в месяц обследуют на наличие клопов. Помещение осмат-
ривают не менее чем в 10 разных местах. Особое внимание обра-
щают на щели в насестах и оборудовании птичников. Пустовав-
шие в зимнее время птичники обследуют с наступлением теплой
погоды.
С профилактической целью птичники обрабатывают не позднее
чем за 2 сут до поступления в помещение птицы.
При обнаружении в птичниках клопов вывод ее из цеха, фер-
мы, хозяйства, за исключением вывоза для убоя, прекращают. Не
допускается также передавать или обменивать инвентарь, предме-
ты ухода за птицей.
В птичниках и цехах, пораженных клопами, проводят дезинсек-
цию, устраивая ее по возможности во время профилактических пе-
рерывов. Помещения опрыскивают из ДУК, ЛСД, ВДМ или УДС
2%-ным раствором хлорофоса, 0,5%-ной водной эмульсией неоци-
дола (диазинона) или циодрина, 0,25%-ными водными эмульсиями
ДДВФ или карбофоса, 2%-ной водной эмульсией алкамата,
0,05%-ной водной эмульсией перметрина (стомозана), 0,003%-ной
водной эмульсией бутокса из расчета 100—200 мл на 1 м2.
472
Помещения также обрабатывают аэрозолями из специальных
установок. Для этого используют 1—1,5%-ную водную эмульсию
циодрина или неоцидола. Эффективны и термические аэрозоли,
получаемые из шашек ШИФ-Ц, ШИФ-П, ПХСШ и др.
Выборочную дезинсекцию птичников в присутствии птицы
проводят 1,5 %-ной эмульсией оксамата, которую наносят на мес-
та обитания клопов из расчета 200—400 мл на 1 м2. Птичники об-
рабатывают двукратно с интервалом 9—16 сут в зависимости от
температуры птичника.
19.2.4. ТАРАКАНЫ
Тараканы — насекомые отряда Blattoptera, часто заселяющие
животноводческие фермы, кормокухни, склады комбикормов и
продуктов животного происхождения. Наибольшее значение име-
ют Blatta germanica (рыжий таракан), Blatta orientalis (черный тара-
кан); встречаются пепельный, туркестанский и американский та-
раканы.
Морфология. Тело их уплощено, продолговато-овальной фор-
мы, у рыжего таракана длиной до 13 мм, у черного до 30 мм. Рото-
вой аппарат грызущего типа. Антенны длинные, из 75—90 члени-
ков. Имеется пара фасеточных глаз и пара простых глазков. Ноги
бегательные, оканчиваются двумя коготками и присосками между
ними. Крылья нежные, прозрачные, в покое скрыты под надкры-
льями. Брюшко плоское, состоит из восьми—десяти тергитов и
семи—девяти стернитов. Последний тергит называется анальной
пластинкой, а стернит — генитальной пластинкой и обычно несет
один-два грифелька. На конце брюшка имеется пара веретеновид-
ных церков.
Биология развития. Насекомые с неполным превращением.
Самки откладывают яйца в особую капсулу — оотеку, находящую-
ся на заднем конце тела. Число яиц в оотеке от 17 до 41, причем
одна самка за жизнь откладывает три-четыре оотеки. Метаморфоз
длится у рыжих тараканов 2—6 мес, у черных до 4 лет. Тарака-
ны — ночные насекомые, днем они скрываются в щелях, под кам-
нями, опавшей листвой и др. Они всеядные. Способны голодать
более 2 мес. Общая численность популяции через 3— 4 мес увели-
чивается в 1000 раз.
Тараканы, кроме того, что портят животноводческие продукты,
являются механическими переносчиками некоторых возбудителей
кишечных инфекций и инвазий и промежуточными хозяевами не-
матод рода Gongylonema.
Меры борьбы. Корма хранят в таре, не пропускающей насеко-
мых. Стены, полы, предметы ухода опрыскивают инсектицидами:
1%-ными водными эмульсиями карбофоса, циодрина или неоци-
дола; 0,005%-ными водными эмульсиями бутокса или К-отрина;
473
0,005%-ной водной эмульсией перметрина (анаметрина, стомоза-
на), 0,1%-ной водной эмульсией ДДВФ и др.
Эффективны отравленные приманки, состоящие из (г): борной
кислоты 50, сахара 500; дрожжей 5, борной кислоты 20, вареного
картофеля 100, подсолнечного масла 5; борной кислоты 20, ман-
ной каши 80, сахара 10.
Можно использовать инсектицидные препараты в аэрозольных
упаковках «Прима», «Неофос», «Карбофос», «Эстрозоль» и др.
Термические аэрозоли получают сжиганием шашек ШИФ-1,
ШИФ-П, ШИФ-Ц, ПХСШ и др.
19.2.5. КОЖЕЕДЫ
Кожееды семейства Dermestidae известны как вредители про-
дуктов, изделий растительного и животного происхождения, а
также музейных коллекций, книг и др. На кожевенном и пушно-
меховом сырье чаще встречаются представители родов Attagenus,
Dermestes и Anthrenus.
Наиболее распространены из них Dermestes lardarius (ветчин-
ный кожеед), Dermester Frishi (кожеед Фриша) и Dermester sibiricus
(сибирский кожеед).
Морфология. Жуки длиной 2—3,5 мм, коричневого цвета, го-
лова и среднеспинка черные. Личинка имеет удлиненное, сужа-
Рис. 177. Ли-
чинка кожееда
рода Dermes-
tes
ющееся к концу тело желто-коричневого цвета
(рис. 177). На конце тела хорошо виден пучок длин-
ных волосков.
Биология развития. Кожееды развиваются с пол-
ным метаморфозом. Самки кожеедов за жизнь спо-
собны откладывать от 100 до 200 яиц. Оптимальны
для развития личинок температура 22—28 °C и от-
носительная влажность 70—80 %. Стадия личинки
длится 50—95 сут, стадия куколки — 5—35 сут. Ли-
чинки и жуки ветчинного кожееда предпочитают
свиные кожи, шкурки нутрий и лисиц. Кожеед
Фриша во всех фазах наиболее интенсивно развива-
ется на обезжиренной пресно-сухой овчине.
Меры борьбы. Все пресно-сухое сырье, пушни-
ну и изделия из них нужно хранить в сухих неотап-
ливаемых помещениях при температуре не выше
12 °C и относительной влажности 50—60 %. В этих
условиях кожееды не могут питаться и погибают.
Исключительно стойки к инсектицидам куколки и
зимующие жуки, высокочувствительны перезимо-
вавшие жуки, приступившие к откладке яиц. По-
этому сплошную дезинфекцию сырья и складских
помещений нужно проводить в средней полосе в
474
первой декаде мая, а для уничтожения второй генерации — во
второй декаде июля.
Эффективны следующие инсектициды: 0,5%-ная водная
эмульсия ДДВФ; 1%-ный раствор хлорофоса; 0,2%-ные водные
эмульсии циодрина, неоцидола и карбофоса, а также 0,05%-ная
водная эмульсия перметрина, 0,01%-ная водная эмульсия цимбу-
ша и 0,0025%-ная водная эмульсия бутокса. Препараты применя-
ют из расчета 100 мл на 1 м2 поверхности.
19.2.6. МОЛИ
Большая восковая моль (пчелиная огневка, ша-
шень) — Galleria mellonella распространена повсеместно. Самки
длиной 13—25 мм, крылья и тело покрыты чешуйками. Цвет пе-
редних крыльев фиолетово-серый со светло-бурыми и темными
пятнами, а задних — серый с темными штрихами по заднему краю.
Голова удлинена, глаза фасеточные, усики длинные. Ротовые
органы и пищеварительный аппарат недоразвиты. Брюшко состо-
ит из 10 члеников, яйцеклад длинный. Взрослые насекомые не
питаются.
Малая восковая моль — Achrola grisella. Самки дли-
ной 11 мм, самцы до 9 мм. Цвет варьирует от темного до пепель-
но-серого.
Биология развития. Самки откладывают яйца (до 50 шт.) на
стенки ячеек со свежей пыльцой, под крышечки частично запеча-
танных ячеек с медом. Откладка яиц при температуре 2 ГС про-
должается в течение четырех ночей. За свою жизнь самка откла-
дывает до 1850 яиц. Через 5—8 сут из яйца выходит личинка дли-
ной около 1 мм, дважды питается в течение 10—30 мин медом из
открытых ячеек, а затем и воском. В возрасте 1 дня личинки спо-
собны к активной миграции в другие пчелосемьи на расстояние
до 50 м. На 2-й день личинки начинают строить туннель, направ-
ленный к средостению сота, выедая по пути воск. Когда основа
сота съедена, личинки принимаются за стенки ячеек. Взрослая
личинка длиной около 18 мм состоит из 13 сегментов. Закончив
рост, личинки забираются в щели, трещины улья и окукливают-
ся, из куколок выходит имаго. Весь цикл длится 57—63 дня. В
течение года моль дает три поколения. Зимуют в улье только ли-
чинки.
Одна личинка может повреждать 500 и более ячеек. Возникает
так называемый неприкрытый, или горбатый, расплод. У незапе-
чатанных пчелиных куколок личинки моли повреждают ножки и
крылья. Фекальные шарики моли, попавшие на дно ячейки, нару-
шают конечную линьку пчел. Воздух в улье делается неприятным,
и пчелы покидают его. Нередко восковая моль вызывает гибель
пчелиной семьи.
475
Характер питания личинок малой восковой моли такой же, как
и большой, но они могут хорошо развиваться, питаясь только пер-
гой. Крышечки над поврежденным расплодом пчелы не допеча-
тывают, вокруг оставшегося отверстия края утолщены и надстрое-
ны в виде ободка (трубчатый расплод).
Для обнаружения личинок малой восковой моли держат рамку
с сотами, освобожденную от пчел, над листом бумаги. Стамеской
ударяют несколько раз по верхней планке, при этом личинки па-
дают на бумагу.
Меры борьбы. На пасеках содержат только сильные пчелиные
семьи. Поддерживают чистоту в ульях и сотохранилищах. Следят за
тем, чтобы пчелы содержались в исправных ульях без щелей. Еже-
годно меняют не менее 1/3 старых сотов на вновь отстроенные.
Для борьбы с молью в пчеловодстве используют биологические
средства на основе энтомопатогенных микроорганизмов: турицид,
энтобактерин, агритол, бактан, инсектин, турингин и др. Они гу-
бительны для гусениц моли, не действуют на пчел.
Шуб н а я (Tinea pellionella), войлочная (Tinea соас-
ticella) и меховая (Monopis rusticella) моли. Причиняют
большой вред кожевенному и пушно-меховому сырью. Встреча-
ются в жилых и складских помещениях (рис. 178).
Являясь кератофагами, гусеницы этих молей питаются воло-
сом, мехом, шерстью, щетиной, пером, кожей, рогом, костями и
476
др. Большинство из них живут в отапливаемых помещениях. Раз-
виваются с полным метаморфозом. Продолжительность всего
цикла развития 3—6 мес.
Применяют комплекс мер, направленных на создание условий,
тормозящих или не допускающих развитие молей: очистку скла-
дов от пыли и мусора, регулярное их проветривание, поддержание
низких температур, создание различных преград для молей и при-
менение отпугивающих веществ.
Для предохранения от заражения молью изделий или сырья,
находящихся в зараженном помещении, необходимо тщательно
чистить вещи и упаковывать их в плотно закрывающиеся шкафы
или чехлы из плотной бумаги с применением отпугивающих
средств: камфоры, нафталина, парадихлорбензола, махорки, лис-
тьев лаванды и др. Из химических методов борьбы при дезинсек-
ции складов и хранилищ используют 2%-ный раствор хлорофоса,
0,5%-ную водную эмульсию перметрина (стомозана), 0,2%-ную
водную эмульсию неоцидола (диазинона), 0,003%-ную водную
эмульсию бутокса или К-отрина и др.
Эффективны термические аэрозоли из шашек ШИФ-П на ос-
нове перметрина, ШИФ-Ц на основе циперметрина, ШИФ-1 на
основе ДДВХ, ПХСШ на основе хлорофоса.
Контрольные вопросы. 1. Какова характеристика биотопов гнуса? 2. Какие ин-
сектициды наиболее эффективны и удобны для борьбы с мухами? 3. Какие сред-
ства и методы защиты животных от гнуса используют на пастбищах? 4. На чем
основана резистентность членистоногих к пестицидам? Каковы ее механизмы и
способы преодоления?
Примечание. Лабораторную работу и практические занятия см. на с. 516.
20. АКАРИФОРМНЫЕ КЛЕЩИ И ВЫЗЫВАЕМЫЕ ИМИ
БОЛЕЗНИ
Акариформные клещи — самый большой отряд клещеобраз-
ных — Acariformes, насчитывающий более 15 тыс. видов. Делится
на два подотряда: саркоптиформные клещи — Sarcoptiformes и
тромбидиформные — Trombidiformes. К первому относятся такие
обширные и разнообразные группы, как панцирные, акароидные
клещи и ряд паразитических — перьевые, волосяные, чесоточные
и др. Второй подотряд включает очень много группировок, но
наибольшее ветеринарное значение имеют клещи семейства
Demodecidae (железничные клещи).
20.1. САРКОПТОИДОЗЫ
Саркоптоидозы (чесотка) — собирательное название группы
инвазионных болезней, в основу которых положен один из глав-
нейших и постоянных клинических признаков — зуд, а также вос-
477
паление кожи и выпадение волос и шерсти. Заболевания вызыва-
ются саркоптоидными (чесоточными) клещами.
Клещи надсемейства Sarcoptoidea объединены в два семейства:
Psoroptidae (роды Psoroptes, Chorioptes, Otodectes) и Sarcoptidae
(роды Sarcoptes, Notoedres).
У животных каждого вида паразитируют клещи, свойственные
только данному виду.
20.1.1 САРКОПТОЗ
Саркоптоз — остро или хронически протекающее заболевание,
вызываемое клещами рода Sarcoptes (зуднями). У лошадей парази-
тирует S. equi, у свиней — S. suis, у крупного рогатого скота —
S. bovis, у коз — S. саргае, у собак — S. canis, у северных оленей —
S. tarandi, у лисиц — S. vulpis, у верблюдов — S. cameli.
Возбудители. Зудни — мелкие клещи размером 0,2—0,45 мм,
тело округлое, грязно-серого цвета. Хоботок подковообразной
формы, грызущего типа. Ноги короткие, конусовидные, с коло-
кольчатыми присосками на длинных стерженьках (рис. 179).
Биология развития. Зудни — внутрикожные паразиты. Самка
под эпидермальным слоем проделывает ходы, в каждом из кото-
рых откладывает 2—8 яиц. Всего одна самка откладывает 40—60
яиц. Для полного развития клещей требуется 15—19 сут. Во внеш-
ней среде зудни не размножаются, но сохраняют жизнеспособ-
ность до 15 дней (рис. 180)
Саркоптоз свиней.
Эпизоотологические данные. Источник инвазии — взрослые
свиньи. Передаются зудни от больных восприимчивым животным
при непосредственном
Рис. 179. Клещ рода
Sarcoptes
контакте, через предметы ухода, одежду
обслуживающего персонала. Встречает-
ся саркоптоз в любое время года. Клещи
Sarcoptes могут внедряться в кожу чело-
века, имитировать симптомы саркопто-
за, однако не размножаются, не откла-
дывают яиц и погибают. Такую форму
поражения рассматривают как псевдо-
саркоптоз.
Патогенез. Прогрызая эпидермис,
питаясь эпидермальными клетками и
лимфой и образуя ходы в коже, клещи
травмируют ее, раздражают нервные
окончания механически, а также про-
дуктами своей жизнедеятельности, воз-
никает сильный зуд. В коже развивается
очаговое воспаление, сопровождающее-
ся сильной болезненностью. Продукты
478
Рис. 180. Самка рода Sarcoptes в просвете хода
в роговом слое кожи:
7 —вентиляционное отверстие; 2 — яйцо; 3 — поверх-
ность кожи; 4 — роговой слой кожи; 5 — клетки зернис-
того слоя эпидермиса кожи
распада клеток и выделения клещей проникают в кровь, вызыва-
ют аллергическую реакцию организма, происходит нарушение
сердечно-сосудистой и центральной нервной систем. Развивает-
ся хрониосепсис, что может вызвать истощение и гибель живот-
ного.
Симптомы болезни. У свиней отмечают через 10—15 дней после
заражения. Различают ушную и тотальную формы саркоптоза.
Ушная форма клинически проявляется преимущественно у старых
свиноматок и хряков и характеризуется поражением внутренней
поверхности ушных раковин и кожи вокруг уха. Тотальная форма
встречается в основном у молодняка 3—6 мес, протекает по типу
аллергического воспаления кожи всей поверхности тела, в том
числе и ушных раковин. На коже появляются папулы, везикулы,
корочки,зуд.
Диагностика. Ставят диагноз на основании эпизоотологических
данных, клинических признаков (зуд, воспаление кожи) и лабора-
торных исследований. С этой целью берут глубокий соскоб до по-
явления сукровицы на границе между пораженной и здоровой ко-
жей. Помещают на предметное стекло, увлажняют керосином, на-
крывают другим стеклом и смотрят под малым увеличением.
Лечение. Хороший лечебный эффект дают водные эмульсии:
0,5%-ные карбофоса, циодрина и дикрезила;
0,15%-ная неоцидола; 0,01%-ная стомозана, а также 4—
5%-ная суспензия коллоидной серы. Препараты приме-
няют методом опрыскивания 0,5—2,0 л на одно животное в зави-
симости от возраста. Температура эмульсий 15—25 °C. Свиней оп-
рыскивают на специальной площадке с отстойным колодцем или
в душевых камерах, с лечебной целью — двукратно с интервалом
7—10 дней, с профилактической — однократно. При работе с ака-
рицидами необходимо строго соблюдать правила, изложенные в
наставлениях по их применению.
479
Наиболее целесообразно для локальных обработок при ушной
форме саркоптоза применение акарицидов в аэрозольных и
беспропеллентных баллончиках (акродекс, дерматозоль, циодрин,
псороптол и др.).
Весьма эффективен и в о м е к, его вводят внутримышечно в
виде 1%-ного раствора 1,5 мл на 50 кг массы животного.
Профилактика. Для дезакаризации свинарников и инвентаря
применяют 0,25%-ный циодрин, 0,1%-ный неоцидол и 0.3%-ный
дикрезил.
20 1.2. ПСОРОПТОЗ
Псороптоз — остро или хронически протекающее заболевание,
вызываемое клешами-накожниками рода Psoroptes. Накожники
адаптировались к паразитированию у овец (Р. ovis), крупного ро-
гатого скота (Р. bovis), лошадей, ослов, мулов (Р. equi) и кроликов
(Р. cuniculi).
Возбудители. Размеры 0,5—0,8 мм, хоботок копьевидный, при-
способлен для прокола кожи и сосания лимфы. Ноги развиты, на
свободном конце их имеются четырехчленистые стерженьки,
оканчивающиеся присосками (рис. 181).
Биология развития. Самки откладывают яйца на коже животно-
Рис. 181. Клеш
а — самка с вентральной стороны; б— самец с вентральной
480
го. Из яиц вылупляются личинки, которые затем превращаются в
нимфу I (протонимфу), нимфу II (телеонимфу) и. наконец, в има-
го. Весь цикл развития длится 2—3 нед.
Псороптоз овец. Сезонное энзоотическое заболевание
овец, проявляющееся сильным зудом, выпадением шерсти, экзе-
моподобным воспалением кожи, истощением.
Эпизоотологические данные. Заболевают овцы всех возрастов,
особенно тонкорунных и полутонкорунных пород. Благоприятное
время для развития псороптоза — осень и зима. После весенней
стрижки развитие инвазионного процесса обычно замедляется, а
затем и совсем прекращается, однако клещей можно обнаружить в
глубоких складках кожи. Такие животные являются носителями
Р. ovis. Осенью шерсть отрастает, увеличивается влажность при-
корневого воздуха, что создает оптимальные условия для развития
накожников, и болезнь обостряется.
Источник инвазии —больные псороптозом животные и носи-
тели Резервуаром возбудителя могут быть помещения, где ранее
содержались больные животные. Наиболее долго (до 24 сут) кле-
ши во внешней среде выживают при температуре 8—1 ГС и отно-
сительной влажности воздуха 70—80 %.
Патогенез и симптомы болезни. Ползая по коже, клеши раздра-
жают кожные рецепторы и вызывают первичный зуд. Зудящие ме-
ста овцы начинают хватать зубами, в результате чего ранят кожу и
Psoroptes ovis:
стороны (по Шустровой); в — овца, больная псороптозом
481
смачивают ее слюной. Это способствует размножению накожни-
ков в очаге поражения. Слюна клещей, попадая в ранки, раздра-
жает нервные окончания тканей, возникает вторичный зуд, а с
внедрением микроорганизмов и воспалительные явления, нару-
шается питание волос, они выпадают.
Наиболее характерный признак болезни — зуд. Овцы чешут
или кусают зубами пораженные участки, трутся о кормушки и
другие предметы. Через некоторое время шерсть выпадает, появ-
ляются облысевшие участки, покрытые корками. У ягнят зуд ме-
нее выражен, шерсть не выпадает (спутывается), воспалительный
процесс в коже менее выражен.
Диагностика. Ставят по эпизоотологическим данным и клини-
ческим признакам, а для его уточнения проводят микроскопичес-
кое исследование соскобов кожи, которые берут на границе между
пораженной и здоровой кожей. При отсутствии микроскопа со-
скобы помещают на черную бумагу и слегка подогревают, при
этом обнаруживают движущихся клещей. При дифференциальной
диагностике исключают вшивость, экзему, мелофагоз (рунец), ко-
выльную болезнь, демодекоз.
Лечение. Основным методом обработки овец против псоропто-
за, как и других саркоптоидозных заболеваний, является полное
насыщение шерстного покрова акарицидной жидкостью. Для
этого животных купают в ваннах с акарицидной эмульсией. Инва-
зионный процесс прекращается независимо от интенсивности и
места локализации, так как во время купания обеспечивается то-
тальная дезакаризация всего кожного покрова.
При большом многообразии форм, вместимости и конструктив-
ных особенностей наиболее распространены проплывные («руч-
ные») ванны траншейного типа. Технология купания в ванне зак-
лючается в следующем: небольшую группу овец из предкупочного
база перегоняют в загон, откуда их вручную сбрасывают в ванну. Во
время проплыва животных не менее 2 раз погружают (рогачами) с
головой в жидкость. Из ванны овцы выходят на отстойную площад-
ку, где их выдерживают до полного стекания жидкости.
Сложнее всего подогнать овец к ванне и загнать их в нее. Из-
вестны различные приемы и способы, приспособления и техни-
ческие средства, ускоряющие и механизирующие подачу овец.
По этому принципу купонные установки деляг на сбрасывающие
и погружные. В сбрасывающих используют транспортеры, толка-
ющие щиты (тележки), наклоняющиеся и раздвижные платфор-
мы и др. В погружных устройствах группу овец загоняют в клеть
и опускают в ванну, затем поднимают и выпускают в отстойный
загон.
В процессе купания овец акарицидная жидкость в ванне «исто-
щается», т. е. в ней снижается содержание действующего веще-
ства (д. в.) за счет адсорбции на кожно-шерстном покрове живот-
ных, а также загрязнения и изменений pH (увеличения щелочнос-
482
ти). Чтобы компенсировать потери д. в. и поддерживать концент-
рацию на исходном уровне, в ванну в процессе купания овец вно-
сят дополнительно акарицидный препарат в количестве и по ме-
тодике, предусмотренным соответствующим наставлением. Обра-
ботанные эмульсии (после купания овец) из ванны сливают в по-
глощающий (отстойный) колодец.
Одновременно с овцами обрабатывают рабочий скот и собак,
находящихся в отаре.
В холодную погоду при отсутствии условий для купания боль-
ных овец и коз подвергают дустотерапии, обрабатывают препара-
тами в аэрозольных баллонах или акарицидами системного дей-
ствия.
Обработку дустами проводят на защищенной от ветра площад-
ке, в ненастную погоду — под навесом; на одну нестриженую овцу
расходуют до 300 г дуста. Системно действующие препараты ис-
пользуют, поливая их на кожу вдоль позвоночного столба (себа-
цил, эктопор, байтикол и др.) или делая подкожные инъекции
(ивомек, цидектин, аверсект и др.). С наступлением теплой пого-
ды животных, подвергавшихся обработке дустами и аэрозольными
препаратами, после стрижки обрабатывают в ванне.
Профилактика. В хозяйствах, где поголовье овец не болеет псо-
роптозом, проводят комплекс профилактических мероприятий
против заноса накожников. Овец, поступающих в хозяйство, сна-
чала карантинируют, а затем купают в акарицидных эмульсиях.
Пастбища для овец не должны быть смежными с выпасами со-
седнего хозяйства. Помещения, базы, где находились больные
овцы, а также оборудование, предметы ухода подвергают дезака-
ризации 5%-ной водной эмульсией каменноугольного фенольного
креолина (температура эмульсии 80—85 °C), а также другими ака-
рицидами с высокой устойчивостью к гидролизу во внешней сре-
де. Норма расхода акарицидов 400 мл на 1 м2 обрабатываемой пло-
щади.
Псороптоз крупного рогатого скота. Энзоо-
тическое сезонное заболевание, вызываемое клещом Psoroptes
bovis. Проявляется зудом, воспалением и утолщением кожи, выпа-
дением шерсти, корковыми напластованиями в местах паразити-
рования возбудителя.
Строение и биология развития аналогичны Р. ovis.
Эпизоотологические данные. Заболевание широко распростра-
нено при беспривязном содержании животных в стойловый пери-
од. Способствуют его возникновению неудовлетворительное корм-
ление и антисанитарное содержание животных.
В стаде псороптоз передается от больного животного здоровому
при их контакте, а также через предметы ухода. Без лечебного
вмешательства инвазия может сохраняться годами. В оптималь-
ных условиях (от минус 8 до минус 12 °C и высокой относитель-
ной влажности) клещи вне тела хозяина живут до 1 мес.
483
Патогенез и симптомы болезни. При травмировании клещами
эпидермиса и при расчесах животных выделяется лимфа, которая
вместе с отмершими ороговевшими клетками образует на коже
корковые напластования. Воспалительные явления приводят к
гиперплазии рогового слоя кожи и образованию складчатости, функ-
ции ее нарушаются. При обширных поражениях кожи отмечается
интоксикация организма, развиваются дистрофические процессы
во внутренних органах.
Инкубационный период длится 2—3 нед. Первые признаки
псороптоза появляются в области шеи, спины, крестца, у корня
хвоста и внутренней поверхности бедер. Ведущий симптом — зуд.
На коже образуются корки, кожа становится складчатой и утол-
щенной, появляются трещины, облысение значительных участков
кожи и истощение организма.
Диагностика. Диагноз ставят на основании клинических при-
знаков и микроскопических исследований соскобов кожи на на-
личие клещей. Соскобы берут скальпелем со свежепораженных
участков или по краям старых, ранее не подвергавшихся лечению
очагов. Взятые корочки помещают на предметное стекло, увлаж-
няют керосином и рассматривают под микроскопом.
Лечение. Применяют коллоидную и высокодис-
персную серу (к оксан, ти ов ит) в форме 3%-ной вод-
ной суспензии. Готовят их непосредственно перед применением
на воде или в смеси с эмульгаторами (препараты 30, 30-С, ОП-Ю,
ОП-7). В предварительно отвешенный препарат небольшими пор-
циями при помешивании добавляют 5—10 частей воды или ра-
створа эмульгатора до получения однородной смеси, а затем дово-
дят до нужной концентрации. Температура рабочей суспензии
18—25 °C. Кожный покров животных обрабатывают с помощью
щетки-душа или путем опрыскивания на специальных площадках
с отстойным колодцем из установок ЛСД, ВМОК, ДУК, из гидро-
пульта из расчета 3—4 л суспензии на одно взрослое животное.
Больных животных обрабатывают 2 раза с интервалом 7—10 дней,
с профилактической целью — 1 раз. В холодное время года колло-
идную серу используют в виде дуста. В очаге поражения ее втира-
ют, а непораженные места опыляют.
Можно использовать 0,1%-ную суспензию и з о ф е н а, вод-
ные эмульсии: 0,1%-ную фоксима, 0,025%-ную тактика,
0,02%-ную стомозана, а также препарат и в о м е к.
Для локальных обработок животных рекомендуют препараты в
аэрозольных и беспропеллентных баллонах: «Акродекс», «Дерма-
тозоль», «Псороптол» из расчета 60 — 80 г на одно животное дву-
кратно с интервалом 8—12 дней.
Профилактика. Не допускают ввоза животных из неблагополуч-
ных по псороптозу хозяйств, а также совместного содержания в
стаде больных и носителей клещей со здоровым скотом. Своевре-
484
менно проводят профилактические осмотры, а при необходимос-
ти и обработки животных.
Псороптоз лошадей. Вызывается клещом Psoroptes
equi. Протекает остро или хронически. Жизненный цикл тот же,
что и у клещей животных других видов. Паразитирует на лошадях
и ослах.
Патогенез и симптомы болезни. Подобны ранее описанным.
Диагностика. Диагноз ставят по клиническим признакам, а при
необходимости делают соскобы кожи и исследуют под микроско-
пом.
Лечение. Пораженные очаги моют водой с мылом и после вы-
сыхания обрабатывают 0,015—0,025%-ными по гамма-изомеру
эмульсиями активированного креолина, гек-
салина, гексаталпа. Через 10—12 дней процедуру повто-
ряют. Расход эмульсии на одно животное должен быть не более
2 — 3 л. В холодный период применяют 6%-ный дуст гек-
сахлорана— 300—400 г на одну лошадь. С наступлением вес-
ны рекомендуют дважды обрабатывать лошадей эмульсией гекса-
хлорана.
Можно также применять 3%-ную водную суспензию
коллоидной серы, 0,01%-ную водную эмульсию
стомозана и ивомек подкожно в дозе 200 мкг на 1 кг
массы тела. Для локальных обработок эффективны «Акродекс»,
«Дерматозоль», «Циодрин» и «Псороптол» — 60—80 г на живот-
ное. Дезакаризацию помещений и инвентаря проводят гексахло-
ран-креолиновой эмульсией с содержанием 0,03 % гамма-изомера
гхцг.
Профилактика. См. псороптоз крупного рогатого скота.
Псороптоз кроликов. Вызывается клещом Psoroptes
cuniculi.
Симптомы болезни. У кроликов возбудитель локализуется в слу-
ховом проходе и на внутренней поверхности ушной раковины.
Места поражения покрываются корками и струпьями серо-корич-
невого цвета, ушные раковины отечны. Кролики беспокоятся, че-
шут лапами уши, трясут головой. Осложненная форма псороптоза
характеризуется выделением гнойно-ихорозного экссудата, кото-
рый склеивает волосы нижнего края ушной раковины. При про-
бодении барабанной перепонки наблюдается «кривоголовость»,
развивается мезотимпанит (воспаление среднего уха), менингит,
абсцессы мозга и сепсис.
Диагностика. Диагноз ставят по клиническим признакам и на
основании микроскопического исследования соскобов.
Лечение. Применяют масляные составы из гексахлора н-
креолиновых препаратов с содержанием 0,03% гам-
ма-изомера (гексахлоран технический или обогащенный, активи-
рованный креолин, гексалин, гексаталп, минерально-масляная
эмульсия гамма-изомера гексахлорана), а также 40—50%-ную мас-
485
ляную суспензию фенотиазина, 0,5%-ный масляный
состав циодрина. В каждую ушную раковину вводят по 1,5—
2 мл акарицида, подогретого до 30—35 °C. Для более полной обра-
ботки акарицидом всей внутренней поверхности ушной раковины
и слухового прохода ушную раковину складывают по длине попо-
лам и тщательно массируют ее основание. Повторяют лечение че-
рез 8—10 дней.
Обработку кроликов аэрозольными акарицидными пенами
(«Акродекс», «Циодрин», «Дерматозоль», «Псороптол») проводят
без предварительного удаления корочек с пораженной кожи с рас-
стояния 5—10 см путем нажатия на клапан аэрозольного баллона в
течение 1—2 с.
Эффективен при псороптозе ивомек в дозе 200 мгк на 1 кг
массы тела при подкожном введении.
Клетки для кроликов, а также предметы ухода за ними опрыс-
кивают 4— 5%-ным раствором гидроксида натрия или 2%-ным
раствором хлорофоса.
Профилактика. Вновь поступающих кроликов карантинируют в
течение 1 мес. Не реже 2 раз в год в каждое ухо вносят масляные
составы гексахлоран-креолиновых препаратов (0,03 % по гамма-
изомеру). Периодически проводят дезактивацию клеток и поме-
щений, где они установлены.
20.1.3. ХОРИОПТОЗ
Хориоптоз — сезонное (осенне-зимнее) заболевание крупного
рогатого скота, лошадей, овец и коз, проявляющееся умеренным
зудом, воспалением и образованием корковых напластований
нижних частей конечностей.
Возбудитель. Клещи рода Chorioptes — кожееды живут на по-
верхности кожи, питаются отслоившимися клетками эпидермиса
и лимфой. Они меньше накожников — 0,3—0,5 мм, хоботок ко-
роткий, подковообразной формы, присоски на коротких нечлени-
стых стерженьках. У лошадей паразитирует Ch. equi, у крупного
рогатого скота — Ch. bovis, у овец — Ch. ovis (рис. 182).
Биология развития. Недостаточно изучена. Предполагают, что
она такая же, как у накожников.
Симптомы болезни. У крупного рогатого скота поражаются
обычно корень хвоста, промежности, вымя, конечности в области
пута. Первые признаки — усиленное шелушение эпидермиса и ги-
перемия кожи в области локализации возбудителя, кожа утолща-
ется, трескается, образуются корки. У лошадей клещи локализу-
ются на конечностях в области щеток, внутренней поверхности
бедер. Зуд интенсивный. Лошади ударяют о предметы и стараются
кусать зудящие места, что осложняет патологический процесс и
усиливает воспалительные явления. У овец клещи чаще всего об-
486
Рис. 182. Chorioptes bovis (по Шустровой):
а — самка и б — самец с вентральной стороны
наруживаются на конечностях в области путового сустава, на го-
лове, у баранов — на мошонке.
Диагностика. Диагноз ставят по клиническим признакам, а так-
же микроскопическим исследованиям соскобов кожи, взятых в
центре пораженного очага.
Лечение и профилактика. Аналогичны проводимым при псоро-
птозе.
20.1.4. НОТОЭДРОЗ
Нотоэдроз — хроническое заболевание собак, кошек и кроли-
ков, проявляющееся воспалением кожи в области головы, расче-
сами, зудом, выпадением волос. Вызывается клещом Notoedres
cati. Величина его 0,15—0,35 мм, по форме похожи на зудней, но
ноги более короткие. Анальное отверстие у самцов, а у самок и
копулятивное отверстие смещены на спинную сторону.
Биология развития. Недостаточно изучена. По-видимому, она
аналогична описанной у зудней.
Эпизоотологические данные. Источник инвазии — больные жи-
вотные. Максимальное перезаражение нотоэдрозом животных
происходит в периоды их наиболее интенсивных контактов: при
случке, в подсосный период, во время отсадки молодняка от са-
мок.
Механическими переносчиками клещей могут быть блохи,
мухи и другие насекомые. Клещи могут переходить на человека.
487
Симптомы болезни. Заболевание проявляется зудом. Кошки ца-
рапают кожу в области головы, появляются папулы, везикулы, ко-
торые затем покрываются корками светло-серого цвета.
Диагностика. Диагноз ставят на основании клинической карти-
ны болезни и микроскопических исследований глубоких, до появ-
ления сукровицы, соскобов кожи.
Лечение. Наилучшие результаты получены от применения вод-
ных эмульсий: 0,2%-ной неоцидола и 0,05 %-ной стомо-
зана. Одновременно этими эмульсиями обрабатывают клетки и
инвентарь. Высокоэффективен при нотоэдрозе и в о м е к при од-
нократном подкожном введении в дозе 200 мкг на 1 кг массы тела.
20.1.5. ОТОДЕКТОЗ
Отодектоз — ушная чесотка плотоядных. Вызывается клещом
Otodectes cynotis, который сходен с клещами рода Otodectes, но
недоразвита четвертая пара ног. Болеют собаки, кошки и пушные
звери (рис. 183).
Симптомы болезни. Различают три формы болезни: типичную,
атипичную и осложненную.
Типичная форма сопровождается зудом, образованием
в слуховом проходе и завитковой части ушной раковины корок и
струпьев серого или серо-коричневого цвета, среди которых нево-
оруженным глазом заметны живые клещи.
Атипичная форма регистрируется у молодняка до
4 мес и часто заканчивается летальным исходом. Характеризуется
Рис. 183. Самец Otodectes cynotis с
вентральной стороны (по Шустровой)
приступом. В период приступа
животное трясет головой, пада-
ет, отмечаются судороги. При-
падок длится до 10 мин, и жи-
вотное погибает.
Осложненная фор-
м а характеризуется нагноени-
ем, истечением гнойно-ихороз-
ного экссудата. При прободении
барабанной перепонки у живот-
ных наблюдается «кривоголо-
вость». Воспалительный про-
цесс переходит на мозговые
оболочки, вызывая менингит,
абсцессы мозга и сепсис.
Диагностика. Диагноз ставят
на основании клинических
признаков болезни и обнаруже-
ния клещей в корочках из уха.
Лечение и профилактика. См.
Псороптоз кроликов.
488
20.1.6. КНЕМИДОКОПТОЗ КУР
Кнемидокоптоз кур вызывается перьевым клещом Knemido-
coptes mutans. Болеют также индейки, цесарки, голуби, попугаи и
другие птицы. Клещи размером 0,25 — 0,45 мм паразитируют под
роговым слоем неоперенной части ног.
Патогенез и симптомы болезни. Хоботком и продуктами своей
жизнедеятельности клещи раздражают эпидермис кожи нижних
частей ног. Куры расклевывают пораженные места, нанося новые
травмы. Места поражений нередко инфицируются, что ведет к
возникновению осложнений в виде некроза пальцев. Нижние час-
ти конечностей утолщены и деформированы, на неоперенных ча-
стях ног отмечают отложения грязно-белого цвета. При длитель-
ном течении болезни пальцы некротизируются и отпадают.
Диагностика. Диагноз ставят на основании характерных симп-
томов и микроскопического исследования чешуек, взятых с пора-
женных мест.
Лечение и профилактика. На кнемидокоптоз осматривают все
поголовье кур старше 6 мес. Больных птиц убивают на мясо или
лечат. При выделении более 10 % больной птицы поголовье целе-
сообразно заменить здоровым. Для лечения неоперенные части
ног погружают на 1 мин в бе ре з о вы й деготь, 0,02%-ную
водную эмульсию стомозана, 4—5%-ную водную
суспензию коллоидной серы или 0,1%-ную водную
эмульсию неоцидола. Через 10 дней процедуру повторяют.
Помещение подвергается очистке и дезакаризации.
20.1.7. ДЕМОДЕКОЗ КРУПНОГО РОГАТОГО СКОТА
Демодекоз — хроническое сезонное заболевание, вызываемое
паразитирующим в волосяных фолликулах клещом Demodex bovis
семейства Demodecidae подотряда Trombidiformes.
При сильном поражении клещами удои у коров снижаются на
15—20 %, молодые животные могут погибать от интоксикации и
истощения. Стоимость кожи вследствие демодекозного порока
снижается на 20—40 %, а иногда кожевенный товар приходит в
полную негодность.
Возбудитель. Форма тела клеща червеобразная. Самка длиной
0,21—0,25 мм, самцы 0,23—0,28 мм. Яйца бобовидной формы, раз-
мерами (0,068 — 0,083) х (0,019 — 0,033) мм.
Биология развития. Взрослые клещи спариваются в демодекоз-
ной колонии, после чего самка откладывает яйца, из которых на
3—4-е сутки вылупляется личинка, пребывающая вначале в актив-
ном, а затем в пассивном состоянии. Активная личинка подвиж-
на, она усиленно питается и растет. Напитавшаяся личинка, дос-
тигнув наибольших для этого состояния размеров (до 0,14 мм в
489
длину), переходит в пассивное состояние. В этот период она не
питается, не растет, становится неподвижной, в ее организме про-
исходит гистолиз органов личинки и гистогенез органов новой
особи. После завершения этих процессов личинка линяет и пре-
вращается в протонимфу. Аналогичное развитие проходит прото-
нимфа длиной около 0,25 мм при превращении в дейтонимфу и
последняя длиной до 0,31 мм — при превращении в имаго. Весь
цикл развития длится 30—35 сут.
Эпизоотологические данные. Демодекоз крупного рогатого скота
выявлен в различных географических зонах России. Болезнь чаще
встречается в регионах с длительным стойловым периодом. Чаще
болеют животные в возрасте 1—3 лет. В хозяйствах с традицион-
ной технологией разведения животных он шире распространен у
взрослых животных. Экстенсивность и интенсивность инвазии
осенью снижаются, доходя до минимума в январе — феврале, а
весной повышаются, достигая максимума в июле — августе. Ново-
рожденные телята заражаются от больных матерей при подсосном
выращивании. Источник инвазии — больные животные.
Патогенез. Клещ D. bovis, проникнув с поверхности кожи в во-
лосяной канал фолликула, по пути следования уничтожает эпите-
лиальные клетки внутреннего и наружного корневых влагалищ
волоса, а на дне волосяного фолликула — эпителиальные клетки
волосяного сосочка. В результате внутреннее волосяное влагали-
ще больше не восстанавливается. Патоморфологические измене-
ния кожи характеризуются положением волосяных фолликулов —
некротизическими процессами с последующим нагноением.
Формируется демодекозный очаг в виде абсцесса. Близлежащие во-
лосяные комплексы кожи атрофируются. Эпидермис над колония-
ми некротизируется. В дермисе отмечаются мукоидное и фибри-
ноидное перерождение соединительной ткани, а также диффузное и
грануломатозное скопление эпителиоидных, лимфатических, плаз-
матических и гигантских клеток. Одновременно в организме накап-
ливаются продукты жизнедеятельности клещей. Отмечаются лей-
коцитоз, эритропения, эозинофилия и нейтрофилия с регенератив-
ным сдвигом ядра влево, а также уменьшение бактерицидной и ли-
зоцимной активности сыворотки крови и иммуноглобулинов.
Таким образом, при демодекозе происходит изменение гомео-
стаза, что обусловливает иммунодефицитное состояние организма
по Т-системе иммунитета. Если уменьшение резистентности орга-
низма в начале инвазии представляет защитную реакцию на вне-
дрение клещей D. bovis, то дальнейшее ее снижение становится
критическим и вызывает клиническое проявление болезни.
Симптомы болезни. У животных старше 3 мес появляются ок-
руглые узелки, расположенные в толще кожи, изолированные
друг от друга и окружающей ткани. Такие демодекозные колонии
чаще всего обнаруживаются в области головы, шеи, подгрудка, пе-
редних конечностей. Размеры колоний от 1 до 10 мм в диаметре.
490
Отмечают вихревые образования волос, а также склеивание их.
Некоторые узелки лишены волос и покрыты корочками красно-
коричневого цвета.
Диагностика. Диагноз ставят на основании клинических при-
знаков. Обнаружив при пальпации кожи характерные для демоде-
коза узелки, проводят микроскопическое исследование их содер-
жимого. Если в центре узелка имеется струп, его удаляют пинце-
том, содержимое переносят на предметное стекло в каплю вазели-
нового масла и микроскопируют. При отсутствии струпа
стерильной инъекционной иглой делают укол в центре узелка на
глубину 2—3 мм. После этого содержимое выдавливают из бугорка
и помещают на предметное стекло, как и в первом случае.
При отсутствии клинических признаков демодекозных клещей
можно обнаружить, исследуя соскобы кожи животных. Для этого
выщипывают волосяной покров на площади 1,5—2 см2 в местах
наиболее частой локализации клещей и на этот участок кожи на-
носят одну-две капли вазелинового масла. Затем кожу в этом мес-
те берут в складку и, нажимая тупой стороной лезвия скальпеля,
проводят по коже, стараясь выдавить демодекозных клещей из во-
лосяных фолликулов. Полученные таким образом соскобы кожи и
волосы исследуют под микроскопом.
Лечение. Существующие методы борьбы с демодекозом предус-
матривают в основном многократные тотальные обработки жи-
вотных акарицидами: 0,5%-ной суспензией севина (1 раз в 3—
4 сут, 6 раз), 1—2%-ными растворами кристаллического хлоро-
фоса, 0,05%-ной водной эмульсией азунтола, 0,5%-ной вод-
ной эмульсией циодрина (1 раз в 4сут, 4—6 обработок),
аэрозолями акродекс и дерматозоль (не менее 4 раз с
интервалами между обработками 4—6 сут из расчета 60—80 г на
одно животное).
Для лечения и профилактики демодекоза рекомендуют скармли-
вать элементарную серу (ГОСТ 127—76) в дозах 40—50 мг на 1 кг мас-
сы тела. Ее включают в рацион за 1 мес до начала сезонной линьки
животных и скармливают в течение 4 мес подряд (декабрь —март).
Эффективны двукратные подкожные инъекции 1%-ного раствора
ивомека, цидектина и аверсект а-2 (фармаци-
н а) в дозе 1 мл на 50 кг массы тела с интервалом 7 сут.
Профилактика. Всех животных, поступающих в хозяйство, сле-
дует карантинировать и обследовать на демодекоз. Больных и по-
дозрительных по заболеванию изолируют и лечат.
Для предупреждения заболевания в марте — мае необходимо по-
головно обследовать скот на демодекоз, начиная с молодняка 3-ме-
сячного возраста.
Свободные помещения перед постановкой животных тщатель-
но чистят, содержат пустыми в течение 6 сут либо обрабатывают
струей горячей (70—80°) воды под давлением и после просушива-
ния вводят животных.
491
В неблагополучных по демодекозу хозяйствах необходимо ис-
ключить контакт новорожденных телят с матерями. Если в хозяй-
ство поступают телята, подозреваемые в заражении, их необходи-
мо с профилактической целью обработать ивомеком, цидектином
или аверсектом в вышеуказанных дозах.
20.1.8. ДЕМОДЕКОЗ СОБАК
Демодекоз собак — заболевание, вызываемое клещом Demodex
canis семейства Demodecidae подотряда Trombidiformes. Тело дли-
ной 0,2—0,26 мм, сигарообразной формы. Паразитирует в волося-
ных фолликулах и сальных железах (рис. 184),
Биология развития. Сходна с D. bovis. Срок развития возбудите-
ля от яйца до имаго 25—30 сут.
Эпизоотологические данные. Болеют собаки всех возрастов, но
тяжелее от 6 мес до 2 лет. Источник инвазии — больные собаки.
Передача возбудителя возможна через предметы ухода, одежду и
др. Неполноценное кормление, отсутствие или недостаток в раци-
оне протеина, витаминов, минеральных веществ, сопутствующие
Рис. 184. Биология развития клеща демодекс:
О — яйцо; !(„) — личинка активная; — личинка пассивная; PNiay — протонимфа активная;
PNlpj — протонимфа пассивная; — дейтонимфа активная; DN^y — дейтонимфа пассив-
ная; 1 — имаго: самец и самка
492
заболевания, а также наследственный дефицит Т- и В-лимфоци-
тов способствуют развитию болезни. Чаще болеют короткошерст-
ные породы собак.
Во внешней среде при температуре воздуха 18 °C и влажности
85—90 % клещи сохраняют жизнеспособность на предметах ухода,
подстилке, полу до 5 сут, на коже собак до 7, в водопроводной
воде 6 сут.
При температуре воды более 50 °C гибель клещей наступает в
течение 1 — 2 мин.
Патогенез. Имаго, внедряясь в волосяной фолликул при нали-
чии в нем волоса, проникает преимущественно в сальные железы
и постепенно заполняет их. Изменения в волосяных комплексах
выражены некротическими процессами. В эпидермисе отмечают
некроз, а также десквамацию; в дермисе — нарушение гемодина-
мики, стазы и отеки; в собственно коже — пролиферативное вос-
паление, характеризующееся скоплением лимфоцитов, эозинофи-
лов, клеток Лангерганса и др. При этом волос выпадает, кожа по-
крывается чешуйками.
Симптомы болезни. Различают чешуйчатую (сквамозную),
узелковую (папулезную), пустулезную и смешанные формы де-
модекоза.
. Сквамозная форма характеризуется образованием ал-
лопеций и ран. Поражаются голова, конечности и другие участки
тела. Измененные участки тела сухие, с хлопьевидным налетом,
серо-белого цвета. В местах поражения отмечаются облысение,
утолщение кожи и образование складок. Часто встречаются стру-
пья темно-красного цвета, мягкой консистенции, в виде крошко-
видных масс.
При папулезной форме на различных участках тела
образуются округлые и отчетливо ограниченные от окружающих
тканей узелки диаметром 1—6 мм.
Пустулезная форма характеризуется образованием в
коже бугорков диаметром 1—4 мм, наполненных гноем, они лопа-
ются, и содержимое вытекает наружу. В местах локализации коло-
ний волосяной покров редкий, через него хорошо видны демоде-
козные узелки. В центре крупных колоний шерстный покров от-
сутствует, а их поверхность покрыта корочками желтого цвета с
покраснением кожи по периферии.
При всех формах демодекоза клещи могут паразитировать в
коже внутренней поверхности ушных раковин и дистальной части
конечностей, образуя небольшие узелки диаметром 1—3 мм.
Диагностика. Диагноз устанавливают на основании эпизоото-
логических, клинических данных и микроскопического исследо-
вания соскобов кожи. Соскобы берут из нескольких мест пораже-
ния, глубоко проникая в кожу (до появления крови). При пусту-
лезной форме исследуют пустулезную жидкость, нанося ее по кап-
лям на предметное стекло.
493
Демодекоз следует дифференцировать от стафилококкоза, дер-
матофитозов, экзем, аллергических поражений кожи, саркоптоза
и др.
Лечение. Применяют комплексное лечение, направленное на
подавление жизнедеятельности клещей, нормализацию функции
кожи, улучшение роста волос, усиление иммунных реакций, а так-
же ликвидацию гормональных отклонений.
Внутривенно вводят 1%-ный раствор трипансинана
физиологическом растворе в дозах 0,5—1,0 мл на 1 кг массы тела
четырехкратно с интервалом 7 сут.
Амитразом (митобан, тактик, вапрозин) в виде
0,025%-ной водной эмульсии обильно смачивают кожу поражен-
ной зоны и пограничные участки здоровой кожи шириной 0,5—
1 см 7—8 раз с интервалом 5 сут.
П е д е м с (на основе перметрина) наносят на места пораже-
ния в дозе 1—1,5 мл на 1 кг массы тела двукратно с интервалом
7 сут.
Цидем, цибон, паноцид и демизон в аэрозоль-
ных и беспропеллентных баллонах наносят на места поражения из
расчета 1 г на 1 кг массы тела четырехкратно с интервалом 7 сут.
Децис, данитол, байтикол применяют в виде масля-
ных растворов 0,025%-ной концентрации, втирая в пораженные
участки кожи 3—4 раза с интервалом 10 сут.
При сквамозной форме демодекоза эффективны 5%-ная
эмульсия мыла К, а также гиподерми н-х лоро-
ф о с, который наносят на пораженные участки в дозе 0,15 мл на
1 кг массы тела четырехкратно с интервалом 7 сут.
Для лечения генерализованной пустулезной формы демодекоза
С. В. Ларионов предложил комплексный метод, включающий
подкожное введение и в о м е к а, наружное применение серно-
дегтярного линимента и скармливание алимен-
тарной серы. Больным животным серу дают внутрь в дозе
40 мг на 1 кг массы тела в течение 30 сут. Пораженные участки
кожи обрабатывают серно-дегтярным линиментом (2 части серы,
1 часть березового дегтя и 4 части тетравита) первую неделю ежед-
невно, а затем 1 раз в 4 сут в течение 1 мес. Ивомек применяют
подкожно двукратно с интервалом 14 сут первый раз в дозе 0,2 мл
на 10 кг , а второй — 0,3 мл на 10 кг массы тела.
Ушные раковины обрабатывают аэрозолями акродек-
с а, дерматозоля, циодрина, псороптола и други-
ми с расстояния 10 см путем нажатия на клапан в течение 1—2 с.
Наряду с применением специфической терапии собакам назна-
чают витамины по Рыссу, пушновит, гендевит, а
также иммуностимуляторы и модуляторы согласно действующим
наставлениям.
Профилактика и меры борьбы. Питомники, клубы необходимо
укомплектовывать здоровыми собаками, не допускать контакта
494
больных собак со здоровыми, полноценно кормить собак, ежеме-
сячно клинически обследовать животных, начиная с месячного
возраста, регулярно чистить и мыть горячей водой (60—70 °C)
клетки, коврики, места отдыха собак и т. д. Хорошим средством
профилактики демодекоза собак является использование ошейни-
ков с инсектицидами.
20.1.9. ХЕЙЛЕТИОЗ СОБАК
Возбудитель. Акариформный клещ Cheyletiella jascuri семейства
Cheyletidae подотряда Trombidiformes. Длина самки 0,4—0,5 мм,
самца 0,3—0,35 мм (рис. 185).
Биология развития. Взрослая самка приклеивает яйца к волосам
с помощью тонких нитей клейкого секрета. Через 3—15 сут из
яйца выходит личинка, которая через 3—5 сут превращается в
протонимфу, а последняя — в дейтонимфу. Через 1—2 нед из дей-
тонимф дифференцируются самцы и самки.
Эпизоотологические данные. Болеют собаки различных пород
без выраженной возрастной динамики. Заболевание чаще встреча-
ется весной, летом и осенью. Вне тела хозяина клещи живут не-
продолжительное время (1—5 сут).
Патогенез. Не изучен.
Симптомы болезни. Отмечается зуд. Шерстный покров на спи-
не, дорсальной поверхности
шеи, ушах редкий, плохо удер-
живается на коже. На поражен-
ных участках кожи признаки
аллергического воспаления —
гиперемия, папулы, везикулы,
пустулы и др.
Диагностика. Диагноз ставят
на основании клинических
признаков и результатов мик-
роскопического исследования
соскобов с кожи.
Следует дифференцировать
хейлетиоз от саркоптоза, демо-
декоза, дерматофитозов, стафи-
лококкоза и др.
Лечение. Обрабатывают кожу
собак 0,02%-ным масляным ра-
створом бутокса, который вти-
рают в пораженные участки
двукратно с интервалом 5 сут,
эффективны и другие пиретро-
иды.
Рис. 185. Клещ Cheyletiella jascuri
495
20.1.10. ХЕЙЛЕТИОЗ КРОЛИКОВ
Возбудитель. Cheyletiella parasitivorax семейства Cheyletidae под-
отряда Trombidiformes. Паразитирует на поверхности кожи. Самка
светло-желтого цвета, длиной 0,45—0,5 мм, длина самца 0,32—
0,34 мм. Яйца удлиненно-овальные, мутно-белого цвета, прикреп-
ляются к волосам с помощью клейкого секрета. Личинка светло-
желтого цвета, имеет три пары конечностей, длина личинки 0,15—
0,2 мм. У протонимфы четыре пары конечностей, наружные поло-
вые органы отсутствуют, длина протонимфы 0,24—0,26 мм.
Дейтонимфа светло-желтого цвета, по форме напоминает имаго,
длина дейтонимфы 0,38—0,41 мм.
Биология развития. Через 2—3 сут после копуляции самка откла-
дывает яйца, приклеивая их к волосам с помощью клейкого секре-
та. Через 3—15 сут из яйца вылупляется личинка, которая через 6—
8 сут превращается в протонимфу, а последняя через 5—15 сут — в
дейтонимфу, линяющую в половозрелых самца или самку.
Эпизоотологические данные. Изучены недостаточно. Однако ис-
следования показали, что хейлетиоз широко распространен в ви-
вариях и кролиководческих хозяйствах.
Патогенез. Не изучен.
Симптомы болезни. При помощи острых хелицер клещи спо-
собны прокалывать эпидермис и питаться вытекающими из про-
колов лимфой и тканевой жидкостью. У кроликов вначале появ-
ляются беспокойство и зуд в области шеи и дорсальных участков
туловища. Затем в волосах этих участков обнаруживают мелкие
сухие чешуйки серого цвета, отмечаются сечение и выпадение во-
лос. Кожа на оголенных участках гиперемирована, покрыта серы-
ми чешуйками. У пуховых кроликов пух сваливается.
Диагностика. От больных животных берут пробы волос, выст-
ригая их на отдельных участках вокруг пораженной зоны, а также
делают соскоб кожи. Собранный материал выдерживают в чашках
Петри при температуре 27—30° С в течение 20 мин и просматрива-
ют через бинокулярную лупу.
Хейлетиоз следует дифференцировать от саркоптоза и сифун-
кулятоза.
Лечение. Эффективны стомазан в разведении с водой
1 : 200, б у т о к с в виде 0,0025%-ной водной эмульсии и не о -
ц и д о л в разведении с водой 1 : 1000.
20.1.11. ЭПИДЕРМОПТОЗ КУР
Эпидермоптоз — болезнь, вызываемая клещами из отряда
Acariformes подотряда Sarcoptiformes надсемейства Analgesoidea се-
мейства Epidermoptidae вида Epidermoptes bilobatus (самцы разме-
ром 0,2 х 0,12 мм, самки — 0,23 х 0,16 мм) и вида Rivoltasia bifurcata
(самцы размером 0,18 х 0,13 мм, самки — 0,26 х 0,18 мм). Цвет кле-
496
щей желтоватый, они живут на коже, под чешуйками эпидермиса,
у основания перьев, среди пуха, но не в перьях.
Эпизоотологические данные. Эпидермоптозом болеют как моло-
дые, так и взрослые птицы. Заражение происходит при совмест-
ном содержании здоровых и больных птиц. Болезнь характеризу-
ется сезонностью, проявляется и распространяется преимуще-
ственно в теплое время года. С наступлением холодов симптомы
болезни исчезают, но остается клещеносительство.
Симптомы болезни. При паразитировании Е. bilopatus процесс
начинается преимущественно в области головы, шеи и груди, при
паразитировании R. bifurcata — в области спины и крестца, а- по
мере развития болезни процесс распространяется по всему телу. В
местах обитания клещей кожа гиперемирована, эпидермис шелу-
шится, выпотевшая лимфа засыхает, образуя корки сначала тон-
кие, отрубевидные, затем толстые, слоистые, грязно-бурого цвета.
Под корками находится мокнущая поверхность, издающая непри-
ятный запах. Зуд умеренный или отсутствует. На пораженных уча-
стках часть перьев выпадает, а оставшиеся взъерошены. Птица ху-
деет, снижается яйценоскость. В запущенных случаях возможен
падеж птицы.
Диагностика. Диагноз ставят на основании эпизоотологических
данных, клинических признаков и обнаружения в соскобах кожи
возбудителя болезни.
Для обнаружения перьевых клещей других видов, паразитиру-
ющих в перьях и очинах, проводят исследование. Клещи имеют
вид мелких темных точек, расположенных поодиночке или ряда-
ми между бородками опахал. Если очин пера непрозрачен, то его
следует расщепить и исследовать, нет ли внутри его перьевых (се-
мейство Dermoglyphidae) или тромбидиформных (семейство
Syringophilidae) клещей.
Лечение и профилактика. Обрабатывают пораженные участки
кожи акарицидами (мази, линименты, эмульсии, порошки
и др.). Для тотальной обработки птицу опрыскивают акарицид-
ными препаратами, используя гидропульты, ЛСД и др. Одновре-
менно проводят дезакаризацию помещений, оборудования, ин-
вентаря.
Профилактика основана на выполнении зооветеринарных пра-
вил содержания, кормления птицы и ухода за ней. Вновь поступа-
ющих в хозяйство птиц карантинируют, при необходимости ис-
следуют соскобы кожи и перьевой покров.
21. КРУСТАЦЕОЗЫ РЫБ
Заболевания вызываются ракообразными из класса Crustacea.
В СНГ описаны паразитические рачки 60 видов. В озерах, водо-
хранилищах и прудах паразитические рачки нередко вызывают за-
болевания и гибель рыбы.
497
21.1. ЛЕРНЕОЗ
Возбудитель. Самки рачков из рода Lernaea (L. cyprinacea и
L. elegans отряда Copepoola). Первый вид паразитирует главным
образом у карасей, второй — у многих пресноводных рыб: карпов,
амуров, толстолобиков (рис. 186).
Длина половозрелой самки 12—15 мм. На голове имеются вет-
вистые выросты, при помощи которых она внедряется в тело хозя-
ина. Развитие Lernaea происходит без участия промежуточного хо-
зяина.
Рис. 186. Возбудитель лернео-
за — Lernaea cyprinacea
Эпизоотологические данные. Лернеозом болеют мальки и сего-
летки, энзоотии при этом сопровождаются гибелью рыб. Источ-
ник инвазии—больные рыбы и инвази-
онные стадии рачка, находящиеся в во-
доеме в свободном состоянии, откуда
они вместе с водой проникают в рыбо-
водные пруды. Заболевание встречает-
ся главным образом в южных районах
России. Наибольшего развития лерне-
оз достигает в летние месяцы.
Патогенез. Не изучен.
Симптомы болезни. При внедрении
паразита глубоко в кожу хозяина он
своими твердыми головными выроста-
ми достигает мышечного слоя, где и
закрепляется. На месте внедрения па-
разита развивается воспалительный
процесс, образуются глубокая язва, аб-
сцесс, свищ. Края язвы ярко-красного
цвета, иногда сероватые, резко отгра-
ничены от здоровой ткани. Помимо
механического повреждения паразит
выделяет в ткани хозяина токсины, что
приводит к увеличению фагоцитирую-
щих элементов крови.
Диагностика. Диагноз ставят на ос-
новании клинических признаков бо-
лезни, эпизоотологических данных и
обнаружения рачков с учетом их обще-
го количества на одной рыбе.
Лечение. Больную рыбу обрабатыва-
ют водным раствором хлорофоса
концентрацией 100 мг на 1 л с экспози-
цией 1 ч. Непосредственно в прудах
применяют хлорофос в концентрации
0,5 мг на 1л двукратно через 2 нед, а
также карбофос в дозе 0,1 мг на 1 л дву-
498
кратно через 15 сут. Не рекомендуется применять карбофос при
pH воды выше 8. Для освобождения рыб от самок рачков с профи-
лактической целью используют перманганат калия в разведении
1 : 50 000. Экспозиция при температуре воды 15—20 °C не должна
превышать 1,5—2 ч.
Профилактика и меры борьбы. Проводят ветеринарно-санитар-
ные и рыбоводно-биотехнологические мероприятия, направлен-
ные на предотвращение проникновения возбудителя в водоем, со-
здание в прудах оптимальных зоогигиенических и санитарных ус-
ловий. Для уничтожения свободноживущих личинок лерней уве-
личивают pH в воде прудов до 8,5—9,0 путем внесения извести,
применяют органические красители: основные фиолетовый К и
ярко-зеленый при концентрации одного из них не более 0,1—0,2 г
на 1 м3. Борьбу осуществляют в соответствии с действующими ин-
струкциями.
В зависимости от степени поражения рыбы, результатов орга-
нолептического анализа, осмотра и определения товарной конди-
ции ее пускают в продажу на общих основаниях без ограничения
или направляют на рыбоперерабатывающие предприятия.
21.2. АРГУЛЕЗ
Возбудитель. Паразитические рачки из отряда жаброхвостых
(Branchiura) рода Argulus. На рыбах России паразитируют два вида
аргулюсов: A. foliaceus — карповый, с продолговатым телом и
A. coregoni — лососевый, округлой формы. A. foliaceus — карповая
вошь, карпоед. Размеры 6—7 мм, тело широкое, овальное, серова-
то-зеленого цвета. Имеются сосательный хоботок и присосковид-
ные органы, четыре плавательные ножки, два фасеточных глаза
(рис. 187).
Биология развития. Размножа-
ются аргулюсы яйцами, которые
самки откладывают на подводные
предметы. В каждой кладке на-
считывается от 130 до 300 яиц. Из
них за 15—50 сут выходят личин-
ки, нападающие на рыбу. На рыбе
личинки растут и через 2—3 нед
превращаются в половозрелых
рачков. За летнее время аргулюсы
дают три-четыре поколения. Па-
разитируют и самки, и самцы.
Эпизоотологические данные.
Аргулезом болеют мальки, сего-
летки и двухлетки карпов, форе-
лей, амуров, сазанов, лещей и
Рис. 187. Возбудитель аргулеза —
Argulus foliaceus
499
других рыб. Резервантами рачков могут служить сорные рыбы.
Максимальная зараженность карпов наблюдается в середине лета
и осенью. Зимой инвазированность рыб резко снижается.
Симптомы болезни. Прикрепляясь к телу рыбы, рачки хоботком
прокалывают кожу и сосут кровь. На месте ранения развиваются
воспалительный процесс, отечность, кровоизлияния и некроз.
Образуются ранки и мелкие язвочки. Секрет ядовитой железы
рачка, попадая в ранку, оказывает токсическое воздействие на
рыбу.
Диагностика. Диагноз ставят на основании клинических при-
знаков болезни и эпизоотологических данных. Мальки рыб мас-
сой 1—2 г погибают при паразитировании на них 1—2 рачков, се-
голетки — 20 и более.
Лечение, профилактика и меры борьбы. Те же, что и при лернеозе.
22. ВАРРООЗ
Заболевание медоносных пчел, вызываемое клещом Varroa
jacobsoni надсемейства Gamasoidea. Клещи высасывают гемолим-
фу пчел из расплода (личинок и куколок), в результате чего из
ячеек выходят неполноценные пчелы, неспособные нормально
выкармливать расплод и перезимовывать.
Больные варроозом пчелосемьи снижают продуктивность на
70 %, срок жизни рабочих пчел сокращается на 20—40 %.
Возбудитель. Размеры самки 1,2 х 1,75 мм, самцов 0,85 х 0,8 мм.
Самки коричневого цвета, самцы желто-серые. У самок хорошо
развит ротовой аппарат, а у самцов он недоразвит, они не питают-
ся и погибают после спаривания. У клещей четыре пары конечно-
стей с присосками, служащими для фиксации на теле пчел
(рис. 188).
Биология развития. После спаривания оплодотворенная самка
клеща заползает в ячейку сота,
Рис. 188. Клещ Varroa jacobsoni
где есть личинка трутня или
пчелы, и откладывает яйца на
стенке ячейки. Самка делает до
трех яйцекладок и в течение
жизни может отложить от 2 до
37 яиц. Все стадии развития кле-
ща проходят за 9 сут в запеча-
танной ячейке. Здесь же проис-
ходит и спаривание самцов и са-
мок. Когда пчела выходит из
ячейки, вместе с ней выходит и
половозрелая самка клеща.
Самки клеща паразитируют
на личинках, куколках, рабочих
500
пчелах и трутнях. Продолжительность их жизни летом 2 мес, зи-
мой около 5 мес. Зимуют самки клеща на взрослых пчелах, по од-
ной самке на пчеле. Вне пчелы клещ живет несколько суток. Харак-
терно, что клещ развивается больше в трутневом расплоде.
Эпизоотологические данные. Варрооз встречается повсеместно.
Самка клеща от одной пчелиной семьи к другой переносится
взрослыми пчелами и трутнями. Инвазия передается при переста-
новке рамок из ульев в улей, формировании сборных отводков,
постановке расплода, воровстве и залете пчел. С пасеки на пасеку
варрооз распространяется роями, при продаже семей, пакетов, ма-
ток, во время кочевки. Установлено, что клещ может паразитиро-
вать и на некоторых других насекомых (например, на божьих ко-
ровках).
В 1-й год возникновения заболевания на пасеке идет массовое
размножение клещей в семьях пчел. На 2-й год болезнь поражает
все семьи пасеки, причем интенсивность инвазии может достигать
30 тыс. (и более) экземпляров клеща на одну пчелиную семью. На
3-й год отмечается массовая гибель пчелиных семей.
Патогенез и симптомы болезни. Самка клеща, питаясь гемолим-
фой личинок и куколок, вызывает их гибель. Паразитируя на
взрослой пчеле, самки также питаются гемолимфой, вследствие
чего сокращается срок жизни пораженных пчел, появляются не-
жизнеспособные и деформированные пчелы и трутни.
Наблюдается слабый лёт пчел за взятком, эти семьи весной
плохо развиваются, в течение лета они слабеют, у летка можно об-
наружить погибших недоразвитых пчел. При осмотре рамок вид-
ны пестрый расплод на сотах, под крышечкой запечатанного рас-
плода — погибшие личинки и куколки. В зимнее время пчелы из
неблагополучных семей могут выкучиваться из летка и гибнуть от
переохлаждения.
Диагностика. Диагноз ставят на основании осмотра пчел, лабо-
раторного исследования, а также диагностической обработки
пчел. При внимательном осмотре пчел и куколок невооруженным
глазом видны клещи. Их можно увидеть также на личинках, рас-
плоде (особенно трутневом), теле трутней, в мусоре на дне улья.
Для лабораторного исследования посылают: весной — кусочек
сота с запечатанными ячейками трутневого расплода, а также рас-
плода пчел размерами 15x3 см; летом и осенью — участок сота с
запечатанным расплодом и не менее 50 молодых пчел от каждой
исследуемой семьи, зимой — трупы пчел, восковую крошку с со-
ром со дна улья (200 г).
Лечение. Мероприятия по борьбе с варроозом направлены про-
тив самок клещей, находящихся на пчелах.
Важно своевременно и правильно обработать пчелиные семьи
акарицидами. Для этой цели служат фенотиазин, в ар р о -
кс ан Т-1, ф о л ь б е к с, ф о л ь б е к с В А, муравьиная,
щавелевая и молочная кислоты, растительный
501
акарицид КА С-8 1 , в а р р о а б р аул и н, санвар и др.
Эти препараты необходимо применять весной сразу после массово-
го очистительного облета пчел и санитарной очистки ульев, а также
в конце лета — после отбора товарного меда. Предварительно пре-
парат проверяют на трех пчелиных семьях, разных по силе.
Перед применением фенотиазина, варроксана Т-1, фольбекса,
фольбекса ВА улей герметизируют, на дно помещают сетчатый
подрамник. При полном гнезде одну-две соторамки удаляют, ос-
тальные раздвигают. Препараты используют согласно действую-
щим наставлениям.
Муравьиную кислоту (30 мл) наливают в пластмассовую крыш-
ку диаметром 9 см, накрывают фанерой размерами 10 х 10 см и
ставят на соторамки ближе к задней стенке улья. Под действием
паров кислоты клещи осыпаются с пчел. Удобно использовать
кислоту в специальном испарителе ИМК-1.
Щавелевую кислоту применяют в виде 2%-ного, а молочную —
в виде 10%-ного водного раствора. Растворы готовят на кипяче-
ной воде (30° С) непосредственно перед обработкой пчел. Для оп-
рыскивания служат распылители типа «Блеск». Расход раствора
должен быть 10—12 мл на одну соторамку. Из улья убирают сото-
рамки с пергой и опрыскивают пчел. В течение сезона пчелиные
семьи обрабатывают 3—4 раза.
К А С-8 1 (отвар почек сосны и горькой полыни) применяют с
сахарным сиропом при осенней подкормке пчел, препарат губи-
тельно действует на клеща варроа, стимулирует развитие семей и
профил актирует нозематоз.
Варроабраулином пчел опыливают с помощью порошкораспы-
лителя с расстояния 25—30 см или непосредственно между рамка-
ми. Клещи осыпаются с пчел, но не погибают. Бумагу с осыпав-
шимися клещами извлекают со дна улья и сжигают.
Эффективны также апистар, байварол и др.
Профилактика. Важное значение в профилактике варрооза
имеет строгое выполнение охранно-карантинных мероприятий
при кочевках пасек, продаже маток и пакетов. Пасеки разрешает-
ся вывозить на кочевку только после проведения исследования и
полного курса обработок.
Пасеки следует располагать в сухих, хорошо освещенных солн-
цем местах, на подставках высотой не менее 30 см, комплектовать
пчелиными семьями из условно благополучных по варроозу хо-
зяйств. Вновь поступивших пчел в течение 30 сут исследуют на
варрооз и обрабатывают против этого заболевания.
23. АКАРАПИОЗ
Возбудитель болезни — акариформный клещ Acarapis woodi.
Тело овальное, сплюснутое сверху. Самка несколько крупнее сам-
ца, длиной до 0,19 мм. Болеют взрослые пчелы. Клещ паразитиру-
502
ет в грудных трахеях пчел (при помощи ротовых органов прокалы-
вает трахею).
Эпизоотологические данные. Акарапиоз передается непосред-
ственным контактом здоровых пчел с инвазированными. Источ-
ник инвазии — больные пчелы. Кроме того, клещей заносят на
пасеку при покупке пчел и маток из неблагополучных по этому
заболеванию пасек, когда купля-продажа осуществляется без кон-
троля ветеринарной службы или не соблюдаются правила каран-
тинирования и исследования завозимых семей пчел.
Патогенез. Не изучен.
Симптомы болезни. Болеют пчелы в любое время года, но легче
акарапиоз выявляется в дни весеннего облета. У летка улья обна-
руживают пчел-ползунков, неспособных подняться в воздух, а
также пчел с раскрылицей (асимметрично расположенными кры-
льями). У ползающих пчел брюшко увеличено, они погибают вне
улья при вечернем похолодании.
В период зимовки пчелы беспокоятся, при осмотре находят
мертвых особей, соты испачканы испражнениями.
Диагностика. Окончательно диагноз на акарапиоз устанавли-
вают микроскопированием трахей пчел. Пораженные трахеи ста-
новятся пятнистыми, затем черными и ломкими (у здоровых
пчел они прозрачные, с хорошо выраженной поперечной исчер-
ченностью). Методика исследования на акарапиоз следующая: от
больной пчелиной семьи берут несколько десятков пчел, кипятят
их 5—6 мин в 10%-ном растворе гидроксида калия, затем промы-
вают водой. Ножницами удаляют голову, отрезают у основания
крыльев переднюю часть груди и помещают ее на предметное
стекло. Под лупой разрыхляют двумя препаровальными иглами
хитин и отделяют переднюю пару грудных трахей — они имеют
вид маленьких серебристо-белых трубочек. На наличие клещей
просматривают трахеи под микроскопом в капле воды под по-
кровом стекла.
Лечение. Аэрозолями наиболее эффективно лечение в начале
весны. Препараты применяют в вечернее время, когда все летные
пчелы возвращаются в улей. Перед применением препарата из
гнезда удаляют две крайние рамки, чтобы между спинкой улья и
рамками получилось свободное пространство. Щели в улье зама-
зывают глиной.
Рекомендуют тедион, эфирсульфонат, фольбекс
и этилдихлорбензилат согласно действующим настав-
лениям.
Меры борьбы и профилактика. При установлении диагноза на
неблагополучную пасеку, а также на все другие пасеки, располо-
женные в радиусе до 5 км, накладывают карантин. Запрещается
ввоз на территорию пасеки и вывоз из нее пчелиных семей. Сни-
мают карантин через год после полного выздоровления пчел.
Последнее подтверждается двукратным лабораторным исследо-
503
ванием пчел на акарапиоз: первый раз — весной, после выставки
пчел из зимовника, второй раз — осенью, перед постановкой их
на зимовку. При проведении оздоровительных мероприятий
принимают меры по дезакаризации ульев, инвентаря, а также со-
блюдают ветеринарно-санитарные правила содержания пчел на
пасеках.
Лабораторная работа
Задания. 1. Освоить методы взятия и исследования соскобов с
кожи при зудневой, накожниковой, кожеедной и железничной че-
сотке лабораторными методами. 2. Изучить морфологические осо-
бенности клещей, их дифференциацию.
Оборудование и материалы: микроскопы; лупы; предметные стекла; пинцеты;
скальпели; вата; палочки; спирт; керосин; таблицы определения видов клещей;
препараты клещей — накожников, кожеедов, зудней и демодексов.
Место занятия: лаборатория паразитологии.
Методика проведения занятия. Преподаватель кратко объясняет
места локализации и особенности строения саркоптоидных кле-
щей, знакомит с методами взятия соскобов с кожи животных.
Учащиеся рассматривают под микроскопом и лупой соскобы
кожи и исследуют клещей в разных стадиях развития. Преподава-
тель напоминает основные морфологические признаки, по кото-
рым определяют клещей до рода (размер, форма хоботка, присос-
ки на конечностях).
При наличии больных животных учащиеся берут соскобы са-
мостоятельно и исследуют их под микроскопом. Клещей зарисо-
вывают в тетради.
Практическое занятие
Задания. 1. Ознакомиться с акарицидами, содержащими гамма-
изомер ГХЦГ, перметрин, циперметрин, серой коллоидной, нео-
цидолом, фоксимом, акродексом, псороптолом, дерматозолем.
2. Рассчитать дозы и освоить технику приготовления рабочих
эмульсий, суспензий и дустов акарицидных препаратов. 3. Осво-
ить методы обработки животных против саркоптоидозов (купа-
ние, опрыскивание, обработка аэрозольными и беспропеллентны-
ми препаратами).
Оборудование и материалы: гидропульт; ДУК; автомакс; купонная ванна; спец-
одежда (халаты, сапоги, перчатки, респираторы, защитные очки); препараты
гексахлорана; пиретроиды; сера коллоидная; неоцидол (диазинон); фоксим; акро-
декс; псороптол; дерматозоль.
Место занятия: ферма колхоза (совхоза) или учебно-производ-
ственное хозяйство.
504
Методика проведения занятия. Группу учащихся делят на зве-
нья. Преподаватель объясняет задание. Учащиеся под руковод-
ством преподавателя и ветеринарных специалистов хозяйства осу-
ществляют купание овец в проплывной ванне, обрабатывают жи-
вотных препаратами, соблюдая правила личной профилактики и
меры предосторожности. После выполнения задания учащиеся
составляют акт по общепринятой форме.
Контрольные вопросы. 1. Какие саркоптоидозы встречаются у сельскохозяй-
ственных животных? 2. Животных каких видов поражают накожники, кожееды,
зудни и демодексы? 3. У каких животных встречается ушная чесотка? 4. Какие ме-
тоды обработки животных против саркоптоидозов наиболее эффективны? 5. Ка-
кие акарицидные препараты применяют против саркоптоидозов? 6. От каких жи-
вотных саркоптоидные клещи могут переходить на человека?
24. КЛЕЩИ — ПЕРЕНОСЧИКИ ВОЗБУДИТЕЛЕЙ
ТРАНСМИССИВНЫХ БОЛЕЗНЕЙ
Краткая характеристика и систематика. Клещи — переносчики
возбудителей трансмиссивных болезней относятся к отряду
Parasitiformes, который делится на два надсемейства: Ixodoidea и
Gamasoidea. Надсемейство Ixodoidea включает два семейства —
Ixodidae и Argasidae. Надсемейство Gamasoidea объединяет боль-
шое количество семейств, но в ветеринарии имеет значение се-
мейство Dermanissidae.
24.1. ИКСОДОВЫЕ КЛЕЩИ
Иксодиды — крупные, длиной до 20 мм клещи. Тело их оваль-
но-удлиненной формы. В передней части тела находится хобо-
ток, видимый с дорсальной стороны. На спинной поверхности
имеется плотный хитиновый щиток. Глаза есть только у некото-
рых видов иксодовых клещей, расположены они на краю передней
части спинного щитка. На брюшной части туловища расположе-
ны половое и анальное отверстия. У самцов дорсальный щиток
покрывает всю поверхность спины, у самок — только переднюю
часть.
Величина иксодовых клещей меняется в зависимости от фазы
развития клещей и насыщения их кровью. Тело самки при пита-
нии кровью увеличивается во много раз. Нападая на животное,
клещ проделывает хоботком рану в коже и при помощи гипостома
удерживается на ней.
Иксодиды — кровососущие членистоногие. Продолжитель-
ность жизни их зависит и от природных условий — температуры,
среды, влажности, наличия животных-прокормителей. Время па-
разитирования клещей на животных в разных климатических зо-
нах также неодинаковое.
505
Иксодиды широко распространены в различных зонах страны,
однако количество иксодовых клещей может резко меняться от
системы землепользования и зоны их обитания. Распашка целин-
ных и залежных пастбищ, перевод крупного рогатого скота и овец
на лагерное и стойловое содержание создают неблагоприятные ус-
ловия для развития клещей и их распространения.
Биология развития. Иксодовые клещи в процессе своего разви-
тия проходят ряд последовательных фаз: яйца, личинки, нимфы и
имаго, отличающихся друг от друга морфологически и биологи-
чески. Напитавшись кровью, самки падают на землю и через не-
которое время откладывают яйца. Одна самка (у отдельных видов
клещей) может откладывать от 3 до 15 тыс. яиц. После этого самка
погибает. Из яиц вылупляются личинки (имеют три пары конеч-
ностей); они отыскивают прокормителей и питаются кровью в те-
чение 2—4 сут. Личинки иксоид одних видов могут оставаться на
теле животных и превращаться в нимф, у клещей других видов
процесс метаморфоза личинки в нимфу проходит на земле. Ним-
фа также питается кровью животного (4—6 сут), затем она отпада-
ет на землю и превращается в имаго (взрослого самца или самку).
Процесс превращения нимфы в имаго может произойти и на жи-
вотном. В зависимости от ареала длительность цикла развития у
клещей разных видов колеблется от нескольких месяцев (в южном
ареале) до 3—4 лет (в северном ареале).
В зависимости от числа нападений активных фаз иксоид на
животных их разделяют на одно-, двух- и треххозяинных
(рис. 189). Если клещи в течение всех фаз развития питаются на
одном хозяине, их относят к однохозяинным. Двуххозяинные кле-
щи в фазе личинки и нимфы паразитируют на одном животном
(хозяине), а в фазе имаго — на другом. У треххозяинных клещей
личинка, нимфа и имаго питаются на трех разных хозяевах.
На территории нашей страны обитают иксодовые клещи шести
родов. Различают их по признакам, свойственным клещам каждо-
го вида.
Морфологическая характеристика клещей семейства Ixodidae по
родам:
Hyalomma — хоботок длинный, глаза есть;
Ixodes — глаз нет;
Dermacentor — хоботок короткий, основание хоботка четырех-
угольное, щиток с мраморным рисунком;
Haemaphysalis — щиток без мраморного рисунка;
Rhipicephalus — основание хоботка шестиугольное, анальная
бороздка есть, дыхальце запятовидное;
Boophilus — анальной бороздки нет, дыхальце округлое или
овальное.
Род Ixedes. Клещи служат переносчиками возбудителей бабези-
оза и анаплазмоза крупного рогатого скота, а также возбудителей
ряда вирусных и бактериальных инфекций человека. I. ricinus и I.
506
Рис. 189. Биология иксодовых клещей с различным циклом развития:
] — однохозяинным; 2 —двух-; 3 — треххозяинным
persulcatus — треххозяинные клещи. Встречаются в центральных,
западных и северо-западных областях Российской Федерации, а
также в предгорьях и горах Кавказа. В северном ареале клещи
обитают преимущественно в лесной зоне, южнее — в лиственных
и хвойных лесах.
Паразитируют в фазе имаго на сельскохозяйственных живот-
ных всех видов (рис. 190), а также на диких животных, в том числе
на птицах. Личинки и нимфы обитают на мелких грызунах, пре-
смыкающихся, птицах, особенно интенсивно на ежах. Имаго и
нимфы нападают на человека. Взрослые клещи голодают более
2 лет. В северных областях жизненный цикл клещей длится 3 —
4 года, а в центральных и западных — одна генерация в течение
года. В центральных областях страны клещи нападают на живот-
ных весной и летом, а в Закавказье — в любое время года.
Род Hyalomma. На сельскохозяйственных животных паразити-
руют: Н. anatolicum, Н. detritum, Н. scupense, Н. plumbeum.
Н. anatolicum— треххозяинный клещ, паразитирует на крупном
рогатом скоте и на животных других видов. Переносчик возбуди-
телей тейлериозов животных. Северная граница его ареала начи-
нается от Астраханской области, проходит по Южному Казахстану
и Киргизии. В северных районах клещи обитают в помещениях
для скота, в южной части ареала клещей находят как в помещени-
ях, так и на пастбищах.
507
Рис. 190. Иксодовые клеши, присосавшиеся к телу коровы
У этих клещей одна генерация в течение года.
Н. detritum — двуххозяинный клеш: личинки и нимфы парази-
тируют на одном животном, имаго — на другом. Переносчик воз-
будителей тейлериоза. Распространен в полупустынных зонах За-
кавказья, Южном Казахстане, республиках Средней Азии.
Н. plumbeum—двуххозяинный клеш. Переносчик Р. caballi,
N.equi. Распространен в Закавказье, на Северном Кавказе, в
Нижнем Поволжье. Калмыкии, на Украине, в Южном Казахстане
и республиках Средней Азии. Личинки и нимфы питаются в ос-
новном на птицах. Имаго паразитирует преимущественно на
крупном рогатом скоте и лошадях.
Н. scupense — однохозяинный клещ. Переносчик Th. annulata,
N. equi. Распространен в Саратовской и Курской областях, Ниж-
нем Поволжье, на Украине, в Центральном Казахстане и южнее,
где он встречается повсеместно, в том числе и в горах до 1000 м
над уровнем моря.
Клеши паразитируют преимущественно в холодное время
года — с октября по май. В период потепления (в марте — мае)
самки отпадают с животных, в июне откладывают яйца, личин-
ки выходят в июле и остаются неактивными до наступления хо-
лодов.
Род Dermacentor. Включает шесть видов, паразитирующих на
животных, но эпизоотологическое значение имеют D. pictus и
D. marginatus. Треххозяинные клеши. Распространены преимуще-
ственно в лесных, лесостепных районах европейской части Рос-
сийской Федерации, Нечерноземной зоне, на Украине, в Казах-
508
стане, республиках Средней Азии, Западной Сибири и на Дальнем
Востоке.
В стадии имаго паразитируют ранней весной на лошадях, круп-
ном рогатом скоте, овцах, козах, верблюдах, собаках, зайцах, вол-
ках и т. д. Личинки и нимфы обитают на грызунах, а иногда на
хищниках. Самки в апреле — мае откладывают яйца, из которых
четом вылупляются личинки, нападающие на животных с наступ-
лением более влажного летнего периода или осенью. Перезимо-
вывают в имаго.
Род Haemaphysalis. Треххозяинные клеши. Распространены на
Северном Кавказе, в Восточном Закавказье, степных районах Ук-
раины и на Дальнем Востоке. Особенно много клешей обитает на
целинных степных и предгорных пастбищах. Клеши паразитиру-
ют на овцах, козах, крупном рогатом скоте преимущественно осе-
нью, но иногда и весной. Личинки и нимфы паразитируют на
мелких животных — зайцах, ежах и на степных птицах.
Н. otophila переносит возбудителей анаплазмоза и пироплазмо-
за овец. Н. longicornis переносит Th. sergenti на Дальнем Востоке.
Род Rhipicephalus. Наибольший вред животным причиняет
двуххозяинный клеш Rh. bursa — переносчик возбудителей пиро-
плазмидозов и анаплазмоза овец и коз.
Распространен клеш преимущественно в зонах пастьбы овец и
коз — в Северной Осетии, Чеченской Республике, в Ингушетии,
Дагестане, Закавказье, Краснодарском крае, Крыму, на побережье
Черного моря и в Туркмении. Основные биотопы клешей — це-
линные пастбища и пастбища с редкими кустарниками. Имаго
паразитирует на овцах и крупном рогатом скоте с начала весны
(с марта), но самая интенсивная заклешеванность — май — июль.
Личинки нападают на крупный рогатый скот и овец во второй по-
ловине лета и осенью.
Род Boophilus. На территории Российской Федерации из этого
рода обитает однохозяинный клеш В. calcaratus, который парази-
тирует только на крупном рогатом скоте. Он служит переносчи-
ком Babesia bigeminum, Francaiella colchica. Напившись крови,
самки отпадают с животных и откладывают яйца, из которых че-
рез 1 — 1,5 мес вылупляются личинки, способные голодать до
7 мес. Прикрепившись к животному, личинки, а затем нимфы и
имаго паразитируют на нем 21—30 дней. В течение года клеши об-
разуют до трех генераций: первую — в апреле — мае, вторую — в
июле — августе и третью — в сентябре — ноябре.
Меры борьбы с иксодовыми клещами. С иксодидами борются
путем уничтожения их в биотопах (местах обитания) и на живот-
ных. Борьба с клешами в биотопах более целесообразна, так как
исключает использование акарицидов для обработки животных.
Учитывая то, что многие виды клешей проходят фазы развития на
земле, наиболее эффективный метод борьбы с ними — распахива-
ние и создание пастбищ с сеяным травостоем. При распахивании
509
изменяются температура и влажность почвы, что создает небла-
гоприятные условия для существования клещей.
При перегоне животных на горные пастбища и обратно необ-
ходимо правильно определить время их перегона, так как долины
и предгорные зоны обычно заселены клещами. Перегонять живот-
ных в горы лучше весной, а спускать осенью при низкой темпера-
туре почвы, когда активность клещей не проявляется. Целесооб-
разно животных перевозить на отгонные пастбища по железной
дороге или автотранспортом.
Для борьбы с Н. anatolicum и Н. detritum применяют обработки
помещений 0,2%-ной водной эмульсией бензофосфата, 2%-ным
раствором кристаллического (97%-ного) хлорофоса, 0,5%-ной
водной эмульсией анометрина-Н (весметрин, перметрин, стомо-
зан) из расчета 200—400 мл на 1 м2 площади.
Удобно обрабатывать помещения аэрозолями. Для этого при-
меняют «Аэрол-2» или аэрозоли хлорофоса (д. в. 97 %). Норма
расхода 20 мл на 1 м3. Рекомендуют также термические аэрозоли,
которые получают из шашки инсектицидной фумигантной
(ШИФ-1) и перфорированной хлорофоссодержащей шашки
(ПХСШ-143) из расчета 1 г на 1 м3.
Перед тем как размещать животных, помещения проветривают
в течение 3—4 ч, а затем обмывают горячей водой кормушки и
проветривают 3—4 ч.
Уничтожение клещей на животных. С этой целью наиболее ши-
роко применяют опрыскивание или купание животных в акари-
цидных жидкостях.
Для крупного рогатого скота и овец используют стационарные
проплывные ванны. Сооружают их по проектам обычно из желе-
зобетона недалеко от ферм, но вдали от водоисточников.
При выборе препарата для обработки учитывают возможность
его токсичного воздействия на организм животных. Нельзя обра-
батывать акарицидами беременных животных за месяц до родов
и молодняк до 3-месячного возраста. Необходимо строго руко-
водствоваться инструкцией (наставлением) по применению пре-
парата.
Крупный рогатый скот опрыскивают 0,05%-ной водной эмуль-
сией анометрина-Н (весметрин, перметрин, стомозан), 0,2%-ной
водной эмульсией бензофосфата (фозалон), 1%-ным раствором
хлорофоса (хлорофос 97%-ный кристаллический) 1 раз в 7—
10 дней из расчета 1—3 л на животное. Рекомендуют также поли-
вать спину препаратом сульфидофос-20 в дозе 1 мл на 10 кг массы
тела с интервалом 20 дней, а также препарат дерматозоль в аэро-
зольных и беспропеллентных баллонах (60—80 г препарата на
одно животное).
Уничтожение иксодовых клещей на овцах осуществляется пу-
тем обработки их эмульсиями препаратов в ваннах (как при псо-
510
роптозе). Для купания овец используют водные эмульсии: 0,02%-
ную анометрина-Н (весметрин, перметрин, стомозан), 0,2%-ную
бензофосфата, 0,05%-ную диазинона (неоцидол). Купают живот-
ных 1 раз в 10 дней. Эффективны также препараты, применяемые
при псороптозе.
24.2. АРГАСОВЫЕ КЛЕЩИ
Клещей семейства Argasidae делят на два подсемейства:
Argasinae и Omithodoriae. У первых имеются выраженный боковой
шов и краевые ранты, передний край тела округленный, у вторых
не видно ни бокового шва, ни ранта, передний край тела углова-
тый.
Персидский клещ —Argas persicus. Паразитирует на птице. В
стадии имаго достигает 5—10 мм длины и 3—6 мм ширины. Хо-
боток находится на вентральной поверхности тела, глаз нет.
Голодные клещи желто-серого цвета, яйцевидной формы,
плоские, насосавшиеся — темно-стального цвета, бобовидные.
Клещ широко распространен на юге (Саратовская область, Се-
верный Кавказ, Закавказье, юг Украины, Южный Казахстан,
Средняя Азия).
Метаморфоз персидского клеща возможен при температуре не
ниже 20° С. Все активные фазы клеща, кроме личинки, избегают
света и поэтому нападают в ночное время. Днем клещи прячутся в
различных укрытиях (трещины, щели, насесты, под корой деревь-
ев). Могут многократно питаться, и после каждого питания самка
откладывает яйца. При оптимальной температуре (27—30° С) из
яиц выходят личинки, которые нападают на птиц и присасывают-
ся на шею, под крыльями, в области клоаки и в других местах. Че-
рез 3—10 дней они отпадают и превращаются в нимфу первой ста-
дии, которая после питания сначала превращается в нимфу вто-
рой, затем третьей и иногда четвертой стадии. Последняя нимфа
линяет в имаго. Цикл развития завершается за 1—2 года. В пусту-
ющих птичниках клещи способны голодать до 2—3 лет.
A. persicus — в активных фазах переносчик возбудителей бор-
релиоза, холеры, туберкулеза, тифа и паратифа птиц. При интен-
сивной инвазии клещи обескровливают птицу, беспокоят ночью,
лишая отдыха, куры истощаются, снижается яйценоскость. При
укусах в ранку попадает слюна, обладающая токсичными свой-
ствами.
Меры борьбы. Мероприятия по борьбе с персидскими клещами
проводят во время санитарных перерывов. Для обработки птични-
ков используют 0,5%-ные водные эмульсии бензофосфата, карбо-
фоса (шанс), диброма, 1%-ные водные эмульсии неоцидола (диа-
зинон), циодрина и трихлорметафоса-3, а также пиретроиды на
511
основе перметрина и циперметрина (перметрин, стомозан, экто-
мин и др.). Норма расхода 100—200 мл на 1 м2. Препараты при-
меняют двукратно с интервалом 12—15 дней. Средства механиза-
ции—ДУК, ВДМ, гидропульты. Широко используют направ-
ленные аэрозоли, получаемые при помощи ТАН, ИВАН, САГ-1,
АГ-УД-2; при этом расход препарата сокращается.
В целях профилактики заноса персидского клеща с птицей ее
перед вводом в помещение тщательно осматривают и выдержива-
ют в условиях изоляции 12 сут.
Кошарный клещ — Alveonasus lahorensis. Паразитирует на овцах,
верблюдах, реже на других животных. Нападает и на человека. Об-
наружен на Кавказе, в Казахстане и Среднеазиатских республи-
ках. В кошарах клещей обнаруживают в щелях и трещинах стен,
между камнями, а также в норах грызунов.
Самка сосет грызунов и откладывает яйца, из которых через
14—15 дней выходят личинки. После питания личинки, не поки-
дая животного, линяют и превращаются последовательно в нимфу
первой, второй и третьей фаз. Весь этот период длится от 3 нед до
1,5 мес. Отпавшие нимфы через несколько месяцев линяют в има-
го. Имаго могут голодать 7—10 лет.
Уничтожают кошарного клеща теми же препаратами, что при-
меняют и для обработок помещений крупного рогатого скота.
Рекомендуют купание овец в ваннах (см. Псороптоз). В стойло-
вый период эффективны поливания спины животного диоксафо-
сом-К в дозе 40 мг на 1 кг массы тела, а также препаратом суль-
фидос-20 в дозе 20 мг на 1 кг массы тела двукратно с интервалом
30 дней.
24.3. ГАМАЗОИДНЫЕ КЛЕЩИ
Из паразитических клещей надсемейства Gamasoidea большую
опасность представляет куриный клещ — Dermanyssus gallinae. Он
переносит возбудителей боррелиоза, орнитоза, холеры и чумы
птицы, а также является жадным кровососом. При интенсивном
нападении снижается яйценоскость, упитанность, отмечается па-
деж молодняка.
Тело клеща удлиненно-овальное, длиной 0,75 мм, густо покры-
то волосками, хоботок длинный, колюще-сосущего типа
(рис. 191). В голодном состоянии клещи светло-желтого цвета, на-
сосавшись крови, становятся красными, а затем лилово-коричне-
выми. Личинки кровь не сосут.
Клещи обитают в птичниках, укрываются в щелях, трещинах,
мусоре, а также в гнездах синантропных птиц. Могут нападать на
обслуживающий персонал и вызывать у них зуд кожи.
Полный цикл развития D. gallinae при оптимальных условиях
512
(температура 20—25 °C, влажность
70—100 %) длится 6—12 дней и про-
ходит фазы яйца, личинки, прото-
нимфы, дейтонимфы и имаго.
Клещи активны ночью, днем пря-
чутся в укрытиях. Голодать способны
более 11 мес. Температура ниже 5 °C
убивает клещей.
Борьбу с куриными клещами про-
водят в освобожденных от птиц по-
мещениях во время санитарного пе-
рерыва. Птичники опрыскивают из
ДУК, ЛСД, ВДМ или УДП двукрат-
но с интервалом 5—7 дней 1—2%-ным
раствором хлорофоса, 0,25%-ной
эмульсией диазинона, 0,02%-ной
эмульсией ДДВФ или стомозана,
0,25—0,5%-ной эмульсией циодрина
или дикрезила. Норма расхода 100—
200 мл препарата на 1 м2 поверхнос-
ти. Используют и аэрозоли указан-
Рис. 191. Самка куриного клеща
ных препаратов, которые получают
при помощи аэрозольной насадки
ТАН или ПВАН, применяют также термомеханические акари-
цидные аэрозоли при помощи аэрозольного генератора АГ-УД-2
из расчета 7—10 мл на 1 м3 помещения. Эффективны термичес-
кие аэрозоли перметрина и циперметрина, получаемые при воз-
гонке шашек ШИФ-Ц и ШИФ-П, последнюю можно применять
в присутствии птицы.
Лабораторная работа
Задания. 1. Изучить морфологию различных фаз иксодовых, га-
мазоидных и других клещей. 2. Освоить методы диагностики вар-
рооза, акарапидоза пчел, лернеоза и аргулеза рыб.
Оборудование и материалы: лупы; микроскопы; предметные, часовые стекла;
препаровальные иглы; бактериологические чашки; спирт, 10%-ный раствор гид-
роксида калия; иксодовые, аргасовые, гамазоидные клещи, их яйца; клещи — воз-
будители варрооза пчел; соты с запечатанными ячейками трутневого расплода;
пораженные клещами пчелы, личинки и куколки пчел; разные фазы трутней;
рыба, зараженная рачками родов Lernaea и Argulus.
Место занятия: лаборатория паразитологии.
Методика проведения занятия. Преподаватель объясняет мето-
дики изучения клещей, основные морфологические признаки, ха-
513
рактерные для семейства и рода. Затем учащиеся при помощи луп
определяют пол клещей, дифференцируют до семейства и рода.
Самостоятельно при помощи луп обнаруживают клещей — возбу-
дителей варрооза на пчелах, трутнях, расплоде; исследуют пора-
женных акарапидозом пчел, проводят обработку пчел в 10%-ном
растворе гидроксида калия путем кипячения в течение 5—6 мин;
под малым увеличением микроскопа препарируют трахеи пчел;
обнаруживают A. woodi; исследуют рыбу, зараженную аргулезом и
лернеозом; изучают морфологические особенности рачков из ро-
дов Lernaea и Argulus.
Занятия заканчиваются проверкой усвоения материала.
25. ЛИНГВАТУЛЕЗ (ПЕНТАСТОМОЗ)
Лингватулез вызывает носовая пятиустка Linquatula serrata.
Взрослые особи паразита локализуются в дыхательных путях (но-
совой полости и лобных пазухах), личиночные стадии — в мезен-
териальных лимфатических узлах собак, волков, лисиц, лошадей,
крупного и мелкого рогатого скота, змей, крокодилов и других
животных.
Возбудитель. Тело вытянутое, червеобразное, суживающееся к
заднему концу. Состоит из 40—80 отдельных колец. Кутикула тон-
кая, светлая. Самки длиной 130 мм, самцы —20 мм. Кишечник в
виде прямой трубки. Дыхательной, кровеносной и выделительной
систем нет.
Личинки длиной 4—6 мм, шириной 1,2—1,5 мм. Яйца мелкие,
до 0,09 мм (рис. 192).
Биология развития. Яйца во внешнюю среду из носовой полос-
ти дефинитивного хозяина выделяются со слизью. В организм жи-
вотных они попадают с растениями (травоядные), пищей (хищ-
ные), реже при обнюхивании объектов внешней среды.
Промежуточными хозяевами служат зайцы, кролики и другие
млекопитающие. В желудках этих животных из яиц выходят ли-
чинки (шиповатые), мигрируют в мезентериальные лимфоузлы и
другие внутренние органы. Человек — случайный хозяин парази-
та, в его организм он попадает при поедании сырого мяса или при
питье из водоемов, зараженных яйцами паразита.
Симптомы болезни. У зараженных животных развивается ката-
рально-гнойный ринит, фронтит. Отмечается истечение из носа,
животные беспокоятся, трясут головой, снижается аппетит, рабо-
тоспособность, животные худеют.
Диагностика. При жизни диагноз ставят на основании клини-
ческих признаков, исследования носовых истечений и фекалий.
Посмертно вскрывают носовую полость и придаточные пазухи
носа и обнаруживают взрослых особей. Тканевый лингватулез
514
Рис. 192. Биология развития Linquatula serrata:
7 —самка; 2 — яйцо; 3 — личинка 7стадии в промежуточном хозяине; -/—личинка 77
покоящейся стадии в дефинитивном хозяине; 5 — шиповатая личинка; 6 — взрослая особь
(пентастомоз) животных (жвачных, грызунов и др.) диагностиру-
ют при вскрытии и осмотре туш. С помощью компрессориума
(как при трихинеллоскопии) исследуют мезентериальные (брыже-
ечные), средостенные, плечевые, подвздошные и поясничные
лимфатические узлы. Узелки лингватулезного происхождения до-
вольно крупные, паразиты 4—7,8 мм длиной и 1,4 мм шириной,
поэтому их довольно легко обнаружить.
У змей и других пресмыкающихся, рептилий и черепах диагноз
ставят, как указано выше, с использованием трихинеллоскопичес-
кой техники. При этом особое внимание обращают на легкие и
ткани, соприкасающиеся с ними.
Лечение. Эффективны подкожные инъекции ивомека из
расчета 1 мл на 50 кг массы тела трехкратно с интервалом 7 дней.
Лабораторная работа
Задания. Ознакомиться с анатомоморфологическими призна-
ками имагинальных фаз слепней, комаров, мошек, мокрецов,
вшей, власоедов, пухопероедов, овечьего рунца, оленьей крово-
соски, блох; с препаратами яиц гиподерм, гастрофилюсов, вшей,
власоедов, пухопероедов. Схематично зарисовать контуры вши и
власоеда.
Оборудование и материалы: микроскопы; лупы; пинцеты; препаровальные
иглы; чашки бактериологические; предметные и покровные стекла; коллекция
насекомых (слепни, комары, мошки, мокрецы, вши, власоеды, пухопероеды, бло-
хи и кровососки); плакаты, рисунки и таблицы этих насекомых; препараты яиц
оводов, вшей, власоедов, пухопероедов.
Место занятия: лаборатория паразитологии.
Методика проведения занятия. В начале занятия преподаватель
кратко объясняет, используя плакаты и рисунки, морфологичес-
кие особенности имагинальных фаз насекомых.
С помощью луп и микроскопов учащиеся самостоятельно оп-
ределяют строение вышеуказанных насекомых и выполняют схе-
матические зарисовки.
Практическое занятие 1
Задания. Ознакомиться с инсектицидами — карбофосом, гипо-
дермин-хлорофосом, диоксафосом, перметрином, оксаматом, ди-
фосом, аэрозольными препаратами и дустами; освоить технику
приготовления 3—20%-ных эмульсий оксамата, 0,025—0,05%-ных
эмульсий перметрина, 3—5%-ной суспензии коллоидной серы;
обработать крупный рогатый скот 0,025%-ной водной эмульси-
ей перметрина (стомозана) против вшей, 3%-ной водной
516
эмульсией оксамата методом крупнокапельного опрыскивания
против слепней.
Оборудование и материалы: перметрин; оксамат; гидроксид натрия; весы; вед-
ра; вода; воронки; мерные цилиндры; марлевые повязки; респираторы; защитные
очки; резиновые перчатки; фартуки; резиновые сапоги; гидропульт; марлевые
мешочки.
Место работы: учебно-производственное хозяйство техникума
или ферма колхоза, совхоза.
Методика проведения занятия. Учащихся делят на несколько
звеньев. За звеном закрепляют животных — крупный рогатый
скот, овец, свиней. Определяют участки для проведения дезин-
секции животных (специально оборудованные площадки, загоны
и т. п.). Обработку проводят вне помещений.
Преподаватель объясняет цель обработки животных, выбор
инсектицида, механизм действия препарата на паразитов, его
дозу. Затем учащиеся самостоятельно (но под наблюдением пре-
подавателя или ветеринарного врача) обрабатывают животных.
По окончании занятия учащиеся моют с мылом руки, лицо и
очищают одежду от инсектицида. О проведенной обработке жи-
вотных учащиеся составляют акт по установленной форме.
Практическое занятие 2
Задания. Ознакомиться с препаратами: гиподермин-хлорофос,
диоксафос-К, турингин, битоксибациллин, оксамат, терпеноид-
ный репеллент и др.; освоить технику приготовления щелочного
раствора хлорофоса, 3%-ной водной эмульсии оксамата, 0,5%-ной
водной суспензии битоксибациллина; обработать свиноферму в
присутствии свиней против мух аэрозолем ДДВФ, крупный рога-
тый скот против гнуса 3%-ной эмульсией оксамата (опрыскива-
нием); овец аэрозолями турингина-1 против эстроза.
Оборудование и материалы: гидроксид натрия; оксамат; турингин-1; битокси-
бациллин; вода; весы; воронки; мерные цилиндры; респираторы; резиновые пер-
чатки; фартуки; резиновые сапоги; автомаксы; аэрозольный генератор.
Методика проведения занятия. Учащихся делят на группы. За
каждой закрепляют животных. Определяют участки для проведе-
ния работ (свиноферму, овчарню, специально оборудованную
площадку для крупного рогатого скота).
Преподаватель объясняет цель и задачи занятия, выбор инсек-
тицида, механизм его воздействия на паразита, дозу и ограниче-
ния по применению. Затем учащиеся под наблюдением врача об-
рабатывают помещения и животных. О проведенной обработке
животных учащиеся составляют акт по установленной форме.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Авителлиноз 167
Адолескарий 78, 86
Акантелла 206, 210, 211, 213
Акантор 206, 214
Акантоцефалезы 204
Акарапидоз пчел 502, 503
Акариформные клещи 477
Аллергическое влияние 29, 51, 100
Альвеококкоз 159
Альфортиоз 254
Амидостомоз 273
Анаплазмоз 422
Анкилостоматидозы 276
Анкилостомоз 276
Антискребнин 208
Антропогельминтозооноз 14
Апистар 502
Арахнология 9
Аргасовые клещи 511
Аргулез 499
Аскаридиоз кур 227, 239
Аскаридный тип развития 231, 234
Аскариоз свиней 227
----кишечный 228
----миграционный 228
Афаниптероз 454
Ацемидофен 82
Ацетвикол 82
Аэрозоль 434, 441, 444
Бабезиоз 332, 335, 342—345
Байварол 502
Балантидиоз 409
Барбагалло 63, 430
Биовермин 238
Биогельминтоз 48
Бирки ушные 434
Битионол 88, 173, 210
Бициллин 391, 426
Блохи 454
Бокоплав (гаммарус) 209, 300
Боррелиоз 426
Ботрии 127, 191
Ботриоцефалез 191
518
Браулез 456
«Бродяжки» 417
Бульбус 220
Бунамидин оксинафтоат 179
Буностомумы 260, 262, 264, 265
Бурса половая 127
— хвостовая 218
Вакуоли пищеварительные 387, 409
— сократительные 410, 412
Ванны противопаразитарные 68, 70,
388
Варроабраулин 502
Варроксан Т-1 501
Варрооз пчел 500
Вермитан 273
Вирулентность 32
Власоглав 243
Влияние паразитов аллергическое 29,
50
----инокуляторное 30
----механическое 28, 50
----токсическое 30, 50
----трофическое 30
Водянка тела 113
Вольфартиоз 444
Вскрытие гельминтологическое непол-
ное 63
----полное 62
Галосфен 196
Гамазоидные клещи 512
Гаметогония 354
Гамонт 386
Гастролиенальная связка 304
Гастрофилез 445
Гвоздичники 194
Гельмингозоонозы 13
Гельминголарвоскопия 58
Гельминтология 9
Гельминтоовоскопия 54
Гельминтоскопия 59
Гемагглютинация 444
Гематурия 322
Гемолимфа 500
Гемомеланин 108
Геогельминт 220
Геогельминтоз 48
Гетеракиоз птиц 224
Гидатигероз кошек 187
Гиподерматоз 436
Гипопигий 456
Гиродактилез рыб 66
Гистомоноз 403
Глаза фасеточные 452
Глазки Лейкарта 90
Глиссонова капсула 80
Гнус 464
Гранатные тела 338
Дактилогирозы рыб 68
Дафния 216
Двенадцатиперстник 445
ДДВФ 297
Дегельминтизация диагностическая 61
— имагинальная 49
— постимагинальная 49
— преимагинальная 49
Дезакаризация 480
Дезинвазия (текущая, профилакти-
ческая, заключительная) 45
Дезинсекция 473
Делафондиоз 254
Демодекоз 489, 492
— папулезная форма 493
— пустулезная форма 493
Дестробиляция 169
Диагностика иммунологическая 61
— посмертная 62
Дигенетические 71
Диграммоз рыб 188
Дикроцелиоз 89 .
Диктиокаулезы жвачных 282 V
Диноспоры 389
Дипилидиоз 175
Диплостомоз рыб 105
Дирофилярии 279
Дирофиляриоз плотоядных 279
Диск фиксаторный (прикрепитель-
ный) 66
Дискокотилез рыб 73
Дифиллоботриоз 179
Дронтал 179
Жгутики 387
Жгутиконосец 387, 388, 394
Желвак 437
Железы цементные 214
— межпроглоттидные 159
«Желтые шары» 386
Желудочный сок искусственный 249,
273
Жизнеспособность метацеркария 123
Зигота 325
Зона латентная, благополучная, угро-
жаемая, энзоотическая 327
Зоошампунь 434
Ивомек 230, 273
—плюс 83
— микрогранулированный 224, 275
Изоспорозы 379
Иксодовые клещи 505
Имаго 129, 158
Имагомикропопуляция 36
Имагопопуляция 35
Иммунитет при гельминтозах 56
Инвазионные болезни 31, 32
Индифферентное сожительство 19
Инсектицид 432
Инсектоакарицид 432
Интенсивность инвазии 40, 41
Инфекционные болезни 9
Инфильтрирующий рост 158
Инфузория 409
Источник заражения 39
— распространения 38
Ихтиободоз (костиоз) 387
Ихтиофтириоз 415
Кавиоз 194
Камала 196
Камбендазол 93
Канал экскреторный 72, 119, 128
Кариофиллез 194
Карпоед (карповая вошь) 499
КАС 502
Кастрация паразитарная 118
Кинетопластида 316
Кислота молочная 501
— муравьиная 501
— щавелевая 501
Клонорхис 101
Кнемидокоптоз 489
Кожееды 474
Кокцидиозы 353
Кокцидиостатики 359
Коллембола 168
Кольцепреципитация 444
Комары 467
Комменсализм 22
Конъюгация 318
Корацидий 192
Кошарный клещ 512
Кровососка оленья 452
Крустацеозы рыб 497
Ларва (личинка) 24, 129
Ларвоэндопопуляция 36
Левамизол 223
Лейшманиоз 406
Лентецы 127, 179
519
Лернеоз рыб 498
Либеркюновы железы 244
Лигулез рыб 189
Лигулидозы 188
Лимоновидная капсула 245
Лингватулез 514
Липоптеноз 452
Локсуран 296
Лопатол 179
Макраканторинхоз 206
Макрогамета 318, 354
Макрогаметоцит 318
Макромеронт 338
Макронуклеус 409
Маллофагоз 459
Марита 73
Мебендазол 233, 234, 267
Мезоцестоидоз 183
Мелеоз 457
Мелофагоз 450
Мерозоит 317, 354
Метагонимус 101
Метаморфоз неполный 436
— полный 436
Метастронгилезы свиней 291
Метацеркарий 92, 95, 98, 103, 105, 108,
121
Метод борьбы биологический 114
---с моллюсками 114
---физический 114
---химический 114
Методы (исследования фекалий)
гельминтоларвоскопические 58
— Дарлинга 57
— последовательных смывов 56
— Фюллеборна 57
— Щербовича 57
Меторхис 101
Миграция личинок 311
Микрогамета 354
Микрогаметоцит 318
Микромерозоит 338
Микромеронт 338
Микронуклеус 409
Микрофилярии 279
Минуции 431
Мирацидий 73, 77, 91, 121
Мокрецы 304, 467
Моли восковая, шубная, меховая 475,
476
Мониезиоз весенний 162
— осенний 162
Мошки 304, 465
Муравьи 90
Мутуализм 20
Мухи зоофильные 461
— коровницы 294
Мюллериоз 290
Насекомые 429, 430
Нафтамон 238
Нематодирус 260
Нематодозы 217
Неоэхиноринхоз рыб 212
Нилверм 230, 266
Нимфа 481, 490
Нить полюсная 418
Нозематоз пчел 418
Нотоэдроз 487
Нутталлиоз 346
Оводы 436, 439, 441, 445
Оксиуратозы 220
Оллуланоз свиней 270
Онкосфера 131, 138
Онхоцеркозы 303
Оодиниумоз рыб 388
Ооциста 353, 356, 360, 363, 367, 2
372
Описторхоз 97, 119
Орган Брандеса 105, 108
Орган железистый апикальный 199
Орибатидные клещи 160, 184
Отодектоз 488
Пальмелла 389
Панакур 93, 97
Парагонимоз 101
Паразит временный, постоянный,
периодический 24
Паразитизм 15
Паразитология 5, 15
Паразитоценоз 31
Парамфистоматозы 85
Параскариоз лошадей 230
Парафиляриоз 307
Партеногенетическое размножение
Пассалуроз кроликов 223
Патогенность 32
Паукообразные 429
Перфектор 458
Пестициды 432
Пиаветрин 275
Пиперазин 229, 274
Пироплазмидозы 324
Планы перспективный, текущий 44
Платенол 89
Плероцеркоид 180, 189, 197, 201
Полиморфоз уток 209
Политрем 83, 89
Помфоринхоз рыб 214
Постодиплостомоз рыб 107
Празиквантел 100, 179
Преакантелла 210, 214
Присоска терминальная 199
Проглоттида 127
Прокариоты 6, 315
Протеоцефалезы рыб 199
520
Протозоология 9, 315
Протосколекс 150
Протостронгилез 288
Протостронгилидозы 288
Процеркоид 180, 189, 192, 194, 201
Прудовик малый 77
Псевдоамфистомумы 101
Псевдонимфа 457
Псевдоцисты 372
Псороптоз 480
Пузырь экскреторный 119
Пурон 434
Пути заражения (контактный,
перкутанный, трансмиссивный,
внутриутробный) 38, 39
Пчелы-«ползунки» 503
Ракообразные 497
Раскрылица 503
Расплод (пчел) 500
— пестрый 501
— печатный 501
— пчелиный 501
— трутневый 501
Редия 98, 103
Ремнецы 179, 189
Репеллент 432
Реснички 409, 414, 416
РКП 155
РЛА 135, 155
РИГА 135, 155
Рогор 458
Роленол 83
РСКП 155
Рыба сорная 70, 415
Сальмонеллез 420
Санвар 502
Сангвиниколез рыб ПО
--жаберная форма 113
--хроническая форма 113
Сапролегния 70, 311
Сарколемма 244
Саркоптоз 478
— тотальная форма 479
— ушная форма 479
Саркоптоидозы 477
Саркоцистозы 375
Свищевые капсулы 437
Семявыводящие канальцы 72
Сенотаиниоз пчел 458
Сетариоз 303
Симбиоз 19, 20
Синойкия 20
Сифункулятозы 452
Сколекс 127
Скребень-великан 206
Слепни 464
Случная болезнь 401
Солефенотиазиномедно-купоро-
совая смесь 45, 166
Солитер бычий 131
Спикула 218
Спорогония 354
Спорозоит 318, 353
Спороциста 91, 95, 353
Споры 418
Стрептокароз 300
Стробила 127
Стробилоцеркус 187
Стронгилез 254
Стронгилидозы лошадей 253
Стронгилоидозы молодняка 250
Стронгилятозы жвачных 260
Су-ауру 398
Суспензия 434
Схизоцель 218
Таксономия 37
Талерные бляшки 402
Тараканы 473
Тегумент 71, 127
Тедион 503
Тейлериоз 338
Тельце Мелиса 72, 127
Телязиозы 294
Тениаринхоз 131
Тетракотилезы 115
Тетрамизол 253
Тетратиридий 184
Течение болезни (субклиническое,
латентное, хроническое) 40, 41
Тиабендазол 93
Тиазон 459
Тивидин 267
Токсаскариоз плотоядных 237
Токсикоз падевый 420
Токсокароз плотоядных 234
Токсоплазмоз 369, 371
Травняк 445
Триангулины 457
Триенофорозы рыб 196
Трипаносомозы 398
Трипафлавин 391
Трихинелла кишечная 245
Трихинеллезы 244
Триходинозы рыб 414
Трихомоноз 395
Трихоцефалятозы 241
Трофозоит 372, 409
Универм 230
Унцинариоз 276
Усовермит 82
Усоклей 445
Ущемляющий застежковидный
фиксаторный аппарат 73
521
Фазинекс 82
Фасковерм 82
Фасциолезы 76
Фебантел (ринтал) 179, 230
Феналидон 156
Фенасал 179
Фенбендазол 208, 230
Фенотиазин 222, 259, 303, 501
Филиколлез уток 210
Филометроидоз карпа 309
Фольбекс 503, 516
Форезия 457
Формальдегид 413
Фумагиллин 420
Фуразолидон 386
«Фурокарп» 386
Хасстилезиоз 94
Хейлетиоз 496
Хилодонеллез рыб 412
Химиопрофилактика 45
Хищничество 6
Хлорофос 498
Хоботок сосательный 499
Хозяева паразитов 23
— дефинитивные 23
— дополнительные 23
— облигатные 23
— промежуточные 23
— резервуарные 23
— факультативные 23
Хориоптоз 486
Ценуроз 146
Цепень 127
Церкарий 73, 91, 95, 103
Церки 456
Цестода 127
Цестодозы 127
Цилиатозы 409
Циодрин 479, 485
Циприноцестин 192, 196
Циррус 72
Цистицеркоз крупного рогатого
скота 130
— овец 143
— оленей и косуль 144
— пизиформный 145
— свиней 136
— тенуикольный 140
— целлюлозный 136
Цистицеркоид 129, 163, 176
Цистицеркус 130, 136
Цистозоит 372
Цисты 409, 417
— покоя 413
Цитоплазма 316
Черви колючеголовые 204
Черноус 445
Членик гермафродитный 127
— зрелый 127
— молодой 127
Членистоногие 429
Шизогония 354, 385
Шизонт 385
Шистоцефалюс 189
Штаммы 32, 134, 154
Эдемагеноз 439
Эзофагостомоз свиней 268
Эймериозы 353
Экзопопуляция 36
Экстенсивность инвазии 40, 41
Экстенсэффективность 41
Эктопаразит 24
Эндодиогения 372
Эндозоит 372
Эндопаразит 24
Энтеросептол 420
Энтомозы 435
Энтомология 9
Эпидермоптоз 496
Эпизоотология паразитарных бо-
лезней 37
Эстроз 441
Этилдихлорбензилат 503
Эукариоты 6, 315
Эфирсульфонат 503
Эхинококкоз 151
Эхиноринхоз 215
Эхиностоматидозы 102
Эхинохазмоз 101
Ювенильный гормон 469
Яйцо трематодного типа 127, 180, 189
Якорек 445
Ямки присосковидные 115
ОГЛАВЛЕНИЕ
Введение (М. Ш. А к б а е в)....................................... 3
Краткая история развития паразитологии (М. Ш. А к б а е в)..........9
Раздел 1. ОСНОВЫ ОБЩЕЙ ПАРАЗИТОЛОГИИ (М. Ш.Акбаев)..................15
1. Биологические основы паразитологии..............................15
1.1. Типы взаимоотношений организмов в природе..................15
1.2. Хозяева паразитов..........................................23
1.3. Паразито-хозяинные взаимоотношения ........................24
1.4. Паразитоценозы и их роль в развитии патологии..............31
2. Инвазионные (паразитарные) болезни..............................31
2.1. Классификация паразитов и номенклатура инвазионных болезней.32
2.2. Предпосылки возникновения и распространения паразитарных
болезней........................................................33
2.3. Значение систематики в паразитологии.......................37
2.4. Эпизоотология паразитарных болезней........................37
2.5. Учение Е. Н. Павловского о природной очаговости и трансмиссив-
ных болезнях....................................................41
2.6. Противопаразитарные мероприятия............................42
Раздел 2. ВЕТЕРИНАРНАЯ ГЕЛЬМИНТОЛОГИЯ (М. Ш. А к б а е в)...........46
3. Общие сведения о гельминтах и вызываемых ими болезнях...........46
3.1. Виды и направленность дегельминтизации, дезинвазия.........49
3.2. Патогенез и иммунитет......................................50
4. Диагностика гельминтозов ......................................54
4.1. Прижизненные методы диагностики............................54
4.2. Специальные методы диагностических исследований............60
4.3. Посмертные методы диагностики..............................62
Лабораторная работа..........................................63
Практическое занятие.........................................64
5. Моногенеозы рыб.................................................66
5.1. Гиродактилезы рыб..........................................66
5.2. Дактилогирозы рыб..........................................68
Лабораторная работа..........................................70
6. Трематодозы.....................................................71
6.1. Систематика, краткая морфология и биология трематод........71
6.2. Дискокотилез рыб...........................................73
523
6.3. Тетраонхоз рыб.............................................75
6.4. Фасциолезы.................................................76
6.5. Парамфистоматозы...........................................85
6.6. Дикроцелиоз................................................89
6.7. Хасстилезиоз мелкого рогатого скота........................94
6.8. Описторхоз и другие трематодозы плотоядных.................97
6.9. Эхиностоматидозы птиц.....................................102
6.10. Диплостомоз рыб..........................................105
6.11. Постодиплостомоз рыб.....................................107
6.12. Сангвиниколезы............................................НО
6.13. Тетракотилезы............................................115
6.14. Описторхоз карповых рыб..................................119
Лабораторная работа.........................................123
Практическое занятие........................................126
7. Цестодозы......................................................127
7.1. Ларвальные цестодозы .....................................130
7.1.1. Цистицеркоз крупного рогатого скота (финноз).........130
7.1.2. Цистицеркоз свиней (финноз)..........................136
7.1.3. Цистицеркоз тенуикольный ............................140
7.1.4. Цистицеркоз овец.....................................143
7.1.5. Цистицеркозы северных оленей и косуль................144
7.1.6. Цистицеркоз пизиформный кроликов и зайцев............145
7.1.7. Ценуроз церебральный (вертячка)......................146
7.1.8. Эхинококкоз..........................................150
7.1.9. Альвеококкоз.........................................156
7.2. Имагинальные цестодозы....................................158
7.2.1. Мониезиозы жвачных...............'...................159
7.2.2. Авителлиноз жвачных..................................167
7.2.3. Дрепанидотениоз и некоторые другие гименолепидозы гусей.171
7.2.4. Дипилидиоз собак и кошек.............................175
7.2.5. Дифиллоботриозы плотоядных...........................179
7.2.6. Мезоцестоидоз плотоядных животных....................183
7.2.7. Гидатигероз кошек....................................186
7.2.8. Лигулидозы рыб.......................................188
7.2.9. Ботриоцефалез рыб....................................191
7.2.10. Кавиоз и кариофиллез рыб............................194
7.2.11. Триенофорозы хищных и других рыб....................196
7.2.12. Протеоцефалезы пресноводных рыб.....................199
Лабораторная работа.........................................201
Практическое занятие........................................203
8. Акантоцефалезы.................................................204
8.1. Макраканторинхоз свиней...................................206
8.2. Полиморфоз уток...........................................209
8.3. Филиколлез уток...........................................210
8.4. Неоэхиноринхоз рыб........................................212
8.5. Помфоринхоз хищных рыб ...................................214
8.6. Эхиноринхоз рыб...........................................215
Лабораторная работа.........................................217
524
9. Нематодозы...........................................:.........217
9.1. Оксиуратозы...............................................220
9.1.1. Оксиуроз лошадей.....................................220
9.1.2. Пассалуроз кроликов..................................223
9.1.3. Гетеракиоз птиц......................................224
9.2. Аскаридатозы .............................................226
9.2.1. Аскариоз свиней......................................227
9.2.2. Параскариоз лошадей..................................230
9.2.3. Токсокароз плотоядных................................234
9.2.4. Токсаскариоз плотоядных..............................237
9.2.5. Аскаридиоз кур.......................................239
9.3. Трихоцефалятозы...........................................241
9.3.1. Трихоцефалез свиней................................. 242
9.3.2. Трихинеллезы.........................................244
9.4. Стронгилоидозы молодняка..................................250
9.5. Стронгилятозы...........................;.................253
9.5.1. Стронгилидозы лошадей................................253
9.5.2. Стронгилятозы пищеварительного канала жвачных........260
9.5.3. Эзофагостомоз свиней.................................268
9.5.4. Оллуланоз свиней.....................................270
9.5.5. Амидостомоз гусей....................................273
9.5.6. Анкилостоматидозы плотоядных.........................276
9.5.7. Дирофиляриоз плотоядных .............................279
9.5.8. Дикгиокаулезы жвачных................................282
9.5.9. Протостронгилидозы мелких жвачных....................288
9.5.10. Метастронгилезы свиней..............................291
9.5.11. Телязиозы крупного рогатого скота...................294
9.5.12. Тетрамероз уток.....................................297
9.5.13. Стрептокароз уток...................................300
9.5.14. Эхинуриоз уток и гусей............................ 301
9.5.15. Онхоцеркозы животных................................303
9.5.16. Парафиляриоз (сечение) лошадей......................307
9.5.17. Филометроидоз карпов ...............................309
Лабораторная работа.........................................312
Практическое занятие 1......................................313
Практическое занятие 2......................................314
Раздел 3. ВЕТЕРИНАРНАЯ ПРОТОЗООЛОГИЯ (Н. К. К о н о в а л о в,
Т. В. Балагул а)..................................................315
10. Общие сведения о ветеринарной протозоологии...................315
11. Диагностика протозойных болезней..............................320
12. Лечение животных при протозойных болезнях.....................322
13. Профилактика протозойных болезней.............................323
14. Пироплазмидозы животных.......................................324
14.1. Бабезиоз крупного рогатого скота, вызываемый Babesia bigemina.332
14.2. Бабезиоз крупного рогатого скота, вызываемый Babesia bovis....335
14.3. Тейлериоз крупного рогатого скота........................338
14.4. Бабезиозы овец и коз ....................................342
14.5. Бабезиоз (пироплазмоз) лошадей...........................344
525
14.6. Нугталлиоз лошадей.......................................346
14.7. Бабезиоз (пироплазмоз) собак.............................349
Лабораторная работа.........................................351
Практическое занятие........................................352
15. Кокцидиозы животных...........................................353
15.1. Эймериозы кроликов.......................................356
15.2. Эймериозы кур............................................359
15.3. Эймериозы крупного рогатого скота........................363
15.4. Эймериозы мелкого рогатого скота.........................366
15.5. Токсоплазмоз кошек.......................................369
15.6. Токсоплазмоз сельскохозяйственных и других животных......371
15.7. Саркоцистозы сельскохозяйственных и других животных..;...375
15.8. Изоспорозы плотоядных....................................379
15.9. Саркоцистозы собак и кошек...............................383
15.10. Эймериоз карпа и толстолобика...........................385
15.11. Ихтиободоз (костиоз) карпов.............................387
15.12. Оодиниумоз аквариумных рыб..............................388
Лабораторная работа.........................................392
Практическое занятие........................................393
16. Протозойные болезни животных, вызываемые жгутиковыми..........394
16.1. Тритрихомоноз (трихомоноз) крупного рогатого скота.......395
16.2. Трипаносомозы............................................398
16.2.1. Су-ауру (сурра) верблюдов и других животных.........398
16.2.2. Случная болезнь лошадей.............................401
16.2.3. Гистомоноз птиц.....................................403
16.2.4. Лейшманиоз собак....................................406
Лабораторная работа.........................................408
16.3. Цилиатозы ...............................................409
16.3.1. Балантидиоз свиней..................................409
16.3.2. Хилодонеллез рыб............................’.......412
16.3.3. Триходинозы рыб.....................................414
16.3.4. Ихтиофтириоз рыб....................................415
16.3.5. Нозематоз пчел .....................................418
Лабораторная работа.........................................420
Практическое занятие........................................421
17. Прокариоты и вызываемые ими болезни...........................422
17.1. Анаплазмоз крупного рогатого скота.......................422
17.2. Боррелиоз (спирохетоз) птиц..............................426
Раздел 4. ВЕТЕРИНАРНАЯ АРАХНОЭНТОМОЛОГИЯ (Ф. И. В а си-
ле в и ч) ........................................................429
18. Энтомозы.........................................................435
18.1. Морфология, систематика и биология паразитических насекомых.435
18.2. Гиподерматоз крупного рогатого скота.....................436
18.3. Эдемагеноз северных оленей...............................439
18.4. Эстроз овец..............................................441
18.5. Гастрофилез непарнокопытных..............................445
18.6. Вольфартиоз..............................................449
18.7. Мелофагоз овец...........................................450
18.8. Липоптеноз оленей........................................452
18.9. Сифункулятозы............................................452
526
18.10. Афаниптероз собак, кошек и пушных зверей...................454
18.11. Энтомозы пчел..............................................456
18.11.1. Браулез...............................................456
18.11.2. Мелеоз................................................457
18.11.3. Сенотаиниоз...........................................458
18.12. Маллофагозы птиц...........................................459
Лабораторная работа...............................................460
19. Насекомые — переносчики возбудителей трансмиссивных болезней.461
19.1. Зоофильные мухи.............................................461
19.2. Кровососущие двукрылые насекомые ...........................464
19.2.1. Гнус...................................................464
19.2.2. Блохи..................................................470
19.2.3. Клопы..................................................471
19.2.4. Тараканы...............................................473
19.2.5. Кожееды................................................474
19.2.6. Моли...................................................475
20. Акариформные клещи и вызываемые ими болезни.....................477
20.1. Саркоптоидозы...............................................477
20.1.1. Саркоптоз..............................................478
20.1.2. Псороптоз..............................................480
20.1.3. Хориоптоз..............................................486
20.1.4. Нотоэдроз..............................................487
20.1.5. Отодектоз..............................................488
20.1.6. Кнемидокоптоз кур......................................489
20.1.7. Демодекоз крупного рогатого скота......................489
20.1.8. Демодекоз собак........................................492
20.1.9. Хейлетиоз собак........................................495
20.1.10. Хейлетиоз кроликов....................................496
20.1.11. Эпидермоптоз кур......................................496
21. Крустацеозы рыб..................................................497
21.1. Лернеоз ....................................................498
21.2. Аргулез.....................................................499
22. Варрооз.........................................................500
23. Акарапиоз.......................................................502
Лабораторная работа............................................504
Практическое занятие...........................................504
24. Клещи — переносчики возбудителей трансмиссивных болезней........505
24.1. Иксодовые клещи.............................................505
24.2. Аргасовые клещи.............................................511
24.3. Гамазоидные клещи...........................................512
Лабораторная работа............................................513
25. Лингватулез (пентастомоз).......................................514
Лабораторная работа............................................516
Практическое занятие 1.........................................516
Практическое занятие 2.........................................517
Предметный указатель.................................................518