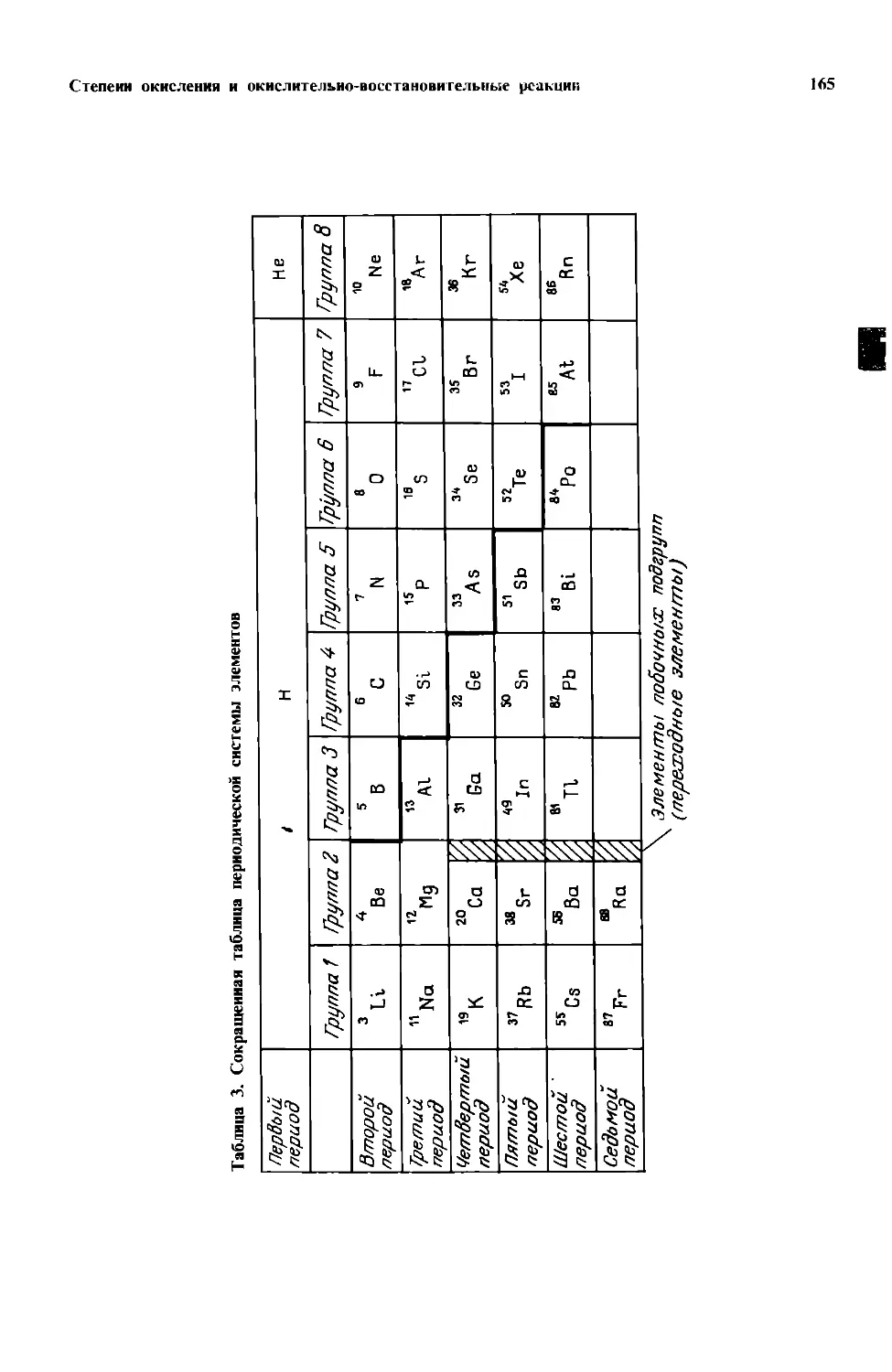
Текст
Й.Нентвиг
М. Кройдер
К. Моргенштерн
Химический
тренажер
Химический тренажер
II
J. Nentwig M. Kreuder K. Morgenstern
Chemistry Made Easy
Part II
A Programmed Course for Self-Instruction
Translated by Edeline Wentrup-Byrne
Verlag Chemie
Weinheim - Deerfield Beach, Florida - Basel
Й.Нентвиг
М.Кройдер
К. Моргенштерн
Химический тренажер
Программированное пособие
для средней школы
В 2-х частях Часть II
Перевод с английского канд. хим. наук Е. Л. Розенберга под редакцией профессора В. М. Потапова
Москва «Мир» 1986
ББК 24.1
Н51
УДК 546
Нентвиг Й. и др.
Н51 Химический тренажер: Программированное пособие для средней школы: В 2-х ч. Ч. II.
Пер. с англ./Нентвиг Й., Кройдер М., Моргенштерн К-М.: Мир, 1986.-535 с.
Учебное пособие по химии, написанное авторами из ФРГ, предназначено для средней школы. По объему материала пособие соответствует подпой школьной программе по химии, но форма подачи материала необычна -это программированный учебник, рассчитанный в основном на самостоятельную работу учащегося и снабженный системой постоянного самоконтроля.
В части II продолжено ознакомление с основными химическими законами и подробно изложена органическая химия в объеме курса средней школы.
Предназначена для преподавателей и учащихся средней школы, учебных заведений, входящих в систему профтехобразования, техникумов.
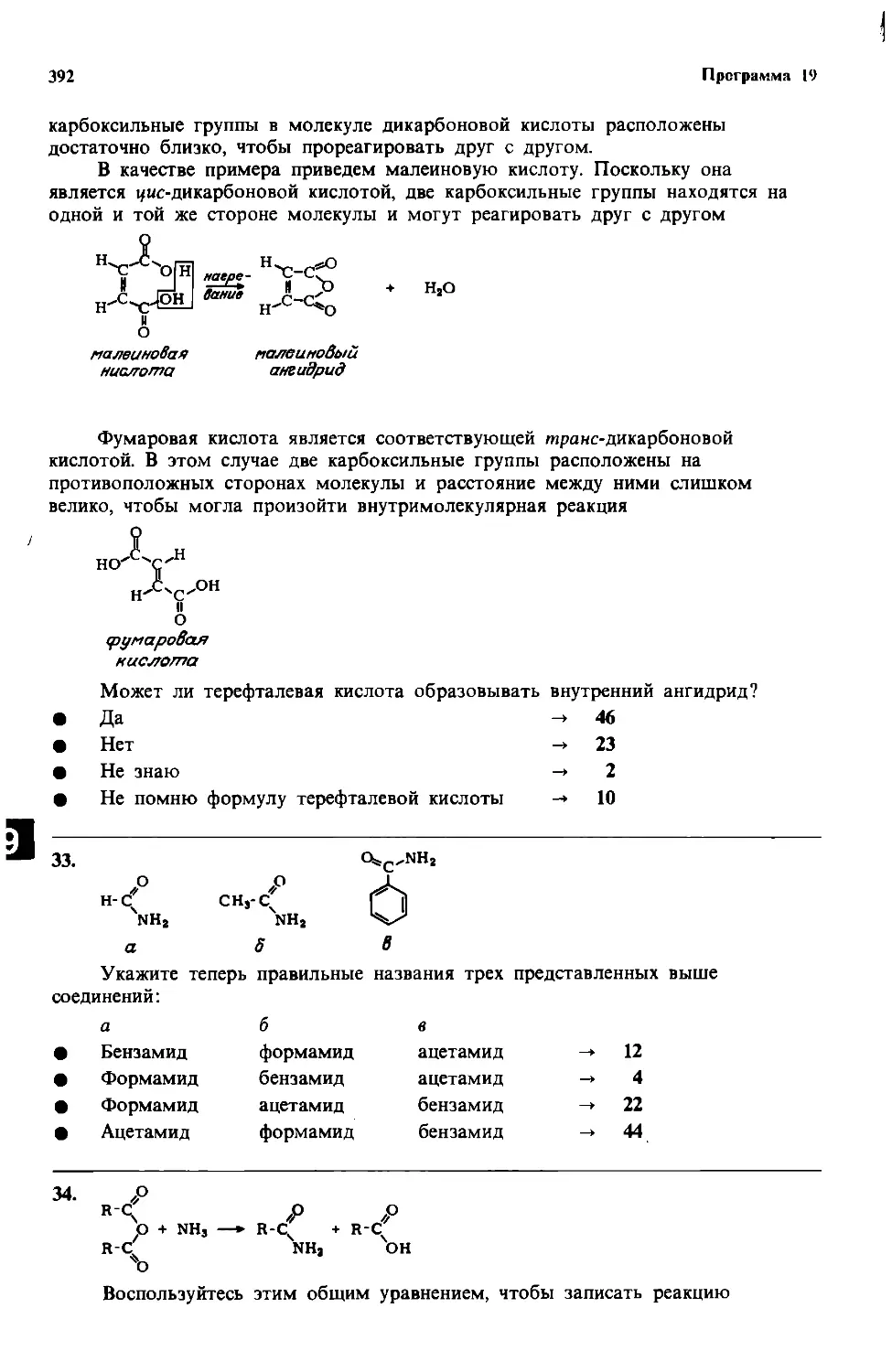
181000000-380 н----------------
041 (01)-86
82-86, ч. 1
ББК 24.1
Редакция литературы по химии
© Verlag Chemie GmbH, D-6940 Weinheim, 1983 © перевод на русский язык, «Мир», 1986.
Как пользоваться этой книгой
Для тех, кто заинтересован в получении основательных знаний по общей химии, эта книга представляет собой эффективное и простое пособие. Используемый в ней метод обучения основан на зарекомендовавшем себя подходе, который носит название «программированное обучение». Охватываемый книгой материал разбит на 25 отдельных программ. В начале к читателю предъявляются минимальные требования, но ситуация изменяется по мере изучения курса. Поскольку наш метод довольно необычен, ниже подробно описываются его особенности.
Материал каждой программы подразделяется на множество мелких частей, или рубрик. В конце каждой рубрики задается один или несколько вопросов. Это делается с целью проверить-действительно ли понято содержание данной рубрики. Такие вопросы могут потребовать записи формулы или уравнения, вычисления некоторой величины, подстановки пропущенных слов в выражения и т. п. После ответа предлагается перейти к другой рубрике, где содержится правильный ответ или где анализируются ошибки, которые вы могли допустить при ответе. Только после этого вы сможете продвинуться в изучении излагаемой темы. Следуя такому принципу, вы пройдете шаг за шагом по всем программам.
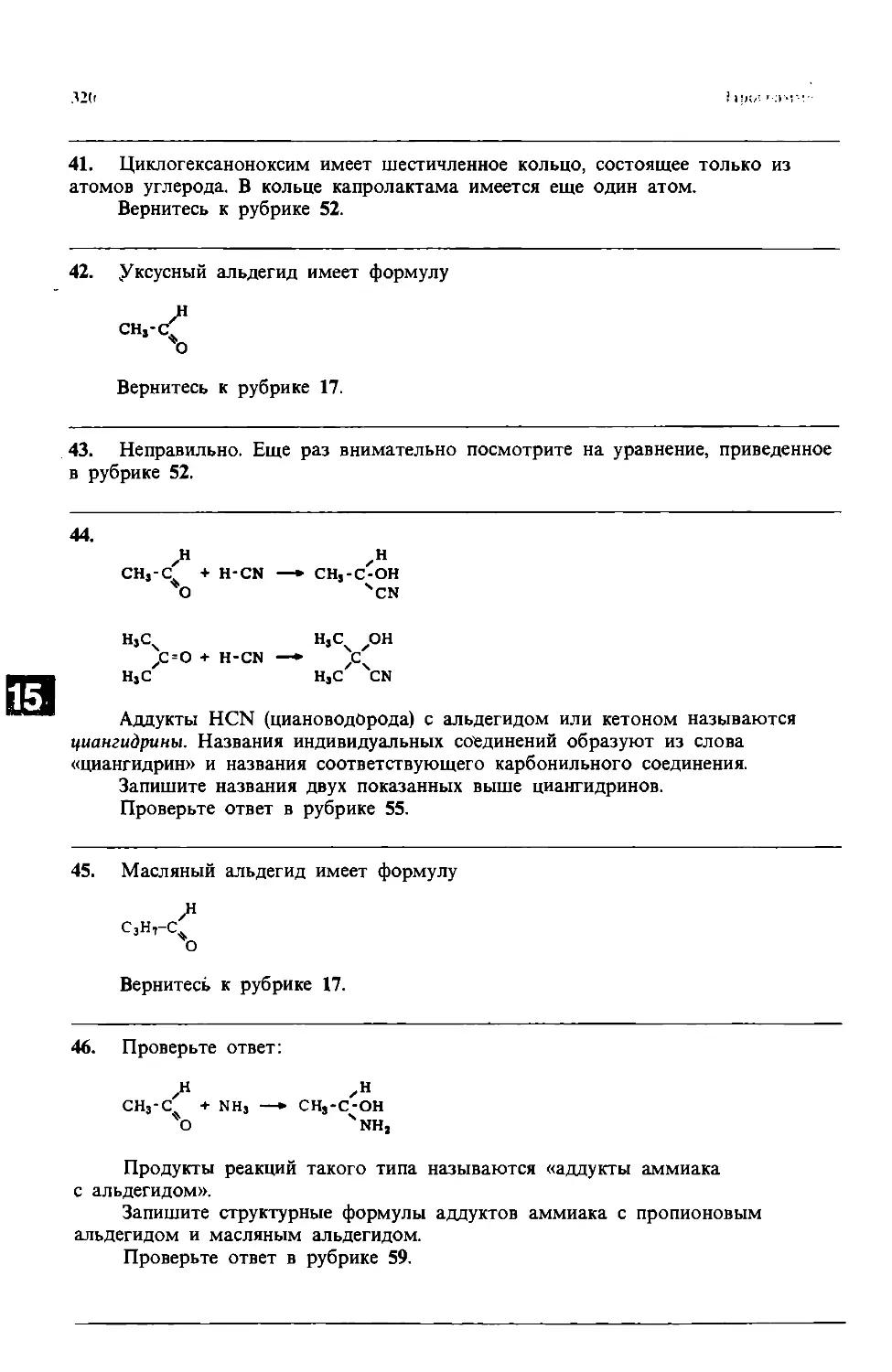
Чтобы подробнее проиллюстрировать наш подход, разберем здесь в качестве примера две очень простые рубрики. Эти примеры продемонстрируют два основных способа постановки вопросов. Заметим, что при изучении каждой программы постоянно нужно иметь при себе карандаш (или ручку) и бумагу.
1. Химию можно изучать по эффективной методике, носящей название «программированное обучение». Материал, рассматриваемый в данном томе, представлен в виде 25 отдельных программ. Теперь вставьте пропущенное слово в следующее предложение:
Мы будем изучать химию по методу ... обучения. Продолжайте чтение с рубрики 11.
От вас требовалось написать: «Мы будем изучать химию по методу «программированного обучения».
Пожалуйста, не вписывайте ваш ответ в книгу-это помешает вам повторить материал на более поздней стадии обучения! Следует записывать все ваши ответы и замечания в тетради или на отдельных листках бумаги.
После записи ответа переходите к указанной вам рубрике.
В рассматриваемом примере следует перейти к рубрике И. Там вы сможете проверить свой ответ. (Постарайтесь убедиться, что, переходя к соответствующей рубрике, вы по ошибке не перескакиваете к новой программе!)
Последовательность прохождения каждой программы определяется не нумерацией страниц, а номерами рубрик, указанными жирным шрифтом. Таким образом, переходя к рубрике 11, вы сможете проверить правильность своего ответа. Слова, которые необходимо было вставить в пропущенную часть фразы, всегда приводятся курсивом.
11. Мы будем изучать химию по методу программированного обучения.
Доказано, что программированное обучение является более эффективной методикой, чем обучение при помощи обычного учебника.
При программированном обучении процесс облегчается тем, что материал разбивают на небольшие порции: это позволяет учащемуся сразу же проверить ответ на каждый вопрос и продвигаться вперед в удобном для него темпе.
Какой способ обучения является наиболее эффективным?
• Использование обычного учебника -> 3
• Использование программированного учебника -> 18
• Между этими способами нет никакой разницы -► 34
• Не знаю -> 54
Теперь учащийся должен выбрать один из предложенных вариантов ответа и затем обратиться к рубрике, указанной в выбранном им варианте.
Если учащийся выберет рубрики 3 или 34, он обнаружит, что его ответ является неправильным. Не следует огорчаться по этому поводу: во всех таких случаях учащемуся оказывается дополнительная помощь. Правильный ответ, разумеется, содержится в рубрике 18.
В тех случаях, когда вы не знаете, как ответить на поставленный вопрос и хотели бы получить дополнительные разъяснения, вам советуют перейти к такой рубрике, как 54. Всегда разумнее последовать этому пути, чем пытаться ответить на вопрос при помощи догадки.
Систематически работая с этим учебником, вы убедитесь в том, что программированное обучение не только легче и приятнее, чем чтение обычного учебника, но также позволяет проходить материал более быстрыми темпами. Однако не следует относиться к программированному обучению, как к волшебному методу, который позволит вам достичь цели без всякого труда! Этот метод отнюдь не позволит вам выучить химию «во сне». Лишь добросовестная проработка каждой программы обеспечит достижение успеха.
Ниже мы дадим некоторые полезные для вас указания:
1. Приступать к проработке каждой программы следует, отдохнув и располагая достаточным временем для ее полного прохождения. Если это возможно, лучше всего проработать каждую программу за один прием, а затем повторно пройти ее несколько раз в последующие дни. Разумеется, если приходится прервать изучение программы, следует отметить номер последней пройденной вами рубрики.
2. Каждая рубрика предназначается для проработки, а не просто для прочтения. Не переходите к следующей рубрике, пока вы не будете полностью уверены, что поняли содержание данной рубрики. Программа не предусматривает возможности прочтения материала в обратной последовательности! Внимательно сверяйте свои ответы с приведенными в следующей рубрике и исправляйте любые ошибки, которые вы допустили. Не расстраивайтесь, если вы сделали ошибки при первой проработке программы. Однако будет весьма прискорбно, если вы не извлечете урока из этих ошибок.
3. Каждый раз, когда вам предлагается выбрать один из возможных ответов на заданный вопрос, следует быть абсолютно честным. Разумеется, мы понимаем, что смошенничать здесь очень просто. Однако мы советуем всегда делать серьезную попытку получить правильный ответ. Мошенничество, несомненно, не приведет вас к успеху. Время от времени у вас будет возможность выбрать в качестве ответа такую фразу, как «Не понял вопроса» или просто «Не знаю». Никогда не отказывайтесь выбрать такой ответ, если
вы, действительно, чувствуете себя неуверенно. Тогда вы будете переадресованы к рубрике, где сможете получить дополнительную помощь.
4. Постоянная проверка усвоения материала и правильного выбора ответов на вопросы вносит в учебный процесс элемент развлечения. Тем самым он постепенно превращается в некое подобие игры. Этот эффект предусмотрен и является очень желательным, хотя таит в себе опасность слишком быстрой проработки программы и даже предпочтения догадки продуманным ответам. Будьте настороже и не допускайте ничего подобного! Работать следует не торопясь, оставаясь спокойным и предельно сосредоточенным.
Успешное обучение требует активного участия со стороны учащегося, немедленной проверки всех ответов и прохождения материала в индивидуально приемлемом темпе. Программированное обучение удовлетворяет всем этим требованиям.
01 Программа 1
Строение атома
1. Эта, вторая, часть книги «Химический тренажер. Программированное пособие для средней школы» начинается с несколько более подробного обсуждения строения атома, поскольку без него нельзя достичь хорошего понимания химических свойств молекул.
Каждый атом состоит из ядра и внешнею электронного облака.
Атомное ядро
Электронное одлако
Ядро состоит из протонов и нейтронов.
Электронное облако, как видно из его названия, состоит из электронов.
Завершите следующую, схему и проверьте затем ответ в рубрике 11.
ядро ~
нейтроны
Атом
электронное ...
1. Атом, в ядре которого содержится 4 протона и 5 нейтронов, имеет атомный номер 4.
Число нейтронов не влияет на величину атомного номера.
Сколько электронов содержится в электронном облаке атома с атомным номером 7?
Проверьте ответ в рубрике 12.
3. ZV-Оболочка может принять максимум 32 электрона. Повторим теперь кратко все сказанное до сих пор о строении атома.
__протоны
, ядро
Атом ' ^-нейтроны
х элентрон-
ное облако - электроны
Электроны заполняют сначала внутренние оболочки электронного облака. Каждая и-я оболочка может принять максимум 2и2 электронов.
После этого краткого повторения уже известных нам сведений об атоме перейдем к его более подробному обсуждению. Протоны и электроны обладают равными по величине, но противоположными по знаку зарядами.
Протоны заряжены положительно (+ ).
Электроны заряжены отрицательно ( — ).
Нейтроны являются электрически нейтральными частицами. Все атомы имеют нулевой результирующий заряд, т. е. электрически нейтральны.
Строение атома
9
Отсюда следует, что число электронов в атоме
Больше, чем число протонов в его ядре
Меньше, чем число протонов в его ядре
Равно числу протонов в его ядре
Равно сумме числа протонов и нейтронов в его ядре
- 43
- 15
-> 37
- 29
4. Протоны, действительно, вносят вклад в массу атома. Однако электронами обычно пренебрегают при рассмотрении атомной массы, потому что электроны имеют очень малую массу. Их масса составляет лишь 1/1850 часть массы протона.
Переходите к рубрике 50.
5. Совершенно верно, атом, у которого заполнены К-, Lr и М-оболочки, имеет 28 электронов.
Нет никакой необходимости запоминать число электронов, которые способна принять каждая оболочка, поскольку существует формула, позволяющая легко вычислить это число. Начнем с примеров:
Первая оболочка (К-оболочка) может принять максимум 2 электрона
2 = 2-1 -1
Вторая оболочка (L-оболочка) может принять максимум 8 электронов
8 = 2-2-2
Третья оболочка (М-оболочка) может принять максимум 18 электронов
18 = 2-3-3
п-я оболочка может принять максимум х электронов
х = 2-п-п
Следовательно, нужно лишь запомнить формулу: максимальное число электронов равно 2п2, где п- порядковый номер оболочки.
Вычислите, сколько электронов требуется для того, чтобы заполнить М-оболочку.
• 2 электрона —► 18
• 8 электронов —> 26
• 18 электронов —> 35
• 32 электрона —> 44
6. Вы забыли, что нейтроны являются электрически нейтральными частицами, т. е. не несут па себе заряда.
Атомное ядро, содержащее 4 протона и 4 нейтрона, должно иметь суммарный заряд ....
Проверьте ответ в рубрике 34.
7. Рассмотрим следующую задачу.
Сколько атомов из исходных 20000 атомов определенного радиоактивного элемента останется неизменными по прошествии 25 суток, если период полураспада этого элемента равен 5 суткам?
1
Число нераспавшихся атомов составляет:
В начальный момент 20000
Через 5 суток 10000
Еще через 5 суток, т. е. всего через 10 суток 5000
Еще через 5 суток, т.е. всего через 15 суток 2 500
Еще через 5 суток, т.е. всего через 20 суток 1 250
Еще через 5 суток, т.е. всего через 25 суток 625
Проверьте этот ответ в рубрике 105.
8. Ваш ответ правилен в том случае, если вы записали
2-4-4
Вычислите теперь, сколько электронов необходимо для заполнения четвертой оболочки. Проверьте ответ в рубрике 3.
9. Вы невнимательно прочли вопрос.
Требовалось определить только число электронов в самой внешней оболочке.
Последовательность оболочек объясняется в рубрике 22.
10. Вы правильно указали относительную массу протона, но ошиблись при указании относительной массы нейтрона.
Приведем два примера, которые помогут вам: атомы водорода и гелия.
Число Число Число протонов нейтронов электронов Относительная атомная масса
1 4
Водород 1
Г елий 2
Какова относительная масса нейтрона?
Относительная масса нейтрона равна 1 -> 32
Относительная масса нейтрона равна 2 -► 63
Нуждаюсь в разъяснениях -» 57
11 ' протоны
• атомное г
ядро / г нейтроны
Атом С элентрон- ----------электроны
ное одлано
Протоны, нейтроны и электроны можно уподобить кирпичикам, из которых построены атомы каждого элемента.
Число и расположение этих строительных кирпичиков, или-как их принято называть-элементарных частиц, изменяются при переходе от одного элемента к другому.
Прежде чем мы начнем обсуждение конкретных элементов, нужно подробнее ознакомиться со свойствами электронного облака.
Даже на уровне современных знаний очень сложно и трудно дать наглядное представление о строении атомов. Однако для простоты можно предположить, что электроны движутся вокруг ядра по вполне определенным
орбитам. Эта простая модель способна объяснить многие наблюдения, касающиеся природы вещества. Однако более точное описание таких наблюдений нуждается в применении более сложных теорий.
Завершите теперь следующие предложения:
... движутся по вполне определенным ... вокруг атомного ядра, которое состоит из протонов и ....
Проверьте ответ в рубрике 22.
"К
12. Если атом имеет атомный номер 7, то он должен иметь 7 электронов в своем электронном облаке.
Можно ли также предсказать число нейтронов в ядре атома, зная только его атомный номер?
• Да -» 21
• Нет - 31
13. Ядро, состоящее из 4 протонов и 4 нейтронов, имеет 4 положительных элементарных заряда (4 + ). Число положительных зарядов в ядре атома определяет его атомный номер.
Таким образом, атомный номер каждого атома указывает, сколько протонов содержится в его ядре.
Каким должен быть атомный номер атома, в ядре которого содержится 4 протона и 5 нейтронов?
• Атомный номер равен 4 -* 2
• Атомный номер равен 5 -► 39
• Атомный номер равен 9 -► 28
14. А-оболочка является четвертой оболочкой (первые четыре оболочки обозначаются буквами К, L, М и N).
Подставляя в формулу 2п2 значение п = 4, можно вычислить искомое число электронов.
Проверьте ответ в рубрике 8.
15. Напомним, что протоны и электроны имеют одинаковые по величине, но противоположные по знаку заряды. Следовательно, положительный заряд одного протона нейтрализует отрицательный заряд одного электрона.
Вернитесь к рубрике 3 и еще раз попытайтесь ответить на поставленный там вопрос.
16.
У этого атома первая оболочка (К-оболочка) имеет 2 электрона, а вторая оболочка (L-оболочка) содержит 8 электронов.
12
Программа I
Атом не может иметь больше 10 электронов на двух первых внутренних оболочках. Однако по мере перемещения к внешним оболочкам обнаруживается, что они могут принять все больше и больше электронов. Так, третья оболочка (М-оболочка) оказывается полностью занятой, когда она содержит 18 электронов.
Сколько электронов содержится в электронном облаке атома, у которого
заполнены L- и М-оболочки?
• Атом имеет 10 электронов -> 42
• Атом имеет 18 электронов -> 25
• Атом имеет 24 электрона -» 33
• Атом имеет 28 электронов -> 5
• Атом имеет 30 электронов -> 36
17. Относительная атомная масса бора равна 11
Относительная масса 5 протонов — 5
Число нейтронов 6
Следовательно, атом бора содержит 5 протонов и 6 нейтронов.
Поскольку число электронов в каждом атоме равно числу его протонов, зная относительную атомную массу и число электронов, можно вычислить состав атомного ядра.
Азот имеет 7 электронов и относительную атомную массу 14.
Сколько протонов и нейтронов содержится в ядре азота?
Проверьте ответ в рубрике 52.
18. Неправильно! Вы вычислили число электронов для какой-то другой оболочки.
Начните еще раз с рубрики 30.
19. Вы не поняли объяснение.
Прочтите теперь рубрику 57.
20. Вы не обратили внимания на то обстоятельство, что требовалось определить число электронов только в самой внешней оболочке.
Последовательность оболочек объясняется в рубрике 22.
21. Атомный номер ничего не говорит о числе нейтронов в ядре атома.
После того как мы познакомились с зарядами элементарных частиц, перейдем к их массам.
Массы протона и нейтрона почти одинаковы; их массу принимают за единицу. Масса же электрона очень мала; она составляет лишь 1/1850 часть массы протона (нейтрона).
Какие элементарные частицы дают важнейший вклад в массу всего атома в целом?
• Протоны и электроны -► 4
• Нейтроны и электроны -» 41
• Протоны и нейтроны -* * 50
('роение агома
13
22. Электроны движутся по вполне определенным орбитам вокруг атомного ядра, которое состоит из протонов и нейтронов.
Эти орбиты можно также рассматривать как «оболочки», поскольку электроны в них свободно движутся по всем направлениям относительно ядра. Приближенно можно представить их себе как сферические оболочки*. Существует всего семь таких оболочек.
Ближайшая к ядру оболочка называется первой оболочкой. Затем следует вторая оболочка и т.д.; седьмая оболочка - самая далекая от ядра.
Для обозначения оболочек используются не только номера, но и буквы. Однако первая оболочка обозначается буквой К, а не Л; дальнейшие оболочки обозначаются следующими за К буквами латинского алфавита. Таким образом, первая оболочка называется К-оболочкой, вторая - L-оболочкой, третья-М-оболочкой и последняя, седьмая, называется 2-оболочкой.
Какие буквы используются для обозначения четвертой, пятой и шестой оболочек? Проверьте ответ в рубрике 30.
23. N-оболочка является четвертой оболочкой (первые четыре оболочки обозначаются буквами К, L, М, N).
Подставьте теперь в формулу 2и2 значение и = 4 и проверьте ответ в рубрике 8.
24. Ядро атома всегда несет положительный заряд. Электронное облако всегда несет отрицательный заряд.
Заряд протона или электрона является мельчайшим экспериментально обнаруживаемым зарядом. По этой причине он называется элементарный заряд.
Допустим, что ядро некоторого атома содержит 4 нейтрона и 4 протона.
Сколько элементарных зарядов имеет это ядро?
• 4 отрицательных элементарных заряда (4 —) -» 34
• 4 положительных элементарных заряда (4 + ) -> 13
• 8 элементарных зарядов -> 6
25. Вы учли только электроны третьей оболочки, т.е. М-оболочки, но забыли об электронах других оболочек.
Еще раз внимательно прочтите рубрику 16.
* Приведенное здесь описание несколько упрощенно. Электрон следует рассматривать скорее не как точку, а как облако (электронное облако), заполняющее определенную область пространства вокруг ядра -электронную орбиталь. Формы орбиталей отнюдь не всегда сферические: это правильно только для 5-орбиталей, в то время как р-орбитали имеют форму гантелей, а другие-еще более сложные формы. Только такое рассмотрение позволяет подвести к понятию гибридизации. Все эти понятия совершенно необходимы как фундамент для подлинного понимания строения и свойств органических соединений. Некоторые из них вводятся в гл. 25,- Прим. ред.
I-I
1
26. Неправильно! Вы вычислили число электронов для какой-то другой оболочки.
Начните еще раз с рубрики 30.
В отличие от К-оболочки, которая полностью заполняется уже двумя электронами, L-оболочка может принять до 8 электронов.
Нарисуйте схематическое изображение атома, имеющего восемь электронов в этой электронной оболочке.
Проверьте правильность вашего рисунка в рубрике 16.
28. Вы не запомнили, что атомный номер определяется только числом протонов в ядре данного атома.
Вернитесь к рубрике 13.
29. Напомним, что нейтроны являются электрически нейтральными частицами. Атомы тоже не имеют результирующего заряда. Протоны и электроны имеют заряды одинаковые по величине, но противоположные по знаку. Другими словами, положительный заряд одного протона нейтрализует отрицательный заряд одного электрона.
Вернитесь к рубрике 3 и еще раз попытайтесь ответить на поставленный там вопрос.
30. Четвертая, пятая и шестая оболочки называются также N-, 0-и Р-оболочки соответственно.
На приведенном ниже схематическом рисунке представлена упрощенная картина ядра и электронных оболочек атома.
' к
Нарисуйте аналогичную схему, пронумеровав на ней все оболочки. Переходите к чтению рубрики 38.
31. Правильно! Атомный номер ничего не говорит о числе нейтронов в ядре атома.
После того как мы познакомились с зарядами элементарных частиц, перейдем к их массам.
Массы протона и нейтрона почти одинаковы; их массу принимают за единицу. Масса же электрона очень мала; она составляет лишь 1/1850 часть массы протона (нейтрона).
Какие элементарные частицы дают важнейший вклад в массу всего атома в целом?
• Протоны и электроны 4
• Нейтроны и электроны -» 41
• Протоны и нейтроны -» 50
32. Относительная масса и протона, и нейтрона равна 1.
Для того чтобы вычислить относительную массу любого элемента, нужно лишь знать число протонов и число нейтронов в ядре его атома и просуммировать эти числа.
Какова относительная масса атома, имеющего 6 протонов, 6 нейтронов и 6 электронов?
Проверьте ответ в рубрике 46.
33. Вы подсчитали неправильно.
Чтобы узнать, сколько электронов содержится в электронном облаке атома, имеющего полностью занятые К-, L- и М-оболочки, нужно просуммировать число электронов, находящихся на каждой из этих оболочек.
Начните еще раз с рубрики 22.
34. Атомное ядро, содержащее 4 протона и 4 нейтрона, имеет 4 элементарных заряда.
Хотя такой ответ правилен, в нем еще ничего не сказано о том, какого типа этот заряд-положительный или отрицательный. Протоны всегда заряжены положительно. Заряд ядра равен • 4+ -> 13
• 4 - -> 45
35. M-Оболочка (третья оболочка) может принять максимум 2-3-3= 18 электронов.
Вычислите теперь, сколько электронов может принять N-оболочка.
• 16 электронов -► 47
• 20 электронов -» 23
• 32 электрона -» 3
• 50 электронов -* * 14
16
Программа 1
36. Вы подсчитали неправильно.
Чтобы узнать, сколько электронов содержится в электронном облаке атома, имеющего полностью занятые К-, L- и М-оболочки, нужно просуммировать число электронов, находящихся на каждой из этих оболочек.
Начните еще раз с рубрики 22.
37. Правильно. Число протонов в ядре каждого атома совпадает с числом его электронов. Положительные заряды протонов компенсируют отрицательные заряды электронов.
Таким образом, атомное ядро всегда несет ... заряд
Электронное облако всегда несет ... заряд.
Завершите эти предложения и переходите к чтению рубрики 24.
Исправьте ошибки, если вы их сделали.
Протоны, нейтроны и электроны распределены внутри атома не беспорядочно. Расположение этих элементарных частиц подчиняется четким правилам. Поведение электронов определяется следующими правилами:
1. Электроны заполняют сначала внутренние, а затем внешние оболочки.
2. На каждой оболочке может находиться не больше определенного числа электронов.
Рассмотрим в качестве примера атом, имеющий два электрона, которые движутся вокруг его ядра,
Электроны обозначены буквой е. Оба электрона в данном случае занимают самую внутреннюю оболочку, т.е. К-оболочку.
Эта оболочка уже полностью заполнена, если на ней находятся
2 электрона. Если у атома есть третий электрон, то ему приходится занимать следующую оболочку, т.е. L-оболочку.
Ci роение агома
17
Нарисуйте схематическое изображение атома, имеющего 5 электронов.
Проверьте ответ в рубрике 27.
39. Вы не запомнили, что атомный номер определяется только числом протонов в ядре данного атома.
Вернитесь к рубрике 13.
40. Вы правильно указали относительную массу нейтрона, но ошиблись при указании относительной массы протона.
Приведем в качестве примера сведения об атомах водорода и гелия, которые помогут вам разобраться в обсуждаемом вопрюсе.
Число протонов Число нейтронов Число электронов Относительная атомная масса
Водород 1 — 1 1
Гелий 2 2 2 4
Какова относительная масса прютона?
Относительная масса прютона равна 1 -* 32
Относительная масса протона равна 2 -» 63
Нуждаюсь в разъяснениях 57
41. Нейтрюны, действительно, вносят вклад в массу атома. Однако электронами обычно пренебрегают при рассмотрении атомной массы, потому что электрюны имеют очень малую массу. Их масса составляет лишь 1/1850 часть массы прютона.
Переходите к рубрике 50.
42. Вы учли только электроны на К- и L-оболочках, но не приняли во внимание электроны на М-оболочкс.
Еще раз внимательно прючтите рубрику 16.
43. Напомним, что поскольку электроны и протоны имеют одинаковые по величине, но противоположные по знаку заряды, положительный заряд одного прютона нейтрализует отрицательный заряд одного электрюна.
Вернитесь к рубрике 3 и еще раз попытайтесь ответить на поставленный там вопрюс.
44. Неправильно! Вы вычислили число электронов для какой-то другой оболочки.
Начните еще раз с рубрики 30.
45. Вы все еще путаете положительные и отрицательные заряды. Обратите внимание на следующее мнемоническое правило:
Прютоны - положительно заряжены (оба слова начинаются буквой «п»). Вернитесь к рубрике 24.
2 29
Программа 1
I"
46. Элемент, состоящий из атомов с 6 протонами, 6 нейтронами и
6 электронами, имеет относительную атомную массу 12.
Электроны не принимаются здесь в расчет, потому что масса электрона составляет лишь 1/1850 часть массы протона или нейтрона.
Если известны озносительная атомная масса элемента и число протонов в ядре его атома, то можно вычислить число нейтронов в ядре. Для этого нужно вычесть число протонов из относительной атомной массы элемента.
Сколько нейтронов имеет атом бора? Атомная масса бора равна 11, и его ядро содержит 5 протонов.
Проверьте ответ в рубрике 17.
47. N-Оболочка, действительно, является четвертой оболочкой. Это вы сообразили правильно. Однако вы сделали ошибку при использовании формулы 2п2. Для четвертой оболочки п = 4.
Проделайте вычисления еще раз и проверьте ответ в рубрике 8.
48. Относительная атомная масса трития равна 3.
Ниже показаны атомные структуры трех различных сортов водорода.
Химически эти атомы различить нельзя, потому что все они имеют одинаковое электронное облако.
Атомы с одинаковым атомным номером, но различными относительными атомными массами, называются изотопы.
У лития также существуют два изотопа. Один из них имеет относительную массу 7, а другой-относительную массу 6.
Изобразите атомную структуру каждого из двух изотопов лития.
Сведения об атомной структуре лития содержатся в табл. 1, приведенной в конце данной программы.
Проверьте ответ в рубрике 69.
49. Вы подсчитали все электроны, тогда как требовалось определить число электронов только в самой внешней оболочке. Внешняя оболочка удалена от ядра дальше других.
Изобразите атомную структуру хлора. Необходимые для этого данные вы найдете в табл. 1, помещенной в конце программы.
Проверьте ответ в рубрике 66.
Строение атома
I
50. Масса атома слагается только из масс протонов и нейтронов.
Массой электронов можно пренебречь, потому что она очень мала.
Легчайший из всех элементов-водород-имеет относительную атомную массу 1. Следующий элемент-гелий-имеет атомную массу 4. Атом водорода содержит 1 протон и 1 электрон. Атом гелия содержит 2 протона, 2 нейтрона и 2 электрона.
Число протонов Число нейтронов Число электронов Относительная атомная масса
Водород 1 1 1
Г елий 2 2 2 4
Ответьте теперь на следующие вопросы: I. Какова относительная масса протона?
2. Какова относительная масса нейтрона?
Вопрос 1 Вопрос 2
• 1 I - 32
•2 1 >40
•2 2 >19
• 1 2 - 10
Нуждаюсь в разъяснениях -► 57
51. Неправильно. Прочтите еще раз рубрику 53, посвященную изотопам.
52. В атоме азота 7 протонов (соответственно 7 электронов) и 7 нейтронов (относительная масса азота минус относительная масса протонов, т. е. 14-7).
Завершите приведенную ниже таблицу, в которой содержатся некоторые данные о первых семи элементах периодической системы.
Элемент Символ Атомный номер Число протонов Число нейтронов Число электронов Относительная атомная масса
Водород н 1 1 0 / 1
Гелий Не 2 2 «2. 2 4
Литий Li 3 3 Ч 3 7
Бериллий Be U 4 5 4 9
Бор В 5 5 6 5 п
У глерод С & (э 6 5 12
Азот N 7 м 7 X
Внесите в эту таблицу недостающие данные и проверьте ответ в рубрике 64.
53. Разделение изотопов одного элемента возможно только физическими методами.
Мы уже знаем, что элемент литий имеет два изотопа.
Литий содержит 92,7?„ изотопа с относительной атомной массой 7 (7Li) и 7,3",, изотопа с относительной массой 6 (6Li).
20
Программа 1
Эти сведения позволяют вычислить относительную массу встречающейся в природе изотопной смеси лития:
92 7 7 3
7 —^г+6-—’ - = 6,93
100 00
Этот результат хорошо согласуется с экспериментально установленным значением 6,94.
Элемент хлор также представляет собой смесь двух изотопов:
приблизительно 75% 35С1
приблизительно 25% 37С1
Пользуясь этими данными, вычислите относительную атомную массу хлера.
Относительная атомная масса хлора:
• Меньше 35 —► 62
• Равна 35 -> 108
• Больше 35 и меньше 36 —► 80
• Равна 36 -> 103
• Больше 36 и меньше 37 -> 95
• Равна 37 -» 88
• Больше 37 -» 70
54. Вы не обратили внимания на то обстоятельство, что требовалось определить число электронов только в самой внешней оболочке.
Последовательность оболочек объясняется в рубрике 22.
55. Углерод имеет во внешней оболочке только 4 электрона, а сера
6 электронов. Внешняя оболочка является наиболее удаленной от ядра оболочкой.
Изобразите атомную структуру хлора. Необходимые для этого данные вы найдете в табл. 1, помещенной в конце программы.
Проверьте ответ в рубрике 66.
56. Неправильно. Обратитесь за разъяснениями в рубрику 99.
57. Относительная атомная масса = Относительная масса протонов + + Относительная масса нейтронов.
Электроны имеют настолько малую массу, что ею можно пренебречь.
Число протонов Число нейтронов Число электронов Относительная атомная масса
Водород 1 — 1 1
Гелий 2 2 2 4
Относительная атомная масса водорода равна 1. Поскольку атом водорода состоит из одного протона и одного электрона и не содержит нейтронов, в данном случае атомная масса определяется только протоном.
Значит, протон имеет относительную массу 1.
Строение атома 21
Относительная атомная масса гелия равна 4.
Следовательно, вклад протонов в относительную атомную массу гелия равен 2 1 =2.
Вклад нейтронов в относительную атомную массу гелия тоже равен 2.
Какова же, стало быть, относительная масса нейтрона?
• Относительная масса нейтрона равна 1 -♦ 32
• Относительная масса нейтрона равна 2 -> 63
58. Сравните построенную вами таблицу с приведенной ниже
Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Группа 7 Группа 8
Н Не В С N О F Ne
Li Be Al Si Р S Cl Ar
Na Mg
К Са
Такой способ классификации элементов будет обсуждаться подробнее в программе 4 в связи с периодической системой элементов. Пока что удовлетворимся сказанным, но кратко повторим основные положения теории строения атома. Завершите следующие предложения.
1. Относительная атомная масса представляет собой сумму относительных масс протонов и ....
2. Число ... во внешней оболочке атома определяет химические свойства каждого элемента.
3. Число протонов в атомном ядре всегда совпадает с суммарным числом ... в электронном облаке.
4. Атомный номер равен числу ... в ядре.
Проверьте ответ в рубрике 68.
59. Актиний превращается в торий в результате превращения одного из нейтронов в его ядре в протон, что сопровождается испусканием бета-лучей (бета-распад). Относительная атомная масса в этом процессе не изменяется, но атомный номер возрастает на 1.
Превращение одного элемента в другой, сопровождаемое испусканием альфа-, бета- или гамма-лучей, занимает определенное время. Это время индивидуально у разных элементов. Чтобы измерять его в сравнимых масштабах, используется понятие периода полураспада.
Период полураспада указывает, какое время необходимо для превращения точно половины атомов одного элемента в атомы другого.
Периоды полураспада различных элементов варьируют от миллионов лет до долей секунды.
Приведем пример.
Предположим, что имеется 160000 атомов радиоактивного элемента.
Допустим, что период полураспада этого элемента равен пяти суткам. Сколько атомов превратится в атомы другого элемента по прошествии пяти суток?
Проверьте ответ в рубрике 93.
60. Правильно. При испускании альфа-частицы (ядра гелия, содержащего два протона) атомный номер уменьшается на две единицы.
Прсмрамма I
1;
Подведем итог сказанному.
При альфа-распаде атомная масса и атомный номер элемента уменьшаются соответственно на ... и ... единицы.
Завершите это предложение и проверьте ответ в рубрике 71.
61. Углерод имеет в самой внешней оболочке четыре электрона, а сера-шесть электронов.
Мы уже упоминали, что электроны внешней оболочки обусловливают химические свойства атома. В качесгве иллюстрации этого положения’ рассмотрим три элемента-углерод, серу и хлор.
Углерод-четырехвалентный элемент; в его внешней оболочке содержится четыре электрона.
Сера может быть шестивалентной (как, например, в H2SO4); она имеет шесть электронов в самой внешней оболочке.
Хлор может быть се.иивалентным (как, например, в НС1О4); он имеет семь внешних электронов.
H2SO4-3to серная кислота.
НС1О4-это хлорная кислота.
Укажите все трехвалентные элементы в табл. 1.
Проверьте ответ в рубрике 74.
62. Вы выбрали ответ наугад, потому что атомная масса смеси двух изотопов не может быть меньше массы наиболее легкого из них. Прочтите рубрику 53 еще раз.
63. Из вашего ответа видно, что он сделан просто наугад. Прочтите еще раз внимательно рубрику 31.
/64. Сверьте полученную вами таблицу с приведенной ниже.
Элемент Символ Атомный номер Число протонов Число нейтронов Число электронов Относительная атомная масса
Водород н 1 1 0 1 1
Гелий Не 2 2 2 2 4
Литий Li 3 3 4 3 7
Бериллий Be 4 4 5 4 9
Бор В 5 5 6 5 11
Углерод С 6 6 6 6 12
Азот N 7 7 7 7 14
Если вы сделали при заполнении этой таблицы более трех ошибок, вам следует повторить материал, начиная с рубрики 37, прежде чем переходить к дальнейшему чтению.
Теперь мы займемся обсуждением атомной структуры различных элементов. Отметьте себе номер данной рубрики, чтобы в дальнейшем вы могли легко найти ее. После этого переходите к табл. 1, помещенной в конце данной программы. В ходе ее обсуждения мы будем пользоваться следующими обозначениями:
Протоны: р
Нейтроны: п
Электроны: е
Строение атома
23
водород гелий литий
Отметим, что помещаемые здесь схематические изображения атомной структуры выполнены не в масштабе. Ядра показаны на них слишком большими по сравнению с электронными оболочками.
Изобразите атомные структуры атомов углерода и серы. Необходимые для этого данные вы найдете в табл. I, помещенной в конце данной программы.
Проверьте ответ в рубрике 76.
65. Неправильно. Обратитесь за разъяснениями в рубрику 104.
Сколько электронов содержится во внешней оболочке хлора?
2 электрона -» 54
8 электронов -» 20
7 электронов -» 78
17 электронов -» 9
67. Хлор, обнаруживаемый в природе, представляет собой смесь двух изотопов. Он имеет следующий состав:
приблизительно 75% изотопа хлор-35 и
приблизительно 25% изотопа хлор-37.
Если бы хлор содержал 100% изотопа-35, его относительная атомная масса была бы равна 35. Если бы он состоял на 100'% из изотопа-37, его относительная атомная масса была бы равна 37. В том случае, если бы хлор состоял на 50% из каждого изотопа, его относительная атомная масса была бы точно равна среднему значению из 35 и 37, т. е. 36.
Однако в действительности хлор представляет собой смесь, состоящую из приблизительно 75% изотопа-35 и приблизительно 25% изотопа-37.
2-4
Программа 1
1
Какова же, следовательно, относительная атомная масса этой смеси?
Относительная атомная масса смеси заключена между 35 и 36 -» 80
Относительная атомная масса смеси заключена между 36 и 37 -» 51
68. Проверьте пропущенные слова:
нейтронов электронов электронов протонов Если вы сделали при ответе на эти вопросы какие-нибудь ошибки, прочтите еще раз рубрику 58.
Атом водорода имеет в ядре один протон и в электронном облаке-один электрон. Его относительная атомная масса равна 1.
Существуют и другие атомы водорода, называемые атомами тяжелого водорода, или дейтерия.
Атом дейтерия имеет в своем ядре один протон и один нейтрон, а в электронном облаке-один электрон.
Какова относительная атомная масса дейтерия?
Проверьте ответ в рубрике 101.
69. Ниже показаны атомные структуры двух изотопов лития.
Атомный номер: 3 3
Относительная атомная масса: 6 7
Почти все элементы имеют изотопы. У тяжелых элементов особенно большое число изотопов. Почти во всех случаях различные изотопы одного элемента удается разделить только довольно сложными физическими методами. Один из наиболее известных изотопов-это изотоп урана с относительной атомной массой 235 (уран-235, или 235U). Именно этот изотоп урана используется в атомной бомбе. Какие методы обычно применяются для разделения изотопов одного элемента?
• Химические методы —> 96
• Физические методы —> 53
• Их вообще нельзя разделить —> 87
• Не знаю —> 79
70. Неправильно. По-видимому, вы выбрали ответ наугад, потому что атомная масса смеси двух изотопов не может быть больше атомной массы наиболее тяжелого из них.
Прочтите еще раз внимательно рубрику 53.
Строение атома
ГК
71. При альфа-распаде атомная масса и атомный номер элемента уменьшаются соответственно на 4 и 2 единицы.
Рассмотрим следующий пример.
Изотоп уран-238 имеет атомный номер 92. В результате испускания альфа-лучей уран превращается в другой элемент с атомным номером 90. Этот элемент - торий.
Какова относительная атомная масса тория, образующегося из урана-238?
Проверьте ответ в рубрике 83.
72. Неправильно. Прочтите объяснение в рубрике 106.
73. Неправильно. Обратитесь за разъяснениями в рубрику 104.
74. Из табл. 1 следует, что
бор и алюминий
являются элементами, во внешней оболочке которых содержится по
3 электрона. В своих соединениях эти элементы всегда трехвалентны.
Все элементы табл. 1 можно подразделить на группы в соответствии с числом .электронов в их внешней электронной оболочке.
1-я группа: элементы с 1 электроном во внешней оболочке
2-я группа: элементы с 2 электронами во внешней оболочке
3-я группа: элементы с 3 электронами во внешней оболочке
8-я группа: элементы с 8 электронами во внешней оболочке
Завершите следующую таблицу, записывая символы пропущенных элементов на соответствующих местах.
Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Группа 7 Группа 8
н (L N О р*
Li Na К ЛЛЛ Si Р 5
Переходите к чтению рубрики 58.
75. Неправильно. Обратитесь за разъяснениями в рубрику 107.
76. Сравните изображенные вами атомные структуры углерода и серы со следующими рисунками:
углерод
сера
1
Подобным образом можно изобразить атомные структуры для каждого элемента. Они наглядно показывают число протонов и нейтронов в атомном ядре и число электронов в электронном облаке каждого атома-его важнейшие характеристики.
Число электронов в самой внешней оболочке электронного облака обусловливает химические свойства конкретного элемента.
Сколько электронов содержится во внешних оболочках углерода и серы?
• У углерода 4 и у серы 16 —> 85
• У углерода 6 и у серы 16 —> 49
• У углерода 4 и у серы 6 —> 61
• У углерода 6 и у серы 6 —► 55
77. Неправильно. Обратитесь за разъяснениями в рубрику 104.
78. Правильно. Хлор имеет в самой внешней оболочке 7 электронов. Переходите к чтению рубрики 61.
79. Один изотоп элемента отличается от другого только числом нейтронов в ядре. Электронное облако, определяющее химические свойства атома, одинаково для всех изотопов одного элемента.
Следовательно, разделение изотопов какого-либо элемента возможно только ... методами.
Переходите к чтению рубрики 53.
।
80. Правильно. Относительная атомная масса смеси (состава 3:1) изотопов хлор-35 и хлор-37 равна 35,5.
В табл. 2, помещенной в конце программы 7, указаны относительные атомные массы всех встречающихся в природе (естественных) изотопных смесей для каждого из элементов.
В приведенной ниже таблице указаны атомные массы изотопов нескольких первых элементов периодической системы. В скобках приведено естественное содержание каждого изотопа.
Атомный иомер Символ элемента Относительная атомная масса смеси изотопов Атомные массы изотопов (содержание, %)
1 н 1,008 1(99,985); 2(0,015)
3 Li 6,94 7(92,7); 6(7,3)
4 Be 9,013 9(100)
5 В 10,82 11(81,2); 10(18,8)
6 С 12,01 12(98,9); 13(1,1)
Завершите следующее предложение, а затем проверьте ответ в рубрике 89.
Атомы с одинаковым атомным номером, но с различными относительными ..... называются ....
81. Неправильно. Обратитесь за разъяснениями в рубрику 99.
С гроение атома
К
82. Неправильно. Обратитесь за разъяснениями в рубрику 107.
83. Образующийся торий имеет относительную атомную массу 234. Завершите следующее предложение и проверьте ответ в рубрике 92.
Уран в результате испускания ядра гелия (испускание альфа-частицы) превращается в .... Относительная атомная масса последнего оказывается меньше на ..., а атомный номер уменьшается на ....
84. Правильно. Относительная масса тяжелого ядра уменьшается на
4 единицы, поскольку ядро атома гелия состоит из 2 протонов и 2 нейтронов.
Теперь определите, на сколько единиц изменяется атомный номер элемента в том же самом процессе. Атомный номер остающегося ядра оказывается:
• Меньше прежнего на 2 -> 60
• Больше прежнего на 2 -> 97
• Неизменным -> 72
85. Углерод имеет во внешней оболочке атома 4 электрона, а сера-6 электронов. Внешняя оболочка атома является наиболее удаленной от ядра оболочкой.
Изобразите атомную структуру хлора. Необходимые для этого данные вы найдете в табл. 1, помещенной в конце данной программы.
Проверьте ответ в рубрике 66.
86. Неправильно. Обратитесь за разъяснениями в рубрику 107.
87. Неправильно. На самом деле изотопы можно разделить. Переходите к чтению рубрики 96.
88. Неправильно. Обратитесь за подробными разъяснениями в рубрику 67.
89. Атомы с одинаковым атомным номером, но с различными относительными атомными массами называются изотопы.
Обладая одинаковым атомным номером и одинаковой структурой электронных оболочек, изотопы имеют почти одинаковые химические свойства. Поэтому для их разделения приходится использовать ... методы.
Завершите это предложение и проверьте ответ в рубрике 98.
90. Образующийся атом тория имеет атомную массу 227. Превращение нейтрона в протон, сопровождаемое испусканием бета-лучей, приводит к превращению атома актиния в ....
Относительная атомная масса при этом остается ..., тогда как атомный номер возрастает на ....
Проверьте ответ в рубрике 59.
28
Программа 1
1
91. Правильно. При испускании бета-лучей атомный номер возрастает на 1. В этом процессе один из нейтронов внутри ядра превращается в протон. Следовательно, суммарное число протонов в ядре возрастает на 1 и поэтому атомный номер также увеличивается на 1.
Чтобы подвести итог сказанному, завершите следующее предложение: При испускании бета-лучей ... возрастает на 1, а ... остается неизменной. Проверьте ответ в рубрике 100.
92. Уран в результате испускания ядра гелия (испускание альфа-частицы) превращается в торий. Относительная атомная масса последнего оказывается меньше на 4 единицы, а атомный номер уменьшается на 2.
Рассмотрим теперь радиоактивный распад в результате испускания бета-лучей.
В этом процессе нейтрон в ядре атома превращается в протон. Одновременно с этим появляется единица отрицательного заряда, которая выбрасывается из ядра в виде электрона, имеющего очень большую скорость. Этот процесс называется испускание бета-лучей, или бета-распад. Он сопровождается высвобождением избыточной энергии в форме гамма-излучения.
Какое изменение относительной атомной массы происходит при превращении нейтрона в протон, сопровождаемом бета- и гамма-излучением?
• • Она уменьшается на 1 Она уменьшается на 2 —> —> 75 86
• Она уменьшается на 3 —> 82
• Она не изменяется —> 102
93. По прошествии 5 суток останется еще 80000 атомов со свойствами исходного элемента. Остальные 80000 атомов уже превратятся в другой элемент. По прошествии следующих 5 суток произойдет превращение еще 40000 атомов из оставшихся 80000. Еще через 5 суток произойдет превращение дополнительных 20000 атомов и так далее.
Сколько атомов останется неизменными еще через 25 суток?
Проверьте результат своих вычислений в рубрике 105.
94. Бета-излучение: электроны
Альфа-излучение: ядра гелия
Гамма-излучение: рентгеновские лучи
Все процессы, связанные с радиоактивным распадом, происходят в атомном ядре в соответствии с вполне определенными законами.
Альфа-распад, или альфа-излучение, представляет собой испускание атома гелия из ядра распадающегося элемента. Одновременно с этим происходит также испускание гамма-излучения.
Какое изменение относительной атомной массы элемента происходит при испускании ядра гелия в процессе альфа-распада?
• • Уменьшение на 2 Уменьшение на 3 —> —> 65 77
• Уменьшение на 4 —> 84
• Уменьшение на 6 —> 73
Строение атома
29
1
,95. Неправильно. Обратитесь за подробными разъяснениями в рубрику 67.
96. Различные изотопы одного и того же элемента отличаются только числом нейтронов в ядре. Электронное облако, определяющее химические свойства атома, одинаково для всех изотопов одного элемента. Вследствие этого разделение изотопов какого-либо элемента возможно только ... методами.
Переходите к чтению рубрики 53.
97. Неправильно. Прочтите объяснение в рубрике 106.
98. Почти во всех случаях изотопы удается разделить только физическими методами.
Последняя тема, которую мы обсудим в этой программе, касается естественного радиоактивного распада элементов.
Большинство элементов устойчивы. Лишь некоторые элементы или отдельные изотопы элементов самопроизвольно испускают излучение и превращаются при этом в другие элементы или изотопы. Элементы, изменяющиеся в результате самопроизвольного излучения, называются радиоактивные элементы (от латинского слова радиус -луч).
Самопроизвольный распад некоторых изотопов в другие изотопы называется ... распад. Это превращение сопровождается испусканием ....
Завершите эти предложения и проверьте ответ в рубрике 109.
99. Атомный номер конкретного элемента совпадает с числом протонов в его ядре. Число нейтронов в ядре не влияет на атомный номер элемента (вспомним изотопы водорода).
Когда в результате бета-распада ядра один из его нейтронов превращается в протон, число протонов в ядре возрастает на 1, а число нейтронов уменьшается на 1.
В процессе бета-распада атомный номер ... на 1.
Завершите это предложение и проверьте ответ в рубрике 91.
100. В процессе бета-распада атомный номер возрастает на 1, а атомная масса остается неизменной.
Применим этот вывод к следующему примеру.
Изотоп актиний-227 имеет атомный номер 89. В результате испускания бета-лучей он превращается в элемент с атомным номером 90. Этот элемент-торий.
Какова атомная масса тория, образующегося из актиния-227?
Проверьте ответ в рубрике 90.
101. Относительная масса дейтерия равна 2.
Дейтерий обозначается химическим символом D.
Существует еще более тяжелый изотоп водорода-тризий (химический символ Т). Ядро трития содержит 1 протон и 2 нейтрона. В его электронном облаке содержится 1 электрон.
Какова относительная атомная масса трития?
Проверьте ответ в рубрике 48.
Программа 1
1
102. Совершенно верно. В результате бета-излучения не происходит изменения относительной массы ядра, поскольку при превращении одного из нейтронов в ядре в протон, из ядра выбрасывается только электрон. Как мы уже знаем, электрон не дает практически никакого вклада в атомную массу.
Как изменяется атомный номер в результате бета-распада?
• Уменьшается на 1 -> 56
• Увеличивается на 1 -> 91
• Не изменяется -> 81
103. Неправильно. Обратитесь за подробными разъяснениями в рубрику 67.
104. Ядро атома гелия состоит из двух протонов и двух нейтронов. Когда ядро какого-либо тяжелого атома испускает ядро гелия, относительная масса этого тяжелого атома уменьшается на ....
Проверьте ответ в рубрике 84.
105. По прошествии следующих 25 суток из исходных 20000 атомов останется неизменными только 625 атомов.
Если вы получили другой ответ, обратитесь к рубрике 7, где проводится подробное обсуждение соответствующих вычислений.
Самопроизвольный распад радиоактивного элемента продолжается до тех пор, пока не образуется устойчивый нерадиоактивный элемент. Одним из таких элементов является свинец.
К числу важнейших радиоактивных элементов принадлежат: уран-235 и уран-238, а также торий-232. Все они распадаются, превращаясь сначала в другие радиоактивные элементы, а в конце концов образуют свинец.
Конец программы 1.
106. Ядро атома гелия состоит из 2 протонов и 2 нейтронов. Протоны, как мы уже знаем, являются положительно заряженными частицами. Число протонов в ядре определяет атомный номер элемента.
Когда ядро тяжелого атома испускает ядро атома гелия (альфа-частицу), число протонов в ядре тяжелого атома, а следовательно, и его атомный номер уменьшаются.
При альфа-распаде атомный номер уменьшается на ... единицы.
Проверьте ответ в рубрике 60.
107. Относительная атомная масса определяется суммой числа протонов и числа нейтронов в ядре.
Когда в ядре какого-либо элемента происходит превращение нейтрона в протон, приводящее к испусканию электрона в виде бета-излучения, сумма числа протонов и числа нейтронов не изменяется.
Завершите следующее предложение.
В результате бета-излучения ... изменения ... массы ядра.
Переходите к чтению рубрики 102.
('троение атимя
108. Неправильно.
Обратитесь за подробными разъяснениями в рубрику 67.
109. радиоактивный распад
излучения
Радиоактивный распад может сопровождаться излучением трех типов:
1. Лль^а(а)-излучение, когда испускаются ядра гелия.
2. Бета (Р)-излучение, когда в атомном ядре происходит превращение нейтрона в протон, что сопровождается испусканием образующегося в результате этого превращения электрона.
3. Гамма (у)-излучение, когда избыточная энергия, образующаяся в процессе радиоактивного распада, испускается в виде рентгеновского излучения.
(а, Р и у-греческие буквы альфа, бета и гамма.)
Как называются и обозначаются виды излучения, возникающие при следующих процессах радиоактивного распада?
Испускание электрона из ядра: ...
Испускание ядра гелия более тяжелым элементом: ...
Испускание рентгеновского излучения: ...
Проверьте ответы в рубрике 94.
Таблица 1. Состав атомов
Атомный номер Элемент Число электронов в дочке обо- Состав ядра Относительная атомная масса
ЧИСЛО протонов ЧИСЛО нейтронов
1-й 2-й 3-й 4-й
1 Водород Н 1 1 1
2 Гелий Не 2 2 2 4
3 Литий Li 2 1 3 4 7
4 Бериллий Be 2 2 4 5 9
5 Бор В 2 3 5 6 11
6 Углерод С 2 4 6 6 12
7 Азот N 2 5 7 7 14
8 Кислород О 2 6 8 8 16
9 Фтор F 2 7 9 10 19
10 Неон Ne 2 8 10 10 20
И Натрий Na 2 8 1 11 12 23
12 Магний Mg 2 8 2 12 12 24
13 Алюминий Al 2 8 3 13 14 27
14 Кремний Si 2 8 4 14 14 28
15 Фосфор P 2 8 5 15 16 31
16 Сера S 2 8 6 16 16 32
17 Хлор Cl 2 8 7 17 18 35
18 Аргон Ar .2 8 8 18 22 40
19 Калий К 2 8 8 1 19 20 39
20 Кальций Ca 2 8 8 2 20 20 40
Программа 2
2
Химическая омвь (1)
1. В программе 1 было описано строение атомов. Давайте теперь еще раз посмотрим на табл. 1, помещенную в конце программы 1, обратив внимание на все элементы, которые имеют восемь электронов в самой внешней (валентной) оболочке. Какие это элементы?
Переходите к чтению рубрики 12.
2. Неправильно. Вы указали число электронных пар, которые не являются общими для’ двух атомов в молекуле.
Вернитесь к рубрике 11.
3. Правильно. Число электронов в валентной оболочке иона железа в комплексе [Fe (CN)6]4 ” увеличивается на 12.
Сколько же электронов содержится теперь в электронной оболочке железа в комплексе [Fe (CN)6]4 ” ?
Fe имеет атомный номер 26 (см. табл. 5 в конце программы 7). Следовательно, у атома железа 26 электронов.
В ионе Fe2+ на два электрона меньше, т.е. он имеет 24 электрона.
К этому числу в комплексе [Fe(CN)6]4~ добавляется еще 12 электронов от шести ионов CN-. Таким образом, в комплексе [Fe(CN)6]4- атом железа окружают 24 + 12 = 36 электронов.
Благородный газ криптон тоже имеет 36 электронов. Следовательно, атом железа в комплексе [Fe(CN)6]4~ имеет конфигурацию благородного газа.
Проведите такие же рассуждения относительно атома меди в комплексе [Cu(CN)4]3~ (Си имеет атомный номер 29).
Сколько электронов содержится в электронной оболочке атома Си в этом комплексном ионе?
Запишите ответ и проверьте его затем в рубрике 14.
Если вы нуждаетесь в дополнительных пояснениях, обратитесь к рубрике 70.
4. Н:С1:
Молекулу воды можно записать при помощи таких электронных схем:
.ft. Q
н н или н н или н н Аналогичные записи для молекулы аммиака выглядят так:
H:N:H или H-N-H или H-N-H H Н Н
Таким образом, и в соединениях, состоящих из двух различных элементов, каждый атом приобретает конфигурацию благородного газа.
Запишите аналогичными способами электронные формулы для молекулы СН4.
Проверьте ответ в рубрике 20.
Химическая связь (I)
33
Молекула СН4 имеет форму правильного четырехгранника-тетраэдра, в каждой вершине которого находится атом водорода. Атом углерода помещается в центре тетраэдра.
Если такой тетраэдр мысленно поставить перед собой на стол, он будет стоять на основании из трех атомов водорода, находящихся в плоскости стола, а четвертый атом водорода расположится наверху точно над атомом углерода. Схематическая запись этой молекулы такова:
н Дн
Завершите теперь следующее предложение.
Молекула воды имеет изогнутое строение, молекула аммиака образует ..., а молекула метана (СН4) имеет форму .......
Проверьте ответ в рубрике 25.
6. Хлорид-ион заряжен отрицательно.
Когда натрий и хлор реагируют друг с другом, атом хлора приобретает один электрон, который отдает ему натрий.
Na'^+^-Ci: —► Na*:Ci:"
хлорид натрия
Запишите соответствующее уравнение для реакции
Калий + Фтор -> Фторид калия
Проверьте ответ в рубрике 16.
7. Вы ошиблись. Вспомните, что каждому атому хлора необходим всего один дополнительный электрон, чтобы приобрести конфигурацию благородного газа.
Прочтите еще раз рубрику 35.
8. Na
Mg2 +
Fe2 +
Cu2 +
Эти ионы металлов располагаются в ионной решетке, подобной кристаллической решетке хлорида натрия. Электроны перемещаются между ионами, образуя «электронный газ», который удерживает положительные ионы металла в решетке. Поскольку электроны в кристаллической решетке металла
3 29
могут перемещаться свободно, металлы являются хорошими проводниками электрического тока.
Завершите следующие предложения.
Атомы металлов образуют ..., чтобы приобрести конфигурацию благородного газа. Они выстраиваются в ионную решетку, в которой ... имеют возможность свободно перемещаться. Это объясняет хорошую ... металлов.
Проверьте ответ в рубрике 71.
9. Сери превращается в двухзарядный сульфид-ион в результате присоединения двух электронов.
Приведем примеры некоторых солей, содержащих сульфид-ион:
Na+ S2’ Na+ Mg2+ s2- или Na2S (сульфид натрия) или MgS (сулырид магния)
После того как мы обсудили ионную связь, перейдем к рассмотрению ковалентной связи.
Ковалентная связь совершенно отличается от ионной связи. Однако главной причиной образования связи и в этом случае является достижение конфигурации ... газа атомами, участвующими в образовании соединения.
Завершите это предложение и переходите к чтению рубрики 35.
10. Между электрюнными оболочками иона металла и цианидного иона обобществляется электронная пара каждого цианидного иона.
Следовательно, ваш ответ неправилен, потому что электронная пара содержит два электрона.
В комплексе [Fe(CN)6]4~ имеется шесть цианидных ионов. На сколько же увеличивается число электронов вокруг иона железа в этом комплексе?
Запишите ответ и проверьте его в рубрике 3.
Мы уже познакомились с ковалентными связями в молекулах С12, О2 и N2.
Сколько обобществленных электронных пар имеется в молекулах О2, N2
и С12? о2 n2 С12
• 2 1 3 -» 2
• 4 2 6 - 61
• 2 3 1 - 21
• 2 2 1 - 51
12. Неон (Ne), аргон (Аг).
Оба этих элемента называются благородные газы. Они обнаруживаются в природе в свободном состоянии и обычно не образуют химических соединений.
Какой вывод можно сделать из этого?
Атомы, имеющие 8 электронов в самой внешней электронной оболочке,
характеризуются особой химической активностью/инертностью (вычеркните то из этих слов, которое неприменимо в данном случае).
Проверьте ответ в рубрике 23.
13. Благородный газ, имеющий два электрона,-это гелий.
Рассмотрим теперь ковалентные соединения, образованные из двух различных элементов.
Н2 + С12 —► 2 НС1 или
Н-Н + —► Н-Cl: + Н-Cl:
Вместо таких записей можно сделать другие, в которых электронные пары обозначаются черточками (см. рубрики 4 и 50).
Переходите к чтению рубрики 4.
14. Электронное облако Си в комплексном ионе [Cu(CN)4]3- содержит 36 электронов, и, следовательно, атом Си в данном случае тоже имеет конфигурацию благородного газа.
Для других комплексных ионов ситуация не всегда оказывается столь идеальной. Другими словами, было бы неправильно думать, что центральный атом в комплексном ионе всегда имеет электронную конфигурацию благородного газа.
Обратимся теперь к рассмотрению составных частей комплексных ионов и их обозначениям.
1. Атом металла в центре комплекса называется центральный атом.
2. Группы атомов, располагающиеся вокруг центрального атома, называются лиганды.
3. Число лигандов в комплексе называется координационное число.
Укажите центральный атом, название лигандов и координационное число для каждого из следующих комплексных соединений:
Na3[Cu(CN)4] и K4[Fe(CN)6]
Проверьте ответ в рубрике 62.
15. Ион железа в [Fe(CN)6]4- несет два положительных заряда, т.е. представляет собой ион Fe* 2 * +. Поскольку цианидные ионы заряжены отрицательно, имеем
2+ +6“=4“
Однако в комплексном ионе эти положительные заряды центрального атома и отрицательные заряды цианидных лигандов имеют лишь формальный смысл. Комплексный ион как целое представляет собой частицу, несущую определенный общий заряд, в данном случае 4“. Электронные облака центрального атома и лигандов перекрываются. Следовательно, электронная пара, первоначально принадлежащая каждому цианидному иону, в комплексе обобществляется между центральным атомом и лигандом.
Это обобществление электронов приводит к увеличению числа электронов во внешней (валентной) оболочке атома металла. Насколько увеличивается число электронов в валентной оболочке атома железа в комплексе [Fe(CN)6]4-?
3*
36 Программа 2
• На 6 электронов -► 10
• На 12 электронов -» 3
16. к- + F: —► к*:Ё:'
калий <ртор фторид
калия
Ионы являются заряженными частицами, которые в зависимости от знака заряда отталкиваются или притягиваются друг к другу. Ионная связь обусловлена электростатическим притяжением между частицами с зарядами противоположного знака.
Этот закон известен из физики.
Какие частицы притягиваются друг к другу?
• С зарядами одинакового знака -» 24
• С зарядами противоположного знака -+ 32
17. [Cu(NH3)4]2 +
Правильно ли вы записали эту формулу? Если нет, советуем вам, прежде чем продолжить изучение программы, еще раз повторить материал, начиная с рубрики 14.
Мы заканчиваем эту программу описанием металлической связи.
Металлическая связь имеет много общего с ионной связью и позволяет понять физические свойства металлов.
Атомы металлов чаще всего имеют 1-3 внешних электрона. Чтобы приобрести конфигурацию благородного газа, они отдают эти внешние электроны, превращаясь в ионы соответствующих металлов.
Какие ионы образуются из следующих атомов?
Na-
•Mg-
•Fe
•Си-
Проверьте ответ в рубрике 8.
18. Атом хлора электрически нейтрален. Если он присоединяет один электрон и тем самым приобретает электронную конфигурацию благородного газа, то вместе с этим приобретает и заряд.
После присоединения одного электрона атом хлора становится положительно/отрицательно заряженным.
‘ Выберите правильный ответ и проверьте его в рубрике 6.
19. Сере легче присоединить два электрона, чем отдать шесть. Переходите к чтению рубрики 9.
20. « V
Н-.С: Н Н-<р-Н
H Н
Такой способ записи формул для соединений, подобных НС1, Н2О, NH3 и СН4, не всегда соответствует реальному пространственному расположению атомов. Рассмотрим этот вопрос подробней.
Химическая связь (I)
37
НС! линейная («вытянутая») молекула: Н—С1
Н2О изогнутая молекула и'°'
(три атома Н, О и Н располагаются в вершинах треугольника) NH3 молекула, имеющая форму пирамиды, основанием которой является равносторонний треугольник. Атомы водорода располагаются в вершинах этого треугольника, а атом азота занимает вершину пирамиды:
основание пирамиды
Изобразите молекулу аммиака в соответствии с описанным строением. Проверьте ответ в рубрике 5.
21. В О2 между двумя атомами кислорода имеются две обобществленные электронные пары.
В N2 между двумя атомами азота имеются три обобществленные электронные пары.
В С12 между двумя атомами хлора имеется одна обобществленная электронная пара.
Примечание. Каждая обобществленная электронная пара соответствует химической связи.
Химические связи, с которыми мы познакомились на этих трех примерах, называются по-разному:
при наличии одной обобществленной электронный пары -простая связь, при наличии двух обобществленных электронный пар-двойная связь, при наличии трех обобществленных электронных пар-тройная связь. Атом водорода имеет всего один электрон. В молекуле водорода два электрона принадлежат одновременно двум ядрам:
© Н Н © или Н : Н или н-н или н2
Таким образом, в молекуле водорода каждый атом имеет электронную конфигурацию благородного газа, поскольку К-оболочка полностью заполняется двумя электронами.
Мы уже обсуждали благородный газ, обладающий двумя электронами. Помните ли вы его? Если нет, отыщите его в табл. 1, помещенной в конце программы 1.
Проверьте ответ в рубрике 13.
22. (О-О)
Удалось ли вам сделать эту запись безошибочно?
Горизонтальные черточки (изображающие ковалентные связи) соответствуют двум обобществленным электронным парам.
Атом азога имеет в валентной оболочке пять электронов (одну электронную пару и три неспаренных электрона). Поэтому молекулу азота
можно схематически представить следующим образом:
l№NI
Запишите теперь молекулу N2, изображая все валентные электроны точками.
Проверьте ответ в рубрике 11.
23. Атомы, имеющие 8 электронов в самой внешней электронной оболочке, характеризуются особой химической инертностью.
Следовательно, восемь электронов во внешней оболочке атома делают его особенно устойчивым.
Все благородные газы, за исключением гелия, имеют 8 электронов во внешней оболочке. По этой причине такая электронная конфигурация получила название электронная конфигурация благородного газа.
Конфигурация благородного газа получается, когда атом имеет ... электронов во внешней электронной оболочке.
Завершите это предложение, вставив в него пропущенное число, а затем проверьте ответ в рубрике 34.
24. Нет. Частицы с зарядами одинакового знака отталкиваются друг от друга. Это явление известно также из учения о магнетизме: одинаковые магнитные полюса отталкиваются друг от друга.
А что можно сказать в этом отношении о ионах Na + и С1 “ ?
Частицы с зарядами противоположного знака ....
Переходите к чтению рубрики 32.
25. Молекула воды имеет изогнутое строение, молекула аммиака образует пирамиду, а молекула метана (СН4) имеет форму правильного четырехгранника (тетраэдра), в центре которого находится атом С. Теперь мы можем сформулировать следующее утверждение о валентности или числе связей, которые способен образовывать атом.
Атом может образовывать столько связей, сколько у него есть неспаренных электронов. Это число связен и является валентностью атома.
А теперь завершите следующую таблицу, пользуясь при необходимости данными табл. 1, помещенной в конце программы 1.
Элемент Символ Число электронных пар Число неспареиных электронов Валентность атома
Водород Н 0 1 1
Хлор С1
Кислород о 2 2 2
N
F 3
С 0
Проверьте ответ в рубрика 54.
26. Каждый атом хлора имеет во внешней оболочке семь электронов (три электронные пары и один неспаренный электрон).
Химическая еря::, .-’t
Было бы неправильно сказать, что два атома хлора в молекуле хлора обобществляют только один электрон. А куда же девается другой «неспаренный» электрон?
Прочтите еще раз рубрику 35.
27. Когда атом натрия отдает один электрон, он приобретает положительный заряд и тем самым превращается в ион:
потеря одного
Na- -ИИШ™.—». Na электрона
Na + означает ион натрия.
Хлор имеет семь внешних (валентных) электронов. Он приобретает конфигурацию благородного газа, присоединяя один дополнительный электрон:
присоединение одного
электрона
Cl:"
При этом образуется хлорид-ион. Как заряжен хлорид-ион?
Отрицательно (—) -» 6
Положительно (+ ) -» 18
Нейтрален -» 36
28. Неправильно. Прочтите объяснение в рубрике 57.
29. s
Сера имеет в самой внешней оболочке шесть электронов-две электронные пары и два неспаренных электрона.
Каким образом атом серы может превратиться в ион?
• В результате присоединения двух электронов -> 9
• В результате отдачи шести электронов -» 19
30. Неправильно. Прочтите объяснение в рубрике 57.
31. Атом натрия в целом электрически нейтрален. Если он отдает один электрон, чтобы приобрести электронную конфигурацию благородного газа, то при этом становится заряженным.
Атом натрия, отдав электрон, становится положительно/отрицательно заряженным.
Выберите правильный ответ и проверьте его в рубрике 27.
32. Частицы с зарядами противоположного знака притягиваются друг к другу. Положительно заряженный ион натрия Na + притягивает отрицательно заряженный хлорид-ион О " (и разумеется, хлорид-ион притягивает ионы натрия).
40
Программа 2
2
В результате такого взаимного притяжения возникает ионная связь.
Положительно заряженные ионы называются катионы, а отрицательно заряженные ионы-анионы. Эти названия произошли из учения об электролизе, при котором положительные ионы перемещаются к катоду (отрицательному электроду), а отрицательные ионы перемещаются к аноду (положительному электроду).
С какими анионами вы познакомились в данной программе? Запишите их (пока их было только два).
Переходите к чтению рубрики 42.
33. о-
Атом кислорода имеет шесть внешних электронов.
Каким образом атом кислорода может приобрести конфигурацию благородного газа?
Кислород существует в природе в виде молекул О2.
Когда два атома кислорода сближаются настолько, что могут образовать молекулу, их внешние электронные оболочки начинают в некоторой мере перекрываться между собой. В результате бывшие прежде «неспаренными» электроны каждого атома становятся общими для обоих атомов. Таким образом, каждый атом приобретает конфигурацию благородного газа, и образуется молекула кислорода:
•О- + О. —► \о: ю:
Запишите теперь молекулу кислорода, используя штрихи для изображения двухэлектронных связей и электронных пар*.
Проверьте ответ в рубрике 22.
34. Конфигурация благородного газа получается, когда атом имеет 8 электронов во внешней электронной оболочке.
Исключением из этого правила является гелий: он имеет только 2 электрона.
Для указания числа электронов во внешней оболочке (т.е. валентных электронов) принято использовать условное обозначение. Каждый валентный электрон указывают точкой рядом с химическим символом соответствующего элемента. Например,
Li- Be- -В- С-
Спишите эти примеры и сопоставьте число точек у каждого символа с числом внешних электронов, указанным в табл. 1, которая помещена в конце программы 1.
Когда число валентных электронов становится больше 4, электроны начинают объединяться по два, образуя электронные пары. Это происходит у азота:
^электронная пара
-N-
неспаренные
(„свободные”} электроны
* Молекула кислорода имеет более сложное строение (см. гл. 25). По-видимому, лучше было бы рассмотреть двойную ковалентную связь на другом примере.- Прим. ред.
Химическая связь (I)
41
Изобразите схему атома кислорода, указывая его валентные электроны точками.
Проверьте ответ в рубрике 45.
35. конфигурации благородного газа Рассмотрим еще раз атом хлора
=ci-
Хлор встречается в природе не в виде свободных атомов, а только в виде молекул С12, в которых два атома хлора связаны друг с другом. Как осуществляется эта связь?
Атом хлора имеет во внешней оболочке семь электронов: три электронные пары и один неспаренный электрон. Когда два атома хлора сближаются настолько, что их электронные оболочки начинают перекрываться (взаимно проникать друг в друга), два неспаренных электрона, ранее принадлежавшие двум атомам, обобществляются в возникающей при этом молекуле. Таким образом, каждый атом в молекуле приобретает электронную конфигурацию благородного газа. Схематически это можно представить следующим образом:
:СР + -С1: —* :С1:С1:
В молекуле хлора каждый атом имеет восемь электронов во внешней электронной оболочке. Сколько электронов обобществляют эти два атома? • Один электрон -» 26
• Два электрона -» 58
• Семь электронов -> 7
• Восемь электронов -> 47
36. Протоны заряжены положительно, а электроны-отрицательно. Когда электрически нейтральный атом хлора присоединяет дополнительный электрон, он превращается в электрически заряженный хлорид-ион.
Вернитесь к рубрике 27.
37. Некоторые из ионов натрия на приведенном выше схематическом рисунке действительно имеют по соседству только два хлорид-иона. Однако вам должно быть ясно, что этот схематический рисунок изображает лишь часть кристаллической поверхности.
Чтобы правильно ответить на поставленный вопрос, нужно рассмотреть какой-либо ион натрия во внутренней части кристаллической решетки.
Проверьте ответ в рубрике 65.
38. Конфигурация благородного газа.
Атомы всех элементов, не имеющих конфигурации благородного газа, образуют химические связи с другими атомами, чтобы достичь этой конфигурации. Это объясняет реакционную способность различных элементов.
Программа 2
Ниже показана схема строения атома натрия:
Простейший способ, при котором натрий может приобрести конфигурацию благородного газа, заключается в том, чтобы отдать один электрон
Какой заряд приобретает атом натрия после того, как он отдает один электрон?
• Положительный
• Отрицательный
• Никакого заряда
• Не знаю
27
31
49
44
39. Правильно, ион натрия имеет заряд 1 + ион магния имеет заряд 2 + хлорид-ион имеет заряд 1 —
А теперь загляните в табл. 1, помещенную в конце программы 1, и с ее помощью запишите символическое обозначение атома серы с указанием числа электронов в его внешней оболочке.
Проверьте ответ в рубрике 29.
40. Если вы забыли подробности, прочтите еще раз рубрику 55.
41. Следует признать, что на поверхности кристалла существуют некоторые ионы натрия, которые имеют по соседству только три хлорид-иона. Однако вам должно быть ясно, что приведенный выше схематический рисунок изображает лишь небольшую часть кристаллической поверхности.
Чтобы правильно ответить на поставленный вопрос, следует рассмотреть ион натрия во внутренней части кристаллической решетки.
Проверьте ответ в рубрике 65.
42. В данной программе до сих пор были упомянуты два аниона:
CI ~ хлорид-ион
F “ фторид-ион
Все положительно заряженные ионы называются .... Проверьте ответ в рубрике 53.
43. Неправильно. Прочтите еще раз рубрику 55.
44. Атом натрия в целом электрически нейтрален. В его ядре содержится двенадцать нейтронов и одиннадцать протонов, последние несут положительные заряды. В электронном облаке этого атома находится одиннадцать электронов, которые несут отрицательные заряды.
Если атом натрия отдает один электрон, приобретая при этом конфигурацию благородного газа, он становится электрически заряженным.
Вернитесь к рубрике 38 и постарайтесь правильно ответить на поставленный там вопрос.
45. Атом кислорода можно схематически представить одним из двух способов:
•О- или -о:
Кислород имеет шесть электронов во внешней электронной оболочке. Четыре из них образуют две электронные пары. Два остальных электрона остаются неспаренными, или свободными.
Дайте схематическое изображение внешних электронов для фтора и неона.
Проверьте ответ в рубрике 56.
46. Подсчитайте еще раз!
Выберите для этого ион натрия в центре рисунка и подсчитывайте только те хлорид-ионы, которые удалены от натрия на одинаковое расстояние, являясь его ближайшими соседями.
Проверьте ответ в рубрике 55.
47. Неправильно. Вспомните, что каждому атому хлора необходим всего один дополнительный электрон, чтобы приобрести конфигурацию благородного газа.
Прочтите еще раз рубрику 35.
48. :Cl-*+x-Mg-Z+4-ci: ----» :С1;- Mg* * :С1:‘
Чтобы упростить обозначения, можно не указывать внешние электроны, сохраняя только заряды:
--» Cl" Mg* * С1‘
или, еще проще, только общую формулу:
—► MgCl,
Вместо Mg+ + можно также записывать Mg2 + .
Из этих записей легко определить заряды ионов.
44
Программа 2
2
Для положительно заряженных ионов заряд равен числу отданных электронов, а для отрицательно заряженных ионов-числу присоединенных электронов.
Укажите заряды следующих ионов:
Ион натрия Ион магния Ион хлора
• 1 + 1 + 1 - >28
• 1 + 1 - 1 + >68
• 1 - 2 + 1 - >30
• 1 + 2 + 1 - -> 39
• 1 + 2 + 1 + -> 60
49. Протоны заряжены положительно, а электроны отрицательно.
Когда нейтральный как целое атом натрия отдает электрон, он должен стать электрически заряженным.
Вернитесь к рубрике 38 и попытайтесь правильно ответить на поставленный там вопрос.
50. Характерной особенностью ковалентной связи является наличие обобществленной, или связывающей, электронной пары.
Остановимся теперь на обозначениях, принятых для записи ковалентной связи. Вместо двух точек для обозначения электронной пары, обобществленной двумя атомами, принято использовать валентный штрих-черту (символ химической связи), например
фСГ-
неподеле иные электронные пары
обобществленная элентронная па рановалентная связь
Иногда неподеленные электронные пары обозначают горизонтальной или вертикальной чертой
icj-cjl
Во многих случаях интерес представляют только связывающие электронные пары. В подобных случаях используется упрощенная запись такого вида:
С1—С1
Теперь запишите символическое обозначение атома кислорода, изобразив его валентные электроны точками.
Проверьте ответ в рубрике 33.
51. Ваш ответ правилен для кислорода и хлора, но не для азота. Посмотрите еще раз на электронную формулу молекулы азота. Вернитесь к рубрике 11.
52. Правильно. Соединения с ионными связями обладают низкой летучестью. Ковалентные соединения значительно более летучие.
Химическая связь (I)
45
Достижение электронной конфигурации благородного газа может рассматриваться как причина образования ионных и ковалентных связей. Эта же причина объясняет образование более сложных соединений.
В качестве примера рассмотрим несколько комплексных соединений K4[Fe(CN)6]-3To комплексная соль, состоящая из ионов 4К + и [Fe(CN)6]4-.
Комплексный анион, указанный в квадратных скобках, несет четыре отрицательных заряда. Запишите его снова, по памяти.
Примером другого комплекса является
Na3 [Cu(CN)4]
2
Запишите комплексный анион, который входит в состав этой соли. Проверьте ответ в рубрике 72.
53. катионы
Примерами катионов являются ионы натрия Na + и ионы калия К +. Комбинация катионов с анионами дает соль в результате образования ионной связи.
Ионы натрия и хлора соединяются, образуя кристаллы соли хлорида натрия.
Располагаясь в кристалле, ионы образуют решетку. Чтобы понять пространственное расположение ионов в решетке, рассмотрим сначала одну ее плоскость, в которой ионы натрия символически обозначены черными кружками, а хлорид-ионы-белыми кружками.
• ион натрия
о хлорид-ион
Сколько хлорид-ионов окружает каждый ион натрия в этой плоскости кристалла?
• Два -» 37
• Три ->• 41
• Четыре -> 65
54. Заполненная таблица должна иметь такой вид:
Элемент Символ Число электронных пар Число неспаренных электронов Валентность атома
Водород Н 0 1 1
Хлор CI 3 1 1
Кислород О 2 2 2
Азот N 1 3 3
Фтор F 3 1 I
Углерод С 0 4 4
46
Таким образом, валентность атома равна числу его неспаренных электронов*.
Если вы сделали при составлении этой таблицы больше двух ошибок, то, прежде чем двигаться дальше, повторите еще раз материал, начинающийся с рубрики 9.
Соединения, в которых атомы связаны друг с другом ковалентными связями, существуют в виде изолированных молекул. Однако в твердом состоянии изолированные молекулы тоже связываются друг с другом в кристаллические решетки.
В отличие от этого ионные соединения в твердом состоянии образуют ....., но не существуют в виде изолированных молекул.
Завершите это предложение и проверьте ответ в рубрике 63.
55. Каждый ион натрия в кристаллической решетке хлорида натрия окружен шестью хлорид-ионами, отстоящими от него на одинаковое расстояние. Ниже показан фрагмент этой решетки. На нем изображен только один ион натрия в центре решетки, окруженный шестью хлорид-ионами.
Из этого видно, что хлорид натрия в твердом состоянии существует не в виде отдельных молекул NaCl, а в виде протяженной кристаллической решетки, в которой каждый ион натрия окружен шестью хлорид-ионами. Точно так же каждый хлорид-ион окружен шестью ионами натрия.
Чтобы подвести итог сказанному, завершите следующие предложения.
Элементы натрий и хлор реагируют друг с другом, образуя соединение ..... Образование соединения происходит в результате того, что атом натрия отдает электрон, который присоединяет атом хлора. При этом образуются положительно заряженный ион ... и отрицательно заряженный ион.... Каждый из этих ионов имеет в своей валентной оболочке ... электрюнов.
Проверьте ответ в рубрике 66.
56. Атомы фтора и неона изображаются такими схемами:
:F- и ;Ne:
Фтор имеет три электрюнные пары и один неспаренный электрон, а у неона четыре электронные пары в валентной оболочке.
Структура из восьми электронов в виде четырех пар представляет собой электронную конфигурацию благородного газа.
Воспользуйтесь табл. 1, помещенной в конце программы 1, и запишите схемы валентных электронов для элементов натрия и хлора.
Проверьте ответ в рубрике 67.
* Столь категорическое утверждение не совсем точно: почти все приведенные в таблице элементы могут иметь и другую валентность.-Прим. ред.
\НМНЧСЧ'КДИ
57. Заряд иона определяется изменением, происходящим в его электронной оболочке при переходе от нейтрального атома к иону (приобретение или потеря электронов).
Заряд
Превращение иона
Na- ► Na+ 1+
К- -----► К+ 1+
:С1- —► или С1" 1-
Вернитесь к рубрике 48 и поставленный там вопрос.
постарайтесь дать правильный ответ на
58. Совершенно верно. Два атома хлора обобществляют два электрона. Таким образом, каждый атом хлора приобретает внешнюю (валентную) оболочку с восемью электронами: шесть из них-это три его электронные пары и еще два-обобществленная электронная пара.
Схематически это можно представить следующим образом:
Два электрона принадлежат одновременно двум атомам хлора. Таким образом, эти два электрона образуют обобществленную электронную пару, или связывающую электронную пару.
Завершите следующее предложение.
Ковалентная связь характеризуется наличием ... электронной пары.
Проверьте ответ в рубрике 50.
59. Mg-
Магний имеет два электрона в третьей оболочке (М-оболочке).
Чтобы приобрести конфигурацию благородного газа, магний должен отдать оба этих электрона, в результате чего он превратится в двухзарядный положительный ион магния.
В качестве примера рассмотрим реакцию между магнием и хлором. Два электрона, которые отдает магний, принимают два атома хлора.
Запишите электронную схему реакции между магнием и хлором.
Проверьте ответ в рубрике 48.
60. Неправильно. Прочтите объяснение в рубрике 57.
61. Неправильно. Вы указали не то, что требовалось в вопросе, а число несвязывающих электронных пар, т. е. число тех электронных пар, которые не обобществлены двумя атомами.
Вернитесь к рубрике 11.
48
Программа 2
62.
Центральный атом
Лиганд
Координационное число
Na3 [Си (CN)J Си CN
4
K4[Fe(CN)6] Fe CN
6
।—лиеанд
Na, [Cu(CN)4]
L[________координационное
число центральный атом
Встречаются не только комплексные анионы, но также и комплексные катионы, как, например, в соединении
[Ag(NH3)2]Cl
Укажите катион и анион в этом соединении, а также центральный атом, лиганды и координационное число.
Проверьте ответ в рубрике 73.
63. Ионные соединения в твердом состоянии образуют кристаллические решетки, но не существуют в виде изолированных молекул.
Ионные соединения имеют очень низкую летучесть. При нагревании они превращаются в жидкость лишь при довольно высоких температурах, а при обычных условиях не поддаются перегонке.
Ковалентные соединения, подобные Cl2, N2, О2, НО, NH3 и СН4 (а также большинство органических соединений), довольно летучи. Некоторые из них при нормальных температуре и давлении находятся в газообразном состоянии (например, все перечисленные выше соединения) и большинство из них можно перегнать без разложения.
Какое из следующих утверждений является правильным?
Ионные соединения Ковалентные соединения
• летучие нелетучие -> 77
• нелетучие летучие -»• 52
64. Хотя на рисунке действительно имеются ионы натрия, которые окружены только четырьмя хлорид-ионами, эти ионы натрия имеют соседние хлорид-ионы не со всех сторон. Наш схематический рисунок показывает лишь небольшую часть ионной решетки. Выберите для подсчета какой-нибудь ион натрия, расположенный в центре рисунка, и вы получите правильный ответ.
Проверьте его в рубрике 55.
65. Правильно. Ион натрия окружен в кристаллической решетке четырьмя хлорид-ионами, расположенными на одинаковом расстоянии от него.
В кристалле имеется много плоскостей, расположенных одна над другой таким образом, что над каждым ионом натрия помещается хлорид-ион, а над каждым хлорид-ионом-ион натрия.
Химическая сваи. (1)
49
Срисуйте себе в тетрадь при помощи прозрачной бумаги следующий рисунок:
После этого добавьте в ваш рисунок светлые и темные кружки на те места, где должны находиться соответственно ионы хлора и ионы натрия.
Проверьте полученный рисунок в рубрике 75.
66. Пропущенные слова:
хлорид натрия (NaCl)
натрия
хлора
восемь
Ионы натрия и хлора притягиваются друг к другу и образуют ионную решетку, кристаллическую решетку хлорида натрия.
Существуют ли в этой решетке молекулы NaCl?
• Да -► 43
• Нет -> 76
• Не знаю -► 40
67. Na- :cj-
Ни один из этих атомов не обладает электронной конфигурацией благородного газа. Все атомы, не имеющие конфигурации благородного газа, стремятся приобрести ее. По этой причине они образуют соединения, и это объясняет, почему натрий и хлор не обнаруживаются в природе в свободном состоянии.
Элементы могут связываться в химические соединения различными способами. Важнейшими типами химической связи являются:
а) ионная связь,
б) ковалентная связь.
Спишите эти названия. Рассмотрим последовательно эти типы связи.
Какое понятие используется для того, чтобы указать наличие восьми электронов в самой внешней электронной оболочке атома?
Проверьте ответ в рубрике 38.
68. Неправильно. Прочтите объяснение в рубрике 57.
69. Примеры соединений с ковалентными связями: о2, n2, С12, н2, н2о, nh3, сн4
Приведите теперь примеры ионных соединений.
Переходите к чтению рубрики 74.
70. Повторим вопрос: сколько электронов содержится в электронной оболочке атома меди, входящего в комплексный ион [Cu(CN)4]3 " ?
Программа ;
50
Я Медь имеет атомный номер 29. Следовательно, в электронной оболочке атома Си имеется 29 электронов, а у иона Си + -только 28. В комплексном ионе [Cu(CN)4]3* каждый цианидный ион обобществляет одну электронную пару с ионом меди. На этом основании можно произвести такой подсчет:
Си + 28 электронов
4CN ” 8 электронов
Итого ...
Число электронов в электронной оболочке атома Си в комплексе [Cu(CN)4]3' равно ....
Запишите ответ и проверьте его в рубрике 14.
71. ионы электроны электропроводность Подобно солям, металлы обычно имеют высокую температуру плавления и низкую летучесть.
Конец программы 2.
Дальнейшее обсуждение химической связи проводится в программе 25.
72. [Cu(CN)4]3’
Ранее мы уже познакомились с комплексным анионом [Fe(CN)6]4 .
Рассмотрим теперь пространственное расположение атомов в этих двух комплексных анионах.
В анионе [Cu(CN)4]3" атом меди находится в центре между четырьмя цианидными группами, являющимися его соседями. В целом этот комплексный анион несет три отрицательных заряда.
В анионе [Fe(CN)6]4~ центральный атом железа окружен шестью цианидными группами. В целом этот комплексный анион несет четыре отрицательных заряда.
Поскольку комплексный ион [Cu(CN)4]3- несет три отрицательных заряда, тогда как четыре цианидных иона соответствуют четырем отрицательным зарядам, атом меди должен нести один положительный заряд и, следовательно, он представляет собой ион одновалентной меди
1 + +4" =3”
Определите заряд на атоме железа в комплексном ионе [Fe(CN)6]4-.
Проверьте ответ в рубрике 15.
73. Соединение [Ag(NH3)2]Cl включает комплексный катион Ag(NH3)2 и анион С1 ~.
лиганд
_____ноораинационнов число центральный атом
Комплексный катион, центральным атомом которого является Ag, а лигандами-NH3, несет единичный положительный заряд.
Химическая связь (I)
51
Запишите формулу комплексного катиона, имеющего: центральный атом Си
лиганды NH3
координационное число 4
общий заряд 2 +
Проверьте ответ в рубрике 17.
74. Примеры ионных соединений (солей): LiCl, NaCl, К.С1 и MgCl2 Прочтите еше раз рубрику 63.
Добавьте снизу еще одну плоскость кристалла и вы получите такой результат:
Это и есть кристаллическая решетка. Она показывает пространственное расположение ионов в кристалле. На приведенном выше рисунке изображена кристаллическая решетка хлорида натрия.
Сколько хлорид-ионов окружают ион натрия в этом кристалле, являясь его ближайшими соседями?
• Четыре -> 64
• Шесть -> 55
• Восемь —» 46
76. Совершенно верно. В кристалле хлорида натрия не существует отдельных молекул NaCl. Каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион окружен шестью ионами натрия.
Познакомимся теперь с другими примерами ионной связи.
Запишите символическое обозначение атома магния с указанием числа электронов в его внешней оболочке (при необходимости воспользуйтесь данными табл. 1, помешенной в конце программы I).
Переходите к чтению рубрики 59.
4*
Программа 2
77. Ионные соединения образуют ионные кристаллические решетки. Они удерживаются как единое целое силами электростатического притяжения между ионами с зарядами противоположного знака. Ионные соединения не образуют изолированных молекул и поэтому нелетучие.
Ковалентные соединения образуют изолированные молекулы и являются
летучими.
Запишите примеры ковалентных соединений.
Переходите к чтению рубрики 69.
Программа 3
Химические равновесия
1. Рассмотрим следующий эксперимент.
В трех сосудах находятся
а) дистиллированная вода,
б) раствор хлорида натрия NaCl в воде,
в) раствор сахара в воде.
Между этими тремя жидкостями нет видимого различия. Однако они отличаются по своей способности проводить электрический ток. Дистиллированная вода и раствор сахара практически не проводят ток. В отличие от этого раствор хлорида натрия является хорошим проводником электрического тока.
Завершите следующую таблицу:
Проводит электрический ток
да нет
Дистиллированная вода
Раствор соли
Раствор сахара
Проверьте ответ в рубрике 13.
2. Правильно. [СН3СООН] очень велика по сравнению с [СН3СОО " ] и [Н + ]. А теперь сформулируем закон действия масс в более общем виде. Уравнение
АВ^А+ + В"
описывает обратимую диссоциацию молекул АВ на ионы А + и В . Закон действия масс математически описывается выражением
где К константа диссоциации.
Каждый электролит характеризуется определенной константой диссоциации. Константа диссоциации уксусной кислоты очень мала:
К = 0,000018
В приведенном выше общем уравнении АВ означает молекулу уксусной кислоты. Тогда
А+ означает ...
В" означает ...
Завершите эти предложения и проверьте ответ в рубрике 15.
3. НО-сильная кислота.
NaO является солью этой сильной кислоты и сильного основания. Следовательно, данный раствор не может быть буферным, и ваш ответ неправилен.
54
Программа 3
Буферный раствор должен содержать:
а) слабую кислоту и ее соль с сильным основанием или б) слабое основание и его соль с сильной кислотой. Какой из следующих растворов должен обладать буферными свойствами?
• HC1/NH4C1
• NH3/CH3COONH4
• NH3/(NH4)2SO4
• КОН/СН3СООК
32
12
16
37
4. Правильно. Сахар не диссоциирует в водном растворе. Раствор сахара очень плохо проводит электрический ток.
Следовательно, не все соединения диссоциируют при растворении в воде.
Большинство растворимых в воде органических соединений ведут себя так же, как сахар. В качестве примера приведем спирт.
В отличие от этого большинство солей, подобно NaCl, диссоциируют
в растворе.
Завершите уравнения диссоциации хлорида калия и нитрата натрия:
КС1 -> ...
NaNO3 - ...
Проверьте ответ в рубрике 35.
5. [Си2 + ] [S2 - ] = Lcus
LcuS имеет значение 10 ~29.
Это означает, что, если в растворе, содержащем ионы меди и сульфид-ионы, произведение концентраций этих двух ионов превышает 10 29, из раствора должен осаждаться твердый CuS.
Точно так же как ионное произведение воды позволяет вычислять [Н + ] или [ОН], произведение растворимости соединения может быть использовано, чтобы вычислить, какая масса данных ионов останется в растворе после того, как в нем завершится реакция осаждения.
Конец программы 3.
6. Для того чтобы определить, какой из растворов обладает буферными свойствами, нужно убедиться, что он содержит:
- слабую кислоту и ее соль, образованную сильным основанием или - слабое основание и его соль, образованную сильной кислотой.
Какой из следующих растворов обладает буферными свойствами?
• HC1/NH3
• HCl/NaCl
• NH3/CH3COONH4
• NH3/(NH4)2SO4
• KOH/CH3COOK
32 3
12
16
37
7. Добавление соляной кислоты приводит к тому, что ионы Н + соединяются с ионами СН3СОО", образуя недиссоциированную уксусную кислоту.
В результате [СН3СОО “ ] уменьшается, а [СН3СООН] увеличивается.
Химические ранновссии
55
Другими словами, ионы Н * от соляной кислоты связываются ацетатными ионами. Вследствие этого концентрация Н + в буферном растворе при добавлении НО изменяется лишь незначительно, и pH раствора остается практически постоянным.
А что произойдет, если к буферному раствору, состоящему из ацетата натрия и уксусной кислоты, добавить некоторое количество гидроксида натрия? • Ничего не произойдет, потому что NaOH не содержит никаких
ионов, способных изменить равновесие -> 36
• [СН3СОО - ] должно уменьшиться вследствие образования
CH3COONa -> 19
• [СН3СООН] должна уменьшиться, а [СН3СОО ]-возрасти -> 28
8. Ранее было дано следующее упрощенное описание связи между концентрацией протонов в растворе и его pH: значение pH равно показателю степени концентрации протонов, взятому с обратным знаком.
Несколько точнее это определение следует дать так:
Если концентрация протонов выражена в виде степени числа 10, то pH равно показателю этой степени, взятому со знаком минус.
Например, если [Н + ] = 10 “ 4 моль/л, то pH = — ( — 4) = 4.
Еще строже следующее определение:
Значение pH равно логарифму концентрации протонов, взятому с обратным знаком.
[ pH = — lg [Н+]~]
Например, пусть [Н + ] = 10 “ 7 моль/л, тогда
pH = — 1g 10“ 7
1g 10“ 7 = - 7
pH = - ( - 7) = 7
Пользуясь логарифмами, можно вычислить pH и для следующего значения концентрации ионов водорода:
[Н + ] = 4 • 10 “ 7 моль/л
pH = — lg(4-10”7) = -(1g 4+ lg 10" 7) =
= - (0,6 - 7) = - 0,6 + 7 = 6,4
Второй пример: [Н + ] = 2 • 10 “ 3 моль/л
pH = - lg(2 • 10 3) = - (0,3 - 3) = 2,7
Третий пример: [Н + ] = 7 • 10 ” 5 моль/л
pH = — lg(710"5) = -(0,84-5) = 4,16
Из приведенного выше уравнения можно также вычислить [Н + ] по заданному значению pH.
Продолжайте чтение со второй части рубрики 39. 9
9. Символ называется двойные стрелки (символ обратимости).
До сих пор мы изображали обе стрелки в уравнениях равновесий так, что они имели одинаковую длину и одинаковую толщину.
Чтобы указать, куда смещено равновесие (или, иначе, каково положение равновесия), можно сделать длиннее стрелку в ту сторону уравнения, которая соответствует более высокой концентрации. Поясним сказанное на следующих
5ft
11ро1рамми 3
примерах:
СНзСООН СНзСОО" + н+
CHjCOONa 5Z-» СН3СОСГ + Na+
Н2О Н+ + он-
NH4CI NHT + Cl-
Укажите положения следующих равновесий, удлинив соответствующую стрелку:
NaOH Na+ + ОН-
NaCl Na+ + СГ
HCN H+ + CN~
Проверьте ответы в рубрике 95.
[сн3соо - ] [Н + ]
[СН3СООН]
Недиссоциированная уксусная кислота, которая указана в левой части уравнения реакции, записывается в знаменателе математического выражения закона действия масс. Образующиеся при диссоциации ионы (протон и ацетат-ион), которые указаны в правой части уравнения диссоциации, записываются в числителе выражения, описывающего закон действия масс.
Постоянная К называется константа диссоциации.
При растворении уксусной кислоты в воде выполняется соотношение [СН3СОО “ ] = [Н + ]
поскольку из каждой диссоциирующей молекулы уксусной кислоты образуется один ацетат-ион и один протон.
Оцените величину [СН3СООН] относительно величин [Н + ] и [СН3СОО-]. Напомним, что уксусная кислота является слабым электролитом.
По сравнению с [Н + ] и [СН3СОО - ] концентрация СН3СООН должна быть
• очень велика -> 2
• очень мала -> 25
• того же порядка величины -> 18
11. HCN?±H++CN-
Уравнение такого вида указывает, что молекулы постоянно диссоциируют на ионы, а последние непрерывно воссоединяются в нейтральные молекулы. Если прямая и обратная реакции имеют одинаковые скорости, т.е. если в заданный промежуток времени диссоциирует такое же число молекул, какое вновь образуется в результате соединения ионов, то при этом достигается равновесие. Равновесие символически обозначается двойными стрелками т±.
Рассмотренные здесь реакции-это реакции диссоциации. Поэтому такие равновесия называются равновесия ....
Завершите это предложение и проверьте ответ в рубрике 52.
Химические равновесия
57
12. NH3-слабое основание. CH3COONH4 является солЫо этого слабого основания и слабой кислоты.
Следовательно, данный раствор не может быть буферным, и ваш ответ неправилен.
• • • • Буферный раствор должен содержать: а) слабую кислоту и ее соль с сильным основанием или б) слабое основание и его соль с сильной кислотой. Какой из следующих растворов должен обладать буферными свойствами? HC1/NH4C1 - 32 HCl/NaCl - 3 NH3/(NH4)2SO4 -+ 16 КОН/СН3СООК -> 37
13. Проверьте ответ: Проводит электрический ток да нет Дистиллированная вода + Раствор соли + Раствор сахара + Почему только раствор хлорида натрия проводит электрический ток? Дело в том, что хлорид натрия в водном растворе диссоциирован на ионы NaCl -> Na + + Cl ’ Растворы, содержащие ионы, хорошо проводят электрический ток. Зная это, можно ли предположить, что молекулы сахара в водном
растворе диссоциированы на ионы!
• • Да 24 Нет -> 4
14. Неправильно. Все три соединения-NaCl, H2SO4 и NaOH-принадлежат
к сильным электролитам.
Вернитесь к рубрике 44 и попытайтесь правильно ответить на
поставленный там вопрос.
15. Проверьте ответ. А + означает Н + (протон) В “ означает СН3СОО - (ацетат-ион) АВ означает уксусную кислоту А теперь запишите выражение для константы равновесия диссоциации
HCN:
[•••][•••] к =к
Проверьте ответ в рубрике 55.
i ;р.я |>ямма
16. Правильно. Смесь слабого основания аммиака с сульфатом аммония образует буферный раствор.
Чтобы пояснить, в чем заключаются особенности буферного раствора, применим к рассмотрению системы уксусная кислота/ацетат натрия закон действия масс.
Константа равновесия диссоциации уксусной кислоты в водном растворе К = 1,81О“5.
ГСН3СОО - 1 ГН + ]
[СН3СООН] =к=1’810 5
Ту же величину имеет константа равновесия диссоциации любого буферного раствора, содержащего уксусную кислоту и ацетат натрия. Входящие в выражение для константы равновесия концентрации имеют в этом случае следующий смысл:
[СН3СОО - ] концентрация добавленного в раствор ацетата натрия,
[СН3СООН] который полностью диссоциирован концентрация добавленной в раствор уксусной кислоты,
[Н + ] которая практически недиссоциирована концентрация протонов, которая очень мала, поскольку уксусная кислота диссоциирована лишь в очень небольшой степени. В зависимости от соотношения между концентрациями уксусной кислоты и ацетата натрия [Н + ] имеет значения в пределах от 10‘ 4 до 10-6. Следовательно, pH такого раствора должен быть равен 4-6
Если к такому буферному раствору добавить какую-либо сильную кислоту, например НО, то [Н + ] сначала увеличится, нарушив равновесие диссоциации. Вследствие этого другие концентрации ([СН3СОО - ] и [СН3СООН]) немедленно станут изменяться до тех пор, пока не восстановится прежнее значение К = 1,8 • 10 " 5.
Как должны изменяться эти концентрации при добавлении к раствору НО?
СН3СОО _ ] уменьшится
• ^СН3СООН^ увеличится -» 7
^СН3СОО ~ увеличится
• [СН3СООН] уменьшится -» 27
17. NH4C1 является солью слабого основания и сильной кислоты.
Еще один буферный раствор может быть получен смешением разбавленной уксусной кислоты с раствором ацетата натрия.
Уксусная кислота является слабой кислотой.
Ацетат натрия является солью сильной/слабой кислоты и сильного/слабого основания.
Выберите правильный вариант этого предложения и проверьте ответ в рубрике 26.
18. Неправильно. Уксусная кислота-слабый электролит. Это значит, что в водном растворе уксусной кислоты менее 1% молекул диссоциировано на ацетат-ионы и протоны.
Химические равновесии
59
Следовательно, [СН3СООН] очень велика/мала по сравнению с [СН3СОО " ] и [Н + ].
Выберите правильный вариант этого предложения и проверьте ответ в рубрике 2.
19. Вы забыли, что ацетат натрия представляет собой соль и, следовательно, принадлежит к сильным электролитам. Такие соединения полностью диссоциированы в водном растворе.
Прочтите еще раз рубрику 7 и попытайтесь правильно ответить на поставленный там вопрос.
20. [CHjCOOH] означает концентрацию уксусной кислоты
[СН3СОО ] означает концентрацию ацетат-иона
[Н + ] означает концентрацию протона
К любым равновесным реакциям применим закон действия масс. Этот закон устанавливает математическое соотношение между концентрациями диссоциированных и недиссоциированных молекул.
Отношение произведения концентраций ионов к концентрации недиссоциированных молекул равно постоянной величине К.
Применительно к диссоциации уксусной кислоты
CHjCOOH СН3СОО + н+
закон действия масс можно математически записать так:
[ -][н + ] ;
[СН3СООН]
Завершите это выражение и проверьте ответ в рубрике 10.
21. Нет, как раз наоборот. Давайте внимательно разберемся в этом примере. Поскольку ацетат натрия представляет собой соль, он полностью диссоциирует в растворе.
[Na + ] = [СН3СОО “ ] = [CHjCOONa]
Вода диссоциирована лишь в незначительной мере. Равновесие диссоциации воды описывается уравнением
Н2О н* + он
где [Н + ] = [ОН ] и обе концентрации очень малы.
В водном растворе ацетата натрия должно происходить взаимодействие между ацетат-ионами и протонами, образовавшимися при диссоциации воды:
СНзСОО + Н* t» СНзСООН
Это равновесие сильно сдвинуто вправо, а следовательно, из раствора удаляется часть протонов, образующих недиссоциированные молекулы уксусной кислоты. Таким образом, раствор теперь содержит меньше протонов, чем их было в чистой воде. Поэтому [Н + ] больше уже не совпадает с [ОН ~ ].
Какую реакцию должен иметь полученный раствор?
• Щелочную -» 58
• Кислую -► 65
• Нейтральную -+ 42
60
Программа 3
3
22. Символ а означает степень диссоциации. Примером слабого электролита является уксусная кислота СН3СООН. При ее растворении в воде меньше 1% молекул диссоциирует на ионы. Поэтому полученный раствор содержит не только ионы СН3СОО" и Н + , но также недиссоциированные молекулы CHjCOOH. Можно представить себе ситуацию в этом растворе следующим образом: часть ионов, имеющихся в растворе, постоянно соединяются с ионами, имеющими заряд противоположного знака, образуя недиссоциированные молекулы, и одновременно с этим часть молекул диссоциирует на ионы. Химическое уравнение диссоциации такого электролита записывается при помощи двойных стрелок:
СН3СООН СН3СОО + н+
Выше мы указывали еще одну слабую кислоту, цианид водорода, HCN.
Запишите уравнение электролитической диссоциации HCN.
Проверьте ответ в рубрике 11.
23. Для каждого из соединений в выбранной вами строке ниже указано, какими кислотами и основаниями-сильными или слабыми-образована соответствующая соль.
Основание Кислота Реакция в водном растворе
MgCl2 среднее сильная нейтральная
FeCl3 слабое сильная кислая
NaNO3 сильное сильная нейтральная
Таким образом, ваш ответ неправилен. Выберите в конце рубрики 47 строку, в которой все соли дают кислые водные растворы.
24. Поскольку раствор сахара не проводит электрический ток, можно сделать вывод, что он не содержит ионов.
Следовательно, сахар не диссоциирует в водном растворе.
Переходите к чтению рубрики 4.
25. Неправильно. Уксусная кислота-слабый электролит. Это значит, что при ее растворении в воде менее 1% молекул диссоциируют на ацетат-ионы и протоны.
Следовательно, [СН3СООН] очень велика/мала по сравнению с [СН3СОО“] или [Н + ].
Выберите правильный вариант этого предложения и проверьте ответ
в рубрике 2.
26. Ацетат натрия является солью слабой кислоты и сильного основания.
Сравним теперь оба описанных выше буферных раствора.
NH3: слабое основание СН3СООН: слабая кислота
NH4C1: соль слабого CH3COONa: соль слабой
основания и сильной кислоты и сильного
кислоты основания
Химические равновесия
61
В общем случае:
Буферные растворы состоят
а) из слабого основания и его соли с сильной кислотой или
б) из слабой кислоты и ее соли с сильным основанием.
Обдумайте это утверждение, а затем попытайтесь определить, какой из указанных ниже растворов обладает буферными свойствами.
• HC1/NH4C1 -+ 32
• HCl/NaCI -> 3
• NH3/CH3COONFU -> 12
• NH3/(NH4)2SO4 - 16
• КОН/СН3СООК -> 37
• Не знаю -> 6
27. Неправильно. Разберемся подробнее, что происходит в рассматриваемом случае.
Обсуждаемый буферный раствор состоит из
ацетата натрия, сильного электролита, который полностью диссоциирован на [СН3СОО-] и [Na + ],
уксусной кислоты, слабой и лишь незначительно диссоциированной кислоты, которая существует главным образом в виде недиссоциированных молекул CHjCOOH.
При добавлении к этому раствору соляной кислоты, сильной и полностью диссоциированной кислоты, часть протонов от НС1 соединяется с ионами СН3СОО ", образуя СН3СООН.
Следовательно, при этом
[CHjCOO “ ] увеличивается/уменьшается
[СН3СООН] увеличивается/уменьшается
Выберите правильный вариант ответа и проверьте его в рубрике 7.
28. Правильно, [СН3СООН] уменьшается, а [СН3СОО " ] возрастает.
Ионы ОН " от гидроксида натрия соединяются с имеющимися в растворе немногочисленными ионами Н +, образуя недиссоциированную воду. Вследствие этого часть уксусной кислоты диссоциирует, чтобы восстановилась концентрация протонов. Поскольку ионы ОН _ удаляются из раствора в форме недиссоциированной воды, pH раствора остается практически неизменным.
Для обсуждавшихся нами буферных растворов изменения pH происходят лишь в следующих пределах:
уксусная кислота/ацетат натрия: pH 4-6
аммиак/хлорид аммония: pH 9-11
Наиболее важное применение буферных растворов заключается в поддержании заданного значения pH при проведении реакций, протекающих только в определенном диапазоне значений pH. Это относится главным образом к биохимическим реакциям, но также и к некоторым неорганическим и органическим процессам.
На этом мы заканчиваем обсуждение буферных растворов и после краткого повторения перейдем к новой теме.
В связи с обсуждением равновесий мы ввели новый символ <=s. Как называется этот символ?
Проверьте ответ в рубрике 9.
62
Программа 3
29. Нет, [Н + ] не может совпадать с [ОН ].
3
СНлСООН CHjCOO’ + Н +
а на [ОН ] -равновесие
NaOH +* Na* + ОН
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 45.
30. Неправильно.
Если [ОН _] = 10 “ 9 моль/л, то
10 14
[И + ] = iq_9 =10 5 моль/л
и, следовательно, pH = 5.
Раствор является нейтральным, когда pH = 7.
Как можно охарактеризовать раствор с pH = 5?
• Щелочный раствор -» 43
• Кислый раствор -> 39
31. Неправильно. В выбранной вамй строке одно
соединение - СП 3СООН-представляет собой слабый электролит, но другие два соединения-Са(ОН)2 и Н3РО4-являются средними электролитами.
Вернитесь к рубрике 44 и попытайтесь правильно ответить на поставленный там вопрос.
32. НС1-сильная кислота.
NH4C1 является солью этой сильной кислоты и слабого основания. Следовательно, данный раствор не может быть буферным, и ваш ответ неправилен.
Буферный раствор должен содержать:
а ) слабую кислоту и ее соль с сильным основанием или
б ) слабое основание и его соль с сильной кислотой.
Какой из следующих растворов должен обладать буферными свойствами?
• HCl/NaCl - 3
• NH3/CH3COONH4 - 12
• NH3/(NHJ2SO4 -+ 16
• КОН/СН3СООК -> 37
33. Правильно, пять соединений из числа названных-электролиты и диссоциируют в водном растворе. Два из названных соединений-сахар и спирт-являются неэлектролитами.
Между соединениями с полярно противоположными свойствами-совсем недиссоциирующими в растворе (как, например, сахар или спирт) и полностью диссоциирующими (например, NaCl или НС1) существуют еще соединения с промежуточной способностью к диссоциации. Различным степеням
диссоциации соответствуют соединения, которые называются слабые электролиты, средние электролиты и сильные электролиты.
Завершите следующие предложения.
Полностью диссоциируют ... электролиты.
Частично диссоциируют ... электролиты.
Очень слабо диссоциируют ... электролиты.
Проверьте ответ в рубрике 44.
34. Неправильно. В выбранной вами строке два соединения-NaOH и Na2SO4. -являются сильными электролитами, но H2SO3 представляет собой средний электролит.
Вернитесь к рубрике 44 и попытайтесь правильно ответить на поставленный там вопрос.
35. КС1 -+ К+ + СГ
NaNOj -> Na+ + NO 7
Диссоциацию соли в воде принято называть электролитическая диссоциация, поскольку образующийся раствор представляет собой электролит, т. е. способен проводить электрический ток.
Сульфат натрия Na2SO4 диссоциирует на два иона натрия и один сульфат-ион. Последний несет два отрицательных заряда и записывается как
SO4 или SO^-
В дальнейшем мы будем пользоваться только символом SO4-. Запишите уравнение электролитической диссоциации Na2SO4. Проверьте ответ в рубрике 46.
36. Вы не приняли во внимание, что добавление гидроксида натрия приведет к повышению концентрации ионов ОН " и что существует определенное соотношение между [Н + ] и [ОН-].
Запишите это математическое соотношение и его название.
После этого проработайте снова материал, начинающийся с рубрики 40.
37. КОН-сильное основание.
СН3СООК является солью этого сильного основания и слабой кислоты. Следовательно, данный раствор не может быть буферным, и ваш ответ неправилен.
Вернитесь к рубрике 26 и попытайтесь еще раз ответить на поставленный там вопрос.
38. Неправильно. Среди названных соединений два являются неэлектролитами - сахар и спирт. Однако вопрос относился к числу электролитов.
Прочтите объяснение в рубрике 51.
39. Правильно.
При [ОН - ] = 10-9 моль/л раствор имеет [Н + ] = 10-5 моль/л, т.е. pH = 5 и, следовательно, является кислым.
64
Ilpoi рамма '
3
Напомним, что
все кислые растворы имеют pH ниже 7
все щелочные растворы имеют pH выше 7
Концентрации протонов, с которыми мы встречались до сих пор, выражались как целочисленные степени числа 10, например [Н + ]=10“2, 10'4 10“10. Это позволяло легко вычислить соответствующие значения pH.
А как вычислить pH в таких случаях, когда концентрация Н + равна, например, 4 • 10 “ 7, 2-10“ 3 или 7 • 10 - 5?
Для этого нужно знать, как проводятся вычисления с логарифмами. Примеры подобных расчетов приведены в рубрике 8.
Если концентрация протонов в растворе изменяется в результате добавления кислоты или основания, то соответственно этому изменяется значение pH. Однако существуют такие растворы, которые способны поддерживать заданное значение pH в определенных пределах при добавлении
кислоты или основания.
Такие растворы называются буферными. Если определенная смесь соединений обладает свойством поддерживать в достаточной мере постоянное значение pH в растворе, то говорят, что она обладает буферными свойствами.
Примером буферного раствора является смесь разбавленного аммиака с NH4C1.
Водный раствор аммиака МНДводн.) является слабым основанием.
NH4C1 представляет собой соль слабого/сильного основания и слабой/сильной кислоты.
Выберите правильный вариант этого предложения и проверьте ответ в рубрике 17.
40. [Н + ][ОН“] = 10 14. Это соотношение называется ионное произведение воды.
При добавлении NaOH часть ионов Н + в буферном растворе будет реагировать с добавляемыми ионами ОН , образуя нейтральную воду.
Однако в буферном растворе, состоящем из уксусной кислоты и ацетата натрия, содержится очень мало ионов Н + . Обычно их концентрация [Н + ] составляет от 10“4 до 10'6 моль/л, поэтому после добавления NaOH ионы Н + быстро израсходуются. Но это приведет к немедленному образованию новых ионов Н + в результате диссоциации уксусной кислоты, и этот процесс будет продолжаться до тех пор, пока не восстановится прежнее равновесие.
Как изменятся указанные ниже концентрации при добавлении NaOH к буферному раствору, состоящему из ацетата натрия и уксусной кислоты?
[СН3СООН [СН3СОО -[СН3СООН [СН3СОО"
уменьшится увеличится
увеличится уменьшится
49
-» 28
41. Правильно. Степень диссоциации средних электролитов заключена в пределах от 1 до 60%, что соответствует значениям а от 0,01 до 0,6.
Сильные электролиты при растворении в воде диссоциируют больше, чем на 60%, т.е. характеризуются степенью диссоциации а = 0,6-1.
Слабые электролизы при растворении в воде диссоциируют на ионы меньше, чем на 1%, т.е. характеризуются степенью диссоциации а, меньшей 0,01.
M'xj
Символ а означает .....
Завершите это предложение и проверьте ответ в рубрике 22.
42. Неправильно. Раствор имеет щелочную реакцию.
Повторите еще раз материал, начинающийся с рубрики 56.
43. Неправильно. Прочтите объяснение в рубрике 50.
44. Полностью диссоциируют симные электролиты.
Частично диссоциируют средние электролиты.
Очень слабо диссоциируют слабые электролиты.
К сильным электролитам относятся:
почти все соли, например NaCl, КС1, Na2SO4
сильные кислоты, например НС1, H2SO4, HNO3, НС1О3
сильные основания, например NaOH, КОН
К средним электролитам относятся:
кислоты типа Н3РО4 и H2SO3
основания типа Са(ОН)2 и Ва(ОН)2
К слабым электролитам относятся:
органические кислоты, например СН3СООН
слабые неорганические кислоты, например Н2СО3, HCN, H2S
слабое основание NH3 (водн.)
Выберите среди шести приведенных ниже строк ту, где указаны соединения, из которых два являются сильными электролитами, а одно-слабый электролит.
• NaCl, H2SO4. NaOH -» 14
• HCN, Ba(OH)2, NH3 -» 54
• H2SO3, NaOH, Na2SO4 - 34
• H2SO4, NH3, Na2SO4 64
• CHjCOOH, Ca(OH)2, H3PO4 -> 31
• H2S, HCN, NH3 - 61
45. гидролиз
Явление гидролиза можно объяснить как результат одновременного установления нескольких равновесий. В качестве примера укажем, что гидролиз ацетата натрия можно представить следующим образом:
CHjCOONa +* СНзСОО’ + Na*
Н2О Н* + он-
В данном случае в водном растворе присутствуют четыре иона-СН3СОО , Na*, Н* и ОН",-которые могут взаимодействовать друг с другом четырьмя различными способами, что приводит к установлению двух дополнительных равновесий:
СНзСООН СНзСОО- + Н+
NaOH Na* + ОН"
Внимательно рассмотрите эти четыре уравнения, а затем попытайтесь решить следующую задачу.
5-29
Ацетат натрия растворяют в воде. Каковы относительные концентрации ионов Н+ и ОН " в образующемся растворе?
• [Н+ ] больше, чем [ОН “ ] -> 21
• [ОН “ ] больше, чем [Н+ ] -> 58
• [Н + ] = [ОН~] 29
46. Na2SO4 - 2Na+ + SO42~
В водном растворе диссоциируют не только соли, но также кислоты и основания. Например,
НС1 - Н + + СГ
NaOH -» Na+ + ОН ’
Процесс ионизации вещества при растворении называется ..
Завершите это предложение и проверьте его в рубрике 57.
47. Совершенно верно. Раствор NH4NO3 в воде имеет кислую реакцию.
Чтобы легче было предсказывать, кислыми или щелочными будут растворы различных солей, ниже указаны некоторые сильные, средние и слабые кислоты и основания.
Сильные: НО, H2SO4, HNO3, НС1О3; гидроксиды щелочных металлов.
Средние: Н3РО4, H2SO3, Са(ОН)2, Mg(OH)2, Ва(ОН)2.
Слабые: СН3СООН, Н2СО3, HCN, H2S; NH3, гидроксиды металлов (кроме щелочных и щелочно-земельных).
Выберите из приведенных ниже четырех строк ту, где перечислены только соли, дающие кислые водные растворы.
• MgCl2, FeCl3, NaNO3 -+ 23
• CH3COONa, BaCl2, MgSO4 -» 60
• A12(SO4)3,-SnCl2, NH4C1 - 70
• NH4C1, Na2CO3, K2SO4 -» 92
48. Неправильно. Обратитесь за разъяснениями в рубрику 51.
49. Неправильно. Вернитесь к рубрике 39.
50. Проверьте ответ:
[Н+] pH
10"5 моль/л 5
10”13 моль/л 13
10“7 моль/л 7
10”2 моль/л 2
Дистиллированная вода является нейтральной средой, и концентрация протонов в ней равна концентрации гидроксид-ионов [Н + ] = [ОН“]. Поскольку
[Н + ][ОН-] = 1014, в дистиллированной воде выполняется равенство [Н+] = = [ОН ~ ] = 10 _ 7 моль/л.
Соответственно тому, что [Н + ]=10-7, pH дистиллированной воды равно 7. •
В нейтральных растворах pH равно 7.
Водные растворы кислот имеют pH ниже 7.
Водные растворы оснований имеют pH выше 7.
Нейтральный раствор 1
pH = 1 2 34 5 6789 10 11 12 13 14
Повышенная Повышенная
кислотность 1 основность
Как можно охарактеризовать раствор, в котором [ОН“]= 10“9 моль/л?
Нейтральный раствор -+ 30
Кислый раствор -» 39
Щелочной раствор -» 59
51. Электролитами являются соединения, которые в водном растворе диссоциируют на ионы. Электролитами могут быть соли, кислоты и основания. Наличие ионов в водном растворе делает его проводником электрического тока. Соединения, которые не диссоциируют в растворе, являются неэлектролитами.
Процесс ионизации при растворении в воде называется .......
Завершите это предложение, вставив недостающие слова, после чего вернитесь к рубрике 57.
52. диссоциации
Стрелки в уравнениях диссоциации указывают направление реакций
-» означает диссоциацию молекулы на ионы «- означает воссоединение ионов в молекулу
Обе реакции протекают одновременно и при равновесии имеют одинаковые скорости.
Это иллюстрируется следующим примером.
При растворении уксусной кислоты в воде сразу же начинается ее электролитическая диссоциация
СН3СООН - CHjCOO” + н + уксусная кислота ацетат-ион проток
Обратная реакция
CHjCOOH - CHjCOO" + Н +
вначале протекает очень слабо, но, по мере того как диссоциирует все большее и большее количество молекул уксусной кислоты, она постепенно усиливается. Через некоторое время число воссоединяющихся ионов в точности уравнивается с числом диссоциирующих молекул уксусной кислоты.
Когда выполняется это условие, наступает ... диссоциации.
Завершите это предложение и проверьте ответ в рубрике 63.
5*
53. Правильно. Все три соли в выбранной вами строке гидролизуются, образуя щелочные растворы.
Закон действия масс применим и к соединениям, которые диссоциируют больше, чем на два иона.
Примером может служить H2SO4.
H2SO4 2Н+ + SO*~
[H + ]2[SO2-] к
[H2SO4]
Соответственно тому, что в левой части химического уравнения реакции указаны два протона (2Н +), в выражение для константы равновесия концентрация протонов входит в квадрате.
В общем случае:
Коэффициент, указывающий число определенных ионов в уравнении диссоциации, служит показателем степени концентрации соответствующих ионов в выражении для константы равновесия.
Приведем еще один пример:
H2S 2Н+ + S2'
Запишите математическое выражение для закона действия масс применительно к данному равновесию.
Проверьте ответ в рубрике 96.
54. Неправильно. В выбранной вами строке два соединения - HCN
и МН3(водн.(-являются слабыми электролитами, а одно-Ва(ОН)2-средний электролит.
Вернитесь к рубрике 44 и попытайтесь правильно ответить на поставленный там вопрос.
[Н 4 ] [CN ~ ]
551 —[HCNT-
Дальнейшее изложение будет понятно вам только в том случае, если вы знакомы с представлением численных величин в виде степеней числа десять. Тогда вы можете переходить к решению приведенных ниже численных примеров. В противном случае обратитесь сначала к рубрике 82.
Выполните следующие вычисления:
102
IO"2 =
102 -104 =
104102=
Проверьте ответ в рубрике 79.
[Н*][ОН]
“• - [Н2О]
Мы уже знаем, что вода всегда диссоциирована в очень малой степени. Поэтому концентрации [Н‘], [ОН-], а также константа диссоциации К воды очень малы.
Поскольку концентрация недиссоциировапной воды очень велика по сравнению с [Н + ] и [ОН ' ], можно приближенно считать [Н2О] постоянной величиной. Умножая ее на К, получим новую постоянную к:
[Н + ] [ОН"] = К [Н2О] = к
Постоянная к имеет значение 10’’*
Таким образом, мы приходим к важному соотношению:
[Н+][ОН] = IO"771
Это выражение называется ионное произведение воды.
Перепишите себе в тетрадь выражение, определяющее ионное произведение воды, а затем завершите следующее предложение.
Произведение концентрации протонов и концентрации ... всегда равно 10“14
Проверьте ответ в рубрике 89.
57. электролитическая диссоциация
Все соединения, которые диссоциируют на ионы в водном растворе, называются электролиты. Этот термин используется также для обозначения образующихся водных растворов. Водорастворимые кислоты, основания и соли являются электролитами.
Мы уже познакомились с поведением в водном растворе
хлорида натрия, сахара, хлорида калия, нитрата натрия, спирта, сульфата натрия, соляной кислоты.
Сколько из этих соединений являются электролитами?
• Семь -> 66
• Шесть —► 72
• Пять -» 33
• Четыре -► 77
• Три -» 48
• Два -► 38
58. Правильно. Ацетат-ионы и протоны соединяются, образуя недиссоциированную уксусную кислоту. Следовательно, в растворе должны преобладать ионы ОН".
Раствор ацетата натрия является щелочны м.
На основании проведенного нами обсуждения можно прийти к следующим общим правилам.
Раствор соли сильной кислоты и сильного основания является нейтральным.
Раствор соли слабой кислоты и сильного основания является щелочным.
Раствор соли сильной кислоты и слабого основания является кислым.
Ацетат натрия, который мы обсудили подробно, образует щелочной раствор. Значит, он представляет собой соль слабой кислоты и сильного основания.
А каким должен быть раствор NH4NO3 в воде?
• Кислым -> 47
• Щелочным -> 73
• Нейтральным -» 69
59. Неправильно.
Если известно, что [ОН " ] = 10“9 моль/л, то из ионного произведения воды можно вычислить
□ . 10-14
[Н ] = 9 = 10 5 моль/л
и, следовательно, pH = 5.
Как можно охарактеризовать раствор с pH = 5?
• Щелочной раствор -» 43
• Кислый раствор -» 39
60. Для каждого из соединений в выбранной вами строке ниже указано, какими кислотами и основаниями-сильными или слабыми-образована соответствующая соль.
Основание Кислота Реакция в водном растворе
CH3COONa сильное слабая щелочная
BaClj среднее сильная нейтральная
MgSO4 среднее сильная нейтральная
Однако задача заключалась в том, чтобы выбрать строку, все соли в которой дают кислую реакцию в водном растворе. Следовательно, ваш ответ неправилен.
Вернитесь к рубрике 47.
61. В выбранной вами строке все три соединения-H2S, HCN и
NH3 (водн.)-являются слабыми электролитами. Поскольку требовалось указать строку, в которой названы два сильных и один слабый электролит, ваш ответ неправилен.
Вернитесь к рубрике 44 и попытайтесь правильно ответить на поставленный там вопрос.
62. [ОН-] = 10-7 моль/л
В чистой воде концентрации протонов и гидроксид-ионов одинаковы и равны 10“7 моль/л.
10-710"7= 10-14
Ионное произведение воды (10-14) является постоянной величиной. Если, например, концентрация протонов [Н 4 ] увеличивается в результате добавления небольшого количества соляной кислоты, то концентрация [ОН “ ] уменьшается таким образом, что соотношение [Н + ] [ОН - ] = 10 - 14 остается в силе.
Допустим, что концентрация ионов Н+ в воде в результате добавления кислоты возросла до 10-3. Какой при этом должна быть величина [ОН-]?
Проверьте ответ в рубрике 97.
63. равновесие диссоциации
Когда достигается равновесие, в растворе устанавливаются вполне определенные концентрации уксусной кислоты и двух образующихся из нее ионов-ацетат-ионов и протонов.
CH3COOH CH3COO“ + H + уксусная кислота ацетат-ион протон
Для обозначения концентраций ионов и молекул используются квадратные скобки, например
[CHjCOOH] означает концентрацию уксусной кислоты
[CHjCOO ” ] означает........
[Н + ] означает ......
Завершите эти предложения и проверьте ответ в рубрике 20.
64. Совершенно верно. В выбранной вами строке указаны два сильных электролита-H2SO4 и Na2SO4-H один слабый электролит- 1ЧН3(водн.).
Степень диссоциации конкретного соединения определяется как доля диссоциированных молекул:
Степень диссоциации =
Число диссоциированных молекул Общее число растворенных молекул
или
Число диссоциированных молекул
в процентах Степень диссоциации = —---------------------------------
Общее число растворенных молекул
( = 100%)
Перепишите себе в тетрадь эти две формулы.
Если некоторое соединение при растворении в воде диссоциирует на 20%, то степень диссоциации этого соединения равна
20
Степень диссоциации = = 0,2
Вычислите степень диссоциации соединения, при растворении которого диссоциирует 35% его молекул.
Проверьте ответ в рубрике 74.
65. Неправильно. Раствор имеет щелочную реакцию.
Повторите еще раз материал, начинающийся с рубрики 56.
66. Неправильно. Обратитесь за разъяснением в рубрику 51.
67. Неправильно. Чтобы приобрести опыт в вычислениях со степенными величинами, внимательно ознакомьтесь со следующими примерами:
10“8
Ю-8-(-4)= 10- 8 + 4 = Ю-4
10“4
10“10
—----- = 10-10-(-2) = Ю-10 + 2 = 10- 8
10“2
Теперь попытайтесь решить поставленную ранее задачу еще раз.
Известно, что
ю-7[он-] = 10~14
г Ю-'4
Следовательно, [ОН ] =
Проверьте ответ в рубрике 62.
68. Вы правильно указали максимальную степень диссоциации, но неправильно указали ее минимальное значение.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 71.
69. Неправильно. Нитрат аммония NH4NO3 представляет собой соль слабого основания и сильной кислоты.
NH3 + HNO3 -» NH4NO3
Прочтите еще раз рубрику 58.
70. Правильно. Все три соли в выбранной вами строке гидролизуются, образуя кислые растворы.
Выберите теперь строку, все соли в которой дают щелочную реакцию в водном растворе.
• KNO3, К2СО3, Na2S - 93
• NH4C1, Ca(NO3)2, NaClO3 -> 85
• CHjCOOK, Na2SO3, (NH4)2CO3 -> 80
• Na2CO3, CH3COOK, NaCN - 53
71. Если при растворении в воде некоторое соединение оказывается диссоциированным всего на 0,7%, то его степень диссоциации
Переход от сильных электролитов к слабым является постепенным. Можно .определить следующие пределы степени диссоциации, которым соответствуют сильные, средние и слабые электролиты:
сильные электролиты: а = 1 — 0,6
средние электролиты: а = 0,6 —0,01
слабые электролиты: а меньше 0,01
Каковы верхний и нижний пределы степени диссоциации средних электролитов в процентном выражении?
Степень диссоциации
максимальная
• 60%
• 6%
• 60%
• 6%
• 60%
• 6%
минимальная
0,01% —► 68
0,01% —> 81
0,1% —► 98
0,1% —► 91
1% —► 41
1% —► 88
раннткспя
72. Неправильно. Обратитесь за разъяснением в рубрику 51.
73. Неправильно. Нитрат аммония NH4NO3 представляет собой соль слабого основания и сильной кислоты.
NH3 + HNO3 -> NH4NO3
Прочтите еще раз рубрику 58.
74. Степень диссоциации = —— = 0,35
10U
Для обозначения степени диссоциации принято пользоваться греческой буквой а (альфа).
Приведем несколько примеров.
100
При 100%-ной диссоциации: а=——-=1
10U
80
При 80%-ной диссоциации: а = ——- = 0,8
100
50
При 50%-ной диссоциации: а = —— = 0,5
100
Чему равна степень диссоциации а при 1%-ной диссоциации?
Проверьте ответ в рубрике 84.
75. Ионное произведение воды
Зная ионное произведение воды и значение [Н+ ], всегда можно вычислить соответствующее ему значение [ОН “ ] и наоборот.
Для чистой воды [Н+] = 10" 7 моль/л (моль на литр). Подставляя это значение в выражение для ионного произведения воды, получим
ю-7[он-] = 10-14
Вычислите теперь [ОН~]. Какой результат вы получили?
102 моль/л -» 67
10 2 моль/л -» 86
10-7 моль/л -> 62
76 lNH>]2 К
[n2][h2]3
В программе 18 (рубрики 3 и 10) мы встретимся с применением закона действия масс в органической химии.
Теперь рассмотрим еще один пример применения закона действия масс в неорганической химии.
Многие соединения обладают очень ограниченной растворимостью в воде, в частности AgCl, BaSO4, CuS, PbS. Допустим, что небольшое количество такого вещества, например AgCl, помещенного в воду, находится
в равновесии с соответствующими ионами
AgCl Ag + + СГ
[Ag*][Cl-]
[AgCl]
где D- константа диссоциации.
Большая часть AgCl не переходит в раствор, а остается в виде нерастворенного твердого осадка. Это позволяет считать величину [AgCl] постоянной, которая, будучи умноженной на D, дает новую постоянную L:
[Ag + ] [С1 ’ ] = D [AgCl] = UgCl
Постоянная L называется произведение растворимости. В рассмотренном выше примере ^AgCl является произведением растворимости AgCl в воде.
Обратите внимание на аналогию произведения растворимости с ионным произведением воды. Запишите выражение для произведения растворимости CuS.
Проверьте ответ в рубрике 5.
77. Неправильно. Обратитесь за разъяснением в рубрику 51.
78. При [Н + ] = 1011 моль/л pH = 11.
Завершите следующую таблицу.
[н+] pH
10"5 моль/л
10"13 моль/л моль/л 7
моль/л 2
Проверьте ответ в рубрике 50.
79. Проверьте ответ.
102 = 10-10= 100
10"2=—^ = —= 0,01
102 100
102 -10* = 102+4 = 106
ю4
104:102 =—-= 104-2 = 102
102
Если вы сделали в этих вычислениях какие-нибудь ошибки, обратитесь к рубрике 82.
Представление численных величин в степенной форме особенно удобно в тех случаях, когда приходится иметь дело с очень малыми и очень большими числами. Например:
1000 = 103
1000 000= 106
0,01 = 10"2
0,00007 = 7 -10“ 5
0,0000008 = 8 -10 “ 7
Кимически*.’ ран»иикч им
75
Продолжим теперь обсуждение и использование закона действия масс. Завершите следующее выражение:
3
[Н2О]
Проверьте ответ в рубрике 56.
80. Для каждого соединения в выбранной вами строке ниже указано, какими свойствами обладают основание и кислота, образующие данную соль.
Основание Кислота Реакция в водном растворе
СН3СООК сильное слабая щелочная Na2SO3 сильное средняя нейтральная (NHJjCOj слабое слабая нейтральная Однако задача заключалась в том, чтобы выбрать строку, все соли в которой образуют щелочные водные растворы. Следовательно, ваш ответ
неправилен.
Вернитесь к рубрике 70.
81. Неправильно. По-видимому, вам трудно переводить а в процентную степень диссоциации. В этдм вам помогут следующие примеры:
а Степень диссоциации
1 1 • 100 = 100%
0,8 0,8 • 100 = 80%
0,5 0,5-100=50%
0,05 0,05 • 100 = 5%
Средние электролиты имеют степень диссоциации а от 0,6 до 0,01.
Переведите эти значения а в проценты и сравните с результатами, указанными в рубрике 71.
82. Если вы незнакомы с представлением численных величин в степенном виде, прочтите следующее:
102-это десять в степени 2, иначе 10 в квадрате.
При таком способе записи 10 представляет собой основание, а 2-показатель степени.
Что означает запись 102?
Она означает 10-10= 100.
Что означает 103?
Это означает 10-10-10= 1000.
А что означает 105 б)?
Проверьте ответ в рубрике 94.
83. а) 105 • 102 = 107
б) 107-10’ 5 = 102
в) 102-10=103
Деление
При делении численных величин, представленных в степенной форме с одинаковым основанием, показатель степени делителя вычитается из показателя степени делимого.
Например:
10s: 102 = 105“2 = 103
1010
= ю10 : ю3 = 10*0 3 = 107
103
10“10
л = 10“10 :104 = 10“10-4 = 10“14
104
Проведите следующие вычисления:
102 =
10“2 =
102•104 =
104 _
ю2“
Проверьте ответ в рубрике 79.
84. Если при растворении некоторого соединения в воде лишь 1% его диссоциирует на ионы, то степень диссоциации этого соединения
Вычислите теперь а для случая, когда диссоциировано 0,7% растворенного соединения.
Проверьте ответ в рубрике 71.
85. Для каждого из соединений в выбранной вами строке ниже указано, какими свойствами обладают кислота и основание, образующие данную соль.
Реакция в водном
Основание Кислота растворе
NH4C1 слабое сильная кислая
Ca(NO3)2 среднее сильная нейтральная
NaClOj сильное сильная нейтральная
Однако задача заключалась в том, чтобы выбрать строку, все соли в которой образуют щелочные водные растворы. Следовательно, ваш ответ неправилен.
Вернитесь к рубрике 70.
86. Неправильно. Вам следует приобрести навыки в вычислениях со степенными численными величинами. Для этого внимательно ознакомьтесь со следующими примерами:
10“8
-----= 10“в“<“4)= 10“8 + 4= 10“4
10“4
1О“10
_^_= 10-Ю-(-2)= ю-Ю-2 = 10-В
10“2
Теперь попытайтесь решить поставленную задачу еще раз. Известно, что
107 [ОН ] = 10“14
Ю“14
Следовательно, [ОН ] = = ?
Проверьте ответ в рубрике 62.
87. [Н+] = 10 10 моль/л
Это следует из того, что
[Н + ] [ОН] = 10’14 моль/л
и что [ОН“] = 10“4 моль/л
Следовательно,
[Н + ]10’4 = 10’14 или
10’14
[Н+] = -^-^=10’10
L J 10~4
До сих пор мы выражали все концентрации, пользуясь степенями числа 10. Хотя это намного проще, чем обычное десятичное представление численных величин, можно еще больше упростить записи, если обозначать концентрацию иона водорода при помощи водородного показателя pH. Водородный показатель pH представляет собой показатель степенного выражения для [Н + ], взятый с обратным знаком.
Пример. Допустим, что в некотором растворе [Н + ]= 10’9 моль/л. Показатель степенного выражения концентрации в данном случае равен — 9. Взяв его с обратным знаком, получим соответствующее значение pH. Таким образом, pH = 9.
Приведем еще ряд примеров:
Пусть [Н + ] = 10 “ 2 моль/л, тогда pH = 2
Пусть [Н + ] = 10“7 моль/л, тогда pH = 7
Пусть [Н + ] = 10“10 моль/л, тогда pH = 10
Теперь решите следующую задачу. Каково значение pH при [Н+ ] = 10“11 моль/л.
Проверьте ответ в рубрике 78.
88. Вы правильно указали минимальную степень диссоциации в процентном выражении, но неправильно указали ее максимальное значение.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 71. Возможно, вам будет легче получить правильный ответ, если вы будете записывать свои вычисления.
89. Произведение концентрации протонов и концентрации гидроксид-ионов всегда равно 10“14:
[Н + ][ОН“] = 10’14
Как называется это произведение? Проверьте ответ в рубрике 75.
П'ржрзмиа 3
90. а) 103 4-4 -103 = 5 -103 = 5 000
6) 103 + IO4 = 1000 + 10000= 11000
в) 7-102 — 2-102 = 5-102 = 500
Умножение
При умножении двух численных величин, представленных в степенной форме с одинаковым основанием, их показатели степени суммируются.
В следующих примерах основание степени всегда равно 10:
103-103 = 103 + 3 = 106
102-104 = 102 + 4 = 106
io~3-io~3 = ю-3+<-3’= 10-6
10“2-10“4 = Ю’2 + ,’4,= 10~6
10“2-104= 10’2 + 4= 102
Решите следующие примеры:
a) 10s•102 =
6) 107-10-5 =
в) 102 -10 =
Проверьте ответ в рубрике 83.
91. Неправильно. По-видимому, вам трудно переводить а в процентную степень диссоциации. В этом вам помогут следующие примеры:
а Степень диссоциации
1 1100 =100%
0,8 0,8-100 = 80%
0,5 0,5-100 = 50%
0,05 0,05 100 = 5%
Средние электролиты имеют степень диссоциации а от 0,6 до 0,01. Переведите эти значения а в проценты и сравните с результатами, указанными в рубрике 71.
92. Для каждого из соединений в выбранной вами строке ниже указано, какими кислотами и основаниями-сильными или слабыми-образована соответствующая соль.
Основание
Кислота
Реакция в водном растворе
NH4C1
Na2CO3
K2SO4
слабое сильное сильное
сильная слабая сильная
кислая щелочная нейтральная
Однако задача заключалась в том, чтобы выбрать строку, все соли в которой дают кислую реакцию в водном растворе. Следовательно, ваш ответ неправилен.
Вернитесь к рубрике 47.
93. Для каждого из соединений в выбранной вами строке ниже указано, какими свойствами обладают кислота и основание, образующие данную соль.
Реакция в водном
Основание Кислота растворе
KNO3 сильное сильная нейтральная
К2СО3 сильное слабая щелочная
Na2S сильное слабая щелочная
Однако задача заключалась в том, чтобы выбрать строку, все соли в которой образуют щелочные водные растворы. Следовательно, ваш ответ неправилен.
Вернитесь к рубрике 70.
94. 105 = 10 10 10 10 10=100 000
Численные величины с отрицательными показателями степени можно представить в виде дробей, например 10'*=-^-.
Аналогично
Представьте 10 4 в такой же форме.
Проверьте ответ в рубрике 99.
95. Проверьте ответы:
NaOH > <— Na+ + OH’
NaCl 4— Na+ + CT
HCN —► 4 H* + CN’
Для описания взаимодействия между водой и растворенными в ней веществами используется термин гидролиз.'
Начнем с описания следующих наблюдений:
NaCl при растворении в воде дает нейтральный раствор (pH = 7)
NH4C1 при растворении в воде дает кислый раствор
CH3COONa при растворении в воде дает щелочной раствор
Обратим внимание на то, что растворы солей могут быть кислыми или щелочными, несмотря на то, что соли не вносят в раствор ни ионов Н +, ни ионов ОН-. Дело в том, что при растворении NH4C1 или CH3COONa происходит гидролиз.
Постарайтесь запомнить это и завершите следующее предложение.
Если водный раствор становится кислым или щелочным при растворении соли, не содержащей ионов Н+ или ОН', то это указывает, что в нем происходит ....
Проверьте ответ в рубрике 45.
KO
Hfioi рачмл t
3
[H + ]2[S2-]
Для трехосновной кислоты, например фосфорной, полное уравнение диссоциации имеет вид
Н3РО4 ЗН+ + РО3-
и соответственно этому выражение для закона действия масс записывается в виде
[н+]3[ро3-] ; к
[Н3РО4]
Закон действия масс применим не только к равновесиям диссоциации, но также к любым химическим реакциям. Необходимым условием его применения является липп. существование равновесия. В качестве примера рассмотрим синтез аммиака:
N2 + ЗН2 2NH3
[NH3]2
[N2][...]
Завершите начатое выше выражение для закона действия масс применительно к реакции синтеза аммиака
Проверьте ответ в рубрике 76.
97. [ОН] = 10“11 моль/л
Это следует из того, что
[Н + ][ОН] = 10“14 и что
[Н + ] = 10-3 моль/л
Следовательно,
Ю-3[ОН-] = 10-14 или
Ю-14
[он-] = По^=10"1
Если же, наоборот, добавить к воде какое-нибудь основание, это приведет к возрастанию [ОН-].
Решите такую задачу. Раствор имеет [ОН - ] = 10-4 моль/л. Требуется вычислить [Н + ].
Проверьте ответ в рубрике 87.
98. Вы правильно указали максимальную степень диссоциации в процентном выражении, но неправильно указали ее минимальное значение.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 71.
Кратко покажем, как выполняются различные арифметические действия с численными величинами, представленными в степенной форме.
Химические равновесии
XI
Сложение и вычитание
Ю2+ 102 = 2 -102 = 2 -10 -10 = 200
3 • 102 + 2 • 102 = 5 • 102 = 5 10 10 = 500
2-102 — 102 = 102 = 10-10 = 100
3 -105 — 105 = 2 • 105 = 2-10-10 -10 • 10-10 = 200000
Сумму 102 + 103 нельзя получить таким способом, поскольку у слагаемых отличаются показатели степени. Приходится выполнять вычисления поэтапно:
Ю2+ 103 = 10 10+ 10 10 10= 100+ 1000= 1100
Решите следующие примеры:
а) 103 + 4 103 =
б) 103 + 104 =
в) 7 -102 — 2 -102 =
Проверьте ответы в рубрике 90.
1. К настоящему времени известно 106 химических элементов; однако последние три из них еще настолько мало изучены, что здесь не рассматриваются.
Все химические элементы располагаются в соответствии с зарядом атомного ядра, называемым также атомный (порядковый) номер элемента, в периодическую таблицу.
Удобства этой таблицы станут яснее по мере прохождения данной программы.
Отыщите табл. 3 в конце программы 7 и положите в этом месте между страницами закладку. Эта таблица представляет собой сокращенный вариант полной периодической таблицы.
Горизонтальные линии, или строки, периодической таблицы называются ряды или периоды *.
Вертикальные столбцы, или колонки, периодической таблицы называются группы.
Сколько периодов и сколько групп в периодической таблице?
Завершите следующее предложение:
Периодическая таблица элементов состоит из ... периодов и ... групп. Проверьте ответ в рубрике 13.
2. Правильно. Серебро, кадмий, иттрий и цирконий являются элементами побочных подгрупп 1, 2, 3 и 4 пятого периода.
В четвертом и пятом периодах переходные элементы помещаются между элементами главных подгрупп. В шестом периоде появляется дополнительный ряд из 14 элементов - лантаноиды,- которые помещаются между переходными элементами. Это показано в полной периодической таблице (табл. 4 из программы 7). Ради простоты в этой таблице указано только положение лантаноидов, а сами элементы указаны под таблицей.
Лантаноиды имеют атомные номера ....
Завершите это предложение, а затем проверьте ответ в рубрике 14.
3. Хром Сг и медь Си имеют только по одному электрону во внешней оболочке. Все остальные переходные элементы, указанные в таблице из рубрики 15, имеют два таких электрона.
Как известно, число электронов во внешней оболочке атома ответственно за его химические свойства. Поскольку переходные элементы имеют сходные, но не полностью одинаковые свойства, применительно к ним следует пользоваться следующей уточненной формулировкой.
Химические свойства элементов переходного ряда определяются не только числом электронов во внешней оболочке, но также числом электронов в частично заполненных внутренних оболочках.
Зная, что все переходные элементы имеют во внешней оболочке один или два электрона, можно провести важную классификацию этих элементов. Чтобы
* В другой, короткопериодной, форме записи периодической системы период может занимать и два ряда.- Прим. ред.
1ери«.* ^И'НЧЧ<.’0' -•'.‘i W • \\|НН \>
решить, относятся ли они к металлам или неметаллам, ответьте сначала на следующий вопрос.
К какому семейству относятся переходные элементы, имеющие один или два электрона во внешней оболочке?
• К металлам -> 26
• К неметаллам -> 19
4. Лантаноиды имеют
2 электрона в первой оболочке,
8 электронов (вплоть до Gd) во второй оболочке,
18 электронов в третьей оболочке.
Приводимая ниже таблица показывает заселенность только четвертой, пятой и шестой оболочек лантаноидов.
Атомный номер Элемент 4-я оболочка (N-оболочка) 5-я оболочка (О-оболочка) 6-я оболочка (Р-оболочка)
58 Церий Се 20 8 2
59 Празеодим Рг 21 8 2
60 Неодим Nd 22 8 2
61 Прометий Pm 23- 8 2
62 Самарий Sm 24 8 2
63 Европий Eu 25 8 2
64 Г адолиний Gd 25 9 2
65 Тербий Tb 27 8 2
66 Диспрозий Dy 28 8 2
67 Гольмий Ho 29 8 2
68 Эрбий Er 30 8 2
69 Туллий Tm 31 8 2
70 Иттербий Yb 32 8 2
71 Лютеций Lu 32 9 2
В этом ряду происходит заполнение четвертой оболочки до 32 электронов, начиная с 18 электронов у лантана (элемент 57).
Продолжайте чтение с рубрики 14.
5. Неправильно. Ваш ответ показывает, что вы еще недостаточно хорошо знаете строение атомов. Прежде чем изучать дальше данную программу, вам следует повторить программу 1.
6. Четвертый период включает следующие элементы:
К, Са, Sc, Ti, V. Сг, Мп, Fe, Со, Ni, Си, Zn, Ga, Ge, As, Se, Br, Kr
Десять переходных элементов, от Sc до Zn, могут быть распределены в соответствии с их химическими свойствами по восьми группам точно так же, как это делается с типическими элементами. В результате этого каждая из групп 1-7 получает по одному переходному элементу, а остальные три переходных элемента попадают в группу 8.
Чтобы различить в периодической таблице типические (непереходные) и переходные элементы, их называют соответственно элементы главных и побочных подгрупп; главные подгруппы принято обозначать, присоединяя
6*
Х4
Программа 4
к номеру группы букву А, а побочные подгруппы-присоединяя к номеру группы букву Б (см. табл. 4 в программе 7).
Четвертый период начинается с элементов К и Са, которые принадлежат соответственно к 1-й и 2-й главным подгруппам. Скандий принадлежит к 3-й побочной подгруппе, титан-к 4-й побочной подгруппе и т.д.
1А 2А ЗБ 4Б
К Са Sc Ti
Ознакомьтесь с положением элементов четвертого периода в различных подгруппах по табл. 4 из программы 7, а затем ответьте на следующий вопрос.
Какие элементы четвертого периода принадлежат
к побочной группе 4?
к главной подгруппе 5?
к побочной подгруппе 6?
к побочной подгруппе 7?
Запишите химические символы соответствующих элементов и укажите для каждого из них его подгруппу, например 4Б, 5А и т.д.
Проверьте ответ в рубрике 18.
7. Неправильно. Прочтите еще раз материал, начиная с рубрики 17.
8. Правильно. Максимальное число внешних электронов равно восьми; это соответствует наличию восьми групп в периодической таблице.
У элементов конкретных групп* имеются специфические названия,
характеризующие эти семейства Первая группа: элементов: щелочные металлы
Вторая группа: Третья группа: щелочноземельные металлы группа бора
Четвертая группа: Пятая группа: группа углерода группа азота
Шестая группа: группа кислорода
Седьмая группа: галогены
Восьмая группа: инертные, или благородные, газы
Завершите следующие предложения:
Щелочные металлы имеют ... внешних электронов.
Щелочноземельные металлы имеют ... внешних электронов.
Галогены имеют ... внешних электронов.
Благородные газы имеют ... внешних электронов. Проверьте ответ в рубрике 20.
9. 1Б Си
2Б Zn
ЗА Ga
4А Ge
Расположение подгрупп в периодической таблице может быть кратко охарактеризовано так.
* Точнее, речь идет о подгруппах (см. табл. 4 в конце программы 7, где видны подгруппы А и Б).-Прим. ред.
Периодическая система элементе
«5
Переходные элементы (элементы подгрупп Б) внедряются между второй и третьей главными подгруппами таким образом, что после второй главной подгруппы (2А) следует третья побочная подгруппа (ЗБ). Затем идут четвертая и следующие побочные подгруппы вплоть до восьмой и лишь после этого подгруппы 1Б и 2Б, как это показано ниже:
1А, 2А ЗБ,4Б,5Б, 6Б, 75,86,1Б.2Б ЗАДАЛА, 6А, 7А, 8А
Побочные подгруппы Б, содержащие переходные элементы, для ясности взяты в рамку.
Ознакомьтесь с длиннопериодной формой периодической таблицы, помещенной в программе 7 (табл. 4). Запишите элементы четвертого, пятого и шестого периодов, которые принадлежат к главной подгруппе 1 и побочной подгруппе 1 соответственно.
Проверьте ответ в рубрике 33.
10. Периодическая таблица была создана в 1869 г. Д.И. Менделеевым и Л. Мейером, которые работали независимо друг от друга.
Конец программы 4.
11. Указанное вами число слишком мало. Внимательно посмотрите еще раз в табл. 3 и обратите внимание на то, сколько групп существует
в периодической таблице. Для элементов, которые были рассмотрены до сих пор, выполняется следующее правило:
элементы первой группы имеют один внешний электрон, элементы второй группы имеют два внешних электрона, элементы третьей группы имеют три внешних электрона.
Следовательно, элементы восьмой группы должны иметь максимальное число внешних электронов.
Вернитесь к рубрике 17.
12. Неправильно.
Прочтите еще раз материал, начиная с рубрики 17.
13. Периодическая таблица элементов состоит из семи периодов и восьми групп.
Найдите в периодической таблице элементы углерод, серу и калий: углерод С находится во втором периоде сера S находится в третьем периоде калий К находится в четвертом периоде
Из табл. 3 видно, что рядом с каждым элементом указан его атомный номер.
Запишите атомные номера элементов С, S и К.
Вспомните то, что вы должны знать о строении атомов, а затем ответьте на следующий вопрос, пользуясь табл. 1, помещенной в конце программы 1.
В каких по порядку электронных оболочках находятся внешние электроны у элементов С, S и К соответственно?
С S К
• в первой во второй в третьей оболочке -» 28
• во второй во второй в третьей оболочке -»• 5
• во второй в третьей в четвертой оболочке -» 22
• в четвертой в шестой в первой оболочке -» 32
14. Лантаноиды-это элементы с атомными номерами от 58 до 71. Название «лантаноиды» происходит от элемента 37, лантана. Подобно лантану, все лантаноиды имеют два электрона во внешней оболочке (Р-оболочке) и в следующей под ней О-оболочке у них имеется 8 или 9 электронов. Главное различие между отдельными лантаноидами относится к 1У-оболочке, заселенность которой в ряду лантаноидов увеличивается от 18 до 32 электронов. Это подробно показано в таблице, помещенной в рубрике 4.
Поскольку электронное строение двух внешних оболочек у элементов с атомными номерами от 58 до 71 почти совпадает с лантаном, а различия относятся только к Л1-оболочке, химические свойства всех лантаноидов очень близки к свойствам лантана.
Подобно тому как в шестом периоде за лантаном следует ряд лантаноидов, в седьмом периоде за актинием следует ряд актиноидов.
Воспользуйтесь табл. 4 из программы 7 и выпишите атомные номера актиноидов. ,
Проверьте ответ в рубрике 86.
15. В ряду переходных элементов с атомными номерами от 21 до 30 каждый новый электрон поступает на М-оболочку. Это видно из следующей таблицы.
Элемент Атомный номер Число электронов в оболочке
К L М N
Са 20 2 8 8 2 Типический элемент главной подгруппы '<
Si 21 2 8 9 2
Ti 22 2 2 10 2
V 23 2 8 11 2 Переходные
Cr 24 2 8 13 1 элементы побочной
Мп 25 2 8 13 2 подгруппы
Fe 26 2 8 14 2
Со 27 2 8 15 2
Ni 28 2 8 16 2
Си 29 2 8 18 1
Zn 30 2 8 18 2
Ga 31 2 8 18 3 Типический элемент главной подгруппы
Нетрудно видеть, что в заполнении М-оболочки происходят два скачка, когда М-оболочка приобретает дополнительный электрон за счет /У-оболочки. У двух соответствующих элементов имеется только по одному электрону во внешней оболочке.
Найдите эти два элемента.
Проверьте ответ в рубрике 3.
16. В выбранном вами наборе содержатся элементы пятого периода из подгрупп от 1А до 4А, которые являются главными подгруппами. Однако требовалось выбрать элементы побочных подгрупп. Эти элементы помещаются между стронцием Sr и индием In и имеют атомные номера от 39 до 48.
Для ясности в табл. 4 (из программы 7) переходные элементы заштрихованы.
Вернитесь к рубрике 33.
17. электроны
Номер электронной оболочки, в которой содержатся внешние электроны атома, соответствует периоду, к которому принадлежит данный химический элемент.
Число электронов во внешней оболочке атома определяет группу, к которой принадлежит данный элемент.
При наличии одного внешнего электрона элемент принадлежит к первой группе.
При наличии двух внешних электронов элемент принадлежит ко второй группе.
При наличии трех внешних электронов элемент принадлежит к третьей группе.
При наличии четырех внешних электронов элемент принадлежит к четвертой группе.
Пользуясь этим правилом, определите максимальное число внешних электронов, возможное для атомов любого элемента.
• Максимальное число внешних электронов равно 4 —> 11
• Максимальное число внешних электронов равно 8 —► 8
• Максимальное число внешних электронов равно 16 —> 21
• Максимальное число внешних электронов равно 18 —> 34
• Максимальное число внешних электронов равно 32 —> 29
18. Проверьте ответ:
Побочная подгруппа 4 = 4Б
Главная подгруппа 5 = 5А
Побочная подгруппа 6 = 6Б
Побочная подгруппа 8 = 8Б
Ti
As
Cr
Fe, Co, Ni
В периодической таблице, имеющей длиннопериодную форму, побочные подгруппы 1Б и 2Б следуют за побочной подгруппой 8Б.
Какие элементы четвертого периода принадлежат
к побочной подгруппе 1 ?
к побочной подгруппе 2?
к главной подгруппе 3?
к главной подгруппе 4?
Воспользуйтесь табл. 4 из программы 7 и укажите не только символы соответствующих элементов, но и обозначения названных подгрупп.
Проверьте ответ в рубрике 9.
19. Элементы, имеющие во внешней оболочке один или два электрона, принадлежат к первой и второй группам в сокращенной периодической системе (первая и вторая главные подгруппы в длиннопериодной таблице).
Программа 4
Я8
Посмотрите еще раз внимательно на короткопериодную периодическую таблицу (табл. 3 из программы 7) и постарайтесь определить, металлами или неметаллами являются элементы из первой и второй групп.
Проверьте ответ в рубрике 26.
20. Проверьте ответ:
Щелочные металлы имеют один внешний электрон.
Щелочноземельные металлы имеют два внешних электрона.
Галогены имеют семь внешних электронов.
Благородные газы имеют восемь внешних электронов.
Как называются группы 4, 5 и 6? Для ответа на этот вопрос воспользуйтесь табл. 3 из программы 7.
Третья группа называется группа бора.
Четвертая группа называется группа ....
Пятая группа называется группа ....
Шестая группа называется группа ....
Проверьте ответ в рубрике 30.
21. Неправильно. Вы уже должны знать, что один внешний электрон означает принадлежность к группе 1 два внешних электрона означают принадлежность к группе 2 три внешних электрона означают принадлежность к группе 3 И наоборот, элементы группы 1 имеют 1 внешний электрон элементы группы 2 имеют 2 внешних электрона элементы группы 3 имеют 3 внешних электрона
Воспользуйтесь табл. 3 и попытайтесь еще раз ответить на вопрос, поставленный в рубрике 17.
22. Правильно. Внешние электроны находятся:
у углерода-во второй оболочке
у серы-в третьей оболочке
у калия-в четвертой оболочке
Теперь посмотрите на периодическую таблицу еще раз, и вы убедитесь, что углерод находится во втором периоде сера находится в третьем периоде калий находится в четвертом периоде
Таким образом, период, к которому принадлежит химический элемент, соответствует номеру оболочки, в которой находятся его внешние электроны.
Существует семь оболочек и им соответствует семь периодов.
Другими словами, номер периода равен номеру валентной оболочки у атома данного элемента.
Электронные оболочки обсуждались в программе 1. Напомним, что они обозначаются буквами. Укажите соответствующие буквы.
Первая оболочка = .. .-оболочка
вторая оболочка = ...-оболочка
третья оболочка = ...-оболочка
четвертая оболочка = ...-оболочка
пятая оболочка = ...-оболочка
шестая оболочка = Р-оболочка
седьмая оболочка = 2-оболочка
Проверьте ответ в рубрике 37.
Периодическая система элементов
89
23. Правильно. Период, к которому принадлежит элемент, определяется номером внешней электронной оболочки.
А чем определяется, к какой группе принадлежит данный типический элемент?
• Числом внешних электронов -»• 39
• Номером внешней электронной оболочки -» 12
• Числом протонов -» 7
24. HF, действительно, является кислотой, но СН4 обычно не называют гидридом, поскольку это соединение не диссоциирует.
Вернитесь к рубрике 63.
25. Элементы, у которых внешние электроны находятся в Р-оболочке, принадлежат к шестому периоду.
Период, к которому принадлежит элемент, определяется номером электронной оболочки, в которой находятся внешние ....
Завершите это предложение и переходите к рубрике 17.
26. Совершенно верно. Все элементы с одним или двумя электронами во внешней оболочке являются металлами.
Зная это, а также то, что химические свойства элемента определяются числом электронов в его внешней оболочке, можно заключить, что все переходные элементы являются металлами.
Начнем более подробное обсуждение переходных металлов с четвертого периода периодической таблицы.
Десять переходных элементов в этом периоде помещаются между кальцием и галлием в порядке возрастания атомных номеров. Посмотрите на табл. 4 в конце программы 7 и перепишите в свою тетрадь весь четвертый период элементов.
После этого переходите к рубрике 6.
27. Электроотрицательность элементов возрастает при перемещении слева направо вдоль периодов (т.е. с увеличением атомного номера) и снизу вверх в пределах каждой группы (т.е. с уменьшением атомного номера).
Металлический характер элементов и основность их гидроксидов изменяются в противоположных направлениях.
Вернитесь к рубрике 39.
28. Неправильно. Ваш ответ показывает, что вы еще недостаточно хорошо знаете строение атомов. Прежде чем изучать дальше данную программу, вам следует повторить программу 1.
29. Число 32 имеет совсем другой смысл: это максимальное число электронов в N-оболочке (2-4-4). Однако поставленный в рубрике 17 вопрос касается максимального числа внешних электронов. Внимательно ознакомьтесь с табл. 3 в конце программы 7 и определите число групп в периодической таблице. Для
4
элементов, которые мы обсуждали до сих пор, выполняется следующее правило: элементы группы 1 имеют 1 внешний электрон, элементы группы 2 имеют 2 внешних электрона, элементы группы. 3 имеют 3 внешних электрона и т. д.
Следовательно, элементы группы 8 имеют максимальное число внешних электронов.
Вернитесь к рубрике 17.
30. Проверьте ответ:
Четвертая группа называется группа углерода.
Пятая группа называется группа азота.
Шестая группа называется группа кислорода.
Запомните, что благородные газы имеют во внешней оболочке восемь электронов. Познакомьтесь теперь со следующим общим правилом:
Элемент никогда не может иметь больше восьми аиешннх электронов.
Как это объяснить?
Казалось бы, сформулированное выше правило противоречит тому, что число электронов в оболочках последовательно возрастает. Как мы уже знаем, максимальное число электронов, которые могут находиться на различных электронных оболочках, таково:
2 электрона на К-оболочке,
8 электронов на L-оболочке,
18 электронов на М-оболочке,
32 электрона на N-оболочке.
Чтобы понять это, обсудим некоторые элементы.
Как называется элемент с атомным номером 9, и сколько электронов он имеет на К- и L-оболочках?
Элемент 9 называется ....
Он имеет ... электронов на К-оболочке, а также ... электронов на L-оболочке.
Проверьте ответ в рубрике 40.
31. Неправильно. Повторите материал, начиная с рубрики 39.
32. Неправильно. Ваш ответ показывает, что вы еще недостаточно хорошо знаете строение атомов. Прежде чем изучать дальше данную программу, вам следует повторить программу 1.
33. Проверьте ответ:
1А 1Б
К Си
Rb Ag
Cs Au
Если вы допустили при ответе на этот вопрос какие-либо ошибки, то, прежде чем переходить к дальнейшему чтению, внимательно ознакомьтесь с длиннопериодной периодической таблицей (табл. 4 из программы 7).
Сопоставление подгрупп 1А и 1Б показывает, насколько значительно различие между типическими (непереходными) элементами и переходными
элементами. Хотя все переходные элементы являются металлами, их химические свойства значительно отличаются от свойств непереходных металлов. Так, щелочные металлы (элементы подгруппы 1 А) обладают большой реакционной способностью, тогда как два благородных металла, используемые в монетных сплавах, а именно серебро и золото (подгруппа 1Б), обладают очень низкой реакционной способностью. Более подробные сведения о химии и применении переходных металлов содержатся в программе 5.
Попрактикуемся снова в обращении с периодической таблицей элементов. Ниже приведены четыре набора элементов из пятого периода. Выберите набор, который содержит элементы из побочных подгрупп 1, 2, 3 и 4.
• Rb, Sr, In, Sn —> 16
• Ag, Cd, Y, Zr —► 2
• Rb, Sr, Y, Zr —> 56
• Ag, Cd, In, Sn —> 96
34. Л/-оболочка (третья оболочка) может содержать до 2-3-3= 18 электронов. Однако поставленный в рубрике 17 вопрос относился совсем к другому: требовалось указать максимальное число внешних электронов у любого элемента. Из табл. 3, помещенной в конце программы 7, вы можете установить, сколько групп имеется в периодической таблице. До сих пор мы видели, что элементы группы 1 имеют 1 внешний электрон, элементы группы 2 имеют 2 внешних электрона, элементы группы 3 имеют 3 внешних электрона.
Учитывая, что в периодической таблице имеется всего восемь групп, вы сможете дать правильный ответ на вопрос, поставленный в рубрике 17.
35. На Л/-оболочке могло бы поместиться еще 10 электронов. Полная емкость М-оболочки равна
2•3•3 =18 электронов
У элемента 18 имеется 8 электронов
На М-оболочке могло бы поместиться еще 10 электронов
Заполнение М-оболочки до полных 18 электронов происходит у элементов с номерами от 21 до 30. Эти элементы не показаны на сокращенной периодической таблице (табл. 3 из программы 7) и называются переходные элементы. Поэтому в сокращенной таблице за элементом 20Са следует элемент 3lGa.
Познакомившись с характером заполнения электронных оболочек, вы сможете понять, в чем заключается различие между двумя основными семействами элементов.
а) Семейство, в котором каждый новый элемент по сравнению с предшествующим элементом содержит один дополнительный электрон во внешней электронной оболочке, называется семейство типических, или непереходных, элементов. Эти элементы образуют главные подгруппы.
б) Семейство, в котором каждый новый элемент содержит по сравнению с предшествующим элементом один дополнительный электрон во внутренней не полностью заполненной оболочке, называется семейство переходных элементов. Эти элементы образуют побочные подгруппы.
Завершите следующие предложения:
92
Программа 4
4
Каждый типический элемент имеет на один электрон больше, чем элемент с предыдущим атомным номером, в ... электронной оболочке.
Каждый переходный элемент имеет на один электрон больше, чем элемент с предыдущим атомным номером, в ... электронной оболочке.
Проверьте ответ в рубрике 48.
36. NaH, действительно, представляет собой гидрид, но NH3 не является кислотой.
Вернитесь к рубрике 63.
37. Проверьте ответ: Первая оболочка вторая оболочка третья оболочка четвертая оболочка пятая оболочка
= К-оболочка = L-оболочка = М-оболочка = N-оболочка = О-оболочка
шестая оболочка = Р-оболочка
седьмая оболочка = Q-оболочка
Существует всего семь электронных оболочек, обозначаемых буквами латинского алфавита от К до Q, как показано выше.
Всякий элемент, у которого внешние электроны находятся в К-оболочке,
принадлежит к первому периоду.
Если у какого-либо элемента внешние электроны находятся в Е-оболочке, этот элемент принадлежит ко второму периоду.
Если внешние электроны находятся в М-оболочке, элемент принадлежит к третьему периоду и т. д.
Завершите следующее предложение.
Если внешние электроны элемента находятся в Р-оболочке, этот элемент принадлежит к ... периоду.
Проверьте ответ в рубрике 25.
38. Неправильно. Прочтите еще раз материал, начиная с рубрики 35.
39. Правильно. Номер группы в периодической таблице, к которой принадлежит данный типический элемент, определяется числом электронов во внешней оболочке.
Прежде чем рассматривать переходные элементы, познакомимся с периодичностью химических и физических свойств типических элементов, которая может быть установлена при помощи периодической таблицы.
Прежде всего элементы можно подразделить на металлы и неметаллы. Металлы имеют характерный металлический блеск и хорошо проводят электрический ток. При нормальных условиях они находятся в твердом состоянии (исключением является переходный элемент ртуть, которая при нормальных условиях находится в жидком состоянии).
Неметаллы могут быть твердыми, жидкими или газообразными, и все они являются плохими проводниками электрического тока.
Многие элементы находятся на границе раздела между металлами и неметаллами и характеризуются средней электропроводностью.
К сокращенной периодической таблице (табл. 3 из программы 7) применимо следующее правило:
Периодическая система элементов
93
При перемещении слева направо в пределах каждого периода происходит уменьшение металлических свойств элементов. И наоборот, неметаллические свойства элементов возрастают в этом направлении.
Во втором периоде элементы литий и бериллий являются металлами; бор, углерод, азот, кислород, фтор и неон являются неметаллами.
Перечислите теперь металлические элементы в третьем периоде.
Проверьте ответ в рубрике 49.
40. Элемент 9 называется фтор. Он имеет два электрона на К-оболочке и семь электронов на L-оболочке.
Запишите теперь название и электронное распределение для элемента 18.
Элемент 18 называется .... Он имеет
на К-оболочке ... электронов,
на L-оболочке ... электронов,
на М-оболочке ... электронов.
Проверьте ответ в рубрике 50.
41. Вы еще недостаточно хорошо ориентируетесь в периодической таблице. Прочтите еще раз материал, начиная с рубрики 95.
42. Неправильно. Проработайте еще раз внимательно материал, начиная с рубрики 39.
43. Неправильно. Вернитесь к рубрике 22.
44. Н2О вода
H2S сероводород
Кислотность соединений в данном случае заметно возрастает.
Н2О-нейтральное соединение
H2S-слабая кислота
Гидриды селена и теллура являются более сильными кислотами, чем H2S.
Повышение кислотности гидридов различных элементов зависит от положения этих элементов в периодической таблице, как показано на следующей схеме:
Периоды
Возрастание кислотности гидридов
Группы
Рассмотрим теперь три кислоты: H2S, НО и НВг. Какая из них должна быть самой сильной?
• Сероводород H2S
• Хлороводород НО
• Бромоводород НВг
83
76
63
45. Совершенно верно. Калий-элемент с атомным номером 19, имеет такое распределение электронов по оболочкам:
К-оболочка L-оболочка М-оболочка N-оболочка
2881 электрон
(Примечание. Хотя М-оболочка у аргона содержит только 8 электронов, у следующего элемента, калия, начинается заполнение N-оболочки.)
Сформулируем теперь такое общее правило:
Как только заселенность оболочки достигает 8 электронов, начинается заполнение следующей оболочки.
Поэтому не полностью заполненная М-оболочка у калия становится внутренней оболочкой.
Сколько электронов могло бы еще поместиться на М-оболочке? Запишите соответствующее число и проверьте ответ в рубрике 35.
46. Нет, сурьма Sb не является наиболее ярко выраженным металлом среди элементов группы 5, хотя она действительно имеет металлический блеск и проводит электрический ток. Металлический характер элементов нарастает при перемещении вниз вдоль группы.
Какой элемент находится в самом низу группы 5?
Проверьте ответ в рубрике 68.
47. Неправильно. Прочтите еще раз материал, начиная с рубрики 35.
48. Проверьте ответ:
Каждый типический элемент имеет на один электрон больше во внешней электронной оболочке, чем элемент с предыдущим атомным номером.
Каждый переходный элемент имеет на один электрон больше во внутренней электронной оболочке, чем элемент с предыдущим атомным номером.
В сокращенной периодической таблице указаны только типические элементы. Все остальные элементы принадлежат к переходным.
Посмотрите на атомные номера элементов в четвертом, пятом и шестом периодах сокращенной периодической таблицы, и вы увидите, какие элементы пропущены в ней. Это и есть переходные элементы. Какие номера у этих элементов?
В четвертом периоде пропущены элементы с номерами от 21 до 30.
В пятом периоде пропущены элементы с номерами от ... до ....
В шестом периоде пропущены элементы с номерами от ... до ....
Завершите два последних предложения и проверьте ответ в рубрике 57.
49. Металлами в третьем периоде являются:
натрий, магний и алюминий.
Третий период является хорошим примером постепенного изменения свойств элементов от металлических к неметаллическим.
Металлический характер элементов возрастает при перемещении влево от кремния, а неметаллический характер-при перемещении вправо от него:
металлы <- Si -» неметаллы
Сам кремний находится на границе раздела между металлами и неметаллами. По внешним признакам его можно отнести к металлам, но в химическом отношении он ведет себя как неметалл.
4
твердые вещества при ном- г(
наптосС температуре
с металлическим блеском
хорошие проводники изоляторы
проводники (непроводники)
Элемент на самом правом краю третьего периода-аргон-представляет собой благородный газ. Хлор тоже является газообразным и неметаллическим элементом. Хотя сера и фосфор при комнатной температуре-твердые кристаллические вещества, они обладает свойствами неметаллов.
Приведем еще одно правило, касающееся металлического характера элементов.
Металлический характер элементов возрастает при перемещении сверху вниз в пределах каждой группы.
Посмотрите на четвертую группу в табл. 3 (программа 7) и перечислите все металлы в этой группе.
Проверьте ответ в рубрике 59.
50. Элемент 18 называется аргон Аг. Он имеет
на К-оболочке два электрона
на Z-оболочке восемь электронов
на М-оболочке восемь электронов
Сколько электронов находится на каждой оболочке калия-элемента с атомным номером 19?
к- L- М- lV-оболочка
• 2 8 9 0 электронов -» 70
• 2 8 8 1 электрон -» 45
• 2 8 7 2 электрона -> 60
• 2 8 6 3 электрона -» 65
51. Правильно. Бромоводород НВг является кислотой. СаН2, гидрид кальция, как это видно из его названия, представляет собой гидрид.
Вернемся теперь к описанию периодической таблицы и посмотрим, как в нее входят переходные элементы (элементы побочных подгрупп).
Как мы уже знаем, между элементами Са и Ga в четвертом периоде сокращенной таблицы пропущено десять элементов.
Ниже показано распределение электронов в атомах кальция и галлия по электронным оболочкам
Элемент Атомный номер Число электронов в оболочке
к L м N
Са 20 2 8 8 2
Ga 31 2 8 18 3
96
llpoipasiMa 4
Какая электронная оболочка заполняется электронами у переходных элементов с атомными номерами от 21 до 30?
Проверьте ответ в рубрике 15.
52. Вы еще недостаточно хорошо ориентируетесь в периодической таблице. Проработайте еще раз материал, начиная с рубрики 95.
53. А1(ОН)3- амфотерный гидроксид
Гидроксид кремния Si(OH)4 вообще не является основанием, а ведет себя как кислота. Поэтому лучше записывать его в виде H4SiO4. Когда это соединение теряет одну молекулу воды, получается кремниевая кислота H2SiO3.
Способность элементов третьего периода образовывать кислородсодержащие кислоты возрастает в такой последовательности:
Р -» Н3РО4 (фосфорная кислота, средней сцлы)
S -» H2SO4 (серная кислота, сильная)
С1 -» НС1О4 (хлорная кислота, сильная)
Итак, мы познакомились с тремя свойствами, последовательно изменяющимися в периодической системе элементов:
1) металлический характер элементов,
2) электроотрицательность элементов и
3) основность гидроксидов элементов.
Как изменяются эти три свойства при перемещении слева направо в пределах периодов (т. е. при увеличении атомного номера элементов) и при перемещении снизу вверх в пределах групп (т. е. при уменьшении атомного номера)?
Металлический характер элементов Электроотрицательность элементов Основность гидроксидов
• возрастает возрастает возрастает -» 27
• убывает убывает убывает -> 74
• убывает убывает убывает -» 64
• возрастает убывает возрастает -» 42
54. Первые четыре элемента в группе 7 соединяются с водородом, образуя
следующие кислоты:
HF фтороводород
НО хлороводород
НВг бромоводород
HI иодоводород
Эти кислоты имеют неодинаковую силу. Уже хлороводород представляет собой сильную кислоту, a HI-еще более сильная кислота.
Познакомимся со следующим общим правилом:
Кислотность соединений водорода с элементами одной группы возрастает при переходе к ннжией части группы.
Вы убедитесь в справедливости этого правила, применив его к первым двум элементам группы 6.
Запишите формулы и названия соединений водорода, образуемых первыми двумя элементами группы 6.
Проверьте ответ в рубрике 44
Периодическая система мемеигс
55. Неправильно. Вернитесь к рубрике 22.
56. В выбранном вами наборе содержатся первые четыре элемента пятого периода. Однако Rb и Sr принадлежат к главным подгруппам.
Для ясности в длиннопериодной периодической таблице (табл. 4 из программы 7) переходные элементы заштрихованы.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 33.
57. В сокращенной периодической таблице пропущены следующие элементы: в четвертом периоде элементы с номерами 21-30, в пятом периоде элементы с номерами 39-48 и
в шестом периоде элементы с номерами 57 80; или, другими словами,
10 элементов в четвертом периоде,
10 элементов в пятом периоде и
24 элемента в шестом периоде.
Седьмой период в сокращенной периодической таблице тоже неполный. Однако в данном случае его неполнота частично обусловлена тем обстоятельством, что пропущенные типические элементы (с номерами 104-109) в большинстве своем еще неизвестны. В седьмом периоде надежно установлено 20 элементов. Два из них являются типическими элементами, а остальные принадлежат к переходным. (Элементы с номерами 104-106 не включены в таблицу.)
Итак, подведем итог.
Все элементы можно подразделить на два основных семейства:
а) типические, или непереходные, элементы (элементы главных подгрупп);
б) переходные элементы (элементы побочных подгрупп).
В чем заключается принципиальное различие между этими двумя семействами элементов?
• В атомных массах -> 47
• В числе нейтронов -» 73
• В положении последнего валентного электрона на
электронных оболочках -> 67
• Принципиального различия нет, классификация условна -» 38
58. Большинство элементов, образующих катионы, имеют во внешней электронной оболочке один, два или три электрона. Такие элементы превращаются в ионы, отдавая свои валентные электроны. Образующиеся ионы имеют во внешней электронной оболочке восемь электронов (октет электронов, или конфигурацию благородного газа).
В периодической таблице элементов
элементы с одним внешним электроном находятся в группе 1, элементы с двумя внешними электронами находятся в группе 2, элементы с тремя внешними электронами находятся в группе 3. Посмотрите на элементы первых трех групп в сокращенной периодической таблице (табл. 3 в программе 7).
Являются ли эти элементы преимущественно металлами или неметаллами?
• Металлы -> 81
• Неметаллы -► 31
7-29
98
Программа 4
59. В группе 4 к металлам относятся свинец РЬ и олово Sn. Германий Ge тоже рассматривается как металл, хотя по некоторым химическим свойствам его следует скорее отнести к неметаллам.
Группа 4 начинается неметаллическим элементом углеродом, при переходе к кремнию и германию металлический характер элементов постепенно увеличивается, и группа завершается ярко выраженными металлами оловом и свинцом.
Аналогичное изменение свойств от неметаллов к металлам ясно видно и в группе 5.
Азот N газ
Фоссрор Р
Мышьяк Аз твердые
Сурьма Sb вещества
Висмут Bi .
усиление металли ческого блесна
'^непроводники
1 проводники электричества
Учитывая эти данные, укажите, какой элемент группы 5 должен иметь наиболее ярко выраженный металлический характер.
• Bi ->68
• As -> 75
• Sb ->46
60. Неправильно. Заполнение N-оболочки не может начаться, пока на М-оболочке еще нет восьми электронов.
Вернитесь к рубрике 50.
61. Неправильно. За разъяснениями обратитесь в рубрику 87.
62. Проверьте ответ:
А1(ОН)3 + ЗНС1 -> А1С13 + ЗН2О
Гидроксид алюминия реагирует здесь как основание, образуя соль с катионрм А13 +.
Однако в реакции с сильным основанием-гидроксидом натрия - гидроксид алюминия ведет себя как кислота
NaOH + А1(ОН)3 -> Na[Al(OH)4]
Гидроксид алюминия растворяется в растворе гидроксида натрия, образуя соль с комплексным анионом [А1(ОН)4]“, в котором алюминий является центральным атомом*.
Повторим еще раз рассмотренную только что последовательность гидроксидов:
NaOH: сильное основание
Mg(OH)2: слабое основание
А1(ОН)3: ...
* В действительности образуются более сложные комплексные анионы с шестикоординационным алюминием,- Прим. ред.
Периодическая система элементов
99
Каков кислотно-основный характер описанного выше гидроксида А1(ОН)3? Запищите термин, обозначающий способность реагировать как с кислотами, так и с основаниями.
Проверьте ответ в рубрике 53.
4
63. Совершенно верно. Из элементов S, С1 и Вг последний находится ближе всего к правому нижнему углу периодической таблицы. Это значит, что бромоводород-более сильная кислота, чем НС1 или H2S.
Слева от кислорода в периодической таблице находятся азот, а затем углерод. Эти два элемента образуют с водородом следующие соединения:
NH3 аммиак
СН4 метан
Аммиак не диссоциирует с образованием протонов. Подобно этому, метан тоже не диссоциирует. Метан является простейшим органическим соединением (см. программу 8).
Таким образом, мы убедились, что свойства соединений водорода с элементами второго периода значительно изменяются при перемещении вдоль периода. То же самое справедливо и в отношении других периодов.
Ниже указаны четыре пары соединений водорода. Найдите среди них такую пару, в которой первое соединение представляет собой кислоту, а второе-гидрид.
• NH3, NaH - 36
• HF, СН4 - 24
• НВг, СаН2 - 51
• HI, SiH4 - 85
64. Правильно. Существует еще много характерных свойств элементов, которые закономерно изменяются вдоль периодов и групп периодической таблицы. При увеличении атомного номера элементов в пределах периодов и при уменьшении атомного номера элементов в пределах групп происходят такие систематические изменения свойств:
ослабление металлического характера элементов, усиление неметаллического характера элементов, возрастание электроотрицательности элементов, уменьшение электроположительности элементов, уменьшение основности гидроксидов элементов и возрастание кислотности кислородсодержащих кислот. Пользуясь этими закономерностями, постарайтесь ответить на следующий вопрос.
Является ли гидроксид кальция Са(ОН)2 более сильным основанием, чем гидроксид бария Ва(ОН)2?
• Да -89
• Нет - 80
65. Неправильно. Заполнение N-оболочки не может начаться, пока на М-оболочке еще нет восьми электронов.
Вернитесь к рубрике 50.
7*
1П'> Программа 4
66. Неправильно. За разъяснениями обратитесь в рубрику 87.
Я 67. Правильно. Классификация элементов основана на различии в положении последнего электрона*:
а) у типических элементов последний электрон появляется во внешней оболочке;
б) у переходных элементов последний электрон появляется во внутренней оболочке.
Периодическая таблица элементов состоит из периодов и групп.
Какими признаками определяется период, к которому принадлежит какой-либо типический элемент?
• Числом электронов во внешней оболочке -> 55
• Числом протонов -» 43
• Номером внешней электронной оболочки -» 23
68. Правильно. Висмут Bi является последним элементом в группе 5. Он имеет наиболее ярко выраженный металлический характер.
Ниже кратко охарактеризованы направления возрастания металлических свойств:
Периоды
Гриппы | возрастание нз 1 металлические ’ свойств
В программе 2 мы узнали, что заряженные атомы, или ионы, бывают двух типов: катионы, или положительно заряженные ионы, и анионы, или отрицательно заряженные ионы.
Подумайте, какие элементы легче образуют катионы?
• Металлы -» 81
• Неметаллы -► 88
• Не знаю -► 58
69. Из всех элементов цезий Cs легче всего образует катион.
Другими словами, цезий легче всего отдает электрон и поэтому является наиболее электроположительным элементом.
Периоде!
- возрастание
'Руппы электроположи-
тельности
И наоборот, элементы, которые легко присоединяют электроны, являются электроотрицательными. Электроотрицательность элементов возрастает при
* Понятие «последнего электрона» весьма условно, ведь все электроны сами по себе одинаковы. Речь идет о том, где оказывается электрон, появляющийся по сравнению с предыдущим элементом,-во внешней или в одной иэ «недостроенных» внутренних оболочек,- Прим. ред.
Периодическая система j.wmuitoh
перемещении снизу вверх в пределах каждой группы и слева направо в пределах каждого периода.
Пру/7/W^
Периоды возрастание элентроотри -цательности
Какой элемент должен характеризоваться наибольшей электроотрицательностью в периодической таблице?
При ответе на этот вопрос не обращайте внимания на группу 8 и седьмой период
Запишите символ соответствующего элемента.
Проверьте ответ в рубрике 79.
70. Неправильно. На М-оболочке не может оказаться 9 электронов, если N-оболочка незанята. Как только на М-оболочке окажется восемь электронов, у следующего элемента начинается заполнение N-оболочки.
Вернитесь к рубрике 50.
71. Пентоксид азота N2O5.
Высшие валентности элементов, проявляемые в их соединениях с кислородом, таковы:
в группе 1: 1
в группе 2: 2
в группе 3: 3
в группе 4: 4
в группе 5: 5
в группе 6: 6
в группе 7: 7
Эти высшие валентности могут достигаться в соединениях элементов с кислородом, но существует много кислородных соединений, в которых элементы проявляют более низкие валентности.
Так, наряду с N2O5 азот образует с кислородом соединения NO (моноксид или оксид азота) и NO2 (диоксид азота). Кроме SO3 существует еще SO2 (диоксид серы), а хлор образует с кислородом не только С12О7, но также оксиды С12О и С1О2.
Запишите эти пять новых оксидов, указав, какие валентности проявляют в них элементы, связанные с кислородом.
Проверьте ответ в рубрике 95.
72. Гидроксид цезия CsOH является наиболее сильным основанием среди всех гидроксидов.
Основность гидроксидов элементов возрастает при перемещении сверху вниз в пределах каждой группы. Однако в группе 1 LiOH является еще достаточно сильным основанием.
Изменение основности гидроксидов различных элементов при изменении последних в пределах одного периода хорошо иллюстрируется гидроксидами элементов третьего периода. Первые четыре гидроксида из этой совокупности
102
Программа 4
таковы:
NaOH
Mg(OH)2
А1(ОН)3
Si(OH)4
Выберите среди этих гидроксидов: а) наиболее сильное основание и б) наиболее слабое основание.
Проверьте ответ в рубрике 82.'
73. Неправильно. Прочтите еще раз материал, начиная с рубрики 35.
74. Металлический характер элементов уменьшается при перемещении слева направо вдоль периодов (т. е. с увеличением атомного номера) и к верхней части группы (т. е. с уменьшением атомного номера). В этих же направлениях уменьшается основность гидроксидов, но не электроотрицательность элементов. Проработайте еще раз внимательно материал, начиная с рубрики 39.
75. Неправильно. Хотя мышьяк имеет металлический блеск и проводит электрический ток, он не является наиболее ярко выраженным металлом среди элементов группы 5. Металлический характер элементов нарастает при перемещении сверху вниз вдоль группы.
Какой элемент находится в самом низу группы 5?
Проверьте ответ в рубрике 68.
76. Неправильно. За разъяснениями обратитесь в рубрику 94.
77. Проверьте ответ:
LiH гидрид лития
ВеН2 гидрид бериллия
ВН3 гидрид бора (боран)
СН4 метан
NH3 аммиак
ОН2 или Н2О вода
FH или HF фтороводород
Боран ВН3 не удается изолировать; он существует только в виде димерных молекул диборана В2Н6.
Кислотность соединений водорода возрастает с увеличением атомного номера связанного с водородом элемента в пределах периода.
Какие из указанных выше соединений диссоциируют с образованием протонов?
Проверьте ответ в рубрике 91.
78. а) Водород принадлежит к первой группе, хотя он не является металлом.
б) Благородные газы образуют нулевую группу.
Итак, вы познакомились с некоторыми правилами и периодическими закономерностями свойств элементов и убедились в том, что последовательность расположения элементов в периодической таблице определяется электронным строением их атомов.
Периодическая система элементов
103
Это позволит вам осознать огромное значение открытия периодического закона и создания периодической таблицы Д. И. Менделеевым и Л. Мейером в 1869. Оба ученых, работавшие независимо друг от друга, не располагали сведениями об электронном строении атома. Они расположили элементы в периодическую таблицу *, руководствуясь их атомными массами и известными в то время химическими свойствами.
Завершите следующее предложение.
Периодическая таблица элементов была создана в 1869 г. ... и ....
Проверьте ответ в рубрике 10.
79. Наиболее электроотрицательным элементом является фтор F. Он очень легко присоединяет электрон, образуя при этом фторид-ион F-.
Наиболее электроположительный элемент (цезий) находится в нижнем левом углу периодической таблицы; наиболее электроотрицательный элемент (фтор) находится в верхнем правом углу таблицы. Неметаллы тоже сосредоточены в верхней правой части периодической таблицы, тогда как металлы сосредоточены в нижнем левом углу и располагаются наверх и направо от него.
Пограничная линия между металлами и неметаллами проходит вдоль элементов бора, кремния, мышьяка, теллура и радиоактивного быстрораспадающегося элемента астата At. Эти элементы относят к неметаллам.
Найдите указанную границу в табл. 3 из программы 7 и перечислите прилегающие к ней со стороны металлов пограничные элементы.
Проверьте ответ в рубрике 90.
80. Правильно. Гидроксид бария-более сильное основание, чем гидроксид кальция.
Сравните между собой четыре кислоты:
Н2СО3, H2SiO3, HNO3 и Н3РО4
Какая из этих кислот является наиболее слабой?
• Угольная кислота -► 92
• Кремниевая кислота -► 97
• Азотная кислота -► 66
• Фосфорная кислота -» 61
Группы
* Однако только Д. И. Менделеев сделал правильные выводы из наблюдаемых закономерностей, открыл периодический закон и на основании его предсказал свойства неизвестных еще элементов. Именно поэтому Д. И. Менделеева считают основателем периодического закона.- Прим. ред.
81. Металлы образуют катионы.
Способность образовывать катионы возрастает в указанных ниже направлениях:
Периоды
возрастание способности образовывать натионы
Программа 4
f;?-'
Какой элемент в периодической таблице обладает наибольшей способностью образовывать положительно заряженный ион? (При ответе на этот вопрос не обращайте внимания на седьмой период.)
Запишите символ соответствующего элемента.
Проверьте ответ в рубрике 69.
82. Из четырех указанных гидроксидов NaOH-наиболее сильное основание и Si (О Н)4-наиболее слабое основание. Обсудим этот вопрос более подробно. NaOH является сильным основанием. Он образует соли при взаимодействии с кислотами, например с НС1:
NaOH + НС1 NaCl + Н2О
Мд(ОН)2 является слабым основанием. Кроме того, он имеет низкую растворимость. Однако этот гидроксид образует соли при взаимодействии с кислотами, например с соляной кислотой:
Mg(OH)2 + 2НС1 - MgCl2 + Н2О
А1(ОН)3 является амфотерным гидроксидом. Это означает, что он реагирует как с кислотами, так и с основаниями, и сам может выступать то в роли основания, то в роли кислоты. Характер его поведения в реакции зависит от свойств того вещества, с которым он реагирует, с кислотами он реагирует как основание, с основаниями он реагирует как кислота.
Запишите уравнение реакции гидроксида алюминия с соляной кислотой. Проверьте ответ в рубрике 62.
83. Неправильно. За разъяснениями обратитесь в рубрику 94.
84. Элементы третьего периода образуют следующие оксиды:
Na2O оксид натрия
MgO оксид магния
А12О3 оксид алюминия
SiO2 оксид кремния
Р2О5 пентоксид фосфора
SO3 триоксид серы
С12О7 гептоксид хлора
(Аг, благородный газ, не образует оксида.)
Валентность по отношению к кислороду у элементов любого периода повышается с увеличением атомного номера. Элементы проявляют свои высшие валентности в соединениях с кислородом.
Каким должен быть оксид азота, в котором последний проявляет свою высшую валентность?
Проверьте ответ в рубрике 71.
85. HI, действительно, является кислотой. Но, поскольку кремний находится под углеродом в группе 4 периодической таблицы, SiH4, подобно СН4, нельзя назвать гидридом; это соединение вообще не диссоциирует.
Вернитесь к рубрике 63.
Периодическая система элементов
105
86. К актиноидам относятся элементы с атомными номерами 90-103. Подобно всем элементам седьмого периода, они радиоактивны.
В заключение мы остановимся на рассмотрении периодических закономерностей у переходных элементов. Как и для типических элементов, существуют определенные закономерности свойств в зависимости от расположения переходных элементов по подгруппам, хотя эти закономерности не всегда столь четко проявляются.
Типические элементы проявляют свои высшие валентности в соединениях с кислородом; их высшая валентность совпадает с номером группы. Это простое правило применимо также и к переходным элементам.
Основываясь на сказанном, укажите высшие валентности хрома Сг и марганца Мп.
Чтобы ответить на этот вопрос, найдите сначала оба указанных элемента в периодической таблице.
Проверьте ответ в рубрике 93.
87. Гидроксиды металлов являются основаниями, и их основность возрастает при переходе к металлам нижней левой части периодической таблицы.
В отличие от этого гидроксиды неметаллов (или их дегидратированные формы) являются кислотами. Сила этих кислот возрастает при переходе к неметаллам верхней правой части периодической таблицы. Эти закономерности можно схематически изобразить так:
Группы
Периоды
возрастание основности гидроксидов металлов
Периоды
1 кислородсодержащих кислот
Поставленный в рубрике^80 вопрос заключался в следующем:
Какая из четырех кислот-Н2СО3, H2SiO3, Н3РО4 или HNO3-является наиболее слабой?
Эти кислородсодержащие кислоты образованы неметаллами С, Si, Р и N. Отыщите данные четыре элемента в сокращенной периодической таблице (табл. 3 из программы 7). Тот из них, который располагается ниже и левее других в этой таблице, должен образовывать наиболее слабую кислородсодержащую кислоту.
Какой это элемент?
• С - 92
• Si -» 97
• Р - 66
• N - 61
88. Неправильно. Неметаллы образуют анионы. Переходите к чтению рубрики 58.
Программа 4
89. Неправильно. Основность гидроксидов элементов одной группы возрастает при увеличении атомного4 номера элементов. Кальций, элемент 20, расположен выше бария, элемента 56. Следовательно, гидроксид кальция Са(ОН)2-более
Л слабое основание по сравнению с Ва(ОН)2
Проработайте еще раз материал, начиная с рубрики 72.
90.
Проверьте ответ:
Бериллий Be (второй период)
Алюминий А1 (третий период)
Германий Ge Сурьма Sb Полоний Ро
(четвертый период) (пятый период) (шестой период)
У каждого из этих элементов сосед со следующим по порядку атомным номером является неметаллом.
Основность гидроксидов различных элементов изменяется таким же образом, как и электроотрицательность соответствующих элементов
/ру/7ЛЬ!^
Периода!
возрастание основности
Основываясь на этом, укажите, гидроксид какого металла должен быть самым сильным основанием? При ответе на этот вопрос не принимайте во внимание седьмой период
Проверьте ответ в рубрике 72.
91. Фтороводород при растворении в воде диссоциирует на протон и фторид-ион:
HF Н+ + F"
Вода тоже диссоциирует, однако очень слабо:
Н2О Н+ + ОН“
Таким образом, оба этих соединения образуют при диссоциации протоны.
В отличие от этого в LiH водород находится в анионной форме-в виде гидрид-иона Н “.
Как мы видим, водород может образовывать с элементами второго периода соединения двух типов:
в форме Н " соединения с элементами левой части периода и
в форме Н + соединения с элементами правой части периода.
Элементы других периодов также могут образовывать с водородом либо гидриды, либо кислоты.
Какие кислоты образуются первыми четырьмя элементами группы 7 в соединении с водородом?
Запишите ответ и проверьте его в рубрике 54.
92. Неправильно. За разъяснениями обратитесь в рубрику 87.
Периодическая система элементов
107
93. Хром Сг имеет высшую валентность 6, а марганец Мп 7.
Подробнее вы узнаете об этом из программы 5.
Поскольку подгруппа 8А содержит только благородные газы, которые не вступают в обычные химические реакции, эта подгруппа называется иногда нулевой группой.
Элемент водород также обладает исключительными свойствами. Хотя его помещают в группу 1, он не является металлом, подобно всем остальным элементам первой группы, а представляет собой газ.
В чем заключаются две особенности периодической таблицы, связанные а) с положением водорода и
б) с положением благородных газов?
Проверьте ответ в рубрике 78.
94. Кислотность соединений водорода с различными элементами возрастает при перемещении к правой части периодов и нижней части групп. Чтобы правильно ответить на вопрос, поставленный в рубрике 44, сравните положения элементов S, С1 и Вг в периодической таблице (табл. 3 из программы 7).
Какой из трех элементов ближе всего к правому нижнему углу периодической таблицы?
• Вг - 63
• С1 -52
• S - 41
95. Проверьте ответ:
NO (N двухвалентен)
NO 2 (N четырехвалентен)
SO 2 (S четырехвалентна)
С12О (О одновалентен)
СЮ2 (О четырехвалентен)
Рассмотрим теперь валентности элементов по отношению к водороду.
Валентность элементов по отношению к водороду увеличивается в каждом периоде от группы 1 до группы 4. После этого валентность снова уменьшается с ростом номера группы.
Номер группы 12 3 4 5 6 7
Валентность по отношению к Н: один два три четыре три два один
Запишите формулы соединений с водородом элементов второго периода и по возможности их названия.
Проверьте ответ в рубрике 77.
96. В выбранном вами наборе содержатся четыре последовательных элемента из пятого периода. Однако In и Sn принадлежат к главным подгруппам.
Для ясности в длиннопериодной периодической таблице (табл. 4 из программы 7) переходные элементы заштрихованы.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 33.
108
Программа 4
97. Правильно. Кремниевая кислота является наиболее слабой из четырех указанных кислот. Из элементов С, N, Si и Р кремний располагается в периодической таблице левее и ниже остальных.
Следующие элементы образуют сильные кислородсодержащие кислоты:
N: азотная кислота HNO3
S : серная кислота H2SO4
О : хлорная кислота НС1О4
Фтор F не образует кислородсодержащую кислоту, т.е. является исключением из рассматриваемой закономерности.
Подведем итог сказанному.
1. Почти все элементы образуют кислородсодержащие кислоты.
2. Высшие валентности элементов достигаются в их соединениях с кислородом.
3. Высшая валентность элемента равна номеру группы, к которой он принадлежит.
Запишите формулы оксидов элементов третьего периода и, если знаете, их названия. (Примечание. Благородный газ аргон не образует оксида.)
Проверьте ответ в рубрике 84.
Программа 5
Переходные элементы
1. В программе 4 мы познакомились со строением атомов и положением переходных элементов в периодической таблице.
В данной программе мы начнем с описания закономерностей, которые можно вывести на основе периодической системы элементов. После этого мы остановимся на распространенности в природе, получении и применении переходных металлов.
Перепишите себе в тетрадь слова, набранные выше курсивом, после чего переходите к чтению рубрики 13.
2. Олово, действительно, является одним из компонентов бронзы. Однако никель не используется для изготовления латуни.
Вернитесь к рубрике 12.
3. Неправильно. Царская водка, действительно, содержит азотную кислоту, но другим ее компонентом является не фосфорная кислота.
Вернитесь к рубрике 25 и внимательно прочтите ее еще раз.
4. Ag, Си, Ti, Ni, Pt, Hg, W и U используют в виде чистых металлов.
Ад и Си применяют в электронике и средствах связи, так как они имеют хорошую электропроводность.
Ti и Ni устойчивы к воздействию гидроксидов щелочных металлов и разбавленных неокисляющих кислот, поэтому их используют в химическом машиностроении. Поскольку титан является легким металлом, он находит все большее применение как важный конструкционный материал в судостроительной и авиационной промышленности.
Pt является благородным металлом. Ее используют для изготовления высококачественной лабораторной посуды. Например, платиновые тигли можно нагревать до температур выше 1000°С.
Повторим сказанное. Какие металлы используются
а) для изготовления лабораторного оборудования,
б) в электронике и средствах связи,
в) в химическом машиностроении и
г) в авиа- и судостроении?
Запишите химические символы соответствующих металлов.
Проверьте ответ в рубрике 11.
5. В указанных ниже соединениях металлы четырехвалентны:
PtO2 оксид платины(1У), или диоксид платины
RuO2 оксид рутения(ТУ), или диоксид рутения
1гС14 тетрахлорид иридия
PdCl4 тетрахлорид палладия
Платина, рутений, иридий и палладий - четырехвалентные металлы.
Укажите теперь два металла, которые могут быть восьмивалентными.
Проверьте ответ в рубрике 15.
III)
Программа 5
6. 2ZnS + 3O2 -► 2ZnO + 2SO2
5
SO2 используется для получения серной кислоты.
Пирит железа FeS2 тоже используется в больших количествах для получения серной кислоты.
Ниже показано, какие продукты получаются при обжиге пирита железа. Однако приведенное уравнение реакции не является полным. Завершите это уравнение, указав в нем правильное число молей каждого участвующего в реакции вещества,
FeS2 + О2 -»• Fe2O3 + SO2
Проверьте ответ в рубрике 41.
7. Серебро и золото являются благородными металлами, а медь нет. Вернитесь к рубрике 34.
8. 83,5% серебра.
Познакомимся еще с одним важным применением переходных элементов.
Переходные элементы используются (в чистом виде или в виде сплавов) в качестве катализаторов в химической промышленности.
Платину применяют как катализатор для окисления аммиака в оксид азота NO. В этом процессе аммиак сжигают над платиновой сеткой при 600°С.
NH3 + О2 -> NO + Н2О
Завершите это уравнение, расставив в нем недостающие коэффициенты.
Проверьте ответ в рубрике 37.
9. МоО3 + ЗН2 - Мо + ЗН2О
WO3 + ЗН2 — W + ЗН2О
Третий метод восстановления оксидов основан на повышенной способности некоторых металлов связывать кислород. В качестве примера таких металлов приведем алюминий, натрий и кальций.
Так, хром и марганец получают восстановлением их оксидов алюминием.
Запишите уравнение реакции MnO2 с А1.
Проверьте ответ в рубрике 61.
10. Оксид ртути: HgO. Оксид вольфрама: WO3
Теперь вы знаете, каковы валентности различных металлов в их оксидах, и знаете, что эти валентности соответствуют номеру группы. Как и типические элементы, переходные элементы тоже могут проявлять в своих соединениях различные валентности.
Однако для переходных элементов способность изменять валентность в химических реакциях более характерна.
Валентность металлов часто обозначают римской цифрой после его химического символа.
Переходные племени.!
Приведем несколько примеров:
Сг,О3 МпО2 СгС13 Cr2(SO4)3 12Н2О оксид хрома(Ш) оксид марганца(1У) хлорид хрюма(Ш) сульфат хрюма(Ш) с 12 молекулами кристаллизационной воды
MnSO4 сульфат марганца(П)
Запишите названия HgO, WO3 и СгО3.
П рю верь те ответ в рубрике 48.
11. а) Для изготовления лабораторного оборудования используют Pt
б) В электрюнике и средствах связи используют Ag, Си
в) В химическом машинострюении используют Ni, Ti
г) В авиа- и судостроении используют Ti
Ртуть является единственным металлом, который при комнатной температура находится в жидком состоянии. Ее температура плавления р>авна — 38,8°С. Ртуть используют для изготовления лабораторных термометрюв и манометрюв.
Пары ртути ядовиты. Если в помещении по неосторожности разлилась ртуть, ее следует тщательнейшим образом собрать.
Вольфрам обладает очень высокой температурой плавления (338О°С), его используют для изготовления нитей в лампах накаливания.
Уран используется как ядерное горючее в атомных реакторах. Он подвержен радиоактивному распаду, и при определенных условиях в нем может поддерживаться контрюлируемая цепная реакция ядерного деления.
Повторим сказанное. Завершите следующие предложения:
а) Металл, используемый для изготовления нитей накаливания в электрюлампах: ....
б) Металл, используемый для изготовления термометров: ....
в) Металл, используемый в ядерных реакторах: ....
г) Металлы, используемые в электрюнике: ....
д) Металлы, используемые в химическом машинострюении: ....
Проверьте ответ в рубрике 80.
12. Си, Ag, Аи побочная подгруппа 1.
Zn побочная подгруппа 2.
Ni, Pt побочная подгруппа 8.
Медь добавляют практически во все сплавы, не содержащие железа.
Медь-главный компонент различных сортов бронзы и латуней.
Сплав меди с оловом или алюминием называется бронза, а сплав меди с цинком-латунь.
Какие из этих сплавов содержат элемент главной подгруппы?
Прюверьте ответ в рубрике 33.
13. 1. Закономерности, устанавливаемые при помощи периодической системы
элементов.
2. Распрюстраненность в природе.
3. Получение.
4. Применение.
112
Программа 5
5
Рассмотрим эти четыре вопроса поочередно.
Итак, начнем с закономерностей, которые можно вывести на основе периодической системы.
В предыдущей программе было показано, что валентности типических элементов по отношению к кислороду возрастают по мере перемещения от группы 1 к группе 7. Это верно и в отношении переходных металлов. Так, переходные металлы побочной подгруппы 1 одновалентны в своих оксидах, переходные металлы побочной подгруппы 2 двухвалентны и т. д.
Запишите формулы оксидов следующих металлов:
Си, Zn, Ti, Cr, Мп
(Вы сможете установить положение этих металлов в периодической системе, пользуясь табл. 4, помещенной в конце программы 7.)
Проверьте ответ в рубрике 26.
14. Золото растворяется в царской водке.
Серебро растворяется в азотной кислоте.
Платина растворяется в царской водке.
Знаете ли вы, каким образом приготовляется царская водка?
Царская водка представляет собой смесь
• концентрированной соляной кислоты и концентрированной серной кислоты -> 30
• концентрированной азотной кислоты
и концентрированной серной кислоты -> 21
• концентрированной азотной кислоты
и концентрированной фосфорной кислоты -> 3
• концентрированной азотной кислоты
и концентрированной соляной кислоты -» 36
15. Осмий и рутений могут быть восьмивалентными.
Металлы железо, кобальт и никель имеют более низкие валентности:
Fe может быть двух- и трехвалентным
Со двухвалентный металл, в комплексах является трехвалентным
Ni двухвалентный металл
Запишите эмпирические формулы сульфата железа(Ш), нитрата никеля(И) и хлорида кобальта(П).
Проверьте ответ в рубрике 34.
16. Следующие соединения содержат восьмивалентные металлы:
OsO4 оксид осмия(УШ), или тетроксид осмия
RuO4 оксид рутения(УШ)
OsF8 октафторид осмия
Таким образом, осмий и рутений являются восьмивалентными элементами.
Ниже приведен еще один ряд соединений:
Fe2(SO4)3, PtO2, PdCl2, RuF5, RuO2, RhCl3, FeCl3, IrCl4, PdCl4, OsCl2
Выберите из них те соединения, которые содержат четырехвалентные металлы.
Проверьте ответ в рубрике 5.
Переходные элементы
113
17. Ванадий находится в побочной подгруппе 5.
Следовательно, высшая валентность этого элемента равна пяти. Однако ванадий легко меняет валентность: известны соединения двух-, трех-, четырех-и пятивалентного ванадия. Это свойство ванадия вполне может быть ответственно за его каталитическую способность.
Металлические никель, палладий и платина способны поглощать большие количества водорода, а затем передавать его ненасыщенным органическим соединениям; в этом случае указанные металлы играют роль катализаторов гидрирования. С примерами подобных реакций мы познакомимся далее в программах, посвященных органической химии.
Завершите следующие предложения.
Металлические элементы ... являются катализаторами гидрирования, а ... являются катализаторами окисления.
Проверьте ответ в рубрике 65.
18. По-видимому, вы ответили просто наугад. Советуем вам обратиться к таблице периодической системы еще раз и найти В ней положение всех элементов, которые могут сплавляться с железом.
Вы уже переписывали себе в тетрадь эти элементы.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 45.
19. Алюминий, действительно, является одним из компонентов бронзы. Однако существует и другой металл, который при сплавлении с медью дает бронзу.
Что же касается латуни, то вы неправильно ответили на вопрос о том, какой металл следует добавить к меди, чтобы получить этот сплав.
Вернитесь к рубрике 12.
20. Амальгама натрия
Благородные металлы серебро и золото очень мягки, но добавление к ним даже небольших количеств меди вызывает значительное повышение твердости. Серебряные и золотые монеты обычно содержат приблизительно 10% меди. В других случаях содержание меди может быть выше. Проба серебра или золота (определение которой объясняется ниже) указывает, сколько соответствующего благородного металла содержится в конкретном изделии.
Чистое серебро или золото имеют пробу 1000
Золото, содержащее 10% меди, имеет пробу 900
Золото, содержащее 15% меди, имеет пробу 850
Проба гравируется на каждом изделии из золота или серебра.
Каково процентное содержание чистого серебра в серебряном предмете, имеющем пробу 835?
Проверьте ответ в рубрике 8.
21. Неправильно. Царская водка, действительно, содержит концентрированную азотную кислоту, но другим ее компонентом является не серная кислота.
Прочтите еще раз внимательно рубрику 25, после чего попытайтесь правильно ответить на вопрос, поставленный в рубрике 14.
8-29
1U
Программа 5
22. Вы перепутали металлы, которые добавляют к меди, чтобы получить латунь и бронзу.
Вернитесь к рубрике 12.
23. Проверьте ответ:
Си двухвалентна
А и трехвалентно
А как обстоит дело с валентностью элементов побочной подгруппы 8?
Некоторые элементы побочной подгруппы 8 восьмивалентны, но обычно проявляемая элементами этой подгруппы высшая валентность ниже, однако она не меньше двух.
Приведем несколько примеров:
FeCl3, RuO2, OsO^ RhCl3, PdCl4, NiSO4, RuO4, Co(N03)2, OsF8
Выберите из этих соединений те, в которых металл восьмивалентен.
Проверьте ответ в рубрике 16.
24. Правильно. Обратите внимание на то, что элементы, влияющие на свойства стали, располагаются в таблице периодической системы вблизи железа.
Эти элементы влияют на твердость, упругость, прочность и способность к растяжению стали.
Для получения сплавов стали нужно примешивать небольшие количества чистых металлов к расплавленному железу. Вместо этого можно смешивать железную руду с рудами, содержащими легирующие добавки, еще до восстановления металла из руды.
Например, молибденовую сталь получают восстановлением коксом смеси оксида железа и оксида молибдена.
Кроме сталей существует много сплавов, не содержащих железа. В таких сплавах участвуют медь, серебро, золото, цинк, никель или платина.
В каких побочных подгруппах находятся элементы медь, серебро, золото, цинк, никель и платина?
Запишите ответ, а затем проверьте его в рубрике 12.
25. Правильно. Серебро, золото и платина-наиболее известные благородные металлы.
Благородные металлы устойчивы по отношению к кислороду и не подвержены коррозии.
Переход от «обычных» металлов к «благородным» не слишком резок.
Следовательно, должны существовать различия и между самими «благородными» металлами.
Существует общая закономерность, согласно которой в каждой группе периодической системы элементы с высшими атомными номерами имеют наиболее ярко выраженный характер благородных металлов.
Различие между благородными металлами выявляется по их реакции с азотной кислотой, которая действует только на серебро, образуя нитрат серебра. Уравнение этой реакции рассматривается в программе 6.
Золото и платина не растворяются в азотной кислоте, но растворяются в смеси азотной и соляной кислот. Такая смесь кислот называется царской водкой, потому что она растворяет «царя металлов» - золото.
Завершите теперь следующие предложения.
Ilepevo,'iin.K' . 7. i-i 115
Золото растворяется в ....
Серебро растворяется в ....
Платина растворяется в ....
Проверьте ответ в рубрике 14.
26. Проверьте ответ:
Cu2O, ZnO, TiO2, CrO3, Mn2O7 и исправьте ошибки, если вы их сделали.
Запишите теперь формулы оксида ртути (Hg) и оксида вольфрама (W).
Проверьте ответ в рубрике 10.
27. Проверьте ответ:
Окраска Пигмент
Белая Оксид цинка ZnO
Диоксид титана ТЮ2
Желтая Сульфид кадмия CdS (желтый кадмий)
Красная Оксид железа Fe2O3
Зеленая Оксид хрома Сг2О3
Черцая Оксид железа (гидроксид железа)
Синтетические пигменты превосходят природные по яркости и постоянству тона.
Конец программы 5.
28. Правильно. Серебрю и золото встречаются в прирюде в чистом виде, а медь и железо встречаются как в виде оксидов, так и в виде сульфидов.
В зависимости от того, в какой форме металлы находятся в прирюде, для получения их в чистом виде используются следующие методы.
1. Металлы, встречающиеся в свободном состоянии, прюсто собирают и переплавляют.
2. Металлы, встречающиеся в виде сульфидов, получают путем предварительного обжига этих сульфидов (для превращения их в оксиды) и восстановления.
3. Металлы, встречающиеся в прирюде в виде оксидов, получают восстановлением оксидов.
Прежде всего остановимся на прюцессе обжига, при которюм сульфидные руды превращаются в оксиды. Обжигом называется реакция сульфида с кислородом воздуха, прютекающая при прюкаливании. В результате этой реакции сульфид металла превращается в оксид металла; побочным прюдуктом реакции является диоксид серы.
Цинковую обманку (сульфид цинка ZnS) превращают в оксид цинка ZnO именно таким путем.
Запишите уравнение этой реакции обжига.
Прюверьте ответ в рубрике 6.
29. Платина и палладий являются благорюдными металлами, а никель нет. Вернитесь к рубрике 34.
8*
116
Программа 5
30. Неправильно. Царская водка, действительно, содержит концентрированную соляную кислоту, но другим ее компонентом является вовсе не серная кислота. Чтобы узнать, какой это компонент, прочтите еще раз внимательно рубрику 25, после чего вы сможете правильно ответить на вопрос, поставленный в рубрике 14.
31. Неправильно. Только один из названных металлов, титан, принадлежит к подгруппе 4Б. Существует побочная подгруппа, к которой принадлежат сразу три металла.
Определите положение каждого элемента в периодической системе и попытайтесь еще раз ответить на вопрос, поставленный в рубрике 47.
32. Задача заключалась в том, чтобы найти среди перечисленных элементов тот, который не принадлежит к переходным. Однако вольфрам принадлежит к побочной подгруппе 6 и, следовательно, является переходным элементом. Воспользуйтесь периодической системой элементов и попытайтесь еще раз ответить на вопрос, поставленный в рубрике 66.
33. Бронза содержит в качестве главного компонента медь, сплавленную с оловом или алюминием, которые располагаются в главных подгруппах.
Из бронзы изготавливают статуи и колокола.
Латунь применяют в машиностроении.
Какие металлы используют вместе с медью для получения
латуни? бронзы?
• Олово Цинк -» 22
• Никель Олово -» 2
• Цинк Олово -» 44
• Олово Алюминий -» 19
34. Проверьте ответ:
Fe2 (SO4)3
Ni(NO3)2
СоС12
Благородные металлы принадлежат к побочным подгруппам и сосредоточены в группах 1 и 8. Вы, несомненно, знакомы с некоторыми благородными металлами.
Ниже приведены пять наборов металлов по три металла в наборе. Выберите набор, содержащий только благородные металлы.
• Медь, серебро и золото —► 7
• Никель, палладий и платина —► 29
• Хром, никель и платина —► 52
• Серебро, платина и золото —► 25
• Ртуть, золото и медь —► 46
35. По-видимому, вы ответили просто наугад. Советуем вам обратиться к таблице периодической системы еще раз и найти в ней положение всех
Переходные элементы
117
элементов, которые могут сплавляться с железом. Вы уже переписывали себе в тетрадь эти элементы.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 45.
36. Правильно. Вследствие большой химической инертности благородные металлы встречаются в природе в свободном (несвязанном) состоянии.
Другие переходные металлы находятся в природе главным образом в виде оксидов или сульфидов.
Укажите три обычные формы, в которых встречаются в природе переходные элементы.
1....
2....
3....
Проверьте ответ в рубрике 49.
Pt
37. 4NH3 + 5О2--------> 4NO + 6Н2О
В этой реакции платина выступает в роли катализатора окисления. Другим катализатором окисления является пентоксид ванадия V2O5. При промышленном синтезе серной кислоты SO2 окисляют до SO3 над поверхностью контактного катализатора V2O5:
2SO2 + О2 ->• 2SO3
К какой группе периодической системы принадлежит ванадий?
Проверьте ответ в рубрике 17.
38. Неправильно. Ни один из перечисленных металлов не относится к побочной подгруппе ЗБ.
Определите положение каждого названного элемента в периодической системе, а после этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 47.
39. Задача заключалась в том, чтобы найти среди перечисленных элементов тот, который не принадлежит к переходным. Однако никель принадлежит к побочной подгруппе 8 и, следовательно, является переходным элементом. Чтобы правильно ответить на вопрос, поставленный в рубрике 66, надо установить положение каждого из перечисленных элементов в периодической системе.
40. Желтый кадмий имеет формулу CdS.
Среди других пигментов укажем оксид хрома Сг2О3 и оксид железа Fe2O3.
Оксид хрома-зеленый пигмент; оксид железа-красный пигмент, но он может существовать также в гидратированной форме в виде гидроксидов, которые имеют желтую или черную окраску.
Постройте таблицу окрасок всех перечисленных пигментов. Укажите химические или тривиальные названия соединений и, если возможно, их формулы.
'18
Про) рамма 5
5
Окраска Пигмент
Белая
Желтая
Красная
Зеленая
Черная
Проверьте ответ в рубрике 27.
41. Проверьте ответ:
4FeS2 + 11О2 —>- 2Fe2O3 + 8SO2
Образующийся в этой реакции Fe2O3 восстанавливается затем до свободного железа. Получение железа основывается главным образом на восстановлении его оксидных руд
Существует много способов выделения переходных элементов в свободном состоянии. Мы остановимся на четырех общих методах:
1) восстановление оксида коксом,
2) восстановление оксида водородом,
3) восстановление оксида другим металлом,
4) электролиз раствора соли и приведем примеры применения этих методов к некоторым переходным элементам.
Примером применения метода 1 является восстановление Fe2O3 углеродом в доменных печах. В этой реакции образуются железо и оксид углерода.
Завершите уравнение этой реакции:
Fe2O3 + С -» ...
Проверьте ответ в рубрике 55.
42. Правильно. Раствор соли цинка можно получить из оксида цинка, обрабатывая последний разбавленной серной кислотой:
ZnO + H2SO4 -» ZnSOj. + Н2О
Затем водный раствор ZnSO4 подвергают электролизу.
После того как мы познакомились с различными методами получения чистых металлов, перейдем к вопросу применения переходных металлов.
Переходные металлы применяют:
1) в виде чистых металлов,
2) для нанесения защитных покрытий,
3) для получения сплавов,
4) в качестве катализаторов и
5) в качестве пигментов.
Перепишите себе в тетрадь эти важнейшие области применения переходных металлов.
В чистом виде находят широкое применение лишь немногие переходные металлы: серебро, медь, титан, никель, платина, ртуть, вольфрам и уран.
Запишите химические символы элементов, которые применяют в виде чистых металлов.
Переходите к рубрике 4.
11ереходные элементы
119
43. Хотя сульфид цинка ZnS имеет белый цвет, он не используется в качестве пигмента для изготовления красок. 1
В отличие от этого оксид цинка ZnO используется в качестве белого пигмента для изготовления цинковых белил.
Переходите к рубрике 51.
44. Правильно.
Сплавы ртути имеют особое название: амальгамы.
Ртуть образует амальгамы со многими металлами. В зависимости от содержания ртути амальгамы могут быть жидкими или твердыми. Хорошо известная амальгама серебра используется для пломбирования зубов. Свежеприготовленная серебряная амальгама пластична, но быстро затвердевает. , Запишите название амальгамы ртути и натрия.
Проверьте ответ в рубрике 20.
45. Правильно. За исключением кремния, все элементы, сплавляемые с железом, являются переходными металлами. Различные стали получают свои названия от элементов, используемых для сплавления с железом: например, хромовая сталь представляет собой сплав железа с хромом. То же самое относится и к другим металлам, сплавляемым с железом (Мп, Ni, Mo, W, V, Со); они дают соответственно марганцовую сталь, никелевую сталь и т. д.
Различные сорта стали отличаются твердостью, упругостью, прочностью, или устойчивостью к растяжению, и используются для различных целей.
Найдите различные легирующие компоненты сталей (Cr, Мп, Ni, Mo, W, V, Со) в таблице периодической системы.
Где располагаются эти переходные элементы в таблице периодической системы?
• Вблизи железа -> 24
• Вдали от железа -» 56
• В левой части таблицы периодической системы -> 18
• В правой части таблицы периодической системы -> 35
46. В выбранном вами наборе только золото является благородным металлом, а медь и ртуть нет.
Вернитесь к рубрике 34.
47. Правильно. Водород, растворенный в катализаторе, активирован и обладает большей реакционной способностью. Он легче вступает в реакцию с гидрируемым соединением.
В современной химической технологии катализаторы играют все более важную роль. Помимо уже рассмотренных выше металлов, в качестве катализаторов для синтеза различных соединений используются также Си, Ag, Ti, Cr, Mo, W, Мп и Co.
Определите, к каким группам периодической системы принадлежат эти металлы.
К какой группе принадлежит большая часть указанных элементов?
• К побочной подгруппе 1 -» 73
• К побочной подгруппе 2 -» 78
120
Программа 5
• к побочной подгруппе 3 —► 38
• к побочной подгруппе 4 —► 31
• к побочной подгруппе 5 —► 58
• к побочной подгруппе 6 —► 83
• к побочной подгруппе 7 —► 68
3 • к побочной подгруппе 8 —► 63
48. HgO оксид ртути (II)
WO3 оксид вольфрама (VI)
СгО3 оксид хрома (VI)
Хром находится в побочной подгруппе 6. Следовательно, он может быть шестивалентным, хотя известны также соединения, в которых хром трехвалентен.
Марганец находится в побочной подгруппе' 7. Следовательно, он может быть семивалентным, хотя известны также соединения, в которых марганец двух- и четырехвалентен.
Если металл способен иметь в своих соединениях различные валентности, то обычно он проявляет свои низшие валентности, входя в соединения в форме катиона, например
Сг3 +
Мп2 +
Высшие валентности металлов проявляются, когда они входят в состав анионов, например
СгО2-
Мпо;
Запишите формулы и названия солей, содержащих следующие ионы:
Сг3 +
Мп2 +
СгО* 1 2- 3
Мпо;
где в роли противоиона в первых двух случаях выступает сульфат-ион SO^-, а в последних двух случаях-Na+ .
Проверьте ответ в рубрике 59.
49. Переходные элементы встречаются в природе главным образом в трех формах:
1. В свободном (несвязанном) виде.
2. В виде оксидов.
3. В виде сульфидов.
В свободном виде встречаются: серебро, золото и платина
В виде оксидов встречаются:
медь, титан, хром, уран, марганец и железо
В виде сульфидов встречаются: медь, серебро, цинк, ртуть и железо Было бы слишком сложно подробно описывать все переходные элементы. Мы указали здесь только распространенные формы наиболее важных переходных металлов.
Ниже приведены пять наборов переходных металлов по четыре металла
Переходные элементы
121
в каждом наборе. Выберите такой набор, в котором два металла встречаются в природе в, свободном состоянии, а два других металла встречаются как в виде сульфидов, так и в виде оксидов.
• Си, Ti, Ag, Pt -► 57
• Си, Ag, Fe, Au -» 28
• Au, Pt, Mn, Fe -» 64
• U, Zn, Ag, Ti -» 69
• Pt, Си, Cr, Ag 74
50. Можно восстановить оксид цинка коксом до свободного металла, а затем растворить полученный металл в кислоте. Однако это слишком обременительно. Оксид цинка сам растворяется в разбавленной серной кислоте. Завершите уравнение этой реакции
ZnO + H2SO4 -» ...
Проверьте ответ в рубрике 42.
51. Правильно. Оксид цинка используется в качестве белого пигмента (цинковые белила).
Сульфид цинка тоже имеет белый цвет, но он не используется как пигмент.
Сульфид кадмия является распространенным желтым пигментом, он известен под названием желтый кадмий. Его можно осадить из раствора какой-либо соли кадмия добавлением сероводорода.
На основании этих сведений выведите формулу желтого кадмия.
Проверьте ответ в рубрике 40.
52. Хотя хром и никель используются для нанесения защитных покрытий на другие металлы, они не относятся к благородным металлам. В выбранном вами наборе только платина является благородным металлом.
Вернитесь к рубрике 34.
53. Обработка вещества, подлежащего гидрированию, одним только -водородом не приводит к протеканию реакции. Гидрирование начинается лишь при добавлении в реакционную смесь тонкоизмельченного металлического катализатора. По-видимому, гидрированию подвергаются лишь молекулы, находящиеся поблизости от катализатора. Таким образом, налицо различие в реакционной способности чистого водорода и водорода, растворенного в металле.
Металлический катализатор повышает реакционную способность водорода. Переходите к чтению рубрики 47.
54. Задача заключалась в том, чтобы найти среди перечисленных элементов тот, который не принадлежит к переходным. Однако кобальт является элементом побочной группы 8 и, следовательно, принадлежит к переходным элементам. Чтобы правильно ответить на вопрос, поставленный в рубрике 66, надо установить положение каждого из перечисленных элементов в периодической системе.
1’2
Программа 5
5
55. Fe2O3 + С - 2Fe + ЗСО
Это, несомненно, одна из важнейших реакций восстановления. Она подробно описана в программе 25 первой части данного учебника.
Аналогичный способ используется для получения цинка восстановлением оксида цинка коксом.
Запишите уравнение последней реакции.
Проверьте ответ в рубрике 75.
56. Найдите в таблице периодической системы положение каждого из элементов, которые могут образовывать сплавы с железом. Вы уже выписывали эти элементы в свою тетрадь.
После этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 45.
57. Серебро Ag и платина Pt встречаются в свободном состоянии. Медь Си встречается как в виде оксида, так и в виде сульфида, но титан Ti встречается только в виде оксида.
Вернитесь к рубрике 49 и выберите строку, в которой указаны два благородных металла и два других металла, встречающиеся в природе как в виде оксидов, так и в виде сульфидов.
58. Неправильно. Ни один из перечисленных металлов не относится к подгруппе 5Б.
Определите положение каждого названного элемента в периодической системе, а после этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 47.
59. Проверьте ответ и исправьте ошибки, если вы их сделали:
Cr2(SO4)3 сульфат хрома(Ш)
MnSO4 сульфат марганца(П)
Na2CrO4 хромат натрия
NaMnO4 перманганат натрия
Хромат натрия является солью хромовой кислоты.
Перманганат натрия является солью марганцовой кислоты.
Вы убедитесь в аналогии с типическими элементами, сравнивая названные выше соединения со следующими соединениями серы (группа 6) и хлора (группа 7):
Na2SO4 сульфат натрия
NaClO4 перхлорат натрия
Сульфат натрия является солью серной кислоты.
Перхлорат натрия является солью хлорной кислоты.
Запишите теперь формулы хромовой кислоты и марганцовой кислоты.
Проверьте ответ в рубрике 85.
Переходные элементы
12,1
60. Ваш ответ правилен лишь отчасти. Главная цель нанесения покрытий состоит в том, чтобы защитить покрываемый металл (чаще всего железо) от воздействия воды и кислорода воздуха.
Переходите к рубрике 82.
61. 3MnO2 + 4А1 - ЗМп + 2А12О3
Продуктами этой реакции являются марганец и оксид алюминия.
Данная реакция используется в термическом, или алюмотермическом, процессе, который мы уже обсуждали в программе 28 первой части учебника.
Таким образом, мы познакомились со следующими реакциями:
1) восстановление коксом -»Fe, Zn
2) восстановление водородом -»W, Мо
3) восстановление алюминием, натрием или кальцием -»Мп, Сг
Четвертый метод получения металлов основан на электролизе растворов солей. Например, медь и серебро очищают электролитическим методом. Неочищенный металл растворяют в какой-нибудь кислоте и полученный таким образом раствор соли подвергают электролизу. Цинк тоже во многих случаях получают электролизом раствора его соли.
Как можно получить раствор соли цинка из оксида цинка?
• Обработкой оксида цинка разбавленной серной кислотой -► 42
• Восстановлением оксида цинка коксом и затем
растворением металла в серной кислоте -► 72
• Не знаю -► 50
5
62. Проверьте ответ:
TiCl4 + О2 - TiO2 + 2С12
Мы познакомились с двумя белыми пигментами, для получения которых применяются цинк или титан.
Какое из соединений цинка представляет собой белый пигмент?
• Оксид цинка -» 51
• Сульфид цинка -» 43
63. Неправильно. Из упомянутых металлов только кобальт находится
в подгруппе 8Б. Существует другая побочная подгруппа, к которой принадлежат сразу три металла.
Определите положение каждого названного элемента в периодической системе, после чего попытайтесь еще раз ответить на вопрос, поставленный в рубрике 47.
64. Золото Au и платина Pt встречаются в природе в свободном состоянии. Железо Fe встречается как в виде оксида, так и в виде сульфида, но марганец Мп-только в виде оксида.
Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 49.
124
Программа 5
65. Катализаторы гидрирования: Ni, Pd, Pt
Катализаторы окисления: Pt, V2O5
Для придания активности катализаторам гидрирования их приходится очень сильно измельчать. Такие тонкоизмельченные металлы имеют
5
специальные названия, например в случае
никеля - никель Ренея (скелетный никель)
палладия-палладиевая чернь
платины-платиновая чернь
Растворимость водорода в палладии характеризуется такими данными: твердый палладий способен растворить 600-кратный объем водорода Н2, а тонкоизмельченный палладий растворяет 1200-кратный объем водорода.
На практике гидрирование осуществляется добавлением катализатора к раствору гидрируемого соединения, после чего такую смесь обрабатывают газообразным водородом, обычно под давлением. Часть водорода растворяется в катализаторе, из которого он переносится в гидрируемое соединение в ходе реакции.
К какому выводу можно прийти на основании этих сведений?
• Водород растворенный в катализаторе, обладает большей реакционной способностью, чем газообразный водород -> 4П
• Нет никакого различия между реакционной способностью газообразного водорода и водорода, растворенного в катализаторе -» 53
66. Ni, Сг, Zn и Cd используются для нанесения защитных покрытий.
Сплавы получают при добавлении различных металлов или неметаллов к расплаву другого металла.
Добавление в сплав различных присадок или легирующих добавок изменяет свойства чистого металла.
Железо, которое используется в больших количествах в различных конструкционных материалах, не является чистым металлом. В форме стали оно содержит по меньшей мере 0,5% углерода. Хрупкий чугун может содержать до 4% углерода.
Свойства стали значительно изменяются при добавлении хрома, кремния, марганца, никеля, молибдена, вольфрама, ванадия или кобальта. Запомните эти легирующие добавки и запишите их химические символы.
Один из перечисленных выше элементов не принадлежит к переходным металлам. Какой это элемент?
• Сг - 84
• Si - 45
• Мп - 77
• W - 32
• Ni 4 39
• Со - 54
67. Ангидрид хромовой кислоты имеет формулу СгО3.
Ангидрид марганцовой кислоты имеет формулу Мп2О7 Вы уже знакомы с оксидами этих двух металлов.
Подведем итог сказанному выше.
Переходные элементы
125
S сера главная подгруппа 6 Na2SO4 сульфат натрия
Сг хром побочная подгруппа 6 Na2CrO4 хромат .натрия
С1 хлор главная подгруппа 7 NaClO4 перхлорат натрия
Мп марганец побочная подгруппа 7 NaMnO4 перманганат натрия
Как видно, важные соединения переходных металлов имеют состав, сходный с составом соединений типических элементов из группы с тем же номером.
Найдите в таблице периодической системы элементы вольфрам W и ванадий V (воспользуйтесь для этого табл. 4 в конце программы 7). Запишите формулы кислородсодержащих кислот этих элементов, а затем формулы вольфрамата натрия и ванадата натрия.
Проверьте ответ в рубрике 76.
5
68. Неправильно. Только один из перечисленных металлов-марганец -находится в подгруппе 7Б. Существует другая побочная подгруппа, к которой принадлежат сразу три металла. Определите положение каждого названного элемента в периодической системе, а после этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 47.
69. Серебро Ag встречается в природе в свободном состоянии, а уран U и титан Ti-только в виде оксидов, тогда как цинк Zn встречается главным образом в виде сульфида.
Вернитесь к рубрике 49 и выберите строку, в которой указаны два благородных металла и два других металла, встречающиеся как в виде оксидов, так и в виде сульфидов.
70. Проверьте ответы:
Свойства Применения
Hg: жидкость при комнатной температуре термометры, манометры
W: высокая температура плавления нити накаливания в электролампах
Pt: благородный металл, высокая механическая прочность тигли, лабораторное оборудование
Ti: легкий металл авиастроение
Си: хорошая электропроводность электроника, средства связи
Ti и Ni: устойчивость к растворам кислот и оснований химическое машиностроение
U: радиоактивный распад атомные реакторы
Рассмотрим теперь применение различных переходных металлов для изготовления защитных покрытий.
Покрытия из цинка, кадмия, хрома и никеля предохраняют металл (главным образом железо) от коррозии.
Для нанесения защитного покрытия из цинка предмет просто погружают в расплавленный цинк. Кадмиевые покрытия наносят таким же способом. Оцинкованные листы железа используют, например, для изготовления водосточных труб и желобов. На покрытый кадмием металл может быть нанесен методом электролитического осаждения еще слой хрома, что позволяет
126
Программа 5
создать особенно устойчивое защитное покрытие. Электролитическим методом наносят и никелевые покрытия. Покрытые никелем предметы имеют специфический блеск.
Почему железные предметы покрывают цинком, кадмием, хромом или никелем?
О
• Чтобы защитить железо от кислорода и воды -► 82
• Чтобы придать железным предметам блеск -» 60
71. 2Zn + О2 -» 2ZnO
ZnO оксид цинка.
Другой белый пигмент все возрастающего значения-это диоксид титана. Краски, содержащие диоксид титана, обладают особенной яркой белизной. TiO2 можно получать двумя способами, более современный из которых заключается в сжигании тетрахлорида титана.
Запишите уравнение горения тетрахлорида титана. (Примечание: одним из продуктов этой реакции является хлор.)
Проверьте ответ в рубрике 62.
72. Восстановить оксид цинка до свободного металла углеродом, а затем растворить полученный металл в кислоте, конечно, можно, но это слишком обременительно. Оксид цинка сам растворяется в разбавленной серной кислоте. Завершите уравнение этой реакции:
ZnO + H2SO4 -» ...
Проверьте ответ в рубрике 42.
73. К подгруппе 1Б относятся только два из указанных металлов: медь Си и серебро Ag. Существует другая побочная подгруппа, к которой принадлежат сразу три металла. Определите положение каждого названного элемента в периодической системе, а после этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 47.
74. Платина Pt и серебро Ag встречаются в природе в свободном состоянии. Медь Си встречается как в виде оксида, так и в виде сульфида, но хром Сг-только в виде оксида.
Вернитесь к рубрике 49 и выберите строку, в которой указаны два благородных металла и два других металла, встречающиеся как в виде оксидов, так и в виде сульфидов.
75. ZnO С —* Zn + СО
Эта реакция проводится в шахтной печи при температуре выше температуры плавления цинка (908°С). Образующийся при таких условиях расплавленный цинк постепенно стекает вниз и, проходя через систему охлаждения, собирается в приемнике.
Хотя железо и цинк получают восстановлением углеродом, для этого требуются совершенно разные промышленные установки.
Восстановление оксида коксом - наиболее экономичный из всех упомянутых выше способов восстановления.
Переходные мем
Перечислите четыре метода восстановления металлов из их оксидов. Представьте ответ в следующей форме:
1. Восстановление оксида коксом.
2. Восстановление оксида ....
3. Восстановление оксида ....
4. Электролиз .....
Проверьте ответ в рубрике 81.
5
76. Вольфрамовая кислота: H2WO4, вольфрамат натрия: Na2WO4.
Ванадиевая кислота: H3VO4, ванадат натрия: Na3VO4.
Вольфрам и ванадий находятся в побочных подгруппах 6 и 5 соответственно.
Аналогичными соединениями соответствующих элементов главных подгрупп являются
серная кислота: H2SO4, сульфат натрия: Na2SO4.
фосфорная кислота: Н3РО4, фосфат натрия: Na3PO4.
Некоторые из элементов побочной подгруппы 1 могут иметь валентности, превышающие номер группы. В качестве примеров приведем медь и золото
Типичными соединениями этих элементов являются
CuSO4 и АиС13
Какие валентности имеют медь и золото в этих соединениях?
Си ...валентна.
Аи ...валентно.
Проверьте ответ в рубрике 23.
77. Задача заключалась в том, чтобы найти среди перечисленных элементов тот, который не принадлежит к переходным. Однако марганец является элементом побочной группы 7 и, следовательно, принадлежит к переходным элементам. Чтобы правильно ответить на вопрос, поставленный в рубрике 66, нужно установить положение каждого из перечисленных там элементов в периодической системе.
78. Неправильно. Ни один из перечисленных металлов не относится к подгруппе 2Б.
Определите положение каждого названного элемента в периодической системе, а после этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 47.
79. Реакция
Ангидрид + Вода -» Кислота
представляет собой один из способов получения кислот.
Чтобы получить формулу ангидрида из формулы соответствующей кислоты, достаточно просто вычесть из последней формулу воды, например
H2SO4 - Н2О - SO3
128
Программа 5
Таким образом, SO3 является ангидридом серной кислоты.
Если кислота содержит только один атом водорода, нужно вычесть формулу воды из удвоенной формулы кислоты, например
2НС1О4 = Н2С12О8
Н2С12О8 - Н2О - С12О7
Таким образом, ангидрид хлорной кислоты имеет формулу С12О7
Запишите формулы ангидридов
хромовой кислоты Н2СгО4
марганцовой кислоты НМпО4
Проверьте ответ в рубрике 67.
80. а) Металл, используемый для изготовления нитей накаливания в электролампах: W.
б) Металл, используемый для изготовления термометров: Hg.
в) Металл, используемый в ядерных реакторах: U.
г) Металлы, используемые в электронике: Ag, Си.
д) Металлы, используемые в химическом машиностроении: Ti, Ni.
Ниже указаны некоторые свойства и области применения различных переходных элементов.
Дополните недостающие данные:
Свойства Применение
Ag: хорошая электропроводность Hg: жидкость при комнатной температуре электроника и средства связи
W Pt благородный металл, высокая механическая прочность Ti нити накаливания в электролампах авиастроение
Си Ti и Ni устойчивость к растворам кислот и оснований радиоактивный распад электроника и средства связи атомные реакторы
Проверьте ответы в рубрике 70.
81. Проверьте ответ:
1. Восстановление оксида коксом, или углеродом.
2. Восстановление оксида водородом.
3. Восстановление оксида другим металлом.
4. Электролиз раствора соли.
Во втором методе - восстановление оксида водородом-газообразный водород пропускают через нагреваемые трубки, содержащие оксид.
Восстановление водородом может быть в принципе применено к оксидам почти всех металлов. Однако на практике оно используется только в тех случаях, когда не существует другого, более экономичного, метода.
В качестве примера приведем вольфрам и молибден.
Запишите уравнения реакций МоО3 и WO3 с водородом.
Проверьте ответ в рубрике 9.
11ерем> inuc uiwin ы
129
82. Правильно. Защитные покрытия предохраняют железо от коррозии. Механические свойства железа остаются при этом неизменными.
Укажите, какие из следующих металлов используются для нанесения защитных покрытий:
W, Ni, Си, Сг, Zn, Ti, Cd, Со
Таких металлов всего четыре. Запишите их химические символы.
Проверьте ответ в рубрике 66.
83. Правильно. Из указанных элементов три находятся в побочной подгруппе 6. Это Сг, Мп и W.
Учитывая, что мы уже описали большинство элементов группы 8Б и выбрали только самые важные катализаторы, можно понять, что почти все переходные элементы в четвертом, пятом и шестом периодах находят применение в качестве катализаторов.
В заключение остановимся на использовании соединений некоторых переходных металлов в качестве пигментов.
Пигменты применяют для изготовления красок, а также для окрашивания синтетических материалов, бетона и штукатурки.
Оксид цинка является распространенным белым пигментом и используется для изготовления белой краски-цинковых белил. Пигмент ZnO получают сжиганием паров цинка. Запишите уравнение реакции получения оксида цинка.
Проверьте отвез в рубрике 71.
84. Задача заключалась в том, чтобы найти среди перечисленных элементов тот, который не принадлежит к переходным. Однако хром является элементом побочной подгруппы 6Б. Чтобы правильно ответить на вопрос, поставленный в рубрике 66, нужно установить положение каждого из перечисленных там элементов в периодической системе.
85. Хромовая кислота: Н2СгО4
Марганцовая кислота: НМпО4
Запишите теперь формулы ангидридов этих кислот.
Проверьте ответ в рубрике 67.
Если вы затрудняетесь записать эти формулы, обратитесь за разъяснениями в рубрику 79.
9-29
Программа 6
Электрохимический ряд
1. В предыдущих программах мы познакомились со строением атомов, природой химической связи, химическим равновесием и периодической системой элементов.
В данной программе мы обсудим законы окисления
и восстановления-процессов, которые можно понять на основе рассмотрения электрохимического ряда.
Элементы и ионы располагаются в электрохимический ряд согласно их окислительному потенциалу.
Процессы окисления и восстановления неизменно связаны друг с другом.
Приведем в качестве примера такую реакцию:
Fe2O3 + ЗС -> 2Fe + ЗСО
Что окисляется в этой реакции?
• Fe2O3 -> 12
• С >17
2. Вы немного поторопились с ответом. Иод приводился только в тех примерах, где реакция не идет.
Прочтите еще раз внимательно рубрику 21.
3. Эта реакция возможна:
Си + HgCl2 -> Hg + СиС12
Если погрузить в раствор HgCl2 полоску меди, она покрывается пленкой амальгамы меди. Одновременно с этим часть меди будет переходить в раствор.
Где располагаются Си и Hg2+ в электрохимическом ряду?
Нетрудно видезъ, что Си располагается на три строки выше Hg2 +, а значит, Си может восстанавливать Hg2 +. Другими словами, Hg2 + способен окислять Си.
Прочтите еще раз рубрику 10 и, прежде чем снова ответить на поставленный там вопрос, определите положение каждого металла и каждого катиона в электрохимическом ряду.
4. Из четырех указанных металлов алюминий располагается сразу же под магнием в ряду уменьшения восстановительной способности. Оба этих металла являются довольно хорошими восстановителями, т.е. легко отдают свои электроны.
Прочтите рубрику 24 еще раз.
5. Хлор окисляет бромид-ионы до молекулярного брома
2Вг“ + С12 -> Вг2 + 2СГ
Бромид-ионы отдают электроны и, следовательно, окисляются.
Аналогичным образом происходит реакция между иодидом натрия
и бромом
2NaI + Вг2
I2 + 2NaBr
Электрохимический ряд
131
Чтобы нагляднее представить перенос электронов в этой реакции, перепишем ее уравнение в ионном виде:
2Na+ + 21 + Br2 -> I2 + 2Na+ + 2Вг“
Два иона натрия Na+ остаются в реакции неизменными. Каждый из двух отрицательно заряженных иодид-ионов отдает по электрону, в результате чего образуется молекулярный иод
21“ -> 12 + 2е“
Молекулярный бром Вг2 присоединяет два электрона, в результате чего образуются два бромид-иона
Вг2 + 2е - 2Вг -
Какую роль играет Вг2 в этой реакции?
• Является окислителем -> 21
• Является восстановителем -> 30
6. Реакция
Нитрат серебра + Хлорид натрия = Нитрат натрия + Хлорид серебра
не является окислительно-восстановительной реакцией, потому что в ней не происходит изменения валентностей ни одного из участвующих элементов.
Попытайтесь еще раз ответить на вопрос об окислительно-восстановительной реакции, поставленный в рубрике 17.
7. Неправильно. Воспользуйтесь табл. 5 в конце программы 7 и определите в помещенном там электрохимическом ряду положения Al, Ag + , Zn2 + и Си.
После этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 61. Проверьте ответ:
н2 2Н + + 2е" + 0,00 В (вольт)
21- ~7~> 12 + 2е" + 0,53 В
2Вг Вг2 + 2е" + 1,06 В
2СГ С12 + 2е- + 1,36 В
2F F2 + 2е" + 2,65 В
Кроме водорода и хлора, все остальные из этих неметаллов уже рассматривались в данной программе.
Упоминавшийся ранее факт, что хлор-более сильный окислитель, чем бром, а бром-более сильный окислитель, чем иод, отражает положение этих элементов в электрохимическом ряду.
Какой из четырех галогенов является самым сильным окислителем. Запишите его.
Проверьте ответ в рубрике 56.
9. Неправильно. В электрохимическом ряду, который помещен в табл. 5 из программы 7, вы найдете, что
Zn & Zn2 + + 2е “ - 0,76 В
Си Си2 + + 2е" + 0,34 В
9*
Программа 6
t.12
Следовательно, цинк может восстанавливать Си2 +, но Си не может восстанавливать Zn2 +.
Проведите такое же рассмотрение для А1 и Ag + и после этого попытайтесь еще раз ответить на вопрос, поставленный в рубрике 61.
10. Нормальный окислительно-восстановительный потенциал водорода равен 0 В.
Элементы, стоящие в электрохимическом ряду выше водорода, имеют отрицательный окислительно-восстановительный потенциал, а элементы, расположенные в этом ряду ниже водорода, имеют положительный потенциал.
Электрохимический ряд позволяет предсказывать, возможно ли протекание конкретной окислительно-восстановительной реакции.
Для элементов, расположенных в электрохимическом ряду ниже водорода, справедливо следующее утверждение.
Любой элемент или анион, стоящий в левой части уравнения окислительно-восстановительной реакции, будет восстанавливать катион или элемент, стоящий в правой части уравнения, при условии, что последний расположен в электрохимическом ряду ниже первого.
Мы уже знакомы со следующими примерами:
1. 2NaBr + С12 -> 2NaCl + Вг2
где бромид-ион Вг“ расположен в электрохимическом ряду на две строчки выше С12.
В данном случае бромид-ион способен восстанавливать хлор до хлорид-иона, другими словами, хлор окисляет бромид-ион до брома.
2. 2NaI + Вг2 -> 2NaBr + 12
где I- располагается в электрохимическом ряду на три строки выше Вг2.
Рассмотрим теперь три следующих уравнения:
1. Си + 2AgNO3 ->• 2Ag + Cu(NO3)2
2. Си + HgCI2 - Hg + СиС12
3. Hg + 2AgNO3 -> 2Ag + Hg(NO3)2
Определите положение металлов и катионов, входящих в каждое уравнение, в электрохимическом ряду и на основании этого решите, возможна ли соответствующая реакция. Одна из трех приведенных реакций невозможна. Какая это реакция?
• Реакция 1 не может протекать -> 58
• Реакция 2 не может протекать -> 3
• Реакция 3 не может протекать -> 61
11. Хотя бром окисляет иодид-ион, он не способен окислять другие галогенид-ионы и, следовательно, не может быть самым сильным окислителем.
Прочтите еще раз внимательно рубрику 21.
12. Нет. Вопрос заключался в том, какой элемент окисляется в реакции Fe2O3 + ЗС -> 2Fe -1- ЗСО
Дальнейшего окисления Fe2O3 здесь не происходит, а реакция С -> СО представляет собой ....
Завершите это предложение и проверьте ответ в рубрике 17.
Электрохимический ряд
1Л’
13. Правильно. Возможна только реакция 1:
Al + 3AgNO3 -> 3Ag + A1(NO3)3
Запишите наиболее существенную часть этой реакции в ионной форме, чтобы нагляднее представить перенос электронов от алюминия к серебру.
Проверьте ответ в рубрике 22.
14. Правильно. Восстановитель отдает электроны.
Различные окислители неодинаковы по своей окисляющей способности, как это можно видеть на примере галогенов.
Рассмотрим сначала реакцию
2NaBr + С12 -> 2NaCl + Вг2
Когда хлор добавляют к раствору бромида натрия, раствор становится коричневым из-за образования молекулярного брома.
В этой реакции бромид-ионы превращаются в молекулярный бром
2Вг~ ->• Вг2 + 2е~
а молекулярный хлор превращается в хлорид-ионы
С12 + 2е“ - 2СГ
В целом весь процесс описывается уравнением
2Вг“ + С12 -> Вг2 + 2С1“
Завершите следующее предложение.
Бромид-ионы ... (окисляются/восстанавливаются) до брома под действием хлора.
Проверьте ответ в рубрике 5.
15. Неправильно. Рассмотрим подробнее нормальные потенциалы участников этих реакций.
Mg -> Mg2 + + 2е" — 2,34 В
2С1' С12 + 2е - + 1,36 В
Следовательно, магний расположен в электрохимическом ряду выше хлора. Магний может отдавать электроны, которые будет присоединять хлор. Магний восстанавливает С12 до 2С1 ~.
Рассмотрим теперь нормальные потенциалы главных участников реакции 2:
Fe -> Fe2 + + 2е ~ — 0,44 В
Н2 - 2Н+ + 2е~ ±0,00 В
С учетом этого ответьте, будет ли происходить реакция
Fe + H2SO4 -> FeSO4 + Н2
• Да >39
• Нет -> 25
134
Программа 6
16. Железо имеет не самый низкий восстановительный потенциал среди четырех указанных металлов. Сильные восстановители легко теряют свои электроны, а слабые-не столь легко.
Вернитесь к рубрике 24 и внимательно прочтите ее еще раз.
17. Правильно. В реакции
Fe2O3 + ЗС -> 2Fe + ЗСО происходит окисление С до СО.
Одновременно с этим происходит восстановление Fe2O3 до Fe.
Восстановление и окисление-неразрывно связанные друг с другом процессы.
Это обстоятельство находит отражение в понятии окислительно-восстановительный процесс.
Примером окислительно-восстановительного процесса является рассмотренная нами реакция
Fe2O3 + ЗС - 2Fe + ЗСО
Какая из трех записанных ниже реакций представляет собой окислительно-восстановительную реакцию?
1. 2NaOH + H2SO4 -> Na2SO4 + 2Н2О
2. AgNO3 + NaCl -<• NaNO3 + AgCl
3. CuO + H2 -> Cu + H2O
Окислительно-восстановительная реакция соответствует
• Уравнению 1 -> 32
• Уравнению 2 -> 6
• Уравнению 3 -» 26
18. Самым сильным восстановителем является литий.
Самым сильным окислителем является фтор.
Таким образом, самый сильный восстановитель принадлежит к металлам. Самый сильный окислитель относится к неметаллам.
Какие неметаллы содержатся в электрохимическом ряду? Запишите уравнения окислительно-восстановительного равновесия и нормальные потенциалы для этих элементов.
Проверьте ответ в рубрике 8.
19. Нет. Реакция между Си и H2SO4 невозможна. Медь расположена в электрохимическом ряду ниже водорода, поэтому она не может восстанавливать Н+.
А что можно сказать по поводу реакции 1 между цинком и серной кислотой? Возможна ли эта реакция?
Вернитесь к рубрике 57.
20. Нет. Восстановителем является то вещество, которое вызывает восстановление другого вещества. Восстановитель отдает электроны и сам окисляется в этом процессе. Окислитель присоединяет электроны и таким образом восстанавливается.
Переходите к рубрике 14.
Электрохимический ряд
135
21. Правильно. В данном случае Вг2 действует как окислитель.
Бром присоединяет электроны, которые отдают иодид-ионы. Иодид-ионы окисляются до молекулярного иода бромом.
Хлор тоже способен окислять иодид-ионы до иода. Ниже приведены всевозможные комбинации галогенидных ионов со свободными галогенами (за исключением фтора), и в каждом случае указано, протекает ли соответствующая
реакция или нет.
NaCl +Вг2 реакция не идет
NaCl + 12 реакция не идет
NaBr + С12 реакция идет
NaBr + 12 реакция не идет
Nal + С12 реакция идет
Nal + Вг2 реакция идет
Основываясь на этих данных, ответьте на следующий вопрос.
Какой из указанных галогенов является наиболее сильным окислителем?
• Иод -» 2
• Бром -> 11
• Хлор -> 31
22. Al + 3Ag + - А13+ + 3Ag
Алюминий значительно более сильный восстановитель, чем серебро. Электроны переходят от алюминия к иону серебра и в результате образуется металлическое серебро.
Рассмотрим теперь следующие реакции:
1 . Mg + С12 -> MgCl2
2 . Fe + H2SO4 -> FeSO4 + H2
Какая из этих двух реакций может осуществляться?
• Ни одна из них -» 15
• Реакция 1 -> 33
• Реакция 2 -> 43
• Обе реакции -> 39
23. Неправильно. Восстановитель сам должен окисляться в реакции. Однако МпО2 в данном случае восстанавливается.
Вернитесь к рубрике 36.
24. Правильно. Уравнение протекающей при этом реакции имеет вид
Zn + 2Ag+ -> Zn2 + + 2Ag
Цинк является более сильным восстановителем, чем медь или серебро. Ниже приведен более длинный ряд металлов в порядке уменьшения их восстановительной способности.
136
Ilpoi |>;пгаа 6
Na
Mg
Al В этом ряду натрий является самым
Zn сильным восстановителем, а серебро-самым
Fe слабым восстановителем
РЬ
Си
Ag
Рассмотрим теперь только четыре элемента из данного ряда: Pb, Al, Fe и Mg. Какой из них обладает наименьшей способностью отдавать электроны? • Fe ^16
• Al -> 4
• Pb -> 35
• Mg -> 48
25. Очевидно, вы недостаточно разобрались в применении электрохимического ряда. Вам следует еще раз проработать материал, начиная с рубрики 46.
26. Правильно, уравнение
СиО + Н2 - Си + Н2О
описывает окислительно-восстановительную реакцию, в которой СиО восстанавливается, а Н2 окисляется.
Поскольку водород вызывает восстановление, он считается восстановителем. Восстановительный процесс, который он вызывает, таков:
СиО ->• Си
Одновременно с этим Н2 окисляется до Н2О
Н2 - Н2О
В любой окислительно-восстановительной реакции среди исходных веществ обязательно присутствуют восстановитель и окислитель.
Что является окислителем в реакции
Си + Н2 -> Си + Н2О?
Проверьте ответ в рубрике 36.
27. Неправильно. Реакция 1 между Zn и H2SO4 возможна.
Цинк расположен в электрохимическом ряду выше водорода, следовательно, он может восстанавливать 2Н + до Н2.
А что можно сказать по поводу реакции 2 между Си и H2SO4? Возможна ли эта реакция?
Вернитесь к рубрике 57.
28. Ниже водорода в электрохимическом ряду расположены следующие металлы:
медь, серебро, ртуть, платина и золото
Ни один из них не реагирует с серной кислотой, поскольку они не способны восстанавливать ионы Н +.
) ici. i |><)\нмн>1сс1<И|1 ри.1
IГ
Как вы уже знаете, часть из этих элементов принадлежит к благородным металлам. Чтобы растворить любой из указанных пяти металлов, нужно воспользоваться кислотами, являющимися сильными окислителями, или смесями таких кислот. В этом случае окислителем является не Н+, а другие ионы или молекулы.
В качестве примера можно привести реакцию между серебром и азотной кислотой:
Ag + 2HNO3 -> AgNO3 + Н2О + NO2
В этой реакции образуются не только нитрат серебра, но также Н2О и диоксид азота.
Окислительно-восстановительные реакции рассматриваются более подробно в программе 7.
Конец программы 6.
29. Правильно. В реакции
2 Na + С12 —» 2 Na+ + 2 СГ
2 NaCl
окисляется натрий.
В этой реакции происходит перенос электрона от атомов натрия к атомам хлора, в результате чего образуются два отрицательных хлорид-иона и, следовательно, два положительно заряженных иона натрия.
Окислителем в этой реакции является хлор. Он присоединяет электроны, которые отдает натрий.
Какое из следующих утверждений является правильным?
• Восстановитель присоединяет электроны ->• 20
• Восстановитель отдает электроны -> 14
30. Нет. Молекулярный бром Вг2 присоединяет в этой реакции два электрона. Следовательно, он восстанавливается. Окислитель сам всегда восстанавливается в реакции.
Следовательно, в реакции
2NaI + Вг2 —» I2 + 2NaBr
бром является (окислителем или восстановителем?) ....
Завершите это предложение и проверьте ответ в рубрике 21.
31. Из трех галогенов-С12, Вг2 и 12-хлор является самым сильным окислителем.
Хлор окисляет бромид- и иодид-ионы.
Бром окисляет только иодид-ион.
(Следовательно, иод не окисляет ни хлорид-ион, ни бромид-ион).
Другими словами, бром является более сильным окислителем, чем иод, а хлор-более сильным окислителем, чем бром. Хлор-самый сильный окислитель из этих трех галогенов.
Последовательность уменьшения окислительной способности (иначе,
I3N
Программа 6
окислительных потенциалов) галогенов такова:
F;
С12
Вг2
12
6
Она соответствует порядку расположения этих элементов в периодической системе.
Окислительно-восстановительные реакции могут протекать также между металлами и ионами металлов.
Если, например, поместить цинковый стержень в раствор сульфата меди, то ионы цинка переходят в раствор, ионы меди разряжаются и выделяется металлическая медь
Zn + Си2 + ->• Zn2 + + Си
Для большей ясности этот процесс можно представить в виде двух стадий:
Zn -> Zn2 + + 2е “ цинк отдает электроны
Си2 + + 2е" -» Си ионы меди присоединяют электроны
Что происходит в этой реакции с ионами Си2 +
• Си2 + восстанавливается -> 45
• Си2 + окисляется ->• 38
32. Реакция
Гидроксид натрия + Серная кислота = Сульфат натрия + Вода представляет собой реакцию нейтрализации, а не окислительно-восстановительную реакцию.
Попытайтесь еще раз ответить на вопрос об окислительно восстановительной реакции, поставленный в рубрике 17.
33. Ваш ответ правилен лишь отчасти: реакция 1-восстановление хлора магнием-возможна, но возможна также и реакция 2. Сравните нормальные потенциалы
Fe -» Fe2 + + 2е " — 0,44 В
Н2 - 2Н + + 2е - ± 0,00 В
Поскольку железо стоит в электрохимическом ряду выше водорода, оно может восстанавливать Н +.
Запишите уравнения реакций 1 и 2 в ионной форме.
Проверьте ответ в рубрике 57.
34. Нет. Ион Na + не окисляется. Повторите определение окисления
и восстановления, а потом еще раз попытайтесь ответить на вопрос, заданный в рубрике 50.
35. Правильно. Свинец РЬ имеет самый низкий восстановительный потенциал и самую меньшую способность терять электроны, образуя ионы РЬ2 +.
Уравнения окисления свинца и железа записываются так:
Электрохимический рид
I V)
Pb - Pb2+ + 2е" Fe -> Fe2 + + 2e “
Запишите аналогичные уравнения для элементов Са и Zn. Проверьте ответ в рубрике 44.
36. Окислителем в данном случае является оксид меди СиО. Он окисляет водород н2 -<• Н2О а сам в то же время восстанавливается до меди СиО -> Си Окислитель окисляет другое вещество, а сам восстанавливается. Восстановитель восстанавливает другое вещество, а сам окисляется. Приведем еще один пример окислительно-восстановительной реакции 3MnO2 + 4А1 -> ЗМп + 2А12О3 Укажите, какое вещество является восстановителем в данной реакции. • МпО2 -» 23 • А1 51 • Мп ->• 47 • А12О3 -> 42
37. На самом деле в этом случае должна происходить реакция. Как вы уже знаете, цинк восстанавливает ионы Си2 + Zn + Си2 + -> Zn2 + + Си Вы знаете также, что металлическая медь восстанавливает ионы серебра Си + 2Ag+ -> Си2 + + 2Ag Поскольку даже медь восстанавливает Ag+, цинк наверняка способен сделать это. Переходите к рубрике 24.
38. Вы не уяснили себе основную взаимосвязь между окислением и восстановлением, и поэтому не поняли, какой перенос электронов происходит в данном случае. Вернитесь к рубрике 51.
39. Правильно. Обе реакции 1 и 2 возможны. Завершите уравнения этих реакций в ионной форме 1. Mg + С12 - 2. Fe + 2Н+ + 5ОГ - Проверьте ответ в рубрике 57.
40. Нет. Окисляются атомы, молекулы или ионы, которые отдают электроны. Хлор-не такая молекула, она присоединяет электроны. Вернитесь к рубрике 50.
140
Программа 6
41. Нет. Символ е означает электрон. В полуреакции
С12 + 2е’ - 20'
хлор присоединяет два электрона, в результате чего образуются два
хлорид-иона.
м Присоединение электронов -это восстановление.
[ГД Если вам ясно это, переходите к рубрике 50.
42. Неправильно. А12О3 не является восстановителем. Восстановителем должно быть одно из исходных веществ, присутствующих в начале реакции. Какое из них является восстановителем в данном случае?
Вернитесь к рубрике 36.
43. Ваш ответ правилен лишь отчасти.
Возможны обе реакции. В табл. 5 из программы 7 вы найдете нормальные потенциалы
Mg -> Mg2 + + 2е - - 2,34 В
2С1" -> С12 + 2е“ +1,36 В
Поскольку магний располагается в электрохимическом ряду выше хлора, электроны могут переходить от Mg к С12.
Магний восстанавливает С12 до 20 “.
Завершите следующие два ионных уравнения:
1. Mg + С12 ->
2. Fe + 2Н+ + SOi ->
Проверьте ответ в рубрике 57.
44. Проверьте ответ и исправьте ошибки, если вы их сделали:
Са -» Са2 + + 2е'
Zn -» Zn2 + + 2е “
Эти два процесса являются обратимыми, и, следовательно, их уравнения должны записываться при помощи двойной стрелки:
Са <=► Са2+ + 2е~
Zn # Zn2 + + 2е "
Запишите эти уравнения в свою тетрадь.
Если реакция протекает слева направо, участвующий в ней металл действует как восстановитель.
Он отдает электроны и окисляется до катиона.
Если реакция протекает в противоположном направлении, справа налево, катион действует как окислитель.
Катион ... (присоединяет/отдает) электроны и ... (окисляется/восстанавливается) до металла.
Завершите это предложение и проверьте ответ в рубрике 55.
).1ектрохимический ряд
141
45. Правильно. Ионы меди восстанавливаются цинком
Zn + Си2 + -> Zn2 + + Си
В этом процессе происходит окисление самого цинка до ионов цинка.
Электроны, которые отдает цинк, присоединяют к себе ионы меди. Цинк сравнительно легко отдает свои электроны.
Если сравнить цинк с медью, то какой из этих элементов является более сильным восстановителем?
• Цинк -»• 59
• Медь -» 54
46. Правильно. Чем более отрицательным является нормальный
окислительно-восстановительный потенциал, тем большей восстановительной способностью обладает элемент.
Электрохимический ряд-это перечень элементов в порядке возрастания их нормального окислительно-восстановительного потенциала.
Электрохимический ряд, содержащий наиболее важные элементы, представлен в табл. 5, помещенной в конце программы 7.
В этом ряду элементы или ионы, стоящие слева от двойной стрелки, находятся в восстановленной форме, а стоящие справа от двойной стрелки-в окисленной форме. Элементы в восстановленной форме рассматриваются как восстановители, а в окисленной форме-как окислители.
Самый сильный восстановитель в этом ряду находится на самом верху слева.
Самый сильный окислитель находится в самом низу ряда справа.
Завершите предложения:
Самый сильный восстановитель: ....
Самый сильный окислитель: ....
Проверьте ответ в рубрике 18.
6
47. Неправильно. Вам следовало указать восстановитель, а им может быть только одно из исходных веществ, присутствующих в начале реакции, так что его следует искать в левой части уравнения реакции.
Вернитесь к рубрике 36.
48. Магний стоит довольно высоко в ряду уменьшения восстановительной способности металлов и, следовательно, является сильным восстановителем; он легко теряет электроны. Однако задача заключалась в том, чтобы указать элемент, который отдает электроны с наибольшим трудом.
Вернитесь к рубрике 24.
49. Возможна только реакция 1. Если вы пришли к этому ответу без колебаний, это значит, что вы хорошо разбираетесь в обсуждаемой теме. Приведем еще раз эту реакцию
Zn + H2SO4 -» ZnSO4 + Н2
или
Zn + 2Н+ -> Zn2+ + Н2
Программа 6
6
Металлический цинк окисляется до Zn2+ ионами 2Н + . Одновременно с этим два иона Н+ восстанавливаются цинком до Н2. Цинк является в данной реакции восстановителем, а Н+ окислителем.
В отличие от этого реакция 2 между медью и серной кислотой вообще не протекает.
Почему?
Медь расположена в электрохимическом ряду ниже водорода. Следовательно, она не способна восстанавливать Н +.
Выпишите все металлы, стоящие в электрохимическом ряду ниже водорода. Проверьте ответ в рубрике 28.
50. Молекула хлора присоединяет два электрона, в результате чего она превращается в два хлорид-иона. Этот процесс представляет собой восстановление.
Откуда же поступают эти электроны?
Они должны поступить от других атомов, молекул или ионов.
В реакции
Натрий + Хлор -> Хлорид натрия
атом натрия отдает электрон и в результате превращается в положительный ион
Na -> Na + + е "
Этот электрон должен перейти к хлору, что позволяет завершиться реакции
2 Na + С12 -> 2 Na+ + 2 СГ
2 NaCl
Какой участник этой реакции окисляется?
• Na -> 29
• С12 >40
• Na+ -> 34
• С1 ’ -> 60
51. Совершенно верно. Восстановителем в данном случае является А1. Он восстанавливает МпО2 до Мп, а сам окисляется до А12О3.
В реакциях, обсуждавшихся до сих пор, всегда происходило восстановление оксида свободным элементом, а этот элемент окислялся с образованием нового оксида. Но не следует думать, что кислород является неотъемлемым участником окислительно-восстановительной реакции!
Отличительной особенностью окислительно-восстановительной реакции является не перенос кислорода, а изменение валентности элементов.
Рассмотрим реакцию
3MnO2 + 4А1 -> ЗМп + £А12О3
Какие изменения валентности происходят в данном случае?
Чтобы ответить на этот вопрос, запишите сначала валентности следующих
Электрохимический ряд
143
элементов, участвующих в данной реакции:
Мп в МпО2 ... Мп(элементный)...
А1 в А12О3 ... А1 (элементный) ...
а затем изменения валентности в ходе реакции:
Мп: ... -> ...
А1: ... -> ...
Проверьте ответ в рубрике 62.
52. Неправильно. Реакция 2 невозможна. Медь расположена
в электрохимическом ряду ниже водорода, следовательно, она не может восстанавливать Н +.
А что можно сказать по поводу реакции 1 ? Возможна ли реакция между цинком и серной кислотой?
Вернитесь к рубрике 57.
53. Неправильно. Воспользуйтесь табл. 5 в конце программы 7 и определите в помещенном там электрохимическом ряду положения Al, Ag+, Zn2 + и Си.
После этого попытайтесь еще раз ответить на вопрос, поставленный
в рубрике 61.
54. Неправильно. Цинк, а не медь является более сильным восстановителем.
Если погрузить кусочек цинка в раствор какой-нибудь соли меди, он немедленно начинает восстанавливать ионы меди:
Zn + Си2 + -> Zn2 + + Си
но медь не восстанавливает ионы цинка.
Таким образом, цинк является более сильным ..., чем медь.
Завершите это предложение и переходите к рубрике 59.
55. Катион присоединяет электроны и восстанавливается до металла.
В качестве примера приведем реакцию
Си2 + + 2е “ -> Си
Ионы меди восстанавливаются до элементной меди.
Сильными восстановителями являются те элементы, которые особенно легко отдают электроны.
Способность отдавать электроны может быть измерена экспериментально. Эти измерения дают значение напряжения, выраженное в вольтах (В). Такие напряжения измеряются для всех элементов и называются нормальные окислительно-восстановительные потенциалы.
Ниже указаны нормальные окислительно-восстановительные потенциалы цинка, меди и серебра-элементов, с которыми мы уже знакомы:
Zn <=> Zn2 + + 2е — 0,76 В (вольт)
Си Си2 + + 2е " + 0,34 В
Ag Ag + + е + 0,80 В
Как видно из этих примеров, окислительно-восстановительные потенциалы
могут быть положительными или отрицательными.
144
UpOipKMMU 6
Какой знак имеет нормальный окислительно-восстановительный потенциал для тех металлов, которые являются наиболее сильными восстановителями?
• Отрицательный (—) -> • Положительный (+) -» 46 63
6
56. Фтор является самым сильным окислителем среди галогенов (F2, С12, Вг2, 12). Более того, фтор-самый сильный окислитель среди всех элементов.
Какой нормальный окислительно-восстановительный потенциал имеет водород?
Для ответа на этот вопрос воспользуйтесь табл. 5 из программы 7
и запишите его.
Проверьте ответ в рубрике 10.
57. 1. Mg + С12 -« Mg2 + + 2СГ
2. Fe + 2Н+ + SO2" - Fe2 + + SO2" + Н2
В реакции 1 магний окисляется до Mg2 + хлором. Хлор восстанавливается до 2С1 “ магнием.
В реакции 2 железо окисляется до Fe2 + двумя ионами Н +, которые в свою очередь восстанавливаются до Н2 железом.
Какая из следующих двух реакций должна протекать?
1. Zn + H2SO4 -»
2. Си 4- H2SO4 —►
• Ни одна из них -» 27
• Только реакция 1 -> 49
• Только реакция 2 -» 19
• Обе реакции -» 52
58. Вы уже знакомы с реакцией
Си -I- 2AgNO3 -> 2Ag + Cu(NO3)2
Если погрузить в раствор нитрата серебра полоску меди, она покрывается слоем серебра. Одновременно с этим часть меди растворяется, переходя в раствор в виде ионов Си2 +.
Установите положения Си и Ag+ в электрохимическом ряду. Нетрудно видеть, что Си расположен на две строки выше Ag+ и, следовательно, может восстанавливать Ag +. Другими словами, Ag + может окислять Си.
Прочтите еще раз рубрику 10 и, прежде чем ответить на поставленный там вопрос, определите положение каждого металла и катиона в электрохимическом ряду.
59. Правильно. Цинк является более сильным восстановителем, чем медь.
В качестве другого примера рассмотрим нанесение серебряного покрытия на медь при погружении последней в раствор нитрата серебра
Си -I- 2Ag+ -» Си2+ + 2Ag
В данном случае медь восстанавливает ионы серебра. В результате происходит выделение металлического серебра, а ионы меди переходят
).тект»ох<’мичсскчй ряд
в раствор
2Ag+ + 2е “ -> 2Ag
Си -► Си24 + 2е
Таким образом, в реакции
Zn + Си2 + -» Zn2 + + Си цинк восстанавливает ионы меди. иав
В реакции gffii
Си + 2Ag+ -> Си2 + + 2Ag медь восстанавливает ионы серебра.
Ответьте теперь на следующий вопрос.
Что произойдет с кусочком цинка, если его погрузить в раствор нитрата серебра?
• Цинк растворится, а серебро выделится из раствора -> 24
• Ничего не произойдет -> 37
60. Нет. Ион С1 “ не окисляется. Он не может в этой реакции окисляться, поскольку находится в правой части уравнения реакции, т.е. является продуктом реакции.
Повторите определение окисления и восстановления, после чего еще раз попытайтесь ответить на вопрос, заданный в рубрике 50.
61. Правильно. Реакция
Hg + 2AgNO3 -> 2Ag + Hg(NO3)2 не может протекать.
Дело в том, что Ag+ находится выше Hg в электрохимическом ряду. Реакция может протекать только в том случае, если участвующий в ней восстановитель расположен в электрохимическом ряду выше участвующего в реакции окислителя.
Разберемся теперь, как обстоит дело с элементами, располагающимися в электрохимическом ряду выше водорода.
Все элементы, стоящие в электрохимическом ряду выше Н2, способны восстанавливать Н + и любые элементы или ионы, расположенные ниже Н + (т.е. катионы металлов и галогены).
Рассмотрим два эксперимента.
1. Кусочек алюминия помещают в раствор нитрата серебра.
2. Кусочек меди помещают в раствор сульфата цинка.
В каком из этих экспериментов будет протекать реакция? Воспользуйтесь для ответа на этот вопрос табл. 5 из программы 7.
1. Al + 3AgNO3 - 3Ag + A1(NO3)3
2. Си 4- ZnSO4 -» Zn + CuSO4
• Обе реакции невозможны -> 7
• Возможна только реакция 1 -► 13
• Возможна только реакция 2 -> 9
• Возможны обе реакции -> 53
10-29
146
Программа 6
6 2. Проверьте ответ:
Мп: 4 -» 0 МпО2 -» Мп
А1: 0 -> 3 А1 -> А12О3
Свободный марганец нульвалентен, а Мп в МпО2 четырехвалентен.
Свободный алюминий нульвалентен, а А1 в А12О3 трехвалентен.
Валентность всякого элемента в определенном соединении неизменна, но тот же элемент может образовывать другие соединения, где проявляет другую валентность. Валентность любого элемента в свободном состоянии (т. е. в виде простого вещества) всегда равна нулю.
Когда элемент изменяет свою валентность, его атомы обязательно отдают или присоединяют электроны.
Таким образом, можно дать следующие определения процессов окисления и восстановления.
Окисление представляет собой удаление (отдачу) электронов от атомов, молекул или ионов*.
Восстановление представляет собой присоединение электронов атомами, молекулами или ионами.
Запишите в свою тетрадь эти определения!
Решим теперь следующую задачу.
Что представляет собой реакция
С12 + 2е~ -> 2С1"
где е~ -электрон?
• Окисление
• Восстановление
-> 41
-> 50
6 3. Неправильно. Цинк-самый сильный восстановитель среди трех указанных металлов-цинка, меди и серебра. Цинк вызывает выделение свободной меди из раствора, содержащего соль меди, и выделение серебра из раствора, содержащего соль серебра. В этих реакциях сам цинк переходит в раствор в виде ионов Zn2 + .
Нормальные окислительно-восстановительные потенциалы этих металлов таковы:
Zn - 0,76 В
Си + 0,34 В
Ag + 0,80 В
Существуют многие другие металлы-восстановители, и некоторые из них являются еще более сильными восстановителями, чем цинк.
Чем сильнее восстановительная способность металла, тем более ... (положительным/отрицательным) является его нормальный окислительно-восстановительный потенциал.
Завершите это предложение и проверьте ответ в рубрике 46.
* Полезно для запоминания мнемоническое правило: окисление -> отдача (электронов).//рим. ред.
Программа 7
Степени окисления и окислительно-восстановительные реакции
1. В данной программе рассматриваются степени окисления элементов и использование этого понятия при составлении уравнений сложных окислительно-восстановительных реакций.
Что представляет собой степень окисления?
Существуют четыре простых правила, позволяющие определить степень окисления любого атома в любом соединении. Эти правила следует запомнить. Начнем с первых двух.
1. Элементы в свободном состоянии всегда имеют'степень окисления, равную нулю.
2. Простые (одноатомные) ионы имеют степень окисления, равную электрическому заряду иона.
Приведем несколько примеров:
натрий (элемент) степень окисления О
ион натрия Na + степень окисления + 1
сульфид-ион S2 ” степень окисления — 2
Ответьте теперь на следующий вопрос. Каковы степени окисления железа, хлорид-иона, протона и серы?
Степень окисления 0 имеют ... и ....
Степень окисления —1 имеет ....
Степень окисления + 1 имеет ....
Проверьте ответ в рубрике 17.
2. В реакции серебра с азотной кислотой, помимо нитрата серебра, образуются еще NO2 и Н2О
Ag + 2HNO3 -> AgNO3 + NO2 + H2O
Поскольку в данном случае не происходит образования Н2, не происходит и восстановления ионов Н +.
Рассмотрим эту реакцию подробнее. Начнем с вопроса.
Какова степень окисления азота в NO2? Запишите ответ и проверьте его в рубрике 63.
3. Неправильно. Прочтите объяснение в рубрике 31.
4. Правильно. 5 молей FeSO4 окисляются 1 молем КМпО4.
Мп: + 7 -> +2 (присоединение 5 электронов)
Fe: + 2 -» +3 (высвобождение 1 электрона)
Следовательно, в этой реакции 5 атомов Fe может окислить 1 атом Мп.
Мп: +7 -> +5 = —5
5Fe: + 10 -> + 15= +5
“0“
и, следовательно, молярное отношение КМпО4 к FeSO4 равно 1 :5.
На этом основании можно записать уравнение реакции следующим
148
Программа 7
образом:
KMnO4 + 5FeSO4 + H2SO4 - MnSO4 + Fe2(SO4)3 + H2O + K2SO4
В левой части этого уравнения соблюдено правильное молярное отношение окислителя к восстановителю. Чтобы сбалансировать уравнение, нужно записать в правой части 21/2Fe2(SO4)3.
Вместо того чтобы пользоваться дробными коэффициентами, можно умножить коэффициенты перед КМпО4, FeSO4 и Fe2(SO4)3 на 2.
2КМпО4 + 10FeSO4 + H2SO4 -
-> MnSO4 + 5Fe2(SO4)3 + H2O + K2SO4
Однако это уравнение еще не сбалансировано по отношению к марганцу. Сколько Мп должно быть в его правой части? Проверьте ответ в рубрике 28.
5. Проверьте ответ:
Na2Cr2O7 + 6FeSO4 + H2SO4 ->
- Cr2(SO4)3 + 3Fe2(SO4)3 + H2O + Na2SO4
3. Сбалансируем теперь стехиометрию остальных ионов или молекул.
Прежде всего подсчитаем число атомов натрия: оно одинаково в обеих частях уравнения.
Затем подсчитаем число сульфат-ионов в правой части, вычтем из него число сульфат-ионов, обеспечиваемых молекулами FeSO4 в левой части, а разность даст нам число сульфат-ионов, поставляемых в форме серной кислоты в левой части уравнения.
Сколько молей серной кислоты требуется для этой реакции?
Проверьте ответ в рубрике 64.
6. Вы уже знаете, что степень окисления сульфид-иона равна — 2.
Сумма степеней окисления всех атомов в соединении должна быть равна нулю. Это позволит вам вычислить степень окисления железа в FeS.
Проверьте ответ в рубрике 26.
7. В левой части уравнения должно быть записано 2КМпО4, а в правой части 5С12. Эти 5С12 образуются из ЮНО. Однако в уравнение входит 16НС1.
Что происходит с остальными шестью молями НС1?
Проверьте ответ в рубрике 20.
8. Ваш подсчет неправилен. Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 28, а если вы не знаете, как это сделать, обратитесь за разъяснениями в рубрику 45.
0 +2
Си -> Си2+ 0-* +2 = +2
+6 +4
H2SO4 —> SO2 +6 —> +4 = —2
О
Степень окисления и окислительно-восстановительные реакции
149
Медь окисляется, сера восстанавливается. Чтобы восстановить 1 атом меди, требуется 1 молекула H2SO4.
Таким образом, по изменению степеней окисления можно определять отношение необходимого количества окислителя к количеству восстановителя.
Уравнение, сбалансированное только по степеням окисления, приобретает вид: О +6 + 2 +4
Си + H2SO4 Си2+ + SO2
но стехиометрически это уравнение еще не сбалансировано. Зная, что в реакции образуется также Н2О и что ион Си2 + должен входить в уравнение в соединении с сульфат-ионом, вы сможете завершить это уравнение.
Запишите сбалансированное уравнение.
Проверьте ответ в рубрике 51.
10. Неправильно. Прочтите объяснение в рубрике 29.
ц 0+1 +20
’ Zn + 2 НС1 ->• ZnCl2 + Н2
Изменения степеней окисления таковы:
0 +2
Zn ->• Zn2+ 0 —» +2 = +2
+ i о
2Н‘ -» Н2 +2-> 0=^2
0
Рассмотрим теперь уравнения более сложных окислительно-восстановительных реакций. В качестве примера начнем с реакции между серебром и азотной кислотой
Ag + 2HNO3 -> AgNO3 + NO2 + H2O
Обычно в результате реакции металла с кислотой образуются водород и соль металла. Но в данном случае реакция протекает не так.
В чем заключается главное отличие между этой реакцией и обычной реакцией металла с кислотой? Различие заключается в образовании, кроме соли, не водорода, а других продуктов, а именно ... и ....
Завершите это предложение и переходите к рубрике 2.
12. Неправильно. Нулевую степень окисления имеют только свободные элементы. Атом, входящий в соединение, должен иметь степень окисления, отличную от нуля.
Повторите правила, определяющие степени окисления, начиная с рубрики 1.
13. Ваш подсчет неправилен. Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 28, а если вы не знаете как это сделать, обратитесь за разъяснениями в рубрику 45.
150
Программа 7
14. Неправильно. Прочтите объяснение в рубрике 29.
15. Неправильно. Прочтите объяснение в рубрике 31.
16. 1 моль КМпО4 окисляет 5 молей НС! до молекулярного хлора. При этом происходят такие изменения степеней окисления. + 7 + 2 КМпО4 —» МпС12 +7 —> +2 = -5 -1 0 5 НС! -» 2 СЬ -5 -> 0 = +5 0 Переходите к рубрике 23.
17. Проверьте ответ:
Степень окисления 0 имеют железо и сера.
Степень окисления — 1 имеет хлорид-ион.
Степень окисления + 1 имеет протон.
Железо и сера являются свободными элементами, их степень окисления равна нулю. Хлорид-ион несет один отрицательный заряд, его степень окисления равна —1. Протон Н+ несет один положительный заряд, его степень окисления равна + 1.
Третье правило, определяющее степени окисления, таково:
3. Сумма степеней окисления всех атомов в соединении всегда равна нулю.
Приведем следующие примеры:
+ 1 -1
H-CI +1-1=0
+ 1 -2
H2S 2(4-1)—2 = + 2—2 = 0
Это правило позволяет вычислять степени окисления каждого атома в молекуле.
Мы уже знаем, что степень окисления С1“ равна — 1. Какую степень окисления имеет золото в АиС13?
Сумма степеней окисления трех хлорид-ионов в АиС13 равна 3( —1) = — 3. Поскольку соединение в целом должно иметь нулевую степень окисления (согласно приведенному выше правилу 3), степень окисления Au в АиС13 должна быть + 3.
+ 3- 1
AuCh +3 + 3(-1) =+3-3 = 0
Какова степень окисления Fe в FeS?
Если вы можете ответить на этот вопрос, проверьте ответ в рубрике 26. Если вы не знаете, как ответить на него, переходите к рубрике 6.
Степени окисления si окисли j (ч1':»п«^носсгаиовмте;<Ы1ые реакции
151
18. Неправильно. Очевидно, что вы не учли число молей каждой соли. Попытайтесь еще раз ответить на вопрос, поставленный в рубрике 28, а если вам неясно как это сделать, обратитесь за разъяснениями в рубрику 45.
19. Вы неправильно указали степень окисления марганца после реакции. Прочтите объяснение в рубрике 39.
20. Проверьте ответ:
6 остальных молей НО расходуются на образование
40 “ в форме 2МпС12 и
2С1 ~ в форме 2КС1.
Водород из 16НС1 и кислород из 2КМпО4 соединяются, образуя 8Н2О.
Составление уравнения столь сложной окислительно-восстановительной реакции проводится в три стадии:
1) определение молярного отношения окислителя к восстановителю на основе изменения их степеней окисления;
2) балансирование стехиометрии основных участников окислительно-восстановительной реакции;
3) балансирование стехиометрии остальных ионов или соединений.
Если следовать такому способу постадийного составления уравнений окислительно-восстановительных реакций, дело очень упрощается.
Изменение степени окисления марганца от + 7 до +2 происходит во многих окислительно-восстановительных реакциях. Эти реакции всегда осуществляются в кислых растворах.
Мы можем поупражняться в поэтапном составлении уравнений таких окислительно-восстановительных реакций на примере окисления железа(И) в железо(Ш), т. е. увеличения его степени окисления от + 2 до +3.
Незавершенное уравнение реакции:
+ 7 + 2 +2 +3
КМпОд + FeSO+ + H2SO4 —* MnSO+ + Fe2(SO4)3 + Н2О + K2SO4
Перепишите это уравнение, которое нам предстоит сбалансировать.
Подсчитайте, с учетом изменения степеней окисления, сколько молей FeSO4 окисляет один моль КМпО4?
• 1 ->10
• 3 >14
• 5 ->4
• Не знаю -> 29
О +1 +6-2 +2+6-2 О
Ре+Нг5О4 —> FeSO4 + Н?
Чтобы сбалансировать уравнение окислительно-восстановительной реакции, нужно учесть только те степени окисления, которые изменяются в результате реакции.
Поэтому нет необходимости указывать степень окисления сульфат-иона SO4 , которая остается неизменной в ходе реакции.
152
Программа 7
0+1 +20
Fe + H2SO4 —» FeSO4 + H2
Элементное железо (степень окисления 0) отдает два электрона, превращаясь в ион Fe2 + (степень окисления +2). Два протона [степень окисления 2-( + 1) = = + 2] присоединяют два электрона, превращаясь в элементный водород (степень окисления 0).
0 +2
Fe-----»Fe2+; .0 -->+2 = +2 (увеличивается на 2)
+ 1 о
2 Н*---» Н2 +2--------► 0 = — 2 (уменьшается на 2)
Суммарное изменение : О
Сумма изменений всех степеней окисления в реакции должна быть равна нулю.
Запишите теперь уравнение реакции между цинком и соляной кислотой, указывая изменения степеней окисления.
Проверьте ответ в рубрике 11.
22. Совершенно верно. Сбалансированное уравнение должно иметь вид
Си + 4HNO3 - Cu(NO3)2 + 2NO2 + 2Н2О
Если вы получили этот ответ с первой попытки, то это значит, что вы хорошо разбираетесь в обсуждаемой теме.
Окислительно-восстановительные реакции могут происходить не только между металлами и кислотами. Существует множество других реакций, в которых восстанавливаются или окисляются ионы растворенных соединений.
Ниже мы приведем ряд характерных примеров.
Перманганат калия КМпО4 является одним из важных реагентов. Какова степень окисления Мп в КМпО4?
Степень окисления Мп в КМпО4 равна
• + 3 - 15
• +5 -+ 3
• + 7 -+ 57
• + 9 -+ 43
23. 1 моль КМпО4 окисляет 5 молей НО до молекулярного хлора.
Если вы получили другое число, прочтите объяснение в рубрике 16. Теперь нам известно количественное отношение окислителя
к восстановителю, но необходимо еще сбалансировать стехиометрию участников рассматриваемой окислительно-восстановительной реакции.
5НС1 дают 2‘/2 С12. В уравнениях реакций нежелательно пользоваться дробными коэффициентами, поэтому целесообразно удвоить все коэффициенты.
Сколько молей КМпО4 должно содержаться в левой части уравнения
и сколько молей С12 должно быть в его правой части?
Проверьте ответ в рубрике 7.
Степени окисления и окисли ге-тыю-коссгаипчм .ел.пые реакции
153
24. В правой части уравнения должно быть 8Н2О.
Число атомов кислорода теперь тоже сбалансировано: 2КМпО4 и 8Н2О содержат по восемь атомов кислорода.
Окончательно сбалансированное уравнение имеет вид
2КМпО4 + 10FeSO4 + 8H2SO4 -+
- 2MnSO4 + 5Fe2(SO4)3 + 8H2O + K2SO4
Бихромат натрия Na2Cr2O7-3T0 еще один окислитель, сопоставимый с перманганатом калия.
Какова степень окисления хрома в Na2Cr2O7?
Запишите ваши выкладки и проверьте ответ в рубрике 46, а если вам нужны дополнительные разъяснения, обратитесь к рубрике 32.
25. Сбалансируем уравнение поэтапно.
1. Сначала определим молярное отношение бихромата к FeSO4, исходя из изменений степеней окисления
Сг: +6 -» +3 (присоединение 3 электронов)
Fe: + 2 -» +3 (высвобождение 1-го электрона)
Следовательно, при восстановлении 1 атом Сг может окислить 3 атома Fe:
Сг: +6-> + 3 = — 3
3Fe: +6 - +9 = +3
Число окисляемых атомов железа должно втрое превышать число восстанавливаемых атомов хрома. Но в Na2Cr2O7 имеются два атома Сг. Следовательно, 1 молекула Na2Cr2O7 может окислить ... молекул FeSO4.
Завершите это предложение и проверьте ответ в рубрике 56.
26. Железо в FeS имеет степень окисления + 2. Сумма степеней окисления всех атомов в соединении должна быть равна нулю.
+2-2
FeS: +2—2 = 0
Теперь вычислите степени окисления:
атома брома в НВг и
атома титана в TiCl4.
Степени окисления равны
Вг: ...
Ti: ...
Проверьте ответ в рубрике 36.
27. Вы неправильно указали степень окисления марганца после реакции. Прочтите объяснение в рубрике 39.
28. Проверьте ответ:
2KMnO4 + 10FeSO4 + H2SO4 -+
-+ 2MnSO4 + 5Fe2(SO4)3 + H2O + K2SO4
154
Программа 7
Теперь в уравнении сбалансирована стехиометрия окислительно-восстановительных партнеров реакции. Но остается еще сбалансировать стехиометрию остальных ионов и соединений.
Число ионов калия в обеих частях уравнения одинаково.
Подсчитайте теперь число сульфат-ионов в правой части уравнения.
Сколько их в правой части?
• 5 -> 18
• 9 -> 13
• 17 -> 8
• 18 ->38
• Не знаю -> 45
29. KMnO4 -> MnSO4: + 7 -> + 2 = - 5
FeSO4 -> Fe2(SO4)3: + 2 -> + 3 = + 1
Степень окисления марганца изменяется от + 7 до +2. Это происходит в результате того, что марганец присоединяет пять электронов. Эти электроны поступают от атома железа, которое окисляется. Его степень окисления изменяется от + 2 до +3. Атом железа в процессе окисления отдает 1 электрон.
Таким образом, 1 моль КМпО4 окисляет ... молей FeSO4.
Завершите это предложение и проверьте ответ в рубрике 4.
30. Итак, завершенное уравнение имеет вид
Na2Cr2O7 + 6FeSO4 + 7H2SO4 ->
- Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O + Na2SO4
Правильно ли вы нашли все коэффициенты в этом уравнении?
На этой сложной окислительно-восстановительной реакции мы заканчиваем знакомство с неорганической и общей химией в данной части учебника.
Конец программы 7.
31. Вы должны были ответить, какова степень окисления Мп в КМпО4.
Степень окисления К равна + 1; К: +1
Степень окисления О равна —2; О: 4-( — 2) = - 8
Итого — 7
Чтобы сумма степеней окисления всех атомов в КМпО4 была равна нулю, Мп должен иметь степень окисления ....
Запишите ответ и проверьте его в рубрике 57.
32. Как определить степень окисления хрома в Na2Cr2O7?
Степени окисления натрия и кислорода в химических соединениях известны: +1 для натрия и —2 для кислорода.
Следовательно,
Na2: 2(+1)= +2
О7: 7-( —2) = -14
- 12
Степень окисления и окислительно-восстановительные реакции
155
Зная, что сумма степеней окисления всех атомов в соединении должна быть равна нулю, можно вычислить степень окисления хрома в бихромате натрия.
Проверьте ответ в рубрике 46.
33. Вы неправильно указали степень окисления марганца после реакции. Прочтите объяснение в рубрике 39.
34. Неправильно. Вы не учли, что в молекуле H2SO4 имеются 2 атома Н. Вернитесь к рубрике 62.
35. Вы не учли, что в молекулу Na2Cr2O7 входят 2 атома хрома. Следовательно, для окисления 6FeSO4 необходима лишь половина указанного вами количества Na2Cr2O7. Указанное вами число молекул H2SO4 тоже неправильно.
Исправьте ошибки в вашем уравнении и проверьте его в рубрике 30, а если вы нуждаетесь в дополнительных разъяснениях, обратитесь к рубрике 25.
36. Проверьте ответ:
Вг: -1
Ti: +4
или подробнее
+i -1
Н-Br: + 1+( —1)=1 —1=0
+4 -1
Ti СЦ: +4 + 4-(-1) = 4-4 = 0
Познакомьтесь теперь с четвертым правилом, определяющим степени окисления.
4. Степень окисления кислорода в химических соединениях всегда равна — 2.
(Имеется только одно исключение: в пероксидах кислород имеет степень окисления — 1. Однако этот класс соединений не рассматривается в данной книге.)
Запомнили ли вы остальные три правила?
Ответьте на следующие вопросы:
1. Какую степень окисления имеют свободные элементы?
2. Чем определяется степень окисления простых (одноатомных) ионов?
3. Какой должна быть сумма степеней окисления всех атомов в соединении?
Проверьте ответ в рубрике 47.
37. Неправильно. Изменения степеней окисления показывают, что для окисления 1 атома Си требуется 2 молекулы HNO3. Это означает, что в правой части уравнения должно находиться по меньшей мере 2NO2.
Попытайтесь еще раз сбалансировать уравнение этой окислительно-восстановительной реакции и дать правильный ответ на вопрос, поставленный в рубрике 61.
156
Программа 7
38. Всего в правой части уравнения, записанного в рубрике 28, содержится 18 ионов SO4~.
В левой части этого уравнения уже имеется 10 ионов SO4~ в форме FeSO4, а остальные 8 ионов SO4“ должна поставлять H2SO4, Следовательно, в левой части уравнения должно быть записано 8H2SO4.
2КМпО4 + 10FeSO4 + 8H2SO4 -
- 2MnSO4 + 5Fe2(SO4)3 + H2O + K2SO4
Остается еще сбалансировать число атомов водорода.
Сколько молекул Н2О должно быть в правой части уравнения?
Запишите ответ и проверьте его затем в рубрике 24.
39. По окончании реакции Мп существует в форме МпС12.
Чтобы определить степень окисления Мп в МпС12, нужно знать степень окисления хлорид-иона. Она равна — 1. В МпС12 входят 2 хлорид-иона.
Используя правило, согласно которому сумма степеней окисления всех атомов, входящих в соединение, должна быть равна нулю, вы сможете правильно ответить на вопрос, поставленный в рубрике 57.
40. Приведем еще раз изменения степеней окисления восстановителя и окислителя в рассматриваемой реакции:
+ 7 + 2
КМпОд — МпС12: +7 -* +2=-5
-1 о
HCI — |С12: -1 -> 0=+1
—4
Когда марганец присоединяет 5 электронов, его степень окисления изменяется от + 7 до +2. Эти электроны поступают от хлорид-ионов, каждый из которых отдает по 1 электрону, превращаясь в молекулярный хлор.
Сколько же хлорид-ионов может окислить 1 моль КМпО4?
Проверьте ответ в рубрике 16.
41. Ваши выкладки неправильны, либо вы просто взяли для серы степень окисления, соответствующую сульфидному иону (— 2).
Повторите правила, определяющие степени окисления, начиная с рубрики 1.
42. Неправильно. Если в левой части уравнения имеются 4 атома водорода (в составе 4HNO3), то их должно быть 4 и в правой части уравнения.
Проверьте коэффициенты в обеих частях уравнения, обсуждаемого в рубрике 61.
43. Неправильно. Прочтите объяснение в рубрике 31.
Степени окисления и окислительно-восстановительные реакции
157
44. Проверьте ответ.
+1 +5-2
Н-МОз =4-14-54-3- (-2) = 1 + 5 - 6 = О
Проследим теперь за степенями окисления в некоторых простых реакциях, с которыми вы уже знакомы.
Железо растворяется в разбавленной серной кислоте
Fe + H2SO4 -» FeSO4 + Н2
Запишите это уравнение, указав степень окисления каждого атома.
Проверьте ответ в рубрике 21.
45. Требуется определить, сколько сульфат-ионов содержится в правой части
уравнения, приведенного в рубрике 28. Там записано:
2MnSO4, т.е. 2 иона SO4“
5Fe2(SO4)3, т.е. 15 ионов SO4“
1K2SO4, т.е. 1 ион SO4“
Итого: ... ионов SO4“
Сколько всего ионов SO4 содержится в правой части уравнения? Проверьте ответ в рубрике 38.
46. Хром имеет в Na2Cr2O7 степень окисления + 6.
Na2Cr2O7 тоже способен окислять FeSO4 до Fe2(SO4)3.
Неполное уравнение этой реакции таково:
+6 +2 +3 +3
МагСггО? + FeSO4 + H2SO4 —> Сгг(5О4)з + Ре2(5Од)з + Н2О + NazSO4
Перепишите это уравнение и завершите его. Делайте это поэтапно точно таким же способом, как в предыдущей реакции с КМпО4.
1. Определите молярное отношение Na2Cr2O7 к FeSO4, пользуясь данными об изменениях степеней окисления.
2. Сбалансируйте стехиометрию окислителя и восстановителя.
3. Сбалансируйте стехиометрию остальных ионов и молекул.
Какие коэффициенты должны стоять в уравнении перед
Na2Cr2O7 FeSO4 H2SO4
• 1 6 7 >30
• 2 6 9 >65
• 1 3 5 +58
• 1 3 7 + 60
• 2 6 8 -> 35
• Нуждаюсь в разъяснении -+ 25
47. Проверьте ответы:
1. Степень окисления любого элемента в свободном состоянии равна нулю.
Программа 1
I5H
2. Степень окисления одноатомных ионов равна их электрическому заряду.
3. Сумма степеней окисления всех атомов в соединении должна быть равна нулю.
Помните ли вы и четвертое правило? Запишите степень окисления кислорода в его соединениях.
Проверьте ответ в рубрике 62.
48. В завершенной форме уравнение имеет вид
7
Ag т Z П1\Оз —> AgINO3 т INUz + г>2О
Таким образом, в этой реакции должны участвовать 2 моля HNO3:
1 моль для окисления серебра
(степень окисления азота изменяется от + 5 до +4) и
1 моль в виде нитрат-иона в AgNO3
(в котором степень окисления азота остается неизменной).
Окисление меди горячей серной кислотой представляет собой аналогичную реакцию. Медь растворяется, превращаясь в сульфат меди, а газообразный SO2 выделяется из раствора.
Как изменяются в этой реакции степени окисления меди и серы?
Завершите следующие записи, указав в них изменения степеней окисления:
Си --------» Си2+:.......... ► ...... = .......
H2SO4 -----» SO2: ........... ► ...... = .......
Проверьте ответ в рубрике 9.
49. Правильно. До реакции марганец имел степень окисления + 7 (КМпОД, а после реакции + 2 (МпС12).
Изменяя степень окисления от + 7 до +2, марганец восстанавливается.
Хлор, наоборот, окисляется, изменяя степень окисления от — 1 до 0.
+7 +2
КМпО4 -> МпС12: +7 -* +2=-5
-1 о
НС1 -» 1/2 С12: -1 -» 0= + 1
—4
Теперь мы можем установить количественное отношение окислителя к восстановителю.
Сколько молей НО может быть окислено 1 молем КМпО4?
Если вы можете дать ответ, проверьте его в рубрике 23.
В противном случае обратитесь к рубрике 40 за дополнительными разъяснениями.
Степени окислении и лкислигельшипсп*iuiiorhic.iuhmc реакции
159
50. Правильно. Сера в H2SO4 имеет степень окисления + 6.
Степень окисления Н равна +1; Н2:2(+1) = +2
Степень окисления О равна —2; О4: 4-( — 2) —8
Итого — 6
Для того чтобы сумма степеней окисления всех атомов в H2SO4 была равна нулю, сера должна иметь степень окисления + 6.
+ 1 +6-2
H2SO4 = 2 • (+1) + 6 + 4 (-2) = 2 + 6 — 8 = 0
Вычислите степень окисления в азотной кислоте. Запишите свои выкладки и дайте ответ. Проверьте ответ в рубрике 59.
51. Си + 2H2SO4 -+ CuSO4 + SO2 + 2Н2О
Медь может быть окислена также концентрированной азотной кислотой;
в этом случае из раствора выделяется газообразный NO2
О + 2
Си —» Си2*: 0 —» +2 = +2
+ 5 +4
H-NO3 -> NO2: +5 —» +4 = — 1
+ 1
В рассматриваемой реакции отношение количества окислителя к восстановителю не может быть равно 1:1, поскольку суммарное изменение степени окисления отлично от нуля.
Медь при переходе
О +2
Си -*Си2+,
отдает два электрона, но азот при переходе
hno3-*no2
присоединяет только один электрон.
Поскольку медь отдает два электрона, а азот присоединяет только один электрон, молярное отношение меди к азотной кислоте должно быть равно 1 :2.
Завершите следующие уравнения, указывая изменения степеней окисления, и проверьте, равно ли нулю их суммарное изменение.
О +2
Си---->Си2*: ----► ..... = ......
+ 5 +4
2 HNO3---->2NO;: ....... ......> ..... =.......
Суммарное изменение'.
Проверьте ответ в рубрике 61.
!6!l
Ilpiir^awi ,
52. Вы неправильно указали степень окисления марганца после реакции. Прочтите объяснение в рубрике 39.
53. Непрарильно. Вы не учли, что в молекуле H2SO4 на каждый атом серы приходится 2 атома Н и 4 атома О. Повторите выкладки, полагая степень окисления водорода равной + 1, а степень окисления кислорода равной — 2, и вы сможете правильно ответить на вопрос, поставленный в рубрике 62.
54. В левой части уравнения недостает еще одной молекулы HNO3.
Эта дополнительная молекула HNO3 используется для образования AgNO3; протон идет на образование воды.
Завершите рассматриваемое уравнение.
Проверьте ответ в рубрике 48.
55. Неправильно. В составленном вами уравнении правая часть содержит 2Н2О, а левая часть-только 3HNO3, т.е. слева недостает атомов водорода. Проверьте равенство числа других атомов в обеих частях уравнения, и тогда вы сможете правильно ответить на вопрос, поставленный в рубрике 61.
56. 1 молекула Na2Cr2O7 окисляет 6 молекул FeSO4.
Учитывая этот результат в уравнении, получаем
Na2Cr2O7 + 6FeSO4 + H2SO4 -»
—> Cr2(SO4)3 + Fe2(SO4)3 + H2O + Na2SO4
2. Сбалансируем теперь стехиометрию окислительно-восстановительных партнеров реакции.
Молярное отношение Na2Cr2O7 к FeSO4 в левой части уравнения уже установлено на основе учета изменений степеней окисления. Теперь следует найти коэффициенты при Cr2(SO4)3 и Fe2(SO4)3 в правой части уравнения.
Найдите эти коэффициенты и проверьте ответ в рубрике 5.
57. Правильно. Мп .имеет в КМпО4 степень окисления +7.
+1+7-2
КМпО4 = +1 +7 +4 (-2) =
+ 1+7-8 = О
КМпО4 является сильным окислителем. Он окисляет хлорид-ион до хлора:
2КМпО4 + 16НС1 -+ 2КС1 + 2МпС12 + 5С12 + 8Н2О
Разберем это уравнение подробно.
Перепишите его в тетрадь, а затем ответьте на следующий вопрос.
Каковы степени окисления марганца до и после реакции?
Степени окисления и окислительно-восстановительные реакции
161
До реакции После реакции
• + 7 + 6 —► 19
• + 7 4- 5 —► 27
• + 7 + 4 52
• + 7 + 3 33
• + 7 4- 2 —> 49
• Нуждаюсь в разъяснении 39
58. Вы забыли, что в Na2Cr2O7 входят 2 атома хрома. Следовательно, одна молекула Na2Cr2O7 может окислить вдвое больше указанного вами числа молекул FeSO4. Указанное вами число молекул H2SO4 тоже неправильно.
Исправьте ошибки в вашем уравнении и проверьте его в рубрике 30, а если вы нуждаетесь в дополнительных разъяснениях, обратитесь к рубрике 25.
59. Степень окисления азота в азотной кислоте равна 4-5.
Запишите формулу азотной кислоты и укажите степень окисления каждого атома в молекуле.
Проверьте ответ в рубрике 44.
60. Вы забыли, что в Na2Cr2O7 входят 2 атома хрома. Следовательно, одна молекула Na2Cr2O7 может окислить вдвое больше указанного вами числа молекул FeSO4. Указанное вами число молекул H2SO4 тоже неправильно.
Исправьте ошибки в вашем уравнении и проверьте его в рубрике 30, а если вы нуждаетесь в дополнительных разъяснениях, обратитесь к рубрике 25.
61. Проверьте ответ:
Си —> Си2*:
0 —» +2 = +2
+ 5 +4
2 HNO3 -> 2 NO2:
+ 10 -» +8 = -2
0
Таким образом, всегда можно определить отношение количества окислителя к восстановителю. В рассматриваемом случае мы установили, что 1 грамм-моль меди окисляет 2 моля азотной кислоты.
Все еще незавершенное уравнение к настоящему моменту имеет вид
Си + 2HNO3 -> Си2+ + 2NO2 + Н2О
Сбалансируем теперь это уравнение стехиометрически. Для этого разберемся, какое количество азотной кислоты требуется для образования соли.
Какие коэффициенты должны стоять в уравнении перед молекулами?
HNO3 no2 Н2О
• 2 1 1 -> 37
• 3 2 2 -> 55
• 4 2 1 -> 42
• 4 2 2 -> 22
11-29
162
Про, рамма 7
62. Степень окисления кислорода в его химических соединениях всегда равна — 2.
Изложенные четыре правила позволяют во всех случаях определить степени окисления каждого атома в молекуле.
Приведем пример.
Какова степень окисления фосфора в фосфорной кислоте Н3РО4?
Степень окисления Н:+1; Н 3: 3 ( + 1) = + 3
Степень окисления О: —2; О4: 4-( — 2)= —8
Итого — 5
Чтобы сумма всех степеней окисления в Н3РО4 оставалась равной нулю, Р должен иметь степень окисления + 5.
+ 1+5-2
Н3РО4 3 (+1) +5 +4 • (-2) = О
Какова степень окисления серы в H2SO4?
Запишите свои выкладки и назовите ответ.
• - 2 -» 41
• О -> 12
• + 1 -> 53
• +6 +50
• +7 -> 34
63. Атом азота в NO2 имеет степень окисления + 4
+4-2
NO2: +4 +2 (-2) = 0
Поскольку азот в азотной кислоте имеет степень окисления + 5, в рассматриваемой реакции должно происходить восстановление азота с изменением степени окисления от + 5 до +4. Одновременно с этим протекает окисление серебра с изменением степени окисления от 0 до + 1.
Запишем подробно изменения степеней окисления в этих процессах
+5 +4
HNO3------>NO2 +5-----»+4 = —1
о +1
Ag----->Ag+ 0------► +! =+1
0
Баланс изменения степеней окисления означает, что 1 молекула HNO3 окисляет 1 атом Ag.
Начнем составлять уравнение этой реакции со следующей записи:
0 +5 +1 +4
Ag + HNO3 -> Ag+ + NO2
Запишите это уравнение, которое еще не является полным.
В этом уравнении еще не сбалансирована стехиометрия, так как в его левой части слишком много атомов Н и О.
Степени окисления и окисли 1елы1о-яосс1аиови1сльные реакции
163
В правой части уравнения нужно нейтрализовать ион Ag * в форме AgNO3. Что нужно записать в левой части этого уравнения, чтобы сбалансировать его?
Проверьте ответ в рубрике 54.
64. 7H2SO4
Уравнение приобретает вид
Na2Cr2O7 + 6FeSO4 + 7H,SO4 ->
- Cr2(SO4)3 + 3Fe2(SO4)3 + H2O + Na2SO4
Остается еще проверить число молекул воды.
Согласуется ли число атомов кислорода в Na2Cr2O7 и число атомов водорода в H2SO4 с одной молекулой Н2О в правой части уравнения?.
Определите правильное число молекул Н2О и проверьте ответ в руб-
рике 30.
65. Вы забыли, что в Na2Cr2O7 входят два атома хрома. Следовательно, для окисления 6FeSO4 необходима лишь половина указанного вами количества Na2Cr2O7. Указанное вами число молекул H2SO4 тоже неправильно.
Исправьте ошибки в вашем уравнении и проверьте его в рубрике 30, а если вы нуждаетесь в дополнительных разъяснениях, обратитесь к рубрике 25.
164
Программа 7
Приложение
Таблица 2. Химические элементы
Название Символ Атомный номер Атомная масса Название Символ А томный номер Атомная масса
Азот N 7 14,00 Натрий Na 11 22,98
Актиний Ас 89 (227) Неодим Nd 60 144,24
Алюминий А1 13 26,98 Неон Ne 10 20,18
Америций Ат 95 (243) Нептуний Np 93 (237)
Аргон Аг 18 39,94 Никель Ni 28 58,71
Астат At 85 (210) Ниобий Nb 41 92,90
Барий Ва 56 137,36 Нобелий No 102 (254)
Бериллий Be 4 9,01 Олово Sn 50 118,69
Берклий Bk 97 (247) Осмий Os 76 190,2
Бор В 5 10,82 Палладий Pd 46 106,4
Бром Вг 35 79,91 Платина Pt 78 195,09
Ванадий V 23 50,94 Плутоний Pu 94 (244)
Висмут Bi 83 208,98 Полоний Po 84 (209)
Водород Н 1 1,00 Празеодим Pr 59 140,90
Вольфрам W 74 183,85 Прометий Pm 61 (145)
Гадолиний Gd 64 157,26 Протактиний Pa 91 (231)
Галлий Ga 31 69,72 Радий Ra 88 (226)
Гафний Hf 72 178,50 Радон Rn 86 (222)
Гелий Не 2 4,00 Рений Re 75 186,2
Германий Ge 32 72,60 Родий Rh 45 102,90
Гольмий Но 67 164,94 Ртуть Hg 80 200,59
Диспрозий Dy 66 162,1 Рубидий Rb 37 85,47
Европий Eu 63 152,0 Рутений Ru 44 101,07
Железо Fe 26 55,84 Самарий Sm 62 150,35
Золото Au 79 197,0 Свинец Pb 82 207,2
Индий In 49 114,82 Селен Se 34 78,96
Иод I 53 126,9045 Сера S 16 32,06
Иридий Ir 77 192,2 Серебро Ag 47 107,86
Иттербий Yb 70 173,04 Скандий Sc 21 44.95
Иттрий Y 39 88,90 Стронций Sr 38 87,62
Кадмий Cd 48 112,41 Сурьма Sb 51 121,76
Калий К 19 39,10 Таллий TI 81 204,37
Калифорний Cf 98 (251) Тантал Ta 73 180,94
Кальций Ca 20 40,08 Теллур Те 52 127,60
Кислород О 8 15,99 Тербий Tb 65 158,92
Кобальт Co 27 58,9332 Технеций Tc 43 (97)
Кремний Si 14 28,08 Титан Ti 22 47,90
Криптон Kr 36 83,80 Торий Th 90 232,03
Ксенон Xe 54 131.30 Тулий Tm 69 168,93
Курчатовий Ku 104 260 Углерод C 6 12,01
Кюрий Cm 96 (247) Уран u 92 238,03
Лантан La 57 138,91 Фермий Fm 100 (257)
Литий Li 3 6,93 Фосфор P 15 30,97
Лоуренсий Lr 103 (257) Франций Fr 87 (223)
Лютеций Lu 71 174,97 Фтор F 9 19,00
Магний Mg 12 24,31 Хлор Cl 17 35,45
Марганец Mn 25 54,93 Хром Cr 24 52,01
Медь Cu 29 63,546 Цезий Cs 55 132,91
Менделевий Md 101 (256) Церий Ce 58 140,13
Молибден Mo 42 95,94 Цинк Zn 30 65,37
Мышьяк As 33 74,92 Цирконий Zr 40 91,22
Эйнштейний Es 99 (254)
Эрбий Er 68 167,27
Таблица 3. Сокращенная таблица периодической системы элементов
Первый период i H He
Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Группа 7 Группа 8
Второй период 3 Li 4 Be 5 В 6 c 7 N 8 0 9 F 10 Ne
Третий период 11 Na 12 Mg 13 Al 14 Si 15 P 18 s 17 CL 1*. Ar
Четвертый период 19 К 20 Ca 77 31 Ба 32 Ge 33 As 34 Se 35 Br 36 Kr
Пятый период 37Rb 38 Sr 49 In so Sn 51 Sb 52 Те 53 I 54 Xe
Шестой период 55 Л Cs 5Б Ba 81 TI 82 Pb 83 Bi 84 Po 85 At 86 Rn
Седьмой период 87 Fr 88 Rd
Элементы побочных подгрупп (переходные элементы)
Степенн окисления и окислительно-восстановительные реакции
О'
Таблица 4. Полная таблица периодической системы элементов (в длиннопернодной форме)
1А
ZA
36 46 56 66 76
86
16 Z6
ЗБ
46
56
56
7Б
Первый период
Второй период
Третий период
ЧетВертый период
Пятый ’ период
Шестой ! период
Седьмой 1 период
Н
L’l
11 Na
19
К
37
Rb
55 Cs
rt
Fr
Ga
49
In
12
Mg
20 Ca
81 Ti
38 Sr
13 Al
ве
5 В
6
C
N
ГВГ 0 2
He
О
10 Ne
14
Si
15 P
16 s
17
Cl
18
Аг
32
Ge
50
Sn
зз
As
51 Sb
34
Se
35
Br
36
Кг
56 Ba
82 Pb
83
Bi
52
Те
84
Po
л”"тю&"
Антикои»,,
54
Хе
85
At
ев Rn
Степени окислении и окислительно-восстановительные реакции
167
Таблица 5. Электрохимический ряда
Li Li + + e -3,05 В
К K + + e" -2,92 В
Ва T± Ba2 + + 2e~ -2,90 В
Sr Sr2 + + 2e~ -2,89 В
Са Ca2 + + 2e” -2,76 В
Na Ti Na+ + e" -2,71 В
Mg Ji Mg2 + + 2e" -2,34 В
Al Ti Al3 + + 3e" -1,67 В
Сг T± Cr2 + + 2e“ -0,91 В
Zn Ti Zn2 + + 2e" -0,76 В
Fe Fe2 + + 2e' -0,44 В
Co T± Co2 + + 2e“ -0,28 В
Ni T± Ni2 + + 2e“ -0,25 В
Pb Pb2 + + 2e’ -0,13 В
h2 T± 2H + + 2e~ + 0,00 В
Cu T± Cu2 + + 2e” + 0,34 В
2Г T*» Iz + 2e~ + 0,53 В
Ag Ag+ + e" + 0,80 В
Hg Hg2 + + 2e" + 0,85 В
2Br' Br2 + 2e“ + 1,06 В
Pt pt2+ + 2e“ + 1,2 В
2СГ Cl2 + 2e” + 1,36 В
Au Au3 + + 3e“ +1,50 В
2F“ «z» f2 + 2e~ + 2,65 В
a Электрохимический ряд называют также ряд
напряжений, или ряд электродных потенциалов-Прим. ред.
В последующих программах излагается органическая химия. Исторически сложившееся разделение химии на неорганическую и органическую в настоящее время уже не может быть абсолютно строгим. Тем не менее отрасль химии, занимающуюся соединениями углерода, по-прежнему называют органической химией. (Лишь оксиды углерода, угольная кислота и ее соли-карбонаты-причисляются к неорганическим соединениям.)
Переходя к программам, посвященным органической химии, вы вскоре убедитесь, что к ней применимы те же общие химические законы, что и к неорганической химии. И все же отдельное рассмотрение органических соединений углерода оправдано по причинам, связанным с систематизацией соединений.
Программа 8
Углеводороды (I)
1. Углеводороды, как показывает их название, являются соединениями углерода и водорода. Хотя углеводороды состоят только из двух элементов, существует много способов, которыми эти два элемента могут соединяться друг с другом, образуя различные молекулы. Нам прежде всего предстоит разобраться в этом многообразии соединений.
Сначала повторим кое-что из того, что нам уже знакомо. Однако, если то, о чем пойдет речь, неизвестно вам, обратитесь к рубрике 6, в которой дано более подробное изложение.
Углерод всегда четырехвалентен. Атом углерода может образовывать связи с другими атомами углерода. Таким образом возникают цепи (неразветвленные или разветвленные) и кольца из атомов углерода. Оставшиеся валентности используются для связывания с водородом, что и приводит к образованию углеводородов.
Простейшим углеводородом является метан СН4.
Следующий за ним по сложности-этан С2Н6.
Цепь из трех атомов углерода имеется в пропане С3Н8.
Бутан С4Н10 имеет цепочку из четырех атомов углерода, а пентан С5Н12-из пяти атомов углерода.
Запишите структурные формулы пяти названных выше углеводородов.
Проверьте ответ в рубрике 7.
Если вы нуждаетесь в дополнительных разъяснениях, обратитесь за ними в рубрику 6.
2. В рассматриваемой структуре
имеется ветвление, и поэтому она существенно отличается от линейной структуры
Прочтите еще раз внимательно рубрику 17.
3. Правильно. Бутен превращается в бутан гидрированием. Пропан превращается в пропен дегидрированием.
Вслед за гидрированием рассмотрим теперь еще один очень важный тип реакций алкенов -полимеризацию ненасыщенных соединений.
В этой реакции происходит образование очень больших молекул (макромолекул) из маленьких молекул (например, этилена). Образующиеся макромолекулы, или полимеры, могут иметь молекулярные массы 10000, 100000 или больше.
Ниже схематически показано образование полимеров из большого числа
Углеводороды (I)
169
малых молекул:
До полимеризации: много малых молекул
нннннннн i-c <£-<!: с*с с-с
АТ I I I I I н н н н н н
После полимеризации: макромолекула
нннннннн
... ц rnS.
нннАнннн
полимере (макромолекуле) можно получить, если продолжить рост в обоих направлениях.
Представление о реальном в приведенной выше схеме
Какие из указанных ниже соединений способны полимеризоваться?
• Этен и бутан -» 18
• Этан, пропан и бутан -> 21
• Этен и пропен -> 10
• Этан и пропен -> 28
4. При гидрировании этена к нему присоединяются 2 атома водорода:
С’Ч + на н Н
молекулярная масса 28
Н Н
I I —► н-с-с-н
I I н н молекулярная масса 30
А что образуется при гидрировании пропена и какова молекулярная масса продукта этой реакции?
Проверьте ответ в рубрике 40.
5. Неправильно. Воспользуйтесь уравнениями обсуждаемых реакций:
н н н н н н н
а) н-с-с-ос' + на —- н-с-с-с-с-н III Ъ Illi
нннм нннн
н н н н н
6) Н-С-С-С-Н —► С'С-С-Н + на н н н н н н
Перепишите эти уравнения, а затем с их помощью попытайтесь еще раз ответить на вопрос, поставленный в рубрике 23.
6. Углерод всегда четырехвалентен, а водород одновалентен. Сколько атомов водорода может присоединиться к одному атому углерода?
Проверьте ответ в рубрике 13.
Г’
Программа Я
7. V н-с-н 1 н н 1 1 н-<р-£-н н н н H-<j:-(j:-<j!-H Н Н Н Н iiii H-c-VW’H н-ЭД-^-с-н
н н н н н н н н н н н н н н н
СН, V~CR3 VCHz-CH3 HjC - СН2- CHZ- CHj- СН3
метан этан пропан бутан пентан
Этот ряд можно продолжить. Известны углеводородные цепи, содержащие более сотни атомов углерода.
Пока что нам достаточно ознакомиться с первыми пятью членами этого ряда. Запишите их названия и эмпирические формулы.
Проверьте ответ в рубрике 14.
8. Неправильно.
Вернитесь к рубрике 17 и прочтите ее внимательно еще раз.
9. Вы добавили к этену и пропену только по одному атому водорода.
В реакции гидрирования к двойной связи присоединяются сразу 2 атома водорода.
Вернитесь к рубрике 47.
10. Правильно. Только алкены, например этилен и пропилен (этен и пропен), могут полимеризоваться.
При полимеризации этилен дает полиэтилен, а пропилен дает полипропилен.
Полиэтилен используют как прозрачный упаковочный материал, из него делают игрушки, посуду, ведра и много других изделий. Вы узнаете больше об этом и других синтетических материалах из программы 23.
Продолжим изучение ненасыщенных углеводородов.
До сих пор мы имели дело с алкенами, обладающими только одной двойной связью, как, например, этен и пропен. Известны, однако, и соединения с двумя или большим числом двойных связей.
В качестве примера рассмотрим бутадиен. Он получается из бутана введением в него двух двойных связей.
Запишите эмпирическую формулу бутадиена и вычислите его молекулярную массу. (Необходимые для вычислений атомные массы: С =12, Н=1.)
Молекулярная масса бутадиена равна
• 58 - 77
• 56 - 56
• 54 - 35
• Нуждаюсь в разъяснениях -» 75
И. Вы привели правильную эмпирическую формулу только для бутана, с4н10.
Этан имеет эмпирическую формулу С2Н6 (а не СН4, которая соответствует метану).
> t леводороды (I)
Пентан имеет эмпирическую формулу С5Н12 (а не С6Н14, которая соответствует гексану).
Вернитесь к рубрике 7.
12.
а)
И и н н
н, —- н-с-с-с-<*-н н н н н
н н н н н -с-с-н + Hs и
Перепишите эти уравнения, а затем с их помощью попытайтесь ответить на вопрос, поставленный в рубрике 23.
13. К атому углерода может присоединиться 4 атома водорода. Эмпирическая формула такого соединения СН4.
Запишите его структурную формулу.
Проверьте ответ в рубрике 20.
14. Метан СН4
Этан С2Н6
Пропан С3Н8
Бутан С4Н10
Пентан С5Н12
Рассматривая этот ряд, можно увидеть, что каждое следующее соединение имеет на один атом углерода и на два атома водорода больше, чем предыдущее.
Бутан имеет на одну группу СН2 больше, чем пропан, и на одну меньше, чем пентан.
Какой же, следовательно, должна быть эмпирическая формула углеводорода, следующего за пентаном?
• С6Н]2 - 32
• С6Н14 - 22
• С4Н10 -> 33
• Не понимаю вопроса -» 34
15. Неправильно. Воспользуйтесь уравнениями обсуждаемых реакций:
НН н н н н н
а) н-<{;-<^-<р-с' + н, —► H-<*;-<{:-^-<f-H
Н Н нН нннн
н н Н Н Н
В) н-{-6-(}-н — ¥•?-<}-« * н, н нн H н
Перепишите себе эти уравнения, а затем с их помощью попытайтесь еще раз ответить на вопрос, поставленный в рубрике 23.
172
Программа 8
16. Вы привели правильные эмпирические формулы только для этана С2Н6 и пентана С5Н12.
Бутан имеет формулу С4Н10 (а не С3Н8, которая соответствует пропану).
Вернитесь к рубрике 7.
17. Ваши структуршне формулы еще не вполне правильны. Три изомера пентана имеют такие структурные формулы:
। । । -с-с-с-с-с-I I I
।
в
а
Иных изомеров пентана не существует, но формулы а, б и в могут быть записаны другими способами, например
-с-с-с-с- -c-i-c-c- -c-i-c- <r’c'<r'<r' -с-с-с-
'v v 1 1 v 1 '-г- 1 1 1 1 -6-4-
1 .A. • ।
az a3 a« as
Все эти формулы эквивалентны формуле а. Формулы at -as изображают лишь изогнутые цепи, а не разветвленные структуры. Растяжение таких цепей приводит к структуре а. Проверьте это для каждой структурной формулы!
Точно так же следующие формулы эквивалентны формуле б
। । । । । । ill -с- । । । -С-С-С-
.’£’1 -с-с-с-с-с- ' 1 '
-С- '-С-1 V,.,!. 1 1 -с-с-
1 1
4 s3 Ъ Ъ
Растяжением или поворотами можно совместить их с формулой б. Проверьте это для каждой из формул.
Вариантом какой структуры-а, б или e-является приведенная ниже формула?
• а -> 2
• б ->24
• в -> 8
18. Вы забыли о важном требовании для осуществления полимеризации: молекула должна обладать двойной связью.
Углеводороды (I)
173
• • Итак, какие соединения способны полимеризоваться? Алкены -> 10 Алканы -> 37
19. Н 1 Н—С—Н метан; эмпирическая формула СН4 1 Н И Н —_ । । Е Н—С— С—Н этан; эмпирическая формула С2Н6 । 1
। । Н Н Продолжим этот ряд н н н 1 1 1 Н—С—С—С—Н пропан С3Н8 1 1 1 н н н бутан С4Н10 пентан С5Н12 Запомните эти названия! Впишите теперь структурные формулы бутана и пентана. Проверьте ответ в рубрике 7.
н
I Н—С—н
I н
Атомы углерода обладают важным свойством образовывать связи друг с другом. В случае двух атомов углерода возникает структура
I I
—С—С—
I I
Точно так же происходит образование цепи из трех, четырех, пяти и большего числа атомов углерода, например
I I !
—С—С—С—
I I I
Изобразите цепи из четырех и пяти атомов yi лерода.
Проверьте ответ в рубрике 27.
Программа 8
21. Вы забыли о важном требовании для осуществления полимеризации: молекула должна иметь двойную связь.
Итак, какие соединения способны полимеризоваться?
• Алкены -> 10
• Алканы -> 37
22. Правильно, после С5Н12 следует С6Н14.
Соединение С6Н14 называется гексан.
Постарайтесь запомнить названия и формулы шести углеводородов, обсуждавшихся до сих пор.
В каком из следующих вариантов приведены правильные формулы этана, бутана и пентана?
Этан Бутан Пентан
• сн4 с4н10 С6Н14 - 11
• сгн6 С3Н8 С5Н12 - 16
• с2н6 с4н]0 С5Н12 - 29
23. Гидрирование.
Известен и обратный процесс - удаление водорода с образованием двойной связи. Такая реакция называется дегидрирование:
НН,.. н н
1 1 дегидрирование \ У1
7 Т Гидрирование 1
Рассмотрим две реакции:
а) Бутен -> Бутан
б) Пропан -> Пропен
Являются ли обе эти реакции реакциями гидрирования, либо дегидрирования, или же одна из них относится к реакциям гидрирования, а другая-к реакциям дегидрирования?
• Обе являются реакциями дегидрирования -> 15
• Обе являются реакциями гидрирования -> 39
• Реакция а) является реакцией дегидрирования, а
реакция б)-реакцией гидрирования -> 5
• Реакция а) является реакцией гидрирования, а
реакция б)-реакцией дегидрирования -> 3
• Чтобы ответить на этот вопрос, нуждаюсь
в уравнениях указанных реакций -» 12
24. Правильно. Растяжением и поворотом указанной формулы можно совместить ее со структурой 6:
Vr.ieno/iopo.ibr (>
Теперь попытайтесь еще раз записать структурные формулы всех трех
изомеров пентана.
Проверьте ответ в рубрике 38.
25. Вы привели молекулярные массы этена и пропена.
Однако требовалось вычислить массы соединений образующихся при гидрировании этена и пропена.
Вернитесь к рубрике 47.
26. Соединение со структурной формулой и н
(или сн-сн=снр
8
имеет эмпирическую формулу С3Н6 и называется пропен (а не пропан, который имеет эмпирическую формулу С3Н8).
Пропен имеет еще другое название. Какое оно?
Проверьте ответ в рубрике 47.
1111
27. — С— С— С— С—
1111
I I I I I
—с—с—с—с—с— I I I I I
Цепь из шести атомов углеводорода выглядит так:
I I I I I I
-С- С С С С С
I I I I I I
Если все оставшиеся свободными валентности в таких углеродных цепях насыщаются связями с водородом, получаются углеводороды:
Н
I
Н—С—Н метан
I Н н н
I I
Н—С—С—Н этан
I I
н н
Запишите эмпирические формулы этих двух соединений. Проверьте ответ в рубрике 19.
176
Программа 8
28. Вы забыли о важном требовании для осуществления полимеризации: молекула должна иметь двойную связь.
• • Итак, какие соединения способны полимеризоваться? Алкены -» 10 Алканы -> 37
29. Правильно! Ряд углеводородов: метан СН4 этан С2Н6 пропан С3Н8 бутан С4Н10 пентан С5Н12 гексан С6Н14
является примером гомологического р.чда. Любые два последовательных члена таких рядов всегда отличаются на постоянное число атомов, в данном случае на группу СН2. Общая формула соединений этого гомологического ряда
Qi + z
Эта общая формула позволяет записать эмпирическую формулу любого соединения, принадлежащего к гомологическому ряду углеводородов с незамкнутой цепью. Приведем пример. Какова эмпирическая формула углеводорода, содержащего шесть атомов углерода? Из общей формулы СлН2П+2, зная, что п = 6, находим: С6Н2.6 + 2. Какое число атомов водорода содержится в этом углеводороде? Проверьте ответ в рубрике 36.
30. Алканы являются насыщенными углеводородами. Алкены являются ненасыщенными углеводородами. Как называется реакция присоединения водорода к алкенам? Проверьте ответ в рубрике 23.
31. -С- 1 1 1 1 1 Illi III -С’С-С-С-С- -с-с-с-с- -с-с-с- till! Illi III -с- -С- 1 1
Сравните составленные вами структуры с этими изомерами пентана. Совпадают ли они? Если да, переходите к рубрике 38. Если нет, обратитесь к рубрике 17.
32. Вы правильно указали, что следующий за пентаном углеводород должен иметь шесть атомов углерода. Однако вы неправильно указали число атомов водорода.
Прочтите еще раз внимательно рубрику 14.
Углеводороды (I)
177
33. Вы невнимательно прочли вопрос!
Требовалось записать эмпирическую формулу углеводорода, следующего за пентаном. Однако бутан С4Н10 находится перед пентаном в ряду углеводородов с незамкнутой цепью.
Прочтите еще раз внимательно рубрику 14.
34.
Ряд метан этан пропан бутан пентан
СН4 с2н6 С3Н8 с4н10 С5Н12
может быть продолжен. Следующее в нем соединение имеет на одну группу СН2 больше, чем пентан. Какова эмпирическая формула этого соединения?
Проверьте ответ в рубрике 22.
35. Правильно, бутадиен имеет эмпирическую формулу С4Н6 и молекулярную массу 54.
и н н н
бутадиен
Названия ненасыщенных соединений с одной двойной связью всегда имеют окончание -ен, например этен, пропен.
В названиях соединений с двумя двойными связями окончанию -ен предшествует суффикс ди (означающий два), например бута-ди-ен.
Дайте письменные ответы на следующие вопросы.
а) Сколько атомов водорода должно быть присоединено к бутадиену при его полном гидрировании?
б) Как называется соединение, которое образуется при полном гидрировании бутадиена?
Проверьте ответ в рубрике 42.
36. Число атомов водорода равно 2-6 + 2=14.
Следовательно, углеводород с незамкнутой цепью из 6 атомов углерода (гексан) имеет эмпирическую формулу С6Н14.
Итак, в незамкнутых углеводородах, принадлежащих к гомологическому ряду метана, число атомов водорода равно удвоенному числу атомов углерода плюс два.
Это сразу же становится понятным, если посмотреть на структурную формулу одного из соединений данного ряда, например гексана
Каждый атом углерода связан с двумя атомами водорода, кроме концевых групп, содержащих на один водород больше. (Концевые атомы Н выделены на этом рисунке жирным шрифтом.)
12-29
i78
Программа Я
Вот почему число атомов водорода превышает число атомов углерода вдвое и еще на два.
Выведенное здесь правило выражается общей формулой, с которой мы уже познакомились.
Какова общая формула гомологического ряда углеводородов с незамкнутой цепью (ряда метана)?
Сп.... Проверьте ответ в рубрике 43.
37. Вы не понимаете различия между алканами и алкенами. Начните еще раз с рубрики 40.
38. Ваш ответ правилен, если вы записали следующие структурные формулы:
-с-с-с-с-
•-г-' 1 ।
Чем длиннее углеродная цепь, тем больше число возможных изомеров. Это видно из следующих примеров:
бутан: 4 атома углерода, 2 изомера
пентан: 5 атомов углерода, 3 изомера
гексан: 6 атомов углерода, 5 изомеров
декан: 10 атомов углерода, 75 изомеров
(Если хотите, можете составить структурные формулы изомеров гексана. Они показаны в рубрике 44.)
Поскольку существуют два изопентана (см. выше формулы бив), для них нужны разные названия.
Чтобы понять, как образуются эти названия, нужно сначала дать определение метильной группы.
Метильную группу можно называть также метильный радикал, или метильный остаток. /
Знаете ли вы, что такое метильная группа? Если знаете, запишите ее формулу, включая атомы водорода, и проверьте ответ в рубрике 46. Если не знаете, в той же рубрике вы найдете объяснение.
39. Неправильно. Воспользуйтесь уравнениями обсуждаемых реакций:
НН Н н н н н
a) H-<]:-i-c-<f + н> — H-<j:-i-<J-^-H нн н " нннн
н н н н н
8) н-<£-ф-ф-н —• + н»
н н н "нн
Перепишите эти уравнения, а ответить на вопрос, поставленный
затем с их помощью попытайтесь еще раз в рубрике 23.
> I .icno.iopo 1Ы (I)
!7V
40. Гидрирование этена дает этан (молекулярная масса 30).
Гидрирование пропена дает пропан (молекулярная масса 44).
Поскольку этан и пропан не содержат двойных связей, они неспособны больше присоединять водород. Такие соединения насыщены водородом, поэтому их называют насыщенные углеводороды.
Завершите следующие предложения:
Алканы являются ... (насыщенными/ненасыщенными) углеводородами.
Алкены являются ... (насыщенными/ненасыщенными) углеводородами.
Проверьте ответ в рубрике 30.
41. ? » Ч V
“VW11 н н н н
н- Бутан
Н н н । । । н-с-с-с-н
А I н П I М н-с-н I н изобутан
Поскольку, для того чтобы различать изомеры, нужно следить только за атомами углерода, формулы в этих случаях можно изображать без указания атомов водорода. Это значительно упрощает формулы
1111 -с-с-с-
-с-с-с-с-1111 1 -с-' 1
бутан изобутан
Нормальный бутан (н-бутан) можно называть просто бутаном. Существует только один изомерный ему бутан-изобутан. Всякие попытки изобразить эту разветвленную цепь другими способами приводят к одному и тому же соединению. Вы убедитесь в этом, рассматривая приведенные ниже формулы: в принципе нет никакой разницы между различными способами изображения молекулы изобутана. Поворачивая эти формулы, можно совместить их друг с другом:
В случае пентана существуют три способа связать между собой пять атомов углерода. Это приводит к нормальному н-пентану и двум изопентанам. Запишите структуры этих трех изомеров пентана и убедитесь в том, что они действительно различаются. (Атомы водорода можете опустить.)
Проверьте ответ в рубрике 31.
42. а) Четыре атома водорода.
б) Бутан.
Ацетилен представляет собой еще одно важное ненасыщенное соединение. Он имеет два атома углерода, соединенных тройной связью.
180
Программа 8
Запишите структурную формулу ацетилена. Сколько атомов водорода содержится в его молекуле?
• 8 -> 82
• 6 -> 63
• 4 -> 81
• 2 ->51
43. Общая формула данного гомологического ряда (ряда метана)
Сп^2П+2
Рассмотрим еще один пример. Пусть требуется определить формулу девятого члена данного ряда. Полагая п = 9, находим
А теперь решите следующую задачу. Приведите эмпирическую формулу 15-го члена рассматриваемого гомологического ряда углеводородов.
Проверьте ответ в рубрике 50.
44. Ниже показаны структуры пяти изомеров гексана (без атомов водорода)
I I I I I I -с-с-с-с-с-с-I I I I I I
। । । । । -с-с-с-с-с-Ч-1 1 1
I I I I I
-V-c-c-V-c-
-с-с-с-с-
V
Вернитесь к рубрике 38.
45.
Теперь вам должно быть понятно название «метилбутан»: так называется соединение, которое образовано из бутана замещением одного из атомов водорода на метильную группу.
нннн
н-с-с-с-с-н 1111 нннн
нннн 1111
н-с-с-с-с-н
1 I I 1 н н н
H-(j!-H
Как вы уже знаете, формула метилбутана может быть записана различными способами, однако все они эквивалентны. Все показанные ниже формулы соответствуют одной и той же молекуле
Углеводороды (I)
181
с-с-с '-г-1 । -с-I
в
Ради простоты в таких случаях отдают предпочтение формуле, имеющей наиболее длинную горизонтальную углеродную цепь.
Какая формула удовлетворяет этому требованию в случае метилбутана?
• а -> 52
• б ->66
• в -> 64
• г -> 62
46. Метильная группа (иначе метильный остаток или метильный радикал) получается из метана в результате удаления одного атома водорода:
V н
н-с-н н-С-Н Н
метан метил
Метильный радикал сам по себе неустойчив, но метильная группа присутствует • во множестве соединений, где она связана с другими элементами или группами (например, —О, —СН3, —С2Н5 или —ОН). Эти соединения будут описаны позже.
Аналогичным образом этильная группа получается удалением атома водорода из этана, пропильная группа-из пропана, бутильная группа-из бутана и т. д.
Запишите недостающие структуры:
Н
I
метил Н—С— (или Н3С—)
I
Н
этил
пропил бутил
Проверьте ответ в рубрике 53.
47. Правильно. Другое название пропена-пропилен.
Все алкены содержат по крайней мере одну двойную связь. Двойная углерод-углеродная связь обладает повышенной реакционной способностью: реакции алкенов с другими атомами или молекулами протекают в результате присоединения по этой связи.
Примером присоединения по двойной связи является гидрирование. В этой реакции к алкену присоединяется два атома водорода.
182
llpoipaMMa 8
Гидрирование легче протекает в присутствии катализаторов типа платины или никеля; в таких случаях говорят о каталитическом гидрировании.
Решим теперь такую задачу. Какие соединения образуются при гидрировании: а) этена, б) пропена? Укажите эмпирические формулы и молекулярные массы продуктов. (Необходимые для вычислений атомные массы: С = 12, Н = 1.)
• а) 28 б) 42 -> 25
• а) 29 б) 43 -> 9
• а) 30 б) 44 -> 40
• Нуждаюсь
в разъяснениях -> 4
48. Правильно. Ветвление трехчленной углеродной цепи, как в молекуле пропана, невозможно. (Более подробное объяснение вы найдете в рубрике 49.) Ветвление становится возможным в цепочках, содержащих не менее четырех атомов углерода.
Запишите структурные формулы н-бутана и изобутана.
Проверьте ответ в рубрике 41.
49. Пропан не имеет изомеров.
Возможно, вы записали для пропана такие формулы:
-С-6-С- 1 1 1 II II -С-С- -с-?-
а б в
однако эти формулы идентичны; структуры б и в не соответствуют разветвленным молекулам.
Следует учитывать, что реальные молекулы представляют собой трехмерные, пространственные структуры. Наши рисунки являются лишь двумерными, плоскостными изображениями реальных молекул. Мы изображаем эти формулы линейно, под прямыми углами и симметрично лишь для наглядности. Однако такие формулы определяют лишь последовательность связанных между собой атомов, а не пространственную структуру молекулы.
В действительности углеводороды с незамкнутой цепью существуют не в виде жестких, вытянутых цепей, а в виде зигзагообразных, волнистых спиралей или сложно изогнутых форм, особенно если это длинные цепи. Другими словами, атомы связаны друг с другом не жестко, а образуют структуры, которые могут сгибаться или вращаться вокруг некоторых связей.
Поэтому изогнутые формулы бив, указанные выше, не имеют ничего общего с настоящим ветвлением. Выпрямляя такие формулы, можно прийти к формуле а
I 6 а
I l III
--С-С- ---► -С-С-С-
С.А. ' ' 1
т В а
Углеводороды (I)
183
Таким образом, три формулы-а, б и в-соответствуют не изомерам, а просто трем разным способам изображения одной и той же молекулы.
Ветвление становится возможным только при наличии в цепи четырех или большего числа атомов углерода; это и приводит к появлению изомеров.
Запишите структурные формулы н-бутана и изобутана.
Проверьте ответ в рубрике 41.
50. С15Н32
(Если ваш ответ не совпадает с этим, проработайте еще раз материал, начиная с рубрики 29.)
Атомы углерода могут соединяться друг с другом не только в неразветвленные цепи, как это рассматривалось до сих пор, но также образовывать разветвленные цепи.
Приведем такой пример:
। । । til
-с-с-с-с- -с-с-с-
III til
-с-।
Соединение слева представляет собой неразветвленный бутан, с которым мы уже познакомились. (Для упрощения здесь не указаны атомы водорода.)
Соединение справа тоже содержит четыре атома углерода, но в этом случае они образуют разветвленную цепь (атомы водорода тоже не указаны).
Перепишите эти структурные формулы, добавьте к ним атомы водорода и приведите эмпирические формулы этих двух соединений.
Проверьте ответ в рубрике 57.
51. Ацетилен С2Н2: Н—С=С—Н
Другое название ацетилена-этин. Класс углеводородов, содержащих по крайней мере одну тройную связь, называется алкины.
Ацетилен можно гидрировать. Сколько атомов водорода при этом присоединится к нему?
• 2 58
• 4 -<-80
• 6 ->76
52. Правильно. Изображенный ниже изомер пентана
5-
представляет собой метилбутан.
А как, по-вашему, должен называться еще один изомер пентана?
Тетраметилметан -> 70
Триметилэтан -> 68
Диметилпропан —> 60
184
Программа 8
53. 11 н н н5-с5-?-н н н нннн
тип СэН,- пропил бутил СзН7“ С4Н9-
Названия радикалов (остатков, или групп) образуются от названий соответствующих алканов изменением окончания -ан на -ил. (В приведенных выше примерах исходными алканами являются этан, пропан и бутан.)
Спишите начало следующей таблицы и продлите ее до гексана:
Метан СН4 Метил СН3—
Этан С2Н6 Этил С2Н5—
Проверьте таблицу в рубрике 59.
54. Правильно, на 4 атома водорода меньше. А теперь вернитесь к рубрике 10.
55. С2Н4 С3Н6
этен (или этилен) пропен (или пропилен)
Какую структуру имеет этен?
Мы знаем, что у этена С2Н4 на два атома водорода меньше, чем у этана
С2Н6. if у
Этан имеет структуру н-(^-(р-н
н н
Удаляя два атома водорода, получим свободный радикал с двумя неспаренными электронами которые, однако, могут связываться друг с другом в новую электронную пару но это то же самое, что и новая связь, обозначаемая как обычно валентным штрихом
Таким образом, два атома углерода соединены теперь двумя штрихами, изображающими две связи. Такую связь называют двойная связь.
Как называется следующее соединение?
• Пропан -> 26
• Бутен -» 74
• Пропен -> 4П
Углеводороды (I)
185
56. Вы вычислили молекулярную массу бутена, но бутен имеет только одну двойную связь, а не две.
Вернитесь к рубрике 10.
н н н н lilt н-с-с-с-с-н 1111 н н н н
ttjC-CH^CH^CHg
С4Н,о
н н н
I I I н-с-с-с-н н | и н-с-н
I н
НдС-СН-СНз снэ
С«Н10
Как видите, существуют два соединения с формулой С4Н10! Соединения с одинаковой эмпирической формулой, но разными структурными формулами называются изомеры. Два показанных выше бутана являются изомерными соединениями. Они представляют собой вещества с различной молекулярной структурой и различными свойствами, например с разными температурами плавления и кипения.
Но различные соединения должны иметь и разные названия. Линейный бутан, структурная формула которого показана слева, называется нормальный бутан, или н-бутан. Разветвленный бутан (его структура показана справа) называется изобутан (так как он изомер нормального, неразветвленного, бутана).
Посмотрим, какие из соединений, представленных до сих пор, имеют изомеры.
Метан СН4 и этан С2Н6 не имеют изомеров.
Возможно ли ветвление в цепи пропана, т.е. существует ли изомер пропана?
Прежде чем ответить на этот вопрос, запишите структурную формулу пропана!
• Да -> 49
• Нет ->48
58. Можно начать с присоединения к ацетилену двух атомов водорода. При этом из ацетилена С2Н2 получится этен С2Н4. Однако этен может присоединить еще 2 атома водорода, образуя этан С2Н6. Следовательно, к ацетилену может присоединиться, четыре атома водорода.
Все упомянутые до сих пор углеводороды присутствуют в нефти и могут быть выделены из нее. Этот процесс подробнее описан в следующей программе.
Однако ацетилен можно получать не только в процессе переработки нефти, но и другими способами, которые мы опишем здесь.
Первый способ получения ацетилена.
Ацетилен получается при добавлении воды к карбиду кальция СаС2. При этом одновременно с ацетиленом образуется также гидроксид кальция.
Запишите уравнение этой реакции.
Проверьте ответ в рубрике 65.
I8(
Программа 8
59.
Метан сн4 Метил СН3—
Этан СгН6 Этил С2Н5-
Пропан С3На Пропил С3Н7-
Бутан с4н10 Бутил С4Н9-
Пентан С5Н12 Пентил С5НИ-
Гексан с6н14 Гексил с6н13-
Теперь вы знакомы с алкильными гру
[, как, например, метильная, этильная группа и т.д. Запишите структурную формулу для метильной группы, включая атомы водорода.
Проверьте ответ в рубрике 45.
60. Правильно, изомер пентана со структурой
-с-с-с-' -с-1
называется диметилпропан.
Теперь вы знаете, что наличие изомеров зависит от возможности существования разветвленных и неразветвленных углеродных цепей.
Попытайтесь дать определение изомера:
Изомерами называются соединения с одинаковой ... формулой, но различными ....
Завершите это предложение и проверьте ответ в рубрике 67.
61. Бутен С4Нв.
Этен известен также под названием этилен, а пропен-под названием пропилен.
Запишите эмпирические -формулы и по два разных названия для каждого из этих соединений.
Проверьте ответ в рубрике 55.
62. Выбранная вами структура имеет только два атома углерода в горизонтальной цепи (они выделены жирным шрифтом):
Однако среди структур, показанных в рубрике 45, можно найти имеющие более длинные горизонтальные цепи.
Вернитесь к рубрике 45.
63. Указанное вами число атомов водорода слишком велико! Внимательно посмотрите на следующие записи:
н н
этан С2Н6: н-^-ф-н
> i леводороды (I)
1X7
этен С2Н4:
ацетилен С2Н...: -С»С-
Сколько атомов водорода содержится в ацетилене? Проверьте ответ в рубрике 51. <
64. Выбранная вами структура имеет только три атома углерода в горизонтальной цепи
। ।
-I-
I
Однако среди структур, показанных в рубрике 45, можно найти такую, которая имеет более длинную горизонтальную цепь.
Вернитесь к рубрике 45.
65. СаС2 + 2Н2О->С2Н2 + Са(ОН)2
Карбид кальция получают в промышленности из углерода и негашеной извести под действием электрической дуги, в которой развивается температура 2200 °C.
Второй способ получения ацетилена.
Метан быстро пропускают через электрическую дугу, в центре которой развивается температура 20000°С*. В результате образуются ацетилен и водород, а также другие продукты.
...СН4 - С2Н2 + ... Н2
Завершите это уравнение, расставив в нем недостающие коэффициенты.
Проверьте ответ в рубрике 73.
66. Выбранная вами структура имеет только три атома углерода в горизонтальной цепи:
।
Однако среди структур, показанных в рубрике 45, можно найти такую, которая имеет более длинную горизонтальную цепь.
Вернитесь к рубрике 45.
67. Изомерами называются соединения с одинаковой эмпирической формулой, но различными структурами.
Число атомов водорода в разветвленных и неразветвленных углеводородных молекулах нетрудно подсчитать; оно равно удвоенному числу
* Для осуществления подобной реакции (электрокрекинга метана) достаточна температура 1600°С.- Прим. ред.
188
Программа 8
атомов углерода плюс два. Какой вид имеет общая формула, выражающая это соотношение?
Запишите ее и проверьте ответ в рубрике 72.
68. Название триметилэтан для изомера пентана со структурой
в принципе нельзя считать неправильным, но оно не является систематическим и поэтому не используется*. Названия соединений образуются от наиболее длинной (записанной горизонтально) углеродной цепи, имеющейся в них.
Рассматриваемое соединение имеет трехуглеродную цепь и поэтому не должно быть отнесено к производным этана.
Вернитесь к рубрике 45.
69. Этен, пропен и бутен являются алкенами. Другое название алкенов-олефины.
Алкены имеют на два атома водорода меньше, чем соответствующие алканы.
Внимательно изучите следующую таблицу и завершите ее.
Этан С2Н6 Этен С2Н4
Пропан С3Н8 Пропен С3Н6
Бутан С4Н10 Бутен
Впишите сюда формулу бутена и проверьте ответ в рубрике 61.
70. Название тетраметилметан для изомера пентана со структурой
-6-
в принципе нельзя считать неправильным, но оно не является систематическим и поэтому не используется *. Названия соединений образуются от наиболее длинной (записанной горизонтально) углеродной цепи, имеющейся в них.
Рассматриваемое соединение имеет трехуглеродную цепь и поэтому не должно быть отнесено к производным метана.
Вернитесь к рубрике 45.
н н н н н и । । । । । । н-с-с-с-с-с-с-н
। । । । । । н н н н н н
гексан
циклогексан
* Это название построено по принципам рациональной (радикало-функциональной) номенклатуры, которая также находит применение наряду с рассматриваемой здесь «систематической» (точнее-заместительной) номенклатурой.-Прим. ред.
Углеводороды (I)
189
Чтобы замкнуть цепь гексана в кольцо, приходится удалить два концевых атома водорода (указанные жирным шрифтом).
Названия углеводородов, которые мы обсуждали до сих пор, имеют окончание -ан (например, этан, диметилпропан, циклогексан).
Общее название этих соединений алканы (или парафины).
Обратите внимание, что название «алкан» тоже имеет окончание -ан.
Существует еще другой класс углеводородов, которые называются алкены (или олефины).
Названия алкенов имеют окончание -ен.
К какому классу принадлежат этан, пропан и бутан? Они принадлежат к классу ....
Проверьте ответ в рубрике 78.
72. С„Н2я + 2
Существуют и такие углеводороды, которые не соответствуют этой общей формуле.
Например, существуют углеводороды, имеющие только вдвое больше атомов водорода по сравнению с атомами углерода. Такие соединения образуются, когда протяженная углеводородная цепь замыкается в кольцо. Поэтому они называются
циклические углеводороды (цикл означает кольцо).
Важным примером подобных соединений является циклогексан. Он имеет такую структуру:
Запишите эмпирические формулы для гексана и циклогексана и сравните их. В чем заключается отличие?
Проверьте ответ в рубрике 79.
73. 2СН4 -> С2Н2 + ЗН2
Конец программы 8.
74. Бутен содержит 4 атома углерода.
Соединение со структурной формулой
имеет эмпирическую формулу С3Н6 и называется пропен. Какое другое название имеет это соединение? Проверьте ответ в рубрике 47.
1*Л1
Программа Н
75. В молекуле бутана 4 атома углерода и 10 атомов водорода.
нннн
н-«-«н нннн
Мы уже знаем, что при образовании одной двойной связи высвобождаются два атома водорода.
Бутадиен имеет две двойные связи и, следовательно, на ... атома водорода меньше, чем бутан.
Завершите это предложение и проверьте ответ в рубрике 54.
76. Чтобы присоединить к ацетилену 6 атомов Н, следовало бы разорвать все углерод-углеродные связи. Однако в процессе гидрирования двойных или тройных связей простая связь между атомами углерода сохраняется.
Вернитесь к рубрике 51.
77. Вы вычислили молекулярную массу бутана. Бутадиен имеет 4 атома углерода, но меньше атомов водорода, чем бутан, поскольку у него две двойные связи.
Вернитесь к рубрике 10.
78. Этан, пропан и бутан принадлежат к классу алканов (иначе, парафинов). Названия алкенов выглядят очень похожими на соответствующие алканы, поэтому читать их нужно внимательно!
Соответствующими алкенами являются этен, пропен и бутен.
Завершите следующее предложение. Этен, пропен и бутен являются ....
Проверьте ответ в рубрике 69.
79. Циклогексан: С6Н12; гексан: С6Н14.
Циклогексан имеет на два атома водорода меньше, чем гексан.
Чтобы замкнуть цепь гексана в кольцо, приходится удалить два концевых атома водорода.
Запишите структурные формулы гексана и циклогексана, включая атомы водорода. Проверьте ответ в рубрике 71.
80. Правильно. Гидрирование, однако, можно остановить и после присоединения лишь двух атомов водорода. При этом тройная связь превращается в двойную.
Какое соединение образуется при присоединении двух атомов водорода к ацетилену?
Назовите его и напишите эмпирическую формулу. Ответ проверьте в рубрике 58.
81. Указанное вами число атомов водорода слишком велико.
Внимательно посмотрите на следующие записи:
V н
этан С2Н6: н н
У 1 леводороп.
l*»i
этен С2Н4:
н
•с' н
ацетилен С2Н... -С»С-
Сколько атомов водорода содержится в ацетилене? Проверьте ответ в рубрике 51.
82. Неправильно. Присоединение восьми атомов водорода к двум атомам углерода возможно только в двух молекулах метана: 2СН4.
Внимательно посмотрите на следующие записи:
этан С2Н6: X х-и-х х-и-х X
этен С2Н4: % S н н
ацетилен С2Н... -ос-
Сколько атомов водорода содержится в ацетилене? Проверьте ответ в рубрике 51.
Программа 9
5 । леводороды (II)
1. В предыдущей программе мы рассматривали незамкнутые и циклические углеводороды, которые имеют общее название алифатические углеводороды.
В настоящей программе мы займемся особым классом циклических углеводородов-ароматическими углеводородами.
Вы уже знакомы с таким циклическим углеводородом как циклогексан
С6Н12. Запишите его структурную формулу.
Проверьте ответ в рубрике 7.
9
2. Вы путаете названия важных процессов.
Полимеризация -это образование очень больших молекул из множества малых молекул.
Гидрирование-это присоединение водорода.
Дегидрирование-это отщепление (элиминирование) водорода.
Вернитесь к рубрике 14.
3. Вы путаете понятия «ги а^чрование» и «дегидрирование».
Гидрирование-это присоединение водорода по двойной связи, как, например, в реакции
Дегидрирование представляет собой обратную реакцию, отщепление водорода, как, например, в реакции
С6Н12 - С6Н6 + зн2
циклогексан бензол
Получение бензола из циклогексана представляет собой .... Завершите это предложение и проверьте ответ в рубрике 21.
4. Вы подсчитали все связи в молекуле бензола, включая углерод-водородные связи. Однако требовалось указать лишь число связывающих электронов между шестью атомами углерода.
Вернитесь к рубрике 19.
5. алифатическими соединениями ароматическими соединениями Алифатические углеводороды подразделяются на 1) насыщенные углеводороды-алканы (или парафины), например метан, изобутан, циклогексан;
2) ненасыщенные углеводороды:
а) с двойными связями-алкены (или олефины), например этен, пропен, б) с тройными связями-алкины, например этин( = ацетилен).
Запишите полные структурные формулы упомянутых выше молекул.
Углеводороды (II)
193
Помните, что углерод всегда четырех валентен. Убедитесь, что в ваших формулах каждый атом углерода имеет четыре и только четыре валентные связи.
Проверьте ответ в рубрике 12.
6. Подумайте над вашим ответом.
Действительно ли перегонка является химическим процессом? Возможно, вы обнаружите вашу ошибку.
Вернитесь к рубрике 15.
циклогексан
Существует другой циклический углеводород, содержащий также шесть атомов углерода в кольце,-бензол С6Н6.
Сравнивая формулы бензола и циклогексана, вы убедитесь, что бензол имеет меньше атомов водорода.
На сколько меньше атомов водорода у бензола по сравнению с циклогексаном?
Запишите ответ и проверьте его затем в рубрике 14.
8. Каждая связь (каждый валентный штрих) в структурной формуле химического соединения соответствует электронной паре, т.е. двум связывающим электронам.
Подсчитайте число связей (валентных штрихов) между шестью атомами углерода в молекуле бензола и умножьте это число на 2, тогда вы получите искомое число электронов. Структурная формула бензола приведена в рубрике 19.
9. Подумайте над вашим ответом.
Действительно ли перегонка является химическим процессом? Возможно, вы обнаружите вашу ошибку.
Вернитесь к рубрике 15.
10. Нет, они вовсе не являются полимерами!
Полимеры-это очень большие молекулы, образованные из множества малых молекул.
Совершенно очевидно, что ксилолы не относятся к таким молекулам.
Вернитесь к рубрике 29.
11. Правильно, 9 связей между шестью атомами углерода в молекуле бензола соответствуют 18 связывающим электронам.
13-29
J94
i Spui рамчм
Структурная формула бензола
н
правильно указывает число связывающих электронов в молекуле бензола, но не их распределение между шестью атомами углерода. В действительности эти 18 электронов не распределены между тремя двойными и тремя простыми связями. На самом деле все связи между шестью атомами углерода в бензоле эквивалентны и представляют собой нечто промежуточное между простыми и двойными связями. Эквивалентность этих связей означает, что электроны между ними распределены равномерно.
Таким образом, в среднем, между любой парой соседних атомов углерода в бензоле должно быть ... связывающих электрона.
Укажите пропущенное число электронов и проверьте ответ в рубрике 20.
12. Проверьте записанные вами структурные формулы и исправьте ошибки, если вы их допустили.
Алифатические углеводороды
1) насыщенные углеводороды-алканы (или парафины)
H-i-H । н
циклогексан
метан
2) ненасыщенные углеводороды
а) с двойной связью-алкены (йли олефины)
нч ,н н
.с'сч 'с-с-сн,
НН н ii
этен пропен
б) с тройной связью-алкины
н-с=с-н
этин (ацетилен)
А теперь дайте определения алканов, алкенов и алкинов, завершив следующие предложения.
Алканы (или парафины)-это ... алифатические углеводороды.
Алкены (или олефины)-это ... алифатические углеводороды с .....
Алкины-это ... алифатические углеводороды с .....
Проверьте ответ в рубрике 25.
13. Дизельное топливо (газойль) поддается перегонке.
Его температура кипения указана в рубрике 74. Вернитесь к этой рубрике и попытайтесь еще раз ответить на поставленный там вопрос.
S I ЮНО iopo.11.1 ill)
195
14. Бензол имеет на шесть атомов водорода меньше, чем циклогексан. При получении бензола из циклогексана эти шесть атомов водорода приходится удалить.
С6Н12 - С6Н6 + зн2 циклогексан бензол
Как называется такая химическая реакция?
Гидрирование -» 3
Полимеризация -» 2
Дегидрирование -» 21
Не знаю -> 22
15. Правильно, асфальт и мазут не поддаются перегонке. Поэтому они являются остатком перегонки нефти.
Фракции, полученные первичной перегонкой нефти, имеют лишь ограниченное прямое применение, главным образом как горючие. Часть полученного при перегонке нефти бензина, керосина, дизельного топлива (газойля) и смазочных масел подвергают дальнейшей переработке, что позволяет получать важнейшие вещества для химической промышленности.
Существуют три главных метода переработки нефти:
1. Повторная перегонка, позволяющая разделить смеси на индивидуальные углеводородные фракции.
2. Крекинг более тяжелых углеводородов с образованием более легких.
3. Дегидрирование циклических алифатических углеводородов, превращающее их в ароматические углеводороды.
Один из указанных выше методов переработки нефти представляет собой чисто физический процесс; два других являются химическими процессами. Укажите-какие процессы являются химическими.
• Перегонка и крекинг -» 9
• Крекинг и дегидрирование -» 31
• Перегонка и дегидрирование -> б
Е
16. Неправильно. Обратите внимание на то, что одна двойная связь образуется в результате высвобождения двух атомов водорода.
Вернитесь к рубрике 21.
17. Неправильно. Обратите внимание на то, что одна двойная связь образуется в результате высвобождения двух атомов водорода.
Вернитесь к рубрике 21.
18. Неправильно. Обратите внимание на то, что одна двойная связь образуется в результате высвобождения двух атомов водорода.
Вернитесь к рубрике 21.
13»
196
Программа 9
I Н бензол
Каждый атом углерода в бензоле как всегда четырехвалентен.
Подсчитайте валентности каждого атома углерода в приведенной выше формуле, чтобы убедиться в этом.
Хотя для бензола принято пользоваться приведенной выше структурной формулой, она правильно описывает только общее расположение атомов, но не распределение связывающих электронов между шестью атомами углерода.
Напоминаем, что каждая валентная связь (валентный штрих) соответствует двум связывающим электронам.
Сколько всего связывающих электронов распределено между шестью атомами углерода в бензоле?
• 9 ->26
• 18 ->11
• 24 ->4
• Нуждаюсь в разъяснениях -> 8
20. Между любой парой соседних атомов углерода в бензоле в среднем находится 3 связывающих электрона.
Другими словами, можно формально считать, что на каждый атом углерода в бензоле приходится три связывающих электрона. Два из этих электронов используются на образование простых связей между атомом углерода и двумя соседними с ним другими атомами углерода. Оставшийся электрон идет на образование двойной связи. Однако двойные связи в молекуле бензола нельзя считать строго закрепленными: все шесть углерод-углеродных связей совершенно одинаковы. Как это объяснить? Можно сказать, что двойные связи в бензоле не имеют определенного положения. Иначе это можно выразить, сказав, что каждая углерод-углеродная связь в бензоле имеет порядок связи (кратность) 1,5, как это схематически показано в приведенной ниже формуле а. Поскольку шесть «избыточных» электронов не жестко связаны с определенными атомами углерода, а могут перераспределяться между ними, можно схематически изобразить это при помощи формулы б, где пунктирные линии символизируют «половинки» двойных связей. Вместо формул а и б можно воспользоваться формулой в, где кружок в центре символизирует шесть электронов, равномерно распределенных между шестью атомами углерода.
Подведем краткий итог сказанному выше:
Из 18 электронов, связывающих шесть атомов углерода в бензоле, 12
Углеводороды (II)
197
используются попарно для образования шести простых связей между этими атомами, а остальные шесть электронов равномерно распределены между всеми шестью атомами углерода.
Это следует иметь в виду, пользуясь обычной структурной формулой бензола с чередующимися простыми и двойными связями, которая приведена в рубрике 19.
Запишите эту формулу еще раз. Лучший способ выучить и запомнить структурные формулы часто рисовать их! Переходите к рубрике 27.
21. Правильно. Эта реакция представляет собой дегидрирование.
Ненасыщенные соединения образуются при дегидрировании насыщенных углеводородов. Ненасыщенными соединениями называются те, которые содержат двойные или двойные связи.
Бензол образуется в результате дегидрирования циклогексана. В этом процессе высвобождается шесть атомов водорода. Сколько двойных связей имеется в бензоле?
• Одна -» 16
• Две - 17
• Три -► 28
• Четыре -» 18
22. Присоединение водорода по двойной связи представляет собой реакцию гидрирования, например
нч И НН
zc-c' + н2 —* н-с-с-н
НН А А
Дегидрирование-это обратная реакция, т.е. отщепление водорода, например С6Н12 - С6Н6 + зн2
циклогексан бензол
Итак, реакцией какого типа является превращение циклогексана в бензол? Проверьте ответ в рубрике 21.
23.
орто-ксилол мета-ксилол пара-ксилол
Других изомеров диметилбензола не существует. Любая попытка расположить по-другому две метильные группы приводит лишь к формам, которые эквивалентны показанным выше. Проверьте это утверждение, рассматривая следующие формулы (и поворачивая их, если необходимо).
198
Про1рамма 9
Итак, сколько же изомеров существует у ксилола? Проверьте ответ в рубрике 29.
24. Нет, они не являются изотопами.
Изотопы-это не химические соединения, а элементы. Изотопы имеют одинаковый атомный номер, заряд ядра, число электронов и занимают одно и то же место в периодической таблице. Они различаются только атомными массами.
Вернитесь к рубрике 29.
25. Алканы (или парафины)-это насыщенные алифатические углеводороды.
Алкены (или олефины)-это ненасыщенные алифатические углеводороды с двойной связью.
Алкины-это ненасыщенные алифатические углеводороды с тройной связью.
Обратимся теперь к рассмотрению свойств углеводородов.
Как видно из следующей таблицы, при комнатной температуре и атмосферном давлении углеводороды могут существовать в форме газов, жидкостей или в твердом состоянии (числа в скобках после названий углеводородов означают их молекулярные массы):
газы: например, метан (16), этан (30), пропан (44), этен (28), ацетилен (26) жидкости: например, гексан (86), циклогексан (84), бензол (78), толуол (92) твердые вещества: например, нафталин (128).
Обратите внимание, что физическое состояние вещества зависит от его молекулярной массы!
Завершите следующие предложения:
а) Вещества с малой молекулярной массой обычно являются ....
б) Вещества со средней молекулярной массой обычно являются ....
в) Вещества с большой молекулярной массой обычно являются .......
Проверьте ответ в рубрике 33.
26. Вы подсчитали лишь число связей между шестью атомами углерода в бензольном кольце. Напоминаем, что каждая связь соответствует двум электронам.
Вернитесь к рубрике 19.
*• н.нолороды 1 lh
199
27.
н
Вместо подробной структурной формулы бензола, изображенной здесь слева, часто используется упрощенная формула, показанная справа.
Известно много производных бензола, в которых один или несколько атомов водорода замещены группами —СН3, —С1, —NO2, —ОН или другими атомами либо группами.
Толуол-это соединение, которое получается из бензола в результате замещения одного атома водорода на метильную группу *. Какую эмпирическую формулу имеет толуол?
• С7Н7 42
• С7Н8 - 34
• С7Н6 - 45
• Нуждаюсь в разъяснениях -> 49
28. Правильно. Бензол содержит 3 двойные связи.
При записи структурной формулы бензола простые и двойные связи чередуются между шестью атомами углерода в кольце. Следовательно, у каждого атома углерода остается еще по одной свободной валентности, которая используется на образование связи с атомом водорода.
Ниже приведена незавершенная структурная формула бензола. Дорисуйте в ней недостающие связи.
Л нс с с н н с с с н н
Проверьте ответ в рубрике 19.
29. Правильно. Существует только три ксилола.
Они различаются приставками орто-, мета- и пара- (или о-, м- и и-).
Все три ксилола имеют одинаковые эмпирические формулы, но различные структуры.
Подобные соединения называются
• Изотопы -» 24
• Полимеры -> 10
• Изомеры -» 38
• Алканы -» 36
* Следует подчеркнуть, что речь идет о формальной, мысленной операции, а не о реальном синтезе,- Прим. ред.
200
Программа 9
30. Вы еще не усвоили названия углеводородов.
Вернитесь снова к рубрике 1 и проработайте тщательно весь материал программы вплоть до рубрики 82.
9
31. Правильно. Крекинг и дегидрирование являются химическими процессами. Рассмотрим теперь эти два метода переработки нефти более подробно. Крекинг-это процесс расщепления больших молекул (содержащих приблизительно 10-20 атомов углерода) на меньшие (содержащие всего 2-4 атома углерода).
Крекинг углеводородов осуществляется их кратковременным нагреванием до высоких температур в газообразном состоянии.
Повторим: превращение больших углеводородных молекул в меньшие называется ....
Проверьте ответ в рубрике 39.
32. Вы привели правильное название только для пара-ксилола. Вернитесь к рубрике 37.
33. газами жидкостями твердыми веществами Указать четко определенные границы между этими физическими состояниями (например, задав соответствующие значения молекулярной массы) невозможно, поскольку температуры кипения и плавления веществ зависят не только от их молекулярной массы, но также и от других факторов. Тем не менее, как показывает следующая таблица, в пределах определенного гомологического ряда происходит последовательное повышение температуры кипения.
Молекулярная масса Температура кипения, °C
Метан 16 - 161
Этан 30 -89
Пропан 44 -42
Бутан 58 -0,5
Пентан 72 + 36
Гексан 86 + 69
(Запоминать эти численные данные не требуется!)
Ниже указаны три соединения с их молекулярными массами (в скобках): толуол (92), ксилол (106), бензол (78).
Расположите эти соединения в ряд в соответствии с повышением температуры кипения, так чтобы соединение с наименьшей температурой кипения стояло в этом ряду слева.
Проверьте ответ в рубрике 51.
34. Толуол имеет эмпирическую формулу С7Н8.
Структурную формулу толуола можно получить, заменив в формуле бензола один атом водорода на метильную группу.
Запишите структурную формулу толуола и проверьте ответ в рубрике 43.
> 1.1ево.(<>ро.1ы (II)
35. Вы еще недостаточно усвоили названия углеводородов. Повторите материал, начиная с рубрики 43.
36. Алканы-это насыщенные углеводороды. Их названия имеют окончание -ан, например этан или гексан. Ксилол-это не алкан.
Вернитесь к рубрике 29.
37. Возможно, вы обратили внимание на то, что существуют три разных варианта расположения метильных групп у бензольного кольца ксилола. Ваш ответ правилен, если вы изобразили любую из трех показанных ниже структур:
СН1
СИ)
орто-ксилол мета-ксилол пара-ксилол
(или о-ксилол) (или м-ксилол) (или п-ксилол)
Существуют ли еще другие ксилолы, т.е. возможны ли иные варианты расположения двух метильных групп у бензольного кольца, приводящие к соединениям, отличающимся от показанных выше?
• Да -► 23
• Нет -► 29
38. Правильно. Такие соединения являются изомерами. Все изомерные ксилолы имеют одинаковую эмпирическую формулу (С8Н10), но разные структуры.
Запишите структурные формулы трех разных ксилолов, пользуясь упрощенной формулой для бензола.
Проверьте ответ в рубрике 46.
39. крекинг
Важнейшими продуктами крекинга являются этен, пропен и изомерные бутены*. Как видно, здесь преобладают ненасыщенные углеводороды.
Ниже приведена возможная схема крекинга молекулы, содержащей 10 атомов углерода. Показанные на схеме молекулы служат только примерами возможных продуктов, среди которых могут находиться как большие, так
и меньшие углеводородные молекулы:
н
н н
I I
с-с
А н
* Перечисленные газообразные алкены действительно важны как химическое сырье. Однако не менее важно и образование при крекинге алканов с 5-8 атомами углерода; они входят в состав крекинг-бензина,- Прим. ред.
Запишите названия четырех показанных здесь продуктов. Проверьте ответ в рубрике 56.
40. Вы привели правильное название только для орто-ксилола. Вернитесь к рубрике 37.
41. Вы еще недостаточно усвоили названия углеводородов. Повторите материал, начиная с рубрики 43.
42. Неправильно. Бензол имеет формулу С6Н6. Толуол получается из бензола при замещении одного атома водорода (Н) на метильную группу (СН3).
Какова эмпирическая формула толуола?
Проверьте ответ в рубрике 34.
43.
или
CHj
Ксилол получается из бензола аналогичным образом: в результате замещения двух атомов водорода на метильные группы *.
Какова эмпирическая формула ксилола?
• С7Н7 - 54
• С8Н10 - 50
• С8Н12 —► 57
44. Вы еще недостаточно усвоили названия углеводородов. Повторите материал, начиная с рубрики 43.
45. Неправильно. Бензол имеет формулу С6Н6. Толуол получается из бензола при замещении одного атома водорода (Н) на метильную группу (СН3).
Какова эмпирическая формула толуола?
Проверьте ответ в рубрике 34.
46.
СН1
сн, 6
* См. примечание к рубрике 27.- Прим. ред.
> । лево.юроды (II)
Как называются эти три ксилола?
• а) орто- б) пара- в) .мемд-ксилол
• а) мета- б) орто- в) лпра-ксилол
• а) пара- б) мета- в) орто-ксилол
• а) орто- б) мета- в) пара-ксилол
- 40
-► 32
-► 65
- 55
47. Неправильно. Ниже показана разъединенная на две части структурная формула стирола, которая должна помочь вам узнать его составные части:
Н-С«СН1
Вернитесь к рубрике 69.
48. Вы еще недостаточно усвоили названия важнейших углеводородов. Повторите материал, начиная с рубрики 34.
49. Бензол имеет формулу С6Н6. Толуол получается из бензола при замещении одного атома водорода (Н) на метильную группу (СН3).
Какова эмпирическая формула толуола?
Проверьте ответ в рубрике 34.
50. Правильно. Ксилол имеет эмпирическую формулу С8Н10.
Теперь изобразите структурную формулу ксилола, исходя из структурной формулы бензола и заменяя в ней два атома водорода метильными группами.
Проверьте ответ в рубрике 37.
51. Бензол (80°С), толуол (11ГС), ксилол (смесь изомеров, 140°С).
(В скобках указаны температуры кипения.)
Обратите внимание, что температуры кипения повышаются с увеличением молекулярной массы вещества.
Химические свойства углеводородов, например их реакции с хлором и азотной кислотой, будут рассматриваться в последующих программах.
В данной программе мы рассмотрим только процесс горения.
При поджигании углеводородов и наличии достаточного количества кислорода они горят, иногда со взрывом. В этом процессе углеводороды полностью сгорают с образованием СО2 и Н2О.
Завершите уравнение горения метана:
СН4 + ... - ... + ...
Проверьте ответ в рубрике 58.
52. Вы ошибочно привели удвоенную эмпирическую формулу бензола вместо нафталина. Обратите однако внимание, что оба бензольных кольца в молекуле нафталина имеют два общих атома углерода. Подсчитайте число атомов углерода в молекуле нафталина!
Вернитесь к рубрике 62.
204
Программа 9
53. Вы не учли того обстоятельства, что два общих атома углерода, по которым соединяются бензольные кольца в молекуле нафталина, не имеют свободных валентностей. Следовательно, к ним не могут быть присоединены атомы водорода!
Какова же правильная эмпирическая формула нафталина?
Проверьте ответ в рубрике 69.
54. Неправильно, эмпирическая формула ксилола не С7Н7.
Вы удалили из бензола два атома водорода, а добавили только одну метильную группу. Следовало заменить метильными группами оба атома водорода.
Вернитесь к рубрике 43 и попытайтесь правильно ответить на поставленный там вопрос.
55. Правильно. Название «ксилол» без всякого дополнительного уточнения означает смесь трех изомеров ксилола.
Когда имеется в виду конкретный изомер ксилола, нужно привести его название с определенной приставкой.
Запишите названия всех трех ксилолов как с полными, так и с сокращенными приставками.
Проверьте ответ в рубрике 62.
56. Пропен ( = пропилен), метан, бутен, этен ( = этилен).
Как мы уже указывали ранее, это не единственные углеводороды, образующиеся в реакциях крекинга. Кроме них могут быть выделены, например, этан, пропан, бутан и изобутан. Таким образом, среди продуктов крекинга встречаются разветвленные и неразветвленные, насыщенные и ненасыщенные углеводороды.
Особую ценность имеют ненасыщенные продукты.
Смеси углеводородов, полученные в процессе крекинга, подлежат (в зависимости от их дальнейшего использования) более или менее полному разделению, например путем перегонки.
Еще одним химическим процессом, который используется для переработки нефти, является дегидрирование, например н-с^н н
<г''ц дегидрирование Н''с^-""схН rrcVSr Н'С'Н н
Запишите полное уравнение этой реакции с названиями всех участвующих в ней соединений.
Проверьте ответ в рубрике 64.
57. Неправильно, эмпирическая формула ксилола не С8Н12.
Вы просто добавили к бензолу две группы СН3, не удалив одновременно двух атомов водорода.
Вернитесь к рубрике 43 и попытайтесь еще раз ответить на поставленный там вопрос.
Углеводороды (II)
205
58. СН4 + 2О2 - СО2 + 2Н2О
Опасность взрыва особенно велика в случае ацетилена. Смеси ацетилена с воздухом легко детонируют, поэтому при обращении с ацетиленом нужно соблюдать крайнюю осторожность.
Запишите уравнение полного сгорания ацетилена.
Проверьте ответ в рубрике 66.
59. Ацетилен имеет тройную связь! н-с=с-н
Вернитесь к рубрике 69.
60. Неправильно. Температуры кипения различных фракций нефти указаны в рубрике 74. Вернитесь к этой рубрике и попытайтесь еще раз ответить на поставленный там вопрос.
9
толуол
бензильный радикал (остаток)
К сожалению, названия бензильного и фенильного остатков, или групп, легко перепутать, потому что термин «бензил» казалось бы логичным производить от «бензола». Вам следует внимательно разобраться в этих названиях, когда вы будете завершать следующие предложения:
а) Фенильный остаток получается из ....
б) Бензильный остаток получается из ....
Проверьте ответ в рубрике 70.
62. орто-ксилол о-ксилол
мета-ксилол или .м-ксилол пара-ксилол п-ксилол
Нафталин-это еще одно важное соединение, содержащее бензольные кольца. Ниже приведена его сокращенная структурная формула
°»сА:.с
показывающая, что нафталин состоит из двух «конденсированных» (срощенных друг с другом) бензольных колец. В этой формуле для простоты опущены атомы водорода.
Срисуйте эту формулу, добавив к ней атомы водорода. Убедитесь при этом, чтс каждый атом углерода четырехвалентен.
Какую эмпирическую формулу имеет нафталин?
® С10Н10 —► 53
• С10Н8 - 69
• С12Н12 - 52
11 poi рамма 4
63. Вы перепутали между собой этильную и винильную группы, а также бензильную и фенильную группы.
Вернитесь к рубрике 83.
64.
н"с"н
<рн дегидрирование hJ. Lh н^\.г,/хн н' хн
дензол
з н2
циклогексан
Водород
9
Таким образом, дегидрирование позволяет получать ароматические углеводороды из алициклических (т.е. из циклических алифатических углеводородов).
Кратко опишите, для какой цели используются следующие методы переработки нефти:
а) Перегонка
б) Крекинг
в) Дегидрирование
Проверьте ответ в рубрике 73.
65. Вы привели правильное название только для .мета-ксилола. Вернитесь к рубрике 37.
66. 2С2Н2 + 5О2 -> 4СО2 + 2Н2О
Соблюдать осторожность следует не только при обращении с ацетиленом, но и со всеми углеводородами.
Все углеводороды легко воспламеняются и могут образовывать взрывчатые смеси с воздухом.
Экспериментальное определение числа атомов углерода и водорода в заданном углеводородном соединении основано на его сжигании с последующим тщательным измерением количества образующихся СО2 и Н2О.
Где содержатся углеводороды и как их получают?
Они содержатся в природном газе, нефти и каменноугольной смоле. Природный газ состоит главным образом из метана и используется в основном как топливо*.
Завершите следующее предложение.
Природный газ представляет собой в основном ... и поэтому легко ....
Проверьте ответ в рубрике 72.
67. Вы привели правильное название только для стирола. Повторите материал, начиная с рубрики 76.
* Метан имеет большое значение и как химическое сырье.- Прим. ред.
I, !<'
68. толуола
Когда из метильной группы толуола удаляется атом водорода, получается бензильный радикал. Запишите структурные формулы толуола и бензильного радикала, а под ними укажите соответствующие названия.
Проверьте ответ в рубрике 61.
69. Эмпирическая формула нафталина с10н8. Структурная формула нафталина:
нафталин
или
Существуют высшие ароматические соединения, в которых соединены друг с другом три, четыре, пять и больше бензольных колец. Однако мы ограничимся лишь примером нафталина.
Рассмотрим теперь еще одно производное бензола -стирол. Это соединение является важным исходным сырьем для получения синтетических полимеров (см. программу 23).
Стирол имеет структурную формулу
В ней вы должны узнать части двух уже знакомых вам соединений. Какие это соединения?
• Бензол и ацетилен —► 59
• Толуол и метан —♦ 47
• Бензол и этен —► 76
• Не понятен вопрос —► 77
70. а) Фенильный остаток получается из бензола.
б) Бензильный остаток получается из толуола.
Вернемся теперь ненадолго к стиролу. Вспомним, как происходит полимеризация этена (этилена). Стирол может полимеризоваться аналогичным образом.
Отдельные молекулы стирола
полимеризуются в полимер полистирол
С- и т.д.
I н
HpoipaMMj 9
Таким образом, полистирол состоит из длинных углеродных цепей, в которых каждый второй атом углерода несет фенильную группу.
Молекулу стирола можно представить себе составленной из двух радикалов. Как они называются?
• Этильный и бензильный —► 63
• Этильный и фенильный —► 80
• Винильный и фенильный —► 82
• Винильный и бензильный —► 86
71. Вы привели правильное название только для стирола. Повторите материал, начиная с рубрики 76.
72. Природный газ представляет собой в основном метан и поэтому легко воспламеняется.
Нефть является смесью множества различных углеводородов. В ней содержатся все упоминавшиеся до сих пор углеводороды и многие другие.
В настоящее время нефть-наиболее важный источник получения углеводородов. Вот почему она считается незаменимым сырьем для получения органических химических веществ.
Как мы узнаем позже, большинство органических соединений получают непосредственно или косвенно из химикатов, вырабатываемых из нефти.
Из чего состоит нефть? Запишите ответ и проверьте его в рубрике 79.
73. Проверьте ответ:
а) Перегонка: разделение углеводородов
б) Крекинг: получение углеводородов с меньшей длиной цепи
(особенно ненасыщенных) из углеводородов с большей длиной цепи
в) Дегидрирование: получение ароматических углеводородов
Эти и другие методы широко используются в настоящее время для получения большинства исходных веществ, применяемых в промышленной органической химии.
В прежнее время главным источником сырья для органической химии служила каменноугольная смола, получаемая при сухой перегонке каменного угля (см. программы 15-17 из первой части учебника).
Перегонка каменноугольной смолы позволяет получать главным образом ароматические углеводороды, такие, как бензол, толуол, ксилол, нафталин.
Уголь и каменноугольная смола и сегодня используются для этой цели, причем их значение как источников органического сырья вновь возрастает.
Все же наиболее важным сырьем для органической химии в настоящее время является ....
Проверьте ответ в рубрике 84.
74. Бензин, керосин, дизельное топливо (газойль), смазочные масла, асфальт или мазут.
Эти фракции нефти также представляют собой смеси различных углеводородов.
Бензин-это смесь углеводородов с температурой кипения не выше 150°С.
Керосин-это смесь углеводородов с температурами кипения приблизительно от 150 до 250°С.
Дизельное топливо (газойль)-это фракция нефти с температурой кипения
приблизительно от 250 до 350°С.
Какая из главных пяти фракций нефти i не поддается перегонке?
• Смазочные масла —> 91
• Дизельное топливо (газойль) -» 13
• Керосин —► 97
• Бензин —> 60
• Асфальт и мазут —> 15
75. Проверьте ответ:
Метан сн4 метильный радикал —сн3
Этан с2н6 этильный радикал ~С2Н5
Продан С3Н8 пропильный радикал с3н7
Бензол С6н6 фенильный радикал С6н5
Этен С2Щ винильный радикал -С2Н3
Как вы должны были заметить, запоминание терминов «винил» и «фенил»
требует особого внимания, поскольку названия этих радикалов не имеют ничего общего с названиями углеводородов, из которых они получены.
Еще одна трудность возникает с названием бензильный радикал
S
который получается не из бензола, а из .... Укажите пропущенное название исходного соединения.
Проверьте ответ в рубрике 68.
76. Правильно. Молекулу стирола можно представить себе как результат соединения бензола с этеном.
Удаляя один атом водорода из этена, мы получаем радикал
н-с=сн2
Аналогично, удаляя один атом Н из бензола, мы получаем
Н''С<С"С'Н с t H-^C' 'H
I н
или
Комбинация двух радикалов, полученных из этена и бензола, дает молекулу стирола.
Запишите структурную и эмпирическую формулу стирола.
Проверьте ответ в рубрике 83.
14-29
Программ:! Ч
77. Следующий пример поможет вам понять вопрос, поставленный в рубрике 69, и ответить на него.
Нафталин имеет (упрощенную) структурную формулу
Нетрудно видеть, что эта молекула состоит из двух уже знакомых вам колец. Как называется соединение с одним таким кольцом?
Ответ: Очевидно, вы узнали бензол
Теперь попытайтесь ответить на вопрос, поставленный в рубрике 69.
78. Правильно.
Как называются радикалы и молекулы, структуры которых показаны ниже?
• Бензол стирол этен —► 71
• Фенил стирол винил —► 85
• Винил стирол фенил —► 67
• Фенил толуол винил —► 87
79. Нефть представляет собой смесь множества различных углеводородов.
Нефть нельзя использовать непосредственно для проведения химических реакций. Сначала эту смесь углеводородов нужно разделить перегонкой или другими способами.
Перегонка нефти при постепенном повышении температуры позволяет последовательно выделить из нее следующие фракции:
бензин
керосин
дизельное топливо (газойль)
смазочные масла
Первой отгоняемой фракцией является бензин, затем отделяется керосин, за ним при более высоких температурах перегоняется дизельное топливо. Последняя фракция, состоящая из смазочных масел, выделяется путем перегонки в вакууме. Остатком перегонки является мазут либо асфальт (в зависимости от типа нефти).
Вы, несомненно, должны быть знакомы с применениями этих продуктов.
Завершите следующие предложения:
... используется как горючее для автомобилей.
... используется для изготовления дорожных покрытий.
... используется в качестве горючего для реактивных двигателей, а раньше использовался для освещения.
У> .iCH».iopiUb:
... используются для смазки.
... используется как дизельное горючее и печное топливо. Проверьте ответ в рубрике 88.
80. Вы все еще путаете между собой этильный и винильный радикалы. Вернитесь к рубрике 83.
81. Название «ксилол»-неполное. Вы должны присоединить к нему приставку, указывающую положения метильных групп.
Вернитесь к рубрике 89.
82. Правильно.
Теперь вы знаете названия, структуры и формулы важнейших углеводородов. Прежде чем перейти к обсуждению их свойств, распространенности в природе и получения, кратко повторим пройденный материал.
Важно знать названия и структуры соединений: зная структуры, нетрудно вывести и эмпирические формулы. Учитывая, что в данной программе представлено большое число новых структур, следует тщательно потренироваться, чтобы их запомнить.
Каковы названия следующих соединений?
а 6 в
I
• Толуол бензол стирол —► 30
• Бензол ксилол толуол —► 48
• Бензол фенил о-ксилол —► 90
• Бензол толуол о-ксилол —► 89
• Бензол толуол ксилол —► 95
Стирол: С8Н8
Радикалы, полученные из этена и бензола удалением одного атома водорода, имеют специальные названия
-^•сн, винильный радикал
фенильный радикал
Поскольку эти названия будут часто использоваться, вам следует их запомнить!
Окончание (или суффикс) -ил всегда означает радикал (т.е. остаток или группу).
Завершите теперь следующую таблицу, в которой вы должны указать правильные названия радикалов, в частности полученных из бензола и этена.
14*
> ipoi p.iM-.i;,
Метан CH4 Этан Пропан ... Бензол Этен
метильный радикал — СН3 этильный радикал ...
Проверьте ответ в рубрике 75.
радикал ... радикал ... радикал ...
84. нефть
Приведите названия по крайней мере двух ароматических соединений, которые можно выделить из каменноугольной смолы.
Проверьте ответ в рубрике 98.
85. Правильно.
Повторим теперь кратко классификацию углеводородов. Все углеводороды подразделяются на два больших класса:
1 ) алифатические углеводороды и
2 ) ароматические углеводороды.
Все соединения, упоминавшиеся в программе 8, относятся только к алифатическим углеводородам.
Соединения, которые были описаны до сих пор в данной программе, принадлежат к числу ароматических углеводородов.
К алифатическим углеводородам относятся цепные неразветвленные или разветвленные, а также циклические углеводороды, за исключением бензола и его производных.
Бензол и его производные являются ароматическими углеводородами (сюда относятся все соединения с одним или несколькими бензольными кольцами).
Выберите из приведенных ниже строк ту, в которой перечислены только алифатические углеводороды.
• Метан, толуол, стирол, ацетилен, циклогексан -» 93
• Циклогексан, пентан, этен, о-ксилол, этан -> 94
• Изобутан, циклогексан, этен, гексан, ацетилен -> 96
• Стирол, и-ксилол, этан, пропан, бутан -> 92
86. Вы все еще путаете между собой фенильный и бензильный радикалы. Вернитесь к рубрике 83.
87. Вы привели правильные названия для фенильного и винильного радикалов. Однако соединение со структурной формулой
н-с-сн,
представляет собой стирол.
Толуол имеет структуру
СНэ
> I .ieiio.iopo.11.1 ili;
Обратите внимание на различие между этими соединениями, чтобы в дальнейшем не повторить свою ошибку.
Переходите к рубрике 85.
88. Бензин, асфальт, керосин, смазочные масла, газойль
Все это-фракции, получаемые при перегонке нефти.
В какой последовательности получаются эти фракции при перегонке нефти?
Запишите названия фракций нефти в правильной последовательности:
1-я фракция-....
2-я фракция -....
3-я фракция-....
4-я фракция -....
Остаток-...
Проверьте ответ в рубрике 74.
89. Правильно. Изображенные в рубрике 82 структуры представляют бензол, толуол и орто-ксилол.
Как называются следующие соединения?
в
• Ксилол нафталин ксилол —> 81
• Стирол нафталин фенил —> 41
• и-Ксилол стирол о-ксилол —> 44
• и-Ксилол нафталин о-ксилол —> 78
• л<-Ксилол нафталин и-ксилол —> 35
90. Вы еще недостаточно усвоили названия важнейших углеводородов. Повторите материал, начиная с рубрики 83.
91. Смазочные масла не поддаются перегонке при обычном давлении, они имеют температуру кипения выше 35О°С и разлагаются при столь высокой температуре.
Поэтому смазочные масла приходится перегонять в вакууме, что позволяет снизить их температуру кипения.
Вернитесь к рубрике 74.
92. Стирол и п-ксилол не являются алифатическими соединениями. Запишите структурные формулы этих двух молекул. Проверьте ответ в рубрике 99.
93. Толуол и стирол не являются алифатическими соединениями. Запишите структурные формулы этих двух молекул. Проверьте ответ в рубрике 99.
Программа 9
94. о-Ксилол не является алифатическим соединением. Запишите структурную формулу о-ксилола. Проверьте ответ в рубрике 99.
95. Вы указали правильные названия бензола и толуола. Однако слово «ксилол» означает смесь трех изомеров ксилола.
Вопрос, поставленный в рубрике 82, относился к одному конкретному изомеру ксилола, а именно
Каково полное название этого вещества?
Проверьте ответ в рубрике 89.
96. Правильно.
Завершите теперь следующие предложения:
Изобутан, циклогексан, этен, гексан и ацетилен являются ... соединениями.
Бензол, толуол, ксилолы и нафталин являются ... соединениями.
Проверьте ответ в рубрике 5.
97. Неправильно, керосин поддается перегонке. Его температура кипения указана в рубрике 74. Вернитесь к этой рубрике и попытайтесь еще раз ответить на поставленный там вопрос.
98. Бензол, толуол, ксилол, нафталин.
Конец программы 9.
толуол
носи, d
стирал
о-ксилол
снэ
CHj п-ксилол
Каждое из этих соединений включает бензольное кольцо. Следовательно, они являются ароматическими соединениями.
Вернитесь к рубрике 85.
Программа 10
Галогензамещенные органические (?)
1. В двух предшествующих программах были описаны углеводороды. Эти органические соединения состоят только из двух элементов-углерода и водорода.
Теперь мы займемся органическими соединениями, содержащими кроме углерода и водорода еще и другие элементы. Начнем с соединений, содержащих галогены -фтор, хлор, бром и йод. Органические соединения, в состав которых входят атомы углерода, водорода * и галогенов, называют галогенпроизводные. Наиболее важны галогензамещенные органические соединения, содержащие хлор.
Хлорсодержащие соединения получают, замещая один или несколько атомов водорода в углеводороде на атомы хлора. (Практическое осуществление этой реакции будет описано ниже.)
Какова эмпирическая формула соединения, полученного замещением одного атома водорода в простейшем углеводороде (метане) одним атомом хлора?
• СН4С1 -► 8
• С2Н5С1 - 13
• СН3С1 -> 11
Н
I 2. Н С С1
I н
метилхлорид
Атомы хлора могут замещать не только один, но и два, три и даже все четыре атома водорода в метане.
Запишите эмпирические формулы соединений, полученных замещением двух, трех и четырех атомов водорода в метане на атомы хлора.
Проверьте ответ в рубрике 12.
3. Вы привели неправильные названия для всех четырех соединений.
Проработайте еще раз внимательно весь предыдущий материал, начиная с рубрики 1.
4. Выбранные вами условия реакции не приведут к образованию о-хлортолуола.
Получение о-хлортолуола хлорированием толуола представляет собой
• хлорирование в кольцо -► 61
• хлорирование в боковую цепь -> 54
Водорода в галогенпроизводных может и не бъпъ.-Прим. ред.
5.
+ ci,
20°C катализатор
+ HC1
Эта реакция представляет собой хлорирование в кольцо. Обычно такие реакции хлорирования проводятся при сравнительно низкой температуре и в присутствии катализатора.
Укажите характерные условия хлорирования такого типа.
Переходите к рубрике 14.
6. Неправильно. В этой реакции должно образовываться не 92 г бензилхлорида.
Хлорирование 92 г (1 моль) толуола дает 1 моль бензилхлорида.
Вернитесь к рубрике 43.
7 Хлорирование ароматических соединений в кольцо катализируется железом или иодом.
При каких температурах проводится такая реакция?
• При температуре кипения -» 38
• При комнатной температуре -> 45
8. Вы просто добавили атом хлора к формуле метана СН4. Однако атом хлора должен заместить атом водорода. Удалите атом водорода из СН4 и заместите его атомом С1. Тогда вы сможете правильно ответить на вопрос, поставленный в рубрике 1.
9. Хлорирование ароматических соединений в кольцо катализируется железом или иодом.
При каких температурах проводится такая реакция?
• При температуре кипения -» 38
• При комнатной температуре -> 45
10. Выбранные вами условия реакции не приведут к образованию о-хлортолуола.
Получение о-хлортолуола хлорированием толуола представляет собой
• хлорирование в кольцо -> 61
• хлорирование в боковую цепь -> 54
11. Правильно, СН3С1.
Это соединение называется метилхлорид. Обратите внимание на наличие в нем метильной группы.
Запишите теперь структурную формулу данного соединения.
Проверьте ответ в рубрике 2.
12. СН2С12 СНС13 СС14
метиленхлорид хлороформ тетрахлорид углерода
(четыреххлористый углерод)
Запомните эти названия. Возможно, вы уже знакомы с хлороформом и четыреххлористым углеродом.
Запишите структурные формулы этих трех соединений вместе с их названиями.
Проверьте ответ в рубрике 19.
13. Неправильно. Вы исходили из формулы этана С2Н6. Требовалось же указать эмпирическую формулу продукта замещения атома водорода хлором в молекуле метана.
Вернитесь к рубрике 1.
14. Низкая температура и наличие катализатора благоприятствуют хлорированию в кольцо.
В качестве катализаторов для этих реакций используются железо (в виде железных опилок или солей железа) или иод.
Каковы характерные условия реакции хлорирования в боковую цепь? Проверьте ответ в рубрике 34.
15.
Неправильно. Соединение
называется м-дихлорбензол.
Вспомните структурную формулу о-ксилола; две метильные группы находятся при соседних атомах углерода
Аналогично расположены заместители в о-дихлорбензоле
В м-ксилоле два атома углерода, несущие заместители, не являются соседями, а разделены между собой одним атомом углерода
сн3
Аналогично расположены заместители в м-дихлорбензоле
С1
С1
Ilpoiоам.ма lii
В n-ксилоле две метильные группы находятся на противоположных сторонах кольца:
Точно так же расположены заместители в и-дихлорбензоле:
Теперь изобразите структурные формулы всех трех дихлорбензолов и проверьте их в рубрике 53.
16. Хлорирование ароматических соединений в кольцо катализируется железом или иодом.
При каких температурах проводится такая реакция?
• При температуре кипения -» 38
• При комнатной температуре -» 45
17. «Тетрахлорид углерода»-правильное и распространенное название СС14. Однако это не строго систематическое название данного соединения.
Вернитесь к рубрике 19.
18. Правильно.
Прежде чем продолжить рассмотрение хлорсодержащих органических соединений, нам придется ввести одно важное понятие.
Мы видели, что хлорсодержащие соединения получаются из углеводородов в результате замены атомов водорода на хлор. Химическая реакция замены атомов водорода другими атомами или группами называется замещение.
Таким образом, метилхлорид является продуктом замещения атома водорода в молекуле метана хлором. Иначе можно сказать, что хлор ... атом водорода в метане.
Завершите это предложение и переходите к рубрике 25.
19.
Н С1 С1
Н—A—Cl Н—A—Cl Cl—A—Cl
Ai Ai Ai
мегклеихлорид хлороформ тетраллорнд углерода
К сожалению, многие органические соединения имеют по нескольку употребительных названий, и их приходится запоминать.
По международному соглашению каждая молекула может получить
2 а.ни сн pt
единственное систематическое название. Тем не менее часто используются и другие, несистематические названия, главным образом по историческим причинам.
Так обстоит дело, например, с четырьмя хлорсодержащими соединениями, которые мы только что представили. Названия «метилхлорид», «метиленхлорид», «хлороформ» и «тетрахлорид углерода» не являются систематическими. Тем не менее они часто используются в лабораторной практике и в химической технологии.
Правильные систематические названия этих соединений таковы: хлормета н, дихлорметан, трихлормета н, тетрахлорметан.
Запишите эти четыре систематических названия и рядом с каждым из них соответствующую эмпирическую формулу соединения.
Проверьте ответ в рубрике 26.
20.
Неправильно. Соединение
называется .м-дихлорбензол.
Вспомните структурную формулу о-ксилола; две метильные группы находятся при соседних атомах углерода
Аналогично расположены заместители в о-дихлорбензоле
В .м-ксилоле два атома углерода, несущие заместители, не являются соседями, а разделены между собой одним атомом углерода
Аналогично расположены заместители в .м-дихлорбензоле
В и-ксилоле две метильные группы находятся на противоположных сторонах кольца
снэ
220
Программа HI
Точно так же расположены заместители в и-дихлорбензоле:
Теперь изобразите структурные формулы всех трех дихлорбензолов и проверьте их в рубрике 53.
21. Правильно. Толуол реагирует с газообразным хлором при комнатной температуре и в присутствии катализатора, образуя продукт хлорирования в кольцо - о-хлортолуол. (Одновременно с этим образуется и некоторое количество н-хлортолуола; подробнее об этом будет сказано позже.)
Завершите уравнение этой реакции:
о
20 °C катализатор
Переходите к рубрике 5.
22. Выбранные вами условия реакции не приведут к образованию о-хлортолуола.
Получение о-хлортолуола хлорированием толуола представляет собой
• хлорирование в кольцо -> 61
• хлорирование в боковую цепь -> 54
23.
толуол
СНаС1 — + НС1 Еензилшлорид
Образование бензилхлорида из толуола является результатом хлорирования в боковую цепь.
Вспомните, что радикал
называется бензил.
На практике хлорирование в боковую цепь осуществляется действием газообразного хлора на пары кипящего толуола при облучении ультрафиолетовым светом. Хлорирование при этих условиях происходит только в боковую цепь, а не в кольцо.
Итак, для успешного хлорирования толуола в боковую цепь должны выполняться два условия:
1. Толуол должен ...
2. Он должен облучаться ...
Завершите эти предложения.
Проверьте ответ в рубрике 30.
i a ioi en UMiiin'inn.if opi аиические соединении (I)
Cl
называется 1,4-дихлорбензол.
Таким образом, и-дихлорбензол имеет систематическое название 1,4-дихлорбензол.
Завершите теперь следующие сопоставления:
о-Дихлорбензол - это .. .-дихлорбензол.
м-Дихлорбензол - это .. .-дихлорбензол.
-это 1,4-дихлорбензол*.
Проверьте ответ в рубрике 36.
25. замещает
Итак, можно сказать, что
«атом водорода замещен атомом хлора» или
«атом хлора замещает атом водорода».
Аналогично хлор может замещать атомы водорода в бензоле.
При замещении одного атома водорода в бензоле образуется хлорбензол Замещение двух атомов водорода дает ....
Укажите название продукта. Проверьте ответ в рубрике 32.
26. Хлорметан: СН3С1
Дихлорметан: СН2С12
Трихлорметан: СНС13
Тетрахлорметан: СС14
Перечисленные соединения имеют и другие распространенные названия. Какие это названия?
СН3С1 СН2С12 СНС13 СС14
• Метилен- хлороформ тетрахлорид метил-
хлорид углерода хлорид -> 3
• Метилен- метил- хлороформ тетрахлорид
хлорид хлорид углерода -> 33
• Метил- метилен- хлороформ тетрахлорид
хлорид хлорид углерода -> 18
• Метил- хлороформ метилен- тетрахлорид
хлорид хлорид углерода -> 35
27. Метилхлорид: СН3С1
Метиленхлорид: СН2С12
Хлороформ: СНС13
Каково правильное, систематическое, название СС14?
• Тетрахлорид углерода -> 17
• Тетрахлорметан -► 18
* Для запоминания можно предложить следующее мнемоническое правило: орто ассоциируется со словом около, пара - со словом против,- Прим. ред.
Про1рамма !0
28. Вы забыли, в чем различие между обозначениями орто, мета и пара. Это различие было объяснено в предыдущей программе, где вы должны были поупражняться над употреблением соответствующих приставок на примере о-, м- и и-ксилолов.
Ниже еще раз приведены структурные формулы этих соединений:
о-ксилол
м-ксилол
п- ксилол
Укажите название соединения:
С1
о-Дихлорбензол -> 15
ju-Дихлорбензол -+ 44
и-Дихлорбензол -» 20
29. Вы забыли, в чем различие между обозначениями орто, мета и пара. Это различие было объяснено в предыдущей программе, где вы должны были поупражняться над употреблением соответствующих приставок на примере о-, м- и и-ксилолов.
Ниже еще раз приведены структурные формулы этих соединений:
JH-ксилол
п-ксилол
Укажите название соединения:
о-Дихлорбензол -> 15
ju-Дихлорбензол -> 44
и-Дихлорбензол -+ 20
30. Условия хлорирования толуола в боковую цепь:
а) толуол должен кипеть,
б) необходимо облучение ультрафиолетовым светом.
Ультрафиолетовое излучение присутствует в солнечном свете, особенно на больших высотах.
В отличие от условий хлорирования в боковую цепь хлорирование в кольцо осуществляется при комнатной температуре в присутствии катализатора.
Г V'< глмепи’чш.ч '*»•* кн:
Итак,
при температуре кипения и ультрафиолетовом облучении осуществляется реакция в боковой цепи;
при низкой температуре и в присутствии катализатора осуществляется реакция в кольце.
Это позволяет, выбирая надлежащие условия реакции, получать необходимый продукт.
Укажите, какие условия необходимы для получения о-хлортолуола
• Ультрафиолетовое облучение, комнатная температура —► 4
• Ультрафиолетовое облучение, кипение —► 10
• Катализатор, комнатная температура —► 21
• Катализатор, кипение —► 22
31. Правильно.
Завершите теперь уравнение хлорирования толуола в боковую цепь
♦ С1, —► • • • + НС1
толуол
Проверьте ответ в рубрике 23.
32. дихлорбензол
Запишите эмпирические формулы хлорбензола и дихлорбензола.
Проверьте ответ в рубрике 39.
33. Вы перепутали метилхлорид с метиленхлоридом.
Систематическое название метилхлорида - хлорметан.
Систематическое название метиленхлорида-дихлорметан.
Спишите приведенные ниже названия и укажите эмпирическую формулу для каждого соединения:
Метилхлорид имеет формулу ....
Метиленхлорид имеет формулу ....
Хлороформ имеет формулу ....
Проверьте ответ в рубрике 27.
34. Ультрафиолетовое облучение или солнечный свет и кипение.
Получение бензилхлорида из толуола представляет собой хлорирование в боковую цепь:
С11
УФ-свет кипение
СН,С1
О +нс1
В этой реакции могут образовываться и другие продукты. К концу реакции получается много бензилхлорида и остается немного толуола. В этот
момент образовавшийся бензилхлорид может вступать в дальнейшую реакцию с хлором, в результате чего образуется продукт двойного хлорирования в боковую цепь
СН2С1 УФ-свет
J * С12 ----------
кипение
+ НС1
бензилхлорид
а в конце концов происходит введение и третьего атома хлора
+ С12
УФ-свет нипение
Завершите последнее уравнение.
Проверьте ответ в рубрике 43.
35. Вы перепутали метиленхлорид с хлороформом.
Систематическое название метиленхлорида-дихлорметан.
Систематическое название хлороформа-трихлорметан.
Спишите приведенные ниже названия и укажите эмпирическую формулу для каждого соединения:
Метилхлорид имеет формулу ....
Метиленхлорид имеет формулу ....
Хлороформ имеет формулу ....
Проверьте ответ в рубрике 27.
36. о-Дихлорбензол-это 7,2-дихлорбензол.
ju-Дихлорбензол - это 1,3-дихлорбензол.
и-Дихлорбензол-это 1,4-дихлорбензол.
Ксилол имеет другое название-диметилбензол. Следовательно, о-ксилол-это 1,2-диметилбензол .и-ксилол-это ...-диметилбензол и-ксилол-это ...-диметилбензол.
Проверьте ответ в рубрике 42.
37. Реакции Время реакции Полнота протекания Неорганические Малое Полная Органические Большое Неполная
Приведенная выше таблица может служить лишь для грубой ориентировки. Естественно, существуют исключения из этого простого правила.
Для органических реакций типична относительно низкая скорость. Однако медленно протекающие реакции можно ускорить
а) повышением температуры и
б) введением катализатора.
Какие катализаторы соединений в кольцо? • Иод и железо • Диоксид марганца • Платина • Не знаю используются для хлорирования ароматических - 45 - 7 -> 9 - 16
38. По-видимому, вы забыли о требованиях, предъявляемых к условиям замещения в кольцо.
Эти требования таковы: низкая температура и наличие катализатора.
А какие требования предъявляются к условиям замещения в боковую цепь? Проверьте ответ в рубрике 62.
39. Хлорбензол: С6Н5С1
Дихлорбензол: С6Н4С12
Изобразите структурную формулу хлорбензола.
Проверьте ответ в рубрике 46.
40. о-Ксилол состоит из бензольного кольца и двух метильных боковых цепей. Боковой цепью в ароматическом соединении может быть метильный, этильный, пропильный или какой-либо другой радикал.
X лорирование в кольцо
означает замещение атома водорода в бензольном кольце атомом хлора. Хлорирование в боковую цепь
означает замещение атома водорода в боковой цепи атомом хлора.
Как может быть получено следующее соединение?
СН2С1
Хлорированием толуола в кольцо -> 55
Хлорированием ксилола в боковую цепь -> 50
Хлорированием толуола в боковую цепь -> 31
41. Неправильно. Использование ультрафиолетового облучения и кипения приводит к хлорированию в боковую цепь.
Повторно проработайте материал, начинающийся с рубрики 30.
42. 7,3-диметилбензол (ai-ксилол)
7,4-диметилбензол (п-ксилол)
Продолжим изучение хлорсодержащих соединений. Введение одного или нескольких атомов хлора в какую-либо молекулу называется хлорирование.
Мы уже описывали хлорирование метана и бензола. В каждом из этих случаев хлор может замещать один или большее число атомов водорода. Таким же образом можно хлорировать и другие углеводороды.
Рассмотрим хлорирование ароматических соединений. Простейшим
15 29
! ipoiII:
примером является хлорирование бензола, приводящее к хлорбензолу:
Для наглядности здесь изображен тот атом водорода в кольце, который замещается хлором. Однако это вовсе не обязательно, и обычно подобные реакции замещения записывают так:
С1
Как вы заметили, один из атомов молекулы хлора входит в бензольное кольцо, а другой соединяется с замещаемым атомом водорода, образуя с ним молекулу НС1.
Другие галогены, например бром или иод*, могут замещать водород в ароматическом кольце точно так же, как и хлор.
Запишите уравнения следующих реакций:
а) бензола с бромом
. б) бензола• с иодом
Проверьте ответ в рубрике 49.
УФ-свет кипение
Этот пример иллюстрирует трудность проведения строго определенных реакций в органической химии. Нежелательные побочные реакции часто снижают выход требуемого продукта.
Выход требуемого соединения принято выражать в процентах от теоретически достижимого выхода.
Например, хлорирование 92 г толуола (1 моль), согласно уравнению,
сн3 СН,С1
УФ-свет
С1’ кипение
+ НС1
теоретически должно приводить к образованию ... г бензилхлорида. Сколько граммов бензилхлорида должно получиться?
• 253 г -> 57
• 126,5 г -> 51
• 92 г -> 6
• Не знаю -» 63
(Необходимые для вычислений атомные массы: С =12, Н = 1, 0 = 35,5.)
* Замещение на иод требует особых условий. Хлорирование и бромирование бензола ложе не протекают самопроизвольно, а лишь в присутствии катализатора.-Прим. ред.
44. Совершенно верно.
Систематическое (номенклатурное) название дихлорбензолов иное. Для того чтобы понять это название, пронумеруем шесть атомов углерода в бензоле от 1 до 6, двигаясь по часовой стрелке
о 4
С учетом такой нумерации
С1
называется 1,2-дихлорбензол
(произносится «один-два-дихлорбензол»)
С1
>4 называется 1,3-дихлорбензол (произносится «один-три-дцхлорбензол»).
Положение заместителей (в данном случае атомов хлора) указывается номерами атомов углерода, к которым они присоединены.
Дайте соответствующее название соединения
Проверьте ответ в рубрике 24.
45. Правильно. Хлорирование в кольцо проводится при комнатной температуре и катализируется железом или иодом.
Органические реакции, вообще говоря, могут быть ускорены при помощи:
1) ...
2) ...
Проверьте ответ в рубрике 60.
хлорбензол
В дальнейшем мы будем пользоваться только упрощенной формулой бензольного кольца, показанной справа.
Изобразите структурную формулу дихлорбензола. Вы обнаружите, что существуют три способа разместить два атома хлора у бензольного кольца. Вспомните о-ксилол, „и-ксилол и и-ксилол.
Изобразите структурные формулы трех дихлорбензолов.
Проверьте ответ в рубрике 53.
I Ipoi |uimm:i 10
47. а) Побочные реакции.
б) Неполное превращение.
в) Потери в процессе очистки.
Эти обстоятельства отличают многие органические реакции от неорганических.
Неорганические реакции обычно протекают полностью и не сопровождаются побочными реакциями.
В качестве примера приведем количественное осаждение хлорида серебра при обработке водного раствора нитрата серебра соляной кислотой.
Органические и неорганические реакции отличаются также по скорости реакции. Неорганические реакции нередко протекают очень быстро (например, осаждение AgCl протекает мгновенно).
В отличие от этого органические реакции могут требовать большого времени для их завершения.
Заполните следующую таблицу:
Реакции Время реакции Полнота протекания
Неорганические
Органические
В графе «Время реакции» укажите - большое/малое, в графе «Полнота протекания» укажите -полная/неполная.
Проверьте ответ в рубрике 37.
48. Фтор F
Хлор С1
Бром Вг
Иод I
Галогенирование ароматического соединения, например хлорирование толуола, может протекать по двум направлениям:
1) хлорирование в кольцо и
2) хлорирование в боковую цепь.
Выражения «кольцо» и «боковая цепь» означают соответственно бензольное кольцо и алифатический заместитель.
Например, толуол
сн3
о
состоит из бензольного кольца и метильной боковой цепи.
Аналогично о-ксилол
сн3
состоит из .... и двух метильных ....
Завершите это предложение и проверьте ответ в рубрике 40.
I.lioi он именинные opi эпические гпслппинн !;
I
Уравнение а) описывает бромирование бензола.
Уравнение б) описывает иодирование бензола*.
Введение хлора в органическое соединение при его обработке С12 называется ....
Введение брома в органическое соединение при его обработке Вг2 называется ....
Введение иода в органическое соединение при его обработке 12 называется ....
Завершите эти предложения.
Проверьте ответ в рубрике 56.
50. Ксилол имеет две боковые цепи и, следовательно, не может служить исходным веществом в обсуждаемой реакции.
о-нс и по л
Вернитесь к рубрике 40.
51. Правильно, 92 г толуола (1 моль) теоретически должны давать 126,5 г бензилхлорида (1 моль).
Эти 126,5 г соответствуют 100%-ному выходу.
На практике из 92 г толуола удается получить лишь около 90 г бензилхлорида.
Эти 90 г бензилхлорида соответствуют выходу 71%.
(Если вы желаете познакомиться еще с одним примером вычисления выхода реакции, обратитесь к рубрике 52.)
Теоретический выход 100% в органических реакциях обычно недостижим.
Вы уже знаете одну причину этого-наличие побочных реакций.
Возможна еще одна причина-неполное использование исходных веществ в реакции; другими словами, неполное превращение.
Бензилхлорид получается хлорированием толуола в боковую цепь, но неочищенный продукт этой реакции содержит примеси вследствие побочных реакций и неполного превращения исходного вещества.
* Оба уравнения, и особенно второе, лишь формально изображают результат реакции: хлорирование требует участия катализатора, иодирование же свободным иодом вовсе не идет-Прим. ред.
Каковы возможные примеси в неочищенном бензилхлориде?
а) примеси, обусловленные протеканием побочных реакций:
б) примеси, обусловленные неполным превращением: ....
Укажите структурные формулы для четырех названных вами соединений.
Проверьте ответ в рубрике 58.
52. Бромбензол получают бромированием бензола
Из 100 г бензола получены 151 г бромбензола. Каков выход этой реакции в процентах? Теоретический выход реакции равен 100%, атомная масса брома 80.
Проверьте ответ в рубрике 59.
Приведите название соединения, написанного слева
о-Дихлорбензол -> 44
л<-Дихлорбензол -> 29
и-Дихлорбензол -> 28
54. Различие между бензольным кольцом и боковой цепью описано в рубрике 48, которую вам следует прочесть еще раз.
^55. Неправильно. Внимательно изучите следующую схему:
Боновая цепь -. СН3
Нольцо: [ Ц
хлорирование в боновую цепь хлорирование в кольцо
Вернитесь к рубрике 40.
56. хлорирование
бромирование
иодирование
в общем случае -галогенирование
Термин галогенирование означает введение атома какого-либо галогена в органическую молекулу.
Таким образом, под галогенированием может подразумеваться фторирование, хлорирование, бромирование или иодирование. Часто для атома галогена используется сокращенное обозначение Hal.
-это общая формула, которая может означать фторбензол, хлорбензол, бромбензол или иодбензол
Укажите названия и химические символы четырех элементов, которые сокращенно обозначаются Hal. Проверьте ответ в рубрике 48.
57. Результат вашего расчета соответствует образованию двух молей бензилхлорида. Однако из 1 моля толуола может получиться только 1 моль бензилхлорида.
Вернитесь к рубрике 43.
58. а) Примеси, обусловленные побочными реакциями:
Эти соединения образуются вследствие дальнейшего хлорирования в боковую цепь.
б) Примеси, обусловленные неполным превращением:
Эти примеси представляют собой непревратившиеся исходные вещества.
Чтобы выделить необходимый продукт, нужно удалить примеси из неочищенного продукта. Бензилхлорид лучше всего очищается перегонкой. (Для других соединений более удобны другие методы, например перекристаллизация.) В процессе очистки также возможны потери необходимого продукта.
Таким образом, существуют три причины, по которым 100%-ный выход редко достижим. Укажите эти причины:
а) ...
б) ...
в) ...
Проверьте ответ в рубрике 47.
59. Решение:
1 моль бензола (78 г) теоретически должен давать 1 моль (157 г) бромбензола.
157-100
100 г бензола теоретически должны давать-------— = 201 г бромбензола.
78
Таким образом, 201 г бромбензола соответствует выходу 100%.
Однако получено лишь 151 г бромбензола. Это соответствуез выходу 75%. Вернитесь к рубрике 51.
60. 1) повышения температуры,
2) катализаторов.
До сих пор мы обсуждали только галогенирование ароматических углеводородов.
Алифатические углеводороды тоже можно галогенировать. Так, прямая реакция с хлором приводит к их хлорированию. Эти реакции осложняются образованием смесей по-разному замещенных и нередко трудноразделимых продуктов реакции. По этой причине для введения атома галогена в определенное положение молекулы часто используются непрямые методы. Эти методы и рассматриваются в следующей программе.
Конец программы 10.
61. Правильно. о-Хлортолуол является продуктом хлорирования толуола в кольцо.
Какие условия требуются для хлорирования в кольцо?
• Ультрафиолетовое облучение, кипение -» 41
• Катализатор, комнатная температура -» 21
п------------------------------------------------------------------------
62. Для замещения в боковой цепи ароматических соединений требуются ультрафиолетовое облучение и высокая температура (кипение).
Кратко ответьте на следующие вопросы:
Какие катализаторы ускоряют хлорирование в ароматическое кольцо?
Какая температура требуется для хлорирования в кольцо?
Проверьте ответ в рубрике 45.
63. При хлорировании 1 моля толуола (92 г) образуется 1 моль бензилхлорида. Молекулярную массу бензилхлорида нетрудно вычислить таким образом: молекулярная масса толуола: 92
минус атомная масса водорода: — 1
плюс атомная масса хлора: + 35,5
молекулярная масса бензилхлорида: Проверьте ответ в рубрике 51.
1. В конце предыдущей программы мы упоминали, что прямое хлорирование алифатических углеводородов часто приводит к образованию смеси хлоралканов, которые трудно разделить.
Эта программа начинается с описания метода, позволяющего вводить атомы галогенов в алифатические соединения таким образом, что при этом образуются индивидуальные вещества, а не их смеси.
Бром представляет собой красно-коричневую жидкость, которая растворяется в хлороформе, образуя раствор коричневого цвета. Хлороформ в этом случае служит лишь растворителем, он не реагирует с бромом. Если через полученный раствор пропускать этен, происходит постепенное обесцвечивание раствора вследствие протекания реакции
н ^н ¥ ¥
)c=cs + Вг, —► Вг-С-С-Вг
Н Н НН
К какому типу принадлежит эта реакция?
Реакция замещения этена, в которой водород замещается бромом -» 21
Реакция замещения этана, в которой водород замещается бромом -» 14
Присоединение брома по двойной связи в этене -> 8
2. Выбранное вами название, 1,1-дихлорэтан, означает, что два атома хлора присоединены к одному и тому же атому углерода (с номером 1).
Однако это не соответствует структурной формуле б, которая еще раз приведена ниже:
Н Н
Два атома углерода в этой формуле пронумерованы числами 1 и 2. Название соединения получается перечислением номеров атомов углерода, к которым присоединены замещающие атомы (эти номера указывают перед названием соединения, отделяя от последнего дефисом).
Попытайтесь еще раз указать название соединения со структурной формулой б.
Проверьте ответ в рубрике 12.
3. Неправильно. Присоединение Вг2 к ацетилену сначала приводит
к образованию 1,2-дибромэтенщ дальнейшее присоединение Вг2 дает в качестве окончательного продукта 1,1,2,2-тетрабромэтан.
Однако вопрос, поставленный в рубрике 48, относился к получению
1,2-дибромэтана.
Его получение описано в рубрике 8. Вам придется повторить весь материал, начиная с этой рубрики.
4. Выбранное вами соединение на самом деле является горючим. Оно содержит слишком много водорода.
Вернитесь к рубрике 24, запишите структурные формулы всех трех названных там соединений, а затем еще раз попытайтесь ответить на поставленный вопрос.
5. Проверьте ответ: а) 1,2-Дииодэтан
Н Н
I I
I—С-С—I (или I—СН2 СН2— I)
н н
б) 1,1-Дибромэтан
Н Вг
I I
Н—С—С—Вг (или СН3 СНВг2)
Н Н
в) 2-Хлорпропан
Н Н Н
I । 1 н ссс- н
Н С1 н
(или СНз -СН—СН3) I С1
При составлении названий соединений для указания положений заместителей следует пользоваться минимальными из возможных номеров.
Например, соединение Н Вг
Н С (L- Вг
I I н н называется 1,1-дибромэтан. Первый атом углерода (считая справа) получает номер 1. Левый атом углерода получает номер 2.
Можно было бы воспользоваться и обратной нумерацией: 1 для атома углерода слева и 2 для атома углерода справа. Тогда та же самая молекула получила бы название 2,2-дибромэтан. Такая неоднозначность, конечно, нежелательна, поэтому руководствуются правилом выбора минимальных из возможных номеров атомов. Таким образом, из двух предложенных выше названий, правильным является только 1,1-дибромэтан.
Однако не существует правила, указывающего, с левого или правого конца молекулы должна начинаться нумерация атомов. Формула
Вг Н
I I
Вг—С С -Н (или Вг,НС СН3)
н н
тоже означает 1,1-дибромэтан.
Укажите название следующего соединения:
Н Н С1
Н— (t—<L—Cl I I I
H H H
• 3,3-Дихлорпропан -> 27
• 1,2-Дихлорпропан -> 20
• 1,1-Дихлорпропан -> 13
6. Реакции галогенов по двойным или тройным связям приводят
к образованию продуктов, в которых два атома галогена присоединяются не к одному и тому же атому углерода.
Запишите уравнение реакции присоединения хлора к пропану.
Проверьте ответ в рубрике 19.
7. Неправильно. Любое соединение, имеющее плотность больше воды, после приливания к воде опускается на дно сосуда.
Поскольку галогенпроизводные обладают большей плотностью, чем вода, они образуют в системе с водой ... (верхний/нижний) слой.
Завершите это предложение и проверьте ответ в рубрике 24.
8. Правильно. Эта реакция представляет собой присоединение брома по двойной связи в этилене.
Химический термин присоединение сродни математическому термину суммирование. Эмпирическая формула продукта реакции присоединения получается суммированием формул реагентов:
С2Н4 + Вг2 - С2Н4Вг2
Запишите это уравнение с помощью структурных формул и с указанием названий каждого соединения.
Переходите к рубрике 15.
9. Судя по полученному вами продукту, вы добавили к 1 молю ацетилена 2 моля хлора. Однако вопрос относился к реакции, в которой к 1 молю ацетилена добавляется 1 моль хлора.
Укажите название соединения, образующегося при добавлении 1 моля хлора к 1 молю ацетилена.
Проверьте ответ в рубрике 17.
10. Неправильно.
Правило Марковникова гласит:
в реакциях присоединения га логе но во до родов к олефинам атом галогена присоединяется к более высокозамещенному атому углерода* * (т.е. к атому углерода, имеющему наименьшее число атомов водорода).
* В правиле Марковникова речь идет, конечно, о выборе между атомами, связанными двойной связью. Прим. ред.
I Ipoi рамма 11
Укажите такой атом углерода в соединении н н н н
Н- (!?—С -С=(^ (или СН3—СН2 СН=СН2)
I I I
НН н 4 3 2 I
Проверьте ответ в рубрике 18.
11. Выбранное вами соединение на самом деле является горючим. Оно содержит слишком много водорода.
Вернитесь к рубрике 24, запишите структурные формулы всех трех названных там соединений, а затем попытайтесь еще раз ответить на поставленный вопрос.
^01 12. Правильное название соединения со структурной формулой б-1.2-дихлорэтан.
Название 1,2-дихлорэтан означает, что один атом хлора присоединен к атому углерода номер 1, а другой-к атому углерода номер 2.
Н Н
I I
С1—С—С—С1
н н 2 I
Запишите теперь структурные формулы следующих соединений: а) 1,2-дииодэтан б) 1,1-дибромэтан в) 2-хлорпропан
Проверьте ответ в рубрике 5.
13. Правильно. Соединение
Н Н С1
Н -С- С- 1’-С1 (или СН3 СН2—СНС1)
н н н
называется 1,1-дихлорпропан.
(Название 3,3-дихлорпропан было бы неправильным, поскольку следует пользоваться минимальными из возможных номеров атомов углерода.)
Поупражнявшись в применении номенклатурных правил, продолжим снова обсуждение реакций присоединения.
Галогеповода роды присоединяются к алкенам (олефинам) во многом подобно свободным галогенам. Запишите уравнение присоединения бромоводорода (НВг) к этену, пользуясь структурными формулами.
Проверьте ответ в рубрике 23.
Галоген шмеинпные opi иннчгскш с<ч -мкини HP
14. Продукт реакции
Н Н
I I
Вг С С—Вг
может рассматриваться как производное этана, полученное из последнего замещением двух атомов водорода на атомы брома. Однако уравнение, приведенное в рубрике 1, описывает совсем не такую реакцию. Посмотрите еще раз внимательно на это уравнение!
Вернитесь к рубрике 1.
15.
н ZH н н
~'С = С + Вг-Вг —► Вг-С-С-Вг
Н 'н НН
этен бром дибромзтан
11
Обратите внимание, что в этой реакции имеется только один продукт.
В отличие от этого при проведении галогенирования посредством замещения одним из продуктов реакции является
галогеноводород, например
сн3
СН2С1
+ Cl2
+ НС1
толуол
хлор Бензилхлорид
хлороводород
к реакциям присоединения.
брому, можно присоединить к алкену хлор или иод.
Вернемся
Подобно
Пользуясь структурными формулами, составьте уравнения реакций: а) хлор + этен б) иод + этен
а также запишите названия продуктов этих реакций.
Проверьте ответ в рубрике 22.
16. Соединения CC12F2 и СС14 рассматриваются как органические, несмотря на то что они не содержат атомов водорода. Атомы хлора в CC12F2 и СС14 не поддаются ионизации.
Вернитесь к рубрике 39.
17. Правильно. Продукт реакции 1 моля ацетилена с 1 молем хлора называется 1,2-дихлорэтен
н хн
Н-СаС-Н + С12 —► zC=c'
С1 С1
1,2- дихлор этен
Поскольку 1,2-дихлорэтен обладает двойной связью, он может вступать в дальнейшую реакцию с галогенами либо с галогеноводородами. Запишите
уравнения присоединения к 1,2-дихлорэтену: а) хлора
б) хлороводорода
Проверьте ответ в рубрике 25.
18. Правильно. В соединении
Н Н Н Н
II I I
Н—С—С—С=С (или СН3—СН2—СН=СН2)
НН н 4 3 2 1
наименьшее число атомов водорода несет ненасыщенный атом углерода номер 2.
Следовательно, когда НС1 присоединяется к бутену-1 (соединению, структурная формула которого показана выше), атом хлора присоединяется к атому углерода номер 2, а атом водорода-к атому углерода номер 1. Укажите название продукта этой реакции и запишите его структурную формулу. Проверьте ответ в рубрике 28.
19. Н Н Н Н Н Н
Ml III
н с—С=С—Н + С12 - Н—С—С С—Н
I 11 I
Н Н Cl С1
1,2-дихлорп ропак
Обратите внимание на то, что два атома галогена в результате реакции присоединения оказываются связанными с разными атомами углерода.
Вернитесь к рубрике 28.
20. Два атома хлора в 1,2-дихлорпропане присоединены к различным атомам углерода. Проработайте внимательно еще раз материал, начиная с рубрики 22.
21. Посмотрите внимательнее на уравнение, приведенное в рубрике 1.
Исходное вещество (этен) имеет 4 атома водорода. Продукт реакции тоже содержит 4 атома водорода.
Следовательно, в этой реакции не происходит замещения.
Вернитесь к рубрике 1.
22. нч zh нн
zc=c + С1-С1 —- С1-С-С-С1
НН н н
дихлорэтан
н н н н
"£=€ + I-I —► I-C-C-I
Yl Хн н н
п п дииодэтан
Названия соединений типа «дихлорэтан», «дибромэтан» или «дииодэтан» построены правильно, но не являются полными. Это видно из того, например, что соединение
Н С1
Н—(^—(L С1
н н а
тоже представляет собой дихлорэтан.
Как мы видим, два атома хлора в дихлорэтане могут быть присоединены к одному и тому же атому углерода, как в структуре а, или к двум различным атомам углерода, как в структуре б:
Н Н
о—<L—<L—ci
I I
н н
б
Чтобы различать эти два случая, атомы углерода нумеруют, и в названии соединения с помощью соответствующих чисел указывают положения заместителей.
Так, соединение со структурой а называется 1,1-дихлорэтан. (В этом соединении оба атома хлора присоединены к атому углерода с номером 1.)
А как называется соединение со структурой б?
• 2,2-Дихлорэтан -► 29
• 1,2-Дихлорэтан -+ 12
• 1,1-Дихлорэтан -» 2
Таким образом, присоединение галогеноводородов к алкенам (олефинам) приводит к образованию лгоногалогенированных соединений.
В отличие от этого присоединение галогенов к алкенам приводит к образованию ......
Завершите это предложение.
Проверьте ответ в рубрике 30.
24. Правильно. Галогенпроизводные в системах с водой образуют нижний слой.
Галогенпроизводные-хорошо растворяют многие органические соединения, например жиры. Поэтому их часто используют как растворители, либо как средства для чистки, например при удалении жировых пятен.
Способность органического соединения гореть тем меньше, чем больше оно содержит атомов галогена и меньше атомов водорода. Некоторые галогенпроизводные используются даже в огнетушителях.
На основании сказанного выше какое, по-вашему, соединение должно быть наиболее пригодным для тушения огня?
• 2-Хлорпропан -» 4
• Винилхлорид -> 11
• Тетрахлорид углерода -» 36
25. н ,н нн
а) )с«С + С1а —► С1-С-С-С1
Cl Cl С1С1
$ + НС1 —► Н-<£-<?-С1
C1 С1 С1С1
Запишите названия продуктов двух указанных выше реакций. Не забывайте указать цифрами положения атомов хлора и помните, что при этом следует пользоваться минимальными из возможных номеров.
Проверьте ответ в рубрике 32.
26. Неправильно. Атомы углерода номер 3 и 4 в обсуждаемой реакции не участвуют, поскольку они не принадлежат к числу ненасыщенных.
Прочтите еще раз внимательно рубрику 37.
27. Напоминаем, что при указании атомов углерода в соединении следует пользоваться минимальными из возможных номеров.
Вы нарушили это правило. Соединение н н н
Н—С—С1 (или СН3 СН,—СН2С1)
III н н н
могло бы называться J-хлорпропан либо 3-хлорпропан, поскольку мы могли бы пронумеровать атомы углерода справа налево или слева направо:
3 2 1 12 3
С—С—С или С—С—С
Однако правильным названием является только 1-хлорпропан, поскольку при выборе названия следует пользоваться минимальными из возможных номеров.
Вернитесь к рубрике 5.
28. Правильно. В реакции присоединения НО к бутену-1 образуется 2-хлорбутан
НННН
н—<!:—(!?—с—i—н
I I I I
Н Н С1 н .
a a.h>i ен1амеиа*нм|.1г oji ••biuimcci.-wi- ; к ателия (И) 241
Галогены и галогеноводороды могут присоединяться не только по двойным связям, но также и по тройным связям. Каков продукт реакции 1 моля хлора с 1 молем ацетилена? Запишите уравнение этой реакции.
Какой продукт вы записали в правой части этого уравнения?
• Хлорэтен -> 42
• 1,1-Дихлорэтен -> 6
• 1,2-Дихлорэтен -» 17
• 1,1,2,2-Тетрахлорэтан -» 9
• Не знаю -» 35
29. Выбранное вами название, 2,2-дихлорэтан, означает, что два атома хлора присоединены к одному и тому же атому углерода (поскольку в названии соединения дважды участвует одно и то же число). Однако это не соответствует структурной формуле б, которая еще раз приведена ниже:
Н Н
ci—i—i—ci б
н н 2 I
Два атома углерода в этой формуле пронумерованы числами 1 и 2. Название соединения получается перечислением номеров атомов углерода, к которым присоединены замещающие атомы (эти номера указывают перед названием соединения, отделяя от последнего дефисом).
Следовательно, соединение со структурной формулой б имеет название .... Запишите это название!
Переходите к рубрике 12.
30. дигалогенированных соединений (дигалогеналканов)
Присоединение НС1 к пропену (пропилену) приводит к образованию 2-хлорпропана.
Запишите уравнение этой реакции, пользуясь структурными формулами.
Проверьте ответ в рубрике 37.
31. Неправильно. В рубрике 39 было ясно сказано, что органические галогенсодержащие соединения не диссоциируют.
Переходите к рубрике 74.
32. \ zh нн
ХС = СЧ + С12 —► С1-С-С-С1
С1 <Ь1С1
1, 1, 2, 2- тетрахлорзтан
\ ,н нн
zc = c + НС1 —► н-с-с-о
Г1 * 1
С1С1
1,1,2- трихлорэтан
16-29
242
Программа 11
Поскольку при перечислении положений заместителей следует пользоваться минимальными из возможных номеров, последнее соединение должно называться 1,1,2-трихлорэтан, а не 1,2,2-трихлорэтан.
Как вы убедитесь далее, присоединение галогенов или галогеноводородов к алкеиам либо алкинам позволяет синтезировать разнообразные галогензамещенные углеводороды.
В частности, при помощи такой реакции синтезируют промышленно важное соединение винилхлорид: в химическом производстве его получают присоединением 1 моля хлороводорода к 1 молю ацетилена.
Запишите уравнение присоединения НС1 к ацетилену.
Проверьте ответ в рубрике 40.
33. Неправильно. Присоединение НВг к этену дает бромэтан.
Запишите уравнение этой реакции, пользуясь структурными формулами, а затем повторите материал, начиная с рубрики 23.
Н-|-С1 н
зслорметан (метилхлорив), газ
н
н
дихлорметан (метиленхлорид), жидкость
н
H-i-Br
। н бромметан (метилбромиВ), жидкость
трихлорметан (хлороформ), жидкость
тетрахлорметан (тетрахлорид углерода), жидкость
Вг
С-С
Вг Вг
тетрабромзтен (тетрадром -этилен), твердое вещество
Многие галогенпроизводные имеют сладковатый запах и обладают наркотическим действием; в качестве примера приведем хлороформ.
Галогенпроизводные нерастворимы в воде и имеют плотность больше, чем у воды.
Поэтому приливание жидкого галогенпроизводного к воде приводит к образованию двух фаз. Какая из них образует нижний слой?
• Вода -> 7
• Галогенпроизводное -+ 24
35. Когда молекула какого-либо галогена присоединяется по двойной связи, к каждому концу этой связи переходит по одному атому хлора:
НН НН
(LA + Hal2 - Hal—i—i—Hal
II Л
НН НН
Присоединение 1 моля галогена к 1 молю соединения с тройной связью происходит следующим образом:
Га.tot еизамешспные органические соединения (II)
243
Н Л
H-CsC-H + Halz —► Hal Vai
Теперь попытайтесь ответить на вопрос, поставленный в рубрике 28, еще раз.
36. Правильно. Тетрахлорид углерода используется для наполнения огнетушителей.
Тушение огня распылением СС14 происходит благодаря испарению СС14. Газообразный тетрахлорид углерода предотвращает доступ воздуха к огню и тем самым гасит его.
Огнетушителями, наполненными СС14, не следует пользоваться в закрытых помещениях, потому что при пиролизе (тепловом разложении) СС14 образуются ядовитые газы (например, фосген).
(Фосген будет рассматриваться в программе 18.)
Галогенпроизводные имеют множество других применений. Например, некоторые из них используются в качестве пестицидов (средств для борьбы с вредоносными микроорганизмами или растениями).
Реакционноспособность и хорошая растворяющая способность СС14 объясняют его разнообразное использование в химической промышленности.
Прежде чем перейти к химическим свойствам этих соединений, нам следует познакомиться с некоторыми принятыми для них терминами.
Общее название «галогенпроизводные» охватывает все соединения, состоящие из углеводородного радикала и одного или нескольких атомов галогена. Для полностью галогенированных углеводородов используются также такие названия, как «хлоруглерод», «фторуглерод» и т. д.
Ответьте на следующие вопросы:
а) Какие четыре элемента объединяются под общим названием «галогены»?
б) Какое сокращение используется для термина «галоген»?
Проверьте ответ в рубрике 44.
37. Н Н Н Н Н Н
н—(L (t=(t + на -> н—(!:—с—i—н
I I I I I
НН Н С1 н
2-хлорпропан
Обратите внимание, что атом хлора присоединяется к центральному атому углерода, а атом водорода-к концевому атому углерода
С1-Н
Противоположная ориентация обычно не наблюдается. Атом хлора всегда присоединяется к более высокозамещенному концу двойной связи, т.е. к атому углерода, имеющему минимальное число атомов водорода*. В случае пропена
* Такой порядок присоединения установил в 60-х годах прошлого столетия ученик
А. М. Бутлерова - В. В. Марковников. Во всем мире эту закономерность называют правилом Марковникова-Прим. ред.
16*
244
Программа 11
центральный атом углерода имеет минимальное число атомов водорода.
К какому атому углерода в бутене-1 следует ожидать присоединения атома хлора при реакции с НС1?
н н н н
Н—(^—(^—1'=<^ (или СН3—СН2—СН=СН2)
НН н
бутен-1
• К атому углерода номер 1 —► 10
• К атому углерода номер 2 —► 28
• К атому углерода номер 3 —► 45
• К атому углерода номер 4 —► 26
38. Вы не понимаете, что происходит при присоединении галогеноводородов Я к ацетилену.
Проработайте еще раз материал, начиная с рубрики 28.
39. а) Винилхлорид получается присоединением хлороводорода к ацетилену.
б) Винилхлорид получается отщеплением хлороводорода от 1,2-дихлорэтана.
Такое отщепление галогеноводорода не всегда легко осуществимо. Хлор связывается довольно сильно, тогда как бром, и особенно иод, элиминируют гораздо легче-в форме НВг и HI соответственно.
Вы уже знаете, что неорганические галогениды, например хлорид натрия NaCl, бромид калия КВг или иодид натрия Nal, в водном растворе диссоциируют на ионы. В отлцчие от этого органические галогенсодержащие соединения не диссоциируют. Они не дают галогенид-ионов в водном растворе.
Какие из следующих соединений должны образовывать осадок в растворе нитрата серебра?
CH3I, NaBr, С6Н5С1, КС1, СаС12, CC12F2, СС14.
• Все перечисленные соединения -+ 65
• NaBr, КО, СаС12 -> 46
• СН31, С6Н5С1, CC12F2, CCU -> 31
• NaBr, КО, СаС12, CCI2F2, ССЦ -> 16
• NaBr, КО, СаО2, CCI2F2, СС14 -> 16
• Нуждаюсь в раз*ьяснениях -+ 74
40 нх ,н
H-CSC-H + НС1 —- ос'
н' ЧС1
винилхлорид
Систематическое название винилхлорида-хлорэтен.
Вы уже знакомы с винильным радикалом из программы 9. Запишите его структурную формулу.
Проверьте ответ в рубрике 48.
Галогензамещенные opi эпические соединения (II)
245
41. Н Н
I I Н—С—С—Н -> ... + НС1
Элиминируемые атомы Н и О никогда не отрываются от одного и того же атома углерода. Элиминирование приводит к образованию двойной связи.
Теперь постарайтесь завершить это уравнение и укажите названия всех участвующих в нем соединений.
Проверьте ответ в рубрике 51.
42. Хлорэтен образуется в реакции ацетилена с хлороводородом
н\ /Н н-с=с-н + но —► \>с/
/ \
Н С1
хлорзтен (винилхлорид)
Е
Однако заданный в рубрике 28 вопрос относится к реакции ацетилена с хлором.
Вернитесь к рубрике 28.
43. а) фреон
б) тефлон
Обратимся теперь к свойствам галогенпроизводных углеводородов. Подобно самим углеводородам, эти соединения при комнатной температуре и нормальном давлении могут находиться в газообразном, жидком либо твердом состоянии. Как и в других случаях, соединения с низкой молекулярной массой при нормальных температуре и давлении обычно представляют собой газы. Соединения с более высокими молекулярными массами находятся в жидком и, наконец, в твердом состояниях.
Приведем ряд примеров:
Соединение Молекулярная масса Нормальное состояние
Хлорметан (метилхлорид) 50,5 Газообразное
Дихлорметан (метиленхлорид) 85 Жидкое
Бромметан (метилбромид) 95 Жидкое
Трихлорметан (хлороформ) 119,5 Жидкое
Тетрахлорметан (тетрахлорид
углерода) 154 Жидкое
Тетрабромэтен (тетрабромэтилен) 344 Твердое
Запишите название и структурную формулу для одного газообразного, одного жидкого и одного твердого галогенпроизводного.
Переходите к рубрике 34.
246
Программа 11
44. а) Фтор, хлор, бром, иод.
б) Hal.
Сокращение Hal может использоваться подобно символам химических элементов в химических формулах. Мы уже встречались с несколькими примерами таких записей.
Запишите названия и эмпирические формулы для четырех соединений, объединяемых общим обозначением СН3—Hal.
Проверьте ответ в рубрике 54.
45. Неправильно. Атомы углерода номер 3 и 4 в обсуждаемой реакции не участвуют, поскольку они не принадлежат к числу ненасыщенных.
Прочтите еще раз внимательно рубрику 37.
46. Правильно. Мы познакомились с элиминированием галогеноводородов Н—Hal от галогенпроизводных R—Hal. Рассмотрим теперь замещение Hal на Гидроксильную группу ОН. Такое замещение происходит при взаимодействии галогенпроизводных с водой или основаниями:
R—Hal + Н2О - R—ОН + Н—Hal
Рассмотрим такой пример.
Кипячение бензилхлорида в водном растворе основания, например NaOH, вызывает замещение С1 группой ОН
Завершите уравнение этой реакции.
Проверьте ответ в рубрике 55.
47. Вы не понимаете, что происходит при присоединении галогеноводородов к ацетилену.
Проработайте еще раз материал, начиная с рубрики 28.
/С=Сч н
CHj- СН-
Винильный радикал
01^= CHCL Винилхлорид
Винилхлорид может полимеризоваться подобно этилену или стиролу.
Вы наверняка знакомы с продуктом его полимеризации-поливинилхлоридом, сокращенно ПВХ.
Завершим обсуждение реакций присоединения кратким повторением.
Запишите структурную формулу 1,2-дибромэтана и укажите, как можно получить это соединение.
• Присоединением НВг к этену -► 33
• Бромированием (замещением) этана -► 62
Г алогензамещенные органические соединении (II)
247
Присоединением Вг2 к этену
Присоединением Вг2 к ацетилену
-> 56
-+ 3
49. Прочность связи атомов хлора в бензилхлориде и хлорбензоле неодинакова.
Сравните условия реакции замещения С1 на группу ОН в бензилхлориде и в хлорбензоле.
Это поможет вам правильно ответить на вопрос, поставленный в рубрике 46. Вернитесь к рубрике 46.
50. Нет, пропан в этой реакции не образуется.
При элиминировании HI из соединения
Н Н Н
Н—i—С—(t—Н (или С3Н71)
Н I н
продукт реакции имеет эмпирическую формулу С3Н6. Эмпирическая формула пропана С3НВ!
Как называется соединение с эмпирической формулой С3Н6?
Проверьте ответ в рубрике 59.
51. V V
H-C-(j!-H Cl Cl
Н Н )с«с'
Н ЧС1
+ НС1
1,2-д ихлорэтан винилхлорид хлороводород
Теперь вам известны два метода получения винилхлорида. Сформулируйте эти методы, завершив следующие предложения:
а) Винилхлорид получается присоединением ... к ....
б) Винилхлорид получается элиминированием ... от ....
Проверьте ответ в рубрике 39.
52. а) дихлордифторметан
б) тетрафторэтилен (тетрафторэтен) Укажите промышленные названия а) дихлордифторметана: ....
б) полимера тетрафторэтилена: ....
Проверьте ответ в рубрике 43.
53. Тетрафторэтилен (тетрафторэтен) получается из этилена (этена) замещением всех четырех атомов водорода на фтор. Эти сведения помогут вам записать структурную формулу тетрафторэтилена.
Проверьте ответ в рубрике 60.
24Я
Пр<>| p iMMa I I
54. Фторметан: CH3F
хлорметан: бромметан: СН3С1 СН3Вг
иодметан: СН31
Общее название: CH3Hal
Обобщенное обозначение Hal для галогенов очень удобно. Аналогично этому для общего обозначения всего семейства углеводородных радикалов может использоваться единый символ R. Например:
хлорметан: СН3С1
хлорэтан: С2Н5С1
хлорбензол: С6Н5С1
Общая формула: RC1
Какова общая формула для моногалогенированных углеводородов?
Проверьте ответ в рубрике 61.
a
Н,С1 снаон
j] + NaOH -100 С» + NaCl
бензилхлорид
Приведем еще один пример. Реакция по указанному ниже уравнению протекает при ЗОО°С и повышенном давлении.
хлорбензол
На основании сопоставления различных условий этих двух реакций сделайте вывод, где атом хлора связан прочнее-в бензилхлориде или в хлорбензоле?
• Оба они связаны одинаково прочно -» 49
• Атом хлора в бензилхлориде -» 72
• Атом хлора в хлорбензоле -► 67
56. Правильно.
Укажите продукт реакции 1 моля хлороводорода с 1 молем ацетилена.
• Хлорэтан -» 38
• Винилхлорид -► 63
• Дихлорэтен -» 47
57. Реакцией между галогенсодержащим органическим соединением и магниевыми стружками в эфире.
Очень важно исключить воду из этой реакции. Почему?
Запишите краткий ответ. Проверьте его в рубрике 71.
Г:1.!<>ге1памеИ|спн1.|е <>р> шшчс* Mie <ос UKirimii ill!
58. CH3I + Mg - CH3—Mg- I
Реакционная способность реактивов Гриньяра иллюстрируется примером реакции с водой:
СН3—Mg—I + Н2О ч СН4 + Mg(OH)I
Таким образом, реактивы Гриньяра расщепляются водой, образуя углеводород и основной галогенид магния. Что образуется при действии воды на
Mg-Br
Укажите названия образующихся продуктов.
Проверьте ответ в рубрике 66.
59. Правильно. При элиминировании иодоводорода из 2-иодпропана образуется пропен (пропилен). Реакция протекает по уравнению
н н н н н н
III 111
Н-С-С-С-Н -♦ Н-С-С=С + HI III II
Н 1 Н НН
2 - иодпропан пропен
Эту реакцию можно также записать следующим образом:
СН3—CHI—СН3 ч СН3СН=СН2 + HI
Она протекает с выходом 94% в спиртовом растворе гидроксида калия (т.е.
в КОН, растворенном в спирте) при 80°С. (Спирт служит только растворителем и не принимает участия в реакции.)
Вводимое в реакцию основание служит для связывания иодоводорода в форме иодида калия, что предотвращает протекание обратной реакции.
Однако присутствие основания не всегда необходимо. Элиминирование галогеноводородов в промышленных условиях часто осуществляется в результате расщепления паров галогенпроизводного при высоких температурах (реакция в газовой фазе).
Приведем пример. Газофазное элиминирование 1 моля НС1 от 1 моля 1,2-дихлорэтана приводит к образованию промышленно важного продукта, с которым вы уже знакомы.
Запишите уравнение этой реакции с указанием названий всех соединений и проверьте затем ответ в рубрике 51, а если вы нуждаетесь в дополнительных разъяснениях, обратитесь к рубрике 41.
60. Проверьте ответ:
\ Л
С*С (4Л7« F,C= CF )
F F 2 а
тетра<рторзтилен
(тегпрсирггюрэтен)
Подобно этилену (этену) и другим олефинам (Как, например, стирол или винилхлорид), тетрафторэтилен тоже может полимеризоваться. Образующийся полимер имеет промышленное название тефлон
Jf'O Программа II
Завершите следующие предложения:
а) Химическое название фреона ....
б) Тефлон представляет собой полимеризованный ....
Проверьте ответ в рубрике 52.
61. R—Hal
Символ R используется для обозначения углеводородных радикалов как, например, СН3—, C2HS—, Н2С=СН—, C6HS— и т. д.
В дальнейшем мы будем широко пользоваться символом R.
Еще один термин, с которым мы будем постоянно иметь дело в следующих программах,-это функциональная группа.
Функциональная группа-это атом или группа атомов, присоединенная к какому-либо органическому радикалу R. Химические реакции органического соединения обычно осуществляются по его функциональной группе, поэтому такая группа определяет химическую «функцию» рассматриваемого соединения.
Приведем несколько примеров:
R—Hal - галогенпроизводные
R-органический радикал
Hal-функциональная группа
R—ОН-спирты
R-органический радикал
ОН-функциональная группа
R—NH2-амины R-.............
NH2-......
Завершите два последних предложения.
Проверьте ответ в рубрике 68.
(Пусть вас не смущают названия и формулы, которые пока еще неизвестны вам-мы подойдем к этому позже.)
62. Неправильно. В начале этой программы подчеркивалось, что при прямом галогенировании насыщенных углеводородов образуется смесь трудно разделимых соединений. Следовательно, прямое бромирование
этана-нерациональный способ получения 1,2-дибромэтана. Существует намного более удачный метод его получения.
Вернитесь к рубрике 48.
63. Правильно.
Прежде чем перейти к свойствам галогенпроизводных, упомянем два промышленно важных соединения фтора. Возможно, вы знакомы с одним из промышленных названий дихлордифторметана-фреон.
Запишите структурную формулу фреона.
Проверьте ответ в рубрике 70.
64. Правильный ответ должен быть таким.
«Органическое соединение разлагается при высокой температуре. Галоген реагирует с медью. Галогенид меди испаряется (в отличие от металлической меди). Пары галогенида меди окрашивают пламя».
Какую окраску имеет пламя?
Проверьте ответ в рубрике 73.
I ujioi vh laMemeinibiv <>p< аничсскт с*м чип* пия JI)
251
65. Вернитесь к рубрике 39 и внимательно прочтите ее еще раз, тогда вы сможете дать правильный ответ на поставленный там вопрос.
(Если вам необходимо вспомнить, как происходит осаждение галогенид-ионов при взаимодействии с нитратом серебра, обратитесь к рубрике 74.)
66. Бензол и основной бромид магния.
Как получают реактив Гриньяра?
В каком растворителе проводится реакция Гриньяра?
Запишите краткие ответы на эти вопросы.
Проверьте их в рубрике 57.
67. Правильно. Атомы хлора в боковой цепи вступают в реакции легче, чем атомы хлора в ароматическом кольце.
Запишите уравнение реакции между хлорбензолом и гидроксидом натрия.
Проверьте ответ в рубрике 76.
68. R-органический радикал (остаток).
Hal, ОН и NH2-функциональные группы.
Перейдем теперь к описанию некоторых .реакций галогенпроизводных.
Эти соединения могут реагировать с водой или основаниями: а) с элиминированием (отщеплением) галогеноводорода, либо б) с замещением атома галогена на группу ОН
Будет ли происходить реакция а) и б), зависит не только от исходного соединения, но также от условий проведения реакции (например, от температуры и давления).
Элиминирование галогеноводорода приводит к образованию ненасыщенного продукта реакции.
В качестве примера рассмотрим реакцию
н н н । । । Н-(р-С-С-Н Н I н
отцлпле-нив HI
+ HI
Как называется продукт этой реакции?
Пропан -> 50
Пропен -> 59
Нуждаюсь в разъяснениях -» 75
69. R—Hal + Mg -♦ R—Mg—Hal
Такие соединения магния называются реактивы Гриньяра (в честь открывшего их французского химика Гриньяра).
Запишите уравнение образования реактива Гриньяра из метилиодида.
Проверьте ответ в рубрике 58.
Нршрамма 11
70- Г I C1-C-F или С1-С-С1
I I
F F
дихлордисртор -метан (сррвон)
Еще одно важное фторсодержащее соединение-тетрафторэтилен.
Запишите структурную формулу этого соединения и проверьте ее
в рубрике 60, а если вы нуждаетесь в помощи, обратитесь к рубрике 53.
71. При получении реактивов Гриньяра очень важно удалять воду, поскольку она разрушает эти реактивы.
В завершение этой программы опишем аналитическую пробу * на галогенсодержащие органические соединения.
В исследуемое соединение погружают кусок медной проволоки. Затем эту проволоку вносят в пламя газовой горелки. Если в соединении присутствуют атомы галогена, пламя заметно окрашивается в зеленый цвет.
При этой пробе происходит такая реакция: органическое соединение разлагается при высокой температуре. Высвобождающийся галоген реагирует с медью, образуя галогенид меди, например СиС12, который испаряется (металлическая медь не испаряется). Пары галогенида меди вызывают появление зеленой окраски.
Чистая медная проволока не вызывает окрашивания пламени. Кратко объясните, почему после внесения в пламя проволоки, предварительно погруженной в галогенсодержащее соединение, пламя окрашивается в зеленый цвет.
Проверьте ответ в рубрике 64.
72. Неправильно. Сравните условия реакции замещения С1 на группу ОН в бензилхлориде и в хлорбензоле. Это поможет вам правильно ответить на вопрос, поставленный в рубрике 46.
Вернитесь к рубрике 46.
73. При внесении в пламя газовой горелки медной проволоки, которую перед этим погружали в галогенсодержащее органическое соединение, пламя приобретает зеленую окраску.
Конец программы 11.
74. Соли галогеноводородных кислот диссоциируют в водном растворе, например
NaCl - Na+ + СГ
Их добавление в раствор нитрата серебра вызывает осаждение нерастворимого галогенида серебра, например
Na+ + СГ + Ag+ + NO; -> AgCl + Na+ + NO;
* Эту пробу называют пробой Бейлыитейна по имени русского ученого Ф. Ф. Бейльштейна,- Прим. ред.
I a.to! ен is.wiiuiiiw
Таким образом, необходимым условием образования осадка в растворе при добавлении к нему нитрата серебра является присутствие в этом растворе галогенид-ионов.
Поскольку органические галогенсодержащие соединения не диссоциируют, они не образуют в растворе галогенид-ионов.
Вернитесь к рубрике 39.
75. Внимательно посмотрите на уравнение реакции
н н н н н н
ill ill
Н-С-ОС + Hl —► н-с-с-с-н II III
НН Н I н
2-иодпропсгн
которое описывает присоединение HI к алкену.
Обратная реакция представляет собой элиминирование иодоводОрода из 2-иодпропана.
Вернитесь к рубрике 68.
76.
+ NaOH
Как правило, атомы галогенов в алифатических соединениях или в боковых цепях ароматических соединений обладают большей реакционной способностью, чем атомы галогенов, непосредственно связанные с ароматическим кольцом.
Мы уже познакомились с примером, когда галогенсодержащие соединения используются в качестве исходных веществ для введения других функциональных групп, например группы ОН.
Реакция галогенсодержащего органического соединения R—Hal с металлическим магнием приводит к образованию магнийорганических соединений, т.е. органических соединений, содержащих магний. Подобные соединения называют металлоорганические соединения.
Приведем пример:
Эта реакция проводится при постепенном добавлении раствора бромбензола в эфире к магниевым стружкам.
Структурная формула продукта реакции показывает, что атом магния внедряется между органическим радикалом и атомом галогена.
Завершите общее уравнение подобных реакций:
R—Hal + Mg -+
Проверьте ответ в рубрике 69.
Программа 12
Гидроксильные прпизво. шьк
1. Группа —ОН называется гидроксильная группа*.
Все соединения, содержащие гидроксильную группу, обладают некоторыми общими для них химическими свойствами. Различия в их химическом поведении обусловлены положением гидроксильной группы в молекуле. Но вначале нужно познакомиться с некоторыми новыми понятиями.
Мы уже знаем, что углеродные цепи в органических молекулах построены различными способами. Например, атом углерода может быть непосредственно связан с одним, двумя, тремя или четырьмя другими атомами углерода. Атом углерода, непосредственно соединенный только с одним соседним атомом углерода, называется первичный.
Укажите число первичных атомов углерода в соединении
СН3—СН—СН3
I
сн3
Один -► 22
Два -» 15
Три -► 10
Четыре -► 12
2. Правильно. Ниже еще раз приведены формулы обсуждаемых соединений, в которых вторичные атомы углерода помечены символами 2°:
CHj-CHj
2е
CHj-CH2-CHj
2е
СН3-СН-СН2-СН2
СН3
Итак, вы уже знаете, что
первичный атом углерода непосредственно связан с одним соседним атомом углерода,
вторичный атом углерода непосредственно связан с двумя другими атомами углерода.
Со сколькими атомами углерода связан третичный атом углерода? Содержится ли хотя бы в одной из, приведенных выше формул третичный атом углерода? Если да, запишите эту формулу и пометьте в ней третичный атом углерода символом 3°.
Проверьте ответ в рубрике 14.
3. 1°-первичный атом углерода
2° - вторичный' атом углерода 3°-третичный атом углерода
4° - четвертичный атом углерода
* В неорганической химии ион ОН “ принято называть гидроксид-ион. В данном же случае речь идет о группе ОН, не несущей заряда, ее в органической химии называют гидроксил или гидроксильная группа-Прим. ред.
Гидроксильные производные
Внимательно посмотрите на структурную формулу следующего соединения и укажите число содержащихся в нем первичных, вторичных, третичных и четвертичных атомов углерода.
СН3
I
СН3—С—СН2—СН—СН2—СН3
I I
СН3 СНз
Сколько атомов каждого типа вы обнаружили в этом соединении?
Первичные Вторичные Третичные Четвертичные
• 3 4 1 1 —► 16
• 4 3 1 1 —♦ 19
• 5 2 1 1 —> 13
• 5 2 0 1 —► 23
• 5 3 1 0 —> 26
• Получились другие числа —> 29
4. Общая формула вторичных спиртов
R Н R4 R
или СН(ОН) или СНОН
R ОН RZ R
В сокращенных формулах группа ОН иногда записывается в скобках, чтобы обратить внимание на эту функциональную группу и тем самым избежать возможной путаницы. Хотя третья из приведенных выше формул тоже правильна, она не столь ясно свидетельствует о наличии в соединении группы ОН.
Сравните следующие записи:
первичный спирт:
вторичный спирт:
R-CHjOH или
'сНОН или R
Н
R-6-OH
Н
r' 'Ън
Запишите общую формулу третичных спиртов и проверьте ее в рубрике 17.
5. Вторичный атом углерода связан с двумя другими атомами углерода. Так, соединение
СН3—СН2—СН3
содержит один вторичный атом углерода.
Прочтите еще раз внимательно рубрику 20, и вы сможете дать правильный ответ на поставленный там вопрос.
flpm р.гчма 12
Проверьте ответ:
Z ,н
R-C—ПТ1 + [О] —► R-C\ + HaO
\>-[hJ \>
HaO
R-'C-OH ♦ (O] —► реакция не идет RX
Соединения, образующиеся в этих реакциях, будут обсуждаться позже.
Обратимся сейчас к номенклатуре спиртов.
Согласно международному соглашению, названия спиртов образуют из названий соответствующих углеводородов, прибавляя к ним окончание -ол.
Перепишите следующие формулы и укажите названия соединений:
СН3ОН СН3—СН2ОН
метанол
Проверьте ответ в рубрике 21.
7. Неправильно. Вернитесь к рубрике 24 и начните ее читать со второго абзаца.
8. Еще раз внимательно прочтите содержание рубрики 22, и вы сможете правильно ответить на поставленный там вопрос.
9. Вторичный атом углерода связан с двумя другими атомами углерода. Так, соединение
СН3—СН2—СН3
содержит один вторичный атом углерода.
Прочтите еще раз внимательно рубрику 20, и вы сможете теперь дать правильный ответ на поставленный там вопрос.
10. Правильно. Соединение со структурной формулой
СН3—СН—СН3 I сн3
содержит три атома углерода, каждый из которых связан только с одним соседним атомом углерода.
Такие атомы углерода называются ....
Завершите это предложение и проверьте ответ в рубрике 20.
11. Неправильно. Вернитесь к рубрике 24 и начните ее читать со второго абзаца.
12. Еще раз внимательно посмотрите на структурную формулу соединения, изображенную в рубрике 1. Не все четыре атома углерода в этом соединении имеют одинаковое окружение.
13. Правильно.
Теперь спишите следующую структурную формулу и укажите в ней символами Г, 2°, 3° и 4° соответственно первичные, вторичные, третичные и четвертичные атомы углерода.
СН3
I
СН3 СН -СН2- с- сн2 сн3
I I
сн3 сн3
Проверьте ответ в рубрике 24.
14.
3”
CHj-^H-CHj-CHj
СН3
Атом углерода, связанный с четырьмя другими атомами углерода, называется четвертичный.
Запишите теперь, какой смысл имеют следующие четыре символа:
1° ....
2° ....
3° ....
4° ...,
и проверьте ответ в рубрике 3.
15. Еще раз внимательно посмотрите на структурную формулу соединения, изображенную в рубрике 1. В этом соединении имеются три атома углерода с одинаковым окружением.
16. Неправильно. Обратитесь за разъяснением в рубрику 29.
В третичном спирте к атому углерода, несущему гидроксильную группу, присоединены три группы R. Ответьте теперь на такой вопрос.
Существуют ли четвертичные спирты?
• Да -31
• Нет - 27
• Не знаю -> 33
17-29
25S Программа 12
18. Неправильно. Вернитесь к рубрике 24 и начните ее читать со второго абзаца.
19. Неправильно. Обратитесь за разъяснением в рубрику 29.
20. первичные
Атом углерода, непосредственно связанный с двумя другими атомами углерода, называется вторичный.
Сколько соединений из числа изображенных ниже содержат вторичный атом углерода?
сн3—сн3 сн3—сн2—сн3 сн3—снсн2- сн3
• Три -> 9
21. СН3—ОН СН3—сн2—ОН
метанол этанол
(В этих словах ударение ставится на последнем слоге.) Сокращенная формула этанола: С2Н5ОН.
Следующий (высший) спирт образуется от пропана, углеводорода с тремя атомами углерода сн3—сн2—сн3 Сколько различных спиртов можно получить из пропана?
• Один -► 35
• Два -> 32
• Три -► 42
• Не знаю -► 54
22. Неправильно. В соединении
1° 3° г
CHj-CH-CHj
CHj 1°
присутствуют три атома углерода, каждый из которых связан только с одним соседним атомом углерода.
Эти три атома углерода помечены символом 1°. Четвертый атом углерода (помеченный символом 3°) связан с тремя другими атомами углерода.
Атом углерода, связанный только с одним соседним атомом углерода, называется первичный.
Сколько первичных атомов углерода содержится в соединении, структурная формула которого изображена выше?
• Один -> 8
• Три -► 10
• Четыре -► 12
23. Неправильно. Обратитесь за разъяснением в рубрику 29.
24. Внимательно сверьте ваш ответ с приведенной ниже схемой
сн3
с н3—с н-с на-с -с н2-с н3 сн3 сн3
Если вы сделали какие-нибудь ошибки, вернитесь к рубрике 2.
Теперь приступим к изучению соединений, содержащих гидроксильную группу.
Если в органическом соединении гидроксильная группа непосредственно связана с первичным атомом углерода, это соединение представляет собой первичный спирт.
Приведем примеры:
Н-С-С-ОН и н-с-с-с-он
II III
НН н с н
н3
Запишем эти первичные спирты сокращенными структурными формулами:
СН3—СН2ОН и ...
Завершите это предложение и проверьте ответ в рубрике 40.
Е
25. Правильно. Среди перечисленных в рубрике 37 соединений содержатся три первичных спирта:
сн3
сн3-снаон с3н5-сн-сн3 сн3-с-сн3
сн2он снаон
один вторичный спирт:
сн3-снон-сгн5
один третичный спирт:
н3сч
н3с-с-он
н3с'
Различия между первичными, вторичными и третичными спиртами заключаются не только в их формулах, но и в химических свойствах, например в их реакциях с окислителями. Первичные и вторичные спирты могут окисляться, превращаясь в соединения с новыми функциональными группами:
zH zH
R-с—Гн| + [о] —► R-c' + Н2О (1) чо-[н] 'о
R ПТ
А R О- Н
Чо]
♦ Н2О (2)
17-
В качестве окислителей в таких реакциях используются перманганат калия или бихромат калия. Уравнения подобных реакций часто записывают в сокращенной форме, используя для обозначения окислителя символ [О], как показано выше.
В отличие от первичных и вторичных спиртов третичные спирты не взаимодействуют с окислителями при аналогичных условиях реакции:
юс-он + [о] —► реакция не идет (3) r'
Перепишите все три уравнения и завершите уравнение (2).
Проверьте ответ в рубрике 6.
26. Неправильно. Обратитесь за разъяснением в рубрику 29.
27. Правильно. Четвертичный атом углерода связан с четырьмя другими атомами углерода, следовательно, у него не остается свободной валентности для присоединения функциональной группы.
Таким образом, следует различать
первичные, вторичные и третичные спирты
Сколько из следующих соединений принадлежат ко вторичным спиртам?
HjC\ zCHOH CH,-CH(OH)-CHj r-choh-r
HjC
• Три -> 37
• Два -> 39
• Одно -<• 41
• Ни одного -► 43
28. Неправильно.
Еще раз внимательно посмотрите на формулы, приведенные в рубрике 42.
29. В приведенных ниже схемах ради простоты опущены атомы водорода: Первичные атомы углерода (1°):
1° г с-с
Вторичный атом углерода (2°):
2° с-с-с
Третичный атом углерода (3°):
з°
C-J-C
Четвертичный атом углерода (4°):
fZ
с
Вернитесь к рубрике 3.
30. Неправильно.
Еще раз внимательно посмотрите на формулы, приведенные в рубрике 42.
31. Неправильно. Четвертичных спиртов не существует.
Четвертичный атом углерода связан с четырьмя другими атомами углерода, как, например, в соединении
CHJ4"
CHS-C-CHS chs
Следовательно, у четвертичного атома углерода не остается свободной валентности для присоединения функциональной группы.
Переходите к рубрике 27.
32. Правильно. Из пропана можно получить два спирта. Они имеют формулы
н н н н н н 1 1 1
1 1 1 н—с—с—с—он 1 1 1 и 1 1 1 н-с- с—с—н 1 1 1
1 1 1 н н н 1 1 1 . н он н
(или СН3—СН2—СН2ОН) (или СН3—СНОН—СН3)
Очевидно, название пропанол недостаточно для описания этих двух соединений.
Помните ли вы настолько хорошо правила номенклатуры, чтобы дать систематические названия этим двум пропанолам?
• Да -> 44
• Нет -> 47
33. Четвертичный атом углерода связан с четырьмя другими атомами углерода, как, например, в соединении
^4’
CHj-C-CHj сн,
Следовательно, у четвертичного атома углерода не остается свободной валентности для присоединения функциональной группы.
Переходите к рубрике 27.
34.
Формула спирта Систематическое Тривиальное название название
СН3ОН сн3—СН2ОН сн3—сн2—СН2ОН СН3—СНОН—сн3 Метанол Метиловый спирт Этанол Этиловый спирт Пропанол-1 Пропиловый спирт Пропанол-2 Изопропиловый спирт
'.62
Для указания положения функциональной группы используется номер атома углерода, к которому она присоединена.
Перейдем теперь к описанию синтеза спиртов.
С этой целью может использоваться гидролиз алкилгалогенидов
R—Hal + Н2О -> R—ОН + Н -На1
Как и в предыдущей программе, Hal здесь означает галоген, т.е. —Вг или —I, a R означает алифатический остаток (алкильный радикал).
Составьте уравнение реакции получения этанола из соответствующего алкилхлорида. Какой это должен быть алкилхлорид?
• Метилхлорид -<• 50
• Этилхлорид -» 46
• Пропилхлорид -» 53
35. Неправильно. Обратитесь за разъяснением в рубрику 54.
3 36. Проверьте ответ:
н3сх н,с
НЭС^С-С1 + Н,О —►HjC-C-OH + НС1
HjC H,CZ
Образующееся соединение представляет собой третичный бутиловый спирт, или сокращенно mpem-бутанол.
Третичные алкилгалогениды гидролизуются легче, чем вторичные, а вторичные-легче, чем первичные.
Другие общие методы получения спиртов будут описаны позднее. Сначала мы рассмотрим несколько конкретных спиртов.
Простейшим из спиртов является метанол. Это первичный спирт, формула которого может рассматриваться как частный случай общей формулы
R—СН2ОН
где R = Н.
Запишите развернутую структурную формулу метанола.
Проверьте ответ в рубрике 48.
37. Правильно. Посмотрите теперь на формулы следующих соединений.
Сколько среди них первичных, вторичных и третичных спиртов?
сн3
сн3-снаон сан,-<рн-сн3 сн3- с-сн,
снаон СНаОН
н,сч HjC-COH снэ-снон-сан,
н,с
Первичные Вторичные Третичные
• 2 2 1 -> 7
• 3 1 1 -> 25
• 4 0 1 - 11
• 4 1 0 - 18
Гидроксильные произво диме
263
38. Проверьте ответ:
СН3—СН=СН2 + Н—ОН - сн3—снон—сн3
пропен пропанол-2 (или нзопоопиловый спирт)
Присоединение воды к олефину является обратимой реакцией: при более высокой температуре вода может отщепляться от спирта, в результате чего снова образуется олефин.
Запишите уравнения отщепления воды от
а) этанола,
б) изопропилового спирта.
Проверьте ответ в рубрике 49.
39. Неправильно. Еще раз внимательно посмотрите на формулу вторичных спиртов, приведенную в рубрике 4.
После этого попытайтесь снова ответить на вопрос, поставленный в рубрике 27.
40. СН3—СН2ОН и СН3— СН—СН2ОН
I
сн3
Оба этих соединения являются первичными спиртами. В первичном спирте всегда содержится группа
Н
I
—СН2ОН или иначе —С—ОН
I
Н
Следовательно, первичные спирты имеют общую формулу
н
I
R—СН2ОН или иначе R—С—ОН
I
Н
Гидроксильная группа в первичном спирте присоединена к первичному атому углерода.
Во вторичных спиртах группа —ОН связана со вторичным атомом углерода.
Запишите общую формулу вторичных спиртов и проверьте ее в рубрике 4.
41. Неправильно. Еще раз внимательно посмотрите на формулу вторичных спиртов, приведенную в рубрике 4.
После этого попытайтесь снова ответить на вопрос, поставленный в рубрике 27.
42. Неправильно. Хотя в молекуле пропана три атома углерода СН3—сн2—сн3
два из них находятся в одинаковом окружении. Если поочередно заменить один атом водорода на каждом атоме углерода группой ОН, получим
СН2ОН—СН2—СН3 CHj CHOH СН3 СН3—СН2—СН2ОН
а б в
Однако две из этих формул идентичны. Какие это формулы?
• а и б -» 28
• а и в -» 32
• б и в -» 30
43. Неправильно. Еще раз внимательно посмотрите на формулу вторичных спиртов, приведенную в рубрике 4.
После этого попытайтесь снова ответить на вопрос, поставленный в рубрике 27.
44. СН3—СН2—СН2ОН СН3—СНОН—СН3
пропанол* 1 пропанол-2
Тривиальные (обиходные) названия пропанола-1-«пропиловый спирт», а пропанола-2-«изопропиловый спирт».
Другими словами, тривиальное название спирта образуется от соответствующего алкильного радикала в сочетании со словом «спирт». В следующей таблице проводится сопоставление двух номенклатур спиртов.
Формула спирта Систематическое название Тривиальное название
СН3ОН сн3—СН2ОН СН3 СН2—СН2ОН СН3—СНОН—СН3 Метанол Метиловый спирт Пропил Изопропил
Завершите эту таблицу и проверьте результат в рубрике 34.
45.
_ брожение г-ч
Сахар или крахмал-------------------------► Этанол
ферменты (катализаторы)
Основной промышленный способ получения этанола заключается в гидратации этилена.
Можете ли вы записать уравнение реакции присоединения воды (Н—ОН) по двойной связи в этилене?
• Да -» 55
• Нет -► 65
46. СН3—СН2С1 + Н2О -> СН3—СН2ОН + НС1 этилхлорид этанол
Эта реакция проводится при нагревании алкилхлорида с водой или каким-нибудь основанием. Если в качестве основания используется гидроксид
натрия, то вместо НС1 образуется NaCl:
СН3—СН2С1 + NaOH -> СН3—СН2ОН + NaCl этилхлорид этанол
Как мы знаем из программы 11, в подобных реакциях может происходить также отщепление воды
СН3—СН2С1 + NaOH - СН2=СН2 + Н2О + NaCl этилхлорид этилен
Поэтому для повышения выхода спирта в реакциях гидролиза приходится тщательно подбирать условия их проведения.
Третичные алкилхлориды гидролизуются с особой легкостью.
Запишите уравнение реакции гидролиза простейшего третичного алкил хлорида.
Проверьте ответ в рубрике 36.
Если вы нуждаетесь в предварительных разъяснениях, обратитесь сначала к рубрике 56.
47. Если функциональная группа может занимать в соединении не одно, а несколько разных положений, то следует указать ее конкретное положение. С этой целью атомы углерода в углеводородной цепи нумеруют. Например, в случае пропана дается нумерация
сн3—сн2—сн3 3 2 1
Положение функциональной группы указывают номером атома углерода, к которому она присоединена.
Запишите теперь формулы и названия двух пропанолов
СН3 -СН2 СН2С)Н И сн3—снон—сн
Проверьте отет в рубрике 44.
48. Проверьте ответ:
Н
Н—(^—ОН
I н
В промышленных условиях метанол получают из водяного газа, который представляет собой смесь оксида углерода и водорода (см. часть 1 учебника):
со + ... -> сн3он
Сколько молей водорода расходуется в этой реакции?
• Один 60
• Два -> 58
• Три -> 62
Программа I?
49. СН3—СН2ОН СН2 =СН2 + Н—О—Н
этанол этилен
СН3—СНОН—СН3 сн3—сн=сн2 + н—он
изопропиловый спирт пропен
Двойные стрелки указывают, что реакции могут протекать в обоих направлениях. Приходится подбирать надлежащие условия проведения реакции-температуру, давление, катализатор,-которые благоприятствуют протеканию реакции в желательном направлении.
Растворимость изопропилового спирта в воде меньше, чем у этанола и метанола. Высшие спирты еще менее растворимы. Уже пентанолы, т. е. спирты с пятью атомами углерода в молекуле, практически нерастворимы в воде.
Метанол, этанол и изопропиловый спирт используются для синтеза других органических веществ, т. е. являются промежуточными продуктами органического синтеза. Этанол используется не только для приготовления алкогольных напитков, но также в химической промышленности (в частности, в парфюмерной).
Еще один важный спирт, с которым мы познакомимся,-это бензиловый спирт. Он представляет собой первичный спирт, содержащий фенильную группу.
Запишите формулу бензилового спирта, основываясь на сказанном выше. Проверьте ответ в рубрике 72.
50. Посмотрите на формулу этанола в таблице, приведенной в рубрике 34. Это поможет вам правильно ответить на поставленный там вопрос. Предварительно прочтите еще раз рубрику 44.
51. Брожение не является общим методом получения спиртов. Оно служит только для получения этанола.
Вернитесь к рубрике 72.
52. Существуют спирты трех типов
R-CHjOH
первичный спирт
СНОН R Вторичный спирт
R R^C-OH R третичный спирт
Посмотрите еще раз внимательно на формулу глицерина
СН2ОН
I
снон
I
СН2ОН
Какого типа гидроксильные группы имеются в глицерине?
Три первичные -► 79
Три вторичные -► 81
Две первичные и одна вторичная -► 77
Одна первичная и две вторичные -» 83
53. Посмотрите на формулу этанола в таблице, приведенной в рубрике 34. Это поможет вам правильно ответить на поставленный там вопрос. Предварительно прочтите еще раз рубрику 44.
54. Пропан имеет формулу
сн3—сн2—сн3
Поскольку в молекуле пропана содержатся атомы углерода двух разных типов, существует больше одного способа присоединения гидроксильной группы к этой молекуле.
Сколько различных спиртов может быть получено из пропана? Запишите их формулы.
• Два спирта -» 32
• Три спирта -» 42
55. Проверьте ответ:
СН2=СН2 + Н—ОН -> сн3—СН2ОН этилен этанол
Эта реакция проводится над катализатором при повышенном давлении.
Аналогичным образом вода может присоединяться к пропену, в результате чего образуется вторичный спирт.
Запишите уравнение этой реакции и проверьте ответ в рубрике 38, но если вы нуждаетесь в дополнительных разъяснениях, обратитесь сначала к рубрике 66.
56. Простейший третичный алкилхлорид имеет формулу
нэс\
HjC-C-Cl HjC
Составьте уравнение гидролиза этого соединения.
Проверьте ответ в рубрике 36.
57. Гидрирование оксида углерода не является общим методом получения спиртов. Эта реакция позволяет получать только метанол.
Вернитесь к рубрике 72.
58. Уравнение реакции имеет вид
СО + 2Н2 -> СН3ОН
Эта реакция протекает при температуре около 400°С, .повышенном давлении и в присутствии катализаторов.
Метанол смешивается с водой в любых отношениях.
Метанол по внешним признакам и вкусу напоминает этанол, но гораздо более ядовит. Употребление его вовнутрь даже в небольших количествах приводит к слепоте и смертельному исходу.
Спирты образуют гомологический ряд, подобно углеводородам
и алкилгалогенидам. Первые два члена этого ряда -метанол и этанол. Этанол тоже ядовит, если поглощается в больших дозах. В меньших дозах он вызывает опьянение и хроническое отравление - алкоголизм.
Один из древнейших химических процессов, .известных человечеству, это получение этанола брожением.
Процесс брожения превращает крахмал или сахар в этанол под действием катализаторов, присутствующих в дрожжах. Эти катализаторы называются ферменты.
Завершите следующую схему:
...(процесс)
Крахмал или сахар -----------------------> Этанол
...(катализатор)
Проверьте ответ в рубрике 45.
59. Подобно всем алкоголятам, метилат натрия и этилат натрия неустойчивы к действию воды. Алкйголяты гидролизуются в воде, в результате чего снова образуется исходный спирт и гидроксид соответствующего металла, например
R—ONa + Н2О -> ... + ...
Завершите это уравнение и проверьте ответ в рубрике 75.
60. Обратите внимание, что в правой части уравнения содержится четыре атома водорода. Значит, и в левой части уравнения должно содержаться четыре атома водорода.
Вернитесь к рубрике 48.
61. Присоединение воды к олефинам позволяет получать разнообразные спирты. В качестве примеров можно привести этанол и изопропиловый спирт. Тем не менее этот метод не является общим.
Вернитесь к рубрике 72.
62. Обратите внимание, что в правой части уравнения содержится четыре атома водорода. Значит, и в левой части уравнения должно содержаться четыре атома водорода.
Вернитесь к рубрике 48.
63. СН3—ONa и С2Н5—ONa
Как называются эти два алкоголята?
Проверьте ответ в рубрике 73, а если вы нуждаетесь в помощи, обратитесь предварительно к рубрике 75.
64. СН]С1 снаон
ГД + нао — ГД + НС1
Укажите названия двух органических соединений, участвующих в этой
реакции.
Проверьте ответ в рубрике 74.
65. Этилен имеет формулу СН2=СН2.
Присоединение воды Н—ОН по двойной связи в этилене приводит к образованию этанола.
Запишите уравнение этой реакции.
Проверьте ответ в рубрике 55.
66. Пропен имеет формулу СН3—СН=СН2. Присоедините к этому соединению воду Н—ОН таким образом, чтобы получился вторичный спирт. Запишите уравнение этой реакции и проверьте его в рубрике 38.
67. сн2 ОН 1 (или НОСН2—СН2ОН) СН2—ОН Этот двухатомный спирт называется гликоль (более точно-этиленгликоль). Глицерин представляет собой трехатомный спирт: СН2ОН 1 СНОН 1 СН2ОН Какого типа гидроксильные группы имеются в глицерине?
• Три первичные -» 79
• Три вторичные -» 81
• • Две первичные и одна вторичная -> 77 Одна первичная и две вторичные -► 83
• Не знаю -» 52
68. Теперь мы рассмотрим соединения, в которых гидроксильная группа присоединена непосредственно к ароматическому кольцу.
Такие спирты называются фенолы. Это название образовано от фенильного радикала и суффикса -ол.
Простейшим из этих соединений является сам фенол. Этот спирт состоит из фенильного радикала и гидроксильной группы.
Запишите формулу фенола.
Проверьте ответ в рубрике 78.
69. Проверьте ответ:
+ NaOH
* Н2О
фенолят натрия
Итак, фенолы являются слабыми кислотами. Их «соли» называются феноляты.
В алифатических спиртах водород гидроксильной группы тоже может замещаться на металл. Однако в этом случае приходится проводить реакцию между спиртом и свободным металлом. Продуктами такой реакции являются газообразный водород и соответствующий алкоголят металла.
Ниже приведено уравнение подобной реакции между этанолом и натрием
2С2Н5 ОН + 2Na -> 2С2Н5—ONa + Н2
Запишите общее уравнение реакции произвольного спирта R—ОН с натрием.
Проверьте ответ в рубрике 85.
70. Г идрокситолуолы.
Существуют три гидрокситолуола: о-, м- и «-соединения
Правильные названия этих трех фенолов: о-, м- и n-крезолы (или о-, м-и «-метилфенолы).
Аналогично существуют три разных хлорфенола.
Запишите формулы и названия трех хлорфенолов.
Проверьте ответ в рубрике 80.
71. СН3—ONa + Н2О -> СН3- ОН + NaOH
метилат натрия метанол
Этот процесс называется реакция гидролиза.
Алифатические алкоголяты отличаются от фенолятов своей неустойчивостью к действию воды.
Конец программы 12.
72. Бензиловый спирт имеет формулу сн,он
Бензиловый спирт можно получить, используя общий метод синтеза спиртов. Каков этот общий метод?
• Процесс брожения 51
• Гидрирование оксида углерода -> 57
• Присоединение воды к олефинам -> 61
• Гидролиз алкилгалогенидов -> 90
73. СН3—ONa С2Н5—ONa
мезилат па1рия этилат натрия
Устойчивы ли эти соединения по отношению к воде?
• Да -> 82
• Нет -> 86
• Не знаю 59
i !МР0кЧ'И.'1ЬНоК.* Пром IBP ’.НЬН’
74. Бензилхлорид, бензиловый спирт.
До сих пор мы имели дело со спиртами, содержащими лишь одну гидроксильную группу.
Такие спирты называются одноатомные спирты.
Органические соединения, содержащие более одной гидроксильной группы, называются диолы, триолы и т. д., или в целом - полиолы, иначе многоатомные спирты.
Гидроксильные группы в многоатомных спиртах всегда связаны с различными атомами углерода. Соединения, имеющие больше одной гидроксильной группы при одном атоме углерода, неустойчивы, от них отщепляется вода, например
✓н хН
R-cA)-[h1 ---► R-c' + Н2О
]О—н| о
z°—и
R-СНЭ-Гн] ---- R-C + Н2О
Спишите эти уравнения и завершите второе из них.
Проверьте ответ в рубрике 84.
75. Гидролиз алкоголятов описывается общим уравнением
R—ONa + Н2О -> R—ОН + NaOH
Алкоголяты часто используются для проведения реакций в лабораторных условиях. Важнейшими алкоголятами являются натриевые производные метанола и этанола. Они называются метилат натрия и этилат натрия.
Запишите формулы этих двух соединений.
Проверьте ответ в рубрике 63.
76. Проверьте ответ:
СН3—СН=СН2 + С12 -> СН2С1—СН СН2 + НС1
После этого проводится реакция присоединения хлорноватистой кислоты к продукту предыдущей реакции:
СН2С1—СН=СН2 + НО—С1 -> СН2С1—СНОН—СН2С1
На завершающей стадии процесса проводится гидролиз полученного продукта, при этом два атома О замещаются группами ОН.
Составьте уравнение последней реакции и проверьте его в рубрике 88.
77. Правильно. Глицерин используется для изготовления косметических кремов и мазей. Кроме того, глицерин является важным компонентом в производстве синтетических смол (см. программу 23).
Запишите формулы гликоля и глицерина и укажите в них первичные (символом 1°) и вторичные (2°) гидроксильные группы.
Проверьте ответ в рубрике 87.
78. Фенол имеет формулу
Фенол содержится в каменноугольном дегте, из которого его можно выделить. Однако этот способ не позволяет удовлетворить всей потребности в феноле, поэтому для его получения разработано несколько синтетических методов. Один из них основан на реакции хлорбензола с водой.
Запишите уравнение этой реакции.
Проверьте ответ в рубрике 89.
79. Неправильно. Три атома углерода в глицерине не идентичны! Вернитесь к рубрике 67.
80.
о-хлорфенол
jh-хлорфенол
п- хлорфенол
Многие фенолы обладают некоторой растворимостью в воде. Их водные растворы являются слабо кислотными. Фенолы могут нейтрализоваться при добавлении гидроксида натрия или других сильных оснований, в результате чего атом водорода гидроксильной группы замещается металлом.
Завершите уравнение реакции нейтрализации фенола:
+ NaOH —* • • • +
Проверьте ответ в рубрике 69.
81. Неправильно. Три атома углерода в глицерине не идентичны! Вернитесь к рубрике 67.
82. Неправильно. Прочтите еще раз последний абзац из рубрики 85.
83. Неправильно. Обратитесь за разъяснением к рубрике 52.
84. ,н
R-C.-O
R-C^ + Н2О
О альдегид
ZO-H R-C-O-tHl
ZOH
R-C^ + H2O
карбоновая кислота
' идроксильные крон анодные 2^3
Продукты этих реакций будут описаны в последующих программах.
Простейший многоатомный спирт (полиол) получается из этана СН3СН3 замещением одного атома водорода в каждой метильной группе на группу ОН.
Запишите формулу этого диола и проверьте ответ в рубрике 67.
85. 2R—ОН + 2Na -> 2R—ONa + Н2
Эта реакция полностью аналогична реакции между натрием и водой
2Н—ОН + 2Na -> 2Н—ONa + Н2
но натрий реагирует со спиртами не столь энергично, как с водой.
Полученные в описанных реакциях алкоголяты неустойчивы в присутствии воды-они гидролизуются. Их гидролиз приводит к образованию исходного спирта и гидроксида соответствующего металла:
R—ONa + Н2О -> ... + ...
Завершите это уравнение и проверьте его в рубрике 75.
86. Правильно. Метилат натрия и этилат натрия неустойчивы к действию воды.
Запишите уравнение реакции между метилатом натрия и водой. Как называется такая реакция?
Проверьте ответ в рубрике 71.
87. СНгОН 1° СНгОН I"
СНгОН 1° СНОП 2°
СН2ОН 1°
гликоль глицерин
Глицерин входит в состав жиров и растительных масел. Э.о будет описано в программе 24.
Глицерин получают также синтетическими методами. Описание синтеза глицерина позволяет познакомиться со многими интересными химическими фактами. Однако при желании вы можете опустить эту часть материала и продолжить чтение с рубрики 68.
Один из способов синтеза глицерина начинается с пропена (пропилена), который обрабатывают хлором при повышенной температуре. При этих условиях хлор не присоединяется по двойной связи. Вместо этого происходит замещение водорода в метильной группе хлором.
СН3—СН=СН2 + С12 ->... + НС1
Попытайтесь завершить это уравнение. Проверьте ответ в рубрике 76.
88. Проверьте ответ:
СН2С1—СНОН—СН2С1 + 2Н2О -> СН2ОН—СНОН—СН2ОН + 2НС1
Нетрудно видеть, что продукт последней реакции представляет собой глицерин.
На этом мы пока закончим обсуждение глицерина. Очень хорошо, что вы познакомились с этим необязательным для изучения материалом.
18 29
274
Программа iz
Теперь мы рассмотрим соединения, в которых гидроксильная группа присоединена непосредственно к ароматическому кольцу.
Такие соединения называются фенолы. Это название образовано от фенильного радикала и суффикса -ол.
Простейшим из этих соединений является сам фенол. Этот спирт состоит из фенильного радикала и гидроксильной группы.
Запишите формулу фенола.
Проверьте ответ в рубрике 78.
89. Проверьте ответ:
и + н’°
хлорбензол
IH
""й + НС1
<ренол
Поскольку атом хлора в хлорбензоле обладает не слишком высокой реакционной способностью, эту реакцию приходится проводить под давлением и при температуре около 400° С.
Позже мы обсудим и другие методы получения фенола.
Фенол можно называть и «гидроксибензолом», однако это название не является систематическим. Если воспользоваться аналогией с названием «гидроксибензол», то как следует назвать соединения, полученные из толуола замещением атомов водорода в ароматическом кольце на группу ОН?
Проверьте ответ в рубрике 70.
90. Гидролиз алкилгалогенидов представляет собой общий метод получения спиртов. Бензиловый спирт получают из бензилхлорида этим методом:
Завершите уравнение этой реакции и проверьте ответ в рубрике 64.
Программа 13
1фирЬ!.. и{'1>фиры И !ИС, £Ы
1. Эфирами называются соединения типа
R—О—R
в которых углеводородные радикалы R могут быть одинаковыми или разными. Название каждого конкретного эфира слагается из названий двух входящих в него радикалов с добавлением слова «эфир».
Как должно вызываться соединение
сн3—о—сн2—сн3 ?
Проверьте ответ в рубрике 10, а если вы нуждаетесь в предварительных разъяснениях, обратитесь за ними в рубрику 20.
2. Метилфениловый эфир имеет формулу
о-сн
Получение эфиров основано на реакции алкоголятов или фенолятов с алкилгалогенидами:
R—ONa + R— Hal -> ...
Завершите это уравнение. Проверьте ответ в рубрике 13.
3. СН3—СН2—ONa + СН31 -> СН3—СН2—О—СН3 + Nal
этилат натрия метилиодид метилэтиловый эфир
Для получения эфиров можно использовать и алкилхлориды. Однако, поскольку не все соединения обладают одинаковой реакционной способностью, приходится тщательно подбирать исходные вещества.
Как следовало бы, по-вашему, получать метилфениловый эфир?
• Из фенолята натрия и метилхлорида —> 17
• Из хлорбензола и метоксида натрия —► 19
• Оба указанных выше способа одинаково
хороши —> 23
• Не знаю —> 28
4. Атом хлора в метилхлориде обладает большей реакционной способностью (иначе говоря, он подвижнее), чем в хлорбензоле. Поэтому реакция фенолята натрия с метилхлоридом протекает легче, чем реакция между метилатом натрия и хлорбензолом.
18*
276
Программа 13
Эфиры можно получать также из спиртов отщеплением воды. В качестве примера такой реакции укажем получение диэтилового эфира из этанола:
СНз-СН2-О}Н + Н-О^-СНг-СНз -> ...
Завершите это уравнение и проверьте ответ в рубрике 14.
5. Неправильно.
Вспомните названия радикалов
сн2-
Бензил фенил
Запишите теперь формулу бензилметилового эфира.
Проверьте ответ в рубрике 15.
а
6. Правильно.
Запишите уравнения указанных ниже реакций и укажите, какие из этих реакций являются внутримолекулярными!
__Ц Q
а) Изопропиловый спирт----------1----> Пропен
(дегидратация)
__н
б) Изопропиловый спирт ----------?---+ Ацетон
(дегидрирование)
в) Изопропиловый спирт --------> Диизопропиловый эфир
(дегидратация)
• Ни одна из них -г 18
• а) и б) 16
• а) и в) -> 39
• б) и в) -» 41
• Все три -» 26
• Нуждаюсь в дополнительных разъяснениях -► 29
7. Атом хлора в метилхлориде обладает большей реакционной способностью (или, как говорят, более подвижен), чем в хлорбензоле. Поэтому реакция фенолята натрия с метилхлоридом протекает легче, чем реакция между метилатом натрия и хлорбензолом.
Запишите уравнение реакции между фенолятом натрия и метилхлоридом. Проверьте ответ в рубрике 17.
8. Неправильно. Еще раз внимательно прочтите рубрику 25, и вам будет понятен смысл терминов
межмолекулярная реакция (между двумя или несколькими молекулами), внутримолекулярная реакция (в пределах одной молекулы).
Эфиры, тиоэфиры и тиолы
277
9. Неправильно. Еще раз внимательно прочтите рубрику 25, и вам будет понятен смысл терминов
межмолекулярная реакция (между двумя или несколькими молекулами), внутримолекулярная реакция (в пределах одной молекулы).
10. Метилэтиловый эфир.
Запишите формулы диметилового эфира и диэтилового эфира.
Проверьте ответ в рубрике 21.
11. Неправильно.
Обратитесь за разъяснением в рубрику 7.
12. Неправильно. Еще раз внимательно прочтите рубрику 25, и вам будет понятен смысл терминов:
межмолекулярная реакция (между двумя или несколькими молекулами), внутримолекулярная реакция (в пределах одной молекулы).
13. R—О—Na + R—Hal -► R—О—R + NaHal
В этой реакции обычно используются алкилбромиды или алкилиобибы, потому что алкилхлориды обладают меньшей реакционной способностью.
Метилэтиловый эфир СН3—СН2—О—СН3 может быть получен из этилата натрия и метилиодида. Запишите уравнение этой реакции. (В этом вам поможет уравнение, приведенное в начале данной рубрики.)
Проверьте ответ в рубрике 3.
14. СН3—СН2—ОН + НО—СН2—СН3 -
-► сн3—сн2—о—сн2—сн3 + Н2О
Однако отщепление воды (дегидратация) от спирта может протекать и по-иному.
Что представляет собой продукт отщепления воды от одной молекулы этанола?
Н Н
I I
н—С—С—ОН ->
I I
н н
Завершите это уравнение и проверьте затем ответ в рубрике 25.
15. Бензилметиловый эфир имеет формулу сн2-о-сн3
d
Запишите теперь формулу метилфенилового эфира.
Проверьте ответ в рубрике 2.
27Я
Ир<‘1 ра ,;м;| I/
16. Правильно.
Чтобы лучше запомнить два введенных выше термина, завершите следующие предложения:
а) Реакция между двумя или несколькими молекулами называется .....
б) Реакция, протекающая в пределах одной молекулы, называется ....
Проверьте ответ в рубрике 27.
17. Реакция между фенолятом натрия и метилхлоридом представляет собой лучший метод получения метилфенилового эфира:
Способ, основанный на реакции между хлорбензолом и метилатом натрия,
приводит к тому же самому продукту, но оба метода не одинаково удобны. Почему метод а) удобнее?
Проверьте ответ в рубрике 4.
18. Неправильно. Реакция является внутримолекулярной, если превращение происходит в пределах одной молекулы исходного вещества.
Проверьте, сбалансированы ли составленные вами уравнения.
Вернитесь к рубрике 6.
19. Неправильно. Этот вопрос не из легких. Разъяснения приведены в рубрике 28.
20. Соединение
СН3—О—СН2—СН3
содержит метильный и этильный радикалы, связанные с атомом кислорода. Следовательно, это соединение представляет собой эфир. Его название получается перечислением названий двух входящих в эфир радикалов с добавлением слова «эфир».
Как называется указанное соединение?
Проверьте ответ в рубрике 10.
21. СН3—О—СН3
СН3—СН2—О—СН2—СН3
диметиловый эфир
диэтиловый эфир
Формулу диэтилового эфира можно записать проще: С2Н5—О—С2Н5
Эфиры, |иоэфиры И 1И0.1Ы
279
Назовите теперь соединение
O-CHj
Бензилметиловый эфир -> 5
Метилфениловый эфир 2
22. Неправильно. Еще раз внимательно прочтите рубрику 40, и вы сможете дать правильный ответ на поставленный там вопрос.
23. Ваш ответ не вполне рравилен. Хотя обе указанные реакции приводят к одному и тому же продукту, основанные на них методы получения метилфенилового эфира не одинаково удобны.
Причины этого изложены в рубрике 28.
24. Правильно. Вследствие наличия водородных связей между молекулами спиртов их температуры кипения заметно отличаются от температур кипения соответствующих алкилхлоридов.
Должны ли спирты иметь более высокую или, наоборот, более низкую температуры кипения, чем алкилхлориды с углеродной цепью такой же длины? (Сравните, например, метанол или этанол соответственно с хлорметаном или хлорэтаном.)
• Более низкую -> 44
• Более высокую -> 34
25. V V н гн н-с-с-он —► 'с=с + нао
НН н чн
этилен
или проще
а) СН3 СН2—ОН - СН2=СН2 + Н2О
Сравните с этой реакцией такую:
б) СН3 СН2 ОН + ОН—СН2—СН3 -
-> СН3—СН2—О—сн2—сн3 + Н2О
Реакции, подобные указанным в пунктах а) и б) можно различать, пользуясь двумя важными понятиями:
1) внутримолекулярные реакции-реакции, протекающие в пределах одной молекулы,
2) межмолекулярные реакции -реакции, протекающие между двумя или несколькими молекулами.
К какому типу, внутри- или межмолекулярному, относятся реакции, указанные в пунктах а) и б)?
• Обе реакции являются внутримолекулярными 8
• Обе реакции являются межмолекулярными -> 9
280
Программа 13
а) - внутримолекулярная, б) - межмолекулярная а) - межмолекулярная, б) - внутримолекулярная
6
12
26. Неправильно. Реакция является внутримолекулярной, если превращение происходит в пределах одной молекулы исходного вещества.
Проверьте, сбалансированы ли составленные вами уравнения.
Вернитесь к рубрике 6.
27. а) Реакция между двумя или несколькими молекулами называется межмолекулярная реакция.
б) Реакция, протекающая в пределах одной молекулы, называется внутримолекулярная реакция.
Обратимся теперь к другой важной реакции.
Реакциями конденсации называются превращения, в которых две или несколько молекул соединяются, отщепляя молекулы воды*, с образованием более крупной молекулы.
Так, образование диэтилового эфира из двух молекул этанола представляет собой реакцию конденсации:
2С2Н5—ОН ->...+ Н2О
Завершите это уравнение. Проверьте ответ в рубрике 43.
28. Два возможных способа получения метилфенилового эфира основаны на следующих реакциях
ONa
О-СНэ
fl + CHjCl
^j| + NaCl
+ NaCl
Хотя оба этих метода дают один и тот же продукт, они не одинаково удобны.
Напомним, что атомы хлора в метилхлориде и хлорбензоле обладают не одинаковой реакционной способностью. Следует выбирать реагенты таким образом, чтобы реакция, приводящая к желаемому продукту, протекала как можно легче.
Можете ли вы теперь сказать, какой метод лучше?
17
11
Не знаю -► 7
* При реакциях конденсации вместо воды могут отщепляться и другие простые молекулы.-Прим. ред.
Эфиры, гиоэфнры И 1И0.1Ы
281
29. Приведем полные уравнения указанных реакций
а) сн3-сн(он)-сн3 —► сн3-сн=сн2 + н2о
б) сн3-сн(он)-сн2 —► сн3-со-снэ + н2
сн3-сн-сн3
в) СН3-СН(ОН)-СН3 + СН3-СН(ОН)-СН3 —► 6 + Н2О
сн3-сн-сн3
Интересующее нас в данном случае различие между этими тремя реакциями заключается в том, что часть из них протекает в пределах одной молекулы, а одна из реакций протекает между двумя молекулами.
Укажите, какие реакции являются внутримолекулярными:
• а) и б) -> 16
• а) и в) -> 39
• б) и в) -> 41
30. реакцию конденсации
Образование диэтилового эфира из двух молекул этанола в результате отщепления молекулы воды представляет собой реакцию конденсации.
Как по-вашему, имеет ли диэтиловый эфир более высокую или более низкую температуру кипения, чем этанол?
• Более низкую -> 48
• Более высокую -> 40
• Приблизительно одинаковую -> 42
31. Правильно. Водородные связи значительно слабее обычных химических связей.
К чему приводит образование водородных связей между молекулами?
• К ассоциации -> 62
• К конденсации -> 49
• Не могу дать ответ -> 52
32. Опасные свойства эфира, которые следует учитывать при работе с ним:
1. Легкая воспламеняемость.
2. Образование парами эфира взрывоопасных смесей с воздухом.
3. Способность образовывать взрывоопасные пероксиды.
4. Анестезирующее действие паров.
По этим причинам при работе с эфиром следует соблюдать предельную осторожность. Недопустимо использование в помещении открытого пламени или других установок, способных вызывать возгорание. Для нагревания эфира следует пользоваться водяными банями. Эфир следует очищать от пероксидов. Это делают встряхиванием смеси эфира с водным раствором сульфата железа.
Эфир имеет дурманящий запах и раньше широко использовался в качестве анестезирующего средства.
Какова реакционная способность диэтилового эфира?
• Он очень легко вступает в реакции -> 53
• Он является довольно инертным веществом -> 47
• Не знаю —> 56
:н2
llpoipaMvia 13
33. Неправильно. Водородные связи значительно слабее обычных химических связей.
Переходите к рубрике 31.
34. Правильно. Спирты имеют более высокую температуру кипения, чем соответствующие алкилхлориды, например:
хлорметан: т. кип. 24°С, метанол: т. кип. 65°С,
хлорэтан: т. кип. 12°С, этанол: т. кип. 78°С.
Молекулы спиртов связаны друг с другом ......, например:
CjHs
НхохС,Н5
Такие ... связи не могут возникать между молекулами алкилхлоридов.
Завершите эти предложения и проверьте ответ в рубрике 57.
35. Тиоляты натрия-это соединения общей формулы R—SNa
в которых тиольный атом водорода замещен атомом натрия. Диалкилсульфиды получают по реакции тиолятов с алкилгалогенидами R—SNa + R—Hal NaHal
Завершите это уравнение (группы R могут быть неодинаковыми). Проверьте ответ в рубрике 55.
36. Неправильно. Водородные связи значительно слабее обычных химических связей.
Переходите к рубрике 31.
37. R—Hal + NaSH -> R—SH + NaHal
алкил- гидросульфид тиол
галогенид натрия
Аналогичная реакция алкилгалогенида с сульфидом натрия Na2S приводит к соответствующему тиоэфиру (иначе, диалкилсульфиду).
Сколько молей алкилгалогенида реагирует с 1 молем сульфида натрия при образовании тиоэфира?
• Один -► 58
• Два -► 54
• Три -> 63
• Нуждаюсь в разъяснениях -> 66
38. R—SH
ТИОЛ
Тиолами называются тиоспирты, т.е. спирты, в которых кислород замещен
Эфиры. Iио >фирм и !ii<> .i.i 283
серой. Так, соединение
СН3—SH носит название метантиол. Запишите название и формулу соответствующего этильного соединения. Проверьте ответ в рубрике 51.
39. Неправильно. Реакция является внутримолекулярной, если превращение происходит в пределах одной молекулы исходного вещества.
Проверьте, сбалансированы ли составленные вами уравнения.
Вернитесь к рубрике 6.
40. Диэтиловый эфир образуется в результате конденсации двух молекул этанола с отщеплением молекулы воды.
Следовательно, диэтиловый эфир имеет большую молекулярную массу, чем этанол, и для него можно ожидать более высокую температуру кипения. Однако в действительности это не так:
этанол: т. кип. 78°С,
диэтиловый эфир: т. кип. 35°С.
Причина отклонения от ожидаемого поведения заключается в том, что молекулы спирта в жидкой фазе связаны друг с другом водородными связями, например в жидком этаноле возникают такие водородные связи
С»Н»
СЛ^Н-О^и
Отдельные молекулы этанола в жидкой фазе не свободны, а слабо связаны с соседними молекулами. Поэтому температура кипения этанола выше, чем она была бы в отсутствие водородных связей.
Впрочем, водородные связи намного слабее, чем обычные химические связи.
Эфиры не имеют гидроксильных атомов водорода и поэтому не могут образовывать водородные связи. Вследствие этого их температуры кипения подчиняются обычным закономерностям, т.е. соответствуют их молекулярным массам.
Ответьте теперь, какое вещество имеет более высокую температуру кипения-метанол или диметиловый эфир?
• Метанол -> 24
• Диметиловый эфир -► 22
41. Неправильно. Реакция является внутримолекулярной, если превращение происходит в пределах одной молекулы исходного вещества.
Проверьте, сбалансированы ли составленные вами уравнения.
Вернитесь к рубрике 6.
42. Диэтиловый эфир образуется в результате конденсации двух молекул этанола с отщеплением молекулы воды. Следовательно, молекулярная масса
284
Программа 13
этого эфира больше, чем у этилового спирта. Значит, нельзя ожидать, что два рассматриваемых соединения имеют близкие температуры кипения.
Вернитесь к рубрике 30.
43. 2С,Н5—ОН -> С,Н5—О—С,Н5 + Н,О X J X J Лг J 'Ля
Отщепление воды осуществляется с помощью серной кислоты при повышенной температуре. На этой реакции основан промышленный способ получения диэтилового эфира.
К какому типу относится эта реакция? Образование больших молекул из меньших в результате отщепления молекулы воды представляет собой реакцию .... Завершите это предложение и проверьте ответ в рубрике 30, а если вы затрудняетесь это сделать, обратитесь к рубрике 27.
44. Молекулы спирта связаны друг с другом в большие агрегаты водородными связями. Такие связи не образуются между молекулами алкилхлоридов. Следовательно, спирты имеют более ... (высокую/низкую) температуру кипения, чем соответствующие алкилхлориды.
Завершите это предложение и проверьте ответ в рубрике 34.
45. Приведем полную таблицу сераорганических соединений
Формула Название
r-sh тиолы
r-S-r тиоэфиры (диалкилсульфиды)
R-S-R сульфоксиды
а О
о а R-S-R а о
сульфоны
В приведенных выше формулах группы R могут быть как одинаковыми, так и разными. Это можно указать следующим образом:
r‘-s-r2 для диалкилсульфидов
о
r‘-s-rj для диалкилсульфонов
о
Анализ органических соединений на содержание серы осуществляется их нагреванием с кусочком .... При наличии серы образуется .... После его
подкисления и смешения с раствором какой-либо соли свинца образуется осадок ... цвета.
Завершите эти предложения и проверьте ответ в рубрике 59.
46.
СНэ-S-CH, о
диметилсульфон
CHj-S-CHj о
диметилсулыр -оксии
Некоторые сульфоны применяются в качестве снотворных средств.
Эфиры, тиоэфиры И 111О.1Ы
285
Обнаружение серы в органических соединениях осуществляется нагреванием исследуемого соединения с кусочком натрия. Это приводит к разложению органического соединения и образованию сульфида натрия. При подкислении образуется H2S, который после добавления раствора какой-либо соли свинца дает черный осадок PbS.
Чтобы повторить названия сераорганических соединений, заполните следующую таблицу
Формула Название
R—SH
R—S—R
Проверьте ответ в рубрике 64.
47. Правильно. Диэтиловый эфир химически инертен по отношению к большинству реагентов.
Перейдем теперь к описанию тиоэфиров.
В большинстве органических кислородсодержащих соединений атомы кислорода могут замещаться серой. Соединения, содержащие серу, называют сераорганические соединения*. Но хотя в химических формулах замена символа О на S не составляет труда, в действительности синтез сераорганических соединений часто осуществляется совершенно иными способами.
Замещение кислорода на серу в эфирах
R О- R
приводит к тиоэфирам (или диалкилсульфидам).
Запишите общую формулу и названия, используемые для этого класса соединений.
Проверьте ответ в рубрике 60.
48. Диэтиловый эфир образуется в результате конденсации двух молекул этанола с отщеплением молекулы воды. Следовательно, молекулярная масса этого эфира больше, чем у этилового спирта. Значит, следует ожидать, что эфир имеет более высокую температуру кипения.
Однако в действительности дело обстоит совсем не так. Возможно, вам известно, что диэтиловый эфир имеет более низкую температуру кипения, чем этанол.
Причина этого разъясняется в рубрике 40.
49. Неправильно. Обратитесь за разъяснением к рубрике 52.
50. Проверьте ответ
СН3—S—СН3 СН3—S—С2Н5
диметилсульфид метилэтилсульфид
Запишите общую формулу сераорганических соединений, образуемых замещением атома О в спиртах на S. Проверьте ответ в рубрике 38.
* В названиях таких соединений присутствие серы обозначают слогом тио или сульфо-Прим. ред.
286
Программа I'
51. С2Н5—SH этаитиол
Алкантиолы (или просто тиолы) можно получать при помощи реакции алкилгалогенидов с гидросульфидом натрия NaHS.
Запишите уравнение этой реакции и проверьте ответ в рубрике 37, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 61.
52. В реакции конденсации две или несколько молекул соединяются, отщепляя молекулу воды, с образованием нового соединения.
Ассоциация -это другое явление, а именно образование агрегатов молекул, удерживаемых вместе водородными связями.
Убедитесь в том, что вы понимаете эти два понятия и способы различать их, а затем переходите к рубрике 62.
53. Неправильно. Прочтите о химических свойствах эфира в рубрике 62.
54. С 1 молем сульфида натрия должно реагировать 2 моля алкилгалогенида
2R—Hal + Na2S -> R—S—R + 2NaHal
По этой реакции образуются диалкилсульфиды с двумя одинаковыми заместителями R.
Чтобы синтезировать тиоэфиры с различными заместителями R, в качестве исходных реагентов используются тиоляты- содержащие серу аналоги алкоголятов.
В свою очередь тиоляты получают из тиолов R—SH.
Запишите общую формулу тиолятов натрия.
Проверьте ответ в рубрике 35.
55. R-S-Na + R Hal -> R—S—R + NaHal
Большинство тиолов и диалкилсульфидов (тиоэфиров) имеет неприятный, резкий запах. Эти соединения не играют в химии столь важной роли, как их кислородные аналоги.
В отличие от кислорода сера может проявлять валентность выше двух. Это объясняет способность диалкилсульфидов к окислению. В зависимости от условий реакции к ним может присоединяться один или два атома кислорода с образованием сульфоксидов или соответственно сульфонов
о и R-SR RS-R
II II
О О
сульфоксид нуль срои
Какую валентность имеет сера в этих двух соединениях?
• Два и четыре -► 67
• Два и шесть -► 68
• Четыре и шесть -► 65
56. Прочтите о химических свойствах эфира в рубрике 62.
>фиры. 1и.>>фи[)Ь;
57. водородными связями
Водородные связи между молекулами обусловливают образование более крупных агрегатов. Это явление называется ассоциация.
Насколько сильны водородные связи по сравнению с обычными химическими связями?
• Водородные связи намного слабее обычных -> 31
• Водородные связи сильнее обычных -» 33
• Они настолько же сильны, как обычные связи -> 36
58. Неправильно. За разъяснениями обратитесь в рубрику 66.
59. натрия
сульфид натрия черного цвета
Конец программы 13.
60. R-S— R
диалкилсульфиды (тиоэфиры)
Названия конкретных диалкилсульфидов образуются по аналогии с эфирами: они составляются из названий двух углеводородных радикалов R в сочетании со словом «сульфид».
Запишите формулы ди метил сульфида и метилэтилсульфида.
Проверьте ответ в рубрике 50. ‘
61. Алкидгалогениды имеют общую формулу
R—Hal
Завершите общее уравнение реакции алкилгалогенида с гидросульфидом натрия:
R Hal + Na—S—Н -> .... + NaHal
Проверьте ответ в рубрике 37.
62. Правильно. Образование водородных связей приводит к ассоциации молекул.
С химическими реакциями эфиров можно познакомиться очень быстро-они не взаимодействуют с большинством реагентов. Другими словами, эфиры химически инертны.
По этой причине, а также поскольку диэтиловый эфир (часто называемый просто эфир) является хорошим растворителем многих органических соединений, он широко используется в лабораторной практике в качестве растворителя или разбавителя.
При работе с эфиром следует соблюдать особые предосторожности:
1. Эфир легко воспламеняется.
2. Эфир обладает большой летучестью. Его пары тяжелее воздуха и образуют с воздухом взрывчатую смесь.
3. Жидкий эфир при соприкосновении с атмосферным кислородом образует
288
Про|рамма 13
пероксиды. При перегонке эфира остаток перегонки обогащается чрезвычайно взрывоопасными пероксиоами.
4. Эфир является анестезирующим средством и может вызывать тошноту. Не следует вдыхать его пары.
Дайте краткое описание четырех опасных свойств эфира.
Проверьте ответ в рубрике 32.
63. Неправильно. За разъяснениями обратитесь в рубрику 66.
64. Формула
R—SH R—S—R
Название
тиолы
диалкилсульфиды (тиоэфиры)
Заполните теперь еще одну таблицу для двух других классов сераорганических соединений
Формула Название
R-S-R И О
Проверьте ответ в рубрике 45.
65. Правильно. В сульфоксидах сера четырехвалентна, а в сульфонах-шестивалентна.
Запишите формулы диметилсульфона и диметилсульфоксида, указав под каждой из них название соответствующего соединения.
Проверьте ответ в рубрике 46, а если вы затрудняетесь его дать, обратитесь к рубрике 55.
66. Диалкилсульфиды (тиоэфиры) - это соединения общей формулы R—S—R
Их получают реакцией между сульфидом натрия Na2S и алкилгалогенидами R—Hal.
Сколько же, следовательно, молей алкилгалогенида должно прореагировать с 1 молем Na2S?
Проверьте ответ в рубрике 54.
67. Неправильно. Еще раз внимательно посмотрите на формулы сульфоксидов и сульфонов. Подсчитайте число связей, образуемых в них атомом серы, и вы, несомненно, получите правильный ответ.
Вернитесь к рубрике 55.
68. Неправильно. Еще раз внимательно посмотрите на формулы сульфоксидов и сульфонов. Подсчитайте число связей, образуемых в них атомом серы, и вы, несомненно, получите правильный ответ.
Вернитесь к рубрике 55.
Программа 14
Карбонильные соединения (1)
1. Функциональная группа, которая будет обсуждаться в данной программе -карбонильная группа, -имеет общую структуру
-с-о
в которой две свободные валентные связи могут означать связи
с углеводородными радикалами R или с водородом.
Запишите общую формулу карбонильных соединений, включающих два углеводородных радикала R.
Проверьте ответ в рубрике 10.
2. С2Н5—СО—С2Н5 СН3—СО—С2Н5
диэтилкетои метилэтилкетон
^-СО-СНз метилфенилкетои
Назовите теперь следующие ароматические кетоны:
С6Н5 СО С6Н5 С6Н5 СО СН3 А \_chj-co-ch.
Проверьте ответ в рубрике 19.
3. Правильно. Кетоны и альдегиды содержат карбонильную группу.
По этой причине те и другие соединения называются карбонильные соединения (иначе, оксосоединения)
R-C-R и о
кетон
,н
альдегид
Простейшее карбонильное соединение
тоже представляет собой альдегид. Оно называется формальдегид.
Карбонильная группа содержится также в карбоновых кислотах, соединениях общей формулы
/ЭН
"%
Однако эти соединения называются карбоксильные, а не карбонильные, и с их химическими свойствами мы познакомимся в следующих программах. Диоксид углерода, О=С=О, тоже может рассматриваться как карбонильное соединение, но его геометрия отличается от геометрии обычной карбонильной группы. По этой причине в данной программе карбоновые кислоты и диоксид углерода не рассматриваются как карбонильные соединения.
В типичных карбонильных соединениях карбонильная группа связана только с углеводородными радикалами или с атомами водорода. Пользуясь
19-29
2Э(|
этим определением, решите, сколько соединений, из числа приведенных ниже, относятся к карбонильным соединениям.
н
н
R-C *О
• СН3ОН Шесть —► /эн "% 18
• Пять —► 21
• Четыре —► 13
• Три —► 25
• Два —► 28
СНэ-СО-СНэ
сн3-сно
4. Три альдегида, следующие за формальдегидом,-это
ZH zh н ✓
CjHj-C С3н,-с vo
И уксусный альдегид пропионовый альдегид масляный альдегид
Проверьте ваши ответы и спишите названия этих альдегидов.
Систематические названия альдегидов образуются от названий соответствующих углеводородов (с тем же числом атомов углерода) путем добавления окончания -аль.
Например,
н-/1 о zh сн’-%
метаналь этаналь
Систематическое название формальдегида (формальдегид - это тривиальное название) образуется от метана.
Уксусный альдегид имеет столько же атомов углерода, что и этан, поэтому его систематическое название - этаналь.
Укажите систематические названия следующих двух соединений:
/н н
CjHj-C и с3н,-с' о *о
Проверьте ответ в рубрике 15.
5. Неправильно. Окисление вторичных спиртов приводит к образованию кетонов.
Прочтите подробнее об окислении спиртов в рубрике 37.
291
6. ZH
R-CH2OH —► R-C
О
первичный альдегид
спирт
R—СН (ОН)—R -> R—CO—R вторичный спирт кетон
Запишите теперь полные уравнения дегидрирования двух следующих спиртов:
СН3СН2ОН -> этиловый спирт
СН3—СН(ОН)—сн3 ->
изопропиловый спирт
Проверьте ответ в рубрике 11.
7. 1. Окисление:
R—СН2ОН + [О] -> R—СНО + Н2О
2. Дегидрирование:
R— СН2ОН —~ 300°с-> R—СНО + Н2 катализатор
Для получения кетонов используют вторичные спирты
V
R 'ОН
Запишите общее уравнение окисления вторичных спиртов и проверьте результат в рубрике 17, а если вы нуждаетесь в разъяснениях, обратитесь предварительно к рубрике 37.
8. Вам следует более внимательно вглядываться в структурные формулы. Для полного понимания органической химии чрезвычайно важно научиться распознавать функциональные группы в структурных формулах.
Вернитесь к рубрике 1.
формальдегид
(или метаналь)
/н СНз-С о
уксусный альдегид
(или этаналь)
Кетоны получают свои названия от двух входящих в них углеводородных
19*
292
Программа 14
остатков в сочетании со словом «кетон», например
CHj-C-CjH, о мвтилпропилнетон
CHj-C-CHj О димвта-лнвтон
Спишите следующие формулы и дайте название каждого из этих соединений
сэнб-со-с,н, СНэ-СО-С>Нб
Проверьте ответ в рубрике 2.
fyco-CH,
10. Общая формула карбонильных соединений с углеводородными радикалами
ZC’O R
может быть также записана в виде
___ R-C-R или R-CO-R
□ ’
Соединения с этой общей формулой называются кетоны. Как называется функциональная группа, содержащаяся в кетонах?
• Гидроксильная группа -> 20
• Карбонильная группа -» 23
• Не уверен в ответе -» 1
И. СН3—СН2ОН -* СН3—СНО + Н2 ЭТИЛОВЫЙ спирт
СН3—СН(ОН)—сн3 -+ сн3—со—сн3 + н2 изопропиловый спирт
Укажите названия соединений, образующихся в этих реакциях:
• Уксусный альдегид и этаналь —► 33
• Уксусный альдегид и диметилкетон —► 22
• Ацетон и диметилкетон —► 36
• Не знаю —► 40
12. Кетоны:
R-C-R или R—СО—R; О
Карбонильная группа может быть соединена всего с одним углеводородным остатком. Другой заместитель в этом случае-атом водорода:
R-C-H и о
Карбонильные соединения (I) 293
Как называется функциональная группа в соединениях этой общей формулы?
Проверьте ответ в рубрике 24.
13. Правильно. Среди указанных в конце рубрики 3 шести соединений содержатся четыре карбонильных соединения:
zH zH
R-с НС СНЭ-СО-СНЭ CHj-CHO
о о
Сколько среди этих четырех соединений альдегидов?
• Четыре -» 30
• Три -» 27
• Два -> 35
• Один -> 39
14. Вам следует более внимательно вглядываться в структурные формулы. Для полного понимания органической химии чрезвычайно важно научиться распознавать функциональные группы в структурных формулах.
Вернитесь к рубрике 1.
15. Пропаналь, бутаналь.
Запишите теперь структурные формулы формальдегида (метаналя) и уксусного альдегида (этаналя). Проверьте ответ в рубрике 29, а если вы затрудняетесь его дать, обратитесь еще раз к рубрике 27.
16. Правильно. Побочным продуктом при получении формальдегида из метанола является вода.
Полное уравнение этой реакции имеет вид
2СН3—ОН + О2 - 2Н—СНО + 2Н2О
После того как мы познакомились с общими методами получения кетонов и альдегидов, перейдем к конкретному рассмотрению некоторых синтезов.
Ацетон получают в промышленных условиях из уксусной кислоты при температуре около 400°С в присутствии катализаторов
2СН3—СООН -----400°с > СН3—СО—СН3 + ... + ...
катализаторы
Какие побочные продукты образуются в этой реакции?
• СО + Н2О - 47
• СО2+Н2О -> 42
• СО2 + 2Н2О - 50
• Нуждаюсь в разъяснениях -> 53
17 R zH R\
,с * [о] —* с=о + нао
R ОН R
вторичный спирт
кетон
294
! Spin pj .im.i !4
или проще
R—CH (OH)—R + [O] -* R—CO—R + H2O вторичный спирт кетой
Дегидрирование вторичных спиртов тоже приводит к образованию кетонов.
Запишите общее уравнение дегидрирования вторичных спиртов типа
R—СН(ОН)—R. Если можете, укажите также условия проведения этой реакции. Проверьте ответ в рубрике 32.
18. Не каждое органическое соединение, содержащее кислород, является карбонильным соединением!
Прочтите еще раз рубрику 3, записывая структурные формулы для каждого из приведенных там соединений. Это облегчит вам распознавание карбонильной функциональной группы.
19.
с,н,-со-с,н, дшренилквгпон
С.Н.-СО-СН, метшпренилквтон
^^-СН,-СО-СНэ бензилметилкетон
Вы уже, видимо, обратили внимание, что С6Н5-это сокращенное обозначение фенильного радикала,
Познакомимся теперь с получением карбонильных соединений.
Мы уже описывали один очень распространенный способ их синтеза в программе, посвященной спиртам.
Из каких спиртов можно при окислении получать альдегиды?
• Из первичных спиртов -> 31
• Из вторичных спиртов -> 5
• Из третичных спиртов -» 34
• Нуждаюсь в разъяснениях -» 37
20. Вы ошиблись:
—ОН-это гидроксильная группа
-С=О - это карбонильная группа
Если к карбонильной группе присоединены два углеводородных радикала, получаются ....
Укажите название этого класса соединений. Проверьте ответ в рубрике 23.
21. Не каждое соединение, содержащее группу С=О, рассматривается в рамках данной программы как карбонильное соединение.
Вернитесь к рубрике 3.
22. Правильно. В обсуждаемых реакциях образуются уксусный альдегид и диметилкетон.
Диметилкетон СН3—СО—СН3 более известен под тривиальным названием ацетон.
'Л'^Гюии;;;.sii.se .«sw.f'W
29-.
Ацетон получают в промышленных условиях дегидрированием изопропилового спирта*.
Простейший альдегид-формальдегид-тоже получают из спирта. Какой это спирт?
• Метанол -> 38
• Этанол -» 66
• Изопропиловый спирт -> 45
• Не знаю -+ 48
23. кетоны
Кетоны содержат карбонильную группу
Запишите общую формулу и общее название карбонильных соединений, •содержащих два углеводородных остатка.
Проверьте ответ в рубрике 12.
24. Карбонильная группа. Соединения общей формулы
RVH О называются альдегиды.
Формула альдегидов часто записывается в виде
или короче: R—СНО
Функциональная группа в этих соединениях
/Н
-С или -СНО
чо
называется альдегидная группа.
Какую общую группу имеют альдегиды и кетоны?
• )с=о -» 3
н
• -с -> 14
чо
• -СНО -» 8
25. Прочтите еще раз рубрику 3, обращая особое внимание на приведенные в ней формулы!
* В настоящее время главный промышленный метод получения ацетона-окисление ароматического углеводорода кумола С6Н5—СН(СН3)2. При этом получают кроме ацетона еще другой ценный продукт-фенол. Об этом см. рубрику 52.-Прим. ред.
296
Программа 14
26. кумол
кумольный процесс
Кумольный процесс является важным промышленным процессом получения фенола и ацетона. Приведем еще раз уравнение этого процесса:
СНэ-СН-СН,
бензол пропен
изопропил -бензол
фенол ацетон
(нумол)
Еще один важный промышленный спосоо получения высших альдегидов, так называемый оксосинтез или гидроформилирование, описывается уравнением
СН3—СН=СН2 + СО + Н2 - СН3—СН2—СН2—СНО
Запишите самостоятельно это уравнение и укажите названия всех участвующих в нем соединений.
Проверьте ответ в рубрике 44.
27. Правильно.
Перейдем теперь к описанию некоторых конкретных карбонильных соединений.
Простейшим альдегидом является формальдегид
Напомним, что альдегиды имеют общую формулу
Л
С
и тогда станет ясно, что формальдегид представляет собой частный случай, когда R = Н.
Запишите структурные формулы следующих трех соединений
гомологического ряда альдегидов (т.е. альдегидов с R = CH3, С2Н5 и С3Н7).
Проверьте ответ в рубрике 4.
28. Неправильно. Прочтите еще раз рубрику 3, запишите структурную формулу для каждого из приведенных там соединений. Это облегчит вам распознавание карбонильной функциональной группы.
29. Формальдегид: Н-с/
zH
Уксусный альдегид: СН3 СЧ
'о
Приведите теперь систематические названия этих двух соединений.
Проверьте ответ в рубрике 9, а если вы затрудняетесь его дать, обратитесь вместо этого еще раз к рубрике 4.
Карбонильные соединенна (I)
297
30. Неправильно. Вам следует более внимательно вглядываться в структурные формулы соединений.
Вернитесь к рубрике 24.
31. альдегидов
Альдегиды получают окислением первичных спиртов
R—СН2ОН + [О] -> R—СНО + Н2О
На практике эта реакция может проводиться двумя различными способами:
1. Окисление
Для этого могут использоваться такие окислители, как перманганат калия, бихромат калия или даже просто атмосферный кислород (последний особенно при промышленном получении альдегидов). Если для простоты обозначать окислитель символом [О], то уравнение этой реакции должно иметь вид
R—СН2ОН + [О] -> R—СНО + ...
2. Дегидрирование
Альдегиды получают также каталитическим дегидрированием первичных спиртов при повышенной температуре. Реакция протекает по уравнению
R—СН2ОН ------~ 300~ -» + Н2
катализатор
Завершите оба начатых выше уравнения и укажите название соответствующего способа получения альдегидов.
Проверьте ответ в рубрике 7.
32.
R—СН(ОН)—R —~ 300 С -♦ R—СО—R + Н2 катализатор
Повторим реакции окисления спиртов. Запишите соответствующие уравнения, включая названия продуктов:
zh и-сн2он —► и-с
первичный
спирт
R-CH(OH)-R —► R-CO-R
вторичный
спирт
R4
r-c-oh -ы* реакция не идет
Rz
третичный
спирт
Проверьте ответ в рубрике 6.
298 •
33. Уксусный альдегид и этаналь-два названия одного и того же соединения. Систематические названия альдегидов (по женевскому соглашению) основаны на использовании названий соответствующих углеводородов с добавлением окончания -аль, например
СН3—СНО: два атома углерода, как в этане, поэтому этаналь
СН3—СН2—СНО: три атома углерода, как в пропане, поэтому пропаналь Вернитесь к рубрике 11.
34. Неправильно. Третичные спирты не взаимодействуют с окислителями. Они химически инертны.
Прочтите подробнее об окислении спиртов в рубрике 37.
35. Неправильно. Вернитесь к рубрике 13 и спишите приведенные в ней структурные формулы. Это поможет вам распознать среди них формулы альдегидов.
36. Ацетон и диметилкетон-два названия одного и того же соединения. Названия кетонов образуются из названий двух входящих в них углеводородных остатков и слова кетон, например
СН3—СН—СН3 диметилкетон
СН3—СО—С2Н5 метилэтилкетон
Вернитесь к рубрике 11.
37. Кратко напомним сведения о реакциях спиртов с мягкими окислителями (в приведенных ниже уравнениях символ [О] означает окислитель, например перманганат калия или бихромат калия).
Первичные спирты:
R—СН2ОН + [О] -> R—СНО + Н2О
Вторичные спирты:
R1 —СН(ОН)—R2 + [О] -> R1—СО—R2 + Н2О
Третичные спирты:
r’>C-OH * [О] -*• реакция не идет
R3
Завершите следующее предложение:
Окисление первичных спиртов приводит к образованию ....
Проверьте ответ в рубрике 31.
38. Правильно. Метанол является исходным сырьем для получения формальдегида. Эту реакцию проводят, пропуская пары метанола над нагретым медным катализатором вместе с избытком воздуха.
Что образуется в данной реакции кроме формальдегида? Завершите
h'.i;x'>i»iH.u.iibie .o<- i.nicinix -I)
249
уравнение реакции
2СН3ОН + о2 —►
• н2 —► 49
• Н2О —► 16
• Не знаю —► 51
39. Неправильно. Вам следует более внимательно вглядываться в структурные формулы соединений.
Вернитесь к рубрике 24.
40. Продуктами двух обсуждаемых реакций являются
СН3—СНО и СН3—СО—СН3
Первое из этих соединений представляет собой альдегид, а второе-кетон. Зная это, вы сможете теперь ответить на вопрос, поставленный в1 рубрике 11.
41. Хлораль: н
о
59
61
56
Какое из следующих трех названий хлораля правильно передает его строение?
• Хлорацетальдегид
• Хлоральдегид
• Трихлорацетальдегид
42. Правильно. На 1 моль ацетона образуются еще 1 моль СО2 и 1 моль Н2О.
Следующая схема показывает, из каких частей молекул уксусной кислоты образуются эти продукты:
CHj-CO-CHj + COj + нао
Помните ли вы, при каких условиях протекает эта реакция? Запишите их и проверьте ответ в рубрике 52.
43. При разложении гидропероксида изопропилбензола образуются фенол и ацетон.
Эта реакция имеет важное значение для промышленного получения обоих указанных соединений.
Изопропилбензол известен также под тривиальным названием кумол, поэтому описанная выше реакция носит название кумольный процесс.
300
Программа 14
Завершите теперь начатое ниже уравнение реакции получения ацетона и фенола из изопропилбензола; вставьте в него формулы изопропилбензола и двух окончательных продуктов вместе с их названиями.
[^j] + снэ-сн = сн2 —- —► +
бензол пропен изопропилбензол
Проверьте ответ в рубрике 63, а если вы нуждаетесь в разъяснениях, обратитесь к рубрике 52.
44. CH, СН--СН, + СО + Н2 - СНЭ—СН2—СН2 —СНО
пропен оксид водород масляный альдег ид
углерода (бутаналь)
Олефин
СН3—СН2 СН2- СН2 -СН2—CI1CH,
тоже используется в промышленном оксосинтезе.
Запишите формулу образующегося альдегида. Проверьте ответ в рубрике 75.
И 45. Вы сделали две ошибки.
1. Изопропиловый спирт имеет углеродную цепь из трех атомов.
В реакции его окисления получается соединение, содержащее тоже три атома углерода. Формальдегид же имеет всего один атом углерода.
2. Изопропиловый спирт является вторичным спиртом. При окислении вторичных спиртов получаются кетоны.
Запишите себе в тетрадь последнее предложение.
Какой спирт используется для получения формальдегида?
• Метанол -> 38
• Этанол -> 66
• Не знаю -» 48
46. Типичным ароматическим соединением является бензол. Он имеет три сопряженные двойные связи в шестичленном кольце.
Хинон имеет структурную формулу
о
о
о
Является ли хинон ароматическим соединением?
• Да >84
• Нет -> 55
47. Неправильно. Следует, однако, отметить, что этот вопрос не из легких. Прочтите объяснение в рубрике 53.
Карбонильные соединение (1)
301
48. Альдегиды можно получать из первичных спиртов по реакции
R—СН2ОН + [О] - R -СНО + Н2О
Образующийся альдегид имеет такое же число атомов углерода, что и исходный спирт.
Формальдегид Н—СНО имеет всего один атом углерода.
Следовательно, для его получения в качестве исходного вещества следует использовать первичный спирт, содержащий один атом углерода.
Какой это спирт?
• Метанол -> 38
• Этанол -> 66
49. Пары метанола пропускают с избытком воздуха над нагретым медным катализатором. Образующийся водород сразу же соединяется с кислородом воздуха, образуя ....
Переходите к рубрике 16.
50. Неправильно. Следует, однако, отметить, что этот вопрос не из легких. Прочтите объяснение в рубрике 53.
51. Альдегиды получают из спиртов двумя методами
1. Окисление:
R СН2ОН + [О] -> R СНО + Н2О
2. Дегидрирование:
R—СН2ОН -> R—СНО + Н2
Формальдегид получают окислением метанола, пропуская смесь паров метанола с избытком воздуха над поверхностью нагретого медного катализатора. Составьте уравнение этой реакции.
Какой побочный продукт образуется в этой реакции?
• Водород ->• 49
• Вода ->• 16
14
52. Получение ацетона из уксусной кислоты проводится при температуре около 400°С в присутствии катализаторов.
Ниже описан еще один метод получения ацетона. Этот метод несколько сложнее, поэтому внимательно следите за формулами.
Сначала из бензола и пропена синтезируют изопропилбензол
нэс-сн-снэ
бензол
сн3-сн=сн2
пропен
изопропилбензол
Окисление изопропилбензола дает так называемый гидропероксид
«12
Hpoi p;niv,,, ; ;
(гидроперекись) изопропилбензола
изопропил- гидропероксид
бензол изопропилВензола
Этот гидропероксид разлагается, причем гидроксильная группа перемещается (мигрирует) на бензольное кольцо*.
Конечными продуктами описываемого процесса являются фенол и ацетон. Запишите уравнение образования этих продуктов из гидропероксида изопропилбензола.
Проверьте ответ в рубрике 82.
14
53. Образование ацетона из уксусной кислоты можно схематически представить следующим образом:
СНз-СО-СН, 400 °C катализатор + + .......................
Запишите формулы (и соответствующее число молей) двух побочных продуктов, образующихся в этой реакции.
Проверьте ответ в рубрике 42.
54. Правильно. Хинон следует отнести к дикетонам.
Попытайтесь теперь самостоятельно записать структурную формулу хинона. Он представляет собой дикетон, содержащий кольцо из шести атомов углерода. Если записанная вами структурная формула кажется вам правдоподобной, проверьте ее в рубрике 79. Если же вы не уверены в ней, проработайте материал еще раз, начиная с рубрики 78.
в хинон
55. Правильно. Хинон не является ароматическим соединением. Это обнаруживается в его химических свойствах.
Хинон неустойчив и легко восстанавливается.
При восстановлении хинона образуется гидрохинон - соединение, которое мы уже упоминали выше. Гидрохинон может снова окисляться, превращаясь
восстановление
окисление
гидрохинон
* Подобные реакции называют внутримолекулярными перегруппировками.-Прим, ред.
хинон
r.'.l- Иг,
?()?
Завершите уравнение этой обратимой реакции.
Проверьте ответ в рубрике 68.
56. Правильно. Трихлорацетальдегид (хлораль) раньше использовался в качестве снотворного средства.
В альдегидах, которые были описаны до сих пор,
радикал R всегда представлял собой алифатический углеводородный остаток (алкил). Однако известны также ароматические альдегиды, т. е. соединения, в которых R = арил (ароматический углеводородный остаток). Простейшим из них является бензальдегид.
Какую структурную формулу имеет бензальдегид?
Проверьте ответ в рубрике 69.
57. Сравните три формулы:
Н,ОН
фенол бензальдегид 8ензим8ый спирт
Очевидно, бензальдегид нельзя получить окислением фенола-для этого у последнего не хватает одного атома углерода!
Бензальдегид получают окислением ....
Проверьте ответ в рубрике 76.
14
58. Правильно. Соединения, в которых к одному атому углерода присоединено больше одной гидроксильной группы, неустойчивы.
В рассматриваемом случае отщепление воды приводит к образованию бензальдегида:
+ Н2О
Бензальдегид имеет запах горького миндаля.
Рассмотрим теперь два ароматических кетона:
ацетофенон бензофенон
Эти названия являются тривиальными. Каковы систематические названия двух указанных выше ароматических кетонов? (Напомним, что систематическое название ацетона, СН3—СО—СН3,-диметилкетон.)
Запишите формулы и систематические названия ацетофенона и бензофенона.
Проверьте ответ в рубрике 78.
304
Программа 14
59. Соединение СС13—СНО, действительно, представляет собой хлорацетальдегид, но это название неполное. Рассматриваемое соединение содержит три атома хлора. Следовательно, это соединение должно называться
Завершите это предложение и проверьте ответ в рубрике 56.
60. Неправильно. При изучении спиртов было указано, что соединения, в которых к одному атому углерода присоединено больше одной гидроксильной группы, неустойчивы:
хн н
%.н.°
Перепишите себе в тетрадь ту часть предыдущей фразы, которая набрана курсивом.
Переходите к рубрике 58.
4
61. Название «хлоральдегид» означает альдегид, содержащий хлор. Оно не Является конкретным названием.
Как следует правильно назвать хлораль?
• Хлорацетальдегид -> 59
• Трихлорацетальдегид -» 56
62.
или подробнее
Тривиальное название этого соединения -гидрохинон.
Окисление гидрохинона приводит к образованию хинона
+ (О)
Внимательно посмотрите на формулу хинона и запомните имеющиеся в нем функциональные группы. Теперь ответьте на следующий вопрос.
Соединение какого типа представляет собой хинон?
• Альдегид -» • Кетон -»• • Диальдегид -» • Дикетон -> • Не знаю -» 70 71 72 54 77
63. Проверьте ответ:
О СНа-Й-СНз
бензол пропен изопропил- сренол ацетон
бензол
Тривиальное название изопропилбензола-.... Поэтому процесс
одновременного получения фенола и ацетона называется ... процесс.
Завершите эти два предложения и проверьте ответ в рубрике 26.
64. Оксосинтез
Укажите три исходных вещества, используемых в оксосинтезе:
а) ...
б) ...
в) ...
На сколько атомов углерода отличаются исходное вещество и продукт этого процесса?
Проверьте ответы в рубрике 74, а если вы не уверены в них, прочтите еще раз рубрику 26, начиная со второго абзаца.
65. Формальдегид (метаналь): газ
Уксусный альдегид (этаналь): газ
Пропионовый альдегид (пропгналь): жидкость Масляный альдегид (бутаналь): жидкость
Водный раствор формальдегида называется .... Проверьте ответ в рубрике 73.
66. Этанол содержит два атома углерода. Альдегид, образующийся при его окислении, а именно уксусный альдегид, тоже имеет два атома углерода.
Л сна-снаон + (О] —► сн,-с + нао о
Формальдегид НСНО содержит всего один атом углерода.
Какой спирт следует окислять для получения формальдегида?
• Метанол -» 38
• Изопропиловый спирт -> 45
• Не знаю -> 48
67. Соединения, в которых к одному атому углерода присоединено больше одной гидроксильной группы, неустойчивы
хн хн
-c-o-lHl —► -с + нао
Го?н| V)
Постарайтесь запомнить это.
Переходите к рубрике 58.
20 29
3(»f>
I Ipoi рамма 14
68.
восстановление
окисление
хинон гидрохинон
В отличие от хинона гидрохинон представляет собой ароматическое соединение. Он используется как проявитель в фотографии.
Конец программы 14.
69.
Бензальдегид'.
н-с*°
Как можно получить бензальдегид?
Из фенола -> 80
Из бензилового спирта -»• 76
Не знаю -» 83
70. Альдегиды - это соединения, имеющие функциональную группу
хн
Еще раз внимательно посмотрите на структурную формулу хинона, и вы убедитесь, что он не содержит альдегидной группы.
Вернитесь к рубрике 62.
71. Ваш ответ не вполне правилен. Кетоны-это соединения, содержащие функциональную группу
^С=О
Хинон содержит две такие группы
О
1 1
о
Следовательно, хинон лучше охарактеризовать как
• Кетон -»• 81
• Дикетон -> 54
72. Верно, что в хиноне имеются две группы
;с=о
Однако это не альдегидные группы, альдегиды представляют собой соединения
Карион» nu’s.iv ci>' «пнгиин ti1
507
с функциональными группами
н ✓
Еще раз внимательно посмотрите на структурную формулу хинона, приведенную в рубрике 62.
73. формалин
Формалин используется, например, как консервирующее средство*.
Другой важный альдегид- хлораль. Вы можете вывести его формулу, заменив три атома водорода в метильной группе уксусного альдегида атомами хлора.
Проверьте результат в рубрике 41.
74. Исходными веществами для оксосинтеза являются
а) олефин
б) оксид углерода
в) водород
Конечный продукт оксосинтеза имеет на один атом углерода больше, чем исходный олефин.
Кратко рассмотрим теперь физические свойства альдегидов. Первые два члена этого ряда при комнатной температуре являются газами, а следующие-жидкостями.
Поскольку формальдегид представляет собой газ, его часто используют в виде водного раствора приблизительно 40%-ной концентрации. Такой раствор называется формалин.
Запишите названия четырех первых представителей ряда альдегидов и укажите их физическое состояние при нормальных условиях.
Проверьте ответ в рубрике 65.
1
75. СН3—СН2—СН2—СН2—СН2—СН2—СН2—СНО
Вероятно, вы уже обратили внимание, что продукт этой реакции содержит на один атом углерода больше, чем исходное вещество.
Запомнили ли вы название синтеза альдегидов из олефинов, СО и Н2?
Если запомнили, запишите это название и проверьте ответ в рубрике 64.
Если же вы не запомнили название этого процесса, прочтите еще раз рубрику 44.
76. Правильно. Получение бензальдегида из бензилового спирта описывается уравнением
* Важнейшее применение формальдегида-исходное сырье для получения таких полимеров, как полиформальдегид, фенол-формальдегидные смолы,- Прим. ред.
20*
30S
ilpoipjMMii 14
Бензальдегид можно также синтезировать из толуола. На первой стадии хлорированием толуола получают бензальхлорид
С1
н"схС1
СНЭ
толуол
бензальхлорид
Затем бензальхлорид гидролизуют кипячением с водой или каким-нибудь основанием С1
Нчс"с1
ОН Нх^хОН
Как видно из приведенного выше уравнения, продукт второй стадии содержит две гидроксильные группы, присоединенные к одному и тому же атому углерода.
Как по-вашему, устойчивы ли такие соединения?
• Да -> 60
• Нет -> 58
• Не знаю -» 67
77. Альдегиды - это соединения, содержащие функциональную группу
а кетоны-соединения с функциональной группой
Rx С«Ю (R * Н)
Rz
Какие из этих групп содержатся в хиноне? Вернитесь к рубрике 62.
78.
со-сн,
нетилфенил-нетон
дигренилкетон
Метод получения ароматических кетонов будет описан позже.
Особый класс карбонильных соединений образуют хиноны.
Формулу простейшего хинона можно получить из формулы бензола, если сначала ввести в нее гидроксильные группы в положения 1 и 4 (пара-положения).
Запишите эту формулу и проверьте ее в рубрике 62.
79. Хинон имеет структурную формулу
о
Карбонильные соединении
309
Является ли хинон ароматическим соединением? (Подумайте над ответом как следует!)
• Да -> 84
• Нет -» 55
• Не знаю -+ 46
80. Сравните две формулы он снаон
фенол бензиловый
спирт
а затем сравните их с формулой бензальдегида. Это поможет вам ответить на следующий вопрос.
Как можно получить бензальдегид?
• Из фенола -» 57
• Из бензилового спирта -> 76
81. Неправильно.
Поскольку хинон содержит 2 группы С=О, его следует отнести к ....
Завершите это предложение и переходите к рубрике 54.
82.
Внимательно сверьте составленное вами уравнение с приведенным ниже
гидроперокси!) изопропилбензола
+ сн,-с-сн,
Итак, в результате реакции образуются ... и .... Запишите названия продуктов этой реакции.
Проверьте ответ в рубрике 43.
83. Напомним, что альдегиды получают окислением первичных спиртов. Ниже приведены формулы фенола и бензилового спирта:
он снгон
фенол бензиловый
спирт
Окислением какого соединения можно получить бензальдегид?
Фенола -»• 57
Бензилового спирта
76
84. Нет. Хинон не является ароматическим соединением. Объяснение содержится в рубрике 46.
Программа 15
Карбонилькме сое дииенни Jh
1. Рассмотрим химические свойства карбонильных соединений.
Прежде всего зададимся вопросом: могут ли альдегиды и кетоны восстанавливаться ?
• Да ^10
• Нет - 20
• Не знаю 13
2. Проверьте ответ:
zh
нс' * н, —► н-сн,он
или короче
R—СНО + Н2 - R—СН2ОН
Кетоны могут восстанавливаться аналогичным образом. Завершите уравнение
R
/>О ♦ На —►
R
или в сокращенной форме
R—СО—R + Н2 ->
Проверьте результат в рубрике 12.
3. В качестве катализаторов гидрирования используются благородные металлы и тонко измельченный никель (скелетный никель).
Этот процесс называется каталитическое гидрирование, и принято говорить, что в нем используется каталитически активированный водород.
В другом процессе гидрирования водород генерируется непосредственно в реакционной смеси.
Приведем такой пример. К смеси альдегида или кетона с цинковой пылью добавляют соляную кислоту. В результате реакции между цинком и кислотой образуется водород. Свежеобразующийся водород обладает повышенной реакционной способностью. Такой водород называют водород в момент выделения.
Причина повышенной реакционной способности водорода в момент выделения заключается в том, что сначала образуются атомы водорода. Они успевают прореагировать с гидрируемым соединением раньше, чем превращаются в неактивные молекулы водорода*.
Таким образом, гидрирование может осуществляться двумя различными
* О новых представлениях по гидрированию водородом в момент выделения см. в Маки Р„ Смит Д., Путеводитель по органическому синтезу.-Пер. с англ.: М., Мир, 1985, с. \Н9.-Прим. ред.
КарГ><|Пи.1ьи|.|с сое Uiitcuiiii (11! 311
способами: а) с использованием .... б) с использованием водорода .... Завершите следующие предложения и проверьте ответ в рубрике 14.
4. Правильно. Каталитически активированный водород обладает большей реакционной способностью.
Карбонильные соединения способны не только восстанавливаться, ио также и окисляться. Окисление альдегидов приводит к образованию карбоновых кислот
н он
R-С + [О]—►R-C
О О 1
Основываясь иа этом общем уравнении, составьте конкретные уравнения окисления уксусного альдегида, пропионового альдегида и масляного альдегида:
zh
сн,-с ♦ [О] —» о
уксусный альдегид
••• + [О] —
••• + [О] -*
масляный альдегид
Проверьте ответ в рубрике 16.
пропионовый альдегид
5. Альдегид + [О] -► Карбоновая кислота
Кетон + [О] -> Реакция не идет
Для обсуждения реакций следующего типа нам понадобятся общие формулы альдегидов и кетонов.
Запишите эти формулы.
Проверьте ответ в рубрике 18.
6. Если в молекуле имеется двойная связь, она, как правило, является наиболее реакционноспособным местом молекулы. В частности, реакции присоединения осуществляются по двойной связи.
Вернитесь к рубрике 18.
7. Нет, щелочные катализаторы не оказывают влияния на гидрирование. Катализаторами гидрирования являются благородные металлы или тонко измельченный никель (скелетный никель).
Спишите последнее предложение.
Переходите к чтению рубрики 3.
8. присоединение (или реакция присоединения)
Продукт такой реакции называется продукт присоединения (или аддукт).
Когда соединение Н—X присоединяется к карбонильной группе С=О, с каким концом карбонильной группы связывается атом водорода?
С атомом кислорода С атомом углерода Не знаю
19
26
29
9. Если в молекуле имеется двойная связь, она, как правило, является наиболее реакционноспособным местом молекулы. В частности, реакция присоединения осуществляется по двойной связи.
Вернитесь к рубрике 18.
10. Правильно. Альдегиды и кетоны могут восстанавливаться до спиртов. Какие соединения образуются при восстановлении альдегидов?
• Первичные спирты -► 21
• Вторичные спирты 25
• Третичные спирты -» 28
• Не знаю 30
И. Соединения ванадия используются в качестве катализаторов окисления! - Катализаторами гидрирования являются благородные металлы и тонко измельченный никель (скелетный никель).
Спишите последнее предложение и продолжайте чтение с рубрики 3.
12. R—СО—R + Н2 -> R—СН(ОН)— R
Назовите продукт этой реакции.
Первичный спирт -<• 24
Вторичный спирт -» 22
Третичный спирт -» 27
• Не знаю -> 30
13. В действительности альдегиды и кетоны могут восстанавливаться.
Вспомните, что альдегиды образуются при окислении первичных спиртов. Аналогично кетоны получаются окислением вторичных спиртов. Поскольку альдегиды и кетоны могут быть получены окислением, должна существовать возможность их обратного превращения в спирты восстановлением.
Переходите к рубрике 10.
14. Гидрирование может осуществляться двумя различными способами: а) с использованием катализатора;
б) с использованием водорода в момент выделения.
Немаловажно, какой из этих двух методов используется в каждой конкретной реакции. Так, водород в момент выделения не способен
4';»j>6<-.ii1 i ue mi.riiHH (II)
восстанавливать любые двойные связи: с карбонильной группой реакция протекает, но двойные связи С=С не восстанавливаются.
Следовательно, более реакционноспособным является водород
• при каталитическом гидрировании -> 4
• в момент выделения 23
15. Проверьте ответ:
'с-о + н-о zc-oh
' zs-o —► d
Na* "О 4S=O
Na* ~OZ
Составьте теперь уравнение реакции ацетона (диметилкетона) с гидросульфитом натрия и проверьте ответ в рубрике 36.
16.
ZH он
сн»-с ♦ [О] — сн,-с
уксусный уксусная
альдегид кислота
zH zoh
CjHj-C + [О] — c2Hs-c О / о
пропионовый пропионовая
альдегид кислота.
ZH ОН
СЭН7-С + (О) —. сэн,-с' О О
масляный масляная
альдегид кислота
Нетрудно видеть, что названия альдегидов происходят от названий кислот, образующихся при окислении этих альдегидов:
уксусная кислота получается из уксусного альдегида пропионовая кислота получается из пропионового альдегида масляная кислота получается из масляного альдегида
Кетоны не окисляются в мягких условиях. При более жестких условиях окисления молекулы кетонов расщепляются на меньшие фрагменты (например, при горении). Однако такие процессы окисления не представляют особого интереса.
Завершите следующую схему:
Альдегид + [О] -»
Кетон + [О] -»
Проверьте ответ в рубрике 5.
314
11р<нрамма 15
С-ОН os S’O Ne* "O'
Аддукты альдегидов или кетонов с гидросульфитом натрия легко превращаются снова в исходные вещества. Обычно для этого достаточно нагреть их водный раствор. В качестве примера приведем разложение аддукта уксусного альдегида с гидросульфитом натрия:
Л Л но
СН,-С-ОН —► CH,-C=o + S’O
So Ne* "о"
zs=o Na* ~O
Какие вещества образуются при разложении следующих аддуктов?
н,с он н
С CaHs-(>OH
HjC о и о
S’O S’O
Na* "о" Na* "О
Ацетон и пропионовый альдегид 37
Ацетон и уксусный альдегид -> 42
Ацетон и масляный альдегид -» 45
Нуждаюсь в разъяснениях -» 54
18.
г11
R‘%
альдегид кетон
Альдегиды и кетоны вступают в реакции присоединения с многочисленными реагентами. На основании записанных выше формул сделайте вывод, в каком месте молекулы должно происходить это присоединение.
• Между R и С —> 6
• Между С и Н -► 9
• По двойной связи С=О -» 29
• Не понимаю вопроса -> 31
19. Правильно. Атом водорода из соединения Н—X присоединяется к атому кислорода карбонильной группы.
Запишите общее уравнение этой реакции.
Проверьте ответ в рубрике 32.
20. Неправильно. В действительности альдегиды и кетоны могут восстанавливаться.
Вспомните, что альдегиды образуются при окислении первичных спиртов. Аналогично кетоны образуются при окислении вторичных спиртов. Поскольку
\'а|)б<Н1И j.iibte г < •<*. |иш-игл* НЬ
альдегиды и кетоны могут быть получены окислением, должна существовать возможность их обратного превращения в спирты восстановлением.
Переходите к рубрике 10.
21. Правильно. При восстановлении альдегидов образуются первичные спирты.
Попытайтесь теперь записать общее уравнение этой реакции, полагая, что в качестве восстановителя в ней используется водород:
,н
R-С ♦ н2 —-
О
Проверьте ответ в рубрике 2.
22. При восстановлении кетонов образуются вторичные спирты. Если роль восстановителя играет водород, реакция называется гидрирование.
Вы уже знаете, что для проведения реакций гидрирования требуются катализаторы. Помните ли вы, какие в этом случае применяются катализаторы? • Щелочные катализаторы -» 7
• Благородные металлы -» 3
• Соединения ванадия -» И
23. Водород в момент выделения способен восстанавливать двойную связь С О в карбонильных соединениях, но не восстанавливает двойные связи С=С.
В отличие от этого каталитически активированный водород восстанавливает также двойные связи С=С.
Какая же форма водорода является более активной?
Проверьте ответ в рубрике 4.
24. Неправильно. Прочтите объяснение в рубрике 30.
25. Неправильно. Прочтите объяснение в рубрике 30.
26. Неправильно. Вам следует быть внимательнее; правильный ответ содержится в рубрике 29.
27. Неправильно. Прочтите объяснение в рубрике 30.
28. Неправильно. Прочтите объяснение в рубрике 30.
29. Присоединение происходит по двойной связи С=О.
Альдегиды и кетоны вступают в реакции присоединения одного и того же типа. Это позволяет воспользоваться для карбонильных соединений общей формулой
-С-О
'<16
11р«ч рамма 15
В реакциях присоединения другими реагентами чаще всего бывают соединения типа Н—X. Соединения Н—X всегда присоединяются по двойной связи С=О таким образом, что атом водорода связывается с кислородом карбонильной группы, а группа X связывается с карбонильным углеродом
х
Эта реакция называется ....
Проверьте ответ в рубрике 8.
30. Кратко сформулируем, какая связь существует между первичными и вторичными спиртами, альдегидами и кетонами:
Н
r-ch2oh первичный спирт
окисление
восстанов-ление
О F альдевид
R-CH(OH)-R
вторичный спирт
окисление Восстанов-
ленив
R-CO-R
кетон
Запишите самостоятельно эти уравнения.
Какого типа спирт образуется при восстановлении альдегида?
Проверьте ответ в рубрике 21.
31. Вы уже знакомы с реакциями присоединения. В качестве примера напомним реакцию между этиленом и хлором, в которой происходит присоединение хлора по двойной связи С=С
\ 2* н хн
ZC’CX ♦ С1а —► н-с-с-н
Н Н с/ ХС1
Реакции присоединения с участием карбонильных соединений протекают аналогичным образом.
Вернитесь к рубрике 18.
32.
^-он
Рассмотрим теперь несколько примеров соединений Н—X, используемых в реакциях присоединения. Одним из таких соединений является гидросульфит натрия:
н-о
'оо + s»o —►
Ne**OZ
Это уравнение, вероятно, выглядит несколько сложно. Тем не менее попытайтесь завершить его, пользуясь приведенным выше общим уравнением.
К ipuoiiiMLhsie J>!
Ч”
Проверьте ответ в рубрике 15, а если вы затрудняетесь дать его, обратитесь за разъяснениями к рубрике 33.
33. Напомним общее уравнение реакции присоединения к карбонильной группе:
X
Гидросульфит натрия является частным случаем соединений типа Н—X, в котором роль X играет группа
-о
S-O
Ne* "О
Вероятно, вы сможете теперь завершить следующее уравнение: н-о
zc-o + \=о —►
Ne* *OZ
Проверьте ответ в рубрике 15.
34.
хон С=О + H-CN —*
Исходя из этого общего уравнения, завершите уравнения следующих конкретных реакций:
н
СНэ-с( + H-CN —►
°.
уксусный
альаееид
H,CS
zOO + н-CN —-
н,с
ацетон
1.5
Проверьте результат в рубрике 44.
35. Проверьте ответ: и
циангидрин пропионового альдегида: с,н5-с-он 4cn
нэсч zoh
циангидрин метилэтилкетона: с
с2н5' scn
Аммиак тоже легко присоединяется к карбонильной группе, особенно к альдегидам. Если, как и прежде, обозначать реагенты присоединения общей формулой Н—X, то в аммиаке NH3 в роли X выступает группа NH2; другими словами, Н—NH2 реагирует как Н—X.
Hpoi pi'Mvia J;
Теперь вы сможете составить уравнение реакции между аммиаком и уксусным альдегидом.
Проверьте результат в рубрике 46.
36. нэс н-Оч нэс он
zc=o + s=o —► zc
НаС Na* "Oz HjCZ 'o
>O
Na* "O
Этот аддукт можно записать проще:
НЭС ZOH
,Cs
Н3С OSOjNa
5
Реакция присоединения такого типа протекает очень легко. Достаточно лишь встряхивать концентрированный водный раствор гидросульфита натрия с альдегидом или кетоном. Аддукты представляют собой чаще всего кристаллические соединения, которые выделяются из концентрированных растворов. Они растворимы в воде.
Аддукты получают названия от соединений, из которых они образованы, простой комбинацией слов «аддукт бисульфита» с названием соответствующего карбонильного соединения (бисульфит = гидросульфит; молчаливо предполагается, что имеется в виду натриевая соль), например:
продукт присоединения бисульфита к ацетону называется
«аддукт бисульфита с ацетоном»,
продукт присоединения бисульфита к уксусному альдегиду называется
«аддукт бисульфита с уксусным альдегидом».
Запишите формулу аддукта бисульфита с бензальдегидом. Вспомните, что бензальдегид является простейшим из ароматических альдегидов.
Проверьте ответ в рубрике 17.
37. Правильно. Продуктами разложения являются ацетон и пропионовый альдегид.
Реакция карбонильных соединений с гидросульфитом натрия часто используется для их очистки.
Обработка альдегида или кетона концентрированным водным раствором гидросульфита натрия дает кристаллический аддукт. Последующее фильтрование позволяет удалить нежелательные растворимые побочные продукты. Нагревание водного раствора выделенного аддукта бисульфита приводит к его разложению на исходные вещества, т.е. альдегид или кетон и гидросульфит натрия.
Циановодород является еще одним примером молекулы, которая легко присоединяется по связи С=О. Циановодород имеет формулу
Н C=N
Вспомним общую ориентацию присоединения соединений типа Н—X к карбонильным группам. К какому атому карбонильной группы должна присоединяться группа CN из циановодорода HCN?
• К кислороду -> 53
• К углероду -> 51
• Не знаю -> 57
Карбонильные соединения (II)
н3с
zOO + NHjOH —► Н3С
н3сч zoh н,сч
С —► zC=NOH + НаО
Н3С NHOH Н3С
Конечный продукт такой реакции называется оксим. В данном случае это оксим ацетона (или ацетоксим). Оксимы образуются из карбонильных соединений в результате замены карбонильного атома О группой =NOH.
Укажите название следующего соединения:
н с2н6-с'
NOH
Оксим альдегида 50
Гидроксиламин пропионового альдегида 60
Оксим пропионового альдегида -» 49
39. Проверьте ответ: ZCH, н»с Yh, н3с <!:н3 'сн/ циклогексан
Циклогексанон представляет собой соответствующий кетон zch3 н2<р "С-О Н3С сн3 'сн/ циклогексанон
Реакция этого кетона с гидроксиламином приводит к образованию оксима циклогексанона (или циклогексаноноксима). Составьте уравнение этой реакции, не указывая в нем промежуточных продуктов.
Проверьте ответ в рубрике 52.
40. Правильно. В рассматриваемой реакции происходит расширение цикла: циклогексанон - шестичленный цикл, а продукт реакции-семичленный. Этот продукт называется капролактам и представляет собой сырье для производства найлона (капрона). (Подробнее об этом см. в программе 23.)
Завершите начатое ниже уравнение, которое описывает образование капролактама из циклогексаноноксима
ZCHK
Н3С СН, *
'сн/
Внимательно проверьте ваши формулы, прежде чем сверить ответ с указанным в рубрике 56.
н,с y«NOH
41. Циклогексаноноксим имеет шестичленное кольцо, состоящее только из атомов углерода. В кольце капролактама имеется еще один атом.
Вернитесь к рубрике 52.
42. Уксусный альдегид имеет формулу
сн,-
Вернитесь к рубрике 17.
43. Неправильно. Еще раз внимательно посмотрите на уравнение, приведенное в рубрике 52.
44.
/н /н
СН3-С + H-CN —► CHS-C-OH
*О 4CN
н3сч Н3С zoh
ZC = O + H-CN —► ZC
HjC H,C CN
Аддукты HCN (циановодОрода) с альдегидом или кетоном называются циангидрины. Названия индивидуальных соединений образуют из слова «циангидрин» и названия соответствующего карбонильного соединения.
Запишите названия двух показанных выше циангидринов.
Проверьте ответ в рубрике 55.
45. Масляный альдегид имеет формулу
Л
СзН’-%
Вернитесь к рубрике 17.
46. Проверьте ответ:
Л хН
СН3-С + NHj —* CHj-C-OH
*О 4 NH,
Продукты реакций такого типа называются «аддукты аммиака с альдегидом».
Запишите структурные формулы аддуктов аммиака с пропионовым альдегидом и масляным альдегидом.
Проверьте ответ в рубрике 59.
<П|М«ОКШ№НЫ.? C'XVjWt’rfn» (' Г 1
321
47. капролактам
Это соединение используется для получения синтетического волокна-найлона (капрона).
Конец программы 15.
48. Проверьте ответ: гидроксиламин:
\-ОН (или NH-OH) н
Гидроксиламин образует с карбонильными соединениями на первой стадии аддукты
н он
zc=o + \-он —► с н
hz z V
\>н
или проще
ZC=O + NHaOH
\ /ОН Zcz
NHOH
Таким образом, NH2OH реагирует, подобно другим соединениям типа Н—X, причем группа —NHOH присоединяется к углеродному атому карбонильной группы.
Однако аддукты, показанные выше в квадратных скобках, неустойчивы и после отщепления воды превращаются в конечные продукты реакции:
'V-’f
Z°H zc
NHOH
zC«NOH + H2O
Запишите две стадии реакции между ацетоном и гидроксиламином. Проверьте ответ в рубрике 38.
49. Правильно.
Важное практическое значение имеет оксим циклогексанона. Выведем формулу этого соединения поэтапно.
Циклогексанон представляет собой кетон, производное циклогексана.
Запишите структурную формулу циклогексана и проверьте ее в рубрике 39, а если вы сомневаетесь в ней, обратитесь за дополнительными сведениями в рубрику 58.
50. Это название недостаточно конкретное. Данный оксим представляет собой производное определенного альдегида и должен быть назван соответственно.
Вернитесь к рубрике 38.
21-29
322
Программа 15
51. Правильно. Группа CN присоединяется к углеродному атому карбонильной группы, а атом водорода связывается с кислородом
;С = О + H-CN->
Завершите это уравнение.
Проверьте ответ в рубрике 34.
52.. Проверьте ответ: н, н2
Н, на
циклогексанон циклогексанон- ।
оксин
В концентрированном растворе серной кислоты указанный выше оксим перегруппировывается.
Перегругшировка-это внутримолекулярная реакция, в которой состав молекулы сохраняется, но происходит структурное превращение.
Ниже показана перегруппировка циклогексаноноксима
Н, /Н.-СО
HiC^N-OH _ Н><? \ н
5
циклогексанон- капролактам оксим
Эта реакция довольно сложная: происходит разрыв связи С—С, образование новой связи С—N, а атом кислорода перемещается от азота к углероду.
Сколько атомов входят в кольцо у каждого из этих соединений?
Циклогексаноноксим Капролактам
• 6 6 -> 41
• 6 7 ->40
• 6 8 ->43
53. Вы не поняли общего принципа присоединения к группе С—О. Прочтите внимательно рубрику 57.
54. Рассмотрим еще один пример разложения аддуктов гидросульфита натрия. Аддукт бисульфита с уксусным альдегидом
н
СНэ-С-о4н
...\о
Na*'Oz
при нагревании в водном растворе расщепляется на составные части (см. пунктирные линии на рисунке) уксусный альдегид и гидросульфит натрия.
i• ’< И
323
Какие карбонильные соединения образуются при разложении следующих двух аддуктов?
н,сч рн 21
zc CjHj-C-OH
HSC 'os « чо
/•о \=о
Na* 'О Na* 'О
Ацетон и пропионовый альдегид -> 37
Ацетон и уксусный альдегид -> 42
Ацетон и масляный альдегид -► 45
55. ,он
сн2-с-н 4CN
циангидрин уксусного альдегида
Нэсч ZOH ZC
HjC 4CN циангидрин . ацетона
Запишите структурные формулы циангидринов пропионового альдегида
и метилэтилкетона.
Проверьте ответ в рубрике 35.
с1
Н2С"'C-NOH
Н2С>схСНа н2
Новое соединение называется ... и используется для получения .... Завершите это предложение и проверьте ответ в рубрике 47.
57. Мы уже указывали, что при присоединении молекулы Н—X.
к карбонильной группе атом Н всегда связывается с атомом кислорода карбонильной группы, а группа X связывается с карбонильным атомом углерода.
Д;Х —- :<р-ОН
X
Если X = CN, то Н—Х = Н—CN, т.е. циановодород. Как присоединяется HCN к карбонильной группе?
• CN связывается с атомом О -» 29
• CN связывается с атомом С -> 51
58. Циклогексан представляет собой циклический углеводород, содержащий кольцо из шести (гекса) атомов углерода. Это насыщенное соединение, т.е. алкан, поэтому его название имеет окончание -ан.
Теперь вы, несомненно, сможете записать структурную формулу данного соединения.
Проверьте ответ в рубрике 39.
32<4
Программа 15
59. Формулы аддуктов аммиака с пропионовым альдегидом и масляным альдегидом:
zh сгн5-с-он xNHa
zH
CSH7-C-OH
4nh2
Аддукты аммиака устойчивы только в водном растворе.
Важное значение имеет реакция между альдегидами или кетонами и гидроксиламином.
Гидроксиламин представляет собой производное аммиака, в котором атом водорода замещен на гидроксильную группу.
Запишите на основании этих сведений формулу гидроксиламина.
Проверьте ответ в рубрике 48.
60. Неправильно. Рассматриваемое соединение представляет собой оксим, образованный из пропионового альдегида и гидроксиламина:
н
c2hs-c;
NOH
Как называется это соединение?
• Оксим альдегида -» 50
• Оксим пропионового альдегида -► 49
Программа 16
Карбонильные соединения (III)
1. В этой последней программе, посвященной карбонильным соединениям, мы обсудим реакции полимеризации, альдольную конденсацию и реакцию Канниццаро.
Начнем с реакций полимеризации.
Под полимеризацией понимают соединение нескольких ненасыщенных молекул одного сорта в большую молекулу с незамкнутой цепью или с циклической структурой. Для протекания таких реакций нередко требуются катализаторы.
Большинство карбонильных соединений, за исключением формальдегида и уксусного альдегида, не способны к полимеризации.
Чтобы пояснить, как осуществляется полимеризация формальдегида, сначала «раскроем» двойную связь С=О:
Первая стадия полимеризации соответствует соединению двух таких гипотетически «раскрытых» карбонильных групп:
I I
н н
Завершите это уравнение и проверьте ответ в рубрике 10.
2. полимера
Полиформальдегид (= параформальдегид) состоит из длинных цепей, содержащих десятки, сотни и даже тысячи мономерных звеньев.
Если параформальдегид состоит из 1000 мономерных звеньев, то с учетом того, что молекулярная масса СН2О равна 30, чему равна молекулярная масса полимера? • 300000 -ч. 24
• 30000 -► 13
• 3000 -> 22
•3* Число соединяющихся Название реакции молекул
Две Димеризация
Три Тримеризация
Много Полимеризация
Полимеризующиеся молекулы рассматривают как мономеры. Продукт полимеризации называется полимер.
326
Завершите следующую схему реакции.
полимеризация
Проверьте ответ в рубрике 14.
СН3
—С—О—
н
Запишите теперь продукт соединения трех молекул уксусного альдегида. Проверьте ответ в рубрике 16.
5. Правильно, это шестичленное кольцо.
Как правильно назвать данное соединение?
Мономерный уксусный альдегид -» 33
Димерный уксусный альдегид -» 35
Тримерный уксусный альдегид -► 15
Полимерный уксусный альдегид -► 38
6. Правильно. Атом водорода присоединяется к кислородному концу карбонильной группы, а на ее углеродном конце образуется новая углерод-углеродная связь.
V Л
сн3-с + н-с-с
У н О
Запишите формулу продукта этой реакции. Проверьте ответ в рубрике 18.
>т альдегид
На примере альдольной конденсации мы впервые познакомились с тем, какое влияние может оказывать функциональная группа на реакционную способность других групп или атомов в той же молекуле. В рассматриваемом случае карбонильная группа повышает реакционную способность соседнего атома водорода.
Запишите структурные формулы следующих соединений:
формальдегид, уксусный альдегид, пропионовый альдегид, масляный альдегид и бензальдегид.
Карбонильные соединения (III) 327
Обратите внимание на указанные выше структурные требования к альдольной конденсации и ответьте на следующий вопрос.
Сколько из названных выше альдегидов могут вступать в реакцию альдольной конденсации?
• Все пять -» 32
• Четыре -» 36
• Три - 17
• Два -» 39
• Один -» 41
• Не знаю -> 45
8. Карбонильная группа активирует атомы водорода в а-положении.
Прежде чем перейти к последней реакции, характерной для альдегидов, кратко освежим в памяти, как протекает реакция их восстановления. Запишите общее уравнение реакции восстановления альдегида. Что образуется в такой реакции?
• Первичный спирт -» 19
• Вторичный спирт -> 42
• Третичный спирт -» 47
• Карбоновая кислота -» 49
9. Неправильно. За разъяснениями обратитесь в рубрику 12.
10. н н нн
-с-о- + -с-о- —► -с-о-ср-о-Н Н НН
Полимеризация продолжается, если к цепи присоединяется третья молекула формальдегида.
Запишите формулу продукта второй стадии реакции.
Проверьте ответ в рубрике 21.
И. Неправильно. Вы не понимаете, какие условия необходимы для альдольной конденсации.
Прочтите еще раз рубрику 45.
12. Мы уже знаем, что при присоединении молекул типа Н—X к группе С=О атом Н соединяется с кислородом, а группа X соединяется с углеродом.
Завершите уравнение реакции
)с=о + н-Х —►
Переходите к рубрике 27.
13. Молекулярная масса равна 30000.
Такую полимерную молекулу называют также макромолекула.
Полимеры могут быть неустойчивыми (особенно при нагревании),
разлагаясь на мономерные молекулы. Такой процесс называется деполимеризация.
Образование полимера из мономеров называется реакция ....
Образование мономеров из полимера называется реакция .... Завершите эти предложения и проверьте ответ в рубрике 23.
полимеризация
14. Мономер-----------------> Полимер
Молекулу полимера называют также макромолекула.
Оба конца параформальдегидной цепи имеют свободные валентности
Н Н Н Н Н
которые могут насыщаться, реагируя с небольшим количеством воды и образуя
н н н н н
но—(L—o—(t—о—(t—о—(t—о—(i:—о—н
I I I I I
н н н н н
Эти концевые группы при записи формулы полимера часто не учитывают. Так, параформальдегид можно условно записать следующим образом:
н ।
с-о-
I н
X
Эта формула указывает, что большое число (х) молекул формальдегида соединилось с образованием молекулы ....
Завершите это предложение, вставив в него общее название подобных молекул. Проверьте ответ в рубрике 2.
15. Правильно. Тримерный уксусный альдегид. Это соединение называется также паральдегид. Тримеризация уксусного альдегида катализируется концентрированной соляной кислотой. Ниже еще раз приведены формулы параформальдегида и паральдегида
Нх ,о ,н Hjcnr Y'CHj н^сн3
Могут ли параформальдегид и паральдегид вступать в реакции
присоединения ?
• Да —> 29
• Нет —> 25
• Только параформальдегид —> 34
• Только паральдегид —> 37
ХирСиигельнде? с-.мпнякчяи. (i:i)
329
16.
СНЭ СНз сн3
Свободные валентности в данном случае насыщаются, когда два конца цепи замыкаются, образуя кольцо.
Какой размер имеет полученное кольцо?
• Трехчленное кольцо -> 26
• Шестичленное кольцо -> 5
• Девятичленное кольцо -» 28
• Не знаю -> 31
17. Правильно. Из пяти предложенных альдегидов только три вступают в реакцию альдольной конденсации.
Эти пять альдегидов включают: формальдегид, уксусный альдегид, пропионовый альдегид, масляный альдегид и бензальдегид. Запишите формулы и названия двух из этих альдегидов, которые не вступают в реакцию альдольной конденсации, и кратко объясните причину этого.
Проверьте ответ в рубрике 40.
18. Ниже приведено завершенное уравнение обсуждаемой реакции. Проверьте полученную вами формулу продукта реакции
-------- сн’оо + н-с-с
хн Л чн
ОН И о сн’-i—Ь-с'
н н н
с
или проще СН3—СН(ОН)—СН2—СНО.
Эта реакция называется альдольная конденсация. Строго говоря, она не является настоящей реакцией конденсации, потому что не сопровождается отщеплением какой-либо молекулы. Правильнее ее следовало бы называть димеризацией, т. е. частным случаем полимеризации. Однако эту реакцию принято называть «конденсация».
Вы можете кратко освежить в памяти понятия «конденсация» и «полимеризация», обратившись к рубрике 30.
Альдольная конденсация осуществляется в присутствии какого-либо основания. Название продукта реакции-альдоль связано с тем, что он представляет собой альдегид и в то же время спирт, что отражено в окончании -ол.
Укажите в продукте альдольной конденсации альдегидную и спиртовую функциональные группы.
Проверьте ответ в рубрике 7.
19. Правильно. Восстановление альдегида протекает по общему уравнению
zH
r-c' + н, —► r-ch2oh
зло
Программа 16
Как вам уже известно, альдегиды могут также окисляться н
R-c' + [О] — о
Завершите это уравнение. Что представляет собой продукт реакции окисления альдегида?
• Карбоновая кислота -> 43
• Первичный спирт -> 53
• Вторичный спирт -> 56
20. Правильно. Альдегид со структурной формулой
<?н3 н
СН3 О
не имеет а-атомов водорода (т.е. атомов водорода на углероде, соседнем с карбонильной группой). Следовательно, этот альдегид не может вступать в реакцию альдольной конденсации. Условием осуществимости альдольной конденсации является наличие у альдегида а-атома водорода. Протекание этой реакции обусловлено тем, что карбонильная группа активирует атомы ... в ... положении.
Завершите последнее предложение и проверьте ответ в рубрике 8.
21. Н НН I I I
—С—О—С—О—С—О— I I I
н н н
Присоединение новых молекул формальдегида приводит к удлинению цепи:
н :н :н :н !н
। л । и '|
-с-о-с-о-<р-о-с-о-<р-о-н н н н и
Для большей ясности в последней формуле вертикальными пунктирными линиями указаны звенья, из которых образован полимер.
Полимер формальдегида называется параформальдегид. Если конденсируется всего лишь несколько молекул, не пользуются термином «полимеризация». Вместо этого реакцию соединения только двух одинаковых молекул называют димеризация, а трех молекул - тримеризация. Подлинный полимер образуется из многих сотен или тысяч молекул.
Завершите следующую таблицу.
Число соединяющихся Название реакции молекул
Две Три Много
22. Неправильно. Молекулярная масса формальдегида равна 30. Полимеризация 1000 таких молекул дает полимер с молекулярной массой ....
Укажите пропущенное число и проверьте ответ в рубрике 13.
23. полимеризации
деполимеризации деполимеризация , .
Полимер < > Мономеры
полимеризация
Деполимеризация параформальдегида происходит при его нагревании
и
-с-о- —•> а: сн2о
” L
Полное разложение полимера приводит к образованию х молекул мономера. '
Уксусный альдегид тоже обладает способностью полимеризоваться.
Прежде чем будет рассмотрена его полимеризация, запишите «раскрытую» форму двойной связи С=О
СН3
С=О -
I
н
Проверьте ответ в рубрике 4, а если вы затрудняетесь его дать, обратитесь предварительно к рубрике 50.
24. Неправильно. Формальдегид имеет молекулярную массу 30. Полимеризация 1000 таких молекул дает полимер с молекулярной массой ....
Укажите пропущенное число и проверьте ответ в рубрике 13.
25. Правильно. Реакции присоединения осуществляются по двойным связям. Но в полимерах альдегидов уже нет таких связей. Поэтому параформальдегид и паральдегид не вступают в реакции присоединения.
На этом мы закончим обсуждение полимеризации карбонильных соединений.
Важные реакции карбонильных соединений обусловлены тем, что группа С=О активирует а-атомы водорода; другими словами, карбонильная группа облегчает диссоциацию связи С—Н на соседнем атоме углерода. Карбонильное соединение, имеющее а-атом водорода, может реагировать таким же образом, как соединение типа Н—X, например можно условно записать, что
V ,н
н-с-с = Н-Х, где
А о
332
Программа 16
В программе 15 мы обсуждали присоединение молекул Н—X к карбонильной группе (например, молекул Н—CN). Аналогичным образом молекула уксусного альдегида может присоединяться по двойной связи С—О другой молекулы уксусного альдегида.
К какому концу карбонильной группы направляется атом водорода в таких реакциях присоединения?
• К атому кислорода -+ 6
• К атому углерода -♦ 9
• Не знаю -♦ 12
26. Неправильно. Прочтите объяснение в рубрике 31.
27. 'с=-х —* ‘'с-он
х ж-------— xi
X
Итак, к какому концу группы С=О присоединяется атом водорода? Проверьте ответ в рубрике 6.
28. Неправильно. Прочтите объяснение в рубрике 31.
29. Неправильно. Реакции присоединения осуществляются в карбонильных а соединениях по двойной связи С=О. В полимерах, которые мы обсуждаем, нет таких двойных связей. Следовательно, параформальдегид и паральдегид не могут вступать в реакции присоединения.
Переходите к рубрике 25.
30. Конденсация -это соединение двух или нескольких молекул, сопровождаемое отщеплением воды, а иногда и других простых молекул.
Полимеризация -это соединение нескольких ненасыщенных молекул.
Вернитесь к рубрике 18.
31. Соединение двух концов рассматриваемой молекулы дает циклический продукт, показанный ниже
СНЭ СНз снэ
Hs о „н Н3сЛ |"снэ о ° н хсн3
Какой размер имеет образовавшееся кольцо?
Проверьте ответ в рубрике 5.
32. Неправильно. За разъяснениями обратитесь в рубрику 45.
33. Ненасыщенные мономерные соединения являются исходными веществами для получения полимеров. Мономеры полимеризуются, образуя полимер.
Карбонильные соединения (III)
333
Завершите следующую схему:
деполимеризация полимеризация
Проверьте результат в рубрике 23.
34. Неправильно. Реакция присоединения осуществляется в карбонильных соединениях по двойной связи С=О. В полимерах, которые мы обсуждаем, нет таких двойных связей. Следовательно, параформальдегид и паральдегид не могут вступать в реакции присоединения.
Переходите к рубрике 25.
35. Соединение двух молекул дает димер. Соответствующая реакция называется димеризация.
Аналогично этому три молекулы тримеризуются, образуя тример.
Вернитесь к рубрике 5.
36. Неправильно. За разъяснениями обратитесь в рубрику 45.
37. Неправильно. Реакции присоединения осуществляются в карбонильных соединениях по двойной связи С=О. В обсуждаемых полимерах нет таких двойных связей. Следовательно, параформальдегид и паральдегид не могут вступать в реакции присоединения.
Переходите к рубрике 25.
16
38. Рассматриваемое соединение представляет собой частный случай полимерного уксусного альдегида, в котором полимеризованы только три молекулы. Такая реакция называется тримеризация.
Вернитесь к рубрике 5.
39. Неправильно. За разъяснениями обратитесь в рубрику 45.
40. н Формальдегид: нс *О не вступает в реакцию альдольной конденсации из-за отсутствия соседнего
Бензальдегид: Нхс*° атома углерода не вступает в реакцию альдольной
0 конденсации из-за отсутствия атомов водорода на соседнем атоме углерода
Необходимым условием альдольной конденсации является наличие на
соседнем атоме углерода атомов водорода, которые активируются карбонильной группой.
Атом углерода, соседний с функциональной группой, называется также а-атом углерода. Следовательно, можно сказать, что карбонильная группа активирует <х-атомы водорода, или атомы водорода в а-положении.
Вступает ли в реакцию альдольной конденсации следующий альдегид?
рн3 н сн,-^-с . СНЭ О
• Да -11
• Нет — 20
41. Неправильно. За разъяснениями обратитесь в рубрику 45.
42. Неправильно. В этой реакции образуется первичный спирт.
Завершите уравнение реакции восстановления альдегида, присоединив один атом водорода к углероду, а другой-к атому кислорода карбонильной группы.
ZH R-c + Hl о
Проверьте ответ в рубрике 19.
43. Окисление альдегидов протекает по общему уравнению
н ZOH
+ (о)—»R-c о о
Продуктом окисления альдегида является карбоновая кислота.
Как мы убедились, альдегиды могут и окисляться, и восстанавливаться. Кроме того, альдегиды могут вступать еще в особую реакцию, в которой принимают участие две молекулы: одна из которых окисляется, а другая восстанавливается. Это происходит, когда альдегид обрабатывают водным раствором NaOH
zH
2 R-c' + NaOH —► R-CH2OH + R-COONa 'o
Эта реакция называется по имени открывшего ее итальянского ученого реакция Канниццаро.
Завершите приведенное ниже словесное описание реакции Канниццаро.
2 моля альдегида реагируют с ..., образуя 1 моль соответствующего ... и 1 моль натриевой соли соответствующей карбоновой кислоты.
Проверьте ответ в рубрике 58.
44. Правильно.
Запишите названия и структурные формулы двух альдегидов, которые легко вступают в реакцию Канниццаро. (Эти два альдегида вы должны выбрать из числа четырех: формальдегид, уксусный альдегид, пропионовый альдегид и бензальдегид.)
Проверьте ответ в рубрике 65.
Карбонильные соединения (III)
335
45. Еще раз укажем основное условие, необходимое для альдольной конденсации: наличие атомов водорода у соседнего с карбонильной группой атома углерода. Карбонильная группа активирует эти соседние атомы водорода.
Внимательно посмотрите на приведенные ниже структурные формулы пяти обсуждаемых альдегидов и укажите, какие из них не могут вступать в реакцию альдольной конденсации.
ZH zh
Н-С CHj-C
о о
формальдегид уксусный альдегид
Н сн3-сн2-с' 'о пропионовый альдегид
zH сн3-сн2-сн2-с'
масляный альдегид
н'с*°
дензальдегид
Формальдегид и уксусный альдегид -» 60
Формальдегид и пропионовый альдегид -> 63
Масляный альдегид и бензальдегид -> 68
Формальдегид и бензальдегид -> • 72
+ NaOH —►
COONa
дензальдегид вен лиловый
спирт
Na-co/zd вензой-ной кислоты
В программе, посвященной окислительно-восстановительным реакциям, мы познакомились с понятием, которое можно применить к реакции Канниццаро. Какое это понятие?
• Окисление -» 66
• Восстановление -> 69
• Одновременное окисление
и восстановление -> 70
• Диспропорционирование -» 61
47. Неправильно. В этой реакции образуется первичный спирт.
Завершите уравнение реакции восстановления альдегида, присоединив один атом водорода к углероду, а другой к атому кислорода карбонильной группы.
zH + н2 -* о
Проверьте ответ в рубрике 19.
336
' UpOS jliiMM-l !-6
48. Правильно. Для нейтрализации образующейся карбоновой кислоты нужно использовать по крайней мере 0,5 моля NaOH в расчете на 1 моль альдегида. Вернемся теперь к альдольной конденсации. В присутствии кислот или оснований протекает эта реакция?
• В присутствии оснований -»• 62
• В присутствии кислот -> 64
• Не знаю -> 67
49. Неправильно. Карбоновые кислоты образуются при окислении альдегидов. Восстановление альдегидов приводит к образованию первичных спиртов.
Вернитесь к рубрике 8.
50. Мы записывали «раскрытую» форму формальдегида следующим образом:
Н
I
—с- о-
I
н
Можете ли вы записать соответствующую форму уксусного альдегида?
сн3
с=о -
I н
Проверьте ответ в рубрике 4.
51. Неправильно. За разъяснениями обратитесь в рубрику 59.
52. Реакция альдольной конденсации протекает быстрее, чем реакция Канниццаро. Вследствие этого все альдегиды, способные к альдольной конденсации, вступают в эту реакцию, и реакция Канниццаро для них не наблюдается. Поскольку уксусный альдегид может вступать в альдольную конденсацию, Именно эта реакция и протекает при добавлении к нему гидроксида натрия.
Переходите к рубрике 74.
53. Неправильно. При окислении альдегидов образуются карбоновые кислоты. Внимательно ознакомьтесь с общим уравнением окисления альдегидов, которое приведено в рубрике 43.
54. Неправильно. За разъяснениями обратитесь в рубрику 59.
337
55. Реакция альдольной кондесации протекает быстрее, чем реакция Канниццаро. Вследствие этого все альдегиды, способные к альдольной конденсации, вступают в эту реакцию, и реакция Канниццаро для них не наблюдается. Поскольку уксусный альдегид может вступать в альдольную конденсацию, именно эта реакция и протекает при добавлении к нему гидроксида натрия.
Переходите к рубрике 74.
56. Неправильно. При окислении альдегидов образуются карбоновые кислоты.
Внимательно ознакомьтесь с общим уравнением окисления альдегидов, приведенным в рубрике 43.
57. Неправильно. За разъяснениями обратитесь в рубрику 59.
58. 2 моля альдегида реагируют с NaOH, образуя 1 моль соответствующего спирта и 1 моль натриевой соли соответствующей карбоновой кислоты.
Вместо NaOH в реакции Канниццаро могут использоваться другие гидроксиды щелочных металлов.
В реакции Канниццаро бензальдегид (2 моля) образует 1 моль бензилового спирта и 1 моль натриевой соли бензойной кислоты.
Запишите уравнение этой реакции и проверьте ответ в рубрике 46.
59. Альдольная конденсация протекает быстрее, чем реакция Канниццаро. Зная это, можно установить, какой из четырех альдегидов - формальдегид, уксусный альдегид, пропионовый альдегид, бензальдегид-вступает в реакцию Канниццаро.
В реакцию альдольной конденсации вступают два из этих альдегидов, потому что они имеют а-атомы водорода. Следовательно, эти два альдегида не вступают в реакцию Канниццаро.
Другие два альдегида не могут вступать в альдольную конденсацию, поэтому добавление к ним гидроксида натрия вызывает протекание реакции Канниццаро.
Укажите названия и запишите структурные формулы двух альдегидов, вступающих в реакцию Канниццаро.
Проверьте ответ в рубрике 65.
60. Ваш ответ не вполне правилен. Формальдегид не вступает в реакцию альдольной конденсации.
Однако уксусный альдегид имеет атомы водорода на углероде, соседнем с карбонильной группой. Эти атомы активируются карбонильной группой, и в результате уксусный альдегид вступает в реакцию альдольной конденсации.
Прочтите еще раз рубрику 45.
61. Реакция Канниццаро представляет собой диспропорционирование.
Эта реакция протекает только в присутствии сильных оснований, например NaOH.
Прежде чем дать ответ на следующий вопрос, внимательно подумайте.
22-29
338
Программа 16
Какое количество NaOH необходимо для завершения реакции Канниццаро
с участием 1 моля альдегида? • Каталитическое количество • 0,5 моля • 1 моль -► 71 - 48 - 73
62. Правильно. Альдольная конденсация протекает в присутствии сильных оснований. Это же относится и к реакции Канниццаро.
Как можно предсказать, какая из этих двух реакций произойдет при добавлении сильного основания к альдегиду? Этот вопрос определяется тем, какая из двух реакций протекает быстрее. Если бы они имели одинаковую скорость, обе реакции протекали бы одновременно.
В действительности из двух реакций большую скорость имеет альдольная конденсация. Поэтому, для тех альдегидов, которые вступают в реакцию альдольной конденсации, реакция Канниццаро не наблюдается.
Как реагирует уксусный альдегид с гидроксидом натрия?
• Вступает в реакцию альдольной конденсации -> 74
• Вступает в реакцию Канниццаро -> 52
• Одновременно участвует в реакции альдольной
конденсации и в реакции Канниццаро -> 55
63. Вы правильно указали, что формальдегид не вступает в реакцию альдольной конденсации. Однако пропионовый альдегид вступает в нее. Пропионовый альдегид имеет атомы водорода на углероде, соседнем с карбонильной группой. Эти связи С—Н активируются карбонильной группой.
Прочтите еще раз рубрику 45.
64. Неправильно. Альдольная конденсация протекает в присутствии оснований. Переходите к рубрике 62.
н
65. Формальдегид: н-с
*о
бензальдегид:
Запишите уравнение реакции Канниццаро с участием формальдегида. Проверьте ответ в рубрике 75.
66. Ваш ответ неполон. В реакции Канниццаро 2 моля альдегида реагируют друг с другом. Один из них окисляется, а другой восстанавливается.
Переходите к рубрике 70.
67. Альдольная конденсация протекает в присутствии оснований. Переходите к рубрике 62.
Карбонильные соединения (III)
339
68. Вы правильно указали, что бензальдегид не вступает в реакцию альдольной конденсации. Однако масляный альдегид вступает в нее.
Масляный альдегид имеет атомы водорода на углероде, соседнем
с карбонильной группой. Эти связи С—Н активируются карбонильной группой. Прочтите еще раз рубрику 45.
69. Ваш ответ неполон. В реакции Канниццаро 2 моля альдегида реагируют друг с другом. Один из них окисляется, а другой восстанавливается.
Переходите к рубрике 70.
70. Действительно, в реакции Канниццаро происходит как окисление, так и восстановление. 2 моля альдегида реагируют друг с другом, один из иих окисляется, а другой восстанавливается.
Нечто подобное происходит и в других окислительно-восстановительных реакциях: один атом переходит в более высокое состояние окисления, а другой атом того же элемента переходит в более низкое состояние окисления.
Такая реакция называется диспропорционирование.
Переходите к рубрике 61.
71. Неправильно. Небольшого количества NaOH недостаточно. В реакции Канниццаро образуется 1 моль первичного спирта в расчете на 1 моль карбоновой кислоты. Кислота сразу же нейтрализует NaOH, образуя соль. Таким образом, реакция Канниццаро не могла бы протекать дальше. Минимальное количество должно быть достаточным для нейтрализации всей образующейся карбоновой кислоты.
Следовательно, для 1 моля альдегида необходимо по крайней мере ... моля NaOH.
Завершите это предложение и проверьте ответ в рубрике 48.
72. Правильно. Формальдегид и бензальдегид не вступают в реакцию альдольной конденсации.
Запишите структурные формулы этих двух альдегидов и объясните, почему они не могут вступать в реакцию альдольной конденсации.
Переходите к чтению рубрики 40.
73. Неправильно. Для проведения реакции Канниццаро с 1 молем альдегида вовсе не нужно использовать целый моль NaOH. 2 моля альдегида образуют 1 моль соответствующего спирта и 1 моль карбоновой кислоты. Следовательно, из 1 моля альдегида получится 0,5 моля карбоновой кислоты. Эта кислота нейтрализует присутствующий NaOH. Чтобы иметь достаточное количество NaOH для завершения реакции, на 1 моль альдегида необходимо ... моля NaOH.
Завершите это предложение и проверьте ответ в рубрике 48.
74. Правильно. Уксусный альдегид вступает в реакцию альдольной конденсации. Поскольку она протекает быстрее, чем реакция Канниццаро, последняя не наблюдается.
340
Программа 16
Сколько альдегидов из перечисленных ниже вступают в реакцию Канниццаро при обработке гидроксидом натрия?
Формальдегид, уксусный альдегид, пропионовый альдегид, бензальдегид.
• • • • • Все четыре -> 51 Три - 54 Два -+ 44 ' Один -+ 57 Не знаю -» 59
75. ,Н V 2 Н-Cl + NaOH —► Н-С ОН + H-COONa 'о А формальдегид метанол На-соль муравьи- ной нислоты Конец программы 16.
3
Программа 17
Карбоновые кислоты
1. Органические соединения типа
R-С или R-COOH
'он
называются карбоновые кислоты.
Отличительный признак карбоновых кислот-функциональная группа
.°
•С или -СООН ОН
которая называется карбоксильная группа.
Запишите структурные формулы двух простейших карбоновых кислот, в которых
a) R = Н
б) R = СН3
Проверьте ответ в рубрике 8.
2. Вы указали неправильные формулы для уксусной и масляной кислот.
Проработайте еще раз внимательно весь материал, начиная с рубрики 8.
3. Нет, муравьиная кислота является продуктом окисления метанола. Промежуточным продуктом этой реакции является формальдегид
О
CHjOH + [О]—► н-с( + н>о
н
формальдегид
метанол
формальдегид
Е
,О
+ [О] -- H-CZ
'он
муравьиная кислота
Запишите теперь уравнение окисления этанола и укажите название продукта этой реакции.
Проверьте ответ в рубрике 20.
4. Неправильно, рще раз внимательно прочтите рубрику 35.
5. Вы дали правильное название только для щавелевой кислоты. Прочтите еще раз материал, начиная с рубрики 50.
6. Вы назвали неправильно все три кислоты. Проработайте еще раз материал, начиная с рубрики 8, и постарайтесь получше запомнить все названия и формулы.
342
Программа 17
7. Вы указали неправильную формулу для пропионовой кислоты.
Проработайте еще раз внимательно весь материал, начиная с рубрики 8.
О. ,, //
а) н-С б) CHj-c
он хон
муравьиная уксусная
кислота кислота
Вы, несомненно, должны быть знакомы с уксусной кислотой. Столовый уксус представляет собой 3-5%-ный раствор уксусной кислоты. Чистая уксусная кислота затвердевает уже при 16,6°С, превращаясь в твердое вещество, похожее на лед. Поэтому ее называют ледяная уксусная кислота.
Муравьиная кислота-это вещество, выделяемое муравьями и крапивой, которое при соприкосновении с кожей вызывает жжение.
Продолжим знакомство с рядом алифатических карбоновых кислот.
Запишите структурные формулы двух следующих членов этого ряда, в которых соответственно R = этил и R = пропил.
Проверьте ответ в рубрике 16.
9. Вы назвали правильно только уксусную кислоту. Проработайте еще раз материал, начиная с рубрики 8, и постарайтесь получше запомнить все названия и формулы.
10. Вспомните о существовании двух изомерных спиртов
снэ CHj-CHj-CHj-OH "сн-он
сн3х пропанол -1 пропанол-2
(пропиловый спирт) (изопропиловый спирт)
Аналогичная взаимосвязь существует между масляной и изомасляной кислотами. Запишите структурную формулу изомасляной кислоты.
Проверьте результат в рубрике 24.
11. Исходные вещества: оксид углерода СО и гидроксид натрия NaOH. Продуктом реакции является HCOONa.
Завершите теперь уравнение этой реакции. Проверьте ответ в рубрике 31.
12. Нет, пропионовая кислота образуется при окислении пропанола-1. Промежуточным продуктом этой реакции является пропионовый альдегид
о
СНЭ-СН,-СН2-ОН + [О] —► СНз-СН2-С^ + н,о
пропанол-1 пропионовый
альдееиВ
,О /°
CHj-CHj-C +(О]—► сн3-сн2-с' н "он
пропионовый пропионовая
альдегид кислота
Карбоновые кислоты
343
Запишите теперь уравнение окисления этанола и укажите название продукта этой реакции.
Проверьте ответ в рубрике 20.
13. Вы правильно выбрали формулу для хлоруксусной кислоты, но неправильно для малеиновой кислоты.
Проработайте еще раз материал, начиная с рубрики 50.
14. На данном этапе обучения вам следовало бы уже твердо знать формулу пропионовой кислоты. Постарайтесь больше не делать таких ошибок!
Проработайте еще раз материал, начиная с рубрики 34.
15. Правильно.
Укажите теперь правильные формулы следующих кислот.
Уксусная кислота Масляная кислота Пропионовая кислота
• нсоон СН3СООН СН3СН2СООН —► 2
• сн3соон СН3СН2СООН СН3СН2СН2СООН —► 23
• сн3соон СН3СН2СН2СООН СН3СН2СООН —► 30
• сн3соон СН3СН2СН2СООН нсоон —► 7
16.
гР сн3-сна-с он о СНЭ-СН2-СН1-С чон
пропионовая масляная
кислота кислота
Название «пропионовая» образовано от слова «пропан» *. Оба этих соединения имеют по три атома углерода.
Масляная кислота содержится в прогорклом сливочном масле и выделениях потовых желез человека, придавая им неприятный запах. , Существует еще одна карбоновая кислота, изомерная с масляной кислотой. Запишите ее структурную формулу и проверьте в рубрике 24, а если вы не можете этого сделать, обратитесь к рубрике 10.
17. Неправильно. Еще раз внимательно прочтите рубрику 35.
18. Неправильно. Прочтите объяснение в рубрике 28.
* Исторически дело обстояло наоборот: была известна кислота
С3Н6О2-protospios-«первая жирная», от нее произвели потом название углеводорода С3Н8 -пропан,-Прим. ред.
544
19. Вы путаете три ксилола
о-ксилол
сн3
м-ксилол
п-ксилол
Окисление о-ксилола дает орто-дикарбоновую кислоту. Окисление м-ксилола дает идра-дикарбоновую кислоту.
Вернитесь к рубрике 73.
20. ,р
CHsCHjOH +[О]—- CHj-c; + н2о н этанол уксусный
альдегид zp
Сн3-сч +1О]—» СНз-с'
чн 'он
уксусный уксусная
альдегид кислота
Описанная реакция лежит в основе промышленного получения уксусной кислоты. В качестве окислителя при этом используется атмосферный кислород.
Познакомимся теперь с двумя другими методами, применяемыми для получения муравьиной и уксусной кислот. •
Натриевую соль муравьиной кислоты получают, проводя реакцию
и гидроксида натрия с оксидом углерода при температуре 150°С и давлении 7 атм.
Запишите уравнение этой реакции и проверьте результат в рубрике 31, а если вы нуждаетесь в разъяснениях, обратитесь к рубрике 11.
21. Ваш ответ не вполне правилен. Реакция между NaOH и СО дает только муравьиную кислоту.
Вернитесь к рубрике 56.
22. Карбоновые кислоты имеют общую формулу
R—СООН
где R-органический остаток (или Н в случае муравьиной кислоты), а —СООН-функциональная карбоксильная группа.
Карбоксильная группа содержит кислотный атом водорода. Его кислотный характер обусловливается диссоциацией связи О—Н. Атомы водорода, входящие в состав углеводородного радикала, не диссоциируют.
Следовательно, общее уравнение диссоциации карбоновой кислоты должно записываться так
R—СООН R—СОО" + Н +
Запишите соответствующее уравнение для уксусной кислоты.
Проверьте ответ в рубрике 37.
23. Вы перепутали формулы пропионовой и масляной кислот. Вернитесь к рубрике 16.
24. НэС £Н*СЧ Н,С ОН изомасляная кислота Каковы правильные названия следующих кислот? нсоон СН3СООН сн3—сн2—соон
• • • Уксусная кислота пропионовая кислота масляная кислота -» 6 Пропионовая кислота уксусная кислота масляная кислота -> 9 Муравьиная кислота уксусная кислота пропионовая кислота 15
25. Правильно.
Рассмотрим теперь некоторые ароматические карбоновые кислоты.
Простейшая из них-бензойная кислота. Она образуется при окислении бензальдегида на воздухе, и поэтому образцы бензальдегида, находящиеся в контакте с воздухом, неизбежно содержат некоторое количество бензойной кислоты.
Запишите уравнение окисления воздухом бензальдегидов в бензойную кислоту. Для простоты обозначьте окислитель символом [О].
Проверьте ответ в рубрике 55.
Если вы затрудняетесь дать ответ, обратитесь за разъяснениями в рубрику 63.
д'иялор-нтС\ уксусная С1 ОН кислота
С1 о трихлор-
I /, уксусная
С1-С-С кислота
С1 ОН
Какая из четырех указанных ниже кислот является самой сильной?
Уксусная кислота -»• 4
Хлоруксусная кислота -> 17
Дихлоруксусная кислота -»• 43
Трихлоруксусная кислота' -> 34
27. Нет, в этой реакции используется NaOH.
Посмотрите на уравнение, приведенное в рубрике 31.
28. Атом углерода, к которому присоединены четыре различные группы, называется асимметрический.
В качестве примера рассмотрим три атома углерода в молекуле молочной
346
Программа 17
кислоты
н /> н-с-с-с
Н ОН ОН
Левый атом углерода связан с тремя атомами Н и группой
он он
и, следовательно, не является асимметрическим.
Центральный атом углерода связан со следующими четырьмя группами:
—Н
—сн3
—он
—соон
и поскольку все они разные, является асимметрическим.
Правый атом углерода не может быть асимметрическим, поскольку к нему вообще присоединено только три группы
=О
—ОН н I
СН3—С—
Вернитесь теперь к рубрике 44.
29. СН3СООН + NaOH CH3COONa + Н2О
Обратимся теперь к получению жирных кислот. Высшие жирные кислоты можно выделить из растительных или животных жиров. Низшие члены ряда жирных кислот приходится получать синтетическим путем.
Вы уже знакомы с синтезом карбоновых кислот: окисление первичных спиртов приводит сначала к образованию соответствующих альдегидов, а затем карбоновых кислот.
Запишите уравнение окисления этанола в соответствующий альдегид, а затем в карбоновую кислоту. В качестве окислителей в таких реакциях могут использоваться KMnO4, HNO3 или О2. Для простоты воспользуйтесь в ваших уравнениях символическим обозначением окислителя как [О].
Как называется конечный продукт этой реакции?
• Муравьиная кислота -> 3
• Уксусная кислота -> 20
• Пропионовая кислота -> 12
• Не помню формулы уксусного альдегида -» 39
Карбоновые кислоты
347
30. Правильно.
Систематические названия карбоновых кислот - метановая кислота, этановая кислота, пропановая кислота и т. д.-еще не получили широкого распространения.
Мы уже указывали, где встречаются муравьиная, уксусная и масляная кислоты. Укажите эти сведения самостоятельно.
Муравьиная кислота: ...
Уксусная кислота: ...
Масляная кислота: ...
Проверьте ответ в рубрике 38.
31. NaOH + СО - HCOONa
Муравьиную кислоту можно высвободить из ее соли, добавляя к ней более сильную кислоту, например разбавленную H2SO4. Запишите уравнение этой реакции.
Проверьте ответ в рубрике 40.
32. Нет, для этой реакции используется СО.
Посмотрите на уравнение, приведенное в рубрике 31.
33. Правильно.
Выберите теперь формулы, соответствующие следующим названиям: Малеиновая кислота Хлоруксусная кислота
?
Нх„„Сч £ ОН
ЛХ „ОН
НХ СХ и о
-> 79
Нх_„Сх с он
(- „ОН н' с'
II О
н-с-с он
- 25
О ZOH
Л
у #° Н-С-С
С1 он
- 13
34. Правильно. Чем больше атомов хлора по соседству с карбоксильной группой, тем сильнее кислота.
Рассмотрим теперь оксикислоты, т.е. карбоновые кислоты, имеющие дополнительную гидроксильную группу.
Примером таких соединений является молочная кислота. Она содержится в кислом молоке. Молочная кислота получается из пропионовой кислоты
348
Программа 17
в результате присоединения группы ОН к центральному атому углерода (вместо одного из атомов водорода).
Какова ее структурная формула?
Проверьте ответ в рубрике 44.
35. ¥ *°
сгс-с н он хлорунсус пая кислота
кттл хлора, соседний с карбоксильной группой, усиливает кислотность. Этот эффект еще больше выражен при наличии двух или трех атомов хлора.
Запишите структурные формулы
дихлоруксусной кислоты и трихлоруксусной кислоты. Проверьте ответ в рубрике 26.
36. Первый метод получения карбоновых кислот, а именно окисление первичных спиртов через соответствующие альдегиды, имеет общее применение.
Он используется в больших масштабах в промышленности, особенно для получения уксусной кислоты из этанола*.
Второй метод, окисление альдегидов, также имеет общее применение. Его тоже используют в химической промышленности, например
Р Р
СНЭ«^ + [О] —► CHj-Cs н он
17
Третий метод (реакция между СО и NaOH при повышенных температуре и давлении) представляет собой специфический метод синтеза муравьиной кислоты .
NaOH + СО -> HCOONa
2HCOONa 4- H2SO4 -♦ 2НСООН -f- Na2SO4
Четвертый метод (уксуснокислое брожение спиртовых жидкостей) представляет собой специфический метод получения уксусной кислоты. Этанол, сам получаемый брожением, окисляется до уксусной кислоты микроорганизмами.
ВерЙитесь к рубрике 56.
37. СН3—СООН - СН,СОО + Н +
При реакции карбоновой кислоты с основанием образуются соль этой кислоты и вода. Завершите уравнение нейтрализации уксусной кислоты
СН3СООН 4- NaOH ->
Проверьте ответ в рубрике 29.
* Наиболее современный промышленный способ получения уксусной кислоты-каталитическое окисление бутана кислородом воздуха: СН3—СН2—СН2—СН3 -i°l2CH3COOH. Прим. ред.
кат.
Карбоновые кислоты
349
38. Муравьиная кислота: в выделениях муравьев и в крапиве.
Уксусная кислота: в столовом уксусе. '
Масляная кислота: в прогорклом масле и в выделениях потовых желез человека.
Карбоновые кислоты с большей длиной углеродной цепи, особенно содержащие 16-18 атомов углерода, входят в состав жиров. Поэтому их называют жирные кислоты. В качестве примера укажем стеариновую кислоту, С17Н35—СООН. (Обратите внимание: стеариновая кислота имеет в целом 18 атомов углерода!)
Жиры рассматриваются в программе 24. В настоящий момент мы ограничимся тем, что будем различать
а) низшие жирные кислоты - алифатические карбоновые кислоты вплоть до С4; эти кислоты растворимы в воде;
б) высшие жирные кислоты-с более длинными углеродными цепями; чем длиннее углеродная цепь, тем хуже растворимость соединения в воде.
Приведите по одному примеру низшей и высшей жирных кислот. Запишите формулы и названия этих кислот.
Проверьте ответ в рубрике 46.
39.
сн,-с н
уксусный альдегид
Вернитесь к рубрике 29.
40. 2HCOONa + H2SO4 - 2НСООН + Na2SO4
Какие исходные вещества используются для получения натриевой соли муравьиной кислоты?
• NaOH + СО2 - 32
• NaOH + СО -48
• Na2CO3 + СО - 27
. - r-v окисление окисление
41. Этанол ---------► ... ------* Уксусная кислота
Как называется промежуточный продукт этой реакции?
Проверьте ответ в рубрике 56.
42. Ваш ответ неполон. Малеиновая кислота ненасыщенная, поскольку она содержит двойную связь С=С.
Однако она является также дикарбоновой кислотой, поскольку содержит две карбоксильные группы.
350
Программа 17
Следовательно, данное соединение правильно охарактеризовать как .... Завершите это предложение и проверьте ответ в рубрике 50.
43. Неправильно. Еще раз внимательно прочтите рубрику 35.
44.
н-с-с-с н 6н он
молочная кислота
Молочная кислота имеет асимметрический атом углерода. Что это значит?
Центральный атом углерода в этом соединении называется асимметрический, потому что он связан с четырьмя различными атомами или группами. Ими являются
—СН3
—Н
—ОН
—СООН
Какое из следующих соединений содержит асимметрический атом углерода?
а S V н-с-сч (11 он хлоруксусная кислота в н । н-с-он 1 н-с-он н-с-он н глицерин г " V1 ,р н-с-с-с н н он Н л 2 - хлорлролио -новая кислота
НН О H<f<r‘cC Н Н ОН пропионовая кислота
• а, в н г - 54
• биг -> 71
• Только г - 62
• Все четыре соединения - 18
• Не знаю -> 28
45. Ваш ответ не вполне правилен: уксусную кислоту можно получать и из вина.
Переходите к рубрике 48.
46. Низшие жирные кислоты:
муравьиная кислота уксусная кислота пропионовая кислота масляная кислота Пример высшей жирной кислоты: нсоон СН3СООН С2Н5СООН С3Н7СООН
стеариновая кислота С17Н35СООН
Карбоновые кислоты
351
Карбоновые кислоты диссоциируют в водном растворе подобно тому, как это происходит с неорганическими кислотами: в результате образуются протон и карбоксилат-анион. Кислотными свойствами обладает только функциональная группа ОН (из группы —СООН), связи С—Н не диссоциируют.
Запишите уравнение диссоциации уксусной кислоты. Проверьте ответ в рубрике 37. Если вы затрудняетесь это сделать, обратитесь к рубрике 22.
Фумаровая
кислота
Перейдем теперь к галогензамещенным карбоновых кислот.
Хлоруксусная кислота получается при пропускании хлора через ледяную уксусную кислоту (т.е. через безводную кислоту). В этой реакции один атом водорода в метильной группе замещается хлором.
Запишите структурную формулу хлоруксусной кислоты.
Проверьте ответ в рубрике 35.
48. Правильно.
Разбавленную уксусную кислоту получают из вина (отсюда название винный уксус), в котором она образуется при ферментативно-каталитическом окислении этанола воздухом (уксуснокислое брожение спиртовых жидкостей).
В этой реакции образуется промежуточный продукт окисления. Какой это продукт? Проверьте ответ в рубрике 56, а если вы нуждаетесь в разъяснениях, обратитесь к рубрике 41.
49. Правильно, малеиновая кислота является i/uc-соединением, фумаровая кислота представляет собой транс-соединение.
Укажите название такого типа изомерии и проверьте ответ в рубрике 57.
50. Малеиновая кислота является ненасыщенной дикарбоновой кислотой. Существует еще одна ненасыщенная дикарбоновая кислота с такой же химической формулой. Она называется фумаровая кислота.
Сравните две структурные формулы:
малеиновая кислота
фумаровая кислота
Вас наверное удивляет, что эти две формулы описывают две разные кислоты.
Ранее мы указывали, что углерод-углеродные связи нежесткие, а, стало быть, структурные формулы, которые можно превратить друг в друга
распрямлением или вращением вокруг связей С—С, идентичны и не изображают изомерные молекулы. Например, две формулы:
Н
I Н— С—С1
I
Н—С—С1
I
н
н
I С1—с—н
I Н—С—С1
I
н
соответствуют не двум изомерам, а лишь одному соединению-1,2-дихлорэтану.
Однако сказанное выше относится только к простым углерод-углеродным связям С—С. В отличие от этого двойные углерод-углеродные связи С=С являются жесткими, и вращение вокруг двойной связи требует затраты большой энергии (оно может осуществляться при сильном нагревании или в присутствии катализаторов).
Малеиновая кислота имеет две карбоксильные группы с одной и той же стороны относительно двойной связи и поэтому представляет собой цис-соединение (латинское слово цис означает «по эту сторону»).
Фумаровая кислота имеет две карбоксильные группы по разные стороны от двойной связи и поэтому ее называют транс-соединение (латинское слово транс означает «по другую сторону»).
Запишите теперь структурные формулы
1/ис-1,2-дихлорэтена и
транс- 1,2-дихлорэтена.
Проверьте ответ в рубрике 58.
51. асимметрический атом углерода
А теперь снова потренируемся в названиях соединений. Выберите правильные названия следующих трех кислот
°Y°H н н D н он он НО^'С-" ВАС,ОН II о
о он
• Щавелевая пропионовая малеиновая -» 5
кислота кислота кислота
• Щавелевая пропионовая фумаровая -> 14
кислота кислота кислота
• Щавелевая молочная фумаровая -> 33
кислота кислота кислота
• Масляная молочная фумаровая -> 80
кислота кислота кислота
о-ксилол
фталевая кислота
Карбоновые кислоты
357
Запишите теперь структурную формулу терефталевой кислоты. Проверьте ответ в рубрике 59.
53. Вы путаете три ксилола:
Окисление о-ксилола дает орто-дикарбоновую кислоту. Окисление n-ксилола дает иара-дикарбоновую кислоту. Вернитесь к рубрике 73.
54. Неправильно. Ни пропионовая кислота, ни глицерин не содержат асимметрического атома углерода.
Центральный атом в пропионовой кислоте
н н 'он
не имеет четырех разных заместителей', его заместителями являются
—СН3
—н н
—соон
т.е. только три разных заместителя. Аналогично в глицерине
Н
Н—С—ОН
I
н—с—он
I
н—с—он
I
н
центральный атом имеет только три разных заместителя
— Н
—ОН
— СН2ОН
— СН2ОН
Вернитесь к рубрике 44.
23-29
+ (О]
бензальдегид
бензойная кислота
Ароматические карбоновые кислоты можно также получать окислением метильных групп, связанных с ароматическим кольцом.
Какой метилзамещенный ароматический углеводород необходим для такого окислительного получения бензойной кислоты?
Запишите его название и структурную формулу.
Проверьте ответ в рубрике 64/
56. Уксусный альдегид.
Мы рассмотрели следующие методы получения карбоновых кислот:
1. Окисление первичного спирта (через соответствующий альдегид).
2. Окисление альдегида.
3. Реакция между СО и NaOH при повышенных температуре и давлении.
4. Окисление этанола в вине микроорганизмами.
Как по-вашему, являются ли эти четыре метода общими, или же некоторые из них пригодны лишь для получения определенных карбоновых кислот?
Какие методы могут использоваться для получения уксусной кислоты?
• Методы 1 и 2 -» 45
• Методы 1, 2 и 4 -► 78
• Методы 1 и 4 -► 68
• Методы 3 и 4 -► 21
• Нуждаюсь в кратком описании всех четырех методов -> 36
57. цис-транс-изомерия
Чтобы облегчить запоминание, воспользуйтесь таким мнемоническим правилом:
малеиновая кислота является i/ис-изомером,
фумаровая кислота является транс-изомером.
Запишите структурную формулу фумаровой кислоты.
Проверьте ответ в рубрике 47.
Н-С-С1 С1-С-Н
II л
Н-С-С1
НС-С1
цис-1,2- дихлорэтен транс -1,2- дихлорзтвн
Такой тип изомерии называется цис-транс-изомерия. Малеиновая кислота является цис- или транс-соединением?
цис
транс
Нуждаюсь в дополнительных сведениях
49
66
74
59.
О^„„он
сг '-он
терефталевая кислота
Этим завершается наше знакомство с индивидуальными карбоновыми кислотами. Низшие алифатические кислоты при нормальных условиях находятся в жидком состоянии (например, муравьиная, уксусная, пропионовая и масляная кислоты); высшие члены этого ряда представляют собой твердые вещества (например, стеариновая кислота).
Ароматические карбоновые кислоты и алифатические дикарбоновые кислоты являются бесцветными твердыми веществами (например, щавелевая кислота, малеиновая и фумаровая кислоты, бензойная, фталевая и терефталевая кислоты).
Можете ли вы записать структурные формулы всех этих соединений? Если нет, вам следует повторно проработать всю эту программу!
Вы уже знаете, что карбоновые кислоты при реакции с сильными основаниями образуют соли. Кратко опишем способ наименования этих солей.
Запишите уравнения реакций следующих кислот с гидроксидом натрия:
а) муравьиная кислота,
б) уксусная кислота,
в) бензойная кислота.
Проверьте ответ в рубрике 70.
60. Щавелевая кислота.
Необходимо запомнить названия и структурные формулы еще нескольких карбоновых кислот. Впрочем, мы ограничимся знакомством только с важнейшими из них.
В предыдущих программах описаны:
Ненасыщенные соединения
Аналогами этих соединений являются следующие карбоновые кислоты:
Г алогенсодержащие соединения Спирты
Ненасыщенные карбоновые кислоты (содержащие связи С=С) Галогензамещенные карбоновые кислоты
Оксикислоты (соединения, содержащие одновременно группы ОН и СООН)
Перейдем к описанию этих трех классов карбоновых кислот, начиная с ненасыщенных.
Ниже приведена неполная формула ненасыщенной дикарбоновой кислоты
С'ХО и С'^
в которой не указаны атомы водорода. Завершите эту формулу и проверьте результат в рубрике 67.
23’
360
Программа 17
61. Правильно. Окисление о-ксилола дает орто-дикарбоновую кислоту, а именно фталевую кислоту.
Окисление и-ксилола дает иара-дикарбоновую кислоту, а именно терефталевую кислоту.
Запишите уравнение окисления о-ксилола.
Проверьте ответ в рубрике 52.
62. Правильно.
Соединения, содержащие асимметрические атомы углерода, существуют в двух формах, которые являются зеркальными отражениями друг друга. Между ними имеется такая же взаимосвязь, как между левой и правой руками.
Ниже схематически изображены две зеркально отраженные формы молочной кислоты. Асимметрический атом углерода находится в центре тетраэдра, а четыре различные группы-в его вершинах
соон ' ноос
Эти две формы можно различить при помощи поляризованного света. Одна форма вращает плоскость поляризации света в правую сторону, а другая форма-в левую сторону.
Таким образом, существуют две различные формы молочной кислоты: а) одна форма вращает плоскость поляризации света вправо, б) Другая форма вращает плоскость поляризации света влево.
Эти две формы называются оптические изомеры, поскольку они имеют одинаковую эмпирическую и структурную формулы, но по-разному влияют на поляризованный свет.
При каком условии соединение существует в двух оптически изомерных формах?
Такое соединение должно содержать ....
Завершите это предложение и проверьте ответ в рубрике 51.
63. Бензальдегид легко окисляется воздухом в бензойную кислоту
Завершите это уравнение и проверьте результат в рубрике 55.
64. Толуол сн3
6
Запишите уравнение окисления толуола в бензойную кислоту.
Проверьте ответ в рубрике 73.
Карбоновые кислоты
353
65. Декарбоксилирование.
Какого типа органическое соединение образуется при декарбоксилировании ?
Проверьте ответ в рубрике 81.
66. Неправильно. Малеиновая кислота является i/uc-соединением. Прочтите рубрику 74.
о
малеиновая кислота
Правильно ли вы записали эту формулу?
К какому классу кислот принадлежит малеиновая кислота?
Ненасыщенная кислота -» 42
Дикарбоновая кислота -» 76
Ненасыщенная дикарбоновая кислота -> 50
68. Ваш ответ не вполне правилен: вы забыли наиболее важный способ получения уксусной кислоты.
Прочтите рубрику 36 и обратите особое внимание на описание первого метода.
69. о он
I
/'он
Укажите название этой дикарбоновой кислоты.
Проверьте ответ в рубрике 60.
70. а) НСООН + NaOH - HCOONa + Н2О
б) СН3СООН + NaOH - CH3COONa + Н2О
в) С6Н5СООН + NaOH - C6H5COONa + Н2О
Натриевая соль муравьиной кислоты называется формиат натрия.
Натриевая соль уксусной кислоты называется ацетат натрия.
Натриевая соль бензойной кислоты называется бензоат натрия.
Таким образом, названия солей карбоновых солей (карбоксилатов) имеют окончание -ат, подобно неорганическим солям, как, например, сульфат или нитрат.
Запишите названия и формулы следующих солей:
С6Н5СООК, (НСОО)2Са и СН3СООК
Проверьте ответ в рубрике 77.
71. Неправильно. Хлоруксусная кислота не имеет асимметрического атома углерода!
Гън
Левый атом углерода связан со следующими группами: —Н
—н
—С1
—соон
среди которых нет четырех разных групп. Атом углерода является асимметрическим только в том случае, если он связан с четырьмя разными группами или атомами.
Вернитесь к рубрике 44.
72. R—СООН -» R—Н + СО2
В этой реакции происходит удаление карбоксильной группы и ее замена атомом водорода.
Как называется такая реакция?
Проверьте ответ в рубрике 65.
73.
о он
бензойная кислота
Окисление алифатических углеводородов (алканов) происходит не так легко. Поэтому окисление алканов приводит к образованию смесей карбоновых кислот, которые трудно разделить.
Познакомимся теперь с двумя важными ароматическими дикарбоновыми кислотами
о^он
Х)Н
ср талевая кислота
терефталевая кислота
Как фталевая, так и терефталевая кислоты используются в производстве синтетических полимеров. Эти два соединения получают окислением на воздухе соответствующих ксилолов.
Какие ксилолы используются для окисления
во фталевую кислоту в терефталевую кислоту
• о-ксилол Л1-КСИЛОЛ —► 83
• -М-КСИЛОЛ И-КСИЛОЛ —> 53
• и-ксилол о-ксилол —> 19
• о-ксилол и-ксилол —> 61
74. Малеиновая кислота является i/uc-соединением. В молекуле малеиновой кислоты две карбоксильные группы расположены по одну сторону от двойной связи С=С
? он
ХОН н'
о
Фумаровая кислота представляет собой соответствующее транс-соединение. В этом соединении две карбоксильные группы расположены по разные стороны от двойной связи С=С
и о
фумаровая кислота
Как называется подобный тип изомерии?
Запишите его название и проверьте ответ в рубрике 57.
75. Мыла представляют собой натриевые или калиевые соли высших жирных кислот.
Почему мыло не действует в жесткой воде?
Запишите ответ и проверьте его в рубрике 82.
76. Ваш ответ неполон. Естественно, малеиновая кислота является дикарбоновой кислотой
? ОН хОН нх с и
однако вместе с тем она содержит двойную связь С=С и, следовательно, \ является ненасыщенной.
Следовательно, малеиновая кислота является .........
Завершите это предложение и проверьте ответ в рубрике 50.
356
Программа 17
77. С6Н5СООК бензоат калия
(НСОО)2Са формиат кальция
СН3СООК ацетат калия
Соли пропионовой кислоты называются пропионаты.
Соли стеариновой кислоты называются стеараты.
Запишите и заполните следующую таблицу:
Название кислоты Название соли
Муравьиная кислота Уксусная кислота Пропионат Стеарат
Бензойная кислота
Проверьте ответ в рубрике 84.
78. Правильно.
До сих пор мы ограничивались рассмотрением карбоновых кислот, имеющих только одну карбоксильную группу.
Однако молекула может иметь две, три и больше карбоксильных групп.
Соединения, имеющие две карбоксильные группы, называются дикарбоновые кислоты. Простейшая из тх-щавелевая кислота. Это соединение состоит из двух непосредственно связанных друг с другом карбоксильных групп.
Запишите структурную формулу щавелевой кислоты.
Проверьте ответ в рубрике 69.
79. Вы правильно выбрали формулу для малеиновой кислоты, но неправильно для хлоруксусной кислоты.
Проработайте еще раз материал, начиная с рубрики 35.
80. Вы дали правильные названия только для молочной и фумаровой кислот. Масляная кислота не является дикарбоновой кислотой. Она имеет формулу СН3СН2СН2СООН.
Вернитесь к рубрике 51.
81. Углеводород R—Н.
Конец программы 17.
82. В жесткой воде (богатой карбонатом кальция) образуются нерастворимые кальциевые соли жирных кислот.
В следующих двух программах будут рассмотрены другие реакции карбоновых кислот. Здесь мы ограничимся только знакомством с декарбоксилированием.
Декарбоксилирование -это термическое отщепление СО2 от карбоновой кислоты.
Завершите следующее уравнение декарбоксилирования: R СООН -► R—Н + ...
Проверьте ответ в рубрике 72.
путаете три ксилола:
о-ксилол ун-ксилол
п-ксилол
Окисление о-ксилола дает орто-дикарбоновую кислоту.
Окисление n-ксилола дает пара-дикарбоновую кислоту. Вернитесь к рубрике 73.
84.
Название кислоты Название соли
Муравьиная кислота Формиат
Уксусная кислота Ацетат
Пропионовая кислота Пропионат
Стеариновая кислота Стеарат
Бензойная кислота Бензоат
Натриевые и калиевые соли высших жирных кислот представляют собой мыла (например, стеараты натрия и калия). Они растворяются в воде с образованием пены.
В отличие от этого кальциевые соли высших жирных кислот нерастворимы в воде. Поэтому пользование мылом в жесткой воде приводит к осаждению кальциевых солей жирных кислот (жесткая вода богата карбонатом кальция), и мыло теряет свою моющую способность.
Что представляют собой мыла?
Опишите химическую природу мыла (а не их использование в качестве моющих средств), завершив следующее предложение.
Мыла представляют собой ....
Проверьте ответ в рубрике 75.
I UvH рз w>.:.
'.-Ji i Kl-JS' . bhij.
1. В программе 17 мы рассмотрели карбоновые кислоты и некоторые их замещенные производные. Эти последние получаются из карбоновых кислот изменением их углеводородных остатков:
- замещение водорода атомом галогена дает галогенированные карбоновые кислоты (например, хлоруксусную кислоту),
- замещение водорода гидроксильной группой дает оксикислоты (например, молочную кислоту).
Теперь мы рассмотрим производные, полученные изменением функциональной группы карбоновых кислот-карбоксильной группы*.
Важнейшие из этих соединений
а) сложные эфиры,
б) хлорангидриды,
в) ангидриды,
г) амиды и
д) нитрилы.
Познакомимся сначала со сложными эфирами.
Сложными эфирами называются соединения типа
чо-и'
в которых вместо кислотного атома водорода стоит углеводородный остаток R'.
Найдите сложный эфир среди следующих соединений:
• СН3—СН2—COONa О • СН,-СН-С он чон -► 20 - 27
о • СНз-С* О-С2Н6 -► 13
/> • chj-ch-c Cl он - 8
2. Вы неправильно назвали соединение а, оно не является эфиром уксусной кислоты.
Вернитесь к рубрике 19.
3. Запишите, пользуясь законом действия масс, константу равновесия для реакции
Кислота + Спирт Эфир + Вода
(воспользуйтесь при этом не химическими формулами, а словесными
* Такие соединения называют функциональные производные карбоновых кислот,-Прим. ред.
обозначениями: кислота, спирт и т.д.)
[Эфир]-...
1\ =------------
Проверьте ответ в рубрике 10.
4. а) Сложный эфир о сн,-с* о-с>н, является производным уксусной кислоты
Р CHj-C чон
б) Углеводородный остаток-С2Н5 представляет собой этильный радикал. Название рассматриваемого сложного эфира-этиловый эфир уксусной кислоты.
Таким образом, названия сложных эфиров образуют от
1) названия исходной кислоты и
2) названия алкильной группы
3) с добавлением слова «эфир».
Запишите названия следующих сложных эфиров: о о-с,н, V
♦° *° Л
сн,-с’ н-сг Г |
О-CHj о-с»н,
Проверьте ответ в рубрике 12.
5. Жиры и душистые вещества.
Сложные эфиры низших кислот и спиртов представляют собой жидкости. Сложные эфиры длинноцепочечных спиртов находятся в твердом состоянии. Все сложные эфиры имеют низкую растворимость в воде или совсем нерастворимы в ней. Они являются хорошими растворителями для жиров, лаков и многих других органических соединений.
Какое из следующих утверждений применимо к этиловому эфиру уксусной кислоты.
• Он представляет собой нерастворимое в воде твердое вещество -> 37
• Он представляет собой нерастворимую в воде жидкость -> 15
• Он представляет собой жидкость, растворимую в воде -> 47
6. Сначала запишите уравнение гидролиза этилового эфира уксусной кислоты водой.
Затем замените воду гидроксидом натрия.
Проверьте результат в рубрике 43.
Л68 Программа 18
7. Вы спутали ацетилхлорид с бензоилхлоридом.
Проработайте еще раз материал, начиная с рубрики 64.
Соединение сн,-сн-с* -это 2-хлорпропионовая кислота, ci 40,1
Оно представляет собой не сложный эфир, а производное пропионовой кислоты, в котором атом водорода в алкильной цепи замещен хлором.
Сложные эфиры-это соединения, образованные замещением в карбоксильной группе.
Вернитесь к рубрике 1.
9. Следующее соединение
СН,-Оч
so,
сн,-о"
представляет собой диметиловый эфир серной кислоты (или диметилсульфат).
Запишите теперь структурную формулу диэтилсульфата.
Проверьте ответ в рубрике 17.
10- к _ [Эфир] [Вода]
[Кислота] [Спирт]
Равновесные концентрации при этерификации 1 моля уксусной кислоты с 1 молем этанола таковы:
[Кислота] -1/3 моля, [Спирт] -1/3 моля
[Эфир]-2/3 моля, [Н2О]-2/3 моля
Подставляя эти численные величины в выражение для константы равновесия, получим 2 2
3 ’ 3
Вычислите К и проверьте ответ в рубрике 34.
И. Вы неправильно назвали соединение б; существуют два радикала, образованные из пропана:
1) пропильный радикал СН3—СН2—СН2—
2) изопропильный радикал СН3—СН—СН3
I
Следовательно, должны существовать как пропиловый, так и изопропиловый сложные эфиры.
Соединение в названо вами также неправильно; оно не является ни фениловым эфиром, ни производным пропионовой кислоты.
Вернитесь к рубрике 19.
Карбоновые кислоты
361
12.
° о-с,н, с
"о-сн3
о-сан,
метиловый эфир уксусной кислоты
этиловый зуэир муравьиной кислоты
этиловый э<рир бензойной
кислоты
Названия сложных эфиров могут образовываться также по аналогии с солями, например
этиловый эфир муравьиной кислоты = этилформиат,
этиловый эфир уксусной кислоты = этилацетат,
этиловый эфир бензойной кислоты = этилбензоат.
Напомним, что соли муравьиной кислоты называются формиаты,
соли уксусной кислоты называются ацетаты, соли бензойной кислоты называются бензоаты.
Завершите следующий перечень: бутиловый эфир уксусной кислоты метиловый эфир муравьиной кислоты
= бутилацетат
= пропилбензоат = этилацетат
метиловый эфир бензойной кислоты
Проверьте ответ в рубрике 21.
= фенилацетат
13. Правильно. Указанное вами соединение представляет собой сложный эфир. Сравните структурные формулы кислот и сложных эфиров:
'о-н
'о-и'
карбоновая сложный
кислота эфир
Сложный эфир представляет собой производное карбоновой кислоты. Он образуется замещением кислотного атома водорода углеводородным остатком R'. Этот остаток R' обычно представляет собой алкильную или арильную группу.
Посмотрите на формулу
о-с,н,
и укажите
а) название и структурную формулу кислоты, из которой получен данный
эфир;
б) название и формулу углеводородного остатка, который замещает в данном сложном эфире карбоксильный протон.
Проверьте ответ в рубрике 4.
14. 1) Удаление одного или обоих продуктов реакции из равновесной смеси.
2) Повышение концентрации одного из исходных веществ (реагентов). На этом заканчивается наше знакомство с синтезом сложных эфиров.
166
Теперь мы кратко опишем их распространенность в природе, свойства и применения.
Сложные эфиры входят в виде жиров в ткани животных и растений. Жиры представляют собой сложные эфиры высших жирных кислот (например, стеариновой кислоты), образуемые последними в сочетании с глицерином. Эти соединения будут описаны подробнее в программе 24.
Многие природные душистые вещества представляют собой сложные эфиры низших карбоновых кислот.
Итак, какие природные вещества образованы сложными эфирами?
Проверьте ответ в рубрике 5.
15. Правильно. Сложные эфиры применяются в качестве душистых веществ, растворителей и пластификаторов.
Что такое пластификаторы?
Пластификаторы -это добавки к жестким полимерам (например, к поливинилхлориду), придающие им пластичность. Это позволяет формовать полимеры, прокатывать их в тонкие листы и т. д.
Завершите следующее предложение.
Жесткие полимеры становятся пластичными при добавлении к ним ...
Проверьте ответ в рубрике 32.
16. Неправильно. Катализатор может ускорить химическую реакцию, т. е. сократить время, необходимое для установления равновесия. Но никакой катализатор, взятый в каком угодно количестве, не может изменить положение равновесия.
Вернитесь к рубрике 35.
дизтиловый эфир
серной нислоты
(или аиэтилсульфат)
Диметилсульфат и диэтилсульфат-очень ядовитые соединения!
Аналогичным образом получаются сложные эфиры азотной кислоты.
Запишите структурную формулу этилнитрата.
Проверьте ответ в рубрике 25.
18. Формиат серебра не может образовывать сложный эфир уксусной кислоты!
Завершите следующие предложения:
Соли муравьиной кислоты называются ....
Соли уксусной кислоты называются ....
Соли пропионовой кислоты называются ....
Соли бензойной кислоты называются ....
Проверьте ответ в рубрике 26.
19.
О* ZO-CHS с о
метиловый Эфир бензойной кислоты (или метилбензоат)
фениловый atpup уксусной кислоты (или фенилацетат)
Укажите правильные названия следующих сложных эфиров:
ZO-C5H5
H-с* сн,-с* сн, |А
O-CHi-CHg-CH, чо-сн Чх1
чсн3 a S в
• Пропилацетат изопропилацетат этилбензоат —► 2
• Про пил фо рми ат пропилацетат фенилпропионат —► И
• Пропилформиат изопропилацетат этилбензоат —► 28
• Пропил формиат пропилацетат этилбензоат —► 36
20. СН3—СН2—COONa-это натриевая соль пропионовой кислоты.
Вернитесь к рубрике 1 и внимательно посмотрите еще раз на общую формулу сложного эфира. Обратите внимание на то, что R означает органический остаток.
21. Проверьте ответ
метиловый эфир муравьиной кислоты пропиловый эфир бензойной кислоты этиловый эфир уксусной кислоты метиловый эфир бензойной кислоты фениловый эфир уксусной кислоты
= метилформиат = пропилбензоат = зтилацетат
= метилбензоат
= фенилацетат
Запишите структурные формулы метилового эфира муравьиной кислоты
и этилацетата.
Проверьте ответ в рубрике 29.
22. Концентрация эфира не изменяется после того, как устанавливается равновесие (это и видно из термина «равновесие»). Число молекул эфира, образующихся в процессе этерификации, точно равно числу его молекул, распадающихся в процессе гидролиза.
Допустим, что некоторая реакция этерификации находится в равновесии. Может ли измениться концентрация карбоновой кислоты в результате продолжительного нагревания смеси в колбе с дефлегматором (вертикальным холодильником)?
• Да + 39
• Нет - 52
23. Правильно. Если удалять в процессе реакции образующийся эфир или воду (или сразу оба этих продукта) при помощи отгонки, то обратный процесс-гидролиз-не сможет протекать. В этом случае равновесие непрерывно смещается в сторону образования эфира и реакция протекает до полного завершения.
Отгонка воды или эфира из реакционной смеси возможна, однако лишь при условии, что другие участники реакции имеют более высокую температуру кипения. Например, в рассматриваемом случае такой метод позволяет непрерывно смещать равновесие в сторону образования эфира, и реакция протекает до полного завершения, потому что участники реакции имеют такие
температуры кипения: этанол 78°С
уксусная кислота 118°С
вода 100°С
этилацетат 77°С
Второй метод смещения равновесия в сторону образования эфира заключается в повышении концентрации одного из реагентов.
Например, если 1 моль уксусной кислоты смешать с 2 молями этанола (т.е. создать избыток спирта), выход этилацетата повышается до 85%.
(Повышение выхода можно рассчитать, пользуясь законом действия масс, как это показано в рубрике 3. Для проведения таких расчетов нужно уметь решать квадратные уравнения.)
В чем заключаются два описанных выше метода смещения равновесия этерификации в сторону образования эфира?
Проверьте ответ в рубрике 14.
24. Вы не учли, что из пропана могут быть получены два разных радикала:
1) пропильный радикал СН3—СН2—СН2— и
2) изопропильный радикал СН3—СН—СН3
Следовательно, должны существовать и два типа эфиров:
пропиловые и изопропиловые эфиры
Какой эфир образуется в реакции 1-бромпропана с карбоксилатом серебра, пропиловый или изопропиловый?
Вернитесь к рубрике 33.
25. СН3—СН2—О—NO2
этиловый эфир азотной кислоты (или этилнитрат)
Обратимся теперь к получению сложных эфиров. Один из методов их получения заключается в обработке карбоксилата серебра (т.е. серебряной соли карбоновой кислоты) алкилгалогенидом. В результате образуются сложный эфир и галогенид серебра.
Завершите следующее уравнение и укажите названия входящих в него соединений:
СН3—COOAg + I—С2Н5 -► ... + ...
(Примечание: I—С2Н5 это то же самое, что С2Н5—I.)
Проверьте ответ в рубрике 33.
Производные карбоновых кислот (I)
369
26. Проверьте ответ:
Соли муравьиной кислоты называются формиаты.
Соли уксусной кислоты называются ацетаты.
Соли пропионовой кислоты называются пропионаты.
Соли бензойной кислоты называются бензоаты.
Вернитесь к рубрике 33.
27
Соединение сн.-сн-с -это молочная кислота. он ч°н
Она не является сложным эфиром. Молочная кислота получается из пропионовой кислоты замещением атома Н в алифатической цепи на группу ОН. В отличие от этого сложные эфиры образуются замещением в карбоксильной группе.
Вернитесь к рубрике 1.
28. Правильно.
Сложные эфиры образуют не только карбоновые кислоты. Известны также сложные эфиры неорганических кислот. Например, диэтилсульфат представляет собой сложный эфир серной кислоты.
Запишите структурную формулу диэтилсульфата. Проверьте ответ в рубрике 17.
Если вы нуждаетесь в разъяснениях, обратитесь в рубрику 9.
29.
н-с*° 'о-сн,
метиловый жрир муравьиной нислоты (или метилформиат)
О СН,-С О-С,Н,
зтиловый эфир уксусной нислоты (или атилацетат)
Е
Сравните эти формулы с записанными вами самостоятельно и исправьте возможные ошибки в своих формулах.
Запишите теперь структурные формулы метилбензоата и фенилового эфира уксусной кислоты. Укажите по два названия для каждого из этих соединений.
Проверьте ответ в рубрике 19.
30. В начале реакции имелся 1 моль уксусной кислоты. После достижения равновесия в смеси оставалось еще 1/3 моля уксусной кислоты.
Сколько молей уксусной кислоты прореагировало?
Проверьте ответ в рубрике 38.
31. Неправильно. Концентрация эфира не изменяется после того, как устанавливается равновесие (это и видно из термина «равновесие»). Число молекул эфира, образующихся в процессе этерификации, точно равно числу его молекул, распадающихся в процессе гидролиза.
Допустим, что некоторая реакция этерификации находится в равновесии. Может ли измениться концентрация карбоновой кислоты в результате
24-29
370
Программа 18
продолжительного нагревания смеси в колбе с дефлегматором (вертикальным холодильником) ?
• Да -» 39
• Нет -ч. 52
32. Жесткие полимеры становятся пластичными при добавлении к ним пластификаторов.
В качестве пластификатора часто используется диэтиловый эфир фталевой кислоты. Запишите структурную формулу этого соединения и проверьте ее в рубрике 42, а если вы нуждаетесь в разъяснениях, обратитесь в рубрику 73.
33. о
CHj-COOAg + I-C,Hj —► CHj-C* + Ag]
чо-с,нв
ацетат этил- этилацетат иодид
серебра иодид серебра
Общее уравнение реакции получения сложных эфиров о
R-COOAg + Hal-R' --► R-C + AgHal
\>-R’
где R и R' могут быть различными или одинаковыми.
Для наглядности иногда полезно заключать в рамку в уравнении реакции атомы или группы, вступающие друг с другом в реакцию о
СНд-СОО~ | Ag* 4 HbiHr' —► R-C + AgHal 4O-R'
Какой сложный эфир образуется при обработке 1-бромпропана формиатом серебра?
• Пропилацетат -» 18
• Пропилформиат -» 41
• Изопропилформиат -» 49
• Нуждаюсь в разъяснениях -» 24
34. Константа равновесия К равна 4.
Эта величина относится только к следующему равновесию:
Уксусная кислота + Этанол +* Этилацетат + Вода
Если в реакции этерификации используются другие кислоты или спирты, то им соответствуют другие численные значения К.
Зная значение константы равновесия К, можно определить концентрацию эфира, образующегося при реакции 1 моля уксусной кислоты с 2 молями этанола (т.е. при 100%-ном избытке этанола).
Если обозначить концентрацию эфира х, то концентрация воды имеет то же значение: [Вода]=х. В реакции расходуются х молей кислоты и х молей спирта.
Кислота: исходное количество 1 моль
израсходовано х молей
остается при равновесии (1 — х) молей
Спирт: исходное количество 2 моля
израсходовано х молей
остается при равновесии (2 — х) молей
I ipoil 1HO. UII.1C Карбоновых KUC.lOi (I)
371
Следовательно, [Эфир] [Вода] x x x2
[Кислота] [Спирт] (1 — х) (2 — х) 2 — Зх + х2
Это уравнение имеет два решения
Xi = 0,85
х2 = 3,16
Второе из этих решений не имеет химического смысла, поскольку из 1 моля кислоты не может быть получено 3,16 моля эфира. Следовательно, выход этилацетата равен 0,85 моля = 85%.
Вернитесь к рубрике 23.
35. Правильно. В ходе реакции было израсходовано 2/3 моля уксусной кислоты (и столько же молей спирта) и образовалось 2/3 моля этилацетата (и столько же молей воды).
сн3соон + С2Н5ОН СН3СООС2Н5 + Н2О
При равновесии в смеси содержится соответственно: 1/3 1/3 2/3 2/3 моля
Следовательно, выход эфира составляет всего 2/3 моля = 66%. Желательно было бы сместить равновесие вправо, чтобы выход превысил 66%.
Один из способов сделать это заключается в предотвращении обратной реакции, т.е. гидролиза.
Как это можно сделать?
• При помощи катализатора -» 16
• Удаляя один из продуктов реакции из реакционной смеси -» 23
Добавляя воду
46
36. Вы не учли, что из пропана могут быть получены два разных-радикала:
1) пропильный радикал СН3—СН2—СН2—
2) изопропильный радикал СН3—СН—СН3
I
Следовательно, должны существовать и два типа эфиров:
пропиловый и изопропиловый эфиры
Вернитесь к рубрике 19.
37. Этиловый эфир уксусной кислоты образован из кислоты и спирта, молекулы которых имеют короткие углеводородные цепи. Следовательно, этот сложный эфир должен быть жидким.
Вернитесь к рубрике 5.
38. Прореагировало 2/3 моля уксусной кислоты. Сколько эфира образовалось?
Вернитесь к рубрике 44.
24*
372
Программа 18
39. Неправильно. При равновесии количество образующегося эфира точно равно его количеству, исчезающему в процессе гидролиза. Следовательно, концентрация карбоновой кислоты не должна изменяться.
Еще раз внимательно проработайте материал, начиная с рубрики 45.
40.
HCOOAg + CHj-CH-CH, —► Н-С ZCH, + AgBr Вг \j-CH
SCH, изопропилфорниат
Теперь запишите уравнение реакции между формиатом серебра и 1-бромпропаном. Затем укажите название образовавшегося в этой реакции эфира.
Проверьте ответ в рубрике 54.
41. Правильно.
Запишите теперь уравнение реакции между 1-бромпропаном и формиатом серебра (пользуясь структурными формулами), а также назовите образующийся сложный эфир.
Проверьте ответ в рубрике 54.
Q'SS-CjH.
диэтилсрталат
Одна из наиболее важных реакций сложных эфиров-их расщепление на исходные карбоновую кислоту и спирт. Как мы уже знаем, данная реакция представляет собой гидролиз. Эта конкретная реакция гидролиза называется омыление (образование мыла, которое, действительно, происходит при щелочном гидролизе сложных эфиров высших жирных кислот).
Сложный эфир + Вода Кислота + Спирт
Гидролиз сложных эфиров обычно осуществляется их кипячением с водой в присутствии небольшого количества серной кислоты, играющей роль катализатора.
При кипячении 1 моля этилацетата с 1 молем воды достигается гидролиз только 1/3 моля эфира. Другими словами, в результате образуются лишь 1/3 моля уксусной кислоты и 1/3 моля этанола. Так обстоит дело при равновесии.
Таким образом, равновесие гидролиза ничем не отличается от равновесия этерификации.
Как можно осуществить полный гидролиз сложного эфира?
1) Удалением ..... из реакционной смеси.
2) Повышением концентрации ....
Завершите эти предложения и проверьте ответ в рубрике 50.
Производные карбоновых кислот (I)
373
43.
сн,-с \>с>н,
этилацетат
+ NaOH
CHj-COO'Na
+ С,Н5ОН
еидронсид натрия
ацетат натрия
этанол
Образование смеси
соли приводит к удалению
уксусной кислоты из равновесной
Сложный эфир + Вода Кислота + Спирт
По этой причине щелочной гидролиз идет до полного завершения.
На этом мы заканчиваем обсуждение сложных эфиров. Второй важный класс производных карбоновых кислот-это
хлорангидриды
Хлорангидриды получаются из соответствующих кислот замещением гидроксильной группы на атом С1.
Запишите структурную формулу хлорангидрида уксусной кислоты.
Проверьте ответ в рубрике 64.
44. Концентрированная серная кислота катализирует реакцию, т.е. ускоряет достижение равновесия.
Рассмотрим теперь количественные соотношения между реагентами и продуктами при протекании реакции этерификации.
Допустим, что исходная смесь содержит 60 г (1 моль) уксусной кислоты, 46 г (1 моль) этанола и приблизительно 1 г концентрированной H2SO4, используемой в качестве катализатора. Эту смесь нагревают в колбе с вертикальным холодильником. Время от времени из смеси извлекают небольшие образцы (по 200 мг) и определяют концентрацию уксусной кислоты титрованием 0,1 н. раствором гидроксида натрия. (Разумеется, при этом титруется и серная кислота, но ее количество настолько мало, что им можно пренебречь. Наконец, можно учесть количество H2SO4 в образце массой 200 мг путем вычислений.)
Экспериментальные данные показывают, что в начале реакции концентрация уксусной кислоты быстро уменьшается. Однако после продолжительного кипячения дальнейшие изменения концентрации прекращаются. Реакция достигает равновесия. В положении равновесия реакционная смесь содержит 1/3 моля уксусной кислоты (33% ее исходного количества). На приведенном ниже графике показаны результаты описанного титрования:
Продолжительность реакции, мин
В начале реакции (0 мин) в реакционной смеси находился 1 моль уксусной кислоты. Уже в течение первой минуты ее количество значительно уменьшилось
374
HpoipJMMa IS
(приблизительно до 0,4 моля). Равновесие было достигнуто приблизительно через 5 мин. По истечении этого времени уже не наблюдается никаких изменений концентрации.
Какое количество этилацетата присутствует в реакционной смеси при равновесии?
• 1 моль —► 56
• 2/3 моля —► 35
• 1/3 моля —> 63
• Не знаю —> 30
45. а) Этерификация, б) Гидролиз.
При кипячении карбоновой кислоты со спиртом (вместе с каталитическим количеством серной кислоты) сначала осуществляется этерификация. По мере возрастания концентрации эфира и воды все большее количество эфира снова гидролизуется с образованием кислоты и спирта. По истечении некоторого времени количество образующегося эфира становится точно равным количеству эфира, распадающегося в результате гидролиза.
В реакции устанавливается равновесие.
Можно ли изменить концентрацию эфира более продолжительным кипячением после того, как реакция достигла равновесия?
• Да, концентрация повышается —► 59
• Нет —► 52
• Да, концентрация понижается —► 31
• Не знаю —> 22
46. Добавление воды оказывает противоположное действие: равновесие Кислота + Спирт Эфир + Вода
смещается влево, т.е. осуществляется гидролиз.
Однако задача заключалась в том, чтобы найти метод, способствующий этерификации.
Вернитесь к рубрике 35.
47. Неправильно. Все сложные эфиры плохо растворимы в воде. Вернитесь к рубрике 5.
48. /> °
С.Н,-С + С,Н5ОН —- С.Н,-С + НС1
'ci ЧО-С,Н5
5ензоилтлорид этанол этилбензоат тлороВодород
Следовательно, реакция между хлорангидридом и спиртом приводит к образованию ......
Завершите это предложение и проверьте ответ в рубрике 58.
49. Неправильно. Изопропилформиат образуется из 2-бромпропана и формиата серебра.
Запишите уравнение этой реакции, пользуясь структурными формулами. Проверьте ответ в рубрике 40.
Производные карбоновых кислот (I)
375
50. 1) Удалением продукта реакции (уксусной кислоты или этанола) из
реакционной смеси.
2) Повышением концентрации одного из реагентов. Проще всего добавить в реакционную смесь избыток воды.
Гидролиз легко довести до завершения добавлением какого-либо основания. В этом случае образующаяся кислота выводится из реакционной смеси в форме соли.
Запишите уравнение гидролиза этилацетата с участием гидроксида натрия. Укажите название всех участвующих в реакции соединений и проверьте ответ в рубрике 43, а если вы нуждаетесь в предварительных разъяснениях, обратитесь в рубрику 6.
51. Неправильно. Вы перепутали бензильный и фенильный радикалы сн,-
б “ о
бензил фенил
Убедитесь в том, что вы понимаете различие между этими двумя радикалами.
Вернитесь к рубрике 58.
52. ' Правильно. При равновесии не происходит никаких изменений концентрации. Катализатор (серная кислота или другая сильная кислота) только ускоряет достижение равновесия. Он не влияет на положение равновесия.
Запишите ответ на следующий вопрос.
Почему в реакциях этерификации используется небольшое количество концентрированной H2SO4 ?
Проверьте ответ в рубрике 44.
53. Завершите уравнение реакции
£> сн,-с + с,н5-он —* ... + н,о
он
уксусная . # . этилацвтат
кислота (или ...)
Проверьте ответ в рубрике 71.
HCOOAg + Вг-СН,-СН,-СН, —► Н-С* + AgBr
чо-сн,-сн,-сн, пропиловый. зсрир муравьиной кислоты (или пропилформиат)
Из-за высокой стоимости серебра эту реакцию проводят только в лабораторных условиях.
В промышленности используются другие методы получения сложных
376
Программе 18
эфиров. Важнейшим из них является этерификация карбоновой кислоты спиртом. (Термин этерификация означает образование сложного эфира из кислоты.) Завершите приведенное ниже общее уравнение этой реакции и назовите все участвующие в ней соединения:
R-C* + R'-ОН —► +
"он кислота спирт слосксший жрир
Проверьте ответ в рубрике 62, а если вы нуждаетесь в разъяснениях, обратитесь в рубрику 70.
55. Правильно. Поскольку этерификация ч гидролиз являются противоположными и обратимыми процессами, уравнение следует записывать при помощи двойной стрелки:
о о
R-C + R'OH R-C + НЭО
ЧОН 4OR'
Назовите
а) реакцию, протекающую по этому уравнению в правую сторону, и
б) реакцию, протекающую по этому уравнению в левую сторону. Проверьте ответ в рубрике 45.
56. Неправильно. 1 моль эфира не мог образоваться, поскольку это потребовало бы полного протекания реакции между 1 молем кислоты и 1 молем спирта.
Хотя в исходной реакционной смеси, действительно, содержалось по 1 молю каждого из этих реагентов, реакция не протекает до полного завершения.
Следовательно, в результате образуется меньше 1 моля эфира.
Вернитесь к рубрике 44.
57. В реакции между ацетилхлоридом и водой образуются уксусная кислота и хлороводород
СН,-С — сн,-с*
ГС1 + ннэ-н ОН
ацетилхлорид Йода уксусная
кислота
+ НС1
хлороводород
Многие хлорангидриды реагируют с водой уже при комнатной температуре (например, ацетилхлорид). Другие требуют нагревания (например, бензоилхлорид).
Спирты и фенолы тоже реагируют с хлорангидридами.
Все эти реакции могут быть выражены общим уравнением
R-C _______ —► R-C
Га + Hl-O-R' 4O-R'
НС1
Производные карбоновых кислоi (I)
377
Здесь R' = Н соответствует реакции с водой, R' = СН3 соответствует реакции с метанолом, R' = соответствует реакции с фенолом.
Запишите уравнение реакции между бензоилхлоридом и этанолом с указанием названий всех соединений.
Проверьте ответ в рубрике 48.
58. сложных эфиров
Хлорангидриды, реагируя с фенолами, также образуют сложные эфиры. Как можно получить фениловый эфир бензойной кислоты?
• Из бензоилхлорида и бензилового спирта -» 51
• Из бензоилхлорида и фенола -» 67
• Из бензилхлорида и фенола -» 77
• Из бензилхлорида и бензилового спирта -» 84
59. Неправильно. Концентрация эфира не изменяется после того, как устанавливается равновесие (это и видно из термина «равновесие»). Число молекул эфира, образующихся в процессе этерификации, точно равно числу его молекул, распадающихся в процессе гидролиза.
Допустим, что некоторая реакция этерификации находится в равновесии. Может ли измениться концентрация карбоновой кислоты в результате продолжительного нагревания смеси в колбе с дефлегматором (вертикальным холодильником)?
• Да
• Нет
39
52
60. 1) Карбоксилат серебра + алкилгалогенид
2) Карбоновая кислота + спирт
3) Хлорангидрид + спирт (или фенол)
Фосген представляет собой промышленно важный хлорангидрид:
о-с
/С1
ЧС1
Производным какой кислоты является этот хлорангидрид? Вы получите ответ, если замените оба атома хлора группами ОН.
Проверьте ответ в рубрике 75.
61. Неправильно. Еще раз внимательно посмотрите на уравнение, приведенное в рубрике 69. Назовите реакцию, протекающую по этому уравнению справа налево.
П-с" + R’-OH —► R-C* + Н,О
ЧОН SO-R‘
зислота спирт сложный вода.
эсрир
Запишите теперь соответствующее уравнение для получения этилацетата.
378
Программа 18
Укажите названия всех соединений, участвующих в этой реакции. Проверьте ответ в рубрике 71, а если вы нуждаетесь в разъяснениях, обратитесь в рубрику 53.
63. Неправильно. В начале реакции смесь реагентов содержала 1 моль уксусной кислоты. При равновесии в смеси оставалось еще 1/3 моля неизрасходованной кислоты.
Сколько молей уксусной кислоты прореагировало?
Проверьте ответ в рубрике 38.
64. Р
снэ-с
ЧС1
а цегпщкслорид
Хлорангидриды - это соединения общей формулы
Хлорангидрид, образованный из уксусной кислоты, называется ....
Хлорангидрид, образованный из бензойной кислоты, называется бензоилхлорид.
Запишите структурные формулы и названия этих двух хлорангидридов.
Проверьте ответ в рубрике 72.
65. СН3—СН2—СН2—СН2—ОН + SOC12 -
бутанол-1 тионнлхлорид
СН, СН2- СН2—СН2 С1 + so2 + НС1 хлорбутан-1 диоксид серы хлороводород
Эта реакция лежит в основе удобного метода получения алкилхлоридов из спиртов.
Обратимся теперь к химическим свойствам хлорангидридов. Их реакция с водой приводит к получению исходной карбоновой кислоты. Запишите уравнение реакции между ацетилхлоридом и водой. Какие продукты образуются в этой реакции?
• Бензойная кислота и хлороводород -» 7
• Уксусная кислота и хлороводород -» 57
• Уксусная кислота и хлор -» 79
• Не знаю -» 76
66. ci о=с ЧС1
фосген
Фосген-очень ядовитый газ. Он особенно опасен, потому что симптомы отравления появляются лишь через несколько часов после контакта с ним, когда оказывать медицинскую помощь уже поздно!
Подобно другим хлорангидридам, фосген реагирует с водой и спиртами.
I l|inu uni ci.se । , 1,101 ... 379
Запишите уравнения реакций и названия продуктов для
а) реакции между фосгеном и водой и
б) реакции между фосгеном и этанолом.
Проверьте ответ в рубрике 82.
67. Правильно.
Запишите теперь уравнение синтеза фенилового эфира бензойной кислоты и укажите названия всех участников реакции.
Проверьте ответ в рубрике 78.
68. 1) Ацетат серебра + метилиодид (или метилбромид)
2) Уксусная кислота + метанол
3) Ацетилхлдрид + метанол
Сформулируйте три метода получения сложных эфиров. Запишите их, пользуясь общими названиями исходных веществ:
1) ... + ...
2) ... + ...
3) ... + ...
Проверьте ответ в рубрике 60.
69- £>
СН,-С + Н,О —► CHj-C + с,н5-он \>-C2Hs 'он
этилацетат Вада уксусная этанол
кислота
Это расщепление эфира под действием воды называется гидролиз. (Гидролиз сложных эфиров в щелочной среде называется также омыление, т.е. образование мыла.)
Укажите, какая из названных ниже реакций является обратной по отношению к гидролизу сложного эфира:
• Этерификация -» 55
• Спиртовое брожение -» 83
• Уксуснокислое брожение -» 61
70. Запишем уравнение этерификации следующим образом: о R-C • • +
(Ьн + hI-o-R'
кислота спирт сложный
ярир
Теперь вы, несомненно, сможете завершить его. Проверьте ответ в рубрике 62.
СН,-С* ♦ С,Н5-ОИ —► СН,-С* +HjO
'он ЧО-С2Н5
инсисная этанол этилацетат вода кислота (или этиловыи
э/рир уксусной кислоты)
380
Программа 18
Из групп, набранных в этом уравнении жирным шрифтом, образуется вода. Перепишите это уравнение таким образом, чтобы можно было взять в рамку набранные жирным шрифтом группы в исходных веществах.
Проверьте результат в рубрике 80.
Если вам неясно, как это сделать, обратитесь в рубрику 85.
72.
о сн,-с*
'а
аретилхлорид
Бензоилхлорид
Обратите внимание на различие между бензоильным и бензильным радикалами!
О С1 ’Ь' СН,С1
6 о
вензоилхлорид Бензилхлорид
Хлорангидриды чаще всего получают обработкой соответствующей карбоновой кислоты тионилхлоридом SOC12. В качестве упражнения завершите следующее уравнение: о
С.Н.-С; + —► + + на
он бензойная тионил-
нислота хлорид
(Укажите также названия продуктов реакции.) Проверьте ответ в рубрике 81.
73.
"ОН но-с,н5
<дс*° +
"OH HO-C,Hj
+ Н,О
фталевая этанол
наело та
дизтилфталат
Завершите это уравнение.
Проверьте ответ в рубрике 42.
о о
СН,-С + SOC12 -----► CHj-C*
'он 'ci
SO2 + НС1
уксусная кислота
тионил-хлорид
ацетил-хлорид
диопсид хлороводосеры род
Тионилхлорид позволяет замещать гидроксильную группу ОН на С1 не только в карбоновых кислотах, но также и в спиртах.
Производные карбоновых кислот (I)
381
Что представляет собой продукт реакции между бутанолом-1 и тионилхлоридом? Составьте уравнение этой реакции и укажите названия всех участвующих в ней соединений.
Проверьте ответ в рубрике 65.
75. Фосген является хлорангидридом угольной кислоты Н2СО3. Запишите еще раз структурную формулу фосгена.
Проверьте ответ в рубрике 66.
76. Завершите уравнение
Запишите структурные формулы и названия продуктов. Проверьте ответ в рубрике 57.
77. Неправильно. Бензилхлорид
СН,-С1
не является хлорангидридом! Следовательно, он не может образовывать при взаимодействии с фенолом сложный эфир.
Вернитесь к рубрике 57.
бензоилхлорид
фенол
фенилЬензоат
+ НС1
хлороводород
Эта реакция протекает в присутствии основания, поэтому в действительности она не приводит к образованию НС1.
Теперь вы знакомы с тремя способами получения сложных эфиров, которые кратко можно представить таким образом:
1) карбоксилат серебра 4- алкилгалогенид
2) кислота 4- спирт
3) хлорангидрид 4- спирт (или фенол)
Из каких исходных веществ можно получить метилацетат, пользуясь этими тремя методами?
1) ... 4- ...
2) ... + ...
3) ... + ...
Запишите названия необходимых веществ и проверьте ответ в рубрике 68.
382
79. Вы сделали ошибку в своем уравнении. Завершите следующее уравнение
,°
снз‘^------1
Га hI-o-h
Запишите структурную формулу и название продукта реакции. Проверьте ответ в рубрике 57.
80- Р Р
CHj-C______ — CHj-c* + нао
ГЬн + н|-о-с,н< о-сан5
Указанная здесь реакция этерификации проводится при нагревании смеси из
46 г (1 моль) этанола,
60 г (1 моль) уксусной кислоты и
1 г концентрированной H2SO4
вместе с некоторым количеством кипятильных шариков в круглодонной колбе на 250 мл, соединенной с вертикальным (обратным) холодильником. Смесь кипятят в течение 1 ч.
(Концентрированная серная кислота присутствует в этой реакции в качестве катализатора. Вместо нее могут использоваться другие сильные кислоты, например НО.)
В описанных условиях полная .реакция ,не осуществляется, поскольку образующаяся вода реагирует с эфиром, в результате чего снова образуются исходные вещества.
Запишите уравнение реакции между этилацетатом и водой.
Проверьте ответ в рубрике 69.
ЕГ81. Проверьте ответ:
с,н5-с*
он
бензойная кислота
+ SOC1, —►
тионил-хлорид
с,н,-с*°
ХС1 бензоил-хлорид
+ so, + НС1
диоксид серы
хлоро -водород
Кроме бензоилхлорида (жидкость) в этой реакции образуются только газообразные побочные продукты. Это делает указанный способ очень удобным для получения хлорангидридов, поскольку остается только перегнать хлорангидрид, чтобы освободить его от непрореагировавших карбоновой кислоты и тионилхлорида.
Эта реакция проводится нагреванием в установке с вертикальным холодильником смеси 50 г бензойной кислоты и 150 г тионилхлорида. Из-за сильного выделения паров SO2 и НС1 реакцию приходится проводить в вытяжном шкафу. Когда выделение’ газов прекращается, избыток тионилхлорида отгоняют, после чего перегоняют полученный бензоилхлорид (температура кипения 194°С).
Запишите уравнение получения ацетилхлорида из уксусной кислоты и тионилхлорида. Укажите названия всех участников реакции.
Проверьте ответ в рубрике 74.
Производные карбоновых кислот (I)
ЛХЗ
82. ci zoh
а) О-с' + 2 Н,О ------► О'С + 2 НС1
"ci 'он
I
COj + н,о
Продуктами этой реакции являются диоксид углерода, вода и хлороводород.
zci НО-С,Н5 О-С,Н5
5) О-С + —► O-CZ + 2 НС1
'ci HO-CjHj 'o-CiH,
Продуктами этой реакции являются диэтилкарбонат и хлороводород.
Конец программы 18.
83. Неправильно. Еще раз внимательно посмотрите на уравнение, приведенное в рубрике 69, и назовите процесс, протекающий по этому уравнению справа налево.
84. Вы сделали две ошибки:
1) бензилхлорид не является хлорангидридом, следовательно, он не может образовывать сложный эфир при взаимодействии с фенолом,
2) вы перепутали между собой два радикала
<5 ° 6
бензил сренил
Проработайте еще раз материал, начиная с рубрики 57.
85. ,°
R-C _____ —► R-C + н,о
|Ън + h|-o-r' 'o-r'
кислота спирт сложный Вода
эсрир
Чтобы пояснить отщепление воды, образующие ее при реакции группы заключены в рамку.
Вернитесь к рубрике 71.
Программа 19
Производные карбоновых кислот (1!)
I. После рассмотрения в предыдущей программе сложных эфиров и хлорангидридов перейдем теперь к обсуждению
ангидридов карбоновых кислот, амидов и
нитрилов.
Ангидрид карбоновой кислоты образуется в результате отщепления одной молекулы воды от двух молекул кислоты
ангидрид
Составьте, пользуясь приведенным выше общим уравнением, уравнение образования ангидрида уксусной кислоты из двух молекул уксусной кислоты.
Проверьте ответ в рубрике 8.
2. Запишите структурные формулы фталевой и терефталевой кислот.
Во фталевой кислоте две карбоксильные группы находятся в орто-положении друг к другу.
В терефталевой кислоте они находятся в пара-положении друг к другу.
Для образования ангидрида две карбоксильные группы в молекуле дикарбоновой кислоты должны находиться достаточно близко друг к другу.
Ответьте теперь на вопрос, поставленный в рубрике 32.
3. Поскольку пропионовая кислота не является дикарбоновой кислотой, она не может образовывать внутренний ангидрид. Она способна образовывать ангидрид только в результате отщепления воды от двух молекул кислоты:
сна-сна-сх он
ZOH
CHj-cHj-d^
CHj-CHa-Cx zo + HjO сна-сн,-сч о
пропионовая нислота
пропионовый ангидрид
Вернитесь к рубрике 25.
4, Вы назвали правильно только формамид Вернитесь к рубрике 33.
Производные кпрпоповых кислот (II)
385
5, . наарь- ..
сщ-соо-кнг^с^ +нао
nh2
ацетат ацегпамид
аммония
Амиды часто получают из хлорангидридов и аммиака. Попытайтесь записать уравнение реакции получения бензамида из соответствующего хлорангидрида и аммиака.
Проверьте ответ в рубрике 18, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 28.
6. CH3CN, действительно, ацетонитрил, но HCN вовсе не «нитрил». Нитрил-это соединение типа R—C=N.
Вернитесь к рубрике 30.
7. Р2О5 является ангидридом фосфорной кислоты Н3РО4.
Мы уже знаем, что ангидриды являются обезвоживающими веществами. Так, бензойный ангидрид получается из бензойной кислоты и уксусного ангидрида. Уксусный ангидрид реагирует с водой, выделяющейся в этой реакции, образуя уксусную кислоту.
Вернитесь к рубрике 52.
8.
сн,-с
чо + н,о сн5-с^
унсусный. ангидрид
Таким образом, получить ангидрид из карбоновой кислоты очень просто, по крайней мере на бумаге. Названия ангидридов карбоновых кислот образуются столь же просто: заменой слова «кислота» словом «ангидрид».
Запищите названия ангидридов
пропионовой кислоты, бензойной кислоты и фталевой кислоты.
Проверьте ответ в рубрике 16.
19
9. Правильно.
Второй метод получения нитрилов заключается в обработке соответствующего алкилгалогенида каким-нибудь цианидом. При этом происходит замещение атома галогена цианидной группой —C=N
R-I-Hal + Na]CN-----► R-CN + NaHal
Согласно этому методу, можно получить пропионитрил, нагревая смесь 1-иодпропана с цианидом натрия. Запишите уравнение этой реакции с указанием названий всех участвующих в ней соединений.
Проверьте ответ в рубрике 20.
25-29
386
Программа 19
10. Терефталевая кислота имеет структурную формулу о<сХ>н
о^он
Может ли это соединение образовывать внутренний ангидрид?
• Да -» 46
• Нет —> 23
• Не знаю -> 2
И.
малеиновая кислота
малеиновый ангидрид
+ н,о
вода
Образующуюся в этой реакции воду необходимо удалять перегонкой, иначе происходит гидролиз с образованием исходной кислоты. Гидролиз ангидридов карбоновых кислот является их общей реакцией:
Ангидриды карбоновых кислот реагируют с водой, образуя соответствующие карбоновые кислоты.
Запишите уравнение реакции между уксусным ангидридом и водой.
Проверьте ответ в рубрике 19.
12. Вы неправильно назвали все три амида. Нужно учитывать, из какой кислоты образуется амид.
Вернитесь к рубрике 33.
13. Проверьте ответ
O^NH,
«А
NH, <рормамид
сн,-с NH, ацетамид
вензамид
Большинство амидов представляют собой бесцветные кристаллические соединения. Исключением является только формамид -жидкое вещество.
Амиды можно получать нагреванием аммонийных солей соответствующих карбоновых кислот
R-COO'NH? t » оание
р
+ нао NH,
Эта реакция тоже является обратимой, и, следовательно, образующуюся воду необходимо удалять, например, путем отгонки.
Какое соединение образуется при нагревании аммонийной соли уксусной кислоты ?
Производные карбоновых кислот (П)
387
Запишите уравнение реакции и названия участвующих в ней соединений. Проверьте ответ в рубрике 5.
14. Неправильно. Возможно, вы спутали малеиновую кислоту с фумаровой кислотой.
Вернитесь к рубрике 25.
фталевая нислота
Запишите теперь структурную формулу и название ангидрида, образуемого этой кислотой.
Проверьте ответ в рубрике 32.
16. Пропионовый ангидрид, бензойный ангидрид и фталевый ангидрид.
Запишите структурную формулу бензойного ангидрида. Это удобнее всего сделать, записав две молекулы бензойной кислоты таким образом, чтобы можно было взять в рамку отщепляемую молекулу воды.
Проверьте ответ в рубрике 25.
17. Правильно. Обе кислоты-и малеиновая, и фталевая - образуют при нагревании соответствующие ангидриды.
Запишите следующее уравнение, пользуясь структурными формулами молекул:
Малеиновая кислота ► Малеиновый ангидрид + Вода
Проверьте ответ в рубрике И.
Бензоил- аммиак Бензамид аглорово-аглорид дород
Обратите внимание на то, что образующийся хлороводород должен реагировать с аммиаком, образуя хлорид аммония NH4C1.
Если вам удалось правильно записать уравнение этой реакции и названия всех участвующих в ней соединений, это значит, что вы успешно осваиваете органическую химию.
Познакомимся теперь с третьим методом получения амидов.
Амиды получаются из ангидридов карбоновых кислот в результате их обработки аммиаком.
Запишите уравнение получения ацетамида этим методом. Укажите названия всех соединений, участвующих в этой реакции. Проверьте ответ в рубрике 26, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 34.
388
Программа 19
19. zo снэ-< О + HjO —-2 СНа-Сч cHj-c он о уксусный уксусная ангидрид кислота
Таким образом, в принципе уксусный ангидрид способен связывать воду. Это свойство используется в методе 2 получения ангидридов карбоновых кислот, который состоит в нагревании кислоты вместе с уксусным ангидридом.
Какие соединения образуются при нагревании смеси бензойной кислоты с уксусным ангидридом?
Проверьте ответ в рубрике 27.
20. СН3—СН2—СН2—I + NaCN -► СН3СН2СН2—CN 4- Nal
1-иодпропан цианид бутироинтрил иодид
натрия натрия
В этой реакции происходит удлинение углеродной цепи на 1 атом.
Указанная реакция лежит в основе удобного способа получения карбоновых кислот из алкилгалогенидов, поскольку образующиеся в ней нитрилы могут затем гидролизоваться в соответствующие кислоты
+ 2 Н,0 Р
R'C5N NH * R’C4 ’NH" он
Рассмотрим эту реакцию более подробно.
Напомним, что нитрилы могут быть получены из амидов. Запишите общее уравнение получения нитрилов из амидов.
Проверьте ответ в рубрике 37.
21. Цианид калия (цианистый калий): KCN Циановодород и его соли-цианиды-чрезвычайно ядовиты. Подберите правильные названия к следующим формулам: HCN CH3CN
• • • • цианид ацетонитрил -► 56 нитрил ацетонитрил -> 6 нитрил муравьиной кислоты нитрил уксусной кислоты -> 54 циановодород ацетонитрил -> 9
22. Правильно. Запишите теперь названия всех трех амидов. Проверьте ответ в рубрике 13.
Производные карбоновых кислот (II)
389
23. Терефталевая кислота
нск
нсг*о
не образует внутренний ангидрид; карбоксильные группы находятся слишком далеко друг от друга.
В отличие от этого фталевая кислота образует внутренний ангидрид
'Г'С
£ Ь + Н«О
фталевая фталевый
кислота ангидрид
Какая из следующих карбоновых кислот образует внутренний ангидрид?
Пропионовая кислота -» 3
Бензойная кислота -» 40
Фумаровая кислота -» 14
Малеиновая кислота -» 31
24. Ваш ответ не вполне правилен.
Две карбоксильные группы в молекуле фумаровой кислоты находятся в транс-положении друг к другу
и поэтому расстояние между ними оказывается слишком большим для образования внутреннего ангидрида.
Вернитесь к рубрике 31.
бензойный ангидрид
Две карбоксильные группы, реагирующие друг с другом при образовании ангидрида, не обязательно должны принадлежать разным молекулам. Некоторые дикарбоновые кислоты образуют внутренние ангидриды. Примером может
390
Программа 19
служить малеиновая кислота:
нагревание
+ н,о
малеиновая кислота
малеиновый ангидрид
Фталевая кислота тоже образует внутренний ангидрид.
Запишите структурную формулу фталевого ангидрида и проверьте ответ в рубрике 32. (Фталевая кислота является о-дикарбоновой кислотой; если вы забыли ее формулу, обратитесь к рубрике 15.)
26. о сн,-с ' ,о
о + NHj —♦ СНЭ-С ' + CHj-C
СНэ-с' NHa ОН
О
уксусный ангидрид
аммиак ацетамид уксусная нислота
Чтобы еще раз повторить все три следующие словесные записи реакций:
метода получения амидов, завершите
нагревание
1) ... ---------► Амид + Вода
2) ... + ... -> Амид + НС
3) Ангидрид карбоновой кислоты +’... -» Амид + ...
Проверьте ответ в рубрике 36.
27. Образуются бензойный ангидрид и уксусная кислота. Метод 3.
Ангидриды карбоновых кислот образуются хлорангидрида с солью карбоновой кислоты:
Хлорангидрид:
Карбоксилат:
в результате реакции
NaCl
хлорид натрия
Какие исходные вещества нужны для получения уксусного ангидрида этим методом? Запишите их названия и структурные формулы.
Проверьте ответ в рубрике 35.
28.
R-C_______ Н —► R-C4 + НС1
|С1 + NHa
Запишите теперь аналогичное уравнение для получения бензамида. Не забудьте указать названия всех участников реакции.
Проверьте ответ в рубрике 18.
Производные карбоновых квслот (II)
391
29. Неправильно. Р2О5 не является катализатором.
Р2О5 представляет собой ангидрид фосфорной кислоты. Следовательно, он должен реагировать с водой, выделяющейся в реакции, образуя фосфорную кислоту. Поскольку в этом процессе Р2О, расходуется, он не является катализатором:
катализаторы ускоряют химические реакции, но не расходуются в них.
Когда ацетамид нагревается вместе с Р2О5, происходит отщепление воды и образование фосфорной кислоты. Запишите название еще одного продукта этой реакции.
Проверьте ответ в рубрике 38.
30. ,о
3 СН3-Сх XNHa
ацетамид
PjO5
3 CHj-C=N
пентоксид фосфора
ацетонитрил
2 Н3РО4
фосфорная
кислота
Простейший нитрил-формнитрил-получается из муравьиной кислоты H-CsN
но его обычно называют циановодород.
Водный раствор циановодорода является слабой кислотой и называется циановодородная кислота. Другими словами, уравнение его диссоциации в водном растворе сильно сдвинуто влево
H-C=N Н+ + CN-
Соли этой кислоты называются цианиды, например
NaCN-цианид натрия
Запишите формулу и название калиевой соли циановодородной кислоты.
Проверьте ответ в рубрике 21.
______________________________________________________________________к
31. Правильно.
Рассмотрим теперь способы получения ангидридов карбоновых кислот.
Метод 1.
Внутренние ангидриды некоторых дикарбоновых кислот образуются просто при нагревании последних. Вы уже знакомы с двумя дикарбоновыми кислотами, способными образовывать внутренние ангидриды. Какие это кислоты?
• Фталевая кислота и фумаровая кислота -> 24
• Малеиновая кислота и бензойная кислота -> 39
• Малеиновая кислота и фталевая кислота -» 17
• Малеиновая кислота и фумаровая кислота -> 47
а"
с*о
(ргпалебд/й
ангидрид
Внутренний ангидрид образуется только в том случае, если две
392
Программа 19
карбоксильные группы в молекуле дикарбоновой кислоты расположены достаточно близко, чтобы прореагировать друг с другом.
В качестве примера приведем малеиновую кислоту. Поскольку она является iync-дикарбоновой кислотой, две карбоксильные группы находятся на одной и той же стороне молекулы и могут реагировать друг с другом
нагревание
+ Н2О
малеиновая малеиновый
нислота ангидрид
Фумаровая кислота является соответствующей транс-дикарбоновой кислотой. В этом случае две карбоксильные группы расположены на противоположных сторонах молекулы и расстояние между ними слишком велико, чтобы могла произойти внутримолекулярная реакция
и о
фумаровая кислота
Может ли терефталевая кислота образовывать внутренний ангидрид?
Да -> 46
Нет -> 23
Не знаю -> 2
Не помню формулу терефталевой кислоты -» 10
33. О»с^н2
о ,О
н-сч снэ-сч nh2 nh2
а 5 8
Укажите теперь правильные названия трех представленных выше соединений: а б в
• Бензамид формамид ацетамид —> 12
• Формамид бензамид ацетамид —> 4
• Формамид ацетамид бензамид —> 22
• Ацетамид формамид бензамид —> 44
34. О + NHj —* R-C4 ч R-C^ NH, 'он
Воспользуйтесь этим общим уравнением, чтобы записать реакцию
Производные карбоновых кислот (II)
393
получения ацетамида из ангидрида соответствующей кислоты и аммиака.
Укажите также название каждого соединения.
Проверьте ответ в рубрике 26.
Ацвтилтлорид: СНЭ-С С1
Ацетат натрия: СНЭ-СОО~ Na*
Завершите эту схему получения уксусного ангидрида.
Проверьте ответ в рубрике 43.
__ .. . _ - нагревание . _
36. 1) Аммонийная соль карбоновой кислоты ----------► Амид + Вода
2) Хлорангидрид + Аммиак -> Амид + НС1
3) Ангидрид карбоновой кислоты + Аммиак -> Амид + Карбоновая кислота
Ранее при изучении хлорангидридов мы познакомились с одним частным случаем-дихлоридом угольной кислоты.
Запишите название и структурную формулу этого соединения.
Проверьте ответ в рубрике 45.
37. J3
Л-С^ R-caN + HjO
NH2
амид нитрил вода
Запишите теперь общее уравнение получения амидов нагреванием аммонийной соли карбоновой кислоты.
Проверьте ответ в рубрике 48.
38. Правильно. Пентоксид фосфора Р2О5 является сильным обезвоживающим средством, т. е. связывает воду, образуя фосфорную кислоту
Р2О5 + ЗН2О -> 2Н3РО4
При нагревании ацетамида с Р2О5 образуется ацетонитрил.
Запишите уравнение этой реакции и проверьте его в рубрике 30, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 55.
39. Ваш ответ не вполне правилен. Бензойная кислота не является дикарбоновой кислотой и, следовательно, не может образовывать внутренний ангидрид.
Вернитесь к рубрике 31.
40. Бензойная кислота образует ангидрид, но не внутренний. Внутренние ангидриды могут образовывать только дикарбоновые кислоты.
Вернитесь к рубрике 25.
Программа 19
41. R-C=N + 2 Н2О -► R-COO-NHZ
ннтрнл вода карбоксилат аммония
Гидролиз нитрилов обычно проводят в присутствии какого-либо основания. В этом случае происходит высвобождение NH3 и после испарения избытка воды образуется соль карбоновой кислоты с щелочным металлом
R—C=N + Н2О + NaOH ->
Завершите это уравнение. Проверьте ответ в рубрике 49. '
42. р сн3-сч р р
о + c^jOH —► CHj-c; + chs-c снэ-с£ о-с,н4 он
уксусный этанол этилацетат уксусная ангидрид кислота
Нетрудно видеть, что эта реакция представляет собой метод 4 получения сложных эфиров.
После ознакомления с ангидридами карбоновых кислот обратимся к амидам.
Амид получается из карбоновой кислоты замещением группы —ОН на группу —NH2. Общая формула амидов
Запишите формулы амидов, полученных из муравьиной, уксусной и бензойной кислот.
Проверьте ответ в рубрике 33.
Ацвтилалорид: CH3<L__________ сн3-с*
Гс1 —► 'о + NaCl
Ацетат натрия'. сн3-соо~рта* CH’~C*q
уксусный ангидрид
Итак, мы познакомились с тремя методами получения ангидридов карбоновых кислот:
1) нагревание дикарбоновой кислоты;
2) реакция карбоновой кислоты с ангидридом другой кислоты;
3) реакция хлорангидрида с солью карбоновой кислоты. Какие исходные вещества необходимы для получения фталевого ангидрида по методу 1, бензойного ангидрида по методу 2, уксусного ангидрида по методу 3?
Проверьте ответ в рубрике 51.
Производные карбоновых кислот (II)
395
44. Вы назвали правильно только бензамид. Зная название кислоты, легко дать название соответствующего амида.
Вернитесь к рубрике 33.
45. ZC1
О-Сх С1
фосген
При реакции между этим соединением и аммиаком образуется мочевина-диамид угольной кислоты:
,С1
о-с + 2 NHS —» ... +
Cl
фосген аммиак мочевина • •
Завершите это уравнение и проверьте ответ в рубрике 53.
46. Неправильно. Терефталевая кислота не образует внутренний ангидрид.
Две карбоксильные группы находятся в пара-положении друг к другу и расстояние между ними оказывается слишком большим. Вы легко убедитесь в этом, если запишете структурную формулу терефталевой кислоты. Запишите также структурные формулы фталевой кислоты и фталевого ангидрида.
Проверьте ответ в рубрике 23.
47. Ваш ответ не вполне правилен.
Фумаровая кислота является транс-дикарбоновой кислотой
нс/Ц"н
н^'с-он U
о
и поэтому расстояние между двумя карбоксильными группами слишком велико, чтобы могло произойти образование внутреннего ангидрида.
Вернитесь к рубрике 31.
R-COO-NH/ R-с* + НО
нив \
NH1 аммонийная амид вода
соль Последнее уравнение и уравнение в рубрике 37 описывают обратимые реакции.
Запишите уравнения обратных реакций, т.е.
1) Нитрил -► Амид
2) Амид -> Аммонийная соль
Проверьте ответ в рубрике 57.
396
Программа 19
49. R-ON + HjO + NaOH —► R-COO-Na* + NH3 нитрил натриевая аммиак
саль (испаряется)
Свободная карбоновая кислота высвобождается из натриевой соли в результате ее обработки какой-либо неорганической кислотой
RCOONa + НС1 —► R-C + NaCl ОН Завершите теперь приведенную ниже схему получения карбонбвых кислот
ИЗ алкилгалогенидов: +NaCN H,0 *° +NaOH +HCI R-Hal » . . - R-C ► RCOONa ► - • • —NaHal \Н2 —NH3 алкил- натриевая еалогенид • • • • • • соль • • •
Проверьте ответ в рубрике 58.
50. Сложный эфир и карбоновая кислота.
Запишите уравнение получения этилацетата из уксусного ангидрида.
Проверьте ответ в рубрике 42.
нагрева кке
51. 1. Фталевая кислота------------» Фталевый ангидрид
2. Бензойная кислота + Уксусный ангидрид -► Бензойный ангидрид
3. Ацетилхлорид + Ацетат натрия -> Уксусный ангидрид
Вы уже знакомы с одной реакцией ангидридов карбоновых кислот: это их реакция с водой. Какой продукт образуется в этой реакции?
Проверьте ответ в рубрике 59.
52.
„о
CHj-C\ —- CHj-CsN + HjO
NH2
ацетамид ацетонитрил Soda
Эта реакция проводится путем нагревания смеси ацетамида и пентоксида фосфора. Образующийся ацетонитрил отделяется перегонкой.
Какую роль играет пентоксид фосфора Р2О5 в этой реакции?
(Обратите внимание на то, что Р2О5 является ангидридом фосфорной кислоты.)
• Р2О5 является катализатором -> 29
• Р2О5 является обезвоживающим веществом -» 38
• Не знаю -► 7
Производные карбоновых кислот (II)
397
53. NH,
О=С + 2 NH3 —► О-С^ + 2 НС1
'Cl NH,
фосген аммиан мочевина тлоро-
водород
Мочевина является продуктом обмена веществ и содержится в моче. Она осуществляет функцию удаления избытка азота из перевариваемой пищи (главным образом, белков). Человек выделяет около 30 г мочевины за день.
Мочевину используют как удобрение и для этой цели получают промышленным способом из СО2 и NH3 при повышенном давлении:
NH,
СО] + NH3 - * о-с + • • • \н,
Завершите это уравнение и укажите названия всех участвующих в нем соединений.
Проверьте ответ в рубрике 60.
54. HCN и CH3CN, действительно, являются нитрилами муравьиной
и уксусной кислот соответственно, но вы дадите их правильные названия, если еще раз внимательно прочтете рубрику 30.
55. Обратите внимание, что / моль Р2О5 реагирует с 3 молями Н2О
Р2О5 + ЗН2О - 2Н3РО4
Составьте уравнение получения ацетонитрила, исходя из 3 молей ацетамида и 1 моля Р2О5.
Проверьте ответ в рубрике 30.
56. CH3CN, действительно, ацетонитрил, а название «цианид» применимо к любой соли цианистоводородной кислоты HCN.
Вернитесь к рубрике 30.
J) R-C=N + HjO —► R-C* nh2 нитрил амид
р
2) R-C + HjO —► R-COO'NH^ NH2
амид нарбонсилат
аммония
Эти реакции иллюстрируют получение карбоновых кислот из нитрилов. Обе реакции обычно проводят как единый процесс, т.е. не выделяют амид, а сразу же гидролизуют его, превращая в карбоксилат.
398
Программа 19
Запишите общее уравнение гидролиза нитрила с образованием карбоксилата аммония.
Проверьте ответ в рубрике 41.
58. „ , +N.CN
R-Hal
алкил-галогвнид
= *н1° „ *° +n*°"
R-C=N ------► R-C, ----------
\н, *NH‘ амид
нитрил
RCOONa
R-Z
карбоксилат натрия
карвоновая кислота
Эти реакции
позволяют получать карбоновые кислоты из Обратите внимание, что при таком способе в углеродную цепь дополнительный атом углерода.
Конец программы 19.
алкилгалогенидов. вводится
59. Карбоновая кислота.
Ангидриды карбоновых кислот реагируют со спиртами и фенолами по уравнению
R-C'°
R./ %
R'-OH
,О
O-R'
~ Л
хон
ангидрид
спирт
Запишите названия образующихся продуктов. Проверьте ответ в рубрике 50.
60.
со,
2 NHj
NH, о=сг 4NH,
Н,О
диоксид углерода
аммиак
мочевина
вода
для получения некоторых синтетических полимеров.
Аммиак используется
На этом мы завершаем знакомство с амидами и переходим к обсуждению нитрилов карбоновых кислот.
Нитрил получается в результате отщепления воды от амида
R-C
R-C«N + HiO
амид
нитрил
Запишите аналогичным образом уравнение получения ацетонитрила из ацетамида. Укажите названия всех соединений, участвующих в этой реакции.
Проверьте ответ в рубрике 52.
Программа 20
Сульфоновые кислоты
1. Сульфоновые кислоты (или сульфокислоты) - это органические соединения, содержащие функциональную группу
—SO3H сульфоновая группа (или сульфогруппа)
в которой сера шестивалентна и связана с двумя атомами кислорода и группой
ОН. Запишите подробную структурную формулу для группы —SO3H
и проверьте ее в рубрике 10.
2. Проверьте ответ:
S*O + NHj ЧС1 бензалсульфо-хлорид
бензолсульфамид
+ НС1
Многие сульфамиды обладают бактерицидными свойствами и некоторые из них используются как лекарственные препараты (сульфамидные препараты).
Названия сульфохлоридов и сульфамидов легко образуются из названий соответствующих сульфокислот. Запишите названия следующих соединений:
Проверьте ответ в рубрике 12.
+ 2 нгО
бензойная кислота
20
бензонитрил
Таким образом, сульфокислоту можно в две стадии превратить в карбоновую кислоту
стадия t
стадия 2
СООН
Как проводится первая стадия этого процесса?
Нагреванием сульфокислоты с гидроксидом натрия -> 23
Нагреванием сульфокислоты с цианидом натрия -> 13
400
Программ? 20
Сульфоновые кислоты и их производные могут обозначаться таким образом, как это показано ниже для бензолсульфоната натрия
Производные сульфоновых кислот получаются такими же способами, как и производные карбоновых кислот. Так, хлориды сульфоновых кислот (сульфохлориды, или сульфонилхлориды) получаются замещением группы ОН на С1.
Запишите структурную формулу бензолсульфохлорида. Вычислите его молекулярную массу. (Необходимые для вычислений молекулярная масса бензолсульфокислоты = 158, атомная масса С1 = 35,5).
Какой результат получился у вас?
• 158 -> 21
• 176,5 - 14
• 193,5 -> 24
• Совсем иной -► 27
5. SOjNa CN
(^J) + NaCN — (^j) + NajSQ,
Эта реакция тоже проводится при повышенной температуре в расплаве. Как называется продукт этой реакции?
Бензойная кислота -t 19
Бензонитрил
15
Бензилцианид Не знаю
- 25
-> 31
6. Соединение
HjC-f VsOjH
представляет собой сульфоновую кислоту, производное толуола. Следовательно, его название: и-толуол... .
Завершите предложение и проверьте ответ в рубрике 16.
7. Правильно. Заместитель, уже имеющийся в ароматическом кольце, определяет положение другого, вновь вступающего заместителя.
В чем заключается действие ортолара-направляющего заместителя?
• Он направляет вновь вступающий заместитель только
в орто- и лара-положения -» 17
Он направляет вновь вступающий заместитель в любое положение ароматического кольца -» 33
Не знаю —> 26
8. Правильно.
При реакции толуола с 1 молем H2SO4 образуются о-и п-толуолсульфокислоты
и
SO1H
В качестве второго примера рассмотрим реакции между
а) 1 молем С12 и 1 молем бензолсульфокислоты;
б) 1 молем С12 и 1 молем толуола
В какое положение войдут атомы хлора?
В обоих случаях в орто- и пара-положения -> 40
В обоих случаях в .мета-положение -► 43
В случае а) в мета-положение и в случае б) в орто-и пара-положения -► 35
В случае а) в орто- и пара-положения, а в случае б) в мета-положение -► 49
1- нафталин-сульфонаслота
2-нафталин-сульфокислота
Ароматические сульфоновые кислоты получают в реакциях углеводородов с .... или .... Эта реакция называется ....
Завершите эти предложения и проверьте ответ в рубрике 29, а если вы нуждаетесь в предварительных разъяснениях, обратитесь в рубрику 20.
чон
Сульфоновые кислоты-это соединения общей формулы
R—SO3H
в которых алкцльная или арильная группа связана непосредственно с атомом серы.
Особо важное практическое значение имеют ароматические сульфоновые кислоты, которые к тому же легко получить. Так, бензолсульфокислота получается при обработке бензола концентрированной серной кислотой при комнатной температуре.
0 + ho-s*o —- ... + н,о
чон
бензол серная
кислота
Завершите это уравнение и проверьте ответ в рубрике 20.
26-29
Программа 20
11. Неправильно. Группа —СН3- орто,пара-направляющий заместитель. Вернитесь к рубрике 34.
о-толуолсульфо хлорид
и-толуолсульфамид
Завершите следующую таблицу:
Название Функциональная Свойства и применение группа (формула)
Сульфокислоты Кислотные/основные свойства? Растворимость в воде?
Сульфохлориды Сульфамиды Используются в синтезе ... Используется как
Проверьте ответ в рубрике 22.
13. Правильно. Сульфогруппа замещается на —CN-rpynny при сплавлении сульфокислоты или ее соли с цианидом натрия.
Познакомимся теперь с правилами замещения для ароматических соединений.
Если толуол и бензолсульфокислоту обрабатывать хлором, получатся продукты замещения:
В реакции а) атом хлора входит в орто-положение по отношению к метильной группе. В реакции б) атом хлора входит в мета-положение к сульфогруппе.
Эти примеры иллюстрируют общее явление: заместитель, уже имеющийся в ароматическом кольце, определяет положение нового заместителя. Он направляет новый заместитель либо в орто- и пара-положения, либо в мета-положение.
орто,пара-Направляющие заместители: алкильные группы, галогены и группа ОН.
мета-Направляющие заместители: сульфогруппа, карбоксильная и карбонильная группы.
Запишите по памяти названия и формулы важнейших
орто,пара^направляющих заместителей и мета-направляющих заместителей.
Проверьте ответ в рубрике 26.
.-•.H- I.v:
.111 I
14. Правильно. Молекулярная масса бензолсульфохлорида равна 176,5. Бензолсульфохлорид имеет структурную формулу
Сульфохлориды используются для получения сульфамидов. Последние являются аналогами амидов карбоновых кислот.
Завершите уравнение
NH3 —-
бензолеульфо -Флорид
+ НС1
бензолсульфамид
Проверьте ответ в рубрике 2.
15. Правильно. Соединение
это бензонитрил. Вы уже знаете, что его можно гидролизовать в бензойную кислоту.
Завершите уравнение
CN
I] + 2 НгО
+ NH3
Проверьте ответ в рубрике 3.
16.
Н9С
SOjH
п-талуолсульфо -кислота
Сульфоновые кислоты очень хорошо растворимы в воде. Кроме того, они являются сильными кислотами. Это позволяет получать соли сульфоновых кислот, которые называются сульфонаты.
Запишите структурную формулу бензолсульфоната натрия и n-толуолсульфоната калия.
Проверьте ответ в рубрике 4.
17. Правильно.
В чем заключается действие мета-направляющего заместителя?
Проверьте ответ в рубрике 34.
26*
f ipoi t:rwM3 20
18. SOjNa OH
Hjj + NaOH —’ [^j) + Na2SO3
Эту реакцию раньше использовали для промышленного получения фенола, но теперь этот процесс считается неэкономичным. Наиболее важный современный метод получения фенола-кумольный процесс, который был описан в программе 14. Его краткое описание повторно приведено в рубрике 28 настоящей программы.
При нагревании сульфонатов с цианидом натрия NaCN сульфогруппа замещается на группу CN, например
SOjNa
Г J + NaCN -►
Завершите это уравнение и проверьте ответ в рубрике 5.
19. Неправильно. Бензойная кислота-это карбоновая кислота формулы
СООН
Карбоновые кислоты и их производные подробно обсуждались в предыдущих программах. Вернитесь к рубрике 5.
20.
W4
бензол
+ но- s=o
'он серная кислота
S-O + Н2О 4 он
Этот процесс называется сульфирование.
Сульфирование обычно ускоряется при нагревании или при использовании олеума (раствор SO3 в концентрированной серной кислоте) вместо серной кислоты.
Названия сульфоновых кислот образуются путем добавления термина «сульфокислота» к названию соответствующего углеводорода.
Как называется сульфоновая кислота, полученная из бензола в соответствии с приведенным выше уравнением?
Проверьте ответ в рубрике 30.
21. Неправильно. Внимательнее вчитайтесь в поставленный вопрос и приведенные справочные данные.
Вернитесь к рубрике 4.
22. Проверьте ответ:
Название Функциональная группа Свойства и применение
Сульфокислоты -S=O или —SO3H 'он Сильные кислоты. Очень хорошая растворимость в воде
Сульфохлориды -s=o или “SOjCI ЧС1 Используются в синтезе сульфамидов
Сульфамиды -SO2NH2 xnh2 Используются как лекарственные препараты
Замещение сульфогруппы гидроксильной группой представляет собой важную реакцию, которая протекает при нагревании с избытком щелочи, например
+ NaOH
+ Na,SOj
Запишите названия каждого из продуктов, образующихся из натриевой соли бензолсульфокислоты.
Проверьте ответ в рубрике 32.
23. Неправильно. Сульфокислоты и их соли при сплавлении с гидроксидом . натрия превращаются в фенолы
+ NaOH
NajSOj
Чтобы заместить группу —SO3H на группу —CN, нужно проводить реакцию с.......
Завершите последнее предложение и проверьте ответ в рубрике 13.
24. Неправильно. Вы просто просуммировали молекулярную массу бензолсульфокислоты (158) и атомную массу хлора (35,5).
Запишите структурные формулы бензолсульфокислоты
и бензолсульфохлорида, и вы убедитесь в том, что ваш ответ неверен. Вычислите правильную молекулярную массу и переходите к рубрике 14.
25.
Неправильно. Бензилцианид-это соединение формулы
-это бензильный радикал.
Ранее мы познакомились со многими бензильными соединениями,
406
например
СН2С1
О
Вензил-хлорид
СН2ОН
бензиловый спирт
Вернитесь к рубрике 5.
26. орто, гшра-Направляющие алкил —R —Hal —ОН
заместители: галоген
гидроксил
jwema-Направляющие сульфогруппа —SO3H заместители: карбоксильная группа —СООН , 1 карбонильная группа С— О 1 Какой заместитель определяет результат реакции замещения? Заместитель, уже имеющийся в ароматическом кольце -» 7
• Вновь вступающий заместитель 36
• Не знаю -> 13
27. Неправильно. Запишите структурную формулу бензолсульфохлорида рядом с приведенной ниже формулой бензолсульфокислоты (мол. масса 158)
а заменив группу ОН на О. Чтобы получить молекулярную массу продукта, нужно вычесть массу группы ОН (17) и прибавить массу С1 (35,5). Запишите правильный результат и проверьте его в рубрике 14.
28. Сырье для кумольного процесса -кумол (изопропилбензол). Его окисляют до пероксида изопропилбензола. Последний расщепляется на фенол и ацетон:
н
HjC-C'CHj
н I ?
о
H.C-6-CHj
кумол
пероксид изо -пропилВензола
сренол ацетон
Вернитесь к рубрике 18.
Сульфоновые в ис.кп ы
407
29. серной кислотой или олеумом сульфирование
Запишите название соединения
Н3С
so,H
и проверьте ответ в рубрике 16, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 6.
30.
бензолсулыронислота
Существуют две разные нафталинсульфокислоты в зависимости от положения группы —SO3H, как показано ниже
положение 1
положение 2
Запишите структурные формулы этих двух нафталинсульфокислот. Проверьте ответ в рубрике 9.
31. Вы уже знаете, что названия нитрилов образуются от соответствующих карбоновых кислот, например
СН3СН2СООН СН3СН2—CN
пропионовая кислота пропионитрил
По аналогии образуйте название указанного ниже нитрила
бензойная кислота
Проверьте ответ в рубрике 15.
32. В реакции между бензолсульфонатом натрия и гидроксидом натрия образуются фенол и сульфит натрия.
Реакция проводится нагреванием смеси реагентов до ее расплавления (приблизительно при 300°С). Поэтому в данном случае принято говорить о «сплавлении со щелочью».
Запишите уравнение реакции между бензолсульфонатом натрия и гидроксидом натрия.
Проверьте ответ в рубрике 18.
33. Неправильно. Понимание правил замещения в ароматическом кольце очень важно, поэтому еще раз внимательно прочтите рубрику 13.
34. мета-Направляющий заместитель направляет вновь вступающий заместитель только в мета-положение.
мета-Направляющими заместителями являются главным образом ненасыщенные группы, например
-s«o 'он Л -С С»о он
сульфоеруппа карбоксильная карбонильная группа группа
Чтобы предсказать, какой продукт получится в реакции ароматического замещения, нужно ответить на следующие вопросы:
1) Какой заместитель уже имеется в исходном соединении?
2) Какое направляющее действие оказывает этот заместитель?
Рассмотрим такой пример.
1 моль толуола реагирует с 1 молем концентрированной H2SO4.
В результате образуется сульфокислота. В какое положение входит сульфогруппа?
• В орто-положение —> 44
• В мета-положение -► 11
• В пара-положение -» 51
• В орто- и пара-положения -> 8
35. Правильно. Группа —SO3H направляет вновь вступающий заместитель в мета-положение, а метильная группа-в орто- и пара-положения.
Следовательно, реакции протекают таким образом:
SO3H SO3H
и
С1
Сколько заместителей из указанных ниже являются орто, пара-направляющими?
—СООН, —С1, —Вг, —С2Н5
• Один -> 55
• Два -f 58
• Три -> 45
• Все четыре -► 62
36. Неправильно. Положение вновь вступающего заместителя определяется заместителем, уже присутствующим в ароматическом кольце.
Вернитесь к рубрике 13.
37. Как можно получить .м-хлорбензолсульфокислоту?
SOjH
Возможные пути ее синтеза таковы:
1) сначала введение группы —SO3H, а затем-атома О.
2) сначала введение атома О, а затем-группы —SO3H. Соответствующие реакции будут протекать так:
сульфирование
иморирова-ние
хлорирование
сульфирование
Ясно, что только первый путь синтеза приводит к желаемому продукту. Переходите к рубрике 48.
38. Проверьте ответ:
С1 хлорирование
сульфирование
Когда в ароматическом кольце имеются два заместителя, оба они оказывают направляющее влияние на вновь вступающий заместитель.
Следующее соединение содержит одновременно карбоксильную и гидроксильную группы:
С ООН
Куда должен вступить новый заместитель?
• В положения 2 и 3 —> 53
• В положения 3 и 5 —> 50
• В положения 5 и 6 —> 57
• В положения 2 и 6 —> 61
• Нуждаюсь в разъяснении —> 64
410
Программа 20
39.
Проверьте ответ:
>° HOS-O 'он
+ н2о
Эта реакция обратима. Следовательно, ее уравнение правильнее записывать при помощи двойной стрелки
fl + HjSO,
SOjH
+ Нг°
Какие продукты образуются при реакции между бензолсульфокислотой и водой?
Проверьте ответ в рубрике 52. (
40. Неправильно. Прочтите объяснение в рубрике 60.
41. Неправильно. Прочтите объяснение в рубрике 37.
42.
Na* или R-SOjNa
Алкилсульфонаты с 12-18 атомами углерода используются в качестве детергентов (моющих средств) и эмульгаторов.
Чтобы вспомнить, как получают эти соединения, завершите следующее уравнение:
Л
r___pj сульфохлорирование гидролиз ______gQ
алкан алкнлсульфохлорнд алкнлсулы$онат натрия
Проверьте ответ в рубрике 56.
43. Неправильно. Прочтите объяснение в рубрике 60.
44. Метильная группа является орто- и пара-направляющим заместителем. Следовательно, при сульфировании толуола группа SO3H должна входить как в орто-, так и в пара-положения.
Укажите формулы и названия двух образующихся соединений.
Проверьте ответ в рубрике 8.
45. Правильно. Только три из четырех названных заместителей являются орто,пара-направляющими. Это заместители
—С1, —Вг, —С2Н5
411
Сколько заместителей из указанных ниже являются .иета-направляющими?
-SO*H -СН, -ОН н н
• Один
• Два
• Три
• Четыре
• Все пять
-> 55
-> 58
-> 59
-> 62
-> 65
46. Сульфохлорирование проводится с помощью диоксида серы SO2 и хлора. Конец программы 20.
47. Неправильно. Прочтите объяснение в рубрике 37.
48. Правильно. Нужно сначала сульфировать бензол, а затем хлорировать продукт первой реакции.
сулырироИани^
хлорирование
Какие продукты получатся, если проводить эти реакции в обратной последовательности
хлорирование
сульфироВание
Проверьте ответ в рубрике 38.
49. Неправильно. Сульфогруппа -.иета-направляющий заместитель, поэтому реакция между бензолсульфокислотой и хлором приводит к образованию м-хлорбензол сульфокислоты.
В отличие от этого метильная группа является орто,пара-направляющим заместителем. Следовательно, реакция между толуолом и хлором приводит к образованию о- и п-хлортолуола.
Запишите структурные формулы всех трех продуктов указанных выше реакций.
Проверьте ответ в рубрике 35.
50. Правильно. Новый заместитель должен входить в положения 3 и 5 ^доон
он
Эти положения являются орто-положениями по отношению к гидроксильной группе и .иета-положением по отношению к карбоксильной группе.
UpoipuviMit 20
Следовательно, в данном примере направляющие эффекты двух заместителей усиливают друг друга.
Дело обстоит, однако, по-иному в следующем соединении:
ООН
Введение третьего заместителя приведет в этом случае к образованию смеси продуктов, поскольку гидроксильная группа направляет заместитель в положения, указанные пунктирными стрелками, а карбоксильная группа-в положение, указанное сплошной стрелкой: заместители действуют несогласованно.
На этом мы заканчиваем знакомство с правилами замещения.
Завершите теперь следующее уравнение реакции:
j + HO-S«O 'он
+ н2о
Проверьте ответ в рубрике 39.
51. Неправильно. Метильная группа о,n-направляющий заместитель. Что же представляют собой два продукта, образующиеся при сульфировании толуола?
Запишите их формулы и названия.
Проверьте ответ в рубрике 8.
52. Реакция между бензолсульфокислотой и водой приводит к образованию бензола и серной кислоты
Удаление сульфогруппы осуществляется продолжительным кипячением с водой.
Какие продукты образуются при кипячении и-толуолсульфокислоты с водой?
Проверьте ответ в рубрике 63.
53. Неправильно. Прочтите объяснение в рубрике 64.
54.
R-H + SO, + Cl, —► R-S“O + HC1
Эта реакция называется сульфохлорирование.
В присутствии гидроксида натрия сульфохлорид гидролизуется, образуя соль сульфокислоты.
Запишите формулу этой соли.
Проверьте ответ в рубрике 42.
С У 1>>Ф<>1«1ВЫС КИГ.’Х) >
55. Неправильно. Проработайте еще раз материал, начиная с рубрики 26.
56.
R-H
сулырохлори-рование
fl гидролиз
R-S-O —---------►
ЧС1
#О
R-S-O
ЧО
Na*
алкал
алкилсульфо-хлорид
алкил -сульфонат натрия
Какие реагенты используются при сульфо хлорировании? Запишите названия двух реагентов, необходимых для этого. Проверьте ответ в рубрике 46.
57. Неправильно. Прочтите объяснение в рубрике 64.
58. Неправильно. Проработайте еще раз материал, начиная с рубрики 26.
59. Правильно. Только три из пяти названных заместителей являются .мето-направляющими:
Знание правил замещения необходимо для получения индивидуальных ароматических соединений. Рассмотрим в качестве примера получение из бензола м-хлорбензолсул ъфокислоты
В каком порядке следует вводить необходимые заместители?
Сначала О, а затем SO3H -> 41
Сначала SO3H, а затем О -> 48
В любой последовательности -» 47
Не знаю -> 37
б) толуола
При хлорировании
а) бензолсульфокислоты
характер замещения неодинаков, поскольку в случае а) уже имеющийся
в соединении заместитель (SO3H) является .мета-направляющим, а в случае б) заместитель (СН3) является орто.иара-направляющим. Попытайтесь теперь еще раз ответить на вопрос, поставленный в рубрике 8.
JU
61. Неправильно. Прочтите объяснение в рубрике 64.
62. Неправильно. Проработайте еще раз материал, начиная с рубрики 26.
63. При кипячении смеси n-толуолсульфокислоты с водой образуются толуол и серная кислота.
До сих пор мы занимались только ароматическими сульфокислотами, поскольку они получаются легче алифатических. При реакции между каким-либо алканом и серной кислотой обычно образуется трудно разделимая смесь продуктов.
Однако реакция между высшими алканами, SO2 и С12 приводит к введению в органическую молекулу сульфохлоридной группы
-s,= o
ХС1
Побочным продуктом этой реакции является НС1
r—н + so2 + ci2 -> ... + на
алкан алкилсульфохлорид
Завершите это уравнение и проверьте ответ в рубрике 54.
64. В соединении
С сюн
ф
он
имеются два различных заместителя.
Карбоксильная группа -.иета-направляющий заместитель, т. е. новый заместитель должен входить в положение 3 или 5.
Гидроксильная группа - орто,пара-направляющий заместитель, т. е. новый заместитель должен входить в положение 3, 5 или 1. Однако, поскольку положение 1 уже занято карбоксильной группой, для вновь входящего заместителя доступны только положения 3 и 5.
Таким образом, направляющие эффекты двух заместителей в данном случае усиливают друг друга*.
Переходите к рубрике 50.
65. Неправильно. Проработайте еще раз материал, начиная с рубрики 26.
Такую ориентацию называют согласованная-Прим. ред.
Программа 21
Органические соединения азота (I)
1. Вы уже познакомились с некоторыми органическими соединениями азота, как, например, амиды карбоновых и сульфоновых кислот. Продолжим дальнейшее обсуждение, начав с нитрогруппы
Р
-N или -NOa
*О
Органические соединения, содержащие нитрогруппу, называются нитросоединения. Названия индивидуальных соединений этого класса образуются присоединением приставки нитро- к названию соответствующего углеводорода. Например, соединение СН3—NO2 называется нитрометан.
Назовите следующие соединения:
NOj
CjHj-NO, и (^J|
Проверьте ответ в рубрике 12.
2. Положение каждой функциональной группы должно быть указано числом. Дальнейшие разъяснения смотрите в рубрике 15.
3. Подобно толуолу, фенол нитруется очень легко.
При нитровании избытком азотной кислоты в толуол вводятся три нитрогруппы. Сколько нитрогрупп вводится в фенол при его нитровании?
Вернитесь к рубрике 34.
4. Вы неправильно сбалансировали уравнение R—NO2 + ...Н2 -> R—NH2 + 2Н2О
Подсчитайте число атомов водорода в правой части уравнения и попытайтесь еще раз ответить на вопрос, поставленный в рубрике 19.
21
5. Неправильно. Прочтите объяснение в рубрике 15.
6. Вы неправильно сбалансировали уравнение
R—NO2 + ...Н2 - R—NH2 + 2Н2О
Подсчитайте число атомов водорода в правой части уравнения и попытайтесь еще раз ответить на вопрос, поставленный в рубрике 19.
7. Подобно толуолу, фенол нитруется очень легко.
При нитровании толуола избытком азотной кислоты в него вводятся три нитрогруппы. Сколько нитрогрупп вводится в фенол при его нитровании?
Вернитесь к рубрике 34.
8. Неправильно. Прочтите объяснение в рубрике 15.
2,4,6- тринцтросренол
Это соединение называется также пикриновая кислота (от греческого пикрос- горький) за свой вкус и кислотность. Напомним, что фенолы обычно проявляют слабые кислотные свойства. Однако наличие трех нитрогрупп в пикриновой кислоте сильно повышает ее кислотность.
Рассмотренный пример показывает, что функциональные группы в молекуле могут оказывать друг на друга взаимное влияние. Это следует всегда иметь в виду, имея дело со сложными соединениями.
Итак, какое соединение является более сильной кислотой, фенол или тринитрофенол?
Проверьте ответ в рубрике 20.
10. Смесь азотной и концентрированной серной кислот, известная под названием нитрующая смесь.
В уравнениях реакций нитрования нет необходимости указывать серную кислоту, поскольку она служит только для связывания воды *. Спишите следующее уравнение и укажите под каждым соединением его название:
NO,
+ HNO,
I] + н,о
бензол
Проверьте ответ в рубрике 21.
11. Реакция 1 моля толуола с 1 молем азотной кислоты приводит к образованию о- и n-толуола, потому что метильная группа является орто,пара-направляющим заместителем.
$,Л Реакция толуола с избытком азотной кислоты приводит к образованию
тринитротолуола.
Запишите структурную формулу этого соединения и проверьте ее в рубрике 25, а если вы затрудняетесь записать формулу, обратитесь за дополнительными разъяснениями в рубрику 36.
12.
NO,
CjHj-NO,
нитробензол
нитроэтан нитробензол
Наибольшее значение имеют ароматические нитросоединения; их легко
* В настоящее время известно, что роль серной кислоты иная. См., например: Моррисон Р., Бойд Р., Органическая химия.-Пер. с англ.: М., Мир, 1974, с. 338. -Прим. ред.
получить реакцией исходного ароматического вещества с азотной кислотой. Этот процесс называется нитрование.
Завершите уравнение реакции
бензол азотная нитробензол кислота
Проверьте ответ в рубрике 23.
13. Неправильно. Прочтите объяснение в рубрике 22.
14. Название соединения Общая формула
Аммиак NH3
Первичный амин r-nh2
Вторичный амин >н
Третичный амин r>n"r
В указанных выше соединениях углеводородные остатки R могут быть как одинаковыми, так и различными.
Названия аминов образуются от соответствующих углеводородных радикалов с присоединением суффикса -амин. Так, соединение
СН3—NH2 называется метиламин.
Какого типа амином является метиламин?
• Первичный амин -> 28
• Вторичный амин -» 42
• Третичный амин -» 46
15. Положение заместителей в ароматическом кольце указывают соответствующими номерами:
Считается, что в тринитротолуоле метильная группа занимает положение 1:
NO2
Запишите теперь полное название этого соединения. Проверьте ответ в рубрике 34.
27-29
1
16. Неправильно. Прочтите объяснение в рубрике 22.
17. Диметиламин
снк [ нэсч
NH ила 1 сн/ \ н3с
Сокращенная формула диметиламина (CH3)2NH или HN(CH3)2.
Триметиламин получается из аммиака замещением трех атомов водорода метильными группами: сн. н3сх
СН3—N или HjC-N или (CHj)jN или N(CH3)3 сн/ НЭС
Вторичные и третичные амины могут включать неодинаковые углеводородные остатки. В качестве примера таких соединений укажем метил этилами н, диметилэтиламин и мети лдиэти л амин.
Запишите структурные формулы этих трех соединений. Проверьте ответ в рубрике 29.
18. Правильно.
До сих пор мы имели дело только с алифатическими аминами. Простейший ароматический амин-это анилин
NH]
анилин
Хотя это соединение могло бы называться фениламин, обычно пользуются его тривиальным названием - анилин.
Запишите формулу соединения, образованного замещением одного из атомов в группе NH2 анилина на метильную группу. Это соединение называется метиланилин.
’' Проверьте ответ в рубрике 47.
19.
С ООН
Нитросоединения нерастворимы или плохо растворимы в воде.
Важнейшей химической реакцией нитросоединений является их восстановление с превращением в амины. Это восстановление может проводиться различными восстановителями, .включая водород. Восстановление при помощи водорода называется также гидрирование.
Образование амина происходит по уравнению
R—NO2 + ...Н2 -> R—NH2 + 2Н2О
Opi aiui'KCKHc соединении a i > i;i (I)
Сколько молей нитросоединения ? • 1 -> • 2 -> • 3 • 4 • Не знаю -н водорода расходуется в расчете на 1 моль 4 6 > 30 > 33 • 38
20. Тринитрофенол-гораздо более сильная кислота, чем сам фенол: три нитрогруппы усиливают кислотность группы ОН.
Бензойная кислота тоже нитруется азотной кислотой. В какое положение ароматического кольца вводится при этом нитрогруппа?
• В орто-положение —► 37
• В .мета-положение —► 32
• В пара-положение —» 40
• В орто- и пара-положения —► 43
• Не знаю —► 48
21. NO,
О 4 HNO, — ф * н1°
Бензол азотная нитро- Вода
кислота бензол
Эта реакция проводится в промышленных условиях.
Аналогичным образом нитруются и другие ароматические соединения. Что является продуктом реакции 1 моля толуола с 1 молем HNO3?
• о-Нитротолуол —► 31
• .и-Нитротолуол —► 35
• п-Нитротолуол —► 39
• Смесь о- и п-толуола —► И
• Не знаю —► 45
22. Реакция между фенолом и избытком азотной кислоты приводит
к введению трех нитрогрупп в орто- и пара-положения относительно ОН-групп
t
Образующийся продукт представляет собой тринитрофенол, точнее 2,4,6-тринитрофенол.
Запишите формулу этого соединения и проверьте ее в рубрике 9.
27*
23. Побочным продуктом нитрования является вода. Образование воды приводит к разбавлению используемой азотной кислоты, и, если не добавить в реакционную смесь концентрированную серную кислоту, реакция останавливается.
Что же, следовательно, представляет собой реагент, используемый для нитрования?
Проверьте ответ в рубрике 10.
24. Правильно. Реакция между фенолом и избытком азотной кислоты дает тринитрофенол, точнее 2,4,6-тринитрофенол.
Запишите структурную формулу этого соединения.
Проверьте ответ в рубрике 9.
25. ?н,
NO,
тринитротолуол
Это название не вполне точное. Как правильно назвать данное соединение?
• Тринитротолуол -> 2
• 1,2,3-Тринитротолуол -> 5
• 2,4,6-Тринитротолуол -> 34
• 1,3,5-Тринитротолуол -> 8
• Нуждаюсь в разъяснениях -> 15
26. Правильно. Существуют четыре изомерных метиланилина. Три из них имеют метильную группу, присоединенную к ароматическому кольцу; четвертый представляет собой N-метиланилин.
Запишите структурные формулы всех четырех изомеров.
Проверьте ответ в рубрике 50.
27. \
N-R
RZ
третичный амин
Завершите следующую таблицу.
Название соединения Общая формула
Аммиак NH3
Первичный амин
Вторичный амин
амин
Проверьте ответ в рубрике 14, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 41.
28. Правильно. Метиламин СН3—NH2 представляет собой первичный амин.
Диметиламин-это вторичный амин; его можно рассматривать как продукт замещения двух атомов водорода в NH3 на метильные группы.
Запишите структурную формулу диметиламина.
Проверьте ответ в рубрике 17.
29. НЭСЧ
Метилэтиламин: NH
С2Н5"
Н3СЧ
Диметилэтиламин: H3C-N
С2Н/
НЭСЧ
Метилдиэтиламин: C2h5-N
С2Н5'
Если вы сделали при записи этих формул какие-либо ошибки, вернитесь к рубрике 41. Если вы не сделали ошибок, то, несомненно, сможете ответить: первичными, вторичными или третичными являются следующие амины:
Метилэтиламин Диметилэтиламин Метилдиэтиламин
• первичный вторичный третичный -* 44
• вторичный вторичный вторичный -> 49
• вторичный третичный третичный -> 18
• третичный • Не знаю третичный третичный -> 53 -> 55
30. Правильно. Восстановление группы NO2 в группу NH2 требует трех молей водорода.
Запишите общее уравнение восстановления нитросоединений R—NO2 водородом. Проверьте ответ в рубрике 41, а если вы нуждаетесь в предварительных пояснениях, обратитесь к рубрике 19.
31. Метильная группа-орто,napa-направляюший заместитель. Следовательно, при нитровании толуола образуются два соединения.
Какие именно соединения образуются при этом?
Проверьте ответ в рубрике 11.
32. Правильно. Нитрование бензойной кислоты дает л«-нитробензойную кислоту.
Запишите структурную формулу продукта этой реакции
Проверьте ответ в рубрике 19.
1
Пртрамма 21
33. Подсчитайте число атомов водорода в правой части уравнения
R—NO2 + ...Н2 -> R—NH2 + 2Н2О
Сколько молей водорода должно содержаться в левой части уравнения, чтобы обеспечить это число атомов водорода в правой части?
Вернитесь к рубрике 19.
34. Три нитрогруппы находятся в положениях 2, 4 и 6, следовательно, соединение
NO,
называется 2,4,6-тринитротолуол.
Это соединение, обозначаемое как ТНТ, тротил или тол, используется в качестве взрывчатого вещества. Взрывная сила атомного оружия выражается в «тоннах ТНТ».
Фенол тоже лргко нитруется азотной кислотой. Сколько нитрогрупп должно войти в молекулу фенола при его нитровании избытком азотной кислоты?
• Одна -► 3
• Две 7
• Три - 24
35. Неправильно. Прочтите объяснение в рубрике 45.
36. Нитрование толуола избытком азотной кислоты приводит к введению трех нитрогрупп в орто- и пара-положения относительно метильной группы:
СНЭ
1
Запишите теперь структурную формулу образующегося тринитротолуола.
Проверьте ответ в рубрике 25.
37. Неправильно. Прочтите объяснение в рубрике 48.
38. Подсчитайте число атомов водорода в правой части уравнения
R—NO2 + ...Н2 - R—NH2 + 2Н2О
Сколько молей водорода должно содержаться в левой части уравнения, чтобы обеспечить это число атомов водорода в правой части?
Вернитесь к рубрике 19.
39. Метильная группа-орто,пара-направляющий заместитель. Следовательно, при нитровании толуола образуются два соединения.
Какие именно соединения образуются при этом?
Проверьте ответ в рубрике 11.
40. Неправильно. Прочтите объяснение в рубрике 48.
41. R—NO2 + ЗН2 -> R—NH2 + 2Н2О
Соединения R—NH2, содержащие аминогруппу, называются амины.
Амины можно формально рассматривать как производные аммиака, полученные из него замещением одного или нескольких атомов водорода на углеводородные остатки
NH3 R—NH2
аммиак первичный амии
Соединения R—NH2, формально рассматриваемые как продукт замещения одного атома водорода в аммиаке, называются первичные амины.
Соединения вида
NH R
формально рассматриваемые как продукт замещения двух атомов водорода в аммиаке, называются вторичные амины.
При замещении всех трех атомов водорода в аммиаке получаются третичные амины.
Запишите общую формулу третичных аминов.
Проверьте ответ в рубрике 27.
42. Общие формулы для первичных, вторичных и третичных аминов были указаны в рубрике 14. Сравните эти формулы с формулой метиламина, и вы сможете правильно ответить на вопрос, поставленный в рубрике 14.
43. Неправильно. Прочтите объяснение в рубрике 48.
44. Существуют первичные, вторичные и третичные амины. Первичные амины имеют общую формулу R—NH2, т.е. могут рассматриваться как продукты замещения в аммиаке только одного атома водорода на углеводородный остаток. Соединения, указанные в рубрике 29, не подходят под это определение. Вернитесь к рубрике 29.
45. Метильная группа направляет вновь .вступающий заместитель в орто-и пара-положения. Другими словами, положение вновь вступающего заместителя определяется уже присутствующим в соединении заместителем.
Какие же, следовательно, два соединения образуются при нитровании толуола?
Проверьте ответ в рубрике 11.
46. Общие формулы для первичных, вторичных и третичных аминов были указаны в рубрике 14. Сравните эти формулы с формулой метиламина, и вы сможете правильно ответить на вопрос, поставленный в рубрике 14.
NHCHj
47. h-.n„ch3
или
метиланилин
Поскольку существует несколько различных метиланилинов, это соединение правильно называть N-метиланилин. Стоящая впереди буква N указывает, что метильная группа находится у атома азота. Другие, изомерные метиланилины получаются при расположении метильной группы у атомов углерода ароматического кольца. Сколько существует изомерных метиланилинов (включая N-метиланилин)?
• Два —> 58
• Три —> 63
• Четыре —► 26
• Пять —> 67
• Не знаю —> 70
48. Карбоксильная группа является мета-направляющим заместителем. Следовательно, нитрование бензойной кислоты
соон
приводит к образованию м-нитросоединения.
Запишите структурную формулу этого соединения.
Проверьте ответ в рубрике 19.
49. Неправильно. Три указанных амина имеют неодинаковое число алкильных остатков.
Вернитесь к рубрике 29.
50. Четыре изомерных метиланилина имеют следующие структурные формулы:
NH(CHj)
СНэ
Три из этих соединений, метилированные в кольце, имеют свои тривиальные названия: они называются соответственно о-, м- и и-толуидин.
Вы уже знаете, что положения заместителей может указываться также числами вместо символов о-, м- и п-.
Запишите соответствующие названия трех толуидинов и проверьте ответ в рубрике 88. (Если вы нуждаетесь в предварительных разъяснениях, обратитесь в рубрику 72.)
51.
Бензол
нитрование
нитробензол анилин
Для восстановления нитробензола в анилин в химической промышленности используют два метода:
1) восстановление газообразным водородом в присутствии катализатора;
2) восстановление водородом в момент выделения при реакции железа с соляной кислотой.
В качестве побочных продуктов во второй из этих реакций образуются оксиды железа. В зависимости от условий проведения реакции они могут иметь желтую, коричневую, красную или черную окраску и используются в качестве пигментов. Пигменты-это нерастворимые соединения, используемые в качестве красителей при изготовлении красок, синтетических материалов, бетона и т. п.
Как получается водород в момент выделения?
Из ... и .....
Что является побочным продуктом этой реакции?
Проверьте ответы в рубрике 64.
52. CH3I + NH3 -> CH3 NH2 + HI метилиодид . метиламин
Эта реакция, однако, отнюдь не так проста, как записано в приведенном здесь уравнении. Часть алкиламина реагирует с алкилгалогенидом, образуя в качестве побочных продуктов вторичные и третичные амины.
Какие побочные продукты могут образовываться в реакции между метилиодидом и аммиаком? Запишите их структурные формулы и проверьте ответ в рубрике 71, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 81.
53. Неправильно. Три указанных амина содержат не одинаковое число алкильных остатков.
Вернитесь к рубрике 29.
54.
+ 2 СНэВг
+ 2 НВг
Это уравнение описывает реакцию метилирования; в данном примере метилируется анилин. Метилирование представляет собой частный случай реакции алкилирования. Используя различные алкилгалогениды и амины, можно проводить аналогичные реакции N-алкилирования.
Существует иной способ получения первичных аминов, не приводящий к образованию в качестве побочных продуктов вторичных или третичных аминов. Он основан на реакции, которая называется расщеплением амидов по Гофману. В результате этой довольно сложной реакции происходив превращение амида карбоновой кислоты в первичный амин:
О
R-C* —► R-NH,
NH,
Эта реакция называется расщепление, потому что ее продукт содержит на один атом углерода меньше, чем исходное соединение.
Не входя в рассмотрение механизма данной реакции, познакомимся с двумя примерами ее применения.
Какие амины образуются в реакции расщепления по Гофману а) ацетамида и б) пропионамида?
Проверьте ответ в рубрике 74.
55. Существуют первичные, вторичные и третичные амины.
Общие формулы соединений этих типов приведены в рубрике 14.
56. Правильно. Восстановление (гидрирование) нитросоединений приводит к образованию первичных аминов
R-NO2 + ЗН2 -> R—NH2 + 2Н2О
Какого типа амины обычно получают этим способом?
• Алифатические амины -> 80
• Ароматические амины -> 68
57.
C,Hj CHi 'n сан/ C,Hj
СГ
хлорид метилтризтил-аммония
Назовите следующее соединение:
HjCs СанЛ* N h3cz СаН»
С1“
Проверьте ответ в рубрике 69.
58. Неправильно. Прочтите объяснение в рубрике 70.
Opi :1НИчсскиг соединения Hnn (i>
427
59. Н3С4 СНз
N, N - димвтиланилин
Существуют не только тризамещенные, но и четырехзамещенные амины. Последние называются четвертичные аммониевые соли.
Вы уже знакомы с одним неорганическим аммониевым соединением-это хлорид аммония (см. часть Г учебника):
NH3 + НС1 - NH4C1
Структурную формулу NH4C1 можно записать следующим образом:
СГ
Четвертичные аммониевые соли представляют собой тетраалкил (или арил)производные иона аммония
СГ
Запишите формулу соответствующего соединения, в котором R = СН3.
Проверьте ответ в рубрике 73.
60. Правильно, органическое нитросоединение не реагирует с разбавленными водными растворами кислот; наличие кислоты не придает такому соединению и растворимость.
А что должно произойти при взаимодействии с кислотой неизвестного соединения, если предположить, что оно представляет собой амин?
• Это соединение растворится -> 77
• Ничего не произойдет -> 85
61. Вопрос относился к названию продукта, а не исходного соединения. Вернитесь к рубрике 84.
62. Правильно. Метильная группа является орто,идрд-направляющим заместителем, поэтому нитрование толуола не приводит к образованию м-нитротолуола. Следовательно, дальнейшее восстановление продуктов нитрования не позволяет получить м-толуидин.
Рассмотрим теперь получение алифатических аминов. Их получают алкилированием аммиака в реакции с алкилгалогенидами, например
С2Н5Вг + NH3 - С2Н5—NH2 + НВг
Запишите аналогичное уравнение для реакции аммиака с метилиодидом. Проверьте результат в рубрике 52.
63. Неправильно. Существуют три разных замещенных в кольце метиланилина (в которых метильная группа связана с атомом углерода). Кроме того, имеется и четвертое соединение, в котором метильная группа связана с атомом азота.
Таким образом, существуют всего четыре метиланилина.
Запишите их структурные формулы и проверьте ответ в рубрике 50.
64. Водород в момент выделения получают из железа и соляной кислоты. Побочными продуктами реакции являются оксиды железа. Последние могут иметь желтую, коричневую, красную или черную окраску и используются при изготовлении красок, синтетических материалов или бетона.
Как называются такие красители?
Проверьте ответ в рубрике 76.
65. Правильно. Соединение
V нэсх \
сг
называется хлорид диметиламмония.
Запишите структурную формулу бромида тетраметиламмония.
Проверьте ответ в рубрике 89.
66. Реакция аммониевых солей с основаниями известна из неорганической химии. Приведем такой пример:
СГ + NaOH —► NHj + NaCl + НаО
Хлорид триметиламмония вступает в аналогичную реакцию с гидроксидом натрия, образуя триметиламин
н,с снэ л
HSC н
СГ + NaOH
Завершите это уравнение. Проверьте ответ в рубрике 92.
67. Неправильно. Прочтите объяснение в рубрике 70.
68. Правильно.
Восстановление нитросоединений имеет важное значение для получения ароматических аминов.
Таким способом получают анилин: процесс начинают с нитрования бензола, а продукт этой реакции затем восстанавливают.
нитрование
Бензол
восстановление
нитробензол
анилин
Завершите это уравнение и проверьте ответ в рубрике 51.
69. Хлорид диметилдиэтиламмония.
Во всех приведенных выше примерах роль противоиона играет хлорид-ион. Известны также бромиды, иодиды и сульфаты четвертичного аммония. Их названия образуются таким же образом, как это было показано на примере хлоридов.
Обратимся теперь к получению аминов.
Мы уже знакомы с восстановлением (гидрированием) нитросоединений R—NO2.
Какие амины можно получать таким способом?
• Первичные, вторичные и третичные —> 79
• Только первичные —> 56
• Только вторичные —► 83
• Только третичные —► 86
• Не знаю —> 91
70. В тех случаях, когда в ароматическом кольце есть два заместителя, должно существовать три изомерных соединения.
Из программы 9 вы уже знаете о трех ксилолах:
снэ
о-нсилол м-нсилол
п-нсилол
Точно так же существуют три изомерных бензола, несущие метильную группу и аминогруппу. Однако нам уже известно, что существует и четвертое изомерное соединение, в котором бензольное кольцо имеет метилзамещенную аминогруппу:
HNCH,
Следовательно, существуют всего четыре изомерных метиланилина. Запишите структурные формулы всех этих четырех метиланилинов. Проверьте ответ в рубрике 50.
71. Диметиламин и триметиламин
нэс нэс
'nh n-ch,
н3с< н3сг
являются побочными продуктами в реакции между аммиаком и
4311
11 poi pa м.1 21
метилиодидом
CH3I + NH3 -► CH3—NH + HI
Поскольку смесь образующихся первичного, вторичного и третичного аминов трудно поддается разделению, реакция между аммиаком и алкилгалогенидами не представляет большого интереса для получения первичных алкиламинов.
Однако, если реакция с аммиаком проводится до полного завершения, она дает хороший выход третичных аминов. В качестве примера укажем реакцию между 1 молем NH3 и 3 молями метилбромида, дающую триметиламин. Аналогичным образом анилин реагирует с 2 молями метилбромида, образуя Ы,М-диметиланилин.
Запишите уравнение последней реакции. Проверьте ответ в рубрике 54.
72. По правилам систематической номенклатуры атомы углерода в бензольном кольце нумеруются от 1 до 6:
и положения заместителей тоже указываются числами, например
1,2 - толуидин
(или о-толуидин)
Укажите соответствующие названия для м- и n-толуидина и запишите структурные формулы этих соединений.
Проверьте ответ в рубрике 88.
73.
HjCs zch3 N h3cz \:н3
Ci-
Это соединение называется хлорид тетраметиламмония.
Запишите структурную формулу хлорида метилтриэтиламмония.
Проверьте ответ в рубрике 57.
74. сн3-сх —► ch3-nh2
NH2
ацетамид метиламин
С2Н5-С* —► CjHj-NHj
nh2
пропионамид этиламин
Как называется эта реакция? Проверьте ответ в рубрике 84.
Если вы забыли ее название, вернитесь к рубрике 54.
75.
NH(CH3)
N-метил-n - толуидин
Это соединение представляет собой вторичный амин. Соединение
НЭС^СН3
представляет собой третичный амин. Оно называется диметил-и-толуидин, или точнее N,N-диметил-и-толуидин (N,N потому, что обе метильные группы находятся при атоме N).
Запишите структурную формулу N.N-диметиланилина и проверьте ответ в рубрике 59.
76. Пигменты.
Толуидины-это ароматические амины. Некоторые из них получают из толуола нитрованием с последующим восстановлением. Однако один из толуидинов нельзя получить таким способом. Какой это толуидин?
• о-Толуидин -> 87
• м-Толуидин -> 62
• n-Толуидин -> 90
• Не знаю -> 95
(Указание. Чтобы ответить на этот вопрос, нужно рассмотреть соединения, образуемые при нитровании толуола.)
77. Правильно. Амины растворяются в форме солей в разбавленных водных растворах кислот.
Итак, мы познакомились с тем, как можно отличать амины от нитросоединений. Другие химические свойства аминов обсуждаются в следующей программе.
Конец программы 21.
78.
H,CS CHj
V Hj</ schs
Теперь вы знаете, что амины образуют аммониевые соли. Следовательно, некоторые из приведенных выше уравнений, описывающих алкилирование аминов, были неполными: например, свободный амин не может существовать
в присутствии НС1, как это было записано в уравнении
Н,сч HjC
NH + CHjCl —► \-CHi + НС1
Н,С' HjC
а вместо этого образуется соль триметиламмония
HjCs Н3С СН,
NH + СН,С1 —» N
H3CZ Н3с/ hi
Cl’
Свободные амины можно выделить из их солей подщелачиванием, например добавлением NaOH. При этом из хлорида триметиламмония получаются триметиламин и хлорид натрия.
Запишите уравнение этой реакции нейтрализации и проверьте ваш результат в рубрике 92, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 66.
79. Неправильно. Прочтите объяснение в рубрике 91.
80. Неправильно. Исходные алифатические нитросоединения получать трудно. Поэтому восстановление нитросоединений мало используется для получения алифатических аминов.
Это восстановление имеет важное значение для получения ... аминов. Завершите это предложение и проверьте ответ в рубрике 68.
81. Первоначальная реакция между аммиаком и метилиодидом может быть записана следующим образом:
СН3—I + NH3 -> СН3—NH2 + HI
В качестве побочного продукта этой реакции образуется диметиламин, поскольку часть метиламина вступает в дальнейшую реакцию с метилиодидом
н,с
CHj-NHj + CHjI —► SNH + HI
Н3с'
Диметиламин может вступать в дальнейшую реакцию, образуя триметиламин.
Следовательно, в рассматриваемом процессе образуется два побочных продукта-диметиламин и триметиламин.
Запищите формулы этих двух побочных продуктов.
Проверьте ответ в рубрике 71.
82.
анилин
Анилин - жидкость с температурой кипения около 200°С. Он мало растворим в воде.
Ароматические амины-важные промежуточные вещества в химической промышленности. Они используются, например, в синтезе красителей.
Рассмотрим теперь метод, позволяющий отличать нитросоединения от аминов.
Допустим, что вы имеете неизвестное жидкое органическое соединение. Вам известно лишь, что оно является чистым соединением, содержит азот и нерастворимо в воде.
Смешайте это соединение с разбавленным водным раствором соляной кислоты. Что должно произойти, если неизвестное вещество является нитросоединением ?
• Вещество растворится -> 93
• Ничего не произойдет -» 60
83. Неправильно. Прочтите объяснение в рубрике 91.
84. Расщепление амидов по Гофману о
R-Cx -* R-NH2
xnh2
Эта реакция называется расщепление, потому что ее продукт имеет на один атом углерода меньше, чем исходное соединение.
Познакомимся теперь с химическими свойствами аминов.
При взаимодействии с кислотами амины образуют соли. Подобно аммиаку, все амины-основания. Для них типичны следующие реакции:
н \-н
н
+ НС1 —•>
аммиак хлорид аммония
НЭС
N-H + НС1 —► н2с/
Н2СЧ /И
Nx н3с' н
сг
диметилами н
Укажите название продукта последней реакции.
Диметиламин -> 61
Хлорид диметиламмония -> 65
Хлорид метиламмония -► 94
85. Неправильно. Амины являются основаниями и при взаимодействии с кислотами образуют соли. Следовательно, амин, который сам по себе нерастворим в воде, должен растворяться в водном растворе кислоты, образуя в этом растворе соль.
Переходите к рубрике 77.
86. Неправильно. Прочтите объяснение в рубрике 91.
87. Неправильно. Прочтите объяснение в рубрике 95.
28-29
434
Программа 21
88.
о-толуидин м-толуидин п-толуидин
(или 1,2-толуидин) (или 1,3-толуидин) (1,9-толуидин)
Как и в случае анилина, в указанных выше соединениях аминные атомы водорода могут быть замещены метильными группами.
Запишите структурную формулу N-метил-и-толуидина.
Проверьте ответ в рубрике 75.
89.
’нэСч zCHj' А Н3С СН3
Вг'
дромид тетраметил -аммония
Известны также аммониевые соли других кислот, как, например, указанная ниже соль двухосновной кислоты
са
CjHs C3Hj
SO4'
2
Назовите следующее соединение:
Н3сх zCHj
Н3С сн3
SO42
а
Проверьте ответ в рубрике 78.
90. Неправильно. Прочтите объяснение в рубрике 95.
91. Восстановление нитросоединений в амины происходит в соответствии с общим уравнением
R—NO2 + ЗН2 -> R—NH2 + 2Н2О
Обратите внимание, что при этом получаются только первичные амины.
В чем заключается важнейшее значение этой реакции?
• Она позволяет получать алифатические амины -» 80
• Она позволяет получать ароматические амины -> 68
Органические соединении азота (1)
435
92. Проверьте ответ:
H3cs снэ н3с
Nx Cl"+ NaOH —- N-CH3 + NaCl + HjO
н3</ хн H3CZ
хлорид триметил- триметиламмония амин
Перечислим теперь важнейшие физические свойства аминов.
Низшие алифатические амины (например, метиламин, диметиламин, триметиламин и этиламин) при комнатной температуре - газы. Они растворимы в воде.
Высшие алифатические амины при комнатной температуре-жидкости или твердые вещества, они нерастворимы в воде.
Простейший ароматический амин-жидкость с температурой кипения около 200°С. Он мало растворим в воде.
Как называется этот ароматический амин?
Запишите его структурную формулу и название.
Проверьте ответ в рубрике 82.
93. Нет, водонерастворимое нитросоединение должно быть также нерастворимым в водном растворе кислоты. Нитросоединения не являются основаниями и поэтому не образуют солей при взаимодействии с кислотами. Следовательно, при смешении нитросоединения с разбавленным водным раствором соляной кислоты ничего не должно произойти.
Переходите к рубрике 60.
94. Прочтите еще раз внимательнее рубрику 84. Продукт обсуждаемой реакции содержит, как вы должны были заметить, две метильные группы.
95. Поскольку метильная группа является орто,пара-направляющим заместителем, нитрование толуола дает смесь о- и п-нитротолуола
Поскольку .«-нитротолуол не образуется в этой реакции, ясно, что один из толуидинов нельзя получить таким способом. Вернитесь к рубрике 76.
Программа 22
Органические соединения a jos h (II)
1. Продолжим описание химических реакций аминов, начаюе в программе 21.
Напомним, что хлорангидриды реагируют с аммиаком, образуя амиды о о
R-C + NH, —► R-C* + НС1
SC1 NH2
Первичные амины реагируют таким же образом:
R-C + HtN-R —► • • • + НС1
SCI
Завершите это уравнение. Проверьте ответ в рубрике 13.
+ 2 НС1
анилин фосген фвнил-ияоцианат
Изоцианаты обладают очень высокой реакционной способностью. Эти соединения используются, например, в производстве некоторых синтетических полимеров, о чем будет более подробно рассказано в программе 23.
Другая важная реакция происходит при взаимодействии аминов с азотистой кислотой HNO2. Атом азота в азотистой кислоте трехвалентен. Запищите структурную формулу азотистой кислоты.
Проверьте ответ в рубрике 18.
3. Проверьте ответ:
СТ R-NH. + jC-O —► R-NH-C-O —► • •
Cl Cl
I
Соединение I неустойчиво; оно отщепляет молекулу НО.
Что является конечным продуктом этой реакции? Проверьте ответ в рубрике 14.
4. NaNO2 + НО -> HNO2 + NaCl
нитрит азотистая
натрия кислота
Азотистая кислота реагирует с амином, образуя соль диазония. Эту реакцию нужно проводить при температуре ниже + 5°С, поскольку соль диазония может разлагаться. В связи с этим раствор приходится охлаждать, добавляя в него лед.
Органические соединения aioia (II)
4.37
Завершите уравнение этой реакции
R—NH2 + HNO2 + НС1 -> ... + 2Н2О Проверьте ответ в рубрике 16.
5. В реакциях азотистой кислоты с метиламином и этиламином образуются соответственно метанол и этанол.
Первичные ароматические амины тоже реагируют с азотистой кислотой:
_н2о
R—NH2 + НО—N=O----------> R—NH—N=O -> R—N=N—ОН
i n
В данном случае продукт II разлагается не столь легко; в присутствии кислот (например, соляной кислоты) он образует устойчивую соль:
R—N=N—ОН + НС1 -> [R—N=N] + C1“ + ...
Что является побочным продуктом этой реакции?
Проверьте ответ в рубрике 21.
6. Правильно. Образуется амид.
Реакция между этиламином и ацетилхлоридом представляет собой ацилирование.
Подведем итог сказанному:
Реакция Возможные реагенты Продукты реакции
Алкилирование Алкилхлориды Вторичные и третичные амины
Ацилирование Хлорангидриды Амиды карбоновых кислот
Алкилхлориды являются алкилирующими агентами.
Хлорангидриды - ацилирующие агенты.
В качестве алкилирующих агентов могут использоваться и другие алкилгалогениды, например бромиды или иодиды. В качестве ацилирующих агентов вместо хлорангидридов могут использоваться также ангидриды карбоновых кислот, например
ю снэ-с'° амад
СНЭ-С XNH-CHj
CHj-NH, + Q----► +
CHj'C* гм -rz°H уксусная
О Чх кислота
О
метиламин уксусный
ангидрид
Запишите соответствующее уравнение реакции между этиламином и уксусным ангидридом.
Проверьте ответ в рубрике 17.
438
Программа 22
1- \ \
NH + HO-N’O ---► N-N=O + Н2О
RZ RZ
Важно запомнить, что в реакции вторичных аминов с азотистой кислотой происходит выделение воды.
Могут ли третичные амины вступать в аналогичную реакцию?
• Да -> 25
• Нет -> 20
• Не понимаю вопроса -> 32
СН,-С* + CHj-NHj —►CHs-C* + НС1
'Cl NHCH3
О СНЧ
СН,-С + NH —► сн3-сг zCHj + НС1
ЧС1 сн/ 4N
чсн. Образуют ли третичные амины аналогичным образом амиды карбоновых кислот?
• Да - 29
• Нет 19
• Нуждаюсь в разъяснениях -> 40
9. Начальная реакция между первичным амином и азотистой кислотой приводит к выделению воды
R— NH2 + НО—N=O -> R—NH—N=O + Н2О i
Продукт I (нитрозоамин) неустойчив и перегруппировывается в соединение II в результате перемещения атома водорода от N к О с одновременным смещением двойной связи:
R—NH—N=O -> R—N=N—ОН
1
Соединение II тоже неустойчиво; оно разлагается на спирт R—ОН и ....
Завершите это предложение и проверьте ответ в рубрике 22.
10. Правильно. Температура реакции диазотирования поддерживается приблизительно при + 5°С или ниже, поскольку при более высокой температуре соли диазония разлагаются.
Неустойчивость солей диазония позволяет провести многие важные реакции. Приведем несколько примеров.
При нагревании водного раствора соли фенилдиазония происходит выделение азота и образование фенола
№N]* СГ ОН
+ нао
+ N, + НС1
Ор1анические соединения азота (II)
439
Эта реакция аналогична одной из уже знакомых нам реакций для определенного класса алифатических аминов при их взаимодействии с азотистой кислотой. О каком классе аминов идет речь?
• Первичные амины • Вторичные амины • Третичные амины • Нуждаюсь в разъяснениях -> 41 -> 47 -> 50 -> 53
11. Правильно. Атом азот-1 в ионе диазония четырехвалентен, как и в ионе аммония. Следовательно, он несет на себе положительный заряд.
Название «соли диазония» указывает, что речь идет о соединениях, в которых два атома азота связаны с органическим радикалом.
На основании этих сведений выведите общую формулу солей диазония.
Проверьте ответ в рубрике 23.
12. С6Н5—NH2 + HNO2 + НС1 -> [С6Н5— N=N]+ Cl' + 2Н2О
Образующаяся соль диазония называется хлорид фенилдиазония. Впрочем, вам не обязательно запоминать названия индивидуальных солей диазония. Для простоты можно говорить о соли диазония - производном определенного амина.
Соль диазония, являющаяся производным о-толуидина, имеет структурную формулу
N=NJ+ СГ
Запишите структурную формулу соли диазония, являющейся производным и-толуидина.
Проверьте ответ в рубрике 34.
13. Проверьте ответ: о о
R-C + NHe-R ----► R-C + НС1
ЧС1 XNHR
Реакция между первичными аминами и хлорангидридами приводит к образованию замещенных амидов (т. е. амидов, имеющих заместитель у атома азота).
Реакция со вторичными аминами
2
протекает аналогично. Запишите общее уравнение такой реакции. Проверьте ответ в рубрике 24.
14. R—N=C=O
Соединения этого типа называются изоцианаты. Изоцианатная группа имеет формулу
—N=C=O
-MH
Программе 22
Примером образования изоцианатов является реакция между анилином и фосгеном.
Продукт этой реакции называется фенилизоцианат.
NH,
+ СОС1.
Завершите это уравнение и проверьте ответ в рубрике 2.
15. Схема алкилирования и ацилирования аминов:
Реакция Реагенты Продукты реакции
Алкилирование Алкилгалогениды Вторичные и третичные амины
Ацилирование Хлорангидриды или Амиды карбоновых ангидриды карбоновых кислот кислот
Первичные амины вступают в интересную реакцию с фосгеном СОС12 (дихлорангидридом угольной кислоты).
Первая стадия этой реакции представляет собой ацилирование амина с высвобождением одной молекулы НС1.
С1
R-NH, + 'С'О ---► +
С1
Завершите уравнение этой реакции и проверьте результат в рубрике 3.
16. R—NH2 + HNO2 + НС1 -> [R-N=N]+ СГ + 2H2O
Реакция этого типа называется диазотирование. В результате того, что амин диазотируется, образуется соль диазония.
Запомнили вы условия проведения этой реакции? Завершите следующие предложения:
1) Амин растворяют в избытке ....
2) Азотистую кислоту вводят капельным добавлением водного раствора
3) Температура реакции должна поддерживаться приблизительно при ... °C.
Проверьте ответ в рубрике 27.
17. Проверьте ответ:
снэ-с C,H,-NHa + 'О—►
СН,-С' О
NH-C,H, + он
CHj-C о
амид уксусной кислоты
уксусная кислота
этиламин уксусный анеидрид
(/[панические соединения aioia (ilj
441
Какие из следующих соединений являются алкилирующими агентами? а) Метилхлорид
б) Этилхлорид
в) Этилбромид
г) Этилиодид
д) Ацетилхлорид
е) Уксусный ангидрид
• а) и б) ->37
• а), б), в) и г) -> 28
• Д) и е) -> 31
• Все шесть соединений -> 35
18. Н—О—N=O азотистая кислота Первичные, вторичные и третичные амины по-разному реагируют с азотистой кислотой, и это обстоятельство можно использовать, чтобы различать их.
Рассмотрим сначала вторичные амины: R \н + ho-n=o —►
R азотистая кислота
Реакция протекает с выделением воды. Зная это, выведите структурную формулу продукта данной реакции, а затем запишите уравнение реакции. Проверьте ответ в рубрике 7.
19. Правильно. Поскольку третичные амины не содержат функциональной группы N—Н, они не могут реагировать с хлорангидридами.
Реакция между амином и хлорангидридом называется ацилирование.
В такой реакции амин ацилируется. В предыдущей программе были описаны родственные реакции алкилирования. Сравните реакции этих двух типов:
Алкилирование: R-NH, + R-C1 -------► R-NH-R +НС1 ,
О ?
Ацилирование: R-NH2 + R-Cz ------► R-NH-C-R + НС1
ЧС1
В реакции алкилирования к аминному атому азота присоединяется алкильная группа, а в реакции ацилирования-доильная группа.
Какой продукт образуется в реакции ацилирования между этиламином и ацетилхлоридом?
• Такая реакция невозможна —► 30
• Образуется вторичный амин —► 33
• Образуется амид —► 6
• Нуждаюсь в разъяснениях —► 36
142
Пршрамма 22
20. Правильно. Поскольку третичные амины не содержат функциональной группы N—Н, они не реагируют с азотистой кислотой.
Однако первичные амины содержат группу N—Н и их реакция с азотистой кислотой вначале протекает точно так же, как и для вторичных аминов:
R—NH2 + НО—N=O - ... + Н2О
Завершите это уравнение и проверьте результат в рубрике 9.
21. Побочным продуктом является вода
R—N=N—ОН + НС1 -> [R—N=N]+ + СГ + Н2О
Соединения типа
[R—N=N] + X’
где R -- ароматический радикал, называются соли диазония, поскольку они включают два атома азота; суффикс -оний означает наличие в молекуле положительно заряженного катиона, подобно иону аммония,
[R-N=N]+ X-г.оль диазония
соль аммония
Следовательно, эти соединения существуют только в виде солей, в которых X- -это противоион.
Пронумеруем два атома азота в ионе диазония следующим образом:
1 2 [R-N = Nf
Какой из этих двух атомов азота несет на себе положительный заряд?
• Азот-1 -» 11
• Азот-2 -+ 38
• Не знаю -+ 44
22. азот
Приведем полное уравнение этой реакции
R-NH2 + НО—N=O - R—NH- N=O - R—N=N—ОН -- R ОН + N2
Какие спирты должны образовываться в реакциях азотистой кислоты с метиламином и этиламином?
Проверьте ответ в рубрике 5.
23. [R—N=N] + X -
Если в полученной вами формуле есть ошибки, вернитесь к рубрике 5.
Наиболее распространенным противоионом в солях диазония является хлорид-ион, т. е. X ~ = СГ .
Opi анические соединении айна (II)
443
Для проведения реакции первичного ароматического амина с азотистой кислотой амин сначала растворяют в избытке соляной кислоты. Поскольку свободная азотистая кислота неустойчива, ее вводят путем медленного добавления раствора нитрита натрия в воде. Нитрит натрия реагирует с соляной кислотой, которая присутствует в избытке:
NaNO2 + НС1 -> ... + ...
нитрит азотистая
натрия кислота
Завершите это уравнение и проверьте ответ в рубрике 4.
24- ,О R р
R-C + HNy --------► R-C R + НС1
XC1 R 4NZ
XR
Запишите теперь уравнение реакции между ацетилхлоридом
СНэ-Сч
ЧС1 и а) метиламином, б) диметиламином. Проверьте ответ в рубрике 8.
25. Неправильно. Прочтите объяснение в рубрике 32.
26. Продукты алкилирования спиртов -простые эфиры.
Продукты ацилирования спиртов-сложные эфиры.
Завершите теперь следующую схему алкилирования и ацилирования аминов.
Реакция Возможные реагенты Продукты реакции
Алкилирование
Ацилирование
Проверьте результат в рубрике 15, а если вы нуждаетесь в разъяснениях, обратитесь к рубрике 6.
27. Реакции диазотирования (т.е. получение водных растворов солей диазония) проводятся в следующих условиях:
1) Амин растворяют в избытке соляной кислоты.
2) Азотистую кислоту вводят капельным добавлением раствора нитрита натрия.
3) Температура реакции должна быть не выше +5°С. Завершите начатое ниже уравнение диазотирования анилина:
С6Н5—NH2 + ... + НС1 - ... + ...
азотистая кислота
Проверьте ответ в рубрике 12.
i u
Программа 2?
28. Правильно. Метилхлорид, этилхлорид, этилбромид и этилиодид являются алкилирующими агентами.
Какие производные карбоновых кислот могут использоваться в качестве ацилирующих агентов? Укажите два класса подобных соединений и проверьте ответ в рубрике 39, а если вы нуждаетесь в разъяснениях, обратитесь к рубрике 6.
29. Поскольку третичные амины
Rx
4N-R /
R
не имеют аминного атома водорода, они не могут реагировать с хлорангидридами.
Вернитесь к рубрике 40.
30. Неправильно. Реакция между ацетилхлоридом и этиламином осуществима. Общее уравнение реакций такого типа приведено в рубрике 1.
31. Производные карбоновых кислот их хлорангидриды и ангидриды-являются не алкилирующими, а ацилирующими агентами.
Подумайте внимательнее над вопросом, поставленным в рубрике 17.
32. Вторичные амины реагируют с азотистой кислотой, выделяя воду
R Ry
4NH + HO-N=O ---► N-N=O + Н,О
R R
Поскольку третичные амины не содержат аминного атома водорода (функциональной группы N—Н)
R ''N-r
Rz
они не могут реагировать аналогичным образом с азотистой кислотой. Они вообще не способны вступать в реакцию с азотистой кислотой.
Переходите к рубрике 20.
33. Продуктами реакций между хлорангидридами и аминами являются амиды карбоновых кислот. Примеры таких реакций приведены в рубрике 8.
34. N=N]*cr
Некоторые соли диазония могут быть выделены в виде твердых веществ. Однако обычно этого не делают, потому что большинство солей диазония
Opi апические сое пшениц окна 'll)
чрезвычайно взрывоопасны и легко детонируют. В химических реакциях используются безопасные водные растворы этих солей. Поскольку соли диазония неустойчивы в растворе, работать с ними необходимо при низких температурах.
Ниже указаны три экспериментальных условия, необходимые для получения солей диазония. Какое из этих условий связано с неустойчивостью солей диазония?
• Амин растворяют в избытке соляной кислоты -» 45
• Азотистую кислоту получают медленным добавлением раствора нитрита натрия -» 48
• Температура реакции должна быть не выше + 5JC -+ 10
35. Не все шесть указанных соединений являются алкилирующими агентами. Часть из них является ацилирующими агентами!
Подумайте еще раз над вопросом, поставленным в рубрике 17.
36. На данном этапе обучения вы должна быть в состоянии ответить на поставленный вопрос. Примеры реакций между аминами и хлорангидридами приведены в рубрике 8.
37. Не только алкилхлориды являются алкилирующими агентами. Такими же свойствами обладают и другие алкилгалогениды, например бромиды и иодиды.
Подумайте над вопросом, поставленным в рубрике 17, еще раз.
38. Неправильно. Следует, правда, признать, что вопрос этот не из легких. Обратитесь за разъяснением в рубрику 44.
39. Ацилирующими агентами являются хлорангидриды и ангидриды карбоновых кислот.
В качестве примеров приведем ацетилхлорид и уксусный ангидрид.
Помимо аминов существуют и другие соединения, обладающие реакционноспособными атомами водорода и поддающиеся алкилированию и ацилированию, например спирты:
Алкилирование: R-OH + R-C1 —► R-O-R + НС1
Ацилирование: R-OH + R-d* —► R-Cz + MCI
ЧС1 * * * 4O-R
Вы уже знакомы с этими двумя реакциями и поэтому легко сможете завершить следующие предложения:
а) Алкилирование спиртов приводит к образованию ....
б) Ацилирование спиртов приводит к образованию ....
Проверьте ответ в рубрике 26.
4-1С Программа 22
40. Ниже приведены формулы первичных, вторичных и третичных аминов \ R
R-NH, NH xN-r
RZ RZ
которые показывают, что только первичные и вторичные амины имеют аминные атомы водорода (точнее, группы N—Н). Следовательно, только первичные и вторичные амины могут реагировать с хлорангидридами, образуя амиды.
Могут ли третичные амины образовывать амиды, реагируя с хлорангидридами?
• Да -29
• Нет -» 19
41. Правильно. Реакция между первичными алифатическими аминами и азотистой кислотой приводит к выделению азота и образованию спиртов. Родственная с ней реакция превращения ароматических аминов в фенолы протекает при более высоких температурах.
Эта реакция проводится диазотированием ароматических аминов в разбавленной серной кислоте и последующим кипячением раствора полученной соли диазония.
Описываемая реакция позволяет получать фенолы из ароматических нитросоединений в соответствии со следующей схемой:
он
Если соль диазония нагревают с водным раствором иодида калия KI, а не просто в воде, вместо фенола образуется арилиодид
Завершите уравнение этой реакции и проверьте его в рубрике 54.
Э42. Правильно. Реакция азосочетания фенолов протекает в щелочном растворе. Обычно азосочетание фенолов или анилинов с солями диазония происходит в ипрд-полйжении по отношению к группе ОН или NR2.
Замещенные фенолы и анилины тоже вступают в реакцию азосочетания с солями диазония.
В качестве примера рассмотрим реакцию между салициловой кислотой и хлоридом фенилдиазония
С1-
соон
салициловая кислота
Завершите это уравнение. Проверьте ответ в рубрике 52.
Органические соединения азо га (II)
447
При каких экспериментальных условиях проводится эта реакция?
В щелочном растворе -> 59
В кислом растворе ->• 55
В нейтральном растворе -+ 65
Не знаю -»• 56
44. В формуле соли диазония
I 2
[R-№N]+ X
азот-1 четырехвалентен, а азот-2 трехвалентен. Такие же валентности имеют атомы азота соответственно: в солях аммония и аминах
R R" ♦ R4
Х‘ 4N-R
RZ 4R RZ
четверти чная соль аммония третичный амин
Соединения четырехвалентного азота должны иметь положительный заряд. Поэтому соединения аммония существуют только в виде солей. В отличие от этого амины являются нейтральными соединениями.
Аналогичным образом обстоит дело и с солями диазония. Какой из двух атомов азота в ионе диазония несет на себе положительный заряд?
Запишите ответ и проверьте его в рубрике 11.
45. Выбранное вами условие проведения реакции не связано с неустойчивостью солей диазония.
В связи с термической неустойчивостью солей диазония даже в водном растворе температура реакции должна быть не выше + 5°С.
Переходите к рубрике 10.
46. —ОН и —I.
Одной из важнейших реакций для солей диазония является реакция азосочетания. В этой реакции участвуют фенолы или ароматические амины. ' Ниже приводится пример такой реакции с участием фенола
N=N
ОН
Е
Завершите уравнение аналогичной реакции с участием амина
№N] ♦ci"
••• + НС1
Проверьте ответ в рубрике 58.
448 !Ipoi рам’-i:i 22
47. В реакции между вторичным алифатическим амином и азотистой кислотой происходит выделение воды, а не азота.
Сводка реакций различных аминов с HNO2 содержится в рубрике 53.
48. Выбранное вами условие проведения реакции не связано с неустойчивостью солей диазония.
В связи с термической неустойчивостью солей диазония даже в водном растворе температура реакции не должна превышать + 5°С.
Переходите к рубрике 10.
49, [C6H5-№N]+ CN" C6Hj_CN + N2
Эта реакция тоже представляет собой реакцию Зандмейера.
Реакция Зандмейера имеет важное значение для органического синтеза. Она позволяет вводить несколько различных групп в ароматический цикл, используя в качестве исходных реагентов легко доступные нитросоединения (которые получают нитрованием). Нитросоединения сначала восстанавливают, получая амины, затем амины диазотируют и после этого проводят реакцию Зандмейера:
1
> R-OH 2
R NO, , R МП. » [R N—N1+C1- 3 Р Пг
4 Ь р I
5 » R-CN
Какие из указанных выше реакций Зандмейера требуют применения солей Cu(I) в качестве катализатора?
• Все пять реакций —> 63
• Реакции 1 и 4 —► 66
• Реакции 2, 3 и 5 —> 60
• Реакции 2, 3 и 4 —► 61
• Не знаю —► 71
50. Неправильно. Третичные амины вообще не реагируют с HNO2.
Сводка реакций различных аминов с азотистой кислотой содержится в рубрике 53.
51. бис-Азосоединение, образующееся из диазотированного бензидина и салициловой кислоты, имеет следующую структурную формулу:
соон
соон
Opiгшическис соединении ;поти (II)
449
Рассмотрим теперь, как осуществляется количественное определение содержания азота в органических соединениях. Анализируемое соединение смешивают с каким-либо окислителем и проводят его полное сжигание в специальной установке.
Какие продукты образуются при этих условиях из атомов углерода и водорода, содержащихся в Органическом соединении?
Проверьте ответ в рубрике 70.
52.
N=N]+ СГ ♦ / Ч-ОН
Vn«N-C VOH + НС1
С СЮН салициловая кислота
СООН
Азосоединения, образующиеся в реакциях азосочетания, имеют важное прикладное значение как красители.
Как можно получить следующий азокраситель:
сн,
Vn=n-^A-nh,
Из диазотированного анилина азосочетанием с о-толуидином Из диазотированного о-толуидина азосочетанием с анилином
Не знаю
67
62
69
53. Ниже приводится краткая сводка реакций различных аминов с азотистой кислотой.
Первичные алифатические амины образуют соответствующие спирты:
R-NH2 + НО -N=-O -> R—ОН + N2 + Н2О
Вторичные алифатические амины реагируют с выделением воды
Третичные алифатические амины вообще не реагируют с HNO2. Переходите к чтению рубрики 41.
54. N=N)+ СГ
+ KI
Попытки получения бром- и хлорбензола с помощью аналогичной процедуры приводят к очень низким выходам. Однако эти реакции катализируются солями Cu(I) и поэтому в присутствии Cu(I)Br и Cu(I) Cl удается добиться хороших выходов соответственно бром- и хлорбензола. Каталитическое действие солей меди(1) обнаружил Зандмейер, по имени которого стали называть эту реакцию.
29-29
1
Завершите уравнения следующих реакций Зандмейера:
[C6H5-N = N+]cr -U(1)C> С6Н5С1 + N2
[C6H5-N=N+]Br’ --->
+ N2 ->
Проверьте ответ в рубрике 64.
55. Правильно. Азосочетание аминов с солями диазония проводится в кислом растворе.
Другие соединения вступают в реакцию азосочетания в щелочном растворе. К какому классу относятся эти соединения?
Проверьте ответ в рубрике 42.
56. Прочтите еще раз общие правила проведения реакций азосочетания с фенолами и аминами, приведенные в рубрике 68.
57.
Органическое соединение (например, анилин)
сжигание S потоке
С0г (с окислителем)
Газообразные продукты сгорания (С02, Н20, NJ
Газообразный
N2
поглощение
В КОН
I
Измерение объема
Качественное определение азота в органических соединениях проводится их нагреванием с горошинкой натрия до разложения. Азот, углерод и натрий соединяются, образуя цианид натрия NaCN, который можно обнаружить по его цветной реакции.
Конец программы 22.
Не заглядывая назад в рубрику 46, запишите уравнения азосочетания фенола с хлоридом фенилдиазония. Проверьте ответ в рубрике 68.
59. Неправильно. Посмотрите на общие правила для реакций азосочетания фенолов и аминов с солями диазония, приведенные в рубрике 68.
60. Правильно. Катализатор Си (I) необходим для следующих реакций Зандмейера:
----»R-C1
[R-N=N]+ Cl-------► R-Вг
R-CN
Органические соединении азота (II) 451
Существуют два других заместителя, которые могут быть введены в ароматическое кольцо посредством аналогичных реакций, но без применения катализатора Си(1). Какие это заместители?
Проверьте ответ в рубрике 46.
61. Неправильно. Прочтите внимательно рубрику 71.
62. Правильно, сн,
/ VnsNI* сг +
NH,
N-N
NH, + НС1
Зиазотиро- анилин ванный о-толуидин
Более сложные азокрасители, содержащие две азогруппы, могут быть получены из бензидина
H,N
NHj
Диазотирование бензидина дает соль бис-диазония
СГ ’|№N
N=N)‘ СГ
которая вступает в реакцию азосочетания с двумя молекулами салициловой кислоты
соон
образуя бис-азосоединение (приставка бис употребляется вместо ди-). Запишите структурную формулу образующегося соединения. Проверьте ответ в рубрике 51.
63. Неправильно. Проработайте еще раз материал, начиная с рубрики 41.
Си (I) CI
64. [C6H5-N=N] + Cr------------— С6Н5С1 + N2
Си (I) Вг
[С6Н5--N=N] + Вг -----------► С6Н5Вг + N2
Аналогичным путем можно также получать ароматические нитрилы, если использовать в качестве катализатора цианид меди(1).
Завершите уравнение
Cu(llCN
[С6Н5 W-N]+CN---------------> ... + N2
и укажите общее название этой реакции. Проверьте ответ в рубрике 49.
452
Про! рачма 22
65. Неправильно. Реакции азосочетания не проводятся в нейтральном растворе.
Проработайте еще раз материал, начиная с рубрики 46.
66. Неправильно. Для этих двух реакций не требуется катализатор! Прочтите внимательно рубрику 71.
67. Указанные вами компоненты будут реагировать следующим образом:
^^-N=N) * Cl “ ♦
СН3
Приводит ли эта реакция к желаемому соединению? Вернитесь к рубрике 52.
68.
он —►
N-N
Н + НС1
К реакциям азосочетания применимы следующие общие правила:
- фенолы сочетаются в слабощелочном растворе,
- амины сочетаются в слабокислом растворе.
Эти правила легко запомнить, поскольку
- фенолы растворяются (и сочетаются) в щелочных растворах, тогда как
- амины растворяются (и сочетаются) в кислых растворах.
Запишите теперь уравнение реакции азосочетания между хлоридом фенилдиазония и М,М-диметиланилином
Проверьте ответ в рубрике 43.
з----------------------------------
69. Азосоединение
должно быть получено из соли диазония и ароматического амина (анилина)
|R-N=N)+ Cl
Какую соль диазония вы использовали бы для этой цели? Вернитесь к рубрике 52.
Органические соединения азота (II)
453
70. Диоксид углерода и вода.
Азот, содержащийся в органическом соединении, при этой реакции высвобождается в виде газообразного азота.
Сжигание органического соединения проводится в струе СО2 в присутствии какого-либо окислителя. Образующиеся газы пропускают через раствор гидроксида калия, который поглощает СО2 и Н2О (при этом поглощается не только СО2, образовавшийся в результате сгорания, но и газ-переносчик). Не поглощается раствором только газообразный N2, объем которого позволяет вычислить количество азота в исходной органической молекуле.
Описанная аналитическая процедура схематически представлена ниже. Срисуйте эту схему и укажите формулы газов, образующихся при сгорании органического соединения.
Органическое соединение (например, анилин)
сжигание 8 потоке
С02 (с окислителем)
Газообразнь /е продукты сгорания
Газообразный
поглощение в КОН
Измерение объема
Переходите к рубрике 57.
71. Выше были в качестве примера приведены следующие реакции солей диазония:
Г D - М = КГ1 * “ :—► R-OH 2 *. и . ГП
3 г р - Qr
[П Р» 141 1^1 * Г ° “ 1
—5—» R-CN
Образование фенолов и иодидов (реакции 1 и 4) протекает при повышенных температурах без использования катализатора. Три остальные реакции требуют применения в качестве катализаторов соответствующих соединений Cu(I). Завершите следующую схему, касающуюся только катализируемых реакций,
*
(R-N=N]‘ СГ------►
Проверьте ответ в рубрике 60.
Программа 23
Синтетические полимеры
1. Прошло время, когда синтетические полимеры использовались только как заменители природных материалов. Сегодня синтетические вещества повсеместно применяются и как конструкционные материалы, волокна, краски и т. д.
Подробное обсуждение этой интереснейшей области химии заняло бы отдельный том. Настоящая программа предназначена лишь для ознакомления с важнейшими основополагающими принципами химии синтетических полимеров.
Ранее мы уже обсуждали явление полимеризации. Как называется продукт полимеризации?
Запишите название этого продукта и проверьте ответ в рубрике 13.
2. Правильно. Простейшим ненасыщенным соединением является этилен
Н Н
Н Н
Первые методы получения полиэтилена (1935 г.) требовали очень высоких давлений (приблизительно 2000 атм), поэтому продукт получил название полиэтилен высокого давления.
Потребовалось 20 лет, чтобы обнаружить, что в присутствии определенных металлоорганических катализаторов можно проводить полимеризацию этилена при значительно более низких давлениях (приблизительно 50 атм). Полимер, получаемый таким способом, называется полиэтилен низкого давления.
Запишите структурную формулу фрагмента молекулы полиэтилена, состоящего всего из трех этиленовых звеньев. Сравните вашу формулу с приведенной в рубрике 16, а если вы нуждаетесь в разъяснениях, обратитесь сначала к рубрике 27.
3. 1,6-Гексаметилендиамин имеет формулу
h2n—сн2—сн2—сн2—сн2—сн2—сн2 nh2
3 Поликонденсацию проводят нагреванием смеси этого диамина с адипиновой кислотой при температуре выше 200°С. В результате отщепления воды образуется макромолекула найлона
+ _С(СНа)4с( + >(СНа),1<^ + C(CHj)4C + N(CH2)eN + 'с-
'Н На £>н„...н; дг ....но;
Запишите формулу продукта этой реакции, которая представляет собой фрагмент макромолекулы. Проверьте ответ в рубрике 15.
4. Найлон-6,6 получают из адипиновой кислоты
НООС СП, СН2 СН2 СП, СООН
и 1,6-гексаметилендиамина
H2N СН2—СН2 СН2 СН2—СН2 СН2 NH,
Найлон-6,6 и найлон-6 используются как синтетические материалы, особенно в форме волокон. Найлон-6 имеет фирменное название перлон.
В отличие от полиакрилонитрила полиамидные волокна получают из расплава, а не из раствора. Расплавленный полиамид, выдавливаемый из тонких отверстий фильеры, в результате охлаждения затвердевает, превращаясь в волокна.
Важный полиэфир, который также используется как синтетическое волокно, получают поликонденсацией метилтерефталата и этиленгликоля. Попытайтесь записать формулы этих реагентов и проверьте их в рубрике 22.
Если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 34.
5. Винилхлорид имеет формулу
Н Н
i i сн сна
С—С или СН7=СНС1
I I
н а
Поливинилхлорид (ПВХ) очень важный материал, используемый, например, для изготовления линолеума, труб и плащей-дождевиков.
Стирол (винилбензол) тоже образует важный полимер. Если вы забыли формулу стирола, но знаете формулу винилхлорида, то, несомненно, сможете записать формулу винилбензола. Проверьте ответ в рубрике 20.
Сложные эфиры фталевой кислоты используются в качестве пластификаторов, т. е. соединений, которые размягчают полимеры.
Многие полимеры используются для получения синтетических волокон. Важным примером таких полимеров является полиакрилонитрил. Его получают из акрилонитрила (винилцианида).
Попытайтесь записать структурную формулу акрилонитрила.
Проверьте ответ в рубрике 19, а если нуждаетесь в разъяснениях, обратитесь предварительно к рубрике 31.
7. Гомополимер, состоящий из звеньев В: .. В В- В —В—В—...
Сополимер, состоящий из звеньев А и В состава 1 :1, можно представить различными формулами:
(I) - А В А В А— В —АВ..
(II) ...—А—А—В—А—В—В—В—А—В—А—...
Формула I отвечает регулярному сополимеру. Чаще встречаются сополимеры нерегулярного состава (II).
456
Программа 23
Все рассмотренные до сих пор полимеры являются линейными. Такие полимерные материалы состоят из нитевидных молекул, частично перепутанных, а частично расположенных параллельно друг другу
Интенсивные исследования тонкой структуры полимерных материалов представляют интерес не только с теоретической точки зрения, но также для практического применения и обработки полимерных материалов.
Запишите названия четырех рассмотренных выше конкретных полимеров. Проверьте ответ в рубрике 17, либо обратитесь к рубрике 24, где содержится краткое изложение пройденного материала.
8. Пропилен (пропен) является исходным веществом для получения полипропилена.
Пропилен имеет три атома углерода и содержит простую и двойную углерод-углеродные связи.
Запишите структурную формулу пропилена и проверьте ответ в рубрике 18.
9. Правильно. Амиды образуются из карбоновых кислот и первичных или вторичных аминов.
Для получения полиамида нужно, чтобы дикарбоновая кислота реагировала с диамином
Отщепление воды приводит к образованию макромолекулы.
Первым полиамидом, который начали производить в больших масштабах, был найлон. Слово «найлон» сначала было фирменным названием, но сейчас используется как общее название всех полиамидов.
Полимер, которому впервые было дано название «найлон», получили из адипиновой кислоты и гексаметилендиамина.
Адипиновая кислота представляет собой алифатическую дикарбоновую кислоту, содержащую шесть атомов углерода.
Запишите формулу этого соединения. Проверьте ответ в рубрике 21.
10. Метиленовая группа имеет формулу —СН2—. В 1,6-гексаметилендиамине содержится шесть метиленовых групп (гекса означает шесть)
и 6).
СН2- СН2 -СН2 сн2 сн2 сн2
К каждому концу этой цепи присоединена аминогруппа (в положениях 1
Завершите формулу гексаметилендиамина и проверьте ее в рубрике 3.
С ин готические полимер:.!
157
11. Вы неправильно понимаете этот вопрос! Третичный амин
R
'n-r
Rz
не имеет атомов водорода, связанных с азотом и, следовательно, не может рассматриваемым образом реагировать с карбоновой кислотой.
Амиды образуются только из первичных или вторичных аминов.
Переходите к рубрике 9.
12.
О О О о
и и и у^А и
....-о-с-е ус-о-сна-сна-о-с-с у-е-о-....
Продолжение этой реакции приводит к образованию макромолекулы.
Сополимер, образующийся из диметилтерефталата и этиленгликоля, используется исключительно для производства синтетических волокон; их фирменные названия -диолен, терилен и тревира.
Важные применения находит поликарбонат, имеющий формулу
В ФРГ он выпускается под фирменным названием макролон, а в США-под названием лексан.
Что представляет собой этот полимер?
• Полиамид -> 42
• Сложный полиэфир -+ 37
• Простой полиэфир -<• 46
• Не знаю -> 51
13. Макромолекула.
Молекулярная масса макромолекул может составлять от десятков до сотен тысяч.
Для получения полимерных материалов используются химические реакции трех видов:
а) полимеризация,
б) поликонденсация и
в) полиприсоединение.
Для первой из них-реакции полимеризации-в качестве исходных веществ используют ненасыщенные соединения. Что является простейшим ненасыщенным соединением?
• Этан 23
• Этилен 2
• Не знаю -» 26
14. Правильно. Капролактам имеет семичленное кольцо
Полимеризация капролактама с образованием полиамида происходит в результате размыкания капролактамного кольца:
JC-O
(cHjXJ NH
....-NH-fCHJj-C-....
полиамид
капролактам
Этот полиамид называется найлон-6 и образуется из единственного шестиуглеродного мономера.
Помните ли вы, какие реагенты используются для получения найлона-6,6?
Запишите их названия и проверьте ответ в рубрике 4.
Если вы не уверены, прочтите еще раз материал, начиная с рубрики 3.
15. Найлон имеет формулу
... -NH-C(CHa)4C-bm(CHJ)eNH-C(CHJ)4C-NH(CHJ)eNH-C-...
Молекулярная масса этого полиамида 24000-50 000. Поскольку оба исходных вещества (адипиновая кислота и гексаметилендиамин) содержат по шесть атомов углерода, образующийся из них полимер называется найлон-6,6.
Полиамиды этого типа получают в результате реакции двух мономеров, имеющих соответственно две аминогруппы и две карбоксильные группы.
Однако вместо этого могут использоваться и другие реагенты. Например, соединение, содержащее одновременно аминогруппу и карбоксильную группу, тоже может образовывать полиамид. Одним из примеров таких соединений является 6-аминогексановая кислота (аминокапроновая кислота).
Какие две концевые группы нужны для завершения формулы аминокапроновой кислоты?
—СН2—СН2—СН2—СН2—СН2—
• Две группы NH2 -► 32
3 9 Две группы СООН -> 38
• Одна группа —NH2 й одна группа —СООН -» 25
16. Указанный ниже фрагмент полиэтилена получается из трех молекул этилена:
... сн2—сн2—сн2—сн2—сн2—сн2 ...
Полиэтилен имеет молекулярную массу порядка 100 000. Это один из наиболее широко применяемых пластиков. В 1970 г. мировое производство полиэтилена составило более 8 миллионов тонн. Всевозможные сосуды, трубы и упаковочный материал-это лишь несколько примеров применения полиэтилена.
Синтетические полимеры
459
Существуют два способа получения полиэтилена. В зависимости оз используемого метода получают полиэтилен .......... или
полиэтилен .....
Завершите эти два названия и переходите к рубрике 29. Если вы забыли названия способов получения полиэтилена и соответствующих продуктов, вернитесь к рубрике 2.
17. Полиэтилен
полипропилен
, поливинилхлорид полистирол
Эти полимеры называются термопластики, потому что они размягчаются при нагревании, а это позволяет формовать из них детали горячим прессованием.
При изготовлении изделий из пластмасс порошкообразный или гранулированный полимер размягчают нагреванием, и под давлением заполняют им пресс-форму. Когда материал затвердевает, пресс-форму открывают и извлекают из нее требуемое изделие. Таким образом изготовляют пластмассовые стаканы, тарелки, выключатели, расчески, радиодетали и другие изделия.
Термопластики можно также прокатывать в нагретом состоянии в листы (пленки) или трубы.
Чтобы размягчить твердые полимеры для удобства их обработки, к ним добавляют так называемые пластификаторы (мягчители).
В качестве пластификаторов широко применяются сложные эфиры фталевой кислоты с высшими спиртами.
Запишите общую формулу таких сложных эфиров, обозначая спирт как R—ОН. Проверьте ответ в рубрике 6, а если вы нуждаетесь в разъяснениях, предварительно обратитесь к рубрике 30.
18. Пропилен имеет структурную формулу
сн3—сн=сн2
а структурная формула полипропилена:
. . .-CH-CHi-tjIH-CHrCH-CHr- • • CH, CH, CH,
По своим свойствам полипропилен подобен полиэтилену, но обладает более высокой температурой размягчения.
Поливинилхлорид-еще один важный пластик, получаемый полимеризацией винилхлорида.
Запишите структурную формулу винилхлорида и проверьте ответ в рубрике 5, а если вы нуждаетесь в разъяснениях, обратитесь сначала к рубрике 28.
19. Акрилонитрил (винилцианид) имеет формулу СН2=СН—CN.
Получение волокон полиакрилонитрила осуществляется растворением этого полимера в подходящем растворителе; затем раствор продавливают через отверстия фильеры в нагреваемую шахту, где растворитель испаряется, а образующееся волокно вытягивается. Хотя этот способ может показаться очень простым, на его разработку ушли годы исследований, так как понадобилось создать совершенно новую технологию.
46<)
Программа 2.
Для изготовления текстильных синтетических материалов часто используют полиакрилонитриловые волокна марок дралон и орлон.
Обратимся теперь ко второй химической реакции, позволяющей получать макромолекулы: к поликонденсации.
В реакции поликонденсации на каждой стадии конденсации происходит отщепление молекулы воды (или какой-нибудь другой малой молекулы). Например, по такой реакции получают полиамиды. Полиамиды представляют собой полимерные амиды карбоновых кислот. Как образуются такие соединения? • Из карбоновой кислоты и спирта -» 36
• Из карбоновой кислоты и первичного или вторичного
амина -► 9
• Из карбоновой кислоты и третичного амина -> 33
• Не знаю -► 40
20. Стирол (винилбензол) имеет структурную формулу
Полимеризация этого соединения приводит к образованию полистирола -прозрачного как вода, довольно хрупкого материала.
Полимеры, получаемые из одного только типа мономерных звеньев, называются гомополимеры. Но полимеры также образуются при взаимодействии между собой двух или нескольких различных ненасыщенных исходных веществ. Такие полимеры называются сополимеры, а процесс их получения называется сополимеризация.
Свойства и возможности применения синтетических макромолекул зависят от состава сополимеров, поэтому можно изготовлять синтетические материалы с такими свойствами, которые необходимы для конкретных применений. Стирол представляет собой один из наиболее распространенных компонентов сополимеров.
Обозначим два разных мономерных звена как А и В, тогда гомополимер можно схематически представить формулой
... —А—А—А—А—А— ...
Запишите схематическую формулу аналогичного гомополимера, образованного только звеньями В, а также сополимера, образуемого смесью веществ А и В состава 1 :1. Проверьте ответ в рубрике 7.
21. ноос -сн2- сн2 сн2 - сн2 соон
адипиновая кислота
Эта дикарбоновая кислота является одним из компонентов, используемых для получения найлона.
Другим компонентом является диамин-1,6-гексаметилендиамин. Это линейный алифатический диамин, содержащий шесть атомов углерода.
Запишите формулу 1,6-гексаметилендиамина и проверьте ответ в рубрике 3, а если вы нуждаетесь в предварительных разъяснениях, обратитесь в рубрику 10.
f.инптическмс яолимепы
22.
носн2-сн,он
диметилтере<ралат
этиленгликоль
В процессе реакции поликонденсации между этими двумя соединениями
происходит отщепление метанола
+ сн,о
....... .....-Л
-JOCHA_+ ДС-СИа-СИа-ОН + CHjPj-C
-ОСНэ
Продукт реакции представляет собой сложный полиэфир-полимер сложного эфира. Запишите формулу продукта, образующегося из двух молекул каждого исходного соединения.
Проверьте ответ в рубрике 12.
23. Неправильно. Этан-это насыщенное соединение: Н Н
Простейшей ненасыщенной молекулой является этилен (этен). Он содержит два атома углерода и четыре атома водорода.
Запишите структурную формулу этилена. Проверьте ответ в рубрике 2.
24. Первый полимер, с которым мы познакомились в данной программе,-это полиэтилен. Далее упоминались другие полимеры, которые можно получать из пропилена, винилхлорида и стирола.
Запишите названия всех четырех рассмотренных до сих пор полимеров и проверьте ответ в рубрике 17.
25. Аминокапроновая кислота имеет формулу
hn2—сн2—сн2 сн2—сн2—сн2—соон
На практике для получения полиамидов вместо аминокапроновой кислоты используется капролактам. Капролактам-это циклическое соединение, которое образуется в результате внутримолекулярного отщепления воды с образованием связи между двумя концевыми группами аминокапроновой кислоты.
Запишите структурную формулу капролактама. Сколько атомов содержится в его кольце? Молекула капролактама имеет
• Пятичленное кольцо —> 35
• Шестичленное кольцо —> 41
• Семичленное кольцо —> 14
• Восьмичленное кольцо —> 44
• Не знаю —► 49
462
Программа 23
26. Этан является насыщенным соединением
Н Н
Простейшим ненасыщенным соединением является этилен (этан). Он содержит два атома углерода и четыре атома водорода.
Запишите структурную формулу этилена. Проверьте ответ в рубрике 2.
27. Полимеризацию этилена можно представить следующим образом:
сн,=сн
сн2=сн2
сн2=сн2
-CHj-CH2-CH2-CHj-CH2-CHj-. . . полиэтилен
Сколько мономерных звеньев требуется для получения показанной выше
полимерной цепи?
Проверьте ответ в рубрике 16.
28. Запишите следующие формулы и названия СНз— СНз—С1 сн2=сн—
метильная iруппа метнлхлорид вннильная группа
Теперь запишите структурную формулу винилхлорида и проверьте ее в рубрике 5.
29. В зависимости от используемого способа синтеза получают полиэтилен высокого давления или полиэтилен низкого давления.
Материалы, получаемые в этих двух процессах, обладают различными физическими и химическими свойствами; полиэтилен низкого давления состоит преимущественно из линейных молекул
... СН2—СН2—СН2- СН2—СН2 СН2 ...
тогда как материал, получаемый при высоком давлении, представляет собой сшитый полимер
... -сн2-сн2-сн.-сн2-сн2-...
<рн2 сн2
Полипропилен-это пластик, подобный полиэтилену. Из какого исходного вещества он получается? Укажите название и формулу этого соединения и проверьте ответ в рубрике 18 или, если вы нуждаетесь в разъяснениях, обратитесь сначала в рубрику 8.
30. 1 моль фталевой кислоты реагирует с 2 молями спирта R—ОН, образуя
пластификатор и воду
Ол-с-он
Ц-ОН + 2 R'OH
+ 2 HjO
Запишите формулу образующегося сложного эфира. Проверьте ответ в рубрике 6.
31. Винилхлорид имеет формулу
СН2=СН—С1
Винилцианид имеет родственную молекулу, в которой атом С1 замещен на цианогруппу —CN.
Запишите формулу винилцианида (акрилонитрила) и проверьте ответ в рубрике 19.
32. Неправильно. Для получения полиамида нужно исходить из соединения, располагающего группами —NH2 и —СООН.
Название «алшнокапроновая кислота» ясно показывает, что в молекуле этого вещества содержатся именно такие две функциональные группы. Завершите формулу аминокапроновой кислоты
—СН2— СН2—СН2—СН2—СН2—
Проверьте ответ в рубрике 25.
33. Амид карбоновой кислоты получается из карбоновой кислоты и амина:
R-Cx + HjN-R —► R-Cx + HjO OH XNH-R
первичный амин
Р Л
R-C4 + HNs —♦ R-C R + НЭО
OH R 4n'
. - 4R
Вторичный амин
Реагирует ли подобным образом третичный амин?
R n-r
R третичный амин
•Да -11
• Нет -+ 9
464
Программа 23
34. Терефталевая кислота является ароматической дикарбоновой кислотой, в которой две кислотные функциональные группы расположены
в пара-положении друг к другу. Нужно записать формулу диметилового эфира этой дикарбоновой кислоты. Этиленгликоль формально получается из этилена СН2=СН2 присоединением группы ОН к каждому концу двойной связи.
Запишите формулы этих двух соединений.
Проверьте ответ в рубрике 22.
35. Неправильно. Прочтите объяснение в рубрике 49.
36. Неправильно. Из карбоновой кислоты и спирта получается сложный эфир
ZO р
R-c' + HO-R —► R-CZ + Н*О
ОН SOR
Вернитесь к рубрике 19.
37. Правильно. Обсуждаемое соединение представляет собой сложный полиэфир
Его получают из исходного вещества, относящегося к Классу фенолов, которое называется «бисфенол А». Это вещество имеет формулу
CHj
Чтобы из «бисфенола А» получился сложный полиэфир, этот реагент следует обрабатывать двухосновной кислотой.
Какая это должна быть кислота?
• Адипиновая -> 53
• Угольная -► 48
• Терефталевая -» 57
• Нуждаюсь в разъяснениях -► 74
38. Неправильно. Для получения полиамида нужно исходить из соединения, располагающего группами —NH2 и —СООН.
Название а.иннокапроновая кислота ясно показывает, что в молекуле этого соединения содержатся именно такие две функциональные группы. Завершите формулу аминокапроновой кислоты:
- сн2- сн2- СН2 СН2 сн2
Проверьте ответ в рубрике 25.
Синтетические полимеры
465
39. В указанной реакции поликонденсации должно отщепляться 10 молей воды.
Сшитый полимер можно схематически представить таким образом:
Сшитые полимеры - неплавкие и нерастворимые.
Сшивание может осуществляться также при полимеризации алкенов. Хотя из простейших алкенов получаются линейные полимеры
Н Н । । ...-с-ср-...
н н
алкены с двумя двойными связями могут сшиваться вследствие того, что они обладают четырьмя реакционными центрами
НННН 1111 с=с-с=<р н н
нннн I I I I
Н : • Н
Являются ли сшитые полимеры термопластиками?
• Да - 63
• Нет -> 55
• Не знаю -► 76
40. Амид карбоновой кислоты получается из карбоновой кислоты и амина
R-C* + HjN—R —► R-C* + н2о
ОН первичный NH-R амин или
G R О
R-C + H-jf —► R-C _ + Н2О он R
вторичный к
амин
Реагирует ли подобным образом третичный амин?
R-N X
R
третичный амин
• Да -11
• Нет -9
30-29
466
Программа 23
41. Неправильно. Прочтите объяснение в рубрике 49.
42. Полиамид-это соединение, которое должно содержать азот. Однако соединение, указанное в рубрике 12, не содержит азота! Вернитесь к рубрике 12.
43. Поскольку фумаровая кислота представляет собой ненасыщенное соединение, она действительно может полимеризоваться. Однако поставленный в рубрике 65 вопрос касается реакции между фумаровой кислотой и этиленгликолем. К какому типу относится эта реакция?
Переходите к рубрике 54.
44. Неправильно. Прочтите объяснение в рубрике 49.
45. Неправильно. Прочтите объяснение в рубрике 56.
46. Обратите внимание на следующие формулы и названия О
II
R—О—R R—С—OR
простой эфир сложный эфир
Вернитесь к рубрике 22.
47. Неправильно. Мы еще не обсуждали реакции полиприсоединения. Вернитесь к рубрике 65.
48. Правильно. Угольная кислота
НО—С—ОН
II
о
3 является одним из компонентов, необходимых для синтеза макролона (лексана). Поскольку такие полимеры являются сложными эфирами угольной кислоты, они называются поликарбонаты. Однако в связи с тем, что свободная угольная кислота неустойчива, для получения поликарбонатов используются только ее производные.
Укажите формулы пяти компонентов, используемых для получения поликонденсатов (терефталевая кислота, адипиновая кислота, гексаметилендиамин, этиленгликоль и «бисфенол А»), Проверьте ответ в рубрике 59.
49. Аминокапроновая кислота имеет формулу
h2n- сн2—сн2—сн2—сн2—сн2 соон
Если записать карбоксильную группу более подробно и «согнуть»
Синтетические полимеры
467
молекулу, получим такую структупную формулу:
zCH2-CHa-C
HjC4 soh
ch2-ch2-nh2
Из этой молекулы получается амид в результате внутримолекулярного отщепления воды с образованием связи между карбоксильной группой и аминогруппой.
Запишите формулу образующегося амида и проверьте ответ в рубрике 14.
50. Для получения ненасыщенного сложного полиэфира используется
а) поликонденсация, а для сшивания смолы со стиролом
б) полимеризация.
Теперь перейдем к описанию третьего процесса, используемого для получения полимеров; таким процессом является
в) полиприсоединение.
В реакции полиприсоединения одно из исходных веществ, которое должно обладать лабильными атомами водорода (в составе аминных или гидроксильных групп), присоединяется по реакционноспособной двойной связи к другому исходному веществу. Таким образом, атомы водорода занимают в продукте совсем не такое положение, как в молекуле исходного вещества.
В отличие от этого при полимеризации ненасыщенных соединений не происходит никакого смещения атомов.
В реакции поликонденсации мономерные звенья соединяются в результате отщепления молекул воды или других малых молекул, т. е. продукт поликонденсации имеет химический состав, отличающийся от исходных веществ.
Важнейшими ненасыщенными исходными веществами для реакций полиприсоединения являются изоцианаты.
Изоцианаты подробно обсуждались в программе 22. Их получают путем обработки первичных аминов фосгеном:
С1
r-nh2 + Ь-О —► + 2 НС1
С1'
Завершите это уравнение и проверьте ответ в рубрике 64.
51. Обратите внимание на следующие формулы и названия: О
II
R—О—R R—С—OR
простой эфир сложный эфир
Вернитесь к рубрике 22.
52. O=C=N—СН2—СН2—СН2—СН2—СН2—СН2—N=C=O
1,6- диизоинанатогексан
В реакциях полиприсоединения изоцианатов в качестве их партнеров часто используются диолы (либо триолы). Отдельную стадию присоединения можно
30’
468
Программа 23
схематически представить так:
R-N-C-O
H-O-R
R-N-C=O I O-R
Другими словами, спирт присоединяется по двойной связи C=N таким образом, что атом водорода переходит к азоту, а алкоксигруппа присоединяется к атому углерода в изоцианате.
Следовательно, это полиприсоединение можно схематически изобразить следующим образом:
Волнистые линии между атомами азота и между атомами кислорода символизируют углеводородные цепи.
Завершите уравнение этой реакции полиприсоединения, указав формулу ее продукта.
Проверьте ответ в рубрике 83.
53. Неправильно. Прочтите объяснение в рубрике 74.
54. Правильно. Реакция между фумаровой кислотой и этиленгликолем является реакцией поликонденсации.
Какую структуру имеет продукт этой реакции?
• Линейный полимер -► 69
• Сшитый полимер -> 78
• Не знаю -+ 75
55. Правильно. Сшитые полимеры - неплавкие и, следовательно, не являются термопластиками.
Чтобы проиллюстрировать реакцию сшивания, опишем образование ненасыщенных полиэфирных смол. Первой стадией этой реакции является поликонденсация между фумаровой кислотой и этиленгликолем.
Запишите структурные формулы этих двух реагентов и проверьте ответ в рубрике 65, а если вы нуждаетесь в разъяснениях, обратитесь сначала к рубрике 73.
56. Линейные полимеры получаются из моноалкенов, т.е. из ненасыщенных соединений, содержащих одну двойную связь
При наличии двух двойных связей у соединения могут возникать четыре реакционных центра, что открывает возможность для сшивания
Синтетические полимеры
469
НННН 1111 с=с-с-с -»
I I
нннн 1111
-с-с-с-с-I I
Сложный полиэфир, к которому относится поставленный в рубрике 69 вопрос, имеет несколько двойных связей. Какого же типа сополимер образует он при реакции со стиролом?
Линейный сополимер -> 45
Сшитый сополимер -* 79
57. Неправильно. Прочтите объяснение в рубрике 74.
58. Неправильно. Прочтите объяснение в рубрике 66.
59. СООН HOOC-CHj-CHrCHj-CHj-COOH г'']] терефталевая адипиновая кислота нислота СООН HaN-CHj-CHj-CHj-CHj-CHj-CHj-NH, сексаметилвндиамин
но-сн2-сн,-он зтиленеликолб
бисфенол А
Эти пять веществ принадлежат к следующим классам соединений: дикарбоновые кислоты НООС--------СООН
диамины H?N-------- NH?
диолы НО---------ОН
Из указанных здесь исходных веществ получают линейные полимеры.
Если же в молекулах исходных веществ содержится больше двух функциональных групп, их полимеризация приводит к образованию сшитых полимеров. Приведенная ниже схема показывает, каким образом может происходить полимеризация при реакции между дикарбоновой кислотой
и триолом
СООН...
470
Программа 23
Сколько молей воды будет отщепляться в конкретной реакции поликонденсации, указанной выше?
Проверьте ответ в рубрике 39.
60. Правильно. Сшитые полимеры-неплавкие и нерастворимые. Поэтому, после того как произошло их отверждение, они уже не поддаются формованию. Вследствие этого реакцию сшивания проводят таким образом, чтобы твердый продукт сразу имел желаемую форму. Прочность полиэфирных смол можно повысить, включая в них стекловолокно, подобно тому, как прочность бетона повышают включением в него железных стержней. С этой целью кусок стекловолокна пропитывают в растворе ненасыщенного полиэфира и стирола, а затем прессуют, придавая необходимую форму. Сшивание между ненасыщенным полиэфиром и стиролом инициируется нагреванием.
Запишите названия реакций, используемых для получения:
а) ненасыщенного сложного полиэфира, б) сшивания смолы со стиролом. Проверьте ответ в рубрике 50, а если вы нуждаетесь в предварительных разъяснениях, обратитесь сначала в рубрику 55.
61.
толуол
2,4- Диизоцианатотолуол представляет собой производное толуола, получаемое введением замещающих групп —NCO в положения 2 и 4. Запишите его формулу и проверьте ответ в рубрике 71.
62. Неправильно. Прочтите объяснение в рубрике 66.
63. Термопластиками называют полимеры, которые размягчаются (т. е. становятся пластичными) при нагревании.
Сшитые полимеры-неплавкие и, следовательно, не являются термопластиками.
Переходите к чтению рубрики 55.
64. Изоцианаты имеют общую формулу R—N=C=O.
Для осуществления реакции полиприсоединения в молекуле исходного вещества должно содержаться не менее двух изоцианатных групп.
Одним из таких соединений является 1,6-диизоцианатогексан. Его получают по реакции гексаметилендиамина с 2 молями фосгена.
Запишите формулу этого диизоцианата и проверьте ответ в рубрике 52, а если вы нуждаетесь в предварительных разъяснениях, обратитесь сначала к рубрике 77.
65. НООС—СН=СН—СООН НО—СН2—СН2—ОН
фумаровая кислота
этиленгликоль
Синтезические полимеры
471
Реакция какого типа может происходить между этими двумя
соединениями?
• Полимеризация
• Поликонденсация
• Полиприсоединение
43
54
47
66. Линейные полимеры - плавкие и растворимые.
Сшитые полимеры - неплавкие и нерастворимые. Поэтому такие полимеры нельзя формовать ни из расплава, ни из раствора.
Переходите к чтению рубрики 60.
67. А-линейный полимер
В-сшитый полимер
Степень сшивания полимера, разумеется, может быть различной.
В действительности существует широкий спектр возможностей между такими крайними случаями как линейный и полностью сшитый полимеры.
Полимер может быть также разветвленным без сшивания, например
Такие полимеры являются термопластиками.
Ниже показаны различные возможные структуры сшитых полимеров:
В3
Г
Их можно охарактеризовать соответственно как слабо- или сильносшитые полимеры. Завершите следующие предложения:
Bt: ...сшитый полимер.
В2: ...сшитый полимер.
Проверьте ответ в рубрике 80.
68. Неправильно. Полимерный материал, получаемый из
1,6- диизоцианатогексана и диола, относится к термопластикам.
Изоцианатная функциональная группа играет очень важную роль, потому что она может реагировать не только со спиртами, но также с аминами или карбоновыми кислотами: ° н II s
-N=C*"---^N-R —►
^н' о о и Ж—X II
—N=C + ir-O-C-R —►
Завершите эти два уравнения и проверьте ответ в рубрике 81.
472
Программа 23
69. Правильно. Реакция поликонденсации между фумаровой кислотой и этиленгликолем приводит к образованию линейного полимера:
... -с-сн=сн-с-о-сна-сна-о-с-сн=сн-с-о-сна-сна-о-с-сн-сн-с-...
Он представляет собой ненасыщенный сложный полиэфир, содержащий двойные связи. Будучи ненасыщенным соединением, он может подвергаться дальнейшей сополимеризации со стиролом.
Какого типа сополимер образуется при этом?
• Линейный -> 45
• Сшитый -> 79
• Не знаю -> 56
70. Неправильно. При реакции 1,6-диизоцианатогексана с диолом получается линейная макромолекула.
Вообще говоря, полимеры с линейными макромолекулами способны расплавляться' и, следовательно, относятся к термопластикам.
Переходите к чтению рубрики 68.
71.
Следует отметить, что изоцианаты обладают очень высокой реакционной способностью по отношению к воде
R-N'C'O + НаО —► R-NH-C
ОН
Образующаяся при этом аминокарбоновая кислота неустойчива и разлагается с отщеплением диоксида углерода:
R-NH-C4
ОН
Завершите это уравнение и проверьте ответ в рубрике 82.
72. При реакции 1,6-диизоцианатогексана с диолом получается линейная макромолекула.
Вообще говоря, полимеры с линейными макромолекулами способны расплавляться и, следовательно, относятся к термопластикам.
Переходите к чтению рубрики 68.
Синтетические полимеры
473
73. Фумаровая кислота представляет собой алкен
----СН=СН—
несущий две карбоксильные группы СООН. Завершите ее формулу.
Этиленгликоль формально получается из этилена СН2=СН2 присоединением к каждому концу двойной связи по группе ОН. Запишите его формулу.
Проверьте ответ в рубрике 65.
74. Макролон (лексан) представляет собой сложный полиэфир. Гидролиз этого полиэфира в соответствии со следующей схемой
приводит к образованию кислоты
НО—С—ОН или Н2СО3
II О
Как называется эта кислота? Вернитесь к рубрике 37.
75. Чтобы понять различие между линейным и сшитым полимерами, прочтите еще раз рубрику 59.
76. Термопластики-это полимеры, которые размягчаются (т.е. становятся пластичными) при нагревании.
Сшитые полимеры - неплавкие и не размягчаются при нагревании. Они не являются термопластиками.
Переходите к чтению рубрики 55.
77. 1,6-Гексаметилендиамин имеет формулу
h2n—сн2—сн2—сн2—сн2—сн2—ch2—nh2
Запишите теперь формулу соответствующего диизоцианата. Проверьте ответ в рубрике 52.
78. Неправильно. Чтобы понять различие между линейным и сшитым полимерами, прочтите еще раз рубрику 59.
79. Правильно. При этом образуется сшитый полимер. Можно ли формовать прессованием такой материал?
• Да, из расплава -» 58
• Да, из раствора -► 62
1
Программа 23
-> 60
-> 66
474
• Нет, ни из расплава, ни из раствора
• Не знаю
S0.
силыюсш.итый полимер
слабосшитый полимер
Слабосшитые полимеры обладают свойствами, подобными природному каучуку.
Мы привели лишь несколько примеров множества известных полимерных материалов.
Возможность получения линейных, разветвленных и сшитых полимеров различной сложности и с различными свойствами привела к созданию синтетических материалов, имеющих самое широкое применение в современной жизни.
Конец программы 23.
81.
О н
II . X
-N=C4^N-R ------Н
О -NH-C-NH-R
О О О О
II II и и
-N=C + H-O-C-R —* NH-C-O-C-R
2,4-Диизоцианатотолуол представляет собой чрезвычайно важный изоцианат. Учитывая, что приставка «изоцианато» для группы —N=C=O используется точно таким же образом, как приставки «хлоро», «бромо» и т.д., запишите формулу 2,4-диизоцианатотолуола и проверьте результат в рубрике 71. Если же вы нуждаетесь в предварительных разъяснениях, обратитесь сначала к рубрике 61.
82.
R-NH-C4 —► R-NH, + СОа ОН
Данная реакция используется для получения полимерных пенопластов: с этой целью диизоцианат сополимеризуют с диолом (либо триолом) В присутствии воды. Часть изоцианатных групп при этом реагирует с водой, образуя СО2. Выделение газообразного СО2 приводит к тому, что образующийся полимер приобретает пенистую структуру. По такому принципу получают и полиуретановые пенопласты.
Рассмотрим теперь два типа полимеров, схематически представив их строение таким образом:
Синтетические полимеры
475
Каковы общие названия таких полимеров?
А: ...
В: ...
Проверьте ответ в рубрике 67.
83. Полиприсоединение между диизоцианатом и диолом протекает следующим образом:
.. . + C-N-N-C +
+ C-N-N-C + ...
I
.. . -O-C-NH-NH-C-О—O-C-NH—NH-C-O-
Относится ли полученный в этой реакции полимерный материал к термопластикам?
• Да -68
• Нет -> 70
• Не знаю — 72
Программа 24
Природные продукты и гетероциклические соединения
1. Большинство органических соединений, которые были описаны до сих пор в этрй книге, являются синтетическими и не встречаются в природе. Хотя многие природные органические соединения содержат уже описанные выше функциональные группы, их общая структура, как правило, чрезвычайно сложна. Поэтому мы познакомимся лишь с отдельными примерами этой увлекательной области органической химии.
Существуют три класса природных органических соединений, которые имеют особо важное значение для нашей повседневной жизни: белки, жиры и углеводы.
Аминокислоты -это основные звенья, из которых построены белки. Простейшая аминокислота-аминоуксусная; она получается из уксусной кислоты заменой алифатического атома водорода на группу NH2.
Запишите структурную формулу аминоуксусной кислоты и проверьте ее в рубрике 14.
2. Правильно. Глюкоза имеет химическую формулу
(СН2О)6 или С6Н12О6
Структурная формула глюкозы включает углеродную цепь из шести атомов, первый из которых принадлежит альдегидной группе
/< с-с-с-сс-с
Каждый из остальных пяти углеводородных атомов несет на себе по одной гидроксильной группе. Завершите структурную формулу глюкозы, включив в нее атомы водорода и гидроксильные группы, а после этого определите, сколько первичных и вторичных групп ОН содержится в этой молекуле.
• Пять вторичных групп ОН 22
• Пять вторичных групп ОН и одна первичная -► 26
• Четыре вторичные группы ОН и одна первичная -> 18
• Пять первичных групп ОН -> 31
за! >11
CHj-CH-COOH СН2-СН2-СООН
NH2
2-аминопропионовая кислота
3- аминопропионовая кислота
Все природные аминокислоты являются 2-аминокарбоновыми кислотами. Они называются также а-аминокарбоновые кислоты, или короче а-аминокислоты.
Белки образуются в результате поликонденсации а-аминокислот. Рассмотрим эту реакцию подробнее.
Две аминокислотные молекулы могут образовать амид в результате отщепления молекулы воды с образованием связи между карбоксильной
Природные продукты и гетероциклические соединения
477
группой одной молекулы и аминогруппой другой молекулы, например
сн2-сГ + СН3-СН-СООН —►
Лн2 он nh2
аминоуксусная аминопропионовая кислота кислота
Завершите это уравнение и проверьте ответ в рубрике 15.
4. Г лицерин
СН2ОН I
снон I
СН2ОН
Жиры являются продуктами реакции этерификации длинноцепочечных карбоновых кислот с глицерином. Пользуясь сокращенным обозначением карбоновой кислоты как R—СООН, вы сможете завершить уравнение этой реакции
о
СН2ОН HO-C-R
СНОН + HO-6-R --► ............. + 3 Н2О
I 1
СНаОН HO-C-R
Проверьте ответ в рубрике 19.
5. Неправильно. Прочтите объяснение в рубрике 9.
6. Полимер с каркасной структурой называется сшитый полимер.
Целлюлоза, действительно, обладает такими свойствами, которых следует ожидать для сшитого полимера. Например, ее нельзя расплавить. Сшивание в этом полимере обусловлено наличием бесчисленных гидроксильных групп, которые связывают различные полимерные цепи водородными связями:
। о । Н 6-Н J________
6-Н й I о ______I
I о-н
н
I о
I
АО-Н 5 I I
Н НН
I о-н о о-н
J____!___|_____
6 А 6-н
н н н
о-н о-н у
О О S-H
I I
Н НН
: : I
о-н о-н о
J____!____|____
24
478
Программа 24
Какая химическая реакция способна превратить целлюлозу в полимер, относящийся к термопластикам?
Назовите одну или две такие реакции и проверьте ответ в рубрике 16, а если вы нуждаетесь в предварительных разъяснениях, обратитесь к рубрике 24.
7. Неправильно. Прочтите объяснение в рубрике 9.
8. ,н н
R-с + H-OR —* R-C-OR
V) 'он
Молекула глюкозы содержит одну альдегидную группу и несколько гидроксильных групп. Поэтому она способна образовывать внутримолекулярный полуацеталь:
Н Fl Н (j)H Ijl Ji Н Н Н <рн Н Ji
Эту циклическую молекулу часто изображают следующим образом:
СН2ОН
н он
. Такая структура соответствует обычной форме глюкозы. Глюкоза-самый распространенный из простых углеводов. Более сложный углевод получается конденсацией двух молекул глюкозы. Завершите уравнение этой реакции, пользуясь только эмпирическими формулами
2С6Н12О6 - ... + Н2О
Проверьте ответ в рубрике 20.
9. В состав глюкозы входят элементы углерод, водород и кислород в отношении
С:Н:О = 1:2:1
Следовательно, ее химическая формула должна быть кратна простейшей (эмпирической) формуле СН2О.
Чтобы определить правильную химическую формулу глюкозы, нужно знать ее молекулярную Массу. Последняя оказывается равной 180. Следовательно, глюкоза состоит из шести единиц СН2О, т.е. имеет формулу
(СН2О)6
На основании этих данных запишите химическую формулу глюкозы. Проверьте ответ в рубрике 2.
Природные продукты и гетероциклические соединения
479
10. Карбоксильные группы содержатся в аминокислотах.
Когда аминокислоты превращаются в белки, карбоксильная группа в каждой из них превращается в другую функциональную группу. Какая это группа?
Вернитесь к рубрике 27.
11. Глицерин представляет собой трехатомный спирт, производное пропана
СН3
СН2
I
СН3
Формулу глицерина вы сможете получить из формулы пропана, заменив в ней атом водорода при каждом атоме углерода пропана группой ОН.
Запишите формулу глицерина и проверьте ее в рубрике 4.
12. Правильно. В молекулах белков аминокислоты связаны друг с другом посредством амидных групп.
Существует более 20 природных аминокислот. Каждый белок состоит из нескольких различных аминокислот. Последовательность, в которой соединены различные аминокислоты, индивидуальна для каждого конкретного белка. Очевидно, существует огромное число способов соединения 20 аминокислот в различной последовательности; Поэтому каждое живое существо обладает собственными, специфичными для него белками. Белки, поглощаемые с пищей, расщепляются в организме на аминокислоты, из которых затем синтезируются новые, специфические белки. Именно поэтому оказывается столь трудной проблема трансплантации органов: организм может отторгать чужеродный орган, потому что он содержит чужеродные белки.
В химическом отношении белки родственны определенному классу синтетических полимеров, который был описан в предыдущей программе.
Если вы знаете название этого класса синтетических полимеров, проверьте его в рубрике 23; в противном случае обратитесь к рубрике 29.
13. Аминогруппы содержатся в аминокислотах. Однако, поскольку эти группы принимают участие в реакции образования белка, в результате появляется новая функциональная группа. Какая это группа?
Вернитесь к рубрике 27.
14. Аминоуксусная кислота имеет структурную формулу
СН2— СООН
nh2
Из пропионовой кислоты
сн3 сн2- СООН
получаются две аминокислоты. Запишите структурные формулы этих двух аминопропионовых кислот и проверьте их в рубрике 3, а если вы нуждаетесь в дополнительных разъяснениях, обратитесь сначала к рубрике 25.
481)
Программа 24
ll I J
ch2-c-nh-ch-cooh
nh2
В этом соединении есть еще карбоксильная группа, которая может реагировать с аминогруппой третьей молекулы аминокислоты. Таким образом, реакция может продолжаться, и в результате образуется макромолекула.
Какая реакция протекает в данном случае?
• Полимеризация -» 30
• Поликонденсация -» 27
• Полиприсоединение -» 34
• Не знаю -» 38
16. Образование сложных или простых эфиров уменьшает число групп ОН в целлюлозе и тем самым лишает ее полимерные цепи способности сшиваться посредством водородных связей. Вследствие этого сложные и простые эфиры целлюлозы являются ценными полимерами-термопластиками.
При обработке целлюлозы кислотой она гидролизуется на мономерные молекулы. Эти молекулы имеют формулу С6Н12О6. Как называется такое соединение?
Проверьте ответ в рубрике 35.
17. Вы путаете амидную группу и сложноэфирную группу. Эти две функциональные группы имеют такой вид:
'он
сложный эфир нарбоновой нислоты
амид нарвоно-вой нислоты
Вернитесь к рубрике 27.
18. Правильно. В молекуле глюкозы четыре вторичные и одна первичная гидроксильные группы:
Н Н Н Н Н н
I 1 I I I
но—с—с—с—с—с— н 6н он 6н ОН ЧО
Однако эта структурная формула все еще не является окончательной. Подобно всем остальным углеводам, глюкоза имеет асимметрические атомы углерода.
Сколько асимметрических атомов углерода имеется в глюкозе?
• Четыре -» 28
• Пять -» 37
• Шесть -» 41
• Не помню определение асимметрического атома
углерода -» 33
Природные продукты и гетероциклические соединении
481
CHj-O-C-R
I °
CH-O-6-R
I °
ch2-o-c-r
Радикал R жирной кислоты обычно представляет собой алифатическую цепь из 16 или 18 атомов углерода.
Сложные эфиры глицерина, образуемые им с насыщенными жирными кислотами, обычно являются твердыми или воскообразными веществами, а продукты, образуемые глицерином с ненасыщенными жирными кислотами, представляют собой жидкости или масла.
Ненасыщенные жирные кислоты легко превратить в насыщенные. Какая химическая реакция требуется для этого?
• Гидрирование -» 32
• Окисление -» 36
• Конденсация -» 40
• Не знаю -» 42
20. 2С6Н12О6 -> С12Н22ОИ + Н2О глюкоза
Аналогичный состав имеет обычный сахар*.
При соединении подобным образом многих молекул глюкозы образуется макромолекула. Такие макромолекулы создают протяженный каркас, в котором
индивидуальные полимерные цепи связаны друг с другом водородными связями между группами ОН. Этот материал представляет собой целлюлозу, широко распространенный природный продукт.
। О I н
6-н I
I о
I н 6-н
I
6-н
I о-н
н I о I
I о
I н
6-н I
о-н о I н н
I о о-н
______! I____________ 6_____6_______6-н
I I
н н н
I о-н о-н <р
6 6-н
I н н
I о-н о
______!_______I_______
24
В предыдущей программе было указано специальное название для полимеров с каркасной структурой. Какое это название?
Проверьте ответ в рубрике 6.
* Макромолекула обычного сахара-сахарозы построена путем конденсации молекулы глюкозы с молекулой другого, изомерного углевода состава С6Н12О6-молекулой фруктозы.-Прим. ред.
3129
482
Программа 24
21- ?
h2-o-c-r
О CHjOH
CH-O-C-R + 3 NaOH —► <!:HOH + 3 R-COONa | О CHjOH
CHj-O-C-R
Натриевые соли жирных кислот представляют собой мыла.
Получение мыла, как и спиртовое брожение, является одной из химических реакций, известных человеку с древнейших времен - тысячи лет.
После того как мы познакомились с белками и жирами, перейдем к рассмотрению углеводов. Важнейшим углеводом является глюкоза, которую называют также виноградным сахаром. Выведем поэтапно ее формулу.
Химический анализ показывает, что глюкоза содержит три элемента-углерод, водород и кислород. По данным количественного анализа эти элементы находятся в глюкозе в отношении
С:Н:О = 1 :2:1
На основании этого можно вывести эмпирическую формулу (СН2О)Х.
Измерение молекулярной массы данного соединения дает величину 180. Зная это, вычислите значение х.
• 6 -> 2
• 30 - 7
•180 - 5
• Не могу дать ответ -> 9
22. Пять атомов углерода в молекуле глюкозы, к которым присоединены группы ОН, не идентичны!
Первичная гидроксильная группа должна быть присоединена к первичному атому углерода, т.е. к атому углерода, связанному только с одним соседним атомом углерода. Вторичная гидроксильная группа связана с вторичным атомом углерода, имеющим два соседних атома углерода.
Вернитесь к рубрике 2.
4
23. Как белки, так и полиамиды связаны в цепи амидными группами.
В живых организмах синтез белков протекает в очень мягких условиях (при температуре живого тела). В отличие от этого для получения синтетических полимеров химикам приходится проводить реакции при температурах выше 200° С.
Рассмотрим теперь следующую группу пищевых веществ -жиры.
Жиры представляют собой сложные эфиры глицерина и жирных кислот.
Запишите структурную формулу глицерина и проверьте ответ в рубрике 4. Если вы нуждаетесь в дополнительных разъяснениях, обратитесь сначала к рубрике И.
24. Число водородных связей в целлюлозе уменьшится, если уменьшить в ней число гидроксильных групп. Какие химические реакции можно использовать для замены атомов водорода в группах ОН другими радикалами?
Проверьте ответ в рубрике 16.
Природные продукты и гетероциклические соединения
483
25. Из пропионовой кислоты СН3—СН2—СООН могут быть образованы две аминокислоты.
Они получаются в результате замещения аминогруппой атома водорода в группе СН3 либо в группе СН2.
Запишите структурные формулы двух образующихся при этом
аминокислот и проверьте их в рубрике 3.
26. В молекуле глюкозы только пять гидроксильных групп. Вернитесь к рубрике 2.
27. Правильно. Образование белка из молекул аминокислот происходит в результате реакции поликонденсации. Ниже показана часть молекулы белка:
о о о О
и и и и
• • . -CH-C-NH-CH-C NH-CH-C-NH-CH-C-NH-- • • A A R R
Эта формула представлена в упрощенном виде: все органические радикалы обозначены в ней символом R.
Укажите названия групп в молекуле белка, образовавшихся при соединении аминокислот.
• Карбоксильные группы -» 10
• Аминогруппы -> 13
• Амидные группы -» 12
• Сложноэфирные группы -» 17
28. Правильно. Молекула глюкозы содержит четыре асимметрических атома углерода. В приведенной ниже структурной формуле эти атомы отмечены звездочками.
Н Н Н Н Н м
I I I I I Xм
но-с-с*-с*-с*-с*-с^
н 6н ОН ОН ОН °
Группы, связанные с асимметрическим атомом углерода, обладают определенной пространственной ориентацией и не могут обмениваться друг с другом путем простого вращения. В молекуле глюкозы одна из гидроксильных групп направлена в сторону, противоположную трем остальным
н н н он н н
। । I I । /
но-c-tp* -с» -с* -с* -С'Ч
н он бн Н ОН 'о
(Ориентация пятой группы ОН не имеет значения, поскольку она не связана с асимметрическим атомом углерода.)
То обстоятельство, что глюкоза представляет собой альдегид, имеет важные следствия. Вспомним реакцию между простыми альдегидами и соединениями типа Н—X
H н
R-C< + Н-Х ------► r-c'-x
'о 'он
31*
484
Программа 24
Примером таких реакций является реакция со спиртом, продукт которой называется полуацеталь
Л
R-C + H-OR—► ...
О
альдегид спирт полуацеталь.
Завершите это уравнение и проверьте результат в рубрике 8.
29. В программе 23, посвященной синтетическим полимерам, были описаны полиамиды. Как видно из самого названия, полиамиды содержат амидные группы. Эти же группы содержатся в белках.
Переходите к рубрике 23.
30. Неправильно. Прочтите краткое описание всех названных реакций в рубрике 38.
31. В молекуле глюкозы пять атомов углерода, к которым присоединены группы ОН, не идентичны!
Первичная гидроксильная группа должна быть присоединена к первичному атому углерода, т.е. к атому углерода, связанному только с одним соседним атомом углерода. Вторичная гидроксильная группа присоединена к вторичному атому углерода, который связан с двумя соседними атомами углерода.
Вернитесь к рубрике 2.
32. Правильно. Ненасыщенные жирные кислоты могут быть превращены в насыщенные посредством гидрирования. Это относится и к жирам. Другими словами, жидкие ненасыщенные жиры превращают гидрированием в более удобные для использования твердые жиры. С помощью такого процесса получают маргарин.
Будучи сложными эфирами, жиры могут быть также подвергнуты омылению, т.е. гидролизу основаниями. Продуктами гидролиза жиров являются глицерин и соль жирной кислоты
О
CH-O-^-R + 3 NaOH —►
4
Завершите это уравнение и проверьте ответ в рубрике 21.
33. Атом углерода является асимметрическим, если он несет на себе четыре различных заместителя. Рассмотрим в качестве примера центральный атом углерода в молекуле молочной кислоты
Природные продукты и гетероциклические соединения
485
Исследуйте каждый атом углерода в молекуле глюкозы и определите, сколько среди них асимметричных атомов. Проверьте ответ в рубрике 28.
34. Неправильно. Прочтите краткое описание всех названных реакций в рубрике 38.
35. Гидролиз целлюлозы приводит к ее расщеплению на молекулы глюкозы.
Повторите теперь названия трех классов соединений, являющихся основными компонентами всех продуктов питания человека.
Проверьте ответ в рубрике 48.
36. Неправильно. Прочтите объяснение в рубрике 42.
37. Неправильно. Запомните определение асимметрического атома углерода, приведенное в рубрике 33, а затем вернитесь к рубрике 18.
38. Существуют три основных процесса, приводящие к образованию макромолекул:
а) Полимеризация ненасыщенных мономеров. В этой реакции ни один из атомов не изменяет своего положения.
б) Поликонденсация, при которой молекулы мономеров соединяются в результате отщепления молекулы воды или других малых молекул.
в) Полиприсоединение, при котором одна из мономерных молекул присоединяется по двойной связи другой молекулы. Образующийся полимер имеет не такое расположение атомов, как молекулы мономеров*.
После того как вы хорошо запомните эти уже известные вам факты, переходите к чтению рубрики 27.
39.
U/74Z
Как видно из структурной формулы фурана (вторая формула более правильна), он представляет собой простой эфир. Соответствующий тиоэфир, который называется тиофен, получается из паров фурана и H2S, взаимодействующих при температуре 400" С в присутствии катализатора**. Другими словами, при этом происходит превращение одного гетероциклического соединения в другое:
2-
О 400 °C
+ H’S * Н2О
Фуран тиофен
Завершите это уравнение, указав в нем структурную формулу тиофена.
Проверьте ответ в рубрике 53.
* Лучше сказать-продукт поликонденсации имеет иное химическое строение, чем
мономеры.- Прим. ред.
** Реакция Ю. К. Юрьева-Прим. ред.
486
Программа 24
40. Неправильно. Прочтите объяснение в рубрике 42
41. Неправильно. Запомните определение асимметрического атома углерода, приведенное в рубрике 33, а затем вернитесь к рубрике 18.
42. Превращение ненасыщенной жирной кислоты (жира) в насыщенную кислоту представляет собой реакцию следующего типа:
н н
1 1 -
>с=с' + н2 —► Х-сс
Как называется такая реакция? Проверьте ответ в рубрике 32.
43. Правильно. При окислении никотина воздействию подвергается преимущественно неароматическое, гидрированное пиррольное кольцо. Следовательно, пиррольное кольцо ведет себя как алкильная боковая цепь
Метильная группа в толуоле может быть окислена до карбоксильной группы сн, окисление
СООН
Аналогично, гидрированное пиррольное кольцо в никотине под действием мягких окислителей превращается в карбоксильную группу. Укажите формулу образующейся при этом карбоновой кислоты.
Проверьте ответ в рубрике 70.
44.
,N
c6Hj-cs c-c6H4 t с6н,-с*"'с-свн!
N
C«H, i„H,
Известны также гетероциклические соединения, содержащие два или несколько (одинаковых либо различных) циклов. Простейший пример соединений такого типа -хинолин
Из каких двух циклических систем состоит хинолин?
Бензол И фуран -> 55
Бензол и тиофен -> 57
Бензол и пиррол -> 59
Бензол и пиридин -> 66
Природные продукты н гетероциклические соединения
487
45. Неправильно. Следует однако отметить, что поставленный вопрос не из легких. Прочтите объяснение в рубрике 49.
46.
н2<р—сн2 НООС'НС. 2н2
I сн.
Структура этого продукта окислительного расщепления никотина тоже оказалась известной, что позволило идентифицировать его.
Ниже схематически показано, как осуществлялось выяснение структуры никотина химическими средствами:
!) кВатерииэация 2)онисление
никотин
Н,С--СН
НООС N
CHj
г г
Идентификация двух указанных продуктов расщепления никотина позволила установить его полную структуру. Ее окончательное подтверждение было получено в результате синтеза никотина из известных исходных веществ.
Структурные исследования путем расщепления и синтеза играли важную роль в классической органической химии. В настоящее время эти методы заметно уступили место современным спектроскопическим методам. В этой программе мы лишь коснулись химии природных веществ. Но все же можно надеяться, что приведенный выше пример установления структуры никотина позволит проиллюстрировать увлекательность и сложность проблем органической химии.
Конец программы 24.
47. Неправильно. Следует однако отметить, что поставленный вопрос не из легких. Прочтите объяснение в рубрике 49.
48. Белки, жиры и углеводы являются тремя основными компонентами питания человека.
Теперь нам предстоит описать класс органических соединений, который еще не рассматривался до сих пор. Ранее мы уже познакомились с двумя важнейшими классами органических соединений:
1) алифатические соединения и
2) ... соединения.
Третий класс называется
3) гетероциклические соединения.
Запишите (по памяти) названия всех трех важнейших классов органических соёдинений и проверьте ответ в рубрике 61.
2
488
Программа 24
49. В молекуле никотина
пиридиновое кольцо является ароматическим. Следовательно, оно довольно устойчиво.
Второе кольцо в молекуле никотина-гидрированное пиррольное кольцо-не является ароматическим, поэтому не обладает ароматической устойчивостью. Оно ведет себя во многом подобно простой алкильной боковой цепи и настолько же подвержено окислению, как группа СН3 в молекуле толуола, который при этом превращается в бензойную кислоту.
Какой продукт образуется, когда гидрированное пиррольное боковое кольцо в никотине окисляется с образованием группы СООН?
Проверьте ответ в рубрике 70.
или
50. Н
Н-С^'С-Н H-\Nx-H пиридин
Пиридин является аналогом бензола н
нс^хсн н бензол
и ведет себя во многих реакциях подобно бензолу. Подобно бензолу, пиридин - ароматическое соединение.
Однако отличительной особенностью пиридина является атом азота. К какому из названных ниже типов относится этот атом азота?
• Атом азота в первичном амине —> 60
• Атом азота во вторичном амине —> 64
• Атом азота в третичном амине —> 62
• Атом азота в четвертичных солях аммония —> 69
• Не знаю —> 74
51.
нс—сн н%.сн н
пиррол
Пиррол-слабоосновное соединение. Следовательно, не все вторичные амины являются основными; свойства соединения в большой мере зависят от
Природные продукты и гетероциклические соединения
489
взаимодействий между соседними группами атомов в молекуле. Именно так обстоит дело в пирроле: неподеленная пара электронов азота взаимодействует с четырьмя электронами двух двойных связей С=С, в результате чего образуется шестиэлектронная система, подобная электронной системе бензола:
। н
Е
н
По этой причине неподеленная пара электронов данного амина не обладает такой доступностью, как в обычных вторичных аминах, и пиррол не образует солей.
Фуран представляет собой пятичленный гетероцикл, формулу которого можно получить из пиррола замещением группы NH на атом О.
Запишите формулу фурана и проверьте ответ в рубрике 39.
52. Пиррол-это пятичленное гетероциклическое соединение, содержащее один атом азота
О
N I Н
Гемоглобин (красный пигмент крови) и
хлорофилл (зеленый пигмент листьев) являются сложными производными пиррола.
Гетероциклические соединения образуют большое число алкалоидов. Алкалоиды - это вещества, извлекаемые из растений и часто используемые в качестве лекарственных препаратов.
В качестве примера алкалоидов приведем кокаин, хинин, кофеин и никотин. Эти и многие другие родственные соединения, представляющие интерес для химии и физиологии, выделены и исследованы уже много лет назад. Их строение было установлено при помощи классических методов органической химии: превращением в известные соединения и полным синтезом.
В качестве примера рассмотрим подробнее никотин
В молекуле никотина присутствуют две циклические системы. Как они называются?
• Пиридин и пиррол -» 71
• Гидрированный пиррол и пиридин -> 68
• Гидрированный пиридин и пиррол -» 73
• Нуждаюсь в разъяснении -» 58
53.
H<ff—<йн
НС^^СН
или
тиофен
490
Иршрамма 24
Тиофен является ароматическим соединением. Это видно, например, по его реакции с хлором. Какого типа реакция протекает при этом?
• Реакция присоединения -» 63
• Реакция замещения 65
• Не знаю -» 75
н н
Являются ли эти соединения гетероциклическими?
• Да -67
• Нет - 72
55. Неправильно. Вернитесь к рубрике 65, где представлены все известные вам гетероциклические соединения.
56. н2с—сн2
Н2С Сн2 нб 6н
-НдОг
н2<р—СН2
H2CXq£H2
-з н;
Н«Н HtkjyCH
Эта реакция может рассматриваться как одно из доказательств структуры фурана.
Большинство гетероциклических соединений содержат пяти- или шестичленные циклы. Они могут включать один, два, три или больше гетероатомов.
В качестве примера рассмотрим шестичленный гетероцикл с тремя атомами азота, образующийся в результате тримеризации бензонитрила:
c,h5-c®nc-c6hs
N ~~*
£вн5
, Образующееся соединение называется трифенилтриазин.
Завершите приведенное выше уравнение и проверьте его в рубрике 44.
57. Неправильно. Вернитесь к рубрике 65, где представлены все известные вам гетероциклические соединения.
58. В предложенных соединения: 0 ответах на поставленный вопрос перечислены следующие g* н,<г' 'fHa к—1 н2с— (L J н2с*сн2 н н н
пиридин гидрированный пиррол гидрированный пиридин пиррол
Природные соединения и гетероциклические соединения
491
Никотин имеет структурную формулу
Какие циклы имеются в никотине?
Пиридин и пиррол -+ 71
Гидрированный пиррол и пиридин -► 68
Гидрированный пиридин и пиррол -► 73
59. Неправильно. Вернитесь к рубрике 65, где представлены все известные вам гетероциклические соединения.
60. Неправильно. Прочтите объяснение в рубрике 74.
61. 1) Алифатические соединения.
2) Ароматические соединения.
3) Гетероциклические соединения.
Гетероциклические соединения (или гетероциклы) имеют циклические молекулы, содержащие в цикле один или несколько атомов, отличных от углерода. К наиболее распространенным из таких гетероатомов относятся азот, кислород и сера.
Так, молекула пиридина представляет собой шестичленное кольцо, состоящее из пяти атомов углерода и одного атома азота. Это соединение имеет три двойные связи, как в бензоле, и может быть получено из бензола замещением группы СН на атом азота.
Запишите структурную формулу пиридина и проверьте ее в рубрике 50.
62. Правильно. Пиридин напоминает третичный амин. Он представляет собой растворимую в воде жидкость с неприятным запахом и образует соли с сильными кислотами.
Еще одно азотсодержащее гетероциклическое соединение - пиррол. Его молекула имеет пятичленное кольцо с одним атомом азота. Она содержит две двойные связи С=С. и все пять атомов в кольце несут на себе по атому водорода.
Запишите структурную формулу пиррола. Проверьте ответ в рубрике 51.
63. Неправильно. Прочтите объяснение в рубрике 75.
2
64. Неправильно. Прочтите объяснение в рубрике 74.
65. Правильно. Обсуждаемая реакция описывается уравнением Г“Й + ei2 — ГПГ + нс1
Тиофен вступает с хлором в реакцию замещения, т.е. реагирует как ароматическое соединение.
492
Программа 24
Все рассмотренные выше гетероциклы могут гидрироваться:
пиридин
ZCH2 н2с' "'СН2 нс 2н
Н
Н пиррол
фуран
2 Н2 —►
тиофвн
Запишите структурные формулы продуктов всех этих четырех реакций. Проверьте ответ в рубрике 54.
66. Правильно, хинолин состоит из бензольного и пиридинового колец
К гетероциклическим соединениям принадлежат многочисленные природные вещества. Например, гемоглобин (красный пигмент крови) и хлорофилл (вещество, придающее зеленую окраску листьям) представляют собой довольно сложные производные пиррола.
Каков размер кольца у пиррола и какой гетероатом он содержит? Проверьте ответ в рубрике 52.
67. Правильно. Продукты гидрирования пиридина, пиррола, фурана и тиофена-все это гетероциклические соединения. Гидрированные гетероциклические соединения обладают свойствами алифатических соединений. И вообще тот факт, что некоторое соединение является гетероциклическим, вовсе не означает еще, что оно принадлежит к ароматическим соединениям.
Гетероциклические соединения часто синтезируют из алифатических исходных веществ. В качестве примера приведем реакцию отщепления воды от бутандиола-1,4. Первичным продуктом является тетрагидрофуран (гидрированный фуран), который дегидрированием превращается в фуран
Н2С—CHj
H2i сн2 нб 6н
-HjO
-3 Нд
Завершите это уравнение и проверьте ответ к рубрике 56.
Природные продукты н гетероциклические соединения
493
68. Правильно. Никотин состоит из пиридинового кольца и гидрированного пиррольного кольца.
Н2С—сн2
Г if ।
V снэ
Пиридиновое кольцо является ароматическим, а гидрированное пиррольное кольцо - нет.
Следует ли из этого, что одно из этих колец особенно чувствительно к окислению?
• Да, пиридиновое кольцо -> 45
• Да, пиррольное кольцо -► 43
• Нет, оба кольца одинаково реакционноспособны -► 47
• Не знаю -► 49
69. Неправильно. Прочтите объяснение в рубрике 74.
70.
окисление
-СООН
Поскольку образующаяся пиридинкарбоновая кислота представляет собой хорошо известное соединение, эта реакция дает сведения о структуре одной половины молекулы никотина. Посмотрим теперь, как удается определить структуру второй ее половины.
Для этого необходимо подобрать метод, который оставляет неприкосновенным гидрированное пиррольное кольцо. С этой целью никотин сначала метилируют, чтобы получить четвертичную роль пиридинового ядра (кватернизация)
«»<?—?н, /СН, т ।
;N?I- сн’ I
CHj
Это делает пиридиновое кольцо способным к окислительному превращению в карбоновую кислоту.
Какая карбоновая кислота образуется в результате этого окисления?
Проверьте ответ в рубрике 46.
2
71. Неправильно. Прочтите объяснение в рубрике 58.
72. Неправильно. Гидрированные гетероциклы по праву принадлежат к гетероциклическим соединениям: в определении гетероциклического соединения говорится только, что такое вещество должно содержать в цикле гетероатом.
494
Программа 24
Оно вовсе, не обязательно должно быть ароматическим. Наиболее распространены гетероатомы азот, кислород, сера.
Переходите к рубрике 67.
73. Неправильно. Прочтите объяснение к рубрике 58.
74. Посмотрите внимательно на следующие формулы
первичный амин: R-nh2
вторичный амин: zNH
R
R4
третичный амин: N-R
RZ
X"
четвертичная соль аммония:
R R-N-R I R .
Пиридин содержит трехвалентный атом азота, который не связан с атомом водорода. К какому типу аминов он относится?
• Первичный амин -+ 60
• Вторичный амин -» 64
• Третичный амин -> 62
75. Двойные связи в обычных алкенах.
Вспомните, что двойной связи
?С=СС + С12—►
С=С в ароматических соединениях ведут себя не так, как
в алкенах хлор присоединяется по углерод-углеродной
В отличие от этого ароматические соединения вступают с галогенами в реакцию замещения
С1
| + НС1
Сможете ли вы предсказать с учетом этого, как будет реагировать с хлором ароматическое соединение-тиофен?
+ С1, —
По типу замещения
По типу присоединения
65
63
Программа 25
Химическая vrhjl
1. Более 2000 лет назад греческие философы ввели представление о том, что материя состоит из неделимых «атомов» конечного размера. Однако современная модель атома начала создаваться лишь в 1808 г., когда Дальтон выдвинул предположение, что каждый элемент состоит из присущих только ему неделимых атомов.
Эту модель в дальнейшем пришлось усовершенствовать. Как вам уже известно, в действительности атомы не неделимы, а состоят из еще меньших частиц. Усовершенствованная модель атома должна учитывать это, а также правильно описывать свойства материи.
Например, хотя при помощи модели неделимых атомов Дальтона удалось объяснить законы стехиометрии, она не позволяла дать удовлетворительное объяснение природы химической связи.
Вспомните, какие три частицы входят в состав атома?
Проверьте ответ в рубрике 7.
2. Неправильно. Принцип неопределенности Гейзенберга утверждает, что точное и одновременное определение положения и импульса электрона невозможно.
Согласно описанной ранее оболочечной модели атома, электроны движутся по жестким сферическим оболочкам строго определенного радиуса. Этим точно определяется расстояние электронов от ядра, т.е. его положение. Оболочечная модель позволяет также точно вычислить импульс электрона.
Следовательно, оболочечная модель атома противоречит принципу неопределенности.
Переходите к чтению рубрики 8.
3. Неправильно. К-оболочка может содержать максимум два электрона. Переходите к чтению рубрики 20.
4. Нет, вероятность нахождения электрона неодинакова повсюду. Это видно из приведенного ниже рисунка
который схематически показывает вероятность нахождения электрона в определенной области пространства. Чем выше плотность точек на рисунке, тем больше вероятность нахождения электрона в данном месте.
496
Программа 25
Как изменяется вероятность нахождения электрона, начиная от области с максимальной плотностью?
• Медленно уменьшается в направлении от центра
и быстро уменьшается в направлении к центру -► 32
• Вероятность повсюду одинакова -► 50
• Электрон движется по поверхности сферы -+ 14
5. Неправильно. Атом может образовывать четыре связи только при наличии у него четырех однократно занятых орбиталей.
Переходите к чтению рубрики 26.
6. Основное (невозбужденное) состояние L-оболочки атома углерода описывается следующей электронной конфигурацией:
2s2, 2рх, 2ру
Если, как вы предположили, 25-электрон перейдет на рх-орбиталь, то она будет дважды занятой. Однако в результате перехода электрона должны образоваться четыре однократно занятые орбитали.
Вернитесь к рубрике 26.
7. Атомы содержат элементарные частицы трех типов: протоны, нейтроны й электроны.
В атомное ядро входят только протоны и нейтроны.
В программе 1 была описана оболочечная модель атома. Согласно этой модели, электроны движутся вокруг ядра по строго определенным («жестким») сферическим оболочкам. Такая модель позволяет объяснить периодическую систему элементов и понять их некоторые химические свойства.
Что определяет химические свойства элемента?
• Число протонов в ядре его атома -» 15
• Число электронов в электронной оболочке атома -> 22
• Число внешних электронов (во внешней электронной -► 29
оболочке) атома
• Не знаю -► 36
8. Одновременное и точное определение положения и импульса электрона невозможно. Следовательно, оболочечная модель атома не может быть . правильной.
Эта невозможность одновременного и точного определения положения и импульса электрона вовсе не связана с недостатками измерительных приборов. Любой измерительный прибор обязательно оказывает непредсказуемое воздействие на импульс электрона, причем чем точнее метод измерения, тем больше такое воздействие. Поэтому точное измерение становится невозможным.
Описанная выше невозможность одновременного точного определения положения и импульса является фундаментальным законом природы. Он применим не только к электронам, но и к любым субатомным частицам.
Укажите принятое название этого закона по имени открывшего его ученого.
Проверьте ответ в рубрике 16.
Химическая связь (II)
497
9. Неправильно. Числа в выражении 2(.sp3)4 имеют следующий смысл:
2: номер оболочки, к которой принадлежат орбитали (в данном случае L-оболочка).
3: число р-орбиталей, используемых для зр3-гибридизации.
4: число электронов, занимающих гибридные орбитали.
Сколько же хр3-орбиталей в L-оболочке атома углерода? Переходите к рубрике 37.
10. Вы путаете основное состояние атома углерода и его возбужденное состояние!
Вернитесь к рубрике 27.
11. Неправильно. Атом углерода в состоянии зр2-гибридизации имеет три 5р2-орбитали и одну р-орбиталь. ст-Связь между двумя атомами углерода образуется в результате перекрывания двух 5р2-орбиталей, принадлежащих этим атомам. Сколько неиспользованных в образовании связей орбиталей остается еще после этого на двух атомах углерода? Две р-орбитали и еще ... 5р2-гибридные орбитали. Завершите это предложение, вставив в него пропущенное число и переходите к чтению рубрики 46.
12. К-Оболочка может содержать максимум два электрона. Переходите к чтению рубрики 20.
13. Ваш ответ не вполне правилен. Недостаточно, чтобы атом имел четыре электрона во внешней оболочке. Чтобы атом был способен образовывать четыре ковалентные связи, эти электроны должны располагаться на четырех однократно занятых орбиталях.
Переходите к чтению рубрики 26.
14. Ваш ответ показывает, что вы не понимаете, о чем идет речь. Еще раз внимательно прочтите рубрику 16.
15. Неправильно. За химические свойства элемента ответственно число электронов во внешней оболочке его атомов. Число протонов в атомном ядре оказывает на химические свойства элемента лишь косвенное влияние, поскольку это число определяет заполнение электронных оболочек и, следовательно, число электронов во внешней оболочке.
Переходите к чтению рубрики 29.
16. Принцип неопределенности Гейзенберга.
В соответствии с принципом неопределенности орбитальная модель атома не ограничивает движение электрона жесткой сферой, а вместо этого определяет вероятность нахождения электрона в заданной области пространства. Эта вероятность может быть вычислена математически, однако нам придется ограничиться упрощенным схематическим описанием результатов таких вычислений.
На приведенном ниже рисунке а показана орбиталь электрона в атоме водорода. Эта орбиталь определяет область пространства (в данном случае
32 29
498
Программа 25
сферическую), в которой достаточно велика вероятность нахождения электрона (например, 90%). Это значит, что в 90 из 100 атомов водорода электрон действительно движется внутри такой сферы.
На рисунке б показано поперечное сечение сферы вероятности. Плотность точек соответствует мгновенным «фотографиям» электрона. Вероятность нахождения электрона в пределах сферы неодинакова. Она максимальна в области, близкой к ядру, и медленно уменьшается по мере продвижения к поверхности сферы. В центре сферы, где находится ядро, вероятность нахождения электрона равна нулю.
Рисунок в дает грубое схематическое изображение орбитали, определяя только границу сферы вероятности, в пределах которой велика вероятность нахождения электрона (например, вероятность 90%).
На рис. бив выносная линия указывает ядро атома.
Как изменяется вероятность нахождения электрона в пределах сферы, начиная от области с максимальной плотностью?
Медленно уменьшается в направлении от центра и быстро уменьшается в направлении к центру -» 32
Медленно уменьшается по направлению к центру
и быстро уменьшается по направлению от центра -+ 23
Вероятность повсюду одинакова -► 4
Электрон движется по поверхности сферы -► 41
17. Правильно.
Вновь образующееся состояние атома углерода называется возбужденное состояние. Укажите электронную конфигурацию этого возбужденного состояния.
Основное состояние атома Возбужденное состояние
углерода атома углерода
Is* 2 Is2
2s2 2s1
2px
2p'y
Проверьте ответ в рубрике 27.
18. Неправильно. Числа в выражении 2(sp3)4 имеют следующий смысл:
2: номер оболочки, к которой принадлежат орбитали (в данном случае L-оболочка).
3: число р-орбиталей, используемых для $р3-гибридизации.
4: число электронов, занимающих гибридные орбитали.
Сколько же 5р3-орбиталей в L-оболочке атома углерода? Переходите к рубрике 37.
Химическая связь (II)
499
19. Чтобы ответить на поставленный вопрос, следует знать, что в образовании химических связей между атомами могут принимать участие только однократно занятые атомные орбитали.
Вернитесь к рубрике 71.
20. Правильно. К-оболочка может содержать максимум два электрона. Ими являются s-электроны с противоположными спинами.
Электронные конфигурации атомов принято обозначать особыми символами; например, для атома водорода:
1s1
Единица перед буквой указывает, что электрон находится на первой оболочке (К-оболочке); символ «s» означает, что электрон находится на s-орбитали.
Показатель степени 1 указывает, что на s-орбитали находится один электрон.
А что означает конфигурация 1s2 и какой элемент она описывает?
Проверьте ответ в рубрике 28.
21. Вы путаете основное состояние атома углерода и его гибридизованное состояние! Вернитесь к рубрике 27.
22. Ваш ответ не вполне правилен. Химические свойства электронов во внешней оболочке. Переходите к чтению рубрики 29. определяются числом
23. Неправильно. Вероятность нахождения электрона изменяется так, как это показано на приведенном ниже рисунке
Чем выше плотность точек на рисунке, тем больше вероятность нахождения электрона в данном месте.
Как изменяется вероятность нахождения электрона, начиная от области с максимальной плотностью?
• Медленно уменьшается в направлении от центра и быстро уменьшается в направлении к центру
• Вероятность повсюду одинакова
• Электрон движется по поверхности сферы
32
50
14
2
24. Неправильно. Если шесть атомов углерода в бензольном кольце 5р2-гибридизованы, то сколько р-орбиталей и сколько р-электронов не принимают в этом участия?
Вернитесь к рубрике 73.
32'
500
Программа 25
25. Вспомните, что атом гелия имеет дважды занятую орбиталь. Вам должно быть также известно, что гелий-будучи благородным газом-имеет заполненную электронную оболочку.
Вернитесь к рубрике 35.
26. Правильно. Чтобы атом был способен образовывать четыре ковалентные связи, он должен обладать четырьмя однократно занятыми орбиталями. На приведенном здесь рисунке показана электронная конфигурация основного (невозбужденного) состояния L-оболочки атома углерода, в которой имеются только две однократно занятые орбитали 2р1, 2р*:
Как же атом углерода может образовывать четыре ковалентные связи? Чтобы этот атом приобрел четыре однократно занятые орбитали, один из 25-электронов переходит на пустую 2р-орбиталь.
Какая из р-орбиталей в атоме углерода является пустой?
• 2рх -> 6
• 2ру -> 34
• 2р2 -4 17
27. Основное состояние атома углерода Возбужденное состояние атома углерода
1s2 152
2s2 2s1
2pl 2р12ру
2р| 2р1
5
Конфигурация такого возбужденного состояния допускает образование четырех ковалентных связей. Однако наша модель еще не является полной. Вы знаете, что четыре связи, образуемые углеродом, например в метане, идентичны. Однако указанная выше конфигурация должна была бы привести к двум различным типам связей, поскольку в ней присутствуют орбитали двух разных типов-s и р.
Чтобы разрешить это противоречие, нужно подвергнуть четыре имеющиеся орбитали гибридизации, т.е. смешать одну 25-орбиталь и три 2р-орбитали таким образом, чтобы получились четыре новые идентичные друг другу орбитали. Новые орбитали называются зр3-гибридные орбитали.
Химическая связь (II)
501
Схематически гибридизацию можно представить следующим образом:
Символическая запись этой процедуры выглядит так:
Конфигурация L-оболочки 2а1
атома углерода 2р1
в возбужденном состоянии: 2р* гн6Рил"заци,,2(;;р3)4
2р1
Сколько орбиталей в L-оболочке имеет $р3-гибридизованный атом углерода?
• Одну -> 9
• Две -> 18
• Три - 79
• Четыре -> 37
25
28. Обозначение 1s2 показывает, что s-орбиталь в первой оболочке (К-оболочке) содержит 2 электрона. Следовательно, это обозначение описывает атом элемента гелия.
Заполнение второй оболочки (L-оболочки) начинается с элемента лития. Литий содержит два электрона в (заполненной) К-оболочке и еще один электрон в L-оболочке. Третий электрон находится тоже на s-орбитали. Поэтому атом лития описывается конфигурацией
Is2, 2s1
502
Программа 25
Четвертым элементом в периодической системе является бериллий. В атоме этого элемента два электрона находятся на ls-оболочке. Укажите электронную конфигурацию бериллия.
Проверьте ответ в рубрике 39.
29. Правильно. Химические свойства элемента определяются числом электронов во внешней оболочке его атомов.
«Оболочечная модель» атома имеет ограниченное применение. Например, она не позволяет объяснить существование двойных и тройных связей в органических соединениях.
К более глубокому пониманию химической связи приводит орбитальная модель атома. Однако понять, что представляет собой орбиталь, можно лишь после того, как мы познакомимся с одним из законов атомной физики, который называется принцип неопределенности Гейзенберга. Этот принцип утверждает, что точное и одновременное определение положения и импульса (произведение массы на скорость) электрона невозможно. Вопреки данному принципу, оболочечная модель атома исходит из того, что электрон движется по строго определенной сферической поверхности на вполне определенном расстоянии от ядра. А поскольку электрон имеет строго определенную массу, законы классической физики позволяют вычислить его импульс. Постараемся разобраться в различии между предсказаниями оболочечной модели атома и принципом неопределенности Гейзенберга.
Противоречат ли друг другу оболочечная модель и принцип Гейзенберга? • Нет -► 2
• Да -> 8
• Нуждаюсь в разъяснениях -> 38
30. Неиспользованными остаются две р-орбитали
Н* sp* Г\ sp2
sp2 SP2\
Н* sp2 'Оp p sp2
Ниже показано пространственное расположение этих двух р-орбиталей:
Обсуждаемые р-орбитали ориентированы перпендикулярно плоскости, образуемой ст-связью С—С и четырьмя ст-связями С—Н (соответствующие ст-орбитали на рисунке не показаны, чтобы не усложнять его).
Сколько электронов находится на обсуждаемых р-орбиталях?
• Один -► 81
• Два -> 44
• Четыре -> 74
Химическая связь (II)
503
31. Правильно. Два электрона в атоме гелия занимают одну и ту же орбиталь, но различаются в другом важном отношении: они имеют противоположные спины. Спин электрона -это квантовохимическая характеристика, которую можно уподобить вращению волчка. Такое вращение может происходить в двух противоположных направлениях, и поэтому спин обозначают стрелками: J или [. Если два электрона имеют противоположные спины, это схематически изображают при помощи символа: U.
Поскольку два электрона в атоме гелия обладают противоположными спинами, в этом случае выполняется принцип Паули.
Сформулируйте принцип Паули и проверьте ответ в рубрике 43.
32. Правильно. Вероятность нахождения электрона медленно уменьшается в направлении от центра и быстро уменьшается в направлении к центру сферы. Медленное уменьшение вероятности в направлении от центра хорошо видно на рисунке б. Быстрое уменьшение в направлении к центру труднее показать на рисунке, поскольку оно происходит на очень небольших расстояниях от ядра. Вероятность нахождения электрона становится равной нулю на самом ядре, т. е. в центре сферы.
Сферическое распределение вероятности нахождения электрона называется s-орбиталь.
Поскольку орбиталь не описывает точное положение электрона в пространстве, а только вероятность его нахождения, орбитальная модель атома находится в соответствии с принципом неопределенности Гейзенберга.
Сформулируйте этот принцип и проверьте ответ в рубрике 40.
33. Атом углерода в состоянии хр2-гибридизации имеет три зр2-гибридные орбитали и еще одну р-орбиталь. Образование простой связи между двумя атомами углерода происходит в результате перекрывания двух таких хр2-орбиталей. После этого неиспользованными в образовании связей остаются две р-орбитали и еще ... зр2-гибридные орбитали. Завершите это предложение, вставив в него недостающее число, и переходите к чтению рубрики 46.
34. Неправильно. Основное (невозбужденное) состояние L-оболочки атома углерода описывается электронной конфигурацией
2s2, 2р1, 2р{,
Если 25-электрон перейдет на 2ргорбиталь, то она станет дважды занятой. Следовательно, при этом не будет достигнуто желаемое образование четырех однократно занятых орбиталей.
Вернитесь к рубрике 26.
504
Программа 25
35. Согласно принципу Паули, два электрона, занимающие одну и ту же орбиталь, должны иметь различные спины.
Дважды занятая (заселенная двумя электронами) s-орбиталь в атоме гелия соответствует К-оболочке, которая была описана в программе 1.
Каково максимально допустимое число электронов в К-оболочке?
• Один -> 25
• Два -► 20
• Восемь -> 3
• Не знаю -> 12
36. В программе 1 было рассказано о том, что за химические свойства элемента ответственно число электронов во внешней оболочке его атомов.
Переходите к чтению рубрики 29.
37. Правильно. Ниже показаны четыре $р3-орбитали.
Такая орбитальная модель согласуется с нашими сведениями о стереохимии соединений углерода. Четыре $р3-гибридные орбитали направлены к вершинам тетраэдра, в центре которого находится атом углерода. Когда они перекрываются с четырьмя s-орбиталями четырех атомов водорода, образуется молекула метана.
Как называются смешанные орбитали, подобные показанным на этом рисунке? Проверьте ответ в рубрике 70.
38. Принцип неопределенности Гейзенберга утверждает, что невозможно в один и тот же момент времени точно определить положение и импульс электрона.
Согласно изложенной в программе 1 оболочечной модели атома, электронные оболочки имеют строго определенные радиусы, которыми определяется точное расстояние между электронами и ядром, т.е. точное положение электронов. Кроме того, оболочечная модель атома в принципе позволяет точно определить импульс электрона.
Поэтому ясно, что оболочечная модель противоречит принципу неопределенности Гейзенберга.
Переходите к чтению рубрики 8.
Химическая связь (II)
505
39. Is2, 2s2.
На s-орбитали не может находиться больше двух электронов. Это согласуется с принципом Паули, который позволяет двум электронам занимать s-орбиталь при условии, что они имеют противоположные спины. Следующим элементом в периодической таблице является бор. У него уже не остается вакансии на s-орбитали, поэтому дополнительный электрон должен занимать р-орбиталь.
Следовательно, бор имеет электронную конфигурацию
Is2, 2s2, 2р2
Какую форму имеет р-орбиталь? Проверьте ответ в рубрике 48.
40. Принцип неопределенности Гейзенберга утверждает, что в один и тот же момент времени невозможно точно определить положение и импульс электрона.
Согласно другому закону атомной физики -принципу Паули, два электрона в одном и том же атоме не могут быть идентичными по всем своим характеристикам.
Атом гелия имеет два электрона. Могут ли эти два электрона занимать одну и ту же орбиталь (т.е. одну и ту же сферу вероятности)?
• Да, при условии, что эти два электрона отличаются
в каком-либо ином отношении -> 31
• Нет - 49
• Не понимаю вопроса -> 58
Неправильно. Рисунок в является лишь упрощенным вариантом рисунка б, а вовсе не изображением жесткой электронной оболочки в том смысле, как она была введена в программе 1. Поскольку распределение вероятности, показанное на рисунке б, сложно изображать и оно все равно не является точным, можно пользоваться грубо упрощенной формой такого изображения, представленной на рисунке в.
Внимательно рассматривая рисунок б, вы сможете правильно ответить на поставленный вопрос. Плотность точек на этом рисунке схематически изображает вероятность нахождения электрона. Эта вероятность не имеет резкой границы: рисунок б можно было бы продолжить в пространстве, указав на нем медленное уменьшение плотности точек.
Как изменяется вероятность нахождения электрона, начиная от области с максимальной плотностью?
• Медленно уменьшается в направлении от центра и быстро уменьшается в направлении к центру —► 32
• Медленно уменьшается в направлении к центру и быстро уменьшается в направлении от центра —► 14
• Вероятность повсюду одинакова —► 50
33 29
506
Программа 25
42. Неправильно. Два из электронов L-оболочки находятся на дважды занятой s-орбитали. Два другие находятся на однократно занятых р-орбиталях
2Ру
Согласно этой орбитальной модели следует ожидать, что углерод должен быть двухвалентным.
Какое условие должно быть соблюдено для образования четырех ковалентных связей между атомами?
• Наличие четырех электронов -> 5
• Наличие четырех электронов во внешней оболочке -> 13
• Наличие четырех однократно занятых орбиталей -> 26
43. Принцип Паули утверждает, что в атоме не может быть двух электронов, имеющих все идентичные характеристики.
Поскольку в атоме гелия два электрона находятся на одной орбитали, они должны различаться в каком-либо другом отношении: эти электроны имеют противоположные спины.
Схематически атом гелия можно представить следующим образом:
ядро
Здесь «жирная» окружность означает дважды занятую (т. е. занятую двумя электронами) орбиталь.
Какую форму имеют орбитали, на которых находятся электроны в атомах водорода и гелия? Проверьте ответ в рубрике 52, а если нуждаетесь в разъяснениях, обратитесь к рубрике 16.
44. Правильно. Два р-электрона.
Вторая связь С—С образуется в результате перекрывания этих двух р-орбиталей, как показано на рисунке:
Эта связь, образованная двумя параллельно ориентированными р-орбигалями, называется л-связь.
Химическая связь (II)
507
Как образуются ст- и л-связи?
Проверьте ответ в рубрике 67, а если вы нуждаетесь в разъяснениях, обратитесь сначала к рубрике 69.
45. Неправильно. 2рх-Орбиталь дважды заполнена и, следовательно, не может вовлекаться в образование химических связей. Для этого требуются однократно заполненные орбитали. Вернитесь к рубрике 71.
46. Правильно, четыре.
Четыре гибридные орбитали образуют в молекуле этена четыре связи С—Н. Орбитали, в результате перекрывания которых образуются эти связи, показаны на следующем рисунке:
Н s SP2 Р~\ SP2 s Н
ррг
|-| s spz sp2 s |-|
Какие орбитали атомов углерода остаются еще после этого неиспользованными и могут принять участие в образовании двойной связи С С? Проверьте ответ в рубрике 30, а если вы нуждаетесь в дополнительных разъяснениях, обратитесь сначала к рубрике 69.
47. Рисунок, приведенный в рубрике 57, схематически изображает атом гелия с двумя электронами на s-орбитали.
Находясь на одной орбитали, электроны должны в соответствии
с принципом Паули различаться в каком-либо ином отношении.
Чем они различаются? Проверьте ответ в рубрике 35.
48. р-Орбиталь имеет форму гантели, как это показано ниже:
Существуют три такие орбитали, направленные под прямыми углами друг к другу.
Учитывая это, укажите, сколько р-электронов может располагаться на L-оболочке?
• Три -► 63
• Шесть -> 56
• Восемь -> 72
2
33*
508
Программа 25
49. Неправильно. Принцип Паули утверждает, что в атоме не могут находиться два электрона, имеющие все идентичные характеристики. Однако два электрона в атоме гелия могут занимать одну и ту же орбиталь при условии, что они различаются в каком-либо ином отношении.
Продолжайте чтение с рубрики 31.
50. Ваш ответ показывает, что вы не понимаете, о чем идет речь. Еще раз внимательно прочтите рубрику 16.
51. Правильно. Какое условие должно быть выполнено, чтобы атом способен был образовывать четыре химические связи?
• Атом должен иметь четыре электрона -> 5
• Атом должен иметь четыре электрона
в валентной оболочке -> 13
• Атом должен иметь четыре однократно занятые -> 26
орбитали
52. Орбитали, на которых находятся электроны в атомах водорода и гелия, имеют сферическую форму. Они называются s-орбитали.
Существуют орбитали с другими формами. Ниже показаны две возможные формы таких орбиталей
d-орбиталь
Верхние рисунки схематически изображают вероятность нахождения электронов в определенной области пространства. Нижние рисунки являются более упрощенными изображениями этих орбиталей.
Левая орбиталь называется р-орбиталь, а правая - d-орбиталь. Посмотрите на верхнее изображение р-орбитали и опишите область (или области) пространства с наибольшей вероятностью нахождения электрона.
Проверьте ответ в рубрике 60.
53. Правильно. Остается всего шесть хр2-орбиталей. Их перекрывание с шестью ст-орбиталями атомов водорода приводит к образованию шести связей С—Н.
Химическая сини. (В)
509
В молекуле бензола образуется шесть ст-связей С—С и еще шесть ст-связей С—Н, и все они лежат в одной плоскости. Но атомы углерода имеют еще шесть р-орбиталей. Какова ориентация этих р-орбиталей относительно плоскости, образуемой ст-связями?
Проверьте ответ в рубрике 73.
54. Правильно. В образовании химических связей между атомами могут принимать участие только однократно занятые атомные орбитали.
В атоме кислорода однократно занятыми орбиталями являются две взаимно перпендикулярные орбитали 2ру и 2pz. Молекула воды образуется в результате перекрывания этих орбиталей с двумя водородными ^-орбиталями, как это схематически изображено ниже
Слева на рисунке показаны атомные орбитали (АО), а справа-молекулярные орбитали (МО).
Какова величина угла Н—О—Н в образующейся молекуле воды?
Проверьте ответ в рубрике 62.
55. Неправильно. Ваш ответ соответствует конфигурации возбужденного состояния углерода, а не гибридизованного состояния.
Вернитесь к рубрике 69.
56. Правильно. L-Оболочка может принять шесть р-электронов плюс еще два s-электрона, что дает в сумме уже известные нам восемь электронов. Ниже показаны четыре орбитали, образующие L-оболочку
510
Программа 25
Эти четыре орбитали имеют общий центр--ядро атома. Три р-орбитали вместе дают следующую картину:
Таким образом, так называемые «оболочки» представляют собой не что иное, как просто совокупность орбиталей.
Построение электронных конфигураций других элементов периодической системы осуществляется последовательно, аналогичным способом: для каждой «оболочки» приходится добавлять новые орбитали.
Перейдем теперь к описанию образования химических связей в рамках орбитальной модели.
Когда две однократно заполненные орбитали, принадлежащие различным атомам, перекрываются друг с другом, образуется химическая связь, которая состоит из новой орбитали, общей для этих двух атомов. Два электрона на этой новой связывающей орбитали должны иметь различные спины. Почему?
Проверьте ответ в рубрике 64.
57. Атом водорода Н; один электрон; s-орбиталь.
А что означает следующее схематическое изображение?
Какой атом представляет эта схема? Сколько электронов в данном атоме? Как называется изображенная на рисунке орбиталь?
Проверьте ответ в рубрике 47. (Если вам неизвестен смысл «жирной»
окружности, прочтите объяснение в рубрике 65.)
58. Принцип Паули утверждает, что в атоме не может быть двух электронов, имеющих все идентичные характеристики. Однако два электрона в атоме гелия могут занимать одну и ту же орбиталь при условии, что они различаются в каком-либо ином отношении.
Переходите к чтению рубрики 31.
59. Неправильно. Сколько р-орбиталей не принимает участия в $р2-гибридизации у шести атомов углерода в бензольном кольце?
Вернитесь к рубрике 73.
5
Химическая связь (II)
511
60. Область вероятности нахождения р-электрона состоит из двух почти сферических лепестков, отделенных друг от друга атомным ядром
Вероятность нахождения электрона максимальна в центре каждого лепестка.
Обратите внимание на то, что р-орбиталь имеет пространственную ориентацию: она образует связи только в определенных направлениях.
Нарисуйте упрощенные формы р- и s-орбитали и проверьте ответ в рубрике 68.
61. Правильно: 2s2, 2 pi, 2р*.
Укажите теперь конфигурацию L-оболочки атома углерода в возбужденном состоянии. Проверьте ответ в рубрике 69.
62. Поскольку р-орбитали перпендикулярны друг другу, можно предсказать, что угол Н—О—Н в молекуле воды равен 90°. Однако две занятые молекулярные орбитали между атомом кислорода и каждым из атомов водорода отталкиваются друг от друга, вследствие чего угол Н—О—Н увеличивается до 107 :
Рассмотрим теперь атом углерода. Его Е-оболочка имеет конфигурацию
Мы уже знаем, что углерод в его соединениях четырехвалентен. Согласуется ли этот факт с орбитальной моделью атома углерода?
• Да - 42
• Нет -> 51
512
Программа 25
63. Неправильно. Существуют три р-орбитали, но на каждой из них может располагаться по два электрона (с противоположными спинами). Сколько же р-электронов может находиться на L-оболочке?
Проверьте ответ в рубрике 56.
64. В соответствии с принципом Паули два электрона, занимающие одну и ту же орбиталь, не могут быть полностью идентичными. Следовательно, они должны иметь противоположные спины.
Поскольку никакая орбиталь не может принять больше двух электронов, связывающие орбитали чаще всего образуются в результате объединения двух однократно занятых атомных орбиталей. Это иллюстрируется образованием молекулы водорода:
н ♦ н -----------*- н2
Обратите внимание, что новая связь между двумя атомами соответствует связывающей орбитали. Такая орбиталь называется также молекулярная орбиталь (МО) в отличие от двух атомных орбиталей (АО), из которых она получена.
Опишите словами, как происходит образование молекулы водорода: орбитали, содержащие валентные электроны атомов водорода, ....
Проверьте ответ в рубрике 71.
65. «Жирные» окружности изображают орбитали, занятые парами электронов. Вернитесь к рубрике 57.
66.
/
р^~ орбиталь s-орбиталь р-орбиталь
р^-орбиталь
Рассмотрим теперь, пользуясь орбитальной моделью, как происходит заполнение электронных оболочек атомов у различных элементов периодической системы. Какой атом схематически изображен на следующем рисунке?
или
Химическая связь (II)
513
Укажите символ соответствующего элемента. Сколько электронов имеет его атом? Как называется орбиталь, изображенная на рисунке?
Проверьте ответ в рубрике 57, а еслй вы нуждаетесь в разъяснениях, обратитесь к рубрике 16.
67. Образование о-связи происходит в результате перекрывания $р2-орбиталей, а образование л-связи-в результате перекрывания р-орбиталей, ориентированных параллельно друг другу.
Орбитальная модель показывает, что две связи, образующие двойную связь С=С, не идентичны, а это обстоятельство не обнаруживается в структурной формуле молекулы этена
н н
X н н
Вследствие менее сильного перекрывания параллельных р-орбиталей л-связь оказывается менее прочной и, следовательно, более реакционноспособной, чем ст-связь. Укажем, например, что именно л-связь разрывается в ходе реакций присоединения, которые рассматривались в программе 8.
В программе 9 было дано приближенное описание характера химической связи в молекуле бензола. Орбитальная модель позволяет дать более глубокое объяснение этой связи. С этой ..целью начнем с рассмотрения 5р2-гибридизованного атома углерода. Какие орбитали имеются в L-оболочке такого атома?
Проверьте ответ в рубрике 82.
68.
у- орбиталь
р-орбиталь
Не забывайте, что эти изображения являются грубо схематическими! В действительности электронное облако не имеет точных границ.
Сферическая s-орбиталь простирается равномерно во всех направлениях пространства. В отличие от этого р-орбитали имеют направленность, простираясь каждая вдоль одной из трех главных осей декартовой системы координат. По этой причине три р-орбитали обозначаются символами рх, ру и р2.
514
Программа 25
Все четыре орбитали, разумеется, имеют общий центр-ядро атома. Дайте словесные описания формы этих орбиталей!
s:
Рх:
Ру-
Pz;
Проверьте ответ в рубрике 76.
69. L-Оболочка атома углерода имеет следующую электронную конфигурацию: 2s2, 2рх, 2р1у
Образование 5р3-гибридных орбиталей является только одним из возможных способов смешения орбиталей. Возникающие после перехода 25-электрона четыре однократно занятые орбитали
2s1, 2pl, 2ру, 2pz
можно смешать еще таким образом, чтобы поучились 5р2-гибриды. Каждая 5р2-гибридная орбиталь образуется из одной s- и двух р-орбиталей.
Укажите, какая электронная конфигурация образуется после возникновения зр2-орбиталей.
• 2s1, 2pl, 2ру, 2р1 -> 55
• 2(sp2)3, 2р! -> 77
• 2(sp3)4 -> 83
70. Смешанные орбитали называются гибридные орбитали.
Химическая связь в этане аналогична описанной выше в молекуле метана. Каждый атом углерода связан с тремя атомами водорода в результате перекрывания водородных ls-орбиталей с тремя 5р3-орбиталями атома углерода.
У каждого атома углерода имеется еще одна (четвертая) $р3-орбиталь. Перекрывание двух таких орбиталей приводит к образованию простой связи С—С, а образуемая орбиталь называется а-орбиталь, и соответствующая ей связь называется а-связъ.
Для того чтобы описать образование двойной связи С=С, нужно снова начать с рассмотрения L-оболочки атома углерода в основном состоянии. Укажите ее электронную конфигурацию.
• 2s2, 2pi, 2ply -> 61
• 2s1, 2px, 2py, 2pl -> 10
• 2(sp3)4 -> 21
71. Атомные орбитали (АО) двух атомов водорода перекрываются друг с другом, образуя новую орбиталь, общую для двух атомов (связывающую молекулярную орбиталь, МО).
Образование молекулы воды можно описать аналогичным образом.
Начнем с атома кислорода. Электронная конфигурация его L-оболочки имеет следующий вид:
5
Химическая связь (II)
515
В этой оболочке имеется шесть электронов и четыре орбитали, две из которых дважды заняты электронами. (Объяснение конкретной электронной конфигурации, показанной на рисунке, возможно только с помощью правила Гунда. Недостаток места не позволяет нам излагать его здесь, но интересующиеся читатели могут познакомиться с этим правилом в учебниках по атомной физике.)
Какие из четырех показанных выше орбиталей могут вовлекаться в образование химических связей?
• 2s2 -> 78
• 2pi 84
• 2ру, 2pz -> 54
• 2р2, 2ру, 2р\ -> 45
• Не знаю -> 19
72. Неправильно. L-Оболочка может принять всего восемь электронов, но два из них являются s-электронами.
Сколько же р-электронов может разместиться на L-оболочке?
Вернитесь к рубрике 48.
73. р-Орбитали атомов углерода перпендикулярны плоскости бензольного кольца
На этом рисунке ради простоты шесть ст-связей С—С изображены тонкими линиями. По этой же причине на рисунке вообще не показаны атомы водорода и их связи с атомами углерода.
Параллельные р-орбитали участвуют в боковом перекрывании, что приводит к образованию протяженной л-связи.
516
Программа 25
Сколько электронов участвует в образовании этой л-связи?
• Три -<• 24
• Шесть 80
• Двенадцать -► 59
74. Неправильно. Каждая из двух р-орбиталей является однократно занятой. Напомним, что вначале каждый атом углерода имел четыре однократно занятые орбитали. После гибридизации три орбитали были использованы для образования ст-связей.
Вернитесь к рубрике 30.
75. Неправильно. Каждый $р2-гибридизованный атом углерода имеет три $р2-орбитали. Шесть атомов углерода соединены в кольцо шестью ст-связями. Для образования шести ст-связей требуется 12 атомных орбиталей, т. е. 12 электронов. Сколько $р2-орбиталей остается еще неиспользованными после этого? Проверьте ответ в рубрике 53.
76. Орбиталь s: Рх: pv: pz:
Форма сфера гантель гантель гантель
Укажите названия четырех орбиталей, изображенных выше. Проверьте ответ в рубрике 66.
77. Правильно. $р2-Гибридизованный атом углерода описывается орбитальной конфигурацией 2(sp2)3, Ip1. Ниже показано пространственное расположение орбиталей этой конфигурации
Химическая связь (II)
517
р-Орбиталь перпендикулярна плоскости, образуемой тремя хр2-орбиталями.
Каждая р-орбиталь простирается равномерно в одну и другую стороны пространства относительно ядра. В отличие от этого гибридные орбитали вытянуты преимущественно в одном направлении. В противоположном направлении зр3-орбиталь простирается гораздо меньше, образуя так называемый задний лепесток; такие лепестки хорошо видны на рисунке, помещенном в рубрике 27. Ради простоты на рисунке, помещенном в данной рубрике, задние лепестки зр2-орбиталей не показаны.
В молекуле этена (этилена) два атома углерода соединены ст-связью, образуемой в результате перекрывания двух зр2-орбиталей. Сколько зр2-орбиталей остается еще после этого на двух атомах углерода?
• Два -» 33
• Четыре -> 46
• Шесть -> 11
78. Неправильно. Обозначение 2s2 означает дважды занятую 2з-орбиталь. В образовании химических связей участвуют только однократно занятые орбитали. Вернитесь к. рубрике 71.
79. Неправильно. Числа в выражении 2(sp3)4 имеют следующий смысл:
2-номер оболочки, к которой принадлежат орбитали (в данном случае L-оболочка).
3-число р-орбиталей, используемых для зр3-гибридизации.
4-число электронов, занимающих гибридизованные орбитали.
Сколько же зр3-орбиталей в L-оболочке атома углерода? Переходите к рубрике 37.
80. Правильно. В бензоле имеется шесть л-электронов. Циклическая структура системы из шести л-электронов в молекуле бензола особенно благоприятна в энергетическом отношении и обеспечивает повышенную устойчивость ароматических соединений (см. программу 9). Общая стабилизация л-системы бензола превышает стабилизацию трех изолированных л-связей.
Мы продемонстрировали здесь лишь некоторые возможности применения орбитальной модели. Эта модель имеет важное значение и для других областей химии, например для описания комплексов, образуемых переходными элементами.
Но какими бы важными ни были подобные модели, нужно отчетливо понимать, что они лишь приближенно описывают действительность. Каждая модель применима для описания определенных наблюдений и для получения новых предсказаний. Однако возможны случаи, когда для удовлетворительного
25
518
Программа 25
описания всех известных фактов приходится применять несколько различных моделей или постулатов. Если же какая-либо модель противоречит экспериментальным наблюдениям, ее приходится модифицировать или совсем отказаться от нее. Можно лишь надеяться на создание моделей, которые будут все больше приближаться к реальной действительности. Процесс познания никогда не кончается.'
Конец программы 25.
81. Неправильно. На каждой из двух р-орбиталей находится по одному электрону, следовательно, всего на них находится два электрона.
Переходите к чтению рубрики 44.
82. зр2-Гибридизованный атом углерода имеет следующую конфигурацию L-оболочки:
2(sp2)3, 2р’
В молекуле бензола шесть зр2-гибридизованных атомов углерода образуют шесть ст-связей друг с другом.
Сколько зр2-орбиталей остается неиспользованными после этого у шести атомов углерода?
• Шесть - 53
• Двенадцать -> 75
• Не знаю -+ 69
83. Неправильно. Ваш ответ соответствует зр3-гибридизованному атому углерода, тогда как поставленный вопрос относится к зр2-гибридизации!
Вернитесь к рубрике 69.
84. Неправильно. 2р2-Орбиталь дважды заполнена. Однако в образовании химических связей между атомами могут принимать участие только однократно заполненные орбитали.
Вернитесь к рубрике 71.
5
Предметный указатель
При работе над учебником предполагается, что каждая входящая в него программа будет проработана в одни прием. Помещенный ниже предметный указатель составлен в помощь читателю с целью необходимого для дальнейшего прохождения курса повтр-рения отдельных тем.
В каждом случае жирным шрифтом указан номер программы, а светлым шрифтом -соответствующие рубрики, где находится конкретное понятие.
Адипиновая кислота 23/21
Азосоединения 22/52,62
Азот
группа 4/8
количественное определение в органических соединениях 22/51
молекула, электронная конфигурация 2/22
Азотная кислота, этиловый эфир 18/25
Азотистая кислота 22/2,4
реакция с аминами 22/5,18
Акрилонитрил 23/19
Актиний 1/100
Актиноиды 4/14
Алкалоиды 24/52
Алканы 8/71,9/25
Алкены 8/10,47,71, 9/25
присоединение галогенов 11/15
- галогеноводородов 11/13
Алкилгалогениды, гидролиз 12/46
Алкилирование 21/54, 22/19,39
аминов 21/78
Алкнлируюшие агенты 22/6
Алкилхлориды 12/56
Алкины 8/51, 9/25
Алкоголяты 12/69 гидролиз 12/71,85
Альдегиды восстановление до первичных спиртов 15/13,21
номенклатура 14/4,33, 15/16
окисление 15/16
определение 14/24
получение из первичных спиртов 14/31
свойства физические 14/74
Альдольная конденсация 16/18,62
условия 16/45
Алюминия гидроксид 4/53
амфотерность 4/82
Алюмотермнческий процесс 5/61
Амальгамы 5/44
Амиды 19/42
замещенные 22/13
получение из ангидридов 19/18
- - солей аммония 19/13
- - хлоридов кислот 19/18
расщепление по Гофману 21/54
Аминокапроновая кислота 23/25
Аминокислоты 24/1
2-Аминопропионовая кислота 24/3
3-Аминопропионовая кислота 24/3
Амины 21/41
вторичные 21/14,28,41
первичные 21/14,28,41
получение 21/69
реакции с азотистой кислотой 22/5,18,53
- - фосгеном 22/15
свойства физические 21/92
- химические 21/84, 22/1
соли 21/84
третичные 21/14,41
Аммиак
аддукты с альдегидами 15/35,59
молекула, электронная конфигурация 2/4
Аммониевые соли четвертичные 21/59
Амфотерность 4/82
Ангидриды внутренние 19/25,32
Анилин 21/18
получение из бензола 21/51
Анион 2/32
комплексный 2/52
Анод 2/32
Аргон, строение атома 4/50
Ассоциация 13/52,57
Асфальт 9/79
Атом 1/1
валентность 2/25
масса относительная 1/50,58
модель оболочечная 1/1,22, 25/29
- орбитальная 25/29,52
строение 1/1,48,64,76, 4/40,45,50
центральный 2/14
Атомное ядро 1/1
Атомный (порядковый) номер 4/1
Ацетальдегид см. Уксусный альдегид
Ацетамид 19/13
получение из ацетата аммония 19/5
- - уксусного ангидрида 19/26
Ацетат 17/70, 18/12
ион 3/10
Ацетилен 8/42,51
получение из карбида 8/58
— метана 8/65
присоединение галогенов 11/17
Ацетилхлорид 18/64
получение нз уксусной кислоты 18/74
Ацетон
оксим 15/38
получение из кумола 14/26,52,63
— уксусной кислоты 14/16
присоединение бисульфита натрия 15/36
циангидрин 15/55
Ацетонитрил 19/52
получение из ацетамида 19/52
Ацетофенон 14/58
Ацилирование 22/6,19,39
Ацилирующие агенты 22/6
520
Предметный указатель
Бария гидроксид 4/64
Белки 24/1,12
Бензальдегид 14/56,57,69, 16/58
получение из бензилового спирта 14/76
— толуола 14/76
присоединение бисульфита иатрия 15/36
Бензальхлорид 14/76
Бензамид 19/13
получение из бензилхлорида 19/18
Бензидин 22/62
Бензилметилкетон 14/19
Бензилметидрвый эфир 13/15
Бензиловый спирт 12/49,72, 14/57,80,83
Беизилхлорид 10/23
гидролиз 11/46
Бензильный радикал 9/75
Беизин 9/79
Бензоаты 17/70, 18/12
Бензоилхлорид 18/72
получение из бензойной кислоты 18/81
Бензойная кислота 17/25
получение из бензальдегида 17/25
- - толуола 17/64'
эфир метиловый 18/19
- фениловый 18/78
- этиловый 18/12,48
Бензойный альдегид 19/25
Беизол 9/19
кольцо 10/48, 25/73
г нумерация атомов 10/44
распределение электронов 9/20, 25/80
- связи 25/67
- структура 9/27 •
хлорирование 10/42
Бензолсульфамид 20/2
Беизолсульфокислота 20/30
Беизолсульфохлорид 20/2,14
Бензонитрил 20/15
Беизофенои 14/58
Бериллий, электронная конфигурация 25/28
Бисфенол А 23/37
Благородные газы 2/12, 4/8,93
электронная конфигурация 2/23,56
Благородные металлы 5/25,34
как катализаторы восстановления 15/3,7,11
проба (стандарт) 5/20
Бор 25/28
группа 4/8
Брожение 12/45,58
Бром как окислитель 6/5,21
Бромбензол 10/56
Бромирование 10/49,56
зтилена 11/1
Бромэтан 11/23
Бутадиен 8/10
Бутан 8/1,57
Бутаналь см. Масляный альдегид
Бутен 8/61
Бутиловый спирт (бутанол) 12/36, 14/44
Бутильная группа 8/46
Буферный раствор 3/16,17,39
Валентность 1/61, 2/25
изменение 6/51
символ (связь) 2/22,50
Ванадий 5/17
пентоксид 5/37 г
Винилбеизол (стирол) 23/20
Винилхлорид
получение из ацетилена 11/32
— 1,2-дихлорэтаиа 11/39,51
Винилцианид 23/19
Вииильиый радикал 9/83
Виииый уксус 17/48
Вода, молекула
орбитали 25/54
структура 25/54
электронная конфигурация 2/4
Водород
атом, строение 1/48,64
- орбиталь электрона 25/16
в момент выделения 15/3
ион 3/15
- концентрация в воде 3/75
каталитически активированный 15/3,4
молекула, орбитали 25/56
- электронная конфигурация 2/21
соединения
- кислотность 4/44,54,63,77,91
- с галогенами 4/54
тяжелый 1/68,101
хлорид 2/13
цианид 3/22
Водородные связи 13/40, 24/6
Восстановитель 6/26,36
сила 6/18,46
Восстановление 6/1,62
кетоиов 15/22
металлов 5/9 ;
нитросоединений 21/19
хинонов 14/55
Волокна синтетические 23/4,12,19
Вольфрам, применение 5/11
Выход реакции 10/43
расчет 10/51
Газ природный 9/72
Галогены 4/8
как окислители 6/14,31
присоединение к алкенам 11/15
— ацетилену 11/17
производные, диссоциация 11/39
- замещение Hal на ОН 11/46
- углеводородов, обнаружение 11/71
— отщепление НС1 11/68
— применение 11/24
— реакции 11/68
— свойства 11/43
Галогенирование 10/56
Галогеиоводороды 11/13,15
применение 11/24
присоединение к алкеиам 11/13
Гейзенберга принцип неопределенности
25/16,29,40
1,6-Гексаметилендиамин 23/3
Гексан 8/22
Гексильная группа 8/59
Гелий 25/31
строение атома 1/64
электронная конфигурация 25/28
а-частицы 1/60
ядра 1/83,109
Предметный указатель
521
Гемоглобин 24/52,66
Гетероатом 24/61
Гетероцикл 24/61 гидрирование 24/65
Гибридизация 25/27
Гидрид-ион 4/91
Гидрирование 8/3,47, 9/2,3
гетероциклов 24/65
катализаторы 5/65, 8/47, 15/3,22
каталитическое 8/47 нитросоединений 21/19,65 условия 15/22
Гидроксиламин 15/48,59
Гидроксильная группа 12/1
Гидрокситолуолы 12/70
Гидролиз 3/95, 18/42,45,46
Гидропероксиды в кумольном процессе 14/52
Гидроформилирование 14/26
Гидрохинон 14/55,62
Гликоль 12/67
Глицерин 12/67
синтез 12/87
применение 12/77
Глюкоза 24/8,21
Гомологический ряд 8/29
Гомополимеры 23/20
Горение 9/51
Гофмана расщепление 21/54
Гриньяра реактивы 11/69
получение 11/76
реакции с водой 11/58
Группы элементов 1/74, 4/17
главные 4/6,35,67
и количество электронов во внешней оболочке 4/17
названия 4/8
побочные 4/6,35,51,67
расположение переходных элементов 4/6 число 4/8,13
Двойные стрелки 3/11,22
Дегидрирование 8/2^, 9/2,3
спирта 14/31
- вторичного 14/17
- изопропилового 14/11
- этилового 14/11
Дейтерий 1/68
строение атома 1/48
Декарбоксилирование 17/82 Деполимеризация 16/13,23 Детергенты 20/42
Диазония соли 22/21
свойства 22/34
сочетание 22/46
Диазотирование 22/27
Диалкилсульфиды 13/37,47
номенклатура 13/60
1,1- Дибромэтан 11/5
1,2- Дибромзтан 11/1
Дизельное топливо 9/72 1,6-Диизоцианатогексан 23/52 2,4-Диизоцианатотолуод 23/73 1,2-Дииодэтан 11/5
Дикарбоновые кислоты 17/78
Димеризация 16/3,21
Диметиламин 21/17,28
34-29
Диметиламмония хлорид 21/65 Диметилкетон 14/9,22 Диметиловый эфир 13/21 Диметилпропан 8/38,60 Диметилсульфат 18/17 Диметилсульфид 13/50 Диметилсульфоксид 13/46 Диметилсульфон 13/46 НМ-Диметил-и-толуидин 21/75 Диметилэтиламин 21/29 Диолен 23/12
Диспропорционирование 16/61
Диссоциация
константа 3/2,10
- для уксусной кислоты 3/2 равновесие 3/11,52,63
реакции 3/11
степень 3/64
уравнение 3/22
электролитическая 3/35 - карбоновых кислот 17/46 - гидроксида натрия 3/46 - нитрата натрия 3/4 - соединений галогенов 11/39 - соляной кислоты 3/46 - сульфата натрия 3/4 - хлорида калия 3/4
Дифенилкетон 14/19,78
Дихлорбензол 10/15,39,44 Дихлордифторметан 11/70 Дихлорметан 10/19 1,1-Дихлорпропан 11/13 Дихлоруксусная кислота 17/26 1,1-Дихлорэтан 11/22 1,2-Дихлорэтан 11/22 1,2-Дихлорэтен 11/17, 17/58 Диэтилкетон 14/2 Диэтиловый эфир 13/21 получение из этанола 13/43
Диэтилсульфат 18/17
Дралбн 23/19
Железа оксид 5/40 гидратированный 5/40 как пигмент 5/40, 21/51
Жирные кислоты 17/38
получение 17/29 соли 17/84, 24/21
Жиры 24/1,23 омыление 24/32,42,69
Закон действия масс 3/2,20 применение при диссоциации воды 3/79 ----- серной кислоты 3/53 -----сероводорода 3/53,96 -----фосфорной кислоты 3/96 -----цианида 3/15 — этерификации 18/3
Замещение 10/18
в бензольном кольце 20/13,34 правила 20/13,59
Зандмейера реакция 22/49,54
Заряд
элементарный 1/24 ядра 1/13, 4/1
Защитные покрытия 5/70
Золото 5/25 хлорид 7/17
Излучение 1/98 рентгеновское 1/109 а, 0, у 1/109
Изомасляная кислота 17/24 Изомерия оптическая 17/62 цис-транс 17/58
Изомеры 8/57,67
Изопропилбензол 14/26,52,82 гидропероксид 14/52,82
Изопропиловый спирт 12/44 дегидратация 14/11
Изотопы 1/48,89 природные 1/80 разделение 1/53 смесь одного элемента 1/53
Изоцианаты 22/14 Иодбеизол 10/56 Иодирование 10/49,56 2-Иодпропаи, отщепление HI 11/59 Ион 2/16,17 заряд 2/48 кристаллическая решетка 2/75 связывание 2/16,27
Иониое произведение воды 3/40,56,62 Ионные уравнения 6/5 Иридия тетрахлорид 5/5
Кадмий желтый 5/51
Калий, строение атома 4/45 Кальция гидроксид 4/64 Каменноугольная смола 9/73 Канниццаро реакция 16/43,58,61,62 Капролактам 15/52 полимеризация 23/14
Карбоксильная группа 17/1 Карбонильная группа 14/1 активация а-водорода 16/25 реакции присоединения 15/18,33 — бисульфита натрия 15/36 Карбонильные соединения 14/3 полимеризация 16/1 получение 14/19,31,37 свойства химические 15/1,10,13
Карбоновые кислоты 17/1 алифатические 17/8 амиды 19/13,18,42, 21/54 ангидриды 19/1 - получение 19/19,29,31 - реакции 19/51 — с водой 19/51 — спиртами 19/59 — фенолом 19/59 ароматические 17/25 декарбоксилирование 17/82 диссоциация 17/46 ненасыщенные 17/60 образование солей 17/59 получение из алкилгалогенидов 19/58 -- нитрилов 19/57 — сульфокислот 20/3 свойства 17/59 хлорангидрид 18/43
- получение 18/72
- реакции с водой 18/65 — спиртами 18/57 фенолом 18/58
Катализ реакций гидрирования 8/47, 15/3,22 - Зандмейера 22/54 хлорирования в кольцо 10/14
Катализаторы гидрирования 5/65 окисления 5/65
Катионы 2/32,53 комплексные 2/62 металлов 4/81
Катод 2/32
Каучук природный 23/80
Керосин 9/79
Кетоны 14/10 восстановление 15/22 - до вторичных спиртов 15/22 номенклатура 14/9 получение из вторичных спиртов 14/7
Кислород, группа 4/8 Кислоты карбоновые см. Каобоновые кислоты сила 4/44,64
Кислотность 4/44,64
Комплексные анионы 2/52 х
ионы 2/15 соедииеиия 2/52 соли 2/52 Концентрация, обозначения 3/63 Координационное число 2/14 Красители 22/52 Крезолы 12/70 Крекинг 9/31 Кремниевая кислота 4/53 Кристаллическая решетка 2/55,75 Ксилол 9/43,50,55 .м-Ксилол 9/37 о-Ксилол 9/37 окисление 17/73 п-Ксилол 9/37 окисление 17/73
Кумол см. Изопропилбензол
Кумольный процесс получения фенола и ацетона 14/26,52
Лантаноиды 4/2,14
Латунь 5/12
Лексан 23/12
Лиганд 2/14
Литий гидроксид 4/91 изотопы 1/48 электронная конфигурация 25/28 строение атома 1/64
Магний иои 2/59 - заряд 2/39 органические соединения 11/76 получение 5/9 сталь 5/45 сульфат 5/59
523
сульфид 2/9 хлорид 2/59
Мазут 9/79
Макролон 23/12
Макромолекула 8/3, 16/3,14
Малеиновая кислота 17/58,67 ангидрид 19/25 - получение 19/11
Марганцовая кислота 5/85
Масляная кислота 17/16
Масляный альдегид 14/4,44 присоединение аммиака 15/59
Масса
атомная 1/80 нейтрона 1/31 протона 1/31 электрона 1/31
Медь, использование 5/4
Металлический характер 4/39,49,59,64
Металлоорганические соединения 11/76 Металлы 4/26,39,79
восстановительные свойства 6/24.45 получение 5/28,81 связывание 2/17
Метан 8/1 связывающие орбитали 25/37
Метаналь см. Формальдегид
Метанол 12/21
получение нз водяного газа 12/48 свойства 12/58
Метантиол 13/38
Метиламин 21/28
Метиланилин 21/18,47
Метилбензоат 18/19
Метилбутан 8/38
Метилдиэтиламин 21/29
Метилпропилкетон 14/9
N-Метил-и-толуидин 21/75
Метилтриэтиламмония хлорид 21/57 Метилфенилкетон 14/2,19,78 Метилфениловый эфир 13/2 Метилформиат 18/29 Метилхлорид 10/12
Метилэтиламин 21/29
Метилэтилкетон 14/2, 15/35 Метилэтилсульфид 13/50 Метильная группа 8/46,53,59 Молочная кислота 17/44 оптические изомеры 17/62
Моноалкены 23/56
Мономер 16/3
Мочевина 19/45
производство 19/53
Муравьиная кислота 17/8 получение 17/20,36 распространенность в природе 17/8 эфиры 18/12,29
Мыла 17/84, 24/21
Найлон 23/9,14,15
Натрий 2/38
алюминат 4/62
ацетат 3/26
бисульфит, аддукты с органическими соединениями 15/36
ванадат 5/76
вольфрамат 5/76
гидросульфит 15,36
ион 2/27
- заряд 2/39
метилат 12/75
перманганат 5/59
перхлорат 5/59'
строение атома 2/38
сульфат 5/59
сульфид 2/9
тиолят 13/35
хромат 5/59
хлорид, кристаллическая решетка
2/53,55,75
этилат 12/75
Нафталин 9/62
Нафталинсульфокислота 20/9
Нейтрон 1/1,3
масса 1/31
Неметаллы 4/39,79
как окислители 6/31
свойства 4/39,49,59,64
Непереходные (типические) элементы 4/35
Нефть 9/15,72
крекинг 9/31
перегонка 9/79
Неэлектролиты 3/33
Никель
как катализатор 15/3,7.11
применение 5/4
Ренея (скелетный) 5/65
сталь 5/45
Никотин 24/52,68
структура 24/46,49,70
Нитрилы
гидролиз 19/41
получение 19/60
л|-Нитробензойная кислота 21/19
Нитробензол 21/12,21
восстановление до анилина 21/51
Нитрование 21/12
Нитрометан 21/1
Нитросоединения 21/1
ароматические 21/12
восстановление 21/56
номенклатура 21/1
свойства химические 21/19
Нитроэтан 21/12
Нитрующая смесь 21/10 ч
Нумерация атомов
' в алифатических соединениях 11 5
- бензоле 10/44
Обезвоживающие вещества 19/38,52
Обжиг 5/28
Огнетушители 11/36
Окисление
агенты 6/36
- галогены 6/14.31
сила 6/14,18
алифатических углеводородов 17/73
альдегидов 15/16
гидрохинона 14/62
карбонильных соединений 15/4
катализаторы 5/37,65
о- и н-ксилола 17/73
14’
524
Предметный указатель
определение 6/62
спиртов 14/31
- вторичных 14/7
- первичных 14/31
степень см. Степень окисления
толуола 17/64
ферментативно-каталитическое 17/48
Окисления-восстановления уравнения 7/1, 6/17,21,51
балансирование 7/21
составление 7/20,21,46,48,57,63
потенциал 6/10,55
Оксикислоты 17/34
Оксимы 15/38
Оксосинтез 14/26
Олефины см. Алкены
Омыление 18/32,42,69
Орбитали 25/64
атомные 25/54
гибридные 25/27
молекулярные 25/54
связывающие 25/56
- в бензоле 25/67
- - воде 25/54
- - водороде 25/56
- - метане 25/37
— этане 25/70
— этене 25/77
р 25/48,56,68
п 25/73
s 25/32
Орлон 23/19
Осмий
октафторид 5/16
тетраоксид 5/16
Основность 4/64,90
гидроксидов 4/72
Отщепление
НО от галогенорганических соединений 11/68
СО2 от карбоновых кислот 17/82
Палладий
тетрахлорид 5/5
чернь 5/65
Паральдегид 16/15
Парафины см. Алканы
Паули принцип запрета 25/40
Пенопласты 23/82
Пентан 8/1
Пентильная группа 8/59
Переходные элементы 4/3,6,35
анионы 5/48
валентность по отношению к кислороду 5/13
группы в периодической таблице 4/3,6,35
как защитные покрытия 5/70
катионы 5/48
получение 5/28,81
применение 5/4,11,42,80,83
распространенность в природе 5/36
Периодическая таблица 4/1
группы 4/1,13,17
- число 4/8,13
периоды 4/17,22
- длинные 4/9
- короткие 4/19
- число 4/13,22
подгруппы главные 4/6,35,67
- побочные 4/6,35
Период полураспада 1/59
Перлон 23/4
Пигменты 5/83, 21/51
Пикриновая кислота 21/9
Пиридин 24/50
Пириты 5/6
Пиррол 24/51,52,62
производные 24/66.
Пластификаторы (мягчители) 18/15, 23/6,17
Платина 5/25
оксид 5/5
применение 5/4
чернь 5/65
Полиакрилонитрил 23/19
Полиамиды 23/9,19
Поливинилхлорид 11/48, 23/5,17
Поликарбонаты 23/48
Поликонденсация 23/19,50, 24/38
Полимеризация 8/3, 9/2, 16/3, 23/13,20,50,
24/38
карбонильных соединений 16/1
этилена 8/3
Полимеры 16/3
линейные 23/66
разветвленные 23/67
синтетические 23/1
сшитые 23/59,66
термопластики 23/17
Полиприсоединение 23/50,52, 24/38
Полипропилен 8/10, 23/8,17,29
Полистирол 23/17,20
Полиуретаны 23/82
Полиформальдегид 16/14,21
деполимеризация 16/23
Полиэтилен 8/10
высокого и низкого давления 23/2,29
Полиэфир 23/4
ненасыщенный 23/69
Полиэфирные смолы 23/55,60
Полуацеталь 24/28
Превращение одного элемента в другой 1/59
Присоединение 11/8
бисульфита натрия к альдегидам и кетонам 15/36
галогенов к алкенам 11/15
--ацетилену 11/17
галогеноводорода к алкенам 11/13
гидроксиламина к карбоксильной группе 15/48
к альдегидам и кетонам 15/18,33
по двойной связи 15/31
циановодорода к уксусному альдегиду
15/34
ацетону 15/34
Произведение растворимости 3/76
Пропан 8/1
Пропанол-1 12/44
Пропанол-2 12/32,38
Пропен 8/55
получение из 2-иодпропана 11/59
Пропилен 8/55
Пропиловый спирт 12/44
Предметный указатель
525
Пропильная группа 8/46
Пропионаты \ЦП
Пропионовая кислота 17/16,44
Пропионовый альдегид 14/4
присоединение аммиака 15/59
- циангидрина 15/35
Протон 1/1, 3/10,15
заряд 1/3,37
масса 1/31
pH 3/8,87
значения 3/50
Равновесие 3/11
этерификации 18/45
Радиоактивный распад 1/98,105
Реакции
азосочетания 22/46,68
внутримолекулярные 13/25
конденсации 13/27
между металлами и ионами металла 6/3 межмолекулярные 13/25
окисления - восстановления 6/17,26,51
органические, отличие от неорганических
•0/47
Реакционная способность 13/4 (
влияние функциональной группы 16/7
Ртуть, применение 5/11
Рутений
(IV) оксид 5/5
(VIII) оксид 5/16
Сахар 24/20
Связи
двойные 2/21, 8/47, 25/46
- реакционная способность 15/9
ионные 2/16,67
ковалентные 2/9,67
- в рамках орбитальной модели 25/56
образование 2/67
простые 2/21
типы 2/67
тройные 2/21, 8/42
Сера ,
валентность 1/61
в органических соединениях 13/45
--обнаружение 13/46
строение атома 1/76
Сераорганические соединения 13/47
Серебро 5/25
применение 5/4
хлорид, растворимость 3/76
Серная кислота 4/53
диэтиловый эфир 18/17
Смазочные масла 9/79
Соединения
ионные 2/63
ковалентные 2/63
Сополимеризация 23/20
Сополимеры 23/20
Спин 25/31
Спирты
вторичные 12/4,25,40
- дегидрирование 14/17
многоатомные 12/74
номенклатура 12/6,34
отщепление воды 12/38, 13/25
первичные 12/24,25
- окисление 14/31
получение 12/49
- из алкилгалогенидов 12/34,46
— аминов 22/9
применение 12/49
реакции с ангидридами 19/59
- - хлорангидридами 18/48,57
третичные 12/17,25
Сплавы 5/24,44,66
Сталь 5/24
Стеараты 17/77
Стеариновая кислота 17/38
Степень окисления
азота в HNO3 7/59
- в NO2 7/63
брома в НВг 7/36
железа 7/17
- в FeS 7/26
кислорода в химических соединениях 7/36,62
марганца в КМпО4 7/57
одноатомных ионов 7/1
протона 7/17
серы в H2S 7/17
- - H2SO4 7/50
сульфид-иона 7/1
суммарная в соединениях 7/17
титана в TiCl4 7/36
фосфора в Н3РО4 7/62
хлорид-иона 7/17
хрома в Na2Cr2O7 7/46
элементов 7/1
- в химических соединениях 7/62
Стирол 9/69, 23/20
Столовый уксус 17/8
Сульфид-ион 2/9
Сульфирование 20/20
обратимость 20/39
Сульфоксиды 13/55
Сульфонаты 20/16
как детергенты 20/42
Сульфоновые кислоты
алифатические 20/63
амины 20/14
ароматические 20/10
превращение в карбоновые кислоты 20/3
производные 20/22
соли 20/4,16
- как детергенты 20/42
функциональные группы 20/1,10
хлориды 20/4
Сульфоны 13/55
Сульфохлорирование 20/54
Сшивание 23/39,59
Терелен 23/12
Терефталевая кислота 17/73
получение из и-ксилола 17/73
метиловый эфир 23/22
Термопластики 23/17
Тетраметиламмония
бромид 21/89
сульфат 21/78
хлорид 21/73
Тетрафторэтилен 11/70
526
Тетрахлорметан 10/19
Тетрахлорзтан 11/32
Тетраэтиламмония сульфат 21/89
Тефлон 11/60
Тиолы 13/38
получение 13/51
Тиоляты 13/54
Тионилхлорид 18/72
Тиоспирты 13/38
Тиофеи 24/39,53
замещение 24/65
Тиоэфиры 13/47
номенклатура 13/60
получение 13/37
Титан
диоксид 5/71
тетрахлорид 5/71
применение 5/4
Толуидины 21/76,88
Толуол 9/27,42, 14/76
окисление 17/64
хлорирование в боковую цепь 10/31
— кольцо 10/21
и-Толуолсульфамид 20/12
и-Толуолсульфокислота 20/16
о-Толуолсульфохлорнд 20/12
Торий 1/83
Тревира 23/12
Тримеризация 16/3,21
2,4,6-Тринитротолуол 21/34
2,4,6-Тринитрофенол 21/9
Тритий 1/101
строение атома 1/48
Трифеиилтриазии 24/56
Трихлорацетальдегид 14/41,56
Трихлорметан 10/19
Трихлоруксусная кислота 17/26
1,1,2- Трихлорэтаи, получение 11/32
Углеводороды 8/1
алифатические 9/1,85
- классификация 9/5
- окисление 17/73
- хлорирование 10/60
ароматические 9/1,5,85
Гйлогензамешенные 10/1
горение 9/51
классификация 9/85
насыщенные 8/40
ненасыщенные 8/40
неразветвленные (линейные) 8/50,57
разветвленные 8/50
распространенность в природе 9/66
свойства 9/25
цепи 8/1
циклические 8/72
Углеводы 24/21
Углерод
асимметрический 17/28,44, 24/18
валеитиость 1/61
возбужденное состояние 25/17,27
вращение плоскости поляризации 17/62
вторичный 12/20
группа 4/8
основное состояние 25/27
первичный 12/1
строение атома 1/76
третичный 12/2
тетрахлорид 10/12
использование в огнетушителях 11/36
четвертичный 12/14
электронная конфигурация 25/62
Уюльиой кислоты диэтиловый эфир (ди*
этилкарбопат) 18/82
Уксусная кислота 17/8,16
диссоциация 17/37
ледяная 17/8
получение брожением спиртовых жидко-
стей 17/48
- из уксусного альдегида 17/20
- -- вина 17/48
реакция с NaOH 17/37
эфиры, метиловый 18/12
- этиловый 18/4
- - получение 18/33,71, 19/42
- фениловый 18/19
Уксусный альдегид 14/4,9,33, 19/8
получение из ацетилхлорида и ацетата на-
трия 19/35
присоединение аммиака 15/46
— бисульфита натрия 15/36
тримерный 16/5
циангидрин 15/55
Уран
изотопы 1/69,71
применение 5/11
Фениламины 21/18
Фенилацетат 18/19
Фенилдиазония хлорид 22/12
Фенилизоцианат 22/2,14
Фенильный радикал 9/83
Фенол 12/88, 14/26,57,63,80,83
кислотность 12/80
получение из аминов 22/41
— бензолсульфокислот 20/18
- - хлорбензола 11/55, 12/89
- кумольным процессом 14/63, 20/18
реакция с ангидридами карбоновых кислот 19/59
- - хлорангидридами карбоновых кислот 18/58
Феноляты 12/69,71
Ферменты 12/58
Формалин 14/74
Формальдегид 14/4,9,27
полимеризация 16/1
получение из метанола 14/38
Формамид 19/13
Формиаты 17/70, 18/12
Фосген 18/60
реакция с аминами 22/15
- - водой 18/82
— этанолом 18/82
Фосфорная кислота 4/53
ангидрид как дегидратирующий агент
19/52
Фреон 11/63
Фталевая кислота 17/73
ангидрид 19/32
получение из о-ксилола 17/73
Фтор
соединения 11/63
строение атома 4/40
Фторбензол 10/56
Фторирование 10/56
Фумаровая кислота 17/50
Функциональные группы 11/61 взаимодействие между ними 21/9
Фуран 24/39,51
получение из бутандиола-1,4 24/56
Хинолин 24/44,66
Хинон 14/55,62,68,78,79
Хлор
валентность 1/61
как окислитель 6/29
молекула, электронная конфигурация 2/35
соединения 10/1
- реакционная способность 13/4
Хлораль 14/41
Хлорбензол 10/39,42,56
гидролиз до фенола 11/55
1-Хлорбутан 18/65
2-Хлорбутаи 11/28
Хлорид-ион 2/6
заряд 2/39
Хлорирование 10/42,56
алифатических углеводородов 10/60
ароматических соединений 10/40
- - катализаторы 10/14
— условия реакции 10/30
бензола 10/42
толуола 10/21, 14/76
Хлорметан 10/19
Хлорная кислота 4/53
Хлороводород 2/13
Хлорофилл 24/52,66
Хлороформ 10/12
2-Хлорпропан 11/5,30
2-Хлорпропионовая кислота 17/44
о-Хлортолуол 10/21
Хлоруксусная кислота 17/47
Хлорфенолы 12/80
Хром 5/48
получение 5/9
сталь 5/45
сульфаты 5/59
Хромовая кислота 5/85
Царская водка 5/25
Цезия гидроксид 4/72
Целлюлоза 24/20
Цепи
боковые 10/48
- хлорированные 10/40
- - в толуоле 10/31
- - условия реакции 10/30
удлинение 19/58
Циангидрины 15/44
Цианид-ион 2/15
Циановодород, присоединение к карбонильной группе 15/37
Циклогексан 8/72
Циклогексанон 15/52
оксим 15/49,52
Цинк оксид 5/28 сульфид 5/28 Цинковая обманка 5/28 Цинковые белила 5/51
Щавелевая кислота 17/78
Щелочноземельные элементы 4/8
Щелочные металлы 4/8
Электролиты 3/35,57
слабые, средние и сильные 3/33,44
Электрон 1/1 вероятность нахождения в заданной области 25/16 заряд 1/3,37 масса 1/31,46 обозначения 2/34 отдача 6/62 пара 2/34
- обобществленная (связывающая) 2/50,58 присоединение 6/62 спии 25/31
Электронная оболочка 1/22 заселенность 1/38 - максимальная 1/5 обозначения 1/22 образование орбиталей 25/56 порядок заполнения 1/38
Электронная сфера 25/16
Электронное облако 1/1,22
Электронное распределение в бензольном кольце 9/20 — галии 4/51 -- калии 4/45 -- кальции 4/51
Электронный газ 2/8
Электроотрицательность 4/64,69,79
Электроположительность 4/64,69,79
Электрохимический ряд 6/10,46 Элементы атомный (порядковый) номер 4/1 валентность по отношению к водороду 4/95 ------кислороду 4/71,84,97 методы выделения в свободном состоянии 5/41 непереходные, (типические) 4/35 переходные см. Переходные элементы подгруппы главные 4/6,35 - побочные 4/6,35 радиоактивные 1/98
Эмульгатор 20/42
Этан 8/1
химическая связь в молекуле 25/70
Этаналь см. Уксусный альдегид
Этанол 13/51
Этен см. Этилен
Этерификация 18/54
катализ 18/80
количественные соотношения 18/44 равновесие 18/35,45
Этилацетат 18/29 получение 18/33,71
Этилен 8/55
бромирование 11/1 полимеризация 8/3, 23/2
528
Предметный указатель
химическая связь в молекуле 25/77
Этиленгликоль 23/22,34
Этилнитрат 18/25
Этиловый спирт (этанол) 12/21
дегидратация 14/11
получение брожением 12/45,58
- гидратацией этилена 12/45
Этильная группа 8/53
Этин 8/51
Эфиры простые 13/1
номенклатура 13/1
получение 13/2
предосторожности при обращении 13/62
свойства химические 13/62
Эфиры сложные 18/1
получение 18/25
- из ангидридов и спиртов 19/59
- - хлорангидридов кислот 18/48
природные 18/14
применение 18/5
свойства 18/5
Содержание части I
Программа 1
Введение. Химия как естественная наука-химические и физические процессы-химическое соединение
Программа 2
Воздух. Состав воздуха - кислород и азот-реакции с участием кислорода -сжижение воздуха-получение азота и кислорода
Программа 3
Кислород. Электролиз воды-химические элементы - процесс горения-катализ и катализаторы-дыхание-закон сохранения массы
Программа 4
Вода. Круговорот воды в природе-плотность воды-температурная шкала Цельсия-жесткая и мягкая вода-перегонка-электролиз воды - гремучий газ и хлорный гремучий газ
Программа 5
Водород. Его свойства-получение в лабораторных условиях и в промышленности-применения-меры предосторожности - окисление и восстановление
Программа 6
Теоретические основы (I). Химические процессы-синтез-анализ-элементы и соединения-металлы и неметаллы-химические символы элементов-химические уравнения - атомы и их строение
Программа 7
Теоретические основы (II). Атомы и молекулы-химические уравнения-двухатомные газы-валентность-структурные формулы-химические формулы-ионы-ионная связь-ковалентная связь
Программа 8
Натрий и калий. Тяжелые и легкие металлы-свойства натрия и калия-реакция с водой-гидроксиды-щелочи-индикаторы-электролиз раствора хлорида натрия-электролиз расплава хлорида натрия
Программа 9
Теоретические основы (III). Стехиометрические вычисления-атомная масса -грамм-атом - молекулярная масса - грамм-молекула - закон постоянства массовых отношений
Программа 10
Теоретические основы (IV). Свойства газов - взаимосвязь между объемом и давлением-влияние изменения температуры - нормальные условия-молярные объемы-закон Авогадро
Программа 11
Теоретические основы (V). Кислоты, основания и соли-диссоциация -индикаторы-кислотные остатки-нейтрализация-одноосновные и многоосновные кислоты - кислые соли-экзотермические и эндотермические реакции
Программа 12
Сера и ее соединения (I). Свойства-аллотропные формы-оксидыгидросульфид-сульфиды-получение диоксида серы-окисление гидросульфида-проба на сульфиды-ангидриды кислот-серная и сернистая кислоты-сульфиды и сульфаты
Программа 13
Сера и ее соединения (И). Получение серной кислоты-контактный процесс-башенный процесс-олеум-соли с кристаллизационной водой-свойства серной кислоты-аналитические реакции
Программа 14
Теоретические основы (VI). Эквивалентная масса-грамм-эквивалент-концентрация-нормальность-нормальные растворы — титрование -объемный анализ
Программа 15
Углерод (I). Свойства-аллотропные формы-активированный уголь . и адсорбция-оксид углерода-диоксид углерода-угольная кислота-карбонаты-промышленное получение диоксида углерода
Программа 16
Углерод (И). Угольная кислота и карбонаты - получение соды сульфатным способом (процесс Леблана)-кислые соли-гидрокарбонат натрия-карбонат калия - карбонат кальция
Программа 17
Углерод (III). Обжиг известняка-гашеная известь-жесткая и мягкая вода-строительный раствор - проба на карбонаты
Программа 18 ,
Органическая химия (I). Определение - углеводороды - ненасыщенные соединения-алифатические и ароматические соединения - бензол-спирты фенол-эфир-тетрахлорид углерода
Программа 19
Органическая химия (II). Амины-анилин-уксусная кислота-этерификация-нефть и уголь-спиртовое брожение-типы угля-получение кокса и каменноугольного газа - пищевые продукты
Программа 20
Азот (I). Распространенность-аммиак-соли аммония-термическая диссоциация - химические реакции в процессе пайки-проба на соединения аммония
Программа 21
Азот (II). Процесс Габера-генераторный газ и водяной газ - получение соды аммиачным способом (процесс Сольве)-соли аммония в качестве удобрений-азотная кислота-окисление аммиака
Программа 22
Азот (III). Оксиды азота - нитраты - получение азотной кислоты-азотистая кислота - нитриты - аналитические реакции
\
Программа 23
Хлор и его соединения. Свойства-получение-хлороводород (соляная кислота)-хлорноватистая, хлорноватая и хлорная кислоты-гипохлориты, хлораты и перхлораты-проба на хлориды
Программа 24
Фосфор и кремний. Белый и красный фосфор - пентоксид фосфора-фосфорная кислота-фосфаты-применение в качестве удобрений-трихлорид фосфора-пентахлорид фосфора. Кремний-диоксид кремния-стекло-процессы сплавления - кремниевая кислота - силикаты
Содержание час и
Программа 25
Железо (I). Оксидные и сульфидные руды железа-обжиг пирита-доменная печь-химические процессы в доменной печи-флюсы
Программа 26
Железо (И). Белый и серый чугун - сталь - процесс Бессемера-процесс Томаса-процесс Сименса-Мартена-сплавы-соли железа-аналитические реакции-весовой анализ
Программа 27
Медь, свинец, цинк и олово. Оксиды меди - получение меди-электролитическое получение меди - применение меди-аналитическая реакция. Свинец-свойства и соединения-аналитическая реакция. Цинк-свойства и соединения-олово
Программа 28
Алюминий. Свойства - оксид алюминия-соли алюминия-алюмотермическая реакция - термитная смесь-получение алюминия-боксит-алюминат натрия-двойные соли-квасцы-ацетат алюминия
Программа 29
Магний. Свойства- соединения получение - применение
Содержание части П
Как пользоваться этой книгой 5
Программа 1 8
Строение атома. Протоны, нейтроны, электроны - атомное ядро, электронное облако - электронные оболочки-заряд ядра-атомная масса - изотопы - изотопный состав - радиоактивный распад - радиоактивное излучение - период полураспада
Программа 2 32
Химическая связь (I). Конфигурация атома благородного газа-ионная связь - катионы, анионы-ионная решетка-валентность элементов в ионных соединениях-ковалентная связь-валентность элементов в ковалентных соединениях - металлическая связь - комплексы
Программа 3 53
Химические равновесия. Электролиты, неэлектролиты-электролитическая диссоциация - равновесие диссоциации - константа диссоциации-закон действия масс-ионное произведение воды-pH-буферные растворы - гидролиз - произведение растворимости
Программа 4 82
Периодическая система элементов. Периоды и группы-главные группы, подгруппы-сокращенная и полная таблицы периодической системы элементов-лантаноиды-актиноиды-химические свойства типических элементов и их гидроксидов, оксидов и соединений с водородом во взаимосвязи с положением в периодической таблице
Программа 5 109
Переходные элементы. Химические свойства во взаимосвязи с положением в периодической системе - валентность - образование комплексных катионов и анионов - распространенность - получение - применения
Программа 6 130
Электрохимический ряд. Окисление, восстановление и перенос электронов-окислители и восстановители-окислительная способность - нормальный окислительно-восстановительный потенциал - электрохимический ряд и его применение к обсуждению окислительно-восстановительных реакций
Программа 7 147
Степени окисления и окислительно-восстановительные реакции. Правила установления степеней окисления-использование степеней окисления при составлении уравнений окислительно-восстановительных реакций
Программа 8 168
Углеводороды (I). Цепные, разветвленные и циклические углеводороды -гомологические ряды-изомерия-ненасыщенные углеводороды-гидрирование - дегидрирование - полимеризация - ацетилен
Программа 9 192
Углеводороды (И). Ароматические углеводороды-бензол-изомерия -классификация и свойства углеводородов-природный газ и нефть и их применения
Программа 10 215
Галогензамещенные органические соединения (I). Простейшие хлорированные соединения - номенклатура - замещение - галогенирование - хлорирование ароматических соединений в кольцо и боковую цепь
Программа И 233
Галогензамещенные органические соединения (II). Присоединение галогенов и галогеноводородов по кратным связям-фторов'одороды-свойства и применения галогензамещенных углеводородов - функциональные группы-реакции-реагенты Гриньяра-обнаружение галогена в органических соединениях
Программа 12 254
Гидроксильные производные. Первичные, вторичные, третичные и четвертичные атомы углерода-первичные, вторичные и третичные спирты-номенклатура-получение и свойства - бензиловый спирт-многоатомные спирты-фенолы, получение и применение-замещенные фенолы-феноляты, алкоголяты
Программа 13 275
Эфиры, тиоэфиры и тиолы. Номенклатура эфиров-синтез-внутри-и межмолекулярные реакции-водородные связи-ассоциация-тиоэфиры и тиолы - сульфокислоты и сульфоны-обнаружение серы в органических соединениях
Программа 14 289
Карбонильные соединения (I). Альдегиды и кетоны-номенклатура-синтез из спиртов - получение ацетона - оксосинтез (гидроформилирование)-хлоральдегид - бензальдегид - ароматические кетоны - хинон
Программа 15 310
Карбонильные соединения (И). Восстановление и окисление-реакции присоединения-аддукты бисульфита-циангидрины-аддукты аммиака-оксимы -капролактам
Программа 16 325
Карбонильные соединения (III). Полимеризация формальдегида и уксусного альдегида-альдольная конденсация-реакция Канниццаро - конкуренция между альдольной конденсацией и реакцией Канниццаро
Программа 17 341
Карбоновые кислоты. Важнейшие карбоновые кислоты-жирные кислоты-получение-уксусная кислота-дикарбоновые кислоты-ненасыщенные карбоновые кислоты-цис-транс-изомерия-галогензамещенные карбоновые кислоты - оксикислоты -асимметрический атом углерода-оптическая изомерия
Программа 18 362
Производные карбоновых кислот (I). Сложные эфиры-получение -этерификация - омыление - равновесие этерификации - получение и применения эфиров-хлорангидриды-получение и реакции хлорангидридов
Программа 19 384
Производные карбоновых кислот (II). Ангидриды карбоновых кислот -получение и реакции; амиды карбоновых кислот - получение и реакции: нитрилы-получение и реакции
Программа 20 399
Сульфоновые кислоты. Синтез ароматических сульфоновых кислот-сульфонаты-производные сульфоновых кислот - получение фенолов и нитрилов из сульфоновых кислот-ароматическое замещение-направляющие эффекты заместителей-хлорсульфирование-алифатические углеводороды
Программа 21 415
Органические соединения азота (I). Нитросоединения-нитрование-восстановление нитрогруппы-амины-номенклатура-четвертичные ,
соли аммония-синтез аминов-расщепление амидов по Гофману
Программа 22 436
Органические соединения азота (II). Реакции аминов с хлорангидридами-ацилирование и алкилирование-изоцианаты-реакция аминов с азотистой кислотой; диазотирование-соли диазония-получение и свойства-азокрасители-количественное определение азота в органических соединениях
Программа 23 454
Синтетические полимеры. Полимеризация - макромолекулы-сополимеризация - термопластики - обработка - синтетические волокна -
Содержание части II
полиамиды - полиэфиры - поликарбонаты - сшивание - ненасыщенные полиэфирные смолы полиприсоединение - изоцианаты - каучукоподобные полимеры
Программа 24 476
Природные и гетероциклические соединения. Белки-жиры-углеводы -гетероциклы, пиридин, пиррол, фуран, тиофен - получение и свойства гетероциклических соединений-гемоглобин, хлорофилл-пример классического определения структуры: никотин
Программа 25
Химическая связь (II). Принцип неопределенности Гейзенберг а-принцип Паули-орбитали-связывающие орбитали-связь в молекулах водорода и воды-атом углерода-орбитали-возбужденные состояния-гибридизация, гибридные орбитали-связь в метане и этене-о- и л-орбитали в бензоле
Предметный указатель
519
УЧЕБНОЕ ПОСОБИЕ
Йоахим Нентвиг.
Манфред Кройдер, Карл Моргенштерн
Химический тренажер
Программированное пособие для средней школы
Часть П
Старший научный редактор И. Н. Лаврова
Младший редактор И. С. Ермилова
Художник А. А. Медников
Художест ненный редактор М Н. Кузьмина Технический редактор М. А. Страшнова Корректор С. А. Денисова
ИБ № 5445
Сдано в набор 27.12.85. Подписано к печати 07.08.86.
Формат 70 х l00'/ib Бума1а офсетная .Nv 2. Печать офсетная. Гарнитура тайме.
Объем 16,75 бум.л. Усл.печ.л. 43,55. Усл.кр.-оп.
87,43. Уч. изд. л. 32,97.
Изд. № 3/4037. Тираж 85 000экз. Зак. 29. Цена 2 руб.
ИЗДАТЕЛЬСТВО «МИР»
129820. ГСП, Москва, И-НО, 1-й Рижский пер., 2
Можайский полиграфкомбинат Союзполиграф-прома при Государственном комитете СССР по делам издательств, ноли! рафии и книжной гор-ювли. I. Можайск, ул. Мира, 93.
!«-?;'?j^;'*'«s«Si^fc’4fctiS‘at&ifbfXv-i' '••тайS®
v.»^?'-‘;*v'. садЛ.Л'* .-ca^.’ . '. ,;«*•¥ 5-- -. ?;••<'•
Aj^’J
w
________________________________________________________________________________________________________, Й1*‘ л_________________________®₽>'•«»*:> t • >•>*! r>'-'A®S*Al2t',ei*.ft^/-G*-i^»?>*<»»4,? 1ЛЖЛ^"'#.,Л^^2®»ФаЗ'« »rt4* J.". .-’/’*
<;$ ЛЖа*уУ^' .• Л игГ» tt<? *i З^лУ
& з
>®*Й5йГ»Й*а^51?п^й
&тШт£&я
0*4^ д
^ww^w^^w «лч.'? r-v-svS'v^S'W-^-v- 'iw^iS
*%
№-y"^."•’“•'’^'•'•^'••’’’““^ifig^^S^Slfe^W
1®ЙЙЖЙв^^
tea
м
КЗ*
' J’Asv».’* !i*?**£>•#££
b*J
?&«%••• '’L’'Л;-1<Х*^Ч^&?^*^ФлТл’вВР ?/5ь »л»4
&&Л №№&. х^.ж
да.
«»14 •' *'•’'«
.Л.-' .“-';У‘<Р,“^
yr,. . ,itf.йм/л^гл;.’
fA ',/S>- '^X'
ЙШ
l4‘
to;
О
, Ж.’"
®B2Wg
* X <JI<‘
t
, V-
H ? '
iifc
<4%Л' -.ж . ....... • а-.
;!' а^Хз^эчЙС5Й*’Л*$,^?П
:^гйЛЛг22и<Л?Й8?^; &
.s&i
W •<с«.лл#с^ «йжй'в&й ате^шж$
ta^sj-ais^Wssfeias!» .«z
^C^z22»’4‘J? ’*'
&.i>5:
tS
-Я
t•• ay&j*.,: ...&л »:• л:' .*• y.a^ft!»'*': <Л®да>.*.’!* S.
:: V*? , -
lr« ^«ЗвдЛ^.. - ?_>, ft р-^к:«”«т9?* X.vrjzx
• ч* ^Тийк-*"
да ;45в&й»