Автор: Михайлов А.Н.
Теги: медицина лучевая диагностика
Текст
А.Н. Михайлов
ЛУЧЕВАЯ ДИАГНОСТИКА
ГАСТРО • ЭНТЕРОЛОГИИ
СПИСОК СОКРАЩЕНИЙ
АД — артериальное давление
АКТГ — адренокортикотропный гормон
АРД — аэронная релаксационная дуоденогра-
фин
АРИ — аэроннан релаксационная ирригоско-
пия
гд — гипотоническая дуоденографин
дк — двойное контрастирование
жкт — желудочно-кишечный тракт
ик — инфракрасный
ИРС — исследование рельефа слизистой
КА — коэффициент абсорбции
КТ — компьютерная томография
кмц — карбоксиметилцеллюлоза
ЛФ — лимфоидные фолликулы
ммк — межпищеварительные миоэлектриче-
ские комплексы
МРТ — магнитно-резонансная томографии
пдк — постдизентерийный колит
пж — поджелудочная железа
пмк — псевдомембранозный колит
пп — пиковый потенциал
РЕ — релаксационная еюнографин
РКБВ — рентгенография компрессионной ба-
риевой взвеси
РПЭ — релаксационная пероральнаи энтеро-
графия
РРГД — рефлексогенная релаксационная гаст-
родуоденография
РРЖ ' — рефлексогенная релаксации желудка
РРИ — релаксационная ретроградная илеоце-кография
PPK — рефлексогенная релаксация кишеч-
ника
соэ — скорость оседания эритроцитов
спв — селективная проксимальная ваготомия
тз — тугое заполнение
ТБЗ — тугое (большое) бариевое заполнение
ТЕ — титрационные единицы
УАР — универсальный анализ рентгенограмм
УЕ — условные единицы
УЗД — ультразвуковая диагностика
УЗИ — ультразвуковое исследование
УРИ — усилитель рентгеновского изображе-
ния
ФКД — функциональная кишечная диспепсии
ФРИ — функциональное рентгеновское иссле-
дование
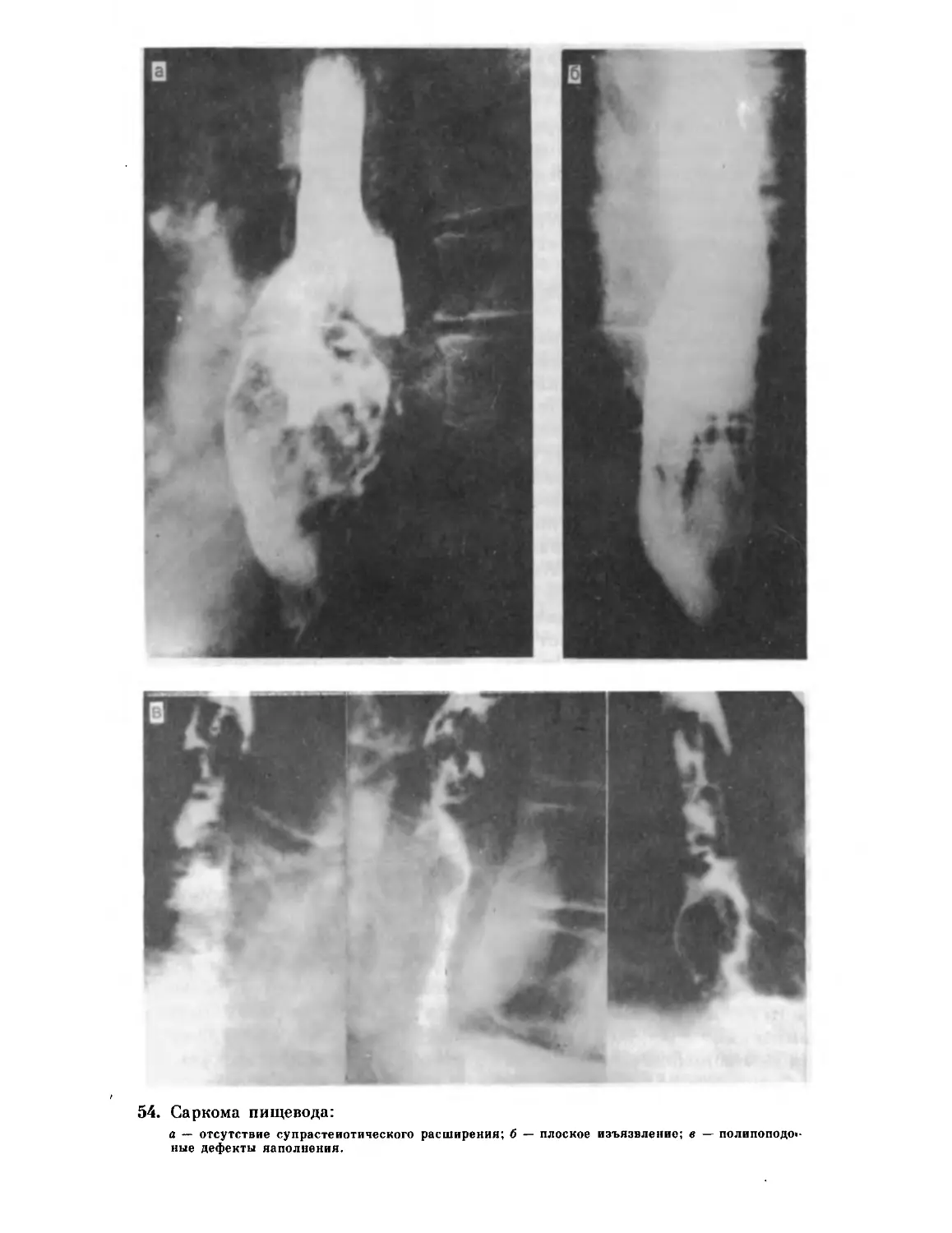
хк — хронический колит
хнк — хронический неязвенный колит
цнс — центральная нервная система
ЭОУ — электронно-оптический усилитель
ЭРПХГ — эндоскопическая ретроградная пан-
креатохолангиографин
ЭУЗИ — эндоскопяческое ультразвуковое ис-
следование
ЭУСГ — эндоскопическая ультразвуковая со-
нографин
ЯБЖ — язвенная болезнь желудка
ЯМР — ядерно-магнитный резонанс
ЯНК — нзвенный неспецифический колит
Раздел I
ОБЩИЕ ВОПРОСЫ
Глава 1. ЛУЧЕВЫЕ МЕТОДЫ И СРЕДСТВА ДИАГНОСТИКИ В ГАСТРОЭНТЕРОЛОГИИ
Успехи современной медицины во многом определяются внедрением в клиническую практику достижений науки и техники. Выдающимся вкладом в этом смысле явился переход от использования одного лишь коротковолнового электромагнитного излучения (рентгеновского и в меньшей степени гамма-излучения) к применению различных по природе и характеристикам излучений, в том числе упругих колебаний (ультразвуковая диагностика) и длинноволновых электромагнитных излучений, лежащих в инфракрасном (термография) и радиочастотном (магнитно-резонансная томография) диапазонах.
Рентгенологическое исследование
В гастроэнтерологии к ведущим методам диагностики относится рентгенологическое исследование, базирующееся на получении и анализе рентгеновского изображения органов пищеварения. Но главное значение рентгенологического исследования состоит в том, что оно является одним из основных источников получения объективной информации о состоянии аппарата пищеварения. Эта информация необходима для своевременного установления правильного диагноза, точной локализации и протяженности выявленных патологических изменений, а также их динамики в процессе лечения.
В зависимости от способа регистрации и представления результатов рентгенологического исследования различают два общих метода этого исследования: рентгеноскопию и рентгенографию. Рентгеноскопия — метод рентгенологического исследования, основанный на получении рентгеновского изображения на флюоресцентном экране, экране УРИ или телевизионном экране. Рентгенография — метод рентгенологического исследования, при котором рентгеновское изображение получают на фотопленке и других чувствительных к рентгеновскому излучению материалах.
Каждый метод рентгенологического исследования имеет свои позитивные особенности. Так, рентгеноскопия позволяет изучать движущиеся органы в процессе их функционирования. Благодаря возможности менять в ходе исследования положение тела пациента относительно пучка рентгеновского излучения рентгеноскопия дает возможность определять взаиморасположение анатомических структур, локализацию и сме-щаемость патологических образований. Обычно рентгеноскопию применяют вместе с рентгенографией. Последняя обладает рядом преимуществ: более высокое качество и детализация изображения, наличие рентгенограммы, которая может храниться с целью сопоставления с предыдущими и последующими рентгенограммами, меньшая лучевая
нагрузка на больного, чем при рентгеноскопии.
С годами рентгенологические исследования стали универсальным диагностическим методом. Больные ожидают от этих исследований четкого результата; врачи, хотя и сознают возможность ошибки или неполной информации, не могут оценить степень их вероятности. Больные полагают, что проводимое врачом обследование будет неполным, если им не сделают «рентген». Поэтому процедура рентгенологического исследования приносит им удовлетворение. Кроме того, она не причиняет особого дискомфорта и неудобств. Для врача назначение на рентгенологическое исследование — удобный ритуал.
Гастроэнтерологи, направляющие больных на рентгенологические исследования, находятся под влиянием потока технических рекомендаций, касающихся проекций или более изощренных процедур. Однако мало кто пытается критически оценить пользу, которую можно ожидать от усиленного применения рентгенологических исследований.
По данным ВОЗ, на долю рентгенологии приходится 6 — 10 % всех затрат здравоохранения. В глобальном масштабе рентгенодиагностические исследования являются самым значительным искусственным источником облучения населения. В мире в целом такое облучение составляет 20 % естественной фоновой радиации, а в развитых странах оно достигает 50 %. Поэтому ни один человек, имеющий отношение к этой проблеме, не может позволить себе быть благодушным.
Выбор метода исследования также не может быть статическим процессом. По мере развития знаний и появления новой техники отдельные виды рентгенологических исследований, которые считаются эффективными, выйдут из употребления. Те методы, кото
рые сейчас провозглашаются как усовершенствованные, могут оказаться не столь эффективными, как считалось ранее.
Повышению качества рентгенологического обслуживания способствует обмен мнениями между рентгенологом и клиницистом. Когда рентгенолог находится в курсе клинических проблем, он может подсказать своим коллегам-клиницистам, показано или нет рентгенологическое исследование и какой вид его в данном случае предпочтителен. Если непосредственный контакт между клиницистом и рентгенологом невозможен, клиницист, направляющий больного на исследование, должен установить характер клинической проблемы, которую необходимо решить. Без такой информации рентгенологическое исследование может стать бесполезным.
Гастроэнтерологи и проктологи должны чаще обращаться за консультацией к рентгенологам, чтобы наиболее эффективно использовать рентгенологические данные. Они должны отдавать себе отчет в том, что в ряде случаев лучше не направлять больного на это исследование. На принятие решения влияют статистические факторы, которые варьируются в разных группах населения. К таким факторам относятся чувствительность того или иного метода исследования и его специфичность. Значение этих терминов можно легко понять, если рассмотреть четыре возможных исхода исследования. Когда заболевание существует и результат рентгенологического исследования положительный, это истинно положительный результат. Если же рентгенологическое исследование устанавливает отсутствие заболевания (т. е. дает отрицательный результат), хотя болезнь существует, это ложноотрицательный результат. Аналогично могут наблюдаться ложноположительные и истинно отрицательные результаты.
Чувствительность исследования характеризуется процентом от общего числа больных, у которых получен истинно положительный результат, тогда как специфичность — процентом от общего числа лиц, не имеющих болезни, у которых результат исследования истинно отрицательный. Чем выше этот процент, тем выше чувствительность и специфичность. Правильное понимание этих терминов приведет к лучшему использованию рентгенологических исследований, а значит и к уменьшению случаев необоснованного их применения.
Знание показателей чувствительности и специфичности необходимо потому, что каждому врачу и больному оно позволяет ответить на вопросы: «Показано ли рентгенологическое исследование больному?» и «Если результат положительный или отрицательный (что в равной степени важно), то как это влияет на диагноз?»). Ни одно рентгено-логичекое исследование не может быть совершенным, и к характерным для любого из них ограничениям (чувствительность и специфичность) следует добавить ошибки исследователя: дефекты восприятия (неумение видеть поражение) или дефекты интерпретации (утверждение, что находка важна или не имеет значения, либо обнаружение «признака», который в действительности артефакт).
Хорошая рентгенографическая и рентгеноскопическая техника в сочетании с высокой квалификацией и опытом рентгенолога уменьшают частоту ошибок, но не могут исключить их полностью. Принято считать, что дополнительные’ исследования с применением различных проекций или методик полезны для больного. Однако во многих случаях польза довольно сомнительна, поскольку при этом увеличиваются стоимость исследования и доза облучения. Нельзя забывать также, что вследствие ограниченности средств де
тальное исследование одного больного может быть выполнено за счет большого числа других больных, которым будет отказано в основных высококвалифицированных исследованиях или в какой-либо из форм медицинской помощи.
Направлять больного на рентгенологическое исследование нельзя, если неизвестно, подвергался ли он недавно такому же исследованию, поскольку оно делает новое исследование ненужным. Любые предыдущие рентгенограммы — это часть истории болезни, и они необходимы при интерпретации данных нового исследования. Надежная система хранения и поиска информации — неотъемлемое условие эффективности рентгенологических методов, такая система способствует ограничению числа непродуктивных исследований.
Совершенно ясно, что для эффективного использования рентгенодиагностических методов требуются рентгенограммы высокого качества. Плохие снимки увеличивают количество диагностических ошибок и вынуждают делать повторные снимки, что повышает стоимость исследования и дозу облучения. Эффективная программа контроля за качеством должна стать составной частью любой рентгенологической службы.
Средства, устройства и способы рентгенологического исследования пищеварительного аппарата
Органы пищеварения имеют почти одинаковый физико-химический состав с окружающими их тканями, вследствие чего обладают практически одинаковой способностью поглощать рентгеновы лучи. Поэтому при рентгеноскопии, как и на рентгенограммах, эти органы дают тени, близкие по плотности, мало или вовсе неотличимые друг от друга. Чтобы сделать органы пищеварения хорошо видимыми при рентгенологиче
ском исследовании, их необходимо искусственно контрастировать.
В качестве контрастных веществ для исследования пищеварительного тракта могут быть использованы газы (воздух, кислород, углекислый газ и др.), которые по плотности и атомной массе уступают тканям организма и вследствие этого в меньшей степени поглощают рентгеновы лучи. Контрастированные газами снаружи, изнутри или снаружи и изнутри одновременно, органы пищеварительного тракта при рентгеноскопии и на рентгенограмме выглядят более прозрачными, «просветленными» по сравнению с окружающими тканями.
Однако чаще всего пищевод, желудок, 12-перстная, тонкая и толстая кишки контрастируются позитивными контрастными веществами, которые по атомной массе превосходят ткани человеческого организма и в связи с этим поглощают рентгеновых лучей больше, чем окружающие ткани. К ним относятся широко применяющийся химически чистый сернокислый барий и используемые в отдельных случаях йодистые органические соединения.
Сернокислый барий в качестве рентгеноконтрастного вещества для исследования Ж КТ впервые предложил в 1912 г. Р. Krause. Этот препарат оказался наилучшим контрастным веществом для исследования ЖКТ, так как поглощает значительное количество рентгеновых лучей и легко смешивается с различными жидкостями (в том числе с секретами, выделяемыми слизистой оболочкой этого тракта), не растворяясь в них и не образуя с ними соединений. Сернокислый барий легко измельчается, позволяет получить взвесь необходимой вязкости, хорошо прилипает к слизистой оболочке. Для рентгенологического исследования можно применять только тот сернокислый барий, который получен из аптеки в
оригинальной упаковке. На ней должно быть написано: «Бария сульфат (барий сернокислый) для рентгеноскопии», с указанием номера серии и даты химического анализа. Хранить препарат следует в сухом месте, вдали от пахучих веществ.
Для исследования глотки, пищевода, желудка, 12-перстной, тонкой и толстой кишок, как правило, применяется водная взвесь бария. Ее готовят следующим образом: 1 кг химически чистого сернокислого бария подсушивают и пропускают через мелкое сито. Полученный порошок высыпают в 800 мл горячей воды. Смесь кипятят 10—15 мин при постоянном помешивании, затем пропускают через марлю. После остывания она имеет консистенцию полугустой сметаны и может храниться в стеклянной посуде в прохладном месте 3—4 дня. Бариевая взвесь не оседает в стакане в течение 10—15 мин.
Однако приготовленная таким образом взвесь не совсем устраивает рентгенологов в основном из-за неоднородной величины частиц бария и их быстрого оседания. Уменьшить частицы бария можно высокоскоростными смесителями, и все же получить из них однородную взвесь не удается.
Современный технический уровень рентгенологического исследования пищеварительного тракта настоятельно требует использования в широкой клинической практике рентгеноконтрастного вещества, которое отвечало бы стандартным требованиям: имело высокую степень дисперсности и концентрации частиц сульфата бария при корригируемой вязкости суспензии.
На вязкость и концентрацию бариевой взвеси большое влияние оказывают различные стабилизирующие добавки — желатина, карбоксиметилцеллюлоза, слизь семени льна, крахмал, экстракт алтейного корня или исландского мха, поливиниловый спирт и др. Чаще всего
1. Смеситель для приготовления бариевой взвеси (водного бариевого «коктейля»): а — «Воронеж»; б — Сильченко; в — Нечаева; г — размельчитель мягких тканей.
1 г карбоксиметил целлюлозы добавляют к 100 г сульфата бария и 70 мл кипяченой воды. Концентрация сернокислого бария в этой взвеси около 58 %. Такая взвесь долго остается гомогенной.
Измельчать взвесь сульфата бария можно и ультразвуком. Источником ультразвуковых колебаний служит маг-нитно-стрикционный генератор, работающий на частотах 20 кГц в таком режиме: ток подмагничивания 12 А, анодный ток 0,8—1 А, напряжение выхода 300 В, выходная мощность 300 Вт. В генераторной установке предусмотрено поочередное попадание частиц обрабатываемой суспензии в зону активной кавитации источника ультразвуковых колебаний. Это достигается путем одновременного вращения и возвратно-поступательного перемещения емкости со взвесью сульфата бария относительно излучателя. Обработка взвеси обычно длится 3—4 мин. Частицы сульфата бария не превышают диаметра 1—2 мкм. Обработанная ультразвуком бариевая масса очень гомогенна и благодаря постоянству величины частиц сульфата бария практически не оседает, при температуре 8 °C долго не изменяет своих свойств.
Готовая к использованию мелкодисперсная бариевая взвесь высокой концентрации за рубежом выпускается в виде оригинальных патентованных препаратов с различными стабилизаторами, вяжущими веществами, вкусовыми добавками (баростраст, баролоид, баро-сперс, микропак, миксобар, микротраст, новобариум, оратраст, скиабарий, теле-брикс, гексабрикс, хитраст и др.).
Для улучшения свойств сульфата бария применяют сложные методики. В США и Великобритании, например, к сульфату бария добавляют кислотоустойчивый защитный коллоид-анионо-вый гетерополисахарид. В Японии в водную дисперсию сульфата бария с концентрацией 70 %, содержащую такие известные диспергаторы, как нат-рийкарбоксилметилцеллюлоза, альгинат натрия, желатину, аравийскую каломель, вводят микродобавку аскорбиновой кислоты. В качестве диспергирующего агента в питательную среду вносят полиалкилсульфат натрия и как стабилизатор — лимонную кислоту, сорбинат калия или ароматизирующий агент — натриевую соль сахарина.
Можно, перечислить множество ве
ществ (полиметафосфат, этиловый спирт, гуммиарабик, агар и т. д.) и механических способов, которые направлены на то, чтобы получить контрастные вещества с хорошей прилипаемостью к слизистой желудка, высокой степенью дисперсности частиц, низкой вязкостью при высокой концентрации сульфата бария. В. С. Пручанский и др. (1976, 1978) в качестве стабилизатора водно-бариевой взвеси применяли карбокси-метилцеллюлозу. Они производили тщательную механическую обработку бария с помощью скоростных миксеров, которые снабжены металлическими фильтрами с растирающими щетками. Однако перечисленные стабилизаторы и миксеры во многих лечебных учреждениях отсутствуют. Этим, очевидно, объясняется тот факт, что большинство практических рентгенологов не придают серьезного значения коллоидным свойствам сульфата бария, который они используют в рентгенологическом исследовании рельефа желудка.
С. Т. Тусупбеков с соавт. (1987) разработали методику совершенствования свойств обычно применяемого сульфата бария с использованием яичного желтка и молока. Это повышает информативность рентгенологического метода при диагностике заболеваний слизистой пищевода, желудка и кишки (эрозии, воспалительных процессов, начальных форм рака), не уступает водорастворимым контрастным веществам при выявлении пенетрации, выраженных сужений пищевода и выходного отдела желудка.
В качестве диспергатора водно-ба-риевой взвеси использовался яичный желток. Небольшие добавки его к пастообразной суспензии сульфата бария изменяют рентгенологические свойства. Сырой желток для водной суспензии сульфата бария служит хорошим пепти-затором. Адсорбируясь на поверхности частиц порошка сульфата бария, ингре
диенты желтка образуют студнеобразные адсорбционные слои, обращенные в воду полярными группами. Благодаря большой гидрофильности они покрываются многочисленными слоями ориентированных молекул воды. Это ослабляет воздействие между частицами порошка сульфата бария и соответственно стабилизирует суспензию и понижает ее вязкость. Кроме того, белковые молекулы яичного желтка проникают в мельчайшие поры частиц сульфата бария и, отталкиваясь своими одноименно заряженными функциональными группами, оказывают расклинивающее давление. Это приводит к измельчению частиц, т. е. к повышению дисперсности. Оптимальное соотношение компонентов взвеси: сульфат бария 95 — 100 г, вода 45—50 г, яичный желток 1,2-2 г.
Под влиянием яичного желтка количество крупных частиц сульфата бария размером 8—33 мкм уменьшается с 67 % до 6 %, а процент более мелких частиц (8—4 мкм) возрастает с 18 до 64. Количество частиц размером до 2 мкм увеличивается с 14 % до 30 %. Оказывая эффективное диспергирующее действие, яичный желток снижает вязкость пастообразной водно-бариевой суспензии при сохранении высокой концентрации.
Применение сложных методик приготовления водно-бариевой суспензии за рубежом и в отечественной практике обусловлено тем, что одни компоненты действуют как диспергаторы, а другие, имея студнеобразный характер коллоидной системы, обеспечивают лучшее прилипание к слизистой. Для получения пенящейся суспензии вводят газы (двуокись углерода, закись азота, азот).
Результаты наших исследований показали, что яичный желток обладает всеми указанными свойствами: выраженным диспергирующим действием, снижением вязкости, а студнеобразный
характер этой коллоидной системы улучшает прилипание сульфата бария к слизистой пищевода и желудка. При обработке водно-бариевой суспензии с добавлением желтка в миксере получается пенистая коллоидная система.
В нашей стране применяется готовое мелкодисперсное рентгеноконтрастное средство — сульфобар. Препарат содержит (из расчета на 100 г): бария сульфата 50 г, метилцеллюлозы 100 1,4 г, твина 80 0,2 г, спирта этилового 95%-ного 5 г, глицерина 4,5 г, натрия гидрокарбоната 0,5 г, воды очищенной до 100 мл. В медицинской практике используется в виде пасты. Приготовленная из пасты суспензия отличается достаточной вязкостью, гомогенна и стабильна. Суспензия сульфобара хорошо обволакивает слизистую оболочку и обеспечивает высокое качество рентгеновского изображения. Ее применяют как контрастное средство при рентгенологическом исследовании пищевода, желудка и кишечника.
Для рентгенологического исследования пищевода, желудка и тонкой кишки пасту сульфобара принимают внутрь. Чтобы туго заполнить пищевод, используют неразведенную пасту. Она дозируется ложками. Одна столовая ложка содержит 30 г пасты (15 г бария сульфата) . При необходимости пасту разводят, добавляя к 180 г ее 70 мл воды комнатной температуры. Ориентировочная доза неразведенной пасты сульфобара при рентгеноскопии пищевода — 120— 180 г, разведенной в соотношении 3:1 — 200-250 мл.
Чтобы исследовать желудок и тонкую кишку, готовят суспензию: к 240 г пасты порциями (в 2—3 приема) добавляют 70—80 мл воды и тщательно перемешивают. Применять миксеры нежелательно. Ориентировочный расход суспензии сульфобара на одно исследование — 300—450 мл.
При ирригоскопии используют еще более разведенную суспензию, которую вводят в клизме: к 240—360 г пасты добавляют 700—800 мл воды. На одно исследование расходуется около 1000— 1500 мл такой суспензии. Подготовку больного к рентгенологическому исследованию проводят обычным способом.
Сульфобар выпускают в виде пасты в алюминиевых тубах (60 и 120 г) и в стеклянных банках (240 и 360 г).
Качество рентгенологического исследования таких органов, как глотка, пищевод, желудок, тонкая и толстая кишка, желчевыводящие пути и поджелудочная железа, в значительной мере зависит от оснащения рентгеновского кабинета современной аппаратурой, приспособлениями, наличия в нем необходимых фармакологических препаратов. Для исследования этих органов желательно иметь мощный аппарат, позволяющий очень быстро переходить от просвечивания к одиночным и серийным прицельным снимкам при очень коротких выдержках с автоматической или ручной, но достаточно быстрой и легкой подачей кассеты. Наиболее совершенным является рентгеновский аппарат с электронно-оптическим усилителем яркости изображения, кинокамерой и телевизионной установкой с видеомагнитной записью. Они обеспечивают ускоренную, замедленную киносъемку и передачу изображения на расстояние, чтобы за исследованием могли наблюдать все желающие, не подвергаясь воздействию ионизирующего излучения.
В каждом рентгеновском кабинете, где производится исследование органов пищеварения, должны быть приспособления для выполнения прицельных снимков и компрессии (тубусы и ком-прессоры-дистинкторы различной формы и размеров). Кроме того, для компрессии при рентгеноскопии и производстве обзорных снимков необходимо
иметь люфу или надутую резиновую футбольную камеру. Во избежание задержки при производстве снимков или при проведении специальных методик в кабинете должно быть не менее 3 наборов кассет всех размеров (13Х 18 см; 18X24 см; 24X30 см; 30X40 см или 35X35 см). Должны быть также: 1) приборы для двойного контрастирования пищевода и желудка, предложенные Л. Д. Файтельсоном, Л. С. Ро-зенштраухом, К. И. Амброзайтисом и др.; 2) аппарат для введения контрастной клизмы и двойного контрастирования толстой кишки (предложенный Ф. А. Астраханцевым, В. И. Петровым, Д. Е. Кунцевич, К. В. Оболончиком, А. Н. Михайловым и др.) или аппарат А. А. Боброва; если по каким-либо причинам этих приборов в кабинете нет, то должна быть эмалированная, стеклянная или резиновая кружка Эсмарха и баллоны Ричардсона; 3) несколько наконечников из пластмассы или стекла и вазелин для смазывания их перед употреблением; 4) зонд Штрауса или Шнигера (двухканальный резиновый зонд с резиновым баллоном вблизи дистального конца его); 5) дуоденальный зонд; 6) сосуд с бариевой взвесью и 4—5 стаканов; 7) питьевая, или двууглекислая, сода и кислота (лимонная, таниновая и др.).
Все устройства, предложенные для ретроградного введения рентгеноконтрастного вещества в кишечник, делятся на три типа:
I — устройства разового действия: только для введения контрастной взвеси в кишечник, например аппарат Боброва, шприц Жанэ, кружка Эсмарха и др. Они очень просты по устройству: емкость, система нагнетания, соединительный (клизменный) шланг и клизменный наконечник;
II — аппараты, приспособленные как для введения контрастной взвеси в кишечник, так и нагнетания воздуха в тол-
2. Различные аппараты для клизмы контрастного вещества и двойного контрастирования толстой кишки:
а — Боброва; б — Петрова; в — Астраханцева
стую кишку через трехходовый кран, например ирригоаппарат В. Г. Караваева, аппарат В. А. Астраханцева и др. Они состоят из емкости, системы ручного нагнетания (система баллонов Ричардсона), трехходового крана, соединительного шланга и клизменного наконечника. В отличие от аппаратов I типа, на них выполняют две операции: нагнетание контрастного вещества и нагнетание воздуха. Эти аппараты тоже разового действия: больной после обследования вынужден встать со стола, идти опорожниться й затем снова ложиться на стол, чтобы продолжить исследование после введения в кишечник воздуха;
III — аппарат для введения контрастной взвеси в кишечник, ее обратного отсоса и нагнетания воздуха в толстую кишку без извлечения клизменного наконечника, предложенный Д. Е. Кунцевич. Аппарат конструируется из емко-
3. Схема модернизированного аппарата для ретроградного контрастного исследования толстой кишки:
1,8 — емкости для контрастных взвесей; 2, 6, 9 — соединительные шланги; 3 — клизменный наконечник; 4 — распределительное устройство; 5 — зажимы; 7 — трехходовой кран; 10 — система нагнетания и отсоса.
4. Распределительное устройство в модернизированном аппарате:
1 — корпус; 2 — клизменный наконечник; 3 — трехходовой кран с отметками «Нагнетание» и «Отсос»; 4 — предохранительный клапан; 5 — штуцер для подсоединения емкости с контрастной взвесью; 6 — штуцер для подсоединения емкости с содержимым кишечника.
сти, системы ручного нагнетания и отсо-са (системы баллонов Ричардсона), трехходового крана для подачи контрастного вещества или воздуха, соеди-
нительного шланга и клизменного наконечника. Однако и этот аппарат имеет существенные недостатки. Для работы с ним врачу, производящему исследование, необходим помощник. Исследование длится долго, особенно у больных с недостаточностью анального сфинктера или с противоестественным заднепроходным отверстием. Контрастная взвесь, введенная в кишечник, отсасывается в ту же емкость (кружку) путем опускания ее ниже уровня больного. Этим обусловлено только разовое применение аппарата. Оставшуюся в емкости бариевую взвесь нельзя использовать для другого исследования, так как она нередко инфицируется. >
Чтобы сократить время исследования и уменьшить расход контрастных веществ, мы модернизировали этот аппарат (Михайлов, Коломыцкий, 1978). На нашем аппарате врач может без помощника быстро провести несколько ретроградных исследований толстой кишки в стационарных и в амбулаторных условиях после одной заправки аппарата. Поскольку емкости могут быть любого объема, аппарат можно применять и для массовых профилактических осмотров населения.
При рентгенологическом исследовании прямой и ободочной кишок у больных с недостаточностью анального сфинктера или с противоестественным заднепроходным отверстием приходится использовать кишечные обтураторы. Кишечные обтураторы Штрауса — Зингера и Шнигера трудно установить и зафиксировать в анальном канале. На дистальном конце их имеется баллон, который выскальзывает из прямой кишки или, проходя в глубь ее, закрывает большой просвет прямой кишки и мешает рентгенологическому исследованию. К тому же этим баллоном нельзя герметично закрыть просвет прямой кишки, и у большинства больных часть вводимого контрастного вещества изли-
вается наружу. Поэтому мы модифицировали устройство для введения жидкого содержимого в кишечник — аноректальный обтуратор. Двумя лежащими рядом баллонами можно прочно закрепить этот обтуратор в анальном канале, герметично закрыть просвет прямой кишки и заполнить туго жидким содержимым прямую и ободочную кишки.
Следует особо подчеркнуть важность наличия в рентгеновском кабинете всех необходимых защитных средств (перчаток, фартуков и юбок). В каждом кабинете необходимо также иметь судно и ширму, а еще лучше туалетную комнату.
Пищевод. Применяемые практическими врачами физикальные методы исследования пищевода дают очень мало информации о характере заболевания и его стадии. Поэтому наряду с изучением анамнеза и жалоб больного используют различные инструментальные методы.
Показаниями к рентгенологическому исследованию пищевода служат: дисфагия; инородное тело пищевода; кровотечение из верхних отделов пищеварительного тракта, в частности подозрение на опухоль или варикозное расширение вен пищевода; болевой или компрессионный медиастинальный синдром; поражение органов средостения; анамнестические показания на сщера-цию на пищеводе или лучевое лечение опухоли пищевода; необходимость оценки состояния медиастинальных лимфатических узлов, в том числе при раке легкого. Особых противопоказаний к рентгенологическому исследованию пищевода нет.
Первый этап рентгенологического исследования — это обзорная рентгеноскопия органов грудной и брюшной полости. Оценивается состояние срединной сердечно-сосудистой тени, позвоночника, хрящей гортани, легочных по-
5. Схема модифицированного аноректального обтуратора:
1 — внутренний цилиндр; 2 — устройство для подачи жидкого содержимого; 3 — устройство для подачи воздуха в воздуховод; 4 — сквозные отверстия; 5 — разделитель; 6 — наружный цилиндр (корпус обтуратора); 7 — обтурирующие баллоны.
лей и плевры, диафрагмы и газового пузыря желудка. Выявленные отклонения следует зафиксировать на снимках. При этом можно обнаружить наличие воздуха и жидкости в просвете пищевода, дивертикулах или грыже пищеводного отверстия диафрагмы, увеличение лимфатических узлов средостения, отсутствие или деформацию газового пузыря желудка.
Второй этап рентгенологического исследования пищевода — контрастное по-липозиционное исследование, включающее просвечивание и снимки пищевода. Оптимальное положение больного зависит от исследуемого уровня пищевода. Исследование глотки и пищевода начинается с вертикального положения больного. Для шейного отдела пищевода более выгодно боковое положение, для грудного — косые положения: правое переднее или левое заднее. Для изучения диафрагмального и брюшного отделов пищевода также лучшим положением является косое: тень левой доли печени отделяется от тени пищевода. При комбинации боковой проекции шеи с косым положением туловища больного можно получить хорошее изображение всего пищевода на одном снимке.
В качестве контрастных веществ применяют бариевую взвесь различной кон-
6. Рентгенограммы контрастированного пищевода (варианты а, б).
систенции, йодолипол, водорастворимые контрастные вещества (гастрографин, верографин, урографин и др.), танталовый порошок, газы (воздух, кислород) и их комбинацию. Наиболее часто используют бариевую взвесь, однородность и мелкую дисперсность которой обеспечивают гомогенизацией в механическом смесителе типа «Воронеж» или длительным кипячением с последующей обработкой электромиксером. Стандартная бариевая взвесь — это 50 % водная
суспензия (100 г порошка сульфата бария и 100 мл воды). Регулируя содержание воды, получают жидкую, более густую бариевую взвесь или бариевую пасту. Конечно, самые лучшие — патентованные препараты типа микротраст, миксобар и др. Жидкая водная взвесь бария в норме быстро пробегает по пищеводу — примерно за 3—5 с от полости рта до желудка в вертикальном положении больного и за 6 — 10 с — в горизонтальном. На прохождение бариевой пасты требуется в 2—3 раза больше времени.
Контрастное исследование пищевода проводят по клиническим показаниям, наиболее часто в связи с дисфагией. Выбор методики исследования требует учета клинических данных о характере дисфагии. Если жидкая и твердая пища легко проглатывается больным, можно провести исследование с использованием в качестве контрастного вещества сернокислого бария. Если жидкая пища проходит легко, а твердая — плохо, то можно предполагать стриктуру пищевода, в том числе обусловленную злокачественной опухолью. В этих случаях показана жидкая бариевая взвесь. При затруднениях проглатывания жидкой и твердой пищи возможно наличие спазма, если эти явления временные, либо ахалазии или склеродермии. Если глотание затруднено или известно, что больной легко может подавиться, возможно неврологическое или мышечное расстройство. В таких ситуациях необходима осторожность, исследование надо начинать с небольшой порции жидкой бариевой взвеси или неионного водорастворимого контрастного вещества. При жалобах больного на жжение за грудиной и боли во время глотания можно подозревать рефлюкс-эзофагит. Начинать исследование лучше с использованием также неионного контрастного вещества, а при отсутствии осложнений — продолжить его бариевой взвесью,
что дает более надежные результаты (D. N. Hupscher, 1986).
Наш опыт и литературные данные свидетельствуют, что для определения проходимости пищевода и состояния его тонуса необходимо использовать жидкую бариевую взвесь, а для изучения как морфологии, так и двигательной активности пищевода — стандартную бариевую взвесь. Густую бариевую взвесь, по мнению В. Б. Антонович (1987), следует применять для тугого заполнения глотки и верхнего отдела пищевода, чтобы обеспечить лучшую визуализацию этих быстро опорожняющихся отделов, предварительно убедившись в отсутствии выраженных сужений или нарушений акта глотания.
Способ двойного (барийгаз) контрастирования пищевода получил большое распространение во всем мире. Хороший пневморельеф и двойное контрастирование пищевода можно получить, если жидкую бариевую взвесь проглатывать большими глотками («залпом») или мелкими порциями, как горячий чай. Эффект двойного контрастирования получается при приеме контрастного вещества через перфорированную трубочку И. А. Санпитера или поильник-сатуратор Л. С. Розен-штрауха и Л. Д. Файтельсона. Для этих целей применяют также специальные газогенезирующие смеси или введение воздуха через зонд.
Изучение методики двойного контрастирования пищевода в условиях пробы Мюллера показало, что развивающееся в процессе данной функциональной пробы отрицательное внутригрудное давление оказывает растягивающее действие не только на стенки пищевода, но и на стенки ззофагокардиальной области. Все элементы последней, в том числе и анатомическая кардия, становятся рентгенологически видимыми в условиях двойного контрастирования и получают на снимках свойст
венное пневмограммам хорошее отображение.
В связи с трудностями, возникающими при рентгенологическом изучении анатомической кардии, Р. М. Агранович предложил (1972) методику, позволяющую выявить морфологические и функциональные особенности кардии. Для ее изучения наиболее целесообразны рентгенограммы в следующих двух основных положениях: с небольшим поворотом в направлении первого косого и в близком к левому боковому вертикальных положениях. Степень поворота исследуемых в каждую из этих позиций желательно определять под контролем экрана так, чтобы плоскость закрытого отверстия кардии оказалась паралельной центральному лучу в первой из них и перпендикулярной во второй.
На пневмограммах в первом из указанных положений исследуемых конечная часть пищеводной трубки имеет форму неправильной воронки. Узкая часть этой трубки обращена к желудку и представляет собой канал длиной 1 — 1,5 см, заканчивающийся изображением анатомической кардии. Внутриже-лудочные границы отверстия кардии, изображенной в профиль, хорошо различимы по расходящимся в противоположных направлениях контурам внутренней поверхности кардиальной части желудка, контрастированным тонким слоем бариевой взвеси. Рентгенологически не дифференцирующаяся наружная стенка этого отдела желудка локализуется на снимке условно, исходя из данных о толщине ее, составляющей 3—5 мм в зависимости от степени растяжения свода желудка воздухом. Для этого, отступив на избранное расстояние к средней линии, параллельно видимому внутреннему контуру следует провести дугообразную линию, указывающую расположение наружной границы карпиального отверстия. Подле по
добного построения анатомическая кардия окажется ограниченной с трех сторон рентгенологически видимыми границами и условной с четвертой стороны. По данным пневмоэзофагокардиогра-фии, ширина отверстия кардии в' этой проекции не превышает 15 мм. На снимках во втором из указанных положений исследуемых кардия определяется как истинное отверстие между полостью пневматизированного пищевода и сводом желудка.
Анализом многих наблюдений установлены различия в форме отверстия анатомической кардии в зависимости от степени ее раскрытия при пневмо-эзофагокардиографии, зафиксированной на снимках. Полностью открытая кардия (80,4 % случаев) чаще имела форму подковы или арки с незамкнутым аборально сегментом, в области которого совершался плавный переход правой стенки пищевода в малую кривизну желудка. Размеры максимально открытого кардиального отверстия при пневмоэзофагокардиографии в норме: по горизонтали — не более 14 мм и по вертикали — не более 15 мм. Ширина подковообразной кардии измеряется на уровне максимального удаления передней и задней полудужек ее изображения, высота — от вершины ее дуги до линии, соединяющей незамкнутые ее концы. При средней степени открытия (12,5 % наблюдений) отверстие кардии имеет овоидную форму с преобладанием вертикального размера. Величина его не превышает 9X11 мм. Если кардия открывается незначительно (7,1 % наблюдений), размеры ее отверстия не превышают 3—5 мм, кардия представляется круглой. На снимках в левом боковом положении исследуемых нормально локализованная кардия располагается в пределах краниальной трети вертикали, проводимой через центр кардии между стенками свода желудка.
Форма кардии в виде контрастного
пятна на стенке кардиальной части желудка, от которого в виде «вилки» или «звезды» отходят контрастные полоски, не отмечена ни в одном из наших наблюдений открытой кардии. Подобные картины характерны, очевидно, для закрытого кардиального отверстия, дополненного контрастированием межскладочных промежутков рельефа слизистой желудка вокруг кардии. Наоборот, изображение кардии в виде двух вписанных друг в друга окружностей разной формы встречается довольно часто. Возникновение такого теневого рисунка объясняется некоторыми авторами пролабированием слизистой пищевода в желудок, где выпавший конгломерат образует вокруг кардии валик, внешние границы которого контрастируются бариевой взвесью и служат причиной появления второго теневого ободка вокруг кардии. Р. М. Агранович установил (1972), что внешний ободок является изображением расширенных воздухом и контрастированных бариевой взвесью стенок пищевода, участки которых, расположенные вблизи кардии, при съемке в левом боковом положении на некотором протяжении совпадают с направлением центральных лучей и изображаются на снимках как дополнительное кольцо вокруг тени кардиального отверстия.
В практической работе для уточнения характера двигательных расстройств, а также при дифференциальной диагностике спазма и органических сужений широко используют фармакологические пробы. Такие препараты, как аэрон, атропин, метацин, папаверин, нитроглицерин, сустак, нитролонг, нит-ронг, спазмолитин, апрофен, пирилеп и другие, оказывают выраженное спазмолитическое действие, снижают мышечный тонус пищевода, снимают спазмы, значительно ослабляют перистальтику. Противоположным действием обладают холинергические и иные сред
ства: ацетилхолин, мехолин, карбохолин, ацеклидин, домперидон, прозерин и т. и., которые повышают тонус мышц пищевода и усиливают его перистальтику.
Функциональная рентгенодиагностика дает возможность объективно толковать физиологию и патофизиологию пищевода. Применение нейро- и мио-тропных фармакологических веществ позволяет выявить ряд функциональных расстройств и способствует раннему распознаванию органических заболеваний и повреждений пищевода. Наряду с рентгеноскопией необходима рентгенография — минимум в двух проекциях с короткой экспозицией.
Для объективной регистрации сме-щаемости пищевода во время дыхания нередко применяется респираторная полиграфия. Она показана в решении вопроса о возможности перехода злокачественного процесса на окружающие органы и ткани. Техника респираторной полиграфии заключается в том, что сразу после приема больным бариевой взвеси в одном и том же положении на одну пленку производятся два снимка: на глубоком вдохе и затем на выдохе. На полученной рентгенополиграмме можно видеть два изображения пищевода, отличающиеся друг от друга по форме и положению, учитывать амплитуду смещения и изменения диаметра просвета пищевода. В зависимости от полученных данных выделяют 3 степени диапазона смещений: I — смещение пищевода больше чем на 1 см (благоприятная, нет прорастания опухоли); II — смещение пищевода менее чем на 1 см (ограниченно подвижная, частичное прорастание опухолью клетчатки средостения); III — нет смещения (опухоль неподвижна, просвет пищевода на уровне опухоли остается без изменений при дыхании, имеется значительное прорастание опухоли в окружающую ткань, опухоль не операбель
на). Метод респираторной полиграфии прост и доступен, не обременителен для больного. Полученные с его помощью данные могут оказаться решающими при выборе тактики лечения злокачественной опухоли пищевода.
Еще нередко в практической работе да и в научных исследованиях применяется рентгенокимография при обследовании больных с различными опухолями пищевода, после перенесенного оперативного вмешательства, в ходе и после лучевого лечения по поводу злокачественных поражений пищевода. С помощью рентгенокимографии можно определить тонус пищевода, скорость и амплитуду его перистальтических сокращений. При злокачественной инфильтрации мышечного слоя стенки пищевода на рентгенокимограмме возникают участки с деформированными ки-мографическими зубцами, высота последних снижена, количество уменьшено, иногда они вовсе отсутствуют.
Для оценки состояния наружных стенок пищевода, уточнения границ распространения злокачественного процесса, выявления взаимоотношения опухоли с окружающими тканями показана пневмомедиастинография. Техника этой методики состоит в том, что контрастированный бариевой взвесью пищевод исследуется на фоне введенного в средостение газа (диагностический пнев-момедиастинум). Если у -наружной стенки пищевода имеется прослойка газа, это указывает на отсутствие прорастания опухоли в клетчатку средостения. Отсутствие прослойки газа у наружной стенки пищевода может наблюдаться при увеличении лимфатических узлов средостения, параэзофагеальном росте опухоли, поражении трахеи, бронхов и другой патологии средостения.
С внедрением в практику рентгено-телевизионного просвечивания с последующей видеомагнитной записью представилась возможность неоднократно
воспроизводить рентгеновское изображение пищевода, изучать его при остановке магнитной ленты. Вместе с тем видеомагнитная запись движущегося рентгеновского изображения проще и экономичнее рентгенокинематографии и рентгенокимографии. По сравнению с этими методиками она обусловливает меньшую лучевую нагрузку. Преимуществом видеомагнитной записи является отказ от применения пленки, ее фотообработки и др.
В последние годы широко внедряется в практику негативная и позитивная электрорентгенография пищевода. Однако первая предпочтительнее при тугом заполнении бариевой взвесью органа, а обе в отдельности — при воздушном и двойном контрастировании. Электрорентгенография пищевода проводится по общепринятой методике рентгенологического исследования с использованием тех же контрастных веществ. Благодаря фотографической широте и краевому эффекту можно отчетливо определить изображение тканей и органов, окружающих пищевод, выявить его наружный и внутренний контуры, рельеф внутренней поверхности, деформацию стенок, дефекты наполнения, выпячивания стенок и другие патологические состояния.
Исследование пищевода должно проводиться обязательно в комплексе с исследованием желудка. В протоколе рентгенологического исследования необходимо отмечать форму, положение, размеры, контуры, рельеф внутренней поверхности и двигательно-эвакуатор-ную функцию «пищевода, а не ограничиваться формулировкой типа «пищевод свободно проходим». При обнаружении той или иной патологии описание общих рентгенологических признаков соответственно дополняется частной рентгеносемиотикой.
Желудок. Рентгенологическое исследование — один из основных методов
диагностики заболеваний желудка. Оно показано всем больным, которые предъявляют жалобы на желудочный дискомфорт, для своевременного установления правильного диагноза, точной локализации и протяженности патологического процесса, выяснения особенностей и степени нарушения функции органа.
По мнению многих исследователей, клинические показания к рентгенологическому исследованию желудка отсутствуют при всех перечисленных обстоятельствах:
1) в качестве обычного периодического скринингового обследования лиц, у которых нет симптомов болезни. Исключение из этого правила может быть сделано в тех географических районах, где необычайно высока заболеваемость раком желудка;
2) с целью контроля за заживлением язвы 12-перстной кишки;
3) в районах, эндемичных по кишечным паразитарным инвазиям (например, по аскаридозу), больных не следует подвергать рентгенологическому исследованию по поводу дискомфорта в животе до тех пор, пока анализ кала не исключит наличие гельминтов;
4) как рутинное исследование в комбинации с исследованием тонкой кишки, когда направивший больного клиницист, исходя из клинических данных, хочет оценить состояние только тонкой кишки;
5) для дополнительной оценки состояния язвы желудка, если имеется возможность выполнить квалифицированную эндоскопию;
6) в качестве исходного исследования резецированного желудка, когда подозревается язва или рак и есть возможность выполнить квалифицированную эндоскопию. Исключение — подозрение на обструкцию пилорического отдела желудка;
7) для оценки острого кровотечения из верхнего отдела желудочно-кишеч
ного тракта, когда можно использовать эндоскопию;
8) в качестве первого исследования при подозрении на заболевание поджелудочной железы, если есть возможность применить эндоскопию, ультразвуковое исследование или компьютерную томографию.
Главная рекомендация гласит, что все рентгенологические исследования должны выполнять только квалифицированные рентгенологи с использованием соответствующего рентгенологического оборудования. Для уменьшения дозы облучения рекомендуется применять усилители рентгеновского изображения. Оптимизация как комплекс организационных мероприятий, направленных на повышение качества рентгенологического исследования желудка, должна включать следующие основные этапы-, подготовку больного к рентгенологическому исследованию; подготовку персонала к рентгенологическому исследованию; приготовление высококачественного рентгеноконтрастного вещества; оптимизацию физико-технических условий рентгенологического исследования; стандартизацию методики рентгенологического исследования; оптимизацию процесса принятия диагностического решения.
Исследование заключается в рентгеноскопии и рентгенографии желудка, которые обычно дополняют одна другую и проводятся как в стационаре, так и в амбулаторных условиях.
Противопоказаний к таким исследованиям весьма немного. Это тяжелый коллапс, неукротимая рвота, гемипарез, параличи конечностей, тяжелое лихорадочное состояние и др. Что касается желудочного кровотечения, то, если его причину невозможно установить другими способами, рентгенологическое исследование желудка проводится в первые сутки или дни после геморрагии, причем только в стационаре. Вопрос
о рентгенологическом исследовании желудка в каждом конкретном случае решает рентгенолог вместе с лечащим врачом.
Рентгенологическое исследование желудка будет успешным при условии тщательной подготовки больного, которая заключается в освобождении желудка от слизи и пищи и кишечника — от каловых масс и газов. Готовить пищеварительный тракт каждого больного для любой методики исследования приходится индивидуально с учетом возраста больного, особенностей основного страдания, функций сердечно-сосудистой и нервной систем, кишечника, желудка и других органов. Молодых людей с нормальной функцией кишечника не нужно специально подготавливать к исследованию, если перед исследованием у них был самостоятельный стул. У пожилых людей, страдающих запорами, необходимо освобождать толстую кишку от каловых масс очистительными клизмами накануне исследования, утром за 1 — 1,5 ч. Если в желудке много слизи и остатков пищи, надо за 1—2 ч до исследования промыть его теплым 2—3 % раствором гидрокарбоната натрия.
На рентгенологическое исследование желудка больной должен являться натощак. Между последним приемом пищи или жидкости и началом исследования должно пройти не менее 10—12 ч. Поэтому исследование желудка, особенно у тяжелых больных, нужно проводить утром, когда секреция желудка наименьшая. В день исследования больному нельзя пить и курить, так как выкуренные натощак сигареты значительно повышают желудочную секрецию и способствуют накоплению слизи в желудке. Не разрешается также накануне исследования принимать алкогольные напитки, лекарственные средства, подавляющие или, наоборот, усиливающие двигательную активность
гладкой мускулатуры пищеварительного тракта.
Для контрастного исследования желудка можно использовать газы, которые по плотности и атомной массе уступают таковым у тканей организма и поэтому в меньшей степени поглощают рентгеновы лучи. Желудок, контрастированный газами, кажется более прозрачным, чем окружающие ткани. Однако чаще всего желудок контрастируют позитивными веществами, которые по атомной массе превосходят окружающие ткани и поэтому поглощают больше рентгеновых лучей. К ним относятся химически чистый сернокислый барий и йодистые водорастворимые органические соединения (гастрографин, кардиотраст, трийодтраст и др.). Наиболее широко используется водно-бариевая взвесь, приготовленная из расчета 100 г сухого порошка сульфата бария на 80 мл кипяченой воды.
Рентгенологическое исследование желудка начинают с обзорной рентгеноскопии, еще лучше — с рентгенографии органов грудной клетки и брюшной полости в условиях естественной контрастности. Это необходимо для того, чтобы: исключить патологические процессы в легких, средостении, сердце и крупных сосудах, могущие повлиять на органы пищеварения и вызвать их изменения; проверить, как подготовлен больной к предстоящему исследованию; выяснить, нет ли признаков перфорации полых органов и кишечной непроходимости; определить форму, положение, размеры и контуры газового пузыря желудка; установить, нет ли патологических образований на его фоне, а также в брюшной полости, из-за которых исследование затруднится или придется применить специальные методики. Только после этого можно приступать к рентгенологическому исследованию желудка с использованием контрастной массы.
При контрастном исследовании желудка перед рентгенологом стоят задачи изучить его морфологические особенности (положение, форму, величину, емкость, макро- и микрорельеф слизистой оболочки, контуры, толщину стенок, их эластичность, состояние сосудов) и функциональное состояние (секреторный слой, кислотность желудочного сока, тонус, перистальтику, «игру» кардии и привратника, сменяемость, моторно-звакуаторную деятельность, .фармакодинамику и др.).
Исследование желудка начинается в вертикальном положении больного, заканчивается — в горизонтальном. Пациент делает 1 — 2 глотка контрастной массы, а врач при соответственно суженной диафрагме прослеживает продвижение этой массы по глотке, пищеводу и через кардию в желудок. Обычно, когда порция контрастной массы приближается к диафрагме, больного просят глубоко вдохнуть и задержать дыхание. В этот момент пищеводная щель диафрагмы замыкается, и продвижение бария в норме приостанавливается, а при выдохе контрастная масса смещается в брюшную часть пищевода и далее — в желудок. Последними исследуются луковица и другие отделы 12-перстной кишки.
Путем умеренной компрессии и направленной пальпации изучают рельеф слизистой оболочки желудка, начиная с тела при нормальном и повышенном тонусе или с антрального отдела — при гипотонии желудка. У здоровых людей распределение небольшой порции бариевой взвеси оптимальное — равномерное в бороздках между складками, в то время как сами складки или, точнее, их гребни остаются не прикрытыми контрастным веществом и выступают на экране во время просвечивания или на прицельных снимках светлыми полосками. По указанию врача больной принимает следующие порции
бариевой взвеси. Затем исследуют желудок после ТБЗ в различных проекциях при вертикальном и горизонтальном положении больного, а иногда — и в положении Тренделенбурга. В ходе исследования, следя по рентгеновскому или телевизионному экрану, делают обзорную и прицельную рентгенограммы.
Во время просвечивания больного поворачивают в разные стороны, причем тщательно изучают не только малую, но и большую кривизну желудка, а также переднюю и заднюю его стенки. Обязательно делают обзорные снимки всего желудка — в прямой передней, в первой косой и в боковой проекциях. Большую диагностическую ценность представляют серийные прицельные снимки, сделанные в процессе исследования.
Вследствие глубокого расположения желудка и его контрастирования для производства снимков необходима большая мощность излучателя. Условия рентгенографии диктуются следующим. Чтобы разница в насыщенности теней при искусственном контрастировании желудка была большой, необходимо высокое напряжение на трубке. Приемлемую динамическую нерезкость, обусловленную двигательной деятельностью желудка, получают при выдержках 0,1-0,2 с.
Близкий к оптимальному режим гастрорентгенографии бывает при большом фокусе трубки, напряжении 90 — 125 кВ, экспозиции до 50 мАс, выдержке 0,05 — 0,1 с с использованием экранов ЭУ-В2А, ЭУ-ВЗА, ЭУ-Ф, ЭУ-СБС-2, ЭУ-Л4, ЭУ-ИЗ, ЭУ-И4 и др.
Иногда жесткую съемку желудка рекомендуется выполнять с напряжением 112 — 125 кВ на трубке. Рентгенограммы желудка, сделанные при этом напряжении с использованием обычной бариевой взвеси, достаточно контрастны. Более того, на них появляются дополнитель-
7. Рентгенограмма контрастированного желудка.
ные детали. На снимке, произведенном жесткими лучами при полутугом заполнении желудка, можно одновременно увидеть структуру его рельефа и контуры.' Благодаря использованию жесткого излучения сокращается время выдержки и вследствие этого уменьшается динамическая нерезкость структур, особенно микрорельефа слизистой оболочки желудка.
Желудочные поля выявляют после 2—3 небольших глотков специально приготовленной бариевой взвеси. Для получения на снимках рисунка ареол прицельным тубусом создают компрессию желудка до полного или почти полного раздавливания складок и образования тонкого, .едва видимого глазом на просвечивающем или телевизионном экране слоя контрастного вещества. По
мнению В. С. Пручанского (1978), чрезмерная компрессия желудка недопустима, так как можно полностью раздавить ареолы и не получить их отражения на снимках. С этими целями необходимо использовать рентгеновские трубки с микрофокусом или малым фокусом. Чтобы легко выявить ареолы, оптимальное фокусное пятно должно быть величиной 0,9 мм2, но можно применять и рентгеновские трубки с фокусным пятном 1,2 мм2. При фокусе площадью 2 мм2 также выявляется рисунок микрорельефа. Однако качество его хуже, поскольку ареолы увеличиваются и становятся менее четкими по контурам. Выдержка при рентгенографии желудка колеблется от 0,03 до 0,08 с и зависит от комплекции больного, но никогда не должна превышать 0,1 с.
Для изучения перистальтики желудка проводится полиграфия, которая заключается в получении триплограммы, т. е. трех снимков части желудка на одной пленке, с целью обнаружения перистальтики стенки желудка в интересующем врача месте. Снимки делают после ТБЗ желудка, в фазе задержки дыхания, с интервалом между ними 10 — 15 с. При этом напряжение на трубке увеличивается на 3—5 кВ выше обычного, а выдержку делят на три равные части.
В некоторых случаях приходится исследовать желудок в латеропозиции, чтобы выявить 'изъязвления слизистой оболочки и плоские бляшковидные раки на стенках тела желудка. Меняя положение больного на латероскопе, находят околожелудочные сращения и определяют их распространенность.
Получить отчетливое изображение макро- и микрорельефа слизистой оболочки любого отдела желудка, определить эластичность его стенок, когда предполагается их инфильтрация, уточнить распространенность выявленного в желудке опухолевого процесса можно
после двойного контрастирования желудка бариевой взвесью и газом (создания пневморельефа). Некоторые рентгенологи полагают, что, если у больного подозревается рак верхнего отдела желудка, исследование надо начинать с раздувания желудка (пневмографии) и только после этого контрастировать желудок бариевой взвесью.
Желудок раздувают воздухом чаще через тонкий дуоденальный зонд, введенный в дистальный конец пищевода (над кардией) или непосредственно в желудок. Через этот зонд можно ввести в желудок воздуха столько, сколько нужно (обычно около 300—350 см3), наблюдая за растяжением стенок желудка, определяя их эластичность под рентгеновским экраном и производя во время исследования необходимые снимки в самых различных проекциях.
Раздувание желудка через зонд (Антонович, Фирсов, Розенштраух и соавт.) или введение воздуха в резиновый баллон, укрепленный на зонде (Херсонская), позволяет дозировать количество газа. Но заглатывание зонда вызывает у всех больных неприятное ощущение, а у некоторых значительно затруднено из-за повышенного рвотного рефлекса. Введение зонда через нос нередко невозможно из-за полипов, искривления носовой перегородки. Кроме того, применение зонда противопоказано ослабленным больным и страдающим сердечно-сосудистыми заболеваниями, бронхиальной астмой и др.
Если ввести зонд в желудок трудно, то пневмогастрографию выполняют следующим образом: больному дают принять внутрь газовыделяющую шипучую смесь, состоящую из 2—3 г лимонной, уксусной или виннокаменной кислоты и 4—5 г гидрокарбоната натрия, которую он запивает 50 мл воды. П. В. Власов и В. Ф. Якименко предлагают брать 3 г гидрокарбоната натрия и 2 г ли
монной кислоты. Смесь больной высыпает на язык и запивает глотком воды.
Чтобы использовать шипучие смеси, по мнению многих исследователей, к контрастной взвеси следует добавлять пеногасители. Наиболее распространены силиконовые пеногасители: диметилполисилоксан, гаскон, супаритин, симетикон, муликон и др. В нашей стране для этих целей применяется анти-фомсилан, по 2,5 мл на стакан бариевой взвеси.
Наилучший метод введения газа в желудок — беззондовое раздувание желудка кислородом в виде белково-кислородной пены, предложенное Е. Ф. Фирсовым. Чтобы получить пену, кислород из баллона с редуктором для регуляции потока газа пропускают через спиралевидную трубку с мелкими отверстиями, находящуюся в смесителе с пенообразующим составом (500— 700 мл кипяченой воды, смешанной со взбитым белком одного свежего куриного яйца). Для заполнения желудка белково-кислородной пеной исследуемый заглатывает ее через сменный про-стерилизованный наконечник. Под периодическим контролем рентгеновского экрана достигают дозированного введения пены.
Белково-кислородную пену можно заменить белково-воздушной. Такую пену получают следующим образом. Один свежий яичный белок смешивают с одним стаканом холодной водопроводной воды с помощью миксера, используемого для получения бариевой взвеси. В зависимости от необходимости больной съедает 2—3 или более стаканов образовавшейся воздушно-белковой пены (более 1 л) под контролем рентгеновского экрана. Способ прост, не вызывает у больного неприятных ощущений и может быть рекомендован для широкого применения во всех рентгеновских кабинетах.
Л. С. Розенштраух рекомендовал исследовать рельеф слизистой оболочки желудка на фоне воздуха после двойного контрастирования желудка поильником-сатуратором без введения в желудок зонда и газообразной смеси. Двойное контрастирование желудка можно осуществить с помощью прибора Л. Д. Фай-тельсона и К. И. Амброзайтиса.
При анализе перечисленных методик рентгенологического исследования желудка в отдельности или в их комбинации установлена различная диагностическая эффективность. Так, при тугом бариевом заполнении желудка выявляют патологические изменения в 51 % случаев, при рентгенографии компрессионной бариевой взвеси — 65, изучении рельефа слизистой — 62, двойном контрастировании — 82 %. Если сочетают две методики, тА это двухфазное исследование желудка, если три — трехфазное, четыре — четырехфазное. Такое многофазное рентгенологическое исследование в различных комбинациях дает различную диагностическую эффективность, а именно: при использовании 3 методик без применения ДК найдено 89 % изменений, при сочетании методики первичного ДК с последующим ТБЗ изменения выявлены в 91 %, при сочетании ТБЗ, РКБВ и ДК — в 99 %, при сочетании ТБЗ, ИРС и ДК — в 97 %. Многофазное рентгенологическое исследование желудка, а также двухфазное исследование (ДК+ТБЗ) и применение трех методик, включая ДК, дают лучшие результаты, чем изолированное использование ДК или обычного рентгенологического исследования без ДК (Gelfand et al., 1987).
Объемные патологические процессы в желудке, особенно в его верхнем отделе, а также сращения желудка с соседними органами лучше диагностируются при исследовании этого органа в условиях пневмоперитонеума с одновременным раздуванием желудка газом
(париетографией). Париетографию желудка нередко сочетают с его тройным контрастированием (после приема внутрь бариевой взвеси). Чтобы выяснить точную локализацию, определить степень распространенности и особенности патологического процесса в желудке в этих условиях, показана и томография.
Для диагностического пневмоперито-неума в брюшную полость в зависимости от объема живота, тонуса брюшной стенки и задач исследования вводят от 500 до 2000 см3 газа. Больной является в рентгеновский кабинет на исследование натощак, кишечник его накануне очищен промывной клизмой. Перед исследованием больному освобождают мочевой пузырь. В процедурной больного укладывают на спину. Операционное поле обрабатывают спиртом, место пункции обезболивают 0,5 % раствором новакаина. Брюшную стенку чаще всего прокалывают в точке, расположенной на 4 см влево и книзу от пупка. Если в брюшной полости обнаружена жидкость, ее выпускают, затем в полость вводят газ (закись азота или углекислый) со скоростью 100— 200 см3/мин.
При париетографии желудок контрастируют дополнительно. Тогда через 10—15 мин после создания пневмо-перитонеума желудок раздувают, чаще всего через дуоденальный зонд, и больного укладывают на стол на спину. Производят обзорный рентгеновский снимок брюшной полости. Убедившись в правильности укладки и соблюдении технических условий, на высоте неглубокого вдоха и при задержанном дыхании делают томограммы. Первый слой выделяют, в зависимости от комплекции больного, на расстоянии 9—12 см от стола, последний — на глубине 4 — 6 см от передней брюшной стенки.
Томограммы можно получить и в других положениях больного. Если трудно
установить распространение опухоли и ее отношение к стенке желудка, можно дополнительно провести тройное контрастирование желудка и полученное изображение зафиксировать на обычных или послойных снимках.
Диагностическая ценность данных томографии в условиях двойного или тройного контрастирования огромна, особенно результатов определения толщины стенки желудка. Если в норме стенка желудка в зависимости от сокращения его мышечной оболочки имеет толщину 2—5 мм, то при воспалительной и особенно опухолевой инфильтрации она значительно шире.
Применение белково-кислородной или белково-воздушной пены для контрастирования желудка значительно улучшило качество рентгенодиагностики. На парието- и томопариетограммах получают отчетливое изображение стенок желудка и имеющихся новообразований во всех его отделах. Качество изображения не уступает получаемому при парието- и томопариетографии, произведенных с введением воздуха в желудок через зонд.
•
Чтобы оценить эластичность стенок и сократительную способность желудка при слабой перистальтике или длительных спазмах его выходного отдела, используют различные фармакологические средства, влияющие на тонус, перистальнику и пропульсивную деятельность органа. С этими препаратами легче выявлять болезни желудка в начальных стадиях, определять степень уже ' распознанного патологического процесса и отличать органические изменения от функциональных. Из множества таких препаратов наибольшей популярностью пользуются нейротропные, в частности 0,1 % раствор атропина в дозе 0,5 — 1 мл и 1 % раствор морфина в дозе 0,25—0,5 мл, которые вводят внутривенно. Для снижения тонуса и двигательной функции наряду с атропи
ном широко используют и второй холи-нолитик — метацин (под кожу 2—3 мл 0,1 % раствора). С целью повышения тонуса и увеличения глубины перистальтики вместо морфина можно вводить под кожу или внутримышечно 0,5—1 мл 0,2 % раствора ацеклидина. Заслуживает внимания и аэрон, обладающий центральным й периферическим действием. В дозе 1—2 таблеток, принимаемых под язык, он усиливает двигательную деятельность желудка,а в дозе 3—4 таблеток, наоборот, расслабляет желудок.
В практической работе рентгенолога все большее применение находят рефлексогенная релаксация желудка методом акупунктуры. Чаще всего иглоукалывание производят в точку желудка левой ушной раковины и билатерально в корпоральную точку Хоуси как точку общего антиспастического действия. Время воздействия 20— 25 мин. После иглоукалывания больной принимает бариевую взвесь. Рефлексогенная релаксация способствует понижению тонуса, увеличению объема, замедлению эвакуации, ослаблению пропульсивной активности желудка, лучшему выявлению рельефа слизистой оболочки.
В установлении причины желудочного кровотечения, определении точной локализации, степени распространенности и особенностей патологического процесса большое значение в некоторых случаях имеют данные ангиографии, точнее — результаты суперселективной ангиографии желудка. Ангиография проводится после тщательного общеклинического исследования, потому что она противопоказана при острых заболеваниях печени и почек, общем тяжелом состоянии, активном туберкулезе, острых инфекционных заболеваниях, повышенной чувствительности больного к йодистым препаратам, склонности к аллергическим реакциям.
Для определения индивидуальной чувствительности больного к контрастным препаратам ставится йодная проба: за сутки до исследования внутривенно вливают 1,5—2 мл любого водорастворимого контрастного вещества. Йодная проба считается положительной, если появляются кожные высыпания, слезотечение, насморк, кашель, тошнота и рвота, изменяется сердечный ритм, возникают изменения на ЭКГ, свидетельствующие о нарушении функции проводящей системы сердца. В таких случаях надо отказаться от исследования. Если же йодная проба отрицательная, больной готовится к ангиографии.
При подготовке больного к исследованию прежде всего необходимо психологическое разъяснение ему необходимости проведения ангиографии. На ночь больному назначают транквилизирующие средства. В день исследования больной не принимает пищу, ему тщательно выбривают волосы в области пункции сосуда. За 30 мин до исследования проводят так называемую премедикацию — внутривенно вливают по 2 мл 2,5 % раствора пипольфена и 1 % раствора промедола.
В зависимости от локализации поражения желудка целенаправленно подводят контрастное вещество поближе к месту поражения. Чрескожная кате-теризационная аортография выполняется специальными инструментами: троакаром, металлическим проводником с мягким концом и полиэтиленовым рентгеноконтрастным катетером. Катетер вводится через бедренную артерию по методике Сельдингера. Предварительно он моделируется (создается один или два изгиба), чтобы плотно прилегал к стенке аорты. Такой катетер удобно подводить к устью исследуемого сосуда: катетер легко попадает в сосуд и прочно фиксируется в нем на все время исследования. Такое, разумеется,
возможно при условии, что исследователь хорошо знает анатомию сосудистой системы органов брюшной полости.
Артерии желудка берут начало от чревного ствола и его ветвей. На малой кривизне желудка лежат две артерии: слева от чревного ствола — левая желудочная и справа, начинающаяся от собственно печеночной артерии, — правая желудочная. Обе артерии анастомозируют на малой кривизне своими конечными отделами и отдают на переднюю и заднюю поверхности желудка множественные ветви. На большой кривизне, желудка находятся правая желудочно-сальниковая артерия (которая ответвляется от желудочно-дуоденальной артерии), левая желудочно-сальниковая (от селезеночной артерии) и короткие желудочные артерии (также начинаются от селезеночной артерии). Эти артерии анастомозируют между собой, образуя на большой кривизне артериальное кольцо, от которого к передней и задней поверхности желудка направляются ветви.
Чревный ствол ответвляется от аорты на уровне тела Тхп • Сюда, следя по телевизионному экрану, подвигают катетер и, перемещая его конец по передней стенке аорты, пытаются вставить катетер в чревный ствол. После того как катетер окажется в устье исследуемой артерии, вводят контрастное вещество в пробной дозе (5—6 мл). Убедившись, что зонд установлен правильно, по заданной программе, чаще всего в течение 3—5 с, производят серию снимков, на которых отражаются артериальная и паренхиматозная фазы контрастирования. После исследования зонд извлекают, на область пункции накладывают давящую повязку. После ангиографии больной остается на постельном режиме в течение суток.
Рентгенологически можно определить и кислотность желудочного сока путем использования тестовых таблеток.
В одних случаях применяют таблетки сернокислого бария, покрытые диметиламиноэтиловым эфиром полиметак-риловой кислоты. После приема больным этих таблеток рентгенологически исследуют его желудок через каждые 2—3 мин. Время распада таблеток колеблется от 6 до 43 мин. В других случаях используют таблетки из бария сульфата и натрия гидрокарбоната. В желудке они распадаются за 10— 12 с (Амиров и др., 1974).
Кислотообразующую функцию желудка можно установить по методике И. О. Неймарка. В основу ее положено рентгенологическое определение изменений размеров и формы газового пузыря желудка, отражающих результаты взаимодействия введенного в желудок натрия гидрокарбоната (1 чайная ложка) и соляной кислоты желудка. Введенная сода нейтрализует свободную соляную кислоту с образованием углекислого газа. Последний при соблюдении больным вертикального положения поднимается в верхние отделы желудка. В результате газовый пузырь увеличивается, причем тем больше, чем больше кислоты имелось в желудке в момент приема соды. У больных ахлоргидрией размеры газового пузыря не изменяются.
В последние годы в нашей стране и за рубежом получило признание радионуклидное исследование желудка с твердой пищей. Гастросцинтиграфия перспективна потому, что на организм исследуемого ложится небольшая лучевая нагрузка, при этом удается диагностировать функциональные нарушения и органические поражения желудка.
Суть радионуклидного исследования заключается в следующем. Больной получает натощак 200 г стандартно приготовленной манной каши, меченной коллоидным раствором 99п.тс ,и 200 г сладкого чая. Информация записывается на гамма-камеру непрерывно 12 или
24 мин. Если параллельно использовать ЭВМ, можно получить кривые «активность — время», отражающие передвижение меченой пищи из желудка в кишечник, а также провести математическую коррекцию этих кривых и вычислить время эвакуации из желудка половины пищи.
После принятия больным пробного завтрака на экране осциллоскопа можно наблюдать развертывание и постепенное заполнение отделов желудка и таким образом получить представление о тонусе, перистальтических волнах по малой и большой кривизнам желудка, об эвакуаторной его функции. Радионуклидным методом выявляются и очаговые поражения желудочной стенки (Попова, Огнева, 1980).
По данным радионуклидного исследования можно изучить и всасывательную функцию желудка. С этой целью используют радиоактивный йод. Активность последнего определяют над областью лучевой артерии и над щито-видной железой накапливающей 1. Время появления импульсов соответствует времени всасывания радиоактивного йода. Для исследования секреторной функции желудка больной должен принять внутрь препарат трехвалентного радиоактивного хрома на ионообменной катионидной смоле, которая разрушается кислой средой желудка и при этом освобождается радиоактивный хром. Чем выше кислотность желудочного содержимого, тем больше разрушается смолы и больше выделяется хрома. Поэтому количество выделенного с мочой радиоактивного хрома косвенно отражает кислотность желудочного содержимого.
Особенности рентгенологического исследования желудка у детей — поводом для направления детей раннего возраста на рентгенологическое исследование желудка, как правило, служат срыгивания и рвота, начавшиеся с момента
рождения или вскоре после него и продолжающиеся без каких-либо причин. При этом прибавление массы тела ребенка приостанавливается или нарастает его похудание. Относительными показаниями к рентгенологическому исследованию желудка являются срыгивания и рвота, сопровождающие какую-то болезнь и продолжающиеся после излечения ребенка. Такое исследование желудка противопоказано детям, находящимся в тяжелом состоянии, страдающим вялотекущими энтероколитами и колиэнтеритами, с признаками желудочного кровотечения. Исследовать рентгенологически желудок у детей, особенно у новорожденных и грудных, весьма сложно не только из-за их беспокойства, но и вследствие трудности проведения исследования и трактовки полученных результатов. При рентгенологическом исследовании желудка у детей надо учитывать также один из основных принципов современной рентгенологии: получение наибольшей диагностической информации при наименьшей лучевой нагрузке на пациента.
Предложено много разнообразных методик рентгенологического исследования желудка у детей. Согласно Ю. Р. Левину (1968), по характерным особенностям их можно объединить в три большие группы:
I — после обзорной рентгеноскопии органов грудной и брюшной полостей ребенок через соску или с ложечки получает взвесь бария объемом до 100 мл, приготовленную на грудном молоке с концентрацией от 5 до 30 %. Исследования проводят сразу после приема контрастной взвеси, через 15—20 мин и затем через 2, 4, 6, 8 и 24 ч. Рентгеноскопию выполняют в вертикальном положении ребенка, а рентгенограммы — в положении лежа на животе. Подготовка к исследованию ограничивается 8—10-часовым голоданием, у некоторых
детей дополняется очистительной клизмой;
II — детям делают только рентгенограммы. После дачи через соску бариевой взвеси производят серию снимков до получения на них изображения контрастированного пилорического канала. В это время ребенок лежит на животе с приподнятым левым боком под углом 45° (правое косое положение по отношению к кассете);
III — контрастная взвесь вводится в желудок через зонд под экраном. Предварительно отсасывается желудочное содержимое.
Каждая из этих методик имеет свои достоинства и недостатки. При всех исследованиях по этим методикам ребенок получает большую лучевую нагрузку, снизить которую можно путем преимущественного выполнения рентгенографии или вообще только рентгено-гастрографии или рентгенологического исследования строго по показаниям. Причем исследование нужно ограничивать 3—5 снимками.
Ю. Р. Левин еще в 1968 г. предлагал проводить рентгеногастрографию у грудных детей перед очередным кормлением без предварительной их подготовки. Для изучения состояния органов грудной клетки, обнаружения газа и жидкости в желудке и распространения газа по кишечнику делается обзорный снимок органов грудной и брюшной полостей одновременно на кассете размером 18X24 см в вертикальном положении ребенка при заднепереднем направлении лучей. После обзорного снимка — через нос, а при катаральных явлениях в полости носа — через рот в желудок вводится зонд (катетер) и отсасывается содержимое желудка. В дальнейшем 20—30 % бариевая взвесь, приготовленная на 5 % растворе глюкозы, подогревается до 37 °C, набирается в шприц емкостью 20 см3 и 15 мл взвеси вводится через зонд в желудок. Затем зонд
подтягивается до начального отдела пищевода и вводятся оставшиеся в шприце 5 мл бариевой взвеси. В то же время делается снимок в первом косом положении, лицом вниз по направлению к кассете. На рентгенограмме, полученной в таком положении ребенка, хорошо видны контрастированные пищевод, желудок, пилорический канал и луковица 12-перстной кишки. После этого снимка ребенок в палате получает очередное кормление. Последний, третий снимок рекомендуется делать через 2 ч после введения контрастной взвеси и очередного кормления, положив ребенка на кассету лицом вниз. По этому снимку определяются динамика и эвакуаторная функция желудка.
Тонкая кишка. Клинические показания к рентгенологическому исследованию тонкой кишки должны определяться индивидуально лечащим врачом совместно с рентгенологом. Они включают подозрения на энтерит или туберкулез, опухоль или непроходимость. Такое исследование может быть полезным при оценке нарушений всасывания, а также у больных с желудочно-кишечным кровотечением, у которых результаты всех других методш исследования соответствуют норме. Существуют, однако, ситуации, в которых больных очень часто направляют на исследование с естественным пассажем бария, хотя оно не требуется. Это — контрастное исследование желудка и тонкой кишки при диспепсии. Следует учитывать, что отказ от исследования чреват худшими последствиями, чем расширение показаний к нему.
Исследование тонкой кишки обычно начинается с рентгеноскопии брюшной полости. При этом можно иногда выявить скопления газа и горизонтальные уровни жидкости в петлях тонкой кишки. Более детальные сведения получают, используя контрастную бариевую взвесь. Больных исследуют натощак, после очи-
8. Рентгенограммы контрастированных желудка и петель тонкой кишки (варианты а, б).
щения толстой кишки. Каждую часть тонкой кишки изучают в отдельности. Рентгеноскопию необходимо сочетать с рентгенографией. Наиболее распространено пероральное контрастирование тонкой кишки 200 мл водной взвеси сульфата бария («контрастный завтрак»).
После предварительного исследования пищевода и желудка изучаются 12-перстная, тощая и подвздошная кишка. Содержимое «завтрака» продвигается по 12-перстной кишке быстро, в течение 5—8 с. Причем в ее верхней горизонтальной части, непосредственно у верхнего изгиба, изредка задерживается немного контрастного вещества.
Здесь находится верхний бульбодуоденальный сфинктер. Очень быстро бариевая взвесь продвигается в проксимальной половине нисходящей части 12-перстной кишки, минует второй, медиодуо-денальный, функциональный сфинктер — сфинктер Капанджи. Далее движение контрастного вещества несколько замедляется и взвесь ненадолго задерживается в нижней части, в том месте, где находится третий функциональный сфинктер — сфинктер Окснера. Миновав этот сфинктер, бариевая взвесь без задержки по нижней горизонтальной, восходящей ветви и 12-перстно-тощему изгибу поступает в тощую кишку.
Через 10—15 мин после приема взвеси бария становится видна тень первых петель тощей кишки, а через 1,5—2 ч — всех остальных ее отделов. Фазы заполнения тонкой кишки фиксируют на рентгенограммах через 15, 30 мин, 1, 2 и 3 ч после перорального приема взвеси бария. Илеоцекальный отдел исследуют спустя 4 —6 ч.
В результате удается изучить состояние тонкой кишки в день исследования пищевода и желудка. В близких к нормальным условиях определяются темпы продвижения контрастного вещества по тонкой кишке, уточняются особенности распределения бариевой взвеси по петлям кишечника, выявляются патологические изменения кишки и соседних органов.
Существует много способов ускорения продвижения бариевой взвеси по кишечнику: фракционный прием,
охлаждение бариевой взвеси до 3—5 °C, применение лекарственных средств и др. Чтобы ускорить пассаж контрастного вещества по кишечнику, мы длительное время используем пищевой сорбит. Для перорального контрастирования тонкой кишки применяют сорбитно-водно-бариевую взвесь. Способ приготовления: в 1 /з стакана горячей воды растворяют 20 г сорбита или ксилита, затем добавляют густую бариевую пасту до целого стакана. Бариевая паста готовится следующим образом: 10 пачек сульфата бария смешивают с 1 л воды миксером в течение 15—20 мин, после чего смесь кипятят 15—20 мин.
Трехкратная энтерография — больной выпивает 200 мл сорбитно-водно-бариевой взвеси. Изучают пищевод, желудок и 12-перстную кишку по общепринятой методике. Через 15—20 мин после приема контрастной взвеси делают первую обзорную рентгенограмму брюшной полости, через 40—45 мин — вторую, через 90—Q5 мин — третью. При нормальной эвакуаторной функции
тонкой кишки на первой рентгенограмме определяется заполнение контрастной взвесью тощей кишки и проксимального отдела подвздошной кишки, на второй — дальнейшее заполнение среднего и дистального отделов подвздошной кишки и, возможно, слепой кишки, на третьей рентгенограмме — заполнение слепой кишки, восходящего или более дистальных отделов толстой кишки. По трем рентгенограммам определяют топографию петель тонкой кишки, судят о характере заполнения, ширине просвета и рельефе слизистой оболочки. Не только подвздошную, но и тощую кишку целесообразно исследовать в горизонтальном положении пациента. При необходимости делают дозированную компрессию валиком или кладут пациента на живот. Технические условия съемки не отличаются от обычных при обзорной рентгенографии брюшной полости. Снимки выполняют в фазе выдоха. Преимущество этой методики в сокращении времени исследования в 3 раза.
Ускорение нропульсии контрастной взвеси по тонкой кишке под влиянием сорбита проис: одит при отсутствии изменения темпо! опорожнения желудка, что создает естественную фракционность заполнения тонкой кишки, в особенности тощей кишки. Это дает возможность не только избежать наложения петель кишки друг на друга, но и более длительно наблюдать рельеф слизистой оболочки при средней степени растяжения кишечного просвета.
Пероральная илеоцекография с двойным контрастированием используется в качестве дополнения к методу трехкратной энтерографии. При контрастировании сорбитно-водно-бариевой взвесью илеоцекального отдела делают две прицельные рентгенограммы его в косых проекциях на пленках 18Х 24 см в положении больного на спине или животе. По снимкам изучают ширину
9. Рентгенограммы контрастированной тонкой кишки после приема сорбитно-бариевой взвеси: а — через 15 мин; б — через 40 мин.
просвета и рельеф слизистой оболочки терминального отдела подвздошной кишки в динамике. Затем ретроградно, через прямую кишку, вводят воздух, поворачивая больного последовательно на правый (для заполнения нисходящей и поперечной ободочной кишок), на левый бок (заполнения восходящей и слепой кишок), на правый бок (для заполнения подвздошной кишки). В условиях двойного контрастирования делают прицельные рентгенограммы илеоцекального отдела в прямой и косых проекциях. Желательна дозированная компрессия валиком.
Если предполагается проведение илеоцекографии с двойным контрастированием, рекомендуется подготовить больного. Исключается прием пищи за 12 ч до исследования. Вечером дела
ется первая очистительная клизма, вторая — за 3 ч до исследования.
Интубационная энтерография — контрастную взвесь в различные отделы тонкой кишки можно ввести с помощьн специальных длинных зондов, напримег двухканального зонда Миллера — Эбб<-та. Суть метода: при горизонтально!* положении больного, лучше на правок боку, производится интубация тонко! кишки. Затем постепенно вводят в кишку бариевую взвесь со скоростьк 75 мл/мин до заполнения всей тонко! кишки или определенной ее части. Прг необходимости двойного контрастирова ния дополнительно вводят воздух 1 делают снимки в различных положениях. Во время выполнения исследова ния дают оценку следующих рентген* логических критериев состояния тонког
кишки: положения, тонуса, воздушного просвета, способности к растяжению, содержимого, ширины, конфигурации и расстояния между циркулярными складками, толщины стенок, контуров, поверхности, подвижности петель, сме-щаемости и времени пассажа контрастной массы.
Преимущества этой методики: сокращение времени исследования до 20 мин, равномерное заполнение кишки, возможность одновременно видеть все отделы тонкой кишки, а также обнаружить любое поражение на всем протяжении и установить его связь с соседними органами, определить ригидность стенок кишки.
Релаксационная интестинография — чтобы лучше выявить морфологические и функциональные признаки различных нарушений ЖКТ в начальных стадиях болезни, определить степень уже распознанного патологического процесса и отличить органические изменения от функциональных, при рентгенодиагностике используется множество фармакологических средств. Наиболее пригодны в этом отношении холинолитические препараты и ганглиоблокато-ры. Они способствуют снижению моторики и тонуса различных отделов тонкой кишки, воздействуя на блуждающий нерв или собственные нервные сплетения кишки.
Релаксационная дуоденография выполняется двояко — через зонд и без зонда. Оба способа не следует противопоставлять, потому что их назначение различно. По мнению Ю. В. Линевского, И. С. Павловой (1974), А. Н. Михайлова (1978, 1985) и других, дуоденография без зонда используется как один из основных методов диагностики патологических изменений 12-перстной кишки, когда данных обычного рентгенологического исследования недостаточно. Она проста, доступна для выполнения широким кругом рентгенологов,
особенно в поликлинических условиях. По результатам дуоденографии через зонд уточняют детали уже обнаруженных патологических изменений петли 12-перстной кишки, прежде всего выявляют изменения головки и перешейка поджелудочной железы.
Релаксационная дуоденография была предложена и подробно разработана в 1953 г. аргентинским хирургом D. Li-otta, который вызывал гипотонию 12-перстной кишки путем парентерального введения 4—5 мл холинолитического препарата — антренила, подкрепляя его действие местной анестезией через зонд слизистой оболочки 12-перстной кишки 10 мл 2 % коллоидного раствора ксилокаина. Спустя 15— 20 мин 12-перстная кишка через этот зонд заполнялась бариевой взвесью (300—400 мл) и производились рентгенограммы в различных положениях больного. Затем контрастное вещество отсасывалось, выполнялась новая серия рентгенограмм. После этого кишка раздувалась воздухом и делался снимок рельефа слизистой оболочки.
В нашей стране дуоденографию в условиях искусственной гипотонии в 1958 г. впервые осуществили Г. И. Вар-новицкий и В. В. Виноградов. Они заменили антренил отечественным ганг-лиоблокатором — метацином, а для анестезии слизистой оболочки использовали раствор новокаина, контрастное вещество вводили через зонд.
Гипотоническая дуоденография через зонд — методика разработана Ю. В. Ли-невским и И. С. Павловой в 1974 г. Больного готовят так же, как для обычного исследования верхних отделов пищеварительного тракта. Исследование начинают с введения в 12-перстную кишку дуоденального зонда. Предпочтительнее использовать зонд с оливой, так как он легче проникает в 12-перстную кишку и в силу особенностей строения оливы позволяет в дальнейшем по-
10. Релаксационная дуоденография:
а — выполнена без зонда; б — через зонд.
лучать более четкую картину пневморельефа. Утром натощак больной проглатывает 40—50 см зонда. Если у больного повышен рвотный рефлекс, перед введением зонда слизистую оболочку глотки и корня языка целесообразно смазать 1 % раствором дикаина или 10 % масляным раствором анестезина. Если больной не может проглотить зонд, последний можно ввести через нос. Для этого в одну из ноздрей необходимо закапать 4—6 капель 1 % раствора дикаина и спустя 3—5 мин ввести в нее зонд без оливы. В дальнейшем астеников и нормостеников лучше уложить на правый бок и попросить их в этом положении медленно проглотить еще 30—
35 см зонда. Когда зонд из желудка в 12-перстную кишку продвигается с трудом, больным рекомендуют периодически поворачиваться на живот и совершать дыхательное движение животом. Гиперстеников лучше укладывать на правый бок с поворотом на спину, поскольку у них луковица 12-перстной кишки обычно находится позади желудка. Ускорить продвижение зонда из желудка в 12-перстную кишку можно путем прицельной, пальпации пилоро-дуоденальной зоны под экраном.
О локализации зонда судят по месту ощущения больным толчка от вводимого через зонд воздуха. Если зонд находится в желудке, больные обычно четко
ощущают толчок в эпигастральной области. При этом нередко слышно урчание. Если же зонд находится в 12-пер-стной кишке, больные ощущают очень слабый толчок в правой половине живота в сторону нижних конечностей или, реже, поясничной области. Из 12-перстной кишки через зонд начинает вытекать щелочное содержимое, окрашенное желчью. Положение конца зонда уточняют под экраном.
Большинство исследователей пришли к выводу, что конец зонда лучше установить на уровне верхней трети — середины нисходящей части 12-перстной кишки, поскольку рельеф слизистой оболочки наиболее отчетлив дистальнее выходного отверстия зонда. Если же конец зонда будет ниже, рельеф слизистой оболочки самой важной в клиническом отношении нисходящей части 12-перстной кишки не всегда достаточно четкий. Поэтому в состоянии гипотонии кишки зонд необходимо подтянуть непосредственно перед введением в кишку бариевой взвеси. После подтягивания зонда больному предлагают проглотить его снова, чтобы зонд описал дугу по большой кривизне желудка. В противном случае при незначительных поворотах больного зонд может выскользнуть обратно в желудок. При обычной моторике кишечника вся эта процедура менее эффективна, так как зонд во время подтягивания нередко антиперистальтическими движениями выбрасывается в желудок или при повторном заглатывании опускается ниже заданного уровня.
Гипотонию 12-перстной кишки Ю. В. Линевский и И. С. Павлова вызывали в основном атропином и, реже, мета-цином. Данные баллонокимографии и результаты рентгеновских наблюдений убедили этих исследователей в том, что для необходимого расслабления 12-перстной кишки обычно достаточно ввести внутривенно 5—10 мл 10 % раствора
хлорида кальция или, предпочтительнее 10 % раствора глюконата кальция вместе с 0,1 % раствором атропина: больным с массой тела до 60 кг — 1 мл, массой 60—90 кг — 1,5 мл и свыше 90 кг — 2 мл. Больным, которым внутривенное введение атропина затруднено, Ю. В. Линевский и И. С. Павлова инъецировали его внутримышечно или подкожно.
Метацин вызывает те же побочные действия, что и атропин, однако они значительно менее выражены. Метацин особенно показан больным с массой тела свыше 90 кг, которым введение атропина подкожно или внутримышечно нежелательно из-за опасности развития побочных явлений, поскольку необходимая доза препарата превышает 2 мл. Гипотонический эффект метаци-на, введенного внутримышечно или подкожно, ниже, чем атропина, который введен внутривенно, и приблизительно соответствует его эффекту после подкожного или внутримышечного введения. Чтобы достигнуть эффекта атропина, введенного внутривенно, дозу мета-цина нужно увеличить в 1,5—2 раза, т. е. с 2—3 до 4—6 мл 0,1 % раствора: назначить подкожно или внутримышечно больным с массой тела менее 60 кг 2—3 мл раствора препарата, массой 60—90 кг — 3—4 мл и свыше 90 — 4— 6 мл метацина. Такой же эффект можно получить, если сочетать подкожное или внутримышечное введение до 2 мл раствора атропина с 2 мл раствора но-шпы или 1—2 мл 2 % раствора папаверина.
Расслабление 12-перстной кишки наступает через 8—12 мин после внутривенного введения растворов атропина и глюконата кальция (хлорида кальция), 15—20 мин после их подкожной или внутримышечной инъекции и 25 — 30 мин после подкожного или внутримышечного введения метацина. За это время 12-перстная кишка заполняется бариевой взвесью.
Исследование проводят в положении больного лежа на трохоскопе в различных проекциях. Ориентировочную рентгеноскопию с прицельной пальпацией дополняют рентгенограммы рельефа слизистой оболочки, ее пневморельефа и туго заполненной 12-перстной кишки. Наиболее целесообразно вначале вводить в 12-перстную кишку через зонд 30 —50 мл контрастной взвеси, чтобы изучить рельеф слизистой оболочки, и дополнительно 200—400 см3 воздуха. Для ТБЗ 12-перстной кишки контрастом через зонд вводят еще 250—300 мл бариевой взвеси. Следует использовать более жидкую контрастную взвесь, чем для обычного исследования пищевого канала (800 мл.бариевой взвеси обычной консистенции разбавить 1 стаканом воды). Чтобы расслабить 12-перстную кишку, лучше вводить взвесь теплой (36—38 °C). Для профилактики закупорки зонда комочками бариевой взвеси последнюю предварительно необходимо процедить через марлю или пропустить через миксер. Бариевую взвесь и воздух удобно вводить шприцем Жане, пригоден и аппарат Боброва.
Под влиянием атропина тонус кишки снижается: после внутривенного вливания препарата — на 25—30 мин, подкожной или внутримышечной инъекции — на 30—35 мин, после подкожного или внутримышечного введения метацина — на 45—50 мин. Для тщательного рентгенологического исследования 12-перстной кишки обычно достаточно 10—15 мин.
Аэронная релаксационная дуоденография — в связи с тем, что нейротропным средствам, в частности атропину, свойственны побочные реакции, с 1969 г. на кафедре рентгенологии Белорусского института усовершенствования врачей вместо атропина стали применять аэрон в таблетках (0,0001 г скополамина и 0,0004 г гиосциамина), который блокирует периферические и
центральные М-холинореактивные системы. Побочных явлений от действия аэрона не отмечено.
В зависимости от возраста и массы тела больного ему назначают под язык от 1 до 3 таблеток аэрона. Взрослые чаще получают 2—3 таблетки. Детям в возрасте 3 лет дают 0,5 таблетки, в возрасте 8—10 лет — 1,5; 10— 14 лет — 2 таблетки. После рассасывания таблеток аэрона начинают обычное исследование пищевода, желудка и 12-перстной кишки, делают снимки интересующих отделов, которые обрабатывают в фотолаборатории и тщательно изучают. Затем приступают к непосредственному исследованию 12-перст-ной кишки. К этому времени (спустя 20—30 мин) усиливается перистальтика желудка, пилорический канал широко раскрывается и бариевая взвесь свободно заполняет просвет релаксированной 12-перстной кишки, особенно надежно — ее луковицу. Предоставляется возможность изучить один из важных отделов 12-перстной кишки — желудочно-дуоденальный переход.
Вначале исследуют кишку в вертикальном положении больного, при этом обращают внимание на ее подвижность, форму, положение, размеры, изучают рельеф слизистой оболочки. Чтобы получить пневморельеф кишки, больного переводят в горизонтальное положение и укладывают на левый бок, затем — на живот или спину в зависимости от формы и положения 12-перстной кишки. При таком положении больного воздух из желудка попадает в 12-перстную кишку и равномерно распределяется по ее петле.
Для ТЗ контрастным веществом 12-перстной кишки больному дают еще стакан бариевой взвеси и укладывают его на правый бок на 3—5 мин. За это время контрастное вещество равномерно заполняет просвет релаксированной 12-перстной кишки. На рентгенограм-
мах, сделанных после перемещения больного в правое полубоковое положение, на спину и живот, хорошо определяются контуры туго заполненной 12-перстной кишки.
При аэронной релаксационной дуоде-нографии у здорового челоека поперечник 12-перстной кишки расширяется до 5—6 см, контуры кишки четкие, равномерно-зубчатые. Расстояние меж
ду зубцами соответствует ширине нормальных круговых складок. Стенки кишки остаются эластичными. Поэтому несмотря на расслабление мышц, кон трастная масса медленно продвигается по кишке. В результате на снимке можно получить не только четкий рель еф слизистой оболочки, но и контуры кишки, исследовать зону фатерове соска и определить соотношение 12-пер-
11. Релаксационные дуоденограммы после приема аэрона под язык и бариевой взвеси через рот (ТЗ, варианты а, б, в, г, д, е).
стной кишки с окружающими органами и тканями.
Аэрон наиболее пригоден для функционального рентгенологического исследования 12-перстной кишки. Путем аэронной релаксационной дуоденогра-фии хорошо выявляются новообразования и язвы 12-перстной кишки, ее дивертикулы, рак головки поджелудочной железы и другие поражения органов гепатопанкреатодуоденальной зоны. В результате сильного расслабления мускулатуры 12-перстной кишки и продолжительной задержки бариевой взвеси в ней можно обнаружить симптомы компрессии в местах соприкосновения кишки с головкой поджелудочной железы, желчным пузырем, печенью, брыжейкой тонкой кишки и забрюшинными лимфатическими узлами, когда они уве
личены. Симптом опухолевой инфильтрации, обусловленный прорастанием рака соседних органов в 12-перстную кишку, проявляется ригидностью, сужением просвета кишки и изъеденностью ее контуров. Симптом дефекта наполнения с фестончатыми неровными контурами возникает у больных раком фатерова соска, причем один из краев дефекта, чаще дистальный, бывает с острым выступом. Наиболее четко этот симптом определяется в положении больного на спине с поворотом на 15° на правый бок.
Аэронная релаксационная дуодено-графия, как наиболее щадящая, легко переносится больными и особенно приемлема для тяжелобольных. Благодаря своей простоте она быстро выполняется врачом-рентгенологом.
12. Релаксационные дуоденограммы после приема аэрона под язык и бариевой взвеси через рот (ИРС, варианты а, б).
Релаксационная пероральная энтерография предназначена для исследования всех петель тощей и подвздошной кишок с введением контрастного вещества через кишечный зонд и без него. Релаксационная еюнография проводится так же, как и релаксационная дуоденография.
Особенно эффективен при этом исследовании аэрон. Под его влиянием бариевая взвесь быстро продвигается по петлям умеренно релаксированных кишок и распределяется по кишке равномерно. Поэтому можно детально изучить рельеф слизистой оболочки и контуры кишки на всем ее протяжении, отдифференцировать стеноз кишки опухолью от спастических сужений, более точно определить протяженность и границы поражения, обнаружить патоморфоло-гические изменения кишки, которые не
видны при обычном рентгенологическом исследовании.
Релаксационная ретроградная илео-цекография — предложена французов Е. Cheriqie в 1957 г. Проводят для де тального изучения илеоцекальной обле сти. Для релаксации кишки внутри венно вводят 10 мл 10 % раствора хл<-рида кальция с 1 мл 0,1 % растворг атропина. Через 10—15 мин больном} на трохоскопе ретроградно заполняю" обычной бариевой взвесью освобождее ный от каловых масс кишечник, вплотг до дистальных петель тощей кишки. По еле опорожнения толстой кишки от контрастного вещества или ее двойногс контрастирования исследуют слепук кишку, область илеоцекального клане на, петли подвздошной кишки. Опреде ляют состояние стенок кишок, их пр<-света и рельефа, а также смещаемост;
13. Ретрогралнлн |н*.1аксациоинан нлеоцеко- (< и интестинографни (б).
кишок, делают прицельные рентгенограммы.
Дли релаксации подвздошной кишки и ликвидации спазма сфинктера Варо-лиуса можно назначать и другие фар-макологичоские < ре щтва, рекомендуем I | iyu (CHOI I'.'
фин. С. атой целью мы даем больным аэрон в дозировке от 2 до 4 таблеток под язык, чаще 2 3 таблетки. Ретроградна* введение контрастного вещества в кишечник начинаем через 25— 30 мин. Подвздошная кишка заполняется барие вой взвесью равномерно почти у всех исследуемых.
Ре^лексосснноя релаксационная гаст-родуоденоерафия методом акупунктуры разработана и внедрена в практику И. X. Райкиным с совет, в 1985 г. По мнению авторов, проводить исследование с помощью акупунктуры целе
сообразно вскоре после обычного рент генологического исследования, в про цессе которого выявляются изменения требующие уточнения. Для воздействия на моторику желудка и 12-перстной шишки выбирают чаща точки ушной ра ковины, имеющие свойство органона правленного воздействия. Пренмущест-венное значение имеет левая ушная раковина и ее точки желудка и 12-пер стной кишки. Кроме того, вводят иглы в точки Шэньмэнь и симпатической нервной системы, а также билатерально в корпоральную точку Хоуси как точку общего антиспастического действия. Иглы вводят на 20 25 мин. После иглоукалывания больному дают дополнительную порцию бария для контрасти рования расширившейся кишки и про изводят снимки в различных положениях.
Мезентерикография — рентгенологическое исследование кровеносных сосудов брыжейки после их селективной катетеризации. Основные показания: сложные случаи диагностики опухолей кишечника, прежде всего опухолей тонкой кишки, эмболии или тромбоза брыжеечных артерий, выявление источника кишечного кровотечения.
Больного готовят к исследованию так же, как и к артериографиям других видов. После чрескожной катетеризации бедренной артерии катетер под экраном продвигают в брюшную аорту и, повернув его загнутый конец, сагиттально смещают по передней стенке аорты, пока он не попадает в устье верхней брыжеечной артерии,— тогда отмечается своеобразное движение («кивок») зонда. Обычно устье верхней брыжеечной артерии находится на уровне Li, реже — на уровне Тхп или Lп позвонка. Локализацию катетера устанавливают путем введения в артерию 1 — 2 мл контрастного вещества и последующего вливания 20 мл изотонического раствора натрия хлорида. Затем автоматическим шприцем через катетер вводят 25—40 мл 50 % раствора гинака со скоростью 10 мл/с и в зависимости от целей и задач исследования делают серию снимков.
Толстая кишка. Рентгенологический метод исследования — один из основных в диагностике болезней толстой кишки. Исследование начинают с обзорной рентгеноскопии брюшной полости. Чтобы уточнить распределение газов по кишечнику при подозрении на его непроходимость, толстую кишку лучше изучать на обзорных рентгенограммах брюшной полости, если в кишке есть газ и каловые массы. Вторым показанием для обзорной рентгенографии живота является пневмоперито-неум. Снимки следует выполнять в вертикальном и горизонтальном положениях больного. Если снимок в верти
кальном положении сделать невозможно, показан снимок в положении на боку с горизонтальным ходом рентгенова луча.
Для более детального определения анатомо-функциональных особенностей толстой кишки прибегают к ее искусственному контрастированию. Контрастное вещество вводится двумя путями: пероральным (тогда прослеживается его продвижение по ЖКТ) и ретроградным (клизмой), в зависимости от целей и задач исследования. Назначая больному рентгенологическое исследование, лечащий врач должен четко знать, какую информацию он хочет и может получить. План исследования согласовывается с рентгенологом. Весьма желательно, чтобы полученные данные рентгенолог обсудил с клиницистом.
Пероральное контрастирование толстой кишки проводится в первую очередь с целью изучения ее моторно-эва-куаторной функции, а затем уже для определения положения и формы всех отделов толстой кишки, их калибра, смещаемости, болезненности, особенностей гаустрации и др. В основном оно показано больным: с длительными упорными запорами или поносами; неясными патологическими изменениями в правой илеоцекальной области, в частности больным, у которых предполагается хронический аппендицит; с вну-трибрюшными и межкишечными сращениями и после оперативных вмешательств на кишечнике.
Для исследования никакой подготовки больного не требуется. Через 3—4 ч после обычного рентгенологического исследования желудка и 12-перстной кишки производят просвечивание и съемку илеоцекального отдела кишечника. В дальнейшем исследования повторяют, фиксируя постепенное заполнение контрастным веществом всей толстой кишки. Сроки повторных наблюдений зависят от задач исследования и моторно-
эвакуаторной функции кишечника. Чтобы детально изучить пассаж контрастной массы, делают просвечивания и снимки через 5, 8, 24, 48, 72 ч, а иногда и позже после исследования желудка. При ориентировочном суждении о скорости продвижения контрастного вещества по кишечнику ограничиваются более редкими исследованиями.
Толстая кишка в норме обычно заполняется бариевой взвесью через 20 — 24 ч, а полностью опорожняется от него в течение 24—72 ч. Для ускоренного исследования кишечника рекомендуется назначать фракционный прием охлажденной бариевой взвеси по Л. С. Розенштрауху: больной должен принимать по 50 мл бариевой взвеси через каждые 15 мин в течение часа. Тогда толстая кишка контрастируется через 2—3 ч. Еще более скоро движется контрастное вещество по кишечнику после добавления к бариевой взвеси 20 г сорбита или ксилита.
При всех достоинствах перорального контрастирования по его результатам нельзя получить полного представления о строении и морфологических изменениях толстой кишки. Поэтому приходится прибегать к ирригоскопии.
Ретроградное контрастирование толстой кишки чаще всего используется для рентгенологического исследования проктологических больных. Проводится по весьма широким показаниям: различные хронические колиты; длительные упорные запоры; кишечные кровотечения; признаки непроходимости толстой кишки, туберкулеза кишечника, опухоли толстой кишки, новообразований органов брюшной полости, дивертику-леза (дивертикулита) толстой кишки, спаек толстой кишки с желчным пузырем или желчно-толстокишечного свища; диафрагмальные грыжи — для уточнения, является ли содержимым их толстая кишка. Разумеется, перечислены далеко не все ситуации, когда может
14. Мезентерикограмма.
понадобиться ирригоскопия, а лишь се мые частые или важные. Только по ре зультатам ирригоскопии можно относи тельно рано выявить органические в частности опухолевые, поражение толстой кишки.
Ирригоскопию не рекомендуется проводить в следующих случаях: 1) до те: пор, пока не будет выполнена ректо- илг ректороманоскопия; 2) перед обычно! операцией по поводу паховой грыжи 3) в качестве периодического скриниь гового исследования у нормально чуь-ствующих себя лиц без веских клиниче ских показаний; 3) у детей, страдак-щих хроническими болями в животе но не имеющих других симптомов, таких как диарея, запор, кровотечение или снижение массы тела; 4) рутиннс перед хирургическими вмешательстве ми у женщин с диагностированны* опухолевидным образованием половы.
15. Рентгенограмма толстой кишки через 24 ч после перорального контрастирования (варианты а, б).
органов; 5) у больных со свежим кровотечением из прямой кишки, если имеется возможность выполнить квалифицированную эндоскопию или ангиографию; 6) периодически для оценки роста полипа, если есть возможность выполнить колоноскопию.
Перед ирригоскопией необходимо очистить толстую кишку от содержимого, в противном случае остатки фекальных масс будут симулировать различные опухолевые процессы, а слизь, гной и кровь — мешать контакту бариевой взвеси с внутренней поверхностью кишки. Слизистая оболочка кишки отмывается от содержимого 1 % изотоническим раствором натрия хлорида. С одной стороны, такая клизма уменьшает вероятность развития гипоосмоти-ческой гипергидратации («водяной интоксикации»), а с другой — предупреждает развитие ацидоза в организме. Весь процесс подготовки занимает двое
суток. В первые сутки производится подготовка толстой кишки к ректороманоскопии и осуществление последней, а во вторые сутки — к ирригоскопии.
Больному дважды, в 18 и 22 часа, ставятся глубокие клизмы. Такая же клизма делается и утром за 2 ч до ректороманоскопии, после проведения которой больной завтракает. Во время обеда больной принимает первое и третье блюда, на ужин — чай. Затем вновь в 18 и 22 часа ставятся глубокие клизмы, а утром на следующий день — еще одна клизма за 2—3 ч до ирригоскопии. Перед исследованием больной не должен завтракать. Газоотводная трубка не применяется. Слабительные средства в процессе подготовки не используются: они противопоказаны при язвенном колите. Кроме того, масляные слабительные оставляют на слизистой оболочке кишки капли жира, рентгенологически трудно отличимые от полипов.
В день проведения ректороманоскопии (или колоноскопии) делать ирри-госкопию не рекомендуется, так как в кишке после этих исследований остается много воздуха. А это приводит к нежелательным последствиям: неравномерному и неполному заполнению кишки бариевой взвесью, неполному сокращению стенок кишки в период ее опорожнения, что в свою очередь ведет к исчезновению рельефа слизистой оболочки кишки и, следовательно, к исчезновению возможности его изучения (при милиарном полипозе мелкие высыпания лучше видны на рельефе в виде кружевного или зернистого рисунка) . Воздух, смешиваясь с сульфатом бария, образует пузырьки, которые при рентгенографии дают картину, подобную полипам.
Кроме того, при ретроградном заполнении ободочной и прямой кишок бариевой взвесью в день проведения ректороманоскопии или колоноскопии больные ведут себя беспокойно. Это и понятно, так как вначале, т. е. при эндоскопии, нагнетается воздух на весь объем кишки, а затем уже при ирригоскопии на такой же объем необходимо ввести в ободочную и прямую кишку и взвесь сульфата бария. Практика показывает, что газоотводная трубка в этих случаях не помогает, потому что она способствует только уравнению давления воздуха в кишке и вне ее, не удаляя его из кишки наружу.
Для контрастирования ободочной и прямой кишок мы используем мелкодисперсную 35 % взвесь сульфата бария с танином 0,33 % концентрации. Заполнение толстой кишки бариевой взвесью во всех случаях должно быть порционное и умеренное, чтобы хорошо были видны гаустры. Физико-технические условия ирригографии всегда стандартные, но при разной патологии различные.
Ретроградное контрастирование обо-
16. Рентгенограмма ободочной кишки после ретроградного заполнения ее бариевой взвесью.
дочной и прямой кишок проводим под контролем экрана и все снимки делаем только на первом рабочем месте при рентгеноскопии. Наш опыт показывает, что наибольшее количество ошибок допускают те рентгенологи, которые под предлогом «уменьшения облучения себя и больного» делают снимки вслепую на втором рабочем месте. При этом очаг поражения фиксируется на пленке не в оптимальной проекции или же вовсе не попадает на пленку.
После заполнения бариевой взвесью прямой и сигмовидной кишок делается снимок этих отделов в строго боковой или первой косой проекции. Если подозревается поражение опухолевым процессом только прямой кишки, проводится рентгенография и в прямой проекции, но при этом больной лежит на животе, а рентгенов луч имеет вентродорсальный ход.
Далее взвесью сульфата бария заполняются и остальные отделы ободочной кишки. Если необходимо детальное изучение сигмовидной и прямой кишок,
17. Рентгенограмма ободочной кишки после ее опорожнения от бариевой взвеси (виден рельеф слизистой оболочки толстой кишки, варианты а, б).
ТЗ слепой кишки нежелательно, так как контрастированные петли подвздошной кишки будут перекрывать изображение
нужных нам отделов и исследование придется повторять.
Обязательно проведение обзорной рентгенографии на пленке 35,6Х 35,6 см в прямой или в одной из косых проекций. Если все петли ободочной кишки не умещаются на одной пленке, больного просят сделать глубокий вдох и задержать дыхание. При таком методическом приеме печеночный и селезеночный углы кишки опускаются вниз и на рентгеновском экране видна вся кишка. Выбор правой или левой косых проекций зависит от уровня поражения кишки: если опухолевый процесс локализуется в правом фланге, больной лежит на левом боку, если поражен левый фланг — на правом боку. Обзорную рентгенографию необходимо дополнять прицельным снимком зоны поражения на пленке размером 18X24 см или 24X30 см.
Для изучения рельефа слизистой оболочки достаточно сделать прицельный снимок зоны поражения на пленке 13X18 см или 18X24 см и обзорный снимок на пленке 35,6Х 35,6 см в оптимальной проекции, иногда с задержкой дыхания на глубоком вдохе, чтобы вместить изображение рельефа слизистой оболочки всей ободочной кишки.
В обязательном порядке приступают к третьему этапу ирригоскопии — раздуванию кишки воздухом, т. е. к двойному контрастированию. Прямую и сигмовидные кишки снимают на пленку 24X30 см в боковой (чаще всего правым боком к пленке) или косой (чаще первой) проекции. При подозрении на поражение только прямой кишки тут же делается ее снимок в прямой проекции при положении больного на животе на пленке 18X24 см или 13X18 см. После раздувания воздухом всей кишки делается обзорный снимок на пленке 35,6Х 35,6 см в оптимальной проекции, часто на глубоком вдохе, и по необхо-
димости он дополняется прицельными снимками зоны поражения.
В качестве стандартной комбинации при рентгенографии живота довольно часто делают снимки в вертикальном и горизонтальном положении больного, а нередко показана латерография с горизонтальным ходом рентгенова луча.
Итак, при подозрении на любой объемный процесс в ободочной и прямой кишках на все исследование мы расходуем как минимум 3 пленки размером 35,6X 35,6 см, 2 пленки 24X30 см, 3 пленки 24Х 30 см и 3 пленки 13Х 18 см или 18Х 24 см. Оптимальными режимами рентгенографии на этапе умеренного заполнения кишки бариевой взвесью являются: напряжение на трубке НО—125 кВ, сила тока 300— 500 мА, выдержка 0,06—0,1 с; па этапах изучения рельефа слизистой оболочки и двойного контрастирования соответственно 70—85 кВ, 150—300 мА, 0,2— 0,42 с.
Для выявления эластичности ножки полипа на этапе двойного контрастирования проводится рентгенография зоны поражения при горизонтальном и вертикальном положении пациента.
Исследование ободочной и прямой кишок с помощью пассажа бариевой взвеси для выявления опухолевых заболеваний, как правило, не проводится.
Если результаты ректороманоскопии указывают на воспалительные заболевания кишки, то физико-технические условия рентгенографии на всех этапах рентгенологического исследования одинаковые: напряжение на трубке 70— 90 кВ, сила тока 150—300 мА, выдержка 0,2—0,4 с, причем на снимках максимально используется малый фокус трубки. Количество снимков несколько меньше, чем при опухолевых процессах: один прицельный снимок прямой и сигмовидной кишок в правой боковой или в первой косой проекции на пленке размером 24Х 30 см и один обзорный
18. Рентгенограмма толстой кишки после ее двое ного контрастирования.
на пленке 35,6Х 35,6 см. Для изучение рельефа слизистой оболочки делаетсг один обзорный снимок на пленке размером 35,6Х 35,6 см, иногда он дополняется прицельным снимком сигмовидной кишки на пленке 18Х 24 см.
Заканчивается рентгенологическое исследование двойным контрастиров>-нием толстой кишки. К сожалению многие рентгенологи последнее недоопе нивают и проводят его реже, чем необходимо. Раздувать воздухом кишк; также следует осторожно, постепеннс активно нажимая рукой на живот. Пс еле введения большого количества во;-духа с целью раздуть пошире все отделы ободочной кишки у некоторые больных возникают резкие боли, чрезмерно пневматизируются петли тонко! кишки, перекрывая просвет ободочног кишки (чаще всего ректосигмоидны! отдел или удлиненную сигмовиднук кишку), что мешает проведению исследования даже при многоосевом просвечивании.
После двойного контрастирования делать снимки необходимо в нескольких проекциях, так как нередко тени, находящиеся вне просвета кишки и про-екционно накладывающиеся на нее, симулируют изменения кишечника. К примеру, обызвествленные лимфоузлы, поперечные отростки позвонков, ангиолиты иногда принимают за полипы ободочной кишки. Из-за топографо-анатомических особенностей толстой кишки при ее поражении воздух распределяется неравномерно. Поэтому рентгенография восходящего, нисходящего, ректосигмоидного отделов и прямой кишки производится в положении больного на животе, а снимки поперечной ободочной и сигмовидной кишок — в положении на спине.
Из всех отделов ободочной кишки удлиненная сигмовидная кишка наиболее сложна для рентгенологического исследования. Ее дополнительные петли накладываются и перекрывают одна другую на снимках, сделанных при обычных укладках больного, даже когда выполняется полипозиционное исследование. В этих случаях необходимы специальные укладки. Одна из самых популярных — укладка по методике Шас-сара — Лапине. Ее лучше назначать больным, у которых петли кишки лежат горизонтально. После ТБЗ сигмовидной кишки больной, сев на трохоскоп, максимально наклоняется вперед и охватывает руками голеностопные суставы. Центральный луч направляется на область крестца перпендикулярно кассете. Если больной не может согнуться как следует, нужно наклонить трубку на 10—15° в краниальную сторону. В таком положении у большинства больных сигмовидная кишка видима почти на всем протяжении и можно изучать переднюю и заднюю стенки кишки.
У некоторых больных петли удлиненной сигмовидной кишки сразу же за ректо-сигмовидным отделом резко пово
рачивают книзу и лежат почти продольно к оси тела. В таких случаях у них рентгенограммы нужно получить в строго боковом или левом косом положении. Снимки делаются на кассетах размерами 24X 30 или 30X40 см в зависимости от конституции больного. Фокусное расстояние около 70 см, напряжение 100—125 кВ, сила тока 150— 200 мА, время выдержки до 1 с.
Ободочная и прямая кишки подвергаются раздуванию и тогда, когда танин вызывает очень сильное сокращение (спазм). Это приводит к нарушению кровоснабжения стенки кишки и развитию сильных болей в животе. Чтобы купировать боли, мы не пользуемся медикаментозными средствами. Абдоминальные боли ликвидируем очень простым, всем доступным и в то же время безопасным и эффективным методом: раздуванием кишки воздухом — спазм кишки исчезает, боли купируются.
Таким образом, при обследовании проктологических больных мы рекомендуем выполнять следующие мероприятия: подготовку больных к ректороманоскопии; проведение ректороманоскопии; подготовку больных к ирригоскопии; приготовление мелкодисперсной водно-бариевой взвеси; выбор оптимальных физико-технических условий рентгенографии; стандартизацию и оптимизацию методики ирригоскопии; анализ полученных результатов исследования и составление диагностического заключения.
Залог успешной постановки диагноза — не только правильное выявление каждого симптома, но и правильное его осмысление и истолкование.
Помимо классической ирригоскопии, успешно применяется методика одномоментного двойного контрастирования. Ее впервые предложил S. Welin в 1958 г., а усовершенствовали многие зарубежные и отечественные авторы. Суть методики в следующем: 1) конт
растную водно-бариевую взвесь готовят при соотношении сульфата бария и воды 1:1 с обязательным добавлением в качестве стабилизатора пищевой карбо ксиметилцеллюлозы (КМЦ). Применение КМЦ дает возможность значительно воздействовать на концентрацию и вязкость контрастной взвеси, которые способствуют хорошему контакту со слизистой оболочкой и равномерному распределению бария по внутренней поверхности кишки, а также обеспечивают высокое качество изображения; 2) бариевая взвесь должна быть мелко-измельченной и гомогенизированной. Это достигается кипячением и механическим размешиванием с помощью миксера; 3) способ включает введение контрастного вещества не более 300— 400 мл с последующей инсуфляцией воздуха до 2000 мл; 4) исследование чаще проводится в условиях релаксации толстой кишки, вызванной спазмолитическими препаратами, например аэроном.
Бариевая взвесь вводится под контролем просвечивания медленно, небольшими порциями до селезеночного изгиба. После инсуфляции воздуха первые снимки прямой и сигмовидной кишок производятся в дорсовентральной проекции. Затем больного поворачивают на правый бок для двойного контрастирования левой половины ободочной кишки, на левый бок — правого фланга и на живот, опуская и поднимая головной конец трохоскопа с целью равномерного распределения бариевой взвеси и воздуха. Снимки поперечной ободочной кишки и обеих кривизн получают чаще в вертикальном положении больного.
Успех одновременного двойного контрастирования зависит от подготовки кишечника, качества проведенного исследования и квалификации рентгенолога. Если все три момента отлично срабатывают, эффективность диагностики почти 100 %, а если нет, эффективность очень низкая (иногда 10—15 %).
19. Общий вид больного в положении Шасса-ра г- Лапине.
Пневмоколонография — способ исследования толстой кишки, заключающийся в раздувании ее воздухом с последующей рентгенографией. Методика проста, может быть применена в поликлинике для диагностики опухолей толстой кишки. Нагнетание воздуха в кишку проводится с помощью баллона Ричардсона или аппарата Боброва под контролем экрана вначале в вертикальном, затем в горизонтальном положении. Заканчивается исследование производством обзорных и прицельных снимков брюшной полости.
Нами разработан и внедрен в практику способ рефлексогенной релаксацион-
кишки, уложив больных на живот и на бок с согнутыми коленями. Глубину выделяемых слоев определяют во время многоосевой рентгеноскопии.
Результатам ангиографии толстой кишки придается большое значение в сложных случаях диагностики ее опухолей, неспецифического язвенного колита, болезни Крона, эмболии или тромбоза брыжеечных артерий, источника кишечного кровотечения и других болезней и изменений толстой кишки.
Противопоказано это исследование при острых инфекционных болезнях, болезнях печени и почек, общем тяжелом состоянии больного, активном туберкулезе, повышенной чувствительности к йодистым препаратам, склонности к аллергическим реакциям.
Ангиография проводится после тщательного общеклинического исследования больного. С целью определения индивидуальной чувствительности к контрастным препаратам ставится йодная проба: за сутки до исследования внутривенно вливают 1,5—2 мл урографина, уротраста, верографина, триом-браста, йодамида или другого контрастного вещества. Йодная проба считается положительной, если появляются кожные высыпания, слезотечение, насморк, кашель, тошнота и рвота, изменяется сердечный ритм, возникают выраженные изменения на ЭКГ, свидетельствующие о нарушении проводящей системы сердца. В таких случаях от исследования надо отказаться. Если же йодная проба отрицательная, больной готовится к ангиографии.
Накануне исследования назначают очистительную клизму, а на ночь — транквилизирующие средства. Перед исследованием больной принимает пищу, ему тщательно выбривают волосы в области пункции сосуда. За 30 мин до исследования проводят премедикацию — внутривенно вливают по 2 мл
ной ирригографии методом акупунктуры. Суть его в следующем. Релаксация толстой кишки вызывается иглоукалыванием в симметричные точки Да-чан-шу (V-25). Расслабление толстой кишки начинается через 25—30 мин после введения игл в избранную точку, достигает максимума к 30—35 мин и сохраняется в течение 20 мин после извлечения игл. Этого времени достаточно для рентгеноконтрастного исследования толстой кишки по общеизвестной методике.
Париетография толстой кишки проводится для определения распространенности опухолевого процесса в стенке кишки, выявления прорастания опухоли в окружающие кишку органы и ткани, обнаружения метастазов в клетчатке или лимфатических узлах вблизи пораженного сегмента кишки и других нарушений. Сущность париетографии заключается в контрастировании газом как наружной, так и внутренней стенок органа путем введения в брюшную полость 1500—2000 см3 закиси азота, а в кишечник — ретроградно воздуха через резиновый зонд, соединенный с аппаратом типа аппарата Боброва. Толстую кишку раздувают под экраном. Затем делают снимки и томограммы пораженного отдела кишки, выбрав во время многоосевой рентгеноскопии оптимальные проекции для съемки и глубину срезов для томографии.
Диагностические возможности париетографии увеличиваются после тройного контрастирования толстой кишки, когда в кишку введут немного бариевой взвеси.
При париетографии прямой кишки пресакрально вводят 600 —800 см3 закиси азота или кислорода, больным придают положение Тренделенбурга или коленно-грудное (под углом 30—40°), прямую кишку раздувают через катетер или резиновую трубку аппаратом Боброва. Затем делают томограммы прямой
2,5 % раствора пипольфена и 1 % раствора промедола.
В зависимости от локализации поражения осуществляется селективная ангиография верхней или нижней брыжеечных артерий. Чрескожная катете-ризационная аортография выполняется троакаром, металлическим проводником с мягким концом и полиэтиленовым катетером через бедренную артерию по методике Сельдингера. Предварительно рентгеноконтрастный катетер моделируется с одним или двумя изгибами, чтобы обеспечить его плотное прилегание к стенке аорты. Такой катетер удобно подводить к устью исследуемого сосуда: катетер легко попадает в сосуд и прочно фиксируется в нем на все время исследования.
Верхняя брыжеечная артерия ответвляется от аорты на уровне Li вперед, вниз и вправо, нижняя брыжеечная артерия — на уровне L ш вперед, книзу и влево под острым углом. Исследование ведется под телевизионным экраном. Катетер продвигают к аорте до необходимого уровня. После того как катетер окажется в устье исследуемой артерии, вводится контрастное вещество в пробной дозе 5—6 мл. Убедившись в том, что зонд установлен правильно, производят серийную ангиографию (8—10 снимков со скоростью 1—2 кадра в секунду). В верхнюю брыжеечную артерию вводится 25—40 мл препарата со скоростью 8—12 мл/с, в нижнюю брыжеечную артерию — 8—12 мл со скоростью 4—5 с. На полученных ангиограммах определяются фазы контрастирования: артериальная — на снимках, сделанных в первые 3 с, паренхиматозная — в следующие 3—5 с, венозная фаза — спустя 5 с.
После исследования на область пункции накладывается давящая повязка. Больной остается на постельном режиме в течение суток.
Таким образом, по результатам рент-
20. Рентгенограмма толстой кишки после одномоментного двойного контрастирования.
генологических исследований толстой кишки можно своевременно определить точную локализацию и протяженность патологического процесса, установить участие в нем окружающих тканей и органов, изучить морфологический субстрат новообразования, функциональные и органические нарушения и прочие ненормальные состояния кишки.
В зависимости от предполагаемой болезни рентгенолог должен выбрать методику рентгенологического исследования и способ приготовления контрастных веществ, учесть физико-технические и фотохимические условия рентгенографии. Главное, чтобы они были доступны и соответствовали поставленной задаче.
Нужно пересмотреть общепринятую диагностическую доктрину «от простой к более сложной методике». К правильному диагнозу следует идти кратчайшим путем — проводить только те исследования, результаты которых необходимы и достаточны для определения природы и особенностей болезни, ее распространенности, а также для
выбора лечебной тактики, суждения о прогнозе, не забывая о небезвредном воздействии рентгеновского излучения на организм больного.
Печень и желчевыводящая система. Рентгенологический метод исследования занимает важное место в общем комплексе диагностических мероприятий при многих болезнях печени и желчных протоков. План обследования больного составляется после тщательного изучения клинических данных и результатов других методов исследования.
Обзорная рентгеноскопия и рентгенография позволяют судить о положении, величине и форме печени, о наличии в ней инородных тел или конкрементов (обызвествлений), скоплений газа и др. Технические условия съемки варьируют в зависимости от рентгеновского аппарата и телосложения больного. Обычно требуется около 75 кВ и 200 мАс. Снимок производят при задержанном дыхании после выдоха.
Гепатография — искусственное контрастирование печени с последующим ре нтге нологи чес ки м исследование м.
Метод выявляет патологические образования внутри печени. Для контрастирования печеночной ткани применяют три основных способа: 1) искусственное контрастирование сосудистой системы печени. Особенно ценна паренхиматозная фаза при целиакографии, портографии и спленопортографии; 2) введение через воротную вену масляных контрастных веществ (сверхжидкого йодолипола и др.); 3) введение в кровь контрастных веществ, частицы которых захватываются ретикулогистиоцитар-ной системой печени и селезенки — это гепатолиенография. В результате на снимках появляется интенсивная тень печени и селезенки, что позволяет изучить их положение, величину, форму, очертание, структуру.
Холецистография — рентгенография желчного пузыря после введения в орга
низм контрастного вещества, которое улавливается из крови печенью, выделяется с желчью и концентрируется в желчном пузыре, что обеспечивает его изображение на рентгенограмме. В практике используются пероральная, серийная и лапароскопическая холе-цистографии.
Пероральная холецистография применяется наиболее часто. При ее выполнении исследуемый принимает контрастное вещество перорально (через рот). Серийная холецистография — зто холецистография с повторной рентгенографией в процессе заполнения желчного пузыря контрастированной желчью, что позволяет оценить его концентрационную функцию. Лапароскопическая холецистография проводится в ходе хирургического вмешательства с вскрытием брюшной полости, причем контрастное вещество вводят непосредственно в желчный пузырь при его пункции.
Показаниями для проведения холе-цистографии являются: желчнокаменная болезнь, хронические бескаменные холециститы, скрытые холецистопатии, дискинезии желчного пузыря; дифференциальная диагностика обызвествлений и опухолевидных образований, расположенных в области желчного пузыря. Противопоказаниями служат желтуха, тяжелые поражения печени, почек, выраженный тиреотоксикоз, непереносимость препаратов йода.
В качестве контрастного вещества служат холевид, йопагност, билимин, осбил, билитраст и др. Препараты предназначены исключительно для приема внутрь и содержат 66 — 77 % йода. Они малотоксичны, а достаточно высокое содержание йода обеспечивает надежное контрастирование желчного пузыря. Максимальная концентрация контрастных веществ в желчном пузыре наступает через 12—14 ч после приема.
Методика однократного вечернего приема контрастного вещества: накану
не вечером в 20 ч больной принимает 30 г контрастного вещества запивая его сладким чаем, минеральной водой. После приема препарата ему разрешается только питье чая или воды. При дробном приеме больной принимает контрастное вещество в течение 1 часа с 19 до 20 ч по 1 таблетке каждые 10 мин (3 г). Утром натощак больной приходит в рентгеновский кабинет (через 12 —15 ч после приема контрастного вещества). Снимки желчного пузыря выполняют в вертикальном положении в прямой передней проекции без компрессии и с компрессией. После этого переходят к изучению функции желчного пузыря. Для этого больной принимает 2 сырых яичных желтка — сильные желчегонные раздражители. Снимки выполняют каждые 30 мин до ясного расслабления пузыря. Недостатком концентрационной холецистографии является отсутствие изображения на снимках внепеченочных желчных протоков, что обусловлено недостаточным процентным содержанием йода в препарате.
Методка двукратного вечернего приема контрастного вещества: больной принимает две дозы контрастного вещества — 3 г с 19 до 20 ч и 3 г с 22 до 23 ч (по 1 таблетке каждые 10 мин). Дальнейшее исследование проводят так же, как и при методике однократного приема. Обычно методика двукратного приема используется при исследовании полных больных и отсутствии тени желчного пузыря в первый день исследования.
Осложнения и побочные реакции наблюдаются довольно часто, но выражены, как правило, незначительно. Отмечаются послабление стула, тошнота, чувство тяжести. Очень редко появляются рвота и уртикарные высыпания.
Недостатки пероральной холецистографии: невозможность получения изображения желчных протоков и изучения
21. Холецистограмма.
концентрационной функции желчного пузыря, длительность подготовки к исследованию.
Холеграфия — последовательная рентгенография желчных путей после введения в организм контрастных веществ, которые улавливаются из крови печенью и выделяются с желчью. Различают следующие способы холеграфии: внутривенная, внутривенная ускоренная, инфузионная и пероральная.
Внутривенная холеграфия является основным рентгенологическим методом дооперационного исследования желчного пузыря и внепеченочных желчных протоков. При этом способе исследования контрастное вещество вводится больному внутривенно, оно соединяется с альбуминами сыворотки крови и, минуя кишечник, захватывается из крови клетками печени. Затем выделяется в большой концентрации в желчные протоки, благодаря чему через 10—15 мин после инъекции и в течение часа на
снимках можно видеть изображение внепеченочных желчных протоков. Через 30—45 мин контрастным веществом начинает заполняться желчный пузырь.
Показания: обострение хронического холецистита, состояние после холецистэктомии, отрицательные результаты пероральной холецистографии, необходимость изучения концентрационной функции желчного пузыря. Исследование не проводится, если уровень билирубина в сыворотке крови превышает 30 мкм/л. Противопоказания: непереносимость йодсодержащих препаратов, тяжелое острое поражение печени, сочетанная недостаточность печени и почек и др. В качестве контрастных веществ используют: билигност, билиграфин, адипиодон, эндоцистобил, холографин и др.
Методика исследования: накануне исследования больному проводится проба на чувствительность к йоду, для чего внутривенно вводят 1—2 мл контрастного вещества. Признаки повышенной чувствительности: общая слабость, насморк, тошнота, рвота, зуд кожи, аллергические высыпания на коже, покраснение, болезненность и припухлость в месте инъекции.
Рентгенологическое исследование осуществляют утром натощак после предварительной очистки кишечника. Вначале выполняют обзорную рентгеноскопию области правого подреберья, чтобы определить качество подготовки больного. Затем в локтевую вену больного медленно (в течение 4—5 мин) вводят 30—40 мл 20 % раствора би-лигноста из расчета 0,6—0,8 мл 20 % раствора на 1 кг массы тела больного. Снимки выполняют в течение первого часа исследования каждые 15 мин, по ним изучают желчные протоки. Через 90—120 мин контрастированной желчью полностью заполняется желчный пузырь. После этого производят снимки желчного пузыря в вертикальном поло
жении больного без компрессии и с компрессией. Затем дают больному желчегонный раздражитель (2 сырых яичных желтка) и изучают сократительную функцию желчного пузыря, как при пероральной холецистографии.
В случае необходимости изучить концентрационную функцию желчного пузыря рентгенограммы выполняют лишь в вертикальном положении больного, так как только в этом положении можно оценить характер формирования слоистости тени желчного пузыря в зависимости от концентрационной функции слизистой оболочки.
При подозрении на наличие конкрементов в желчных протоках рекомендуется томография.
Побочные реакции и осложнения: чувство жара, тошнота, боли в животе, реже рвота. Могут наблюдаться и более серьезные осложнения — потеря сознания, судороги, отек мозга.
Инфузионная холеграфия — сильно разведенное контрастное вещество вводят путем капельного вливания в вену. Это обеспечивает более длительное контрастирование желчных путей и уменьшает побочные явления. Контрастная взвесь включает 40—60 мл 20 % раствора билигноста (из расчета 0,7 мл на 1 кг массы тела) и 150 мл изотонического раствора натрия хлорида. Указанную смесь вводят с помощью капельницы в течение 20—25 мин. Медленное капельное введение^репарата обеспечивает более полную связь всей дозы препарата с альбумином и постепенное его поступление в печень.
Методика инфузионной холеграфии (положение больного, центрация, выполнение рентгенограмм) такая же, как и при внутривенной холеграфии. Важным достоинством метода является снижение количества и интенсивности побочных реакций. Контрастные вещества, показания и противопоказания те же, что и для внутривенной холеграфии.
Внутривенная ускоренная холегра-фия — при ней, кроме внутривенного введения контрастных веществ, применяют лекарственные средства, усиливающие желчевыделительную функцию печени. Для этих целей М. М. Марквар-де и И. И. Сергеева (1987) предлагают использовать гидрокортизон. Суть методики в следующем. В контрастную взвесь, указанную в методике обычной инфузионной холеграфии, дополнительно включают 50—100 мг гидрокортизона (1 мг на 1 кг массы тела). Контрастную смесь вводят медленно, в течение 20— 25 мин. Введение гидрокортизона в состав контрастной смеси стимулирует процессы желчеотделения и предупреждает развитие аллергических реакций. Медленное введение контрастной смеси позволяет длительное время поддерживать в крови постоянную концентрацию не связанного с белками активного гидрокортизона. Гидрокортизон купирует развитие аллергических реакций, активно воздействуя на все стадии их развития. Более выраженному эффекту способствует одновременное введение гидрокортизона с йодистым препаратом, который в определенных условиях становится аллергеном. Капельное введение гидрокортизона в кровяное русло важно еще и потому, что хронические заболевания желчных путей сопровождаются снижением концентрации в крови собственных глюкокортикоидов.
Закончив введение контрастной смеси, рентгенологическое исследование проводят, как и при внутривенной струйной холеграфии.
Преимущества инфузионно-капельной холеграфии с гидрокортизоном: значительное снижение числа отрицательных результатов исследования, увеличение интенсивности и длительности контрастирования желчевыводящей системы, уменьшение числа и интенсивности побочных реакций.
Показания: признаки желчнокаменной болезни, отрицательные результаты пероральной холецистографии, признаки отключенного желчного пузыря, состояние после холецистэктомии, повышенное содержание билирубина в сыворотке крови, но не более 40 мкм/л; исследование больных с положительной пробой на йодистый препарат.
Томография желчных путей — послойная рентгенография, при которой получают изображение органа на определенной глубине (угол качания томографа 30—45°). К томографии приступают после изучения обычных холе-грамм в тех случаях, когда имеются подозрения на наличие конкрементов в желчевыводящих протоках, при слабом их контрастировании, а также наслоении изображения кишечника и других внутренних органов на изображение желчного пузыря и протоков.
Томограммы производят при горизонтальном положении больного на спине с небольшим поворотом (30°) в сторону второго косого положения, чтобы устранить вероятность наслоения тени общего желчного протока на позвоночник. Центрация та же, что и при холеграфии. Томограммы лучше всего выполнять на 30-й и 45-й минутах после окончания введения контрастной смеси, вместо очередного снимка. Поскольку внепеченочные желчные протоки и желчный пузырь располагаются в различных плоскостях, глубина томографического среза для их исследования определяется раздельно с помощью специальных методик.
Томография позволяет уточнить калибр, форму и положение внепеченочных желчных протоков, обнаружить в них камни диаметром до 0,3—0,4 см, выяснить локализацию и характер препятствия или сужения в протоках, положение и форму культи пузырного протока после холецистэктомии, особен
ности терминального отдела общего желчного протока и т. д.
Зонография желчных путей — послойное исследование под углом 8—10°. Зонография обеспечивает получение изображения желчных путей в более толстом срезе по сравнению с обычной томографией. Данное обстоятельство облегчает попадание в срез органа, подлежащего исследованию, и позволяет ограничиться меньшим количеством снимков. Это способствует уменьшению лучевой нагрузки. Именно поэтому данный метод целесообразно использовать при исследовании желчевыводящих путей у детей.
Методика зонографии та же, что и при томографии.
Методика определения глубины залегания желчных протоков и желчного пузыря при томографии разработана на кафедре рентгенологии и радиологии Минского мединститута М. М. Марквар-де с соавт. (1971). Больных исследуют в положении на спине. Положение на животе применяют при чрезмерной полноте больного. В основе методики — ориентация на средний уровень передне-заднего размера туловища в области мечевидного отростка, который измеряют в положении больного на спине. Такая ориентация автоматически включает соответствующую поправку на особенности телосложения и толщину подкожно-жирового слоя в каждом конкретном наблюдении. Первые два среза устанавливают на 1 и 1,5 см вентральнее срединной отметки передне-заднего размера туловища. При необходимости исследование можно дополнить срезами на расстоянии 0,5 и 2,0 см вентральнее срединного уровня.
Внепеченочные желчные протоки. Уровень первого и второго томографических срезов определяется по формулам:
С| = А/2+1 см; Сг= А/2+1,5 см.
Желчный пузырь. Уровень томографических срезов при исследовании желчного пузыря в горизонтальном положении неодинаков для различных его отделов.
Расположение шейки желчного пузыря и пузырного протока чаще всего совпадает с плоскостью, в которой находятся внепеченочные желчные протоки. Поэтому изображение контрастированной шейки желчного пузыря обычно получается на глубине томографиро-вания желчных протоков по приведенным расчетам.
Уровень срезов, проходящих через тело желчного пузыря, определяется по формулам:
Ci = A/2 + 3 см; Сг= А/2—1-5 см.
Чрескожная чреспеченочная холангиография показана при дифференциальной диагностике механической и печеночной желтух, уточнении локализации, природы и характера окклюзии желчных путей. Противопоказания: непереносимость йодистых соединений, геморрагический диатез, резкое нарушение свертывающей системы крови, гипотромбинемия, расп рост ранен ный эхинококкоз или поликистоз печени. В качестве контрастного вещества применяют 50 % раствор гипака.
Методика: исследование выполняют натощак после предварительной очистки кишечника и премедикации. Перед исследованием больному вводят дуоденальный зонд. После анестезии брюшной стенки производят пункцию печени. Прокол осуществляют чаще всего в правом подреберье на 4 см ниже реберной дуги и на 3—4 см правее мечевидного отростка грудины. Во время пункции больной должен задержать дыхание. Иглу с введенным в нее полиэтиленовым катетером вводят в ткань печени на глубину 10—12 см под углом 45° к горизонтальной плоскости. Затем иглу мед
ленно извлекают, потягивая за ее поршень, чтобы заметить, когда конец иглы окажется в просвете желчного протока (покажется желчь). Тогда иглу удаляют, а через катетер выкачивают избыток желчи и затем под контролем рентгенотелевизионной установки вводят в желчные пути 50 % раствор гипа-ка, подогретый до температуры тела. Просвечивание позволяет выбрать оптимальные проекции, время выполнения рентгенограммы и количество вводимого контрастного вещества. Для уточнения взаимоотношения между желчными протоками и 12-перстной кишкой в последнюю через зонд вводят взвесь сульфата бария.
Возможные осложнения: кровотечение, истечение желчи в брюшную полость, шок, холангитический криз и др. Учитывая возможность тяжелых осложнений, чрескожную чреспеченочную холангиографию следует делать лишь при возможности выполнения срочной лапаротомии.
В хирургической практике Минской областной больницы при проведении чрескожной чреспеченочной холангиографии больше находят применение тонкие (с наружным диаметром 1,4 мм) и сверхтонкие (с наружным диаметром 0,6 мм) иглы длиной 20 см. Для пункции используют чаще точку в VIII —IX межреберье по среднеаксилярной линии. Она выбирается под контролем рентге-нотелевидения с учетом размеров печени. После обработки кожи и инфильтрации новокаином брюшной стенки при задержанном дыхании игла быстро вводится по направлению к позвонкам Txi-xii. Положение иглы при уколе горизонтальное. После установки конца иглы приблизительно на расстоянии 2 см справа от позвоночника иглу начинают медленно извлекать, создавая одновременно с помощью шприца отрицательное давление. При появлении желчи вводят небольшое количество
22. Чрескожная чреспеченочная холангиография.
водорастворимого контрастного вещества. Если игла находится в просвете протока, он хорошо контрастируется. В таких случаях вводят под контролем экрана телевизора весь препарат (30— 50 мл) и делают снимки. В случае непопадания контрастного вещества в протоки пункцию повторяют, иногда до 5 раз, несколько меняя направление укола иглы. В поиске желчных протоков можно применять принцип пробного контрастирования.
Наш опыт свидетельствует, что чрескожная чреспеченочная холангиография позволяет в большинстве случаев успешно решать диагностические задачи при неэффективности других методов исследования. Применение тонких игл резко снижает частоту осложнений и значительно повышает эффективность метода. С помощью метода можно делать и декомпрессию расширенного желчного дерева и вывести больного из критического состояния.
Чрескожную хоЛецистохолангиогра-фию применяют в тех случаях, что и чрескожную чреспеченочную холангиографию, и, кроме того, при изучении состояния желчного пузыря и проходимости пузырного протока.
Подготовка больного та же, что и для чрескожной чреспеченочной холангиографии. Под местной анестезией пунктируют пальпируемый желчный пузырь, удаляют застойную желчь, вводят в него 50 % раствор гипака и наблюдают за перемещением контрастного вещества по желчным путям с помощью рентгеноскопии или рентгенотелевидения, выполняя снимки в необходимых проекциях. Осложнения те же, что и при чрескожной чреспеченочной холангиографии.
Лапароскопическая холангиография — разновидность транспариетальной холангиографии. Ее применяют по тем же показаниям, но особенно — для исследования желчного пузыря и пузырного протока.
Подготовка больного та же, что и для чрескожной чреспеченочной холангиографии. Исследование выполняется специалистом, владеющим лапароскопией. Лапароскоп вводят справа и несколько выше пупка. Производят осмотр брюшной полости и определяют положение и состояние желчного пузыря. Затем производят чрескожную пункцию желчного пузыря, отсасывают желчь и вводят небольшое количество контрастного вещества, чтобы убедиться в правильном положении иглы. После этого медленно вводят 50 % раствор гипака под контролем просвечивания и выполняют серию снимков.
Осложнения те же, что и при других видах транспариетальной холангиографии.
Операционная холангиография — при этом методе контрастное вещество вводят прямо в желчные протоки во время операции, после вскрытия брюшной полости. Метод позволяет получить четкое представление о положении, форме, ширине протоков, наличии в них конкрементов.
Показания: камни или подозрение на наличие их в протоках, расширение
внепеченочных желчных протоков и наличие в них мутного содержимого, множественные мелкие конкременты в желчном пузыре, увеличение головки поджелудочной железы.
Противопоказания: абсолютных противопоказаний нет. Относительное противопоказание — острый холангит.
Методика исследования: до начала операции в операционную доставляют передвижной рентгеновский аппарат и кассеты. Кассету подводят под больного и производят обзорный снимок, чтобы уточнить положение больного и технические условия. Затем устанавливают следующую кассету для - холангиографии.
Контрастное вещество может быть введено в желчный пузырь, в пузырный проток или общий желчный проток.
Различают одномоментную холангиографию, когда контрастное вещество вводят однократно. При узких протоках иногда достаточно 6—7 мл контрастного вещества, при расширенных — 15 — 20 мл. Можно производить и многомоментную холангиографию — контрастное вещество вводят под визуальным контролем несколько раз. Первый снимок делают после введения 3—4 мл, второй — за введением следующих 4— 5 мл, третий — при введении 12—15 мл препарата. Кассеты меняют после каждого снимка. Такое исследование отражает картину динамического наполнения желчного пузыря или желчных путей контрастным веществом.
По окончании съемки пленки обрабатывают в фотолаборатории. Хирург в это время продолжает операцию. Через несколько минут рентгенлаборант доставляет снимки в операционную, где хирург и рентгенолог совместно анализируют его на негатоскопе.
Осложнений при правильной методике холангиографии не наблюдается.
Холангиография через дренажную трубку (чрездренажная холангиогра-
23. Чрездренажпая холангиография (варианты в, б).
фия) — контрастирование желчных путей производят, вводя контрастное вещество через катетер или дренажную трубку, оставленную после операции на желчных путях.
Показания: послеоперационный контроль проходимости желчных путей, определение причины нарушения оттока желчи (сужение протоков, забытые камни и др.). Специальных противопоказаний нет.
Методика: исследование проводят натощак. Дренажную трубку пережимают зажимом и выше зажима производят прокол шприцем с иглой. В желчные пути медленно вводят 25—50 % раствор гипака. Под контролем рентгеноскопии наблюдают за продвижением контрастного вещества и выполняют снимки в оптимальных проекциях. Осложнений при правильной методике не наблюдается.
Холангиография через свищ (фис-тулохолангиография) выполняется при
наличии у больного спонтанного или искусственно созданного наружного желчного свища. После обзорной рентгенографии через катетер, введенный в свищевой ход, под контролем просвечивания вводят 50 % раствор гипака, следят за его распространением и выполняют рентгенограммы.
Рентгенологическое исследование печени и желчевыделительной системы можно дополнять радиологическими методиками, например радиохолецисто-графией и радиогепатографией. В ряде случаев они играют решающую роль в правильном распознавании заболевания. Так, Л. Д. Линденбратен и Л. А. Юдин (1968) изучали концентрационную функцию желчного пузыря у больных с помощью I131 — бенгальской розы. Один датчик радиодиагностического прибора устанавливают над левым венозным синусом, второй — над печенью, третий — над желчным пузырем и четвертый — над кишечником, несколько
левее и ниже пупка. При анализе радиохолецистограмм и холеграмм показатели обоих методов совпадали. Вместе с тем выявились определенные преимущества радиоизотопного метода. Он позволяет изучать приток радиоактивного вещества в желчный пузырь с первых минут после введения, когда на рентгенограммах тень желчного пузыря еще отсутствует. В дальнейшем радиохолецистография дает возможность непрерывно изучать процесс наполнения желчного пузыря, в то время как рентгеновские снимки по соображениям радиационной безопасности можно производить с интервалами в 15—30 мин. Данные этого исследования важны также для одновременной оценки функции печени. Радиохолецистография обеспечивает измерения в течение многих часов, тогда как по холеграммам о концентрации желчи удается судить лишь до фазы однородности тени пузыря.
Создание меченых 1|3|-соединений отечественного производства (били-гност — I131, билитраст — I131) способствовало разработке методик радионуклидного исследования функционального состояния и анатомо-топографических особенностей желчного пузыря с помощью этих препаратов. Для функционального исследования предпочтительнее билигност — I131. Он вводится внутривенно из расчета 0,1—0,2 мк Кюри на 1 кг массы тела больного.
Противопоказания: беременность, период лактации, детский возраст и заболевания крови. С помощью трех коллимированных сцинтилляционных счетчиков, имеющихся на универсальной ра-диодиагностической установке отечественного или зарубежного производства, осуществляется запись кривой накопления билигноста — I131 желчным пузырем или печенью. По характеру изменения кривой радиоактивности судят об их функциональном состоянии.
Способ сочетанной холедуоденогра-фии позволяет получить четкое представление о взаимосвязи патологии желчевыделительной системы и 12-перстной кишки. Исследование начинается с холеграфии, к которой подсоединяется релаксационная или обычная гастроду-оденография. После исследования желудка и 12-перстной кишки больному дают-20 мл сырого желтка (можно сорбит или ксилит вместе с бариевой взвесью). Сочетанный метод исследования позволяет не только одновременно изучить двигательную функцию желчного пузыря, желудка и 12-перстной кишки, но и выявить их морфологические изменения. А это имеет важное значение при постановке диагноза заболевания.
Поджелудочная железа. Своевременное распознавание и дифференциальный диагноз воспалительных и опухолевых заболеваний ПЖ очень трудны из-за полиморфизма клинических проявлений и отсутствия достаточно эффективных и общедоступных методов исследования. Нет единого мнения в общей лечебно-профилактической сети и по вопросу, с чего нужно начинать исследование при подозрении объемного процесса в ПЖ. По мнению большинства, в случае подозрения на заболевание ПЖ, особенно острое (острый живот), всегда целесообразно делать обзорные снимки.
Обзорные снимки живота в норме не выявляют ПЖ. Она может быть видимой только при наличии в ней известковых включений или конкрементов. При остром панкреатите можно наблюдать сегментарные скопления газов в тощей и поперечной ободочной кишке, дисковидные ателектазы в нижнем отделе легкого и жидкость в левом реберно-диафрагмальном синусе. В 50—75 % алкогольного панкреатита встречается кальциноз ПЖ. В случае рака головки ПЖ у больных с желтухой увеличенный
и напряженный желчный пузырь, увеличенная печень, нижний контур которой ровный, размер селезенки нормальный (что отвергает паренхиматозную желтуху).
При обычном контрастном рентгенологическом исследовании желудка, релаксационной дуоденографии7 холеграфии о состоянии ПЖ судят лишь по косвенным признакам, а именно по особенностям деформации желудка, 12-перстной кишки и изменениям билиарного тракта и других органов брюшной полости. Опыт показывает, что эти изменения, как правило, свидетельствуют о запущенном процессе.
Определенным прогрессом в диагностике заболеваний ПЖ явилось внедрение в практику эндоскопической ретроградной панкреатохолангиографии. Этот метод исследования проводят совместно эндоскопист и рентгенолог. Он позволяет получить полную и точную информацию о состоянии 12-перстной кишки, фатерова соска, билиарного тракта и протоков поджелудочной железы.
Показаниями для ЭРПХГ служат: 1) хронический панкреатит (необходимо знать, нет ли в поджелудочной железе или в желчных протоках локальных поражений, которые можно устранить только хирургическим путем; подозрения на такие поражения возникают, когда панкреатит обостряется без видимых причин, не поддается терапии, если имеется длительный болевой синдром) ; 2) упорный болевой синдром неясного генеза, когда применение других методов не позволяет оценить состояние желчевыводящих и панкреатического протоков; 3) механическая желтуха (до операции целесообразно установить причину или уровень препятствия оттоку желчи); 4) необходимость дифференцировки хронического панкреатита и опухолевого поражения ПЖ; 5) решение возможности хирур
гического вмешательства при раке ПЖ.
Перед исследованием больному не рекомендуется принимать пищу в течение 12 часов, за 2—3 дня до эндоскопии ему нельзя производить контрастное исследование пищеварительного тракта. Исследование выполняется под анестезией глоточного кольца 1 % раствором дикаина, для создания искусственной гипотонии 12-перстной кишки используется премедикация: 1 мл 2 % раствора димедрола и 1—2 мл 0,1 % раствора сернокислого атропина в сочетании с 4—6 мл 10 % глюконата или хлорида кальция или 2—3 таблетки аэрона. В премедикацию некоторых больных по индивидуальным показаниям включают седативные и нейролептические препараты.
ЭРПХГ осуществляется в рентгеновском кабинете, оснащенном ЭОУ и рентгенотелевизионной установкой, которая позволяет производить серийные и отдельные снимки. В исследовании принимают участие эндоскопист, рентгенолог и два ассистента (медицинские сестры), обеспечивающие весь комплекс вспомогательных процедур. Для эндоскопического исследования используются японские фибродуоденоскопы «Olympus» типа В и IF типа В-2. Основные достоинства их: гибкость, наличие управляемого дистального конца, хорошее освещение, возможность фотографирования и получения прицельной биопсии.
После визуального изучения слизистой оболочки желудка и 12-перстной кишки отыскивается ее большой сосочек. Обнаружив последний, тонкий тефлоновый катетер с металлической канюлей (проводником) устанавливают перпендикулярно его поверхности и плавным целенаправленным движением вводят в отверстие фатерова соска. Глубина погружения канюли в его ампулу зависит от состояния соска и опыта исследователя. С приобретением навыка
в процессе исследования удается точно установить вариант анатомического строения фатерова соска в каждом конкретном наблюдении и таким образом осуществить избирательную катетеризацию. При отсутствии органических изменений в преампулярной зоне канюлирование проводится на глубине 2—7 мм. После фиксации катетера металлический проводник извлекается и через катетер под визуальным контролем телевизионного экрана или ЭОУ вводится контрастное вещество со скоростью 30 мл/мин.
В качестве контрастных веществ можно использовать 40—50—60 % раствор верографина или урографина. Можно применять и другие водорастворимые йодистые препараты. Количество вводимого контрастного вещества определяется в ходе исследования при помощи ЭОУ или рентгенотелевидения с одновременной серийной и одиночной рентгенографией. Для вирсунгографии достаточно от 2 до 4 мл контрастного вещества, а при контрастировании желчевыводящих путей его количество увеличивается до 20—40 мл. Контрастное вещество вводится обычным 10 — 20-граммовым шприцем и под небольшим дозированным давлением. В процессе заполнения контрастным веществом билиопанкреатических протоков производится серийная или одиночная рентгенография в оптимальной проекции.
После введения контрастного вещества фибродуоденоскоп извлекается (так как от действия рентгеновых лучей он быстро портится) и при необходимости изучается время опорожнения билиопанкреатических протоков от контрастного вещества. В основном полное опорожнение протоков наступает через 3—5 мин, а внутри- и внепеченочных желчных протоков — через 5—10 мин. Задержка контрастного вещества более 5—10 мин наблюдается при контрасти
ровании паренхимы поджелудочной железы или кистозной полости. По окончании исследования больного переводят в палату, где за ним ведется наблюдение.
Успех селективного и одновременного канюлирования билиопанкреатических протоков зависит от их состояния, анатомического варианта строения большого сосочка 12-перстной кишки, локализации устья общего желчного протока и основного протока поджелудочной железы. Технические трудности, встречающиеся при ретроградной панкреато-холангиографии, зависят от следующих причин: 1) воспалительная или опухолевая инфильтрация околососковой зоны; 2) атипичное положение большого дуоденального сосочка; 3) атипичное расположение устья общего желчного и вирсунгова протоков в стенке 12-пер-стной кишки; 4) параампулярный дивертикул, когда сосочек находится на его стенке.
Противопоказания к ЭРПХГ включают противопоказания к введению фибродуоденоскопа и контрастных веществ в билиопанкреатические протоки. Введение фибродуоденоскопа противопоказано при инфекции (активный туберкулез легких и др.), стенозе пищевода, кардии и пилороантрального отдела желудка, большом дивертикуле пищевода, аневризме аорты, резких сколиозах позвоночника, варикозе пищевода, нарушении свертывающей системы крови и других заболеваниях. Противопоказаниями к введению контрастных веществ являются: острый панкреатит, холангиохолецистит и другие острые хирургические заболевания органов брюшной полости, требующие неотложного оперативного вмешательства, общее тяжелое состояние больных (сердечно-легочная недостаточность III степени, инфаркт миокарда и острый инсульт и др.). Преклонный возраст больных не может служить противопоказанием к применению ЭРПХГ.
24. Эндоскопическая ретроградная панкреатохолангиография (варианты а, 6).
После проведения ЭРПХГ возможны: повышение температуры, боли в животе, диастазурия и обострение панкреатита с образованием панкреанекроза или холангита, как реакция на введение контрастных веществ. Кратковременное повышение температуры и содержание диастазы в моче, как правило, нормализуются в течение 24—48 ч после ретроградной панкреатохолангиографии без применения специальных лечебных средств. К серьезным осложнениям относится обострение панкреатита и холангита.
Причины осложнений ЭРПХГ — это чаще всего нарушение технического правила эндоскопии пищеварительного тракта, введение большого количества рентгеноконтрастных веществ под высоким давлением, которое способствует разрыву стенок мелких ветвей основного панкреатического, или вирсунгова, протока и контрастированию паренхимы
поджелудочной железы, необоснованное показание к исследованию.
По мнению С. Т. Тусупбекова (1982), диагностические возможности ЭРПХГ при правильных показаниях и строгом соблюдении методики, техники исследования столь демонстративны и ценны, что было бы ошибочным отказаться от нее исходя из редких, но возможных осложнений. Существенный недостаток, ограничивающий широкое применение этого метода, заключается в сложности техники выполнения, требующей участия подготовленных специалистов. Дальнейшее совершенствование конструкции дуоденофиброскопа и его управления, накопление коллективного опыта, подготовка специалистов позволят расширить круг клинического использования ЭРПХГ. Опыт показывает, что ЭРПХГ доступна в условиях любой больницы, оснащенной современным фи бродуоде носко пом.
Экскреторная панкреатография включает три главных момента: 1) наложение пневмоперитонеума; 2) введение го рмо нал ьного п ре парата-сти мулл тора и контрастного вещества; 3) собственно рентгенологическое исследование поджелудочной железы (рентгено- и томография). Основные показания к применению экскреторной панкреатогра-фии:
определение положения, формы и функционального состояния паренхимы поджелудочной железы;
уточнение природы патологических изменений, выявленных при использовании клинических методов исследования;
определение взаимоотношений пораженной поджелудочной железы с соседними органами и тканями — в частности, прорастания в желудок, 12-перстную кишку, толстую кишку;
при предполагаемом облучении производство разметки полей для лучевой терапии.
По мнению Л. С. Розенштрауха и других, панкреатографию следует производить в условиях стационара, так как после наложения пневморетроперито-неума и введения стимулирующего и контрастного препаратов больные до конца дня должны находиться под наблюдением врача. По истечении этого срока больной, как правило, может быть выписан или переведен в соответствующее отделение для необходимого лечения. .
Противопоказания для проведения исследования: общее тяжелое состояние больного, высокая температура тела, острые воспалительные процессы в забрюшинной клетчатке, выраженная сердечно-сосудистая недостаточность, ишемическая болезнь сердца, застой в системе верхней полой вены и другие патологические состояния.
Алгоритм экскреторной панкреато-графии:
1. За сутки до исследования накладывается диагностический пневмопери-тонеум. Наиболее распространен метод де Жена с соавт.: пункция производится специальной иглой на глубину 4—5 см в предкопчиковую клетчатку по средней линии между копчиком и заднепроходным отверстием в коленнолоктевом положении больного. Предварительно проводится дезинфекция кожи, затем местная анестезия ее и подкожной клетчатки.
В впередикрестцовую клетчатку игла вводится медленно по направлению кверху и кзади с продвижением до упора в заднюю поверхность копчика. Продвижению иглы постоянно предпосылается введение 0,25 % раствора новокаина. Это обеспечивает обезболивание и, кроме того, способствует оттеснению задней стенки прямой кишки кпереди, предотвращая ее ранение. При недостаточном опыте рекомендуется контролировать продвижение иглы в клетчатке с помощью пальца, введенного в прямую кишку. Движением поршня шприца на себя устанавливается отсутствие повреждения кровеносных сосудов.
Перед введением газа в предкопчиковую клетчатку вводится еще 30—40 мл новокаина. Затем вводят газ. Могут быть использованы воздух, кислород, закись азота, углекислый газ. Последние рассасываются слишком быстро, поэтому для наложения пневморетроперитонеума они малопригодны. Воздух рассасывается медленно и успевает хорошо «проработать» клетчатку забрюшинного пространства. Его недостаток заключается в опасности возникновения эмболии при попадании в кровеносный сосуд во время пункции. Оптимальным газом для наложения пневмоперитонеума является кислород.
Как правило, первые 200—300 мл газа поступают в клетчатку, не вызывая каких-либо ощущений, и лишь при дальнейшем введении возникает ощу
щение умеренного давления. С появлением этих признаков последующее введение проводится дробно по 100 мл через 3—4 мин, что уменьшает болезненные ощущения. Время инсуфля-ции — 20—25 мин. Всего вводится 1200—1500 мл кислорода или воздуха. В конце введения у некоторых пациентов появляются ощущения давления в пояснице, в области крестца, на уровне диафрагмы, иногда в правом или левом плече или ключице. Через 30—40 мин после окончания инсуфляции зти ощущения уменьшаются или исчезают.
После пункции больному рекомендуется лежать в основном на животе, со слегка приподнятой грудной клеткой. Он может также сидеть и даже немного ходить по палате и коридору. Вертикальное положение способствует более быстрому продвижению газа кверху, а лежание на животе — кзади.
2. В день исследования после очистительной клизмы натощак производится обзорный снимок живота в положении больного на спине.
3. Сейчас же после снимка внутривенно в течение 1—2 мин вводится секретин из расчета 2 ЕД на 1 кг массы тела, в среднем 80 ЕД. Вместо секретина можно применять шведский панкреозимин или французский патентованный препарат — эритрозин-В. Введение этих гормональных препаратов необходимо для того, чтобы вызвать усиление внешнесекреторной функции поджелудочной железы и в результате этого создать повышенное кровенаполнение органа в момент его максимальной нагрузки.
4. Через 10 мин после введения секретина внутривенно вводится контрастный препарат в количестве 1 мл на 2 кг массы тела больного. Находящаяся в гиперактивном состоянии поджелудочная железа способна накапливать в своей паренхиме больше контрастного вещества, чем окружающие ткани, по-
& *»
этому она становится видимои и полу-чает четкое изображение на рентгенограмме.
5. Тотчас после введения контрастного вещества желудок раздувают воздухом с помощью тонкого зонда и баллона Ричардсона, или больной принимает газообразующую смесь.
6. Сразу же после контрастирования желудка и поджелудочной железы приступают к рентгенологическому исследованию. Делают обзорные снимки и томограммы в прямой и боковой проекциях. Прямые срезы производятся лежа на спине на глубине 12—15 см при условиях 80—85 кВ и 50 мАс, боковые — на правом боку на уровне остистых отростков, а также до 5 см выше и ниже их при 90—95 кВ и 75 мАс. В ряде случаев достаточно трех срезов: на уровне головки, тела и хвоста. Лучше зонография, так как более толстый срез более информативен.
В контрастированном состоянии поджелудочная железа находится около 35 мин, поэтому времени хватает на исследование и производство дополнительных снимков или томограмм. Даже при полном выключении секреторной функции или резком ее снижении окаймление газом наружных контуров железы позволяет получить ценные дополнительные сведения.
Ангиография поджелудочной железы представляет собой сложный инвазивный рентгенологический метод, который включает целиакографию и мезентери-кографию. В зависимости от контрастирования сосудов выделяют три фазы: I — артериографии, II — паренхимо-графии, III — флебографии.
Основными показаниями для проведения ангиографии поджелудочной железы являются хронический панкреатит и рак, а также их дифференциальный диагноз. Правда, этот метод эффективен и при других заболеваниях поджелудочной железы, но проводить его нужно
после менее трудоемких методов исследования, включая и КТ.
Последовательность и необходимый комплекс используемых методов исследования поджелудочной железы устанавливаются в зависимости от предполагаемого диагноза и технической оснащенности лечебных учреждений. Перед использованием специальных методов исследования поджелудочной железы производятся рентгенозндоскопические исследования желудка, 12-перстной кишки и билиарного тракта по общепринятой методике. При необходимости применяются зондовая или беззондовая релаксационная дуоденография, методика которой разработана и подробно описана. В своей практической работе мы отдаем предпочтение беззондовой релаксационной дуаденографии. Одномоментное рентгенологическое исследование желудка и 12-перстной кишки до и после применения фармакологических препаратов позволяет получить сведения об анатомо-топографическом и функциональном состоянии гастродуоденальной области при хроническом панкреатите и раке поджелудочной железы.
Компьютерная томография
К неинвазивным методам диагностики, получившим в последнее время широкое распространение, относится компьютерная томография. Разработка и внедрение в клиническую практику компьютерной томографии — крупнейшее достижение науки и техники XX ст. Доказательством этого является присуждение в 1979 г. Нобелевской премии физикам А. М. Cormack (США) и G. Hounsfield (Англия) за разработку этого метода и внедрения его в клиническую практику.
Математические принципы КТ обоснованы А. М. Cormack в 1963 г., а первые опытные образцы компьютерных
томографов впервые созданы в Англии в 1971 г. Первое официальное сообщение о клиническом применении КТ при исследовании головы человека сделано G. Hounsfild и J. Ambrose -19 апреля 1972 г. на ежегодном конгрессе Британского института рентгенологии. Через 2 года R. Ledley (1974) разработал новый вариант КТ для всего тела. Применение компьютерных томографов в клинической практике за небольшой срок показало высокую эффективность метода в распознавании заболеваний многих органов, в том числе пищеварительного аппарата.
Термин «компьютерная томография» имеет много синонимов: трансаксиальная компьютерная томография, вычислительная рентгеновская томография, томоденситометрия и др. КТ — это метод рентгенологического исследования, заключающийся в круговом просвечивании объекта рентгеновским излучением и последующем построении с помощью быстродействующей ЭВМ послойного изображения этого объекта.
Томографическая компьютеризированная система включает: 1) сканирующее устройство, состоящее из источника рентгеновского излучения, детекторов, его воспринимающих, и системы, обеспечивающей их перемещение; 2) систему преобразования регистрируемой детекторами информации; 3) специализированную ЭВМ, производящую необходимые для построения изображения вычисления по заданному алгоритму; 4) систему записи и воспроизведения реконструированных изображений внутреннего строения тонких слоев объекта в осевом (поперечном) сечении.
Современный компьютерный томограф представляет собой рентгеновский аппарат, в котором и приемник излучения и сам излучатель вращаются относительно одной общей оси, вдоль которой расположено тело пациента. Рентгеновская трубка и расположенные коль
цом многочисленные чувствительные сцинтилляционные детекторы, направленные в сторону трубки, укреплены в специальной круговой раме. В центре этой рамы имеется отверстие, куда перемещается специальный стол с пациентом. Перемещение пациента осуществляется в горизонтальном положении автоматически по сигналу ЭВМ.
Панель наблюдения оснащена клавиатурой со специальными функциональными ключами. Все операции наблюдения, манипуляции с изображением и обработки данных управляются с помощью этой клавиатуры. КТ-изобра-жения можно получать двумя способами, а именно: 1) с вращением системы трубка — приемник вокруг тела пациента; 2) с неподвижной трубкой. Очевидно, что в этом случае КТ превращается практически в обычный рентгеновский аппарат с математической обработкой изображения. Этот режим необходим для более точной локализации области интереса, т. е. для «прицеливания». Кроме того, в самом начале исследования можно производить необходимые клинические записи о пациенте. Вся информация записывается на магнитный диск, в том числе полученные в процессе работы изображения.
С помощью программного обеспечения можно обрабатывать полученные данные и получать, например, увеличенные в 5 раз изображения нужных участков картинки, проводить программно «разрезанные» пакеты слоев в другом направлении, получать на одной картинке несколько срезов, что особенно ценно для обучения или наблюдения за прогрессирующим процессом. Важным достоинством системы является возможность выбора изображений для последующего получения фотоснимков.
Большинство операций осуществляется нажатием ключа или поворотом одного рычага, как, например, управление шириной и уровнем окна, где
25. Основные элементы компьютеризированной томографической системы:
а — сканирующее устройство и стол пациента; б — преобразователь рентгеновых лучей; в — ЭВМ с блоками памяти информации и снимков и сетевым распределителем; г — центральный пункт управления, система записи и воспроизведения изображений.
регулируемая величина пропорциональ-на положению рычага управления. Система рассчитана на применение различных устройств для получения выходной документации таких, как многоформатные камеры, печатающие устройства и т. д.
В процессе исследования рентгеновская трубка вращается вокруг неподвижного объекта. При этом тонкий коллимированный пучок рентгеновского излучения падает на исследуемый слой организма под разными углами. Проходя через ткани различной плотности, интенсивность пучка рентгеновского излучения ослабляется, что регистрируется высокочувствительными детекторами по каждому направлению, данные с которых передаются для обработки в ЭВМ.
При обработке изображения используется сложный алгоритм реконструкции образа для превращения снятых во время сканирования показаний интенсивности рентгеновых лучей в цифровую информацию о той части тела, через которую прошли рентгеновы лучи. Благодаря возможности дифференцирования мягких тканей и отображения самых тонких костных деталей КТ имеет широкий спектр диагностических применений на всем теле.
Диагностика с помощью КТ основана на прямых рентгеновских симптомах, т. е. на показателях плотности или абсорбции. Поскольку различные анатомические структуры (вода, ткань, кость, жир) характеризуются разным поглощением рентгеновых лучей, то была предложена искусственная шкала цифровых оценок (шкала единиц плотности Хаунсфильда, или КТ-единиц) — коэффициентов поглощения, или коэффициентов абсорбции (КА). Для измерения КА принята условная единица EMI. По системе, предложенной фирмой «Ohio Nucler» (telta), оценка колебаний КА осуществляется в диапазоне условных единиц от —1000 (воздух) до + 1000 (кость). При этом величина коэффициента поглощения рентгеновского излучения водой принимается равной нулю. Исходя из этого для каждого органа выработан средний показатель КА. Значение показателей для каждой точки сканируемого тела устанавливается с помощью ЭВМ. Плотность на срезе может быть измерена как в одной точке, так и в заданной области произвольной формы.
Для визуализации изображения ЭВМ выдает на экран телевизионного устройства величины поглощения рентгеновского излучения не только в условных КТ-единицах, но и преобразует их в градацию световой яркости. На экране телевизора большим значениям плотности соответствует более светлое
изображение и наоборот. При этом воспроизводятся обычно до 20 различаемых для человеческого глаза ступеней серого изображения. Все градации плотностей одновременно получить на экране невозможно. Поэтому при исследовании последовательно выбирается «область интереса», на которой воспроизводятся детали изображения в черно-белом или цветном варианте.
Чтобы увеличить разрешающую способность КТ, нередко применяется методика «усиления» изображения. Она основана на введении рентгеноконтрастных препаратов, в результате чего происходит повышение денситометриче-ской разницы между обычной и контрастированной тканью или органом. Сравнение коэффициента абсорбции до и после введения контрастных препаратов позволяет выявлять очаги патологической плотности, которые при обычной КТ не определялись.
Лучевые нагрузки при выполнении таких исследований зависят от режима работы аппарата, толщины среза, исследуемой области и составляют, по данным В. Н. Петухова с соавт. (1988), около 0,013 мГр на один срез.
В современных компьютерных томографах детекторная система имеет тончайшую настройку, позволяющую различать детали 0,4 мм и визуализировать при толщине слоя 1 мм структуры объектов 0,16 мм3. Минимальными интервалами сканирования являются 1,3; 2 и 2,7 с, которые удовлетворяют всем требованиям в высоком и низкоконтрастном диапазоне и позволяют выполнять все виды повседневных диагностических работ. К другим преимуществам следует отнести малые интервалы циклов: уже в стандартном режиме возможно выполнить до 6 циклов в минуту, включая формирование изображения и архивизацию. Таким образом, даже при сверхоперативной и быстрой работе параллельно режиму сканирования можно
осуществлять просмотр и анализ изображения. Изображение просвещенного слоя с телевизионного экрана может быть переснято фотокамерой моментального действия «Поляроид» или воспроизведено на листовой рентгеновской пленке с помощью специального устройства.
Со времени разработки и внедрения компьютерного томографа для исследования всего тела началась новая эра в диагностике заболеваний организма человека. При исследовании органов грудной полости отчетливо видны легкие, сердце, сосуды, лимфатические узлы, опухоли средостения и др. Большие возможности имеет КТ в диагностике заболеваний брюшной полости, особенно в распознавании поражений паренхиматозных органов. Так, КТ играет важную роль при заболеваниях печени. С ее помощью можно проследить за распространением патологических процессов за пределы печени, в соседние органы, обозначить очаговые поражения паренхимы печени диаметром 2 мм и более. К этим поражениям печени относятся прежде всего разнообразные кистозные изменения, в том числе кисты печени диаметром от 0,5 до 3 см, эхинококкоз, синдром Кароли. КТ применяется для распознавания солидных доброкачественных поражений печени: гематом, гемангиом, аденом, она дает важную информацию при диффузных заболеваниях паренхимы печени, в первую очередь доброкачественных. Так, при жировой инфильтрации печени, как правило, определяется значительное снижение показателей плотности, зависящее от содержания жира в клетках печени. Отмечается корреляция между содержанием жира и измеренными с помощью КТ величинами плотности. При больших отложениях жира в печеночной клетке КТ картина отличается от таковой окружающей ткани, причем сосуды печени представ-
26. Компьютерная томография печени.
лены как ареолы с пониженной плотностью. КТ позволяет диагностировать ожирение печени средней и резкой интенсивности.
Однако компьютерно-томографической характеристики для гепатита и цирроза печени не существует. В последних случаях в зависимости от тяжести поражения видна нерегулярно контурируемая поверхность, а также заметно уменьшенная в размерах печень. При заболеваниях паренхимы печени большое значение имеет сцинтиграфия печени, а также ультразвуковая диагностика.
У больных гемосидерозом (хромато-зом) гомогенное отложение железа в клетках ретикулогистиоцитарной системы вызывает повышение плотности печени. Компьютерная томографическая денситометрия позволяет примерно определять содержание железа, гомогенное отложение 1 г железа ведет к увеличению плотности печени. Особенно полезна КТ для динамического контроля за изменением содержания железа в печеночной ткани под воздействием лечебных мероприятий.
КТ является методом выбора при определении очагов абсцедирования в области печени или поддиафрагмально
го абсцесса, имеющих вид неправильной формы с пониженной плотностью участков; центр абсцесса с помощью указанной методики не выявляется. КТ применяют и при чрескожном дренаже абсцессов печени или поддиафрагмальных абсцессов. Современная КТ позволяет установить очаговые поражения паренхимы, начиная от 5 мм в диаметре, при использовании внутривенного введения контрастных веществ. Так, КТ оказалась высокочувствительным методом диагностики метастазов печени, превосходящим чувствительность методик с применением радиоактивных веществ. Хотя при диффузных заболеваниях печени (жировая инфильтрация печени, гемохроматоз или сидероз) посредством КТ не выявляется отчетливая характеристика процессов, тем не менее имеется основа для применения других методов исследования.
Таким образом, КТ печени дает возможность выявить ее воспалительные и дистрофические изменения, первичные и вторичные опухоли, кисты, холелитиаз, циррозы, опухоли желчных протоков и желчного пузыря. Нормальная печень на томограммах имеет четкие границы с визуальной дифференциацией всех ее анатомических структур: правой, левой и квадратной долей печени, желчных протоков и желчного пузыря, воротной вены, печеночной артерии. Коэффициент абсорбции нормальной печеночной ткани — от +55 до + 70 ед.
Наиболее сложна диагностика опухолевых поражений печеночной ткани. Обычно патологические очаги выявляются как зоны пониженной плотности различных размеров с расширением внутрипеченочных протоков и воротной вены, хотя на фоне цирротических изменений они могут и не определяться. Внутривенное контрастное усиление приводит к быстрому накоплению рентгеноконтрастного препарата в этой зоне,
что связано с преимущественным артериальным кровоснабжением опухолевой ткани. Выраженная неровность контуров, наличие в узлах небольших участков некроза, вовлечение в процесс портальных и парааортальных лимфатических узлов позволяют установить правильный клинический диагноз (Петухов и др., 1988).
Как свидетельствуют работы разных авторов, желчный пузырь при КТ обычно идентифицируется. Внутрипеченоч-ные желчные пути диаметром 1—2 мм с помощью этого метода фиксировать не удается. Внепеченочные желчные пути, как и общий желчный проток, без введения контрастных веществ прослеживаются непостоянно. После внутривенного введения контрастных веществ их можно различить вполне определенно.
При нарушении оттока желчи в 12-перстную кишку и стазе с помощью КТ можно констатировать расширение как внутри-, так и внепеченочных путей. Удается локализовать место обтурации (в частности, при опухолях, расположенных в печени или ее воротах, при желчнокаменной болезни, поражении головки поджелудочной железы).
Посредством КТ можно получить изображение желчного пузыря, составить представление о его величине и форме. Конкременты (преимущественно из кальция) определяются при размерах 1—2 мм. Однако конкременты, не содержащие камней, часто не обнаруживаются без применения контрастных средств. При этом не всегда можно отличить их от опухолей. Изменения стенки желчного пузыря (утолщения, размытость) могут указывать на холецистит.
Наш опыт свидетельствует, что в диагностике заболеваний желчного пузыря и желчных путей первичными исследованиями являются эхография и холецистография. Следующим этапом может быть КТ как уточняющий и до
полняющий метод, дающий достоверные результаты до 80 % при первичных опухолях (рак желчного пузыря), конкрементах, закупорке камнями или вторично опухолью, воспалительных поражениях, абсцессах, водянке желчного пузыря.
С введением в практику КТ возможности диагностики заболеваний поджелудочной железы значительно обогатились. Однако в отношении ранней диагностики ее заболеваний, особенно злокачественных опухолей, эти надежды не оправдались. Тем не менее при КТ поджелудочная железа (ее величина, форма, структура паренхимы) выявляется достаточно хорошо. Нормальная ПЖ имеет четкие ровные контуры с коэффициентом абсорбции 30—45 ЕД, по задней поверхности железы дифференцируется селезеночная вена.
В норме панкреатические ходы не определяются, но они видны в случае расширения. При этом прохождение поражения определить не представляется возможным (карцинома, воспаление). Также невозможно с помощью КТ дифференцировать поражения эндокринного и экзокринного отделов ПЖ. Отчетливо видны изменения при ее атрофии и ожирении паренхимы. Применение контрастных веществ значительно облегчает исследование.
При остром неосложненном панкреатите ПЖ видна как диффузно увеличенный орган без сосудистых некрозов. После прекращения острого процесса могут определяться кисты в паренхиме или очаги обызвествления. В случае некротической формы поражения рано возникают поражения тканей (некрозы, кисты), определяемые посредством КТ. Хронический панкреатит ведет к обызвествлению в тканях ПЖ. Оно также выявляется с помощью этого метода.
Кисты или псевдокисты ПЖ диагностируются при их размерах 5 мм и более;
27. Компьютерная томография живота. Кальциноз стенки желчного пузыря.
зта картина не меняется и после введе-ния контрастных веществ. В опухолях, напротив (при сохранении сосудистой структуры), замедляется накопление контрастного вещества по сравнению со здоровой паренхимой. Исключение составляет инсулинома, которая в связи с гиперваскуляризацией имеет начальную повышенную плотность.
При раке проксимального отдела ПЖ на компьютерной томограмме определяются увеличение головки, неравномерность ее контуров, появление псевдокист в теле и хвосте, облитерация перипанкреатических жировых прослоек с увеличением плотности. В случае опухолей небольших размеров (1,5—2,5 см) важное значение имеют косвенные признаки, связанные с обтурацией общего желчного или панкреатического протоков с развитием ретенционного панкреатита в теле и хвосте ПЖ. Если имеется рак дистальных отделов железы, характеризующийся бессимптомностью клинического течения заболевания в ранние стадии, диагноз ставится на основе выявления при КТ значительной деформации тела и хвоста железы, понижения коэффициента абсорбции, наличия очагов распада, опу-
28. Компьютерная томография поджелудочной железы, печени и других органов брюшной полости.
холевой инфильтрации магистральных сосудов, спленомегалии.
Таким образом, рентгеновская КТ является современным эффективным методом диагностики различных заболеваний и открывает большие научные и практические перспективы. КТ не исключает применения обычных методов клинического и рентгенологического исследования. Она дополняет их данные и позволяет получить более полную информацию об исследуемых объектах, поэтому заняла достойное место в гастроэ нте рологи и.
Ультразвуковая диагностика
Метод УЗИ основан на эхолокации глубоких тканей организма, а именно на излучении зондирующего импульса ультразвука и приеме сигналов, отраженных от поверхностей раздела тканевых сред, которые обладают различными акустическими свойствами. Возвращаясь на ультразвуковой преобразователь, создают на нем легко регистрируемый электрический сигнал. Амплитуда сигнала тем больше, чем значительнее
разница волновых сопротивлений граничащих друг с другом сред.
Впервые ультразвук с диагностической целью был использован в 1942 г. австрийским ученым R. Dussik для распознавания опухолей мозга. В 1951 — 1958 гг. Т. Wild и D. Howry провели с помощью ультразвука успешные исследования паренхиматозных органов. В развитие и внедрение в практику ультразвуковой диагностики значительный вклад внесли ученые нашей страны.
Метод ультразвуковой диагностики обладает высокой разрешающей способностью, возможностью проведения многократных исследований, безопасен для больного. Отсутствие каких-либо противопоказаний способствовало тому, что метод получил широкое распространение в клинике. Методы УЗИ дополняют рентгенодиагностику, КТ при распознавании заболеваний, дифференциальной диагностике, наблюдении за динамикой патологического процесса и оценке результатов лечения.
В ультразвуковой диагностике используются несколько способов представления информации, полученной с помощью эхометода. В каждом из них подача анализируемых электрических сигналов на электронно-лучевой индикатор осуществляется по-разному. Различные типы представления изображения на индикаторе принято обозначать как А, В, АВ, С и М.
Остановимся кратко на наиболее широко применяемых в нашей стране и за рубежом способах представления информации, получаемой с помощью эхографии. Индикаторы типа А используются при одномерном методе. Метод заключается в регистрации на экране осциллографа отраженного сигнала в виде пика на прямой линии (изолинии) развертки электронного луча. При этом высота (амплитуда) пика пропорциональна интенсивности отраженного сигнала и, следовательно, разнице между
значениями акустического сопротивления двух сред. По расстоянию между отметкой начального зондирующего ультразвукового сигнала и пиком эхо-сигналов можно судить о глубине расположения границы раздела двух сред. При одномерном методе исследования датчик эхолокатора устанавливают на поверхности тела в одном положении, и эхосигналы позволяют определить расстояние до отражающих ультразвук объектов только в одном заданном направлении зондирования.
Индикаторы типа В применяются при двухмерном методе эхографии, основанном на принципе сканирования объекта ультразвуковым лучом (ультразвуковая томография, эхотомография), во время которого ультразвуковой луч движется по поверхности исследуемой области тела. Отраженные от акустически неоднородных структур сигналы преобразуются на экране телевизионного дисплея в светящиеся точки, формирующие пространственное двухмерное изображение. Интенсивность яркости свечения на обычном экране мало зависит от интенсивности эхосигнала. При использовании электронно-лучевой трубки, имеющей экран с серой шкалой, яркость точки зависит от интенсивности эхосигнала, т. е. от акустического сопротивления исследуемых тканей. Изображение в этом случае воспроизводится в различных оттенках серого тона, отражающих акустическую структуру сканируемого слоя тела человека (метод «серой шкалы»).
Преобразователь может либо перемещаться относительно пациента в горизонтальной плоскости (просто? сканирование), либо качаться из стороны в сторону (сложное сканирование). Перемещение ультразвукового датчика и его положение в пространстве преобразуются в электрические сигналы, которые управляют временной разверткой индикатора. Использование индикаторов ти
па В позволяет получить картины поперечного сечения исследуемого объекта либо путем фотографирования, либо с помощью электронно-лучевых трубок с запоминанием. Сложное сканирование дает значительно большую информацию об объекте, поскольку в этом случае возрастает вероятность того, что посланный ультразвуковой сигнал, отразившись от границ раздела сред со сложной конфигурацией, вернется на преобразователь. Такая возможность очень важна, поскольку амплитуда эхосигнала от препятствия резко уменьшается, если угол падения ультразвукового пучка, на поверхность тела заметно отличается от 90°. Недостаток приборов с индикаторами типа В — относительно большое время, необходимое для получения информативного изображения. Обычно с помощью этой аппаратуры за 1 ч можно обследовать лишь 2—3 больных.
Индикаторы типа С дают информацию в виде яркостномодулированного двухмерного изображения в плоскости, перпендикулярной к плоскости сканирования при использовании индикаторов типа В. Индикаторы типа М позволяют исследовать мгновенное положение во времени того или иного движущегося объекта. Этот метод является вариантом A-метода с разверткой одномерного эхосигнала во времени.
Одна из разновидностей двухмерной эхографии — комбинированный метод ультразвуковой диагностики, в котором ультразвуковое сканирование сочетается с определением линейной скорости кровотока, основанным на эффекте Допплера (допплеросонография, допплеро-тахография, ультразвуковая флоумет-рия). Метод используется для выявления зоны тромбоза или сдавления сосудов, а также распознавания облитерирующего зндартериита.
Обычно в приборах для ультразвуковой диагностики используют ультразвуковое излучение в диапазоне 0,5—
15 Мгц. Разрешающая способность современной ультразвуковой аппаратуры, определяемая минимальным расстоянием между двумя объектами, при котором они на экране различаются как отдельные структуры, составляет 1 — 2 мм. УЗИ органов и анатомических структур осуществляют с помощью ультразвуковых преобразователей различной конструкции.
Технические достижения в воспроизведении изображения с помощью ультразвука открыли для гастроэнтерологов новые возможности диагностики. Создание ультразвуковых установок с новыми диагностическими головками (датчики с внутренним фокусированием пучка, генераторы и приемники импульсного и непрерывного ультразвука) привело к тому, что линейное механическое (статическое) ультразвуковое сканирование уступило место сложному ручному (динамическому). Появились аппараты, работающие в режиме реального времени, обладающие значительными преимуществами (возможность использовать ультразвук различной частоты, изменять при необходимости его параметры, применять линейные, секторные, конвексные датчики, последующая компьютерная обработка изображения) и позволяющие фиксировать изображение (документировать исследование) не только на дорогостоящей пленке «Поляроид», но и на рентгеновской и фотографической пленках. Новая аппаратура дала возможность активно внедрить в диагностику различных заболеваний органов брюшной полости и забрюшинного пространства метод УЗИ, ранее ограниченно применявшийся в этом разделе медицины.
Благодаря совершенствованию аппаратуры и накопленному опыту выявлено, что при некоторых патологических состояниях пищеварительный тракт становится видимым. Поэтому предложено обязательно выполнять эхографию
перед морфологическим или контрастным исследованием. Особой подготовки для сканирования не требуется. Как и для всякой абдоминальной эхографии, необходимо голодание в течение 12 ч. Мочевой пузырь заполняется при исследовании тазовых отделов кишечника. Используют обычные аппараты и датчики с частотой 3,5 и 5 Мгц. Желательно применять мешок с водой, что улучшает качество изображения поверхностно расположенных структур.
При сканировании необходимо тщательно изучить все структуры брюшной полости, осуществляя срезы в медленном темпе и нажимая датчиком на брюшную стенку для выжимания газа из кишки. Желудок и 12-перстная кишка визуализируются при исследовании поджелудочной железы. Для облегчения работы эти органы могут быть заполнены негазированной жидкостью. Эхографические аспекты зависят от изучаемого сегмента. В середине между стенками имеется гиперэхогенный сигнал, связанный с содержимым кишки и ее слизистой оболочкой. Раздельно увидеть 5 слоев стенки практически невозможно, но при эндолюминальном исследовании зто достижимо. В норме оценить стенки пищеварительной системы трудно, за исключением антрального отдела желудка. Изображения в виде «мишени», «сандвича» очень лабильны и быстро изменяемы, поэтому оценку следует проводить очень быстро. В норме толщина стенок не должна превышать 3 мм.
Эхографически возможно оценить 3 синдрома: стаз, опухоль, воспаление. Стаз характеризуется увеличением содержимого изучаемого сегмента натощак. На уровне тонкой кишки хорошо визуализируются поперечные, или кер-кринговы, складки. Возможен небольшой выпот в брюшную полость. Калибр тонкой кишки превышает 10 мм. При поражении ободочной кишки диагностика затруднена, так как в ее просвете
29. Эхоскапограмма живота:
а — выпот в брюшную полость; б — абсцесс брюшной полости после аппендэктомии в, г — аневризма брюшной аорты.
скапливается большое количество газа. Толщина стенок практически не меняется. Желудочный стаз проявляется расширением полости органа до 6—8 см, появлением большого количества жидкости. При обструкции на уровне угла Трейтца 12-перстная кишка хорошо визуализируется вокруг головки поджелудочной железы. Особый случай стаза представлен инвагинацией, эхосемиоти-ка которой хорошо изучена. Синдром дополнительной массы был первой аномалией, которую описали при эхографии под видом «псевдо почки» или «сосиски».
Пораженный участок полностью теряет свою обычную картину и выглядит
в виде узла больших размеров, состоя щего из двух компонентов: периферг-ческой зоны — гипоэхогенной, с нероь-ными полицикличными, четкими контурами, толщиной свыше 10 мм, г центральной зоны — эхогенной, иногдг с конусами ультразвуковой тени, неправильной формы. Чтобы успешно обнаружить опухоль, ее размер должен превышать 2 см. Воспалительный синдром проявляется правильным утолщениел стенок от 4 до 10 мм. Центральный сю нал остается симметричным. Перисталг тические волны свободно проходят чере; пораженную зону. Чаще всего исслед< вания проводят при болезни Кронг. васкулярных и лучевых поражениях
30. Камень (а) и камни
(б) желчного пузыря.
Некоторые опухоли (злокачественные лимфомы, инфильтрирующие формы эпителиомы) имеют схожие признаки.
Метод УЗИ обладает значительными возможностями в диагностике заболеваний желчного пузыря. Особенно информативно УЗИ при распознавании конкрементов. Определение камня в желчном пузыре основано на выявлении отчетливых эхосигналов в его просвете. Еще более важным симптомом конкремента является наличие акустической тени дистальнее эхосигнала. По данным Ш. А. Давитадзе и соавт. (1989), чувствительность метода составляет 92,4 %, а А. И. Алтунина и соавт. (1989) — 98,54 %.
Значительной диагностической эффективности достигают с помощью поли позиционного исследования, позволяющего наблюдать смещение конкрементов в пузыре; полипроекционного сканирования (при незначительном изменении плоскости сканирования может отмечаться эффект «прыгания» — скачкообразного перемещения эхосигнала в пространстве, что обусловлено приемом отраженного ультразвука от различных граней камня). Наименьший диаметр конкремента, который может быть выявлен при УЗИ, достигает
2—3 мм. Особым преимуществом УЗИ следует считать возможность оценить состояние так называемого «отключенного» желчного пузыря.
С помощью УЗИ можно изучить состояние стенки желчного пузыря. Как известно, при хроническом холецистите наблюдается утолщение стенок пузыря в среднем до 5—8 мм. Это удается найти с помощью УЗИ, а также констатировать неровность контуров стенок, развитие в них очагов склероза. Симптомом хронического холецистита служит также наличие в просвете пузыря мелких плавающих включений. При остром холецистите стенки желчного пузыря становятся еще более утолщенными, вследствие отека появляется их много-контурность, в стенках возникают эхонегативные пространства. УЗИ позволяет также диагностировать такое осложнение острого холецистита, как эмпиема желчного пузыря, а также гангренозный и геморрагический холецистит, паравезикулярные инфильтраты и абсцессы. УЗИ дает возможность выявить деформации желчного пузыря (перетяжки, загибы, перегородки, многокамерные желчные пузыри и т. д.), поражение его злокачественной опухолью.
Одной из актуальных проблем современной гастроэнтерологии остается дифференциальный диагноз желтух. Нередко наблюдающееся сочетание печеночного и подпеченочного механизмов желтух обычно обусловливает сложную клиническую и биохимическую картину заболевания и нередко вводит врача в заблуждение. Ввиду высокой билиру-бинемии контрастное рентгенологическое исследование у таких больных невозможно, и до недавнего времени способами разграничения механической и паренхиматозной желтухи в таких ситуациях являлись ЭРПХГ, чрескожная чреспеченочная холеграфия. УЗИ обладает большой чувствительностью и высокой специфичностью при выявлении обтурации желчных протоков, так как с его помощью с высокой степенью достоверности удается определить ширину просвета внутри- и внепеченочных протоков. Наличие расширения позволяет судить о механическом препятствии для оттока желчи, причем даже на тех этапах, когда отсутствуют желтуха и другие клинические проявления (Hill et al., 1985; Chagnon et al., 1988).
УЗИ эффективно и в диагностике заболеваний печени. Так, при остром гепатите эхолокация демонстрирует увеличение печени, закругление контура, небольшое диффузное уплотнение структуры, хорошее проведение звука. При острых токсических гепатитах обнаруживают диффузную акустическую неоднородность печени уже в ранние периоды (5—12 сут.) после отравления. Выявлена закономерная зависимость степени плотности распределения отраженных сигналов на эхогепатограммах от тяжести клинической картины острого отравления. В случаях средней тяжести и тяжелых они бывают весьма выраженными и достигают III и IV степени. Через 6 мес. и более во время повторных ультразвуковых исследований эхогепатограммы демонстрируют
31. Расширенный общий желчный проток при желчнокаменной болезни.
множественные акустические неоднородности. Хроническому гепатиту при эхолокационном исследовании свойственны увеличение печени, округление контуров, хорошее проведение звука.
В случае хронических гепатитов имеют место 4 типа эхогепатограмм: 1) «безимпульсный»; 2) затухающий; 3) лентоподобный; 4) смешанный. Между ними обнаружены переходные формы.
«Безимпульсный» тип характерен для холестатической клинической формы хронического гепатита, но бывает и при персистирующем хроническом гепатите. Затухающий тип наблюдается преимущественно при персистирующей форме хронического гепатита, почти у ‘/г больных с агрессивной формой и менее чем у ’/з — с холестатическим хроническим гепатитом. У больных с лентоподобным типом эхогепатограмм наблюдается наличие однородных промежуточных сигналов между импульсами от передней и задней стенок печени. Это промежуточная форма эхогепато-
32. Кальцинат печени.
грамм между затухающим и смешанным типами, поскольку при мелкоочаговой неоднородности он напоминал затухающий, а при включениях средней величины на фоне мелкоочаговой неоднородности — смешанный тип. Лентоподобный тип встречается преимущественно при агрессивной форме хронического гепатита и только в единичных случаях — при персистирующей. Смешанный тип эхогепатограмм отражает выраженные патологические изменения в печени при агрессивном гепатите (его конечную фазу). Мелкоочаговая неоднородность в сочетании со средне-крупноочаговой и особенно сливной неоднородностью характеризует глубокие нарушения структуры печени и отражает в ряде случаев длительность и клинико-морфологическую форму заболевания.
При циррозе печени обнаруживают: увеличение печени, выпуклость вентрального контура, закругление нижнего края печени, уплотнение структуры, часто неравномерное распределение эха, отчетливое ослабление звука в печени, асцит, увеличение селезенки. Как известно, размеры печени варьируют. Если подозревается цирроз, необходимо дальнейшее исследование, чтобы определить
состояние воротных вен, а также выявить изменения, связанные с застойной спленомегалией, сочетающейся с портальной гипертензией. Наиболее грубые и обширные изменения ультразвуковой картины печени при постнекротическом циррозе (слабые изменения с образованием уширенных эхоимпульсов и отсутствием возможности получать отражения от задней стенки печени); обширность поражения типична в III—IV степени цирроза.
Для портального цирроза печени характерна мелкоочаговая акустическая неоднородность, тип эхогепатограмм приближается к лентоподобному. При включениях смешанного типа эхогепа-тограммы представляют собой только сочетание мелких и средних величин уплотненной ткани печени; в отличие от других морфологических типов циррозов нередко выявляется задняя стенка печени. В случае билиарного цирроза печени наблюдаются диффузные включения смешанного типа: на фоне мелкоочаговой неоднородности — в большом количестве среднеочаговые включения; эхосигнал от задней стенки печени снижается или отсутствует. Если цирроз смешанный, для ультразвуковой картины типичны многообразие акустических сигналов, их пестрота, различная интенсивность. Эхосигналы в большинстве случаев сливаются друг с другом. Наличие диффузных акустических неоднородностей различной величины и интенсивности, хаотичность их распределения и сливной характер отличают ультразвуковую картину печени при смешанном циррозе от эхогепатограмм других морфологических форм.
УЗИ абсцессов печени основана на обнаружении в ней полости с содержимым, несколько более эхогенным по сравнению с кистозной жидкостью, в котором могут определяться единичные точечные включения, свидетельствующие о присутствии в нем детрита. Мини-
33. Эхогепатограммы при метастазах: а — у ворот печени; б — у ее края.
мальные размеры абсцесса, при которых он может быть определен с помощью УЗИ,— 1,5 см и даже менее. Свежие абсцессы, очаги некроза с отсутствием гнойного расплавления тканей с помощью УЗИ не выявляются.
Чрезвычайно важной представляется роль УЗИ в диагностике эхинококковых кист печени. Проведение УЗИ в предоперационном периоде резко уменьшает вероятность рецидива эхинококкоза, нередко развивающегося при использовании других методов диагностики. Отмечены также хорошие диагностические результаты УЗИ в выявлении внутри-печеночных гематом и внутрипеченоч-ных билом (билиарных кист) после закрытых травм печени с возможностью динамического ультразвукового наблюдения за характером наступающих при этом изменений.
С помощью УЗИ в печени можно находить очаги гепатоцеллюлярного рака, диаметр которых может быть даже менее 2 см. Однако картина при этом не отличается специфичностью, в связи с чем необходимо морфологическое подтверждение диагноза. Большим разно
образием акустической картины характеризуются ангиосаркомы печени и ее метастатические поражения. Минимальный размер метастаза, который может быть определен при ультразвуковом исследовании — 8 мм.
Ткань поджелудочной железы по акустическим свойствам близка к тени паренхимы печени. Поскольку в ультразвуковом изображении ПЖ не имеет таких четких границ, как печень или почки, она является более сложным объектом для УЗИ. О размерах и контурах железы судят по взаимному расположению окружающих ее органов и других анатомических образований, в первую очередь артерий и вен, так называемых «сосудистых маркеров». Дополнительные трудности при исследовании этого органа часто возникают в связи с присутствием газа в желудке и кишечнике, которые находятся в тесном анатомическом контакте с ПЖ. Избежать помех в изображении ПЖ позволяют использование некоторых приемов (полипозиционное исследование, прием внутрь 400—800 мл жидкости) и предварительная подготовка больных с
применением очистительных клизм и фармакологических средств.
Изображение ПЖ получают при помощи продольного, поперечного и косого срезов вдоль продольной оси поджелудочной железы. ПЖ расположена ретроперитонеально, длина ее — 10— 15 см, масса 60—100 г. Хотя поджелудочная железа представляет собой ретроперитонеальную структуру, она может располагаться и близко к передней стенке на расстоянии 2,5 см от нее (у худых больных). Головка поджелудочной железы помещается в подкове 12-перстной кишки, а хвост достигает ворот селезенки вплоть до листков спленоренальной связки, где она становится интраперитонеальной структурой. Поперечное расположение ПЖ варьирует в широких пределах, и получение изображения ее по всей длине требует косого среза.
Для идентификации ПЖ необходимо визуализировать нормальную анатомию сосудов. Наиболее важные сосуды при идентификации поджелудочной железы — верхняя брыжеечная артерия и селезеночная вена.
Селезеночная вена расположена за телом и хвостом ПЖ и направлена к краю ее головки с достаточным постоянством, так что визуализация селезеночной вены создает уверенность в получении изображения поджелудочной железы. Селезеночная вена идентифицируется при поперечном сканировании и соединяется с верхней брыжеечной веной, образуя воротную вену, находящуюся кзади от спинки поджелудочной железы.
Верхняя брыжеечная артерия видна впереди аорты влево от верхней брыжеечной вены. На этом поперечном или косом срезе область поджелудочной железы видна как плотная эхогенная структура, в которой эхо имеет более высокую амплитуду, чем в окружающей печени. Поджелудочная железа видна вокруг перивертебральных структур,
включая верхние брыжеечные сосуды. Головка поджелудочной железы видна медиально, 12-перстная кишка часто содержит газ или секрет и заметна между ПЖ и желчным пузырем. Тело и хвост ПЖ идут вокруг превертебраль-ной области по направлению к воротам левой почки. Хвост левой почки часто лучше демонстрируется при помощи среза через левую почку; желудок растягивают водой для того, чтобы получить оптимальные контуры поджелудочной железы.
О размерах ПЖ лучше всего судить по продольному срезу. При продольном сканировании видно, что верхняя брыжеечная артерия начинается от передней части аорты. Сосудистое пространство между аортой и верхней брыжеечной артерией пересекается 12-перстной кишкой, левой почечной веной и изогнутой частью поджелудочной железы. При продольном сканировании ПЖ распознают как высокоэхогенную массу, поверхностную по отношению к верхним брыжеечным артериям и венам. Переднезадний размер поджелудочной железы в этом положении не превышает 2 см.
Эхогенность ПЖ относительно высо--ка, даже несколько больше, чем у нормальной печени. Однако получаемые данные варьируют в широких пределах, в частности, при сравнительном исследовании печени эхогенность ее может быть почти такой же, как у печени или несколько меньшей.
Перед телом ПЖ располагается левая доля печени. Эта структура помогает смещению содержащей газ кишки с поджелудочной железы, создавая акустическое окно.
Нормальная ПЖ хорошо смещается при дыхании и пальпации. Так как область ее хвоста практически всегда прикрыта воздухом, содержащимся в желудке, то в косом правом положении больного за состоянием области хвоста
железы можно наблюдать, ориентируясь на изменения селезенки. В качестве многостороннего, не наносящего вреда, не обременительного и хорошо репродуцируемого метод эхолокации ПЖ занимает прочное место.
При остром панкреатите УЗИ является наиболее предпочтительным видом инструментальной диагностики, поскольку применение инвазивных методов резко ограничено тяжестью состояния больного, а обычное рентгенологическое исследование желудка и 12-перстной кишки часто оказывается малоинформативным. Для острого панкреатита характерно увеличение размеров ПЖ и снижение ее эхогенности, что объясняется отеком органа. Подобные изменения, как правило, выявляются также в околоподжелудочной клетчатке. Нередко острый панкреатит сопровождается скоплением в сальниковой сумке экссудата, который может быть выявлен при УЗИ.
Особенно ценное качество УЗИ — возможность динамического наблюдения за течением острого панкреатита, которое позволяет диагностировать одно из осложнений этого заболевания — образование кист поджелудочной железы. УЗИ наиболее предпочтительно, поскольку ретроградная панкреатохо-лангиография таким больным противопоказана из-за угрозы панкреонекроза, а возможности других методов исследования, может быть за исключением КТ, явно меньше.
УЗД хронического панкреатита основана на изменениях размеров и контуров ПЖ, общем повышении ее эхогенности, выявлении характерной гетерогенности с островками ярких эхосигна-лов. Несмотря на некоторые объективные трудности (эхогенность поджелудочной железы увеличивается и в норме с возрастом исследуемого, иногда при хроническом панкреатите ультразвуковая картина может оставаться неизмен-
34. Эхосканограмма при остром панкреатите.
ной), всесторонняя оценка данных УЗЕ как правило, позволяет достаточно дс-стоверно распознавать это заболевание
В. М. Махова и соавт. (1983) доказе ли высокую диагностическую ценност; УЗИ при алкогольных панкреатитах выявляемых уже на ранних стадия: развития. На основании степени изме нения ультразвуковой картины при хр<-ническом панкреатите можно предположить возможность нарушения функциг эндокринной части ПЖ. У одних и те:: же больных хроническим панкреатитох эти авторы сопоставляли результать УЗИ и ЭРПХГ. Оказалось, что с п< мощью УЗИ удается получить весьма точную информацию о степени фиброз; железы, а при ЭРПХГ — о ее протоковой системе.
С целью дифференциальной диагностики индуративного панкреатита и опухолей поджелудочной железы, оказь-вающейся иногда чрезвычайно затруднительной даже с учетом данны: ЭРПХГ, ангиографии и цитологической исследования. В. Г. Смагин и соавт (1983) предложили тест с лазиксом В выполнении теста основная рол. принадлежит УЗИ подозрительного нс наличие патологии участка железы д« и после введения препарата. При воспг
лительной природе изменений ультразвуковая картина непостоянна — очаг поражения становится меньше.
Широко обсуждаются возможности УЗИ в диагностике рака ПЖ. По утверждениям одних исследователей, УЗИ настолько информативно при этой патологии (чувствительность метода — 94 %, специфичность — 99 %), что способно полностью заменить все прочие диагностические исследования. Другие специалисты отдают предпочтение ЭРПХГ, КТ, ангиографии. Очевидно, в тех случаях, когда речь идет о больших неоперабельных опухолях поджелудочной железы, УЗИ позволяет получить исчерпывающую диагностическую информацию. В то же время стремление к раннему выявлению заболевания в той стадии, когда опухоль может быть резецирована, приводит к признанию необходимости обследовать больных комплексно с применением УЗИ (как первичного метода), КТ, ЭРПХГ (для уточнения диагноза), ангиографии (для оценки возможности проведения операции), чрескожной биопсии с последующим цитологическим исследованием. По мнению I. Ariyama (1983), комплексная диагностика дает возможность выявить опухоли поджелудочной железы размером менее 3 см (т. е. резекта-бельные) в 100 % случаев.
Типичный признак карциномы поджелудочной железы — ее увеличение, в 75 % случаев — в области головки. Величина опухоли значительно колеблется в зависимости от скорости роста и стадии заболевания. Самая маленькая карцинома поджелудочной железы при эхографическом исследовании имеет размеры 2X3 см. В краниокаудальном направлении карцинома расширяется более значительно, чем в дорсовентраль-ном, так что распространение процесса по продольному срезу выражено в большей мере, чем по поперечному.
Форма ПЖ при поражении карцино
мой многообразна. Как правило, она угловатая или шишкообразная, бывает и кругло-овальная. Контуры железы полициклические или с остроконечными выступами. Иногда выступы принимают форму псевдоподий. При динамическом эхографическом наблюдении можно определить рост опухоли. Внутренняя структура карцином поджелудочной железы при эхолокационном исследовании в соответствии с тканевым составом неоднородна.
У большинства больных определяется структура, лишенная отражения или со слабым отражением, что связывают с наличием опухолевой ткани. У других больных находят рыхлое, умеренно плотное расположение внутренних отражений с неравномерным распределением. Отражения имеют различную величину, что создает неспокойную картину: отграничение от окружающих тканей подтверждает диагноз опухоли. Непрямые признаки опухоли могут быть получены при исследовании соседних органов (признак Курвуазье, застой во внутрипеченочных желчных путях, метастазы в печень, вдавление в области нижней поверхности печени, нижней полой вены и брюшной аорты).
Из непрямых признаков особое значение имеют результаты динамических наблюдений, проводимых при помощи аппаратуры, которая позволяет получать быстрое изображение. Так, почти у всех больных раком ПЖ отсутствует подвижность ее при дыхании и пальпации, имеет место пальпаторная резистентность и в '/з случаев — болезненность. Остальные критерии проявляются при экспансивном и инфильтрирующем росте: смещение крупных сосудов (полая, селезеночная, воротная вены), вдавление дорсальной поверхности печени при сращении с ней опухоли, оттеснение печени вверх, стеноз выхода из желудка, смещение желудка и 12-перстной кишки.
35. Эхопанкрсатограммы при раке:
а — головки; б — хвоста поджелудочной железы.
Особое значение приобретает престе-нотическое расширение общего желчного протока с застоем в желчном пузыре или без него. Застойный общий желчный проток диагностируется на основании характерного расположения его по отношению к воротной вене. Оба образования представлены (при косом срезе параллельно левой реберной дуге) в виде темных лент, окаймленных двумя сильными полосами отражений. Общий желчный проток располагается несколько каудальнее и вентральнее воротной вены. Если проследить его ход влево, он прерывается на уровне луковицы 12-перстной кишки, в то время как воротная вена непрерывно связана с селезеночной. По расширению панкреатических протоков определяют локализацию пораженной головки ПЖ, оно может быть единственным признаком у больных с малой карциномой желчных протоков или фатерова соска. Это дает возможность ранней диагностики неоплазмы (до того как она, достигая соответствующих размеров, изменяет контур железы).
Рано метастазирующая карцинома ПЖ диагностируется и по метастазам в печени при помощи ультразвука. Метастазы в печени видны как круглые
очаги, лишенные отражений или с небольшим отражением. Эхолокационно эти очаги обнаруживаются при поперечнике от 1,5 см и выше. Диффузное метастазирование труднее диагностируется, оно вызывает неспокойную, разбрызганную или пеструю картину.
Если одновременно имеет место внут-рипеченочное расширение желчных путей, то распознать печеночные метастазы едва ли возможно. Круговые опухоли ПЖ в благоприятных условиях исследования определяются эхографически при поперечнике 2 см. Однако ранняя диагностика опухолей ПЖ, локализующихся в ее теле и хвосте, остается неудовлетворительной. Направляемая ультразвуком пункция тонкой иглой с цитологической оценкой аспирационного материала может улучшить диагностику. При эхолокационном исследовании невозможно различить первичные и вторичные карциномы в области головки ПЖ.
Инсуломы диагностируются в том случае, если их величина превышает 2 см. Опухоль имеет не везде четкие границы со слегка негомогенной структурой, так что при одном эхолокационном исследовании можно поставить диагноз солидной опухоли тела ПЖ.
36. Рак головки поджелудочной железы, резко расширенный общий желчный проток.
Дифференциальный диагноз карцином ПЖ связан с рядом трудностей, в первую очередь с тем, что нет достоверных признаков для определения злокачественного объемного процесса. Дифференцировать маленькие карциномы при эхоскопии и эхотомографии нет возможности. Помочь диагностике может направленная ультразвуком биопсия. Нередко эхолокационно трудно дифференцировать доброкачественное и злокачественное увеличение ткани ПЖ (карцинома и хронический панкреатит). Кроме того, многие карциномы ПЖ окружены фокальным панкреатитом. По мнению G. Bettenmaier, дифференциальный диагноз хронического панкреатита и карциномы ПЖ — наиболее трудная проблема, решаемая эхолокационно.
Кистозные изменения имеют круглую, овальную, гладко отграниченную форму, структура лишена отражений и является источником светлой зоны. Это характерное «усиление звука» нередко не замечается при кистах, наполненных кровью, гноем или некротизирующимися полостями. Гнойные жидкости могут быть неплотной или средней плотности структуры и прибли
жаться к солидной ткани. От злокачественного поражения ПЖ помогает отличить их динамическое наблюдение.
Большими диагностическими возможностями обладает эндоскопическое ультразвуковое исследование, или эндоскопическая ультрасонография. Одно из перспективных направлений развития метода — изучение внутристеночных структур пищеварительного тракта и органов, прилегающих к нему. При ЭУЗИ УЗ-датчик, установленный на дистальном конце фиброэндоскопа, подводится к изучаемому отделу или органу, что позволяет значительно повысить разрешающую способность УЗИ.
В современных моделях эхоэндоско-пов используются аппараты с торцевой, косой и боковой оптикой, снабженные встроенными в дистальный конец кон-вексными, линейными, секторными механическими и электронными датчиками с частотой от 2,5 до 10 Мгц. Глубина зондирования колеблется от 5 до 15 см, а разрешающая способность датчиков достигает 0,2 см.
Перед исследованием больному назначают премедикацию атропином и седативными препаратами. К местной анестезии иногда не прибегают из-за опасности аспирации жидкости во время исследования. В ряде случаев во время процедуры вводят препараты, подавляющие моторику пищеварительного тракта. УЗИ осуществляется путем контакта датчика с поверхностью слизистой оболочки органа, через заполненный баллон на дистальном конце эндоскопа, а также в предварительно введенной деаэрированной воде. Для улучшения качества УЗ-изображения перед исследованием предлагают прием через рот масляной эмульсии. Накоплен опыт ЭУЗИ пищевода, желудка, 12-перстной, прямой и толстой кишок. При исследовании верхнего отдела пищеварительного тракта с помощью ЭУЗИ можно изучать стенки пищевода, желудка и
12-перстной кишки, левые отделы сердца, дугу и нисходящий отдел аорты, перикард, левую почку, поджелудочную железу, селезенку, селезеночную вену, нижнюю полую вену, воротную вену, крупные ветви брюшного отдела аорты и брыжеечные сосуды, селезеночный угол толстой кишки, прилегающие к желудку и 12-перстной кишке отделы печени, внепеченочные желчевыводящие протоки, желчный пузырь, фатеров сосок. УЗ-изображение может выводиться на телемонитор, фиксироваться на видеокассете, фотопленке. Многие авторы считают, что проведение ЭУЗИ должны обеспечивать 2 специалиста — по УЗ-диагностике и эндоскопист.
ЭУЗИ — уникальная диагностическая процедура, дающая возможность детально изучить строение стенки пищеварительного тракта в норме и при патологии. Экспериментально установлено соответствие УЗ-изображения стенок пищевода, желудка, 12-перстной и толстой кишки и их гистологического строения. Гастроинтестинальная стенка состоит из 5 слоев: слизистого, мышечной пластинки, слизистого, подслизистого, мышечного и серозы (адвенти-ции). На УЗ-картине также определяются 5 слоев. Однако вопрос о полном соответствии каждого слоя гастроинтестинальной стенки УЗ-изображению окончательно не решен.
R. Lambert, J. С. Souquet, Р. J. Valette (1988) отмечают высокую диагностическую эффективность ЭУЗИ в выявлении .опухолей пищеварительного тракта. ЭУЗИ позволяет с большой точностью определить площадь и глубину распространения опухоли в стенке органа и даже вовлеченность в процесс каждого из ее слоев, установить характер опухолевого роста, прорастание в соседние органы, выявляет лимфоузлы размером более 0,5 см. Она способна определить метастатический или воспалительный характер увеличения лимфоузла; одна-
37. Эхопанкреатограмма при кисте головки и тела поджелудочной железы.
ко еще не разработаны критерии обнаружения в них микрометастазов. Существуют трудности в оценке новообразований при стенозах органа, не позволяющие исследовать опухоль на всем протяжении. С этой целью при стенозирующих опухолях пищевода, желудка и прямой кишки предлагают проводить ЭУЗИ после эндоскопической лазерной реканализации, восстанавливающей прохождение в этих зонах.
ЭУЗИ начинает занимать ведущее положение в диагностике эзофагеаль-ных и периэзофагеальных новообразований, в ряде случаев опережая КТ. Опухоли пищевода определяются как локальное утолщение стенки с прерыванием ее эхослоев. Точно устанавливаются распространенность опухоли в стенке пищевода, прорастание аорты, трахеи, перикарда, наличие и локализация пораженных лимфоузлов, что служит важным критерием операбельности. Методика позволяет уточнить наличие ахалазии пищевода, интра-и зкстрамуральных опухолей, варикозных узлов, выявить другие поражения, вызывающие стеноз или деформацию
стенок пищевода. Установлено утолщение стенки пищевода у больных с эзофагитом, ахалазией кардии, язвой пищевода, эзофагоспазмом (в основном за счет мышечного и подслизистого слоев). ЭУЗИ является точным методом оценки состояния варикозных вен пищевода до и после эндоскопической склеротерапии или шунтирующих операций по этому поводу. Имеются сообщения о чреспищеводной двухмерной цветной допплеровской УЗИ, определяющей гемодинамику варикозных вен пищевода и восходящих коллатералей при портальной гипертензии.
ЭУЗИ точнее других методов позволяет оценивать стадию и определять операбельность опухолей желудка, выявляя площадь патологии и вовлечение в процесс отдельных слоев стенки желудка, поражение региональных лимфоузлов, прорастание в соседние органы, крупные сосуды (аорту, чревный ствол, печеночную артерию, воротную вену), в печеночно-дуоденальную связку, инфильтрацию малой кривизны желудка, метастазы и микрометастазы в поджелудочной железе и печени. На эхограммах рак желудка определяется как негомогенное гипоэхогенное образование. По проникновению опухоли в мышечный слой дифференцируют ранний рак желудка от растущего, что дает возможность использовать в качестве метода лечения эндоскопическую лазерную фото коагуляцию с последующей оценкой ее эффективности с помощью ЭУЗИ.
Вызывают интерес успехи ЭУЗИ в ранней диагностике лимфом желудка, определении их операбельности и оценке эффективности химио- и радиотерапии. (КТ не обладает подобной разрешающей способностью, а эндоскопия с биопсией часто нерезультативна вследствие подслизистого расположения опухоли.) С помощью ЭУЗИ возможно дифференцировать болезнь Менетрие, опухолевую инфильтрацию стенки и
варикозных вен желудка. Благодаря ЭУЗИ выявлено нарушение структуры желудочной стенки в области язвенного дефекта: язвенный кратер в ряде случаев доходит до мышечного слоя, утолщение стенок вследствие воспаления достигает 14 мм. Учитывая, что пе-риульцерозный отек часто невозможно отличить от диффузного подслизистого рака, рекомендуют в сомнительных случаях проводить контроль ЭУЗИ в процессе противоязвенного лечения. Новая методика позволяет дифференцировать интрамуральные и внешние причины деформаций желудка и 12-перстной кишки, определить их характер.
ЭУЗИ применяется и при заболеваниях ободочной и прямой кишок. Отмечена большая, чем при трансректальном УЗИ, точность в определении раннего рака, размеров и инвазии опухоли, поражения ближайших лимфоузлов, в дифференциальном диагнозе интра- и эк-страмуральных образований кишечной стенки. Это обусловлено большей разрешающей способностью эхоэндоскопа. Важное преимущество ЭУЗИ — возможность исследовать не только прямую, но и ободочную кишки. В то же время жесткий датчик, применяющийся для трансректального УЗИ, более эффективен в диагностике параректальных заболеваний вследствие более глубокого УЗ-зондирования.
Перед обычной УЗ-диагностикой, КТ, ЭРПХГ и ангиографией ЭУЗИ имеет определенные преимущества при диагностике заболеваний поджелудочной железы, особенно при выявлении малых опухолей размером менее 20 мм. Рак ПЖ на УЗ-картине характеризуется неоднородной внутренней структурой, неровностью границ. При этом можно установить размер опухоли, прорастание в соседние органы и ткани, брыжеечные артерии и чревный ствол, увеличенные лимфоузлы. К косвенным признакам относят компрессию и дила
тацию панкреатического протока, реже — общего желчного протока. С помощью ЭУЗИ выявляют также гастриному, инсулому, метастазы в ПЖ и др. ЭУЗИ улучшает распознавание хронического панкреатита. На эхограммах выявляются прежде описанные только патологоанатомически околопротоко-вый фиброз, расширение протоков и воспаление долек, мелкие кальцифика-ты и псевдокисты, другие признаки хронического панкреатита. Хорошо визуализируются и кисты ПЖ. Однако пока не определены надежные признаки, позволяющие отличить рак ПЖ от хронического панкреатита.
В ряде случаев ЭУЗИ предпочтительнее УЗИ, КТ и ангиографии в диагностике заболеваний билиарного, или желчного, тракта. Новая методика способствует выявлению опухолей размером менее 3 мм во внепеченочных желчевыводящих путях, уточняет распространение опухоли в окружающие ткани, ее размеры, вовлеченность региональных лимфоузлов, прорастание сосудов, внутрипротоковую инвазию. Присутствие билиарных искажает данные выявляются камни
протока. ЭУЗИ позволяет не только установить и адекватно оценить характер опухолевого поражения фатерова соска, но и провести дифференциальный диагноз с обтурирующим канал соска камнем, что часто невыполнимо с помощью других методов исследования.
Параллельно с развитием эхоэндоско-па разрабатывались УЗ-зонды, свободно вводимые через биопсийный канал стандартного эндоскопа. Это обеспечивает более гибкое использование различных моделей эндоскопов и зондов с неодинаковыми частотами. Однако при этом несколько уменьшается глубина УЗ-зондирования. Ультразвуковыми УЗ-зондами диагностируются кисты даже очень маленьких размеров, уплотнения
эндопротезов не метода. Хорошо общего желчного
паренхимы, мелкие конкременты в протоках поджелудочной железы, камни, стенозы, опухоли желчных прдтоков и желчного пузыря, опухоли желудка и пищевода, уточняются возможность и объем хирургического вмешательства при этой патологии. С помощью одномерной допплерографии можно определить простые изъязвления типа Дъела-фуа в желудке и толстой кишке у больных с повторными желудочно-кишечными кровотечениями неясного генеза. Эндоскопическая допплерография используется также для определения риска повторного массивного кровотечения из пептических язв. При этом УЗ-зон-дом выявляют артерии в дне язвы, по соотношению продвижения зонда и затухания сигнала косвенно определяют глубину расположения сосуда.
С помощью допплеровских зондов удается определить наличие кровеносного сосуда ниже опухоли при паллиативном эндоскопическом лечении, а также риск повреждения артерии при эндоскопической папиллосфинктерото-мии, исследуя большой сосочек 12-перстной кишки со стороны кишки и внутри его канала. УЗ-зонд дает двухмерное изображение в серой шкале с разрешающей способностью 0,3 мм при глубине исследования 2—3 см. Высказывается соображение, что диагностика поражений стенки пищеварительного тракта более эффективна УЗ-зон дом, а соседних органов — с помощью эхоэндоско-па. С усовершенствованием технических характеристик эхоэндоскопов, оборудованием в них каналов для прицельной-щипцовой и пункционной биопсии диагностическая ценность метода еще более возрастает.
Магнитно-резонансная томография
Внедрение в практику медицинских исследований метода МРТ (или ЯМР) — крупное достижение современной науки
и техники. Впервые явление ЯМР открыто в 1946 г. F. Bloch и одновременно Е. Purcell с соавт. в твердых телах. Практическое применение метода МРТ в биологии и медицине стало возможным лишь в 1971 — 1973 гг. после публикации работ R. Damadian (1971) и особенно Р. Lauterbur (1973).
МРТ можно рассматривать как неразрушающий метод химического анализа, позволяющий наблюдать за процессами обмена веществ и производить дифференциальную диагностику по данным об изменении характера химических связей. Сущность явления основана на возможности изменять реакцию ядер водорода (Н), находящихся преимущественно в тканевой жидкости или жировой ткани, в ответ на применение радиочастотных импульсов в стабильном магнитном поле. Ядро атома водорода обладает положительным зарядом, а при наличии нечетного числа протонов или нейтронов — также собственным внутренним моментом количества движения или ядерно-магнитного спина. В результате каждый атом подобен небольшому магниту.
В нормальных условиях атомы расположены хаотично, но при помещении биологического объекта в достаточно сильное магнитное поле (0,35—1,5 Т) атомы ориентируются либо по направлению магнитного поля (параллельно), либо в противоположном направлении (антипараллельно). При этом возникают два энергетических уровня с определенной разницей в величине энергии. Если на данное магнитное поле наложить радиочастотное поле (6,6— 15 Мгц), то возникает явление ЯМР, поскольку ядра будут быстро переходить с одного электрического уровня на другой, в частности, при антипарал-лельном движении отмечается поглощение кванта энергии, а при параллельном движении — выделение его. Поглощенная энергия, зарегистрированная элек
тротехническими средствами, является ЯМР-сигналом. Причем резонансная частота его зависит от характера радиочастотного импульса. Это позволяет получить ЯМ-спектр исследуемой ткани. После снятия радиочастотного сигнала энергетическое равновесие между двумя уровнями восстанавливается. Это ведет к появлению электродвижущей силы, которая также может быть зарегистрирована. Данный процесс называется релаксацией, причем различают спин-решетчатую, или продольную (Т1), и спин-спиновую, или поперечную (Т2), релаксацию.
Таким образом, основными параметрами, с помощью которых проводится визуализация объекта, являются протонная плотность (р) тканей и показатели Т1 и Т2. После математической обработки полученного сигнала с помощью преобразований Фурье можно воспроизвести изображение объекта, используя аналоговый компьютер на экране дисплея. В практике наибольшее значение имеют показатели Т1 и Т2, поскольку они варьируют в гораздо большей степени, чем протонная плотность вещества. В практику внедрен ряд типов аппаратов МРТ для исследования головы и всего тела. Наибольшее распространение получили 3 варианта ЯМР-исследования: восстановление — насыщение, или Saturation recovery (SR), инверсионное восстановление, или Inversion recovery (IR), и спин-зхо, или Spin-echo (SE). Вариант SR в основном позволяет судить о протонной плотности объекта; вариант IR основан главным образом на учете показателя Tl, a SE — на учете показателя Т2. Существенное значение в практике имеют такие параметры исследования, как TR (время повторения радиосигнала) . Эта величина колеблется от 0,5 до 2 с; ТЕ (время задержки эхо-сигнала в миллисекундах) — от 28 до 160 мс, чаще всего 28—56 мс; Т1 (время за-
38. Магнитно-резонансная томография живота (варианты а, б, в,).
держки инверсии магнитного поля) — от 20 до 400 мс. Во время проведения исследований каких-либо серьезных осложнений при использовании метода не выявлено.
Особенность МРТ-изображения — его зависимость от способа получения ЯМР-сигнала и величин параметров TR, ТЕ и Т1. Это дает возможность использовать большое количество комбинаций условий исследования и проводить дифференциальный диагноз различных
заболеваний. Изучение таких показателей, как р, Т1 и Т2, для различных органов и тканей показало, что наименьшая величина Т1 характерна для жира (140 мс), наибольшая — для жидкости (2000 мс). Для показателя Т2 эти величины составляют 70—400 мс, для опухолевой ткани Т1 и Т2 в среднем 800 и 200 мс. В результате самый яркий сигнал дает жир, обладающий наибольшей протонной плотностью, а наименьший сигнал — костная ткань. По мере нарастания количества жидкости в объекте значительно увеличивался показатель Т1 и изображение становилось более темным.
В соответствии с распределением контрастности и яркости ЯМР-изобра-жения по градациям оттенков так называемой «серой шкалы» жировая ткань на томограммах представляется белой, несколько темнее — головной и спинной мозг, паренхиматозные органы, сосудистые стенки, мышцы. Воздух, кости и кальцификаты практически не дают ЯМР-сигнала и поэтому отображаются темным цветом. Соответственно этому цвет легочной паренхимы и просвета кишечника близок к черному. Полости, содержащие жидкость, имеют низкую плотность.
Разработаны специальные таблицы значений Т1 для органов и тканей в норме, а также при некоторых патологических изменениях. В определенных случаях это позволяет проводить дифференциальную диагностику.
Большинство авторов при исследовании внутренних органов используют вариант SE, основанный на определении показателя Т2. ДополнителыЛями служат варианты IR и SR. Исследование печени как наиболее крупного объекта в брюшной полости, содержащего много воды, является благоприятной областью применения метода МРТ. При использовании МРТ хорошо видны не только* паренхима печени, но и сосуды, особенно портальная система, благодаря низкой интенсивности ЯМР-сигнала движущейся в сосудах крови. В случае патологических изменений в печени показатели Т1 и Т2 обычно увеличиваются, за исключением гемохроматоза, при котором показатель Т1 уменьшен, в то же время этот показатель более вариабелен, чем Т2. Метод МРТ лучше, чем КТ, дифференцирует патологические изменения паренхимы печени, в частности отличает гепатит от жировой инфильтрации печени. Отчетливо видны размеры и конфигурация органа при циррозе. Использование варианта SE позволяет не только диагностировать опухоль (гепатому), но и судить о ее внутренней структуре, характере контуров и взаимоотношении с крупными сосудами печени. Если новообразование первичное, величина Т1 возрастает, в результате опухоль представляется в виде темного участка, метастазы в печень могут выявляться в виде очагов увеличенной (SE) или низкой (IR) плотности. Особенно хорошо видны метастазы рака кишки, пищевода и карциноидной опухоли. Метод МРТ применяется и для исследования желчного пузыря. Интенсивность ЯМР-сигнала зависит от состава камней, обычно
лучше выявляются конкременты с повышенным содержанием холестерина. Рост концентрации желчи ведет к укорочению показателя Т2, а уменьшение концентрации — к увеличению этого показателя, что позволяет судить о функции желчного пузыря.
В диагностике заболеваний поджелудочной железы метод МРТ распространен менее, чем при поражении печени, из-за особенностей строения ПЖ. Методом МРТ в большинстве случаев можно выявить часть или всю ПЖ. При этом МРТ дает лучшие результаты, чем УЗИ, поскольку газ в кишечнике не мешает проведению МРТ. Высокие результаты получены в диагностике кист и абсцессов ПЖ, а также скоплений асцита, при которых величина Т1 достигала 800—1000 мс. Новообразование выявляют по критериям, которые применяются в практике КТ, включая увеличение и нечеткость контуров органа, причем величина Т1 доходила до 961+461, а Т2 — до 65 + 17 мс. Отчетливо были видны островково клеточные опухоли ПЖ из-за значительного удлинения показателя Т2. Большим преимуществом метода МРТ является то, что он лучше, чем КТ, обнаруживает прорастание новообразованием сосудов ПЖ, а также экстрапанкреатическое распространение патологического процесса, включая обструкцию желчных путей, инвазию почки и метастазы в печень. Этот метод имеет определенные преимущества также при выявлении распространения воспалительного процесса из ПЖ в окружающие ткани и сдавления панкреатического протока с образованием вторичных кист. Однако в то же время не были обнаружены мелкие кальцинаты в тканях органа.
Таким образом, МРТ имеет большие возможности в диагностике многих заболеваний органов пищеварения, в первую очередь печени и поджелудочной железы.
Тепловидение
Тепловидение (термография, инфраскопия) — метод регистрации инфракрасного излучения от поверхности тела человека, используемый в целях диагностики различных заболеваний и патологических состояний по изменению температуры тела в определенных его зонах. Известно, что воспалительные процессы сопровождаются повышением температуры в зоне поражения тканей. В опухолевой ткани также усиливается обмен веществ и повышается температура. Вот эти свойства и используются в распознавании болезней.
Наличие патологического процесса проявляется одним из трех качественных термографических признаков: появлением аномальных зон гипертермии или гипотермии, нарушением нормальной термотопографии сосудистого рисунка, а также изменением такого количественного признака, как градиент температуры в исследуемой зоне. Можно регистрировать разницу температур в 0,1 °C на расстоянии 1 мм.
Принцип тепловидения заключается в улавливании на расстоянии с помощью специальных оптических систем инфракрасных лучей, излучаемых человеческим телом, и превращении их в электрические сигналы в виде изображения на экране электронно-лучевой трубки или фиксации на специальной бумаге. Эти изображения представляют собой температурный рельеф поверхности тела со всеми его особенностями и оттенками, обусловленными физиологическими и патологическими процессами, протекающими в глубине органов и тканей человека. Метод безвреден для больного и персонала, отличается простотой при регистрации получаемой информации.
Тепловидение впервые применил в медицине в 1956 г. канадский врач Р. Лоусон (R. N. Lowson) для диагнос
тики заболеваний молочных желез. В нашей стране в 1962 г. это осуществили М. М. Мирошников и М. А. Собакин.
Воспринимают и регистрируют тепловое излучение тела в невидимой инфракрасной области спектра специальные медицинские диагностические приборы — тепловизоры (термографы), работающие по принципу оптико-механического сканирования. Основным элементом тепловизора является высокочувствительный приемник инфракрасного излучения, который улавливает энергию внутри малого телесного угла, называемого мгновенным полем зрения прибора. Благодаря перемещению при сканировании мгновенного поля зрения в пространстве осуществляется последовательный анализ общего поля зрения. Если это поле имеет неоднородную структуру, то величина потока излучения, падающего на приемник при данном положении мгновенного поля зрения, изменяется. Это изменение преобразуется приемником в электрический сигнал, который усиливается и воспроизводится на экране дисплея в виде черно-белого или цветного изображения — термограммы.
Наиболее важные технические характеристики тепловизора: пороговая чувствительность, характеризующая минимальный перепад температур объекта, различимый на экране дисплея; угловая разрешающая способность, определяющая возможность раздельного наблюдения и идентификации формы небольших объектов, быстродействие (время формирования одного кадра изображения) .
Основным типом тепловизора является «Рубин» («Рубин-1», «Рубин-2», «Рубин-3», или «Факел»). На базе тепловизора типа «Рубин» создан комплекс «Тепловизор-ЭВМ», комплекс «Гамма-11». Для наблюдения и контроля нестационарных и быстро меняю
щихся тепловых полей, а также экс-пресс-диагностики при массовых осмотрах людей имеются быстродействующие тепловизоры типа «Янтарь», ТВ-03 (БТВ, БТВ-1) и его модификация ТВ-ОЗЦФ, АТП-12М и др. Используется также тепловизионная аппаратура зарубежных стран: термографы Барнса и спектротерм-800 (США), тепловизоры шведской фирмы «Ага», термоскан и пироскан Смита (Англия), ИР 815 ЦСФ (Франция), инфра-Ай 103 Фудзицу и термовьюэр МБ Джеол (Япония) и др.
Основные задачи клинической термодиагностики — распознавание той или иной болезни по ее термографической семиотике, разработка алгоритмов сочетания термографии с другими методами диагностики, определение показаний к термографическому исследованию. С помощью тепловидения диагноз не ставят, тепловидение служит лишь для измерения физической величины — температуры на поверхности тела. Термограмма должна расшифровываться с учетом данных анамнеза, клинических и лабораторных показателей, полученных в соответствии с диагностическим алгоритмом (Розенфельд, 1989).
При проведении тепловизионных исследований больных в процедурной и смежных с ней комнатах создается нормированный микроклимат. Это обеспечивается с помощью автономного кондиционера, который производит 5— 6-кратную смену объема воздуха рабочего помещения в течение часа при отсутствии сильных воздушных потоков. Во время термографии в процедурной устанавливаются постоянные температура (+ 22,5 ± 1,0 °C) и влажность (60±5 %) воздуха. Контроль за температурным режимом в процедурной осуществляется периодически в течение рабочей смены.
Перед проведением термографии тело больного полностью или частично (исследуемая область) обнажают, и в таком
виде происходит адаптация его к температуре окружающей среды. У большинства обследуемых тепловое равновесие между человеком и окружающей средой наступает через 15—20 мин, в основном за счет физической терморегуляции. В дальнейшем незначительные отклонения температуры не оказывают существенного влияния на термографическую картину и величину радиационной температуры. Следует отметить, что после адаптационного периода визуально на термограммах более четко выделяются очаги температурной аномалии за счет стабилизации тепловых процессов кожного покрова.
При подготовке к тепловизионному исследованию в период адаптации используется естественное воздушное охлаждение тела человека, после чего производится регистрация ИК-излуче-ния определенных его областей.
Термографическое исследование больных с заболеваниями органов брюшной полости осуществляют обычно натощак, т. е. через 6—10 ч после приема пищи, что сводит к минимуму экзотермический фон, обусловленный процессами пищеварения. В тех случаях, когда для лечения местно применяется холод, например больным с острым панкреатитом, обследование в первые сутки после поступления не проводится. Ведь даже при кратковременном (в течение нескольких минут) применении пузыря со льдом на передней брюшной стенке возникают изменения в структуре термографического рисунка, которые могут привести к ошибочной трактовке термограмм. Непосредственно перед исследованием больным не вводят сосудорасширяющих и сосудосуживающих препаратов, не назначают кварц, УВЧ, массаж, горчичники, так как они приводят к нарушению теплового излучения в исследуемых областях.
При тепловизионном исследовании большое значение придается положению
тела обследуемого, т. е. укладке больного: она существенно влияет на правильность последующей интерпретации термограмм. В случае заболеваний органов брюшной полости применяют различные укладки: лежа на спине, лежа на боку (левом и правом), лежа на четверть или половину поворота влево или вправо.
После установления стабильного режима работы тепловизора и адаптации больного производится тепловизионное исследование, которое состоит из двух этапов: а) записи термограмм — регистрации теплового излучения определенных областей тела человека на ЭХЕ (прибор работает в режиме сканирования) ; б) измерения радиационной температуры исследуемых областей (прибор работает в режиме радиометрии). Первоначально записывают полутоновые термограммы с постепенным повышением уровня компенсации сигнала от низких температурных значений уровней, позволяющих получить контуры исследуемого объекта, до более высоких, при которых на термограммах регистрируются наиболее высокотемпературные зоны. Различные по величине сигналы, пропорциональные интенсивности ИК-излучения, регистрируют на термограмме в виде темных и светлых очагов, что соответствует более низкой или более высокой температуре кожного покрова тела человека. Последующие термограммы записывают при большем электронном усилении сигнала. Поэтому получаются более контрастные тепловизионные изображения, на которых четко выделяются изотермические зоны повышенного ИК-излучения. Полутоновые и контрастные термограммы записывают при постепенном увеличении значения (уровня) компенсации напряжения. Соответствующий подбор компенсации напряжения на термограммах дает возможность наблюдать целую серию тепловых изображений живота на
различных температурных уровнях, что позволяет врачу получать необходимую информацию о тепловом излучении и его изменениях в случае различных патологических процессов в брюшной полости.
Теплограмма передней брюшнойстен-ки здорового человека имеет пятнистый рисунок, выраженность которого зависит от толщины подкожного жирового слоя, пола и возраста человека. Она носит индивидуальный характер и воспроизводится с точностью. Термоасимметрия регистрируется при желчекаменной болезни, холецистите, гепатите, циррозе печени и других заболеваниях. Формы и размеры участков гипертермии не зависят от нозологической единицы болезни, а соответствуют области наиболее проявляющихся патологических изменений, выраженных градиентами температуры в исследуемой зоне. Например, хронический воспалительный процесс вызывает изменение величин градиента температур между зоной поражения и окружающими тканями до 0,7—1 °C, острый — до 1 — 1,5, гнойно-деструктивный — 1,5—2 °C и т. д.
Возможности'применения тепловидения в гастроэнтерологии изучены еще недостаточно. Это обусловлено трудностями интерпретации термограмм брюшной полости как в норме, так и при патологии. Особо эффективна термодиагностика в случае острой патологии органов брюшной полости. Так, острый холецистит у 85—90 % больных в области правого подреберья дает зону гипертермии, которая в 10—15 % наблюдений может распространяться на надчревную, чревную и пупочную области, что чаще наблюдается при осложненных формах холецистита. Имеется зависимость между размерами зоны гипертермии и тяжестью воспалительного процесса. К примеру, при катаральном холецистите площадь гипертер
мии составляет 200—250 см2, а при деструктивных формах она возрастает до 350 см2. Выраженность гипертермии также прямо зависит от активности воспалительного процесса. Достоверность исследования возрастает при его сочетании с УЗИ, которое дает объективную информацию о структурных изменениях желчного пузыря. Термография используется и для динамического наблюдения за ходом лечения больных острым холециститом. Стихание воспалительного процесса в желчном пузыре под влиянием консервативной терапии проявляется уменьшением зоны гипертермии, превращением ее из гомогенной в гетерогенную.
Абсцесс печени проявляется зоной гипертермии с четкими границами в проекции гнойника. Размеры этой зоны и интенсивность излучения зависят от величины абсцесса.
При отечной форме острого панкреатита наблюдается зона гипертермии, захватывающая надчревную область и переходящая на левое и правое подреберье. Если отечная форма панкреатита переходит в деструктивную, на термограмме появляются крупные участки гипертермии, причем площадь гипертермии увеличивается до 415—520 см2. При хроническом панкреатите термографическое исследование неинформативно. Специфическая термосимптоматика появляется лишь в случае обострения процесса.
Тепловизионная картина при сочетанных поражениях желчного пузыря и поджелудочной железы вариабельна и зависит от формы и фазы воспаления, развития осложнений (холангита, абсцесса, перитонита и др.). В случае катарального холецистита и отечной формы панкреатита на термограммах отмечается умеренное повышение ИК-излучения в подложечной области и в меньшей степени — в правом подреберье. При развитии гнойного холе
цистита и отеке поджелудочной железы на общетермальных термограммах наблюдается увеличение интенсивности ИК-излучения в верхней части живота. На изотермальных термограммах нередко определяется зона наибольшей гипертермии в правом подреберье, которая соответствует проекции очага гнойного воспаления в области печени. Деструктивные формы холецистопанкреатита характеризуются диффузным усилением теплового излучения в эпигастральной области, которое равномерно распределяется в правом подреберье и подложечной области.
На термограммах у больных с острым холангитом преобладает центральная локализация зоны повышенного ИК-излучения. В подложечной области имеются многочисленные очаги интенсивного свечения различной формы и размеров с преобладанием мелко- или среднеочаговой структуры термографического рисунка. Интенсивность теплового излучения бывает умеренно или резко выраженной (при гнойном холангите). Четкая тепловизионная картина регистрируется у больных с острым рецидивирующим холангитом после холецистэктомии. Величина температурного перепада колеблется от 0,7 до 1,2 °C. Если острый холангит с холедохолитиа-зом сочетается с обтурационной желтухой, отмечается обширная зона повышенного теплового излучения, которая занимает не только правое подреберье, но и подложечную область.
Термографическая картина при остром аппендиците характеризуется наличием зоны повышенного теплового излучения в правой подвздошной области. Площадь гипертермического очага бывает различной: при катаральном аппендиците это небольшое пятно повышенного свечения, при деструктивной форме воспаления и развитии перитонита она занимает правую подвздошную область, иногда распространяется на
смежные участки передней брюшной стенки. Форма зоны повышенной термической активности чаще бывает неправильной и реже овальной или палочковидной. Интенсивность ИК-излучения резко выражена при деструктивных формах воспаления червеобразного отростка. Величина температурного перепада колеблется от 0,9 до 2,1 °C.
Проведение дифференциального диагноза между острым аппендицитом и острыми заболеваниями женских внутренних половых органов представляет трудности. Если имеет место острое воспаление придатков и матки, апоплексия яичников, тепловизионная картина выражена слабо. В гипогастральной области отмечается небольшое диффузное повышение ИК-излучения без локальной гипертермии в правой подвздошной области, которая чаще наблюдается при остром аппендиците. В случае острых воспалительных заболеваний придатков на термограммах нередко проявляется увеличение интенсивности теплового излучения не только в обеих подвздошных областях, но и в области молочных желез, связанное, по-видимому, с изменением гормонального баланса.
Тепловизионная картина при перитоните отличается разнообразием термографической семиотики, которая зависит от локализации, характера и степени воспалительных изменений как в первично измененном органе, так и в окружающих тканях. На термограммах у этой группы больных выявляется обширная зона ИК-излучения, которая чаще занимает всю переднюю брюшную стенку. На изотермальных термограммах на фоне повышенного свечения в половине случаев удается выявить зону с наибольшей термической активностью, которая соответствует проекции очага воспаления в брюшной полости. Гипертермическая область чаще представлена однородной структурой термо-
39. Теплограмма живота в норме (центральный тип).
графического рисунка. Интенсивность тепловой радиации различна. Чаще отмечается наиболее выраженное свечение в зоне проекции воспалительного очага в брюшной полости. Величина температурного перепада между зоной теплового излучения и симметричным участком передней брюшной стенки колеблется от 1,2 до 1,8 °C. Термографическая картина при остром холецистите с развитием желчного перитонита отличается от картины при неосложненном холецистите большей площадью и интенсивностью ИК-излучения.
Термографическая картина при абсцессах брюшной полости характеризуется однотипностью тепловизионной семиотики. На термограммах соответственно проекции развивающегося или существующего внутрибрюшинного гнойника определяется крупный одиночный очаг резко повышенного ИК-излучения с четкими границами и однородной структурой термографического изображения. Перепад температуры между зоной свечения и симметричным участком передней брюшной стенки составляет 2,2 ±0,2 °C (колебания от 1,1 до 4,6 °C).
Таким образом, использование тепловидения при воспалительной патологии органов брюшной полости, особенно при остром аппендиците, холецистите, панкреатите, ограниченном и разлитом перитоните, весьма полезно и диагностически эффективно. При острых воспалительных процессах тепловизионная картина зависит в основном от степени выраженности морфологических изменений в пораженном органе и распространенности воспаления на окружающие ткани и органы. Локализация гипертермической области в большинстве случаев соответствует расположению очага воспаления в брюшной полости. Интенсивность теплового излучения зависит от характера и формы воспаления, а также от развития осложнений.
При хронических воспалительных процессах (аппендицит, холецистит, панкреатит и др.) на термограммах соответственно очагу воспаления выявляется небольшая зона теплового излучения с незначительно выраженной интенсивностью свечения. Нередко наблюдается атипичное расположение зон повышенного ИК-излучения (в 10— 20 %). В этих случаях в формировании теплового изображения на поверхности кожи, по-видимому, принимает участие нервно-рефлекторный механизм с вовлечением рефлексогенных зон Захарьина — Геда.
При опухолях органов брюшной полости очаги повышенного теплового излучения соответствуют их локализации. Убедительные термографические данные получены при метастазах рака в печень.
Диагностическая ценность термографии при острых воспалительных про
цессах различна, и число положительных ответов колеблется от 59 до 93 %. В случае острого аппендицита, холецистита, панкреатита, перитонита и гнойников брюшной полости указывается на высокую диагностическую информативность тепловизионного метода исследования, обусловленную резким повышением интенсивности ИК-излучения. Это находит отражение на термограммах в виде выраженной термоасимметрии. .При хроническом воспалении и опухолях органов брюшной полости термоасимметрия выражена незначительно вследствие небольшой калори-генности этих процессов. Положительные термографические результаты регистрируются в 45—77 % случаев, в основном в период обострения хронического воспалительного процесса или при значительном распространении опухолевого процесса и появлении метастазов в печени.
Заслуживает внимания комплексное применение тепловидения в сочетании с другими диагностическими методами исследования патологических процессов органов брюшной полости (эхография, радиоактивное сканирование, радиотелеметрия). Это позволяет проводить более точный дифференциальный диагноз острых и хронических воспалительных процессов в печени и желчевыводящих путях.
Имеются единичные сообщения об использовании термографии при язвенной болезни желудка и 12-перстной кишки, хронических гастритах, дуоденитах и колитах. Однако полученные результаты противоречивы как в определении термографической картины, так и в отношении диагностической ценности тепловизионного метода исследования.
Глава 2. ГНОСЕОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ЛУЧЕВОЙ ДИАГНОСТИКИ
Современный уровень развития естественных, технических и общественных наук требует всестороннего философского осмысления отношения наших знаний к объективной реальности, особенностей «вида», или способа, отражения внешнего мира субъектом. Это значит, что гносеология (теория познания) своим исследованием сущности познавательного отношения человека к действительности, исходных и всеобщих оснований этого отношения служит методологической предпосылкой для анализа путей познания и его методов в конкретных науках, включая медицину, в том числе лучевую диагностику.
Врач, на органы чувств которого действуют соответствующие возбуждения, распознает образ, если он способен выполнять следующие операции: 1) сопоставлять полученные возбуждения с теми, которые он получил ранее, и устанавливать аналогии между ними; 2) отличать эти возбуждения от тех, которые соответствуют другим образам. Так возникают понятия восприятия информации, ее анализа и классификаци.
Теория познания оказывает существенное влияние на формирование основных принципов и идей семиотики. В теории познания, связанной с достижениями кибернетики и теории информации, изучаются наиболее общие свойства отражения, выражения и обозначения, присущие знакам и символам. Названные свойства проявляются в широком диапазоне: от простейших «знаков-признаков» и «иконических (изобразительных) знаков», имеющих причинно-следственную связь либо сходство с объектами, до различных систем естественной или искусственной сигнализации, а также знаков и символов естественного и искусственного (формализованного) языка.
Развитие общей семиотики как междисциплинарного направления в современной науке вместе с возрастанием абстрактного характера теоретических построений во всех областях научного знания — свидетельство движения познания от непосредственного чувственного контакта человека с окружающим миром к его опосредованному освоению. Понятие «опосредование» предполагает как способ абстрактно-теоретического отражения того, что не «схватывается» непосредственно органами чувств, так и превращение сигналов или знаков информации от недоступных прямому наблюдению объектов в их «вторичную», чувственно воспринимаемую форму с помощью измерительной и информационной аппаратуры.
Опосредованное познание объектов в медицине, включающее прежде всего семиотику как выявление диагностического значения симптомов болезни,— одна из характерных особенностей лучевой диагностики. В ней основную роль играет умение врача распознавать, интерпретировать смысл связи информации, превращенной в зрительно воспринимаемый «облик», с внутренними причинами и динамикой заболевания.
Основными принципами распознавания болезней являются понимание целостности организма, клиницизм и функционализм. На этой базе лучевая диагностика интегрируется с остальными медицинскими науками. Исходя из названных принципов, врачи классифицируют семиотику, создают мысленные модели болезней, проводят дифференциальный диагноз. Последний в медицине вообще — важное звено врачебнодиагностической задачи в целом, в структуру которой входят по меньшей мере три элемента: распознавание вида заболевания; клинические факты как
эмпирическая основа диагноза; субъективно-идеальные и объективно-материальные средства диагностики.
Лучевая диагностика относится к сфере врачебной деятельности, в которой информация о здоровье или болезни представлена в виде скиалогических (теневых) образов, или «заместителей объекта» на рентгеновском либо телевизионном экране и рентгеновской пленке или бумаге. Рентгеновский образ является в высшей степени специфическим, условно-схематическим изображением типа «знака-индекса» внутреннего строения организма и отдельных органов и систем. Поэтому для правильного истолкования результатов исследования необходимы глубокие специальные знания и большой клинический опыт. Так, рентгенограмма как таковая имеет весьма отдаленную степень общности с исследуемым объектом, но в руках специалиста — врача-рентгенолога — она приобретает функцию изображения (образа) большой информативной силы.
Значение каждого метода лучевой диагностики всегда и неизменно будет полноценным только при условии, если их данные .рассматриваются и оцениваются в тесной связи со всей остальной клинической картиной заболевания. Важнейшие из лучевых методов диагностики — рентгенологические. Знание клиники неизмеримо обогащает врача-рентгенолога, ибо он ищет у больного те признаки, которые могут и должны быть при данной клинической картине, т. е. рентгенолог проводит целенаправленное исследование. Сопоставляя данные рентгенологического исследования с клиникой, он добивается повышения информационной значимости, достоверности изучаемых им признаков.
Врачи знают, что диагностическая ценность признаков меняется в зависимости от того, в каком сочетании они встречаются. Корреляция клинической семиотики с рентгенологической или
другой нередко позволяет найти у больного такой симптомокомплекс, который окажется патогномоничным именно для определенного заболевания и тем самым поможет дополнить вероятностную диагностику и выйти на более определенную, достоверную основу. Таким образом, интеграция рентгенологической картины, КТ- или MPT-семиотики с клинической рождает комплексный синдромный подход в распознавании болезней.
Основные задачи лучевой диагностики следующие: установить, имеется ли у исследуемого какое-либо заболевание, и по возможности определить его нозологическую принадлежность (устанавливающая диагностика); выявить признаки, отличающие данное заболевание от других патологических процессов со сходными проявлениями (дифференциальная диагностика); установить точную локализацию и распространенность патологического процесса (топическая диагностика); установить форму и стадию развития заболевания, наличие или отсутствие осложнений (качественная диагностика); оценить общее состояние больного, выявить сопутствующие заболевания и др.
Чтобы при названном подходе выявить основные, наиболее важные симптомы заболевания, не обязательно применять все известные методы исследования, которых может не выдержать не только больной, но и здоровый человек. Необходимо использовать избирательно один или несколько методов диагностики, которые несут максимальную информацию для установления правильного диагноза.
Системно-комплексное применение клинических, функционально-морфологических, рентгенологических и других методов должно проводиться на основе четкой регламентации показаний и последовательности их использования, где каждый предыдущий метод опреде-
I.., ! нока.мния для последующего. Все »то делается с учетом степени инфор-матипностн каждой) из методов, характера и распространенности патологического процесса. В этом, па наш взгляд, заключается реальный путь интеграции рентгенологии, КТ, ЯМР-диагпостики и других методов как самостоятельных наук между собой и с другими медицинскими дисциплинами, а также с методами клинической и функционально морфологической диагностики.
Тактика лучевой диагностики усложнилась в связи г тем, что арсенал средств и способов, а также различных процедур насчитывает много десятков названий, и квалифицированный рентгенолог должен в каждом отдельном случае определить, какие методы целесообразно использовать и в какой последовательности. Применение обычной рентгеноскопии и рентгенографии часто бывает достаточным для установления диагноза. Однако в ряде случаев появ ляется необходимость в использования дополнительных рентгенологических методов. Их выбор должен отвечать требованию: максимум достоверной информации в кратчзц ши и срок при мини мальцом количестве использованных методов.
В процессе рентгенологического исследования выявляют морфологические и функциональные изменения в тех или иных органах и системах. Так, при обнаружении морфологических признаков рака желудка (дефект наполнения, перестройка рельефа слизистой оболочки и др.) одновременно определяют характер перистальтики на уровне поражения и в соседних отделах, сменяемость желудка при дыхании и изменении положения тела и др. Для выявления функционального состояния того или иного органа в ряде случаев используют лекарственные средства. Например. чтобы стимулировать перистальтп
у 1ка, применяют морфин, прозе-
рин; чтобы ускорит|, опорожнение желчного пузыря и вторично контрасти ровать общий желчный и печеночные протоки секретин, холецистокинин и другие вещества: в случае необходимости ослабить моторику исследуемых органов (12-перстной кишки, илеоцекального клапана) применяют атропин, мета ци н и др. Для снятия спазма сфинктеров (привратника желудка) используют препараты из группы нитритов и др.
В лучевой диагностике, как и в каждой науке, существует несколько уровней абстракции: 1) внешнее, описательное. феноменологическое рассмотрение явлений, простая констатация их свойств; 2) элементарное объяснение природы и свойств объектов, выраженное качественно либо количественно; 3) более обстоятельное объяснение явлений на основе количественных методов. модельное конструирование основных изучаемых процессов, аналитическое представление их свойств и зависимостей; 4) объяснение явлений с использованием наиболее высоких ступеней абстракции посредством применения сложного математического или логического формализма, обладающего широкой обобщенностью по охвату эмпирических данных, глубине их теоретического осмысления.
Исходя из сказанного, в мышлении врача — лучевого диагноста выделяют 4 этапа: скиалогический. семиотический, синдромный и нозологический. На первом этапе производится оценка качества снимка, определение исследуемого органа, его проекции и методики исследования, осуществляется предварительное, наиболее общее разделение нормы и патологии. Анализ скиалоги веских признаков требует глубокого знания анатомии и физиологии исследуемых органов, вариантов их развития, особенностей лучевого отображения структуры и функции этих Органон
д за подробным описанием патоло-ического очага дается характеристика ругим изменениям, которые могут иметь место н пораженном органе или системе. Например, при обнаружении дефекта в стенке желудка с помощью рентгенологического метода подробно описывают рельеф его слизистой оболочки. состояние стенок и их моторику, характер эвакуации бариевой взвеси из желудка, состояние соседних органов и др. Только полный скиалогический анализ дает возможность поставить правильный диагноз. Пренебрежение какой-либо деталью приводит к диагностическим ошибкам.
На втором этапе выявляются и отби раются симптомы, из которых затем образуется симптомокомплекс. или синдром, т. е. формируется модель заболевания. Установление патоморфоло-гического и патофизиологического суб страта выявленных скиалогических изменений — важный этап лучевой диагностики. Расшифровка теневой картины с заменой скиалогических категорий на патологоанатомические и патофизиологические — это сложный процесс, ведь признаки редко бывают патогномоничными. Сходные скиалогические признаки могут быть обнаружены при различных патологических процессах. Так, дефект наполнения пищевода, желудка или кишечника может отражать наличие опухоли, местного отека стенки, давление извне и др. Известные трудности возникают при определении перестройки рельефа слизистой пищеварительного тракта и ряда других картин.
На протяжении многих десятилетий рентгенология ограничивалась именно первыми двумя этапами. Раньше самая распространенная и основная форма осмысления рентгенологической картины состояла в узнавании изображенных на ней объектов. Теперь этого уже недостаточно. Требуется глубокий анализ
ной картины болезни, синдромноеп и корреляция в объяснении мнших заболеваний. Иначе говоря, необходим ко м п леке н ый систем но-стру кту рны и анализ не только рентгенологического но и других изображений.
Следует подчеркнуть, что врачебно диагностическое мышление в своеобри зии его структуры и применяемого им инструментария предполагает взаимо связь чувственного познания, логиче скоп» мышления и практической дея тельности врача (навыков врачевании результатов лечения, сопоставлении рентгенологических и клинических дай ных и т. д.).
Точно так же в мышлении врачи проявляется взаимосвязь формально логических схем — анализа и синтеза, индукции и дедукции, аналогии и мо Полирования и других, с принципами диалектической логики. Последние он ределяют стратегию решения врачебнодиагностической задачи, состоящую н восхождении от абстрактного («сими том», «скиалогический образ», «спид ром», «норма», «нозологическая фор ма») к конкретному, т. е. к больному человеку, являющемуся неповторимой личностью. Вместе с тем в русле этой стратегии врач применяет многообраз ные принципы диалектической логики, составляющие содержание теоретике ского мышления,— движение от явления к сущности, от простых уровнен абстракции к более сложным, от структурных изменений к функциональным и обратно, от непосредственного к оно средованному и обратно, включая та кую разновидность «вторично-непосред . ственного», как скиалогические образы
Необходимость системно структурно го анализа лучевого изображения одно из принципиальных следствш широкого развития системного подхода который обусловлен достижениями био-। логин и медицины и является важ-
нейшей методологической ориентацией современной науки и техники. Системный подход служит своеобразным связующим звеном между философией и конкретными науками.
С точки зрения целостности организм человека — это сложная система с различными уровнями организации. Информация, получаемая при лучевом исследовании, позволяет судить об одном или нескольких органах. Целостное представление о больном составляется на основе нескольких лучевых исследований вместе с клиническими данными. В этой связи целесообразно выделить три уровня признаков заболевания: 1) признаки нарушений состояния больного организма в целом; 2) признаки изменений всего органа; 3) признаки местных патологических изменений в пределах органа, т. е. частная лучевая семиотика. Подобный подход к лучевой диагностике обеспечивает ее интеграцию с клиникой, способствует развитию синдромного и нозологического способов мышления врача, позволяет получить представление не только о локализации и характере процесса, но и о состоянии пораженного органа, а также больного человека в целом.
Последовательность мыслительных операций, например в рентгенодиагностике, или структуру диагностического мышления рентгенолога можно представить следующим образом.
1. Формирование предварительной мысленной модели больного на основе информации, полученной в процессе применения общих методов клинико-рентгенологического исследования.
2. Выявление ведущих признаков заболевания для последующего обоснования одной из синдромных гипотез об основной болезни.
3. Отбрасывание многих возможных типов заболеваний, которые не соответствуют признакам, обнаруженным у
больного (ограничение количества дифференцируемых болезней).
4. Построение дифференциальнодиагностического ряда наиболее вероятных болезней, которыми может страдать данный больной.
5. Поиск в выделенном ряду таких симптомокомплексов, которые позволяют еще больше ограничить перечень заболеваний.
6. Применение наиболее информативной специальной рентгенологической методики (например, ангиографии, бронхографии и др.) или других способов лучевой диагностики для получения максимально достоверных, несомненных признаков заболевания.
7. Корреляция, рентгенологической семиотики с клиническими данными, характеризующими больного в целом и исследуемый орган в частности.
8. Составление окончательного диагностического заключения, которое может в дальнейшем уточняться врачебной практикой — терапевтическим лечением, хирургическим воздействием, биопсией, наконец, аутопсией.
Практика показывает, что установление диагноза начинается уже с беседы врача с больным, выяснения его жалоб, истории настоящего заболевания. Это нужно во всех случаях и независимо от того, имеются ли соответствующие сведения в истории болезни. Как правило, личная беседа с больным дополняет данные, поступившие от лечащего врача, а иногда и вносит в них существенные коррективы. Значение собеседования заключается также и в том, что оно позволяет врачу наметить наиболее рациональный план обследования данного больного и выбрать ту методику исследования, которая менее безопасна и более информативна.
Таким образом, к врачебному диагнозу предъявляются следующие требования- 1) диагноз должен быть максимально ранним, убедительным и досто
верным; 2) должен быть поставлен в предельно короткий срок; 3) путь распознавания болезни должен быть наиболее экономичным; 4) принципы диагностического мышления должны быть универсальными, позволяя по единой методологии диагностировать любую патологий всех органов и систем человека; 5) на пути к диагнозу нужно с исчерпывающей полнотой использовать те методы исследования, которые наиболее доступны врачу и наименее обременительны для больного. Переходить к более сложным методам следует в тех случаях, когда полученных сведений недостаточно для установления диагноза.
Итог всей проведенной работы — формулировка заключения. Заключение может быть различным в зависимости от ряда факторов: полноты полученных сведений, длительности наблюдения и др. Иногда это точный диагноз с указанием нозологической формы, распространенности, формы и фазы развития болезни, имеющихся осложнений. Подобное заключение является оптимальным. Однако далеко не всегда имеется возможность сформулировать заключение однозначно. В ряде случаев в заключении указывают перечень заболеваний, которые могут обусловить наблюдаемую рентгенологическую картину, в порядке уменьшающейся вероятности. При этом часто указывают, какие дополнительные процедуры могут позволить сузить этот дифференциально-диагностический ряд, например эндоскопическое исследование, биопсия. Недопустимо в заключении повторить лишь описание скиалогической картины («дефект наполнения в желудке»).
Иногда в заключении может быть отмечено, что, несмотря на наличие клинической симптоматики, рентгенологическая картина не представляет отклонений от нормы. Это может быть обусловлено следующим: развившееся за
болевание по своему характеру не проявляется четкими рентгенологическими признаками (например, кишечная колика) ; фаза развития процесса такова, что рентгенологическая картина еще не сформировалась (например, ранняя стадия болезни Крона, язвенного колита); в связи с неясной клинической картиной лечащий врач направил больного для рентгенологического исследования не того органа (системы), который в действительности поражен (например, при остром животе, имитирующем пневмонию, когда рентгенолог не обнаруживает изменений в органах грудной клетки); симуляцией или аггравацией.
Заключение должно быть ясным, по возможности лаконичным, но достаточно полным. При необходимости указывают на целесообразность повторного исследования через определенный срок. Протокол рентгенологического или другого лучевого исследования вписывают или вклеивают в историю болезни.
Возникающие иногда диагностические ошибки с гносеологической точки зрения имеют как объективные, так и субъективные причины. Объективные причины: чаще всего дефекты медицинской аппаратуры, фототехники или ограниченность возможностей самого метода исследования. Субъективные причины ошибок, расхождения в заключениях, например, рентгенологов с данными оперативного вмешательства и секцией обычно обусловлены нарушением логико-методологических принципов анализа рентгеновских образов, неправильным толкованием рентгенологических симптомов, неопытностью рентгенолога, проводящего сложные исследования.
Диагностические ошибки могут возникать на любой ступени познания, начиная с того момента, когда врач бросает первый (часто «мимолетный») взгляд на рентгенограмму или эхо-
сканограмму и у него формируется начальное впечатление о ней. Образы, возникающие в процессе восприятия рентгенологического или любого другого лучевого изображения, должны осмысливаться и идентифицироваться обязательно посредством словесных, четко выраженных обобщений — формулировок, чтобы полученная врачом информация, нередко субъективно окрашенная «кажимостью», получила общезначимый, всем понятный смысл. Поэтому лучевая диагностика, построенная на эффекте кажущегося достигнутого в ограниченном личном опыте, несовершенна и часто ведет к диагно
стическим ошибкам. С другой стороны, выявление ошибок и противоречий, их логическое сопоставление — эффективный путь познания истинной природы заболевания, проявление творческой деятельности лучевого диагноста и его коллег.
Диалектическое мышление — это самый реальный барьер на пути возникновения диагностических ошибок и самое эффективное средство их преодоления. Поэтому наиболее ценное качество врачебно-диагностического мышления — умение видеть собственные противоречия, сопоставлять и разрешать их.
Раздел II
ПИЩЕВОД
Глава 3. НЕКОТОРЫЕ АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ И РЕНТГЕНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
Пищевод — часть пищеварительного тракта, расположенная в грудной полости кпереди от позвоночника между глоткой и желудком и служащая для проведения пищи в желудок. Он представляет собой легко сокращающуюся и расширяющуюся фиброзно-мышечную трубку, сплющенную в заднепереднем направлении.
Начинается пищевод на уровне нижнего края перстневидного хряща, что соответствует у взрослого проекции Cvi-vii (у детей на 1—2 позвонка выше). Проходя через пищеводное отверстие диафрагмы, пищевод впадает в желудок на уровне Т xxi. Длина пищевода у взрослых 21—30 см и зависит от конституции, роста и пола человека, ширина просвета — около 2 см, толщина стенки — 0,3 см.
В пищеводе выделяют 4 отдела: шейный, грудной, диафрагмальный и брюшной со средней длиной каждого из них соответственно 5—6, 16—18, 1,5—2,5 и 3—4 см. Вместе с тем различают 5 физиологических сужений (при у меньше-, нии диаметра пищевода более чем на 1/3): 1) перстнеглоточное, образованное глоточно-пищеводным сфинктером; 2) аортальное, обусловленное давлением дуги аорты; 3) бронхиальное, вызванное вдавлением в стенку пищевода левого главного бронха; 4) диафрагмальное, связанное со сдавлением пищевода ножками диафрагмы; 5) карди
нальное, находящееся у входа пищевода в желудок и обусловленное сфинктерами кардии.
На своем протяжении пищевод анатомически близок или соприкасается с трахеей и бронхами, нисходящей аортой, общей сонной артерией, грудным протоком, блуждающими нервами, грудной частью симпатического пограничного столба, легкими и плеврой, диафрагмой, верхней и нижней полой веной и задней поверхностью перикарда и сердца. Со всех сторон пищевод окружен рыхлой соединительной тканью. Это обеспечивает ему возможность некоторого смещения из обычного положения, создает условия для распространения воспалительного процесса с наружной оболочки пищевода на средостение и соседние органы.
Стенку пищевода образуют 4 слоя: слизистая, подслизистая, мышечная и наружная соединительнотканная оболочка. Между слизистым и подслизистым слоями имеется прослойка из гладких мышечных волокон, расположенных продольно. В проксимальной части пищевода эти мышечные волокна могут отсутствовать, зато в дистальной они обычно хорошо выражены. Нередко здесь имеются также циркулярные мышечные волокна. Мышечный слой состоит из внутренних круговых и наружных продольных мышц. Продольные мышечные волокна вдвое тоньше цир-
40. Части глотки:
а — ротовая; б — гортанная.
кулярных. Мышечная оболочка верхней трети пищевода состоит из поперечнополосатых волокон, нижней трети — из гладкой мускулатуры, а средней трети — из смешанных волокон.
Кровоснабжение пищевода выражено слабее, чем в других отделах пищеварительного тракта из-за отсутствия единой пищеводной артерии. Шейный отдел снабжается кровью из ветвей подключичной артерии, верхней межреберной и артерии щитовидной железы.
Грудной отдел васкуляризируется ветвями бронхиальных и межреберных артерий и грудной аорты. Брюшной отдел снабжается кровью из нижней диафрагмальной и левой желудочной артерий. Все артерии пищевода анастомозируют между собой. Отток из вен пищевода совершается по венам, соответствующим питающим пищевод артериям, в основном в верхнюю полую вену и частично из нижней трети в портальную систему и нижнюю полую
41. Нормальный пищевод и его отделы:
а - шейный; б — грудной: в диафрагмальный брюшной.
вену. Лимфоотток осуществляется через хорошо развитые лимфатические сплетения в слизистой и подслизистой
оболочках. Для лимфатической системы пищевода характерна продольная ориентация, т. е. отток лимфы или вверх в сторону глотки, или вниз в сторону желудка. Из верхней части пищевода лимфа попадает в шейные, трахеальные и трахеобронхиальные лимфатические узлы, из нижней части — в лимфатические узлы кардии, по ходу левой желудочной артерии и вдоль малой кривизны желудка. Часть лимфатических сосудов пищевода открывается непосредственно в грудной проток, что, видимо, обусловливает возникновение отдаленных метастазов рака пищевода.
Иннервация пищевода обеспечивается парасимпатической и симпатической нервной системой. Нервные волокна обеих систем образуют поверхностные переднее и заднее сплетения пищевода. Переднее сформировано в основном волокнами правого блуждающего нерва, заднее — левого. От них в толщу пищевода отходят тонкие волокна, образующие интрамуральный нервный аппарат, который состоит из трех тесно связанных между собой сплетений'. адвентициального, межмышечного (ауэрбахова) и подслизистого (мейсснерова) . Шейный отдел иннервируется возвратными нервами, грудной — ветвями блуждающего и симпатического нервов, диафрагмальный и брюшной отделы — чревным нервом. Сенсорная иннервация осуществляется блуждающими нервами, которые регулируют моторику пищевода. Симпатическая нервная система контролирует тонус мышц.
Основным в функции пищевода является обеспечение глотания, в котором выделяют 3 фазы, последовательно отражающие прохождение пищевого комка из полости рта в глотку и затем — по пищеводу в желудок: 1) пережевывание и проталкивание пищи изо рта в глотку; 2) чисто рефлекторная
42. Взаимоотношение пищевода с органами средостения: а — пищевод; б — бронх, в — аорта; г — трахея, д — сердце; в — диафрагма.
В норме у здоровых людей наблюдается задержка пищи сразу же позади дуги аорты на уровне аортальнобронхиального сужения и над диафрагмальным отверстием в зоне эпи-френального расширения (ампулы пищевода) . Это физиологическое локальное расширение достигает при глотании 2—3 см и является одной из фаз моторики пищевода. Его не следует путать с грыжей пищеводного отверстия диафрагмы.
На двигательную функцию пищевода оказывают влияние психические факторы и соматические заболевания органов грудной и брюшной полостей. Хорошо изучен, например, пищеводно-слюнный рефлюкс: раздражение слизистой оболочки пищевода вызывает обильное слюнотечение. Двигательные расстрой-
фаза глотания проявляется мощным сокращением мышц глотки при закрытых голосовых складках и открытом устье пищевода, обеспечивающим «впрыскивающий эффект глотки», и заканчивается проталкиванием пищи в полость пищевода; 3) прохождение пищи по пищеводу через кардию в желудок.
Скорость продвижения пищевого комка зависит от количества и качества пищи, положения тела, состояния нервно-мышечного аппарата пищевода и организма в целом и обеспечивается равномерным и последовательным сокращением мышечных слоев пищевода. Так, глоток воды проскальзывает в желудок за 2—3 с, опережая активную перистальтику пищевода, а плотный пищевой комок — за 6 — 15 с.
ства пищевода возникают при страхе, испуге, радости и других состояниях. Раздражения трахеи и бронхов, желудка и кишечника, желчного пузыря и диафрагмы могут сопровождаться дискинезиями пищевода. Описаны случаи, когда глотание вызывало приступы стенокардии, экстрасистолии, пароксизмальной тахикардии и даже сердечного блока с синдромом Морганьи — Адамса.
Рентгенологическая картина контрастированного пищевода весьма изменчива и зависит от его функциональных и анатомических особенностей, а также от фазы глотания и дыхания, положения обследуемого и проекции исследования. При ТЗ пищевода контрастным веществом он выглядит как слегка изогнутая лентовидная тень шириной 1,5— 3 см с четкими и гладкими контурами. Глотка и верхний отдел в прямой проекции имеют вид булавы, в боковой — неправильной воронки. В боковой проекции тень контрастированного пищевода располагается между позвоночником и воздушным столбом трахеи, а в ретрокардиальном пространстве плавно ,отклоняется кпереди в направлении кардии. В левой косой проекции пищевод выглядит почти прямым, за исключением вдавления на уровне Т v-vi из-за тесного прилегания к нему нисходящей части грудной аорты. Переходы между суженными и расширенными участками пищевода плавные, закругленные. После прохождения комка бариевой взвеси стенки пищевода спадаются, контуры их уплощаются, формируется рельеф слизистой оболочки в виде 2—4 параллельно идущих продольных складок шириной около 2 мм.
О тонусе пищевода судят по ширине просвета, размерам и конфигурации органа, а также по характеру продвижения бариевой взвеси. При повышенном тонусе пищевод укорачивается и вы
прямляется, просвет его сужается, бариевая взвесь по пищеводу проходит быстро, складки слизистой высокие, узкие, слегка извилистые и четко очерчены контрастом. Пониженный тонус характеризуется удлинением и искривлением пищевода, просвет которого широкий, стенки долго не спадаются, а в просвете имеется воздух. Продвижение бариевой взвеси по пищеводу замедлено. При пониженном тонусе складки слизистой уплощены и расширены, изображение их нечеткое, а при атонии складки вовсе не определяются.
Моторно-эвакуаторная функция пищевода является основной. Она обеспечивается тоническими и перистальтическими сокращениями мышц пищевода. Перистальтические дижения (волны) идут со скоростью 3—5 см/с. Они имеют вид ритмично возникающих сегментарных сокращений пищевода, смыкающих просвет его, протяженностью 1—8 см. Участкам сокращений всегда предшествуют участки расширения, что является, по мнению В. Б. Антонович (1987), отражением высокого тонуса в кольце перистальтики и его снижения в предшествующих отделах пищевода, благодаря чему и происходит перемещение содержимого в определенном направлении. От раскрытого устья пищевода перистальтика распространяется на стенки пищевода, вызывая пропульсивную перистальтическую волну, направленную в сторону желудка. Перистальтика пищевода более выражена при приеме густой бариевой взвеси.
Различают первичную и вторичную перистальтику пищевода. Первичная перистальтика возникает при акте глотания, а вторичная появляется в результате местного повышения давления. Обе перистальтики сопровождаются понижением тонуса кардии.
Глава 4. АНОМАЛИИ И ПОРОКИ РАЗВИТИЯ
Аномалии и пороки развития пищевода — результат нарушения органогенеза на 3—12-й неделе внутриутробного периода. Выраженные аномалии пищевода, нередко сочетающиеся с пороками развития других органов, обычно несовместимы с жизнью. Заслуживают внимания аномалии и пороки развития, ведущие к нарушению питания и обнаруживаемые уже в первые дни после рождения, которые можно исправить хирургическим путем, и те, которые выявляются случайно в более позднем возрасте при эзофагоскопии или рентгенологическом исследовании.
Атрезия пищевода. Под атрезией понимают такую аномалию развития, при которой просвет пищевода на каком-то участке или на всем протяжении отсутствует. Иногда этот термин применяется для обозначения аналогичных последствий воспалительных процессов (например, атрезия пищевода в результате рубцовых изменений при химических ожогах).
Различают 3 основные формы атрезий. При мембранозной форме непрерывность кишечной трубки сохранена, просвет ее разделен перегородкой, состоящей из слизистого и подслизистого или (реже) всех слоев стенки кишки. В случае тяжеобразной формы слепые концы соединены тяжем, который является гипоплазированным, лишенным просвета участком кишечной трубки или (реже) состоит лишь из фиброзной ткани. Атрезия в виде изолированных (свободных) слепых концов всегда сопровождается У-образным дефектом брыжейки. Стеноз может выглядеть как простое сужение участка кишечной трубки или представлять собой мембрану, имеющую одно или несколько отверстий.
Клинические признаки непроходимости пищевода появляются уже в пер
вые часы и дни жизни новорожденного. Сразу же после рождения у младенца изо рта и носа выделяется пенистая слизь и слюна. При каждой попытке его кормления возникает сильный кашель, одышка и цианоз и срыгивание нествороженным молоком. На 2—3 день ребенок слабеет, становится вялым, худеет, у него западает живот, прогрессируют цианоз и легочная недостаточность.
Рентгенологическое исследование является решающим. Лишь оно дает наиболее полный, исчерпывающий диагноз. Применив контрастное вещество (воздух или 1 — 2 мл йодолипола), рентгенолог может выявить не только форму и уровень непроходимости, но и состояние органов грудной и брюшной полостей, исключить сочетанные аномалии. Правильно проведенное рентгенологическое исследование позволяет обнаружить слепой конец пищевода, уровень его расположения, наличие или отсутствие сообщения с бронхами или трахеей.
Атрезия пищевода рентгенологически проявляется наличием воздуха и уровня жидкости, а также слепого проксимального конца пищевода и отсутствием воздуха в ЖКТ. Наиболее часто (в 90 %) оральный отрезок пищевода заканчивается слепо выше уровня бифуркации трахеи, а аборальный — сообщается свищевым ходом с одним из главных бронхов. Выявление на рентгенограмме газового пузыря желудка и воздуха в кишечнике свидетельствует о наличии достаточно широкого сообщения между трахеей и дистальным отрезком пищевода. Локализация свища устанавливается при бронхоскопии. В отличие от атрезии врожденный стеноз пищевода рентгенологически характеризуется равномерным сужением со сравнительно ровными и четкими кон-
43. Различные типы атрезии пищевода:
а, б, в — варианты соотношения разделенных отделов пищевода (2) с трахеей (1) ; г — пищеводно-трахеальный широкий свищ; д — среднего отдела пищевода нет; е — стеноз пищевода (иревратившегоси в соединительнотканный тяж) в средней трети
турами и имеет вид песочных часов. В ряде случаев может наблюдаться супрастенотическое расширение вышележащих отделов.
Диэзофагия. Эта аномалия характеризуется удвоением пищевода, наличием двух пищеводов. Различают сферические (кистозные), тубулярные и дивертикулоподобные удвоения, имеющие изолированный или сообщенный с пищеводом просвет. Кистозные удвоения называют еще энтерогенными кистами. Реже встречаются изолированные удвоения, которые "внутри содержат жидкость. Они ничем внешне не отличаются от солитарных врожденных кист пищевода. Распознавание удвоений пищевода трудное.
Клиническая картина многообразная, зависит от характера и величины удвоений. На раннем этапе развития, когда жидкого содержимого нет или его слишком мало, изолированное добавочное образование может не проявляться клинически. Если изолированные удвоения
наполняются секретом и увеличиваются в объеме, превращаясь в кисту, то они сдавливают пищевод и дыхательные пути. Появляются срыгивание, поперхи-вание, дисфагия, боль при глотании, кашель, одышка. У детей часто бывают бронхиты и пневмонии, нередко развиваются бронхоэктазы.
Рентгенологическое исследование выявляет дополнительную тень в заднем средостении с четкими контурами, оттесняющую пищевод и вызывающую вдавление его контура. Стенки тени эластичные, конфигурация ее меняется при дыхании, глотании, повышении и снижении внутригрудного давления. Если удвоение дивертикулопОдобное, рентгенологическая картина напоминает дивертикул. Во избежание возникновения тяжелых осложнений подлежит удалению.
Врожденный короткий пищевод. Для этой аномалии развития типично наличие желудочного эпителия в дистальном отделе пищевода. Клинически проявля
ется желудочно-пищеводным рефлюксом, вызывающим пептический эзофагит с последующим развитием стеноза пищевода.
Рентгенологическая картина врожденного короткого пищевода — расположение пищеводно-желудочного перехода на уровне бифуркации трахеи или несколько ниже. При этом значительная часть желудка находится в заднем средостении и над диафрагмой. Об этом свидетельствуют характерные для желудка складки слизистой оболочки.
Пищевод выпрямлен и укорочен (у новорожденных в норме его длина 10 — 11 см), с параллельно идущими стенками, контуры которых четкие и ровные. Угол Гиса и угол желудка отсутствуют. В области перехода пищевода в желудок имеется перетяжка с гладкими контурами в виде восьмерки или песочных часов. Пищеводное отверстие широкое. В горизонтальном положении ребенка содержимое желудка переходит в пищевод. В отличие от фиксированной грыжи пищеводного отверстия диафрагмы, при врожденном коротком пищеводе в «грудном» желудке горизонтальный уровень жидкости отсутствует.
Врожденный стеноз пищевода. Встречается редко. Клинически проявляется уже в первые дни после рождения срыгиванием нествороженным молоком, дисфагией. По мнению большинства исследователей, врожденный стеноз пищевода чаще обнаруживается в возрасте 4—7 мес. и позже. В этот период он может проявляться внезапно; во время еды ребенок начинает двигаться, возникают рвотные движения и т. д. Такое состояние может повторяться при поспешной еде через несколько дней или месяцев. Это и заставляет мать обратиться к врачу.
Рентгенологическая картина характеризуется выявлением чаще коротких
44. Врожденный короткий пищеводе внутригруд-ным желудком.
сужений протяженностью 0,5—1,5 см с отсутствием перистальтики в зоне стеноза. Контуры сужения четкие и ровные, стенки его эластичные. Имеют место небольшое супрастенотическое расширение и умеренные двигательные расстройства (дискинезии). Сужения чаще всего определяются в диафрагмальном и брюшном отделах пищевода, а также в нижней трети его грудного отдела. В хирургической практике обычно встречаются циркулярные фиброзные, хрящевые или мышечные стенозы, а в педиатрической и терапевтической — мембранозные, или перепончатые, сужения с эксцентричными от
верстиями (частичный, или парциальный стеноз). Имеют место наличие нормального желудочно-кишечного перехода и отсутствие желудочно-пищеводного рефлюкса (Dominguer et al. 1985).
Дивертикулы пищевода. Под дивертикулом пищевода понимают ограниченное выпячивание его стенки. Обычно они обнаруживаются у больных старше 40 лет, чаще у женщин. По частоте занимают третье место после дивертикулов ободочной и 12-перстной кишок.
Различают глоточно-пищеводные и собственно пищеводные — параброн-хиальные (бифуркационные) и зпифре-нальные (наддиафрагмальные) дивертикулы. По литературным данным, одиночные дивертикулы наблюдаются у 70 %, множественные — у 30 % больных. Множественные дивертикулы пищевода почти у половины больных сочетаются с дивертикулами других отделов пищеварительного тракта.
Глоточно-пищеводные, или Ценкера, дивертикулы образуются в задней стенке нижнего отдела глотки в месте перехода глотки в пищевод. Здесь имеются два участка слабо развитых мышц глотки и пищевода. Первый носит название треугольника Ланнье — Геккер-мана, расположен между нижним сжимателем глотки и перстневидно-глоточной мышцей. А между последней и мускулатурой пищевода находится второй слабый участок, который носит название треугольника Лемера — Киллиана. По нашему мнению, основной причиной образования глоточно-пищеводных дивертикулов, как, между прочим, и других, является врожденная неполноценность стенки пищевода.
В развитии дивертикула Ценкера выделяют 3 стадии: 1) выпячивание только слизистой оболочки; 2) формирование дивертикулярного мешка в пространстве между пищеводом и позвоночником; 3) большой дивертикул, спу
скающийся в верхнее средостение грудной полости. Развитие дивертикула происходит медленно, годами, диагностируют его только в возрасте старше 15 лет. Отверстие дивертикула вначале довольно широкое и служит как бы продолжением глотки, вход в пищевод смещен вперед, к гортани. Величина дивертикула бывает различной — от маленького выпячивания до огромного мешка, вмещающего до 1,5 л жидкости. В конечных стадиях вход в дивертикул сужается, опорожнение его затруняется, что способствует застою пищевых масс. Переполненный дивертикул оттесняет пищевод кпереди и резко затрудняет глотание, вызывая дисфагию. Для дивертикулов Ценкера характерны следующие симптомы: регургитация старой пищи, постоянное наличие слизи в глотке, неприятный запах изо рта, появление припухлости на шее, при надавливании на которую слышны булькающие звуки или шум плеска (симптом Купера).
При рентгенологическом исследовании бариевая взвесь заполняет дивертикул, а затем переходит в пищевод. Контрастированный дивертикул виден на задней или боковой стенке пищевода и в зависимости от стадии развития имеет характерную форму. Так, в I стадии он напоминает шип розы, во II — булаву, в III — мешок. Исследование больных должно проводиться преимущественно в боковой проекции, иначе дивертикул можно не обнаружить.
Собственно пйщеводные (параброн-хиальные, или бифуркационные) дивертикулы чаще располагаются на уровне корней легких, несколько выше места пересечения пищевода с левым главным бронхом. Поэтому их иногда называют эпибронхиальными. Эти дивертикулы, как правило, имеют небольшие размеры (до 2 см), хорошо опорожняются, поэтому в течение длительного времени протекают бессимптомно. Ча
ще всего обнаруживаются случайно при рентгенологическом исследовании пищевода. Если бифуркационный дивертикул достигает значительных размеров, он может причинить значительные страдания больным (жалобы на затрудненное глотание, боли в грудной полости, отрыжку, срыгивание).
Рентгенологический метод исследования позволяет быстро и точно определить место локализации дивертикула, его форму и размеры. Как правило, дивертикул средней трети пищевода в зоне бифуркации трахеи — это конусообразное или округлое выпячивание его стенок, чаще передней или левой. Контуры дивертикула четкие, ровные, стенки эластичные. Независимо от количества попавшей в дивертикул бариевой взвеси она образует в нем горизонтальный уровень. При тракционных дивертикулах шейка отсутствует и редко задерживается бариевая взвесь, вследствие чего не часто бывает виден горизонтальный уровень. Длительная задержка бария в дивертикуле (свыше 24 часов), а также неровные контуры его, грубый рельеф слизистой, отек шейки и отсутствие сокращений стенок дивертикула свидетельствует о наличии дивертикулита.
К осложнениям бифуркационных дивертикулов относятся кровотечения, образование пищеводно-бронхиальных свищей, нагноения с образованием абсцессов.
Эпифренальные (наддиафрагмальные) дивертикулы чаще всего исходят из ампулы пищевода или из участка, расположенного непосредственно над ампулой или несколько проксимальнее ее. Характерные клинические признаки их: отрыжка, изжога, рвота, боли в области подреберий или эпигастрии. У некоторых больных жалобы могут отсутствовать. Рентгенодиагностика эпифре-нального дивертикула не вызывает особых затруднений. В большинстве
45. Дивертикул пищевода.
случаев он располагается на 2—10 см выше диафрагмы. Форма дивертикула шарообразная или грибовидная, а иногда слегка удлиненная в виде мешка. Размер чаще до 2—3 см, реже — 5— 10 см. Иногда дивертикул может достигать больших размеров, занимая почти всю левую плевральную полость. Иногда в полости дивертикула над бариевой взвесью появляется пузырек воздуха. Лучшими положениями при рентгенологическом исследовании являются заднебоковое или Тренделенбурга.
В дифференциальной диагностике эпифренального дивертикула следует исключить характерную грыжу, пептическую язву пищевода, деформацию при ахалазии, изъязвленную опухоль, удвоение пищевода, кисту средостения и др.
В практике рентгенолога могут встречаться интрамуральные псевдодиверти
кулы — множественные мелкие бутылкообразные карманы в стенке пищевода глубиной 1 — 10 мм. Многие из них могут соединяться между собой фистулами и сообщаться с просветом пищевода тонкими каналами. При наличии стеноза на компьютерных томограммах обнаруживают утолщение стенки пищевода на различном протяжении, отображающее соединительнотканные рубцовые периэзофагеальные изменения.
По мнению R. A. Niekel et al. (1988),
такие интрамуральные псевдодивертикулы, вероятнее всего, являются расширенными протоками пищеводных желез, а не истинным пролабированием слизистой оболочки через мышечную стенку пищевода, как при обычных дивертикулах. При ложных дивертикулах обычно обнаруживают признаки рефлюкс-эзофагита, который считают основным этиологическим фактором возникновения псевдодивертикулеза пищевода (Gerlach et al, 1984; Lax et al., 1986; Levine et al., 1986).
Г л а в a 5. ФУНКЦИОНАЛЬНЫЕ РАССТРОЙСТВА
Нарушения функции пищевода связываются с расстройствами прежде всего нервно-рефлекторных механизмов акта глотания. В одних случаях возникает поражение блуждающего нерва, в других — нервных сплетений вокруг пищевода под влиянием интоксикаций или инфекций. Расстройства двигательной функции (дискинезии) пищевода чаще отражают общий, а не органный невроз, становятся следствием нарушения висцеро-висцеральных и ваговагальных связей при заболеваниях других органов, а иногда начальным проявлением органического заболевания.
Дискинезия пищевода сопровождается нарушением тонуса и перистальтики: гипотонией пищевода или его спазмами в виде разнообразных спастических деформаций (наподобие штопора, четок, пилы, бус и др.), атипери-стальтическими сокращениями и др. Следует различать 2 формы болезни: гипертоническую — гиперкинетическую (гиперкинезия) и гипотоническую — гипокинетическую (гипокинезия) . Парез и паралич пищевода встречаются при поражениях соединительной ткани (склеродермия), в далеко зашедших случаях ахалазии кардии,
а также при заболеваниях эндокринных органов (миастения).
Дисфагия. Общее название расстройств глотания органической или функциональной природы. Для выявления этиологической принадлежности синдрома дисфагии необходимо проводить комплексное обследование, включающее тщательный опрос, рентгенологическое исследование пассажа бария по пищеводу при глотании, эзофагоскопию и манометрию органа. Среди причин дисфагии выделяют ахалазию кардии, являющуюся результатом поражения постганглионарных нейронов межмышечного сплетения, грыжу пищеводного отверстия диафрагмы, приводящую к развитию рефлюкс-эзофагита, избирательную глоссофарингеальную недостаточность (идиопатическое выпадение устья задней части языка в акте глотания при сохранении прочих его функций), сидеропеническую дисфагию (синдром Пламмера — Винсона), «крикофарингеальный спазм» и др.
У больных дисфагией при приеме контрастная масса длительно задерживается на корне языка и в грушевидных синусах, собираясь над входом в пищевод, и поступает в него узкой струей.
Во время акта глотания бариевая взвесь нередко попадает в дыхательные пути. Нарушение акта глотания может наблюдаться в результате сужения пищевода, вызванного аномально отходящей и расположенной справа подключичной артерией. На задней, реже на передней стенке в области верхней трети грудного отдела пищевода появляется характерное вдавление (дефект наполнения) линейной или желобообразной формы шириной 1 — 1,5 см. Оно расположено поперечно или косо слева снизу, вправо и кверху и напоминает симптом «штыка» или «перелома» с небольшим захождением «отломков».
Сидеропеническая дисфагия обусловлена дистрофическими изменениями слизистой оболочки пищевода, наблюдающимися при синдроме Пламмера — Винсона. Бывает при недостатке в организме железа, обычно сочетается с желудочной ахилией и железодефицитной анемией. В начальной части пищевода, несколько ниже перстневидного хряща, на уровне С v-vn определяется узкий дефект наполнения или сужение, обусловленное мембранозной перегородкой между передней и задней стенками пищевода толщиной 2 мм. Иногда выявляются несколько втяжений в стенке пищевода, а в выраженных случаях — спазм или сужение его начальной части.
Дисфагия наблюдается при синдроме Шегрена, у больных ревматоидным артритом шейного отдела позвоночника и височно-челюстного сустава. При вертикальной дислокации на уровне С12, при деструкции головки нижней челюсти и снижении высоты ее ветви со стороны глотки рентгенологически обнаруживаются патологический наклон надгортанника, неправильное закрытие преддверия глотки, парез констриктора глотки и нескоординированность функции перстневидно-глоточной мышцы (Kjellen, Fransson, Lindstrom et al.,
4(i. Парез глотки.
1986; Ekberg, Redlung-Johnnel, Sjoblom, 1987).
У больных сахарным диабетом отмечены функциональные изменения глотки и пищевода, нарушения подвижности надгортанника и закрытия преддверия гортани с аспирацией бариевой взвеси в трахею, парез констрикторов глотки, неполное раскрытие верхнего пищеводного сфинктера и нарушения пропульсивной перистальтики пищевода (Borg-strom, Olsson, Syndkrist et al., 1988).
Дисфагия вследствие нарушения иннервации мышц, участвующих в глотании, нередко наблюдается после ваготомии, при полиомиелите, амиотрофическом боковом склерозе, сирингомиелии, бульбарном параличе, энцефалитах, опухолях головного мозга, кровоизлияниях в мозг и других заболеваниях центральной и периферической нервной системы. Дисфагия — один из первых и основных симптомов миастении, при которой рентгенологически
47. Деформации пищевода, обусловленные аномально отходите; и расположенной справа подключичной артерией.
определяются снижение тонуса и ослабление перистальтики пищевода, реже — желудочно-пищеводный рефлюкс. У многих больных миастенией отмечаются ослабление глотательных сокращений глотки и пищевода, гипотонус глоточно-пищеводного сфинктера.
Дисфагия — один из основных симптомов грыжи пищеводного отверстия диафрагмы, воспалительных, опухолевых и других заболеваний пищевода. Причиной дисфагии могут быть инородные тела, мембранозные сращения, паралич пищевода вследствие полиомиелита, болезнь Паркинсона, химические ожоги, пульсионные дивертикулы, сдавления и смещения пищевода, кровоизлияние в мозг, перелом основания черепа, опухоли мозга и другие заболевания.
Кардиоспазм. Характеризуется нарушением сократительной способности пищевода и рефлекторного раскрытия кардиального отверстия. Это приводит к затруднению поступления пищевых
масс из пищевода в желудок, d теченш и развитии заболевания важную рол. играют нервные потрясения и переживания. Клиника кардиоспазма характе ризуется триадой симптомов — дисфь гией, регургитацией и болями.
Постоянный симптом у всех болг пых — дисфагия. Вначале она период; ческая, затем становится стабильной причем зависит от эмоционального со стояния. При усталости, волнения:, возбуждении, реже без особых причин она усиливается. Если вначале боль ные отмечают легкое затруднение i прохождении пищи по пищеводу, то : развитием болезни задерживается твег дая пища, а затем и жидкая. Принят; считать, что при кардиоспазме дисфн гия возникает на третьем — четвертол глотке, а при эзофагоспазме — па пег-вом. В течении болезни отмечаются светлые промежутки, когда дисфагия полностью исчезает, однако чаще бывае постоянная дисфагия, реже — периодическая.
К основным симптомам заболевания относится и регургитация. В период небольшого расширения пищевода она наступает после приема нескольких глотков пищи на высоте затруднения глотания. Это рефлекторная регургитация. В начальном периоде болезни может быть и пищеводная рвота из-за сильных сокращений пищевода, иногда после давления на живот. С увеличением расширения пищевода регургитация становится более редкой, но и более обильной. Особо опасна ночная регургитация, так как она может быть причиной аспирации пищеводного содержимого. Проснувшись, больной обнаруживает па подушке мокрое пятно (симптом «мокрой подушки»).
Частым симптомом являются боли, предшествующие дисфагии или сопровождающие ее. Прохождение пищи в желудок или срыгивание устраняет боль. Боль, наступающая после еды, связывается с растяжением стенок пищевода или спазмом кардии. Постоянная боль за грудиной свидетельствует в основном об эзофагите или периэзофагите. Нередко у молодых людей в раннем периоде болезни имеют место болевые кризы, чаще ночью, без непосредственной причины. Боли очень сильные, иррадиируют в спину, шею, нижнюю челюсть, держатся несколько часов. Они проходят под влиянием нитроглицерина.
•У некоторых больных можно обнаружить признаки нарушения функции вегетативной нервной системы: болевые ощущения в эпигастральной области, связанные со спазмом привратника, цианотичные или бледные руки, влажные ладони. Часть больных ощущает зябкость, сердцебиение, головокружение и др. В отдельных случаях отмечается симпатикотония — расширение зрачков, сухость кожи. У ряда больных имеется повышенное слюноотделение вследствие пищеводно-слюн-
48. Кардиоспазм (вторая стадия).
ного рефлюкса, нередко бывает неприятный запах выдыхаемого воздуха.
В дагностике болезни все решает рентгенологическое исследование. Оно позволяет выявить спазм пищеводножелудочного перехода. Выделяют 4 стадии кардиоспазма: 1) при прохождении контрастного вещества по пищеводу отмечается кратковременный спазм кардии, моторика пищевода несколько усилена с возникновением сегментарных сокращений, но выраженной задержки бария в нем не отмечается,
она составляет от 15—20 с до 1 —1,5 мин. Дистальный отдел пищевода сужен, с ровными гладкими контурами, просвет не расширен, поперечник его 2—2,5 см. Газовый пузырь желудка небольшой; 2) обнаруживается более стойкий, стабильный спазм кардии, эвакуация бариевой взвеси из пищевода замедлена. Характерный рентгенологический признак — расширение грудного отдела пищевода от 2,5 до 4 см, конусообразное сужение его терминального отдела с ровными контурами, нарушение эвакуации контрастного вещества в желудок и изменение перистальтической деятельности. Это проявляется выраженными сегментарными некоординированными сокращениями преимущественно в средней и нижней трети пищевода, не обладающими пропульсивной способностью. Иногда наряду с сегментарными сокращениями выявляются и истинно перистальтические волны. Длительность задержки бария в пищеводе от 1 — 5 до 20 мин; 3) отмечается значительное (4 — 9 см), довольно равномерное расширение грудного отдела пищевода. Причем имеется некоторое его удлинение и искривление. Степень и протяженность сужения терминального отдела более выраженные, чем во II стадии. Характерен постепенный переход расширенной нижней трети пищевода в суженный терминальный отдел с гладкими контурами — конусообразное сужение терминального отдела. У большинства больных моторика пищевода усилена, глубина сегментарных сокращений, по сравнению со II стадией, уменьшается, становится поверхностной. Длительность задержки контрастного вещества — 5—20 мин и более; 4) прохождение пищи через желудочно-кишечный переход резко затруднено, что приводит к значительному расширению, удлинению и искривлению пищевода. Сегментарные сокращения отсутствуют, пищевод выглядит
широким атоничным мешком с конусовидным сужением в концевом отделе. Натощак в пищеводе обнаруживается большое количество жидкого содержимого и пищевых масс. Длительность задержки содержимого пищевода 10 — 30 мин и более.
У больных кардиоспазмом прохождение первого глотка контрастного вещества нередко свободное, а потом задерживается. Ширина струи бария при эвакуации обычно узкая. Выявить рельеф слизистой абдоминального отдела пищевода, как правило, не удается. Эвакуация бариевой взвеси не зависит от высоты столба в пищеводе, т. е. от повышенного гидростатического давления.
Кардиоспазм следует отличать от врожденной ахалазии пищевода, при которой страдает его нервно-мышечный аппарат: отсутствуют или имеются в дефиците ганглионарные аргирофильные клетки. Число аргирофобных клеток может быть нормально или уменьшено. Отсутствие либо дегенерация внутристеночных ганглионарных клеток и нервных сплетений приводит к дискоординации чрезвычайно сложных двигательных функций пищевода. Эти нарушения функций пищевода выражаются в двух видах: неспособностью нижнего пищеводного сфинктера расслабляться в ответ на глотание и неспособностью глотания вызвать нормальное сокращение гладкомышечной дистальной части пищевода.
Сужение кардиального отверстия может быть обусловлено морфологическими изменениями (опухолями, спайками и др.). Рентгенологически обнаруживают стойкий стеноз кардии (диаметр сужения менее 5 мм), супрасте-нотическое расширение пищевода, деформацию кардии и газового пузыря желудка и другие симптомы, зависящие от характера органического поражения.
Халазия кардии. Это стойкое расширение кардиального отверстия, обусловленное разными причинами и приводящее к желудочно-пищеводному рефлюксу. Проявляется отрыжкой, рвотой, признаками эзофагита.
Чаще наблюдается при аксиальных грыжах пищеводного отверстия диафрагмы, встречается также после операций, сопровождающихся резекцией или повреждением замыкательного аппарата кардии, при склеродермии и других заболеваниях. Функциональная недостаточность кардии развивается при повышении внутрижелудочного давления, гипертонусе желудка, значительном повышении внутрибрюшного давления.
Рентгенологически недостаточность функции пищеводно-желудочного перехода характеризуется его зиянием, плохим смыканием стенок, в результате чего в горизонтальном положении больного выявляется желудочно-пищеводный рефлюкс — забрасывание в пищевод желудочного содержимого. При этом грудной отдел пищевода расширяется. Во время исследования применяют различные специальные диагностические приемы: натуживание, покашливание, давление тубусом в проекции желудка и другие, вызывающие повышение внутрибрюшного давления.
Частый желудочно-пищеводный рефлюкс приводит к различным осложнениям, в первую очередь к развитию рефлюкс-эзофагита, периэзофагита, пептических язв, рубцовых сужений и др.
Дисфункция верхнего пищеводного сфинктера. Акт глотания осуществляется благодаря серии сокращений и расслаблений мускулатуры языка, гортани, глотки и пищевода. В нем значительная роль отводится верхнему пищеводному сфинктеру, который находится между глоткой и пищеводом и имеет длину от 2 до 4 см. Функцию сфинктера выполняют перстневидно-глоточная мыш-
49. Халазия кардии, желудочно-пищеводный рефлюкс.
ца и циркулярные мышечные волокна прилежащего шейного отдела пищевода. Закрытие просвета пищевода поддерживается постозщям сокращением поперечнополосатой мускулатуры стенок этого сегмента, которое в свою очередь определяется тоническими импульсами, поступающими по холинергическим нервным путям. Во время глотания эти импульсы прекращаются, мускулатура расслабляется, что позволяет верхнему пищеводному, или глоточно-пищеводному сфинктеру открыться. Таким образом, релаксация сфинктера — одно из звеньев сложного механизма глотания, который регулируется центром глотания, расположенным в стволе мозга.
Дисфункция верхнего пищеводного сфинктера может быть как нервного,
так и мышечного происхождения. Наиболее частым нервным заболеванием, вызывающим дисфункцию этого сфинктера, является поражение ствола мозга из-за закупорки задней нижней артерии мозжечка. Аналогичную дисфункцию вызывает полиомиелит, поражая центральные нервные структуры, реже — боковой амиотрофический склероз, рассеянный склероз, периферические и краниальные нейропатии смешанной этиологии.
Другую группу причин дисфункции верхнего пищеводного сфинктера составляют заболевания поперечнополосатой мускулатуры: миастения, или миастенический синдром, миотоническая дистрофия, околофарингеальная мышечная дистрофия, дерматомиозит-полимиозит и др.
Клиническая картина дисфункции верхнего пищеводного сфинктера характеризуется ротоглоточной дисфагией, чувством затруднения при глотании, которое ощущается в области шеи. При этом возможны аспирация или носоглоточный рефлюкс заглатываемой пищи, регургитация пищи в полость рта, поперхивание, аэрофагия и другие симптомы.
Выделяют 2 формы функциональных расстройств глоточно-пищеводного сфинктера: гипертоническую (гиперкинетическую) и гипотоническую (гипокинетическую) дисфункции. Первая называется ахалазией верхнего пищеводного сфинктера, вторая форма — ха-лазией его.
Рентгенологическое исследование больных ахалазией сфинктера, особенно в боковой проекции, позволяет выявить в устье пищевода дефект наполнения, обусловленный спазмированной перстневидно-глоточной мышцей, наполнение грушевидных синусов, растяжение глотки контрастной массой. Бариевая взвесь узкой струей проходит в пищевод. У этой группы больных
нередко из-за дискоординации сокращений глотки и расслаблений верхнего пищеводного сфинктера возникает глоточно-пищеводный, или ценкеров, дивертикул.
У больных халазией верхнего пищеводного сфинктера отсутствует сокращение его в промежутках между глотательными движениями. Рентгенологически выявляют зияние глоточно-пищеводного перехода между глотаниями, неспадение стенок, ослабление или полное отсутствие перистальтики в шейном отделе пищевода, попадание бариевой взвеси в гортань и трахею. Из-за расслабления мускулатуры глотки и устья пищевода в грушевидных синусах и валлекулах долго задерживается контрастное вещество (Erberg et al., 1985).
Эзофагоспазм. Термин применяется для обозначения нарушения сократительной функции гладкой мускулатуры пищевода в виде усиления его тонуса и моторики вне акта глотания. Нарушение заключается в том, что вместо единичного пропульсивного сокращения происходит одновременное сокращение всего гладкомышечного сегмента или непоследовательное сокращение различных участков пищевода.
По мнению Christensen (1988), такое сокращение может отличаться от нормального более высокой амплитудой или большей длительностью, доходящей до 30 с. Таким образом, утрата пропульсивного характера возбуждаемых глотанием сокращений пищевода — главный признак диффузного эзофагоспазма.
Причины заболевания полностью не установлены. В одних случаях они связываются с инфекционно-аллергическим механизмом, в других — с рефлекторным. Существенное влияние на возникновение и течение болезни оказывают отрицательные эмоции, страх, беспокойство. К эзофагоспазму предрасполагают поспешная еда, курение, злоупотребление алкоголем, употреб
ление острой, слишком горячей или слишком холодной пищи и др.
Клиническая картина складывается из немногочисленных признаков: дисфагии, которая воспринимается больным как ощущение задержки пищи в пищеводе, загрудинного «кома», сдавления и нередко сопровождается острой болью в глотке, за грудиной или в межлопаточной области. Иногда спазм пищевода может возникнуть вне приема пищи, во время работы, прогулки или в спокойном состоянии. Если приступ сопровождается болью за грудиной, он нередко расценивается как приступ стенокардии.
Эзофагоспазм может быть первичным, если протекает на фоне неврозов (особенно вегетативных форм). Вторичный же спазм пищевода (симптоматический) имеет место при наличии инородного тела в пищеводе (рыбья кость), травмы, воспалительного процесса (эзофагит) .
Рентгенологическая картина характеризуется локальной фрагментацией пищевода, при которой выявляют 5 разновидностей спазма: пилообразный, волнообразный, клиновидный, четко-и штопорообразный. По протяженности сужение бывает коротким (менее 1 см) и длинным диффузным (более 6 см). Сократившийся участок имеет четкие и ровные контуры и эластичные стенки. Почти постоянный признак эзофаго-спазма — кратковременное нарушение проходимости пищевода. Длительность спазма различна и колеблется от 1—2 до 10—15 с. Перистальтика пищевода неравномерная и нерегулярная. Из-за эзофагоспазма задержка жидкой бариевой взвеси наступает на 3—5 и густой — на 10—15 с на ограниченном участке пищевода длиной 2—5 см. Здесь нередко видны маятникообразные движения контрастного вещества, получившие название «танец контрастного вещества». Спастические сокращения циркуляр-
50. Штопорообразный пищевод при синдроме
Баршоня — Тешендорфа.
ных мышц пищевода придают ему че’ кообразный вид (штопорообразныг пищевод), который наблюдается npi синдроме Баршоня — Тешендорфа. Этг изменения особенно хорошо видны г нижних двух третях пищевода.
Течение эзофагоспазма может быт. длительным (до 15 лет). В большинства случаев заболевание проявляется в фог ме кратковременных неприятных эш-зодов, возникающих после переуток-ления, интоксикации, стрессов, недось пания. Трудоспособность, как правиле не нарушается. Осложнений не наблю
дается. Прогноз для жизни благоприятный.
Парез и паралич пищевода. Такое состояние возникает при поражении нервных механизмов регуляции функции пищевода. В одних случаях оно имеет центральное происхождение и наблюдается при нарушениях мозгового кровообращения, травмах черепа, опухолях головного мозга, сифилисе, энцефалите, сирингомиелите, полиомиелите и др. В других случаях парез и паралич пищевода развиваются вследствие поражения блуждающего нерва и нервных сплетений пищевода. Причиной могут быть склеродермия, миастения, интоксикация при ботулизме, алкоголизме, дифтерии и других инфекциях.
Вследствие потери тонуса мышц и нарушения перистальтических движений пищевода развивается дисфагия, а при снижении чувствительности слизистой оболочки глотки нарушаются глотательный и рвотный рефлексы, пища поступает в гортань, аспирируется в легкие и вызывает аспирационные пневмонии.
Клиническая картина зависит от степени поражения иннервации пищевода, наличия аналогичных изменений в глотке, степени сохранности тонуса глоточно-пищеводного и кардиального сфинктеров и ряда других причин. Определенное диагностическое значение имеет регургитация пищи при наклоне туловища или в положении лежа.
Рентгенологическое исследование с
приемом контрастного вещества выявляет расслабление тонуса мускулатуры глотки с длительным заполнением грушевидных синусов и валлекул бариевой взвесью, зияние устья, гипотонию мышц пищевода в нижнем его отрезке, не-спадение стенок. Из-за расслабления и зияния кардии наступает регургитация контрастного вещества из желудка. Часто это состояние сопровождают грыжи пищеводного отверстия диафрагмы.
Для пареза пищевода характерны также другие симптомы: расширение просвета его более 3 см, задержка контраста не менее 7—10 мин, картина «бариевого столба» высотой 3—15 см, симптом аэроэзофагита в течение 1—3 мин после эвакуации контраста, избыточная складчатость слизистой оболочки (4—5 складок вместо 2—3), отсутствие формирования ампулы пищевода, извитость и изгибы пищевода, резкое ослабление или отсутствие перистальтики (симптом «пропульсивной немощи пищевода»).
Кардиоэзофагеальная недостаточность с регургитацией желудочного содержимого приводит к развитию эзофагита, иногда геморрагического, который может осложняться кровотечениями. Гипокинезия пищевода и эзофагит образуют «порочный круг», взаимно усугубляя клиническую картину. Парез и паралич пищевода жизни больного не угрожают. Лечение их должно быть направлено прежде всего на устранение основного заболевания.
Г л а в а 6. ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ
В группу воспалительных заболеваний пищевода входят эзофагиты, пептическая язва пищевода, рефлюкс-эзофагит, абсцесс и флегмона пищевода.
Эзофагиты. Воспаление слизистой оболочки пищевода — одно из распро
страненных заболеваний. Различают острый и хронический эзофагит. Как первичное изолированное заболевание наблюдается редко. Чаще эзофагиты бывают вторичными, сопутствующими тем или иным более серьезным заболеваниям пищевода или других орга-
51. Рентгенологическая картина рефлюкс-эзофагита (варианты а, б).
нов либо осложняющими течение тяжелых инфекционных заболеваний.
Клинические проявления эзофагита зависят от этиопатогенетических факторов и течения его. При остром эзофагите больные жалуются на боль за грудиной, усиливающуюся при глотании, иногда отмечается дисфагия. Характерны обильное слюнотечение, часто тягостное для больного, отрыжка, срыгивание проглоченной пищей, слизью, иногда с примесью крови. Если эзофагит хронический, возникают жжение, боли за грудиной или у мечевидного отростка, которые могут иррадиировать в спину или в область сердца, напоминая стенокардию. Как правило, боли резко усиливаются при приеме грубой или горячей пищи и жидкости.
Эндоскопия — один из ведущих методов диагностики. С помощью ее можно распознать 4 стадии эзофагита: 1) отек и артериальная гиперемия слизистой оболочки, обилие слизи; 2) появление одиночных эрозий на вершинах отечных складок слизистой; 3) значительный отек и гиперемия с очагами эрозиро-ванной и кровоточащей слизистой; 4) «плачущая» слизистая оболочка диф
фузно эрозирована, кровоточит при малейшем прикосновении эндоскопа.
Рентгенологическая картина эзофагитов разнообразная. Так, при остром катаральном эзофагите обнаруживают нарушение двигательной функции пищевода, неровность его контуров, сма-занность складок слизистой из-за наличия слизи в просвете пищевода. При эрозивном гастрите также отмечается обилие слизи, перестройка рельефа слизистой с образованием плоских депо бария продольной формы длиной до 1 см преимущественно в дистальной трети пищевода.
Наиболее часто встречается хронический эзофагит, при рентгенологическом исследовании которого выявляются изменение рельефа слизистой, неровные контуры пораженного отдела, замедленное прохождение контрастной массы, ослабление перистальтики. Пептический (или язвенный) эзофагит проявляется желудочно-пищеводным рефлюксом, отечностью, наличием эрозий, язв, грубых складок слизистой, неровностью контуров, деформацией, укорочением пищевода, спазмом его дистального отдела. При периэзофагите на
блюдается укорочение пищевода, вследствие чего часть желудка через пищеводное отверстие втягивается в заднее средостение.
Особый интерес представляет воспаление слизистой оболочки пищевода, обусловленное гастроэзофагеальным рефлюксом и проявляющееся загрудинными болями и изжогой. Это рефлюкс-эзофагит, в развитии которого выделяют 4 стадии. Для эзофагита I стадии чувствительность рентгенологического исследования составляет 50 %, Пстадии — 70, III - 85, IV стадии - 100 %. Рентгенологические признаки рефлюкс -эзофагита: спазм в кардиальном сегменте, отсутствие или снижение амплитуды перистальтики в дистальной половине пищевода, задержка или замедление продвижения бариевой взвеси, локальное или диффузное утолщение пищеводной стенки, недостаточная эластичность с ригидностью пораженной стенки, регургитация содержимого желудка в пищевод, изъязвления и стриктуры в дистальном отделе пищевода, деформации и псевдодивертикулы, наличие фиксированных поперечных складок шириной 2—5 мм, грыжа пищеводного отверстия диафрагмы.
Язва пищевода. Встречается довольно часто. Поражает чаще лиц среднего и пожилого возраста, причем мужчины болеют в 4—5 раз чаще женщин. Язва пищевода проявляется дефектом слизистой оболочки пищевода и подлежащих тканей, процессы заживления которого нарушены или очень замедлены. Чаще встречается одиночная язва, реже — множественные. В развитии язв пищевода важную роль играет забрасывание кислого содержимого желудка в пищевод при желудочно-пищеводном рефлюксе.
Клинические признаки язвы пищевода многообразны. Она может симулировать многие заболевания. Основные жалобы больных: боли за грудиной или
в эпигастральной области, дисфагия, рвота, изжога, кровотечения. Наиболее важный симптом — боль в области мечевидного отростка, возникающая и усиливающаяся во время еды, особенно в положении лежа. Иногда боли появляются через 10—30 мин после еды на высоте пищеварения. Дисфагия связывается со спазмом пищевода, но может быть обусловлена рубцовым сужением кардии.
Рентгенологическая картина язвы пищевода довольно характерна: ниша на контуре или рельефе в виде остаточного пятна бариевой взвеси. В большинстве случаев ниша локализуется в надкардиальном отделе пищевода. Форма ее округлая или слегка продолговатая. Размеры ее чаще 0,2—2 см. Язва обычно неглубокая, но нередко напоминает эпифренальный дивертикул. Могут наблюдаться «целующиеся» язвы. Часто определяется дефект наполнения вокруг язвы — вал, окружающий ее, анатомическим субстратом которого является отек и спазм. Контуры ниши и вала обычно ровные и четкие, при рубцующихся язвах контуры могут быть неровными. Язву почти всегда сопровождают признаки гиперкинезии пищевода и рефлюкс-эзофагита и очень часто — хиатальная грыжа.
Язву, которая располагается в дистальном отделе пищевода над грыжей, называют язвой Квинке, язву мешка грыжи — язвой Кея, а язву ворот грыжи — язвой-«всадником» («сидящей верхом» язвой). Конвергенция складок к нише непостоянна, велико значение сохранности складок вблизи язвы. Как правило, имеет место сопутствующий язве спазм противоположной стенки или дистального отдела пищевода. Выше язвы может определяться супра-стенотическое расширение просвета пищевода.
После заживления истинной пептической язвы пищевода остается ли
нейный или звездчатый рубец либо грубая дивертикулоподобная деформация стенки и сужение просвета (стриктура) пищевода.
При развитии стриктуры пищевода выявляется циркулярное сужение просвета с четкими ровными или неровными контурами. Различают короткие (до 2 см) и длинные (2—6 см) стриктуры. Рубцово-воспалительный процесс в стенке пищевода нередко приводит также к его укорочению («приобретенный короткий пищевод»). В практике встречаются и незаживающие хронические, часто рецидивирующие язвы.
Одно из наиболее тяжелых осложнений — перфорация пищевода чаще в средостение и реже — в левую плевральную полость, аорту. Язва пищевода часто осложняется внезапным и сильным кровотечением, при котором изо рта выделяется алая кровь «струей» или «фонтаном». При заглатывании крови возможна рвота, и рвотные массы могут частично или полностью приобретать вид кофейной гущи. Такое же кровотечение бывает и при синдроме Маллори — Вейсса. Оно обусловлено разрывами слизистой оболочки брюшного отдела пищевода и кардиальной части желудка при упорной рецидивирующей рвоте. Рентгенологически проявляется стойкой задержкой контрастного вещества в местах разрывов слизистой оболочки и наличием контрастного депо бариевой взвеси линейной, округлой или неправильно-овальной формы. В зоне разрыва слизистой обнаруживается ее отек и спазм пищевода. Если разрыв распространяется на подслизистый слой, можно определить на контуре остроконечную нишу.
Течение язвы пищевода длительное и цикличное. Все больные должны находиться на диспансерном учете и дважды в год, в начале весны и осени, обследоваться у врача.
52. Язва пищевода:
а — под диафрагмой; б — над диафрагмой; в - средняя треть пищевода с пенетрацисй в средостение.
Абсцесс и флегмона пищевода. Возникают чаще всего вокруг внедрившегося в стенку пищевода инородного тела. Излюбленным местом является задняя стенка шейного отдела. Они могут быть следствием повреждения слизистой инструментами, эзофагита, осложнением
воспалительных заболеваний полости рта, лимфатических узлов, средостения, позвоночника и других органов. Воспалительный процесс развивается в подслизистом слое пищевода и может носить местный (ограниченный) и диффузный характер.
Клиническая картина зависит от распространенности процесса. При ограниченном воспалении процесс локализуется чаще всего в верхней части пищевода. При этом больные жалуются на резкие боли в шее или в верхнем загрудинном отделе, дисфагию и повышение температуры тела. Общее состояние страдает мало. Если гнойник прорывается в просвет пищевода, воспалительный процесс стихает, а полость абсцесса облитерируется.
Однако бывают случаи, когда воспалительный процесс принимает диффузное распространение вдоль стенки пищевода и вглубь, в сторону средостения, с образованием периэзофагита и медиастинита. Основные симптомы развивающейся флегмоны пищевода: сильные загрудинные боли или боли в области шеи и спины, усиливающиеся при глотании, а также дисфагия, саливация и рвота. Во время рвоты может отторгаться омертвевшая слизистая оболочка, ощущаться гнилостный запах изо рта. Температура тела повышается, сопровождается потрясающими ознобами и проливными потами. Состояние боль
ного тяжелое. В крови высокий лейкоцитоз. Имеется припухлость шеи. Движения головы ограничены из-за резкой боли.
Если воспалительный процесс переходит на средостение, состояние больного резко ухудшается, нарастают одышка и дисфагия, развивается недостаточность сердечной деятельности.
Рентгенологическая картина абсцесса пищевода характеризуется наличием дефекта наполнения овальной или округлой формы с четкими и гладкими контурами, размером до 2—4 см. Складки слизистой оттеснены, как бы огибают образование со всех сторон. Перистальтика в зоне поражения чаще сохранена, но может и не прослеживаться. При флегмоне пищевода отмечается некоторое сужение просвета, складки слизистой сглажены или отсутствуют, сама слизистая изъязвляется, контуры пищевода становятся неровными. В случае развития медиастинита иногда можно обнаружить расширение тени средостения, увеличение расстояния между позвоночником и пищеводом. Нередко можно выявить жидкость в плевральной области. В поздних стадиях заболевания наступает некроз слизистой оболочки и развиваются обширные язвы пищевода, которые рентгенологически выглядят как депо бариевой массы неправильной формы и различной величины.
Глава 7. ОПУХОЛЕВЫЕ ЗАБОЛЕВАНИЯ
Опухоли пищевода подразделяются на доброкачественные и злокачественные. К доброкачественным относятся лейомиомы, полипы, кисты и др. Они встречаются сравнительно редко. Злокачественные опухоли — это рак и саркома. Могут быть первичные опухоли пищевода, исходящие из его тканей, и вторичные, метастатические.
Рак пищевода. Согласно литературным данным и нашим наблюдениям,
рак пищевода по частоте занимает третье место среди злокачественных новообразований пищеварительного тракта, уступая раку желудка и толстой кишки. Ежегодная летальность от него в регионах мира колеблется от 1,9 до 87,5 случаев и более на 100 000 населения. Самая низкая летальность в Беларуси, самая высокая — в Гурьевской области Казахстана, в Якутии и Бурятии. Ежегодная летальность от рака пищевода
никновения рака пищевода до его первых клинических проявлений проходит обычно 1 — 2 года. Первую группу составляют признаки, вызванные сужением просвета пищевода, нарушением его проходимости и инфильтрацией стенки пищевода опухолью. Самым частым первым и нередко единственным симптомом рака служит дисфагия, затем появляется боль за грудиной во время глотания. И все же более характерный симптом — ощущение кома за грудиной, как при инородных телах. Ранним симптомом рака пищевода является усиленное слюнотечение, интенсивность которого прямо пропорциональна степени сужения пищевода.
К признакам далеко зашедшего ракового процесса относятся: постоянная отрыжка воздухом или пищей, кашель при глотании, осиплость голоса, быст-[ рое похудание, пищеводная рвота (иногда кровавая), открытое кровотечение, увеличение надключичных лимфатических узлов. Эта опухоль, обладая злокачественным ростом, прорастает соседние ткани и органы, быстро суживает пищевод, распадается, дает мета- стазы и приводит к высокой интоксикации и прогрессирующему истощению больного. В результате интоксикации больные легко устают, теряют интерес к окружающему, к выпоняемой работе. У них повышена раздражительность, плохой сон. У части больных появляется лихорадка. В результате прорастания опухоли нижней и средней части пищевода в трахею, бронхи и ее распада образуется соустье между этими органами. При проглатывании жидкой пищи у больных с пищеводно-бронхиальным свищом появляется сильный кашель. В случае прорастания опухоли । в легкое и плевру больные жалуются на боли в грудной клетке, повышение температуры и др. У них могут возникнуть пневмония, абсцесс легкого, эмпиема плевры. Результатом прораста-
в Китае — 31,7 для мужчин и 15,9 для женщин. Из стран Центральной Азии более высокая заболеваемость раком пищевода отмечается в районах Ирана, Афганистана и Турции. Среди стран Карибского бассейна раком пищевода часто болеют в Пуэрто-Рико. Высокая заболеваемость раком пищевода в странах Южной Африки (до 40 случаев на каждые 100 000 населения). Во Франции ежегодный показатель летальности от рака пищевода у мужчин составляет 14,1; в Италии — 8,6; Швейцарии — 7,3; Англии и Уэльсе — 5,5; Финляндии — 5,2; в США — 4,9; в Канаде — 2,6 (Day, 1984).
Подавляющее большинство больных раком пищевода (около 75 %) — лица в возрасте старше 50 лет. Мужчины заболевают раком пищевода чаще женщин. Причем в зависимости от возраста больных и местности их проживания соотношение мужчин и женщин может колебаться от 1,5:1 до 7,9:1 (Chan et aL, 1987); Тамулевичюте, Витенас, 1986; Антонович, 1987).
Рак пищевода чаще локализуется в средней его трети (внутригрудной отдел) — 50 % случаев, далее следуют нижняя треть (дистальная часть, включающая диафрагмальный и абдоминальный сегменты) — 37 и верхняя треть (шейный отдел) — 13 %. Макроскопически различают эндофитные и экзофитные раки. По гистологическому строению эндофитные формы чаще бывают плоскоклеточными, а экзофитные — аденокарциномами. Рост эндофитных опухолей сравнительно медленный, экзофитных — быстрый, размеры поражения обычно меньше и метастазы встречаются реже, чем при экзофитных.
Клинические проявления рака пищевода подразделяются на 3 основные группы: 1) симптомы поражения пищевода; 2) общие симптомы; 3) симптомы вовлечения в патологический процесс соседних органов. От момента воз-
ния опухоли могут быть также перикардит, медиастинит, кровотечение из крупных сосудов.
В зависимости от локализации опухолевого процесса в клинической картине рака пищевода имеются свои особенности. Так, для рака шейного отдела и верхней трети грудного отдела пищевода характерен симптом глоточной недостаточности, который проявляется, попаданием пищевых масс в носоглотку, дыхательные пути. Разрастающаяся опухоль сдавливает трахею и нередко вызывает синдром Бернара — Горнера. Рак средней и нижней третей грудного отдела пищевода чаще всего проявляется дисфагией или болью. Он сдавливает бронхи, трахею, аорту, вены, прорастает в плевру, перикардит. Рак диафрагмального и брюшного отделов пищевода сопровождается нарастающей дисфагией и истощением. Рак этой части пищевода принимается часто за пептическую язву. Нередко у больных этой группы наблюдается стенокардия рефлекторного происхождения, в связи с чем они могут длительно лечиться у кардиолога.
Диагностика рака пищевода основывается на данных анамнеза, клинической картины, эзофагоскопии, рентгенологического и других лучевых методов исследования. Каждому больному, жалующемуся на дисфагию, должно быть проведено рентгенологическое исследование. В случае обнаружения опухоли необходимо установить: локализацию, протяженность, наличие или отсутствие прорастания опухоли в средостение, степень сужения и величину супрастенотического расширения пищевода.
Различают 4 стадии рака пищевода: 1) опухоль в виде узла или язвы поражает слизистую оболочку и подслизистый слой; 2) опухоль не выходит за пределы стенки пищевода; 3) обширная опухоль или язва прорастает всю стенку
пищевода, переходя на окружающую клетчатку; имеются метастазы в регионарные лимфатические узлы; 4) отмечаются прорастания опухолью жизненно важных органов и отдаленные метастазы.
Рентгенологическая картина рака пищевода в зависимости от формы опухоли, стадии процесса и локализации опухоли имеет свои особенности. В ранних стадиях рака пищевода вследствие разрушения слизистой оболочки возникают ее изменения в виде беспорядочного расположения и обрыва складок слизистой. Одним из первых и ранних симптомов рака пищевода является дискинезия, обусловленная раздражением интрамурального нервного сплетения. С развитием опухоли органический компонент начинает преобладать над функциональным.
Целесообразно различать рентгенодиагностику малого и выраженного рака. К малым формам относят раки размером до 3 см. Некоторые авторы называют их карциномами суперфи-циального типа. Если опухоль имеет размер не более 1 см, ее именуют карциномой протрузионного типа (Yama-ki, Kobayaschi Maruyama et al., 1983). Рентгенологическими проявлениями такой «ранней» карциномы пищевода бывают: легкая ригидность стенки пищевода, наличие неровного контура его, мелкие округлые дефекты рельефа слизистой оболочки, исчезновение одной из складок на небольшом участке, внутрипросветные полиповидные образования, неравномерное утолщение стенки пищевода, узловатый рельеф слизистой, сужение дистального отдела пищевода. Контрастное рентгенологическое исследование с сульфатом бария позволяет правильно диагностировать раннюю стадию рака пищевода только у 70—73 % больных (Weiser, Lange, Fens-sner, 1986).
В более поздних стадиях экзофитная
53. Формы рака пищевода: а — малая; б — развитая.
форма рака рентгенологически проявляется дефектом наполнения с неровными, полициклическими контурами, с изъязвлением или без такового, патологической тенью на фоне заднего средостения соответственно расположению дефекта наполнения, ригидностью стенки пищевода (аперистальтическая зона, неподатливость стенки) в области расположения опухоли, супрастенотиче-ским расширением расположенных выше отделов при выраженном сужении просвета пищевода вдающейся опухолью.
При раке гортанной части глотки бывает нарушен акт глотания и бариевая взвесь забрасывается в дыхательные пути, наблюдается асимметричное заполнение и опорожнение валлекул и грушевидных синусов, длительная задержка в них бариевой взвеси после многократных глотательных движений. Помимо этих признаков, выявляется зияние устья пищевода с маятникообразными движениями бариевой взвеси
в глоточно-пищеводном сегменте («танец бариевой взвеси») и периодическим выбрасыванием ее в рот или аспирацией контраста в дыхательные пути.
Нередко приходится рентгенологически диагностировать рак корня языка. Наиболее эффективна методика двойного контрастирования в условиях опыта Вальсальвы. Чаще обнаруживают изъязвленный рак, который в боковой проекции представляет собой скопления контрастной массы неправильной формы, выступающие кпереди от корня языка. Обычно скопления имеют треугольную форму с основанием, обращенным кзади. У некоторых больных изъязвления могут располагаться на средней линии или вблизи ее, что видно на рентгенограммах в прямой проекции. Иногда в области края языка обнаруживают экзофитные образования, видимые лучше в боковой проекции в виде полипоидных масс, распространяющихся от корня языка в сторону задней стенки ротоглотки. На прямых рентге
нограммах определяется оттеснение нормальных анатомических структур. При подслизистом росте рака корня языка целесообразно применение КТ.
В случае низко расположенных экзофитно растущих раковых опухолей обычно наблюдается нарушение функции пищеводно-желудочного перехода из-за механического препятствия развивающегося сопутствующего эзофагита, вызывающего спазм. Иногда экзофитно растущие ойухоли, расположенные вблизи кардии, образуют клапанный механизм и резко увеличивают газовый пузырь желудка, что является косвенным признаком ракового поражения.
При эндофитно растущих опухолях пищевода основными рентгенологическими признаками являются: ригидность, отсутствие перистальтики, более или менее выраженное сужение просвета пищевода, супрастенотическое расширение, зависящее от степени выраженности и длительности существования сужения просвета пищевода, истончение или сглаженность складок слизистой оболочки, утолщение стенки пищевода на ограниченном участке соответственно расположению опухоли, мелкая зазубренность (изъеденность) контуров пораженного участка, выявляемая на рентгенограммах. Если опухоль располагается вблизи кардии, отмечается непроходимость или зияние последней. ,
Если опухоль изъязвлена, контрастная масса задерживается в язвенном кратере в виде депо бария неправильной формы с нечеткими очертаниями. Величина язвенного кратера и его форма на рентгенограммах варьируют в зависимости от размеров и глубины изъязвления, а также от степени заполнения пищевода контрастным веществом и проекции исследования. Вокруг изъязвления определяется более или менее выраженный опухолевой вал.
Чтобы установить распространенность рака пищевода на окружающие ткани, применяют методику респираторных полиграмм пищевода, которая позволяет изучить подвижность пищевода в различные фазы дыхания. Подвижность пищевода на уровне расположения опухоли указывает на отсутствие сращений его с окружающими тканями и органами средостения.
Для уточнения стадий рака пищевода и отбора неоперабельных больных применяют КТ. Эффективность предоперационной диагностики рака пищевода с помощью КТ варьирует от 55 до 100 %. При этом точность диагностики во многом определяется опытом специалиста, проводящего исследование. Практика показывает, что примерно у 80 % больных стадия опухоли, установленная при КТ, соответствует операционным и патологоанатомическим данным.
С помощью сравнения данных обычного рентгенологического исследования и КТ нами установлено, что при опухолях до 8 см длиной поражение медиастинальных лимфатических узлов имеется у 71,9 %, абдоминальных — у 48,3, периэзофагиальная инфильтрация выявляется у 81 и поражение соседних органов — у 59 % больных. При размерах новообразования более 8 см эти показатели составляют соответственно 65, 66, 90 и 81 %. Если имеется рентгенологический симптом углового смещения оси пищевода, периэзофаге-альная инфильтрация выявляется у 89 % больных, поражение соседних органов — у 73 %, без данного симптома — соответственно у 73 и 53 %.
КТ доказано, что опухоль средней трети пищевода вызывает периэзофаге-альную инфильтрацию у 90,3 % больных, при наличии выраженного стеноза просвета пищевода — у 76,9, а при свободном прохождении бариевой взвеси — у 46,7 %. Все новообразования длиной 8 см с осевым изгибом сопро
вождаются поражением абдоминальных лимфатических узлов (Schild et al., 1984).
В дагностике раковой инфильтрации целесообразно использовать и метод МРТ. Но для общепринятой предоперационной диагностики рака пищевода его пока рекомендовать нельзя (Weiser, Lange, Feussner, 1986; Salohen et al., 1987).
В раннем выявлении рака пищевода высокоэффективно ЭУЗИ. Оно дает возможность уточнить распространенность процесса, степень околопищевод-ной инвазии, провести дифференциацию от других заболеваний средостения. Применение УЗИ во время эндоскопии позволяет диагностировать глубину опухолевой инвазии пищевода, определить стадию рака пищевода и решить вопрос об операбельности. Точность диагностики глубины инвазии ЭУЗИ составляет 75 % (Dancygier et al., 1986; Weiser et al., 1986; Takemoto et al., 1986).
Прогноз рака пищевода плохой — 5-летняя выживаемость составляет 3 — 5 % (Weiser et al., 1986; Salone et al., 1987). Но если рак своевременно диагностирован и оперирован, выживаемость больных ранним раком пищевода может быть высокая: 90 % больных живут 5 и более лет (Levine, Dillon et aL, 1987).
Саркома пищевода. Встречается редко. Частота ее колеблется от 0,013 до 0,04 % случаев заболеваний пищевода. Основное клиническое проявление болезни — дисфагия. В далеко зашедшей стадии появляется боль за грудиной или в верхнем эпигастрии. Среди других симптомов отмечаются слабость, нарастающая потеря массы тела, кровотечение, анемизация.
Во время рентгенологического исследования обнаруживают диффузную (инфильтрирующую) либо полипозную формы саркомы пищевода. Диффузная саркома вызывает циркулярное сужение
пищевода, или циркулярный дефект наполнения. Пищевод в месте поражения представляется более или менее равномерно суженной трубкой с небольшими неровностями ее контуров. При полипозной форме в просвете пищевода выявляются большого размера четко очерченные множественные дефекты наполнения, расположенные на некотором расстоянии друг от друга. На этапе отсутствия инвазии в мышечный слой перистальтика сохранена.
Обнаружение с помощью рентгенологического контрастного исследования пищевода изолированного поражения большой протяженности, плоских и многочисленных изъязвлений, отсутствие супрастенотического расширения при сохранении эластичности стенок дают право врачу-рентгенологу заподозрить саркому пищевода. Окончательный диагноз обычно устанавливается при гистологическом исследовании био-птата.
Лейомиома пищевода. Среди доброкачественных опухолей пищевода ведущее место принадлежит лейомиоме: почти 70 % случаев. Лейомиома возникает из гладких мышечных волокон пищевода. Выделяют 3 типа лейомиом: 1) солитарно-нодозные; 2) множественно-нодулярные; 3) диффузный лейо-миоматоз. Локализуются лейомиомы в основном в нижней трети пищевода. Они имеют экстра- или интрамуральный рост. Небольшие опухоли чаще протекают бессимптомно и обнаруживаются случайно во время исследования или операции.
Лейомиома пищевода рентгенологически проявляется дефектом наполнения овальной формы с четкими, но не всегда ровными контурами, имеющим широкое основание, которое постепенно, без резких границ переходит в нормальную стенку пищевода. Рельеф слизистой сохранен, однако ее складки вследствие растяжения внутристеночно растущей
54. Саркома пищевода:
а — отсутствие супрастеиотического расширения; б — плоское изъязвление; в — полипоподо.-ные дефекты наполнения.
опухолью чаще всего уменьшены в калибре. Основная особенность лейомиомы — симптом двух полуовалов (опухолевых половинок), из которых один соответствует внутрипросветной части опухоли, а другой — медиастинальной. Встречается подковообразная лейомиома, дающая картину муфты или симптом перекреста контуров. Холмистая лейомиома может симулировать ложную картину изъязвления или рака пищевода, когда бариевая взвесь проникает в ложбинки и карманы крупнобугристой опухоли. При лейомиомах сохраняются эластичность и подвижность стенок.
Кисты пищевода. По частоте встречаемости среди доброкачественных опухолей занимают второе место, пропуская вперед лейомиому. Кисты пищевода возникают из переднего отдела кишечной трубки зародыша в период образования трахеопищеводной перегородки при отщеплении групп клеток или дивертикулоподобных вытягиваний. Стенка кисты состоит из соединительной ткани, которая внутри выстлана эпителием и содержит жидкость.
В зависимости от происхождения кисты пищевода делятся на ретенционные, редупликационные, энтерогенные, бронхогенные, дермоидные, паразитарные; выделяют кистозный, или фолликулярный, эзофагит и кисты, образующиеся из островков желудочной слизистой оболочки. Кисты пищевода встречаются в возрасте 30—50 лет и локализуются преимущественно в области бифуркации трахеи и ниже.
При рентгенологическом исследовании выявляют характерные симптомы обтекания бариевой взвесью дефекта наполнения с гладкими, четкими контурами. Если киста значительных размеров, имеют место различной степени обструкции, а также полулунные дефекты наполнения с гладкими контурами. В процессе исследования форма
55. Лейомиома пищевода.
кисты меняется в различные фазы дыхания и при париетографии. Мелкие кисты с помощью рентгенологическоп исследования не определяются. Что кг сается редупликационных кист, образе вавшихся в результате удвоения стеь ки, они обнаруживаются в виде долог нительного образования в средостении Дифференциальную диагностику доброкачественных опухолей и кист пищевода в ряде случаев осуществить нс возможно.
Невринома пищевода. Представляв" большую редкость. Растет в просве пищевода и может достигать больши: размеров. Если имеет ножку, смещается. При рентгенологическом исследовании — это дефект наполнения с четким! и чаще всего ровными контурами. В мес
те опухоли пищевод веретенообразно расширен, эластичность стенок сохранена. Спускаясь книзу, опухоль может закупорить просвет пищевода и вызвать его непроходимость.
Полипы пищевода. Эти доброкачественные эпителиальные опухоли встречаются редко. Основным клиническим симптомом полипа является перемежающаяся дисфагия, длящаяся годами. Полип обычно имеет ножку, что позволяет ему перемещаться в просвете пищевода вплоть до выпадения в полость рта или в просвет желудка при соответствующей локализации.
Рентгенологические признаки: солитарный дефект наполнения округлой или овальной формы размером не более 2—3 см с ровными и четкими контурами, подвижность при глотании, сохраненный рельеф слизистой оболочки с симптомами «обтекания», «оттеснения» в области опухоли, истончение складок, четкость границы между опухолью и нормальной слизистой оболочкой, сохранение эластичности стенок в области опухоли, хорошая перистальтика, иногда гиперкинезия. В трудных случаях диагностики показано комплексное рентгеноэндоскопическое исследование с биопсией.
Метастатическое поражение пищевода. Метастазирование в пищевод, по данным вскрытий, отмечается в 3 % случаев. Наиболее часто лимфогенно метастазируют в пищевод опухоли желудка,
легких и молочной железы, значительно реже — опухоли щитовидной железы, почек, шейки матки, печени и других органов. Вторичное поражение пищевода развивается и вследствие прямой инвазии опухолью, в результате лимфатического распространения опухоли и метастазирования по кровеносным путям. Внутристеночное лимфогенное местное метастазирование процесса возможно при раке самого пищевода. В последнем случае такое метастазирование вызывает короткие сегментарные стенозы пищевода, подобные раку. Лимфогенное же распространение опухоли приводит к полиповидным опухолевым образованиям с достаточно гладкой поверхностью. По мере прогрессирования опухоли с увеличением ее размеров появляется центральное изъязвление метастатического образования. При поражении опухолью субмукозных лимфоузлов можно выявить варикозоподобные дефекты наполнения. Проводя дифференциальную диагностику полипоидных лимфатических метастазов, следует иметь в виду первичную карциному пищевода, доброкачественную опухоль, воспалительный процесс на фоне полипа.
Диагностика облегчается при наличии достоверно установленных первичной опухоли и множественных метастазов в другие органы. Окончательный диагноз формируется после гистологического исследования опухоли.
Глава 8. СПЕЦИФИЧЕСКИЕ ПОРАЖЕНИЯ
Специфические поражения пищевода включают группу грибковых поражений (актиномикоз, бластомикоз и кандидоз) и группу специфических воспалительных заболеваний (туберкулез, сифилис пищевода и стенозирующий гранулематозный эзофагит (болезнь Крона)).
Актиномикоз пищевода. Вызывается актиномицетами и характеризуется гранулематозным поражением стенки пищевода с развитием плотных инфильтратов, образованием абсцессов, свищей и рубцов. Первичное заражение пищевода грибком возможно при повреждении его слизистой оболочки (травма,
ожог, эзофагит и др.). Как правило, актиномикоз пищевода чаще бывает вторичным при распространении процесса с соседних органов.
Клинические проявления актиномикоза пищевода малоспецифичны. Заболевание проявляется дисфагией.
Рентгенологически выявляют деструктивные изменения в виде изъязвлений, функциональные расстройства, атипизм рельефа, ригидность складок, свищи. Диагноз подтверждается эндоскопией, бактериологическим исследованием и микроскопией слизи и гноя, иммунологическими реакциями и другими пробами.
Бластомикоз пищевода. Относится к глубоким микозам, возбудителями которых являются дрожжевые и дрожжеподобные грибки. Наибольшее распространение имеют бластомикоз Гилкриста (североамериканский) и паракок-цидиоидоз (южноамериканский). Они проявляются гранулематозом, образованием в стенке пищевода папул и плотных инфильтратов и их изъязвлениями. Возможно образование свищей, перфораций с развитием нагноительных осложнений. Клинически бластомикоз пищевода проявляется дисфагией. Рентгенологическое исследование позволяет обнаружить признаки язвенного эзофагита с атипизмом рельефа слизистой и функциональными расстройствами.
Диагноз устанавливается на основе эндоскопии, гистологически и бактериологически, а также с помощью реакции агглютинации и аллергических проб с антигенами из культуры гриба.
Кандидоз пищевода. Занимает первое место среди грибковых поражений пищевода. Заражение происходит эндогенным и экзогенным путем. Кандидоз может быть локальным или генерализованным. Чаще всего развивается у ослабленных и истощенных больных при длительном применении антибиоти
ков широкого спектра действия. Предрасполагает к возникновению кандидоза также одновременное применение стероидных гормонов.
Клинически заподозрить кандидоз можно, если у больного, принимающего антибиотики, возникли боли при глотании, рвота с выделением пленок, характерные изменения языка и полости рта.
Рентгенологическое исследование выявляет со стороны пищевода дистонию, ригидность стенок, перестройку рельефа слизистой и только в отдельных случаях видны мелкие псевдополипоз-ные изменения. Исследование с двойным контрастированием обеспечивает диагностику у 88 %, а при однократном контрастировании правильный диагноз устанавливается только у 55 % больных (Levine, Macones et al., 1985).
При прогрессировании кандидоза обнаруживают бляшковидные образования на контуре и рельефе, даже закупорку пищевода грибковым телом, утолщение складок слизистой, изъязвления, локальные сужения (требующие дифференциальной диагностики с карциномой пищевода), пищеводнобронхиальную фистулу с развитием абсцесса легкого, псевдодивертикулы пищевода. В поздних стадиях заболевания развивается укорочение пищевода. Основание для окончательного диагноза — обнаружение в мазках со стенки пищевода характерных скоплений спор и нитчатых переплетений гриба (Agha, 1984).
Туберкулез пищевода. Может быть первичным и вторичным. Первичное поражение встречается редко. Чаще туберкулез пищевода возникает вторично при далеко зашедшем туберкулезе легких, лимфатических узлов средостения, позвоночника и других органов. Туберкулезное поражение обычно локализуется в средней и реже в верхней третях пищевода. Различают язвенную, гипер
трофическую (склерозирующую) и смешанные формы заболевания.
Клиническая картина туберкулеза пищевода чаще характеризуется болевым дисфагическим синдромом, реже бывает стертой.
Рентгенологическое исследование при первичном поражении выявляет диффузный эрозивный эзофагит. При гипертрофической форме туберкулеза пищевода развивается его сужение. Поражение носит локальный характер, имеют место деформация стенок, сглаженность складок, изъеденность контуров. При смешанной язвенно-склеротической форме сочетаются признаки двух форм туберкулеза. На фоне склеротических изменений определяются овальные неглубокие нишевые образования с неравномерным воспалительным валом вокруг. Склеротическую форму туберкулеза всегда сопровождает фибропластический периэзофагит. Диагностика облегчается наличием па-раэзофагеальных кальцинатов и поражения легких. Наиболее частые осложнения туберкулеза пищевода — тракционные бифуркационные дивертикулы и дивертикулиты, различного рода фистулы, гнойный медиастинит, кровотечения. •
Сифилис пищевода. Довольно редкое заболевание. Сифилис встречается в язвенной и стенозирующей формах. Сифилитическое поражение чаще локализуется в верхней и средней частях пищевода.
Клинически сифилис пищевода проявляется болями за грудиной и прогрессирующей дисфагией.
Рентгенологическая картина зависит от формы сифилиса пищевода. При наличии гумм в пищеводе отмечаются краевые ограниченные дефекты наполнения, неровность контуров и ригидность стенок. Наиболее часто сифилитические изменения проявляются в виде
циркулярной инфильтрации стенок протяженностью 5—10 см. Складки слизистой оболочки и перистальтика исчезают. При изъязвлении гумм определяются плоские и длинные депо контрастного вещества или округлые сифилитические ниши. После рубцевания язв обнаруживаются звездчатые рубцы и сужения просвета пищевода. Нередко образуются фистулы с другими органами.
Диагноз сифилиса пищевода основывается на результатах полного клинического обследования, эзофагоскопии с биопсией, положительной серологической реакции Вассермана.
Болезнь Крона (стенозирующий гранулематозный эзофагит). Встречается редко. Поражает в основном лиц молодого возраста. Различают отечную, язвенную, псевдополипозную и стенозирующую формы заболевания. Клиническая картина поражения пищевода зависит от глубины и протяженности поражения органа. Наиболее ранний признак — нарастающая дисфагия, а в поздних стадиях — непроходимость.
Рентгенологическая картина зависит от стадии заболевания. На ранней стадии выявляют неровные контуры, ригидность стенок, складки слизистой утолщены. Имеют место увеличенные лимфатические узлы средостения. Позднее, с развитием процесса, появляются поверхностные изъязвления и даже свищи. В более выраженных случаях обнаруживаются стриктуры, утолщение стенки пищевода, укорочение его, сращения с клетчаткой средостения и выраженная аденопатия на уровне стеноза пищевода.
Диагноз ставится на основе комплексного обследования: клинических и рентгенологических данных, эзофагоскопии с биопсией (Freson, Kottler, Wright, 1984).
Г л а в а 9. ИНОРОДНЫЕ ТЕЛА И ПОВРЕЖДЕНИЯ
Проглоченные инородные вещества и застрявшие в пищеводе, а также повреждения последнего требуют экстренной помощи пострадавшим. В связи с этим возникает необходимость и неотложной диагностики. В этом плане рентгенологическому исследованию придается основное диагностическое значение. Выбор объема и методики рентгенологического исследования должен быть индивидуальным в зависимости от общего состояния пострадавшего.
Инородные тела пищевода. Встречаются во врачебной практике скорой помощи почти ежедневно. Инородными телами могут быть кости, пуговицы, монеты, значки, куски твердой пищи, зубные протезы и другие разнообразные предметы. Инородное тело задерживается в пищеводе в том случае, когда имеет довольно большие размеры и заостренный конец, либо при наличии в пищеводе заболевания (опухоль, сужение, дивертикул и др.). Заглоченные инородные тела, по данным А. И. Иванова и А. С. Киселева (1988), чаще задерживаются в области физиологических сужений: перстнеглоточного (50—60 %), аортального и бронхиального (25—45 %), диафрагмального и кардиального (10—15 %). Некоторые инородные тела ранят слизистую оболочку и инфицируют подлежащие ткани.
Клинические проявления во многом зависят от величины, формы, локализации, длительности нахождения инородного тела в пищеводе. Чаще всего инородные тела вызывают боль за грудиной, у части больных — дисфагию и срыгивание. Нередко имеет место триада Киллиана — сочетание трех симптомов при инородном теле в пищеводе: усиление боли при глотании, инфильтрация наружных покровов шеи, повышение температуры тела, сопро
вождающееся ознобом. Для исследования больных в таких случаях применяется рентгенологический метод.
Рентгенологическое исследование можно начинать только после тщательного сбора анамнеза и осмотра зева и глотки с помощью гортанного зеркала. Иногда таким способом удается обнаружить инородное тело в области грушевидных синусов. При подозрении на инородное тело шейного отдела пищевода вначале производят рентгенографию шеи по Г. М. Земцову, суть которой в получении строго бокового снимка на пленке 13Х18 см при фокусном расстоянии 2 м. Технические условия: напряжение 95—110 кВ, сила тока 100 мА, экспозиция не более 0,1 с. В случае подозрения на инородное тело в грудном отделе пищевода можно производить контрастное исследование пищевода по методике С. В. Ивановой-Подобед (1932). После получения боковых обзорных рентгенограмм пищевода без контрастного вещества больному дают принять ложку бариевой пасты, которая оседает на инородное тело, обмазывая его. Затем больной проглатывает 50—100 мл воды. Вода смывает бариевую взвесь с неизмененной слизистой оболочки пищевода. Осевшее на инородном теле контрастное вещество делает его видимым. При глотании и смещении пищевода вверх, а затем вниз может выявляться симптом маятникообразного смещения контраста.
Рентгенологическое исследование обязательно при любых инородных телах пищевода. Легко распознаются рентгеноконтрастные инородные тела (монеты, иглы, гвозди, шурупы, гайки, значки и др.). Для выявления рентгеноконтрастных инородных тел применяется рентгеноскопия с последующей рентгенографией в различных положениях больного.
56. Инородное тело пищевода, симулирующее рак.
При исследовании без искусственного контрастирования основным прямым симптомом инородного тела является дополнительная тень, располагающаяся во фонтальной плоскости длин-ником вдоль пищевода. Косвенный признак — наличие «воздушной стрелки», острием направленной кверху. Этот симптом непроникающего ранения ели1 зистой характеризуется задержкой газа в пищеводе в виде стрелки или пузырька на уровне поражения или выше его, наблюдается обычно при травмах шейного отдела пищевода.
Одним из признаков инородного тела служит расширение предпозвоночного пространства, обусловленное воспалительным процессом. Симптомом, свидетельствующим о проникающем ранении шейного отдела, является и пузырек воздуха в превертебральных тканях шеи или в расширенном ретрофарин-геальном пространстве. При запущенной перфорации обнаруживают пузырьки воздуха в расширенном шейном и
грудном отделах средостения со смещением трахеи и пищевода, а также исчезновение контуров дуги аорты. Грозный признак проникновения инородного тела в клетчатку верхнего средостения предпозвоночного пространства — это выпрямление лордоза шейного отдела позвоночника.
В случае отрицательных данных бес-контрастного рентгенологического исследования для искусственного контрастирования инородного тела следует использовать бариевую взвесь или воднорастворимые йодосодержащие препараты. Повторяющаяся кратковременная задержка контрастной массы в виде «помарки» или «полоски» по ходу складок слизистой оболочки — признак повреждения ее. Важными признаками наличия инородного тела в пищеводе являются также задержка контрастной массы и полная непроходимость пищевода на уровне расположения инородного тела. Если пищевод перфорирован, можно выявить остаточное пятно
на рельефе слизистой оболочки, инородное тело за пределами пищевода, воздух в средостении или в мягких тканях шеи, проникновение контрастного вещества в мягкие ткани шеи или средостения, наличие горизонтального уровня жидкости в мягких тканях шеи или средостения.
Если рентгеносемиотика повреждения стенок пищевода инородными телами сомнительна, обязательно применение эндоскопии. При этом у некоторых больных могут быть обнаружены внедрившиеся в стенку пищевода мелкие инородные тела. После выполнения эзофагоскопии и удаления инородного тела рекомендуется проводить повторное рентгенологическое исследование для выявления осложнений, связанных с пребыванием инородного тела с острыми краями в пищеводе или возникающих во время его извлечения (Синев, Волков, Щербатенко, 1987).
Наиболее частое осложнение инородных тел пищевода — развитие местного воспалительного процесса: травматического эзофагита. К тяжелым осложнениям относится перфорация пищевода инородным телом. Обычно она сопровождается периэзофагитом, гнойным медиастинитом и может привести к гибели больного (Крылов, Земляной, Михайлович, Иванов, 1988).
Повреждения пищевода. Наиболее частая причина повреждений пищевода — лечебно-диагностические манипуляции (эзофагоскопия, гастроскопия, бужирование пищевода и др.). Причиной перфорации могут быть инородные тела с острыми краями или концами (иголки, булавки, осколки стекла, рыбьи и куриные кости и др.). Огнестрельные и ножевые ранения шеи и грудной полости тоже могут сопровождаться повреждением пищевода. При автомобильных авариях или падениях с большой высоты возможны разрывы и грудного отдела пищевода. Разрывы и перфора
ции пищевода могут возникать почти при всех заболеваниях пищевода и средостения. Нередко бывают и спонтанные разрывы ранее здорового пищевода.
Повреждения пищевода целесообразно рассматривать по локализации относительно уровня (шейный, грудной, диафрагмальный и брюшной отдел) и стенок пищевода (передняя, задняя, левая, правая), по глубине повреждения (проникающие и непроникающие), механизму травмы (колотые, резаные, рваные, огнестрельные, пролежни и сочетанные), состоянию стенки пищевода (неизмененная, рубцово-изМененная, пораженная раком и др.), по сопутствующим повреждениям (без сопутствующих повреждений, только с ложным ходом в средостении, повреждения ме-_ диастинальной плевры, трахеобронхиального дерева, крупных сосудов).
Чаще других повреждается шейный отдел пищевода в результате застревания инородных тел и извлечения их с помощью эзофагоскопа. При этом возможны даже разрывы стенок пищевода. В грудном отделе пищевода повреждения его возникают, как правило, при бужировании, а в наддиафрагмальном и брюшном — при кардиодилатации. Множественные повреждения наблюдаются чаще при неудачных попытках извлечь осложненные инородные тела. Что касается повреждения стенок инородными телами, то наиболее часто травмируются боковые — левая и Правая. Инструментальные разрывы имеют место преимущественно на задней стенке шейного и на правой стенке грудного отделов. При тупой травме груди и живота возможен циркулярный разрыв (отрыв) пищевода чаще всего в наддиафрагмальном сегменте.
Повреждения пищевода нередки во время хирургических вмешательств. Так, шейный отдел может быть поврежден при трахеостомии, операциях на
щитовидной железе по поводу рака и зоба, грудной отдел — при операциях на легком, трахее, бронхах, удалении опухолей средостения.
Клиническая картина повреждений многообразна. Чаще в первые 6—12 ч симптоматика зависит в основном от локализации, механизма и других особенностей повреждения пищеводной стенки. В более поздние сроки эти различия сглаживаются и на первый план выступают особенности течения воспалительного процесса в околопищевод-ной клетчатке, т. е. развитие медиастинита.
При повреждении шейного отдела пищевода появляются боли в области шеи, усиливающиеся при глотании, дисфагия, повышение температуры, подкожная эмфизема, а при развитии воспалительного процесса — отечность и ту-гоподвижность шеи. Типичные признаки повреждений внутригрудного отдела — резкая загрудинная боль, иррадиирующая в межлопаточное пространство и нарастающая во время глубокого вдоха, кашля и глотания, повышение температуры, тахикардия, одышка, подкожная эмфизема. Прободение в нижней части пищевода вызывает резкие боли в эпигастральной области. Обычно больные занимают сразу же вынужденное сидячее положение, стремясь уменьшить боли. Имеет место защитное напряжение брюшного пресса в эпигастрии.
Рентгенологическое исследование больных начинается без применения контрастных веществ путем обзорной рентгеноскопии и рентгенографии грудной клетки. Рентгенологически появление воздуха в средостении и подкожной клетчатке определяется раньше, чем клинически. По данным А. А. Крылова и др. (1988), для развития эмфиземы околопищеводной клетчатки достаточно перфоративного отверстия в пищеводе размером около 1 мм2.
В случае повреждения шейного отдела позвоночника может наблюдаться прослойка газа в мягких тканях шеи в стороне от пищевода или горизонтальный уровень жидкости. На боковой рентгенограмме шеи отмечается увеличение превертебрального пространства и смещение пищевода и трахеи кпереди. При даче контрастного вещества имеется затекание его в мягкие ткани шеи.
Перфорация внутригрудного отдела пищевода сопровождается эмфиземой средостения и пневмотораксом, которые видны на рентгенограммах раньше клинически выявляемой подкожной эмфиземы. В тех случаях, когда признаки перфорации не обнаруживаются, показано контрастное исследование пищевода. Если повреждена слизистая оболочка, находят контрастные пятна. В отличие от инородного тела контрастное вещество, оседающее в местах ссадин, смывается при последующих глотках воды. Отличить глубокие ссадины с образованием подслизистых карманов от инородных тел пищевода в ряде случаев трудно. Проникновение контрастного вещества за пределы пищевода дает право диагностировать полный разрыв стенки пищевода.
Основная задача рентгенологического исследования — определение уровня и стороны проникающего повреждения стенки пищевода, потому что данные, полученные при этом, во многом определяют лечебную тактику и вид хирургического доступа. Наш опыт и литературные данные свидетельствуют, что входное отверстие на слизистой оболочке в виде контрастного пятна может располагаться значительно выше, чем уровень выхождения контрастного вещества в клетчатку средостения. Это так называемый интрамурально расположенный ложный ход.
Врачам-рентгенологам и специалистам, занимающимся патологией пище-
ИТ. Рентгенологическая картина при перфорации шейного отдела позвоночника: а — прямая проекция; 6 — косая проекция.
вода, следует помнить, что из-за быстрого перемещения контраста по пищеводу не всегда можно заметить ту или иную патологию тотчас ниже контрастного пятна, или входа проникающего ранения стенки пищевода. Поэтому больного необходимо исследовать как в вертикальном положении, так и в горизонтальном. Для этих целей можно использовать релаксационную эзофагогра-фию, вызванную приемом под язык 2— 3 таблеток аэрона или введением больному внутривенно 1 мл 0,1 % раство
ра атропина и 5 мл раствора хлорида кальция.
По характеру затекания контрасте можно судить о механизме разрыва пищевода. Если пищевод повреждается инородным телом, то в околопищевод ную клетчатку попадает небольшое количество контрастного вещества. Про повреждении стенки пищевода эзофагоскопом виден длинный ложный ход Бужирование рубцово-измененного пг щевода нередко заканчивается перфорацией и образованием стойкого ложного
хода в виде узкой полоски, направленной под острым углом к продольной оси пищевода. При перфорации нижнегрудного отдела пищевода контрастное вещество, заполнив нижние отделы заднего средостения, может подняться выше места перфорации (Комаров и др., 1981).
Если рентгенологический метод не может подтвердить или исключить повреждение пищевода либо его данные сомнительны, то следует, по мнению Б. Д. Комарова и др. (1981), провести эзофагоскопию.
Наряду с рассмотренными повреждениями заслуживают внимания спонтанные и гидравлические разрывы пищевода, возникающие во время рвотных или глотательных движений. Очень редко спонтанный разрыв пищевода возникает при кашле, чиханье, смехе и напряжении при дефекации. В абсолютном большинстве случаев повреждается продольно нижняя треть заднелевой стенки грудного отдела пищевода. Около 75 % спонтанных разрывов происходит у мужчин в возрасте 50—60 лет, находящихся в состоянии сильного алкогольного опьянения.
Спонтанные повреждения пищевода имеют 3 степени: 1) разрывается более слабая мышечная оболочка; 2) разрываются мышечная и слизистая оболочки; 3) имеет место одномоментный разрыв всех слоев органа с повреждением медиастинальной плевры.
Клинически спонтанные разрывы пищевода проявляются внезапными резчайшими болями в нижней половине грудной клетки и эпигастральной области, отдающими в область позвоночника. Нередко развиваются левосторонний гидропневмоторакс и опасные профузные кровотечения. Сразу после разрыва пищевода, особенно III степени, появляются бледность, акроцианоз, цианоз губ, холодный пот, частое поверхностное дыхание, тахикардия, гипо
тония. Диагноз устанавливается окончательно с помощью рентгенологического исследования.
Таким образом, своевременная и квалифицированная диагностика повреждений пищевода — важное условие оказания эффективной лечебной помощи этой категории больных. Судьба больного решается практически в первые сутки заболевания. Лечение может быть консервативным или хирургическим, либо комбинированным. По мнению Б. Д. Комарова и др. (1981), повреждение пищевода, обнаруживаемое рентгенологически в виде затекания контрастного вещества за пределы стенки на 1,5—2 см, дает возможность назначить консервативное лечение при условии тщательного динамического наблюдения. Затекание контрастного вещества более чем на 2 см должно служить показанием к оперативному лечению. Промедление с операцией приводит к быстрому развитию медиастинита и наступлению смерти от сепсиса на 2—3-и сутки (Крылов и др., 1988).
Ожоги пищевода. В основном бывают химические ожоги. Причина их — уксусная эссенция, едкие щелочи, каустическая сода и др. У детей до 10 лет наблюдается 75 % ожогов. У взрослых ожоги обычно возникают в результате приема вместо алкоголя химически агрессивных веществ либо суицидальной попытки. Тяжесть ожога зависит от количества и концентрации химического яда. Все они приводят к развитию острого ожогового эзофагита. Кислоты вызывают сухой коагуляционный некроз, а щелочи — более глубокий и обширный колликвационный некроз тканей стенки пищевода. В зависимости от глубины поражения ожоги пищевода делят на 4 степени: I — поверхностное повреждение слизистой оболочки; II — неравномерный некроз слизистой, распространяющийся местами на всю ее
58. Состояние после ожогов пищевода: а — термического; б — химического.
глубину; III — некроз всех слоев стенки пищевода; IV — распространение некроза на прилегающие к пищеводу ткани и органы.
Клиническая картина ожога пищевода характеризуется сильными болями в полости рта, глотке, по ходу пищевода с распространением по грудной клетке, а при ожоге желудка и в эпи
гастральной области. У больных постоянно имеется саливация, нередко возникает осиплость голоса. При всех ожогах пищевода в результате интенсивных болей и выраженной экссудации с развитием гемоконцентрации могут наступить тяжелые нарушения гемодинамики, вплоть до смертельного шока.
Преобладание тех или других симптомов зависит от стадии, или периода заболевания. В острый период, когда имеются гиперемия, отек, некроз и изъязвления, из-за сильных болей глотание невозможно. В подострый период в области ожога образуются грануляции. Больной начинает пить и принимать пищу, однако глотания еще болезненные. Третий период — период рубцевания и нарастания сужения пищевода. У больных возвращается дисфагия и появляется гиперсаливация. И, наконец, четвертый, хронический, период — стойкие рубцовые стриктуры, которые приводят к вынужденному голоданию, исхуданию вплоть до истощения.
Диагноз химического ожога устанавливается на основе анамнеза и наличия характерных признаков химического ожога на коже лица, губах, на слизистой оболочке полости рта и в глотке.
Рентгенологическое исследование необходимо для определения степени повреждения пищевода и назначения правильного лечения. Поверхностный
Глава 10. ИЗМЕНЕНИЯ ПИЩЕВОДА ПРИ ЗАБОЛЕВАНИЯХ ДРУГИХ ОРГАНОВ И СИСТЕМ
Довольно часто пищевод вовлекается в патологический процесс при заболеваниях других органов и систем. В первую очередь надо иметь в виду рядом расположенные органы, их аномалии и пороки развития, воспалительные и опухолевые заболевания. Пищевод может поражаться при многих системных заболеваниях, нарушениях обмена веществ, портальной гипертензии, заболеваниях нервной системы и другой патологии.
Хронический медиастинит (медиа-стиноэзофагопатия). В патологический процесс пищевод нередко вовлекается при хроническом медиастините, который может быть следствием гнойной
ожог сопровождается признаками гиперкинезии пищевода. Имеется отечность складок слизистой. При глубоких ожогах спустя некоторое время рентгенологически обнаруживают признаки умеренно выраженного эзофагита, сужение просвета, деформацию и ригидность стенок, умеренное супрастено-тическое расширение с ровными контурами. В более отдаленные сроки более точно устанавливаются место, протяженность и степень сужения пищевода.
Хронический коррозивный эзофагит характеризуется сформированными рубцовыми стриктурами (стенозами), которые имеют чаще трубчатую, реже кольцевидную форму. Могут быть изъязвления, свищи и другие изменения. В ряде случаев послеожоговую стриктуру трудно отличить от стенозирующего рака — скирра. Как в одном, так и в другом случае просвет пищевода над сужением расширен. Однако при доброкачественном сужении чаще имеет место коническая форма расширения, а при раке — бокаловидная (симптом Три-мадо).
или специфической инфекции. Одна из частых причин развития хронических воспалительных изменений в средостении — туберкулез. Причем выраженность изменений в пищеводе зависит от характера и степени развития фиброза периэзофагеальной клетчатки средостения.
Клинические проявления хронического медиастинита и вовлеченного в процесс пищевода зависят от давности заболевания, степени выраженности склеротических изменений в клетчатке средостения, локализации и степени изменений в самом пищеводе. Основными симптомами поражения пищевода являются нарастающая дисфагия,
ощущение задержки пищевого комка в пищеводе. В дальнейшем может возникнуть полная непроходимость пищевода.
При рентгенологическом исследовании обнаруживают неравномерность просвета пищевода, расширенные участки чередуются с суженными, стенки пищевода не спадаются, просвет его зияет. Контуры стенок пищевода четкие, но неровные. Если имеются тракции и спайки, образуется зубчатость стенок или тракционные дивертикулы. Наблюдаются смещения и искривления пищевода. При глотании и дыхании пищевод остается неподвижным (свиде-детельство его фиксации).
В пользу туберкулезной этиологии хронического медиастинита говорят специфические изменения в легких, плевре, средостении, обызвествления лимфатических узлов средостения, смещение тени средостения и пищевода и др.
Васкулярно-кардиальные ззофагопа-тии. Нередко встречаются локальные сужения пищевода, обусловленные сдавлением его аномально расположенными кровеносными сосудами. Так, наиболее часто имеется сдавление пищевода аномально расположенной правой подключичной артерией. Она вызывает на задней стенке пищевода выше дуги аорты пульсирующий дефект наполнения, идущий слева снизу вправо вверх.
Сдавление и смещение пищевода на уровне дуги аорты кпереди и чаще всего влево с образованием на задней стенке его полукруглого вдавления с совершенно гладкими стенками являются наиболее достоверными признаками правосторонней дуги аорты. Иногда на задней стенке прослеживается передаточная пульсация. Эластичность и перистальтика стенок пищевода в месте сужения сохранены.
Значительно реже сдавление пищево
да вызывает удвоение дуги аорты, при котором находят дефекты наполнения на правом контуре пищевода или циркулярное сужение его на разных уровнях соответственно расположению аортальных дуг (аортальное кольцо или «сосудистая рогатка» пищевода). Сдавление пищевода может вызываться аномально расположенной артериальной связкой при незаращении артериального протока.
В практической работе врача-рентгенолога наиболее часто проходят больные митральными пороками сердца. Известно, что при этих пороках увеличивается левое предсердие, которое смещает пищевод в основном кзади. Если левое предсердие увеличено значительно, оно вызывает выраженное сдавление пищевода, что клинически проявляется дисфагией.
Заболевания щитовидной железы. Многие заболевания щитовидной железы (воспалительные, опухолевые) оказывают влияние на рядом расположенный пищевод. В одних случаях это прямое воздействие, в других — результат эндогенной интоксикации тиреоидными гормонами или их недостаточности.
Клинически воздействие на пищевод со стороны щитовидной железы проявляется дисфагическим синдромом.
При рентгенологическом исследовании обнаруживают смещение шейного отдела пищевода увеличенной щитовидной железой кзади и в стороны. Стенки пищевода деформированы, просвет сужен. Контуры суженного участка гладкие, рельеф слизистой не изменен. Перистальтика в зоне сужения прослеживается, хотя имеет место дискинезия.
Увеличение бифуркационных лимфатических узлов и другая патология средостения. При увеличении лимфатических узлов средостения рентгенологически в пищеводе определяются
центральные или краевые дефекты наполнения с четкими контурами. Рельеф слизистой не нарушен, оттеснены только складки.
Изменения пищевода могут быть при опухолях и кистах средостения, значительном увеличении левой доли печени и других заболеваниях, вызывающих дисфагию. Большие плевральные выпоты и пневмоторакс, объемные уменьшения легких и фиброторакс вызывают смещения пищевода либо в здоровую, либо в больную сторону. При этих смещениях наблюдается компрессия пищевода с затруднением прохождения пищи.
Опухоли трахеи могут создавать вдавления на пищеводе и смещать егс кзади и в сторону. Пространство межд' пищеводом и трахеей расширено. Пищевод и трахея смещаются либо в одном, либо в противоположных направлениях.
Приобретенные пищеводно-респира торные свищи. Среди причин приобретенных фистульных сообщений межд? пищеводом и трахеобронхиальным де ревом первое место занимает рак ш щевода, второе — опухоли средостениг или дыхательных путей. Значительна реже свищи бывают воспалительно! и травматической природы. Из пише
59. Сдавление и оттеснение пищевода:
а — аномально отходящей артерией от дуги аорты; б — праволежащей дугой аорты; в — аневризмой аорты.
водно-респираторных свищей чаще все-го наблюдаются пищеводйо-бронхиаль-ные, которые считаются наиболее неблагоприятными.
Клинические проявления зависят от причины возникновения, локализации, ширины просвета свищей. Следует различать синдром проксимального и дистального свища. Синдром проксимального свища наблюдается при сообщениях между пищеводом и трахеей, главными, долевыми и сегментарными бронхами. Ведущие симптомы синдрома — сильный мучительный кашель, возникающий после еды, удушье и цианоз. Нередко в отхаркиваемой мокроте можно обнаружить частицы проглоченной пищи и кровь. Наличие дисфагии обычно связывают с основным заболеванием пищевода. У многих боль
ных имеется боль в грудной клетке, спине, за грудиной, которая обусловлена воспалением тканей вокруг свища. Дистальные свищи характеризуются соединением пищевода с мелкими бронхами и бронхиолами. Синдром дистального. свища не выражен и протекает под маской хронического бронхолегочного заболевания, трудно поддающегося лечению.
Если пищеводно-респираторный свищ образовался в результате травмы; он проявляется, как правило, внезапной болью, сильным кашлем, поперхива-нием и др. Вскоре при этом свище развиваются пневмония и медиастинит. Образованию свищей воспалительной природы предшествует клиническая картина соответствующего воспалительного заболевания. В диагностике пище-
60. Вдавления и смещение пищевода увеличенными лимфоузлами средостения.
водно-трахеальных и пищеводно-бронхиальных свищей основным является рентгенологический метод.
Рентгенологическая картина пищеводно-респираторных свищей складывается из прямых и косвенных симптомов. К прямым относится обнаружение свищевого хода — затекание контрастной массы из пищевода в дыхательные пути и из последних в пищевод. Узкий свищевой ход во время исследования можно не заметить. Однако наличие затемнений в легких и жидкости в превральной полости, усиление и деформация легочного рисунка, а также воздух в пищеводе могут служить косвенными доказательствами пищеводно-респираторного соустья.
При необходимости можно применять комбинированные методы исследования, в частности рентгеноэндоскопические (рентгеноэзофагоскопию, ретро
градную рентгеноэзофагоскопию прг наличии гастростомы, бронхоэзофагс-скопию и бронхоэзофагографию).
Заболевания позвоночника (вертебр<-эзофагопатии). Некоторые заболевание позвоночника, сопровождающиеся деформацией его, оказывают давление ш пищевод или оттесняют в сторону. Такими заболеваниями могут быть чаше остеохондроз позвоночника и де фор мт-рующий спондилез, реже — воспали тельные и опухолевые процессы. Прг-чем наибольшее значение имеют порг жения нижних шейных и грудных сегментов позвоночника.
Клиническая картина вертеброэзофа-гопатий характеризуется компрессионной дисфагией. Иногда при остеохонд розе шейного отдела позвоночника отмечаются признаки глоточной мигрени или синдром Terracoli — Hilding, боли в горле и за грудиной, усиливающиеся при глотании, сухость и першение г
61. Изменения пищевода при гипохромной анемии (варианты а, б, в).
горле, охриплость голоса, ощущение инородного тела.
Рентгенологическое исследование — основной метод диагностики. На рентгенограммах можно обнаружить изменения со стороны позвоночника (сколиоз, кифоз), остеофиты позвонков, спондилолистез, смещение межпозвонкового диска кзади и другие симптомы, а также волнистость контура задней стенки контрастированного пищевода на участке, прилегающем к пораженным позвонкам. Нередко имеют место изгиб пищевода, сужение его просвета, нарушение проходимости и функциональные расстройства.
Эзофагопатии при болезням крови. ^Изменения в пищеводе бывают при многих заболеваниях крови: анемиях, гемобластозах, лимфогранулематозе, лимфо-саркоме, агранулоцитозе и др. С жалобами на дисфагию чаще обращаются больные анемией (железодефицитной, гипохромной, микроцитарной). У каждого третьего больного обнаруживается спленомегалия.
Рентгенологическое исследование позволяет выявлять у части больных мо-торно-эвакуаторные нарушения по типу эзофагоспазма, у других — сужения, обусловленные тонкими мембранами и пленками, локализующиеся обычно на передней стенке пищевода и выступающие в его просвет размером от 1 до 6 мм.
При системных опухолевых заболеваниях кроветворной ткани нередко наблюдаются дисфагия и загрудинные боли при глотании. Они обусловлены изъязвлениями слизистой оболочки, стриктурами либо сдавлениями пищевода увеличенными лимфатическими узлами.
Метаболические эзофагопатии. Поражение пищевода может наблюдаться при гипо- и авитаминозах. Так, недостаточное поступление в организм витаминов группы В, особенно Bi, и никотиновой кислоты обусловливает развитие дисфагии и других симптомов, напоминающих кардиоспазм. Тяжелые дисфагии встречаются у боль-
62. Склеродермия пищевода (поздняя стадия).
шинства больных пеллагрой из-за отека, изъязвлений и множественных сужений пищевода. Нарушение кальциевого обмена также приводит к нарушению глотания и гипокальциевой тетании. При рентгенологическом исследовании обнаруживают эзофаго-спазм.
Амилоидоз пищевода. Относится к системному заболеванию, встречается редко. Он является морфологической разновидностью амилоидоза, при котором амилоид откладывается по ходу ретикулярных волокон кровеносных сосудов. Вначале поражаются сосуды подслизистого слоя, затем всей стенки пи
щевода. Клинически амилоидоз пищевода проявляется изнурительной изжогой и дисфагией. Рентгенологическая картина характеризуется слабой двигательной активностью пищевода, задержкой в нем контрастной массы, зиянием кардии и желудочно-пищеводным рефлюксом.
Склеродермия пищевода. При системной склеродермии пищевод поражается чаще других органов пищеварительного тракта. Склеродермия пищевода встречается преимущественно среди медицинского персонала, что объясняют контактом и непереносимостью медикаментов.
Основные клинические симптомы — чаще дисфагия, реже — изжога, срыгивание, рвота и боли в эпигастральной области, усиливающиеся в горизонтальном положении. Боли нередко иррадиируют за грудину, в глотку и сопровождаются кислой отрыжкой.
Рентгенологическая картина зависит от стадии заболевания. 'Ранними признаками пор'ажения пищевода являются ослабление перистальтики, эзо-фагоспазм, замедление продвижения жидкой контрастной массы по пищеводу в вертикальном положении больного, затрудненное освобождение пищевода от бариевой взвеси при горизонтальном положении и отсутствие формирования эпифренальной ампулы пищевода. При этом кардия функционирует нормально, рельеф слизистой не изменен.
С течением времени рентгенологическая картина нарастает, появляется дилатация пищевода на всем протяжении, бариевая взвесь задерживается уже до 30 мин и более, имеется выраженная гипокинезия, складки слизистой оболочки сглажены или вовсе отсутствуют, кардия зияет (халазия), развивается рефлюкс-эзофагит.
В поздней стадии заболевания наступают атония пищевода и резкое
сужение, расположенное на 4—5 см выше диафрагмы. В расширенном пищеводе много пищевого содержимого, бариевая взвесь иногда задерживается до 3—4 ч. По мере опорожнения пищевода от бариевой взвеси под влиянием гидростатического давления его форма почти не меняется и он заполняется воздухом, на фоне которого лучше виден измененный рельеф слизистой оболочки. В результате медленного опорожнения в пищеводе нередко развиваются воспалительные изменения, застойный эзофагит, а нередко и изъязвления.
Варикоз пищевода. Развитие варикозных вен пищевода имеет в своей основе портальную гипертензию, при которой повышается давление в портальной системе свыше 250 мм вод. ст. Основными причинами портальной гипертензии могут быть хронические гепатиты и циррозы печени, врожденный фиброз печени, обтурация воротной или селезеночной вены, нарушение венозного оттока по печеночным венам вследствие их тромбоза и склерозирования. Реже флебэктазии наблюдаются при гипертензии большого круга кровообращения вследствие хронической сердечнососудистой недостаточности, при синдроме верхней полой вены и других заболеваниях.
Клиническая картина варикоза пищевода не имеет характерных признаков. Расширение вен пищевода может иногда годами протекать бессимптомно или сопровождаться незначительными признаками: тяжестью за грудиной, умеренной дисфагией, жжением, отрыжкой, регургитацией и другими, которые обычно маскируются симптомами основного заболевания. Грозным осложнением является кровотечение из варикозных вен.
Рентгенологическое исследование — основное в диагностике варикоза пищевода, который проявляется довольно характерными симптомами. Так, при I
63. Варикоз пищевода.
степени определяют неравномерное расширение просвета пищевода и замедле-
ние прохождения бариевой взвеси, особенно в дистальных сегментах, из-за снижения тонуса стенок. Рельеф слизистой оболочки образован утолщенными и извитыми складками, похожими на желудочные. Иногда обнаруживается недостаточность кардии в виде желудочно-пищеводных рефлюксов. II степень варикоза характеризуется появлением единичных или групповых дефектов наполнения на рельефе или контуре пищевода, расположенных главным образом вдоль оси его. Форма дефектов округлая, овальная или извитая. В процессе исследования рентгенологическая картина постоянно изменяется. Наряду с признаками, подобными псевдополипозу, при растяжении слизистой оболочки во время прохождения бариевой взвеси рельеф слизистой может полностью исчезнуть. При III степени варикоза складки слизистой оболочки расширены постоянно, отчетливо выявляются крупные узлы и гроздевидные и полиповидные их конгломераты, резко выбухающие и суживающие просвет пищевода. Эти изменения выявляются в средней и нижней трети пищевода, контуры стенок которого становятся фестончатыми с полулунными краевыми дефектами, просвет его сужается. Но в отличие от опухоли никогда не наблюдается полной закупорки пищевода. Нередко обнаруживаются признаки эзофагита, неполное смыкание кардии, гастроэзофагеальные рефлюксы и варикозное расширение вен в верхнем отделе желудка.
Рентгенологическое исследование пищевода должно быть полипозиционным как в вертикальном, так и в горизонтальном положениях. Доказано, что варикозные вены в вертикальном положении больного набухают меньше, чем в горизонтальном. Лучшим является первое косое горизонтальное положение, а консистенция бариевой взвеси обычная или более густая. Диагности
ческая эффективность рентгенологического метода исследования зависит от степени варикоза и квалификации врача-рентгенолога и колеблется от 75 до 95 %.
Большими возможностями обладает и эхографическая диагностика. Диагностическими критериями УЗИ варикоза пищевода служат: утолщение стенки, часто эксцентричное, неровность внутреннего ее контура и изменение толщины при дыхании. Специфичность УЗИ — 91 % (Saverymuttu, Wright, Maxwell, Joseph, 1988).
Грыжи пищеводного отверстия диафрагмы. Это перемещение брюшных органов в грудную полость через естественное пищеводное отверстие диафрагмы. Составляют 80—98 % грыж диафрагмы. Могут быть врожденными и приобретенными. В процессе формирования грыжи через пищеводное отверстие обычно цоследовательно пролабируют абдоминальный отдел пищевода, кардия и верхний отдел желудка. Возникшие таким образом выпячивания над диафрагмой обозначаются как осевая, аксиальная или скользящая (наиболее правильно — эзофагеальная) грыжи пищеводного отверстия.
Крайне редко через пищеводное отверстие выпадает (выворачивается) верхний отдел желудка без смещения кардии и брюшного сегмента пищевода. При этом грыжевой мешок располагается рядом с нижнегрудным отделом пищевода. Сам пищевод не меняет своей длины, а пролабированный в заднее средостение отдел желудка обычно небольшой. Такую грыжу пищеводного отверстия называют параэзофагеальной. Возможны и смешанные типы грыж в виде параэзофагеальной со смещенной кардией и эзофагеальной с параэзофагеаль-ным смещением верхнего отдела желудка.
В зависимости от степени выпадения (эвентрации) желудка в грудную по-
64. Схема различных видов грыжи пищеводного отверстия диафрагмы:
7 — пищеводная; 2 — кардиальная; 3 — фундальная; 4 — антральная; 5 — кишечная;
6 — приобретенный короткий пищевод, 7 — врожденный короткий пищевод; 8 — субтотальная желудочная грыжа.
лость различают следующие степени грыжи пищеводного отверстия диа-фрагмы: 1) над диафрагмой расположен брюшной сегмент пищевода, а кардия — на уровне диафрагмы, желудок — под диафрагмой; чрезмерная смещае-мость абдоминального сегмента считается начальной грыжей (смещаемость по вертикали в норме не превышает 3—4 см); 2) преддверие пищевода и кардия находятся над диафрагмой, в диафрагмальном отверстии видны складки слизистой оболочки желудка; 3) вместе с брюшным сегментом пищевода и кардией в грудную полость выпадает и часть желудка.
Клиническая картина грыж пищеводного отверстия разнообразна. У детей она характеризуется ранним развитием осложнений: эзофагита с частичными срыгиваниями или рвотой с примесью крови, анемии, бронхита и пневмонии, задержкой роста и т. д. Быстрое прогрессирование болезни делает таких людей инвалидами, они не поддаются
консервативному лечению. У взрослых клинические проявления грыжи пищеводного отверстия обусловлены слабостью замыкательного механизма кардии, появлением гастроэзофагеального рефлюкса и пептического эзофагита. Наиболее часто встречаются боли, дисфагия и анемический синдром. Из самых тяжелых осложнений грыж можно отметить пептические язвы пищевода и грыжевого мешка, ущемление грыжи.
Рентгенодиагностика диафрагмальной грыжи, выходящей через расширенное пищеводное отверстие, осуществляется с помощью обзорного и контрастного многоплоскостного исследования. Обзорная рентгеноскопия и рентгенография позволяют выявить добавочную тень в заднем средостении с просветлением в центре или уровнем жидкости (псевдоабсцесс), 1 или 2 газовых пузыря на фоне сердечной тени, расширение средостения с четким наружным контуром, изменения формы, величины и положения газового пузыря
желудка и др. Контрастирование пищевода и желудка дает возможность провести дифференциальный диагноз между грыжей пищеводного отверстия и врожденным коротким пищеводом (распознать фиксированную или частично фиксированную грыжу II—III
стадии). Важные симптомы грыжи пищеводного отверстия: сглаженность или отсутствие угла Гиса, отклонение пищевода от диафрагмы и позвоночника, «утолщение» и деформация свода и изменение газового пузыря желудка, расширение пище-
65. Рентгенологическая картина грыж пищеводного отверстия диафрагмы:
а, б — фундальная; в — кишечная; г, д — субтотальная i прямой и боковой проекциях.
водного отверстия диафрагмы. и присутствие в нем 3 и более складок желудка, отек кардии и свода желудка (зубчатость или волнистость контуров), транскардиальные миграции и выпадения слизистой оболочки (дополнительная тень у входа в кардию или удвоение слизистой на фоне желудочного пузыря). При инвагинации пищевода в желудок наблюдается характерная картина воротничка, надетого на шею, венчика инвагинации («кольцо Сатурна») над диафрагмой. Такое состояние некоторые авторы называют грыжей смешанного типа или манжетообразной грыжей.
Для эзофагеальных грыж характерны эпифренальное образование (грыжевой мешок, колокол, шапка, луковица), сообщение его с желудком (грыжевые ворота) и отграниченность от пищевода, присутствие более 3 желудочных складок в грыжевых воротах и эпи-френальном мешке. Признаком грыжи может быть скопление бария над диафрагмой более 3,5 см длиной и 2,5 см
шириной р задержкой контраста дольше одного глубокого вдоха.
С' целью динамического контроля некоторые исследователи рекомендуют проводить рентгенометрию грыжи при горизонтальном положении больного и различать малые грыжи (не более 3 см), средние (от 3 до 8 см) и крупные (более 8 см).
В хирургической практике для улучшения диагностики грыж пищеводного отверстия диафрагмы нередко примет няется метод тракционной рентгенобал-лонографии. Исследование выполняется натощак в рентгеновском кабинете. После предварительной обзорной рентгеноскопии больному предлагают выпить 100 мл бариевой взвеси. Обращают внимание на форму, контуры пищевода, его двигательную активность. После этого больным с подозрением на грыжу пищеводного отверстия диафрагмы в желудок вводят зонд, снабженный рентгеноконтрастной оливой и раздувным баллончиком на конце. Как только конец зонда с оливой окажется в же
лудке, производится раздувание баллона шприцем Жане до 70 мл. Накладывают зажим и вытягивают раздутый баллон под контролем динамометра с силой 1 кг. В норме пищеводное отверстие, размеры которого 2—3 см, препятствует продвижению зонда с раздутым баллоном. При грыже, когда пищеводное отверстие расширено, баллон объемом в 70 мл свободно проходит в грудную полость, увлекая за собой контурированное барием дно желудка. Причем поперечный размер раздутого газом баллона на уровне диафрагмы на рентгенологическом снимке точно соответствует размеру пищеводного отверстия. Последнее особенно важно для определения тактики лечения, вы
бора метода хирургической операции. После того, как снят зажим и из баллона выпущен воздух, зонт извлекают. Исследование заканчивается общим обследованием желудка и 12-перстной кишки.
Достоверность рентгенологического исследования, по данным Ш. X. Ганцева и О. В. Гилимова (1989), составила 94 %. Полученные ими результаты свидетельствуют о том, что применение в комплексе диагностических исследований у больных с грыжами пищеводного отверстия диафрагмы тракционной рентгенобаллонографии повышает информативность рентгенологического метода, дает объективную оценку размеров грыжевых ворот.
Г л а в а И. БОЛЕЗНИ ОПЕРИРОВАННОГО ПИЩЕВОДА
Бурному развитию хирургии пищевода способствуют усовершенствование старых, разработка и внедрение в практику новых методов диагностики и лечения врожденных и приобретенных заболеваний. К основным хирургическим методам лечения относятся: эзофагоэктомия, эзофаготомия, эзофа-гостомия, изоперистальтическая и ани-зоперистальтическая пластика пищевода (искусственный пищевод), паллиативные и комбинированные операции.
Наиболее часто проводятся операции при грыжах пищеводного отверстия диафрагмы. Среди этих грыж эзофаге-альные составляют 90 %. Особенность эзофагеальных грыж в том, что кардиальный отдел желудка смещается выше диафрагмы, развивается тяжелый рефлюкс-эзофагит вследствие нарушения замыкательной функции кардии и выпрямления угла Гиса. Параэзофагиаль-ные грыжи встречаются в 5 % случаев. При этом кардия остается на месте, через отверстие выходят дно и большая
кривизна желудка. Замыкательная функция кардии не страдает, рефлюкс-ззофагит не развивается.
Задачи хирурга при эзофагеальных грыжах — устранение грыжи, профилактика эзофагита в будущем и «удлинение пищевода». Для этих целей применяют следующие операции: Хилла — сшивают ножки диафрагмы. В нижние швы захватывают стенку кардии спереди и сзади от пищевода. В этот же стежок захватывают предаортальную фасцию. Воссоздают угол Гиса, подшивая дно желудка к пищеводу слева; Ниссена — ушивают ножки диафрагмы. Накладывая швы, захватывают дно желудка спереди, пищевод справа и дно желудка сзади отдельными стежками, в виде манжетки окутывают нижний отрезок пищевода стенкой дна желудка, желудок фиксируют к передней брюшной стенке; Латейста — устраняют грыжу и ушивают ножки диафрагмы. Для воссоздания угла Гиса подшивают дно желудка к пищеводу и несколькими
швами фиксируют его к диафрагме. Пищеводно-диафрагмальную связку подшивают к брюшному отделу пищевода.
Грыжи пищеводного отверстия в сочетании с рефлюкс-эзофагитом и укорочением пищевода требуют «удлинения пищевода». Из этой группы операций наиболее известны: Коллиса — начиная от левого края пищевода, рассекают насквозь переднюю и заднюю стенку желудка. В результате из стенок желудка со стороны малой кривизны формируется трубка, которая служит продолжением пищевода. Пищевод удлиняется на длину разреза обеих стенок желудка; Каншина— после устранения грыжи вокруг кардиального отдела пищевода накладывают поочередно кисетные швы, суживающие кардию до размеров пищевода. Количество швов зависит от длины, на которую необходимо удлинить пищевод; Тупе — предусматривает восстановление угла Гиса. При ушивании ножек диафрагмы или отдельными швами дно желудка сзади подшивают к правой ножке дифрагмы, затем, окутывая нижний отдел пищевода дном желудка сзади, слева и спереди, фиксируют переднюю поверхность дна желудка к передней поверхности брюшного отдела пищевода. Этим приемом воссоздается угол Гиса, окутывая пищевод дном желудка не по всей поверхности, а только по его левой полуокружности.
Иногда пищевод удлиняют с помощью пластических операций, а именно: за счет тонкой кишки на сосудистой ножке, толстой кишки, илеоцекального угла и др. Кроме того, применяют резекцию кардии или проксимальную резекцию желудка в различных модификациях.
Как правило, все хирургические вмешательства на пищеводе всегда являются тяжелыми как для больного, так и для хирурга. Не менее трудная задача стоит и перед рентгенологом: опреде
лить точную локализацию и характер выполненной операции, установить особенность этой вновь созданной анатомической «нормы», оценить состояние оперированного органа, выявить возможные осложнения или заболевания. Для решения поставленных задач рентгенологическое исследование больного начинают в вертикальном положении при различных проекциях, применяя жидкую бариевую взвесь, а при подозрении на несостоятельность швов — только водорастворимые контрастные вещества. Проверяют проходимость оставшейся части пищевода, соустья и использованных для пластики отделов, а также эластичность стенок и характер их контуров. Далее устанавливают уровень наложения пищеводно-пищеводного, пищеводно-желудочного или пищеводно-кишечного анастомоза и оценивают его функцию, проводят дифференциальную диагностику оперированного органа.
Рентгенологическая картина оперированного пищевода различна и зависит от характера и объема хирургического вмешательства. При эзофагокардиоми-отомии — продольном рассечении мышц пищевода на протяжении до 8 см, которое проводится для лечения ахалазии пищевода и кардиоспазма, просвет пищевода восстанавливается. В послеоперационном периоде возможно Образование пульсионного дивертикула, рубцового стеноза и других осложнений. Если резекция пищевода частичная, накладывается пищеводно-пищеводный или пищеводно-желудочный анастомоз по типу конец в конец или конец в бок. Последний вид соустья обычно встречается при внутригрудной эзофа-гогастростомии, которая сочетается с ваготомией и пилоропластикой. После этого вида операции пищевод рентгенологически выглядит укороченным, желудок перемещен в грудную полость и его газовый пузырь располагается выше
диафрагмы и левее позвоночника. В зоне соустья могут быть выявлены дефекты наполнения, обусловленные погружением вовнутрь тканей при сшивании стенок пищевода и желудка. После операции наблюдается гастроэзофагеальный рефлюкс, который нередко приводит к рефлюкс-эзофагиту, даже к язве, стенозу и другим осложнениям. Если пищевод замещается сегментом кишечника, рентгенологически выявляют типичное изображение тонкой или толстой кишки.
У оперированных больных могут возникать ранние (1—2 нед.) и поздние (2—6 нед.) осложнения (анастомозит, несостоятельность швов, некрозы, кровотечения, гангрена трансплантата, эмпиема плевры и др.), а также болезни оперированного пищевода — патологические состояния, развившиеся в адаптационный период, спустя 1,5—2 мес. после операции. Болезни адаптационного периода зависят не от этиологии бывшего заболевания, а от объема операции и локализации патологического процесса. Чем выше располагается в пищеводе патологический очаг, тем хуже как непосредственные, так и отдаленные результаты хирургического вмешательства (Тамулевичюте, Вите-нас, 1986).
Основными болезнями оперированного и искусственного пищевода являются функциональные расстройства пищевода или трасплантата, рефлюкс-эзофагит или рефлюкс-трансплантит, пептическая язва оперированного или искусственного пищевода, грыжевая болезнь (хиатальная или пластическая грыжа), органические стенозы (рубцовые, воспалительные, опухолевые), дивертикулы (рецидивы и псевдодивертикулы), опухоли (не рецидив), чаще злокачественные, другие заболевания (варикоз, аллергозы и др.).
Функциональные расстройства оперированного пищевода клинически про
являются дисфагическим синдромом, рентгенологически — дисфункцией сфинктеров, нарушением моторно-эва-куаторной функции пищевода. Характерны дистония с преобладанием спастических сокращений и дискинезия. После пластики пищевода наблюдаются нарушение акта глотания,отрыжки, срыгивания, изжога, боли и другие симптомы. При рентгенологическом исследовании обнаруживают дискинезию, атонию трансплантата и рефлюкс желудочного содержимого. Более выражена дисфункция трансплантата при антиперистальтическом расположении кишечных петель в грудной полости или под кожей. Это может быть вызвано провисанием избыточной петли трансплантата ниже уровня анастомоза с желудком. Рентгенологически это проявляется задержкой принятой бариевой взвеси в провисающей петле и регургитацией.
Рефлюкс-эзофагит встречается у 40 % оперированных с сохраненным пищеводом и у 20 % больных после пластических операций. Клиническая картина характеризуется изжогой или жжением в эпигастральной области и за грудиной, болями и другими симптомами, характерными для пептического рефлюкс-эзофагита. Но в этом случае симптомы более выражены. При рентгенологическом исследовании в начальном периоде развития рефлюкс-эзофагита определяются гипо- или гиперкинезия пищевода и новой кардии. В дальнейшем к дискинезии пищевода присоединяются признаки эзофагита, на фоне которого можно обнаружить депо контрастного вещества и нишевые образования. Имеют место зияние соустья и регургитация содержимого желудка или кишечника в пищевод. В искусственном пищеводе дискинезия нарастает, что ведет к длительным рефлюксам и задержке пищевого содержимого, а в конечном счете — к рефлюкс-трансплан-
титу. Пептическая язва обычно развивается в дистальном отделе трансплантата.
Нередко в послеоперационном периоде развиваются и грыжи пищеводного отверстия диафрагмы. Особой опасности для больных они не представляют. А вот стенозирование оперированного пищевода вызывает беспокойство у больного и врача. Наиболее часто бывает стеноз соустья. Рентгенологически различают 3 степени стеноза: I — диаметр просвета суженного участка 1—0,7 см, супрастенотическое расширение отсутствует; II — диаметр 0,7—0,4 см, супра
стенотическое расширение — умеренное; III — диаметр просвета суженного участка — 0,3 см и меньше, имеются выраженное супрастенотическое расширение пищевода и длительная задержка бариевой взвеси над анастомозом. Стенозы могут возникнуть вследствие непроходимости тонкокишечного или толстокишечного трансплантата из-за перегиба или перекрута, опухолевого процесса и других причин, требующих повторных хирургических вмешательств. В практике врача могут встречаться и другие осложнения.
Раздел III ______________ЖЕЛУДОК_________________ Глава 12. РЕНТГЕНОАНАТОМИЯ И ФИЗИОЛОГИЯ
Желудок — наиболее расширенная часть пищеварительного тракта. Он расположен между пищеводом и 12-перстной кишкой, обеспечивает накопление пищи, частичное ее переваривание и всасывание. Форма и положение желудка весьма вариабельны и зависят от конституции, пола, возраста, степени упитанности, внутрибрюшного давления, положения обследуемого, тонуса желудка и передней брюшной стенки и др.
В связи с изложенным названия частей (отделов) желудка в анатомии и рантгеноанатомии не во всем совпадают. С рентгенологической точки зрения различают следующие части желудка: свод — верхний выпуклый отдел желудка под левым куполом диафрагмы; кардия с кардиальным отделом, подразделяющимся на супра- и субкардиальный; тело, имеющее верхнюю, среднюю и нижнюю трети; синус — нижний участок тела клиновидной формы, вершина которого находится в области угла желудка; антральный отдел, включающий препилорическую часть; привратник (пилорус) — суженная часть желудка в месте его перехода в 12-перстную кишку.
С практической точки зрения общепризнано объединение некоторых рядом расположенных частей желудка и деление его на 3 важнейших отдела: верхний, или проксимальный (свод, кар
диальная часть и прилегающие к ним передняя и задняя стенки, малая и большая кривизна желудка), средний (тело и синус желудка), выходной (антральный отдел и привратник).
У новорожденных и детей первых месяцев жизни дифференцировка отделов желудка выражена недостаточно. Поэтому целесообразно выделить 3 его отдела: входной, средний и выходной. По форме желудок у новорожденных может напоминать овоид, зллипс, шар и др. У некоторых младенцев при опорожнении желудка его форма меняется. По мере роста ребенка увеличиваются большая кривизна и выходной отдел желудка, в результате изменяется форма и дифференцируются его отделы.
Форма желудка грудного ребенка неопределенная. Она зависит от особенностей и концентрации принятой пищи, мышечного тонуса стенок желудка, объема заглоченного воздуха и от состояния соседних органов, в частности от вздутия кишечника.
У детей раннего возраста относительно часто обнаруживается двойной желудок с каскадным перегибом. Его образование обусловлено избытком газа в петлях кишечника, высоким положением левого купола диафрагмы и другими причинами.
На рентгеновском экране перегиб желудка выглядит в виде двух газовых пузырей в левом подреберье, наслаиваю
щихся один на другой. Введенное контрастное вещество выполняет верхний «пузырь» и, заполнив его, переливается через угол перегиба в основную дистальную часть желудка (нижний «пузырь»), напоминая каскад.
Размеры желудка зависят от его формы, степени наполнения, тонуса его стенок, индивидуальных особенностей и возраста. В 1-й день после рождения емкость желудка ребенка не превышает 7 мл, а уже на 10-й день примерно в 10 раз превосходит начальный объем. К 3 мес. жизни объем желудка достигает 100 мл, к году — 250 мл, к 8 годам — 950 — 1000 мл. Средняя емкость желудка взрослого человека 1,5—2,5 л, у мужчин несколько больше, чем у женщин.
У новорожденного длина желудка 5 см, ширина 3 см, у годовалого — длина 8—9 см, ширина 6—7 см. К 8 годам жизни длина желудка увеличивается до 14—18 см, ширина — 8—10 см. У взрослого длина умеренно наполненного желудка — расстояние от свода до нижнего полюса — колеблется в зависимости от индивидуальных особенностей от 14 до 30 см (чаще 20—25 см). Ширина желудка в различных отделах неодинакова, в среднем 8—9 см. Длина малой кривизны 10,5—24,5 см, чаще 18 — 19 см, длина большой кривизны — 32—64 см, чаще 45—56 см. Толщина стенки желудка, определяемая путем париетографии, зависит от сокращения его мышечной оболочки и изменяется от 2 до 5 мм.
Продольная ось желудка направлена сверху, слева и сзади вниз, вправо и кпереди. Соответственно степени наклона продольной оси различают вертикальное, косое и горизонтальное положение желудка. При вертикальном положении обследуемого свод желудка выявляется слева у позвоночника, под диафрагмой, и проецируется на уровне Tix, а кардиальное отверстие — на уров-
66. Деление желудка:
а — анатомическое; б — рентгенологическое (1а — дно, 16 — свод; 2 — кардиальная часть; 3 — тело; 4 а — привратниковая пещера, 4 б — синус; 5 а — канал привратника, 5 6 — антральный отдел; 6 а — привратниковая, или пилорическая, часть, 6 6 — привратник; 7 — малая кривизна,# — большая кривизна).
67. Положение и форма желудка:
у а — нормостеников, 6 — астеников, в — гиперстеников.
не Txi. Свод, или дно желудка, прилегая к левому куполу диафрагмы, образует вместе с ним полоску шириной около 0,5—1 см. Кардия протяженностью 2 — 3 см примыкает к кардиальному отверстию и определяется слева у позвоночника или почти в 1,8 см от него, граничит с левой долей печени. Наибольшая часть желудка — тело — у людей долихоморфной и мезоморфной конституции параллельно позвоночному столбу и его малая кривизна удалена от позвоночника не более чем на 3,5—4 см. Привратник обнаруживается в проекции Li-ш или несколько правее. У мужчин нижний полюс (синус) находится на гребешковой линии, у женщин — ниже ее. В горизонтальном положении больного желудок занимает ко
сопоперечное положение, его большая кривизна приподнимается.
У людей долихоморфного телосложения, или астеников, желудок удлинен и его нижний полюс проецируется у входа в малый таз. При брахиморфной конституции (гиперстеников) нижний полюс желудка определяется на 5 — 6 см выше гребешковой линии. Очень высокое положение желудка бывает при ожирении, беременности, релаксациях диафрагмы, асците, болезнях самого желудка и других органов брюшной полости.
В косых и боковых проекциях отмечается более однотипная форма желудка — напоминает косо лежащий цилиндр. Свод желудка и газовый пузырь в этом «цилиндре» обнаруживаются выше и кзади, у позвоночника. Передняя стенка желудка соприкасается (слева направо) с диафрагмой, передней брюшной стенкой и нижней поверхностью печени. Задняя стенка прилежит к аорте, поджелудочной железе, селезенке, верхнему полюсу левой почки и левому надпочечнику и частично — к диафрагме и поперечной ободочной кишке.
Большая кривизна простирается от свода желудка до привратника по латеральной стороне. Она в 2 раза длиннее малой кривизны. Внизу прилежит к поперечной ободочной кишке и ее брыжейке. К малой кривизне прикрепляется малый сальник. Малая кривизна антрального отдела желудка проецируется на Ln ш, а большая кривизна — на Liн-IV. Для малой и большой кривизны желудка характерна выпуклость — признак того, что стенки желудка не инфильтрированы.
На выходе из желудка имеется небольшой препилорический отдел, длиной 2—3 см. В месте перехода желудка в 12-перстную кишку образуется привратник. Края его гладкие и параллельные, симметричные у основания луко
вицы. Если привратник открыт и заполнен контрастной массой, имеет вид полосы шириной 5 мм и длиной от 5 до 17 — 18 мм, в среднем — около 10 мм. Привратник, как и кардия, фиксирован, однако его фиксация слабее.
У новорожденных и грудных детей желудок расположен высоко. У новорожденных он почти вертикальный, у грудных — более горизонтальный, малая кривизна напоминает серп, большая кривизна направлена каудально. Кардиальный отдел желудка находится на уровне Т ix-x, а пилорический, лежащий несколько наискось, кверху и кзади,— на уровне Тхп — L . Пилорический канал у детей раннего возраста короткий, длиной 2—4 мм. Его ширина зависит от скорости эвакуации содержимого из желудка и тонуса мышц, колеблется в широких пределах, достигая 5—6 мм.
Контуры стенок контрастированного желудка из-за его анатомических особенностей бывают ровными или зазубренными. Контур малой кривизны, передней и задней стенок четкий и ровный, контур большой кривизны зазубренный. Наиболее отчетлива зубчатость контуров тела и синуса желудка вследствие проекции поперечных складок, образующихся при переходе складок слизистой оболочки с одной стенки на другую. Рисунок рельефа складок слизистой желудка зависит от анатомических особенностей их строения, степени заполнения желудка контрастным веществом, фазы пищеварения, тонуса мышц, перистальтики, эмоционального состояния пациента, его конституции, пола, возраста и др.
Различают макро- и микрорельеф слизистой оболочки желудка. У здорового человека макрорельеф слизистой бывает трех основных видов: магистральный, ячеисто-трабекулярный и промежуточный. Для магистрального вида складок слизистой оболочки характерно преобладание продольных скла
док, преимущественно параллельных малой кривизн?. При ячеисто-трабекулярном виде слизистая оболочка образует больше коротких, извилистых, косых и даже поперечных складок, беспорядочно соединенных между собой. Между этими двумя видами находится множество промежуточных. Подобное деление схематично, так как рентгенологическая картина нормального рельефа желудка разнообразна и изменчива.
Складки со своими соединениями образуют ячейки (лакуны) различной формы. Ширина складок обычно равна ширине промежутков между ними и достигает: в своде и синусе — 10 мм, в антральном отделе — 5 мм. Широкие и высокие складки слизистой оболочки желудка рассматриваются как «физиологический запас» для максимального растяжения его во время приема пищи. Толстые и извитые складки встречаются в норме преимущественно у гиперстеников, тонкие, вытянутые и параллельные — у астеников. Рельеф слизистой желудка у мужчин образован широкими и извитыми, у женщин — тонкими и продольными складками.
Рельеф слизистой оболочки обусловлен функцией различных отделов желудка. В отделах, где преобладает двигательная деятельность, происходит механическая обработка и эвакуация пищи, складки продольные, а где в основном осуществляются пищеварительные функции — складки преиму-щетвенно поперечные.
На основании литературных данных и собственного опыта мы пришли к выводу, что рентгенологический макрорельеф слизистой оболочки желудка в различных отделах следующий.
В области свода поперечные и продольные складки создают сложный рельеф слизистой оболочки, который подобен «извилинам головного мозга». Вследствие рыхлого соединения слизистой оболочки с подлежащими тканями
68. Рентгенограмма контрастированного желудка в норме.
в области пищеводно-желудочного перехода она постоянно перемещается. Рельеф слизистой оболочки кардиальной части в зоне пищеводно-желудочного перехода образован поперечными складками, которые отличаются от продольных пищеводных. Из-за впадения пищевода в желудок под углом получается ' кардиальная вырезка — угол Гиса. У 81 % людей этот угол бывает меньше 90°, а у 19 % — колеблется от 90 до 180°. Соответственно вершине кардиальной вырезки у места
соединения пищевода с желудком со стороны слизистой оболочки обнаруживается кардиальная складка А. П. Губарева, выполняющая функции затворного устройства. Во время сокращения желудка его кардиальное отверстие закрывается 'этой складкой.
Выступающие в желудок складки конечной части пищеводной трубки формируют треугольную неправильную воронку, узкая часть (вершина) которой обращена к желудку. Эта часть воронки представляет собой канал длиной 10— 15 мм, заканчивающийся у кардии. Ширина отверстия кардии в первом косом положении не превышает 15 мм. Форма отверстия зависит от степени его открытия. Полностью открытая кардия напоминает подкову или арку с незамкнутым аборально сегментом, частично открытая — овоид, в котором большой вертикальный размер. Закрытое кардиальное отверстие выглядит контрастным пятном на стенке кардиальной части желудка с контрастными полосками в виде «вилки» или «звезды» вследствие контрастирования межскладочных промежутков слизистой оболочки желудка вокруг кардии. Иногда на экране кардия изображена двумя вписанными одна в другую окружностями разной величины. Возникновение такого теневого рисунка иногда объясняют пролабированием слизистой оболочки пищевода в желудок, где выпавшая слизистая создает вокруг кардии валик, внешние границы которого в результате контрастирования бариевой взвесью и служат причиной появления второго теневого ободка вокруг кардии. Другие исследователи считают, что внешний ободок кардиального отверстия в левом боковом положении обследуемого — зто расширенные и контрастированные стенки пищевода.
Изучение рельефа слизистой оболочки субкардиального отдела затруднено вследствие функционального перегиба
желудка. В некоторых случаях при резком перегибе желудка возникает суперпозиция складок передней и задней стенок свода и складок субкардиального отдела. Причем отчетливее складки задней стенки. У гиперстеников этот перегиб бывает наибольшим, особенно задней стенки желудка, которая становится наклонной или даже почти горизонтальной. Складки задней стенки желудка проекционно укорачиваются и, наслаиваясь одна на другую, образуют на экране сплошную поперечную полосу. Контрастное вещество, задержавшееся между складками, симулирует «нишу» (рельефную или контурную).
В теле желудка у малой кривизны слизистая оболочка двумя — четырьмя параллельными складками создает желудочную дорожку. На задней стенке желудка насчитывается 5—7 продольных складок, на передней стенке их значительно меньше. Ближе к большой кривизне складки становятся извилистыми, часто косыми и поперечными. В зависимости от состояния тонуса желудка и количества в нем содержимого выраженность складок и рельеф слизистой значительно меняются. Чем ниже тонус желудка, тем тоньше вытянутые продольно складки. В хорошо тонизированном желудке складки толстые и извилистые. При накоплении бариевой взвеси в желудке формируются преимущественно продольные складки.
На границе тела и синуса желудка латеральные складки желудочной дорожки отклоняются в сторону большой кривизны, разделяя желудок на 2 части: проксимальную, выполняющую основную секреторную и пищеварительную функцию, и дистальную — выводную. В синусе желудка обнаруживаются дугообразные складки параллельно малой кривизне, веерообразные складки, направляющиеся от угла к большой кривизне, а также смешанные складки.
Если в области тела желудка рельеф слизистой оболочки очень вариабельный, то в антральном отделе он чрезвычайно функционально изменчив. В течение одного и того же перистальтического цикла рельеф слизистой перестраивается. В расслабленном желудке скЬадки выражены слабо, а затем бывают полностью сглажены. При повышении тонуса желудка, на высоте глубокой перистальтической волны, в момент циркулярного сокращения антрального отдела складки вытягиваются, становятся продольными и почти вдвое тоньше, чем в теле желудка. В конце циркулярного сокращения антральный отдел несколько укорачивается, что приводит к перестройке рельефа слизистой. Складки превращаются в извилистые, изломанные, временами поперечные. Вследствие этого на экране видны полукруглые зарубки по контуру большой кривизны. Изменение складок в антральном отделе во время перистальтики свидетельствует о хорошей функциональной приспособляемости слизистой оболочки желудка.
Складки слизистой оболочки в дистальной части антрального отдела желудка радиально сходятся к привратнику и иногда продолжаются в складки луковицы 12-перстной кишки. Если рентгеновские лучи параллельны оси луковицы, то сходящиеся у привратника складки иногда образуют фигуру звезды. В концевой части антрального отдела на границе с 12-перстной кишкой находится отверстие, окруженное утолщенными циркулярными мышечными волокнами наподобие сфинктера. Эта суженная дистальная часть иногда бывает длиной до 2 см с толщиной стенки до 1 см. На свободном крае мышечного кольца привратника слизистая оболочка заворачивается в валикообразную складку (двустворчатую заслонку), выступающую в просвет луковицы 12-перстной кишки. Заслонка
69. Макрорельеф слизистой оболочки средней части желудка.
закрывается при наполнении луковицы. Этим предупреждается регургитация содержимого луковицы.
Результатами углубленного изучения рентгенологической картины выходного отдела желудка и пилоробулъбарного перехода доказано, что пилорический канал весьма изменчив. У него в некоторых случаях на обоих концах бывают небольшие воронкообразные расширения или раструбы. Одна воронка своим расширением направлена в луковицу 12-перстной кишки (луковичный раструб), другая воронка — в препилорическую часть желудка (желудочный раструб). У здорового человека при дозированной компрессии желудка можно выявить какой-нибудь один, иногда и оба раструба. Чаще виден луковичный раструб.
Ю. Н. Соколов и др. (1975) установили, что даже в момент сокращения мышечного сфинктера привратника, когда сам канал полностью освобождается от бариевой взвеси и перестает быть виден, остаток контрастного вещества все же задерживается в маленьком углублении, образуемом раструбом. Чаще всего это маленькое пятнышко (симптом «остаточного пятна»)
можно видеть в центре основания луковицы. От него отходят радиальные полоски. Получаемое изображение напоминает «зонтик». Всю эту рентгенологическую картину многие рентгенологи ошибочно трактуют как «нишу» с конвергенцией складок.
Под влиянием перистальтики контрастное пятнышко в раструбе меняет свои размеры и форму. В момент наибольшего перистальтического сокращения антрального отдела оно значительно уменшается, вытягивается по оси воронки и как бы становится продолжением одной из бороздок между складками слизистой оболочки. В большинстве случаев форма контрастного пятна в раструбе достаточно характерна, чтобы не путать ее с язвенной «нишей». По форме оно чаще приближается к треугольнику. Причем две стороны треугольника четкие и слегка вогнутые, а третья сторона неопределенная, с расплывчатым контуром. В общем пятнышко повторяет конфигурацию раструба или воронки, связанной с пилорическим каналом.
Выявление рельефа слизистой оболочки желудка у детей раннего возраста — одна из самых трудных задач. Из-за высокого положения желудка и невозможности его пальпации рельеф слизистой определяется только в области кардиального отдела: обнаруживаются относительно плоские, широкие, продольные складки с мелкими бороздками между ними либо мелкая ячеистость. В других отделах желудка складки слизистой оболочки не выявляются (Левин, 1974). У новорожденных и детей первых недель жизни контур большой кривизны желудка такой же гладкий, как и контур малой кривизны. По мере роста ребенка в первые 2 года жизни складки слизистой становятся выше и больше вдаются в просвет желудка, они начинают лучше выявляться во время рентгенологического исследо
вания. К 6 годам жизни ребенка слизистая оболочка желудка и сам желудок приобретает такие же форму, рельеф и положение, как и у взрослого.
Если макрорельеф слизистой оболочки желудка весьма изменчив, то микрорельеф — желудочные поля — обладает большим постоянством. Желудочные поля округло-овальные или полигональные, при неизмененной слизистой почти не выступают над окружающими их бороздками. В норме их размер преимущественно колеблется в пределах 0,5—1,5 мм. Увеличение желудочных полей свидетельствуете поражении слизистой оболочки.
При обследовании больного большое значение имеют результаты изучения смещаемости желудка. Различают активную смещаемость желудка — при втяжении и опущении живота, вдохе и выдохе и пассивную смещаемость — при перемене положения тела и пальпации живота. Не все части желудка смещаются одинаково. Фиксированная кардия и привратник смещаются меньше, большая кривизна перемещается на 5—12 см в зависимости от конституции и упитанности больного. У астеников смещения желудка большие, чем у гиперстеников. В горизонтальном положении тела больного желудок смещается кверху, в боковом и косом положении — в соответствующие стороны.
Желудок, в котором нет пищи и жидкости, не образует полости. Он спавшийся, т. е. его передняя стенка прилегает к задней, и только верхний отдел желудка заполнен воздухом (газовый пузырь). У новорожденных детей первых месяцев жизни газовый пузырь большой — занимает почти половину объема желудка. Газовый пузырь облегчает и регулирует поступление пищи в спавшийся желудок. Контрастная масса, попав в газовый пузырь, опускается в его нижний отдел и образует треугольник, обращенный вершиной
вниз. Затем она медленно движется вдоль малой кривизны по пищевой дорожке, клиновидная тень при этом удлиняется и попадает в нижние отделы желудка. Наименьший объем желудка обеспечивается сокращением мышечных волокон его стенок, т. е. тонусом. Тонус желудка непостоянен и изменяется под влиянием эмоционального состояния человека, поражения смежных органов и других факторов. Он определяет особенности перистальтики желудка и порог его раздражения.
Если тонус желудка нормальный, желудок развертывается до обычной формы в течение минуты, газовый пузырь становится полушаровидным. При повышенном тонусе стенок для полного расправления желудку требуется более 1 мин, газовый пузырь приобретает форму широкого полуовала, вытянутого в поперечном направлении. У людей с пониженным тонусом желудка из-за ослабления перистолы он быстро развертывается, контрастная масса не задерживается в субкардиальной части, лентой опускается в наиболее низкие отделы желудка, образуя в них чашеобразную тень с горизонтальным уровнем.
От тонуса желудка зависит и его перистальтика, обусловленная циркулярными ритмическими сокращениями круговых мышц и проявляющаяся волнообразными движениями его стенок. Ширина передвигающейся волны сокращения по окружности желудка варьирует от 1 до 1,5—2 см. Волна начинается в верхнем отделе тела желудка и распространяется до привратника. Благодаря тонусу стенок и перистальтике содержимое желудка перемешивается и порционно эвакуируется в 12-перстную кишку. Резервуарная функция желудка совмещена с гидролитической и осуществляется в основном телом и сводом желудка, а эваку-аторная функция — его антральным отделом. Натощак желудок сокращается
слабо. После приема пищи в нем появляются движения трех основных видов: перистальтические волны, систолические сокращения антрального отдела и уменьшение полости свода и тела желудка. Сразу же после приема пищи желудок расслабляется и наступает его рецептивная пищевая релаксация. Спустя некоторое время возникают сокращения желудка, которые затем усиливаются. Эти сокращения меньшие в верхнем отделе и наибольшие — в антральном.
Перистальтические сокращения мышц желудка начинаются в непосредственной близости от пищеводно-желудочного перехода, где локализуется кардиальный водитель ритма. Перистальтика наступает быстрее, если быстро заполняется желудок. У лежачего человека она лучше заметна в проксимальных отделах, а у стоячего — в дистальных отделах желудка.
Выделяют волны сокращений желудка трех типов: 1) простые однофазные волны низкой амплитуды, продолжающиеся по 5—20 с; 2) также простые волны, но более длительные — 12—60 с. Волны I и II типов перистальтические. Они поддерживают давление в полости желудка и способствуют перемешиванию пищи с желудочным соком. Возникнув в теле желудка, волны распространяются с возрастающей амплитудой до привратника. Если здесь перистальтика затухает, привратник не раскрывается; 3) эвакуаторные (изгоняющие) сокращения, которые появляются на фоне повышенного базального давления. Это пропульсивные волны.
Различают ритм перистальтики (чередование волн) и длительность отдельной перистальтической волны. В норме отмечается около 3 перистальтических волн в 1 мин. Их частота изменяется под влиянием нервных и гуморальных факторов. Распространяется волна со скоростью 1 см/с, быстрее по большой,
чем по малой кривизне, примерно на 1—2 см желудочной стенки. В антральном отделе скорость волны больше — до 3—4 см/с. Обычно на контуре желудка можно видеть сразу 2 — 3 волны. Если в 1 мин определяется больше 3 перистальтических волн, такую перистальтику называют усиленной, или «живой» (с укороченным ритмом); если 1 волна в 1 мин и реже — ослабленной, или «вялой», перистальтикой (с удлиненным ритмом).
О глубине перистальтики судят по степени сужения просвета желудка на уровне перистальтической волны. Глубина перистальтики пропорциональна силе сокращения мышц желудка и зависит от их тонуса: чем выше тонус мышц, тем ниже порог возникновения перистальтики, тем глубже перистальтические волны и начинаются они выше. При поверхностной перистальтике волны малой глубины, сужение просвета желудка небольшое — на четверть поперечника. Вследствие перистальтики средней глубины на уровне перистальтической волны просвет желудка суживается наполовину. Глубокая перистальтика обусловливает сужение желудка до 3/4 его просвета, а сегментирующая образует циркулярные перехваты и делит желудок на сегменты.
Сократительная способность мышц желудка зависит от степени их расслабления. Длина волны всегда будет больше, если мышца не утратила способности полностью расслабляться после сокращения. В результате поражения гладких мышц желудка воспалительными, опухолевыми и другими процессами стенка желудка хуже поддается растяжению. Распространение перистальтической волны нарушается. Вместо необходимой перистальтики регистрируются пассивные движения стенки желудка.
Глубина и скорость перистальтической волны наиболее заметны в ант
ральном отделе желудка. Каждая 3-я и 5-я перистальтическая волна соответствует систоле желудка. Они способствуют перемещению его содержимого в 12-перстную кишку. Промежуток между систолами называется желудочным циклом.
Во время систолы антрального отдела давление внутри желудка повышается до 10—25 мм рт. ст., привратник открывается и небольшая часть желудочного содержимого попадает в 12-перстную кишку. Большая часть его отбрасывается в проксимальный отдел и в нем еще раз перемешивается. Если препилорическая часть желудка не сокращается, даже когда заметна перистальтика и открыт привратник, эвакуации содержимого желудка может не быть.
В движениях желудка отмечается чередование активных сокращений и относительного покоя. Периодические колебания движения бывают двух типов: 1) перистальтический характеризуется кратковременным повышением тонуса желудка синхронно с каждой перистальтической волной; 2) минутный — продолжительность фаз повышения и снижения тонуса различна. Так, тонус нормотонического желудка повышен в течение 37—40 с, сменяясь фазой покоя на 19 — 21 с. Если желудок гипотонический, преобладает фаза покоя, которая длится 2—5 мин, а повышение тонуса кратковременное, не более 22 — 25 с. При гипертоническом желудке фазы расслабления не бывает, тонус желудка постоянно высокий и амплитуды перистальтики изменяются незначительно.
Скорость эвакуации желудочного содержимого в кишечник зависит от многих условий: объема этого содержимого, градиента давления между антральным отделом желудка и 12-перстной кишкой, состояния привратника, консистенции желудочного химуса, его осмотического давления, температуры и кислотности желудочного сока и др.
Почти у 20 % больных контрастная масса попадает в луковицу с первыми глотками. В норме желудок полностью опорожняется от стандартной порции обычной бариевой взвеси в течение 1,5 — 2 ч. Скорость опорожнения желудка не зависит от плотности контрастной массы и соответствует времени поступления ее первых порций в слепую кишку.
У детей различают первичную и вторичную эвакуацию контрастной массы. Под первичной эвакуацией понимают выведение контрастной взвеси из желудка в момент введения ее в этот орган. Первичная эвакуация длится 1—2 мин. За это время хорошо контрастируется выходной отдел желудка. В результате удается получить точную диагностическую информацию об анатомическом и функциональном состоянии пилорического канала. Под вторичной эвакуацией следует понимать эвакуацию бариевой взвеси из желудка, которая начинается и заканчивается вместе с эвакуацией пищи, полученной ребенком при очередном кормлении Бариевая взвесь вместе с пищей эвакуируется из желудка либо медленно текущим сплошным потоком, либо отдельными быстро передвигающимися порциями через короткие интервалы.
По вторичной эвакуации можно судить об эвакуаторной функции желудка в нормальных условиях. У новорожденных и детей первых месяцев жизни выход содержимого из желудка в 12-перстную кишку в основном обусловлен тоническими сокращениями и зависит от выжимающего эффекта, т. е. от общей контрактильности мышц желудка. Полная эвакуация содержимого из желудка у них завершается через 3—4 ч. Изредка остатки бария задерживаются в желудке до 24—30 ч.
Двигательная деятельность желудка регулируется миогенными, нервными и гуморальными механизмами.
Наиболее важная роль принадлежит нервной системе. Иннервация желудка обеспечивается экстрамуральными (блуждающими, чревными, диафрагмальными) и интрамуральными нервами.
Парасимпатическая иннервация желудка осуществляется блуждающими нервами, содержащими преганглионар-ные волокна, которые заканчиваются перицеллюлярными аппаратами в мио-энтеральном сплетении на клетках До- геля I типа. Это вторые нейроны парасимпатической системы.
Симпатическая иннервация осуществляется волокнами, идущими в составе । вагосимпатических стволов блуждаю-> щих нервов, и волокнами чревных нервов, достигающими желудка в составе i брыжеечных нервов. Кроме того, в эфферентной иннервации желудка принимают участие волокна диафрагмального нерва, задних корешков спинного мозга, исходящих из Tv и Бш (преимущественно Tv-Xi), которые образуют в стенке [ желудка разнообразные рецепторы. . Интрамуральная система сформирована из 3 сплетений: подслизистого, [ межмышечного и подсерозного. Наиболее развитое миоэнтеральное сплетение располагается между продольным и циркулярным слоями вдоль экстраму-ральных нервов. Это мощная сеть нервных волокон различной толщины. Миоэнтеральное сплетение имеет связь с । подслизистым сплетением. Подслизис-i тое сплетение состоит из более тонких пучков нервных волокон, чем межмы-[ шечное. В нем меньшие петли, более мелкие ганглии с небольшим количеством малодифференцированных ней-> ронов. Субсерозное сплетение — это I широкопетлистая сеть нервных пучков. Оно тесно связано с кровеносными и лимфатическими сосудами.
i Во всех тканях желудка много ре-I цепторов разветвлений нервных волокон из интрамуральных нервных сплетений, 169
в основном системы блуждающих нервов, а также большого и малого чревных нервов, печеночного сплетения, грудных и поясничных спинномозговых нервов. В результате интрамуральных связей отростков клеток Догеля II типа с клетками Догеля I типа в желудке замыкается местная рефлекторная дуга.
Основными моторными нервами желудка считаются блуждающие, тормозными нервами — чревные. Желудок возбуждается в результате выделения ацетилхолина в нервных окончаниях (нейроэффекторных соединениях) блуждающих нервов и действия этого медиатора на гладкие мышцы. Атропин и гиосциамин устраняют это действие.
Вследствие раздражения чревных нервов возникают преимущественно тормозные эффекты. Передатчиком импульсов этих нервов является норадреналин, а возможно и другие адре-налоподобные вещества. Тормозные эффекты снимаются симпатолитиками (адреноблокаторами). В некоторых случаях во время раздражения чревных нервов отмечается обратное явление: усиливается двигательная деятельность желудка, особенно после введения сим-патолитиков.
Глава 13. АНОМАЛИИ
Желудок человека развивается из заднего отдела передней кишки. У эмбриона на 4-й неделе развития желудок представляет собой веретенообразное расширение передней кишки. Его продольная ось совпадает с продольной осью тела. У 6-недельного зародыша в желудке можно различить большую кривизну, обращенную кзади, и малую, направленную кпереди. В последующие стадии до 4-месячного возраста эмбрионального развития происходят повороты желудка вокруг сагиттальной и продольной осей. При повороте вокруг сагиттальной оси желудок переходит из
Под влиянием раздражений чревных и периартериальных нервов желудок сокращается в результате запуска холинергических механизмов и возбуждения адренергических а -рецепторов. Расслабляется желудок, как правило, вследствие стимуляции В-адренорецепторов. Высказывается мысль о наличии в стенке желудка неадренергических постсинаптических нейронов, тормозное действие которых не блокируется известными адреноблокаторами.
Таким образом, парасимпатическая и симпатическая нервные системы нередко в зависимости от состояния органа функционируют не как антагонисты, а как синергисты. При физиологических воздействиях на желудок обычно возникает комплексный ответ обеих систем: симпатической и парасимпатической. Раздражая различные нервы, можно получить не только моторые, но и тормозные эффекты. Для регуляции моторно-эвакуаторной деятельности желудка имеют значение также энтерогастральный рефлекс, гастроинтестинальные гормоны, интенсивность гидролиза питательных веществ в желудке и тонкой кишке и другие механизмы, вещества и факторы.
И ПОРОКИ РАЗВИТИЯ
вертикального положения в косое.При этом кардиальная часть желудка перемещается влево, а пилорическая — вправо. Поворот вокруг продольной оси приводит к тому, что левая поверхность желудка становится передней, а правая — задней. Большая кривизна желудка переходит влево и книзу, малая — вправо и вверх. Желудок в целом перемещается книзу. К концу 8-й недели завершается закладка структур, составляющих стенку желудка. В последующем происходит дифференцировка тканей желудка. С особенностями эмбриогенеза желудка связано образова
ние некоторых его пороков развития. Так, если поворот желудка и кишечной трубки произойдет в обратном направлении (справа налево), образуется обратное положение внутренностей, которое может быть полным — всех внутренностей или частичным — только брюшных. Известны случаи отсутствия и удвоения желудка, его дивертикулы, обусловленные нарушениями в формировании первичной кишечной трубки на ранних стадиях эмбриогенеза. Наблюдаются атрезии и стенозы первичной кишечной трубки в месте перехода желудка в 12-перстную кишку, а также образование мембран, закрывающих вход в желудок. Рассмотрим наиболее важные и часто встречающиеся аномалии и пороки развития желудка.
Пилоростеноз. Встречается чаще других пороков развития желудка. Он возникает в результате гипертрофии и гиперплазии круговых мышечных волокон привратника и нарушения их иннервации. Толщина стенки и длина пилорического канала увеличиваются в 3—4 раза, а иногда и более, по сравнению с нормой. В результате сужения выходного отдела желудка затрудняется поступление пищи из желудка в кишечник.
Клинические проявления пилоростеноза обычно отмечаются на 2—4-й неделе жизни ребенка. Наиболее постоянный и ведущий симптом — рвота. У некоторых новорожденных в течение 1-й и 2-й недель жизни рвоте предшествует срыгивание, которое постепенно учащается, а объем выбрасываемой пищи нарастает. К концу 3-й или началу 4-й недели обильные срыгивания постепенно сменяются упорной обильной рвотой желудочным содержимым по типу фонтана. Сначала рвота появляется после каждого кормления, в дальнейшем, когда снижается тонус желудка и расширяется его полость,— после 2—3
приемов пищи. Количество рвотных масс обычно больше количества принятой до этого пищи. Это свидетельствует о задержке эвакуации пищи из желудка. Причем рвотные массы имеют кислую реакцию и не содержат желчи. Вследствие длительной задержки в желудке молока развивается гнилостное брожение; в рвотных массах с неприятным и тухлым запахом заметны коричневые прожилки гематина.
Из-за интенсивной и длительной рвоты быстро истощается организм ребенка и его масса снижается на 20— 30 %, нарушается водно-солевой обмен, развиваются обменный гипохлореми-ческий алкалоз и гипокалиемия. С недо-саточным поступлением пищи в кишечник уменьшается количество кала, отмечается задержка стула. С прогрессированием болезни уменьшается объем выделяемой мочи, значительно урежа-ется мочеиспускание, развивается олигурия, концентрированная моча оставляет на пеленках интенсивно-желтые пятна. Характерный внешний вид истощенного обезвоженного ребенка: черты лица заострены, оно становится морщинистым, старческим, землисто-серым; глаза впалые и тусклые, страдальческие; подкожно-жировой слой истончен, кожа туловища и конечностей, собранная в складки, серая; верхняя часть живота выбухает из-за увеличенного желудка, а нижняя часть запавшая.
В поздних стадиях болезни через истонченную стенку живота в эпигастральной области можно наблюдать сильную перистальтику желудка, которая начинается у левого подреберья и распространяется вправо. У некоторых больных, если передняя брюшная стенка справа не напряжена, над пупком прощупывается утолщенный привратник — плотное, напоминающее желудь подвижное образование, тесно связанное с желудком.
Если итоги клинического обследования ребенка дают основание предположить у него пилоростеноз, для решения вопроса о лечебной тактике больного нужно подвергнуть рентгенологическому исследованию, которое, по выражению Ю. Р. Левина (1974), «является тем кульминационным моментом в истории болезни ребенка, после которого он либо возвращается на консервативное лечение к педиатру, либо направляется к хирургу для оперативного вмешательства». Результаты рентгенологического исследования надо рассматривать вместе педиатру, рентгенологу и хирургу и только в сопоставлении с данными клинического наблюдения, потому что в противном случае возможны диагностические ошибки, последствия которых бывают тяжелыми.
Рентгенологические признаки врожденного пилоростеноза достаточно разнообразны. До введения контрастного вещества на рентгенограммах в желудке определяется натощак жидкое содержимое, а количество газа в петлях кишечника уменьшено или вовсе отсутствует. При контрастировании желудка отмечаются его увеличение, сужение и удлинение пилорического канала, длительное закрытие привратника (иногда от 2 до 5 ч), переход контрастной массы небольшими порциями в петли тонкой кишки. Перистальтика желудка усиленная, глубокая или сегментирующая. Желудок принимает форму песочных часов с образованием двух валов, изменяется и положение его. Эвакуаторная способность желудка резко замедлена и часть бария выявляется в нем спустя 24—72 ч после приема.
Прямыми рентгенологическими признаками пилоростеноза являются сужение и удлинение пилорического канала. В процессе исследования рентгенологическая картина меняется: начальная часть привратника может выглядеть в
форме клюва, когда в результате гипертрофии и спазма привратника его просвет закрывается и дальнейшее контрастирование прекращается; антральный отдел — в виде клина или с образованием клюва либо клюва с вдавле-ниями в области антрума за счет гипертрофированной мускулатуры. О сужении и удлинении пилорического канала говорит симптом «усика» или «жгутика», образующийся тогда, когда контрастное вещество не доходит до луковицы 12-перстной кишки и не контрастирует ее, т. е. имеется частичное заполнение стенозированного участка, дающее большой разрыв между клювом и луковицей 12-перстной кишки. На фоне суженного канала в ряде случаев могут быть видны 2—3 продольно расположенные избыточно выраженные складки слизистой (симптом складки).
Выраженный гипертрофированый пилоростеноз характеризуется сужением и удлинением пилорического канала до 4 см, а также наличием дефекта наполнения у основания луковицы в виде полумесяца, образующегося за счет выпячивания гипертрофированного привратника в ее просвет. При выраженном гипертрофированном пилоростенозе имеется и симптом плечиков, или фигурной скобки, когда стенки антрального отдела надвигаются на гипертрофированный, ригидный привратник и вокруг антрального клюва появляются вдавления, напоминающие приподнятые плечи.
Рентгенологически выделяют 3 степени пилоростеноза: 1) наличие суженного и удлиненного пилорического канала; 2) симптом клюва с плечиками; 3) полное отсутствие эвакуации бариевой взвеси из желудка. Большинство исследователей считают, что если при пилоростенозе имеются расширенный атонический желудок, суженный и удлиненный более чем на 0,5 см пилорический канал и остаток бариевой взвеси
через 4 ч после ее приема превышает 50 %, такие дети должны подвергаться оперативному вмешательству.
Все большее применение находит ультразвуковая диагностика гипертрофированного пилорического стеноза. УЗИ проводится на частоте 5—5,7 Мгц после иммобилизации детей в положении на спине. У больных в возрасте от 3 до 7 недель с гипертрофическим пилорическим стенозом отмечаются следующие изменения: толщина мышечного слоя в области пилоруса составляет 4,8 ±0,6 мм, длина мышечного слоя —2,1 ±0,3 см, длина пилорического канала — 1,8 ±0,4 см. В то же время у детей без признаков гипертрофического пилорического стеноза эти данные бывают соответственно 1,8 ± ±0,4 мм; 1,3±0,3 и 1,1 ±0,3 см. По мнению S. D. Blumhagen, L. Maclin, D. Kranter et al. (1988), УЗИ позволяет выявить пилоростеноз у 100 % больных.
Врожденное сужение привратника необходимо отличать прежде всего от пилороспазма (спастического пилоростеноза) — функционального дискинети-ческого расстройства желудка, которое наблюдается в первые недели и месяцы жизни ребенка. При спастическом пилоростенозе имеется недоразвитие нервного аппарата желудка, что проявляется в период новорожденности срыгиванием и функциональной рвотой. На раннем этапе заболевания у некоторых детей рвоты может и не быть, падение массы тела отсутствует или она уменьшается незначительно, видимой перистальтики не наблюдается.
Рентгенологически у больных пилоро-спазмом выявляются большое количество газов в кишечнике и отсутствие натощак жидкого содержимого в желудке. Сужения и удлинения пилорического канала не наблюдается. Желудок обычных размеров, привратник закрыт не более 15 — 20 мин, а после открытия
70. Рентгенологические признаки пилоростеноза:
/ — суженный канал, на протяжении которого видны складки слизистой оболочки; 2 — клюв с вдавленном в области антрума вследствие гипертрофии его мышц; 3 — антральный клюв; 4 — вдавлен не в области основания луковицы 12-перстной кишки; 5 — неполное выполнение луковицы 12-перстной кишки; 6 — неполное выполнение стенозированного участка (в результате получается большой разрыв между клювом и луковицей 12-перстной кишки).
его контрастная масса большими порциями тотчас поступает в кишечник, в котором имеются явления дистонии — чередование спастических и расширенных участков. Бариевая взвесь не задерживается в желудке дольше 6—8 ч, отсутствует и сегментирующая перистальтика его.
Применение спазмолитических средств и витамина В, приводит к исчезновению симптомов пилороспазма, нервный аппарат желудка восстанавливается и ребенок выздоравливает. Если же развитие нервного аппарата останавливается, то частота и длительность спастических явлений увеличиваются, мускулатура привратника начинает гипертрофироваться, к пилороспазму присоединяется кардиоспазм.
Врожденный пилоростеноз необходимо дифференцировать от адреногени-тального синдрома (синдром Дебре — Фибигера). Этот синдром характеризуется врожденной гиперплазией надпочечников, усиленной продукцией андрогенов и псевдопилороспазмом.
Клинические проявления: при этом синдроме у ребенка в первые недели жизни отмечаются недостаточный прирост массы тела, прогрессирующая апатия и гипотония, срыгивание или рвота,
нередко спастическая и неукротимая из-за пилороспазма, признаки обезвоживания организма, сильная перистальтика желудка, учащенный стул. Периодически возникает коллаптоидное состояние с цианозом и бледностью кожи, ускоренным нерегулярным пульсом, потливостью, судорогами и потерей сознания. Такое состояние развивается «беспричинно», продолжается от нескольких минут до получаса и нередко заканчивается смертью ребенка. Часто у детей, страдающих этим синдромом, сильно пигментирована кожа. У девочек нередко выявляются признаки ложного гермафродитизма, а у мальчиков — гипоспадия. Определяются гипохлоремия, гипонатриемия, гиперкалиемия, гипо-хлоремическая азотемия, гиперхлору-рия. Резко повышено количество 17-кетостероидов в моче.
В отличие от врожденного пилоростеноза при адреногенитальном синдроме ребенок отказывается от питья, у него отмечается склонность к поносам. Рвотные массы нередко с примесью желчи.
Рентгенологические признаки: пилорический отдел желудка обычных размеров, контрастное вещество не задерживается в желудке.
Врожденный пилоростеноз иногда сочетается с грыжей пищеводного отверстия диафрагмы. Это — френопилори-ческий синдром. Многие исследователи считают, что грыжа пищеводного отверстия диафрагмы развивается вторично и обусловлена постоянным повышенным внутрижелудочным давлением. После ликвидации пилоростеноза развитие грыжи приостанавливается, и в дальнейшем нередко у ребенка ее признаки вообще полностью исчезают. Выявляют этот синдром, как правило, рентгенологически.
Рентгенологические признаки: на снимке желудок заканчивается слепо, его опорожнение замедленно.
Таким образом, клинические симпто
мы пилороспазма и пилоростеноза весьма незначительны и плохо различимы. Поэтому правильный и своевременный диагноз болезни можно поставить по результатам рентгенологического исследования, если соблюдены правила рентгеногастрографии, налажен тесный деловой контакт с лечащим врачом, глубоко проанализированы клинические и рентгенологические данные.
Врожденные мембраны желудка. Эта аномалия развития характеризуется наличием в выходном отделе желудка перепонки различных видов и размеров: от формы полумесяца до полной диафрагмы с небольшим (до 1 см) отверстием в центре или эксцентрично. Располагается обычно на 1 — 1,5 см проксимальнее привратника, но встречается и на большом (до 7 см) расстоянии от него. Толщина диафрагмы, как правило, йе превышает 2—3 мм. В зависимости от наличия и размеров отверстия в мембране непроходимость желудка может проявляться в раннем детском возрасте, что бывает чаще всего, реже — у взрослых.
Происхождение данного порока развития связано, по-видимому, с задержкой процесса реканализации эмбриональной эпителиальной окклюзии пищеварительной трубки. Поздние проявления заболевания, вероятно, обусловлены травматизацией мембраны и постепенным рубцеванием ранее проходимого отверстия в ней. Врожденная мембрана состоит из грубоволокнистой соединительной ткани с небольшим количеством кровеносных сосудов, с отдельными беспорядочно расположенными гладкомышечными волокнами и с обеих сторон покрыта слизистой оболочкой желудочного типа с нерезко выраженным подслизистым слоем.
Клиническое проявление заболевания зависит от ряда особенностей: наличия и размеров отверстия в мембране, толщины и эластичности мембраны.
Сплошные мембраны у новорожденных требуют неотложного хирургического вмешательства. При наличии в мембране отверстия диаметром не менее 5 — 7 мм клиника характеризуется постепенно нарастающей непроходимостью привратникового канала. В случае наличия в мембране отверстия 8 мм и более заболевание может ничем себя не проявлять в течение многих лет.
'Рентгенологическое исследование желудка с бариевой взвесью выявляет стойкую циркулярную деформацию в виде тонкой симметричной ленты, полукольца или кольца, расположенных перпендикулярно к продольной оси антрального отдела желудка. Эластичность стенок и их перистальтика не нарушены. Если отверстие в мембране малое и бариевой взвесью заполняется препилорический отдел желудка, он может иметь вид второй луковицы (симптом двойной луковицы). При этом отчетливо выражены нарушения эвакуации содержимого из желудка и дилатация его вышележащих отделов. Если у новорожденного больших размеров желудок с уровнем жидкости и большим газовым пузырем, а в петлях кишечника нет газа, следует думать о сплошной перепончатой мембране в области привратника.
Двойной желудок. Эта аномалия развития характеризуется наличием изолированного или сообщающегося с желудком или с 12-перстной кишкой полого образования, чаще расположенного на большой кривизне или на задней поверхности желудка. Бывает полное и неполное удвоение желудка. Добавочные полости напоминают кисту, дивертикул или трубку, сообщающуюся с основной полостью желудка и 12-перстной кишки. Полное удвоение желудка сочетается с полным или частичным удвоением пищевода. Обе полости желудка сообщаются между собой, чаще в месте перехода в 12-перстную кишку.
Клинические проявления зависят от размеров добавочного образования и степени сообщения с желудком. Обычно наблюдаются срыгивание, рвота. При изъязвлении слизистой оболочки добавочной полости желудка в рвотных массах кровь, мелена. В некоторых случаях изъязвление осложняется перфорацией стенки полости и последующим развитием перитонита.
Основным методом диагностики удвоения желудка является рентгенологический с применением контрастных веществ.
Рентгенологические признаки: при сообщении добавочной полости с желудком определяется дополнительный уровень жидкости, чаще по большой кривизне, выше или ниже газового пузыря основной полости желудка. Отмечаются разделение контрастной массы в субкардиальном отделе на две струи и их соединение в выходном отделе желудка.
При дивертикулообразном удвоении желудка во время обзорного просвечивания брюшной полости выявляются два газовых пузыря в левой половине живота: один соответствует газовому пузырю основного желудка, второй — дополнительному органу. Контрастная масса в средней трети желудка раздваивается: одна струя попадает в основной желудок, а другая — в добавочное образование, имеющее форму второго желудка. Из второго желудка она попадает в полость основного желудка через вторую луковицу и небольшой отрезок 12-перстной кишки. Дополнительный желудок бывает размером 15 X 6 см и располагается кпереди и кнутри от основного желудка.
Дивертикулы желудка. Встречаются реже, чем в других отделах пищеварительного тракта. Они обнаруживаются одинаково часто у людей обоего пола. На дивертикулы приходится в среднем около 0,04 % болезней желудка.
О врожденном происхождении дивертикула свидетельствует факт его обнаружения у детей раннего возраста. Развивается дивертикул в неполноценных участках стенки желудка — там, где наступили нейротрофические изменения и стенка потеряла мышечный тонус. В итоге такая стенка пролабирует, т. е. развивается преддивертикулярное состояние. В дальнейшем развитию дивертикула способствуют многие факторы, важнейший из них — возрастное изменение тканей.
Различают истинные и ложные дивертикулы. Дивертикул считается истинным, если его стенки образованы из всех слоев стенки желудка. Ложный дивертикул возникает в результате соответствующих нервно-мышечных изменений в стенке желудка и образуется при надрыве мышечного слоя, через который выпячивается слизистая оболочка желудка.
В области свода и кардиального отдела желудка находят 75 % дивертикулов, в выходном отделе — 15, в других отделах — 10 %.
Клинические проявления: неосложненный дивертикул желудка нередко протекает без каких-либо клинических симптомов (латентная форма). При его воспалении (дивертикулите) клиника напоминает симптомы гастрита (гастри-тическая, или диспептическая, форма), пептической язвы желудка с периодическими болями, гиперсекрецией, кровотечениями и другими явлениями (псевдоязвеиная форма). У некоторых больных дивертикулом желудка отмечаются истощение, адинамия, диспеп-тические явления и другие симптомы, симулирующие злокачественное новообразование (псевдоканцероматозная форма). Иногда дивертикул сочетается с язвой, раком желудка, хроническим холециститом и другими болезнями (комбинированная форма).
Основное значение в распознавании
дивертикула желудка имеют данные рентгенологического исследования в комбинации с фиброгастроскопией.
Рентгенологические признаки: определяется своеобразное ограниченное округлое или овальное выпячивание стенки желудка с ровными, четкими контурами, чаще по малой кривизне, в кардиальном отделе. Характерны складки слизистой оболочки в шейке, а нередко и в самом дивертикуле, которые сходятся радиально у ворот дивертикула. Дивертикул бывает в поперечнике от 1 до 3 см. Его стенки эластичные, способны сокращаться, поэтому дивертикул нередко во время исследования уменьшается. Если дивертикул крупный, в нем иногда определяются три слоя: слой бариевой взвеси, содержимого желудка и воздуха.
Воспаление дивертикула сопровождается изменением рельефа слизистой, нарушением эвакуации содержимого из дивертикула и длительной задержкой бариевой взвеси в нем. Нередко изменяется форма дивертикула. Тогда он сморщивается, его очертания становятся неправильными, а контур извилистым и нечетким. Неправильная форма тела дивертикула с заострениями по контурам свидетельствует о перидивертикулите.
В некоторых случаях при спазме шейки дивертикула или заполнении его полости пищевыми массами и слизью диагностировать дивертикул основными рентгенологическими методами невозможно. Тогда рекомендуется провести многоосевое исследование в желудке в горизонтальном и вертикальном положении больного с использованием фармакологических средств.
Дивертикул желудка необходимо дифференцировать от язвенной «ниши», грыжи пищеводного отверстия диафрагмы, перфорации желчного пузыря и др.
Существует и интрамуральный дивертикул желудка. Он является истинным
дивертикулом в пределах стенки желудка без деформации рельефа слизистой оболочки. Располагается на большой кривизне в области антрального отдела. Встречается при рентгенологических исследованиях желудка в 0,05 % наблюдений. Размеры интрамурального дивертикула иногда достигают 1 см. Такие’ дивертикулы могут быть множественными. При рентгенологическом исследовании обнаруживают интрамуральное скопление контрастного вещества округлой формы с гладкими контурами по большой кривизне в антральном отделе. Для интрамурального дивертикула типично изменение его формы в процессе исследования как результат активной сократительной способности. В области окружающей дивертикул слизистой оболочки отсутствуют признаки отека и деформации (Cockrell, Cho Chao-Ru, Messmer, 1984).
Заворот желудка. Это чрезвычайно тяжелая форма непроходимости пищеварительного тракта. К завороту желудка предрасполагает врожденная слабость (недоразвитие) его связочного аппарата или врожденная аномалия — слабость левой половины диафрагмы, релаксация ее с чрезмерной подвижностью и смещаемостью желудка. Завороту опущенного желудка способствуют метеоризм, перерастяжение и переполнение полости желудка пищевым содержимым. Заворот желудка с одинаковой частотой встречается у мужчин и женщин. Описаны случаи его и у детей.
Заворот желудка классифицируется по оси поворота — вдоль оси брыжейки, оси органа или вдоль комбинированной оси, по степени поворота — полный или частичный и по направлению заворота — передний или задний. Чаще всего обнаруживаются завороты по поперечной оси органа — мезентерико-аксиаль-ные, реже — завороты вокруг продольной оси органа — органо-аксиальные.
Поперечный, или мезентерико-акси-
71. Дивертикул желудка: а — схема; б — рентгенограмма ильный, заворот происходит в результате поворота- желудка по оси, проходящей через середины большой и малой кривизны, вокруг печеночно-желудочной связки. Этот вид заворота наблюдается у больных с патологией связочного аппарата желудка и 12-перстной кишки и встречается в 3—4 раза чаще продольных заворотов. Различают также два варианта поперечного заворота желудка. В случае первого варианта заворот происходит по ходу часовой стрелки, при этом пилорический отдел поворачивается кверху справа налево, а кардиальный — вниз и вправо. Этот вариант заворота называется еще изопери-стальтическим. При втором, антипери-
стальтическом, варианте поперечного заворота желудок поворачиваетсн против движении часовой стрелки.
Продольный, органо-аксиальный, заворот происходит по оси, идущей от кардии к привратнику, и обычно сочетается с диафрагмальной грыжей. Различают два варианта этого вида заворота. В случае первого варианта большая кривизна желудка поворачивается на переднюю поверхность его к малой кривизне, увлекая за собой поперечную ободочную кишку и большой сальник. При дальнейшем повороте в этом направлении может возникнуть разрыв малого сальника и большая кривизна оказывается у задней стенки желудка, образуя заворот на 180° с полной обтурацией входа и выхода желудка. Первый вариант продольного заворота нередко возникает при полной релаксации левого купола диафрагмы.
Клинически различают острые и хронические завороты желудка. Если заворот острый, желудок, как правило, ротируется в кардиопилорической плоскости и образует замкнутую петлю. Клинически проявляется катастрофой в брюшной полости — признаками высокой кишечной непроходимости: возникают сильные боли в эпигастрии с иррадиацией в спину и нижние отделы грудной клетки. Эти боли притлотании воды и пищи сопровождаются позывами к рвоте, рвотными движениями и срыгиваниями. В левом подреберье пальпируется раздутый газами желудок, вызывающий вздутие верхнего отдела живота, его асимметрию, а также отмечается сильное напряжение мышц передней брюшной стенки. Здесь же перкуторно определяется тимпанит. Общее состояние больного тяжелое. Оно быстро ухудшается в связи с нарастанием гемодинамических нарушений, обезвоживанием, интоксикацией организма и развитием коллапса.
При хроническом завороте обычно
происходит ротация желудка справа налево вокруг сагиттальной плоскости. Этот вид даворота встречается чаще, проявляется симптомами стойкой или интермиттирующей желудочной диспепсии. Клинически хронический заворот в ряде случаев может вообще не проявляться.
Диагноз заворота желудка основывается на клинической картине, невозможности ввести в желудок зонд или гастроскоп из-за непроходимости пищеводножелудочного перехода и на данных рентгенологического исследования.
Рентгенологически при продольном полном завороте, ротации желудка слева направо через кардию и привратник определяются: высокое расположение левого купола диафрагмы; сразу под ней — растянутый газами желудок, часто с уровнем жидкости; бариевая взвесь в желудок не проникает, а задерживается в пищеводе, над диафрагмой; антиперистальтика пищевода. Если произошел поперечный полный заворот, т. е. поворот желудка поперек малого сальника и через обе кривизны, бариевая взвесь заполняет верхний отдел желудка, если же заворот частичный — желудок деформируется соответственно степени и особенностям заворота. Антральный отдел смещается кверху и влево и накладывается на верхний отдел. Вследствие высокого положения антрального отдела в нем определяются второй газовый пузырь и горизонтальный уровень жидкости слева и спереди от нормального газового пузыря желудка.
Болезнь Менетрие. Впервые описана в 1888 г. французским патологоанатомом Менетрие, именем которого это заболевание называется чаще всего. Существуют и другие названия (избыточная Слизистая оболочка желудка, аденопапилломатоз желудка, опухолеподобный гастрит, экссудативная гастропатия, гиперпластическая гастропатия и др.).
Имеется множество теорий образования избыточной слизистой оболочки желудка. Такая гиперпластическая реакция ее при болезни Менетрие, но нашему мнению, может возникать либо в результате воздействия экзогенных или эндогенных факторов при врожденной предрасположенности слизистой оболочки, либо она является аномалией развития желудка.
Болезнь Менетрие обнаруживается у людей в различные периоды их жизни. Она может появиться уже в детстве (Marks et al., 1986), однако значительно чаще проявляется у взрослых в возрасте от 20 до 77 лет, но наиболее часто у мужчин во втором периоде зрелого возраста. О наследственной природе этого заболевания ничего не известно. Оно одинаково часто встречается у белого населения, у негров, арабов, китайцев и японцев (Adrian, Bloom, Polak, 1981).
Клинические проявления различные. Дебют заболевания чаще незаметный, постепенный, но не исключено и острое начало. Самая частая жалоба — чувство тяжести в эпигастрии. Боль в эпигастральной области отмечают 75 % больных, похудание — 60, тошноту — 40 %. Очень важный симптом — отеки, встречается приблизительно в 40 % случаев и иногда может быть единственным проявлением болезни. Весьма характерны анорексия и снижение массы тела почти в 30 % случаев. Нередко отмечается тошнота, которая обычно сопровождается рвотой с примесью крови. У 20 % больных имеются поносы, часто гипо-или ахлоргидрия, признаки гипохромной анемии. В крови снижено содержание натрия, калия, протеинов при нормальном уровне альбумина и резкой гипогаммаглобулинемии. Заболевание может протекать с периодическими обострениями, напоминая язвенную болезнь.
Избыточная слизистая оболочка же
лудка — классический пример гастро-энтеропатии с потерей белка и нарушением его всасывания у 50—60 % больных. Количество белка в желудочном соке, по сравнению с нормой, увеличивается почти в 1,5—2 раза. У 75 % больных определяются гистаминоустойчивая ахилия, увеличение первичной щелочности и главным образом — буферной способности желудочного сока.
Избыточной становится вся слизистая либо часть ее. Поэтому различают диффузную и локализованную формы болезни. Наиболее часто избыточные складки слизистой оболочки обнаруживаются в области синуса и большой кривизны, но иногда выявляются на малой кривизне вдоль всей ее длины, в антральном отделе, кардии и своде желудка. Избыточная слизистая четко локализована и отграничена от нормальной слизистой оболочки желудка. Зона избыточных складок заметно приподнята над непораженной слизистой и выглядит в виде отграниченной и приподнятой площадки.
Через гастроскоп избыточные складки слизистой оболочки напоминают «мозговые извилины» высотой 2—3 см и шириной до 2 см и более. В некоторых случаях вдоль складок видны рыхлые, синеватые узловатые полиповидные образования. Тогда рельеф слизистой приобретает вид булыжной мостовой. Пораженная зона с избыточными складками резко отграничивается от остальной слизистой оболочки желудка. На гребнях складок нередко заметны язвы или эрозии, сами складки покрыты слоем густой, вязкой и обильной слизи.
Гистологически в такой слизистой оболочке желудка обнаруживают увеличенное количество железистых складок, признаки гипертрофии желез и кистозного расширения их основания, инфильтрации плазматических и эозинофильных клеток, пролиферации клеток
поверхностного эпителия и прочие изменения. Полагают, что кисты являются кардиальным диагностическим гистологическим признаком.
По мнению многих авторов, болезнь Менетрие не имеет патогномоничных гастроскопических признаков, так как при этом исследовании нельзя исключить другие патологические процессы. Патологический материал не играет никакой роли в диагностике этой болезни. Только аспирационная биопсия с взятием мышечного слоя слизистой оболочки дает возможность поставить правильный диагноз. Но сделать это трудно из-за утолщения слизистой до 0,5 см.
Одним из основных методов диагностики избыточной слизистой оболочки желудка является рентгенологическое исследование.
Рентгенологически складки слизистой оболочки желудка, как правило, значительно увеличены обычно вдоль большой кривизны в области синуса и тела желудка, особенно проксимальной его половины. Складки не только толстые, но и высокие, плотно примыкают одна к другой, так что не всегда жидкая бариевая взвесь сразу попадает в борозды между ними. Рельеф слизистой нередко нормальный, хотя «узловатая» слизистая может давать ограниченные возвышения. Иногда контрастирование борозд затрудняется, потому что в желудке много слизи. В процессе исследования складки слизистой оболочки при мануальной пальпации не изменяются, отмечается некоторая их ригидность. По большой кривизне желудка складки образуют зазубренность или изъеденность контура, подобно злокачественному новообразованию. Вследствие утолщения складок на ограниченном участке рентгенологически иногда выявляют дефекты наполнения, имитирующие картину опухолевого поражения. В таких случаях целесообразно создать дозированную компрессию, про
вести пневмогастрографию, при которой складки имеют тенденцию к расправлению. Иногда помогает повторное рентгенологическое исследование после курса противовоспалительной терапии. С помощью повторного исследования устанавливают особенности рельефа слизистой, убеждаются, что нет обрыва ее складок, определяют их эластичность, отмечают четкую перистальтику в зоне поражения, резкую отграниченность от остальной, непораженной, слизистой оболочки.
Локальное поражение верхнего отдела желудка проявляется уменьшением и деформацией желудочного пузыря, дополнительными тенями на его фоне, увеличением расстояния между сводом желудка и куполом диафрагмы, медиальной стенкой желудка и краем позвоночника, сужением просвета верхней трети тела желудка. Эта форма болезни представляет особые дифференциальнодиагностические трудности для врачей.
Между расширенными складками часто образуются ямки глубиной 1 — 2 см, которые заполняются бариевой взвесью. Рентгенологически это проявляется грубыми разделительными линиями, имеющими шипообразные отростки. Как правило, они видны на большой кривизне и являются характерным признаком этого заболевания. В некоторых случаях заполненная контрастным веществом ямка трудно дифференцируется от язвы желудка.
В отличие от рака при избыточной слизистой оболочке в верхнем отделе желудка отмечается симптом перемещения патологического образования вдоль стенок кардиального отдела и свода желудка в сочетании с изменчивостью его формы и величины. Иногда после введения газа в желудок и сильного растяжения газового пузыря обнаруженные дефекты наполнения полностью исчезают. В процессе исследования у некоторых больных избыточная слизистая
72. Рентгенологическая картина контрастированного желудка при болезни Менетрие:
а — локальная форма; б, в — диффузная форма; г — часть избыточной слизистой оболочки
пролабирует в дистальный отдел пищевода, а затем самопроизвольно перемещается в желудок. Выпадения слизистой нередко сопровождаются болью, дисфагией, желудочным кровотечением.
Избыточная слизистая оболочка иногда обнаруживается и в антральном отделе. Тогда она симулирует изъязвив-шуюся раковую опухоль. Гипертрофированные складки оболочки из-за большой подвижности относительно часто выпадают через привратник в луковицу 12-перстной кишки и возвращаются обратно. При этих перемещениях слизистой исчезают дефекты наполнения и ложные изъязвления.
Диффузная форма болезни встречается реже локальной. У больных выявляют утолщенные, извитые, угловатые и отечные складки слизистой оболочки, которые лежат беспорядочно или направлены преимущественно поперек, в сторону большой кривизны. Стенка желудка утолщена, ее эластичность и перистальтика не изменены. После приема дополнительной порции бария просвет желудка увеличивается, складки слизистой растягиваются. Этим желудок больных диффузной формой избыточной слизистой оболочки отличается от «застывшего» («пластмассового») желудка больных эндофитным диффузным раком.
Таким образом, диагностика избыточной слизистой оболочки желудка основывается на результатах комплексного обследования больных, в том числе рентгенологического и инструменталь
ного исследования желудка с прицельной биопсией. Полиморфизм рентгенологической картины и гистологической структуры избыточной слизистой оболочки желудка, видимо, определяется различными вариантами поражения оболочки (интерстициальным, пролиферативным, железистым) и стадией процесса (истинной гиперплазией париетальных клеток, вытеснением дифференцированного эпителия слизьпро-дуцирующими клетками, формированием аденоматозных внутрислизистых разрастаний).
По мнению многих авторов, основные критерии, подтверждающие диагноз болезни Менетрие, следующие: 1) утолщенные складки слизистой желудка; 2) узловатость слизистой с ограниченными возвышениями; 3) утолщение стенки желудка в' пораженной зоне; 4) характерный сетчатый рисунок на рентгенограммах, образованный смесью бариевой взвеси и желудочной слизи; 5) излюбленная локализация процесса — тело желудка, особенно проксимальная его половина и большая кривизна.
Прогноз относительно благоприятный. Болезнь протекает с продолжительными ремиссиями. За больными необходим постоянный контроль: клинический — 2 раза в год, рентгенологический — 1 раз. В случае диагностических сомнений выполняют гастроскопию и биопсию. При тяжелом течении показана тотальная или частичная гастрэктомия.
Глава 14. ФУНКЦИОНАЛЬНЫЕ РАССТРОЙСТВА
Нарушения функционального состояния желудка складываются из нарушений двигательной и секреторной функций с симптомокомплексом желудочной диспепсии и нередко болевым синдромом; морфологические изменения в желудке отсутствуют.
Все органы и системы организма находятся в тесном функциональном взаимодействии, осуществляемом нейро-гуморальными путями при включении гормонального звена регуляции, под постоянным корригирующим влиянием высших отделов нервной системы —
коры головного мозга и подкорковых вегетативных центров, главным образом таламогипоталамической области.
Новейшие поиски подтверждают незыблемость взглядов И. М. Сеченова, И. П. Павлова и других отечественных ученых на рефлекторные механизмы регуляции функций пищеварительной системы, а установленные молекулярные основы физиологических механизмов являются новым дополнением к кортиковисцеральной теории К. М. Быкова и И. Т. Курцина. Обнаруженные в стенке пищеварительного тракта многочисленные пептиды образуют единую систему регуляторных влияний на моторную и секреторную функции органов пищеварения.
Некоторые пептиды (гастрин, секретин, холецистокинин) замедляют темп опорожнения желудка. Мотилин-пеп-тид, оказывающий сильное действие на желудок, ускоряет эвакуацию твердой пищи. Действие соматостатина на желудочную эвакуацию сложно: в низких дозах он ускоряет эвакуацию, в высоких — тормозит.
Вопросами функциональной рентгенодиагностики занимаются с раннего периода открытия рентгеновых лучей. Основой трактовки получаемых рентгенологических показателей явились и до сих пор являются те огромные успехи, которые имеет наша отечественная физиология. Наиболее доступна для рентгенологического исследования внутренних органов, в частности желудка, двигательная деятельность нервно-мышечного аппарата путем просвечивания и регистрации ее на серийных снимках при рентгенокинематографии и видеомагнитофонной записи. Основные и наиболее ценные особенности свойственны именно рентгенологическому методу, позволяющему изучить не только морфологию, но и все многообразие функций желудка в норме и патологии.
Это важно еще и потому, что морфологические изменения вызывают нарушение функции, а извращение функции ведет к органическим изменениям. Нередко болезнь начинается раньше, чем проявляется. В начале возникновения она может быть результатом функциональных нарушений, которые затем меняют анатомическую структуру органа. Поэтому раннее распознавание дисфункций желудка и последующее их устранение ведет к предупреждению развития патологического процесса.
Функциональные нарушения желудка могут быть первичные и вторичные. Чаще всего они развиваются вторично при патологических изменениях в желудке или при заболеваниях других органов и систем организма по принципу висцеро-висцерального рефлекса. Причиной дисфункции желудка бывают нарушения в питании, различные проф-вредности, нервно-эмоциональные переживания и другие факторы.
Нарушения двигательной функции желудка называются дискинезиями. Они могут проявляться по-разному: наступают расстройства тонуса, опорожнения, пропульсивной деятельности и др. Нарушения тонуса разнообразны: либо парез и паралич, либо гипертония и спазм. Наивысшая степень усиления тонуса — спазм. Он может быть выражен в кардиальном (кардиоспазм) или в пилорическом (пилороспазм) отделе желудка. От состояния тонуса желудка зависит его опорожнительная и пропульсивная деятельность.
Таким образом, при функциональных расстройствах наступают изменения координации двигательной и секреторной функций желудка с симптомокомплек-сом желудочной диспепсии без морфологических изменений со стороны слизистой оболочки. Рассмотрим основные, наиболее часто встречающиеся функциональные расстройства желудка.
Гастроспазм. Это нарушение двигательной функции желудка характеризуется тетаническим сокращением его мышц и расстройством перистальтики. Гастроспазм наблюдается как на фоне общих заболеваний, проявляющихся спастическим состоянием мускулатуры (столбняк, свинцовая интоксикация и др.), так и при рефлекторных изменениях перистальтики желудка (пептическая язва желудка, привратника, желчнокаменная болезнь и др.). Иногда заболевание является следствием истерического невроза или результатом временного повышения тонуса желудка под влиянием эмоций, психического напряжения.
Органическая (локальная, местная) гипертония и спазм мышечной оболочки стенки желудка обычно бывают рефлекторными (например, локальный спазм большой кривизны при пептической язве малой кривизны желудка, пилороспазм при язве привратника или луковицы 12-перстной кишки). Желудочная тетания может быть следствием и одним из проявлений недостаточности паращитовидных желез и гипокальциемии.
Клинически гипертоническая дискинезия протекает бессимптомно или проявляется болями в эпигастральной области, иногда язвенно-подобными. При пилороспазме имеется наклонность к рвоте. Одной из форм гипертонической дискинезии желудка, поддерживаемой патологически закрепленным рефлексом у лиц, страдающих неврозами, служит привычная рвота.
При рентгенологическом исследовании размеры желудка (в случаях тотальной гипертонии) небольшие, он имеет форму рога. Контрастная масса длительное время задерживается в верхних отделах желудка, принимает форму уширенного клина с вершиной, направленной дистально. Если пилороспазм изолированный, продвижение контрастного вещества через привратник за
труднено и совершается небольшими редкими порциями, наблюдаются мощные перистальтические сокращения желудка; в фазе декомпенсированного пилороспазма и пилоростеноза желудок расширен, его перистальтика ослаблена.
Длительно существующий пилороспазм может привести к формированию органического пилоростеноза. Пилороспазм и органический (вторичный) стеноз привратника следует дифференцировать от редкой патологии, известной в литературе как гипертрофический (врожденный) стеноз привратника у взрослых (Василенко, Гребнев, 1981).
Во всех случаях пилороспазма необходимо тщательно обследовать больного, чтобы исключить возможность органической патологии, сопровождающейся спастическими сокращениями мышечных слоев стенки желудка.
Острое расширение желудка (гастроэктазия). Расширение полости желудка с растяжением его стенок — одна из наиболее тяжелых форм непроходимости пищеварительно тракта. Наиболее частой причиной этого страдания считается оперативное вмешательство на органах брюшной полости, и в частности операции на блуждающих нервах. Среди других причин могут быть инфаркт миокарда, тиреотоксикоз, травма, тяжелые инфекции, прием большого количества алкоголя и обильной пищи с последующим ее брожением и газообразованием.
Основным патогенетическим механизмом острого расширения желудка является паралич его нервно-мышечного аппарата, главным образом в результате тяжелых, электролитных нарушений и сдвигов кислотно-основного состояния. Развивающаяся атония желудка приводит к увеличению его размеров, при этом желудок оттесняет петли тонкой кишки книзу и сдавливает нижнюю горизонтальную ветвь 12-пер-
стной кишки и корень брыжейки, что приводит к функциональным изменениям всей пищеварительной системы.
Острое расширение желудка клинически проявляется как высокая тонкокишечная непроходимость. Заболевание начинается и протекает остро. Больной жалуется на икоту, боли и чувство тяжести в животе, распирание в подложечной области, вздутие верхних отделов брюшной полости. Отмечаются шум плеска, сухость кожи и слизистых оболочек. Температура тела часто понижена. Стул отсутствует. АД снижено, пульс частый и малый. Быстро нарастает общая слабость, черты лица заостряются, могут возникнуть опасные осложнения — нарушения кровоснабжения стенки желудка, разрыв его.
Рентгенологическая картина довольно характерна. Желудок резко расширен, видна интенсивная однородная тень с выпуклым нижним контуром, достигающая малого таза. Типично наличие двух горизонтальных уровней жидкости. Левая половина диафрагмы расположена выше правой, подвижность ее ограничена. Важные симптомы: отсутствие перистальтики желудка и длительная задержка контрастной массы в нем. Газовый пузырь больших размеров, по ширине равен поперечнику левого купола диафрагмы и располагается над легко перемещающимся горизонтальным уровнем жидкости. Бариевая взвесь медленно тонет и достигает уровня симфиза. Из-за большого количества жидкости в желудке судить о состоянии слизистой оболочки невозможно, при тугом заполнении желудка контрастной массой последняя располагается в виде широкой чаши.
Аэрофагия желудка. Гастроаэрофа-гия — это заглатывание воздуха во время разговора, при быстрой еде, при некоторых заболеваниях пищеварительного аппарата, при неврозах. Клинически проявляется чувством вздутия и
73. Га ст росу к ко рея.
переполнения в эпигастрии, особенно после еды, и сопровождается частой громкой отрыжкой воздуха. В верхней половине живота отмечаютс'я выбухание и тимпанит. У некоторых больных может развиться гастрокардиальный синдром — комплекс субъективных и объективных признаков нарушений деятельности сердца. Признаками аэрофагии у грудных детей являются крик во время еды, быстрое вздутие живота и отказ от пищи.
Рентгенологически функция кардии не нарушена, обнаруживают резко увеличенный газовый пузырь желудка, высокое стояние левого купола диафрагмы. Возможен функциональный каскад желудка. При пальпации области желудка появляется отрыжка воздухом и газовый пузырь спадается. Складки слизистой оболочки желудка не изменены. Контуры его гладкие, перистальтика стенок не нарушена.
Гастросуккорея. Это нарушение секреторной функции желудка. Ее назы
вают «секреторным неврозом». Может встречаться в любом возрасте. Клинические проявления немногочисленны. Возникают изжога, ночные боли в эпигастральной области, нередко рвота большим количеством кислого содержимого.
При рентгенологическом исследовании желудка обнаруживают повышенную желудочную секрецию с горизонтальным уровнем жидкости. После приема бариевой взвеси над ней образуется слой жидкости, четко отграниченный сверху газовым пузырем желудка, а снизу — контрастным веществом. Поражения слизистой желудка отсутствуют. Такие функциональные секреторные нарушения непродолжительны.
Амиксорея. Это увеличенное отделение желудочной слизи. Клинически проявляется жалобами на понижение аппетита, отрыжку воздухом, ощущение горечи во рту, срыгивание; имеет место понижение кислотообразования в желудке.
Рентгенологическая картина: после приема бариевой взвеси происходит медленное смешивание ее с желудочным содержимым с образованием бесформенных хлопьев. Это свидетельствует о повышенном содержании в желудке слизи.
Другой симптом слизи в желудке (феномен слизи) — мелкоточечные просветления в слое бариевой взвеси. Это мельчайшие капельки слизи, взвешенные в суспензии бария. Феномен слизи не обнаруживается во время просвечивания. Его можно констатировать только на снимках желудка, подвергшегося компрессии.
Нарушение эвакуаторной функции желудка. Состояние эвакуаторной функции желудка нами оценивается по моменту поступления контрастного химуса в слепую кишку (Михайлов, Черемухин, 1986). Нормальной эвакуацией желудка считается такая, при кото
рой время полного опорожнения его совпадает со временем контрастирования дистальных отделов подвздошной и слепой кишок, а при несовпадении времени диагностируется нарушенная периодическая деятельность ЖКТ, в том числе и желудка.
В понимании характера этих нарушений еще много неясного. По мнению I. Christensen (1988), в соответствии с физиологическими зонами мускулатуры желудка следует по характеру движений выделить 2 области: 1) антральный отдел, где имеется перистальтика (циркулярные сокращения, идущие в сторону привратника), и 2) дно желудка, где перистальтика отсутствует, а происходят только медленные непрерывные сокращения, подобные изменениям тонуса, охватывающие большую часть или весь фундальный отдел одновременно. Известно, что гладкая мускулатура дна желудка состоит из 3 слоев. Часто забывают, однако, что имеются большие отличия в размерах и толщине внутреннего, или косого, мышечного слоя. Тем не менее именно этот слой является отличительным признаком мускулатуры дна желудка. Логично было бы связать особенности моторики этой части желудка с наличием косого слоя, но пока эта связь не установлена. Физиологические исследования мускулатуры фундального отдела (в тех пределах, в которых они вообще проводились) не касались специально косого слоя.
Сокращения проксимального отдела желудка часто очень медленные, непрерывного характера, походки на тонические. Кроме них, описаны более быстрые сокращения, получившие название фазовых. Первые длятся 1—3 мин, могут повышать внутрижелудочное давление до 40—50 мм вод. ст. Фазовые сокращения, наоборот, длятся 10—15 с и повышают давление в желудке только до 5—15 мм вод. ст. Оба типа сокра
щений, по-видимому, вовлекают весь фундальный отдел желудка сразу, а не передают возбуждение от одного участка к другому.
Наличие миогенного тонуса фундальной мускулатуры, подобного тонусу нижнего пищеводного сфинктера, можно соотнести с тем фактом, что между мышцей сфинктера и косым мышечным слоем фундального отдела желудка существует непрерывный переход. Тонус фундального отдела, однако, может меняться под воздействием нервной системы.
Фундальные сокращения имеют отношение к процессам заполнения и опорожнения желудка. Во время приема пищи объем желудка увеличивается во много раз, а внутрижелудочное давление при этом меняется мало. Это осуществляется благодаря релаксации мускулатуры, главным образом фундального отдела. Расслабление желудка, получившее название «рецептивная релаксация», является нейрогенным, вагусным и неадренергическим процессом.
Желудок способен расслабляться, достигая огромных размеров, не только в ответ на прием пищи. Заполнение желудка через зонд или растяжение баллоном также дает возможность продемонстрировать его способность увеличиваться в объеме при незначительном повышении давления. Такая аккомодация осуществляется за счет фундального отдела, как и в случае рецептивной релаксации во время приема пищи.
Сокращения заполненного дна желудка, по-видимому, мало влияют на перемешивание содержимого, а служат скорее всего его продвижению в дистальном направлении, создавая такой уровень внутрипросветного давления, который позволяет содержимому проходить через антрум. Поэтому фундальный отдел играет важную роль в осво
бождении желудка от жидкостей: резекция дна желудка ускоряет выведение жидкостей и почти не влияет на эвакуацию плотной пищи (Schlag et al., 1977).
В дистальном отделе желудка косой мышечный слой или вообще неразличим, или очень тонкий, за исключением 2 широких пучков, лежащих вдоль малой кривизны. Функция этого отдела желудка осуществляется главным образом циркулярным и продольным мышечными слоями. Циркулярная мышца постепенно утолщается по направлению к привратнику. Мембранный потенциал покоя в дистальном отделе выше, чем в проксимальном. Его величина непостоянна: через равные промежутки времени происходят колебания, но конфигурация потенциала при этом не меняется. Исследования с помощью внеклеточных электродов показывают, что деполяризация, возникающая приблизительно в середине большой кривизны, распространяется в сторону привратника с постоянной скоростью, частотой и конфигурацией импульсов (Ihamaki et al., 1979).
Эти сигналы получили разные названия: генераторные потенциалы, медленные волны, базальный электрический ритм, электрическая контролирующая активность. Общепризнано, что эти миогенные сигналы, распространяясь кольцом по дистальной части желудка, определяют время и локализацию кольцеобразных пропульсивных сокращений, антральную перистальтику, т. е. являются генераторами перистальтики. Нужно отметить, что не всегда они сопровождаются сокращениями. Мышца может реагировать или не реагировать сокращением на какой-либо отдельный электрический сигнал.
Значение антральных сокращений понятно. Каждое перистальтическое движение продвигает вперед пищевой комок. Поскольку антральные сокращения
(вначале поверхностные, затем более глубокие) закрывают просвет желудка перед привратником, только часть содержимого проталкивается в кишку, а часть возвращается в полость желудка. Таким образом, благодаря поступательно-возвратным движениям происходит измельчение плотных пищевых масс. Способность дистального отдела желудка измельчать плотные частицы до очень мелких размеров называется «просеивающей» функцией антрума. При резекции антрума эта функция выпадает, поэтому эвакуация из желудка плотных компонентов пищи ускоряется (Christensen, 1988).
Исследованиями А. Н. Михайлова и Е. П. Черемухина (1986), Е. П. Черемухина с соавт. (1988) доказано, что время поступления химуса в слепую кишку является надежным критерием, устанавливающим индивидуальные сроки эвакуации из желудка. Точность определения не зависит от физических и химических свойств принимаемой при рентгенологическом исследовании пищи, так как в основе метода лежит закономерность, определяющая условия перемещения химуса в зависимости от фазного характера периодической деятельности.
Ускоренной эвакуацией следует считать отсутствие контрастного вещества в желудке и 12-перстной кишке при наличии его в дистальном отделе тощей кишки, подвздошной и слепой кишках. Замедленную эвакуацию необходимо определять при наличии бария в желудке, а также в подвздошной и слепой кишках и отсутствии контрастирования 12-перстной и тощей кишок. Нами установлено, что функциональные заболевания желудка протекают на фоне нарушений пищеварительной моторики тонкой кишки и связаны с расстройством фазности ее.
Нарушение эвакуаторной функции желудка обусловлено не только диски
незией кишечника, но и тоническим состоянием мышц желудка, их дизритмией. Так, по данным М. Camiller et al. (1986), антральная гипомотор-ность связана с желудочным стазом и проявляется в пролонгировании времени задержки плотной пищи и замедлении скорости опорожнения. Нарушение кишечной подвижности не влияет на время задержки твердой пищи и удлиняется для жидкости. Желудочный стаз при нарушении периодической деятельности кишечника происходит, по мнению этих авторов, из-за ухудшения антральной перистальтики,обусловленной антральной гипомоторностью или возросшим сопротивлением в тонкой кишке в связи с нарушением кишечной моторики.
Освобождение желудка от содержимого затруднено не только из-за дистонии и дизритмии его мускулатуры, но может наблюдаться и при фиброзе мышечного слоя. Давно известно, что при склеродермии происходит дегенерация гладких мышц и замещение их коллагеном. В основе атонии желудка при склеродермии также лежит дизритмия его нервно-мышечной ткани, потому что распространение по измененной мышце генераторного потенциала затруднено из-за прослоек фиброза. Причиной нарушения эвакуации из желудка содержимого может быть вегетативная невропатия, обусловленная, например, сахарным диабетом, метаболическим ацидозом и другими заболеваниями.
Гастрогенная диспепсия. Характеризуется нарушением процессов переваривания пищи в желудке. Возникает вследствие недостаточной секреции пепсина и соляной кислоты, нередко встречается при чрезмерно быстрой эвакуации содержимого из желудка. Клинически проявляется ощущением тяжести, распиранием в подложечной области после приема пищи, отрыжкой и
тошнотой. Иногда бывают рвота, гастрогенные поносы.
При рентгенологическом исследовании морфологических изменений, как правило, не находят, имеются лишь расстройства двигательной функции желудка. Частыми признаками их служат спастические сокращения желудка или атония, гастроптоз, усиленная или ослабленная перистальтика, дисфункция кардии и привратника. Ритмические сокращения привратника в ряде случаев отсутствуют, отверстие зияет, часто отмечается рефлюкс дуоденального содержимого в желудок. При желудочной гиперсекреции наблюдается большое количество жидкости натощак, которая располагается в области свода, образуя горизонтальный уровень под газовым пузырем. После поступления в желудок принятой больным контрастной взвеси секреторная жидкость скапливается над последней, располагаясь между ней и газовым пузырем желудка и давая серую полоску различной высоты (гиперсекреторная зона). Гиперсекреция замедляет опорожнение желудка.
Недостаточность привратника желудка (зийние, или халазия, привратника). Одна из форм нарушения моторной функции желудка в виде неполного сокращения его запирательной мышцы. Характерно длительное или постоянное расслабление привратника, которое возникает в связи с превалированием процесса расслабления над сокращением. Это функциональное нарушение связано с патологическими рефлексами, исходящими из желудка и смежных органов, в частности 12-перстной кишки. Дискоординация ее моторной функции, дуоденальная гипертензия приводят к нарушению полостного градиента давления между желудком и 12-перстной кишкой и играют важную роль в возникновении недостаточности пилорического сфинктера и развитии дуоденогастрального рефлюкса.
Распознается недостаточность привратника при рентгеноскопии, рентгенографии с использованием контрастного вещества и фармакологических препаратов в различных проекциях при вертикальном и горизонтальном положениях исследуемого. Рекомендуется применять в основном два способа диагностики. Первый способ заключается в следующем : в 12-перстную кишку через зонд вводят обычной концентрации бариевую взвесь и на экране рентгеновского аппарата или телевизора регистрируют заброс контрастного вещества в желудок. Второй способ предусматривает применение внутривенной и пероральной холецистографии. Недостаточность привратника и наличие синдрома дуоденогастрального рефлюкса определяют по регургитации контрастного вещества из 12-перстной кишки в полость желудка. Этот способ наиболее объективный: осуществляется без нарушения физиологических взаимоотношений в гастродуоденальной зоне.
Выявлению дуоденогастрального рефлюкса следует придавать большое значение, так как у больных с гастродуоденальной патологией он встречается в 33—67 % случаев. Дуоденогаст-ральный рефлюкс служит одним из важнейших патогенетических факторов в развитии хронического гастрита и язвенной болезни желудка. При рентгенологическом исследовании хорошо определяется расширение просвета привратника, беспрепятственно пропускающего контрастное вещество. Это приводит к ускоренному опорожнению желудка и (или) дуоденогастральному рефлюксу.
Невроз желудка. Встречается довольно часто. Причинами этого функционального нарушения могут быть: эмоциональное или умственное перенапряжение, конфликтные ситуации, сильные психические травмы, ятрогения. Способствуют развитию невроза .желудка
факторы, ослабляющие организм и его нервную систему, — инфекции, интоксикации, неполноценное питание, органические заболевания других органов. К патогенетическим факторам относятся повышенная возбудимость и легкая истощаемость нервной системы, в частности вегетативной нервной системы, висцеро-висцеральные рефлексы, ведущие к нарушениям всех фуйкций желудка.
Клинически жалобы больных чрезвычайно многообразны. В них сочетаются симптомы желудочной диспепсии (отрыжка, тошнота, рвота, срыгивание, изжога, ощущение жжения в подложечной области, тяжести, распирания) и нарушения со стороны центральной и вегетативной нервной системы (расстройство сна, неустойчивое настроение, повышенные раздражительность и потливость, тахикардия).
При рентгенологическом исследовании обнаруживают повышение секреторной и моторной функций желудка без изменения структуры его слизистой оболочки. В случае гастроневрозов чаще наблюдаются симптомы повышенной ваготонин: гипертония, различные спазмы желудка, живая, глубокая, иногда сегментирующая перистальтика. У некоторых больных выявляются признаки симпатикотонии: вялость, гипотония желудка, отсутствие перистальтики и пониженная моторная деятельность.
Спазмы имеются ограниченные, регионарные, тотальные и встречаются в различных отделах желудка: в области кардии, тела, препилорической части и привратника. При спазме в теле желудка наблюдается разделение его на две части, что рентгенологически проявляется наличием поперечной полоски просветления, которая лучше определяется при горизонтальном положении больного. Спазмы неврогенного происхождения, как правило, кратко
временные, они появляются и исчезают. Имеются и другие виды дискоордина-ции двигательной деятельности в виде усиленной перистальтики, множественных втяжений, неправильных волнообразных контуров и т. д.
Органическая (локальная, местная) гипертония и спазм мышечной оболочки стенки желудка обычно бывают рефлекторными — например локальный спазм большой кривизны при пептической язве малой кривизны желудка, пилороспазм при язве привратника или луковицы 12-перстной кишки. Эти спазмы, развившиеся на почве язвы, постоянные. При повторных исследованиях они видны на одном и том же месте.
В случае тотальной гипертонии желудок уменьшается в размерах и может иметь самую разнообразную форму: шара, овоида, рога или уширенного клина с вершиной, направленной дистально. Одной из форм гипертонической дискинезии желудка, поддерживаемой патологически закрепленным рефлексом у лиц, страдающих неврозами, является так называемая привычная рвота.
Во всех случаях спазма желудка, локального или тотального, необходимо тщательно обследовать больного, чтобы исключить возможность органической патологии, сопровождающейся сокращениями мышечных слоев стенки желудка.
Раздраженный желудок. Функциональное расстройство желудка, в последние годы выделенное в отдельную нозологическую форму заболевания. Особенно это важно при диагностике предъязвенного состояния — функциональной стадии язвенной болезни. Выделяют парапилорические язвы (антро-пилорический отдел и 12-перстная кишка) и медиогастральные (язвы тела и кардиального отдела). Синдром раздраженного желудка наблюдается при
предъязвепном состоянии в парапило-рической зоне.
Рентгенологическая семиотика раздраженного желудка характеризуется большим многообразием. Так, в желудке натощак имеется значительное количество, а у ряда больных очень много гиперсекреторной жидкости и слизи. У большинства из них это количество нарастает в процессе исследования. Бариевая взвесь вначале тонет в ней, оседая на комках слизи в виде хлопьев, складки слизистой в этот момент не видны, и только после эвакуации значительного количества содержимого под действием пальпации бариевая взвесь смешивается с ним, после чего становится доступным для изучения рельеф слизистой оболочки. Обычно рельеф представлен крупными, извитыми, часто поперечно расположенными складками слизистой. У ряда больных поступление нескольких первых глотков бариевой взвеси в желудок приводит в движение его содержимое, бариевая взвесь чв виде крупных комков совершает также беспорядочные движения — содержимое желудка «бурлит». Тонус его несколько снижен, перистальтика вялая, желудок умеренно растянут.
Очень часто возникает начальный кратковременный спазм привратника, после чего повышается тонус желудка, появляется глубокая перистальтика и начинается ускоренная эвакуация из желудка в 12-перстную кишку (в течение 15 — 20 мин желудок почти полностью освобождается от бария).
Луковица раздражена, содержит много слизи, очень быстро освобождается от контрастного вещества, ввиду чего ее истинная форма не может быть определена, складки слизистой не видны. Как правило, выражен дуоденальный рефлюкс — поступление бариевой взвеси в нисходящий отдел 12-перстной кишки часто сменяется обратным забросом ее в желудок. Ниша в пилоро-
дуоденальной зоне не выявляется. Дискинетические расстройства отмечаются также в проксимальных петлях тощей кишки. Иногда определяется недостаточность кардии.
Следует отметить, что рентгенологическая картина раздраженного желудка встречается редко, обычно у больных с коротким анамнезом и выраженной клинической картиной язвенной болезни (Антонович, 1987).
Перегибы желудка. Характеризуются перемещением верхнего отдела желудка кзади вокруг поперечной оси. Особенно часто возникают у детей раннего возраста из-за большого количества газа в поперечной ободочной кишке. Желудок как бы «садится верхом» на кишку. Немаловажную роль в их возникновении играет повышенное внутрибрюш-ное давление, приводящее, в частности, к перемещению вверх ' левого купола диафрагмы; перегибы желудка при этом весьма стойкие.
Клиническое значение перегибов желудка велико, поскольку у детей раннего возраста они приводят к возникновению срыгиваний и рвоты.
Рентгенологически различают • три степени перегибов желудка в зависимости от уровня расположения переместившейся кзади части желудка. При I степени она находится на уровне кардиальной части желудка, при II — на уровне средней трети тела желудка, при III — на уровне привратника.
Перегиб желудка можно определить на обзорной рентгенограмме брюшной полости по наличию двух газовых пузырей в области свода, наслаивающихся друг на друга. Особенно отчетливо такие перегибы видны при исследовании в боковой проекции. При приеме бариевой взвеси в прямой проекции желудок кажется укороченным, антральный отдел его сужен и расположен отвесно, несколько наклонно в каудальном направлении. Желудок обра
зует проксимальный и дистальный резервуары. Сводом первого (верхнего) резервуара оказывается свод желудка, а образование нового свода происходит за счет других нижележащих частей передней стенки тела желудка. По мере заполнения желудка бариевой взвесью перегиб обычно полностью или частично расправляется.
Гастроптоз. Это опущение желудка. Наблюдается у людей долихоморфного телосложения (астеников), часто сочетается с общим спланхноптозом. Может развиться вследствие резкого ослабления мышц брюшной стенки, при значительном похудании, после извлечения асцитической жидкости и других причин.
Клиническая картина: чувство тяжести и переполнения желудка, особенно после еды. Эти явления уменьшаются в горизонтальном положении, при ношении бандажа. Отрыжка, тошнота, эпизодически рвота, мало облегчающая состояние. Наблюдается западение верхней и выпячивание нижней половины живота.
При обзорной рентгеноскопии брюшной полости желудочный пузырь вытянут, натощак в желудке видна жидкость. При контрастном исследовании взвесь медленно опускается на дно, располагающееся в зависимости от степени гастроптоза на разном уровне. Желудок смещен и находится в левой половине брюшной полости. Угол желудка острый. Малая кривизна опущена, сближена с большой. Складки слизистой оболочки не изменены. Перистальтика вялая. Эвакуация замедлена. Луковица 12-перстной кишки при значительном гастроптозе располагается вертикально.
Гастроптоз бывает тотальным и частичным (антропилороптоз). Последний встречается чаще. По положению малой кривизны желудка различают 3 степени гастроптоза: I — малая кривизна на
ходится па 2—3 см выше гребешковой линии; II — она определяется на уровне этой линии; III — малая кривизна располагается ниже гребешковой линии, а нижний полюс желудка уходит в малый таз. Опущение антропилори-ческого отдела желудка способствует перегибу начальной части 12-перстной кишки.* Это усугубляет нарушение эвакуации из желудка.
Трансмиграция слизистой оболочки желудка. Это своеобразное состояние слизистой, когда из-за чрезвычайной подвижности она может смещаться как в оральном, так и каудальном направлениях, выпадая в пищевод или 12-перстную кишку. Выпадение слизистой оболочки желудка встречается в 0,1 до 4,3 % случаев рентгенологических исследований желудка. Причем на долю транспилорического пролапса приходится 70 — 80 %, транскардиального — 20—30 % всех наблюдений.
Этиопатогенез трансмиграции слизистой оболочки желудка выяснен недостаточно. Имеется несколько мнений, не дающих четкого представления о нем. Одни считают, что субстратом данного состояния служат набухание эластических волокон подслизистого слоя при ненормальной мышечной деятельности желудка, наличие избыточной подвижной слизистой, предопределенной необычным развитием подслизистого слоя. Другие объясняют трансмиграцию слизистой повышенной подвижностью рыхлого подслизистого слоя, усиленной моторной функцией желудка, повышением внутрижелудочного давления. Существует и нейрогенная теория, согласно которой под влиянием нейрогенных факторов может наступить такая перистальтика, которая приводит к ослаблению подслизистого слоя с дальнейшим выпадением слизистой желудка в 12-перстную кишку.
Подвижная слизистая под влиянием перистальтики вначале периодически
собирается перед привратником и при нормальном просвете пилорического канала не выпадает в 12-перстную кишку. Если привратник широкий и стенки его податливы, возникает транспилорический пролапс, т. е. слизистая желудка выпадает в луковицу. Степень и характер пролапса зависят также от условий исследования и положения больного.
По клиническому течению различают пролапсы острые и хронические, непостоянные и постоянные, анатомически фиксированные. При смещении относительно небольшого массива слизистой клинические симптомы могут отсутствовать и ее трансмиграция выявляется случайно при рентгенологическом исследовании. Симптомы пролапса зависят от степени ущемления пролабированной слизистой, закрывающей вход или выход из желудка. Чаще всего отмечаются боли в подложечной области или в правом подреберье, возникающие после еды. Они носят эпизодический и схваткообразный характер. Некоторые предъявляют жалобы на боли в ночное время, особенно после обильного ужина жирной или острой пищей. На высоте болей может появляться рвота. Между приступами болей неприятные ощущения в подложечной области сохраняются. В это время могут появляться тошнота и отрыжка. Пролапсы слизистой желудка чаще встречаются в сочетании с другими заболеваниями (гастритом, язвенной болезнью, грыжей пищеводного отверстия диафрагмы и др.), что существенным образом влияет на клиническую картину, в которой преобладают симптомы основного заболевания.
Рентгенологический метод исследования является одним из основных в диагностике трансмиграции слизистой оболочки желудка. Начинают исследование в вертикальном, а заканчивают в горизонтальном положении больного
74. Трансмиграция слизистой оболочки желудка в луковицу 12-перстной кишки.
с различными поворотами его в I и II косые положения. В качестве контрастного вещества применяют обычную бариевую взвесь. Неотъемлемое условие — производство большой серии прицельных снимков (от 8 до 10—12 рентгенограмм), дозированная компрессия и целенаправленная рентгенопальпа-ция, особенно при транспилорических пролапсах слизистой желудка.
Выпадения слизистой желудка в луковицу 12-перстной кишки вызывают различные дефекты наполнения, занимающие треть или половину луковицы, реже достигающие ее верхнего изгиба и занимающие от 10—15 до 25—30 мм дистальнее привратника. Вместе с тем следует различать циркулярную, центральную, одностороннюю и переходную формы выпадения слизистой желудка, а также три фазы его: 1) пролапс (выпадение), 2) отшнуров-
ка и 3) релапс (возврат выпавшей слизистой оболочки из луковицы в желудок) . Впервые выпадение слизистой в луковицу 12-перстной кишки описал немецкий хирург V. Schmieden. Поэтому в литературе встречается название этого страдания как синдром Шмидена.
Трансмиграция слизистой оболочки желудка в луковицу 12-перстной кишки проявляется следующими рентгенологическими симптомами: 1) неравномерно-фестончатый, грибовидный или подобно цветной капусте дефект, связанный с основанием луковицы, но иногда глубоко вдающийся в просвет ее; не всегда он располагается симметрично к оси лукорицы и может тяготеть к латеральному или медиальному (чаще) ее карману; 2) заметное расширение просвета пилорического канала в фазе расслабления сфинктера, когда в канале прослеживаются 2—3 и более утолщенные складки, как бы связывающие между собой дефект в луковице с рельефом складок препилорической части желудка; 3) периодический, хотя в некоторых случаях и редко наблюдаемый, «релапс», т. е. возвращение в желудок выпавшей слизистой; 4) довольно часто наблюдается усиленная и ускоренная перистальтика, но эвакуаторная функция желудка может быть неизмененной.
Транспилорический пролапс слизистой желудка необходимо отличать от некоторых заболеваний этой зоны. Картину пролапса симулирует полип на ножке. Но для него характерен центральный дефект наполнения у основания луковицы 12-перстной кишки, форма и величина которого постоянны и не изменяются в процессе исследования. Натянутая ножка полипа имеет вид одиночной узкой полоски в пилорическом канале. Дифференциации с пролапсом требует и гастродуоденит. Если слизистая пилорического канала и луковицы отечна и воспалительно
набухла, а складки грубы и утолщены, то у основания луковицы также образуется дефект наполнения. Узкие бороздки между складками веерообразно расходятся от пилорического канала к этому дефекту, напоминая симптом аркад и симптом раскрытого зонтика. Как правило, такая картина сочетается с перестройкой рельефа слизистой, соответствующей перестройке при хроническом или подостро протекающем гастропилородуодените с достаточно выраженной клинической симптоматикой. Дефект у основания луковицы выявляется при наклоне ее кзади, его может образовать масса ткани самого привратника. Особенно это заметно при давлении компрессионным тубусом, когда мышечное кольцо пилорического сфинктера вдавливается в просвет луковицы, образуя у основания луковицы полуовальный дефект с заостренными карманами по обе его стороны. Пролапс слизистой желудка в луковицу следует дифференцировать и с рубцово-язвенной деформацией ее, при которой рентгенологическая картина постоянна, а при пролапсе изменчива даже в течение одного исследования.
Ретроградное выпадение складок слизистой оболочки желудка в пищевод встречается гораздо реже транспилорического пролапса. Здесь также различают острые и хронические, непостоянные и постоянные, подвижные и фиксированные выпадения слизистой оболочки.
Клинические проявления пролапса зависят от степени выпадения слизистой оболочки желудка в пищевод. При небольшой степени выпадения симптоматика может отсутствовать, но чаще всего больные предъявляют жалобы, характерные для гастрита, язвенной болезни, грыжи пищеводного отверстия диафрагмы, рефлюкс-эзофагита. Возможна острая закупорка пищевода с дисфагией.
Рентгенологическое исследование больных проводится в положении на спине, с поворотом в первую косую проекцию, в момент покашливания или патужи вания.
Рентгенологическая картина при желудочно-пищеводных и пищеводно-желудочных пролапсах слизистой также довольно характерна. При смещении слизистой желудка в пищевод непосредственно над кардией образуется дефект наполнения грибовидной, яйцевидной или кустовидной формы с фестончатым или ровным контуром. Одновременно можно увидеть булавовидное расширение пищевода и замедленное прохождение бария в нем, указывающее на частичную закупорку просвета пищевода. Характерны изменчивость формы и величины дефекта наполнения
в процессе исследования, а также наличие в абдоминальном отделе пищевода более 4 складок слизистой оболочки.
Пролапс слизистой пищевода в желудок рентгенологически проявляется образованием в медиальном отделе газового пузыря желудка дополнительной тени, окружающей область кардиального отверстия. Нерйдко контуры этой тени фестончатые и напоминают бугристую опухоль. Но в отличие от нее имеется изменчивость формы и размеров тени или дефекта в процессе исследования, эластичность стенок сохраняется, отсутствуют признаки нарушения механизма раскрытия и замыкания кардии, за исключением осложненных случаев. Всегда отмечается периодическое ритмическое сокращение нижнего пищеводного сфинктера.
Глава 15. ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ
В группу воспалительных заболеваний входят хронический гастрит, язвенная болезнь, флегмона желудка, туберкулез желудка, сифилис желудка и другие воспаления.
Хронический гастрит. Это медленно прогрессирующее заболевание желудка, характеризующееся в начальной стадии поверхностными воспалительными изменениями, а в конечной — необратимой атрофией слизистой оболочки желудка с последующей кишечной ее метаплазией, которая приводит к превращению секретирующей слизистой в абсорбирующую и сопровождается нарушением функции желудка и других систем организма. Заболевание является одним из наиболее распространенных (до 50 %) среди населения не только нашей страны, но и всего мира. Поэтому диагностика хронического гастрита — одна из самых актуальных проблем гастроэнтерологии.
Хронический гастрит — полиэтиоло-гическое заболевание и может вызы
ваться многочисленными как эндогенными, так и экзогенными факторами. Патогенез его также весьма сложен. При переходе острого гастрита в хронический наблюдается прогрессирование первично возникающих воспалительных изменений слизистой оболочки желудка с последующими дистрофиче-ски-регенераторными изменениями желудочных желез. В механизме развития отдельных форм хронического гастрита, возникшего в результате нарушения питания и нервно-рефлекторных влияний на желудок, на первом месте стоят секреторно-двигательные его расстройства, затем появляются структурные изменения в железистом аппарате и воспалительный процесс в строме. Определенную роль играют задержка желудочного содержимого и дуоденогаст-ральный рефлюкс, а также пилорические кампило-, или хеликобактерии.
По характеру секреции выделяют гастриты с повышенной, пониженной, нормальной секрецией и кислотностью,
но более характерно уменьшение желудочного сокоотделения. Функция кис-лотообразования нарушается раньше и чаще, чем ферментообразовательная и экскреторная. В диагностике хронических гастритов, протекающих с сохраненной и повышенной секрецией, должны быть отражены фазы течения заболевания: фаза обострения, фаза ремиссии и неполной ремиссии; при гастритах с секреторной недостаточностью — фазы компенсации и субкомпенсации.
Сочетание регенеративных гиперпластических, атрофических, фиброзных и язвенных процессов дает очень пеструю клинико-морфологическую картину гастрита, находящуюся в тесной зависимости от многочисленных экзогенных и эндогенных факторов.
Клиническая картина хронического гастрита проявляется диспептическими расстройствами и болями вскоре после приема пищи. Большинство больных предъявляют жалобы на снижение аппетита, ощущение неприятного вкуса во рту, тошноту, слюнотечение, изжогу, отрыжку воздухом и пищей, вздутие живота, урчание и переливание в животе, нарушение стула. У некоторых тошнота и слюнотечение бывают стойкими и мучительными. Боли обычно носят тупой, ноющий характер, локализуются в эпигастрии и возникают после или вскоре после еды, особенно острой, грубой, реже натощак. Но боли в эпигастрии у отдельных больных могут иметь и язвено-подобный характе'р. Иногда больные даже после приема небольшого количества пищи ощущают давление в надчревной области, переполнение желудка.
Если нарушено всасывание в желудке, при хроническом гастрите могут наблюдаться признаки дефицита различных витаминов, чаще группы В (заеды в углах рта, повышенное шелушение кожи, преждевременное выпадение волос, ломкость ногтей и т. д.), дисэлек-
тролитный синдром с дефицитом в организме в основном ионов калия, кальция и железа. Нарушение всасывания, пей-рогуморальная перестройка функции пищеварения проявляются у ряда больных, особенно у женщин, астеноневро-тическим синдромом: парестезиями, неврогенными кардиоваскулярными нарушениями, артериальной гипотонией, зябкостью конечностей и другими симптомами. Могут развиваться умеренная надпочечниково-гипофизарная недостаточность и нарушение половой функции.
Диагностика хронического гастрита должна быть комплексной. Диагноз его должен устанавливаться на основе анализа клинических проявлений болезни, результатов исследования желудочной секреции (базальной и стимулированной гистамином или пентагастрином и их комбинацией), данных гастрофиб-роскопии с прицельной (аспирационной) биопсией и рентгенологических исследований. Каждый метод в отдельности не дает возможность установить диагноз гастрита. У ’/з —2/з больных с гастритическими жалобами при биопсии обнаруживают нормальную слизистую оболочку желудка и почти у 50 % лиц без аналогичных жалоб при биопсии слизистой желудка выявляют изменения, характерные для хронического гастрита. У 2/з больных, у которых рентгенологически был установлен диагноз гастрита, при биопсии слизистой оболочки желудка воспалительных изменений не обнаружено, и наоборот, у */з обследованных, которых рентгенологически рассматривали как здоровых, в слизистой оболочке желудка при биопсии были выявлены симптомы гастрита.
Об этом следует помнить всем гастроэнтерологам и знать, что морфологические признаки часто не соответствуют клинической картине обострения хронического гастрита. Кроме того, выра-
женност.ь морфологических изменений слизистой оболочки в разных отделах неодинакова и может носить очаговый и диффузный характер. По мере трансформации процесса первоначально поражается антральный отдел, в дальнейшем — малая кривизна и свод желудка. Поэтому при гастрофиброскопии забор тканей для микроскопического исследования необходимо делать прицельно из разных участков слизистой оболочки желудка и в первую очередь антральной части и его тела. При расхождении клинических и гистологических данных показана повторная биопсия.
В классификации хронического гастрита произошли значительные изменения. Многие считают, что по выраженности морфологических изменений ткани желудка и по топографии следует различать поверхностный гастрит и атрофический с его типами (Steinheber, 1985; Koch, Romen, 1987; Graham, Klein, 1987).
Поверхностный хронический гастрит характеризуется лимфоплазмоцитарной инфильтрацией субэпителиальной зоны. В апикальном отделе клеток отсутствуют нейтральные мукополисахариды, а на поверхности обнаруживается большое количество слизи. Воспалительная инфильтрация области шеек желез может нарушать клеточное обновление эпителия, что приводит к гиперплазии ямок и эрозиям. В одних случаях воспаление носит очаговый характер, в других — диффузный. Длительность течения поверхностного хронического гастрита 15—20 лет. Но зто процесс обратимый, поэтому лечебные мероприятия оправданы и должны проводиться как можно раньше. Если поверхностный гастрит не лечится, то морфологические изменения распространяются на глубокие отделы слизистой оболочки и тогда он трансформируется в атрофический хронический гастрит.
При атрофическом хроническом гастрите уменьшается число главных и добавочных клеток, углубляются желудочные ямочки, эпителий уплощается и содержит много РНК и мало нейтрофильных мукополисахаридов, местами замещен кишечным эпителием с типичными энтероцитами, бокаловидными клетками и клетками Панета (кишечная метаплазия).
Существуют два главных морфологических типа хронического атрофического гастрита — тип А и Б и третий — тип АБ. Хронический гастрит типа А считается аутоиммунным заболеванием и редко связан с инфицированием. Он характеризуется атрофией слизистой оболочки тела желудка, а антральный отдел почти не изменен. При этом типе гастрита появляются антитела к париетальным клеткам, содержание гастрина в крови повышено. В случае хронического гастрита типа Б поражается антральный отдел желудка, где имеет место лоскутовидная атрофия слизистой оболочки желудка без антител к париетальным клеткам. В этиологии его придают значение дуоденогастральному рефлюксу и инфицированию Campilo-bakter pyloridis (СВР), которые были описаны в 1983 —1984 гг. австралийскими учеными Маршаллом и Уорреном. Третий тип хронического гастрита — диффузный гастрит (тип АБ).
Частота хронического гастрита увеличивается с возрастом. Атрофический хронический гастрит у лиц в возрасте 31—50 Лет в антральном отделе встречается в 20 %, в теле желудка — в 7 %; у больных старше 65 лет поражены антральный отдел и тело желудка в 40 %, однако тяжелый хронический атрофический гастрит встречается только в 6 %. И далее, наиболее частый тип атрофического гастрита — мультифокальный, характеризующийся участками атрофии, мононуклеарной инфильтрации, прогрессирует с возрастом.
У молодых больных чаще поражается малая кривизна в области угла желудка. С возрастом зоны поражения расширяются и появляется кишечная метаплазия, которую следует рассматривать как облигатный предрак (Соггеа, 1988).
По мнению W. Koch и W. Romen (1987), диагностика хронического гастрита возможна только с помощью биопсии. Изменения секреции не коррелируют с морфологической картиной. Рентгенологическое исследование выявляет лишь выраженный атрофический хронический гастрит. Эндоскопический признак этого гастрита — увеличение количества сосудов. Показанием для биопсии служит не диагностика хронического гастрита, а поиск других заболеваний желудка.
Макроскопические изменения внутренней поверхности желудка, обусловленные расширением кровеносных сосудов, отеком и воспалительной клеточной инфильтрацией в строме слизистой и подслизистого слоя, при гастрите рентгенологически проявляются патологически перестроенной слизистой оболочкой. Эти изменения прежде всего отражаются в определенной последовательности на состоянии рельефа желудочных полей, которые увеличиваются в размерах и изменяют свою форму.
Желудочные поля, или ареолы желудка, представляют собой преформирован-ные возвышения (группу желез) на поверхности слизистой оболочки, которые окружены соединительной тканью и имеют округлую или полигональную форму. По описанию морфологов, размеры их 1—6 мм. Ареолы желудка при неизмененной слизистой оболочке в живом организме почти не выступают над окружающими их бороздками и рентгенологически не выявляются.
Вследствие воспалительных изменений при хроническом гастрите размеры ареол увеличиваются, а очаговая или
диффузная атрофия и развитие соединительной ткани обусловливают огрубление и неравномерность рисунка желудочных полей, способствуя лучшему их выявлению. Ареолы обычно видны на гребнях складок слизистой оболочки при неполном их раздавливании и лучше обнаруживаются в фазе расслабления стенок желудка. Величина желудочных полей находится в определенной зависимости от степени выраженности структурных изменений слизистой желудка. Когда морфологические изменения в биоптатах из различных отделов желудка у одного и того же больного оказываются неоднородными, это состояние расценивается как очаговый гастрит. Однородные морфологические изменения во всех частях желудка — это диффузный гастрит. Направление распространения гастрита (пилокардиальное или кардиоантраль-ное) оценивается по степени выраженности гастритических изменений в отдельных зонах желудка.
Поверхностный гастрит наблюдается преимущественно у лиц молодого возраста. Изменения слизистой оболочки обнаруживаются примерно с одинаковой частотой во всех изучаемых отделах желудка: антральном, малой кривизне и своде. По данным В. С. Пру-чанского (1978), при поверхностном гастрите у 90,5 % больных рентгенологически выявляется нежный неравномерный рисунок, ареол неправилыю-округлой или полигональной формы, имеющих в поперечнике 1—3 мм (реже 0,5—1 мм) и отграниченных друг от друга очень тонкими бороздками с контрастным веществом. Ареолы до 1 мм в поперечнике свидетельствуют об умеренно выраженной поверхностной инфильтрации слизистой и наблюдаются при начальных стадиях хронического гастрита. При выраженном поверхностном гастрите ареолы достигают 2 — 3 мм, значительно возвышаются над
поверхностью слизистой и более отчетливо определяются на рентгеновских снимках в виде мелких дефектов наполнения, создавая картину однородной сетчатости или мелкой зубчатости большой кривизны выходного отдела желудка.
Хронический гастрит с поражением желез без атрофии более четко уже в самом названии конкретизирует степень воспалительной инфильтрации в толще слизистой. Эта инфильтрация в значительной степени влияет на характер изменений микрорельефа слизистой желудка. В основном встречается в зрелом возрасте, чаще у женщин. Рентгенологически эта форма гастрита у 77,4 % больных характеризуется равномерным зернистым рисунком, который обусловливается более выраженной высотой округлых или овальных по форме ареол размерами от 2—3 до 5 мм, расположенных иногда в виде частокола. Умеренно выраженная клеточная инфильтрация стромы слизистой желудка наблюдается в тех случаях, когда размеры ареол не превышают 3 мм в поперечнике. Если на рентгенограммах зернистого рельефа выявляются ареолы более 3 мм (вплоть до 5 мм), это соответствует патологической картине более выраженного гастрита.
Наряду с изображенйем желудочных полей на рельефе слизистой их отображение обнаруживается также на контуре желудка. При этом желудочные поля придают контуру мелкую фестон-чатость, характер которой соответствует типу тонкого рельефа.
Атрофический гастрит — конечная стадия хронического гастрита. Он может быть умеренным, выраженным, с явлениями перестройки эпителия, сюда включают атрофический гиперпластический гастрит и прочие редкие формы атрофического гастрита (с явлениями жировой дегенерации, без подслизистой
основы, с образованием кист). Атрофический гастрит — наиболее часто встречающаяся форма гастрита. Морфологические изменения в слизистой оболочке желудка могут носить очаговый или диффузный характер и локализоваться преимущественно либо в антральном и фундальном отделах, либо поражают весь желудок. При очаговом атрофическом гастрите у 95 % больных процесс локализуется, как правило, в антральном отделе и у 5 % — в области малой кривизны, а в своде желудка атрофических изменений не выявляется. В случае диффузного атрофического гастрита у больных 'в возрасте до 40 лет слизистая оболочка желудка изменяется преимущественно в антральном отделе. По мере увеличения возраста больных происходит постепенное распространение атрофического гастрита на тело, а затем и свод желудка (Лобанова, Михайлов, Роттенберг, 1981).
По данным В. С. Пручанского (1978), у 93,1 % больных атрофическим гастритом выявляется рентгенологически грубый неравномерный микрорельеф слизистой желудка. Ареолы различной формы и величины, максимальный поперечник их превышает 5 мм. Они значительно возвышаются над поверхностью слизистой оболочки и напоминают полиповидные образования. Поперечный размер и высота ареол зависят от степени выраженности атрофических изменений и воспалительной инфильтрации стромы слизистой желудка. При умеренно выраженном атрофическом гастрите размер ареол 5 — 6 мм, при выраженном они увеличиваются в высоте и площади, неоднородны, имеют различную величину и форму, контуры их нечеткие, распространяются по поверхности слизистой оболочки неравномерно.
При рентгенологическом исследовании желудка у больных хроническим
75. Рентгенологическая картина контрастированного желудка при хроническом гастрите: деформация антрального отдела, жидкое содержимое с горизонтальным уровнем, перестройка макрорельефа слизистой.
гастритом изучается не только микрорельеф слизистой, но обращается вни мание на другие морфологические и рентгенофункционалъные симптомы. Любой хронический гастрит характеризуется расширением кровеносных сосудов, отеком и воспалительной клеточной инфильтрацией, развивающимися в слизистом и подслизистом слоях. Они и формируют рентгенологическую картину патологического состояния желудка. Изменяется не только рисунок желудочных полей, а утолщаются и неравномерно набухают складки слизистой. Они становятся более изви
листыми и представляются в виде бесформенных подушкообразных и полипоподобных выбуханий. Если гастрит поверхностный, грубый макрорельеф слизистой в выходном отделе желудка выявляется у */з, при глубоком атрофическом гастрите — у '/а больных.
При распространении процесса на подслизистый слой складки вначале могут сглаживаться, а затем полностью исчезнуть. Подобная картина, по мнению Ю. Н. Соколова и П. В. Власова (1968), может наблюдаться и при чрезмерном развитии в подслизистом слое фиброзной соединительной ткани в случаях далеко зашедших гастритов, т. е. при склерозирующем (ригидном) гастрите. Тогда стенки желудка, преимущественно выходного отдела, становятся плотными и неподатливыми, складки слизистой полностью теряют свойство изменчивости.
У некоторых больных хроническим гастритом могут наблюдаться и рентгенофункциональные признаки: избыточная секреция натощак, быстрое нарастание секреторной жидкости, изменение тонуса, стойкая деформация привратниковой части желудка, нарушение перистальтики и др. При поверхностном гастрите эти симптомы мало выражены. Наличие небольшого количества слизи имеет место лишь у 30 — 35 % больных, снижение тонуса и перистальтики — у 5, повышение тонуса и сегментирующая перистальтика в антральном отделе — у 3, нарушение эвакуаторной функции желудка в виде ускорения или замедления — у 3—5 %.
При глубоком поражении слизистой оболочки натощак у 40—45 % больных в желудке отмечается умеренное количество слизи и у 4 % — секреторная жидкость. Изменение тонической и перистальтической деятельности обнаруживается почти у 10 % больных. Причем у одних эти показатели могут быть усилены, а у других, наоборот, умень-
шены. Эвакуаторная функция желудка нарушена в 18 % случаев как в сторону ускорения, так и замедления.
Атрофический гастрит может сопровождаться снижением или повышением тонуса желудка. Слизь обнаруживается в желудке натощак у 1 /з, а секреторная жидкость у 0,7 % больных. Перистальтическая деятельность у преобладающего большинства больных не нарушается. У 10,5 % больных, по данным В. С. Пручанского (1978), может быть некоторое ослабление перистальтики и у 2,8 % — усиление ее. Приблизительно такая же картина наблюдается при оценке эвакуаторной функции желудка: у 69 % больных эвакуация контрастного вещества из желудка наступает в обычные сроки, у 27 — бывает ускоренной и у 4 % лиц — замедленной.
Таким образом, все описанные формы хронического гастрита следует рассматривать как стадии одного и того же процесса, как фазы нарушения физиологической регенерации слизистой оболочки желудка: поверхностный гастрит переходит в атрофический. На трансформацию поверхностного гастрита в атрофический необходимо около 20 лет. Однако изменения слизистой желудка, свойственные поверхностному гастриту, в большинстве случаев могут быть обратимыми.
Наши наблюдения и литературные данные свидетельствуют, что на основе обычного рентгенологического исследования ставить диагноз гастрита нельзя. Независимо от морфологической формы хронического гастрита такие рентгенологические признаки, как изменение складок слизистой оболочки, наличие слизи и секреторного слоя, состояние тонуса, перистальтики и эвакуаторной функции желудка не являются типичными признаками данного заболевания. Подобная рентгенологическая картина нередко может быть при самых различных поражениях желудка.
76. Проявления антрального гастрита: а — начальные; б — поздние.
По данным Р. Keto, Н. Souranta, Н. Myllarniemi, I. Nickels (1983), это относится и к характеру изменения
желудочных полей, так как отсутствует корреляция между их размерами и гистологической картиной. Авторы считают, что выявляемые при рентгенологическом исследовании с двойным контрастированием характеристики желудочных полей неэффективны в диагностике гастрита.
По нашему мнению, особое значение следует придавать антральному ригидному гастриту, который сопровождается временными или постоянными спазмами. Эти спазмы вначале способствуют рабочей гипертрофии мышечной оболочки, а прогрессирующий склероз ее приводит к уплотнению и сужению антрального отдела желудка, просвет которого напоминает узкую трубку. Клинически ригидный антральный гастрит проявляется болями, нередко язвенно-подобными, диспептическими расстройствами. При рентгенологическом исследовании желудка определяются признаки относительной или полной ригидности антрального отдела в зависимости от длительности и тяжести течения заболевания. Рельеф слизистой либо сглажен, либо стабильно перестроен. Антральный отдел укорочен, сужен и представляется в виде конуса, складки в нем чаще расположены поперечно, вследствие чего контуры равномерно зазубрены. Привратник в большинстве случаев располагается эксцентрично, просвет его удлинен, расширен, деформирован. Нарушения моторной функции глубокие, перистальтические сокращения редкие и слабые, а при выраженном склерозе вовсе отсутствуют. Так возникает выраженный ригидный (склерозирующий) антральный гастрит, который, несомненно, является поздней стадией хронического антрального гастрита с секреторной недостаточностью.
Заслуживает внимания и эрозивный гастрит, который характеризуется выраженным экссудативно-инфильтратив
ным воспалением и поверхностным некрозом. Он может быть как самостоятельным заболеванием, так и вторичным, сопровождая ряд заболеваний панкреатодуоденальной зоны или осложняя течение некоторых заболеваний других органов и систем. Выявление эрозивного гастрита стало возможным благодаря использованию современной рентгенотелевизионной аппаратуры, усовершенствованию методики рентгенологического исследования и производству высококачественных рентгенограмм. Следует макроскопически различать мелкие (менее 2 мм) и более крупные воспалительные эрозии. Первые возникают чаще в верхних отделах желудка, не сопровождаются отеком и воспалительной инфильтрацией,очень изменчивы и рентгенологически не распознаются. Вторые, более крупные эрозии, обнаруживаются преимущественно в антральном отделе желудка. Они сопровождаются выраженным отеком и воспалительной инфильтрацией, могут существовать длительно и давать определенную клиническую картину.
Эрозии могут быть распространенные и локальные. Рентгенологически на фоне утолщенных складок (реже сглаженного рельефа) обнаруживают множественные нестойкие, нечетко очерченные, неинтенсивные депо контрастной взвеси. В момент прохождения перистальтической волны они исчезают. Кроме этих морфологических изменений, имеются другие признаки гастрита. Локальные эрозии встречаются значительно реже, размер их часто не превышает 1 см, рентгенологически проявляются па контуре плоской нишей, а на передней или задней стенках — малоинтеисивным контрастным пятнышком.
Наиболее сложна диагностика эрозивных воспалительных инфильтратов, располагающихся на контуре желудка. Основные рентгенологические проявле-
иия подобного поражения — краевой дефект с небольшой «помаркой» бариевой взвеси и плавным переходом его в утолщенную складку слизистой, изменчивость величины и формы краевого дефекта, непостоянство депо контрастной взвеси. Уточняют диагноз эндоскопия с биопсией или динамическое рентгенологическое исследование после противовоспалительной терапии.
При длительно протекающем хроническом гастрите с секреторной недостаточностью рельеф слизистой оболочки беспорядочен и состоит из бесформенных выбуханий и хаотично расположенных между ними пятен и полосок бария. В ряде случаев слизистая оболочка рыхлая и подвижная. Через пилорический канал она смещается в луковицу 127перстной кишки, образуя здесь своеобразный дефект наполнения, напоминающий опухолевое поражение.
В диагностике хронического гастрита большая роль придается эхографии, которая позволяет отдифференцировать различные формы гастритов. Так, при гиперсекреторпых гастритах наблюдается значительное увеличение диффузных эхо-сигналов в просвете желудка натощак, при эрозивных гастритах — появление неровности контура стенки слизистой в местах локализации эрозий, что подтверждалось при фиброгастро-дуоденоскопии. Если' гастрит гипертрофический, определяется локальное утолщение стенки в местах гипертрофических изменений. При поверхностных и особенно антральных гастритах часто наблюдается симптом «расслоения» стенки желудка, что связывают с экссудативным воспалением стенки.
Характерно, что антральные гастриты чаще, чем распространенные, сопровождаются повышенной эвакуацией содержимого из желудка. Причем время эвакуации в периоде обострения укорачивается до 30 — 90 мин (в среднем 62,0±1,2 мин), тогда как при распро
страненном гастрите время эвакуации содержимого из желудка сокращается в тот же период менее значительно, варьируя от 60 до 90 мин (составляя в среднем 76,2 + 1,8 мин).
В периоды неполной и полной ремиссии время эвакуации содержимого из желудка на фоне проводимой терапии постепенно приближается к нормальным показателям (120 — 150 мин).
Итак, хронический гастрит продолжает оставаться многоаспектной, динамической проблемой, практическое значение которой трудно переоценить ввиду его широкого распространения. По ряду кардиальных вопросов, особенно в клинико-практическом плане, в литературе можно найти общую позицию. Это прежде всего унифицирование представлений о клинической картине разных вариантов гастрита. Все более важными для практики становятся разделение гастритов (по крайней мере с позиций патогенеза) на «гастрит иммунологический» и «гастрит неиммунологический» (типы А и Б), изучение гастрита типа АБ, объективный анализ изменений секреторной функции желудка и данных эндоскопических исследований в сочетании с результатами изучения биоптатов, полученных при эндоскопии. Врач всегда должен иметь в виду онкологический аспект хронического атрофического гастрита с секреторной недостаточностью. Лучевые методы исследования имеют значение в комплексе с другими инструментальными данными и должны учитываться только при наличии клинических признаков заболевания.
Язвенная болезнь. Это хроническая, циклически протекающая и периодически обостряющаяся болезнь. Она характеризуется нарушением функции и образованием язвенного дефекта стенки желудка или 12-перстной кишки. Актуальность проблемы определяют высокая распространенность заболевания во всех
странах мира, сложность патогенеза, разнообразие клинических проявлений, длительное, упорное, часто рецидивирующее течение.
ЯБЖ может возникать в любом возрасте. Распространенность ее среди взрослого населения составляет в среднем 8—10 % с определенной тенденцией к учащению заболеваемости. В детском возрасте это заболевание встречается реже и выявляется в 0,7—4,5 % случаев. Среди заболеваний пищеварительной системы язвенная болезнь обнаруживается, по нашим данным, у 1 /з больных. Наибольшее количество больных наблюдается в возрасте от 20 до 50 лет (70—80 %), причем максимальная частота отмечается в 30 — 40 лет. Среди взрослых чаще болеют мужчины, особенно молодого возраста, а у женщин язвенная болезнь встречается преимущественно после наступления менопаузы.
Этиопатогенез ЯБЖ весьма сложен и до сих пор полностью не раскрыт. Язвенную болезнь принято считать по-лиэтиологическим и полипатогенетиче-ским заболеванием. И хотя еще не все изучено, можно с уверенностью сказать, что в возникновении ЯБЖ имеют значение взаимодействие и взаимовлияние трех основных компонентов: нервного, эндокринного и местного. Ведущее значение принадлежит нервной и гормональной системам. Причем это связывается прежде всего с конституциональными и наследственными факторами. Для проявления свойств генов необходимы сопутствующие факторы внешней среды или стресс. Особенно важны уменьшение резистентности слизистой оболочки желудка, ее метаплазия, гипертрофия желез, активация гастрина и частое повышение кислотности желудочного сока. Среди провоцирующих факторов следует отметить нарушение ритма питания, курение, алкоголь, прием некоторых лекарств
(например, ацетилсалициловой кислоты, кортикостероидов и др.).
В развитии ЯБЖ придается значение нарушению функции привратника и развитию дуоденально-гастрального рефлюкса. Регургитация дуоденального содержимого приводит к снижению факторов защиты (угнетение слизеобразо-вания, снижение секреции кислых и нейтральных мукополисахаридов), к дополнительному стимулированию выработки соляной кислоты и усилению факторов агрессии (высокая кислотнопептическая активность желудочного сока, повышение функции серотонин-продуцирующих клеток, желчные кислоты, забрасывающиеся в желудок вместе с желчью), т. е. образование язвенного дефекта, по мнению Ф. И. Комарова, О. С. Радбиль (1978), реализуется на путях динамического взаимодействия двух факторов — фактора агрессии и фактора защиты слизистой оболочки желудка.
Таким образом, роль местных механизмов в развитии ЯБЖ чрезвычайно велика. Усиление факторов агрессии или ослабление факторов защиты приводит к нарушению координации функции гастродуоденальной системы и обусловливает язвообразование.
Изменения в желудке проявляются в форме острых, хронических и каллез-ных язв. Острая язва — это дефект слизистой оболочки глубиной до мышечного слоя, с гладкими, мягкими краями. При хронической язве разрушается мышечный слой вплоть до серозного покрова, края язвы уплотнены, дно ее белого или серого цвета, покрыто фибриноидным, некротическим слоем. Для каллезной язвы характерно значительное уплотнение ее краев вследствие развития грубой соединительной ткани. Отмечается конвергенция складок слизистой к язве.
Чаще всего наблюдаются одиночные и только в 5 —10 % случаев множествен
ные язвы. Величина язв в основном колеблется от 1 до 3 см в диаметре, но иногда встречаются большие, так называемые гигантские язвы, достигающие в диаметре 10 см и более.
Имеется ряд классификаций ЯБЖ, большинство из них спорные и в полной мере не удовлетворяют теоретическую и особенно практическую медицину, потому что учитывают лишь патологическое состояние с синдромом «ниши». Это создает, по мнению Г. И. Дорофеева и В. М. Успенского (1980), ограниченный подход к диагностике ЯБЖ, основанный на выявлении язвенного дефекта, и концентрирует внимание врача не на ранней диагностике заболевания, а на раннем обнаружении язвы. Лишь в немногих классификациях имеются указания на существование начальной функциональной стадии ЯБЖ.
Первым мысль о существовании «прелюдии» (функциональной стадии) ЯБЖ высказал М. П. Кончаловский (1936 и 1941 г.). Язвенный дефект он оценивал как финал предшествующего ему процесса. Мысль М. П. Кончаловского получила дальнейшее развитие в работах И. Ф. Лорие, И. М. Флекеля, Г. Л. Левина, А. С. Белоусова, К. И. Широковой, Г. И. Дорофеева, В. М. Успенского и других исследователей. Они доказали существование предъязвенно-го состояния и рассматривали его как клиническое выражение функциональной стадии ЯБЖ.
Таким образом, учитывая изложенное, представляется целесообразным с клинико-рентгенологической точки зрения выделить следующие стадии развития ЯБЖ.
1. Стадия функциональных расстройств (предъязвенное состояние).
2. Стадия язвенного дефекта:
а) острая язва;
б) хроническая язва;
в) послеязвенный рубец;
г) каллезная язва.
3. Стадия осложнений (кровотечение, перфорация, пенетрация, пилоро-дуоденальный стеноз, малигнизация, перивисцерит, рубцовая деформация желудка или пилорического канала, двухполостной желудок).
Клиническая картина связана с локализацией язвы. Язвы, расположенные в области угла желудка или выше, относятся к медиогастральным, а локализованные в препилорической части привратника желудка и 12-перстной кишке — к пилородуоденальным. Наиболее часто ЯБЖ проявляется болями в животе и выраженностью болевого синдрома, похуданием, слабостью, тошнотой, рвотой и другими симптомами. При медио-гастральных язвах боль появляется вскоре после еды, при пилородуоденаль-ных — через 1,5—2 ч, а иногда и позже или ночью.
Для предъязвенного состояния, предшествующего язвообразованию в выходном отделе желудка, информативными симптомами служат боли в эпигастрии, возникающие натощак и вскоре после приема пищи, локальный характер их в пилородуоденальной зоне при пальпации живота, гиперхлоргидрия желудочного сока натощак, гиперсекреция соляной кислоты в стимулированную фазу, гиперсекреция пепсина натощак и в стимулированную фазу, антральный стаз, длительное и выраженное снижение pH в антральном отделе. Однако не всегда просто решать, является ли гастрит обязательным предшественником ЯБЖ при пилородуоденальной локализации, поскольку как антральный гастрит, так и дуоденит обнаруживаются только у 70—80 % больных.
В стадии язвенного дефекта также типичен язвенный симптомокомплекс. Основные жалобы больных: боли, изжога, отрыжка, тошнота и рвота. Главная жалоба — боли. Они локализуются в эпигастрии, реже — в правом или левом подреберье. Выраженность и характер
болевого синдрома могут быть различными и во многом определяются возрастом больных, локализацией язвы, характером нарушения секреторной функции желудка, длительностью заболевания. В начале болезни боли, как правило, не имеют четкой связи с приемом пищи, непродолжительные, нело-кализованные, неинтенсивные. По мере прогрессирования процесса болевой синдром становится все более выраженным и приобретает особенности, характерные для ЯБЖ.
Отличительные особенности язвенных болей — периодичность, ритмичность, сезонность, изменение характера болей, их исчезновение после рвоты, приема пищи, антацидов, применения тепла, холинолитиков. В зависимости от локализации язвы боли могут быть ранними, поздними, ночными и голодными. Ранние боли свойственны высоким язвам и язвам на задней стенке желудка, возникают или усиливаются вскоре после приема пищи и локализуются преимущественно в эпигастральной области, несколько выше пупка по средней линии живота или справа от нее. При язвах кардиального отдела желудка боль локализуется в основном за мечевидным отростком. Язвы малой кривизны характеризуются болью в подложечной области, которая носит четкий ритм и возникает, в зависимости от уровня локализации язвы, через 15 — 60 мин после еды. При язвах антрального отдела боли поздние, возникают через 1,5—2 ч после еды. Если имеются сочетанные язвы, т. е. одновременно в желудке и 12-перстной кишке, боль носит двухволновой характер: появляется через 40 — 60 мин, затем через 1,5— 2 ч резко усиливается и длительно продолжается.
Боли при ЯБЖ достигают максимальной силы на высоте пищеварения. Они носят интенсивный характер, отличаются упорством и продолжительностью.
Нередко иррадиируют за грудину, левую лопатку, в область сердца, симулируя приступы стенокардии. Таким больным часто ставят неправильный диагноз ишемической болезни сердца. В ряде случаев боли могут усиливаться при физической нагрузке, тогда следует думать о перигастрите или перидуодените. У большинства больных болевой синдром исчезает после рвоты, которая возникает без предшествующей тошноты. Для ЯБЖ типично также молниеносное прекращение болей после приема щелочей.
Из диспепсических признаков ЯБЖ следует отметить изжогу, которая наблюдается в 50 — 80 % случаев. Она может быть постоянной или периодической и связана в основном с нарушением двигательной деятельности и развитием дуоденогастрально-ззофагеального рефлюкса. Отрыжка при язвенной болезни бывает горькой, кислой или пищевой. Аппетит у язвенных больных, как правило, сохранен, а в ряде случаев даже повышен. У некоторых больных может наблюдаться слюнотечение, которому предшествует тошнота.
По своему течению ЯБЖ характеризуется разнообразием клинических проявлений и патоморфологических изменений. В одних случаях она может протекать доброкачественно с редкими рецидивами и короткими периодами обострений, в ряде случаев даже бессимптомно или субклинически с мало выраженными болевым и диспепсическими синдромами. Обострения бывают редко, длятся не более 1—2 недель, повторяются не чаще 1 раза в 1—2 года, болезнь хорошо поддается консервативной терапии. У других больных течение прогрессирующее с ежегодными обострениями и затяжными рецидивами. Периоды ремиссий короткие, боли полностью не исчезают и в период ремиссий, а консервативное лечение малоэффективно. У третьей группы боль
ных ЯБЖ с самого начала может приобретать тяжелое течение с потерей трудоспособности и развитием ряда осложнений.
Существует много методов диагностики язвенной болезни, но идеальных нет, нужно учитывать предельную возможность каждого из них. Так, эффективность обычного рентгенологического метода составляет 63 %, причем язвы до 5 мм выявляются в 24 %, тогда как язвы диаметром более 5 мм диагностируются в 89 %. Двойное контрастирование несколько улучшает выявление крупных язв, однако его эффективность в диагностике малых язв ниже, чем при обычном контрастировании, и составляет только 6 % (Ott, Yu Men Chen, Gelfand et al., 1986).
Точность рентгенологической и эндоскопической диагностики язв желудка изучалась многими исследователями как в отдельности, так и в комплексе. С этой целью для сравнения выделено 3 группы больных ЯБЖ: 1) обнаружена рентгенологически; 2) установлена эндоскопически; 3) диагностирована обоими методами. Общая точность исследования соответственно группам колебалась в пределах 80, 88 и 80 %, положительный прогностический индекс — 69, 72 и 73, отрицательный прогностический индекс — 81, 95 и 82, чувствительность — 43, 86 и 38, специфичность — 93, 89 и 95 %. В целом достоверность данных методов исследования, по мнению Т. Gjorup, Е. Agner, L. В. Jensen et al. (1987) , во всех группах приблизительно равная, что не позволяет отдать предпочтение какому-либо одному методу исследования.
По данным Р. Ch. Shaw, L. К. Romun-de, C. Griffionen et al. (1987), если применять двухфазную рентгенографию (двойное контрастирование и компрессию), чувствительность рентгенологического метода при ЯБЖ равняется 91 %, а эндоскопии — 85 %. Что касает
ся многофазного рентгенологического исследования, включающего ТБЗ желудка, снимки с компрессией и двойное контрастирование, эффективность его составляет 99 % (Gelfand et al., 1987).
По мнению А. С. Белоусова (1978, 1984), В. X. Василенко и А. Л. Гребенева (1981) и других, клинические данные в подавляющем большинстве случаев имеют решающее, первостепенное значение и отсутствие эндоскопического или рентгенологического подтверждения не должно влиять на диагноз.
Распознавание язвенной болезни с помощью рентгенологического метода исследования значительно улучшилось в связи с оснащением лечебных учреждений новой современной рентгеновской аппаратурой с электронно-оптическими усилителями яркости рентгеновского изображения, телевидением и видеомагнитофонной записью, совершенствованием методик рентгенологического исследования, а также значительно возросшей квалификацией врачей-рентгенологов. Все это обеспечивает получение высококачественных обзорных и прицельных снимков, на которых детально можно изучить морфологическое и функциональное состояние всех отделов желудка, выявить даже очень небольшие язвы, под контролем просвечивания зафиксировать на рентгенограммах нужные фазы динамической картины контрастированных отделов желудка.
Рентгеносемиотика ЯБЖ многообразна. Она зависит от возраста больного, стадии язвенного процесса, величины, формы и локализации изъязвления, а также от методики рентгенологического исследования. В зависимости от локализации язвы необходимы специальная методика исследования и особый методический прием. Так, рентгенодиагностика язв верхних отделов желудка должна проводиться не только в вертикальном, но обязательно и в горизон
тальном положениях больного на спине, на животе, а иногда в положении Трен-деленбурга. Непременное условие успешной диагностики язв — производство высококачественных обзорных и особенно серии прицельных снимков рельефа с дозированной компрессией, пневморельефа слизистой и тугого заполнения желудка. Иногда на рентгенограммах удается обнаружить маленькие язвы размером 0,2—0,3 см, не выявляемые рентгеноскопически даже с использованием ЭОУ и телевидения. Большое значение в диагностике язв имеет применение различных фармакологических средств, вызывающих релаксацию стенок желудка.
Первая функциональная стадия ЯБЖ чаще наблюдается в молодом возрасте, нередко в юношеском и старшем детском возрастах, и с рентгенологической точки зрения характеризуется признаками дискинезии желудка с нарушением тонической, пропульсивной и эвакуа-торной деятельности. Преимущественно наблюдаются спастические сокращения в различных участках желудка, которые могут быть постоянными или временными. У большинства больных вначале отмечается быстрая эвакуация контрастного вещества из желудка, а затем его длительная задержка из-за развившегося спазма антрально-пилорического отдела. Перистальтика желудка обычно глубокая, даже сегментирующая, ритм ее ускоренный. В предъяз-венной стадии отмечаются высокой степени кислотность желудочного содержимого, быстрое накопление жидкости в желудке во время исследования, болезненность при пальпации, появление изжоги и тяжести в подложечной области. На основании этих симптомов можно думать о воспалительном процессе в желудке: гастрите или ЯБЖ. Но, если сопоставить эти признаки и учесть периодичность их появления, связать с качеством пищи, усилением секретор
ной, кислото- и ферментообразующей, а также двигательной функцией желудка, можно, по мнению А. С. Белоусова (1978, 1984), К. И. Широковой (1981), высказаться в пользу ЯБЖ.
На современном этапе развития рентгенологии врач может безошибочно определить по рентгенологической семиотике предъязвенное состояние в парапилорической либо медиогастраль-ной зоне. Так, парапилорические предъязвенные состояния имеют несколько вариантов проявления, среди которых может иметь место раздраженный желудок (см. главу 14). Но такое состояние встречается редко, обычно у больных с выраженной клинической картиной и коротким анамнезом (Антонович, 1984, 1987). Более частый вариант предъязвенного состояния — хронический антральный гастрит и хронический гастродуоденит, предшествующие язвообразованию в пилородуоденальной зоне. В ряде случаев бывает эрозивный антральный гастрит и эрозивный дуоденит. Перистальтика обычно глубокая, эвакуация беспорядочная, ускоренная, начинается после кратковременного, а нередко и более длительного начального спазма привратника. Этот вариант предъязвенного состояния также часто сопровождается дуодено-гастральным рефлюксом и дискинезией 12-перстной и верхних петель тощей кишок, недостаточностью кардии, а в ряде случаев — грыжей пищеводного отверстия и рефлюкс-эзофагитом. Он наблюдается у лиц с длительным анамнезом.
Предъязвенное состояние для медио-гастральных язв характеризуется развитием хронического антрального или распространенного гастрита. В желудке имеется значительное, а при распространенном гастрите — большое количество слизи. Тонус желудка нормальный, перистальтика — средними и глубокими волнами. Отмечается антральный
77. Депо контрастного вещества (а) и контурная ниша (б).
стаз. У этих же пациентов выражен дуоденогастральный рефлюкс: у одних тотчас же возникает забрасывание порций бария обратно в желудок, у других прошедшая через привратник бариевая взвесь доходит до 12-перисто-тоще-кишечного изгиба, затем возвращается обратно в желудок. Такие антиперис-тальтические движения повторяются неоднократно, а в тощую кишку содержимое не поступает. Следовательно, дискинезия 12-перстной кишки, дуо-дено-гастральный рефлюкс и стаз в выходном отделе желудка взаимосвязаны. Наблюдается также недостаточность кардии (рефлюкс-эзофагит), грыжа пищеводного отверстия диафрагмы.
При медиогастральной локализации язвенного дефекта диагноз предъязвен-ного состояния также должен быть
клинико-рентгенологическим (Антонович, 1984, 1987).
Стадия язвенного дефекта характеризуется многообразием рентгенологической семиотики, зависящей как от локализации язвы, так и от стадии ее развития. Наряду с морфологическими признаками в желудке имеется множество функциональных изменений верхнего отдела ЖКТ, выявление которых чрезвычайно важно для дифференциальной диагностики и выбора рационального лечения язвенной болезни.
Основной рентгенологический признак язвенного дефекта на контуре желудка — «ниша». Это заполненный контрастным веществом язвенный кратер, выступающий за контур желудка. Длинник ниши перпендикулярен стенке желудка. При расположении язвы на
a в г
78. Формы язвенной «ниши»:
а - коническая; б — цилиндрическая, в — поверхностная — «штрих»; г — гигантская.
передней или задней стенке рентгенологически выявляется контрастное пятно или депо контрастного вещества на фоне рельефа слизистой оболочки желудка. К прямым признакам язвы относятся конвергенция складок слизистой к нише и воспалительный вал вокруг нее, который плавно переходит в неизмененную стенку.
Язвенную нишу не всегда можно обнаружить. Это связано в ряде случаев с небольшими размерами язвы, неглубоким проникновение ее в стенку, выраженностью секреторных изменений и двигательных расстройств. Ниша может не определяться из-за выраженного воспалительного состояния слизистой оболочки, приводящего к ее набуханию и закупорке входа в нишу. Язвенный дефект слизистой иногда бывает замаскирован сгустком слизи или крови, остатками пищи, прикрыт гипертрофированными складками. По данным авторов и нашим наблюдениям, язва желудка приблизительно у 3/4 больных располагается в теле желука и преимущественно на малой кривизне или примыкающих к ней участках передней или задней стенки. По данным Л. М. Портного с соавт. (1978), субкардиальный отдел поражается в 9,8 % случаев. Остальная локализация язв приходится на выходной отдел желудка.
В зависимости от локализации изъязвления и клинических проявлений
некоторые зарубежные авторы, в частности Н. Johnson (1965), выделяют 3 типа язв. Первый тип характеризуется наличием язвы на малой кривизне желудка без изменения его антрального отдела, с низкой секрецией соляной кислоты. Встречается наиболее часто (57 %) и преобладает у лиц с группой крови А. При втором типе язва на малой кривизне сочетается с активной язвой 12-перстной кишки или органическим сужением пилорического канала, секреция может быть повышенной или пониженной, группы крови различны. Прогноз более неблагоприятный, потому что имеется тенденция к стенозированию, кровотечениям, перфорациям. Встречается данный тип в 22 % случаев. Третий тип — это препилорические язвы. Они ведут себя как дуоденальные язвы, характеризуются гиперсекрецией соляной кислоты и преобладают у лиц с группой крови О. Наблюдаются в 20 % всех язв желудка.
В практической деятельности врача-рентгенолога могут встречаться и множественные язвы желудка. Они составляют не более 6 % всех язв желудка и рентгенологически диагностируются редко. Локализуются язвы в основном по малой кривизне, которая при рентгенологическом исследовании представляется неровной и напоминает частокол из-за множества язвенных контурных ниш преимущественно конической формы. Размеры изъязвлений колеблются от 0,3 до 1 см.
Имеют место также сочетанные язвы желудка и 12-перстной кишки. Среди больных язвенной болезнью желудка на долю сочетанных язв приходится около 20 %. Первой возникает чаще язва 12-перстной кишки, лишь через несколько лет к ней присоединяется язва желудка. У 15 % лиц могут быть одновременно обнаружены обе язвы. У большинства же больных активная язва желудка обычно сочетается с рубцовыми измене
ниями 12-перстной кишки. Множественные язвы желудка при сочетанных язвах встречаются в 12—15 %, при изолированной ЯБЖ — в 2 раза реже. При сочетанных язвах желудка и 12-перстной кишки язва желудка располагается наиболее часто в антральном отделе, чем при изолированной форме.
Форма язвенной ниши наиболее часто бывает в виде конуса, овала, цилиндра. Наблюдаются также «крошечная», плоская, неправильная и другие формы язвенных дефектов стенки желудка. П. В. Власов и И. Д. Блинчевский (1982) установили зависимость формы язвенной ниши от размеров. Маленькие язвы диаметром до 5 мм дают небольшое округлой формы контрастное пятнышко («крошечная» язва). Язвы диаметром от 6 до 10 мм, как правило, имеют коническую форму. С увеличением размеров язвы до 20 мм дно ее из конического становится более пологим, закругленным, и тогда форма ниши напоминает овал. При размере 21—30 мм дно ниши плоское и в рентгеновском изображении язва по форме подобна прямоугольнику (цилиндру). Гигантские язвы диаметром более 3 см обычно имеют неправильную форму и неровные контуры, а иногда и неоднородную структуру тени. При доброкачественной язве небольших размеров наблюдается преобладание глубины ее над поперечником. С прогрессированием процесса увеличение поперечника язвы опережает ее рост в глубину до 1,5—2 раз. Следует помнить, что форма и размеры ниши могут меняться в процессе исследования.
Плоские поверхностные изъязвления независимо от формы язвы на контуре в рентгеновском изображении дают линейную тень. Линейные язвы диагностируются на основании следующих критериев: деформации контура, проекции ниши, наличия складок, конвергирующих к определенной линии (крате-
79. Язвы желудка:
а — малая; б — гигантская.
ру), и смазанности границ линии. Чех более выражена деформация, тем более вероятно обнаружение линейной язвь. Ниша при линейной язве не имеет то12 ной геометрической формы и выявляется при дозированной компрессии, краг ее смазанные, нерезкие, очертания неравномерные.
Второй важный морфологически! симптом язвы — окружающий ее иг
80. Схема рентгенологического изображения инфильтративного вала вокруг ниши:
а — язвенная «ниша» на рельефе; б — язвенная «ниша» с широким устьем (в профиль); вокруг язвы вал в виде двух симметричных дефектов наполнения выше и ниже язвенной «ниши»; в — пенетрирующая язва с узким перешейком (края язвы нависают над язвенным кратером); г —та же язва после компрессии (в основании язвенной «ниши» появилась прозрачная полоска вследствие нависания краев язвы).
фильтративный вал. Основу вала составляют три компонента: локальный спазм мускулатуры стенки желудка, воспалительный процесс и склеротические изменения, от выраженности которых, а также от формы язвы и проекционных условий, зависит характер рентгенологического изображения вала. При выведении язвы на контур стенки желудка инфильтративный вал дает два симметричных дефекта наполнения выше и ниже язвы. Дозированная компрессия зоны язвы обеспечивает получение симптома «воротничка» — светлой полоски, отделяющей нишу от полоски желудка. Если язва локализуется на передней или задней стенке, то вокруг нее при соответствующей компрессии можно получить различной степени выраженности светлый ободок.
Третий, морфологически довольно частый признак язвы — конвергенция к ней складок слизистой оболочки желудка, т. е. изменение обычного направления складок, характеризующееся схождением, сближением их к участку изъязвления. Конвергенция складок в начале развития патологического процесса обусловлена сокращением мышц слизистой оболочки в зоне язвенного
процесса, в последующем зависит преимущественно от воспалительной инфильтрации и разрастания соединительной ткани. Конвергирующие к язвенному кратеру складки обычно доходят непосредственно до ниши. В зависимости от этапа заживления язвы или «возраста» язвы конвергенция складок может отсутствовать.
Язвенная болезнь проявляется рентгенологически не только прямыми, морфологическими признаками, но и функциональными изменениями: гиперсекрецией натощак, спастическими сокращениями в различных участках желудка, вызывающими деформацию его, нарушением моторно-эвакуатор-ной функции и другими симптомами. Слизь и жидкость на фоне газового пузыря желудка образуют горизонтальный уровень. О них судят также по медленному смешиванию и характерному оседанию контрастного вещества с образованием бесформенных хлопьев. Наличие жидкого содержимого в желудке наиболее часто наблюдается при язвах выходного отдела желудка, особенно язвах привратника. В некоторых случаях в начале исследования слизь и жидкость в желудке могут отсутство
вать, а в периоде исследования, особенно к концу его, над бариевой взвесью появляется слой жидкости, четко отграниченный сверху газовым пузырем и снизу контрастным веществом.
Спастические сокращения в желудке могут быть временными или постоянными. Весьма характерен симптом указующего перста (симптом де Кервена) — стойкое втяжение большой кривизны желудка, направленное в сторону локализации язвы на малой кривизне. Уровень локализации асимметричного локального спазма, как правило, несколько ниже уровня расположения язвы. Подобного рода втяжения могут возникать в разных отделах желудка и отображают спазм циркулярных или косых мышц. При преобладании спазма циркулярных мышечных волокон направление втяжения обычно перпендикулярно к контуру желудка, а при спазме косорасположенных мышц оно идет под углом к нему. Захваченные во втяжение участки желудка имеют ровные и гладкие контуры, перистальтика и эластичность их сохранены, складки- слизистой оболочки повторяют форму втяжения.
Важными признаками ЯБЖ являются выпрямление и неподвижность на определенном протяжении контура стенки желудка, появление аперисталь-тической зоны, что фиксируется на прицельной серии рентгенограмм. Практика показывает, что выпрямление и неподвижность стенки на ограниченном участке малой кривизны в процессе исследования сменяются небольшими изменчивыми дефектами наполнения, затем в этом месте выявляется и ниша, обычно маленьких размеров.
Косвенным признаком язвы можно считать и ощущение болезненности при пальпации желудка. Если имеется симптом де Кервена и на соответствующем уровне малой кривизны обнаруживается фиксированная болевая точка,
81. Конвергенция складок слизистой к гигантской язве малой кривизны желудка.
такое сочетание симптомов заставляв" врача-рентгенолога думать о язве мало? кривизны желудка. Однако отсутствие болевой точки не исключает язвы. В< время рентгенологического исследования в ряде случаев могут наблюдаться уплощение (ретракция) малой кривизны и образование карманов, ди вертт кулообразных выпячиваний по большой кривизне. Подобные деформации хараь терны для язв выходного отдела желудка. При данной картине для окончательного решения вопроса рентгеноло’
82. Симптом де Кервена при язве:
а — верхней трети малой кривизны; б — нижней трети тола желудка.
должен сделать серию прицельных ренгенограмм этой зоны в различные фазы моторно-эвакуаторной деятельности желудка.
Препилорические язвы часто сопровождаются регионарными спазмами препилорического отдела желудка и развитием его трубкообразного сужения. Спазм в области привратника может быть длительным, что задерживает эвакуацию содержимого из желудка. При язвах субкардиального отдела наблюдается его деформация в виде каскада, иногда очень стойкого и выра
женного. Важными косвенными пр: знаками изъязвления малой кривизнь являются его деформация и укорочение Все эти деформации вначале обусловле ны спастическими сокращениями соответствующих групп мышечных волокон в последующем — преобладанием скле ротических процессов.
Язвенная болезнь может сопровождаться гипертонией и гиперперистальтикой желудка. Перистальтика в таки: случаях обычно живая и глубокая, носи" размашистый характер. Опорожнение желудка от содержимого ускоренное
или нормальное. Замедление эвакуации наблюдается только при локализации язвы в выходном отделе желудка. Один из косвенных признаков ЯБЖ — сопутствующий гастрит.
Для своевременной постановки диагноза ЯБЖ имеет значение наличие всего симптомокомплекса, комбинация всех названных выше признаков. Однако в практической деятельности врачей они не всегда встречаются в своей совокупности, а в ряде случаев рентгенологические симптомы язвы могут вообще отсутствовать. Но это ни в коем случае не должно влиять на диагноз. Первостепенная роль в нем принадлежит клиническим данным.
В зависимости от локализации изъязвлений желудка как клиническая, так и рентгенологическая картина имеют свои особенности. Язвы кардиального отдела желудка в основном небольшие (до 1,5 см), выявить их трудно из-за грубого рельефа слизистой верхнего отдела желудка, частого отсутствия воспалительного вала и конвергенции складок. Распознавание язвы весьма затруднено из-за неровностей контуров малой кривизны в этой зоне, обусловленных складками слизистой оболочки. При спазмах язва вначале может не обнаруживаться. Только спустя некоторое время, к концу исследования язвенную нишу удается контрастировать. При этом большое значение имеет исследование больного в горизонтальном положении и в условиях двойного контрастирования.
Доброкачественные язвы большой кривизны встречаются в 7 —8 % случаев всех ее изъязвлений. В силу анатомофизиологических особенностей данной области рентгенологически установить природу изъязвления иногда трудно. Часто наблюдающаяся зубчатость большой кривизны затрудняет распознавание ниши. Обязательным сопутствующим признаком язвы большой кривизны
должен быть окружающий нишу небольшой воспалительный вал, проявляющийся вогнутостью по обеим ее сторонам. Вал сравнительно плавно переходит в соседние неизмененные участки желудочной стенки. При серийной прицельной рентгенографии в условиях различной дозированной компрессии выявляются изменчивость ниши, а также лучеобразная конвергенция к ней складок слизистой. Если язва хроническая, на ее уровне часто наблюдается поперечная складка, идущая от ниши поперек тела желудка к малой кривизне. Большими диагностическими возможностями обладает пневмогастрография, которая позволяет получить хорошую рентгенологическую информацию. Для доброкачественных изъязвлений характерны: заполнение воздухом выведенного на контур желудка язвенного кратера, отсутствие утолщения стенок язвенного кратера и желудка в окружности изъязвления, сохранение эластичности стенок ниши.
Литературные данные и наши наблюдения свидетельствуют, что ЯБЖ — хроническое рецидивирующее заболевание и ее диагностика должна проводиться с учетом фазы процесса. Между тем диагностические возможности как рентгенологического, так и эндоскопического исследования изучены недостаточно. Важную роль в их уточнении может иметь связанная с фазой заболевания трансформация язвенной ниши. У большинства пациентов ниша диагностируется в фазу обострения процесса. Боль в эпигастральной области отмечалась у 98 % больных, рвота — у 28, диспептические явления — у 69, плохой аппетит и похудание — у 20 %. Именно в фазу обострения при изучении рентгенограмм (87 %) в нише отчетливо выявлялись инфильтративно-воспалительный вал и сопутствующий спазм, которые имеют решающее значение для диагностики язвенного дефекта. В то же
время мы установили, что выраженность этих компонентов в каждом случае могла быть самой различной, а в динамике при повторных исследованиях они были чрезвычайно изменчивыми, что не могло не отразиться на трансформации ниши во время рентгенологического исследования. При минимальной выраженности нишу выявить было трудно, при достаточной — определяется типичный симптом ниши на контуре или на рельефе. Если же эти явления развиты избыточно, они закрывают вход в кратер язвы и симптом ниши отсутствует. В таких случаях важное диагностическое значение принадлежит трансформации рентгенологической картины ниши в процессе противоязвенного лечения (Струнин, 1986).
Клиническое значение трансформации ниши велико, так как она может стать основной причиной не только рентгенологических, но и эндоскопических ошибок, когда выраженный отек слизистой вокруг язвы эндоскопист принимает за опухолевую инфильтрацию стенки желудка или дуоденит с отечным набуханием складок 12-перстной кишки, закрывающих вход в язвенный кратер.
Иногда рентгенодиагностика язвы с такой трансформацией ниши возможна даже при первом исследовании, так как в отличие от эндоскопии этот метод позволяет проводить исследование не только в прямой, но и в боковой проекции. Это касается тех язв луковицы 12-перстной кишки, в кратер которых при исследовании больных в ортоположении через суженный воспалительным валом вход может проникнуть воздух. Рентгенологически это может проявляться симптомом газового пузырька. Однако его часто приходится дифференцировать от газа, проникшего через узкий свищевой ход в приемник ниши при пенетрации язвы. Если пузырек обусловлен наличием трансформа
ции, то в процессе противоязвенного лечения всегда можно наблюдать динамику рентгенологической картины ниши вплоть до полного ее рубцевания.
Следовательно, для рентгенологического исследования фаза обострения ЯБЖ является оптимальной. Учитывая закономерности трансформации рентгенологической картины ниши, укажем, что возможности метода в диагностике язв не уступают таковым при фибро-гастроскопии. Они выше при уточнении осложнений (стеноз, пенетрация), но имеют второстепенное значение в дифференциальной диагностике доброкачественных и злокачественных язв желудка.
Язвенная болезнь в пожилом и старческом возрасте также отличается своеобразием как клинической, так и рентгенологической картины. Следует различать 3 ее вида: старческие язвы, ЯБЖ, впервые возникшую в пожилом и старческом возрасте (поздняя язвенная болезнь), и ЯБЖ, начавшуюся впервые в молодом и среднем возрасте, но продолжающую рецидивировать и в пожилом возрасте (длительно текущие язвы).
По клиническим данным, истинно старческие язвы, как правило, возникают остро на фоне выраженного общего атеросклероза, имеют стертую, часто малосимптомную клиническую картину без склонности к циклическому течению с наиболее частым и грозным осложнением — массивными кровотечениями. ЯБЖ, возникшая у больных в пожилом и старческом возрасте, характеризуется частыми обострениями, нередко непрерывным рецидивирующим течением, без склонности к рубцеванию, развитием часто каллезных язв, малигнизации, пенетрации и (реже) кровотечений. Язвенная болезнь, начавшаяся еще в молодом и среднем возрасте и продолжающаяся многие годы с различной дли
тельности рецидивами и ремиссиями, в пожилом возрасте характеризуется более затяжным течением и более частым развитием перечисленных осложнений, т. е. отражает черты, свойственные клинической картине ЯБЖ.
Впервые возникшие язвы у больных в пожилом возрасте локализуются в основном в средней и верхней трети по малой кривизне или задней стенке желудка. Размер язвы больше, чем у молодых, и колеблется от 2,5 до 4—5 см, нередки гигантские язвы. Как правило, ниша плоская, продольный размер в 2—5 раз превышает ее глубину, контуры язв в ранней фазе развития обычно четкие. Л. И. Ганченко и В. М. Майоров (1976) у 2/3 больных обнаружили вокруг ниши инфильтративный вал и ригидность стенки в зоне изъязвления. У некоторых больных язвы могут сочетаться с обызвествлением левой желудочной артерии.
У больных с поздней язвенной болезнью размеры язв колеблются от 1 до 2—3 см, гигантских язв почти не встречается. В отличие от старческих язв глубина ниши преобладает над ее поперечником, инфильтративный вал выражен. Длительно текущие язвы, развившиеся еще в молодом возрасте, часто характеризуются рубцовой деформацией стенки и в месте локализации язвы и всего желудка. Размеры язв могут быть различными, но гигантских язв не бывает.
Язва желудка у детей чаще наблюдается в возрасте от 7 до 14 лет. Наряду с одиночными возможны множественные язвы разной локализации. Чаще язва локализуется в верхней трети тела желудка. Диагноз обычно устанавливается поздно из-за отсутствия в ряде случаев характерного «язвенного» анамнеза, стертости клинических проявлений, недостаточной настороженности педиатров. У новорожденных и детей грудного возраста язвенный процесс
чаще поражает только слизистую и проявляется кровавой рвотой.
Рентгенологическая семиотика ЯБЖ на различных этапах ее лечения имеет свои особенности и характеризуется рядом довольно типичных изменений. При обратном развитии язва меняет свою форму и величину. Вначале исчезает воспалительный вал, в последующем уменьшается сама ниша с образованием при всех формах и размерах язвы остроконечной воронки или отсутствием ее вообще в конце лечения. В одних случаях процесс заканчивается полным излечением, в других — образованием послеязвенного рубца или деформацией стенок желудка. Так, у 22,3 % больных под влиянием современной противоязвенной терапии полностью исчезает язвенная ниша с отсутствием в последующем рентгенологических признаков послеязвенного рубца или деформации желудка. У 51,3 % больных в результате лечения происходит постепенное уменьшение язвенной ниши с образованием в последующем на месте язвы послеязвенного рубца. У 26,4 % характер заживления язв резко отличается от такового в предыдущих группах. По данным Л. М. Портного с соавт. (1978), у больных с большими язвами (свыше 2 см) при повторном рентгенологическом исследовании через 1 — 1,5 мес. на месте язвы могут выявляться две, а иногда три ниши меньшего размера, в дальнейшем они уменьшаются в размере вплоть до полного исчезновения или исчезновения одной из них с формированием послеязвенного рубца.
Изучение рентгенологической картины ЯБЖ в фазе рубцевания позволило D. W. Celfand, D. S. Ott (1981), Л. М. Портному, В. А. Марченко, Е. В. Кониной (1982) и другим установить несколько признаков, свойственных послеязвенному рубцу. Выделяются следующие типы рубцовых измене-
83. Основные типы послеязвенных рубцов в же-
лудке:
1 — конвергенция складок слизистой оболочки к месту бывшей язвы при ровном контуре желудка; 2 — конвергенция складок слизистой оболочки с центральным углублением или остроконечным вдавлением до 0,4 см; 3 — конвергенция складок слизистой оболочки с неровным, зазубренным контуром на месте бывшей язвы, иногда сочетающимся с 2 — 3 мелкими (0,2 —0,3 см) округлыми дефектами наполнения непосредственно в области рубца; 4 — остаточное углубление на месте бывшей язвы без конвергенции складок слизистой оболочки.
ний в желудке язвенного происхождения, базирующиеся главным образом на оценке состояния контура желудка и рельефа его слизистой в области бывшей язвы.
1. Конвергенция складок слизистой к месту бывшей язвы при ровном контуре желудка.
2. Конвергенция складок слизистой с центральным углублением или вдавливанием остроконечного характера размером до 0,4 см.
3. Конвергенция складок слизистой с неровным, зазубренным контуром на месте бывшей язвы, сочетающимся в ряде случаев с 2—3 мелкими (0,2—0,3 см) округлыми дефектами наполнения непосредственно в области рубца.
4. Остаточное углубление на месте бывшей язвы без конвергенции складок слизистой оболочки.
Анализ литературных данных и наш опыт показывают, что рентгенологическая картина постъязвенного рубца отличается значительным полиморфизмом
и не имеет каких-либо типичных черт. Все описанные признаки ее как в отдельности, так и в совокупности реально могут встретиться и при раке желудка.
В процессе наблюдения за уменьшением язвенной ниши и эволюцией постъязвенного рубца необходимо учитывать ряд важных моментов. Прежде всего мы должны быть уверенными в доброкачественности рентгенологически выявленной язвы желудка. При этом нельзя забывать, что доброкачественная язва желудка может перерождаться в рак. Под влиянием противоязвенной терапии, как известно, могут рубцеваться язвы желудка и раковой природы. В то же время рак может возникнуть в дне и краях уже рубцующейся язвы желудка. Определенный интерес представляет и вопрос о развитии рака в зоне рубца после заживления язвы желудка.
Таким образом, диагностика постъязвенного рубца — это комплексная рентгенологическая и эндоскопическая проблема. Однако фиброгастроскопия необходима еще и потому, что при полном исчезновении язвенной ниши и рентгенологически выявленной постъязвенной деформации бывает трудно исключить наличие еще «открытой» язвы и утвердительно высказаться в пользу уже окончательно сформированного постъязвенного рубца.
В практике врача-рентгенолога довольно часто встречается и каллезная язва. Обычно она небольших размеров с твердыми, омозолелыми и возвышенными краями, чаще неправильной формы, окружающий ее вал неравномерный, конвергирующие складки не переходят в вал язвы, а продолжаются до ее края, причем отдельные складки у края язвы колбовидно утолщены. Ниша и вал не меняют своей формы и размеров, в процессе наблюдения остаются ригидными. Как правило, имеется перигастрит, а
пальпаторно — неподвижность и неизменяемость формы язвы.
Необходимо помнить, что не всякая обнаруженная ниша является симптомом ЯБЖ, например, развитие язв, связанных со стрессовыми ситуациями, приемом лекарственных веществ и др. Врачам известны язвы Кушинга, возникающие при повреждениях и заболеваниях ЦНС, язвы Курлинга, развивающиеся у ожоговых больных, солитарные изъязвления Дьелафуа, линейные эрозии — трещины при синдроме Маллори — Вейсса, диафрагмальных грыжах и других заболеваниях. В подобных ситуациях помогают анамнез, клинические данные и, конечно, фиброгастро-скопия.
Осложнения ЯБЖ могут наблюдаться в любом периоде развития язвы. Одни возникают внезапно и угрожают жизни больного, другие развиваются постепенно. Наиболее часто бывают перигастриты с образованием спаек между желудком и поджелудочной железой, печенью, реже с желчным пузырем и ободочной кишкой. Это вызывает деформации желудка и нарушение его функции. Под влиянием современной противоязвенной терапии характер послеязвенных деформаций желудка значительно изменился. Сейчас почти не встречаются кисето- и улиткообразные формы деформации его, а преобладают формы с умеренным укорочением малой кривизны без подтягивания выходного отдела желудка к его телу и с сужением антрального отдела. Деформации желудка по типу «улитки» или «кисета» могут наблюдаться только у пациентов с длительно текущей и периодически рецидивирующей ЯБЖ.
Стеноз привратника (пилоростеноз) развивается у больных ЯБЖ с язвой, локализующейся в области привратника. Основные признаки пилоростеноза: указания на наличие ЯБЖ, повторяю
щихся рвот, начинающихся, как правило, после обильной еды, чувство тяжести в эпигастральной области, нередко тошноты.
Пилоростеноз может быть компенсированным, субкомпенсированным и де-компенсированцым. При компенсированном пилоростенозе изредка возникают рвоты.после обильной еды и питья. Компенсированный стеноз характеризуется усиленной сегментирующей перистальтикой, чередующейся со снижением тонуса и умеренным расширением желудка. Отчетливо выражены минутные периодические колебания тонуса. Продолжительность фаз покоя превышает продолжительность периодов двигательной активности. Эвакуация замедлена. Субкомпенсированный стеноз привратника всегда сопровождается рвотой после приема пищи, задержкой пищи в желудке на 12 ч и более. Здесь уже наблюдается снижение массы тела на 5—10 % из-за нарушения питания. При рентгенологическом исследовании определяются снижение тонуса желудка, наличие натощак жидкости и пищевых масс. Перистальтика вначале оживленная, но скоро затухает, истощается, периоды кратковременной двигательной активности чередуются с продолжительными паузами покоя длительностью до 5 мин. Контрастное вещество задерживается в желудке на сутки.
Декомпенсированный стеноз привратника проявляется резким нарушением водного и электролитного обмена, что может приводить к гипохлоремической коме. Больные отказываются от приема пищи и быстро худеют. Ренгенологиче-ское исследование выявляет больших размеров желудок, который имеет вид растянутого мешка со слабой, а в ряде случаев отсутствующей перистальтикой. При наличии перистальтики паузы покоя длятся до 5—10 мин. Контрастная масса в желудке задерживается на мно-
го суток, оседает в виде серпа или чаши на дне синуса.
В диагностике стеноза ведущая роль принадлежит рентгенологическому исследованию, однако его возможности, особенно на ранних этапах, используются недостаточно. Выраженное сужение и деформация пилородуоденального канала затрудняют проведение эндоскопии. Большинство больных со стенозом оперируют в осложненных стадиях, в то время как формирующийся компенсированный стеноз уже является показанием к хирургическому лечению. Повысить эффективность рентгенологического исследования при стенозах можно рациональным использованием комплекса его методик.
Рентгенологическое изучение стеноза должно включать полипозиционно-по-липроекционное исследование с использованием двойного контрастирования и дифференцированным применением фармакологических препаратов холинолитического и холиномиметического действия (атропина, аэрона, метацина, морфина и др.).
Независимо от стадии стеноза обязательно исследование больных в горизонтальном положении во второй боковой, а затем в первой косой проекциях. Это способствует контрастированию пилородуоденальной области, выявлению сужения на фоне тугого заполнения и двойного контрастирования, определению точной локализации и размеров
84. Возможные деформации желудка у больных язвенной болезнью по типу:
а, б — «улитки»; в, г — «песочных часов»; д — «кисета».
сужения, заполнению бариевой взвесью или газом язвенной полости.
Данные литературы и наш опыт свидетельствуют, что применение в ходе рентгенологического исследования препаратов холиномиметического действия, повышающих тонус и усиливающих перистальтику желудка, способствует установлению стеноза и его причины. Наши исследования показали, что введение этих препаратов на фоне медикаментозной гипотонии оказывает выраженное стимулирующее влияние на моторную функцию желудка. Гипотония сменяется повышением тонуса и ускорением эвакуации. Сочетанное применение препаратов холинолитического и холиномиметического действия позволяет сократить время рентгенологического исследования, уточнить стадию стеноза и оценить сократительную способность стенки желудка, что служит важным критерием в выборе метода операции.
Диагностика стеноза выходного отдела желудка должна основываться не только на задержке эвакуации бариевой взвеси из желудка, но и на других симптомах. Так, рубцово-язвенный стеноз сопровождается значительным расширением желудка, привратник асимметрично сужен, не удлинен, малая кривизна желудка укорочена, по большой кривизне имеется карманоподобное выпячивание. Рельеф слизистой желудка сохранен, часто отмечаются утолщение и извитость складок, иногда ниша. Луковица 12-перстной кишки не изменена, иногда определяется умеренная вогнутость ее основания, которое может нависать над привратником.
Кровотечение является частым тяжелым осложнением язвенной болезни и наблюдается в основном при язвах, локализующихся вдоль малой кривизны желудка. Источником его могут быть как острые, так и хронические язвы, на долю последних приходится 80—
90 % случаев язв. Рентгенологические признаки кровоточащей язвы лучше всего выявляются в условиях двойного контрастирования, включающего прием бариевой взвеси и 400 см3 воздуха. Сгусток крови у основания язвы или над кровоточащим участком определяется в виде дефекта язвенного кратера. Артерия в основании язвы дает симптом небольшого круглого дефекта наполнения. К признакам активного кровотечения относятся нарушение продвижения бариевой взвеси в желудке, дефект наполнения и неконтрастирования слизистой оболочки в зоне кровотечения. Большими диагностическими возможностями обладает методика селективной (чревной или верхней брыжеечной) ангиографии.
Результаты ангиографического исследования, проведенного нами, показывают, что 85 % кровотечений бывают из бассейна левой желудочной артерии, 5 — из коротких артерий желудка, 5 — из правой желудочной артерии, 3% —из желудочно-сальниковой артерии и по 1 % — из гастродуоденальной и нижней диафрагмальной артерий. Из 85 % больных, у которых кровоточащая зона снабжалась левой желудочной артерией, источником кровотечения у 52 % лиц послужила нисходящая ветвь этой артерии, у 32 % — восходящая ветвь и у 16 % — кардиально-пищеводная ветвь. Зона кровотечения располагалась в кардиоэзофагеальной области в 10 % наблюдений, в области свода и проксимальных 2/3 тела желудка — в 81, в дистальной трети тела и антральном отделе желудка — в 8 %. Совпадение данных гастроскопии и ангиографии (Kelemouridis, Athanasoulis, Waltman, 1983) отмечается в 83 %, если гастроскопия позволяет видеть точку кровотечения, и в 72 %, если ее не удается обнаружить.
Пенетрация язвы — осложнение ЯБЖ в виде распространения инфиль-
тративно-деструктивного процесса из желудка или 12-перстной кишки в толщу соседнего органа — печени, поджелудочной железы, сальника. Пенет-рация язвы наблюдается в 6—10,7 % случаев. При расположении на малой кривизне язва может проникнуть в желудочно-печеночную связку, затем — в печень, поджелудочную железу или переднюю брюшную стенку. Для пене-трирующей язвы типичны: глубокая ниша, выступающая далеко за контур желудка и имеющая подрытые контуры, стенка желудка нависает над язвенным кратером, поперечник входа меньше поперечника самого язвенного кратера, воспалительный вал хорошо выражен. При исследовании больного в вертикальном положении, вследствие задержки жидкости и воздуха в нише, пене-трирующая язва дает известные симптомы двух- или, чаще, трехслойности: нижний слой образован барием, средний — жидкостью, верхний — газом. Пальпаторно определяется неподвижность этой картины, а после опорожнения желудка — сохранение остатков контрастной массы рядом с тенью желудка.
Одно из частных осложнений пилорической язвы — пенитрация в соседние органы, распознать которую в ряде случаев весьма сложно. Для иллюстрации приводим одно из наших наблюдений.
Вольной С., 24 лет, поступил в Минскую областную клиническую больницу в связи с обострением и тяжелым течением язвенной болезни. Из анамнеза: болен около 13 лет, в течение которых ему производилось дважды ушивание язвы желудка и язвы 12-перстной кишки в связи с прободением. Периодически длительно лечился амбулаторно и в стационаре, но улучшения не наступало. При поступлении: жалобы па выраженные боли в эпигастрии, больше справа, с иррадиацией в спину и грудную клетку, особенно в ночное время, тошноту, изредка рвоту. Для облегчения состояния больной часто вызывал рвоту сам. Объективно: рост 180 см, масса 76,5 кг. При пальпации живот мягкий, отмечается уме
ренная болезненность в эпигастрии, больше справа, симптомов раздражения брюшины нет, печень и селезенка не увеличены. Данные гематологического исследования: эр. 4,0 X Ю12/л, Нв 132 г/л, цвет. пок. 0,9 л 7,1 X 10®/л, с. 0,56, эоз. 0,02, мои. 0,10, лимф. 0,32, СОЯ 45 мм. Биохимическое исследование крови: общий белок 82,8 г/л, мочевина 4,99 ммоль/л, глюкоза 4,05 ммоль/л, билирубин общий 9,23 мкмоль/л, натрий 140 ммоль/л, кальций 2,25 ммоль/л, калий 4,3 ммоль/л, хлор 90 ммоль/л, хлориды 148,52 ммоль/л, протромбиновый индекс 0,6 р СО2 4,5 кПа, BE крови + + 2,4 ммоль/л, кислотно-основное состояние: pH крови 7,4, ВВ 50 ммоль/л, АВ 27,4 ммоль/л, 13 плазмы 26,4 ммоль/л, АВ плазмы 27,4 ммоль/л. Анализ мочи: цвет желтый, реакция кислая, плотность 1022, белок — следы, сахар не определяется.
Данные фиброгастросконии: в желудке содержится большое количество светлой жидкости, слизистая гиперемирована, отечная, в подслизистом слое кровоизлияния до 0,2—0,3 см в диаметре. Пилорический канал расположен эксцентрично. Луковица 12-перстпой кишки деформирована, уменьшена в объеме, слизистая ее гиперемирова-па. Заключение: геморрагический гастрит, рубцовая деформация луковицы 12-перстпой кишки на почве язвенной болезни. .
Результаты рентгенологического исследования: желудок увеличен в размере с большим количеством жидкого содержимого натощак, выходной отдел его сужен и деформирован, подтянут к малой кривизне, пилорический канал сужен, проходимость бариевой взвеси затруднена. Контуры стенок желудка ровные, нишевых образований не обнаружено. Перистальтика желудка вначале оживлена, но скоро затухает, истощается. Периоды кратковременной двигательной активности чередуются с продолжительными паузами покоя. Учитывая наличие сужения привратника и плохое контрастирование луковицы, решено провести исследование в условиях медикаментозной релаксации, вызванной приемом под язык двух таблеток аэрона. Под влиянием релаксанта привратник умеренно расширился и контрастное вещество заполнило большую полость («нишу») округлой формы, размером 4 X 4,5 см, расположенную вверху и сзади от луковицы 12-перстной кишки. Полость сообщалась с просветом пилорического канала посредством шейки шириной около 1 см и длиной 1,5 см.
При вертикальном положении четко определялась трехслойность «яиши». Луковица 12-перстной кишки в размере не увеличилась, осталась деформированной. В остальных отделах 12-перстпой кишки морфологических изменений не обнаружено. Заключение: гигантская пенетри-рующая язва пилорического отдела желудка, суб-компенсированный стеноз привратника.
85. Гигантская язва пилорического канала с пенетрацией в печень: а — вертикальное; б — горизонтальное положение больного.
Во время хирургического вмешательства больному произведена резекция 2/з желудка по Биль-рот-П с гастроэнтероанастомозом на короткой петле позади ободочной кишки. Во время операции установлено: желудок больших размеров, пилорический отдел его припаян к нижней поверхности печени и гепатодуоденальной связке. Пальпаторно в печени выявлялись кратер язвы, резкая деформация луковицы и стеноз привратника. При отделении пилорического канала от печени обнаружено дно пенетрирующей язвы диаметром около 3 см и глубиной 1,5 см. Макроскопически: протяженность удаленной части желудка по большой кривизне — 25 см, по малой кривизне — 12 см; серозная оболочка бледно-розового цвета, складчатая. Дистальный край препарата утолщен до 2 см, плотный, периметр его 1,5 см. Микроскопически: хроническая язва пилорического отдела желудка с признаками обострения, выраженный фиброз подслизистого и мышечного слоев.
Послеоперационное состояние больного было обычным. При удовлетворительном общем состоянии и хороших гематологических показателях че
рез месяц после операции он был выписан домой.
Таким образом, пенетрирующая язва пилорического отдела желудка у данного больного была диагностирована рентгенологически в условиях медикаментозной релаксации, в то время как обычное рентгенологическое исследование и фиброгастроскопия оказались малоинформативными. Интенсивный и длительный спазм мощной мускулатуры привратника препятствовал заполнению язвенной «ниши» контрастным веществом.
Перфорация, или прободение язвы, характеризуется разрушением стенки органа на всю ее толщу с образованием канала, сообщающего полость или просвет пораженного органа с соседней брюшной полостью. Прободение язвы желудка в числе многих острых заболеваний органов брюшной полости занимает не последнее место. Ошибочная
диагностика язвенной перфорации в крупных хирургических клиниках наблюдается в 8—22 % случаев. Рентгенологический метод диагностики является ведущим. Исследование больного с подозрением на прободную язву желудка начинают с обзорной рентгеноскопии и рентгенографии грудной клетки и брюшной полости для выявления симптомов прободения, главным образом свободного газа в брюшной полости. Поступивший в брюшную полость газ всегда стремится занять самое высокое положение, на чем и основано проведение исследования в разных положениях. При вертикальном исследовании больного газ собирается под диафрагмой в виде серповидной полоски, при горизонтальном положении — накапливается между печенью и передней брюшной стенкой, при латерографии на левом боку — между боковой поверхностью печени и брюшной стенкой. Наличие газа под куполом диафрагмы сопровождается и более высоким его стоянием с ограничением подвижности диафрагмы.
Однако симптом пневмоперитонеума обнаруживается лишь в 47—75 %слу-чаев из-за трудности выявления небольшого количества свободного газа в брюшной полости, закупорки перфорационного отверстия содержимым желудка или прикрытия его каким-либо органом.
В диагностике прободной язвы желудка придается значение и второму симптому — свободной жидкости в брюшной полости, которая скапливается в ее нижних отделах и дает гомогенное затемнение их с горизонтальной верхней границей. Свободная жидкость при прободении язвы наиболее часто располагается в подпеченочном пространстве, вокруг желудка в правом латеральном канале. Обнаружение ее в брюшной полости, а также наличие широкого горизонтального уровня жидкости в желудке позволяют, не
смотря на отсутствие свободного газа в брюшной полости, заподозрить прободение язвы (Щербатенко и соавт., 1980).
Если свободный газ и свободная жидкость в брюшной полости не обнаружены, а клинические данные не позволяют исключить наличие прободной язвы, то по согласованию с хирургом применяют специальные методики исследования: пневмо гастро графию, исследование желудка с водорастворимыми контрастными веществами и методику двойного контрастирования при различных положениях больного.
Пневмогастрография дает возможность исключить или подтвердить прободение язвы желудка. Через введенный зонд с помощью шприца Жане по возможности максимально удаляют содержимое желудка и вводят в него до 600 см3 углекислого газа или закиси азота. Больной в течение 3—5 мин должен находиться в положении Тренделенбур-га, затем его переводят в горизонтальное положение, укладывают на левый бок и производят снимок в латеропози-ции. Если на рентгенограмме виден газ в правом боковом канале живота, исследование прекращают и больного доставляют в операционную. Если симптомов газа нет, снимок производят в вертикальном положении. Появление свободного газа под диафрагмой вблизи желудка — прямой достоверный признак прободения стенки желудка. При отсутствии прободения введенный в желудок газ сравнительно быстро переходит в петли тонкой кишки (Каган, Милославский, 1971).
Одним из существенных недостатков методики пневмогастрографии (Щербатенко, Береснева, 1977) является невозможность установить характер и локализацию патологического процесса, осложнившегося прободением. Для этих целей используется контрастирование желудка водорастворимыми контрастными веществами. При прободной язве
желудка контрастное вещество распространяется за пределы его и скапливается в основном в области малой кривизны на уровне перфорации. Если размеры перфорационного отверстия небольшие, отмечается минимальное вы-хождение контрастного вещества в виде небольшого «усика». Значительными диагностическими возможностями обладает методика двойного контрастирования, когда к 40—60 мл водорастворимого контрастного вещества добавляют 400—600 см3 газа, которые позволяют установить не только локализацию, но и причину перфорации.
Раковое перерождение язвы наблюдается в 0,4—12 % случаев, причем большинство авторов оценивают вероятность малигнизации язвы в 0,4—1,4 % случаев. Такое расхождение показателей частоты малигнизации объясняется отсутствием абсолютно надежных и достоверных не только клинических, но и патологоанатомических признаков. Чаще всего озлокачествляются язвы выходного отдела желудка и реже язвы малой кривизны.
Перерождение язвы в рак сопровождается изменением клинической картины: исчезает периодичность и цикличность течения заболевания, боли становятся менее интенсивными и принимают постоянный характер, не зависят от приема пищи, резко снижается аппетит, нарастает похудание, уменьшается болезненность при пальпации, развивается ахлоргидрия.
По данным Б. Е. Петерсона с соавт. (1979), злокачественное превращение язвы наступает чаще всего в одном из ее краев, реже рост опухоли начинается в области дна или в глубине, под краем язвы. Известно, что рентгенологическими критериями доброкачественной язвы являются гладкий симметричный вал слизистой вокруг нее, нормальный рельеф слизистой вокруг язвы, гладкий округлый или овальный кратер
язвы желудка. При озлокачествлении язвы отмечают появление нодулярного деформированного рельефа слизистой вокруг язвы, ампутации складок, кратер язвы асимметричный с окружением ее валом неправильной формы (Thompson, Somers, Stevenson, 1983).
Однако, по нашему мнению, совпадающему с мнением многих исследоватетей, подобная картина может наблюдаться не только при озлокачествлении язвы, но и при изъязвленном раке и даже иногда при хронической язве. Диагностика таких изъязвлений желудка должна быть комплексной. Рентгенологическое исследование дает возможность выявить изъязвление, а эндоскопия с прицельной биопсией краев и дна язвы — определить его доброкачественный и злокачественный характер. Окончательно вопрос решается с помощью гистологического исследования удаленного препарата, которое устанавливает, имеет ли место озлокачествившаяся язва либо первично-язвенный рак (Власов, Блин-чевский, 1982; Виннер и соавт., 1983).
Флегмона желудка. Острое, четко не отграниченное гнойное воспаление желудочной стенки с преимущественным поражением подслизистого слоя. Заболевание встречается преимущественно у мужчин в возрасте 40—60 лет. У детей бывает чрезвычайно редко.
Различают первичную и вторичную формы заболевания, которые могут протекать остро, подостро и хронически. По распространенности воспалительный процесс может быть ограниченным, а может поражать весь желудок. Считают, что первичная флегмона желудка в 75 % случаев вызывается стрептококковой инфекцией, а в 25 % возбудителями являются стафилококк, кишечная палочка, пневмококк и анаэробные микробы. Заболевание развивается в результате механического повреждения слизистой оболочки желудка инородными телами, при хирургических вмешатель
ствах и т. д. Возникновение вторичной флегмоны бывает связано с гастритом, язвой или раком желудка. В редких случаях флегмона желудка является осложнением сепсиса, брюшного тифа, фурункула. Большое значение в возникновении флегмоны желудка имеют сенсибилизирующие моменты, т. е. перенесенные накануне инфекционные заболевания. Инфекционно-аллергический характер заболевания подтвержден экспериментальными исследованиями С. И. Минкова (1972).
По мнению А. А. Пономарева, А. А. Курыгина (1987), флегмона желудка — самое тяжелое воспалительное заболевание этого органа. Вначале воспалительный процесс захватывает подслизистый слой, где наличие рыхлой соединительной ткани способствует распространению гноя. Стенка утолщена, отечна, на разрезе представляется студнеобразной, желто-зеленого цвета. При наличии ограниченных абсцессов в стенке желудка обнаруживаются опухолевидные образования. Иногда имеется множество субсерозных гнойничков и точечных кровоизлияний. Нередко воспалительный процесс выходит за пределы органа, распространяясь на пищевод и 12-перстную кишку. В отдельных случаях в печени, селезенке и поджелудочной железе находят метастатические гнойники и дистрофические изменения.
Диагностика флегмоны желудка трудна, и до операции обычно ставится диагноз панкреатита, перфоративной язвы, пищевой токсикоинфекции и др. Правильный дооперационный диагноз бывает очень редко — у 25 % больных, потому что симптоматика флегмоны желудка весьма разнообразна и зависит от формы заболевания.
Клинически острая первичная флегмона характеризуется болями в животе, рвотой и высокой температурой тела. Боли локализуются в подложечной об
ласти, они сильные, режущие или схваткообразные, и доводят больных до физического и душевного изнеможения. Характерным симптомом считается усиление болей в животе в горизонтальном положении больного и уменьшение — в вертикальном. Рвота бывает многократной, болезненной и мучительной. Высокая температура тела и озноб появляются почти вместе с болями в животе. Постоянные симптомы заболевания — отрыжка, жажда, слюнотечение и зловонный запах изо рта. К 3-му дню заболевания обычно развиваются тяжелые общие расстройства гнойно-токсического типа, дыхание становится поверхностным, АД снижается, нарастают метеоризм и напряжение передне^ брюшной стенки. В эпигастральной области иногда удается прощупать тестоватой консистенции опухолевидное образование (Пономарев, Курыгин, 1987).
При острой вторичной флегмоне желудка первоначально в клинической картине преобладают общие симптомы: высокая температура тела, озноб, головная боль, многократная рвота. В дальнейшем присоединяются боли в животе. К рентгенологическому исследованию прибегают редко, однако, если позволяет состояние больного, в ряде случаев оно может иметь решающее диагностическое значение. Утолщенная в результате флегмонозного воспаления желудочная стенка утрачивает эластичность, воспалительный инфильтрат подслизистой оболочки выпячивается подобно опухоли в просвет желудка, создавая дефект наполнения. Если консервативная терапия успешна, эти изменения быстро исчезают. При гастроскопии в желудке обнаруживаются гнойная жидкость и гипертрофические изменения в слизистой оболочке.
Разновидностью выраженной острой флегмоны может быть анаэробный (газовый, или эмфизематозный) гастрит.
Рентгенологически определяют небольшие газовые пузырьки в стенке желудка, чаще в области газового пузыря, не меняющие своего положения при изменении позиции больного. Толщина стенки желудка заметно увеличена, слизистая оболочка под давлением газа выпячивается в просвет органа в виде отдельных пузырей. При хронической флегмоне обнаруживают отечные и обрывистые складки с отсутствием перистальтики, дефекты наполнения соответственно пораженному участку (единичные и множественные), расширение желудка, сужение выходного отдела с нарушением эвакуации из желудка.
Вторичные флегмоны желудка характеризуются подострым течением. Основные клинические признаки заболевания остаются такими же, как и при первичной флегмоне, но развиваются медленнее, с преобладанием вначале местных симптомов. В эпигастральной области часто можно прощупать болезненное опухолевидное образование. В результате снижения вирулентности микроорганизмов под влиянием лечения антибиотиками процесс может принять хроническое течение. Больные жалуются на ноющие боли в области желудка, тошноту, плохой аппетит. В период обострения заболевания повышается температура тела. При рентгенологическом исследовании складки слизистой желудка прослеживаются на всем протяжении, перистальтика сохранена. Пилорическая часть желудка поражается наиболее часто, и в этом месте может развиться сужение просвета его, похожее на рак.
При флегмоне желудка наблюдается ряд осложнений, и наиболее ранним из них является перитонит. Он развивается на 3—4-е сутки от начала заболевания в результате гнойного пропитывания всех слоев желудочной стенки или прорыва в брюшную полость абсцесса. При прорыве абсцесса в просвет желуд
ка возможно самоизлечение. В литературе описаны такие осложнения острой флегмоны желудка, как острое расширение его, перфорация, массивное кровотечение, гангрена.
Сифилис желудка. Сифилитическое поражение желудка наблюдается в раннем и позднем периодах этой болезни и отличается большим многообразием. Частота его колеблется от 0,25 до 1,4 %. Заболевание встречается в любом возрасте, причем у мужчин сифилис желудка распознается в 2—4 раза чаще, чем у женщин. Обычно развивается на фоне сифилитического поражения других органов. При ранней стадии сифилиса имеют место функциональные расстройства желудка и только потом появляются органические изменения. Чаще всего поражается антральный отдел желудка (75%), реже — тело (20%), очень редко — кардиальная часть (3%) и весь желудок (2%).
Клиническая картина заболевания неспецифична и может проявляться симптомами желудочного дискомфорта. Больные жалуются на боли в эпигастральной области, тошноту, рвоту, потерю аппетита, слабость. Иногда боли в желудке возникают натощак и уменьшаются после еды. Наиболее характерными считаются резкие и кратковременные боли, усиливающиеся по ночам. Следует учитывать, что желудочный дискомфорт у больных сифилисом обусловлен непосредственным поражением не только желудка, но и нервной системы и позвоночника. Рвота наблюдается нередко в ранней стадии болезни, когда речь еще идет о функциональном поражении желудка. Поэтому немотивированная рвота должна обратить на себя внимание и заставить врача тщательно исследовать больных в отношении сифилиса. Позднее при грубых деформациях желудка рвота приобретает обильный и мучительный характер, а в рвотных массах видны остатки при
нятой накануне пищи. Частая рвота, повторяющаяся иногда до 10 раз в сутки, приводит больных к резкой слабости и исхуданию. Нередко бывает рвота свежей кровью или в виде «кофейной гущи», что является результатом геморрагического сифилитического диатеза или изъязвления гуммы (Шапошников, 1980).
Учитывая отсутствие специфичности в симптоматике сифилиса желудка, при обследовании больных особое внимание, по мнению А. А. Пономарева и др. (1987), следует уделять осмотру кожных покровов и слизистых оболочек. Изменения в желудке нередко возникают одновременно с поражением слизистых оболочек полости рта в виде папулезных высыпаний, гиперемии зева. На коже туловища и конечностей может отсутствовать характерная сыпь, а вокруг заднего прохода часто обнаруживаются папулезно-кондиломатозные мокнущие элементы. Можно обнаружить следы твердого шанкра и увеличенные регионарные лимфатические узлы, а также мелкоочаговое выпадение волос на голове.
При поздних сифилитических висце-ропатиях объективные симптомы со стороны живота довольно разнообразны. Пальпацией можно обнаружить опухоль в эпигастральной области, плотную и бугристую печень, увеличенную селезенку. Сифилитические поражения желудка могут возникнуть в любой стадии заболевания. Чаще всего с момента появления первичного сифилиса до поражения желудка проходит от 10 мес. до 15 лет и более. Обращает внимание относительно острое развитие диспепсии и болевого синдрома у больных, у которых раньше жалоб со стороны ЖКТ не наблюдалось. Сифилис может присоединиться к ранее существовавшему заболеванию желудка, в этом случае он ухудшает течение предшествовавшего заболевания.
Рентгенодиагностика сифилиса желудка трудная и зависит от формы заболевания. С практической точки зрения следует различать инфильтративную, язвенную и опухолевидную формы заболевания. Инфильтративная форма чаще всего проявляется воронкообразной деформацией желудка с сужением антрального отдела из-за разрастания соединительной ткани в нем. В некоторых случаях желудок поражается сифилисом диффузно, что приводит к трубкообразной деформации его и микрогастрии. Одной из форм рубцового перерождения желудка является доброкачественный линит. При рентгенологическом исследовании находят малый желудок, зияние привратника, ригидность стенки и отсутствие перистальтики.
Язвенная форма поражения — следствие изъязвления гуммы и рентгенологически представляется в виде дефекта наполнения с изъязвлением. Размер язвы может быть от 1 до 10 — 15 см. Сифилитическая язва неглубокая, не имеет типичных для пептической язвы террасовидных уступов, дно ее лежит в одной плоскости с краями язвы. Язвы могут быть одиночными и множественными, располагающимися на передней или задней стенках в выходном отделе и своде желудка.
При опухолевидной форме сифилиса в желудке развиваются гуммы, которые по внешнему виду напоминают новообразования, дающие дефект наполнения или проявляющиеся дополнительной тенью с ровными и четкими контурами. Гумма желудка локализуется преимущественно в выходном его отделе, имеет гладкую поверхность и плотную консистенцию. Размеры ее могут быть от нескольких миллиметров до 10 см и более. Одиночные гуммы, как и гуммозные инфильтраты, рентгенологически трудно отличимы от злокачественных новообразований. Под-
86. Рентгенологическая картина желудка при сифилитическом его поражении (варианты а, б).
тверждают диагноз данные гистологического исследования.
Таким образом, в диагностике сифилиса желудка большое значение имеет рентгенологический метод. Однако на разных стадиях болезни рентгенологическая картина может быть полиморфной, так как в желудке одновременно наблюдаются процессы пролиферации, изъязвления и соединительнотканного уплотнения. Но существуют признаки, которые позволяют заподозрить сифилис. Среди них следует назвать уменьшение размеров желудка при быстрой эвакуации содержимого, вторичное расширение пищевода или начальной части 12-перстной кишки. Желудок приобре
тает форму трубки, песочных часов или фляжки. Отмечается резкое отграничение пораженной части его от здоровой Характерны множественные стенозь. появление симптома ниши в места?; не свойственных пептическим язвам Более 80 % больных висцеральным ш-филисом не знают о своем заболевании У них же в 65 % случаев стандартные серологические реакции крови оказь ваются отрицательными. Это свидетелг ствует о снижении иммунологической реактивности организма и заставляв" применять более совершенные серологг ческйе исследования — иммобилизации бледных трепонем и иммунофлюоресценцию. В то же время положительные
серологические реакции не являются еще доказательством поражения сифилисом желудка, так как больные сифилисом могут одновременно болеть гастритом, язвой несифилитического происхождения (Пономарев и др., 1987).
По нашему мнению, в пользу сифилиса свидетельствуют молодой возраст, ахлоргидрия, длительное течение болезни и сравнительно хорошее общее состояние больного, положительные серологические реакции и эффективность специфической терапии.
Туберкулез желудка. Заболевание редкое. Возникает, как правило, вторично на фоне туберкулезного поражения других органов. Встречается в 2—3 раза чаще у мужчин, чем у женщин, главным образом в возрасте до 30 лет. Довольно часто болеют дети и юноши.
Все формы туберкулеза желудка делятся на 2 основные группы: туберкулез желудка и сопутствующий туберкулез желудка, последний в свою очередь разделяется на эрозивно-язвенный, милиарный и инфильтративный. Изолированная форма заболевания разделяется на язвенную, гипертрофически-тумо-розную, рубцово-стенозирующую, смешанную, комбинированную и диффузно-склеротическую. Наиболее часто встречается гипертрофически-тумороз-ная форма (42,3 %), реже — рубцово-стенозирующая (34 %) и еще реже — язвенная (15,7 %) и смешанная форма (8 %).
Различают 4 пути поражения желудка туберкулезом: гематогенный, лимфогенный, вследствие заглатывания инфицированной мокроты и непосредственный переход с других органов. Наиболее распространен лимфогенный путь поражения желудка. В пользу такой точки зрения говорит то обстоятельство, что излюбленным местом поражения являются препилорический и пилорический отделы желудка, богатые лимфоидной
тканью. Известно также, что при изолированной форме туберкулеза желудка почти всегда поражены лимфатические узлы брюшной полости, бронхиальные и периферические. В таких случаях правильнее говорить не о первичном туберкулезе желудка, а о хроническом течении первичного туберкулеза, на фоне которого поражение желудка служит одним из его проявлений. Отсутствие у этих больных клинико-рентгенологической симптоматики поражения легких не исключает хронического течения туберкулеза с локализацией в лимфатических узлах, по ходу которого в патологический процесс последовательно может вовлекаться и желудок. В ряде случаев туберкулезному процессу в желудке способствуют хронический кардиоспазм, гастрит, язва (Пономарев и др., 1987).
Клинические признаки туберкулеза желудка можно разделить на 3 периода: бессимптомный или малосимптомный, период ярких клинических проявлений и, наконец, период осложнений, среди которых ведущие — стеноз привратника, перфорация органа, кровотечение и образование свищей. Длительность заболевания колеблется от нескольких месяцев до нескольких лет. В период клинических проявлений больные обычно жалуются на общую слабость, потерю аппетита, похудание. Позднее возникают боли в эпигастральной области. При сужении привратниковой части желудка присоединяются частые рвоты, больные истощаются. Нередко имеет место частый жидкий стул, реже бывают запоры. Кислотность желудочного сока снижена, в нем много лейкоцитов, точнее лимфоцитов, СОЭ увеличена. В желудочном содержимом и в кале обнаруживают туберкулезные бактерии.
Рентгенологическая картина зависит от характера и степени инфильтрации стенки, наличия язвы, фиброза, пора
жения лимфатических узлов и др. Ги-пертрофически-туморозная форма туберкулеза желудка характеризуется наличием плотной, с четкими границами опухоли. Рентгенологически определяются бугристый или узловатый рельеф слизистой и дефект наполнения, который напоминает таковой при экзофитной форме рака. Иногда обнаруживают циркулярное сужение пораженного участка желудка и 12-перстной кишки, однако перистальтика сохраняется. При диффузно-склеротической форме заболевания рентгенологическая картина напоминает атрофический гастрит или скирр. В результате развития соединительной ткани просвет антрального отдела желудка резко деформируется, суживается и представляется в виде ригидной трубки. Рельеф слизистой сглажен, перистальтика отсутствует, что обычно принимается за скиррозный рак желудка.
Язвенная форма туберкулеза желудка характеризуется наличием «ниши». Рельеф слизистой оболочки вокруг язвы обычно изменен, складки утолщены, конвергируют к язвенной нише или местному инфильтративно-рубцовому очагу. Язвы бывают поверхностными или глубокими. Размер их 1 — 1,5 см, при слиянии они достигают иногда гигантской величины. Края их плотные, нависают над кратером и заметно выступают над соседними участками слизистой. Чаще всего эти язвы бывают единичные, имеют округлую, овальную или звездчатую форму. Язвы, как правило, находятся на разных стадиях формирования, поэтому рентгенологическое проявление их различно.
Распознавание туберкулеза желудка затруднено и часто бывает запоздалым. Окончательно диагноз устанавливается с помощью гастроскопии, гастробиопсии и других специфических тестов.
Глава 16. ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Доброкачественные опухоли желудка относятся к малосимптомным болезням, встречаются у людей разного пола и возраста и составляют около 4—10 % всех опухолей желудка. Эти новообразования исходят из слизистой оболочки (эпителиальные), из мышечной, фиброзной, жировой, нервной тканей, а также из кровеносных и лимфатических сосудов стенки желудка (неэпителиальные). К последним принадлежат лейомиома, лейомиобластома, фиброма, невринома, липома и др.
Опухоли слизистой оболочки растут, как правило, в просвет желудка, остальные локализуются внутри его стенки или растут наружу.
Рентгенодиагностика доброкачественных опухолей во многом зависит от методики и техники выполнения рентгенологического исследования желудка. Наибольшее диагностическое значение
имеют результаты супервольтной рентгенографии с дозированной компрессией желудка, пневмограстрографии, исследования после двойного контрастирования желудка, изучения рельефа слизистой оболочки.
Эпителиальные опухоли. Из доброкачественных эпителиальных опухолей самые распространенные — полипы. Термин «полип» — клинико-анатомическое понятие. Он обозначает истинную доброкачественную опухоль слизистой оболочки, которая связана с оболочкой широким основанием или ножкой и состоит из соединительнотканой основы и гипертрофированной или атрофированной слизистой оболочки с разросшимися железами и др.
Общепринятой классификации полипов нет. Целесообразно выделять солитарные, множественные полипы и полипоз. Величина полипов варьирует
от 0,3 до 10 см и более, чаще от 0,5 до 3 см. Внешний вид полипов разнообразен и зависит от формы головки и основания. Они напоминают грибы, цилиндры, шары, имеют самую причудливую форму. В 10 % случаев основание полипа втягивается и образует узкую или широкую ножку. В отечественной литературе все полипы желудка называются аденоматозными, среди них выделяют простые и пролиферирующие. В большинстве классификаций, в том числе в классификации ВОЗ, аденоматозные полипы (доброкачественные опухоли) отделяют от гиперпластических, которые включены в группу опухолеподобных процессов. Более подробную классификацию предложил К. Elster et al. (1977). По гистологической структуре они выделили полипы следующих типов: фовеолярная (очаговая) гиперплазия, гиперплазиогенный (гиперпластический) полип, высокодифференцированная аденома, аденоматозный полип, пролиферация с клеточной атипией (так называемые пограничные поражения). По мнению Л. И. Аруина (1981), преимущества этой классификации перед другими заключаются в выделении наиболее ранней формы полипов — фовеолярной гиперплазии и разделении аденом желудка по степени зрелости эпителия.
Значительно чаще встречаются гипер-плазиогенные полипы, которые возникают в результате нарушений клеточного обновления на ограниченном участке слизистой оболочки. Их не относят к предраковым новообразованиям. Малигнизируются такие полипы чрезвычайно редко. Истинные доброкачественные эпителиальные опухоли, так назывываемые аденоматозные полипы (фиброаденомы), по данным Л. И. Аруина (1981), выявляются в 16,3 раза реже гиперплазированных. До 40 % случаев они подвергаются малигнизации, а в 29—59 % случаев
их находят у больных раком желудка. Также редко обнаруживаются высокодифференцированные аденомы пилорических желез.
Клинические проявления у больных с полипами желудка чрезвычайно многообразны. Болезнь развивается медленно, без характерных симптомов полипов. Ее признаки зависят от состояния слизистой оболочки желудка, обусловливают боли в подложечной области, отрыжки, тошноту, горький вкус во рту. Большинство больных отмечают боли после приема пищи, а некоторые жалуются на постоянные боли. Полипы с длинной ножкой иногда выпадают в 12-перстную кишку и ущемляются в привратнике с развитием симптомов острой высокой непроходимости пищеварительного тракта. Вследствие изъязвления полипов начинаются желудочные кровотечения и развиваются признаки гипохромной анемии. О скрытом кровотечении свидетельствуют слабость, головокружения, шум в ушах и голове, бледность кожи и слизистых оболочек. Для явного желудочного кровотечения характерна рвота с примесью крови в рвотных массах, дегтеобразный стул и общие симптомы малокровия. При озлокачествлении полипа у больного отмечаются потеря аппетита, общая слабость, похудание, т. е. симптомы, аналогичные признакам первичного рака желудка. Распознавание полипов желудка в значительной мере зависит от осложнений, которые вынуждают больного обратиться к врачу. Первостепенное значение в диагностике полипов принадлежит результатам тщательно собранного анамнеза, рентгенологического, эндоскопического и морфологического исследований. Во время гастроскопии определяются цилиндрические, полушаровидные или шаровидные выбухания слизистой оболочки, полипы на ножке, подвижные относительно стенок желудка.
87. Полипы антрального отдела желудка: а — одиночный; б — множественный.
Рентгенологические признаки полипов зависят от количества полипозных разрастаний и их особенностей.
Полипы образуют одиночные или множественные, чаще округлые или овальные, с четкими контурами дефекты наполнения. Иногда встречаются и дольчатые полипы с фестончатыми краями и сетчатым рисунком. Полипы с ножкой распознаются по смещае-
мости дефекта наполнения и по созданной ножкой полосе просветления, которая тянется от головки полипа к стенке желудка. Получается своеобразная картина «гриба» или «ракетки». Полипы обнаруживаются в любом отделе желудка, но в основном — в антральном. Чаще встречаются небольшие множественные полипы с гладкой поверхностью. Множественные полипы
определяются по нескольким характерным для полипов дефектам наполнения с нормальным рельефом слизистой оболочки между ними. В зоне полипов стенки желудка эластичные, перистальтика сохранена.
Дефекты наполнения выявляются после заполнения желудка бариевой взвесью и его дозированной компрессии. Форма дефектов наполнения меняется как во время компрессии, так и при прохождении перистальтической волны. После ТЗ желудка контрастным веществом и без соответствующей компрессии полипы можно вовсе не обнаружить. По образному выражению С. А. Рейнберга, они «тонут в бариевой взвеси».
Наибольшие диагностические сведения получают путем супервольтной рентгенографии желудка после его полутугого заполнения и дозированной компрессии. При этом нередко удается отчетливо увидеть полипы даже высотой 0,3—0,5 см. Желудок подвергают компрессии прицельным тубусом до полного или почти полного раздавливания складок слизистой оболочки. На жестких рентгенограммах можно не только определить форму и размеры полипа, но и обнаружить его ножку. Данные такого исследования особенно ценны при диагностике небольших одиночных полипов.
Большие полипы в антральном отделе, на высоте перистальтической волны иногда обнажаются, тогда появляется симптом маятникообразного смещения дефектов наполнения во время перистальтики (по направлению к привратнику и обратно), которые с силой проскальзывают через суженный канал.
Очень важно изучить рельеф слизистой вокруг полипа. Складки слизистой оболочки раздвигаются растущим полипом, как бы дугообразно огибают дефект наполнения, нигде не прерываются. Однако, по мнению В. Б. Антоно
вич (1987), иногда эти складки истончаются, сглаживаются, частично исчезают и обрываются у верхнего или нижнего полюса большого полипа. Чтобы уточнить положение полипа по отношению к передней или задней стенке, показано многопроекционное исследование желудка после его двойного контрастирования.
На рельефе слизистой оболочки желудка в некоторых случаях удается обнаружить симптом «кольца» — это проекционное отражение периферических краев полипа, обмазанных бариевой взвесью. Крупные полипы в результате оттеснения стенок желудка набухают, поэтому отмечается неполное спадение желудка после его опорожнения от контрастной массы.
После двойного контрастирования желудка головка полипа становится заметной по характерной отчетливой тени, а ножка — по дополнительному тяжу. Весьма типичен для ножки также симптом «мишени» — образование двух колец, одно в другом, вследствие тангенциального прохождения рентгеновых лучей через поперечное сечение ножки и периферический край головки полипа. Маленькое, более интенсивное, колечко находится в центре большего кольца или несколько эксцентрично, в зависимости от угла направления рентгеновых лучей к поперечному сечению ножки. О том, что у полипа короткая ножка, иногда можно судить и по зарубке на стенке желудка. При динамическом наблюдении наряду с ростом полипа отмечается и увеличение его ножки.
Если полип в антральном отделе с длинной ножкой, то во время сильной перистальтики он нередко выпадает в луковицу 12-перстной кишки и образует дефекты наполнения у ее основания. При этом в зоне привратника часто определяется и сама ножка по узкой полосе просветления. Вследствие частого выпадения полипа, а также раз
вития пилороспазма нарушается кровоснабжение самого полипа, на нем возникают изъязвления и в последующем начинается кровотечение.
Полипоз желудка проявляется множеством дефектов наполнения, полностью нивелированным рельефом слизистой оболочки, на которой складки не определяются. Если обнаружен полипоз желудка, следует провести полное исследование ЖКТ, так как нередко определяются полипозные поражения и кишечника.
Больные с одиночными полипами диаметром до 1,5 см, если полипы не растут или не изъязвляются, должны находиться под наблюдением врача и подвергаться контрольному исследованию не реже 1 раза в 6 мес.
Малигнизацию полипов по рентгенологическим признакам установить крайне сложно. Известно, что стебельчатые полипы, как правило, доброкачественные, а полипы на широком основании нередко оказываются полипоидной карциномой. В. Б. Антонович (1987) считает, что о малигнизации полипа свидетельствуют симптом втяжения стенки желудка в месте полипа, определение здесь аперистальтической зоны, утолщение ригидной стенки до 1—4 см и более, появление узлов атипичной формы, которые быстро растут, потеря четкости их контуров. Эти признаки общеизвестны, но они абсолютно достоверны. Чаще полип начинает злокачественно перерождаться с основания. Тогда макроскопически у него выявляют широкое основание, изъязвление в центре или у основания, а также хрящевую консистенцию.
Предполагая малигнизацию полипа, необходимо учитывать возраст больного и предрасположение его организма к развитию опухоли, распространенность процесса, величину и локализацию полипа, наличие у него ножки, данные рентгенологического, эндоскопического,
88. Пролабирование полипов антрального отдела желудка в луковицу 12-перстной кишки.
а также гистологического и цитологического исследований. Только после тщательного анализа результатов комплексного обследования можно своевременно поставить правильный диагноз.
Неэпителиальные опухоли. Встречаются сравнительно редко: на них приходится от 0,5 до 3,6 % новообразований желудка. Несколько чаще выявляются у женщин, особенно старше 40 лет. Опухоли находятся главным образом в подслизистом и мышечном слоях желудка или под его серозной оболочкой. В подслизистом слое образуются фибромы и липомы, в мышечном слое — лейомиомы, в оболочках нервов — невриномы и шванномы, в сосудах — ангиомы и т. д.
89. Множественные полипы антрального отдела желудка (а) и их малигнизация через 3 года (6).
Наиболее часто находят гладкомышечные опухоли — лейомиомы (40— 60 % неэпителиальных новообразований). По данным А. Н. Кишковского (1983), в большинстве случаев лейомиомы обнаруживаются на задней стенке средней и нижней трети тела желудка (39 %) и в антральном отделе (26 %), реже —в зоне привратника, свода и кардии. Как правило, эти опухоли бывают одиночными.
Клинические проявления: чаще всего кровотечение (48 %), боли (32 %), немного реже — рвота, тошнота, диарея, диспептические явления. Если опухоль растет в просвет привратника, нередко развиваются симптомы его непроходимости. Большая лейомиома у некоторых
больных хорошо пальпируется чере: брюшную стенку.
Из рентгенологических признаков первый и главный — округлый дефек" наполнения с четкими, ровными, гладкими контурами. Складки слизистог оболочки не разрушены, они раздвиге ются или оттесняются опухолью, огибаг ее. Рельеф слизистой в зоне лейомиомь. зависит как от ее величины и направле ния роста, так и от дозированно! компрессии этого участка. Если опухол. развивается в подслизистом слое, склад ки слизистой над лейомиомой натяп-ваются и даже разглаживаются и исчезают, особенно во время чрезмерно! компрессии. Тогда создается впечатль ние обрыва складок.
90. Изъязвленная лейомиома субкардиального отдела желудка (а) и его угла (6).
Лейомиома часто изъязвляется. Изъязвление бывает поверхностным или глубоким. При поверхностном изъязвлении в центре дефекта образуется плоская «ниша», а при глубоком — депо бариевой взвеси формирует большой кратер или полость, проникающую глубоко внутрь опухоли. В зоне поражения эластичность стенки желудка, ее сократительная способность и ритмичная перистальтика не изменяются.
Экзогастрально растущая лейомиома находится вне просвета желудка, но тесно связана с ним. Определяется краевой дефект наполнения, обусловленный давлением опухоли на стенку желудка извне, опухоль дугообразно оттесняет складки слизистой оболочки и смещает желудок. Лейомиомы иногда обызвествляются, тогда на экране видна интенсивная тень большого экзогастрального образования. Истинные размеры и особенности роста опухоли легче установить путем париетографии, а также УЗИ.
Иногда экстрагастральная лейомиома может оттягивать у своего основания часть стенки желудка, образуя углубление, в котором задерживается бариевая взвесь (симптом «ямочки»). Это создает ложную картину изъязвления. В одной трети случаев лейомиома переходит в лейомиосаркому, но рентгенологически установить это трудно.
Фиброма — вторая по частоте встречаемости неэпителиальная опухоль желудка. Выявляется у 20—25 % больных опухолями желудка. Возникает из подслизистого слоя и серозной оболочки передней или задней стенок преимущественно антрального отдела желудка и соответственно растет больше в просвет или наружу органа. По величине фибромы весьма вариабельны, порой достигают 10 см в диаметре и более. Чаще опухоль представляет одиночный округлый узел на широком основании или, реже, на ножке. Фибромы склонны
изъязвляться, иногда в них находят известковые включения.
Клинические проявления разнообразны и зависят как от локализации опухоли, особенно ее роста, так и от величины. Основной симптом — постоянная тупая боль, не связанная с приемом пищи. Часты диспептические явления из-за снижения кислотности желудочного сока и нарушения опорожительной деятельности желудка.
Рентгенологические признаки эндо-гастральной фибромы следующие: округлый или овальный дефект наполнения, чаще с ровными контурами и гладкой поверхностью, складки слизистой оболочки не разрушены, а дугообразно огибают его, большими опухолями сглаживаются, смещаемость желудка не нарушена. В. Б. Антонович (1987) отметила, что у больных с большими фибромами антрального отдела резко деформирована выходная часть желудка, контур большой кривизны неровный или даже втянутый и не перис-тальтирует. Этим большие фибромы антарального отдела напоминают раковые опухоли.
Фибромы бывают твердыми или мягкими. Деструктивных изменений в большинстве фибром не отмечается. Контур дефекта наполнения, образованного твердой фибромой, преимущественно ровный и четкий. Если фиброма мягкая и подвергается недостаточной дозированной компрессии, контур ее нечеткий. Дольчатые фибромы создают неровные, волнистые контуры дефекта наполнения, его структура неравномерная. При наличии ножки дефект наполнения образуется как за счет ее, так и головки фибромы, напоминая симптомы «мишени» или «ракетки». Если опухоль с большой ножкой растет в выходном отделе желудка, она нередко пролабирует через привратник в просвет луковицы 12-перстной кишки.
Фибромы сравнительно редко растут
экзогастрально. Они находятся вне желудка, но тесно связаны с его стенкой и вместе с ней смещаются. Дефект наполнения не возникает, рельеф слизистой оболочки желудка не изменен. Большие опухоли иногда смещают желудок, а из-за натяжения его стенки в области основания фибромы появляется симптом «ямочки», похожей на изъязвление. Такие опухоли лучше диагностировать по данным парието-. графин или тройного контрастирования желудка.
Невриномы возникают из шванновских оболочек ауэрбаховского сплетения стенки желудка. На них приходится от 17,9 до 22,2 % неэпителиальных опухолей желудка. Они четко отграничены от окружающих тканей. В основном обнаруживаются на задней стежке, ближе ’ к большой кривизне тела и антрального отдела желудка. К. Heyden (1977) наиболее часто выявлял невриномы на малой кривизне желудка.
Характерно изъязвление опухолей — в 50—80 % случаев (Антонович, 1987). Главным образом это одиночные образования, иногда большие. Множественные опухоли встречаются редко.
Клинические проявления: в большинстве случаев боли, диспепсия, желудочные кровотечения.
Рентгенологические признаки: округлый, четко очерченный дефект наполнения, который оттесняет неизмененные складки слизистой оболочки желудка, перистальтика стенки желудка в зоне опухоли не нарушена. При изъязвлении в дефекте наполнения накапливается бариевая взвесь и определяется депо контрастной массы.
Липомы обнаруживаются в 2—11,4 % случаев неэпителиальных опухолей желудка. Развиваются в подслизистом слое и субсерозной оболочке желудка, преимущественно в антральном отделе. Опухоли различной величины, иногда до 15 см в диаметре и более.
91. Лейомиома большой кривизны тела желудка при вертикальном (а) и горизонтальном (б, в) положениях одного и того же больного, с дозированной компрессией желудка (б) и без нее (в).
Клинические проявления: в большинстве случаев боли, постоянные ноющие, нередки и диспепсии. Из осложнений следует отметить желудочное кровотечение, частичную непроходимость выходного отдела желудка и его нагноение с соответствующими клиническими признаками.
Рентгенологические признаки: вследствие мягкоэластичной, тестовидной консистенции и меньшей плотности липом, чем окружающих стенок желудка, на рентгенограммах большие липомы образуют прозрачный фон и, в зависимости от компрессии, различной величины дефект наполнения и разный рельеф слизистой оболочки. Но складки слизистой на границе с опухолью не обрываются резко. Большая липома нередко суживает и деформирует антральный отдел желудка и затрудняет его опорожнительную деятельность.
На сосудистые опухоли, или ангиомы, приходится всего от 3,9 до 7,1 % неэпителиальных опухолей желудка. Чаще они локализуются в антральном отделе и растут преимущественно эндо-гастрально. Образуется округлый одиночный небольшой опухолевой узел.
Клинические проявления: в большинстве случаев отчетливых признаков нет, преобладает болевой синдром.
Рентгенологические признаки такие же, как и при других неэпителиальных доброкачественных опухолях. Выявляют дефект наполнения с четкими контурами. Нередко при ангиомах выявляют тени мелкоточечных флеболитов.
К сосудистым новообразованиям относится и гломусная опухоль, исходящая из артериовенозных анастомозов гломусного типа. В основном локализуется в антральном отделе, растет преимущественно эндогастрально в виде одиночного небольшого опухолевого узла, имеет округлую форму. В клинической картине чаще выражен болевой синдром. Рентгенологически подобна
92. Изъязвленная невринома желудка.
остальным доброкачественным опухолям.
Таким образом, по клиническим и рентгенологическим симптомам дифференцировать неэпителиальные опухоли весьма трудно. Точно определить вид доброкачественного новообразования желудка можно только после операции по результатам гистологического исследования удаленного новообразования. По клинико-рентгенологическим признакам можно лишь предположить, что опухоль доброкачественная.
Правда, с целью дифференциальной диагностики иногда прибегают к селективной ангиографии. С ее помощью в ряде случаев удается определить характер новообразования по особенностям
его васкуляризации. Разработан метод инъецирования в подслизистую оболочку желудка через фиброэндоскоп водорастворимых рентгеноконтрастных веществ, способствующих уточняющей диагностике патологических изменений в стенке желудка.
Имеются сообщения об успешном раз
решении диагностических затруднений в распознавании доброкачественных опухолей желудка с помощью УЗИ и аксиальной КТ. Чаще к этим методам обращаются при обнаружении пальпируемого опухолевидного образования в брюшной полости, чтобы уточнить его локализацию и природу.
Глава 17. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Из злокачественных опухолей желудка в 95 % случаев встречается рак, в остальных случаях — ретикулосаркомы (лимфосаркомы), миосаркомы, фибросаркомы, злокачественные невриномы, полиморфно-клеточные саркомы и др.
Рак желудка. Среди опухолей ЖКТ рак желудка наблюдается в 50 % случаев и по частоте занимает первое место. Он обладает резко выраженными агрессивными свойствами. Заболевают в основном люди зрелого возраста, заболеваемость возрастает после 40 лет, а пик ее приходится на возраст свыше 50 лет. Мужчины болеют раком желудка в 1,5—2 раза чаще женщин. Приблизительно в 3 % случаев рак желудка возникает у больных в возрасте 35 лет и моложе. Наиболее часто поражается антральный отдел (45 %), реже — тело (33 %) и проксимальная часть желудка (22 %).
Распространенность этого заболевания в разных регионах неодинакова. Наиболее высокая заболеваемость раком желудка в России и Беларуси, где на 100 000 жителей она составляет соответственно 52 и 43 случая. Наименьшая заболеваемость регистрируется в Средней Азии. Закавказье и Молдове (от 13 до 26). Отмечается тенденция к снижению заболеваемости раком желудка.
Частота заболеваемости раком желудка значительно варьирует и в разных странах мира. Наиболее высокая заболе
ваемость в Японии, Чили, Финляндии, Исландии, Коста-Рике, Австрии, низкая — в США, Таиланде, Индонезии, Нигерии, Австралии, Канаде, Новой Зеландии. Так, в Японии заболеваемость раком желудка на 100 000 населения среди мужчин около 70 и женщин — 66, а смертность 60 случаев, в США — соответственно 7,5 и 3,7 (Fayenz, 1985).
Этиопатогенез рака желудка до конца не выяснен. Не вызывает сомнений, что существует теснейшая связь и взаимозависимость между развивающейся опухолью и целостным организмом. Возникновение рака во многом определяется прежде всего состоянием регуляторных систем организма. На развитие опухолевой болезни и на характер ее течения оказывают влияние нервная, эндокринная и иммунологическая системы.
Еще в 19 в. некоторые клиницисты обращали внимание на связь возникновения опухоли с состоянием нервной системы. Так, Г. А. Захарьин, например, считал, что процент рака на почве горя так же велик, как процент сухотки на почве сифилиса. На развитие опухоли оказывают существенное влияние конституциональные особенности организма и тип его высшей нервной деятельности. У лиц со слабым или сильным неуравновешенным типом высшей нервной деятельности опухоль возникает чаще, протекает более бурно, злокачественно и раньше дает метастазы.
Л. А. Орбели, И. П. Павлов, А. Д. Сперанский, Н. Н. Зайко, А. М. Чернуха и другие отечественные ученые доказали, что нервная система регулирует интенсивность и качественные особенности обменных процессов в клетках органов и тканей и тем самым обеспечивает сохранение их структуры и функции. Нарушение иннервации органа, повреждение нервов, перенапряжение возбудительного процесса ведут к развитию нейрогенной дистрофии. Изменения, наблюдаемые в этих условиях на субклеточном уровне, очень близки к тем, которые характерны для опухолевого процесса. Как при нейрогенной дистрофии, так и при опухолевом росте происходит синтез клетками необычных, не свойственных данному органу белков. Такие дистрофические процессы можно рассматривать как предраковое состояние (Кривчик, 1983).
Рак не возникает внезапно в здоровом, неизмененном органе, ему предшествуют ряд изменений, которые в большей или меньшей степени могут быть названы предраковыми. Из факторов риска следует отметить заболевания: 1) пернициозная анемия (риск в 22 раза выше, чем среди здорового населения); 2) группа крови А (II); 3) хронический атрофический гастрит и кишечная метаплазия слизистой оболочки желудка; 4) полипы желудка; 5) состояние после резекции желудка, а именно в сроки через 25 лет после операции около 20 % больных заболевают раком желудка (Miller, Cloor, 1986).
По мнению многих исследователей, основным предраковым состоянием бывает атрофический гастрит с кишечной метаплазией. Аденоматозный полип не всегда является предраковым, но при больших размерах его вероятность ма-лигнизации имеется. Четкой этиологической связи между раком желудка и язвой не установлено. По данным М. Г. Виннера с соавт. (1983), озло-
качествление язвы желудка происходит нечасто (до 1—2 % случаев). В этиологии рака желудка (Fayenz, 1985) большую роль играют алиментарные факторы: употребление пищи, содержащей бензопирен, дибензантрациен и их производные, находящиеся в копченых и жаренных на огне продуктах, а также нитраты.
Реализации канцерогенного действия нитратов способствует образование из них нитрозоаминов в желудке. Бактерии, осуществляющие этот процесс, обнаружены в желудке больных ахлоргидрией и атрофическим гастритом.
Патологическая анатомия: по микроскопической картине все современные классификации рака желудка выделяют 4 основные гистологические формы: 1) дифференцированная аденокарцинома, 2) малодифференцированная аденокарцинома, 3) недифференцированный рак, 4) аденоакантома. Из них заслуживают внимания две основные группы: недифференцированный и дифференцированный. К недифференцированным относятся раки, полностью потерявшие способность строить железистые структуры. Это полиморфно-клеточные раки с крайне неблагоприятым течением. Дифференцированные раки более разнообразны, могут сопровождаться повышенным слизеобразованием. Они включают следующие формы: железистый рак (аденокарцинома), солидный (альвеолярный) рак, фиброзный рак (скирр), редкие формы — плоскоклеточный рак и др. Малодифференцированная аденокарцинома — это опухоль промежуточного строения, встречается в виде двух вариантов: трабекулярного и солидизирующего. Аденоакантома представляет собой смешанный железистый и плоскоклеточный рак, встречается крайне редко.
Внешний вид раковой опухоли различный. Он зависит от особенностей роста новообразования, предшествую
щих патологических образований и развившихся некробиотических процессов (изъязвление поверхности, распад). По внешнему виду и характеру роста выделяют экзофитные, эндофитные, диффузные и смешанные формы рака с наличием или отсутствием его распада. В зависимости от этого опухоль соответственно вдается в просвет желудка либо вызывает только изменение стенки или рельефа его слизистой. Так, экзофитный рак выступает над поверхностью слизистой оболочки желудка, эндофитный распространяется в глубь органа, а диффузный характеризуется рассеянным, равномерно распространенным ростом, интенсивным развитием фиброзной стромы, уплотнением и сморщиванием стенки желудка.
Распространение рака в желудке происходит по типу ползучей инфильтрации в слизистом и главным образом в подслизистом слоях. Макроскопическая и микроскопическая границы опухоли не совпадают. При экзофитной опухоли раковые клетки находят на расстоянии 2—3 см от новообразования, а при инфильтративной и смешанной — на 5—7 см и более, преимущественно к кардиальному отделу по направлению оттока лимфы. В дальнейшем опухоль проникает в мышечный слой и серозную оболочку. По стенке желудка раковая опухоль может распространяться на пищевод протяженностью до 2 —7 см от краев опухоли и на 12-перстную кишку по типу ракового лимфангита, реже по типу продолжающегося роста или «пылевых» метастазов в стенку кишки. При прорастании серозной оболочки опухоль переходит на прилегающие органы.
Метастазирование рака желудка во внутренние органы и ткани идет главным образом по кровеносной системе (система воротной вены). Но не исключено и отдаленное метастазирование лимфогенным путем в надключичные
лимфатические узлы (метастаз Вирхова), яичники (метастаз Крукенберга), брюшину дугласова пространства (метастаз Шнитцлера). Из паренхиматозных органов наиболее часто метастазами поражается печень (около 30 %), далее следуют поджелудочная железа, легкие, кости, кожа, пупок и другие органы. Распространение метастатических опухолей на брюшине на большом протяжении принято называть канцерома-тозом.
Клиническая картина рака желудка отличается большим разнообразием и зависит от локализации, анатомической формы, темпа роста опухоли и стадии процесса. Вначале симптоматология рака желудка не специфична, она отражает предраковые заболевания. В подавляющем большинстве случаев заболевание развивается медленно и скрыто.
Хронический воспалительный процесс, на фоне которого чаще всего возникает опухоль, истощает резервные возмножности организма и способствует ее росту. Развитие рака желудка сопровождается снижением уровня биохимической дифференцировки этого органа, его деспециализацией, расстройством координированного функционирования (Шапот, 1975). Возникают многогранные сложнейшие нарушения в деятельности многих органов и систем организма. Происходящие в результате этого сдвиги стимулируют включение разнообразных компенсаторно-приспособительных механизмов. В ходе развития опухолевой болезни меняется психический статус, соотношение возбудительных и тормозных процессов у больного. В первое время превалируют процессы возбуждения с последующим нарастающим угнетением коры головного мозга. Изменяется стимуляция активности гипофиз-адренало-вой системы как основной в адаптационном гомеостазе. Наконец нарастает иммунодепрессия.
По мнению Б. Е. Петерсона с соавт. (1979), в каждом случае рака желудка имеется своеобразная «собственная» клиническая картина, в которой отдельные симптомы выступают более ярко, другие отсутствуют либо выражены слабо. «Немые» формы рака желудка встречаются редко (в 2—3 %). В большинстве случаев (около 80 %) врач при опросе, осмотре и пальпации живота улавливает «синдром малых признаков» и может заподозрить рак желудка при первичном обращении больного.
Многие авторы выделяют следующие ранние клинические симптомы рака желудка: 1) диспептические явления — понижение аппетита (23,4 %), нередко связанное с легкой тошнотой, иногда полная потеря аппетита вплоть до отвращения к простой пище, особенно к мясной; 2) желудочный дискомфорт — неприятные ощущения, чувство тяжести в эпигастральной области (33,6 %), потеря физиологического чувства удовлетворения от принятой пищи, больной ограничивает себя в еде, избегает «тяжелой пищи»; 3) беспричинно прогрессирующее похудание, признаки ане-мизации организма (11,2 %); 4) психическая депрессия — потеря радости жизни, интереса к труду и окружающему, апатия, отчужденность; 5) появление беспричинной слабости, быстрой утомляемости, снижение трудоспособности. Этот симптомокомплекс называют синдромом малых признаков рака.
Поздние клинические симптомы при раке желудка характеризуются большей выраженностью и разнообразием и во многом зависят от локализации и стадии ракового процесса. В зависимости от преобладания тех или иных симптомов рака желудка, по мнению В. X. Василенко, можно выделить несколько вариантов течения заболевания, при которых ведущим является какой-либо синдром (болевой, диспептический, анемический, отечный и др.).
Болевая форма рака желудка протекает с доминирующим симптомом боли. Особенно часто боль наблюдается при язвенно-инфильтративном раке и в случаях проникновения опухоли в поджелудочную железу, солнечное сплетение и брюшную стенку. Характер, интенсивность и локализация болей различные. Опухоль, прорастающая в забрюшинное пространство, обычно вызывает постоянные, интенсивные, мучительные боли, иррадиирующие в поясницу.
Диспептической форме рака желудка свойственны общие симптомы: снижение или полное отсутствие аппетита, безразличие к пище, потеря чувства удовлетворения после еды, наличие тяжести и давления в эпигастральной области, нередко сопровождающееся тошнотой, которая может закончитьсй рвотой. Больные отмечают легкую насыщаемость. Соблюдение диеты приносит иногда временное облегчение.
При анемической форме в клинической картине заболевания преобладают симптомы, связанные с первичной или, чаще, вторичной гипохромной анемией. Угнетение гемопоэза развивается преимущественно у женщин вследствие разрушения и атрофии слизистой оболочки желудка, утраты желудком способности вырабатывать антианеми-ческий фактор Касла.
Отечная форма встречается редко. Возникает чаще в терминальной стадии болезни и связана с нарушением белкового баланса. В этих случаях возникают отеки лица, тела, ног.
Нередко при раке желудка температура субфебрильная. Иногда она может повыситься до 39—40 °C и бывает единственным ярким симптомом болезни.
Каждая локализация рака имеет свои специфические признаки. Так, при поражении антрального отдела развиваются симптомы нарушения проходимости выходного отдела желудка. Все
больные предъявляют жалобы на боли в эпигастрии, у 70 % наблюдается потеря массы тела, у 55 % после еды появляется чувство распирания в эпигастральной области, у 50 — отрыжка, у 30 % — потеря аппетита. При резком сужении привратника постоянны рвота и отрыжка.
Рак в области кардии проявляется дисфагией, умеренно выраженной или тяжелой анемией, реже эпигастральными или диффузными болями всего живота, тошнотой, рвотой, слабостью и лихорадкой. Сужение пищеводно-желудочного перехода может достичь резкой степени. Тогда, помимо затруднения глотания, появляется чувство давления и боли за грудиной, что обусловлено супрастенотическим расширением пищевода и застоем в нем пищи. В результате рефлекторного сокращения диафрагмы из-за раздражения ветвей диафрагмального нерва отмечаются срыгивание и икота.
Рак тела желудка в отличие от рака его входного и выходного отделов сравнительно долго протекает без местных симптомов и относится к так называемым «немым» формам. На первое место выступают общая слабость, снижение аппетита, психическая депрессия, похудание, анемизация. Если рак располагается на малой кривизне желудка, особенно характерны однократные или повторные желудочные кровотечения из-за вовлечения в процесс крупных ветвей левой желудочной артерии. Кровавая рвота — нередко один из важных признаков опухолей подобной локализации.
Характер и степень выраженности клинических симптомов зависят от локализации опухолевого процесса и формы роста опухоли. Если опухоли, растущие преимущественно в просвет желудка, проявляются в основном кровопотерей, утомляемостью, похуданием, снижением аппетита, повышением тем
пературы тела, то диффузные формы рака желудка отличаются больше местными симптомами — болями в области желудка, желудочным дискомфортом, рвотой и др.
В распознавании рака желудка имеют значение не только перечисленные симптомы, но и результаты физикальных, лабораторных, рентгенологических, эндоскопических и морфологических исследований. Лабораторные исследования позволяют установить ахлоргидрию или гипохлоргидрию при относительно высоком титре общей кислотности, умеренный лейкоцитоз с нейтрофилезом и сдвигом формулы влево, повышенную СОЭ, анемию, угнетение эритропоэза. Гастроскопия современным фиброскопом способствует выявлению рака желудка на самых ранних стадиях развития. С помощью гастробиопсии можно определить морфологическую структуру опухоли.
Особенно эффективны эндоскопия и эндоскопическая биопсия в диагностике небольших опухолей желудка. С помощью их можно своевременно поставить диагноз у 90 % больных (Miller, Gloor, 1986; Oiwa, Mori, Sugimachi et al., 1986).
Рентгенодиагностика — ведущий метод раннего и своевременного распознавания рака желудка. Для выявления карциномы данной локализации применяются как основные методы (рентгеноскопия и рентгенография), так и дополнительные (пневмография, двойное контрастирование, полиграфия, парие-тография и др.). При постановке диагноза рентгенолог учитывает результаты клинических и лабораторных исследований, сопоставляет данные рентгеноскопии и рентгенографии. Если клинические данные свидетельствуют о наличии ракового процесса в желудке, а рентгенолог не находит рака, но подозревает его, он должен направить больного на
эндоскопическое исследование, а именно: фиброгастроскопию с прицельной биопсией.
Рентгенологическая картина при раке желудка многообразна и зависит в каждом конкретном случае от характера роста опухоли, глубины поражения стенки желудка, локализации и стадии ракового процесса. В течении рака выделяют 4 стадии: 1) поверхностный (начальный, или ранний) рак — опухоль, независимо от размеров, захватывает либо одну слизистую оболочку, либо слизистую и подслизистую оболочки вместе без метастазирования в регионарные лимфатические узлы; 2) ограни-ченно-растущий рак — характеризуется уже более глубокой инвазией, инфильтрирует мышечную оболочку, но не прорастает серозный покров, занимает не более половины одного анатомического отдела, метастазы отсутствуют; 3) рак значительных размеров — занимает один или более анатомических отделов и распространяется на соседние органы, прорастая серозный покров. В процесс могут быть вовлечены или только перигастральные лимфатические узлы, или узлы по ходу левой желудочной, чревной, общей печеночной, селезеночной артерий, печеночно-12-перстной связки; 4) распространенный рак — любое сочетание роста опухоли с метастазированием в лимфатические узлы по ходу аорты, брыжеечных и подвздошных артерий или с наличием отдаленных метастазов.
Появилось много работ, посвященных рентгенодиагностике начальных форм рака желудка. Умение выявлять небольшие изменения желудка в рентгенологическом изображении остается актуальной задачей, особенно в поликлинических условиях. Поэтому главная задача диагностической службы — диагностика рака раннего, т. е. соответствующего I стадии заболевания по терминологии Минздрава бывшего
СССР или Т1 N0M0P1-2 по классификации ВОЗ.
Различают 3 фазы рака желудка I стадии: 1) рак in situ; 2) поверхностный рак — раковые клетки в пределах слизистой желудка; 3) инвазивный рак — ограниченный подслизистым слоем. Макроскопические формы рака желудка I стадии также многообразны. Их классификации и описание приводят многие авторы. Некоторые из них наблюдали ранние стадии рака в виде эрозии и ограниченных грядко-, гребневидных, бородавчатых или полипозных разрастаний, а также плоских, малозаметных утолщений слизистой размером 1—2 см и назвали их пролиферативно-гиперпластическими формами. По данным других исследователей, рак в начальной стадии имел вид небольшой плоской язвы. Описаны псевдодеструктивная форма рака, при которой имеется неправильное плоское углубление в слизистой, очень напоминающее истинное изъязвление, и конструктивная форма в виде гребневидных, бородавчатых и полиповидных разрастаний на поверхности слизистой. Имеются сообщения об опухолевых поражениях желудка гребневидной, язвенной формы, а также о поверхностной неинвазивной карциноме, имеющей вид возвышающихся над поверхностью слизистой образований и поверхностных эрозий размером 6— 20 см2 и более. К этой группе относят и бляшковидный рак, внутрислизистые начальные раковые очаги, 4 макроскопические формы рака I стадии (полипоидный, бляшковидный, поверхностный, изъязвленный) или 3 разновидности начального рака (эрозивно-язвенный полиповидный, плоскоинфильтри-рующий). Описан и эндофитный рак желудка I- стадии. Ряд авторов рассматривает только две макроскопические формы рака желудка I стадии: 1) полиповидную (конструктивную); 2) эрозивно-язвенную (деструктив
ную). Японская ассоциация гастроэнтерологов-эндоскопистов разработала макроскопическую классификацию ранних форм рака желудка, выделив 3 типа опухолей: I — выбухающий; II — поверхностный; II А — поверхностно-приподнятый; II В — поверхностно-плоский; II С — поверхностно-вдавленный; III — экскавированный.
По мнению большинства, наиболее частой патоморфологической формой рака желудка I стадии является эрозивно-язвенный рак, встречающийся в 34,1—45,7 % случаев. Макроскопически он представляет собой дефект слизистой желудка. Глубина изъязвления на ранней стадии небольшая, дно плоское, неровное, часто выражена конвергенция складок. В ряде случаев имеется вал разной степени выраженности. Выбухающая, полиповидная, или конструктивная, форма встречается реже. Так, В. П. Харченко и соавт. (1982) из 112 больных у 14 наблюдали выбухающую форму рака желудка I стадии и у 21 — рак из полипов, который на ранней стадии часто напоминает доброкачественный полип. Лишь в некоторых случаях имеются неровные контуры, изъязвления на поверхности или западения в центре. Озлокачествленные полипы также относят к выбухающей форме рака. Плоская форма встречается еще реже. Так, она отмечается в 6,95—16,58 % всех наблюдений рака желудка I стадии. Макроскопически эндофитная поверхностная опухоль — это участок уплотнения (утолщения) стенки желудка, складчатость на котором отсутствует, в отдельных случаях поверхность слизистой может быть мелкобугристой. Л. В. Власова (1988), рассматривая отдельно подтип ПА, назвала его поверхностно-приподнятым (бляшковидным), тип ПВ — поверхностноплоским, тип ПС — поверхностноуглубленным (язвенным). Е. Г. Фридман и В. И. Реттенберг (1972) относят
93. Ранний рак желудка:
а — полиповидный; б — язвенный.
бляшковидный рак к пролиферативногиперпластической форме, а поверхностно-углубленный — к изъязвленной, не разделяя II тип на подтипы.
Вопрос о возможности озлокачествле-ния хронической язвы детально про
анализировали Л. М. Портной и соавт. (1987). Т. Sakita и соавт. (1971) описали возможность заживления озлока-чествленных язв под действием интенсивного противоязвенного лечения — предполагаемый так называемый жизненный цикл «злокачественной язвы». Такой цикл может повторяться несколько раз. По мнению авторов, заболевание начинается с изъязвления в зоне опухоли или озлокачествления язвы. В дальнейшем наступает заживление язвы вследствие разрастания немалигнизированной ткани из ее краев. Затем происходят злокачественная инвазия образовавшегося рубца и повторное его изъязвление. Данные о частоте возникновения рака на фоне язвы желудка противоречивы. Одни авторы не считают язву предраком, другие пишут о редкости этого явления (1—2 % наблюдений). Имеется мнение, что в подавляющем большинстве случаев рак желудка, кроме полиповидного, произошел из язвы либо из поверхности рубца после заживления язвы.
Полипы желудка относятся к облигатным предракам. Патоморфологи считают, что деление полипов на доброкачественные и злокачественные условно, так как э.то этапы единого процесса. Возможность злокачественного перерождения полипов желудка была известна еще в начале 19 в. Частота малиг-низации полипов колеблется от 1 до 74,9 %. Мнения в отношении начала малигнизации полипов противоречивы. Одни считают, что полипы размером более 1,5—2 см, имеющие неправильную форму и мелкобугристую поверхность с участками изъязвления,—злокачественные; по мнению других, достоверность перечисленных выше признаков сомнительна. Предполагается возможность возникновения и развития рака на фоне хронического гастрита или неизмененной слизистой желудка. Заслуживает внимания высказы
вание В. И. Рятсена и соавт. (1972) о том, что малигнизация полипа может наступить и до момента его образования, т. е. в ранних фазах атрофического гастрита — на уровне мукоидной трансформации или аденоматоза. Не наличие полипа является угрозой малигнизации, а другие факторы (возникновение очагов дисрегенеративной пролиферации эпителия, полиморфизм ядер, неравномерность распределения хроматина в ядрах и др.).
Возможностям раннего выявления рака желудка уделяется большое внимание. В отечественной литературе 15 лет назад имелись лишь единичные наблюдения раннего выявления рака желудка, теперь таких наблюдений сотни. Очевидно, что «малые признаки» рака желудка решающего значения для ранней диагностики опухоли не имеют. Распознавание рака желудка I стадии затруднено отсутствием специфической клинической картины, скудная симптоматика, как правило, обусловлена предшествующими заболеваниями желудка — хроническим гастритом, язвенной болезнью, полипозом. Большинство авторов пишут об идентичности симптомов рака желудка I стадии и симптомов хронических заболеваний его (боли и тяжесть в эпигастральной области, отрыжка, снижение аппетита, немотивированная слабость). В связи с этим дифференцированный диагноз доброкачественных и злокачественных изъязвлений по клиническим данным практически невозможен. Положительная динамика изъязвлений в процессе терапии, как указывалось, не исключает возможность малигнизации.
Появилась классификация Lauren (1988). В соответствии с ней рак желудка делится на 2 группы в зависимости от экзогенных и эндогенных факторов: 1) интестинальный рак, связанный с факторами окружающей среды, встречающийся в основном у мужчин старших
94. Эрозивно-язвенный ранний I стадии (варианты а, б, в).
рак
желудка
возрастных групп, 2) диффузный рак, обусловленный генетическими и иммунологическими факторами и возникающий в более молодом возрасте вне связи с полом.
Первые в отечественной рентгенологии работы, касающиеся методики рентгенологического исследования и рентгенологической семиотики рака желудка I стадии, принадлежат Ю. Н. Соколову. Важное значение в диагностике рака желудка придается и рентгенотелевиде-
нию. Подчеркивается необходимостг тщательно изучать рельеф слизистое Рентгенологическое исследование должно включать обычную классическук методику (изучение рельефа слизисто! с дозированной компрессией, исследование с тугим наполнением в различны: положениях больного (полипозициог ное), а также двойное контрастарова ние. Широко применяется методика двойного контрастирования с использованием газообразующих смесей, разра
95. Выбухающий ранний рак желудка:
а, 6 — тела (ступенька Гаудека);в — антрального отдела.
ботанная Schirakabe в 1953 г. Правда, мнения в отношении двойного контрастирования различны. Так, одни авторы подчеркивают важность и обязательное использование одномоментного двойного контрастирования в ранней диагностике рака желудка и придают ему основное значение, другие подвергают сомнению возможности этой методики либо не видят ее преимущества перед обычным исследованием. Опыт показал, что двойное контрастирование должно использоваться как фрагмент, дополнение к обычному исследованию желудка.
Как указывают большинство специалистов, более изучена рентгенологическая семиотика эрозивно-язвенной (изъязвленной) формы рака желудка I стадии. Рентгенологическим симптомом изъязвленной формы рака желудка I стадии является «депо» бариевой взвеси на рельефе слизистой, окруженное валом больших или меньших размеров. Ю. Н. Соколов описывал этот симптом как «контрастное пятнышко» на рельефе слизистой, имеющее форму тонкого, иногда выпрямленного штриха, своим длинником располагающегося вдоль малой кривизны и нередко совпадающего с его контуром. Светлый ореол вокруг штриха, в иных случаях напоминающий небольшой дефект на рельефе, представляет собой отражение валика, окружающего эрозию или плоское изъязвление.
Конвергенция складок, расположение «ниши» (не выходящей за контур желудка) , неровность и подрытость ее контуров, асимметричность вала, ранее ^читавшиеся дифференциально-диагностическими симптомами хронической язвы желудка и эрозивно-язвенного рака, потеряли свое значение. Выявляемые изъязвления в желудке требуют морфологической оценки и только комплексное рентгеноэндоскопическое с биопсией исследование позволяет провести дифференциальную диагностику.
При локализации процесса в препи лорическом отделе- развивается его су жение в результате спазма и анатоми ческих особенностей этого отдела (ши рины его просвета), а также сопутст вующего вторичного воспаления. Рент генологическая картина контрастной пятна бариевой взвеси на рельеф» может наблюдаться при псевдодеструк тивной форме за счет западения центре опухоли. Л. В. Власова (1988) описыва ет рентгенологическую картину поверхностно-вдавленного, или эрозивного, рака типа ПС (по японской классификации) и отмечает, что наибольшие дифференциально-диагностические трудности создает III тип (углубленный, или экскавированный).
Выбухающая форма рака желудка I стадии (полиповидная, полипоподобная, возвышенная), развившегося на фоне хронического гастрита или неизмененной слизистой, встречается реже. Одни авторы рассматривают тип ПА (поверхностно-приподнятый, или бляшковидный) и тип I по японской классификации в совокупности как выбухающую форму рака, другие — отдельно. Рентгенологическая семиотика полиповидного рака в ранней стадии (особенно при величине его 1,5—2 см) часто такая же, как и при доброкачественных полипах. Определяется «дефект наполнения» или дополнительная тень на фоне пневморельефа с ровными четкими контурами на широком основании. Складки слизистой в окружности не изменены. Рентгенологическая картина полиповидной формы рака желудка I стадии при локализации по малой кривизне имеет вид краевого «дефекта наполнения». Диаметр основания последнего равняется поперечнику дефекта или немного меньше его, а углы, образованные скатами опухоли и малой кривизной, чаще всего острые или прямые. Дефекты наполнения размером 1,5—2 см имеют четкие ровные контуры,
а большие —чаще волнистые или даже бугристые. Складки слизистой у основания опухоли обрываются.
Описанную рентгенологическую картину трудно отличить от таковой при озлокачествленном и гиперплазированном полипе. Только при наличии неправильной формы, неровной поверхности или нечетких контуров таких экзофитных образований точный диагноз может быть поставлен на основе рентгенологических данных. В остальных случаях единственной особенностью экзофитного образования может быть широкое основание, а правильная форма и гладкая поверхность позволяют отличить его от доброкачественной аденомы, что заставляет прибегать к гистологической верификации.
Метод двойного контрастирования с использованием контрастных веществ только высокого качества (Fernando, Nakamura, 1986) позволяет выявить опухоли высотой от 5 мм и глубиной от 10 мм. Рак меньших размеров этим методом не обнаруживается.
Плоская форма —тип НВ (плоскоин-фильтрирующий, эндофитный рак) — наиболее сложна для диагностики и поэтому, видимо, реже других выявляется в I стадии заболевания. Она описана в основном японскими авторами, которые изучают эндоскопическую картину при этих опухолях. Рентгенологическая семиотика этих опухолей в нашей стране впервые описана Ю. Н. Соколовым в 1959 г., приводят ее и другие авторы. В. Б. Антонович (1987) рентгенологическую картину этих опухолей характеризует следующим образом: «На небольшом участке одна-две складки слизистой оболочки могут быть утолщены, промежутки между ними расширены, складки могут быть сглажены или наблюдается их обрыв. На участке измененного рельефа нередко может определяться маленькое депо бариевой взвеси, расположенное цент
рально или ближе к одному из краев этого участка. В части случаев выявляется ригидность малой кривизны в этой области и аперистальтическая зона на малой кривизне».
Известно, что при опухолевых поражениях слизистой оболочки желудка рентгенологически наблюдается локальное отсутствие или трансформация обычного рисунка желудочных ареол. Так, обнаружение ареол грубонодулярного типа должно ориентировать рентгенолога на тщательный поиск возможного опухолевого поражения. Локальное отсутствие и трансформация обычного рисунка желудочных ареол — важные рентгенологические признаки раннего рака желудка. При подслизистом распространении опухолевого процесса рисунок тонкого рельефа интактной слизистой сохраняется (Зубарев, 1987, 1988).
В литературе по рентгенодиагностике рака желудка недостаточно внимания уделяется деформации органа, особенно его малой кривизны. Л. В. Власова (1988) установила, что при выбухающем (полиповидном) типе начального рака парциальные деформации в рентгенологическом изображении в условиях тугого или полутугого заполнения желудка и дозированной компрессии проявлялись в виде краевого дефекта наполнения. Диаметр его основания равнялся поперечнику дефекта или был немного меньше его, а углы, образованные скатами опухоли и малой кривизной, чаще всего оказывались острыми или прямыми. Дефекты размером 1,5—2 см имели четкие и ровные контуры, а большие — волнистые или даже бугристые. Если основание опухоли малой кривизны распространяется на переднюю и заднюю стенки, то из-за скиалогических особенностей изображение дефекта наполнения будет двухконтурным. Складки слизистой у полюсов опухоли обрываются, в некоторых
же случаях на фоне дефекта видны продольные складки слизистой противоположной неизмененной стенки желудка. В условиях тугого заполнения желудка краеобразующая опухоль данного типа может проявляться и симптомом «плоской дощечки». Особенно четко этот симптом с тенью самой опухоли в просвете органа будет определяться при двойном контрастировании желудка.
При II типе опухолей — поверхностном (поверхностно-приподнятом, поверхностно-плоском, поверхностноуглубленном) парциальные деформации имеют вид выпрямленной ригидной площадки — «дощечки», напоминающей «вштампованную или впрессованную пластинку». Основное условие для выявления этой деформации — выведение опухоли на контур желудка, для чего так важно применять полипозици-онное рентгенологическое исследование желудка при ТЗ его и двойном контрастировании.
Существует прямая зависимость между типом опухоли, размерами ригидной площадки и степенью выраженности ра-кавого процесса. Так, в случае раннего рака II типа размеры площадки были 1,5—2 см, она меняла в какой-то степени свою форму на высоте перистальтики. Опухоли большей протяженности (до 4 см) всех трех подтипов, а поверхностно-плоские даже меньших размеров образуют стойкие ригидные площадки. Новообразования, локализующиеся в области угла, всегда вызывают его выпрямление. Все опухоли II типа часто сопровождаются нарушением перистальтики, давая симптомы «плавающей дощечки, качающейся на волнах», «упругой косточки от корсета», «скользящей дощечки» (Gutmann, 1967).
При новообразованиях типа ПА (поверхностно-приподнятые, или бляшковидные) на рентгенограммах после
тугого заполнения желудка чаще всего выявляется более или менее выраженная в зависимости от размеров опухоли ригидная площадка. В условиях двойного контрастирования отчетливее определяется неровный, шероховатый ее контур с бляшковидной тенью опухоли. Диаметр основания опухоли преобладает над ее высотой. Угол между тенью опухоли и неизмененной стенкой желудка тупой. Возможна асимметричная конвергенция складок слизистой ко всей тени опухоли или к одному из ее полюсов.
Наибольшие диагностические трудности возникают при поверхностноплоском раце — ПВ (инфильтративном), который может напоминать рубцовые изменения язвенной этиологии. Выраженная ригидная площадка может располагаться на уровне контура или быть слегка погруженной в просвет желудка на высоте перистальтической волны. Во время прохождения последней наблюдается симптом «дощечки, качающейся на волнах». Только эндоскопическое исследование желудка с прицельной биопсией позволяет уточнить диагноз.
Рак типа ПС (поверхностно-вдавленный, или эрозивный) в классификации Японского эндоскопического общества описывается как плоский язвенный дефект слизистой, углубляющийся и в подслизистый слой. Подобные раки предпочитают называть «эрозивно-язвенными», так как это понятие отображает как ту, так и другую фазы их развития. При ТЗ желудка раки этого типа на рентгенограммах проявляются парциальной деформацией в виде ригидной площадки с неровной, шероховатой поверхностью, погруженной в просвет желудка и меняющей в какой-то степени свою форму во время перистальтики. У верхнего полюса этой площадки довольно часто определяется ступенька Гаудека. Дозированная ком-
96. Зрелый экзофитный рак проксимальной части желудка:
а — малой кривизны; б — большой кривизны; в — свода.
прессия позволяет выявить эрозию или плоское изъязвление, которое имеет форму выпрямленного или изогнутого штриха. Если изъязвление располагается на задней стенке желудка у малой кривизны, на рентгенограммах в усло
виях пневморельефа вокруг изъязвления определяется неширокий плоский вал с нечеткими наружными очертаниями и конвергенцией к нему складок слизистой. При двойном контрастировании лучше видны само изъязвление,
опухолевый вал и рельеф слизистой вокруг новообразования. Эрозии опухолевого генеза во время и после прохождения перистальтической волны сохраняют остатки бариевой взвеси на своей поверхности в отличие от эрозии воспалительного характера. Необходимо отметить, что депо бариевой взвеси встречается и при псевдодеструктивной форме рака, т. е. при западении центра опухоли без изъязвления. Решить вопрос о происхождении депо контрастной массы может только фиброгастро-скопия.
Наибольшие дифференциально-диагностические трудности создает начальный рак III типа (углубленный, или экскавированный ). При эндоскопическом исследовании углубленный рак выглядит как дефект слизистой, края которого выступают над ее поверхностью, а глубина кратера превышает 5 мм. В рентгенологическом изображении он напоминает доброкачественную пептическую язву. Однако при детальном изучении ракового изъязвления можно найти некоторые отличительные признаки, например неровность контура самой ниши, негомогенность тени контрастированной ниши, отсутствие линии Хемптона, неполная асимметричная конвергенция складок слизистой к изъязвлению.
Таким образом, наиболее частой причиной образования парциальных деформаций малой кривизны желудка раковой природы являются малые опухоли одного из типов согласно классификации Японского эндоскопического общества. Выявление подобных деформаций в условиях поликлиники возможно при методически правильно проводимом рентгенологическом исследовании желудка с помощью, классической методики и двойного контрастирования. Однако описанные деформации контура малой кривизны в виде ригидной площадки характерны не только для рака.
Данные литературы и наши наблюдения показали, что они могут встречаться при хронических язвах, послеязвенных рубцах, рубцах после операций на желудке, доброкачественных опухолях, небольших саркомах. Знание парциальных деформаций желудка, выявляемых при диспансерных рентгенологических обследованиях, может послужить методом скрининга для более тщательного рентгено-эндоскопического исследования желудка в условиях стационара (Власова, 1988).
Дальнейшие пути эволюции начального рака различны. В каждом конкретном случае рентгенологическая картина зависит от макроскопического типа опухоли, локализации и стадии ракового процесса. Это положение обязывает изучать частную рентгеносемиотику отдельных форм рака желудка.
Зрелый экзофитный рак желудка определяется по дефекту наполнения неправильно-округлой формы с нечеткими контурами размером до 5—7 см. Часто наблюдается скопление (депо) бариевой взвеси в дефекте наполнения, что указывает на изъязвление его. У краев дефекта наполнения складки слизистой обрываются. Перистальтика желудка в области поражения отсутствует. В ряде случаев после частичной эвакуации бария из желудка может определяться симптом обруча и неспа-дение стенок. При локализации опухоли в кардинальном отделе изменяется форма газового пузыря, деформируется и утолщается свод желудка, появляются асимметричность и неровность его контуров. Характерен симптом айсберга, обусловленный тем, что основная часть опухоли скрыта в бариевой массе, а верхняя часть его выступает в виде дополнительной тени, проецируясь на газовый пузырь. В процесс очень часто вовлекается абдоминальный отдел пищевода, что вызывает его деформацию. Изменяются положение и функция пи-
9 2160
97. Чашеподобный рак желудка:
а — небольшой кратер с изъеденными контурами; б — большой язвенный кратер; в — овально-вытянутый язвенный кратер с неравномерноопухолевым валом.
щеводно-желудочного перехода. Пищевод отклоняется влево, и угол Гиса увеличивается до 90° (в норме 40—50°). Контрастная масса течет в желудок узкой зигзагообразной струей и далее неравномерно растекается по бугристой поверхности опухоли. Иногда выявляются симптомы «шприца» и «зияния кардии».
Симптом «шприца» проявляется выбрасыванием бариевой взвеси в желудок в виде узкой дугообразной или прямой струи или же она имеет форму «облака». У части больных попадание бария в желудок вызывает «волнение» поверхности желудочного содержимого типа «кипения воды», иногда струя имеет вид «водопада». Зияние кардии — несостоятельность жома пищеводно-желудочного перехода — развивается при субмукозном распределении и трансмуральной инвазии рака и сопровождается отсутствием газового пузыря желудка.
Бляшковидный рак желудка дает рентгенологически округлый, бесструктурный дефект на рельефе слизистой оболочки, реже — центральный дефект наполнения с четкими, ровными границами. В центре дефекта иногда видно пятно бария (более или менее глубокое депо) —результат изъязвления опухоли.
К экзофитным формам рака относится и чашеподобный 'рак — опухоль, растущая в просвет желудка, с кратерообразным изъязвлением и валикообразными краями, возвышающимися над слизистой оболочкой. Опухоль четко отграничена от окружающей слизистой оболочки желудка. При заполнении желудка бариевой взвесью выявляется дефект наполнения более 5—7 см с депо контрастной массы свыше 4 см в диаметре. Опухоль обычно неправильноокруглая или овальная, с четкими, неровными, иногда волнистыми и гладкими контурами. Дно раковой язвы неравномерно бугристое, а язвенный кратер глубиной до 1,5 см. Под нависаю
щими над дном кратера краями опухоли, в их подрытостях могут длительно задерживаться остатки бария после рентгенологического исследования. Опухолевой вал имеет неравномернобугристую поверхность, неодинаковую ширину (в среднем до 2 см) и высоту. Иногда определяется симптом «обруча», когда контрастная масса, обмазывая отвесные стенки опухолевого вала, создает тонкую кольцевидную тень, очерчивающую наружные границы опухоли. Выраженность рентгенологической картины чашеподобного рака зависит от степени заполнения желудка бариевой взвесью и дозированной компрессии. При ТЗ и без компрессии перечисленные рентгенологические признаки могут не выявляться.
Ю. Н. Соколов. В. Б. Антонович (1981, 1987) доказали, что на ранних стадиях развития вал опухоли имеет гладкую или слегка волнистую поверхность. В более поздних стадиях поверхность его становится неровной и бугристой. Вал начинает разрушаться, теряет свою четкую границу и образует постепенный, инфильтративный переход на соседние участки стенки желудка. Рентгенологически это проявляется прорывом вала, выраженной бугристостью его и исчезновением в местах прорыва симптома обруча. Чашеподобная форма рака желудка обладает выраженной инвазивностью и метастатической активностью (Несветов, Жданов, 1981).
Эндофитный рак желудка дает плоский дефект наполнения большой протяженности. Контуры дефекта иногда шероховатые, слегка волнистые, в большинстве случаев выпрямлены и видны только при тугом заполнении желудка бариевой взвесью. Стенка желудка на уровне дефекта наполнения ригидна, не перистальтирует. Нередко выявляются укорочение желудка из-за инфильтрации малой кривизны и его деформации. При тотальном поражении стенок же-
98. Эндофитный рак желудка:
а, б — поражение проксимальной части желудка и над- и поддиафрагмального сегментов пищевода; в, г — субтотально-поражение желудка
99. Тотальное раковое поражение стенок желудка:
а — микрогастрия; б — злокачественный рельеф слизистой оболочки;в — изъеденные контуры.
лудка развивается микрогастрия. Если раковая инфильтрация ограничивается телом желудка, возникает деформация по типу песочных часов. Складки слизистой ригидные, рельеф местами сглажен. При изъязвлении опухоли опреде
ляются неглубокие депо контрастно! массы (плоские ниши), к которым Mt-гут конвергировать складки слизистое Часто на границе опухолевой инфильтрации и нормальной стенки желудкг образуется угол из-за растягивания еп
tOO. Рак антрального отдела желудка:
а — с начальным» проявлениями; б — с резким сужением н удлинением; в — с сужением н изъязвлением
101. Рак проксимальный (а), средней (6) части и всего желудка (в).
нормальных стенок. Если опухоль локализуется в зоне привратника, обнаруживается дефект наполнения, деформирующий препилорический сегмент же-ледка, просвет привратника становится неровным, складки его слизистой исчезают. Эндофитный рак вызывает дефор
мацию и уменьшение в размерах верхнего отдела желудка. Расширение пь щевода или задержка бариевой взве« в его нижнем отделе должны наводит, на мысль об опухоли кардии.
Диффузный рак желудка локализуется чаще в антральном его отделе. Рен,г-
102. Некоторые язвенные формы рака желудка с локализацией ниши по малой кривизне:
а — в субкардиальном отделе;б — в теле желудка;в — варианты первично-язвенного рака.
генологически проявляется концентрическим и симметричным сужением и удлинением антрального отдела. Характерна беспорядочная зубчатость (изъ-еденность) по одной или обеим кривизнам. Не пораженная опухолью часть стенки желудка нависает на пораженную ее часть в виде ступенек. Рельеф слизистой в начале заболеванйя сглажен, в дальнейшем появляется «злокачественный рельеф». Перистальтика стенок в начальных стадиях болезни не нарушена, при резком сужении просвета органа — отсутствует, определяется аперистальтическая зона. В случаях субтотального и тотального поражения желудка раковая инфильтрация вызывает деформацию и сморщивание пораженных стенок, уменьшение емкости желудка и развитие микрогастрии.
По нашему мнению, следует выделять и язвенную форму рака желудка, когда преобладают симптомы изъязвления При рентгенологическом исследовании раковые ниши имеют свои особенности: продольный размер ниши больше ее поперечника и глубины, изъязвление располагается ближе к дистальному краю опухоли и параллельно длинной оси органа, оно неправильной формы с неровными бухтообразными очертаниями. Дно раковой язвы, как правило, неравномерно-бугристое. Инфильтративный вал вокруг ниши большой, асимметричный, вытянут в продольном направлении, края его слегка приподняты и неровные, как бы размытые. Если раковая ниша находится в центре дефекта, то она чаще округлой или конусовидной формы и подобна доброкачественной язве (но раковая ниша имеет плотные и плоские края с неровными контурами). Окончательный диагноз устанавливается с помощью эндоскопии с гастробиопсией, так как злокачественные и доброкачественные изъязвления по многим рентгенологическим показателям совпадают. Поэтому любая язва у
лиц старше 40 лет должна быть верифицирована путем 4-кратной биопсии дна и краев язвы.
Большими диагностическими возможностями при раке желудка обладает фармакорентгенодиагностика. Применение фармакостимуляторов в большинстве случаев позволяет подтвердить или исключить опухоль желудка. О наличии опухолевой инфильтрации стенки свидетельствуют отсутствие перистальтики при морфирной пробе, отсутствие понижения тонуса и расширения просвета желудка после приема или введения релаксантов и др.
По мнению И. С. Петровой (1979), для определения границ распространения опухоли некоторое значение имеет ангиографическое исследование. В очаге поражения наблюдается умеренная гиперваскуляризация, которую создают слабоизвитые, реже штопорообразные и фрагментированные сосуды. Опухолевый узел обычно контрастируется незначительно. Венозная фаза ангиографии изредка дает дополнительную информацию в виде раннего и хорошо различимого венозного оттока от опухоли. При тотальном поражении желудка экзофитные и инфильтративно-язвенные формы рака проявляются выраженной сетью собственно опухолевых сосудов, накоплением контрастного вещества в опухоли, интенсивным венозным оттоком от зоны поражения. В то же время диффузный рак на ангиограммах, как правило, дает слабо выраженные признаки опухолевого поражения, а порой имеет вообще негативную ангиографическую картину.
По результатам селективной ангиографии не всегда можно сказать о степени распространения рака желудка. Наш опыт и данные литературы говорят о том, что ангиографические симптомы при раке желудка не являются специфическими и во многом сходны с таковыми при язве и воспалительном
процессе. Поэтому из-за трудоемкости методики целиакографию широко применять в клинике не рекомендуется.
В поздних стадиях рак прорастает серозный покров желудка, выходит за его пределы и распространяется на соседние органы. Распространение процесса на малый сальник устанавливается рентгенологически по выходу контрастного вещества через измененную стенку малой кривизны. При прорастании стенки толстой кишки бариевая взвесь поступает в нее со стороны большой кривизны желудка. Распространение рака на тело поджелудочной железы и малый сальник проявляется выраженным смещением задней стенки желудка, неровностью ее контуров и укорочением малой кривизны. Наличие округлых плотных тенеобразований у контуров малой кривизны свидетельствует об увеличенных лимфатических4 узлах в малом сальнике. О степени распространенности новообразования на окружающие органы и ткани при тотальном поражении желудка судят и по изменению собственно желудочных и экстраорганных артерий бассейна чревной артерии и воротной вены. При этом в опухолевый процесс могут быть вовлечены одновременно все основные ветви чревного ствола, а нередко и сам ствол.
Таким образом, диагноз рака желудка ставится на основании результатов комплексного исследования больного: клинических данных, результатов рентгенологического исследования, фибро-гастроскопии и биопсии. Ни один из указанных методов не является самодовлеющим, нет оснований переоценивать роль некоторых из них и игнорировать значение других. Гастроскопия с использованием биопсии позволяет выявить ранний рак желудка в 95— 98 % случаев, в то время как одна эндоскопия — в 70 %. При 4-кратной биопсии во время эндоскопии вероят
ность выявления рака желудка повышается до 100 % (Stender, Seifert, 1977; Lawrence, 1980; Reitzig, Guts, 1980; Barentsz et al., 1986).
Диагностическая эффективность рентгенологического метода 60—99 %. Рентгенологически невозможно выявить неинвазивный рак и часть поверхностно распространяющихся опухолей. В установлении протяженности поражения при раке дистального отдела желудка рентгенологический метод и фиброгаст-роскопия равноценны. В оценке проксимальной границы поражения при эндофитном раке оба метода малоинформативны. Одним из путей ранней диагностики этой патологии является массовое рентгенологическое и эндоскопическое обследование групп повышенного риска с применением цитологического исследования мазков и соскобов из подозрительных участков. Что касается КТ, то она выявляет только патологическое утолщение стенки желудка более 10 мм и полезна лишь для оценки резекта-бельности опухоли, эффекта химиотерапии и лучевой терапии, диагностики рецидивов после операций (Lee et al., 1979; Grosser et al., 1985).
Все большее и большее применение находит УЗИ, с помощью которого визуализируется 50 % новообразований желудка в виде масс и 50 % — в виде утолщения стенок его. По данным УЗИ, толщина стенки желудка у здоровых людей 3—7 мм, в среднем 5,1±1,1 мм, а у больных раком желудка — 7—28 мм, в среднем 15,9 ±4,5 мм. Будущее гастроэнтерологии — за ЭУЗИ.
Прогноз у больных раком желудка на территории бывшего СССР, странах Европы и Америки остается плохим из-за поздней диагностики его. Средняя продолжительность жизни больных, перенесших операцию, 37,5 ±9 мес. (для женщин 47,8 ± 18,5 мес., для мужчин — 33,5±10,8 мес.). Показатель 5-летней выживаемости для всей группы 19,8 %,
103. Саркома желудка.
в том числе для перенесших резекцию желудка — 38,8 %, гастрэктомию — 16,7 %. Для больных, имевших более длительный анамнез, прогноз был лучше, чем при коротком анамнезе (Zilotto, Kunzle, De Souza, Colicchio-Filho, 1987; Mikulin, Hardcastle, 1987).
Саркомы. На эти неэпителиальные злокачественные опухоли приходится около 2 — 3 % злокачественных новообразований желудка. Саркома чаще поражает лиц в первом периоде зрелого возраста. Опухоль преимущественно располагается по большой кривизне, реже на передней и задней стенках, по малой кривизне. Исключительно редко саркома локализуется в антрально-пилорическом и кардиальном отделах. Из всех видов сарком наиболее часто встречаются ретикулосаркомы (лимфосарко-мы), затем идут миосаркомы, фибросаркомы, злокачественные невриномы,
полиморфно-клеточные саркомы и др. (Петерсон и соавт., 1979).
Исходя из оболочек стенки желудка, опухоль может расти в просвет желудка в виде небольших полипов, чаще на широком основании, или кнаружи от него, в брюшную полость, сдавливая и прорастая соседние органы. Наиболее часто встречаются инфильтрирующие опухоли, которые быстро растут вдоль желудочной стенки, прорастают желудок на большом протяжении в виде бугристых узлов, впоследствии распадающихся с образованием обширных язв. Наблюдается и смешанный (эндоэкзогастраль-ный) тип роста саркомы, которая достигает иногда больших размеров. В регионарные лимфатические узлы, легкие, костный мозг, кожу и другие органы 30 % сарком желудка дают метастазы. Более злокачественно протекают круглоклеточная и миосаркома. Веретеноклеточная саркома обычно не дает метастазов, лимфо- и фибросаркомы метастазируют поздно.
Рентгенологическая картина отличается большим полиморфизмом и зависит от характера роста и стадии процесса. При тотальном поражении желудка образуются большие, сливающиеся друг с другом дефекты наполнения, между которыми расположены широкие ригидные складки слизистой. Из-за малой емкости желудка контрастная взвесь задерживается в пищеводе. Желудок имеет форму воронки со значительно суженным, горизонтально расположенным выходным отделом. Контуры стенок его неровные. На фоне пораженной слизистой оболочки желудка могут выявляться единичные или множественные изъязвления — депо контрастного вещества с подрытыми неровными краями. Эвакуация бариевой взвеси из желудка замедлена или происходит непрерывной струей.
В случае узловатой формы саркомы выявляются солитарные или множест
венные округлые или овальные дефекты наполнения. Перистальтика обычно не нарушена. При инфильтративной форме роста стенки желудка утолщены, ригидны. Если опухоль растет преимущественно в брюшную полость, то в области поражения желудка определяются небольших размеров плоский дефект контура, умеренное сужение просвета желудка и несоответствие большой пальпируемой опухоли мало выраженным рентгенологическим симптомам.
Диагностика саркомы желудка дол
жны быть комплексной, главная роль в ней принадлежит рентгенологическому исследованию (эндоскопический метод базируется лишь на косвенных данных) . Морфологически подтвердить диагноз чрезвычайно трудно или вообще невозможно, так как опухоль растет под слизистой. Окончательный диагноз ставится после хирургического вмешательства и гистологического исследования препарата. Без лечения больные живут 1 — 2 года и погибают от метастазов.
Глава 18. РЕДКИЕ ЗАБОЛЕВАНИЯ
Врачу в своей практической работе приходиться встречаться с так называемыми редкими заболеваниями желудка, которые описаны в литературе в виде отдельных наблюдений. Мы сделали попытку собрать эти редкие заболевания. При изложении материала учитывались современные представления о патогенезе и диагностике таких заболеваний.
Эозинофильная гранулема желудка. Болезнь характеризуется развитием в желудке опухолеподобного инфильтрата, состоящего из крупных гистиоцитов и эозинофилов. Она относится к группе ретикулогистиоцитозов и считается -среди них наиболее доброкачественным заболеванием. Встречается в любом возрасте в ограниченной (полиповидной) или диффузной (инфильтрирующей) форме. Обычно поражается антральный отдел желудка. Заболевание протекает длительно — от 3 до 25 лет.
Клиническая картина не имеет характерных признаков и зависит от локализации, вида и распространенности поражения. В отдельных случаях больные предъявляют жалобы на боли в эпигастральной области, тошноту, рвоту и др. При изъязвлении возникает желудочное кровотечение и даже перфорация. Нередко отмечаются вегетативная лабиль
ность, психическая неустойчивость и предрасположенность к аллергическим заболеваниям. Часто определяется гистаминорефрактерная ахлоргидрия, в кале кристаллы Шарко — Лейдена. В периферической крови наблюдается эозинофилия у 24—30 % больных, как правило свидетельствующая об инфильтративной форме поражения. При наличии асцита или полисерозита асцитическая жидкость богата эозинофилами. У больных с преимущественным поражением слизистой оболочки имеет место синдром мальабсорбции с потерей белков, гипохромной анемией. При поражении мышечной ткани наблюдается обструктивный синдром, при поражении серозного покрова — асцит и перитонит.
Диагностика эозинофильной гранулемы желудка чрезвычайно трудна и практически стала возможна в результате улучшения качества рентгенологического исследования и фиброэндоско-пии с биопсией. Последняя может помочь в диагностике только при биопсии подслизистого участка стенки желудка.
Рентгенологическая картина эозинофильной гранулемы желудка разная. Она зависит от формы поражения и характера роста гранулемы. При локализованной форме заболевания в антральном отделе определяется дефект
наполнения с четкими контурами, напоминающий доброкачественную опухоль. При изъязвлении гранулемы обнаруживают депо бария в дефекте наполнения. Иногда эозинофильная гранулема становится подвижной и выпадает в 12-перстную кишку вместе со слизистой желудка. В редких случаях заболевание сочетается с язвой или раком желудка, но сама гранулема никогда не озлока-чествляется. При инфильтративной форме в месте поражения отмечаются ригидность стенки желудка и замедление перистальтики. В отличие от рака при диффузных гранулемах процесс может переходить на 12-перстную кишку и другие отделы кишечника, сальник и брыжейку. В дифференциальной диагностике часто помогает пробное гормональное (глюкокортикоиды) лечение, сопровождающееся положительной динамикой рентгеноэндоскопической картины, уменьшением эозинофилии. Прогноз при эозинофильной гранулеме желудка благоприятный.
Лимфогранулематоз желудка. Изолированный лимфогранулематоз желудка относится к весьма редким опухолевым заболеваниям мезенхимального ряда или к злокачественным лимфомам. В основе этих заболеваний лежит опухолевидная пролиферация лимфоидной и ретикулярной ткани. Лимфогранулематоз желудка составляет 0,5—2,5 % злокачественных опухолей желудка.
Клиническая картина нехарактерна. Из симптомов следует отметить отсутствие боли при наличии опухоли, безболезненность при пальпации, частые желудочные кровотечения, лихорадку, кожный зуд, изменения гемограммы (лимфопения, резко увеличенная СОЭ, лейкоцитоз и др.).
Рентгенологическая картина весьма разнообразна. Наиболее часто процесс поражает область большой кривизны и передней стенки желудка. Узловатая форма лимфогранулематоза рентгеноло
гически проявляется солитарными или множественными, округлыми или овальными дефектами наполнения. Складки слизистой оболочки чаще огибают опухолевидное образование, если оно небольших размеров, или могут обрываться у его краев при значительных размерах гиперплазированной лимфоидной ткани. Перистальтика желудка обычно не нарушена. При инфильтративной форме стенка желудка утолщена. В некоторых случаях лимфогранулематозная инфильтрация распространяется и на 12-перстную кишку. Складки слизистой расширены, полипообразно выпячены, склонны к изъязвлению. Перистальтические волны небольшой глубины, замедлены.
При ранней стадии лимфомы имеет место плавное утолщение складок слизистой оболочки. Утолщенные складки легко деформируются, а при раздувании желудка сглаживаются. Изъязвление, как правило, имеет вид плоского углубления с неровными контурами, реже это глубокий кратер.
К основным рентгенологическим симптомам лимфогранулематоза желудка относят изъязвления, выступающие в просвет органа, полипоидные образования, изменения рельефа слизистой и стенок желудка. При использовании УЗИ основными симптомами первичной злокачественной лимфомы желудка являются так называемая кокарда или полукокарда за счет диффузной или локальной инфильтрации стенки желудка, а при КТ — утолщение стенки желудка, перигастральная инфильтрация и асцит. По нашему мнению, методы УЗИ и КТ имеют вспомогательное значение по отношению к обычному рентгенологическому исследованию.
Склеродермия желудка. При системной склеродермии нередко поражается и желудок. В стенке его, главным образом в подслизистом слое, разрастается фибриноидно измененная соединитель
ная ткань. Чрезмерное развитие этой ткани приводит к дегенерации и атрофии мышечного слоя, истончению слизистой. Отмечается распространенное поражение сосудов с облитерацией просвета и нарушением питания, приводящее в ряде случаев к изъязвлению.
Клинические проявления сводятся к потере аппетита, чувству полноты и тяжести в эпигастральной области, возможно снижение кислотности желудочного сока вплоть до ахилии. Фибро-гастроскопия, даже с биопсией слизистой, малоэффективна, так как патологический процесс развивается в подслизистом слое.
Рентгенологическая картина характеризуется некоторым утолщением и ригидностью складок слизистой, гипотонией желудка, образованием изъязвлений. В отличие от рака желудка подобные изменения находят в пищеводе и других отделах пищеварительного тракта.
Болезнь Крона. Первое описание болезни Крона с локализацией в желудке принадлежит F. Martin и R. Carr (1953). Этиология ее полностью не изучена. Считают, что прогрессирующий облитерирующий лимфангит подслизистого слоя приводит к изъязвлению слизистой оболочки, а кишечная инфекция присоединяется к этому процессу.
Клинически заболевание проявляется схваткообразными болями в эпигастральной области или во всем животе, если поражены и другие отделы пищеварительного тракта. Эти боли не поддаются антацидной терапии. Часто наблюдаются тошнота и рвота, которые бывают обусловлены нарушением проходимости выходного отдела желудка. Более чем в половине случаев наблюдаются поносы, астения, похудание и лихорадка. Иногда возникает гастродуоденальное кровотечение, которое носит упорный, массивный характер. Приступы печеночной колики свидетельствуют о вовлечении в воспалительный про
цесс фатерова соска. Нередко больные жалуются на боли в коленных и голеностопных суставах без признаков местного воспаления, температуры и симптомов со стороны сердца. Исследование желудочной секреции обнаруживает ахлоргидрию, в крови определяются гиперлейкоцитоз, высокая СОЭ, макроцитарная анемия, гиполипимия, гипокальциемия и гипопротеинемия. Если будут внутренние желудочно-кишечные свищи, то у больных отмечаются профузные поносы и катастрофическое ухудшение состояния.
Рентгенологическая картина характеризуется деформацией антрального отдела за счет неравномерной инфильтрации его и ригидностью стенки органа, сужением просвета и вялой перистальтикой.
К ранним симптомам относятся атония и вялая перистальтика. Позднее развивается сужение просвета выходного отдела желудка, вызванное отеком, а впоследствии фиброзом его стенки. Возможны множественные эрозии слизистой оболочки. Наиболее информативными рентгенологическими методами являются двойное контрастирование и париетография.
Карциноид желудка. На долю этого полузлокачественного новообразования приходится около 0,3 % злокачественных опухолей желудка и 2,3 % карциноидов пищеварительного тракта (В. Б. Антонович, 1987). Опухоли возникают в подслизистом слое желудка в основном у мужчин старше 40 лет.
Клинически почти не проявляется, чаще протекает бессимптомно и выявляется случайно. Но в практике бывают случаи, когда в клинике может иметь место карциноидный синдром, характеризующийся приступообразными и постоянными симптомами: быстрым изменением окраски верхней половины туловища, лица, шеи от красного до багрово-цианотичного, чувством жа
ра, обильным потоотделением, сердцебиением, приступами удушья, головокружением и др.
Рентгенологическая картина разнообразна. В одних случаях выявляется дефект наполнения, напоминающий полип, в других — имеют место изъязвления и инфильтрация стенки желудка. Иногда карциноид бывает в виде большой ниши, окруженной инфильтративным валом. Чаще процесс локализуется на малой кривизне желудка. При расположении карциноида в выходном отделе развивается его стеноз. Опухоль может метастазировать в позвоночник, кости таза, ребра, бедренные и плечевые кости. При отсутствии карциноидного синдрома для постановки диагноза необходимо гистологическое исследование биоптатов.
Саркоидоз желудка. Относится к группе хронических эпителиоидно-клеточных ретикулоэндотелиозов. Поражает желудок в 1 % случаев. Заболевание встречается в возрасте от 20 до 40 лет одинаково часто среди лиц обоего пола. Морфологическим субстратом саркоидоза является туберкулоидная гранулема, которая вначале локализуется в слизистой оболочке.
Клинические проявления своеобразные, у разных больных различные. Иногда больные жалуются на боли в эпигастральной области, в других случаях — на рвоту и похудание, в третьих — на желудочное кровотечение и др.
Рентгенологическая картина сарко-идозд желудка может проявляться в виде стенозирующей опухоли антрального отдела желудка, симулирующей скирр, или в виде язвы. Помогает в постановке диагноза фиброгастроби-опсия.
Амилоидоз желудка. Чаще всего встречается вторичный амилоидоз желудка, развивающийся при туберкулезе, гнойно-деструктивных процессах в легких, остеомиелите и других длительно
и тяжело протекающих заболеваниях. При амилоидозе желудка амилоидное вещество откладывается как внутри, так и вокруг мелких кровеносных сосудов подслизистого слоя, между мышечными волокнами, что способствует развитию атрофии и изъязвлению слизистой оболочки.
Клинические проявления: жалобы на потерю аппетита, тошноту, рвоту, изжогу, чувство тяжести в подложечной области и другие симптомы.
Рентгенологическая картина локализованного амилоидоза напоминает таковую при опухоли и зависит от ее локализации. Опухолевидная форма заболевания встречается в виде отдельного узла, инфильтрата, язвы и полипоза. Наиболее часто характерными рентгенологическими признаками являются угнетение двигательной деятельности желудка, воронкообразное сужение и ригидность антрального отдела, задержка опорожнения органа на многие часы после приема бариевой взвеси. Отмечаются также утолщение складок слизистой и наличие дефектов наполнения. Дифференциальную диагностику необходимо проводить в основном с раком желудка. При амилоидозе желудка типично наличие амилоидного поражения других органов. В диагностике большую помощь оказывают фиброгаст-роскопия с биопсией.
Микоз желудка. В последние годы заметно возросло число грибковых заболеваний, среди которых наибольший интерес представляет микоз желудка. Выделяют 3 его типа: 1) когда колонии грибков образуют сплошную массу, которая почти полностью заполняет желудок; 2) колонии в виде многочисленных мелких узелков размером 3— 5 мм в диаметре; 3) комбинация первых двух типов колоний. Для всех типов характерно, что грибковые массы не прилипают к стенке желудка и свободно перемещаются в просвете его,
напоминая инородное тело (безоар). Клиническая картина не характерна.
Рентгенологически обнаруживают неравномерные дефекты наполнения, смещающиеся в просвете желудка. Окончательно диагноз устанавливается при микроскопическом исследовании и после посева на соответствующие среды материала, полученного с помощью фиброгастроскопа.
Гистоплазмоз желудка. Инфекционная болезнь из группы системных микозов, вызываемая гистоплазмой. Характеризуется гиперплазией элементов ретикулоэндотелиальной системы желудка. Чаще наблюдается у детей. Клинически проявляется тошнотой, рвотой, редкими желудочными кровотечениями, поносами, спленомегалией, истощением, лихорадкой и др.
Рентгенологическое исследование обнаруживает гиперсекрецию, инфильтративные изменения рельефа слизистой и полиповидные разрастания, часто с иъязвлениями, затруднение эвакуации бариевой взвеси из желудка в результате сужения просвета его выходного отдела. Дифференциальная диагностика с опухолеподобными заболеваниями облегчается реакцией повышенной чувствительности на гистоплазмин, а также пункцией грудины и микроскопией лимфатических узлов, в которых находят гистоплазму.
Мукороз желудка. Мукороз вызывается низшими плесневыми грибами. Они распространены в природе, могут быть сапрофитами в организме человека, но при определенных условиях становятся патогенными. Особенно интенсивно возбудители мукороза развиваются на фоне сахарного диабета, лечения стероидными гормонами, антибиотиками и иммунодепрессантами.
Выделяют два типа поражения желудка мукорозом — глубокая инвазия гриба в стенКу и поверхностная локализация колоний на слизистой оболоч
ке без резкой воспалительной реакции. Прорастая через стенки сосудов, мицелий гриба образует сплетения, что приводит к развитию тромбозов и инфарктов стенки желудка. Наступает некроз ткани, и прогноз в этом случае становится крайне неблагоприятным.
Клинические признаки: боли в эпигастральной области, слабость, тошнота, рвота, возможны желудочные кровотечения и перферации стенки желудка с развитием перитонита.
Рентгенологическая картина своеобразна и зависит от характера поражения стенки желудка. Прежде всего изменяется рельеф слизистой оболочки за счет обширных возвышающихся участков ее, которые имеют неправильные очертания, но четкие границы. При прогрессировании процесса на пораженных участках образуются язвы различной величины — от 1 см и больше, в которых задерживается контрастное вещество.
В диагностике помогают специфические аллергологические пробы и серологические реакции с сывороткой больного и антигенами из аутоштаммов, полученных в очаге поражения.
Синдром Ослера. Это наследственная телеангиэктазия кожи и слизистых оболочек внутренних органов, в том числе желудка. Встречается у лиц обоего пола, нередко проявляется впервые в детстве в виде носовых кровотечений. Клинические симптомы: желудочные кровотечения, вторичная постгеморрагическая анемия и др.
Рентгенологическая картина обусловлена наличием сгустков крови в желудке, которые образуют дефекты наполнения в антральном отделе, свободно перемещающиеся при компрессии и напоминающие остатки пищи. При смещении этих дефектов под ними обнаруживаются складки слизистой оболочки. Иногда рентгенологически можно выявить и изъязвления типа Дьелафуд.
Они располагаются чаще в кардиальной части желудка параллельно малой кривизне, отступая от нее на 3—4 см. Ниши имеют круглую, овальную или звездчатую форму. Располагаются они на полипоподобных образованиях размером 3—5 мм в диаметре.
В диагностике желудочных кровотечений при синдроме Ослера большое значение имеет эндоскопическое исследование. Обнаружение на слизистой телеангиэктазий решает вопрос диагностики.
Варикоз желудка. Узловато-расширенные вены желудка наиболее часто наблюдаются при застойных явлениях в портальной системе на почве цирроза печени, тромбоза воротной или селезеночной вен, сдавления воротной вены опухолевым процессом или камнями желчных протоков, сифилиса и опухоли печени, врожденного или рубцового сужения воротной вены, тромбофлебитической спленомегалии, лимфоидной лейкемии, сопровождающейся увеличением селезенки. Реже расширение вен желудка имеется при сердечной декомпенсации, сдавлении и врожденных аномалиях верхней полой вены. Варикоз желудка, как правило, сочетается с варикозом пищевода.
Клинически наиболее частый и нередко первый симптом — профузное кровотечение или кровавая рвота. Они могут наблюдаться на фоне кажущегося полного благополучия у людей, считающих себя здоровыми или страдающих хроническими заболеваниями печени. Как при всяком профузном кровотечении, у больных наблюдаются головокружение, резкая общая слабость, бледность кожных покровов, чувство страха, жажда и другие признаки, характерные для быстро развивающегося и нарастающего малокровия.
Рентгенологическая картина: утолщение и извилистость складок слизистой оболочки в основном верхней
трети желудка с ослаблением перистальтики его из-за отека стенок. Свод желудка утолщен, газовый пузырь деформирован. Одновременно подобные изменения отмечаются и в пищеводе. Возможно изменение и положения желудка из-за увеличения печени и селезенки.
Актиномикоз желудка. Актиномикозом желудок поражается исключительно редко. В зависимости от пути заражения различают околожелудоч-ный и интрамуральный актиномикоз желудка. Первый встречается чаще и характеризуется наличием воспалительного инфильтрата или абсцесса в тканях, прилегающих к желудку. Заболевание развивается в результате заражения брюшной полости актиномице-тами во время перфорации язвы, при ранении живота и хирургическом вмешательстве. Поражению желудка актиномикозом нередко сопутствуют поддиафрагмальный и подпеченочный абсцессы.
Клинически различают 3 стадии болезни: 1) в подслизистой желудка образуются актиномикозы, которые симулируют гастрит, язвенную болезнь, опухоль. Больные жалуются на периодические боли и ощущение тяжести в эпигастральной области, тошноту, рвоту, похудание, частый и жидкий стул; 2) образование ограниченных плотных инфильтратов в эпигастральной области, малоболезненных при пальпации. При гастроскопии можно выявить плоские возвышения с изъязвлением в центре; 3) формируются свищи. Этому предшествуют усиление болей в животе, повышение температуры тела, анемия, лейкоцитоз.
Рентгенологическая картина характеризуется изменением рельефа слизистой оболочки. При наличии изъязвлений имеют место нишевые образования, а при разрастании актиномикомы появляются дефекты наполнения. До
вольно часто в центре дефекта наполнения определяется округлое депо бария. Если свищи наружные, с помощью фистулографии можно увидеть множественные ветвящиеся свищевые ходы, сообщающиеся иногда с просветом желудка или другими отделами пищеварительного тракта.
Для диагностики используют кожные аллергические реакции, реакции связывания комплемента. В 80—88 % случаев эти реакции бывают положительными. Однако диагноз актиномикоза в основном должен ставиться при выявлении друз лучистого гриба в тканях.
Аберрантная поджелудочная железа. Порок развития, при котором отдельные участки железы располагаются изолированно от основного органа. Встречается в 5—6 % всех вскрытий. На желудок приходится 25 % дистопий поджелудочной железы. Частота локализаций островков ПЖ в антральном отделе составляет 58,3 %, на малой кривизне — 28,8, на большой — 12,4, в зоне кардии — 8,5 % (Пономарев, Курыгин, 1987).
Клинически присутствие аберрантной ПЖ в стенке желудка, как правило, ничем не проявляется.
При рентгенологическом исследовании обнаруживают куполообразный дефект наполнения, напоминающий доброкачественную опухоль с ровными контурами. В случае небольших дефектов наполнения складки слизистой огибают его. Часто в центре дефекта наполнения выявляют небольшое пятно бариевой взвеси, обусловленное устьем выводного протока дополнительной ПЖ Если аберрантная ПЖ локализуется в антральном отделе, наступает его сужение из-за циркулярной инфильтрации, перистальтика здесь вялая вплоть до непроходимости пилорического канала.
Метастатическая опухоль желудка. Встречается редко (приблизительно в
1 % случаев). Наиболее часто в желудок метастазируют рак молочной железы и пищевода, реже — рак легкого, матки и меланома кожи. Метастазами поражаются преимущественно антральный отдел и нижня треть тела желудка. Метастазы бывают единичные и множественные. Имеют вид узлов, резко отграниченных от окружающих здоровых тканей, сидящих на широком основании или связанных со стенкой желудка ножкой. Могут изъязвляться и кровоточить.
Клинически метастатическая опухоль желудка проявляется симптомами основного заболевания, а со стороны желудка жалоб может и не быть.
Рентгенологически при контрастировании желудка бариевой взвесью метастазы дают одиночные и множественные дефекты наполнения, чаще округлой формы. Контуры их четкие. Размеры различные — диаметр может колебаться от 0,5 до 5 см. При наличии ножки опухоль смещается. В случае изъязвления опухоли в центре дефекта наполнения определяется депо бария и картина напоминает симптом мишени. Для окончательного решения вопроса показана фиброгастроскопия с биопсией.
Плазмоцитома желудка. Это локальное, в виде опухоли, проявление миеломной болезни. Изолированная плазмоцитома чаще наблюдается в молодом возрасте, не сопровождается клиническими признаками, характерными для миеломной болезни. Рентгенологически характеризуется наличием неправильной формы дефекта наполнения, суживающего просвет органа. Опухоль часто прорастает окружающие ткани. Диагноз устанавливают по результатам гистологического исследования.
Эмфизема стенки желудка. Патология редкая, характеризуется накоплением газа в стенке желудка из не
бактериального источника. Образованию газа часто предшествуют растяжение желудка и рвота. Развитию этой патологии способствуют легочные заболевания, инструментальные исследования желудка и обструктивные
поражения антрального и пилорического отделов. Больные чаще жалуются на тошноту и рвоту. При рентгенологическом исследовании находят расширение желудка и наличие интрамурального газа (Lee, Rutledge, 1984).
Глава 19. ИНОРОДНЫЕ ТЕЛА И ПОВРЕЖДЕНИЯ
В практической деятельности вра- 1 ча-рентгенолога нередко приходится ) иметь дело с инородными телами и 1 повреждениями желудка, т. е. заниматься неотложной рентгенодиагностикой. 1 От условий организации рентгенологической службы и соблюдений алго- 1 ритма деятельности зависить успех диагностики.
Инородное тело желудка. Встречает- i ся довольно часто. Оно бывает одиночным и множественным, металличе- ] ским и неметаллическим. Металличе- 1 ские инородные тела можно обнаружить без дополнительного контрастирования. Для определения места точной лока- 1 лизации инородного тела рекомендует- ( ся принять 2—3 глотка контрастного i вещества, которое обрисовывает контур 1 желудка. Контрастное вещество необ- i ходимо применять при невидимых 1 инородных телах, дающих рентгеноло- 1 гическую картину дефекта наполнения той или иной формы. Следует обяза- 1 тельно проверить подвижность (сме- 1 щаемость) инородного тела в просвете i желудка путем пальпации под экраном 1 и перемены положения больного. Отсут- : ствие динамики в продвижении инород- ’ ного тела в течение 3—5 дней заставляет заподозрить внедрение его в стенку 1 органа или выхождение за пределы органа. В связи с этим требуется тща- 1 тельный осмотр брюшной полости, чтобы выявить признаки перфорации < или абсцесса. <
Травматическое повреждение желуд- j
ка. При тупой травме живота повреждение желудка встречается довольно часто. Клиническая диагностика закрытых повреждений желудка, особенно в случае сочетанной и множественной травмы живота, нередко вызывает большие затруднения. Клинически травматические повреждения желудка проявляются картиной шока и резкими болями в надчревной области.
Рентгенологическое распознавание разрыва желудка базируется на появлении свободного газа в брюшной полости, лучше всего выявляемого при латерографии в положении больного на левом боку, чаще — на спине. Свободный газ в виде узкой полоски располагается под передней брюшной стенкой. Если излившейся свободной жидкости и газа много, может обнаруживаться широкий горизонтальный уровень жидкости. Наряду с этим определяются высокое стояние и ограничение подвижности левого купола диафрагмы; возможно однородное затемнение левой поддиафрагмальной области за счет наибольшего скопления жидкости вблизи места разрыва. При этом могут отсутствовать или быть нечеткими контуры селезенки и печени: петли тонкой и толстой кишок умеренно вздуты.
Отсутствие свободного газа и жидкости в брюшной полости не исключает повреждения желудка. В неясных ситуациях необходимо прибегать к исследованию желудка с помощью контрастных средств.
Чаще всего в желудок через зонд вводится 500—600 см3 закиси азота или углекислого газа. Больной при исследовании находится в горизонтальном положении на левом боку. Если на снимке при латерографии обнаруживают газ в правом боковом канале, это свидетельствует о повреждении стенки желудка. Можно применять и водорастворимые контрастные вещества. Выход введенного в желудок контраста в брюшную полость говорит о нарушении целости стенки желудка.
Ожоги желудка. Возникают чаще всего от местного воздействия теплового или химического фактора, реже — от ионизирующего излучения. Основная цель рентгенологического исследования — раннее определение локализации и степени поражения органа. Противопоказание к исследованию — лишь состояние шока. При тяжелой форме отравления кислотами и щелочами в первые 3 дня ограничиваются производством обзорных снимков, чтобы выявить различные осложнения со стороны грудной и брюшной полостей. Исследовать пищевод и желудок можно по истечении 6—8 дней.
Ожог желудка в остром периоде сопровождается образованием большого количества слизи и жидкости. Рельеф представлен резко утолщенными, подушкообразными складками слизистой оболочки. Нередко с первых же дней отмечается деформация желудка за счет отека и сужения выходного отдела. Ожоговые язвы и эрозии в преобладающем большинстве случаев значительных размеров, без воспалительного «вала» и локализуются на задней стенке антрального отдела. В период мнимого благополучия, когда воспалительные явления стихают, проводить исследование нежелательно. В позднюю стадию при обширных поражениях развивается микрогастрия. Возможна деформация желудка в виде песочных ча
сов, улитки, фляги и т. п. Если поражен препилорический отдел, имеет место рубцовое его сужение с неровными контурами вплоть до стеноза привратника. Перистальтика здесь отсутствует. Отмечается длительная задержка бариевой взвеси в желудке.
Безоары (псевдоопухоли желудка). Это инородные тела растительного или животного происхождения, которые появляются и развиваются в желудке и не подвергаются переваривающей деятельности желудочного сока («безоар» — по-арабски «противоядие»). Произошло название от особой породы коз, живущих на Ближнем Востоке, которые при облизывании заглатывают большое количество шерсти. В желудке козы из нее возникают плотные шары. Эти образования ранее применялись в восточной медицине в качестве противоядия при различных отравлениях. В зависимости от происхождения различают несколько типов безоаров: фито-, трихо-, пило-, себо-, шеллак-, пиксо-, гемато-, псевдобезоары и смешанные безоары.
Фитобезоары встречаются наиболее часто — около 75 % всех безоаров. Их причиной являются стручки, оболочки, зернышки фруктов,.особенно незрелых фиников, слив, апельсинов, кокосовых орехов, тыквы, изюма, петрушки и других растений. Наиболее часто причиной безоара служат плоды кавказской хурмы, которые богаты клетчаткой и трудно перевариваются. Фитобезоары из хурмы могут развиваться за несколько дней и даже часов.
Трихо- и пилобезоары образуются при попадании в желудок волос и шерсти. Трихобезоары наблюдаются у нервных субъектов, имеющих привычку грызть концы своих волос. Чаще зто дети. Такие безоары иногда достигают громадных размеров и заполняют весь желудок. Пилобезоары встречаются у лю
дей, занятых стрижкой овец, уходом за домашними животными.
Себо- или стибобезоары развиваются при употреблении в растопленном виде козьего и говяжьего жира. В желудке при его приеме происходит кристаллизация триглицеридов и образование жировых камней. Пиксо- и шеллакбе-зоары образуются из смолистых веществ, в частности последние — при приеме внутрь спиртовых растворов шеллачной смолы (лаков, политур). Гематобезоары формируются из сгустков излившейся в желудок крови. Причины их возникновения — кровотечения из язв, варикозно-расширенных вен пищевода, сильные носовые кровотечения. Выделяют и псевдобезоары, появляющиеся из плохо прожеванной пищи, сухого молока, слизи и др.
Большая часть безоаров обнаруживается в оперированном желудке. Нередко они развиваются в культе желудка после его резекции, особенно после органосберегающих операций, в частности после пилоропластики, сопровождающейся стволовой или селективной ваготомией. По литературным данным, образование безоаров после обычной резекции наблюдается в 0,4 % и после ваготомии — в 7,4 % случаев.
Способствуют образованию фитобезоаров после операций на желудке снижение кислотообразования и пептической активености желудочного сока, нарушение моторно-звакуаторной функции желудка, большое кличество густой и вязкой слизи, которая склеивает остатки богатой клетчаткой и трудно переваривав мой пищи. Имеет значение и характер микрофлоры желудка после оперативных вмешательств, усиленное развитие дрожжеподобных грибков, которые играют роль «затравки» в формировании безоаров.
Клиническая картина зависит от ве
личины и сроков пребывания безоаров в желудке. Как правило, заболевание начинается постепенно, за исключением безоаров, образовавшихся из плодов кавказской хурмы. Наиболее частые жалобы: чувство тяжести в эпигастральной области, периодические или постоянные боли и желудочный дискомфорт, который связан с нарушением эвакуаторной функции желудка. Клинически безоары могут симулировать язвенную болезнь желудка, стеноз привратника, доброкачественную и злокачественную опухоли. Частые осложнения безоаров желудка — пролежни-язвы, частичная или полная непроходимость, множественные эрозии, приводящие к кровотечениям.
Безоары желудка имеют весьма характерные рентгенологические симптомы. При исследовании желудка с помощью бариевой взвеси определяются единичный или множественные дефекты наполнения, на фоне которых могут быть видны неравномерные скопления бария на обычно неровной поверхности безоара. Эти инородные тела в большинстве случаев располагаются в верхнем отделе желудка и выявляются на фоне газового пузыря в виде патологического образования. В процессе по-липозиционного исследования и дозированной компрессии отмечаются смещае-мость безоаров и отделение их от стенки желудка, т. е. обнаруживаются свободно плавающие образования.
Более убедительные симптомы безоара могут наблюдаться при пневмо-гастрографии или париетографии: безоар отделяется от стенок желудка, свободно перемещается при пальпации или изменении положения тела больного, стенки желудка сохраняют обычную толщину. Эффект смещения безоара получить удается далеко не всегда, что может объясняться массивностью его или спаянностью со стенкой желудка, состоянием самого органа.
После хирургических вмешательств на желудке возникают благоприятные условия для выживания и размножения грибов. Развитие грибковой флоры может быть вторичным: грибы растут на уже сформировавшихся безоарах, как на питательной среде. Однако при определенных условиях крупные скопления грибковых колоний сами становятся безоарами. Такие микобезоары могут прикрепляться к стенке желудка, имитируя экзофитные образования, или, оторвавшись от слизистой оболочки, свободно плавать в содержимом желудка, становясь рентгенологически неотличимыми от остатков пищи (Айзенштат, 1978).
С широким внедрением в практику фиброгастроскопии проблема диагностики безоаров значительно упростилась. Гастроскопист, будучи ориентирован рентгенологом, может получить дополнительные сведения о внутренней поверхности желудка и о составе, форме, размерах и консистенции безоар-ных масс. Имея возможность непосредственного визуального исследования, а также инструментальной пальпации образования, он может с большой достоверностью судить не только о природе безоара, но и о выборе метода лечения.
Г л а в а 20. РЕНТГЕНОЛОГИЯ ОПЕРИРОВАННОГО ЖЕЛУДКА
Подавляющее большинство хирургических вмешательств на желудке осуществляется по поводу язвенной болезни и новообразований. В каждом конкретном случае характер оперативного вмешательства определяется прежде всего болезнью желудка, ее осложнением и состоянием больного. При язвенной болезни желудка производят как органосохраняющие, так и органо-несохраняющие операции. В последнем случае удаляется большая или меньшая часть желудка. Если новообразования желудка злокачественные, наиболее часто выполняется гастрэктомия.
Предложено более 200 различных модификаций хирургических вмешательств на желудке. Часть из них сейчас имеет чисто теоретическое и историческое значение и в практике применяется редко, другие, наоборот, получили широкое распространение. Все модификации знать невозможно, да и не нужно, посколько они отличаются несущественными элементами. Особенно это трудно сделать после повторных реконструктивных операций и после
дующих хирургических вмешательств на других органах брюшной полости, неизбежно приводящих к спаечному процессу и нарушению топографии. Поэтому все операции целесообразно разделять на 3 основные группы: органосохраняющие, органонесохраня-ющие (резекции и тотальное удаление желудка) и повторные. Об этом необходимо указывать и в протоколе исследования.
Органосохраняющими операциями являются ваготомия, гастроэнтеросто-мия и гастродуоденостомия.
Ваготомия — хирургическая операция пересечения стволов блуждающих нервов или их отдельных ветвей. Применяется для лечения язвенной болезни. В зависимости от анатомических деталей операции и достигаемой при этом степени денервации органов брюшной полости существуют различные варианты ваготомии:
1) по Драгстедту — трансторакальная наддиафрагмальная резекция блуждающего нерва с подшиванием его центрального конца к плевре;
2) стволовая — операция, при которой стволы блуждающего нерва пересекаются над диафрагмой до их разветвления. После данной ваготомии происходит денервация всех органов брюшной полости;
3) селективная — избирательная ваготомия, при которой под диафрагмой пересекаются все желудочные ветви блуждающего нерва с сохранением важных в функциональном отношении ветвей, идущих к печени и солнечному сплетению;
4) селективная проксимальная — операция, при которой избирательно пересекаются ветви блуждающих нервов только к верхним отделам желудка и сохраняются нервные стволы, проходящие вдоль малой кривизны к углу желудка вместе с нисходящими ветвями сосудов (нервы малой кривизны Латарже).
Гастроэнтеростомия — хирургическая операция наложения анастомоза между желудком и, как правило, тощей кишкой. Применяется главным образом при стенозирующей язве или неоперабельной опухоли выходного отдела желудка или пилородуоденальной области у престарелых либо резко ослабленных больных. Существует несколько модификаций гастроэнтеростомии:
1) передняя — анастомоз с тощей кишкой накладывается на передней стенке желудка, кпереди от поперечной ободочной кишки;
2) задняя — анастомоз между тощей кишкой и задней стенкой желудка позади поперечной ободочной кишки через отверстие в его брыжейке;
3) вертикальная — анастомоз бок в бок с расположением кишечной петли в направлении от малой кривизны желудка к большой;
4) горизонтальная — анастомоз бок в бок с расположением кишечной петли в направлении от кардии к привратнику желудка;
5) по Брауну — межкишечный анастомоз между приводящей и отводящей петлями тощей кишки при передней впередиободочной гастроэнтеростомии;
6) по Бельфлеру — анастомоз бок в бок между передней стенкой желудка и тощей кишкой кпереди от поперечной ободочной кишки;
7) по Гаккеру — задний горизонтальный гастроэнтероанастомоз с проведением длинной петли тощей кишки позади поперечной ободочной кишки;
8) по Гаккеру — Брауну — модификация гастроэнтеростомии по Гаккеру, заключающаяся в одновременном наложении межкишечного анастомоза между приводящей и отводящей петлями тонкой кишки по Брауну;
9) по Гаккеру — Петерсену — задняя горизонтальная гастроэнтеростомия с проведением короткой петли тощей кишки позади поперечной ободочной кишки;
10) по Кохеру — задняя вертикальная гастроэнтеростомия с поперечным дугообразным рассечением тонкой кишки;
11) по Петерсену — вертикальная задняя гастроэнтеростомия, при которой приводящую петлю кишки фиксируют ближе к малой кривизне, а отводящую — к большой кривизне;
12) по Ру — вариант гастроэнтеростомии при операции желудка по Биль-рот-П: производят поперечное рассечение тощей кишки, отводящий конец ее вшивают в заднюю стенку культи желудка и образуют анастомоз конец в бок между приводящей и отводящей петлями кишки.
Из всех перечисленных гастроэнте-ростомий наиболее часто встречаются задняя позадиободочная на короткой петле и передняя впередиободочная на длинной петле с межкишечным соустьем.
Гастродуоденостомия — операция создания искусственного соустья между
желудком и 12-перстной кишкой. Гастродуоденостомия имеет несколько модификаций:
1) по Жабуле — анастомоз бок в бок между передней стенкой препилорического отдела желудка и правым краем нисходящей части 12-перстной кишки;
2) терминальная — для анастомоза используется терминальный отдел 12-перстной кишки;
3) по Элеккеру — Финнею — модификация гастродуоденостомия, заключающаяся в ее сочетании с пилоро-пластикой. Применяется наиболее часто при современных методах лечения язвенной болезни в сочетании с ваготомией.
Резекция желудка занимает главенствующее положение среди операций на желудке. Она имеет несколько разновидностей: дистальная, проксимальная резекция, резекция 1 /з, 1 /2 и 2/з желудка, субтотальная резекция и полное удаление желудка — гастрэктомия. Непрерывность ЖКТ восстанавливают по одному из способов Бильрота.
Операция Бильрот-1 — хирургическое вмешательство, при котором производится циркулярная резекция желудка с наложением гастродуоденального анастомоза конец в конец. Операция Билърот-П — хирургическая операция циркулярной резекции желудка с ушиванием культей его и 12-перстной кишки и наложением гастроеюнального анастомоза бок в бок.
По мере развития абдоминальной хирургии многие авторы предлагали различные варианты I и II способов операции Бильрота. Описано более 30 модификаций каждого из способов резекции желудка. Но наиболее распространена операция резекции желудка по Гофмейстеру — Финстереру: анастомоз с культей желудка накладывают на тощую кишку на расстоянии 4—6 см от 12-перстно-тощекишеч-
ного изгиба, причем кишку слегка ротируют.
После полного удаления желудка анастомоз накладывают между пищеводом и, как правило, тощей кишкой. При проксимальной субтотальной резекции анастомоз образуют между пищеводом и оставшейся частью антрального отдела желудка.
Среди резекций желудка особое место занимает антрумэктомия — удаление антральной части желудка. Очень часто ее сочетают с селективной ваготомией. При пилоросохраняющей резекции желудка удаляют ^/з его и оставляют 1,5—2 см препилорической части антрального отдела и привратника. Операция заканчивается наложением гастро-гастроанастомоза.
Заслуживает внимания и другой способ операции — трубковидная резекция желудка с сохранением пилорического и восстановлением кардиального замыкательного аппарата. Такая операция применяется для лечения язвы кардиального отдела. Язва удаляется вместе с малой кривизной и ’/2 желудка. Из оставшейся части большой кривизны желудка формируется культя в виде трубки и выполняется фундопликация по Ниссену и фундоэзофагосто-мия.
Фундопликация — подшивание желудка к диафрагме вокруг пищеводного отверстия. То есть создается манжетка из свода желудка, охватывающая брюшную часть пищевода, с фиксацией малой кривизны желудка к брюшной стенке для восстановления острого угла Гиса (между дном желудка и брюшной частью пищевода). Фундопликация применяется для лечения рефлюкс-эзофагита и скользящей грыжи пищеводного отверстия диафрагмы.
Повторные операции: у людей, перенесших резекцию желудка, нередко развиваются диспептические явления.
Стремясь избежать многих функциональных нарушений пищеварения, хирурги стали широко выполнять реконструктивные пластические операции. Повторные корригирующие операции проводятся с целью: 1) замедлить эвакуацию содержимого из культи желудка, 2) улучшить эвакуацию содержимого из культи 12-перстной кишки или 3) восстановить пассаж пищи по 12-перстной кишке.
К операциям I типа относятся: сужение гастроеюнального анастомоза, трансторакальная двусторонняя стволовая ваготомия, сужение гастроею-налйного анастомоза в сочетании со стволовой ваготомией, фиксация культи желудка и приводящей петли кишки к печеночно- 12-перстной связке, реверсия сегмента отводящей петли между культей желудка и тонкой кишкой, реконструкция анастомоза по Бильрот-1 в анастомоз по Бильрот-II с антипери-стальтическим расположением тонкой кишки, образующей гастроеюнальный анастомоз.
Операциями II типа являются: наложение межкишечного анастомоза по типу бок в бок, широкий межкишечный анастомоз — от гастроеюнального анастомоза до позадиподжелудочной фасции (фасции Трейтца), дуоденоеюнальный анастомоз, реконструкция га-строеюнальных терминолатеральных анастомозов в V-образный анастомоз.
В группу операций III типа включаются следующие вмешательства: реконструкция гастроеюнальных анастомозов и гастродуоденальные анастомозы по Бильрот-I, Шемакеру и по Га-береру — Финнею, реконструкция гастроеюнальных и гастродуоденальных анастомозов с тонкокишечной пластикой, реконструктивная гастроколодуо-денопластика, реконструкция 12-перстной кишки с ее инверсией. Иногда применяют и операцию Бебла.
Особенности рентгенологического исследования
Исследовать оперированный желудок и правильно интерпретировать полученные сведения под силу только опытному рентгенологу высокой квалификации.
Перед рентгенологом всегда стоят сложные задачи: выяснить причину оперативного вмешательства и сроки выполнения ее; определить вид и объем оперативного вмешательства; изучить рельеф слизистой оболочки; установить тип анастомоза и его функциональное состояние; выявить адаптационно-компенсаторные процессы в организме оперированного; обнаружить особенности и определить степень возникших патологических изменений, а также показания к их устранению хирургическим путем.
Чтобы ответить на поставленные вопросы, рентгенологу в 25—30 % случаев недостаточно данных обычного рентгенологического исследования. Прежде всего это касается приема контрастного вещества. Наш опыт показывает, что больной должен принимать сразу всю порцию взвеси сульфата бария, т. е. исследование необходимо начинать с ТЗ желудка. Преобладать должна рентгенография. Производят как прямые, так и строго боковые снимки. Обращается внимание на зону резекции и анастомоза. Боковой снимок необходим для решения вопроса о наличии переднего или заднего анастомоза.
Неровность стенки, нишеподобные выпячивания по малой кривизне нередко симулируют язвенный процесс, а на самом деле обусловлены грубым погружением ее в желудок и многорядными швами. В отличие от истинной язвы эти выпячивания в процессе исследования динамически изменяются. При ТЗ определяется объем операции по
104. Рентгенологическая картина оперированного желудка: а — по Бпльрот-I; б — по Бильрот-11.
уровню сохранности малой кривизны. Если желудок резецирован на уровне нижнего' края кардии, говорят об субтотальной резекции; если сохранившаяся малая кривизна имеет протяженность 2—3 см, это резекция 2/з желудка; если больше, то резецирована 1/з его.
После опорожнения желудка создаются условия для оптимального изучения рельефа его слизистой. Складки слизистой хорошо контрастируются, и на снимках изображение их четкое и ясное. Большими диагностическими возможностями обладает метод двойного контрастирования. Для этих целей мы широко применяем кислородную подушку. Больной ложится на трохоскоп, ему дают в рот загубник и плавно открывают кран до создания достаточного
давления в ротовой полости. Пациен" делает глотательные движения, и кислород начинает поступать в желудоь до необходимого растяжения его стенок В этих условиях устраняются нишеподобные складки вблизи анастомоза стенки культи желудка расправляются создаются благоприятные условия для диагностики. Если двойное контраста рование проводить в условиях медь каментозной релаксации желудка ошибки в диагностике уменьшаются в 3—4 раза.
Не следует забывать и самый простоя способ — исследование в горизонталь ном положении на спине. Контрастноь вещество перемещается в свод, а газ — в дистальную часть желудка, что дае-возможность увидеть и изучить анг стомоз.
105. Рельеф слизистой оболочки резецированного желудка:
а — после опорожнения желудка; б — в условиях двойного контрастирования.
Двойное контрастирование очень ценно для решения вопроса о характере изменений свода желудка, которые возникают после дистальных резекций этого органа. Нами установлено, что у 17 % таких больных развивается провисание или перешнуровка свода желудка. Деформация области свода культи желудка может быть от едва заметного втяжения до глубокой щели, четко отделяющей паракардиальную часть. Если деформация свода функционального характера, то при раздувании желудка она исчезает, если органического, то остается.
При рентгенологическом исследовании резецированного желудка, особенно приводящей петли, можно использовать обтурационный зонд. Для этих
целей применяется двухканальный ог-турирующий катетер, один канал которого соединен со шприцем Жане, другой со стандартным сфигмоманометрол для измерения АД крови, оканчиваю щимся переходной канюлей. Зонд вв< дится под контролем рентгеновской экрана в отводящую петлю анаст<-моза. Заполнение обтурирующего пузыря производится под контролем мане-метра, что исключает визуальное наблю дение за степенью раздувания ег< под контролем рентгеновского экрана Во всех случаях, независимо от тош ческого состояния стенки кишки, достг гается постоянное давление обтурирую щего пузыря, так как манометр реп стрирует суммарное давление внутрг пузыря и сопротивление кишечно!
стенки. После обтурации просвета отводящей петли вводится взвесь сульфата бария до полного заполнения приводящей кишки и выполняются снимки. Наш опыт показывает, что применение обтурационного зонда со сфигмоманометром значительно облегчает исследование, снижает лучевую нагрузку на больного и медицинский персонал и делает исследование безопасным в отношении возможной травматизации стенки кишки.
В раннем послеоперационном периоде исследование желудка показано как для оценки операции, так и при появлении клинических признаков осложнений, например несостоятельности швов культи, перитонита, резкого нарушения эвакуации содержимого из желудка. Противопоказание может быть только одно — агональное состояние больного. Следует помнить, что количество диагностических ошибок возрастает в соответствии с тяжестью состояния больного. Это железный закон. Чем тяжелее больной и чем ограниченнее время исследования, тем больше будет ошибок и, естественно, нареканий врачу-рентгенологу.
Рентгенологическое исследование можно проводить в любые сроки после оперативного вмешательства, даже на операционном столе. Но, что касается применения контрастных веществ, подход необходим индивидуальный. При подозрении на несостоятельность швов культи и развитии перитонита нельзя использовать взвесь сульфата бария. Попав в брюшную полость, бариевая взвесь не только не рассасывается и длительно остается в ней, но может вызвать раздражение брюшины и образование гранулем. В этих ситуациях для контрастирования желудка необходимо применять только водорастворимые рентгеноконтрастные вещества, причем высокой концентрации.
Объем культи, проходимость анасто-
106. Исследование приводящей петли анастомоза с использованием обтурирующего катетера.
моза определяется при приеме обычной бариевой взвеси. Количество ее зависит от целей и задач исследования — от 15—20 до 150—200 мл, т. е. контрастного вещества вводится столько, сколько нужно для решения поставленных задач.
Рентгенологическая картина
Рентгенологическая картина оперированного желудка находится в прямой зависимости от характера хирургического вмешательства и техники формирования желудочно-кишечного соустья. Захват в шов больших участков вывернутой слизистой, гофрирование губ анастомоза, многорядные швы —все это деформирует область анастомоза и его слизистую, имитирует опухолевое поражение культи оперированного желудка.
Ваготомия сопровождается снижением тонуса желудка и ослаблением перистальтики, которые исчезают через 3 мес. При СПВ наблюдается гипотония проксимального отдела желудка (расширение свода, кардиального отде
ла и тела, желудка). Перистальтика в указанных отделах обычно слабая, а в антральном отделе — активная. У 25—30 % больных при приеме бариевой взвеси желудок раскрывается по типу «каскада». Это обусловлено разницей в тонусе его проксимального и дистального отделов и отсутствием фиксации кардии малым сальником, который отделяется от малой кривизны во время операции СПВ.
В ближайшем периоде после СПВ (Зелинский, 1984) снижение тонуса желудка отмечается у 76,8 %, а изменение темпов и скорости его опоро-жения — у . 16,6 % больных. Из них у 10 % обнаружено ускорение начальной эвакуации и у 6,6 % лиц — замедление ее до 4—6 ч. В результате изучения моторной деятельности желудка и 12-перстной кишки путем измерения внутрипросветного давления с помощью открытого катетера и метода баллонографического исследования сократительной способности стенок органа установлено, что базальный и пластический тонус исследуемых отделов после селективной проксимальной ваготомии не снижается. В области тела желудка он составляет в среднем соответственно 12,6 ±0,47 и 13,95 ± 0,45 мм рт. ст. В прежних пределах сохраняется положительный градиент давления между фундальным и антральным отделами желудка. Если до операции он 2,6, то после ваготомии — 2,5 мм рт. ст.
При наблюдении за опорожнением желудка Э. А. Рустамов и С. С. Мана-фов (1988) установили, что начальная фаза эвакуации (первые 15—20 мин исследования) после СПВ ускорена, что, по-видимому, связано с гидростатическим давлением принятого контрастного вещества и нарушением рецептивной релаксации дна желудка. При этом нормально функционирующие антральный отдел и привратник
не в состоянии противостоять быстрому поступлению контрастного вещества из проксимального отдела желудка. После СПВ с дренирующей желудок операцией происходит еще более выраженное ускорение начальной фазы эвакуации в результате самой дренирующей операции, вследствие которой исчезает регулирующая функция привратника.
У больных после СПВ с дренирующей операцией рентгенологическая картина представляется более разнообразной и в основном зависит от типа дренирующих операций. У всех оперированных наблюдается деформация выходного отдела желудка, а у 25 % — деформация в виде двухполостного желудка («каскадный» перегиб).
Спустя 2 недели после СПВ без дренирования желудка у 46,5 % больных имеется замедленный тип эвакуации, у 42,5 — нормальный, у 9,5 % — ускоренный. СПВ с дренированием желудка указанные типы эвакуации отмечаются соответственно в 43,7, 45,7 и 10,1 % наблюдений.
Через 6 мес. после СПВ с дренирующей операцией полного восстановления тонуса проксимального отдела желудка не происходит, однако в этот срок после СПВ без дренирования увеличивается процент больных с нормальным типом эвакуации (70,3) по сравнению с этим показателем спустя 2 недели после операции (42,5). После СПВ с дренирующей операцией изменения аналогичные.
Спустя год после СПВ без дренирования преобладают обследованные с нормальным типом опорожнения (84 %), тогда как ускоренный и замедленный типы эвакуации отмечаются соответственно у 7 и 8,7 % оперированных. После СПВ с дренирующей операцией прослеживается подобная тенденция, однако не столь выраженная, как после СПВ без дренирования желудка. Полное восстановление тонуса проксимального
отдела желудка происходит через 3— 5 лет и более. Процент лиц с нормальным типом эвакуации остается приблизительно на одном уровне — 91,3 через 3—5 лет и 89,9 через 7 — 10 лет. После СПВ с дренирующей операцией через 3—5 и 7 — 10 лет процент пациентов с нормальным типом эвакуации составляет 85,3 и 86,5, что несколько меньше, чем после СПВ без дренирующей операции.
Таким образом, наименее выраженные изменения моторно-эвакуаторной функции благодаря сохранению сократительной активности привратника происходят после СПВ без дренирования, нежели после СПВ с дренирующей желудок операцией. Нарушения сократительной функции проксимального отдела желудка незначительны и кратковременны (6—12 мес.). При наблюдении до 5 лет показатели, характеризующие эвакуацию после СПВ без дренирования, приближаются к норме и в последующие годы (через 7 —10 лет) остаются на одном уровне. Аналогичные изменения, однако выраженные в меньшей степени, происходят и после СПВ с дренирующей желудок операцией.
При гастроэнтеростомии эвакуация бария обычно осуществляется через анастомоз и частично через привратник, за исключением случаев полной обструкции последнего. Пилоропласти-ка характеризуется выраженной деформацией антрального отдела — укорочением и неравномерным сужением, неровностью контуров. Ушивание перфоративной язвы влечет за собой деформацию желудка и неровность его контуров в области операционного шва, напоминающие симптом «тройки», или буквы «3», формирующиеся за счет вворачивания внутрь желудка краев ушитой язвы при наложении погружных швов. После операции по Биль-рот-I в рентгеновском изображении желудок укорочен, угол его сглажен,
синус отсутствует, верхнее горизонтальное колено 12-перстной кишки подтянуто кверху и влево. Перистальтика обычно поверхностная, эвакуация ускорена: через 15—20 мин желудок полностью освобождается от бария. При резекции по Бильрот-II культя желудка обычно имеет форму усеченного конуса малая кривизна культи неровная, ввернутые внутрь желудка ткани иногда дают дефект наполнения, напоминающий таковой при опухоли. Полное опорожнение культи желудка наступает через 15—17 мин.
После резекции проксимальной части желудка и наложения анастомоза между пищеводом и передней стенкой желудка по типу конец в бок рентгенологически определяется укорочение желудка, сглаженность его угла, отсутствие синуса. Анастомозирующий конец пищевода неровный, зашитый наглухо проксимальный конец культи смещается кзади, а новый свод с газовым пузырем сформирован из передней стенки. Привратник и 12-перстная кишка подтянуты кверху и влево. Антральный отдел расположен вертикально. Эвакуация бария ускорена и через 15—20 мин после приема 180—200 мл контрастного вещества культя желудка полностью опорожняется. При гастрэктомии бариевая взвесь из пищевода сразу попадает в тонкую кишку. Иногда в этих случаях имеются межкишечный брау-новский и другие виды анастомозов. При пластических операциях с использованием сегмента тонкой или толстой кишки замещение желудка может проводиться с включением 12-перстной кишки и без нее.
Пилоросохраняющая резекция желудка не приводит к серьезным пострезекционным расстройствам, но создает характерные формы культи желудка: мешковидную, округлую, в виде изогнутого конуса или перевернутой реторты. Последняя более типична для труб
ковидной резекции как следствие иссечения малой кривизны. После резекции по Бильрот-I почти в половине случаев культя желудка имеет форму изогнутой) конуса, в остальных — мешковидную или округлую. Контуры культи представляются неровными. Причем неровность малой кривизны наиболее выражена после трубковидной резекции. Наложение гастро-гастроанастомоза на расстоянии 1,5—2 см от привратника не вызывает деформации привратника и препилорической части выходного отдела желудка, но нередко приводит к изменению положения луковицы 12-перстной кишки (горизонтально или косо), что в некоторых случаях сопровождается деформацией последней. Сохранение привратника и изменение положения луковицы 12-перстной кишки влияют на механизм и характер пассажа бариевой взвеси по этим отделам. Несмотря на то что сокращения привратника выражены слабо, бариевая взвесь небольшими порциями поступает в луковицу и образует в ней горизонтальный уровень.
Особый интерес представляет рентгеновское изображение самого гастро-гастроэнтероанастомоза, который имеет вид симметричных, расположенных по большой и малой кривизне втяжений с ровными четкими контурами на расстоянии 1 — 1,5 см проксимальнее привратника. Ширина анастомоза колеблется от 15 до 35 мм (23,76 + 0,49 мм). Такая картина наблюдается в позднем и отдаленном послеоперационном периодах. В ранние же сроки после наложения анастомоза картина несколько иная: дистальная часть культи желудка имеет форму воронки с неровными контурами и ригидными стенками, ширина в наиболее узком ее месте (область анастомоза) 5—30 мм (13,8 + 0,84 мм), дистально суженная часть вновь переходит в расширение. Эти изменения обусловлены послеоперационным воспа
лительным процессом — анастомозитом. Ширина анастомоза вполне достаточна для беспрепятственного прохождения бариевой взвеси.
В раннем послеоперационном периоде отмечается снижение мышечного тонуса стенки культи желудка или полная ее атония. При этом в культе желудка натощак определяется жидкость. В позднем и отдаленном периодах тонус культи восстанавливается, количество жидкости натощак заметно снижается. Складки слизистой культи желудка чаще представляются неизменными, реже утолщены. Также у всех больных наблюдается снижение глубины перистальтических волн. В раннем послеоперационном периоде у некоторых перистальтика определяется с трудом. В поздние и отдаленные сроки она становится более выраженной и расценивается как имеющая среднюю глубину. Выявляется следующая закономерность: чем меньшая часть желудка резецировалась, тем большая глубина перистальтических волн.
Привратник располагается симметрично препилорическому отделу культи желудка и луковице 12-перстной кишки. Функция привратника зависит от срока, прошедшего с момента операции. Так, в раннем послеоперационном периоде его сокращения бывают выражены слабо, аритмичные, малой амплитуды, у некоторых могут вообще не определяться. Как правило, ширина привратника колеблется от 3 до 9 мм (5,88 + 0,2 мм), что связано, по-видимому, с повышенным тонусом его мышечного кольца. В позднем и отдаленном периодах амплитуда сокращения пилорического жома нарастает, ритм его восстанавливается, увеличивается ширина до 6,22 + 0,14 мм (Васильков, 1985).
Функциональное состояние пилорического жома непосредственно отражается на характере и времени эвакуации ба
риевой взвеси из культи желудка. Типичная черта для больных (независимо от срока, прошедшего после операции) — достаточно длительное опорожнение культи желудка. Так, эвакуация из культи желудка у большинства больных, перенесших пилоросохраняю-щую операцию, протекает исключительно по порционному типу в пределах 45—180 мин и составляет 106 + 5,0 мин в раннем и 90 + 3,5 мин в отдаленном периодах, что соответствует нормальным показателям. Порционность и заметное увеличение сроков эвакуации, по нашему мнению, предупреждают развитие демпинг-синдрома.
У 90 % больных луковица 12-перстной кишки располагается горизонтально или косо. При обычном расположении луковицы форма ее остается прежней, у 42 % оперированных она изменяется в результате втяжения или уплощения медиального контура. Такую деформацию луковицы 12-перст-ной кишки называют «ложной», так как она определяется лишь в вертикальном положении больного. Ложная деформация — по-видимому, следствие изменения положения и появления некоторых особенностей заполнения луковицы бариевой взвесью. Последняя, поступая через привратник, стекает в латеральный карман луковицы и располагается горизонтально. Медиальный карман, как правило, содержит газ. В вертикальном положении больного бариевая взвесь оказывает давление на стенку луковицы, лишь в области латерального контура, в области же медиального контура стенка такого давления не испытывает. В положении на трохоскопе луковица заполняется газом, давление которого на все ее стенки одинаково.
В раннем послеоперационном периоде тонус и моторная активность всех отделов 12-перстной кишки снижаются. Позднее их функциональное состояние
восстанавливается, о чем свидетельствуют активные сокращения стенки кишки (Васильков, 1985).
Адаптационно-компенсаторные процессы
Неосложненный ближайший послеоперационный период характеризуется умеренными нарушениями биологического равновесия в организме и нерезко выраженными реактивными процессами в операционной ране. В связи с новыми условиями функционирования желудка и кишечника и длительным воздействием неблагоприятных факторов нарушается течение физиологических функций. А это приводит к развитию разной степени выраженности патологического процесса.
Для восстановления трудоспособности больного после хирургического вмешательства на желудке требуется длительное время, в течение которого происходят репарация и адаптация как пищеварительного тракта, так и организма в целом к новым анатомо-физиологическим соотношениям, созданным операцией.
Особый интерес представляет состояние эвакуаторной и пропульсивной деятельности культи желудка и кишечника в отдаленном периоде, потому что литературные данные весьма противоречивы. Согласно современной концепции, эвакуация твердых и жидких компонентов пищи предполагает различное функциональное участие фундального и антрального отделов желудка. Так, антральный отдел является активным транспортером и обеспечивает перемещение твердых частиц пищи в дистальном направлении. После резекции этого отдела, по мнению некоторых исследователей, нарушается эва-куаторный процесс твердых компонентов пищи. Другие утверждают, что
возможна компенсация эвакуаторной функции культи желудка.
Чтобы уточнить функциональное состояние культи желудка в процессе выведения жидкой и смешанной пищи, мы (А. Н. Михайлов, Е. П. Черемухин) изучили эвакуаторную и пропульсивную деятельность пищеварительного канала в отдаленном послеоперационном периоде. Обследовано 136 больных в возрасте от 22 до 60 лет, оперированных по поводу язвенной болезни желудка и 12-перстной кишки. Женщин было 15, мужчин — 121. Резекция 2/з желудка произведена у 119, расширенная резекция — у 15, удаление антрального отдела желудка — у 2 больных. Сохранение непрерывности ЖКТ путем наложения гастродуоденального анастомоза осуществлено у 16 больных, 120 человекам наложен гастроеюналь-ный анастомоз. Контрольную группу составили 10 здоровых лиц в возрасте 21—35 лет.
Эвакуаторная функция изучалась с помощью жидкой и твердой контрастной смеси. Жидкая смесь включала 100 мл 50 % глюкозы и 100 г сернокислого бария. После обработки на миксере и доведения температуры смеси до 37 °C она приобретала свойства, необходимые для исследования ЖКТ. Твердая пища состояла из завтрака диетического стола № 15 и 100 мл обычной взвеси сернокислого бария, которую больной принимал порционно: в начале, в середине и в конце завтрака. Исследование заканчивали тогда, когда содержимое полностью покидало желудок и тонкую кишку. Нормальной эвакуаторной функцией считали совпадение полного опорожнения желудка, 12-перстной и тощей кишок с поступлением контрастного вещества в слепую кишку.
В контрольной группе на нормальную эвакуацию жидкой пищевой контрастной смеси потребовалось 229 +
8,1 мин. Индивидуальные колебания продолжительности опорожнения желудка от содержимого составили 170— 270 мин.
Анализ результатов исследования показал, что нормальная эвакуация отмечается у 22, или 16,1 %, обследованных после дистальной резекции желудка. Выведение жидких и твердых компонентов пищи наступает в различное время. Так, жидкие покидают культю желудка через 227 ±4, твердые — через 274 + 11,4 мин. Значит, жидкая пища удаляется из культи желудка быстрее, чем твердая.
Нарушенная эвакуаторная функция характеризуется несовпадением полного опорожнения желудка, 12-перст-ной и тощей кишок с поступлением контрастного вещества в слепую кишку и проявляется тремя формами диссоциации функциональной зависимости моторной деятельности: 1) контрастное вещество поступает в слепую кишку раньше, чем наступает опорожнение желудка, 12-перстной и тощей кишок; 2) эвакуация из желудка происходит раньше, чем опорожняются 12-перстная и тощая кишки и контрастное вещество поступает в слепую кишку; 3) эвакуация из желудка происходит позже, чем опорожняются 12-перстная и тощая кишки и контрастное вещество поступает в слепую кишку.
Первый вариант нарушения эвакуаторной функции с жидкой пищевой смесью наблюдается у 23,9 % больных. Время освобождения желудка от содержимого составило 179 + 7,5 мин. При смешанной пище аналогичная форма нарушения встречалась у 20,5 % и проявлялась сокращением сроков выведения содержимого (200 + 15,8 мин) по отношению к времени нормальной эвакуации.
Вторая форма нарушения эвакуации с жидкой пищевой смесью отмечалась у 29 % оперированных. Время эвакуа
ции составило 144 ±7,3 мин и было значительно короче, чем в контрольной группе. При смешанной пище нарушение эвакуаторной функции выявлено у 33,3 % обследованных. Продолжительность опорожнения культи желудка от содержимого — 180 ± И мин, что также значительно меньше времени нормальной эвакуации.
Третья форма нарушения эвакуаторной функции желудка отмечена при рентгенологическом исследовании с использованием жидкой пищевой смеси у 33,4 % обследованных. Содержимое выводилось за 369 ±12,7 мин, что намного превышало время нормальной эвакуации. У 4 из них выявлена задержка контрастного вещества в желудке до 24 ч при отсутствии выраженных сужений в области анастомоза и отводящей петли тощей кишки, подтвержденных гастрофиброскопически.
Замедление опорожнительной функции эвакуации смешанной пищи, сопровождающееся указанными взаимоотношениями моторной деятельности желудка и тонкой кишки, установлено у 30,8 % обследованных. Продолжительность освобождения от пищевых масс составляла 440 ±10,4 мин, что значительно превышало время нормальной эвакуации. У 1 больного выявлена задержка контрастированного содержимого в желудке до 24 ч.
Степень выраженности этого вида расстройств коррелирует с моторной деятельностью подвздошной кишки и проявляется тремя формами зависимости: 1) желудок опорожняется раньше, чем контрастное вещество покидает подвздошную кишку; 2) желудок опорожняется одновременно с подвздошной кишкой; 3) желудок не освобождается от содержимого после опорожнения подвздошной кишки. В случае третьей формы нарушения эвакуаторной функции рекомендуется проводить досмотр брюшной полости через
24 ч, чтобы обнаружить остатки контрастированного химуса в желудке.
Если степень замедления эвакуации легкая, продолжительность освобождения желудка от жидкой смеси составляет 276 ±11,5 мин, что превышает сроки нормальной эвакуации. При средней степени замедления эвакуации время выведения жидкой смеси составляло 374 ±13,9 мин и было значительно больше, чем в предшествующей группе. В случае выраженной степени замедления эвакуации время эвакуации составило 420 ± 15,3 мин, что превышало сроки выведения пищи у больных со средней степенью выраженности эва-куаторных расстройств.
Таким образом, установленные формы моторно-эвакуаторной зависимости могут быть приняты во внимание при оценке степени компенсации пилоро-дуоденальных стенозов.
Больные с ускоренной эвакуацией желудочного содержимого составили 53,2 % обследованных. В соответствии с признанной точкой зрения сокращение продолжительности выведения пищевого химуса рассматривается как следствие удаления анатомических отделов желудка, ответственных за организацию эвакуаторного процесса. Полученные нами данные показали, что сохранение нормальной эвакуации после дистальной резекции желудка возможно, а характер выявленных нарушений опорожнительной функции соответствует до-операционным проявлениям их в форме стаза или ускоренного выведения химуса. На этом основании сделано заключение, что резекция желудка, произведенная по поводу осложненной язвенной болезни, только частично устраняет эвакуаторные расстройства, развившиеся до операции. Для изучения пропульсивной деятельности тонкой кишки и выявления связи ее с эвакуаторной функцией желудка использованы электрофизиологический и рент
генологический методы с последующей статистической обработкой данных, полученных при обследовании 57 больных после резекции желудка.
Биопотенциалы регистрировали на двухканальном миографе с помощью кишечного зонда с резиновой камерой, имеющей на конце электроды, введенного в начальный отдел тощей кишки. Исследование выполняли натощак и после приема больным 100 мл 50 % глюкозы, способной вызывать торможение натуральных пищевых рефлексов. Запись электрической активности выполняли при наполненной воздухом и спавшейся камере. Раздувание ее под контролем манометра использовали для дозированного растяжения кишечной трубки.
Рентгенологическое изучение двигательной активности ЖКТ производилось на модели жидкого пищевого вещества, в качестве которого использовали смесь 100 мл 50 % глюкозы с 100 г сернокислого бария. Непищеварительные двигательные реакции изучали после приема больными водной взвеси сернокислого бария, приготовленной в той же пропорции.
Электрические потенциалы, возникающие в ответ на раздражение слизистой оболочки начального отдела тощей кишки зондом, находящимся в ней, характеризовались электрической активностью в виде ПП амплитудой 46 ±2,5 мкВ и длительностью И ±1,9 с/мин. После раздражения кишки растяжением амплитуды ПП увеличивалась до 72 ±5,7 мкВ, а длительность — до 20 ±3 с/мин.
При рентгенологическом исследовании ЖКТ с водной взвесью сернокислого бария установлено время прохождения ее по петлям тощей кишки за 37 ±4,3 мин, подвздошной — 130± 15,6 мин. Эвакуация взвеси из желудка протекала за 22 ±3,7 мин.
После приема глюкозы двигательные
реакции тощей кишки характеризовались амплитудой ПП 58 ±12,8 мкВ, длительностью 12 ±2,7 с/мин. После раздражения кишки растяжением амплитуда ПП увеличилась до 110±7,1 мкВ, длительность до 20 ±3 с/мин. Отмечалось появление второй волны ПП через 102 ±8,8 мин после приема глюкозы.
При рентгенологическом исследовании с глюкозо-бариевой взвесью время пассажа по тощей кишке составило 17 ± 2,2 мин, по подвздошной 196 ± 13,7 мин, время эвакуации из желудка — 38 ±4,3 мин.
Полученные результаты свидетельствуют, что: 1) моторная деятельнсть, проявляющаяся периодическими ритмическими сокращениями тонкой кишки, обладающая постоянным соотношением количественных характеристик амплитуды и длительности сокращений, изменения которых находятся в полном соответствии с силой сокращения и временем продвижения содержимого по тощей кишке, по функциональному признаку должна быть отнесена к пропульсивным движениям; 2) пропульсивные движения возникают многократно в течение пищеварительного процесса, распространяются последовательно на все отделы ЖКТ и выполняют транспортную функцию; 3) пропульсивная деятельность не влияет существенно на время эвакуации содержимого из желудка. Коэффициент корреляции между временем эвакуации и скоростью продвижения контрастного вещества по тощей и подвздошной кишкам в условиях пищеварения составляет 0,535 (t= 1,3; Р>0,1) и 0,431 (t= 0,7; Р>0,1). Аналогичные данные получены при непищеварительных движениях кишечника.
Итак, можно сделать следующие выводы.
1. Как морфологические, так и функциональные заболевания желудка про
текают на фоне нарушений пищеварительной моторики тонкой кишки, которые связаны с расстройством фазного характера ее.
2. Прямое следствие этого — изменение сократительной активности гладких мышц тонкой кишки, форм и скорости транзита содержимого по ней, что сопровождается конкретными видами функциональной зависимости от нее моторики желудка с соответствующими ей видами эвакуаторных расстройств.
3. Предлагаемая методика оценки функционального состояния моторики тонкой кишки и эвакуации из желудка проста, надежна, позволяет снизить лучевую нагрузку и повысить точность диагностики функциональных расстройств пищеварительного тракта.
Болезни оперированного желудка
Болезни оперированного желудка — общее наименование расстройств, возникающих после резекции желудка или гастроэнтеростомии. Встречаются в 10—15 % случаев. Распознавание их сложное. Большими диагностическими возможностями обладает двойное контрастирование. А если его проводить в условиях медикаментозной релаксации, ошибок в диагностике можно избежать.
Степень выраженности осложнений и их частота зависят от характера предшествующей болезни, дооперационного состояния двигательной деятельности и размера удаляемой части желудка, а также от вида хирургического вмешательства. Различают ранние и поздние осложнения. К ранним осложнениям относят нарушение эвакуации из культи желудка, острую непроходимость приводящей петли анастомоза и др. В позднем послеоперационном периоде могут возникнуть демпинг-синдром, синдром отводящей петли, синдром приводящей петли, пептиче-
скал язва, гастрит и другие осложнения.
При оценке рентгенологической картины оперированного желудка нужно сначала определить тип и объем операции, а затем имеющиеся морфологические и функциональные изменения, т. е. болезни оперированного желудка.
Несостоятельность швов анастомоза или культи. Наиболее тяжелое осложнение в раннем периоде после резекции желудка. Клинические проявления: боли в животе, напряжение мышц передней брюшной стенки, симптомы раздражения брюшины, повышение температуры до 38—39°, коллаптоидное состояние. Несостоятельность швов анастомоза или культи 12-перстной кишки устанавливается только рентгенологически.
Рентгенологическое исследование включает обзорную рентгенографию и применение различных контрастных методов. Наиболее часто применяется пероральное контрастирование жидкой взвесью сульфата бария. Рентгенологическое исследование проводится, как правило, в течение первых 4—9 суток.
Рентгенодиагностика наступившей несостоятельности швов различных анастомозов и культи 12-перстной кишки основывалась на выявлении ее прямых и косвенных рентгенологических признаков.
Прямым рентгенологическим признаком нарушения целости желудочной или кишечной стенки является затекание контрастного вещества за пределы органа на уровне анастомоза. К косвенным рентгенологическим признакам, указывающим на «неблагополучие в брюшной полости», мы относим реактивные изменения со стороны диафрагмы, плевры и базальных отделов легкого, а также функциональные изменения ЖКТ в зоне развивающейся несостоятельности швов.
Прямой рентгеологический признак — затекание контрастного вещества
за пределы анастомоза или ушитои кишки — обнаруживается у 2/з больных. Наиболее ранний срок выявления несостоятельности швов — 4-е сутки после операции, наиболее частое нарушение целости швов — на 5—9-е сутки после операции преимущественно при локализаци несостоятельности швов в области пищеводно-тонкокишечного и желудочно-тонкокишечного анастомозов. В более поздние сроки (12—14-е сутки) выявляется несостоятельность швов культи 12-перстной кишки при формировании дуоденального свища. Больные с четкой клинической картиной развившейся несостоятельности швов культи 12-перстной кишки нередко направляются на рентгенологическое исследование в поздние сроки при уже сформировавшемся дуоденальном свище.
У всех больных с наступившей несостоятельностью швов дуоденоанасто-моза, пищеводно-желудочного анастомоза, ушитой стенки кишки и культи желудка, как правило, удается обнаружить затекание контрастного вещества за пределы анастомоза или кишки. Реже устанавливается наступившая несостоятельность швов ушитой культи 12-перстной кишки, желудочно-тонкокишечного анастомоза и отхождение краев наложенных желудочной или кишечной стом. Трудность выявления наступившей несостоятельности швов культи 12-перстной кишки обусловлена тем, что при контрастном исследовании не всегда удается заполнить приводящую петлю.
Рентгенологически у значительного числа больных выявляются различные косвенные признаки, приобретающие особое значение в тех случаях, когда не удается обнаружить прямых признаков несостоятельности швов. Приблизительно у 85 % больных развиваются функциональные нарушения желудка и прилегающих к зоне опе
ративного вмешательства отделов кишечника, заключающиеся во вздутии этих отделов, иногда со скоплением жидкости в их просвете.
Изменения со стороны органов грудной клетки наиболее часто возникают при развитии несостоятельности швов анастомозов, локализующихся в верхнем этаже брюшной полости. Наиболее частым и ранним симптомом является ограничение подвижности соответствующего купола диафрагмы, которое обнаруживается начиная с 2—3-х суток после операции. Дисковидные ателектазы и пневмония в базальных отделах легких выявляются с одинаковой частотой у ’/з больных. У ряда больных имеется сочетание дисковидного ателектаза и пневмонии.
По литературным данным, у 73,6 % больных обнаруживаются гнойные осложнения: у 40 % — рентгенологические признаки абсцесса, у 20 % — разлитого перитонита, причем у 12,5 % на фоне рентгенологических симптомов перитонита имеются и данные о наличии ограниченного гнойника.
Анализ клинико-рентгенологических данных показывает, что формирование абсцессов наиболее часто обусловлено возникшей несостоятельностью швов культи 12-перстной кишки, желудочнотонкокишечного анастомоза, межкишечных анастомозов. Реже возникают абсцессы при развившейся несостоятельности пищеводно-тонкокишечного анастомоза.
Рентгенологически абсцессы наиболее часто выявляются на 6—8-е и на 12—14-е сутки после операции. Рентгенологические признаки формирования абсцесса в зоне наступившей несостоятельности швов — наличие полости с горизонтальным уровнем жидкости, расположенной вне просвета ЖКТ, или скопление мелких газовых пузырьков на фоне затемнения участка брюшной полости; смещение и деформация смеж
ных с абсцессом органов (желудка, тонкой и толстой кишок). Разлитой послеоперационный перитонит, развившийся вследствие нарушения герметичности швов, рентгенологически проявляется выраженными функциональными нарушениями ЖКТ, более генерализованными, с большей степенью вздутия кишечника, отеком складок слизистой оболочки и кишечной стенки, наличием свободной жидкости в брюшной полости.
Острое расширение оперированного желудка. Крайне тяжелое и опасное для жизни осложнение. Может возникнуть после любого оперативного вмешательства на желудке. Клинические проявления: чувство тяжести и распирания в подложечной области, симптомы коллапса (частый малый пульс, снижение артериального давления), вздутие верхних отделов живота, шум плеска.
Рентгенологические признаки: резкое расширение желудка, в котором много жидкости и газа; перистальтики стенок желудка и эвакуации содержимого из него не видно. Левый купол диафрагмы находится высоко, его подвижность ограничена.
Нарушение эвакуации содержимого из культи желудка. Одно из наиболее частых постгастрорезекционных осложнений, которое в большой степени зависит от дооперационного состояния моторной функции желудка. Но чаще нарушения эвакуации содержимого из культи желудка возникают при дисфункции анастомоза, обусловленной воспалительным отеком анастомоза, недостаточностью его швов, острым панкреатитом и другими осложнениями. Иначе говоря, эвакуация содержимого из культи желудка зависит не только от двигательной активности желудка, но и от функции анастомоза. Вследствие отека анастомоза просвет его суживается. Клинические проявления: за
держка эвакуации содержимого желудка.
Рентгенологические признаки: большая мешковидная культя желудка с широким и низким горизонтальным уровнем контрастного вещества. Мы заметили, что высококонцентрированные водорастворимые препараты рентгеноконтрастных веществ можно использовать как с диагностической, так и с лечебной целью. Контактируя с отечными тканями анастомоза, они способствуют уменьшению отека и полному восстановлению проходимости анастомоза. Если после контрастирования желудка бариевая взвесь обнаруживается в петлях тонкой кишки через 2—3 дня, то проведенную операцию следует считать эффективной. Факт отсутствия контрастного вещества в кишечнике спустя 2—3 дня после приема бариевой взвеси свидетельствует о полной непроходимости анастомоза и о том, что показана повторная операция.
Нарушение эвакуации из культи желудка наблюдается при анастомозите. Проявляется воспалительной инфильтрацией стенки желудка в области анастомоза. Складки резко утолщаются, возникают полипоидные и подушкообразные возвышения, анастомоз суживается, проходимость его нарушается, что сопровождается задержкой эвакуации контрастного вещества из культи желудка. Последняя больших размеров, мешковидной формы, с широким и низким горизонтальным уровнем контрастного вещества. Сужение анастомоза наблюдается и в позднем послеоперационном периоде, чаще после тотальной гастрэктомии, как следствие воспаления анастомоза с последующим рубцеванием.
Острая непроходимость приводящей петли анастомоза. Развивается после ущемления длинной приводящей петли кишки между анастомозом и поперечной ободочной кишкой, если наклады-
107. Нарушение эвакуации содержимого из культи желудка вследствие резкого воспалительного отека в зоне анастомоза.
вался гастроэнтеростомоз, вследствие перегиба приводящей петли кишки, если она слишком коротка. Клинические проявления: внезапные резкие боли в верхних отделах живота, повторная рвота желудочным содержимым без примеси желчи и др.
Рентгенологические признаки: при контрастировании желудка бариевая взвесь не поступает в приводящую петлю кишки.
Синдром приводящей петли. Развивается в позднем периоде после резекции желудка по Бильрот-П. В основе синдрома — нарушение эвакуации содержимого из слепого отдела кишечника.
Клинические проявления: распирающие и нарастающие боли в эпигаст
ральной области и в правом подреберье, которые усиливаются вскоре после еды и сопровождаются обильной рвотой с примесью желчи в рвотных массах. У оперированных с резко выраженным синдромом возникает ежедневная, иногда 2—3 раза в день, рвота желчью, быстро истощающая больного. Рвота сменяется ощущением голода, разбитости, слабости.
Рентгенологические признаки: поступление бариевой взвеси в слепую петлю анастомоза, которая из-за снижения тонуса резко расширена. Нередко выявляют рубцовую деформацию или пептическую язву в области приводящей петли кишки и анастомоза. Массивный рефлюкс контрастного вещества из культи желудка в приводящую петлю кишки наиболее часто наблюдается у больных после операций по поводу язвенной болезни и реже — у оперированных по поводу новообразований желудка. Характерен длительный стаз бариевой взвеси в атоничной приводящей петле анастомоза.
Синдром отводящей петли (желудочно-кишечный блок). Позднее осложнение резекции желудка или гастро-энтеростомии, обусловленное нарушением проходимости отводящей кишечной петли из-за спазма ее на протяжении 15—20 см. При остром желудочно-кишечном блоке этот спазм определяется в течение 1—2 и более суток. Клинические проявления напоминают признаки высокой кишечной непроходимости.
Рентгенологические признаки: при обзорном исследовании в желудке отмечают широкий и высокий уровень жидкости, над которым виден большой газовый пузырь, чаще растянутый в горизонтальном направлении. Второй газовый пузырь с горизонтальным уровнем жидкости находят в 12-перстной кишке. Иногда можно обнаружить и третье скопление жидкости и газа,
соответствующее растянутому приводящему сегменту кишечной петли. У некоторых больных, помимо газа и жидкости, в желудке видна одна чаша Клой-бера — отражение раздутой приводящей петли кишки.
Результаты контрастирования желудка играют решающую роль в установлении диагноза. После заполнения желудка бариевая взвесь поступает в растянутую приводящую петлю тощей кишки как через желудочно-кишечное соустье, так и через привратник. Отводящая петля кишки взвесью сульфата бария не заполняется из-за ее спазма. Образуется порочный круг (круговорот пищи в желудке и приводящей петле) со слабой и редкой перистальтикой приводящей петли.
Хронический желудочно-кишечный блок чаще развивается вследствие сужения просвета отводящей петли кишки, обусловленного развитием еюнита. У этих больных, так же как и у больных с острым блоком, поступление бариевой взвеси в отводящую петлю либо ничтожное, либо вовсе не отмечается.
Демпинг-синдром. Это совокупность клинических, рентггенологических и лабораторных признаков, проявляющихся после резекции желудка вследствие быстрого поступления желудочного содержимого из культи желудка в тонкую кишку. В послеоперационном периоде встречается в 10,7 — 58 % случаев.
Клинические проявления характеризуются разнообразием. Симптомо-комплекс демпинг-синдрома порой причудлив по количеству и сочетанию признаков. Иногда преобладают черты симпатико-адреналового криза — больные возбуждены, бледны, у них повышаются АД и температура тела, возникают озноб, сухость во рту. В других случаях в период пароксизма можно отметить преимущественно ваготониче-ские симптомы: покраснение лица,
108. Синдром приводящей петли.
усиленное слюноотделение, брадикардию, артериальную гипотензию, потливость. Нередко симпатико-адреналовые и ваготонические черты криза сочетаются. На высоте демпинг-парок-сизма возможны потеря сознания, коллапс, немотивированные поступки, выраженные изменения эмоциональнопсихической сферы (раздражительность, плаксивость, резкие перемены настроения, суицидальные попытки, галлюцинации и др.).
Демпинг-синдром чаще всего возникает в первый год после операции. С течением времени он нередко ослабевает, но в ряде случае не улучшается и даже прогрессирует.
Продолжительность демпинг-криза различна — от нескольких минут до 2—3 ч. У больных отмечаются резкая слабость, головная боль, сердцебиение, потливость, неудержимое желание лечь, наступающее вскоре после приема сладкой или молочной пищи. В легких случаях приступ продолжается от 10 до 20 мин и возникает 1—2 раза в неделю. Тяжелые случаи длятся 1,5—2 ч после каждого приема пищи.
Рентгенологические признаки: быстрое опорожнение культи желудка и
ускоренный пассаж содержимого по тощей кишке, а также выраженные признаки дискинезий всех отделов кишечника.
Гастрит оперированного желудка. Развивается в результате возникновения новых анатомических соотношений и появления новых ситуаций вследствие хирургического вмешательства. Чаще всего начинается после операции по Бильрот-П. Регургитация в культю желудка желчи и щелочного секрета 12-перстной кишки с активными пищеварительными ферментами, являющимися факторами агрессии для слизистой оболочки, способствует возникновению воспалительного процесса в первую очередь в зоне анастомоза и развитию анастомозита.
Клинические проявления обычного гастрита: снижение аппетита, неприятные ощущения в эпигастральной области после еды, отрыжки, срыгивания и др. Наиболее важные диагностические сведения получают во время фибро-гастроскопии: находят отек, эрозии, изъязвления и другие изменения слизистой оболочки желудка.
Рентгенологически выявить перечисленные изменения трудно.
Пептическая язва анастомоза. Одно из тяжелых осложнений послеоперационного периода. Может возникать после любой операции, но наиболее часто развивается после резекции желудка по Бильрот-П и после гастроэнтеростомии. Пептическая язва располагается в области соустья или на некотором расстоянии от него, чаще в отводящей кишке.
Клинически проявлется резко выраженными, жесткими, постоянными болями, тошнотой, изжогой, отрыжкой кислым и горьким, рвотой и другими симптомами. Трудно поддается лечению. Если развивается пенетрация и язва прорывается в ободочную кишку, то боли исчезают, появляются понос,
отрыжка с каловым запахом, больной быстро теряет в массе тела.
Рентгенодиагностика пептических язв очень трудна из-за наличия деформаций, «карманов», перигастрита, выраженной воспалительной реакции слизистой оболочки, что суживает вход в нишу и препятствует ее контрастированию. Диагностировать нужно в условиях двойного контрастирования. Ниша при пептической язве может быть в виде ниши контура, если при исследовании она является краеобразующей, но чаще это стойкое остаточное контрастное пятно — ниша рельефа. Инфильтративный вал вокруг ниши выражен слабо, конвергенция складок отсутствует. В зоне язвы выявляются спазм и другие функциональные расстройства. При подозрении на желудочно-ободочный свищ пероральное контрастирование малоэффективно из-за узкого извилистого хода, затрудняющего прохождение взвеси сернокислого бария. Такие свищи лучше диагностировать с помощью ирригоскопии.
Рак резецированного желудка. Рецидивы опухоли обычно возникают в сроки от 1 года до 6 лет. Первичный рак развивается, по нашим данным, спустя 7 —10 и более лет после резекции желудка. Интервал между резекцией желудка по поводу язвенной болезни и возникновением рака культи желудка (Coenen, Borsch, Reitmeyer et al., 1986) может колебаться от 9 до 55 лет и в среднем составляет 28,6 года.
Клинические проявления такие же, как и при первичной локализации рака в желудке.
Рентгенологически исследовать оперированный желудок наиболее эффективно с применением двойного контрастирования и фармакологических препаратов, ослабляющих или усиливающих моторно-эвакуаторную деятельность культи желудка. Рентгенологические признаки опухолевого процесса
109. Рак:
а — анастомоза; б — культи желудка
культи желудка — наличие дефекта наполнения, деструкция складок слизистой, уменьшение размеров культи, укорочение малой кривизны, переход процесса на дистальную часть пищевода, полипозные изменения и стеноз культи.
При рецидиве экзофитного рака кардиальной части культи желудка обнаруживаются деформация и уменьшение размеров газового пузыря за счет наличия тени на его фоне. Расстояние от позвоночника до медиального контура желудка увеличено, а абдоминальный отрезок пищевода укорочен. Экзофит-но растущий рецидив рака области анастомоза встречается редко. Проявляется в виде полиповидного дефекта наполнения. Даже при больших размерах опухоли функция анастомоза не нарушается.
Эндофитный рак культи желудка встречается чаще. Он вызывает уменьшение размеров культи вследствие ригидности ее утолщенных стенок. При опухолевой инфильтрации желудочно-пищеводного перехода абдоминальный отдел пищевода сужается, деформируется и не замыкается на глубоком вдохе, т. е. зияет. Ранним осложнением эндофитного рака является нарушение функции анастомоза. Рентгенологически выявляют органический стеноз различной степени и обнажение анастомоза, а также эктазию культи желудка. Нередко наблюдается рецидив рака передней и задней стенок резецированного желудка с локализацией преимущественно в области анастомоза или вновь созданной малой кривизны. Тогда определяется деформация передней или задней стенки культи желудка,
не расправляющаяся при медикаментозной релаксации, вызванной приемом аэрона или других веществ и введением газа в просвет ее.
Рак анастомоза может быть экзофитным и эндофитным, с нарушением и без нарушения функции его. Эндофитные формы сопровождаются нарушением функции анастомоза, замедлением эвакуации и наличием жидкости в резецированном желудке. Характерны эктазия культи, обнажение анастомоза, ригидность его стенки и наличие у края инфильтрации «ступеньки».
При экзогастральном рецидиве рака культи желудка, вызванном метастазами первичного рака желудка, рентгенологически устанавливают деформацию стенки культи, как и при их прорастании, симулируя истинный рецидив рака. Ранние признаки зкзогастраль-ного рецидива — локальная инфильтрация в области анастомоза, умеренное количество жидкости в культе натощак, незначительное сужение анастомоза, ригидность стенок пораженного участка культи желудка и нарушение эвакуации из нее.
Раздел
IV
ТОНКАЯ КИШКА
Глава 21. РЕНТГЕНОАНАТОМИЯ И ФИЗИОЛОГИЯ
Тонкая кишка — самый длинный (около 5 м) отдел кишечника, расположенный между желудком и толстой кишкой, в котором продолжается переваривание пищи и всасывается основная часть пищевых веществ. По протяженности она составляет 75 %, а по площади слизистой оболочки — 90 % пищеварительного тракта. Тонкая кишка включает 12-перстную, тощую и подвздошную кишки.
Двенадцатиперстная кишка
Двенадцатиперстная кишка — начальная часть тонкой кишки, расположена между желудком и тощей кишкой у задней стенки брюшной полости на уровне L,_IV, огибает головку поджелудочной железы. При дыхании и перемене положения тела смещается вверх и вниз на 3—4 см и на 1,5—2 см вправо. Форма, длина, ширина и емкость 12-перстной кишки весьма вариабельны, зависят от особенностей эмбрионального развития, возраста, конституции человека и других факторов.
Форма 12-перстной кишки у живого человека очень разнообразна, потому что этот орган с богатым нервно-мышечным аппаратом подвижный, находится во взаимосвязи с окружакг-щими органами и зависит от их состояния. У новорожденных форма 12-перстной кишки чаще кольцевидная, в
юношеском возрасте одинаково часты кольцевидная и подковообразная, у взрослых могут быть U-образная, (55 %), С- (27 %) и V-образная (18 %).
Длина 12-перстной кишки 10—30 см, в среднем у 80 % взрослых она 22— 25 см. В зависимости от длины емкость 12-перстной кишки составляет 150— 250 см3. О нормальной ширине 12-перстной кишки при рентгенологическом исследовании судить трудно, так как она в значительной степени зависит от нервно-мышечного тонуса кишки, поэтому подвержена большим колебаниям (от 0,5 до 4 см).
12-перстная кишка подразделяется на 4 части: верхнюю, нисходящую, нижнюю и восходящую. Верхняя часть в большинстве случаев наиболее короткая и представлена луковицей длиной 3—4 см и диаметром до 4 см. Расположена непосредственно за привратником желудка, направлена слева направо и спереди назад, огибая тело позвонка. К верхней части 12-перстной кишки сверху прилежит печень, спереди — желчный пузырь, сзади — воротная вена, желудочно-двенадцатиперстная артерия и общий желчный проток, снизу и изнутри — головка ПЖ.
Нисходящая часть 12-перстной кишки длиной 9—12 см начинается от верхнего ее изгиба, располагается справа вдоль тел и заканчивается
у нижнего изгиба кишки. К нисходящей
110. Варианты рентгеноанатомической формы 12-перстной кишки и ее сегментарное строение: а — С-образнан; б — V-образнан; в, г — U-образная.
части 12-перстной кишки спереди прилежат правая доля печени и брыжейка поперечной ободочной кишки, где проходит средняя ободочная артерия, сзади — правая почка и нижняя полая вена, снаружи — восходящая ободочная кишка и правый ее изгиб, изнутри — головка поджелудочной железы и частично общий желчный проток. В нисходящей части по заднемедиальной стенке расположено ампуловидное расширение — фатерова ампула, в которой открываются общий желчный и панкреатический протоки, образующие возвышение — большой сосочек 12-перстной кишки.
Нижняя, горизонтальная, часть 12-перстной кишки по длине весьма вариабельна — от 1 до 9 см. Расположена преимущественно (75 %) на уровне LIV, ниже брыжейки поперечной ободочной кишки, частично за корнем брыжейки тонкой кишки. Задняя поверхность ее прикрывает нижнюю полую вену (правее), аорту (левее) и начало нижней
брыжеечной артерии, отделяясь от них фасцией Трейтца. Нижнегоризонтальная часть 12-перстной кишки, пересекая позвоночник справа налево, поднимается косо кверху и на уровне LK переходит в восходящую часть длиной от 6 до 13 см, которая образует отчетливый дуоденоеюнальный перегиб. В зависимости от положения нижнегоризон-тальной части колеблется и положение изгиба при переходе в тощую кишку, но, как правило, он располагается слева и на один позвонок выше нижнегоризонтальной части. В единичных случаях переход в тощую кишку локализуется по средней линии или справа. К горизонтальной и восходящей частям сверху прилежит головка и тело поджелудочной железы, сзади, кроме сосудов, располагается большая поясничная мышца.
Анализ рентгенограмм 12-перстной кишки показывает, что ее петля не является равномерной по диаметру, а состоит из отдельных сегментов разной протяженности и диаметра, каждый из которых имеет самостоятельную продольную ось. Любая из известных анатомических частей кишки представляется при этом одним или двумя сегментами бочкообразной или цилиндрической формы. Сегмент с наибольшей шириной просвета обычно располагается в нисходящей части кишки. В том случае, если эта часть кишки представлена одним сегментом, наибольший диаметр приходится на середину его длины (экваториальная плоскость). При наличии двух сегментов наибольший диаметр чаще располагается в экваториальной плоскости дистального сегмента (Герасимов с соавт., 1972). Определение сегментов нисходящей части имеет практическое значение, поскольку в сегмент с наибольшим диаметром открывается общий желчный проток.
Взаимоотношение сегментов в каждой из частей 12-перстной кишки обусловлено расположением их продольных
111. Рельеф слизистой оболочки 12-перстной кишки (варианты а, б).
осей и представляется тремя вариантами: 1) оси сегментов — одна прямая линия; 2) образуют между собой угол, открытый внутрь, и 3) образуют угол, открытый кнаружи. Различные сочетания этих вариантов — это U-, С-, V-об-разные формы кишки с индивидуальными особенностями, влияют на конфигурацию ее контуров.
Рентгенологически контур луковицы 12-перстной кишки ровный, в остальных отделах — мелкозубчатый из-за наличия поперечных складок и затекания между ними контрастного вещества. Зубчатость контуров не стабильная, величина зубцов и выраженность их меняются в процессе исследования. При прохождении перистальтической волны контуры кишки могут выравниваться, а
зубчатость — уменьшаться или исчезать. Если ось двух смежных сегментов совпадает, отмечается правильное чередование зубчатости. В местах изгибов кишки, в зонах перехода одного сегмента в другой, складки слизистой оболочки приобретают веерообразное направление, конвергируя к внутреннему контуру. В этом месте они могут образовывать дубликатуру, вдающуюся в просвет кишки, и обусловить своеобразную картину контура. Одним из таких вариантов контура в месте изгиба является картина, известная под названием широкого раздвоенного на вершине зубца с остроконечной нишей в центре его. Другой вариант контура в месте изгиба напоминает верхушку елочки. Такую рентгенологическую картину дают
112. Варианты расположения тощей кишки в брюшной полости:
а — в верхнелевой части; б — в центральной части.
крупная поперечная центральная склад-ка и конвергирующие к ней более мелкие.
Изгиб в месте перехода 12-перстной кишки в тощую имеет множество вари
антов угла. Угол может быть округлым, тупым, прямым, острым, в виде двустволки, спиральным, иногда с поворотом кишки в медиальную сторону.
Рельеф слизистой оболочки 12-перстной кишки в луковице образован продольными складками, в постбульбарном отделе верхней части и в верхнем изгибе — косыми, извитыми или поперечно направленными складками (редко). В остальных отделах существует 3 основных вида складок: поперечно извитые с веерообразным ходом в изгибах (часто встречаются), перистые и продольные (редко). Расположение складок и их количество в значительной степени обусловлены длиной и формой кишки. При С-образной форме кишки складки расположены циркулярно, при других формах они имеют чаще косой и извилистый ход. Ширина складок в луковице в среднем 2 мм, в остальных отделах — 3 мм. В С-образной кишке складки более широкие, при V- и U-формах ширина складки меньше, число их возрастает. В начальных отделах 12-перстной кишки складки редкие и низкие. По мере приближения к тощей кишке высота складок слизистой увеличивается. Направление и размеры складок меняются в процессе деятельности кишки. На высоте перистальтических волн круговые складки принимают продольное направление, а после прохождения волны приобретают свое обычное поперечное направление.
В месте сращения кишки с головкой поджелудочной железы складки низкие, причем у большого сосочка 12-перстной кишки одна из них лежит продольно. Эта складка образована проходящим вдоль задневнутренней стенки общим желчным протоком. Она заканчивается возвышением — большим сосочком 12-перстной кишки (фатеров сосок). Высота сосочка до 10 мм и более, ширина 5—10 мм. На вершине сосочка открываются общий желчный и поджелудоч
ный (вирсунгов) протоки. На 2 см выше большого сосочка располагается малый дуоденальный сосочек. На нем открывается добавочный (санториниев) проток поджелудочной железы.
Если складки слизистой оболочки теряют эластичность, появляются их ригидность и малая изменчивость, т. е. наблюдается «застывший рельеф», а также стойкое расширение складок. Это свидетельствует о патологическом состоянии и наблюдается при воспалительных и опухолевых процессах. Отрыв складок слизистой или отсутствие их на определенном участке (здесь же ригидность стенок кишки), стойкое сужение просвета и нарушение опорожнительной функции характерны для опухолевых процессов.
О двигательной функции 12-перстной кишки судят по моторной, тонической деятельности и опорожнению ее от контрастного вещества. Своеобразие анатомического положения 12-перстной кишки обусловливает теснейшую взаимосвязь ее с такими органами, как желудок, поджелудочная железа, гепатобилиарная система. Поступающая в 12-перстную кишку пища встречается в ней с пищеварительными соками поджелудочной железы, печени, а также с соком заложенных в слизистой оболочке 12-перстной кишки желез (брун-неровских, либеркюновых) и эпителиальных клеток.
По данным рентгенологических исследований, содержимое по 12-перстной кишке проходит быстро, в течение 5 — 8 с, реже 25—30 с. Сокращения мышечной оболочки кишки сопровождаются двумя видами движений: пропульсивно направленными и локальными (сегментарными) . Пропульсивные сокращения перемешивают и продвигают содержимое кишки в дистальном направлении, выдавливая его как пасту из тюбика. Сегментарные сокращения выталкивают содержимое в оба конца и способ
ствуют его перемешиванию. Эти сокращения варьируют по локализации и продолжительности: длятся 1—3 с и возникают с интервалами 6—11 с (Сальман, Гурвич, 1974).
Важную роль в двигательной деятельности 12-перстной кишки имеют 3 функциональных сфинктера: верхний, бульбодуоденальный, сфинктер; средний, медиодуоденальный, сфинктер (Капанджи), который располагается в средней трети нисходящей ее части; нижний (Окснера), локализующийся в нижнегоризонтальной части 12-перст-ной кишки. Сфинктерные зоны лучше выявляются при изучении кишки с помощью усилителей рентгеновского изображения. Особенно хорошо они выражены при патологических состояниях, вызывающих повышение тонуса кишки. Сокращение стенок кишки на участках расположения сфинктеров, особенно нижнего, ведет к нарушению двигательной функции с возникновением дуоденостаза.
Тощая и подвздошная кишки
Тощая и подвздошная кишки — самая длинная часть пищеварительного тракта. Они лежат внутрибрюшинно, прикреплены широкой подвижной брыжейкой к задней стенке брюшной полости. Образуют множество петель, обладающих значительной подвижностью, вследствие чего их положение чрезвычайно изменчиво. Начальная часть тощей кишки малоподвижна вследствие фиксации дуоденоеюнального изгиба и наличия короткой брыжейки. Начинаясь у левой стороны тела Ln, петли кишки располагаются преимущественно в центральных отделах живота- и в области таза.
Тощая кишка размещена в основном в верхней и левой частях брюшной полости между 12-перстной и подвздошной кишками. На ее долю приходится
почти 2/5 тонкой кишки. Подвздошная кишка является продолжением тощей кишки. Она — самый большой отдел кишечника, составляет около 3/5 длины тонкой кишки. Расположена преимущественно в нижнеправой части брюшной полости и в заднем отделе малого таза. Конечная петля подвздошной кишки впадает в слепую кишку с медиальной или заднемедиальной ее стороны по типу конец в бок, образуя острый угол, открытый книзу и влево. В месте впадения тонкой кишки в толстую имеются складки, создающие илеоцекальный клапан, или баугиниеву заслонку. Илеоцекальный клапан препятствует забросу содержимого из слепой кишки в подвздошную.
Петли брыжеечной части тонкой кишки вверху граничат с поперечной ободочной кишкой и ее брыжейкой, спереди прикрыты большим сальником, с боков соприкасаются с восходящей и нисходящей ободочными кишками, сзади примыкают к позвоночнику, почкам, мочеточникам, нижней полой вене и брюшной аорте, в малом тазу граничат с мочевым пузерем, половыми и другими органами.
Петли тонкой кишки лежат в разных плокостях, накладываются одна на другую, что затрудняет их исследование. Проследить ход петель можно при изменении положения тела больного и с помощью пальпации. Рентгенологическая картина петель весьма изменчива, зависит от тонуса кишки, степени заполнения ее контрастным веществом, перистальтических движений, фазы пищеварения, от положения смежных органов. На положение кишки влияют дыхательные экскурсии диафрагмы, положение больного и другие факторы. При исследовании больного на трохоскопе петли кишечника смещаются кверху, особенно тощей кишки.
Ширина просвета тощей и подвздошной кишок неодинакова. Начальные
сегменты тощей кишки имеют ширину 2,5—3 см. Постепенно просвет кишки суживается в дистальном направлении и в терминальных петлях подвздошной кишки составляет около 1,5 см. Характерная особенность рельефа слизистой оболочки тонкой кишки — наличие круговых складок, мышечных ворсинок и кишечных крипт (желез). Длина складок 4—5 см, высота 0,8 см, ширина около 0,2 см. Расстояние между складками 0,2—0,5 см. Самые крупные из них и густо расположенные находятся в начальной трети тощей кишки, а дистальнее размеры и количество складок уменьшаются. В проксимальной части подвздошной кишки складки уплощаются, становятся редкими, затем постепенно переходят в продольные, а в конечном отделе этой кишки вовсе отсутствуют.
Кроме постоянных анатомических складок, на слизистой оболочке образуются также непостоянные (физиологические) складки. Пульсация кровеносных и лимфатических сосудов в подслизистом слое, тургор тканей и сокращения собственной мышечной ткани слизистой оболочки обусловливают аутопластику слизистой. При сокращении мышечной оболочки стенок кишки в различные фазы перистальтических движений круговые складки изменяют свое направление и становятся продольными. Потеря эластичности складок, ригидность, стойкое их набухание, нечеткость контуров, уменьшение числа, стабильное расположение складок слизистой оболочки свидительствуют о воспалительных и других патологических процессах кишки.
В собственном слое слизистой оболочки находятся скопления лимфоидной ткани, образующие одиночные или групповые лимфатические фолликулы (пейеровы бляшки), которые могут выявляться рентгенологически. Одиночные фолликулы диаметром до 3 мм
распределены по всей длине тонкой кишки, причем количество их возрастает в подвздошной кишке. В ней образуются целые скопления лимфоидной ткани, которые располагаются на противобры-жеечном крае кишки.
Контуры стенок тонкой кишки различны. В тощей кишке контуры мелкозубчатые, обусловлены выхождением на контур круговых, керкринговых складок слизистой оболочки. Зубчатость же контуров подвздошной кишки выражена слабо, а в ее терминальном отделе она вовсе не выявляется. Заполненная бариевой взвесью конечная петля подвздошной кишки рентгенологически изображается в виде лентообразной тени с ровными контурами.
Главное назначение тонкой кишки — пищеварение и всасывание. Кишечное пищеварение протекает при активном участии мышечных сокращений, которые перемешивают химус, способствуют контакту пищеварительных соков и пищевых веществ, а также соприкосновению последних с кишечной стенкой и продвигают содержимое кишечника. К основным видам сокращений относятся: ритмическая сегментация, маятникообразные движения, перистальтика. Первые два направлены на перемешивание содержимого в определенном участке кишки. Ритмическая сегментация состоит в сокращении циркулярного слоя мышц и наблюдается преимущественно в подвздошной кишке. Участок кишки в нескольких местах перешнуровывается, и его содержимое образует сегменты. В следующий момент происходит расслабление, которое сменяется сокращением мышц в других отрезках кишки. При этом сегменты делятся на две части, затем эти движения снова в той же последовательности повторяются. При таком перемешивании не происходит передвижения химуса вдоль кишечника. Существует, однако, тип сегментации, при котором содержимое
ИЗ. Рентгенологическая картина и топография контрастированных желудка, 12-перстной, тощей и подвздошной кишок.
кишки каждый раз несколько перемещается в дистальном направлении, что обеспечивается некоторым запаздыванием дистальной перетяжки кишки по сравнению с проксимальной (Фролькис, 1975).
Многие авторы описывают также сегментирующие сокращения, при которых перетяжки сменяются общим расслаблением кишки и только после этого возникают новые сокращения в других местах, причем осуществляются они менее регулярно. Ритмические сокращения кишечной мускулатуры всегда происходят на фоне некоторого ее напряжения — тонуса, который изменяется в зависимости от фазы пищеварения. Это может проявляться в длительных изменениях длины и просвета отдельных
участков кишки. Тонус тонкой кишки в норме неодинаков на всем протяжении. Тощая кишка тонизирована больше, подвздошная меньше. О тонусе судят не только по ширине просвета, но и по силе перистальтических движений, а также по состоянию рельефа слизистой оболочки. В дистальных петлях подвздошной кишки из-за сниженного тонуса бариевая взвесь в просвете кишки располагается толстым слоем, что затрудняет изучение рельефа слизистой оболочки и ее морфологических1 изменений.
Маятникообразные движения вызываются сокращениями главным образом продольного слоя мышц при некотором участии кругового слоя. Сокращение продольной мускулатуры вызывает укорочение и тем самым расширение участка кишки. Сокращение циркулярных мышечных волокон, наоборот, суживает просвет кишки. Благодаря этим сокращениям бариевая взвесь продвигается в участке кишки на 2—3 см то в одну, то в другую сторону. Эти движения выявляются чаще в подвздошной кишке, чем в тощей.
Перистальтические сокращения распространяются волнообразно вдоль кишки и способствуют продвижению содержимого в дистальном направлении. Перистальтика наиболее выражена в тощей кишке, которая полностью заполняется бариевой взвесью в среднем за 105 мин. В начальных петлях подвздошной кишки продвижение контрастного вещества значительно замедляется, но в конечном отрезке перистальтика вновь становится весьма активной и продвижение бария ускоряется. Полагают, что в том или ином отрезке кишки сначала происходит ритмическая сегментация, затем маятникообразные движения и лишь после основательного перемешивания химуса возникают перистальтические волны, обусловливающие перемещение — про-
пульсию содержимого кишки в дистальном направлении.
Поступление бариевой взвеси в слепую кишку начинается через 3—4—5 ч после ее приема и осуществляется ритмично отдельными порциями. Эвакуация из тонкой кишки в толстую длится 7—9 ч. В регуляции моторной деятельности кишечника важную роль играют местные стимулы, воздействующие на механорецепторы кишки. Моторная деятельность находится также под контролем высших отделов центральной нервной системы. Импульсы, идущие к кишечнику по блуждающим нервам, оказывают на нее возбуждающее, а идущие по чревным нервам — тормозящее действие. На двигательную деятельность кишечника влияют гуморальные и другие факторы.
На границе тощей и подвздошной кишок находится дифференцированный Мышечный механизм, осуществляющий функциональное разобщение тощей и подвздошной кишок и участвующий в управлении и согласовании их моторики путем модуляций внутрипросветного давления.
Рентгенологическая картина при приеме сорбитно-водно-бариевой взвеси
В результате изучения нормальной рентгенологической картины тощей и подвздошной кишок при приеме 20 г сорбита в составе 200 мл водно-бариевой взвеси А. Н. Михайлов и Е. В. Ильяше-вич установили количественные параметры эвакуаторной функции. Эти параметры можно принимать за основу в оценке нарушений эвакуаторного процесса: среднее время начальной про-пульсии по тощей кишке — 18,2 ± ± 1,2 мин, по подвздошной — 29,3 ± ± 2,9, по тощей кишке — 47,4 ± ± 3,4 мин; среднее время полной эвакуации из желудка и 12-перстной
114. Рентгенологическая картина при заполнении сорбитно-водно-бариевой взвесью: а — тощей; б — проксимальной части подвздошной кишки.
кишки — 129,9 ± 5,0 мин, и тощей кишки — 139,5 ± 22,3, из подвздошной кишки — 354,6 ± 9,6 мин. Коэффициент соотношения времени начальной пропульсии по подвздошной и тощей кишкам 1: 2,5.
Средняя степень растяжения просвета тощей кишки наблюдалась через 15—30 мин, подвздошной — через 30— 60 мин после приема сорбитно-водно-бариевой взвеси. Поэтому по рентгенограммам, выполненным в это время, оценивали показатели тонической функции тонкой кишки. Полученные данные могут служить критериями нормальной рентгенофункциональной и рентгеноанатомической картины тонкой кишки при приеме сорбитно-водно-бариевой взвеси.
Для тощей кишки было характерно полутугое равномерное заполнение сорбитно-водно-бариевой взвесью (100%), для подвздошной — полутугое заполнение: наиболее часто равномерно-сегментарное (68,4%), реже равномерное (15,8 %) и неравномерное (13,2 %), крайне редко сегментарно-спазматическое (2,6 %). Причем заметной разницы в характере заполнения отделов
подвздошной кишки не отмечалось. Через 90—120 мин и позже, а именно в конце опорожнения тощей кишки, распределение контрастной взвеси по подвздошной кишке становилось неравномерным. Из-за этого в 16,8 % наблюдений возникла необходимость дифференциальной диагностики функционального и органического сужения в терминальном отделе подвздошной кишки. Применение разработанной нами методики ускоренной илеоцекографии с двойным контрастированием позволило решить эту проблему.
Установлено постепенное сужение просвета тонкой кишки в дистальном направлении. Средние значения ширины просвета тощей кишки колебались от 24,1 + 0,5 до 18,3 + 0,4 мм, проксимального и среднего отделов подвздошной кишки — от 20,4+0,4 до 13,2+ + 0,4 мм, среднее значение ширины просвета терминального отдела подвздошной кишки составляло 12,7 ± + 0,3 мм. Расширение просвета проксимального отдела подвздошной кишки относительно дистального отдела тощей кишки было статистически достоверным.
Контрастность рельефа слизистой оболочки тощей кишки на рентгенограммах, выполненных через 15 и 30 мин после приема сорбитно-водно-бариевой взвеси, была высокой (100 %). Удовлетворительная контрастность изображения подвздошной кишки через 30 или 45 мин после приема контрастной взвеси наблюдалась довольно редко (23,7 %). В большинстве случаев (76,3 %) в это время она была снижена, затем постепенно повышалась, и через 90 мин во всех случаях (100 %) отмечалась удовлетворительная контрастность. Первоначальное снижение контрастности существенно не влияло на выявление анатомических деталей слизистой.
Рельеф слизистой оболочки тощей кишки в начале заполнения сорбитно-водно-бариевой взвесью чаще имел перистый вид (86,8 %), реже — ажурный (10,5 %), крайне редко был выражен поперечной складчатостью (2,7 %). Рельеф слизистой оболочки подвздошной кишки в 15,8 % случаев был недоступен исследованию из-за неравномерности заполнения ее контрастной взвесью. В большинстве наблюдений (84,2 %) рельеф был представлен чередованием поперечной и продольной складчатости. После опорожнения от сорбитно-водно-бариевой взвеси в тощей кишке определялся равномерно-мелкопятнистый остаточный рельеф (100 %), в подвздошной кишке — мелкопятнистый и точечный (100 %).
Изменчивость рельефа слизистой оболочки в процессе исследования с сорбитно-водно-бариевой взвесью была характерна для нормальной тонкой кишки (100 %) и проявлялась изменением направления и ширины складок.
Средние значения ширины складок и межскладочных промежутков были соответственно следующими: тощая кишка — 2,3+0,1 и 2,4+0,1 мм, проксимальный и средний отделы подвздош
ной кишки — 2,1+0,1 и 2,4+0,1 мм, терминальный отдел — 1,9+0,1 и 2,0+ +0,1 мм. Установлено статистически достоверное уменьшение ширины складок в направлении от тощей кишки к дистальному отделу подвздошной кишки, а также ширины межскладочных промежутков в направлении от среднего к терминальному отделу подвздошной кишки. При сравнении ширины складок и межскладочных промежутков разница была статистически недостоверной в тощей кишке и дистальном отделе подвздошной кишки, статистически достоверной в проксимальном и среднем отделах подвздошной кишки.
Таким образом, ширина складок в дистальном направлении уменьшается более постепенно, чем ширина межскладочных промежутков. В тощей кишке складки и межскладочные промежутки практически одинаковы по ширине. В направлении от тощей кишки к дистальному отделу подвздошной происходит сужение складок, отчего создается впечатление расширения межскладочных промежутков. Последние начинают суживаться дистальнее среднего отдела подвздошной кишки, и в терминальном отделе складки и межскладочные промежутки практически сравниваются по ширине. Выявленная закономерность в изменении соотношения складок и межскладочных промежутков отражает различие в двигательной функции проксимального, среднего и дистального отделов подвздошной кишки при приеме сорбитно-водно-бариевой взвеси. Установлено снижение высоты складок в дистальном направлении, начинавшееся на уровне проксимального отдела подвздошной кишки.
Сравнение показателей рентгенологической картины желудка и тонкой кишки при приеме водно-бариевой и сорбитно-водно-бариевой взвесей выявило сходство и различие между ними и позволило
определить влияние 20 г сорбита на эвакуаторно-тоническую функцию и анатомию этих отделов пищеварительного тракта.
В действии сорбита на процесс эвакуации 200 мл контрастной взвеси из тонкой кишки можно выделить два периода: 1) ускорение пропульсии контрастной взвеси по тощей и подвздошной кишкам в течение 60—90 мин; 2) замедление пропульсии, преимущественно выраженное в подвздошной кишке.
Добавление 20 г сорбита к водно-бариевой взвеси незначительно изменяет тоническое состояние тощей кишки, существенно влияет на тонус подвздошной кишки, особенно проксимального его отдела. Следствием таких изменений тонической функции подвздошной кишки и являются изменения пропульсии контрастной взвеси в первый и второй периоды.
Под влиянием 20 г сорбита происходит ускорение контрастирования тощей, подвздошной и слепой кишок, снижается индивидуальная вариабельность времени начальной пропульсии контрастной взвеси по отделам тонкой кишки. Это создает перспективу для выработки стандартных интервалов наблюдений, которые позволят сократить облучение пациента без ущерба для информации об эвакуаторной функции тонкой кишки. Сорбит, принятый в дозе 20 г, влияет на эвакуаторный процесс в ЖКТ как пищевой раздражитель, сохраняя благодаря этому его нормальное функциональное состояние. Отмечены хорошее качество изображения пищевода, желудка и 12-перстной кишки, естественная фракционность заполнения тонкой кишки при приеме сорбитно-водно-бариевой взвеси. Качество изображения анатомических деталей слизистой оболочки тонкой кишки при заполнении сорбитно-водно-бариевой взвесью не уступает качеству изо
бражения при приеме водно-бариевой взвеси.
Возрастные рентгеноанатомические особенности
В разные возрастные периоды тонкая кишка отличается по форме и размерам, положению и внутренней структуре. Наиболее высокое положение нижней границы петель тонкой кишки (Lv) наблюдается у детей, наименее высокое (IV крестцовый позвонок) — у женщин II периода зрелого возраста и в пожилом возрасте, т. е. происходит каудальное смещение на 4 позвонка.
Длина кишки у новорожденных 1,5— 3 м. Особенно интенсивно она растет в первом полугодии, а также в период 1—3 и 13—16 лет. Ширина просвета начальных петель кишки у новорожденных в среднем 12 мм, в 8 лет — 21, в 15 лет — 23 мм. Положение петель тонкой кишки у грудных детей также имеет свои особенности. Вследствие больших размеров печени, высокого положения слепой кишки и нахождения в брюшной полости мочевого пузыря петли тонкой кишки располагаются посередине между печенью и поперечной ободочной кишкой — сверху и сигмовидной ободочной кишкой и тазовыми органами — снизу. Из-за короткой брыжейки тощей кишки положение ее петель в основном вертикальное. Петли подвздошной кишки имеют более длинную брыжейку, а потому и самые подвижные.
При рентгенологическом исследовании у детей раннего возраста контрастная масса быстро проходит 12-перстную кишку. После перехода контрастного вещества в тощую кишку скорость продвижения его значительно замедляется, а в подвздошной кишке снова ускоряется. Это отчетливо выражено у новорожденных. Головной конец бариевой взвеси у них достигает терминаль
ного отдела подвздошной кишки через 2 ч после приема пищи, а через 8 ч уже заполняется толстая кишка (Панов и др., 1972).
Слизистая оболочка тонкой кишки у грудного ребенка также имеет свои особенности. Круговые складки плоские и обнаруживаются только в начальной части тощей кишки. С возрастом количество круговых складок возрастает, достигая максимума к периоду полового созревания. Контрастное вещество у новорожденных располагается отдельными скоплениями, без определенной формы, с неровными, смазанными контурами. Наибольшую отчетливость рельеф слизистой оболочки приобретает на 2-м году жизни ребенка. В подвздошной кишке у грудных детей рельеф своеобразный, с множеством мелких
округлых дефектов наполнения (Тагер, Филиппкин, 1974). Подобная картина возникает вследствие нахождения в этом отделе кишечника большого количества одиночных и множественных лимфатических фолликулов (узелков) .
У людей пожилого и старческого возраста складки слизистой оболочки нежные, видимо вследствие атрофических изменений и ослабленной сократительной способности мышечного слоя слизистой; перистый рельеф встречается в более дистально расположенных петлях, включая подвздошную кишку. В данной возрастной группе считается нормальным скопление газов в тощей кишке, в то время как в зрелом возрасте это расценивается как патологическое состояние.
Г л а в а 22. АНОМАЛИИ И ПОРОКИ РАЗВИТИЯ
Аномалии и пороки развития тонкой кишки определяются преимущественно у детей с периода новорожденности. Причем на долю 12-перстной кишки приходится около 15 % случаев недоразвития ЖКТ и до 50 % пороков развития тонкой кишки.
Аномалии вращения. Это расстройства поворота кишечника, его незавершенный поворот, когда в эмбриогенезе нормальный поворот останавливается или происходит в обратном направлении. В случае отсутствия поворота кишечника нисходящая часть 12-перстной кишки не поворачивается налево, а опускается прямо вниз. При этом нет дуоденоеюнального изгиба и 12-перстпая кишка незаметно переходит в тощую. Клинически порок не проявляется.
Диагностика возможна только по результатам рентгенологического исследования. Применяется пероральное контрастирование ЖКТ бариевой взвесью.
Незавершенный поворот кишечника проявляется расположением тонкой кишки справа, а толстой — слева. Верхнегоризонтальная и нисходящая ветви 12-перстной кишки расширены, дистальная часть ее расположена вертикально и легко смещается при пальпации.
Когда же один или несколько отрезков тонкой кишки (чаще 12-перстная) фиксируются эмбриональными тяжами в ненормальном положении, у новорожденных возникают различные органические препятствия в выходном отделе 12-перстной кишки: заворот, спайки, высокая кишечная непроходимость. т. е. состояния, требующие немедленной рентгенодиагностики и срочного оперативного вмешательства.
Завороту петель кишечника способствует отсутствие фиксации брыжейки или недостаточное ее прикрепление на всем протяжении. Заворот может произойти в эмбриональном или постнаталь
ном периоде. Он приводит к сдавлению проксимальных отделов тощей кишки, к тромбозу брыжеечных сосудов, омертвению средней кишки.
Клинически врожденный заворот средней кишки проявляется усиленной перистальтикой кишечника, задержкой стула, редким мочеиспусканием, рвотой с примесью желчи. При осмотре живота отмечается увеличение его в объеме, при перкуссии — тимпанит. Ренгепо-логически желудок и 12-перстная кишка значительно увеличиваются в размерах с горизонтальными уровнями жидкости.
Непроходимость 12-перстной кишки может развиваться также при сдавлении ее извне тяжами брюшины, отходящими из слепой кишки, или поперечной ободочной кишкой, которая располагается в поперечном направлении (Панов, Гингольд, Москалева, 1972).
Сдавление 12-перстной кишки и заворот кишечника встречаются как изолированно, так и в сочетании. В последнем случае патологию именуют синдромом Ладда. При синдроме Ладда рентгенологически обнаруживают два горизонтальных уровня жидкости: в желудке и 12-перстной кишке.
При наличии брыжейки 12-перстная кишка становится подвижной, удлиняется и может образовывать несвойственные ей изгибы и петли. Если удлинен нисходящий отдел, 12-перстная кишка образует дополнительный изгиб, располагающийся, как правило, медиальнее ее верхнего и нижнего изгибов. Но чаще всего, удлиняется верхняя, проксимальная, часть 12-перстной кишки. Тогда рентгенологически обнаруживают подвижную провисающую вниз петлю верхней части 12-перстной кишки.
Атрезия и стеноз. Эти пороки развития тонкой кишки — следствие нарушения стадии вакуолизации в процессе эмбриогенеза. Встречаются различные анатомические варианты патологии.
115. Обратное положение 12-перстной кишки:
а — кишка повернута полностью, б, в — кишка повернута с нижнего колена; г — то же самое, но верхняя часть кишки удлинена и провисает.
Наиболее часто разиваются атрезия и стеноз 12-перстной и тощей кишок. Различают 3 формы врожденного нарушения проходимости кишечника: полное закрытие просвета кишок, перепончатое сужение в виде мембраны и полный перерыв кишечной трубки, когда полностью отсутствует просвет кишки.
При атрезии и резкой степени стеноза, локализующихся на уровне 12-перст-ной кишки и начального отдела тощей кишки, развивается картина острой высокой непроходимости кишечника. В первые сутки после рождения возникает рвота, которая носит застойный характер, цвет рвотных масс зеленый или бурый, что характерно для атрезии 12-перстной кишки. Рвота постепенно усиливается, особенно после кормления. Живот вздутый в эпигастральной области и умеренно запавший в нижних отделах. Как правило, отмечается однократное отхождение мекония в количестве несколько меньшем, чем у здорового ребенка (Долецкий и др., 1976). Затем стул отсутствует, газы не отходят. Из-за упорной рвоты организм ребенка быстро обезвоживается, прогрессируют истощение, слабость, анемизация. При
116. Удлиненная и подвижная 12-нррстная кишка, образующая дополнительные изгибы и петли:
а — удлинение и провисание верхней части; б — с образованием петли в нисходящей части; в — кишка в виде цифры «8»; г — удлинение и провисание верхней и нижней частей; д — кишка повернута и расположена справа от средней линии;е — образование петли в верхней и провисание в нижней частях
117. Атрезия 12-перстной кишки:
а — с полным разделением кишки, оба ее конца заращены и плотно прилегают друг к другу; б — в виде тонкого рубцового шнура.
перфорации стенки кишки развивается мекониальный перитонит, от которого в большинстве случаев погибают.
Рентгенологическое исследование начинают с обзорного снимка грудной клетки и брюшной полости. Обращают внимание на наличие свободного газа в брюшной полости, под куполом диафрагмы, на характер заполнения газами ЖКТ. Газ будет находиться всегда выше места атрезии. Для диагноза большое значение имеют и результаты контрастного исследования.
Чаще всего атрезирован вертикальный отдел 12-перстной кишки в области фатерова соска. Типичный признак ее атрезии — два горизонтальных уровня:
один в проекции желудка, второй горизонтальный уровень жидкости с газом над ним справа от средней линии, в зоне проекции 12-перстной кишки. Вся остальная брюшная полость гомогенно затемнена. Во время контрастирования желудка находят его расширение и отсутствие пассажа контрастного вещества в тонкую кишку. При атрезии тощей кишки на обзорных снимках обнаруживают газ в желудке и 12-перстной кишке и отсутствие продвижения контраста в подвздошную кишку. В случае атрезии терминального отдела подвздошной кишки расположенный выше отдел ее расширен, воздух и жидкость находятся над слепым участком, у илеоцекального клапана. Здесь же определяется полость с уровнем жидкости. Иногда возникает несколько горизонтальных уровней (Панов и др., 1972; Михайлов, 1980).
Врожденный стеноз 12-перстной кишки имеет достаточно типичные признаки. Чаще всего определяется расширение желудка, иногда значительное, форма его не изменяется. Перистола резко снижена. В желудке натощак содержится большое количество жидкости, пищевых остатков. Когда удается выявить рельеф слизистой оболочки, обнаруживают широкие извитые складки, идущие в различных направлениях. В результате торможения прохождения пищи через 12-перстиую кишку давление в ней повышается, вызывая зияние пилорического отверстия желудка, через которое контрастное вещество без задержки поступает в 12-перстную кишку. Одновременно определяются неглубокие, поверхностные перистальтические сокращения желудка с частыми антиперистальтическими забросами содержимого кишки в желудок. Супрасте-нотическая часть 12-перстной кишки расширена. Диаметр ее просвета превышает 1,5 см, иногда достигает поперечника увеличенного желудка. Конт
растное вещество задерживается над сужением от 10 — 15 мин до нескольких часов, в зависимости* от степени сужения.
Нередко встречаются и перегородки в 12-перстной кишке (внутрикишечные перепонки). Клиническая картина зависит от отсутствия или наличия дефектов в перепонке и их размеров. Так, при отсутствии дефектов развивается клиническая картина атрезии. Если дефекты небольшие, наблюдаются срыгивание и рвота застойной пищей с примесью слизи и желчи, запоры, истощение и дистрофия. Рентгенологическое исследование имеет решающее значение. Находят расширение желудка и повышенную перистальтику 12-перстной кишки, иногда — антиперистальтику (До-лецкий и др., 1976).
Мегадуоденум. Врожденная гигантская 12-перстная кишка возникает в результате отсутствия или недоразвития в ней ганглионарных клеток собственных нервных сплетений в отдельных участках. Первые клинические признаки заболевания развиваются в раннем детстве, однако могут иметь место значительно позднее — к 20—30 годам.
В зависимости от степени выраженности аганглиоза сроки проявления симптомов различны. Если ганглионарные клетки полностью отсутствуют, уже в первые месяцы жизни у детей наблюдаются рвота желчью после каждого кормления, резкое истощение, судороги. При осмотре отмечается выпячивание верхней правой половины живота. Пальпацией этой зоны определяют болезненность и плеск. Рентгенологически в отличие от атрезии 12-перстной кишки при мегадуоденум воздуха в кишечнике бывает достаточно. Контрастная взвесь быстро поступает из желудка в 12-перстную кишку. Отмечаются расширение 12-перстной кишки и задержка в ней бариевой взвеси.
118. Мегадуоденум.
При недоразвитии ганглионарных клеток в собственных нервных сплетениях мегадуоденум может проявиться позднее — в юношеском и молодом возрасте. Больные жалуются на общую слабость, похудание, плохой вкус во рту, постоянное чувство тяжести в подложечной или околопупочной области. Аппетит снижен или отсутствует. Нередко имеет место рвота пищей, содержащей обильное количество желчи и панкреатического сока. В ряде случаев нарушается стул, появляется понос с примесью крови и слизи вследствие изъязвления слизистой оболочки 12-перстной кишки (Белоусов, 1978, 1984). Рентгенологически обнаруживают расширенную и удлиненную 12-перстную
119. Формы удвоения 12-перстной кишки:
а — дивертикулярная, б — кистовидная, в — трубчатая.
кишку, в ней длительно задерживается бариевая взвесь, затрудняется ее опорожнение. Нередко наблюдаются случаи, когда 12-перстная кишка бывает больше желудка. Аганглионарная зона чаще всего локализуется в нижнегоризонтальной ветви 12-перстной кишки, провляется сужением ее просвета и ригидностью стенок.
Удвоения. Они формируются в ранней фазе эмбрионального развития и могут наблюдаться в любом отделе ЖКТ. Удвоения — это сферические или удлиненные образования, толстостенные, тесно спаянные со смежным участком кишечника и расположенные на брыжеечном или боковом крае. Если строение стенки на участке удвоенной кишки нормальное, т. е. имеются все слои, ее называют дубликатурой, если имеются лишь отдельные элементы стенки кишки (например, только слизистый или только мышечный слой) — дивертикулом. Дубликация может быть изолированной или сообщаться проксимальным, дистальным или обоими концами с просветом основной трубки.
При удвоении 12-перстной кишки развивается добавочная трубка диаметром 1—4 см и длиной 15—20 см, она имеет общую стенку с основной 12-перстной кишкой. Трубчатая форма удвоения встречается редко. Наиболее частой является дивертикулярная форма удвоения, реже — кистовидная.
Врожденные удвоения кишечника многие годы могут протекать бессимп
томно и иногда обнаруживаются уже на операционном столе. Этот порок развития в основном выявляют, когда возникают осложнения, изъязвления, кровотечения, завороты и кишечная непроходимость. Нередки жалобы на боль в животе. Боль возникает как следствие перерастяжения стенок кисты скапливающейся жидкостью или развивающейся непроходимости. Во время приступа болей иногда бывает рвота. Кишечные кровотечения обусловливаются локальным некрозом и развитием пептической язвы. При перфорации ее возникает острый гнойный перитонит.
Диагностика удвоений кишечника сложная и трудная. Правильной диагностике может способствовать рентгенологическое исследование. Трубчатая форма удвоения дает равномерную полоску просветления на фоне рельефа слизистой оболочки 12-перстной кишки от давления добавочной трубки. При выведении ее в краевое положение прослеживают некоторое сужение просвета и сглаженность ребристости края кишки со стороны добавочной трубки. Перистальтика на этом участке кишки ослаблена. Если имеется сообщение, в добавочную трубку проникает контрастное вещество. Тогда определяются две параллельные полосы контраста различной ширины или неопределенной формы тень у края кишки. Функциональные нарушения, затрудняющие исследование, могут быть устранены при исследовании кишки в условиях медикаментозной релаксации. Подсерозные кисты, сообщающиеся с просветом кишки, дают изображение, подобное дивертикулам. Кисты, свисающие на ножке в просвет кишки, характеризуются дефектом наполнения по внутреннему краю кишки с четкими контурами и создают впечатление доброкачественной опухоли. Рельеф слизистой оболочки вокруг кисты не изменен. Обтурация кишки сопровождается расширением вышеле
жащего участка ее и желудка с застоем содержимого. Изменчивость картины при различном заполнении кишки и в различном положении ребенка дает возможность высказать предположение о наличии кисты.
Дивертикул Меккеля. Возникает в результате неправильного и незаконченного обратного развития эмбрионального кишечно-пупочного желточного протока. Желточно-брыжеечный проток образуется в первом периоде внутриутробной жизни между терминальным отделом подвздошной кишки и пупком. В норме к моменту рождения желточный проток зарастает (облитерируется), но в 2 % случаев он остается. Причем может остаться частично не-облитерированным или в своем пара-пупочном отделе, или в средней части, или в области впадения в подвздошную кишку.
Оставшийся яеоблитерированный проток у новорожденных обычно отходит от подвздошной кишки на расстоянии около 20 см от илеоцекального клапана, а у взрослых это расстояние равно 20—200 см.
Если внутренний просвет дивертикула выстлан слизистой оболочкой тонкой кишки, тогда клинической картины, указывающей на его существование, нет. Если же он содержит островки гетеротопной ткани (слизистая оболочка желудка, 12-перстной кишки, ткань поджелудочной железы), то создаются условия для возникновения изъязвления, кровотечения, воспаления — дивертикулита. Клиническая картина напоминает таковую при аппендиците.
Рентгенодиагностика: если имеется сообщение между дивертикулом и подвздошной кишкой, его можно заполнить бариевой взвестью. В зависимости от степени и характера облитерации протока дивертикул Меккеля может иметь форму конуса, шара или аппендикса. Величина его колеблется в широ
ких пределах — от 1—2 до 20—30 см. Контрастное вещество длительно задерживается в дивертикуле. Заполненный контрастным веществом дивертикул следует дифференцировать с червеобразным отростком. В отличие от дивертикула червеобразный отросток отходит от слепой кишки. При пероральном контрастировании кишечника он заполняется бариевой взвесью позже дивертикула. Если дивертикул открывается в пупочный канатик, то он определяется в виде яркого возвышения на коже и из него выделяется жидкость. Контрастировать дивертикул в таких случаях можно через существующий пупочный свищ.
Дивертикулы. Дивертикулами кишечника называют мешковидные выпячивания его стенки. Локализация дивертикулов часто совпадает с областью возникновения врожденных пороков развития кишечника — местом перехода эмбриональной передней кишки в заднюю. В связи с этим существует мнение о врожденном недоразвитии мышечной оболочки стенки кишки, ведущем к образованию дивертикулов в различные периоды жизни человека. Здесь имеют значение и слабость кишечной стенки вследствие врожденной неполноценности мышечной оболочки, и снижение мышечного тонуса, и утрата механической прочности соединительнотканного каркаса при старении организма.
Дивертикулы чаще встречаются в 12-перстной кишке и составляют около 35—40 % всех дивертикулов ЖКТ. По нашим данным, дивертикулы располагаются чаще в нисходящем отделе (63 %) и, как правило, на вогнутом контуре, в тех местах, где в стенку 12-перстной кишки входят протоки и сосуды. В верхнем изгибе встречается 5,5 %, в нижнегоризонтальном отделе — 21, восходящем — 10 % дивертикулов. В области дуоденоеюнального изгиба ди-
120. Локализация дивертикулов в 12-перстной кишке (в процентах).
вертикулы бывают редко (0,5 %). Из 115 наших наблюдений на внутренней стороне 12-перстной кишки располагалось 112, наружной — 3 дивертикула.
Дивертикулы бывают одиночные и множественные. В последнем случае говорят о дивертикулезе, или «дивертикулярной болезни». Форма и величина дивертикулов зависят от их локализации и возраста больного. С возрастом увеличиваются и количество, и размеры дивертикулов. Чаще встречаются дивертикулы округлой, овальной или грушевидной формы, реже воронкообразной или цилиндрической, двудольковые. Описаны и «дочерние» дивертикулы (Василенко, Гребенев, 1981).
Величина дивертикулов может быть от едва заметных выпячиваний до больших образований диаметром 3—5 см и более, с широким или узким входным отверстием (шейкой дивертикула). Диаметр шейки дивертикула зависит от его формы и размеров. Широкое входное отверстие имеют цилиндрические, мешковидные и грушевидные дивертикулы, узкое — шаровидные дивертикулы.
Неосложненные дивертикулы клинически не проявляются, могут существовать бессимптомно и быть случайной находкой при рентгенологическом исследовании или вскрытии.
Рентгенологически дивертикулы выявляются в виде мешковидных выпячиваний стенки 12-перстной кишки, дополнительных полостей различных размеров и формы (тело дивертикула), заполненных бариевой взвесью и связанных с просветом кишки перешейком. Контуры тела дивертикула и шейки четкие, в большинстве случаев гладкие. Величина дивертикула зависит от степени его заполнения контрастной взвесью и от растяжимости как его самого, так и кишки. Рельеф слизистой оболочки дивертикула такой же, как и слизистой оболочки 12-перстной кишки. Складки слизистой переходят из кишки в дивертикул и являются его продолжением. Слизистая оболочка у канала-перешейка дивертикула образует гофрированные складки. При широком просвете канала, ось которого перпендикулярна к оси кишки, опорожнение дивертикула, как правило, хорошее. Малая ширина входного отверстия, наблюдаемая, например, в шаровидных дивертикулах, значительно затрудняет эвакуацию попавшего в него содержимого, что способствует камнеобразованию и развитию воспалительных явлений.
Самое частое осложнение — дивертикул, возникающий обычно из-за застоя богатых микробами пищевых масс и жидкости в полости дивертикула. Чем больше полость дивертикула и чем меньше диаметр шейки, тем больше условий для застоя пищевых масс. Воспалительный процесс распространяется на окружающие ткани и развивается перидивертикулит. Воспаление легко приводит к изъязвлению с последующим кровотечением и перфорации истонченной стенки с развитием свища или разлитого гнойного воспаления окружающей клетчатки, в частности перитонита. Может наблюдаться и пенетрация в соседнюю ткань или орган. Редкое осложнение — развитие в дивертикуле новообразований.
121. Дивертикулы 12-перстной кишки’ а — одиночный; б, в — двойные
Осложненные дивертикулы клинически проявляются рядом симптомов ди-спептического или язвенного характера, сходных с картиной заболеваний печени и желчного пузыря или симулирующих заболевания поджелудочной железы, ведущий симптом — боль. Чаще всего она локализуется в эпигастральной области с преимущественной иррадиацией в правое подреберье, в спину, в околопупочную область. Боли обычно ноющие,
постоянные, иногда интенсивные и отличаются от язвенных отсутствием длительных ремиссий. При пальпации локальная болезненность ощущается справа от пупка. У некоторых отмечаются диспептические расстройства в виде изжоги, тошноты, отрыжки воздухом или съеденной пищей, реже рвоты. В редких случаях возможно сдавление большим дивертикулом общего желчного протока или протока поджелудочной
122. Дивертикулы тощей кишки:
а — одиночный; б, в — множественные.
железы с возникновением желтухи, холангита или панкреатита. Задержка оттока панкреатического сока может привести к расстройству стула и метеоризму. Осложнения дивертикулов лучше выявляются в условиях медикаментозной релаксации кишки. Рентгенологические признаки дивертикулита — нарушение эвакуации содержимого из дивертикула, или резко ускоренная эвакуация, или длительная задержка бария в нем. Характерна трехслойность в дивертикуле: барий внизу, над ним жидкость и воздух. Нередко изменяется форма дивертикула, тогда он приобретает неправильные очертания, сморщивается, а его контур становится извилистым и нечетким. Часто наблюдаются спазмы шейки дивертикула. Иногда удается обнаружить симптом утолщения стенки. В таких случаях между наружным контуром кишки и бариевой взвесью определяется различной ширины тень небольшой интенсивности, а также явления дуоденита. Складки слизистой в шейке и полости дивертикула утолщены, набухшие, деформированные и ригидные. Иногда при дивертикулите еще до дачи больному бариевой взвеси определяется газовый пузырек и уровень жидкости. Неправильная форма тела дивертикула с заострениями по контурам и отсутствием смещаемости свидетельствуют о перидивертикулите. При изъязвлении дивертикула выявляют нишу с конвергенцией к ней складок слизистой и воспалительный вал вокруг язвы. Новообразование в дивертикуле дает при его контрастировании дефект наполнения округлой формы с четкими контурами. Если имеется изъязвление опухоли, определяется стойкое депо бариевой взвеси.
Дифференцировать дивертикул необходимо с внелуковичной язвой 12-перст-ной кишки, с дивертикулоподобной ампулой фатерова соска, с изъязвленным раком большого соска 12-перстной киш
ки или раком головки поджелудочной железы, прорастающим в 12-перстную кишку, и с другими заболеваниями.
Хроническая непроходимость 12-пер-стной кишки. Чаще возникает при арте-рио-мезентериальной компрессии и кольцевидной поджелудочной железе. Такая непроходимость часто является причиной тяжелых страданий и представляет трудности для распознавания. Объясняется это отсутствием типичных признаков заболевания.
Артерио-мезентериалъная непроходимость вызывается сдавлением нижней горизонтальной части 12-перстной кишки, чаще корнем врожденной короткой брыжейки или добавочными ветвями верхней брыжеечной артерии. Может наблюдаться при висцероптозе, похудании, выраженном лордозе, вялости брюшной стенки и других состояниях. Корень брыжейки может удерживаться постоянно в натянутом состоянии спайками петель тонкой кишки после широких брюшных операций, а также при различных патологических процессах в этой зоне.
Клинически проявляется чувством тяжести в подложечной области, болями, иногда метеоризмом. Боли обычно появляются спустя 2—4 ч после еды. Продолжительность их колеблется от нескольких часов до суток и более. Наблюдаются отрыжка и рвоты. Диспепти-ческие расстройства исчезают при коленно-локтевом положении больного или положении на животе, у некоторых — на правом боку.
При рентгенологическом исследовании в вертикальном положении больного чаще всего отмечается расширение 12-перстной кишки до ее перехода влево от позвоночника. Здесь тень кишки как бы отрезана. Наибольшие порции бариевой взвеси поступают в дистальные отделы кишки после усиленных сокращений ее расширенных отделов. Остатки бариевой массы в желудке и 12-перст-
ной кишке над сужением можно обнаружить через 24 ч и даже спустя 48 ч после приема. В горизонтальном положении больного на правом боку и на животе, а особенно в коленно-локтевом положении натяжение брыжейки уменьшается и прохождение бариевой взвеси через сдавленный отдел улучшается. При этом удается увидеть неизмененные складки слизистой оболочки и контуры сдавленной кишки. По результатам релаксационной дуодено-графии можно наиболее точно определить зону и особенности компрессии, а также протяженность сужения от 1,5 до 3 см.
Нарушение проходимости 12-перстной кишки может быть вызвано поро
ком развития поджелудо'.... при котором головка ее охва ку в виде кольца, чаще вер^ вину нисходящей части кише ческая картина определяется и степенью сдавления 12-пепс г ки, общего желчного протока, рг.„ воспалительных и функциональь менений кишки, патологии в жеи путях и самой железе, а также спс развития этих нарушений. Кольцов ная (аннулярная) поджелудочная жг леза проявляется признаками непроходимости 12-перстной кишки с развитие» частичной мегадуоденум. Отмечается сглаженность складок слизистой об<-лочки кишки на ограниченном сегмента вдоль передней поверхности 12-перс'5
□
124. Схема артериомезентери-альной компрессии 12-перстной кишки:
1 — 12-перстная кяшка; 2 — аорта;
3 — чревная артерия; 4 — верхняя брыжеечная артерия.
ной кишки. В типичных случаях определяется сужение кишки со стойко перестроенным рельефом слизистой оболочки (из поперечного в продольный) на месте сужения. В некоторых случаях обнаруживаются скопления газа над и под сужением.
Таким образом, хроническая компрессия 12-перстной кишки не столько редкое, сколько трудно диагностируемое заболевание. Наличие препятствия для продвижения пищевых масс приводит к усилению моторно-эвакуаторной функции 12-перстной кишки. Повышение тонуса циркулярной мускулатуры сразу же сказывается на повышении внутриполостного давления. Оно служит самым ранним признаком возникших нарушений.
Дуоденальная гипертензия оказывает постоянное влияние на работу клапанных аппаратов 12-перстной кишки и мо-
125. Рентгенологическая картина 12-перстной кишки при ее артериомезентериальной компрессии:
а — умеренное сдавление; б — тень кишки как бы отрезана; в — конусовидная тень.
126. Схема кольцевидной поджелудочной железы.
жет стать ведущей причиной развития их недостаточности. Это способствует
регургитации дуоденального содержимого через зияющий клапан в вышележащие отделы пищеварительного тракта, желчные и панкреатические протоки и приводит к заболеванию этих органов.
Для диагностики необходимо комплексное исследование больного: рентгенологическое исследование желчевыводящей системы, желудка и 12-перстной кишки, дуоденография в условиях медикаментозной релаксации в вертикальном и горизонтальном положении больного, на основании которой можно судить о степени и протяженности сдавления, а также о состоянии вышележащих отделов 12-перстной кишки.
Г л а в а 23. ФУНКЦИОНАЛЬНЫЕ РАССТРОЙСТВА
Функциональные расстройства тонкой кишки включают нарушения тонического состояния, пропульсивной и опорожнительной функций ее, а также нарушения всасывания, или синдром мальабсорбции. Нарушение функций тонкой кишки бывает первичное и вторичное.
Нередко болезнь начинается раньше, чем проявляется. В начале возникновения она является результатом функциональных изменений, которые затем меняют анатомическую структуру органа. Поэтому раннее распознавание нарушений функций, устранение их ведет к предупреждению патологического процесса, часто в последующем не обнаруживаемого.
Из этого следует, что описание отдельных морфологических симптомов без достаточно глубокой оценки функционального состояния органа и вне связи с жизнедеятельностью организма в целом может привести к грубейшим методологическим, принципиальным ошибкам. Возможности рентгенологического способа в определении физиологических
и патофизиологических состояний органов очень велики. С. А. Рейнберг отмечал в свое время, что рентгенов луч — не только нож для бескровного вскрытия, но и писчик физиологического прибора, способный регистрировать функциональные явления органа в наиболее физиологичных условиях. При этом не нарушается орган как таковой и не нарушается его связь со всем организмом.
Вопросами функциональной рентгенодиагностики занимаются со времени открытия рентгеновых лучей. Основой трактовки получаемых рентгенологических показателей служили и служат успехи отечественной физиологии. Наиболее доступной для рентгенологического исследования внутренних органов, в частности кишечника, является двигательная деятельность нервно-мышечного аппарата путем просвечивания и регистрации ее на серийных снимках, при рентгенокинематографии и видеомагнитофонной записи. Именно рентгенологический метод позволяет изучить не только морфологию,
но и все многообразные функции кишечника в норме и патологии.
Все органы и системы организма находятся в тесном функциональном взаимодействии, осуществляемом нейрогу-моральными путями при включении гормонального звена регуляции, под постоянным корригирующим влиянием высших отделов нервной системы — коры головного мозга и подкорковых вегетативных центров, главным образом таламо-гипоталамической области.
Функциональные нарушения моторной деятельности (дискинезии) кишечника чаще всего развиваются вторично при патологических изменениях в самом кишечнике или смежных органах по принципу висцеро-висцерального рефлекса.
Дискинезии 12-перстной кишки
Функциональные двигательные нарушения 12-перстной кишки — наиболее частые отклонения от нормы в состоянии этого органа. Преобладают не изолированные дискинезии, а содружественные изменения моторики желудка и кишечника. Чаще такие двигательные расстройства — результат нервно-рефлекторных нарушений вследствие язвенной болезни желудка и 12-перстной кишки, панкреатита, а также патологических изменений в желчных путях и желчном пузыре.
Непосредственное влияние на моторную функцию 12-перстной кишки оказывает кислое желудочное содержимое, избыток которого, особенно при нарушениях ощелачивающей функции 12-перстной кишки, может приводить к развитию в ней моторных нарушений (Василенко, Гребнев, 1981).
К дискинезиям, кроме того, могут привести эндокринные и нервные заболевания, гиповитаминоз, патологические процессы в центральной нервной
системе, травмы черепа, воздействие фармакологических препаратов и другие причины. Дискинезии же 12-перст-ной кишки в свою очередь нарушают эвакуацию из желудка, а также являются причиной желчевыделительных и панкреатических расстройств.
Механизм стойких расстройств мотор-но-звакуаторной деятельности 12-перстной кишки, по-видимому, связан в основном с возникновением реактивных и дегенеративных изменений в интрамуральном нервном аппарате кишки. Эти расстройства развиваются в результате длительных и многообразных импульсов, которые поступали в 12-перстную кишку (Мирзаев, 1976).
Клиническая картина дискинезий 12-перстной кишки многообразна. Они могут протекать латентно, но могут сопровождаться различными нарушениями пищеварения. Наиболее ранние проявления функциональных двигательных расстройств 12-перстной кишки и в частности дуоденостазов — чувство тяжести и периодические тупые боли в эпигастральной области и в правом подреберье, появляющиеся вскоре после еды, тошнота, временами срыгивание и рвота (как правило, с примесью желчи), приносящие облегчение. Кроме того, бывают жалобы на запоры, плохой аппетит, похудание, выражены общие симптомы интоксикации. В период обострения процесса периодически может наблюдаться вздутие в верхнем отделе живота. Что касается других форм нарушений двигательной функции 12-перстной кишки, то самостоятельной клинической картины они не имеют.
Распознать нарушения двигательной деятельности 12-перстной кишки — задача довольно трудная. Правильный диагноз можно установить только рентгенологически.
При обычном рентгенологическом исследовании можно выявить различные функциональные двигательные на-
рушения 12-перстной кишки: задержку контрастного вещества в одном или нескольких ее участках на срок свыше 35—40 с (проявление стаза), быстрое (за 1—2 с) продвижение этого вещества по 12-перстной кишке, антиперистальтику, обратное забрасывание контрастного вещества из дистальных отделов 12-перстной кишки в вышележащие части вплоть до луковицы и даже в желудок. Нарушения эвакуаторной функции сопровождаются в большинстве случаев и изменением тонуса кишки.
Функциональные двигательные нарушения 12-перстной кишки (Сальман, 1976) целесообразно делить на:
1) частичные дуоденостазы, которые включают бульбостазы и стазы в различных ее отделах;
2) тотальные дуоденостазы;
3) сочетание стаза с ускорением продвижения бариевой массы в различных ее частях;
4) ускоренное прохождение контрастного вещества по 12-перстной кишке.
Среди дискинезий 12-перстной кишки наиболее часто встречаются дуоденостазы. Они бывают частичные и тотальные. Частичный стаз бариевой взвеси, как правило, отмечается в луковице (бульбостаз) и в нижнегоризонтальной ветви 12-перстной кишки. Бульбостаз бывает преимущественно у больных язвой желудка или луковицы 12-перстной кишки, холециститом. Он может сочетаться со стазом контрастного вещества в других отделах 12-перстной кишки. Это часто наблюдается у больных внелуковичной язвой, гепатохолецисти-том и холецистопанкреатитом. Частичный дуоденостаз без бульбостаза известен при панкреатите.
Тотальный дуоденостаз (гипер- или гипотонический) встречается реже частичного. Возникает чаще при гепатохо-лецистопанкреатите и постбульбарной (внелуковичной) язве, нервных заболеваниях, после воздействия фармаколо
гических препаратов, поражений центральной нервной системы. У некоторых больных обнаруживается также частичный гипотонический стаз в луковице на фоне гипертонии или спазма нисходящего отдела 12-перстной кишки.
Таким образом, функциональный дуоденостаз рентгенологически проявляется следующими симптомами: 1) задержкой бариевой взвеси в каком-либо участке 12-перстной кишки; 2) расширением просвета кишки в месте замедленного прохождения контрастного вещества; 3) обратным забрасыванием содержимого из нижележащих отделов 12-перстной кишки в проксимальные; 4) сочетанием спастического сокращения в одном из участков 12-перстной кишки со стазом контрастного вещества в другом ее участке (Василенко, Гребенев, 1981).
Дискинезии 12-перстной кишки могут проявляться рентгенологически как изменением тонуса, так и ускорением или замедлением продвижения контрастного вещества. Очень быстрое продвижение контрастного вещества по кишке следует расценивать как симптом ги-перэвакуаторной дискинезии. Задержка бариевой взвеси в любом из ее отделов до 35—40 с называется гипоэвакуатор-ной дискинезией, а свыше этого времени является признаком аэвакуаторной дискинезии, или стазом. Гипотоническая дискинезия выражается снижением тонуса, расширением кишки, антиперистальтикой или вялостью перистальтики. У больных с гипертонической дискинезией кишка спазмирована, появляются признаки ее стеноза. Выделяются также смешанные формы дискинезии с различными нарушениями тонуса кишки и ее опорожнения.
Если в норме базальное давление в 12-перстной кишке равно 80—130 мм вод. ст., то при гипертензии I степени оно составляет 130—150, при гипертензии II степени — 150—200 и III степени — свыше 200 мм вод. ст. Эти данные
в совокупности с результатами рентгенологических исследований имеют большое значение в диагностике расстройств моторно-эвакуаторной функции 12-пер-стной кишки.
Из осложнений дискинезий наиболее часто встречаются дуодениты, реже — изъязвления и кровотечения. При развитии функционального стеноза 12-пер-стной кишки появляются расширение и атония желчных путей, происходит инфицирование желчи, возникают воспалительные изменения паренхимы печени типа ангиохолита и признаки острого панкреатита. У 83,3 % больных с различными формами дискинезий 12-перстной кишки (Василенко, Гребенев, 1981) выявляется патология органов гепатопанкреатодуоденальной системы.
Одна из разновидностей дискинезий 12-перстной кишки — дуоденогастралъ-ный рефлюкс, т. е. перемещение содержимого 12-перстной кишки в желудок. Рефлюкс может быть обусловлен недостаточностью, расслаблением или зиянием привратника. Недостаточность его функции бывает врожденной и приобретенной вследствие дегенератцвных изменений, возникающих в ауэрбахов-ском сплетении, а также при висцеро-висцеральных рефлексах из патологически измененных органов. Она может развиться и из-за ослабления замыкательной функции привратника, которая, по мнению некоторых исследователей, регулируется 12-перстной кишкой. Дис-координация ее моторной деятельности, дуоденальная гипертензия приводят к нарушению полостного градиента давления между желудком и 12-перстной кишкой и играют важную роль в возникновении недостаточности пилорического сфинктера и развитии дуоденогастрального рефлюкса.
Рентгенологический метод является одним из ведущих в диагностике недо
статочности привратника. Рекомендуется применять в основном 2 способа. При первом в 12-перстную кишку через зонд вводят бариевую взвесь и на экране рентгеновского аппарата или телевизора регистрируют заброс ее в желудок. Второй способ предусматривает применение внутривенной и пероральной хо-лецистографии. Недостаточность функции привратника и наличие синдрома дуоденогастрального рефлюкса определяют по регургитации контрастного вещества из 12-перстной кишки в желудок. Способ наиболее объективный: осуществляется без нарушения физиологических взаимоотношений в гастродуоденальной зоне.
В последние годы для диагностики дуоденогастрального рефлюкса предлагается физиологический радионуклидный метод. Он позволяет точно и с минимальной лучевой нагрузкой выявлять забросы желчи из 12-перстной кишки в желудок.
Выявлению дуоденогастрального рефлюкса следует придавать большое значение, так как у больных с гастродуоденальной патологией он встречается в 33—67 % случаев. Дуоденогастральный рефлюкс служит одним из важнейших патогенетических факторов в развитии хронического гастрита и язвенной болезни желудка.
Дискинезии тощей и подвздошной кишок
Нарушения моторной функции тощей и подвздошной кишок бывают первичные и вторичные. При первичных дискинезиях двигательные расстройства кишечника — основа болезни. Главными причинами их являются психогенные факторы (отрицательные эмоции), расстраивающие нервную регуляцию моторной функции кишечника. Определенную роль играют и нарушения гу
моральной, в первую очередь гормональной, регуляции двигательной деятельности тонкой кишки, употребление малошлаковой пищи и большого количества лекарственных препаратов, а также пищевая аллергия.
Функциональные нарушения тонкой кишки встречаются при витаминной и белковой недостаточности, ряде патологических состояний (спру, стеаторее, пеллагре, анемии и др.), при которых нет органической основы заболевания, но наблюдаются функциональные изменения тонкой кишки (медленное прохождение контрастной массы, гипотония и расширение). Недостаток витаминов может проявляться спастической или гипотонической гипокинетической дискинезией.
Выраженное усиление двигательной деятельности кишечника вызывают прием холодных жидкостей, послабляющих пищевых (чернослив, тыква, свекла, абрикосы, свежие молочнокислые продукты) и несовместимых продуктов (дыни и молоко, помидоры и молочнокислые продукты). Функциональные расстройства кишечника отмечаются при неврозах: наблюдалось усиление перистальтики, а иногда даже тотальный спазм тонкой кишки при страхе или гневе. Угнетенное состояние, наоборот, сопровождается торможением всех движений кишечника. Чувства радости, энтузиазма, испуга, ужаса, внушенные исследуемому под гипнозом, сопровождаются часто повышением тонуса и двигательной активности всех отделов пищеварительного тракта; чувство усталости, тоски ведет к отчетливому угнетению тонуса и моторики. Известны случаи неврогенной спастической непроходимости кишечника, наблюдаются и так называемые нервные поносы.
Большую группу функциональных заболеваний кишечника составляют диспепсии. В их основе лежат наруше
ния процессов кишечного переваривания, а вследствие этого и усвоения пищи главным образом белковой или углеводной. Если нарушено переваривание углеводов, развивается бродильная диспепсия, белков — гнилостная. Чаще одновременно нарушается переваривание белков и углеводов с усилением бродильных и гнилостных процессов в кишечнике с преобладанием или бродильного, или гнилостного компонента. Часто повторяющиеся и длительно существующие диспепсии могут приводить к возникновению органических заболеваний кишечника типа энтерита и энтероколита или к нарушению функций других звеньев системы пищеварения.
Вторичные дискинезии тощей и подвздошной кишок появляются при заболеваниях других отделов пищеварительной системы, мочевыводящих путей, эндокринных желез, нарушениях мезентериального кровообращения и др. Для этого отдела кишечника наиболее мощной стимулирующей зоной является 12-перстная кишка, а тормозящей — илеоцекальная область.
Двигательная функция тонкой кишки в зависимости от функционального состояния представлена в виде голодной и пищеварительной моторной активности. Голодная моторика характеризуется наличием 2-часовых мигрирующих моторных комплексов, распространяющихся от желудка к толстой кишке, и состоит из двух фаз. Фаза нерегулярных сокращений с различными ритмом и амплитудой длится около 40 мин. Другая фаза характеризуется регулярным сокращением с максимальной амплитудой в 10—18-секундном ритме и длится 6—8 мин. При приеме пищи вместо этой циклической активности появляется нерегулярная продолжительная активность в течение 8—12 ч, зависящая от качества и объема пищи (Bueno, Fiora-monti, Frexinos, 1987).
В межпйщеварительном периоде существует повторяющаяся на электромиограммах последовательность 4 фаз активности тонкой кишки, называемая мигрирующим двигательным комплексом. В I фазе — фазе покоя — наблюдается базальная электрическая активность. Фаза II характеризуется наличием на электромиограмме беспорядочных потенциалов действия. Фаза III — период ритмического сокращения: на электромиограмме появляются ритмичные высокоамплитудные импульсы. В фазе IV происходит быстрое снижение амплитуды и частоты импульсов.
L. Centerick et al. (1987) установили корреляцию между электрической и двигательной активностью тонкой кишки, а именно: I фазе соответствует отсутствие двигательной активности; во II фазе сегментарные сокращения нерегулярные; в III фазе отмечаются перистальтические сокращения, распространяющиеся по всей длине тонкой кишки и приводящие к ее полному опорожнению; в IV фазе перистальтическая активность снижается.
В регуляции двигательной деятельности тонкой кишки ведущая роль принадлежит нервной системе. Афферентные пути интероцептивных рефлексов проходят в блуждающих и симпатических нервах. Импульсы стимулирующего характера передаются по системе блуждающих нервов, а также по «коротким путям» через местные интрамуральные механизмы. Тормозные импульсы идут по симпатическим нервам. В эксперименте установлено выраженное угнетение движений тонкой кишки с одновременно определявшимися признаками активизации симпатической нервной системы в виде повышенного содержания свободного адреналина и норадреналина. В осуществлении передачи возбуждения, как известно, велико значение реализующихся в нервных окончаниях химических медиаторов
нервного возбуждения, а также гормонального звена регуляции.
Нарушения двигательной функции тонкой кишки могут вести в конечном счете к недостаточному усвоению пищевых веществ. В частности, при усиленной двигательной функции тонкой кишки из-за ускорения продвижения пищевые массы не успевают подвергнуться достаточному перевариванию и всасыванию. Вследствие ослабления моторики тонкой кишки недостаточное перемешивание пищевых масс нарушает интенсивность переваривания в полости кишечника, а нарушение оптимального контакта пищевого химуса с поверхностью кишки ведет к недостаточному гидролизу и всасыванию. В связи с нарушением моторики тонкой кишки при ряде заболеваний (King, 1979) наблюдается инфицирование ее. Таким образом, функциональные расстройства с течением времени ведут к развитию органических изменений в кишке. Эти процессы, в свою очередь, становятся источником патологической афферентной импульсации, и устанавливается «порочный круг».
Клиническая картина дискинезий тонкой кишки изучена недостаточно. Нередко выраженные функциональные нарушения кишечника могут клинически не проявляться, а болевой синдром, сопровождающий случаи спастической формы дискинезии, врачи обычно относят к основному страданию. В подобных случаях топография болей выходит за пределы топической локализации и болевой синдром имеет упорный характер. Больные могут жаловаться на изжогу, тошному и даже рвоту. Причем изжога бывает тем чаще, чем быстрее продвигается контрастная взвесь по тощей или подвздошной кишке. Наоборот, тошнота и рвота возникают заметно чаще при более медленном пассаже и реже — при ускорении пассажа по кишечнику. Отрыжка воздухом и пищей чаще на
блюдается при замедлении пассажа кишечного содержимого.
Если кишечная деятельность ослаблена, могут отмечаться вздутия живота преимущественно в центральной его части. Они сопровождаются чувством тяжести, распирания или, в случае выраженного метеоризма, тупыми болями в околопупочной области. Значительное вздутие живота может сопровождаться затрудненным дыханием и неприятными ощущениями в области сердца. При резком снижении моторики пищеварительного тракта, в том числе и тонкой кишки, вследствие дисфункции гладкой мускулатуры могут появиться клинические симптомы идиопатической кишечной псевдонепроходимости, очень сходные с истинной непроходимостью, что может приводить к ненужной лапаротомии (Губергриц, Линевский, 1975).
Если двигательная функция кишечника усиливается, могут отмечаться урчание и движения в центральных отделах живота, послабление стула, иногда с наличием в кале недостаточно переваренных пищевых веществ из-за расстройства пищеварения. Лишь при значительном усилении двигательной функции тонкой кишки могут наблюдаться периодические болевые ощущения в центральных отделах живота. Однако в отличие от энтерита пальпация околопупочной области и терминальных отделов тонкой кишки безболезненна. В случае усиленной двигательной деятельности аускультативно определяют громкие, а при ее ослаблении — более тихие кишечные шумы вплоть до полного их исчезновения. Равномерное вздутие живота бывает, как правило, при атонии кишечника. Во время спазма кишечника живот втянут, перистальтические шумы его не прослушиваются (Михайлов, 1974).
Вследствие эндогенного нарушения усвоения питательных веществ при дисфункциях кишечника у больных неред
ко возникают недостаток белков, анемии кишечного происхождения, недостаток витаминов, минеральных солей, наступают исхудание, изменения нервной, эндокринной и других систем, снижаются иммунобиологическая реактивность и компенсаторно-приспособительные реакции организма.
Рентгенологический метод в оценке состояния тонуса и двигательно-эвакуа-торной функции тонкой кишки и в выявлении дискинетических расстройств является одним из ведущих. Причем методики рентгенологического исследования, применяемые для выявления дискинезий тонкой кишки, должны быть физиологичными, позволять определить тоническое состояние и темпы продвижения бариевой взвеси по тонкой кишке, уточнить характер ее распределения, выявить патологические изменения как в самой кишке, так и в соседних органах. Чтобы понять сложные функциональные взаимосвязи различных отделов пищеварительной системы, целесообразно проводить одномоментное рентгенологическое исследование различных звеньев пищеварительного тракта. Функциональные нарушения тонкой кишки устанавливаются при длительном наблюдении за продвижением бариевой взвеси и сопоставлении с нормальной рентгенологической картиной ее либо с помощью ускоренной методики трехкратной энтерографии, разработанной А. Н. Михайловым и Е. В. Илья-шевич (А. с. № 1266524, 1986 г.).
Дискинезии тощей и подвздошной кишок характеризуются нарушениями тонического состояния, изменениями ритма и амплитуды перистальтических движений, расстройством пропульсивной и эвакуаторной деятельности.
Б. М. Штерн (1939) делит дискинезии на: 1) гипермоторные — нарушения, связанные с изменениями в симпатической нервной системе; 2) гипомоторные, связанные с нарушениями в равновесии
парасимпатической нервной системы; 3) связанные с нарушением тонуса тонкой кишки (гипер-, гипо- и атонические): 4) смешанные: а) гипермоторногипертонические, б) гипермоторно-ги-потонические. I форма выражается в усилении двигательной активности с ускорением продвижения содержимого. При II форме перистальтические движения вялые, эвакуация содержимого замедлена. Следующие два вида проявляются различными степенями повышения или понижения тонуса кишки тотально или на отдельных участках.
Близка к описанной и другая классификация дискинезий (Вельтц, 1987) тонкой кишки: 1) общая или сегментарная гипертония; 2) общая или сегментарная гипотония; 3) гипер- или гипо-мотильность и их различные комбинации.
К. А. Маянская (1970) предложила классификацию дискинетических расстройств тонкой кишки, характеризующую тип и степень выраженности функциональных расстройств.
1. Гипертоническая гиперкинетическая дискинезия I степени, выражающаяся в повышении мышечного тонуса, усилении перистальтики и небольшом ускорении продвижения содержимого. Заполнение слепой кишки начинается спустя 1,5—2 ч после приема контрастного завтрака. Рельеф слизистой не изменен.
2. Гипертоническая гиперкинетическая дискинезия II степени — значительное повышение тонуса и резкое усиление перистальтики со стремительным продвижением контрастной массы, особенно по тощей кишке. Складки слизистой мелкие, тесно сгруппированные, придающие контуру кишки мелкозубчатый вид. Заполнение слепой кишки начинается уже спустя 45—60 мин после начала перехода контрастного содержимого в кишечник. Через 3—4 ч тонкая кишка освобождается от контраст
ного содержимого, за исключением пре-цекального отрезка подвздошной кишки.
3. Спастическая аритмическая дискинезия, представляющая крайнюю степень раздражения кишечника: просвет петель 1онкой кишки неравномерный из-за чередования гипертонических и гипотонических участков и множества спастических перехватов. Заполнение сегментарное. Перистальтика аритмичная, раздраженная. Поступательные движения скачкообразные. Общее время продвижения по тонкой кишке чаще замедлено. Нередко имеется стаз в пре-цекальном отрезке подвздошной кишки на почве спазма илеоцекального сфинктера. Раздраженный рельеф слизистой придает контурам кишки ребристость.
4) Атонически-спастическая дискинезия — регионарные спазмы по ходу кишечника, между которыми образуются атонические «карманы» с дилатацией петель и длительным застоем в них содержимого.
5. Гипотоническая гипокинетическая дискинезия характеризуется расширенными, расслабленными петлями кишечника. Перистальтика вялая, поверхностная, маятникообразные движения мелкого объема, поступательные движения медленные, как бы с переливанием содержимого, длительно задерживающегося в низко свисающих петлях нижней трети тощей и подвздошной кишки. Складки слизистой раздвинуты, сглажены. Заполнение слепой кишки запаздывает. При ирригоскопии нередко выявляется недостаточность илеоцекального сфинктера.
Варианты рельефа слизистой при дискинезиях тонкой кишки являются результатом ее-повышенной раздражимости. В отличие от воспалительных изменений аутопластика рельефа слизистой сохранена, газы и жидкость в просвете кишки не выявляются.
127. Дискинезии тонкой кишки:
а — спазматическая;б — паретическая.
А. Н. Михайлов (1980) различает следующие виды дискинезий: 1) спазматическая гиперэвакуаторная — ей свойственны сужение просвета кишки и ускорение продвижения контрастной массы по ее петлям с более быстрой, чем
в норме, эвакуацией содержимого в слепую кишку; 2) паретическая гипоэва-куаторная — сопровождается расширением просвета тонкой кишки и медленным продвижением контрастной массы по ее петлям, эвакуация содержимого запаздывает; 3) дистоническая — про является чередованием суженных и рас ширенных сегментов тонкой кишки, вследствие чего контрастная масса надолго задерживается, перебрасываясь вперед или назад в расширенных петлях; в других сегментах кишки эвакуация ее бывает ускоренной.
При антеградном контрастировании тонкой кишки сорбитно-водно-бариевой взвесью наблюдается ускорение продвижения. Поэтому для полного представления о тонкой кишке достаточно 3 снимков брюшной полости: через 15 — 20, 40—45 и 90 — 95 мин. Контрастирование на третьей рентгенограмме восходящего отдела толстой кишки свидетельствует о нормальной эвакуаторной функции тонкой кишки. Если на третьей рентгенограмме указанный отдел не контрастирован, диагностируют гипоэвакуаторную дискинезию. Если же контрастирование его отмечается на второй рентгенограмме либо раньше, диагностируют гиперэвакуаторную дискинезию.
Диагностика нарушений тонической функции основывается на сравнении с нормальными показателями характера заполнения, ширины просвета, рельефа слизистой оболочки.
Для нормальной тощей кишки характерно довольно равномерное заполнение сорбитно-водно-бариевой взвесью. Просвет тощей кишки постепенно суживается от 2,5 — 3 см в проксимальном отделе до 2 см в дистальном. Рельеф слизистой оболочки контрастный, четкий, имеет ажурный либо перистый вид. Складки и межскладочные промежутки практически не отличаются по ширине и равны 2 — 3 мм.
В нормальной подвздошной кишке наблюдается чаще полутугой равномерносегментарный характер заполнения, реже — равномерный. Благодаря полуту-гому заполнению рельеф слизистой подвздошной кишки выявляется на довольно большом протяжении. В этом преимущество сорбитно-водно-бариевой взвеси перед водно-бариевой. Просвет подвздошной кишки постепенно суживается от 2 см в проксимальном и среднем отделах до 1,5—1 см в дистальном отделе. Рельеф слизистой оболочки в проксимальном отделе представлен преимущественно поперечной складчатостью, которая в среднем и дистальном отделах все чаще перемежается участками с косой и продольной складчатостью. В проксимальном и среднем отделах подвздошной кишки межскладочные промежутки выглядят шире складок, в терминальном отделе они практически уравниваются по ширине (1 — 2 мм).
Различают спазматическую, паретическую и смешанную дистонии. Спазматическая дистония: в процессе исследования большинство участков тонкой кишки сужено до такой степени, что рельеф слизистой в них не определяется, характер заполнения неравномерный. Паретическая дистония: на большом протяжении тонкая кишка расширена, рельеф слизистой представлен преимущественно поперечными складками. Смешанная дистония: неравномерное заполнение тонкой кишки контрастной взвесью, определяются спазмированные и паретические участки. Эва-куаторные и тонические нарушения встречаются в различных сочетаниях.
Если функция тонкой кишки нарушена, может иметь место переполнение петель тощей кишки. В противоположность нормальным условиям, когда в тощей кишке тонким слоем распределяется поступающая в нее контрастная взвесь, давая хорошо выраженную кар
тину слизистой, в патологических случаях возникает продолжительное тугое заполнение, наподобие того, что наблюдается в подвздошной кишке. Разумеется, при этом следует исключать такие состояния желудка и 12-перстной кишки, которые могут вести к переполнению тощей кишки, в особенности ее верхних петель. Переполнение петель тощей кишки наблюдается при недостаточности функции привратника, желудочной ахилии, иногда дуоденальной язве, гаст-роэнтеростомии и резекции желудка. Если исключить эти состояния, то обнаружение туго заполненных бариевой взвестью петель тощей кишки приобретает известную диагностическую ценность, так как свидетельствует о нарушении ее функции.
Спазмы в тонкой кишке определить труднее, чем в других отделах пищеварительного тракта. Относительно легко выявляются спазмы в подвздошной кишке, где петли заполнены контрастной массой туго. Спазмы подвздошной кишки проявляются сужением ее на ограниченном участке. Контуры спастически суженного места представляются гладкими. При использовании спазмолитиков спастические сужения в отличие от органических сменяются расслаблением.
Изменения моторной функции тонкой кишки бывают функциональные и энтерогенные, т. е. вызванные изменениями в самой кишке. Рентгенологически при гипермотильности тонкой кишки функционального происхождения контрастная масса ускоренно продвигается равномерно по всей кишке (Фанарджян, 1964), а при гастроэнтерите это ускорение неравномерное. Объясняется это тем, что воспалительный процесс поражает стенку кишки на ее протяжении тоже неравномерно, воспалительные явления в различных участках кишки неодинаковой интенсивности. Кроме различия в характере ускорения
продвижения контрастной массы по тонкой кишке при функциональной и энтерогенной гипермотильности, при этих двух формах наблюдаются также различные изменения тонуса кишки. При гипермотильности функционального происхождения усиление тонуса кишки равномерное. Когда воспалительные явления носят очаговый характер (например, при хроническом гастроэнтерите), на протяжении всей кишки имеются участки с различным тонусом.
Замедление продвижения контрастной массы по тонкой кишке также делят на функциональное и энтерогенное. У больных хроническим энтеритом пассаж бария может замедлиться до 8 ч и более. Это характерно для так называемых гиперсекреторных форм энтерита и для обтурационной желтухи. В отличие от функциональных дискинезий при энтерогенных на первый план выступает воспалительное выпотевание жидкости в кишку. На это указывают слабая контрастность и «помутнение» рентгенологической картины (Фанарджян, 1964; Мироненко, 1974; Фролькис, 1975; Юлдашев, 1981; Михайлов, Ильяшевич, 1989).
Нарушения двигательной деятельности тонкой кишки неспецифичны, сопутствуют разнообразным патологическим процессам в организме и клинически в большинстве случаев не распознаются. Нерезко выраженные функциональные сдвиги, по-видимому, клинически ла-тентны, а болевой синдром, сопровождающий спазмы кишечника, которые наиболее часто имеют рефлекторное происхождение, обычно относят за счет основного страдания. Подобная картина часто свойственна язвенной болезни. В начальном периоде рентгенологически выявляются повышенное тоническое состояние и гипермотильность тонкой кишки, сопровождающиеся болевым синдромом. Затем по мере прогрессирования процесса может развиваться гипо
тонус ее, иногда со значительной дилатацией просвета кишечных петель и вялой сегментацией. Могут наблюдаться явления дистонии. Складки слизистой в начальном периоде утолщены, позднее сглажены.
Изменения слизистой тонкой кишки, выявляемые при данной патологии рентгенологически (Маянская, 1970), являются вторичными на почве длительного расстройства моторной функции. Это подтверждается тем, что утолщение складок слизистой тонкой кишки у язвенных больных не сопровождается характерным для энтерита скоплением в кишечнике газов и жидкости, а также сохранением аутопластики рельефа слизистой, обратной динамикой имеющихся сдвигов по мере стихания обострения язвенной болезни. В дифференциальной диагностике измененных складок слизистой при дискинезии с рельефом слизистой в случае морфологических процессов велико значение фармакологических проб (Михайлов, 1978, 1985).
При известном опыте (Маянская, 1970) можно по степени дискинезий тонкой кишки даже делать заключения о предполагаемом течении язвенной болезни. Так, гипертоническая гиперкинетическая дискинезия тонкой кишки I и II степеней наблюдалась главным образом при сравнительно легко протекавшей неосложненной язвенной болезни. Напротив, случаи с бурными функциональными сдвигами тонкой кишки типа спастической дискинезии характерны для тяжелого течения заболевания.
Рентгенологическое исследование очень важно при идиопатической кишечной псевдонепроходимости. В этом случае имеется дискенезия не только тонкой кишки, но также пищевода, желудка и толстой кишки. Это заболевание может быть острым или хроническим и проявляться 2 формами дискинезий: 1) гиперактивность гладкой мус
кулатуры проявляется хаотичными, спонтанными сокращениями пищевода и тонкой кишки в сочетании с диверти-кулезом последней; 2) имеется гипоактивность, пищевод атоничен, тонкая и толстая кишки расширены и гиподина-мичны. Эти рентгенологические симптомы заставляют думать об идиопатической псевдонепроходимости и позволяют избежать ненужной пробной лапаротомии.
Дискинезии тонкой кишки рентгенологически определяются и при гастритах с нарушением кислотности. Многие жалобы и клинические симптомы, которые обычно относят за счет гастрита, П. И. Мироненко (1974) объясняет дискинезиями тонкой кишки. Он вывел некоторую зависимость моторики тонкой кишки от кислотности желудочного сока: так, при общей кислотности свыше 61 т е рентгенологически отмечается ускорение пассажа по тонкой кишке при замедленном опорожнении желудка.
Очень большое значение имеют рентгенологические исследования при аллергических состояниях. В таких случаях наблюдаются в основном функциональные нарушения тонуса, перистальтики тонкой кишки. Иногда аллергия сопровождается повышением тонуса, ускорением пассажа по тонкой кишке, значительным уменьшением калибра последней, причем складки слизистой в суженных петлях нормальные. Когда пищевой аллерген сложного состава, можно, исключая отдельные ингредиенты и используя при этом рентгенологическое исследование, установить аллерген в пищевом продукте, вызывающий у данного больного патологические явления.
Своевременное распознавание и правильная оценка характера функциональных расстройств важны для своевременной и рациональной терапии, нормализующей нарушенную функцию аппарата пищеварения на стадиях, ко
торые еще не осложнены структурными изменениями.
Выявление дискинезии заставляет обратить внимание лечащих врачей на необходимость произвести дополнительные исследования и найти причины дискинезии, а значит и возможность для устранения этих нарушений. В дальнейшем контрольное рентгенологическое исследование может показать обратное развитие патологической реакции кишечника по устранении причины, вызвавшей эти функциональные нарушения.
Функциональные подходы к изучению патогенеза заболеваний кишечника все шире входят в клиническую практику. Доказано, что изменения моторной функции, сопровождающиеся ускоренной эвакуацией и уменьшением ритмического компонента, могут явиться причиной нарушения переваривания и всасывания в кишечнике и при отсутствии морфологических повреждений слизистой оболочки его. С другой стороны, компенсаторное усиление моторики главным образом за счет ритмического компонента и замедления эвакуации улучшает состояние пристеночного пищеварения.
Изучение моторики тонкой кишки при энтеральном синдроме позволило А. Р. Златкиной и др. (1977) сделать вывод, что необходимо отойти от шаблонного назначения миотропных препаратов (типа но-шпа, папаверин). Ведь вызываемое ими подавление ритмической активности тонкой кишки препятствует физиологическим механизмам компенсации этого синдрома.
Таким образом, осведомленность широкого круга врачей в вопросах дискинезий тонкой кишки открывает перспективы более глубокого понимания патогенеза и клиники заболеваний пищеварительной системы и дает возможность наметить пути их дифференцированной терапии.
Синдром мальабсорбции
Синдром мальабсорбции — сочетание гиповитаминоза, анемии и гипопротеинемии, обусловленное недостаточностью всасывания (абсорбции) в тонкой кишке врожденного или приобретенного характера. Это приводит к различной выраженности нарушениям метаболизма, способствующим потере питательных веществ с калом и появлению копрологических и внекишечных синдромов.
Копрологический синдром включает полифекалию, стеаторею, креаторею, большую потерю многих биологически активных веществ, а внекишечный синдром — похудание, поливитаминную недостаточность, железодефицитную анемию, дистрофические изменения паренхиматозных органов, гипофункцию желез внутренней секреции.
Выделяют первичную (врожденную) и вторичную (преимущественно приобретенную) мальабсорбции. К первой относятся глюкозогалактозная непереносимость, триптофан-мальабсорбция (болезнь Хартнапа), непереносимость фруктозы, метионин-мальабсорбция, ви-тамин-В 12-мальабсорбция, мальабсорбция фолиевой кислоты и др. Вторичная мальабсорбция включает гастрогенную (резекция желудка, гастриты, рак желудка и др.), панкреатогенную (панкреатиты, муковисцедоз, рак, опухоль островкового аппарата и др.), гепатогенную (острые и хронические диффузные заболевания печени, внутри- и внепеченочный холестаз), энтерогенную (энтероколиты, целиакия, болезнь Крона, резекция тонкой кишки, синдром «слепой петли», инфекционные, паразитарные, сосудистые заболевания кишечника и др.), эндокринную (сахарный диабет, гипер- и гипотиреоз, гипопаратиреоидизм), ятрогенную (слабительные, цитостатики, антибиотики, аминогликозиды, ПАСК, лучевая болезнь).
Первичная, или наследственная, мальабсорбция — это нарушение мембранного пищеварения и всасывания, генетически обусловленное и связанное с отсутствием активности какого-либо фермента или транспортного вещества, необходимого для гидролиза и абсорбции пищевых субстратов. Может быть первичной — мальабсорбция, вызванная патологией отдельных функциональных элементов слизистой оболочки кишок (ферменты, транспортные системы), и вторичной, включающей нарушения пристеночного, мембранного пищеварения и всасывания вследствие патологического процесса внекишечной локализации.
Значительно чаще встречается приобретенный синдром мальабсорбции, который возникает вследствие патологии кишечной или внекишечной локализации. Приобретенные нарушения пищеварения и всасывания могут быть первичными (обусловлены функционально-морфологическими изменениями слизистой оболочки тонкой кишки) и вторичными (вызваны различными заболеваниями внекишечной локализации, активно влияющими на процессы гидролиза и всасывания пищевых субстратов) .
Клиника нарушения процессов гидролиза и всасывания в тонкой кишке сопровождается диспепсией (диареей) или протекает без нее. Это ведущий симптом. Независимо от характера мальабсорбции патогенез диспепсии и интоксикации общий.
Компоненты пищи накапливаются в просвете кишки и подвергаются бактериальному разложению. Продукты расщепления раздражают кишечную стенку, усиливают перистальтику, метеоризм и общую интоксикацию. Выделение в просвет кишки натрия и воды способствует усилению диареи — «осмотический понос». В зависимости от нарушения гидролиза и всасывания отдель
ных пищевых ингредиентов (углеводов, белков, жиров и т. д.) характер испражнений различен. Они могут быть от темно-коричневого до серого и белесоватого цвета, мало- и полиобъемные, пенистые с бродильным, гнилостным или тухлым запахом, кислой или щелочной реакцией, содержать зерна крахмала или капли жира, непереваренные мышечные волокна, растительную клетчатку, дрожжи. По консистенции — жидкие, полужидкие, тестообразные.
Для синдрома мальабсорбции белков типичны отеки, а электролитов — дряблость кожи. При мальабсорбции поли-субстратного характера наряду с изменениями стула наблюдаются сухость и пигментация кожи, ломкость волос, нарушение роста ногтей, заеды в углах рта, красный «лакированный» язык с атрофией сосочков, афтозный стоматит, остеопороз, выражена гипотрофия, железодефицитная анемия, могут наблюдаться тетания (нарушение всасывания кальция), адинамия, вялость и т. д. У детей, кроме дистрофии, может быть отставание в психомоторном развитии, признаки экси- и токсикоза. В зависимости от степени тяжести процесса различают тяжелые, легкие и субклинические формы мальабсорбции.
Диагностика синдрома мальабсорбции основывается на комплексе клинических, лабораторных и рентгенологических данных. Причем рентгенологический метод занимает одно из основных мест.
Среди нарушений всасывания наиболее важными являются интестинальная липодистрофия (болезнь Уиппла, целиакия, спру, болезнь Хартнапа, синдром «короткой кишки» и др.).
Интестинальная липодистрофия (болезнь Уиппла). Встречается преимущественно у мужчин после 30—40 лет. Длительность заболевания от нескольких месяцев до нескольких лет, нередко с продолжительными ремиссиями. Бо
лезнь обычно заканчивается летально.
Этиология неясна. Наиболее вероятной считается гипотеза о бактериальной природе интестинальной липодистрофии, высказанная впервые Дж. Уипплом в 1907 г. В генезе болезни предполагается наличие иммунологического фактора. Поражение лимфатической системы брюшной полости ведет к нарушению транспортных процессов через слизистую оболочку тонкой кишки, в связи с чем расстраиваются процессы всасывания жиров, витаминов, электролитов.
Патогенез этой своеобразной обменно-дистрофической болезни также недостаточно изучен. По современным представлениям, одним из основных патогенетических звеньев патологического процесса являются нарушения обмена мукополисахаридов, которые ведут к изменениям в слизистой тонкой кишки и развитию синдрома мальабсорбции. Некоторые основой патогенеза считают нарушения ресинтеза жира в тонкой кишке с образованием необычных для организма белково-липоидных комплексов, которые, накапливаясь в лимфатических сосудах, блокируют регионарные лимфоузлы. Впоследствии в процесс вовлекается вся ретикулоэндотелиальная система. Существует мнение, что само заболевание и особенно пролиферация клеток ретикулоэндотелиальной системы провоцируются специфическими микроорганизмами, обнаруженными под электронным микроскопом.
Болезнь Уиппла имеет определенную морфологическую картину изменения тонкой кишки, которая является важнейшим диагностическим тестом. При макроскопическом исследовании находят сегментарное расширение просвета тонкой кишки; стенки ее ригидны, складки слизистой утолщены. На слизистой оболочке иногда видны небольшие желтоватые опухоли, на серозном
покрове — фибринозные наложения (Губергриц, Линевский, 1975; Белоусов, 1984). Брыжейка утолщена, брыжеечные и парааортальные лимфатические узлы увеличены, иногда спаяны между собой, содержат избыточное количество хилезной жидкости. Нередко увеличена селезенка. А. К. Апатенко (1958) описал морфологические проявления двух стадий заболевания: в ранней стадии происходит накопление белково-липид-ных веществ в лимфатических узлах и лимфатических сосудах; в конечной стадии развивается картина липогрануле-матоза.
Ранние клинические проявления заболевания неспецифичны: субфебрильная температура с ознобами, недомогание, мигрирующая артралгия, умеренные проявления кишечной диспепсии. Через несколько лет развивается характерная картина: жалобы на резкую общую слабость, ноющие боли в животе, частый, жидкий, блестящий стул до 10 — 15 раз в сутки, вздутие живота, резкое похудание (от 20 до 40 кг), боли в суставах. В период обострения болезни у всех больных температура повышается до субфебрильной. Упорные поносы сопровождаются большим количеством жира в стуле.
В поздней стадии отмечаются истощение, увеличение лимфоузлов, особенно в брюшной полости, гипопротеинемия (5,2 —6,4 г%) с нарушением белковых фракций (альбумины — 54 %). У больных наблюдаются гипохромная анемия, гипотония, у большинства — хилезный асцит, хилоторакс, хилопери-кард, отеки нижних конечностей, расстройство деятельности центральной нервной и сердечно-сосудистой систем, функции почек, печени. При осмотре — слабое развитие подкожной клетчатки, кожа суховата, иногда желтушна, лимфоузлы увеличены и уплотнены. Печень и селезенка увеличены умеренно. Тоны сердца приглушены, АД понижено.
В крови нейтрофильный лейкоцитоз, гипохромная анемия, повышенная СОЭ, при исследовании каловых масс — полифекалия, обилие жира, мышечные волокна, иногда кровь. У больных отмечаются гипопротеинемия, гипохолесте-ринемия, гипокалиемия, умеренно выраженная гипонатриемия, гипо- и авитаминоз; постепенно развивается синдром мальабсорбции. Аспирационная энтеробиопсия устанавливает, что слизистая оболочка тонкой кишки инфильтрирована в основном плазматическими клетками, среди которых встречаются скопления макрофагов с РА-положи-тельной зернистостью в протоплазме (Белоусов и соавт., 1970, 1977).
Рентгенологически интестинальная липодистрофия проявляется расстройством моторно-эвакуаторной функции тонкой кишки в виде ускорения продвижения бариевой взвеси с явлениями дистонии и преимущественной дилатацией петель тощей кишки. В просвете кишечника в большинстве случаев определяются газ и жидкое содержимое, которые при вертикальном исследовании больного дают уровни жидкости (чаши Клой-бера). Рентгеноморфологические изменения сводятся к стойкой деформации рельефа слизистой тонкой кишки. Складки слизистой утолщены, деформированы, нечеткие, смазанные. Из-за утолщения и инфильтрации собственной слизистой оболочки и подслизистого слоя просвет кишки может сужаться. Все зависит от стадии процесса, от степени накопления жира в стенке кишки. Поражение начинается в слизистой оболочке кишечника, распространяясь в последующем на остальные слои стенки кишки и лимфатические узлы брыжейки.
В конечной стадии заболевания, когда развивается картина липогранулемато-за, утолщенные складки слизистой становятся огрубевшими, ригидными, не изменяющимися во время исследования.
Отечность и инфильтрация стромы ворсинок кишечника обусловливают картину зернисто-узелкового рельефа слизистой или мелких псевдополипов. Стенка кишки утолщается, кишка увеличивается в объеме, петли кишечника теряют нормальную спиралевидную форму, становятся выпрямленными и развернутыми. Увеличенные лимфоузлы могут вызывать краевые дефекты наполнения и сдавления кишки, смещение ее петель.
Диагноз интестинальной липодистрофии основывается в основном на данных клинического обследования с обязательным морфологическим исследованием биопсированной слизистой оболочки тощей кишки, синовиальной оболочки сустава или периферического лимфоузла. Рентгенологические признаки заболевания малоспецифичны и учитываются только при наличии клинических данных и результатов биопсии. Решающее значение для диагностики имеют стеаторея, лимфаденопатия, полиартрит, кожная пигментация, выраженная гипотония и данные энтеробиопсии (Белоусов, 1984).
Интестинальная лимфангиоэктазия. В основе лежат нарушения всасывания в тонкой кишке, потери белков, стеаторея, гипопротеинемия.
Клинические проявления: понос, отеки, серозные выпоты, потеря белка (не-усвояемость) в ЖКТ. Стенки кишки отечны, серозная поверхность темная, напряженная. Просвет несколько расширен, складки слизистой и ворсинки набухшие и широкие. Наиболее типичный признак — расширение лимфатических сосудов слизистого и подслизистого слоев. Стеаторея и потеря белка могут быть объяснены неполноценностью лимфатической сети и истечением лимфы, содержащей жиры и белки, в просвет кишки.
Рентгенологическое исследование выявляет диффузное утолщение складок
128. Интестинальнан липодистрофия:
а — неравномерная ширина просвета н из рельеф слизистой оболочки; б — «чаша», или Кло ибера.
слизистой в тощей и подвздошно-ках, гиперсекрецию, расширение тель тонкой кишки. В сочетании с нико-лабораторными данными эти знаки позволяют поставить ди и
Целиакия. Хроническое заболевание, обусловленное недостаточностью фер-0 ментов, которые участвуют в переваривании глютена. Проявляется снижением питания, отставанием ребенка в росте, значительным увеличением живота при общем истощении, обильными испражнениями, содержащими большое количество жира вследствие нарушения всасывания в кишечнике. При рентгенологическом исследовании ЖКТ обнаруживают многочисленные горизонтальные уровни жидкости в тонкой и особенно в толстой кишке и явления хронического энтерита с гипермоторной дискинезией.
Спру. Хроническая болезнь неясной этиологии, характеризующаяся нарушением всасывания в кишечнике глюкозы, жиров и витаминов, диареей, анемией, возникновением афт. Встречается в странах с тропическим и субтропическим климатом (в Средней Азии и Закавказье). В Узбекистане болезнь известна под названием «чилляшир» (по-ирански «сорок»). Такое название она получила в связи с тем, что возникала у женщин спустя 40 дней после родов при соблюдении ими обычая «чиля» (в течение этого времени женщина должна была питаться безбелковой, обезжиренной пищей).
Наряду с изменениями в полости рта (глоссит) и желудка (атрофический гастрит) при патанатомических исследованиях обнаруживаются атрофия слизистой тонкой кишки, дегенерация подслизистого и межмышечного нервных сплетений, иногда изъязвления, лимфоцитарные, эозинофильные и плазмацитарные инфильтраты. Изменения более выражены в тощей кишке. При далеко зашедшем процессе поражается вся тонкая кишка вплоть до илеоцекального клапана. В тяжелых случаях укорачиваются и оголяются ворсинки. Кишечные железы лишаются выстилки, на поверхности слизистой появляются мел
кие изъязвления. В толстой кишке — атрофия слизистой, обычно осложненная бактериальной или протозойной инфекцией. В печени атрофия, реже — ожирение долек.
Клиническая картина характеризуется медленным, постепенным началом. Жалобы на слабость, боли в животе, урчание, отхождение большого количества газов. Язык приобретает малиновую окраску, в результате атрофии нитевидных сосочков становится как бы полированным. Повышается слюноотделение. На слизистой рта и глотки появляются мелкие эрозии. Возникают поносы, частота стула доходит до 10 — 15 раз в сутки. Типичны изменения со стороны кала. Вначале он светлый, водянистый, пенистый, затем темнеет, сгущается, в нем обнаруживаются непереваренные мышечные волокна, большое количество дрожжевых грибков, жира и жирных кислот (стеаторея). Последний симптом настолько характерен, что иногда термином «стеаторея» обозначают все заболевания этой группы. При дальнейшем течении заболевания поносы чередуются с запорами, нарастают метеоризм, а затем общие симптомы — похудание, анемия, гиперкератоз, остеопороз как нарушение фос-форно-кальциевого обмена, парестезии конечностей, отеки, иногда тетаноподоб-ные судороги.
Рентгенологическое исследование в начальных стадиях обнаруживает типе рмобильность тонкой кишки с ускорением продвижения бариевой взвеси. Вследствие отека складки слизистой становятся шире, а просвет кишки несколько суженным. Вскоре описанная картина сменяется гипотонией. Петли кишки расширяются, складки слизистой истончаются, продвижение бария замедляется и он может задерживаться в желудке до 5—6 ч. Если процесс прогрессирует, степень расширения петель настолько большая, что иногда может
129. Рентгенологическая картина энтерита:
а — калибр кишки и распределение бариевой взвеси неравномерные; б — рельеф слизистой оболочки и края кишки смазаны и нечеткие; в — зернисто-нодулярный рельеф слизистой оболочки тощей кишки
возникать мысль о непроходимости, но стенки кишки остаются мягкими. Затем нарастает гиперсекреция, особенно в подвздошной кишке. Расширенные, атоничные петли тонкой кишки, заполненные бариевой взвесью и жидкостью, имеют гладкие очертания из-за растяжения и сглаживания складок слизистой. Они создают иногда картину, получившую название «симптом муляжа».
Резкое замедление продвижения бариевой взвеси усиливает впечатление застывших, неподвижных петель кишки. Часто наблюдается картина сегментации, когда между резко расширенными петлями появляются участки спастических сужений, разделяющих бариевую взвесь на отдельные фрагменты. Изъязвления выявляются редко. Атонические стенки кишки иногда создают картину инвагинации. Обычно такая картина нерезко выражена и быстро проходит, не требует оперативного вмешательства.
В отдельных случаях при этом отмечаются непродолжительные боли в животе. В петлях тонкой кишки скапливается большое количество газов и тогда бывают видны горизонтальные уровни, отличающиеся от истинных чаш Клой-бера нечеткостью, закругленными краями, немногочисленностью. Для ранних стадий заболевания характерны гипермобильность и ускоренное продвижение бариевой взвеси. В далеко зашедших случаях заполнение слепой кишки может начинаться через 30 мин после приема бариевой взвеси.
Болезнь Хартнапа. Характеризуется наследственными нарушениями всасывания триптофана в петлях тонкой кишки. Обычно одновременно наблюдаются также нарушения обмена других аминокислот.
Клинически болезнь проявляется чаще всего в детском возрасте. Характерны гиперемия кожи, шелушение, образование пузырей на участках, доступ
ных солнечному свету, т. е. фотодерматоз. У значительной части больных имеются мозжечковая атаксия (обратимая), тремор пальцев рук, расстройства почерка. При неврологическом обследовании выявляют нистагм, нарушение конвергенции, симптомы поражения пирамидной системы, хореиформный гиперкинез. Иногда присутствуют психические расстройства — приступы гнева, депрессия, страх.
В ряде случаев всасывание продуктов разложения триптофана не происходит, так как из индольных соединений некоторые микроорганизмы кишечника синтезируют безвредную краску — синий индиго. Тогда единственное проявление болезни — синяя окраска мочи, а заболевание называется «болезнью синих пеленок».
Диагноз ставится по результатам комплексного исследования. Так, в моче больных полностью отсутствует триптофан, значительны количества глутамина, аспарагина, гистидина, серина — объясняется это повреждением почечных канальцев индольными продуктами, поступающими из кишечника. Рентгенологически обнаруживают признаки кишечной диспепсии.
Лактозо дефицитный синдром. Это изолированный первичный дефицит энзимов, которые осуществляют гидролиз молока, или вторичное поражение энтероцитов, вырабатывающих энзимы, вызванное какими-либо заболеваниями кишечника, которые приводят к поносам и болям в животе при приеме молока. Рентгенологически обнаруживаются гипермоторная дискинезия тонкой кишки, резкое ускорение продвижения бариевой взвеси, гиперсекреция, беспорядочный рельеф слизистой. Даже при небольшом добавлении молока к бариевой взвеси возникают эти симптомы, позволяющие поставить диагноз (Розен-штраух и др., 1985).
Синдром «короткой кишки». В по
следние годы синдром мальабсорбции наблюдается после резекции тонкой кишки, особенно в ближайший послеоперационный период. В литературе также отмечается, что синдром мальабсорбции наблюдается и на почве недостаточности поджелудочной железы.
Резекция до 40 % тонкой кишки удовлетворительно переносится больными при сохраненной 12-перстной кишке, дистальной половине подвздошной и илеоцекального угла. В случае резекции более 40 % кишки может иметь место синдром мальабсорбции. Первые проявления синдрома мальабсорбции при этом — снижение тургора кожи, затем похудание, сопровождающееся анемией, судороги, нарастающая кожная пигментация, остеомаляция, периферическая нейропатия.
Значительно страдает всасывание Д-ксилозы, снижается уровень холестерина в крови. При обширной резекции подвздошной кишки нарушается абсорбция витамина Bt2, энтерогепатическая циркуляция желчных кислот. Печень увеличена, страдают ее функции. Возникает сочетанное нарушение пигментной, водной, холестеринобразующей и эстерифицирующей холестерин, белковообразовательной (снижение общего белка, альбуминов, а- и аг-глобулинов, альбумино-глобулинового коэффициента, увеличение 0- и у-глобулинов), а также протромбино-мочеобразователь-ной функции печени. У большинства больных снижена сулемовая проба, у некоторых увеличено количество фибриногена. Функция поджелудочной железы характеризуется патологической сахарной кривой, повышением гипер-и гипогликемических коэффициентов. Иногда обширная дистальная резекция вызывает макроцитарную или мегалобластическую анемию, патологические сдвиги (снижение) в содержании меди, железа, кобальта в крови, витами
нов В12, Вб, С и других; диспротеине-мию.
Клинически гиповитаминоз может проявляться глосситом, гингивитом, кровоточивостью десен, сухостью кожи, выпадением волос, ломкостью ногтей. Появляются вторичные нарушения эндокринных желез — общая слабость, адинамия, снижение АД, нарушения овариально-менструального цикла у женщин, снижение половой активности у мужчин. У детей, перенесших обширные резекции тонкой кишки, возможно развитие инфантилизма.
Имеются сообщения о смертельных исходах от прогрессирующего алиментарного истощения после обширных резекций кишечника.
Кахексия. Одно из проявлений синдрома мальабсорбции — развитие выраженной кахексии. В связи с этим возникают значительные затруднения и требуются тщательное обследование, анализ полученных данных в каждом отдельном случае. Дифференциальная диагностика в стадии выраженной кахексии проводится по двум направлениям.
1. Исключение других причин кахексии: психогенной анорексии, болезни Симмондса, тяжелых истощающих заболеваний.
2. Выяснение причин развития синдрома мальабсорбции, которая может быть обусловлена следующими заболеваниями кишечника: нетропической спру, целиакией взрослых, болезнью Крона и Уиппла, хроническим энтероколитом, дисбактериозом, опухолями и туберкулезом кишечника, стриктурой кишечника с застоем содержимого.
Первая группа заболеваний, приводящих к кахексии, отличается достаточно очерченной симптоматикой. Для психогенной анорексии (Хеглин, 1964) характерны напряженная конфликтная ситуация, хорошее самочувствие и физическая активность при значительном
истощении, а для диэнцефально-гипофизарной — симптомы плюригрануляр-ной недостаточности, отсутствие отеков, кишечных и копрологических симптомов мальабсорбции.
Из большой группы заболеваний собственно кишечника наибольшие диагностические трудности возникают при целиакии, спру, энтероколите и стриктурах кишечника. Кроме того, не всегда могут быть четкими причинно-следственные взаимосвязи между синдромом мальабсорбции и вызванными им последствиями, такими, как недостаточность никотиновой кислоты с развитием пеллагры, дисбактериоз и недостаточность желез внутренней секреции. Сравнительно недавно обращено внимание на то, что иногда при первичном иммунодефиците развивается выраженная мальабсорбция. Спруподобная клиника наблюдается примерно в 20 % случаев гипогаммаглобулинемии. У части больных развивается ворсинчатая атрофия слизистой оболочки тонкой кишки различной степени.
Болезнь альфа-цепей. Принадлежит к группе расстройств, известных как болезни тяжелых цепей. Это лимфопролиферативные состояния, характеризующиеся продукцией неполноценных иммуноглобулинов, которые лишены легких цепей и содержат дефектные тяжелые цепи с интактным Fc-фрагментом, утратой основной части Fd-фрагмента и/или изменениями в области вариабельной части цепи. В 1964 г. Е. С. Franklin с соавт. впервые описали случай болезни тяжелых цепей, именно альфа-цепей. Уже тогда они предвидели открытие аналогичных нарушений, связанных с другими классами иммуноглобулинов. В течение нескольких лет одно за другим появились сообщения о болезни а-цепей (1968 г.), ц-цепей (1970 г.) и о-цепей (1978 г.).
Болезнь а-цепей — по-видимому, наиболее частый вариант болезни тяжелых
цепей. Впервые она была распознана в Сирии по данным исследования сыворотки крови у молодой женщины, страдавшей от первичной диффузной лимфомы кишечника, которая сочеталась с синдромом нарушенного всасывания. Этот тип лимфомы давно получил название «средиземноморской абдоминальной лимфомы», так как часто обнаруживается и преимущественно распространен в средиземноморском регионе. Однако случаи этого заболевания описаны и в других странах. Этот тип лимфомы отличается от других первичных кишечных лимфом, встречающихся в западных странах у лиц пожилого возраста, у которых имеются признаки злокачественного поражения или синдрома мальабсорбции в сочетании с целиакией. Несмотря на то что болезнь а-цепей и лимфома средиземноморского типа имеют одни и те же клинико-патологические признаки (единственное отличие — секреция специфического иммуноглобулина при первом заболевании), вопрос об их взаимосвязи все еще не решен. Для обозначения этого состояния применяются различные термины, такие как «первичная лимфома верхней части тонкой кишки», «средневосточная лимфома» или «иммунопролифератив-ная болезнь тонкой кишки», что вносит большую путаницу. Ни один из этих терминов не является адекватным. Название «лимфома средиземноморского типа» принято как наиболее распространенное.
В настоящее время болезнь а-цепей описана почти во всех странах. Заболевание характеризуется диффузной и массивной плазмоцитарной инфильтрацией собственного слоя кишечника и брыжеечных лимфоузлов и поражает преимущественно лиц молодого возраста. К основным клиническим признакам относятся поносы, тяжелые нарушения всасывания, уменьшение массы тела и абдоминальные боли. Заболеванию свой
ственны прогрессирующее течение и летальный исход, хотя очень редко возможна ремиссия.
Рентгенологическая картина тонкой кишки в большинстве случаев такая же, как и при прочих синдромах нарушенного всасывания. Патологические изменения слизистой оболочки характеризуются диффузным утолщением складок по ходу всей тонкой кишки. Края складок неправильной формы, иногда в виде узелков. Иногда грубые складки и утолщение слизистой оболочки сочетаются со стриктурами и дефектами наполнения. В ряде случаев на эти признаки наслаиваются изменения, обусловленные сдавлением кишки опухолевыми образованиями. Пищевод, желудок и толстая кишка обычно не изменены.
Дисфункция тонкой кишки в раннем послеоперационном периоде
Любое хирургическое вмешательство на тонкой кишке в некоторой степени меняет ее моторику и скорость транзита содержимого. Двигательные нарушения иногда вызывают функциональные расстройства кишки и ведут к появлению клинической симптоматики.
Проведенные нами экспериментальные исследования на животных и клинические наблюдения на людях с применением рентгенологических методов показали, что в раннем послеоперационном периоде нарушаются тоническая и опорожнительная функции кишечника, характер и продолжительность которых зависят от локализации и величины травматического повреждения ткани при хирургическом вмешательстве. В нарушении тонического состояния кишечника наблюдается двутфазностъ: I фаза — спазм, II — парез. Обе фазы связаны между собой. В частности, парезу всегда предшествует спазм. Во время спазма и пареза содержимое тонкой кишки в каудальном направлении не
продвигается, опорожнительная функция ее замедляется по сравнению с нормой почти в 2 раза. Основной причиной двигательных расстройств кишечного тракта в раннем послеоперационном периоде является, по-видимому, хирургическое вмешательство. Наркоз, равно как и эмоциональное перенапряжение в предоперационном периоде, незначительно отражаются на функции кишечника.
Отмечается своеобразное сочетание клиники и рентгенологических данных дисфункции кишечника: спазм субъективно не проявляется, в этом периоде больных беспокоят лишь боли в операционной ране; развивающийся парез и сопутствующие ему задержка газов и стула, тошнота, рвота и другие общие изменения причиняют больным наибольшие страдания и значительно отягощают послеоперационный период. Эта развивающаяся послеоперационная непроходимость характеризуется отсутствием пропульсивных сокращений пищеварительной трубки. Тонкая кишка расширяется. В просвете ее накапливаются пищеварительные соки, остатки пищи и газы. Живот раздувается, перистальтика не определяется, возможны тошнота, рвота. Непроходимость возникает почти после каждой операции, во время которой вскрывается брюшная полость и проводятся манипуляции на кишечнике. В общем, чем длительнее операция и чем обширнее вмешательство, тем сильнее проявляется непроходимость.
Главным двигательным нарушением при непроходимости является исчезновение циклических межпищеварительных миоэлектрических комплексов (ММК), которые в период голодания распространяются по пищеварительному тракту. Физиологический смысл ММК состоит в очистке кишечника в межпищеварительный период от остатков пищи, газов и непереваримых продуктов питания. В случае непроходимо
сти ММК отсутствуют и в кишечнике накапливаются шлаки. Исчезновение комплексов можно объяснить повышенным выбросом норадреналина нервными клетками кишечника, рефлекторно активизирующимся при операционной травме. Норадреналин, возможно, подавляет ММК, вызывая гиперполяризацию гладкомышечных клеток тонкой кишки и тормозя выделение нервными клетками ацетилхолина. Комплексы исчезают не только в тонкой кишке, но и в желудке, и в толстой кишке. Обычно
проходит от 2 до 5 дней, пока снизится уровень нарадреналина, восстановятся ММК и начнутся кишечные сокращения.
Лечение послеоперационной непроходимости состоит в отсасывании содержимого желудка через носовой катетер и переводе больного на парентеральное питание. Чтобы ускорить восстановление моторики, применяют симпатоли-тики ц парасимпатомиметики в сочетании с адреноблокаторами (Михайлов, 1974).
Глава 24. ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ
Воспалительные заболевания в тонкой кишке встречаются довольно часто в виде как острого, так и хронического процесса. В практике врача-рентгенолога наибольшее значение имеют хронические воспалительные заболевания. Учитывая особенности клинического течения, целесообразно рассматривать раздельно воспаления 12-перстной, тощей и подвздошной кишок.
Дуодениты. Дуоденит характеризуется воспалительно-дистрофическими изменениями 12-перстной кишки, захватывающими все слои стенки или ограничивающимися пределами слизистой оболочки. Встречаются в 22—30 % всех желудочно-кишечных заболеваний. Заболевают преимущственно мужчины среднего возраста.
Причины дуоденита самые разнообразные. Первичный дуоденит развивается в результате длительного воздействия на слизистую оболочку 12-перстной кишки протеолитических ферментов кислого желудочного сока при дисфункциях желудка и 12-перстной кишки, паразитов (лямблии, аскариды, анкило-стомиды и др.), а также чрезмерного употребления раздражающей пищи, алкоголизма и курения, частых нервных и
психических перенапряжений, гормональных сдвигов.
Этиологическими моментами вторичного дуоденита могут явиться патогенные и токсические вещества, выделяемые в просвет 12-перстной кишки вследствие экскреторной деятельности ее слизистой (уремический дуоденит и др.). Вторичный сопутствующий дуоденит может быть следствием гастрита, язвенной болезни, панкреатита, дивер-тикулеза, желчнокаменной болезни, гепатитов и других болезней.
Важнейшее условие развития дуоденита — дуоденостаз, ведущий к более длительной задержке в 12-перстной кишке перешедшего из желудка его содержимого, а также желчи, кишечного и панкреатического сока. Это приводит к длительному контакту слизистой оболочки с протеолитическими ферментами, раздражающими и токсическими веществами и развитию воспалительного процесса. В застоявшемся дуоденальном содержимом возникает брожение с развитием инфекции, что также способствует местному воспалению.
Клиническая картина отличается большим разнообразием. Иногда отмечаются общий дискомфорт, небольшая
температура, диспептический синдром, боль и чувство тяжести в эпигастральной области, падение АД. Во многих случаях в период обострения заболевания наблюдаются общее недомогание, нередко головные боли типа мигрени, вегетативные нарушения, появляющиеся через 1,5—2—2,5 ч после еды, изредка реакции, напоминающие демпинг-синдром. Наиболее характерный симптом — боли, которые часто подобны язвенным, но не носят сезонного характера. Иногда первыми признаками заболевания оказываются желтуха или синдром стенозирования кишки.
Рентгенодиагностика складывается из функциональных и морфологических изменений 12-перстной кишки. Функциональные нарушения проявляются изменением ее тонуса и моторно-эва-куаторной деятельности, но эти нарушения весьма непатогномоничны, так как наблюдаются и при других заболеваниях. Тоническое состояние 12-перстной кишки может быть как повышенным, так и пониженным или смешанным. Что касается продвижения контрастного вещества, оно чаще бывает ускоренным. В зависимости от локализации процесса различают распространенный (тотальный) и ограниченный (локальный) дуоденит. К последнему относят бульбит, папиллит, дистальный и проксимальный дуоденит. Из ограниченных дуоденитов чаще всего встречаются бульбит и перипаппилит.
Рентгеноморфологические признаки дуоденита: деформация кишки, изменение ее контуров и рельефа слизистой. Рельеф слизистой весьма разнообразен, нечеткий. Складки слизистой чаще расширены, утолщены до размера более 4 мм. Характерны узловатость складок слизистой, деформация и эрозия луковицы. Широкие складки часто выпрямляются, становятся поперечными. Реже складки сглаживаются. Бариевая взвесь задерживается в ложбинках между
складками. Скопления ее неравномерные. Иногда видны лишь отдельные глыбки взвеси бария. Нередко углубления очень узкие, едва заметные. Создается впечатление, что одна складка наслаивается на другую. Изредка рельеф слизистой оболочки зернистый вследствие того, что контрастная масса на ровной поверхности образует мелкие точечные вкрапления. Из-за отека складки слизистой могут исчезать, контур кишки выравнивается, становится гладким. Характерно также утолщение стенки кишки. В некоторых случаях обнаруживаются плоские депо бария, которые свидетельствуют о появлении поверхностных эрозий. При вовлечении в процесс фатерова соска (папиллите) последний увеличивается (более 1 см в диаметре) и дает дефект наполнения округлой формы.
При оценке рентгенологической картины перед врачом-рентгенологом стоит задача — выяснить и отличить воспалительный процесс от неврогенно-функционального состояния 12-перстной кишки. Точно не установлено, в какой мере та рентгенологическая картина, которую считают характерной для дуоденита, отображает именно воспалительные изменения, особенно со стороны слизистой оболочки 12-перстной кишки. Увеличение калибра складок, изменение моторной функции кишки, быстрое прохождение бариевой взвеси по ее петле, наличие слизи в просвете 12-перстной кишки (Василенко, Гребенев, 1981) могут быть временными, быстро исчезающими состояниями и обусловлены неврогенными воздействиями, которые нарушают тонус, моторную функцию и секрецию.
Важнейшим в рентгенодиагностике дуоденитов является использование методики релаксационной дуоденографии. При ней изменения слизистой оболочки под воздействием гипотензивных средств не исчезают, а выявляются бо
лее четко. По данным Ю. В. Линевского и И. С. Павловой (1974), при гипотонической дуоденографии определяются следующие рентгеноморфологические признаки дуоденита.
1. Утолщение складок кишки свыше 0,4 см, которое нередко сочетается с их деформацией и сужением межскладочных промежутков. Более выражены эти изменения в нисходящей части 12-пер-стной кишки. В отдельных случаях складки приобретают подушкообразный вид (псевдотуморозная форма дуоденита) . Нередко складки слизистой выглядят нечеткими, т. е. как бы размытыми, что, вероятно, обусловлено пристеночным скоплением значительного количества слизи. Указанные изменения наблюдаются в основном при значительно выраженном обострении дуоденита.
2. Зернистый рельеф, характеризующийся мелкими дефектами наполнения овальной или округлой формы от 0,2 до 0,5 см в диаметре, которые напоминают «зерна» или мелкие полипы. Симптом «зернистого» рельефа, по-видимому, служит отображением очагового отека слизистой оболочки, закупорки и набухания отдельных железистых комплексов или гипертрофии фолликулярного аппарата. При расположении «зерен» на складках последние теряют ровность своих контуров и выглядят как бы «изъеденными» или лохматыми. Зернистый рельеф обычно выявляется у больных с нерезко выраженным обострением заболевания.
3. Истончение и уплощение складок слизистой вплоть до полного их отсутствия и сглаживания рельефа. Этот признак является отображением атрофии слизистой оболочки. Он свойствен длительному хроническому дуодениту в фазе ремиссии или нерезкого обострения процесса.
4. Плоские депо бария различной величины и неправильной формы. Они отображают поверхностные эрозии, ко
торые образуются в результате чрезмерного отека слизистой оболочки и отторжения эпителия (эрозивный дуоденит).
Все перечисленные рентгеноморфологические признаки хронического дуоденита сочетаются различным образом и лучше выявляются при слабом наполнении кишки бариевой взвесью или при изучении ее пневморельефа.
Таким образом, релаксационная дуо-денография позволяет дифференцировать перестройку рельефа слизистой оболочки функционального характера от ее стойких морфологических изменений, в частности обусловленных дуоденитом: первые исчезают, а вторые остаются. В большинстве случаев складки слизистой широкие, местами углубления между ними из-за отека отсутствуют и складчатость почти полностью исчезает. Вместо обычной крупной зубчатости по контурам кишки определяются (Гребенев, 1981) отдельные зигзагообразные полости бариевой взвеси («гармошка»). По контурам кишки видна полутень выступающих кнаружи отечных складок, а в Цросвете кишки выявляется большое количество слизи.
При изолированном поражении луковицы последняя при обычном рентгенологическом исследовании может быть уменьшена в размерах, контуры ее нечеткие, в ряде случаев зазубрены, а прохождение контрастного вещества по ней резко ускорено. Многие деформации луковицы обусловлены воспалением ее слизистой, на которой обнаруживаются полипоидные набухания.
В диагностике дуоденитов большое значение имеет дуоденофиброскопия, которая позволяет обнаружить воспалительные изменения слизистой оболочки 12-перстной кишки: воспалительный отек, гиперемию, бледность окраски слизистой, иногда эрозии, легкую кровоточивость слизистой при дотрагивании биопсионными щипцами. Некоторые авторы указывают, что диагностика дуо
денита на основе эндоскопических признаков должна проводиться с известной долей осторожности, поскольку такие эндоскопические признаки дуоденита, как отек и гиперемия слизистой оболочки, чаще являются следствием функциональных гемодинамических расстройств, а не результатом ее воспалительных изменений (Marlicz et al., 1986). Только гистологическое и гистохимическое исследование биоптатов позволяет распознать заболевание.
Следовательно, достоверный диагноз хронического дуоденита должен устанавливаться с учетом всех клинических данных, результатов повторного рентгенологического исследования, позволяющих обнаружить стойкие изменения слизистой оболочки 12-перстной кишки, и при наличии гистологического подтверждения.
Энтериты. Они представляют собой различные по этиологии воспалительные поражения тонкой кишки. Могут быть острыми и хроническими. Ведущая роль в возникновении острых энтеритов принадлежит возбудителям пищевых токсикоинфекций. Острые энтериты могут наблюдаться в период острой бактериемии, вызываются некоторыми серотипами аденовирусов, вируса гриппа, эпидемического гепатита, вирусами Коксаки, токсинами некоторых штаммов стафилококков и ботулинуса и другими причинами. Наблюдаются энтериты алиментарного происхождения, возникающие при чрезмерном переедании, употреблении слишком грубой пищи и сильно раздражающих пряностей, крепких спиртных напитков и т. д. Не последнюю роль играет аллергический фактор, в частности идиосинкразия к некоторым пищевым продуктам и лекарствам.
Причиной хронического энтерита чаще является острый энтерит при неправильном или недостаточном его лечении. Развитию хронического энтерита
могут способствовать ослабление или истощение организма, нервные потрясения и другие факторы. Но может наблюдаться и первично хронический энтерит, основная причина которого — длительные систематические алиментарные нарушения: переедание, нерегулярное питание, еда всухомятку, употребление недоброкачественных продуктов, преимущественно углеводное питание, голодание и другие факторы.
Вследствие функциональной и морфологической взаимосвязи различных отделов пищеварительного тракта в процесс чаще одновременно вовлекаются желудок и тонкая кишка (гастроэнтерит), тонкая и толстая кишка (энтероколит) или развивается гастроэнтероколит.
При воздействии различных описанных факторов в тонкой кишке развивается воспалительный процесс, который сопровождается десквамацией эпителия слизистой оболочки тонкой кишки, усилением отделения ею слизи. Одновременно возникают двигательные расстройства тонкой кишки (дискинезии) и нарушаются процессы мембранного пищеварения, которые (Сенютович и др., 1975) обусловлены: нарушениями структуры ворсинок (при их атрофии), ультраструктуры поверхности кишечных клеток (деструкция микроворсинок) , общим снижением ферментативной активности поверхности щеточной каймы.
А. В. Фролькис (1975) полагает, что в тех случаях, когда в патологический процесс вовлекается значительная часть тонкой кишки, страдает выделение энтерокиназы и щелочной фосфатазы, т. е. обоих ферментов. При более локальных поражениях может расстраиваться выделение одного из них. В случаях, когда воспалительный процесс локализуется только в ппоксимальных отделах, по-видимому, преимущественно нарушается выделение энтерокиназы, которая выра
батывается исключительно в верхних отделах тощей кишки. При изолированном поражении более дистальных отделов расстраивается главным образом секреция щелочной фосфатазы, которая вырабатывается не только в верхних, но и в средних отделах тонкой кишки. В случае тяжелых форм энтеритов снижается концентрация ферментов, что связано с атрофическими изменениями слизистой.
При легких формах энтеритов (Фро-лькис, 1975) чаще всего секреция ферментов повышается. Наблюдается нарушение адсорбции ферментов, резорбции и секреции воды и натрия энтеро-цитами. На процессы всасывания воды в кишечнике влияют интестинальные гормоны, выработка которых нарушается из-за воспалительных изменений в стенке тонкой кишки. Вследствие нарушенной выработки интестинальных гормонов возникают расстройства моторики тонкой кишки, при которых уменьшается продолжительность контакта субстрата с поверхностью тонкой кишки, т. е. развиваются нарушения полостного пищеварения.
Если нарушено мембранное и полостное пищеварение, промежуточные продукты гидролиза начинают усиленно утилизироваться бактериальной флорой тонкой и толстой кишок. Образующиеся в избыточном количестве продукты бактериального метаболизма (гниения и брожения) еще больше раздражают слизистую оболочку тонкой кишки, усиливая ее двигательную активность. Это ведет к потере с фекалиями жидкости, солей, а электролитные сдвиги (Фроль-кис, 1975) являются одним из механизмов (вместе с интестинальными гормонами, неабсорбированными пищевыми продуктами, нарушением автономной нервной системы кишечника), усиливающих моторные расстройства, что приводит к развитию порочного круга.
В результате всех этих процессов,
помимо расстройства всасывания воды и солей, нарушается всасывание жиров. При более тяжелом течении болезни, особенно в случае выраженных поражений проксимальной части тощей кишки, в которой (Chung, 1979) переваривается и всасывается 60 % альбумина, расстраивается всасывание белков и углеводов, нарушается витаминный обмен. Некоторые инфекционные и токсические агенты, поступающие из кишечника в кровь, пагубно воздействуют в первую очередь на сердечно-сосудистую и нервную системы. Не исключено, что при заболеваниях тонкой кишки, вследствие структурных изменений слизистой оболочки кишечника, некоторые белковые ее компоненты приобретают антигенные свойства. А это приводит к образованию соответствующих антител.
У больных хроническим энтеритом с помощью различных аллергических методик удается установить сдвиги в иммунобиологическом состоянии организма. Так, Е. В. Модестова с соавт. (1977) считают, что в патогенезе хронического энтероколита III степени определенную роль играет дефицит иммуноглобулинов класса А. Больные этой группы торпид-ны к обычным противоэнтеритным методам лечения. Их состояние улучшается на фоне гемотрансфузий, введения у-глобулина и тщательного лечения дисбактериоза.
Обращается внимание на участие генетических факторов в патогенезе ряда заболеваний кишечника, в том числе энтеритов (врожденные дефекты энзимов, ответственных за всасывание пищевых продуктов). По мнению некоторых авторов, инфекция и прочие патогенные факторы превращают генетический метаболический дефект в болезнь.
Таким образом, нарушения со стороны кишечной микрофлоры, кишечный дисбактериоз, вызванный различными причинами, рассматриваются в качестве одного из ведущих патогенетических ме
ханизмов. Известную роль играют аллергические механизмы, иммунобиологические сдвиги, генетические факторы.
Клиническая картина энтеритов многообразна, зависит от этиологии, стадии процесса, индивидуальных особенностей организма. Большинство острых энтеритов, связанных с пищевыми ток-сикоинфекциями, сопровождаются повышением температуры, герпетическими высыпаниями, признаками поражения нервной системы, увеличением печени и селезенки, гиперемией зева с мелкоточечной везикулезной сыпью на миндалинах и мягком небе. Энтерит на почве идиосинкразии сопровождается другими аллергическими проявлениями в виде крапивницы, отека Квинке, зуда и т. д. Энтериты кандидамикозной природы нередко сопровождаются кандида-микозом полости рта. .Энтерит может протекать и без поноса, например при брюшном тифе, ботулизме. В таком случае отсутствуют явления обезвоживания, деминерализации. То есть в зависимости от этиологического фактора большинству острых энтеритов присущи свои особенности. Больные острым энтеритом редко обследуются рентгенологически, чаще врачи-рентгенологи встречаются с людьми, страдающими хроническим энтеритом.
При хронических энтеритах к наиболее постоянным относятся жалобы на расстройство стула (запоры, поносы). Причем диарея больше беспокоит больных во вторую половину дня, т. е. в часы нарастания метеоризма и других патологических проявлений. Вздутие живота локализуется главным образом в его средней части, от чего живот приобретает форму купола. Метеоризм всегда сопровождается отделением обильных и очень зловонных газов.
У больных постоянные и схваткообразные боли, чаще локализующиеся в околопупочной области. Реже отмечают
ся более сильные схваткообразные боли, которые чаще возникают перед стулом. После опорожнения кишечника нередко наступает резкая слабость, ощущение дурноты, иногда холодный пот. Стул не бывает столь частым, как при острых энтеритах, обычно не более 4—5 раз в сутки. Иногда понос появляется вслед за задержкой стула в течение 1—2 дней. Часто больные жалуются на ощущение полноты и распирания сразу после еды, что связано с быстрой эвакуацией пищи из желудка и растяжением петель тонкой кишки, появляются жалобы на урчание, «переливание» в кишечнике (Губергриц, Линевский, 1975; Фроль-кис, 1975; Сенютович с соавт., 1975; Абасов, Саакян, 1977).
Изолированное поражение тонкой кишки воспалительным процессом встречается в практике врача довольно редко. Как правило, патологические изменения распространяются и на толстую кишку, и клиницисты обычно наблюдают больных уже в период развития энтероколита.
При пальпации живота у больных хроническим энтеритом определяется урчание и шум плеска. Наличие плеска в слепой кишке — опорный пункт для диагностики хронического энтерита. Этот симптом описан еще в 1896 г. В. П. Образцовым и Н. Д. Стражеско. Он возникает вследствие нарушения секреторной, всасывательной и моторной функции тонкой кишки, усиления бродильных и гнилостных процессов. Определяется болезненность, нередко более выраженная в зоне слева и выше пупка. При соответствующем поражении толстой кишки наблюдается болезненность также в нижних и нижнебоковых отделах живота.
К общим симптомам хронического энтерита относятся: слабость, снижение работоспособности, похудание, бледность, которые связаны с нарушением минерального, белкового, жирового,
углеводного, витаминного обмена. У больных хроническими энтеритами нередко развиваются изменения ротовой полости, свертывающей, противосвертывающей и сердечно-сосудистой систем, нарушения функции почек и мочевыводящих путей, нервной системы. Все эти симптомы могут быть менее или более выражены в зависимости от характера течения хронического энтерита. А. В. Фролькис (1975) выделяет легкое, средней тяжести и тяжелое течение, а также фазы ремиссии или обострения. При тяжелом течении хронического энтерита больной истощен, жалуется на жажду. Кожа сухая, акроцианоз, глухость тонов сердца, снижается АД, может наблюдаться уменьшение диуреза.
Хронические энтероколиты, обусловленные иммунодефицитом (Виноградова, Модестова и др., 1978), характеризуются сопутствующей повышенной восприимчивостью к заболеваниям верхних дыхательных путей, повторными пневмониями, анацидным состоянием, лямблиозом.
У больных хроническим энтеритом вследствие постоянной потери кальция через кишечник происходит деминерализация костей. Развиваются различные костные поражения от легкого остеопороза до тяжелой остеомаляции — так называемая энтеральная остеопатия. В отдельных случаях диарея может отсутствовать, а костные изменения становятся одним из ведущих клинических симптомов заболевания кишечника. Поэтому при костных поражениях неясного генеза рекомендуется всегда исследовать кишечник, памятуя, что последний играет большую роль в возникновении деминерализованных болезней скелета. Если гастроэнтерит эозинофильный, наблюдается эозинофилия в крови.
Хронический энтерит проявляется энтеральным синдромом недостаточности пищеварения, свидетельствующим о
нарушении всасывания в тонкой кишке и сопровождающимся определенными копрологическими показаниями. Кал чаще всего неоформленный, окраска варьирует от светло-желтой до грязносерой. При сопутствующих бродильных процессах в кишечнике испражнения пенистые, сопровождаются обильным отхождением газов и имеют кислую реакцию, а при гнилостных процессах — кал темный, зловонный, со щелочной реакцией (Губергриц, Линевский, 1975). Фекалии макроскопически содержат остатки непереваренной пищи, микроскопически — много жирных кислот, реже нейтральные жиры, в значительном количестве — измененные мышечные волокна, слизь, непостоянно — внеклеточный крахмал, определяются лейкоциты, клетки кишечного эпителия и их обломки и другие элементы. Выраженная полифекалия наблюдается при преобладании энтерита в энтероколите. Ориентировочное представление о состоянии процесса всасывания можно получить с помощью определения суточной массы тела больного.
Таким образом, диагноз хронического энтерита ставится на основании жалоб больного, результатов общеклинического обследования, лабораторных данных и в частности микроскопического исследования кала, изучения ферментовыде-лителыюй функции тонкой кишки, всасывательной способности с помощью йодкалиевой пробы. Важное значение в диагностике хронических энтеритов принадлежит рентгенологическому исследованию.
Рентгенодиагностика хронических энтеритов должна основываться на характере заполнения тонкой кишки контрастным веществом, диаметре просвета кишки, скорости продвижения контрастного вещества, времени его поступления в слепую кишку, характере рельефа слизистой и контура петель тонкой кишки. Можно применять все физиоло-
гические методы рентгенологического i исследования тонкой кишки, позволяющие судить о функциональных ее пару- 1 шениях, сопровождающих хронические i энтериты.
У больных хроническим энтеритом ] увеличивается калибр тонкой кишки, заполнение ее петель происходит неравномерно. За счет усиленных процессов i экссудации, брожения и нарушений вса- ’ сывания в тонкой кишке может быть 1 наличие газа и мелких уровней жид- i кости. I
Рентгенологически у больных хрони- 1 ческим энтеритом выявляют функциональные нарушения в виде дискинезий, ' при которых пассаж бария может за- i медляться до 8 ч и более или, наоборот, 1 ускоряется до 1—2 ч. Спазм кишки про- < является уменьшением ее диаметра, составляющего примерно '/з—’/4 ее обыч- ; ной ширины. При гипотонии наблюдается резкое увеличение диаметра тонкой 1 кишки, нередко до размеров толстой i кишки. Нарушается продвижение контрастной массы по тонкой кишке. <
Степень рентгенологических функци- i опальных изменений тонкой кишки кор- 1 релирует с тяжестью хронического энте- < рита: у больных с легким и средней 1 тяжести хроническим энтеритом резко 1 ослаблены тонус и моторная деятель- 1 ность тонкой кишки, а при тяжелом i энтерите наблюдаются гипертония и гиперкинезия (Линевский, Павлова, 1974; <
Губергриц, Линевский, 1975).
Многие авторы отмечают, что во время обострения хронического энтерита возрастает продолжительность пе- ' риода «работы», в отдельных случаях моторика кишки становится непрерыв- 1 ной. Увеличивается амплитуда кишеч- i пых сокращений. Вместе с тем при хро- i ническом энтерите тонус кишки в основ- 1 ном повышен. Усиление моторики не : всегда сопровождается ускорением ки- 1 шечной эвакуации, так как нередко уси- ] ливающиеся движения имеют нейро- i
пульсивный характер. А. В. Фролькис (1975) подтверждает это рентгенологическими наблюдениями: у 19,6 % больных при ускоренном продвижении контрастного вещества по тонкой кишке барий поступает в слепую кишку через 1 — 1,5 ч после приема его внутрь; в 7,1 % случаев поступление контрастного вещества в слепую кишку начинается через 6 ч и более (замедленная эвакуация) ; в 73,3 % продвижение содержимого по тонкой кишке происходит в нормальные сроки (слепая кишка заполняется через 3—3,5 ч).
По мнению М. А. Филиппкина (1988), чередование гипертонических сокращений с быстрым прохождением бариевой взвеси с последующей гипотонией и застоем контрастного вещества — характерные рентгенофункциональные признаки энтерита.
Однако указанные функциональные нарушения не столько облегчают, сколько усложняют рентгенодиагностику хронических энтеритов, так как, с одной стороны, они неспецифичны и могут встречаться при многих заболеваниях, в первую очередь системы пищеварения, а с другой — во многих случаях мешают выявлению рентгеноморфологических признаков. Между тем именно последним принадлежит особая роль в рентгенодиагностике данного заболевания. Так, при энтерите легкой степени и средней тяжести изменения рельефа встречаются в 30 %, при тяжелом энтерите — в 83, а нарушение двигательной деятельности соответственно в 30 и 51 % случаев. Рисунок складок слизистой усиливается и заметно расширяется, края кишки становятся неровными. Складки неравномерно утолщены, высокие, вилообразные, раздвинутые, нередко меняют свое направление. Резко выраженное набухание слизистой оболочки может вести к сужению просвета кишки. Иногда слизистая тонкой кишки имеет неравномерно-пятнистый вид. При вы-
раженном отеке, избытке слизи и жидкости рельеф слизистой оболочки кишки смазан и нечеткий. В случае атрофии слизистой оболочки складки сглаживаются и урежаются.
А. Н. Михайлов и Е. В. Ильяшевич установили (1989), что основным морфологическим симптомом хронического энтерита при применении сорбитно-водно-бариевой взвеси является отсутствие существенной изменчивости рельефа слизистой в процессе исследования, т. е. на всех трех рентгенограммах отмечается однообразная стойкая перестройка ее рельефа. Встречаются три типа воспалительной перестройки:
а) стойкое расширение (до 7—8 мм) и поперечное расположение складок из-за отека слизистой оболочки;
б) неравномерно-крупнозернистый рельеф, обусловленный гиперплазией лимфоидного аппарата;
в) рельеф неопределенный из-за атрофии слизистой оболочки. Воспаление слизистой сопровождается снижением контрастности изображения, скоплением газа и жидкости в просвете кишки.
Ренгтенологические проявления энтерита коррелируют с тяжестью течения заболевания. Дискинезии тонкой кишки наблюдаются при легком (I степень), средней тяжести (II степень) и тяжелом (III степень) течении заболевания. Морфологические симптомы энтерита встречаются в 30 % случаев при I и II степенях тяжести заболевания, в 88 % случаев — при III степени тяжести. При тяжелой форме энтерита воспалительный процесс может распространяться и на мышечный слой кишечной стенки, что проявляется ригидностью кишки на большом протяжении, вы-прямленностью петель. Сопутствующий такому процессу мезентериальный лимфаденит значительно раздвигает петли тонкой кишки.
Следует помнить, что изменения рельефа слизистой оболочки могут быть
временными и не связанными с воспалительным процессом, а обусловленными той или иной фазой пищеварения. Деформация рельефа слизистой оболочки может свидетельствовать в пользу энтерита лишь при условии ее стабильности в процессе динамического рентгенологического наблюдения. Ведь подобные хроническому энтериту изменения складок могут иметь функциональную природу или быть связанными с отеком подслизистого слоя, например на почве аллергии и других причин. Вместе с тем решение вопроса о стойкости выявленных изменений рельефа слизистой тонкой кишки — задача весьма сложная. Это вынуждает врача-рентгенолога проводить длительное исследование, повторно изучать участки кишки при подходе к ним новых порций контрастного вещества.
Обычное рентгенологическое исследование не всегда позволяет дифференцировать нарушение рельефа органической природы от нервно-рефлекторной его перестройки или нарушений гидродинамического равновесия. Гиперсекреция слизи в тонкой кишке может встречаться и при отсутствии воспаления. Ю. В. Линевский и И. С. Павлова (1974) показали несостоятельность обычного рентгенологического исследования в распознавании патоморфологи -ческих изменений при ранних стадиях и нерезко выраженных формах хронического энтерита, которые не затрагивают макроструктуру и динамику складок (гистологически поверхностное воспаление). Выявление рентгеноморфологических признаков хронического энтерита во многих случаях лимитируется тем, что рельеф слизистой оболочки тонкой кишки вообще не поддается изучению из-за ускоренного продвижения бариевой взвеси.
Рентгенологическое исследование тонкой кишки в условиях релаксационной энтерографии обладает в этом смыс
ле большей разрешающей способностью. У больных хроническим энтеритом при таком рентгенологическом исследовании рельефа слизистой тонкой кишки можно определить мелкие дефекты наполнения величиной примерно с просяное зерно — так называемый зернистонодулярный рельеф. Этим методом хорошо выявляются утолщение круговых складок и сглаженность рельефа. Они обнаруживаются изолированно или чаще сочетаются друг с другом. Изменения рельефа слизистой тонкой кишки чаще выявляются при среднетяжелом и тяжелом хроническом энтерите.
Таким образом, хронический энтерит может протекать как с повышенным, так и с пониженным кишечным тонусом, с ускоренной или замедленной моторикой кишок. У больных легкими и нередко средней тяжести энтеритами тонус и двигательная функция тонкой кишки резко ослабляются. Для больных тяжелыми энтеритами характерна гипертония и гиперкинезия тонкой кишки. Вследствие усиленной экссудации, брожения и нарушения процессов всасывания в тонкой кишке появляются газ и небольшие уровни жидкости. Отмечается стойкая деформация рельефа слизистой оболочки и сужение просвета кишки. Складки атрофированной слизистой приобретают псевдоилеальный вид. Особенно ценный признак хронического энтерита — единичные мелкопятнистые округлые образования на рельефе слизистой (зернисто-узелковый рельеф). Они свидетельствуют об очаговом отеке слизистой, закупорке и набухании отдельных кишечных желез, гипертрофии солитарных фолликулов и пейеровых бляшек. Лучше всего такой рельеф выявляется при релаксационной энтерографии.
В последние годы в нашей практике имели место 26 случаев хронического лучевого энтерита. Рентгенологическое исследование с помощью методики
130. Лучевой энтерит.
трехкратной энтерографии позволило выявить как функциональные (гиперкинезия, гипотония, гиперсекреция), так и морфологические признаки (отек, изъязвление, утолщение складок, изменение их калибра). Сужение и стенозы обнаружены у 55 % больных, расширение петель — у 35, свищи — у 4,6, поражение слизистой оболочки — у 45 %.
Итак, сказанное свидетельствует о том, что возможности рентгенологического метода в диагностике хронических энтеритов нельзя переоценить. Только комплексная клинико-лабораторно-рентгенологическая диагностика является достоверной и позволяет отдифференцировать хронический энтерит от ряда заболеваний.
131. Локализация впелу-ковичиых язв 12-перстной кишки (в процентах).
Язвы 12-перстной кишки. 12-перстная кишка поражается язвой в 30—32 % случаев патологии пищеварительного тракта. Язвы могут локализоваться в любом отделе 12-перстной кишки. Наибольшее количество язв приходится на луковицу (около 80 — 95 %). Остальные локализуются в постбульбарном отделе 12-перстной кишки, из них 95 % приходится на верхний изгиб и проксимальную треть ее нисходящего отдела.
Клиника и течение язв 12-перстной кишки разнообразны и в ряде случаев атипичны, особенно внелуковичных. В течении болезни имеются периоды сезонных обострений и ремиссий. Длительность периодов обострений, их интенсивность связаны с локализацией язвы, полом, возрастом больных, а также наличием осложнений. Неосложненная язва с локализацией в луковице 12-перстной кишки протекает более благоприятно. Внелуковичные язвы часто проявляются дуоденальным кровотечением, могут симулировать другие заболевания.
Главным симптомом у 90—95 % больных язвенной болезнью 12-перстной кишки является боль, возникающая через 2—3 ч после еды и локализующая
ся в правом верхнем квадранте живота, реже в эпигастральной области, нередко с иррадиацией в спину, поясничную область, иногда за грудину. Боли при внелуковичных язвах в отличие от бульбарных прекращаются не сразу, а через 15—30 мин после еды. Причем интенсивность болей превышает таковую при бульбарной язве. Нередки диспептиче-ские жалобы, первое место среди них занимает изжога. Клиническое течение внелуковичных язв более тяжелое и упорное, характеризуется склонностью к пролонгированным обострениям.
Рентгенологическое исследование в диагностике язв является ведущим. Но следует помнить, что в ряде случаев клинические данные имеют первостепенное значение и отсутствие рентгенологического подтверждения язвы не должно влиять на диагноз. Нет идеальных методов диагностики, нужно учитывать предельную возможность каждого из них. При язвенной болезни рентгенологически хорошо выявляются стойкие деформации луковицы 12-перстной кишки, ее дискинезия, симптом «ниши». Распознавать язвы в деформированной луковице очень трудно, так как рубцовые деформации нередко симулируют язвенные «ниши» или, наоборот, скрывают малозаметный воспалительный вал, измененная слизистая оболочка также затрудняет выявление язвы.
Согласно рентгенологическим и эндоскопическим данным, наиболее часто язва луковицы локализуется на передней и задней стенках (60%), реже— на латеральной и выходном отделе луковицы. Наряду с выявлением «ниши» на контуре или на рельефе наблюдаются втяжения на противоположной от язвы стенке и конвергенция складок слизистой оболочки к «нише». Лучше всего рентгеноморфологические признаки язвы луковицы выявляются в условиях релаксационной дуоденографии, вы-
132. Язвы луковицы 12-перстной кишки:
а, 6 — деформация луковицы; в, г, д — одиночные язвы различных видов.
званной приемом под язык 2 таблеток аэрона (Сосина, Михайлов, 1970, 1971, 1973; Михайлов, 1978, 1985).
Язвы луковицы сочетаются с рубцовыми деформациями ее. Типичны деформации в виде трилистника, узкой трубки с образованием множественных выпячиваний (карманов). Могут наблюдаться сглаживание и укорочение контура, укорочение или втяжение медиального или латерального контуров и другие деформации. Для каждой лока
лизации язвы имеется определенный вид деформации луковицы. Язва передней стенки образует дефект (втяжение) на латеральном контуре или карман (выпячивание) на медиальном контуре луковицы. Язва задней стенки луковицы определяется по дефекту на ее медиальном контуре или по карману на латеральном контуре. «Целующиеся» язвы передней и задней стенок выражаются подобными деформациями по обоим контурам луковицы.
На основании динамических рентгенологических наблюдений установлено 3 фазы развития язвенной болезни.
I фаза включает изменения слизистой оболочки от грубой ее перестройки до образования локального (язвенного) отека в базальных, центральных и верхушечных отделах луковицы. Коэффициент корреляции этого признака с последующей диагностикой язвенного кратера весьма высок. Менее надежен признак сопутствующего спазма стенки луковицы. Корреляция двух признаков (отек + спазм) уже на этом этапе позволяет достаточно уверенно высказаться за язвенную болезнь луковицы.
II фаза характеризуется рентгенологической диагностикой поверхностной, нечеткой язвенной «ниши» на рельефе слизистой оболочки на фоне отека и локального спазма. При этом диагностика язвенного кратера требует применения серийной дуоденографии, проводимой при тщательной импрегнации бариевой взвеси в зоне локального отека и спазма стенки кишки.
III фаза (реконвалесценции) после адекватного противоязвенного лечения выражается статистически достоверным значительным снижением выраженности всех рентгенологических признаков язвенного поражения.
Диагностика внелуковичных язв 12-перстной кишки представляет определенные трудности из-за многообразия их клинических проявлений. Основным рентгенологическим признаком и этих язв является «ниша», выходящая за контур кишки. Постбульбарные «ниши» в большинстве случаев больше, чем «ниши» при луковичных язвах, могут иметь цилиндрическую, призматическую, конусовидную, округлую или неправильную форму. Форма и размеры «ниши» во время перистальтики не меняются. После опорожнения кишки бариевая взвесь задерживается в «нише». Большое диагностическое значение
имеет симптом конвергенции складок, которые, приобретая поперечное направление, начинают напоминать гофрировку или воротничок. В зоне локализации язвы всегда определяются эксцентрическое сужение кишки и признаки сопутствующего дуоденита. Отмечаются также функциональные двигательные нарушения желудка и 12-перстной кишки.
В ряде случаев в начальной части 12-перстной кишки могут наблюдаться гигантские язвы, которые сложны для диагностики, так как их принимают за деформированную луковицу. Эти язвы имеют большую тенденцию к перфорации и массивным кровотечениям. Летальность около 40 %.
R. Fisenberg, A. Margulis, A. Moss (1978); Т. Kuijpers, Р. Schaw, (1985) наблюдали с гигантскими язвами 26 больных в возрасте от 29 до 73 лет. Они отмечают, что больные жаловались на боли в животе, рвоту, мелену. Диаметр язв был 2—6 см, в среднем 3,8 см. По величине они в 80 % случаев превышали размер луковицы. Язвы сопровождались сужениями пилорического канала и 12-перстной кишки дистальнее расположения язвы, что проявлялось нарушением эвакуации содержимого из желудка. У 5 больных имелись дефекты наполнения у основания луковицы. У 8 человек были «язвы внутри язвы». У 2 лиц в центре ниши выявлен дефект наполнения за счет либо сгустка крови, либо развития грануляционной ткани.
В диагностике язвы наиболее ценны данные релаксационной дуоденографии. При обычном рентгенологическом исследовании быстрый пассаж контрастного вещества по 12-перстной кишке препятствует изучению рельефа и контуров слизистой оболочки. Изучение 12-перстной кишки, необходимо проводить поли позиционно как в вертикальном, так и в горизонтальном положении больного. Язва чаще располагается на
133. Постбульбарные язвы:
а — остроконечная «ниша»; б — язва в виде большого кон-трети нисходящего отдела 12-перстной кишки.
134. Различного вида пенетрация язв луковицы 12-перстной кишки в головку поджелудочной железы (варианты а, б, в).
внутренней или задней стенке 12-перст-ной кишки. Многоосевое исследование позволяет вывести ее на контур. В начале исследования обнаруживается, как правило, асимметричное локальное сужение кишки, а затем уже «ниша» с ригидными и измененными вокруг нее складками слизистой оболочки.
Выявляемые сужения в месте локализации язвы бывают протяженностью до 1 —1,5 см, иногда и более, имеют четкие, но неровные контуры.
Симптом нишевого выпячивания язвенной природы необходимо дифференцировать с дивертикулом и изъязвлением рака 12-перстной кишки. Против язвы в пользу дивертикула свидетельствуют: правильно-округлая форма выпячивания, четкие и ровные контуры, эластичность стенок, увеличение размеров при заполнении барием, способность активно сокращаться, наличие складок слизистой оболочки в области перешейка. При изъязвлении опухоли «ниша», стенка которой образована опухолевой тканью, неправильной формы, с нечеткими и неровными контурами.
В случае долго протекающих язв и несвоевременно начатого лечения может
наблюдаться пенетрация в головку поджелудочной железы, печеночно-дуоденальную связку, малый сальник, печень и желчные пути. Для пенетрирующей ( язвы типичны глубокая «ниша», выступающая далеко за контур кишки, и длительная задержка в ней контрастного вещества. При этом нередко появляется симптом трехслойности «ниши»: нижний слой образует барий, средний — жидкость, а верхний слой — газ.
Дифференциальная диагностика весьма затруднительна со спаечным процессом вследствие перидуоденита, перихолецистита, оттягивающих стенку кишки наподобие паруса или конуса. Рентгенологически тогда выявляются деформация 12-перстной кишки, смещение, фиксация и сужение просвета ее соответствующих отделов, некоторая зубчатость контура на большем или меньшем протяжении стенки кишки. Вместе с тем при спаечном процессе отсутствуют рентгеноморфологические и функциональные признаки, присущие язве.
Язвы тощей и подвздошной кишок. Изъязвления в тощей и подвздошной кишках могут быть первичные и вторичные. Происхождение язв и эрозий
слизистой оболочки связывают с самыми различными причинами. Этиопатоге-нез их не совсем ясен. Видимо, опреде--ленную роль играют повреждения слизистой оболочки, переваривающая способность желудочного сока и повышенная протеолитическая активность сока поджелудочной железы. Изъязвления развиваются при воздействии на слизистую оболочку также некоторых лекарственных веществ, в частности ацетилсалициловой кислоты, стероидов и др. Важное значение придается нервно-трофическим изменениям и нарушениям местного кровообращения (спазм сосудов, тромбоз, эмболия). Эрозивно-язвенные поражения наблюдаются при болезнях крови, инфекционных заболеваниях, воздействии на слизистую оболочку токсических веществ и др. Такие поражения могут быть проявлением злокачественного или системного процесса в слизистой оболочке, носить доброкачественный (в виде плоских или гиперпластических эрозий) или эрозивно-геморрагический характер.
Первичные неспецифические язвы — довольно редкое заболевание. Чаще встречаются у мужчин в возрасте 30 — 60 лет. Обычно они единичные, но могут располагаться и небольшими группами или распространяться диффузно. Диаметр их 0,5—4 см. Этиопатогенез язвенных еюноилеитов изучен недостаточно.
Клинически первичные неспецифические язвы тонкой кишки проявляются болями в животе, метеоризмом, диареей и резким похуданием, нарушением общего состояния. Иногда температура может повышаться до 40 °C, развивается отек нижних конечностей. Между обострениями имеются довольно длительные (2—6 мес.) бессимптомные периоды.
Рентгенологически первичные язвы выявляются чаще в подвздошной кишке, преимущественно в ее терминальном
отделе, и в проксимальных петлях тощей кишки в виде «ниши» на рельефе и изменения рельефа слизистой вокруг нее. Эти язвы чаще единичные, но бывают и множественные, округлые или овальные, иногда края язвы подрыты. В ряде случаев рентгенологически язвы, могут не выявляться, а определяется лишь исчезновение складок слизистой. В результате рубцевания в последующем развиваются стриктура кишки и расширение вышележащего участка.
Большими диагностическими возможностями обладают эндоскопия с биопсией. Они позволяют выявить эрозии и язвы слизистой оболочки кишки, атрофию ее и ворсинок.
Некротический энтероколит новорожденных. Встречается у 3—5 % новорожденных, находящихся в отделениях интенсивной терапии, причем '/з из них умирает. Некротический энтероколит развивается при ишемии кишечника, вызванной наружным сдавлением сосудов (странгуляцией) или отчасти недостаточным кровоснабжением органа. У новорожденных с некротическим энтероколитом часто отмечаются недоношенность, интранатальная асфиксия, респираторный дистресс и гипоксия.
Клинические проявления: рвота, вздутие живота, кровь в прямой кишке, сонливость, снижение мышечного тонуса, склонность к апноэ.
Рентгенологические признаки: пневматоз кишечника с расширением петель и истончением кишечной стенки. Причем вначале пневматоз имеет пенообразный вид, в поздних стадиях — пропускающие рентгеновы лучи кольца в пределах кишечной стенки в заднепередней проекции. Далее могут определяться пневмоперитонеум и наличие газа в воротной вене (Marston, 1989).
Флегмона тонкой кишки. Встречается редко. Поражение бывает ограниченным, разлитым и множественным. Процесс может локализоваться в различных
отделах кишечника, но чаще всего — в конечной петле подвздошной кишки.
Воспаление начинается в подслизистом слое, далее распространяется в сторону серозной оболочки и вдоль кишки с одновременным гнойным расплавлением слоев, вовлеченных в процесс. На серозном покрове кишки соответственно участку воспаления откладывается фибрин. В дальнейшем процесс переходит на брыжейку, париетальную брюшину — развивается перитонит.
Различают 3 морфологические стадии заболевания: 1) инфильтрации; 2) абсцедирования; 3) грануляционно-рубцовая. По клиническому течению выделяют острую и хроническую формы.
Острая форма заболевания начинается внезапно, и на первый план выступают общие токсические явления: тяжелое состояние, головная боль, высокая температура (до 38—40 °C), иногда ознобы и понос, в крови высокий лейкоцитоз (до 15—30 • 109/л) со сдвигом лейкоцитарной формулы влево. При пальпации живот мягкий, напряжение брюшного пресса либо отсутствует, либо выражено незначительно. Симптомов, характерных для флегмоны кишки, не описано. Иногда удается пальпировать смещаемый, болезненный тяж тесто-ватой консистенции, представляющий собой инфильтрированный участок кишки. Местные проявления могут напоминать острый аппендицит, непроходимость или инвагинацию кишечника и т. д. В ряде случаев клиническая картина постоянно меняется, поэтому бывает трудно не только поставить правильный диагноз, но и решить вопрос о необходимости самой операции. С переходом воспаления на брюшину появляются симптомы перитонита и операцию производят по поводу какого-либо иного предположительного диагноза.
Иначе говоря, при флегмоне кишки отмечается несоответствие между тяжестью общего состояния больного и ме
стными проявлениями заболевания. Этим флегмона тонкой кишки в известной мере напоминает флегмону желудка с той лишь разницей, что при флегмоне желудка боли имеют определенную локализацию — в эпигастральной области, а при флегмоне кишки болезненность перемещается по животу, что зависит как от смещения самой кишки, так и от возникновения выраженной дискинезии кишки выше места ее воспаления. Кроме того, при флегмоне желудка всегда бывает рвота, в то время как при флегмоне кишки — чаще поносы. То и другое — характерные проявления дисфункции этих органов. Обращает на себя внимание следующая закономерность: чем выше (оральнее) локализуется участок воспаления кишки, тем ярче выражена клиническая симптоматика.
Если помнить о клинике флегмоны кишки, то у некоторых больных можно поставить правильный дооперационный диагноз, хотя это и связано с большими трудностями (Крылов и др., 1988). Хроническая форма флегмоны кишки имеет своеобразную клиническую картину. У таких больных явления интоксикации проходят, общее состояние улучшается, температура нормализуется и наступает видимое самоизлечение. Однако процесс на этом не заканчивается. Образовавшийся участок сужения просвета кишки приводит к новым клиническим симптомам. Появляются жалобы на ноющие боли в животе, чувство вздутия, диспептические расстройства и т. п. В результате рубцового сужения просвета постепенно развивается клиническая картина кишечной непроходимости.
Рентгенодиагностика флегмонозного еюнита возможна уже по обзорным рентгенограммам брюшной полости. На снимках в верхней и центральной частях живота слева от средней линии определяются растянутые и наполнен
ные газом петли тощей кишки. Диаметр просвета их меньше, чем при механической непроходимости, контуры неровные и образованы мелкими высокими зубцами. Совершенно отсутствуют перистальтические движения (паралич кишки). На фоне газа видны широкие набухшие складки слизистой. Одновременно могут наблюдаться значительное расширение желудка и 12-перстной кишки и мелкие уровни жидкости в других отделах кишечника. Показательно постоянное наличие газа в толстой кишке, что также позволяет исключить механическую непроходимость. В отличие от мезентериального тромбоза, как правило поражающего последние петли подвздошной кишки, здесь процесс локализуется гораздо выше.
Рентгенологическое исследование с помощью контрастной массы существенно облегчает диагноз. Бариевая взвесь медленно продвигается по пищеварительному каналу. Пораженные петли расширены, имеют зубчатые контуры, не перистальтируют. Налет контрастной массы остается на слизистой в течение суток и более, хотя основная часть бария переходит в толстую кишку. Ценность своевременного распознавания подчеркивается тем обстоятельством, что методом выбора является консервативное лечение (антибиотики и другие препараты).
Поражение подвздошной кишки в общем встречается чаще, особенно у молодых людей, но протекает легче, поскольку воспаление лишь изредка приобретает флегмонозный характер. В случаях, когда воспалительный процесс привел к значительному сужению просвета кишки или захватил илеоцекальный клапан, первым ясным проявлением болезни могут быть симптомы непроходимости.
При рентгенологическом исследовании определяются растянутые петли тонкой кишки, содержащие скопления
газа и уровни жидкости. Такие же изменения могут отмечаться со стороны слепой и восходящей кишок. Без применения контрастной массы диагноз вряд ли возможен. Бариевая взвесь обрисовывает ригидные петли подвздошной кишки, не меняющие своего калибра. Рельеф слизистой представлен плоскими полями, иногда дефектами наполнения и язвами. В более поздней стадии болезни наступает резкое сужение просвета кишки. Пораженные отделы имеют вид узкой заполненной барием трубки с неровными контурами (симптом «струны»). Контрастная масса в течение 10 — 15 ч задерживается в терминальных петлях подвздошной кишки.
Сифилис тонкой кишки. Может наблюдаться во вторичном и третичном периодах болезни. Во вторичном периоде наступают изменения в слизистой оболочке, в третичном в подслизистом слое образуются воспалительные гуммозные инфильтраты. Они могут быть ограниченными и колебаться в размерах от просяного зерна (гуммозные бугорки) до крупного яйца (гуммозные опухоли) или диффузными с поражением участков кишки протяженностью до 5—20 см (гиперпластическая разлитая форма). В области инфильтратов стенка кишки утолщается, а ее просвет суживается. При изъязвлении инфильтратов иногда возникают кровотечение и перфорация. Гуммозные инфильтраты и сифилитические язвы могут склерозироваться с последующим рубцеванием и образованием кольцевидного стеноза кишки (рубцовая форма).
Диагноз сифилиса вероятен или достоверен, если рентгенологическим признакам сопутствуют явления парасифилиса, положительная реакция Вассермана, а также эффективность специфического лечения.
Туберкулез тонкой кишки. Встречается в виде изолированного поражения или как осложнение туберкулеза
легких у 12 % больных. Туберкулез тонкой кишки бывает как первичным, так и вторичным. Непосредственная причина его развития — внедрение микобактерий туберкулеза в слизистую оболочку кишечника.
Первичный туберкулез, который встречается крайне редко, возникает на месте первичного внедрения в кишку туберкулезных микобактерий. Образуется первичный туберкулезный комплекс в брюшной полости (очаг туберкулеза в кишке и регионарный лимфаденит) .
Вторичный туберкулез кишечника развивается в основном в результате гематогенного распространения туберкулезной инфекции из легких. Но для формирования специфического процесса в кишечнике необходимы благоприятные условия. Их создают неспецифические болезни кишечника, на фоне хронической туберкулезной интоксикации снижающие местную и общую сопротивляемость организма.
По мнению А. Я. Губергрица и Ю. В. Линевского (1975), специфические изменения в стенке кишки сводятся к экссудативно-инфильтративным и пролиферативным процессам. Если развивается первый процесс, вслед за отеком и полиморфно-клеточной инфильтрацией всех слоев кишечной стенки в подслизистом слое кишки, преимущественно в солитарных фолликулах и пейеровых бляшках, из эпителиоидных и гигантских клеток формируются многочисленные бессосудистые туберкулезные бугорки величиной с горошину. В дальнейшем они постепенно, в основном когда преобладают экссудативные процессы, распадаются и образуются небольшие, сравнительно неглубокие, неправильной формы язвы с подрытыми и валообразно приподнятыми краями. Язвы склонны сливаться и образовывать более крупные. Чаще они локализуются вдоль лимфатических сосудов
кишечной стенки и поэтому имеют поперечное или кольцевидное расположение. При рубцевании язв просвет кишки может стенозироваться. У некоторых больных изъязвляются глубокие слои кишечной стенки вплоть до серозной оболочки, кишка перфорируется и развивается перитонит. По литературным данным, перфорация возникает у 3,9 % больных туберкулезом кишечника.
Если в кишке преобладают продуктивные процессы, образуется плотная опухолевидная масса (туберкулема), которая нередко закрывает просвет кишки. В некоторых случаях формируются спайки и сращения между пораженными и соседними с ними кишечными петлями и другими близлежащими органами брюшной полости.
Туберкулезный процесс чаще поражает илеоцекальный угол, несколько реже — тощую кишку, восходящий отдел толстой кишки. На долю туберкулеза 12-перстной кишки приходится около 2—3 % случаев туберкулеза кишечника (Белоусов, 1978, 1984; Vaidya, Sodni, 1978; Bhatia et al., 1985).
Основными формами туберкулеза кишечника являются: язвенная, гипертрофическая или опухолевидная, руб-цово-стенозирующая и сочетанная. Для первичного туберкулеза кишечника характерна опухолевидная форма, для вторичного — язвенная. Как правило, в патологический процесс вовлекаются регионарные лимфатические узлы, которые образуют опухолевидные конгломераты. Гипертрофическую форму диагностировали у 85,3 % больных туберкулезом кишечника, язвенно-гипертрофическую — у 14,7 %.
Клинически течение болезни не всегда отражает тяжесть анатомических изменений. Это зависит от состояния итрамурального нервного аппарата кишки и ЦНС. Вначале болезнь протекает бессимптомно, маскируясь признаками поражения процессом других
органов, в первую очередь легких. Симптомы местного поражения во многом зависят от морфологической формы туберкулеза, локализации очага в кишечнике и стадии болезни. Значительное место в клинической картине занимают проявления функциональных нарушений: понос, запор, вздутие живота, распирание, урчание, обилие газов (Белоусов, 1978, 1984). Наряду с ними отмечаются симптомы туберкулезной интоксикации организма: общая слабость, недомогание, утомляемость, повышение температуры тела вечером, похудание. Для туберкулеза кишечника, как и для туберкулеза легких, характерны смена периодов обострения процесса периодами затихания, повышения температуры тела от малой субфебрильной до высокой фебрильной, причем повышение температуры совпадает с усилением диспептических явлений и похуданием.
Обычно отчетливы клинические симптомы осложненного туберкулеза кишечника: схваткообразные боли в животе, метеоризм, поносы или чередование поносов и запоров, явления частичной кишечной непроходимости. После прободения стенки кишки развивается картина «острого живота»: возникают резкие, иногда «кинжальные» боли в животе, вначале локализованные в месте прободения, затем разлитые по всему животу. Реакция на туберкулин резко положительная. СОЗ повышена. В крови снижается содержание гемоглобина и обнаруживаются другие признаки анемии. При пальпации живота иногда определяется опухолевидное образование, подвижность которого ограничена, или уплотненный болезненный тяж, нередко меняющий свою консистенцию.
По данным рентгенологических исследований кишечника, которые проводят пероральным и клизменным путем, не только уточняются результаты других исследований, но и выявляются как
функциональные, так и морфологические признаки болезни, лучше всего — по данным релаксационной энтерографии.
Рентгенологические признаки туберкулеза кишечника зависят от формы и локализации процесса. G. Black, Е. Carsky (1978); М. Vaidya, I. Sodni (1978); S. К. Gupta et al. (1988) и другие исследователи, а также мы (1980, 1985) установили: стриктуры, чаще одиночные и реже множественные, что приводит к дилатации проксимального отдела кишки и патологическим изменениям рельефа вплоть до его полной сглаженности; изъязвления, которые как правило, сочетаются со стриктурами; внутренние свищи, в том числе между 12-перстной и толстой кишкой; узлообразные утолщения слизистой оболочки при наличии интестинальных лимфангиоэктазий и что пролиферативный туберкулез 12-перстной кишки проявляется расширением и выпрямлением складок слизистой оболочки. В ложбинках между складками скапливается много контрастной взвеси. Стенка кишки утолщена. Эти изменения четко отграниченные, локальные. У больных деструктивным туберкулезом обнаруживаются повреждения складок слизистой оболочки, утолщение стенки кишки, просвет которой бывает сужен. Контуры кишки неровные, кое-где зубчатые, стенка кишки местами ригидная. Двигательная функция кишки нарушена. Туберкулезные язвы часто неправильной формы, неровные, зазубренные, с подрытыми краями, у них нет воспалительного валика. В луковице 12-перстной кишки встречаются множественные мелкие или одиночные гигантские плоские язвы. Последние обнаружить легко не всегда.
Наиболее рано в тощей и подвздошной кишках на рельефе слизистой, обычно между складками выявляются гипертрофированные солитарные фолликулы
и пейеровы бляшки в виде зернисто-нодулярных образований до 2—3 мм в диаметре. Позже на рельефе слизистой оболочки тонкой кишки возникают резидуальные хлопьевидные контрастные пятна, свидетельствующие об изъязвлении слизистой. Множественные изъязвления придают своеобразную мрамор-ность рельефу тонкой кишки. В зонах язв нередки спазмы кишки. После обызвествления туберкулезных бугорков в стенке кишки видны кальцификаты с четкими контурами (Губергриц, Линев-ский, 1975; Михайлов, 1980, 1985). Иногда наблюдаются «вздыбленность», разрозненность, развернутость пораженных петель кишки, по-видимому из-за ригидности кишечной стенки и сопутствующего лимфаденита. При этом определяются болезненные пустоты между кишечным петлями (симптом «лысины»). Выявляются признаки дистонии и дискинезии кишки. Б. А. Шли-мович и др. (1977), проводя больным релаксационную энтерографию, определяли признаки илеостаза и последующей гипермобильности кишки, симптом парадоксального спазма.
У больных гиперпластическим туберкулезом в результате образования дефектов наполнения в местах поражения тонкой кишки отмечаются сужения ее просвета, особенно терминального отдела подвздошной кишки. Петля кишки выше сужения дилатирована, содержит газ. Ее перистальтика вначале нередко усилена, а при далеко зашедшем процессе ослаблена. Вследствие утолщения и инфильтрации илеоцекального клапана появляется симптом полулуния. Илеоцекальный угол изменен: слепая кишка уменьшена и деформирована в ее слепом конце, а в проксимальном отделе бывает расширена. Кишка стенозируется и в результате рубцевания язв. Петли тонкой кишки с множественными язвами неравномерно суживаются и приобретают четкообразный
вид, болезненны при пальпации, ограничены в подвижности, часто спаяны и нередко напоминают гармошку (Линев-ский, Павлова, 1974; Губергриц, Линев-ский, 1975 и др.).
Таким образом, диагноз туберкулеза тонкой кишки нужно обосновывать данными клинических проявлений и лабораторных исследований, в том числе повышенной туберкулиновой чувствительностью, а также результатами эндоскопии, рентгенологического исследования и аспирационной биопсии.
Специфическое поражение лимфатических узлов брыжейки — туберкулезный мезаденит, возникает чаще всего в связи с лимфогенным распространением туберкулезных бактерий из внутригруд-ных лимфатических узлов. Регионарные лимфатические узлы поражаются и вследствие алиментарного заражения. Туберкулезный мезаденит нередко осложняет туберкулез кишечника. При этом, как правило, в воспалительный процесс вовлекаются соседние участки брюшины, создавая многообразные клинические синдромы болезни.
Различают гиперпластическую, фиброзную и фиброзно-казеозную формы мезаденитов.
Клинические проявления: увеличенные брыжеечные узлы пальпируют не часто по причине напряжения стенки живота и метеоризма. После очищения кишечника от каловых масс и отхождения газов в околопупочной области по линии прикрепления брыжейки (между L п слева и L iv справа) можно прощупать бугристые малоподвижные образования без четких контуров, представляющие конгломерат лимфатических узлов и петель тонкой кишки. Реже лимфоузлы пальпаторно обнаруживают в правой подвздошной области.
Рентгенологические признаки: определяются беспорядочное расположение петель тонкой кишки, изменение ее структуры, стойкий илеоспазм или ин-
фильтративно-язвенные изменения в илеоцекальном отделе кишечника. Длительный казеозный процесс на обзорной рентгенограмме проявляется кальцина-тами в лимфатических узлах брюшной полости, чаще справа, на уровне L ur iv или в правой подвздошной области (Крылова, Клочкова, 1975).
Болезнь Крона тонкой кишки. Впервые описана в 1932 г. как своеобразный
135. Туберкулезное поражение терминального отдела подвздошной и слепой кишок:
а — «вздыбленность» и развернутость подвздошной кишки; б, в — сужение просвета терминального отдела подвздошной кишки, слепая кишка уменьшена и деформирована.
гранулематозный терминальный илеит. В дальнейшем выяснилось, что этот процесс может поражать весь ЖКТ людей любого возраста и пола. Заболеваемость населения стран Европы и США— 2—6 случаев на 100 000 человек (Ма1-chow, 1979).
Болезнь Крона заключается в развитии неспецифического гранулематозного процесса с образованием участков
некроза и изъязвлений на поверхности слизистой оболочки и абсцессами в глубине кишки. В результате формируются внутренние и наружные свищи, а при длительном течении процесса рубцуется и стенозируется пораженный сегмент кишки. Выше поражения сегмент кишки суживается, дилатируется. Характерны увеличение регионарных лимфатических узлов, обособленность процесса в каком-то одном сегменте тонкой кишки с четкой границей между пораженным и непораженными сегментами. Иногда в процесс одновременно вовлекаются различные отделы ЖКТ, в котором чередуются пораженные и здоровые петли кишечника. Поражение протяженностью менее 30 см следует считать локальным, а более 30 см — распространенным.
12-перстная кишка поражается у 0,8—2 % больных болезнью Крона. Наиболее часто процесс локализуется в ее проксимальном отделе. Тощая и подвздошная кишки вовлекаются в процесс у 88 % больных, причем подвздошная кишка — у 76,2 %. В терминальном отделе подвздошной кишки процесс локализуется менее чем у 1 /з больных.
В клинической картине болезни Крона различают 3 периода: 1) начальных проявлений; 2) выраженных клинических симптомов; 3) осложнений. Если поражена 12-перстная кишка, возможны боли в эпигастральной области, тошнота, рвота, похудание, симптомы высокой кишечной непроходимости, дуоденальное кровотечение. При типичной локализации процесса в подвздошной кишке у больных определяются болевой и диспептический синдромы. Часты расстройства стула, прежде всего понос (в 85 % случаев). Как правило, обнаруживаются общие симптомы: лихорадка (у 25—50 % больных), похудание (у 79 %), астения (у 85 %), кишечные кровотечения, анемия, лейкоцитоз, повышенные СОЭ и свертываемость кро
ви, гиперпротеинемия, диспротеинемия, уменьшение количества микроэлементов в крови. Иногда определяется опухолевидное образование. Нередки вне-кишечные аллергические проявления: неспецифические ревматоидные артриты, кератиты, изъязвления роговицы, ириты, иридоциклиты, зписклериты, гнойные и гранулематозные процессы в коже — экзематозные, пиодермические, фурункулезные, эритематозные.
Однако более достоверно о болезни Крона свидетельствуют результаты эндоскопического исследования, гистологического анализа биопсийного материла и рентгенологического исследования. Диагностическая эффективность последнего равна 90 %.
Для диагностики целесообразно провести различные рентгенологические исследования, в том числе зондирование, двойное контрастирование тонкой кишки. Весьма ценны, особенно для дифференциации органических сужений и локальных спазмов, данные гипотонической знтерографии. Рекомендуется исследовать тонкую кишку после введения через дуоденальный зонд мик-ропака, который хорошо контрастирует слизистую оболочку, чтобы получить информацию о небольших изменениях слизистой оболочки кишки. В итоге общепринятых рентгенологических исследований можно выявить только грубые изменения кишки. После энтероклизмы получают более подробную информацию о болезни и обнаруживают поверхностные язвы и слабый отек слизистой оболочки, но нельзя установить распространенность патологического процесса.
К ранним рентгенологическим признакам относятся отек слизистой оболочки и подслизистого слоя кишки, поверхностные язвы различных типов, так называемые афтозные язвы — овоидные дефекты слизистой оболочки размером 0,5 —2,5 см. Эрозии возникают на по
верхности гипертрофированного лимфатического фолликула, окружает эрозию выраженный отек стенки кишки. Проявляется это симптомом «мишени», или «линзы».
При прогрессировании болезни язвы укрупняются, развиваются фиброз, стриктуры кишечника, утолщаются, укорачиваются и становятся ригидными стенки кишки. Изменяется рельеф слизистой оболочки, на котором складки превращаются в игольчатые или он напоминает булыжную мостовую, образуются псевдодивертикулы, свищи, вда-вления по контуру кишки увеличенными лимфоузлами.
Изъязвления, щелевидные язвы и псевдополипы создают неровность контуров кишки. Складки слизистой оболочки утолщаются (шире 3 мм в поперечнике). Сужение просвета кишки в виде «струны» вначале обусловлено отеком подслизистого слоя и спазмом кишки и не всегда определяется. Если развивается фиброз и ригидный стеноз, симптом «струны» или «шнура» начинает выявляться постоянно. Поражается кишка частично, сегментарно или тотально, причем чаще ассиметрично. Участки поражения четко ограничены. Кишка, суженная в нескольких местах, похожа на «низку из сосисок» (Линев-ский, Павлова, 1974; Губергриц, Липев-ский, 1975; Holan, Gourtsoyiannia, 1980; Holan, Piris, 1980).
Кишечные петли теряют нормальную спиралевидную форму, выпрямляются и разворачиваются, «вздыбливаются», инфильтрируется и утолщается брыжейка и увеличиваются мезентериальные лимфоузлы. Сегменты кишки выше сужения расширяются, нередко в них скапливаются содержимое кишки и газы, которые образуют чаши Клойбера.
Некоторые исследователи уделяют внимание результатам ангиографии. По ним легче определять степени поражения кишки и дифференцировать воспа
лительные и злокачественные процессы. Пораженные сегменты кишки гиперва-скуляризируются, в них расширяются прямые сосуды и рано возникает венозный обратный ток. В поздних стадиях болезни в участках рубцового стеноза с уменьшенной васкуляризацией, мелкими артериями и слабо контрастированной кишечной стенкой венозный отток нормальный. По мнению этих исследователей, на ангиограммах выявляются ранние изменения сосудов в сегментах кишки с начальными поражениями. Большинство ангиографических симптомов болезни неспецифичные. Наибольшее диагностическое значение имеет сипмтом «зондирования» — интенсивное контрастирование внутреннего слоя и слабое — наружного слоя кишки, а также параинтестинальные брыжеечные неоваскуляризации. Сосудистые изменения исследователи отмечают в артериальной фазе — у 78 % больных, в капиллярной фазе — у 74 и в венозной — у 90 % больных.
Большими диагностическими возможностями в распознавании болезни Крона обладает КТ. Основные КТ-признаки заболевания: утолщение стенок кишки, воспалительный конгломерат кишечных петель, абсцесс, свищи, инфильтрация брыжейки, мезентериальные лимфаденит и липоматоз. При контрастировании кишечника выявляют сужение его просвета, симптом «мишени», обусловленный отеком слизистой и фиброзом наружных слоев кишечной стенки. С помощью КТ легче обнаруживают изменения стенки кишки и брыжейки, более точно определяют локализацию абсцессов, инфильтрацию брюшной стенки и окружающих органов.
Поражение тонкой кишки при псевдотуберкулезе. Псевдотуберкулез, ранее называвшийся дальневосточной скарлатиноподобной лихорадкой, встречается довольно часто. Во время вспышек заболевают 150—300 человек на 100 000
населения. В настоящее время заболевание регистрируется не только в районах Дальнего Востока, но все чаще и в других регионах страны. Среди различных клинических признаков эпидемического псевдотуберкулеза один из ведущих — поражение кишечника.
Клинические проявления: у всех больных боли в правой подвздошной области, причем они бывают резкими, приступообразными, ноющими и умеренными; рвота (9,5 %), тошнота (77,7 %), расстройство стула (67,1 %), вздутие живота (49,7 %), болезненность при пальпации правой подвздошной области (100 %), симптомы раздражения брюшины (13,7 %).
Выделяют 2 формы поражения тонкой кишки: 1) распространенный (диффузный) энтерит (13,8 %), при котором патологические изменения выявляются как в тощей, так и в подвздошной кишке на всем протяжении; 2) сегментарное поражение терминального отдела подвздошной кишки — терминальный илеит (68,8 %).
Патогенез поражения всей тонкой кишки можно объяснить тем, что инвазия возбудителя псевдотуберкулеза вызывает воспалительно - некротический процесс в слизистой оболочке кишки на всем протяжении. Процесс протекает в виде эрозивно-некротического энтерита с образованием гранулем, с их абсцедированием и распадом.
Клиническая картина диффузного энтерита проявляется болями в околопупочной области, резкими, схваткообразными расстройствами стула в виде поносов, вздутием живота, урчанием в слепой кишке. Эта картина развивается на 3—6-е сутки заболевания на фоне общих симптомов псевдотуберкулезной инфекции и бывает кратковременной.
При рентгенологическом исследова
нии в тонкой кишке наблюдаются нарушения моторно-эвакуаторной функции в виде дискинезий, чаще развивающихся на фоне гипо- или гипертонии петель или сочетания их. Просвет тонкой кишки в отдельных местах спазмирован, в подвздошной кишке чаще расширен; в просвете кишки много газа и жидкости, вследствие этого рельеф нечеткий, смазанный. Нередко наблюдается симптом «снежной бури».
Терминальный отдел подвздошной кишки — место наиболее выраженного патологического процесса. В лимфатических мезентериальных узлах, солитарных фолликулах, пейеровых бляшках развивается лимфоретикулярная гиперплазия с образованием гранулем, подвергающихся центральному некрозу.
Клинические патологические изменения в илеоцекальном отделе кишечника проявляются следующими симптомами: болями в правой подвздошной области (у 100 % больных), расстройством стула (67,1), вздутием живота (49,7), урчанием в слепой кишке (58,3 %). У 7,8 % больных отмечалось увеличение мезентериальных лимфатических узлов, иногда до значительных размеров.
При рентгенологическом исследовании обнаруживаются патологические изменения илеоцекального отдела кишечника'. сужение терминального отдела подвздошной кишки протяженностью 5—15 см и более, престенотическое расширение проксимальных петель ее, дефекты наполнения на рельефе слизистой оболочки, зубчатость и неровность контуров кишки, деформация купола слепой кишки (Антоненко, 1990).
Степень выраженности выявленных рентгенологических симптомов соответствует более тяжелому течению инфекционного процесса и более яркой клинической картине заболевания.
Глава 25. ОПУХОЛЕВЫЕ ЗАБОЛЕВАНИЯ
Опухоли тонкой кишки занимают видное место среди других ее заболеваний и встречаются у мужчин и женщин с одинаковой частотой в любом возрасте. По данным В. И. Якушина (1972), новообразования тонкой кишки составляют 1,36 % опухолей пищеварительной системы; 1,53 — новообразований ЖКТ; 6,51 — опухолей кишечника и 14 % опухолей ободочной кишки. Причем на злокачественные опухоли тонкой кишки приходится 70,1 %, доброкачественные — 29,9 %.
Опухоли тонкой кишки имеют ряд особенностей, поэтому их трудно дифференцировать от других опухолей пищеварительного тракта. Наболее часто при опухолях тонкой кишки наблюдаются гастроинтестинальные кровотечения, локализацию которых в большинстве случаев трудно установить из-за невозможности проведения эндоскопического исследования этого отдела кишечника. В результате исследования кишечника с барием и артериография часто не позволяют выявить источник кровотечения, если эти исследования не проводятся в активную фазу кровотечения. Развитие синдрома кишечной непроходимости указывает на необходимость экстренного хирургического вмешательства, но не является диагностическим признаком этого заболевания. Гистологически эти опухоли отличаются от всех других опухолей пищеварительного тракта, поскольку часто встречаются опухоли мышечного типа или лимфосаркома, в то время как в других отделах пищеварительного тракта отмечаются чаще всего опухоли эпителиального типа.
Среди доброкачественных опухолей наиболее распространены аденоматозные полипы, невриномы, липомы, лейомиомы, тератомы. Злокачественные опу
холи бывают как эпителиальной (рак), так и мезенхимальной природы (саркомы). Причем саркомы нередко сочетают в себе фиброзные, мышечные, лимфоидные и другие тканевые элементы.
В диагностике опухолей тонкой кишки большую помощь оказывает рентгенологический метод исследования с помощью контрастной бариевой взвеси. •Этот метод позволяет выявить опухоль, установить уровень и размеры пораженного отрезка кишки и характер имеющихся в ней изменений.
Доброкачественные опухоли
Доброкачественные опухоли тонкой кишки встречаются значительно реже, чем злокачественные. В отличие от последних доброкачественные опухоли, как считает В. И. Якушин (1979), чаще наблюдаются у женщин в возрасте от 20 до 60 лет, а по К. Т. Овнатаняну и А. М. Тарнопольскому (1966) — чаще в возрасте 40—60 лет. ’ '
В. И. Якушин (1972), Л. А. Атанасян, И. Ю. Юдин (1979), J. Gronniger с соавт. (1977) считают, что доброкачественные опухоли чаще локализуются в подвздошной кишке. По наблюдениям Ю. Н. Соколова и В. Б. Антонович (1981, 1987), доброкачественные опухоли локализовались равномерно с одинаковой частотой по ходу тонкой кишки и преобладания опухоли какой-либо одной гистологической структуры не отмечалось.
Доброкачественные опухоли чаще бывают единичными, реже — множественными, могут расти в просвет кишки или кнаружи. Внутрь просвета кишки в основном растут опухоли, исходящие из слизистой оболочки, подслизистого и
внутреннего (циркулярного) мышечного слоев, а кнаружи — возникающие из наружного мышечного и подсерозного слоев.’
Для доброкачественных опухолей характерен рост в виде узла. Они могут иметь широкое основание или располагаться на ножке, что более свойственно опухолям, растущим в просвет кишки. Наружные опухоли чаще достигают больших размеров, чем внутренние. В процессе роста внутренние опухоли могут вести к инвагинации, а наружные — к сдавлению или завороту пораженной петли. Внутренние опухоли могут изъязвляться и давать кровотечения. Большинство доброкачественных опухолей 12-перстной, тощей и подвздошной кишок обладает способностью злокачественно перерождаться (от 10 до 50 % случаев).
Полипы. Исходят в основном из железистых элементов слизистой оболочки, но могут также возникать (Якушин, 1972) из других тканей кишечной стенки (подслизистой — фиброзные полипы, сосудов — ангиоматозные и др.). Полипы могут быть одиночными и множественными (от одного до нескольких десятков, а иногда и сотен), могут располагаться группами или же быть разбросанными по всей длине кишки. Нередко полипоз тонкой кишки сочетается с полипами желудка и толстой кишки. Наибольшую опасность для организма представляют аденоматозные полипы из-за злокачественной трансформации. Для аденом фатерова соска злокачественное перерождение при опухолях диаметром менее 1 см выявлено в 14 %, менее 2 см — в 45, 2 — 3 см — в 54, более 3 см — в 33 %. Для аденом 12-перстной кишки частота развития рака соответственно была 0; 20; 20 и 33 %, для тощей и подвздошной кишок — 0; 0; 33 и 66 % (Sellner, 1987). Поэтому при решении вопроса об объеме операции полипы следует рассматри
вать как потенциально злокачественное образование.
Лейомиомы. Исходят из наружного или внутреннего слоя тонкой кишки и локализуются в основном в подвздошной кишке. Вначале опухоль развивается интрамурально в виде небольшого узелка и рост ее в этой стадии может прекратиться. Но чаще продолжает расти в просвет кишки или же эндофитно. Наружные опухоли называют субсерозными, внутренние — субмукозными. Последние редко достигают больших размеров, так как, достигнув определенной величины, они вызывают обтурацию просвета кишки или инвагинацию. Часто эти опухоли изъязвляются, давая кишечное кровотечение. Субмукозные лейомиомы нередко имеют длинную ножку, могут вызывать непроходимость кишечника. При отрыве ножки наступает самостоятельное излечение. Субсерозные миомы растут медленно, иногда достигают больших размеров. При центральном некрозе опухоли может образоваться полость, сообщающаяся с просветом кишки. Около 15—20 % лейомиом могут перерождаться в злокачественные опухоли.
Фибромы. Возникают в подслизистом или субсерозном слое кишки из фибробластов и коллагеновой ткани и наиболее часто локализуются в начальном и конечном отделах кишки. Подслизистые фибромы растут обычно в просвет кишки, субсерозные — в свободную брюшную полость. Последние встречаются реже, чем подслизистые. Фибромы растут медленно, хорошо отграничены от окружающей ткани и редко достигают больших размеров. Иногда наблюдаются множественные фибромы топкой кишки с некрозом опухолевых узлов и образованием кишечных свищей. Встречаются и смешанные опухоли — фибромиомы, фиб-ромиксомы.
a
136. Изъязвленная липома луковицы 12-перстной кишки (варианты а, б).
Липомы. Растут в виде дольчатого узла различной величины, окруженного хорошо выраженной капсулой, исходят из подслизистого и подсерозного слоев. Они чаще бывают одиночными, встречаются преимущественно у тучных людей и могут сочетаться с липомами в других местах организма. Очень редко бывает липоматоз кишки.
Невриномы. Одна из наиболее редко встречающихся доброкачественных опухолей. Они возникают из нервных волокон межмышечного и подслизистого сплетений. Могут быть субсерозными, подслизистыми и интрамуральными. Нейрогенные опухоли могут вызывать стенозирование, инвагинацию, изъязвление с кровотечением, прорастание в свободную брюшную полость с последующим распадом, злокачественное перерождение в 10 % случаев (Якушин, 1972).
Гемангиомы (сосудистые опухоли). Наблюдаются редко и часто являются секционной находкой. Различают капиллярные, кавернозные, или пещеристые, и ветвистые ангиомы. Геман
гиомы растут из подслизистого слоя преимущественно в просвет кишки, имеют небольшие размеры, часто бывают множественными, изъязвляются и служат причиной обильных кишечных кровотечений. Некоторые авторы выделяют еще ангиоматозные полипы.
Кисты-энтерокистомы (удвоения). Ки сто видные образования, стенка которых по своему строению напоминает стенку тонкой кишки, внутренняя поверхность ее выстлана слизистой оболочкой. Эти кисты образуются из участков ткани, отшнуровавшейся от первичной кишечной трубки в эмбриональном периоде.
Гетеротопия поджелудочной железы. Локализуется чаще всего в 12-перст-ной и тощей кишке. Как все гетеротопные образования, так и аберрантная ПЖ склонна к злокачественному перерождению. В тканях дистопированной ПЖ может развиваться воспаление типа панкреатита. Помимо этого, такая железа может быть причиной инвагинации, может давать изъязвление слизистой
оболочки кишки под влиянием выделяемого секрета.
Воспалительные опухоли. В. И. Якушин (1972) отмечает, что в тонкой кишке могут наблюдаться «воспалительные опухоли». Природа этих образований неясна: в отдельных случаях они возникают после внедрения в стенку кишки каких-либо инфицированных тел. По внешнему виду «воспалительные опухоли» напоминают обычные опухоли, нередко вдаются в просвет тонкой кишки в виде полиповидных образований, вызывая инвагинацию. Только гистологическое исследование указывает, что это не истинное ново-оброзование, а опухоль воспалительной природы.
Эндометриоидная гетеротопия. Развивается при занесении во время операции на внутренних женских половых органах в кишку кусочков эндометрия, который приживляется в ней (Овна-танян, Тарнопольский, 1966; Губергриц, Линевский, 1975).
Клиническая картина доброкачественных опухолей тонкой кишки разнообразна и во многом зависит от характера роста опухоли, локализации, степени стенозирования кишки, наличия спаек, сращений и других проявлений. Ранняя диагностика доброкачественных опухолей затруднена тем, что новообразования тонкой кишки долго остаются бессимптомными, имеют длительный скрытый период. Продолжительность скрытого периода колеблется у взрослого от 3 — 10 и у детей от 2—6 мес. до нескольких лет. Нередко доброкачественные опухоли впервые обнаруживают только на операции или на аутопсии.
По клиническому течению доброкачественные опухоли могут протекать без осложнений и с осложнениями. Симптомы неосложненных доброкачественных опухолей непостоянные, скудные и могут наблюдаться при многих других заболеваниях брюшной полости. Боль
ные в этом периоде могут жаловаться на отрыжку, тошноту и даже рвоту, причем эти симптомы более выражены при высоком расположении опухоли. Если опухоль локализуется в средних или конечных отделах тонкой кишки, часты метеоризм, поносы или запоры, слабость, анемия, мелена. Несколько позднее появляются разнообразные по характеру интенсивные боли.
Локализация болей зависит от расположения опухоли. Если опухоль находится в начальном отделе тощей кишки, то боли в основном будут локализоваться в эпигастральной области или в левом подреберье. Боли в правой подвздошной области типичны для опухолей, локализующихся в терминальных петлях подвздошной кишки, хотя и считается, что для опухолей тонкой кишки наиболее характерны боли в области пупка. В такой период больные наблюдаются и лечатся по поводу хронических гастритов, холециститов, энтероколитов, гипохромных анемий.
Когда опухоль достигает определенного размера и вызывает ту или иную степень изменения кишечного просвета, к общим симптомам присоединяются местные проявления: урчание, «шум плеска», непостоянная пальпация очень подвижной опухоли, которая может периодически «исчезать». Пальпации обычно доступны наружные, достигшие значительных размеров и плотные опухоли (липомы, миомы). Опухоль тощей кишки пальпируется в области пупка или слева от него, а подвздошной кишки — в правой подвздошной области.
Тонкая кишка с опухолью нередко опускается в малый таз, где впервые может обнаруживаться во время пальцевого исследования прямой кишки, а у женщин — при влагалищном исследовании. Это может привести к ошибочному гинекологическому диагнозу.
Осложнения доброкачественных опухолей тонкой кишки клинически про
являются в виде симптомокомплекса хронической механической кишечной непроходимости, развившейся в результате инвагинации, заворота, резкого перегиба кишки. Могут наблюдаться перфорации и кровотечения. Длительность анамнеза может быть от нескольких месяцев до 1,5—2 лет и более. Кишечное кровотечение имеет место в 30 %, иногда оно может быть патогномоничным для доброкачественной опухоли тонкой кишки. В. И. Якушин (1972) считает ценным и достаточно характерным симптомом наличие подвздошной опухоли, не связанной с желудком и толстой кишкой, а также явлений хронической перемежающейся кишечной непроходимости.
Весьма своеобразен синдром Пейтц — Егерса. Это сочетание желудочно-кишечного полипоза, особенно тонкой кишки, со своеобразной меланиновой пигментацией кожи и слизистых оболочек, с желудочно-кишечными кровотечениями и вторичной анемией. Полипы в ЖКТ могут быть единичными или множественными, чаще имеют аденоматозное строение, почти в 20 % случаев они злокачественно перерождаются. Этот синдром часто сочетается с дивертикулами кишечника и опухолями яичников.
При дистопированной ПЖ могут появляться признаки гиперинсулинизма и гипогликемии, могут быть кровотечения, перфорация, явления кишечной непроходимости. Эндометриоидная гетеротопия дает клиническую картину кишечной непроходимости и кишечных кровотечений, которые усиливаются во время менструаций.
Ведущее место в диагностике доброкачественных "опухолей тонкой кишки принадлежит рентгенологическому методу, который позволяет диагностировать опухоли тощей кишки в 85 % случаев, подвздошной — в 67 % (Гольдштейн, 1951). В. И. Якушин (1972)
приводит следующие данные: из 1046 наблюдений опухолей тонкой кишки, опубликованных в отечественной литературе, рентгенологическое исследование произведено в 165 случаях (15,7 %), положительный результат получен в 102 (61,8%). Приведенные данные свидетельствуют о большой диагностической ценности рентгенологического метода. По данным многих иностранных авторов, до 50—80 % случаев опухолевого поражения тонкой кишки можно выявить при рентгенологическом исследовании кишечника. Очень часто к ошибкам в диагностике опухолей тонкой кишки приводят погрешности в обследовании больного. Так, при наличии желудочно-кишечного кровотечения невыясненной этиологии врачи-рентгенологи ограничиваются исследованием пищевода, желудка и толстой кишки. Клиницисты также не вправе говорить и считать, что больному проведено исследование ЖКТ, когда не исследована тонкая кишка, особенно при таких прямых показаниях, как наличие в брюшной полости подвижной опухоли, явление хронической перемежающейся кишечной непроходимости. По мнению ведущих рентгенологов, для рентгенодиагностики опухолей тощей и подвздошной кишок необходимо сначала произвести 2 обзорные бесконтрастные рентгенографии брюшной полости в вертикальном и горизонтальном положении тела больного. Это позволяет оценить распределение газа в петлях тонкой кишки. Прием бариевой взвеси через рот является вторым этапом исследования тонкой кишки. Многочисленные методики, предлагаемые различными авторами, служат предметом выбора, ибо все имеют какие-то преимущества, какие-то недостатки, а единой методики нет.
В. И. Якушин (1972) считал наиболее эффективной для диагностики опухолей методику, разработанную Вейнт
раубом и Вильямсом в 1949 г., с некоторыми изменениями, предложенными в клинической больнице им. С. П. Боткина. Можно применять и другие методики ускоренного рентгенологического исследования тонкой кишки. Достаточно информативна методика, предложенная Л. С. Розенштраухом, а также 3-кратная энтерография по А. Н. Михайлову и Е. В. Ильяшевич.
В диагностике опухолей тонкой кишки целесообразно использовать фармакологические препараты. Гипотониче-сокую энтерографию с успехом применяли Л. Д. Линденбратен и Г. И. Вар-новицкий (1967), Д. Е. Кунцевич (1966), Н. А. Рабухина (1971), Ю. В. Линевский и И. С. Павлова (1974), А. Н. Михайлов (1985). В нашей стране и за рубежом вошли в практику также методики чреззондовой энтерографии, релаксационной илеоцекографии. Имеется необходимость и в париетографии, особенно при подозрении на интрамуральные опухоли.
Полипы рентгенологически выявляются в виде единичных или множественных округлых с четкими контурами дефектов наполнения, в области локализации которых стенка кишки эластична. Липомы и фибролипомы дают округлый или овальный дефект наполнения с ровными или волнистыми контурами и тень малой интенсивности. На уровне расположения опухоли кишка расширена. При наличии изъязвления в дефекте наполнения определяется контрастное пятно неправильной формы. Иногда можно обнаружить признак инвагинации (симптом колец). При стенозировании просвета кишки может определяться дилатация проксимальной по отношению к опухоли кишечной петли и чаши Клойбера в центральной части брюшной полости. Если опухоль имеет ножку, то свободный конец дефекта наполнения обладает подвижностью и часто отклоняется по ходу продвиже
ния бариевой взвеси (Линевский, Павлова, 1974). Особенно трудны для диагностики опухоли небольших размеров, которые не суживают просвет кишки.
При лейомиоме рентгенологически обнаруживаются вдавления в стенке кишки без изменения рельефа слизистой. Если же имеется изъязвление лейомиомы, только тогда нарушается структура слизистой оболочки. Гемангиомы и лимфангиомы образуют дольчатые дефекты наполнения с фестончатыми краями. В ряде случаев наблюдаются дополнительные пристеночные тени расширенных сосудистых образований. Обнаружение флеболитов облегчает диагностику сосудистых опухолей.
Карциноидные опухоли. Своеобразное, не часто встречающееся новообразование тонкой кишки. Обладают эндокринными свойствами и занимают пограничное место с злокачественными опухолями. Среди опухолей данной локализации они составляют от 8,3 до 23 %. Опухоль располагается в основном в терминальном отделе подвздошной кишки. Мужчины болеют в 2—3 раза чаще, чем женщины. В ряде случаев наблюдается множественное поражение карциноидом тонкой кишки, а также злокачественное течение заболевания с возникновением отдаленных метастазов.
Опухоль развивается из кишечных аргентаффиноцитов или напоминающих их по структуре клеток. Узлы опухоли залегают в подслизистом слое. Они представляют собой маленькие плотные образования, хорошо отграниченные от окружающих тканей, по размерам редко превышающие 2 см в диаметре. При доброкачественном течении опухоль растет медленно. По мере роста опухоли вокруг нее может развиваться обширный спаечный процесс. Злокачественный карциноид растет более интенсивно, инфильтрируя мышечный слой и серозную оболочку, дает метастазы в брыжеечные регионарные лимфоузлы,
печень, реже в легкие, головной мозг, яичники, кости. Частота метастазирования зависит от величины опухоли. Так, при опухолях меньше 1 см в диаметре метастазирование встречается в 2 %, от 1 до 2 см в диаметре — около 50 и при опухолях более 2 см — около 80 %. Е. С. Рысс (1966) считает, что карциноиды тонкой кишки метастазируют в 65 — 75 % случаев.
Карциноидный синдром характеризуется как приступообразными, так и постоянными симптомами: быстрым изменением окраски верхней половины туловища, лица, шеи и рук от красного до багрово-цианотичного, чувством жара, обильным потоотделением, сердцебиением, приступами удушья, головокружениями, болями в животе, частым жидким стулом (до 20 — 30 раз в сутки), изменениями со стороны клапанного аппарата сердца, снижением артериального и повышением венозного давления. Впрочем, АД может и повышаться (Меньшиков и др., 1972). Как правило, снижается диурез и в крови повышается уровень серотонина, а в моче — продуктов его распада.
Карциноидный синдром наблюдается у 25 % больных, имеющих метастазы, обусловливается гиперпродукцией серотонина и утратой способности инактивировать его печенью. Повышение уровня серотонина в крови вызывает усиление секретной активности желудка. Это ведет к образованию у 30— 40 % больных пептической язвы и желудке или 12-перстной кишке.
Методики рентгенологического исследования применяются те же, что и при диагностике доброкачественных опухолей. Классический признак карциноидов — эксцентричный внутристеночный дефект в контрастированной кишке. Часто встречается перегиб дистального отдела кишки вследствие образования спаек. Наблюдается также ускоренный пассаж бариевой взвеси по
петлям кишечника и обнаруживаются горизонтальные уровни жидкости в нем. Карциноид (Белоусов, 1978, 1984) может привести к стенозам с явлениями непроходимости тонкой кишки.
Часто складки слизистой набухают, мышечная оболочка кишки утолщается. Одновременно возникает фиброз брыжейки. Рентгенологически все это выглядит в виде увеличения толщины стенки кишки и расстояния между ее петлями. Однако возможности рентгенологического метода ограничены в связи с тем, что первичная опухоль очень часто бывает малых размеров и поэтому трудно определима.
Злокачественные опухоли
Первичные злокачественные новообразования тонкой кишки составляют 0,03 — 3,5 % опухолей пищеварительного тракта. Из злокачественных опухолей наиболее часто наблюдаются рак и саркома. Чаще поражаются раком тощая и подвздошная кишки, реже — 12-перстная кишка (Соколов, Антонович, 1981; Антонович, 1987; Liebert, Schramm, 1976). Саркомы встречаются в подавляющем большинстве случаев в начальном отделе тощей и конечном отделе подвздошной кишки (Шпонтак, Розенфельд, 1979; Ekberg, Ekholm, 1980).
Рак 12-перстной кишки. По локализации делится на надсосковый (супра-ампулярный), оклососковый (перипа-пиллярный) и подсосковый (преею-нальный). Чаще встречается околосос-ковый рак (75 %), реже — надсосковый (16 %) и подсосковый (9 %) (Губерг-риц, Линевский, 1975; Атанасян, Юдин, 1979; Михайлов, 1985). Первичный рак 12-перстной кишки, как правило, возникает у мужчин старше 50 лет. Средний возраст больных 59 лет.
По макроскопическому признаку рак 12-перстной кишки бывает экзофитный
и эндофитный. Экзофитный рак растет в просвет кишки, в большинстве случаев имеет вид полипа или разрастаний типа цветной капусты, редко достигает больших размером (в поперечнике не более 2—3 см) и чаще всего располагается в области большого соска 12-перстной кишки. При инфильтративной форме опухоль разрастается диффузно и имеет тенденцию к циркулярному росту, охватывая всю окружность кишки и вызывая сужения ее просвета. Иногда опухоль, при раннем ее некротизировании, может изъязвляться и давать массивные кровотечения.
Среди гистологических форм преобладают аденокарциномы различной степени дифференцировки, редко встречаются солидный рак, скирр, еще реже — коллоидный и полиморфно-клеточный рак. Следует отметить, что рак 12-перстной кишки сравнительно поздно дает метастазы, которые ограничиваются регионарными лимфатическими узлами в области головки поджелудочной железы, ворот печени. Реже происходит метастазирование в малый сальник, средостение, легкие и другие органы. Гематогенные метастазы и генерализация рака по брюшине при раке 12-перстной кишки наблюдаются крайне редко (Атанасян, Юдин, 1979; Nix, Wilson, Dees, 1985).
Опухоль при достижении больших размеров может прорастать в поджелудочную железу, поперечную ободочную кишку, нижнюю полую вену и другие органы. Врачам следует знать, что иногда маленький рак 12-перстной кишки дает большие метастазы в области головки поджелудочной железы, что симулирует первичный рак ее.
Клиническая картина рака 12-перстной кишки зависит от его локализации, характера роста и гистологического строения. Раковая опухоль известное время может ничем себя не проявлять. По мере роста опухоли у больных появ
ляются разли1 ные жалобы. К частым симптомам относятся боль, нередко мучительная, нарастающие тошнота и рвота, снижение аппетита, истощение. Возникают симптомы частичной механической непроходимости кишечника (частая и сильная рвота, дегидратация и др.).
Раньше всего (Атанасян, Юдин, 1979) клинически проявляются опухоли перипапиллярные, располагающиеся в области фатерова соска. Они очень рано приводят к возникновению механической желтухи, сдавливая и сужая просвет фатерова соска и общего желчного протока. По мере роста опухоли могут развиться воспалительные изменения со стороны поджелудочной железы, проявляющиеся симптомами панкреатита вплоть до панкреонекроза с перитонитом.
В надсосковой и подсосковой частях 12-перстной кишки чаще наблюдается скиррозная форма рака, которая постепенно деформирует и суживает просвет кишки и проявляется симптомами высокой хронической механической непроходимости кишечника, развивающейся постепенно. Появляются чувство тяжести и давления в подложечной области, тошнота, рвота, расширение желудка, шум плеска выше пупка и другие признаки. Рак 12-перстной кишки проявляется и общими признаками: развитием малокровия, похуданием, потерей аппетита, понижением трудоспособности. Метастазирование опухоли вызывает соответствующие дополнительные «органные» симптомы, асцит (Василенко, Гребенев, 1981).
Известно, что клинические проявления зависят и от размера опухоли. Так, при наличии симптома рвоты новообразование, как правило, занимает 82,4± ±8,7 % просвета 12-перстной кишки, при его отсутствии — 60,5± 11,2 %. Время от момента появления жалоб до установления правильного диагно-
137. Рак 12-перстной кишки:
а — эндофитный; б — экзофитный.
за в среднем равно 8 мес. (Nix et al., 1986).
Диагностика первичного рака 12-перстной кишки трудна. Пальпаторно не всегда удается прощупать имеющуюся опухоль, тем более при эндофитной форме рака. С внедрением в практику дуоденофиброскопии и современных усовершенствованных методик и приемов рентгенологического исследования стало возможным распознавать опухоль даже в ранние стадии ее развития. Эффективность различных методов неодинакова. Диагностическая точность дуоденоскопии равняется 80 %, ретроградной эндоскопической холеци-стопанкреатографии — 94, рентгенологического исследования — 67 %, гипо
тонической дуоденографии — 63 % (Nix et al., 1985).
Рентгенодиагностика рака 12-перст-ной кишки складывается из различных функциональных нарушений и морфологических изменений. При обычном рентгенологическом исследовании обнаруживают ослабление или отсутствие перистальтики в зоне поражения, замедление продвижения контрастной массы, маятникообразные и антипери-стальтические движения, усиление перистальтики выше места поражения, расширение желуда, недостаточность функции привратника, увеличение луковицы и другие симптомы. Для выявления морфологических признаков опухоли ведущее значение, по нашему
мнению, имеет релаксационная дуоденография.
При рентгенологическом исследовании обычно выявляют циркулярное или спиралевидное сужение 12-перст-ной кишки, расположенное у 80 % больных в нисходящей части или в зоне перехода нисходящей части в нижний горизонтальный отдел 12-перстной кишки, чаще по внутренней стенке. Типичные признаки — это развитие стеноза кишки, изъязвления и вовлечение в патологический процесс большого сосочка 12-перстной кишки.
В случае экзофитно растущей опухоли рентгенологически выявляется дефект наполнения с неровными контурами, при эндофитной форме рака — циркулярный дефект наполнения с подрытыми неровными контурами, ограниченно суживающий просвет 12-перстной кишки. Протяженность суженного участка может быть 2—4 см и более. Рельеф слизистой в месте локализации рака деформированный и ригидный, круговые складки слизистой разрушены. В случае распада опухоли в зоне дефекта наполнения выявляется депо контрастного вещества с изъеденными контурами.
Рак большого сосочка 12-перстной кишки образует полипообразный дефект наполнения на задней или заднемедиальной стенке нисходящего отдела кишки. Форма дефекта наполнения округлая, иногда с неровными контурами при диаметре 1—2 см и неровными зазубренными при диаметре опухоли более 2—3 см. На ранних стадиях развития рака этого соска один из краев округлого отграниченного дефекта наполнения (чаще дистальный) имеет острый выступ, который впоследствии при увеличении опухоли исчезает.
Рак тощей и подвздошной кишок. По данным В. И. Якушина (1972), составляет почти 15,9 % всех опухолевых и 22,6 % злокачественных новообразо
ваний этих кишок. К. Т. Овнатанян и А. М. Тарнопольский (1966), Л. А. Атанасян и И. Ю. Юдин (1979) считают, что рак тощей и подвздошной кишок встречается в 0,5—3 % случаев всех злокачественных опухолей ЖКТ. Чаще заболевают мужчины 40—60 лет. У людей молодого возраста первичный рак исключительно редок. Среди лиц старше 50 лет заметно увеличивается количество заболеваний. В подавляющем большинстве случаев опухоль локализуется в проксимальных петлях тощей кишки, затем по частоте поражения следуют дистальные отделы подвздошной кишки и средний отдел тонкой кишки.
Выделяют в основном 2 формы рака тонкой кишки: 1) скиррозную, при которой происходит кольцевидное плотное сужение стенок кишки; 2) диффузную, инфильтрирующую. В. И. Якушин (1972) считает целесообразным выделять и полиповидную форму рака, так как нередко аденоматозные полипы переходят в рак. Рак тонкой кишки имеет цилиндрическое строение. Это преимущественно аденокарцинома, реже — солидный и слизистый рак.
Метастазирование карциномы тонкой кишки наступает относительно поздно. Метастазы прежде всего распространяются в регионарные лимфоузлы брыжейки, достигают превертебраль-ных и парааортальных лимфоузлов; отдаленные метастазы обнаруживаются в печени, яичниках, легких, костях. Порой метастазы по размерам во много раз превосходят первичный очаг.
Клиническая картина складывается из местных (кишечных) симптомов и признаков нарушения общего состояния больного. Местные симптомы заболевания в большинстве случаев связаны с развитием частичной интермиттирующей кишечной непроходимости, постепенно прогрессирующей вплоть до полной кишечной непроходимости. При
опухолях, расположенных в начальных отделах тонкой кишки, превалируют незначительные по интенсивности боли в эпигастральной области живота, тошнота, рвота. Определяются вздутие в подложечной области, шум плеска в желудке.
В случае локализации опухоли в средних и конечных петлях тонкой кишки больных беспокоят чаще интенсивные схваткообразные боли в подвздошных областях или в низу живота с задержкой стула и газов, реже тошнота и рвота. Отмечается вздутие живота, нередко локальное, с видимой кишечной перистальтикой в этой зоне, где при пальпации может определяться плеск. Иногда на расстоянии или лучше при аускультации на высоте усиленной перистальтики раздутой кишечной петли слышно урчание, после которого ее вздутие уменьшается. Чаще встречаются скрытые кровотечения, реже — выраженные (Gronniger, Georgi, 1977).
При клиническом обследовании у 25 % больных удается пальпировать опухоль в виде плотного, малоболезненного или безболезненного, чаще подвижного образования неправильной формы. Иногда раковая опухоль почти неподвижна, болезненна.
Признаки нарушения общего состояния (общая слабость, недомогание, исхудание) возникают тем раньше, чем выше расположена опухоль. Часто определяются выраженная анемия, увеличение СОЭ, при вторичном инфицировании и распаде — лейкоцитоз. В случае метастазов (в печень, брюшину) могут наблюдаться асцит, отеки на ногах.
Наиболее достоверными рентгенологическими признаками рака тонкой кишки являются сужение ее просвета, реже дефект наполнения неправильной формы с неровными контурами, обычно краевой, ригидность стенки, деформация (чаще расширение) складок слизистой. Иногда наблюдаются расшире
ние проксимального просвета кишки, усиленная перистальтика, которая в месте поражения, как правило, отсутствует. При изъязвлении опухоли выявляется депо бария. По мере прогрессирования опухолевого роста происходит прорастание раковой ткани в брыжейку и забрюшинное пространство. Рентгенологически это проявляется почти полной неподвижностью пораженных петель тонкой кишки.
Рак тонкой кишки может вызвать кишечную непроходимость, острота которой зависит от характера, уровня расположения опухоли и быстроты закрытия просвета кишки, т. е. может протекать или по типу постепенно нарастающей хронической непроходимости, или же на ее фоне может возникнуть острая непроходимость, обусловленная в 40 % случаев инвагинацией. Менее частым осложнением является перфорация кишечной стенки (Атанасян, Юдин, 1979).
Саркома 12-перстной кишки. Встречается очень редко, приблизительно в 10 раз реже, чем рак. Наблюдается преимущественно у мужчин молодого и среднего возраста. По гистологическому строению различают ретикулосаркому, лимфосаркому, круглоклеточную и полиморфно-клеточную саркомы, фибросаркомы, нейросаркомы и др. Они могут развиваться в подслизистом, интрамуральном и субсерозном слоях 12-перстной кишки и расти в ее просвет или инфильтративно, прорастая все слои ее стенки. Саркомы чаще поражают нижнюю горизонтальную и восходящую ветви 12-перстной кишки ближе к дуоденоеюнальному изгибу.
Клиническая картина лишена патогномоничных симптомов. Больные могут предъявлять жалобы на тяжесть и боли в эпигастральной области и правой половине живота, слабость, прогрессирующее исхудание. При прорастании кровеносных сосудов и изъязвлении
опухоли могут быть дуоденальные кровотечения и нарастающая анемия. В основном саркомы растут быстро и рано дают метастазы в различные органы. ,
Инфильтративная форма саркомы встречается чаще других форм и характеризуется диффузной инфильтрацией стенки кишки с разрушением ее мышечного слоя. Поэтому кишка не суживается, в большинстве случаев ее просвет расширен и замедлено продвижение перистальтической волны в зоне поражения. Иногда рельеф слизистой оболочки неравномерный или разрушенный. Узловая форма имеет вид одиночного или множественных узлов, которые растут как внутрь кишки, так и за пределы ее стенки, делая рентгенологические признаки аналогичными признакам рака соответствующей локализации. В случае изъязвления опухоли в зоне дефекта наполнения выявляется депо контрастного вещества (Михайлов, 1980).
Таким образом, рентгенологическое исследование 12-перстной кишки в условиях ее медикаментозной релаксации — весьма ценный метод в диагностике опухолевых заболеваний. Ведущее место в их распознавании занимает фибродуоденоскопия. Селективная ангиография в большинстве случаев неэффективна.
Саркома тощей и подвздошной кишок. По частоте занимает видное место среди других их злокачественных новообразований и составляет почти 45 % опухолей данной локализации. На долю сарком тощей и подвздошной кишок приходится 75 % всех случаев сарком пищевого канала. Наиболее часто встречаются лимфосаркома и ретикулосар-кома, которые поражают преимущественно начальный отдел тощей и терминальный отдел подвздошной кишки. Саркома может встречаться в любом возрасте, но чаще бывает в возрасте
20—40 лет, а по данным Л. А. Атанасяна и И. Ю. Юдина (1979) — в детском и молодом возрасте (до 30 лет).
Доминируют круглоклеточные саркомы и лимфосаркомы двух видов: одни растут в виде узла, другие диффузно инфильтрируют стенку кишки, разрушая ее мышечный слой. В отличие от рака саркоматозные опухоли достигают значительных величин (описаны случаи, когда саркома была размером 25 см и весила около 5 кг) с неровной поверхностью, множественными участками кровоизлияний и размягчений и большой наклонностью к спаечным процессам с соседними органами (Атанасян, Юдин, 1979).
При инфильтративной форме опухоль растет вдоль стенки кишки, разрушая подслизистую, слизистую и мышечную оболочки. Только в далеко зашедших стадиях саркома прорастает серозную оболочку тонкой кишки и вызывает ее сращение с окружающими тканями и органами.
В некоторых случаях при сращении опухоли с другими тканями и последующем ее распаде могут образоваться патологические соустья. В литературе описаны свищи тонкой кишки с мочевым пузырем, между подвздошной кишкой и сигмовидной и другие соустья. Нередки случаи, когда вследствие распада опухоли возникают кишечные кровотечения или перфорация в свободную брюшную полость с последующим развитием перитонита.
Саркомы полиповидной формы, по данным В. И. Якушина (1972), обладают экзофитным ростом. При росте в просвет кишки опухоль не достигает больших размеров, так как она рано приводит к непроходимости кишечника. Более редкой эндофитной формой роста обладают саркомы, возникающие из подсерозного, наружного мышечного слоев тонкой кишки. Саркомы, располагающиеся субсерозно и растущие в свобод
ную брюшную полость, могут достигать больших размеров, иногда имеют длинную ножку. Полиповидная форма более характерна для лейомио-, нейро- и фибросарком. Опухоль может быть солитарной или множественной.
Термин «лимфосаркома» потерял гистологический смысл и имеет преимущественно топографическое значение, показывая, что опухоль исходит из лимфоузлов или другой лимфоидной ткани. Это заболевание может носить ограниченный характер или же первоначально принять генерализованную форму. Поэтому В. И. Якушин (1972) считает целесообразным различать 3 клинико-анатомические формы поражения тонкой кишки: 1) локализованную, 2) локализованную с генерализацией, 3) генерализованную с поражением тонкой кишки.
Клинические симптомы саркомы тонкой кишки разнообразны и малохарактерны, особенно на ранних стадиях заболевания. Больных могут беспокоить тошнота, тяжесть в подложечной области после приема пищи, повышение температуры, рвота, понос, картина «острого живота» на почве инвагинации опухоли, ограниченный и разлитой перитонит в результате перфорации злокачественной опухоли, кишечные кровотечения, желтуха. У ряда лиц отмечаются анемия, умеренное повышение СОЭ, небольшой лейкоцитоз. При пальпации живота у большинства больных определяется плотная или тугопластическая опухоль, относительно подвижная, размером от ЗХ 5 до 5Х 15 см.
Ретикулосаркома с диффузно-инфильтративным ростом может характеризоваться выраженным отечно-асцитическим синдромом. Как правило, этот синдром предшествует синдрому недостаточности всасывания пищевых веществ. Отмечаются также симптом «барабанных палочек», беспричинный лейкоцитоз, упорная, не поддающаяся
обычной противоэнтеритной терапии диарея.
В связи с тем что специфических клинических симптомов сарком нет, роль рентгенолога, хорошо знакомого с данной патологией, владеющего методикой исследования тонкой кишки, знающего рентгенанатомию и физиологию ее, в диагностике является главной. Следует лишь подчеркнуть, что объективная рентгенологическая оценка ширины просвета и рельефа слизистой оболочки тонкой кишки возможна только при тугом ее заполнении с помощью зонда. Если нельзя ввести зонд в тонкую кишку, используют другие методики. С помощью ангиографии выявляют различные патологические отклонения со стороны сосудов брюшной полости (неравномерный калибр, истонченные стенки, неожиданные искривления и др.). Это позволяет дифференцировать ретикулосаркомы от воспалительных поражений. Гипертрофия лимфоузлов обнаруживается с помощью лимфографии.
Саркома растет в основном диффузно, инфильтрируя, кишечную стенку и образуя здесь аневризматическое расширение кишки. Стенка кишки в области поражения резко утолщена и ригидна, ее контуры неравномерно-зубчатые, складчатость рельефа нарушена. Иногда на рельефе слизистой выявляются бугристые дефекты наполнения или изъязвления. Перистальтика кишки в этом месте не отмечается. Контрастная масса надолго задерживается в пораженном сегменте. Реже саркоматозный узел растет в просвет кишки, обтурирует ее просвет и образует дефект наполнения.
Е. Э. Абарбанель (1952), В. А. Фа-нарджян (1964) и В. И. Якушин (1972) обращали в свое время внимание при ретикулосаркомах на ограниченные расширения тонкой кишки, отдельные из них типы псевдодивертикулов, которые чередуются с суженными ригидными
138. Саркома тонкой кишки.
участками. Они тогда же указывали, что для лимфосарком характерно наличие овальных дефектов наполнения на рельефе слизистой оболочки кишки вследствие специфической гиперплазии лимфоузлов, деформирующих рельеф. Могут быть и полициклические вдавле-ния по контуру кишки и бляшкообразные дефекты наполнения до 1 — 1,5 см в диаметре, которые располагаются группами или поодиночке, разрушая складки слизистой оболочки (Губергриц, Линевский, 1975). При саркомах тонкой кишки наблюдаются признаки нарушения моторной функции,
отсутствие или ослабление маятникообразных и перистальтических движений в области опухоли, супрастеноти-ческое расширение кишки. К этим симптомам можно добавить несоответствие размеров пораженной кишки и пальпируемого образования, смещение последнего вместе с кишкой и чаще сохранение проходимости кишечной трубки (Черненко, Сухин, 1974).
Что касается других методов лучевой диагностики опухолей тонкой кишки, то мнения авторов различны. По данным С. J. Nix et al., (1985), КТ, ангиография и УЗИ не дают существенных диагностических результатов. В то же время W. М. Thompson, R. A. Halvorsen (1987) утверждают, что КТ целесообразно использовать в тех случаях, когда опухоль или метастазы уже выявлены другими средствами, а также для наблюдения за оперированными больными. М. G. Faram et al. (1987) считают, что КТ — ценный метод диагностики опухолей 12-перстной кишки, позволяющий также оценить состояние окружающих структур (брыжейки, крупных сосудов, желчных протоков), печени и регионарных лимфатических узлов.
Таким образом, на сегодняшний день основным средством диагностики и оценки опухолей 12-перстной, тощей и подвздошной кишок является рентгеноконтрастное исследование по традиционной методике, сочетающее эффективность, доступность и низкую стоимость.
Глава 26. НЕКОТОРЫЕ СИСТЕМНЫЕ ЗАБОЛЕВАНИЯ
Системные заболевания тонкой кишки — довольно большая группа, которая включает диффузные болезни соединительной ткани (коллагенозы), лимфогранулематоз и другие системные процессы.
Диффузные болезни соединительной ткани (коллагенозы)
Диффузные болезни соединительной ткани — это вторичные аутоаллергические заболевания инфекционной при
роды, патогенез которых связан с нарушением гомеостатического контроля иммунологических механизмов. В современной клинической практике в эту группу заболеваний включают системную красную волчанку, системную склеродермию, дерматомиозит, узелковый периартериит, ревматоидный артрит, синдром Шегрена и др.
Этиология изучена недостаточно, однако провоцирующими, выявляющими факторами могут быть лекарственная непереносимость, влияние физических факторов — охлаждение, особенно длительное воздействие влажного холода, чрезмерная инсоляция, вибрация, физическая травма; психическая травма, эндокринные влияния при абортах, родах, беременности; вегетативнонейротрофические и эндокринные факторы — нарушение функции гипотала-мо-гипофизарно-надпочечниковой системы. Наблюдения многих авторов свидетельствуют о значении семейно-генетического предрасположения как этиологического фактора коллагеновых болезней (Тареев, 1965; Ганджа с соавт., 1988).
Коллагенозы — классический пример органонеспецифических аутоиммунных болезней, начальным звеном которых является стимуляция иммунокомпетентной системы каким-либо антигеном, различным для каждой коллагеновой болезни, но всегда с участием аутоантигена, усиленной выработкой аутоантител и однозначным для всех этих болезней результатом — иммунными нарушениями, имеющими свои особенности при каждой из них. Для всех таких болезней характерно значительное нарушение гуморального звена иммунитета, связанного с В-лим-фоцитами и проявляющегося безудержной продукцией различных аутоантител, которые направлены против антигенов собственных тканей. Могут развиваться также аутоиммунные синдромы,
связанные с циркулирующими антителами, например аутоиммунная гемолитическая анемия или аутоиммунная тромбоцитопения (Струков, Бегларян, 1963; Нестеров, Сигидин, 1966; Мацке-вичус, 1987).
Из других механизмов развития кол-лагенозов привлекает к себе внимание нарушение метаболизма коллагена, свойстенное всем болезням этой группы. Наиболее ярко эта патология проявляется при системной склеродермии и ревматоидном артрите: повышенная скорость биосинтеза коллагена, формирование менее устойчивых коллагеновых структур с повышенным распадом, тенденция развития избыточного фиброза.
Патологоанатомическую основу коллагеновых болезней составляют имму-нопатоморфологические изменения, имеющие аллергический генез; поражение микроциркулярного русла (микроангиопатия), сосудов мелкого и среднего калибра; системная прогрессирующая дезорганизация соединительной ткани. Сочетание этих процессов дает характерную картину воспаления на иммунной основе (Тареев, 1965; Спасская, Бартусевичене, 1988).
Процесс дезорганизации соединительной ткани имеет 4 фазы (Струков, Бегларян, 1963): I — мукоидное набухание, II — фибриноидное набухание соединительной ткани, III — развитие клеточных реакций, имеющих очаговый (узелки, гранулемы) или диффузный характер, IV — развитие склероза. Течение коллагеновых болезней в большинстве случаев рецидивирующее и прогрессирующее.
Несмотря на большое своеобразие отдельных нозологических форм, всем коллагеновым болезням свойстенны такие общие клинические симптомы, как лихорадка, артриты (полиартриты), рецидивирующие полисерозиты, а также разнообразие висцеральной патоло
гии: миоэндокардиты, гломерулонефри-ты (или амилоидоз почек), поражение печени и гепатблиенальные синдромы, генерализованная лимфаденопатия и другие синдромы (Нестеров, Сигидин, 1966; Ганджа и соавт., 1988).
Достаточно полно изучены висцеральные проявления коллагенозов в сердце и сосудах, нервной системе и опорно-двигательном аппарате. Значительно меньше известно о состоянии пищеварительного тракта и особенно о поражении тонкой кишки (Ганченко и соавт., 1972; Жегин, Фризен, 1977; Жегин, Прибытков, 1978; Спасская, Бартусевичене, 1988).
Поражение кишечника занимает второе место по частоте, уступая патологическим изменениям пищевода. Характерно распространенное, а иногда тотальное поражение тонкой кишки с нарушением всасывательной функции ее.
Клиническая симптоматика в основном обусловлена степенью наибольших изменений. К общим клиническим симптомам поражения кишечника можно отнести боли в животе, запоры или поносы, неустойчивый стул, метеоризм. У 1 /з больных жалобы на заболевания кишечника могут отсутствовать.
Системная склеродермия. При рентгенологическом исследовании 12-перст-ной кишки в начальной фазе склеродермии у 15 % больных отмечаются замедление продвижения бариевой взвеси, задержка ее в луковице, нормальный просвет кишки, нередки маятникообразные движения с обратным забрасыванием содержимого в желудок и признаки артериомезентериальной компрессии. По мере развития склероза в стенке кишки появляются выраженная атония и расширение нижней горизонтальной части 12-перстной кишки с задержкой контрастной взвеси до нескольких часов (дуоденостаз), объем кишки увеличивается.
В тощей и подвздошной кишках рентгенологические изменения обнаруживаются у 55,3—61,5 % больных. Наблюдаются снижение тонуса и ослабление моторно-эвакуаторной функции тонкой кишки. Гипотония проявляется расширением просвета кишки от 3 до 5 см. Замедление продвижения контрастной массы выражается удлинением времени транзита ее по тонкой кишке от 4 до 10 ч. На отдельных участках кишки может наблюдаться перестройка рельефа слизистой в виде утолщения складок с увеличением межскладочных промежутков. При исследовании больного в вертикальном положении тела контрастная масса в кишечнике распределяется неравномерно и скапливается в нижних участках каждой кишечной петли. В. А. Жегин и Ю. Н. Прибытков назвали это явление симптомом «оседания бариевой взвеси». Опорожнение тонкой кишки от контрастного вещества замедляется до 24 ч. При приеме пищи снижается моторный гастроилеальный рефлекс, продвижение бариевой массы мало ускоряется.
У больных системной склеродермией контрастирование тонкой кишки происходит не только медленно, но и неравномерно. Часто наблюдается своеобразная картина в виде чередования неизмененных отделов с ампуловидно расширенными участками стенки кишки или суженных участков с расширенными петлями. В этих расширенных отрезках кишечника наблюдаются жидкость и газ с образованием горизонтальных уровней, что несколько напоминает картину тонкокишечной непроходимости. Наиболее выражены описанные признаки в 12-перстной и начальных отделах тощей кишки, постепенно убывая в дистальном направлении (Жегин, Прибытков, 1978).
Из-за медленного продвижения контрастного вещества для исследования тонкой кишки необходимо дли-
тельное рентгенологическое наблюдение. В процессе исследования получить ТЗ всей тонкой кишки практически не удается. У некоторых больных с выраженной клиникой заболевания рентгенологическая картина может быть иной: тонус кишки повышен, ширина просвета ее не превышает 1,5 см, складки слизистой деформированы. Отмечается усиление моторно-эвакуаторной функции. Первые порции контрастной массы поступают в терминальные петли подвздошной кишки через 1 — 1,5 ч. Гастроилеальный рефлекс усилен. У этих больных (Жегин, Прибытков, 1978) в петлях тощей кишки определяется значительное количество слизи, отчего бариевая взвесь, как бы створа живаясь, принимает вид крупных хлопьев (симптом флокуляции). Подвздошная кишка выглядит в виде различных по форме сегментов размером 0,5Х 1 см, тесно прилегающих друг к ДРУГУ (симптом гиперсегментации). Возможно формирование отдельных участков сужения кишки, чередующихся с участками расширения, где контрастное вещество (сернокислый барий) образует горизонтальные уровни с газом над ними (симптом Клойбера).
Системная красная волчанка. Поражает кишечник в значительно меньшей степени и реже, чем, например, системная склеродермия. Клинические проявления наблюдаются у 1 /з больных, которые жалуются на боли в животе, запоры и неустойчивый стул.
Рентгенологическая картина весьма вариабельна. У части больных она напоминает картину тонкой кишки при склеродермии. Причем изменения более
139. Изменения тонкой кишки при системной склеродермии:
а — чередование суженых и расширеных сегментов; б — симптом гиперсегментации подвздошной кишки.
выражены в 12-перстной кишке. Но в отличие от склеродермической энтеропатии продвижение контрастного вещества по тонкой кишке совершается в нормальные сроки, а в ряде случаев бывает ускоренным. В другой группе больных расширение просвета кишечника рентгенологически может не определяться, но складки слизистой изменены, деформированы. Выражено усиление моторно-эвакуаторной функции кишечника с переходом контрастной массы в слепую кишку уже через 1 — 1,5 ч. В тощей кишке отмечается большое количество слизи с образованием бариевых хлопьев. Для подвздошной кишки характерен симптом гиперсегментации (Жегин, Прибытков, 1978).
Ревматоидный артрит. У ряда больных сопровождается поражением тонкой кишки. Клинически из жалоб чаще всего отмечаются боли по всему животу или в его нижней части, или же в области пупка, запоры и поносы.
Рентгенологические признаки: функциональные изменения выявляются у 35 % больных, причем наиболее часто — гипотония кишечника. Снижение тонуса бывает либо на всем протяжении тонкой кишки, либо в отдельных ее частях. В случаях выраженной гипотонии может выявляться дуоденостаз, а в отдельных кишечных петлях — газ и жидкость с образованием горизонтальных уровней.
У большинства больных двигательная деятельность тонкой кишки нормальная или ускоренная, у некоторых ослабленная функция кишечника. Очень редки изменения иного характера: деформированные складки слизистой оболочки, слизь в просвете кишки, положительные симптомы флокуляции и гиперсегментации, усиленная перистальтика и повышенный гастроилеальный рефлекс (Жегин, Прибытков, 1978).
Узелковый периартериит. Поражает органы пищеварения весьма часто, иногда приводит к выраженному абдоминальному синдрому. Клинически последний характеризуется сильнейшими болями в животе, напряжением брюшной стенки, диспептическими явлениями. Причина абдоминального синдрома — поражение артерий органов брюшной полости, в частности кишечника. Боли в животе довольно часто сочетаются с кишечным кровотечением, которое наступает вследствие разрыва артериальных аневризм, а также инфаркта стенки кишечника, сопровождающегося развитием некрозов и изъязвлений.
Рентгенологические признаки: взвесь сульфата бария, принятая через рот, быстно продвигается по пищеварительному каналу, пропульсивная и эва-куаторная функции кишечника резко ускорены. В просвете тонкой кишки определяется жидкое содержимое. Бариевая взвесь, смешиваясь с ним, контрастирует петли тонкой кишки неравномерно. Диаметр просвета кишки различен. Наряду с обычными выявляются суженные и расширенные сегменты. В пораженном сегменте кишки рельеф слизистой отечный, складки утолщенные, с нечеткими контурами. На слизистой оболочке иногда определяются крапчатость й четкие контрастные пятна (язвы).
Дерматомиозит. Наименее дифференцированное заболевание из группы больших коллагенозов. При нем, как и при других диффузных болезнях соединительной ткани, поражаются и внутренние органы. Поражения органов ЖКТ и брюшной полости занимают значительное место в клиническом течении дерматомиозита. Поражение мышц пищеварительного тракта приводит к нарушению моторно-эвакуаторной функции желудка и кишечника.
Клинически болезнь проявляется
желудочно-кишечным дискомфортом, чувством переполнения, особенно после приема пищи, ранним чувством насыщения, болями, реже — тошнотой и рвотой. Кроме того,отмечаются вздутие живота, поносы или запоры. Происходят изменения в слизистой оболочке: развивается атрофия, метаплазия эпителия, могут возникнуть кровоизлияния, чаще мелкоточечные, отек, некрозы с последующими эрозивными и язвенными изменениями. В случае присоединения вторичной инфекции развивается воспаление, которое проявляется тяжелой клиникой и рентгенологической картиной язвенного энтерита.
Рентгенологические признаки: выявляемые изменения в тонкой кишке скорее всего связаны с дистрофическими процессами в кишечной стенке — с ее амилоидозом или с присоединением энтерита или осложнением им основной болезни.
Легко обнаруживаются нарушейия моторно-эвакуаторной функции пищеварительного тракта. Просвет петель тонкой кишки расширен как вследствие сужения тонуса, так и в результате содержания в нем жидкости и газа. Продвижение бариевой взвеси по кишечнику или ускорено, или замедленно. Рельеф слизистой перестроен, складки ее редкие и сглаженные, на их поверхности выявляются мелкие округлые образования и контрастные пятна.
Лимфогранулематоз
Лимфогранулематоз, или болезнь Ходжкина,— злокачественное новообразование лимфоидной ткани. Характеризуется ее гранулематозным строением с наличием гигантских многоядерных клеток Березовского — Штернберга, увеличением лимфатических узлов и селезенки, лихорадкой и поражением внутренних органов. Встречается в любом возрасте, чаще у мужчин от 20 до
140. Изменения тонкой кишки при лимфо-
гранулематозе.
35 и старше 50 лет. Этиология заболевания неизвестна.
Согласно международной клинической классификации,выделяют 4 стадии заболевания. Для нас представляет интерес IV стадия, когда развиваются диссеминированные формы заболевания, поражаются внутренние органы, в том числе и кишечник, с увеличением лимфатических узлов различной локализации или протекают без него. Частота поражений пищеварительного тракта лимфогранулематозом достигает 60 %. Тонкая кишка и особенно ее проксимальные отделы — 12-перстная и тощая кишки — излюбленная локализация при этом заболевании (Переслегин с соавт., 1975, 1976; Новикова, 1982).
Клинические проявления лимфогранулематоза весьма разнообразны, ха рак-
теризуются динамичностью течения. < Жалобы больного определяются лока- 1 лизацией патологического процесса, i Клиническая картина лимфогранулематоза тонкой кишки, которая поражает- < ся чаще других отделов ЖКТ, обусловлена местными и общими симптомами 1 заболевания, в значительной мере зависит от характера роста опухоли, размеров и локализации патологического очага.
При генерализации процесса появ- । ляются циклическая, постоянная или интермиттирующая лихорадка, профуз- 1 ные, чаще ночные поты, похудание, । кожный зуд, увеличение селезенки, периферических, медиастинальных и за- : брюшинных лимфоузлов. У 5—30 % 1
больных отмечается возникновение болей в лимфатических узлах после прие- i ма даже малых доз алкоголя (поло- ] жительная алкогольная проба). Для лимфогранулематоза топкой кишки ха- < рактерны боли в животе, метеоризм и диарея. Развивается лейкопения, СОЗ повышена. При целенаправленной паль- : пации можно прощупать опухолевидные образования в брюшной полости (увели- i ченные лимфатические узлы). i
Рентгенологическая картина обу- । словливается характером роста патологической ткани. И. А. Переслегин с соавт. (1976) различают 3 основные формы проявления лимфогранулематоза: эндофитную, экзофитную и сме- 1 шанную. Каждая форма может сопро- < вождаться различной степени изъязвле- i ниями. При эндофитной форме пора- । жения наблюдаются неравномерность заполнения и прохождения контрастной взвеси, изменение формы просвета i или деформация пораженного отдела < кишки, ригидность ее стенок, сглаженность контуров, реже — изменение i рельефа слизистой, дефект наполнения 1 или дефект контура. При экзофитных i формах, наоборот, чаще всего выявляют- < ся дефекты наполнения кишки и релье- 1
фа слизистой, нарушение проходимости и деформация пораженного участка кишки встречаются реже и бывают главным образом при больших размерах опухоли. Смешанные формы характеризуются сочетанием всех перечисленных признаков.
По мнению Г. А. Даниеляна, С. А. Мазманяна и др. (1977), целесообразно выделять следующие анатомо-рентге-нологические формы проявлений лимфогранулематоза пищеварительного тракта: инфильтративную, узловатую, язвенную, фиброзно-стенозирующую и смешанную.
Инфильтративная форма характеризуется поражением больших отрезков кишечника, а иногда всего органа. Инфильтрация ограничивается слизистой и подслизистой оболочками или распространяется на все слои стенки. Кишка или отделы ее увеличены в объеме, стенки утолщены. Складки слизистой уплотнены, утолщены, расширены, иногда перестроены, па них обнаруживаются поверхностные изъязвления. Морфологически имеется ретикулярная форма лимфогранулематоза. Клинически — остро протекающая, в большинстве своем генерализованная форма с преобладанием общих симптомов болезни.
Рентгенологически наиболее характерны следую щие симптомы: большая протяженность поражения, увеличение объема пораженного органа или части его; расширение и утолщение складок слизистой оболочки; неизменчивость рельефа слизистой в процессе исследования; резкое утолщение стенки органа; сохранность эластичности и перистальтики пораженной стенки в течение длительного периода; грубая зубчатость контура пораженного отрезка кишечника; отсутствие заметного нарушения его моторной функции. Возможна перестройка рельефа слизистой оболочки с наличием множества небольших поли-
повидных образований и поверхностных изъязвлений.
Узловатая форма характеризуется преимущественно экзофитным ростом опухолевых узлов — чаще множественных, реже одиночных. Слизистая оболочка в окружности узлов мало или вовсе не изменена. Возможно их изъязвление. Морфологически имеется смешанно-клеточная форма лимфогранулематоза. Клинически характеризуется медленным течением с преобладанием местных симптомов над общими.
Рентгенологически для экзофитного варианта узловатой формы поражения характерны такие симптомы: центральные или краевые дефекты наполнения округлой, овальной или неправильной формы; складки слизистой оболочки вокруг узлов неравномерно расширены с образованием мелких полиповидных разрастаний; узлы связаны со стенкой органа широким основанием; возможно изъязвление их; эластичность и перистальтика пораженной стенки долгое время сохранены, хотя и снижены; просвет пораженного отрезка пищеварительной трубки обычно расширен.
Язвенная форма заслуживает особого внимания. Многие исследователи считают ее самостоятельной формой лимфогранулематоза кишечника. Язва выступает на первый план, бывает самой различной формы и величины. Морфологически имеется смешанно-клеточная форма лимфогранулематоза. Клинически проявляется местными и общими симптомами при относительно медленном течении. Нередко возникают осложнения — перфоративный перитонит, кровотечение.
В рентгенологической картине основной и ведущий — симптом изъязвления (язвы) с краевым или центральным расположением. Изъязвление трудно отличить от пептической язвы и первично-язвенного рака. Лимфогранулематозная язва имеет очень боль
шие размеры, окружена широким опухолевым валом, выходит за пределы пораженного органа. Складки слизистой в окружности язвы инфильтрированы. Иногда изъязвления могут быть в виде неправильной формы скоплений бариевой взвеси с нечеткими очертаниями, без воспалительного вала вокруг конвергенции складок.
Фиброзно-стенозирующая форма характеризуется выраженным развитием фиброзной ткани, приводящим к резкому утолщению, уплотнению, уменьшению объема, сужению и деформации стенки пищеварительной трубки. Слизистая оболочка обычно сглажена. Поражение чаще одиночное, реже множественное с локализацией в тонкой кишке. Клинически проявляется медленным доброкачественным течением с преобладанием местных симптомов.
Рентгенологи чески фиброзно-стенозирующая форма характеризуется сужением просвета и деформацией пораженного отрезка пищеварительной трубки; резким утолщением ее стенок, ригидностью и неподвижностью пораженной стенки; отсутствием перистальтических сокращений; некоторой неровностью контура в зоне поражения; сглаженностью складок слизистой оболочки. Если отмечается чередование суженных и ампуловидно расширенных участков, то создается «четкообразная» форма кишки. Рельеф слизистой оболочки — чередование поперечно идущих и продольных складок. При данной форме поражения имеют место и расстройства функционального характера — задержка продвижения контрастного вещества через суженный участок и усиленная перистальтика в участках супрастенотического расширения. В ряде случаев в терминальном отделе подвздошной кишки выявляется резкое шнурообразное сужение ее просвета с неровными контурами (симптом шерстяной нитки). Степень сужения
просвета кишки бывает различной (Пе-реслегин с соавт., 1975).
Смешанная форма — это различная комбинация приведенных выше форм. Рентгенологически обнаруживаются изменения, встречающиеся при любой форме лимфогранулематоза с преобладанием в каждом наблюдении тех или других признаков.
В начальных стадиях лимфогранулематоза тонкой кишки рентгенологически определяются неравномерное продвижение и комкование контрастной взвеси, наличие спастически сокращенных сегментов и дефектов наполнения, исчезновение типичного, например для тощей кишки, так называемого перистого рельефа слизистой оболочки. Только по мере прогрессирования процесса развивается утолщение складок с образованием подушкообразных выбуханий, просвет кишки суживается, стенки ее становятся ригидными, замедляется продвижение контрастной взвеси (Пе-реслегин с соавт., 1976).
Многие исследователи полагают, что описанные рентгенологические признаки будут более достоверными при использовании антиспастических препаратов. Диагностическую ценность гипотонической энтерографии в диагностике изолированного лимфогранулематоза тонкой кишки отмечают и Ю. В. Линевский,. И. С. Павлова (1974). При рентгенологическом исследовании тонкой кишки в условиях искусственной гипотонии более четко определяются границы поражения, рельеф слизистой оболочки, лучше обозначаются краевые вдавления с брыжеечной стороны кишки от увеличенных лимфоузлов.
Чтобы уточнить распространенность процесса в брюшной полости, применяют мезентерикографию, спленопортографию и целиакографию. На ангиограммах выявляются краевые дефекты наполнения, сдавление и смеще
ние сосудов, супрастенотическое их расширение, развитие коллатералей и другие изменения, косвенно указывающие на увеличение лимфоузлов. Вдавления или сужения сосудов, более отчетливо выраженные по контуру печеночных и селезеночных вен, позволяют предполагать наличие увеличенных лимфатических узлов. Последние довольно часто смещают верхнюю брыжеечную артерию. Изменения сосудов отмечаются и в области ворот печени или селезенки, наблюдается увеличение этих органов, обусловленное нарушением венозного оттока. Степень смещения верхней брыжеечной артерии определяется по величине угла и по расстоянию между передней стенкой аорты и верхней брыжеечной артерией, что лучше выявляется на боковых ангиограммах (Пересле-гин, Кривенко, Филькова, 1974).
Таким образом, абдоминальная ангиография имеет определенную диагностическую ценность в общем комплексе клинико-рентгенологического исследования больных лимфогранулематозом, помогая уточнить стадию болезни и тем самым определить рациональный план лечения.
Среди первичных поражений тонкой кишки нелимфогранулематозными лимфомами чаще всего встречается лим-фосаркома, малодифференцированная и смешанно-клеточного типа. Рентгенологическая картина крайне разнообразна и характеризуется различным сочетанием экзофитного и эндофитного роста опухоли, часто с множественными поверхностными или одиночными изъязвлениями. В случае преобладания диффузной инфильтрации выявляется злокачественный рельеф слизистой оболочки пораженного отдела с множественными полипообразными дефектами наполнения различной величины и формы без четких очертаний. Реже наблюдается скиррозная илй первично-язвенная форма поражения.
Макроглобулинемия Вальденстрема
Макроглобулинемия Вальденстрема относится к группе хронических лейкозов, при которых основная опухолевая масса костного мозга и крови состоит из созревающих и зрелых клеток. Заболевание впервые описано в 1944 г. J. G. Waldenstrom.
Клиническая картина: утомляемость, бледность, незначительная одышка; генерализованное увеличение лимфатических узлов (необязательно); расстройства периферического кровообращения: геморрагический диатез (главным образом кровоизлияния в сетчатку с ослаблением зрения, во внутреннее ухо, в ЦНС, в верхние дыхательные пути, в ЖКТ, во влагалище). Время свертывания крови удлинено; положительный симптом Кончаловского — Румпеля — Лееде; уменьшена резистентность капилляров, кроме того, часто удлинено время кровотечения, уменьшен протромбиновый индекс, патологическая тромбоэластограмма, гипер- и парапротеинемия с гомогенным В- или у-градиентом, макроглобулинемия. Положительная проба Сиа. Значительно увеличена СОЭ — до 90 — 100 мм/ч, имеются специфические преципитины; гепато- и спленомегалия (необязательно). В крови нормохромная гипопластическая анемия, часто лимфоцитоз, в терминальных стадиях тромбопения. В костном мозге — увеличенное количество тучных клеток, реже — плазматических клеток. Болеют преимущественно мужчины в возрасте 50-ТО лет.
Рентгенологические данные: отмечаются гиперэвакуаторная дискинезия, утолщение складок слизистой, мелкие дефекты наполнения из-за увеличения солитарных фолликулов и пейеровых бляшек. Это создает гранулярную картину рельефа слизистой.
Болезнь Шенлейна — Геноха
Болезнь Шенлейна — Геноха проявляется аллерготоксической пурпурой (капиллярными геморрагиями), которая развивается при геморрагическом васкулите.
Клиническая картина: кожа и слизистые оболочки имеют сыпь, похожую на крапивницу. Размеры высыпаний от булавочной головки до бляшки диаметром 1—2 см вначале располагаются каждая по отдельности, позднее нередко сливаются друг с другом. Геморрагии обычно приподняты над поверхностью кожи; центр их может подвергаться некрозу. Крапивница иногда предшествует появлению типичной папулезной геморрагической сыпи. Процесс захватывает, как правило, нижние конечности и ягодицы. Верхние конечности, лицо и туловище поражаются значительно реже. Характерна преимущественная локализация сыпи на разгибательных поверхностях конечностей и вокруг больших суставов.
Страдают геморрагическим васкулитом обычно дети, но болезнь может возникнуть впервые в любом возрасте. В отличие от тромбоцитопенической пурпуры при геморрагическом васкулите одновременно с сыпью на коже и слизистых оболочках отмечаются патологические изменения суставов, ЖКТ, почек, сердца, ЦНС.
Поражаются обычно коленные и голеностопные суставы, иногда с периар-тикулярным отеком. Движения в суставах ограничиваются из-за боли, продолжающейся около недели. Характерно расхождение между выраженностью болевых ощущений в суставах и чрезвычайной скудностью объективных признаков их воспаления. При тромбоцитопенических пурпурах боль в суставах и отечность периартикулярной ткани не наблюдаются. В сомнительных случаях окончательный диагноз устанав
ливают по результатам биопсии. Геморрагический васкулит протекает с характерными описанными изменениями мелких сосудов кожи.
Коликообразная боль в животе возникает приблизительно у половины заболевших детей. На высоте боли возможна рвота. Полагают, что боль вызывает отек, связанный с геморрагиями в стенку кишки. Кровотечение в просвет ЖКТ может сопровождаться кровавой рвотой и меленой.
Гематурия, протеинурия и повышение АД чаще наблюдается у детей старше 6 лет. В большинстве случаев отмечается полное выздоровление, по приблизительно у 20 % больных изменения сохраняются в течение многих лет. В длительно прослеженных случаях этой болезни обнаруживаются клинические и гистологические признаки хронического нефрита. Микрогематурия бывает иногда при болезни Верльгофа, но она всегда исчезает во время ремиссии.
Генерализованное поражение мелких сосудов с кровотечением в кожу, слизистые оболочки и другие органы встречается также при тромбоцитопенической пурпуре. Однако геморрагический васкулит протекает обычно благоприятно с субфебрильной температурой и через 3—4 недели оканчивается выздоровлением. При отсутствии поражения почек выздоровление может быть полным. Благоприятный прогноз обычно имеют и рецидивы этой болезни, которые наблюдаются приблизительно у 50 % заболевших. Тромбоцитопеническая пурпура протекает с высокой лихорадкой, гемолитической анемией, тромбоцитопенией, часто с картиной повторных нарушений мозгового кровообращения и отличается неблагоприятным прогнозом. Геморрагический васкулит, как правило, не имеет тромбозов мозговых сосудов.
Рентгенологическая картина: основ
ным симптомом поражения кишечника является утолщение и набухание складок слизистой оболочки. Очертания их нечеткие, смазанные. Если отек резко выражен, то складчатость может исчезать. Иногда наблюдаются разрывы слизистой. Кишка сужена, сегментирована, в просвете ее — жидкое содержимое. При присоединении к отеку внутристеночных кровоизлияний на контурах кишки появляются дефекты наполнения, которые напоминают пальцевидные вдавления и придают контуру кишки фестончатые очертания.
Панкреатическая холера
Панкреатическая холера описана J. V. Verner и A. N. Morrison впервые в 1958 г., повторно в 1974 г. Болезнь чаще всего обусловлена гормональноактивной опухолью (доброкачественной или злокачественной) поджелудочной железы, гиперплазией клеток островков Лангерганса или ганглионевромой (ган-глионевробластомой).
В клинической картине доминирует диарея, которая вначале возникает па-роксизмально. Позднее ремиссии полностью исчезают и диарея становится постоянной. Стул по внешнему виду напоминает разведенный чай, объем его в большинстве случаев составляет 4 — 6 л за сутки. Вместе с жидкостью организм теряет большое количество электролитов.
Суточные потери калия с калом могут достигать 300 ммоль. Следствием этого бывает гипокалиемия, под влиянием которой развивается вакуольная дегенерация канальцевого эпителия. Больные обычно умирают от почечной недостаточности и азотемии, возникших в связи с дегидратацией и гипокалиемией. Характерна также гипокалиемическая мышечная слабость, выраженная особенно резко в проксимальных мышцах конечностей. Содержание
кальция в крови в половине случаев оказывается повышенным. Приблизительно у 75 % больных отмечается ахлоргидрия. Секреция кислого желудочного сока у остальных 25 % больных не изменяется. Предположительный диагноз болезни ставят на основании водной диареи, гипокалиемии и гипохлоргидрии или ахлоргидрии желудочного сока, окончательный диагноз — по результатам пробной терапии, а именно на основе ремиссии, которая наступает после хирургического удаления любой опухоли, найденной в поджелудочной железе, или после удаления дистальной части поджелудочной железы. У 35 % оперированных опухоль оказалась злокачестенной.
При рентгенологическом исследовании тонкой кишки обнаруживают гипермоторную дискинезию, неравномерное распределение бариевой взвеси, утолщение складок слизистой. Иногда наблюдается расширение просвета отдельных петель тонкой кишки.
Панкреатическую холеру приходится дифференцировать от гастриномы и карциноидного синдрома. Водная диарея встречается более чем в половине случаев гастриномы. Дифференциальный диагноз легче всего проводить, используя данные определения кислотности желудочного сока и рентгенологического исследования желудка. Гастринома часто встречается в сочетании с язвой желудка и 12-псрстной кишки, тогда как при панкреатической холере язвы не бывает. Объем желудочного сока при гастриноме всегда увеличен, а кислотность повышена. Соответствующие показатели при панкреатической холере либо ниже нормальных, либо нормальные.
Диарея при панкреатической холере всегда только вбдная, тогда как при гастриноме она бывает водной лишь временами. Временное исчезновение диареи на короткий срок при гастри
номе достигается посредством аспирации желудочного сока или назначения больших доз антихолинергических средств, а при панкреатической холере — посредством приема больших доз кортикостероидов.
Нс мспсс важное дифференциальнодиагностическое значение имеет объем стула за сутки. При гастриноме у 75 % больных он не превышает 1 л и только у 25 % составляет 1—3 л. Суточное выделение жидкости в легких случаях панкреатической холеры колеблется от 1 до 3 л, а в 83,3 % случаев превышает Зли достигает 5 — 6 л. Азотемия встречается только при панкреатической диарее, а желудочно-кишечное кровотечение и перфорация язвы — лишь при гастриноме.
Синдром Черджа — Стросса
В основе синдрома Черджа — Стросса лежит аллергический гранулематозный васкулит, поражающий все сосуды, в том числе и кишечника. Считают, что синдром Черджа — Стросса занимает промежуточное положение в широком спектре васкулитов, на разных полюсах которого находятся узелковый периартериит и гиперэозинофильный синдром.
Клинически синдром проявляется абдоминальными симптомами, в основном болями в животе и диареей. Имеют место также артериальная гипертензия и периодические подъемы температуры до 38-39°.
Рентгенологическая картина зависит от степени поражения сосудов и выраженности интерстинальных осложнений (от изъязвления и воспаления до явного инфаркта и перфорации). Обзорная рентгенография брюшной полости, особенно в начале заболевания, диагностического значения не имеет. Однако в этой клинической ситуации наличие заполненных воздухом петель кишечни
ка с истонченной стенкой позволяет заподозрить мезентериальную ишемию. При контрастировании пищеварительного тракта выявляют нарушение двигательной деятельности кишечника, неравномерное распределение бариевой взвеси, неравномерный просвет кишки. Складки слизистой утолщены, отечны.
Ценным методом для диагностики является глубокая биопсия из прямой кишки. В результате ее обнаруживают специфическую эозинофильную инфильтрацию. Учитывают также положительную реакцию на введение больших доз кортикостероидов, если нет перфорации и инфаркта кишечной стенки.
Глава 27. ПАРАЗИТАРНЫЕ ЗАБОЛЕВАНИЯ
В практике рентгенолога-гастроэнтеролога имеют место и паразитарные заболевания, среди которых наиболее практически значимы гельминтозы (аскаридоз, лямблиоз, тениидоз, стронгило-идоз).
Аскаридоз. Возбудителем заболевания является аскарида. Длина самки 25—40 см, самца 15—25 см. Тело аскариды веретенообразной формы, задний конец у самки прямой, у самца крючкообразно загнут.
Аскарида паразитирует в тонком кишечнике человека. Продолжительность жизни ее в организме человека составляет не более 1 года. В кишечнике она удерживается, упираясь своим телом в его стенки. Аскарида питается содержимым, а также клетками поверхностного слоя слизистой оболочки тонкого кишечника хозяина. Половозрелая самка аскариды в сутки выделяет с калом около 240 000 яиц. В кишечнике хозяина яйца не развиваются, так как для развития им необходим кислород. Во внешней среде при благоприятных климатических условиях происходит развитие яиц до личинки. Сроки созревания яиц зависят от температуры окружающей среды. Яйца аскарид развиваются при температуре 12° — 37 °C. При температуре 24°—30 °C они созревают в течение 12—15 дней, при более низких температурах этот процесс затягивается до нескольких месяцев.
Заражение человека происходит в результате заглатывания созревших яиц аскарид. В тонком кишечнике из яиц вылупливаются личинки, внедряющиеся в капилляры кишечной стенки. Через венозные капилляры они попадают в ток крови печеночной вены, заносятся в печень, затем в нижнюю полую вену, в правое сердце, откуда гпо-падают через легочную артерию в малый круг кровообращения. В легких личинки разрывают капилляры и выходят в просвет альвеол. При помощи мерцательного эпителия, выстилающего бронхиолы, бронхи и трахею, личинки продвигаются по этим воздухоносным путям и проникают в глотку, затем в рот. Из ротовой полости они заглатываются и попадают в желудок, затем в кишечник, где происходит развитие их до взрослого гельминта. Длительность миграции личинок аскарид 14—15 дней. С момента заражения человека аскаридозом до появления яиц в фекалиях происходит 63 — 84 дня.
Клиническая картина: во время миграции личинок происходит сенсибилизация организма продуктами жизнедеятельности паразита. В результате этого в миграционной фазе аскаридоза у человека наблюдаются аллергические явления в виде крапивницы, насморка, кашля, эозинофилии крови. Во время миграции личинок в легких появляются очаги инфильтрации, обнаруживаемые
при рентгенологическом исследовании. При проглатывании большого количества яиц возникают бронхопневмонии с субфебрильной температурой, бронхиты. В кишечной фазе аскаридоза продолжаются сенсибилизация и интоксикация организма человека продуктами жизнедеятельности аскарид. Клинические симптомы аскаридоза наиболее выражены у детей. Интоксикация организма в первую очередь отражается на нервной системе. У детей наблюдаются быстрая утомляемость, плохой соп, головокружение. Со стороны пищеварительного тракта отмечаются тошнота, слюнотечение, неприятное ощущение в эпигастрии, ухудшение аппетита, иногда рвота. Ребенок часто значительно теряет в весе. Аскаридоз ухудшает течение дизентерии, брюшного тифа, кори, дифтерии. Аскариды оказывают иммунодепрессивное действие, осложняют течение беременности, родов и послеродового периода. В результате значительной подвижности аскарид возможно заползание их в желчные пути, в проток поджелудочной железы, в органы дыхания. Такая извращенная локализация аскарид может приводить к тяжким хирургическим осложнениям. При интенсивной инвазии может произойти закупорка кишечника клубком аскарид. Даже при наличии единичных особей возможно развитие спастической непроходимости кишечника.
При контрастировании кишечника бариевой взвесью в рентгеновском изображении аскариды имеют вид лентовидных просветлений длиной до 25—40 см и диаметром 0,3 — 0,5 см с четкими, ровными контурами, с заостренными концами, расположенными вдоль тонкой кишки и пересекающими круговые складки. Нередко удается видеть заполненный контрастной массой кишечник аскариды в виде нитевидной полоски вдоль ее тела. При наличии клуб-
141. Аскариды в тонкой кишке.
ков аскарид просвет кишки расширяется, а контрастная масса обтекает клубок наподобие опухолевидного образования (Мельник, Булгаков, 1978).
По мнению Л. С. Розенштрауха и др. (1985), длительное существование аскарид в кишечнике, как правило, вызывает картину диффузного энтерита.
Анкилостомидозы. Они относятся к группе гельминтозов, вызываемых нематодами семейства анкилостомид. Ан-килостомиды встречаются в тропической и субтропической зонах. К ан-килостомидозам человека относят анкилостомоз и некатороз, возбудители которых были открыты в 1843 г. и 1902 г. Русское название гельминтов — «кривоголовки». Основным источником инвазии паразита является человек. Размер этих гельминтов колеблется от 7 до 15 мм.
Анкилостомиды паразитируют в верхнем отделе тонкого кишечника, прикрепляясь при помощи хитинового аппарата ротовой капсулы к слизистой оболочке. Оплодотворенные самки выделяют яйца — бесцветные, прозрачные, овальной формы, с закругленными полюсами, покрытые тонкой оболочкой. Зародыш свежевыделенных яиц находится на стадии 2—4 бластомеров. Дальнейшее развитие яиц происходит
во внешней среде. При оптимальных условиях через сутки из них вылупливается рабдитовидная личинка (длиной 0,3 мм), которая через 2—4 суток после линьки достигает 0,5 мм длины. Развившаяся филяриевидная личинка еще раз линяет и при этом отделившийся эпидермис сохраняется на ней в виде чехлика. На этой стадии развития личинка инвазионна. Дальнейшее развитие ее и превращение в половозрелого паразита возможно лишь в организме хозяина.
Считают, что заражение анкилостомами происходит через рот — личинки заглатываются, попадают в кишечник без миграции по кровяному руслу и там развиваются во взрослых паразитов. Личинки некатора проникают в организм хозяина через кожу или слизистую рта, мигрируют по кровяному руслу, проходят через легкие и затем приживаются в тонком кишечнике.
Патологические изменения в организме при анкилостомидозах обусловлены в основном сенсибилизирующим воздействием на него паразита и характером питания последнего. Под влиянием действия личинок наступает механическое повреждение тканей в местах их нахождения и аллергизация организма за счет полисахаридных компонентов тканей личинок и продуктов их метаболизма. Паразитируя в кишечнике, половозрелые гельминты своим хитиновым вооружением ротовой полости ранят слизистую и поглощают вытекающую кровь. При этом они выделяют антикоагулянты крови, вследствие чего кровотечения бывают длительными.
Клинические проявления анкилосто-мидозов, связанные с проникновением и миграцией личинок, характеризуются появлением на коже жжения, зуда и крапивницы. Изменения в легких выражаются наличием эозинофильных инфильтратов, бронхопневмонии, бронхи
тов. Иногда наблюдаются озноб, лихорадка, кашель, сухие и влажные хрипы в легких. Число эозинофилов в крови увеличено. Кишечная фаза заболевания развивается через 4—6 недель после заражения. В этот же период появляются яйца паразита в фекалиях. Больные жалуются на общую слабость, сонливость, понижение аппетита, боли в подложечной области, головные боли, неустойчивый стул. Наблюдаются бледность кожных и слизистых покровов, одутловатость лица, отеки ног, в тяжелых случаях асцит. Иногда увеличиваются печень и селезенка. Кислотность желудочного сока понижается. Ведущим признаком является гипохромная железодефицитная анемия. СОЭ увеличена. В мазках крови — анизоцитоз, пойкилоцитоз, полихрома-тофилы и нормобласты.
Течение анкилостомидозов хроническое. Паразиты находятся в организме хозяина от нескольких месяцев до 20 лет. Клиническая картина болезни может быть различной — от крайне тяжелых декомпенсированных форм анемии до латентного течения (Шабловская, 1978).
При приеме бариевой взвеси обнаруживают признаки дискинезии и морфологические изменения преимущественно в проксимальных петлях тонкой кишки: грубую складчатость, гиперсекрецию, неравномерное контрастирование петель кишечника с преобладанием спазма.
Стронгилоидоз. Как заболевание известен с 1876 г. Вызывается раздельнополыми гельминтами из группы кишечных нематодозов. Русское название возбудителя — «кишечная угрица».
Самка паразита — мелкая полупрозрачная нитевидная нематода размером 2,2X0,07 мм. Ротовое отверстие ее окружено четырьмя губами. Из отложенных самкой яиц в слизистой оболочке кишечника вылупливаются раб
дитовидные личинки длиною 0,2-0,3 мм. Развитие рабдитовидных личинок во внешней среде может происходить различно.
Прямой, или простой, тип развития (без гетерогении) заключается в том, что рабдитовидные личинки удлиняются, половые зачатки уменьшаются, пищевод превращается в прямой цилиндрический, занимающий половину длины тела. Таким путем могут развиваться филяриевидные личинки. Длина их тела 0,5—0,6 мм.
Непрямой, или сложный, тип развития (гетерогения) отмечается у рабдитовидных личинок, у которых в процессе роста развиваются половые органы и они превращаются в свободно живущих раздельнополых особей с сохранением рабдитовидпого строения пищевода у обоих полов. Самцы паразита длиной 0,7 мм, хвостовой конец их крючкообразно загнут, имеет две спикулы, почти вся полость тела занята половыми органами. Длина самки 1 — 1,2 мм, матка ее открывается наружу коротким влагалищем. Сквозь прозрачную оболочку тела просвечивают эллипсоидные яйца (до 30—40 штук). Из отложенных самкой яиц вновь вылупливаются рабдитовидные личинки, которые превращаются в инвазионных филяриевидных или снова в раздельнополых свободно живущих особей.
Развитие одной и той же генерации рабдитовидных личинок во внешней среде может происходить прямым и непрямым путем (смешанный тип развития) .
Филяриевидные личинки, являясь инвазионными, проникают в организм человека через кожу или слизистую оболочку рта и пищевода. С током крови или лимфы личинки достигают полости сердца, откуда заносятся в легкие, проникают в альвеолы и по воздухоносным путям попадают в глотку и затем в ЖКТ. Полагают, что ко
пуляция самцов и самок происходит в легких и в кишечнике, после чего самцы погибают. Одпако существование паразитических самцов окончательно не доказано. Считают, что размножение паразитической генерации происходит путем партеногенеза.
Ведущим симптомом в патогенезе стропгилоидоза является сенсибилизация организма вследствие антигенного раздражения паразитическими самками, имеющими преимущественно тканевую локализацию в толще слизистой оболочки кишечника, а также мигрирующими личинками паразита. Это отмечается не только при свежем заражении, но и в результате аутоинвазии. Явление объясняется возможностью развития рабдитовидных личинок в филяриевидные в полости кишечника хозяина без выхода во внешнюю среду (так называемый внутрикишечный тип развития).
Показателями аллергических реакций при стронгилоидозе служат эозинофилия крови, тканевая эозинофиль ная инфильтрация в легких и ки-шечницсз, крапивница на коже. К локальным реактивным изменениям в местах обитания паразита приводит, наряду с механическим раздражением, также воздействие ферментных систем и продуктов его метаболизма, вызывающее воспалительно-деструктивные процессы.
Клиническая картина: стронгилои-доз — заболевание с длительным течением, не имеющее тенденции к самоизлечению, с выраженной сенсибилизацией организма и поражением различных систем и органов. Это обусловливает неспецифичность и полиморфизм клинических проявлений. Первой в патологический процесс вовлекается кожа. Длительность инкубационного периода и клиника начальных стадий стронгилоидоза известны благодаря опытам самозаражения. В об-
ласти накожной аппликации филяриевидных личинок наблюдаются быстрое образование красных пятнышек, отечность и легкий зуд, которые вскоре исчезают. На 3—4-й день возникают кратковременный кашель и ощущение жара в груди. Через 2—3 недели после заражения отмечаются диспепти-ческие явления, боли в животе, диарея, тенезмы, эозинофилия достигает 40 %. В этот же период появляются рабдитовидные личинки паразита в фекалиях. Затем острота клинических проявлений сглаживается, эозинофилия медленно снижается.
Выделяют 3 основные клинические формы стронгилоидоза поздней стадии. Для желудочно-кишечной формы характерны неустойчивый стул, диспеп-тические явления, боли в животе, чаще в эпигастральной области, снижение кислотности желудочного сока, спастический колит, катарально-эрозивный проктосигмоидит. Дуодено-желчпопу-зырный стронгилоидоз провляется болевым синдромом, вызванным дискинезиями 12-перстной кишки и желчных путей, а также дуоденитами. Обе эти формы сопровождаются умеренной эозинофилией крови. Нервно-аллергическая форма заболевания сопровождается функциональными расстройствами нервной системы, крапивницей, зудом кожи и высокой эозинофилией крови. Все эти формы, нередко сочетаясь между собой, составляют основной синдром стронгилоидоза. В патологический процесс при стронгилоидозе может вовлекаться дыхательная система (клинически это выражается наличием эозинофильных инфильтратов в легких, кашлем с выделением мокроты и нахождением в пей личинок ндразита), а также мочевыводящие пути и орган зрения.
При стронгилоидозе возможен широкий диапазон взаимоотношений между хозяином и паразитом — от крайне тя
желых форм со смертельным исходом до латентного течения инвазии.
Клинически заподозрить стронгилоидоз можно на основании следующих признаков: 1) функционального нарушения деятельности пищеварительной и нервной систем; 2) эозинофилии крови, периодических уртикарных высыпаний и зуда кожи; 3) хронического течения заболевания с периодическими ремиссиями и обострениями (Шабловская, 1978).
Рентгенологически обнаруживают дискинезию кишечника, отек и набухание складок слизистой оболочки, эрозии, а в далеко зашедших случаях — стриктуры и стенозы. Петли тонкой кишки вытеснены из центральной части живота конгломератом увеличенных лимфоузлов. Нередко наблюдаются остеопороз и частичное рассасывание сакроилеальных соединений.
Окончательный диагноз ставится только при обнаружении личинок паразита в фекалиях, дуоденальном содержимом, иногда в мокроте и в рвотных массах, очень редко — в моче. В обнаружении личинок возбудителя стронгилоидоза наиболее эффективен метод Бермана.
Тениидозы. В группу тениидозов входят 2 инвазии: тениаринхоз и тениоз. Это цестодозы, вызываемые в первом случае бычьим цепнем и во втором — свиным цепнем.
Бычий цепень имеет плоское, лентовидной формы тело (стробилу) размером 6 — 7 м, состоящее из 1000—2000 члеников (проглотид). Округло-квадратной формы головка снабжена 4 сильно развитыми присосками. Концевые зрелые членики гельминта длинные и узкие, заполнены развитой маткой, представленной центральным стволом с боковыми ответвлениями — от 16 до 32 с одной стороны. Членики средней части тела — гермафродитного строения. Зрелые членики бычьего цепня обладают
самостоятельной подвижностью. Яйца окружены тонкой легко разрушающейся оболочкой. Внутри находится зародыш с 3 парами крючьев (онкосфера), покрытый плотной радиально исчерченной оболочкой коричневого цвета. Размеры онкосферы — 0,03 —0,04 X X 0,02-0,03 мм.
Цикл развития бычьего цепня осуществляется при участии двух хозяев. Окончательным хозяином может быть только человек. Промежуточные хозяева — крупный рогатый скот. Бычий цепень паразитирует в тонком кишечнике человека. Зрелые концевые членики отторгаются от стробилы и активно или пассивно (при дефекации) выделяются во внешнюю среду. При их разрушении освобождаются яйца с онкосферами. Промежуточные хозяева, проглатывая онкосферы, заражаются финнозом. В мышцах сердца, языка, жевательных, скелетных образуются цистицерки, или финны. Эти пузырьковидной формы личинки со ввернутым внутрь сколексом размерами от просяного зерна до горошины инвазион-ны для человека. При попадании в кишечник человека из финны через 3 мес. вырастает половозрелая особь. Длительность паразитирования ее исчисляется годами и десятками лет.
В патогенезе тениаринхоза важное значение имеет механическое и нервнорефлекторное влияние бычьего цепня. Оно связано с мощной фиксацией присосок, регулярным активным продвижением члеников, вызывающих раздражение нервно-мышечного аппарата кишечника. Определенную роль играет нарушение питания, обусловленное всасыванием гельминтом пищевых веществ из кишечника, а также токсико-аллергическое действие продуктов его жизнедеятельности.
Клиническая картина: типична жалоба больных на активное отхождение члеников и ощущение перианального
зуда. Часто бывают схваткообразные боли в животе, иногда симулирующие аппендицит, повышенный аппетит, нарушение стула, реже — тошноты и рвоты.
Несмотря на хороший аппетит, больные худеют, у них отмечаются слабость, головная боль, головокружение, небольшая эозинофилия, незначительное снижение уровня гемоглобина. Показатель СОЭ при этой инвазии нормальный.
В диагностике тениаринхоза наиболее эффективна комбинация методов опроса о выделении члеников с исследованием перианально-ректального соскоба (96,6%). Опрос должен быть индивидуальным, доверительным, с демонстрацией члеников. Эффективность одного опроса 88,9 %, соскоба — 80,8 %. Важное значение имеет макроскопическое исследование члеников.
В сомнительных случаях проводят «провокацию» — накануне вечером дают 30 г тыквенных семян, через час — слабительное, а на следующий день промывают фекалии, чтобы обнаружить членики. В качестве дополнительных способов диагностики могут применяться копроовоскопические — по методу Калантарян, по этому же методу в модификации Брудастова и Красноноса, толстый мазок по методам Като, Фюл-леброна (Лукшина, 1978).
При рентгенологическом исследовании в петлях тонкой кишки выявляются длинные причудливые просветления, отражающие наличие взрослых цепней, длина которых достигает нескольких метров. В отличие от аскарид у цепней пет пищеварительного канала.
Свиной, или вооруженный, цепень — цестода длиной 1,5—2 м. Стробила состоит из 800 — 1000 члеников. Сколекс имеет 4 присоски и венчик хитиновых крючьев. Членики тонкие, нежные, не обладают самостоятельной подвижностью. Гермафродитные членики в отличие от таковых бычьего цепня имеют
яичник с третьей добавочной долькой. В зрелом членике число боковых ответвлений матки не превышает 12 с одной стороны. Яйца и онкосферы морфологически подобны яйцам и онкосферам бычьего цепня.
Окончательный хозяин — человек, промежуточный облигатный — свинья, факультативный — человек. С испражнениями больного человека выделяются членики. Свиньи, поедая нечистоты, заражаются финнозом. Уже через 2— 3 мес. после инвазии свиней онкосферами последние превращаются в пузырьковидные финны с вооруженным сколексом. Человек, поедая свиное фи-нозное мясо, заражается тепиозом, о чем свидетельствует выделение члеников при дефекации через 2—3 мес.
Свиной цепень обитает в верхней части тонкого кишечника. Фиксируясь в слизистой оболочке присосками и крючьями, он раздражает кишечную стенку. Выражены и другие механизмы патогенного действия: поглощение питательных веществ стробилой гельминта, токсико-аллергическое влияние продуктов жизнедеятельности.
Клиническая картина: симптоматология тениоза полиморфна. Больные жалуются на выделение члеников, но они выходят только пассивно, что не сопровождается субъективными нарушениями. Из других жалоб указывают на изменение аппетита, тошноту, рвоту, боли в животе, нарушение стула, головные боли, головокружение. Изменения со стороны крови малохарактерны, у некоторых больных отмечаются эозинофилия и гипохромная анемия (Лукшина, 1978).
Диагностика тениоза несовершенна, хотя при ней применяются те же методы, что и при тениаринхозе. Конечно, решающее значение имеет обнаружение и макроскопическое исследование члеников: по числу боковых ответвлений матки их легко отдиф
ференцировать от члеников бычьего цепня. Рентгенологическая картина аналогична таковой при тениаринхозе.
Лямблиоз тонкой кишки. Лямблиоз — протозойная болезнь, вызываемая кишечной лямблией и характеризующаяся фунциональными расстройствами тонкой кишки. Лямблиозная инвазия встречается среди здорового населения повсеместно, независимо от климатических условий, и в среднем наблюдается у 10 % взрослых и у 30 % детей в возрасте от 2 до 5 лет.
Кишечная лямблия описана впервые в 1859 г. харьковским ученым Д. Ф. Лямблием, наблюдавшим этих простейших в фекалиях при диарее у детей.
Источник инвазии — только человек, выделяющий с испражнениями цисты, которые являются покоящейся стадией жизненного цикла лямблий. Заражение лямблиозом происходит алиментарным путем. Факторами передачи являются загрязненные фекалиями, содержащими цисты лямблий, руки, вода, пищевые продукты, предметы обихода. Цисты лямблий могут передаваться мухами, тараканами.
Продолжительность жизни лямблий в организме человека при отсутствии реинвазии колеблется от 3 до 40 дней, в среднем 4 недели. Они обитают на поверхности слизистой оболочки проксимального отдела тонкой кишки и не способны внедряться в ткань. Не исключено, что лямблии, обитая в зоне мембранного пищеварения, в ряде случаев могут быть причиной нарушения всасывания и дискинезий тонкой кишки.
Клиническая картина: в основном лямблиоз проявляется в форме бессимптомного носительства, и только в 10 — 12 % случаев отмечаются функциональные расстройства кишечника в виде поносов. В случаях массивности лям-блиозной инвазии может развиться энтеральный синдром, выражающийся
дискомфортом, болями тупого или реже схваткообразного характера в мезоэпи-гастралыюй области, диспептическими расстройствами (тошнота, метеоризм, неустойчивый стул).
Рентгенологически в кишечнике обнаруживают метеоризм, гиперсекрецию, неравномерное контрастирование, особенно 12-перстной и тощей кишок, ускоренное прохождение бариевой взвеси, набухание складок слизистой. Довольно часто у детей может иметь место синдром мальабсорбции. При правильно проведенных санитарно-гигиенических и лечебных мероприятиях можно быстро достигнуть ликвидации лямблиоза и нормализации рентгенологической картины.
Анисакиаз тонкой кишки. Аниса-киаз вызывается морскими нематодами. Заболевание распространено в Японии, где в пищу употребляют сырую рыбу. В последнее время заболевание встречается и в других странах.
Ведущим клипическиам симптомом является боль в эпигастрии и в нижних отделах живота. Симптом Щетки-на — Блюмберга положительный или слабо положительный, мышечное напряжение отсутствует. У всех больных прослушиваются усиленные кишечные шумы. Со стороны крови у больных определяется умеренный лейкоцитоз.
На обзорных рентгенограммах брюшной полости определяются горизонтальные уровни жидкости в различном количестве. При контрастном исследовании тонкой кишки обнаруживают неравномерное сужение участка кишки на протяжении около 20 см, различной степени расширение кишки проксимальнее суженного участка, утолщение кишечной стенки и расширенные отечные складки слизистой. У некоторых больных может быть выявлен нитевидный дефект наполнения, являющийся изображением паразита.
Глава 28. РЕДКИЕ ЗАБОЛЕВАНИЯ
Каждому рентгенологу в своей практической работе приходится встречаться с редкими заболеваниями тонкой кишки. Сведения о таких заболеваниях помогут улучшить качество диагностики.
Амилоидоз тонкой кишки. Является морфологической разновидностью амилоидоза, при котором амилоид откладывается по ходу ретикулярных волокон кровеносных сосудов кишечника. Вначале поражаются сосуды подслизистого слоя и брыжейки, затем — всех слоев стенки кишки.
Клинические признаки включают макроглоссию, потерю аппетита, тошноту, рвоту, изжогу, чувство тяжести в животе, гипотензию, поносы, кишечные кровотечения и другие симптомы.
Рентгенологическая картина заболевания своеобразная. Так, чаще всего
обнаруживают расширение просвета и утолщение складок слизистой оболочки кишечника, признаки дискинезии, иногда псевдообструкции. Типичный рентгенологический признак — так называемая еюнизация подвздошной кишки — появление в ней выраженных поперечных складок перистого вида. Могут иметь место и точечные дефекты слизистой в виде бариевых пятен диаметром около 2 мм. В кишечнике нередко наблюдается и опухолевидный амилоидоз с формированием плотных и бугристых узлов, напоминающих злокачественную лимфому. Диагнозу способствуют клиническая картина, биопсия и другие специальные методики исследования (Carlson, Breen, 1987; Smith, Cho, 1987).
Муковисцедоз тонкой кишки. Муко-висцедоз, или кистозный фиброз,—
врожденное аутосомно-рецессивное заболевание, при котором наблюдается распространенная дисфункция экзокринных желез. При муковисцедозе железы выделяют патологически вязкий секрет, богатый гликопротеидами. Из-за закупорки выводных протоков вязким секретом развивается кистозное перерождение желез. Содержимое кишечника приобретает замазкоподобную консистенцию и нередко вызывает механическое запирание кишки.
Клинически муковисцедоз проявляется болями в животе, похуданием, поносом, обильным стулом с примесью жира («жировой стул»), слабостью, потерей аппетита и другими симптомами расстройства пищеварения.
При рентгенологическом исследовании в нисходящем отделе 12-перстной кишки выявляются сглаживание рельефа слизистой, исчезновение зубчатости его стенок, а в петлях тощей и, реже, подвздошной кишки — утолщение и отек складок слизистой, иногда расширение просвета кишки. Нередко комочки слизи, прилипшие к стенкам кишки, могут симулировать картину множественных полипов.
Мастоцитоз тонкой кишки. Мастоцитоз кишечника — одно из проявлений мастоцитоза — хронической болезни, характеризующейся пролиферацией лаб-роцитов (тучных клеток) ретикулоэндотелиальной системы. Эта система стимулирует фиброз и неспецифическую клеточную инфильтрацию.
Клиническая картина характеризуется появлением на коже красно-коричневых пятен, гепатоспленомегалией, болями в животе, рвотой, поносом, непереносимостью алкоголя.
Рентгенологически обнаруживают набухание складок слизистой оболочки, утолщение стенки кишки, множественные мелкие дефекты наполнения в просвете кишечника. При тяжелых формах течения мастоцитоза кишка приобретает
вид ригидной трубки, рельеф слизистой исчезает.
Гистоплазмоз тонкой кишки. Инфекционная болезнь из группы системных микозов, вызываемых грибком гистоплазмой. Кишечная форма гистоплазмоза характеризуется гиперплазией элементов ретикулоэндотелиальной системы тонкой кишки. Ниболее часто наблюдается у детей.
Со стороны кишечника клинически проявляется поносами. Больные истощены, имеют место спленомегалия, лихорадка и другие симптомы.
Рентгенологически обнаруживают сужения дистального отдела подвздошной кишки из-за множества полипо-видных дефектов наполнения, типер-секрецию, гипоэвакуаторную дискинезию тонкой кишки. Хроническое течение и характер рентгенологических изменений напоминают таковые при болезни Крона.
Пневматоз стенки тонкой кишки. Характерно наличие пузырьков газа в стенке кишки. Различают первичный и вторичный пневматоз. Этиопатогенез этого состояния не совсем ясен.
При субсерозном расположении пузырьков газа клинические проявления, как правило, отсутствуют. Но если произойдет разрыв этих воздушных кист, то возникает спонтанный пневмо-перитонеум. При распространенном пневматозе, особенно с локализацией пузырьков газа в подслизистом слое, возможен их прорыв и повреждение слизистой оболочки, что проявляется кишечными кровотечениями и поносами.
Рентгенологическая картина: на обзорном снимке живота можно обнаружить свободный газ в брюшной полости (пневмоперитонеум) без признаков перитонита, а также тонкостенные кистовидные просветления по ходу петель кишечника. При бариевом контрастировании кишечника подслизистый и
внутримышечный пневматоз проявляется множественными мелкими дефектами наполнения. Рельеф слизистой образован утолщенными, отечными склад ками, просвет кишки сужен. Прохождение бариевой взвеси по кишечнику ускоренное.
Интрамуральная гематома 12-перстной кишки. Под интрамуральной ге матомой понимают оиухолеиодобиое скопление излившейся крови в стенке кишки. Такие гематомы бывают травматического и нетравматического происхождения. Первые встречаются при закрытой травме живота, особенно в результате прямого удара в живот. В таких случаях происходит разрыв подслизистых и субсерозных сосудов без повреждения слизистой и серозной оболочек и скопление крови в толще стенки кишки.
Интрамуральная гематома нетравматического происхождения возникает в результате нарушения свертываемости крови при гемофилии, остром лейкозе, на фоне антикоагулянтной терапии. Возникновение интрамуральной гематомы 12-перстной кишки описано при узелковом периартериите, разрыве аневризмы гастродуоденальной артерии, после холецистэктомии и холедохото-мии. Среди причин, вызывающих интрамуральную гематому 12-перстной кишки, следует назвать разрушение сосудов кишки опухолями, ложной кистой поджелудочной железы, варикозное расширение вен 12-перстпой кишки (Пономарев и др., 1987).
По клиническому течению заболевания больных делят на две группы. К первой группе относятся больпыс, у которых заболевание протекает медленно, непосредственно после травмы отсутствуют какие-либо признаки болезни, состояние больных в течение дли тельного времени остается удовлетворительным. Такие больные поступают в лечебное учреждение с клинической
картиной непроходимости 12-перстной кишки. Воли локализуются в эпигастральной области, иррадиируют кзади. Локализация болей в правой подреберной области свидетельствует обычно о повреждении проксимальной ча сти 12 перстной кишки, а слева о повреждении ее дистальной части и тощей кишки. При локализации гематомы в задней стенке забрюшинной части 12-перстной кишки у мужчин боли в некоторых случаях иррадиируют в оба яичка вследствие реактивного воспаления забрюшинной клетчатки и распространения выпота книзу. Иногда боли по такому же механизму перемещаются в правую подвздошную область, и этим больным ошибочно производится аппендэктомия.
По истечении 1-й недели после травмы развиваются симптомы непроходимости 12-перстпой кишки. При осмотре больного можно обнаружить умеренное вздутие живота в верхней части, в половине случаев удается прощупать инфильтрат в брюшной полости, а при сотрясении брюшной стенки слышен шум плеска. Если гематома сдавливает общий желчный проток, обнаруживается симптом Курвуазье (в 6%). Повышается содержание амилазы в крови и моче, что обусловлено травматическим панкреатитом. При упорной рвоте больные обезвоживаются, развиваются гипохлоремия, гипокалиемия, вторичная анемия и похудание. В большинстве случаев наблюдается лейкоцитоз.
У больных второй группы (10 — 30 %) болезнь протекает остро и требует неотложного хирургического лечения. В таких случаях клиническая картина отягощается нарастающим травматическим панкреатитом, внутрибрюшинным кровотечением, повреждением печени и т. д.
Рентгенологически при просвечивании определяются расширение желудка
и 12-перстной кишки с уровнем жидкости, отсутствие газа в топкой кишке и сглаженность контуров поясничных мышц. На фоне газа в желудке и 12-перстной кишке бывает видна тень гематомы. Если гематома забрюшинная, с помощью внутривенной урографии можно увидеть смещение мочеточника кнаружи. При рентгеноконтрастном исследовании желудка и 12-перстной кишки определяется сужение кишки, складки ее принимают вид колец растянутой пружины. Этот признак считается патогномоничным для интрамуральной гематомы 12-перстной кишки. В случае обширных гематом складки слизистой оболочки представляются в виде частокола.
Грыжа Трейтца. Это так называемая грыжа 12-перстно-тощсго кармана, при которой нарушается проходимость 12-перстной кишки.
Клиническая картина: больные жалуются на приступы болей в верхней части живота с иррадиацией в поясницу, проявляющиеся через 2—3 ч после еды. Боли сопровождаются вздутием живота, отрыжкой, тошнотой и рвотой. Продолжаются они недолго и проходят самостоятельно. Чаще всего в таких случаях подозреваются язвенная болезнь, панкреатит, холецистит. Появление шаровидной, мягкоэластичной опухоли в области пупка свидетельствует об ущемлении грыжи и развитии высокой кишечной непроходимости (Ефремов, Эристави, 1969).
При контрастировании пищеварительного тракта характерным признаком этих грыж считается смещение 12-перстной кишки вправо от верхней части луковицы, а тощей кишки — вправо и кзади. Исследование больного должно проводиться в вертикальном положении. При правых грыжах тело желудка смещается вниз и влево, а привратник и антральный отдел остаются на своем месте. Если грыжи ле
вые, желудок располагается высоко над петлями тонкой кишки.
Синдром мезентериального обкрадывания (брюшная жаба). Сочетание острых болей в животе со спазмом мезентериальных сосудов и ишемией стенки кишечника, развивающееся вскоре после приема пищи.
Чаще всего такое состояние возникает на фоне атеросклеротических поражений брюшной аорты и ее ветвей, нередко при их сочетанном поражении. Одни морфологи и клиницисты считают, что атеросклерозом наиболее резко и часто поражается верхняя брыжеечная артерия, реже — нижняя и еще реже — чревный ствол. Другие авторы отмечают значительно большую частоту поражения чревного ствола и меньшую — верхней брыжеечной артерии.
Следует помнить, что поражение чревного ствола наиболее часто наблюдается в результате экстравазальной компрессии (обычно серповидной связкой диафрагмы при врожденном заболевании). Верхняя брыжеечная артерия поражается несколько чаще при неспецифичсском аортоартсриите, причем в этом случае одновременно страдают несколько ветвей висцеральных артерий на большом протяжении. Нижняя брыжеечная артерия поражается чаще других и процесс обычно переходит с аорты на проксимальные сегменты.
Поражение висцеральных артерий в результате экстравазальной компрессии, как правило, наблюдается у лиц молодого возраста, при неспсцифи-чсском аортоартериите — чаще у женщин в возрасте 35—40 лет, атеросклерозе — преимущественно у мужчин в пожилом возрасте.
Клиническая картина характеризуется возникновением приступов болей в животе (обычно в зпи- и мезогастраль-ной области, а нередко и по всему животу) в период наибольшей функци-
опальной активности органов пищеварения. Поэтому некоторые больные ограничивают себя в еде из-за боязни болей или вызывают искусственную рвоту, что может приводить к выраженному похуданию. Нередко болевому синдрому предшествует чувство дискомфорта, тяжести в животе или в подложечной области. Часто это сопровождается метеоризмом, отрыжкой, а в последующем — расстройством стула. На высоте болей может повышаться артериальное давление.
По механизму возникновения болей синдром сходен с приступом грудной жабы, что послужило основанием назвать его субдиафрагмальной «стенокардией». В результате расстройства кровообращения могут появляться обширные кровоизлияния и омертвения кишечной стенки. Описаны многочисленные случаи, когда причиной инфаркта кишечной стенки был длительный спазм’ брыжеечных артерий (чаще — верхней) без их закупорки тромбом или эмболом. Приступы болей в животе обычно возникают у лиц пожилого возраста при выраженном атеросклерозе аорты и других артерий, в том числе коронарных. Чаще всего сильная боль наступает внезапно, а болевой синдром может продолжаться от нескольких минут до нескольких (1 — 2) часов, периодически ослабевая или усиливаясь. Иногда появление болей связано с физическим напряжением. Возможно сочетание грудной и брюшпой жабы; нередко вслед за приступом боли в животе развивается приступ стенокардии и наоборот. Болевой синдром ослабевает или прекращается после приема валидола, нитроглицерина и введения спазматических средств, что может указывать на роль спазма сосудов в его происхождении. У части больных на фоне болей в животе и метеоризма возникают интермиттирующие зловонные поносы (Иванов и др., 1988).
Во время острых болей живот остается мягким при пальпации, иногда отмечается болезненность. Важным диагностическим признаком поражения висцеральных артерий является систолический шум над их проекцией. Чаще всего шум выслушивается по средней линии на 2—4 см выше пупка, реже — несколько правее от средней линии живота. Аускультацию следует проводить, слегка прижимая фонендоскоп к передней брюшной стенке.
На мысль о сосудистом генезе болей в животе могут навести признаки поражения других артерий: ослабление или отсутствие пульсации на артериях конечностей, шумы над проекцией крупных артерий (сонных, надключичных, подкрыльцовых, бедренных, почечных).
У некоторых больных наблюдаются стертые формы ишемии без приступов острых болей: чувство тяжести, дискомфорта, неприятные ощущения в животе, сопровождающиеся метеоризмом, расстройством стула.
Тяжелым осложнением брюшной жабы является тромбоз мезентериальных сосудов, заканчивающийся, как правило, инфарктом кишки и перитонитом. Почти у половины больных с мезентериальным тромбозом последний возникал на фоне стенотического поражения артерий, вызванного атеросклеротическими изменениями.
В зависимости от тяжести течения различают 3 формы мезентериальной сосудистой недостаточности: I — преходящая (без последующих анатомических изменений); II — с обратимыми анатомическими изменениями (типа кровоизлияний в стенку кишки) и III — с развитием некрозов (инфарктов кишечной стенки) с последующим перитонитом. А. В. Покровский и соавт. (1982) в течении хронических нарушений висцерального кровообращения выделяют 3 стадии: I — компенсирован-
пая; II —субкомпенсации; III —декомпенсации.
Диагноз брюшной жабы прежде всего клинический, но чтобы его установить, надо помнить об этой патологии. У пожилых людей чаще, чем принято считать, нарушения функции пищеварительных органов обусловлены их ишемическим состоянием в результате атеросклероза аорты и мезентериальных артерий. Такие расстройства кровоснабжения могут сопровождаться выраженными изменениями секреторной и моторной функций аппарата пищеварения, трофическими нарушениями, иногда с образованием эрозий и язв, которые в отдельных случаях осложняются кровотечением. Нередко наблюдается сахарный диабет. Хроническая ишемия мо
жет вести также к развитию энтеропатии с нарушением переваривания и ассимиляции пищевых продуктов, что проявляется прогрессирующим похуданием.
Рентгенологически на обзорных снимках живота иногда удается обнаружить вкрапления кальция в местах атеросклеротического поражения артерий. Контрастирование кишечника бариевой взвесью выявляет признаки дискинезии кишечника с ускоренным продвижением контрастного вещества и наличие воспалительного процесса, в ряде случаев с участками изъязвления стенок кишки. Для диагностики ишемического процесса в стенке кишки важное значение имеет и селективная брыжеечная артериография.
Глава 29. РЕНТГЕНОЛОГИЯ ТРАВМАТИЧЕСКИ ПОВРЕЖДЕННОЙ И ОПЕРИРОВАННОЙ Тонкой кишки
Травмы живота составляют*0,5 —1 % общего количества повреждений мирного времени, из них 54—62 % относятся к закрытым. Основную массу пострадавших с закрытой травмой живота доставляют в лечебные учреждения в состоянии травматического шока. Характер оперативных вмешательств может быть самый разнообразный: ушивание отверстия, резекция сегмента, пластика и др.
Некоторые особенности рентгенологического исследования
Исследование больных с повреждениями органон пищеварения и с выраженным клиническим синдромом острого живота должно проводиться в самые короткие сроки и с максимальной эффективностью. Выбор объема и
методики рентгенологического исследования должен быть индивидуальным в зависимости от общего состояния пострадавшего. Желательно во всех случаях проводить рентгеноскопию органов грудной клетки и брюшной полости при различных положениях больного с последующей рентгенографией. Если состояние больного не позволяет выполнить рентгеноскопию, исследование ограничивается производством обзорных рентгенограмм.
В послеоперационном периоде контрастное вещество можно применять в любые сроки. При подозрении на несостоятельность швов используют только водорастворимые контрастные вещества. Вариевая взвесь разрушается обычно спустя 2—3 недели и позже после операции. Для тугого заполнения кишки, а также лучшего контрастирования соустья с тощей кишкой или
общим желчным протоком бариевую взвесь под контролем просвечивания вводят через зонд, выполняя серию прицельных снимков в условиях обыч ного и двойного (барий и газ) контрастирования. Исследование проводят в горизонтальном (па спине и животе) положении больного. При необходимости, например с целью дифференциальной диагностики органических и функциональных изменений, его дополняют релаксационной дуоденографией. В сомнительных случаях прибегают к дуоде-носкопии с биопсией.
Рентгенологическая картина оперированной тонкой кишки во многом определяется характером и объемом операции, сроками, прошедшими после ее выполнения, а также наличием в кишке патологических изменений. В связи с этим, приступая к рентгенологическому исследованию таких больных, необходимо выяснить конктерные особенности имевшей место операции.
Рентгенологическая картина поврежденной тонкой кишки
Наиболее часто повреждаются фиксированные отделы тонкой кишки: тощая кишка вблизи позадиподжелудочной фасции (фасции Трейтца), терминальный отрезок подвздошной кишки, реже — забрюшинные отделы 12-перстной кишки.
Общими рентгенологическими признаками, указывающими на «неблагополучие» в брюшной полости, являются: свободный газ в брюшной полости, скопление газа и жидкости в органах, изменение топографических взаимоотношений, величины и положения органов живота, нечеткость их контуров, свободная жидкость или наличие инфильтративных теней в брюшной полости, инородные тела и другие симптомы.
Травматические повреждения 12-
перстной кишки встречаются в среднем в 3—5 % случаев повреждений кишечника. Различают полное или неполное повреждение. При разрыве луковицы и передней стенки 12-перстпой кишки газ и кишечное содержимое поступают в брюшную полость. Ренгенологически это проявляется наличием ппевмопери-тонеума над печенью и свободной жидкости в правом латеральном канале и между кишечными петлями, ограниченностью подвижности правого купола диафрагмы, наличием в желудке значительного количества жидкости с горизонтальным уровнем (в связи с рефлекторным спазмом привратника).
При разрыве забрюшинного отдела 12-перстной кишки газ и кишечное содержимое медленно распространяются в забрюшинном пространстве, обусловливая соответствующую рентгенологическую картину забрюшинной эмфиземы. Если количество газа небольшое, отмечается узкая полоска просветления вдоль контура одной из поясничных мышц или вблизи одной из почек. При большом количестве газа на его фоне отчетливо контурируются тени почек, поясничные мышцы и ножки диафрагмы. Иногда газ определяется в виде скопления мелких пузырьков, чаще справа. Газ в забрюшинном пространстве не меняет формы и положения. Почти в 50 % случаев вне-брюшинные разрывы 12-перстной кишки сочетаются с повреждениями поджелудочной железы.
Если повреждение 12-перстной кишки неполное, образуется интрамуральная гематома — скопление крови в подслизистом или мышечном слое кишечной стенки. Чаще всего она возникает в области нисходящей части кишки вблизи нижнего ее угла, так как именно этот участок кишки в момент травмы оказывается прижатым к позвоночнику. Рентгенологически выявляются резкое расширение желудка с наличием в нем
большого количества жидкости и воздуха, вздутие начальных отделов 12-перстной кишки, замедленное продвижение контрастного вещества по ней, длительная задержка контрастной массы в желудке и начальных отделах 12-перстной кишки, выраженное сужение просвета дистальной части кишки на уровне гематомы с наличием краевых дефектов наполнения. Выше места сужения просвет кишки расширен, складки слизистой оболочки на этом участке отечны, тесно прилегают друг к другу. На обзорных рентгенограммах обнаруживают и признаки забрюшинной гематомы: затемнение поясничной области, отсутствие четкой тени правой почки и правой большой поясничной мышцы. В случае больших гематом возможно смещение желудка кверху, а толстой кишки книзу. Внутривенная холецистохолан-гиография обнаруживает в части случаев расширение желчных путей. При артериографии наблюдается оттеснение (смещение) желудочно-12-перстной артерии кнаружи.
Травматические повреждения тощей и подвздошной кишок бывают наиболее часто при травмах живота, причем подвздошная кишка повреждается чаще тощей. В ней, как правило, наблюдаются множественные разрывы, а в тощей — одиночные. Рентгенодиагностика разрывов тонкой кишки основывается на установлении рентгенологических (свободный газ в брюшной полости) и косвенных признаков, позволяющих заподозрить ее повреждение (симптом свободной жидкости в брюшной полости, появление изолированного вздутия одной из петель тонкой кишки — на уровне разрыва). Газ за пределами кишечника иногда может определяться в виде скопления мелких газовых пузырьков, располагающихся вблизи места разрыва. Выше места повреждения может обнаруживаться нерезко выраженное локальное вздутие отдель
ных петель тонкой кишки с образованием 1 — 2 мелких «воздушных арок» с нечетко выраженными горизонтальными уровнями жидкости. При развивающемся перитоните появляются признаки вздутия желудка и кишечника с горизонтальными уровнями жидкости.
Рентгенологическая картина оперированной тонкой кишки
Знание наиболее часто встречающихся вариантов хирургических вмешательств на тонкой кишке облегчает анализ рентгенологической картины. Оперативные вмешательства на 12-пер-стной кишке могут ограничиться либо только кишкой (дуоденотомия, дуо-деностомия, ушивание прободной язвы или раневого отверстия), либо сочетаться с операцией на желудке, тощей кишке (дуоденоеюностомия), поджелудочной железе или желчных путях.
Ушивание прободной язвы, раневого или операционного отверстия сопровождается деформацией и некоторым сужением просвета кишки в области операционного шва, появлением неровности контуров стенки, а также деформацией рельефа слизистой оболочки. При этом эластичность стенки и ее перистальтическая способность, как правило, существенно не нарушаются.
После резекции тонкой кишки могут быть сформированы разные анастомозы, а именно: конец в конец, бок в бок и анастомоз 3/4 по А. В. Мельникову. При этом хирурги используют узловой и непрерывный, П-образный швы. Узловой шов не сужает просвет кишки, дает возможность кишке расширяться во время перистальтики. Непрерывный шов вызывает сужение просвета кишки: на рентгенограмме выглядит как стриктура.
Более физиологичным является анастомоз конец в конец. Но из-за трудностей осуществления операции (часто
хирург шьет ткани вслепую, ощупью, стараясь не проколоть стенку кишки насквозь) могут возникать гематомы при повреждении прямых артерий. Если же хирург предупреждает увеличение гематомы с помощью лигирования прямых артерий, то это приводит к нарушению питания зоны анастомоза, к ишемии стенки кишки. Развивается несостоятельность швов анастомоза, которая диагностируется по выходу контрастного вещества в брюшную полость.
Некоторые авторы используют полузакрытые методы формирования межкишечных анастомозов конец в конец. Для этого конец кишки на уровне резекции закрывают, прошивая его лигатурой насквозь через обе стенки по типу матрацного шва, или прокалывают таким же образом длинными инъекционными иглами. После этого накладывают краевой серозно-мышечный шов без захватывания слизистой по всему периметру будущего анастомоза. Заканчивают формирование анастомоза накладыванием второго ряда серозно-мышечных швов.
Анастомоз конец в конец, как правило, используют у взрослых и детей старшего возраста. Анастомоз бок в бок накладывают у новорожденных, у больных с наличием воспалительного процесса в зоне анастомоза, а также если хирург не владеет техникой формирования анастомоза конец в конец.
При свищах, разрывах и ранениях кишки во время операции стараются сохранить ее брыжеечный край, выполняя анастомоз 3/4 по А. В. Мельникову. Поврежденную часть кишки иссекают и сохраняют брыжеечную ее часть. Образуется большой дефект по длине кишки, который ушивают двумя рядами швов в поперечном направлении. В результате такой методики кишка в зоне анастомоза расширяется, сосуды в области брыжейки не повреждаются, не покрытая брюшиной часть стенки киш
ки остается интактной. Благодаря всем этим мерам анастомоз получает хорошее кровоснабжение, брюшина плотно прилегает между швами, опасность несостоятельности швов значительно уменьшается.
Гастродуодено- и еюнодуоденостомия сопровождаются явной деформацией 12-перстной кишки и рельефа ее слизистой оболочки в области соустья. Характер деформации и ее степень определяются конкретными особенностями выполненной операции, а также состоянием анастомоза. При нормально функционирующем соустье контрастная масса свободно поступает в нижележащие отделы кишечника. Пассаж ее резко замедляется при анастомозите, рубцовых и других сужениях желудочно-кишечного или межкишечного соустья. В последнем случае может развиться дуоденостаз. Сужение и деформация соустья держатся стойко, не исчезая даже под влиянием спазмолитических препаратов.
После папиллэктомии степень деформации стенки и просвета кишки зависит от объема выполненной операции, определяемого характером процесса (доброкачественный или злокачественный) и его распространенностью, а также от способа наложения соустья между кишкой и общим желчным или панкреатическим протоком. При ТБЗ такой кишки взвесь обычно легко проникает ретроградно через соустье в протоки, вызывая их контрастирование.
Желчевыводящие билиарно-дигес-тивные анастомозы имеют характерную рентгенологическую картину: на фоне заполненных барием 12-перстной и верхних петель тощей кишки отчетливо видны соустье и ретроградно контрастированные желчные протоки. Выполняя серию прицельных рентгенограмм, стремятся изучить функцию соустья и состояние прилегающих к нему участков кишки.
Раздел
ТОЛСТАЯ КИШКА
Г л а в а 30. РЕНТГЕНОАНАТОМИЯ И ФИЗИОЛОГИЯ
Рентгенологическому изучению и анализу нами подвергнута толстая кишка у 300 здоровых людей, в том числе у 103 женщин и 197 мужчин.
Рентгенологические особенности
Толстая кишка — конечный отдел пищеварительного тракта, который идет от места впадения тонкой кишки до анального отверстия. В ней завершается переваривание и всасывание пищевых веществ, происходит всасывание воды и образование кала. Толстая кишка включает слепую кишку с червеобразным отростком, ободочную и прямую кишки. В свою очередь ободочная кишка состоит из восходящей, поперечной, нисходящей, сигмовидной кишок. При переходе восходящей кишки в поперечную ободочную образуется правый, или печеночный, изгиб, при переходе поперечной в нисходящую ободочную — левый, или селезеночный, изгиб.
Варианты формы и положения, длины и диаметра толстой кишки весьма вариабельны и зависят от конституции и пола, фиксации изгибов кишки, степени ее контрастирования, тонуса брюшной стенки и других факторов.
Чтобы было удобно анализировать рентгеновское изображение толстой кишки, ее целесообразно делить на 5 сегментов (отделов): I — правая половина, включающая слепую кишку, восходящую кишку и печеночный из
гиб; II — поперечная ободочная кишка, исключая печеночный и селезеночный изгибы; III — левая половина, включающая селезеночный изгиб и нисходящую кишку; IV — сигмовидный отдел; V — прямая кишка.
В рентгеновском плоскостном изображении толстая кишка характеризуется равномерной бугристостью контуров, обусловленной наличием двух рядов гаустр. После опорожнения кишки от бариевой взвеси определяются складки слизистой, средний диаметр которых около 2 — 3 мм. Рисунок складок различный. Так, в правой половине кишки преобладают поперечные складки и складки смешанного направления, а в левой половине — продольные. В процессе( исследования направление складок нередко меняется. При раздувании просвета кишки воздухом формируется нормальная гаустрация.
В связи с внедрением в практику УАР-1 и УАР-2 создалась возможность объективно анализировать рентгеновский силуэт толстой кишки, а именно оценивать его количественно (площадь, периметр, условный объем и др.). По сравнению с ранее опубликованными данными (Михайлов, 1983) предлагаем новые уточненные рентгеноколонопла-ниметрические показатели (табл. 1).
Диаметр просвета в разных отделах туго заполненной бариевой взвесью толстой кишки колеблется в больших пределах (табл. 2).
Если принять диаметр просвета I сегмента толстой кишки за 1,0, то как при ТЗ, так и при введении воздуха во II сегменте он будет равняться 0,6, в III — 0,5, в IV — 0,4 и в V сегменте — 1,14 (Р<0,01).
Периметр толстой кишки при ТБЗ ее был от 188,3 см до 339,9 см, в среднем 258,6 ±11,9 см. При раздувании воздухом размеры периметра колебались от 212,0 см до 379,9 см (средний показатель (291,1 ±27,7 см; Р<0,01), т. е. периметр увеличился на 32,5 см, или 12,6 %.
Интересные сведения получены при изучении площади силуэта толстой кишки при тугом контрастировании бариевой взвесью и введении воздуха (табл. 3). Отношение средних показателей площадей силуэта толстой кишки при ТБЗ ее и раздувании воздухом посегментно было 1,05; 0,71; 0,70; 0,79; 1,05, а общее — 0,85±0,01 (Р<0,01).
Объем толстой кишки в норме весьма вариабелен. Так, при ТБЗ ее он колебался от 341,3 до 637,5 и в среднем составлял 472,8 ±17,6 у. е., а при ДК — соответственно 407,6, 944,8 и 665,0 ±4,8 у. е. (Р<0,01). Соотношение средних величин условного объема при ТЗ и ДК (1 : 1,4) равнялось 0,71. Иначе говоря, объем толстой кишки при раздувании ее воздухом увеличился на 192,2 у. е., .или на 40,6 %.
Таким образом, рентгеноколономет-рия позволяет объективно оценить силуэт толстой кишки, а сравнение цифровых показателей при ТЗ и ДК характеризует эластичность и сократительную способность продольной и круговой мускулатуры кишки.
При анализе рентгенопланиметрических показателей установлено, что бариевая взвесь воздействует на стенку кишки как механический раздражитель, повышая ее тонус и тем самым уменьшая площадь и объем толстой кишки. В противоположность барию воздух,
142. Рентгенологическая картина туго контрастированной толстой кишки в норме.
применяемый для раздувания кишки, ее не раздражает. Толстая кишка по форме силуэта и гаустрации при введении воздуха находится ближе к нормальным показателям, чем при ТБЗ ее.
Каждый отдел (сегмент) толстой кишки имеет свои особенности. Слепая кишка в 80 % случаев локализуется в середине правой подвздошной области, обладает большой смещаемостью, так как со всех сторон окружена брюшиной. В зависимости от длины брыжейки она смещается на 4—6 см. Из всего многообразия форм и размеров слепой кишки следует выделить 3 основных варианта: 1) широкая и низкая (полушаровидная) слепая кишка, когда ее ширина больше длины; 2) равномерно расширенная слепая кишка, ее ширина и высота равны; 3) высокая и узкая слепая кишка, у которой длинник больше поперечника. Чаще встречается широкая и низкая слепая кишка (в 51 % случаев), реже — высокая и узкая (33 %) и еще реже (16 %) — равномерно расширенная кишка.
Ширина слепой кишки колеблется от 6 до 12 см’(в среднем 7,5 см). Ее длина, в пределах 6—8 см, зависит от
Табл. 1. Длина толстой кишки в норме, см
Сегмент ТБЗ Введение воздуха в просвет кишки
минимальная максимальная средняя минимальная максимальная средняя
I 17,0 30,0 23,6 17,0 30,0 25,0
II 22,0 58,0 31,3 32,0 58,0 40,0
III 12,0 37,0 23,3 25,0 37,0 29,4
IV 22,0 49,0 31,2 22,0 49,0 38,6
V 9,0 19,0 13,4 9,0 18,0 13,7
Общая длина 82,0 186,2 122,8 ±6,5 105,0 192,0 146,9 ±6,0
Табл. 2. Диаметр просвета толстой кишки в норме, см
Сегмент ТБЗ Введение воздуха в просвет кишки
минимальная максимальная средняя минимальная максимальная средняя
I 6,1 10,5 7,8 5,5 8,3 7,3
II 3,3 5,8 4,5 3,8 5,6 4,9
III 2,9 5,5 3,9 3,2 5,2 4,2
IV 2,3 4,2 3,3 3,1 3,6 3,4
V 6,0 12,2 8,9 6,9 10,2 8,4
Средняя величина 4,1 7,6 5,7±0,5 4,5 6,6 5,6±0,6
Табл. 3. Площадь силуэта толстой кишки в норме, см2
Сегмент ТБЗ Введение воздуха в просвет кишки
минимальная максимальная средняя минимальная максимальная средняя
I 113,7 258,7 165,3 112,0 188,0 156,6
II 67,6 171,9 129,3 129,3 214,5 182,8
III 37,7 146,0 86,1 71,6 175,3 122,9
IV 67,2 146,4 103,0 56,4 229,5 130,3
V 86,4 212,5 117,5 52,4 171,0 111,2
Общая площадь 372,6 935,5 601,2±28,6 421,7 978,3 703,8±37,5
конституционных особенностей человека. Гаустры слепой кишки слабо выражены, видны как крупные округлые выпячивания стенки, разнообразные по длиннику. Чаще обнаруживаются 1—2 гигантские гаустры шириной 2,5 — 4 см, реже мелкие. Освобо
жденная после ирригации контрастного вещества слепая кишка смещается на 2—3 см вверх.
В связи со значительной подвижностью слепой кишки ее положение у людей разного возраста и телосложения бывает самым разнообразным:
143. Аномалии положения слепой кишки (варианты а, б, в).
высоким — у нижнего края печени; подвздошным, когда нижний полюс кишки на 6—8 см ниже гребешковой линии; тазовым, когда слепая кишка с червеобразным отростком обнаруживается в малом тазу.
Если у слепой кишки брыжейка общая с восходящей кишкой, то слепая кишка вместе с червеобразным отростком весьма подвижна, размещается в среднем отделе брюшной полости и даже в левой ее половине, при этом нижний полюс кишки обращен влево.
Червеобразный отросток начинается у медиальной или заднемедиальной стенки слепой кишки, иногда у латеральной или заднелатеральной ее стенки и находится ретроцекально. В 60 % случаев ретроцекальный отросток фиксирован, а в 40 % — мобилен.
Контрастированный червеобразный отросток различной формы, от прямой до крючкообразной, провисает книзу, при пальпации свободно смещается и изменяет форму и положение. Длина его очень вариабельна — от 3 до 25 см и более, чаще 7—12 см. Ширина аппендикса одинакова на всем протяжении — в среднем 0,5 см.
У верхнего полюса слепой кишки, на стыке с восходящей кишкой, в медиальную или медиально-заднюю ее стенку открывается дистальный конец
подвздошной кишки. Это отверстие со стороны толстой кишки прикрывается илеоцекальным клапаном, состоящим из двух губ, верхней и нижней, шириной 2—5 мм. Если губы длинные и проецируются на медиальную стенку, на профильном снимке определяется дефект наполнения.
Если илеоцекальный клапан находится на задней поверхности слепой кишки, при компрессии обнаруживается поперечный дефект наполнения с депо бариевой взвеси в центре. Встречается и утолщение губ вследствие отложения в них жира, гипертрофии губ или выпадения слизистой оболочки подвздошной кишки. Если же илеоцекальный клапан определяется на задней поверхности кишки, червеобразный отросток расположен ретроцекально.
Известно, что илеоцекальный переход — это рефлексогенная зона, реагирующая на патологию ЖКТ и других органов функциональными нарушениями, для определения которых еще нет достоверных диагностических критериев. В литературе на этот счет имеются диаметрально противоположные точки зрения. Одни считают критерием функциональной полноценности клапана то максимальное давление, которое он может выдержать, и любой ретроградный заброс контрастного ве
щества в подвздошную кишку расценивает как признак недостаточности. Другие ставят под сомнение достоверность этого симптома в качестве показателя функциональной недостаточности илеоцекального клапана, третьи вообще отрицают запирательную роль клапана, хотя допускают возникновение регургитации как следствие нарушения регуляторной функции илеоцекального перехода.
Н. В. Самохина (1988) разработала манометрический способ определения тонуса илеоцекального отдела в процессе рентгенологического исследования, определила его поведение при ирригоскопии и установила критерии и степень недостаточности. В повседневной практике функциональные признаки обычно оцениваются по степени сокращения стенок в ответ на введение контрастного вещества. При многих заболеваниях проксимальных отделов толстой кишки, особенно воспалительных, тонус кишки повышается, что требует создания дополнительного, более высокого, давления для заполнения контрастной взвесью всех ее отделов. Рентгенологический метод определения недостаточности илеоцекального клапана весьма субъективен, так как основан на выбросе контрастного вещества из толстой кишки в тонкую без учета создаваемого давления в кишке.
Н. В. Самохина изучила состояние тонуса проксимальных отделов толстой кишки в условиях измеренного давления, которое необходимо создать в нагнетающей системе для ТЗ всех ее отделов. Она Определяла давление с помощью ртутного манометра, подключенного к аппарату Боброва, во время заполнения кишки контрастной массой под контролем рентгенотелевизионного просвечивания. Исследование считалось законченным, если была туго заполнена вся слепая кишка. Манометрия, про
веденная у 60 обследованных, показала, что в нормальных условиях достаточно создать давление 40 мм рт. ст., чтобы заполнить все отделы толстой кишки. По мере заполнения толстой кишки давление коле'блется в широких пределах и быстро падает до 20 мм, что указывает на отсутствие препятствия в просвете кишки и сохранение тонуса. При отсутствии патологических изменений только у 2 (с горизонтальным типом впадения тонкой кишки в слепую) из 30 человек отмечался заброс контрастного вещества в подвздошную кишку. В то же время при наличии препятствия опухолевой или воспалительной природы у 30 больных имело место нарушение прохождения контрастной массы и это требовало повышения давления в среднем до 80 мм рт. ст., чтобы преодолеть препятствие и заполнить толстую кишку на всем ее протяжении. При этом колебания давления незначительны или отсутствуют. Это является свидетельством повышенного тонуса. Ретроградный заброс в таких случаях обнаружен у 18 (60 %) больных с различными заболеваниями, преимущественно воспалительного происхождения: патологией червеобразного отростка (9), спаечной болезнью (3), туберкулезом (6). По уровню давления, необходимого для ТЗ толстой кишки на всем протяжении, можно объективно судить о тонусе мышечной стенки и тем самым получить дополнительные сведения о состоянии проксимальных отделов, в частности о функции илеоцекального клапана.
Недостаточность илеоцекального клапана, по-видимому, возникает рефлекторно, так как создать повышенное давление только в слепой кишке не удается. Слепая кишка «открыта» сверху, и при любом повышении давления газ или жидкость скорее распространяются по толстой кишке, чем через закрытый илеоцекальный клапан. Имеет
место факт ретроградного заброса контрастного вещества при стойко фиксированном давлении в нагнетающей системе и до 40 мм рт. ст. Вместе с тем ошибочно оценивать функцию илеоцекального клапана только с точки зрения давления в нагнетающей системе и заброса контрастной массы в подвздошную кишку или его отсутствия.
Проведенные исследования позволили выделить функциональные варианты илеоцекального клапана и их критерии (табл. 4). Отсутствие заброса контрастной массы в терминальную петлю, являющуюся основным вариантом нормы, при увеличении губ клапана, болях при пальпации и раздувании кишки газом в условиях повышенного давления следует рассматривать как нарушение проходимости илеоцекального клапана. Это состояние может быть обусловлено рядом причин: отеком губ илеоцекального клапана и полным их
смыканием из-за баугинита, инвагинацией подвздошной кишки в слепую, а также сочетанием этих процессов.
Ретроградный заброс контрастного вещества в подвздошную кишку может быть разной степени выраженности; он обусловлен вариантом анатомического строения и наблюдается преимущественно при горизонтальном типе впадения тонкой кишки в слепую. О недостаточности илеоцекального клапана как патологическом состоянии можно говорить при наличии: 1) заброса контрастной массы в подвздошную кишку с различной протяженностью ее контрастирования при стойко фиксированном давлении выше 40 мм рт. ст.; 2) увеличения губ илеоцекального клапана, а в ряде случаев деформации его; 3) болей при пальпации; 4) увеличения протяженности контрастирования подвздошной кишки после опорожнения.
Табл. 4. Функциональные варианты илеоцекального клапана и их критерии
Критерий
Вариант клапана контрастирование петель при боли при иссле-дова-нии увеличение клапана форма губ клапана тип впадения тонкой кишки в слепую
ТБЗ опорожнении
Отсутствие заброса: основной вариант Нет Нет Нет Нет Правильнаи Любой нормы спазм клапана Есть Есть » » Ретроградный заброс: регургитации Есть Умень- Нет Нет » Преимущественно (норма) шается горизонтальный недостаточность (патология): I степень (незпачи- 10—15 см Не увели- Есть Есть » Преимущественно тельнаи) чивается восходящий II степень (умерен- До 30 см » » » Преимущественно ная) восходящий или го- ризонтальный III степень (выра- 30 см Увеличи- » » Деформи- Преимущественно женная) вается ровапа нисходящий
Чтобы выделить степень недостаточности, Н. В. Самохина учитывала протяженность заполнения подвздошной кишки, величину и форму илеоцекального клапана, тип впадения тонкой кишки в слепую, а также ответную реакцию на пальпацию.
I степень недостаточности илеоцекального клапана характеризуется забросом контрастного вещества только в терминальную петлю подвздошной кишки преимущественно при восходящем типе впадения ее в слепую, увеличеием губ клапана, проявляющимся краевым дефектом наполнения округлой или треугольной формы и болями при пальпации. После опорожнения толстой кишки от контрастной массы ретроградный заброс не увеличивается. При II степени недостаточности заброс контрастного вещества в подвздошную кишку сопровождается контрастированием 2—3 петель и болевой реакцией на пальпацию. Опорожнение (повышение давления в просвете до 100 мм рт. ст.) не способствует большему забросу. Это соятояние чаще встречается при восходящем и горизонтальном типах впадения подвздошной кишки в слепую.
III степень недостаточности — заброс в подвздошную кишку значительного количества контрастного вещества, заполняющего много петель. При этом обязательно имеются увеличение губ илеоцекального клапана с деформацией элементов, болезненная пальпация; количество контрастного вещества в тонкой кишке увеличивается после опорожнения, тип впадения — преимущественно нисходящий. Неправильной формы дефект наполнения по внутреннему контуру кишки, обусловленный увеличенными губами клапана, переходит на стенки толстой и тонкой кишок, не ограничиваясь изменениями только илеоцекального сфинктера. Пероральное изучение илеоцекального
перехода не позволяет четко дифференцировать виды поведения этого отдела.
Выделенные I и II степени недостаточности илеоцекального клапана отражают характер функциональных нарушений, а при III степени выявлены в.ыраженные морфологические изменения илеоцекального отдела (деформация, нисходящий тип впадения). Отсутствие заброса контрастного вещества в тонкую кишку, чаще наблюдаемое в норме, не всегда может служить признаком нормальной деятельности илеоцекального клапана.
Таким образом, при ирригоскопии необходимо определять состояние илеоцекального перехода, функция которого легко уязвима патологическими процессами в блцзко расположенных и даже удаленных от пего органах. Как регургитация, так и отсутствие заброса не могут быть признаками нормальной деятельности илеоцекального клапана. Уровень давления, выявленный при ирригоскопии, позволяет объективно судить о мышечном тонусе кишки, а необходимость его повышения служит показанием для более углубленного исследования илеоцекального перехода.
Восходящая ободочная кишка является продолжением слепой кишки. Начинается сразу над илеоцекальным клапаном, в большинстве случаев на уровне Lv. По правому краю задней брюшной стенки она направляется кверху вертикально до печени, образуя правый изгиб на уровне Ьц_И1, и становится поперечной ободочной кишкой. В 85,2 % случаев покрыта брюшиной с трех сторон и не имеет брыжейки. Прилежит сзади к подвздошной, квадратной мышце поясницы и поперечной мышце живота, к медиальной части правой почки, иногда к правому надпочечнику, сверху (правый изгиб) — к правой доле печени, желчному пузырю, спереди — к петлям тонкой кишки. Длина восходящей ободочной кишки колеблется
в пределах 13—35 см, в среднем 22,4±2 см. Гаустр не много — от 6 до 16 (в среднем 10), шириной от 1 до 5 (2,4 ±0,1) см. Диаметр интергаустраль-ных промежутков от 2 до 8 (3,5 ± ±0,1) см.
Поперечная ободочная кишка — наиболее вариабельный отдел толстой кишки как по величине, так и по форме, имеет брыжейку. Начальный ее сегмент находится в правом подреберье, затем направляется в подчревную и пупочную области и заканчивается в левом подреберье, образуя левый, или селезеночный, изгиб, преимущественно на уровне ТXi хн. Поперечная ободочная кишка прилежит сверху к печени, желчному пузырю, большой кривизне желудка, нижнему краю селезенки, снизу — к петлям тонкой кишки, спереди — к большому сальнику и передней брюшной стенке, сзади — к правой почке, 12-перстной кишке, поджелудочной железе, левой почке и петлям тонкой кишки.
В зависимости от положения поперечной ободочной кишки в брюшной полости выделяют 4 ее типа-, подковообразный — кишка без четких перегибов, образует дугу, обращенную выпуклостью кверху. Чаще встречается у молодых и среднего возраста мужчин с широкой апертурой грудной клетки; У-образный тип — середина кишки резко провисает книзу в виде дуги или гирлянды с тупым или острым углом, обращенным вершиной к лобку, иногда вершина угла определяется у малого таза. Этот тип отмечается преимущественно у лиц женского пола с узкой нижней апертурой грудной клетки и относительно большим расстоянием между реберным углом и лобковым сращением; поперечный, или косопоперечный, тип — небольшое провисание кишки вниз. Чаще обнаруживается у астеников; выраженный косой тип с тупым печеночным и острым высо
ким селезеночным углом. Выявляется редко.
Длина поперечной ободочной кишки колеблется от 25 до 60 (37,0±0,5) см. Гаустр от 10 до 35, в среднем около 22, шириной от 1 до 3 (1,6 ±0,6) см. Диаметр интергаустральных промежутков в пределах 1—5 (2,5±0,1) см.
Нисходящая ободочная кишка нахю-дится в левой боковой области живота. Вследствие того что брюшина покрывает эту кишку только спереди и с боков, смещаемость ее ничтожна, вариабельность небольшая. Начинается кишка от селезеночного изгиба и почти прямолинейно направляется по задней брюшной стенке вниз в левую подвздошную ямку. Спереди и справа к кишке прилежат петли тонкой кишки, сзади — левая почка, поперечная мышца поясницы и подвздошная мышца. Максимальная длина нисходящей ободочной кишки — 41 см, минимальная — 20 см, средняя — 29,6±0,3 см. Гаустр может быть от 11 до 30, в среднем около 19, шириной от 1 до 3 (1,6 ±0,1) см. Диаметр интергаустральных промежутков различный — от 1 до 5 см, в среднем 2,4 ±0,1 см.
Сигмовидная ободочная кишка локализуется в левой подвздошной и лобковой областях и делится на подвздошную и тазовую части. На уровне Sn -ш она становится началом прямой кишки. Сигмовидная кишка со всех сторон покрыта брюшиной и имеет брыжейку, поэтому обладает значительной подвижностью. Иногда сигмовидная кишка лишается брыжейки и оказывается мезоперитонеально расположенной, полностью или частично. Спереди кишка прилежит к передней брюшной стенке, выше и справа от нее находятся петли тонкой кишки, внизу — мочевой пузырь, матка и прямая кишка.
Общая длина сигмовидной кишки колеблется от 10 до 65 см, в среднем 25,8 ± ±0,7 см. В зависимости от ее длины
следует выделить несколько типов сигмовидной кишки: короткую (до 20 см), среднюю (до 40 см), длинную (до 60 см), сверхдлинную (свыше 60 см). Количество гаустр зависит от длины кишки. Их насчитывается от 9 до 35 (в среднем около 18), шириной от 1 до 3 (1,6±0,6) см. Диаметр иитергаустраль-ных промежутков от 1 до 4 см, в среднем 1,9 ±0,1 см.
В топографии сигмовидной кишки большое значение имеет место прикрепления корня ее брыжейки, которое по мере роста организма опускается с уровня L in -iv до уровня крестца. В зависимости от смещения корня брыжейки изменяется положение петель кишки и их направление. В 75 % случаев сигмовидная кишка обнаруживается в левой подвздошной, левой боковой и частично в пупочной областях. В 12 % случаев она отклоняется вправо от срединной линии и занимает пупочную область. В 7 % случаев кишка определяется в правой подвздошной области, в 4 — в правой боковой, в 2 % — в эпигастральной области.
Короткая сигмовидная кишка иногда образует пологую дугу, обращенную выпуклостью книзу, или без изгибов прямо соединяет нисходящую кишку с прямой. При ее удлинении возникает дополнительно изгиб кверху. У длинной сигмовидной кишки с удлиненной брыжейкой появляются дополнительные изгибы и петли, выпуклые в разные стороны. Иногда сигмовидная кишка достигает селезенки, находится кнутри или кпереди от нисходящей кишки или печени, правой подвздошной ямки после перекрещивания позвоночника.
Прямая кишка — самый дистальный отдел кишечника — начинается на уровне S п in и заканчивается заднепроходным отверстием. Она находится в задневерхнем отделе полости малого таза и окружена многими органами и анатомическими образованиями. Сзади
кишка прилежит к крестцу и копчику, спереди — к матке и влагалищу или к задней поверхности мочевого пузыря, предстательной железе, семенным пузырькам с протоками.
Прямая кишка получила свое название от ее формы, присущей животным. У человека этот отдел кишечника искривлен, зигзагообразен. Для практического врача особенно важны два изгиба в сагиттальной плоскости, которые соответствуют изпибам крестцово-копчикового отдела позвоночника: крестцовый изгиб обращен выпуклостью кзади, а промежностный — кпереди. Вместе с тем есть несколько изгибов кишки во фронтальной плоскости. Из них наиболее заметен изгиб на границе между ампулой и сигмовидной кишкой.
Длина прямой кишки варьирует в пределах 12 —18 см. Кишка делится на 3 части: ректосигмоидальную, ампулярную и анальную. Верхний отдел прямой кишки, включающий ректосигмоидальную и ампулярную части, находится в тазовой полости и называется тазовым, или крестцовым, отделом, а конечная часть кишки, образующая анальный канал, называется промежностной. Длина анального канала колеблется от 1,5 до 4,7 см. Ректосигмо-идальная, или надампулярная, часть является продолжением сигмовидной кишки. Длина ее 3 — 5 см, эта часть кишки покрыта брюшиной спереди и с боков примерно до середины ампулы. Здесь брюшина образует ямку, или карман Дугласа. Положение ректосигмоидаль-ной части вариабельно.
Ампула прямой кишки состоит из 3 отделов: верхне-, средне- и нижне-ампулярпОго. Ампула лежит выше диафрагмы таза, на большем протяжении лишена брюшины. Ее впебрюшин-ная часть окружена висцеральным листком тазовой фасции.
Структурные особенности стенки толстой кишки: стенка кишки состоит из
слизистой, подслизистой, мышечной и серозной оболочек толщиной 1 — 1,5 мм. Слизистая оболочка, в отличие от слизистой оболочки тонкой кишки, не имеет ворсинок и циркулярных складок. Вместо них начиная от слепой кишки появляются полукружные, или полулунные, складки шириной 2—4 мм. В их формировании принимают участие не только слизистая оболочка, но и подслизистый и мышечный слои. В области гаустр они направлены поперечно, а в промежутках между ними — продольно, особенно во время сокращения. В слизистой оболочке ободочной кишки хорошо заметен и собственный слой, который иногда создает временные (физиологические) поперечные складки.
Полулунные складки ограничены продольными лентами, выступают в просвет кишки и участвуют в образовании гаустр. Физиологическими (временными) поперечными складками, возникшими в результате сокращения собственного мышечного слоя, иногда обусловлено появление добавочных мелких гаустр.
Тип складок слизистой оболочки тесно связан с функцией различных отделов толстой кишки. Так, в слепой и восходящей кишках преобладают поперечные, густо лежащие складки, которые отражают функции этих отделов: перемешивания химуса, всасывания воды, уплотнения и формирования кала. В поперечной ободочной кишке определяются поперечные и продольные складки. Рельеф слизистой оболочки здесь бывает сетчатым или ячеистым вследствие наложения рисунка складок передней и задней стенок. В левой половине толстой кишки кал в основном движется к дистальному отделу, поэтому поперечные складки в ней непостоянны. В нижней части нисходящей ободочной и в сигмовидной кишках преобладают продольные складки сли
зистой оболочки. Направление и калибр складок нередко изменяются в процессе исследования в результате сокращений, сегментаций и гаустраций кишки.
В дистальном отделе сигмовидной кишки и в верхней части прямой всегда обнаруживаются неправильные, преимущественно полулунные или поперечные складки, чередующиеся с продольными. По мере наполнения прямой кишки каловыми массами эти складки расправляются, за исключением промежностной части, где короткие, длиной от 2 до 4 см, складки остаются в виде вертикальных валиков (столбиков Морганьи). Число этих валиков колеблется от 6 до 12. Углубления между валиками называют мор-ганьевыми криптами.
Мышечная оболочка ободочной кишки состоит из внутреннего кругового и наружного продольного слоев. В отличие от тонкой кишки продольной мышечный слой по периметру кишки распределяется неравномерно. Мышечные волокна концентрируются в виде трех параллельных полос шириной около 1 см, так назыаемых мышечных лент. Различают сальниковую ленту — по линии прикрепления большого сальника, брыжеечную ленту — по линии прикрепления брыжейки поперечной ободочной кишки и свободную ленту на восходящей ободочной кишке и нисходящей ободочной кишке — по передней их поверхности, а на поперечной ободочной кишке — по задней поверхности. Эти ленты сходятся на верхушке слепой кишки. В прямой кишке на протяжении всей кишки они образуют сплошной слой продольных мышечных волокон, который сливается с волокнами циркулярного слоя.
Мышечные ленты — первая особенность ободочной кишки.
Второй ее особенностью являются неравномерное распределение кругового мышечного слоя и выпячивания
144. Схема локализации сфинктеров толстой кишки (описание в тексте).
(гаустры), между которыми внутренние мышечные волокна более развиты.
Третья особенность заключается в том, что вдоль ободочной кишки на границах различных сегментов возникают жомы (сфинктеры), в которых круговой мышечный слой наиболее мощный (толстый). Они заметны во время сокращения мускулатуры, 2—3 гаустры в этих местах недоразвиты.
Описаны следующие сфинктеры толстой кишки.
1. Сфинктер Варолиуса, колоноиле-альный, на месте перехода тонкой кишки в толстую, шириной до 1 см.
2. Сфинктер Бузи, слепокишечновосходящий, на границе слепой и восходящей ободочной кишки на уровне верхнего либо нижнего края подвздошной кишки или же на 2—4 см выше илеоцекального угла. Лучше этот сфинктер заметен, если у него высокое положение, а также у людей с длинной и узкой слепой кишкой. Сфинктер шириной от 0,6 до 1,1 см, чаще 0,8 см.
3. Сфинктер Гирша, срединно-восходящий, один из наиболее часто встречаемых (63%). У большинства больных он находится в средней трети восходящей кишки, у некоторых — на гра
нице верхней и средней третей или в нижней трети восходящей кишки. Это сужение шириной от 0,5 до 2 см, в среднем около 1 см.
4. Сфинктер Кеннона — Бема, печеночный, обнаруживается в 35 — 50 % случаев в печеночном изгибе ободочной кишки. Сужение длиной от 1 до 2,5 см, чаще 1,8 см.
5. Сфинктер Херста определяется на границе проксимальной и средней трети поперечной ободочной кишки в 13— 15 % случаев, преимущественно у людей с подковообразной поперечной ободочной кишкой длиной около 25 см. Ширина сфинктера колеблется от 1,5 до 2 см, чаще 1,7 см.
6. Сфинктер Кеннона (левый) выявляется в 19 — 21 % случаев на границе средней и дистальной третей поперечной ободочной кишки, чаще у людей с длинной У-образной поперечной кишкой. Ширина сфинктера 1,8—2,5 см, чаще 2 см.
7. Сфинктер Пайра — Штрауса, селезеночный, который находится в селезеночном изгибе на границе поперечной и нисходящей ободочной кишок, диагностируется в 60—65 % случаев. Его ширина 0,9—2,8 см, чаще 1,6 см.
8. Сфинктер А. Н. Михайлова, срединно-нисходящий, чаще локализуется в средней трети нисходящей кишки. Встречается относительно редко (в 17 %), выражен умеренно. Длина сужения не превышает 2—2,5 см.
9. Сфинктер Балли, нисходяще-сигмовидный. Выявляется в месте перехода нисходящей кишки в сигмовидную в 50 —55 % случаев как сужение размером от 1,4 до 2,7 см, чаще 2,1 см.
10. Сфинктер Мутье — Росси, срединно-сигмовидный, определяется в середине сигмовидной кишки с отклонением в проксимальном и дистальном направлениях на 6—8 см. Ширина сужения достигает иногда 4,5 см, чаще оно шириной 2,5 см.
11. Сфинктер О’Берна — Пирогова — Мутье, сигмовидно-прямокишечный, локализуется в месте перехода сигмовидной кишки в прямую. По частоте обнаружения (в 65—75 % случаев) и степени выраженности (сужение длиной до 7,2 см, чаще 3—5 см) стоит на первом месте.
12. Сфинктер Нелатона — Геппера, срединно-прямокишечный, находится в средней трети ампулы прямой кишки. Встречается в 20 — 25 % случаев. Слабо выражен. Длиной до 0,5 см.
В промежностной части прямой кишки выделяются два сфинктера: внутренний (на уровне белой линии) и наружный (непосредственно под кожей). Наружный сфинктер циркулярно охватывает промежностный отдел. Часто волокна внутреннего сфинктера переплетаются с волокнами наружного и оканчиваются на месте соединения анального канала с кожей.
Все сфинктеры на одной рентгенограмме никогда не выявляются. У одного больного одновременно обнаруживается не более 5 сфинктеров, чаще 3: Гирша, Кеннона — Бема и О’Берна — Пирогова — Мутье. Наиболее часто встречаются сфинктеры Гирша, Кеннона — Бема, Пайра — Штрауса, Балли, Мутье — Росси и О’Берна — Пирогова — Мутье.
Функции сфинктеров толстой кишки, особенно сфинктеров Кеннона — Бема, Пайра — Штрауса, Балли, О’Берна — Пирогова — Мутье и Нелатона — Геп-нера, имеют большое значение в регуляции продвижения содержимого кишечника в каудальном направлении. При их нарушениях, в частности при спазме сфинктеров, опорожнение толстой кишки замедляется. Иногда резкий спазм сфинктеров симулирует органический стеноз кишечника. Со сфинктерами связано также новое функциональное деление толстой кишки. Степень выраженности и точную локали-
145. Срединпо-ннсходящий сфинктер (сфинктер А. Н. Михайлова).
зацию сфинктеров необходимо учитывать хирургам, когда они определяют границы резекции кишечника и берут его для пластики отделов толстой кишки.
Кровоснабжение толстой кишки: кишка снабжается кровью из системы верхней и нижней брыжеечных артерий, ответвляющихся от брюшной аорты на уровне Lih Liil В половине случаев верхняя брыжеечная артерия питает кровью правую часть толстой кишки, нижняя брыжеечная артерия — левую ее часть. В 50 % случаев зона распространения верхней брыжеечной артерии достигает селезеночного угла, а в некоторых случаях — средней и даже нижней трети нисходящей кишки.
От нижней брыжеечной артерии ответвляется верхняя артерия прямой кишки. Из нее получают кровь ткани верхних 2/з прямой кишки. Нижняя треть прямой кишки снабжается кровью из средней артерии, которая начинается от подчревной артерии, и из нижней артерии прямой кишки — ветви внутренней половой артерии, являющейся конечной ветвью подчревной артерии.
Все сосуды анастомозируют между собой и образуют до 4 — 5 ярусов артериальных дуг — аркад. Больше всего аркад формируется в самых подвижных сегментах кишки. Соединяясь между собой, аркады создают вдоль всей ободочной кишки так называемый краевой сосуд. Прямые артерии от этого сосуда внедряются в толщу стенки и формируют сети. Расстояние краевой артерии, или аркад, от стенки кишки колеблется от 1,5 до 5 см.
Для ободочной кишки характерно сегментарное кровоснабжение. Направление ветвей верхней и нижней брыжеечных артерий в большинстве случаев совпадает с местоположением в толстой кишке описанных сфинктеров, а сами сфинктеры ограничивают определенные сегменты толстой кишки. В каждом сегменте кишки краевые отделы снабжаются кровью немного лучше, чем средние отделы. К сфинктерам толстой кишки в большинстве случаев направляются отдельные артериальные ветви первого или второго порядка. В местах деления этих ветвей имеются добавочные анастомозы, прямые сосуды непосредственно соединяют их со сфинктерами толстой кишки. В результате кровоснабжение сфинктеров становится лучше, чем соседних участков кишки.
Вены ободочной кишки сопровождают одноименные артерии и являются притоками воротной вены. Вены прямой кишки образуют хорошо выраженное сплетение. Нижняя и средняя вены прямой кишки несут кровь во внутреннюю половую и подчревную вены, которые впадают в подвздошную вену, а верхняя вена прямой кишки — в нижнюю брыжеечную вену — приток воротной вены.
Лучше снабжаются кровью сегменты слепой и сигмовидной кишок, вполне удовлетворительно — сегменты восходящей и поперечной ободочной кишок,
хуже — сегменты нисходящей, особенно в области селезеночного изгиба.
Лимфатическая система-, в стенке кишки определяются лимфатические сети слизистой оболочки, подслизистой основы, мышечной и серозной оболочек. Из этих сетей формируются лимфатические сосуды, отводящие лимфу в регионарные узлы. Для ободочной кишки такими узлами являются: надободочные — у края кишки, околоободоч-ные — у периферических сосудистых аркад, промежуточные — вдоль ветвей ободочных артерий, главные узлы — в корне брыжейки кишки и у нижней полой вены. От этих узлов лимфа, по-видимому, течет к узлам поджелудочной железы, корня брыжейки тощей кишки, к предаортальным узлам, узлам между аортой и нижней полой веной.
Из лимфатических сосудов прямой кишки образуются 3 сплетения-, интрамуральное — в подслизистом и мышечных слоях, промежуточное — в подсерозном и подфасциальном слоях и экстрамуральное — в тканях вне прямой кишки. Отводящие лимфатические пути прямой кишки широко анастамо-зируют с сосудами лимфатических систем смежных органов.
Иннервация толстой кишки-, в толстой кишке обнаруживаются чувствительные волокна спинномозговых нервов, блуждающего нерва, отростков чувствительных нейронов вегетативной нервной системы. Двигательную иннервацию кишки обеспечивает вегетативная нервная система. Симпатические волокна восходящей и поперечной ободочной кишок исходят из Т iv—Li сегментов, а волокна нисходящей и сигмовидной кишок — из Li ni сегментов спинного мозга. Парасимпатические волокна из дорсального ядра блуждающего нерва в его составе распространяются по всей тонкой, восходящей и поперечной ободочной кишкам, а из боковых рогов II — IV крестцовых сег
ментов — по нисходящей ободочной и сигмовидной кишкам.
Слепая, восходящая и часть поперечной ободочной кишки снабжаются нервами от верхнего брыжеечного сплетения, дистальная часть поперечной, нисходящей и сигмовидной кишок — от нижнего брыжеечного сплетения, в которое входят волокна: чувствительные спинно-мозговые и блуждающего нерва, перганглионарпые парасимпатические блуждающего нерва и постганглио-парные симпатические.
Нервные стволики, содержащие волокна всех видов, следуют из сплетений в основном вдоль кровеносных сосудов к стенке кишки. Здесь вместе со скоплениями клеток и их отростками эти стволики формируют интрамуральный нервный аппарат, включающий подслизистое, мышечное и субсерозное сплетения, тонкие нервные стволики во всех оболочках, двигательные окончания в мышечной оболочке и мышцах сосудов стенки кишки и чувствительные окончания во всех оболочках.
Иннервация прямой кишки осуществляется также вегетативной нервной системой и частично спинномозговыми нервами. Ампулярная часть кишки иннервируется преимущественно вегетативной системой, а промежностная — спинномозговыми нервами. Этим и объясняется разница в болевой чувствительности ампулярной и промежностной частей. Анатомической границей между указанными частями является аноректальная линия. Книзу от этой линии болевая чувствительность резко повышена, а кверху она значительно слабее.
Оба вида вегетативной нервной системы, парасимпатический и симпатический, нередко, в зависимости от состояния органа, оказываются не антагонистами, а синергистами. В результате физиологических воздействий на кишечник обычно возникает комплексный
ответ, по импульсы симпатической нервной системы всегда разлитые, диффузные, а парасимпатической — изолированные. Парасимпатические нервы стимулируют двигательную деятельность кишечника, расслабляют сфинктеры и усиливают секрецию, а симпатические — преимущественно проводят импульсы от чувствительных окончаний, в меньшей степени уменьшают кишечный тонус и сужают сфинктеры.
Большую роль в управлении двигательной деятельностью толстой кишки играет внутренняя и ганглионарная иннервация. Кроме того, гладкие мышцы кишечного тракта совершают автономные движения, не обусловленные какими-либо нервными импульсами.
Особенности толстой кишки у детей
Длина толстой кишки приблизительно равна расту ребенка. У новорожденных она колеблется от 35 до 66 см. Восходящая ободочная кишка длиной 2 — 9 см, поперечная ободочная кишка — 11 — 27, нисходящая ободочная кишка — 3 —12, сигмовидная кишка — 12 — 29 и прямая кишка — 3,7—4,7 см. К 4 годам жизни восходящая и нисходящая ободочные кишки уже равной длины, а к 7 годам устанавливается такое же соотношение кишок, как и у взрослых.
Гаустры толстой кишки развиты слабо, они появляются у ребенка в 6 — 8 мес. Полулунные складки низкие и широкие. Циркулярный мышечный слой слабый.
У новорожденных слепая и восходящая кишки соприкасаются с печенью. Поперечная ободочная кишка менее подвижна, чем у взрослых, спереди прикрывается печенью. Сигмовидная кишка имеет длинную брыжейку, образует ряд петель, которые нередко находятся у нижней поверхности печени. Прямая
кишка начинается на уровне Si, и ее длинник соответствует прямой линии. Пассаж бариевой взвеси по толстой кишке быстрее, чем у взрослых, и в зависимости от возраста ребенка колеблется от 4 до 18 ч. При искусственном вскармливании время пассажа удлиняется.
Физиологические основы толстой кишки
Основными функциями толстой кишки являются всасывание жидкости, солей и накопление обезвоженного кишечного содержимого до момента эвакуации. На процесс всасывания в кишечнике влияют многие биологически активные пептиды. Накоплены данные об участии нервных образований в регуляции кишечной деятельности. Так, холинергические системы стимулируют секрецию, а адренергические — усиливают абсорбцию.
Классические рентгенологические исследования, проведенные отечественными и зарубежными исследователями, позволили установить следующие основные типы организованных движений толстой кишки: 1) маятникообразные движения, или ритмическая сегментация,— это антеградные и ретроградные движения в сегменте кишки. Кишечное содержимое перемещается вперед благодаря пропульсивному сокращению; 2) ретроградное продвижение, или антиперистальтическое движение, которое наблюдается в основном в поперечной ободочной кишке и распространяется в проксимальном направлении до слепой кишки; 3) пропульсивное движение — перемещение длинного фекального столба в дистальном направлении толстой кишки. Оно наблюдается несколько раз в день и продолжается несколько секунд; 4) акт дефекации, или испражнения,— это сложный физиологический процесс, в котором принимают участие не только
перечисленные движения, но мышцы таза и брюшного пресса, сфинктеры заднего прохода.
Пассаж содержимого толстой кишки в норме достаточно изучен. Обычно контрастная взвесь, принятая внутрь, начинает поступать в толстую кишку через 3—4 ч. Через 4 — 6 ч заполняется восходящий отдел. Поперечная ободочная кишка заполняется в пределах 10 — 12 ч, в нисходящей части — в пределах 16 — 18 ч, сигмовидная и прямая кишки — 20—24 ч. Ускоренным считается опорожнение толстой кишки до 24 ч, нормальным — 24—72 ч и замедленным — после 72 ч.
В норме по контурам толстой кишки имеются симметрично расположенные углубления — гаустры. Давно установлено, что гаустры толстой кишки не являются постоянным анатомическим образованием. Их форма, количество, распределение и глубина зависят от сократительной функции мышечного слоя кишки и изменяются в зависимости от состояния центральной и вегетативной нервной системы.
Каждому отделу толстой кишки свойствен характерный, в определенной мере отличающийся тип гаустрации. Так, в восходящей части гаустры имеют вид крупных, но сравнительно поверхностных выпячиваний с образованием как бы волнообразного контура. Резче всего они выражены в области поперечной ободочной кишки и напоминают гирлянду. В нисходящей и сигмовидной кишках гаустры более плоские. Характер гаустрации отражает состояние нервных приборов, могущих дать рефлекторную реакцию в виде нарушений гармоничности в формировании типичной для данного отдела гаустрации.
Толстая кишка всегда находится в состоянии определенного тонуса, являющегося функцией мышечного аппарата, регулируемого нервной системой.
Повышение тонического состояния и возбуждение перистальтики толстой кишки относятся к функции парасимпатической нервной системы, а понижение тонуса толстой кишки и торможение перистальтики и пропульсии — к функции симпатической нервной системы.
Рентгенологически тонус толстой кишки определяется по ширине просвета и глубине гаустрации. При нормальном тонусе кишки ширина просвета ее не изменена, гаустры средней глубины (обычно величина их равна половине или 2/з диаметра кишки, расположены правильно, размеры гаустраль-ных извилин на каждой стороне равны по величине и симметричны). Повышенный тонус сопровождается небольшой шириной просвета и резко подчеркнутыми гаустрами. Иногда может наблюдаться сужение просвета кишки в местах расположения функциональных сфинктеров, обусловленное сокращениями круговых мышечных волокон. При резком повышении тонуса просвет кишки более сужен, представляется гладким, лишенным гаустр, развивает-
Глава 31. АНОМАЛИИ
При эмбриональном развитии кишечной трубки могут происходить различного рода отклонения от нормы. Ведущая роль в их диагностике и установлении формы болезни принадлежит рентгенологическому методу исследования.
Болезнь Гиршспрунга. Относится к аномалии развития толстой кишки. Заключается в отсутствии ганглиев внутристеночных нервных сплетений в какой-либо ее части, приводящем к полному выключению этой части из перистальтики, расширению и атонии вышележащих отделов.
Различают 6 анатомических форм гипо- или аганглиоза толстой кишки: 1) супраанальная с поражением нижне-
ся сегментарный или диффузный спазм толстой кишки, вплоть до симптома «шнура». Если тонус пониженный, кишка расширена, количество гаустр уменьшено, гаустрация выражена слабо, едва заметна. При атонии толстой кишки просвет ее резко расширен, гаустры отсутствуют, стенка представляется гладкой.
С рентгенологической точки зрения можно исследовать тоническое состояние, пропульсивную и опорожнителъ-ную деятельность. Но все эти функции толстой кишки одновременно, вместе изучить нельзя. Можно говорить либо о тонической функции, либо о транзите содержимого. Таких терминов, как «повышение двигательной активности», следует избегать. Повышение тонуса круговой мускулатуры еще не означает ускорение продвижения кишечного содержимого. Бывают случаи, когда тоническое состояние нормальное, а опо-рожнительная функция нарушена, и наоборот, при нормальном опорожнении кишечника просвет кишки нередко сужен или расширен из-за спазма или пареза.
И ПОРОКИ РАЗВИТИЯ
ампулярного отдела прямой кишки; 2) ректальная, когда поражается вся прямая кишка; 3) ректосигмоидальная, при которой поражается вся прямая кишка или вся сигмовидная; 4) субтотальная, при которой поражение распространяется на поперечную ободочную кишку; 5) тотальная, когда поражена вся толстая кишка; 6) сегментарная, при которой обнаруживается один суженный сегмент или два сужения с неизменным отделом кишки между ними без поражения прямой кишки (синдром Ирасека — Цюльцера — Уилсона) .
Клинические проявления болезни во многом определяются длиной аганглио-нарной зоны и ее локализацией. Пер-
146. Схема основных анатомических форм болезни Гиршспрунга (по А. И. Лепюшкину, 1976):
/ — ректальная форма (а -- с поражением промежностного отдела прямой кишки; б —с поражением ампулярной части); II — ректосигмоидальная форма (а — с поражением части сигмы; б — с субтотальным или тотальным поражением сигмовидной кишки); III — сегментарная форма (а — с двумя сегментами и участком нормальной кишки между ними; б — с одним сегментом); IV — субтотальная форма {а — с поражением поперечной ободочной кишки; б — с распространением на правую половину толстой кишки); V — тотальная форма.
вые три формы аганглиоза обычно компенсируются организмом, а последние три протекают декомпенсированно. Имеют место запоры и признаки хронической интоксикации. Основной признак — отсутствие самостоятельного стула обычно с рождения или первых дней жизни ребенка. Дети опорожняются только после клизмы. Для них характерны «лягушачий живот» и деформированная грудная клетка. Во время
пальцевого исследования прямой кишки отмечают спазм ее сфинктеров и обнаруживают пустую ампулу.
Диагностика строится прежде всего на тщательном изучении анамнеза, клинической картины заболевания, данных рентгенологического и других методов исследования.
Рентгенологический, метод как один из ведущих в диагностике этой болезни позволяет выявить не только расшире-
147. Формы болезни Гиршсирупга:
а, б — ректальная, в, г — ректосигмовидная
ние и удлинение кишки, но и аганглио-нарную зону. В 44 — 70 % случаев зона локализуется в ректосигмоидальном отделе, в 22—35 % — в прямой кишке, 6—14 % случаев — в нижнеампулярном отделе прямой кишки и редко в остальных отделах толстой кишки. У взрослых больных (43—50 %) аган-глионарная зона проявляется сужением просвета кишки до 1—3 см либо отсутствием такового у остальных. В некоторых случаях возможно даже некоторое расширение просвета кишки в зоне поражения, особенно прямой кишки ,(до 6 — 9 см). Определяются и другие признаки: резкий воронкообразный переход от расширенных к нормальным или несколько суженным дистальным отделам толстой кишки, выпрямлен-ность контуров дистальных отделов и отсутствие ампульности прямой кишки, грубая продольная складчатость с отсутствием гаустр в расширенных отделах. При пассаже бариевая взвесь задерживается в переходной зоне.
Сегментарный врожденный аганглиоз толстой кишки, или синдром Ирасека — Цюльцера — Уилсона,— особая пато-морфологическая форма болезни Гирш-спрунга, при которой в толстой кишке имеется одна либо две аганглионарные зоны с нормальным участком кишки между ними. Кроме того, характерная особенность — аганглиоз не распространяется на прямую кишку. Рентгенологическая картина зоны аганглиоза такая же, как и при болезни Гирш-спрунга.
Окончательный диагноз болезни Гиршспрунга основывается не только на клинических и рентгенологических данных, но и на результатах биопсии с гистохимическим анализом биоп-тата.
Мегаколон. Под этим термином понимают расширение всей или части толстой кишки, сопровождающееся гипертрофией ее стенки вследствие ано
малии развития аноректальной области и ЦНС, механических препятствий в области прямой кишки и нарушений акта дефекации.
Исходя из патогенеза заболевания выделяют следующие типы расширения кишки: аганглионарный (см. Болезнь Гиршспрунга), обструктивный, психогенный, эндокринный, токсический, нейрогенный, идиопатический. По мнению многих исследователей, следует выделять две разновидности мегаколон: преимущественное удлинение толстой кишки и преимущественное ее расширение. Первая разновидность проявляется в основном удлинением сигмовидной кишки с незначительным расширением ее просвета. Вторая разновидность характеризуется главным образом расширением дистальных отделов толстой кишки, чаще в результате спазма или стеноза промежностной части прямой кишки на уровне внутреннего сфинктера.
Клинические проявления: основной признак — хронический запор с задержкой стула на 2—3 дня. У детей он возникает в 3—6 лет. В дальнейшем запор иногда усиливается. В таких случаях для опорожнения кишечника приходится прибегать к слабительным средствам или очистительным клизмам. Упорные запоры сменяются периодами нормального функционирования кишечника. Больные нередко обращают внимание на вздутие живота, урчание и усиленную перистальтику кишечника. Дети часто отмечают недомогание, тошноту, головные боли. Во время пальцевого ректального исследования обнаруживают стенозированный или спазмированный анальный сфинктер и расширенную ампулу прямой кишки, которая заполнена плотными каловыми массами.
Особенности рентгенологического исследования: во время ирригоскопии контрастное вещество необходимо вво
дить небольшими порциями под экраном, внимательно следя за продвижением бариевой взвеси. Следует учитывать возрастные особенности толстой кишки и варианты положения ее отделов, особенно сигмовидной кишки. У детей моложе 5 лет сигмовидная кишка имеет длинную брыжейку и образует петли, которые нередко оказываются у нижней поверхности печени. У детей постарше брыжейка укорачивается и опускается в малый таз. Чтобы установить удлинение сигмовидной кишки у детей, решающее значение имеют клинические данные, так как. у них такое удлинение — явление физиологическое.
При оценке рентгенологической картины надо обращать внимание на количество петель сигмовидной кишки, их положение в брюшной полости по отношению к средней линии и полости малого таза, выраженность гаустрации и степень опорожнения кишки после дефекации. Сигмовидная кишка образует одну или несколько петель. Чаще (в 57—72 % случаев) встречается двупетлистая сигмовидная кишка. Удлиненной считается дву- или многопетлистая сигмовидная кишка, если ее петли находятся в брюшной полости высоко, у правого или левого подреберья.
Существует зависимость появления рентгенологических признаков от клинической стадии болезни. В компенсированной стадии заметна гаустрация сигмовидной кишки, опорожнение кишки не нарушено. В субкомпенсирован-ной стадии отмечаются сглаженность гаустр и небольшое расширение кишки в дистальном отделе, после дефекации в просвете сигмовидной кишки остается около половины введенной бариевой взвеси. В стадии декомпенсации наряду с сигмовидной кишкой расширены и вышележащие отделы толстой кишки, гаустрация незаметна, опорожнение
148. Мегадолихосигма.
кишечника резко нарушено или вовсе не наступает.
Удлиненная сигмовидная кишка, или долихосигма, как правило, образует 2 — 3 и более добавочных петель. Рентгенологически выявляется симптом «трехстволки». При этом рядом со «стволом», соответствующим нисходящему отделу толстой кишки, два «ствола» образует удлиненная сигмовидная ободочная кишка, делающая в селезеночном углу дополнительный изгиб. Вследствие этого селезеночный угол представляется заполненным петлями толстой кишки, растянутыми газом. Такое скопление газа является своеобразной «воздушной подушкой», которая приподнимает левый купол диафрагмы, смещает сердце в противоположную сторону. У детей удлинение сигмовидной кишки обычно сопровождается ее расширением.
Преимущественное расширение дистальных отделов толстой кишки рентгенологически легко определяется сразу же над промежностной частью прямой кишки, проксимальнее ее внутреннего сфинктера. У большинства больных обнаруживается расширение не только прямой кишки (мегаректум), но и ректосигмоидного отдела, а иногда и находящихся выше отделов ободочной кишки.
Мегаколон необходимо в первую очередь отличать от ректальной формы болезни Гиршспрунга, особенно когда в прямой кишке плохо выявляется небольшая аганглионарная зона. В таких случаях важны данные анамнеза и клинические проявления.
Врожденные аноректальные сужения. Встречаются в 10 — 15 % аноректальных аномалий. Стриктуры обычно развиваются в случае неполного разрушения анальной перегородки в эмбриональном периоде, но иногда после травм и вследствие воспалительных процессов.
Клинические проявления: врожденное умеренное сужение в первые месяцы жизни обычно не замечается. У детей с резким стенозом кишки опорожнение кишечника задерживается и затруднено: кал у них выделяется узкой лентой или шнуром при сильном натужи-вании, беспокойстве и крике. Со временем запор прогрессирует, в кишечнике из-за длительной задержки каловых масс образуются каловые завалы, увеличивается живот, развивается каловая интоксикация организма. Во время пальцевого ректального исследования и ректороманоскопии обнаруживается сужение в виде эластического кольца или перепонка из слизистой оболочки с отверстием в центре.
Результаты рентгенологического исследования толстой кишки значительно дополняют данные пальцевого исследования и ректороманоскопии. По ним точнее определяются локализация, про
тяженность, структура и состояние вышележащих отделов толстой кишки. Сужения анального канала чаще обнаруживаются в месте перехода эндодермальной части прямой кишки в эктодермальную, реже — на несколько сантиметров выше заднепроходного отверстия и очень редко — в промежностной и нижнеампулярпой ча;сти прямой кишки. Иногда стриктура бывает таких размеров: 2 — 3 мм в поперечнике и до 3 см по длипнику. Контуры сужения четкие и ровные. Вышерасположенные сегменты кишки резко расширены, особенно проксимальная часть прямой и дистальная половина сигмовидной кишок.
Атрезии толстой кишки. Подобные врожденные уродства встречаются у 0,02 % новорожденных и располагаются наиболее часто в дистальных отделах кишки. Различают полную атрезию прямой кишки, открытие ее просвета в необычном месте промежности либо в просвет какого-либо соседнего органа. Наиболее часто выявляются полные атрезии заднего прохода и прямой кишки. На простые атрезии (без свищей) приходится 43 % аноректальных пороков развития, которые бывают нескольких разновидностей: атрезия анального канала и прямой кишки, атрезия анального канала, прикрытое анальное отверстие, атрезия прямой кишки при нормально развитом анальном отверстии.
Клинические проявления: чтобы распознать атрезию, следует осмотреть промежность ребенка в момент рождения, а тем более в первые 6 —10 ч, если у него не выделяется меконий. У новорожденного на промежности не обнаруживают заднепроходного отверстия.
При подозрении на атрезию ободочной кишки необходимо прежде всего провести ректальное исследование, при котором нередко обнаруживают пустую суженную ампулу прямой кишки, а в дальнейшем перейти к рентгенологическому исследованию.
Рентгенологическое исследование должно начинаться, как правило, с обзорного полипозиционного исследования органов грудной и брюшной полостей при различном положении ребенка. Выявляются резко увеличенные в размерах петли кишечника с горизонтальными уровнями жидкости. После обзорного исследования проводят ирригоско-пию. У места атрезии продвижение контрастного вещества приостанавливается, контрастированный отдел кишки необычно малых размеров (микро-колон), проксимальный (неконтрасти-роваппый) — расширен, содержит газ и жидкость.
Уровень атрезии можно определить по методу Каковича — Вангестина. Для этого место предполагаемого анального отверстия маркируют кусочком про-свинцованной резины: приклеивают его пластырем к промежности. Ребенка поворачивают вниз головой и держат так не менее 1 мин. За это время газ из проксимальных отделов кишечника перемещается до слепого конца прямой кишки. Затем делают снимки в прямой и боковой проекциях. По расстоянию между газовым пузырем в слепом конце кишки и меткой на промежности судят о высоте атрезии. Если край газового пузыря отдален от кожи на 2 см, атрезию называют низкой, если же более чем на 2 см — высокой атрезией.
Метод И. К. Мурашова основан на определении расстояния между седалищными буграми. Когда прямая кишка находится в тазу, межседалищный размер в среднем равен 2,5 см. Его уменьшение свидетельствует о внетазо-вом, высоком расположении прямой кишки.
Независимо от вида атрезии иногда, особенно при позднем поступлении ребенка в стационар, толстая кишка перфорирует. Поэтому во время рентгенологического исследования необхо-
149. Схема врожденных уродств прямой кишки: а — атрезия заднего прохода, б — атрезия прямой кишки; в — атрезия заднего прохода и прямой кишки; г — прямокишечно-уретральный свищ при нормальном строении заднего прохода, д — врожденное сужение прямой кишки; е — атрезия заднего прохода, эктопическое заднепроходное отверстие открывается в преддверии влагалища; ж — врожденная клоака; з — удвоение прямой кишки; и — врожденный дивертикул прямой кишки.
димо поискать свободный газ в брюшной полости (Ленюшкин, 1976).
Характерная особенность аноректальных аномалий — образование врожденных свищей, соединяющих слепо заканчивающуюся прямую кишку с мочеполовой системой или промежностью. Атрезии кишки со свищами встречаются в 50 — 61 % случаев аноректальных пороков развития. Свищи чаще соединяют атрезированную кишку с органами половой системы у девочек, а реже — с органами мочевой системы и открываются па промежность у мальчиков. У девочек через свищ кишка сообщается с преддверием влагалища, реже — с влагалищем, у мальчиков — с мочевым пузырем и с простатической или мембранозной частью уретры.
Свищ на промежности бывает коротким и обычно широким. Его наружное отверстие открывается в непосредственной близости от нормального места заднего прохода, на мошонке и даже в области полового члена. Иногда достаточно осмотра промежности, чтобы поставить правильный диагноз.
Рентгенодиагностика основывается на данных фистулографии и контрастирования соустья бариевой взвесью, так как вследствие затруднения опорожнения кишечника у детей развивается мега-колон. Труднее распознать свищи между кишкой и органами мочевой системы. Их можно обнаружить по методу Ка-ковича — Вангестина: по появлению воздушного свищевого хода или газа в мочевом пузыре. С этой же целью катетеризируется уретра и проводится уретероцистография.
Синдром Хилаидити. Относится к топографической аномалии толстой кишки. Впервые описан в 1909 г. немецким врачом Д. Хилаидити. Характеризуется диафрагмопеченочной интерпозицией толстой кишки.
Внедрение правого изгиба ободочной кишки между куполом диафрагмы и верхней поверхностью печени может носить постоянный либо преходящий характер и вызвано удлинением связок печени, в частности серповидной.
Клинические проявления: синдром не имеет типичного симптомокомплекса. У взрослых он нередко становится случайной находкой при плановых рентгеновских осмотрах, но может протекать под маской спастического колита, язвенной болезни желудка, холецистита. Это объясняется тем, что данная аномалия сопровождается воспалительными изменениями слизистой, спайками, нарушением нормального пассажа по кишечнику. У детей чаще возникает клиника острой хирургической патологии в брюшной полости, обуслов
ленная ущемлением кишечной петли между печенью и диафрагмой.
Рентгенологическая картина интерпозиции достаточно специфична. Под правым куполом диафрагмы определяется скопление газа с характерной для толстой кишки гаустрацией (если интерпонирована толстая кишка). Однако, несмотря на четкость рентгенологических данных, может возникнуть необходимость дифференцировать синдром Хилаидити с поддиафрагмальным абсцессом, скоплением свободного газа при перфорации полого органа, диафрагмальной грыжей. В сомнительных случаях рекомендуется контрастное исследование толстой кишки. В экстренных ситуациях проведение этих исследований затруднено, так как требует специальной подготовки больных и длительного наблюдения, к тому же во время ирригоскопии интерпозиция кишки нередко исчезает.
По рекомендации А. Н. Якиманского и др. (1987) можно применять несложную, но эффективную методику выявления интерпозиции толстой кишки. Больному без предварительной подготовки, непосредственно во время обзорного просвечивания брюшной полости в вертикальном положении с помощью баллона Ричардсона вводят воздух в толстую кишку до печеночного угла. Вертикальное положение больного предупреждает исчезновение интерпозиции во время исследования и тем самым облегчает диагностику.
Таким образом, правильно проведенное рентгенологическое исследование способствует постановке диагноза и позволяет избежать ненужного оперативного вмешательства. Все больные, у которых рентгенологически установлена аномалия толстой кишки, должны быть осведомлены об этом, чтобы в случае развития у них острого заболевания в брюшной полости предупредить врача о наличии аномалии и тем самым
избежать возможной диагностической и лечебной ошибки.
Синистропозиция толстой кишки. Этот вид аномалии наблюдается при расстройствах второго периода поворота кишечника, точнее, если отсутствует поворот толстокишечного отдела первичной трубки на 10—11-й неделе внутриутробной жизни. В случае отсутствия второго поворота нарушаются как направление роста толстой кишки, так и процессы ее фиксации. В конечном счете это приводит к левостороннему расположению всей толстой кишки, правостороннему расположению тонкой и наличию «эмбриональной» общей брыжейки тех отделов кишечника, которые образовались из средней петли кишечной трубки.
На основании рентгенологических данных выделяют 2 различные аномалии: синистропозицию при фиксированной толстой кишке и общую брыжейку при отсутствии ее фиксации. Однако сама брыжейка во время проведения ирригоскопии не видна, поэтому ограничение подвижности толстой кишки может свидетельствовать не об отсутствии общей брыжейки при синистро-позиции, а об ее укорочении, выраженном спаечном процессе, пленчатых отложениях и т. д. Степень подвижности толстой кишки при наличии основных характерных рентгенологических признаков отсутствия второго поворота кишечной трубки дает основание различать лишь варианты данной аномалии: подвижный и фиксированный.
В дифференциальном диагнозе левостороннего положения толстой кишки, особенно его подвижного варианта, необходимо помнить об общей брыжейке толстой и тонкой кишок, образовавшейся в результате несостоявшегося третьего периода поворота кишечной трубки или из-за нарушения фиксации правых отделов толстой кишки. Эти аномалии также характеризуются под
вижностью правых отделов толстой или слепой кишки, но в отличие от аномалии при несостоявшемся втором периоде поворота 12-перстная и тощая кишки расположены правильно, а подвздошная кишка подходит к толстой слева направо. Кроме того, существует большое количество переходных вариантов аномалии положения кишечника, верифицировать которые с помощью рентгенологического метода не всегда представляется возможным (Сидоров и др., 1978).
В клиническом отношении при аномалиях кишечника наибольшее практическое значение имеют смещаемость толстой кишки, взаимное расположение и длина ее отделов, наличие перегибов и рентгенологических признаков спаечного процесса. Подвижные формы аномалий толстой кишки обладают наклонностью к заворотам, инвагинациям, а фиксированные — к образованию различных перегибов, вызывающих явления частичной или полной непроходимости. У больных имеются приступообразные боли в животе, иногда рвота, метеоризм, запоры, чередующиеся с парадоксальными поносами.
Рентгенологическая картина-, при синистропозиции толстая кишка расположена полностью в левой половине брюшной полости, купол слепой кишки — слева внизу. Терминальная часть подвздошной кишки открывается в слепую кишку на ее правой стенке. В редких случаях синистропозиция сочетается с общей брыжейкой. Тогда все отделы толстой кишки, располагающиеся в левой половине живота, обладают хорошей подвижностью. Если нарушен третий период поворота кишечника, возникают подвижная слепая кишка, ретроцекальное расположение червеобразного отростка.
Удвоения толстой кишки. Относятся к аномалиям развития, при которых имеют место сообщающиеся с кишкой
или изолированные сферические или продольные полости, выстланные слизистой оболочкой.
Кардинальный признак удвоения — наличие мышечных слоев с характерной для ЖКТ ориентацией, поскольку просвет их может быть частично или полностью облитерирован. Различают трубчатые (тубулярные) и дивертикулярные формы удвоений. Трубчатые удвоения — удлиненно-овальной формы образования, расположенные параллельно какому-либо отделу пищеварительной трубки, при этом удвоенный отдел кишечника нередко имеет вид двустволки. Степень выраженности порока может варьировать от разделения просвета продольно расположенной мембраной до наличия двух самостоятельных идентичных отделов ЖКТ. Протяженность удвоенных участков от 1—2 см до полного раздвоения кишечной трубки. Дивертикулярные дубли-кации имеют вид кисты, связанной с основным каналом тонкой ножкой, или представляют собой выпячивания всех слоев стенки кишки наружу, реже — внутрь ее просвета (внутрипросветные дивертикулы). Удвоения бывают изолированными или сообщающимися.
Клинически удвоения толстой кишки могут протекать многие годы бессимптомно и иногда обнаруживаются на операционном столе. Этот порок развития в основном выявляют, когда возникают осложнения (изъязвления, кровотечения, завороты и кишечная непроходимость) . Нередко имеется боль в животе — следствие перерастяжения стенок кисты скапливающейся жидкостью или развивающейся непроходимости. Во время приступа болей иногда бывают рвота, видимая перистальтика кишок. Кишечные кровотечения обусловливаются локальным некрозом и возникновением пептической язвы. При перфорации ее развивается острый гнойный перитонит.
Диагностика удвоений кишечника сложная и трудная. Правильной диагностике может способствовать рентгенологическое исследование. Трубчатая форма удвоения дает равномерную полоску просветления на фоне рельефа слизистой оболочки кишки от давления добавочной трубки. При выведении ее в краевое положение прослеживают некоторое сужение просвета и сглаженность гаустр кишки со стороны добавочной трубки. Если имеется сообщение, в добавочную трубку проникает контрастное вещество. Тогда определяются две параллельные толстые кишки различной ширины или неопределенной формы тень у края кишки. Одпако такая картина встречается редко, так как в основном удвоения не сообщаются с основной полостью кишки.
Подсерозные кисты, сообщающиеся с просветом кишки, дают изображение, подобное тем, которые дают дивертикулы. Кисты, свисающие на ножке в просвет кишки, характеризуются наличием дефекта наполнения по внутреннему краю кишки с четкими контурами и создают впечатление доброкачественной опухоли. Рельеф слизистой оболочки вокруг кисты не изменен. Обтурация кишки сопровождается расширением вышележащего участка ее с застоем содержимого. Изменчивость картины при различном заполнении кишки и в различном положении ребенка дает возможность высказать предположение о наличии кисты.
Дивертикулы толстой кишки. Дивертикулы возникают, по нашему мнению, вследствие врожденной неполноценности кишечной стенки, которая с возрастом прогрессирует. Неполноценность мышечной оболочки также способствует снижению тонуса кишки и ее слабости, а повышение внутрикишечно-го давления в связи с запорами, энтероптозом и другими болезнями тол
стой кишки — выпячиванию кишечной стенки и образованию дивертикулов.
В толстой кишке обычно встречаются ложные дивертикулы — грыжеподобные выпячивания слизистой оболочки и подслизистой основы через отверстия в мышечном слое. Дивертикулы локализуются преимущественно у брыжеечного края кишки, в зоне внедрения в нее многочисленных питающих сосудов, в местах наименьшего сопротивления кишечной стенки, где естественна разреженность мышечных элементов. Снаружи дивертикулы покрыты серозной оболочкой или фиброзной тканью.
Дивертикулы бывают одиночные и множественные. В большинстве случаев находят множественные дивертикулы, чаще всего в сигмовидной ободочной кишке, реже в проксимальных отделах толстой кишки. В прямой кишке дивертикулы вообще не определяются. Одиночные дивертикулы, как правило, характерны для слепой и восходящей кишок.
Клинические проявления: неосложненный дивертикулез нередко протекает бессимптомно и обнаруживается случайно во время рентгенологического исследования. Симптомы осложненного дивертикулеза неспецифичны и напоминают признаки многих болезней ободочной кишки и других органов брюшной полости. К осложнениям дивертикулеза относятся воспалительные изменения дивертикулов (дивертикулиты), кровотечения и непроходимость кишечника.
Под нашим наблюдением находилось 104 больных дивертикулезом (от 10 до 68 лет). Из них у 84 дивертикулы обнаружены в левой половине ободочной кишки, у 2 — в поперечной ободочной кишке, у 4 — в восходящей ободочной и у одного — в слепой кишке. Тотальное поражение ободочной кишки установлено у 13 больных. У 66 больных
дивертикулез протекал бессимптомно и у 38 выражался болями в левой половине живота, диспептическими явлениями, запорами, выделениями слизи, иногда и кишечными кровотечениями.
Если воспаление в зоне дивертикула распространяется па окружающие ткани, дивертикул перфорируется и развивается ограниченный или разлитой перитонит с образованием внутренних свищей. Свищи чаще формируются вследствие прорыва абсцессов в мочевой пузырь или во влагалище. У мужчин возникают коловезикальные свищи, которые клинически выражаются пневматурией и фекалурией.
Клиническая картина дивертикулита складывается из болей в животе, иногда острых, метеоризма, диспептических явлений, повышения температуры тела и других симптомов. У некоторых больных появляются сильные кровотечения из прямой кишки (кровопотеря от 200 до 300 мл). Постепенно они уменьшаются до небольших примесей крови в кале (Левитан и др., 1980). Спастически сокращенные дистальные отделы толстой кишки болезненны. Иногда у больных с так называемыми псевдо-туморозными дивертикулитами в левой половине брюшной полости пальпируется напоминающий злокачественную опухоль инфильтрат, который способен вызвать кишечную непроходимость.
Результаты эндоскопического исследования имеют большое значение для диагностики. Но при осложнении дивертикулов и сопутствующих болезнях толстой кишки это исследование малоэффективно, так как не всегда удается осмотреть всю кишку, а в некоторых случаях колоноскопия рискованна. Из-за высоких грубых складок, повышенного тонуса сфинктеров, ригидности, плотности кишечной стенки и прочих изменений кишечника затрудняется проведение эндоскопического исследования.
150. Дивертикулы сигмовидной кишки.
Рентгенодиагностика: дивертикулы толстой кишки выявляются как после перорального введения контрастного вещества, так и после ретроградного заполнения толстой кишки бариевой взвесью. Но чаще всего для этого проводятся ирригоскопии и ирригография после медикаментозной релаксации ободочной кишки (приема под язык 3—4 таблеток азрона). Вследствие релаксации кишки ее просвет расширается, ликвидируется спазм шейки дивертикулов и дивертикулы лучше заполняются бариевой взвесь'ю.
Результаты исследования толстой кишки после ее ТЗ и ДК наиболее существенны для диагностики дивертикулов. Последние проявляются одиночными или множественными округлыми или овальными выбуханиями стенки
кишки с плавными, четкими контурам!, размерами от 0,3—0,5 до 3 см, причел в большинстве случаев длинник болып; поперечника.
Рентгенологическими признаками ди вертикулов толстой кишки являются наличие вытянутого образования, покрытого изнутри тонким слоем бариевой взвеси вне просвета кишки (npi виде сбоку) или представленного в вид; кольцевидной двойной тени от бария (при виде сверху); наличие воздухг в просвете дивертикула; полное запол нение барием просвета дивертикулг или мениски в нем, направленные г центру.
Неосложненные дивертикулы хорош< опорожняются, гаустрация кишки ног-мальная, контуры гаустр четкие и poi--ные, рельеф слизистой оболочки толсто!
кишки не изменен. Эвакуаторная функция кишечника не нарушена.
Контуры воспаленных дивертикулов деформированы, зазубрены и нечеткие. Сами дивертикулы долго не опорожняются от контрастной массы, бариевая взвесь задерживается в дивертикулах на сутки и более. Посде прорыва дивертикула контрастное вещество из него попадает в полость абсцесса или в брюшную полость. Пораженный отдел толстой кишки спазмирован, гаустры резкие, деформированные, с нечеткими контурами. Рельеф слизистой оболочки грубый, часто подушкообразный, складки ригидные, набухшие, отечные, с нечеткими контурами. При пальпации живота отмечается болезненность вдоль пораженных отделов толстой кишки.
Трудно отличить одиночные или групповые дивертикулы от полипов, когда они находятся на передней и задней стенках кишки и, как и полипы, после ТБЗ кишки взвесью создают
округлые дефекты наполнения, а после раздувания кишки образуют «кольцо». Но у дивертикула «кольцо» имеет четкий наружный и нечёткий внутренний контуры, у полипа, наоборот, внутренний контур «кольца», как правило, четкий, а наружный расплывчатый. Далее, полип характеризуется при ДК наличием дефекта наполнения, изогнутого к периферии, грибовидной формы.
Дивертикулез толстой кишки часто сочетается с холелитиазом и грыжей пищеводного отверстия диафрагмы (триада Сента). У некоторых больных дивертикулез толстой кишки комбинируется с неспецифическим язвенным колитом или с болезнью Крона. Сравнительно редко в местах воспаления дивертикулов возникают полипозные разрастания.
При постановке диагноза необходимо учитывать данные клинических, эндоскопических и рентгенологических исследований, особенно результаты релаксационной ирригографии.
Г л а в а 32. ФУНКЦИОНАЛЬНЫЕ РАССТРОЙСТВА
Во всех цивилизованных странах резко увеличилось количество больных с функциональной патологией кишечника. По данным различных исследователей, она составляет 30—70 % всех случаев гастроэнтерологических заболеваний.
Функциональные нарушения толстой кишки, ранее неправильно обозначавшиеся как «спастический колит», характеризуются полиморфной клинической симптоматикой. Этиология и патогенез их достаточно сложны и не могут считаться окончательно выясненными, поэтому лечение кишечных расстройств в значительной степени остается эмпирическим и часто малоэффективным.
До сих пор не существует единой терминологии для обозначения функциональных заболеваний толстой киш
ки. Предложено много наименований, но большинство из них неудачны или не подходят с. позиций деонтологии (несчастная кишка, раздраженная кишка и др.). Другие термины отображают лишь отдельные клинические формы либо имеют чисто отрицательное содержание, например функциональная коло-патия.
Среди специалистов гастроэнтерологического профиля, в том числе врачей-проктологов, широко применяется термин «функциональная кишечная диспепсия», который включает отдельные клинические формы ее: синдром раздраженной толстой кишки, функциональную диарею и спастический запор. В рентгенологической практике наиболее приемлем термин «дискинезия тол~ стой кишки». Заслуживает внимания
клинико-рентгенологическая классификация дискинезий толстой кишки, предложенная А. В. Фролъкисом (1980). Он считает, что дискинезии нужно различать: 1) по этиологии — первичная и вторичная (гастрогенная, гепатогенная, панкреатогенная, аллергическая, медикаментозная и др.); 2) по клиническому течению — с запором (изменчивым стулом), с безболевым поносом, с изолированным болевым синдромом и со слизистой коликой; 3) по характеру моторных нарушений кишечника — с преобладанием гипермоторики (гиперкинетическая) и преобладанием гипомоторики (гипокинетическая).
По нашему мнению, термином «моторика» нельзя обозначать движение стенки и транзит содержимого, потому что моторику невозможно определить количественно. На сегодняшний день не существует измерений, которые могли бы описать обе эти переменные (Henry, Swash, 1985). При изучении контрастированной толстой кишки обычно рассматривают либо движение стенки, либо транзит содержимого.
Дискинезии ободочной кишки сопровождаются изменением тонуса, ускорением или замедлением продвижения и эвакуации кишечного содержимого. По тоническому состоянию выделяют нормотоническую, спазматическую, па-ретически-спазматическую, паретическую и паралитическую дискинезии (Михайлов, 1983, 1989).
Спазматические дискинезии, проявляющиеся сужением просвета, по степени и характеру спазма подразделяются на следующие:
а) сфинктерная, характеризующаяся повышением тонуса круговых мышечных волокон в местах расположения сфинктеров Бузи, Гирша, Кеннона — Бема, Херста, Кеннона, Пайра — Штрауса, Михайлова, Балли, Мутье — Росси и О’Берна — Пирогова — Мутье;
б) гаустральная, выражающаяся в
нарушении правильного ритма га-устральных сегментаций и наличии спастических межгаустральных перетяжек, вплоть до разрыва бариевого столба;
в) шнуровая, проявляющаяся резким сужением просвета кишки и исчезновением гаустрации, подобная симптому «шнура»;
г) комбинированная — сочетание сфинктерного и гаустрального спазмов, гаустрального и шнурового и др.
Сфинктерный спазм относится к легкой степени, гаустральный — к средней и шнуровой — к высокой степени спазма.
Паретически-спазматическое состояние ободочной кишки характеризуется расширением просвета проксимальных и наличием спазма дистальных отделов. Паретическая дискинезия проявляется снижением тонуса, расширением просвета всей кишки со слабо выраженной редкой гаустрацией. Паралитическая форма дискинезии выражается полным расслаблением мускулатуры и отсутствием гаустр.
Дискинезии ободочной кишки могут быть локальными, сегментарными и диффузными (тотальными). При локальных дискинезиях функция ободочной кишки нарушена на ограниченном отрезке, при сегментарных в процесс вовлечены значительные участки или отделы, при диффузных — вся кишка.
При гиперэвакуаторной дискинезии содержимое быстро продвигается по кишке, опорожнение ее наступает до 24 часов, при гипоэвакуаторной — продвижение замедлено, полное опорожнение кишки происходит позже 72 часов, при анэвакуаторной дискинезии продвижение содержимого кишки отсутствует на протяжении длительного времени.
Согласно нашей классификации, нарушения двигательной функции толстой кишки в зависимости от характера
расстройства тонуса и ее опорожнения могут диагностироваться как спазмати-чески-шнуровая гипоэвакуаторная дискинезия, паретически-спазматическая анэвакуаторная дискинезия, нормотоническая гипоэвакуаторная дискинезия, паралитическая анэвакуаторная дискинезия толстой кишки и т. и.
С позиций клиницистов разграничение функциональных и воспалительнодистрофических поражений кишечника представляется крайне важным, так как лечебные мероприятия в том и другом случае оказываются совершенно разными.
Диагностика функциональных заболеваний кишечника предусматривает исключение органической патологии его, и прежде всего энтероколита и злокачественной опухоли. Для этого используются современные методы исследования, обязательно включающие рек-тороманоскопические и рентгенологические методики.
Основа рентгенологической диагностики дискинезий толстой кишки была заложена более 75 лет тому назад с применением главным образом перорального контрастирования пищеварительного тракта. Что касается эффективности ирригоскопии в своевременном распознавании функциональных расстройств толстой кишки, то сведений в отечественной и иностранной печати крайне мало. А если имеются, то они базируются на субъективном анализе рентгенологического изображения толстой кишки.
Анализ литературных данных и наш опыт показывают, что до сих пор отдельные методики рентгенологического исследования толстой кишки не нашли широкого распространения в клинической практике из-за трудностей осуществления их. Так, пероральное контрастирование требует длительного времени наблюдения за пассажем бариевой взвеси, а методика ретроградного вве
дения контрастного вещества с последующей оценкой функционального состояния толстой кишки окончательно не разработана. В литературе почти отсутствуют сведения по объективной интерпретации рентгенологической картины толстой кишки не только при функциональных ее заболеваниях, но даже и при норме. Возник разрыв между потенциальными возможностями рентгенологического метода исследования толстой кишки и реальным использованием результатов исследования в практике.
Одна из основных причин отставания в рентгенодиагностике функциональных расстройств толстой кишки — отсутствие единого методического подхода к исследованию этого отдела пищеварительного тракта и объективных средств интерпретации рентгенологической картины.
При рентгенологическом изучении силуэта толстой кишки минимальные нарушения ее функции, как правило, не фиксируются человеческим глазом, потому что последний их не воспринимает, т. е. не видит. Более того, объем информации иногда бывает настолько велик, а изменения настолько незначительны, что для их фиксации и интерпретации недостаточно человеческого потенциала. С этой задачей может справиться только ЭВМ.
Итак, проблема усовершенствования рентгенодиагностики дискинезий толстой кишки является актуальной, а применение вычислительной техники повысило бы эффективность рентгенологического метода исследования, в частности ирригоскопии при функциональной толстокишечной диспепсии.
Изложенное указывает на целесообразность рентгенологического изучения толстой кишки при ретроградном контрастировании ее у больных с функциональной патологией с переводом изображения на рентгенограмме в циф
ровое выражение. Это поможет объективизировать оценку силуэта толстой кишки и установить закономерности изменений ее параметров при различных функциональных состояниях.
Функциональная кишечная диспепсия
Материалом для настоящего раздела послужили результаты нашего клиникорентгенологического исследования толстой кишки у 105 больных ФКД. Женщин было 64, мужчин — 41, что характеризовалось их соотношением как 1,6 : 1,0. Возраст больных 21—60 лет. На первый период зрелого возраста приходилось 62 человека, или 59 %, на второй — 43, или 41 %. Женщины преобладали в первом и во втором периодах (соответственно 62 % и 58 %, табл. 5).
Основными клиническими симптомами ФКД были: расстройства стула (понос, запор или их чередование), неприятные ощущения или боли в животе, метеоризм, усиленное выделение газов. У некоторых больных имели место диспептические явления (ухудшение аппетита, изжога, горечь во рту и др.). Довольно часто у страдающих ФКД отмечались головная боль, раздражительность, повышенная утомляемость, плохой сон, симптом изменения личности. Частота и особенности симптомов, их преобладание над другими симптомами зависели от клинического
течения заболевания. Так, у больных с изменчивым стулом из клинических симптомов преобладал запор, у больных с функциональной диареей — безболевой понос, у больных с изолированным болевым синдромом — кишечная колика.
В клинической картине ФКД (табл. 6) преобладали симптомы: нарушения стула, абдоминальные боли, метеоризм и урчание в животе. Из нарушений стула (запор, попос или чередование запоров и поносов) чаще бывает запор (47,6 %), реже понос (17,1%). При запоре кал по виду напоминал овечий: был твердым, имел форму круглых шариков небольшого размера. У больных с безболевым поносом кал имел кашицеобразную или жидкую консистенцию. В легких случаях стул не превышал 3—5 раз в сутки, в тяжелых достигал иногда 6—8 раз в сутки.
У 37, или 35,3 %, больных наблюдалось чередование запоров и поносов. Причем в каждом случае это протекало по-разному. Иногда запор сменялся на короткое время выделением кашицеобразного кала, содержащего много слизи. В некоторых случаях выделялся небольшой комочек стекловидной слизи, в других в начале дефекации — шарик твердого кала, за которым следовало небольшое количество слизи. Нередко чередование запора и поноса было в течение суток: в утренние часы — кал плотный или в виде комков с большим количест-
Табл. 5. Распределение больных ФКД по возрасту н полу
Возрастной период Возраст Пол Количество больных Процент
Зрелый возраст I период 22-35 муж. 23 1 62 59
II период 21-35 35-60 жен. муж. 39 J 18 1 43 41
35—55 жен. 25 J
Всего: 105 100
Табл. 6. Частота основных клинических симптомов у больных ФКД
Симптом Количество больных Процент
Абдоминальные боли 100 95,2
Урчание в животе 86 81,9
Метеоризм 75 71,4
Нарушения стула 105 100.0
запор 50 47,6
понос 18 17,1
чередование запора и поноса 37 35,3
Патологические свойства стула (обилие слизи и др.) 61 58,1
Диспепсические расстройства 15 14,2
Эмоциональная неустойчивость 41 39,0
вом слизи, а в течение дня — несколько раз полуоформленный стул.
При изучении активности энтерокиназы и щелочной фосфатазы у больных ФКД установлено, что имеется лишь несущественное (Р>0,05) повышение энтерокиназы — в 1,5 раза и щелочной фосфатазы — в 1,4 раза. Анализ фекалий на содержание растворимого белка также показал, что у больных с функциональной патологией кишечника повышенного выделения белка (протеипо-реи) не отмечается.
Таким образом, отсутствие в кале эн-зимореи и протеинореи свидетельствует о том, что наблюдаемые страдали функциональными расстройствами кишечника, а не воспалительными заболеваниями, для которых характерны повышение активности энтерокиназы и щелочной фосфатазы в 6—8 раз и более и содержания растворимого белка — в 4—5 раз по сравнению с нормой. '
Вторым симптомом по частоте являются абдоминальные боли, характер которых разнообразный: от ноющих и неприятных ощущений в животе до сильных схваткообразных. Больные обычно предъявляли жалобы на боли в разных отделах живота: в эпигастрии, в области правого и левого подреберья, в боковых отделах брюшной полости. Как правило, боль появлялась или интенсивность ее
нарастала во время приема пищи, перед дефекацией, при физическом или нервном перенапряжении.
Наиболее выражена она при изолированном болевом синдроме и при слизистой колике. В зависимости от локализации кишечного спазма боль может ощущаться в левом нижнем квадранте живота, в левом гипогастрии или в околопупочной области. Если имелся спазм высокорасположенного селезеночного изгиба ободочной кишки, боль ощущалась в левом подреберье (синдром левой флексуры). Нередко она иррадиировала в левое плечо, левую руку и имитировала стенокардию. Боль в животе обычно резко усиливалась сразу же после еды. После дефекации или отхождения газов она уменьшалась или даже исчезала.
При слизистой колике боль была непрерывная или схваткообразная, нестерпимая, с большей локализацией в левом нижнем квадранте живота и с иррадиацией в копчик или верхнюю часть бедра. Во время болевого приступа из прямой кишки выделялось большое количество слизи, перемешанной с калом, или чистой дурно пахнущей слизи.
Третья по частоте жалоба больных — урчание в животе (81,9 %). Весьма типичны жалобы: ощущение вздутия кишечника или полноты в животе, в первую очередь зависящее от чрезмерного
151. Рентгенологическая картина толстой кишки при раздражении:
а — п восходящем отделе; б — в поперечной ободочной кишке; в — в нисходящем отделе и сигме (овоидной кишке), г — в сигмовидной кишке; д — во всей ободочной кишке
скопления газов в просвете кишечника, т. е. от метеоризма (71,4 %).
У 39 % больных ФКД отмечалась эмоциональная неустойчивость: симптомы навязчивости, фобических и депрессивных состояний. В ряде случаев больные были одержимы страхом за свое здоровье, мышление их было вязкое и прямолинейное. Нами замечено, что у больных с поносом возбудимость выше, а больные с запорами чаще находились в состоянии депрессий.
При общем осмотре больных ФКД обращало на себя внимание, как правило, хорошее общее состояние их. Клинические анализы крови и мочи в норме. Ректороманоскопическая картина: слизистая оболочка нормальной окраски, иногда гиперемия и наложение слизи.
Анализ результатов рентгенологического исследования показал, что на вводимое ретроградно контрастное вещество у 65 % больных наступает быстрая адаптация толстой кишки: формируются ее гаустры и появляются сокращения. Причем имеют место не только локальные и сегментарные спазмы, но сужаются и значительные по протяженности участки толстой кишки. Довольно часто спазм наблюдался в поперечной ободочной кишке, печеночном или селезеночном ее изгибах в сигме. Продолжительность спазма 5 —10 с и более.
Из-за раздражения кишки гаустраль-ный рисунок все время меняется: гаустры носят неправильный, асимметричный характер. Распределение гаустр по ободочной кишке неравномерное. Участки с гаустральным спазмом часто чередуются с участками кишки, где контуры ее почти гладкие и гаустра-ция отсутствует. В местах спастических сокращений нередко отмечалась зубчатость. Общая рентгенологическая картина толстой кишки в процессе исследования непостоянная.
Если спазмы сегментарные и протекали длительно, то нарушался нормаль-
ныи ритм пропульсии и опорожнения в отдельных сегментах толстой кишки. В первую очередь от бариевой взвеси опорожнялась прямая кишка, а затем раздраженные сегменты. При этом бариевая взвесь перемещалась как в проксимальном, так и в дистальном направлении. Но все же большая часть ее выжималась сокращающейся мускулатурой кишки к заднепроходному отверстию. В слепой и восходящей ободочной кишках отмечалась задержка контрастной массы. Здесь всегда имелся стаз кала и бария.
В освобожденных от бариевой взвеси отделах толстой кишки рельеф слизистой оболочки был нормальный, но контуры складок не совсем четкие, видимо из-за наличия слизи на внутренней поверхности кишки. При введении воздуха в просвет кишки она легко раздувалась до нормального объема, что свидетельствовало об отсутствии ригидности и утолщения кишечной стенки.
У больных с задержкой стула по рентгенологической картине четко выделяются три типа неврогенного запора: гиперкинетический (гипермоторный, спастический), гипокинетический (ги-помоторный) и дискинетический. При гиперкинетическом запоре имеются спазмы толстой кишки, форма и частота гаустр меняется, просвет кишки сужен, наблюдается задержка бария в слепой и прямой кишках. Гипокинетический запор проявляется уменьшением двигательной активности толстой кишки, гаустрация которой теряется, просвет расширяется. Для дискинетического запора характерно чередование спазмов в одних и парезов в других ее участках, пропульсивная и опорожнительная деятельность резко замедлены.
Сопоставление клинических признаков и рентгенологической картины показало, что все эти типы неврогенного запора можно рассматривать как фазы одного и того' же процесса. Первона-
•Табл. 7. Длина толстой кишки у больных ФКД, си
Сегмент ТБЗ Введение воздуха в просвет кишки
минимальная максимальная средняя минимальная максимальная средняя
I 16,8 37,8 23,0 14,0 37,8 24,3
II 14,0 49,0 28,9 21,3 48,9 31,1
III .15,1 33,0 21,9 13,7 30,0 21,9
IV 26,3 57,0 38,0 21,5 48,5 36,1
V 11,5 21,0 16,8 8,0 18,0 13,6
Общая 83,8 197,8 128,8+5,4 78,5 183,2 127,0+5,1
чальной является гиперкинетическая. В эту фазу больные с целью регуляции стула прибегают к частому приему слабительных. Последние, способствуя появлению стула, вместе с тем вызывают потерю жидкости и электролитов, особенно калия, что приводит к слабости мышц толстой кишки и вздутию живота. В это время наступает вторая фаза — гипокинетическая. Толстая кишка расширяется, теряет свою гаустрацию. Расширению кишки способствуют и скапливающиеся в-ней каловые массы.
Злоупотребление слабительными средствами, по нашему мнению, может привести к образованию на отдельных участках кишки глубоких перетяжек, весьма схожих со стриктурами. Такие псевдостриктуры на фоне расширенной толстой кишки являются, по-видимому, патогномоничными признаками третьей, дискинетической, фазы неврогенного запофа с длительной задержкой контрастного вещества в кишечнике.
У больных с поносом толстая кишка резко раздражена, на введение бариевой взвеси резко реагирует сокращениями круговой и продольной мускулатуры, способствуя быстрой пропульсии контрастного вещества в каудальном направлении. При слизистой колике рентгенологически определяются наличие в толстой кишке секрета и нарушение ее моторики, проявляющееся в виде
множественных асимметричных сокращений, выраженной гаустрации, спастических сужений в различных участках толстой кишки, быстрого опорожнения ее.
Наши наблюдения и исследования показывают, что ФКД может симулировать многие заболевания кишечника, которые на основании субъективной оценки рентгенологической картины толстой кишки отдифференцировать в большинстве случаев не удается. Поэтому нами проведена рентгеноколонопла-ниметрия у больных ФКД.
Совместно с Э. Е. Малевич мы установили, что в рентгеновском изображении общая длина толстой кишки при ТБЗ ее колебалась от 83,8 до 197,8 см (в среднем 128,6 + 5,4 см), а при введении воздуха соответственно 78,5 и 183,2 см (средняя 127,0+5,1 см; Р<0,001, табл. 7).
Диаметр просвета толстой кишки при ТЗ барием также колебался и в среднем соответственно был 6,2; 4,0; 3,3; 3,2; 7,4 см (табл. 8). Общий средний показатель для всей кишки равнялся 4,8 + + 0,2 см (Р<0,001). При раздувании просвета кишки воздухом поперечник ее несколько уменьшился. Общий средний показатель для всей кишки равнялся 4,4 + 0,2 см (Р<0,001).
Если принять диаметр просвета I сегмента толстой кишки за 1, то при ТЗ во II сегменте он будет 0,6, в III — 0,5,
Табл. 8. Диаметр просвета толстой кишки у больных ФКД, см
Сегмент твз Введение воздуха в просвет кишки
минимальный максимальный средний минимальный максимальный средний
I 3,6 8,3 6,2 3,6 7,8 5,6
II 2,3 5,7 4,0 1,5 5,6 4,2
III 2,3 4,6 3,3 1,1 4,8 3,2
IV 2,1 4,1 3,2 1,8 5,3 3,2
V 4,8 10,0 7,4 3,1 7,8 5,9
Средняя величина 3,0 6,5 4,8±0,2 2,2 6,3 4,4±0,2
Табл. 9. Площадь силуэта толстой кишки у больных ФКД, см2
Сегмент твз Введение воздуха в просвет кишки
минимальнаи максимальная средняя минимальная максимальная средняя
I 62,4 226,0 142,5 48,0 219,4 123,2
II 61,2 209,0 111,1 44,0 224,1 132,8
III 39,0 100,0 91,2 19,3 136,0 71,7
IV 66,1 228,2 117,6 55,6 230,7 . 122,7
V 51,7 153,3 115,3 23,5 118,9 75,5
Общая площадь 280,4 916,5
в IV — 0,5, в V — 1,19, а при раздувании воздухом он соответственно будет: 1; 0,7; 0,6; 0,6 и 1,05.
Периметр толстой кишки при ТЗ бариевой взвесью у больных ФКД колебался от 176,6 до 367,4 см и в среднем был 265,2+9,8 см. При ДК минимальный размер равнялся 162,4 см, максимальный — 359,2 см и средний — 255,6± 10,5 см (Р<0,001). Как видно из приведенных цифр, при раздувании воздухом периметр толстой кишки уменьшился на 9,6 см, или 3,6 %.
Цифровые показатели площадей сегментов при ТЗ и ДК у больных ФКД представлены в табл. 9. Отношение средних показателей площадей силуэта толстой кишки при ТЗ ее бариевой взвесью и ДК по сегментам было 1,15; 0,83; 1,27; 0,95; 1,51, а общее — 1,09±0,01 (Р< <0,01).
Объем толстой кишки у больных ФКД
577,7±45,8 190,4 929,1 525,9±35,8
также был весьма вариабельным. Так, при ТЗ он колебался от 216,9 до 760,5 (средний 438,0 ±15,7 у. е.), при ДК соответственно 165,6; 708,1 (402,4 + + 24,1 у. е., Р< 0,001). Соотношение средних величин условного объема при тугом и двойном контрастировании было 1,0 : 0,91 и равнялось 1,09+0,01. Иначе говоря, объем толстой кишки при раздувании ее воздухом уменьшился на 35,6 у. е., или на 8,1 %.
Таким образом, рентгеноколономет-рия у больных ФКД объективно отражает рентгенологическую картину толстой кишки и позволяет характеризовать состояние продольной и круговой мускулатуры ее. При тугом и двойном контрастировании общая длина и диаметр толстой кишки почти не меняются и их относительный коэффициент равен соответственно 1,01 и 1,09. Наибольший интерес представляют отношения сред
них показателей площадей и объемов толстой кишки, на основании которых получена для ФКД диагностическая константа 1,09±0,01 (Р<0,001).
Дисфункция толстой кишки в раннем послеоперационном периоде
Дисфункция кишечника в раннем послеоперационном периоде сопровождается задержкой газов и стула, вздутием живота, тошнотой, рвотой и другими изменениями и вызывает страдания у оперированных и беспокойство врача. Механизм нарушения функции кишечника в этом периоде недостаточно изучен, поэтому способы лечения несовершенны. Спорным является вопрос: какие из существующих способов лечения, какую комбинацию лекарственных веществ следует применять на протяжении всего раннего периода после хирургических вмешательств конкретно в каждом отдельном случае. Нет единого мнения и о том, когда нужно начинать лечебные мероприятия.
Нами обследовано 312 человек (124 мужчины, 188 женщин) в возрасте от 21 до 80 лет, подвергшихся следующим операциям: резекции желудка (37), экстирпации и надвлагалищной ампутации матки (33), холецистэктомии (32), аппендэктомии (41), грыжесечению (55), диагностической лапаротомии (17), удалению варикозно расширенных вен нижних конечностей (60), струмэктомии (19) и ампутации нижней конечности (18).
У 149 больных произведено рентгенологическое исследование функционального состояния толстой кишки за час до выполнения операции (через 11 ч после приема бария). Результаты исследований показали, что ширина просвета кишки составляет 5—7 см, диаметр межгаустральных промежутков равен половине или 2/з поперечника кишки, размеры гаустр на каждой стороне равны по высоте и симметричны, что со
ответствует нормальному тоническому состоянию кишечника. Заполнение контрастным веществом толстой кишки перед операцией было различным: у 91 человека (61,1 ±4,0 %) барий находился в восходящем и поперечном отделах, у 58 (38,9±4,0%) определялся и в дистальной половине толстой кишки. Таким образом, за час до операции, нарушений тонического состояния толстой кишки не наблюдалось, лишь у 58 (38,9±4,0%) больных имелось некоторое ускорение ее опорожнительной функции.
Через 24 ч после выполнения хирургических вмешательств у 66 (21,2± ±2,3 %) человек обнаружено сужение просвета кишечника вплоть до резко выраженного спазма, при котором поперечник кишки равнялся 0,3 — 1 см (0,45 ±0,11), гаустры отсутствовали и толстая кишка была подобна «шнуру» (шнуровой спазм). У 198 (63,5±2,7 %) лиц повышение тонуса характеризовалось спастической полиморфной гау-стральной сегментацией (гаустральпый спазм), у 17 (5,4 ±1,3 %) — выраженным сужением просвета кишки с разрывом бариевого столба в местах расположения сфинктеров толстой кишки, обусловленным спазмом круговых мышечных волокон (сфинктерный спазм). У 31 (9,9±1,5 %) больного наблюдалась комбинация различных видов спазма.
Наиболее выраженная степень повышения тонуса толстой кишки — шнуровой спазм преобладал после резекции желудка (81,1 ±6,4 %), комбинированный гаустрально-шнуровой спазм — после гинекологических операций (60,6±8,5%). Гаустральный спазм чаще встречался у лиц после грыжесечения (90,9±3,0 %), аппендэктомии (82,9±5,8%), лапаротомии (73,7 ± ±9,8 %), венэктомии (96,6±2,3 %) и других, а сфинктерный — преимущественно после струмэктомии (66,6 ±
±5,7%). Продолжительность спазма толстой кишки в раннем послеоперационном периоде также была неодинакова и колебалась в пределах от 1 до 3 суток. У большинства лиц после резекции желудка (73±7,3 %), холецистэктомии (84,4 ±6,5), экстирпации и надвлагалищной ампутации матки (60,6 ± ±8,5) спазм наблюдался 2 — 3 суток, а после аппендэктомии (85.4 ±5,5 %), грыжесечения (92,7±3,5%). лапаротомии (89,5±6,8 %) и внебрюшных оперативных вмешательств (83,5 ± ±3,8 %) — 1 сутки.
Таким образом, характер спазма и его продолжительность находятся в зависимости от вида и объема хирургического вмешательства. Так, наиболее травмирующие операции (резекция желудка, экстирпация и надвлагалищная ампутация матки и др.) ведут к длительно протекающему и резко выраженному диффузному спазму толстой кишки вплоть до симптома «шнура», менее травмирующие (аппендэктомия, грыжесечение, лапаротомия и др.), а также внебрюшные операции вызывают непродолжительное и умеренно выраженное повышение тонуса — гаустральный и сфинктерный спазмы.
В дальнейшем у 287 больных (92,3± ±2,3 %) выявлены расширение кишки от 8 до 10 см (8,9±0,6), накопление в ее просвете газа, свидетельствующие о наличии пареза, продолжительность и степень которого при различных операциях были неодинаковы. У 173 человек (60,3±2,9 %) парез кишечника продолжался 1 сутки, у 81 (28,2± ±2,6 %) - 2 и у 33 (11,5± 1,9 %) -3 суток. Развитие пареза начиналось с проксимальных отделов толстой кишки и постепенно распространялось в дистальном направлении на остальные ее отрезки. После операций, произведенных на органах брюшной полости, наблюдался преимущественно резко выраженный и длительно протекающий
парез толстой кишки, а после внебрюш-пых оперативных вмешательств — умеренный и непродолжительный — до суток.
При сопоставлении рентгенологических данных с клинической картиной обнаружено, что во время спазма толстой кишки больные жалоб на дисфункцию кишечника не предъявляют, в этом периоде их беспокоят лишь боли в операционной ране. Только с развитием пареза появляются жалобы на задержку газов, вздутие живота, отсутствие стула и др. Наиболее выражены эти явления после резекции желудка, холецистэктомии, экстирпации и надвлагалищной ампутации матки, а при внебрюшных хирургических вмешательствах они выражены менее. Самые большие страдания причиняет неодновременпость развития пареза в разных отделах толстой кишки: сочетание пареза проксимальных и продолжающегося спазма дистальных ее отрезков, обусловливающего задержку газов, а отсюда — вздутие живота и появление симптомов функциональной кишечной непроходимости.
Нарушение тонического состояния толстой кишки у преобладающего большинства больных (290, или 94,2± ±1,3 %) сопровождалось резким замедлением ее опорожнительной функции — от 4 до 6 суток и более. Вместе с тем продвижение содержимого кишечника в дистальном направлении во время выраженного спазма и пареза отсутствовало, а при аускультации брюшной полости кишечные перистальтические шумы не прослушивались. Опорожнение толстой кишки от бария начиналось только с восстановлением тонуса и нормальных показателей. Наиболее длительная задержка бария в толстой кишке (до 6 суток и более) наблюдалась преимущественно у лиц, у которых операции были произведены на органах брюшной полости: резекция желудка — 97,3 ±
±2,6 %, экстирпация и надвлагалищная ампутация матки — 93,9 ±4,1 %, холецистэктомия — 78,0±7,3 %. При
менее травмирующих брюшно-полосных операциях (аппендэктомия, грыжесечение) полное опорожнение толсто!
152. Рентгенологическая картина толстой кишки через сутки после:
а — аппендэктомии; 6 — грыжесечения; в — резекции желудка; г — надвлагалищной ампутации матки, д — гастрэктомии.
кишки от контрастного вещества у большинства больных (61,5 + 4,9 %) наступило на 4—5-е сутки после хирургического вмешательства. У 40 (41,2 + + 4,9 %) человек, подвергшихся вне-брюшным операциям, задержка бария в кишечнике наблюдалась 4 суток, у 36 (37,1+4,8 %) - 5, у 3 (3,1 + + 1,7 %) — 6 суток, у 18 лиц (18,6 + + 3,9%) опорожнительная функция толстой кишки соответствовала норме.
Суммируя изложенное, можно сказать, что любая операция ведет к нарушению тонической и опорожнительной функций толстой кишки, степень расстройства которых зависит от характера и объема операционной травмы. В развитии нарушений тонической функции в раннем послеоперационном периоде имеется объективная закономерность: парезу кишечника всегда предшествует его спазм. При этом расширение кишки и ее пневматизация начинаются с проксимальных отрезков и постепенно распространяются в каудальном направ
лении на остальные отделы кишечника. Нарушение тонического состояния толстой кишки у 94,2 + 1,3 % человек сопровождается резким замедлением ее опорожнительной функции от 4 до 6 суток и более после операции.
При изучении возможной многопри-чинности возникновения дисфункции кишечника в раннем послеоперационном периоде, сопровождающейся нарушением тонуса и опорожнения, естественно, возникла необходимость в клинических условиях более детально выяснить роль такого существенного фактора, как обезболивание. Это важно еще и потому, что многие хирурги связывают развитие пареза кишечника после различных хирургических вмешательств с воздействием эфирного наркоза, наиболее часто применяющегося при общем обезболивании.
В клинических условиях изучения влияния диэтилового эфира без хирургических вмешательств на функциональное состояние кишечника не прово-
153. Рентгенологическая картина толстой кишки:
а — через 2 суток после резекции желудки зарез проксимальной и спазм дистальной частей толстой кишки о — через 3 суток у того же больного — парез всей кишки
дилось. В этом смысле интересны данные сопоставления рентгенологических показателей тонической и опорожни-тельной функций толстой кишки у 60 больных в раннем периоде после удаления варикозно расширенных вен нижних конечностей, произведенного при различных способах обезболивания. Мужчин было 27, женщин 33 в возрасте от 21 до 68 лет. Из них наибольшее количество больных 54 (90±3,8 %) приходилось на зрелый возраст, меньшее — 6 (10±3,8 %) — на пожилой.
Расширение вен на левой конечности имело место у 25, на правой — у 29, на обеих конечностях — у 6 больных. Степень поражения была различной — от умеренного до резко выраженного узловатого расширения вен. Из 60 больных у 7 человек существовала осложненная форма варикозного расширения подкожных вен: у 4 — варикозные язвы голени с явлениями хронического тромбофлебита, у 3 — острый и подострый
тромбофлебит. Удаление варикозно расширенных вен нижних конечносте! у 32 человек (53,3±6,4 %) произведет по Нарату — Бебкоку, у 15 (25,0 zc ±5,6 %) — по Троянову — Бебкоку — Нарату, у 10 (16,7 ±4,8 %) — по Бег-коку — Маделунгу и у 3 (5,0 ±2,8 % больных — другими способами.
Для удобства анализа больные был1 разделены на две группы по 30 человег в каждой. В I группе венэктомия выпол йена под интубационным эфирно-кисло родным наркозом, во II — под местно! новокаиновой анестезией. У 96,7 — ±3,2 % больных обеих групп в первьи сутки после венэктомии установле> гаустральный спазм толстой кишю. Продолжительность его у преобладающего большинства лиц была 1 сутки разница показателей несущественш (Р<0,5). Парез толстой кишки, развивавшийся после спазма у 93,3 ±4,5 °/< больных I группы и у 96,7 ±3,2 % ли! II группы, наблюдался в течение 1 су
ток, вероятность существенной разницы показателей паретического состояния кишечника составляла меньше 50 % (Р^0,5). Задержка бария в толстой кишке у большинства больных обеих групп в раннем периоде после удаления варикозно расширенных вен нижних конечностей была от 4 до 5 суток, разница показателей опорожнительной деятельности несущественна (Р^0,5).
Таким образом, полученные рентгенологические данные свидетельствуют о том, что отсутствие заметной разницы в нарушениях функционального состояния толстой кишки в раннем послеоперационном периоде в зависимости от способа обезболивания следует объяснять кратковременностью действия средств, применяемых в современной анестезиологии. Причину послеоперационных расстройств двигательной функции кишечника, по-видимому, в основном следует связывать с операционной травмой.
Установив механизм развития послеоперационного пареза кишечника, мы изучили эффективность некоторых лекарственных средств. Результаты исследований, полученные в эксперименте на животных о действии атропина, аэрона, прозерина, ацеклидина на топическую и опорожнительную функции кишечника в раннем послеоперационном периоде, позволили в клинике изучить их эффективность у 260 больных после различных хирургических вмешательств. Среди обследованных — 167 женщин и 93 мужчины в возрасте от 22 до 68 лет. Большинство больных (187, или 71,9 %) приходилось на II период зрелого возраста, из них женщин было в 2,1 раза больше, чем мужчин. Остальные лица находились в I периоде зрелого возраста (30, или 11,5 %) и в пожилом возрасте (43, или 16,6 %).
Спазмолитическая эффективность атропина изучена у 36 больных, оперированных по поводу язвенной болезни
(28) и грыжи передней брюшной стенки (8). Введение атропина производилось под кожу в дозе 0,8 — 1 мг 3 раза в сутки в течение 48 ч после резекции желудка и 24 ч после грыжесечения, т. е. в период спазма кишечника. Рентгенологически установлено, что у большинства лиц (32, или 89±5,2 %) сохраняется спазм толстой кишки, переходящий в последующем в парез. При этом продвижения бария в дистальном направлении в период как спазма, так и пареза не отмечается. Полное опорожнение кишечника от контрастной массы у большинства (31, или 86,2±5,7 %) больных наступает на 5—6-е сутки после операции.
Впервые в хирургической практике для ликвидации спазма толстой кишки, развивающегося в первые 24 — 72 ч после операции, был применен отечественный холинолитический препарат — аэрон в таблетках, обладающий большей активностью, чем атропин (Машковский, 1987). Спазмолитическая эффективность аэрона изучена у ИЗ больных, подвергшихся резекции желудка (10), надвлагалищной ампутации матки (16), холецистэктомии (8), аппендэктомии (19), грыжесечению (15), диагностической лапаротомии (9), венэктомии (31) и ампутации нижней конечности (5).
Применение аэрона по 1 таблетке под язык 4 раза в сутки в течение предполагаемого повышения тонического состояния кишечника, развившегося после хирургических вмешательств, предотвращает наступление спазма толстой кишки у 94,7±2,1 % больных с достоверностью до Р<0,001, вызывает ее релаксацию, явления пареза кишечника отсутствуют. Опорожнительная функция толстой кишки по сравнению с контрольными цифрами ускоряется и у 43,3 ±4,6 % лиц соответствует норме, у остальных 56,7±4,6% — остается замедленной (Р-<0,001),
однако максимальная задержка бария в кишечнике меньше на 1 сутки и более.
Для активизации перистальтических движений кишечника в раннем послеоперационном периоде использованы прозерин и ацеклидин. Действие данных препаратов на функциональное состояние толстой кишки изучено у 111 больных, подвергшихся надвлагалищной ампутации матки (68), холецистэктомии (21), грыжесечению (12) и резекции желудка (10).
Введение под кожу 1 мл 0,05 % раствора прозерина 2 раза в сутки в течение 24—48 ч у 26 женщин после надвлагалищной ампутации матки при спастической и даже при паретически-спасти-ческой фазе нарушения двигательной деятельности толстой кишки не приводило к опорожнению кишечника от контрастной массы. При диффузном парезе толстой кишки после прозерина у 75 ± ±8,0 % больных отмечалось повышение тонуса кишки и максимальное сокращение преимущественно проксимальных ее отделов, появлялась перистальтика и после второй инъекции наступала эвакуация кишечного содержимого. У 25±8,0 % лиц прозерин был неэффективен.
У 22 человек в раннем послеоперационном периоде назначению прозерина предшествовало применение аэрона. Из них у 10 больных была произведена надвлагалищная ампутация матки и у 12 — грыжесечение. Прием аэрона под язык сразу же после операции в течение суток вызывал умеренную релаксацию толстой кишки, а последующее введение 1 мл 0,05 % раствора прозерина 2 раза в сутки привело к ее опорожнению у всех больных в нормальные сроки, т. е. до 72 ч после приема бария. Следует отметить, что у 10,4 ±4,4 % человек к прозерину имелась повышенная чувствительность: ухудшение общего состояния, длительное возбуждение, у од
ного больного наблюдалась даже потеря сознания.
Лучшим в усилении перистальтики оказался ацеклидин. Лечебная эффективность его изучена у 63 больных после падвлагалищной ампутации матки (32), холецистэктомии (21), резекции желудка (10). Ацеклидин вводили подкожно по 2 мл 0,2 % раствора 2—3 раза после предварительного применения аэрона. После инъекций препарата у оперированных больных повышался тонус круговой мускулатуры во всех отделах толстой кишки, появлялась бурная перистальтика кишечника, хорошо выявляемая при аускультации брюшной полости. У 34 человек (54±6,3 %) полное опорожнение толстой кишки от контрастного вещества наступило на вторые сутки и у 29 (46±6,3%) — на третьи сутки после хирургических вмешательств, т. е. в нормальные сроки.
Таким образом, данные фармакорент-генологического исследования дисфункций кишечника в раннем послеоперационном периоде свидетельствует, что лечение таких больных необходимо проводить с учетом фазности нарушения тонической функции. С целью профилактики пареза кишечника следует сразу же после хирургических вмешательств, т. е. в фазу развивающегося спазма, назначать спазмолитические средства.
Известно, что в терапии послеоперационных парезов кишечника успешно применяется перидуральная анестезия. С этой целью используют различные виды новокаиновых блокад рефлексогенных зон.
Мы изучили возможность восстановления эвакуаторной функции кишечника и предупреждения развития пареза его длительной перидуральной анестезией и блокадой фасциально-клетча-точного ложа брюшной аорты у 112 больных в возрасте 31—70 лет с синдромом Лериша после реконструкции
аортоподвздошного сегмента. Восстановительные операции выполняли через полную срединную лапаротомию: протезирование бифуркации аорты у 84, шунтировние у 28 пациентов. Операции производили в условиях эндотра-хеального наркоза, основными компонентами которого являлись нейролепт-аналгезия (у 82 больных) и периду-ральная анестезия (30 пациентов). Катетер проводили в перидуральное пространство между Tix—Txi в краниальном направлении на 4—5 см. У всех больных нарушений функции ЖКТ до операции не было.
По способу профилактики послеоперационного пареза кишечника больных разделили на 3 группы. I группу составили 30 пациентов, у которых пери-дуральный блок поддерживали введением каждые 2—3 ч 8—12 мл 2 % раствора тримекаина через катетер, проведенный перед операцией. Катетер оставляли в перидуральном пространстве до нормализации эвакуаторной функции кишечника. Во II группу вошли 42 больных, у которых в конце операции после ушивания заднего листка брюшины выполняли блокаду новокаином (170—200 мл 0,25 % раствора) рефлексогенной зоны описанного В. В. Ковановым и соавт. фасциально-клетчаточного ложа брюшной аорты и блокаду корня брыжейки. III группа (40 больных) была контрольной.
Рентгенологические исследования кишечника проводили у 10 пациентов трех групп, взятых произвольно (всего у 30 больных). Для этого за 3—3,5 ч до операции пациенты принимали внутрь 100 г сернокислого бария в 150 мл воды комнатной температуры. Рентгеновские снимки кишечника выполняли аппаратом 12П5 на пленке размером 30X40 см в горизонтальном положении пациентов. Первый снимок (контрольный) делали за 30—40 мин до операции (перед премедикацией), последую
щие — через каждые 24 ч с момента окончания операции в течение 4—5 суток. О состоянии тонической функции судили по средней ширине просвета данного отдела кишечника, об эвакуаторной функции — по скорости продвижения контрастной массы из тонкой кишки в толстую и по заполнению различных отделов последней. Рентгенологически исследовали дистальный участок тонкой кишки и восходящей (со слепой), поперечный, нисходящий и сигмовидный отделы ободочной кишки.
Нарушения моторно-эвакуаторной функции кишечника оценивали как парез кишечника легкой или тяжелой степени, а крайнюю степень нарушения этой функции с вовлечением в патологический процесс других органов и систем считали функциональной непроходимостью кишечника (Гальперин, 1975). Основные критерии определения этих нарушений: увеличение периметра живота (при измерении на уровне пупка) по сравнению с исходным (сразу после операции) и время полного восстановления моторно-эвакуаторной функции кишечника. Течение послеоперационного периода считали обычным без пареза кишечника при увеличении периметра живота до 3 см и самостоятельном восстановлении моторно-эвакуаторной функции его в сроки до 3 суток. Для пареза кишечника легкой степени — соответственно 3,5—6 см и 3—4 суток, тяжелой степени — 7 — 11 см и 4—5 суток, для функциональной непроходимости кишечника — более 12 см и свыше 5 суток. Через 48 ч после операции при увеличении периметра живота более чем на 3 см пациентам назначали прозерин по 1,5— 2 мг/сут., а при нарастании тяжести пареза дополнительно и другие средства стимуляции кишечника, декомпрессию желудка и толстой кишки, коррекцию белкового, водпо-электролитно-
Табл. 10. Возникновение и степень выраженности послеоперационного пареза кишечника при синдроме Лериша
Моторно-энакуаторная функция
Группа
Количество больных
без пареза
легкий парез
тяжелый парез
функциональная непроходимость
всего
I 30 16 (4) 8(3) 4(2) 2(1) 30
[53,3] [26,7] [13,3] [6,7] [100]
II 42 13 (1) 18(5) 6(3) 5(1) 42
[30,9] [42,9] [14,3] [11,9] [100]
III 40 8(1) 10(4) 13 (2) 9 (3) 40
(контрольная) 20 25 32,5 22,5 100
Примечание. В круглых скобках - - число больных, которым проводили рентгенологи-
ческое исследование, в квадратных — частота осложнений (%).
го обмена, кислотно-щелочного равновесия.
Длительная перидуральная анестезия, применяемая в послеоперационном периоде, способствовала возникновению чувства комфорта у пациентов в связи с адекватным обезболиванием операционной раны. Кроме того, она явилась и наиболее эффективным способом профилактики развития послеоперационного пареза кишечника (табл. 10). Так, парез кишечника у больных I группы наблюдали в 46,7 % случаев. При этом более чем у половины пациентов он был легкой степени, когда восстановить моторно-звакуаторную функцию кишечника удавалось быстро.
Длительная перидуральная анестезия способствовала также более быстрому восстановлению после отдельных клинических проявлений нарушения моторно-эвакуаторной функции кишечника. У 2 больных I группы с развивавшейся функциональной непроходимостью кишечника восстановить эту функцию не удалось, что явилось основной причиной летального исхода. У обоих пациентов перидуральную анестезию вынуждены были прервать: у одного через 48 ч после операции в связи с возникновением болевой реакции на введение тримекаина, когда пареза кишечника еще не было, у другого через 116 ч после операции из-за появ
ления воспаления кожи вокруг катетера. Необходимо отметить, что у некоторых больных после удаления катетера, казалось бы, на фоне восстановившейся моторно-эвакуаторной функции кишечника опять наблюдалось угнетение ее на 12 — 24 ч.
Операционная травма фасциально-клетчаточного ложа терминального отдела брюшной аорты, наличие инородного тела (сосудистый протез) превращают эту зону в рефлексогенную, поддерживающую тормозной энтеральный рефлекс (Королев и соавт., 1980). Блокада этой зоны у больных II группы патогенетически обоснована. Частота пареза кишечника у них составила 69,1 % (см. табл. 10). При этом у 42,9 % больных был парез кишечника легкой степени. Нормализация моторно-эвакуаторной функции кишечника в этой группе также наступала несколько позже, чем в I группе. От неразрешившейся функциональной непроходимости кишечника летальным был исход у 3 пациентов.
В контрольной группе парез кишечника наблюдали в 80 % случаев. Преобладали наиболее тяжелые формы его, приведшие к летальному исходу у 5 больных.
При рентгенологическом исследовании кишечника перед операцией у пациентов этих групп бариевую массу
обнаруживали в тонкой кишке на расстоянии 20 — 30 см от слепой (определяли также визуально и пальпаторно во время операции). Тонус кишки был нормальным (ширина просвета 2,5 — 3 см).
Тоническое состояние кишечника у больных контрольной группы с развившимся в последующем легким парезом кишечника или без него (клинически) достоверно отличалось от такового у пациентов этой группы с тяжелым парезом либо функциональной непроходимостью кишечника. При парезе легкой степени и без него суженную тонкую и восходящую ободочную кишки наблюдали 24 ч, а следующие отделы толстой кишки — 48 ч. Затем спазм сменялся дилатацией с последующей нормализацией тонуса кишечника. У пациентов с парезом тяжелой степени или функциональной непроходимостью кишечника сужение нисходящей ободочной и сигмовидной кишок отмечалось более чем через 96 ч после операции. У большинства из них сужение было неоднородным, с участками резкого спазма поперечных мышц толстой кишки. У этих больных клинически наблюдали развитие пареза кишечника с конца 2-х, начала 3-х суток, который через 72 — 96 ч был резко выраженным (увеличение периметра живота на 8— 14 см). Этот клинический парез кишечника рентгенологически характеризовался резким расширением петель тонкой и частично восходящей кишок (вид пчелиных сот) с одновременным спазмом дистальных отделов толстой кишки.
Длительная перидуральная анестезия и блокада фасциально-клетчаточного ложа брюшной аорты с блокадой корня брыжеек позволили снизить тонус кишечника в сравнении с тонусом в контрольной группе уже через 48 ч после операции. У больных с парезом тяжелой степени или функциональной
непроходимостью кишечника в дистальных отделах толстой 'кишки также наблюдалось длительное сужение, но менее выраженное. .
Блокады способствовали и более быстрому продвижению контрастного вещества по кишечнику. Так, восходящая ободочная кишка у 10 пациентов I группы заполнилась контрастным веществом за 24 ч, во II — за 28,8 ± ±3,2 ч, в III — за 36±4 ч; поперечная ободочная кишка — соответственно за 48±6,2 ч, 59,6±3,8 и 60±4 ч. Нисходящая ободочная кишка у 9 пациентов I группы заполнилась за 66,7 ±7,77 ч, у 8 больных II и III групп — соответственно за 75 ±9,5 и 69,5 ±5,44 ч. Сигмовидной и прямой кишок контрастное вещество достигло у 8 больных I группы за 81 ±7,77 ч, у 6 пациентов II группы — за 72±11,7 ч, у 7 больных III — за 92,6 ±8,16 ч.
Таким образом, после реконструктивных операций на аортоподвздошном сегменте у больных с синдромом Ле-риша парез кишечника развивается в 80 % случаев, если не проводятся профилактические мероприятия. Изменения тонуса кишечника после операции носят фазный характер: спазм — гипотония — нормализация. Спазм дистальных отделов толстой кишки сохра,-няется при клинической картине тяжелого пареза или функциональной непроходимости кишечника. Причем длительный спазм дистальных отделов толстой кишки как механическое препятствие приводит к истощению уже начавшейся моторно-эвакуаторной работы тонкой и восходящего отдела толстой кишок, их переполнению газами, жидким содержимым и к развитию вторичного пареза.
Длительная перидуральная анестезия и блокада ложа брюшной аорты с блокадой корня брыжеек уменьшают спазм кишечника, способствуют более быстрой нормализации моторно-эвакуаторной
функции его и предупреждают развитие пареза кишечника соответственно в 53,3 и 30,9 % случаев.
В последние годы для ликвидации спазма и нормализации функции кишечника мы широко используем акупунктуру в основном точки да-чан-шу (V = 25). Расслабление толстой кишки
начинается через 25 — 30 мин после введения тормозным методом акупунктурных игл. Переносимость процедур у всех больных была хорошей, отрицательных явлений не наблюдалось, послеоперационная непроходимость кишечника не развивалась. Реабилитация оперированных ускорялась.
Глава 33. ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ (КОЛИТЫ)
Воспалительные заболевания толстой кишки (колиты) наиболее часто встречаются во врачебной практике. Они включают большую группу неспецифических воспалений и специфических процессов. В зависимости от этиологии различают следующие группы колитов: 1) инфекционные (вызванные бактериями, вирусами, грибами или кишечными паразитами); 2) ятрогенные (после лучевой терапии или применения некоторых медикаментов — антибиотиков, нейролептиков, слабительных, иммунодепрессантов, препаратов ртути; при реакции «трансплантат против хозяина»); 3) ишемические (острые некротические колиты или хронические), протекающие обычно в виде ишемических стенозов толстой кишки; 4) колиты неясной этиологии — воспалительные криптогенные поражения толстой кишки (геморрагический ректо-колит, болезнь Крона, поражения толстой кишки при болезни Бехчета и другие; колиты при васкулитах, коллагено-зе толстой кишки; неклассифицируемые колиты, куда отнесены псевдомембранозные, гранулематозные поражения толстой кишки, возникшие без видимых причин).
По клиническому течению выделяют острые и хронические колиты; по фазе заболевания — ремиссии или рецидивы, по типам течения — монотонный, рецидивирующий, латентный, прогрессирующий; по тяжести течения — легкое, среднетяжелое, тяжелое; по характеру
функциональных нарушений — с преобладанием поносов и запоров, с чередованием поносов и запоров. В соответствии с локализацией колиты делятся на панколит, преимущественно левосторонний или преимущественно правосторонний колит, сегментарный колит (ангулит, тифлит, трансверзит, прокто-сигмоидит, проктит). Согласно изменениям в стенке кишки колиты бывают отечные, язвенные, некротические, псевдомембранозные. На основании данных эндоскопического исследования эти залолевания подразделяются на катаральные, атрофические, эрозивноязвенные, полипозные.
Точная диагностика типа колита возможна лишь после всестороннего обследования больных. Это обследование должно включать колоноскопию и биопсию слизистой оболочки, бактериологические и микологические исследования, выявление системных заболеваний, которые могут вызвать изменения в толстой кишке, а также особенностей предшествующей терапии, что важно для обнаружения ятрогенных колитов.
Хронический неязвенный колит. Возникновение чаще всего обусловлено воспалительно-дистрофическим поражением толстой кишки в результате поздно начатого или незаконченного лечения острого колита. Иногда ХНК может сразу протекать хронически (алиментарный и др.).
Нами обследовано НО больных ХНК в возрасте от 21 до 75 лет. Среди них
64 (58,18 %) женщины и 46 (41,82 %) мужчин. На зрелый возраст приходилось 77 (70 %) человек. Продолжительность заболевания 2 —15 лет.
Основные клинические симптомы: боли в животе и по ходу толстой кишки, расстройство стула в виде поносов, запоров и с чередованием поносов и запоров, снижение аппетита, тошнота, рвота. Наиболее типичны ноющие боли в нижних и боковых отделах живота, в месте поражения толстой кишки. Весьма характерны болезненность толстой кишки во время пальпации ее, спазмированные сегменты, чередующиеся с расширенными, урчащими отделами кишки. Частота и особенности симптомов, их преобладание над другими симптомами зависели от локализации и степени тяжести хронического колита.
Панколит сопровождается разлитыми болями по всему животу. Если поражена слепая кишка (тифлит), боли локализуются в правой подвздошной области, если же в процесс вовлечена восходящая ободочная кишка (тифлоколит) или терминальный отдел подвздошной кишки (илеотифлит), боли определяются в правой половине живота. Слепая кишка уплотнена, болезненна, а у больных с сопутствующим перитифлитом ограничена в подвижности. Перитифлит сопровождается нарастанием болей в правой подвздошной области во время физической нагрузки, ходьбы, тряски, иррадиирующих в поясницу, правую паховую область.
Трансверзит — поражение поперечной ободочной кишки — проявляется болями в среднем отделе живота, возникающими непосредственно после еды, урчанием и чувством распирания, сменой поносов и запоров. Больные с изолированным поражением селезеночного изгиба толстой кишки нередко отмечают интенсивные боли, сопровождаю
щиеся чувством распирания и давления в грудь и в спину. Эти боли иногда симулируют приступ стенокардии.
Больные проктосигмоидитом — воспалением прямой и сигмовидной кишок — жалуются на отдающие в поясницу или промежность боли в левой половине живота, которые возникают или усиливаются во время дефекации. Чаще больные страдают запорами, но иногда у них бывает и частый стул в утренние часы без чувства полного опорожнения кишечника. Пальпируется спастически сокращенная или раздутая болезненная сигмовидная кишка.
Эндоскопически обнаруживают гиперемию слизистой оболочки кишки с расширенными кровеносными сосудами подслизистого слоя, в отдельных случаях увеличенные лимфоидные фолликулы, гиперсекрецию слизи, которая покрывает слизистую оболочку диффузно или отдельными комочками и пленками. Изредка видны точки или прожилки крови в слизи.
Рентгенодиагностика основывается на данных ирригоскопии, свидетельствующих не только о морфологических изменениях пораженных отделов толстой кишки, но и о ее функциональных нарушениях.
После ТБЗ толстой кишки пораженные отделы сужены, с неправильной асимметричной гаустрацией и мелкой зубчатостью по контуру кишки. У больных со спаечным процессом контур кишки во многих случаях деформирован, смещаемость кишки нарушена. После опорожнения толстой кишки от бариевой взвеси на рентгенограмме {1Ьльеф слизистой оболочки пестрый вследствие воспалительного отека и изменения контуров ее складок, которые становятся расширенными, подушкообразными, уменьшается их число. Утолщение складок достигает 4—6 мм (против 2—3 мм в норме). Направление складок изменено, нередко в ди-
154. Рентгенологическая картина толстой кишки при хроническом неязвенном колите (ТБЗ).
стальных отделах кишки обнаруживаются поперечные складки. Если к контрастной массе добавлен танин, поперечные складки в сигмовидной киш ке образуются и в норме.
У больных с резким прогрессирующим воспалительным процессом в результате развития склероза и атрофии слизистой оболочки складки иногда исчезают и вовсе не определяются.
Чтобы отличить перестройку рельефа слизистой оболочки, обусловленную функциональными расстройствами, от органических изменений кишки, мы успешно проводим релаксацию толстой кишки аэроном.
Обязательно двойное контрастирова- ние толстой кишки у больных хроническим колитом, так как необходимо определить ригидность ее стенки. Если наступили грубые органические изменения стенки, кишка не полностью расправляется после введения воздуха, если же она сужена из-за спазма, то просвет кишки восстанавливается. Вместе с тем на фоне воздуха хорошо
выявляются псевдополипы, которые создают дополнительные тени.
Первичное или, по терминологии Брауна, прямое двойное контрастирование исключает тугое заполнение и изучение рельефа слизистой оболочки толстой кишки после опорожнения, так как воздух вводится через прямую кишку сразу же вслед за бариевой взвесью. При этой методике рентгено-фукпциопальные признаки колита обычно определяются не хуже, чем при традиционном тугом заполнении. В дополнение к ним на рентгенограммах можно получить изображение рельефа слизистой оболочки толстой кишки после опорожнения ее от бариевой взвеси и воздуха, если в качестве модификатора взвеси используется танин или его аналоги. Хорошие результаты дает бариевая взвесь следующего состава: вода 100 мл, цитрат натрия 1,5 г, сорбит 5 г, сульфат бария 200 г. На одно исследование используется обычно 250 — 300 мл бариевой взвеси.
Анализ полученных данных показал, что постоянными симптомами ХНК в фазе обострения являются значительное количество слизи в просвете толстой кишки и увеличенные ЛФ. У преимущественного большинства больных этой группы ЛФ выявлены главным образом при изучении рельефа слизистой с нарастанием частоты, если процесс обострился, и уменьшением выраженности их в стадии атрофии и пограничных состояний. Расположение ЛФ на всем протяжении толстой кишки встречалось редко (9,5 %), чаще было много-сегментарным. В 66,7—88,9 % случаев в зависимости от стадии заболевания ЛФ локализовались в нисходящей ободочной кишке, в 66,7 — 100 — в поперечной ободочной, в 55 — 77,8 — сигмовидной ободочной, 40—77,8 — в восходящей ободочной и 11,1—45 % — в прямой.
В зависимости от стадии ХНК раз-
155. Изменение рельефа слизистой оболочки: а — при сигмоидите, б — при тотальном колите.
меры ЛФ колебались в определенном сочетании. Мелкие (1 — 2 мм) ЛФ — как правило, характерный элемент рентгенологической картины неизмененной толстой кишки. Для ХНК типичны ЛФ различных размеров. Так, при хроническом течении заболевания у 95,5 % и в стадии обострения у 88,9 % величина ЛФ колебалась от 1 до 10 мм, в стадии атрофии у 100 % и при пограничном состоянии у 50 % — от 1 до 6 мм. Таким образом, постоянство и высокая частота ЛФ различных размеров — характерный признак ХНК. У остальных 11 (20 %) больных из-за большого количества слизи в просвете кишки ЛФ не определялись (Антонович и др., 1989).
Если воспалительный процесс локализуется в слепой кишке, то рентгенологически при остром тифлите находят затемнение в правой подвздошной области, расширение слепой кишки свыше 10—12 см, ее деформацию,
утолщение стенок с нечеткими контурами из-за отека; при хроническом — деформацию слепой кишки, неполное ее сокращение и опорожнение (тифлостаз) .
При тифлоколите рентгенологически отмечаются раздражение и незапол-нение слепой кишки, ограничение ее смещаемости, признаки хронического аппендицита, реакция лимфатической системы илеоцекальной области.
По мнению В. С. Сидорова (1983), рентгенологическое исследование у большинства больных позволяет заподозрить воспалительный процесс в толстой кишке, но не дает надежных критериев, с помощью которых можно уверенно отличить неязвенный хронический колит от вторичных воспалительных процессов в толстой кишке и начальных стадий язвенных колитов. Такое положение объясняется тем, что на различные болезнетворные агенты толстая
кишка часто отвечает одной и той же реакцией — воспалением. Рентгенологические же проявления последнего зависят не столько от этиологических моментов, сколько от распространенности, глубины и активности воспалительной реакции.
Гипердиагностика хронического колита при ирригоскопии не менее опасна, чем недооценка симптомов воспаления толстой кишки. Она дезориентирует клиницистов, заставляя их применять симптоматическое лечение, что оттягивает распознавание основного заболевания, вызвавшего вторичное, часто лишь функциональное, расстройство толстой кишки. Поэтому рентгенолог должен давать заключение о наличии подозрения на хронический неязвенный колит, основываясь в основном на рентгеноморфологических признаках заболевания. Функциональные симптомы имеют вспомогательное значение, а также могут указывать на внекишечные патологические процессы.
Таким образом, возникающие субъективные трудности при интерпретации рентгенологической картины хронического колита побудили нас перевести рентгеновское изображение силуэта толстой кишки в цифровое выражение.
Совместно с В. М. Германом мы установили, что в рентгеновском изображении общая длина толстой кишки при ТБЗ ее в среднем составляет 130,8 ±5,1 см, после опорожнения — 101,7±12,7 см и при раздувании — 128,2 ±7,5 см, а диаметр соответственно 5,6±0,8 см, 2,8±0,4 см и 5,4±1,3 см. Особый интерес представляет характеристика диаметра просвета кишки по сегментам. Так, в I сегменте он колебался от 4,3 до 11 см и в среднем равнялся 8,1 см; во II сегменте соответственно 3,2; 6,5 и 4,6 см; в III - 2,3; 5,5 и 3,6 см; в IV — 1,6; 4,7 и 3,3 см; в V сегменте — 4; 14,4 и 8,7 см.
После опорожнения кишки от кон
трастного вещества поперечник ее значительно уменьшился. Так, в I сегменте минимальный размер был 2 см, максимальный 8,5 см и средний 4,3 ±0,6 см; во II соответственно 1,5; 4,2 и 2,5± ±0,3 см; в III — 0,9; 2,8 и 1,8±0,2 см; в IV — 0,9; 3 и 1,8±0,2 см; в V сегменте — 1,5; 7,5 и 3,9±0,5 см.
При раздувании кишки воздухом поперечный размер ее по сегментам был иным. В I сегменте он колебался от 4,2 до 12,7 см (средний 8,2± 1,9 см); во II соответственно 4; 7,5 и 5,4 ± 1,2 см; в III - 2; 5,2 и 3,5±0,8 см; в IV - 2; 5 и 3,4±0,8 см; в V сегменте — 2,5; 20 и 6,5 ±1,5 см.
Средний диаметр всей толстой кишки при ТБЗ её равнялся 5,6 ±0,8 см, после опорожнения — 2,8±0,4 и при раздувании воздухом — 5,3 ±1,3 см.
Если принять диаметр просвета I сегмента толстой кишки за 1, то при ТЗ в следующих сегментах кишки он будет равен 0,6; 0,5; 0,4 и 1,1; после опорожнения — 0,6; 0,4; 0,4 и 0,9; при раздувании воздухом — 0,6; 0,4; 0,4 и 0,8. Соотношение средних диаметров толстой кишки на всех трех этапах ирригоскопии составляет 1:0,5:0,95.
Периметр толстой кишки при ТБЗ ее у больных ХНК колебался от 162,2 до 376,2 см (средний 308,6±10,7 см), после опорожнения — соответственно 131,1; 277,3 и 190,3 см, при раздувании — 168,8; 280,6 и 307,1 ±16,3 см.
Цифровые показатели площади рентгеновского силуэта толстой кишки были следующие: при ТБЗ ее она составляла в среднем 543,0 ±19,9 см2 и при раздувании воздухом 563,0±61,9 см2. Соотношение этих показателей — 1 : 1,04, или 0,96 ±0,01 (Р<0,001). Считаем, что эта константа может служить диагностическим цифровым показателем для ХНК.
Учитывая, что в практической работе врача-проктолога наиболее часто встречается проктосигмоидит, который в ряде
случаев трудно отличить от функциональной кишечной диспепсии, мы провели детальное рентгенопланиметрическое изучение сигмовидной и прямой кишок у больных ХНК и ФКД в сравнении с нормой.
Для углубленного изучения функциональных и морфологических изменений в стенке толстой кишки выполнена цифровая обработка 220 ирригограмм сигмовидной и прямой кишок в норме (58), при ФКД (84) и ХНК (78). Анализ рентгенограмм проводили с помощью отечественной телевизионной установки УАР-1.
Сравнивая цифровые показатели сигмовидной кишки при ее ТЗ, мы отметили постепенное нарастание всех планиметрических величин, исключая средние показатели диаметра. Так, при ТЗ толстой кишки средняя длина сигмовидной кишки при ФКД увеличивается на 68 мм (21,8%), при хроническом колите — на 70,9 (22,7 %); средний периметр соответственно на 76,3 (10,7 %) и 115,8 мм (16,3 %); средняя площадь — на 1398,5 мм2 (13,5 %) и 1329,6 мм2 (12,8 %); средний условный объем — на 11879,8 у. е. (14,7 %) и 11316 у. е. (13,9%). Уменьшение диаметра сигмовидной кишки при ФКД и хроническом колите на 1,26 мм (3,8 %) и 1,52 мм (4,6 %) можно' объяснить ее раздражением. Это подтверждается уменьшением длины кишки при ТЗ, ФКД и при хроническом колите на 19,83 мм (5,8 %) и 18,7 мм (5,7 %) (в норме длина увеличивается на 74,2 мм (23,7 %), а также снижением всех планиметрических показателей сигмовидной кишки в случае двойного контрастирования, исключая диаметр при хроническом колите.
При двойном контрастировании толстой кишки планиметрические показатели сигмовидной кишки у больных ФКД и ХНК уменьшаются — средняя длина на 25,9 (6,7 %) и 21,9 мм (5,7 %);
средний периметр — на 43 (5,2 %) и 7,7 мм (1,9%); средняя площадь — на 859,3 мм2 (6,5 %) и 966,4 мм2 (7,4%); средний условный объемна 8628,2 у. е. (8,3 и 8602,9 у. е. (7,3%). Если средний диаметр при ФКД уменьшается на 1,5 мм (4,5 %), что можно объяснить раздражением кишки, то увеличение среднего диаметра сигмовидной кишки на 1,2 мм (3,4 %) при ХНК обусловлено, по-видимому, ухудшением эластичности стенки кишки, связанной с отеком слизистой и снижением тонуса мышечного слоя.
Сравнение рентгенопланиметрических показателей прямой кишки выявляет изменение длины. В случае двойного контрастирования при ФКД она уменьшается на 0,7 мм (0,5 %), а при ХНК - на 40,4 (29,5 %). При ТЗ у больных ФКД средняя длина ее увеличивается на 33,8 мм (25,2 %), при ХНК - на 5,8 (4,4 %).
Все другие планиметрические показатели снижаются, исключая периметр при ФКД, причем при ДК они уменьшаются очень значительно. Если при ТЗ средний диаметр прямой кишки у больных ФКД уменьшается на 14,7 мм (16,5 %), ХНК - на 12,64 мм (14,3 %), средняя площадь — на 302,3 мм2 (2,5 %) и 2133 мм2 (8%), средний условный объем на 2196,7 у. е. и 18619,8 у. е. (20,2 %), то при ДК прямой кишки средний диаметр у больных ФКД уменьшается на 25,6 мм (30,4 %), ХНК — на 29,6 (35,1 %), средняя площадь — на 1487,14 мм2 (32,5 %) и 6190,1 мм2 (55,4 %), средний условный объем — на 29533,8 у. е. (33,3 %) и 49866,7 у. е. (56,2%). Средний периметр при ДК уменьшается у больных ФКД на 49,9 мм (22,4 %), при ХНК на 136 мм (33,9 %). В случае ТЗ прямой кишки при ХНК средний диаметр уменьшается на 12,6 мм (14,3 %), а при ФКД увеличивается на 14,68 мм (16,5%). Это можно объяснить ком
пенсаторным расширением прямой кишки при ФКД.
Необходимо отметить уменьшение изменчивости длины прямой кишки и при ФКД, и при хроническом колите — на 32 мм (19,1 %) и 43,7 мм (30,1 %) (в норме средняя длина увеличивается на 2,5 мм (1,8 %)), а также значительное сужение среднего диаметра. Если в норме средний диаметр уменьшается на 4,2 мм (4,8 %), то при ФКД на 15,2 мм (20,5 %), при ХНК на 21,2 мм (27,9 %).
Таким образом, анализ рентгеновского изображения сигмовидной и прямой кишок с высокой достоверностью (Р<0,001) показал, что у больных ХНК отмечается значительное их сужение, уменьшение площади и условного объема с одновременным увеличением длины при ДК и ТЗ.
Воспаление червеобразного отростка (аппендицит). Самое распространенное заболевание в хирургической патологии. Различают острый и хронический аппендицит. Острый подразделяется на простой и деструктивный.
Клинические признаки: острый аппендицит проявляется приступом острых болей в животе с признаками раздражения брюшины и нарушения общего состояния организма. Хронический аппендицит характеризуется нерезкими постоянными или коликообразными болями. Возникает как следствие перенесенного острого аппендицита, а иногда и без него.
Рентгенологическая картина: при простом остром аппендиците в ряде случаев выявить какие-либо изменения не удается. Если аппендицит деструктивный, имеются избыточное количество газа в слепой и восходящей кишках, ограниченное вздутие тонкокишечных петель в илеоцекальной области с нечетким горизонтальным уровнем жидкости, смазанность наружного контура большой поясничной мышцы справа в
нижних отделах, затемнение правой подвздошной области, утолщение стенки слепой кишки; левосторонний сколиоз поясничного отдела позвоночника; отсутствие кала в правой половине толстой кишки. При наличии жидкости в правом латеральном канале он расширен и затемнен. Более редкими признаками являются камни в проекции червеобразного отростка, наличие газа в его просвете, интра- и экстраперито-неальный абсцесс с образованием газа. Описанные рентгенологические симптомы при деструктивном аппендиците обнаруживаются уже через 5—6 ч от начала заболевания и обусловлены как нервно-рефлекторными факторами, так и вовлечением в воспалительный процесс периапендикулярных тканей и брюшины.
При флегмонозном, флегмонозно-язвенном и гангренозном аппендиците почти в 70 % случаев удается выявить рентгенологические симптомы, указывающие па воспалительный процесс в правой подвздошной области: дополнительную тень в нижнеправом квадранте живота и небольшие горизонтальные уровни жидкости в слепой кишке и терминальном отделе подвздошной. В случае контрастирования кишечника определяются уменьшение высоты и дефект наполнения или деформация медиальной стенки слепой кишки (симптом «ягодиц»); сужение и смещение медиально и кверху терминального отдела подвздошной кишки, отсутствие заполнения барием всего червеобразного отростка или дистальных его 3/ъ По нашему мнению, симптом вогнутости, или вдавления внутреннего контура купола слепой кишки, обусловлен спазмом мышц в ответ па воспаление в червеобразном отростке.
В случае прободения аппендицита развиваются признаки нарушения двигательной функции кишечника и изменения локализуются чаще всего в илеоцекальной области. Симптом классиче
ского пневмоперитонеума практически не встречается. Свободный газ при перфорации отростка обычно определяется в виде мелких пузырьков, расположенных чаще под нижним контуром печени в области латерального канала. Пузырек газа нередко имеет форму кофейного зерна с четкими контурами, тень его более интенсивна по сравнению с тенью газа, находящегося в просвете кишечника.
Хронический аппендицит рентгенологически. проявляется фиксацией червеобразного отростка и ограничением его подвижности, изменением положения и деформацией. Наблюдается неравномерное заполнение его барием, задержка опорожнения отростка и локализация болезненности, совпадающая с тенью отростка или с местом вероятного положения его при отсутствии контрастирования. К функциональным признакам относятся: илеостаз, аппендикостаз, це-костаз, спастические явления в слепой кишке, усиление перистальтических волн и др. При хроническом аппендиците может иметь место феномен А. Лемберга, проявляющийся в виде спазма и усиления перистальтики желудка, особенно во время пальпации отростка. Иногда наблюдается также незаполпение отростка контрастным веществом.
В неясных случаях показано УЗИ с дозированной компрессией. С помощью такого исследования обнаруживают наружный диаметр отростка более 6 мм и неспадаемость его при компрессии. Чувствительность УЗИ 75—89 %, точность 90 — 92 %.
Язвенный неспецифический колит. Под этим термином подразумевают гемо ррагически-гнойпое, некротическое неспецифическое воспаление прямой и ободочной кишок. Относится к тяжелейшим болезням пищеварительного тракта.
Этиопатогенез заболевания недоста
точно изучен. Большое значение в его возникновении придается изменению обмена витаминов и ферментов в организме, аллергии, инфекционным, нейротрофическим, аутоиммунным и прочим факторам. Делаются попытки установить связь этой болезни с коллагено-зами. По-видимому, язвенный неспецифический колит — болезнь полиэтио-логическая, в развитии ее ведущую роль играют нейроаллергические и эндокринные расстройства (Белоусов, 1978, 1984).
Первоначально изменяется прямая кишка (70 — 97,6 % случаев). В дальнейшем процесс распространяется на вышележащие отделы толстой кишки, постепенно в него вовлекается вся кишка. Поражение терминального отдела тонкой кишки проявляется так называемым ретроградным илеитом.
Неспецифический язвенный колит подразделяется на острую, хроническую непрерывно текущую и хроническую рецидивирующую формы.
Воспалительный процесс распространяется от слизистой оболочки к мышечной и серозной оболочкам толстой кишки. В ранней стадии острого процесса отмечаются отек и гиперемия, точечные кровоизлияния и рыхлость слизистой оболочки. Она кровоточит при легком дотрагивании. Вскоре появляются единичные, а затем множественные эрозии, мелкие изъязвления. Язвы чаще поверхностные, обычно не глубже толщины слизистого слоя, неправильной или овальной формы, четко очерчены, иногда склонны к слиянию и образованию сплошной язвенной поверхности на большом протяжении. Серозный покров кишки полнокровен. Вследствие прогрессирования воспаления слизистая оболочка становится резко гиперемированной, покрывается большим количеством слизи, нарастают явления отека и увеличивается число изъязвлений. Очаги изъязвлений чере
дуются с участками рубцевания, отмечается избыточное разрастание эпителия, образуются псевдополипы. В результате отека и фиброзных изменений всех слоев кишки утолщается и уплотняется ее стенка, кишка суживается и укорачивается. Из-за атрофии слизистой оболочки внутренняя поверхность кишки становится гладкой. Все эти изменения, видимо, в первую очередь обусловлены поражением сосудов (васкулитом, тромбозом и др.). У больных скоротечным, злокачественным колитом вследствие разрушения мышечного слоя кишки возможны перфорация кишечной стенки, дилатация кишки.
По локализации процесса различают проктит, проктосигмоидит, левосторонний, субтотальный и тотальный колиты, илеоколит и сегментарный колит.
Клинические проявления разнообразны и зависят от тяжести процесса и его локализации. Они складываются из симптомов колита, потери крови, признаков нарушения усвояемости пищи, а также интоксикации организма. Ремиссии иногда длятся годами и даже десятилетиями, но обычно полной репарацией слизистой оболочки они не сопровождаются. Хроническое течение нередко сменяется острым или даже молниеносным обострением. Одна из характерных черт болезни — частые осложнения, которые в итоге становятся смертельными.
Совместно с В. М. Тимофеевым мы обследовали 328 больных в возрасте от 9 до 80 лет (190 мужчин, 138 женщин). Наибольшее количество больных — 284 (86,6 %) — лица зрелого
Табл. 11. Распределение больных ЯНК по полу и возрасту
Возрастной период Возраст Пол Острый Непрерывно текущи й Рецидивирующий Всего
абс % абс % абс % абс %
Второе детство 8-12 мальчики — — —
8-11 девочки — — — 3 0.91 3 0,91
Подростковый 13-16 мальчики — — 1 0,3 — — 1 0,3
12-15 девочки 1 0,3 1 0,3 1 0,3 3 0,91
Юношеский 17-21 юноши 1 0,3 2 0,61 2 0,61 5 1,52
Зрелый возраст, 16-20 девушки — — 3 0,91 1 0,31 4 1,22
периоды I 22-35 мужчины 3 0,91 13 3,96 29 8,83 45 13,72
21-35 женщины 8 2,44 15 4,57 17 5,18 40 12,2
II 36-60 мужчины 11 3,35 29 8,84 85 25,92 125 38,11
36-55 женщины 8 2,44 12 3,66 54 16,47 74 22,57
Пожилой 61-74 мужчины 3 0,91 4 1,22 5 1,52 12 3,66
56-74 женщины — — 4 1,22 10 3,05 14 4,27
Старческий 75-90 мужчины — — — — 2 0,61 2 0,61
женщины — — — •— — — — —
Всего
35 10,7 84 25,6 209 63,7 328 100
возраста. В пожилом возрасте находилось 26 (7,9%), в юношеском — 9 (2,7 %), в подростковом — 4 (1,2%), во втором детстве — 3 (0,91 %) и в старческом возрасте 2 (0,6 %) человека (табл. И).
В зависимости от клинической картины заболевания выделены следующие формы ЯНК: 1) острый; 2) непрерывно текущий (в группу включены больные транзиторной формой, у которых очередная атака начиналась в первые 3 мес. после окончания предыдущей); 3) рецидивирующий.
Острой формой ЯНК страдали 35 (10,7 %), непрерывно текущей — 84 (25,6 %), рецидивирующей — 209 (63,7 %) больных. Во всех группах наибольшее количество пациентов — 199 (60,7 %) — были во втором периоде зрелого возраста и составили соответственно 19 (5,8%), 41 (12,5%) и 139 (42,4 %) человек (125 (62,8 %) мужчин, 74 (37,2 %) женщины).
Во всех возрастных периодах острой формой ЯНК болели 18 (51,4 %) мужчин и 17 (48,6 %) женщин, непрерывно текущей - 49 (58,3 %) и 34 (41,7 %) и рецидивирующей — 123 (58,8 %) и 86 (41,2 %), что указывает на наиболее частое заболевание мужчин.
Основные жалобы; частый жидкий стул (92,4±1,5 %), боли в животе различной локализации и характера (83,7±2,1 %), повышение температуры тела более 37 °C (56,2±2,5 %), тенезмы (17,2±1,2 %), ложные позывы (11,1 ±0,5 %) и др. Боли носили разнообразный характер и локализацию: от ноющих до схваткообразных и от локальных по ходу кишки, причем чаще слева, до разлитых болей по всему животу. Слабость отмечена в 34,96 % случаев.
Менее частыми жалобами были: похудание (9,85 %), урчание в животе (3,69%), вздутие его (1,85 %), тошнота (2,77 %), рвота (2,77 %), по одно-
156. Поражение нисходящей и сигмовидной кишок при язвенном иеспецифическом колите.
му случаю — головокружение и икота.
По тяжести течения больные распределялись следующим образом: легкая степень у 93 (28,35 %), средняя степень у 151 (46,04 %) и тяжелая — у 84 (25,61 %) больных.
Наиболее тяжело ЯНК проявляется у госпитализировавшихся только 1 раз (в 38,46 % случаев — при остром течении и в 26,31 % — при первичном непрерывно текущем). По протяженности наиболее тяжелыми клинически были субтотальный и тотальный колиты. У 3 больных обнаружен токсический мегаколон (в одном случае во время рентгенологического исследования) .
При острой форме ЯНК средняя степень тяжести была у 54,29 % больных. В 48,57 % случаев выявилось субтотальное или тотальное поражение толстой кишки. Температура тела выше 37° была у 48,57 % человек. При первично непрерывной форме ЯНК легкое течение болезни отмечено у 37,1 %, тяжелое — у 27,42 % больных. Субтотальное или тотальное поражение кишки выявлено у 51,61 % больных.
кишкн при язвенном нсснецифическом колите ском исследовании у 95 % больных.
Рентгенологическая картина ЯНК зависит от стадии болезни, степени морфологических изменений и глубины поражения стенки кишки. Вначале выявляются утолщенные и деформированные складки слизистой оболочки. Характерный симптомокомплекс, как правило, обнаруживается у больных с глубокими изменениями всех слоев стенки кишки. Прежде всего кишка укорачивается и суживается.
При острой форме ЯНК самым частым рентгенологическим признаком при ТБЗ толстой кишки является отсутствие гаустрации (80%). Второй по частоте симптом — локальные сужения (63,3 %). Мелкозубчатый характер контура был в 56,7 % случаев. В половине наблюдений определялась сглаженность гаустр. Токсическая дилатация толстой кишки встретилась 1 раз (3 % случаев острого колита). В то же время такие грозные признаки ЯНК, как двойной контур кишки, локальные ее расширения и нсевдополипоз, наблюдались одинаково часто (6,7 % случаев). Деформация складок слизистой оболочки имела место в 96,7 %, а при других формах
157. Рентгенологическая картина толстой а — губтотэльном; б — тотальном
В случае рецидивирующей формы ЯНК при первом поступлении легкое течение наблюдалось в 32,22 %, а средней тяжести — в 48,89 %. Дистальная половина толстой кишки была поражена в 66,29 % случаев этой формы. Температура тела повышалась у 45,45 % больных. Смертельных исходов не было.
При повторном поступлении больных этой формой легкое течение ЯНК выявлено в 30,83 %, а средней степени тяжести в 50 % наблюдений. Субтоталь-пое и тотальное поражение толстой кишки было у 56,6 % больных. Температура тела превышала 37° у 30,25 % больных этой группы. Смертельных исходов и в этой группе не было.
Диагноз устанавливается па основе клинических, эндоскопических, лабораторных исследований и биопсии. Однако итоги рентгенологических исследований имеют для него первостепенное значение. Рентгенологически можно осмотреть всю толстую кишку, установить протяженность и глубину поражения ее стенки, выявить органические, функциональные изменения и осложнения (ирригоскопия и ирригография).
Типичные изменения кишечника обнаружены нами при рентегнологиче-
в 100 % случаев. Второй по частоте признак — отечность складок слизистой оболочки (66,7 %), третий — крапчатость па ее поверхности. Необходимо отметить, что при острой форме ЯНК, когда длительность болезни не превышает 6 мес., уже определяются признаки, характерные для хронического течения: продольная направленность складок слизистой (3(5,7 %), атрофич-ность ее (10 %) и появление псевдополипов (13,3 %). В 3 случаях острого течения ЯНК при подозрении на псевдополипы произведено раздувание кишки воздухом и во всех случаях они выявлены.
При непрерывно текущем ЯНК также наиболее частыми симптомами при ТЗ являются отсутствие гаустр (76 %) и их сглаженность (64%). Мелкая зубчатость контуров определялась в 62 % случаев. Часто наблюдается волнистость контура. В то же время локальные сужения регистрируются всего в 54 % случаев, т. е. реже, чем при других формах. Чаще, чем при острой форме, встречались псевдополипы. Токсическая дилатация толстой кишки не обнаружена. Во всех случаях отмечалась деформация рельефа слизистой оболочки разнообразного характера, в первую очередь в виде отечных складок слизистой (78,3%). Подушкообразные складки выявлены в 47,8 % случаев, а продольно направленные — в 52,2 %. Почти в 3 раза чаще, чем при острой форме, наблюдались атрофические складки (28,3%). Крапчатость на поверхности слизистой встречалась несколько реже (43,4 %). Псевдополипы определялись в 10,8 % случаев, т. е. так же часто, как и при ТЗ. В 83,4 % случаев ДК выявлялись псевдополипы и полипы, а локальные сужения — только в 1/3 случаев.
При транзиторной форме ЯНК во всех случаях определялись отсутствие гаустрации и локальные сужения. До-
158. Симптом «толстого шнура», или «свиь цовой трубки», при язвенном неспециф!-ческом колите.
вольно часто изменялся характер кок туров. В частности, мелкая зубчатость была в 60 %, а глубокая — в 40 °/< случаев. Ни разу не удалось выявитг двойной контур стенки кишки. Де формации гаустр встречались разноог разные, но наиболее часто (50 % случаев) — дугообразная. Ни разу не определялась токсическая дилатация или локальные расширения кишки. Псевдопс липы при ТЗ обнаруживались в 10 °/< случаев этой формы. Деформация скле док слизистой оболочки была у все: больных, и наиболее частыми ее пре-явлениями служили отечность складог слизистой (/5 %), подушкообразные складки (50 %). Мелкопетлистые складки, крапчатость на поверхност! складок и псевдополипы на рельеф* встречались в 37,5 %, зубчатость боро.--
159. Изменения рельефа слизистой оболочки при язвенном неспецифическом колите: а — «причесанный» рельеф; б — крупнопятнистым рельеф (подобный булыжной мостовой).
док — реже (12,5 %), чем при описанных формах. Признаки, характерные для хронического течения,— продольное направление складок слизистой и их атрофичность — обнаруживались в 25 и в 12,5 %.
При рецидивирующей форме ЯНК мелкозубчатым контур стенки толстой кишки был в 40,4 % случаев, глубокозубчатым — в 22,1, двойным — в 3,1 %. Наиболее часто контур был волнистым (74,3 %). Деформации гаустр выявлены в 85,2 % случаев, причем более часто встречалась дугообразная (46,3 %); а остроконечная установлена в 24,2 %. Сглаженность гаустр наблюдалась в 64 % случаев. Локальные сужения диаметра кишки выявлены в 68,4 % случаев и характеризовались тем, что определялись в любых отделах кишки, могли быть одиночными и множественными, различной протяженности и степени сужения. Псевдополипы обнаружены в 13,9 % случаев.
Рельеф слизистой оболочки деформировался абсолютно во всех случаях рецидивирующего ЯНК, но характер
ее складок был различным. Изменения рельефа сочетались между собой в различных комбинациях как на рядом расположенных, так и на отдаленных один от другого участках толстой кишки.
Отечные складки слизистой оболочки выявлены в 70,6 %, подушкообразные — в 35,2, по типу «булыжной мостовой» — в 3,8, продольно направленные — в 52,8, атрофичные — в 23,2, мелкопетлистые — в 31,5, крупнопетлистые — в 22,8 % случаев; в 15,5 % складки слизистой не определялись. Крапчатость на поврехности складок была видна в 42,5 %, зубчатость бороздок — в 14,8 %. Псевдополипы и полипы были видны в 21,1 % случаев. Если кишка раздувалась воздухом, псевдополипы и полипы определялись в 75,5 % случаев, а локальные стриктуры — в 47,9 %.
При первичном поступлении чаще (3,1 %) выявляются такие рентгенологические признаки, как двойной контур (ни разу — при повторных); отечность складок слизистой оболочки после опорожнения кишки от бария, дефор
мация складок по типу «булыжной мостовой» (5,1 % против 1,4 %), зубчатость бороздок, полипы — во время изучения рельефа слизистой оболочки, полипы и псевдополипы — при раздувании кишки воздухом. При повторных поступлениях чаще, чем при первом, определялись следующие рентгенологические признаки: глубокая зубчатость контура кишки (соответственно 26,8 % и 16,9 %), деформация гаустр, сглаженность и отсутствие их, псевдополипы, выявляемые при ТЗ кишки барием; продольные и атрофичные складки слизистой оболочки, крапчатость, псевдополипы и другие признаки.
Таким образом, на одном и том же пораженном участке толстой кишки при ЯНК на каждом этапе ирригоскопии могут присутствовать несколько рентгенологических симптомов. Например, при ТЗ могут сочетаться мелкая и глубокая зубчатость, глубокая зубчатость и волнистость контура кишки, мелкая зубчатость и двойной контур, гаустры могут быть деформированными или отсутствовать, а диаметр — быть неравномерно суженным. Может быть сочетание мелко- и крупноячеистых складок, отечных и продольно направленных складок, продольно направленных складок и зубчатости бороздок, крапчатости на поверхности складок и зубчатости бороздок и др. Однако один и тот же рентгенологический признак может быть в нескольких отделах кишки, причем разделенных значительным расстоянием.
Для диагноза ЯНК нужен симпто-мокомплекс, в котором обязательно
должны сочетаться изменения со стороны контуров, гаустрации и диаметра кишки, изменения со стороны рельефа слизистой оболочки в любой комбинации. Раздувание толстой кишки воздухом помогает в выявлении объемных образований (полипов, псевдополипов, рака), стриктур толстой кишки. Оно дает возможность точно определить структуру этих образований и провести дифференциальный диагноз между ними. ДК эффективно только при хорошо очищенной толстой кишке.
Рентгенопланиметрия силуэта толстой кишки при ЯНК осуществлена по 130 ирригограммам у 77 больных (табл. 12).
Сравнительный анализ показателей при бариевом и двойном контрастировании показывает, что при введении воздуха планиметрические показатели несколько ниже, чем при ТЗ толстой кишки: длина в 1,01, диаметр — в 1,11, периметр — в 1,01, площадь — в 1,02, объем — в 1,01 раза. Если же сопоставить рентгеноколонометрические показатели ЯНК с нормой, то при ТЗ толстой кишки бариевой взвесью отмечается укорочение ее на 4,5 %, уменьшение среднего диаметра кишки на 20,7 %, среднего периметра — на 5,6 %, средней площади — на 22,6 %, среднего условного объема — на 25,0 %. При ДК по сравнению с нормой уменьшились; средняя длина толстой кишки на 20 %, средний диаметр — на 28,9, средний периметр — на 20,8, средняя площадь — на 45,5 и средний объем — на 45,5 % (табл. 13).
Табл. 12. Рентгенометрическая характеристика толстой кишки при ЯНК
Показатель ТЗ ДК
Длина, мм Диаметр, мм Периметр, мм Площадь, мм2 Условный объем 1173,3+35,86 44,79+8.74 2519,97+7867 46889+14259,12 365754+10406 1165,65+71,78 40,16+9,73 2471,43+131,47 45661+2307,66 362092+13085,9
Толстая кишка при ЯНК суживается и укорачивается. Уменьшаются ее периметр, площадь и объем. Причем эти изменения более выражены во II, IV и V сегментах.
Морфологические изменения в толстой кишке зависят от локализации патологического процесса: преимущественное поражение циркулярного слоя мышц в дистальных отделах кишки наблюдается при левостороннем ЯНК, тогда как поперечный размер проксимальных отделов приближается к норме. В случае тотального ЯНК уменьшение диаметра просвета толстой кишки отмечается по всем сегментам. Продольная мускулатура толстой кишки поражается меньше (см. табл. 13).
Определена зависимость морфологических изменений в стенке толстой кишки от тяжести течения ЯНК. Периметр толстой кишки больше уменьшается при тяжелом течении болезни, чем при легком. Это уменьшение было выражено во II и в IV сегментах, тогда как при легком течении все сегменты поражаются с одинаковой интенсивностью. Сказанное еще резче выявляется при сравнении площадей сегментов толстой кишки в случае тяжелого и легкого течения ЯНК. От степени
поражения II и IV сегментов зависят тяжесть течения и прогноз заболевания.
Нами с достоверностью доказано, что сократительная способность мышц толстой кишки при ЯНК зависит от стадии течения заболевания: циркулярная мускулатура толстой кишки поражается в большей степени при острой форме болезни, чем при хронической, и выявляется в основном во II и IV сегментах, что и определяет более тяжелое течение заболевания. Наоборот, поражение продольной мускулатуры толстой кишки резче выявляется при хронической рецидивирующей форме болезни. Из этого следует, что поражение продольной мускулатуры больше проявляется при длительном течении ЯНК, когда патологический процесс глубоко проникает в стенку кишки, захватывая наружный или продольный слой ее.
Проведенные нами рентгенометрические исследования силуэта толстой кишки у больных ЯНК с высокой степенью достоверности (Р<0,01) показали, что колонометрия дает возможность количественно оценить рентгенологические симптомы этого заболевания и исклю
Табл. 13. Разница рентгенопланиметрических показателей толстой кишки у больных ЯНК в сравнении с нормой, %
Показатель Сегмент Вся кишка
I II III IV V
Длина ТЗ -11,3 +3,8 -5,5 +0,6 -23,8 -4,5
ДК -10,4 -15,5 -26,8 -19,9 —41,6 -20,0
Диаметр ТЗ -26,9 -20,0 -10,2 —3,0 -29,2 -20,7
ДК -17,8 -22,4 -21,4 0 -58,3 -28,9
Периметр ТЗ -8,6 -2,7 -7,3 + 13,6 -25,1 —5,6
ДК -3,6 -17,2 —27,4 -1,3 -46,1 -20,8
ТЗ -31,1 -13,9 —9,2 -1,9 -45,8 -22,6
Площадь ДК -21,0 -31,2 -40,0 -18,4 -74,9 -45,5
Объем ТЗ дк -24,1 -8,7 — 21,1 -19,7 — 17,1 -39,2 -5,6 + 17,3 -33,9 -80,4 -25,0 —45,5
чить субъективность при анализе рентгенограмм.
Рентгеноколонометрия является объективным методом оценки силуэта толстой кишки, позволяющим не только своевременно диагностировать ЯНК, но и сделать его прогноз.
Рентгенодиагностика осложнений ЯНК осуществляется по обзорной рентгенографии живота в различных положениях тела больного, данным ирригоскопии и другим специальным методикам исследования.
Токсическая дилатация толстой кишки — осложнение, наиболее отягощающее течение ЯНК. Она встречается от 3 до 25 % больных ЯНК. Ведущий способ диагностики — обзорная рентгенография брюшной полости. Ирригоско-пия в тяжелых случаях ЯНК способна спровоцировать данное осложнение; при развившейся дилатации ретроградное введение контрастного вещества, повышая внутрикишечное давление, может вызвать перфорацию стенки толстой кишки. Обзорные снимки производят в любом положении больного, но чаще в положении на спине. На токсическую дилатацию указывают быстрое увеличение просвета кишки на фоне интоксикации и другие признаки этого осложнения. При токсической дилатации растягиваются все или часто брыжеечные фрагменты, особенно поперечная ободочная кишка, умеренно и реже — нисходящий и восходящий отделы толстой кишки и крайне редко — прямая кишка.
Увеличение просвета кишки зависит от состояния ее стенки. Так, при длительном хроническом течении с выраженным склерозом подслизистого и мышечного слоев растяжение ее, как правило, незначительно. И наоборот, при острой молниеносной форме заболевания величина просвета кишки может достигать 15 —18 см. Иногда отмечается чередование растянутых и относительно
узких участков кишки. С практической точки зрения целесообразно выделять 2 степени расширения толстой кишки при токсической дилатации: 1) до 8 — 10 см и 2) более 8—10 см. При I степени расширения лечебного эффекта часто удается добиться консервативными средствами, при II степени приходится прибегать к хирургическому лечению.' Гаустры при токсическом мегаколопе исчезают совсем или сглаживаются. Неровность и зазубренность контуров свидетельствуют о ригидности и снижении эластических свойств стенки кишки. В некоторых случаях на контурах определяются спикулообразные выступы, указывающие на изъязвление. Весьма характерный признак — перемежающиеся участки истонченной и утолщенной стенки кишки с неровным внутренним контуром.
При сопоставлении рентгенологических и морфологических данных препаратов удаленной во время операции дилатированной толстой кишки оказалось, что внутренняя поверхность ее при токсическом расширении была представлена лишь оставшимися островками слизистой. Микроскопическая картина кишки характеризовалась воспалительной инфильтрацией всех слоев ее стенки и часто деструкцией ганглиозных клеток подслизистого и мышечного слоев (Шнигер, 1989).
У больных токсическим мегаколоном может развиться перфорация стенки кишки. На это, помимо свободного газа в брюшной полости, указывают симптомы прерывистости истонченной стенки и скопление жидкости в кишке. Для определения их используют орто- и да-теропозицию, чаще в положении исследуемого на левом боку.
Перфорация стенки кишки развивается главным образом у больных с тяжелым течением тотального колита, особенно при токсической дилатации толстой кишки. Перфорация в свободную брюшную полость определяется
по свободному скоплению газа, главным образом под куполом диафрагмы в латеро- или ортопозиции больного. Чтобы выявить небольшое количество газа, необходимо правильно произвести снимок брюшной полости в вертикальном положении больного. Свободный газ под диафрагмой отчетливо определяется, если центральный пучок рентгеновых лучей проходит на его уровне. В случае косого направления он перекрывается гомогенной тенью печени. Определенную роль в обнаружении пневмоперитонеума играет фаза дыхания. При среднем или глубоком выдохе правый купол диафрагмы поднимается, самая верхняя часть его перемещается к центру, лучше контурируется, создаются условия для более компактной концентрации газа в медиальном отделе поддиафрагмального пространства, уменьшается толщина легочной ткани над верхним уровнем брюшной полости. Все это способствует лучшему выявлению свободного газа, особенно если его немного (Шнигер и др., 1986).
При внекишечном скоплении газа рентгенологическая картина в отличие от кишечного пневматоза характеризуется стабильностью. Ограниченный перитонит надо дифференцировать от растянутого дивертикула или псевдодивертикула, интрамурального пневматоза, распадающейся опухоли и др.
У всех пациентов с перфорацией стенки кишки развивается ограниченный или разлитой перитонит. Рентгенологическая картина разлитого перитонита характеризуется растяжением толстой и тонкой кишок на всем протяжении, вздутием желудка, утолщением брыжеечной стенки кишечника за счет воспалительного отека ее и самой брыжейки, раздвиганием петель тонкой кишки свободной жидкостью в брюшной полости. Жидкость определяется в боковых каналах и малом тазу.
У 25 % больных ЯНК бывают свищи.
Они чаще локализуются в правом фланге толстой кишки и бывают полными и неполными, простыми и сложными. Полные свищи не представляют больших диагностических трудностей. Неполные свищи обнаруживают при ирри-госкопии. Для эффективной диагностики свищей при ЯНК необходимо использовать фистулографию, ретроградное и антеградное заполнение толстой кишки. У больных ЯНК с расположением внутреннего отверстия свища на задней стенке восходящего и нисходящего отделов толстой кишки свищевой ход, как правило, проникает в забрюшинное пространство, где формируется гнойная полость.
Околокишечный абсцесс рентгенологически проявляется дополнительной тенью с весьма характерной «пористой» структурой, указывающей на множественные гнойные очаги. Иногда наблюдается картина полости с горизонтальным уровнем жидкости. При ирриго-скопии в полость абсцесса проникает контрастное вещество. Поскольку полость абсцесса располагается вблизи кишки, то, как правило, отмечаются вторичные изменения в виде вдавления стенки и некоторое оттеснение этого участка в противоположную сторону. Для выявления этих симптомов целесообразно производить прицельные снимки измененного участка толстой кишки.
У 20 % больных ЯНК имеют место стриктуры. При ирригоскопии определяют их локализацию и характер. Протяженность стриктур колеблется от 1 — 2 см до целого сегмента. Суженный сегмент деформирован, контуры его неровные, по четкие, супрастенотическое расширение представляется умеренным. Определенную роль в дифференциальной диагностике с раком играет париетография. На париетограммах при стриктуре толщина стенки суженного фрагмента почти не меняется, внутренний контур ровный; при наличии около-
кишечных сращений определяются деформация наружной стенки и спайки. При локализации стриктуры в поперечной ободочной кишке париетогра-фию целесообразно проводить в трохо-или ортопозиции, в правых отделах — в латеропозиции на левом боку исследуемого, в левых отделах — также в латеропозиции на правом боку (Михайлов, 1982; Михайлов, Авазашвили, 1988;, Шнигер, 1989).
Осложнение ЯНК в виде рака встречается в 0,8—10 % случаев. Некоторые авторы указывают, что риск возникновения рака у страдающих ЯНК в 5 — 7 раз выше, чем в общей популяции. По мнению большинства исследователей, частота рака при ЯНК находится в прямой зависимости от длительности заболевания, распространенности поражения кишки, характера клинического течения. Чаще рак развивается после 10-летнего анамнеза и при тотальном поражении.
Во всех случаях раковая опухоль имеет циркулярный рост и довольно большую протяженность. Рентгенологическая картина рака на фоне колита характеризуется обычными проявлениями. Следует отметить, что эндофит-но растущие раки толстой кишки могут быть приняты за прогрессирование регионарного язвенного колита. Большую роль в рентгенодиагностике рака при ЯНК играет париетография. На париетограммах, как правило, определяются локальное утолщение стенки кишки, отграниченный наружный контур при отсутствии прорастания, четко ди фферен ци руется вн у три просвет ны й компонент опухоли, неровность внутренней его поверхности свидетельствует об изъязвлении последней.
По клинической и даже морфологической картине язвенный неспецифический колит нередко напоминает многие болезни ободочной и прямой кишок, особенно неврогенные колопа-
тии, бациллярную дизентерию, туберкулез и др.
Неврогенные колопатии протекают без резкого исхудания больных. Их обострения обычно связаны с волнениями, страхом, испугом. Кровь в испражнениях не обнаруживается. Рентгенологически выявляются расстройства функций толстой кишки.
Наиболее трудно дифференцировать ЯНК от бациллярной дизентерии, тем более что принципиальных различий в рентгенологической картине обеих болезней нет (Антонович, Лыкошина, 1976). Большое значение, особенно в случаях острого течения болезни, приобретают клинические признаки и результаты бактериологического исследования.
Туберкулезный колит отличается от ЯНК длительным и монотонным течением. Язвенная форма туберкулеза толстой кишки наиболее часто сочетается с фиброзно-кавернозным или гематогенно-диссеминированным туберкулезом легких. Для дифференциального диагноза важны результаты туберкулиновых проб и бактериологического исследования.
Чаще всего приходится отличать ЯНК от болезни Крона, так как клинически и рентгенологически они схожи. Дифференциальная диагностика основывается на том, что при болезни Крона не бывает равномерной гиперемии и зернистости слизистой оболочки кишки, характерны глубокие и щелевидные язвы, особенно между отечными складками слизистой оболочки. У больных ЯНК изменения кишки диффузные, равномерные, у страдающих болезнью Крона — прерывистые, чередуются с участками нормальной слизистой оболочки. В случаях развития ЯНК отмечаются сглаженность и исчезновение гаустр, просвет толстой кишки равномерный с двойным контуром, рельеф мелко- и крупносетчатый. При болезни
Крона сужен какой-либо один сегмент толстой кишки, ее просвет неравномерный, контуры неровные, резкие, рельеф слизистой оболочки перестроен по типу «булыжной мостовой», обнаруживаются псевдодивертикулы, свищи. Диагностическое значение имеют результаты определения толщины стенки толстой кишки: у больных ЯНК толщина стенки не превышает 5 мм (чаще менее 4 мм), у страдающих болезнью Крона она более 5 мм (до 7 мм).
Пост'дизентерийный колит. Является продолжением хронической дизентерии. В отличие от последней при ПДК инфекционный процесс закончен и возбудитель в организме отсутствует.
Клиническое проявление обусловлено не инфекцией, а функциональными и морфологическими нарушениями ЖКТ. Последние легко возникают под влиянием различных неблагоприятных факторов в связи с повышенной чувствительностью (ранимостью) пищеварительного тракта, возникающей после перенесенной острой дизентерии.
При хронической дизентерии наряду с функциональными и морфологическими нарушениями ЖКТ ведущую роль в патогенезе клинического проявления заболевания играет инфекция.
Клиническое течение ПДК более доброкачественное, общее состояние больных долгое время остается вполне удовлетворительным, потеря в весе, а также авитаминоз могут не наблюдаться или быть незначительными. Трудоспособность чаще сохранена. Если лечение назначено правильно, болезнь обычно редко прогрессирует.
При хронической дизентерии клиническая картина заболевания выражена более резко, заболевание чаще протекает с рецидивами, во время которых отмечаются субфебрильная температура, понос со слизью и кровью. Значительно чаще нарушено общее состояние больных, имеются потери в весе, при
знаки авитаминоза, изменения со стороны крови. Отмечается тенденция к прогрессированию заболевания.
В каждом конкретном случае диагноз «хроническая дизентерия» нужно стараться подкрепить выделением возбудителя. О помощью многократных отрицательных бактериологических исследований можно в большинстве случаев дифференцировать эти два сходно протекающих клинических заболевания. Следует, однако, отметить, что в ряде случаев при атипичном течении хронической дизентерии отличить ее от ПДК трудно.
Клиническая картина ПДК характеризуется большим многообразием. В зависимости от тяжести заболевания дифференцируют легкую, среднюю и тяжелую формы. Необходимо указывать также тип течения и фазу заболевания.
По типу течения различают: 1) монотонное; 2) перемежающееся - в тех случаях, когда хроническое течение сопровождалось более или менее часто повторяющимися значительными обострениями; 3) рецидивирующее, когда после периодов полного затишья или резкого уменьшения клинических симптомов заболевания периодически вновь наблюдалось ухудшение состояния, появление прежних патологических симптомов. При этом выделяют фазы: 1) обострения, 2) затухающего обострения, 3) неполной ремиссии, 4) полной ремиссии.
Как и любой колит, ПДК принято подразделять на различные формы по патоморфологической картине (катаральный, или катарально-слизистый, фолликулярный, или фолликулярноязвенный, гнойный, язвенный и др.). В зависимости от протяженности и преимущественной локализации процесса в кишечнике различают диффузный и сегментарный колиты. Следует отметить, что во всех предложенных классификациях xapai. н'ристика пато
логической картины дается по результатам ректороманоскопии и рентгенологических исследований.
Согласно гистоморфологической картине слизистой оболочки толстой кишки выделяют в основном 3 формы: поверхностное воспаление, диффузное воспаление и атрофию слизистой оболочки толстой кишки. По данным ректороманоскопии дифференцируют катаральный, атрофический, эрозивный и язвенный проктосигмоидит.
На основе изложенных нами клинических и анатомических данных и в зависимости от тяжести заболевания можно выделить 3 формы колита. Легкая форма протекает с выраженными симптомами, особо не беспокоящими больных. Периодически отмечается диарея с небольшой примесью слизи, иногда запоры. Временами опорожнение кишечника нормальное. При копрологическом анализе патология чаще не выявляется. Содержание кишечных ферментов в кале в пределах нормы. Ректороманоскопическое исследование чаще всего определяет нерезко выраженные катаральные изменения. При гистологическом исследовании слизистой оболочки кишки выявляется поверхностное и реже диффузное воспаление. Общее состояние организма удовлетворительное.
В случае тяжелой формы заболевания нарушается общее состояние организма (похудание, упадок сил, дистрофия, гипо- и авитаминоз, резкое понижение трудоспособности). Субъективные и объективные признаки ПДК выражены отчетливо. Беспокоят боли, чаще в нижней половине живота, вздутие и урчание в нем, в большинстве случаев уменьшающиеся после акта дефекации. Во время копрологического исследования определяются патологические элементы: слизь, лейкоциты, гной, кровь, непереваренные мышечные волокна, жиры и т. д. Стул частый, с ложными позывами, тенезмами. В период обостре
ния наблюдается картина, свойственная инфекционным болезням: лихорадка, озноб, головные и мышечные боли. Ректороманоскопическое исследование обнаруживает выраженные морфологические изменения слизистой оболочки дистального отдела толстой кишки: гиперемию, мелкоточечные кровоизлияния, эрозии, реже язвы. С помощью микроскопического изучения слизистой оболочки толстой кишки выявляются выраженные воспалительные и деструктивные изменения в строме слизистой оболочки. Как правило, наблюдается вторичное вовлечение в патологический процесс других органов системы пищеварения (желудка, печени, поджелудочной железы).
Если заболевание средней тяжести, тоже ясно выражена клиническая картина ПДК. Больных беспокоят боли в животе. Определяются патологические элементы при копрологическом анализе, умеренное повышение количества энтерокиназы и щелочной фосфатазы в кале. Ректороманоскопия и гистологическое изучение слизистой оболочки толстой кишки выявляют заметные патоморфо-логические изменения. При длительном течении заболевания общее состояние больных может страдать более или менее значительно. В патологический процесс также вовлекаются другие органы пищеварительного аппарата. Наблюдается похудание, особенно после обострения. По выраженности клиникоанатомических проявлений средняя форма ПДК может быть различной. В одних случаях она ближе к легкой форме, в других — к тяжелой, представляя собой постепенный переход от легкой к тяжелой форме колита.
Клиническая диагностика ПДК представляет значительные трудности. Весьма часто ставятся ошибочные диагнозы: гепатохолецистит, хронический гастрит, язва желудка или 12-перстной кишки, энтерит, желчнокаменная болезнь, хро
нический аппендицит, спастический колит и др. Нередко при правильном диагнозе не уточняется локализация и протяженность язвенного колита. Поэтому лишь комплекс данных — клинических, ректороманоскопии, лабораторного и рентгенологических исследований позволяет своевременно распознать ПДК.
В 50 % случаев (Атабекова, 1975) при постдизентерийном язвенном колите поражается правый отдел толстой кишки. Около 30 % больных поступают в клиники с воспалительным поражением левого ее отдела. Намного реже встречаются постдизентерийные язвенные трансверзиты и панколиты. Обращает на себя внимание тот факт, что ошибочные диагнозы в подавляющем большинстве случаев ставятся при локализации язвенного колита в правой половине толстой кишки и несколько реже — в левой.
В механизме развития хронических ПДК значительная роль принадлежит аллергическому компоненту иммунопатологического характера. Это подтверждают рентгенологические наблюдения за собаками, у которых в эксперименте воспроизводится язвенный колит по типу органоспецифической сенсибилизации (Атабекова, 1971). Наличие аутоаллергического компонента при постдизентерийном язвенном колите в определенной мере обусловливает хроническое течение и определяет клинико-рентгенологические особенности этого заболевания. Динамические рентгенологические наблюдения с учетом клинико-лабораторных показателей позволяют выделить фазы обострения, затихания и клинико-рентгенологического выздоровления.
Одним из ведущих показателей течения ПДК является рентгенологическая картина изменений. Рентгенологическое исследование толстой кишки можно считать методически правильно выполненным и полным, если оно состоит из
исследования ее с помощью контрастной клизмы и контрастного завтрака, а рентгенологическое заключение — достаточно развернутым, если оно базируется на полученных при этом результатах. Только сочетание этих двух методик, которые взаимно дополняют друг друга, дает возможность наиболее полно судить о функциональных и морфологических изменениях в органах ЖКТ и решить ряд вопросов в диагностике и уточнении фазы течения заболевания.
К рентгенологическим симптомам ПДК можно отнести нарушение двигательной функции кишечника, проявляющееся обычно замедленным прохождением контрастной массы по тонкой и толстой кишкам, наличие спастических сокращений анатомических и функциональных сфинктеров толстой кишки, недостаточность функции илеоцекального клапана.
У больных с различной локализацией ПДК частота и ценность отдельных рентгенологических симптомов заметно отличаются. Тем не менее имеются и общие закономерности, которые свойственны различным фазам заболевания.
Фаза обострения характеризуется наличием стойких округлой или овальной формы депо бария — «рельефных ниш», резко утолщенными, отечно гиперплазированными складками слизистой оболочки толстой кишки, нередко симулирующими злокачественное новообразование; скоплением большого количества газа в толстой кишке с горизонтальным уровнем жидкости (симптом Клойбе-ра); большим количеством жидкости (воспалительного секрета); стойким изменением просвета толстой кишки, чаще увеличенного до 10 — 15 см (гипотония), реже уменьшенного (спастическое сокращение); стойкой деформацией гаустр; нарушением моторно-эвакуаторной функции толстой кишки с замедленным прохождением контрастной массы по ее отделам — гипомотор-
ной дискинезией; упорными спазмами анатомических и функциональных сфинктеров, препятствующими равномерному заполнению толстой кишки при ирригоскопии; отрицательным илеоцекальным рефлексом с запаздыванием начального заполнения слепой кишки (от 8 до 11 ч) и длительным илеостазом (до 30 ч и более); недостаточностью илеоцекального клапана.
Одним из основных рентгенологических признаков фазы обострения ПДК является скопление большого количества газа в кишечнике с характерным расположением его в виде множественных пузырей небольших размеров с горизонтальным уровнем жидкости. Наличие значительного количества жидкого воспалительного секрета в толстой кишке указывает на усиление экссудации при нарушении всасывательной функции ее стенок. Этот же воспалительный секрет, обычно жидкой консистенции, заполняя имеющиеся язвы и изъязвления слизистой толстой кишки, резко снижает частоту основного рентгенологического симптома язвенного колита — выявления рельефных и контурных ниш в толстой кишке. Только у 18,3 % больных в фазе обострения при исследовании толстой кишки находят рельефные ниши.
В острой фазе заболевания наряду с нарушением тонуса, моторно-эвакуаторной функции и рельефа слизистой заметно нарушается и секреторная функция желудка. У большинства больных с правосторонним язвенным колитом и панколитом обычно преобладает ахилическое состояние желудочного сока, значительно реже такие изменения наблюдаются у больных с язвенными трапсверзитом и левосторонним колитом.
Фаза затихания ПДК рентгенологически проявляется значительным уменьшением ширины складок слизистой оболочки толстой кишки; уменьше
нием количества газа в кишечнике, который имеет неопределенную форму и располагается обычно в печеночном или селезеночном изгибе, а иногда и вообще отсутствует; уменьшением или отсутствием жидкого воспалительного секрета и появлением секрета вязкой консистенции; сокращением просвета ранее расширенной толстой кишки и расширением ранее суженной кишки, что обусловлено восстановлением нормального тонуса кишечной стенки, нормальной формы и величины деформированных гаустр и моторно-эвакуаторной функции толстой кишки у значительного числа больных (26%); отсутствием упорных и длительных спазмов в анатомических и функциональных сфинктерах; нормализацией функции илеоцекального клапана и тонуса терминального отдела подвздошной кишки, обусловливающих своевременное заполне^ ние слепой и опорожнение подвздошной кишок.
Необходимо отметить, что в этом периоде заболевания количество больных с прямым рентгенологическим симптомом язвенного поражения стенки толстой кишки (стойкими депо бария с окружающим воспалительным валом) существенно не уменьшается, а иногда и увеличивается. Это вызвано тем, что при большом количестве воспалительного секрета в толстой кишке в фазе обострения выявление язв кишечной стенки весьма затруднено, так как они заполнены секретом. После уменьшения количества секрета нередко при рентгенологическом исследовании обнаруживаются язвы толстой кишки (Атабекова, 1975).
В фазе выздоровления рентгенологическое исследование показывает полную нормализацию морфологии органов пищеварительного тракта у всех больных и их обычную функцию у преобладающего большинства. Лишь в редких случаях в этой фазе заболевания у больных
имелось понижение тонуса желудка, замедление эвакуации из него и запаздывание сроков заполнения слепой кишки.
Таким образом, сочетанная клиникорентгенологическая диагностика и дальнейшее динамическое наблюдение за состоянием кишечника в значительной степени способствуют улучшению диагностики постдизептерийных колитов и уточнению фазы течения.
Псевдомембранозный колит. Это своеобразное поражение внутренней поверхности толстой кишки: на фоне отечной, разрыхленной и гипертрофированной слизистой оболочки имеются возвышающиеся желтовато-белые или сероватые бляшки (лентовидные «мембраны») диаметром 2 — 15 мм. Этиопатогенез заболевания мало изучен. Считают, что в возникновении его играют роль токсины и антибиотики (линкомицин, ампициллин, цефалоспорины и др.).
Основной диагностический критерий ПМК — наличие поверхностной мембраны, образованной из полиморфных клеток собственной пластики слизистой оболочки. Эта мембрана состоит из фибрина, слизи, разрушенных полиморфных и эпителиальных клеток.
Клинические проявления: основной симптом — диарея, сочетающаяся у 60 % больных с интермиттирующим субфебрилитетом. Иногда отмечаются колики в животе, что в наиболее тяжелых случаях может симулировать картину острого живота. Редко встречаются изменения по типу токсического мегако-лона. Кал часто содержит избыточное количество слизи, а гной или кровь отсутствуют. В некоторых случаях диарее сопутствуют тошнота и рвота. Клинические признаки у необследованных больных могут наблюдаться как кратковременно (в течение 48 ч), так и длительно (в течение 50 суток); в основном симптоматика полностью разрешается в
пределах 10 — 14 дней после прекращения введения антибиотиков, и больные выздоравливают.
Для диагностики ПМК рекомендуется рентгенологическое исследование толстой кишки с помощью контрастной клизмы. Псевдомембраны можно увидеть только при исследовании с двойным контрастированием. Другие рентгенологические данные не носят специфического характера и свидетельствуют лишь о диффузном колите: выявляются зубчатость контуров толстой кишки, отек ее стенки, расширение складок, нарушение гаустрации. Укорочения кишки не бывает. У некоторых больных могут быть множественные изъязвления слизистой оболочки и признаки пневматоза толстой кишки.
Ишемический колит. Этим термином следует обозначать воспалительный процесс в толстой кишке, вызванный поражением сосудов и не приводящий к полному некрозу (гангрене) ткани. Он варьирует от скоротечного и обратимого эпизода воспаления до массивной фиброзной стриктуры, вызывающей полную кише шую непроходимость (Marston, 1986 .
Клинические проявления: чаще всего начинается остро и обычно возникает на фоне ишемической болезни сердца, недостаточности периферических артерий, коллагенозов или локальных поражений толстой кишки. Типичными симптомами являются острая боль в левой подвздошной ямке, сначала тошнота, а затем и рвота. За этим следуют 1—2 дефекации с выделением рыхлых каловых масс, для которых характерно наличие темной крови и сгустков. Во время осмотра больного отсутствуют признаки тяжелого заболевания или шока, отмечаются лишь гипертермия и учащение пульса. У всех больных резко болезненна при пальпации правая подвздошная область, а также область над тазом, при пальцевом исследовании
прямой кишки обнаруживается темная кровь.
С помощью ректороманоскопии обычно не удается увидеть зону поражения, поскольку эта зона находится вне пределов досягаемости инструментом. Однако в литературе имеются сообщения о случаях, когда диагноз был поставлен с помощью такого метода. При осмотре отмечаются сине-багровые, неправильной формы участки слизистой оболочки с отеком и контактной кровоточивостью. Безопасная для больного колоноскопия — чрезвычайно ценный метод диагностики, позволяющий выявить ранние признаки заболевания. В зависимости от стадии процесса находки варьируют от отека, поверхностного изъязвления до ригидных стриктур, препятствующих проведению колопоскона.
При обзорной рентгенографии па фоне заполненных газом теней кишки определяются «отпечатки большого пальца». Исследование с бариевой клизмой, без сомнения, является наиболее ценным методом диагностики ишемического колита. Его признаки тщательно изучены многими рентгенологами и теперь хорошо известны. Если состояние больного позволяет, кишечник к исследованию готовят по стандартной методике, обычно освобождая от каловых масс с помощью клизм. Толстую кишку заполняют барием под рентгенологическим контролем, а затем выполняют обычную серию снимков в заднепередней и боковой проекциях с последующими рентгенограммами после эвакуации бария и заполнения кишки воздухом. Изменения, обнаруживаемые при ирригоскопии, естественно, зависят от стадии заболевания. Различают 4 следующих основных рентгенологических признака.
1. «Отпечатки большого пальца» — самый ранний ирригоскопический признак, обнаруживаемый уже через 3 дня после предъявления жалоб. Этот тер
мин, впервые предложенный около 20 лет назад Boley и соавт., несмотря па другие названия («псевдонолипоз». «полипоидные изменения», «фестон-чатость»), выдержал испытание временем. «Отпечатки большого пальца» выглядят как ряд полупрозрачных, с тупым углом, вдавлений в просвет кишки, с полупрозрачным краем, безошибочно различаемых рентгенологом при наличии определенного опыта. Сопоставление с эндоскопическими данными почти не оставляет сомнений в том, что появление крупных «отпечатков большого пальца» обусловлено отеком и кровоизлияниями в подслизистом слое. Наиболее часто этот признак определяется в области селезеночного изгиба, однако «отпечатки большого пальца» можно обнаружить в любом отделе ободочной кишки — от слепой до перехода в прямую. «Отпечатки большого пальца» являются изменениями, характерными для ранней стадии заболевания, и могут исчезать спустя 48 ч. Однако в ряде случаев этот признак сохраняется в течение нескольких недель.
2. Прерывистость слизистой оболочки по типу «разодранпости зубом пилы». Спустя дни или недели после начала заболевания рентгенологические признаки меняются в двух направлениях. В большинстве случаев отмечавшиеся ранее «отпечатки большого пальца» полностью исчезают и очертания толстой кишки становятся нормальными. В ряде же случаев в зависимости от степени поражения сосудов рентгенологическая картина «переходит» в следующую фазу, связанную с изъязвлением и деструкцией слизистой оболочки. Язвы различного размера и глубины весьма беспорядочно располагаются по окружности кишки. Ирриго-скопическая картина в этой стадии заболевания может напоминать язвенный колит, могут даже наблюдаться трансмуральные трещины, характерные
для болезни Крона. Однако при язвенном колите в процесс всегда вовлекается прямая кишка; отсутствует отчетливое изображение складок толстой кишки и всей поверхности слизистой оболочки. При болезни Крона глубокие трансмуральные расщелины имеют на рентгенограмме вид шипов розы, и эти участки часто отделяются зонами нормальной кишки. Ни один из указанных признаков не характерен для ишемии.
3. Трубкообразные сужения. Следует еще раз отметить, что изменения при ишемическом колите могут быть обратимыми и прогрессировать до стойких. В последнем случае следующей фазой рентгенологических изменений является образование стриктуры различной протяженности — от нескольких сантиметров в зоне селезеночного изгиба до полной облитерации поперечной ободочной и нисходящей кишок. Ни один из патологических процессов, кроме ишемии, не вызывает столь сильного сужения (и даже иногда облитерации) просвета толстой кишки в течение нескольких недель.
4. Саккуляция (образование мешотчатых выпячиваний) — признак поздней, обычно необратимой фазы заболевания, возникающий в результате неравномерного фиброза подслизистого слоя. Иногда отмечается сужение лишь весьма ограниченного сегмента кишки. Такая картина вызывает диагностические трудности, поскольку любая локализованная стриктура, разумеется, может рассматриваться как связанная со злокачественным новообразованием, что требует исключения. В этом случае дифференциально-диагностическое значение имеет признак, названный «дымоходом», равномерность которого постепенно меняется от начала до конца стриктуры. Такая картина весьма отличается от неправильных «уступов» или «яблочной кожуры» — признаков, ха
рактерных для изъязвленной злокачественной опухоли (Marston, 1986).
По результатм селективной нижней брыжеечной ангиографии выявляются сужения и окклюзии артерий, нарушения их контрастирования: при заполнении контрастным веществом дисталь-пых ветвей основная артерия не заполняется или поздно ретроградно заполняются ветви, а затем ствол артерии. У больных стриктуриругощей и транзи-торной формами ишемического колита полной закупорки сосуда не бывает, однако кровоток недостаточен для обеспечения потребностей слизистой оболочки и мышечного слоя кишки (Седов и др., 1988).
В последние годы довольно широко применяется КТ. Особенно эффективна она при инфаркте кишки. Обнаруживают местное или диффузное расширение кишки, утолщение стенки ее, интрамуральный или мезентериальный газ, перитонит (газ или жидкость), газ в портальной вене. КТ показана при клинической картине инфаркта с отсутствием рентгенологической симптоматики (Fe-derle et al., 1934; Clark, 1988).
Ишемически i колит в первую очередь следует дифференцировать от ЯНК и болезни Крона, от дивертикулита и рака толстой кишки. При ЯНК в отличие от ишемического колита левого изгиба ободочной кишки, как правило, поражается и прямая кишка. О поражении сосудов толстой кишки можно говорить только после исключения других, чаще встречающихся ее болезней. Нарушения функций кишечника и тем более его структурные изменения появляются после сужения просвета брыжеечных сосудов на 50 % и более. Меньшие сужения сосудов отражаются на функциях кишки только тогда, когда имеются сопутствующие расстройства кровообращения, например мерцательная аритмия.
Туберкулезный колит. Встречается в
виде изолированного поражения или как осложнение туберкулеза легких. Наиболее часто поражает слепую кишку и илеоцекальный угол, а также восходящую кишку, реже — селезеночный и ректосигмоидальный углы.
Основные клинические симптомы: нарушение общего состояния, субфебрилитет, пальпируемое образование в правой подвздошной области, боли в животе, нередко кишечное кровотечение, расстройства стула и др.
Рентгенологически отмечается несколько аспектов туберкулеза толстой кишки: гипертрофическая форма (50 %), язвенная форма (30 %) и смешанная, или язвенно-гипертрофическая, форма (20%). Выявляют как функциональные, так и морфологические признаки болезни: деформацию, укорочение и сужение просвета пораженного сегмента кишечника, утолщение илеоцекального клапана, спастический дефект наполнения, исчезающий в процессе исследования, усиленную перистальтику кишечника, контрастное пятно на месте язвы. Контуры кишки неровные, гаустрация исчезает. Дистальная петля подвздошной кишки часто превращается в ригидную выпрямленную трубку. Мелкие хлопья бариевой взвеси оседают в изъязвлениях, а инфильтраты в слизистой оболочке иногда обусловливают образование крупных дефектов наполнения. В пораженных слепой и восходящей кишках контрастная масса не задерживается.
После перорального контрастирования толстой кишки бариевая масса в слепой кишке иногда задерживается в связи с нарушением функции пораженного сегмента и спазмом в илеоцекальном отделе кишечника. В зоне спазма на месте язв выявляется разрыв контрастной тени. В других случаях ускоряется продвижение контрастного вещества по кишечнику — определяется повышенная перистальтика. Смещае-
мость кишечных петель из-за сращений ограничена. Инфильтрация илеоцекального клапана рентгенологически отмечается по симптому «полулуния». Одновременно резко суживается клапанный отдел тонкой кишки. Дифференцировать илеоцекальный туберкулез следует от болезни Крона, ЯНК и илеотифлита, опухоли толстой кишки, аппендицита, лямблиозного колита, амилоидоза кишечника и других кишечных болезней.
Гранулематозный колит. Разновидность болезни Крона, при которой патологический процесс локализуется в толстой кишке. Выделен как самостоятельная нозологическая форма в 1959 г. Характеризуется выраженной воспалительной инфильтрацией, отеком всех слоев стенки кишки и возникновением изъязвлений, которые имеют различную глубину и протяженность и нередко вызывают образование внутренних или наружных свищевых ходов.
Большинство авторов различают 4 вида поражения толстой кишки: 1) изолированное поражение толстой кишки; 2) одновременное поражение подвздошной и слепой кишок; 3) поражение толстой кишки через некоторое время после наложения подвздошно-поперечно-ободочного анастомоза с вовлечением в процесс участка кишки, прилежащего к анастомозу; 4) вторичное поражение толстой кишки путем перехода процесса с тонкой кишки при наличии свища. Чаще всего патологический процесс, возникнув в терминальном отделе подвздошной кишки, распространяется на слепую и восходящую кишки. Отмечается также диффузное поражение всей толстой кишки, вплоть до прямой.
Болезнь выявляется у 0,1—0,2 % людей, впервые обратившихся по поводу заболеваний пищеварительной системы. Встречается у представителей обоего пола любого возраста. В 90 % случаев начинается между 10 и 40 годами жизни.
Одни исследователи считают, что эта болезнь — проявление саркоидоза, другие связывают ее возникновение с действием аллергических факторов, третьи — с коллагенозами, четвертые утверждают, что она — следствие поражения лимфатических мезентериальных узлов, закупорки лимфатических сосудов и развития гранулематозного лимфангита.
Стенки кишки утолщаются в результате воспалительного отека, клеточной инфильтрации и лимфоидной гиперплазии всех ее слоев. В подслизистом и мышечных слоях развивается фиброз, и пораженный сегмент кишки суживается. Лимфатические сосуды обтурируются и умеренно расширяются, развивается гигантоклеточный и гранулематозный лимфангит. Лимфатические узлы не увеличиваются, встречаются саркоидные гранулемы. Резко отграниченные суженные сегменты кишки чередуются с нормальными.
Клинические проявления: в течении болезни выделяют 3 стадии: с начальными проявлениями, выраженными клиническими симптомами и осложнениями. Симптомы зависят не только от стадии болезни, но и от локализации и протяженности процесса; чем он тяжелее и обширнее, тем заметнее и разнообразнее клинические признаки. Из них наиболее часты понос (при обострении — до 20 раз и более в сутки), кровь и слизь в кале, боли и плотное малоподвижное опухолевое образование диаметром 5 — 10 см вдоль толстой кишки, а также слабость, похудание, лихорадка, явления анемии, парапроктита и свищи. Нередки тошнота и рвота. У большинства больных определяются лейкоцитоз (в период обострения иногда высокий), палочкоядерный сдвиг влево, лимфопения, значительно увеличенная СОЭ. Через несколько лет развивается гипопротеинемия. В моче обнаруживаются белок, лейкоциты.
Поражение илеоцекального отдела кишечника проявляется синдромом нарушения всасывания, схваткообразными болями в правой половине живота, метеоризмом, обильным водянистым стулом. Важным симптомом гранулематозного тифлита служит инфильтрат, пальпируемый в правой подвздошной области. О левостороннем гранулематозном колите иногда свидетельствуют частичная толстокишечная непроходимость, запоры. Относительно часто (в 50—70 % случаев) поражается и аноректальная область. Во время осмотра ее выявляют трещины, отек слизистой оболочки и перианальных тканей, набухшую багрово-синюшную кожу вокруг заднего прохода, свищи.
Весьма характерны данные эндоскопического исследования: воспалительный отек, иногда резкий, суженный просвет кишки, ригидность ее стенок, участки зернистой кровоточивой слизистой оболочки с единичными язвами и эрозиями, псевдополипами и другими изменениями чередуются с участками нормальной слизистой оболочки. В би-оптате обнаруживают элементы хронического воспаления, признаки гиперплазии лимфоидной ткани и гигантские клетки.
Осложнения гранулематозного колита встречаются относительно часто и зависят от локализации основного процесса, его тяжести, распространенности, возраста больных и других факторов. Как осложнения болезни образуются наружные и внутренние свищи с выходным отверстием на передней брюшной стенке, промежности или в петли кишок и прилегающие к ним полые органы. Иногда развиваются внутрибрюшные абсцессы. Рубцово-стенозирующая и опухолевидная формы болезни обусловливают развитие кишечной непроходимости, язвенно-перфоративная и фистулезная формы — образование глубоких перфорирующих язв и свищей, возник
новение массивных кишечных кровотечений. Возможна острая токсическая дилатация толстой кишки. Чаще всего наступает острое расширение поперечной ободочной кишки вследствие поражения ее интрамуральных ганглиев и скапливания газа и жидкого содержимого в просвете кишки. Проводить ирригоскопию больным с острой токсической дилатацией толстой кишки следует очень осторожно, чтобы не перфорировать ее резко измененную стенку.
Рентгенодиагностика: одними из первых появляются эрозии или изъязвления слизистой оболочки (ниша, контрастное пятно), окруженные гранулемами и лучше всего обнаруживаемые после двойного контрастирования толстой кишки. Другие симптомы болезни заметны позднее. Если процесс локализуется в терминальном отделе подвздошной кишки, то она впадает в слепую кишку перпендикулярно. Терминальный отдел тонкой кишки суживается, становится ригидным, прерывистым или иногда похож на «свинцовую трубку». Резко изменяется рельеф слизистой оболочки: превращается в ячеистый и напоминает «булыжную мостовую». Появляются краевые дефекты наполнения, зубчатость, свидетельствующая об изъязвлении слизистой оболочки или образовании псевдополипов, свищи и другие изменения. Когда процесс распространяется на слепую кишку, область илеоцекального клапана суживается, купол слепой кишки подтягивается кверху.
Сегментарный гранулематозный колит встречается чаще, чем диффузный. У больного в любом отделе толстой кишки можно обнаружить прерывистость и асимметричность пораженной стенки кишки, суженные сегменты кишки чередуются с нормальными, граница между ними всегда резкая. Степень сужения кишки зависит от давности болезни. Типично затруднение
продвижения бариевой взвеси через суженный сегмент.
Контуры стенотического сегмента четкие, чаще всего неровные, мелко- или крупнозубчатые, изредка ровные. Поперечные и глубокие щелевидные изъязвления слизистой оболочки на контуре пораженного сегмента толстой кишки образуют остроконечные, спикулообразные ниши. Измененный сегмент кишки из-за раздражения обычно бариевой взвесью туго не заполняется. На супервольтных снимках он приобретает ячеистость. В суженных сегментах кишки гаустры сглажены, деформированы или полностью исчезают. Отдельные сегменты укорачиваются. При этом печеночный и селезеночный углы резко смещаются книзу и медиально. Весьма характерен симптом неполного сокращения кишки после ее опорожнения (симптом ригидности кишки).
По мере прогрессирования процесса поражения слизистой оболочки типа «булыжной мостовой» становятся доминирующими. Псевдополипы разделяются продольными и поперечными щелевидными язвами. После двойного контрастирования толстой кишки в некоторых случаях выявляются стойкие бариевые пятна, свидетельствующие об обширных изъязвлениях слизистой оболочки.
При поверхностных язвах стенки кишки в пораженных сегментах имеют толщину от 3 до 7 мм, причем у половины больных — более 5 мм. Если на слизистой оболочке язвы глубокие щелевидные, толщина стенки определяется в 7 мм и более. Этот очень важный симптом лучше всего выявлять путем париетографии с томографией толстой кишки.
К ценным признакам болезни относятся и псевдодивертикулы, возникающие в области поражения вследствие изъязвления и деструкции стенки толстой кишки и последующего выпячива-
160. Болезнь Крона толстой кишки:
а — слепой в части восходящей кишки; б — нисходящей и сигмовидной кишок; в — сигмовидной кишки с глубокой нишей.
ния оставшихся слоев стенки. Они через узкую либо широкую шейку заполняются бариевой взвесью.
С помощью селективной ангиографии брыжеечных артерий у больных определяются изменения интрамуральной сосудистой сети (аваскулярные зоны, резкая извитость и варикозные расширения вен) и брыжеечных сосудов (неравномерный просвет, окклюзионная ампутация прямых артерий, дисторсия и варикозные расширения вен).
Гранулематозный колит необходимо дифференцировать от неспецифического язвенного колита, туберкулеза, амебиаза кишечника, рака толстой кишки, лимфомы, дивертикулеза и других болезней. Только после тщательных клинико-рентгенологического и гистологического исследований удается поставить правильный диагноз.
Болезнь Николя — Фавра. Относится к венерическим заболеваниям и встречается главным образом в странах с тропическим и субтропическим климатом. Возбудителем является хламидия (бедсония). Заражение происходит обычно половым путем и значительно реже бытовым.
Инкубационный период чаще 1,5— 2 недели. В типичных случаях заболевания различают 3 последовательных периода: первичный (лимфогранулематозный шанкр в области половых органов) ; вторичный, развивающийся через 1,5—2 мес. и характеризующийся поражением лимфатических узлов, су
ставов, вен и др.; третичный период, появляющийся через 1,5—2 года и выражающийся главным образом в развитии так называемого генитоаноректального синдрома — тяжелого фистулезно-спаечного процесса в промежности и периа-нальной области с развитием проктита и парапроктита.
Клинические проявления: наиболее ранний признак генитоаноректального синдрома — тянущие боли в области промежности, скудные сукровичногнойные выделения из ануса. Возможны общие явления: слабость, потеря аппетита, головные боли, похудание, боли в суставах, увеличенная СОЭ, лейкоцитоз, анемия.
Рентгенологическая картина: на ранней стадии заболевания на высоте 4 — 8 см от ануса обнаруживают равномерное сужение, утолщение стенки кишки с признаками воспаления и изъязвления, фиксацию прямой кишки. Могут иметь место свищи. По мере прогрессирования процесса прямая кишка резко суживается и просвет ее может быть около 5 мм. Контуры стенок кишки неровные, местами нечеткие. Супрасте-нотический отдел расширен и нависает над суженной частью. Имеют место свищи между прямой кишкой и соседними органами.
Дифференцировать данное заболевание нужно со стенозирующей формой рака, болезнью Крона, ЯНК и другими заболеваниями, вызывающими стриктуры прямой кишки.
Глава 34. ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Доброкачественные опухоли исходят из слизистой оболочки, соединительной, мышечной, жировой и нервной тканей, а также из кровеносных и лимфатических сосудов толстой кишки. Они встречаются у людей разного возраста, по данным различных авторов, от 1 до 13 %.
На эпителиальные опухоли, образующиеся из слизистой оболочки толстой кишки, приходится 95—98 % всех доброкачественных опухолей толстой кишки. Эти опухоли представляют собой одиночные или множественные (групповые или рассеянные по отделам) полипы, диффузный полипоз, ворсинча
тые новообразования, которые отличаются по строению и различной пролиферативной активности, вплоть до малигнизации.
Неэпителиальные опухоли (липомы, фибромы, миомы, нейрофибромы, невриномы, ангиомы, лимфомы и другие) встречаются редко — от 2 до 5 % доброкачественных новообразований толстой кишки. Обнаруживаются в подслизистом или субсерозном слое.
Клинические проявления прямо зависят от количества, размеров, локализации и строения опухоли. Больные с одиночными полипами обычно долго жалоб не предъявляют. Большая субмукозная опухоль иногда обусловливает развитие частичной обтурационной кишечной непроходимости. Во время перистальтики опухоль продвигается вперед и увлекает за собой проксимальные сегменты кишки, вызывая инвагинацию. Больные с низко расположенными опухолями нередко отмечают тенезмы, неприятные ощущения в прямой кишке, чувство инородного тела в ней или неполного опорожнения. Множественные полипы и диффузный полипоз обусловливают боль вдоль толстой кишки, учащенный и болезненный стул с примесью крови, слизи и гноя. Кровотечения из прямой кишки возникают во время или после дефекации. Постепенно у больных развиваются признаки малокровия и истощения.
Рентгенодиагностика доброкачественных опухолей во многом зависит от тщательности подготовки кишечника к исследованию, методики и техники выполнения ирригоскопии после тугого или полутугого заполнения толстой кишки бариевой взвесью и супервольтной рентгенографии, изучения рельефа слизистой оболочки до и после двойного контрастирования толстой кишки.
Рентгенография толстой кишки, раздутой воздухом, должна проводиться в положении больного как на спине, так
и на животе, потому что отделы толстой кишки находятся на разных уровнях. Например, у больного в положении на спине введенный газ в основном'сосредоточивается в поперечной ободочной и сигмовидной кишках, а в положении на животе — в восходящей, нисходящей и прямой кишках.
Одиночные и множественные полипы. Состоят из соединительнотканной основы и гипертрофированной или атрофированной слизистой оболочки с разросшимися железами и покровным эпителием. Наиболее интересны полипы, возникшие в результате разрастания железистой ткани (аденоматозные) и развивающиеся из плоского или переходного эпителия в виде сосочка (папиллома-тозные).
Полипы — это шаровидные или овальные образования, обычно до 1 — 1,5 см в диаметре, на широком основании или на тонкой ножке, выступающие в просвет кишки. Покрыты слизистой оболочкой. Встречаются у людей обоего пола и любого возраста, но несколько чаще (51,9 %), по нашим данным, у женщин 35—55 лет. Из 613 больных одиночные полипы мы обнаружили у 466 (76 %), множественные — у 133 (21,7 %), тотальный полипоз — у 14 (2,3 %). У 7,9 % больных диагностировано сочетание полипов и рака толстой кишки, у 11,1 % выявлен сопутствующий колит и у 4,7 % — малигнизация полипов. Одиночные и групповые полипы у 76,7 % больных локализовались в прямой и сигмовидной кишках, у 12,1 — в нисходящей, у 7 % — в поперечной ободочной и у 4,2 % — в восходящей и слепой кишках. Распознавались по дефектам наполнения, чаще округлым или овальным, реже неправильной формы, с ровными или волнистыми контурами, размером от 0,5 до 2 см и более. Причем ровные контуры отмечались преимущественно у малых полипов, а волнистые контуры — у боль
ших. Полипы были плоскими, промежуточными и с ножкой. Если полип имел длинную ножку, то после ТЗ кишки выявлялся дефект наполнения в виде полоски, соединяющей полип со стенкой кишки (симптом «ракетки»). О короткой ножке свидетельствовал симптом «зарубки» у основания полипа.
Рентгенологическое изображение полипа зависит от степени его дольчатости и сосочковых разрастаний. Дольчатый полип создает полиморфную ячеистость. После опорожнения кишки в месте крупного полипа нередко отмечается неполное сокращение кишки (симптом неспадения стенок кишки), кишка приобретает круглую или веретенообразную форму.
Мелкие полипы на рельефе слизистой оболочки кишки выявлять трудно вследствие их многообразия, грубых отечных складок слизистой оболочки из-за сопутствующего колита. Обнаружить полипы легче, если по величине они больше калибра соседних складок. Тогда на рельефе слизистой определяется симптом «кольца».
Большая диагностическая информация заложена в результатах исследования кишки после двойного контрастирования. На фоне воздуха полипы образуют дополнительные тени, связанные ножкой с внутренней стенкой кишки или сидящие на широком основании. Когда рентгеновский луч параллелен ножке полипа, на снимке нередко получаются два кольца, одно в другом (симптом «мишени», или «бычьего глаза»).
С помощью метода двойного контрастирования можно выявить полипы размером 10 мм и более у 100 % больных, размером 6 — 9 мм — у 83, 4—5 мм — у 56, 2—3 мм — у 22 % (Михайлов, Коломыцкий, 1978; Rex, Lehman, Lappas, Miller, 1986).
По рентгенологическим признакам (Шнигер, 1973, 1989) можно установить
строение полипа. Это, несомненно, имеет большое практическое значение, так как индекс злокачественности полипов различный. Аденопапилломатозные полипы, по данным многих исследователей, озлокачествляются чаще, чем аденоматозные, а ювенильные вовсе не перерождаются в рак.
Н. У. Шнигер считает, что аденоматозный полип проявляется дефектом наполнения до 1 см в диаметре, чаще с ровными контурами. Его форма и размеры не меняются в процессе ирриго-скопии, на фоне воздуха тень полипа интенсивная. Аденопапилломатозные полипы с ножкой имеют диаметр более 1 см, волнистые контуры дефектов наполнения, ячеистую структуру тени. Тень изменяет форму при повышении внутрикишечного давления, она менее интенсивная после двойного контрастирования. Ювенильные полипы встречаются главным образом у детей и подростков. В большинстве случаев они округлые или неправильной формы, нередко большие и с гладкой или слегка волнистой поверхностью. Часто группируются преимущественно в дистальном отделе толстой кишки. После двойного контрастирования кишки образуют однородную интенсивную тень и не меняют своей формы во время исследования.
Из описанных полипов чаще встречаются одиночные и множественные аденоматозные полипы.
Данные о возникновении рака из доброкачественных полипов и значительном уменьшении заболеваемости раком прямой кишки и ректосигмоидного отдела толстой кишки после эксцизии всех аденом, обнаруженных при ректороманоскопии, позволили большинству исследователей считать удаление полипов профилактикой рака этих отделов кишечника. Если распространить накопленный положительный опыт на ободочную кишку, то можно ожидать умень-
161. Одиночные полипы толстой кишки:
а, б, в, г — при тугом бариевом заполнении; д, е, ж, з — при двойном контрастировании
шения частоты развития рака в этой области после удаления всех выявленных в ней полипов. Таким образом, непременным условием подтверждения этого предположения является своевременное обнаружение полипов, а также раннее распознавание их малигнизации.
Самыми распространенными методами распознавания полипов и «раннего» рака ободочной кишки остаются рентгенологическое исследование и колоноскопия.
При традиционной методике рентгенологического исследования толстой кишки полипы диагностируют примерно в 60 % случаев, а при двойном контрастировании — в 76—88 %. Появление фиброэндоскопической техники некоторые специалисты расценили как альтернативу рентгенологическому методу, однако более глубокое изучение диагностической эффективности колоноскопии показало ее существенные недостатки (Сидоров и др., 1986).
Так, при эндоскопическом исследовании невозможно осмотреть слепую и восходящую кишки по крайней мере у 15 % больных. Далее, неправильная трактовка обнаруженных при коло
носкопии изменений и выявление опухолей наблюдаются примерно в 10 % случаев. Визуальные ошибки при распознавании озлокачествленных полипов встречаются-еще чаще (в 74,1 %). В то же время имеются указания на то, что точность диагностики полипов ободочной кишки возрастает до 97 % при использовании сочетанного исследования — ирригоскопии и колоноскопии. Необходимость такого сочетания несомненна, так как эти методы, дополняя друг друга, компенсируют свои недостатки (Сидоров и др., 1986).
Наиболее типичными рентгенологическими признаками озлокачествления полипа ободочной кишки считаются большой диаметр его и широкое неров ное основание опухоли. Основание малигнизированных полипов может быть разным (Сидоров, 1986), но чаще широким. Зазубренное или втянутое основание опухоли наиболее характерно для полиповидных «малых» раков, что, по-видимому, можно объяснить завершением перехода полипа в рак и прорастанием опухоли в подслизистый и более глубокие слои кишечной стенки.
Таким образом, наиболее важный
162. Симптомы при полипе нисходящей кишки: а — кольца; б — неспадения стенок.
рентгенологический признак малигнизации полипа — широкое, неровное или втянутое основание опухоли.
Больные с полиповидными образованиями диаметром до 1 см и более на широком, неровном или втянутом основании подлежат эндоскопии с последующим гистологическим исследованием биоптатов в первую очередь, что является решающим фактором ранней диагностики рака ободочной кишки. Своевременное удаление выявленных полипов толстой кишки в свою очередь существенно снижает опасность возникновения рака этого органа (Сидоров и др., 1986).
По мнению Л. А. Атанасяна и И. Ю. Юдина (1979), критерии малигнизации полипов (клинические, рентгенологические, эндоскопические, гистологические и тем более цитологические), особенно каждый в отдельности, далеко не всегда надежны. Ни величина полипа, ни его изъязвление, ни широкая ножка не дают права уверенно ставить диагноз малигнизированного. Иногда и маленький полип оказывается малигнизированным или представляет солидный
рак, саркому или эндотелиому в начальной стадии.
Ворсинчатые опухоли. Ворсинчатая опухоль — аденома, характеризуется экзофитным ростом с образованием сосочков. На аденомы приходится от 2 до 5,7 % всех опухолей и 20 % доброкачественных опухолей толстой кишки. В 90 % случаев ворсинчатая опухоль одиночная и только в 10 % — множественная. Эти опухоли обычно развиваются из аденоматозных полипов и отличаются от них широким основанием, крупными размерами (диаметр от 1,5 до 5 см и более), своеобразной сосочковой структурой и интенсивной продукцией слизи. Очень склонны к озлокачествлению и служат почти облигатным предраком. Чаще растут в прямой кишке и ректосигмоидном сегменте отдельными опухолевыми узлами или выстилают стенку кишки на относительно большом протяжении, рентгенологически проявляясь дефектом наполнения, границы которого преимущественно волнистые и нечеткие. Форма и размеры опухолевого узла самые различные. Из-за мягкой консистенции ново
образования изменяются во время рентгенологического исследования. В месте ворсинчатой опухоли определяются ограниченное расширение кишки, сетчатый или ячеистый рисунок рельефа слизистой и дополнительная тень на фоне воздуха. Стелющаяся форма опухоли устанавливается по краевому или циркулярному дефекту наполнения, иногда обширному как по глубине, так и по протяженности, с нечеткими, неровными, зубчатыми контурами. Стенка кишки остается эластичной.
Характерной особенностью ворсинчатой опухоли является то, что при компрессии или при сильном раздувании кишки она расплющивается, не вызывает нарушения кишечной проходимости даже при больших размерах опухоли. Отсутствует также и супра-стенотическое расширение кишки.
Увеличение кровянистых выделений из прямой кишки, ухудшение общего состояния больных, признаки анемии служат косвенным свидетельством озло-качествления процесса. При этом выявляются симптомы изъязвления опухоли (стойкое депо бариевой взвеси), ригидности стенки кишки. Стенка кишки неровная и втянутая у ее основания. Форма опухоли уже не меняется при различном заполнении кишки контрастным веществом. После двойного контрастирования кишки отмечаются бугристость опухоли и неравномерная плотность отдельных ее сегментов или всего новообразования.
Диффузный полип толстой кишки. Эта тяжелая системная болезнь толстой кишки, обусловленная развитием в ней множества полипов, часто возникает у членов одной семьи. Передается по наследству. Обычно проявляется в 16 — 25 лет. Различают милиарные, аденоматозные, аденопапилломатозные, ювенильные и смешанные полипы, которые (Мушникова, 1978, Никитин и др., 1978) представляют последовательные
стадии развития диффузного полипоза. Милиарные полипы нередко постепенно трансформируются в аденоматозные, которые в свою очередь способны перестраиваться в аденопапилломатозные.
Клинические проявления: характерна триада симптомов — частый стул, кровь в испражнениях и анемия. В I стадии болезни, когда слизистая оболочка кишки преимущественно поражена милиарными гиперпластическими полипами, эти симптомы определяются только у 55 % больных. Во II стадии аденоматозные полипы делают клиническую картину болезни более четкой, и ее признаки выявляются уже у 77—91 % больных. В III стадии, когда слизистая оболочка кишки покрыта аденопапилло-матозными полипами, почти у каждого больного отмечаются клинические признаки полипоза.
По мнению В. Н. Мушниковой (1977), в каждую стадию заболевания должна быть своя методика рентгенологического исследования, чтобы получить более полное представление о болезни. При выборе методики большое значение имеют результаты ректороманоскопии. Например, больного со смешанными полипами необходимо тщательно исследовать и после небольшого заполнения толстой кишки бариевой взвесью, и после ее двойного контрастирования.
В результате выбора оптимальной методики исследования уменьшается облучение больного, сокращается расход рентгеновской пленки и главное — улучшается диагностика полипозного поражения толстой кишки.
Плоские гиперпластические полипы у больных милиарной формой полипоза лучше всего видны после небольшого заполнения кишки бариевой взвесью (Мушникова, 1977; Шнигер, 1973, 1989). Как правило, во всех отделах толстой кишки множественные дефекты наполнения до 0,5 см в диаметре обра-
163. Диффузный полипоз толстой кишки: а — милиарный; 6 — аденопапилломатозный
зуют кружевной или зернистый рисунок и мелкую зубчатость контуров кишки, гаустрация которой не изменена.
При аденоматозном полипозе дефекты наполнения с гладкими или слегка волнистыми контурами уже достигают 1 см в диаметре. Обнаруживаются отдельные гнезда полипов или полипы покрывают всю поверхность кишки. Контуры гаустр становятся зазубренными. Количество дефектов наполнения увеличивается в дистальном направлении, иногда в восходящем отделе кишки их совсем нет. После опорожнения толстой кишки отмечается неполное ее сокращение, а рисунок рельефа слизистой оболочки становится ячеистым.
У больного аденопапилломатозным полипозом толстой кишки полипы самого различного диаметра (чаще от 1 до 2 см и более), с ровной или мелкобугристой поверхностью, «сидят» на ножках и на широком основании. Как правило, определяются группы полипов, которые на рельефе слизистой создают «кольца». Эти полипы лучше выявляют
ся после двойного контрастирование кишки: на фоне воздуха они образую’ дополнительную тень с мелкосетчато! структурой.
На фоне воздуха четко определяются и ювенильные полипы, которые вслед ствие большого содержания соедини тельной ткани более плотные, поэтом? тень от них достаточно интенсивная Эти полипы часто с ножками, непрг вильной формы и с гладкими контурами.
По данным А. М. Никитина и др (1978), Л. А. Атанасяна, И. Ю. Юдинг (1979), Н. У. Шнигера (1989) и други: исследователей, диффузному полипоз? свойствен высокий индекс малигнизг-ции (80—100 %). Нередко в раковук опухоль превращаются сразу нескольк< полипов в разных отделах толсто! кишки. Характерен также быстрый рос раковых опухолей, возникших у боль пых диффузным полипозом.
Эндометриоз толстой кишки. Болезн.. обусловленная эндометриоидной гете ротопией — опухолевидным включе
нием в толстую кишку эндометриоидной ткани, которая, как и эндометрий, подвержена циклическим изменениям. Встречается у женщин 30—50 лет. Чаще всего поражаются червеобразный отросток, слепая, сигмовидная и прямая кишки.
Клиническими признаками эндометриоза толстой кишки являются боли в низу живота и в крестце, примесь крови в кале, запор или понос, чувство распирания в прямой кишке, метеоризм, дисменорея, бесплодие, меноррагия и др. Характерна длительность проявления этих симптомов, усиление в период менструации.
Рентгенологически эндометриоз в начальном периоде проявляется признаками раздражения сегмента толстой кишки, неравномерной гаустрацией, сглаженностью складок или грубым рельефом слизистой оболочки. В дальнейшем пораженный сегмент кишки эксцентрично суживается, постепенно переходя в кишку с нормальными стенками. Гаустрация спастическая, неравномерная, рельеф слизистой перестраивается. Измененный сегмент кишки часто фиксирован. Экзофитная форма эндометриоза напоминает раковую опухоль.
В прямой кишке эндометриозом поражается чаще ректовагинальная перегородка. При рентгенологическом исследовании обнаруживают дефект наполнения на передней стенке прямой кишки, который, как правило, плоский, полуовальной формы, с довольно четкими очертаниями. Несмотря на большие размеры образования, его изъязвление отсутствует. Прямая кишка заметно смещается кзади. Если при эндометриозе ректовагинальной перегородки увеличивается матка, наблюдается также развертывание петли сигмовидной кишки (Шнигер, 1989).
При раздувании экзофитная форма эндометриоза ректовагинальной перегородки дает картину сужения прямой
кишки. Дополнительной тени на фоне воздуха отчетливо не выявляется. Если дополнительная тень бывает все же видна, то обращает на себя внимание несоответствие между ее величиной и размерами дефекта наполнения. На фоне воздуха может различаться нежная сетчатость, которая обусловливается попаданием бариевой взвеси в междольковые щели патологического образования, проникшего через всю толщу стенки в просвет кишки.
Весьма характерная рентгенологическая картина наблюдается при экзофитном эндометриозе ректосигмоидного отдела и сигмовидной кишки. В этом случае на передней стенке кишки определяется плоский, четко очерченный дефект наполнения; границы его довольно резкие. Кишка на этом уровне фиксируется и значительно сужается. Последнее обусловлено не только ростом самой эндометриомы, но и фиброзными изменениями на почве воспаления. Сужение и фиксация кишки являются при данной локализации эндометриоза главной причиной частых запоров. На рентгенограммах таза можно видеть дополнительную, почти однородную тень, которая на уровне ректосигмоидного отдела на ограниченном участке переходит в дефект наполнения. Дополнительная тень свидетельствует о пара-кишечном патологическом образовании.
При двойном контрастировании на боковой рентгенограмме, по данным Н. У. Шнигера, отчетливо выявляется эксцентрично расположенное равномерное сужение ректосигмоидного отдела, главным образом за счет давления на переднюю стенку кишки извне расположенным образованием. Методика двойного контрастирования позволяет также более отчетливо видеть само образование. Последнее особенно хорошо вырисовывается на париетограммах.
При эндометриозе толстой кишки может развиться стеноз как следствие не
только рубцового процесса из-за воспаления, но и бурного инфильтративного роста эндометриомы по окружности кишки. Это приводит к полной или частичной толстокишечной непроходимости. Нередко эндометриома имеет вид кисты, располагающейся внутристеноч-но или паракишечно. Она интимно связана со стенкой кишки, иногда сообщается с ее просветом.
Липома толстой кишки. В группе неэпителиальных опухолей встречается наиболее часто и занимает первое место. Локализуется главным образом в слепой и восходящем отделе ободочной кишки и сигме. Может протекать бессимптомно или проявляться клиникой осложнений — изъязвлениями и перемежающейся инвагинацией.
Рентгенодиагностика: на экране или снимке липома создает округлый или овальный дефект наполнения с четкими гладкими контурами диаметром от 0,5 до 3 см и более. Иногда у дефекта наполнения определяется фестончатый контур. Опухоль эластична и у некоторых больных в результате сильной компрессии раздавливается, уплощается и сливается с неизмененной окружающей тканью. После опорожнения в месте опухоли кишка сокращается не полностью и появляется симптом «ободка». После двойного контрастирования кишки на месте липомы обнаруживается гомогенная дополнительная тень, ее интенсивность зависит от величины новообразования.
Лейомиома толстой кишки. Исходит из гладкомышечных волокон стенки кишки. Локализуется чаще в прямой кишке. Вначале развивается интраму-рально в виде небольшого узелка и рост ее в этой стадии может прекратиться. Но чаще она продолжает расти в просвет кишки или эндофитно. Наружные опухоли называют субсерозными, внутренние — субмукозными. Последние редко бывают больших размеров, так
как, достигнув определенной величины, вызывают обтурацию просвета кишки или инвагинацию.
Клинически лейомиомы часто протекают бессимптомно. Нередко они изъязвляются, давая кишечное кровотечение. Субмукозные лейомиомы часто имеют длинную ножку, могут вызывать непроходимость кишечника.
Рентгенологически лейомиома проявляется краевым дефектом наполнения с четкими или чаще гладкими контурами и тенью внекишечного компонента опухоли. Эластичность стенок кишки сохранена. При изъязвлении опухоли обнаруживается стойкое депо бария в дефекте наполнения.
Субсерозные лейомиомы растут медленно, иногда достигают больших размеров. При центральном некрозе опухоли может образоваться полость, сообщающаяся с просветом кишки. Около 15—20 % лейомиом могут перерождаться в злокачественные опухоли.
Лимфома толстой кишки. Встречается очень редко, чаще в прямой кишке. Состоит из лимфоидной ткани и растет в подслизистом слое кишки. Строение опухоли дольчатое, с соединительнотканными перегородками.
Клинически проявляется кровотечениями.
Рентгенологические признаки лимфомы напоминают таковые при аденоматозном полипе. Нередко может наблюдаться множественно-очаговая лимфома, которая дает множественные дефекты наполнения размерами от 3 до 25 мм. Как правило, поверхность их гладкая, основание широкое. Вместе с тем у большинства больных имеют место растяжение и уменьшение гаустрации.
Ангиома толстой кишки. Эта доброкачественная сосудистая опухоль встречается редко. Больные с ангиомой могут быть любого возраста. Опухоль растет или в виде ограниченного узелка, или диффузно.
Клинические симптомы: различной интенсивности кровотечения, возникающие как в связи с дефекацией, так и независимо от нее. Длительно не диагностированная ангиома довольно быстро приводит к резкой анемизации больного.
Рентгенологическая картина при узловатой ангиоме идентична таковой при полипах. Диффузная ангиома напоминает системное заболевание. При нетугом заполнении гаустрация усиливается или, наоборот, сглаживается; контуры приобретают вид грубой неравномерной зазубренности. Последняя нестойка. В случае более тугого заполнения кишки контуры становятся почти гладкими. После опорожнения рельеф слизистой грубоячеистый, а местами может совсем отсутствовать. При раздувании воздух плохо удерживается в пораженных участках кишки, что свидетельствует о нарушении ее тонуса. Неровность контуров сохраняется. Большие узлы могут давать пристеночно или центрально расположенные дополнительные тени. Форма, размеры, очертания их заметно меняются в зависимости от величины внутри кишечного давления.
Доброкачественным сосудистым новообразованием является и гломусная опухоль. Она исходит из клеток артериовенозных анастомозов гломусного типа. В толстой кишке встречается редко. Наиболее частой локализацией является желудок. Среди клинических признаков преобладает болевой синдром. Рентгенологическая картина подобна доброкачественным опухолям. Первое подробное описание гломусной опухоли в толстой кишке сделал австралийский ученый В. Вагна (1988).
К группе редко встречающихся заболеваний относится ангиодисплазия толстой кишки, которая чаще возникает у лиц пожилого возраста и в большинстве случаев протекает асимптоматично. Реже бывают острые и хронические кровотечения из нижних отделов пищеварительного тракта. При гистологическом исследовании в слизистой и подслизистом слое выявляют сосудистую эктазию капилляров, венул и вен. Для диагностики ангиодисплазии применяют селективную мезентериальную ангиографию и эндоскопическое исследование толстой кишки (Carella et al., 1986).
Глава 35. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Из злокачественных новообразований толстой кишки в 98—99 % случаев выявляется рак (аденокарцинома, солидный, коллоидный), в остальных случаях лимфосаркома, ретикулосаркома и др.
Рак толстой кишки. По литературным данным, на долю колоректального рака приходится около 15 % всех больных злокачественными новообразованиями. В США 1 из 20 взрослых в течение жизни заболевает колоректальным раком (Leffal, 1985). По частоте и смертности рак толстой кишки находится на втором месте после рака легкого. Важнейшим экзогенным фактором, влияющим на возникновение рака, является
нарушение питания: употребление диет, содержащих большое количество жира и ненасыщенных жирных кислот, при уменьшении потребления овощей и продуктов, содержащих клетчатку (Leffal, 1985; Sula, 1986; Stubbs, Long, 1986).
Мы наблюдали 345 больных раком толстой кишки в возрасте 23—73 года. Наибольшее количество больных приходилось на пожилой и второй период зрелого возраста (87,8 %). Средний возраст у женщин составлял 62 года, у мужчин — 57 лет. У 214 человек выявлен рак ободочной кишки, у 131 — рак прямой кишки. Правый фланг ободочной кишки был поражен у 43,2 %,
левый — у 56,8 % больных. Причем наиболее часто рак встречался в сигмовидной кишке и ректосигмоидальном отделе (50 %). Из 345 наблюдений у 30, или 8,6 %, больных обнаружены первично-множественные опухоли (у 18 — синхронный, у 12 — метахронный рак).
Клинические проявления: начальные формы рака толстой кишки долго протекают скрыто. Жалобы появляются, когда нарушается деятельность кишечника или развиваются общие симптомы болезни: недомогание, слабость, «кишечный дискомфорт» (неустойчивость стула, метеоризм), иногда незначительные боли, спастические или тянущие.
При опухолях в правой половине толстой кишки характерны раннее развитие общей слабости, недомогания и признаки постепенно нарастающего гипохромного малокровия. Последнее бывает как следствием раковой интоксикации, так и результатом кишечного кровотечения — тогда в кале обнаруживается примесь крови, а иногда кал становится темным.
Рак левой половины толстой кишки обнаруживают по нарушению двигательной деятельности кишки и «кишечному дискомфорту»: болям в животе, раздутию кишечника, урчанию, задержке стула, сменяющейся поносом с примесью слизи, а иногда и крови в испражнениях. Опухоли дистального отдела толстой кишки периодически вызывают частичную или постепенно нарастающую непроходимость кишечника.
Раковые опухоли толстой кишки медленно растут и поздно метастазируют в лимфатические узлы и отдаленные органы, прорастают в соседние органы и образуют соустья вдоль ЖКТ.
Давно доказано, что полноценное излечение больных может быть осуществлено при условии, если новообразование выявлено на тех стадиях роста,
когда оно не распространяется за пределы подслизистого слоя и из-за отсутствия лимфатических сосудов в слизистой оболочке не дает еще отдаленных метастазов. Как свидетельствуют литературные данные, на этих относительно ранних стадиях рак толстой кишки либо вообще клинически не проявляется, либо сопровождается малохарактерной симптоматикой, свойственной многим, в том числе и функциональным заболеваниям.
По данным многих исследователей и наших наблюдений, у 30—70 % больных рак прямой и ободочной кишок в момент диагностики носит распространенный характер и является запущенным. Осуществить раннюю диагностику рака весьма трудно. Так, ректальное пальцевое исследование позволяет диагностировать 25—30 % колоректальных поражений, ректороманоскопия — 50 — 75 %. Только рентгенодиагностика рака толстой кишки оказывается достоверной в 90—95 % случаев. В запоздалой диагностике рака в 54 % случаев повинны сами больные, а в 47 % — врачи (Robinson et al., 1986; Stubbs, Long, 1986).
Прогноз колоректального рака можно значительно улучшить, осуществляя раннюю диагностику до появления симптомов заболевания. Американское противораковое общество предлагает в качестве скрининг-системы проводить ежегодное обследование всех мужчин и женщин старше 50 лет на скрытую кровь в кале, пальцевое исследование и ректороманоскопию. Установлено, что у больных колоректальным раком имеется характерная фекальная pH: 7,98 ± ±0,67 (в норме 6,63±0,46, при синдроме раздраженной кишки 6,55 ±0,48). Возраст больных, пол, диета, масса стула и присутствие в нем крови или слизи не оказывают влияния на pH стула (Pietroiusti et al., 1985). При наличии положительных данных скрининг-тес-
тов целесообразно выполнять колоно-или ирригоскопию (Leffal, 1985).
Результативность ирригоскопии в значительной мере зависит от качества очищения кишечника, ибо каловые камни нередко симулируют опухоль. Ирригоскопию нельзя подменять исследованием толстой кишки после приема внутрь контрастного вещества. Обязательны ретроградное тугое заполнение
164. Раки слепой кишки (варианты а, б, в).
толстой кишки бариевой взвесью с супервольтной рентгенографией, изучение рельефа слизистой оболочки после опорожнения кишечника, двойное контрастирование кишки. Большое внимание следует уделять релаксационной ирригографии. Заслуживают внимания и методы исследования кровеносных сосудов и лимфатической системы толстой кишки для установления степе-
165. Рак ободочных кишок:
а — восходящей; б — поперечной; в — сигмовидной.
ни распространения опухоли и обнаружения метастазов.
Рентгенодиагностика: с анатомо-клинико-рентгенологических позиций рак толстой кишки целесообразно подразделять на: 1) экзофитный, растущий преимущественно в просвет кишки и имеющий вид полипа, бляшки, цветной капусты; 2) блюдцеобразную карциному, также преимущественно экзофит-
ный рак, но с глубоким изъязвленные кратером; 3) эндофитный; 4) эндофи'* но-язвенный; 5) смешанный (эндофи’ но-экзофитный).
Реитгепосемиотика рака толстой кишки разнообразна и зависит от патологоанатомической формы опухоли, л<-калидации и степени распространение новообразования, а не от размеров егс Чем меньше размеры опухоли, тем ме
нее выражены рентгенологические признаки не только злокачественности, но и ее самой (Мушникова и др., 1985).
По степени развития рак толстой кишки принято делить на 4 стадии: I — небольшая опухоль в толще слизистой оболочки и подслизистого слоя кишечной стенки без регионарных метастазов; Па — опухоль занимает до половины окружности кишки, не распространяется за ее пределы и на соседние органы, без регионарных метастазов; Пб — опухоль той же или меньшей величины с одиночными метастазами в ближайших лимфатических узлах; Ша — опухоль занимает более полуокружности кишки, прорастает всю ее стенку или спаяна с окружающими органами и тканями, но без метастазов; Шб — опухоль любой величины с множественными метастазами в регионарные лимфатические узлы; IV — обширная опухоль, проросшая соседние органы, с множественными регионарными метастазами или любая опухоль с отдаленными метастазами.
В правой половине ободочной кишки экзофитные опухоли выявляются чаще эндофитных, а в левой половине кишки, наоборот, встречается преимущественно эндофитный рак. Наиболее часто (около 85 % случаев) в ободочной кишке развивается аденокарцинома, но нередко (в 15 % случаев) в ней возникает слизистый, коллоидный рак.
Экзофитный рост опухоли присущ ракам ампулярного отдела прямой кишки. Раки супраампулярного отдела обычно, подобно ракам левой половины ободочной кишки, инфильтрируют ткани прямой кишки и образуют опухолевое «кольцо», стенозирующее просвет кишки. Экзофитные раки встречаются у 81 % больных злокачественными новообразованиями прямой кишки, а эндофитные раки — у 19 %. В подавляющем большинстве случаев (73,6 %) зто типичные аденокарциномы, значительно
реже (24,4 %) — слизистый, солидный и скиррозный раки.
Каждая форма рака имеет свойственные только ей рентгенологические симптомы. На рентгеновском изображении экзофитный рак проявляется краевым, центральным или циркулярным дефектом наполнения с неровными, зазубренными контурами кишки, ригидностью ее стенок, исчезновением гаустрации, обрывом складок, атипичностью рельефа слизистой оболочки на месте опухоли, стойким депо контрастной массы в дефекте наполнения или на рельефе слизистой оболочки, неполным сокращением кишки на уровне опухоли и задержкой бариевой взвеси в суженном сегменте кишки после ее опорожнения и другими симптомами. У 60 % больных определяются спазмы или расширения кишки вблизи опухоли и нарушения эвакуаторной функции кишки, вплоть до возникновения кишечной непроходимости.
Наиболее трудно обнаружить бляшковидные раки. Они небольшие и незначительно выступают в просвет кишки, образуя плоский краевой дефект наполнения с четкими контурами размером до 1,5—2 см. Эта форма рака лучше диагностируется по полипозиционным супервольтным рентгенограммам и результатам исследования кишки после ее двойного контрастирования: выявляют не только краевой дефект, но и ригидность стенки кишки, на которой он находится, а также вдающуюся в просвет кишки небольшую плоскую дополнительную тень со слегка волнистой поверхностью.
Трудно распознавать и раковые опухоли в ректосигмоидном отделе толстой кишки, особенно когда тень многопетельной сигмовидной кишки накладывается на тень этого отдела кишечника. В таких случаях рекомендуется провести серийную рентгенографию, обязательно в различных проекциях, в том
числе в проекции по Шассару — Лапине.
Актуальной задачей является изуче
ние возможностей рентгенологического метода в диагностике малого рака толстой кишки. В силу наибольшей рас-
166. Рак прямой кишки:
а, б, в — верхнеампулярнон; г — среднеампулярной; д — нижнеампулярнон части.
пространенности, простоты и доступности этот метод остается основным при исследовании толстой кишки.
Рентгенологическое изображение малого экзофитного рака (Мушникова и др., 1985) отличается прежде всего размером до 3 см, достаточно четкими границами и различной величины дополнительной тенью внутрипросветного образования. Дифференциация при рентгенологическом исследовании полило- и бляшковидного рака не имеет принципиального значения. В основном их рентгеносемиотика идентична и проявляется в наличии дефекта наполнения или дополнительной тени по контуру кишки. Эти симптомы лучше всего определяются в условиях гипотонии при прицельном исследовании с дозированной компрессией. Характерны выпрям-ленность, неровность, нечеткость контура кишки в области основания опухоли. Внутренний контур внутрипросветной ее тени может быть ровным или волнистым, что зависит от характера поверхности опухоли (гладкая, дольчатая).
Чаще он бывает крупно- или мелковолнистым. Нередко на фоне этой тени видны множественные мелкие скопления контрастного вещества, чаще всего обусловленные затеканием бариевой взвеси между дольками опухоли, иногда — небольшими поверхностными изъязвлениями.
Отличительной особенностью полиповидного и бляшковидного рака является высота тени экзофитного образования. При полиповидном раке высота тени опухоли примерно равна ее диаметру, а при бляшковидном она в 2 или 3 раза меньше. Именно поэтому при полиповидном раке после опорожнения кишки в области опухоли иногда можно отметить булавовидное расширение. В некоторых наблюдениях в случае прорастания опухоли в подслизистый слой нечеткость ее основания определяется на очень ограниченном участке, что, по-видимому, обусловлено инвазией опухоли. Всегда, если опухоль прорастает в мышечный слой и глубже, нечеткость ее основания определяется
практически на всем протяжении. Это объясняется «конусовидным» характером внутристеночного роста опухоли. При проникновении опухоли в толщу кишечной стенки подслизистый слой, как правило, инфильтрирован опухолевыми и воспалительными элементами на всем протяжении основания (Муш-никова и др., 1985).
Малый блюдцеобразный рак лучше всего выявляется при исследовании с дозированной компрессией. На фоне тугого или полутугого наполнения бариевой взвесью в кишке определяется четкий дефект наполнения, в центре которого имеется бариевое пятно округлой формы. При двойном контрастировании видна слабоинтенсивная дополнительная тень. Рентгенологические признаки блюдцеобразного рака лучше выявляются при краевом расположении опухоли. Высота экзофитного компонента, как правило, 0,5—1 см. Если высота по какому-то краю экзофитного компонента больше, лучше определяется бугристость. Раковая язва при краевом расположении представлена либо штриховой полоской, либо скоплением контрастного вещества неправильной формы в области основания дефекта наполнения или даже выходит за контур кишки. Рентгенологические признаки блюдцеобразной опухоли лучше видны после раздувания кишки при неполном опорожнении ее от бариевой взвеси (Мушникова, 1985). Эта методика особенно результативна в случае небольшой высоты экзофитного компонента опухоли. Рентгеноморфологические сопоставления показали, что четко выраженные симптомы «кольца» и «зарубок» по краям наблюдаются при глубокой раковой инфильтрации кишечной стенки и выходе за ее пределы. Рентгенологическим признаком малого эндофитного рака является либо краевой, как правило, четко очерченный плоский дефект наполнения, либо неровность
и нечеткость контура. Могут быть видны локально утолщенные складки слизистой оболочки. После опорожнения на этом месте отмечается их прерывистость. Если опухоль прорастает в клетчатку, отчетливо определяются признаки фиксации кишки в виде ее углообразной деформации, симптома «паруса» и т. д. В других случаях, когда опухоль ограничивается пределами стенки кишки, бывают видны только неровность и нечеткость контура.
Опухоли менее 3 см чаще плоские (Fork, 1988). Они вызывают неровность и вогнутость контуров стенки кишки. Отмечаются конвергенция и другие изменения хода межгаустральных складок. Имеют место сглаженность или отсутствие гаустр. Объем раздутого участка поражения кишки уменьшен из-за спазма или ригидности стенок. Реже бывают дефекты наполнения и дополнительная тень на фоне газа.
Нередко после резекции пораженного отдела кишки злокачественный процесс рецидивирует. Это часто наблюдается после выполнения передней резекции ректосигмоидального отдела кишечника по поводу злокачественной опухоли. Оценка рентгенологических проявлений у больных с рецидивами позволила выделить 4 типа патологических данных: 1) нодулярный тип поражения; 2) экспансивный тип;2) инфильтрацию за пределами кишки с вовлечением брюшины; 4) сложное поражение кишки с формированием стенозирования. В диагностике послеоперационного рецидива ректосигмоидальной злокачественной опухоли большое значение следует придавать оценке ширины пресакрального пространства, которое в норме не превышает 10 мм. При рецидивирова-нии опухоли ректосигмоидального отдела ширина пресакрального пространства достигает 25 мм и более.
Большими диагностическими возможностями обладает КТ. Эффективность
ее составляет 85 % (Freeny et al., 1986). KT позволяет установить первичную локализацию опухоли в виде утолщения стенки кишки либо дополнительного образования. Плотность опухолевой ткани составляет 25—50 Н. При экстраму-ральном распространении опухоли, сопровождающемся выходом ее на серозную оболочку и за пределы кишечной стенки, на компьютерных томограммах определяется уплотнение жировой клетчатки вокруг кишки. Параколические абсцессы, возникающие на фоне микроперфораций опухоли, выглядят как участки с плотностью жидкости, содержащие газ в уплотненной клетчатке.
При прорастании опухоли в окружающие структуры жировая прослойка между опухолью и соседними органами уменьшается или отсутствует. Повышение плотности прилежащих к пораженной кишке структур и интимная связь между ними могут быть обусловлены также перифокальной воспалительной реакцией и спаечным процессом, что создает трудности при определении опухолевой инвазии. Кроме того, у худых и истощенных больных со слаборазвитой клетчаткой, как правило, отсутствует жировая прослойка между органами. В подобных случаях судить о распространении опухоли можно только при наличии убедительных данных, когда пораженный участок кишки образует единый конгломерат с прилежащими органами или тканями.
При локализации опухоли в прямой кишке процесс может распространяться на мочевой пузырь, предстательную железу, матку и придатки, мышцы и фасции, при локализации опухоли в ободочной кишке нередко поражаются мочеточники, печень, селезенка, тонкая кишка.
Прорастание опухоли в мочевой пузырь характеризуется отсутствием границы между задней стенкой пузыря
и стенкой прямой кишки, а также наличием опухолевых масс в полости мочевого пузыря. Этот симптом четко выявляется при исследовании мочевого пузыря после контрастирования его водорастворимым контрастным веществом. Наличие воздуха в полости мочевого пузыря свидетельствует об образовании кишечно-пузырного свища.
При прорастании рака в мочеточники определяется уретерогидронефроз. Мочеточник вовлекается в околокишечный инфильтрат с расширением вышележащих отделов мочевыводящих путей. В случае прорастания в мышцы таза и тазового дна увеличивается их объем, появляется нечеткость контуров.
Точность КТ в оценке распространенности колоректального рака составляет 79 %, чувствительность — 74, специфичность — 92 %.
КТ имеет преимущества перед обычным рентгенологическим исследованием и колоноскопией, дает возможность судить о внепросветном компоненте новообразования, его величине, инфильтрации соседних органов, наличии метастазов в лимфатических узлах и других системах. Наименьшие размеры выявляемой опухоли — 2 см (Stetter, Lux, Hering, 1986).
В предоперационном периоде КТ позволяет оценить операбельность поражения. В зависимости от локализации опухоли в толстой кишке метастатическому поражению подвергаются различные группы лимфатических узлов соответственно оттоку лимфы: из правой половины кишки — верхние брыжеечные, из левой — нижние брыжеечные. При раке прямой кишки метастазы распространяются по трем направлениям: вверх и кзади в аноректальные узлы, а затем в лимфатические узлы, расположенные по ходу верхней прямокишечной артерии, и далее в забрюшинные и парааортальные лимфатические узлы; латерально и вверх по
направлению к боковым стенкам таза в подчревные и внутренние подвздошные лимфатические узлы: латерально и вниз в паховые лимфатические узлы. Размеры перечисленных групп лимфатических узлов в норме 0,5—1 см. Увеличение их может быть обусловлено как наличием метастазов, так и воспалительной реакцией. Нередко метастазы обнаруживаются в неувеличенных лимфатических узлах.
Точность КТ в диагностике метастазов в лимфатические узлы при колоректальном раке, по данным ряда авторов, составляет 56 %, чувствительность — 34 %. Можно обнаружить в 80 % случаев увеличенные лимфатические узлы, особенно при размере их более 6 мм. Оценка неоперабельное™ опухоли с помощью КТ возможна в 100 % случаев. Важнейшая роль принадлежит КТ в оценке рецидивов опухоли. В послеоперационном периоде в обнаружении рецидива опухоли эффективность этого метода достигает 98 % (Gnann et al., 1984; Adalsteinson et al., 1985).
В первичной диагностике опухолей толстой кишки полезно УЗИ. Точность положительного заключения в случае УЗИ брюшной полости составляет 52 % (Price, Metrewely, 1988). При диагностике рака прямой кишки широкое распространение, особенно за рубежом, получило эндоректальное УЗИ. С помощью метода определяют размеры и глубину инвазии раковой опухоли, которая является гипоэхогенным образованием. В целом метод эндоректального УЗИ в выявлении стадии развития опухоли прямой кишки обладает чувствительностью 89 %, специфичностью 100 % и точностью 81 % (Badea et al., 1988; Goldman et al., 1988).
Прогноз при раке толстой кишки размером 3,5—6 см плохой, а при раке меньше 3,5 см или очень больших раках прогноз достоверно лучше. После операции 5-летняя общая выживаемость со
ставляет 31 %, при раке I стадии — 91, II стадии — 68 %.
Саркомы толстой кишки. На эти неэпителиальные злокачественные опухоли приходится от 0,5 до 2 % всех злокачественных новообразований толстой кишки. Различают ретикулярную, круглоклеточную саркомы и лимфосар-кому, которые представляют собой различной величины узлы, покрытые неповрежденной слизистой оболочкой.
Клинические проявления: заболевают преимущественно мужчины моложе 30 лет. Вначале они особых жалоб не предъявляют. В дальнейшем начинают отмечать примесь крови и слизи в кале, боли в животе, слабость, похудание. Саркомы относительно быстро растут, становясь большими (до 8—10 см в диаметре), но редко вызывают кишечную непроходимость. Для них характерно раннее метастазирование сперва в лимфатические узлы брыжейки, а затем в отдаленные органы (печень, почки, плевру, легкие, грудные позвонки) гематогенным путем. Нередко саркоматозные клетки диссеминируют по брюшине, и у больного развивается асцит.
Рентгенодиагностика: саркома встречается в 2 раза чаще в слепой кишке, чем в других отделах толстой кишки. Экзофитные саркомы образуют округлый или овальный дефект наполнения с четкими гладкими или слегка волнистыми контурами. Складки слизистой оболочки кишки отодвигаются опухолью и окружают ее параллельными, лежащими рядом кольцами. Кишка в этом месте расширена и не спадается после опорожнения. Опухоль хорошо обнаруживается после двойного контрастирования по тени высокой плотности на фоне воздуха.
У больных экзофитной лимфосарко-мой илеоцекальной области по медиальной стенке слепой и восходящей кишок определяется краевой дефект наполне
ния, терминальный сегмент подвздошной кишки резко сужен, рельеф слизистой оболочки изменен. Диффузная лим-фосаркома проявляется утолщением стенки кишки вследствие утолщения подслизистого слоя на значительном протяжении, мышечный слой не поражается. Стойко изменяется рельеф слизистой оболочки, на котором возникают отдельные полиповидные образования.
Диагностика лимфосаркомы иногда трудна. В таких случаях всегда следует иметь в виду, что больные лимфосар-комой — это молодые люди. ^Болезнь у них развивается быстро, часто обнаруживается легко смещаемая малоболезненная плотная опухоль с относительно гладкой поверхностью, а общее состояние хорошее.
Меланома толстой кишки. Встречается относительно редко, в основном в прямой кишке и дистальном отделе сигмовидной кишки. Чаще локализуется в аноректальной области, в частности в анальном канале. Отличается от других новообразований темным цветом. Небольшой величины, растет экзофитно, напоминает полип. Рано метастазирует.
Рентгенологически диагностируется по округлому дефекту наполнения с полициклическими контурами. При распаде опухоли в дефекте наполнения появляется контрастное пятно.
Опухолевый метастаз толстой кишки.
Наблюдается относительно часто. В стенку толстой кишки метастазируют раки поджелудочной железы, желудка, яичников и др. Метастазы бывают одиночные и множественные. Метастазы меланобластомы всегда множественные. Как правило, они имеют вид узлов, четко отграниченных от окружающих здоровых тканей, нередко изъязвляются и кровоточат. Метастазы рака молочной железы склонны к инфильтрирующему росту, а рака почки — к образованию крупных внутристеночных узлов. В толстой кишке метастазы напоминают чаще
картину множественного рака, выявляются обычно на фоне метастазирования в другие органы. Метастазы кишечника могут вызвать деформацию и сужение кишки, а также ее фиксацию из-за поражения смежных тканей, в том числе и участков брыжейки. Рентгенологически выявляют различных размеров одиночные или множественные дефекты наполнения, напоминающие полипы, однако края их менее приподняты, т. е. дефекты имеют широкое основание и тупой угол с нормальной стенкой кишки. Контуры дефекта наполнения четкие. При изъязвлении в центре его определяется относительно правильной формы ниша. Диагноз солитарной метастатической опухоли кишечника поставить трудно. В пользу метастаза может свидетельствовать наличие доказанной первичной опухоли другой локализации. Рентгенологическая картина при множественных метастазах напоминает карциноид, лимфогранулематоз кишечника и другие злокачественные лимфомы кишечника. Окончательно решить вопрос можно только на основе результатов эндоскопии с биопсией.
Карциноидные опухоли толстой кишки. Морфологическим субстратом этих опухолей являются кишечные аргентаф-финоциты или напоминающие их по структуре клетки. Карциноидные опухоли полузлокачественные. Они возникают в подслизистом слое толстой кишки в основном у мужчин старше 40 лет. Наиболее часто поражается червеобразный отросток, затем прямая и слепая кишки. Опухоль небольшая, редко ее диаметр превышает 2—3 см. При доброкачественном течении растет медленно. По мере роста опухоли вокруг нее может развиваться обширный спаечный процесс. Если формы злокачественные, карциноид растет более интенсивно, инфильтрируя мышечный слой и серозную оболочку, дает метастазы в брыжеечные
регионарные лимфоузлы, печень, реже в легкие, головной мозг, яичники, кости. Частота метастазирования зависит от величины опухоли. Так, при опухолях, диаметр которых меньше 1 см, метастазирование встречается в 2 %, при опухолях 1—2 см — около 50 % и при опухолях более 2 см — йриблизительно в 80 % случаев.
Клинически характерен карциноидный синдром с приступообразными и постоянными симптомами: быстрым изменением окраски верхней половины туловища, лица, шеи и рук от красного до багрово-цианотичного, чувством жара, обильным потоотделением, сердцебиением, приступами удушья, головокружениями, болями в животе, частым жидким стулом до 20—30 раз в сутки, изменениями со стороны клапанного аппарата сердца, снижением артериального и повышением венозного давления. Впрочем, АД может повышаться. Как правило, отмечается снижение диуреза и увеличение в крови уровня серотонина, а в моче — продуктов его распада.
Рентгенологическая картина разнообразна. Чаще находят небольшой округлый дефект наполнения, эластичность стенок не нарушена, рельеф слизистой вокруг опухоли не изменен. При наличии нескольких рядом распо
ложенных карциноидов возникает множество дефектов наполнения, разделенных неизмененными участками кишки. Если несколько карциноидов сливаются в единый конгломерат, образуется бугристая опухоль, диаметр которой может быть равным диаметру просвета кишки или превышать его. Иногда наблюдается инфильтративный рост опухоли, характеризующийся коротким циркулярным сужением пораженной кишки с ее супрастенотическим расширением и задержкой пассажа.
Карциноидная опухоль прямой кишки располагается не более чем в 12 см от анального отверстия (Sato, Sakai, Sonoyama, 1984). Размер опухоли 0,3— 6 см, в среднем 1,8 см. Опухоли, величина которых не превышает 2 см, на рентгенограммах выглядят как округлые полипоидные образования с гладкими контурами на широком основании. Если размер опухоли 2 см и более, то выявляют кратер в центре образования и анулярный стеноз прямой кишки, связанный с прорастанием кишечной оболочки прямой кишки.
Литературные данные и наш опыт свидетельствуют о том, что рентгенологического исследования недостаточно для диагностики карциноида. Необходимо обязательно производить эндоскопию и биопсию.
Глава 36. ПАРАЗИТАРНЫЕ ЗАБОЛЕВАНИЯ
Паразитарные заболевания толстой кишки встречаются в основном в тропических регионах мира. В этих регионах природные, культурные и социальные условия способствуют широкому распространению таких тропических болезней, как амебиаз, балантидиаз, трихо-цефалез, трипаносомоз, шистосомоз и др. Подобные заболевания наблюдаются и в нашей стране.
Амебиаз толстой кишки (амебная дизентерия). Протозойная болезнь, вы
зываемая дизентерийной амебой — Entamoeba hystolytica и характеризующаяся развитием рецидивирующего геморрагически-язвенного колита, иногда осложняющегося абсцессами различных органов.
Амебиаз эндемичен в странах, расположенных между 40° северной и 30° южной широты, причем в них может быть поражено до 50 — 83 % населения. На всем земном шаре до 20 % жителей больны амебиазом. Поражаются глав
ным образом слепая и восходящая кишки (90%), реже — прямая и сигмовидная.
В цикле развития дизентерийной амебы имеются 2 стадии: вегетативная и стадия покоя, или цисты. Заразными для человека являются цисты, которые в отличие от вегетативной формы (трофозоита) могут существовать независимо от хозяина во влажной среде в течение нескольких месяцев, особенно при температуре ниже 20 °C.
Распространение ’ амебиаза происходит орально-фекальным путем, в основном от человека к человеку. Особенно подвержены заражению лица, живущие в замкнутых коллективах, или активные мужчины-гомосексуалисты. Человек может заболеть в любом возрасте, однако пик заболеваемости приходится на зрелый возраст жизни. Поражаются оба пола, но клинически амебиаз тяжелее протекает у мужчин. Из женщин только у беременных, которые очень восприимчивы к амебной дизентерии, заболевание проявляется в тяжелой форме.
Клинические признаки: инкубационный период чрезвычайно вариабелен и продолжается от 1 недели до 3 мес., бывает и дольше. Главный симптом кишечного амебиаза — понос. Он развивается обычно постепенно: от легкой преходящей диареи и дискомфорта в брюшной полости до кровавого поноса со слизью. В других случаях может иметь место внезапное начало заболевания, очень напоминающее острую бациллярную дизентерию. Но чаще течение бывает смешанное: то диарейный, то слизистый колитный стул. Редко можно отметить слизисто-кровянистые испражнения типа «малинового желе». Тенезмы наблюдаются в острой стадии болезни; в дальнейшем они выражены слабо.
Температура тела, как правило, нормальная или субфебрильная. Симптомы общей интоксикации отсутствуют или
выражены нерезко. Живот вздут, болезненный при пальпации в подвздошных областях. Слепая кишка уплощена, сигмовидная — спастически сокращена. При ректороманоскопии обнаруживают признаки проктосигмоидита и часто с подрытыми, приподнятыми краями язвы, содержащие некротические массы и окруженные пояском гиперемии.
Если течение хронической формы кишечного амебиаза длительное, развиваются астенический синдром, упадок питания, гиповитаминозы и даже кахексия. Существуют также стертые формы амебиаза, при которых кишечные расстройства наступают время от времени и поэтому мало обращают на себя внимание больных.
Самым быстрым, дешевым и точным способом диагностики амебного колита является непосредственное исследование слизи или свежего кала. Таким образом можно обнаружить кишечные простейшие типа трофозоитов и цисты.
Отмечен ряд осложнений амебиаза: 1) амебиома — локальное опухолеподобное поражение, встречающееся у 1,5—8,4 % больных, требует дифференцирования от рака толстой кишки; 2) амебный абсцесс (8,5—10 %), который в 2/з наблюдений является солитарным и в 80 % случаев локализуется в правой доле печени; 3) непроходимость кишки; 4) свищи и др.
Основными рентгенологическими признаками амебных поражений толстой кишки являются изъязвления, дефекты наполнения, изменения рельефа, гаустрации. Изъязвления проявляются в виде небольшой неровности стенки кишки, ее зазубренности, возможны изъязвления в виде «воротника» и «кнопки», а также глубоких язв диаметром более 2 мм, расположенных вдоль длинной или поперечной оси кишки. Перестройка рельефа и псевдополипы неспецифичны, их чаще обнаруживают при неспецифическом грану
лематозном колите, чем при амебиазе. Нарушения гаустрации в виде неравномерности, потери и уменьшения числа гаустр, сужение просвета и утолщение стенки могут быть и при других поражениях кишки. Характерными признаками амебиаза, который отмечается у 90 % больных, являются конической формы сужения и деформация слепой кишки. Недостаточность илеоцекального клапана наблюдают у 60—90 % больных. Терминальный отдел подвздошной кишки не поражен, что отличает амебиаз от болезни Крона и туберкулеза. Возможно также развитие концентрического сужения других отделов толстой кишки, что требует дифференциальной рентгенодиагностики с другими заболеваниями.
При распространенном отеке стенок кишки появляются пальцевидные вдав-ления, напоминающие картину ишемического колита. В поздних стадиях амебиаза может развиться стеноз, чаще поперечной и сигмовидной ободочных кишок. Причем протяженность суженных участков небольшая, они имеют постепенный плавный переход в соседние неизмененные отделы. Иногда в зоне поражения кишки обнаруживают амебные гранулемы (амебиомы), симулирующие опухоль. Нередки осложнения в виде токсического мегаколона (1—3%), который характеризуется сегментарным расширением сигмовидной и поперечной ободочной кишок.
В диагностике амебиаза применяется и УЗИ. Оно позволяет установить правильный диагноз у 50 % больных. Для амебного абсцесса характерны неравномерные контуры, хорошее отграничение от соседней паренхимы, подкапсульное расположение, обедненная эхоструктура и низкая рефлексоген-ность патологического участка. Усиление краевого эхосигнала говорит о наличии хронического абсцесса. Дифференциальная диагностика обычного
и амебного абсцессов нередко требует биопсии с тонкими иглами (Nogel et al., 1983; Ludewig et al., 1986).
Балантидиаз толстой кишки (инфузорная дизентерия). Протозойная болезнь, вызываемая паразитической инфузорией рода балантидий, обитающей в тканях толстой кишки, и характеризующаяся язвенным поражением толстой кишки с нарушением ее функции и наличием общих явлений интоксикации.
Паразит выявляется как в северном, так и в южном полушарии, хотя чаще он встречается в тропических и субтропических регионах мира. Частота обнаружения обычно от 0,5 до 1 %, но в гиперэндемических зонах этот показатель значительно выше.
Основной источник инфекции — свиньи, которые почти поголовно инва-зированы балантидиями. Человек, зараженный балантидиазом, может служить дополнительным источником инфекции при особо неблагоприятных санитарно-гигиенических условиях. Переносится заболевание цистами орально-фекальным путем. Болеют, как правило, жители сельской местности, наиболее часто люди, занимающиеся свиноводством.
Жизненный цикл возбудителя состоит из вегетативной стадии и стадии цисты. Выделенные из организма вегетативные формы могут оставаться живыми в фекалиях 3—5 ч, а цисты сохраняют жизнеспособность в течение нескольких недель. Проникнув в организм человека через рот, балантидии локализуются в толстой кишке, преимущественно в слепой кишке.
Клинические признаки: при острой форме имеются выраженная интоксикация, лихорадка, боли в животе, частый обильный понос. Хроническая непрерывная форма характеризуется постепенным развитием нарушений функции кишечника и вялым течением.
Хронический рецидивирующий балантидиаз проявляется чередованием обострений с ремиссиями продолжительностью 3—6 мес. Лихорадка отсутствует,' симптомы интоксикации мало выражены.
При рентгенологическом исследовании обнаруживают грубую перестройку рельефа слизистой, изъязвления различной формы и размеров, плохую выраженность или полное отсутствие гаустрации, утолщение и ригидность стенки кишки и др.
Диагноз должен быть подтвержден микроскопией нативных мазков кала и обнаружением в них балантидий, чаще их трофозоитов, чем цист.
Американский трипаносомоз (синдром Шагаса). Относится к протозойной болезни, вызываемой трипаносомами класса жгутиковых. Встречается в основном в Центральной й Южной Америке. Переносчиками трипаносом служат клопы. Американцы называют их «поцелуйными клопами», так как они, нападая на спящих людей, кусают их преимущественно в губы и другие части лица.
В основе патогенеза этого заболевания лежат токсико-аллергические реакции, по-видимому, на продукты распада погибающих паразитов. В результате поражаются нервно-мышечные сплетения кишки, а точнее клетки нервных ганглиев, что приводит к развитию мегаколон. Этой болезнью страдают преимущественно дети. Развивается болезнь медленно и проявляется у 90 % лиц в возрасте старше 20 лет.
Клинические признаки кишечной формы американского трипаносомоза можно кратко суммировать как «мегасиндромы», а именно: при данном заболевании развиваются мегаэзофагус и мегаколон с соответствующей клиникой. Наиболее типичными жалобами являются растяжение живота, абдоминальные боли и запоры. К ранним жалобам
относятся метеоризм и значительные затруднения в начале дефекации.
Рентгенологическая картина: резкое расширение в основном прямой и сигмовидной кишок, напоминающее болезнь Гиршспрунга.
Положительная серологическая реакция на трипаносому и возникновение заболевания у взрослого свидетельствуют в пользу американского трипаносомоза. Болезнь Гиршспрунга, как правило, проявляется уже в первые месяцы или годы жизни.
Шистосомоз толстой кишки. Относится к гельминтозам и вызывается кишечной шистосомой из рода трематод, паразитирующей в просвете кровеносных сосудов брюшной полости млекопитающих. Распространен в Африке, Южной Америке и др. Промежуточные хозяева — моллюски. Заболевание человека происходит при купании в зараженных водоемах или питье зараженной воды. Поражается толстая кишка, иногда дистальный отдел подвздошной кишки.
Различают кишечный шистосомоз Мэнсона и японский шистосомоз. Первый встречается в странах Африки, Бразилии, Венесуэле, второй — в Южной Японии, Китае, на Филиппинских островах. Шистосомоз Мэнсона более агрессивный, рано поражает толстую кишку и протекает тяжелее японского.
Клинически болезнь проявляется признаками аллергии и повреждения слизистой оболочки толстой кишки мигрирующими яйцами гельминта. Характерны гепатоспленомегалия и признаки портальной гипертензии.
Обзорная рентгенография брюшной полости позволяет диагностировать свободную перфорацию, хотя чаще бывает прикрытая перфорация с образованием паракишечного абсцесса. Нередко обнаруживают интрамуральные кальцифи-каты в месте скопления яиц паразита.
При ирригоскопии, включая и двой
ное контрастирование, определяются спастические сокращения, чаще на уровне слепой и восходящей кишок, грубый рельеф слизистой, обусловленный отеком, мелкие поверхностные изъязвления. Гаустрация поверхностная, неравномерная. Позднее в ректо-сигмоидальном отделе появляются множественные гранулемы, дающие дефекты наполнения и напоминающие полипы. При развитии фиброза кишки просвет ее сужается, возникают ригидность стенок, стриктуры.
Для диагноза важен факт обнаружения яиц шистосомы в кале или при биопсии прямой кишки.
Трихоцефалез толстой кишки. Гельминтоз из группы кишечных нематодо-зов, вызываемый власоглавом. Распространен широко и тесно связан с санитарным благоустройством населенных мест и личной гигиеной. Излюбленной локализацией паразита являются слепая кишка и червеобразный отросток. При масивной инфекции власоглав расселяется по всей толстой кишке, включая и прямую кишку. Зрелый гельминт погружает тонкий головной конец в слизистую оболочку, оставляя дистальную часть свободной в просвете кишки. Нарушение целостности слизис
той оболочки может способствовать развитию вторичной бактериальной инвазии с изъязвлениями прямой и ободочной кишок.
Клинические проявления трихоцефа-леза у большинства больных отсутствуют. При тяжелой инфекции имеет место диарея с выделением крови и слизи. Появляются боли в животе и диспептические расстройства, гипо- или нормохромная анемия, гипоальбуми-немия.
Рентгенологические изменения неспецифичны. Обнаруживаются перестройка рельефа слизистой, ее набухание, спастические сокращения кишки. При двойном контрастировании можно выявить небольшие (около 1 см) множественные округлые дефекты наполнения на поверхности слизистой в проксимальной половине толстой кишки, обусловленные свернувшимися в кольцо мужскими особями паразитов. Самки же видны как небольшие (около 3—4 см) дугообразно вытянутые дефекты, тесно связанные со слизистой оболочкой, в которую они проникают своим острым передним концом. Диагноз уточняется обнаружением в кале типичных бочкообразных или лимоноподобных яиц с крышкой, характерных для власоглава.
Глава 37. РЕДКИЕ ЗАБОЛЕВАНИЯ
В группу редких заболеваний толстой кишки отнесены некоторые метаболические, воспалительные, опухолевые и другие патологические процессы.
Квашиоркор. Это болезнь раннего детского возраста, связанная с нарушением преимущественно белкового питания. Распространена в тропической Африке, Азии, Центральной и Южной Америке. Отдельные случаи описаны в Европе.
Клинические проявления начинаются с ослабления активности, понижения аппетита вплоть до полной анорексии, похудания, жидкого стула, зябкости,
отставания ребенка в росте, появления раздражительности и плаксивости. Общее состояние довольно быстро ухудшается, диарея прогрессирует. Иногда присоединяется рвота. Стул зеленоватого цвета, жидкий или кашицеобразный, нередко имеются признаки стеатореи. Вскоре появляются отеки, вариабельные по характеру и локализации. Типична депигментация кожи с признаками дерматита (дерматоза). Депигментиро-ванная кожа и волосы у негров иногда принимают красноватый оттенок. Отсюда и. название болезни (квашиоркор —
«красный мальчик»). Отмечается вздутие живота, урчание и выделение большого количества газов. При ректороманоскопии слизистая оболочка выглядит гиперемированной и зернистой.
Рентгенологическая картина: толстая кишка расширена, гаустрация слабо выражена. Часто в просвете кишки имеется большое количество газов. Нередко отмечается тенденция к сегментации кишки. Тем не менее даже в таких случаях кишка опорожняется легко.
Таким образом, состояние кишечника отражает главные патофизиологические особенности заболевания. Характерная для этой болезни диарея частично обусловлена патологией толстой кишки, а частично — последствиями инфицирования тонкой кишки и (или) ее дисфункцией.
Пеллагра. Болезнь развивается при недостатке в диете никотиновой кислоты и триптофана, который в организме метаболизируется в никотиновую кислоту. К развитию пеллагры предрасполагают алкоголизм, цирроз печени, амебная дизентерия, анкилостомоз, малярия и др. Пеллагра распространена во многих районах мира, где преобладает богатая углеводами и бедная белками, в частности триптофаном, монотонная диета. Следовательно, это заболевание обусловлено социально-экономическими причинами. Заболевают преимущественно люди среднего и пожилого возраста.
Клинические проявления в начале болезни весьма неопределенны: чувство желудочного дискомфорта, изжога, отрыжка, тошнота, неустойчивость стула. Классическая триада (диарея, дерматит и деменция) обычно появляется в далеко зашедшей стадии болезни и может приводить к летальному исходу. Главные причины смерти — истощение и интеркуррентные инфекции.
На обзорных рентгеновских снимках брюшной полости выявляют раздутую
газами толстую кишку. При ирригоско-пии имеют место изменения в основном в дистальных отделах, где находят признаки колита.
Правильность диагноза проверяется посредством назначения больному никотиновой кислоты. В результате клинические проявления нетяжелой пеллагры исчезают полностью через 24 ч.
Трихомоноз толстой кишки. Это воспалительное заболевание вызывается кишечными трихомонадами, относящимися к классу жгутиковых.
Клинические признаки зависят от вирулентности возбудителя, реактивности организма и сопутствующей патологии (хронический алкоголизм, тяжелые инфекционные болезни и др.). Инкубационный период длится от 5 до 15 дней. Клинически инфестация проявляется в виде диареи, часто с императивными позывами. Стул жидкий, без запаха, не более 2—3 раз в сутки.
При рентгенологическом исследовании находят признаки раздражения и гипермотильности кишки со спастическим синдромом, расширение и деформацию складок слизистой оболочки.
Диагноз ставят по нахождению паразитов в нативных мазках, приготовленных из свежевыпущенного кала, который разведен изотоническим раствором натрия хлорида.
Коллагенозный колит. Редкое заболевание толстой кишки. Развивается при больших коллагенозах, чаще при склеродермии. Поражение толстой кишки наблюдается в 20—25 % случаев.
Клинические симптомы выражаются болями в животе и хронической водянистой диареей. При колоноскопии с биопсией находят утолщение субэпителиального слоя.
Рентгенологическая картина характеризуется симптомами раздражения отдельных участков толстой кишки, сочетающимися с расширением смежных сегментов кишки со сглаженными
гаустрами, выпрямленными контурами.
Эозинофильный колит. Обычно поражаются слепая и восходящая ободочная кишки. Этиология заболевания остается неизвестной, доказать связь его с аллергией и глистной инвазией не удается.
Клинически заболевание проявляется болями в животе, поносом или запорами, тошнотой, похуданием и кишечными кровотечениями. Обычно предварительный диагноз — воспалительное заболевание кишечника или рак. Только у 50 % больных отмечают повышение содержания эозинофилов в крови. При гистологическом исследовании выявляют утолщение стенок кишки за счет отека подслизистой основы. Встречаются изъязвления и диспластические изменения слизистой оболочки. Самый типичный признак — выраженная эозинофильная инфильтрация.
Рентгенологическая картина характеризуется признаками тифлоколита с преимущественной локализацией изменений слизистой оболочки в слепой кишке.
Мукоцеле червеобразного отростка. Это ретенционная киста червеобразного отростка, возникающая вследствие нарушения проходимости его и скопления там муцинозного содержимого.
Клинические признаки неспецифичны. Главный из них — боли в правом нижнем квадранте живота.
На обзорных рентгенограммах часто выявляют дополнительную округлую тень в области аппендикса, могут быть видны дугообразные обызвествления по ее периферии (кальцинация стенки мукоцеле), реже — центральные обызвествления. При исследовании толстой кишки с бариевой взвесью отмечают смещение слепой кишки, сдавление ее извне, незаполнение аппендикса, полиповидный дефект наполнения в слепой кишке, вызванный инвагинацией основания аппендикса.
С помощью УЗИ определяют дополнительное образование в области аппендикса различной структуры и эхогенности в зависимости от характера содержимого. Образование может быть кистозным, гипоэхогенным или смешанной эхогенности. Эпителиальная выстилка имеет вид тонкого внутреннего эхогенного кольца, сосочковые разрастания — вид небольших эхогенных участков. Выявляется обызвествление стенки мукоцеле.
При КТ определяют образование в области аппендикса жидкостной или мягкотканной плотности (структура его может быть неоднородной), а также обызвествление стенки ретенционной кисты червеобразного отростка.
Гипертрофия илеоцекального клапана. Илеоцекальный клапан состоит из двух губ, имеющих вид полулунных складок, которые по бокам соединены спайками. В стороны от спаек тянутся складки слизистой — уздечки илеоцекального клапана. Наличие клапана обусловлено выпячиванием на 1—2 см конечного отдела тонкой кишки в слепую. В этом месте в стенке кишки циркулярный (ышечный слой несколько утолщен. Ллеоцекальный клапан, пропуская содержимое из тонкой кишки в толстую, в норме не пропускает его обратно, если давление в толстой кишке не превышает 40 мм вод. ст.
Гипертрофия илеоцекального клапана — зто патологическое состояние, при котором имеется увеличение размеров клапана: высота, или вертикальный размер, его превышает 2,5 см. Доказано, что морфологическим субстратом увеличения клапана чаще всего является липоматоз.
Клинические проявления гипертрофии клапана характеризуются схваткообразными болями в правой подвздошной и околопупочной областях, вздутием живота, тошнотой, иногда рвотой.
Рентгенологическое изображение увеличенного илеоцекального клапана зависит от его локализации, проекции, в которой производится исследование, формы, толщины и высоты створок. Если клапан локализуется на задневнутренней стороне кишки, он дает конусовидный дефект наполнения с линейными или выпуклыми верхним и нижним контурами. Клапанный же сегмент подвздошной кишки представлен узкой полоской контрастного вещества, по форме напоминающей «пасть акулы» (Hilkel, 1952). При задней локализации клапана образуется круглый или овальный дефект наполнения со щелевидным или звездчатым депо бариевой взвеси в центре.
После опорожнения кишечника от бария на месте расположения клапана рисунок рельефа слизистой напоминает розетку. Такая картина получается в результате обмазывания барием внутренней поверхности сократившихся и принявших фестончатые очертания губ илеоцекального клапана. При раздувании толстой кишки выявляется дополнительная тень на фоне воздуха на стыке слепой и подвздошной кишок, имеющая в зависимости от хода рентгеновых лучей различную форму: грибовидную, овальную, полуовальную или округлую. С увеличением раздувания дополнительная тень при эластичном илеоцекальном клапане уменьшается в размерах. Контуры тени клапана четкие, чаще ровные, реже волнистые из-за дольчатого его строения.
Дифференциальный диагноз гипертрофии илеоцекального клапана проводится с экзофитной формой рака, бау-гинитом, злокачественной лимфомой и другими патологическими состояниями.
Баугинит. Воспаление илеоцекального клапана (баугиниевой заслонки). Как самостоятельное заболевание возникает редко. Обычно встречается у больных энтеритами или колитами.
Клинические признаки баугинита напоминают тифлит, аппендицит и другие процессы в этой области.
Рентгенологическая картина сходна с липоматозом илеоцекального клапана. Типичны утолщение и деформация губ клапана. Определяется зияние илеоцекального отверстия, что подтверждается непрерывным столбом контрастного вещества от подвздошной кишки до слепой без разделительной линии.
Баугинит следует отличать от илеоцекального пролапса, при котором имеется изменчивость величины дефекта наполнения на стыке подвздошной и слепой кишок в разных фазах исследования, в частности увеличение размеров дефекта при сокращении и опорожнении кишки. При опухолях клапана тоже наблюдается дефект наполнения, но еще в относительно ранних стадиях развития он характеризуется выраженной асимметрией створок клапана, неровностью и нечеткостью их контуров. Важно в дифференциальной диагностике и то, что опухоли илеоцекального клапана довольно рано приводят к кишечной непроходимости.
Абдоминальный актиномикоз. Актиномикоз — хроническое инфекционное, неконтагиозное заболевание. Вызывается актиномицетами и характеризуется гранулематозным поражением тканей и органов с развитием плотных инфильтратов, образованием абсцессов, свищей и рубцов. Желудок и 12-перстная кишка поражаются весьма редко. Склеротический процесс в забрюшинной клетчатке может вызвать непроходимость 12-перстной кишки. Наиболее часто поражается илеоцекальный отдел кишечника. Заболевание начинается образованием в стенке кишки или околокишечной клетчатке специфической гранулемы, превращающейся в плотный воспалительный инфильтрат, который распространяется преимущественно в забрюшинной клетчатке. Образующиеся в инфиль
трате гнойники прорываются через брюшную стенку, образуя свищи, которые иногда сообщаются с просветом кишки.
Клинические проявления: заболевание начинается остро. Характерны сильные схваткообразные или постоянные боли в животе, высокая температура тела. Иногда присоединяются диспеп-тические расстройства, реже перитонеальные явления.
Рентгенологические признаки зависят от стадии и локализации процесса. При преимущественной локализации актиномикоза в брюшной стенке и брюшной полости со стороны кишечника может наблюдаться нормальная рентгенологическая картина. В случае прогрессирования процесса и поражения кишечника отмечается мелкая зубчатость контуров кишки — симптом «пилы» за счет вдавлений в ее просвет расположенных в стенке актиномиком. Если поражения более обширные, контуры кишки становятся выпрямленными, неровными и ригидными, просвет кишки сужается. Наиболее выражены изменения в слепой кишке, где находят дефекты наполнения с неровными контурами, симптом сдавления кишки. Характерен симптом «пелотирования» кишки инфильтратом извне при сохранении рельефа слизистой оболочки. При больших спаечных процессах отдельные кишечные петли образуют неподвижные конгломераты; контуры петель неравномерно угловатые, нередко выявляются внутренние и наружные свищи.
Диагноз подтверждается обнаружением в отделяемом из свища друз лучистого грибка.
Баритома толстой кишки. После ир-ригоскопии может развиться довольно редкое осложнение — бариевые гранулемы, или баритомы. Возникают они, как правило, через 2 дня и позднее вслед за ретроградным контрастированием толстой кишки бариевой взвесью. Раз
витие баритомы происходит после проникновения бария в подслизистую оболочку кишки в результате травматического повреждения слизистой оболочки прямой кишки в процессе исследования или предшествующего воспалительного процесса, например язвенного колита.
Клинические проявления: наиболее часто могут быть боли и ректальные кровотечения, реже — отсутствие симптомов.
Рентгенологическая картина типична: на обзорном снимке таза, выполненном вскоре после ирригоскопии, определяются контрастные пятна в проекции крестца; при введении воздуха участки контрастирования локализуются в 4—8 см от заднепроходного отверстия, чаще по передней или задней стенке прямой кишки.
Профилактика баритом — атравматическое выполнение ирригоскопии.
Поражение толстой кишки при гемобластозах. Гемобластозы — это опухолевые заболевания кроветворной ткани. Их разделяют на 2 основные группы: 1) лейкозы; 2) гематосаркомы. Последние исходят из лимфоидной и ретикулярной ткани. Изменения в толстой кишке опухолевого характера бывают при лимфоидных лейкозах и злокачественных лимфомах. Что касается миелоидных лейкозов, то при них чаще имеют место вторичные некротические язвенные процессы в слизистой оболочке. У больных лейкозом лимфоидного типа чаще поражаются слепая и прямая кишки в виде эндофитно-экзофитно растущей опухоли.
Первично-опухолевые поражения лимфоидной ткани толстой кишки, как правило, относятся к лимфосарко-мам, первичному лимфогранулематозу и редко к экстраоссальной плазмоцитоме. Выделяют инфильтративные и узловатые формы поражения. Лимфо-саркома может проявляться утолщением овальной формы одной или не
скольких складок при сохранении направления их. Гаустрация и эластичность стенок в период развития опухоли сохранены, а в дальнейшем могут иметь место ригидность стенки и сужение просвета кишки.
Для инфильтративной формы поражения характерно неравномерное циркулярное сужение просвета кишки с довольно значительной протяжен
ностью. Контуры суженного участка неровные. Они плавно переходят в патологически расширенную часть кишки. Складки слизистой в пораженных отделах перестроены, атипичны или полностью отсутствуют. Что касается узловатых форм патологического процесса, то они напоминают рак и встречаются очень редко. Изменения в кишке при гемабластозах лучше видны при ДК.
Г л а в а 38, АНОРЕКТАЛЬНЫЕ СВИЩИ
Аноректальные свищи относятся к одним из самых частых поражений прямой кишки и тканей параректальной области. Представляют трубчатые гнойные ходы в клетчатке, окружающей конечную часть прямой кишки и анальный канал. Свищи прямой кишки, как правило, возникают вследствие острого парапроктита, а’ также язвенного проктита, сифилиса, гонореи, актиномикоза, врожденных атрезий прямой кишки и заднего прохода и других заболеваний. Нередко они образуются после травм, чаще огнестрельных или родовых, пластических операций, криминальных абортов.
Свищи прямой кишки принято разделять на интрасфинктерные (подкожноподслизистые) , транссфинктерные (чрезсфинктерные), экстрасфинктер-ные (сложные высокие), ректовагинальные и неполные внутренние. Существуют также свищи параректальной области, не связанные с просветом кишки, которые формируются из эпителиального хода копчиковой области, дермоидных кист, и прочие свищи параректальной области.
Клинические проявления: в развитии прямокишечных свищей различают 2 стадии: I стадия — сразу же после вскрытия параректального гнойника, выражается болезненностью в области заднего прохода и постоянными обильными гнойными выделениями из свище
вого хода; II стадия — хроническая — наступает спустя несколько месяцев. Больные жалуются на незначительные выделения из наружного свищевого отверстия. При сложных свищах прямой кишки страдает и общее состояние, возникает раздражительность, понижается трудоспособность. Из свищевого отверстия постоянно выделяется много гноя, который вызывает экзему в анальной области. У некоторых больных развивается катаральный проктит со слизистыми выделениями из прямой кишки. Если нарушается отток гноя из свищей, наступает обострение. Самочувствие резко ухудшается, повышается температура тела. Больные не могут сидеть, передвигаться. Затрудняется акт дефекации. После вскрытия гнойника общее состояние улучшается.
Наружные отверстия свищей прямой кишки обнаруживают во время осмотра промежности, а при аноскопии, пальцевом исследовании прямой кишки, исследовании свищевого хода пуговчатым зондом после введения в свищевой ход 1 % раствора метиленового синего и рентгеноконтрастных препаратов находят внутренние отверстия свищей. Фистулография проводится для уточнения направлений дополнительных ходов сложных свищей, определения их отношения к наружному сфинктеру и связи с прямой кишкой и другими соседними органами, установления затеков, карма-
нов. Противопоказано это исследование больным с резкой воспалительной реакцией вокруг наружного отверстия, высокой температурой тела, менструацией.
Эффективность фистулографии аноректальных свищей зависит от подготовки ободочной и прямой кишок к исследованию, их очистки от каловых масс. В качестве контрастных веществ наиболее часто используют йодолипол или масляный пропилиодол, подогретый до температуры тела больного. Эти препараты обладают высокой контрастностью, не вызывают побочных явлений, за исключением легкого жжения в окружающих свищ тканях. Неплохие снимки получаются после введения в свищ трийодированных препаратов, в том числе урографина, гипака и особенно кавумбрена, который хорошо растворяется в воде и быстро всасывается из свищей и патологических полостей. Контрастное вещество вводят в свищи при строгом соблюдении правил асептики. Шприцы, иглы и зонды предварительно стерилизуют кипячением, аноректальные наконечники и трубки обрабатывают холодными дезинфицирующими растворами.
Перед фистулографией вокруг заднепроходного и наружного свищевого отверстий сбривают волосы. После осмотра наружного свищевого хода и обзорной рентгенографии в двух проекциях больного укладывают на трохоскопе или в центре снимочного стола на живот или на спину, чтобы наружное отверстие свища оказалось сверху. Ноги слегка разводят. Края отверстия обрабатывают спиртом или 5 % раствором йода. Затем, чтобы приблизительно определить глубину свищевого хода и его направления, зондируют свищ пуговчатым зондом или затупленной отшлифованной иглой. Вводить контрастную массу в свищевой канал целесообразно через катетер. После введения контрастного вещества наружное свищевое отверстие заклеи
вают липким пластырем, подложив под пластырь свинцовую метку места введения. Производят снимки в двух взаимно перпендикулярных проекциях — прямой и боковой. Иногда их дополняют прицельными рентгенограммами в косых проекциях. Часто взаимосвязи свища и органов малого таза сложные, поэтому особенно важно сочетать просвечивание и рентгенографию. Снимать наклейку со свищевого хода и выпускать контрастное вещество не следует, пока не проанализированы полученные фистулограммы. Если по ним установлено, что свищ направляется в кишку, рекомендуется контрастировать и исследовать кишку, чтобы точно определить локализацию свищевого отверстия.
X. К. Туйджанов и Н. У. Шнигер (1974) для фистулографии сконструировали вакуумный цилиндр с иглой, а также аноректальную линейку, использовав для этого обычную резиновую трубку диаметром около 8 мм и длиной 20 см. В один конец этой трубки вставляется градуированная по 1 см металлическая трубка, просвет которой заполняется круглыми свинцовыми дробинками диаметром 5 мм или цилиндриками из органического стекла длиной 9 мм. Между соседними цилиндриками прокладываются металлические кольца соответствующего диаметра толщиной 1 мм. Для обозначения заднего прохода на резиновую трубку в конце металлической линейки надевается свинцовое колечко диаметром 10 мм.
Обычно фистулографии безболезненна. Если во время исследования появилась резкая болезненность, значит допущена какая-то погрешность в ее проведении. При резком повышении давления внутри свища нередко разрывается стенка свища и контрастное вещество попадает в окружающую клетчатку. После фистулографии иногда обостряется воспалительный процесс вокруг свища.
167. Аноректальные свищи:
а — одиночный; б, в — множестве иные.
Основными рентгенологическими признаками свищей являются свищевые ходы, гнойные полости и внутренние свищевые отверстия. Свищевые ходы бывают главные и дополнительные. Главные ходы свищей прямой кишки определяются в околопрямокишечной клетчатке, они соединяют наружное отверстие свища с внутренним. Согласно X. К. Туйджанову, Н. У. Шни-геру (1974) и другим исследователям, главные фистульные ходы бывают прямыми, изогнутыми, извилистыми, подковообразными и в виде неполной подковы.
Прямолинейный свищевой ход по отношению к стенке прямой кишки косой или перпендикулярный. Обычно он короткий, с одним наружным и внутренним отверстием. Длина хода 0,5 — 7 см, чаще 3 см, ширина не более 2—3 мм. Такие свищевые ходы выявляются преимущественно у подкожноподслизистых и чрезсфинктерных свищей прямой кишки, они чаще сообщаются с ее задней стенкой. Широкие прямые свищевые ходы (до 1 см) обнаруживаются редко, в основном у экстра-сфинктерных свищей.
Изогнутые или извилистые свищевые ходы у наружного свищевого отверстия чаще параллельны прямой кишке, затем делают различные изгибы и повороты и соединяются с кишкой под прямым углом. Но у некоторых больных между фистулой и кишкой образуется острый или тупой угол. От этого зависит вид операции. Такие свищи преимущественно экстра- и чрезсфинктерные, длиной до 30 см и шириной 1 см и более, чаще с одним наружным отверстием.
Подковообразные свищи образуются из двух главных фистульных ходов с обеих сторон прямой кишки, соединенных дополнительным поперечным ходом. С просветом кишки такие ходы сообщаются на уровне перемычки. Поперечный гнойный ход чаще находится
сзади кишки и реже — спереди. Тогда образуется задняя подкова или передняя подкова. Если нет дополнительного поперечного хода, с кишкой соединяется ближайший гнойный ход. Ширина просвета свищевых ходов, как правило, неравномерная, варьирует от 0,2 до 1 см и более. Контуры неровные и нечеткие. Подковообразные свищевые ходы бывают подкожно-подслизистые, чрез- и экстрасфинктерные, с двумя наружными отверстиями по обе стороны заднего прохода.
Если подковообразный свищ с двумя наружными отверстиями можно диагностировать клиническими методами, то неполный подковообразный свищ с одним наружным отверстием удается выявить только во время операции и после фистулографии. Как подковообразный свищ, так и свищ, имеющий форму неполной подковы, образуются после нерадикальной операции по поводу острого парапроктита. Иногда свищ в виде неполной подковы — результат облитерации одного из концов подковообразного свища прямой кишки. В этом месте на коже едва заметен маленький рубец.
У большинства больных дополнительные свищевые ходы слепо заканчиваются в параректальной клетчатке с одной стороны сзади, реже — на противоположной стороне. Из параректальной клетчатки свищи направляются в ишиоректальные и пельвиоректальные пространства, а затем открываются на передней брюшной стенке и в других местах тела. Бывают ректоуретральные, ректовагинальные, ректогенитальные и прочие свищи. В большинстве случаев добавочные фистульные ходы, наряду со слепо заканчивающимися в мягких тканях, имеют множественные наружные отверстия.
У аноректальных свищей иногда дополнительные ветви длиннее и шире главного свищевого канала. Они нередко
заканчиваются гнойными полостями в фасциально-клетчаточных пространствах, чаще позади прямой кишки и в ишиоректальном пространстве, реже — в подкожном, пельвиоректальном пространствах и впереди кишки. Полости в основном неправильно-округлые или треугольные с неровными и нечеткими контурами. Размеры варьируют от 1 до 10 см и более.
Один из главных рентгенологических симптомов параректальных свищей — их внутреннее отверстие в прямой кишке, которое выявляется по стойкому контрастному пятну на стенке кишки, непосредственному продолжению стенки свищевого хода в стенку кишки, дефекту наполнения в месте соединения главного свищевого хода с кишкой. По локализации внутреннего отверстия свищи разделяются на передние, задние и боковые, которые, как правило, находятся на 4 см выше заднепроходного отверстия, а иногда и выше.
В зависимости от отношения главного свищевого хода к волокнам наружного сфинктера прямой кишки свищи делятся на подкожно-подслизистые, чрез-и экстрасфинктерные. Подкожно-подслизистые свищи определяются на 2— 4 мм кнутри от наружного сфинктера. Свищевой канал открывается в просвет кишки почти на 4 см выше анального отверстия. Чрезсфинктерные свищи пересекают подкожные или поверхностные волокна наружного сфинктера. Свищевой канал в окружающей прямую кишку клетчатке лежит как с боков, так и спереди или сзади кишки на расстоянии 0,5—1,7 см и более от ее стенки и соединяется с просветом кишки почти на 2,5 см выше заднепроходного отверстия. Экстрасфинктерные свищи огибают или проникают через глубокие волокна наружного сфинктера прямой кишки. На фистулограммах свищевой ход обнаруживается на расстоянии 0,5 — 2,2 см и более от стенки кишки, а его
соединение с просветом кишки — на высоте 2,5—4 см от анального отверстия, редко выше.
По мнению некоторых исследователей, локализация наружного свищевого отверстия косвенно свидетельствует о виде свища. Так, если это отверстие находится на 1—4 см выше заднепроходного, то свищ обычно бывает подкожно-подслизистым, если же выше — то чрез- или экстрасфинктерным.
В практической работе особое место занимают неполные внутренние свищи с одним внутренним отверстием на задней стенке прямой кишки. Они возникают после острого парапроктита и образования абсцесса, перфорировавшего или вскрытого оперативным путем через просвет прямой кишки. Путем пальцевого исследования, аноскопии и ретроградного зондирования изогнутым зондом удается определить только внутреннее отверстие, а не особенности таких свищей.
Способы рентгенодиагностики неполных внутренних свищей разработаны плохо: как в отечественной, так и в зарубежной литературе им посвящены лишь единичные работы. По результатам рекомендуемой X. К. Туйджановым и Н. У. Шнигером (1974) для рентгенодиагностики свищей фистулографии, после введения контрастного вещества через специально изогнутую иглу с обтурирующим диском диагноз можно поставить только в 64,3 % случаев. После заполнения контрастным веществом неполных внутренних свищей выявляют свищевой ход кнутри от анального сфинктера, между его волокон или снаружи. Свищ бывает глубоким и неглубоким. Глубокие свищи чаще изогнутые, определяются в толще сфинктера или вокруг него и заканчиваются слепо в параректальной клетчатке. Неглубокие свищи лежат кнутри от волокон сфинктера и поверхностно, в подслизистом слое анального канала. Они обычно
прямолинейные, без разветвлений и гнойных полостей, плохо удерживают контрастное вещество. Неполные внутренние сйищи отделяются от стенки кишки под разными углами: если под прямым углом, зонд проводится легко, и то только до первого изгиба свища, если же под острым или тупым углом, зондировать свищ невозможно.
У неполных наружных свищей прямой кишки одно наружное отверстие. В большинстве своем они развиваются из полного прямокишечного свища, когда его внутреннее отверстие временно или полностью закрывается. На фисту-лограммах удается установить гнойный канал свища, чаще прямолинейный, реже изогнутый или извилистый, который заканчивается слепо в параректальной клетчатке. Ширина просвета свищевого хода неравномерная, до 0,5 см и более. Иногда свищи заканчиваются гнойными полостями в подкожной клетчатке или в ишиоректальном пространстве.
Свищи параректальной области, не связанные с просветом кишки, возникают как осложнения эпителиального хода копчиковой области, дермоидных кист, а также остеомиелита, туберкулеза, травмы крестца и копчика.
Эпителиальный копчиковый ход имеет одно или несколько входных отверстий в межъягодичной складке. На фистулограммах определяется прямолинейным или косым узким каналом с неровными контурами, шириной до 2 — 3 мм и длиной до 2 см, в подкожной жировой клетчатке позади копчиковых позвонков, строго по срединной копчиковой линии, слепо заканчивающимся в мягких тканях над верхушкой копчика. С кишкой не сообщается. От копчиковых позвонков он отстоит на 1—2 см и повторяет изгибы копчика. При нагноении расширяется до 1 см и более. Заполняется контрастным веществом, как правило, неравномерно. Ответвле
ния от прямолинейного свища образуют множество наружных отверстий, одно из которых находится около заднепроходного отверстия. Нередко как прямолинейные свищи, так и разветвленные ходы в параректальном пространстве имеют гнойные полости и затеки, которые узкими каналами сообщаются с копчиковым ходом. Полости бывают различных размеров, чаще до 3—5 см в диаметре. Их контуры неровные и нечеткие. Контрастным веществом полости заполняются неравномерно из-за разросшейся в них грануляционнорубцовой ткани. Иногда разветвленные фистулы сообщаются с просветом прямой кишки. В таких случаях внутреннее отверстие свища чаще выявляется на задней стенке, не менее чем на 3—4 см выше края заднепроходного отверстия (Туйджанов, Шнигер, 1974, 1989).
Свищи на промежности исходят и из дермоидных кист крестцово-копчиковой области, возникших вследствие дисэмб-риогенеза. Крестцово-копчиковые дермоидные кисты локализуются ретрорек-тально, между копчиком и задним проходом, а также в толще ягодичных мышц. Растут медленно и долго ничем не проявляются. При нагнаивании они самопроизвольно вскрываются и образуют свищ. Последний диагностируется на обзорных снимках малого таза в прямой и боковой проекциях, на фистулограммах, во время ДК, томографии и париетографии прямой кишки.
На обзорных снимках нагноившаяся дермоидная киста часто обнаруживается по скоплению газа в пресакральной или перианальной клетчатке. Но лучше она выявляется после фистулографии.
X. К. Туйджанов и Н. У. Шнигер (1974) разработали методику двойного контрастирования крестцово-копчиковых кист. Она заключается в следующем. После отсасывания шприцем через свищ содержимого кисты последнюю заполняют небольшим количеством во
дорастворимого трийодированного рентгеноконтрастного вещества. Затем подсоединенную к игле резиновую трубку пережимают, больной несколько раз поворачивается на трохоскопе вокруг продольной оси тела. После этого в полость кисты вводят любой газ до появления у больного чувства давления в области кисты и производят рентгенографию малого таза в двух проекциях.
Дермоидные кисты крестцово-копчиковой области бывают однокамерные, многокамерные и лентовидные. Однокамерная киста создает овальную или округлую гомогенную тень диаметром 2—3 см, контуры которой ровные и четкие. Многокамерные кисты заполняются контрастным веществом неравномерно. Формы полостей этих кист самые разнообразные, а контуры четкие и волнистые. Кисты достигают иногда 10 — 12 см в поперечнике и резко расширяют ретроректальное пространство, смещая и сдавливая прямую кишку и мочевой пузырь. Лентовидные кисты также заполняются неравномерно, их ширина колеблется от 0,5 до 1 см, длина — от 4 до 18 см, контуры стенок четкие. Они часто изгибаются, делают много поворотов, приобретая различную форму (кольца, подковы, дерева и др.), но с просветом кишки не сообщаются. Свищи лентовидных кист открываются на поверхность промежности около заднего прохода, на копчик или во влагалище.
При дифференциальной рентгенодиагностике параректальных кист и свищей прямой кишки большое значение имеет точное определение уровня расположения патологических изменений, выявленных при проктографии. Так, если кисты дренирующиеся, у 60 % больных все изменения локализуются на уровне нижне- и среднеампулярного отделов прямой кишки. В остальных случаях они определяются на уровне
нижнеампулярного отдела или даже анального канала. При свищах все изменения бывают на уровне анального канала или на границе его с нижнеампулярным отделом.
Дугообразное вдавление стенки прямой кишки — один из частых рентгенологических признаков недренирующих-ся параректальных кист. При дренирующихся кистах данный признак встречается лишь у половины больных. Поэтому он не может быть решающим в дифференциальной рентгенодиагностике дренирующихся кист. Значительно большее значение в этом плане имеют определение уровня локализации патологических изменений, выявляемых при проктографии, а также данные фисту-лографии.
Свищевые ходы при дренирующихся кистах и свищах прямой кишки отличаются друг от друга. У всех больных с кистами они являются одиночными, неразветвленными, с четкими контурами, длиной в среднем 3 см, шириной 0,5 см и, как правило, не сообщаются с просветом прямой кишки.
При хроническом парапроктите свищевые ходы в 50 % случаев бывают множественными, разветвленными с нечеткими контурами, длиной в среднем 5,3 см, шириной 0,3 см.’ У половины больных определяются их сообщения с просветом прямой кишки.
Дренирующая параректальная киста обычно правильной округлой формы с четкими, ровными контурами. Она часто многокамерная и локализуется на уровне нижне- и среднеампулярного отдела прямой кишки. Патологическая полость при хроническом парапроктите чаще одиночная, неправильной формы, с неровными контурами и локализуется на уровне анального канала. Таким образом, при дифференциальной диагностике дренирующихся кист и свищей прямой кишки решающее значение имеет весь комплекс изменений, выявляе
мых при фистулографии и прокто-графии.
Свищи в параректальной области могут формироваться и после травм прямой кишки, в основном острыми предметами (чаще при падении), вследствие остеомиелита, туберкулеза, актиномикоза и других болезней пояснично-крестцового отдела позвоночника, коп
чика и костей таза. В каждом случае на обзорных рентгенограммах и фисту-лограммах уточняются особенности свища, его отношение к наружному жому прямой кишки, соседним органам и тканям, определяются гнойные полости, внутреннее отверстие, дополнительные свищевые ходы — все это утяжеляет общее состояние больного.
Глава 39. РЕНТГЕНОЛОГИЯ ОПЕРИРОВАННОЙ ТОЛСТОЙ КИШКИ. ТРАВМАТИЧЕСКИЕ ПОВРЕЖДЕНИЯ
Современные рентгенологические средства и подготовка персонала рентгеновских кабинетов позволяют осуществлять все виды рентгенологических исследований в любое время после операций па толстой кишке. В зависимости от состояния больного рентгенологическое исследование проводится в палате с помощью передвижного аппарата или в стационарном рентгеновском кабинете.
Особенности рентгенологического исследования оперированной толстой кишки
Рентгенологическое исследование толстой кишки после резекции брыжеечных отделов ее проводится по общепринятой методике с использованием тугого заполнения, изучения рельефа слизистой оболочки и в случае необходимости — двойного контрастирования. Затем, чтобы выявить двигательную функцию толстой кишки в послеоперационном периоде, ее исследуют после перорального приема бариевой взвеси.
В практике нередко возникает необходимость рентгенологического исследования межкишечных анастомозов в раннем периоде вслед за операцией на ободочной кишке. Показаниями являются клинические признаки несостоятельности анастомоза, выраженное в
различной степени вздутие живота и повышение температуры тела у больных более чем через 3—4 суток после операции, если отсутствуют причины, объясняющие это состояние.
Заслуживает внимания методика, разработанная и предложенная в 1984 г. группой ученых НИИ проктологии М3 России во главе с В. Н. Мушниковой. По их мнению, рентгенологическое исследование по соответствующим показаниям может быть проведено даже на 3—4-е сутки, но оптимальным сроком являются 6—8-е, когда уменьшается послеоперационный отек анастомоза и создаются благоприятные условия для его изучения.
Залог успешного рентгенологического изучения межкишечпых анастомозов — правильная методика исследования. Врачу-рентгенологу необходимо до начала исследования точно знать не только характер операции, но и вид анастомоза (конец в конец, конец в бок, бок в бок). В ряде случаев требуется тщательный дифференциальный диагноз между рентгенологическим изображением слепого конца кишки в случае анастомоза конец в конец и патологической полостью.
В первые 2 недели после операции больных можно исследовать практически без специальной подготовки. В дальнейшем перед исследованием ставят очистительную клизму.
Методика неотложной ирригоскопии
в раннем периоде после операции заключается в следующем. Исследование начинают с обзорной рентгеноскопии брюшной полости, когда обращается внимание на состояние петель кишечника, наличие свободного газа в брюшной полости или свободной жидкости. Затем в кишку ретроградно с помощью аппарата Боброва вводят 150—300 мл бариевой взвеси (в разведении 1:4) без танина. Количество вводимой бариевой взвеси зависит от вида оперативного вмешательства: чем дистальнее расположен анастомоз, тем меньше требуется бариевой взвеси.
Бариевую взвесь вводят в кишку медленно в положении Тренделенбурга. При резко выраженном раздражении или спазме в области анастомоза исследование продолжается через 10 —1'5 мин после сублингвального приема 3 таблеток аэрона. Важную роль в процессе исследования играет полипозиционное изучение анастомоза под контролем просвечивания.
Наибольшую информативность в распознавании несостоятельности имеют рентгенограммы в стадии тугого заполнения области анастомоза контрастной взвесью. Кишка в этом случае расправляется максимально, что облегчает дифференциальную рентгенодиагностику «линейных» небольших затеков с зазубренностью контуров за счет раздражения, гаустрации и т. д. Вслед за опорожнением кишки от контрастной взвеси обязательна рентгенограмма в оптимальной проекции, так как после дефекации могут контрастироваться не выявленные ранее патологические затеки. Если они уже были диагностированы, то на этом этапе изучается их опорожнение от бариевой взвеси, что имеет немаловажное значение в выборе тактики лечения.
Двойное контрастирование кишки осуществляется, как правило, в более поздние сроки после операции, если
имеется подозрение на наличие большой паракишечной полости, или с дифференциально-диагностической целью.
Весьма трудно проводить рентгенологическое исследование толстой кишки после внутрибрюшной экстирпации прямой и дистальной части сигмовидной кишки (операция Гартманна). Трудности’связаны главным образом с введением контрастных веществ (бариевая взвесь и воздух) через колостому, особенно в случае различных парако-лостомических осложнений (парако-лостомическая грыжа, стриктура коло-стомы, выпадение кишки и др.). Для рентгенологического исследования толстой кишки у таких больных предложены специальные устройства. Принцип их действия основан на обтурации коло-стомы, чтобы предупредить вытекание контрастного вещества и удержать его в просвете кишки с помощью катетера с надувными баллонами на конце.
Для обтурации стомы в НИИ проктологии М3 России при рентгенологическом исследовании толстой кишки у больных с колостомой используют интубационную трубку или специальное магнитное устройство. Оно состоит из 2 магнитных колец. Одно надевается на стому и крепится поясом к телу больного, в другое продевается трубка от аппарата Боброва, конец которой вводится в стому. Плотно соединяясь друг с другом, эти кольца препятствуют вытеканию бариевой взвеси.
Исследование функционирующих отделов ободочной кишки требует предварительной подготовки. При нормальном функционировании толстой кишки и отсутствии параколостомических осложнений больному за день до исследования назначают 50 г касторового масла. Вечером и утром за 1 — 1,5 ч до исследования делают очистительную клизму через стому. Больным со склонностью к запорам назначают 10—15 % раствор сернокислой магнезии по 30 мл
3—4 раза в день в течение 2—3 дней, а накануне исследования — 50 г касторового масла и очистительную клизму.
У больных с параколостомическими осложнениями методика подготовки к исследованию несколько меняется. Так, при эвагинации кишки из стомы целесообразно назначать касторовое масло: вызывая раздражение слизистой кишки, оно усиливает перистальтику. Но одновременно с ускорением опорожнения кишки это способствует большей эвагинации кишки через стому и мацерации окружающей кожи, что затрудняет проведение полноценного исследования. Таких пациентов подготавливают путем ирригации кишки через стому вечером накануне и утром в день исследования. Ирригацию кишки выполняет врач с помощью желудочного зонда не позже,чем за 1 — 1,5 ч до исследования.
Наибольшие трудности возникают при исследовании больных со стриктурой стомы, когда через узкий рубцовоизмененный канал сложно заполнить контрастной взвесью длинный отдел функционирующей кишки. Чтобы успешно выполнить исследование, больных за 3—5 дней до него переводят на бесшлаковую диету, назначают слабительные и ирригацию кишки через стому. Однако и это не всегда позволяет провести адекватное исследование, поэтому у некоторых пациентов стому предварительно бужируют или прибегают к рассечению рубцовой стриктуры с последующей механической очисткой кишки.
Обычно начинают исследование с ретроградного тугого контрастирования отключенных отделов бариевой взвесью. Больного укладывают на спину в положение Тренделенбурга под углом 15— 20°. Затем приступают к исследованию функционального отдела кишки с помощью магнитного обтуратора или интубационной трубки. Трубку вводит, как правило, сам больной. При выпадающей
стоме кишку осторожно вправляют и только после этого проводят трубку. Во всех случаях контрастное вещество вводят медленно, маленькими порциями, под небольшим давлением с помощью аппарата Боброва. После акта дефекации изучают рельеф слизистой отключенного и функционирующего отделов кишки, а затем исследуют их в условиях двойного контрастирования. При этом производят снимки в различных положениях больного. В случаях выраженного раздражения кишки, особенно функционирующих ее отделов, исследование начинают через 15— 20 мин после сублингвального приема 3 таблеток аэрона.
При рентгенологическом исследовании детально изучают форму, размер, положение, контуры, гаустрацию, рельеф слизистой, эластичность, тонус, сметЦаемость как отключенного, так и функционирующего отделов толстой кишки. Эти данные позволяют наметить план предоперационной подготовки и способ пластической реконструктивно-восстановительной операции (Араблинский и др.,' 1985).
У детей после обширных резекций толстой кишки по поводу болезни Гиршспрунга также применяют ретроградное контрастирование. Для введения контрастного вещества используют аппарат Боброва. Исследование больного проводят в положении на спине под контролем ЭОП. Мягкий резиновый катетер (зонд), смазанный вазелиновым маслом, вводят в прямую кишку на глубину 3—4 см, после чего заполнение кишки контрастным веществом производят медленно, небольшими порциями, с перерывами, не допуская появления болей. По мере заполнения кишки при необходимости выполняют прицельные снимки в прямой и боковой проекциях, а после заполнения всей ободочной кишки — обзорные рентгенограммы, отображающие ее морфофункциональ
ное состояние. Чтобы изучить строение слизистой кишки, исследование заканчивают после освобождения ее от контрастного вещества. Обращается внимание на вновь образованную ампулу из низведенной кишки, форму и размеры перемещенных отделов, а также на их сократительную и эвакуаторную функции.
Рентгенологическая картина оперированной толстой кишки
Наиболее частыми хирургическими операциями на толстой кишке являются наложение цеко- и сигмостомы, а также противоестественного заднего прохода, частичная резекция толстой кишки, субтотальная или тотальная колэктомия и др. Анастомоз между оставшимися отделами кишки накладывают конец в конец, конец в бок или бок в бок.
При правосторонней гемиколэктомии резекции подлежат терминальная часть подвздошной кишки, слепая, восходящая ободочная и проксимальная часть поперечной ободочной кишки. Илео-трансверзальный анастомоз накладывают бок в бок или конец в бок (конец подвздошной в бок поперечной ободочной кишки). В позднем послеоперационном периоде рентгенологически обычно выявляют широкое соустье между кишками и слепо заканчивающуюся культю поперечной ободочной кишки, просвет которой, как правило, расширен. По латеральному контуру толстой кишки в зоне анастомоза часто определяется краевой дефект наполнения с неровными и нечеткими очертаниями — все это обусловлено погружным швом и рубцовыми изменениями, а не рецидивом опухоли. Вопрос решают изучение рельефа слизистой оболочки после опорожнения и двойное контрастирование.
Правосторонняя гемиколэктомия может заканчиваться и другими типа
ми анастомозов тонкой и толстой кишок. Так, нередко применяется концебоковой анастомоз с продольным рассечением ободочной кишки. Преимущество данного типа анастомоза в том, что он антирефлюксный. Техника формирования такого анастомоза почти не отличается от описанной. Ободочную кишку рассекают на ширину просвета тонкой кишки. Но в последнее время хирурги чаще накладывают концебоковой анастомоз с поперечным рассечением ободочной кишки. Достоинство этого вида анастомоза — не повреждаются прямые артерии и циркулярная мускулатура ободочной кишки. Такой анастомоз функционирует как антирефлюксный и кровоснабжение в зоне анастомоза никогда не страдает, как это возможно при продольном рассечении ободочной кишки. Концебоковой анастомоз инвагинационного типа предложил Д. Я. Витебский (1978). Суть его в следующем: поперечную ободочную кишку рассекают в поперечном направлении, в образовавшуюся рану вводят конец тонкой кишки на протяжении 2 см и формируют анастомоз двухрядными серозно-мышечными швами. Слизистые не сшивают в расчете на то, что слизистая тонкой кишки подворачивается и эмитирует илеоцекальный клапан. Наш опыт и литературные данные свидетельствуют, что при таком способе часто возникают стриктуры, некрозы и другие осложнения.
Левостороняя гемиколэктомия включает удаление дистальной части поперечной ободочной, нисходящей ободочной и проксимальной части сигмовидной кишки. Анастомоз между поперечной ободочной кишкой и сигмовидной бывает конец в конец, конец в бок и бок в бок. Место соустья рентгенологически определяется легко по различию в диаметре отрезков кишки.
Резекция части поперечной ободочной кишки заканчивается обычно наклады-
168. Оперированная толстая кишка после:
а, б — правосторонней гем и колэктомии; в — резекции сигмовидной кишки; г — операции Гартман на.
ванием анастомоза конец в конец. После операции место анастомоза определить иногда трудно из-за одинакового диаметра соединенных концов кишки. По
могают его определить ограничение г смещаемости этого сегмента кишки г сближение печеночного и селезеночного изгибов ее.
Субтотальная и тотальная колэктомия обычно заканчивается наложением илеоректального и илеосигмоидного анастомозов. Для этих операций с рентгенологической точки зрения характерен резкий переход широкой культи прямой или сигмовидной кишок в узкую подвздошную кишку с поперечным рельефом слизистой оболочки. Правда, спустя годы просвет терминального отдела подвздошной кишки может стать шире и достигать диаметра толстой кишки.
Операция Кеню — Майлса — одномоментная брюшно-промежностная экстирпация прямой кишки и операция Гартманна — трансабдоминальная резекция прямой и дистальной части сигмовидной кишки производятся при опухолях прямой кишки: первая при локализации опухоли на высоте 6 см от ануса, вторая — на высоте выше 8— 10 см от ануса. Одноствольный противоестественный анус чаще выводится в подздошную область. Анализ данных рентгенологического исследования после операции Гартманна показал, что у большинства больных культя отключенной кишки располагается на уровне Lv или Si—и, а длина ее бывает 6 — 32 см. При большой длине отключенной кишки в проксимальной ее части определяются несколько дополнительных изгибов. Ширина просвета отключенной части толстой кишки близка к нормальной: прямой кишки — от 6 до 8 см, сигмовидной — от 2,5 до 3,5 см. Контуры кишки четкие и ровные. У всех больных отмечается полное опорожнение отключенных отделов кишки от бариевой взвеси, рельеф слизистой в большинстве случаев нормальный. В процессе исследования пациентов, у которых послеоперационный период протекал без осложнений, обычно не выявляют выраженного сужения и снижения тонуса отключенной кишки. Правда, у больных с длинной культей отмечаются иногда
рентгенологические признаки гипертонуса отключенной кишки, особенно в ранние сроки после операции. Причем повышение тонуса тем больше, чем длиннее отключенный отдел кишки.
Из всех хирургических вмешательств резекция сигмовидной и прямой кишок занимает значительное место в оперативной проктологии. Рентгенологическая картина при резекции брыжеечных отделов толстой кишки определяется следующими факторами: характером наложенного анастомоза и типом шва; сроком после операции; осложнениями, возникшими в области анастомоза; соотношением просветов анастомозирующих отрезков резецированных отделов; состоянием толстой кишки в целом, особенно рядом лежащих отделов.
Адаптация толстой кишки при благоприятном послеоперационном течении наступает в срок от 3 до 6 мес. Это проявляется значительным уменьшением или отсутствием симптомов, свидетельствующих о раздражении кишки. В эти сроки в полной мере развиваются репаративные процессы в анастомозе: увеличивается просвет, уменьшаются гипермотильность и протяженность суженного участка. Рентгенологическим методом установлено, что степень сужения соустья в значительной мере обусловлена функциональными (спастическими) изменениями.
Поскольку стабилизация рентгенологической картины после резекции сигмовидной и поперечной ободочной кишок при отсутствии осложнений наступает через полгода, целесообразно первую контрольную ирригоскопию (Шни-гер, 1989) производить в этот период. При этом обязательны рентгенограммы области анастомоза. Они необходимы для сравнения, чтобы своевременно и правильно диагностировать поздние послеоперационные осложнения.
По рентгенологической картине в области анастомоза установлено 5 типов
изменений толстой кишки. I тип анастомоза характеризуется циркулярным симметричным сужением резецированной кишки протяженностью не более 1,5—2 см с резкими границами, ровными или волнистыми, но всегда четкими контурами. Просвет суженного участка кишки колеблется от 1 до 2,5 см. II тип анастомоза отличается большей протяженностью сужения (2,5—4 см). Переход в неизменные участки стенок кишки у обоих полюсов постепенный. Степень выраженности сужения иногда едва заметна. Складки слизистой в области анастомоза всегда направлены продольно. При III типе анастомоза кишка деформируется на счет втяжения антибрыжеечной стенки, расширяется и несколько перемещается в медиальную сторону. Такая картина обусловлена локальными паракишечными сращениями, неравномерным втягиванием стенки кишки при наложении швов и преобладанием односторонних органических внутристеночных изменений. При IV типе анастомоза рентгенологическая картина туго заполненных бариевой взвесью сигмовидной и поперечной ободочной кишок не отличается от нормальной. На уровень анастомоза указывает только резкий переход структуры рельефа слизистой анастомозированных участков резецированной кишки. Этот тип анастомоза встречается при полном совпадении просвета последних, технически правильном наложении мёжкишечного шва, отсутствием каких бы то ни было осложнений в раннем послеоперационном периоде. При V типе анастомоза в рентгенологической картине не удается отметить вообще никаких характерных признаков.
Продвижение бариевой взвеси по толстой кишке после перорального приема происходит в обычные сроки. Исключение составляют больные в первые 3 мес. после операции. У них пассаж контрастированного кала в дистальной
половине толстой кишки бывает ускоренным или, наоборот, замедленным. У отдельных больных в этот период констатируют спазм в области анастомоза с некоторой задержкой контрастного вещества в расширенном престенотиче-ском участке кишки (Шнигер, 1989).
Болезни оперированной толстой кишки
В практической деятельности врача-рентгенолога изучение зоны анастомоза должно быть на первом месте. Трудности рентгенологического распознавания ранних послеоперационных осложнений в области анастомозов обусловлены обычно выраженным гипертонусом или деформацией кишки вследствие оперативного вмешательства, причем характер этих изменений различен в зависимости от срока исследования после операции. Так, в первую неделю в основном доминируют функциональные изменения кишки на значительном ее протяжении. Хотя анастомоз и сужен, не всегда легко его локализовать из-за общего гипертонуса и гипермотильности кишки.
По мнению В. Н. Мушниковой и др. (1984), на 15—16-е сутки в большинстве случаев раздражение кишки либо совсем отсутствует, либо выражено в значительно меньшей степени в виде спазма непосредственно в области анастомоза, который определяется более четко как циркулярное, нередко асси-метричное сужение. На этом этапе могут отчетливо определяться признаки фиксации кишки в результате перипроцесса.
К свободному газу в брюшной полости в первую неделю после операции следует относиться осторожно, так как он может быть проявлением послеоперационного пневмоперитонеума. У 2/з больных на 5—7-е сутки после операции свободного газа либо не бывает, либо он определяется в неболь
шом количестве в виде серпа под правым куполом диафрагмы. Если на 7 —10-е сутки после операции газа под диафрагмой много, то это свидетельствует или об острой недостаточности анастомоза, или о клинической картине кишечной непроходимости и перитоните.
Рентгенологические признаки несостоятельности анастомоза бывают прямые и косвенные. К прямым относятся поступление контрастного вещества за пределы кишки (дефект ее стенки). К косвенным признакам относится ограниченное дугообразное вдавление на стенке кишки вблизи анастомоза кишечной области, особенно если кишка в этом месте оттеснена. Такой косвенный симптом может свидетельствовать о развитии паракишечного инфильтрата или абсцесса.
У 82,9 % больных несостоятельность анастомоза рентгенологически диагностируется в первые 16 суток после операции, причем у половины — на 6—7-е сутки (Мушникова и др., 1984). У большинства больных контрастное вещество из области анастомоза сразу поступает в полости различной формы и размеров. Лишь у 19,3 % больных выявились узкие свищевые ходы длиной от 1,5 до 12 см. Ни в одном наблюдении не отмечено свободного распространения контрастного вещества по брюшной полости.
При рентгенологически диагностированной недостаточности срок повторного исследования зависит от степени ее выраженности и размеров паракишеч-ной полости (но не ранее чем через 10 — 14 дней).
Таким образом, неотложное рентгенологическое исследование в раннем периоде после операций на ободочной кишке имеет высокие диагностические возможности в распознавании недостаточности межкишечных анастомозов и при соблюдении правильной методики
не представляет опасности для больных. Оно должно более широко применяться в клинике и выполняться при подозрении на несостоятельность анастомоза начиная с 4—5-го дня после операции (Мушникова и др., 1984).
У 30 % больных после операции Гарт-манна могут возникнуть различные осложнения: несостоятельность швов ушитой культи, тазовый асбцесс, перитонит и др. При обследовании выявляют различные изменения в отключенном сегменте кишки. Так, у 27,5 % больных имеется выраженная фиксация с перегибом проксимального сегмента кишки, у 18,3 % — рубцовая стриктура проксимальной части культи на протяжении 3—5 см, у 9 % — свищевой ход, сообщающийся с полостью абсцесса в малом тазу, у 12,4 % — свищевой ход между прямой кишкой и органами малого таза (мочевой пузырь, шейка матки и влагалище).
У подавляющего большинства больных в левых отделах ободочной кишки выявлены выраженные признаки гипертонуса в виде неравномерного сужения просвета кишки, учащенной, беспорядочной, глубокой гаустрации и т. д. Периодически в этих отделах могут возникать спастические сокращения, препятствующие ретроградному введению бариевой взвеси или воздуха. Причем у некоторых больных все эти явления резко выражены вблизи колостомы.
Довольно часто у больных с колосто-мой определяется цекоилеальный рефлюкс. С точки зрения В. Н. Муш-никовой, выявленные у больных после операции Гартманна функциональные нарушения в виде гипертонуса левых отделов ободочной кишки и недостаточности илеоцекального клапана можно рассматривать как компенсаторный механизм функции «держания» кишки после этого вида операции, когда больной лишается естественного запирательного аппарата.
Таким образом, после операции Гартманна рентгенологическое исследование толстой кишки с помощью контрастной клизмы является одним из основных диагностических методов. Оно позволяет оценить состояние функционирующих и отключенных отделов толстой кишки и наметить план восстановительной операции.
Одним из наиболее тяжелых осложнений является пресакральный абсцесс. На боковых рентгенограммах таза пресакрально у культи прямой кишки определяется полость с горизонтальным уровнем жидкости. Если прямую кишку контрастировать, то можно заметить сдавление и смещение ее кпереди и лате рал ь но.
Нередко врачу-рентгенологу приходится иметь дело с послеоперационными рубцовыми стриктурами в области анастомоза. Для них характерны: циркулярные и симметричные сужения с ровными или зазубренными контурами, сохранение стенкой суженного участка кишки некоторой эластичности, сохранение складок слизистой оболочки, наличие у верхнего полюса рубцовой стриктуры, карманнообразных выпячиваний наподобие дивертикулов, умеренное супрастенотическое расширение кишки. После аппендэктомии часто развивается деформация внутренней стенки слепой кишки, симулирующая дефект наполнения при опухоли. В отличие от последней эластичность стенки сохранена, складки слизистой не обрываются, форма и размеры дефекта наг полнения меняются в процессе исследования.
Рецидив рака после резекции пораженного участка толстой кишки наблюдается у 10—25 % оперированных. Рецидивирующие раки быстро приводят к стенозированию просвета анастомоза. Чаще всего развивается циркулярное четко очерченное сужение кишки в области анастомоза с бугристыми конту
рами, реже — краевой дефект наполнения. Протяженность поражения небольшая, рельеф слизистой оболочки атипичный. Большую помощь в обнаружении рецидива опухоли может оказать КТ, эффективность которой достигает 98 % (Gnann et al., 1984).
Травматические повреждения толстой кишки
Травматические повреждения толстой кишки — нарушения ее анатомической целости или функционального состояния, вызванные внешним воздействием. Закрытая травма является наиболее тяжелым видом повреждения. Диагностировать ее трудно. Пострадавшие с закрытой травмой живота и таза доставляются в лечебные учреждения в состоянии травматического шока или без сознания. В связи с этим основное диагностическое значение приобретает рентгенологическое исследование, позволяющее не только установить характер и степень повреждений, но и дать правильное направление рациональным лечебным мероприятиям.
При травматическом повреждении толстой кишки чаще всего преобладают одиночные поперечные разрывы и раздавливания. Нередко повреждения кишки сочетаются с переломами костей и возникают от тяжелой травмы.
Клинически выявляют симптомы острого живота, шока и коллапса. Если имеется разрыв внутрибрюшной части толстой кишки, быстро развивается перитонит, рано наступает тяжелая интоксикация. В случае разрыва вне-брюшинной части возникает клиническая картина флегмоны забрюшинной клетчатки.
Основной рентгенологический симптом разрыва толстой кишки — свободный газ в брюшной полости — встречается в 80 —100 % случаев. Свободная жидкость в брюшной полости появляет
ся в более поздние сроки, обычно при уже развившемся перитоните. Если повреждены забрюшинно расположенные отделы толстой кишки (чаще прямой) , обнаруживается забрюшинная эмфизема в виде мелких пузырьков или полосок газа с последующим развитием флегмоны клетчатки. При образовании гематомы в любом отделе кишки опре
деляются неравномерные сужения из-за ограниченного выбухания разных размеров, выступающие в просвет кишки и являющиеся причиной частичной или полной кишечной непроходимости. Слизистая оболочка в области гематомы гладкая, а проксимальнее и дистальнее ее слизистая напоминает груду тарелок из-за сближения складок.
Раздел
VI
ПЕЧЕНЬ, ЖЕЛЧНЫЕ ПРОТОКИ И ЖЕЛЧНЫЙ ПУЗЫРЬ
Глава 40. РЕНТГЕНОАНАТОМИЯ И ФИЗИОЛОГИЯ
Печень — непарный орган пищеварительного аппарата. Она расположена в брюшной полости под диафрагмой, в правой подреберной, собственно надчревной и частично в левой подреберной областях. Выполняет функции обезвреживания токсических веществ, желчеобразования; участвует в различных видах обмена веществ и кровообращении; осуществляет специфические ферментативные и экскреторные функции.
Масса печени около 1500 г, размеры: поперечный — 24—28 см, переднезадний 18—20 см, вертикальный — 6—8 см. Печень имеет диафрагмальную и висцеральную поверхность, отделенные острым нижним краем. На висцеральной поверхности располагается ряд борозд и ямок, формирующих две сагиттальные борозды. Посередине они соединены поперечным углублением, называемым воротами печени. В углублении находятся следующие ямки и борозды: ямка желчного пузыря — в передней части правой сагиттальной борозды; борозда нижней полой вены — в задней части желчного пузыря; щель круглой связки — в передней части левой сагиттальной борозды, она продолжается на нижний край в виде вырезки круглой связки; венозная связка — в задней части левой сагиттальной борозды. Ворота печени — это глубокая поперечная борозда, расположенная приблизительно в центре висцеральной поверхности. В них про
ходят общий печеночный проток, воротная вена и печеночная артерия, а также нервы и лимфатические сосуды.
Печень делится на две доли — левую и правую. Левая доля значительно меньше правой. На диафрагмальной поверхности она отделена от правой доли серповидной связкой брюшины, идущей от печени к диафрагме; на висцеральной поверхности границей служит левая сагиттальная борозда. Правая доля печени значительно больше левой (4Д всей печени) и благодаря наличию борозд и ямок на ее висцеральной поверхности выделяются также квадратная (впереди) и хвостатая (сзади) доли. На основе внутриорганных разветвлений воротной вены печень подразделяется на доли, секторы и сегменты, не совпадающие с внешним делением на доли. Секторами и сегментами называются участки печени, соответствующие крупным внутриорганным ветвям воротной вены. Воротная вена, войдя в печень, разделяется на две ветви первого порядка — правую и левую. Соответственно областям разветвлений этих ветвей печень делят на правую (часть правой доли без квадратной и хвостовой долей) и левую долю (включающую квадратную и хвостатую доли). Ветви II порядка воротной вены обеспечивают секторы, ветви III порядка — сегменты.
Печень покрыта брюшиной почти со всех сторон, кроме небольшого участка на задней части диафрагмальной по
верхности (оголенное поле), где она срастается с диафрагмой. Переходя с печени на органы, брюшина образует ряд складок (связок). Венечная связка лежит вдоль заднего края печени, у места перехода брюшины на диафрагму; по краям она заканчивается правой и левой треугольными связками. Серповидная связка расположена более или менее сагиттально, делит печень на правую и левую доли, оканчивается свободным краем, в котором заложена круглая связка печени. Последняя идет к пупку и представляет заросшую пупочную вену, окруженную брюшиной. От ворот печени к 12-перстной кишке и к малой кривизне желудка протягиваются печеночно-дуоденальная и печеночно-желудочная связки, составляющие малый сальник. Переход брюшины с печени на почку — это печеночно-почечная связка.
Под брюшиной печени находятся тонкая подсерозная основа и соединительнотканная фиброзная оболочка, которая в области ворот продолжается внутрь печени, где расположена по ходу сосу- t дов, образуя околососудистую фиброзную капсулу. Нежная соединительная ткань делит печень на дольки размером 1—2 мм, состоящие из печеночных клеток. Между дольками проходят междольковые артерии, вены (конечные разветвления воротной вены) и желчные протоки. Кровеносные сосуды внутри дольки образуют радиально идущие капилляры, которые впадают в центральную вену. Последняя, выйдя из дольки, сливается с другими венами и образует систему выносящих вен печени (систему печеночных вен). Внутри дольки между печеночными клетками находятся мельчайшие желчные протоки, которые впадают в междольковые протоки. Последние, соединяясь, образуют систему внутрипеченочных протоков (ходов). Из правой и левой долей печени выходят соответственно правый
и левый печеночные протоки, которые в области ворот соединяются, образуя общий печеночный проток.
Общий печеночный проток имеет длину 1,5—5,5 см и ширину 0,2—0,8 см. От уровня отхождения пузырного протока начинается общий желчный проток, который впадает в 12-перстную кишку. Длина протока 2,5—8 см (в среднем около 5,5 см). Ширина общего желчного протока в норме 0,2—0,8 см (в среднем 0,55 см). Пузырный проток имеет длину 2—6 см, ширину 0,2—0,3 см.
Желчный пузырь — полый тонкостенный орган грушевидной или веретенообразной формы, расположен на нижней (висцеральной) поверхности печени. В желчном пузыре происходят накопление и концентрация желчи, которая впоследствии поступает в общий желчный проток и 12-перстную кишку.
Емкость желчного пузыря колеблется от 30 до 70 мл. Длина его у взрослого человека весьма вариабельна: 5—14 см, ширина 2—5 см. В желчном пузыре различают дно, тело и шейку, которая переходит в пузырный проток. Шейка желчного пузыря имеет длину 1 — 1,5 см, ширину 0,6—0,8 см. Она образует изгиб, прилегая к левой или правой стенке тела желчного пузыря.
Стенка желчного пузыря состоит из слизистой оболочки, подслизистой основы, мышечной и серозной оболочек. На слизистой оболочке пузыря определяются складки, в области шейки и пузырного протока имеется спиральная складка, регулирующая поступление и выделение желчи. Желчный пузырь покрыт брюшиной с трех сторон, лежит мезоперитонеально, не имеет серозного покрова на поверхности, обращенной к печени. Дно пузыря покрыто брюшиной полностью.
В желчном пузыре перед переходом в пузырный проток имеется своеобразное выпячивание в виде кармана (кар
ман Гартманна). Этот карман играет определенную роль в клиническом проявлении кальку лезного холецистита, обусловливая так называемый симпто-мокомплекс: «вентильный камень», «острый обтурационный холецистит». Карман Гартманна находится ниже, чем вся остальная полость желчного пузыря. Поэтому при остром приступе или развитии механической желтухи, когда конкремент ущемляется в шейке или протоке желчного пузыря, последний растягивается. Ущемившийся камень отходит назад и выпадает в карман Гартманна. Приступ купируется. Этому явлению способствуют спазмолитики, вводимые в процессе лечения.
В самом пузырном протоке тоже есть свои особенности. Так, складки слизистой оболочки расположены выпуклостью по току желчи, поэтому обратный ток ее затруднен. Дистальный клапан называется спиралевидным или сфинктером Гейстера. На границе желчного пузыря, его шейки и начала пузырного протока под давлением конкремента на слизистую шейки пузыря может образоваться другой клапан. Этот клапан назван по имени его открывателя Люткенса. Он также препятствует обратному току желчи. Следовательно, весь пузырный проток является своеобразным клапанным аппаратом желчного пузыря. В средней части общего печеночного протока имеется сфинктер Мирицци, который предотвращает ретроградный заброс желчи во внутрипе-ченочные ходы.
Таким образом, все желчевыводящие протоки, как и желчный пузырь, кор-
Глава 41. АНОМАЛИИ
Аномалии и пороки развития печени, желчных протоков и желчного пузыря встречаются довольно часто. Ведущими методами диагностики аномалий и пороков развития являются лучевые. Они
ригируются сфинктерами таким образом, что желчь не имеет обратного тока. Эти сфинктеры обеспечивают продвижение желчи в направлении 12-перстной кишки. Важная роль в этом принадлежит и дистальному сфинктеру общего желчного протока, или холедоха (сфинктер Одди).
Функция желчного пузыря заключается в депонировании и повышении концентрации желчи, чтобы в нужный момент произвести выброс ее в 12-перст-ную кишку. Такая сложная координация доставки желчи в просвет кишки осуществляется системой сфинктеров. В состоянии покоя сфинктер Одди закрыт. В этот момент желчный пузырь и его проток расслаблены. Желчь, постоянно вырабатываемая печенью, поступает в желчный пузырь. Слизистой всасываются вода, хлориды, и желчь становится более густой, за счет выделения слизи она находится в коллоидном состоянии. Градиент давления в состоянии покоя в просвете желчных протоков и пузыря составляет соответственно 200 и 100 мм вод. ст. Разница этого градиента и является той движущей силой, которая при замкнутом сфинктере Одди направляет желчь в пузырь.
Рефлекторное опорожнение пузыря в момент поступления пищи в 12-перстную кишку происходит при давлении в нем 250—300 мм вод. ст. В этот момент расслабляется сфинктер Одди. Давление в пузыре снижается до 100 мм вод. ст., что совпадает с его ритмичными сокращениями. Длительность каждой схватки 1—2 ч.
И ПОРОКИ РАЗВИТИЯ
позволяют прижизненно обнаружить неправильность развития печени, желчных протоков, сосудов, изучить их функцию и этим самым определить клиническое значение аномалии.
Пороки развития печени. Различают аномалии положения, формы и смешанные аномалии. К аномалиям положения могут быть отнесены очень редкие случаи расположения печени в левом подреберье при обычном положении остальных органов брюшной полости. Аномалии формы проявляются в изменении размеров различных отделов печени и глубины борозд, встречаются довольно часто и не влияют на функцию органа.
Недоразвитие печени отмечают у 25 % детей с врожденными пороками и ранним постнатальным тромбозом воротной вены. К аномалиям формы относятся гипоплазия левой доли и увеличение квадратной доли печени. Иногда встречается врожденная гипоплазия печени, при которой масса ее у взрослого человека не превышает 1 % от массы тела (в норме 2 — 3%). Описаны случаи врожденной гепатомегалии, при которой не находят никаких патологических изменений, кроме увеличения печени.
Своеобразной аномалией формы печени является так называемая доля Риделя, впервые описанная в 1888 г. Б. Риделем. Эта доля имеет форму языка, исходящего из края правой (квадратной) или редко левой доли печени и образованного нормальной печеночной тканью. Долю Риделя обычно обнаруживают случайно, так как она не вызывает каких-либо болезненных ощущений и не сопровождается изменениями лабораторных показателей. Однако у 1 /з больных эта аномалия сочетается с холециститом и имеет тенденцию к самостоятельному исчезновению после холецистэктомии.
Относительно часто встречаются Добавочные доли печени, имеющие различные размеры и обычно расположенные рядом с печенью. В отличие от эктопии печеночной ткани в другие органы добавочные доли печени соединены с нею сосудисто-секреторной или тканевой нож
кой. Иногда добавочная доля печени располагается супрадиафрагмально и соединяется с печенью ножкой, содержащей артерию, вену, желчный проток и проходящей через отверстие в диафрагме (Линденбратен, 1980).
К аномалиям развития печени относят атрезию внутрипеченочных желчных протоков, частота которой составляет в среднем 1 случай на 20—30 тыс. родов. Сущность патологических изменений заключается не во врожденном отсутствии (агенезии) желчных протоков, а в нарушении их проходимости вследствие облитерации или недоразвития.
Пороки развития желчных протоков и желчного пузыря. Аномалии желчных протоков бывают в виде аплазии, атрезии или стеноза. Клинически непроходимость желчных протоков проявляется желтухой, которая у половины детей возникает на 3—6-й день жизни, но может обнаруживаться и значительно позже (на 2-м месяце жизни). При холеграфии контрастное вещество не выделяется печенью в кишечник.
Возможно врожденное расширение общего желчного протока, которое связано с окклюзией в области большого желчного протока. Различают сегментарное и тотальное расширение. В последнем случае весь общий желчный проток образует кисту, которая может достигать гигантских размеров. Клинически проявляется желтухой и приступообразными болями в животе.
Рентгеносемиотика зависит от величины и положения кисты, состояния желчного пузыря и проходимости желчных протоков. Иногда уже на обзорном снимке можно обнаружить тень образования в верхнем правом отделе живота, которая имеет округлую или овальную форму и вверху сливается с контуром печени. Определение размеров и положения кисты облегчается при обызвествлении ее стенок. Но это на-
169. Варианты желчного пузыря:
а, б, в — двойного; г, д — разделенного.
блюдается редко. Холеграфия во многих случаях обеспечивает прямое изображение кисты и делает диагноз очевидным. Контрастированный желчный пузырь часто смещается кистой кпереди и в сторону и деформируется ею. При болезни Кароли желчные протоки расширены, имеют округлую, цилиндрическую или грушевидную форму. В просвете внутрипеченочных протоков выявляются конкременты.
Гипоплазия желчных протоков — порок, при котором желчные протоки резко сужены и не обеспечивают эвакуацию желчи. Клинически такая гипоплазия проявляется ахоличным стулом. С 5—6-го месяца интенсивность желтухи уменьшается, появляется окрашенный стул. Однако вследствие застоя желчи может развиваться и прогрессировать билиарный цирроз печени. Рентгенологически при контрастировании
обнаруживают тонкие, с узким просветом желчные протоки.
К аномалиям желчного пузыря относятся аномалии его числа, положения, величины, формы и строения. Самый частый вариант порока — аномалия формы желчного пузыря в виде перегибов и перетяжек. Перегибы бывают одиночными и множественными. Чаще наблюдается одиночный перегиб на границе тела и дна желчного пузыря. Во многих случаях на границе его с воронкой можно видеть циркулярные складки на внутренней поверхности. Высота складки редко превышает 0,2—0,4 см. На холецистограммах она обусловливает выемку на контуре тени пузыря или узкое просветление в нем.
Удвоение желчного пузыря встречается редко. Один из двух желчных пузырей располагается в типичном месте, другой может быть смещен в борозду
круглой связки, в паренхиму печени, в стенку желудка и другое место. Пузырные протоки при удвоении желчного пузыря сливаются в один или идут раздельно. Неполное удвоение желчного пузыря проявляется образованием продольной перегородки в его просвете.
К редким аномалиям относятся и дивертикулы желчного пузыря. При контрастировании они имеют вид дополнительной тени овоидной фо.рмы с четкими ровными контурами, обычно расположенной в области дна пузыря. Во время
сокращения пузыря объем дивертикула может длительное время меняться.
Дистопии желчного пузыря бывают в 3 % случаев. При них желчный пузырь может располагаться в области левой доли, круглой связки, задней поверхности печени и др. К аномалиям развития относится и блуждающий желчный пузырь. Причина — недостаточность фиксации к печени, когда он лежит вне ее, со всех сторон покрыт брюшиной и имеет брыжейку, что может обусловливать его заворот.
Г л а в а 42. ФУНКЦИОНАЛЬНЫЕ И ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ
Нарушение функции и воспаление печени, желчных путей и желчного пузыря тесно связаны между собой. Поэтому функциональные и воспалительные заболевания этих органов целесообразно рассматривать вместе.
Дискинезия желчных путей. Проявляется нарушениями отведения желчи из печени и желчного пузыря в 12-пер-стную кишку. Различают первичные и вторичные дискинезии. К первичным дискинезиям относятся заболевания, в основе которых лежат функциональные нарушения желчевыделительной системы на почве расстройства нейрогумо-ральных регуляторных механизмов. Вторичные дискинезии возникают рефлекторно при различных заболеваниях органов брюшной полости. Они могут иметь место при общем неврозе, диэнцефальном вегетативном кризе, после перенесенного вирусного гепатита и других инфекций и интоксикаций.
Клинические проявления весьма многообразны: появление болей в правом подреберье ноющего, колющего или схваткообразного характера с типичной иррадиацией в правую лопатку, плечо, ключицу или без иррадиации. Больные с атонией желчного пузыря страдают тупыми болями в правом подреберье, снижением аппетита, артериальной ги
потензией, плохо переносят жирную пищу.
Рентгенологическая картина: различают гипер- и гипотоническую дискинезию. Гипертоническая дискинезия характеризуется повышением тонуса желчного пузыря и желчных протоков. Желчный пузырь опорожняется неритмично и неравномерно. Может резко сократиться, выбросив всю контрастированную желчь. Иногда он интенсивно сокращается, а затем длительное время находится в состоянии гипертонуса и не опорожняется. Размеры желчного пузыря при этом небольшие — ЗХ 5, 4X6 см. Опорожнение ускорено. Объем пузыря после приема желчегонного через 5—15 мин уменьшается на 75±9 %, через 1,5 — 2 ч — на 92±8 %.
При затруднении оттока желчи развивается желчная гипертензия: давление в магистральных протоках достигает 700—800 мм вод. ст. Причинами желчной гипертензии чаще всего служат камни в желчном протоке, нарушение проходимости большого сосочка 12-перстной кишки (папиллит, стеноз). В последнем случае с помощью холеграфии обнаруживают замедленный переход контрастированной желчи в 12-перстную кишку и расширение общего желчного протока. Терминальный
170. Гипертоническая дискинезия желчного пу-зы ря:
а — исходная холецистограмма; б — холецистограм-ма через 15 мин после приема двух желтков.
его отдел, наоборот, сужен. К косвенным признакам относятся: расширение внепеченочных желчных протоков, постоянный рефлюкс контрастного вещества во внутрипеченочные протоки, заброс его в панкреатический проток. Камни в большом сосочке 12-перстной кишки обусловливают на холангиограм-мах дефекты наполнения в тени контрастного вещества. Полная закупорка общего желчного протока обычно наблюдается при раке головки ПЖ или самого желчного протока.
Гипотоническая дискинезия характеризуется снижением тонуса и двигательной активности желчного пузыря и желчных протоков. Проявляется мышечной слабостью стенок пузыря, большими размерами (8X10X5 см), а следовательно, и большим объемом его. Опорожнение замедлено, начинается через 10 — 15 мин после приема желчегонного. За первые 15 мин объем желчного пузыря уменьшается на 20 — 30 %. Пузырь приобретает округлую форму, в течение 3—4 ч в нем остает
ся 70—80 % контрастированной желчи. Затем пузырь медленно расслабляется. В таком желчном пузыре развиваются застойные явления, воспалительный процесс.
При рентгенологическом исследовании застойный желчный пузырь без применения искусственного контрастирования характеризуется неинтенсивным изображением. Размеры желчного пузыря увеличены, объем желчи составляет до 200 см3 и более, двигательная функция его нарушена. Увеличенный желчный пузырь может вызывать деформацию близко расположенной 12-перстной кишки.
Сравнив эти две формы дискинезии желчного пузыря и протоков, можно отметить их общие особенности — нарушение опорожнения пузыря и создание благоприятных условий для камнеобра-зования как в желчном пузыре, так и в желчных протоках.
Нарушения концентрационной функции желчного пузыря, или дисхолии. Наблюдаются в основном при холециститах, а выявляются, как правило, с помощью внутривенной холангиохоле-цистографии. Усиление концентрационной функции характеризуется более ранним, чем в норме, появлением краевых теневых полосок и контрастированной желчи на дне пузыря, более быстрым темпом накапливания контрастной желчи на дне и уменьшением количества неконтрастированной желчи.
Ослабление концентрационной функции имеет 4 степени: I — все фазы наполнения желчного пузыря сохранены, однако в более поздние сроки, чем в норме, появляются краевые теневые полоски и контрастированная желчь на дне, характерна нечеткость слоистости, II — отсутствуют краевые теневые полоски и феномен трехслойности, гомогенизация тени пузыря происходит постепенно за счет усиления интенсив-
171. Гипотоническая дискинезия желчного пузыря:
а — исходная холецистограмма; б — холецистограмма через 45 мин; в — через 90 мин после приема двух желтков.
ности его дистальной половины; III — однородная тень пузыря появляется сразу после введения контрастного вещества, что объясняется одинаковой плотностью печеночной и пузырной желчи; IV — контрастированная желчь быстро опускается на дно пузыря, его наполнение происходит снизу вверх.
Исследовать нарушение концентрационной функции желчного пузыря можно и с помощью количественного анализа. Динамика объемов слоев желчи в пузыре выражается в процентах к общему объему пузыря (100%).
Холангит. Это катаральное или гнойное воспаление внепеченочных и внут-рипеченочных желчных протоков. Наиболее частая форма поражения желчных ходов — хронический холангит. Он может быть диффузным и локализованным. Диффузный стенозирующий холангит развивается вследствие врожденной атрезии внутри- и внепеченочных желчных ходов. Протекает с механической желтухой, перивисцеритом,
билиарным циррозом печени. Значительно чаще встречаются локализованные стенозирующие холангиты на почве сужения конечной части общего желчного протока в области фатерова соска, общего желчного и печеночного протоков.
Острый холангит начинается с озноба и высокого подъема температуры, нередко рвоты. Больной жалуется на чувство распирания в животе и боли в правом подреберье, тошноту. Боли усиливаются при движении, пальпации, поколачивании в этой области. Иррадиируют в спину, правую лопатку, правую половину грудной клетки, нередко в левую половину ее, в область сердца и вызывают приступ стенокардии. Иктеричность склер появляется на 2-е — 3-и сутки, обычно быстро прогрессирует. При физикальном исследовании больного выявляется слегка увеличенная печень, болезненная при пальпации и поколачивании по реберной дуге. Размеры печени, как правило, быстро увеличи-
172. Ослабление концентрационной способности желчного пузыря.
ваются. На 3—4-й день она может выступать на 4—6 см ниже реберной дуги. Поверхность ее гладкая, край ровный, острый. Консистенция постепенно уплотняется, но плотность умеренная. Болезненность определяется в области желчного пузыря, холедохопанкреатической зоны.
На холеграммах обнаруживают неравномерное расширение желчных протоков и неровность их очертаний, затруднение перехода контрастного вещества в 12-перстную кишку, не устраняемое спазмолитическими препаратами. При склерозирующем холангите выявляют полную или частичную непроходимость желчных протоков или их локальные стенозы. Стриктуры, как правило, кольцевидные. Они часто чередуются, образуя характерный волнистый контур. Протяженность стриктур 1—2 см, реже наблюдаются стриктуры иной протяженности.
При УЗИ изучается состояние желчных протоков (их диаметр, наличие конкрементов, лимфаденопатии в области ворот печени). Обнаруживаются рас
ширенные внутрипеченочные желчные ходы с наличием периваскулярных инфильтратов.
Холецистит. Воспаление желчного пузыря. Выделяют холециститы острые (легкие, средней тяжести, тяжелые) и хронические (неосложненные и осложненные — холецистохолангит, холецис-топанкреатит; по форме — холециститы калькулезные, бактериальные и диски-нетические).
Острый холецистит начинается остро. Повышается температура, иногда возникают озноб, тошнота, рвота. Типичны сильные боли в правом подреберье. Общее состояние больных значительно ухудшается. Тошноты и рвоты повторяются. Температура тела около 38— 40°. Сохраняются ознобы. Температурная кривая приобретает гектический или ремиттирующий характер. Дыхание учащено, часто поверхностное. Желтуха отсутствует. Интенсивная желтуха развивается в том случае, если общий желчный проток закрывается желчным камнем. При обследовании больного обращается внимание на ограниченное участие живота в дыхании. Брюшная стенка в правом верхнем квадранте напряжена. Сильная болезненность определяется в зоне желчного пузыря (симптом Кера). Положителен симптом Мерфи — больной не может вдохнуть глубоко, если пальцы обследующего погружены в правое подреберье ниже края печени. Возникает болезненность при поколачивании по реберной дуге (симптом Ортнера). У тяжелых больных обнаруживается положительный симптом Щеткина — Блюмберга, что свидетельствует о раздражении брюшины. Желчный пузырь не пальпируется из-за напряжения мышц у большинства больных.
Хронический холецистит может быть продолжением острого холецистита, но чаще развивается постепенно, начинается незаметно. Появляются тупые, ною
щие боли в правом подреберье, в спине, под правой лопаткой. Они усиливаются через 1 — 3 ч после еды. У некоторых больных возникают поносы, усиливающиеся после жирной пищи. При обследовании, как и при остром холецистите, обнаруживают боли в зоне желчного пузыря, положительный симптом Мерфи, у некоторых больных — положительный симптом Орт-нера. Печень увеличена при наличии холангита. Температура тела нормальная или временами повышена до 38°. В крови нейтрофильный лейкоцитоз. СОЭ увеличена.
Диагноз устанавливается на основе клинических данных. Дополнительное значение имеют исследования дуоденального содержимого. В пузырной порции желчи обнаруживается увеличенное количество слизи, лейкоцитов, эпителиальных клеток, находятся кристаллы холестерина, соли билирубина кальция. У 60 — 70 % больных холециститом зти изменения выявляются в печеночной желчи. В 10—15 % случаев пузырную желчь получить не удается из-за дискинезии желчного пузыря или сфинктера Люткенса. У 5—8 % больных не удается получить пузырную и печеночную желчь из-за спазма общего желчного протока и сфинктера Одди. При дискинетической форме заболевания эти признаки встречаются чаще. Они отражают наклонность желчных путей к дискинетическим реакциям. Рентгенологическое исследование имеет вспомогательное значение. Если правильность диагноза вызывает сомнение, показана холецистография. Она позволяет изучить размеры и форму желчного пузыря, проходимость протоков, быстроту опорожнения пузыря после применения холецистокинетических средств. При холецистите желчный пузырь может быть увеличенным, деформированным вследствие спаек (изогнутым, с перетяжками, фиксированным).
Опорожнение его бывает замедленным или ускоренным.
Наиболее достоверным методом исследования является внутривенная хо-'лангиохолецистография. При воспалении слизистой оболочки желчного пузыря нарушаются основные процессы, ведущие к возникновению признаков «слоистости», «узкой краевой полоски» и «трехслойности». Двигательная функция желчного пузыря изменяется и характеризуется большим объемом «остаточной желчи» (35 — 55 % первоначальной величины). В результате застоя желчи объем желчного пузыря увеличивается, а интенсивность тени уменьшается. Может наблюдаться утолщение стенок пузыря (до 1 см) с развитием фиброзных изменений. Длительно текущий хронический воспалительный процесс в ряде случаев ведет к склеротическому сморщиванию, уменьшению и деформации желчного пузыря. На обзорном снимке могут быть выявлены конкременты или, не очень часто, отложение извести в виде глыбок в склерозированной стенке желчного пузыря. Иногда обызвествляется сплошь весь пузырь вместе со своим содержимым («каменный желчный пузырь»).
УЗИ дает возможность не только изучить форму желчного пузыря на «разрезах» в различных направлениях, выявить в нем конкременты, но и измерить площадь его разреза, толщину стенки, установить наличие в ней эхоконтрастных образований (чаще это плотные липоидные образования или известковые соединения). Разработаны также методы исследования функции с помощью тестов с желчегонными средствами (например, с хологоном). Основные ультразвуковые признаки холецистита: изменения формы желчного пузыря, толщины стенок, наличие в них эхоконтрастных включений, нарушение опорожнения. и реакция регионарных лимфатических узлов. Признаками острого
173. Острый холецистит:
а — на эхосканограмме; б — на компьютерной томограмме.
холецистита при УЗИ считают толщину стенки желчного пузыря, превышающую 3 мм, наличие металлоотражающих зон в его стенке, обусловленных отеком, увеличение диаметра желчного пузыря более чем до 50 мм. Эхографическое исследование позволяет выявить признаки холецистита у 65 % больных (Kurol, Forsberg, 1984).
Если воспалительный процесс переходит на брюшину, покрывающую нижнезаднюю и боковые поверхности желчного пузыря, то развивается перихолецистит. Рентгенодиагностика заболевания основывается на характеристике положения, формы, величины и двигательной активности пузыря. Если процесс спаечный, изменяется форма и нарушается подвижность желчного пузыря. При спайках желчного пузыря с печенью его дно подтягивается вверх и кнаружи, с 12-перстной кишкой — влево, с толстой кишкой — вниз. Спайки вызывают разнообразные деформации желчного пузыря и неровность контуров. В случае перихолецистита приобретенная деформация желчного пузыря изменяется по мере сокращения и натяжения его спайками, а при вариантах формы контуры пузыря ровные, чет
кие, с плавными переходами, подвил-ность'не нарушена. Спайки обусловлг-вают неровность контуров, обычно : остроконечными выступами, и огранг чивают подвижность пузыря. Эвакуации желчи из него замедлена. При перих<-лецистите примыкающие отделы кь шечника могут быть деформированы что отчетливо определяется во время сочетанного одновременного их исследо вания; положение пузыря в случае пе ремены положения тела исследуемоп не изменяется и наблюдается ограничение его пассивной смещаемости и дг.
Гепатит. В зависимости от распре страненности процесса может быть очг-говым и диффузным, а в зависимости от длительности течения — острым г хроническим.
Заболевание начинается остро и чаше протекает тяжело. Больные предъяг ляют жалобы на слабость, потерю аппетита, тошноту, боли в животе, нередко интенсивные. Печень увеличена г болезненна. Имеются повышение температуры тела и умеренная желтухе.
В острой стадии гепатит рентгенологически проявляется увеличением г повышением интенсивности тени пг-чени. Контуры ее четкие, гладкие, роь-
ные. Вследствие снижения функциональной активности печени при холе-цистохолангиографии наблюдается слабое контрастирование желчного пузыря. Иногда изображение его тени вообще отсутствует. В стадии уменьшения печени обычный рентгенологический метод исследования малоэффективен из-за нарастающего асцита. Если проводится пункция живота и удаление экссудата, то рекомендуется взамен откачиваемой жидкости вводить газ. И тогда на фоне его очень хорошо видна печень, можно точно установить — увеличен или уменьшен этот орган. При КТ печени обнаруживают, что КА= 38,14+ +5,58 ед. Н.
Сифилис печени. Специфическое гуммозное поражение печени, выражающееся в очаговой или распространенной форме. При очаговой форме гуммы развиваются преимущественно под капсулой и проявляются бугристостью печени. Милиарный гуммозный сифилис печени характеризуется ее равномерным поражением и уплотнением. В результате рубцевания сифилитической грануляционной ткани печень иногда резко деформируется («дольчатая печень»).
Клинически сифилис может протекать бессимптомно, но иногда отмечаются локальные боли, повышение температуры тела. При рентгенологическом исследовании чаще определяются малые размеры пораженной доли или всей печени. Большими диагностическими возможностями обладает пневмоперито-неум, в условиях которого отчетливо обнаруживают дольчатость одной из долей печени и увеличение другой доли.
Туберкулез печени. При туберкулезном поражении печени имеет место развитие специфических гранулем, которые могут сливаться и образовывать крупные инфильтраты и гранулемы.
Клиническая картина: милиарный туберкулез нередко проявляется гепато
мегалией, желтухой, спленомегалией. При туберкулезном холангите отмечаются желтуха, боли в правом подреберье.
Рентгенодиагностика', на обзорных снимках обнаруживают очаги обызвествления печени. При распаде инфильтрата в печени возникают полости. Каверны могут наблюдаться и при туберкулезном холангите. Для их выявления используется, как правило, ретроградная холангиография или контрастирование общего желчного протока во время операции.
Абсцесс печени. Это гнойник печени, представляющий собой полость, которая заполнена гноем и отграничена от окружающих тканей пиогенной мембраной. Развиваясь в ткани печени как следствие ее гнойного воспаления, абсцесс является чаще всего результатом холангита. Формируются гнойники главным образом в правой доле печени, под ее капсулой и верхним полюсом, чему способствуют анатомическое строение воротной вены и присасывающее действие диафрагмы.
Абсцессы печени чаще единичные и небольшие, реже множественные. Наблюдаются преимущественно у больных старше 50 лет и крайне редко у детей. Они бывают газосодержащие и без-газовые, последние встречаются чаще.
Основные клинические проявления — симптомы гнойной инфекции: лихорадка неправильного типа, ознобы, потливость, признаки интоксикации и поражения печени (гепатомегалия, болезненность в правом подреберье, болезненность печени при пальпации, у части больных выраженные признаки перигепатита). У некоторых больных печень бугристая. Если абсцесс располагается близко к поверхности органа, обнаруживается зона размягчения и пальпируется флюктуация гноя. При исследовании крови выявляются легкая анемия, нередко лейкоцитоз с нейтро
фильным сдвигом и токсическая зернистость нейтрофилов. Иногда имеет место умеренная гипербилирубинемия с увеличенным содержанием в крови прямой фракции билирубина. Активность трансаминаз и других внутриклеточных ферментов в крови не изменена. Если возникает холестаз в связи с нарушением проходимости печеночного или общего желчного протока, повышается уровень щелочной фосфатозы в крови. В таком случае бывает интенсивная желтуха.
Непаразитарные абсцессы печени вызываются часто кишечной или смешанной микрофлорой (кишечная палочка, другие микроорганизмы кишечной группы). Начало заболевания нередко постепенное. Первые признаки — боли в правом подреберье, лихорадка. Затем присоединяются ознобы, поты. Печень увеличивается, болезненна. В случае трудности в диагностике следует прибегать к изотопному и УЗ-исследованию. Глубоко расположенные абсцессы лучше выявляются УЗИ.
Посттравматические абсцессы могут развиваться сразу вслед за травмой. Известны случаи, когда признаки нагноения появлялись через 1—2 мес. после травмы.
В рентгенодиагностике чаще применяется рентгенография печени. Рентгенограммы должны быть выполнены в вертикальном положении больного при повышенном напряжении на трубке. Можно применять и латерографию в положении больного на левом боку. Прямым признаком абсцесса следует считать изображение его-на рентгенограмме, косвенные — увеличение печени, изменения диафрагмы, легких и плевры. При выявлении полости, содержащей жидкость и газ, диагноз внут-рипеченочного абсцесса ясен. Внутренний контур полости, расположенной внутри печени, обычно неровный, волнистый, что отличает его от поддиа
фрагмальных гнойников; верхний контур полости обычно представлен крутой линией в правой доле печени, ближе к ее верхней выпуклой поверхности.
Наиболее постоянный и важный признак безгазовых гнойников — увеличение тени печени или отдельных ее долей. Увеличение левой доли печени может быть также выявлено во время исследования желудка с бариевой взвесью, при этом отмечается смещение кардиальной части тела и желудка кзади и влево, антрального отдела желудка книзу. Чем больше размеры абсцесса и чем ближе он располагается к диафрагме, тем больше выражены нарушения печени. Распространение воспалительного процесса на диафрагму вызывает развитие острого диафрагматита. Ангиография печени выявляет смещение и дугообразную деформацию внутрипече-ночных артериальных ветвей с образованием характерной бессосудистой зоны и наличием избыточного кровоснабжения по периферии этого участка. В паренхиматозной фазе имеют место дефекты контрастирования, соответствующие бессосудистым участкам.
Большими диагностическими возможностями обладает КТ. Абсцессы обычно имеют вид участков просветления на фоне паренхимы печени. Размеры их варьируют от 1 до 12 см. Форма абсцессов округлая или неправильная (большие размеры). Контуры нечеткие, бугристые. При нагноившейся паразитарной кисте контуры будут четкие и ровные, здесь же имеется капсула толщиной около 6 мм. Наличие вокруг абсцесса зоны снижения плотности свидетельствует о воспалении. При слоистом строении гнойника с некрозом в центре отмечается равномерное снижение КА от периферии к центру. Причем плотность зоны гнойного воспаления в различных участках может колебаться от 0—10 до 25 — 30 ед. и в более широком интервале с разбросом КА свыше 20 ед.
174. КТ-картина острого абсцесса печени (варианты а, б).
Данный критерий особенно важен при отсутствии четкой визуализации полости абсцесса (Вилявин, 1987).
При внутривенном контрастировании с целью «усиления» вокруг гнойника определяется гиперконтрастное кольцо, особенно хорошо выраженное при амебных абсцессах. Это кольцо обусловлено грануляционной тканью, окружающей абсцесс. Динамическое КТ-исследова-ние позволяет врачу наблюдать за формированием абсцесса. Так, первоначально, когда еще нет некроза ткани и собственно абсцедирования, на томограммах в печени выявляется лишь зона пониженной плотности (30—40 ед. Н), которая контрастируется при внутри
венном усилении. В последующем при развитии некроза и расплавления печеночной ткани внутривенное усиление выявляет уже аваскулярный, неконтрастирующий участок. При увеличении зоны расплавления, сопровождающейся резорбцией омертвевших тканей, отмечается прогрессирующее понижение плотности патологического образования.
Таким образом, основными признаками абсцессов печени при КТ-исследовании являются выраженная плотностная гетерогенность до 20 ед. и более, нечеткость контуров, иногда бугристость и снижение КА печени до 35 — 40 ед. (при норме 50—70 ед.).
Глава 43. ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ
Желчнокаменная болезнь относится к весьма распространенным заболеваниям у лиц старше 40 лет. Заболевание связано с образованием конкрементов в желчных протоках и желчном пузыре, которые, часто мигрируя по желчным протокам, вызывают обтурацию пузырного, печеночных или общего желчного протоков, пролежни или воспаление желчного пузыря и желчных протоков, холестаз и поражение печени типа реактивного холангиогенного гепатита и билиарного цирроза печени.
Клиническая картина весьма разнообразна и во многом зависит от величины и положения камней в желчевыделительной системе, наличия воспалительных процессов, осложнений. Наиболее частый симптом — резчайшая боль. Обычно ее связывают с прохождением камня или острым воспалительным процессом. Появляется внезапно, чаще после погрешности в еде или стрессовой ситуации. Имеет характер нарастающего спазма или невыносимого, мучительного распирания в верхних отделах
живота, спины, грудном или поясничном отделе позвоночника, но может иметь и менее определенную локализацию. Как правило, иррадиирует в область сердца, имитируя картину острого инфаркта миокарда, в правую половину грудной полости, область правой лопатки. Во время болевого приступа больной «съеживается», «скорчивается», ищет облегчающее положение, но не находит его. Приступ желчной колики может сопровождаться рвотой, которая не приносит облегчения, нередко высокой температурой, особенно при флегмонозном холецистите, нарушением глубины, ритма дыхания, сердечно-сосудистой деятельности. Живот чаще вздут и напряжен, резко болезнен при пальпации в верхней части, особенно в области правого подреберья. В тяжелых случаях определяется ограниченная «зона перкуторной болезненности», которая при ухудшении состояния больного заметно расширяется.
Иногда желчная колика сопровождается рвотой, кратковременной желтухой, потемнением мочи, обесцвечиваем кала. Наиболее тяжелые формы болезни приводят к возникновению механической желтухи. Во время обострения характерна триада Вийяра, которая включает печеночную колику, лихорадку и желтуху.
Рентгенологически обнаружить желчные камни иногда трудно из-за смешанного их состава. Белковая основа (холестерин) — главная составная часть (центр) большинства желчных камней. Значительно реже встречаются билирубиновые и пигментно-известковые камни. На рентгенограммах смешанные холестерино-пигментно-известковые камни дают темные тени в виде овальных пятен, колец или полукруглых скоплений, напоминающих гроздья винограда. Холестериновые камни могут быть изредка обнаружены по просветлению, которое они дают, так как
задерживают рентгеновы лучи слабее, нежели мягкие ткани.
Выявить желчные камни помогает холеграфия. В тени желчного пузыря, заполненного контрастным веществом, замечаются дефекты наполнения. Единичные камни в большинстве случаев имеют округлые очертания; множественные бывают фестончатой формы, иногда округлой. Если камни занимают весь объем желчного пузыря, то контрастное вещество, попавшее в него, заполняя промежутки между камнями, дает неравномерную ячеистую тень. Мелкие конкременты, располагаясь в области дна, могут давать дефект наполнения, подобный симптому полулуния. Часто камни становятся видимыми после того, как произойдет опорожнение желчного пузыря от контрастного вещества. В таких случаях еще остается контрастная смесь, имби-бирующая поверхность камней, вследствие чего могут быть видимы камни в виде кольцевых контуров. Иногда обнаруживаются так называемые плавающие камни, т. е. перемещающиеся в желчном пузыре. При расположении камней в желчных протоках наблюдается прерывистость и расширение их проксимальных отделов.
Наиболее просты для диагностики множественные конкременты внутрипе-ченочных желчных протоков. Они вызывают многочисленные мелкие округлые дефекты наполнения. Вместе с тем у всех больных, как правило, имеется стриктура общего печеночного протока с престенотическим расширением внут-рипеченочпых желчных протоков, выполненных конкрементами. Как при внутрипеченочном, так и при внепеченочном протоковом холелитиазе также всегда наблюдаются локальные сужения желчных путей, выше которых отмечается дилатация протока, содержащего один или много камней. Этот факт дает право утверждать, что камни про
токов, тем более изолированные, являются вторичными по отношению к сужению.
В результате ущемления конкремента в пузырном протоке, переполнении пузыря конкрементами и других причин бывает отключенный желчный пузырь. Он выявляется при холеграфии через 4 и 24 ч после внутривенного введения контрастного вещества по интенсивности и срокам контрастирования.
Если имеются несмещаемые пристеночно расположенные конкременты, вызывающие дефекты наполнения, то их трудно отличить от полиповидного рака желчного протока и от метастазов в лимфатические узлы по ходу общего желчного протока. Что касается метастатического поражения лимфатических узлов по ходу общего желчного протока, то в случае неполного блока обычно отмечается множество дефектов наполнения, напоминающих полиповидный рак, но расположены они с обеих сторон, деформируя весь проток.
Описанный в литературе симптом «пасти змеи» или «вогнутой линзы» при так называемом «вколоченном» камне — скорее результат спешки во время прямого контрастирования желчных путей, чем отражение полного препятствия. У всех больных осторожный массаж области препятствия и перемена положения способствуют постепенному переходу контрастного вещества ниже камня, и тогда создается дефект наполнения (симптом «раковой клешни»), окруженный контрастным веществом. Это указывает на сохраненную эластичность и большие резервы стенок протока при холедохолитиазе. И только когда симптом «пасти змеи» или «вогнутой линзы» не удается перевести в симптом «раковой клешни», следует думать об экзофитной опухоли протока, полностью обтурирующей его просвет (Халиков, 1989).
Определенные трудности возникают
при идентификации симптома переходящего одиночного округлого дефекта наполнения в общем желчном протоке на уровне устья пузырного протока или ниже его. Обнаружение на холапгио-граммах такого дефекта сразу наводит на мысль о конкременте. Как показывает опыт, подобный дефект обычно возникает при дистальном блоке с выраженной билиарной гипертензией и расширением общего желчного протока; появляется он в начале введения контрастного вещества, по после поворота больного и дополнительного контрастирования исчезает.
Таким образом, дефект наполнения в , желчных путях может быть обусловлен различными причинами, чаще всего камнями, рентгенодиагностика которых несложна. С наибольшими трудностями сопряжена дифференциальная диагностика несмещаемого одиночного конкремента с полиповидным маленьким раком желчного протока и метастазами в лимфатические узлы по ходу общего желчного протока при сохраненной проходимости последнего. Во всех этих случаях дефект наполнения расположен пристеночно, и для правильной интерпретации его следует учитывать такие дифференциально-диагностические признаки, как степень окантован-ности контрастным веществом, наличие участка сужения ниже дефекта, локальную болезненность и инфицированность желчи. Стойкий симптом «пасти змеи» («вогнутой линзы») свидетельствует о полном блоке протока экзофитной опухолью.
Конкременты желчного пузыря следует отличать от полипозной формы холестероза. В последнем случае на хо-лецистограммах обнаруживают хорошо очерченные дефекты наполнения в тени желчного пузыря, которые неравномерно распределены в теле и шейке его и имеют пристеночную локализацию, не смещаются при изменении положения
тела больного, этим отличается от камней желчного пузыря. Размеры «полипов» небольшие — до 0,7 см. Если диаметр дефекта превышает 1 см, следует думать об опухоли.
По данным УЗИ, типичный конкремент желчного пузыря проявляется внутрипросветным сигналом резличной величины. Иногда за ним прослеживают конус УЗ-тени. Если размеры и плотность конкремента небольшие, частота
датчика низкая, фокусировка луча неадекватная, то этого симптома может не быть. В случае перемены положения тела больного конкремент может смещаться. Он определяется при размерах свыше 2 мм. Иногда конкремент располагается в густой «грязной» желчи и не имеет УЗ-тени. В отличие от холецистогра-фии, с помощью эхографии крайне редко выявляют плавающие конкременты. В отдельных случаях их обнару-
175. Камни желчного пузыря и общего желчного протока (д): а, б — единичные; в, г — множественные.
176. Крупный камень (а) и мелкие конкременты (б) в желчном пузыре.
177. Вколоченный камень в шейке желчного пузыря (я) и крупные камни в желчном пузыре и общем желчном протоке (варианты б, в).
живают у длительно голодающих лиц, когда резко возрастает плотность желчи. При большом количестве конкрементов пузырь целиком не виден. Определяются его передняя стенка, затем гиперэхогенный слой и тень от конкремента — симптом «гребешка». Если объем желчного пузыря превышает 50 мл, а ширина — 4 см, то подобное увеличение
может быть связано с обструкцией желчного протока конкрементом. Сканирование при этом болезненно. Получение ложноотрицательных данных может быть связано с мелкими конкрементами, расположенными в протоках. Если имеются внутрипросветные перегородки, дистальные камеры с сигналом от конкремента могут быть приняты за на
слоившуюся кишку. Ложноположительные результаты нежелательны из-за неоправданного затем хирургического вмешательства. За конкремент могут быть приняты содержимое кишки, складки слизистой желчного пузыря, полип и паразиты желчного пузыря. Общая точность эхографии составляет 96 %, специфичность — свыше 96 % (Chagnon, Laugareil, Blery, 1988).
На компьютерных томограммах.конкременты, содержащие известь, видны в желчном пузыре как округлые высоко-плотные (90—155 Н) образования размером от 5 до 25 мм, плотность пигментных камней ниже (25 — 70 Н). Смешанные известково-билирубино-холестериновые камни на компьютерных томограммах не выявляются и становятся видимыми лишь после внутривенного введения гепатотропного контрастного вещества. Кроме того, полипозиционное исследование нередко позволяет определить подвижность одиночного камня в желчном пузыре.
Конкременты могут вызывать обструкцию желчных путей чаще на уровне супрапанкреатического и панкреато-ампулярного сегментов. В большинстве случаев камни протоков вторичные, являются результатом миграции из желчного пузыря. Если камень задерживается в месте соединения печеночных протоков, то наступает их супрасте-нотическое расширение от 0,4 до 2,0 см. Гепатохоледох хорошо прослеживается, его диаметр от 0,9 до 2,2 см. При денситометрии содержимое протоков имеет гетерогенность до 15 ед. Н.
Холедохолитиаз может быть представлен камнями различной природы и строения. Большая часть закупорки протоков на уровне панкреатоампуляр-ного сегмента обусловлена наличием здесь физиологических сужений. При КТ у большинства больных наблюдается расширение внутрепеченочных, право-
178. Отключенный желчный пузырь с камнем.
го и левого печеночных протоков, ка либр которых достигает 0,6 ±0,3 см Гепатохоледох визуализируется у все: больных, диаметр его колеблется о" 0,5 до 1,7 см (1,2±0,5 см). У 92 % лиг видна супрапанкреатическая часть холедоха с шириной просвета до 1,4± ±0,5 см. Панкреатическая часть холедоха до места блока хорошо прослежи вается у всех больных и почти не отягчается по диаметру от супрапанкреатг-ческой (1,4±0,6 см). У 15 % больны: желчный пузырь, как правило, увелг чен в поперечнике, у 7 % — находится в спавшемся состоянии. Камни желчн< -го пузыря выявляются у 15 % больных Средняя плотность содержимого жел,: ного пузыря составляет 8 ед.Н при колебании от —3 до 20 ед.Н. При гетерогенности более ± 10 ед.Н можно предполагать наличие холестериновых камней Наиболее важным косвенным признаком холедохолитиаза является гиподен-сивный ободок желчи, которая располагается в узком промежутке межд> конкрементом и стенкой холедоха. Это"
179. Камень общего желчного протока:
а — на компьютерной томограмме; б, в — на ходим рам-мах.
ободок желчи проявляется в виде двух симптомов: «мишени» и «полумесяца». Расширение холедоха при обструкции
равномерное и умеренное, конец протока резко обрывается над препятствием (Грушин, 1989).
Глава 44. ОПУХОЛИ И КИСТЫ
Благодаря внедрению в практику новых методов лучевой диагностики достигнут существенный прогресс в своевременном распознавании опухолей и кист печени, желчных протоков и желчного пузыря.
Злокачественные опухоли
Злокачественные опухоли печени. Могут быть первичными и вторичными, или метастатическими. Из первичных злокачественных опухолей наиболее часто встречается рак, реже — саркома и другие новообразования.
Клиническая картина складывается из общих симптомов, вызванных опухолевой интоксикацией (слабость, потеря аппетита, похудание, анемия и т. д.), и локальных проявлений заболевания, к которым в первую очередь следует отнести чувство тяжести и давление в правом подреберье. К этим симптомам вскоре присоединяется боль. Увеличение печени и пальпируемая опухоль — наиболее частые диагностические признаки рака печени. Однако при диффузном раке, развивающемся на фоне цирроза, эти симптомы могут отсутствовать. Ряд клинических признаков обусловлен симптомами портального застоя (спленомегалия, асцит, кровотечение из вен пищевода и т. д.). Нередко местные проявления опухоли маскируются метастазами рака или осложненями. К поздним симптомам относятся желтуха, выраженная гепатомегалия, асцит, расширение поверхностных вен живота, отеки, одышка. В зависимости от преобладания тех или иных симптомов выделяют следующие клинические формы рака: 1) типичный рак; 2) рак-цирроз; 3) осложненный рак; 4) маскировочный, или метастатический, рак; 5) бессимптомный, скрыто протекающий рак.
Первичный рак печени — крайне тя
желое, быстротекущее заболевание. У 75 % больных продолжительность анамнеза до госпитализации не превышает 1 мес. Средняя продолжительность жизни при нелеченном раке составляет 4,5 мес.
Прижизненная диагностика первичного рака печени сложна. Его приходится дифференцировать с метастазами рака других органов в печень, циррозом, эхинококковыми кистами, холециститом, доброкачественными, опухолями. В ранних стадиях болезни результаты клинических анализов и функциональных проб не дают отклонений от нормальных показателей.
Рентгенодиагностика: опухоль печени может существовать как солитарное или мультинодулярное образование с вовлечением в процесс почти всего органа. Поскольку при обычном рентгенологическом исследовании практически невозможно провести дифференциальный диагноз доброкачественной и злокачественной опухоли, то целесообразно разделить их по преимущественной локализации: правая и левая доли печени. С помощью рентгеноскопии и рентгенографии злокачественные опухоли печени выявляются только в тех случаях, когда они обызвествляются или достигают значительных размеров и вызывают смещение соседних органов. Особенно ценен пневмоперитонеум, при котором отчетливо определяются деформация соответствующего контура печени и увеличение размеров пораженной доли. На артерио- или спленопортограм-мах выявляются деформации и смещение сосудов пораженной области, появляются бессосудистые участки и др. Злокачественная опухоль сначала сдавливает окружающие сосудистые ветви, затем прорастает и закрывает просвет, а доброкачественная вызывает изменения от сдавливания.
Если имеет место вторичный злокачественный процесс, или метастазирование, то печень увеличивается и контуры ее деформируются. Увеличение бывает либо диффузным, либо ограничивается одной долей. В поздних стадиях болезни печень может достигать гигантских размеров. Появляются бугристость ее контуров, смещение желудка, 12-пер-стной и толстой кишок. В плевральной и брюшной полостях нередко отмечается реактивный выпот. Эти изменения лучше выявляются после наложения диагностического пневмоперитонеума.
В распознавании метастазов, особенно очаговых поражений печени, большую роль играет сканирование. Патологически измененные части органа, в которых располагается объемное образование, не поглощают радиоактивное вещество и обусловливают участки пониженной радиоактивности — дефекты в общем изображении. При спленопортографии метастазы представляют собой множественные бессосудистые участки, особенно демонстративно видимые в паренхиматозной фазе.
На КТ метастазы злокачественных опухолей в печень характеризуются множественными негомогенными округлыми образованиями размером от 1 — 1,5 до 8 см с нечеткими неровными контурами и участками деструкции плотностью 10—45 ед. Н. Плотность очагов в отношении паренхимы печени заметно снижена, а изменение плотности паренхимы не отмечается. Что касается первичного рака, то он тоже дает негомогенную зону умеренно пониженной плотности с участками деструкции с нечеткими неровными контурами.
По мнению М. Ю. Вилявина (1986), Ф. И. Тодуа, М. Ю. Вилявина (1988), для опухолей печени характерно во многом сходное КТ-изображение, что значительно затрудняет их дифференциальную диагностику. Они выявляются на фоне паренхимы печени как зоны
патологической плотности различных размеров и формы. Авторами доказано, что в большинстве случаев независимо от вида новообразования плотность опухолей всегда ниже соответствующих показателей паренхимы печени на 15 — 20 ед. Следует отметить, что встречаются новообразования с денситометриче-скими показателями абсцессов и даже кист, в связи с чем данный критерий не может считаться определяющим при разграничении этих заболеваний.
В некоторых случаях КА первичного рака, метастазов и других новообразований может быть таким же, как у непораженной ткани органа, или выше. Тем самым еще раз подтверждается, что денситометрические показатели не решают проблему дифференциальной диагностики, так как они могут существенно различаться при опухолях одного вида и в то же время быть близкими и даже идентичными при новообразованиях различной гистологической структуры. Аналогичные сложности отмечаются и при использовании многих визуальных критериев, таких, как четкость или нечеткость контуров, гомогенность, количество очагов, наличие участков некроза, обызвествлений и др. (Вилявин, 1986).
Выявление объемного образования небольших размеров зависит от степени изменения его плотности: чем больше разница в плотности между нормальной паренхимой печени и патологическим очагом, тем меньшего размера определяется опухоль. По мнению И. С. Громыко (1981), более высокая плотность свидетельствует о ранней стадии процесса, значение плотности около «0» — о расплавлении некротических масс, а очаги кальциноза — о длительности патологического процесса.
Нередко при дифференциальной диагностике новообразований используют внутривенное контрастирование. После «усиления» КА злокачественной опухо
ли возрастает в среднем на 12,5 ед.Н, паренхимы печени вокруг очага — на 11,7 ед.Н и удаленной от очага паренхимы — на 15 ед.Н. Но плотность опухоли даже после «усиления» остается меньше на 14,9 и 21,1 ед.Н, чем КА паренхимы печени. Применение динамической КТ позволяет проследить за накоплением и вымыванием контрастного вещества в злокачественных опухолях и окружающей паренхиме. Установлено, что плотность опухоли повышается с 10-й секунды, т. е. в артериальную болюсную фазу. КА в среднем увеличивается с 39,8 ±1,6 до 46,1 ±2,4 ед.Н. Максимальное повышение КА наблюдается па 20-й секунде и в среднем составляет 94,2 ±4.2 ед.Н. На КТ это максимальное контрастирование наблюдается в центральных отделах опухоли. В венозную фазу, т. е. па 30—60-й секундах, отмечается постепенное снижение КА в опухоли в среднем до 57,1 ± ±3,7 ед.Н, но он не переходит показатели плотности на бесконтрастном скане. На 2, 5 и 10-й минутах имеет место дальнейшее снижение КА опухоли. Через 10 мин после введения контрастного вещества среднее значение КА равно 48,7 ±2,4 ед., т. е. оно выше, чем до «усиления» (Милонова, 1987).
Что касается паренхимы печени около очага, то при динамической КТ ее плотность имеет в среднем значение, равное 53,0± 1,1 ед.Н. Как правило, КА начинает повышаться с 20-й секунды и достигает 62,0±6,9 ед.Н. Максимальная же плотность наступает па 40-й секунде и составляет, по данным В. И. Милоновой (1986), 70,5 ±7,9 ед., после чего идет снижение КА. На 2-й и 5-й минутах плотность паренхимы, окружающей опухоль, остается повышенной — 67,7±2,2 и 61,9±1,1 ед.Н, а к 10-й минуте КА=56,5±0,9 ед.Н и практически не отличается от исходного. Плотность паренхимы печени вдали от опухоли изменяется по такой же законо-
180. Гиперваскуляризированная опухоль печени (гепатома).
мерности, как и рядом с очагом поражения: КА постепенно возрастает от 56,5 до 74,6 ед.Н, а затем снижается к 10-й минуте до 57,8 ед. Н. Достоверного различия КА в паренхиме печени около опухоли и вдали от нее В. И. Милонова не отмечает.
Методика «усиления» применяется и при метастазах печени. Так, если до контрастирования КА равно 26,5—45,3 (34,8±3,5), то после него — 28,7 — 51,1, или в среднем 35,9±3,6 ед.Н. Ден-ситометрические показатели паренхимы около очага до «усиления» колеблются от 46,8 до 61,3, или в среднем составляют 54,2 ±1,9 ед.Н, а после него — 49,5 — 73,4 (68,3±4,1) ед.Н. Плотность паренхимы печени вдали от метастаза до контрастирования равна 47—68.8 (59,9 ± ±2) ед.Н, а после него — 52,6 — 78,4, или в среднем 71,5± 3,6 ед.Н. При динамической компьютерной томографии КА в метастазах печени в течение всего времени (10 мин) исследования меньше, чем КА окружающей паренхимы. Достоверного различия КА метастазов в течение 10 мин обычно не происходит. Плотности паренхимы печени вблизи
181. Метастазы печени на эхосканограммах (варианты а, б).
очага и вдали от него также достоверно не отличаются. Чаще метастаз печени имеет КА ниже плотности окружающей паренхимы печени. Но при ряде злокачественных опухолей (раке толстой кишки, гипернефроме, меланоме). КА метастаза может быть выше плотности печени. Плотности метастазов печени у одного и того же больного могут быть различными. Динамическая КТ позволяет обнаружить метастазы у 23,1 % больных, у которых они не определяются на обычных сканах (Милонова, 1986).
Таким образом, если при КТ находят одиночные образования в печени с ден-ситометрическими показателями от 29 до 46 ед., то следует, по мнению В. И. Милоновой (1987), дополнительно использовать методику «усиления» или динамическую КТ, т. е. нужен весь комплекс исследований под КТ.
При метастазах печени выявить более мелкие очаги может УЗИ, но оно не различает их природу. В данной ситуации несомненное преимущество получает МРТ, которая позволяет обнаружить очаги в печени диаметром 0,5 см. Трудноразрешимой задачей как для КТ, так и для МРТ является дифференциальная диагностика крупных солитарных метастазов и первичных опухолей печени (Жаров и соавт., 1991).
Рак желчных протоков и желчного пузыря. Первичный рак желчного пузыря составляет около 3 % злокачественных опухолей человека и 5—10 % среди злокачественных опухолей гепатопан-креатодуоденальной области. Рак внепеченочных желчных протоков встречается редко (0,1—0,4%). В желчном пузыре рак локализуется чаще в области его дна, шейки и поверхности, обращенной к печени. В желчных протоках излюбленной локализацией опухоли являются более узкие отделы их и места слияний. Рак желчных протоков и пузыря бывает двух типов: экзофитный и эндофитный.
Клинические проявления рака желчевыводящих путей разнообразные. В начальной стадии рак желчного пузыря протекает бессимптомно. По мере развития опухоли в клинической картине начинают преобладать следующие формы: желтушная, «опухолевая», ди-спептическая, септическая и немая. Чаще имеют- место боль в правом подреберье, тошнота, потеря аппетита, исхудание, слабость, кожный зуд, нарастание желтухи. Рак внепеченочных протоков рано приводит к обтурации и развитию механической желтухи.
Рентгенодиагностика: при экзофитном росте опухоли с помощью холегра-
182. КТ-картина печени:
а — при метастазах; б — при первичной опухоли.
фии обнаруживают дефект наполнения в тени заполненных контрастным веществом желчных протоков или пузыря либо закупорку протока. Эндофитный рак желчного пузыря инфильтрирует стенку, вызывает ее ригидность, приводит к замедлению опорожнения пузыря. Редкое исключение — слизеобразующий рак, при котором в толще опухоли бывают обызвествления в виде мелких очагов или полосок.
Основными УЗ-признаками новообразования являются асимметричное утолщение стенки желчного пузыря, эхогенная масса со слабым отражением сигнала, отсутствие визуализации пузыря при наличии опухолевой массы. Иногда имеются сочетания новообразования и камней в желчном пузыре. Возможны ложноположительные заключения из-за присутствия камней, сгустков крови и др. Эхотомографический диагноз опухоли желчных протоков следует подтверждать другими методами.
Результаты КТ оценивают по 4 показателям: 1) наличие признаков билиарной гипертензии; 2) уровень блока желчных путей; 3) причина обтурации; 4) степень распространенности опухоли. Характерно локальное и диффузное
утолщение стенки. Визуализация утолщенных стенок желчного пузыря при обтурации желчных путей, как правило, свидетельствует об обширном распространении опухоли, локализующейся в шейке пузыря.
КТ-исследование при нарушении оттока желчи позволяет получить изображения расширенных желчных протоков без предварительного введения в них растворов рентгеноконтрастных веществ. Протоки определяются как округлые, овальные или ветвистые образования с плотностью 9—16 ед. Н, имеющие радиальную направленность к воротам печени. Протоки хорошо дифференцируются от сосудов плотностью 30— 45 ед. Н и от метастазов, которые имеют округлую форму, нечеткие контуры, расположены хаотично и, как правило, определяются не более чем на нескольких последовательных сканах.
Визуализация внепеченочных протоков на первом скане свидетельствует о проксимальном внепеченочном блоке, а визуализация на седьмом скане более характерна только для дистальных внепеченочных обтураций. Размеры желчного пузыря не имеют специфического значения ни для одного из уровней бло
ка. То же самое относится к плотности пузырной желчи. По данным Г. Г. Кар-мазаповского (1988), пузырный проток не визуализируется при внутрипеченоч-ных блоках, дифференцируется у 16,5 % больных с дистальными обтурациями и у 2,4 % лиц при проксимальных уровнях блока.
Если причиной обтурации желчных путей является злокачественная опухоль, то диаметр долевых внутрипече-ночных протоков будет равен в среднем 11,3 см, диаметр общего печеночного протока — 17,7 см и диаметр общего желчного протока — 18,2 см, что превышает цифровые показатели этих протоков при доброкачественных новообразованиях соответственно в 1,6; 1,3 и 1,3 раза.
При оценке уровня обтурации желчных протоков необходимо выделять: внутрипеченочный блок, когда поражена паренхима печени и не видны внепеченочные протоки; блок конфлюенса долевых протоков, когда дифференцируются долевые протоки, а причина обтурации локализуется в области их слияния; обтурацию внепеченочных протоков, уровень которой оценивается по количеству «колец» внепеченочных протоков (Кармазановский, 1988).
Доброкачественные опухоли
Из доброкачественных опухолей наиболее часто встречаются аденома и гемангиома. Дигностика их трудная.
Клиника: небольшие опухоли протекают обычно бессимптомно. При значительных размерах их появляются признаки, связанные с механическим давлением на окружающие ткани и органы либо с препятствием оттоку желчи.
Рентгенодиагностика этих опухолей печени с помощью обычных методик в начальные фазы патологического процесса малоинформативна. В поздних стадиях выявляют различной степени
выраженности гепатомегалию, реже — сам опухолевый узел. На ангиограммах видны сосуды, измененные в результате сдавления. По мере достижения определенного размера (1—2 см в диаметре) опухоль становится заметной на гепато-грамме в виде аваскулярного участка, по краям которого сосуды имеют форму дуги, сдавлены, но контуры их четкие и ровные. В непосредственной близости от опухоли печеночная паренхима часто атрофируется, сосуды в этой области тонкие, прямые.
При обычной КТ гемангиома и аденома имеют сходные признаки, что затрудняет их дифференциальную диагностику. Обе опухоли визуализируются на томограммах в виде 1—3 гомогенных участков умеренно пониженной плотности — около 42 ед.Н. Гомогенность их одинаковая. Другой важный симптом — относительно четкие и ровные контуры, реже — волнистые. Размеры образований варьируют от 3 до 15 см. В печени могут выявляться одновременно опухолевые очаги различных размеров. Форма небольших гемангиом (3—4 см) округлая или овальная, при большом диаметре опухоли — относительно неправильная. Нередко в гемангиоме бывают участки более низкой плотности (15—20 ед. Н), неправильной формы, что связано с развитием внутри опухоли некроза. В 16 % случаев гемангиом находят очаги кальциноза с плотностью 168—229 ед. Н, что является специфическим симптомом. При аденоме скопления кальцинатов отсутствуют.
Характерная особенность гемангиомы — динамика изменений ее контрастности при применении внутривенного «усиления». По данным М. Ю. Виляви-на (1986), через 20 с после введения контрастного вещества визуализация -опухоли улучшается в связи с увеличением разницы денситометрических показателей между нею и нормальной паренхимой органа. Через 1—2 мин по пе-
183. Гемангиома печени на
компьютерных томограммах.
риферии опухоли появляется зона повышения плотности, КА остальной части гемангиомы остается прежним. При дальнейшем наблюдении отмечаются постепенное увеличение участка повышенной плотности и соответственное уменьшение зоны пониженной плотности, пока не станет контрастной вся гемангиома. Такая динамика накопления контрастного вещества в кавернозных полостях объясняется замедленным ре
гионарным кровотоком с последовательным перемешиванием крови. Длительность процесса различна и при крупных гемангиомах достигает 6 — 12 мин. Необходимо учитывать, что этот процесс не обнаруживается при малых (до 3 см) гемангиомах, которые не имеют кавернозных полостей и потому в большинстве случаев гомогенны.
В распознавании гемангиом существенную помощь оказывает динамиче-
184. Полип желчного пузыря (варианты а, б).
кая КТ. Так, КА в гемангиоме с 10-й •екунды повышается незначительно 44,2+7,8 ед.), максимальное контрастирование наступает на 30-й секунде
60 + 8,8 ед.). Плотность в гемангиоме за 2-й и 5-й минутах остается выше 54,4 + 5,0 и 46,2 + 7,5 ед.), чем изначальная (38,1+4,8 ед.). На 10-й и 20-й минутах КА гемангиомы равен 40 + + 8,3 ед. и 45,7 + 6,4 ед., окружающей таренхимы — соответственно 56,4 + 3,0 j 54,5 +1,2 ед., т. е. становится изоплот-1ым. Плотность паренхимы органа на эасстоянии от очага также выше (61,6 + zc2,3 ед.), чем плотность в гемангиоме. Максимальный КА наблюдается на 30 — -*0-й секундах (74,4 + 2,6 ед.), но уже •о 2-й минуты отмечается тенденция к снижению плотности в паренхиме печени как около'очага (66,5 + 1,9) , так и здали от него (67,8 + 1,5 ед.). На 10-й и 20-й минутах плотность в паренхиме зечени становится практически такой ке, как и на преконтрастном скане 56,4 + 2,0 и 54,5 + 1,2 ед.; 55,7 + 1,8 и 35,3 + 1,3 ед.). Таким образом, по мне
нию В. И. Милоновой (1986), у больны: с гемангиомами печени на бесконтрас'-ных сканах нет характерных КТ-симг томов, позволяющих поставить правильный диагноз. Это касается визуальны: и денситометрических показателей. П< этому применение динамической Кгг при подозрении на гемангиому обязь тельно. Она позволяет выявить некоторые дополнительные симптомы и проследить, как происходит накопление г вымывание контрастного вещества что помогает отличить гемангиом; от других объемных образований ш-чени.
Для диагностики гемангиомы применяют и УЗИ. Так, гемангиомы, диаметз которых не превышает 3—4 см, имею-вид эхопозитивных образований с некими, но неровными контурами, с хор<-шо различимой удаленной от датчике стенкой. Они хорошо заметны на фош неизмененной паренхимы печени, эхо-структура их однородная. Гемангиомы большого диаметра (5 — 14 см), как пре-вило, дают более сложную эхоструктур;
с наличием эхопозитивных и эхонегативных участков.
Однако, основываясь только на данных УЗИ или КТ, провести дифференциальный диагноз между гемангиомой, гепатомой и метастатическим поражением печени удается не всегда. Если КТ-диагпостика крупных очагов не вызывает особых затруднений, то дифференциация образований менее 2 — 3 см в диаметре на основе изменений плотности при внутривенном «усилении» не всегда представляется возможной. Да и УЗИ только выявляет объемное образование, но установить сосудистую природу его не может (Милонова, 1986; Михайлов, 1992).
В данной ситуации, по мнению И. Н. Жарова и др. (1991), несомненное преимущество получает МРТ, которая позволяет выявить очаги в печени диаметром 0,5 см. При последовательных импульсах в режиме «спин-эхо» (SE) гемангиомы довольно хорошо заметны на фоне неизмененной паренхимы печени как на Т1-«взвешенных» томограммах (TR:500, ТЕ 30 мс), так и на Т2-«взвешенных» томограммах (TR 2000, ТЕ 30 и 60 мс). На Т1-томо-граммах интенсивность изображения гемангиомы была ниже таковой окружающей паренхимы печени. Однако провести дифференциацию гемангиом от гепатом и метастазов на Т1-томограммах затруднительно: последние дают почти такую же интенсивность сигнала. Иначе выглядят гемангиомы на Т2-томограм-мах: имеют вид ярких гиперинтенсивных образований, интенсивность сигнала которых значительно выше, чем сигнала от неизмененной паренхимы печени. Небольшие гемангиомы диаметром менее 1 см, которые при УЗИ и КТ не были обнаружены, на Т2-томограммах имели в среднем более высокую (на 50 % и более) интенсивность сигнала, чем гепатомы. При количественном анализе средняя интенсивность соотноше-
ния контрастность/шум составила
6,7 ±0,7. Для гепатом и метастазов этот показатель не превышал 4.
На основе изложенного можно констатировать большие диагностические возможности УЗИ и КТ в диагностике гемангиом печени. Как наиболее доступное и высокоинформативное исследование, УЗИ должно выполняться на первом этапе инструментального исследования пациентов с риском очагового поражения печени, а КТ с контрастным усилением — на следующем этапе, т. е. в тех случаях, когда по данным УЗИ невозможно однозначно оценить выявленные в печени очаговые поражения. Если же компьютерно-томографическая картина неопределенная, особенно у лиц с высоким риском опухолевого поражения печени, следует выполнять ангиографию или МРТ. Метод МРТ высокоинформативный, неинвазивный, простой и может заменить ангиографию при верификации гемангиом печени (Зубарев и др., 1990). Положительно и то, что МРТ не связана с ионизирующим излучением и может широко применяться в зонах с повышенным радиоактивным фоном.
Кисты
Кисты печени и желчных путей в работе врача-рентгенолога встречаются не так уж редко. Они бывают врожденными и приобретенными.
Клиническая картина кист зависит от их локализации и размеров. Врожденная киста общего желчного протока проявляется симптомами механической желтухи и приступообразными болями в правом подреберье. Кисты печени небольших размеров обычно протекают бессимптомно. Если они достигают больших размеров, то могут сдавливать печеночные желчные протоки и затруднять отток желчи, что приводит к развитию механической желтухи.
185. Киста печени:
а — на компьютерной томограмме; б — на эхосканограмме.
Рентгенодиагностика малых кист трудна и зависит от многих причин: от положения и величины кисты, проходимости желчных протоков. Иногда при обзорной рентгенографии в верхнем правом отделе брюшной полости можно обнаружить тень патологического образования, которое имеет округлую или овальную форму и вверху сливается с контуром тени печени. Рентгенологическое определение размеров и положения кисты облегчается при обызвествлении ее стенок. Киста в печени вызывает ее увеличение и деформацию. При этом нередко определяются высокое положение, деформация правого купола диафрагмы и оттеснение желудка. Ангиография позволяет установить несоответствие между узким калибром печеночной артерии и большими размерами печени. Причем артерии раздвинуты, удлинены и дугообразно искривлены соответственно поверхности кисты или кист. В паренхиматозной фазе обнаруживаются округлые просветления в тени печени.
По данным В. И. Милоновой (1986), М. Ю. Вилявина (1987), большими диагностическими возможностями в распознавании кист обладает КТ. Солитар
ные кисты печени выявляются на КТ t виде округлых тонкостенных гомогенных полостей плотностью от 0 д< 10 ед.Н, т. е. их плотность соответствуе" плотности жидкости. Стенка пепаразг-тарной кисты обычно не дифференш-руется как отграниченная структура Размеры кист весьма разнообразны — от 0,5 до 20 см и более. При поликистоз^ печени также одновременно отмечаютсг кисты разного диаметра — от мелких д< очень больших. Крупные солитарны; кисты могут иметь плотные включение (20 — 30 ед.) неправильной формы размером до 3—4 см, негомогенные. Чаше всего это сгустки крови, образовавшие ся после излияния в полость кист. Дифференциация кист небольшого диаметре (менее 1 см) от внутрипеченочны? желчных протоков требует последовательного просмотра нескольких томе грамм. Небольшие кисты визуализг-руются на одной, реже — на двух том<-граммах. Желчные протоки удается про следить па нескольких томограммах причем проксимальный отдел внутрипс-ченочного желчного протока распола гается в области ворот печени. При п< ликистозе количество полостей вары-рует от 3 — 4 до тотального поражение
органа. Причем в последнем случае встречаются два варианта изображения: 1) кисты располагаются изолированно друг от друга и между ними находится паренхима печени; 2) кисты разделяются перегородками и ткань печени в значительной части органа отсутствует.
На КТ поликистоз печени проявляется множественными округлыми и овальными образованиями размером от 0,3 до 2,5 см и более, сливающимися между собой. КА этих мелких кист колеблется от 3,7 до 8,6 ед.Н, в среднем составляет 5,8±0,68 ед.Н. Печень у всех больных с поликистозом увеличена и деформирована. Передний и задний края ее неровные. Кисты располагаются по поверхности и в толще органа. Неизмененная паренхима печени выглядит в виде небольших островков. В случае применения методики «усиления» достоверных различий в КА кист до и после контрастирования не отмечается. Плотность паренхимы печени около кист повышается на 8,2 ±1,7 ед. и остальной паренхимы — на 10,2 ±2,4 ед.Н. Динамическая КТ у больных поликистозом подтверждает данные методики «усиления». Так, КА кист почти не меняется, а плотность паренхимы печени в непосредственной близости от очага возрастает. Наибольшая плотность паренхимы печени вблизи очага и на расстоянии от него наблюдается на 30—40-й минутах, среднее значение ее составляет 67,9±0,6 и 71,6±2,7 ед. Н (Милонова, 1986).
Эхинококкоз печени на КТ характеризуется единичными или множественными округлыми полостями с четкими ровными контурами различных размеров. Диаметр их колеблется от 1 до 20 см и более. При многоочаговом поражении печени одновременно могут быть кисты разных размеров. Отличительные признаки эхинококкоза от непаразитарных кист следующие.
1. КА кист близки друг к другу лишь на ранних стадиях развития паразита. При размере кист до 3 см КА= 1—7 ед. С течением времени плотность эхинококковых кист постепенно повышается и достигает 15 ед., а после гибели паразита — 20 ед. й более.
2. При длительном существовании эхинококковых кист в 65,3 % случаев обнаруживаются дочерние пузыри, которые хорошо визуализируются в полости кисты: их КА= 1 — 2 ед. при размерах до 2 см в диаметре и до 7 ед. при пузырях более крупных размеров.
3. Наличие капсулы кисты, которая визуализируется как отграниченная структура у кист более 5 см в диаметре. Толщина стенок капсулы варьирует от 2 до 8 мм и более. Наибольшая толщина отмечается при длительном существовании эхинококковой кисты, особенно после гибели паразита.
4. Частичная или тотальная кальцинация капсулы кисты, отложение кальция внутри ее или полное обызвествление кисты. Эти симптомы специфические для эхинококкоза (табл. 14).
Эхинококковые кисты могут осложняться нагноением, прорывом кисты в плевральную полость и желчные протоки, иногда вызывают механическую желтуху и др. Наиболее частым осложнением все же является нагноение эхинококковой кисты, которое устанавливается по следующим признакам: повышение КА кисты до 40—44 ед., наличие плавающих хитиновых оболочек, неоднородность структуры из-за плотных включений, потеря четкости контуров кисты. Кальциноз кисты свидетельствует о ее гибели.
Если киста граничит с диафрагмой, то может иметь место прорыв кисты в плевральную полость. Тогда при КТ выявляется уровень жидкости как в поддиафрагмальной, так и в плевральной полости. Нередко наблюдается прорыв и опорожнение эхинококковой кисты
Табл. 14. Сравнительные КТ-прнзнаки кист по В. И. Милоновой (1986), %
КТ признаки Вид кист
врожденная с дочерними пузырями ацефалоцисты
Вариабельность размеров 100 100 100
Округлая форма 100 100 100
Ровные контуры Фиброзная капсула 100 100 100
а) без кальцинации 1,7 0 0
б) с кальцинозом 0 23 5,7
Хитиновая оболочка Дочерние пузыри КА кисты от 0 до 15 ед. 0 0 100 (7,0+0,9) 94,3 59,8 100 (15,8±0,7) 71,4 0 100 (5,1+0,2) 100
КА кисты после контрастирования от 100 100 (6,4+0,7)
0 до 16 ед. (7,6±0,7) (16,4 ±2,0)
во внутрипеченочные желчные протоки, желчный пузырь и другие органы. В клинической картине наступают изменения: возникают тяжелейший приступ болей в области печени, желтуха, может иметь место аллергическая реакция на попадание эхинококковой жидкости в брюшную полость и др. При подозрении на прорыв эхинококковой кисты в желчные протоки КТ-исследова-ние, по мнению В. И. Милоновой (1986), необходимо проводить до и после внутривенного контрастирования билигностом. Под воздействием последнего через 20—30 мин в желчных протоках при сообщении их с кистой отмечается повышение КА в протоках и повышение плотности кисты. Если сообщение кисты с желчными протоками отсутствует, увеличения КА не отмечается.
Эхинококкоз печени успешно диагностируется с помощью УЗИ. Для эхинококкоза характерно образование дочерних пузырей. При этом у одних больных дочерние кисты определяются как кольцевидные эхогенные структуры на фоне эхонегативного содержимого материнского пузыря. В других случаях материнский пузырь бывает полностью или частично заполнен бесформенными эхо
генными структурами, сливающимися иногда с капсулой материнской кисты. На этом фоне выявляются единичные или множественные' четко очерченные жидкостные образования — дочерние кисты. Последний тип наблюдается преимущественно при кисте значительных размеров. Это согласуется с данными многих авторов о том, что перенасыщение материнского пузыря эхинококка дочерними элементами приводит к внутреннему дефициту питания, гибели части дочерних пузырей и нередко к распаду материнского пузыря. Хитиновые оболочки дочерних пузырей спадаются и вместе с фрагментами материнского пузыря инкапсулируются соединительной тканью.
Эти данные объясняют анатомический субстрат выявляемых изменений и различия типов эхографической картины гидатидной кисты, которые отображают этапы жизнедеятельности паразита. Дочерние пузыри — характерный признак гидатидной кисты, который выявляется в 62,9 %. В 16,8 % случаев наблюдается симптом отслоения кутикулярной оболочки паразита. Отслоение происходит или на небольшом участке, образуя удвоение стенки с эхо
негативным центром в форме полумесяца, или на большом протяжении, создавая картину плавающей внутри пузыря эхогенной мембраны. Нужно отметить, что эхогенность хитиновой оболочки выше эхогенности фиброзной капсулы. Выявление отслоения кутикулярной оболочки имеет значение не только для определения природы кисты, но и для дальнейшей тактики хирургического лечения. Нарушение диффузного контакта наружных слоев кисты с тканями органа приводит к снижению биологической активности материнской кисты, увеличивая опасность обсеменения зародышевыми образованиями.
Диагностическую ценность представляет симптом локального утолщения стенки кисты, который также типичен для гидатидной кисты.
У 46,8 % больных наблюдается неоднородность жидкостного эхонегативного содержимого кисты, причина которой — множественные точечные эхосигналы, которые группируются в облаковидные поля, обусловленные так называемым «гидатидным песком». У части больных отмечаются пристеночные эхогенные наслоения, определяющиеся обычно возле задней стенки кисты.
Начинающаяся гибель паразита сопровождается частичным обызвествлением его капсулы (11,3 %). При этом округлое образование оставляет за собой акустическую тень, однако частично сохраняет свои структуру и признаки, отмеченные выше. Прогрессивный рост и токсичность паразита приводят к образованию в препаразитарном пространстве слоя некротизированной печеночной ткани. В 9,7 % наблюдений по окружности кисты на отдельных участках выявляется равномерный эхонегативный слой в виде ободка шириной около 2 мм, лучше обнаруживаемый в передних отделах кисты. Наиболее вероятно, что этот симптом — отображение описанных изменений печеноч
ной ткани, связанных с жизнедеятельностью паразита.
Следовательно, характерными эхографическими признаками гидатидной кисты являются дочерние пузыри, отслоение кутикулярной оболочки, «гидатидный песок», локальное утолщение стенки кисты и пристеночные наслоения, зона некроза в препаразитарном пространстве и обызвествление кисты. УЗИ в большинстве случаев позволяет не только уверенно диагностировать гидатидную кисту, но и судить о состоянии и характере жизнедеятельности паразита (Третьяков, 1990).
Альвеолярный эхинококкоз — более тяжелая форма эхинококкового поражения печени. Наблюдаются диффузное прорастание опухолью печеночной ткани и метастазирование в другие органы. Узлы альвеококка склонны к омертвению и образованию мелких полостей. На рентгенограмме эти полости проявляются множественными округлыми и овальными просветлениями. При развитии вокруг пузырьков альвеококка и в их стенках рубцовой ткани с последующим ее обызвествлением диагностика значительно облегчается. Наиболее часто выявляются мелкие неправильной формы очаги, группирующиеся в различные по протяженности участки обызвествления. Реже находят крупные одиночные или множественные округлые обызвествленные образования с четкими контурами, разбросанные в значительной части печени. Причем центр этих очагов более прозрачный, чем периферия.
Большими диагностическими возможностями обладает ангиография. Так, при целиакографии в зоне паразитарного узла обнаруживают сужение артерий, их выпрямление и отсутствие ветвей III и IV порядков. С помощью спленопортографии в ранний период выявляют раздвигание и смещение кровеносных сосудов, которые как бы огибают паразитар
ный узел. В последующем, когда узел достигает больших размеров, находят бессосудистые участки неправильной формы, ампутацию крупных внутрипе-ченочных ветвей портальной системы, а в отдельных случаях и основного ствола воротной вены.
По мнению И. С. Петровой, А. Г. Шумакова, О. Г. Югринова, А. С. Шпонтак (1979), особенности роста паразита в печени таковы, что, не прорастая стенки артерий, паразитарная ткань охватывает их в виде муфты и сдавливает извне. Поражение вен при альвеококкозе возникает раньше и выражено в большей степени. Паразитарная ткань, прорастая стенки крупных и мелких печеночных и портальных вен, вызывает частичную или полную обструкцию их просвета, в то время как артериальные магистрали остаются проходимыми.
Таким образом, если обычное рентгенологическое исследование позволяет установить правильный диагноз кистозного поражения печени в 65—85 % случаев, то специальные методы и тем более КТ и УЗИ обладают большей разрешающей способностью. Так, точность УЗИ составляет 95,6 %, а КТ 96,4 %, чувствительность и специфичность — соответственно 94,1; 96,5 и 88,4 % (по Ф. И. Тодуа, Д. М. Люлинскому (1990), специфичность обоих методов одинакова) .
Наибольшие диагностические трудности возникают при малых кистах (менее 2 см в диаметре) и в ранних стадиях их формирования, когда форма кисты неправильная, у нее нет выраженной капсулы. Из всех методов исследования только КТ и МРТ могут диагностировать полости размером 0,5 см. Что касается УЗИ, то оно эффективно при размерах кисты не менее 1,5 см. Поэтому УЗИ следует применять как наиболее безопасный скрининг-тест не только в поликлиниках, но и в больницах. К использованию КТ и особенно МРТ, не
смотря на их высокую разрешающую способность, неоходимо прибегать лишь при определенных показаниях, когда другие неинвазивные методы малойп-формативны или результаты их не совпадают.
КТ-признаки альвеококкоза печени подробно описаны В. И. Милоновой (1986), установлена их частота. Так, альвеококковый узел на фоне неизмененной паренхимы печени выглядит как очаг пониженной плотности с КА = 46,1 ±0,6 ед.Н (100%), контуры которого неровные (84 %), но четкие (100%). По всей поверхности паразитарного узла в 84 % наблюдений определяются множественные, часто сливающиеся между собой обызвествления различной величины. Печепь увеличена и деформирована. Паразитарный узел от нормальной паренхимы печени четко отграничен в виде полоски шириной до 1,5 см, плотностью 42—47 ед.Н, в которой обызвествления не определяются. Следует отметить, что граница, отделяющая узел и нормальную паренхиму печени, всегда обращена в сторону ворот печени, а паразитарный узел имеет тенденцию роста от периферии к центру органа.
При вовлечении в патологический процесс области ворот печени отмечается сдавление или прорастание паразитарными тканями внутрипечепочных желчных протоков, что приводит к их расширению. На КТ зто проявляется наличием линейных или округлых образований размером 0,5 см и более, плотностью 2,9 ед.Н. В центре альвеококкоз-ного узла у 68 % больных имеется полость распада различных размеров и плотности (от 4 до 12 ед.). Повышение КА полости распада до 29 ед.Н свидетельствует о наличии в ней гнойного содержимого. При сдавлении паразитарными тканями нижней полой вены развивается асцит (12 %).
Кроме указанных осложнений, при
альвеококкозе может происходить метастазирование паразита обычно в другие рядом расположенные органы и ткани: легкие и средостение (41,5 %), забрюшинные лимфоузлы (16,7 %), почки (8,3 %), поджелудочную железу (16,7 %), головной мозг (8,3 %), прорастание в желчный пузырь (8,3%).
С помощью внутривенного контрастирования с целью усиления изображения установлено незначительное повышение плотности только по периферии паразитарного узла, а в центральных отделах его КА остается прежним. Что касается денситометрических показателей паренхимы печени около очага поражения, то они до и после контрастирования достоверно ниже, чем плотность паренхимы органа вдали от альвеококкозного узла, на 10—15 ед.Н.
Динамическая КТ показывает, что плотность очага поражения не изменяется в течение всего времени исследования, оставаясь в пределах 45 — 48 ед.Н. Плотность паренхимы печени рядом с паразитарным узлом возрастает
с 55,3 до 71,6 ед.Н на 40-й секунде исследования, после чего отмечается постепенное понижение плотности и к концу 2-й минуты КА равен 57 ± 1,5 ед.Н и достоверно не отличается от исходного значения. Плотность паренхимы печени вдали от альвеококкозного узла возрастает с 58,0 ед.Н к 40-й секунде до 76 ед.Н, а на 2-й минуте КА равен уже 62±1,3 ед.Н. На 5-й и 10-й минутах после внутривенного контрастирования плотность паренхимы печени практически не отличается от КА до введения контрастного вещества (Милованова, 1986).
Таким образом, наиболее часто встречающимися симптомами альвеококкоза являются увеличение и деформация печени, неровность контуров очага и его четкое отграничение от окружающей ткани органа, а также мелкие сливающиеся обызвествления и неизменяю-щийся КА узла после контрастирования. Полость распада и метастазирование — признаки далеко зашедшей стадии заболевания.
Глава 45. ЦИРРОЗЫ ПЕЧЕНИ
Цирроз печени — хроническая прогрессирующая болезнь, характеризующаяся дистрофией и некрозом печеночной паренхимы, сопровождающаяся ее узловой регенерацией, диффузным разрастанием соединительной ткани и глубокой перестройкой печеночной архитектоники. Смертность от цирроза печени колеблется от 10 до 20 случаев на 100 000 населения.
Этиологически выделяют циррозы вирусного, алкогольного, холангиогенного (бактериального, холестатического), алиментарного, паразитарного, обменного (при гемосидерозе и др.), застойного (при сердечной недостаточности) и другого происхождения.
Вирусная природа признается в большинстве случаев цирроза печени. Оте
чественные авторы считают, что вирусный цирроз отмечается у 50—60 % больных. Только у 52 % больных имеет место прямая связь между острым вирусным гепатитом и циррозом печени. У остальных она устанавливается на основе косвенных данных: при наличии подозрения на перенесенный скрытый эпидемический гепатит, обнаружении в крови маркеров гепатита и др. Последние выявляются, как правило, только у 10 — 15 % больных.
Алкогольный цирроз печени часто развивается у больных хроническим алкоголизмом и обостряется после значительного употребления алкоголя.
Обструкция внепеченочных желчных ходов и воспаление печеночных протоков, приводящие в билиарному цирро
зу, возникают у больных холангитами и желчнокаменной болезнью, реже — при хроническом панкреатите, сопровождающемся склерозом головки ПЖ и сужением просвета общего желчного протока. Застойный цирроз печени развивается у больных с хронической недостаточностью кровообращения ПВ — III стадии и является следствием рецидивирующего венозного застоя в печени.
У части больных цирроз может приобретать полиэтиологический характер и связываться с лекарственными, токсико-бактериальными поражениями печени, а у некоторых — и с вирусным ее заболеванием.
Токсические и токсико-аллергические поражения печени описаны рядом авторов. Их причинами могут быть интоксикация четыреххлористым углеводородом, некоторыми лекарственными средствами. Важным условием возникновения цирроза печени являются повторные интоксикации, сопровождающиеся некрозами печеночных клеток. Цирроз развивается нередко у больных туберкулезом легких, которые принимают препараты парааминосалициловой кислоты, изониазид в комбинации со стрептомицином, канамицином.
Генетические причины развития цирроза печени связываются с недостаточностью в организме ряда ферментных систем, которая приводит к обменным нарушениям в гепатоцитах, дистрофии, фиброзу органа, клиническим проявлениям цирроза в раннем детском возрасте.
Неполноценное питание как причина развития цирроза печени связывается с дефицитом в пище белка и полноценных аминокислот, особенно холина. В ряде стран субтропической и тропической климатических зон, где население употребляет в основном растительную пищу, циррозы печени алиментарно-дефицитного характера встречаются часто. Морфогенез алиментарного цирроза
печени складывается из жировой дистрофии печеночных клеток, склероза, процессов регенераторно-пролифера-тивного характера.
Циррозы печени неизвестной этиологии встречаются нередко. В патогенетическом отношении цирроз печени неоднороден. Механизмы развития отдельных форм его изучены недостаточно. Основной механизм цирроза печени любого генеза — гибель большого количества гепатоцитов. При вирусном циррозе он возникает, по-видимому, вследствие реинфекции, аутоаллергических процессов, при алкогольном — в результате повторной алкогольной интоксикации, накопления в гепатоцитах уксусного альдегида, нарушения важнейших механизмов углеводного обмена, при интоксикациях — вследствие токсических поражений гепатоцитов, при нарушении обменных процессов — под влиянием извращения метаболизма и накопления в гепатоцитах несвойственных соединений, повреждающих клетки.
Морфологические изменения в печени при циррозе зависят от формы поражения органа. При микронодулярном циррозе поверхность печени узловатая. Размеры узелков обычно 3—5 мм (не более 1 см) в диаметре, регулярно расположены и имеют почти одинаковую величину. Микроскопически такой цирроз характеризуется наличием тонких соединительнотканных тяжей, разделяющих печеночную дольку на отдельные мелкие фрагменты, псевдодольки. В последних иногда обнаруживаются портальные тракты и печеночные вены. В процесс вовлекается каждая из них или большинство долек.
При макроподулярном циррозе печень резко деформирована, особенно левая доля. На поверхности ее выявляются нерегулярно расположенные узлы до 5 см в диаметре, которые разделены нерегулярными, различной ширины тяжа
ми соединительной ткани и глубокими бороздами. Во время микроскопического исследования обнаруживаются псевдодольки неодинаковой величины — от микроскопических до крупных узлов, состоящих из нескольких долек. Соединительная ткань представлена тяжами различной ширины. Она концентрируется вокруг сосудов.
У отдельных больных выявляются признаки как макро-, так и микроноду-лярного цирроза. Нередко микроноду-лярный цирроз переходит в макроноду-лярный. Дополнительной морфологической формой цирроза является незавершенный (неполный) септальный цирроз, которому свойственно наличие соединительнотканных септ, расчленяющих паренхиму,.без заметных признаков регенерации и гепатоцитов.
В печени выявляются признаки дистрофии и некроза печеночных клеток, регенерации гепатоцитов (увеличение их размеров, часто наличие нескольких ядер, образование печеночных пластинок), пролиферация элементов желчных протоков, инфильтрация межклеточных пространств соединительнотканными клетками, активизация размножения клеток.
Морфологическая картина позволяет выделить несколько форм цирроза печени. При алкогольном циррозе в ткани выявляются тельца Маллори, внутриклеточные включения, окрашивающиеся в ярко-красный цвет гематоксилином и эозином, а также включения алкогольного гиалина. Отложения фиброзной ткани локализуются преимущественно вокруг печеночных вен. Если цирроз билиарный, в раннем периоде обнаруживаются интенсивная лимфопролиферативная инфильтрация стенок малых и среднекалиберных желчных ходов, повреждение их эпителия, воспаление вокруг желчных протоков. Вокруг них' образуются гранулемы, содержащие мо-нонуклеарные эпителиоидные и гигант
ские клетки. В более поздних стадиях заболевания наблюдаются деструкция холангиол, перидуктулярный фиброз. Появляются признаки холестаза, которые более выражены на периферии дольки. В гепатоцитах определяются проявления дистрофических изменений, включения гиалина, накопление меди. Несмотря на некоторые различия, морфологические изменения гепатоцитов, обнаруживаемые при вирусном циррозе печени, имеют место и при других формах цирроза.
Клиническая картина состоит из большого количества разнообразных симптомов, но ведущими являются те, которые отражают глубокие фиброзирующие поражения печени.
Больные циррозом печени обращаются к врачу обычно в связи с появившейся желтухой или по поводу увеличения живота и похудания. При исследовании удается обнаружить увеличение печени. У части больных оказывается увеличенной селезенка. Развитию асцита обычно предшествует период диспепсии, во время которого отмечаются вздутие живота и повышенное газообразование в кишечнике. Отеки нижних конечностей выражены нерезко и появляются значительно позднее асцита. Ко времени образования асцита у больного уже определяются варикозное расширение вен пищевода и признаки развитого коллатерального кровообращения в подкожных венах брюшной стенки.
Мелкоузловой (портальный) цирроз печени встречается значительно чаще других циррозов. Начинается он обычно постепенно с анорексии, исхудания. Асцит бывает иногда первым признаком, который заставляет больного обратиться к врачу. К этому времени у большинства больных обнаруживается увеличение печени и у ’/г—'/з — увеличение селезенки. Желудочно-кишечные кровотечения появляются позднее асцита. Иногда цирроз печени протекает с
рецидивами желтухи, болями в области печени, длительной лихорадкой. Асцит появляется в этих случаях на более поздних этапах болезни. Первичный билиарный цирроз и гемохроматоз осложняются асцитом только на поздних стадиях болезни, и причина его возникновения уже не вызывает диагностических сомнений.
Асцит нередко бывает в поздних стадиях первичного рака печени, который в большинстве случаев возникает в связи с предшествующим ему циррозом. Асцит в подобных случаях рака-цирроза развивается как за счет характерной для цирроза внутрипеченочной блокады кровотока, так и за счет сдавления или тромбоза воротной вены метастазами опухоли. В подобного рода случаях необходимо говорить о комбинированном (внутрипеченочном и внепеченочном) происхождении портальной гипертензии.
Хронический тромбоз воротной вены (например, при полицитемии), как и цирроз печени, иногда начинается синдромом асцита. Одновременное увеличение печени может привести к значительным диагностическим трудностям, преодолению которых помогает систематический анализ следующих признаков.
Тромбоз ветвей воротной вены часто осложняется массивным кровотечением, которое может наступить внезапно. Асцит при этой болезни развивается только в ее поздних стадиях, поэтому, собирая анамнез, важно выяснить не только перенесенные инфекции и операции, травмы и осложнения, но и хронологию отдельных признаков и синдромов. Асцит может появиться раньше желудочно-кишечного кровотечения при циррозе, полицитемии, однако при остром тромбозе ветвей воротной вены он никогда не бывает раньше кровотечения.
Большое дифференциально-диагностическое значение надо придавать и раз
мерам селезенки. Она сильно увеличена в каждом случае тромбоза воротной вены, тогда как у ряда больных циррозом печени размеры ее по данным перкуссии и пальпации остаются без изменений. Печень при тромбозе воротной вены имеет обычно нормальные размеры, тогда как при циррозе она может быть нормальной, уменьшенной или увеличенной. Консистенция и характер края печени при циррозе часто оказываются измененными, тогда как при тромбозе воротной вены они остаются нормальными.
Дифференциальный диагноз сравниваемых синдромов может быть проведен применением лапароскопии в сочетании с биопсией. Цирротическая печень обычно уменьшена в объеме, поверхность ее образована мелкими узелками, которые чередуются с участками соединительной ткани. Край печени всегда заострен, консистенция ее уплотнена. На поверхности печени при циррозе часто определяются участки перигепатита. Поверхность печени при тромбозе воротной вены остается нормальной.
Признаки портальной гипертензии встречаются как при циррозе печени, так и при тромбозе ветвей воротной вены. Они складываются из расширения вен желудка, желчного пузыря, нижней поверхности диафрагмы и связочного аппарата печени.
Гистологическое исследование кусочков печени, полученных во время лапароскопии или посредством аспирационной биопсии, при циррозе печени обнаруживает характерные изменения дольковой структуры ее, тогда как при тромбозе воротной вены строение печени остается нормальным.
Дифференциальный диагноз сравниваемых синдромов может быть проведен также посредством сцинтиграфического исследования с применением коллоидного золота. На сканограммах опреде
ляются размер, форма, равномерность кровенаполнения печени и степень внепеченочного захвата коллоидного золота. На этом этапе заболевания, когда появляется асцит, цирротическая печень оказывается, как правило, уменьшенной (одна доля ее может оказаться уменьшенной, а другая увеличенной), радиоактивность отдельных участков ее- неодинакова. На сканограммах селезенка увеличена и нередко повышена радиоактивность костного мозга.
При рентгенологическом исследовании отмечается увеличение или уменьшение размеров печени. Если цирроз атрофический, тень печени уменьшена, контуры ее неровные, неравномерно-бугристые, полициклические. Вокруг печени развиваются спайки, вследствие чего ее контуры кое-где становятся нечеткими. При пневмоперитонеуме хорошо выявляются фиброзные тени, идущие к диафрагме и брюшной стенке. Вследствие облитерации сосудов печени, развития блокады спленопорталь-ный венозный ствол расширяется и удлиняется, селезеночная вена становится извилистой, архитектоника вну-трипечепочных сосудов резко меняется. Количество сосудистых ветвей уменьшается, их распределение становится нерегулярным, появляются бессосудистые участки. Крупные внутрипеченоч-ные сосуды деформируются и изменяют направление. Скорость заполнения сосудов снижается, время опорожнения удлиняется. Развиваются пути окольного кровотока, в частности возникает варикозное расширение вен пищевода. Возможно развитие асцита.
Эхо графические исследования показали, что специфичность УЗИ для определения гепатопатии составляет 100 % (но чувствительность определения ее характера колеблется от 43 до 84 %), а при циррозе 34 % (Chagnon, Jacque-nod, Blery, 1988).
При циррозе печени в 85—96,2 %
случаев развивается портальная гипертензия, которая проявляется типичными симптомами: варикозным расширением вен пищевода и верхнего отдела желудка, расширением вен передней стенки живота (симптом «головы медузы»), спленомегалией, асцитом, кровотечением из варикозно расширенных вен пищевода, желудка и др.
Рентгенологическое исследование должно начинаться с обзорного просвечивания и снимков органов грудной и брюшной полостей. Дальнейшую тактику определяют в соответствии с полученными данными и клиническими представлениями о природе и локализации блока. Чтобы поставить диагноз, применяют спленопортографию, целиакогра-фию и другие специальные методики рентгенологического исследования. Важное место занимает исследование пищевода и желудка, поскольку в этих органах при портальной гипертензии развивается варикозное расширение вен. Так, при исследовании желудка хорошо видны расширенные вены его свода как свисающие на фоне газового пузыря желудка бахромоподобные образования (симптом «бахромы»). При значительном введении в желудок бариевой взвеси или воздуха они исчезают.
Спленопортография — один из наиболее ценных методов исследования при портальной гипертензии. Она позволяет судить о состоянии спленопортального русла: проходимости селезеночной и воротной вен, локализации блока портальной системы, состоянии внутрипечеиоч-ных разветвлений воротной вены, наличии коллатералей. Если и этот метод не дает четких сведений о портальной системе или требуются дополнительные данные о внутрипеченочном кровообращении при подпеченочном блоке или после спленэктомии, используют прямую портографию (илеомезентерико-графию), которую производят на операционном столе.
При целиакографии на основе ангиографической картины удается выявить очаговые изменения печени (опухоли, кисты, гемангиомы), определить характер портального блока.
В диагностике портальной гипертензии немаловажное значение имеют сканирование печени, а для оценки внутри-печеночного кровообращения — внутривенная радиогепатография и радиоспленопортография. УЗИ выявляет у 1/з больных циррозом печени портосистемные коллатерали. Использование двойного допплер-УЗ позволяет установить скорость .и направление портального тока крови.
При КТ печени обнаруживают увеличение органа, спленомегалию, расширение воротной вены, диаметр которой составляет 1,65 ±0,43 см. Контуры печени ровные, паренхима гомогенная. Денситометрические показатели колеблются от 52,2 до 19,6 ед.Н и в среднем равны 39,0 ±1,9 ед.Н, т. е. по сравнению с нормой снижены почти в 1,5 раза.
Таким образом, диагноз цирроза печени ставится на основании клинической картины заболевания, результатов рентгенологического исследования, сканирования печени, КТ- и УЗ-исследова-ний.
Глава 46. ОБМЕННО-ДИСТРОФИЧЕСКИЕ ЗАБОЛЕВАНИЯ ПЕЧЕНИ
С внедрением в практику новых методов лучевой диагностики стала возможной диагностика многих обменно-дистрофических заболеваний печени.
Жировой гепатоз (жировая дистрофия печени). Самыми частыми причинами гепатоза являются алкоголизм, сахарный диабет, общее ожирение, интоксикация гепатотропными ядами и др. Различают несколько стадий жирового гепатоза по Качу: I — «чистая» жировая дистрофия гепатоцитов; II — жировая дистрофия, сочетающаяся с мезенхимальной реакцией (пролиферацией «звездчатых» эндотелиоцитов); III — жировая дистрофия и нарушение архитектоники дольки (цирротическая перестройка) .
Клиническая картина складывается из признаков основного заболевания (интоксикация, хроническое заболевание ЖКТ и др.) и признаков поражения печени. В раннем периоде жирового гепатоза печень у 80 % больных увеличена диффузно, имеет гладкую поверхность, тупой край, уплотненную консистенцию, иногда чувствительна при пальпации. Обнаруживается замедлен
ный клиренс бромсульфалеина. У части больных отмечаются слабые или умеренные нарушения активности в крови щелочной фосфатазы, гамма-глутамил-транспептидазы, лейцинаминопептидазы. Билирубин, белок и белковые фракции, протромбин и другие элементы содержатся в сыворотке крови в нормальном количестве или изменяются соответственно тяжести формирующегося цирроза печени. Течение жирового гепатоза длительное. Алкоголизм, инфекции и интоксикации могут ускорять эволюцию этого заболевания в гепатит и цирроз печени.
Рентгенологический метод исследования малоипформативен. Отмечается только увеличение печени. С помощью же КТ можно прижизненно распознать жировую дистрофию печени. И. С. Власова и В. В. Китаев (1990) установили, что при жировой дистрофии тень печени становится менее интенсивной, чем в норме, и составляет до 21,1 ±3,4 ед. Н (в норме колеблется от 40 до 60 ед. Н). Резкое снижение плотности паренхимы при жировом гепатозе вызвано низким коэффициентом поглощения рентгеновых
186. Жировой гепатоз:
а, б — на компьютерных томограммах.
лучей жировой тканью. При этом степень снижения плотности, по-видимо-му, зависит от количества отложенного в ткани паренхимы жира. Так, в ранних стадиях жировая инфильтрация выражается небольшим снижением денси-тометрических показателей, а в выраженных клинических случаях плотность паренхимы может приближаться к 0 или имеет отрицательное значение.
На фоне паренхимы со сниженной плотностью внутрипеченочные сосуды выглядят как структуры повышенной плотности, т. е. наблюдается обратное по сравнению с нормой соотношение плотностей. Подобная картина патогно-монична для жирового гепатоза и позволяет с высокой точностью дифференцировать ее от гепатита и цирроза печени.
Хотя у большинства больных жировым гепатозом изменения в печени носят диффузный характер, а ее структура является гомогенной, у 10 % больных может отмечаться неравномерность жировой инфильтрации, вследствие чего структура печени выглядит неоднородной. В этих случаях приходится проводить дифференциальный диагноз между
локальной жировой дистрофией и опухолевым поражением печени.
При этой форме жирового гепатоза компьютерно-томографическая картина различна и зависит от распространенности процесса. Если стадии процесса начальные, на фоне неизмененной паренхимы участки жировой инфильтрации выглядят как зоны пониженной (до 22 — 35 ед. Н) плотности. При дальнейшем развитии заболевания большая часть печени имеет заметно пониженную плотность (17—35 Н), на фоне которой могут определяться участки нормальной, более плотной (40—55 ед. Н) паренхимы. Эти участки сохранившейся паренхимы могут быть единичными и множественными. У 75 % пациентов они по размеру не превышают долю или сегмент. В процессе динамического наблюдения в последующем нередко отмечается распространение очаговой жировой инфильтрации на всю паренхиму печени. Неоднородная структура печени становилась однородной и плотность ее паренхимы равномерно снижалась до 27 ед. Н.
На сцинтиграммах печени у больных с очаговой жировой инфильтрацией на
блюдается неравномерное накопление радиофармпрепарата без отчетливых очаговых дефектов. УЗИ иногда может показать диффузное усиление эхострук-туры печени, но чаще она бывает неоднородной: наряду с участками повышенной имеются зоны сниженной эхогенности. Реже на фоне нормальной эхоструктуры печени можно обнаружить участок повышенной эхогенности.
Таким образом, самый эффективный метод диагностики жирового гепато-за - КТ.
Гемахроматоз печени. Наследственное заболевание, при котором наблюдается увеличенное отложение железа в органах и тканях, в первую очередь в печени, коже, ПЖ.
Первичный гемохроматоз длительное время протекает бессимптомно. Пигментация кожи, сахарный диабет, гепатомегалия, кардиомиопатия, артропатия появляются в большинстве случаев между 45 и 65 годами. Мужчины болеют примерно в 10 раз чаще женщин. Редкость заболевания у женщин объясняется регулярными потерями железа во время менструаций.
Гемохроматоз относится к полисин-дромным заболеваниям. В далеко зашедших случаях болезни наблюдается более или менее выраженное поражение всех внутренних органов.
Гепатомегалия является самым частым признаком гемохроматоза и встречается более чем у 90 % больных. Печень отличается плотной консистенцией, поверхность ее гладкая, край острый, безболезненный. Левая доля печени увеличена более значительно, чем правая. Увеличенная селезенка с плотным закругленным краем прощупывается примерно у 2/з больных. Асцит может быть следствием как портальной гипертензии, так и сердечной недостаточности. Другие признаки портальной гипертензии (варикозное расширение под
кожных вен, кровотечение из вен пищевода) наблюдаются редко.
Усиленная пигментация кожи меланином встречается почти у 90 % больных. Цвет кожи может быть бронзовым (что и отражено в старом названии болезни «бронзовый диабет»), голубоваточерным, аспидным. Резче всего пигментация выражена на лице, шее, предплечьях, дорсальной поверхности кистей, промежности, половых органах, старых рубцах, грудных сосках. Приблизительно у 20 % больных наблюдается пигментация слизистой оболочки рта и конъюнктив.
Сахарный диабет считается третьим классическим признаком гемохроматоза. Встречается он у 75 % больных, т. е. несколько реже, чем меланодермия и гепатомегалия. Примерно у 30 % больных сахарный диабет появляется на несколько лет раньше других признаков болезни. Обычно он с самого начала принимает тяжелое течение и становится инсулинрезистентным.
В постановке диагноза весьма эффективны данные лапароскопии. Печень при обзоре ее через лапароскоп имеет черно-коричневый или нормальный коричневый цвет. В последнем случае гемохроматоз можно отличить от хронического гепатита или цирроза только по результатам биопсии печени. Со временем у больного развиваются все осложнения диабета: ретинопатия, гломерулосклероз, пиелонефрит, полиневрит и др.
Рентгенологическое исследование, особенно рентгенография, позволяет обнаружить гепатомегалию. КТ выявляет уплотнение печени до 100 ед. Н и более из-за накопления в ней железа.
Гепатоцеребральная дистрофия (болезнь Коновалова — Вильсона). Относится к наследственным редким заболеваниям. Характерно нарушение обмена меди, которая откладывается в избыточном количестве в первую очередь в пе
чени и головном мозге, а затем в других органах. Это вызывает дистрофические и склеротические изменения, ведущие к нарушению функций печени и нервной сисемы.
В половине случаев болезнь начинается в детском и подростковом возрасте с поражения печени, что проявляется гепатомегалией, чувством тяжести или болью в правом подреберье и более или менее выраженной желтухой. Значительно реже болезнь дебютирует гемолитической анемией (умеренной или иногда тяжелой из-за повторных кризов) . Большинство больных предстают перед врачом с гепатомегалией, анемией и желтухой смешанного печеночно-клеточного и гемолитического происхождения.
Длительное наблюдение и повторные обследования больных позволили установить, что отложение меди сопровождается воспалительной реакцией. Предполагается такая последовательность событий: первоначально в печеночных клетках развивается жировая дистрофия, позднее к ней присоединяется воспаление в области портальных трактов. Итогом этого процесса становится образование мелкоузлового цирроза с портальной гипертензией.
По клиническому течению болезнь напоминает волнообразно протекающий хронический активный гепатит. Чем моложе больной, тем более быстротечна болезнь. От активного вирусного гепатита она отличается поражением почек с гематурией, фосфатурией и аминоацидурией.
В юношеском возрасте болезнь начинается чаще с экстрапирамидных расстройств. Неврологические нарушения в большинстве случаев проявляются мелкоамплитудным дрожанием верхних конечностей, иногда в сочетании с гиперсаливацией. Дрожание постепенно распространяется и на нижние конеч-нрсти. Голос становится грубым. Из-за
прогрессирующего нарастания ригидности мышц речь и движения оказываются замедленными. Ригидность мышц верхних конечностей раньше всего приводит к затруднениям при письме, а ригидность мышц нижних конечностей — к расстройству походки. Интеллектуальные и эмоциональные нарушения проявляются обычно в виде неврозов истерического типа, напоминающих неврозы при хроническом гепатите.
В более поздних стадиях болезни лицо становится маскообразным, движения замедленными, голос грубым, речь монотонной, скандированной с добавлением лишних звуков. Возникают насильственные смех и плач. К этому времени у больных всегда констатируют гепатомегалию, спленомегалию, асцит, варикозное расширение вен пищевода. Поражение почек встречается в каждом случае этой «лентикулярной» формы болезни, протекающей обычно менее остро, чем описанная «печеночная» форма. В поздней стадии болезни по краю роговицы определяется темно-зеленый ободок содержащего медь пигмента — симптом роговичного кольца (кольцо Кайзера — Флейшера), которое можно увидеть невооруженным глазом, но лучше с помощью щелевой лампы.
Гепатоцеребральную дистрофию чаще всего приходится отграничивать от хронического активного гепатита вирусного происхождения и цирроза печени. Диагностические трудности возникают обычно в доневрологической и в начале неврологической стадии болезни, когда в клинической картине доминируют признаки хронического активного гепатита или цирроза печени. Позднее, когда появляются экстрапирамидные нарушения (ригидность, акинезия, различного типа приступообразные усиления мышечного тонуса, насильственные смех и плач), диагноз гепатоцеребральной
дистрофии становится очевидным, но слишком запоздалым.
Ранняя диагностика гепатоцеребраль-ной дистрофии представляется все же возможной при учете анамнеза и особенностей течения сравниваемых болезней. Хронический гепатит и даже цирроз печени при гепатоцеребральной дистрофии длительное время протекают латентно. В анамнезе больных отсутствует указание на перенесенный в прошлом острый вирусный гепатит. Важно также обратить внимание на возраст больного. Хроническим активным гепатитом и циррозом печени можно заболеть в любом возрасте. Гепатоцере-бральная дистрофия начинается обычно не ранее 6 — 7-летнего и не позднее 32—35-летнего возраста. Если цирроз печени впервые обнаруживают у больного старше 35 лет, его связь с гепатоцеребральной дистрофией крайне маловероятна.
Неврозоподобные нарушения встречаются как при обычном циррозе печени, так и при циррозе печени у больного с гепатоцеребральной дистрофией, но они отличаются друг от друга по времени появления и по клиническому течению. Неврологические нарушения при гепатоцеребральной дистрофии склонны к прогрессированию. Однажды возникнув, они не исчезают никогда. Неврозоподобные нарушения при обычном хроническом гепатите и циррозе печени обратимы.
Во время обострения хронического активного гепатита и в далеко зашедших случаях цирроза печени нередко развивается гепатогенная энцефалопатия. Она проявляется головной болью, заторможенностью и сонливостью больного днем и бессонницей ночью, периодическим выключением сознания. Под влиянием терапии. выраженность указанных признаков, как правило, уменьшается или они полностью исчезают. Таким образом, обратимость всех функ
циональных нарушений ЦНС характерна для хронического гепатита и цирроза печени обычного происхождения, их неуклонное прогрессирование показательно для гепатоцеребральной дистрофии.
Предположительный диагноз гепатоцеребральной дистрофии, как правило, должен быть подтвержден наличием кольца Кайзера — Флейшера. Поскольку этот признак отмечается у 90 — 95 % больных с гепатоцеребральной дистрофией и может встречаться при других болезнях, определение его следует дополнить выявлением таких признаков нарушения обмена меди в организме: пониженным содержанием церулоплазмина в сыворотке крови, постоянно высокой экскрецией меди с мочой. Содержание церулоплазмина в крови устанавливают сцинтиграфическим методом с применением радионуклидов 64Сн или 67Сн.
Диагноз подтверждается повышенной экскрецией меди с мочой, низким содержанием меди и церулоплазмина в крови. Временное понижение содержания церулоплазмина в крови наблюдается при любом тяжелом гепатите. С улучшением общего состояния больного содержание церулоплазмина в крови нормализуется. Низкое содержание церулоплазмина в крови — постоянный признак болезни Коновалова — Вильсона.
Лучевая диагностика гепатоцеребральной дистрофии разработана плохо. При рентгенологическом исследовании обнаруживают гепатомегалию, признаки хронического гепатита и даже цирроза.
Пигментный гепатоз (доброкачественная гипербилирубинемия, или синдром Жильбера — Лербулле). Связан с нарушением обмена билирубина семейно-наследственного генеза. Заболевание выявляется в основном в раннем детстве.
Клинические проявления: в типичных случаях характерна триада Жильбера: печеночная маска, ксантелазмы и желчный цвет кожи. Основной симптом болезни — желтуха: бледно-желтая окраска кожи преимущественно лица, кистей рук и стоп; склеры нормальной окраски. Часты сосудистые или Пигментные пятна, ксантелазмы век и гиперпигментация кожи вокруг глаз. В результате световых, тепловых, химических и механических раздражений в коже усиленно образуется пигмент. Склонность к брадикардии, гипотермии и мигрени. Зябкость; часто — диспепсия, запоры; ортостатическая и интермиттирующая альбуминурия, алиментарная гликозурия, увеличенное количество непрямого билирубина в крови без признаков гемолиза. Все основные печеночные пробы нормальные, при биопсии печени — печеночная ткань нормальная.
Важное диагностическое значение имеет показатель поглощения и задержки радиоизотопных соединений гепатоцитами. Поглощение и выделение печенью бенгальской розовой, меченной 1321, нарушено. Отмечается задержка гепатоцитами бромсульфалеина.
Прогноз доброкачественной гипербилирубинемии в основном хороший.
Амилоидоз печени. Встречается в любом возрасте, чаще после 40 лет. Печень занимает третье место среди органов, поражаемых при амилоидозе. Преимущественное значение в возникновении амилоидоза имеют хронические инфекции (туберкулез, бронхоэктатическая болезнь, остеомиелит и др.), всевозможные затяжные нагноения. Следующую группу составляют неинфекционные заболевания с иммунологическими нарушениями (коллагенозы, опухоли, лимфогранулематоз, миелома и др.). Первичный амилоидоз возникает без ясно выявляемого этиологического фактора
(идиопатический), иногда носит наследственный характер (периодическая болезнь, семейная средиземноморская лихорадка). Патогенез неясен, большую роль играют иммунологические нарушения, изменения белкового обмена.
Клиническая картина амилоидного поражения печени стертая. Самым частым симптомом является гепатоспле-номегалия. Печень плотна, малоболезненна, иногда увеличивается только в поздней стадии болезни. Желтуха наблюдается редко, неинтенсивного характера. Возможно развитие внутрипе-ченочной обструктивной желтухи на фоне первичного амилоидоза печени. В отдельных случаях может развиться геморрагический синдром. Лабораторное исследование выявляет характерные белковые сдвиги, иммунные нарушения, часто повышена активность щелочной фосфатазы сыворотки, другие функциональные пробы мало изменены. Наибольшее диагностическое значение имеет пункционная биопсия печени. Микроскопическое исследование при первичном амилоидозе выявляет локализацию амилоида преимущественно под эндотелием и аргирофильной мембраной внутридольковых артерий печени и в периартериальных тканях, при вторичном — в печеночной паренхиме между балками и капиллярами. Известное диагностическое значение имеет проба с конгорот. Диагностике способствует одновременное выявление поражения почек, кишечника, десен, особенно при пункционной биопсии этих органов.
Из лучевых методов диагностики наиболее эффективна КТ. Она выявляет гепатоспленомегалию и равномерное снижение плотности паренхимы печени до 35 ед. Н. Сцинтиграфия с радиоактивным технецием или золотом также позволяет оценить состояние печени.
Г л а в а 47. ТРАВМАТИЧЕСКИЕ ПОВРЕЖДЕНИЯ. СОСТОЯНИЯ ПОСЛЕ ОПЕРАЦИЙ
Травматические повреждения печени и желчевыводящих путей
Травматические повреждения печени и желчевыводящих путей наблюдаются почти у 25 % больных с повреждениями живота и относятся к наиболее, тяжелой форме повреждений органов брюшной полости. Повреждение печени может быть без разрыва ее капсулы с образованием субкапсулярных, глубоких или центральных гематом или с нарушением целости капсулы с внутрибрюшным кровотечением. Вместе с тем различают открытые и закрытые повреждения. Открытые повреждения бывают колото-резанные и огнестрельные. Закрытые повреждения возникают обычно при тяжелой травме и очень часто сочетаются с повреждениями органов грудной клетки, брюшной полости и переломами различных костей.
Клиническая картина многообразна, но в ней всегда превалируют симптомы кровопотери и травматического шока. Причем последние постоянно преобладают над признаками внутрибрюшного кровотечения.
Обзорное рентгенологическое исследование при травме печени, как правило, дает возможность выявить лишь косвенные симптомы, позволяющие только заподозрить повреждение органа. При одновременном разрыве паренхимы и капсулы печени основным рентгенологическим признаком является наличие свободной жидкости в брюшной полости. Оно проявляется расширением и затемнением правого латерального канала, более выраженными в верхних отделах живота. Если скопления в брюшной полости свободной жидкости (крови) большие, определяются затемнение и расширение также левого латерального канала, затемнение под
вздошных ямок и полости малого таза. Тень печени обычно увеличена за счет скопления крови в подпеченочном пространстве, контуры ее не дифференцируются. Характерно заметное смещение вздутых желудка и толстой кишки книзу и влево. Правый купол диафрагмы, как правило, высоко расположен; при просвечивании подвижность его резко ограничена; отмечается нечеткость или отсутствие контуров правой почки и правой поясничной мышцы; нередко определяются переломы нижних ребер справа, симптомы повреждения легкого и плевры: пневмоторакс, гемоторакс, гемопневмоторакс, внутрилегочные кровоизлияния, эмфизема мягких тканей грудной клетки.
Если повреждение паренхимы печени изолированное с образованием внутри-печеночной гематомы, рентгенологические признаки травмы печени выражены очень неярко или отсутствуют. При образовании большой внутрипече-ночной гематомы могут наблюдаться увеличение и деформация тени печени и смещение соседних органов.
Прямыми признаками повреждения печени служат ступенчатость нижнего контура ее тени, наличие газа или полости с неровными контурами на фоне тени. В артериальной фазе ангиографии наиболее достоверными признаками повреждения печени являются окклюзия внутрипеченочных артериальных ветвей с их смещением и деформацией, экстравазация контрастного вещества и раннее артериовенозное шунтирование между печеночной артерией и воротной веной. Реже встречается шунтирование между печеночной артерией и печеночной веной. При повреждении основного ствола печеночной артерии отсутствует контрастирование внутрипеченочных артерий. В паренхиматозной фазе в зоне
повреждения печени обычно обнаруживают дефекты контрастирования, соответствующие внутрипеченочной гематоме. При наличии подкапсульной гематомы в артериальной фазе все артериальное дерево смещается медиально, а для паренхиматозной фазы характерными становятся дефекты контрастирования в области наружного края печени.
Изолированные разрывы желчного пузыря крайне редки. Они сочетаются с повреждением печени, забрюшинной гематомой и переломами нижних ребер справа. На обзорных рентгенограммах выявляются признаки свободной жидкости в брюшной полости: увеличение тени печени с отсутствием четкости ее контуров, расширение и затемнение правого бокового канала в виде широкой полосы, затемнение межкишечных пространств с образованием полигональных теней между петлями тонкой кишки. Отмечаются также высокое стояние правого купола диафрагмы, вздутие желудка и поперечной ободочной кишки, смещение их влево и книзу и др. В поздних стадиях при развившемся желчном перитоните более выражено вздутие кишечных петель с наличием в них мелких нечетких уровней жидкости, особенно в области правого подреберья.
С помощью УЗИ в ранние сроки после травмы печени обнаруживают гиперэхогенные очаги, позднее преобладают гипо- и анэхогенные очаги. Данные КТ зависят от временного интервала между травмой и проведением исследования: в ранние сроки выявляют участки повышенной и смешанной плотности, в более поздние сроки — участки пониженной плотности.
На основе литературных данных определена чувствительность КТ и УЗИ. Она составляет соответственно 0,93 и 0,83, т. е. оба метода с высокой точностью способны диагностировать травматические повреждения печени. Многие исследователи считают, что при травме
печени УЗИ необходимо применять как скрининг-метод, а при отрицательных УЗ-результатах, но подозрительных клинических данных использовать КТ (Grabenwoger, Dock, Pichler et al., 1989).
По данным M. Ю. Вилявина (1986), на ранней стадии при КТ печени гематомы ее могут быть не обнаружены, так как КА их и паренхимы печени почти одинаковые. В этих случаях весьма эффективно применение внутривенного усиления, при котором гематома в отличие от печеночной паренхимы не контрастируется, что позволяет хорошо ее визуализировать. В последующем с 4— 9-го дня после травмы можно обнаружить гематому с помощью обычной КТ. Форма ее различная: неправильная, овальная, округлая, в виде четырехугольника или полумесяца. В последнем случае, как правило, имеет место субкапсулярная гематома. Отличить ее от интраперитонеального скопления жидкости (крови) позволяет четкая визуализация отслоившейся фиброзной капсулы печени, которая снаружи отграничивает гематому.
При тяжелых травмах грудной и брюшной полостей повреждение печени обычно имеет характер разрыва печеночной паренхимы вместе с сосудами и желчными протоками, а часто и фиброзной, или глиссоновой, капсулы печени. Из крупных внутрипеченочных сосудов легче всего повреждаются тонкостенные печеночные вены и ветви воротной вены.
Гематомы размером до 3 см в диаметре чаще имеют гомогенную структуру и КА=27—30 ед. Н. Если гематома имеет размер около 8 см, то она, как правило, негомогенная и ее КА варьирует от 10 до 60 ед. Н. Форма гематомы на срезах разная: на одном уровне — четырехугольная, на другом — округлая, на третьем — неправильная и т. д. При КТ-исследовании можно четко ви-
зуализировать полости гематом, а также расположение в них секвестров и сгустков крови.
Основные оперативные вмешательства
Резекция печени. Показаниями к ней являются эхинококк, рак печени, травма печени. Резекция правой и левой доли печени считается тяжелой операцией в силу большой кровопотери. Летальность составляет 10—30 %. Наиболее часто в общей хирургии производят резекцию левой доли печени или резекцию 3-го сегмента с целью наложения билиоди-гестивных анастомозов.
Холецистэктомия. Показанием к операции является острый холецистит у пожилых ослабленных больных и лиц, находящихся в тяжелом состоянии. Реже холецистэктомию производят при хроническом холецистите и холецисто-панкреатите. Целью операции является отведение гнойного содержимого желчного пузыря и протоков наружу. У 5 — 10 % больных, перенесших операции на желчном пузыре, во время хирургического вмешательства допускаются ошибки на операционном столе. Наиболее опасной из них является повреждение протоков, которое в 50 % случаев приводит к летальному исходу в разные сроки после операций, а вторая половина больных нуждается в повторных операциях. Чаще всего повторные операции после холецистэктомии бывают необходимы из-за оставленных камней. В то же время повторные операции в 10 раз опаснее первичных («Питтман, 1981).
Холедохотомия. Ее производят с целью ревизии печеночного и общего желчного протоков, а также дренирования желчных протоков. Вскрытие желчного протока производят в супра- и ретродуоденальном или в интрамуральном отделах через 12-перстную кишку. На
иболее часто применяют супрадуоде-нальную холедохотомию. Показанием для вскрытия общего желчного протока является наличие в нем камней. Во время операции в большинстве случаев желчный проток дренируют путем введения в него Т-образной трубки. Скрытое дренирование с одиночной трубкой осуществляют через фатеров сосок в 12-перстную кишку. На уровне раны второй конец трубки выводят наружу.
Холедоходуоденостомия. Эта операция выполняется при непроходимости желчных путей в нижнем отделе общего желчного протока из-за различных причин, когда другая операция в данных условиях невыполнима. Холедоходуоденостомия является лучшей операцией по отведению желчи в 12-перстную кишку по ее физиологичности и несложности выполнения. Недостаток операции'— в наличии слепого мешка общего желчного протока ниже соустья. В этом мешке может продолжаться воспалительный процесс, который нередко приводит к образованию пролежней и свищей.
Некоторые послеоперационные болезни
Постхолецистэктомический синдром. Это общее название поздних осложнений холецистэктомии. Развивается при нарушениях, зависящих от основного патологического процесса, не устраненного полностью при холецистэктомии, от характера и качества произведенной операции, от сопутствующего поражения других органов и систем. Наибольшее значение имеют расстройства, непосредственно связанные с хирургическим вмешательством.
Цель диагностики — прежде всего выявить наличие или отсутствие застоя желчи и возможные причины его.
Внутривенная холеграфия, рентгено-томография или метод радиорентгено-
хромодиагностики выявляют иногда расширение внепеченочных желчных цротоков, препятствие току желчи в виде камней, стеноза желчных протоков, увеличение культи пузырного протока. Отсутствие перехода контрастированной желчи в 12-перстную кишку свидетельствует о стенозирующем од-дите.
Контрастирование, желчевыводящих протоков позволяет обнаружить деформации, сужения, дефекты наполнения и определить состояние культи пузырного протока. Одновременное расширение общего желчного протока и просвета культи пузырного протока часто связано с патологией дистального отдела общего желчного протока. Расширение культи пузырного протока при отсутствии расширения общего желчного протока зависит от дооперационных изменений. Снижение интенсивности контрастирования протока при его расширении характерно для стенозирующего оддита и связано с разбавлением контрастированной желчи скопившейся в протоке желчью.
Инфузионная холеграфия позволяет оценить состояние печеночных протоков. Расширение места слияния печеночных протоков и недостаточная интенсивность тени проксимального отдела печеночного протока характерны для спазма сфинктера Мирицци. Отсутствие контрастирования желчных протоков и кишечника, появление интенсивной тени мочевого пузыря типичны для механической желтухи либо острого холангиогепатита. О недостаточности сфинктера Одди свидетельствует отсутствие контрастирования общего желчного протока при наличии контрастирования кишечника.
Желчные свищи. Развиваются, как правило, после оперативных вмешательств или накладываются хирургом при первом этапе операций у резко ослабленных больных. Ведущим мето
дом диагностики свищей является фи-стулография. Методика ее проста. В положении больного лежа на спине делается первый снимок области печени. После подтверждения правильности укладки и технических данных приступают к введению шприцем в свищевой ход контрастного вещества в количестве 10 — 15 — 20 мл, подогретого до температуры тела. Рентгенограммы производят в прямой и боковой проекциях. При наличии спазма сфинктера Одди рекомендуется применение спазмолитических средств.
Различают наружные и внутренние свищи желчного пузыря и протоков. Наружный свищ желчного пузыря на рентгенограммах представляет собой небольшой величины тень «протока», соединяющего переднюю брюшную стенку и просвет пузыря. Наружный свищ общего желчного протока — это длинный, часто извилистый или прямой канал, расположенный в области удаленного желчного пузыря.
В ряде случаев, когда контрастное вещество через свищ попадает в желчный пузырь и протоки, фистулографии становится холангиографией или хо-лангиодуоденографией, если оно попадает одновременно и в 12-перстную кишку.
Фистулографии дает возможность не только определить причину свища, направление, длину и разветвление свищевого хода, но и выявить ряд патологических процессов в желчном пузыре, протоках и околопеченочной области.
Один из достоверных симптомов внутренних свищей желчевыводящих протоков и ЖКТ — наличие газа в билиарной системе. При подозрении на внутренний свищ дополнительные сведения могут быть получены с помощью обычного рентгенологического исследования желудка, 12-перстной, тонкой и толстой кишок (Петрова, Поляк, 1972).
Р а з д е л VII
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Глава 48. РЕНТГЕНОАНАТОМИЯ И ФИЗИОЛОГИЯ
Поджелудочная железа — вторая по величине (после печени) железа пищеварительного аппарата. Она тесно связана с верхним отделом пищеварительного тракта. Эта железа располагается забрюшинно на задней стенке брюшной полости позади желудка. Имеет дольчатое строение и вытянутую форму. Длина ПЖ у взрослого человека 15—25 см при толщине 2—8 см, а масса колеблется от 65 до 160 г. ПЖ имеет головку, тело и хвост. Головка срастается с 12-перстной кишкой. ТелО призматической формы, имеет три поверхности: переднюю, заднюю и нижнюю. На передней поверхности располагается выпуклый сальниковый бугор. Хвост — суженный левый конец железы, направленный к селезенке.
Ось железы проходит справа налево и снизу вверх. Головка находится на уровне LI-ц тело — на уровне Li хвост — несколько выше.
ПЖ относится к забрюшинным органам (лежит экстраперитонеально). Задняя поверхность, не покрытая брюшиной, срастается рыхло с задней стенкой живота.
Различают эндокринную и экзокринную части ПЖ. Экзокринная часть — сложная альвеолярно-трубчатая железа с системой выводных протоков, состоит из долек, разделенных соединительной тканью. Дольки имеют небольшие протоки, которые, соединяясь, впадают под прямыми углами в проток ПЖ.
Эндокринная часть ПЖ представлена мелкими светлыми островками длиной 0,1—0,3 см, расположенными главным образом в хвосте и теле железы (всего около 500 000). Различные виды клеток островков выделяют гормоны инсулин, глюкагон и соматостатин, поступающие в кровь. Гормоны ПЖ (в большей степени инсулин) являются основными факторами накопления и метаболизма поступающих в организм энергетических субстратов.
Знание особенностей анатомии ПЖ — важнейшее условие для правильной интерпретации рентгенологических снимков, томо- и зонограмм забрюшинного пространства на фоне предварительно наложенного пневморетропери-тонеума с одновременным газовым контрастированием желудка и 12-перстной кишки. Рентгеноанатомия ПЖ и окружающих ее органов в условиях пневморетроперитонеума не вполне соответствует данным анатомов. Головка ПЖ располагается на 2 — 4 см вправо от срединной линии, сверху к ней прилегает задняя стенка пилороантрального отдела раздутого воздухом желудка, спереди и снизу петля 12-перстной кишки, сзади определяются контуры правой почки, а иногда надпочечника. Тело ПЖ находится по срединной линии и левее от нее на 2—3 см, спереди к нему прилегает задняя стенка желудка, сзади проецируются контуры левой почки, околопочечных фасций и др.
Хвостовая часть железы при косом ее положении на боковых зонограммах располагается на 4 — 6 см левее от срединной линии и проецируется над верхним полюсом левой почки, или достигает нижнепереднего контура селезенки, или накладывается на левый надпочечник. При поперечном положении ПЖ хвост ее находится на уровне ворот левой почки. Хвост ПЖ плохо фиксирован и часто меняет свое положение в больших пределах.
ПЖ по данным боковой зонографии имеет разнообразную форму поперечного сечения: округлую, овальную, продолговато-уплощенную, треугольную и в определенной степени зависит от основной анатомической формы и положения. Молоткообразная форма характеризуется округлым и овальным поперечным сечением в области головки, овальным или продолговато-уплощенным сечением на уровне тела и овальным или треугольным в области хвоста. Вытянутая форма железы характеризуется овальным или продолговато-уплощенным сечением в области головки и тела, овальным или треугольным в области хвоста. При косом положении ПЖ на боковой зонограм-ме поперечное сечение ее продолговато-уплощенное, так как продольная ось ПЖ располагается как бы параллельно томографируемой плоскости, а при горизонтальном положении железы по отношению к срединной линии поперечное сечение ее округлое, овальное или треугольное, т. е. на боковой зонограмме получается строгое ор-тоградное отображение ПЖ.
В оценке состояния ПЖ по данным боковой зонографии учитываются следующие показатели: контуры, плотность и структура тени железы, распределение газа вокруг железы, а также состояние прилежащих к ней органов. Тень неизменной ПЖ на зонограмме имеет ровные, закругленные, четкие
187. Ретроградное контрастирование желчевыво-дящих и панкреатического протоков.
контуры. Дольчатая структура железы на фоне газовых прослоек при зонографии не дифференцируется.
Основными критериями неизменной ПЖ при зонографии являются: 1) обычные размеры, т. е. постепенное и равномерное уменьшение ширины и толщины от головки железы к хвостовой части; 2) сохранение формы; 3) ровные и четкие контуры; 4) интенсивность тени железы меньше, чем тени почки; 5) однородная структура тени ПЖ; 6) равномерное окутывание газом, введенным в забрюшинное пространство.
Чтобы правильно интерпретировать данные эндоскопической ретроградной панкреатографии, важно знать анатомическое строение протоков ПЖ. Судя по свободным литературным данным, панкреатический проток у здорового человека имеет диаметр в головке ПЖ в среднем 4,2 мм, в теле — 3 мм, в хвосте — 2 мм, колеблется в пределах 1 — 6 мм. Длина панкреатического протока варьирует от 9,5 до 23 см.
По данным С. Т. Тусупбекова (1981), средняя величина диаметра главного протока в головке составляла у мужчин 0,42±0,02 (варьируя в пределах от 0,3
до 0,6 см), в теле — 0,3±0,01 (от 0,2 до 0,4 см), в хвосте — 0,2±0,01 (от 0,1 до 0,3 см); у женщин в головке — 0,38± ±0,01 (варьируя от 0,3 до 0,5 см), в теле — 0,3±0,01 (от 0,2 до 0,4 см) и в хвосте — 0,18±0,01 (от0,1 до 0,3 см). Длина панкреатического протока у мужчин 15,1 ±0,64 (11,5 — 23 см), у женщин 16,5±0,58 (от 12 до 22 см).
Просвет главного панкреатического протока постепенно и равномерно суживается от головки к хвостовой части и заканчивается в виде тонкой сети ответвлений в хвосте ПЖ. В систему протоков ПЖ входят боковые ветви (II — IV порядка приблизительно одинакового диаметра), отходящие сверху и снизу от основного и дополнительного прото-K0B.
Нормальная панкреатограмма характеризуется равномерным контрастированием главного и дольковых протоков II и IV порядка.
Частота одновременного и отдельного контрастирования общего желчного и панкреатического протоков зависит от анатомических вариантов расположения отверстий устья общего желчного и панкреатического протока на большом сосочке 12-перстной кишки. По данным В. Я. Заводнова, главный проток ПЖ и общий желчный проток в 55 % перед сосочком образуют общую ампулу и одним отверстием открываются на вершине большого сосочка 12-перстной кишки. В 45 % случаев общий желчный и панкреатический протоки открываются в сосочке раздельно и разграничены тонкой перегородкой. При этом устье главного панкреатического протока располагается в нижней полуокружности сосочка в 83 %, а на границе верхней и нижней полуокружности — в 17 %. Общий желчный проток всегда открывается в верхней полуокружности сосочка.
Глава 49. ПАНКРЕАТИТЫ
Панкреатит — это воспаление ПЖ. Оно может быть первичным, основным заболеванием и вторичным, например после травмы живота, при пенетрации язвы желудка или 12-перстной кишки и т. д. Панкреатиты подразделяются на острые и хронические.
Острый панкреатит. Представляет собой острое воспаление, аутолиз и дистрофию ПЖ. Пусковым моментом является, как правило, препятствие оттоку панкреатического сока. Это ведет к острому интерстициальному отеку или к геморрагическому некрозу ПЖ (Скуя, 1986).
Клинические проявления: острый панкреатит обычно начинается внезапно, без предшествующих заболеваний. Наиболее частые симптомы панкреатита — очень интенсивные острые боли в подложечной области без иррадиации или с иррадиацией в спину и левое
плечо и опоясывающие боли. К этим болям затем присоединяются распространенные боли по всему животу. При холецистопанкреатите боли могут отдавать в правое плечо. Они часто сопровождаются рвотой, что заставляет думать о пищевой интоксикации, причем после рвоты боли не уменьшаются. Локальное в начале заболевания напряжение мышц брюшной стенки в подложечной области при дальнейшем течении болезни быстро распространяется на весь живот. При холецистопанкреатите более резко выражено напряжение мышц брюшной стенки в области правого подреберья. Довольно часто появляется вздутие живота с задержкой стула и газов, т. е. картина динамической кишечной непроходимости. Появление бледности или цианоза кожных покровов, поверхностного дыхания, понижение АД, учащение пульса после
предварительной брадикардии указывают на тяжелую интоксикацию.
В крови определяется лейкоцитоз с нейтрофилезом и увеличением палочкоядерных форм, понижается толерантность к сахару. При холецистопанкре-атитах возрастает количество билирубина и холестерина в крови. Исследование диастазы дает чаще всего повышение ее в моче до высоких цифр (увеличение от нормальных 32 — 64 единиц до сотен и тысяч единиц), иногда быстро проходящее. Отмечаются и нормальные цифры диастазы и даже ее исчезновение, что встречается чаще при тяжелом общем состоянии и распространенных некрозах железы.
Исследование начинают с обзорной рентгеноскопии и рентгенографии органов грудной клетки и брюшной полости в вертикальном положении больного. В ряде случаев производят также рентгенограмму брюшной полости при горизонтальном положении больного. Дополнительную информацию дает лате-рография на левом боку. Через 5 — 6 ч от начала заболевания в ряде случаев появляются косвенные рентгенологические признаки, позволяющие заподозрить воспаление ПЖ. Рентгенологические симптомы при обзорном исследовании наиболее выражены через 12 — 24 ч с момента появления первых признаков заболевания.
При рентгенологическом исследовании органов грудной полости наиболее ранними и постоянными признаками процесса являются высокое стояние и ограничение подвижности левого купола диафрагмы. В более поздние сроки присоединяется нарушение функции и правого купола; контуры диафрагмы становятся нечеткими за счет появления фибринозных наложений. В базальных отделах легких, чаще слева, появляются дисковидные ателектазы, в плевральной полости — реактивный выпот.
На рентгенограммах брюшной поло
сти, выполненных в первые часы заболевания, рентгенологические симптомы могут вообще отсутствовать или быть мало выраженными. При прогрессировании воспалительного процесса эти симптомы становятся более очевидными вследствие рефлекторных нарушений моторной функции ЖКТ.
На рентгенограммах живота при остром панкреатите наиболее часто обнаруживается вздутие отдельных петель тонкой (симптом «дежурной петли») и участков толстой кишки с нечеткими уровнями жидкости в них, локализовавшимися преимущественно на уровне Ln— Liv справа или слева от позвоночника (в зависимости от поражения головки или хвоста поджелудочной железы). Отмечаются затемнение верхнего отдела брюшной полости и нечеткость контуров печени, почек и брюшной поясничной мышцы.
По данным М. К. Щербатенко и др. (1980), в первые часы заболевания при тяжелых формах панкреатита характерен регионарный спазм поперечной ободочной кишки при выраженном вздутии печеночного и селезеночного углов (симптом «вырезанной петли»). Если преимущественно поражена головка ПЖ, может иметь место ограниченный спазм поперечной ободочной кишки; иногда наблюдается вздутие только восходящей кишки и печеночного изгиба кишки с четкой границей видимого газа (симптом «отрезанной кишки»). Возможно исчезновение четкости контуров правой почки и большой поясничной мышцы. При деструктивном панкреатите более выражены симптомы функциональной кишечной непроходимости; спазм отдельных участков ЖКТ сменяется парезом. Появляется регионарное вздутие поперечной ободочной кишки (симптом Гобие). В ряде случаев на обзорной рентгенограмме удается видеть тень уплотненной и увеличенной ПЖ в виде клина, обращенного узким
188. Развернутость петли 12-перстной кишки (а) и симптом Фростберга (б).
концом влево. Иногда на фоне тени ПЖ могут быть обнаружены множественные, неправильной формы, чаще мелкие обызвествления — конкременты. Обычно они располагаются продольно в виде цепочки вдоль ПЖ. Обнаружение камня в проекции фатерова соска (кнутри от внутреннего контура вертикального колена вздутой 12-перстной кишки) или в проекции самой железы облегчает диагноз острого панкреатита, так как нарушение оттока секрета является одним из основных патогенетических моментов в развитии процесса.
В случае некроза ПЖ на обзорных рентгенограммах могут выявляться мелкие пузырьки газа, располагающиеся цепочкой или в виде скоплений в проекции ПЖ; признаки нарушения моторной функции ЖКТ более резко выражены. При гнойном процессе в ПЖ на обзорных рентгенограммах отмечается скопление газовых пузырьков в ретро-
гастральном пространстве, дифференцировать которые с очагами некроза железы затруднительно. Если формируется абсцесс в ПЖ, появляется четкий горизонтальный уровень вне просвета ЖКТ.
При перитоните, развившемся на почве острого панкреатита, функциональные изменения кишечника выражены в основном в верхнем этаже брюшной полости. В кишечных петлях, стенки ''которых становятся менее четкими вследствие отека, появляется жидкость с нечеткими горизонтальными уровнями, а в брюшной полости обнаруживается свободная жидкость. Реактивные изменения диафрагмы, легких и плевры с обеих сторон более ярко выражены (Щербатенко и др., 1977).
Второй этап рентгенологического исследования больных с острым панкреатитом — контрастное исследование желудка и 12-перстной кишки. Как прави
ло, для этих целей используется обычная бариевая взвесь, реже воздух. Контрастное исследование верхних отделов ЖКТ может быть проведено или сразу после обзорного исследования, или в течение первых суток пребывания больного в стационаре. М. К. Щербатенко считает, что общее состояние больного не является противопоказанием к проведению этого исследования. Контрастирование желудка выявляет дополнительные рентгенологические симптомы, позволяющие более определенно высказаться в пользу острого панкреатита. Основной признак увеличения размеров ПЖ — расширение ретрогастрального пространства, более характерное при локализации процесса в области тела и хвоста железы. Кроме того, отмечаются явления гипермотильности участков желудка, прилежащих к воспалительному очагу в железе, неравномерная (иногда мгновенная) эвакуация бариевой взвеси из желудка. Складки слизистой оболочки вблизи воспалительного очага отечны, неравномерно расширены.
Контрастное исследование при поражении головки ПЖ выявляет гипер-мотильность, чередование спазмов и парезов различных отделов 12-перстной кишки. Признаки дискинезии 12-перстной кишки наиболее наглядно определяются при рентгеноскопии, характерен спазм вертикального колена кишки с явлениями бульбостаза. Петля 12-перст-ной кишки обычно развернута, внутренний контур ее неравномерно зазубрен или выпрямлен с краевым вда-влением со стороны головки поджелудочной железы. Наблюдается также известный симптом «перевернутой тройки», встречающийся и при остром панкреатите. Складки слизистой оболочки 12-перстной кишки отечны, неравномерно утолщены, в просвете кишки определяется слизь.
При панкреонекрозе или абсцессе ПЖ с помощью контрастного исследования
желудка удается локализовать газовые пузырьки или горизонтальный уровень жидкости в проекции ПЖ, установить степень увеличения органа.
Пассаж бариевой взвеси по тонкой кишке при остром панкреатите резко нарушен; характерна длительная задержка бариевой взвеси (до 15—20 ч) в верхних отделах тонкой кишки в связи с явлениями пареза.
Рентгенологические симптомы в сочетании с клиническими и лабораторными данными позволяют довольно уверенно высказаться об остром панкреатите.
С внедрением в практику КТ удалось изучить многие патоморфологические особенности острого панкреатита (табл. 15). По мнению Е. К. Колеснико-
Табл. 15. Частота симптомов острого и в стадии обострения хронического панкреатита при КТ (по Е. К. Колесниковой, 1983)
Симптом Процент
Увеличение размеров ПЖ 96,3
Деформация ПЖ 92,6
Псевдокисты 75,9
Нечеткие очертания ПЖ 51,8
Уплотнение перипанкреатиче-
ской клетчатки 46,3
Мелкие кальцинаты в ПЖ 24,1
Спленомегалия 22,2
Механическая желтуха 7,4
вой (1983), можно выделять даже три стадии острого панкреатита: I — пери-панкреатический отек, железа увеличена, очертания ее нечеткие, скопление небольшого количества жидкости в забрюшинном пространстве; II — железа увеличена в размерах, количество жидкости нарастает, могут выявляться участки некроза в виде понижения плотности, асцит; III — некроз сегмента или всей железы.
Образованию псевдокист наиболее часто способствуют воспалительные процессы, которые вызывают самопере-
варивание и расплавление тканей ПЖ. Поэтому эта киста представляет собой некротизированные участки ткани, кровь и др. В отличие от истинной кисты псевдокиста не покрыта эпителиальной оболочкой, а окружена воспалительным инфильтратом. Толщина стенки ее доходит до 1 — 1,5 см. Плотность кист может быть различной, иногда КА может достигать высоких показателей (15 — 25 ед. Н). Доказано, что значения КА зависят от содержимого кист. Чем больше в кисте будут иметь место продукты аутолиза, тем выше денситомет-рические показатели (табл. 16).
Табл. 16. Частота КТ-симптомов псевдокист при панкреатите по Е. К. Колесниковой (1983)
Симптом Процент
Нечеткие контуры кисты 88,5
Отсутствие визуализации цапсу-
лы кисты 70,5
Негомогенная структура кисты 64,8
Сочетание различных по форме
кист 40,3
Неправильная форма кисты 35,2
Неровные контуры кисты 28,1
Гомогенная структура кисты 23,0
Неравномерная по толщине кап-
сула 18,7
Овальная форма кисты 17,3
Многокамерные кисты 16,6
Сочетание разных по плотности
КИСТ 12,2
Относительно четкие контуры
кисты 11,5
Тонкая капсула кисты 10,8
Таким образом, наиболее характерными симптомами острого панкреатита являются: увеличение размеров и деформация ПЖ, нечеткие ее очертания с уплотнением перипанкреатической клетчатки и псевдокисты, которые имеют размытые контуры и негомогенную структуру, неправильную форму с различными размерами, отсутствие визуализации капсулы кисты. Другие КТ-симптомы встречаются реже и диагно
стического значения почти не имеют. КА клетчатки вокруг железы выше на 20—30 ед. Н, чем в забрюшинном пространстве.
Хронический панкреатит. Заболеваемость хроническим панкреатитом среди населения довольно большая и имеет тенденцию к увеличению. Поэтому своевременная и качественная диагностика его — одна из актуальных проблем га строэ нтерологии.
Клиническая картина характеризуется болью, признаками панкреатической экзокринной недостаточности ПЖ (диспепсия, поносы, симптомы мальабсорбции, похудание), симптомами диабета и симптомами осложнений (желтуха и др.). Наиболее выраженным симптомом является боль, за исключением далеко зашедших, старых случаев, когда паренхима атрофирована и на первый план выступает панкреатическая недостаточность. Интенсивность боли при хроническом заболевании меньше, а продолжительность больше (недели, месяцы) по сравнению с острым процессом. Чаще интермиттирующая панкреатическая боль продолжается несколько дней в отличие от боли, обусловленной патологией желчных путей, которая продолжается минуты и часы. Нередко боль относительно кратковременная возникает в начале еды и сильно обостряется к ее концу. Во время еды ПЖ получает импульсы к секреции, но обтурация протоков повышает давление в них: возникает боль. Боль может быть обусловлена также воспалением и фиброзом в области нервных окончаний. В этих случаях боль постоянная и мучительная, особенно ночью. Больные прибегают к вынужденному положению, например сидя в постели, притянув колени к груди.
Непереносимость жира, вздутие кишечника, неустойчивый стул и другие симптомы диспепсии указывают на нарушение кишечного переваривания пи
щи; поносы, стеаторея, реже креаторея и др.— на расстройство всасывания в кишечнике. В результате появляются симптомы мальабсорбции: анемия, похудание, гипопротеинемия, недостаток витаминов, особенно жирорастворимых (А, Д, Е, К), низкие показатели в сыворотке крови железа, кальция, холестерина, протромбина и др. Иногда поносы отсутствуют, а стеаторея наблюдается. Возникают отеки и депигментация кожи.
Диабет клинически проявляется лишь при выраженном, далеко зашедшем панкреатите, а в латентном виде существует довольно часто. Приблизительно в 1 /з случаев наблюдается язвенный диабет и в '/з — патологическая сахарная кривая.
При традиционных рентгенологических методах исследования выявляют функциональные нарушения желудка и 12-перстной кишки, а также изменения их формы и положения. В большей степени это касается 12-перстной кишки, тесно соприкасающейся с головкой ПЖ. В ней наиболее характерна преимущественно гипомоторная дискинезия и реже — дуоденостаз. Как правило, эти изменения сочетаются с дискинезией желчного пузыря по гипомоторно-му типу.
У половины больных регистрируются разнообразные рефлюксы: бульбогастральный, дуоденобульбарный, дуодено-дурденальный. Локальная болезненность ПЖ наблюдалась у ’/з больных. Увеличение размеров петли 12-перстной кишки определяется редко (8 — 10 %).
Одним из достоверных признаков хронического панкреатита при тяжелом течении заболевания является обнаружение в паренхиме ПЖ множественных кальцификатов. Тени кальцификатов отчетливо определяются на обзорной рентгенограмме брюшной полости, релаксационная дуоденография уточняет их локализацию.
По данным Ю. В. Батенькова и др. (1987), к прямым признакам хронического панкреатита следует отнести развернутость кольца 12-перстной кишки, разнообразные изменения внутреннего контура ее. Среди них одинаково часто встречаются как сглаженность медиального контура кишки различной протяженности (21,9 %), так и симптом Фростберга (20 %). Последний встречается обычно при длительном течении заболевания. Выявляемый у 13,3 % больных симптом «кулис» по медиальному контуру 12-перстной кишки обусловлен, по мнению М. М. Сальмана (1977), сдавлением кишки увеличенной головкой железы. Одним из рентгенологических признаков хронического панкреатита служит регургитация контрастного вещества в панкреатический проток.
На основании комплексного применения послойного (у 266 больных) и радионуклидного (у 111 больных) исследований ПЖ С. Т. Тусупбеков (1982) установил следующие характерные для хронического панкреатита признаки: увеличение ПЖ (в 89,1 %), реже уменьшение ее (10,9 %), нечеткость контуров (93,7 %), изменения формы (72 %), снижение (85,6 %) и неравномерное (88,3 %) накопление радионуклидов в железе, ускоренное поступление в кишечник (62 %) или замедленное накопление индикатора в паренхиме ПЖ (в 38 %). Очаговое или полное отсутствие накопления радионуклида в паренхиме .железы отмечалось у 16 (14,4 %) больных.
Частота и степень выраженности рентгенорадиологической симптоматики хронических панкреатитов зависит от их формы, длительности существования воспалительного процесса и частоты обострения. Так, хронический рецидивирующий панкреатит характеризуется неравномерным увеличением размеров всей ПЖ, нечеткостью контуров и неоднородной структурой ее тени, выра-
189. Холангиопанкреатографическая картина при хроническом панкреатите.
женным снижением и неравномерным накоплением радионуклида в паренхиме железы, изменением ее формы и ускоренным поступлением индикатора в кишечник. Хронический холецистопан-креатит отличается более или менее равномерным увеличением размеров ПЖ, однородной структурой ее тени, умеренным или локальным снижением накопления индикатора в ПЖ при сохранении ее формы.
При выраженной фибросклеротической форме хронического панкреатита ПЖ уменьшена в объеме и уплотнена, т. е. интенсивность ее тени превышает тень почки и имеет неровные контуры вследствие перипроцесса (или спаек), которые отчетливо выявляются на боковых зонограммах. На сканограмме отмечается деформация контуров с единичными или множественными очаговыми
дефектами накопления препарата в тени ПЖ. Рентгенологические признаки нередко более характерны, чем сканографическая картина.
Хронический индуративный (или псевдотуморозный) панкреатит проявляется чаще преимущественным увеличением головки и тела железы, бугристыми контурами и повышенной плотностью ее тени, резким снижением и замедленным накоплением радиометки в органе или полном отсутствием накопления препарата на определенном участке или во всей железе, а также деформацией ее формы и контуров.
Сочетанное применение зонографии и сканирования ПЖ при хроническом панкреатите с учетом клинических его проявлений позволяет в 85,6 % случаев установить правильный диагноз, в то время как применение только зонографии ПЖ - в 80,8 %.
Для детального изучения состояния основного панкреатического протока при хроническом панкреатите показана ЭРПХГ. По данным С. И. Швайдак (1989), у больных хроническим панкреатитом на панкреатограммах выявлено два варианта изменений: 1) 42,5 % случаев — различные деформации протоков системы, имеющие три степени изменений, которые чаще захватывают главный панкреатический проток и реже распространяются на другие элементы протоковой системы; 2) 57,5 % — проникновение контрастного вещества в паренхиму железы в виде заполнения контрастом мелких (до 0,1—0,3 см в диаметре) кистоподобных образований, местами сливающихся между собой, локального или диффузного характера.
По данным С. Т. Тусупбекова (1982), из 59 больных с контрастированием протоков ПЖ у 6,8 % была получена нормальная панкреатограмма, что дало возможность избежать применения других дополнительных методов исследования ПЖ. Расширение главного панкре-
этического протока (в диаметре от 0,6 см и более) и деформация его боковых ветвей наблюдались у 20 (33,9 %) больных. Основной панкреатический проток имел неровные контуры, боковые его ветви были деформированы, иногда с кистозными расширениями. Эти изменения встречались у больных хроническим рецидивирующим панкреатитом с длительностью заболевания 5 лет и более. Расширение главного протока в сочетании с участками его сужения при отсутствии контрастирования боковых ветвей отмечалось у 21 (35,6 %) больного. У них контрастирование главного протока ПЖ сопровождалось резким усилением болей. Характер, интенсивность и иррадиация болей напоминали больным об очередном обострении хронического воспалительного процесса и наблюдались в основном при хроническом индуративном или склеротическом панкреатите, осложненном механической желтухой.
Сужение начальной части панкреатического протока в сочетании с умеренным или выраженным престенотиче-ским его расширением установлено у 9 (15,2 %) больных. Хронический панкреатит, как правило, сочетался с воспалительными изменениями большого сосочка 12-перстной кишки, что облегчало правильную интерпретацию и дифференциальный диагноз. При этом был необходим тщательный анализ всех визуальных рентгенологических признаков и характера их сочетаний (состояние слизистой околососковой зоны, сохранение эластичности стенок, перистальтика). Стеноз устья протоков в отличие от спазма характеризовался не только сужением, деформацией и замедленным опорожнением от контрастного вещества, но и наличием супрастенотическо-го расширения билиопанкреатических протоков.
Контрастирование паренхимы ПЖ имело место только в 5 (8,5 %) наблю-
190. Коническое сужение желчного протока при хроническом панкреатите.
дениях. Проникновение контрастного вещества в паренхиму ПЖ у больных хроническим панкреатитом сочеталось с неровностью контура панкреатического протока, деформацией дольковых протоков (II — IV порядка), а также замедленной эвакуацией контрастного вещества из железы.
Таким образом, типичными признаками хронического панкреатита, по данным ретроградной панкреатографии, являются расширение главного панкреатического протока, неровность контуров, неравномерное сужение его просвета в сочетании с участками расширения, отсутствие контрастирования дольковых протоков (II — IV порядка) или их деформация, иногда с кистозными расширениями. Перечисленные признаки обнаруживаются в различных сочетаниях у 93,2 % больных при успешной катетеризации устья панкреатического протока.
191. КТ-картина хронического калькулезного панкреатита (варианты а, б).
По мнению В. С. Пручанского с соавт. (1991), существующие традиционные рентгенологические методы исследования малоэффективны при хроническом панкреатите. Более информативными являются ангиография и ЭРПХГ. Однако осуществление этих методов связано с определенными трудностями и большой лучевой нагрузкой. Получивший в последнее время довольно широкое распространение метод УЗИ тоже ограничен в применении. Использование же КТ и МРТ мало освещено в литературе. Наш опыт и данные других исследователей свидетельствуют о том, что при КТ и МРТ можно обнару
жить следующие признаки хронического панкреатита: диффузное и локальное увеличение ПЖ, ее атрофию, расширение панкреатического протока, внутрипротоковые обызвествления и кистозные изменения. Структурные изменения железы: неоднородность стромы, снижение относительной интенсивности получаемого изображения представляются более отчетливо при МРТ, а состояние панкреатического протока, обызвествления и контуры железы — при КТ. Каждый метод несет дополнительную информацию о состоянии ПЖ и способствует улучшению качества диагностики.
Глава 50. ОПУХОЛИ, КИСТЫ И ПОРОКИ РАЗВИТИЯ
Многообразие методов лучевой диагностики вызывает иногда затруднение у врача в определении приоритетности их. Большинство исследователей считают целесообразным такой порядок обследования больных с подозрением на заболевания ПЖ. Вначале в качестве скрининг-метода должно проводйться УЗИ гепатопанкреатодуоденальной области. Этот метод позволяет исключить, заподозрить или выявить патологический процесс. Если результаты исследования сомнительны, проводят КТ, до
полняющую информацию о топике и распространенности патологического процесса. С целью морфологической верификации диагноза в исследование включают прицельную чрескожную биопсию под контролем УЗИ или КТ. При наличии гипертензии желчевыводящих путей выполняют прицельную чрескожную холангиографию, которая обязательно должна завершаться наружным дренированием желчных протоков. Если остаются нерешенные вопросы, комплекс дополнительных исследований
должен включать в себя также целиако-графию, эндоскопию с ретроградной панкреатохолангиографией, релаксационную дуоденографию или панкреато-сцинтиграфию.
Рациональное сочетание и логическая последовательность выполнения исследования значительно расширяют возможности распознавания заболеваний ПЖ, особенно рака, и позволяют определить глубину поражения, распространенность опухоли за пределы органа, сопутствующие изменения в печени, желчных путях и забрюшинном пространстве. Биопсия под визуальным контролем УЗИ или КТ дает важные сведения о морфологическом строении опухоли и открывает новые перспективы для ранней диагностики (Крылов и др., 1987).
Рак поджелудочной железы. Самое коварное злокачественное новообразование из всех опухолей внутренних органов, так как протекает длительное время скрыто и симулирует другие заболевания. Встречается у большинства больных в возрасте 50—70 лет. Диагностика трудна и зависит во многом от квалификации врача и оснащенности лечебного учреждения современной аппаратурой.
Различают рак головки, тела и хвоста ПЖ. Рак головки наблюдается в 75 % случаев, рак тела — в 14, рак хвоста и тела — в 6, тотальное поражение железы — в 5 % случаев. По величине и распространенности опухоли выделяют 4 стадии: 1) диаметр опухоли не превышает 3 см; 2) опухоль более 3 см; 3) опухоль имеет инфильтративный рост и регионарные местастазы в близлежащие лимфатические узлы; 4) появление отдаленных метастазов.
Клинические проявления рака ПЖ весьма вариабельны: у 60,7 % больных они характеризуются развитием желтухи, которая сочетается с зудом кожи, снижением аппетита или прогрессиру
ющим похуданием. При пальпации опухоль определяется примерно у 10 % больных, увеличение печени у 50 %, желчного пузыря у 31 %. Без признаков желтухи в больницы поступают '/з пациентов, причиной их госпитализации являются постоянные боли в верхних отделах живота. Среди лабораторных показателей основное внимание уделяется биохимическим методам исследования, при этом для большинства больных с синдромом механической желтухи характерна гипербилирубинемия со значительным увеличением концентрации прямого билирубина и нарушением обмена липидов.
Анализ особенностей развития заболевания по клиническим признакам свидетельствует о том, что они не всегда соответствуют тяжести, локализации и характеру опухолевого процесса. Сопоставление данных анамнеза, лабораторных показателей и клинического течения заболевания у большинства больных позволяет лишь установить наличие синдрома механической желтухи и заподозрить злокачественное поражение гепатопанкреатодуоденальной области.
Чтобы уточнить диагноз, применяют обычное рентгенологическое исследование с бариевой взвесью, дуоденографию в состоянии искусственной гипотонии, селективную ангиографию, УЗИ и КТ.
Диагностика раннего рака ПЖ трудная. На обзорных рентгенограммах органов брюшной полости имеется иногда увеличение размерор печени и желчного пузыря, что расценивается как проявление желчной гипертензии. При контрастном рентгенологическом, исследовании удается выявить косвенные признаки опухоли в виде смещения антрального отдела желудка кверху и кпереди, развертывание петли 12-перстной кишки, сглаженность или, наоборот, неравномерную зубчатость ее внутреннего контура. Просвет кишки становится неравномерным. Если инфильтрация боль-
192. Смещение антрального отдела при раке головки (а) и тела (6) поджелудочной железы.
шого сосочка 12-перстной кишки ограниченная, появляется признак Фростберга, кулис и др. Рак тела вызывает смещение или прорастание нижней го-
ризонтальной ветви 12-перстной кишки. Рак фатерова соска при релаксационной дуоденографии проявляется дефектом наполнения округлой формы с неровными зазубренными контурами диаметром 1—2 см на заднемедиальной стенке нисходящей части 12-перстной кишки. Фунгозная форма раковой опухоли имеет четко отграниченный дефект наполнения с острым выступом в дистальном отделе. Подкова 12-перстной кишки не развернута, продвижение контрастного вещества по кишке ускорено.
Артериография позволяет получить прямое изображение ПЖ и наблюдать характерное для рака нарушение регулярности сосудистого рисунка, сужение и неровность контуров, смещение сосудов, появление вновь образованной сосудистой сети, задержку контрастной массы в венозной фазе. С помощью спленопортографии выявляются смещение и компрессия селезеночной вены и ее блок. В последние годы стали более сдержанно относиться к ангиографическим исследованиям, что обусловлено их травматичностью, при этом данные ангиографии не всегда отражают истинные изменения ПЖ. Считают, что контрастное исследование сосудов при раке ПЖ наиболее целесообразно, чтобы оценить выраженность опухолевого процесса и распространение его на смежные структуры и окружающие органы.
При операционной панкреатографии обнаруживают изменение протока ПЖ, при холецистографии — косую ампутацию или коническое сужение общего желчного протока. Циркулярная инфильтрация опухолью 12-перстной кишки нарушает ее функцию, в том или ином отделе появляется длительный дуоденостаз и др.
Внедрение в клиническую практику УЗИ и КТ и особенно их сочетанное применение позволило не только полу-
чить прямое изображение ПЖ, оценить ее размеры и форму, но и всесторонне охарактеризовать структуру органа, а также в большинстве случаев предположить природу развившегося патологического процесса.
В частности, при эхографии ПЖ прямые признаки опухоли нами обнаружены у 60 % обследованных. К прямым эхографическим проявлениям заболевания относятся локальное увеличение ПЖ, сопровождавшееся неровностью и нечеткостью контуров патологической зоны со смещением и сдавлением прилежащих органов. Эхоструктура опухолей характеризуется наличием ограниченных участков с пониженной неоднородной эхогенностью. Обширные опухоли с участками некроза, как правило, имеют в центре патологического образования эхонегативную зону.
У 32 % больных опухоль обычно не вызывает деформации ПЖ и по данным эхографии может быть заподозрена лишь на основании косвенных симптомов в виде расширения желчных протоков, увеличения желчного пузыря, метастатического поражения печени и потери четкости изображения перипанкре-атической клетчатки. У 4 % больных, по данным УЗИ, нами были сделаны ошибочные заключения о наличии хронического панкреатита и еще у 4 % из-за содержания в кишечнике значительного количества газа оценить состояние ПЖ оказалось невозможно.
Эффективность КТ при раке ПЖ зависит от распространенности и локализации опухолевого процесса. Семиотика крупных опухолей характеризуется увеличением размеров патологической зоны с отеком остальных отделов железы. В большинстве случаев опухоль сопровождается прорастанием перипанкре-атической жировой клетчатки с вовлечением в патологический процесс прилежащих сосудов. Нередко регистрируются неравномерное снижение КА и
193. Симптом вдавления, или дефекта наполнения, в теле желудка при раке хвоста поджелудочной железы.
неоднородность структуры зоны пора-жения (табл. 17—19).
Рак головки ПЖ вызывает наибольшие трудности в диагностике, что объясняется недостаточным отграничением головки от окружающих структур и наложением их изображения друг на друга. В связи с этим очертания головки обычно нечеткие, нельзя точно определить ее размеры. Если опухоль небольшая, то она не вызывает изменений формы и очертаний железы и не выходит за ее пределы. Что касается КА опухолевой ткани, то он близок к плотности паренхимы ПЖ. При размере опухоли более 2,5 см появляются прямые признаки опухолевых масс, а именно: деформация контура головки или увеличение ее размеров (50 %); контуры опухоли нечеткие, но ровные (80%); смещение верхних мезентериальных со-
Табл. 17. Частота КТ-симптомов рака головки (по Е. К. Колесниковой, 1983)
Симптом Процент
Синдром механической желтухи 84,8
Увеличение головки ПЖ 58,7
Мелкие псевдокисты в дисталь-
пых отделах ПЖ 47,8
Отек тела и хвоста ПЖ 45,7
Бугристость контуров головки 39,1
Негомогенность структуры паренхимы головки ПЖ 34,8
Деформация 12-перстной кишки 32,6
Облитерация перипанкреатиче-ских жировых прослоек 23,9
Увеличение калибра воротной вены 21,7
Вовлечение в процесс аорты и полой вены 17,4
Псевдокисты в опухоли 17,4
Увеличение лимфатических узлов 15,2
Атрофии дистальных отделов ПЖ 10,9
Асцит 6,5
Кальцинаты 2,2
Спленомегалия 2,2
Табл. 18. Частота КТ-симптомов рака тела ПЖ (по Е. К. Колесниковой, 1983)
Симптом Процент
Увеличение размеров тела ПЖ 92
Негомогенность структуры уве-
личенного участка 80
Негомогенность структуры всей
ПЖ 60
Повышение плотности перипан-креатической клетчатки 48
Мелкие участки пониженной плотности (псевдокисты) 40
Равномерное снижение КА дистальных отделов ПЖ 32
Вовлечение в процесс крупных сосудов 32
Увеличение размеров лимфатических узлов 32
Асцит 24
Спленомегалия 8
Мелкие кальцинаты в опухоли 4
Симптом обтурации желчевыво-днщей системы (расширение протоков) 4
Табл. 19. Частота КТ-симптомов рака хвоста ПЖ (по Е. К. Колесниковой, 1983)
Симптом Процент
Увеличение размеров хвоста ПЖ Негомогенность структуры 100
хвоста 90
Спленомегалия Повышение КА перипанкреати- 70
ческой жировой клетчатки 60
Негомогенность структуры тела и головки ПЖ 50
Мелкие участки пониженной плотности (псевдокисты) в теле и головке ПЖ 40
Увеличение лимфатических узлов 40
Уплотнение хвоста по периферии Вовлечение в процесс крупных 30
сосудов 30
Асцит 30
Мелкие кальцинаты в опухоли 10
судов влево от срединной плоскости (70 %). Последний симптом очень важный, впервые он описан Ю. В. Грушиным (1989). Далее расширяется общий желчный проток, диаметр которого колеблется от 1,4 до 3,1 и в среднем составляет 2±0,5 см. Причем имеют место три формы его расширения: I — конусовидное закругление дистального отдела при общем значительном расширении; II — расширение с вдавлением опухолевых масс в просвет протока; III — расширение с сужением в средней трети протока. В 90 % случаев расширяются и внутрипеченочные протоки до 1,2 ±0,5 см. Гепатохоледох всегда виден и его диаметр в среднем равен 1,4± ±0,4 см. Супрапанкреатическая часть холедоха выглядит несколько шире (1,6±0,5 см). Характерны такие симптомы, как горизонтальный ход холедоха и видимость протока ПЖ. Внутрипеченочные желчные протоки на КТ довольно отчетливы даже при небольшом их расширении из-за низкой плотности (КА= +10— 15 ед. Н). Они разветвляются наподобие медузы или рогов оленя
в области ворот печени и кистоподобных образований в периферических отделах (Грушин, 1989).
Чрезвычайно трудна дифференциация между маленькой опухолью головки ПЖ и раком большого дуоденального сосочка. Характерные признаки карциномы этого сосочка следующие: 1) прямой признак — дефект наполнения в 12-перстной кишке в зоне расположения большого дуоденального сосочка; 2) увеличение размеров желчного пузыря, особенно его поперечника, более чем на 4 см; 3) конец холедоха резко обрывается в опухоли или имеет вдавление; 4) гепатохоледох расширяется до 2,5 см (в среднем диаметр его равен 1,4 ± ±0,5 см); 5) расширение печеночных протоков от 0,3 до 0,7 см (Грушин, 1989).
Наличие метастазов в печени при выраженных признаках обтурации желчевыводящей системы при КТ, как правило, установить довольно сложно, так как структура печеночной паренхимы нарушена вследствие очаговых изменений, обусловленных резко расширенными протоками.
Маленькие опухоли (до 2 см) с помощью КТ, как правило, не выявляются в зоне тела и хвоста ПЖ. Вследствие более длительного бессимптомного периода опухоли этой локализации достигают обычно больших размеров, чем в головке. Здесь более выражены процессы некротизации, приводящие к снижению КТ и негомогенности опухоли. Опухоль хвоста ПЖ нетрудна в распознавании, поскольку этот отдел хорошо виден на томограммах. Она схожа с опухолями тела железы. Форма вытянутая, структура негомогенная, плотность невысокая (КА =±25 — 35 ед. Н).
В новообразованиях хвоста более выражены процессы некротизации и аутолиза, что приводит к формированию участков пониженной плотности обычно в центре опухоли и уплотнений по
194. Коническое сужение общего желчного протока при раке головки поджелудочной железы.
195. Рак головки поджелудочной железы.
периферии. Такие опухоли напоминают псевдокисты при панкреатитах. По мнению Е. К. Колесниковой (1983), трудности в интерпретации КТ-картины ПЖ бывают: 1) если она не отделяется от сосудистой ножки селезенки; 2) нередко дуоденоеюнальный изгиб и начальные петли тощей кишки повторяют форму хвоста и могут симулировать его поражение; 3) за опухоль железы могут быть приняты опухоли надпочечника, селезенки, внеорганные опухоли.
196. Билиарная гипертензия с расширением желчных протоков, обусловленным опухолью головки поджелудочной железы (варианты а, б).
Поэтому показано усиление изображения и контрастирование ЖКТ.
Большие опухоли всей ПЖ хорошо определяются на КТ в виде солидных образований, повторяющих ее форму. Структура опухолей негомогенная. В толще опухоли имеются участки низкой плотности. КА опухоли близок значениям КА железы. Рост опухоли в основном наблюдается в левых отделах живота. Она имеет небольшую головку при очень больших размерах тела и хвоста (Колесникова, 1983).
По мнению Н. Л. Крылова и др. (1987), для лучшей визуализации ПЖ, определения ее смещаемости и взаимоотношений с окружающими органами некоторым больным следует проводить полипозиционное исследование в положении на боку или на животе с приемом 3 % раствора уротраста для контрастирования петель тонкой кишки. Именно сочетанное применение лучевых методов исследования позволяет наиболее достоверно распознать или заподозрить опухолевое поражение ПЖ. Это подтверждается и тем, что благодаря различной физической основе рентгеновского и ультразвукового изображе
ний появляется возможность не только провести комплексный анализ скиало-гической картины, но и сопоставить полученные данные с результатами ден-ситометрических показателей. Так, прямые или косвенные признаки опухолевого процесса с помощью УЗИ и КТ выявляются у 96,5 % больных.
Если некоторые вопросы после УЗИ и КТ остаются нерешенными, то показана ЭРПХГ, которая может выявить изменения панкреатического и общего желчного протоков. Информативность ЭРПХГ повышается при одновременной чрескожной аспирационной биопсии тонкой иглой. При раке ПЖ ЭРПХГ расценивается как резервный метод исследования (Ihse, Isaksson, 1984).
Опухоли островковой ткани поджелудочной железы (инсуломы). Эти опухоли представляют собой небольшие солитарные узлы диаметром 1—3 см. У 80 % больных они бывают доброкачественными и у 20 % — злокачественными. Чаще локализуются в хвостовой части ПЖ (75 %), реже в головке (25 %).
Клинические проявления обусловлены избыточным выделением инсулина. Больные чаще всего жалуются на сла
бость, потливость, чувство голода, дрожь, головную боль, головокружения, нарушения зрения. Наблюдаются гиперемия кожи, сменяющаяся бледностью, проливной пот, тахикардия, повышение АД. Возникают эмоциональная неустойчивость, чувство страха, раздражительность, плаксивость, нередко нарушение ориентировки, амнезия, бред, маниакальное состояние. При тяжелом приступе гипогликемии отмечаются потеря сознания, клонические и тонические судороги, гиперрефлексия, иногда симптомы очагового поражения головного мозга. У больного наблюдается снижение до 2,22—2,78 ммоль/л (40— 50 мг %) содержания сахара в крови. Введение глюкозы внутривенно быстро улучшает состояние больного и выводит его из комы.
Больные инсуломой нередко страдают язвенной болезнью 12-перстной кишки, связанной с чрезвычайно высокой желудочной секрецией (синдром Золлинге-ра — Эллисона). Повышенная ' желудочная секреция вызвана постоянной повышенной продукцией инсулина и обусловлена его сокогонным эффектом.
Диагноз инсулом ставится в первую очередь по триаде Уиппла', клиническая картина гипогликемии; снижение уровня сахара в крови при появлении гипогликемических симптомов и кризов до 2,77 ммоль/л (50 мг %) и ниже; устранение болезненных явлений приемом глюкозы.
КТ-признаки опухоли разнообразны, плотность ее колеблется от + 20 до + 60 ед. Н, характерна гомогенная структура опухоли (83,3%). Низкоплотные инсуломы нечеткие, высокоплотные неправильной формы.
Кисты поджелудочной железы. Встречаются редко и обнаруживаются, как правило, у людей в возрасте 20— 40 лет. Морфологически различают кисты протока железы (ложная водянка системы выводных протоков), истинные
кисты — полость, вмещающая несколько литров жидкости и студенистой массы, ложные кисты — осумкованные полости из ткани за счет сращений сальниковой сумки с окружающими тканями.
Клинические проявления зависят от размеров и локализации кисты. При небольших кистах жалоб может и не быть. По мере увеличения кисты и сдавления ею элементов железы появляются нарастающие по интенсивности боли, которые носят опоясывающий характер, диспептические расстройства и другие симптомы. У ряда больных наблюдается чрезмерное слюнотечение.
На обзорной рентгенограмме брюшной полости киста (при величине более 6—8 см) имеет вид массивной тени на уровне L i — ш, может вызвать различные смещения и деформации полых органов пищеварительного тракта. Если киста локализуется в головке ПЖ, наблюдаются вдавления большой кривизны антрального отдела желудка, смещение привратника и луковицы кверху с образованием вдавления задней стенки луковицы, развертывание петли 12-перстной кишки, смещение поперечной ободочной кишки и др. Киста тела ПЖ вызывает вдавление задней стенки или малой кривизны тела желудка, смещение тела желудка влево или кверху с одновременным оттеснением кпереди. При кисте хвоста ПЖ желудок оттесняется кпереди, влево и вправо кверху, поперечная ободочная кишка и селезеночная кривизна смещаются книзу и кнаружи, а кардиальная часть желудка книзу и кнутри, стояние левой половины диафрагмы высокое, изображения контура поясничной мышцы отсутствуют. На томограммах кисты предстают как дополнительное мягкотканное образование с четкими ровными контурами. При спленопортографии определяются сдавление и оттеснение спленопорталь-ного ствола. На артериограммах обнару-
197. Киста поджелудочной железы:
а — на эхосканограмме; б — на компьютерной томограмме.
живаются раздвигание, оттеснение и сдавление сосудов ПЖ. В стенках кист нередко возникают дегенеративные и некротические изменения, являющиеся основой отложений известковых солей. Обызвествления стенок кист представляются в виде множественных крупных очагов, неравномерных скоплений, группирующихся тенями неправильной формы. Тени обызвествления обнаруживаются в типичных местах — между позвоночником и желудком, т. е.
в месте топографии поджелудочной железы.
В диагностике кист ПЖ важна роль УЗИ, позволяющего в большинстве случаев выявить кисту и установить ее локализацию. На эхограмме киста представляет эхонегативное образование с отчетливым изображением задней стенки с повышенной акустической плотностью.
При КТ выявляют весьма характерные визуальные и денситометрические признаки кисты: округлой формы патологический очаг с четкими ровными контурами и гомогенным содержимым, хорошо видимой толстой капсулой, иногда с участками обызвествления. Плотность кисты равна 0—12 ед. по шкале Хаунсфилда, однако она может повышаться при наличии в полости очага некротических масс.
Муковисцедоз поджелудочной железы. Семейный врожденный кистофиброз ПЖ, характеризующийся нарушением ее экзокринной функции. Возникает при обтурации протоковой системы ПЖ в результате как аномалии развития, так и сгущения панкреатического секрета.
Клиническая картина: у детей муковисцедоз проявляется стеатореей, бронхитом и частыми пневмониями вследствие легочного фиброза, синдромом нарушения всасывания на почве гастрита и энтероколита. У взрослых функция ПЖ может быть нормальной или частично нарушенной. Иногда в клинической картине доминирует билиарный цирроз печени или асцит либо портальная гипертензия и желудочно-кишечные геморрагии. По мере прогрессирования заболевания паренхима ПЖ подвергается атрофии, на ее месте развивается фиброзная и жировая ткань.
В некоторых случаях на обзорной рентгенограмме брюшной полости можно видеть мелкие участки кальциноза ПЖ. Важное значение в диагностике принадлежит КТ.
Кольцевидная поджелудочная железа. Относится к аномалиям развития и представляет собой кольцо из ткани головки ПЖ, охватывающее нисходящую часть 12-перстной кишки.
Клинически проявляется признаками непроходимости 12-перстной кишки с развитием частичной мегадуоденум.
Рентгенодиагностика', о кольцевидной Лжесвидетельствует ограниченное циркулярное сужение нисходящей части 12-перстной кишки. Протяженность сужения обычно около 2—3 см с четкими и ровными контурами. Иногда наблюдается скопление газа над и под местом сужения. Нередко имеет место расширение участка кишки над выявленным сужением. Рельеф слизистой оболочки в месте сужения сглажен и очень часто перестроен. Прямые доказательства этой аномалии можно получить при ЭРПХГ: контрастированные протоки
ПЖ окружают 12-перстную кишку.
Добавочная поджелудочная железа. Чаще это добавочные, гетеротопические узлы ПЖ, находящиеся в других органах и тканях организма. Размер их колеблется от нескольких миллиметров до нескольких сантиметров, количество также вариабельно.
Клиническая картина: диспепсия, иногда кровотечение в результате изъязвления узла, возможно развитие различных осложнений.
Рентгенодиагностика добавочной ПЖ, располагающейся в желудке, основана на выявлении округлого и четкого дефекта наполнения диаметром до 2,5 см, похожего на плоский полип. В центре дефекта имеется углубление, дающее картину контрастного пятна,— это скопление бариевой взвеси в устье выводного протока добавочной железы.
Глава 51. ТРАВМАТИЧЕСКИЕ ПОВРЕЖДЕНИЯ. СОСТОЯНИЯ ПОСЛЕ ОПЕРАЦИЙ
Травматические повреждения
Травматические повреждения ПЖ встречаются при травмах живота в 2 — 3 % случаев повреждений органов брюшной полости и забрюшинного пространства. Они нередко сочетаются с повреждением забрюшинной части 12-перстной кишки, печени, селезенки, желудка, с переломом ребер, костей таза, позвоночника и других органов.
Клинические проявления: для всех видов повреждения ПЖ наиболее характерным симптомом является быстрое развитие после травмы острого панкреатита, а нередко перитонита.
При обычном рентгенологическом исследовании распознать травматическое повреждение ПЖ практически невозможно. Обнаружение рентгенологических признаков забрюшинной гематомы и острого панкреатита, появившихся относительно быстро после травмы, при
соответствующей клинике дает основание заподозрить травму ПЖ. Ангиографически можно выявить смещение желудочно-12-перстной артерии и изменение сосудистого рисунка железы.
КТ существенно облегчает выявление повреждений самой железы и сопутствующего внутреннего кровотечения, а также определение характера, протяженности и степени их выраженности. Это позволяет более целенаправлено выполнять оперативное вмешательство. Важным преимуществом КТ является также возможность одновременно оценить состояние других внутренних органов, особенно если имеется сочетанная травма живота. При старении гематом в железе могут выявляться псевдокисты и другие осложнения травмы (Кишков-ский, Тютин, 1989; Дубров, Береснева, 1990).
198. Посттравматическая киста поджелудочной железы.
Основные оперативные вмешательства
Операции на ПЖ производят не только при травматических повреждениях, но и при воспалительных, особенно опухолевых, паразитарных и других заболеваниях. Зная причину операции, объем и методику ее проведения, можно в известной степени облегчить диагностику осложнений.
Основными видами операций на ПЖ являются: ушивание разрывов вместе с капсулой, сшивание протоков и железы, резекция, панкреатэктомия, пан-креатогастростомия, панкреатоеюносто-мия, панкреатодуоденоэктомия.
В случае травм ПЖ без повреждения панкреатического протока применяют паллиативные операции типа клиновидных резекций или простого дренирования сальниковой сумки. При размозжении ткани ПЖ и травмах с повреждением панкреатического протока лучшие результаты получают от резекции ПЖ в пределах здоровых тканей или до места повреждения протока. Если повреждена головка ПЖ, особенно при сочетанных повреждениях головки и 12-перстной кишки, часто производится панкреатодуоденальная резекция.
Резекция хвоста и тела ПЖ выполняется при опухолях ее хвоста, псевдо
кистах, травмах хвоста и тела, некротическом панкреатите, застойном панкреатите дистальной части ПЖ. Нередко в ложе железы оставляют дренаж на случай образования свища. При травмах хвоста ПЖ с повреждением селезеночных сосудов, кистах и опухолях дистальной ее части удаляют не только тело и хвост железы, но и селезенку.
Панкреатодуоденальную резейцию делают в случае рака головки ПЖ и рака фатерова соска. При первом варианте 12-перстную кишку пересекают и культю ее ушивают наглухо справа от верхних брыжеечных сосудов. При втором варианте полностью удаляют всю 12-перстную кишку, пересекая начальный отдел тощей кишки. Отводящий ее конец заглушают или используют для анастомоза с желчным пузырем. Приводящую петлю кишки также ушивают наглухо, выделяя ее из-под мезентериальных сосудов. Если пересаживают панкреатический проток в кишку, ткань железы ушивают до протока, проток рассекается на два лоскута, каждый из которых подшивают к стенке кишки изнутри наружу.
При остром панкреатите, особенно в случае геморрагическо-некротической формы, выполняют радикальную не-крэктомию. Если процесс локализуется в хвосте и теле ПЖ, производят резекцию ее в пределах здоровых тканей, рану дренируют. При распространении процесса на всю железу проводится тотальная или субтотальная панкреатэктомия.
В случае хронического панкреатита, если причина его — стенозирование протока в области фатерова соска, применяют сфинктеротомию — сфинктеропластику и вирзунгопластику. Если причиной хронического панкреатита является сужение панкреатического протока на протяжении, то выполняют операции, восстанавливающие проходимость протока. В случае поражения ди
стальной половины производят дистальную резекцию ее или анастомозирование панкреатического протока со стороны хвоста с петлей тонкой кишки. Если причиной хронического панкреатита служит тотальное поражение всего панкреатического протока, а расширения протока чередуются с его сужениями, то хороший отток панкреатического сока достигается с помощью осуществления операции по Пьюстову — продольный панкреатоеюностомии.
Некоторые послеоперационные болезни
Большие операции (резекции и эктомии ПЖ), сделанные по поводу панкреатита, сопряжены с проблемами, обусловленными интраорганными анастомозами (измененный пассаж желчи и пищи и др.); с рецидивом панкреатита в оставшемся участке железы и с экзо-и эндокринной недостаточностью железы. Встречаются осложнения со стороны желудка и 12-перстной кишки (гастрит, дуоденит, язвы), печени (гепатит), желчных путей (холангит), симптомы перивисцерита, энтероколита и др. (Скуя, 1986).
Лучевая диагностика послеоперационных осложнений должна включать обычные и специальные методики рентгенологического исследования, УЗИ и КТ.
Операции на травмированной ПЖ нередко сопровождаются ранними и поздними осложнениями, среди которых наиболее часто встречается травматический панкреатит. К его особенностям относятся преобладание некротических' и гнойно-некротических форм и атипичная клиническая картина. Операции восстановления дренажа ПЖ (сфинктеротомия, сфинктеропластика, панкреа-тогастростомия, цистоеюно-, цистодуо-дено- или цистогастроанастомоз, пан-креатоеюноанастомоз) сопряжены с
хронизацией или рецидивом панкреатита. Могут наблюдаться симптомы дуоденита, дуоденостаза, дисбактериоза кишечника, холецистита и других заболеваний органов пищеварения. При внутреннем дренаже кист результаты неблагоприятные чаще после цистогастро-анастомоза (постоянные боли в верхнем отделе живота, развитие пептической язвы соустья).
Панкреатические свищи в структуре хирургической патологии имеют довольно большой удельный вес. Наружные свищи могут возникать в результате травмы ПЖ у 7—27 % пострадавших (Толстой, 1983), случайного повреждения при различных операциях, особенно после резекции, вмешательств по поводу кист, острого панкреатита, после операций на других органах ЖКТ (резекция желудка, холецистэктомия и др.). Наружные панкреатические свищи могут быть полными (весь панкреатический сок выливается наружу) и неполными (часть панкреатического сока выливается наружу).
Наиболее приемлемой для практических хирургов классификацией свищей ПЖ в выборе оптимальных методов лечения при данной патологии является следующая:
1) по локализации — исходящие: а) из головки, б) из тела и хвоста железы;
2) по этиологическому фактору: а) после травмы, в том числе операционной, б) после деструктивного панкреатита, в) после радикальных операций по поводу кист;
3) осложненные и неосложненные: а) осложненные, когда свищ связан с воспалительно-некротической тканью поджелудочной железы или с панкреатической кистой; б) неосложненные, когда свищ связан с предшествующей травмой, в том числе операционной, когда указанных изменений в паренхиме железы нет;
4) первичные и рецидивирующие свищи. Свойство вторых — периодически открываться после излечения;
5) полный и «неполный» свищ. Это относится ко всем свищам. Признаком полного свища считается его связь с главным панкреатическим протоком.
Различают еще две разновидности свищей, возникающих из панкреатической кисты: 1) внутренние и 2) комбинированные — внутренний и наружный свищи.
Образованию свищей способствуют затрудненный отток панкреатического секрета по главному выводному протоку железы и непрекращающаяся сокоотделительная функция органа. Свищи обычно локализуются в верхнем отделе брюшной стенки по средней линии, по ходу операционного рубца.
Количество выделяемого из свища панкреатического сока может варьировать в зависимости от диеты, эмоциональных реакций больного и времени суток.
Клинические проявления при наружных панкреатических свищах обусловлены потерей панкреатического сока и характеризуются развившейся анорексией, раздражительностью, похуданием, иногда кратковременной желтухой. Вокруг свища часто отмечается умеренная мацерация кожи, так как панкреатический сок, выделяющийся из фистулы, малоактивный (ферменты в нем находятся в зимогенном состоянии). Закрытие свища часто сопровождается болями опоясывающего характера, повышением температуры. Продолжительность существования наружных панкреатических свищей — от нескольких недель до нескольких лет.
Первым этапом исследования больных с уже сформировавшимися панкреатическими свищами или при подозрении на их развитие является обзорная рентгеноскопия грудной клетки и органов брюшной полости. Она позволяет
получить информацию о подвижности куполов диафрагмы, застойных явлениях в нижних отделах легких, газа в полости абсцесса, кисты или в широком свищевом канале, обызвествлений в ПЖ и желчных путях (Радзиховский, Шпонтак и др., 1984). При обзорной рентгеноскопии органов брюшной полости иногда выявляют кальциноз ПЖ, камни желчного пузыря, полоску газа в широком свищевом канале и др.
Следующим этапом исследования является фистулография с жидким водорастворимым контрастным веществом. Она помогает выяснить связь свища с главным панкреатическим протоком или с протоками малого калибра. Быстрое проникновение контрастного вещества в 12-перстную кишку свидетельствует о том, что свищ может закрыться самостоятельно или под влиянием только консервативной терапии.
Нередко свищевой ход не только сообщается с протоком железы, но и имеет дополнительную полость в околопан-креатической клетчатке. Форма пери-панкреатических «полостей» в грубых очертаниях чаще повторяет пораженный сегмент ПЖ. Полости, расположенные на некотором расстоянии от железы, не имеют каких-либо характерных черт. Забрюшинные затеки у некоторых больных имеют гроздевидную форму, при этом расширенные участки отображают полоски, из которых уже отторглись некротизированные жировые дольки забрюшинной клетчатки. Расположение последних чаще всего бывает гнездовидным или дугообразным по периферии формирующейся полости распада.
Если свищи ПЖ комбинированные, не только заполняется сегмент ее протока, но и контрастируются либо желчные протоки, либо желудок или кишечник. Бывают и желчно-панкреатические свищи двух разновидностей связи между желчной системой и ПЖ. При
одном варианте еще недостаточно отграниченная полость у головки или тела ПЖ может сообщаться с дистальным отделом общего желчного протока. При втором варианте свищ, идущий через спавшийся желчный пузырь и пузырный проток к головке железы, частично сообщается с протоком II порядка, в результате чего контрастируется сегмент основного панкреатического протока через добавочный панкреатический проток (Радзиховский и др., 1984). У больных с комбинированными панкреатическими свищами при фистулографии контрастируются отрезки пищеварительного канала: желудок, 12-перстная кишка.
Можно применять методику одновременного выполнения фистулографии и релаксационной дуоденографии, что дает возможность изучить стенку желудка, 12-перстной кишки и начального отдела тощей кишки в месте наибольшего соприкосновения ее со свищевым ходом, а также выявить заброс бариевой взвеси в околопанкреатическую полость из желудка, из 12-перстной кишки, из начального отдела тощей кишки. Отсутствие смещаемости органов при изменении положения больного свидетельствует о выраженности спаечного процесса.
Чтобы уточнить морфологические и функциональные изменения протоков ПЖ, важно провести эндоскопическую панкреатохолангиографию. Исследование необходимо выполнять в ближайшем предоперационном периоде, чтобы в ходе операции произвести декомпрессию ятрогенной панкреатической гипертензии, возникающей под влиянием введения йодистых веществ. Эндоскопическое контрастирование протоков ПЖ выявляет в ряде случаев патологические изменения, аналогичные таковым во время фистулографии дистальных участков протоковой системы при полных свищах. Очевидно, в этих слу-
199. Абсцессы брюшной полости, развившиеся в результате внутреннего свища в послеоперационном периоде:
а — на эхоскапограмме; б — на компьютерной томограмме.
чаях причиной образования свища является не частичное поражение левой половины поджелудочной железы, а диффузный процесс. Следует подчеркнуть, что при ретроградном заполнении нередко отмечается обрыв контрастирования проксимальнее места впадения свищевого хода, дистальный же участок поджелудочной железы дренируется в таких случаях через свищевой канал.
По мнению многих исследователей, важную информацию для диагностики внутренних свищей дает исследование кишечника. Рентгенологические при
знаки внутренних свищей: заполнение полости контрастным веществом; наличие газа в полости, дренируемой свищом. Такие находки крайне редки, поскольку правильный диагноз у больных с внутренними панкреатическими свищами устанавливается чаще всего во время операции по поводу осложненных форм деструктивного панкреатита. Однако рентгенологическое исследование тонкой и толстой кишок через 2, 6, 8 и 24 ч после выполнения дуоденографии позволяет диагностировать панкреато-ободочные свищи или панкреатоеюналь-ный. Такие свищи, как правило, имеют слегка извитой, шириной до 1 см, свищевой ход, который от задней стенки кишки направляется к области хвоста ПЖ.
Выделительная холецисто холангиография и ее разновидности дают возможность оценить состояние желчевыводящей системы, диагностировать конкременты в желчном пузыре и магистральных желчных протоках, нарушение проходимости терминального отдела холедоха, без устранения которых невозможно адекватное лечение пакреатиче-ских свищей.
Таким образом, рентгенологическое
исследование высокоинформативно в диагностике наружных и внутренних панкреатических свищей. Комплексное применение методик позволяет достаточно полно оценить состояние ПЖ, желчных протоков, желудка, 12-перст-ной кишки, других органов. А это имеет решающее значение для адекватного выбора объема и способа оперативного вмешательства. Исследование больного необходимо начинать с применения наиболее простых и доступных методик, и только при их неинформативности следует проводить наиболее сложные диагностические мероприятия (Радзиховский и др., 1984). Фистулография помогает выяснить связь свища с главным панкреатическим протоком или с протоками малого калибра. Если контрастное вещество быстро проникает в 12-перстную кишку, это свидетельствует о том, что свищ может закрыться самостоятельно или под влиянием только консервативной терапии. Длительное существование периодически закрывающегося свища с повышением температуры и болевыми приступами служит показанием к оперативному лечению.
ЗАКЛЮЧЕНИЕ
Современная лучевая диагностика является важнейшей отраслью клинической медицины, в том числе гастроэнтерологии. Эта диагностическая дисциплина основана на получении, передаче и анализе изображений, формируемых с помощью не только коротковолнового электромагнитного излучения (рентгеновского и в меньшей степени гамма-излучения), но и многих других различных по природе и характеристике излучений, а именно: упругих колебаний (ультразвуковая диагностика) и длинноволновых электромагнитных излучений, лежащих в инфракрасном (термография) и радиочастотном (магнитно-резонансная интроскопия) диапазонах.
Поскольку механизм взаимодействия различных излучений с тканями тела человека совершенно различен, то перечисленные методы не заменяют, а дополняют друг друга: каждый из них дает свою специфическую информацию.
Одно из самых современных средств диагностики — рентгеновская компьютерная томография (РКТ, или КТ), без нее немыслимо полноценное обследование больных с онкологическими и другими заболеваниями. КТ позволяет визуализировать в гастроэнтерологии паренхиматозные органы, средостение, область малого таза, которые мало доступны традиционным рентгенологическим методам.
В РКТ рентгеновская трубка, связанная с системой сбора данных, вращается в аксиальной плоскости вокруг тела пациента. Испускаемый трубкой узкий рентгеновский пучок шириной 1 — 10 мм, проходя под многими углами через исследуемый слой, ослабляется в разной степени для каждой точки данного слоя, улавливается детекторами, оцифровывается в системе сбора данных, затем переводится в условную шкалу поглощения (шкала Хаунсфилда) и подается на графический дисплей в виде черно-белого изображения с большой градацией серой шкалы, где за 0 принята плотность дистиллированной воды, за 1000 — плотность компактного вещества кости, за —1000 — плотность воздуха. Все другие ткани организма имеют условные денситометрические показатели, лежащие в границах этой шкалы.
В МРТ принцип обработки изображений тот же, что и при КТ. Однако существенно разнится способ получения изображения. При МРТ пациента помещают в постоянное магнитное поле небольшой напряженности и затем подвергают воздействию радиочастотных импульсов. Эти импульсы
отклоняют протоны ядер водорода, находящиеся в магнитном поле. Но после прекращения импульса они возвращаются в исходное положение, «сбрасывая» лишнюю энергию, которая и улавливается теми же радиочастотными катушками. По разнице энергий, поступающих из различных точек, осуществляется построение изображения. В отличие от КГ важным достоинством МРТ является возможность получить серии срезов не только в аксиальной, но и во фронтальной и сагиттальной плоскостях.
В мировой практике находят применение три основные линии магнитных томографов: с использованием сверхнизко- и низконапряженных магнитных полей (0,02—0,25 Т), средненапряженных магнитных полей (0,3—0,5 Т) и высоконапряженных магнитных полей (1,5—2 Т). Чаще используются МРТ с напряженностью магнитного поля 0,4—0,5 Т. Эти аппараты не требуют специальных помещений, имеют относительно небольшую массу и эсплуатационные расходы, что чрезвычайно важно для медицинских учреждений.
В ряд ведущих способов визуализации в клинической медицине выдвинулось УЗИ. Наряду с одномерными способами УЗИ (А- и М-методики эхографии) наибольшее распространение в практике получило ультразвуковое сканирование — В-метод УЗИ, который чаще именуется сонографией. Сонография обеспечивает двухмерное изображение исследуемых органов. Все большее распространение приобретает комбинация сонографии и допплерографии (дуплексная сонография). Удобные в обращении звуковые антенны сделали достижимыми эндоскопическую и внутриполостную сонографию и интраоперационную ультразвуковую ревизию органов.
Оснновным прибором радионуклидной диагностики стала гамма-камера, а ведущим методом визуализации — гамма-сцинтиграфия. Посредством статической сцинтиграфии исследуют функциональную анатомию органа и выявляют в нем участки с повышенным и пониженным накоплением радиофармпрепарата. При динамической сцинтиграфии запись идет непрерывно или через короткие промежутки времени, а информация обрабатывается в компьютере, что обеспечивает изучение функции органа вплоть до математического моделирования физиологических и патофизиологических процессов.
К относительно новым способам радионуклидной диагностики принадлежит эмиссионная КТ. Различают однофотонную эмиссионную томографию (ОФЭТ) и двухфотонную, или позитронную, эмиссионную томографию (ПЭТ). ОФЭТ позволяет более точно, чем обычная сцинтиграфия, отражать распределение радиофармпрепарата в разных слоях исследуемого органа. ПЭТ основана на использовании короткоживущих радионуклидов (углерода, азота, кислорода, фтора), которые испускают в процессе распада позитроны. При соединении позитронов с ближайшими электронами происходит их уничтожение (аннигиляция) с выходом в противоположных направлениях двух гамма-квантов. Регистрация этих квантов позволяет получить обычное и объемное изображение объекта, а также исследовать содержание указанных радинуклидов в тканях.
Несомненен прогресс медицинской термографии, которая основана на
бесконтактной дистанционной регистрации градиентов температуры на поверхности тела человека по его инфракрасному излучению, зависящему от различных физиологических и патологических процессов в организме. К основным преимуществам термографии относятся абсолютная безвредность, высокая скорость исследования, высокая разрешающая способность и возможность одномоментной оценки функционального состояния большого числа различных функциональных систем организма (при обзорной термографии).
Если раньше применяли главным образом термографию в микронном диапазоне, при которой регистрируется естественное тепловое излучение поверхности тела человека, то в последнее время появились приборы для регистрации радиоизлучения человека в миллиметровом и дециметровом диапазонах волн, что позволяет определять температуру глубоко расположенных образований. Результатом исследования является термограмма в виде карты распределения температуры по поверхности тела. Анализ карты позволяет дать качественную оценку характера изображения и количественные критерии температурных градиентов. Наиболее эффективно диагностируются заболевания, связанные с нарушением кровообращения и обмена веществ.
Из сказанного видно, что к настоящему времени разработано и внедряется в практику множество различных методов получения диагностического изображения, поэтому практические врачи нуждаются в соответствующих рекомендациях. Как из большого числа существующих методов медицинской визуализации выбрать наиболее эффективный в конкретной клинической ситуации? Какой подход является наиболее эффективным в контексте визуализации этого случая? Какой порядок получения изображения необходим, чтобы обеспечить точную, быструю экономичную диагностику? Не менее важно знать, нужно ли вообще прибегать в ряде случаев к этому методу. В расчет следует принимать и качественные характеристики местного лечебно-профилактического учреждения и ответ на простой вопрос: «Чем можно помочь больному после того, когда будет установлен диагноз?». Следовательно, должны быть определены приоритеты, а порядок выполнения исследований будет иметь много местных вариаций. К сожалению, далеко не всегда и не все'м доступны все методы получения диагностического изображения. Метод визуализации хорош только в руках опытного врача.
По мнению ведущих отечественных и зарубежных ученых, актуальной проблемой современного этапа развития лучевой диагностики является определение объема, порядка и характера выполнения диагностических процедур, связанных с получением медицинского изображения. В зависимости от их сложности и значимости для практического здравоохранения признано целесообразным выделить 3 уровня визуализации.
Первый уровень диагностической визуализации отражает тот минимум, который должен быть принят для обеспечения надлежащего оказания помощи больному. Он включает стандартную рентгенографию, рентгеноскопию с использованием УРИ, конвенциальную линейную томографию, УЗИ с частотой биолокации до 5 МГц.
Во второй уровень диагностической визуализации входят специальные
методики рентгенографии, специализированное УЗИ (внутриполостное, допплеровское, с высокочастотными трансдьюссерами), маммография, ангиография (обычная и дигитальная субтракционная), КТ, термография, радионуклидная сцинтиграфия, включая однофотонную эмиссионную компьютерную томографию. Предполагается, что любое отделение второго уровня должно быть оснащено оборудованием для выполнения методик первого уровня.
К третьему уровню диагностической визуализации относятся все методики, выполняемые на первом и втором уровнях, а также МРТ, позитронная (двухфотонная) эмиссионная томография, иммуносцинтиграфия — метод радионуклидной сцинтиграфии с использованием меченых моноклональных антител. Выбор каждой процедуры визуализации в значительной степени будет зависеть от конкретной клинической ситуации.
Важнейшими являются адекватное оснащение каждого уровня визуализации и соответствие технического оснащения отделения мастерству персонала. Ошибки диагностики, связанные с неадекватной подготовкой и недостаточным опытом врачей и их помощников, представляют не меньшую опасность, чем отсутствие оборудования.
При построении диагностических алгоритмов, экспертных диагностических систем, в основу которых положены принципы диагностической визуализации, важно определение диагностической информативности отдельных видов медицинского изображения. Основополагающими должны быть более точная диагностика, наименьший радиационный риск и минимальная стоимость исследования.
Экономическая ситуация, которую невозможно легко изменить, может быть фактором, ограничивающим выбор диагностического изображения. Следует учитывать и риск ионизирующего излучения. На первичном уровне оказания медицинской помощи рентгенологический метод исследования все еще остается наиболее распространенным. В равной мере это положение справедливо для второго и третьего уровней медицинской помощи, ибо во всех странах мира 80 % диагностических изображений относятся к скелету (50 %) и органам грудной полости (30 %). УЗИ — процедура более дешевая, но в этих областях диагностики оно не играет решающей роли. КТ и МРТ для начального исследования также не могут быть приемлемы. Ни один из современных методов медицинской визуализации не может быть интерпретирован без знания клинического состояния больного, а во многих случаях и без лабораторных данных.
Автор данного руководства считает, что знание альтернативных методов исследования на каждом уровне оказания медицинской помощи будет полезно всем врачам. Поэтому в книге приведены некоторые методологические основы исследования, разработанные Всемирной организацией здравоохранения (1992), которая рекомендует синдромный подход в лучевой диагностике. Для каждого синдрома предлагаются алгоритмы выбора лучевых методов диагностики.
1. Боль в брюшнбй полости (у взрослого).
Боль в брюшной полости может быть острой и хронической: ее причина в ряде случаев определяется возрастом и полом. Выбор процедуры
диагностического изображения зависит от результатов клинического исследования. Маловероятно, что обзорная рентгенография брюшной полости даст полезную информацию, если только боль не может быть достаточно четко клинически охарактеризована. Это относится как к острой, так и хронической боли.
1.1. Острая боль в брюшной полости.
Острая боль в брюшной полости часто сопровождается желудочно-кишечными или другими симптомами, которые прямо указывают на пораженный орган или позволяют поставить диагноз. Она может быть связана с поражением одного из внутренних органов (аппендицит, панкреатит, почечная или печеночная колика, прободение стенки желудка или кишки, кишечная непроходимость, ущемленная грыжа и др.), поражением крупных сосудов (тромбоз и эмболия брыжеечных артерий, тромбоз воротной или печеночных вен), с иррадиацией болей из другой области (пневмония, инфаркт миокарда-, плеврит, пневмоторакс и др.) или может быть проявлением системного заболевания или отравления (соли тяжелых металлов). Боли могут возникнуть и при заболеваниях нервной системы (менингоэнцефалит, опоясывающий лишай и др.), инфекционных болезнях (брюшной тиф, дизентерия, бруцеллез, грипп и др.), гинекологических заболеваниях. Дифференциальная диагностика этих состояний строится прежде всего на изучении анамнестических и клинических данных. Однако нередко лучевая диагностика в этом комплексе приобретает решающее значение.
Основные задачи лучевого исследования: установить причину клинического синдрома; определить локализацию и распространенность патологических изменений в органах брюшной полости; выяснить характер осложнений (внутрибрюшной абсцесс, псевдокиста и др.).
В результате рентгенологического исследования грудной и брюшной полостей могут быть распознаны кишечная непроходимость, прободной пневмоперитонеум, конкременты почек и желчного пузыря, поражения легких и плевры и др. При поражении органов брюшной полости с помощью УЗИ диагностируют холецистит, панкреатит, аппендицит, желчные и почечные камни, небольшие скопления свободного газа в брюшной полости при перфорации язвы желудка или кишки.
Если при рентгенологическом исследовании и УЗИ в условиях естественной контрастности обнаружить признаки прободения полого органа или симптомы кишечной непроходимости не удается, а результаты клинического обследования не позволяют исключить эти патологические состояния, проводят контрастное исследование ЖКТ водорастворимыми контрастными веществами.
При недостаточности данных обычного рентгенологического исследования и УЗИ показана КТ брюшной и тазовой полостей, при подозрении на камень в общем желчном протоке — холесцинтиграфия, при подозрении на нарушение мезентериального кровообращения — мезентерико-графия. Если гастроэнтерит острый неосложненный, диагностические изображения не показаны.
1.1.1. Подозрение на острый аппендицит или перитонит.
Для острого аппендицита характерно появление болей в подложечной области или во всем животе (симптом Кохера — Волковича), впоследствии усиливающихся и локализующихся в правой подвздошной области. Боли носят постоянный характер, не иррадиируют (при ретроцекальном расположении отростка возможна иррадиация в поясницу).
Поскольку перитонит чаще развивается вторично, его клиническая картина обычно наслаивается на симптомы первичного заболевания. Больные жалуются на боли в животе, слабость, жажду, одышку. Боли обычно. резче выражены и более строго локализованы в начале развития перитонита. При перфорациях различных органов отмечается «кинжальная» боль. При распространении воспалительного процесса боль становится менее интенсивной, носит разлитой характер без строгой локализации. Боли могут отсутствовать или быть слабо выраженными в случаях медленно нарастающего хронического перитонита или при молниеносно протекающих формах.
В течении перитонита выделяют три фазы: I фаза продолжается 1 — 2 суток от начала заболевания, II фаза — с 3-го по 5-й день и III фаза — с 5—6-го дня.
Уровень I. Обзорная рентгенография брюшной полости редко (менее чем 10 %) дает полезную диагностическую информацию. УЗИ может принести пользу в клинически сомнительных случаях, однако нормальные данные этого исследования не позволяют исключить воспалительный процесс.
Уровень II. Исследования такие же, как и на уровне I.
1.1.2. Подозрение на острый панкреатит: см. п. 11 «Заболевания поджелудочной железы».
1.1.3. Подозрение на уролитиаз.
Уровень I. Обзорная рентгенография брюшной полости позволяет в большинстве случаев поставить правильный диагноз. Дополнительная информация может быть получена с помощью линейной (конвенциональной) томографии. Если подозревается обструкция мочевыводящих путей, необходимо перейти к УЗИ.
Для того чтобы локализовать камни, изучить функцию почек и выявить обструктивную уропатию, необходимо провести экскреторную урографию. В процессе выполнения урографии можно рекомендовать выполнить цистоуретрографию. Это исследование позволяет определить некоторые заболевания нижних отделов мочевыводящего тракта, способствующие образованию камней.
УЗИ — высокочувствительный метод диагностики почечных камней. Оно обладает большей чувствительностью, чем обзорная рентгенография брюшной полости, но . несколько меньшей, чем сочетанное применение обзорной рентгенографии и линейной томографии. Минимальный размер почечных камней, которые можно выявить ультразвуковой биолокацией, составляет 5 мм. УЗИ менее эффективно при выявлении камней в мочеточнике.
Уровень II. Обычно выполняются те же процедуры, что и на базовом уровне I. Другие более сложные исследования показаны редко.
Для оценки почечной функции, особенно если поражение почек сопровождается почечной недостаточностью или обструктивной уропатией, можно рекомендовать выполнить сцинтиграфию.
Уровень III. МРТ не показана.
1.1.4. Подозрение на расслоение брюшной аорты.
Большинство аневризм имеют атеросклеротическое происхождение, и 95 % из них поражают брюшной отдел аорты ниже отхождения почечных артерий. Аневризмы аорты на почве аортита обычно встречаются у лиц моложе 30 лет (чаще у женщин) и могут вовлекать любую часть аорты.
Уровень I. УЗИ позволяет не только выявить аневризму, но также измерить ее длину и диаметр. Аневризма аорты диаметром более 4 см требует постоянного врачебного контроля. Распространение аневризмы в дистальном направлении аорты не всегда можно диагностировать достаточно уверенно.
Брюшная аортография выполняется в двух проекциях — прямой и боковой, позволяет выявить аневризму в 60—80 % случаев. Однако метод уступает ультразвуковой биолокации в оценке размеров аневризмы и ее протяженности на аорте.
Уровень II. Выполняются те же процедуры, что и на уровне I.
Цветное допплеровское ультразвуковое сканирование может быть использовано для демонстрации вовлеченности в патологический процесс почечных и подвздошных артерий.
Усиленная КТ обычно применяется для визуализации устья почечных артерий и выявления внутрипросветного тромба. КТ имеет преимущества перед УЗИ в выявлении кровоизлияния из аневризмы.
Ангиография при наличии КТ и УЗИ применяется редко, если только не планируется хирургическое вмешательство. Однако дигитальная субтракционная ангиография, в частности с внутривенным введением рентгеноконтрастного вещества, может быть рекомендована для обнаружения вовлечения в патологический процесс почечных и подвздошных артерий.
Сцинтиграфия не применяется.
Уровень III. МРТ благодаря возможности получать срезы в различных плоскостях имеет преимущество перед КТ и УЗИ. Данный метод позволяет получать изображение почечных и подвздошных сосудов, не применяя рентгеноконтрастных средств. Ультразвуковая биолокация более предпочтительна для мониторинга небольших аневризм, не проявляющихся клинически.
1.1.5. Подозрение на перфорацию кишечника: см. п. 6 «Желудочно-кишечная перфорация».
1.1.6. Подозрение на билиарную боль.
Уровень I. УЗИ информативно в диагностике острого холецистита. Оно может выявить конкременты в желчном пузыре, но не позволяет уверенно диагностировать камни в пузырном и общем желчном протоках.
Обзорная рентгенография брюшной полости в прямой проекции менее
информативна, чем УЗИ. Однако, если нет возможности выполнить УЗИ, рентгенограмма брюшной полости может дать определенную полезную информацию. Холеграфия не показана.
Уровень II. Экскреторная гепатобилиарная сцинтиграфия весьма информативна, но следует помнить, что исследование занимает около 1,5 часа.
КТ может выявлять камни в желчных протоках, однако нормальная сцинтиграфия не исключает холелитиаза. Метод дает существенную дополнительную информацию, особенно при наличии у больного абсцесса.
1.1.7. Подозрение на пептическую язву: необходимо провести эндоскопию или контрастное рентгенологическое исследование. Но отрицательные результаты этих процедур не исключают наличия язвы.
1.1.8. Подозрение на заболевания яичников: см. п. 3.8 «Патологические образования в полости таза».
1.1.9. Подозрение на дивертикулит толстой кишки: необходимо провести эндоскопию или контрастное рентгенологическое исследование толстой кишки.
1.1.10. Подозрение на травму: см. п. 12 «Тупая травма живота».
1.1.11. Подозрение на кишечную непроходимость.
Причины острой кишечной непроходимости многочисленны. Динамическая непроходимость (паралитическая и спастическая) может иметь место при перитоните, некоторых заболеваниях нервной системы (спинная сухотка), заболеваниях паращитовидных желез, при истерии, хронической интоксикации свинцом. Обе формы динамической непроходимости могут возникать и рефлекторно при желчнокаменной и почечнокаменной коликах, переломах нижних ребер и др., в связи с чем может быть оправданным применение УЗИ и (или) КТ брюшной полости.
Механическая непроходимость связана с возникновением препятствия в кишке. Тонкокишечная непроходимость встречается сравнительно редко и может быть вызвана опухолью, инвагинацией, обтурацией клубком аскарид, желчными камнями, проглоченными инородными телами, а также возникнуть вследствие узлообразования (странгуляции) или сдавления спайками после перенесенной ранее операции. Острая тонкокишечная непроходимость может быть проявлением тромбоза брыжеечных сосудов. Толстокишечная непроходимость возникает вследствие заворота кишок или обтурации ее опухолью, чаще всего злокачественной.
Уровни визуализации: см. п. 5 «Кишечная непроходимость».
1.1.12. Подозрение на абсцесс брюшной полости: см. п. 3 «Пальпируемое образование брюшной полости (у взрослого)».
1.2. Хроническая боль в брюшной полости.
Хроническая боль в брюшной полости обычно имеет неопределенный характер, трудно локализуема и лишь в редких случаях вызывает изменение состояния больного. Существует сравнительно немного клинических показаний для диагностической визуализации, особено при отсутствии локальных признаков заболевания.
1.2.1. Подозрение на задержку мочи.
Уровень I. УЗИ позволяет точно оценить состояние мочевого пузыря. Оно должно быть повторено после мочеиспускания (или его попытки).
Уровень II. При отсутствии возможности выполнить УЗИ необходимо сделать экскреторную урографию.
Если подозревается обструкция мочеточника, показана контрастная ретроградная уретерография.
1.2.2. Подозрение на воспалительный процесс в кишечнике.
Уровень I. Обзорная рентгенография брюшной полости малоинформативна. УЗИ позволяет установить утолщение петель кишки, однако этот признак малоспецифичен. Метод дает возможность исключить абсцесс брюшной полости.
Уровень II. Необходимо выполнить контрастное рентгенологическое исследование пищеварительного тракта.
1.2.3. Подозрение на лимфоаденопатию брюшной полости.
Уровень I. Рентгенография и УЗИ брюшной полости малоинформативны.
Уровень II. КТ позволяет определить увеличение лимфатических узлов, однако причину лимфоаденопатии с помощью данного метода установить нельзя.
2. Острая боль в брюшной полости (у детей).
Острая боль у младенцев и детей может быть отражением большого числа терапевтических и хирургических заболеваний. Кроме того, она может иметь как интра-, так и экстраабдоминальные причины. В подавляющем большинстве случаев боль в брюшной полости отличается ограниченной продолжительностью и четко не идентифицируется.
Обследование детей с данным патологическим процессом в принципе такое же, как и взрослых, за исключением некоторых присущих только детскому организму заболеваний. Необходимо выполнить обзорную рентгенографию грудной полости, что позволяет исключить пневмонию у детей с острой болью в брюшной полости на фоне повышенной температуры.
2.1. Подозрение на инвагинацию кишечника.
Уровень I. Обзорная рентгенография брюшной полости малоспецифична, однако позволяет выявить обструкцию кишечника, а в далеко зашедших случаях — его некроз или перфорацию.
УЗИ может быть рекомендовано в качестве метода диагностики и одновременно как контролирующий тест при выполнении клизмы с водой.
Уровень II. Ирригоскопия имеет важное диагностическое и одновременно лечебное значение и должна проводиться как неотложная процедура.
КТ показана очень редко.
2.2. Мальротацдя и заворот кишок.
Уровень I. Обзорная рентгенография брюшной полости неспецифична, и нормальная рентгенограмма не позволяет исключить данное состояние.
УЗИ может быть выполнено, но нормальные данные не исключают диагноза.
Уровенъ II. Рентгенологическое исследование с контрастным веществом — неотложная процедура, если только больной не должен подвергнуться немедленному хирургическому вмешательству. Метод всегда позволяет точно поставить диагноз.
КТ не показана.
2.3. Аскаридоз.
Уровень I. УЗИ — гельминты могут быть выявлены внутри различных полых органов, включая гепатобилиарную систему.
Обзорная рентгенография брюшной полости иногда может обнаружить отдельных паразитов либо их скопление в кишечнике.
Уровень II. Рентгенологическое исследование верхних отделов пищеварительного тракта и тонкой кишки путем контрастного завтрака позволяет установить точный диагноз.
КТ не показана.
2.4. Дивертикул Меккеля: см. п. 7 «Желудочно-кишечное кровотечение».
3. Пальпируемое образование в брюшной полости (у взрослых).
Существует множество причин, обусловливающих наличие пальпируемых образований, которые дают весьма различную клиническую картину. Некоторые образования определяются пальпаторно, локализация других может иметь отношение к конкретным органам (например, некоторые метастазы).
Медицинские изображения позволяют в большинстве своем установить происхождение и природу пальпируемых образований в брюшной полости.
3.1. Пальпируемые образования неизвестной природы.
Уровень I. УЗИ в большинстве случаев позволяет установить связь образования с органами брюшной полости, а также природу патологического процесса. Однако при наличии больших образований с вовлечением в патологический процесс нескольких органов, как это нередко бывает, например, при опухолях малого таза, информативность УЗИ оказывается невысокой.
Если УЗИ органов брюшной полости выполнить невозможно либо его данные сомнительны, определенную пользу может дать обзорная рентгенограмма брюшной полости в прямой проекции в положении больного лежа на спине. В некоторых случаях по рентгенограмме можно определить природу образования (например, фибромы, дермоидные и эхинококковые кисты), но, как правило, такие рентгенограммы не несут специфической информации и не влияют на тактику дальнейшего ведения больного.
Если клинически предполагается связь патологического образования с ЖКТ, необходимо также выполнить обзорную рентгенографию брюшной полости в прямой проекции и в вертикальном положении больного.
Если подозревается вовлечение в патологический процесс скелета, обязательна рентгенография этой области, например костей таза или поясничного отдела позвоночника.
Рентгенография грудной полости необходима в тех случаях, когда подозревается злокачественная природа опухоли либо образование располагается в верхней части брюшной полости. Это исследование рекомендуется выполнять у всех лихорадящих больных.
Уровень II. Методом выбора, как и на уровне I, является УЗИ. Если диагноз с помощью этого метода поставлен, то в других процедурах визуализации нет необходимости.
Контрастное рентгенологическое исследование верхних отделов пищеварительного тракта, особенно с применением методики ДК, достаточно надежно выявляет опухоли желудка и 12-перстной кишки. Обнаружение опухолей толстой кишки следует проводить с помощью ирригоскопии. Следует отдать предпочтение методике ДК, которая позволяет устанавливать патологические образования небольших размеров.
Экскреторная урография не показана, за исключением тех случаев, когда невозможно осуществить УЗИ либо клинически предполагается связь образования с почками или ретроперитонеальным пространством.
КТ может быть проведена только в тех случаях, когда выполненное УЗИ оказывается неинформативным.
Сцинтиграфия не имеет преимуществ перед КТ и может быть проведена в тех случаях, когда нет возможности выполнить КТ. Специфичность сцинтиграфии низка. Сцинтиграфия с галлием позволяет диагностировать внутрибрюшной абсцесс. Выполненная с органотропными препаратами сцинтиграфия дает возможность получить изображения отдельных органов.
Уровень III. МРТ не имеет преимуществ перед КТ и УЗИ.
3.2. Образования в печени.
Уровень I. В качестве первого метода исследования, дающего всю необходимую для дальнейшего лечения больного информацию, следует применять УЗИ. При нормальных сканограммах печени вероятность патологических образований, превышающих в диаметре 2 см, чрезвычайно мала. Однако если клинически подозревается абсцесс печени, а УЗ-картина нормальная, исследование необходимо повторить через 24 ч. Это объясняется тем, что развивающийся абсцесс печени при УЗИ иногда не обнаруживается. Если клинически предполагается наличие злокачественного заболевания и нарастает гепатомегалия, рекомендуется повторить УЗИ через 2 недели или еще позднее.
Рентгенография органов грудной полости — при наличии в печени патологических образований значительных размеров позволяет визуализировать диафрагму и выявить плевральную жидкость или поражение органов грудной полости. Рентгенографию рекомендуется выполнять в двух проекциях: передней прямой и боковой.
При сомнительных результатах УЗИ или отсутствии возможности его проведения можно рекомендовать обзорную рентгенографию брюшной полости в задней прямой проекции в положении больного лежа на спине. Такой снимок иногда выявляет очаги обызвествления в печени. Если
подозревается абсцесс печени, определенную помощь может оказать рентгенография брюшной полости в вертикальном положении больного, на которой можно получить изображение горизонтального уровня жидкости. Подобные находки при обзорной рентгенографии брюшной полости нечасты, однако их обнаружение очень важно для постановки диагноза.
Уровень II. Так же, как и на уровне I, первоначально следует выполнить УЗИ, дополнив его при необходимости биопсией.
При сомнительных данных УЗИ определенную ценность в диагностике объемных поражений печени может представить КТ. Однако метод не позволяет ’ дифференцировать воспалительные и опухолевые поражения.
Сцинтиграфия может обнаруживать абсцессы печени, опухоли или метастазы. Но этот метод характеризуется высокой частотой ложнонегативных результатов и низкой специфичностью.
Ангиография может быть полезна для идентификации сосудистых опухолей и абсцесса печени в тех случаях, когда невозможно провести КТ или УЗИ.
Уровень III. МРТ имеет одинаковый потенциал диагностики объемных образований печени с КТ.
3.3. Патологические образования в области желчевыводящих путей.
Уровень I. УЗИ позволяет обнаружить расширение желчного пузыря и холелитиаз. Не представляет труда дифференцировать эмпиему желчного пузыря, однако распознание злокачественного поражения затруднено, если только нет признаков экспансии опухоли. Легко диагностируются кисты желчного протока.
Уровень II. УЗИ полезно, выполняется так же, как и на уровне I.
Если данные УЗИ ошибочны или сомнительны, визуализация желчного пузыря осуществляется надежно с помощью КТ.
Уровень III. МРТ, как и КТ, наглядно демонстрирует расширение желчного пузыря.
Обзорная рентгенография брюшной полости может выявить камни в желчном пузыре, но маловероятно, что на снимках можно обнаружить расширение желчного пузыря.
3.4. Образование поджелудочной железы: см. п. 11 «Заболевания поджелудочной железы».
3.5. Подозрение н^ патологическое образование, исходящее из желудочно-кишечного тракта: см. п. 1 «Боль в брюшной полости; п. 3.1 «Пальпируемое образование неизвестной природы»; п. 7 «Желудочно-кишечное кровотечение».
3.6. Подозрение на абсцесс в брюшной полости.
Клинические признаки внутрибрюшного сепсиса обычно неопределенны. Частота его среди пальпируемых образований в брюшной полости невысока. Заболевание, как правило, носит тяжелый характер. Исследование таких больных затруднено. Дети поражаются чаще, чем взрослые.
Уровень I. УЗИ позволяет определить глубину и распространенность пальпируемого образования, что имеет важное значение при чрескожном
или хирургическом дренировании абсцесса. Метод информативен при большинстве абсцессов, находящихся в печени, селезенке, почках, органах малого таза, а также в окружающей все эти органы клетчатке. Абсцессы, локализованные центрально или в левой половине брюшной полости, могут при УЗИ не выявляться из-за прикрытия их петлями толстой кишки. Для уточнения ультразвуковой визуализации таких абсцессов можно рекомендовать исследование с вращением больного.
Обзорная рентгенография брюшной полости, выполненная при горизонтальном ходе рентгенова луча, позволяет выявить горизонтальный уровень жидкости в полости абсцесса, невидимый при УЗИ. При локализации абсцесса в левом поддиафрагмальном пространстве можно рекомендовать контрастное рентгенологическое исследование желудка: выявляется косвенный симптом абсцесса — смещение желудка. Следует, однако, отметить, что рентгенография менее чувствительна, чем УЗИ.
При рентгенографии грудной полости может выявляться высокое стояние купола диафрагмы, обусловленное поддиафрагмальным абсцессом. В тех случаях, когда имеются отчетливые клинические признаки абсцесса в брюшной полости, а методы исследования, выполненные на данном уровне, оказываются неэффективными, необходимо продолжить исследование.
Уровень II. УЗИ является методом выбора. В большинстве случаев оно позволяет установить абсцесс и его локализацию. Обычно этой процедурой исследование больного заканчивается и производится чрескожное или хирургическое дренирование абсцесса.
Если УЗИ не позволяет определить локализацию абсцесса, следует выполнить КТ. Она дает возможность выявить внутрибрюшинное или забрюшинное скопление жидкости.
Необходимо принять во внимание, что КТ и УЗИ, обнаруживая ограниченное скопление жидкости в брюшной полости, не позволяют установить факт ее инфицирования. Для этой цели нужны тонкоигольная аспирация жидкости и ее микробиологическое исследование. При значительном расширении кишечника некоторые абсцессы становятся недоступными для обнаружения.
Сцинтиграфия показана лишь у небольшого числа больных, у которых данные КТ и УЗИ представляются сомнительными. В определении локализации пиогенных абсцессов следует отдать предпочтение исследованию с мечеными лейкоцитами, которое более эффективно, чем применение галлия. Кроме того, сцинтиграфия с мечеными лейкоцитами требует меньше времени, чем исследование с галлием. В тех случаях, когда тонкоигольная биопсия по тем или иным признакам затруднена, сцинтиграфия может подтвердить факт инфицирования локального скопления жидкости, выявленного ранее при КТ или УЗИ.
3.7. Спленомегалия.
Уровень I. УЗИ позволяет точно определить размеры селезенки, выявить в ней зону инфаркта, кистозное поражение, абсцесс, злокачественную инфильтрацию.
На обзорной рентгенограмме брюшной полости, выполненной в верти
кальном положении больного, иногда удается обнаружить горизонтальный уровень жидкости в локализованном в селезенке абсцессе.
Уровень II. КТ позволяет определить спленомегалию, инфицирование и инфаркт селезенки.
Уровень III. МРТ менее чувствительна, чем КТ.
3.8. Патологические образования в полости таза.
Источником данной локализации патологических образований могут быть кишечник, мочевыводящие пути, скелет. Однако чаще всего патологические образования указанной локализации обусловлены поражением внутренних половых органов. Новообразования, исходящие из мочевыводящего тракта или ободочной и прямой кишок, чаще вызывают симптомы кровотечения и кишечной непроходимости, чем симптом пальпируемого патологического образования.
При обследовании женщин с пальпируемыми образованиями в полости таза всегда следует исключить беременность.
Уровень I. УЗИ позволяет идентифицировать пальпируемые образования в 90 % случаев. Однако данный метод менее чувствителен в установлении локализации и природы пальпируемых образований. Так, дифференциальная диагностика рака яичника и простой овариальной кисты на основании УЗИ затруднена. Чрезвычайно важна корреляция с клиническими данными. Этот метод можно использовать для выявления лимфо-аденопатии и опухолей, исходящих из костей таза. В последнем случае предпочтительнее до УЗИ осуществить рентгенографию скелета.
Если УЗИ выполнить невозможно, рекомендуется провести рентгенографию области таза в положении больного лежа на спине. Однако маловероятно, что такое исследование окажет существенное влияние на последующее лечение. При наличии клинических признаков кишечной непроходимости необходимо дополнительно сделать рентгеновский снимок в вертикальном положении больного. Для исключения колоректальной опухоли обязательна эндоскопия, затем ирригоскопия.
Уровень II. Выполняются те же процедуры, что и на уровне I. УЗИ и обзорная рентгенография области таза имеют аналогичные показания.
При вовлечении в патологический процесс мочевыводящих путей показана экскреторная урография, которую желательно дополнить осадочной цистографией.
В тех случаях, когда на основе УЗИ не удается точно установить природу пальпируемого образования, показана КТ. С помощью этого метода можно выявить увеличение лимфатических узлов, но нельзя установить злокачественную природу лимфоаденопатии.
Лимфография позволяет более точно определить метастатическое поражение лимфатических узлов полости таза, однако не визуализирует лимфатические узлы внутренней подвздошной группы. Нормальная лим-фограмма не исключает метастазов.
Уровень III. МРТ может быть эффективным методом выявления метастазов в лимфатические узлы. В целом информативная способность метода близка к КТ. Вместе с тем можно полагать, что МРТ имеет несколько большую чувствительность в обнаружении прорастания первичной
опухоли в окружающие ткани или в определении экстранодулярных метастазов. МРТ может диагностировать опухоли очень малых размеров с чувствительностью 100 %.
4. Патологические образования в брюшной полости (у детей).
Патологические образования у новорожденных и детей могут иметь врожденную, опухолевую, воспалительную и травматическую природу. Пальпируемые образования в 90 % случаев сопровождаются жалобами. Симптомы заболевания могут быть ограничены брюшной полостью либо иметь распространенный характер и сопровождаться сочетанием ряда признаков. Цель получения изображений — необходимость выявить и локализовать образования, охарактеризовать их структуру, установить протяженность, определить диагностические и терапевтические процедуры. Общие рекомендации для получения изображения у детей совпадают с таковыми у взрослых (см. п. 3).
Уровень I. УЗИ должно использоваться в качестве первого шага, чтобы определить локализацию образования и его характер: кистозное, солидное или смешанное. В некоторых случаях врожденных аномалий и воспалительных заболеваний УЗИ позволяет поставить окончательный диагноз и других процедур проводить не следует.
Если данные УЗИ сомнительны, рентгенография грудной и брюшной полостей может оказаться полезной в выявлении обызвествлений в образованиях, костных поражений и аномалий развития легочных метастазов. В других случаях указанная рентгенография имеет ограниченное значение.
Уровень II и III. УЗИ выполняется так же, как и на уровне I. Устанавливается предположительный диагноз. Дополнительные исследования обязательны только при сомнительных результатах УЗИ или при необходимости получить какую-либо дополнительную информацию для назначения лечения. Последовательность процедур получения изображений обычно определяется типом предполагаемого пальпируемого образования.
Экскреторная урография может быть полезна для уточнения локализации и морфологической характеристики образования в тех случаях, когда данные УЗИ сомнительны. Если же аппаратура для УЗД отсутствует, экскреторная урография должна стать первым диагностическим исследованием. В дополнение к ней может быть выполнена венокавография.
Осадочная цистоуретерография может идентифицировать сторону, причину и последствия обструкции нижних отделов мочевыводящего тракта.
Определенную диагностическую информацию можно получить при рентгенологическом контрастном исследовании ЖКТ.
Рентгенологическое исследование половых органов (генитография) показано при врожденной утеровагинальной патологии. Потребность в нем иногда возникает в случае сомнительных результатов УЗИ.
Артериография и венокавография показаны редко и только тогда, когда нет возможности выполнить КТ и УЗИ. Вместе с тем артериография может оказать существенную помощь в локализации злокачественного поражения печени перед хирургическим лечением.
Сцинтиграфия с галлием у детей не показана.
4.1. Подозрение на гидронефроз.
Почечная сцинтиграфия (статическая и динамическая) более чувствительна, чем экскреторная урография, в изучении почечной функции, особенно у новорожденных.
4.2. Подозрение на опухоль Вильмса (нефробластому).
КТ позволяет точно определить границы опухоли, чувствительна при выявлении двусторонних поражений. Для исключения метастазов необходимо исследовать не только брюшную, но и грудную полость. Распространение опухоли на нижнюю полую вену устанавливается также с помощью КТ или УЗИ.
МРТ является высокочувствительным методом распознавания поражения сосудов опухолью, однако обычная реальная потребность в этом исследовании невелика.
4.3. Подозрение на нейробластому.
КТ позволяет более точно, чем обзорная рентгенография, установить кальцификаты и распространенность опухоли.
Сцинтиграфия С (l31I) MIBG дает возможность выявить метастазы в костный мозг (чувствительность 90 %). Исследование может использоваться для идентификации первичных скрытых опухолей.
МРТ более эффективна, чем КТ, в установлении локализации опухоли, распространяющейся на лимфатические узлы и сосуды.
4.4. Подозрение на гемангиоэндотелиому печени.
УЗИ не отличается высокой специфичностью, однако может оказать большую пользу в клиническом наблюдении больного, может быть полезной и допплеровская ультразвуковая биолокация.
Сцинтиграфия печени (динамическая и статическая) — высокочувствительный и высокоспецифичный метод диагностики и может быть первой диагностической процедурой при наличии выраженных клинических признаков гемангиоэндотелиомы.
Артериография показана только в случае безуспешности терапевтического лечения и необходимости выполнить лечебную эмболизацию сосуда.
КТ и МРТ не показаны.
4.5. Подозрение на неонатальную геморрагию надпочечников (диагноз обычно предполагается клинически).
УЗИ — высокочувствительный и высокоспецифичный метод распознавания данного заболевания и может использоваться для наблюдения за разрушением гематомы.
КТ, сцинтиграфия и МРТ не показаны.
5. Кишечная непроходимость.
Диагноз кишечной непроходимости практически всегда основывается на результатах рентгенографии брюшной полости и контрастного исследования пищеварительного тракта.
Уровень I. Обзорная рентгенография брюшной полости (в прямой проекции в положении больного лежа на спине и стоя) должна быть первой диагностической процедурой. У маленьких детей и тех взрослых, у которых невозможно провести снимки стоя, может быть выполнена латерография с горизонтальным ходом рентгенова луча. Рентгенография имеет высокую (80 %) чувствительность, но незначительную специфичность. Нормальная рентгенограмма не исключает кишечную непроходимость.
Рентгенография грудной полости необходима для выявления пневмонии, особенно у пожилых и детей.
Последующая очередность получения диагностических изображений будет определяться наличием или отсутствием признаков кишечной непроходимости, выявленного уровня обструкции и других обнаруженных патологических изменений, например кишечной перфорации:
а) нормальная рентгенограмма: в других диагностических изображениях нет необходимости. Странгуляционную непроходимость исключить нельзя;
б) патологические изменения на рентгенограмме: в некоторых случаях рентгенологические данные позволяют назначить лечение, в других для решения вопроса о характере лечения необходимо выполнить контрастное рентгенологическое исследование ЖКТ;
в) непроходимость толстой кишки или нижнего отдела тонкой кишки (низкая непроходимость): рентгенологическое исследование толстой кишки обычно выявляет уровень непроходимости, однако зто исследование неспецифично. Исследование кишечника с пероральным введением контрастной массы малоэффективно;
г) непроходимость на уровне желудка и верхних отделов тонкой кишки (высокая непроходимость): при острой форме непроходимости контрастное рентгенологическое исследование не показано. В случае хронической непроходимости контрастное исследование позволяет надежно определить уровень препятствия, менее надежно — его причину.
УЗИ — при сомнительных данных обзорной рентгенографии брюшной полости УЗИ позволяет обнаружить расширенные, содержащие жидкость, утолщенные стенки кишечника. В таких случаях необходимо исключить воспаление и гастроэнтерит:
а) подозрение на пилорический стеноз: УЗИ является чувствительным и специфичным методом диагностики этого заболевания. При отсутствии УЗ-аппарата можно рекомендовать контрастное рентгенологическое исследование верхних отделов ЖКТ. Метод обычно обеспечивает получение всей необходимой информации, однако, если его результаты нормальные, наличие стеноза привратника не может быть исключено;
б) подозрение на заворот кишечника: УЗИ может демонстрировать заворот. Но при вовлечении в патологический процесс толстой кишки обязательна ирригоскопия, которая одновременно может быть использована как попытка ликвидировать заворот.
Уровень II и III. КТ, сцинтиграфия и МРТ не показаны, так как не обеспечивают получения полезной информации при острой непроходимости кишечника.
6. Желудочно-кишечная перфорация.
Желудочно-кишечная перфорация может проявляться пневмоперито-неумом и (или) перитонитом.
Уровень I. Обзорная рентгенография брюшной полости. Если состояние больного позволяет перевести его в вертикальное положение, необходимо сделать два снимка в прямой задней проекции: в вертикальном положении и в положении лежа на спине. В последнем случае рентгенограмма должна захватывать область таза. Когда же состояние больного не позволяет перевести его в вертикальное положение, а также у новорожденных и детей младшего возраста, надо выполнить снимок в положении лежа на боку или на спине при горизонтальном ходе рентгенова луча. При этом всегда обязательно получать изображение диафрагмы.
Нормальные снимки или неспецифические рентгенологические находки не исключают перфорации. В таких случаях следует продолжить наблюдение и, если потребуется, повторить рентгенографию брюшной полости.
УЗИ показано, если пневмоперитонеум не удается обнаружить на рентгенограммах брюшной полости. Оно должно предшествовать контрастному исследованию пищеварительного тракта.
Контрастное рентгенологическое исследование ЖКТ показано только в тех случаях, когда результаты всех предыдущих методов сомнительны либо имеются отчетливые клинические признаки скрытой перфорации. Выбор исследований верхнего или нижнего отделов пищеварительного тракта должен диктоваться клиническими данными; при этом обычно применяют водорастворимые контрастные вещества.
Уровень II и III. Получение медицинских изображений на этих уровнях оправдано редко.
7. Желудочно-кишечное кровотечение.
Причины желудочно-кишечных кровотечений меняются в зависимости от возраста больного и уровня поражения (верхний — от пищевода до тощей кишки; нижний — от подвздошной кишки до прямой). Уровень кровотечения обычно предполагается клинически (например, по наличию кровавой рвоты либо мелены). Диагноз часто может быть поставлен на основании эндоскопии без процедур визуализации. Необходимость последних диктуется тяжестью состояния больного и остротой кровотечения. Получение диагностических изображений должно выполняться в условиях, обеспечивающих проведение возможных реанимационных мероприятий.
7.1. Острое кровотечение.
В острой стадии терапевтическое вмешательство строится с учетом тяжести кровотечения, и диагноз обычно устанавливается на основе эндоскопии.
7.1.1. Тяжелое, обильное кровотечение.
Уровень I. Обзорная рентгенография грудной и брюшной полостей, УЗИ и контрастное рентгенологическое исследование ЖКТ могут ухуд
шить клиническое состояние больного и задержать проведение необходимой терапии.
Уровень II. Брюшная артериография показана больным с тяжелым, угрожающим жизни кровотечением для идентификации уровня поражения, если это невозможно сделать с помощью эндоскопии. Метод позволяет также провести терапевтическую эмболизацию. Ангиография не показана в тех случаях, когда активное кровотечение остановлено. Метод малоэффективен при исследовании больных с острым кровотечением из варикозно расширенных вен пищевода.
Сцинтиграфия с мечеными эритроцитами или коллоидом позволяет также локализовать уровень кровотечения, что может оказать помощь в проведении последующей эндоскопии, ангиографии или хирургического лечения. При перемежающемся кровотечении сцинтиграфию можно повторить через 24 ч.
7.1.2. Подострое кровотечение.
Уровень I. Обзорная рентгенография брюшной полости не дает полезной информации.
УЗИ может быть использовано для изучения спленопортальной венозной системы у больных с варикозным расширением вен.
Уровень II. Контрастное рентгенологическое исследование пищеварительного тракта дополняет эндоскопию.
Ангиосцинтиграфия может быть использована для локализации уровня кровотечения.
Сцинтиграфия с пертехнетатом — чувствительный метод при выявлении дивертикула Меккеля, даже если кровотечение отсутствует.
Если данные эндоскопии и других медицинских изображений нормальные, а кровотечение продолжается, необходимо прибегнуть к артериографии.
Для больных с варикозным расширением вен пищевода при планировании хирургического шунтирования может быть рекомендована портальная венокавография.
7.2. Хроническое кровотечение.
Прежде чем предпринять процедуры визуализации, необходимо лабораторными методами подтвердить наличие скрытого кровотечения. В таких случаях эндоскопия может предшествовать снимкам.
Уровень I. Обзорная рентгенография брюшной полости и УЗИ не дают полезной информации.
Уровень II. Контрастное рентгенологическое исследование ЖКТ, включающее ирригоскопию, может иногда оказаться полезным в установлении уровня кровотечения.
При продолжающемся кровотечении показаны сцинтиграфия и ангиография; эти исследования должны быть проведены немедленно, если возобновляется активное кровотечение.
Уровень III. МРТ не дает полезной информации.
8. Асцит.
Асцитом называется скопление в брюшной полости свободной жидкости, включая серозную жидкость, кровь, хилезную жидкость, мочу, гной и желчь.
В большинстве случаев для постановки диагноза достаточно клинического и лабораторного исследования больного с асцитом. Однако в некоторых случаях, даже когда причина асцита представляется ясной, важно получить изображения, чтобы выявить другие, скрытые при клиническом исследовании патологические состояния (например, у больных с асцитом на почве цирроза печени может быть скрытая гепатома). Диагноз, основанный на данных чрескожной аспирации, ненадежен. Однако это исследование дает возможность иногда распознать гранулему, вызванную тальком для хирургических перчаток.
Уровень I. УЗИ выявляет небольшое количество (до 100 мл) жидкости (чувствительность 80—95 %). Если при исследовании признаки асцита не определяются, получение дальнейших диагностических изображений неоправданно. При выявлении асцита необходимо провести УЗИ нижних отделов грудной полости для исключения сопутствующего плеврального выпота. В случае положительных данных следует выполнить рентгенографию грудной полости.
При отсутствии аппаратуры для УЗИ можно рекомендовать обзорную рентгенографию брюшной полости, которая обнаруживает сравнительно большое (более 800 мл) количество жидкости.
Уровень II. Если причина асцита с помощью УЗИ не установлена или имеется большое количество жидкости, необходимо провести КТ. Это исследование особенно ценно в распознавании ретроперитонеальной опухоли.
При подозрении на портальную гипертензию можно рекомендовать допплерографию.
Уровень III. МРТ не имеет преимуществ перед КТ.
9. Желтуха у взрослых.
Прежде всего обязательно клинически дифференцировать гемолитическую, холестатическую и гепатоцеллюлярную желтуху. При последнем виде желтухи получение диагностических изображений не показано. Редко возникает необходимость получать изображение органов брюшной полости у больных гемолитической желтухой, за исключением тех случаев, когда имеется подозрение на пигментные камни. Рентгенография и сцинтиграфия скелета могут оказаться полезными в выявлении костных инфарктов и инфекционного поражения.
9.1. Холестатическая желтуха.
Важный момент диагностики — дифференциация терапевтических и хирургических причин желтухи, поскольку оперативное вмешательство у больных гепатитом не дает благоприятного результата и сопровождается высокой смертностью, тогда как декомпрессия желчных протоков является необходимой хирургической процедурой при механической желтухе.
Уровень I. Показано УЗИ печени и желчевыводящих протоков. Расширение последних указывает на механическую причину желтухи с высо
кой степенью надежности. Вместе с тем отсутствие расширения желчных протоков не позволяет полностью исключить обструкцию желчных путей (специфичность 90 %).
Менее надежно УЗИ в установлении причины обструкции, однако если уровень поражения и его причина с помощью УЗ-метода установлены, дальнейшие исследования не показаны.
При нормальной УЗ-картине желчных путей, сочетающейся с устойчиво высокой билирубинемией, необходимо повторить это исследование.
Обзорная рентгенография брюшной полости малоинформативна; рентгенологическая диагностика желчных камней на основании этого метода ненадежна.
Уровень II. Пероральная холецистографии и внутривенная холеграфии у больных желтухой не показаны.
УЗИ выполняется так же, как и на уровне I.
КТ может визуализировать опухоли печени и поджелудочной железы, паразитов в желчевыводящих путях и некоторые камни в нижних отделах желчевыводящих путей, не видимые при УЗИ.
При отсутствии возможности выполнить КТ следует провести чрескожную транспеченочную холангиографию, которая служит надежным методом установления причины механической желтухи.
Эндоскопическая ретроградная холангиопанкреатография необходима в тех случаях, когда уровень поражения желчевыводящих протоков не может быть установлен на основе КТ и УЗИ.
Гепатобилиарная экскреторная сцинтиграфия может показать уровень обструкции желчных путей, однако данный метод неспецифичен.
Уровень III. МРТ не имеет преимуществ перед УЗИ и КТ.
10. Желтуха у детей.
Показания для проведения процедур диагностического изображения те же, что и у взрослых (см. п. 9).
Уровень I. УЗИ дает возможность диагностировать аскаридоз или другую паразитарную инвазию как причину холестатической желтухи. У больных с пролонгированной неонатальной желтухой указанный метод может выявить врожденную кисту желчного протока.
Уровень II и III. Гепатобилиарная экскреторная сцинтиграфия может быть использована у новорожденных с пролонгированной желтухой, чтобы дифференцировать неонатальный гепатит от билиарной атрезии.
11. Заболевания поджелудочной железы.
У больных с поражением поджелудочной железы имеется широкий спектр клинических симптомов, включая боль в области живота или спины, потерю массы тела, желтуху, диабет и стеаторею.
Лабораторная диагностика позволяет распознавать острый панкреатит.
Уровень I. УЗИ поджелудочной железы часто оказывается затрудненным из-за скопления газа в толстой кишке. Если же его удастся выполнить, то на УЗ-сканограммах может быть обнаружена аномалия развития железы.
УЗИ может быть полезным в диагностике следующих патологических состояний:
а) кисты или псевдокисты поджелудочной железы (возможность их дифференциации отсутствует);
б) камни желчного пузыря, которые могут встречаться у больных панкреатитом;
в) расширение желчевыводящих протоков.
Иногда этот метод позволяет дифференцировать панкреатит от опухоли поджелудочной железы. Если данные УЗИ неубедительны, необходимо перейти к дальнейшим медицинским изображениям.
Обзорная рентгенография брюшной полости может выявить обызвествления в поджелудочной железе, встречающиеся при хроническом панкреатите и камнеобразовании. Однако с помощью этого метода нельзя дифференцировать указанных два патологических состояния. Камни могут быть обнаружены также в билиарной системе. В пользу панкреатита могут свидетельствовать выявляемые на рентгенограмме небольшие скопления жидкости и газа в отдельных прилежащих к поджелудочной железе петлях тонкой кишки. Это ценный, но неспецифический признак панкреатита. Нормальный рентгеновский снимок не исключает заболевания поджелудочной железы.
Рентгенограмма грудной полости обнаруживает скопление жидкости в левой плевральной полости у 30 % больных панкреатитом. Нормальная рентгенограмма грудной полости не может исключить панкреатит.
Уровень II. На этом уровне выполняются те же процедуры, что и на уровне I.
Первым шагом должно быть УЗИ. О кровотоке в области поджелудочной железы можно судить по дуплексному или доплеровскому исследованию. УЗИ помогает также выполнить тонкоигольную биопсию поджелудочной железы.
Контрастное рентгенологическое исследование верхних отделов ЖКТ может выявить нарушение развития поджелудочной железы при увеличении ее размеров, однако эти находки неспецифичны.
С помощью КТ можно распознать увеличение размеров поджелудочной железы и наличие в ней дополнительных патологических образований. Но дифференцировать опухоль от воспалительного процесса затруднительно.
Сцинтиграфия нецелесообразна.
Эндоскопическая ретроградная холангиопанкреатография дает возможность изучить панкреатический проток, что особенно важно при врожденной его аномалии, которая сопровождается хроническим панкреатитом с болевым синдромом. Это исследование показано в тех случаях, когда все другие методы визуализации оказываются несостоятельными.
Чрескожная транспеченочная холангиография показана при наличии признаков нарушения проходимости желчных путей (см. п. 9 «Желтуха у взрослых»).
Артериография — специфичный метод в диагностике опухолей островковых клеток. Это исследование рекомендуется в тех случаях, когда отсутствует возможность выполнить КТ, а состояние больного требует хирургического вмешательства. Следует помнить, что артериография не позволяет дифференцировать панкреатит от опухоли железы. При эндо
кринных опухолях важное значение может иметь артериальное и чреспеченочное исследование портальной вены.
Уровень III. МРТ менее чувствительна, чем КТ, в распознавании заболеваний поджелудочной железы и не позволяет дифференцировать хроническое инфекционное поражение от злокачественного новообразования.
12. Тупая травма живота.
Травма живота обусловливает 10 % случаев смерти лиц, подвергшихся травме. При закрытой травме живота у пострадавших часто имеются значительные повреждения скелета. Однако последние не должны отвлекать клинициста от повреждений органов брюшной полости, в большей степени угрожающих жизни.
Выбор диагностического изображения определяется клиническим состоянием больного и тяжестью травмы.
12.1. Подозрение на повреждение органов пищеварительной системы.
12.1.1. Неустойчивое состояние пострадавшего.
При таком состоянии времени для получения медицинских изображений может и не быть. Для диагностики рекомендуется выполнить лаваж, хотя точность его невысока.
12.1.2. Стабильное состояние пострадавшего после значительной травмы.
Уровень I. Показано УЗИ, с помощью которого определяется внутри-брюшная жидкость. Одновременно визуализируется печень, почки, селезенка. Такое исследование эффективно даже в случае тяжелой травмы. По клиническим показаниям могут быть произведены повторные исследования.
Рентгенография грудной и брюшной полостей в задней прямой проекции проводится в положении больного на спине. В зависимости от клинических данных могут быть выполнены дополнительные снимки при горизонтальном ходе рентгенова луча в положении больного на спине или на боку (латерография).
Рентгенография и УЗИ дополняют друг друга и, если возможно, должны быть выполнены у всех пострадавших.
Уровень II. КТ проводится тогда, когда данные УЗИ неинформативны. Метод более точно, чем перитонеальный лаваж, позволяет выявить внутри-брюшную жидкость. Он надежно устанавливает забрюшинную гематому и повреждение органов. Важной особенностью КТ является способность определять количество свободной (излившейся) крови.
Если перитонеальный лаваж уже выполнен, необходимость в КТ отпадает.
При отсутствии возможности выполнить УЗИ и КТ следует предпринять рентгенографию, как на уровне I.
Радионуклидное исследование или ангиография в таких случаях позволяют определить разрыв органа и место кровотечения.
Уровень III. МРТ таким больным не проводится из-за технических трудностей.
12.1.3. Стабильное состояние пострадавшего после небольшого повреждения.
Уровень I. Рентгенография грудной и брюшной полостей в положении стоя и лежа на спине. Вслед за этим должно быть выполнено УЗИ, которое дает возможность определить субкапсулярную гематому, разрывы печени и селезенки.
Если результаты исследования позитивны, переходят к необходимому лечению. При сомнительных данных выполняют УЗИ в соответствии с клиническим состоянием пострадавшего. Если результаты негативные, то в других исследованиях нет необходимости.
Уровень II. Выполняются те же процедуры, что и на уровне I.
При сомнениях в диагностике вместо повторного УЗИ рекомендуется провести КТ.
12.2. Подозрение на повреждение почек.
При тяжелой травме почек общепринятой практикой является оперативное вмешательство. Однако все большее распространение и признание при многих типах закрытых повреждений почек начинает получать подход, основанный на консервативном ведении пострадавшего.
Травма почки может быть изолированной или, что встречается чаще, сочетаться с повреждением других органов брюшной полости (см. п. 12.1). Продолжающаяся боль и гематурия свидетельствуют о повреждении нижних отделов мочевыводящих путей (см. п. 12.3).
Уровень I. Вначале необходимо выполнить обзорную рентгенографию брюшной полости в положении больного на спине, дополненную экскреторной урографией. Нормальные данные обычно позволяют исключить значительное повреждение почек. Если клинически сохраняется подозрение на повреждение почки, обязательно УЗИ.
При патологических данных урографии на УЗ-сканограммах, как правило, удается выявить субкапсулярное, околопочечное или внутрипочечное кровоизлияние. УЗИ должно служить базовым исследованием, если рекомендуется консервативное лечение.
Уровень II. Выполняются те же процедуры, что и на уровне I. Затем переходят к КТ. Если КТ и УЗИ выполнить невозможно, можно рекомендовать радионуклидную перфузионную сцинтиграфию почек, с помощью которой распознаются паренхиматозные повреждения. При наличии КТ необходимость в почечной ангиографии обычно отсутствует.
Уровень III. МРТ не проводится, если есть данные КТ.
12.3. Подозрение на повреждение органов области таза.
Травма области таза нередко сопровождается переломами его костей, что приводит к серьезной заболеваемости и стойкой инвалидности, а также является главной причиной смерти пострадавших. Обычно подобные переломы сочетаются с переломами конечностей и повреждениями органов брюшной полости и таза.
Уровень I. Неотложные сохраняющие жизнь лечебные мероприятия должны предшествовать любым медицинским изображениям у больных с множественными повреждениями, особенно при тяжелых травмах живота и области таза. „„„
При нестабильном состоянии пострадавшего выполняется рентгенография костей таза в прямой задней проекции в положении его на спине. Если состояние пострадавшего стабильное, к прямому снимку таза добавляется боковой снимок шейки бедра. У больных с ацетабулярными переломами полезную информацию могут дать конвенциальная томография и снимки в косых проекциях.
Уровень II. Выполняются те же процедуры, что и на уровне I.
При клиническом подозрении на разрыв мочеточника необходима цистоуретерография.
КТ обнаруживает ацетабулярные переломы и внутрисуставные костные отломки. Четко отграничивается поражение мягких тканей.
Ангиография с эмболизацией могут быть полезны у пострадавших с внутрисуставным кровотечением.
Сцинтиграфия позволяет выявить скрытые переломы.
Уровень III. МРТ не показана.
Итак, разграничение трех уровней оказания медицинской помощи и выделение трех уровней визуализации подсказаны самой жизнью. В большинстве регионов нашей страны имеющиеся учреждения соответствуют первому уровню, редко первому-второму и очень редко — второму-третье-му, а третьего уровня диагностической визуализации вообще нет. Исключительное значение имеет надлежащее использование доступной в настоящее время диагностической аппаратуры. Выбор метода диагностической визуализации должен строиться на трех основополагающих принципах, а именно: более ранняя и точная диагностика, наименьший радиационный риск и минимальная стоимость визуализации.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ *
ЖЕЛУДОК
Заболевания
Аберрантная поджелудочная железа 273
Аденоакантома 243
Аденокарцинома 243
Аденопапилломатоз см. Менетрие болезнь
Актиномикоз 272, 273
Амиксорея 186
Амилоидоз 270
Ангиома см. Опухоль сосудистая
Антропилороптоз см. Гастроптоз частичный
Аэрофагия (гастроаэрофагия) 185
Безоар (псевдоопухоль) 275—277
Варикоз 272
Вирхова метастаз 244
Врожденная мембрана 174, 175
Гастрит 195
— антральный ригидный 202
— анаэробный (газовый, эмфизематозный) см. Флегмона
— оперированного желудка 291, 296
— острый 195
— хронический 195—197, 203
— — атрофический 197, 199, 201
— — опухолевоподобный см. Менетрие болезнь
— — поверхностный 197
— — склерозирующий (ригидный) 200
— — аэрозивный 202
Гастроптоз 192
— тотальный 192
— частичный 192
Гастроспазм 184
Гастросуккорея 185
Гастроэктазия см. Острое расширение
Гистоплазмоз 271
Гиса угол 163
Гранулема 267
— эозинофильная 267, 268
Двойной желудок 175
Де Кервена симптом 213, 214
Демпинг-синдром 295, 296
Дивертикул 175—177
— истинный 176
— ложный 176
Диспепсия 188, 189
— гастрогенная 188, 189
Дуоденогастральный рефлюкс см. Недостаточность привратника
Желудочно-кишечный блок см. Синдром отводящей петли
Заворот 177
— острый 178
— поперечный (мезентерико-аксиальный) 177
— продольный (органо-аксиальный) 178
— хронический 178
Зияние привратника см. Недостаточность привратника
Избыточная слизистая оболочка см. Менетрие болезнь
Инородное тело 274
Кардиальная вырезка см. Гиса угол
Карциноид 269
Крона болезнь 269
Крукенберга метастаз 244
Лейомиома 237
Лимфогранулематоз 268
Липома 240
Маллори — Вейсса синдром 219
Менетрие болезнь 178—181
Микоз 270, 271
Миосаркома 266
Мукороз 271
* В указателе в алфавитном порядке выделены отделы желудочно-кишечного тракта. В рубриках приведены заболевания и методы исследования. Если при наименовании заболевания не указано название органа, значит оно соответствует названию отдела ЖКТ. Методы исследования см. также в рубриках «Заболевания».
Нарушение эвакуации 186—188, 293
Невринома 240
— доброкачественная 240
— злокачественная 240
Невроз 189, 190
Недостаточность привратника 189, 204
Недостаточность швов анастомоза 291, 292
Ожог 275
— тепловой 275
— химический 275
Опухоль 235, 236, 241
— гломусная см. Опухоль сосудистая
— неэпителиальная 236, 237, 239, 241
— сосудистая 241
— эпителиальная 232
Ослера синдром 271, 272
Острая непроходимость приводящей петли анастомоза 293
Острое расширение 184
— — оперированного желудка 293
Отшнуровка см. Трансмиграция слизистой оболочки
Пенетрация язвы 222, 223
Пептическая язва анастомоза 296
Перегиб 191, 192
Перитонит 228
Перфорация (прободение) язвы 224, 225
Пилороспазм 173, 184
Пилоростеноз см. Стеноз привратника — спастический 173 Плазмоцитома 273
Пневмоперитонеум 225
Полип 233—235, 249
Пролапс транспилорический см. Трансмиграция слизистой оболочки
Раздраженный желудок 190, 191
Рак 229, 242-266
— анастомоза 297, 298
— антрального (дистального) отдела 261
— выбухающий (полипоидный) 251
— диффузный 262
— культи 297, 298
— плоско инфильтрирующий 253
— поверхностный см. Ранний
— проксимальной (верхней) части 255
— ранний 248, 250, 254
— резецированного желудка 296, 297
— экзофитный 244, 256
— эндофитный 244, 253, 258, 259
— эрозивно-язвенный 248, 250
— язвенный 264
Релапс см. Трансмиграционная слизистая оболочка
Саркоидоз 270
Саркома 266, 267
Симптом указующего перста см. Де Кервена симптом
Синдром отводящей петли 294
— приводящей петли 294
Сифилис 228, 230
Скирр см. Рак
Склеродермия 268, 269
Спазм 183, 191
Стеноз выходного отдела 222, 223
— привратника 171 — 173, 221, 222
Травматические повреждения 274, 275
Трансмиграция слизистой оболочки 192, 193
Туберкулез 231, 232
— сопутствующий 231
Фиброма 238, 239
Фибросаркома 266
Флегмона 226, 227
Халазия привратника см. Недостаточность привратника
Шнитцлера метастаз 244
Эмфизема стенки 273, 274
Язвенная болезнь 203 — 226
Исследования
Компьютерная томография 3, 66, 67
Магнитно-резонансная томография 3, 87, 88
Рентгенологическое 3, 6—8, 10—14, 20—24, 29,
30 98 265
— ангиография 27, 28, 229, 241
— контрастное 13, 14, 22, 24, 25, 225
— обзорная рентгенография 22, 23
— париетография (диагностический пневмопе-
ритонеум) 24, 26, 238
— пневмогастрография 24, 225
— полиграфия 24
— рентгенография 21
— рентгеноскопия 21
— фармакологические пробы 26, 27, 264
Тепловидение 3, 91, 92, 94
Ультразвуковое 3, 74, 75, 86, 203, 238, 265
ПЕЧЕНЬ, ЖЕЛЧНЫЕ ПРОТОКИ, ЖЕЛЧНЫЙ ПУЗЫРЬ
Заболевания
Абсцесс печени 543
Аденома печени 558
Альвеолярный эхинококкоз 565, 566
Амилоидоз печени 577, 578
Аплазия желчных протоков 535, 536
Асцит 570
Атрезия внутрипеченочных желчных протоков 535
Блуждающий желчный пузырь 537
Болезнь Кароли 536
— Коновалова — Вильсона см. Гепатоцеребраль-ная дистрофия
Гемангиома печени 558, 559
Гемахроматоз печени 574
Гепатит 542, 543
Гепатоз 555
— жировой 555, 572, 573
— пигментный 576, 577
Гепатоцеребральная дистрофия 574—576
Гипоплазия желчных протоков 536
Дивертикул желчного пузыря 537
Дискинезия желчных путей 537, 538
Дистопия желчного пузыря 537
Дисхолия см. Нарушение концентрационной функции желчного пузыря
Добавочная доля печени 535
Доброкачественная гипербилирубинемия см. Гепатоз пигментный
Доля (печени) Риделя 535
Желчнокаменная болезнь 545—552
Желчный свищ 581
Жировая дистрофия печени см. Гепатоз жировой
Киста желчных путей 561, 562, 564
— печени 561 — 563
Нарушение концентрационной функции желчного пузыря 538, 539
Перегиб желчного пузыря 536
Перетяжка желчного пузыря 536
Постхолецистэктомический синдром 580, 581
Рак желчного пузыря 566, 567
— — протоков 556, 557
— печени 553
Симптом Кера 540
— Мерфи 540
— Ортнера 540
— Щеткина — Блюмберга 540
Синдром Жилбера — Лербулле см. Гепатоз пигментный
Сифилис печени 543
Стеноз желчных протоков 535
Травматические повреждения 578—580
— — желчного пузыря 579
— — желчных протоков 578
— — печени 578
Туберкулез печени 543
Удвоение желчного пузыря 536
Холангит 539, 540
Холецистит 540, 542
Хронический тромбоз воротной вены 570
Цирроз печени 567, 568
— — билиарный 567, 568
Исследования
Компьютерная томография 3, 66, 67, 69, 70, 71, 544, 545, 554, 557, 560, 572
Магнитно-резонансная томография 3, 87, 88, 90, 556
Радионуклеидное 59, 60
Рентгенологическое 3, 6, 52, 54 , 98, 544
— ангиография 544, 545, 562
— гепатография 52
— зонография желчных путей 56
— обзорная рентгенография 52, 59, 578
— портография 52
— рентгеноскопия 52, 54, 59
— сочетанная холедуоденография 60
— спленопортография 52, 571
— холангиография 58, 540, 581
— — лапароскопическая 58
— — операционная 58
— — фистуло (через свищ) 59
— — чрездренажная 58, 59
— — чрескожная чреспеченочная 56, 57
— холеграфия 53, 540, 546, 581
— — внутривенная 53, 54, 545, 554, 572
— — — ускоренная 53, 55
— — инфузионная 53—55
— холецестография 52, 53, 541
— — лапароскопическая 52, 58
— — пероральная 52, 53
— — радио 572, 581
— — серийная 52
— целиакография 52, 572
Тепловидение 3, 91, 92, 95
Ультразвуковое 3, 72, 76, 77, 548, 557, 560, 571
— эхография 73, 571
ПИЩЕВОД
Заболевания
Абсцесс 125, 126, 135
Актиномикоз 134, 135
Амилоидоз 150
Атрезия 109, 110
Ахалазия кардии 114
Баршоня — Тешендорфа синдром 121
Бластомикоз 134, 135
— Гилкриста 135
Варикоз 151, 152
Вертеброэзофагопатия 148, 149
Врожденный короткий пищевод НО, 111
Гипертензия 151
Гипотония 114, 120
Гиса угол 111, 154, 156, 157
Глоссофарингиальная недостаточность 114
Грыжа пищеводного отверстия диафрагмы 15, 114, 119, 152, 153, 159
— — — — манжетообразная (смешанного типа) 156
— — — — параэзофагеальная 156
— — — — эзофагеальная 156
Грыжевая болезнь 157
Дивертикул 15, 112—114
— Ценкера 112
— эпифренальный ИЗ
Дискинезия 114, 128
Дисфагия 16, 114, 116, 124, 134, 135, 144, 145
— сидеропеническая 115
Дисфункция верхнего пищеводного сфинктера 119, 220
Диэзофагия ПО
Желудочно-пищеводный рефлюкс 119, 123, 152
Инородные тела 137, 138
Кандидоз 134, 135
Кардиоспазм 116 — 118
Карцинома см. Рак
Киллиана триада 137
Киста 133
Крикофарингиальный спазм 114
Кровотечение 15, 125, 127, 151
Крона болезнь 134
Лейомиома 132, 133
Маллори — Вейсса синдром 125
Медиастинит 15, 126, 144
— хронический 144, 145
Медиастиноэзофагопатия см. Медиастинит хронический
Метастатическое поражение 134
Миастения 114
Морганьи — Адамса синдром 108
Невринома 133, 134
Ожог 142, 143
— химический 109, 142
Опухоль 146, 158
Паракокцидидоз 135
Паралич 114, 122
Парез 114, 122
Периэзофагит 119, 123
Перфорация 125, 135, 140
Пищеводная рвота см. Регургитация
Пищеводно-слюнной рефлюкс 107, 108, 117
Пламмера — Винсона синдром см. Дисфагия сидеропеническая
Повреждение 139, 140
Полип 134
Псевдодивертикул 113, 135
Рак 126, 128, 129
— корня языка 129, 130
— экзофитный 127, 128
— эндофитный 127, 130
Регургитация 117, 122
Рефлюкс-трансплантит 158
Рефлюкс-эзофагит 16, 119, 124, 150, 157, 158
Рубцовое сужение 119
Саркома 131, 132
Свищ 109, 135, 146, 147
Сифилис 136
Склеродермия 114, 150, 151
Стеноз 111, 112, 114, 159
Стриктура 125, 136
Сужение (сдавление) 145
Тримадо симптом 144
Туберкулез 135, 136
Шегрена синдром 115
Флегмона 125, 126
Халазия кардии 119
Эзофагит 122, 144, 152
— коррозивный 144
— острый 122, 123
— стенозирующий гранулематозный см. Крона болезнь
— травматический 139
— хронический 122, 123
— эрозивный 123, 136
— язвенный 123
Эзофагопатия 145, 149
— васкулярно-кардиальная см. Сужение (сдавление)
— метаболическая 149, 150
— при заболеваниях крови 149
Эзофагоспазм 120, 121
Язва 124, 125
— всадник 124
— Квинке 124
- Кея 124
— пептическая 124
— целующиеся 124
Исследования
Компьютерная томография 3, 66, 67, 114, 130
Магнитно-резонансная томография 3, 87, 88, 132
Рентгенологическое 3, 6, 10—15, 16, 38, 108
— двойное контрастирование (барий + газ) 15 —
18
— диагностический ппевмомедиастинум 19
— контрастное полипозиционное 15, 141, 152
— обзорная рентгеноскопия 15
— пневтомедиастинография 19
— респираторная полиграфия 19
— фармакологические пробы 18, 19
— эзофагоскопия 142
— электрорентгенография 20
— эндоскопия 123
Тепловидение 3, 91, 92
Ультразвуковое 3, 72, 74, 132, 152
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Заболевания
Добавочная поджелудочная железа 601 — острый 584, 587, 602 — — симптом Гобие 585
Инсулома см. Опухоль островковой части — — — вырезанной петли 585 — — — дежурной петли 585
Киста 588, 599 — — — отрезанной кишки 585
Кольцевидная поджелудочная железа 601 — — — перевернутой тройки 585 — травматический 603 — хронический 588, 589, 591
Муковисцедоз 600, 601 — — Фростберга 586, 589
Опухоль островковой части 599 — — — синдром Золлингера — Эллисона 599 — — — триада Уиппла 599 Рак 595-599 Свищи 603, 606
Панкреатит 584, 585 Травматические повреждения 601
Исследования
Компьютерная томография 3, 66, 70, 72, 587
Магнитно-резонансная томография 3, 90, 592
Рентгенологическое 3, 6, 60—63, 67, 98, 585, 606
— ангиография 65, 66, 592
— контрастное 61, 62, 65, 586
— мезентерикография 65
— обзорные снимки 60, 61, 65, 585
— релаксационная дуоденография 61, 66
— холеграфия 61
— экскреторная панкреатография 64
— эндоскопическая ретроградная панкреатохо лангиография 61—63, 585
Тепловидение 3, 91, 92, 94
Ультразвуковое 3, 73, 79, 80 — 84, 592
ТОЛСТАЯ КЦП1КА
Заболевания
Абдоминальный актиномикоз 513, 514
Амебиаз 506, 507
Амебная дизентерия см. Амебиаз
Американский трипаносомоз 509
Ангиома 494, 495
Аноректальный свищ 515—522
Аппендицит 462, 463
Атрезия 430, 431
Балантидиаз 508, 509
Баритома 514
Баугинит 513
Болезнь Гиршспрунга 425, 427
— Крона 484
— — синдром Ирасека — Цульцера — Уилсона см. Сегментарный врожденный аганглиоз
— — — Николя — Фавра 485
— — — оперированной кишки 528— 530
Ворсинчатая опухоль 490, 491
Воспаление червеобразного отростка см. Аппендицит
Врожденное аноректальное сужение 430
Гипертрофия илеоцекального клапана 512, 513
Дивертикул 431, 434, 435
Дивертикулит 435, 437
Дискинезия 437—439
Диспепсия 440, 441
Диффузный полипоз 491, 492
Инфузорная дизентерия см. Балантидиаз
Карциноидная опухоль 505, 506
Квашиоркор 510, 511
Колит 456—458
— гранулематозный 480, см. также Болезнь Крона
— ишемический 478
— псевдомембранозный 478
— туберкулезный 473, 480, 481
— хронический неязвенный 456—458
— — — илеотифлит 457
— — — панколит 457
— — — перитифлит 457
— — — проктосигмоидит 457, 460
— — — тифлит 457
— — — тифлоколит 457
— — — трансверзит 457
— эозинофильный 512
— язвенный неспецифический 463—469
— постдизентерийный 474
— — токсическая дилатация 471
Лейомиома 494
Липома 494
Меланома 505
Метастаз опухолевый 505
Мукоцеле червеобразного отростка 512
Пеллагра 511
Перитонит 472
Полип 486—489
Поражение при гемобластозах 514, 515
Рак 495-504
Саркома 504, 505
Свищ 431, 432, 472
Сегментарный врожденный аганглиоз 425, 426, 428
Синдром Шагаса см. Американский трипаносомоз
— Хилаидити 432
Синистропозиция 433
Стриктура 472
Травматические повреждения 522, 530, 531
Трихомоноз 511, 512
Трихоцефалез 510
Удвоения 433, 434
Функциональная кишечная диспепсия 440, 441
Шистосомоз 509, 510
Эндометриоз 492, 493
Исследования
Компьютерная томография 3, 66, 70, 502, 503
Магнитно-резонансная томография 3, 87, 88
Ректороманоскопия (колоноскопия) 45, 47, 479 Рентнегологическое 3, 6, 42—48, 98, 411, 412 — ангиография 44, 50, 51 — ирригоскопия 43—46 — контрастирование 42, 47—50, 413, 510
— — перроральное 42, 43
— — ретроградное 42, 45
— обзорная рентгенография 42, 46, 479
— париетография 50, 473
— пневмоколонография 49, 479
— рефлексогенная 49, 50
— эндоскопия 44
Ультразвуковое 3, 73
ТОНКАЯ КИШКА
Заболевания
Амилоидоз 401
Анкилостомидозы 395, 396
Аномалии вращения 310, 311
Аскаридоз 394, 395
Атрезия 311, 312
Болезнь Крона 365, 366
—, Шеилейна — Гепоха 391, 392
— Ходжкина см. Лимфогранулематоз
Брюшная жаба см. Синдром мезентериального обкрадывания
Воспалительная опухоль 372
Гетеротопия поджелудочной железы 371, 372
— эндометриоидная 372, 373
Гистоплазмоз 402
Грыжа Трейтца 404
Дерматомиозит 386
Дивертикул 315—318
— Меккеля 315
Дискинезия 12-перстной кишки 323, 324, 327,
329, 330, 333
— подвздошной кишки 325, 326
— тощей кишки 325, 326
Диспептический синдром 326, 327
Дисфункция в послеоперационном периоде 343, 344
Дуоденит 331, 344 — 347
Дуоденостаз 324, 344
Интрамуральная гематома 12-перстной кишки
403, 404
Карциноид 374, 375
Киста-эптерокистома (удвоение) 371
Коллагенозы 382—384
Лейомиома 370
Лимфогранулематоз 387—390
Липомы 371
Лямблиоз 400, 401
Макроглобулинемия Вальденстрема 391
Мастоидоз 402
Мегадуоденум 313, 314
Муковисцедоз 401, 402
Невриномы 371
Некротический энтероколит новорожденных 359
Непроходимость 12-перстной кишки 319
— — — хроническая 319, 320
Панкреатическая холера 392, 393
Пневматоз стенки тонкой кишки 402, 403
Полипы 370, 374
Псевдотуберкулез 367, 368
Рак 12-перстной кишки 375—377
— подвздошной кишки 378, 379
— тощей кишки 378, 379
Ревматоидный артрит 386
Саркома 12-перстной кишки 379, 380, 382
— подвздошной кишки 380, 381
— тощей кишки 380, 381
Синдром мальабсорбции 334, 336 —342
— — болезнь альфа-цепей 342, 343
— — — Уиппла см. Интестинальная липодистрофия
— — — Хартнапа 334, 340
— интестинальная (лимфангиоэктазия) липодистрофия 335—337
— кахексия 341
— короткой кишки 340, 341
— лактозодефицитный 340
— мезентериального обкрадывания 404, 405
— Пейтца — Егерса 373
— спру 338
— Черджа — Стросса 393, 394
— целиакия 338
Системная красная волчанка 385, 386
— склеродермия 384, 385
Сифилис 361
Стеноз 311, 312
Стронгилоидоз 396—398
Тениидозы 398, 399
Травматические повреждения 407 , 408
Туберкулез 361, 362 — 365
Туберкулезный мезаденит 364, 365
Удвоения 314, 315
Узелковый периартериит 386
Фибромы 370, 371
Флегмона 359, 360
Энтерит 339, 347, 348, 350
— острый 347, 348
— хронический 347, 348, 350 — 352
Язва 12-перстной кишки 354, 355, 357
— подвздошной 358, 359
— тощей 358, 359
Исследования
Компьютерная томография 3, 66
Рентгенологическое 3, 6, 30, 98, 310, 311, 314, 319, 350-354
— ангиография 367
— дуоденография 34, 35, 356
— — гипотоническая через зонд 34
— — релаксационная 34, 35, 345, 346, 354, 374
— — — аэронная 37 — 39
— илеоцекография 32, 40, 41
— — пероральная с двойным контрастирова нием 32, 33
— — релаксационная ретроградная 40
— мезентерикография 42
— обзорная рентгенография 31
— радионуклидный 325
— рентгеноскопия 30
— релаксационная интестинография 34
— ускоренные методы 374
— энтерография 32, 40, 352, 353
— — интубационная 33, 34
— — трехкратная 32
— — релаксационная пероральная 40
ОГЛАВЛЕНИЕ
Предисловие 3
Список сокращений 5
Раздел I. ОБЩИЕ ВОПРОСЫ
Глава 1. Лучевые методы и средства диагностики в гастроэнтерологии 6
Рентгенологическое исследование g
Средства, устройства и способы рентгенологического исследования пищеварительного аппарата 8
Компьютерная томография 66
Ультразвуковая диагностика 72
Магнитно-резонансная томография 87
Тепловидение 91
Глава 2. Гносеологические проблемы лучевой диагностики 97
Раздел П. ПИЩЕВОД
Глава 3. Некоторые аиатомо-физиологи-ческие и рентгенологические особенности 104
Глава 4. Аномалии и пороки развития 109
Глава 5. Функциональные расстройства 114
Глава 6. Воспалительные заболевания 122
Глава 7. Опухолевые заболевания 126
Глава 8. Специфические поражения 134
Глава 9. Инородные тела и повреждения 137
Глава 10. Изменения пищевода при за-
болеваниях других органов и систем 144
Глава 11. Болезни оперированного пищевода 156
Раздел III. ЖЕЛУДОК
Глава 12. Рентгеноанатомия и физиология 160
Глава 13. Аномалии и пороки развития 170
Глава 14. Функциональные расстройства 182
Глава 15. Воспалительные заболевания 195
Глава 16. Доброкачественные опухоли 232
Глава 17. Злокачественные опухоли 242
Глава 18. Редкие заболевания 267
Глава 19. Инородные тела и повреждения 274
Глава 20. Рентгенология оперированного желудка 277
Особенности рентгенологического исследовании 280
Рентгенологическая картина 283
Адаптационно-компенсаторные процессы 287
Болезни оперированного желудка 291
Раздел IV. ТОНКАЯ КИШКА
Глава 21. Рентгеноанатомия и физиология 299
Двенадцатиперстная кишка 299
Тощан и подвздошная кишки 303
Рентгенологическая картина при приеме сорбитно-водно-бариевой взвеси 306
Возрастные рентгеноанатомические особенности 309
Глава 22. Аномалии и пороки развития 310
Глава 23. Функциональные расстройства 322
Дискинезии 12-перстной кишки 323
Дискинезии тощей и подвздошной кишок 325
Синдром мальабсорбции 334
Дисфункция тонкой кишки в раннем послеоперационном периоде 343
Глава 24. Воспалительные заболевания 344
Глава 25. Опухолевые заболевания 369
Доброкачественные опухоли 369
Злокачественные опухоли 375
Глава 26. Некоторые системные заболевания 382
Диффузные болезни соединительной ткани (коллагенозы) 382
Лимфогранулематоз
Макроглобулинемия Вальденстрема Болезнь Шенлейна — Геноха Панкреатическая холера Синдром Черджа — Стросса
Глава 27. Паразитарные заболевания
Глава 28. Редкие заболевания
Глава 29. Рентгенология травматически поврежденной и оперированной тонкой кишки
Некоторые особенности рентгенологического исследования
Рентгенологическая картина поврежденной тонкой кишки
Рентгенологическая картина оперированной тонкой кишки
Раздел V. ТОЛСТАЯ КИШКА
Глава 30. Рентгеноаиатомия и физиология
Рентгенологические особенности Особенности толстой кишки у детей Физиологические основы толстой кишки
Глава 31. Аномалии и пороки развития
Глава 32. Функциональные расстройства
Функциональная кишечная диспепсия
Дисфункция толстой кишки в раннем послеоперационном периоде
Глава 33. Воспалительные заболевания (колиты)
Глава 34. Доброкачественные опухоли
Глава 35. Злокачественные опухоли
Глава 36. Паразитарные заболевания
Глава 37. Редкие заболевания
Глава 38. Аноректальные свищи
Глава 39. Рентгенология оперированной толстой кишки. Травматические повреждения
Особенности рентгенологического исследования оперированной толстой кишки
387
391
391
392
393
394
401
406
406
407
408
410
410
423
424
425
437
440
446
456
485
495
506
510
515
522
522
Рентгенологическая картина оперированной толстой кишки 525
Болезни оперированной толстой кишки 528
Травматические повреждения толстой кишки 530
Раздел VI. ПЕЧЕНЬ, ЖЕЛЧНЫЕ ПРОТОКИ И ЖЕЛЧНЫЙ ПУЗЫРЬ
Глава 40. Рентгеноаиатомия и физиология 532
Глава 41. Аномалии и пороки развития 534
Глава 42. Функциональные и воспалительные заболевания 537
Глава 43. Желчнокаменная болезнь 545
Глава 44. Опухоли и кисты 553
Злокачественные опухоли 553
Доброкачественные опухоли 558
Кисты 561
Глава 45. Циррозы печени 567
Глава 46. Обменно-дистрофические заболевания печени 572
Глава 47. Травматические повреждения.
Состояние после операций 578
Травматические повреждения печени и желчевыводящих путей 578
Основные оперативные вмешательства 580
Некоторые послеоперационные болезни 580
Раздел VII. ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Глава 48. Рентгеноаиатомия и физиоло-
гия 582
Глава 49. Панк|<еатиты 584
Глава 50. Опухо ш, кисты и пороки развития 592
Глава 51. Травматические повреждения.
Состояния после операций 601
Травматические повреждения 601
Основные оперативные вмешательства 602
Некоторые послеоперационные болезни 603
Заключение 607
Литература 632
Предметный указатель 637